Author: Лучинский Г.П.
Tags: неорганическая химия химия монография общая химия издательство химия титан соединения титана гидролиз сульфата титана химия титана
Year: 1971
BsSOii
fees!
ИИ»
ВЙЖВВД
Г.П. лучинский
химия
ТИТАНА
Ор;:,> -..КОГО
сельхез мститута
ИЗДАТЕЛЬСТВО «ХИМИЯ»
МОСКВА 1971
УДК 546.821
Л 87
Лупинский Г. П., Химия титана. Изд-во «Химия»,
1971 г.
В книге описаны химические и физические
свойства элементарного титана,, его простых и
комплексных соединений, сырьевые источники и
способы получения, а также методы анализа ти-
тана и его соединений и сплавов, освещены во-
просы применения их в народном хозяйстве.
Монография рассчитана на широкий круг хи-
миков — научных работников, инженеров, препо-
давателей, аспирантов, студентов старших курсов,
специализирующихся по неорганической химии.
В книге содержится 65 иллюстраций, 73 таб-
лицы, 369 библиографических ссылок.
2-5-2
БЗ-38-71-14
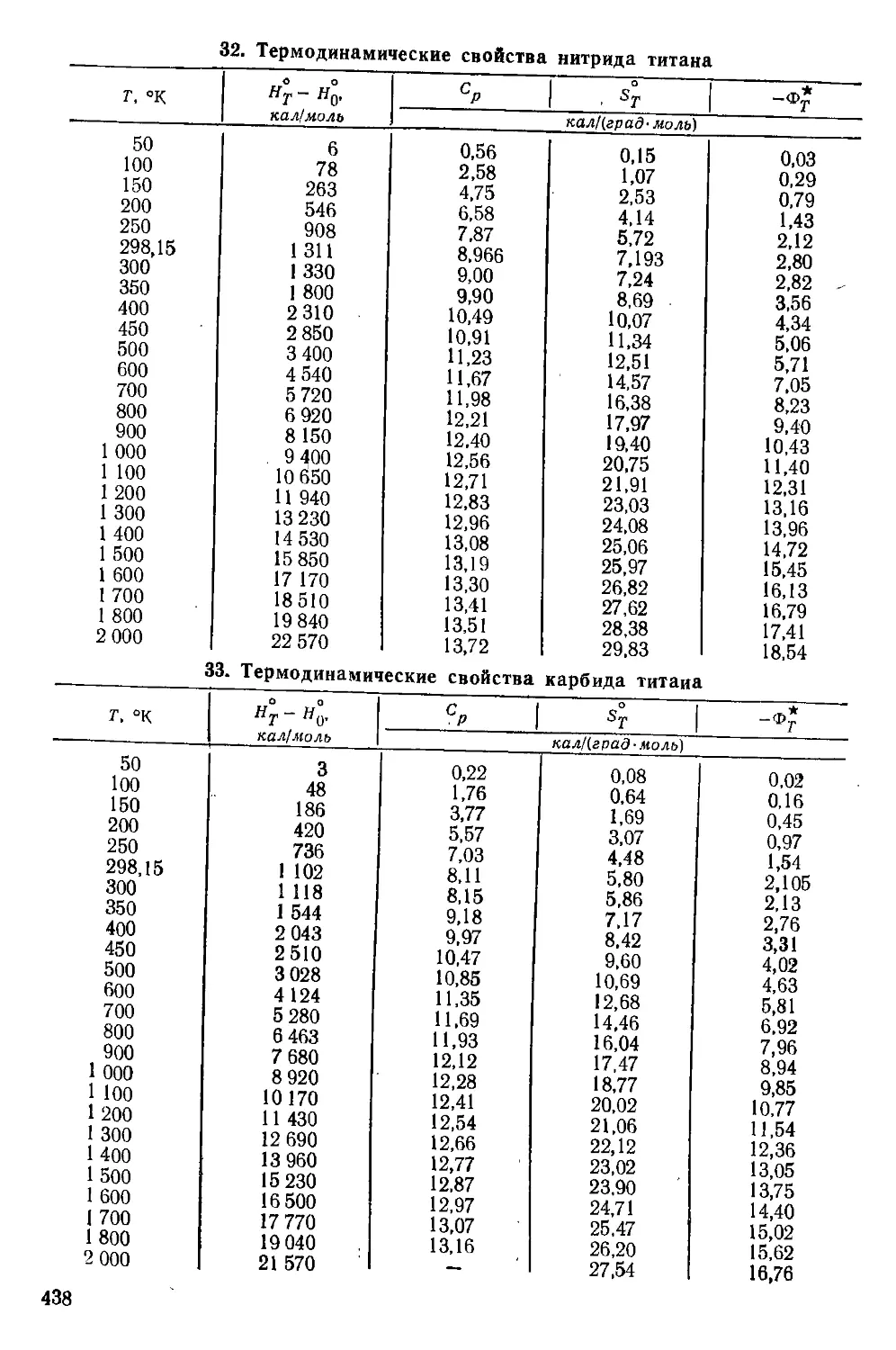
СОДЕРЖАНИЕ
Введение ............................................................. 9
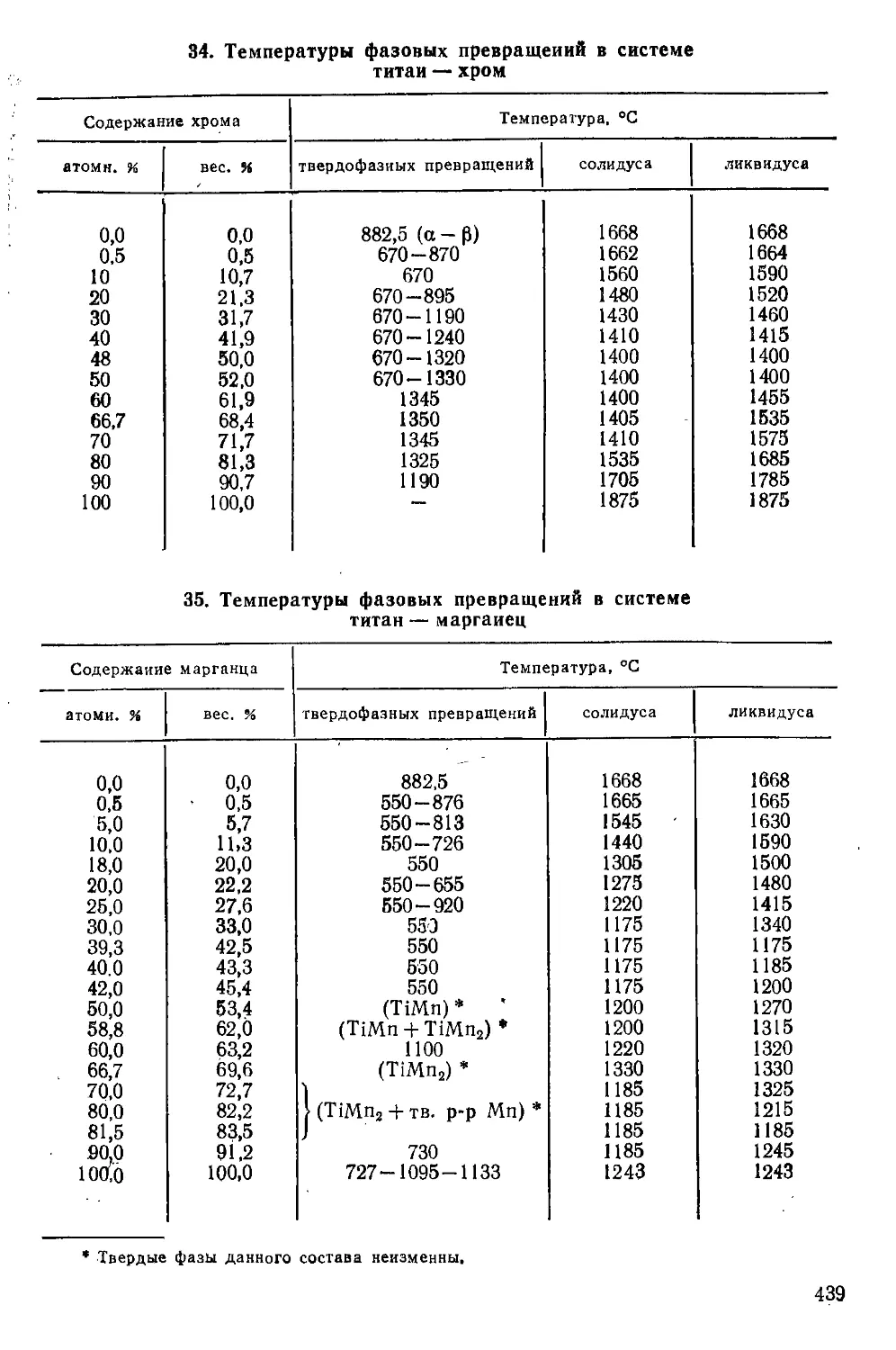
/Глава I. Характеристика титана как элемента > . . -. ...... ,13
Строение атома...................................................13
Атомный вес и изотопия......................................... 14
' ; Положение титана среди химических элементов..................... . 16
Общая характеристика соединений титаиа...........................18
Глава II. Элементарный титан ....................>................. . 23
Физические свойства..............................................23
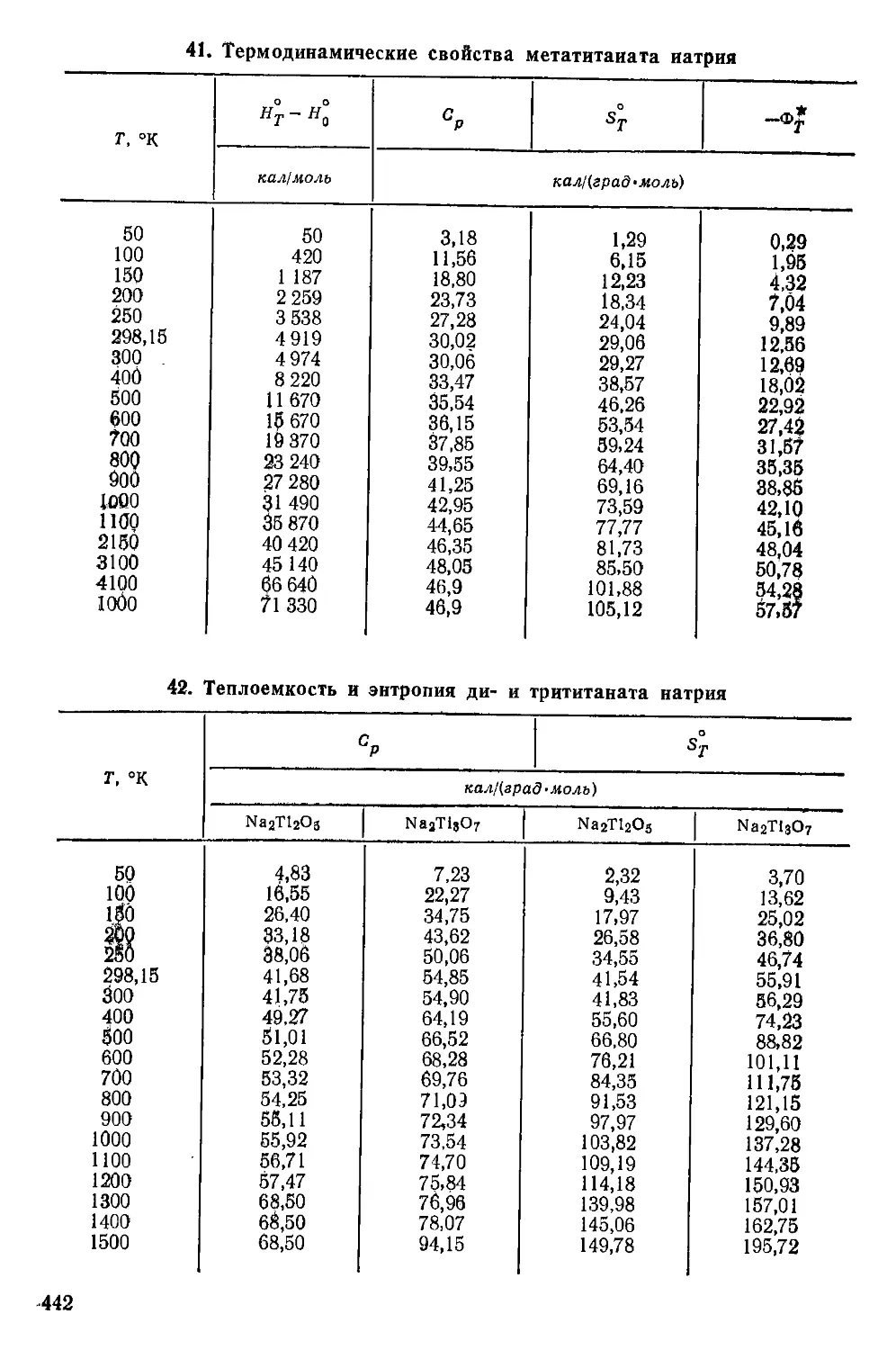
Химические свойства............................................ 33
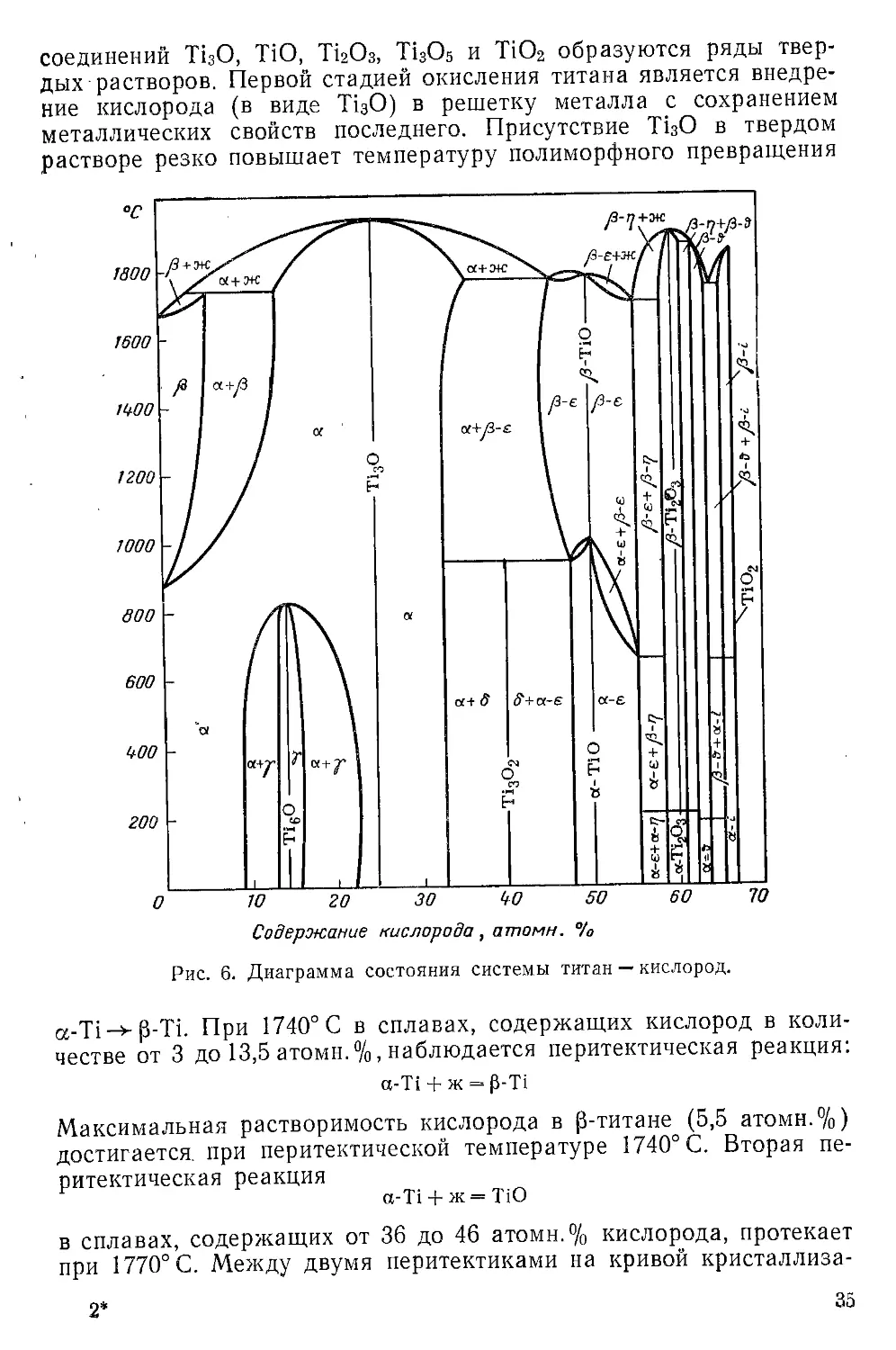
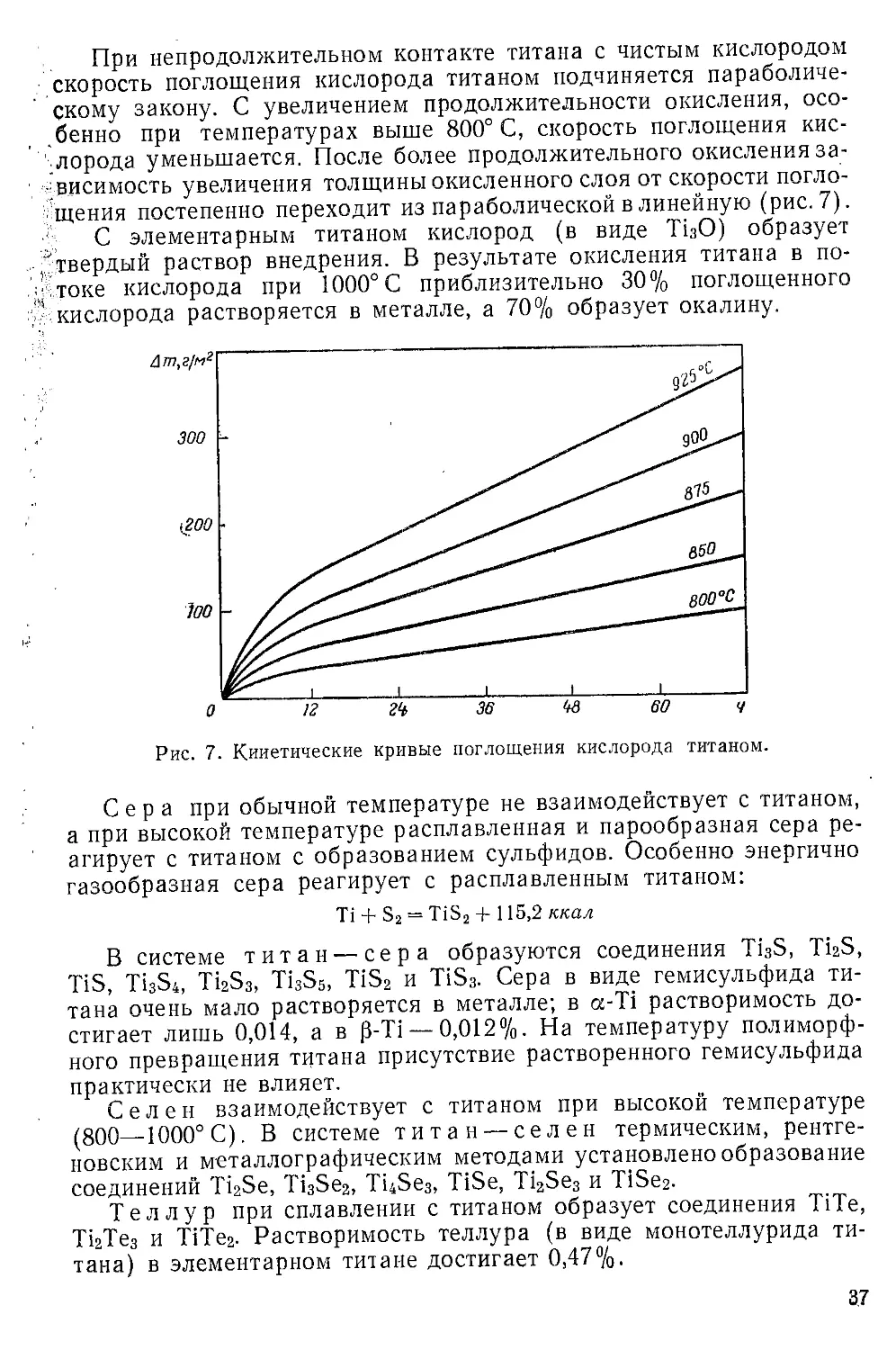
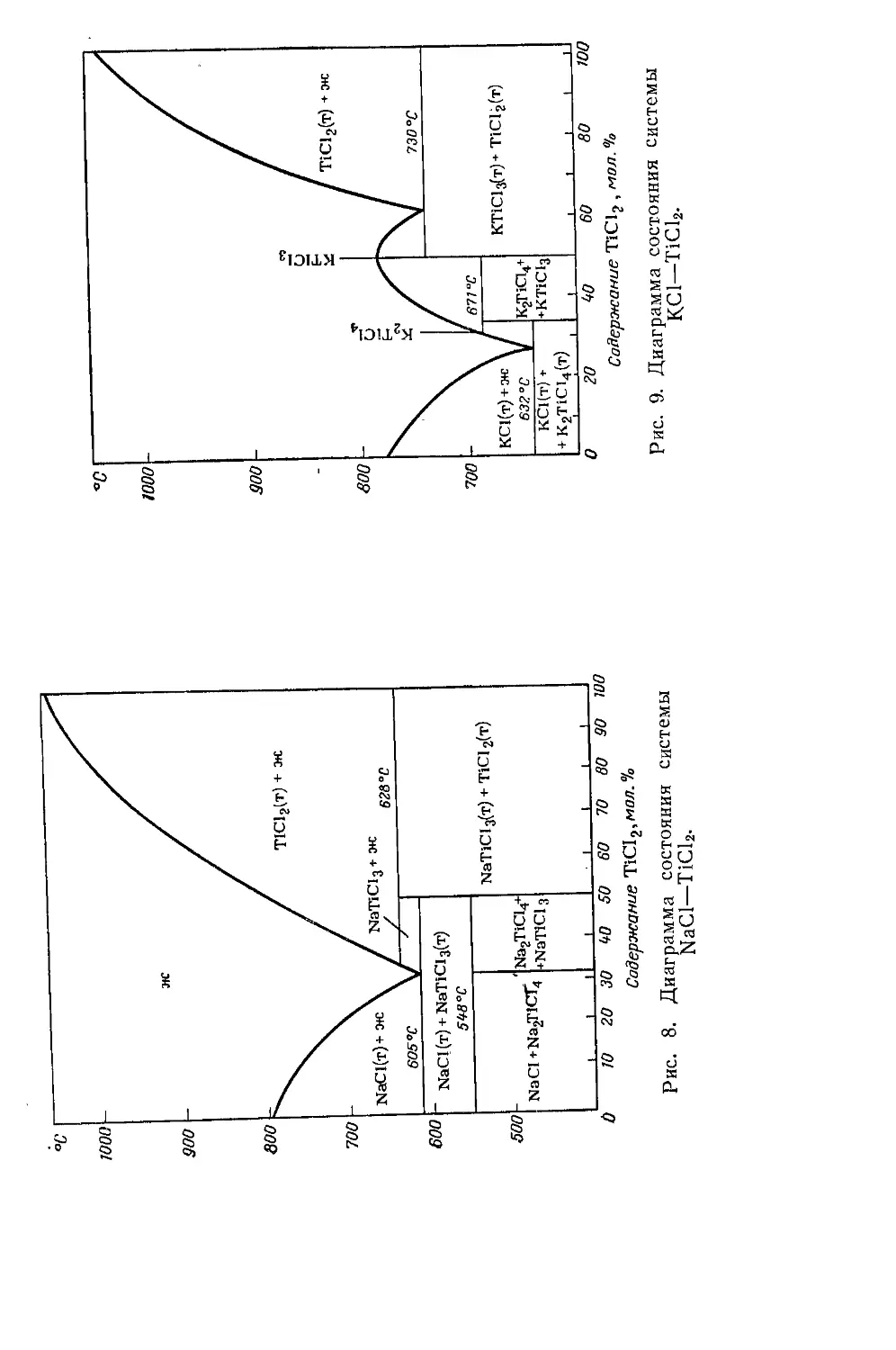
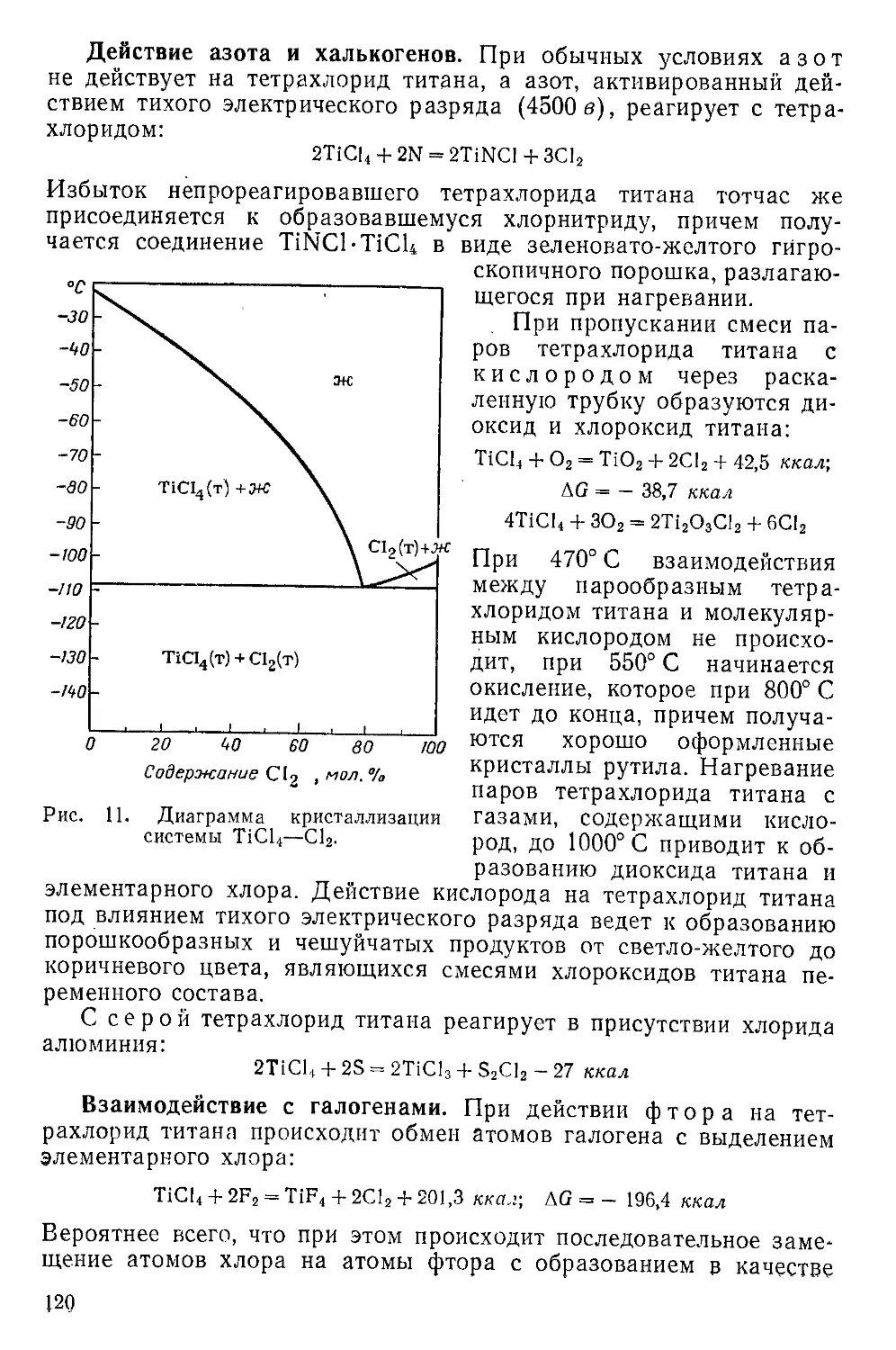
Взаимодействие с элементарными веществами....................33
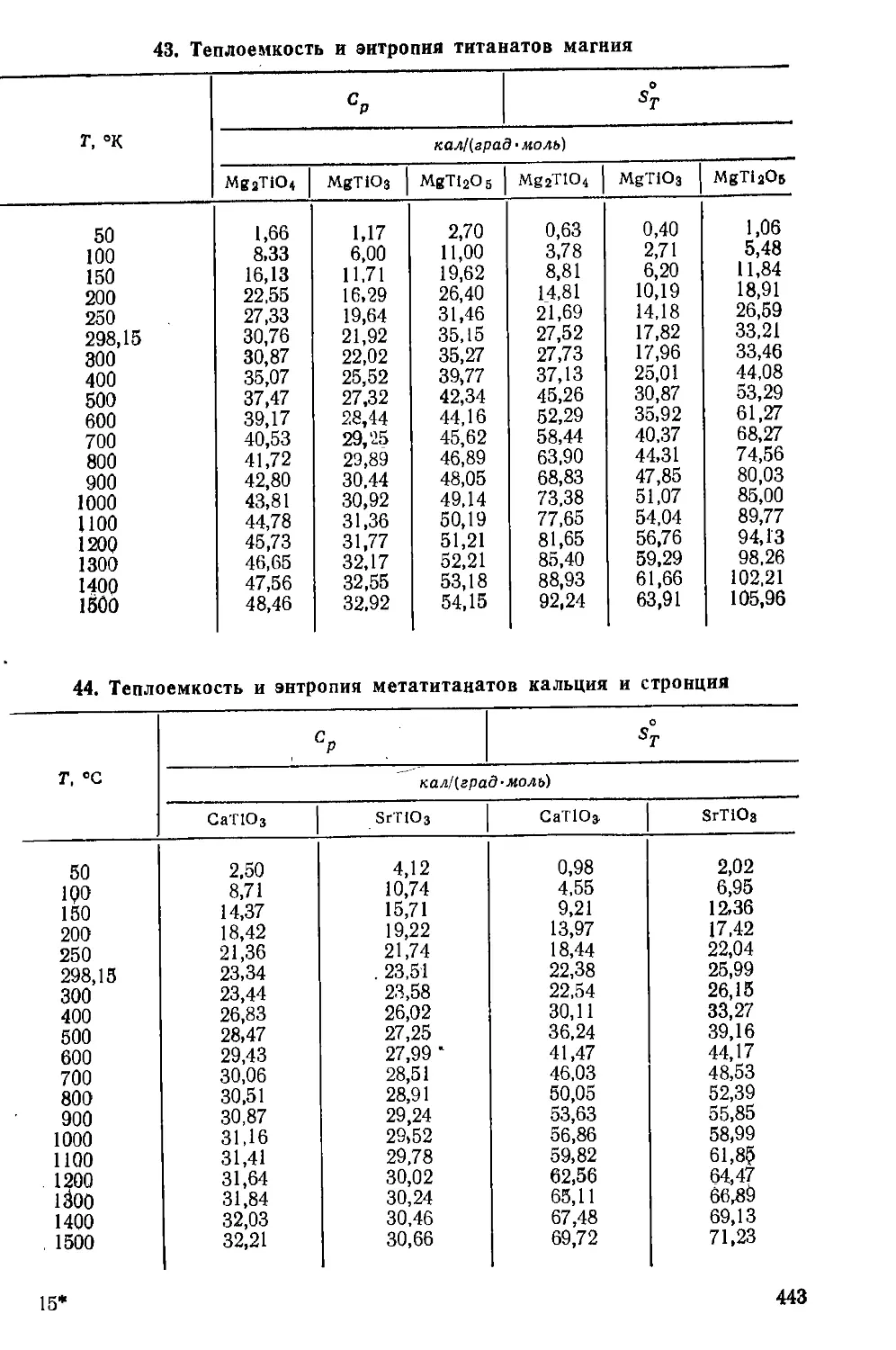
Взаимодействие с галогенными соединениями.....................39
Взаимодействие с халькогенными соединениями...................43
Взаимодействие с азотными, углеродными и другими соединениями 46
Титан как технический материал ..................................47
Конструкционно-технологическая характеристика.................47
Коррозионная стойкость........................................49
Применение металлического титана..............................52
Глава III. Соли двухвалентного титана >54
Галиды титана(П)............................................ 54
Дифторид титана.............................................54
Дихлорид титана.............................................55
Дибромид титана.............................................61
Дииодид титана ............................................ 63
Халькогениды титана (II).......................................64
Одноокись титана .......................................... 65
Двугидроокись титана ...................................... 69
Моносульфид титана..........................................70
Моноселенид титана .........................................71
Монотеллурид титана........................................ 71
Комплексаты титана (II)........................................71
Хлорат титана(II).......................................... 72
Перхлорат титана(П).........................................72
1
3
Сульфат титана(II).............................................
Гидросульфат титаиа(П) .............................. . . . .
Нитрат титана(П)......................................... . .
Нитрит титана(П) ..............................................
Карбонат и гидрокарбонат титана(II)............................
Формиат титана (II)............................................
Ацетат титана(II)..............................................
Оксалат титана (II)............................................
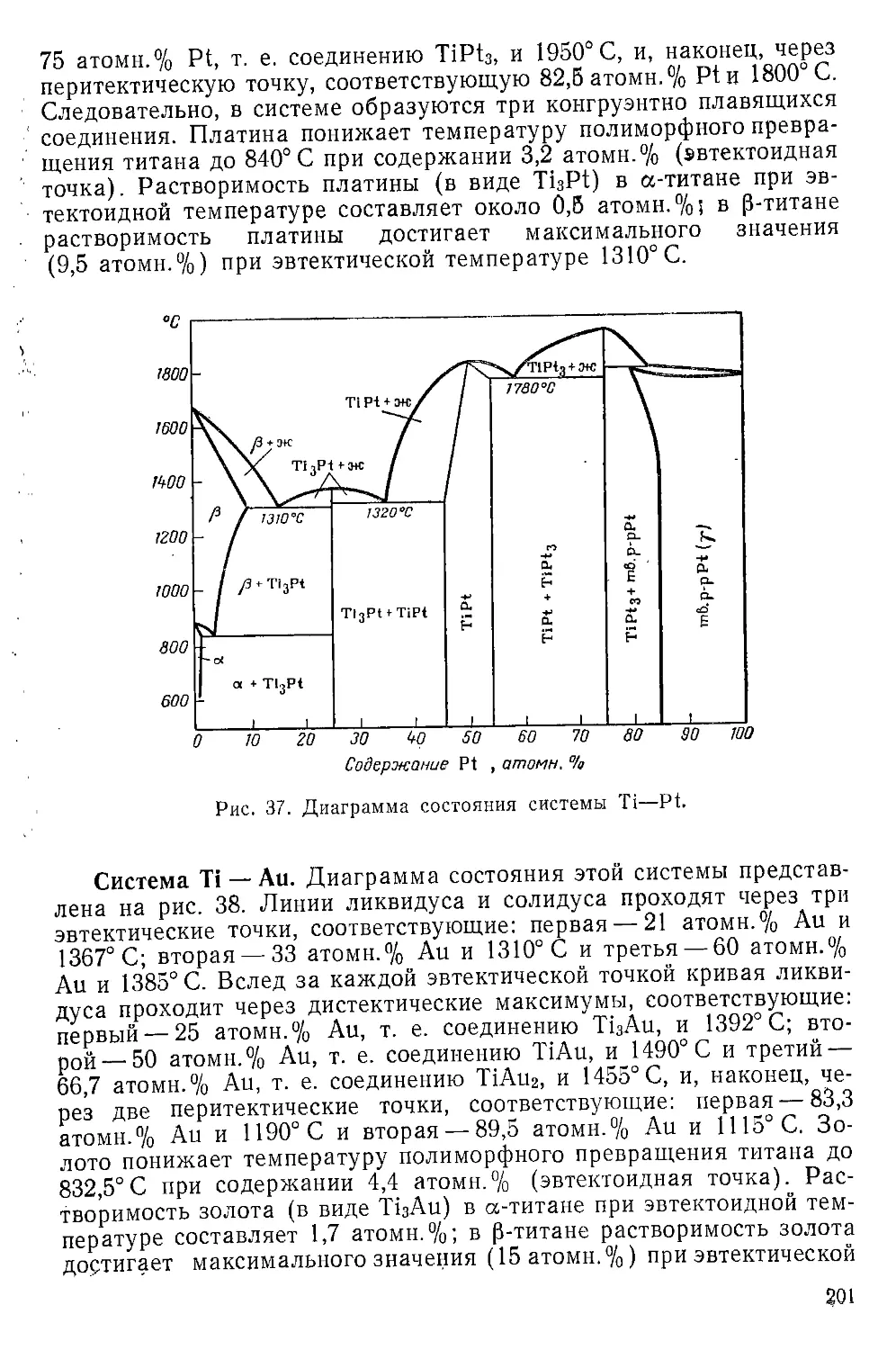
Тиоцианат титана (II)..........................................
72
73
73
73
74
74
74
73
7Б
Глава IV. Соли трехвалентного титана......................................76
Галиды титана(III).............................................
Трифторид титана ................... , .....................
Фторо-(Ш)титанаты.....................................• . . .
Трихлорид титана .............................. .............
Хлоро-(Ш)титаиаты............................................
Трибромид титана ..................... ......................
Трииодид титана .............................................
Халькогениды титана (III)................................... .
Полутораокись титана.........................................
Оксо-(Ш)титанаты ............................................
Гидроокись титана(Ш).........................................
Галогеноксиды титана (III).....................................
Сульфид титана(III)..........................................
Селенид титана (III).........................................
. Теллурид титана(Ш).............................................
у' Комплексаты титана(П1).........................................
Перхлораты титана (III)......................................
/Сульфат титана (III).........................................
(Гидросульфаты титана(Ш)......................................
(^ульфато-(Ш)титанаты........................................
Фосфаты титана(III)..........................................
, Фторо- и гидридобораты титана (III).............................
Соли органических кислот ...................... . ...........
(^арбонат-гидроокись титана (III).............................
Формиат титана(Ш)............................................
(&цетат титана (III).........................................
/Оксалат титана(III)..........................................
ЦаРтРат титана (III)..........................................
Тиоцианат титана/111)........................................
76
76
78
79
85
85
87
88
88
92
92
93
94
95
95
Об
96
96
98
99
99
1С0
100
100
101
101
101
102
103
Глава V. Галиды и халькогениды четырехвалентного титана . . . . 103
Фториды титана (IV) .........................................103
Тетрафторид титана ....................................... 103
Смешанные фториды.............. . 1................... 108
Тетрахлорид титана ......................................... 110
Получение................................................. 111
Физические свойства........................................115
Химические свойства........................................117
Бромид, иодид и смешанные галиды титана (IV).................132
Тетрабромид титана....................................... 132
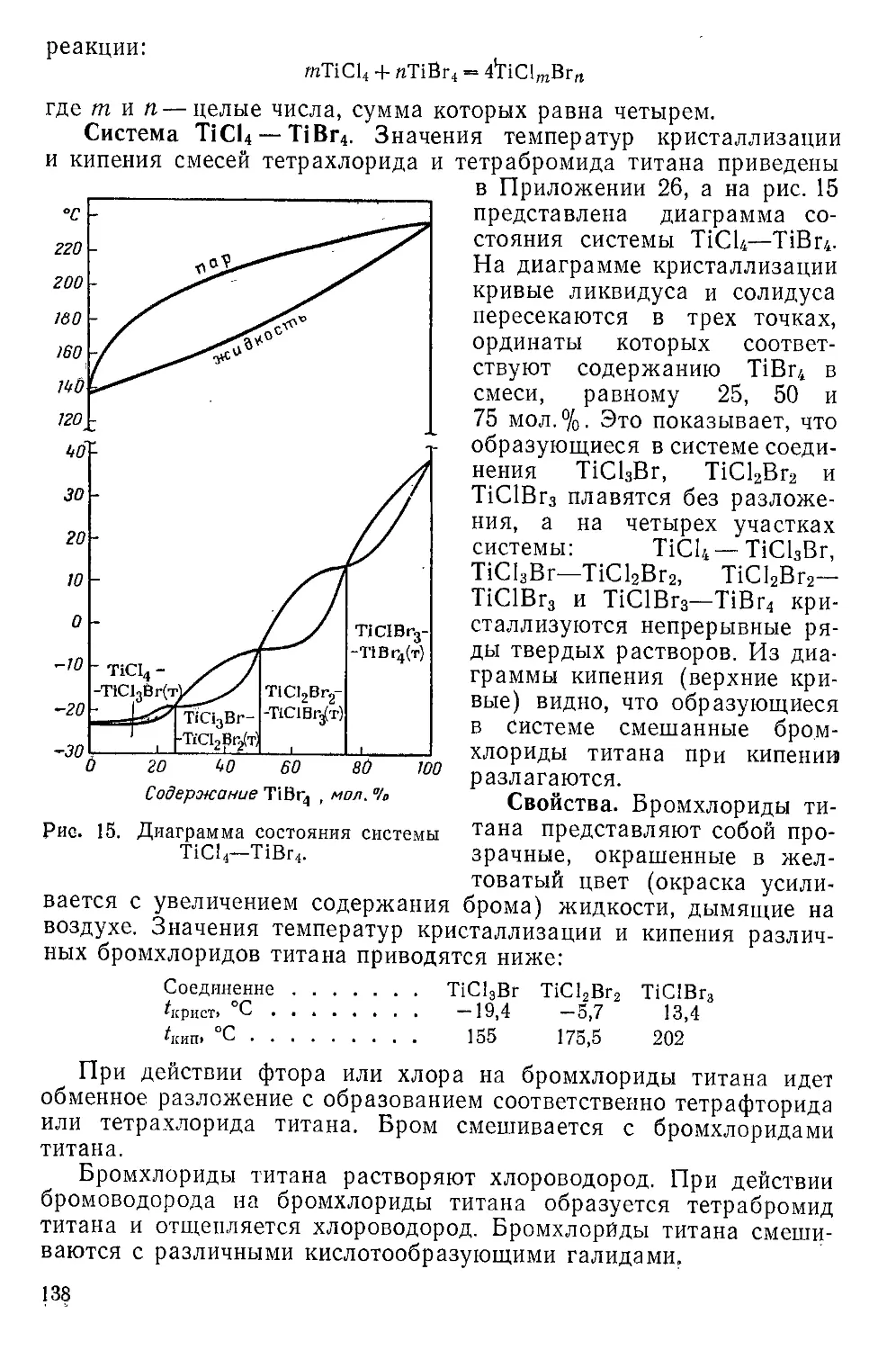
Бромхлориды титана(IV).............................137
Тетраиодид титана........................................ 139
Иодхлориды и иодбромиды титана (IV)..................... 142
Двуокись титана.............................................143
' ” Получение............................................... 143
4
( Физические свойства........................................
\Химические свойства . ......................................
Галогеноксиды титана(IV) ....................................
Дихлороксид титана........................................
Сложные хлороксиды........................................
Бромоксиды титана ........................................
Дииодоксид титана ........................................
Сульфиды титана (IV) и их аналоги............................
Дисульфид титана..........................................
Диселенид и дителлурид титана.............................
Смешанные сульфиды титана (IV)............................
Й'л а в а VI. Соединения титана с водородом, азотом и другими неметалли-
ческими элементами .................
" Гидриды титана . ............................’............
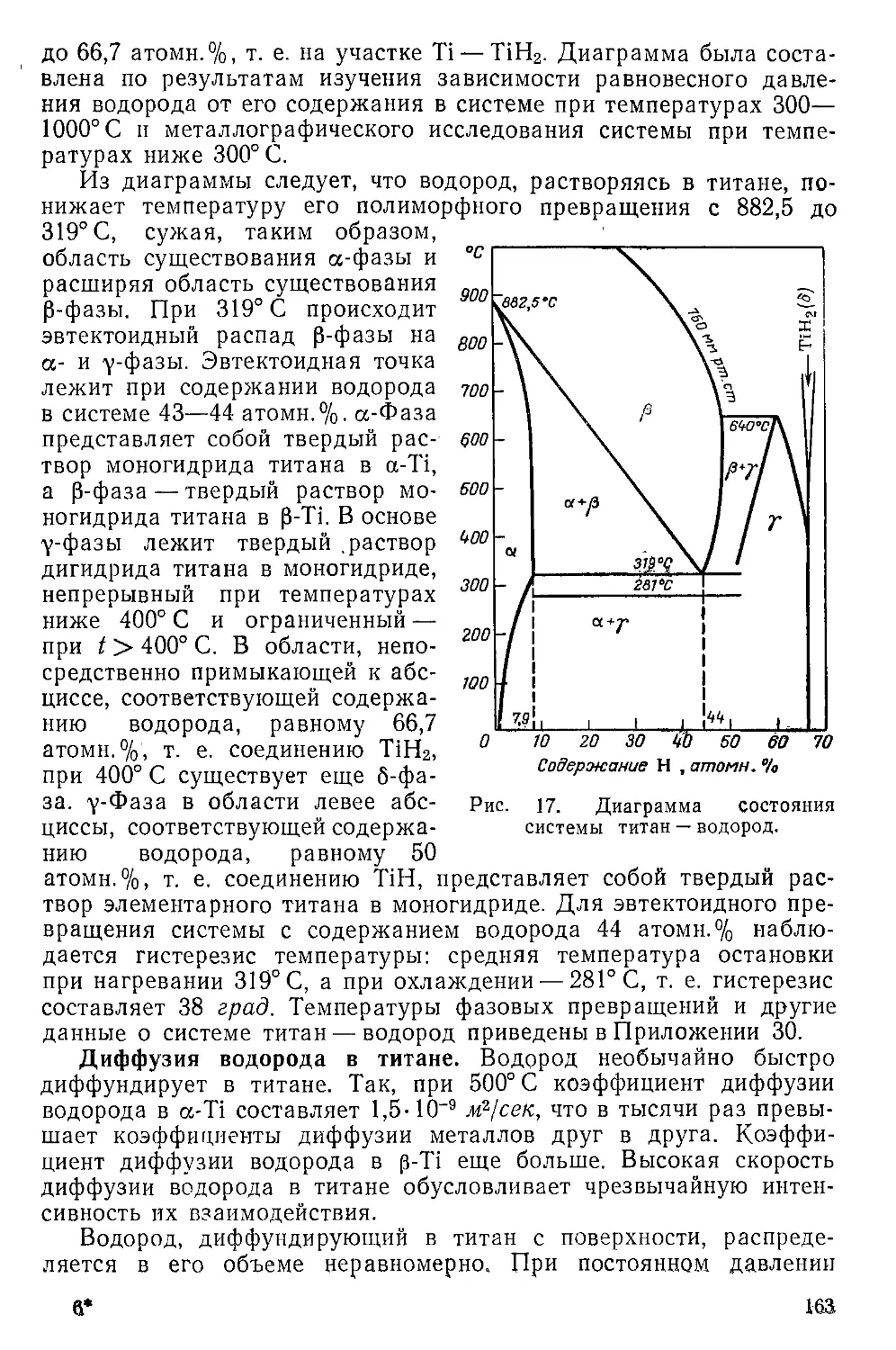
’?; _ Система титан — водород......................................
Система титан — дейтерий...................................
Моногидрид титана .........................................
, Дигидрид титана . ............................................
Дидейтерид титана .....................................
-;у , Другие гидриды титана........................................
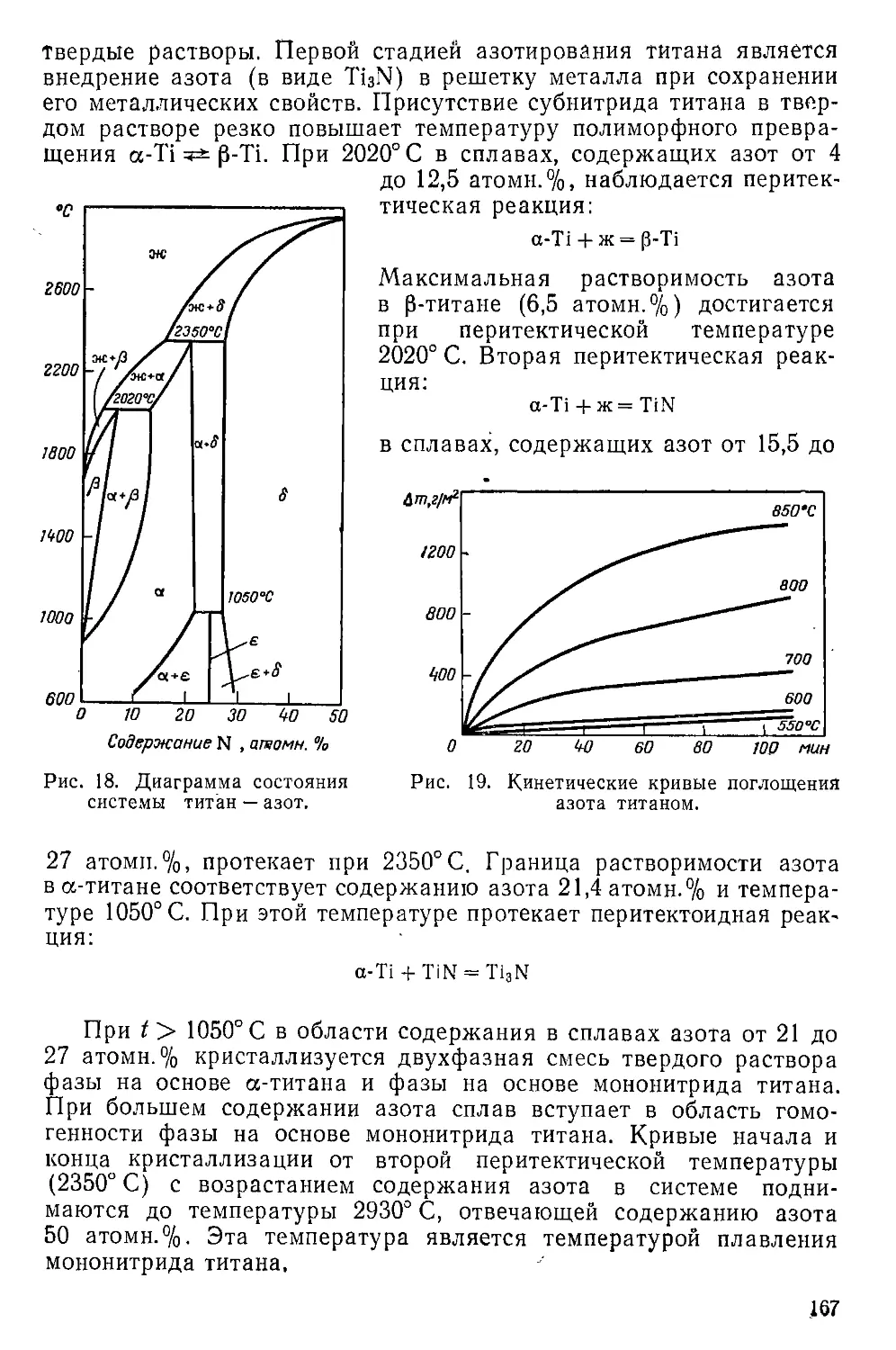
у . Нитриды титана .................................................
*;. Система титан — азот....................................... .
Мононитрид титана .................................... .
. ' Другие нитриды.................................................
,5 . Гидронитриды, нитридоксиды и галиднитриды титана ........
. Амиды титана ..............................................
. Имиды титана .................................................
Нитридоксид титана. .......................................
, Галиднитриды титана ..........................................
' 1 Фосфиды титана и их аналоги.....................................
. Система Ti — Р....................................
.' . Система Ti — As . ...........................................
Система Ti—Sb .............................................
" Система Ti—Bi..............................................
Карбиды титана...............................................
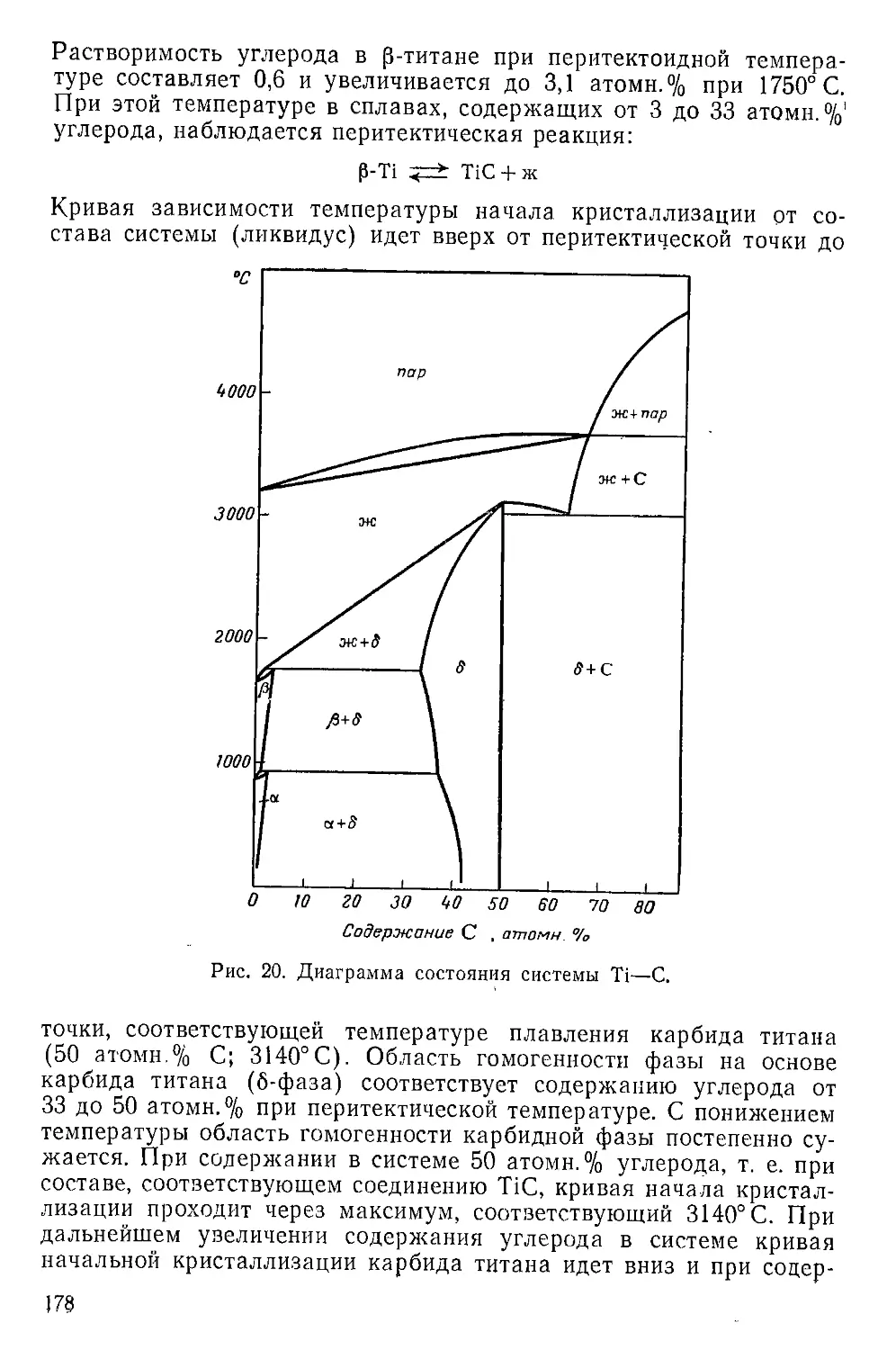
i. Система Ti—С........................................... .
Карбид титана .... ........................................
.. Смешанные карбиды титана.................................
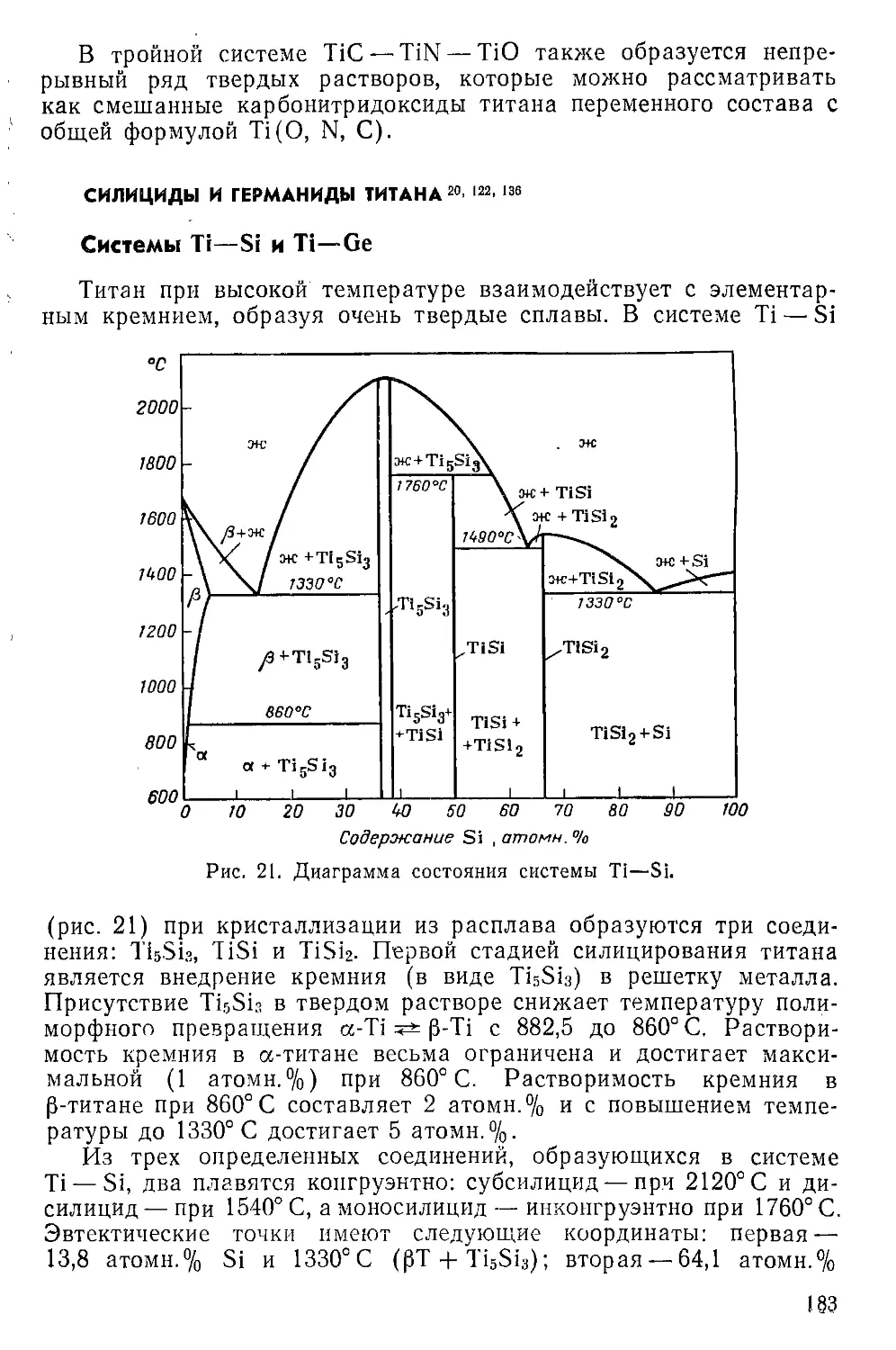
Силициды и германиды титана................................
Система Ti—Si и Ti—Ge......................................
Субсилицид и субгерманид титана .. ........................
Моносилицид и моногерманид титана..........................
Дисилицид и дигерманид титана . ...........................
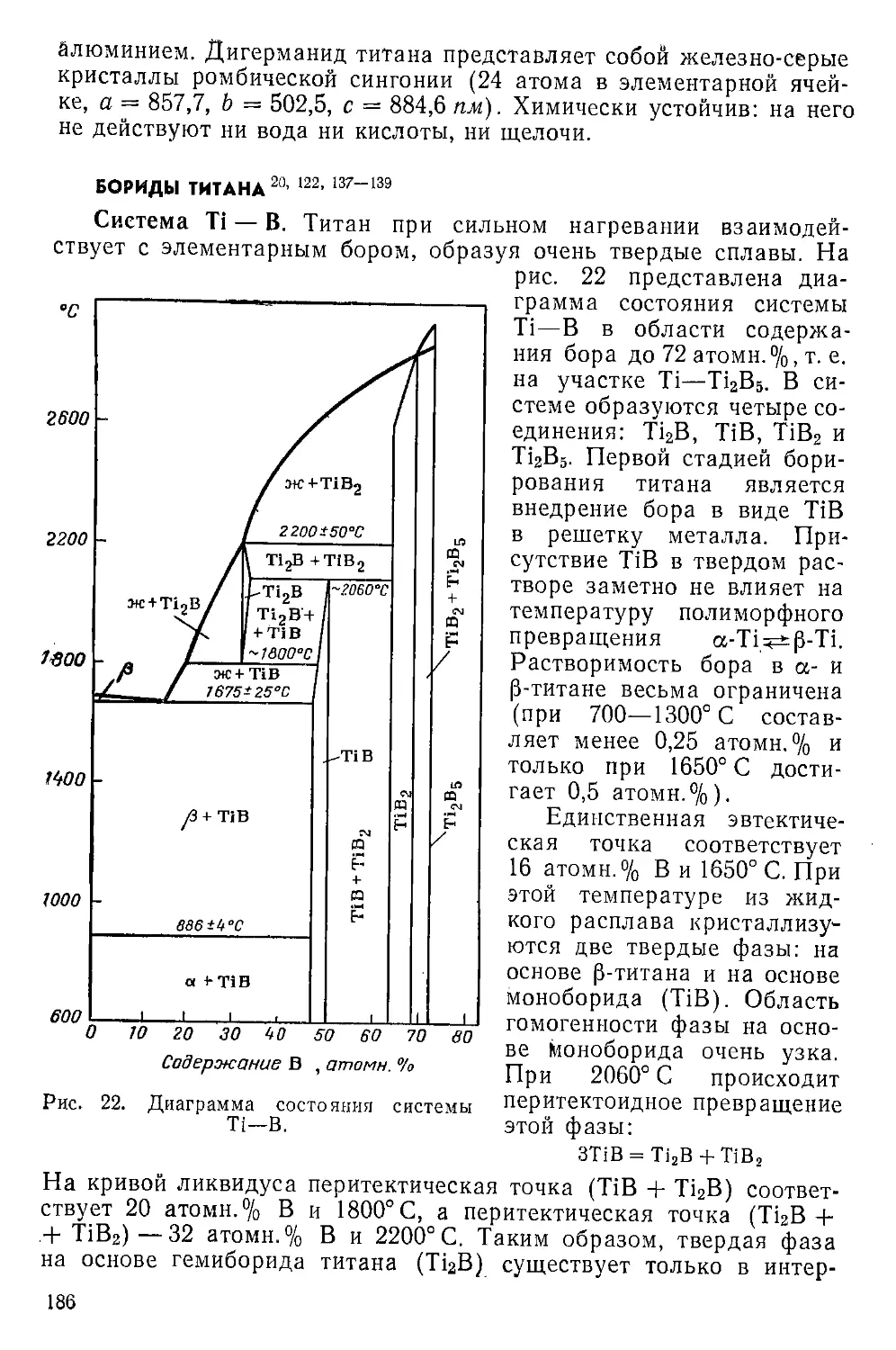
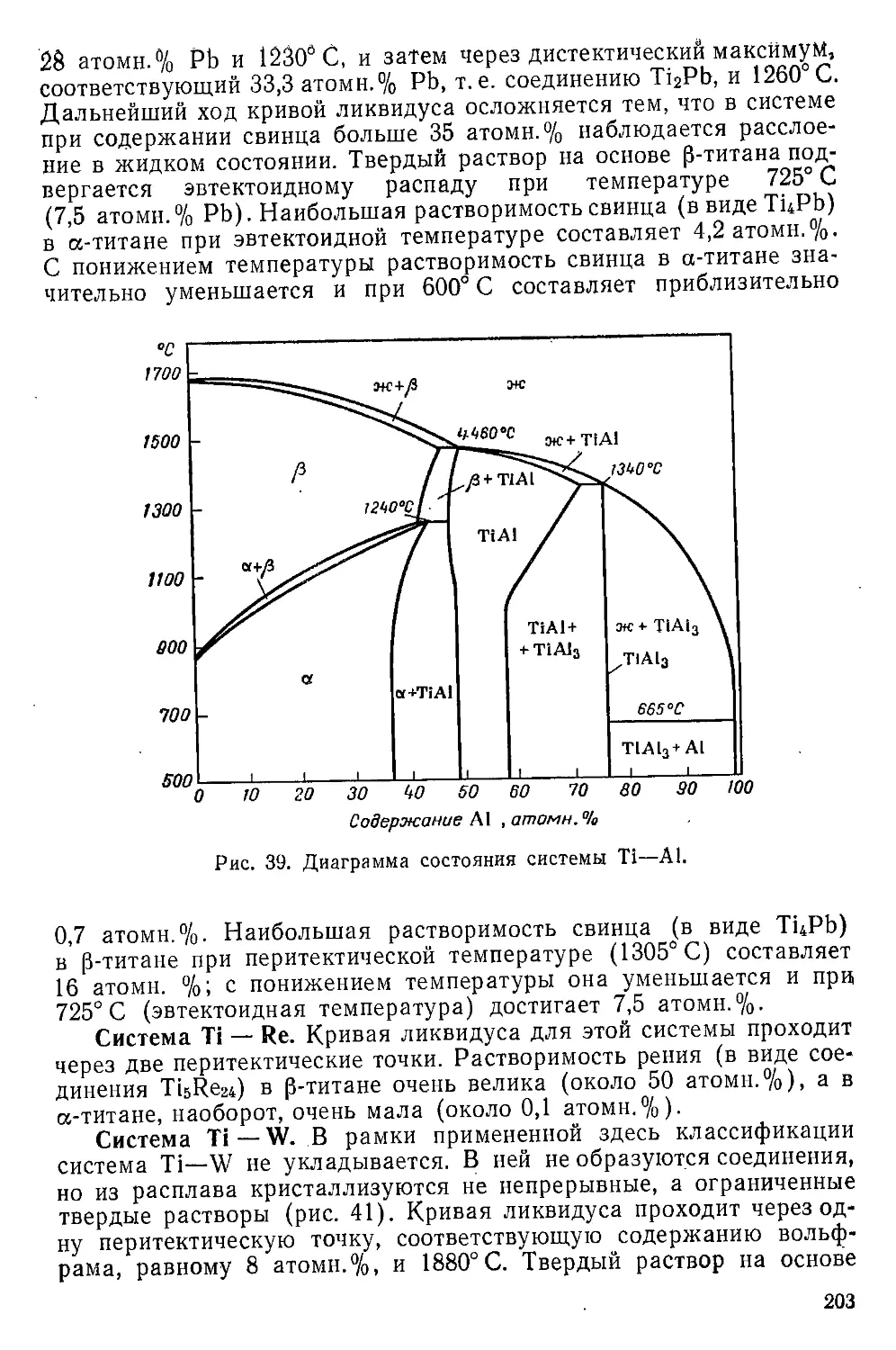
Бориды титана................................................
144
147
152
152
153
154
156
156
156
16Q
160
162
162
162
164
164
164
166
166
166
166
168
171
172
172
174
174
174
176
176
176
177
177
177
177
179
182
183
183
184
185
185
186
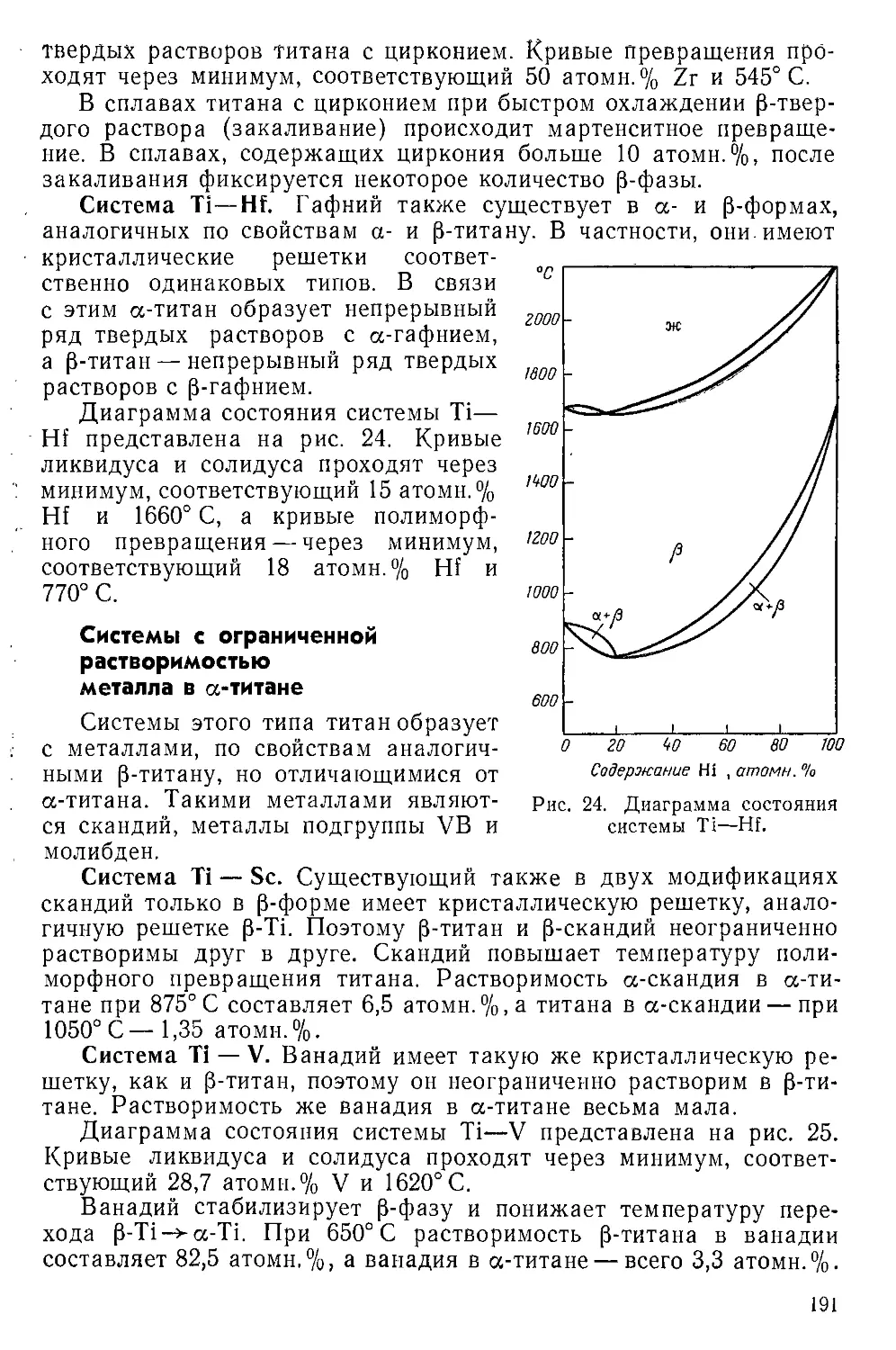
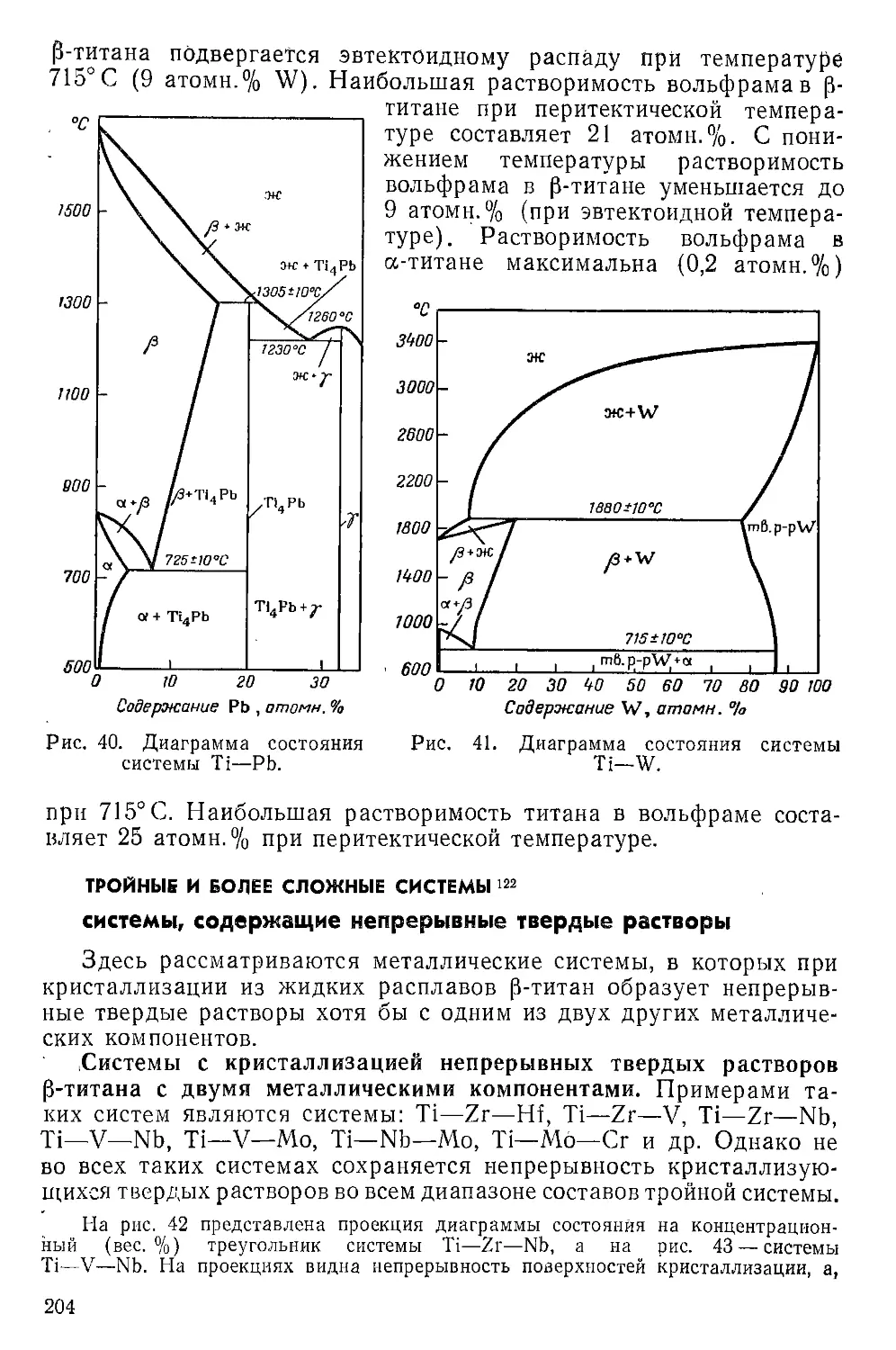
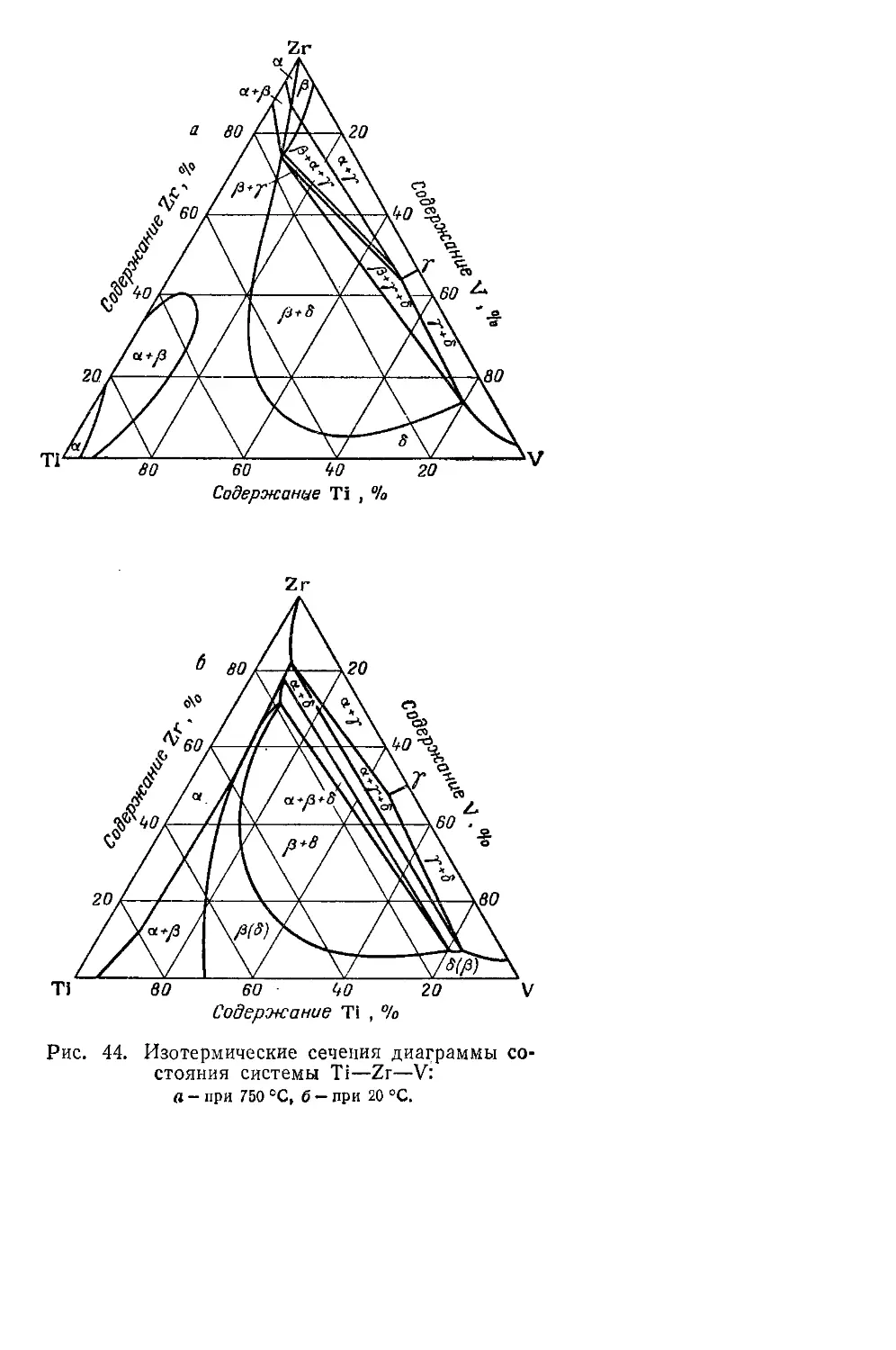
Г Л а в а VII. Металлические сплавы титана.............................189
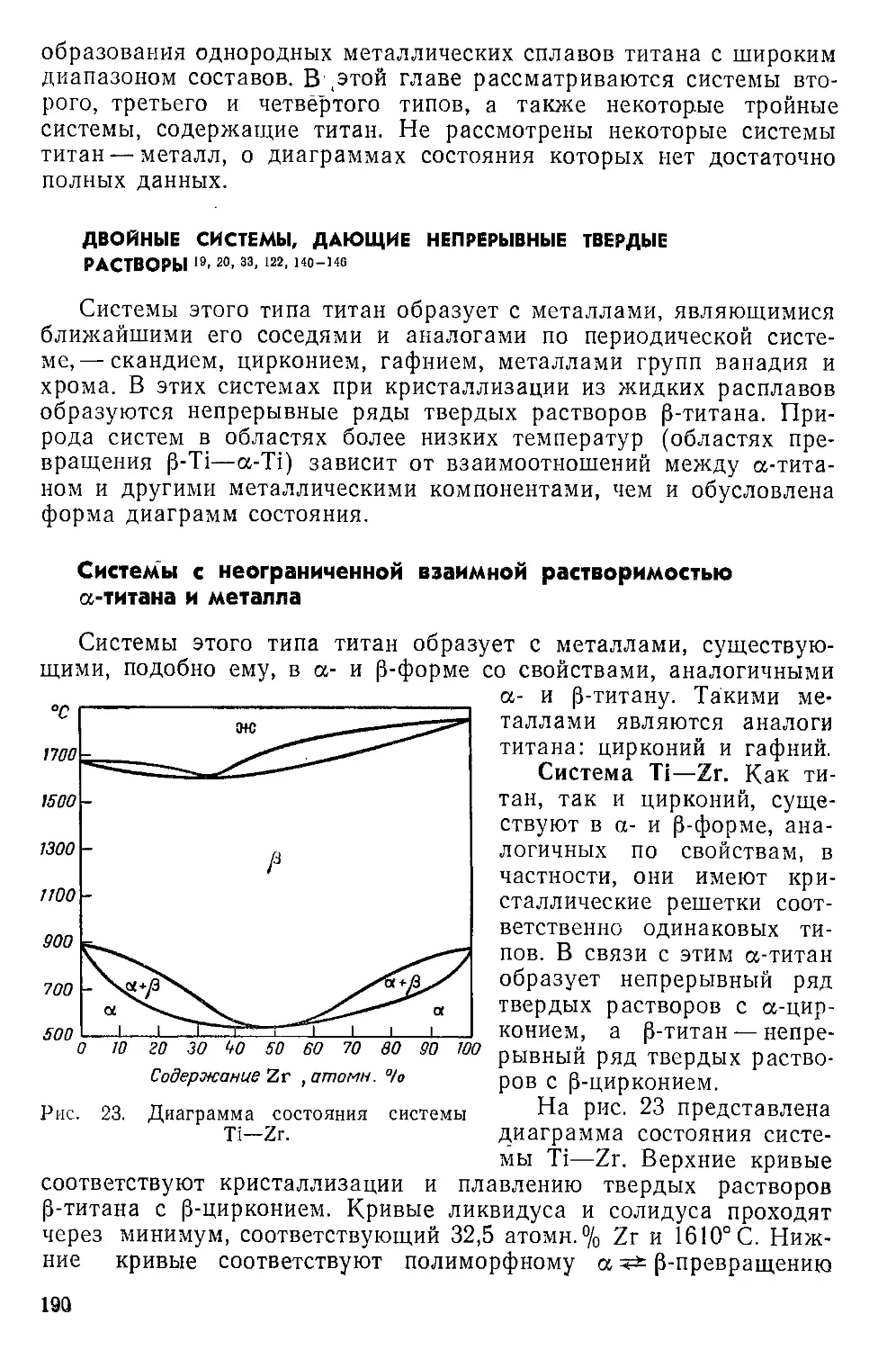
Двойные системы, дающие непрерывные твердые растворы . . . 190
Системы с неограниченной взаимной растворимостью а-титана и
металла...................................................... 190
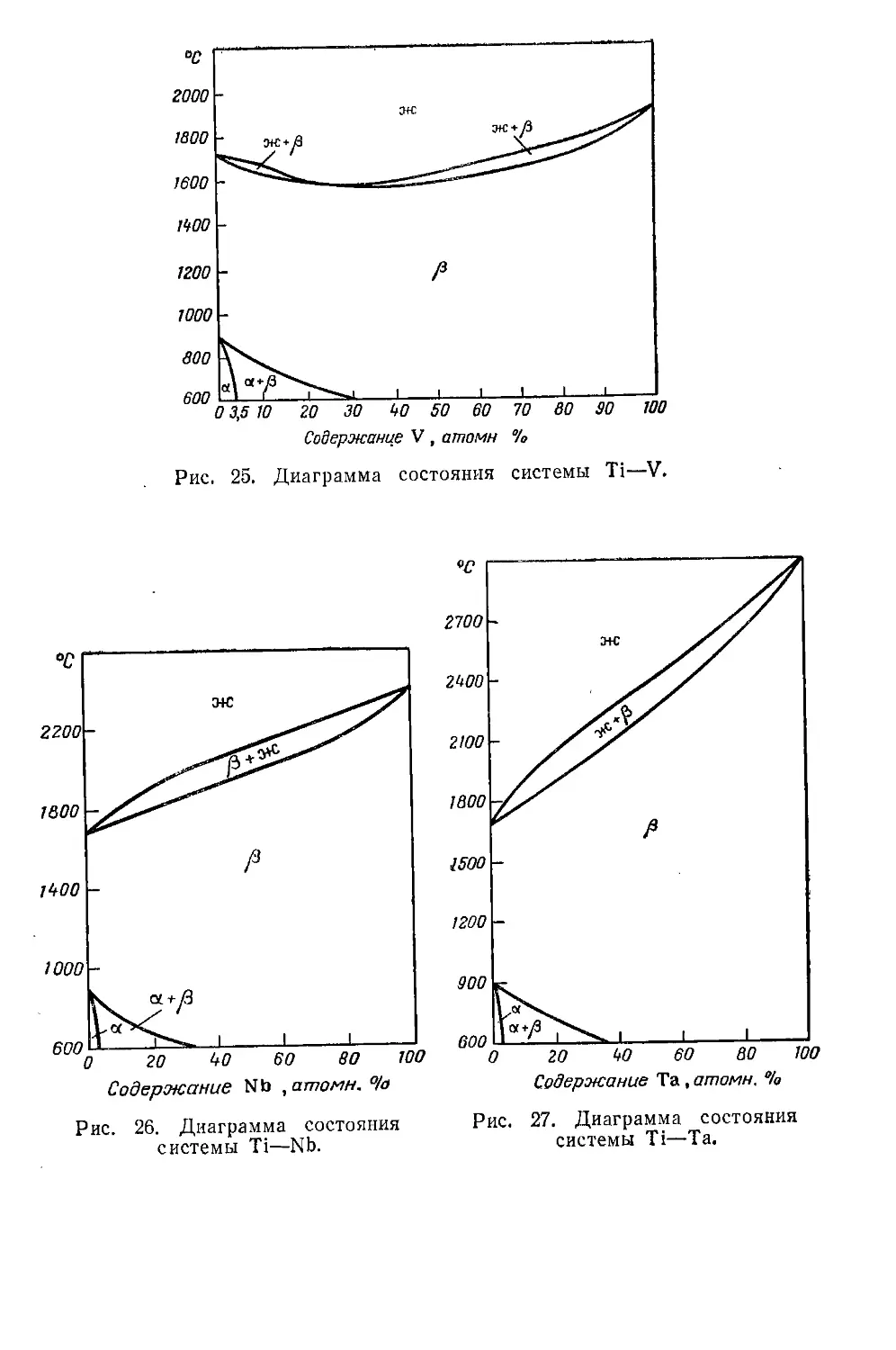
Система с ограниченной растворимостью металла в а-титане . . 191
Системы с образованием соединений с а-титаиом.................193
Двойные системы с образованием соединений, ограниченно раствори-
мых в р-титане................................................ 195
Системы эвтектического типа...................................195
Системы перитектического типа . .......................... 202
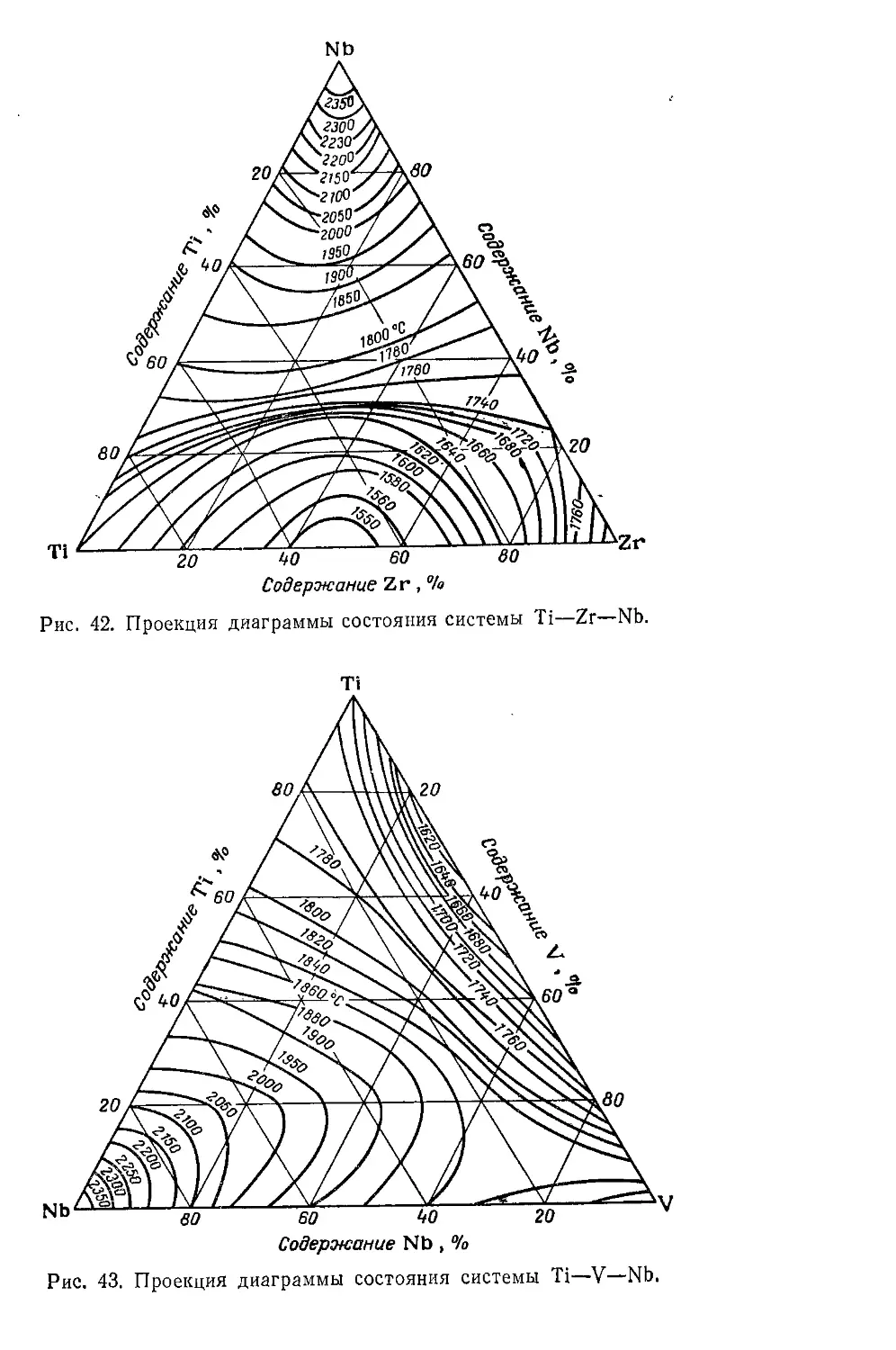
Тройные и более сложные системы..................................204
Системы, содержащие непрерывные - твердые растворы ...... 204
5
Системы, не содержащие непрерывных твердых растворов .... 210
Интерметаллические соединения..................................210
Двойные интерметаллиды.......................................210
Тройные интерметаллиды.......................................215
Технические сплавы титана.................................... 216
Титано-алюминиевые сплавы....................................216
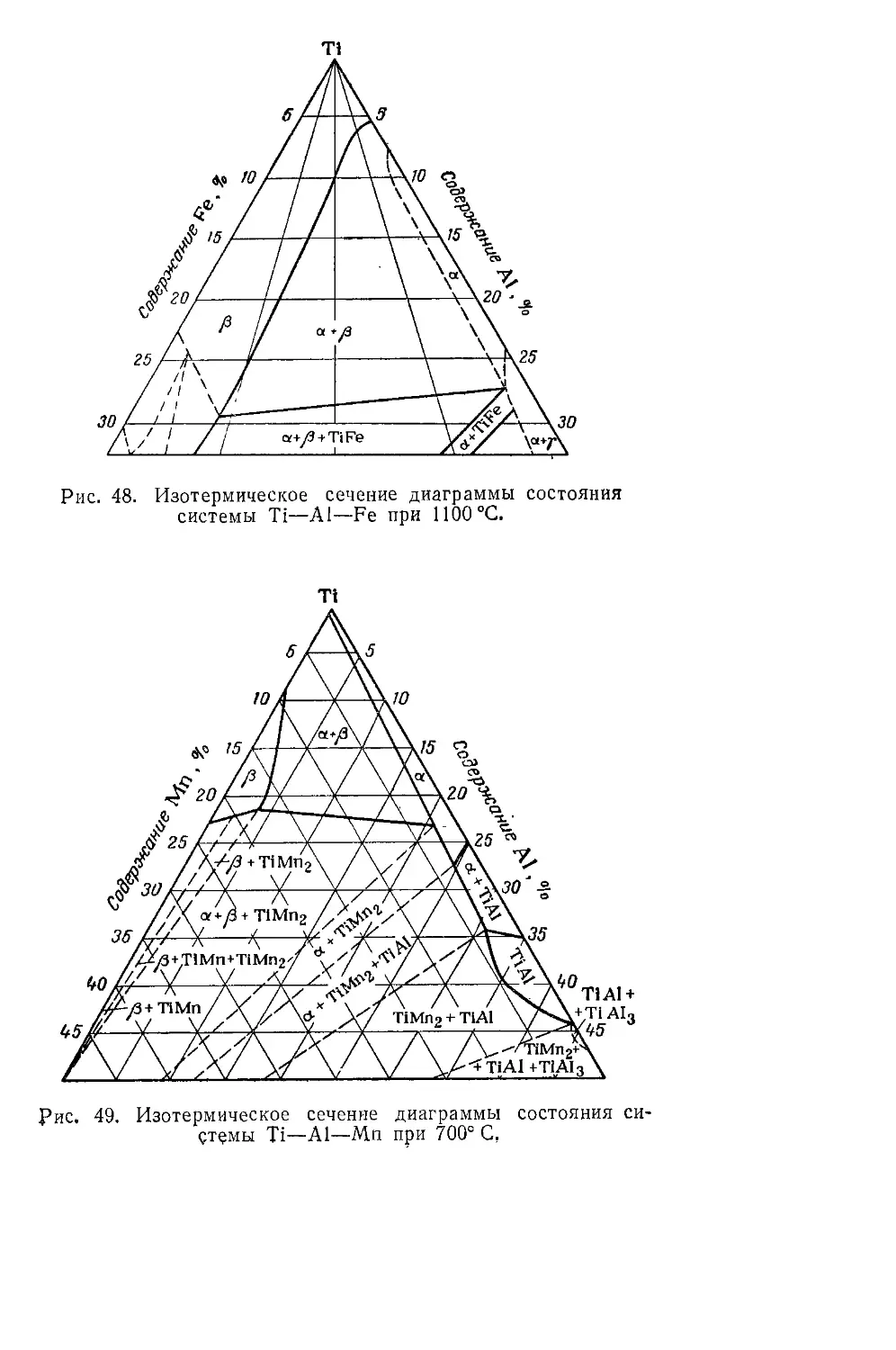
Титано-железные сплавы.......................................217
Сплавы титана с другими металлами............................219
Глава VIII. Титановые кислоты, титанаты..................... . , , , 222
< Оксотитановые кислоты..........................................222
Метатитановая кислота...................................... 222
- Ортотитановая кислота..........................................224
; Оксотитанаты..................................................2.35
ОксоТитанаты щелочных металлов . ............................225
Оксотитанаты щелочноземельных металлов.......................230
Оксотитанаты металлов III группы.............................238
Оксотитанаты переходных металлов.............................240
Оксотитанаты бериллия, свинца и висмута......................245
Перекисные соединения титана.................................. 247
Пероксотитановые кислоты.....................................247
- „Пероксотитаиаты........................................... 248
Галотитановые кислоты. Галотитанаты............................250
Фторотитанаты ...............................................251
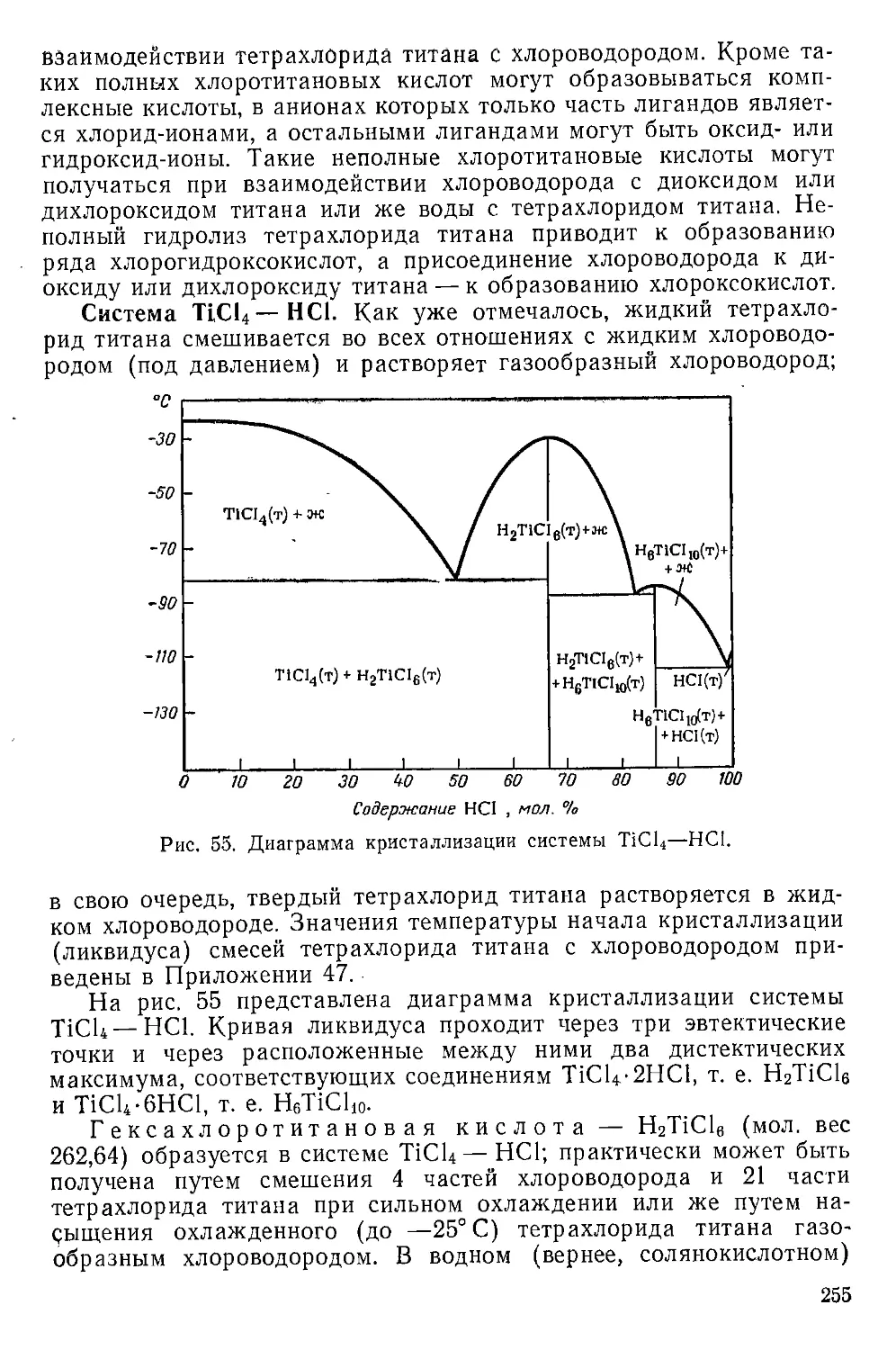
Хлоротитановые кислоты.......................................254
Хлоротитанаты................................................257
Бромо- и иодотитанаты........................................259
Галоксо- и галопероксотитанаты...............................261
Тнотитановые кислоты, тиотитанаты. Нитридотитанаты.............264
Тиотитановые кислоты ....................................... 264
Пертиосоединения титана......................................265
Тиотитанаты металлов.........................................266
Нитридо-, имидо- и амидотитанаты.............................266
Глава IX. Ацидосоединения четырехвалентного титана....................268
Галатосоединения .............................................. 268
Перхлоратосоединеиия ....................................... 268
}4одатосоединения . •........................................269
Периодатосоединеиия..........................................271
Сульфатосоединения..............................................271
Сульфаты титана (IV).........................................271
Селенитосоединения титана .................................. 274
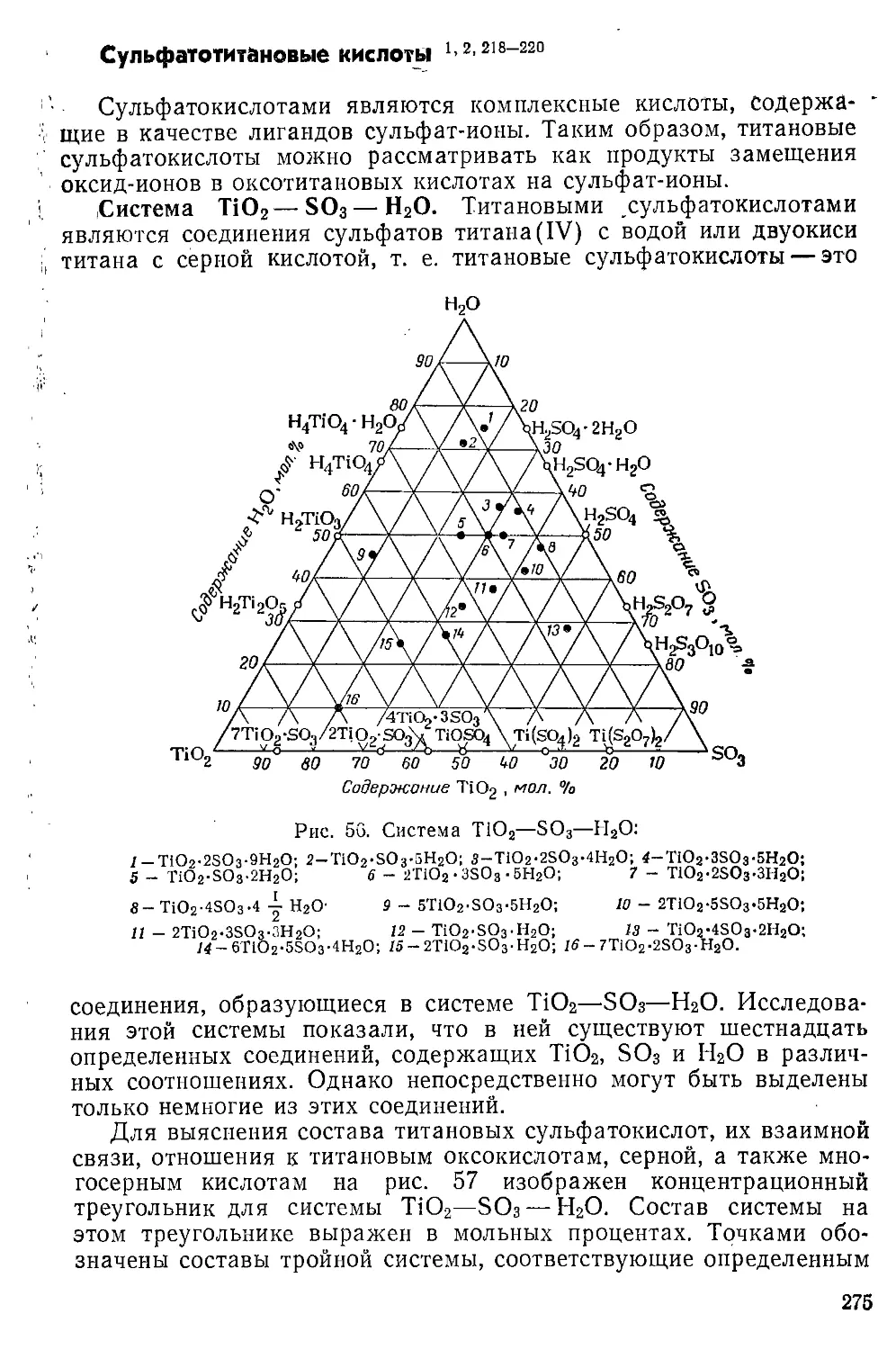
Сульфатотитановые кислоты....................................275
Селенато- и селеиитотитановые кислоты........................278
Сульфатотитанаты.............................................278
Нитрато-, фосфато- и арсенатосоединения н их аналоги............284
Нитратосоединения............................................284
Фосфатосоединеиия............................................286
Арсенатосоединения . . . ....................................289
Стибатосоединения .......................................... 289
Висмутитосоединения..........................................289
Карбацидосоедииения ........................................... 290
кКарбонатосоединения................................; . . . . 290
Роданосоединения.............................................291
Формиато-, ацетате- и пропионатосоединения...................292
Оксалатосоединения ..........................................294
6
(Тартратососдипения . ..................................... 297
1Трочие карбацидосоедииения ................................ . 298
Борато-, силикато-, германато- и металлатосоедииения...........299
Боратосоединения .............................................299
Силикато- и германатосоединения...............................300
Металлатосоедииения...........................................302
Глава X. Органические соединения титана................................306
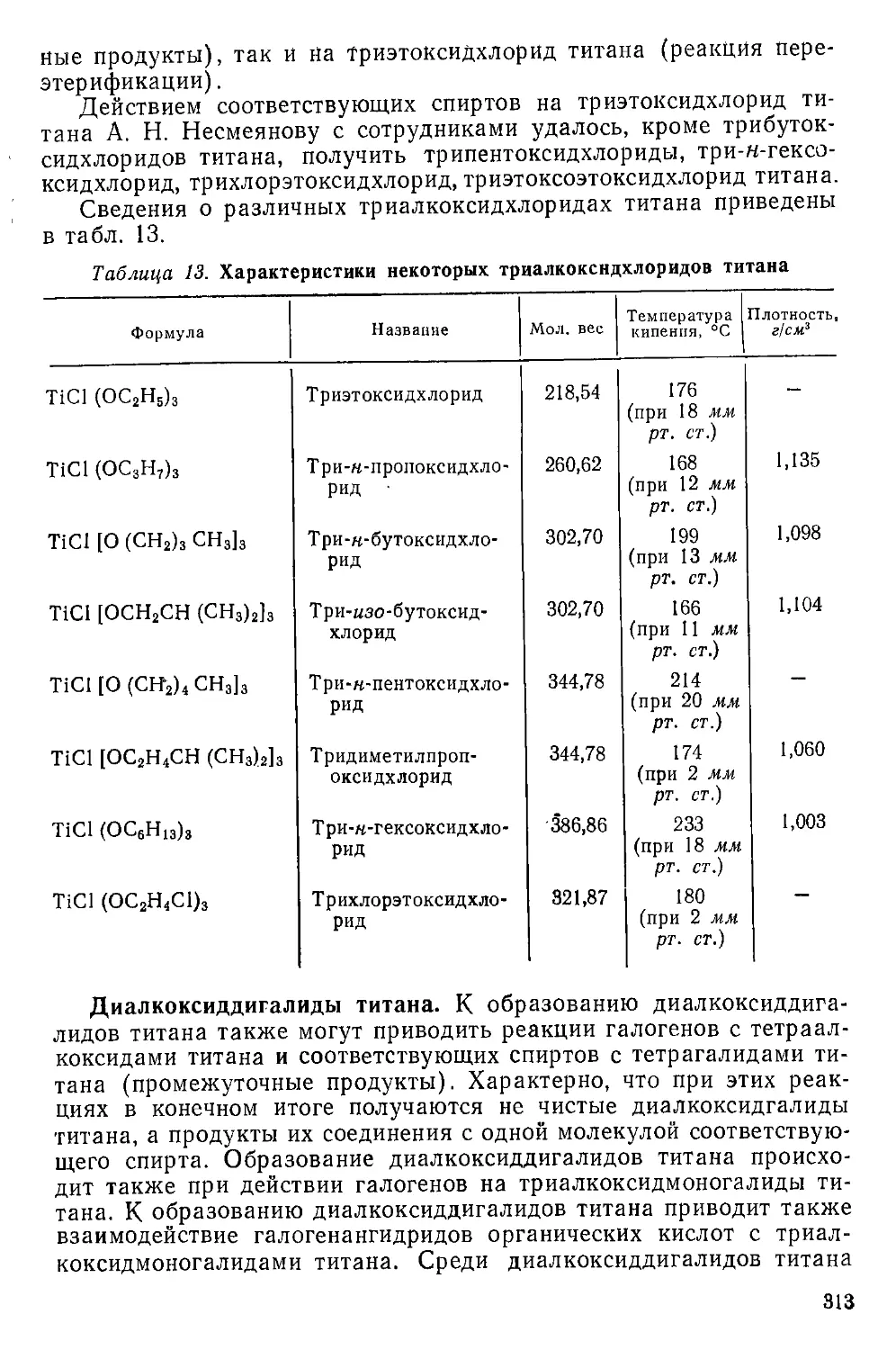
Алкоксиды и ароксиды титана...................................306
Алкоксиды титана, или алкилтитанаты.........................306
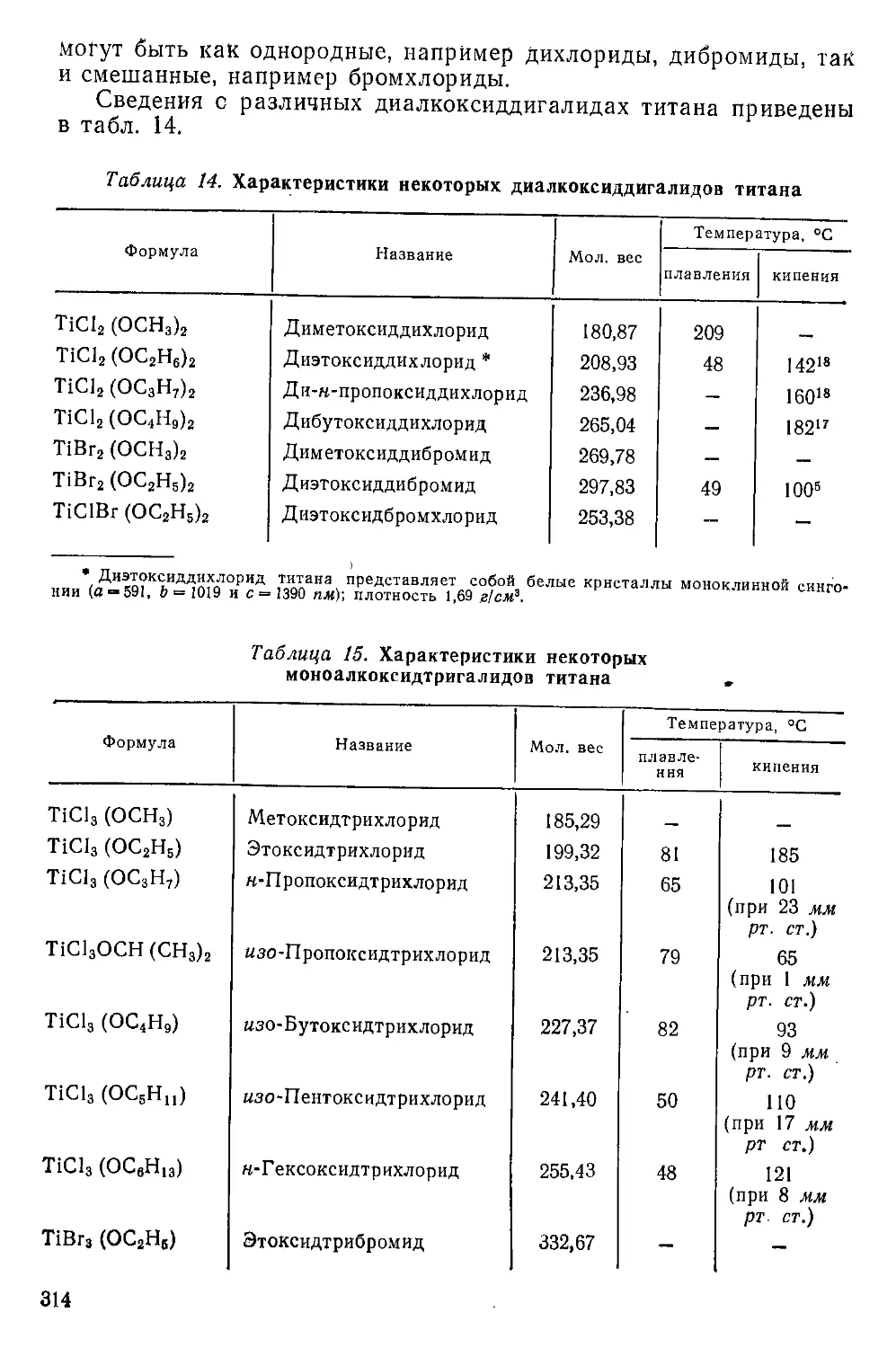
Алкоксидгалиды титана.......................................311
Ароксиды и ароксидхлориды титана ...........................315
Титанорганические соединения..................................317
Титаналкилы.................................................317
Титанциклоалкадиенилы.......................................321
Титанарилы . .............................................324
I/ Комплексы с органическими лигандами..............................327
Комплексы с углеводородами и их галогенопроизводными .... 327
^Комплексы с кислородсодержащими соединениями................328
"Комплексы с азотсодержащими соединениями....................330
Глава XI. Титан в природе
. . ................ 333
Геохимия титана ...............................................333
Распространенность титана в земной коре.....................333
Геохимическая история титана .............................. 335
Титан в космических телах...................................336
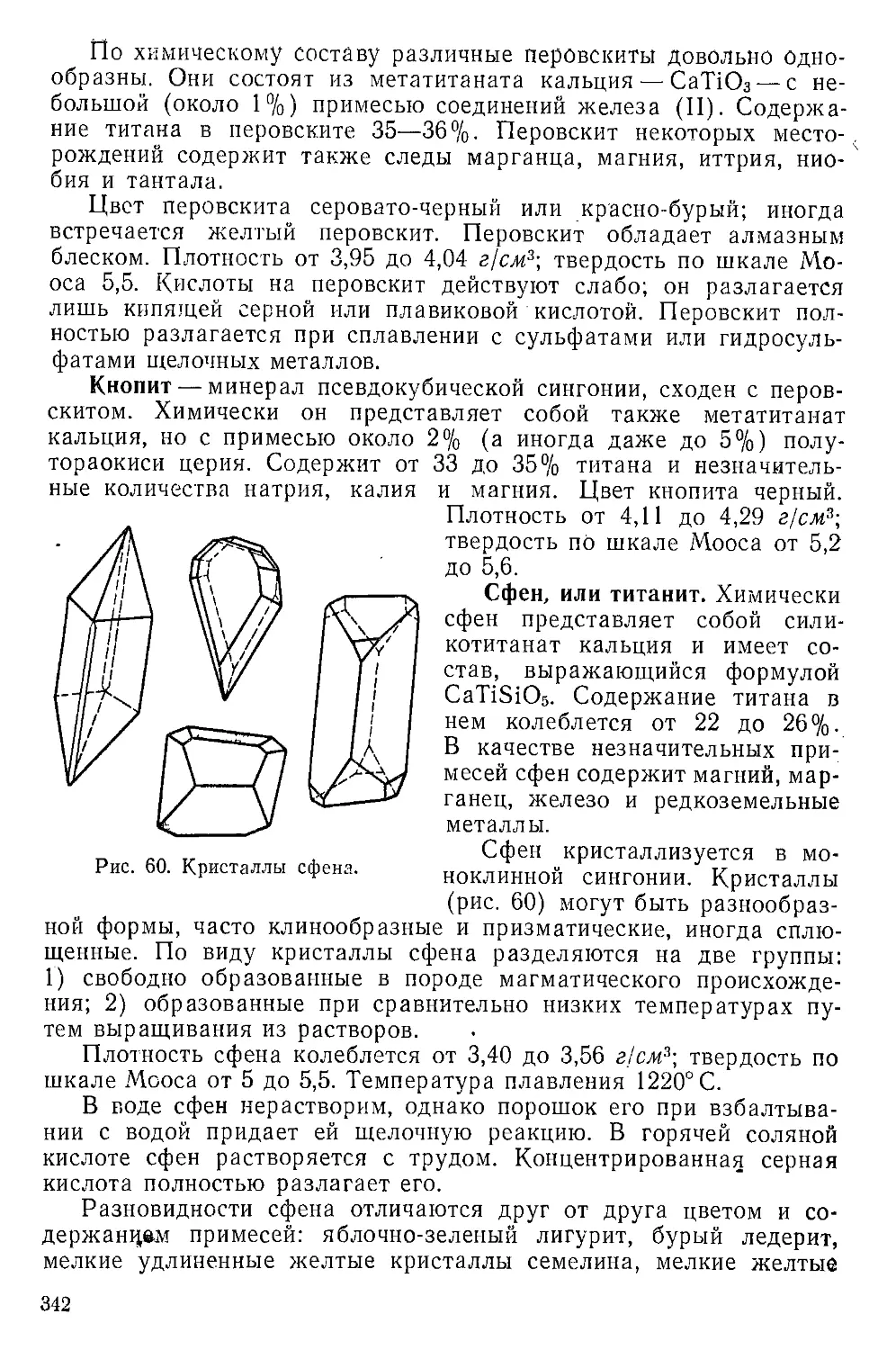
Титановые минералы............................................338
Природная двуокись титана..................................338
Природные титанаты железа.................................340
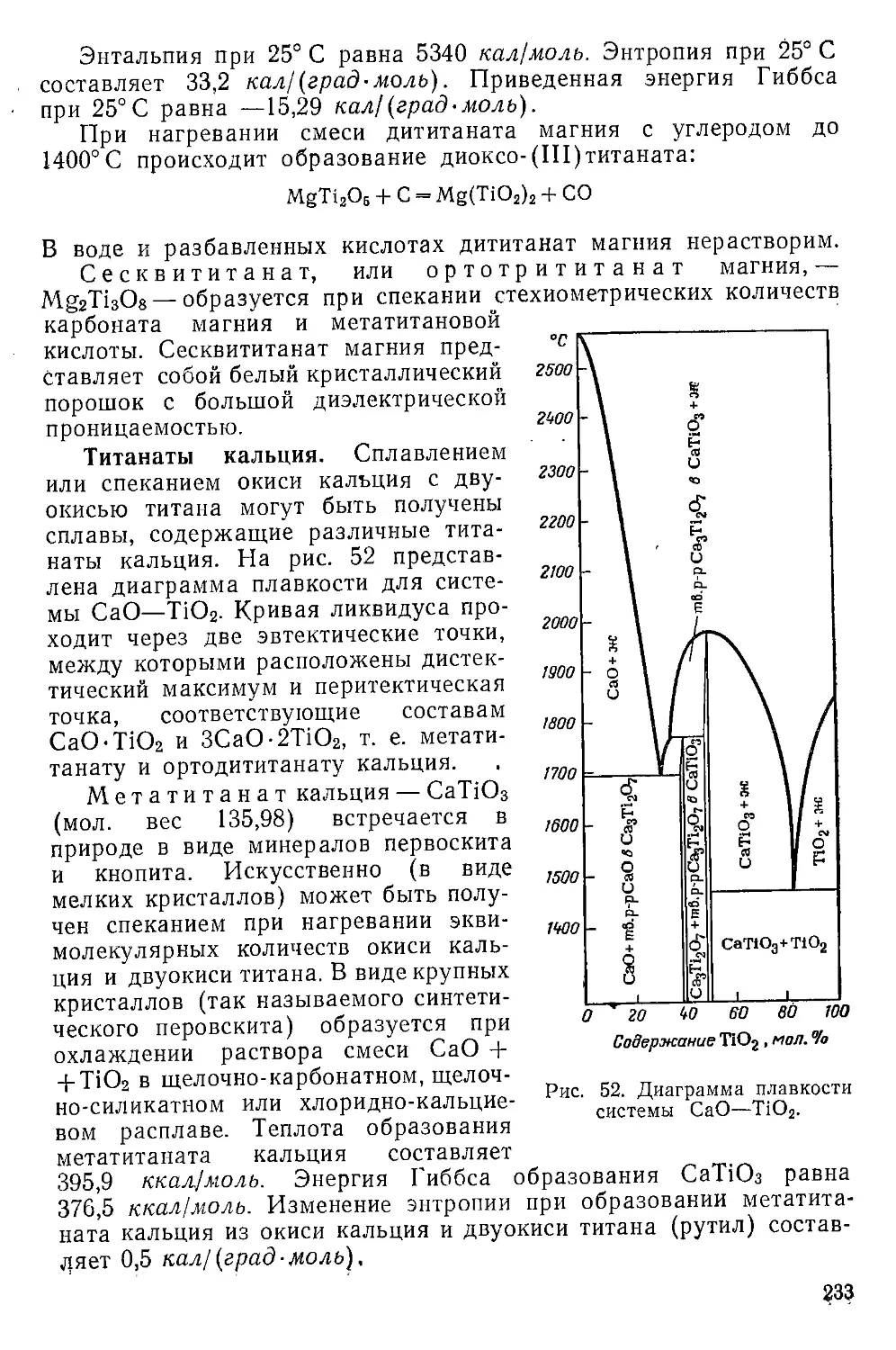
Природные титанаты кальция.................................341
Прочие природные титанаты..................................343
Титановые руды и их месторождение.............................345
Типы месторождений титановых руд...........................345
Оксиднотитановые руды.......................................345
Титано-железные руды........................................346
Силикотитанатные руды.......................................347
Глава XII. Производство титана и его соединений ......... 349
Извлечение титана из руд.........................................349
Обогащение титанового сырья...................................349
Восстановительная плавка железо-титановых руд.................351
Хлорирование титанового сырья................................ 355
Сернокислотная переработка титановых руд .................... 360
Производство титана термическим восстановлением..................363
Восстановление тетрахлорида титана............................364
Восстановление других галидов титана ........................ 366
Восстановление двуокиси титана .............................. 368
Электрометаллургия титана . .................................... 369
Основы процесса электролитического получения титана...........3~9
Электролиз оксидов титана ................................... 370
Электролиз галидов титана .... .............................. 371
Электролитическое рафинирование титана........................373
Металлургия ковкого титана и его сплавов.........................375
7
Плавка титановой губки......................................375
Переработка титанового порошка..............................377
Технология обработки титана и его сплавов ................ 378
Титановые белила ..............................................331
Производство титанового•пигмента из сульфатов титана .... 381
Производство титанового пигмента из тетрахлорида титана . . . 384
Свойства и применение титановых белил.......................385
Глава XIII. Аналитическая химия титана............. ....... 389
Качественное определение титана ............................ 389
Групповые реакции на титан..................................389
Специальные реакции на титан(IV)............................390
Реакции на титан (III) и титан (II).........................392
Количественное определение титана . . .................... 393
Весовые методы ............................................ 393
Объемные методы............................................ 397
Колориметрические методы....................................398
Полярографические методы ...................................402
Анализ титановых соединений, сплавов и руд...................403
Технический анализ соединений титана .................... 403
Анализ титановых сплавов ................................... 405 -
Анализ титансодержащих руд и минералов.................... 411
Применение соединений титана в аналитической химии.............414
Использование восстановительной способности соединений тита-
на(П) и титана(Ш) ..........................................414
Использование образования перекисных соединений титана в анализе 416
Использование соединений титана в анализе органических веществ 416
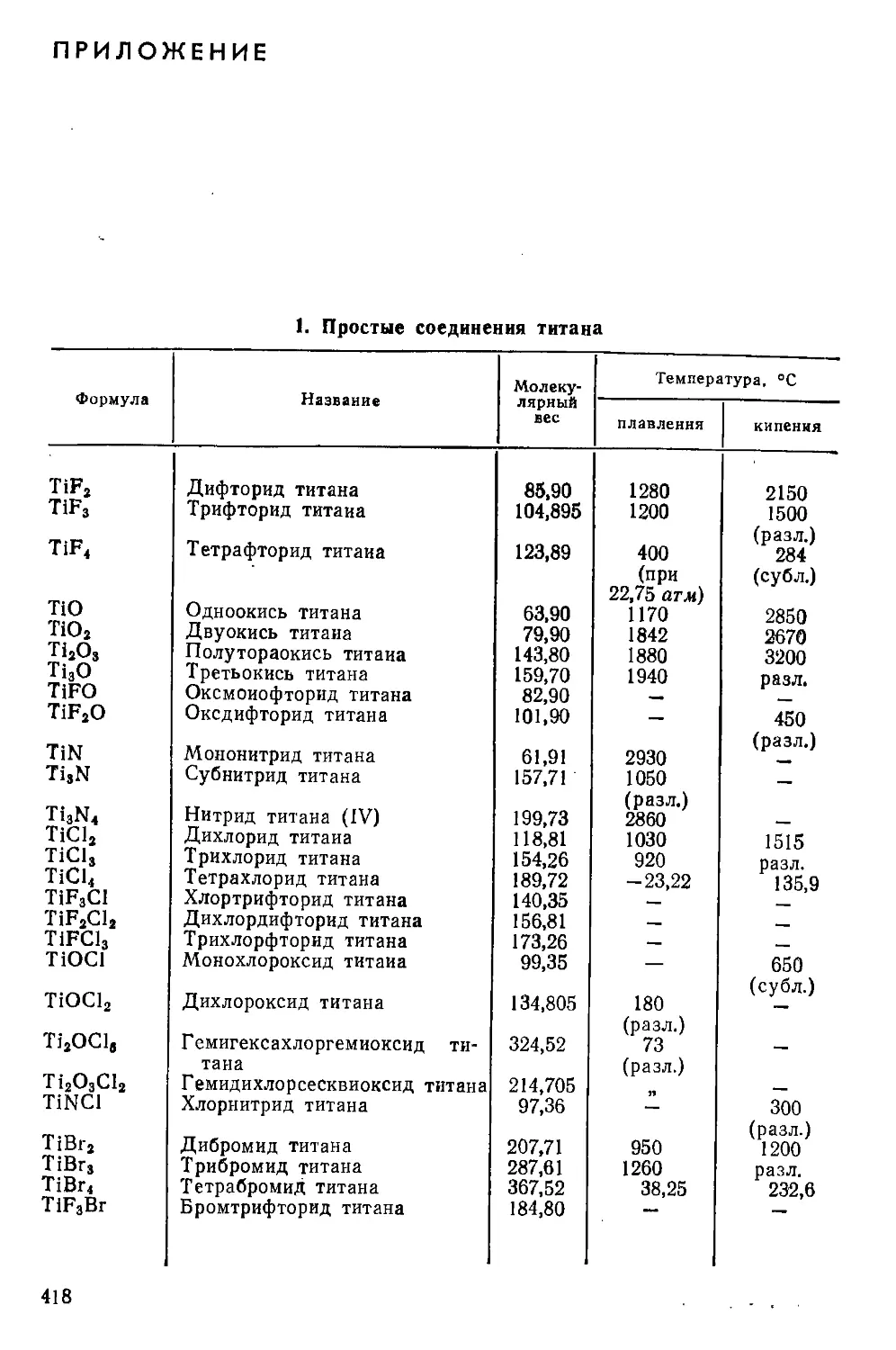
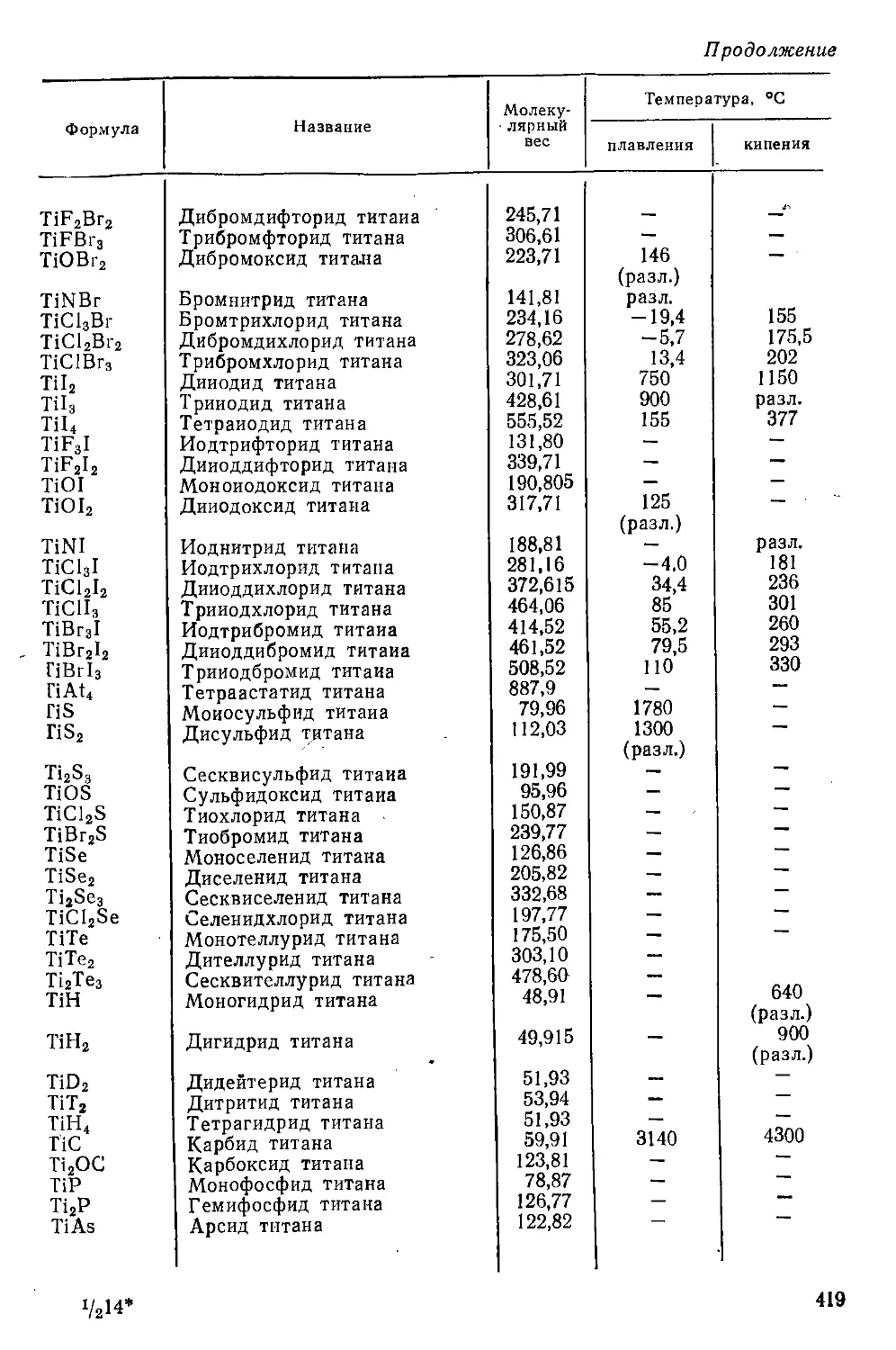
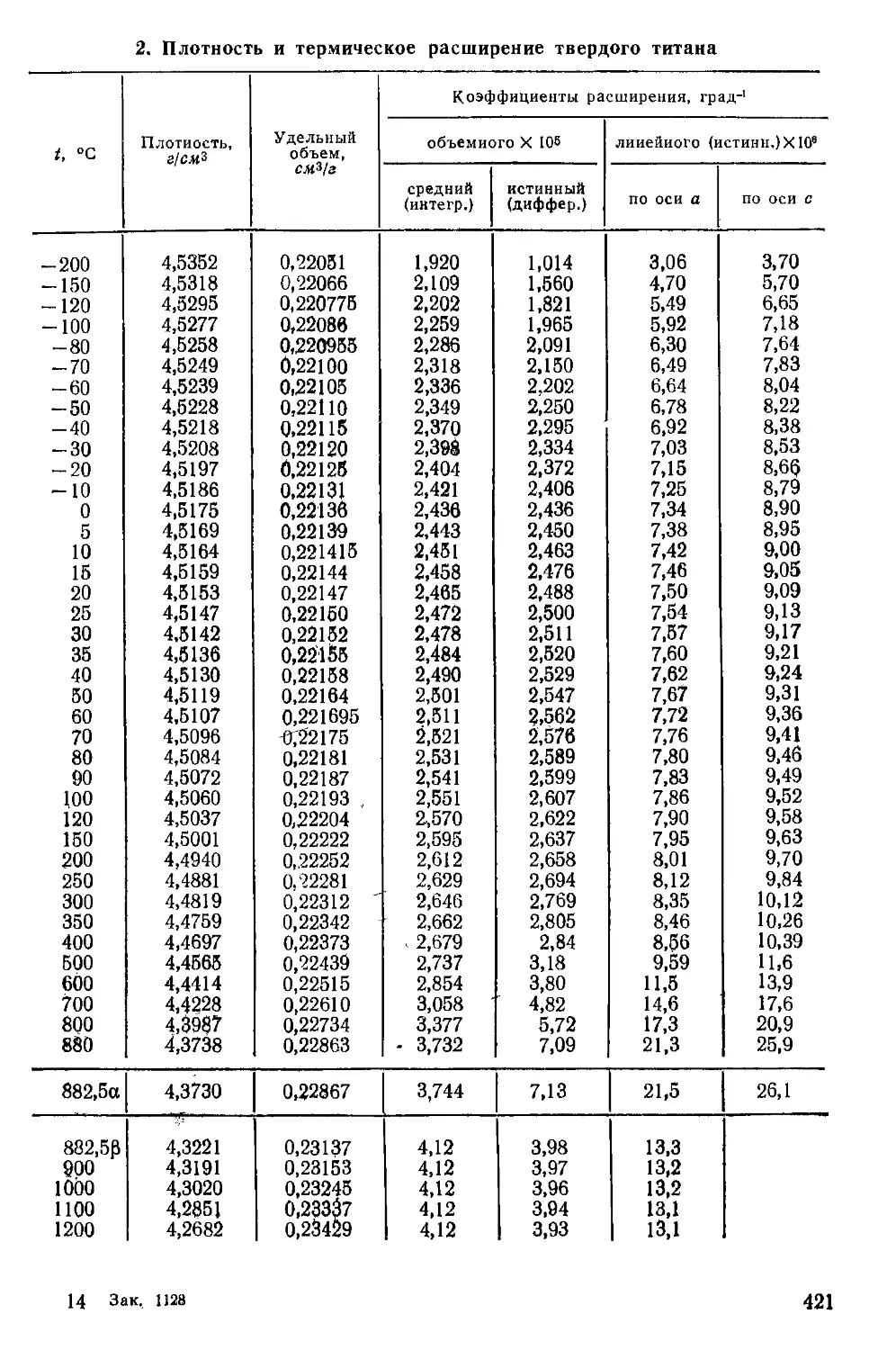
Приложение . . ................................................... 418
Литература..........................................................448
Предметный указатель
458
'ВВЕДЕНИЕ
£Титан является одним из самых распространенных в земной
KOpfe, и притом повсеместно, химических элементов. Как показало
первое знакомство с Луной, на ее поверхности титан распростра-
нен, по-видимому, еще больше, чем на поверхности Земли. Однако
еще не так давно титан называли редким элементом. Это объяс-
няется тем, что значительные скопления его встречаются довольно
редко. К тому же отделение титана от сопутствующих ему в при-
родных минералах химических элементов, главным образом от же-
леза, связано со значительными трудностями. Именно поэтому ти-
тан и его соединения долгое время не находили широкого примене-
ния. В частности, титан не удавалось использовать в металлургии.
Свойства титана, а также его соединений к концу первой полови-
ны XX века были изучены сравнительно мало. Однако те сведения
об элементарном титане, которые все же имелись, показали, что
ОН может представлять большой интерес для машиностроения.
Впервые титан был найден в виде двуокиси в 1789 г. Уильямом
Грегором, священником прихода Менакэн в Корнуэльсе (Юго-За-
падная Англия). У. Грегор нашел в изобилии черный, по внеш-
нему виду очень похожий на порох, магнитный песок, из которого
ОН выделил оксид железа и белый оксид неизвестного металла,
О чем и сообщил в 1791 г. на страницах французского и немецкого
журналов. Этот черный песок (корнуэльский магнитный железняк)
был назван менакэнитом, а выделенный из него белый оксид
менахином. Однако это открытие не привлекло к себе вни-
мания.
В 1795 г. немецкий химик М. X. Клапрот, исследуя так назы-
ваемую «красную землю» из Боиника (Венгрия), или, иначе, вен-
герский рутил, выделил из него новый оксид, который назвал ти-
тановой землей в честь героя древнегреческой мифологии Ти-
тана. Через два года Клапрот установил, что окись, полученная им
из венгерского рутила, и окись, полученная Грегором из менакэ-
нита, — одно и то же вещество, а именно оксид металла, который
Клапрот и назвал титаном. Вскоре идентичность указанных
9
оксидов была подтверждена исследованиями В. А. Лампадиуса,
Т. Е. Ловица и др^
(ТГосле открытия Клапрота соединения титана были обнаружены
и во многих других минералах. В 1805 г. титан найден в анатазе
и доказано, что рутил и аната^ являются минералогическими раз-
новидностями двуокиси титана.| Позднее (1822—1824 гг.) X. Розе
получил титановую кислоту. В. Волластон обнаружил в шлаке до-
менных печей карбонитрид титана, но по внешнему виду принял
его за кристаллический элементарный титан. Лишь в 1849 г. Ф. Ве-
лер доказал истинный состав этого соединения («титана» Волла-
стона), сжигая его в струе хлора. ...
"Некоторое время считали, что элементарный титан (хотя и
не Очень чистый) впервые облучил И. Берцелиус в 1825 г восста-
новлением фторотитаната калия металлическим натрием.[Однако
сравнивая известные Аеперь свойства элементарного .титана со
свойствами «титаПа» Берцелиуса (например, не растворявшегося
в плавиковой кислоте), можно заключить, что вещество, получен-
ное Берцелиусом, не содержало значительных количеств элемен-
тарного титана.
После Берцелиуса было сделано еще много попыток выделить
элементарный титан. В частности, Д. К. Кириллов в 1875 г. восста-
новлением тетрахлорида титана натрием получил сравнительно
чистый титан, а в 1885 г. А. Муассан восстановлением двуокиси
титана углеродом в дуговой печи и двукратным рафинированием
продукта получил элементарный титан с примесью лишь 2% угле-
рода. Л. Нильсон и О. Петерсон в 1887 г., восстанавливая тетра-
хлорид титана металлическим натрием в стальной герметически
закрытой бомбе, получили вещество, содержащее около 95% эле-
ментарного титана. Только в 1910 г. М. Хантер, усовершенствовав
способ Нильсона и Петерсона, впервые получил образец, ковкий
в горячем состоянии, но хрупкий на холоду, содержащий 99,5%
элементарного титана. Еще более чистый титан получили в 1925 г.
А. Ван-Аркель и И. де Бур, разлагая тетраиодид при высокой тем-
пературе.
Из соединений титана долгое время более или менее широкое
распространение и практическое применение имела лишь двуокись
титана, которая используется главным образом для приготовления
белой минеральной краски — титановых белил — и отчасти в
керамической промышленности для производства огнеупоров, вы-
сококачественных цементов, абразивов, глазурей, эмалей и т. п.
Основными производителями титана и его соединений долгое время
являлись Соединенные Штаты Америки и Норвегия.
Некоторые особенности титанового сырья и свойства элемен-
тарного титана существенно осложняли процессы выделения ти-
тана из руд. В связи с этим освоение промышленного производ-
ства металлического титана и его сплавов происходило медленно.
Однако в конце первой половины XX века бр1л разработан способ
промышленного производства металлического титана с исподьзо-
10
ййнием в качестве полупродукта тетрахлорида; при этом многие
затруднения были преодолены. В дальнейшем в основу металлур-
гии титана и был положен метод металлотермического восстанов-
ления тетрахлорида. Поскольку это соединение приобрело большое
Практическое значение как исходный материал для промышленного
производства металлического титана, а также многих титансодер-
ЖВЩих материалов, которые находят из года в год все более ши-
рокое применение, интерес к нему сильно возрос. В последние два
десятилетия тетрахлорид титана подвергся глубокому и всесторон-
нему исследованию, хотя следует отметить, что еще в первой по-
ловине XX века он уже был изучен лучше других соединений ти-
тана.
Со времени первой мировой войны тетрахлорид титана стал
известен как боевое дымообразующее вещество. Он известен также
как одно из самых реакционноспособных неорганических веществ,
благодаря чему он используется для получения многочисленных
продуктов замещения, присоединения и т. д., в частности различ-
ных органических соединений титана, причем все эти вещества
сами теоретически и практически могут быть очень интересны.
В последнее время стали проявлять интерес и к другим галидам
Титана как к возможному сырью для получения металлического
титана. Например, для рафинирования элементарного титана ис-
пользуется способность тетраиодида, легко получаемого прямым
Синтезом при сравнительно низкой температуре, диссоциировать
при высокой температуре.
Из других соединений титана значительный интерес представ-
ляют различные халькогениды (низшие оксиды, сульфиды, селе-
ниды, теллуриды); некоторые из них обладают полупроводнико-
выми свойствами.
Многие титанаты отличаются своеобразными электрическими
свойствами; наиболее интересен метатитанат бария, имеющий ис-
ключительно высокую диэлектрическую проницаемость. Нитрид,
карбид, а также бориды и силициды титана характеризуются на-
ряду с тугоплавкостью и химической стойкостью очень высокой
твердостью, что обусловило широкое применение этих соединений,
особенно карбида титана, для получения твердых инструменталь-
ных сплавов. Все это послужило стимулом для более глубокого
исследования и расширения области применения соединений ти-
тана.
Наша страна располагает богатыми месторождениями титано-
вых руд, разработка и использование которых — одна из важней-
ших народнохозяйственных задач. Развитие титановой промыш-
ленности в СССР связано с решением ряда проблем; особо сле-
дует остановиться на следующих из них.
1. Рационализация процесса получения метал-
лического титана из его соединенийК'В настоящее
время металлический титан получают восстановлением тетрахло-
рида титана магнием или натрием; титан при этом получают
п
губчатым, и для превращения его в компактный необходима спе-
циальная переработка, связанная с рядом трудностей. Такой про-
цесс производства металлического титана очень сложен, а сам ти-
тан еще очень дорог."',
2. Исследование систем титан — металлы и
природы интерметаллических соединений тита-
н а. Решение этой проблемы необходимо для развития металлур-
гии титана, который является прекрасной добавкой для облагора-
живания обычной стали и легирования специальной стали и спла-
вов цветных металлов.
3. Изучение химии нитридов, карбидов, боридов и тому
подобных соединений титана и образуемых ими систем
с целью получения сверхтвердых материалов.
4. Изыскание новых путей получения двуоки-
си титана высокой степени чистоты, что необходимо для про-
изводства титановых белил.
5. Изучение физико-хим ии и кристаллохимии
титанатов и систем, ими образуемых, для решения задачи ис-
пользования их в качестве сегнетоэлектриков.
6. Получение органических соединений тита-
н а. С решением этой проблемы связано использование органиче-
ских соединений титана в качестве катализаторов и веществ, при-
меняемых для обработки (импрегнирования) различных тканей,
а также антидетонаторов для моторного топлива.
7. Использование восстановительных свойств
соединений трех- и двухвалентного титана в химических
производствах, что даст возможность заменить такие дефицитные
восстановители, как цинковая пыль и другие.
Естественно, что в ходе решения этих проблем возникает инте-
рес и к теоретическим вопросам химии титана. Расширение произ-
водства и применения титана стимулирует изучение химических
свойств этого металла и его соединений и систем на их основе, а
также разработку методов синтеза новых, ранее неизвестных со-
единений титана.
ГЛАВА I
ХАРАКТЕРИСТИКА ТИТАНА КАК ЭЛЕМЕНТА
СТРОЕНИЕ АТОМА >-«
УХимический элемент титан — Ti — имеет порядковый номер 22.
Нейтральный атом его состоит из ядра, заряд которого равен два-
дцати двум единицам положительного электричества, и находя-
щихся вне ядра двадцати двух электронов. Таким образом, ядра
атомов титана содержат по 22 протона, а нейтронов — от 20 до 32.
Радиус ядра составляет 5 фм *.
Электронная оболочка атома титана состоит из четырех слоев,
которым соответствуют энергетические уровни К, L, М, N, харак-
теризующиеся главными квантовыми числами 1, 2, 3 и 4. Распре-
деление электронов в свободном деионизированном и невозбу-
Жденпом атоме титана выражается формулой Is2, 2s2p6, 3s2p6d2,
4sa. Ниже приводится схема распределения электронов в ней-
тральном невозбужденном атоме титана:
s
1 W 0 р
2(L) (Е|ц[м|н1
з 1м) Е1нЖЬ||М Т1
Строение атомов титана изучено спектральным методом, при
помощи которого с достоверностью удается определить характер
связи 19-го электрона у нормального атома титана. Самый низкий
терм, соответствующий трехкратно ионизированному атому ти-
тана, не соответствует терму атома калия или терму однократно
ионизированного атома кальция. Это значит, что трехкратно ио-
низированный атом титана не содержит электронов на четвертом
уровне (А^-уровне).
Кажущиеся величины радиусов г нейтрального атома и поло-
жительно заряженных ионов титана для координационного числа
* фм — фемтометр; 1 фм = 10 м.
13
6 приведены ниже:
Атом или ион....... Ti Ti+ Ti2+ Ti3+ Ti4 +
г, пм *............ 146 95 78 69 64
пм — пикометр; 1 /гл =10 12 л = 10 2 A.
Атомный объем титана составляет 10,64 см21г-атом.
Способность атома титана отдавать свои электроны с 4s-, 3d-
и Зр-подуровней характеризуется ионизационным потенциалом
или энергией ионизации (табл. 1).
Таблица I. Ионизационные потенциалы и энергии ионизации
атома титана
Отрывае- мый электрон Подуро- вень Иониза- ционный потенциал, в Энергия ионизации, адж * Отрывае- мый электрон Подуро- вень Иониза- ционный потенциал, в Энергия ионизации, адж *
1-й 4s 6,83 1,09 5-й Зр 100,4 16,06
2-й 4s 13,57 2,17 6-й Зр 122,0 19,51
3-й 3d 27,52 4,40 7-й Зр 143,3 22,9
4-й 3d 44,12 7,06 8-н Зр 173,5 27,8
* адж — аттоджоуль;; I в5жв10 18 дж.
Из табл. 1 видно, что только валентные электроны (4s и 3d)
отрываются более или менее легко (ионизационный потенциал до
50 в); Зр-электроны могут быть оторваны лишь со значительным
трудом (ионизационный потенциал свыше 100 е). Следует отме-
тить, что 48-электроны становятся валентными при возбуждении
атома титана, которое сопровождается переходом одного s-элек-
трона на d-подуровень 3-го уровня (энергия возбуждения
0,13 адж).
АТОМНЫЙ ВЕС И ИЗОТОПИЯ 5-И
Впервые атомный вес титана пытался определить Берцелиус
в 1813 г.; он получил при этом абсурдное значение — 288,16. Че-
рез десять лет Розе, определяя отношение массы дисульфида ти-
тана к массе полученной из него двуокиси, получил более правдо-
подобное значение — 61,6.
Последующими измерениями в 1829 г. Розе уточнил атомный вес титана. Так,
определяя отношение массы тетрахлорида титана к массе полученной из него
двуокиси титана, Розе установил, что его атомный вес равен 50,63, а определяя
содержание хлора в тетрахлориде, получил значения 48,27 и 48,13. В этом же
году Мозандер, определяя содержание кислорода в двуокиси титана, получил
для атомного веса титана значение 47,15. Затем в 1847 г. Пьер, анализируя тет-
рахлорид титана, получил значения 49,91 и 50,28. Демоли, произведя в 1849 г.,
по-видимому, неточные даже для того времени измерения, получил для атомного
веса титана сильно расходящиеся значения: 36,2; 56,4 и 43,9.
14
Весьма точные измерения были сделаны Торпом в 1883—1885 гг. Для этого
ОН ПОДперг тщательному анализу тетрахлорид и тетрабромид титана, а атомный
НО титана вычислил из весовых отношений этих соединений титана и Ag, AgCl,
AfBr и TiOs:
Ввеовыс отпоше-
НИЯ, взятые для [T1C1J [TiCl4] [TiClJ [TiBrJ [TiBr4] [TiBrJ
расчета .... [4Ag] [4AgCl] [TiO2] [4Ag] [4AffBr] [TiO2]
Вычисленный атомный вес титана .... 48,04 48,06 48,09 48,14 48,13 48,08
48,09
В среднем атомный вес титана, по этим данным, равен 48,09. После этого
Ив Долгое время для атомного веса титана/ официально было установлено зна-
чение 48,1.
В 1923 г. Бакстер и Фертиг, анализируя тетрахлорид титана,
Получили значение 47,85 ± 0,03. В 1924 г. Хан с сотрудниками, а
В 1926—1928 гг. Бакстер и Бутлер установили для атомного веса
Титана значение 47,90. Это значение и приводится в интернацио-
Нйльпых таблицах в последние десятилетия. Оно сохранилось и
В интернациональных таблицах атомных весов, вычисленных по
НОВОЙ шкале в углеродных единицах.
Долгое время предполагали, что титан является чистым, т. е.
Мопопзотоппым, элементом и что возможна лишь очень незначи-
TWII.iiiih примесь другого изотопа. Лишь в 1936 г. Астон методом
МЙСГ-1'пектроскопии установил, что природный титан наряду с ОС-
НОВНЫМ изотопом 48Ti содержит еще четыре естественных изотопа:
<«Т1, «7Т1, «Ti и 50Ti.
Были получены и искусственные радиоактивные изотопы ти-
ffllid. Радиоактивный изотоп 52Ti с периодом полураспада 41,9 м
Таблица 2. Изотопы титана
и i' <• i »hi 4 iir .<i о Содсржиппе II HH'.Hin ii nt'Tcr 1 nr и in >h I'Ml’fll, 'Ц Хлрпктср излучения Период полураспада Сече-иие поглощения тепловых нейтронов, барн Сечение рассеяния тепловых нейтронов, барн
42 0,001 PA Y
43 0,007 p - Y 0,58 с
44 0,0015 47- л
45 0,0015 P+, Y 3,08 ч — —
46 7,99 1 0,6 + 0,2 3,3+1,0
47 7,32 1 1,6 + 0,3 5,2 + 1,0
48 73,97 У Устойчивые изотопы 8,0 + 0,6 9,0+4,0
49 5,46 I 1,8 ±0,5 2,8 ±1,0
50 5,25 J 0,2 3,3 ±1,0
51 0,0001 P . Y 5,9 м — —
52 0,0001 P • Y 41,9 м — —.
53 0,0001 P . Y — — —
54 0,003 P“- Y — —
15
получен при бомбардировке титана нейтронами или сс-частицами.
При облучении изотопа 46Ti у-излучением лития образуется до
7,4% радиоактивного изотопа 45Ti с периодом полураспада 3 ч.
Бомбардировка титана дейтронами дает сильно радиоактивный
препарат, излучающий преимущественно позитроны и жесткие
у-лучи.
Бомбардировка изотопа 50Ti ионами 3Не2+, т. е. частицами, со-
стоящими из двух протонов и одного нейтрона, сопровождается
образованием изотопа 5|V и выделением дейтронов.
Современные данные об изотопии титана приведены в табл. 2.
Атомный вес природного титана, вычисленный по результатам
исследования изотопов, составляет 47,926, что довольно близко к
значению, приведенному в интернациональных таблицах.
Сечение поглощения тепловых нейтронов естественной смесью
стабильных изотопов титана составляет 5,8 барн\ сечение актива-
ции тепловыми нейтронами 0,14 барн.
ПОЛОЖЕНИЕ ТИТАНА СРЕДИ ХИМИЧЕСКИХ
ЭЛЕМЕНТОВ 12-16
В периодической системе элементов Д. И. Менделеева титан —
22Ti — расположен в побочной подгруппе IV группы, или, иначе,
в группе IVB, в которую кроме титана входят элементы цирко-
ний — 40Zr, гафний — 72Hf и искусственно полученный курчато-
вий— ю4Ки. Атомы элементов этой подгруппы, называемой также
группой титана, имеют аналогичную конфигурацию наружных
электронных подуровней — d\ s2, отличающуюся от конфигура-
ции наружных электронных подуровней атомов элементов, состав-
ляющих главную подгруппу (IVA), или группу углерода, — s2p2.
Элементы в каждой подгруппе являются полными аналогами, а
аналогия свойств элементов группы титана с кремнием и герма-
нием проявляется лишь для соединений, в которых эти элементы
находятся в высшей степени окисления, т. е. элементы разных
подгрупп являются неполными аналогами (табл. 3).
Из данных табл. 3 видно, что титан и цирконий являются пол-
ными аналогами, в то время как кремний и германий являются
аналогами во всех состояниях, кроме состояния со степенью окис-
ления +4. В этом случае аналогами кремния становятся титан и
цирконий.
Элементы группы титана в отличие от элементов группы угле-
вода обладают металлическими свойствами. У соединений даже
самого титана кислотообразующая способность выражена слабее,
1ем у любого элемента группы углерода, хотя титан, занимающий
:амое верхнее место в своей подгруппе, является среди своих ана-
гогов наименее активным металлическим элементом. Так, дву-
жись титана амфотерна, а двуокиси циркония и гафния обла-
гают основными свойствами, хотя и довольно слабо выражен-
1ымн. Тетрагалиды титана обладают кислотообразующими свой-
6
Таблица 3. Строение электронных оболочек некоторых элементов
амфо-
гафния
циркония
как
тетр а галиды
время
и
в то
.ствами,
терны.
Титан больше, чем другие элементы подгруппы IVB,
сходен
с элементами подгруппы IVA — кремнием, германием и оловом.
А Четырехвалентный титан отличается от кремния и германия боль-
\ шей склонностью к образованию комплексных соединений различ-
I ных типов, чем особенно сходен с оловом.
\ С другой стороны, титан отношением к водороду резко отли-
вается от элементов группы углерода, которые образуют гидриды
' ( со связями ковалентного характера. Он, скорее, напоминает скан-
5 дий, образуя с водородом соединения с металлической связью, '
| причем количества присоединенного водорода обусловливаются
{температурой и давлением. Титан и другие элементы подгруппы
/ IVB — цирконий и гафний — вообще очень близки по свойствам
(к элементам подгруппы ШВ (группы скандия), хотя и отли-
I чаются от последних способностью проявлять большую валент-
{ ность. Титан к скандию по свойствам даже ближе, чем к элемен-
' тЬм подгруппы IVA. Сходство титана со скандием, иттрием, а так-
z же с элементами подгруппы VB — ванадием и ниобием — выра-
жается и в том, что в природных минералах титан часто встре-
чается вместе с этими элементами.
Соединения титана в отличие от соединений элементов под-
группы IVA легко реагируют с перекисью водорода с образова-
нием устойчивых перекисных соединений,
17
Интересно отметить, что титан является первым во всем ряду
элементом, который образует окрашенные элементарные ионы.
Это свойство проявляется у всех последующих элементов побоч-
ных подгрупп, между тем как ни один из элементов главных под-
групп не образует окрашенных элементарных ионов.
Все перечисленные различия и сходства элементов полностью
соответствуют общей закономерности изменения их свойств.
ОБЩАЯ ХАРАКТЕРИСТИКА СОЕДИНЕНИЙ ТИТАНА '-3. ‘2. 17
Валентные состояния титана. Титан образует множество раз-
нообразных соединений. В большинстве из них титан четырехва-
лентен, что соответствует его положению в IV группе периодиче-
ской системы элементов и конфигурации наружных электронных
слоев его атома ЗйР, 4s2. Степень окисления «четыре» является
нормальной и вместе с тем максимальной. В это состояние атом
титана переходит в результате возбуждения атома и «оттягива-
ния» четырех непарных электронов: 4s1 и 3d3. При этом по числу
электронов и электронной конфигурации атом титана становится
подобным атому аргона, обладающему особенно устойчивой
электронной оболочкой: Is2, 2s2p6, 3s2p6. Более четырех электро-
нов «оттянуть» от атома титана не удается; этим и объясняется,
что для титана неизвестна степень окисления больше четырех.
В высшей степени окисления титан образует соединения, в ко-
торых преобладают ковалентные связи. Однако ковалентный ха-
рактер различных соединений четырехвалентного титана прояв-
ляется в разной степени.
В низшей степени окисления титан образует соединения, ха-
рактеризующиеся преимущественно межатомной связью ионного
характера. Титан в двух- и трехвалентном состоянии отличается
высокой восстановительной способностью. В последние годы ве-
дутся работы по изысканию способов получения и стабилизации
соединений титана(II) и титана(III).
Кроме того, титан образует соединения, состав которых не
всегда отвечает валентно-стехиометрическим соотношениям.
Это — интерметаллические соединения. По характеру связи и не-
которым свойствам к ним весьма близки соединения титана с во-
дородом, азотом, углеродом и их аналогами, а также с бором.
Так, все они способны образовывать твердые растворы.
Известны также многочисленные комплексные соединения ти-
тана.
Для того чтобы составить более четкое представление о воз-
можных степенях окисления титана, необходимо рассмотреть, ка-
кой состав имеют различные простые соединения * его с галоге-
нами и халькогенами. Например, соединения с галогенами (Г)
* К простым соединениям титана следует отнести такие, в молекулах кото-
рых все атомы относительно электроотрицательных элементов непосредственно
связаны с атомами титана и не связаны друг с другом.
18
Могут иметь состав Tif2, Tir3 и TiT-i, а соединения с халькогенами
(X) —TiX, Ti2X3 и TiX2, откуда ясно, что титан может быть че-
тырех-, трех- и двухвалентным.
На примере этих соединений очень удобно проследить, как
С изменением окислительного числа титана изменяется и характер
Химической связи. Так, в ряду Т1Г2—TiT3—TiT4 очевиден посте-
пенный переход от типично солевых соединений, характе-
ризующихся ионной связью, к кислотообразующим — с кова-
лентной связью. Подобно этому в ряду оксидов TiO—Ti2O3—TiO2
Наблюдается переход от типично основного оксида с ионной
связью к амфотерному со связью ковалентной, хотя и сильно по-
лярной.
Простые соединения. Большинство простых соединений двух-
валентного титана малоустойчивы. Их получают восстановлением
соответствующих соединений четырех- или трехвалентного титана.
По вопросу об образовании иона Ti2+ и перехода Ti2+->Ti3+ еще
нет достаточно точных данных.
Простые соединения трехвалентного титана сравнительно лег-
ко получаются восстановлением соответствующих соединений че-
тырехвалентного титана. Соединения титана(III) по своей при-
роде занимают промежуточное положение между соединениями
титана (II) и титана (IV). Полутораокись (а также и трехгидро-
окись) титана обладает основными свойствами. Тригалиды ти-
тана хотя и являются солями, но уже способны частично подвер-
гаться гидролизу при растворении в воде.
Оксид, а также и гидроксиды титана (IV) амфотерны. Однако
кислотные свойства их проявляются чрезвычайно слабо, даже по
сравнению с двуокисью кремния. Галиды титана (IV) уже не яв-
ляются солями, а носят характер типичных кислотообразователей.
В воде они подвергаются полному гидролитическому расщеп-
лению.
Все простые соединения титана можно подразделить на три
большие группы: 1) соли; 2) кислотообразователи и 3) интерме-
таллиды. Между этими группами соединений нет резких границ,
а существуют плавные переходы. Этим трем типам соединений ти-
тана соответствуют три типа химической связи: ионная, ковалент-
ная и металлическая. В соединениях промежуточного типа и свя-
зи имеют промежуточный характер.
Простые соединения титана перечислены в Приложении 1.
Комплексные соединения. Все комплексные соединения титана
можно подразделить на две группы.
К первой -группе отнесем соединения с комплексными анио-
нами и титаном в любой степени окисления. Будем называть эти
соединения комплексатами титана. По свойствам они на-
поминают простые соединения титана: если титан в них находится
в низшей степени окисления, они обладают характером солей,
если в высшей, — соединения имеют кислотообразующий ха-
рактер.
19
Ко второй группе комплексных соединений отнесем такие, в ко-
торых комплексный ион образован самим титаном, т. е. такие, в
которых комплексообразователем является атом титана.
Комплекса™ титана (II) сравнительно немногочисленны и ма-
лоустойчивы. Тем не менее можно отметить, что, поскольку дву-
гидроокись титана обладает основными свойствами, хлорат, пер-
хлорат, нитрат, сульфат, нитрит, карбонат, формиат, ацетат, окса-
лат, тиоцианат титана(II) являются типичными солями.
Комплекса™ титана(III) сравнительно легко образуются в
растворах восстановлением растворимых соединений титана (IV)
водородом в момент выделения или при электролизе. Соединения
титана(III) значительно отличаются от комплексатов титана(II).
Основные свойства трехгидроокиси титана выражены очень слабо.
Сульфат, фосфат, карбонат, формиат, ацетат, оксалат и подобные
им соединения титана(III) хотя и являются солями, но уже спо-
собны частично подвергаться гидролизу при растворении в воде.
Водные растворы содержат окрашеные в фиолетовый цвет аква-
комплексные катионы, центром которых является ион Ti3+. Ионы
титана(III) являются столь сильными восстановителями, что спо-
собны выделять из кислых растворов свободный водород. Соеди-
нения, содержащие, комплексные катионы [Ti(H2O)6]3+, обнаружи-
вают сильную склонность переходить в соединения TiIV, при этом
восстановительная способность солей титана (III) значительно
больше восстановительной способности солей олова (II).
Титан(1¥) уже склонен в щелочных средах к образованию
анионов. Правда, кислотные свойства амфотерных гидроксидов
титана (IV) проявляются чрезвычайно слабо. Сравнительно более
основной характер гидроксидов титана (IV), называемых обычно
титановыми кислотами, проявляется в том, что они растворимы
в различных минеральных и органических кислотах и нераство-
римы в растворах щелочей. Титанаты различных металлов могут
быть получены лишь путем сплавления двуокиси титана с окси-
дами или гидроксидами соответствующих металлов. В разбавлен-
ных растворах двуокиси титана в кислотах образуется незначи-
тельное количество аква- и гидроксо-катионов титана(IV).
Такие соединения титана(1¥), как сульфат, нитрат, фосфат,
карбонат и другие, по своему отношению к воде не являются со-
лями, а носят, скорее, характер кислотообразователей. Все эти со-
единения титана (IV), особенно если они растворимы в воде, силь-
но подвержены гидролитическому расщеплению. При неполном
гидролизе могут образовываться соединения, содержащие двух-
валентный радикал TiO, называемый оксотитаном (или ти-
танилом). Кислотообразующий характер этих соединений выра-
жается в том, что при реакции их с сульфатами, нитратами, фос-
фатами, карбонатами активных, например щелочных металлов
(т. е. с типичными солями), образуются устойчивые комплексные
соли — сульфатосоли, нитратосоли, фосфатосоли, карбонатосоли,
а при взаимодействии с соответствующими кислотами (серной,
20
: азотной, фосфорной) — комплексные кислоты (сульфатокислоты
и др.).
Хотя титан(IV) и склонен давать анионы, однако соединения,
включающие анионы, например ТЮз" (метатитанат), TiOt" (орто-
, титанат), TiS*- (тетратиотитанат), неустойчивы. Мета-, орто- и
тиотитанаты, как правило, нерастворимы в воде, а растворимые
подвергаются полному гидролизу. Более устойчивы в водных рас-
творах соединения, включающие комплексные анионы, например
у TIFF (гексафторотитанат), TiClF (гексахлоротитанат), Ti(SO4)F
‘ (трисульфатотитанат) и другие.
Окислительный потенциал Ti1111 TiIV составляет по отношению
V к стандартному водородному электроду —0,05 в. Таким обра-
зом, если одним электродом гальванического элемента будет пла-
< типовая пластинка, погруженная в раствор, содержащий равные
; количества ионов на основе Ti111 и TiIV, а другим — стандартный
водородный электрод, то электроны потекут от платиновой пла-
стинки к стандартному водородному электроду. На водородном
электроде будет выделяться водород, а на платиновой пластинке
Ti111 будет переходить в Tiiv.
Для титана характерны перекисные соединения. Они легко об-
разуются при действии перекиси водорода на растворы соедине-
ний титана. По составу эти соединения соответствуют титановым
оксокислотам, в которых один или несколько кислородных лиган-
дов заменены на пероксо-группу —О—О—. Перекисные соедине-
ния титана являются типичными пероксокислотами. Они ведут
себя как сильные окислители аналогично перекиси водорода и
( способны давать устойчивые соли — п е р о к с о т и т а н а т ы.
‘ Таким образом, все комплексные соединения титана можно
разделить на следующие важнейшие группы.
1. Соединения титана (II)—комп лекса ты (хлорат, пер-
хлорат, сульфаты, нитрат, нитрит, соли органических кислот).
‘ 2. Соединения титана(III) —комплексаты (перхлораты,
сульфаты, фосфаты, фтороборат, гидридобораты, соли органиче-
ских кислот; титанаты (фторотитанаты, хлоротитанаты, оксо-
титанаты); соединения с комплексными катионами ти-
тана (гексаква-, гексаммин-, гексакарбамид- и др.).
3. Соединения титана(IV)—оксотитанаты (метатитана-
ты, ортотитанаты, ди- и полититанаты); п е р о к с о т и т а н а т ы; г а-
логено титанаты (гексафторотитанаты, оксофторотитанаты,
пероксофторотитанаты, гексахлоротитанаты, хлорооксотитанаты,
хлоропероксотитанаты, бромотитанаты, иодотитанаты); тиоти-
танаты (тритиотитанаты, тетратиотитанаты,тиооксотитанаты);
нитрид о-, имидо-, амидотитанаты; комплексаты
(пергалогенаты и галогенаты, сульфаты, нитрат, фосфаты); аци-
дотитанаты (галогенатотитанаты, сульфатотитанаты, нитра-
тотитанаты, фосфатотитанаты); карбацидотитанаты (кар-
бонатститанаты, роданотитанаты, формиатотитанаты, ацетатоти
21
танаты, оксалатотитанаты, тартратотитанаты); гетерополи-
соединения (боротитанаты, силикатотитанаты, металлотита-
наты); органические соединения (алкил-, арил-, алкоксо-
и ароксотитанаты, положительные и нейтральные комплексы с ор-
ганическими лигандами).
Этот перечень не включает некоторых соединений со смешан-
ными функциями, а также комплексных соединений, в которых
степень окисления титана равна нулю.
Следует также упомянуть о соединениях, занимающих проме-
жуточное положение между простыми и комплексными (субком-
плексные соединения). К ним относятся гидроксиды, амиды, ими-
ды, алкокси-, арокси-, алкил- и арилсоединения титана и‘много-
численные соединения подобного рода со смешанными функ-
циями.
ГЛАВА II
ЭЛЕМЕНТАРНЫЙ ТИТАН
Элементарный титан обладает свойствами настоящего, и при-
том довольно активного металла, почему и получил название ме-
таллического. Титан в компактном состоянии по внешнему виду
напоминает сталь. Аморфный титан представляет собой мелкий
серо-черный порошок, очень похожий на восстановленное железо.
ФИЗИЧЕСКИЕ СВОЙСТВА’• »• 18~28
Кристаллическая структура. Кристаллический титан сущест-
вует в двух полиморфных модификациях: низкотемпературной —
а и высокотемпературной — р. а-Ти т а н имеет плотноупакован-
ную гексагональную, а 0-титан — объемноцентрированную ку-
бическую решетку. Параметры решетки а-титана (при 25°С): а =
= 295,11, с = 468,43 пм, а 0-титана (при 900° С)—а = 330,65 пм.
а-Титан имеет большее число элементов скольжения и двойни-
кования, чем другие металлы, обладающие такой же кристалличе-
ской решеткой (магний, цинк, кадмий). При обычной температуре
в а-титане имеется 12 плоскостей скольжения (правда, неравно-
Таблица 4- Плоскости скольжения и двойникования в титане
t. °C Плоскости скольжения Плоскости двойникования t, °C Плоскости скольжения Плоскости двойникования
-196 (1010) (1124) 500 (1010) (1012)
20 (1010) (0001) (1011) (1122) (И21) (1012) (1123) (1121) (1012) (1122) 800 (1011) (0001) (1010) (1011) (1Ц1) (1122)
23
[0001]
Рис. 1. Пространственное изображе-
ние основных кристаллографических
плоскостей н направлений скольжения
и плоскостей двойникования в кри-
сталле титана.
ценных) и 18 плоскостей двойникования (рис. 1), что и объясняет
его значительную пластичность.
Плоскости скольжения и двойникования в титане в одном и
том же направлении [1120] при различных температурах, располо-
женные в порядке частоты их появления, приведены в табл. 4.
Преобладающей плоскостью скольжения при всех температу-
рах является плоскость (1010). Критическое напряжение скольже-
ния по грани призмы равно 49
Мн*/л2 и по плоскости базиса —
108 ЛМ/.м2.
Геометрия деформации, тита-
на зависит от величины и ориен-
тации зерен. Частота появления
скольжения по плоскости базиса
возрастает с увеличением разме-
ра зерна. В мелкозернистом ти-
тане скольжение по базису ино-
гда совершенно не наблюдается.
Микроскопическая картина сдви-
гов изменяется также с измене-
нием ориентации кристаллов. Ме-
ханизм деформации (скольже-
ние или двойникование) в значи-
тельной степени зависит от ориен-
тации кристаллов.
При понижении температуры
до —200° С сдвиги по плоско-
стям (0001) и (1011) прекраща-
ются и появляются две новые пло-
скости двойникования (Н24) и
(1123). Очевидно, критическое на-
пряжение скольжения с пониже-
нием температуры увеличивается
быстрее, чем напряжение двойникования. Преобладающий тип
двойникования в титане также изменяется с температурой, что-
свидетельствует о разном темпе изменения критического напря-
жения двойникования для различных плоскостей.
Полиморфное и фазовые превращения. Температура по-
лиморфного превращения a-Ti |3-Ti лежит при 882,5° С.
Теплота полиморфного превращения, вычисленная по температур-
ной зависимости теплоемкости в области перехода, составляет
850,2 кал/г-атом, а определенная калориметрически — 881,4 кал/г-
атом. Изменение энтропии при полиморфном превращении равно
0,763 кал/(град-г-атом).
При переходе |3-Ti -> a-Ti выполняется ориентационное соответ-
ствие между кристаллографическими плоскостями а- и |3-фазы.
* Мн — меганьютон, 1 Мн -- 10s н — 101 923 кГ,
24
Плоскость (0001 )а после превращения оказывается параллельной
плоскости (ПО)р. При этом направление [1120]а совпадает с на-
правлением [Н1]р. Процесс перегруппировки атомов при переходе
P-Ti -> a-Ti может быть представлен как сдвиг между плоскостями
(2Н) р в направлении [111].
/Титан является сравнительно тугоплавким металлом. Точно
определить температуру его плавления довольно трудно. Ранние
(дб 1939 г.) определения температуры плавления титана из-за не-
достаточной его чистоты, несовершенства аппаратуры и методики
Приводили к завышенным значениям, порядка 1800° С. Начиная
С <939 г. исследователи получили возможность более точно изме-
рять температуру плавления сравнительно чистых образцов ти-
тана, однако совершенно исключить загрязнение исследуемых
образцов (главным образом кислородом и азотом) при столь вы-
сокой температуре не удавалось. В связи с этим найденные раз-
личными исследователями в период 1939—1951 гг. значения темпе-
ратуры плавления титана колебались в--пределах 1725—1690° С.
Только в 1953—1956 гг. различным авторам удалось при исполь-
зовании совершенных аппаратуры и методики для чистых образ-
цов титана получить значения температуры плавления в пределах
1660—1680°С. Наиболее достоверными считают данные Диардор-
фа и Хейса (1956), согласно которым температура плав-
ления титана равна 1668 ± 3° С.
Теплота плавления титана составляет 4,50 ккал/г-атом
(или 94 кал/г). Изменение энтропии при плавлении титана состав-
ляет 2,32 кал/(град г-атом).
, Зависимость давления насыщенного пара (в мм рт. ст.) твер-
дого р-титана от температуры (в °К) выражается уравнением:
' 1g р = 10,088—24200/Т.
Те плота сублимации твердого титана составляет
110,5 ккал/г-атом, или 2307 кал/г.
,/ Зависимость давления пара расплавленного титана от темпе-
ратуры выражается уравнением: Ig р = 9,521—23100/Г.
' Вычисленное по этим уравнениям совпадающее при 1667° С
i значение давления пара составляет 0,0041 мм рт. ст. (тройная
точка).
Температура кипения расплавленного титана 3210° С.
Теплота испарения 105,8 ккал/г-атом, или 2209 кал/г.
Критическая температура титана около 4350° С.
- Критическое давление НЗОатж.
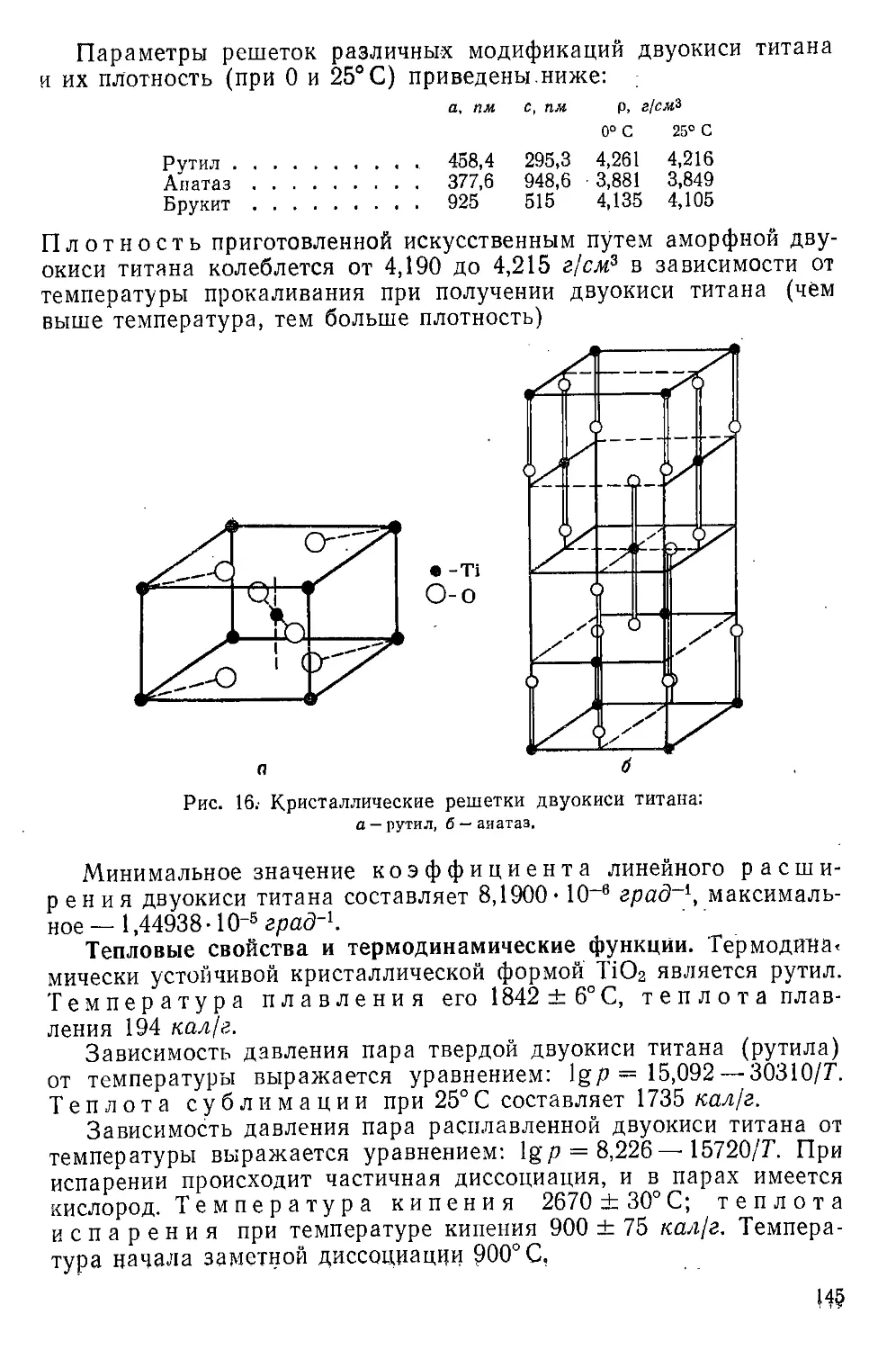
Плохно£ть_твердого титана. Плотность титана при 0°С состав-
.. ляетг'Д 5175 г/см^> и, следовательно, удельный объем при 0° С ра-
вен (5722136 смъ/г- Зависимости плотности (р) и удельного объема
(у) a-титана от температуры в интервале от —200 до 880° С вы-
ражаются уравнениями:
р, = 4,5175- 1,101 • 10~4г —6,4- 10~V+ 1,8- lO-V-2- 10~‘V
vt = 0,22136+ 5,395- 10-6< + 3,35- 10~¥-9- 10“12^ + 1 • 10“
25
. Из последнего уравнения следует, что средний (интегральный)
коэффициент объемного термического расширения а-титана (yt в
град-1) в указанном температурном интервале выражается сле-
дующим образом:
у, - 2,436 • 10“8+ 1,51 • 10“8# — 4,07 -10-1|/2 + 4,5-10“14/8
Зависимость истинного (дифференциального) коэффи-
циента объемного расширения а-титана (|3« в град~1)
от температуры выражается так:
= 2,436 • 10“5 + 2,9- 10“8/- 1,5- 10“"72 + 3- 10“13/3 - 10“16/4
Коэффициенты линейного расширения титана
при 0° С составляют: в направлении оси а — 7,34-Ю”6 и в напра-
влении оси с — 8,9-10“6 град'1. Зависимость истинных (дифферен-
циальных) коэффициентов линейного расширения а-титана в на-
правлении осей а и с от температуры выражается уравнениями:
= 7,34 • 10“8 + 8,75 • 10“9/— 4,5 • 10“"/2 + 9- 10“'4/3 - 4 • 10“17/4
Лс = 8,9 • 10“8 + 1,06 • 10“8/— 5,5 • 10“и/2 + 1,1 • 10“13/3 — 4 • 10“17/4
Плотность |3-титана при 900° С составляет 4,3191 и при
1000° С — 4,302 г!см3. Зависимости плотности и удельного объема
р-титана от температуры в интервале от 890 до 1200° С выра-
жаются уравнениями:
Р/ = 4,4792- 1,842 10“4/ + 7-10“9/2; vt = 0,22326 + 9,2 • 10“af
Значения плотности, удельного объема и коэффициентов тер-
мического расширения твердого титана при различных темпера-
турах приведены в Приложении 2.
Плотность аморфного титана (в присутствии примесей) соста-
вляет 3,54 г/см3.
Упруго-прочностные свойства. Зависимости предела теку-
чести (о0,2 в Л1н/м2) и предела прочности (оьв Мн/м2),
относительного удлинения (6 в %) и сужения площади
поперечного сечения (ф в %) от температуры в интервале от
—200 до 600° С выражаются уравнениями:
(То,2 - 165 - 0,74/ + 2,65 • 10“3/2 - 2,45 • 10“ V - 1,47 • 10“9/4
ей = 268,5— 1,23/+ 2,8- 10“8/2-3,6-10“ V
б = 50 + 8,6 • 10“2/ - 5,4 • 10“4/2 + 1 • 10“9/4
ф = 78,7 - 7,8 • 10“4/2 + 1,6 • 10“8/3
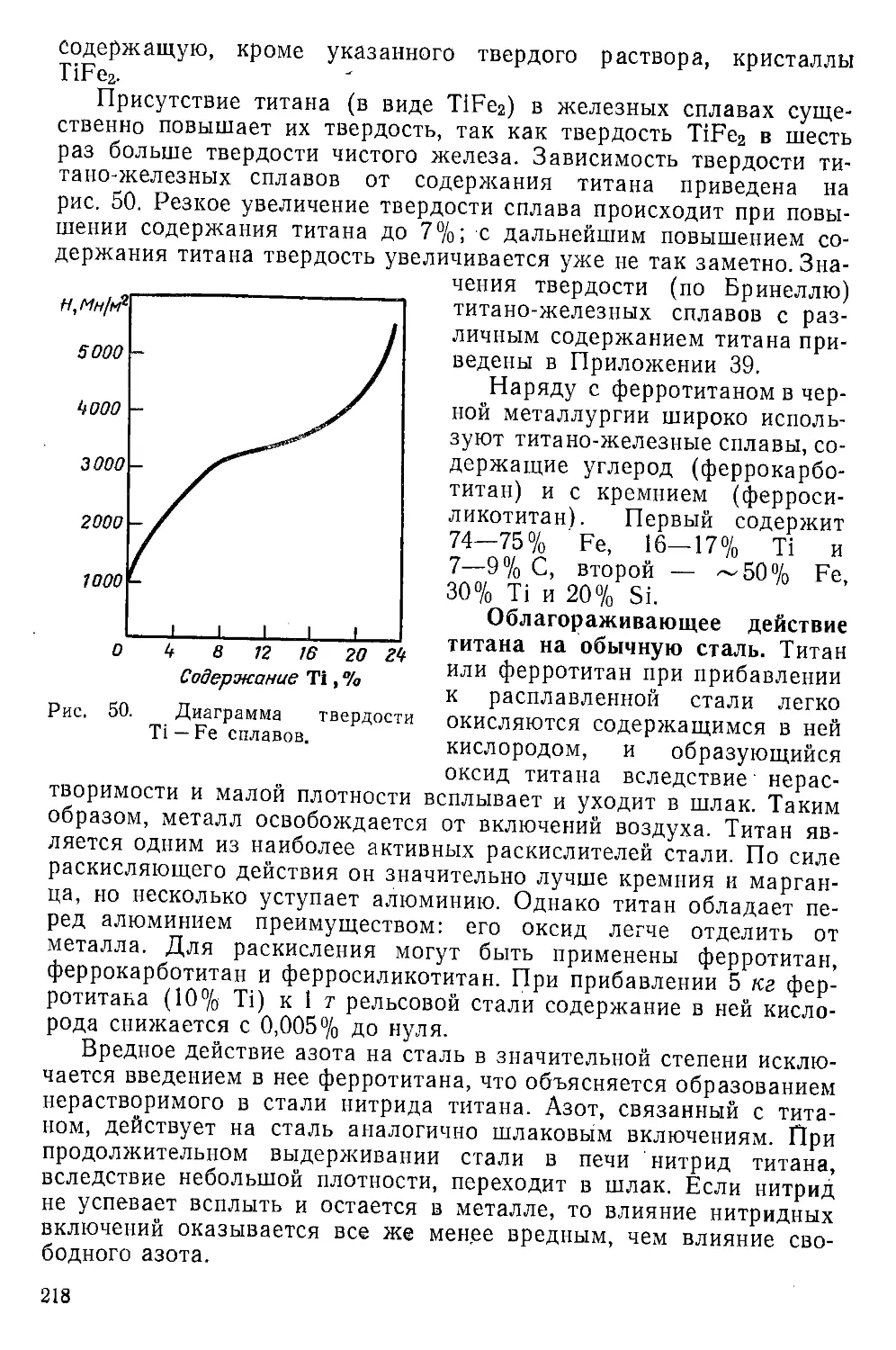
Твердость титана довольно существенно зависит от сте-
пени его чистоты. Зависимость твердости по Бринелю Нв
(в Мн/м2) химически чистого титана от температуры в интервале
от —200 до 600° С подчиняется уравнению:
Нв = 1350 - 3,05/ + 7,85 • 10“3/2 - 3,7 • 10“8/3 - 1 • 10“8/4
26
Зависимость твердости технического титана от температуры в
интервале от —50 до 600° С выражается уравнением: /7в = 2470—
— 4,8£ + 6,4-10’6/3.
Значения упруго-прочностных свойств и твердости титана при
различных температурах приведены в Приложении 3.
Титан допускает на холоду большие степени обжатия. С уве-
личением степени обжатия предел прочности и твердость возра-
стают.
Модуль упругости при растяжении (модуль Юнга) ти-
тана составляет 107 Гн*/м\ модуль жесткости при круче-
нии — 39,8 Гн/м"1, модуль сдви-
га — 37,95 Гн/м\ коэффи-
циент Пуассона — 0,35. Про-
дольная скорость колебаний рав-
на 5990 м!сек, поперечная ско-
рость колебаний — 2960 м/сек.
Механические свойства жид-
кого титана. Плотность рас-
плавленного титана при тем-
пература плавления составляет
У4,11 г/смЬ Кинематическая вяз-
кость' расплавленного титана
при 1730° С равна 8,9-10-5, а при
1920° С составляет 3,7-10-5 м2/сек.
. Поверхностное натя-
жение жидкого титана при
температуре плавления состав-
ляет 1,51 ± 0,018 н/м.
Термодинамические свойства.
Истинная удельная тепло-
емкость титана при 25°С со-
ставляет 0,1248 кал/ {град г).
кал/(град-г-атом)
Атомная теплоемкость Ср при 25° С равна 5,976 кал/ {град г-атом).
Зависимость величины атомной теплоемкости твердого а-титана
от температуры в интервале от 0 до 100° К выражается уравне-
нием:
Ср - 7,5 • 10~4Т + 9,4 • 1(ГВ7’3 - 6 • 10“ 107’6
в интервале от 110 до 300° К — уравнением:
Ср = 0,033 + 0,04957’ - 1,48 • 10-47’2 + 1,64 • 10“77’3
в интервале от 290 до 1150° К — уравнением:
' Ср = 5,228 + 2,56 • 10“ 37’ — 950/Z2 + 2 - 10“47T’ls
Резкий скачок атомной теплоемкости титана при 1155° К,
когда она достигает величины 30 кал/ {град г-атом), связан
* Гн — гиганьютон; 1 Гн — 109 н = 1,01923 • 108 кГ,
27
с полиморфным превращением — переходом a-Ti -> 0-Ti
(рис. 2).
Зависимость теплоемкости р-титана от температуры в интер-
вале от 1200 до 1900° К подчиняется уравнению: Ср — 6,58 +;
+ 9,7-10~4 Т —1,55-10 7 Р.
Вычисленные по данным истинной теплоемкости при различ-
ных температурах интегральные величины средней теплоемкости
титана Ср при нагревании его от 20° С до t приведены ниже:
д °C........................ 20 100 200 300 400 500 600
Ср, кал/{град-г)......... 0,120 0,130 0,133 0,136 0,139 0,141 0,143
£°С........................ 700 800 900 1000 1100 1200
С,р калЦград • г)........ 0,145 0,148 0,166 0,165 0,164 0,164
Теплоемкость расплавленного титана равна 7,9 калЦград г-атом).
Энтальпия титана при 25° С составляет 1149 кал/г-атом.
Зависимость энтальпии а-титана от температуры в интервале от
0 до 200° К выражается уравнением:
Нат - Н/ = 3,23 • 10~674- 2,46- 10~87s + 5,l • КГ'Т8
а в интервале от 200 до 1150° К уравнением:
Н°Г “ = 5,2287 + 0,0012872 4- 950/7 - 523
Зависимость энтальпии 0-титана от температуры в интервале от
1155 до 1900° К выражается уравнением: Нт — Н°о = 1820 + 4,1157 +
+ 0,001244Г2.
Величина энтропии титана при 25° С составляет
7,329 кал/(град г-атом). Зависимость энтропии твердого титана
от температуры в интервале от 0 до 160° К выражается уравне-
нием:
5^ = 4- 10"й73 — 2 - 10~874
в интервале от 160 до 1100° К — уравнением:
5° _ 9,33 + 0,00787 - 1290/7
и в интервале от 1200 до 1900° К (0-титан) —уравнением:
S°T = 8,18 + 0,09757 - 1,5 • 10~672
Зависимость величины энтропии расплавленного титана оттем-
пературы в интервале от 2000 до 3000° К выражается уравнением:
St = 13,36 + 0,00148Т - 6,5 • 10“7Т2.
Приведенная энергия Гиббса титана Ф* = (Gt — Но)/Т
при 25° С составляет —3,47 кал/(град г-атом). Для а-титана за-
висимость Ф* от температуры в интервале от 0 до 300° К выра-
жается уравнением:
-Ф*= 1,1 • 10~673 —6-10~”974 + 9,2 • ю_ 1278
28
-д в интервале от 300 до 1150° К — уравнением:
— Ф* = 0,01327" - 3,7 • 10-6Г2
Для р-титана зависимость величины Ф* от температуры в ин-
тервале от 1200 до 1900° К подчиняется уравнению: —Ф* =
"1V 0,01817 —7,51-+ 1,36- 10-10Т3 — 2,62.
Значения термодинамических свойств твердого титана при раз-
личных температурах приведены в Приложении 4.
Термодинамические свойства газообразного титана рассчи-
таны по данным о строении атома титана.
Ш' Зависимость атомной теплоемкости газообразного
Читана (при постоянном давлении) от температуры в интервале
‘ ‘от 200 до 4000°К выражается уравнением:
W
* Ср = 6,33 -0,002347" + 1,47 • 10“672 - 2 • 1О~1о73
(*,;
’g, Зависимость энтальпии газообразного титана Нт — Но
,‘,(в кал/моль) от температуры выражается уравнением:
7/^. - 77° = 5,927 - 4,9 • 10~773 + 8,5 - 10-1475 -3- 10-2177
+ Зависимость энтропии St [в кал/(град моль)] газообразного
р-титана от температуры в интервале от 0 до 250° К подчиняется
^уравнению:
S°T = 25,2 + 0,1717" - 0.000827"2 + 2,3 • 10“673 - 2,7 • 10~"974
* а в интервале от 250 до 5000° К — уравнению:
I S°t = 56,11 + 0,000487" - 4320/7
I
fe Зависимость приведенной энергии Гиббса [в
f кал/ (град моль)] газообразного титана от температуры выра-
| жается уравнением:
; -Ф* = 23,31 +0,09917-2,86- 10~"472 + 4,9 • 10~773 - 4,6 • 10-1074 +
+ 2,32 • 10~1375 — 5,9 • 10“ 1776 + 5,95 • 10-2177
Значения термодинамических свойств газообразного титана при
различных температурах приведены в Приложении 5.
Теплопроводность. Величина коэффициента теплопроводности
, X [в кал/(м-сек-град)] титана существенно зависит от степени его
чистоты. Изменение величины X для химически чистого и техниче-
ского титана с-температурой показано на рис. 3. На участке от
абсолютного нуля до 30° К Хх. ч линейно зависит от температуры и
подчиняется уравнению: X = 0,26 Т. При температурах выше 30° К
; зависимость отклоняется от линейной, при 50° К величина X дости-
| гает максимального значения 8,8 кал/ (м • сек • град), при Т » 800° К
; проходит через очень пологий минимум, 5,19 кал/ (м- сек -град).
29
Зависимость от температуры при t > 0° С выражается уравне-
нием:
Лх. ч = 6,4 - 7,85 • 10-3/ + 1,97- 10“ V -2,32- 10“ V + 1,1 • 10“ "t*
Коэффициент теплопроводности технического титана вообще
меньше коэффициента теплопроводности химически чистого титана.
При 250° К ^техн достигает максимального значения, равного
4,2 кал/(м •секград), при Т « 580° К проходит через очень поло-
гий минимум, равный 4,04 кал/(м • сек • град). Зависимость коэффи-
циента теплопроводности тех-
нического титана от темпера-
туры при t > 0° С выражается
уравнением:
ЛТехн = 4,2- 1,1 • 10“3/ +
+ 1,8-10“V + 1 • 10“12/4
Зависимость изменения ко-
эффициента теплопроводности
кованого 98%-ного титана от
температуры в интервале от 0
до 150° К выражается уравне-
нием:
Рис. 3. Зависимость теплопроводности
титана от температуры.
Л = 0,057-3,4- 10“еТ3 +
+ 1,55 • 10“874 — 5 • 10"1275
Значения коэффициентов теплопроводности химически чистого
и технического титана при различных температурах приведены
в Приложении 6.
Электропроводность. Электропроводность титана сравнительно
невелика в связи с переходом 4з-электронов (в основном обуслов-
ливающих проводимость) на незаполненный Зб/-подуровень. Она
существенно зависит от степени его очистки и уменьшается в при-
сутствии примесей (рис. 4).
Зависимость удельной электропроводности (в Мсим/м) а-титана
от температуры выражается уравнением:
0t = 2,6-0,01175/4-5,1 • 10“s/2-2- 10“7/34-6- 1О“10/4- 10“12/5 4-6 • 10“16/6
Зависимость удельного электрического сопротивления (в
мком-м) а-титана от температуры выражается уравнением: pt =
= 0,385 + 1,75- IO’3* — 7- 10^4.
Полиморфное превращение a-Ti-*|3-Ti (при 882,5° С) со-
провождается резким увеличением удельной электропроводности:
от 0,665 для а- до 0,741 Мсим/м для |3-титана. Зависимость удель-
ной электропроводности |3-титана от температуры в интервале от
883 до 1150° С выражается уравнением:
ot = 0,255 + 0,002635/ - 4,76 • 10“6/2 4- 3,6 • 10 “9/3 - 10“12/4
30
Удельная электропроводность технического титана при 20°С,
в зависимости от содержания в нем примесей, колеблется от 1,25
до 2,6 Мсим/м. Зависимость удельной электропроводности техни-
ческого а-титана средней степени чистоты от температуры выра-
жается уравнением:
Gt= 1,96-8,6- 10~3/ + 3,7 • 10~6/2- 1,2- 10~7/3 +
+ 2,4- 10~‘¥-2,5- 10~13/5 + 10“‘V
а удельного электрического сопротивления — уравнением: р; =
= 0,51 + 2,25 • 10-3/ — 8,6 • 10-10/3.
При температуре полиморфного превращения удельная элек-
тропроводность технического а-титана достигает 0,525 Мсим/м,
а технического р-титана —
0,59 Мсим/м. Для технического
р-титана аг = 0,628 — 4,7 • 10-5/
(в интервале 885—1150° С).
Влияние давления на электро-
проводность технического титана
при 20° С выражается уравне-
нием: ар = 1,80 + 2 • 10~4 Р + 8 X
•X ЮЛР2 + 4-10~12Р3 (где ор —
электропроводность при избыточ-
ном давлении; Р — избыточное
давление, Л4н/.и2).
Значения удельной электро-
, проводности химически чистого и
технического титана при различ-
ных температурах и давлениях
I приведены в Приложении 7.
Установлено, что титан обла-
дает сверхпроводимостью, т. е.
при очень низких температурах
электрическое сопротивление его
ничтожно. Титан принадлежит к
группе так называемых жестких
Рис. 4. Зависимость теплопровод-
ности титана от температуры.
сверхпроводников, критическая
температура сверхпроводимости которых существенно зависит от
внутренних напряжений в решетке, возникающих при холодной об-
работке, а также обусловленных присутствием примесей. Критиче-
скую температуру для чистого титана, ниже которой он обладает
сверхпроводимостью, можно считать равной 0,4° К-
Термоэлектрические свойства. Исследования зависимости тер-
моэлектродвижущей силы термопары титан — платина от
температуры показали, что при повышенных температурах титан
имеет положительный потенциал по отношению к платине. Темпе-
ратурная зависимость вычисленной термоэлектродвижущей мощ-
ности титана имеет максимум в интервале температур от 200 до
БИЕГ ' '
О ре- ... ao'-Q
сельхс.. .-{ститута
400° С. При температуре полиморфного превращения абсолютная
термоэлектродвижущая сила р-титана больше, чем а-титана.
Магнитные свойства. В соответствии со строением электронной
оболочки атома элементарный титан должен быть парамагнитным.
Зависимость удельной магнитной восприимчивости а-титана от
температуры (см. рис. 5 и Приложение 7) в интервале от —200 до
882°С выражается уравнением:
% = 3,15- 10“3+ 1,05- 10“°/ +
+ 5- 1O“10/2
а р-титана в интервале от 900
до 1160° С — уравнением:
X = 1,743 -10“4- 5,343 -10“7/ +
+ 5,55- 10 “10/2- 1,9- 10“13/3
Рис. 5. Зависимость магнитной воспри- Атомная магнитная воспри-
имчивости титана от температуры. ИМЧИВОСТЬ титана при 20 С
равна 0,152.
Магнитная проницаемость титана составляет 1,00004.
Коэффициент Холла для химически чистого титана при
обычной температуре равен —2,0-Ю-15 л/(а-гс). С повышением
температуры коэффициент Холла плавно возрастает, становится
равным нулю при 400° С и достигает 3,5 • 10“15 л/(а-гс) при 825° С.
Оптические свойства. Коэффициент излучения опреде-
лен для 99,62 %-ного титана при длине волны падающего света
652 нм: для cc-титана при t > 800° С он почти не зависит от темпе-
ратуры и составляет 0,459. Зависимость коэффициента излучения
Р-титана от температуры при / s£Z 1400° С выражается уравнением:
ех = 0,512-3-10“5t.
Коэффициенты отражения, преломления и по-
глощения света, определенные на тонких напыленных пленках
титана, приведены в табл. 5.
Таблица 5. Оптические характеристики титана
Длина волны падающего света, нм Коэффи- циент от- ражения, % Показа- тель пре- ломления Коэффи- циент поглоще- ния Длина волны падающего света, нм Коэффи- циент от- ражения, % Показа- тель пре- ломления Коэффи- циент поглоще- ния
400 53,3 1,88 2,69 580 57,55 2,65 3,43
450 54,9 2,10 2,91 600 57,9 2,76 3,49
500 56,6 . 2,325 3,13 650 59,0 3,03 3,65
550 57,05 2,54 3,34 700 61,5 3,30 3,81
На отражательную способность титана заметное влияние ока-
зывает образующаяся на его поверхности оксидная пленка. Коэф-
32
фицйент отражения при наличии пленки наиболее заметно сни-
жается для видимой области спектра и значительно меньше изме-
няется для инфракрасной области света (см. Приложение 8).
Фотоэлектрические свойства. Работа выхода электронов из эле-
ментарного титана определена на основании результатов исследо-
вания фотоэлектрического эффекта, термической эмиссии и кон-
л тактного потенциала. Наиболее вероятное значение работы выхода
s составляет 4,2 эв.
Максимальная фотоэлектрическая чувствительность титана от-
4 мечается при длинах волн от 260 до 296 нм. Большое влияние на
, фотоэффект оказывает обработка поверхности титана.
Константа А в уравнении насыщения термоэлектронного тока
I = АТ • ехр (—<p/kT) равна 4,4 • 105 а/(м2 • град); <р = 3,95 эв.
Коэффициент электронной теплоемкости у в уравнении Cv =
= уТ 4- рТ3 составляет 8,3-10~4 калЦград-г-атом).
ХИМИЧЕСКИЕ СВОЙСТВА
В химическом отношении элементарный титан представляет ин-
терес главным образом потому, что активность его, как и актив-
ность многих других металлов, весьма существенно зависит от тем-
пературы. При обычных температурах химическая активность ти-
тана чрезвычайно мала и он обладает высокой коррозионной
устойчивостью в большинстве агрессивных сред. С повышением
температуры химическая активность титана растет, и при темпера-
туре плавления он является одним из самых активных металлов.
Реакционная способность титана, например при 1000° С, выше ре-
акционной способности других металлов IVB-группы (циркония и
гафния), а при температуре плавления реакционная способность
титана меньше, чем реакционная способность циркония и гафния
при температурах их плавления.
Взаимодействие с элементарными
веществами 2’ 19>20’29-34
Элементарные вещества по их отношению к титану можно раз-
делить на четыре группы: вещества, образующие с титаном соеди-
нения ковалентного или ионного характера, нерастворимые или
ограниченно растворимые в титане; вещества, взаимодействующие
с титаном с образованием соединений интерметаллического харак-
тера и ограниченных твердых растворов; вещества, образующие
с титаном непрерывные ряды твердых растворов, и, наконец, веще-
ства, не взаимодействующие с титаном. Соединения ковалентного
или даже ионного характера (нерастворимые или только ограни-
ченно растворимые в элементарном титане) титан образует с гало-
генами и халькогенами.
Непрерывные ряды твердых растворов с титаном, образуют скан-
дий, цирконий, гафний, а также металлы групп ванадия и хрома,
2 Зак. 1128
33
соединения интерметаллического характера и ограниченные твердые
растворы — многочисленные элементарные вещества, а именно:
остальные переходные металлы, водород, бериллий, элементарные
вещества подгрупп бора, углерода и азота.
С титаном не взаимодействуют или почти не взаимодействуют,
т. е. не образуют ни соединений, ни твердых растворов, благород-
ные газы, щелочные, щелочноземельные и редкоземельные (кроме
скандия) металлы, а также актиний и торий, т. е. вещества, кото-
рым соответствуют элементы, находящиеся в периодической си-
стеме левее титана.
Галогены. Со всеми галогенами титан способен взаимодейство-
вать с образованием тетрагалидов.
Фтор реагирует уже при обычной температуре:
Ti + 2F2 = TiF4 + 394,2 ккал; kG = - 372,7 ккал
Хлор при обычной температуре также взаимодействует с тита-
ном, а при высокой температуре (порядка 300° С) происходит бур-
ное хлорирование, сопровождающееся ярким свечением:
Ti + 2С12 = TiCl4 + 183,0 ккал; AG = - 173,6 ккал
Бром реагирует с титаном при температуре выше 250° С:
Ti + 2Вг2 = TiBr4 + 146,4 ккал; AG = — 137,6 ккал
Парообразный иод вступает в реакцию с титаном при темпе-
ратуре выше 170° С, причем получается парообразный тетраиодид:
Ti + 2I2 = TiI4 + 98,4 ккал; kG = — 85,35 ккал
С повышением температуры эта реакция идет интенсивнее, однако
образующийся тетраиодид титана при температуре выше 1000° С
разлагается на титан и иод. Таким образом, эта реакция обратима,
но равновесие при температуре до 1000° С заметно сдвинуто вправо.
Аналогична реакция титана с астатом при высокой температуре
(400—500° С); АЯ = —75 ккал.
Кислород и другие халькогены. На воздухе при обычных тем-
пературах титан весьма устойчив. Взаимодействие с кислоро-
дом начинается только при повышенной температуре, но при
100° С скорость реакции окисления еще очень незначительна. При
1200—1300° С титан начинает бурно реагировать с кислородом воз-
духа; эта реакция сопровождается ярким свечением:
Ti + О2 = ТiO2 + 225,5 ккал; kG = — 212,3 ккал
В атмосфере чистого кислорода горение титана начинается уже при
500° С. Интенсивность горения зависит от степени дисперсности ча-
стиц титана и контактирования их с кислородом; взвешенная в воз-
духе пыль титана взрывоопасна. В расплавленном состоянии титан
чрезвычайно бурно реагирует с кислородом воздуха.
На рис.6представлена диаграмма состояния системы титан—
кислород при содержании кислорода от 0 до 66,7 атомн.%, т. е.
на участке Ti—TiO2. Из диаграммы следует, что в системе кроме
34
соединений Ti3O, TiO, TiaOs, Ti3O5 и TiO2 образуются ряды твер-
дых растворов. Первой стадией окисления титана является внедре-
ние кислорода (в виде Ti3O) в решетку металла с сохранением
металлических свойств последнего. Присутствие Т13О в твердом
растворе резко повышает температуру полиморфного превращения
Рис. 6. Диаграмма состояния системы титан — кислород.
a-Tip-Ti. При 1740° С в сплавах, содержащих кислород в коли-
честве от 3 до 13,5 атомн.%, наблюдается перитектическая реакция:
a-Ti + ж = J3-TI
Максимальная растворимость кислорода в р-титане (5,5 атомн.%)
достигается, при перитектической температуре 1740° С. Вторая пе-
ритектическая реакция
a-Ti + ж = TiO
в сплавах, содержащих от 36 до 46 атомн.% кислорода, протекает
при 1770° С. Между двумя перитектиками на кривой кристаллиза-
2*
35
ции a-фазы имеется пологий максимум, соответствующий содержа-
нию кислорода 25 атомн.% и температуре 1940° С. Граница раство-
римости кислорода в a-титане в интервале температур от 800 до
1700° С соответствует содержанию кислорода 33 атомн.°/о. Наличие
максимума на кривой кристаллизации указывает на образование
в системе определенного соединения, содержащего 25 атомн.% кис-
лорода, т. е. соответствующего составу Ti3O. Образование этого
соединения подтверждается также наличием аномального измене-
ния свойств сплава при содержании в нем около 25 атомн. % кис-
лорода.
Микроструктурный анализ сплавЪв показал также, что в си-
стеме титан — кислород имеется еще особая фаза с содержанием
кислорода около 14 атомн.%, т. е. фаза, отвечающая составу Tied,
устойчивая при t < 825° С и ограниченно растворимая как в a-Ti,
так и в Ti3O. Таким образом, a-Ti и Ti3O образуют непрерывный
ряд твердых растворов лишь в интервале температур от 825 до
882° С.
Одноокись титана и твердые растворы на ее основе кристалли-
зуются при содержании кислорода в сплавах от 43,5 (1400—
1700°С) и от 48 (600—900°С) до 55,5 атомн.%. Температура кри-
сталлизации сплава, содержащего 50 атомн.% кислорода, т. е. по
составу соответствующего одноокиси титана, равна 1770° С, и на
кривой кристаллизации она не является максимумом. В области
содержания в сплавах от 34 до 43,5 (1400—1700° С) и до 48
(925° С) атомн.% кислорода кристаллизуется фаза на основе TiO
совместно с твердым раствором ее в Ti3O. В области содержания
кислорода от 34 до 48 атомн.% при температуре ниже 925° С про-
исходит образование новой фазы б, состав которой соответствует
Ti3O2.
В области содержания кислорода от 55,5 до 59 атомн.% крис-
таллизуется двухфазная система TiO—Ti2O3, а в узкой области,
соответствующей содержанию кислорода от 59 до 61 атомн.% > про-
исходит кристаллизация фазы на основе Ti2O3. При содержании
кислорода от 61 до 62,5 атомн.% в системе кристаллизуется двух-
фазная смесь Ti2O3 + TisOs, а в области с содержанием кислорода
от 62,5 до 64 атомн. %—фаза на основе Ti3O5. При большем со-
держании кислорода появляется двуокись титана. Так, при содер-
жании кислорода в системе от 64 до 65,5 атомн. % кристаллизуется
двухфазная смесь Ti3O5 + TiO2, при содержании выше 65,5
атомн.% —фаза на основе двуокиси титана.
На основании рентгеноструктурного и микроструктурного ис-
следования сплавов установлено существование в системе т и т а н —
кислород следующих фаз: Ti—TiOo,42, TiOo.s—TiOi,22, TiOi,46—
TiOl.se, TiOi,67—TiOi,79, TiOi,go—Ti02,oo- Кроме того, в системе при
температуре ниже 800° С существует фаза TiO0,i5—TiOo.is и при
температуре ниже 925° С — фаза TiOo.e?—TiOo,71-
Температуры фазовых превращений в системе титан—кислород
приведены в Приложении 9.
36
При непродолжительном контакте титана с чистым кислородом
скорость поглощения кислорода титаном подчиняется параболиче-
скому закону. С увеличением продолжительности окисления, осо-
бенно при температурах выше 800° С, скорость поглощения кис-
лорода уменьшается. После более продолжительного окисленияза-
- висимость увеличения толщины окисленного слоя от скорости погло-
щения постепенно переходит из параболической в линейную (рис. 7).
С элементарным титаном кислород (в виде Ti3O) образует
твердый раствор внедрения. В результате окисления титана в по-
токе кислорода при 1000° С приблизительно 30% поглощенного
кислорода растворяется в металле, а 70% образует окалину.
Рис. 7. Кинетические кривые поглощения кислорода титаном.
Сера при обычной температуре не взаимодействует с титаном,
а при высокой температуре расплавленная и парообразная сера ре-
агирует с титаном с образованием сульфидов. Особенно энергично
газообразная сера реагирует с расплавленным титаном:
Ti + S2 = TiS2 + 115,2 ккал
В системе титан — сера образуются соединения Ti3S, Ti2S,
TiS, Ti3S4, Ti2S3, T13S5, T1S2 и TiS3. Сера в виде гемисульфида ти-
тана очень мало растворяется в металле; в «-Ti растворимость до-
стигает лишь 0,014, а в (3-Т1 — 0,012%. На температуру полиморф-
ного превращения титана присутствие растворенного гемисульфида
практически не влияет.
Селен взаимодействует с титаном при высокой температуре
(800—1000° С). В системе титан — селен термическим, рентге-
новским и металлографическим методами установлено образование
соединений Ti2Se, Ti3Se2, Ti4Se3, TiSe, Ti2Se3 и TiSe2.
Теллур при сплавлении с титаном образует соединения TiTe,
Ti2Te3 и TiTe2. Растворимость теллура (в виде монотеллурида ти-
тана) в элементарном титане достигает 0,47%.
37
Азот и его аналоги. При нормальной температуре титан устой-
чив к действию азота так же, как и к действию кислорода. При
высоких температурах титан легко вступает во взаимодействие
с азотом: он является одним из немногих металлов, способных го-
реть в атмосфере азота. Интенсивное горение с выделением боль-
шого количества теплоты и свечением происходит при 800° С. Ре-
акция расплавленного титана с азотом протекает чрезвычайно
бурно. В результате взаимодействия титана с азотом образуются
нитриды титана, преимущественно TiN, а такще ряд твердых рас-
творов.
Скорость поглощения азота титаном почти не зависит от давле-
ния азота; скорости поглощения и диффузии азота в титане мень-
ше, чем кислорода. Поведение титана на воздухе, несмотря на то
что последний на 4/5 состоит из азота, определяется в основном
взаимодействием титана с кислородом, а не с азотом.
Парообразный фосфор при 450° С и выше взаимодействует
с титаном с образованием фосфидов Ti2P и TiP.
Мышьяк при сплавлении с титаном образует арсенид TiAs и
ограниченные твердые растворы.
Сурьма при сплавлении с титаном реагирует с образованием
стибидов (антимонидов) Ti4Sb, TiSb и TiSba и ограниченных твер-
дых растворов.
Висмут при сплавлении с титаном образует висмутид Ti3Bi.
Водород. Титан способен поглощать значительные количества
водорода. Так, 1 г титана может поглотить при обычных условиях
400 см3 водорода (т. е. 1 г-атом титана поглощает почти 2 г-атома
водорода). С повышением температуры растворимость водорода
в титане уменьшается: при 1000° С 1 г титана поглощает всего
60 см3 водорода. Растворимость водорода в титане зависит также
от давления, и поглощение водорода титаном—процесс обрати-
мый. Эта способность титана объясняется образованием гидридов
TiH и TiH2 и ряда твердых растворов. С повышением температуры
способность титана к образованию гидридов уменьшается. Харак-
тер поглощения водорода титаном при температуре выше 1000° С
указывает на то, что большая часть поглощенного водорода нахо-
дится в одноатомном состоянии.
Углерод и его аналоги. Титан взаимодействует с углеродом
лишь при высокой температуре с образованием сплава, содержа-
щего карбид титана — TiC. Титан при высокой температуре спосо-
бен также реагировать одновременно с углеродом и азотом с обра-
зованием карбонитрида титана — Ti5CN4.
С кремнием титан взаимодействует при высокой темпера-
туре с образованием весьма твердых силицидов титана TisSig, TiSi
и TiSi2.
При сплавлении титана с германием образуются германиды
TisGes, TiGe и TiGe2, при сплавлении с оловом — станниды Ti3Sn,
Ti2Sn, TisSn3 и TieTn51 а со свинцом — плюмбиды Ti4Pb и Ti2Pb.
38
При нагревании титана с бором в электрической печи обра-
зуются весьма твердые сплавы, содержащие бориды титана Ti2B,
TiB, TiB2 и Ti2B5.
Металлы. Титан почти или совершенно не взаимодействует со
щелочными, щелочноземельными и редкоземель-
ными (кроме скандия) металлами, т. е. не образует с ними ни
соединений, ни твердых растворов.
С остальными металлами титан взаимодействует с образова-
нием сплавов, содержащих твердые растворы или интерме-
таллические соединения. Однако характер взаимодействия
с разными металлами различен. Металлы, являющиеся аналогами
титана и ближайшими его соседями по периодической системе,
именно цирконий, гафний, скандий, ванадий, ниобий, тантал, а так-
же молибден и вольфрам, не образуют с титаном соединений, но
образуют непрерывные ряды твердых растворов. Другие металлы
дают с титаном интерметаллические соединения и ограниченные
твердые растворы.
Хорошо изучены сплавы титана с алюминием, цирконием, вана-
дием, ниобием, танталом, хромом, молибденом, вольфрамом, ура-
ном, марганцем, железом, кобальтом, никелем, медью, рутением,
палладием, серебром, осмием, платиной, золотом, цинком, ртутью,
галлием, индием, оловом, свинцом, а также некоторые тройные
сплавы.
Взаимодействие с галогенными соединениями 12>19 20
Различные галиды, т. е. соединения, в которых галогены играют
роль электроотрицательных элементов, по своему отношению к эле-
ментарному титану могут быть разделены на три группы. К первой
группе могут быть отнесены галогеноводороды, которые способны
энергично реагировать с титаном, ко второй — солевые (ионные)
галиды, которые сами не способны реагировать с титаном, если не
подвергаются разложению с выделением свободных галогенов или
галогеноводородов, и, наконец, к третьей группе относятся кисло-
тообразующие и инертные (ковалентные) галиды, большинство из
которых, кроме самых устойчивых, взаимодействует с титаном.
Галогеноводороды. Газообразный фтороводород при нагрева-
нии реагирует с титаном, образуя тетрафторид титана:
Ti + 4HF = TiF4 + 2Н2 + 135,0 ккал-, AG = — 111,5 ккал
Сухой жидкий фтороводород образует на поверхности элементар-
ного титана плотную пленку тетрафторида, защищающую более
глубокие слои от дальнейшего действия HF.
Водный раствор HF, т. е. плавиковая кислота, является
одним из наиболее активных растворителей титана. Исследования
скорости и мёханизма растворения титана в плавиковой кислоте
показали, что даже при содержании в ней 1 % HF происходит бур-
ное взаимодействие с титаном:
2Ti + 6HF=2TiF3 +ЗН2
39
Если плавиковая кислота содержит в качестве примесей ионы ме-
таллов, последние увеличивают скорость растворения титана в по-
рядке Fe2+ < Ni2+ < Ag+ < Cu2+ < Au3+ < Pt4+; ионы Mg2+ не
влияют на растворимость, а ионы РЬ2+ являются ингибиторами. Ве-
роятно, растворение титана в плавиковой кислоте является элек-
трохимическим процессом, в основе которого лежит действие ло-
кальных гальванических элементов. Электродный потенциал титана
при растворении в плавиковой кислоте составляет —0,77 в.
Сухой хлороводород взаимодействует с титаном при тем-
пературе выше 300° С:
Ti + 4НС1 = TiCl4 + 2Н2 + 94,75 ккал; &G = — 82,5 ккал
Водные растворы НО, т. е. соляная кислота малой кон-
центрации, не действуют на титан. Сравнительно концентрирован-
ная соляная кислота растворяет титан с образованием фиолетового
трихлорида титана:
2Ti + 6НС1 = 2TiCl3 + ЗН,
Скорость коррозии титана при комнатной температуре 18%-ной
соляной кислотой составляет около 1 мм/г, а 36 %-ной соляной кис-
лотой— 18 мм/г. Скорость коррозии увеличивается при содержании
в соляной кислоте растворенного кислорода. Особенно быстро раз-
рушается титан соляной кислотой, содержащей примеси растворен-
ных фторидов; в этом случае концентрация самой соляной кислоты
особого значения не имеет.
Бромо- и иодоводород взаимодействуют с титаном при
высокой температуре с образованием тетрабромида и тетраиодида
титана:
Ti + 4HBr = TiBr4 + 2Н2 + 97,0 ккал; ДО = — 85,2 ккал
Ti 4- 4НI = Ti 14 + 2Н2 + 93,8 ккал; 1\G = — 82,2 ккал
Водные растворы НВг и HI растворяют титан с выделением
водорода:
2Ti+ 6НВг = 2TiBr3 + ЗН2
2Ti + 6HI = 2TiI3 + ЗН2
Солевые галиды. Различные ионные галиды, т. е. галиды ти-
пичных металлов и других катионов, как правило, не реагируют
с титаном, если не подвергаются разложению с выделением сво-
бодных галогенов или галогеноводородов.
Так, нормальные фториды как в сухом виде, так и в водных
растворах не оказывают действия на титан. Растворы же кислых
фторидов (фторогидратов), например KHF2, а также расплавлен-
ные фториды при высокой температуре заметно реагируют с ти-
таном.
Различные хлориды, даже такие, как хлориды магния, мар-
ганца, железа, никеля, меди, цинка, ртути, олова, аммония, за-
метно не взаимодействуют с титаном ни в водных растворах, ни
в сухом виде. При 100° С титан взаимодействует с 25%-ным рас-
40
твором хлорида алюминия, а при высоких температурах (200—
300° С)—с хлоридами аммония, магния, кальция, железа, меди,
цинка и другими подобными солями, разлагающимися с выделе-
( нием хлороводорода или хлора. Расплавленные хлориды и их пары
действуют на титан в присутствии кислорода. Интенсивно взаимо-
действует с титаном расплав смеси хлорида и фторида натрия.
Кислотообразующие галиды. Все кислотообразующие галиды,
если только теплота их образования не превышает теплоты обра-
зования соответствующих тетрагалидов титана, реагируют с ти-
( таном. Реакции эти начинаются, как правило, лишь при высокой
температуре и приводят к образованию тетрагалидов титана. Од-
нако среди галидов неметаллических элементов имеются вещества,
- которые вообще не взаимодействуют с титаном.
Хлорид бора взаимодействует с титаном при температуре
красного каления:
3Ti + 4ВС13 = 3T1CI4 -I- 4В + 160,6 ккал; AG =—146,7 ккал
Фториды углерода, а именно тетрафторид углерода, фто-
роформ, фреоны (CF3CI и CF2C12), не действуют на титан.
Хлорпроизводные углеводородов реагируют с ти-
таном при температуре красного каления с образованием тетра-
хлорида титана и выделением углерода, а если в состав соединения
входит водород, то с образованием и хлороводорода:
Т1 + СС14 — Т1С14 + С -I- 157,1 ккал; AG = — 157,8 ккал
ЗТ1 4- 2С2С16 = ЗТ1С14 + 4С + 477 ккал; AG = - 489,2 ккал
ЗТ1 + 2С6С16 = ЗТ1С14 + 12С + 486,5 ккал; AG = — 521,5 ккал
Ti + 2СНС13 = Т1С14 + 2С + 2НС1 + 177,8 ккал AG = — 185,5 ккал
Ti + С2НС15 = TiCl4 + 2С + НС1 + 169,7 ккал; AG = — 179,45 ккал
Ti + 2С2Н2С14 = TiCl4 + 4С + 4НС1 + 205,25 ккал; \О = - 230,8 ккал
Тетрафторид кремния и гексафторокремниевая кислота
разъедают титан:
Ti + SiF4 = TiF4 4- Si + 8,2 ккал; AG = + 3,15 ккал
Тетрахлорид кремния взаимодействует с титаном при
высокой температуре:
Ti + SiC!, = TiCI4 + Si + 25,9 ккал; AG = — 26,0 ккал
Подобным же образом взаимодействует с титаном тетрахлорид
германия (АЯ = — 61 ккал; AG = — 55,8 ккал). Тетрахло-
риды олова и свинца взаимодействуют с титаном при на-
гревании:
Ti + 2S11CI4 = TiCl4 + 2SnCl2 + 110,5 ккал
Ti + 2PbCl4 = TiCl4 + 2РЬС12 + 205,4 ккал; AG = —192,3 ккал
Трифторид азота не взаимодействует с титаном. Д и-
хлортр и фторид и пентахлорид фосфора реагируют с
41
титаном уже при 170° С:
Ti + 2PF3C12 = TiCl4 4- 2PF3
Ti 4- 2PC15 = TiCl4 4- 2PC13 4- 138,6 ккал; AG = — 155,6 ккал
Пентабромид фосфора при этих же условиях образует
гетрабромид титана:
Ti 4- 2FBr3 = TiBr4 4- 2PBr3 4-114 ккал
Пентафторид мышьяка действует на титан при высокой
температуре с образованием тетрафторида титана:
5Ti 4- 4AsF5 = 5TiF4 4- 4As 4- 833 ккал; i\G = —690 ккал
Трихлорид мышьяка действует на титан при температуре
красного каления:
3Ti 4- 4AsCl3 = 3TiCl4 4- 4As 4- 301,8 ккал; AG = — 285,7 ккал
Пентахлорид сурьмы реагирует с титаном при 170° С:
Ti 4- 2SbCl5 = Т1С14 4- 2SbCl3 4- 155,3 ккал; AG = —334,5 ккал
Фторокислород реагирует с титаном при £^>500°С с обра-
зованием оксид-дифторида (или фторокиси) титана:
Ti 4- OF2 = TiF2O 4- 216,65 ккал
Гексафторид серы не взаимодействует с титаном ни на
холоду, ни при нагревании.
Оксидди фторид и диоксиддифторид серы (фтор-
окиси) также не действуют на титан.
Оксидтетрафторид серы на холоду — медленно, а при на-
гревании быстро реагирует с титаном:
Ti 4- 2SF4O = TiF4 4- 2SF2O 4- 541,05 ккал
Гемидихлорид серы действует на титан при нагревании:
Ti 4- S2C12 = TiCl2S 4- S
Фториды хлора и фториды брома энергично реаги-
руют с титаном:
Ti 4- 2C1F = TiF2Cl2
Ti 4-C1F3 = TiF3Cl
Ti 4- 2BrF = TiF2Br2
Ti 4- BrF3 = TiF3Br
3Ti 4- 2BrF5 = 2TiF3Br 4- TiF4
Последняя реакция идет быстро только при t > 300° С, так как при
более низких температурах образующаяся на поверхности титана
плотная пленка тетрафторида защищает его от действия реагента,
42
Гептафторид иода действует На титан при нагревании с
образованием иодтрифторида и тетрафторида титана:
2Т1 + 1F7 = TiF3I 4- TiF4
Хлориды брома и иода также действуют на титан при
нагревании с образованием смешанных галидов.
Взаимодействие с халькогенными соединениями 2-35-37
Различные кислородные соединения и соединения серы, в кото-
рых она играет роль электроотрицательного элемента (сульфиды),
по своему отношению к элементарному титану могут быть разде-
лены на три группы. К первой группе можно отнести соединения
кислорода и серы с водородом, ко второй — оксокислоты, тиокис-
лоты и кислотообразующие оксиды, а к третьей группе — оксиды,
сульфиды металлов и соли оксо- и тиокислот. Следует указать, что
все эти соединения реагируют с титаном лишь при повышенной
температуре. , —•
Водородные соединения кислорода и серы. .Вода при сопри-
косновении с ювенильной поверхностью титана «вытягивает» из
него ионы Ti2+; стандартный электродный потенциал для этого про-
цесса равен —1,630-е. Судя по этому электродному потенциалу,
титан электрохимически является довольно активным металлом.
Однако поверхность титана обычно покрыта оксидной пленкой, по-
этому практически при обычной температуре вода на титан не дей-
ствует. Кипящая вода взаимодействует с порошкообразным тита-
ном с выделением водорода:
Ti + 4Н2О (г) = Ti(OH)4 4- 2Н2 4- 141,8 ккал
Ti 4- 4Н2О (ж) = Ti(OH)4 + 2Н2 4- 99,8 ккал
Эта реакция сопровождается свечением. На поверхности компакт-
ного образца при действии кипящей воды образуется оксидная
пленка, предотвращающая действие воды на остальную массу ме-
талла. При 700—800° С водяные пары разлагаются титаном с вы-
делением водорода:
Ti 4- 2Н2О = TiO2 4- 2Н2 4- 109,9 ккал', AG = — 103,0 ккал
Для этой реакции, протекающей на ювенильной поверхности ти-
тана, стандартный электродный потенциал при 25° С равен —0,95 в.
Перекись водорода действует на титан уже при обычной темпе-
ратуре с образованием перекиси-двугидроокиси:
Ti 4- ЗН2О2 = Ti(OH)2O2 4- 2Н2О
В аммиачной среде перекись водорода взаимодействует с титаном
с образованием оксид-гидроксида:
Т1 4- 5Н2О2 4- 2NH3 = Ti(OH)2O 4- 7Н2О 4- N2
При взаимодействии титана с сероводородом при обычной тем-
пературе на поверхности титана образуется пленка, препятствую-
43
Щая действию H2S на Остальную массу титана. При высокой тем-
пературе сероводород разлагается титаном с выделением водорода:
Ti + 2H2S = TiS2 + 2Н2 + 70 ккал
С порошкообразным титаном сероводород взаимодействует при
высоких температурах, причем образование сульфидов титана на-
блюдается начиная с 600° С; при 900° С получается продукт, близ-
кий по составу к моносульфиду, а при 1200° С — близкий к сескви-
сульфиду. Водный раствор сероводорода при обычной температуре
почти не реагирует с титаном. Тиосульфиды водорода действуют
на титан аналогично сероводороду. В продуктах реакции при вы-
сокой температуре обнаруживаются трисульфид титана и тиотита-
новые кислоты.
Кислоты и кислотообразующие оксиды. Действие азотной
кислоты на титан зависит от состояния его поверхности. Обычно
при действии на компактный титан азотной кислоты любой концен-
трации на гладкой поверхности металла образуется прочная, не-
растворимая оксидная пленка, защищающая внутренний слон ме-
талла от дальнейшего воздействия кислоты. Таким образом, прак-
тически гладкий элементарный титан оказывается вполне стойким
к действию азотной кислоты любой концентрации и при любых
температурах. Если защитное действие оксидной пленки нару-
шается, что наблюдается при механическом удалении ее, или если
поверхность титана шероховата (особенно если титан аморфный
или губчатый), то разбавленная азотная кислота растворяет титан
и на холоду, и при нагревании:
3Ti + 4HNO3 + 4Н2О = 3H4Ti®4 + 4NO
„ 3Ti + 4HNO3 + H2O = 3H2TiO3 + 4NO
Концентрированная азотная кислота взаимодействует с титаном
при температуре выше 70° С:
Ti + 8HNO3 = Ti(NO3)4 + 4NO2 + 4H2O
Хлорокись азота реагирует с титаном при высокой темпе-
ратуре с образованием тетрахлорида титана и окиси азота:
Ti + 4NOC1 = TiCI4 + 4NO + 219,8 ккал-, ДО = —193,2 ккал
При действии на титан царской водки образуется дихлор-
оксид титана.
При действии на титан разбавленной серной кислоты на
холоду также образуется оксидная пленка, препятствующая рас-
творению титана. Разбавленная серная кислота при нагревании, а
50%-ная — при любых температурах растворяют титан с образо-
ванием сульфатов титана (II) или титана(Ш) и выделением водо-
рода:
Ti + H2SO1 = TiSO4 + H2
2 1 i + 3H2SO4 = Ti2(SO4)3 4- 3H2
44
Концентрированная серная кислота при нагребании восстанавли-
вается титаном до двуокиси серы:
2Ti + 6H2SO4 = Ti2(SO4) 3 + 3SO2 + 6H2O + 202 ккал
Трехокись серы также восстанавливается титаном:
Ti + 3SO3 = TiOSO4 + 2SO2 + 308,4 ккал
При обработке титана сухой двуокисью серы образуется
двуокись титана и сульфид-оксид титана:
ЗТ1 + 2SO2 = TiO2 + 2TiOS
Дихлордиоксид серы (или хлорид сульфурила) реагирует
с титаном уже при 170°С с образованием тетрахлорида титана:
Ti + 2SO2C12 = TiCl4 + 2SO2 4-150,9 ккал', AG = — 164,1 ккал
При высоких температурах титан активно взаимодействует с
двуокисью углерода, а также с окисью углерода
с образованием двуокиси и карбида титана:
2Т1 + СО2 = Т1О2 4- TiC 4- 176 ккал; AG = — 161,7 ккал
ЗТ1 + 2СО = Т1О2 4- 2TiC 4- 262 ккал; AG = - 234 ккал
Хлорокись углерода при высокой температуре также
реагирует с титаном:
Т1 4- 2СОС12 = Т1С14 4- 2СО 4- 129 ккал
Разбавленная и концентрированная муравьиная кислота
при обычной температуре не взаимодействует с титаном, а при по-
вышенной температуре (50—100°С) реакция идет довольно энер-
гично с образованием формиатов титана(II) и титана (III).
Уксусная кислота реагирует с титаном как на холоду, так
и при нагревании, давая ацетаты титана(II) и титана(III). Уксус-
ный ангидрид, хлоруксусная кислота, трихлор-
уксусная кислота и др. действуют на титан главным образом
при нагревании. Щавелевая, молочная, винная, лимон-
ная и стеариновая кислоты действуют на титан при на-
гревании.
Фосфорная кислота слабо действует на титан.
Двуокись кремния при высокой температуре вступает с
титаном в обратимую реакцию.
2Ti + S1O2 2Т1О 4- Si 4- 31,9 ккал; AG = —36,5 ккал
Оксиды и сульфиды металлов. С окисями металлов титан всту-
пает в обратимые реакции при высокой температуре, причем рас-
плавленный титан вступает в химическое взаимодействие со всеми
известными окисями металлов:
nTi + 2MemOn ч«TiO2 + 2mMe
Однако эти окислительно-восстановительные реакции проте-
кают эффективно только тогда, когда теплота образования
45
вступающей в реакцию окиси меньше теплоты образования экви-
валентного количества двуокиси титана. Так, энергично протекают
следующие реакции:
3Ti + 2Fe2O3 = 3TiO2 + 4Fe + 282 ккал; AG = —281,4 ккал
Ti 4- 2CuO = TiO2 4- 2Cu 4- 150,5 ккал; AG = — 150,3 ккал
Титан обратимо реагирует с двуокисью титана:
Ti 4- TiO2 = 2TiO 4- 22,3 ккал; AG = —21,5 ккал
Ti 4- 3TiO2 — 2Ti2O3 4- 49,1 ккал; AG = —47,6 ккал
С расплавленной перекисью натрия титан бурно реагирует с
образованием ортотитаната:
Ti 4- 2Na2O2 = Na4TiO4
С сульфидами металлов титан вступает в обратимые реакции
при высокой температуре:
nTi 4- 2MemSn = wTiS2 4- 2/uMe
С тиосульфидами металлов титан реагирует с образованием
тиотитанатов:
Ti 4- Na2S3 = Na2TiS3
Щелочи и соли кислородных кислот. При сплавлении титана
со щелочами образуются титаниты:
2Ti 4- 6КОН = 2K3TiO3 4- ЗН2
В содовом плаве титан растворяется с воспламенением.
При сплавлении титана с нитратами или хлоратами в присут-
ствии щелочей происходит окисление его до титана (IV):
ЗТi 4- 2КОН 4- 4KNO3 = 3K2TiO3 4- 4NO 4- Н2О
3Ti 4- 4КОН 4- 2КС1О3 = 3K2TiO3 4- 2НС1 4- Н2О
При сплавлении с сульфатом натрия также происходит окис-
ление
Ti 4- 2Na2SO4 = Na4TiO4 4- 2SO2
Смесь порошкообразных титана и перманганата калия взры-
вается.
Растворы солей оксокислот на холоду не оказывают воздей-
ствия на элементарный титан. Окисляют титан растворы таких
сильных солей-окислителей, как гипохлоритов, пероксодисульфатов
и т. п.
Взаимодействие с азотными, углеродными
и другими соединениями 2’32138
Газообразный аммиак при обычной температуре с титаном
не реагирует, а при высокой температуре образует с ним нитрид и
гидрид титана:
5Ti 4- 2NH3 = 2TiN 4- ЗТ1Н2 4- 242,4 ккал; AG = - 214,7 ккал
46
[Годные растворы аммиака при обычных условиях на титан не дей-
ствуют.
Различные углеводороды при нормальных условиях не
оказывают сколько-нибудь заметного влияния на титан, а при
1200° С метан, например, взаимодействует с титаном по уравнению
Ti + СН,( = TiC + 2Н2 + 26,6 ккал; AG — —31,5 ккал
Этан и другие углеводороды при температурах такого порядка ре-
агируют с титаном аналогичным образом:
2Ti + С2Н6 = 2Т1С + ЗН2 + 68,8 ккал; ДО = —79,4 ккал
Газообразный фосфин при нормальной температуре на титан
не действует, а при нагревании порошкообразного титана в токе
фосфина образуются фосфиды титана: после шестичасового выдер-
живания при 800° С — гемифосфид — Ti2P, а при 850° С — монофос-
фид— TiP:
2Ti + 2РН3 = 2TiP + ЗН2 + 66 ккал
Арсин и силан почти не реагируют с титаном. Ди циан
при высокой температуре действует на титан с образованием кар-
бонитрида и карбида титана:
8Ti + 2(CN)2 = Ti5CN4 + 3TiC
Нитриды, имиды и амиды активных металлов заметно
на титан не действуют; нитриды малоактивных металлов могут
взаимодействовать с титаном с образованием твердых растворов, со-
держащих нитрид титана. Подобным образом с титаном реагируют
карбиды и фосфиды металлов. Карбиды малоактивных метал-
лов взаимодействуют с титаном с образованием твердых растворов.
ТИТАН КАК ТЕХНИЧЕСКИЙ МАТЕРИАЛ
Титан как технический металл обладает рядом особенностей.
Характерным для металлического титана является сочетание срав-
нительно малой плотности, высокой механической и термической
прочности и коррозионной стойкости. Такое сочетание свойств де-
лает титан весьма ценным конструкционным материалом. Однако
титан отличается большой химической активностью при высоких
температурах, особенно в расплавленном состоянии. Это вызывает
существенные затруднения при плавке титана.
Конструкционно-технологическая характеристика 18’ 19>39’40
Фрикционные свойства. Фрикционные свойства металлов ха-
рактеризуются коэффициентом трения, износостойкостью при тре-
нии и склонностью трущихся поверхностей к механическому по-
вреждению. Все эти показатели имеют значение при обработке
47
металлов давлением и резанием и при определении пригодности
металлов для изготовления трущихся деталей. Титан по фрикцион-
ным свойствам заметно отличается от других металлов.
Коэффициент сухого трения титана сравнительно не-
велик и несколько уменьшается при повышении внешнего давле-
ния. Коэффициент трения титана почти не зависит от естественных
и случайных загрязнений трущихся поверхностей и не изменяется
при применении смазочных средств. Это означает, что поверхность
титана эффективно не адсорбирует обычные смазочные вещества.
Даже твердые смазочные вещества недостаточно эффективны при
длительной работе из-за слабой связи с поверхностью титана и вы-
давливания при скольжении.
Механизм адгезии смазочных веществ поверхностью титана
принципиально отличен от механизма адгезии другими металлами.
Поэтому многие из обычных смазочных веществ, такие, как угле-
водородные масла, спирты, органические кислоты, жиры и мыла,
оказались для' титана неэффективными. Удовлетворительной смаз-
кой для титана являются графит, дисульфид молибдена и галоген-
ные соединения.
Одной пз наиболее характерных особенностей титана является
исключительно высокая способность его к контактному налипанию
и холодному привариванию при трении. Так, при трении большое
количество титана переносится на другой металл. Металлы тверже
титана при трении с ним оказываются вскоре покрытыми тонким
слоем титана, а металлы мягче титана при трении покрывают его
поверхность. Это создает большие трудности при обработке титана
резанием и делает опасным применение его в трущихся узлах ме-
ханизмов и машин.
Глубокие повреждения поверхности титана при скольжении
обусловлены, с одной стороны, большой склонностью к налипанию
и к холодной сварке трущихся поверхностей, а с другой — большой
склонностью титана к быстрому наклепу, т. е. к упрочнению под
действием пластической деформации. В результате резкого повы-
шения твердости поверхностных слоев при трении за счет местных
пластических деформаций и контактного «схватывания» в точках
соприкосновения разрушение поверхности носит глубинный харак-
тер и приводит к опасному задиранию трущегося узла.
Величина износа титана при трении по сравнению с другими
металлами очень велика.
Механическая прочность. Способность делаться хрупким при
низких температурах, или так называемая хладноломкость, для чи-
стого титана нехарактерна. Однако примеси придают титану это
свойство. Чувствительность чистого титана к надрезу невелика; это
означает, что изменение механических свойств надрезанных образ-
цов по сравнению со свойствами гладких невелико. Однако при-
меси заметно повышают чувствительность титана к надрезу.
Сопротивление титана пластической деформации зависит от
скорости деформации значительно больше, чем сопротивление дру-
48
тих конструкционных материалов (металлов). Ползучесть и дли-
тельная прочность титана существенно зависят от напряжения.
Влияние обработки на структуру и механические свойства. Под
действием холодной пластической деформации микроструктура ти?
тана изменяется, именно по мере увеличения степени деформации
происходит измельчение зерен и вытягивание их в направлении
главной оси Положительной деформации. Характерной особен-
ностью деформированной структуры титана является наличие боль-
шого числа двойников уже при значительных степенях деформации.
Эта особенность делает микроструктуру деформированного титана
очень похожей на микроструктуру деформированного аустенита.
В результате пластической деформации титан получает опре-
деленное упрочнение, т. е. улучшаются его прочностные характе-
ристики и несколько уменьшаются пластичность и вязкость.
При термической обработке металла изменяются его структура
и механические свойства. При нагревании протекают процессы от-
пуска и рекристаллизации наклепанного титана. При отжиге а-ти-
тана после незначительной деформации наблюдается интенсивный
рост зерен до размеров, соответствующих «критической» степени
деформации. С повышением температуры отжига максимум вели-
чины зерна сдвигается в сторону меньших степеней деформации.
Отжиг |3-титана приводит к резкому увеличению размеров зерен до
0,4—0,6 мм. В области устойчивого существования |3-формы макси-
мумы, соответствующие критическим степеням деформации, от-
сутствуют. Для |3-титана характерно то, что при отжиге наиболь-
шего размера достигают зерна в недеформированном титане.
Для титана характерна большая неравномерность процесса ре-
кристаллизации, особенно при малых и средних степенях деформа-
ции. Это объясняется тем, что двойники, по границам которых
наиболее часто возникают новые рекристаллизованные зерна, рас-
пределяются неравномерно.
Коррозионная стойкость 18—20,4i—4в
Одним из важнейших качеств металлического титана является
его высокая коррозионная стойкость (несмотря на высокую хими-
ческую активность его) во многих агрессивных средах, особенно
в водных растворах нейтральных солей. В морской воде и горячих
концентрированных растворах хлоридов коррозионная стойкость
титана значительно выше, чем стойкость всех известных нержавею-
щих сталей и цветных металлов. Если и происходит коррозия ти-
тана, то почти всегда равномерно, без локализации по точкам,
язвам или границам зерен. Высокая коррозионная стойкость ти-
тана объясняется быстрым образованием на его поверхности тон-
кой, инертной, хорошо срастающейся с металлом пленки.
Согласно расчетам стандартный электродный потенциал Ti|Ti2+
составляет —1,630 в, окислительно-восстановительный потенциал
Ti2+|Ti3+ равен —0,37 в. Измеренные значения электродного потен-
циала для свежеочищенной поверхности титана составляют от
49
—0,27 до —0,355 в. Если бы состояние поверхности в растворе не
изменялось, при таком потенциале быстрая коррозия титана была
бы неизбежной. Однако в действительности в большинстве водных
растворов электродный потенциал титана быстро возрастает, до-
стигая положительного значения, а именно +0,46 в. Титан стано-
вится особо коррозцонностойким, или, как говорят, пассиви-
руется. В этом отношении поведение титана похоже на поведение
аустенитовых нержавеющих сталей.
В растворах некоторых веществ, например в плавиковой, соля-
ной и серной кислотах, независимо от начального состояния по-
верхности титана электродный потенциал его остается на уровне
—0,32 в, что обусловливает заметную коррозию.
Таким образом, коррозионная стойкость титана определяется
физико-химическими процессами, происходящими в начальный пе-
риод контакта его с агрессивной средой. В результате этих процес-
сов в большинстве случаев титан пассивируется вследствие образо-
вания на его поверхности прочной нерастворимой защитной пленки;
иногда же происходит разрушение существовавшей ранее пассив-
ной пленки, что приводит к понижению коррозионной стойкости
титана. Одним из важнейших условий, способствующих образова-
нию защитной пленки на поверхности титана, является наличие
в растворе окисляющих веществ, в первую очередь кислорода. На-
личие кислорода делает титан стойким по отношению ко многим
растворам. Пассивирование титана может происходить и под дей-
ствием таких окислителей, как азотная, хромовая, марганцовая
кислоты, и под действием воды, в результате чего и в отсутствие
кислорода на титане образуется защитная гидроксидная пленка.
Пассивирующее действие на поверхность титана оказывают также
ионы различных металлов, например меди.
Титан коррозионностоек в различных атмосферных условиях и
в этом отношении превосходит нержавеющие стали. Высокую кор-
розионную стойкость проявляет титан в пресной воде при различ-
ных температурах, а также в морской воде и морской атмосфере.
Титан не только не корродирует при длительном пребывании в мор-
ской воде, но и хорошо противостоит эрозии' в этой среде. Наибо-
лее агрессивной средой для титана является п л а в и к о в а я кис-
лота. Это объясняется тем, что защитная оксидная пленка раз-
рушается под действием плавиковой кислоты, и в результате титан
сразу теряет свою пассивность, растворяясь даже в 1%-ном рас-
творе кислоты. Скорость растворения титана в плавиковой кислоте
различных концентраций возрастает со временем, а после достиже-
ния максимального значения — уменьшается. Величина максималь-
ной скорости коррозии титана возрастает по мере увеличения кон-
центрации кислоты. Замедление коррозии после достижения макси-
мальной скорости вызвано образованием в процессе коррозии си-
невато-серой пленки, состоящей из гидрида титана. Сильное
корродирующее действие на титан оказывает не только сама пла-
виковая кислота, но и вообще присутствие фторид-ионов. Так, не-
бо
, значительные добавки фторидов могут во много раз увеличить
скорость коррозии титана в различных кислотах.
Титан малоустойчив к действию соляной кислоты, причем ско-
' рость коррозии его резко возрастает с увеличением концентрации
' кислоты и с повышением температуры. Так, на холоду титан энер-
1 гично корродирует в 20%-ной соляной кислоте, при 70° С — в
/ 10%-ной, а при 100° С — в 1%-ной. Коррозионное действие соляной
кислоты может быть снижено добавлением к ней окислителей,
а также солей некоторых металлов, например меди.
Зависимость скорости коррозии титана в серной кислоте
от концентрации кислоты довольно сложна. Заметная коррозия
в аэрированной серной кислоте наблюдается уже при обычной тем-
пературе и концентрации кислоты больше 5%; скорость коррозии
достигает максимума при концентрации кислоты около 40%, сни-
жается до минимума при 60%, затем снова достигает максимума
при 80%, после чего снова снижается.
Титан обладает высокой коррозионной стойкостью к азотной
4 кислоте любой концентрации. Будучи сильным окислителем,
азотная кислота быстро пассивирует титан, который остается
весьма стойким к азотной кислоте даже при высоких температуре
и давлении. В очень концентрированных растворах азотной кис-
лоты, насыщенных оксидами азота, т. е. в красной дымящей азот-
ной кислоте, скорость коррозии титана делается значительной.
Скорость коррозии титана в аэрированных растворах фосфор-
ной кислоты при концентрации до 30% и нормальной темпера-
туре невелика. С увеличением концентрации кислоты и повышением
температуры процесс ускоряется.
Расплавленные соли, используемые обычно для растворения
металлов, оказывают незначительное корродирующее действие на
j: титан. Однако коррозия титана возрастает с повышением темпе-
ратуры. Скорость коррозии в расплавах солей не уменьшается со
временем, т. е. коррозия титана протекает в этой среде без тормо-
жения.
К воздействию органических кислот (за исключением
концентрированных муравьиной и трихлоруксусной кислот при
температуре выше 100° С) и других органических соединений титан
вполне коррозионноустойчив.
Обычно коррозия металлов приводит не только к потере метал-
ла; в результате коррозии образуются злокачественные нарушения
целостности и прочности металла, которые проявляются в виде
коррозионного растрескивания и появления усталостной коррозии.
Большой вред металлическим конструкциям наносит также эрози-
онная коррозия, происходящая в результате сочетания химического
и механического воздействия агрессивных сред.
Обычно к коррозионному растрескиванию наиболее чувстви-
тельны металлы, коррозионная стойкость которых обусловлена об-
разованием поверхностной пленки. Однако титан, относящийся
именно к таким металлам, мало подвержен коррозионному
51
растрескиванию и локальной коррозии. Даже при длительном воз-
действии на титан ряда агрессивных жидкостей коррозионного
растрескивания не наблюдается.
Коррозионно-усталостная прочность титана в ряде агрессивных
сред достаточно велика.
По эрозионной стойкости в воде титан не уступает наиболее
стойким конструкционным и нержавеющим сталям. В отношении
абразивной эрозии титан оказался значительно более стойким, чем
лучшие сплавы на основе меди.
Применение металлического титана 40’45’47-49
До конца первой половины XX века металлический титан при-
меняли мало и главным образом в виде сплава с железом (ферро-
титана) и другими металлами, в качестве добавок к сталям, а так-
же к сплавам меди и др. Применение чистого титана ограничива-
лось лишь некоторыми специальными областями. Это объясняется
значительными трудностями получения чистого металлического ти-
тана.
Компактный металлический титан применяли для
получения электродов для дуговых фонарей. Спектр титана чрез-
вычайно богат линиями почти на всем протяжении, а большая сила
света, испускаемого дугой между электродами из металлического
титана, и высокая температура плавления металла сделали титан
особенно пригодным для осветительных целей.
Пористый металлический титан применяется как
активный и устойчивый катализатор реакций азота с водородом
или с кислородом. Способность металлического титана связывать
азот и кислород используется в вакуум-технике для удаления
остатков газов из электрических ламп и других вакуумированных
сосудов.
Возможность использовать металлический титан в качестве
конструкционного материала давно привлекала внимание, однако
реализация ее зависела от наличия экономически выгодных про-
мышленных методов получения титана. Когда в конце первой по-
ловины XX века был разработан способ промышленного производ-
ства металлического титана, выяснилось, что он может стать цен-
ным конструкционным материалом.
Высокие качества титана как конструкционного материала об-
условлены сочетанием таких свойств, как малая плотность, значи-
тельная удельная прочность (отношение прочности к плот-
ности), которая у титана больше, чем у любого другого металла,
сравнительно высокая термическая, и особенно коррозионная стой-
кость. Титан и его сплавы находят все большее применение в со-
временном машиностроении, авиастроении, турбостроении, в про-
изводстве вооружения. Особенно ценен титан для изготовления
напряженных частей конструкций, и критерием пригодности его
в этом случае является отношение прочности к массе,
52
Титан и его сплавы используют там, где требуется сочетание
минимальной массы с высокой прочностью и термической или кор-
розионной стойкостью. Так, они наиболее широко применяются
в авиационной и ракетной технике и для изготовления различных
космических аппаратов. Одна из наиболее перспективных областей
применения титана,— по-видимому, судостроение, где решающее
значение имеет высокая прочность при малой плотности и высокая
стойкость к коррозии и эрозии в морской воде. Обшивка корпусов
судов и литые детали из титана выдерживают длительное пребы-
вание в быстро текущей морской воде, т. е. в условиях, которые
приводят к быстрому разрушению деталей из всех других доступ-
ных сплавов. Титан применяют также для изготовления трубопро-
водов и паровых котлов высокого давления, легких компрессоров и
лопаток последних ступеней паровых турбин.
Все шире применяют титан в химическом машиностроении, осо-
бенно для изготовления оборудования, используемого при высоко-
температурных процессах в химической промышленности, и дета-
лей, соприкасающихся с различными агрессивными средами. Так,
титан и его сплавы оказались очень ценными для изготовления
лопастей и кожухов центробежных насосов, применяемых для пе-
рекачивания агрессивных жидкостей, инжекторов, вентилей, меша-
лок, высокоскоростных ультрацентрифуг. Титан является ценным
конструкционным материалом для коксохимической, нефтехимиче-
ской, пищевой промышленности, для изготовления медицинских
аппаратов и инструментов. Довольно широко применяются трубы
из титана и его сплавов. Из таких труб изготовляют, например,
теплообменники для аппаратов химических производств.
Существенное значение имеет использование титана в виде ли-
стов (листовой титан) как для обшивки корпусов судов, так и
для покрытия изнутри смесительных барабанов, предназначенных
для перемешивания агрессивных материалов, и для других целей.
В связи с дороговизной листового титана большой практический
интерес для судостроительной, химической и других отраслей про-
мышленности представляет применение титана в качестве плаки-
ровочного материала при изготовлении биметаллических сталь-
ных листов.
Титановая фольга находит пока ограниченное примене-
ние, и производство ее невелико.
Использование титана в качестве конструкционного материала
вызвало потребность не только в трубах и листах, но и в профи-
лях, необходимых для создания каркасов и для связей конструк-
ций.
Из титана изготовляют также проволоку, которую используют
как специальный материал в приборостроении и электротехнике и
в качестве электродов для сварки конструкций главным образом
в авиационной и судостроительной промышленности. Сетку из ти-
тановой проволоки применяют в качестве фильтров, используемых
при работе с агрессивными веществами.
ГЛАВА III
СОЛИ ДВУХВАЛЕНТНОГО ТИТАНА
Известно сравнительно немного соединений титана (II); боль-
шинство из них малоустойчивы, а вообще очень мало исследованы.
Однако установлено, что для титана (II) в соединениях преимуще-
ственно характерна ионная химическая связь и лишь иногда — ме-
таллическая.
ГАЛИДЫ ТИТАН А(Н)
Галиды (галогениды) титана (II), или дигалиды титана, яв-
ляются типичными солями, т. е. соединениями с ионной кристалли-
ческой решеткой. Для них характерны сильно восстановительные
свойства. В свою очередь, сами они образуются при энергичном
восстановлении соответствующих тетрагалидов титана.
Дифторид титана 23’50
Дифторид титана — TiF2 (мол. вес 85,90) —типичная соль.
Получение. До недавнего времени попытки получить дифторид
титана оставались безуспешными, и только в последние годы он
был получен путем разложения гексафторотитаната калия при на-
гревании в сухой атмосфере, содержащей водород:
K2[TiF6] + H2 = TiF2 + 2KHF2
В некотором количестве дифторид титана образуется при разложе-
нии трифторида титана при нагревании его в вакууме в присут-
ствии элементарного титана. Здесь возможны реакции по двум
уравнениям:
2TiF3 — TiF2 + TiF< — 106 ккал
2TiF3 + Ti = 3TiF2 — 81 ккал
При действии паров тетрафторида титана на элементарный титан
также в некотором количестве образуется дифторид титана:
TiF4 + Ti = 2TiF2 + 25 ккал-, AG = — 11,8 ккал
54
Стандартная теплота образования твердого дифторида титана
составляет 198 ккал/моль, газообразного—156,2 ккал/моль. Энер-
гия Гиббса образования твердого TiF2 равна 187 ккал/моль, газо-
образного— 158,2 ккал/моль.
Физические свойства. Дифторид титана представляет собой
темно-фиолетовые призматические кристаллы, плотность его при
25° С равна 3,79 г/см3. Температура плавления дифторида
титана 1280° С; теплота плавления при равна 5 ккал/моль
(93 ккал/г); т е м п е р а ту р а кипения 2150° С; т е п л о т а ис-
парения при этой температуре 37 ккал/моль (605 кал/г).
Теплоемкость дифторида титана при 25° С составляет 15,79
кал/ {град • моль). Зависимость мольной теплоемкости твердого ди-
фторида от температуры выражается уравнением: Ср = 13,7 +
+ 0,007 Т. Теплоемкость жидкого дифторида титана составляет 24,
газообразного (при 25° С)—12,64 кал/ (град • моль). Энтальпия
газообразного TiF2 при 25° С равна 2871 кал/моль. Стандартная
энтропия твердого дифторида титана равна 18,0 кал/(град • моль),
газообразного — 62,36 кал/ (град • моль).
Приведенная энергия Гиббса газообразного TiF2 при 25°С
равна 52,73 кал/(град• моль).
Химические свойства. При нагревании в вакууме дифторид ти->
тана диспропорционирует, распадаясь на элементарный титан и те-
трафторид:
2TiF2 = Ti + TiP4 — 25 ккал; \G = + 11,8 ккал
Дифторид титана, являясь сильным восстановителем, легко под-
вергается окислению. Так, при действии на него кислорода проис-
ходит образование оксиддифторида (фторокиси) титана (IV):
2TiF2 + О2 = 2TiF2O + 150 ккал; AG =—118 ккал
При действии на дифторид титана элементарного фтора проис-
ходит присоединение последнего с образованием тетрафторида:
TiF2 + F2 = TiF4 + 196 ккал; \G = — 186 ккал
При действии же других галогенов происходит образование сме-
шанных галидов титана (IV):
Ti2F2 + С12 = TiF2Cl2; TiF2 -(- Вг2 = TiF2Br2; TiF2 4-12 = TiF2I2
Дихлорид титана 2123’51-56
Получение. Дихлорид титана — TiCI2 (мол. вес 118,81) обра-
зуется при энергичном восстановлении высших хлоридов титана,
а также при действии на элементарный титан хлора, сухого хлоро-
водорода (при 300° С) или соляной кислоты. Однако выделить его
удается не всегда, так как на воздухе окисление идет дальше. Так,
первоначально бесцветный раствор, полученный при растворении
элементарного титана в разбавленной соляной кислоте, содержит,
вероятно, дихлорид титана, но через некоторое время раствор
55
окрашивается, что указывает на появление в нем уже трихлорида
титана.
Дихлорид получается из трихлорида при пропускании над ним
тока сухого водорода при температуре около 500° С:
2TiCl3 + Н2 = 2TiCl2 + 2НС1
Дихлорид титана образуется также в результате многочислен-
ных реакций восстановления тетрахлорида. Так, тетрахлорид ти-
тана восстанавливается до дихлорида при действии натрия или его
амальгамы на холоду:
Т1С14 + 2Na = TiC 12 + 2NaCl
при действии избытка водорода при 700—800° С:
TiCl, + Н2 = TiCl2 + 2НС1
при использовании в качестве восстановителя элементарного ти-
тана при 1050° С:
TiCl., + Ti = 2TiCI2
На последней реакции основан способ получения дихлорида титана.
Сообщение о том, что тетрахлорид титана восстанавливается до
дихлорида газообразным сероводородом при обычной температуре
TiCl, + H2S = TiCl2 + 2НС1 + S
последующими исследованиями не подтвердилось.
Дихлорид титана получается также из трихлорида при нагрева-
нии его в вакууме до 450° С или при температуре хлороводородного
пламени:
2TiCl3 = TiCl2 + TiCl4
Стандартная теплота образования газообразного дихлорида ти-
тана составляет 72,30 ккал!моль, твердого— 123,50 ккал/моль.
Энергия Гиббса образования твердого TiCl2 равна 112,97, газооб-
разного— 74,46 ккал)моль.
Физические свойства. Дихлорид титана — черный кристалли-
ческий порошок. Кристаллизуется в гексагональной сингонии (кри-
сталлы типа Celia): а = 356,1 ± 0,5, с = 587,5 ± 0,8 пм. Энергия
связи Ti—CI равна 0,84 адж.
Плотность дихлорида титана при 25°С равна 3,13 г/см3.
Температура плавления 1030 ±10° С, а теплота
плавления 88 кал! г (или 10,45 ккал/моль).
Зависимость давления пара твердого дихлорида от темпера-
туры выражается уравнением: 1gр = 7,645 — 8570/7.
Теплота сублимации твердого дихлорида титана 46,57
ккал/моль (или 392 кал/г).
Зависимость давления пара расплавленного дихлорида от тем-
пературы подчиняется уравнению: Ig р = 7,294 — 7890/7.
Температура кипения дихлорида титана 1515 ±20° С,
теплота испарения расплавленного дихлорида 304 кал/г
(или 36,1 ккал/моль).
•5Q
Зависимость теплоемкости [в кал/{град моль)] твердого
дихлорида титана от температуры выражается уравнением: Ср =
= 17,4 + 0,00282 7’—77600/72. Теплоемкость жидкого дихлорида
титана равна 23, газообразного — 13,74 кал/ {град-моль), при 25°С.
Зависимость энтальпии твердого дихлорида титана от темпера-
туры выражается уравнением: Нт— Но = 17,4 7 + 0,00141 Т2 +
+ 77600/7'— 1790. Энтальпия газообразного TiCI2 при 25° С равна
3237 кал/моль. Стандартная энтропия TiCl2 составляет: твердого
25,30, газообразного 67,88 кал/{град моль). Зависимость энтропии
твердого дихлорида титана от температуры выражается уравне-
нием: S° = 26,64 + 0,02385 Т — 2520/7. Приведенная энергия
Гиббса TiCl2 при 25°С: твердого —12,61, газообразного
—57,02 кал/ {град • моль). Значения термодинамических свойств
дихлорида титана при различных температурах приведены в При-
ложении 10.
Зависимость удельной магнитной восприимчивости
дихлорида титана от температуры в интервале от —200 до +15° С
выражается уравнением:
% = 4,31 • 10~8- 1,9- 10~Д + 8,05 • 10~и/2 + 10~13/3
Химические свойства. При нагревании в вакууме до 800° С или
в атмосфере водорода до 1000°С дихлорид титана диспропорцио-
нирует на элементарный титан и тетрахлорид:
2Т1С12 = Ti + TiCl4 — 58,2 ккал; . ДО = + 52,2 ккал
Равновесное давление (в мм рт. ст.) может быть вычислено по
уравнению: Igр = 7,67—6350/7.
При нагревании в кислороде или просто на воздухе дихлорид
окисляется:
2TiCI2 + О2 = TiCl t + ТЮ2 +.167,3 ккал; ДО = — 160,1 ккал
Окисление происходит также под действием галогенов. Напри-
мер, под действием фтора образуется тетрафторид:
TiCl2 + 2F2 = TiF4 + Cl2 + 273,6 ккал; AG = —259,8 ккал
а под действием хлора тетрахлорид:
TiCl2 + С12 = TiCl., + 72,3; ДО = -53,4 ккал
При взаимодействии с монофторидом хлора образуется сме-
шанный хлорфторид:
TiCl2 + C1F = TiFCl3
а при взаимодействии с бромом или иодом смешанные бром- или
иодхлориды:
TiC 12 + Br2 = TiCl2Br2 + 48,7 ккал
TiCl2+I2 = TiCl2I2
Дихлорид титана присоединяет серу с образованием тиохло-
рида титана(IV);
TiCl2 + S.= TiCl2S.
57
При нагревании дихлорида титана со щелочными или щелочно-
земельными металлами происходит восстановление его до элемен-
тарного:
TiCl2 + 2Na = Ti + 2NaCl + 76,46 ккал-, = — 70,68 ккал
Дихлорид титана быстро взаимодействует с влагой воздуха
с искрением, при этом окисляясь. В воде он интенсивно раство-
ряется с образованием желто-коричневого раствора и выделением
водорода. Растворение в малом количестве воды сопровождается
воспламенением. Выделение водорода указывает на окисление ти-
тана (II), с чем, возможно, и связано изменение окраски раствора.
Однако в водном растворе, без сомнения, присутствует и титан (II) -
ион, но нельзя считать установленным, окрашен ли он в желтый
или коричневый цвет, или же бесцветен'. Тем не менее титан(II)-
ионы в растворе могут быть обнаружены некоторыми специаль-
ными реакциями, например цветной реакцией с роданид-ионом и
эфиром.
Под действием хлороводорода при высокой температуре дихло-
рид титана окисляется:
2TiCl2 + 2НС1 = 2TIC13 + Н2 + 53,3 ккал-, AG = —41,25 ккал
TiCl2 + 2НС1 = Т1С14 + Н2 + 18,3 ккал-, AG = —15,15 ккал
В концентрированной соляной кислоте он растворяется плохо; рас-
твор окрашивается в зеленый цвет, но по мере окисления титана
окраска переходит в фиолетовую. При испарении солянокислот-
ного раствора образуются кристаллы аквасоединения TiCl2-nH2O.
Дихлорид титана растворим в расплавленных хлоридах щелоч-
ных и щелочноземельных металлов. С хлоридами щелочных ме-
таллов дихлорид титана образует двойные соли, например
NaTiCl3 и Na2TiCU. Исключение составляет хлорид лития; с ним
дихлорид титана дает непрерывный ряд твердых растворов.
Соединение NaTiCI3 образуется при перитектической реакции
(теплота реакции 2,8 ккал/моль)-, соединение- Na2TiCI4 в твердом
состоянии — при 548° С.
На кривой ликвидуса (рис. 8) имеется одна эвтектическая точка
(NaCl + NaTiCl3; t = 605° С) и одна перитектическая точка
(NaTiCb + TiCI2; t = 628°С).
Соединение KTiCl3 конгруэнтно плавится при 762° С. Соедине-
ние K2T1CI4 инконгруэнтно плавится при 671° С, чему соответствует
перитектическая точка (KaTiCR + KTiCl3). Максимум и перитек-
тика находятся (рис. 9) между двумя эвтектическими точками:
КС1 + КУПСЦ; t = 632° С и KTiCl3 + TiCl2; t = 730° С.
В системе RbCl— TiCI2 образуется конгруэнтно плавящееся при
862° С соединение RbTiCI3 и инкогруэнтно плавящееся при 732° С
соединение Rb2TiCU. В системе CsCl — TiCI2 также образуются два
соединения: CsTiCI3 и CS2T1CI4. Теплоты образования RbTiCls,
58
Рис. 8. Диаграмма состояния системы
NaCl—TiCl2.
Содержание TiCl^ , мол. %
Рис. 9. Диаграмма состояния системы
КО—TiCl2.
Rb2TiCl4, CsTiCI3 и Cs2TiCI4 соответственно равны 246,6, 353,5,
245,7 и 354,4 ккал/моль.
В системе MgCi2 — TiCl2 двойных солей не образуется; перитек-
тическая точка (MgCI2 + TiCl2) лежит при 716° С.
При нагревании смеси дихлорида титана с двуокисью титана
получается монохлороксид титана:
TiCl2 + TiO2 = 2TiOCl + 17,9 ккал
При действии на TiCl2 сухим газообразным аммиаком при обыч-
ной температуре получается жемчужно-серый тетр аммин ди-
хлоротитан:
TiCI2 + 4NH3 = [TiCl2(NH3)4]
Реакция идет с выделением тепла. Аналогично протекает реак-
ция и с жидким аммиаком при 78°С, заметное образование тетрам-
миндихлоротитана начинается спустя 12 ч после начала реакции.
Тетрамминдихлоротитан на воздухе разлагается с выделением
аммиака, в вакууме при 300° С — с образованием водорода, амми-
ака, хлорида аммония и нитрида титана (IV):
3[TiCl2(NH3)J = Ti3N4 + 6NH4CI + 2NH3 + 3H2
Водные растворы гидроокиси, сульфида и карбоната аммония
выделяют из раствора дихлорида титана коричневый осадок гидро-
окиси титана (II):
TiC 12 + 2NH4OH = Ti(OH)2 + 2NH4C1
TiCl 2 + (NH4)2S + 2H2O = Ti(OH)2 + 2NH4C1 + H2S
TiCl2 + (NH4)2CO3 + H2O = Ti(OH)2 + 2NH4C1 + CO2
При взаимодействии дихлорида титана с растворами цианидов
образуется ди циан ид титана:
TiCl 2 + 2CN" = Ti (CN) 2 + 2СГ
с растворами роданидов — ди роданид титана (раствор при
этом окрашивается в зеленый цвет):
TiCJ2 + 2CNS" = Ti(NCS)2 + 2СГ
Разбавленная азотная кислота окисляет TiCI2, а концентриро-
ванная— даже с воспламенением.
При действии на дихлорид титана паров тетрахлорида обра-
зуется трихлорид титана:
TiCl2 + TiCl4 = 2TiCl3 + 41,0 ккал
В метаноле и этаноле дихлорид растворяется с выделением во-
дорода и образованием желтых растворов, а в эфире, сероуглероде
и хлороформе не растворяется.
Дихлорид титана восстанавливает органические нитро-, нитро-
зо- и азоксисоединения и нашел применение как реактив для коли-
60
чественного определения микроколичеств этих соединений. При
взаимодействии с циклопентадиенилнатрием TiCla образует д и ци-
клопентад и енилтитан.
Дибромид титана 21 23157
Получение. Дибромид титана — TiBr2 (мол. вес 207,71) обра-
зуется при энергичном восстановлении высших бромидов титана,
а также непосредственно при действии паров брома, сухого бромо-
водорода или его водного раствора на элементарный титан. Однако
выделить TiBr2 не всегда удается, так как на воздухе окисление
идет дальше. Поэтому дибромид титана обычно получают, дей-
ствуя парами брома на титан (при 800—1075° С) в токе благород-
ного газа, например аргона.
Дибромид титана образуется при восстановлении тетрабро-
мида водородом и металлами:
TiBr,| + Н2 = TiBr2 + 2НВг
В качестве восстановителя используют титан:
TiBr4 + Ti = 2TiBra
Дибромид титана получается при нагревании трибромида без
доступа воздуха:
2TiBr3 = TiBra + TiBr4
Теплота образования твердого дибромида титана при 25° С со-
ставляет 97,2 ккал/моль, газообразного — 53,1 ккал/моль. Энергия
Гиббса образования твердого Т1Вг2 равна 89,6, газообразного —
62,6 ккал/моль.
Физические свойства. Дибромид титана — кристаллический по-
рошок черного цвета. Кристаллизуется в гексагональной сингонии
(кристаллы типа Cdl2): а = 362,9, с = 649,2 пм. Энергия связи
Ti — Вг равна 0.73 адж.
Плотность дибромида при 25°С равна 4,31. г/см?. Темпера-
тура плавления 950° С.
Зависимость давления пара расплавленного дибромида титана
от температуры выражается уравнением: 1g р = 7,814—7265/Т.
Температура кипения дибромида 1200° С, теплота
испарения 33,2 ккал!моль (или 160 кал/г).
Зависимость теплоемкости [в кал/град • моль)] твердого
TiBr2 от температуры в интервале 298—1200°С выражается урав-
нением: с = 17,99 + 0,002741 Т. Теплоемкость газообразного TiBr2
при 25°С равна 14,35 кал/(моль-град). Стандартная энтропия
твердого TiBr2 составляет 31,10 кал/(моль-град), газообразного —
75,13 кал/град.
Зависимость величины удельной магнитной восприимчи-
вости дибромида титана от температуры в интервале от —200
до +50° С выражается уравнением:
X = 3,15 • КГ6-3,31 • КГ9/ — 1,34-1(Г12/2 + КГ14/3
61
Химические свойства. При нагревании до 500° С дибромид ти-
тана очень медленно разлагается, диспропорционируя на элемен-
тарный титан и тетрабромид:
2TiBr2 = Ti + TiBr4 — 62,8 ккал; AG = + 43,16 ккал
Под действием галогенов дибромид окисляется с образованием
тетрагалидов:
TiBr2 + 2F2 = TiF4 + Br2 + 297 ккал-, AG = — 283,1 ккал
TiBr2 + 2C12 = TiCl4 + Br2 + 95,7 ккал; AG — — 86,7 ккал
TiBr2 + Br2 = TiBr4 + 50,8 ккал; AG = — 43,4 ккал
С монофторидом брома дибромид образует смешанный бром-
фторид:
TiBr2 + BrF = TiFBr3
а с иодом — смешанный иодбромид:
TiBr2 + I2 = TiBr2I2
Под действием кислорода при высокой температуре дибромид ти-
тана окисляется:
TiBr2 + О2 = TiO2 + Вг2 + 128,3 ккал; AG = — 122,7 ккал
С расплавленной серой он образует тиобромид титана (IV):
TiBr2 + S — TiBr2S
В токе сухого газообразного бромоводорода при 160° С дибро-
мид титана окисляется до трибромида и даже до тетрабромида:
2TiBr2 + 2HBr = 2TiBr3 + Н2 + 55,7 ккал; AG — — 46,4 ккал
TiBr2 + 2НВг = TiBr4 + Н2 + 33,4 ккал; AG = — 25,5 ккал
Дибромид титана растворяется в расплавленных бромидах щелоч-
ных металлов. С бромидами рубидия и цезия дибромид титана
образует двойные соли RbTiBr3 и CsTiBr3. Дибромид титана ре-
агирует также с парами тетрабромида в водороде при температуре
от 280 до 380° С:
TiBr2 + TiBr4 = 2TiBr3 + 38,8 ккал; AG — — 25,5 ккал
В воде TiBr2 растворяется с частичным разложением и выделе-
нием водорода. Водный раствор аммиака выделяет из растворов
дибромида титана коричневый осадок — двугидроокись титана:
TiBr2 + 2NH4OH = Ti(OH)2 + 2NH4Br
Азотная кислота окисляет дибромид титана.
В органических растворителях (эфире, сероуглероде и хлоро-
форме) TiBr2 не растворяется.
62
Дииодид титана 2 2123
Получение. Дииодид титана — Tib (мол. вес 301,71) образуется
при энергичном восстановлении высших иодидов титана, например
при восстановлении тетраиодида водородом и металлами или при
действии на тетраиодид смесью водорода с парами ртути при тем-
пературе красного каления:
T1I4 + Hg = Til2 + Hgl2
В качестве восстановителя могут быть использованы также сере-
бро и титан:
Til4 + Ti = 2ТП2
Дииодид образуется также при нагревании триодида без до-
ступа воздуха:
2TiI3 = Til2 + Til4
или при действии тетрахлорида на сухой иодид калия:
Т1С14 + 4KI = Til2 + I2 + 4КС1
Стандартная теплота образования твердого Tib составляет
64,5 ккал/моль, газообразного—13,8 ккал/моль. Энергия Гиббса
образования твердого Tib равна 64,56 ккал/моль, газообразного —
26,81 ккал/моль.
Физические свойства. Дииодид титана — очень гигроскопичные
листочкообразные кристаллы коричневато-черного цвета с метал-
лическим блеском. Он существует в двух кристаллических модифи-
кациях, из которых лучше изучена модификация II, имеющая
структуру типа Cdl2 (а = 411,0, с = 682,0 пм). Модификация I по
структуре не принадлежит к типу дииодидов,
Плотность дииодида титана при 20° С равна 4,65 г/см3. Тем-
пература плавления лежит около 750°С; теплота плав-
ления примерно равна 7,24 ккал/моль (24 кал/г). Темпера-
тура кипения ~ 1150° С; теплота испарения 60 ккал/моль
(или 200 кал[г). I
Зависимость теплоемкости [в кал/(град • моль)] от
температуры (в интервале 298—1200° К) выражается урав-
нением: С = 20,09 + 0,00174 Т. Теплоемкость газообразного ТП2
14,48 кал/ (град • моль). Стандартная энтропия твердого Т112
равна 35,3 кал/(град моль), газообразного—78,7 кал/(град-моль).
Дииодид титана парамагнитен. Зависимость удельной маг-
нитной восприимчивости модификации II от температуры в интер-
вале от — 185 до + 20° С выражается уравнением:
% = 5,69 • 10~6 — 7,64 • 10-9/— 1,13 • Ю-10/2 + 1,2 • 10-l7/s
Удельная магнитная восприимчивость модификации I больше маг-
нитной восприимчивости модификации II.
Химические свойства. При нагревании в вакууме до 450° С
дииодид титана остается без изменений; при нагревании в
63
глубоком вакууме до t > 480° С он частично испаряется без раз-
ложения, а частично диспропорционирует на элементарный титан
и тетраиодид:
2TiI2 = Ti + Til4 — 60 ккал; \G = + 48,4 ккал
Водород при температуре темно-красного каления не действует
на дииодид титана, а при температуре светло-красного каления
восстанавливает его до аморфного элементарного титана:
Til2 + Н2 = Ti 4- 2HI — 77,1 ккал; AG = + 65,4 ккал
Кислород при температуре красного каления окисляет дииодид
титана до двуокиси с выделением иода:
TiГ2 + О2 = TiO2 + 12 + 161,0 ккал; \G = —147,7 ккал
Окисление дииодида происходит также под действием гало-
генов:
Til2 + 2F2 = TiF4 + I2 + 329,7 ккал; AG = —308,1 ккал
Til2 + 2C12 ~ TiCI4 + I2 + 128,4 ккал; &G — — 111,7 ккал
TiI2 + 2Br2 = TiBr4 + I2 + 83,2 ккал; &G = —76,5 ккал
Til2 + I2 = Til4 + 27,5 ккал; AG = —26,2 ккал.
С серой и фосфором дииодид реагирует при сплавлении:
Т112 + S = TiI2S
В воде дииодид титана растворяется с частичным разложением,
бурным выделением водорода и образованием пурпурного рас-
твора, содержащего титан(III). В растворах щелочей и амм^ка
дииодид разлагается с образованием черного осадка двугидроокиси:
Til2 + 2ОН'= Ti(OH)2 + 2Г
С сухим газообразным аммиаком дииодид образует продукт при-
соединения.
В концентрированной плавиковой кислоте ТПг растворяется с
выделением тепла.
С газообразным хлороводородом на холоду дииодид титана об-
разует желтый кристаллический продукт, а в соляной кислоте рас-
творяется с образованием голубого раствора. Сухой иодоводород
при температуре от —75 до +250° С не присоединяется к дииодиду
ЛИСТ 3
С серной и азотной кислотами дииодид титана бурно реагирует,
причем уже на холоду выделяется иод.
В безводных органических растворителях (спирте, эфире, хло-
роформе, сероуглероде, бензоле) дииодид титана не растворяется.
ХАЛЬКОГЕНИДЫ ТИТАНА(11]
Из халькогенидов (халькидов) титана(II), или монохалькоге-
нидов титана, изучены окись, сульфид, селенид и теллурид, а также
гидроокись титана. Все халькогениды титана (II) обычно неустой-
64
Чивы. Надо отметить, что Эти соединения сравнительно мало изу-
чены. Однако хорошо известно, что одноокись титана имеет до-
вольно четко выраженные основные свойства, причем, как и
.остальные монохалькогениды титана, проявляет некоторые метал-
лические свойства. Характерным признаком халькогенидов тита-
на (II) является их восстанавливающая способность, хотя и не явно
выраженная.
Одноокись титана 21 23> зо, 58-62
Получение. Одноокись (моноксид) титана — TiO (мол.
вес 63,90) образуется в системе титан — кислород. Практически в
этой системе одноокись титана может быть получена при взаимо-
действии титана с его двуокисью:
, Ti + TiO2 = 2ТЮ
При восстановлении двуокиси титана элементарным титаном исходные ве-
щества смешивают в стехиометрических отношениях. Смесь в виде брикета на-
гревают в вакууме в индукционной печи при 1550° С в течение двух часов. По-
лучающийся продукт представляет собой твердую крупнокристаллическую массу
золотисто-желтого цвета.
Для изготовления электродов из одноокиси титана тонко измельченные по-
рошки титана и его двуокиси, смешанные в определенных соотношениях, прес-
суют и спекают в вакууме.
В системе титан — кислород TiO образует широкую область твер-
дых растворов. Фаза на основе одноокиси титана устойчива в ин-
тервале составов от ТЮо,8 до TiOi,22. Одноокись титана и твердые
растворы на ее основе кристаллизуются при содержании в сплавах
от 20,5 (1400—1770°С) и от 23,5 (600—900°С) до 29,5% кислорода.
Образование TiO происходит при восстановлении двуокиси ти-
гана не только элементарным титаном, но и другими металлами.
Так, при восстановлении двуокиси титана парами натрия полу-
чается смесь одно- и полутораокиси титана. При нагревании дву-
окиси титана с магнием или кальцием до 1500°С в токе водорода
реакция идет с образованием одноокиси титана й титаната магния
(или кальция):
2TiO2 + Mg = TiO + MgTiO3
Одноокись образуется также при нагревании двуокиси с избыт-
ком цинка или при пропускании паров цинка над нагретой дву-
окисью. Кроме того, ее можно получить путем восстановления дву-
окиси титана углеродом:
Т1О2 + С = TiO + со
Для получения TiO используется восстановление ТЮг магнием,,
цинком, титаном, углеродом, карбидом титана в вакууме.
Одноокись титана образуется также при восстановлении дву-
окиси титана, нагретой до 2000° С, водородом под давлением
150 атм, а также метаном. Она получается при высокой темпера-
туре и в результате обратимой реакции между двуокисью кремния
3 Зак, 1128 65
и элементарным титаном:
2Ti + SiO2 2Т1О + Si
При электролизе раствора фторо-(III)титаната и фторо-(IV)-
Титаната аммония на свинцовом катоде выделяется черный осадок
ПО.
Стандартная теплота образования твердой одноокиси титана
равна 123,9 ккал/моль-, газообразной равна— 15,1 ккал/моль. Энер-
гия Гиббса образования твердой TiO равна 116,89 ккал/моль, га-
зообразной равна —7,95 ккал/моль.
Одноокись титана обнаружена методом спектрального анализа
на Солнце (главным образом в области пятен) и на многих звез-
дах.
Физические свойства. Индивидуальность кристаллической TiO,
образующейся при восстановлении двуокиси, доказана металло-
графическими и рентгеноструктурными исследованиями.
Одноокись титана представляет собой призматические кристал-
лы от темного коричневато-фиолетового до золотисто-желтого цве-
та и существует в двух полиморфных модификациях: а и 0. Тем-
пература полиморфного превращения 991 ±5° С.
Теплота полиморфного превращения составляет 820 кал/моль.
Кристаллы а-TiO, устойчивой до 991°С, имеют гранецентрирован-
ную кубическую решетку типа NaCl (а = 4,184-4,16 пм).
Плотность ПО при 0°С равна 4,929, при 25° С — 4,888 г/см3.
Твердость по Моосу приблизительно равна 6. По твердости
одноокись титана в 4 раза превосходит стекло и в 13 раз уступает
карбиду вольфрама.
Температура плавления TiO, по данным изучения си-
стемы титан — кислород, 1770° С, теплота плавления
219 кал/г, или 14 ккал/моль.
Зависимость давления пара (в мм рт. ст.) жидкой одноокиси
титана от температуры выражается уравнением: 1g р = 10,43—
— 29421/7' + 5,83-10-4Т. Температура кипения одноокиси
титана 2850°С; теплота испарения при температуре кипения
1590 кал/г (или 101,6 ккал/моль). Теплота сублимации при
25° С равна 2107 кал/г (или 134,6 ккал/моль).
Мольная теплоемкость одноокиси титана при 25° С состав-
ляет 9,556 кал/(град-моль). Зависимость мольной теплоемкости
а-TiO от температуры в интервале от 50 до 298° К выражается
уравнением:
Ср = 0,000387 + 0.000277572 + 5 • 10~773 — 5 10~э74 + 1,8 - 10~1978
а в интервале от 290 до 1264° К — уравнением:
Ср = 10,575 + 0,00367 - 186 000/72
Теплоемкость 0-TiO в интервале от 1264 до 1800° К подчиняется
уравнению: Ср = 11,85 + 0,003 Т. Стандартная теплоемкость жидкой
TiO равна 14,50, газообразной — 7,483 кал/(град-моль).
66
Энтальпия TiO при 25°С составляет 1473 кал/моль. Зави-
симость Нт — Но для а-TiO от температуры в интервале от 0 до
300° К выражается уравнением:
н°т - Н° = 0.0275Т2 - 1,6157 - 1,85 • 10"s73
в интервале от 250 до 1264° К — уравнением:
Н°т - 77° = 10.57Т + 0,001872 + 186000/7 - 2462
а для р-TiO в интервале от 1264 до 1800° К — уравнением:
Н°т -Н°о=\ 1,857 + 0,001572 - 2627
Энтальпия газообразной TiO при 25°С равна 2251 кал/моль.
Стандартная энтропия 5° = 8,33 ± 0,04 кал!(град*моль). За-
висимость энтропии а-TiO от температуры в интервале от 0 до
298° К выражается уравнением:
S°T = 0,000857 + 0,00014772 - 8,214 • 10~’°74 + 6,554 • 10",375
в интервале от 290 до 1264° К — уравнением:
S°T = 10,62 + 0,0147- 1930/7
а р-TiO в интервале от 1264 до 1800° К — уравнением:
S°T = 7,47 + 0,018457 - 2,5 • 10"672
Энтропия жидкой TiO равна 13,95, газообразной (при 25° С) —
55,8 кал] (град • моль).
Приведенная энергия Гиббса Ф* = (GT — Но)/Т твердой
TiO при 25° С равна —3,39, газообразной равна —48,25 кал/(град-
• моль). Зависимость приведенной энергии Гиббса твердой TiO от
температуры имеет вид: — Ф* = 0,0198Т — 5,1 • 10~бТ2— 2,06.
Значения термодинамических свойств твердой одноокиси ти-
тана при различных температурах приведены в Приложении 11.
Удельная электропроводность TiO при 20°С равна
0,249 Мсим]м. При отклонении состава окиси от стехиометриче-
ского в сторону уменьшения содержания кислорода наблюдается
увеличение удельной электропроводности до 0,35 Мсим!м. Элек-
тропроводность одноокиси титана уменьшается с повышением
температуры, т. е. закономерность подобна той, что наблюдается
у металлов.
Величина удельной магнитной восприимчивости
TiO при 20° С составляет 1,38-10~6, а при 183° С равна 1,31 •
• 10~6 э. м. е./г.
Отражательная способность пластинки из однооки-
си титана для ИК-лучей в зависимости от длины волны выра-
жается следующими величинами:
Длина волны излучения, мкм . . . 20,7 29,4 52 63 83 94 117 152
Коэффициент отражения, % ... 1 3 7 14 19 23 38 34
3*
67
Химические свойства. Одноокись титана является основным
оксидом и в то же время — сильным восстановителем. Она срав-
нительно легко окисляется. Под действием фтора образуется те-
трафторид и происходит выделение кислорода:
2TiO + 4F2 = 2TiF4 + О2 + 520,6 ккал; &G = —511,55 ккал
При действии хлора и брома образуются соответствующие гало-
генокиси (галоксиды):
Т1О + С12 = Т1ОС12 + 7,5 ккал
Т1О + Вг2 = Т1ОВг2
При нагревании на воздухе до 800° С одноокись титана окис-
ляется до двуокиси:
2ТЮ + О2 = 2Т1О2 + 203,2 ккал; AG = 190,8 ккал
При нагревании тонкоизмельченной TiO на воздухе до 400° С об-
разуется темно-синяя кристаллическая масса, а при нагревании
до 600° С — серо-зеленый продукт промежуточного состава. При
нагревании с серой TiO окисляется с образованием сероокиси ти-
тана(1У):
TiO + S = TiOS
При сплавлении TiO с элементарным титаном образуется TigO.
Это соединение (третьокись титана) является типичным субоксидом,
в котором атомы титана соединены между собой металлической связью:
/Ti\
Ti\ /°
\TiZ
Третьокись титана представляет собой металлоподобное вещество, изоморф-
ное а-титану. Она кристаллизуется в гексагональной сингонии (а — 297,0, с =
= 477,6 пм). Именно поэтому Ti3O образует с a-Ti непрерывный ряд твердых
растворов, в результате чего температура полиморфного превращения a-Ti->P-Ti
резко повышается. В [3-титане растворимость TigO невелика (максимальная
7,3 мол.% при 1740° С). В Ti3O растворяется одноокись титана (растворимость
достигает 53 мол.%). Третьокись титана плавится при 1940° С с разложением на
титан и одноокись. В системе Ti—TiO точка плавления Ti-.O лежит на пологом
максимуме, расположенном между двумя перитектиками (см. рис. 6), а на кри-
вой коэффициента расширения составу Ti3O соответствует резкий сингулярный
минимум.
В разбавленных соляной и серной кислотах TiO растворяется
с выделением водорода и образованием солей титана(Ш)':
2TiO + 6НС1 = 2TiCl3 + 2Н2О + Н2
2TiO + 3H2SO4 = Ti2(S О4) з + 2Н2О + Н2
Таким образом, здесь также проявляются металлические свой-
ства одноокиси титана, которые могут быть выражены уравне-
нием:
2ТЮ + 6Н+ = 2Ti3+ + 2Н2О + Н3
68
Соли титана (II) образуются при растворении TiO в кислотах
с одновременным пропусканием водорода (под давлением).
В кипящей азотной кислоте TiO окисляется до двуокиси:
TiO + 2HNO3 = TiO2 + 2NO2 + H2O
Одноокись титана может служить катализатором реакции по-
лимеризации этилена.
Двугидроокись титана2
Двугидроокись (дигидроксид) титана — Ti(OH)2 (мол. вес
81,015) является типичным основанием и к тому же обладает силь-
ными восстановительными свойствами.
Получение. Двугидроокись титана осаждается из растворов
солей титана(II) при введении в них гидроксид-ионов. Так, при
введении гидроокиси аммония в раствор соли титана(II) оса-
ждается черный осадок Ti(OH)2:
Ti2+ + 2NH4OH = Ti(OH)2 + 2NH+
Двугидроокись титана осаждается также из растворов солей
титана(П) солями слабых кислот, растворы которых имеют ще-
лочную реакцию. Например, ортофосфаты щелочных металлов
осаждают темно-синий осадок двугидроокиси:
п2+ + род + 2Н2о = Ti(OH)2 + н2ро;
Оксалаты щелочных металлов осаждают лиловато-черный оса-
док:
Ti2+ + С2ОД + 2Н,0 = Ti(OH)2 + Н2С2О,
Карбонат и сульфид аммония выделяют коричневый осадок:
Ti2+ + (NH4)2CO3 + Н2О = Ti(OH)2 + 2NH| + СО2
Ti2+ + (NH4)2S + 2H2O = Ti(OH)2 + 2NH4 + H2S
Двугидроокись титана в виде синего осадка образуется так-
же при действии амальгамы натрия на раствор полутораокиси
титана в соляной кислоте в присутствии цинка.
Стандартная теплота образования двугидроокиси титана со-
ставляет 186 ккал/моль.
Химические свойства. Полученная тем или иным способом гид-
роокись титана(II) первоначально всегда темного цвета (черного,
синего или коричневого), но постепенно светлеет, становится сна-
чала голубой и наконец белой. При этом происходит выделение
водорода. Изменение цвета объясняется тем, что Ti(OH)2 само-
произвольно переходит в двуокись:
Ti(OH)2 = Hj + TiOj + 39,5 ккал
Таким образом, гидроокись титана(II) является сильным восста-
новителем. В то же время она проявляет свойства типичного осно-
вания. Она легко растворяется в кислотах с выделением водорода
и образованием солей титана(Ш):
2Т1(ОН)2 + 6Н+ = 2Ti3+ + 4Н2О + Н2
Если при этом через реагирующие компоненты пропускать водо-
род, то образуются соли титана(II):
Ti(OH)2 + 2Н+ = Т12+ + 2Н2О
При нагревании на воздухе Ti(OH)2 окисляется до метатитановой
кислоты:
2Ti(OH)2 + О2 = 2Н2Т1О3 + 241,4 ккал
Моносульфид титана 2’23134
Получение. Моносульфид — TiS (мол. вес 79,96) образуется
в системе титан — сера. Практически в этой системе моносульфид
титана может быть получен действием расплавленной серы на по-
рошкообразный титан при 400° С. Моносульфид титана получают
также при нагревании дисульфида или сесквисульфида в токе су-
хого водорода или при сплавлении этих сульфидов с порошкооб-
разным титаном:
TiS2 + H2 = TiS + H2S
Ti2S3 + Н2 - 2TiS + H2S
TiS2 + Ti = 2TiS
Теплота образования TiS равна 63,0 кал/моль.
Физические свойства. Моносульфид титана представляет собой
темно-красную массу с металлическим блеском. Это соединение
инконгруэнтно плавится при 1780° С. Плотность TiS при 0
и при 25° С составляет 4,159 и 4,050 г/см2. Энтропия при 25° С
равна 11,7 кал/(град-моль). Удельная магнитная воспри-
имчивость моносульфида при 20°С равна 2,34-10~6, а при
—183° С — 2,7-10'6 э.м.е./г. Теплота сублимации равна
1697 кал/г (или 135,9 ккал/моль).
Химические свойства. На воздухе при обычной температуре
моносульфид титана устойчив, а при нагревании он окисляется до
двуокиси:
TiS + 2О2 = TiO2 + SO2 + 233,4 ккал
При сплавлении моносульфида титана с элементарным тита-
ном под давлением образуется гемисульфид — Ti2S и субсуль-
фид — Ti3S.
Гемисульфид титана представляет собой металлоподобные кристаллы ром-
бической сингонии (а = 1135, b = 1406, с = 332 пм). Плотность гемисульфида
титана при 0 и 25°С равна 4,707 и 4,601 г/см\ При 1410° С инкогруэнтно пла-
вится с выделением кристаллов моносульфида. Щелочи, кислоты и окислители
на гемисульфид титана действуют так же, как на моносульфид, только более
медленно.
70
Вода, плавиковая, соляная и разбавленная серная кислоты не
реагируют с моносульфидом титана, а горячая концентрирован-
ная соляная кислота взаимодействует с ним со слабым выделе-
нием сероводорода. Концентрированная серная кислота раство-
ряет моносульфид титана. Концентрированная азотная кислота,
царская водка или теплая бромная вода окисляют моносульфид
титана с трудом. Растворы щелочей (даже кипящие) на моносуль-
фид не действуют. При действии на него теплым раствором пере-
киси водорода реакция окисления протекает спокойно. При сплав-
лении моносульфида титана с сульфидом алюминия образуется
двойной сульфид Al2TiS4.
Моноселенид титана 63
Получение. Моноселенид титана — TiSe (мол. вес 126,86) обра-
зуется в системе титан — селен и может быть получен при вза-
имодействии стехиометрических количеств элементарных титана
и селена при высокой температуре.
Физические свойства. Моноселенид титана представляет собой
черный порошок; кристаллизуется в гексагональной сингонии
(а = 715, с — 1200 пм). Плотность при 0° С равна 5,71, а при
25° С — 5,521 г/см3. Моноселенид обладает электронной проводи-
мостью; удельная электропроводность равна 5-Ю5 сим]м.
Удельная магнитная восприимчивость при 20°С состав-
ляет 2,19-ЮЛ при — 78° С — 2,23-10~б э. м. е./г.
Химические свойства. При гидролизе моноселенида титана вы-
деляется селеноводород. Концентрированная серная кислота рас-
творяет моноселенид, причем раствор окрашивается в зеленовато-
желтый цвет. Азотная кислота окисляет TiSe до двуокиси титана.
Бромная вода медленно разлагает моноселенид.
Монотеллурид титана64
Получение. Монотеллурид титана — TiTe (мол. вес 175,50)
образуется в системе титан — теллур и может быть получен пу-
тем сплавления стехиометрических количеств титана и теллура.
Физические свойства. Монотеллурид титана представляет собой
черные кристаллы гексагональной сингонии с параметрами решетки:
а — 383,4, с — 639,0 пм. Плотность при 25° С равна 6,137 г]см3.
Удельная электропроводность 1,6• 105 сим/м-, удельная
магнитная восприимчивость при 20° С составляет
2,10-10’6 э. м. е./г.
Химические свойства. В концентрированной серной кислоте
TiTe растворяется, раствор окрашивается в фиолетовый цвет.
КОМПЛЕКСАТЫ THTAHAJ11) -’
Из комплексатов (как мы будем называть соли комплексных
кислот) титана(II) известны такие соли минеральных кислот, как
хлорат, перхлорат, сульфат, гидросульфат, нитрат, нитрит, а также
71
перренат, сульфит, селенат, молибдат, вольфрамат, метасиликат
и соли органических кислот: карбонат, гидрокарбонат, формиат,
ацетат, оксалат, тиоцианат.
Хлорат титана(И)
Хлорат титана (II) — Ti(C103)2 (мол. вес 214,8) образуется в
водном растворе при смешении растворов сульфата титана (II) и
хлората кальция или бария. Получающийся после отделения
осадка сульфата кальция или бария раствор содержит хлорат ти-
тана(П). При осторожном испарении в вакууме из раствора мо-
гут быть выделены кристаллы хлората титана(II). Теплота обра-
зования его составляет 82 к.к.ал1молъ.
Хлорат титана(II) представляет собой кристаллы, раствори-
мые в холодной воде. При нагревании он легко распадается:
Ti (С1О3)2 = TiO2 + 2С1О2 + 94,5 ккал
Перхлорат титана(И)
Перхлорат титана(П)—Ti(C104)2 (мол. вес 246,80) образуется
в водном растворе при смешении растворов сульфата титана(II) и
перхлората кальция или бария. При осторожном испарении в ва-
кууме из раствора, получающегося после отделения осадка суль-
фата кальция или бария, могут, быть выделены кристаллы пер-
хлората титана(II). Теплота образования его составляет
92 ккал!моль.
Перхлорат титана(II) представляет собой кристаллы, раство-
римые в холодной воде. Он очень неустойчив и при нагревании
распадается.
Существует также перренат титана(П)—Ti(ReO4)2,
теплота образования его равна 432 ккал1моль.
Сульфат титана(П)
Сульфат титана(II) —T1SO4 (мол. вес 143'96) образуется при
растворении элементарного титана в разбавленной серной кис-
лоте:
Ti + H2SO4-TiSO4 + H2
Одновременное образование при этом сульфата титана(III) мож-
но предотвратить, пропуская через реакционную смесь ток газо-
образного водорода. Сульфат титана(II) образуется также при
растворении окиси или гидроокиси титана(П) в разбавленной сер-
ной кислоте и одновременном пропускании водорода:
TiO + H2SO4 = TiSO4 + Н2О
Ti (ОН)2 + H2SO4 = TiSO4 + 2H2O
72
Теплота образования сульфата титана(II) составляет
263 ккал/моль.
Сульфат титана(II) представляет собой кристаллы, раствори-
мые в воде. В растворе он способен ко всем реакциям иона Ti2+.
Растворы сульфата титана (И) обладают сильными восстанови-
тельными свойствами. Поэтому он применяется как восстанови-
тель в производстве органических красителей.
Гидросульфат титана(П)
Гидросульфат титана(П)—Ti(HSO4)2 (мол. вес 241,03) об-
разуется при действии на сульфат титана в водном растворе экви-
валентного количества серной кислоты:
TiSO4 + H2SO4 = Ti (HSO4)2
Теплота образования его составляет 464 ккал/моль.
Гидросульфат титана(II) растворим в холодной воде. При на-
гревании раствора на воздухе легко окисляется, образуя сульфа-
тосоединение титана(IV). Известны и другие комплексаты тита-
на(П); для некоторых из них ниже приведены теплоты образова-
ния:
Комплекса?............TiSO3 TiSeO4 TiMoO4 TiWO4
Д//Обр, ккал/моль .... 194 195 300 321
Нитрат титана(И)
Нитрат титана(П)—Ti(NO3)2 (мол. вес 171,91) образуется в
некотором количестве при растворении элементарного титана или
одноокиси титана в разбавленной азотной кислоте при одновре-
менном пропускании водорода:
Ti 4- 4HNO3 4- ЗН2 — Ti (NOg)2 + NH4NO3 4- ЗН2О
TiO 4- 4HNO3 + 4H2 = Ti (NO3)2 4- NH4NO3 4- 4H2O
Нитрат титана(II) образуется также в водном растворе при сме-
шении раствора нитрата серебра с раствором дихлорида титана,
полученным путем осторожного растворения его в воде при одно-
временном пропускании водорода. Получающийся после отделе-
ния осадка хлорида серебра раствор содержит нитрат титана (II).
Теплота образования его составляет 146 ккал/моль.
Нитрат титана(П) представляет собой кристаллы, раствори-
мые в холодной воде. При нагревании легко разлагается:
Ti (NO3)2 = TiO2 4- 2NO2 4- 73,6 ккал
Нитрит титана(П)
Нитрит титана(П)—Ti(NO2)2 (мол. вес 139,91) образуется
в водном растворе при смешении растворов сульфата титана (II) и
нитрита кальция или бария. Получающийся после отделения осад-
ка сульфата кальция или бария раствор содержит нитрит
78
титана (II). При осторожном испарении в вакууме из раствора мо-
гут быть выделены его кристаллы. Теплота образования нитрита
титана(II) составляет 108 ккал]моль.
Нитрит титана(II) представляет собой кристаллы, раствори-
мые в холодной воде. Прй Нагревании легко разлагается:
Ti (NO2)2 = TiO2 + 2NO + 74,4 ккал
Карбонат и гидрокарбонат титана(Н)
Карбонат титана(П)—TiCOg (мол. вес 107,91) образуется
при взаимодействии кристаллического карбоната натрия с холод-
ным насыщенным раствором сульфата титана(II):
TiSO4 4- Na2CO3 — TiCO3 4- Na2SO4
Теплота образования карбоната титана составляет 224 ккал]моль.
Карбонат титана(II) представляет собой крупообразную массу,
нерастворимую в холодной воде; в теплой воде он подвергается
гидролизу:
TiCO3 4* Н2О — Ti (ОН)2 4- СО2 —12,3 ккал
Гидрокарбонат титана(П) —П(НСОз)2— образуется припро-
пускании газообразной двуокиси углерода через взвесь карбоната
титана в холодной воде:
TiCO3 4- Н2О 4- СО2 = Ti (НСО3)2 4- 9,6 ккал
Теплота образования гидрокарбоната титана(II) составляет
396 ккал]моль.
Гидрокарбонат титана(II) растворим в воде.
Карбонат и гидрокарбонат титана(II) очень неустойчивы. При
действии кислорода (находясь даже просто на воздухе) они окис-
ляются до соответствующих соединений титана (IV). С кислотами
карбонаты титана(II) реагируют с выделением двуокиси угле-
рода и одновременно водорода и образованием солей титана(III).
Формиат титана(И)
Формиат титана(П)—Ti(CO2H)2 (мол. вес 137,94) образует-
ся при растворении гидроокиси титана(II) в муравьиной кислоте:
Ti (ОН)2 4- 2НСО2Н = Ti (СО2Н)2 4- 2Н2О
Теплота образования его составляет 253 ккал/моль.
Формиат титана(II) представляет собой кристаллы, раствори-
мые в воде, обладает восстановительными свойствами.
Ацетат титана(Н)
Ацетат титана(П)—ТЦСОгСНз^ (мол. вес 165,99) образуется
при растворении гидроокиси титана(II) в уксусной кислоте:
Ti (ОН) 2 4- 2НСО2СН3 - Ti (СО2СН3)2 4- 2Н2О
Теплота образования его составляет 285 ккал/моль.
74
Ацетат титана (II) представляет собой кристаллы, раствори-
мые в воде, обладает восстановительными свойствами.
Оксалат титана(И)
Оксалат титана (II) —Т1СгО4 (мол. вес 135,92) образуется при
растворении гидроокиси титана (II) в водном растворе щавелевой
кислоты. Теплота образования его равна 264 ккал/моль.
Оксалат титана(II) хорошо растворим в воде, обладает вос-
становительными свойствами.
Тиоцианат титана(П)
Тиоцианат титана(II)—Ti(NCS)2 (мол. вес 164,06) получает-
ся в результате реакции обмена между солями титана (II) (хло-
ридом, сульфатом) и тиоцианатами калия, натрия или аммония:
Ti2+ + 2NCS~= Ti (NCS)2
Теплота образования его равна 10 ккал/моль.
Тиоцианат титана(II) представляет собой зеленые кристаллы,
растворимые в воде, но с незначительной диссоциацией на ионы.
Тиоцианат титана(II) хорошо растворим также в эфире, что ис-
пользуют для извлечения тиоцианата титана(II) из водных рас-
творов. Эта реакция используется в качественном анализе для от-
крытия ионов Ti2+ (интенсивное зеленое окрашивание эфирного
слоя).
ГЛАВА IV
СОЛИ ТРЕХВАЛЕНТНОГО ТИТАНА
Соединения титана(III) сравнительно легко образуются восста-
новлением соединений титана(IV) водородом в растворах или при
электролизе. Для титана(III) в его соединениях характерна скорее
ковалентная химическая связь, чем ионная.
ГАЛИДЫ ТИТАНА (III)
Галиды (галогениды) титана (III), или тригалиды титана, хотя
и считаются солями, но отличаются от типичных солей способ-
ностью подвергаться гидролизу при растворении в воде и образо-
вывать двойные или даже комплексные соли с галидами щелоч-
ных металлов.
Трифторид титана 21-23’66
Трифторид титана — TiF3 (мол. вес 104,895) является соедине-
нием промежуточного характера, хотя обычно его считают солью.
Наряду с солевыми свойствами он проявляет в некоторой мере и
кислотообразующие свойства, что выражается в способности TiF3
к образованию комплексных солей — фторо-(Ш)титанатов. Есть
сообщения, что трифторид титана может существовать в виде
двух изомеров: фиолетового и зеленого.
Получение. Трифторид титана образуется при взаимодействии
фтороводорода с гидридом титана при 700° С:
TiH + 3HF = TiF3 + 2Н2
и с трихлоридом титана:
TiCl3 + 3HF = TiF3+ЗНС1
Трифторид образуется также при восстановлении тетрафто-
рида кремнием:
4TiF4 + Si = 4TiF3 + SiF4
Давно известен способ получения сухого трифторида титана
путем нагревания безводного гексафторотитаната калия в токе су-
76
х.ого водорода:
2К2 [TiFJ + Н2 = 2TiF3 + 4KF + 2HF
Однако в чистом виде трифторид титана получить этим способом
не удается; продукт всегда загрязнен пентафторо-(III)титанатом
калия.
Трифторид титана можно получить при растворении элемен-
тарного титана в 27 %-ной плавиковой кислоте:
2Ti + 6HF.= 2TiF3 + 3H2
а также при восстановлении гексафторо-(IV)титаната калия цин-
ком, кадмием или амальгамой натрия в солянокислотной среде.
Однако растворы также загрязнены фторо-(III)титанатами ка-
лия.
Стандартная теплота образования твердого TiF3 при 25° С со-
ставляет 337,5 ккал/моль, газообразного — 278,2 ккал/моль. Энер-
гия Гиббса образования TiF3 равна: твердого 320,95 ккал/моль,
газообразного 274,77 ккал/моль.
Физические свойства. Безводный трифторид титана — кристал-
лический порошок фиолетового цвета. Кристаллизуется в ромбо-
эдрической сингонии (две молекулы в ячейке, а = 552,3 пм, а =
= 55°88'). Плотность трифторида титана 3,001 г/смъ.
В глубоком вакууме трифторид сублимируется при 930—
1000° С. Температура его плавления 1230° С, темпе-
ратура кипения около 1500° С. Теплота плавления
114 ккал/г, или 11,96 ккал/моль, теплота испарения
467 кал/г, или 48,99 ккал/моль.
Стандартная теплоемкость твердого трифторида титана
21,99 кал/(град• моль). Зависимость теплоемкости твердого три-
фторида титана от температуры выражается уравнением: Ср =
— 18,65 + 0,0112 Т. Теплоемкость жидкого трифторида титана со-
ставляет 24, а газообразного—14,1 кал/(град-моль). Энталь-
пия газообразного TiF3 при 25° С равна 3108 кал/моль. Стандарт-
ная энтропия равна: твердого 24,5 кал/(град - моль), газообраз-
ного 68,49 кал/ (град- моль). Приведенная энергия Гиббса
газообразного TiF3 равна 58,06 кал/ (град-моль).
Эффективный магнитный момент трифторида титана
составляет 1,75 цв-
Химические свойства. При нагревании в вакууме до t > 950° С
трифторид титана медленно диспропорционирует на элементар-
ный титан и тетрафторид:
4TiF3 — Ti 4- 3TiF4 — 237 ккал-, i\G = -I- 197,1 ккал
Сублимация и плавление трифторида титана могут быть осуще-
ствлены в атмосфере паров искусственно вводимого тетрафто-
рида титана.
77
На воздухе TiF3 начинает окисляться при t> 100° С. Под дей-
ствием элементарного фтора образуется тетрафторид:
2TiF3 + F2 = 2TiF4 + 113,4 ккал-, AG = —103,4 ккал
С хлором, бромом или иодом трифторид титана дает смешанные
галиды титана:
2TiF3 + С12 = 2TiF3Cl; 2TiF3 4- Br2 = 2TiF3Br
Трифторид титана плохо растворим в холодной воде, горячей
водой и горячими разбавленными растворами кислот и щелочей
не разлагается, но разлагается концентрированными растворами
кислот и щелочей.
В растворе трифторид взаимодействут с фторидами щелочных
металлов и аммония с образованием комплексных солей двух ти-
пов: пентафторо-(Ш)титанатов — MeaTiFs и гексафторо-(III)-тита-
натов— Me3TiF6, сравнительно плохо растворимых в воде.
Фторо-(Ш)титанаты
Пентафторо-(1П)титанат калия образуется в виде труднорастворнмого осад-
ка (растворимость в воде около 5%) при смешении водных растворов фторидов
калия и титана (III):
2KF+ TiF3 = K2TiF5
Сухой способ получения этого соединения заключается в восстановлении гекса-
фторо-(IV) титаната калия в токе водорода при 770° С:
2К2 [TiF6] + Н2 = 2K2TiF6 + 2HF
При возгонке пентафторо- (III) титанат а калия в глубоком вакууме при
840° С происходит диспропорционирование его на гексафторотитанат и тетрафто-
ротитанат калия:
2К2 [TiFs] = К3 [TiF6] + К [TiF4]
Гексафторо-(1П)титанат калия представляет собой кристаллы фиолетового
цвета; плотность его 2,82 г1см?-, магнитный момент 1,70 цв. Он медленно раство-
ряется в воде и окисляется во влажном воздухе с образованиемгексафторо-(1У)-
титаната калия:
2К3 [TiF6] + 102 + Н2О = 2К2 [TiF6] + 2КОН
Пентафторо-(П1)титанат аммония образуется в виде труднорастворимого
осадка при смешении водных растворов фторидов аммония и титана(III):
2NH4F + TiF3 = (NH4)2 [TiFe]
Гексафторо-(Ш)титанат аммония образуется при обработке раствором фто-
рида аммония пентафторотитанатов аммония или калия:
(NH4)2 [TIF6] 4- NH4F= (NH4)3 [TiF6]
K2 [TiF6] + 3NH4F = (NH4)3 [TiF6] + 2KF
Гексафторотитанат аммония — красно-фиолетовые кристаллы, которые имеют
форму правильных октаэдров; нерастворим в воде, но растворим в кислотах с
78
образованием растворов зеленого цвета. Соединение легко окисляется на воздухе:
2 (NH4)3 [TiF6] + ~ О2 = 2 (NH4)2 [TiF6] + 2NH3 + Н2О
Предложен способ получения пентафторо- и гексафторо-(1П)титанатов ще-
лочных металлов и аммония путем нагревания смеси одноокиси титана и фтори-
дов соответствующих металлов в инертной атмосфере при 100° С.
Трихлорид титана 19> 65'67-71
Трихлорид титана — TiCls (мол. вес 154,26) является соедине-
нием промежуточного характера. Подобно трифториду, он наряду
с солевыми свойствами проявляет в некоторой мере и кислотообра-
зующие свойства, выражающиеся в способности к образованию
комплексных солей — хлоро-(Ш)титанатов. Характерной особен-
ностью трихлорида титана являются также восстановительные
свойства. Трихлорид титана известен как в безводном состоянии,
так и в виде аквасоединений.
Получение. Безводный трихлорид титана образуется при вос-
становлении тетрахлорида различными восстановителями. Так,
водород и тетрахлорид титана реагируют при 500—800° С:
2TiCl4 + Н2 = 2TiCl3 + 2НС1
Реакция обратима; восстановление идет быстро и легко с относи-
тельно хорошим выходом. Восстановление тетрахлорида титана
водородом под действием тихого электрического разряда идет да-
же при обычной температуре, причем также образуется трихло-
рид.
В качестве восстановителей тетрахлорида титана могут быть
использованы металлы, например натрий при 270° С и магний при
400° С:
TiCl4 + Na = TiCl3 + NaCl; 2TiCl4 + Mg = 2TiCl3 + MgCl2
Трихлорид титана образуется при нагревании тетрахлорида с се-
ребром до 180—200° С в запаянной трубке:
TiCl4 + Ag = TiC 13 + AgCl
До трихлорида тетрахлорид титана восстанавливается ртутью при
t> 100° С:
2Ti С14 + Hg = 2TiCl3 + HgCl2
а также алюминием в присутствии хлорида алюминия:
3TiCl4 + А1 = 3TiCl3 + А1С13
Трихлорид титана образуется при взаимодействии тетрахло-
рида с элементарным титаном при 250° С под давлением:
3TiCl4 + Ti = 4TiCl3
При определенных условиях трихлорид титана получается при
взаимодействии дихлорида с тетрахлоридом:
TiCl2 + TiCl4 = 2TiCl3
79
а также при восстановлении тетрахлорида ртутьорганическими
соединениями, например диэтилртутью при 100° С в "атмосфере
хлора:
2T1CI4 + 2Hg (С2Н5)2 = 2Т1С13 + 2HgCl (С2Н5) + С4НЮ
или дифенилртутью в бензольном растворе:
2Т1С14 + 2Hg (С6Н5)2 = 2TiCl3 + 2HgCl (CeHg) + (С6Н5)2
В водных растворах трихлорид титана образуется при рас-
творении элементарного титана в соляной кислоте в атмосфере
водорода:
2Ti + 6НС1 = 2TiCl3 + ЗН2
а также при восстановлении растворов, содержащих соединения
титана(IV), например при действии цинка, кадмия или олова на
раствор диоксида или тетрахлорида титана в соляной кислоте.
Стандартная теплота образования твердого Т1С13 при 25° С со-
ставляет 172,3 ккал/моль, жидкого— 161,0 и газообразного— 129,3.
Энергия Гиббса образования Т1С13 равна: твердого 156,3 ккал/моль,
газообразного 126,0 ккал/моль.
Получение безводного трихлорида титана. Штелер и Бахрон рекомендуют
получать безводный трихлорид титана нагреванием смеси паров тетрахлорида
титана с водородом. Прибор для этого синтеза (рис. 10) состоит из нагревателя,
Рис. 10. Аппарат для получения трихлорида титана:
1 — силундовая трубка; 2 — угольные стержни; 3~ медные проволоки;
4 — стеклянные колпачки; 5 —трубка для ввода реакционной смеси;
6 — медная муфта.
представляющего собой силундовую трубку 1 (длиной 25 см с внешним диамет-
ром -12 мм и внутренним — 4 мм), закрепленную обоими концами в угольных
стержнях 2, к которым по толстым медным проволокам 3 подводится ток высо-
кого напряжения. Этот прибор окружен двойной медной муфтой 6, между стенка-
ми которой циркулирует холодная вода. Концы угольных стержней приблизитель-
но на одну треть выступают из медного холодильника и прикрыты стеклянными
колпачками 4, благодаря чему реакционное пространство между нагревательным
прибором и холодильником оказывается герметически закрытым. Соединения
всех частей уплотнены резиновыми кольцами и покрыты коллодием.
После того как прибор собран, из него вытесняют воздух и влагу током
сухого водорода, причем трубку 1 слабо нагревают. Затем к трубке 5 присоеди-
няют колбу с тетрахлоридом титана. Через эту колбу, нагретую до 60—70° С,
пропускают водород, предварительно тщательно очищенный от кислорода и влаги
80.
пропусканием через платинированный асбест и полупятиокись фосфора. При этом
водород насыщается парами тетрахлорида титана и поступает в реакционное
пространство. Силундовую трубку • нагревают до температуры светло-красного
каления, а водород пропускают с такой скоростью, чтобы в выходящем из реак-
ционного пространства газе содержались следы тетрахлорида титана. Через два
часа внутренняя поверхность медной муфты покрывается толстым слоем три-
хлорида титана. По окончании работы отъединяют колбу с тетрахлоридом ти-
тана и дают аппарату остыть в токе водорода. Восстановление водородом идет %
быстро и легко и с относительно хорошим выходом.
Физические свойства. Безводный трихлорид титана существует
в двух кристаллических модификациях: а — чешуйчатые кристал-
лы, гексагональной сингонии, и 0 — игольчатые кристаллы, ром-
боэдрической сингонии. Кристаллы обоих видов в отраженном свете
черные, в .проходящем — фиолетовые; они изоморфны кристаллам
трихлоридов скандия, ванадия и железа. Параметры решетки
a-формы при Z = 6: а = 612,5, с= 1752 пм; расстояние Ti-> С1
равно 247 пм. Параметры решетки 0-формы при Z = 2: а =
= 682,0 пм, а = 53° 20'. Энергия связи Ti — Cl равна 0,76 адж.
Плотность трихлорида титана при 25° С равна 2,656 г/см3.
Температура плавления 920° С*, теплота плавления
78 кал]г, ил‘и 12,03 ккал/моль.
Зависимость давления пара твердого трихлорида титана от тем-
пературы выражается уравнением: 1g р = 10,947 — 7818/7'.
Теплота сублимации твердого трихлорида титана при
25° С равна 273, а при 415° С — 253 кал/г. Зависимость теплоты
сублимации X (в кал/г) от температуры в интервале от 25 до 415° С
выражается уравнением: К = 281 — 0,0257’— 1,23-10—372.
Теплоемкость трихлорида титана при 25° С составляет
23,22 кал/(град моль). Зависимость теплоемкости твердого три-
хлорида титана от температуры (290—1160° К) выражается урав-
нением: Ср = 22,94 4- 2,62-10-3 Т — 44350/7’2. Теплоемкость жидкого
трихлорида титана равна 31 кал/(град-моль). Зависимость тепло-
емкости газообразного трихлорида титана от температуры (290—
2000° К) выражается уравнением: Ср = 19,86 4- 8,05-10-5 Т —
264 400/7’2.
Зависимость энтальпии твердого трихлорида титана от тем-
пературы (290—1150° К) выражается уравнением: Нт — Но =
= 22,947’4- 0,001317'2-!- 44 350/7' — 2110, а газообразного— урав-
нением: Нт-Но= 19,717'4-4,025 • 10~5Т24-264400/Т - 3050
Стандартная э нт р о пи я твердого TiCl3 составляет 33,4, а га-
зообразного 76,25 кал/(град-моль). Приведенная энергия Гиббса
при 25° С: твердого трихлорида равна —16,63, газообразного
—63,76 кал/(град-моль).
Значения термодинамических свойств трихлорида титана при
различных температурах приведены в Приложении 12.
Зависимость удельной магнитной восприимчивости
(см. также Приложение 13) трихлорида титана от температуры
* Под давлением газообразного тетрахлорида титана.
81
в интервале от 70 до 235° К выражается уравнением:
Х = 1,06- 10-.8Г+ 1 • КГ28?10
а в интервале от —30 до 450° С — уравнением:
X = 7,20 • 10-8 — 1 • 10~8/ + 1 • 10~13/2+ 1 • 10~“/3 + 2,5- 10~‘V-6 - 10~19/5
Химические свойства. При нагревании в вакууме до 500° С
и выше трихлорид титана диспропорционирует на дихлорид и тет-
рахлорид:
2TiCI3 = TiCl2 + TiCI4 — 38,1 ккал-, AG = 4- 26,1 ккал
Значения общего давления и парциальных давлений составных ча-
стей паровой смеси при диспропорционировании для различных
температур приведены в табл. 6.
Таблица 6. Значения давлений пара (в мм рт. ст.)
при диспропорционировании TiCl3
t, °C ^общ РТ1С13 PTiCl2 РТ1С14
530 16,5 4,2 0,001 12,4
575 53,0 14,8 0,005 38,0
590 75,5 21,9 . 0,008 53,2
625 177,4 56,6 0,019 117
655 339 105 0,039 232
Теплота диспропорционирования трихлорида титана при 25°С
составляет 38, а при 400° С — 35 ккал!моль. Изменение теплоем-
кости при диспропорционировании равно 8,1 кал/(град • моль); из-
менение энтропии в среднем равно 36 кал/(град моль).
При нагревании трихлорида титана в токе водорода одновре-
менно с реакцией диспропорционирования происходит восстанов-
ление:
2TiCI3 + Н2 = 2TiC 12 4- 2НС1 — 59,3 ккал-, AG = 4- 41,2 ккал
При нагревании в кислороде трихлорид титана окисляется:
4TiCI3 + О2 = 3TiCl4 + TiO2 + 85,3 ккал-, AG = — 107,6 ккал
Во влажном воздухе окисление сопровождается отщеплением хло-
роводорода.
С парами воды трихлорид реагирует при 600° С:
ТiClз + Н2О = TiOCl + 2НС1 - 4 ккал
Окисление трихлорида титана происходит также под действием
галогенов:
2TiClз 4~ 4F2 — 2TiF4 4- ЗС12 4- 443,8 ккал
2T1CI3 4- Cl2 e 2TiC 14 4- 41,2 ккал
2Т1С13 4_ Вг2 = 2Т1С13Вг 4- 17,7 ккал
2TiCI3 4-12 = 2TiCl3I
82
При нагревании трихлорида титана с серой или селеном в ва-
кууме происходит образование сульфид- или селенидхлорида ти-
тана (IV)
2TiCl3 + S = TiCl2S + TiCl4
При нагревании трихлорида титана со щелочными или щелоч-
ноземельными металлами происходит восстановление его до эле-
ментарного титана:
TiCI3 + 3Na = Ti + 3NaCl 4-122 ккал-, AG = — 119,0 ккал
С фтороводородом трихлорид образует трифторид:
TiCIз + 3HF = TiF3 + ЗНС1 + 37,6 ккал-, AG = — 21,0 ккал
а при действии хлороводорода при высокой температуре окис-
ляется:
2TiCI3 + 2НС1 = 2TiC!4 + Н2 — 24,7 ккал-, AG =4-11,1 ккал
Сухой трихлорид титана растворяется в воде со вспышкой, а во
влажном воздухе расплывается.
С оксидами железа(III), титана(IV) и кремния трихлорид ти-
тана реагирует при 600°С с образованием монохлороксида
титана (III):
5ТiCl3 + Fe2O3 = ЗТЮС1 + 2TiC 14 + 2FeCl2 + 18 ккал
2TiC 13 + TiO2 = 2TiOCl + TiCl4 - 23 ккал
2TiCI3 + SiO2 = 2T1OC1 + SiCl4 — 44,5 ккал
Из водного раствора трихлорида титана при медленном испаре-
нии воды или при пропускании через раствор газообразного хлоро-
водорода кристаллизуется TiCl.r6H2O фиолетового цвета. Это со-
единение представляет собой соль с комплексным гексаквати-
тан (III)-катионом октаэдрической структуры — [Ti (Н2О)6]3+С1з_—
хлорид гекса кв атитана(Ш).
В начале XX века Штелер сообщил о получении им другого изомера шести-
водного соединения трихлорида титана (зеленого цвета) путем смешения насы-
щенного раствора фиолетового водного соединения с абсолютным эфиром и на-
сыщения смеси хлороводородом. По его же сообщению, при выпаривании рас-
твора трихлорида титана в соляной кислоте кристаллизуется соединение
TiCl3 • 4Н2О зеленого цвета. Этим зеленым соединениям может быть приписана
структура хлоридов тетраквадихлоротитана(Ш) [TiCl2 (Н2О) 4] • 2Н2О и
[TiC12(H2O)4]. Однако следует отметить, что в дальнейшем эти зеленые соли
с тетраквадихлоротитан(Ш)-катионом воспроизведены не были.
Из водных растворов трихлорида титана растворы гидроокисей,
карбонатов и сульфидов щелочных металлов и аммония выделяют
осадок гидроокиси титана (III):
TiC 13 + ЗОН- = Ti (ОН)3 + ЗСГ
2TiCI, + ЗСО?~+ ЗН,0 = 2Ti (ОН), + 6СГ+ ЗСО,
Однако при действии на холодный насыщенный раствор трихло-
рида титана кристаллическим карбонатом натрия в осадок
83
выпадает не гидроокись, а карбона т-г и дроксид титана (III):
2TiC 13 + 3Na2CO3 + Н2О = 2Ti (ОН) СО3 + 6NaCl + СО2
Муравьиная, уксусная и щавелевая кислоты осаждают со-
ответственно формиат, ацетат и оксалат титана(III).
В водных растворах трихлорид титана легко проявляет восста-
новительные свойства, т. е. легко восстанавливает в растворах раз-
личные окислители (галогены, перекись водорода, гидроксоамин,
гидразин, азотную, хлорную, марганцовую, хромовую кислоты и их
соли, соли железа(III) и др.). В связи с этим растворы трихло-
рида применяют в аналитической химии для количественного опре-
деления окислителей.
При пропускании газообразного аммиака над трихлоридом ти-
тана при обычной температуре (с выделением теплоты) образуется
белый хлорид гексамминтитана(III):
TiCI3 + 6NH3=[Ti(NH3)6]Cl3
С жидким аммиаком реакция идет аналогичным образом: хлорид
гексамминтитана(III) образуется через 12 ч после начала реакции
в виде белого порошка. При нагревании в вакууме до 300° С хло-
рид гексамминтитана(III) отдает 4 молекулы аммиака и обра-
зуется очень реакционноспособный черный трихлороамидо-(Ш)ти-
танат аммония:
[Ti (NH3)6] Cl3 = (NH4) [Ti (NH2) Cl3] + 4NH3
Трихлорид титана трудно растворим в жидком хлороводороде;
нерастворим в тетрахлориде титана.
Безводный трихлорид растворяется в расплавленных хлоридах
щелочных металлов с образованием комплексных солей трех типов:
тетрахлоротитанатов — MeTiCl4, пентахлоротитанатов — Me2TiCl5 и
гексахлоротитанатов — Me3TiCl6. В солянокислотном растворе три-
хлорид титана также взаимодействует с хлоридами щелочных
металлов с образованием комплексных солей — аквапентахлороти-
танатов — Me2[TiCls(H2O)]— сравнительно плохо растворимых в
соляной кислоте.
Трихлорид титана не растворяется в предельных и ароматиче-
ских углеводородах, галогенпроизводных предельных и аромати-
ческих углеводородов. В то же время трихлорид титана хорошо
растворяется в различных спиртах, в частности в метаноле и эта-
ноле. В спиртовых растворах трихлорид реагирует с метилатом и
этилатом натрия с образованием соответственно триметилата и
триэтилата титана:
TiCl3 + 3NaOCH3 = Ti (ОСН3)3 + 3NaCl
TiCl3 + 3NaOC2H5 = Ti (OC2H6)3 + 3NaCl
В эфирах и сероуглероде трихлорид титана нерастворим.
Трихлорид титана взаимодействует с дикетонами, в частности
с а цетилацетоном реагирует с образованием димерного продукта:
2TiС13 + 4СН3СОСН2СОСН3 = Ti2Cl2 (СН3СОСНСОСН3)4 + 4HCI
84
Хлоро-(Ш)титанаты
Гексахлоро-(111)титанат натрия образуется в системе TiCl3—NaCl:
TiCl3 + 3NaCl = Na3TiCl6
в виде инконгруэнтно плавящегося при 553° С соединения.
Хлоро-(111)титанаты калия. В системе TiCl3—К.С1 образуются три соедине-
ния: тетрахлоротитанат калия — KTiCl4, конгруэнтно плавящийся при 654° С, пен-
тахлоротитанат калия — KaTiClg, инконгруэнтно плавящийся при 605° С, и гекса-
хлоротитанат калия — KaTiCle, конгруэнтно плавящийся при 783° С. При смеше-
нии солянокислотных растворов трихлорида титана и хлорида калия выделяется
аквапентахлоротитанат калия — KstTiCls(НгО)], от которого при нагревании до
112° С отщепляется молекула воды.
Хлоро-(111)титаиаты рубидия. Тетрахлоротитанат рубидия — RbTiCl4—и гек-
сахлоротитанат рубидия — RbsTiClg — образуются в системе TiCl3—RbCl в виде
конгруэнтно плавящихся соответственно при 800 и 794° С соединений. Аквапента-
хлоротитанат рубидия — Rb2[TiCls (Н2О)] — выделяется при смешении концентри-
рованных солянокислотных растворов хлоридов рубидия и титана(III); при на-
гревании до 212° С он разлагается с выделением молекулы воды.
Хлоро-(111)титанаты цезия. В системе TiCl3—CsCl образуются два кон-
груэнтно плавящихся соединения: тетрахлоротитанат цезия — CsTiCl4 (Io =
= 781° С) и гексахлоротитанат цезия — Cs3TiCl6 (/пл = 770° С). При смешении
концентрированных солянокислотных растворов хлоридов цезия и титана(III)
выделяется аквапентахлоротитанат цезия — Cs2[TiCls(H2O)]; температура от-
щепления молекулы воды 270° С. Получен также эннеахлородититанат цезия —
Cs3Ti2Clg.
Тетрахлоро-(111)титанат меди(1)—CuTiCl4 —образуется при действии меди
на тетрахлорид титана в присутствии кислорода как катализатора. Он представляет
собой пурпурно-черные кристаллы гексагональной сингонии (а = 722, с= 1764 пм)
с плотностью 6,20 г1см~\ При нагревании тетрахлоротитанат меди(1) разлагается
на монохлорид меди и трихлорид титана.
Трибромид титана 2’21>23
Трибромид титана — TiBr3 (мол. вес 287,61) является соедине-
нием промежуточного характера. Восстановительные свойства три-
бромида титана сильнее, чем трихлорида, поскольку сказываются
восстановительные свойства бромид-иона.
Получение. Трибромид титана образуется при растворении
элементарного титана в водном растворе бромоводорода:
2Ti + 6НВг = 2TiBr3 + ЗН2
Безводный трибромид получается при восстановлении тетра-
бромида различными восстановителями, например водородом при
температуре красного каления (750° С):
2Т i Вг4 + Н2 = 2Т1Вг3 + 2НВг
или металлами (титаном, серебром, ртутью) при 300° С:
3TiBr4 + Ti = 4TiBr3
Трибромид титана образуется также при взаимодействии тетра-
бромида с дибромидом:
TiBr4 + Ti Вг2 = 2TiBr3
85
В растворе трибромид титана получается при электролитиче-
ском восстановлении раствора тетрабромида в 20%-ном водном
растворе бромоводорода.
Стандартная теплота образования твердого трибромида титана
составляет 133,8, а газообразного — 90,2 ккал!моль. Энергия Гибб-
са образования TiBr3 равна 125,6 ккал/моль.
Физические свойства. Безводный трибромид титана — вещество
красно-фиолетового цвета, существующее в двух кристаллических
модификациях: листочкообразные кристаллы гексагональной син-
гонии и игольчатые — тетрагональной. Энергия связи Ti—Вг равна
0,64 адж.
Плотность трибромида при 25° С составляет 3,94 г/см3, тем-
пература плавления его лежит выше 1260° С, давление
пара при 600° С равно 0,1 мм рт. ст. Теплота сублимации
152 кал/г.
Зависимость теплоемкости от температуры в интервале от
25 до 900° С выражается уравнением: Ср = 23,27 + 0,0035/.
Стандартная энтропия твердого TiBr3 равна 43,4, газообраз-
ного— 87,4 кал//град моль).
Трибромид титана парамагнитен. Зависимость удельной маг-
нитной восприимчивости (см. также Приложение 13) от
температуры в интервале от —200 до +200° С выражается урав-
нением:
% = 4 . Ю~9Г + 4 • 10-12Т2 + 1,5 • 10~13Г3 - 1,5 • 10~17Г6 + 1 • 10-42Г14
Химические свойства. При нагревании до 400° С без доступа
воздуха трибромид титана диспропорционирует на дибромид и тет-
рабромид:
2TiBr3 = Т1Вг2 + TiBr4 — 38,8 ккал
а при нагревании в атмосфере кислорода окисляется:
4TiBr3 + О2 = 3TiBr4 + ТЮ2 + 85,4 ккал
Окисление трибромида титана происходит также под действием
галогенов:
2TiBr3 + 4F2 — 2TiF4 + 3Br2 + 521 ккал
2Т1Вг3 + 4С12 = 2TiCl4 + ЗВг2 + 118,2 ккал
2TiBr3 + Вг2 = 2TiBr4 + 28,4 ккал
2TiBr3 + I2 = 2Ti Br3I
С газообразным бромоводородом трибромид образует тетра-
бромид:
2TiBr3 + 2НВг = 2Т1Вг4 + Н2 + 11,1 ккал
Сухой трибромид титана растворяется в воде, а во влажном
воздухе расплывается. Из водного (содержащего НВг) раствора
может быть выделено шестиводное соединение TiBr3-6H2O, пред-
ставляющее собой фиолетовую кристаллическую массу. Структура
шестиводного соединения [Т1(Н2О)б]Вг3, т. е. это бромид гексаква-
титана (III). Во влажном воздухе он расплывается в коричневую
86
дымящую жидкость. При этом происходит окисление его до т р и-
бромгидроксида титана (IV):
4 [Ti (Н2О)6] Вг3 + О2 = 4 [Ti (ОН) Вг3 • 4Н2О] + 6Н2О
Растворы гидроокисей, карбонатов и сульфидов щелочных ме-
таллов и аммония выделяют из растворов трибромида титана оса-
док гидроокиси титана(III):
TiBr3 + ЗОН- = Ti (ОН)3 + ЗВг-
В растворе трибромид титана проявляет свои восстановитель-
ные свойства, легко окисляясь различными окислителями (галоге-
нами, азотной кислотой и др.).
Безводный трибромид растворяется в расплавленных бромидах
щелочных металлов с образованием комплексных гексабромо-(III)-
титанатов — Me3[TiBr6]. В системе TiBr3—КВг образуется гексабро-
мо-(III) титанат калия — Ks[TiBre] — с температурой плавления
662° С, в системе TiBr3 — RbBr — Rb3[TiBre] (/Пл = 664°С) и
Rb3[TiBr9] (/пл = 647° С) и аналогичные соединения в системе
TiBr3—CsBr.
Трибромид титана хорошо растворяется в метиловом и абсо-
лютном этиловом спиртах и в ацетоне. Не растворяется в бензоле
и тетрахлориде углерода.
Трииодид титана 2>21
Получение. Трииодид титана — ТН3 (мол. вес 428,61) образует-
ся при прямом синтезе из элементарных титана и иода, а также
при растворении элементарного титана в водном растворе иодово-
дорода:
2Т1 +6HI = 2ТП3 + ЗН2
Безводный трииодид титана получается при восстановлении тет-
раиодида, например при взаимодействии тетраиодида с дииодидом:
Til4 + Til2 = 2TiI3
В растворе трииодид титана образуется при элетролитическом
восстановлении раствора двуокиси титана в концентрированном
водном растворе иодоводорода.
Стандартная теплота образования твердого трииодида титана
при 25° С составляет 81,4 ккал/моль, газообразного — 35,9 ккал/моль.
Энергия Гиббса образования твердого Til3 равна 80,5 ккал/моль,
газообразного — 48,4 ккал/моль.
Физические свойства. Безводный трииодид титана представ-
ляет собой фиолетово-черные иглообразные кристаллы с металли-
ческим блеском. Плотность при 25° С равна 4,76 г/см3, температура
плавления около 900° С.
Стандартная теплоемкость трииодида титана равна
27,909 кал/(град моль).
Зависимость теплоемкости от температуры в интервале от
25 до 900° С выражается уравнением: Ср = 27,39 + 0,00174 Т.
87
Энтропия твердого трииодида титана при 25°С составляет
46,0 кал/(град моль), газообразного — 90,9 кал!(град• моль).
Магнитной восприимчивостью трииодид титана не обладает.
Химические свойства. При нагревании в вакууме без доступа
воздуха до t > 350° С трииодид диспропорционирует на дииодид и
тетраиодид:
2TiI3 = Til2 4- Til.( — 29,7 ккал
а при нагревании в атмосфере кислорода — окисляется:
2Ti 13 4~ 2О2 — 2TiO2 4~ 312 4- 288 ккал
Окисление происходит также под действием галогенов:
2Ti 13 4- 4Гз ~ 2Tir4 4~ 312
2Ti 13 4-12 = 2Ti 14 4- 21,2 ккал
Из водного, содержащего иодоводород, раствора трииодида ти-
тана может быть выделено шестиводное соединение ТПз'6Н2О,
представляющее собой фиолетовую кристаллическую массу. Струк-
тура этого соединения [Ti(Н2О)еЦз, т. е. это — иодид гексаква-
титана (Ш). На воздухе он легко окисляется:
4 [Ti (Н2О)6] 13 4- ЗО2 = 4 [Ti (ОН)3 I (Н2О)2] 4- 412 4- ЮН2О
В растворе трииодид титана также легко окисляется при дей-
ствии кислорода и других окислителей.
Трииодид титана образует комплексы с карбамидом (мочеви-
ной), триметиламином, пиридином, а- и у-пиколином, фенантроли-
ном, метилцианидом, диоксаном.
ХАЛЬКОГЕНИДЫ ТИТАНА[1Н)
Из халькогенидов титана(III), или сесквихалькидов титана, из-
вестны оксид, сульфид, селенид и теллурид. Кроме того, известна
еще гидроокись титана(III). Халькогениды титана(III) имеют ос-
новной характер, выраженный, однако, очень слабо. Характерным
их признаком являются восстановительные свойства.
Полутораокись титана 21-23’30’53159’7273
Получение. Полутораокись титана — Т120з (мол. вес 143,80)
образуется в системе титан — кислород. Стандартная теплота об-
разования равна 362,8 ккал/моль. Энергия Гиббса образования
342,23 ккал/моль. Практически полутораокись титана может быть
получена при взаимодействии двуокиси титана с элементарным ти-
таном в вакууме:
Ti 4- 3TiO2 = 2Ti2O3
В системе титан — кислород полутораокись титана образует
твердые растворы, причем фаза на основе полутораокиси титана
устойчива в узком интервале составов от TiOi,4e до TiOi.ss- Полуто-
88
раокйсь титана и образуемые ею твердые растворы кристаллизуют*
ся, когда в системе содержится от 59 до 61 атомн.% кислорода.
Полутораокись титана получают путем восстановления двуоки-
си титана элементарным титаном, а также и другими металлами.
Так, при восстановлении двуокиси титана парами натрия полу-
чается смесь полутораокиси и одноокиси титана, а при нагревании
двуокиси титана с магнием или кальцием до 1200° С или с магнием
в водороде до 750—800° С— полутораокись титана.
Полутораокись титана образуется при восстановлении двуокиси
титана углеродом или окисью углерода при 1400° С:
2TiO2 4- С = Ti2O3 + СО
2ТЮ2 + СО = Ti2O3 + СО2
или карбидом титана в инертной атмосфере при 1000—1200° С:
5TiO2 + TiC = 3Ti2O3 + СО
а также при восстановлении двуокиси титана водородом при
1000—1200° С:
2ТЮ2 + Н2 = Ti2O3 + Н2О
и при пропускании смеси водорода с парами тетрахлорида титана
при 650° С над нагретой до 1000° С двуокисью титана:
3TiO2 + TiCI4 + 2Н2 = 2Ti2O3 + 4НС1
Полутораокись титана получается и при нагревании смесей кар-
бида титана с окисями магния, кальция или цинка до 1000—
1200° С в инертной среде. Она может быть выделена также при
длительном нагревании из кристаллического продукта присоедине-
ния параформальдегида к тетрахлориду титана.
Получают полутораокись титана по методам, основанным на
восстановлении двуокиси титана (восстановители — уголь-, водород,
магний, кальций, титан).
При получении ПгОз восстановлением ТЮ2 элементарным ти-
таном смесь титана и его двуокиси (1:5) после тщательного пере-
мешивания брикетируют и нагревают в вакууме. В продукте,
полученном в результате нагревания до 1400—1500° С и выдержи-
вания в течение 3—6 ч при этой температуре, основной фазой
является полутораокись титана, однако кроме этой фазы в неболь-
ших количествах присутствует также элементарный титан, дву-
окись, одноокись титана и окись ТыСЬ. При нагревании смеси до
температуры выше 1550° С независимо от продолжительности вы-
держивания реакция восстановления идет до конца: образуется
одна фаза — полутораокись титана.
Физические свойства. Полутораокись титана — кристаллы от
темно-фиолетового до черного цвета, относящиеся к тригональной
•сингонии. Существует в двух полиморфных модификациях: аир —
с температурой и теплотой полиморфного превращения 200° С и
219 кал!моль (или 1,52 кал[г) соответственно; a-Ti2O3 устойчива
89
до t = 200° С, имеет ромбоэдрическую решетку типа а-корунда
(а = 524, с = 1361 пм, а = 56° 36').
Плотность полутораокиси титана при 10° С равна 4,601 и
при 25° С — 4,53 г/см3. По твердости она превосходит стекло и усту-
пает кварцу.
Температура плавления Ti2O3, по данным изучения си-
стемы титан — кислород, 1880° С, теплота плавления 26,3 ккал!моль
(или 183 кал/г). Жидкая Ti2O3 разлагается при 3200° С.
Мольная теплоемкость полутораокиси титана при 25° С
составляет 23,25 кал/ (град-моль). Зависимость мольной теплоем-
кости <x-Ti2O3 от температуры в интервале от 298 до 470° К выра-
жается уравнением: Ср = 7,31 + 0,005348 Т. Зависимость мольной
теплоемкости p-Ti2O3 от температуры в интервале от 480 до
1800° К —уравнением: СР = 34,68 + 1,30 • 10"3 Т— 1 020000/Т2. Из-
менение теплоемкости при полиморфном превращении полутора-
окиси титана равно —1,88 кал/ (град • моль).
Зависимость энтальпии полутораокиси титана от темпера-
туры в интервале от 250 до 470° К (a-Ti2O3) выражается уравне-
нием:
н°т - Н° = 7,31 Т + 2,674 • 10~272 - 1122
а в интервале от 480 до 2000° К (fJ-Ti2O3)— уравнением:
Н°т - Н° = 34,687 + 6,5 • 10-2Т2 + 1 020 000/7 - 10 175
Стандартная энтропия полутораокиси титана составляет
18,83 кал/(град-моль). Зависимость энтропии a-Ti2O3 от темпера-
туры (250—470° К)выражается уравнением:
S°T = 0,08077 - 1,04 • 10~572 - 4,3
a fJ-Ti2O3 (480—2000° К) —уравнением:
= 54,1 + 0,01747—14 550/7
Изменение энтропии при полиморфном превращении Ti2O3 состав-
ляет 0,46 кал/(град • моль).
Приведенная энергия Гиббса полутораокиси титана при
25° С равна 7,31 кал/(град • моль).
Значения термодинамических свойств полутораокиси титана при
различных температурах приведены в Приложении 14.
Полутораокись обладает свойствами полупроводника р-типа.
Магнитная восприимчивость Ti2O3 при 20° С состав-
ляет 8,8- 10~7, а при —183° С —9,4-10~7 эмс/г.
Химические свойства. Полутораокись титана характеризуется
слабо выраженными основными свойствами; она обладает также
восстановительными свойствами.
При испарении Ti2O3 диспропорционирует на одноокись и дву-
окись титана:
Ti2O3 = TiO + TiO2 — 13,4 ккал; AG = + 13,05 ккал
90
Температурная зависимость парциальных давлений (табл. 7) со-
ставных частей паровой смеси при диспропорционировании выра-
жается уравнением: lgpTio • pTiO2= 21,65 — 64700/Т — 0,00126т.
Таблица 7. Парциальное давление TiO и TiO2
при диспропорционировании Ti2O3
t, °C Давление, мм рт. ст.
общее Р РТЮ РТЮ2
2000 0,154 0,004 0,15
2200 1,135 0,065 1,07
2400 6,07 0,67 5,4
2600 26,1 4,6 21,5
2800 98,6 20,6 78
3000 284 92 192
3200 760 295 465
На воздухе полутораокись титана только при очень высокой
температуре окисляется до двуокиси (и при этом белеет):
2Ti2O3 4- О2 — 4Т1О2 -f- 176,4 ккал\ Л1/ == — 164,7 ккал
При действии оксидов азота окисление протекает уже при
300° С.
С газообразным аммиаком полутораокись титана образует
нитрид титана:
Ti2O3 + 2NH3 = 2TiN + ЗН2О — 50,5 ккал
С водой ПгОз не реагирует и в ней почти не растворяется, раз-
бавленные соляная, серная и азотная кислоты на нее не действуют,
а концентрированная серная кислота растворяет полутораокись ти-
тана с образованием фиолетового раствора сульфата тита-
на(Ш):
Ti2O3 + 3H2SO4 = Ti2 (SO4)3 + 3H2O
С плавиковой кислотой и царской водкой Ti2O3 взаимодействует
с выделением тепла.
Полутораокись титана взаимодействует при сплавлении с окси-
дами металлов, например магния, кальция и марганца. При этом
образуются двойные оксиды, называемые, однако, оксо-
титанатами, или титанитами соответствующих металлов.
Расплавленный гидросульфат калия растворяет полутораокись
титана, окисляя ее до соединения титана(IV):
Ti2O3 + 4KHSO4 = К2 [TiO2 (SO4)] + К2 [TiO (SO4)2] + SO2 + 2H2O
При расплавлении полутораокиси титана с фосфорной солью
получается фиолетовое стекло.
91
Оксо-(1П)титанаты
Диоксо-(П1)титанат лития, или титанит, — LiTiO2 — образуется при спека-
нии окиси лития с полутораокисью титана. Кристаллизуется в кубической синго-
нии (а — 414,0 пм). Плотность 3,80 г!см3.
Триоксо-(П1)титанат натрия, или титанит, — Na3TiO3 — образуется при спла-
влении полутораокиси титана с гидроокисью натрия и, вероятно, при нагревании
одноокиси титана с парами натрия. Водой легко разлагается с образованием
трехгидроокиси титана; медленно разлагается спиртом.
Триоксо-(П1)титанат магния—Mg(TiO2)2— образуется при спекании окиси
магния с полутораокисью титана, а также при восстановлении углем метатнта-
ната илн дититаната магния при 1400° С. Диоксо-(III)титанат магния кристал-
лизуется в кубической сингонии (а — 847,4 пм). Плотность 4,05 г)см3.
Диоксо-(II 1)титанат кальция —Ca(TiO2)2— образуется при спекании окисн
кальция с полутораокисью титана.
Триоксо-(П1)титанаты редкоземельных металлов —LaTiO3, CeTiO3, PrTiO3,
NdTiO3, EuTiO3 и GdTiO3 — образуются при длительном нагревании стехиометри-
ческих количеств полутораокисей соответствующих металлов и титана до 1150° С.
Диоксо-(П1)титанат марганца(П) —Мп(ПО2)2— образуется при восстано-
влении двуокиси титана элементарным марганцем при 1400° С, а также при спе-
кании одноокиси марганца с полутораокисью титана. Соединение следует рас-
сматривать как двойную окись титана(III) и марганца(II) (типа шпинели); оно
кристаллизуется в кубической сингонии (а = 860 пм). Плотность 4,37 г/см3.
Диоксо-(1П)титанат железа(П) —Fe(TiO2)2 — образуется при нагревании
смеси эквимолекулярных количеств окиси железа и полутораокиси титана до
1000°С. Соединение следует рассматривать как двойную окись титана(Ш) и же-
леза (II) (типа шпинели); оно кристаллизуется в кубической сингонии (а=847 пм).
Плотность 4,68 г/см3.
Гидроокись титана(Ш) 2
Тригидроксид, или трехгидроокись титана — Ti(OH)3 (мол. вес
98,92) является слабым основанием и обладает восстановитель-
ными свойствами.
Получение. Она осаждается из растворов солей титана(III)
растворами гидроокисей, сульфидов или карбонатов щелочных ме-
таллов и аммония:
TiCl3 + ЗОН-= Ti (ОН)3 + ЗСГ
2TiCl3 + 3S2- + 6Н2О = 2Ti (ОН)3 + 6СГ + 3H2S
2TiC 13 + ЗСО2- + 6Н2О = 2Ti (ОН)3 + 6СГ + ЗСО2
Гидроокись титана получается также при гидролизе триоксо-
(Ш)титаната натрия:
Na3TiO3 + ЗН2О = Ti (ОН)з + 3NaOH
Для получения Ti(OH)3 можно кипятить непрокаленную дву-
окись титана с соляной кислотой и медью до растворения двуокиси
и образования прозрачного раствора темно-красного цвета, а за-
тем прилить избыток аммиака. При этом выпадает осадок гидро-
окиси титана(III) темно-вишневого цвета. Теплота образования
Ti(OH)3 равна 284 ккал/моль.
Свойства. Полученная разными способами Ti (ОН)3 может быть
разного цвета — от черного до вишнево-красного, коричневого или
92
синего, но постепенно она светлеет и наконец становится белой.
При этом происходит выделение водорода. Изменение цвета объяс-
няется тем, что при действии воды гидроокись титана(III) окис-
ляется до ортотитановой кислоты:
2Ti (ОН)3 + 2Н2О = 2H4TiO4 + Н2 + 41,4 ккал
Трехгидроокись титана легко окисляется также на воздухе, пере-
ходя при этом в метатитановую кислоту:
2Ti (ОН)з + 4 О2 = 2H2TiO3 + Н2О + 113,7 ккал
Гидроокись титана(Ш) восстанавливает нитраты до аммиака.
Таким образом, очевидно, что гидроокись титана(III) имеет
резко выраженные восстановительные свойства. В то же время
трехгидроокись титана проявляет свойства слабого основания: она
легко растворяется в кислотах с образованием солей титана(III):
Ti (ОН)3 + ЗН+ = Ti3+ + ЗН2О
Из органических производных гидроокиси титана(III) известны
метилат (или метоксид) титана(Ш)—П(ОСНз)з — и этилат
(или этоксид) титана(Ш)—Т1(ОС2Н5)з, образующиеся при взаи-
модействии трихлорида титана с соответствующими алкоголятами
натрия. Этилат титана (III) образуется и при восстановлении на-
трием этилата титана(IV). Известны также н-пропилат тита-
на(Ш)—Т1(н-ОС3Н7)3 и н-бутилат титана(Ш)—ТЦн-ОС^Н^з,
образующиеся при восстановлении калием соответствующих алко-
голятов титана(IV). н-Пропилат и н-бутилат титана(III) представ-
ляют собой розовато-сиреневые кристаллы, труднорастворимые
в органических растворителях и устойчивые только в атмосфере
сухих инертных газов.
Галогеноксиды* титана(Ш)
Монохлорокись титана —TiOCl (мол. вес 99,35) образуется
при взаимодействии трихлорида титана с парами воды:
TiC 13 + Н2О = TiOCl + 2НС1
окисями железа(III), титана(IV) или кремния:
3TiCl3 + Fe2O3 = ЗТЮС1 + 2FeCl3
2TiCl3 + TiO2 = 2TiOCl + TiC 14
2TiC 13 + SiO2 = 2ТЮС1 + SiC 14
Монохлорокись титана образуется также как побочный продукт
при восстановлении тетрахлорида титана в присутствии воз-
духа и в некотором количестве при нагревании смеси двуокиси и
* Из галогеноксидов (галоксидов) титана(П1) в настоящее время известны
моиохлорокись и моноиодокись.
93
дихлорида титана:
TiO2 + TiCl2 = 2Т1ОС1
Теплота образования твердой монохлорокиси титана
при 25° С составляет 182 ккал/моль, газообразной — 58,4 ккал/моль.
Энергия Гиббса образования газообразной ТЮС1 59,73
ккал/моль.
Монохлорокись титана представляет собой коричневато-золоти-
стые листочкообразные кристаллы (ромбическая сингония). При
температуре от 550 до 700° С в запаянной трубке в присутствии
трихлорида титана (подавляющего реакцию разложения ТЮС1)
TiOCl возгоняется. Теплота сублимации ТЮС1 равна
123,6 ккал/моль (или 1244 кал/г). Энтропия монохлорокиси ти-
тана при 25° С составляет 17,5 кал/ (град • моль).
При нагревании в вакууме монохлорокись разлагается на полу-
тораокись и трихлорид:
3TiOCl = Ti2O3 + TiCl3 — 10,9 ккал
а при нагревании на воздухе окисляется с образованием двуокиси
и паров тетрахлорида:
4Т1ОС1 + О2 — 3TiO2 + TiCl4 + 131,5 ккал
Во влажном воздухе образуется бесцветная метатитановая
кислота:
4ТЮС1 + О2 + 6Н2О = 4H2TiO3 + 4НС1 + 240 ккал
Моноиодокись титана —TiOI (мол. вес 190,805) образуется
при разложении дииодокиси титана:
2TiOI2 = 2TiOI + I2
Моноиодокись титана представляет собой листочкообразные
кристаллы черного цвета, парамагнитные и гигроскопичные. В воде
в значительной мере гидролизуется. В жидких углеводородах не
растворяется.
Сульфид титана |П1)
Получение. Сульфид титана(III), или сесквисульфид титана,—
H2S3 (мол. вес 191,99) образуется в системе титан — сера. Практи-
чески в этой системе сульфид титана(III) может быть получен при
действии расплавленной серы на порошкообразный титан или на
моносульфид при 400° С. Сульфид титана(III) образуется также
при длительном нагревании дисульфида в атмосфере азота или во-
дорода при сравнительно низкой температуре. При этом происходит
неполное восстановление титана:
2TiS2 = Ti2S3 + S; 2TiS2 + Н2 = Ti2S3 + H2S
При пропускании сероводорода или смеси водорода с парами
серы над раскаленным нитридом титана также образуется Т125з:
2TiN + 3S + ЗН2 = Тi2S3 -f- 2NH3
94
Он получается и при пропускании смеси сероводорода с парами
сероуглерода над сильно нагретой двуокисью титана;
2TiO2 + 2H2S + CS2 =<Ti2S3 -f- CO2 + 2H2O + S
Теплота образования Т1г5з равна 147 ккал!молъ.
Физические свойства. Сульфид титана(III) представляет собой
зеленовато-черный кристаллический порошок с металлическим
блеском. Плотность его при 0° С равна 3,673 г!см3. Зависи-
мость плотности от температуры в интервале от 0 до 50° С выра-
жается уравнением: рг = 3,673— 0,00829^ + 0,000157^2. Энтро-
пия его при 25° С равна 28,9 кал!(моль град).
Химические свойства. На воздухе при обычной температуре
Т1г£з устойчив, а при обжиге окисляется до двуокиси:
Ti2S3 + 5О2 = 2TiO2 + 3SO2 + 517 ккал
При нагревании в токе сухого водорода восстанавливается до мо-
носульфида;
Ti2S3 + Н2 = 2TiS + H2S — 38 ккал
Вода, растворы кислот и щелочей не действуют на сульфид ти-
тана (III), а концентрированные серная и азотная кислоты рас-
творяют его (растворы зеленого цвета). С фтороводородом он
реагирует только при высокой температуре.
Селенид титана(Ш)63
Селенид титана(Ш), или сесквиселенид титана, — Ti2Se3 (мол.
вес 332,68) образуется в системе титан — селен и может быть полу-
чен при взаимодействии стехиометрических количеств элементар-
ных титана и селена при высокой температуре.
Селенид титана(III) представляет собой черные кристаллы
гексагональной сингонии (а = 358,8, с = 598,0 пм). Плотность
его при 0° С равна 5,32, а при 25° С — 5,165 г!см?. Он обладает
электронной проводимостью; величина удельной электропро-
водности 2-105 cumIm. Магнитная восприимчивость
при 20° С равна 1,72-10~4, а при —78° С—1,47-10-4 эме)г.
Теллурид титана(Ш)64
Теллурид титана(III), или сесквителлурид, — Ti2Te3 (мол. вес
478,60) образуется в системе титан — теллур и может быть полу-
чен при взаимодействии стехиометрических количеств элементар-
ных титана и теллура.
Теллурид титана(III) представляет собой черные кристаллы
гексагональной сингонии (а = 380,2, с = 643,2 пм). Плотность
при 25° С равна 5,988 г!смъ. Магнитная восприимчи-
вость при 20° С составляет 1,99- Ю4 эмс)г. Удельная элек-
тропроводность2-105 сим[м.
95
КОМПЛЕКСАТЫ ТИТАНА(Ш)
Из комплёксатов титана(III) известны такие соли минераль-
ных оксокислот, как перхлорат, средний и кислый сульфаты, фос-
фаты, соли фторокислот — тетрафтороборат, соли гидридокислот—
тетрагидридоборат, тетрагидридоборатхлорид, и такие соли орга-
нических кислот, как карбонат-гидроокись, формиат, ацетат, аце-
тат-гидроокись, ацетатдихлорид, оксалат, тартрат, тиоцианат. Ха-
рактерной особенностью комплексатов титана(Ш) являются их
восстановительные свойства, а также способность их образовы-
вать с соответствующими комплексатами щелочных металлов раз-
личные двойные и комплексные соли.
Перхлораты титана(1П]
Безводный перхлорат титана(III) неизвестен, однако сущест-
вуют соли, в которых перхлорат-анион связан с комплексными ка-
тионами— гексаква- и гексакарбамид-титан(Ш)-ионами.
Перхлорат гексакватитана(Ш) — [Ti(H20)6(C104)3 — образует-
ся при смешении водных растворов сульфата титана(III) и пер-
хлората кальция или бария. Получающийся после отделения осад-
ка сульфата кальция или бария фиолетовый раствор содержит
перхлорат гексакватитана(III). При нагревании этот раствор обес-
цвечивается, что связано с переходом соединения титана(III) в
соединение титана(IV). Однако при осторожном выпаривании
раствора в вакууме из него могут быть выделены фиолетовые
призматические кристаллы перхлората гексакватитана(III).
Перхлорат гексакарбамидтитана (111) —[Ti (OCN2H4) 6] (С1О4) 3—
образуется при смешении концентрированного раствора перхлора-
та натрия с синим раствором, полученным в результате раство-
рения в воде смеси гидросульфата титана (III) и карбамида
(мочевины). Из полученной смеси при охлаждении осаждаются
мелкие фиолетовые призматические кристаллы перхлората гекса-
карбамидтитана (III), которые могут быть промыты спиртом и вы-
сушены на воздухе без разложения. Фиолетовый водный раствор
со временем обесцвечивается в связи с переходом титана(III) в
титан(IV).
Сульфат титана(Ш) 2>74
Получение. Сульфат титана(III) (нормальный, или средний
сульфат) — Ti2(SO4)3 (мол. вес 383,98) образуется при действии
разбавленной серной кислоты на элементарный титан: .
2Ti + 3H2SO4 = Ti2 (SO4)3 + ЗН2
Концентрированная серная кислота восстанавливается титаном
(при нагревании) до двуокиси серы:
2Ti + 6H2SO4 = Ti2 (SO4)3 + 3SO2 + 6H2O
56
Сульфат титана(III) образуется также при растворении полуто-
раокиси титана в серной кислоте:
Ti2O3 + 3H2SO4 = Ti2 (SO4)3 + 3H2O
и может быть выделен при выпаривании полученного раствора в
вакууме. Как промежуточный продукт сульфат титана(III) обра-
зуется при каталитическом окислении двуокиси серы с использо-
ванием в качестве катализатора сульфатоксида титана(1У):
4TiOSO4 + 2SO2 = 2Тi2 (SO4)3
Теплота образования Ti2(SO4)3 809 ккал!моль.
Физические свойства. Безводный сульфат титана (III) пред-
ставляет собой зеленые кристаллы тетрагональной сингонии с па-
раметрами решетки: а = 844, с == 2195 пм. Плотность
2,78 г/см3. Удельная магнитная восприимчивость его
при 0°С составляет 2,9-10-6 эме!г и с понижением температуры
сильно увеличивается. Зависимость удельной магнитной воспри-
имчивости сульфата титана(III) от температуры в интервале от
+ 20 до —272° С выражается уравнением:
1g х = ~ 5,538 - 0,00034/ + 6 • 10-7/2 - 3 • 1027/11
Химические свойства. Безводный сульфат титана(III) при на-
гревании на воздухе разлагается с выделением двуокиси и трех-
окиси серы. Разложение начинается при 300 и полностью заканчи-
вается при 480° С:
Ti2 (SO4)з == 2TiO2 + SO2 + 2SO3 — 98 ккал
При нагревании в токе кислорода выделяется только трехокись
серы и образуется сульфатоксид титана (IV):
2Ti2 (SO4)3 + О2 = 4TiOSO4 + 2SO3 + 359 ккал
Сульфат титана (III) не растворяется в воде, спирте, эфире, концен-
трированной серной кислоте и жидком аммиаке, но растворяется
в разбавленных серной и соляной кислотах; растворы окрашены
в фиолетовый цвет.
Сульфат титана(Ш) образует кристаллы Т12(5О4)з-8Н2О синего
цвета. Структура этой водной соли такова: [Ti(H2O)4]2(SO4)3, т. е.
это сульфат тетракватитана(III). Эта соль может быть полу-
чена растворением элементарного титана в серной кислоте при
одновременном пропускании водорода с последующей кристалли-
зацией.
Получено также кристаллическое соединение сульфата тита-
на (III) состава Ti2(SO4)3-6NH3, в виде объемистого серовато-бе-
лого порошка оно образуется при суточном пребывании безводного
нормального сульфата титана (III) в жидком аммиаке.
4 Зак. 1120
97
Гидросульфаты титана (III)
Получение. В системе Ti2(SO4)3 — H2SO4— Н2О образуются
гидросульфаты титана(III). Практически эти гидросульфаты могут
быть выделены при охлаждении или при упаривании в вакууме
(при 60°С) сернокислотных растворов сульфата титана(III). Со-
став выделяющихся гидросульфатов зависит от содержания в рас-
творе серной кислоты: из растворов, содержащих от 45 до 70 %!
H2SO4, кристаллизуется четырехводный гидродисульфат —
TiH(SO4)2’4H2O, из растворов, содержащих более 80% H2SO4,—
трехводный тетрагидропентасульфат — Ti2H4(SO4)5• ЗН2О.
Физические свойства. Гидродисульфат титана (III) представляет
собой фиолетовые микрокристаллические шелковистые блестящие
пластинки ромбической формы; водные растворы его также окра-
шены в фиолетовый цвет. Не растворяется в 65%-ной и более кон-
центрированной серной кислоте, ледяной уксусной кислоте, мета-
ноле, этаноле, диэтиловом эфире, при нагревании с концентриро-
ванной серной кислотой до 200° С образует ярко-синий раствор, из
которого при охлаждении выпадают кристаллы тетрагидропента-
сульфата.
Тетрагидропентасульфат титана (III) представляет собой голу-
бой кристаллический порошок, устойчивый только в присутствии
концентрированной серной кислоты; в отсутствие серной кислоты
неустойчив и переходит в фиолетовый гйдродисульфат.
Химические свойства. Фиолетовый гидродисульфат на холоду
устойчив; при нагревании на воздухе разлагается с выделением
воды и серной кислоты, окрашиваясь при этом в зеленый цвет:
2TiH (SO4)2 • 8Н2О = Ti2 (SO4)3 • 2Н2О + H2SO4 + 6Н2О
а при дальнейшем нагревании — с выделением серной кислоты:
Ti2 (SO4)3 • 2Н2О = Ti2O2SO4 + 2H2SO4
Сульфат-оксид титана(III) при температуре красного каления
разлагается:
Ti2O2SO4 = 2TiO2 + SO2
Растворы гидросульфата титана (III) могут быть получены пу-
тем обработки трихлорида титана разбавленной серной кислотой
при 60° С или же путем электролитического восстановления раство-
ров сульфатов титана (IV).
Для получения раствора гидросульфата тнтана(Ш) электролитическим вос-
становлением используют простейший прибор, состоящий из стакана, в который
помещен пористый стакан нз глины илн фарфора меньшего размера. В первый
стакан опущена свинцовая пластина — катод, во второй амальгамированная
свинцовая пластина — анод. В больший стакан наливают раствор, полученный
в результате обработки тетрахлорида илн двуокиси титана концентрированной
серной кислотой и растворения в 50%-ной серной кислоте, в меньший, стакан —
20%-ную серную кислоту. Во время электролиза электролит перемешивают. Через
несколько часов испытывают полноту восстановления (тимоловая проба). При
98
достижении полного восстановления полученный раствор переливают в банки с
притертыми пробками, причем жидкость, во избежание окисления, наливают до
самых пробок.
Из полученного раствора сульфат титана(III) получают путем выпаривания
с серной кислотой.
Сульфато-(1П]титанаты
Сульфаты титана могут присоединять сульфаты щелочных
металлов, образуя комплексные соли двух типов: пентасульфато-
трититанаты —Me‘[Ti3(SO4) 5] — и титановые квасцы —Me1?! (SO4)2 •-
• 12Н2О.
Пентасульфато-(Ш)трититанаты образуются при нагревании
смеси растворов 1 моль гидродисульфата титана (III) и 21/2 моль
сульфата щелочного металла. Из этого ряда солей известны: пен-
тасульфатотрититанат натрия — Na[Ti3(SO4)5]-H2O, пентасульфато-
трититанат калия — К[Т1з (SO4) 5] • Н2О, пентасульфатотрититанат
рубидия — Rb[Ti3(SO4)5]* 12Н2О.
Все эти соли — голубые кристаллические вещества, труднорас-
творимые в воде и серной кислоте и легкорастворимые в соляной
кислоте. При кипячении пентасульфатотрититанатов с концентри-
рованной серной кислотой образуются сульфат титана(III) и суль-
фат соответствующего щелочного металла.
Известен также пентасульфатотрититанат аммония —
NH4[Ti3(SO4)s]-9H2O.
Титановые квасцы получают путем кристаллизации из смеси
не очень кислых растворов сульфата титана (III) и сульфата ще-
лочного металла. Квасцы могут быть перекристаллизованы из раз-
бавленных сернокислотных растворов. Из титановых квасцов изве-
стны: калиевые KTi (SO4)2- 12Н2О — вишневые кристаллы, рубидие-
вые RbTi (SO4)2- 12Н2О — красные кристаллы, цезиевые CsTi(SO4)2«
• 12Н2О — светло-фиолетовые кристаллы.
От титановых квасцов несколько отличается тетрасульфатоди-
титанат натрия — Na2Ti2(SO4)4-5H2O. Он представляет собой фио-
летовую кристаллическую массу, растворимую в воде и нераство-
римую в спирте.
Фосфаты титанарП) 2
Метафосфат титана(Ш)—Т1(РОз)3 (мол. вес284,82) образует-
ся в виде фиолетового осадка при взаимодействии растворов суль-
фата титана (III) и фосфата натрия, а также при действии фосфор-
ной кислоты на гидроокись или карбонатгидроокись титана(III).
Метафосфат титана (III)—фиолетовые кристаллы моноклинной
сингонии с параметрами решетки п = 1042, 6 = 1935, с = 954 пм\
плотность 2,93 г!см3. В чистой воде сравнительно растворим и мало
подвержен гидролизу; растворимость уменьшается в присутствии
сульфатов.
Тетраметафосфат титана(Ш) — Ti4(PO3)i2 — образуется при
взаимодействии порошкообразного титана с расплавленным
4*
99
дифосфатом аммония. Тетраметафосфат титана (III) —фиолетовые
кристаллы кубической сингонии с параметрами решетки: а =
= 1382 пм-, плотность 2,84 г]см\ Показатель преломления 1,584.
Фторо-и гидридобораты титана(Ш)
Тетрафтороборат титана(Ш)—Ti(BF4)3 (мол. вес 134,705)
образуется при действии водного раствора тетрафтороборной кис-
лоты на элементарный титан или на гидроокись титана(Ш):
2Ti + 6HBF4 = 2Ti (BF4)3 + ЗН2
Ti (ОН)3 + 3HBF4 = Ti (BF4)3 + 3H2O
Из полученного синего раствора тетрафтороборат титана (III) мо-
жет быть выделен при осторожном выпаривании в вакууме. В не-
котором количестве Ti(BF4)3 образуется также при пропускании
трифторида бора над нагретым трифторидом титана.
Тетрафтороборат титана(III) представляет собой синие кри-
сталлы, без разложения растворяющиеся в холодной воде.
Тетрагидридоборат титана(Ш)—Ti(BH4)3 (мол. вес 92,43) об-
разуется при взаимодействии тетрахлорида титана с тетрагидробо-
ратом лития:
2TiC 14 + 8LiBH4 = 2Ti (ВН4)3 + 8ЫС1 + В2Н6 + Н2
Тетрагидридоборат титана(III) представляет собой кристаллы
зеленого цвета. Даже при обычной температуре он легко разла-
гается на низший гидрид титана, диборан и водород:
2Ti (ВН4)з = 2TiH + ЗВ2Н6 + 2Н2
Тетрагидридоборатхлорид титана(Ш)—TiCl(BH4)2 (мол. вес
113,04) образуется одновременно с тетрагидридоборатом тита-
на (III) при взаимодействии тетрахлорида титана с тетрагидридо-
боратом лития:
2TiCl4 + 6LiBH4 = 2TiCI (BH4)2 + 6LiCI + B2H6 + H2
Тетрагидридоборатхлорид титана (III) представляет собой кри-
сталлы густо-голубого цвета. Легко разлагается с выделением ди-
борана и водорода; давление диссоциации при 25° С составляет
1 мм рт. ст.
СОЛИ ОРГАНИЧЕСКИХ КИСЛОТ 2,75,70
Карбонат-гидроокись титана(Ш)
Основной карбонат титана(Ш)—Ti(OH)CO3 (мол. вес 124,92)
образуется при взаимодействии кристаллического карбоната нат-
рия с холодным насыщенным раствором трихлорида титана:
2TiC 13 + 3Na2CO3 + Н2О = 2Ti (ОН) СО3 + 6NaCl + СО2
Карбонат-гидроокись титана (III) представляет собой черную
крупообразную массу, нерастворимую в холодной воде, в теплой
100
воде подвергающуюся гидролизу с образованием гидроокиси ти-
тана(Ш):
Ti (ОН) СО3 + Н2О - Ti (ОН)з + СО2
Под действием кислорода (находясь даже просто на воздухе)
Ti(bH)CO3 постепенно белеет, Окисляясь до соединения тита-
на(1У); особенно интенсивно окисление происходит в щелочной
средеТ'С минеральными и даже некоторыми органическими кисло-
тами он реагирует с выделением двуокиси углерода и образова-
нием соответствующих солей титана(III).
Формиат титана(Ш)
Формиат титана(Ш)—Ti(HCOO)3 (мол. вес 186,115) обра-
зуется при действии избытка концентрированной муравьиной кис-
лоты на гидроокись или карбонат-гидроокись титана(III). Из обра-
зовавшегося зеленого раствора формиат может быть выделен в
виде темно-зеленых иглообразных кристаллов после выдерживания
в вакуум-эксикаторе. Формиат титана(Ш) образуется также в рас-
творе при взаимодействии трихлорида титана с муравьиной кис-
лотой:
TiС13 + ЗНСООН = Ti (НСОО)з + ЗНС1
Однако из этого раствора он кристаллизуется с большим трудом
и обычно не изолируется.
Формиат титана растворим в воде; в разбавленных растворах
он гидролизуется (особенно быстро — при нагревании) с последую-
щим окислением. Легко образует устойчивые растворы в муравьи-
ной кислоте. В растворе взаимодействует с формиатами калия, ба-
рия, аммония с образованием двойных солей. В бензоле, тетрахло-
риде углерода и глицерине формиат титана(III) нерастворим.
Ацетат титана(Ш)
Ацетат титана(Ш)—Ti(CH3COO)3 (мол. вес 224,975) обра-
зуется при действии концентрированной уксусной кислоты на из-
быток гидроокиси или карбонатгидроокиси титана(III). Из обра-
зовавшегося темно-зеленого раствора ацетат титана может быть
выделен в виде мелких, блестящих, черных кристаллов после вы-
держивания в вакуум-эксикаторе. Ацетат титана(III) образуется
также при взаимодействии растворов трихлорида титана и уксус-
ной кислоты. Из раствора могут быть выделены также черные кри-
сталлы диацетатгидроокиси титана(III)—TiOH (СН3СОО)2, нерас-
творимые в воде, спирте, глицерине, бензоле, тетрахлориде угле-
рода. Известны также двойная соль NaTi2(OH)2(CH3COO)5-4H2O,
которая кристаллизуется в виде зеленых пластинок, и соль
TiCl2(CH3COO).
Оксалат титана(Ш) *
Оксалат титана(Ш)—Ti2(C20i)3- 10Н2О (мол. вес 359,86 +’
+ 180,15) образуется при действии насыщенного раствора
101
щавелевой кислоты на гидроокись или карбонат-гидроокись тита-
на (III), В растворе оксалат титана образуется при взаимодей-
ствии трихлорида титана и щавелевой кислоты:
2T1CI3 + ЗН2С2О4 ~ (СгО^з + 6НС1
Из раствора оксадат титана может быть выделен этанолом.
Оксалат титана(III) представляет собой желтовато-коричневые
призматические кристаллы. Растворим в воде, нерастворим в спир-
те и эфире.
В растворе оксалат титана(III) взаимодействует с оксалатами
калия, рубидия и аммония с образованием труднорастворимых зо-
лотистых кристаллов двойных солей: KTi(C2O4)2-2H2O,
RbTi(C2O4)2-2H2O и (NH4)Ti(C2O4)2-2H2O.
Тартрат титана(Ш)
Тартрат титана(Ш)—Т[2(С4Н40е)з, или TiOH(С4Н40в), обра-
зуется при действии концентрированного водного раствора винной
кислоты на гидроокись титана(III), а также на разбавленный рас-
твор сульфата титана(III). Из полученного темно-бурого раствора
тартрат титана(III) может быть выделен лишь с большим трудом.
Тиоцианат титана(Ш)
Тиоцианат титана(Ш) —Ti(NCS)s— в чистом виде не получен.
При взаимодействии 1 моль сульфата гексамминдвутитана (III) с
9 моль роданида калия в жидком аммиаке образуется смесь, со-
стоящая из тиоцианата титана (49%) и комплексного соединения
гексародано-(Ш)титаната калия и аммиака (51%):
Ti2 (SO4)3 • 6NH3 + 9KNCS = Ti (NCS)3 + Кз [Ti (NCS)e] • 6NH3 + 3K2SO4
При большем избытке роданида калия образуется преимуществен-
но K3[Ti(NCS)e]-6NH3. Смешанный продукт реакции частично рас-
творяется в воде, и фиолетовая окраска раствора указывает на
присутствие в нем иона Ti3+.
Соединение K.3[Ti(NCS)6]-6NH3 представляет собой зеленые
кристаллы, хорошо растворимые в жидком аммиаке, причем рас-
твор окрашен в фиолетовый цвет. При выдерживании этих кри-
сталлов в токе сухого азота в течение нескольких недель они те-
ряют весь аммиак и превращаются в желтовато-коричневые кри-
сталлы гексародано-(Ш)титаната калия — K3Ti(NCS)6, растворы
которого в разбавленных кислотах окрашены в фиолетовый цвет.
Из растворов могут быть выделены фиолетовые кристаллы шести-
водного соединения KsTi(NCS)6-6H2O.
Известно также шестиводное соединение гексародано-(Ш)тита-
ната аммония—(МН4)з[Т[(МС5)б]-6Н2О, представляющее собой
коричневые кристаллы, растворимые в воде.
ГЛАВА V
ГАЛИДЫ И ХАЛЬКОГЕНИДЫ ЧЕТЫРЕХВАЛЕНТНОГО ТИТАНА
В соединениях титана (IV) химическая связь носит типично ко-
валентный характер. В частности, галиды титана (IV) являются не
солями, а кислотообразующими соединениями.
ФТОРИДЫ ТИТАНА|1У)
Из фторидов титана(IV) известны тетрафторид и соединения
смешанного характера — оксиддифторид, гидроксидфториды, хлор-
фториды, бромфториды и иодфториды.
Тетрафторид титана 21e6,77-ei
Тетрафторид титана— TiFi (мол. вес 123,89) в значительной
мере проявляет кислотообразующие свойства, выражающиеся в
способности к образованию комплексных солей — фторо-(IV)тита-
натов.
Получение. Тетрафторид титана образуется при непосредст”
венном действии фтора на титан:
Ti + 2F2 = TiF4
при действии фтора на различные соединения титана, например
оксиды;
ТЮ2 4- 2F2 = TiF4 + О2
2Ti2O3 + 8F2 - 4TiF4 + 3O2
2TiO + 4F2 = 2TiF4 + O2
на различные галиды:
2TiF3 + F2 = 2TiF4
Т1Г4 + 2F2 = TiF4 + 2Г2
2Tir3 + 4F2 = 2TiF4 + ЗГ3
TiT2 + 2F3 = TiF4 -F Г3
103
на сульфиды:
TiS2 + 8F2 = TiF4 + 2SF6
Ti2S3 + 13F2=2TiF4 + 3SFe
TiS + 5F2 = TiF4 + SFe
на нитрид:
2TiN + 4F2 - 2TiF4 + N2
на карбид:
TiC + 4F2 = TiF4 + CF4
на карбонитрид:
2Ti5CN4 + 21F2 = 10TiF4 + 2CNF + 2N2
на силициды:
TiSi + 4F2 = TiF4 + SiF4
Ti Si2 + 6F2 = TiF4 + 2SiF4
Ti5Si3 + 16F2 = 5TiF4 + ?SiF4
а также на различные сплавы титана.
Тетрафторид титана образуется также при действии на мелко-
раздробленный титан при нагревании газообразного фторово-
дорода:
Ti + 4HF = TiF4 + 2H2
пентафторида мышьяка:
5Ti + 4AsF5 = 5TiF4 + 4As
и оксидтетрафторида серы:
Ti + 2SF4O = TiF4 + 2SF2O2
Тетрафторид титана образуется также в результате некоторых
реакций обмена. Так, его можно получить при бурно протекающей
реакции тетрахлорида титана с фтороводородом:
Т iCl4 + 4HF = TiF4 + 4НС12
Медленно он образуется при действии на двуокись титана три-
фторида бора при 500° С:
ЗТЮ2 + 4BF3 = 3TiF4 + 2В2О3
Реакции обмена идут также между тетрахлоридом титана и
фторидами серебра или сурьмы:
TiCl4 + 4AgF = TiF4 + 4AgCl
3TiCl4 + 4SbF3 = 3TiF4 + 4SbCl3
Тетрафторид образуется в результате некоторых реакций раз-
ложения, например в результате диспропорционирования трифто-
рида при нагревании его выше 950° С:
4TiF3 = 3TiF4 + Ti
В виде паров тетрафторид выделяется при прокаливании гексафто-
ро-(IV) титанатов щелочноземельных металлов:
Mg[TiFe] = TiF4 + MgF2
Ba[TiF6] = TiF4 + BaF2
104
При осторожном нагревании гексафторотитаната аммония тетра-
фторид титана выделяется в виде нелетучего остатка:
(NH4)2[TiF6J = TiF4 + 2H3N + 2HF
Стандартная теплота образования твердого тетрафторида со-
ставляет 394,2, газообразного — 371,0 ккал/моль. Энергия Гиб-
бса образования твердого TiF4 равна 372,7, газообразного —
362,2 ккал/моль.
Безводный тетрафторид титана проще всего получать при пере-
гонке смеси фторида кальция и двуокиси титана с концентрирован-
ной серной кислотой:
TiO2 + 2CaF2 + 2H2SO4 = TiF4 + 2CaSO4 + 2H2O
Однако получаемый в виде желтого масла продукт весьма за-
грязнен.
Физические свойства. Тетрафторид титана представляет собой
белый рыхлый порошок. Плотность его при 10°С составляет
2,8367, а при 20° С — 2,7998 г/см3. Зависимость плотности от темпе-
ратуры в интервале от 0 до 30° С выражается уравнением: р( =
= 2,879 — 0,00451 — 0,000027t2. Мольный объем при 20° С состав-
ляет 44,26 см3.
Тетрафторид титана довольно летуч. Зависимость давления
пара от температуры в интервале от 150 до 284° С выражается
уравнением: Igp = 11,881 —5014/Т.
При 284° С давление пара тетрафторида титана достигает
760 мм рт.ст. и он испаряется не плавясь (сублимирует). Зависи-
мость давления пара (в атм) твердого тетрафторида титана от
температуры в интервале от 284 до 400° С выражается уравнением:
1g р = 7,857 — 4377/7.
При 400° С под давлением 22,75 атм тетрафторид плавится.
Теплота сублимации его при 25° С равна 193,5, а при
284° С—172,5 кал/г. Зависимость теплоты сублимации от темпе-
ратуры выражается уравнением: А, = 240—0,126Т — 5-10~6Т2.
Теплоемкость тетрафторида титана при 0°С составляет
26,13, а при 25°С — 27,31 кал/(град• моль). Зависимость теплоем-
кости от температуры в интервале от 0 до 100° К выражается урав-
нением:
Ср = 0,00465Г2 - 5,8 • 10“5Г3 + 2,5 • 10~7Т4
а в интервале от 100 до 300° К — уравнением:
Ср =0,1517’ — 0,000199Г2
Теплоемкость газообразного TiF4 при 25° С равна 20,29 кал/(град-
-моль).
Зависимость теплоемкости газообразного TiF4 от температуры в
интервале от 298 до 2000° К выражается уравнением: Ср = 24,984 +
+ 5,3- IQ-4 Т — 31500/Та,
105
Энтальпия тетрафторида титана при 25° С составляет
4841 кал/моль. Зависимость энтальпии от температуры в интер-
вале от 90 до 400° К выражается уравнением: Нт — Н°о = 22,517 +
+ 0,0096872 + 147 520/7 — 3225. Энтальпия газообразного TiF4 при
25° С равна 4452 кал/моль. Зависимость энтальпии газообразного
TiF4 от температуры в интервале от 298 до 2000° К подчиняется
уравнению: Н°т - Н°о = 24,9847 + 2,65 • 10“472 + 487 500/Г - 4655.
Э нт рои и я ' твердого тетрафторида титана при 25°С обстав-
ляет 32,016 кал/(град-моль). Зависимость энтропии от темпера-
туры в интервале от 60 до 400° К выражается уравнением:
S^. = 0,1567 - 1,21 • 10~*72 + 2,5 • 10~673 - 4,4
Изменение энтропии при сублимации при 25° С равно 42,65, а при
284°С — 37,6 кал/(град-моль). Стандартная энтропия газообраз-
ного тетрафторида титана составляет 74,673 кал/'(град-моль)‘, за-
висимость энтропии газообразного TiF4 от температуры выражает-
ся уравнением: St = 98,3 + 0,012627 — 8166/7.
Приведенная энергия Гиббса твердого TiF4 при 25° С со-
ставляет —15,779 кал/(град-моль). Зависимость ее от температуры
выражается уравнением:—Ф* = 0,06287 + 3,4 • 10-672—3,8- 10“873 —-
—2,24. Приведенная энергия Гиббса газообразного TiF4 при 25° С
равна—59,741 кал/(град-моль).
Значения термодинамических свойств тетрафторида титана при
различных температурах приведены в Приложении 15.
Химические свойства. Тетрафторид титана восстанавливается
до элементарного титана при взаимодействии с щелочными метал-
лами на холоду, а с щелочноземельными, алюминием, железом
и т. п. металлами — при высокой температуре (красное каление):
TiF4 + 4Na = Ti + 4NaF + 152,2 ккал-, AG — — 157,3 ккал
TiF4+ 2Mg = Ti + 2MgF2 + 143,2 ккал; AG = — 149,8 ккал
Он восстанавливается до элементарного титана также и под дей-
ствием бора при температуре красного каления:
3TiF4 + 4В = 3Ti + 4BF3 — 32,6 ккал; AG = + 15,6 ккал
Медь и кремний восстанавливают тетрафторид только до три-
фторида:
4TiF4 + Si = 4TiF3 + SiF4 + 25,2 ккал
Водород, углерод, азот, кислород, сера и галогены на тетрафторид
титана не действуют.
Тетрафторид титана весьма гигроскопичен. В воде он раство-
ряется с выделением большого количества теплоты. При выпари-
вании водного раствора может быть выделено кристаллическое
соединение TiF4-2H2O, которому соответствует структурная фор-
мула [TiF4(НгО)2]. При действии горячей воды на тетрафторид тц-
106
тана происходит постепенный частичный гидролиз:
TiF4 + 2H2O —> TiF3(OH) • Н2О + HF —> TiF2(OH)2 + HF
а при действии водяного пара образуется фтороксид титана:
TiF4 + Н2О —► TiF3(OH) + HF —> TiF2O + HF
Сухой фтороводород не действует на тетрафторид титана. Пла-
виковая кислота с тетрафторидом титана образует гексафтороти-
танат-ионы:
TiF4 + 2F’ = Пре-
подобным образом тетра фторид титана реагирует с фторид-иона-
ми в растворах фторида калия, т. е. в системе TiF4—KF—Н2О
образуются гексафторотитанат-ионы. В определенных условиях из
этой системы могут быть выделены кристаллы как безводного гек-
сафторотитаната калия, так и некоторых водных соединений этой
комплексной соли. Аналогичным образом ведет себя тетрафторид
титана в водных растворах фторидов других щелочных металлов.
Данные о системах TiF4— F“ — Н2О будут приведены в гл. VIII.
При действии сероводорода на тетрафторид титана при темпе-
ратуре красного каления образуется дисульфид титана:
TiF4 + 2H2S = TiS2 + 4HF — 39,5 ккал
а при действии газообразного аммиака на холоду образуется со-
единение состава TiF4-4NH3, которое в твердом состоянии имеет
структуру (NH4)2-[TiF4(NH2)2],— диамидотетрафторотитанат ам-
мония. При нагревании до 120° С аммиак образует с тетрафтори-
дом титана диамминтетрафторотитан, разлагающийся при нагре-
вании:
[TiF4(NH3)2]
нагревание
^охлаждение
TiF4+ 2NH3
В воде это соединение дает прозрачный раствор.
Фториды бора и кремния взаимодействуют с тетрафторидом ти-
тана в газообразном состоянии с образованием тетрафторобората
и гексафторосиликата титана(IV).
Оксиды углерода, кремния, фосфора, мышьяка, серы, хрома не
действуют на тетрафторид титана, как и хлориды и хлорокиси
различных неметаллических элементов. Исключение составляет
хлорокись фосфора, с которой тетрафторид титана энергично реа-
гирует:
3TiF4 + 4РОС13 = 3TiCl4 + 4POF3
Реакция обмена происходит также с трихлорСидридом кремния
(силикохлороформом):
3TiF4 + 4SiCl3H = ЗТ iCl4 + 4SiF3H
В концентрированной серной кислоте тетрафторид тиТана хо-
рошо растворяется.
107
В этаноле тетрафторид титана растворяется с образованием
соединения TiF4-C2H5OH, кристаллы которого могут быть выде-
лены из раствора. В диэтиловом эфире и сероуглероде тетрафто-
рид не растворяется, а из раствора тетрафторида в пиридине мо-
жет быть выделена белая кристаллическая масса соединения
TiF4-NC5H5.
Тетрафторид титана применяют в качестве катализатора про-
цессов фторирования тетрахлорида углерода фтороводородом, изо-
меризации алкенов и других органических реакций.
Смешанные фториды 66>8283
Оксиддифторид и гидроксидфториды титана. Продуктами ги-
дролиза тетрафторида титана являются оксиддифторид — TiF2O,
гидроксидтрифторид — TiFs(OH) и дигидроксиддифторид —
TiF2(OH)2. Гидролиз под действием горячей воды проходит в две
стадии: сначала образуется аквагидроксидтрифторид титана:
TiF4 + 2Н2О = TiF3(OH) (Н2О) + HF
который затем разлагается на дигидроксиддифторид титана и фто-
роводород:
TiF3(OH) (Н2О) = TiF2(OH)2 + HF
При действии горячего водяного пара на тетрафторид титана сна-
чала образуется гидроксидтрифторид титана:
TiF4 + Н2О = TiF3(OH) + HF
который затем разлагается на оксиддифторид и фтороводород:
TiF3(OH) = TiF2O + HF
Образование оксиддифторида титана происходит также при
действци фторокислорода на элементарный титан при температуре
выше 5t)0° С:
Ti + OF2= TiF2O
а также при гидролизе хлортрифторида титана под действием вла-
ги воздуха:
TiF3Cl + Н2О = TiF2O + HF + НС1
и при действии кислорода на дифторид титана:
2TiF2 + O2 = 2TiF2O
Теплота образования TiF2O (газ) равна 221,05 ккал/моль. Энергия
Гиббса образования (газ) 217,39 ккал/моль.
Оксиддифторид титана представляет собой белую рыхлую
кристаллическую массу. Он дает характерную дебаеграмму, кри-
сталлизуется в кубической сингонии (а = 380 пм). Плотность оксид-
дифторида титана 2,94 г/см3. Теплоемкость TiF2O (газ) состан
вляет 15 кал/(град-моль), энтальпия 3245 кал/моль-, энтро-
пия 68,02 кал/ (град-моль). Приведенная энергия Гиббса
—57,13 кал/(град моль).
108
При нагревании в токе сухого воздуха оксиддифторид разла-
гается на диоксид и тетрафторид:
2TiF2O = TiO2 + TiF4 + 154,4 ккал
Причем последний улетучивается. Разложение начинается уже при
150° С, а при 450° С заканчивается в течение 2 ч. В токе влажного
воздуха происходит гидролиз выделяющегося тетрафторида тита-
на; конечными продуктами разложения оксиддифторида при 300 —
350° С являются двуокись титана и фтороводород. При более высо-
кой температуре в летучих продуктах разложения содержится на-
ряду со фтороводородом и тетрафторид титана.
Гидроксидфториды титана представляют собой белые рыхлые
кристаллические массы.
Хлорфториды титана. Хлортрифторид титана — T1F3CI — обра-
зуется при действии хлора на трифторид титана:
2TiF3 + CI2 = 2TiF3Cl
а также при действии строго рассчитанного количества фторово-
дорода на тетрахлорид титана:
TiC 14 + 3HF = TiF3Cl + ЗНС1
При этом в качестве промежуточного продукта возможно образо-
вание дихлордифторида титана — TiF2Cl2.
Хлортрифторид и дихлордифторид титана образуются также
при действии фторидов хлора на элементарный титан и тетрахло-
рид:
Ti + CIF3 = TiF3Cl
Ti + 2C1F = TiF2Cl2
- TiCl4 + 2C1F = TiF2CI2 + 2C12
Образование дихлордифторида титана происходит при действии
хлора на дифторид титана:
TiF2 + Cl2 = TiF2Cl2
Трихлорфторид титана — TiFCls— образуется при действии мо-
нофторида хлора на дихлорид титана:
TiCI2 + CiF = TiFCls
Хлортрифторид титана представляет собой лимонно-желтый
порошок, сублимирующийся легче, чем тетрафторид титана. Хо-
рошо растворим в воде (подвергается при этом гидролизу) и не-
значительно— в хлороформе. На влажном воздухе гидролизуется:
TiFgCl + Н2О - TiF2O + HF + НС1
Бромфториды титана. Бромтрифторид и дибромдифторид ти-
тана образуются при действии фторидов брома на элементарный
109
титан:
Ti + BrF3 = TiF3Br
Ti + 2BrF = TiF2Br2
3Ti + 2BrFs = 2TiF3Br + TiF4
Последняя реакция идет быстро только при температуре выше
300° С, так как при более низких температурах образующаяся на
поверхности титана плотная пленка тетрафторида защищает его
от действия пентафторида брома.
Бромтрифторид титана образуется также при действии брома
на трифторид титана:
2TiF3 + Br2 = 2TiF3Br
фтороводорода на тетрабромид титана:
TiBr4 + 3HF = TiF3Br + ЗНВг
и трифторида брома на раствор соединения титана(IV) в тетрахло-
риде углерода. Дибромдифторид получается при действии брома
на дифторид титана:
TiF2 + Br2 = TiF2Br2
Трибромфторид титана — TiFBr3 — образуется при действии мо-
нофторида брома на дибромид титана:
TiBr2 + BrF = TiFBr3
Бромфториды титана представляют собой желто-коричневые по-
рошки.
Иодфториды титана. Иодтрифторид титана — TiF3I— образуется
при действии гептафторида иода на элементарный титан при на-
гревании!
2Ti + IF7 = TiF3I + TiF4
а также при действии иода на трифторид титана:
2TiF3 + I2 = 2TiF3I
Дииоддифторид титана — TiFah— образуется при действии
иода на дифторид титана:
TiF2 + I2 — 2TiF2I2
ТЕТРАХЛОРИД ТИТАНА
Тетрахлорид титана, или четыреххлористый титан, — TiCh (мол.
вес 189,72) по физическим и химическим свойствам существенно
отличается от трихлорида, и особенно от дихлорида титана, и его
нельзя рассматривать как соль. Тетрахлорид титана при обычной
температуре представляет собой бесцветную или желтоватую
(в присутствии примесей), прозрачную, подвижную, сильно дымя-
щую на влажном воздухе жидкость с едким запахом, не проводящую
электрического тока. Особенно резко тетрахлорид титана отли-
чается от ионных хлоридов своим отношением к воде: при взаимо-
110
действии с водой он полностью гидролизуется, образуя в качестве
промежуточных продуктов аквасоединения и хлоргидроксиды. Тет-
рахлорид титана не отщеПО^‘тгота“Фт44Т^
виях, например при взаимодействии с соляной кислотой и с хлори-
дами ионного характера, способен образовывать комплексный ион
TiCl^.. Все это показывает, что тетрахлорид титана является соеди-
'неЙием, в котором атомы титана и хлора связаны ковалентно, т. е.
что он имеет кислотообразующий характер.
Получение84-95
К образованию тетрахлорида титана приводят реакции четырех
типов. К реакциям первого типа относится непосредственное дей-
ствие свободного хлора на титан, некоторые его сплавы и слабо
экзотермические соединения.
К реакциям второго типа относится действие хлора на сильно
экзотермические галогенные и кислородные соединения титана,
в частности на его двуокись, а также на титанаты. Такие реакции
эндотермичны и практически могут быть осуществлены только
в присутствии восстановителей.
К реакциям третьего типа относятся реакции замещения, проис-
ходящие между различными хлоридами и титаном или его соеди-
нениями. И наконец, к реакциям четвертого типа относится разло-
жение веществ, содержащих титан и хлор, в частности комплекс-
ных хлоротитанатов.
Действие хлора на титан, его сплавы и слабо экзотермические
соединения. Все эти реакции осуществляются непосредственным
действием свободного хлора без участия каких-либо вспомогатель-
ных веществ (восстановителей, катализаторов) на титан и некото-
рые его сплавы и соединения, отличающиеся сравнительно неболь-
шой теплотой образования.
Впервые теграхлорид титана был получен в 1825 г. Э. Жоржем
действием хлора на титан (как чистый, так и содержащий углерод)
при высокой температуре. Таким же способом позднее тетрахлорид
титана получил Ф. Велер, который отметил, что при обычной тем-
пературе хлор не действует на элементарный титан, а при темпера-
туре выше 300° С происходит бурное хлорирование, сопровождаю-
щееся ярким свечением. Реакция образования тетрахлорида титана
из элементарных веществ идет с выделением теплоты:
Ti + 2С12 = TiC 14 (г) + 183,0 ккал
Стандартная теплота образования жидкого TiCh равна
192,9 ккал/моль. Энергия Гиббса образования Т1СЦ составляет
176,3 ккал/моль.
К образованию тетрахлорида титана приводит также действие
хлора при высокой температуре на различные сплавы и интерме-
таллические соединения титана.,
Ill
Тетрахлорид титана получается при действии хлора на гидриды
и бориды титана. Давно известной и излюбленной реакцией обра-
зования тетрахлорида является хлорирование карбида титана при
высокой температуре:
TiC + 2C1Z = Т1С14 + С
При нагревании карбонитридов титана в токе хлора также обра-
зуется тетрахлорид. К образованию тетрахлорида титана приводит
и действие хлора при высокой температуре на силициды, нитриды,
сульфиды и другие подобные соединения титана.
Действие хлора на галогенные и кислородные соединения ти-
тана. Тетрахлорид титана легко образуется при действии хлора
на дихлорид и трихлорид титана:
TiCl2 + С12 = TiCl4
2TiCl3 + Cl2 = 2TiCl4
а также на различные бромиды и иодиды титана.
Наиболее излюбленными реакциями образования тетрахлорида
титана являются различные реакции хлорирования двуокиси ти-
тана и ее производных. Поскольку эти вещества отличаются значи-
тельной теплотой образования, непосредственное действие, хлора
на них не дает хороших результатов. Тетрахлорид титана обра-
зуется лишь при действии на двуокись титана хлором в присут-
етвии восстановителей.
В связи с большой величиной теплоты образования двуокиси
титана реакция ее с элементарным хлором является эндотермиче-
ской :
TiO2 + 2С12 = TiCl4 + О2 — 42,5 ккал
Эта реакция отличается малыми выходами, идет лишь при очень
высоких температурах, да и то не до конца.
Трудность прямого хлорирования двуокиси титана связана с
необходимостью затраты большого количества энергии на разло-
жение двуокиси. Однако этой трудности можно избежать, если
вести процесс так, чтобы кислород отделялся от двуокиси титана
не в элементарной форме, а в форме соединения, имеющего доста-
точную теплоту образования. Это может быть достигнуто введе-
нием специального восстановителя, соединяющегося с кислородом.
В присутствии восстановителей хлорирование двуокиси титана
свободным хлором происходит с заметной скоростью. Чаще всего
в качестве восстановителя применяют углерод в том или ином
виде. Реакция при недостатке углерода идет с образованием дву-
окиси углерода:
ТЮ2 + С + 2С12 = TiC 14 + СО2 + 51 550 кал
а при избытке — с образованием одноокиси углерода:
TiO2 + 2С + 2С12 = TiC 14 + 2СО + 10 330 кал
Для достаточно полного выхода продукта этой реакции темпера-
тура должна быть около 800° С. Таким образом, достаточная вели-
112
чина теплоты образования побочных продуктов реакции хлориро-
вания обусловливает ее экзотермичность.
В качестве восстановителей могут быть использованы также
сера, кремний и такие металлы, как алюминий и магний. Восста-
л повителями при хлорировании двуокиси титана кроме элементар-
ных веществ могут быть различные соединения, например углево-
дороды, углеводы, а также одноокись углерода и двуокись серы:
TiO2 + 2СО + 2С12 = TiC 14 + 2СО2 + 99 780 кал
TiO2 4- 2SO2 + 2С12 = TiC 14 4- 2SO3 4- 4770 кал
Тетрахлорид можно получить также хлорированием различных
титанатов. Однако эта реакция возможна только в присутствии
восстановителей, поскольку теплоты образования титанатов боль-
ше теплоты образования двуокиси титана. При действии хлора на
смесь титаната кальция с углеродом образуется тетрахлорид ти-
тана:
СаТЮ3 4- 2С 4- ЗС12 = TiC14 4- СаС12 4- СО2 4- СО 4- 197,7 ккал
а при действии хлора на смесь силикотитаната кальция с углеро-
дом идет реакция:
CaTiSiOs 4- ЗС 4- 5С12 = TiCl4 4- СаС12 4- SiC 14 4- 2СО2 4- СО
Тетрахлорид титана образуется также при действии хлора на смесь
титаната железа (II) с углеродом:
2FeTiO3 4- ЗС 4- 7С12 ~ 2TiCl4 4- 2РвС1з 4- ЗСО2 4- 468,8 ккал
Действие хлоридов на титан и его соединения. Тетрахлорид
титана получается при действии хлороводорода на элементарный
титан при температуре выше 300° С:
Ti 4- 4НС1 = TiCl4 4- 2Н2 4- 94 750 кал
К образованию тетрахлррида титана приводит также действие
хлороводорода при высокой температуре на дихлорид и трихлорид
титана:
TiC 12 4- 2НС1 = TiCl, 4- Н2 4- 18 280 кал
2TiCl3 4- 2НС1 = 2TiC 14 4- Н2 - 22 720 кал
Тетрахлорид титана может быть получен также в результате
многочисленных реакций двойного обмена. Например, хлорирова-
ние двуокиси титана может быть осуществлено при использовании
вместо свободного хлора некоторых его соединений — хлоридов.
Двуокись титана легко хлорируется такими хлорсодержащими со-
единениями, теплота образования которых сравнительно невелика,
причем эти реакции идут при температуре выше 300° С, а чаще
всего —при температуре красного каления.
При пропускании паров хлордиоксида серы над двуокисью ти-
тана при 300° С образуются пары тетрахлорида титана и трехокиси
серы:
TiO3 4- 2SO2C12 = TiC 14 4- 2SO3 - 27 340 кал
ИЗ
Хлор моноксид серы реагирует с двуокисью титана при высокой
температуре:
Т1О2 + 2SOC12 - tiCl4 + 2SO2 - 2210 кал
Под действием гемидихлорида серы получается тетрахлорид ти-
тана, двуокись серы и элементарная сера. Тетрахлорид титана об-
разуется при действии на двуокись титана хлороксидов азота, хло-
ридов и хлороксида фосфора.
Реакции двуокиси титана с хлорокисью углерода (фосгеном),
тетрахлоридами углерода и кремния идут по одинаковым схемам:
TiO2 + 2СОС12 = Т1С Ц + 2СО2 + 41 360 кал
TiO2 + СС14 == T1CI4 + СО2 + 23 610 кал
Т1О2 + S1CЦ м T1CI4 + SiO2 + 16 340 кал
Образование тетрахлорида титана происходит также при дей-
ствии некоторых хлорсодержащих веществ на титанаты.
Тетрахлорид титана образуется при сплавлении хлорида сере-
бра с тетрабромидом или тетраиодидом титана:
TiBr4 + 4AgCl = TiCl4 + 4AgBr
Til4 + 4AgCl = TiCl4 + 4AgI
при смешении тетраиодида титана с тетрахлоридом германия при
легком нагревании:
T1I4 + GeCl( ™ TiCI4 + Gel4
при взаимодействии хлорида натрия и трехокиси серы с каким-
либо титансодержащим соединением, в том числе и с двуокисью
титана:
TiO2 + 4NaCl + 2SO3 = TiCl4 + 2Na2SO4 + 36 740 кал
Последняя реакция идет только при высокой температуре. Вместо
трехокиси серы может быть применен высокопроцентный олеум.
К образованию тетрахлорида титана приводит также действие
смеси двуокиси серы с кислородом на накаленную (600° С) смесь
двуокиси титана с хлоридом натрия:
ТЮ2 + 4NaCl + 2SO2 + О2 = TiC 14 + 2Na2SO4 + 84 450 кал
Реакции разложения. Образование тетрахлорида титана про-
исходит при разложении трихлорида титана, нагреваемого в ваку-
уме до 450° С или в хлороводородном пламени:
2TiCl3 = T1CI4 + TiCl2
Образование тетрахлорида титана происходит также в резуль-
тате „многочисленных реакций разложения комплексных хлороти-
танатов. Большинство гексахлоротитанатов неустойчиво и при вы-
соких температурах диссоциирует,
114
Физические-свойства 21 -53- 84-88-90’92-94
Молекула тетрахлорида титана представляет собой правильный
.тетраэдр, в центре которого находится атом титана, а в верши-
нах— атомы хлора. Расстояние Ti — Cl равно 219, а расстояние
С1 — Cl —358 пм. Энергия связи Ti — Cl равна 0,71 адж, силовая
постоянная связи — 31 н/м. Тетрахлорид титана мономолекулярен.
Фазовые превращения. Температура кристаллизации
тетрахлорида титана равна —23,22°С, а теплота кристаллиза-
ции (плавления) тетрахлорида равна 11,80 кал/г (или
2239 кал!моль). В твердом состоянии тетрахлорид представляет
собой белые кристаллы с решеткой молекулярного типа моноклин-
ной сингонии с параметрами: а =970, b = 648, с =975 пм (—32°С).
Зависимость давления пара твердого тетрахлорида титана от
температуры в интервале от —60 до —23° С выражается уравне-
нием: 1gр — 9,639 — 2453/7. Теплота сублимации твердого
тетрахлорида титана 59,15 кал/г (или 11 223 кал/моль).
Зависимость давления пара жидкого тетрахлорида от темпера-
туры в интервале от —23 до + 136° С выражается уравнением:
1g р = 7,6825— 1964/7'. Температура кипения тетрахлорида
титана 135,9°С. Зависимости теплоты испарения % (в кал/г)
и L (в кал/моль) жидкого тетрахлорида титана от температуры в
интервале от 0 до 365° С выражаются уравнениями:
А, = 47,35 - 0,0033/-9,8 • 10-5/2-9,18- Ю-24/10 + 2,3 • 10-26/11
L = 8984 - 0,62/ - 0,0185/2 - 1,5 • 10“|2/8 - 8,7 • 10-18/8
Критическая температура тетрахлорида 365° С, крити-
ческое давление 45,7 атм.
Значения давления пара и теплоты испарения тетрахлорида ти-
тана при различных температурах приведены в Приложении 16.
Механические свойства. Зависимость плотности (в г/см3)
твердого тетрахлорида титана от температуры выражается
уравнением: р t = 2,20 — 5JL5-10~8 Г2 — 4-10~10 Г3 + 4 • 10~41 Г4. О б ъ-
е м но е тер КГП'Тёское рас ш ирГе нТГё (в см3/г) твердого тет-
рахлорида титана выражается уравнениями:
иг = 0,4545+ 1,15- 10-вТ2 —8,5- 10-12Г4
^ = 0,4935 + 3,8- 10“8/3 + 3- Ю-10/4-6 - 10“19/8 + 3,5 • Ю-23/10 + 1,1 • 10-25/11
Зависимость истинного коэффициента термического расширения
(в град~1) твердого тетрахлорида титана от температуры выра-
жается уравнением: р = 2,9-10~5 + 4,6- 10~вГ — 7- 10~10Г3.
Зависимость плотности жидкого тетрахлорида титана
от температуры в интервале от — 18 до 150° С выражается уравне-
нием: р< = 1,7613 — 0,00166 t — 4,85-10-7t2 — 6,5-10~12ф4, Объем-
ное распГирение жидкого”тетрахлорида титана подчиняется
уравнению:
1^ = 0,56773 (1 +9,4888-10-4/+ 1,01985- Ю-8/2 +2,325 • 10-9/3 +5,285-10“12/4)
115
Зависимость истинного коэффициента расширения жидкого тетра-
хлорида титана от температуры выражается уравнением: р =
= 9,4888 1 О*4 + 10"4 + 1,07 • 10"61 + 6,75 • 10~° t2.
Значения плотности, удельного объема и коэффициентов рас-
ширения тетрахлорида титана при различных температурах приве-
дены в Приложении 17.
Критическая плотность тетрахлорида титана составляет
(/0,565 г/слЛ) а плотность пара по воздуху равна 6,836.
Кинематическая вязкость тетрахлорида титана при 0°С со-
ставляет 5,75-10-7 м2/сек, абсолютная динамическая вязкость при
0°С равна 0,01012 пз. Зависимость динамической вязкости от тем-
пературы подчиняется правилу А. И. Бачинского и может быть
выражена уравнением: тр = 0,000516/(vt— 0,5171), где vt — удель-
ный объем, см3/г.
Зависимость вязкости от температуры может быть выра-
жена также следующим уравнением: тр = 1/(98,64 + 1,10П).
Поверхностное натяжение тетрахлорида титана при
0°С составляет 0,03528 н/м. Зависимость поверхностного натяже-
ния (в дин/см) тетрахлорида титана от температуры подчиняется
уравнению:
at = 35,28 - 0,1255; + 5 • 10~5;2 + 4 • 10“ V + 10“ V
Парахор тетрахлорида титана равен 262,8.
Значения кинематической и динамической вязкости и поверх-
ностного натяжения тетрахлорида титана при различных темпера-
турах приведены в Приложении 18.
Тепловые свойства и термодинамические функции. Зависимость
теплоемкости [в кал/(град • моль)] твердого тетрахлорида ти-
тана от температуры выражается уравнением: Ср = 11,08 +
+ 0,1302 7’ — 9,1 10~57’2— 4,П10~77’3. Теплоемкость жидкого тетра-
хлорида титана при 25°С равна 0,1829 кал/(град-г), или
34,704 кал/(град-моль). Зависимость теплоемкости жидкого TiCL
от температуры в интервале 250 -г- 400° К выражается уравнением:
Ср = 33,93 + 0,00267'. Средняя теплоемкость при температуре
10—100°С равна 0,203 кал/(град-г). Теплоемкость парообразного
тетрахлорида титана при 25° С составляет 22,815 кал/(град моль).
Зависимость теплоемкости [в кал/(град • моль)) газообразного тет-
рахлорида титана от температуры в интервале от 250 до 2000° К
подчиняется уравнению: Ср = 25,44 + 0,00025 7’ — 240350/7’2.
Энтальпия тетрахлорида титана при 250°К: твердого 5272 и
жидкого 7514 кал/моль-, при 298,15° К: жидкого 9182 и газообраз-
ного 5120 кал/моль. Зависимость энтальпии твердого тетрахлорида
титана от температуры в интервале 100—250° К выражается урав-
нением:
Н°Г - 77° = 29,9137 + 0.005972 + 83160/7 - 2900
жидкого тетрахлорида в интервале 250—400° К:
77г - 77° = 33,937 4- 0,001372 - 1050
116
и газообразного TiCb, в интервале 250—2000° К — уравнением:
= 25,44г + 1,25 • 10'4Г2 + 240350/Г - 3280
Энтропия тетрахлорида титана при 250°К: твердого 49,94 и
жидкого 58,90; при 298,15° К: жидкого 60,306 и газообразного
84,186 кал/(град-моль). Зависимость энтропии жидкого тетрахло-
рида от температуры в интервале от 250 до 400° К выражается
уравнением:
S°r = 53,05 + 0,02185г - 4,98 • 10~6Г2 + 4,47 • 10-8Г3
и газообразного TiCl4 в интервале 250—2000° К — уравнением: =
= 114,4 + О.ОЮбГ — 9950/71.
Приведенная энергия Гиббса твердого тетрахлорида ти-
тана при 250° К равна —28,84, жидкого при 298,15° К —29,51 и газо-
образного при 298,15°К — 67,013 кал/(град-моль). Зависимость
приведенной энергии Гиббса газообразного тетрахлорида титана
от температуры в интервале 250—2000° К выражается уравнением:
—Ф* = 41,7 + 0,114 Т— 1,1 • 10~4 Р + 4,3- IO'8 Т3.
Значения термодинамических функций жидкого и газообразного
гетрахлорида титана при различных температурах приведены в
Приложении 19.
Электрические и оптические свойства. Диэлектрическая
проницаемость тетрахлорида титана при 0°С составляет 2,83.
Зависимость диэлектрической проницаемости от температуры опре-
деляется уравнением: £г = 2,83 — 0,002^ — 2,5- 10~10/6.
Сухой тетрахлорид не проводит электрического тока, электро-
литическая диссоциация его практически равна нулю. Соли, рас-
творенные в тетрахлориде титана, не подвергаются электролитиче-
ской диссоциации. Дипольный момент молекулы тетрахлорида ти-
тана равен нулю.
Тетрахлорид диамагнитен. Магнитная проницаемость
его составляет 8,55, магнитная восприимчивость — 2,87-10~7.
Значения показателя преломления при 20°С для
света с различной длиной волны приведены ниже:
Л, нм . . . 768 670 589 533 508 480 394 358
п........ 1,5895 1,5968 1,6079 1,6191 1,6264 1,6357 1,6874 1,7345
Мольная рефракция равна 65,23, мольная дисперсия —
10,74.
Химические свойства 2’84’91’92 96
Восстановление металлами. Все металлы оказывают восста-
навливающее действие на тетрахлорид титана. При этом в зависи-
мости от условий восстановление может происходить до образова-
ния трихлорида, дихлорида и даже элементарного титана.
117
Натрий на холоду восстанавливает Тетрахлорид титана до
дихлорида:
TiCl4 + 2Na = TiCl2 + 2NaCI + 124,2 ккал; AG = — 120,2 ккал
а при 130—150° С тетрахлорид титана как жидкий, так и парооб-
разный восстанавливаются натрием до элементарного титана:
Т1С14(ж) + 4Ма(ж) = Ti + 4NaCl + 200,3 ккал; \G = — 190,3 ккал
Аналогично реагируют и пары натрия с парами тетрахлорида ти-
тана, причем реакция идет при 270° С; А Н = —313,0; AG =
= — 267,5 ккал.
Калий на жидкий тетрахлорид титана даже при температуре
его кипения не действует, а пары тетрахлорида титана при пропус-
кании над- калием восстанавливаются до элементарного титана:
TiCl4 + 4К = Ti + 4КС1 + 233,7 ккал
С магнием тетрахлорид титана реагирует при 400°С с обра-
зованием трйхлорида фиолетового цвета:
2TiCl4 + Mg = 2TiCl3 + MgCl2 + 131,8 ккал
При более высоких температурах восстановление магнием идет до
элементарного титана, а при избытке тетрахлорида — до дихлорида:
TiCl4 4- Mg = TiCl2 + MgCl2 + 90,8 ккал
В результате реакции между газообразным тетрахлоридом титана
и жидким магнием при температуре выше 750° С образуется эле-
ментарный титан и хлорид магния:
Т1С14 + 2Mg = Ti 4- 2MgCl2 + 109 120 кал
Восстановление должно протекать до конца, поскольку при 750° С
и выше энергия Гиббса образования хлорида магния значительно
превышает энергию Гиббса образования дихлорида титана. В ходе
реакции элементарный титан, обладающий наибольшей плот-
ностью, опускается на дно, а жидкий магний, наоборот, всплывает
на поверхность жидкого хлорида магния. Титан в результате этой
реакции получается в виде губки.
Кальцием при высокой температуре тетрахлорид титана
сравнительно легко восстанавливается до элементарного титана:
TiCl4 + 2Са = Ti + 2СаС12 + 199,2 ккал
Восстановление, тетрахлорида титана алюминием протекает
в зависимости от условий. При 400° С в присутствии хлорида алю-
миния восстановление идет до трихлорида титана:
3TiCl4 + Al = 3TiCl3 + А1С13 + 127 460 кал
а при температуре около 1000° С алюминий восстанавливает тетра-
хлорид титана до металла:
3TiCl4 4- 4А1 — 3Ti 4- 4А1С13 4-19,4 ккал
118 .
Продукт восстановления получается обычно в виде сплава титана
с алюминием.
Тетрахлорид титана может взаимодействовать с элементарным
титаном по уравнению:
TiCl4 + Ti = 2TiCl2 + 58,2 ккал
При недостатке элементарного титана реакция может пойти с об-
разованием трихлорида:
3TiCl4 + Ti = 4TiCl3 + 140,2 ккал
Согласно старым сообщениям, железо не действует на тетра-
хлорид титана даже при температуре красного каления. Однако из
практики промышленной переработки тетрахлорида титана изве-
стно, что при высоких температурах он может быть восстановлен
железом:
2TiCl4 + Fe = 2TiCl3 + FeCl2 + 60,5 ккал
TiCl4 + Fe = TiCl2 + FeCl2 + 19,5 ккал
Медь восстанавливает тетрахлорид титана до трихлорида.
В присутствии кислорода медь взаимодействует с тетрахлоридом
по уравнению:
TiCl4 + Си - Cu[TiCl4]
Серебро при нагревании лишь частично восстанавливает тет-
рахлорид титана до трихлорида:
TiCl4 + Ag = TiCl3 + AgCl + 19,7 ккал
Аналогично действует и ртуть при температуре выше 100° С.
Взаимодействие с водородом и металлоидами. Тетрахлорид ти-
тана реагирует с водородом при 500—700°С:
2TiCl4 + Н2 = 2TiCl3 + 2НС1 + 22,7 ккал; AG=— 11,1 ккал
При более высокой температуре (650—850° С) и избытке водорода
тетрахлорид восстанавливается до дихлорида титана:
TiCl4 + Н2 = TiCl2 + 2НС1 — 18 280 кал; AG = + 15,15 ккал
Повышение температуры до 1000° С и большой избыток водорода
приводят к восстановлению тетрахлорида титана до металла:
TiCl4 + 2Н2 = Ti + 4НС1 - 94 750 кал; AG = + 82,5 ккал
С углеродом тетрахлорид титана не реагирует. При дей-
ствии паров тетрахлорида титана на раскаленный аморфный
кремний образуется силицид титана:
5TiCl4 + 8Si = Ti5Si3 + 5SiCl4 + 9,1 ккал
Реакция обратима и идет заметно только при большом избытке
кремния и при условии отвода образующихся паров тетрахлорида
кремния.
Фосфор и м ы ш ь я к восстанавливают тетрахлорид титана до
трихлорида:
ЗТ1С14 + Р = 3TiCl3 + PC 1з + 36,5 ккал
119
Действие азота и халькогенов. При обычных условиях азот
не действует на тетрахлорид титана, а азот, активированный дей-
ствием тихого электрического разряда (4500 s), реагирует с тетра-
хлоридом:
2TiCl4 + 2N = 2T1NC1 + ЗС12
Избыток непрореагировавшего тетрахлорида титана тотчас же
присоединяется к образовавшемуся хлорнитриду, причем полу-
чается соединение TiNCl-TiCU в виде зеленовато-желтого гигро-
скопичного порошка, разлагаю-
щегося при нагревании.
При пропускании смеси па-
ров тетрахлорида титана с
кислородом через раска-
ленную трубку образуются ди-
оксид и хлороксид титана:
TiCl4 + О2 = TiO2 + 2С12 + 42,5 ккал-,
NG = — 38,7 ккал
4TiCl4 + ЗО2 = 2Ti2O3CI2 + 6С12
При 470° С взаимодействия
между парообразным тетра-
хлоридом титана и молекуляр-
ным кислородом не происхо-
дит, при 550° С начинается
окисление, которое при 800° С
идет до конца, причем получа-
о 20 1»о 60 во 100 ются хорошо оформленные
Содержание С12 , мл. % кристаллы рутила. Нагревание
паров тетрахлорида титана с
Рис. 11. Диаграмма кристаллизации газами, содержащими КИСЛО-
системы TiCl4—С12. род, до 1000° С приводит к об-
разованию диоксида титана и
элементарного хлора. Действие кислорода на тетрахлорид титана
под влиянием тихого электрического разряда ведет к образованию
порошкообразных и чешуйчатых продуктов от светло-желтого до
коричневого цвета, являющихся смесями хлороксидов титана пе-
ременного состава.
С серой тетрахлорид титана реагирует в присутствии хлорида
алюминия:
2TiCI,( + 2S = 2TiCl3 + S2C12 — 27 ккал
Взаимодействие с галогенами. При действии фтора на тет-
рахлорид титана происходит обмен атомов галогена с выделением
элементарного хлора:
TiCl4 + 2F2 = TiF4 + 2С12 + 201,3 ккал- AG = - 196,4 ккал
Вероятнее всего, что при этом происходит последовательное заме-
щение атомов хлора на атомы фтора с образованием в качестве
120
промежуточных продуктов смешанных хлорфторидов титана по
схеме:
TiCl4 + F2 —> T1FCI3 —► TiF2Cl2 —> T1F3CI —► TiF4 + Cla
Однако выделить индивидуальные хлорфториды при этом чрезвы-
чайно трудно.
Тетрахлорид титана смешивается во всех соотношениях с
жидким хлором и растворяет газообразный хлор. Значения тем-
пературы кристаллизации смесей тетрахлорида титана с хлором
приведены в Приложении 20. Диаграмма кристаллизации в си-
стеме TiCk —С12 представлена на рис. 11. На кривой кристаллиза-
ции имеется одна эвтектическая точка, соответствующая 77,8 мол. °/о
Рис. 12. Диаграмма кристаллизации системы TiCl4—Вг2.
С12 и —108° С, следовательно, никаких определенных соединений
тетрахлорида титана с хлором не обнаруживается. Значения рас-
творимости I газообразного хлора в тетрахлориде титана при раз-
личных температурах и давлении 1 атм приведены ниже:
t, °C.............-20 0 20 40 60 80 100 120
/, мол. % . , . . . 56,7 28,1 16,3 10,1 6,75 4,71 3,27 2,27
Тетрахлорид титана смешивается во всех соотношениях с бро-
мом, причем образуются подвижные смеси густо-красного цвета
(см. Приложение 20). Диаграмма кристаллизации системы TiCl4—
Вгг представлена на рис. 12. На кривой кристаллизации имеются три
эвтектические точки и две сингулярные точки, соответствующие:
1) 33,3 мол. % Вг2 и —41,9° С и 2) 66,7 мол. % Вг2 и —20,3° С. Это
показывает, что в системе TiCk— Вг2 образуются два соединения:
TiCkBr и TiCUBri,
.121
Тетрахлорид титана хорошо растворяет иод, окрашиваясь при
этом в фиолетовый цвет (см. Приложение 20). Из диаграммы рас-
творимости системы TiCk—h (рис. 13) следует, что в системе ни-
каких определенных соединений не образуется.
Взаимодействие с галогенными соединениями. Тетрахлорид ти-
тана бурно реагирует с газообразным фтороводородом:
TiCl4 (ж) + 4HF (г) == TiF4 (т) + 4НС1 (г)+ 30,35 ккал; AG = — 26,7 ккал
С жидким фтороводородом протекает энергичная реакция с обра-
зованием твердого осадка, состоящего из тетрафторида титана с
примесью хлортрифторида. При действии строго рассчитанного ко-
личества фтороводорода на тетрахлорид титана образуется хлор-
трифторид титана:
TiCl4 + 3HF = TiF3Cl + ЗНС1
В соответствующих условиях возможно образование дихлордифто-
рида титана:
TiC 14 + 2HF = TiF8Cl2 + 2НС1
Тетрахлорид титана смешивается во всех соотношениях с жид-
ким хлороводородом и растворяет газообразный хлороводород.
При действии бромоводорода на тетрахлорид титана при
обычных условиях образуется тетрабромид титана:
TiС14 + 4НВг <= TiBr4 + 4НС1 + 9550 кал
При действии недостаточного количества бромоводорода происхо-
дит неполное замещение на бром и образуются смешанные бром-
хлориды титана.
При действии иодоводорода на тетрахлорид титана при
обычных условиях образуется тетраиодид титана:
TiCl4 + 4Ш » Til4 + 4НС1 + 13,55 ккал
122
При действии недостаточного количества иодоводорода происходит
неполное замещение на иод и образуются смешанные иодхлориды
титана.
С фторидами щелочных и щелочноземельных металлов тет-
рахлорид титана реагирует лишь при высокой температуре с обра-
зованием тетрафторида титана, а в некоторых случаях — гексафто-
ротитанатов. Между фторидом серебра и тетрахлоридом титана
происходит реакция обмена:
TiCl4 + 4AgF = TiF4 + 4AgCl + 121,6 ккал
При действии хлоридов щелочных металлов на тетрахлорид
титана образуются соли титановых хлорокислот, чаще всего гекса-
хлоротитанаты состава Мег[ПС1в]. Растворимость газообразного
тетрахлорида титана в расплавленных хлоридах щелочных метал-
лов незначительна. Это объясняется тем, что при температуре
выше 700° С гексахлоротитанаты неустойчивы.
Растворимость газообразного тетрахлорида титана в расплав-
ленных хлоридах щелочноземельных металлов очень мала.
Тетрахлорид титана растворяет безводный хлорид алюминия
без какого-либо химического взаимодействия с ним. При действии
дихлорида титана на газообразный тетрахлорид титана образуется
трихлорид титана:
TiCl4 + TiCl2 = 2TiCl3 + 38,1 ккал
Тетрахлорид титана реагирует с йодидами натрия и калия:
Т1С14 + 2Г = Т1С1212 + 2СГ
Бромид и иод ид серебра с тетрахлоридом титана не реаги-
руют. Для тетрахлорида титана характерна способность смеши-
ваться почти со всеми кислотообразующими галидами, при этом ча-
сто получаются продукты присоединения, обычно не очень прочные.
Тетрахлорид титана образует три соединения с тетрахлоридом
серы: 2TiCl4-SCl4, TiCl4-SC14 и TiCl4-2SCl4.
С трихлоридом фосфора тетрахлорид титана смешивается во
всех соотношениях; в системе TiCl4 — РС13 образуется соединение
ПС14-РС1з. С пентахлоридом фосфора тетрахлорид титана образует
молекулярное соединение TiCl4 • PCI5.
С трихлоридом мышьяка тетрахлорид титана смешивается во
всех соотношениях; в системе TiCl4 — AsCl3 образуется соединение
TiCl4-AsCla. Трибромид и трииодид мышьяка растворяются в тет-
рахлориде титана.
Трихлорид, трибромид и трииодид сурьмы также растворяются
в тетрахлориде титана. С пентафторидом сурьмы тетрахлорид ти-
тана реагирует с образованием тетрафторида:
STIC 14 + 4SbF5 = 5TiF4 + 4SbC lfr
Тетрахлорид титана смешивается во всех соотношениях с пента-
хлоридом сурьмы; соединений в системе TiCl4 — SbCls не обра-
зуется.
123
С тетрахлоридами кремния, германия и олова тетрахлорид ти-
тана смешивается во всех соотношениях. Значения температур
кристаллизации и кипения смесей тетрахлорида титана с тетрахло-
ридами кремния, германия и олова приведены в Приложении 21.
Взаимодействие с халькогенными соединениями. Внесение тет-
рахлорида титана в воду вызывает бурную реакцию с образова-
нием объемистого желтого осадка и выделением большого количе-
ства теплоты. При введении 1 моль тетрахлорида титана в
1600 моль воды при 17° С выделяется 57870 кал. Пары тетрахло-
рида титана с парами воды также вступают в реакцию с образо-
ванием желтовато-белых малолетучих продуктов. Вследствие этого
тетрахлорид титана сильно дымит во влажном воздухе. Ход реак-
ции между водой и жидким тетрахлоридом титана довольно сло-
жен и зависит от температуры и других условий. Вначале при со-
прикосновении с водой образуются аквасоединения, которые затем
подвергаются гидролизу. При достаточном количестве воды обра-
зуется преимущественно пятиводное (пентаква-) соединение
TiC14-5H2O; при недостатке воды и при низких температурах —
двухводное (диаква-) соединение TiCl4-2H2O. При гидролизе про-
исходит последовательное отщепление и замещение атомов хлора
на гидроксо-группы, причем образуются хлоргидроксиды титана.
Гидролиз может быть изображен такой цепью реакций:
TiCl4-5H2O —> Ti(OH)Cl3 • 4Н2О + НС1 —> Ti(OH)2Cl2 • ЗН2О+
+ НС1 —> Ti(OH)3 • 2Н2О + НС1 —> Ti(OH)4 • Н2О + НС1
При высокой температуре весь процесс протекает быстро, а на хо-
лоду могут быть выделены промежуточные продукты. До конца
гидролиз идет при избытке воды, причем ортотитановая кислота
выделяется в виде коллоидного раствора. Кипящей водой тетра-
хлорид титана быстро гидролизуется с образованием метатитано-
вой кислоты:
TiC 14 + ЗН2О = H2TiO3 + 4НС1
При действии паров воды на пары тетрахлорида титана при 300—
400° С гидролиз идет до двуокиси титана:
TiCl4 + 2Н2О = TiO2 + 4НС1 + 15 150 кал
Сероводород может действовать на тетрахлорид титана
двояко: 1) восстанавливать его до три- или дихлорида и 2) при-
соединяться аналогично воде, давая тиолсоединения, с последую-
щим замещением атомов хлора на группы SH или атомы серы.
При действии газообразного сероводорода при комнатной темпе-
ратуре обычно происходит восстановление:
2Т1С14 + H2S = 2TiCl3 + 2НС1 + S - 1,9 ккал
TiCl4 + H2S = TiCl2 + 2HC1 + S - 33,0 ккал
При смешении тетрахлорида титана с жидким сероводородом вы-
падает коричневый осадок тиолсоединения 2TiC14-H2S. При низкой
124
температуре образуются тиолсоединения TiC14-H2S (теплота обра-
зования 206,6 ккал/моль) и TiCl4-2H2S (теплота образования
218,9 ккал/моль) в виде желтых кристаллов. При дальнейшем дей-
ствии сероводорода на тиолсоединения протекает тиололиз:
TiCl4-2H2S —> TiCl2(SH)2 + 2НС1 —> Ti(SH)4 + 2НС1
( При действии сероводорода на тетрахлорид титана при температуре
кипения последнего идет тиололиз с образованием тиохлорида
> титана:
TiCl4 + H2S = TiCl2S +2НС1
/ При действии сухой перекиси водорода на тетрахлорид
титана в сухом этилацетате выпадает белый нерастворимый про-
дукт присоединения TiC14-H2O2, который при стоянии на воздухе
? или при растворении в воде переходит в оранжевый пероксотита-
1 нат, при этом выделяется кислород и хлороводород.
Газообразная двуокись серы растворяется в тетрахлориде ти-
тана; жидкие двуокись серы и тетрахлорид титана ограниченно
, растворяются друг в друге, причем происходит расслоение на два
жидких слоя. Значения температуры растворения и состава соот-
ветствующих слоев приведены в Приложении 22. Критическая тем-
пература растворения 12° С; выше ее тетрахлорид титана и жидкая
двуокись серы смешиваются во всех соотношениях.
При смешении трехокиси серые тетрахлоридом титана как
непосредственно, так и в растворах идет чрезвычайно бурная ре-
акция с выделением желтого кристаллического дихлоросульфатди-
хлорида титана:
TiCl4 + 2SO3 = TiCl2(SO3Cl)2
При действии большого избытка трехокиси серы образуется нор-
мальный сульфат титана (IV):
TiCl4 + 6SO3 - Ti(SO4)2 + 2S2O5C12
Последняя реакция идет преимущественно в растворе (в хлордву-
окиси серы) при длительном кипячении в колбе с обратным холо-
дильником.
При действии на тетрахлорид титана концентрированной сер-
ной кислоты образуется сульфатхлорид титана:
TiCl4 + H2SO4 = TiCl2SO4 + 2HCI
Действие двусерной кислоты приводит к образованию ди-
сульфатхлорида титана:
TiCl4 + H2S2O7 = Ti C12S2O7 + 2HC1
Разбавленная серная кислота дает сульфатоксид титана:
TiCl4 + H2SO4 • Н2О = TiOSO4 + 4НС1
С хлородноокисью серы тетрахлорнд титана смешивается во всех
соотношениях с образованием соединения TiCl4 • 2SOC12. При смешении тетра-
хлорида титана с хлордвуокисью серы образуется жидкость, при стоянии тем-
неющая и приобретающая красноватый оттенок. В системе TiCl4 — SO2C12
125
образуется соединение TiCl4-2SO2Cl2. С хлоросерной кислотой тетра-
хлорид титана реагирует с образованием хлоросульфаттрихлорида титана и вы-
делением хлороводорода:
TiC 14 + HSO3C1 = TiCl3(SO3Cl) + НС1
Хлородиоокись селена с тетрахлоридом титана дает продукт при-
соединения состава TiCl4 • 2SeOCl2.
С оксидами азота(1У) тетрахлбрид титана образует твердые соедине-
ния состава T1CJ4 • 2NO2 и 2Т1С14 • 3N2O4. При смешении тетрахлорида титана с
хлородноокисью азота получается соединение TiC 14 2NOC1.
С хлорокисью фосфора тетрахлорид титана образует два соединения:
TiCl4-POCl3 н TiCl4 • 2РОС13.
При пропускании паров тетрахлорида титана над раскаленными
оксидами металлов протекают реакции обмена с образова-
нием двуокиси титана и хлорида соответствующего металла. Так,
с окисью кальция идет реакция:
TiCl। 4- 2СаО = TiO2 + 2СаС12 + 121,1 ккал
а с полутораокисью железа — реакция:
3TiCl4 + 2F2O3 = 3TiO2 + 4FeCl3 — 32,7 ккал
При пропускании паров тетрахлорида титана над двуокисью ти-
тана получаются хлороксиды титана:
TiCl4 + TiO2 = 2TiOCl2
TiCl4 + 3TiO2 = 2Ti2O3Cl2
а над нагретыми сульфидами металлов — дисульфид титана и
хлорид соответствующего металла. Так, с сульфидом цинка идет
реакция:
Т1С14 + 2ZnS — TiS2 + 2ZnCl2
При реакции тетрахлорида с дисульфидом титана образуется тио-
хлорид:
TiCl4 + TiS2 = 2TiCl2S
Взаимодействие с азотными и фосфорными соединениями. Тет-
рахлорид титана бурно поглощает сухой аммиак с выделением
большого количества теплоты. При продолжительном насыщении
аммиаком образуется TiC14-4NH3. При действии газообразного ам-
миака на пары тетрахлорида титана, а также при пропускании
сухого аммиака через раствор тетрахлорида титана в абсолютном
эфире образуется порошкообразный TiCl4-6NH3. При продолжи-
тельном встряхивании твердого тетрахлорида титана с жидким ам-
миаком или при пропускании сухого аммиака через эфирный рас-
твор тетрахлорида титана до испарения всего эфира образуется
TiCL-8NH3.
С гидразином тетрахлорид титана дает комплекс
[TiCl4(N2H4)2].
При продолжительном встряхивании крепкого солянокислот-
ного раствора тетрахлорида титана с хлоридом аммония по-
126
'Лучается гексахлоротитанат аммония:
• TiCl4 + 2NH„C1 = (NH„)2TiCle
Фосфин при обычной температуре и при 0°С энергично по-
глощается тетрахлоридом титана:
* TiCI4 + РН3 TiCl4 • РН3 + 16,4 ккал
I TiCl4 + 2РН3 - TiCl4(PHs)2 + 27,2 ккал
Образующиеся при этом фосфин-соединения стабильнее соответ-
ствующих тиолсоединений.
С нитридами и фосфидами активных металлов тетра-
хлорид титана образует нитрид или фосфид титана.
г- С нитридом серы тетрахлорид титана образует молекулярное
соединение TiCU-SiNi, причем частично происходит восстановление
‘до образования соединения титана (III) 2TiC13-S4N4.
Взаимодействие с гидридами и интерметаллидами. Гидрид на-
трия при 420°С восстанавливает тетрахлорид титана до металла:
1'- TiCl4 + 4NaH = Ti + 4NaCI + 2H2 + 156,1 ккал
При высоком давлении водорода одновременно образуется гидрид
титана.
Тетрагидридоборат лития и тетрахлорид титана взаимодей-
ствуют с образованием тетрагидридобората титана (III):
2TiCl4 + 8LiBH4 = 2Ti(BH4)3 + 8LiCl + B2He + H2
Амальгамой натрия тетрахлорид титана восстанавливается на
холоду до дихлорида; амальгамой висмута он также восстанавли-
вается, причем как в сухом виде, так и в солянокислотном рас-
творе.
Взаимодействие с углеводородами и их галогенопроизводными.
С метаном в обычных условиях тетрахлорид титана не взаимо-
действует, а при температуре 800—1400° С в присутствии водорода
и эффективных катализаторов метан реагирует с тетрахлоридом:
TiCl4 + СН4 = TiC + 4НС1 - 68 150 кал
Этан и пропан ведут себя аналогично.
В жидких предельных углеводородах тетрахлорид титана
растворяется, не вступая' в реакцию.
С моногалогенопроизводньгми тетрахлорид титана дает мутные
растворы, содержащие продукты присоединения.
С дихлорметаном, трихлорметаном, тетрахлорметаном, дихлор-
этаном и аналогичными бромпроизводными тетрахлорид титана
смешивается во всех соотношениях. Свойства смесей тетрахлори-
дов титана и углерода приведены в Приложении 21.
Этилен с тетрахлоридом титана образует при температурах
до 100° С жидкий продукт полимеризации. Таким же образом ведут
себя пропилен и бутилены. Присутствием непредельных углеводо-
родов обусловлено появление коричневой окраски при растворении
тетрахлорида титана в бензинах.
127
Хлорэтилен (хлористый винил) под действием тетрахлорида ти-
тана подвергается полимеризации. С хлорметилэтиленом (хлори-
стым аллилом) тетрахлорид титана дает сначала осадок, который
с повышением концентрации TiCU исчезает, но появляется желтая
окраска, интенсивность которой увеличивается с повышением кон-
центрации TiCk, а электропроводность раствора уменьшается.
С жидкими циклоалканами тетрахлорид титана смеши-
вается не реагируя.
С циклопентадиеном тетрахлорид титана бурно реагирует, при-
чем из реакционной смеси не удается выделить отдельных продук-
тов. Взаимодействие тетрахлорида титана с различными производ-
ными циклопентадиена описано в гл. X.
С бензолом тетрахлорид титана смешивается во всех соотно-
шениях. Смеси окрашены в желтый цвет. Значения температуры
кристаллизации смесей тетрахлорида титана с бензолом приведены
в Приложении 23; ход кривой кристаллизации показывает, что в си-
стеме образуется соединение STiCk-CeHg. С толуолом и ксилолами
тетрахлорид смешивается с образованием желтовато-коричневых
смесей, содержащих продукты присоединения в соотношении 1 : 1.
С хлорбензолом и дихлорбензолами тетрахлорид титана смеши-
вается не реагируя. Без взаимодействия тетрахлорид титана рас-
творяет также трихлорбензолы и гексахлорбензол. Тетрахлорид
титана взаимодействует с продуктами замещения на галоген в бо-
ковой цепи, например с хлоридом и бромидом бензила, хлоридом
бензаля и бензотрихлоридом.
Взаимодействие с органическими соединениями кислорода и
серы. С алкоголями тетрахлорид титана реагирует, давая вна-
чале продукты присоединения, затем происходит последовательное
замещение трех атомов хлора на алкоксильные группы:
TiCI4 + 3ROH —> TiCl4-3ROH —> TiCl3(OR) • 2ROH + НС1 —>
—> TiCl2(OR)2 • ROH + HC1 —> TiCl(OR)3 + HCl
По этой схеме процесс идет с метанолом, этанолом, пропанолами
и бутанолами.
При добавлении тетрахлорида титана к пропенолу получается
сначала раствор интенсивно желтого цвета, затем отделяется мас-
лянистый слой, причем частично образуется хлорид аллила, а на
поверхности слоя выделяется хлороводород.
При добавлении тетрахлорида титана к фенолу идет бурная
реакция с образованием темно-красных кристаллов и выделением
хлороводорода:
- TiCl4 + C6H5OH = TiCl3OC6H5 + HCl
Образующийся феноксидтрихлорид (трихлорфенолят) титана по-
чти всегда подвергается осмолению.
Реакции образования окрашенных соединений идут также с
'крезолами, гидрохиноном, хлорфенолами и другими производными
фенолов,
128
Тетрахлорид титана реагирует с бензиловым и другими аро-
матическими спиртами.
С метиловым, этиловым и пропиловыми простыми эфи-
рами тетрахлорид титана дает продукты присоединения TiCl4-OR2
и TiCl4-2OR2. Тетрахлорид титана реагйрует также с бензилэтило-
вым эфиром. .
Этил-, бутил- и некоторые другие сульфиды образуют с тет-
рахлоридом продукты присоединения состава TiCl4-SR2 и Т1С14 •
• 2SR2.
Ацетальдегид, как и другие альдегиды, разлагается тетра-
хлоридом титана.
Ацетон, другие кетоны и дикетоны бурно реагируют с тетра-
хлоридом титана с образованием продуктов присоединения.
При добавлении тетрахлорида титана к бензальдегиду выпа-
дает желтый осадок состава Т1С14-2СбН5СНО. Коричный альде-
гид дает соединение TiCl4-2CeH5CH = CHCHO красного цвета.
С ароматическими кетонами тетрахлорид титана образует мо-
лекулярные соединения. Так, с ацетофеноном образуется соедине-
ние TiCl4-СН3СОС6Н5 красного цвета, с бензофеноном — мелкие
желтые кристаллы состава TiCl4-CO(C6H5)2.
При действии муравьиной кислоты на тетрахлорид титана
происходит последовательное замещение трех атомов хлора на
формиат-группы:
TiCl4 + 3HCO2H —> TiCI3(CO2H) + НС1 —> TiCI2(CO2H)2+
+ HC1 —> TiCl(CO2H)3 + HC1
При действии уксусной кислоты на тетрахлорид образуется
обычно ацетаттрихлорид титана:
Ti С14 + НСН3СО2 = TiCl3(CH3CO2) + НС1
При растворении же тетрахлорида титана в уксусной кислоте с до-
бавлением уксусного ангидрида образуется диацетатдихлорид:
TiCl 4 + 2НСН3СО2 = TiCl2(CH3CO2)2 + 2НС1
С хлоридом ацетила тетрахлорид титана образует соединение
TiCl4-CH3COCl
При действии пропионовой кислоты на тетрахлорид титана (ки-
пячение) происходит последовательное образование пропионатхло-
ридов и в конечном итоге — пропионата титана (IV).
С непредельными одноосновными кислотами тетрахлорид ти-
тана образует смешанные соединения.
С солями непредельных одноосновных кислот (акрилатом, мет-
акрилатом, кротонатом, олеатом, линолатом натрия) тетрахлорид
титана вступает в реакции обмена с образованием соответствую-
щих производных титана (IV).
5 Зак. 1128
129
С коричной кислотой тетрахлорид взаимодействует с образова-
нием светло-желтого вещества состава TiC^OaCCHCHCeHs).
С салициловой кислотой в эфирном растворе тетрахлорид титана
дает темно-красное окрашивание; из раствора выпадают красные
кристаллы состава Т1С1(ОСбН4СО2Н)3-НС1.
Тетрахлорид титана весьма быстро реагирует с метилхлоросуль-
фатом по уравнению:
TiCI4 + CH3SO3CI = TiCl3SO3CI + CH3CI
Со многими сложными эфирами органических кислот
тетрахлорид титана дает продукты присоединения. С диметиловым
эфиром фумаровой кислоты тетрахлорид образует три соединения
в молекулярных соотношениях 2 : 1, 1 : 1 и 1:2.
С диоксаном, фураном, фурфуролом тетрахлорид титана дает
продукты присоединения. С дитианом и тиофеном тетрахлорид ти-
тана взаимодействует, но устойчивых комплексов с ними не обра-
зует.
Взаимодействие с органическими соединениями азота и фос-
фора. С алифатическими аминами, в частности с метил- и этил-
амином, тетрахлорид титана дает продукты присоединения состава
TiCh-NHaR, TiCl4-2NH2R и TiCl4-4NH2R. С анилином тетрахлорид
титана образует соединение Т1С14-4МН2СбН5. С диметиланилином
он дает черное окрашивание. С хлоридом анилиния (фениламмо-
ния) в спиртовом, насыщенном хлороводородом растворе обра-
зуются желтые кристаллы TiCl4-4NH3(C6H5) С1. При действии
тетрахлорида титана на свободный дифениламин получаются зе-
леновато-коричневые кристаллы, а при действии на разбавлен-
ные растворы дифениламина — зеленовато-желтый осадок со-
става TiC14-NH(CeH5)2-
С первичными алифатическими фосфинами, в частности с
метил- и этилфосфином, тетрахлорид титана образует продукты
присоединения состава TiC14-2PH2R. Подобный продукт образуется
с фенилфосфином и смешанными фосфинами.
С карбамидом (мочевиной) тетрахлорид титана реагирует
с образованием соединений TiCU-СО (NH2)2, TiCl4-2СО (NH2)2,
TiCl4-3CO(NH2)2 и TiC14-4CO(NH2)2. С ацетамидом и бензамидом
тетрахлорид титана также образует аддукты.
Пары синильной кислоты поглощаются сухим тетрахло-
ридом титана на холоду; при этом получается порошкообразный
продукт. При действии жидкой синильной кислоты образуются кри-
сталлы состава TiCl4-2HCN, способные возгоняться. С галогенци-
анами также образуются молекулярные соединения.
С метилцианидом (ацетонитрилом) тетрахлорид титана дает
молекулярное соединение TiCl4- 2CH3CN. С пропионитрилом (этил-
цианидом) образуются шесть молекулярных соединений различ-
ного состава. При смешении тетрахлорида титана с бензонитрилом
как непосредственно, так и в растворах могут быть выделены че-
тыре продукта присоединения различного состава.
130
Тетрахлорид титана образует комплексы с нитрометаном
и нитроэтаном. С нитробензолом тетрахлорид титана
дает молекулярное соединение TiCk-C6H5NO2 — желтые кристаллы
с температурой плавления 77,5° С. С метадинитробензолом обра-
зуется шесть, а с парадинитробензолом — три молекулярных со-
единения.
При действии нитрофенолов на тетрахлорид титана обра-
зуются продукты замещения в нем атомов хлора на нитрофенок-
сильные группы, причем при действии о-нитрофенола и «-нитро-
фенола происходит замещение двух атомов хлора, а при действии
.и-дипитрофсиола — одного атома хлора. Продукты замещения об-
разуются также при реакции тетрахлорида титана с пикриновой
кислотой.
С индолом тетрахлорид титана образует молекулярное со-
единение TiCU-2C8HtN. Аналогичное соединение образуется с три-
индолом.
При взаимодействии тетрахлорида с пиридином в растворе
выпадает желтый осадок молекулярного соединения TiCk-SCsHsN.
С хлоридом пиридиния обоазуются желтые кристаллы состава
TiCl4-2C5H5NHCl.
С а-пиколином тетрахлорид не дает соединений, а с у-пиколи-
ном образует белые иглообразные кристаллы состава TiCk"
• 4СеНтМ. С пиперидином образуются желтые иглообразные кри-
сталлы состава TiCk-CaHuN.
С хинолином тетрахлорид титана дает коричневый продукт
состава TiC14-2CgH7N, а с хлоридом хинолиния — TiCU-SCgHyNHCl.
Взаимодействие с органическими соединениями кремния и ме-
таллов. С алкилсиланами тетрахлорид вступает в реакцию обмена?
TiCl4 + SiR4 = TiCl3R + SiClR3
С триалкилалкоксисиланами тетрахлорид титана реагирует по
схеме:
TiCl4 + nSi(OR) (СН3)3 = TiCl4-n (OR)„ + nSiCl(CH3)3
Тетрахлорид титана реагирует с триалкилсиланолами с образо-
ванием тетратриалкилсилоксититана:
Ti С14 + 4R3SiOH = Ti (OSiR3)4 + 4НС1
Реакция идет лишь в присутствии акцептора хлороводорода, в ка-
честве которого можно использовать аммиак, амины, пиридин
и т. п.
С гексалкилдисилоксанами тетрахлорид титана реагирует по
схеме:
Т1С14 + «Si2OR6 = Ti С14 (OSiR3)„ + nSiClR3
Взаимодействие тетрахлорида титана с алкоксидами и арокси-
дами металлов и с металлоорганическими соединениями описано
в гл. X.
5* 131
БРОМИД, ИОДИД И СМЕШАННЫЕ
ГАЛИДЫ ТИТАНА(1У)
В этом разделе будут рассмотрены тетрабромид, тетраиодид и
смешанные галиды титана(IV), за исключением фторсодержащих.
Все эти тетрагалиды, подобно уже рассмотренному в предыдущем
разделе тетрахлориду титана, характеризуются суммой свойств,
отличающих их от ионных солей. Так, при взаимодействии с водой
они полностью гидролизуются, в жидком состоянии не проводят
электрического тока, обладают относительно высокой летучестью и
плавятся при сравнительно низких температурах. Все эти свойства
указывают на ковалентный кислотообразующий характер этих
тетрагалидов.
Тетрабромид титана 21,97-100
Тетрабромид титана — TiBr4 (мол. вес 367,54) представляет со-
бой желтые весьма гигроскопичные кристаллы. По химическим и
физико-химическим свойствам он во многом напоминает тетрахло
рид титана.
Получение. Тетрабромид титана образуется при непосредствен-
ном действии паров брома на титан при высокой температуре:
Ti + 2Вг2 = TiBr4 + 146,4 ккал
Он легко образуется при действии брома на трибромид и дибро-
мид титана:
2TiBr3 + Br2 = 2TiBr4; TiBr2 + Br2 = TiBr4
а также на различные иодиды титана. Тетрабромид титана полу-
чается также при действии паров брома на карбид титана при вы-
сокой температуре:
TiC + 2Вг2 = TiBr4 + С + 101,9 ккал
К образованию тетрабромида приводит действие паров брома при
температуре красного каления на смесь двуокиси титана с углем:
Т1О2 + 2С + 2Вг2 = TiBr4 + 2СО — 26,3 ккал
По этой реакции тетрабромид титана был впервые получен Ф. Дуп-
па в 1856 г.
Тетрабромид титана легко образуется при взаимодействии бро-
моводорода с нагретым до кипения тетрахлоридом титана:
TiCl4 + 4HBr = TiBr4 + 4НС1
а также в результате некоторых реакций обмена, например при
сплавлении тетраиодида титана с бромидом серебра или тетрабро-
мидом германия:
Til4 + 4AgBr = TiBr4 + 4 Ag I
Стандартная теплота образования твердого TiBr4 равна
148,0 ккал/моль’, энергия Гиббса образования—140,8 ккал/моль.
132
Физические свойства. Молекула тетрабромида титана представ-
ляет собой тетраэдр с атомом титана в центре; расстояния Ti — Вг
равны 231, а Вг — Вг — 377 пм. Энергия связи Ti — Вг составляет
0,61 адж. Силовая постоянная связи Ti — Вг равна 25 н/м.
Тетрабромид существует в двух полиморфных модификациях:
ла-, устойчивой при t<—15, и р-, устойчивой при />—15° С.
сс-Форма кристаллизуется в кубической сингонии (а'= ИЗО пм),
причем на одну ячейку приходится восемь молекул TiBr4. р-Форма
• кристаллизуется в моноклинной сингонии (а = 1017, b — 709, с =
' = 1041 пм).
Зависимость давления пара твердого тетрабромида от темпера-
туры в интервале от 0 до 38° С выражается уравнением: 1gр =
= 11,26 — 3621/7’. Теплота сублимации твердого тетрабро-
- мида 16,43 ккал/моль (или 44,7 кал/г). Температура плав-
. ле ни я 38,25° С; теплота плавления 8,95 кал/г (3289 кал/моль).
Зависимость давления пара жидкого тетрабромида титана от тем-
пературы в интервале от 40 до 230° С подчиняется уравнению:
\g р = 1,Пд1 — 2475/7’. Температура кипения тетрабромида
титана 232,6°С; теплота испарения при 25°С равна 35,71 кал/г
.у (или 13,12 ккал/моль) и при 232° С — 28,20 кал/г (или
. 10,26 ккал/моль).
' Плотность твердого тетрабромида титана при 25°С состав-
ляет 3,37 г/смъ. Зависимость плотности жидкого тетрабромида ти-
тана от температуры в интервале от 40 до 122° С описывается урав-
нением: р( = 3,043 — 0,00225/. Зависимость истинного коэффици-
ъ ента термического (в град-1) расширения жидкого тетрабромида
титана от температуры выражается уравнением: (3 — 7,4-10-4-4-’
+ 5,3- 10-в t + 6-10-9 /2.
Зависимость вязкости (в сп) тетрабромида титана от темпе-
ратуры в интервале от 40 до 120° С выражается уравнением:
; Т] = 3,137 — 0,03142/ + 0,000308/2 — Э-Ю-7/3.
Теплоемкость твердого тетрабромида титана при 25°С со-
; ставляет 31,43 кал/(град • моль). Зависимость теплоемкости жидко-
го тетрабромида титана от температуры в интервале 310—425° К
выражается уравнением: Ср — 31,645 + 0,015667. Теплоемкость
газообразного тетрабромида титана при 25° С составляет
24,071 кал/(град-моль), зависимость теплоемкости газообразного
/ TiBr4 от температуры в интервале 295—2000° К выражается урав-
нением Ср = 25,766 + 3,0 • 10-5Г - 151 500/Т2.
Энтальпия твердого тетрабромида титана при 25° С состав-
ляет 6794, жидкого при 125° С— 13376 и газообразного при 25° С —
.< 5713 кал/моль. Зависимость энтальпии газообразного тетрабро-
мида титана от температуры в интервале 295—2000° К выражается
уравнением: -
гГт - Н° = 25,7667 + 1,5 • 1О“5Т2 + 151 500/7 - 2478
i Энтропия твердого тетрабромида титана при. 25°С состав-
ляет 58,227 кал/ (град • моль), жидкого при 25° С —67,92, а при
.133
125° С — 78,38 кал/ (град-моль), газообразного при 25° С —
95,249 кал/(град-моль). Зависимость энтропии газообразного тетра-
бромида титана от температуры в интервале от 295 до 1100° К вы-
ражается уравнением: S°r = 106 + 0,02517’ — 5437/Т.
Приведенная энергия Г иббса тетрабромида титана при 25° С
составляет: твердого —35,44 кал/(град-моль), газообразного
—76,088.
Значения давления пара, плотности, вязкости и теплоемкости
тетрабромида титана при различных температурах приведены в
Приложении 24.
Химические свойства. Водород реагирует с тетрабромидом
титана при 600— 750° С с образованием трибромида титана:
2TiBr4 + Н2'= 2TiBr3 + 2НВг — 21,8 ккал
а при 800—900°С восстановление идет до дибромида:
TiBr4 + Н2 = TiBr2 + 2НВг — 17,0 ккал
При большом избытке водорода и температуре 1200—1400° С тет-
рабромид восстанавливается до элементарного титана:
TiBr4 + 2Н2 = Т1 + 4НВг — 96,8 ккал
Такими металлами, как алюминий и титан, тетрабромид ти-
тана восстанавливается, в зависимости от температуры, до трибро-
мида или дибромида. Серебром и ртутью при 300° С тетрабромид
восстанавливается до трибромида:
TiBr4 + Ag = TiBr3 + AgBr
С кислородом при высокой температуре (800°С) тетрабро-
мид реагирует с образованием двуокиси титана:
Т1Вг4 + О2 = ТЮ2 + 2Вг2 + 79,1 ккал
Под действием фтора или хлора идет обменное разло-
жение:
TiBr4 + 2С12 = TiС14 + 2Вг2 + 44,9 ккал
В жидком броме тетрабромид титана растворяется; диаграм-
ма состояния системы TiBr4 — Вг2 представлена на рис. 14; из диа-
граммы следует, что в системе никаких определенных соединений
не образуется.
Иод растворяется в жидком тетрабромиде титана.
Тетрабромид титана растворяет хлороводород и бромо-
водород; данные о системе TiBr4— НВг приведены в гл. VIII.
При действии иодоводорода на тетрабромид титана при обыч-
ных условиях образуется тетраиодид титана:
Т1Вг4 + 4HI = Т114 + 4НВг + 4,0 ккал
При недостатке иодоводорода в тетрабромиде титана заме-
щаются на иод не все атомы брома и образуются смешанные иод-
бромиды титана.
При действии бромидов щелочных металлов на тетрабромид
образуются гексабромотитанаты состава Мег[Т1Вг6]. Между фто-
134
:. 14. Диаграмма состояния системы
TiBr4—Вга.
ридом и хлоридом серебра и тетрабромидом титана при
сплавлении идет реакция обмена:
TiBr4 + 4AgCl = TiCl4 + 4AgBr
Для тетрабромида титана характерна способность растворяться
почти во всех кислотообразующих галидах. Часто растворе-
ние сопровождается образованием продуктов присоединения, обыч-
но не очень прочных. Так, тетрабромид титана растворяется в три-
хлоридах и трибромидах фосфора и мышьяка, тетрахлоридах крем-
ния, германия, олова, титана
и в тетрабромиде олова, при-
: чем в двух последних случаях
при охлаждении растворов
выпадают смешанные кри- до
. сталлы.
При внесении тетрабромида
титана в воду идет бурная го
реакция; при этом образуется
прозрачный раствор. Тетрабро- f0
мид титана притягивает также
влагу из воздуха и разлагается
при этом с выделением бро- о
моводорода. При гидролизе
тетрабромида происходит по-
следовательное отщепление и
замещение на гидроксо-группы
атомов брома, причем обра- _го
зуются промежуточные про-
дукты, являющиеся бромгидр-
оксидами титана. Конечным -30
продуктом гидролиза является
ортотитановая кислота.
При действии жидкого се- р
роводорода на тетрабро-
мид образуются тиолсоедине-
ния TiBf4-H2S и TiBr4-2H2S (теплоты образования соответственно
183 и 195 ккал/моль), нерастворимые в жидком сероводо-
роде.
Тетрабромид титана растворяется в жидкой двуокиси серы
и сам ее растворяет, причем образуются два жидких слоя. Значе-
ния температуры растворения и состава соответствующих слоев
приведены в Приложении 25. Критическая температура растворе-
ния 104° С.
С трехокисью серы тетрабромид реагирует (в растворе
хлордвуокиси серы) с образованием сульфата титана(IV) и выде-
лением двуокиси серы и брома:
Т1Вг4 + 450з = Ti(SO4)2 + 2SOa + 2Bra
135
Серной и азотной кислотами теФрабромид разлагает-
ся с выделением брома:
TiBr4 + 3H2SO4 = TiOSO4 + 2SO2 + 2Br2 + 3H2O
TiBr4 + 4HNO3 = H2TiO3 + 4NO2 + 2Br2 + H2O
Растворами едких щелочей тетрабромид разлагается мо-
ментально.
В жидком аммиаке происходит аммонолиз по уравнению:
TiBr4 + 6NH3 = Ti(NH2)3Br + 3NH4Br
Образуется также амминсоединение TiBr4-8NH3. При встряхива-
нии раствора тетрабромида титана в водном растворе бромоводо-
рода и бромида аммония образуется гексабромотитанат аммония:
TiBr4 + 2NH4Br = (NH4)2[TiBr6]
Фосфин поглощается тетрабромидом титана с образованием
фосфинсоединений:
TiBr4 + РН3 = TiBr4 • РН3 + 11,8 ккал
TiBr4 + 2РН3 = TiBr4 • (РН3)2 + 16,0 ккал
Дифосфин также присоединяется к тетрабромиду титана.
Трибромид фосфора образует с тетрабромидом титана соедине-
ние TiBr4-2PBr3 в виде густо-красных иглообразных кристаллов.
Тетрабромид титана растворяется в различных хлор- и бром- .
производных предельных углеводородов (трихлор-, трибром-,
тетрахлор-, тетрабромметане, бром-, дихлор-, дибромэтане и др.).
В абсолютном этиловом спирте тетрабромид титана раство-
ряется на холоду (раствор желтого цвета); растворимость при
20° С достигает 78,4%; плотность насыщенного раствора при 20° С
равна 2,29 г/см3. Уже при незначительном нагревании с метанолом,
этанолом, пропанолами и бутанолами идут реакции последова-
тельного замещения трех атомов брома на алкоксильные группы:
TiBr4 + 3ROH —> TiBr3(OR) —> TiBr2(OR)2 —> TiBr(OR)3 + ЗНВг
При действии соответствующих алкоксидов натрия на тетрабромид
титана происходит замещение всех четырех атомов брома с обра-
зованием соответствующих тетралкоксидов титана:
Т1Вг4 + 4NaOR = Ti(OR)4 + 4NaBr
В диэтиловом эфире тетрабромид титана также растворим
(раствор желтого цвета); растворимость при 20°С равна 4,8%.
При низкой температуре образуется продукт присоединения TiBr4*
«2(С2Н5)2О в виде темно-красных кристаллов.
С альдегидами тетрабромид титана реагирует. При взаи-
модействии с салициловым альдегидом в хлороформном растворе
образуется комплексная кислота H[TiBr3(OCeH4COH)2] в виде ко-
ричневых кристаллов.
Со многими органическими кислотами тетрабромид
титана взаимодействует, причем происходит частичное замещение
133
атомов брома на соответствующие кислотные остатки. При взаи-
модействип тетрабромида с салициловой кислотой в среде абсо-
лютного эфира при кипячении отделяется бромоводород и обра-
зуется комплексная кислота H[TiBr2(OC6H4COOH)3J.
। ' Безводная синильная кислота с тетрабромидом титана
образует комплексную кислоту H2[TiBr4(CN)2] в виде красноватого
кристаллического порошка. С бромцианом тетрабромид образует
продукт присоединения TiBr4-2CNBr, а с метилцианидом — соеди-
• пение TiBr4-2CH3CN.
, При взаимодействии тетрабромида титана с алкильными про-
и; * изводными лития, цинка, алюминия, свинца образуются алкилтри-
3'' бромиды титана — TiBr3R (R— метил, этил, бутил); при дальней-
|рТ шем действии металлалкилов образуются и соответствующие диал-
ь/. килдибромиды титана — TiBraRa. При действии дициклопентади-
‘ енилмагния на тетрабромидтитана образуются циклопентади-
'ь енилбромиды титана.
i> Бромхлориды титана(1У) г< 84>98
f Из смешанных бромхлоридов титана известны все три: бром-
трихлорид— TiClsBr, дибромдихлорид — TiCl2Br2 и трибромхло-
\ рид — TiClBr3.
у ’ Получение. Все бромхлориды титана образуются в результате
последовательного замещения бромом атомов хлора в тетрахло-
3 риде титана при действии на последний бромоводорода:
TiCi4 + HBr = TiCi3Br + Hci
TiCl4+-2НВг == TiCl2Br2 + 2НС1
< ' TiCl4 + ЗНВг = TiClBr3 + ЗНС1
* Следовательно, для получения определенного бромхлорида необ-
‘fp ходимо вводить в реакцию строго рассчитанные количества тетра-
хлорида титана и бромоводорода.
> Бромтрихлорид образуется также при действии брома на три-
' . хлорид титана:
У,' 2TiCl3 + Br2 = 2TiCI3Br
I Подобно этому при действии брома на дихлорид титана получается
дибромдихлорид титана:
TiCl2 + Br2 — TiCl2Br2
Образование бромхлоридов титана происходит также при действии
хлорида брома на элементарный титан (при нагревании) и при
Г сплавлении строго рассчитанных количеств тетрабромида титана и
хлорида серебра.
Теплоты образования TiCl3Br, TiCl2Br2 и TiClBr3 равны соответ-
ственно 181,15; 169,29 и 157,12 ккал/моль.
Образование бромхлоридов титана происходит также в системе
ПС14 — TiBr4. Очевидно, при смешении тетрахлорида с тетрабро-
• ' • МИДом, в зависимости от их количественных соотношений, идут
137
реакции:
mTiCl4 + nTiBr4 = 4tTiClmBrrt
Рис. 15.
Диаграмма состояния системы
TiCl4—TiBr4.
где т и п—целые числа, сумма которых равна четырем.
Система TiCl4 —- TiBr4. Значения температур кристаллизации
и кипения смесей тетрахлорида и тетрабромида титана приведены
в Приложении 26, а на рис. 15
представлена диаграмма со-
стояния системы TiCU—TiBr4.
На диаграмме кристаллизации
кривые ликвидуса и солидуса
пересекаются в трех точках,
ординаты которых соответ-
ствуют содержанию TiBr4 в
смеси, равному 25, 50 и
75 мол.%. Это показывает, что
образующиеся в системе соеди-
нения TiCl3Br, TiCl2Br2 и
TiClBr3 плавятся без разложе-
ния, а на четырех участках
системы: TiCl4—TiCl3Br,
TiCl3Br—TiCl2Br2, TiCl2Br2—
TiClBr3 и TiClBr3—TiBr4 кри-
сталлизуются непрерывные ря-
ды твердых растворов. Из диа-
граммы кипения (верхние кри-
вые) видно, что образующиеся
в системе смешанные бром-
хлориды титана при кипении
разлагаются.
Свойства. Бромхлориды ти-
тана представляют собой про-
зрачные, окрашенные в жел-
товатый цвет (окраска усили-
вается с увеличением содержания брома) жидкости, дымящие на
воздухе. Значения температур кристаллизации и кипения различ-
ных бромхлоридов титана приводятся ниже:
Соединение................. TiCl3Br TiCl2Br2 TiClBr3
Икрист, °C................. -19,4 —5,7 13,4
fKHn, °C................... 155 175,5 202
При действии фтора или хлора на бромхлориды титана идет
обменное разложение с образованием соответственно тетрафторида
или тетрахлорида титана. Бром смешивается с бромхлоридами
титана.
Бромхлориды титана растворяют хлороводород. При действии
бромоводорода иа бромхлориды титана образуется тетрабромид
титана и отщепляется хлороводород. Бромхлорйды титана смеши-
ваются с различными кислотообразующими галидами.
138
При внесении бромхЛоридОв тйтайа в воду идет бурная реакция
гидролиза, причем происходит последовательное отщепление и за-
мещение на гидроксо-группы сначала атомов хлора, а затем брома.
Бромхлориды титана смешиваются с хлороформом, тетрахлори-
дом и тетрабромидом углерода.
Тетраиодид титана 2.21,101,102
Получение. Тетраиодид титана — Til4 (мол. вес 555,52) обра-
зуется при пропускании паров иода над раскаленным титаном:
Ti + 2I2 = Ti 14 (г) + 98,4 ккал
Реакция эта обратима. Тетраиодид легко образуется при действии
иода на трииодид и дииодид титана:
2TiI3 + I2 = 2TiI4
Ti I2 + I2= Til4
Тетраиодид получается также при пропускании иодоводорода
через слегка нагретый тетрахлорид титана с последующим нагре-
ванием жидкости до кипения:
TiCl4 + 4HI = Til4 + 4НС1
Тетраиодид титана образуется при действии смеси водорода и па-
ров иода на пары тетрахлорида титана при температуре очень сла-
бого красного каления:
Ti С14 + 2Н2 + 2I2 = Til4 + 4НС1
а также при разложении трииодида титана, нагреваемого в ваку-
уме до температуры более 350° С:
2TiI3 = Ti I4 + Ti Гд
Стандартная теплота образования твердого тетраиодида титана
составляет 92,0 ккал!молъ. Энергия Гиббса образования равна
90,8 ккал/моль.
Физические свойства. Тетраиодид титана представляет собой
красно-коричневые октаэдрические кристаллы кубической сингонии
с параметром решетки а = 1200 пм (структура типа SnU). При
106° С происходит превращение в кристаллы кубической сингонии
с параметром решетки а = 1221 пм, причем на одну ячейку прихо-
дится восемь молекул Til4; теплота превращения 4,27 кал/г.
Температура плавления тетраиодида титана 155°С; теп-
лота плавления 7,9 кал/г (или 4400 кал/моль). Зависимость давле-
ния пара жидкого тетраиодида титана от температуры в интервале
от 160 до 370° С выражается уравнением: Igp = 7,577 — 3054/Т.
Температура кипения тетрахлорида титана 377°С; теп-
лота испарения при 25° С равна 31,7 кал/г (или
17,6 ккал/моль), а при 377° С — 24,15 кал/г (или 13,4 ккал/моль).
Плотность тетраиодида титана при 25°С равна 4,01 г/см3.
139
Средний коэффициент термического расширения тетра-
иодида титана в интервале температур от —30 до 125° С состав-
ляет 2,22-Ю"4 град~\ Зависимость плотности расплавленного тет-
раиодида титана от температуры в интервале от 160 до 270° С опи-
сывается уравнением: р< = 3,755 — 0,00219 t.
Теплоемкость твердого тетраиодида титана при 25°С со-
ставляет 30,026 кал/(град моль), жидкого — 37,40 и газообразного
при 25°С 24,918 кал/(град-моль). Зависимость теплоемкости газо-
образного Til4 от температуры в интервале от 295 до 3000° К вы-
ражается уравнением: Ср = 25,82 + 6,4 • 10~67 — 80 400/72.
Энтальпия твердого тетраиодида титана при 25°С состав-
ляет 6965 кал/моль, газообразного — 6169 кал!молъ. Зависимость
энтальпии газообразного Til4 от температуры (295 4- 3000° К) вы-
ражается уравнением: Нт — Но = 25,827 + 3,2 • 10~е72 + 80 400/Г —
—1800.
Энтропия твердого тетраиодида титана при 25°С составляет
58,831 кал/(град-моль), жидкого — 74,37 и газообразного при 25°С
103,483 кал/(град моль). Зависимость энтропии газообразного Tih
от температуры в интервале 295—3000° К подчиняется уравнению:
Sr = 133,7 + 0,010167 — 10650/7.
Приведенная энергия Гиббса тетраиодида титана при
25°С: твердого —35,47 и газообразного —82,72 кал/(град-моль).
Расплавленный тетраиодид титана обладает некоторой электро-
проводностью; значения удельной электропроводности в
температурном интервале от 180 до 240° С колеблются между
1 • 1 О*5 и 6 10-5 сим/м.
Значения некоторых физических свойств тетраиодида титана
при различных температурах приведены в Приложении 27.
Химические свойства. Тетраиодид титана при нагревании дис-
социирует на элементарные титан и иод. Диссоциация начинается
при температуре выше 1000° С и идет до конца при 2000° С. На
этой способности тетраиодида титана основан способ получения
чистейшего элементарного титана, называемого иодидным.
Водородом и металлами при высокой температуре тет-
раиодид восстанавливается до дииодида. Так, при действии смеси
водорода с парами ртути на тетраиодид титана при температуре
красного каления идет реакция:
Til4 + Hg — TiI2 + Hgl2 + 14,4 ккал
Тетраиодид титана восстанавливается до дииодида также элемен-
тарными титаном и серебром.
С кислородом при высокой температуре тетраиодид реаги-
рует с образованием двуокиси титана:
Till 4- О2 ~ TiO2 + 2I2 + 127,1 ккал
При пропускании смеси озона и кислорода через раствор тетра-
хлорида титана в циклогексане образуется дииодоксид титана:
Til4 + Оз = TiO 12 + О2 + 12
140
При действии фтора, хлора или брома на тетраиодид
титана идет обменное разложение:
Til< + 2F2 = TiF4 + 2I2
При действии иодоводорода образуется неустойчивая гек-
саиодотитановая кислота:
Til4 + 2Ш = Н2 [Tile]
Между тетраиодидом титана и хлоридом или бромидом
серебра протекает реакция обмена:
Till (ж) + 4AgCl = TiCli (ж) + 4AgI + 45 ккал
Аналогичные реакции идут также с трихлоридом фосфора и
тетрахлоридом германия:
3TiI4 + 4РС13 = 3TiCl4 + 4Р13
Till + GeCli = TiCli + Geh
С тетрахлоридом'титана образуется иодтрихлорид:
Tih + 3TiCli = 4TiCl3I
Водой тетраиодид титана гидролизуется, причем в качестве
промежуточного продукта образуется Ti(OH)3I-2H2O; конечным
продуктом гидролиза является ортотитановая кислота. Вследствие
гидролиза тетраиодид титана дымит во влажном воздухе.
Серной и азотной кислотами тетраиодид разлагается
с выделением иода. Разлагается он и растворами щелочей.
Тетраиодид титана растворяется в циклогексане и бен-
золе; зависимость растворимости в бензоле от температуры выра-
жается уравнением: 1gп — 11,9 lg Г — 31,67 (где п — мольная доля
ТП4 в растворе).
Тетраиодид титана растворяется также в жидких галогено-
производных углеводородов, этаноле, диэтиловом эфире.
Со спиртами (метанолом, этанолом, пропанолами и бутано-
лами) при нагревании тетраиодид титана реагирует, последова-
тельно замещая три атома иода на алкоксильные группы:
Tili + 3ROH —> TiI3(OR) —> TiI2(OR)2 —> TiI(OR)3 + 3HI
При действии алкоксидов натрия на тетраиодид титана происходит
замещение всех четырех атомов иода с образованием соответ-
ствующих тетра алкоксидов титана:
Tih + 4NaOR = Ti(OR)i + 4NaI
В эфирном растворе тетраиодид титана реагирует с магнием
с образованием коричневато-черного продукта восстановления, ко-
торый, однако, не содержит элементарного титана.
С алкильными производными лития, цинка, алюминия тетра-
иодид реагирует с образованием алкилтрииодидов титана — TiI3R
(R— метил, этил, бутил).
141
В бромоформном растворе с гексаметилентетрамином тетра-
иодид титана образует желтый кристаллический порошок состава
Til4-4CeH12N4-5CHBr3.
Иодхлориды и иодбромиды титана(1У) 2’84’98
Из смешанных иодхлоридов и иодбромидов титана известны все
возможные соединения: иодтрихлорид — TiChl, дииоддихлорид —
TiCl2I2, трииодхлорид — TiClIs, иодтрибромид— TiBr3I, дииодди-
бромид — TiBr2I2 и трииодбромид — TiBrI3. Известны также сме-
шанные . галиды титана с тремя галогенами: иодбромдихлорид—
TiCl2BrI, иоддибромхлорид — TiClBr2I и дииодбромхлорид —
TiClBrI2.
Получение. Все иодхлориды титана образуются в результате
последовательного замещения иодом атомов хлора в тетрахлориде
титана при действии на последний иодоводорода:
TiCl4 + HI = TiCl3I + HCl
TiCI4 + 2HI = TiCl2I2 + 2НС1
TiCl4 + 3HI = TiClI3 + 3HCl
Следовательно, для получения определенного иодхлорида необхо-
димо вводить в реакцию строго рассчитанные количества тетра-
хлорида титана и иодоводорода.
Подобно этому при действии иодоводорода на тетрабромид
титана образуются иодбромиды титана.
Иодтрихлорид титана получается также при смешении тетра-
хлорида и тетраиодида титана:
3TiCl4 + TiI4 = 4TiCljI
и при действии иода на трихлорид титана:
2TiCl3 + 12 = 2Т1С131
Дииоддихлорид титана получается при действии иода на ди-
хлорид титана:
TiCl2 + 12 — TiCl2I2
хлорида иода на элементарный титан при нагревании:
Ti + 2IC1 = TiCl2I2
или иодидов щелочных металлов на тетрахлорид титана. Образо-
вание иодхлоридов титана происходит также при сплавлении
строго рассчитанных количеств тетраиодида титана и хлорида се-
ребра.
Иодтрибромид титана также получается при действии иода на
трибромид, а дииоддибромид — на дибромид титана.
Смешанные тройные галиды титана образуются при действии
строго рассчитанных количеств иодоводорода на бромтрихлорид
или дибромдихлорид титана. Иодбромдихлорид титана образуется
также при действии бромида иода на дихлорид титана.
142
Свойства. Иодхлориды и иодбромиды титана представляют со-
бой оранжевато-коричневые (окраска усиливается с повышением
содержания иода) жидкости или кристаллы, дымящие на влажном
воздухе. Значения температур плавления и кипения иодхлоридов
и иодбромидов титана приводятся ниже:
Соединение .... Т1С131 Т1С1212 T1CII3 TiBr3I TiBr2I2 TiBrI3
/пл, °C.............. -4,0 34,4 85,0 55,2 79,5 НО
/кип, °C............. 181 236 301 260 293 331
При действии фтора, хлора или брома на иодбромиды и иод-
хлориды титана идет обменное разложение с образованием соот-
ветствующих тетрагалидов или бромхлоридов. Водой они энер-
гично гидролизуются.
ДВУОКИСЬ ТИТАНА
Двуокись, или диоксид титана, — ТЮ2 (мол. вес 79,90) является
амфотерным оксидом; причем основной его характер выражен не-
сколько сильнее, чем кислотный. Двуокись титана образует три
полиморфные кристаллические модификации: анатаз, брукит и ру-
тил, которые встречаются в природе в виде соответствующих ми-
нералов. Эти природные минералы отличаются от чистой двуокиси
титана тем, что. во-первых, молекулы их полимерны, а во-вторых,
они всегда загрязнены железом, чем и объясняется их окраска.
Чистая двуокись титана представляет собой порошок, на холоду —
белый, а в нагретом состоянии — желтоватый. Нагревание дву-
окиси титана, которая на холоду аморфна, сопровождается кри-
сталлизацией, причем с выделением большого количества теплоты.
Получение 2 21 И03
Двуокись титана образуется в системе титан — кислород. Прак-
тически в этой системе двуокись титана может быть получена при
горении тонко измельченного или расплавленного титана в избытке
чистого кислорода:
Ti + О2 = TiOa + 225,5 ккал
и при нагревании до 800° С на воздухе одноокиси или полутора-
окиси титана:
2TiO + О2 = 2ТЮ2 + 203,2 ккал
2Ti2O3 + О2 = 4ТЮ2 + 176,2 ккал
В системе титан — кислород двуокись титана образует сравнитель-
но узкую область твердых растворов. Фаза на основе двуокиси
титана-устойчива в интервале составов от TiOi,9o до ТЮг.оо- Дву-
окись титана и твердые растворы на ее основе кристаллизуются
при содержании кислорода более 65,5 атомн.%.
Как видно из уравнения реакции образования двуокиси титана
ИЗ элементарных веществ, теплота ее образования 225,5 ккал/моль.
143
Энергия Гиббса образования 212,3 ккал/моль. Большой величиной
теплоты образования двуокиси титана объясняется то, что ее полу-
чают в результате реакции между элементарным (порошкообраз-
ным) титаном и оксидами различных металлов, имеющими срав-
нительно небольшую теплоту образования, например:
3Ti 4- 2Fe2O3 = 3TiO2 + 4Fe 4- 283,9 ккал
2Ti + Fe3O4 — 2TiO2 4- 3Fe 4- 183,5 ккал
Ti + 2CuO = TiO2 + 2Cu + 150,5 ккал
Двуокись титана получают действием кислорода на многие со-
единения титана. Так, при нагревании в атмосфере кислорода ди-,
три- и даже тетрагалиды титана окисляются:
2Т1С12 + О2 = TiO2 + TiCl4 + 167,3 ккал
Til2 4- О2 ~ ТЮ2 4-12 4- 161,8 ккал
4Т1С13 + О2 = TiO2 + 3TiCl4 + 85,3 ккал
2ТП3 + 2О2 — 2ТЮ2 + 312 + 288,2 ккал
Т1С14 + О2 = ТЮ2 + 2С12 + 42,5 ккал
При нагревании на воздухе сульфидов титана происходит их
обжиг:
TiS 4- 2О2 = ТЮ2 4- SO2
Ti2S31- 5О2 = 2ТЮ2 4- 3SO2
TiS2 4- ЗО2 = ТЮ2 4- 2SO2
Двуокись титана образуется при действии различных кислородных
соединений (оксидов) на дисульфид, нитрид и другие соединения
титана, при самопроизвольном разложении двугидроокиси титана:
Т1(ОН)2 = ТЮ2 4-Н2
в результате реакции обезвоживания, например при прокаливании
титановых кислот различного состава:
Н2Т1О3 = ТЮ2 4- Н2О; Н4ТЮ4 = ТЮ2 4- 2Н2О
Физические свойства 2 21 ’1041105
Механические свойства. Двуокись титана существует в трех
кристаллических модификациях: игольчатые кристаллы тетраго-
нальной сингонии (рутил), пирамидальные кристаллы тетраго-
нальной сингонии (анатаз) и кристаллы в виде таблиц ортором-
бической сингонии (брукит). Рутил и анатаз — кристаллы одной
сингонии, но имеют различные кристаллические решетки, и потому
дают различные рентгенограммы. Как в рутиле, так и в анатазе
каждый атом титана находится в центре октаэдра и окружен
шестью атомами кислорода, но в рутиле на один октаэдр прихо-
дится два общих ребра, а в анатазе — четыре, т. е. элементарная
ячейка рутила состоит из двух молекул ТЮ2, а анатаза — из четы-
рех (рис. 16). Брукит — неустойчивая форма; элементарная ячейка
его состоит из щести молекул ПО?.
144
Параметры решеток различных модификаций двуокиси титана
и их плотность (при 0 и 25° С) приведены.ниже:
Рутил..................
Анатаз.................
Брукит.................
а, пм с, пм р, г/см^
0° С 25° С
458,4 295,3 4,261 4,216
377,6 948,6 3,881 3,849
925 515 4,135 4,105
Плотность приготовленной искусственным путем аморфной дву-
окиси титана колеблется от 4,190 до 4,215 г/см3 в зависимости от
температуры прокаливания при получении двуокиси титана (чем
выше температура, тем больше плотность)
Рис. 16; Кристаллические решетки двуокиси титана:
а —рутил, б —аиатаз.
Минимальное значение коэффициента линейного расши-
рения двуокиси титана составляет 8,1900 • 10~в град~\ максималь-
ное __ 1,44938-10-5 град-1.
Тепловые свойства и термодинамические функции. Гермодина<
мически устойчивой кристаллической формой ТЮ2 является рутил.
Температура плавления его 1842 ±6° С, теплота плав-
ления 194 кал/г.
Зависимость давления пара твердой двуокиси титана (рутила)
от температуры выражается уравнением: Igp — 15,092 — 30310/7.
Теплота сублимации при 25°С составляет 1735 кал/г.
Зависимость давления пара расплавленной двуокиси титана от
температуры выражается уравнением: 1gр = 8,226 — 15720/7’. При
испарении происходит частичная диссоциация, и в парах имеется
кислород. Т е м п е р а ту р а кипения 2670 ±30° С; теплота
испарения при температуре кипения 900 ± 75 кал/г. Темпера-
тура начала заметной диссоциации 900° С,
И5
Теплоемкость двуокиси титана при постоянном давлении при
25°С составляет: рутила — 13,20 и анатаза — 13,23 кал/(град-моль).
Зависимость теплоемкости рутила от температуры в интервале от
0 до 300° К выражается уравнением:
ср = 7,2 • 10~4Г2 - 3,2 • 10-6Г3 + 4,3 • 10-9Г*
а в интервале от 298 до 1800°К— уравнением:
ср = 17,21 + 9,93 10"4 Т - 383 000/Г2
Теплоемкость анатаза в интервале от 0 до 300° К подчиняется
уравнению:
Ср = 7,6 • 10-4Г2 - 3,6 • 10-6Г3 + 5,2 . 10-9Т4
а в интервале от 290 до 1300° К — уравнению:
Ср = 17,14+ 1,148- 10-3Г- 378 000/Г2
Энтальпия двуокиси титана при 25° С составляет: рутила —
2072, анатаза —2070 кал/моль. Зависимость энтальпии рутила от
температуры в интервале от 300 до 1800° К выражается уравне-
нием:
Н°т ~ н°о = 17,21 Г + 4,965 ' 10'472 + 383 000/Г - 4380
а анатаза в интервале от 300 до 1300° К — уравнением:
Н°т = = 17,14Г + 5,74 • 10-4Г2 + 378 000/Г - 4320
Энтропия двуокиси титана при 25°С составляет для рутила
12,01, для анатаза 11,93 кал/ (град-моль). Зависимость энтропии
рутила от температуры в интервале от 50 до 1800° К выражается
уравнением:
S°r = 0.0462Г - 2,22 • 10-5Г2 + 8 • 10'9Г3
а анатаза в интервале до 1300° К — уравнением:
= 0,0457Г — 2,15 • 10~5Г2 + 8 • 10-9Г3
Приведенная энергия Гиббса -при 25°С для рутила со-
ставляет —-5,06, а для анатаза —4,99 кал/ (град-моль).
Термодинамические функции газообразной двуокиси титана
при 25° С: теплоемкость 11,076 кал/(град-моль), энтальпия
2644 кал/моль, энтропия 56,438, приведенная энергия Гиббса
—47,57 кал/ (град-моль).
Значения термодинамических свойств двуокиси титана при раз-
личных температурах приведены в Приложении 28.
Электромагнитные и оптические свойства. Диэлектриче-
ская проницаемость двуокиси титана (порошка) при 20° С
составляет: рутила—114, анатаза — 48.
146
Электропроводность двуокиси титана определяется ис-
ключительно стехиометрическим составом. Удельная электропро-
водность обычных образцов двуокиси титана, близких по составу
к TiO2, при 20° С составляет 10-11 сим!м. С повышением темпера-
туры удельная электропроводность двуокиси титана увеличивается
и при 300° С достигает 1 сим/м, а при 1000° С— 105 cumIm. С умень-
шением содержания кислорода в образце электропроводность уве-
личивается, а для образцов, находящихся под давлением кисло-
рода, наоборот, уменьшается; это указывает на электронный ха-
рактер проводимости.
Двуокись титана слабо парамагнитна. Величина удельной
магнитной восприимчивости составляет 10-7 эл.-м. ед.! г
и практически не зависит от температуры. КоэффициентХолла
равен— 10-9 м/(а-ас).
Двуокись титана сильно преломляет и рассеивает свет. Значе-
ния показателя преломлени-я двуокиси титана для света
с различной длиной волны приведены ниже:
Длина волны, нм............... 436
Показатель преломления
рутила ..................... 2,8451
анатаза................. 2,7685
546 589 623 691
2,6506 2,6127 2,5893 2*5554
2,5949 2,5614 2,5404 2^096
Химические свойства !03’1061107
Двуокись титана является амфотерным оксидом с некоторым
преобладанием основных свойств, но и они выражены чрезвычайно
слабо. Слабо выражены и окислительные свойства двуокиси ти-
тана. Поэтому, а также в связи с нерастворимостью в воде и мно-
гих других растворителях двуокись титана следует считать веще-
ством сравнительно инертным. Инертность наряду с такими
физическими свойствами, как малая летучесть и высокая темпера-
тура плавления, объясняются полимерным состоянием двуокиси
титана. Диссоциация с выделением кислорода происходит только
при очень высокой температуре.
Взаимодействие с элементарными веществами. Под действием
водорода и металлов двуокись титана способна восстанав-
ливаться, причем в зависимости от условий восстановление идет до
трех- или двухвалентного титана. Так, при пропускании медлен-
ного тока сухого водорода над раскаленной (750—1000° С) дву-
окисью титана образуется полутораокись:
2TiO2 + Н2 — Ti2O3 + Н2О — 30,4 ккал; &G — + 27,7 ккал
а при действии водорода под давлением 130—150 атм на двуокись
титана, нагретую до 2000° С, восстановление идет до одноокиси ти-
тана:
ТЮ2 + Н2 = TiO + Н2О — 43,8 ккал; AG = + 40,75 ккал
147
При восстановлений двуокиси титана парами натрия получается
смесь полутораокиси и одноокиси титана и титаната натрия:
4TiO2 4- 4Ь1а Ti2Og 4- TiO 4~ Nf^TiC^
При нагревании двуокиси, титана с магнием или кальцием до
1200° С восстановление идет до полутораокиси. Кальций в атмо-
сфере водорода восстанавливает двуокись титана до металла.
С магнием в атмосфере водорода реакция восстановления идет до
одноокиси титана. До одноокиси идет восстановление и при на-
гревании двуокиси титана с избытком цинка или при пропускании
паров цинка над нагретой двуокисью титана:
Т1О2 + Zn = ТЮ + ZnO — 18,3 ккал
Алюминий восстанавливает двуокись титана до полутораокиси,
одноокиси и даже до элементарного титана:
6TiO2 + 2А1 = 3Ti2O3 + А12О3 + 135,8 ккал
3TiO2 + 2А1 = ЗТЮ + А12О3 + 95,6 ккал
ЗТЮ2 + 4А1 = 3Ti + 2А12О3 4-124,2 ккал
Восстановление двуокиси титана до полутораокиси и одноокиси
может быть осуществлено элементарным титаном:
3TiO2 + Ti = 2Ti2O3 + 49,1 ккал', AG = — 47,66 ккал
TiO2 + Ti = 2TiO + 22,3 ккал; &G — — 21,5 ккал
Медь и молибден даже при нагревании до 1100° С практически
не восстанавливают двуокись титана.
Двуокись титана восстанавливается углем, причем обра-
зуется одноокись титана:
TiO2 + С = TiO + СО — 75,2 ккал; &G = + 62,6 ккал
Азот и кислород на двуокись не действуют, а смесь азота
и водорода реагирует с сильно накаленной двуокисью титана с об-
разованием пернитрида титана:
TiO2 + N2 + 2Н2 -= TiN2 + 2Н2О
Фтор легко реагирует с двуокисью титана с образованием тет-
рафторида и выделением кислорода:
TiO2 + 2F2 = TiF4 + О2 + 168,5 ккал; AG = — 160,4 ккал
При действии хлора на двуокись образуется тетрахлорид и вы-
деляется кислород. Однако в связи с большой величиной теплоты
образования двуокиси титана эта реакция является эндотермиче-
ской:
TiO2 + 2С12 = TiCl4 + О2 — 42,5 ккал
поэтому реакция идет только при высокой температуре (1000° С и
выше) и не до конца. Хлор легко действует на двуокись титана в
присутствии восстановителей (уголь, металлы).
148
Бром действует на двуокись титана только в присутствии угля
и при высокой температуре:
TiO2 + 2С + 2Вг2 = TiBr4 + 2СО - 41 ккал; AG — + 38,7 ккал
а иод на двуокись титана не действует.
Взаимодействие с неорганическими соединениями. Фторово-
дород с двуокисью титана образует растворимые в воде оксо-
фторотитановые кислоты. Хлороводород как в газообразном,
так и в жидком состоянии присоединяется к двуокиси титана с об-
разованием дихлородиоксотитановой кислоты:
TiO2 + 2НС1 = Н2[ТЮ2С12]
При температуре выше 800° С хлороводород в присутствии угля
реагирует с двуокисью титана по уравнению:
Т1О2 + 2С + 4НС1 = ТiС14 + 2СО + 2Н2 - 78 ккал
В воде двуокись титана не растворяется. Перекись водорода
действует на нее с образованием пероксометатитановой кислоты.
Сероводород и двуокись серы не реагируют с дву-
окисью, а аммиак взаимодействует с ней при температуре крас-
ного каления с образованием нитрида титана:
6ТЮ2 + 8NH3 = 6T1N + 12Н2О + N2 - 309 ккал
В разбавленных растворах минеральных кислот, за ис-
ключением плавиковой, двуокись титана не растворяется. Плавико-
вая кислота различной концентрации растворяет двуокись титана
с образованием в растворе оксофторотитановых кислот. Двуокись
титана медленно растворяется также в концентрированной серной
кислоте; при этом получаются сульфатотитановые кислоты. Фторо-
борная кислота растворяет двуокись с образованием тетрафторо-
боратотитановых кислот.
Двуокись титана очень медленно растворяется в концентриро-
ванных растворах едких щелочей. В то же время она хорошо
растворяется в насыщенном растворе гидрокарбоната калия с об-
разованием дикарбонатометатитаната калия.
Несмотря на то что вода непосредственно и не присоединяется
к двуокиси титана, все же двуокись следует рассматривать как ан-
гидрид амфотерных гидроксидов, хотя бы потому, что двуокись
титана может быть получена путем обезвоживания этих гидрокси-
дов. Эти амфотерные гидроксиды носят названия титановых кис-
лот, соли которых могут быть получены при сплавлении двуокиси
титана с гидроксидами или карбонатами щелочных металлов, а
также при спекании ее с оксидами или карбонатами щелочнозе-
мельных и других металлов.
При высокой температуре (при сплавлении) двуокись титана
способна реагировать со многими солями. Например, с фтори-
дом калия при 700° С идет реакция с образованием метатитаната
и оксотетрафторотитаната калия:
2TiO2 + 4KF = K2TiO3 + K2[TiF4O]
149
Двуокись титана реагирует также при сплавлении с гидросульфа-
тами, фосфатами, карбонатами, боратами, а расплавленные нит-
раты и цианиды на двуокись титана не действуют.
При сплавлении двуокиси титана с оксидами различных метал-
лов образуются титанаты и двойные оксиды. В частности, при
сплавлении двуокиси титана с полутораокисью титана происходит,
как уже отмечалось, образование фазы на основе третьпятиокиси
титана.
Третьпятиокись титана — Т13О6 — является двойным оксидом трех-
и четырехвалентного титана; его можно рассматривать также как метатитанат-
оксид титана(III) — (ТЮ)2Т1О3. Третьпятиокись титана образуется в системе ти-
тан — кислород в области Ti2O3—ТЮ2, в которой она образует твердые растворы
сравнительно ограниченных составов. Фаза на основе третьпятиокиси титана
устойчива в интервале составов от TiOi.s? до TiOijg. Третьпятиокись титана мо-
жет быть получена также окислением одноокиси титана кислородом или восста-
новлением двуокиси титана углеродом. Стандартная теплота образования треть-
пятиокиси титана 587,65 ккал/моль. Энергия Гиббса образования Т13О5 равна
553,78 ккал/моль.
Третьпятиокись титана существует в двух полиморфных кристаллических
модификациях: а и 0; температура полиморфного превращения 177° С. Модифи-
кация а кристаллизуется в орторомбической сингонии (а = 375, с — 973 пм).
Плотность третьпятиокиси титана 4,29 г/см?. Температура плавления, по данным
изучения системы титан — кислород, 1850° С. Теплоемкость при 25° С составляет
44,27 кал/(град моль). Энтальпия — 5510 кал/моль. Энтропия при 25° С равна
30,92 кал/(град-моль). Приведенная энергия Гиббса при 25° С равна
—12,44 кал/(град моль).
Двуокись титана способна реагировать со многими хлор со-
держащим и соединениями, теплота образования которых срав-
нительно невелика. Реакции взаимодействия двуокиси титана с
хлорсодержащими веществами идут только при температуре выше
300° С, а в большинстве случаев — при температуре красного кале-
ния. Так, при высокой температуре под действием на двуокись ти-
тана хлордвуокиси серы образуются пары тетрахлорида титана и
трехокиси серы:
ТЮ2 + 2SO2C12 = TiС14 + 2SO3 — 26,680 ккал
а под действием хлородноокиси серы — тетрахлорид титана и дву-
окись серы:
TiO2 4- 2SOC12 = Т1С14 + 2SO2 - 2,2 ккал
При действии на двуокись титана гемидихлорида серы обра-
зуются тетрахлорид титана, двуокись серы и элементарная сера:
ТЮ2 + 2S2C12 = TiCl4 4- SO2 4- 3S 4- 19,5 ккал
Гидридами металлов двуокись титана восстанавливается,
в частности при действии гидрида кальция образуется дигидрид
титана и выделяется водород:
ТЮ2 + 2СаН2 = TiH2 + 2СаО 4- Н2 4- 29,3 ккал
Взаимодействие с органическими соединениями. В связи с по-
лимерным состоянием двуокиси титана она является химически
150
инертной по отношению к большинству органических веществ. Если
двуокись титана и вступает в реакции с органическими соедине-
ниями, то только при высокой температуре. В органических раство-
рителях двуокись нерастворима. Наряду с этим многие органиче-
ские вещества хорошо адсорбируются аморфной двуокисью ти-
тана.
С углеводородами в обычных условиях двуокись титана
не взаимодействует, а при температуре выше 1000° С метан, напри-
мер (особенно под высоким давлением), восстанавливает двуокись
титана до одноокиси:
4Т1О2 + СН4 = 4ТЮ + СО2 + 2Н2О - 214650 кал
С х л о р п р о и з в о д н ы м и углеводородов двуокись титана
реагирует при высокой температуре (выше 300° С) с образованием
тетрахлорида титана. Так, при пропускании паров тетрахлорида
углерода над нагретой двуокисью титана идет реакция:
TiO2 4-СС14 = Т1С14 4-СО2 4-25 650 ккал
Если же жидкий четыреххлористый углерод смешать с двуокисью
титана, то реакция между ними пойдет только в присутствии по-
рошкообразных металлов' (магния, алюминия), что обусловливает
быстрое повышение температуры:
ТЮ2 4- CCI4 -J- 2Mg ~ Т1С14 4- С 4- 2MgO 4- 219 ккал
При взаимодействии с другими хлорпроизводными углеводоро-
дов в качестве побочных продуктов образуются окись углерода и
хлороводород. Так, реакции с хлороформом и пентахлорэтаном
идут по уравнениям:
ТЮ2 4- 2СНС13 = TiCI4 4- 2СО 4- 2НС1 — 2,3 ккал
TiO2,4- C2HCI5 = ТiCl4 4- 2СО 4- НС1 — 3 ккал
Эти реакции, особенно последняя, идут с большим трудом при по-
стоянном притоке теплоты извне. Аналогично протекает реакция
между двуокисью титана и гексахлорэтаном, причем, естественно,
хлороводород не образуется:
ЗТЮ2 4- 2С2С1в = ЗТiCI4 4- 2СО 4-2СО2 - 23 560 кал
В присутствии порошкообразных металлов процесс протекает
вполне автотермично.
С л-дитрихлорметилбензолом двуокись титана реагирует при
220—270° С с образованием тетрахлорида титана и хлористого изо-
фталила:
ТЮ2 4- С6Н4(СС13)2 = ТiCl4 4- С6Н4(СОС1)2
Спиртами, в частности этанолом и пропанолом, при высокой
температуре двуокись титана восстанавливается до одноокиси и
даже до металла, причем-спирты окисляются до эпоксидов:
ТЮ2 4- С2Н5ОН = Т1О 4- С2Н4О 4- Н2О
Т1О2 4- 2С2Н5ОН ~ Ti 4" 2С2Н4О 4- 2Н2О
151
С хлорокисью углерода (фосгеном) двуокись титана
реагирует при повышенной температуре с образованием тетрахло-
рида титана и двуокиси углерода. С парами сероуглерода нагретая
двуокись титана реагирует с образованием дисульфида титана.
ГАЛОГЕНОКСИДЫ ТИТАН А(1У)
В этом разделе рассматриваются смешанные соединения тита-
на (IV), в которых атомы кислорода и галогенов непосредственно
связаны с атомами титана. Оксиддифторид титана уже рассмотрен.
Кроме него из галоксидов титана (IV) известны дихлороксид, геми-
дихлорсесквиоксид, гемигексахлоргемиоксид, дибромоксид, ди-
иодоксид.
Дихлороксид титана ’ юв-ио
Получение. Дихлороксид титана — TiOCl2 (мол. вес 134,805) —
образуется при действии хлора на одноокись титана:
TiO + Cl2 = TiOCl2
К образованию дихлороксида титана приводит также действие
кислорода на тетрахлорид титана под влиянием тихого электриче-
ского разряда; однако при этом он получается в смеси с другими
хлороксидами титана.
Дихлороксид титана образуется также при действии полуокиси
хлора на тетрахлорид титана:
TiCl4 + С12О = TiOC 12 + 2С12
и при пропускании избыточного количества паров тетрахлорида
титана над его двуокисью:
TiCl4 + TiO2 - TiOCl2
В связи с этой реакцией дихлороксид титана всегда находится
в некотором количестве в продуктах гидролиза тетрахлорида ти-
тана водяным паром и в продуктах окисления три- и дихлорида
титана кислородом.
Дихлороксид титана получается при нагревании до 1500° С сме-
си двуокиси титана с хлоридом магния: •
2ТЮа + MgCl2 = ТЮС12 + MgTiO3
а также при взаимодействии тетрахлорида титана с полутораоки-
сями мышьяка, сурьмы и висмута:
ЗТ iC 14 + As2O3 = 3TiOC 12 + 2AsCl3
3TiCl4 + Sb2O3 = 3TiOCl2 + 2SbCl3
Стандартная теплота образования газообразного TiOCl2
130,39 ккал!моль. Энергия Гиббса образования газообразного
TiOCl2 127,88 ккал/моль,
15?
Свойства. Дихлороксид титана— светло-желтые, Листочко-
образные гигроскопичные кристаллы кубической сингонии с пара-
метром решетки а = 451 пм. Плотность 2,45 г/см3. Давление пара
при 137° С составляет 1,05 мм рт.ст. Стандартная теплоемкость га-
зообразного Т1ОС12 равна 17,2 кал/ (град-моль), энтропия —
76,70 кал/(град-моль). Растворяется в тетрахлориде титана; зави-
симость растворимости (в %) от температуры в интервале от
— 20 до 136° С выражается уравнением:
I - 0,24 + 0,00575/ Л- 1,125 • 10-4/2 Л- 1,3 • 10-24/11
Фтор действует на дихлороксид титана с образованием тетра-
фторида и выделением кислорода и хлора:
2Т1ОС12 Л- 4F2= TiF4 Л- О2 Л- 2С12 Л- 133 ккал
При 180° С дихлороксид титана начинает разлагаться на двуокись
и тетрахлорид. С кислородом при высокой температуре реаги-
рует с образованием двуокиси титана и хлора:
2ТЮС12 Л- О2 = 2ТЮ2 Л- 2С(2 Л- 190 ккал
С жидкой серой при 120°С реагирует по уравнению:
T1OC12 + 2S = TiS2-f- С12О
Кипящей водой гидролизуется с образованием метатитановой
кислоты:
ТЮС 12 л- 2Н2О = Н2Т1О3 л- 2НС1
Дихлороксид титана растворяется в соляной и серной кислотах.
В солянокислотных растворах в присутствии хлоридов цезия,
рубидия, аммония, тетраметиламмония, тетраэтиламмония, моно-
и дибутила ммония, пиридиния и т. п. происходит образование ком-
плексных тетрахлороксотитанат- и пентахлороксотитанат-ионов:
ТЮС12 л- 2СГ - [TiOClJ2-; Т1ОС12 Л- ЗСГ = [ТЮС15]3"
Дихлороксид титана со многими кислородными и азотными
органическими соединениями (диоксан, диметилэтан-
диол, тетрагидропиран, триметиламин, метилцианид, пиридин, ди-
пиридил и др.) образует нейтральные комплексы, например
[TiOCl2(NC3He)2], [TiOCl2(NCCH3)2] и др.
Сложные хлороксиды 84>103
Из более сложных хлороксидов титана(IV) известны геми-
д ихл о рее с кв иокси д — Ti2O3Cl2 — и ге м и гекс ах л о р ге-
ми оке ид— Т12ОС1б. Первое соединение можно рассматривать как
молекулярное соединение дихлороксида и двуокиси титана —
TiOCl2-TiC>2, второе — дихлороксида и тетрахлорида титана —
153
TiOCl2• TiCU. Их структуры могут быть представлены так:
С1 С1 С1 С1
II II
Ti—О—Ti И Cl—Ti—О—Ti—С1
II II II
0 0 С1 С1
Гемидихлорсесквиоксид титана образуется при пропускании смеси
паров тетрахлорида титана с кислородом через раскаленную
трубку:
4Т iC 14 + ЗО2 = 2Ti2O3Cl2 + 6С12
К образованию его приводит также действие хлора на полутора-
окись титана:
Ti2O3 + С12 = Ti2O3Cl2
Он образуется в числе продуктов взаимодействия паров тетрахло-
рида с диоксидом титана при высокой температуре.
Гемигексахлоргемиоксид титана получается вместе с другими
хлороксидами при действии кислорода на тетрахлорид титана под
влиянием тихого электрического разряда. Он выкристаллизовы-
вается также на холоду из растворов дихлороксида титана в тет-
рахлориде и присутствует в продуктах окисления трихлорида ти-
тана кислородом.
Гемидихлорсесквиоксид и гемигексахлоргемиоксид титана пред-
ставляют собой кристаллические порошки светло-желтого цвета.
Гемигексахлоргемиоксид титана при 73° С частично разлагается на
дихлороксид и тетрахлорид титана; водой он легко гидролизуется.
Гемидихлорсесквиоксид, наоборот, к действию воды достаточно
устойчив.
Бромоксиды титана(1У] И1'112
Из бромоксидов титана(IV) известны выделенный в свободном
состоянии дибромоксид — TiOBr2 (мол. вес 223,7) и г е м и г е к-
саб ромгем и окси д — Ti2OBr6, существующий только в соль-
ватированном состоянии в метилцианидных растворах и выделяе-
мый из них в виде продукта присоединения Ti2OBre-4CH3CN.
Дибромоксид титана. Дибромоксид титана образуется при
Действии брома на одноокись титана:
TiO 4- Вг2 = TiOBr2
а также при действии пяти частей смеси этанола (65%) и воды
(35%) на две части 75%-ного раствора тетрабромида титана в аб-
солютном этаноле:
Ti Вг4 + Нг0 = TiOBr8 + 2НВг
154
К образованию дибромоксида титана приводит также действие
озона или полуокиси хлора на тетрахлорид титана:
Т1В г4 + Оз = ТЮВг2 + О2 + Вг2
Ti Вг4 + С12о = TiOBr2 + 2ВгС1
Для получения дибромоксида титана смесь озона или полуокиси
хлора с кислородом пропускают над тетрабромидом титана при
10°С, образовавшиеся кристаллы отфильтровывают, промывают
тетрахлоридом углерода и высушивают в вакууме.
В некоторых количествах дибромоксид титана образуется
среди продуктов окисления ди- и трибромида титана кислородом и
продуктов гидролиза тетрабромида титана водяным паром.
Дибромоксид титана представляет собой оранжево-желтые ли-
сточкообразные кристаллы плотностью 3,4 г! см3. При нагревании
до 146° С дибромоксид титана разлагается на диоксид и тетра-
бромид:
2TiOBr2 = TiO2 -I- TiBr4
При действии фтора на дибромоксид титана образуется тет-
рафторид и выделяются кислород и бром:
2ТЮВг2'+ 4F2 = 2TiF4 + О2 + 2Вг2
При действии хлора образуется дихлороксид:
ТЮВг2 + С12 = TiOCl2 -J- Вг2
С кислородом при высокой температуре дибромоксид титана
реагирует, давая двуокись титана:
2ТЮВг2 + О2 = 2ТЮ2 + 2Вг2
Кипящей водой дибромоксид гидролизуется:
TiOBr2 + 2Н2О = H2TiO3 + 2НВг
Дибромоксид растворяется в серной кислоте и водном рас-
творе бромоводорода, нерастворим в четыреххлористом углероде.
При 50—60° С растворяется в больших количествах трихлороксида
или трибромоксида фосфора; при охлаждении растворов из них
кристаллизуются продукты присоединения Т1ОВг2-2РОС1з и
TiOBr2-2POBr3 кирпичного цвета, нерастворимые в неорганических
растворителях.
С избытком пиридина дибромоксид титана образует продукт
присоединения TiOBr2-2NC5H5 в виде кристаллов, конгруэнтно пла-
вящихся при 131° С. С бромистым пиридинием в бромоводородном
растворе дибромоксид титана образует комплексную соль
(CsHsNH^fTiOBrs] в виде желтых кристаллов. Эта соль образуется
также при смешении этанольного раствора тетрабромида титана
с раствором бромистого пиридиния.
Гемигексабромгемиоксид титана образуется в сольватированном
состоянии при действии водно-метилцианидной смеси на кипящий
155
метилцианидный раствор диметилцианидтетрабромотитана»
2[TiBr4(NCCH3)2] + Н2О = Ti2OBr6 • 4CH3CN + 2HBr
Этот продукт присоединения выпадает при охлаждении из метил-
цианидного раствора в виде красных кристаллов. Хорошо раство-
рим в диоксане, нерастворим в четыреххлористом углероде и угле-
водородах. При испарении диоксанового раствора в вакууме
образуется комплекс Т12ОВгб-2СНзСП-2О(С2Н4)2О. Термической
обработкой кристаллосольватов выделить свободный гемигекса-
бромгемиоксид титана не удается.
Дииодоксид титана 113
Получение. Дииодоксид титана — TiOI2 (мол. вес 317,71) обра-
зуется при пропускании смеси озона с кислородом через раствор
тетраиодида титана в циклогексане:
Til4 + О3 = TiOI2 + О2 + 12
Для получения чистого дииодоксида титана с хорошим выходом
озоно-кислородную смесь следует тщательно высушить (над полу-
пятиокисыо фосфора); образующийся дииодоксид титана выпадает
в осадок, который отфильтровывают, промывают циклогексаном и
сушат в вакууме.
Свойства. Дииодоксид титана — рентгеноаморфный порошок ко-
ричневого цвета, очень гигроскопичный. При нагревании до 105° С
начинает разлагаться; при выдерживании в вакууме при 125° С
в течение 4—5 ч полностью разлагается с образованием моноиод-
оксида титана:
2TiOI2 — 2T1OI + 12
При нагревании в атмосфере кислорода разлагается с образова-
нием двуокиси титана:
2TiOI2 + О2 = 2ТЮ2 + 212
Водой в значительной степени гидролизуется. В жидких углеводо-
родах дииодоксид титана не растворяется. С безводным пиридином
в среде циклогексана образует продукт присоединения коричне-
вого цвета состава TiOh-SCsHsN, который плавится с разложением
при 177° С.
СУЛЬФИДЫ THTAHA(IV) И ИХ АНАЛОГИ
Дисульфид титана 21,24,114,115
Дисульфид титана — TiSa (мол. вес 112,03) является ближай-
шим аналогом двуокиси. Он представляет собой желтые чешуйча-
тые кристаллы с металлическим блеском.
Получение. Дисульфид титана вместе с другими сульфидами
образуется при непосредственном взаимодействии расплавленной
или газообразной серы с нагретым элементарным титаном, а также
156
V при действии сероводорода на элементарный титан при высокой
1 температуре:
Ti + 2H2S = Ti S2 + 2H2
Образование чистого дисульфида титана происходит при про-
пускании смеси сероводорода с, парами тетрахлорида титана через
сильно нагретую фарфоровую трубку; реакция при этом идет в две
стадии:
TiCl4 + H2S = TiCl2S + 2НС1; TiCl2S + H2S = TiS2 + 2HC1
Дисульфид оседает на стенках трубки.
Дисульфид титана образуется также при действии жидкой серы
на дихлороксид титана при 120°С:
ТЮС12 + 2S = TiS2 + С12О
или сероводорода на тетрафторид титана при температуре красного
каления:
TiF4 + 2H2S = TiS2 + 4HF
Вместе с примесями дисульфид титана получается при пропу-
скании очень медленного тока паров сероуглерода над нагретой
двуокисью титана, предварительно спрессованной и высушенной:
ТЮ2 + CS2 = Ti S2 И- CO2
Дисульфид титана образуется при восстановлении сульфата
титана(IV) водородом:
Ti(SO4)2 + 8Н2 = TiS2 + 8Н2О
Розе получал также загрязненный дисульфид титана при про-
каливании смеси двух частей рутила, двух частей сухой соды, двух
частей серы и одной части угля; полученная после прокаливания
(без доступа воздуха) плотная черная масса содержит много жел-
тых листочкообразных кристаллов дисульфида титана; для очи-
стки от примесей массу обрабатывают водой, а затем разбавлен-
ной серной кислотой.
Стандартная теплота образования дисульфида титана состав-
ляет 80 ккал/моль.
Физические свойства. Цвет дисульфида титана зависит от спо-
соба его получения и от характера образовавшихся кристаллов;
чаще всего дисульфид образуется в виде листочкообразных кри-
сталлов латунного цвета; крупные кристаллы имеют зеленоватый
оттенок, возгон — бурый цвет. Дисульфид титана кристаллизуется
в гексагональной сингонии с параметрами решетки: а = 340, с =
= 569 пм. При 147° С дисульфид претерпевает полиморфное пре-
вращение. Плотность дисульфида титана при 25°С равна
3,22 г/см?. Зависимость плотности от температуры (0 4- 50° С) вы-
ражается уравнением: pf = 3,332 — 0,007581 + 0,000128 ft.
Теплоемкость дисульфида титана при 25°С составляет
16,23 кал/{град моль}. Зависимость теплоемкости от температуры
157
в интервале от 30 до 300° С выражается уравнением:
Ср = 0,14477 - 2,78 • 10"472 + 7 • 10-1877 - 3,68
в интервале от 290 до 420° К — уравнением:
Ср = 8,08 + 0,027347
а в интервале от 420 до 1100° К — уравнением:
Ср = 14,99 + 0,005147
Энтальпия TiS2 при 25°С равна 2983 кал!молъ. Зависимость
энтальпии от температуры в интервале от 290 до 420° К выра-
жается уравнением:
/7°г - /7° = 8,087- + 13,67 • 10-372 - 641
а в интервале от 420 до 1200° К — уравнением:
Н°т - 77° = 14,997 + 2,57 • 10"372 - 1582
Энтропия дисульфида титана при 25° С составляет
18,73 кал,1 (град-моль). Зависимость энтропии от температуры вы-
ражается уравнениями:
в интервале температур 220—420° К
SJ. = 0,08277 - 4,6 • 10-s72 - 1,83
в интервале температур 420—1200°К
= 0,09017 — 8,07 • 10-572 + 4,15 • 10“873 -8,3- 10“1274 - 1,82
Приведенная энергия Гиббса TiS2 при 25° С равна
— 8,72 кал/ (град-моль).
Значения термодинамических функций дисульфида титана при
различных температурах приведены в Приложении 29.
Химические свойства. При нагревании дисульфида титана до
300° С без доступа воздуха (в вакууме или в атмосфере азота) про,-
исходит отщепление серы и образование сесквисульфида титана:
2TiS2 = Ti2S3 + S — 79 ккал
В атмосфере водорода при этой температуре также происходит
неполное восстановление титана:
2TiS2 + Н2 = Ti2S3 + H2S — 8 ккал
При более высоких температурах и большем количестве водорода
восстановление идет до моносульфида титана:
TiS2 + Н2 = T1S + H2S — 12 ккал
На воздухе при обычной температуре дисульфид устойчив,
а при нагревании подвергается обжигу с образованием диоксидов
титана и серы:
TiS2 + ЗО2 — TiO2 + 2SO2 + 287,4 ккал
158
При действии фтора на дисульфид титана Получаются выс*
шие фториды титана и серы:
TiS2 + 8F2 = TiF4 + 2SFe + 891 ккал
при действии хлора — тетрахлорид титана и гемидихлорид серы:
TiS2 + ЗС12 = ТiCl4 + S2C12 + 127,2 ккал
При нагревании дисульфида титана с такими металлами,
как магний или алюминий, происходит восстановление до элемен-
тарного титана:
TiS2 + Mg = TiS + MgS
при нагревании с порошкообразным титаном восстановление идет
до моносульфида:
TiS2 + Ti = 2TiS + 46 ккал
Вода при обычной температуре на дисульфид титана не дей-
ствует, а горячий водяной пар разлагает его с выделением серово-
дорода:
TiS2 + 2Н2О = TiO2 + 2H2S + 39,7 ккал
С разбавленными кислотами дисульфид не реагирует, а
концентрированные плавиковая, соляная и серная кислоты раство-
ряют его, причем особенно хорошо при нагревании. Азотная кис-
лота окисляет (энергично при нагревании) дисульфид титана:
. TiS2 + 8HNO3 = Ti(SO4)2 + 4NO + 4NO2 + 4Н2О
При нагревании в струе двуокиси углерода дисульфид
разлагается:
TiS2 + 2СО2 = TiO2 + 2S + 2СО + 10,2 ккал
В концентрированных растворах гидроксидов щелочных
металлов, а также аммиака дисульфид титана растворяется при
нагревании. При спекании с сульфидами и гидроксидами щелочных
металлов дисульфид образует тио- и тиооксотитанаты. С расплав-
ленными нитратами дисульфид титана при нагревании взрывается.
При действии спиртов на дисульфид титана образуются со-
ответствующие алкоксиды читана, например:
TiS2 + 4С2Н5ОН = Ti(OC2H5)4 + 2H2S
При действии фенола получается тетрафеноксид титана.
Аналогичные реакции идут с органическими аминами, в част-
ности с анилином; в бензольном растворе дисульфид реагирует
при 50° С по уравнению:
TiS2 + 4CeH5NH2 = Ti(NHC6H5)4 + 2H2S
159
Диселенид и дителлурид титана бз>64
Диселенид титана — TiSe2 (мол. вес 205,82) образуется в системе
титан — селен и может быть получен при взаимодействии стехио-
метрических количеств элементарных титана и селена в вакуумиро-
ванной кварцевой ампуле при 550—580° С. Теплота образования
диселенида составляет 97,0 ккал/моль.
Диселенид титана представляет собой темно-коричневый поро-
шок, кристаллизуется в гексагональной сингонии (а = 3,535, с =
= 600,4 пм). Плотность при 0°С равна 5,26, при 25°С — 5,14 г/см3.
Диселенид титана обладает электронной электропроводностью; ве-
личина удельной электропроводности 5-Ю4 сим/м-, он обладает
также выпрямляющими свойствами. Магнитная восприимчивость
при 20° С равна 1,03-10-7, при — 78° С— 1,01-10~7 эл.-м. ед./г.
При температурах до 700° С диселенид достаточно устойчив.
Длительное же выдерживание его при 950° С в вакууме или в токе
водорода сопровождается отщеплением селена, в результате чего
он переходит в сесквиселенид. При нагревании в токе кислорода
или воздуха горит с образованием диоксидов титана и селена, а
в токе хлора (уже при 300° С) —с образованием тетрахлоридов:
TiSe2 + ЗО2 = TiO2 -I- 2SeO2 -I- 189.1 ккал
Дителлурид титана — Т1Те2 (мол. вес 303,10) образуется в си-
стеме титан — теллур и может быть получен при взаимодействии
стехиометрических количеств элементарных титана и теллура. Теп-
лота образования 55 ккал/моль. Дителлурид титана представляет
собой черный порошок, кристаллизуется в гексагональной синго-
нии (а = 376,5, с = 6,52 пм). Плотность при 25°С равна 6,01 г/см3.
Магнитная восприимчивость при 20°С составляет 1,85-10~4. Удель-
ная электропроводность 5-Ю5 сим/м.
Смешанные сульфиды титана(1У) 2 84
Сульфидоксид титана — TiOS (мол. вес 95,96) образуется при
нагревании одноокиси титана с серой:
ТЮ + S = TiOS
В некотором количестве он образуется при спекании диоксида с
дисульфидом титана. Сульфидоксид представляет собой кристал-
лический порошок желтоватого цвета.
Тиохлорид, или сульфидхлорид титана — TiCl2S (мол. вес
150,87) образуется при действии серы на дихлорид или трихлорид
титана (нагревание в вакууме):
TiC 12 + S = ТiC 12S; 2TiCl3 + S = TiCl2S + TiCl4
а также при действии сероводорода на кипящий тетрахлорид ти-
тана:
TiCl4 + H2S = TiCl2S + 2НС1
160
Образование тиохлорида происходит также при пропускании паров
тетрахлорида титана над дисульфидом:
TiS2 + TiCl4 = 2TiC 12S
или над сульфидом мышьяка.
Тиохлорид титана представляет собой желтые чешуйчатые кри-
сталлы. При действии горячего водяного пара гидролизуется
с образованием двуокиси титана:
TiCl2S + 2Н2О = TiO2 + 2НС1 + H2S
При взаимодействии тиохлорида с сероводородом при высокой
температуре образуется дисульфид титана.
Тиобромид титана — TiBrgS (мол. вес 239,77) образуется при
действии серы на дибромид титана и в некотором количестве при
обработке тетрабромида титана жидким сероводородом. Тиобро-
мид титана представляет собой оранжево-бурые кристаллы.
Селенидхлорид титана — TiChSe — образуется при нагревании в вакууме
трихлорида титана с селеном:
2Ti С13 + Se = Ti Cl2Se + TiCl4
Он представляет собой желто-бурую кристаллическую массу. Водой гидроли-
зуется с образованием двуокиси титана, хлороводорода и селеноводорода.
6 Зак, 1125
ГЛАВА VI
СОЕДИНЕНИЯ ТИТАНА С ВОДОРОДОМ, АЗОТОМ И ДРУГИМИ
НЕМЕТАЛЛИЧЕСКИМИ ЭЛЕМЕНТАМИ
С водородом, азотом, его аналогами, углеродом, кремнием, гер-
манием, бором титан образует соединения, отличающиеся от рас-
смотренных ранее тем, что состав их определяется преимуществен-
но не валентно-стехиометрическими соотношениями; соединения
эти склонны к образованию ограниченных твердых растворов. Та-
кой, отчасти бертоллидный, характер, а также некоторые свойства
указанных соединений свидетельствуют о том, что химическая
связь в них близка к металлической. Этих соединений довольно
много, и большинство из них достаточно просты, однако они срав-
нительно мало исследованы. Титан способен образовывать соедине-
ния этого вида с водородом (гидриды), азотом (нитриды), фосфо-
ром (фосфиды), мышьяком (аренды), сурьмой (стибиды), висмутом
(висмутиды), углеродом (карбиды), кремнием (силициды), гер-
манием (германиды), бором (бориды). Многие из этих соединений
представляют практический интерес.
К перечисленным соединениям близки по характеру смешан-
ные, например соединения титана с азотом и каким-либо другим
элементом. К таким соединениям относятся амиды, имиды, галид-
нитриды, карбонитриды и др.
ГИДРИДЫ ТИТАНА
Система титан — водород20321^
Водород хорошо растворим в титане. Растворение водорода
в титане — процесс обратимый. Если температура достаточно вы-
сока, чтобы обеспечить определенную скорость взаимодействия
водорода с титаном, то растворы водорода в титане могут су-
ществовать лишь в равновесии с газообразным водородом, давле-
ние которого будет функцией содержания водорода в твердом
растворе и температуры.
Диаграмма состояния. На рис. 17 представлена диаграмма со-
стояния системы титан — водород в области содержания водорода
162
до 66,7 атомы.%, т. е. на участке Ti — TiH2. Диаграмма была соста-
влена по результатам изучения зависимости равновесного давле-
ния водорода от его содержания в системе при температурах 300—
1000° С и металлографического исследования системы при темпе-
ратурах ниже 300° С.
Из диаграммы следует, что водород, растворяясь в титане, по-
нижает температуру его полиморфного превращения с 882,5 до
319° С, сужая, таким образом,
область существования a-фазы и
расширяя область существования
p-фазы. При 319° С происходит
эвтектоидный распад p-фазы на
а- и у-фазы. Эвтектоидная точка
лежит при содержании водорода
в системе 43—44 атомы.%. а-Фаза
представляет собой твердый рас-
твор моногидрида титана в a-Ti,
а р-фаза — твердый раствор мо-
ногидрида титана в p-Ti. В основе
у-фазы лежит твердый .раствор
дигидрида титана в моногидриде,
непрерывный при температурах
ниже 400° С и ограниченный —
при t > 400° С. В области, непо-
средственно примыкающей к абс-
циссе, соответствующей содержа-
нию водорода, равному 66,7
атомн.%, т. е. соединению TiH2,
при 400° С существует еще 6-фа-
за. у-Фаза в области левее абс-
циссы, соответствующей содержа-
ние. 17. Диаграмма состояния
системы титан — водород.
нию водорода, равному 50
атомн.%, т. е. соединению TiH, представляет собой твердый рас-
твор элементарного титана в моногидриде. Для эвтектоидного пре-
вращения системы с содержанием водорода 44 атомн.% наблю-
дается гистерезис температуры: средняя температура остановки
при нагревании 319° С, а при охлаждении — 281° С, т. е. гистерезис
составляет 38 град. Температуры фазовых превращений и другие
данные о системе титан — водород приведены в Приложении 30.
Диффузия водорода в титане. Водород необычайно быстро
диффундирует в титане. Так, при 500° С коэффициент диффузии
водорода в a-Ti составляет 1,5-10~9 м21сек, что в тысячи раз превы-
шает коэффициенты диффузии металлов друг в друга. Коэффи-
циент диффузии водорода в p-Ti еще больше. Высокая скорость
диффузии водорода в титане обусловливает чрезвычайную интен-
сивность их взаимодействия.
Водород, диффундирующий в титан с поверхности, распреде-
ляется в его объеме неравномерно. При постоянном давлении
а*
163
водорода и постоянной температуре скорость проникновения водо-
рода в титан со временем уменьшается. Кинетика поглощения за-
висит от соотношения скоростей подвода водорода к поверхности
и его отвода в глубь титана.
Система титан — дейтерий
По диаграмме состояния, система титан — дейтерий аналогична
системе титан — водород: в ней так же образуется у-фаза, в основе
которой лежит твердый раствор дидейтерида титана в монодейте-
риде. Равновесное давление газообразного дейтерия в системе,
однако, выше, чем давление водорода в системе титан — водород.
Исследована также система титан — тритий.
Моногидрид титана 20,32,116,117
Получение. Моногидрид титана — TiH (мол. вес 48,91) пред-
ставляет собой серый порошок с металлическим блеском. Как уже
указано выше, он образуется в системе титан — водород, а также
при действии гидрида натрия на тетрахлорид титана:
' 2Т1С14 + 8NaH = 2TiH + 8NaCl + ЗН2
Полученный в результате этой реакции препарат моногидрида ти-
тана представляет собой тонкодисперсный черный порошок, ли-
шенный металлического блеска. Образование моногидрида титана
происходит также при разложении тетрагидридобората титана-
(III). Теплота образования TiH 10,4 ккал/моль.
Свойства. Моногидрид титана кристаллизуется в гексагональ-
ной сингонии (а = 311, с = 5,02 пм). Плотность 3,79 г/см3.
При нагревании моногидрид диссоциирует на титан и водород;
при 640° С давление диссоциации достигает 760 мм рт.ст.
На воздухе при /> 350° С моногидрид титана воспламеняется
и горит голубым пламенем вследствие выделения водорода, а при
800—900° С происходит и бурное горение выделяющегося титана.
По отношению к воде и разбавленным кислотам, не являющимся
окислителями, моногидрид титана устойчив. Обладает восстанови-
тельными свойствами и при действии окислителей переходит в сое-
динения титана (IV). При действии фтороводорода (при 700° С)
образует трифторид титана:
TiH + 3HF = TiF3 + 2Н2 + 132,7 ккал
Дигидрид титана 20’32’ 116-120
Получение. Дигидрид титана — TiH2 (мол. вес 49,915) представ-
ляет собой серовато-черный порошок. Как и моногидрид, он обра-
зуется в системе титан — водород. Однако фаза на основе дигид-
рида титана устойчива только при t > 400° С в атмосфере водорода
при давлении последнего больше 1 атм. Ниже этой температуры
164
дигидрид титана может существовать только в составе фазы на
основе моногидрида титана, т. е, твердого раствора, содержание
дигидрида в котором может достигать очень большой величины;
тем не менее препараты дигидрида титана, полученные в системе
титан — водород, всегда содержат водорода меньше, чем это соот-
ветствует составу TiH2.
Вместе с нитридом дигидрид титана образуется при действии
аммиака на элементарный титан при высокой температуре:
5Ti + 2H3N = 3TiH2 + 2TiN
а также при восстановлении двуокиси титана гидридом кальция:
TiO2 -f- 2СаН2 — TiH2 -I- 2СаО -f- Н2
Стандартная теплота образования дигидрида титана составляет
34,5 ккал/моль. Энтропия образования TiH2 равна 33,9 кал/(град-
• моль). Энергия Гиббса образования 25,13 ккал/моль.
Физические свойства. Дигидрид титана существует в двух по-
лиморфных модификациях; температура превращения
37° С. Модификация, устойчивая ниже 37° С, имеет кристалличе-
скую гранецентрированную решетку тетрагональной сингонии с па-
раметрами а — 452,8, с = 427,9 пм. Модификация, устойчивая выше
37° С, кристаллизуется в кубической сингонии (типа CaF2), а =
= 445,4 пм. Плотность дигидрида титана при 20°С равна
3,912 г/см3.
Теплоемкость TiH2 при постоянном давлении составляет
при 0°С — 6,994 и при 25°С — 7,191 кал/(град-моль). Зависимость
теплоемкости дигидрида от температуры в интервале от 35 до
288° К выражается уравнением:
Ср = О.ОбТ - 0,00016712 + 2 • 10~7 Г3 - 1,66
а в интервале от 290 до 380° К — уравнением:
Ср =0,026Т-6,4- 10-<5Т2
Энтальпия дигидрида титана при 25° С составляет
1181,7 кал/моль.
Стандартная энтропия дигидрида титана составляет
7,101 кал/(град-моль). Зависимость энтропии от температуры
в интервале от 135 до 305° К выражается уравнением:
Зт = 0,536 + 0,0236 Г — 141 /Т.
Приведенная энергия Гиббса TiH2 при 25° С равна
— 3,138 кал/(град-моль).
Значения термодинамических свойств дигидрида титана при
различных температурах приведены в Приложении 31.
Химические свойства. Индивидуальный дигидрид титана ' устой-
чив лишь при температуре выше 400° С в атмосфере водорода, и
163
только в интервале 800—1000°С происходит полная диссоциация
его на титан и водород. В составе твердого раствора в моногид-
риде дигидрид титана (даже при значительном содержании его)
устойчив и при температуре ниже 400°С. На воздухе при 800—
1000°С дигидрид бурно сгорает. По отношению к воде, разбавлен-
ным кислотам и окислителям он подобен моногидриду титана.
Дигидрид титана взаимодействует с изо-бутаном с образова-
нием дибутилтитана.
На практике, по существу, с индивидуальным дигидридом ти-
тана дела не имеют, а дигидридом называют твердые растворы
состава TiHli8 — TiHi.eg.
Дидейтерид титана
Дидейтерид гитана—TiD2 (мол. вес 50,93) образуется в си-
стеме титан — дейтерий. Он представляет собой серовато-черный
порошок. Имеет при температуре ниже 37° С гранецентрированную
кристаллическую решетку тетрагональной сингонии с параметрами
а = 451,6, с = 426,7 пм, выше 37° С — решетку кубической сингонии
с параметрами а = 444,0 пм. Плотность дидейтерида титана
4,1 г/см3. По химическим свойствам он подобен дигидриду.
Известен также дитритид титана — Т1Т2 образующийся в си-
стеме титан — тритий.
Другие гидриды титана121
При насыщении тетрахлорида титана водородом при низких
давлениях и облучении раствора светом ртутной лампы в некото-
ром количестве образуются: тетрагидрид — TiH4, тригидридхло-
рид — Т1С1Н3 (при давлении 4 мм рт.ст.), дигидриддихлорид —
Т1С1гНг и гидридтрихлорид — TiCl3H (8 мм рт.ст.), обнаруживае-
мые с помощью масс-спектроскопического анализа.
НИТРИДЫ ТИТАНА
Система титан — азот 19’20’122
Как уже указывалось в гл. II, титан способен интенсивно ре-
агировать с азотом при высоких температурах. Известно, что ти-
тан— один из немногих металлов, способных гореть в атмосфере
азота. Особенно бурно азот реагирует с расплавленным титаном.
В результате взаимодействия титана с азотом образуется ряд твер-
дых растворов, а также нитриды титана, преимущественно моно-
нитрид— TiN.
Диаграмма состояния. На рис. 18 представлена диаграмма со-
стояния системы Ti — N в области содержания азота до
50 атомн.%, т. е. на участке Ti — TiN. Из диаграммы следует, что
в системе помимо определенных соединений Ti3N и TiN образуются
1.6S
твердые растворы. Первой стадией азотирования титана является
внедрение азота (в виде Ti3N) в решетку металла при сохранении
его металлических свойств. Присутствие субнитрида титана в твер-
дом растворе резко повышает температуру полиморфного превра-
щения a-Ti fJ-Ti. При 2020° С в сплавах, содержащих азот от 4
до 12,5 атомн.%, наблюдается перитек-
тическая реакция:
a-Ti + ж = p-Ti
Содержание N , атомн. %
Рис. 18. Диаграмма состояния
системы титан — азот.
Максимальная растворимость азота
в р-титане (6,5 атомн.%) достигается
при перитектической температуре
2020° С. Вторая перитектическая реак-
ция:
a-Ti + ж = TiN
в сплавах, содержащих азот от 15,5 до
Рис. 19. Кинетические кривые поглощения
азота титаном.
27 атомн.%, протекает при 2350°С. Граница растворимости азота
в a-титане соответствует содержанию азота 21,4 атомн.% и темпера-
туре 1050° С. При этой температуре протекает перитектоидная реак-
ция:
a-Ti + TiN = Ti3N
При t > 1050° С в области содержания в сплавах азота от 21 до
27 атомн.% кристаллизуется двухфазная смесь твердого раствора
фазы на основе a-титана и фазы на основе мононитрида титана.
При большем содержании азота сплав вступает в область гомо-
генности фазы на основе мононитрида титана. Кривые начала и
конца кристаллизации от второй перитектической температуры
(2350° С) с возрастанием содержания азота в системе подни-
маются до температуры 2930° С, отвечающей содержанию азота
50 атомн.%. Эта температура является температурой плавления
мононитрида титана.
167
Кинетика взаимодействия титана с азотом. Процесс поглоще-
ния азота титаном похож на процесс поглощения кислорода: ско-
рость его почти не зависит от давления газа. Однако скорость
поглощения азота значительно меньше скорости поглощения кисло-
рода. Зависимость между количеством поглощенного азота, темпе-
ратурой и временем показана на рис. 19. Процесс поглощения
азота титаном описывается уравнением: V2 = kx (где V — количе-
ство поглощенного азота за время т; k — константа скорости, лога-
рифм которой линейно зависит от обратной абсолютной темпера-
туры).
Количество окалины, образующейся при выдерживании титана
в атмосфере азота при температуре ниже 1000° С, очень мало.
Моноиитрид титана 19-21,72,123-126
Получение. Мононитрид, или нитрид, титана — TiN (мол. вес
61,91) представляет собой очень твердую массу или порошок брон-
зового цвета. Он образуется *в системе титан—азот. Практически
в этой системе нитрид может быть получен путем непосредствен-
ного взаимодействия элементарных титана и азота при ^> 800°С,
например при горении тонко измельченного (или расплавленного)
титана в избытке чистого азота:
2Т1 + N2 = 2TiN + 160940 кал
В системе титан — азот мононитрид титана образует широкую об-
ласть твердых растворов. Фаза на основе мононитрида устойчива
в интервале составов от TiNo,s7 до TiNi.ie.
Нитрид титана образуется при нагревании смеси двуокиси ти-
тана с углеродом в токе азота:
2ТЮ2 + 4С + N2 = 2T1N 4- 4СО
или дициана:
2Т1О2 + 2С + (CN)2 = 2TiN + 4СО
Нитрид титана образуется также при обработке раскаленной дву-
окиси или полутораокиси титана сухим аммиаком:
6TiO2 + 8H3N = 6TiN + 12Н2О + N2
Ti2O3 + 2H3N = 2TiN + 3H2O
Вместе с дигидридом нитрид титана образуется при действии ам-
миака на элементарный титан при высокой температуре
(см. выше).
Нитрид титана осаждается на поверхности раскаленного ме-
талла при действии смеси азота и водорода на тетрахлорид титана:
2Т1СЩ+ N2 + 4H2 = 2TiN+8HCl
Например, чистейший нитрид титана осаждается на вольфра-
мовой нити, нагретой до 1450°С. На поверхности железа образо-
168
вание нитрида может происходить и в отсутствие водорода:
2TiCl4 + N2 + 4Fe = 2T1N + 4FeCl2
;i Чистый нитрид титана образуется также при продолжительном на-
; гревании тетрамминтетрахлоротитана в струе аммиака:
6 [TiCl4(NH3)4] +8H3N = 6TiN +24NH4C1 + Na
Стандартная теплота образования нитрида титана
80,47 ккал/моль. Энергия Гиббса образования 73,64 ккал/моль.
Физические свойства. Мононитрид титана по внешнему виду
металлоподобен; цвет его, в зависимости от степени чистоты и дис-
персности, изменяется от бронзово-желтого до светло-коричневого.
Нитрид титана кристаллизуется в кубической сингонии (гранецен-
трированная решетка типа NaCl, а = 423,5 пм). Плотность ни-
трида при 25° С равна 5,21 г/см3. Твердость очень велика, а именно
9 по шкале Мооса; он царапает рубий и шлифует алмаз.
Температура плавления нитрида титана 2930°С; теп-
лота плавления 284 кал/г, или 17,58 ккал/моль.
Стандартная теплоемкость нитрида титана при постоян-
ном давлении составляет 8,966 кал//град-моль). Зависимость теп-
лоемкости от температуры в интервале от 50 до 300° К подчиняется
уравнению:
Ср = 3,52 • 10~*Т2 - 9,4 • 10-7Т3 + 1,4 • 10~22Г9
а в интервале от 290 до 1900° К уравнению:
Ср = 11,91 +9,4- 10~4Т — 287000/Т2
Теплоемкость жидкого TIN равна 13,5 кал/(град-моль).
Энтальпия нитрида титана при 25° С составляет
1311 кал/моль. Зависимость энтальпии от температуры в интервале
от 250 до 2000° К выражается уравнением: Н°т — Но = 11,91т +
+ 4,7 • 10-4Т2 + 287 000/Г - 3245.
Энтропия нитрида титана равна 7,193 кал/(град• моль)
при 25° С. Зависимость энтропии от температуры в интервале
от 100 до 1900° К выражается уравнением: Sr= 12,41 +0,00957 —
—2400/Т.
Приведенная энергия Гиббса нитрида титана при 25°С
составляет —2,796 кал/ (град • моль).
Значения термодинамических свойств нитрида титана при раз-
личных температурах приведены в Приложении 32.
Нитрид титана проводит электрический ток, и электропро-
водность его уменьшается с повышением температуры, что ука-
зывает на его металлический характер. При 20° С удельная электро-
проводность составляет 8,7 Мсим/м. Зависимость удельной элек-
тропроводности от температуры в интервале от —200 до +50° С
выражается уравнением: сг = 9,6 — 0,056/ + 5,60-10-4/2. При 1,2°К
нитрид титана приобретает сверхпроводимость. В тонких слоях,
169
нанесенных на поверхность диэлектриков, он ведет себя как полу-
проводник.
Химические свойства. При обычных температурах мононитрид
титана химически устойчив. При нагревании его в вакууме наблю-
дается частичное отщепление азота и образование возгона, содер-
жащего несколько пониженное по сравнению с TiN количество
азота; этот возгон способен снова поглощать азот. Чистый моно-
нитрид титана обычно не поглощает азот. Нитрид титана не взаи-
модействует с водородом. В кислороде он сгорает; реакция
идет с большой скоростью при 1200° С и выше сначала по урав-
нению:
2T1N + 2О2 = 2TiO2 + Na + 290 ккал-, AG = 277,3 ккал
С течением времени появившийся белый слой двуокиси титана
исчезает, и поверхность горящего нитрида чернеет, что объясняется
образованием сложного кислородсодержащего твердого раствора.
Непрерывный ряд твердых растворов образуется также в системе
TiN —TiO.
Фтор с нитридом титана реагирует на холоду, а хлор — при
нагревании с образованием соответствующих тетрагалидов:
2TiN + 4F2 = 2T1F4 + N2 + 627,46 ккал; AG = 598 ккал
2TiN + 4CI2 = 2T1CI4 + N2 + 205,06 ккал; AG = 200 ккал
В воде нитрид не растворяется и на холоду с ней не взаимо-
действует; горячим водяным паром он разлагается с выделением
аммиака и водорода:
2TiN + 4Н2О = 2TiO2 + 2NH3 + Н2 + 80,94 ккал
На использовании этой реакции были основаны попытки разрабо-
тать технический способ получения аммиака.
С выделением аммиака действуют на нитрид титана и горячие
водные растворы щелочей, а также расплавленные щелочи:
2TiN + 8КОН = 2К4Т1О4 + 2NH3 + Н2
К действию разбавленных кислот, кроме азотной, нитрид
устойчив. В плавиковой кислоте растворяется в присутствии силь-
ных окислителей. С хлороводородом взаимодействует при 1300° С
с образованием хлоридов титана. Концентрированную серную кис-
лоту при нагревании восстанавливает:
2TiN + 6H2SO4 = 2TiOSO,( + 4SO2 + N2 + 6H2O
При нагревании нитрид титана легко реагирует с оксидами
азота. С одноокисью углерода не взаимодействует, а
с двуокисью углерода медленно реагирует по уравнению:
2TiN + 4СО2 = 2TiO2 + N2 + 4СО +19,51 ккал
При действии ди циан а на нитрид титана образуется карбо-
нитрид;
10TiN + (CN)2 = 2T15N4C + 2Nj
170
Другие нитриды 2’2о-84’ 122~!2?
В системе титан — азот кроме мононитрида образуется также
субнитрид титана Ti3N. Кроме этих соединений, имеющих характер
металлоподобных полусолей, титан образует с азотом соединения
TiaNi — нормальный нитрид титана (IV) и TiN2 — пернитрид тита-
на (IV). Титан образует также соединения, содержащие кроме
азота водород, кислород или галогены. К этим соединениям отно-
сятся смешанные галиднитриды (хлор-, бром- и иоднитрид) и ряд
гидронитридов (амиды и имиды).
Субнитрид титана — Ti3N (мол. вес 157,71) образуется в си-
стеме титан — азот. Практически в этой системе субнитрид может
быть получен путем сплавления мононитрида с элементарным ти-
таном:
TiN + 2Ti = Ti3N
В молекуле субнитрида атомы титана соединены между собой ме-
таллической связью; структура его может быть представлена так:
Т1
Субнитрид титана представляет собой металлоподобное веще-
ство желтовато-серого цвета. Кристаллизуется в тетрагональной
сингонии (а — 492, с = 5,61 пм).
При обычной температуре субнитрид химически устойчив, а при
нагревании до 1050е С диспропорционирует на две фазы: первая —
на основе мононитрида, вторая — на основе a-Ti. При высокой
температуре поглощает азот, переходя при этом < в мононитрид.
С кислородом взаимодействует, подобно мононитриду титана. Со
фтором и хлором легко реагирует с образованием соответствую-
щих тетрагалидов. С горячим водяным паром взаимодействует по
уравнению:
2Ti3N + 12Н2О = 6TiO2 + 2H3N + 9Н2
Нитрид титана(IV)—Ti3N4 (мол. вес 199,73) образуется при
термическом разложении тетрамида, хлорнитрида титана и тетр-
амминдихлоротитана (в вакууме при 300°С):
3Ti(NH2)4 = Ti3N4 + 8H3N; 4TiNCl = Ti3N4 + TiCl4
3[TiCl2(NH3)4] = Ti3N4 + 6NH4C1 + 2NH3 + 3H2
Нитрид титана (IV) представляет собой медно-красные кристал-
лы, при измельчении превращающиеся в фиолетовый порошок. При
нагревании выделяет азот, переходя при этом в мононитрид:
2Ti3N4 = 6TiN + N2
Под давлением азота плавится при 2860°С.
171
По химическим свойствам нитрид титана (IV) напоминает Моно-
нитрид титана (взаимодействие с кислородом, фтором, хлором).
В отличие от мононитрида нитрид титана (IV) реагирует с водяным
паром и щелочами без выделения водорода:
Ti3N4 + 6Н2О = 3TiO2 + 4NH3
Ti3N4 + 12КОН = ЗК4ТЮ4 + 4NH3
Аммиак присоединяется к Ti3N4 с образованием динитридимида
титана. Нитрид лития также присоединяется к нитриду титана (IV)
с образованием нитридотитаната лития:
Ti3N4 + Li3N = Li3Ti3N3
Пернитрид, или динитрид, титана — TiN2 (мол. вес 75,915) обра-
зуется при действии смеси азота и водорода на сильно накаленную
двуокись титана:
TiO2 + N2 + 2Н2 = TiNj 4- 2Н2О
Пернитрид представляет собой фиолетовый порошок. В моле-
куле его атомы азота соединены между собой неполярной кова-
лентной связью; структура пернитрида может быть представлена
в виде
Очевидно, что в этом соединении окислительное число азота
равно —2, и соединение является производным гидразина, кото-
рый выделяется при действии кипящей воды на пернитрид титана.
Окислители действуют на пернитрид титана, аналогично тому, как
они действуют на мононитрид.
ГИДРОНИТРИДЫ, НИТРИДОКСИДЫ И ГАЛИДНИТРИДЫ
ТИТАНА2, 20, 84, 122-127
Амиды титана
Тетрамид титана — Ti(NH2)4 (мол. вес 107,99) образуется при
обработке жидким аммиаком октамминтетрахлорида титана, а
также при нагревании смеси мочевины (карбамида или амидоксида
углерода) и тетрахлорида титана до 150° С:
TiCl4 + 2CO(NH2)2 = Ti(NH2)4 + 2СОС12
Образование тетрамида титана происходит также при взаимодей-
ствии нитрата титана (IV) с раствором амида калия в жидком ам-
миаке:
Ti(NO3)4 + 4KNH2=Ti(NH2),+4KNO3 . -
Тетрамид титана представляет собой темно-желтую кристалли-
ческую массу. При нагревании в вакууме или при длительном хра-
172
нении в вакуум-эксикаторе над серной кислотой он отщепляет ам-
миак, переходя в диимид титана:
Ti(NH2)4 = Ti(NH)2 + 2NH3
’ При действии воды тетрамид титана подвергается гидролизу, при-
L чем сначала образуется амидоксид титана (IV):
Ti(NH2)4 + Н2О = TiO(NH2)2 + 2NH3
Амидоксид титана образуется также при действии амида калия
на аммиачный раствор сульфатоксида титана (IV) (в присутствии
; роданида калия). Амидоксид титана(IV) представляет собой бу-
рую кристаллическую массу. При нагревании выделяет аммиак,
' переходя при этом в нитридоксид титана:
3TiO(NH2)2 = Ti3O3N2 + 4NH3
При действии воды (даже влаги воздуха), медленно гидролизуется
также с отщеплением аммиака:
TiO(NH2)2 + ЗН2О = Ti(OH)4 + 2NH3
С избытком амида калия амидоксид взаимодействует с образова-
нием имидооксотитаната:
TiO(NH2)2 + 2KNH2 = K2[TiO(NH)2] + 2NH3
Известны продукты замещения в тетрамиде одной амидогруппы
на галоген.
Хлортриамид — Т1(ЫНг)зС1 — содержится вместе с хлоридом
аммония в продукте взаимодействия тетрахлорида титана с амми-
аком. Хлортриамид представляет собой темно-желтый порошок.
При нагревании в вакууме выделяет аммиак и переходит в хлор-
нитрид титана:
Ti(NH2)3Cl = TiNCl + 2NH3
При действии воды хлортриамид титана подвергается гидролизу!
Ti(NH2)3Cl + 4Н2О = Ti(OH)4 + NH4C1 + 2NH3
Бромтриамид титана — Ti(NH2)sBr — образуется при аммоно-
лизе тетрабромида титана в жидком аммиаке:
TiBr4 + 6NH3 = Ti(NH2)3Br + 3NH4Br
Бромтриамид представляет собой желтые кристаллы. При нагрева-
нии выделяет аммиак и переходит в бромнитрид титана.
Известен также иодтриамид титана — Ti(NH2)3I.
Из продуктов замещения водорода в тетрамиде известны тетра-
диэтиламид титана — Ti[N(CaH5)2]4 — и тетрадифениламид тита-
на— TifN (СрН5)гЪ, которые образуются при действии диэтиламида
или дифениламида калия на тетрахлорид титана:
TiCl4 + 4KN(C2H5)2 = Ti[N(C2H5)2]4 + 4КС1
Ti Cl4 + 4KN(C6H5)2 = Ti[N(C6H5)2]4 + 4KC1
173
Тетрадиэтиламйд титана (теплота образования 116,0 ккал/моль)
рредставляет собой желтую жидкость, а тетрадифениламид тита-
на— красные кристаллы. Оба соединения растворяются в органи-
ческих растворителях и разлагаются (при нагревании) спиртом и
уксусной кислотой.
Существуют триамид титана — Ti(NH2)3 и диамид титана —
Ti(NH2)2 (теплота образования 52 ккал/моль).
Имиды титана
Диимид титана-—Ti(NH)2 — образуется, как уже отмечалось,
при отщеплении аммиака от тетрамида титана. Он представляет
собой взрывчатое вещество желтого цвета. С имидами активных
металлов образует имидотитанаты.
Динитридимид титана — Ti2(NH)N2 — образуется при действии
аммиака на нитрид титана (IV):
2Ti3N4 + NH3 = 3Ti2(NH) N2
а также при нагревании тетрамминтетрахлоротитана в атмосфере
аммиака до температуры красного каления и последующем охла-
ждении.
Динитридимид титана представляет собой кристаллический по-
рошок голубовато-стального цвета. При прокаливании на воздухе
он переходит в двуокись титана.
Нитридоксид титана
Нитридоксид титана — Ti3O3N2 (мол. вес 219,71) образуется как
уже указывалось, при отщеплении аммиака от амидоксида тита->
на (IV). Он представляет собой синевато-черные кристаллы. При
нагревании на воздухе переходит в двуокись титана. С водой и
растворами кислот и щелочей не взаимодействует.
Кроме нитридоксида титана (IV) существуют бертоллидные со-
единения переменного состава с общей формулой Ti(O, N). Обра-
зование этих нитридоксидов, в частности Ti2ON, в системе TiN —
TiO объясняется тем, что одноокись титана, имея одинаковую
с нитридом титана кристаллическую решетку, способна изоморфно
замещать его.
Галиднитриды титана
Хлорнитрид титана — TiNCl (мол. вес 97,36) образуется при
действии азота, активированного влиянием тихого электрического
разряда (4500 в), на тетрахлорид титана:
2Т1С14 + 2N = 2T1NC1 + ЗС12
а также при действии жидкого аммиака на тетрамминтетрахлоро-
титан:
TiCl4 • 4NH3 + nNH3 = TiNCl + 3NH4C13 • ftNH3
174
Хлорнитрид образуется также при нагревании хлортриамида.
Хлорнитрид титана представляет собой зеленоватый кристалли-
ческий порошок. Примесь титана(III) окрашивает хлорнитрид в
черный цвет. Кристаллизуется в ромбической сингонии (а = 394,
b = 326, с = 780 пм). Плотность 3,235 г)смл. Хлорнитрид титана
диамагнитен.
При нагревании до 300° С хлорнитрид разлагается на нитрид и
хлорид титана(IV):
4TiNCl = Ti3N4 + TiCI4
а при нагревании до более высокой температуры в атмосфере ам-
миака образуется мононитрид титана.
При действии воды легко гидролизуется с образованием ортоти-
тановой кислоты. С тетрахлоридом титана образует продукт при-
соединения состава TiNCl-TiCl4. В концентрированных азотной и
серной кислотах растворяется с разложением.
Бромнитрид титана — TiNBr (мол. вес 141,81) образуется при
нагревании бромтриамида титана:
Ti(NH2)3Br = TiNBr + 2NH3
Бромнитрид представляет собой синий, а с примесью титана-
(III)—черный кристаллический порошок. Кристаллизуется в ром-
бической сингонии (а — 393, b = 335, с = 833 пм). Плотность
4,3 г!см3. Бромнитрид титана диамагнитен.
При нагревании бромнитрид разлагается с образованием моно-
нитрида и тетрабромида титана:
8TiNBr = 6TIN + 2TiB г4 + N2
Водой он легко разлагается с образованием нерастворимого
осадка:
TiNBr + 4Н2О = Ti(OH)4 + NH4Br
В разбавленных серной и соляной кислотах также разлагается, но
с полным растворением.
Иоднитрид титана — TiNI (мол. вес 188,81) образуется при
действии жидкого аммиака на тетраиодид титана:
Til4 + 4NH3 = TiNI + 3NH4I
Он представляет собой черные кристаллы ромбической сингонии
(а = 394, Ъ = 351,5, с = 895,5 пм). Плотность 5,05 г!см3. Диамаг-
нитен.
При нагревании иоднитрид титана легко разлагается, хотя
в атмосфере паров иода может длительное время находиться при
250° С без разложения, Водой легко гидролизуется.
Трихлоразид титана — TiN3Cl3 (мол. вес 196,28) образуется при
взаимодействии азидохлора с тетрахлоридом титана при 0°С:
TiCl4 + C1N3 = TiN3Cl3 + Cl2
Трихлоразид титана представляет собой гигроскопичные кри-
сталлы. При ударе или быстром нагревании взрывается. При
175
медленном нагревании до 168° С взрывается без плавления. В воде
гидролизуется с образованием метатитановой кислоты:
TiN3Cl3 + ЗН2О = Н2Т1О3 + HN3 + ЗНС1
Растворяется в тетрахлориде титана; не растворяется в хлорокиси
фосфора и в неполярных растворителях. Под действием тетрахло-
ридов углерода и титана на трихлоразид титана идет медленная
реакция с образованием полимерного хлорнитрида титана и выде-
лением элементарных азота и хлора.
ФОСФИДЫ ТИТАНА И ИХ АНАЛОГИ 19 20 128
Система Ti — Р
Растворимость фосфора в титане невелика — всего 0,11 атомн.%.
В системе титан — фосфор образуются два соединения: гемифос-
фид — Ti2P — и монофосфид — TiP. Первое соединение не раство-
ряет ни титана, ни монофосфида; второе совсем не растворяет
фосфора, но растворяет гемифосфид, образуя фазу с областью го-
могенности при содержании фосфора от 48 до 50 атомн.%. Таким
образом, в этой системе области твердых растворов весьма огра-
ничены.
Монофосфид титана — TiP (мол. вес 78,87) образуется в си-
стеме титан — фосфор. Практически он может быть получен при
действии нагретых до 450° С паров фосфора на элементарный ти-
тан, нагретый до 95° С. Монофосфид титана образуется также при
нагревании дифосфинтетрахлоротитана в струе фосфина:
6TiCl4(PH3)2 + 16РН3 = 6TiP + РС13 + 21РН4С1
а также при длительном действии фосфина на порошкообразный
титан при 850° С. Образование монофосфида титана (с примесями)
происходит также при восстановлении титановой фосфатокис-
лоты углеродом. Теплота образования монофосфида титана
63,4 ккал/моль.
Монофосфид титана представляет собой твердую серовато-чер-
ную металлоподобную массу. Кристаллизуется в гексагональной
сингонии (а = 349,9, с — 116,9 пм). Плотность при 0°С равна 4,04
и при 25° С — 3,99 г/см3. В элементарной ячейке содержится четыре
молекулы TiP. Монофосфид проводит электрический ток.
Монофосфид титана не растворяется ни в воде, ни в кислотах,
ни в щелочах. При нагревании на воздухе сгорает с образованием
оксидов титана и фосфора, при сплавлении с селитрой — взры-
вается.
Система Ti—As
Растворимость мышьяка в титане составляет 0,19 атомн.%.
В системе Ti — As образуется одно соединение — аренд титана —
TiAs (теплота образования 35,8 ккал/моль), кристаллизующееся
в гексагональной сингонии [а = 363, с = 1220 пм). Аренд титана
электропроводен,
176
При длительном нагревании смеси элементарных титана и
мышьяка в запаянной кварцевой трубке при температуре выше
820° С образуется диарсид титана — TiAs2, имеющий ромбическую
кристаллическую решетку с параметрами: а = .1327, b = 696, с =
— 350 пм. Плотность диарсида титана 6,30 г/см3.
Система Ti—Sb
В этой системе образуются три устойчивых соединения: субсти-
бид— Ti4Sb, моностибид — TiSb и дистибид —TiSb2. Субстибид ти-
тана кристаллизуется в гексагональной сингонии (а = 596, с =
= 480,7 пм)\ плотность при 25° С равна 5,66 г/см3. Моностибид
(теплота образования 67,2 ккал/моль) кристаллизуется в гексаго-
нальной сингонии (решетка типа NiAs; а = 407, с = 630,5 пм).
Дистибид кристаллизуется в тетрагональной сингонии (а = 667,
с = 582 пм)’ изоморфен А12Си.
Система Ti—Bi
Висмут понижает температуру полиморфного превращения ти-
тана до 725° С. Растворимость висмута в a-Ti достигает 1 атомн.%
(725°С), а в p-Ti— 10 атомн.% (1340°С). В системе Ti — Bi обра-
зуются два устойчивых соединения: субвисмутид — Ti3Bi и гемивис-
мутид — Ti2Bi. Субвисмутид кристаллизуется в тетрагональной
сингонии (а = 602, с = 820,5 пм)’, при 1340° С инконгруэнтно пла-
вится с выделением кристаллов p-Ti.
КАРБИДЫ ТИТАНА
Система Ti — С 20-122>129
Как уже указывалось, титан способен взаимодействовать с угле-
родом при высоких температурах. В результате этого взаимодей-
ствия образуются очень твердые сплавы, содержащие карбид ти-
тана (TiC) и ряд твердых растворов.
Диаграмма состояния. На рис. 20 представлена диаграмма со-
стояния системы Ti — Св области, отвечающей содержанию С до
88 атомн.%. Из диаграммы следует, что в системе кроме соедине-
ния TiC образуются твердые растворы TiC с элементарным тита-
ном. Первой стадией науглероживания титана является внедрение
углерода (в виде TiC) в решетку металла с сохранением его метал-
лических свойств. Присутствие карбида титана в твердом растворе
повышает температуру полиморфного превращения a-Ti p-Ti до
920° С. Предельная растворимость углерода в a-титане возрастает
от 1,0 атомн.% при 400° С до 1,9 атомн.% при 920° С. При послед-
них составе и температуре происходит перитектоидная реакция:
a-Ti p-Ti + TiC
177
Растворимость углерода в р-титане при перитектоидной темпера-
туре составляет 0,6 и увеличивается до 3,1 атомн.% при 1750° С.
При этой температуре в сплавах, содержащих от 3 до 33 атомн.%1
углерода, наблюдается перитектическая реакция:
p-Ti TiC + ж
Кривая зависимости температуры начала кристаллизации от со-
става системы (ликвидус) идет вверх от перитектической точки до
Рис. 20. Диаграмма состояния системы Ti—С.
точки, соответствующей температуре плавления карбида титана
(50 атомн.% С; 3140°С). Область гомогенности фазы на основе
карбида титана (б-фаза) соответствует содержанию углерода от
33 до 50 атомн.% при перитектической температуре. С понижением
температуры область гомогенности карбидной фазы постепенно су-
жается. При содержании в системе 50 атомн.% углерода, т. е. при
составе, соответствующем соединению TiC, кривая начала кристал-
лизации проходит через максимум, соответствующий 3140° С. При
дальнейшем увеличении содержания углерода в системе кривая
начальной кристаллизации карбида титана идет вниз и при соцер-
178
жании в системе 63 атомн.% углерода достигает точки, соответ-
ствующей эвтектической температуре 3050° С, при которой карбид
титана кристаллизуется совместно с графитом. Поскольку твердый
карбид титана не растворяет графита, область правее абсциссы,
соответствующей 50 атомн.% углерода, и ниже ординаты, соответ-
ствующей 3050° С, является двухфазной (TiC + C). От эвтектиче-
ской точки кривая начала кристаллизации графита идет вверх до
точки, соответствующей 66 атомн.% углерода и температуре плав-
ления графита 3700° С. От этой точки линия ликвидуса идет далее
горизонтально, и в системе наблюдается превращение
пар + графит —> жидкость
На диаграмме состояния представлены также кривые кипения
в системе титан — углерод. Кривые начинаются в точке на оси
ординат, соответствующей температуре кипения титана (3210°С),
и идут вверх раздельно до точки пересечения, соответствующей
66 атомн.% углерода и 3700°С.
Изменение механических свойств. При диффузии углерода
в титан образуется слой карбида и, таким образом, после малого
начального периода диффузия осуществляется через слой карбида
титана. Глубина проникновения углерода как в а-, так и в р-титан
в результате диффузии пропорциональна корню квадратному из
времени диффузии.
Введение углерода в твердый раствор на основе а-титана уве-
личивает параметры кристаллической решетки, причем с в боль-
шей мере, чем а. Увеличение содержания углерода в твердом рас-
творе на основе карбида титана также приводит к увеличению
параметров кристаллической решетки.
Содержание углерода линейно увеличивает прочность титано-
вого сплава только в пределах области гомогенности а-фазы.
В двухфазной области прочность с возрастанием содержания угле-
рода в системе почти не изменяется. Пластичность сплавов при
увеличении содержания углерода, наоборот, уменьшается. Присут-
ствие в сплавах карбидной фазы приводит к появлению хрупкости.
Карбид титана 20> 72’ 130-134
Получение. Карбид, или монокарбид, титана — TiC (мол. вес
59,91) образуется в системе Ti — Си может быть получен путем
непосредственного сплавления элементарного титана с углеродом.
Не очень чистый карбид титана может быть выделен из титансо-
держащего чугуна: если такой чугун растворить в соляной кислоте,
то карбид титана вместе с графитом окажется в остатке.
Карбид титана образуется при восстановлении двуокиси (а так-
же других оксидов) титана углеродом:
TiO2 + ЗС = TiC + 2СО
К образованию карбида титана приводит также восстановление
различных титанатов, в частности титаната железа.
179
При температуре выше 1600° С карбид титана может образовы-
ваться при действии на углерод смеси водорода с парами тетра-
хлорида титана:
TiCl4 + 2Н2 + С = TiC + 4НС1
а также при взаимодействии газообразного тетрахлорида титана,
окиси углерода и водорода:
TiCl4 + СО + ЗН2 = TiC + 4НС1 + Н2О
с отложением карбида титана на раскаленной проволоке. Карбид
титана образуется также при действии углерода (особенно в при-
сутствии водорода) и на некоторые другие соединения титана. Вме-
сте с двуокисью титана карбид получается при действии двуокиси
углерода на элементарный титан при высокой температуре. Стан-
дартная теплота образования карбида титана составляет
44,5 ккал/моль. Энергия Гиббса образования TiC равна
43,37 ккал/моль.
Физические свойства. Карбид титана — серо-стальные кристал-
лы с металлическим блеском. Карбид титана кристаллизуется в ку-
бической сингонии (кристаллы типа NaCl, а = 432,9 пм). Плот-
ность карбида титана при 20° С равна 4,91 г/см?. Твердость очень
велика, 9,5 по шкале Мооса.
Температура плавления карбида титана 3140°С, теп-
лота плавления 261,5 кал/г. Т е м п е р а ту р а к и п е н и я 4300° С;
теплота сублимации 2417 кал/г.
Теплоемкость карбида титана при 25° С составляет
8,11 кал/(град • моль). Зависимость теплоемкости от температуры
в интервале от 100 до 300° К выражается уравнением:
Ср = 2,2 • 10-4Г2 - 4,3 • 10-773
а в интервале от 295 до 1800° К — уравнением:
Ср = 11,83 + 8,0 • 10—4 Г - 352 000/72
Энтальпия карбида титана при 25° С составляет
1102 кал/моль. Зависимость энтальпии от температуры в интервале
от 290 до 1900° К подчиняется уравнению:
Н°т - Н°о = 11,837 + 4,0 • 10-472 + 352 000/7 - 3663
Энтропия карбида титана составляет 5,108 кал/ (град • моль)
при 25° С. Зависимость энтропии от температуры в интервале
0 до 350° К выражается уравнением:
Sy = 9,7 • 10-572 - 8 • 10“ 1375 - 0,00327
а в интервале от 290 до 2000°К — уравнением:
Sy = 13,445 + 0,007777 - 2970/7
Приведенная энергия Гиббса карбида титана при 25°С
равна —2,105 кал/(град• моль),
180
Значения термодинамических свойств карбида титана при раз-
личных температурах приведены в Приложении 33.
Карбид титана обладает очень большой теплопроводностью. Он
проводит также электрический ток: электропроводность
уменьшается с повышением температуры, что указывает на метал-
лический характер соединения. При 20°С удельная электропровод-
ность составляет 0,518 Мсим/м. Зависимость удельной электропро-
водности от температуры в интервале от — 200 до + 80° С выра-
жается уравнением: п( = 0,604 —4,9-10“а/+ 3-10~42. При 1,1° К
карбид титана приобретает сверхпроводимость. Карбид титана
слабо парамагнитен.
Излучательная способность карбида для света с к — 665 нм
практически не отличается от излучательной способности черного
тела.
Химические свойства. При обычных температурах карбид ти-
тана химически устойчив. Плавится без разложения, но при нагре-
вании в вакууме до температуры, превышающей ЗОО0°С, происхо-
дит выделение паров, содержащих титана больше, чем это соответ-
ствует стехиометрическому соотношению в карбиде.
Карбид титана при нагревании выше 1500° С в атмосфере во-
дорода медленно обезуглероживается.
С азотом карбид реагирует при температуре выше 1200° С,
образуя смешанные карбонитриды титана переменного состава.
Кислородом компактный карбид титана при температуре
около 800° С окисляется очень медленно. При нагревании же по-
рошкообразного карбида титана в атмосфере кислорода до 600° С
он раскаляется и сгорает с образованием диоксидов титана и угле-
рода:
TiC + 2О2 = ТЮ2 + СО2 + 275,05 ккал; AG = —263,2 ккал
При температуре 1200°С реакция карбида титана с кислородом
идет по суммарному уравнению:
2TiC + 30а = 2TiO2 + 2СО + 414,85 ккал-, KG = —403,4 ккал
Следует, однако, иметь в виду, что на первых стадиях окисления
может образоваться монооксид титана, образующий с карбидом
смешанные карбоксиды переменного состава.
Фтор реагирует с карбидом титана на холоду, а хлор и
бром — при нагревании до 400°С с образованием соответствую-
щих тетрагалидов.
В воде карбид титана не растворяется и химически с ней не
взаимодействует. С водяным паром реагирует при температуре
выше 700° С:
2TiC + 6Н2О = 2TiO2 + 2СО + 6Н2 + 68,05 ккал
В соляной кислоте карбид титана нерастворим, но раство-
рим в азотной кислоте и царской водке. В растворах щелочей,
даже кипящих, не растворяется.
С оксидами азота карбид титана реагирует при нагрева-
нии. Так, с полуокисью азота при 1200°С реакция идет по урав-
181
Пению:
TiC + 3N2O = TiO2 + CO + 3N2 + 148,6 ккал
причем возможно образование в качестве промежуточных продук-
тов смешанных карбоксидов титана. С окисью углерода кар-
бид титана не взаимодействует. С двуокисью углерода при 1200° С
реагирует по уравнению:
TiC + ЗСО2 = TiO2 + 4СО + 4,5 ккал; АО =—17,25 ккал
Окись магния при 1900°С восстанавливается карбидом титана:
TiC + 2MgO = TiO + 2Mg + CO — 182,6 ккал
Смешанные карбиды титана135
Образование смешанных карбоксидов и карбонитридов титана
объясняется тем, что монооксид и мононитрид титана, имея одина-
ковые с карбидом титана кристаллические решетки, способны изо-
морфно замещать его. В системах TiC — TiO и TiC — TiN обра-
зуются непрерывные ряды твердых растворов, которые мо-
жно рассматривать как бертоллидные соединения переменного со-
става с общими формулами Ti(O, С) и Ti(N, С).
Карбоксиды титана, в частности Ti2OC, образуются при восста-
новлении двуокиси титана или различных титанатов (например, ти-
таната железа) углеродом. Карбонитриды титана образуются при
тех же восстановительных реакциях в присутствии азота.
Карбонитриды титана. Из карбонитридов титана с давних пор
известен карбонитрид состава Ti5NiC, называемый также циано-
нитридом титана. Это соединение образуется часто в шлаке домен-
ных печей после выплавки богатого титаном чугуна. Его можно
получить также действием дициана на нитрид титана, паров тетра-
хлорида титана на расплавленные цианиды металлов или при
сплавлении двуокиси титана с гексациано-(II)ферратом калия.
Карбонитрид титана — Ti5N4C — представляет собой медно-
красные октаэдрические кристаллы с металлическим блеском.
Плотность при 25° С равна 5,12 г/см3. При нагревании в струе
хлора он разлагается с образованием тетрахлорида титана и хлор-
циана. При нагревании в атмосфере водяного пара разлагается по
уравнению:
T.i5N4C + ЮН2О = 5TiO2 + HCN + 3H3N + 5Н2
Растворяется только в смеси азотной и плавиковой кислот. При
сильном нагревании восстанавливает металлы из их оксидов.
Известен еще карбонитрид титана состава TiN2C2, называемый
также дицианидом титана, или кохранитом. Он образуется при на-
гревании карбида титана или смеси элементарного титана с угле-
родом в струе азота, а также при действии растворов цианидов на
дихлорид титана. Теплота образования TiN2C2 равна —8 ккал/моль.
Карбонитрид титана — TiN2C2 — представляет собой твердые синие
кристаллы (по твердости он превосходит сталь).
182
В тройной системе TiC —TiN —TiO также образуется непре-
рывный ряд твердых растворов, которые можно рассматривать
как смешанные карбонитридоксиды титана переменного состава с
общей формулой Ti(O, N, С).
СИЛИЦИДЫ И ГЕРМАНИДЫ ТИТАНА 20 |22' 136
Системы Ti—Si и Ti—Ge
Титан при высокой температуре взаимодействует с элементар-
ным кремнием, образуя очень твердые сплавы. В системе Ti — Si
Рис. 21. Диаграмма состояния системы Т1—Si.
(рис. 21) при кристаллизации из расплава образуются три соеди-
нения: Ti5Si3, TiSi и TiSi2. Первой стадией силицирования титана
является внедрение кремния (в виде Ti5Si3) в решетку металла.
Присутствие TigSig в твердом растворе снижает температуру поли-
морфного превращения a-Ti p-Ti с 882,5 до 860° С. Раствори-
мость кремния в a-титане весьма ограничена и достигает макси-
мальной (1 атомн.%) при 860° С. Растворимость кремния в
|3-титане при 860° С составляет 2 атомн.% и с повышением темпе-
ратуры до 1330° С достигает 5 атомн.%.
Из трех определенных соединений, образующихся в системе
Ti — Si, два плавятся конгруэнтно: субсилицид — при 2120° С и ди-
силицид — при 1540° С, а моносилицид — инконгруэнтно при 1760° С.
Эвтектические точки имеют следующие координаты: первая —
13,8 атомн.% Si и 1330°С ((ЗТ + Ti5Si3); вторая —64,1 атомн.%
183
Si и 1490°C (TiSi + TiSi2); третья — 85,8 атомн.% Si и 1330°C
(TiSi2-f-Si). Перитектическая точка соответствует 56,4 атомн.%
Si и 1760° С (TiESi3 + TiSi). Субсилицид титана образует в системе
фазу с узкой областью гомогенности, отвечающей содержанию
кремния от 37,5 до 40 атомн.%.
В системе Ti — Ge также образуются три устойчивых соедине-
ния: субгерманид — Ti5Ge3, моногерманид — TiGe и дигерманид —
TiGe2. Присутствие TisGe3 в твердом растворе повышает темпера-
туру полиморфного превращения a-Ti p-Ti до 897° С. Раствори-
мость германия (в виде Ti5Ge3) в а- и |3-титане с понижением тем-
пературы уменьшается.
Субсилицид и субгерманид титана
Субсилицид титана — Ti5Si3 (мол. вес 323,76) образуется в си-
стеме Ti — Si, а также при действии паров тетрахлорида титана на
раскаленный аморфный кремний:
5Т1С14 + 8Si = Ti5Si3 + 5SiCl4
Реакция обратима и идет заметно только при большом избытке
кремния и при условии отвода образующихся паров тетрахлорида
кремния. Субсилицид образуется также при восстановлении дву-
окиси титана кремнием или силидом .кальция при высокой темпе-
ратуре. Теплота образования субсилицида титана составляет
138,6 ккал/моль.
Субсилицид титана представляет собой очень твердую кристал-
лическую массу стального цвета. Кристаллизуется в гексагональ-
ной сингонии (16 атомов в элементарной ячейке, a = 741, с =
= 515 щи). Плотность при 20°С равна 4,18 г/см3. Твердость по
шкале Мооса 5. Температура плавления 2120° С. Зависимость теп-
лоемкости субсилицида титана от температуры в интервале от 25
до 900° С выражается уравнением: Ср = 58,22 + 0,00574 Т —
— 2 646 000/Р.
Химически субсилицид титана устойчив. На него не действуют
ни вода, ни кислоты (кроме плавиковой). Фтор реагирует с ним
на холоду, а остальные галогены —при температуре красного ка-
ления (бром и иод очень медленно) с образованием соответствую-
щих галидов титана и кремния.
Субгерманид титана — Ti5Ge3 (мол. вес 457,27) образуется в си-
стеме Ti — Ge, а также при восстановлении диоксида или тетрахло-
рида титана порошкообразным германием при высокой темпера-
туре. Субгерманид титана представляет собой кристаллическую
массу стального цвета. Кристаллизуется в гексагональной синго-
нии (16 атомов в элементарной ячейке, а = 754, с = 522 пм)\ изо-
морфен субсилициду титана. Химически устойчив. Вода и разбав-
ленные кислоты на него не действуют. Разлагается лишь смесью
HNO3 + HF и царской водкой,
184
Моносилицид и моногёрмайид титана
Моносилицид титана — TiSi (мол. вес 75,985) образуется в си-
стеме Ti — Si. Практически в этой системе он может быть получен
путем непосредственного сплавления эквивалентных количеств эле-
ментарных титана и кремния. Теплота образования моносилицида
титана равна 31,0 ккал]моль.
Моносилицид кристаллизуется в ромбической сингонии (8 ато-
мов в элементарной ячейке, а — 361,1, b = 496,0, с = 649,7 пм).
Плотность при 25° С равна 4,12 г/см3. При 1760°С плавится с раз-
ложением, выделяя твердый субсилицид титана. Зависимость теп-
лоемкости от температуры в интервале от 25 до 1100° С выра-
жается уравнением: Ср = 15,43 — 833 000/Г.
По химическим свойствам моносилицид титана напоминает суб-
силицид.
Моногерманид титана —TiGe (мол. вес 120,49) образуется в си-
стеме Ti — Ge. Кристаллизуется в ромбической сингонии (8 ато-
мов в элементарной ячейке, а = 380,9, b = 523,5, с = 683,4 пм).
Дисилицид и дигерманид титана
Дисилицид титана — TiSi2 (мол. вес 104,07) образуется в си-
стеме Ti — Si, а также при восстановлении двуокиси титана эле-
ментарным кремнием или силицидом кальция при высокой темпе-
ратуре. Дисилицид титана образуется также при электролизе
10%-ного раствора двуокиси титана в расплавленном гексафторо-
силикате калия. Образование дисилицида титана происходит при
алюмотермических реакциях в смесях двуокиси титана или гекса-
фторотитаната калия с двуокисью кремния и алюминием. Теплота
образования дисилицида титана 32,2 ккал]моль.
Дисилицид титана представляет собой очень твердые железно-
серые кристаллы ромбической сингонии (12 атомов в элементарной
ячейке, а = 362, b — 1376, с = 360 пм). Плотность при 25°С равна
3,97 г]см3. Температура плавления 1540°С. Зависимость теплоем-
кости от температуры в интервале от 25 до 900° С подчиняется
уравнению: Ср = 14,94 -|- 0,00832 Т — 455000/7’2. Дисилицид титана
(как и другие силиды титана) проводит электрический ток; удель-
ная электропроводность составляет 0,81 Мсим]м.
Дисилицид химически очень устойчив: на него не действуют ни
вода, ни кислоты (соляная, хлорная, серная, азотная), ни растворы
щелочей. Он разлагается лишь фтором, хлором (при высокой тем-
пературе), плавиковой кислотой (50%-ной), расплавленными ед-
кими щелочами и бурой.
Дигерманид титана —TiGe2 (мол. вес 193,08) образуется в си-
стеме Ti—Ge, а также при восстановлении двуокиси титана
германием и при алюмотермических реакциях в смесях двуокиси
титана или гексафторотитаната калия с двуокисью германия и
185
Алюминием. Дигерманид титана представляет собой железно-серые
кристаллы ромбической сингонии (24 атома в элементарной ячей-
ке, а = 857,7, b = 502,5, с = 884,6 пм). Химически устойчив: на него
не действуют ни вода ни кислоты, ни щелочи.
БОРИДЫ ТИТАНА 20 122’ 137-139
Система Ti — В. Титан при сильном нагревании взаимодей-
ствует с элементарным бором, образуя очень твердые сплавы. На
рис. 22 представлена диа-
Рис. 22. Диаграмма состояния системы
Ti—В.
грамма состояния системы
Ti—В в области содержа-
ния бора до 72 атомн.%, т. е.
на участке Ti—Ti2B5. В си-
стеме образуются четыре со-
единения: Ti2B, TiB, TiB2 и
Ti2B5. Первой стадией бори-
рования титана является
внедрение бора в виде TiB
в решетку металла. При-
сутствие TiB в твердом рас-
творе заметно не влияет на
температуру полиморфного
превращения a-Ti^|3-Ti.
Растворимость бора в а- и
|3-титане весьма ограничена
(при 700—1300°С состав-
ляет менее 0,25 атомн.% и
только при 1650° С дости-
гает 0,5 атомн.%).
Единственная эвтектиче-
ская точка соответствует
16 атомн.% В и 1650° С. При
этой температуре из жид-
кого расплава кристаллизуй
ются две твердые фазы: на
основе |3-титана и на основе
моноборида (TiB). Область
гомогенности фазы на осно-
ве моноборида очень узка.
При 2060° С происходит
перитектоидное превращение
этой фазы:
ЗТ1В = Ti2B + TiB2
На кривой ликвидуса перитектическая точка (TiB + Ti2B) соответ-
ствует 20 атомн.% В и 1800° С, а перитектическая точка (Ti2B +
.+TiB2)—32 атомн.% В и 2200° С. Таким образом, твердая фаза
на основе гемиборида титана (Ti2B) существует только в интер-
186
вале температур 1800—2200° С. Область гомогенности этой фазы
очень узка. Фаза на основе диборида титана (TiB2) имеет область
гомогенности, соответствующую содержанию бора от 65,5 до 69,5
атомн.%. При 2790°С диборид инконгруэнтно плавится, выделяя
твердый гемипентаборид — Ti2B5.
Моноборид титана —TiB (мол. вес 58,71) образуется в си-
стеме Ti—В и практически может быть получен при нагревании
смеси эквивалентных количеств элементарных титана и бора в элек-
трической печи. Теплота образования TiB 38,3 ккал/моль; энергия
Гиббса образования 38,17 ккал/моль.
'* Моноборид титана кристаллизуется в кубической сингонии (гра-
нецентрированная решетка, 8 атомов в элементарной ячейке, а =
= 426 пм). Плотность при 25°С равна 5,09 г/смг. Энтропия при
, 25° С составляет 8,3 кал/(град • моль). Теплоемкость при 25° С
1 7,092 кал/ (град • моль). При 2060° С полиморфно превращается,
разлагаясь на гемиборид и диборид титана. Проводит электриче-
ский ток; удельная электропроводность составляет 2,5 Мсим/м.
Диборид титана — TiB2 (мол. вес 69,52) образуется в системе
Ti—В, а также при электролизе расплава, содержащего оксиды
титана и бора. Образование кристаллического диборида титана
' происходит также при взаимодействии газообразных хлоридов ти-
тана и бора с водородом при температурах от 1000 до 1400° С по
уравнению:
TiCl4 + 2ВС13 + 5Н2 = TiB2 + 10НС1
Для осуществления этой реакции смесь паров чистых хлоридов ти-
тана и бора с очищенным электролитическим водородом пропус-
кают в кварцевом реакторе над индукционно нагреваемым стерж-
нем из борированного графита, на котором и растут кристаллы
’ диборида титана в форме дендритов. Теплота-образования дибо-
. рида титана при 25° С равна 66,8 ккал/моль. Энергия Гиббса обра-
• зования Т1В2 составляет 65,81 ккал/моль.
Диборид титана представляет собой очень твердые металлопо-
добные кристаллы гексагональной сингонии (3 атома в элементар-
ной ячейке, а = 303, с = 322 пм). Плотность при 25° С равна
4,45 г/см3. Температура плавления 2790° С. Твердость по шкале
Мооса 9,5. Удельная теплоемкость при 25° С 0,1522, а в интервале
от 300 до 700° С изменяется в пределах от0,233 до 0,253 кал/(град • г).
Зависимость мольной теплоемкости от температуры в интервале от
25 до 700° С выражается уравнением: Ср = 14,913 + 0,00374Т —
— 484000/74
Энтальпия диборида титана при 25° С составляет 1333 кал/моль;
зависимость энтальпии от температуры в интервале от 290 до
1000° К выражается уравнением: Н°т — Н°о = 14,9137’ + O.OOIS??2 +
+ 484 000/7’ —4910.
Энтропия TiB2 при 25° С равна 6,808 кал/ (град • моль). Приве-
денная энергия Гиббса TiB2 при 25° С равна —2,34 калЦград моль).
187
Теплопроводность диборида титана (образец с пористостью
15%) при 2009С составляет 6,24 калЦм > сек • град). Удельная
электропроводность 3,5 Мсим/м. При температуре ниже 1,25° К
диборид становится сверхпроводником.
Химически диборид титана устойчив. Вода, соляная и плавико-
вая кислоты на него не действуют, а серная кислота действует
лишь при нагревании. Растворим в смесях азотной кислоты с пе-
рекисью водорода или с серной кислотой. Легко разлагается рас-
плавленными фторидами, гидроксидами, пероксидами, карбона-
тами щелочных металлов. Устойчивость прсгив окисления кислоро-
дом объясняется образованием на поверхности диборида титана
стеклообразной оксидной, вернее боратной, пленки.
Гемипентаборид титана — Ti2B3 (мол. вес 149,855) образуется
в системе Ti—В. Кристаллизуется в гексагональной сингонии (а =
= 298, с= 1398 пм). Плавится при 2920° С. По химическим свой-
ствам напоминает диборид титана.
Имеются сообщения, что существует и додекаборид титана —
Т1В12, однако на диаграмме состояния системы Ti—В он не от-
мечен.
ГЛАВА VII
МЕТАЛЛИЧЕСКИЕ СПЛАВЫ ТИТАНА
Все металлы по отношению к титану (см. также гл. II) разде-
ляются на три группы: 1) не образующие с титаном ни соединений,
ни твердых растворов; 2) не образующие с титаном соединений, но
образующие непрерывные ряды твердых растворов и 3) образую-
щие с титаном соединения интерметаллидного характера и ограни-
ченные твердые растворы. Соответственно могут быть классифици-
рованы двойные системы титана с различными металлами. Если за
основу классификации двойных систем титан — металл взять диа-
граммы кристаллизации из расплава, то можно выделить следую-
щие типы.
1. Системы без образования с о е д и н е н и й и т в е р-
дых растворов (впрочем, возможно образование твердых
растворов лишь с незначительными концентрациями одного из
компонентов). Кривые кристаллизации титана могут не быть не-
прерывными; на них могут быть изломы, соответствующие точке
перехода p-Ti a-Ti.
2. Системы с кристаллизацией непрерывного
ряда твердых растворов. Очевидно, что из расплавов кри-
сталлизуются твердые растворы р-титана, а при более низких тем-
пературах, когда происходит переход p-Ti -*• a-Ti, непрерывность
ряда твердых растворов может нарушаться, и в отдельных случаях
могут даже возникать соединения a-титана с другими металлами.
3. Системы эвтектического типа с образованием
ограниченных твердых растворов или конгруэнтно плавящихся ин-
терметаллических соединений, ограниченно растворимых в р-титане.
4. Системы перитектического типа с образованием
ограниченных твердых растворов или инконгруэнтно плавящихся
интерметаллических соединений, ограниченно растворимых в р-ти-
тане.
На диаграммах кристаллизации систем последних трех типов
при температурах ниже температуры кристаллизации наблюдается
переход p-Ti a-Ti.
Из перечисленных систем титан — металлы системы первого
типа не представляют интереса, поскольку в них не происходит
189
образования однородных металлических сплавов титана с широким
диапазоном составов. В .этой главе рассматриваются системы вто-
рого, третьего и четвёртого типов, а также некоторые тройные
системы, содержащие титан. Не рассмотрены некоторые системы
титан — металл, о диаграммах состояния которых нет достаточно
полных данных.
ДВОЙНЫЕ СИСТЕМЫ, ДАЮЩИЕ НЕПРЕРЫВНЫЕ ТВЕРДЫЕ
РАСТВОРЫ |9’20 •33' 122' '«-lie
Системы этого типа титан образует с металлами, являющимися
ближайшими его соседями и аналогами по периодической систе-
ме,— скандием, цирконием, гафнием, металлами групп ванадия и
хрома. В этих системах при кристаллизации из жидких расплавов
образуются непрерывные ряды твердых растворов р-титана. При-
рода систем в областях более низких температур (областях пре-
вращения p-Ti—a-Ti) зависит от взаимоотношений между а-тита-
ном и другими металлическими компонентами, чем и обусловлена
форма диаграмм состояния.
Рис. 23. Диаграмма состояния системы
Ti—Zr.
Системы с неограниченной взаимной растворимостью
a-титана и металла
Системы этого типа титан образует с металлами, существую-
щими, подобно ему, в а- и p-форме со свойствами, аналогичными
а- и р-титану. Такими ме-
таллами являются аналоги
титана: цирконий и гафний.
Система Ti—Zr. Как ти-
тан, так и цирконий, суще-
ствуют в а- и p-форме, ана-
логичных по свойствам, в
частности, они имеют кри-
сталлические решетки соот-
ветственно одинаковых ти-
пов. В связи с этим а-титан
образует непрерывный ряд
твердых растворов с а-цир-
конием, а р-титан — непре-
рывный ряд твердых раство-
ров с р-цирконием.
На рис. 23 представлена
диаграмма состояния систе-
мы Ti—Zr. Верхние кривые
соответствуют кристаллизации и плавлению твердых растворов
р-титана с p-цирконием. Кривые ликвидуса и солидуса проходят
через минимум, соответствующий 32,5 атомн.% Zr и 1610° С. Ниж-
ние кривые соответствуют полиморфному a p-превращению
19Q
твердых растворов титана с цирконием. Кривые превращения про-
ходят через минимум, соответствующий 50 атомн.% Zr и 545° С.
В сплавах титана с цирконием при быстром охлаждении р-твер-
дого раствора (закаливание) происходит мартенситное превраще-
ние. В сплавах, содержащих циркония больше 10 атомн.%, после
закаливания фиксируется некоторое количество р-фазы.
Система Ti—Hf. Гафний также существует в а- и р-формах,
аналогичных по свойствам а- и р-титану. В частности, они. имеют
кристаллические решетки соответ-
ственно одинаковых типов. В связи
с этим а-титан образует непрерывный
ряд твердых растворов с а-гафнием,
а р-титан — непрерывный ряд твердых
растворов с р-гафнием.
Диаграмма состояния системы Ti—
Hf представлена на рис. 24. Кривые
ликвидуса и солидуса проходят через
минимум, соответствующий 15 атомн.%
Hf и 1660° С, а кривые полиморф-
ного превращения — через минимум,
соответствующий 18 атомн.% Hf и
770° С.
Системы с ограниченной
растворимостью
металла в а-титане
Системы этого типа титан образует
с металлами, по свойствам аналогич-
ными р-титану, но отличающимися от
а-титана. Такими металлами являют-
ся скандий, металлы подгруппы VB и
молибден.
Рис. 24. Диаграмма состояния
системы Ti—Hf.
Система Ti — Sc. Существующий также в двух модификациях
скандий только в p-форме имеет кристаллическую решетку, анало-
гичную решетке p-Ti. Поэтому р-титан и р-скандий неограниченно
растворимы друг в друге. Скандий повышает температуру поли-
морфного превращения титана. Растворимость а-скандия в а-ти-
тане при 875° С составляет 6,5 атомн.%, а титана в а-скандии — при
1050° С—1,35 атомн.%.
Система Ti — V. Ванадий имеет такую же кристаллическую ре-
шетку, как и р-титан, поэтому он неограниченно растворим в р-ти-
тане. Растворимость же ванадия в а-титане весьма мала.
Диаграмма состояния системы Ti—V представлена на рис. 25.
Кривые ликвидуса и солидуса проходят через минимум, соответ-
ствующий 28,7 атомн.% V и 1620°С.
Ванадий стабилизирует p-фазу и понижает температуру пере-
хода p-Ti -> a-Ti. При 650° С растворимость р-титана в ванадии
составляет 82,5 атомн.%, а ванадия в а-титане — всего 3,3 атомн.%.
191
Рис. 25. Диаграмма состояния системы Ti—V.
Содержание Nb , атомн. °/о
Рис. 26. Диаграмма состояния
системы Ti—Nb.
Рис. 27. Диаграмма состояния
системы Ti—Та.
В сплавах, содержащих ванадия больше 14 атомн.%, после зака-
ливания фиксируется (3-фаза.
Система Ti — Nb. Ниобий также неограниченно растворим
в (3-титане и весьма ограниченно — в а-титане.
Диаграмма состояния системы титан — ниобий представлена на
рис. 26. Кривые ликвидуса и солидуса равномерно поднимаются от
точки плавления титана до точки
плавления ниобия.
Ниобий также стабилизирует
p-фазу и понижает температуру
перехода P-Ti —> a-Ti. При 750° С
растворимость р-титана в ниобии
составляет 88,5 атомн.%, а нио-
бия в а-титане — около 1 атомн. %.
После закаливания p-фаза фик-
сируется в сплавах, содержащих
ниобия больше 24 атомн.%.
Система Ti — Та. Диаграмма
состояния системы Ti—Та пред-
ставлена на рис. 27. Кривые лик-
видуса и солидуса равномерно
поднимаются от точки плавления
титана до точки плавления тан-
тала. Тантал понижает темпера-
туру полиморфного превращения
титана так же, как, например,
ниобий. Растворимость р-титана
в тантале при 400°С составляет
52,7 атомн.%; растворимость тан-
тала в a-титане при 600°С соста-
вляет около 1 атомн.%.
Система Ti — Мо. Диаграмма состояния этой системы представ-
лена на рис. 28. П'о ходу кривых ликвидуса и солидуса она напо-
минает диаграмму состояния системы Ti—Nb.
Рис. 28. Диаграмма состояния
системы Ti—Мо.
Системы с образованием соединений с а-титаном
Некоторые металлы неограниченно растворимы в р-титане, а с
a-титаном образуют соединения, которые выделяются при эвтек-
тоидном распаде p-твердых растворов. Такими металлами являются
хром и уран.
Система Ti — Сг. На рис. 29 представлена диаграмма состояния
системы Ti—Сг. Хром образует с р-титаном непрерывный ряд твер-
дых растворов. Кривые ликвидуса и солидуса проходят через очень
пологий минимум, соответствующий содержанию хрома48атомн.%
и 1400° С. При охлаждении a-твердого раствора происходит пре-
вращение с образованием соединения TiCr2 в области с содержа-
нием хрома от 10 до 90 атомн.%. Кривая превращения проходит
7 Зак. 1128
193
Рис. 29. Диаграмма состояния системы Ti—Сг.
1100
Содержание U , атомн. %
Рис. 30. Диаграмма состояния системы Ti—U.
через максимум, соответствующий 66,7 атомн.% Сг и 1350°С. Хром
понижает температуру полиморфного превращения титана до 670° С.
Растворимость хрома (в виде TiCr2) в а-титане при этой темпера-
туре достигает 0,5 атомн.%, а при более низких температурах она
/ еще меньше. Эвтектоидная точка, которой соответствует равновесие
трех твердых фаз (0-, а- и TiCr2),соответствует 670° С и 10 атомн.%
. Сг. Область гомогенности фазы на основе TiCr2 простирается от 62
?• до 67 атомн.% Сг. Температуры фазовых превращений в системе
Ti—Сг приведены в Приложении 34.
- Система Ti — U. Диаграмма состояния этой системы представ-
лена на рис. 30. Уран существует в а-, 0- и у-форме. Последняя
аналогична по свойствам 0-титану, в частности имеет аналогии-
•л ную кристаллическую решетку. В связи с этим 0-титан образует
./ непрерывный ряд твердых растворов с у-ураном. Кривые ликви-
' дуса и солидуса равномерно спускаются от точки плавления титана
до точки плавления урана. При охлаждении.твердого раствора про-
? исходит образование соединения TiU2 в области, соответствующей
содержанию U от 28 до 93 атомн.%. Кривая превращения проходит
' через максимум, лежащий при 66,7 атомн.% U и 898°С. Уран пони-
жает температуру полиморфного превращения титана до 620°С.
ДВОЙНЫЕ СИСТЕМЫ С ОБРАЗОВАНИЕМ СОЕДИНЕНИЙ,
, ОГРАНИЧЕННО РАСТВОРИМЫХ В 0-ТИТАНЕ 19 2°’33 122 14°-145’ 147~149
Системы этого типа титан дает с переходными металлами, уда-
; ленными от него в периодической системе, металлами групп цинка,
!. галлия и германия. В этих системах при кристаллизации из жид-
ких расплавов образуются интерметаллические соединения, огра-
: ниченно растворимые друг в друге, в 0-титане и во втором метал-
; лическом компоненте. Природа систем в областях температур,
• близких к температуре превращения 0-Ti в a-Ti, зависит от отно-
шения интерметаллических соединений к a-титану и ко второму
металлическому компоненту. Формы диаграмм кристаллизации
из расплава для этих систем могут быть различными, в зави-
симости от природы образующихся интерметаллических соедине-
ний. При образовании конгруэнтно плавящихся соединений диа-
граммы кристаллизации имеют эвтектический характер, при
йнконгруэнтно плавящихся — перитектический; могут быть также
диаграммы смешанного типа.
Системы эвтектического типа
Для этих систем характерны минимумы, соответствующие одно-
временной кристаллизации двух твердых фаз. С большинством ме-
таллов, в том числе переходных, титан образует системы именно
этого типа.
Система Ti — Мп. Диаграмма состояния этой системы представ-
лена на рис. 31. Линии ликвидуса и солидуса проходят через две
7*
195
эвтектические точки, соответствующие: первая — 39,3 атомн.% Мп
и 1175°С и вторая — 81,5 атомн.% Мп и 1185°С. Между этими
эвтектическими точками кривая ликвидуса проходит через пери-
тектическую точку, соответствующую 42 атомн.% Мп и 1200° С, и
дистектический максимум, соответствующий 66,7 атомн.% Мп, т. е.
соединению TiMn2, и 1330° С. Следовательно, в системе образуется
два соединения: TiMn, плавящееся инконгруэнтно, и TiMn2, плавя-
щееся конгруэнтно. Марганец понижает температуру полиморфного
превращения титана до 550°С при содержании 18 атомн.% (эвтек-
тоидная точка). Растворимость марганца (в виде TiMn) в а-титане
Рис. 31. Диаграмма состояния системы Ti—Мп.
при эвтектоидной температуре составляет всего 0,4 атомн.%. В р-
титане растворимость марганца достигает максимального значения
(30 атомн.%) при эвтектической температуре 1175°С. Температуры
фазовых превращений в системе Ti—Мп приведены в Приложе-
нии 35.
Система Ti — Fe. Диаграмма состояния этой системы представ-
лена на рис. 32. Линии ликвидуса и солидуса проходят через три
эвтектические точки, соответствующие: первая — 28,5 атомн.% Fe и
1100° С; вторая — 57,5 атомн. % Fe и 1280° С и третья — 78,5 атомн. %'
Fe и 1298° С. Между этими эвтектическими точками кривая ликви-
дуса проходит через два дистектических максимума, соответствую-
щих: первый — 50 атомн.% Fe, т. е. соединению TiFe2, и 1500° С и
второй 66,7 атомн.% Fe, т. е. соединению TiFe2, и 1480° С. Кроме
этих двух конгруэнтно плавящихся соединений в системе в резуль-
196
тате перитектоидного превращения при 1000° С образуется еще
соединение, содержащее железа 33,3 атомн.%, т. е. Ti2Fe; перитек-
тоидная линия начинается в точке, соответствующей 19 атомн.%
Fe. Железо понижает температуру полиморфного превращения ти-
тана до 595°С при содержании 12,3 атомн.% (эвтектоидная точка).
Растворимость железа в а-титане при эвтектоидной температуре
составляет всего 0,25 атомн.%; в |3-титане растворимость железа)
достигает максимального значения (22 атомн.%) при эвтектической
температуре 1100° С. Предельная растворимость титана в железе
Рис. 32. Диаграмма состояния системы Ti—Fe.
при эвтектической температуре 1298° С составляет 16 атомн.%.
Температуры фазовых превращений в системе Ti—Fe приведены
в Приложении 36.
Система Ti — Со. Диаграмма состояния этой системы представ-
лена на рис. 33. Линии ликвидуса и солидуса проходят через три
эвтектические точки, соответствующие: первая — 23 атомн.% Со и,
1020° С; вторая — 66,5 атомн.% Со и 1250° С и третья — 78 атомн.%
Со и 1135° С. Между этими эвтектическими точками кривая ликви-
дуса проходит через перитектическую точку, соответствующую
27 атомн.% Со и 1055°С, и два дистектических максимума, соот-
ветствующих: первый — 50 атомн.% Со, т. е. соединению TiCo, и
1450° С и второй — 66,7 атомн.% Со, т. е. соединению TiCo2, и
1255° С. Следовательно, в системе образуется три соединения: Ti2Co,
плавящееся инконгруэнтно,. и TiCo и TiCo2, плавящиеся конгруэнтно.
Ш7.
Кобальт понижает температуру полиморфного превращения титана
до 685° С при содержании 8 атомн.% (эвтектоидная точка). Раство-
римость кобальта (в виде Ti2Co) в а-титане при эвтектоидной тем-
пературе составляет всего 0,8 атомн.%; в р-титане растворимость
кобальта достигает максимального значения (14,5 атомн.%) при
эвтектической температуре 1020° С. Максимальная растворимость
титана в кобальте при 1135°С составляет 13 атомн.%.
Рис. 33. Диаграмма состояния системы Ti—Со.
Система Ti — Ni. Диаграмма состояния этой системы представ-
лена на рис. 34. Линии ликвидуса и солидуса проходят через три
эвтектические точки, соответствующие: первая—24 атомн.% Ni и
955° С; вторая —60 атомн.% Ni и 1110° С и третья —81 атомн.% Ni
и 1287° С. Между этими эвтектическими точками кривая ликвидуса
проходит через перитектическую точку, соответствующую 33 атомн.%
Ni и 1015° С, и два дистектических максимума, соответствующих:
первый — 50 атомн.% Ni, т. е. соединению TiNi, и 1240°С и вто-
рой— 75 атомн.% Ni, т. е. соединению TiNi3, и 1378° С. Следова-
тельно, в системе образуется три соединения: Ti2Ni, плавящееся
инконгруэнтно, и TiNi и TiNi3, плавящиеся конгруэнтно. Никель по-
нижает температуру полиморфного превращения титана до 770° С
при содержании 4 атомн.% (эвтектоидная точка). Растворимость
никеля (в виде Ti2Ni) в а-титане при эвтектоидной температуре
составляет не больше 0,1 атомн.%; в р-титане растворимость ни-
келя достигает максимального значения (11 атомн.%) при эвтек-
тической температуре 955° С.
198
Рис. 34. Диаграмма состояния системы Ti—Ni.
Содержание Си , атпомн. %
Рис. 35. Диаграмма состояния системы Ti—Си.
Система Ti — Си. Диаграмма состояния этой системы представ-
лена на рис. 35. Кривая ликвидуса последовательно проходит через
три перитектические точки, соответствующие: первая — 35 атомн.°/о
Си и 990° С; вторая — 60 атомн. % Си и 920° С и третья —68 атомн. %
Си и 875° С; через две эвтектические точки, соответствующие
43 атомн.% Си и 955° С и 66 атомн.% Си и 850° С; дистектический
максимум, соответствующий 50 атомн.%) Си, т. е. соединению TiCu,
и 1000° С. Следовательно, в системе образуется соединение TiCu,
плавящееся конгруэнтно, и три соединения — Ti2Cu, Ti2Cu3 и TiCu3,
плавящиеся инконгруэнтно.
.Медь понижает температуру
полиморфного превращения ти-
тана до 798° С при содержании
5,5 атомн.%, (эвтектоидная точ-
ка). Растворимость меди (в ви-
де Ti2Cu) в а-титане при эвтек-
тоидной температуре состав-
ляет 1,6 атомн. %); в р-титане
растворимость меди дости-
гает максимального значения
(13,4 атомн.%)) при эвтектиче-
ской температуре 990° С. Тем-
пературы фазовых превраще-
ний в системе Ti—Си приведе-
ны в Приложении 37.
Система Ti — Ag. Диаграм-
ма состояния этой системы
представлена на рис. 36. Кри-
вая ликвидуса проходит через
перитектическую точку, соот-
ветствующую 80 атомн.% Ag
и 1045° С. и эвтектическую
Рис. 36. Диаграмма состояния
системы Ti—Ag.
точку, соответствующую 92 атомн.% Ag и 890°С. В системе обра-
зуется инконгруэнтно плавящееся соединение TiAg. Серебро пони-
жает температуру полиморфного превращения титана до 860° С
при содержании 12 атомн.% (эвтектоидная точка). Растворимость
серебра (в виде (TiAg) в сс-титане при эвтектоидной температуре
составляет 6 атомн.%; в р-титане растворимость серебра достигает
максимального значения (33,5 атомн. %) при перитектической тем-
пературе 1045° С.
Система Ti — Pt. Диаграмма состояния этой системы представ-
лена на рис. 37. Линия ликвидуса и солидуса проходит через три
эвтектические точки, соответствующие: первая—15,5 атомн.% Pt
и 1310° С; вторая — 34,5 атомн.% Pt и 1320° С и третья — 58 атомн.%)
Pt и 1780° С. Вслед за каждой эвтектической точкой кривая ликви-
дуса проходит через дистектические максимумы, соответствующие:
первый — 25 атомн.%) Pt, т. е. соединению Ti3Pt, и 1370° С; второй—>
50 атомн.% Pt, т. е. соединению TiPt, и 1830° С и третий —
200
75 атомн.% Pt, т. е. соединению TiPt3, и 1950° С, и, наконец, через
перитектическую точку, соответствующую 82,5 атомн. % Pt и 1800° С.
Следовательно, в системе образуются три конгруэнтно плавящихся
соединения. Платина понижает температуру полиморфного превра-
щения титана до 840° С при содержании 3,2 атомн.% (эвтектоидная
точка). Растворимость платины (в виде Ti3Pt) в а-титане при эв-
тектоидной температуре составляет около 0,5 атомн. % 5 в р-титане
растворимость платины достигает максимального значения
(9,5 атомн.%) при эвтектической температуре 1310°С.
Рис. 37. Диаграмма состояния системы Ti—Pt.
Система Ti — Au. Диаграмма состояния этой системы представ-
лена на рис. 38. Линии ликвидуса и солидуса проходят через три
эвтектические точки, соответствующие: первая — 21 атомн.% Au и
1367° С; вторая — 33 атомн.% Au и 1310° С и третья — 60 атомн.%
Au и 1385° С. Вслед за каждой эвтектической точкой кривая ликви-
дуса проходит через дистектические максимумы, соответствующие:
первый — 25 атомн.% Au, т. е. соединению Ti3Au, и 1392° С; вто-
рой— 50 атомн.% Au, т. е. соединению TiAu, и 1490° С и третий —
66,7 атомн.% Au, т. е. соединению TiAu2, и 1455° С, и, наконец, че-
рез две перитектические точки, соответствующие: первая — 83,3
атомн.% Au и 1190° С и вторая — 89,5 атомн.% Au и 1115° С. Зо-
лото понижает температуру полиморфного превращения титана до
832,5° С при содержании 4,4 атомн.% (эвтектоидная точка). Рас-
творимость золота (в виде Ti3Au) в а-титане при эвтектоидной тем-
пературе составляет 1,7 атомн.%; в р-титане растворимость золота
достигает максимального значения (15 атомн.%) при эвтектической
301
температуре 1367° С. В системе, таким образом, имеются три
соединения — TiaAu, TiAu и TiAu2, плавящиеся конгруэнтно, и сое-
динение TiAtig, плавящееся инконгруэнтно.
Рис, 38. Диаграмма состояния системы Ti—Au.
Системы перитектического типа
Для этих систем характерны промежуточные положения точек,
соответствующих одновременной кристаллизации двух твердых фаз.
Система Ti — Al. Диаграмма состояния этой системы представ-
лена на рис. 39. Она отличается от рассмотренных ранее тем, что
алюминий повышает температуру полиморфного превращения ти-
тана до 1240°С при содержании 42 атомн.%. Кривая ликвидуса
проходит через три перитектические точки, соответствующие: пер-
вая— 52,8 атомн.% А1 и 1460°С; вторая — 76 атомн.% А1и 1340°С
и третья — 99,9 атомн.% А1 и 665°С. В системе имеются два соеди-
нения AlTi и Al3Ti, инконгруэнтно плавящиеся при соответствую-
щих перитектических температурах. Соединение AlTi образует до-
вольно широкую область гомогенности (у-фаза). Растворимость
алюминия (в виде AlTi) в а-титане при перитектоидной темпера-
туре (1240° С) составляет 42 атомн.%; в р-титане при перитектиче-
ской температуре (1460° С) растворимость алюминия еще больше
(48 атомн.%). Растворимость титана (в виде Al3Ti) в алюминии,
наоборот, невелика: при перитектической температуре (665° С) она
составляет 0,15 атомн.%.
Система Ti — Pb. Диаграмма состояния этой системы представ-
лена на рис. 40. Свинец, в отличие от алюминия, понижает, хотя и
незначительно, температуру полиморфного превращения титана (до
725°С при содержании 4,2 атомн.%). Кривая ликвидуса проходит
через перитектическую точку, соответствующую 21 атомн.% РЬ
и 1305° С, через эвтектическую точку, соответствующую
202
28 атомн.% Pb и 1230е С, и затем через дистектический максимум,
соответствующий 33,3 атомн.% РЬ, т. е. соединению Ti2Pb, и 1260° С.
Дальнейший ход кривой ликвидуса осложняется тем, что в системе
при содержании свинца больше 35 атомн.% наблюдается расслое-
ние в жидком состоянии. Твердый раствор на основе р-титана под-
вергается эвтектоидному распаду при температуре 725° С
(7,5 атомн.% РЬ). Наибольшая растворимость свинца (ввиде^РЬ)
в а-титане при эвтектоидной температуре составляет 4,2 атомн.%.
С понижением температуры растворимость свинца в а-титане зна-
чительно уменьшается и при 600° С составляет приблизительно
Рис. 39. Диаграмма состояния системы Ti—Al.
0,7 атомн.%. Наибольшая растворимость свинца (в виде Ti4Pb)
в р-титане при перитектической температуре (1305° С) составляет
16 атомн. %; с понижением температуры она уменьшается и при
725° С (эвтектоидная температура) достигает 7,5 атомн.%.
Система Ti — Re. Кривая ликвидуса для этой системы проходит
через две перитектические точки. Растворимость рения (в виде сое-
динения Ti5Re24) в р-титане очень велика (около 50 атомн.%), а в
а-титане, наоборот, очень мала (около 0,1 атомн.%).
Система Ti—W. В рамки примененной здесь классификации
система Ti—W не укладывается. В ней не образуются соединения,
но из расплава кристаллизуются не непрерывные, а ограниченные
твердые растворы (рис. 41). Кривая ликвидуса проходит через од-
ну перитектическую точку, соответствующую содержанию вольф-
рама, равному 8 атомн.%, и 1880°С. Твердый раствор на основе
203
Р-титана подвергается эвтектоидному распаду при температуре
715° С (9 атомн.% W). Наибольшая растворимость вольфрама в р-
Содержание РЬ , отомн. % Содержание W, атомн. %
Рис. 40. Диаграмма состояния Рис. 41. Диаграмма состояния системы
системы Ti—Pb. Ti—W.
при 715° С. Наибольшая растворимость титана в вольфраме соста-
вляет 25 атомн.% при перитектической температуре.
ТРОЙНЫЕ И БОЛЕЕ СЛОЖНЫЕ СИСТЕМЫ
системы, содержащие непрерывные твердые растворы
Здесь рассматриваются металлические системы, в которых при
кристаллизации из жидких расплавов р-титан образует непрерыв-
ные твердые растворы хотя бы с одним из двух других металличе-
ских компонентов.
Системы с кристаллизацией непрерывных твердых растворов
р-титана с двумя металлическими компонентами. Примерами та-
ких систем являются системы: Ti—Zr—Hf, Ti—Zr—V, Ti—Zr—Nb,
Ti—V—Nb, Ti—V—Mo, Ti—Nb—Mo, Ti—Mo—Сг и др. Однако не
во всех таких системах сохраняется непрерывность кристаллизую-
щихся твердых растворов во всем диапазоне составов тройной системы.
На рис. 42 представлена проекция диаграммы состояния на концентрацион-
ный (вес. %) треугольник системы Ti—Zr—Nb, а на рис. 43 — системы
Ti—V—Nb. На проекциях видна непрерывность поверхностей кристаллизации, а,
204
Рис. 42. Проекция диаграммы состояния системы Ti—Zr—Nb.
Ti
Содержание Nb , %
Рис. 43. Проекция диаграммы состояния системы Ti—V—Nb.
Рис. 44. Изотермические сечения диаграммы со-
стояния системы Ti—Zr—V:
а - при 750 °C, б — при 20 °C.
следовательно, и однофазность образующихся кристаллов в обеих тройных си-
стемах.
Природа подобных систем в более низкотемпературных областях (областях
превращения p-Ti -> a-Ti) зависит от отношения a-титана к другим металличе-
ским компонентам. От этого зависит и форма диаграмм состояния в соответ-
ствующей температурной области. Из тройных систем, в которых при соответ-
ствующих температурах происходит превращение непрерывных твердых растворов
Р в непрерывные твердые растворы а, можно указать лишь систему Т1—Zr—Hf,
в которой наблюдается неограниченная растворимость как a-титана в а-цирконии
и а-гафнии, так и a-циркония в а-гафнии. В других указанных системах с пони-
жением температуры происходит распад твердых растворов с нарушением их
непрерывности. Появление фазовых границ и многофазных областей в системе
Ti—Zr—V при понижении температуры видно на рис. 44, где представлены изо-
термические сечения диаграммы состояния системы при 750 и 20° С.
Системы с кристаллизацией непрерывных твердых растворов
р-титана с одним из металлических компонентов. Примерами таких
систем являются системы: Ti—V—Fe, Ti—V—Al, Ti—Mo—Mn,
Ti—Mo—Al, Ti—Cr—Fe, Ti—Cr—Al и др.
Рис. 45. Изотермическое сечение диаграммы состояния
системы Ti—V—Fe при 20 °C.
Совершенно естественно, что во всех таких системах непрерыв-
ность кристаллизующихся твердых растворов наблюдается лишь
в отдельных областях тройных систем, границы которых опреде-
ляются отношением металлических компонентов (кроме титана).
Изотермическое сечение диаграммы состояния системы Ti—V—Fe
при 20° С показано на рис. 45.
Представляют интерес также тройные системы, содержащие один неметалли-
ческий компонент, например системы Ti—Zr—В, Ti—Hf—С, Ti—Та—С, Ti—Cr—С,
Ti—Mo—С и др. На рис. 46 и 47 представлены изотермические сечения диа-
грамм состояния систем Ti—Та—С и Ti—Мо—С,
207
Содержание Та,отомн. %
Рис. 46. .Изотермическое сечение диаграммы состояния
системы Ti—Та—С при 1820°C.
С
Содержание МО атомн. °/о
Рис. 47. Изотермическое сечение диаграммы состояния
системы Ti—Мо—С при 1710 °C,
Ti
Рис. 48. Изотермическое сечение диаграммы состояния
системы Ti—А!—Fe при 1100 °C.
Ti
рис. 49. Изотермическое сечение диаграммы состояния си-
стемы Ti—Al—Мп при 700° С,
Системы, не содержащие непрерывных
твердых растворов
Здесь рассматриваются металлические системы, в которых при
кристаллизации из жидких расплавов р-титан не образует непрерыв-
ных твердых растворов ни с одним из металлических компонентов.
Системы эвтектического типа. Примером таких систем является
система Ti—Мп—Fe. В этой тройной системе, однако, происходит
образование непрерывных твердых растворов между соединением
TiFe2, образующимся в системе Ti—Fe, и соединением ПМпг, обра-
зующимся в системе Ti—Мп.
Системы перитектического и смешанного типа. Из таких систем
представляют интерес главным образом системы, содержащие алю-
миний. На рис. 48 и 49 представлены изотермические сечения диа-
грамм состояния систем Ti—Al—Fe и Ti—Al—Мп. Интересны
также тройные перитектические системы, содержащие, кроме алю-
миния, один неметаллический компонент, например системы
Ti—Al—С, Ti—Al—N, Ti—Al—О.
ИНТЕРМЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ
Из диаграмм состояния систем титан — металлы, рассмотрен-
ных в предыдущем разделе, видно, что в этих системах во многих
случаях образуются интерметаллические соединения, или интерме-
таллиды. Интерметаллиды титана являются соединениями, как
правило, сравнительно непрочными. С некоторыми металлами сое-
динения образует только а-титан, а р-титан образует с этими метал-
лами лишь твердые растворы. Тогда интерметаллические соедине-
ния титана с этими металлами существуют только при сравнительно
низких температурах и разлагаются при температуре полиморф-
ного превращения a-Ti p-Ti. Большинство интерметаллических
соединений титана полностью разлагаются при плавлении и лишь
очень немногие интерметаллиды остаются при плавлении частично
или даже полностью неразложившимися.
Двойные интерметаплиды 3’19’20’33, i43,150-156
Как уже отмечалось, титан не образует соединений со щелоч-
ными, щелочноземельными, редкоземельными металлами, метал-
лами подгрупп IVB и VB периодической системы. Он образует сое-
динения с металлами, расположенными в периодической системе
правее подгруппы VIB, т. е. с металлами сравнительно мало ак-
тивными. Ниже будут рассмотрены двойные интерметаллиды титана
с металлами в порядке расположения последних в периодической
системе, начиная с группы хрома.
Соединения с металлами групп хрома и марганца. Из металлов
этих групп титан образует соединения с хромом, ураном (условно
причисляемым к этой группе), марганцем и рением.
С хромом a-титан образует соединение состава TiCr2, суще-
ствующее в Двух полиморфных модификациях — низко- и высоко-
го
'Температурной: первой, устойчивой при t <_ 1300° С и кристалли-
зующейся в кубической сингонии (гранецентрированная решетка
типа MgCu2, 24 атома в элементарной ячейке, а = 692,9 мм), вто-
рой, устойчивой при t> 1000° С и кристаллизующейся в гексаго-
нальной сингонии (решетка типа MgZn2, 12 атомов в элементарной
ячейке, а = 492,2, с = 794,5 пм). Соединение TiCr2 обладает боль-
шой твердостью и хрупкостью, при 1350° С распадается, образуя
твердый раствор р-титана в хроме.
С ураном а-титан также образует соединение состава TiU2, кри-
сталлизующееся в гексагональной сингонии (решетка типа А1В2,
3 атома в элементарной ячейке, а = 481,7, с = 284,4 пм). При 898° С
оно распадается, образуя твердый раствор р-титана в у-уране.
С марганцем титан образует соединения состава TiMn, TiMn2 и
TiMn4. Соединение TiMn образуется как с а-титаном (при t <
< 550° С), так и с р-титаном (при t выше 550° С). Кристаллизуется
в тетрагональной сингонии (а = 888,0; с = 454,2 пм). При 1200° С
соединение инконгруэнтно плавится с выделением кристаллов сое-
динения TiMn2. Соединение состава TiMn2 является наиболее устой-
чивым соединением в системе Ti—Мп, образующим ограниченные
твердые растворы как с соединением TiMn, так и с марганцем
(6-фаза). Соединение TiMn2 кристаллизуется в гексагональной син-
гонии (решетка типа MgZn2, 12 атомов в элементарной ячейке; а =
= 482,5, с = 791,7 пм). При 1330°С TiMn2 конгруэнтно плавится
лишь с частичным разложением. Соединение TiMn4 образуется при
1160° С по перитектоидной реакции при переходе марганца из р-
в у-видоизменение.
С рением титан образует соединение состава Ti5Re24, кристал-
лизующееся в кубической сингонии (объемноцентрированная ре-
шетка, 58 атомов в элементарной ячейке; а = 9,54 пм). Это соеди-
нение отличается большой хрупкостью, микротвердость его около
20 Гн/м1. При 2750° С инконгруэнтно плавится с выделением кри-
сталлов рения.
Соединения с металлами семейства железо — медь. Титан обра-
зует устойчивые соединения со всеми металлами этого семейства:
железом, кобальтом, никелем и медью.
С железом образуются соединения состава Ti2Fe, TiFe, TiFe2 и
TiFe3. Из них устойчивыми являются лишь TiFe и TiFe2. Соеди-
нение TiFe (теплота образования 9,7 ккал/моль) кристаллизуется
в кубической сингонии (объемноцентрированная решетка типаСэС!,
2 атома в элементарной ячейке, а = 297,8 пм). При 1500° С Ti—Fe
конгруэнтно плавится, в основном не разлагаясь. Соединение TiFe2
кристаллизуется в гексагональной сингонии (решетка типа СС14
или MgZn2, 12 атомов в элементарной ячейке, а = 476,9 и с =
= 774,5 пм). Плотность 6,75 г/см3. При 1480° С Ti—Fe2 конгруэнтно
плавится с частичным разложением на TiFe и железо.
С кобальтом титан образует соединения состава Ti2Co, TiCo,
ТСо2 и TiCo3. Соединение Ti2Co кристаллизуется в кубической
сингонии (гранецентрированная решетка, 96 атомов в элементарной
211
ячейке, а = ИЗО пм). При 1055°С инконгруэнтно плавится с выде-
лением кристаллов соединения TiCo. Последнее соединение кри-
сталлизуется в кубической сингонии (объемноцентрированная ре-
шетка типа CsCl, 2 атома в элементарной ячейке, а = 299 пм).
Плотность 7,25 г/см3. При 1450° С конгруэнтно плавится с разло-
жением.
Соединение TiCo2 существует в двух кристаллических модифи-
кациях— 8 и ц; 8-TiCo2 кристаллизуется в кубической сингонии
(решетка типа MgCu2, 24 атома в элементарной ячейке, а = 673 пм),
a r]-TiCo2 — в гексагональной сингонии (решетка типа MgNi2,
24 атома в элементарной ячейке, а = 472 и с= 1539,2 пм). Плот-
ность 7,47 г/см3. При 1260° С TiCo2 конгруэнтно плавится с разло-
жением.
С никелем титан образует соединения состава Ti2Ni, TiNi и
TiNis- Соединение Ti2Ni кристаллизуется в кубической сингонии
(гранецентрированная решетка, 96 атомов в элементарной ячейке,
а = 11,29 пм). При 1015° С инконгруэнтно плавится с выделением
кристаллов соединения TiNi, которое кристаллизуется в кубиче-
ской сингонии (объемноцентрированная решетка типа CsCl, 2 ато-
ма в элементарной ячейке, а = 298,0 пм). При 1240° С конгруэнтно
плавится с разложением. Соединение TiNi3 кристаллизуется в гек-
сагональной сингонии (16 атомов в элементарной ячейке, а = 510 и
с = 830 пм). При 1378° С TiNi3 конгруэнтно плавится с частичным
разложением.
С медью титан образует соединения состава Ti2Cu, TiCu, Ti2Cu3
и TiCu3. Соединение Ti2Cu кристаллизуется в кубической сингонии
(гранецентрированная решетка, 96 атомов в элементарной ячейке,
а = 1124 пм). При 990° С Ti2Cu инконгруэнтно плавится с выделе-
нием кристаллов р-титана. Соединение TiCu кристаллизуется в тет-
рагональной сингонии; при 1000°С конгруэнтно плавится, почти
полностью разлагаясь на Ti и Си. Соединение Ti2Cu3 инконгруэнтно
плавится при 920° С, выделяя кристаллы TiCu. Соединение TiCu3
имеет деформированную ромбическую решетку; при 875° С инкон-
груэнтно плавится с выделением кристаллов а-меди.
Соединения с благородными металлами. С рутением титан
образует соединение состава TiRu, которое кристаллизуется в ку-
бической сингонии (решетка типа CsCl; а = 306 пм).
С палладием образуются соединения состава Ti2Pd (кубическая
сингония), Ti2Pd3, TiPd2 и TiPd3 (гексагональная сингония).
С серебром титан образует соединения состава Ti3Ag и TiAg.
Последнее кристаллизуется в тетрагональной сингонии (решетка
типа AuCu; а = 410,4 и с = 407,7 пм). При 1045° С TiAg инконгру-
энтно плавится, выделяя кристаллы р-титана.
С осмием титан образует соединение состава TiOs, которое
кристаллизуется в кубической сингонии (объемноцентрированная
решетка типа CsCl;cz = 307 пм).
С иридием образуются соединения состава Ti3Ir и Tilr.
212
С платиной титан образует соединения состава Ti3Pt, TiPt и
TiPt3. Соединение Ti3Pt кристаллизуется в кубической сингонии
(8 атомов в элементарной ячейке, а = 503 пм). При 1370° С кон-
груэнтно плавится с почти полным разложением на титан и соеди-
нение TiPt. Последнее кристаллизуется также в кубической синго-
нии (гранецентрированная решетка); при 1830° С конгруэнтно пла-
вится с частичным разложением на титан и соединение TiPt3,
которое кристаллизуется в кубической сингонии (гранецентриро-
ванная решетка типа AuCu3, 4 атома в элементарной ячейке, а =
= 390 пм). При 1950° С конгруэнтно плавится, почти не разлагаясь.
С золотом титан образует соединения состава Ti3Au, TiAu, TiAu2
и TiAue. Соединение Ti3Au кристаллизуется в кубической сингонии
(решетка типа А15, 8 атомов в элементарной ячейке, а = 509,6 пм).
При 1392° С Ti3Au конгруэнтно плавится с разложением на Ti и
соединение TiAu, которое конгруэнтно плавится при 1490° С почти
без разложения. Соединение TiAu2 кристаллизуется в гексагональ-
ной сингонии (деформированная решетка, а = 279 и с = 477 пм).
При 1455° С конгруэнтно плавится также в основном без разложе-
ния. Соединение TiAue кристаллизуется в тетрагональной сингонии
(гранецентрированная решетка; а = 407 и с = 394 пм). При 1115° С
инконгруэнтно плавится с выделением кристаллов TiAu2.
Соединения с металлами II группы. Из металлов этой группы
с титаном образуют соединения бериллий, цинк, кадмий и ртуть.
С бериллием образуются соединения состава TiBe, TiBe2, TiBe.j,
TiBeio и TiBei2. Структура монобериллида твердо не установлена;
плотность его при 25° С составляет 4,17 г/сж3; плавится он при тем-
пературе около 1500° С. Дибериллид титана — TiBe2-» легко обра-
зуется при выдерживании в течение часа при 1200° С брикетов из
порошкообразных титана и бериллия. Дибериллид кристаллизуется
в кубической сингонии (решетка типа MgCu2, а — 643,5 пм). Плот-
ность его при 25° С составляет 3,23 г/сж3; плавится при 1300° С.
Структуры тетрабериллида и декабериллида титана не установ-
лены, а додекабериллид кристаллизуется в гексагональной синго-
нии (624 атома в элементарной ячейке, а = 2944 и с = 733 пм).
С цинком титан образует соединения состава TiZn, TiZna, TiZn3,
TiZnio и TiZnis. Соединение TiZn кристаллизуется в кубической
сингонии (решетка типа CsCl, изоморфно с TiFe), TiZn2 кристалли-
зуется в гексагональной сингонии (а = 506,5, с = 821 пм), TiZn3 —
в кубической сингонии (4 атома в элементарной ячейке, а =
= 393,2 пм). Структуры соединений TiZnio и TiZni5 не установлены.
С кадмием образуется соединение состава Ti2Cd, а с ртутью —
соединения состава Ti3Hg и TiHg. Эти соединения образуются при
нагревании смеси порошкообразного титана с ртутью в вакуумиро-
ванных запаянных ампулах. Соединение Ti3Hg существует в двух
модификациях; первая устойчива до 760° С, кристаллизуется в ку-
бической сингонии (8 атомов в элементарной ячейке; а = 518,9 пм).
Соединение TiHg неустойчиво; на воздухе оно разлагается с выде-
лением жидкой ртути,
213
Соединения с металлами группы 1ПА. Из металлов этой груп-
пы с титаном соединяются алюминий, галлий и индий.
С алюминием образуются соединения состава AlTi и Al3Ti.
Первое (теплота образования 19,3 ккал/моль) кристаллизуется
в тетрагональной сингонии (гранецентрированная решетка, 4 атома
в элементарной ячейке, а = 410 и с = 406 пм), при 1460° С инкон-
груэнтно плавится с выделением кристаллов р-титана; второе
(Al3Ti) образуется в системе Ti—Al, а также при восстановлении
гексафторотитаната калия алюминием:
3K2T1F6 + 13А1 = 3 Al3Ti + 2K3A1F6 + 2A1F3
Теплота образования Al3Ti равна 35,3 ккал/моль. Это соединение
представляет собой серебристо-белые блестящие кристаллы тетра-
гональной сингонии (8 атомов в элементарной ячейке; а = 543 и
с = 558 пм). Плотность при 25° С равна 3,13 г/см3. При 1340°С ин-
конгруэнтно плавится с выделением кристаллов AlTi. Очень
хрупко; царапает сталь и стекло. С растворами сильных (не окис-
ляющих) кислот и щелочей реагирует с выделением водорода.
С хлором реагирует при нагревании с образованием тетрахлорида
титана и трихлорида алюминия.
С галлием титан образует соединения состава Ti3Ga, Ti2Ga,
TiGa, TiGa2 и TiGa3. Соединение Ti3Ga кристаллизуется в гексаго-
нальной сингонии (8 атомов в элементарной ячейке, а = 575 и с =
= 464,5 пм). При 1030°С распадается, образуя две твердые фазы:
на основе р-титана и на основе Ti2Ga. Соединение Ti2Ga кристалли-
зуется в гексагональной сингонии (решетка типа Ni2In, а = 451 и
с = 550 пм), при 1562°С конгруэнтно плавится с частичным разло-
жением; TiGa3 кристаллизуется в тетрагональной сингонии (а =
= 555,9 и с = 810,9 пм).
С индием титан образует соединение Ti3In, кристаллизующееся
в кубической'сингонии (а = 422 пм), и Tiln3.
Соединения с металлами подгруппы IVA. С титаном устойчи-
вые соединения образуют олово и свинец.
С оловом образуются соединения состава Ti3Sn, Ti2Sn, Ti5Sn3 и
TieSn5. Соединение Ti3Sn кристаллизуется в гексагональной синго-
нии (а = 591,6 и с = 476,4 пм), при 1663° С конгруэнтно плавится
с частичным разложением; Ti2Sn кристаллизуется также в гексаго-
нальной сингонии (а = 465,3 и с = 570 пм) и образует фазу пере-
менного состава с узкой областью гомогенности. Твердые растворы
на основе Ti2Sn плавятся в интервале температур 1500—1552°С
с выделением жидкости, более богатой оловом, чем твердая фаза,
а при 1552° С кристаллы твердого раствора переходят в кристаллы
соединения TisSn. Плотность Ti2Sn 6,57 г/см3. Соединение Ti5Sn3
кристаллизуется в гексагональной сингонии (16 атомов в элемен-
тарной ячейке, а = 804,9 и с = 545,4 пм), при 1500°С инконгруэнтно
плавится с выделением кристаллов Ti2Sn (точнее, твердого раство-
ра на его основе); Ti6Sns кристаллизуется в гексагональной синго-
нии (22 атома в элементарной ячейке; а = 922 и с = 569 пм), при
214
1494° С конгруэнтно плавится с частичным разложением. Плотность
TieSn5 равна 6,85 г1см3.
Со свинцом титан образует соединения состава Ti4Pb и Ti2Pb.
Соединение Ti4Pb кристаллизуется в гексагональной сингонии (п =
= 596,2 и с = 481,4 пм), при 1305° С инконгруэнтно плавится с вы-
делением кристаллов р-титана. Соединение Ti2Pb плавится конгру-
энтно при 1260° С с частичным разложением.
Тройные интерметаллиды 157
К интерметаллическим соединениям, образующимся в тройных
системах титан — металлы, близки соединения, содержащие в своем
составе один неметаллический элемент. Из таких соединений из-
вестны двойные, содержащие титан, субоксиды, т. е. соединения ти-
тана одновременно с другим металлом и кислородом. Из чисто
интерметаллических соединений известны тройные интерметаллиды
на основе Ti—Fe.
Тройные интерметаллиды, содержащие титан и железо. Из по-
добных интерметаллидов известны соединения с ванадием, хромом
и марганцем.
Соединение с ванадием образуется в системе TiFe—V и имеет
состав TiVFe с некоторой областью гомогенности, простирающейся
как в сторону титана, так и в сторону ванадия и железа. Соедине-
ние TiVFe кристаллизуется в гексагональной сингонии (а = 488 и
с = 796 плг), при 1390°С инконгруэнтно плавится с выделением
кристаллов р-ванадия. .
Соединение с хромом образуется в системе TiCr2—TiFe2 и имеет
состав TiCrFe с областью гомогенности, простирающейся в сторону
как TiCr2, так и в сторону TiFe2. Таким образом, при постоянном
атомном содержании титана содержания хрома и железа пере-
менны, и формулу соединения правильнее писать так: Ti(Cr, Fe)2.
Это соединение кристаллизуется в гексагональной сингонии.
Соединения с марганцем образуются в системе TiMn2—TiFe2 и
имеют переменный состав Ti(Mn, Fe)2. Соединения TiMn2 и TiFe2
неограниченно растворимы друг в друге, поэтому в системе между
ними образуется непрерывный ряд твердых растворов, кристалли-
зующихся в гексагональной сингонии.
Двойные субоксиды, содержащие титан. Из подобных субокси-
дов известны соединения циркония, хрома, марганца, железа, ко-
бальта и никеля.
Субоксиды титана-хрома. В'системе Ti3O — Cr образуется со-
единение ТцСгзО (s-фаза), кристаллы которого относятся к куби-
ческой сингонии (гранецентрированная решетка, 112 атомов в эле-
ментарной ячейке, а = ИЗО пм). Соединение устойчиво только при
температуре ниже 1300° С. Плотность 5,82 г/см3. В системе Ti3O—
—TiCr2—Cr образуется соединение Ti4Cr4O (ц-фаза), кристалли-
зующееся в тетрагональной сингонии (144 атома в элементарной
215
ячейке, а = 1314 и с = 1120 пм). Соединение устойчиво только при
температуре выше 1400° С.
Субоксиды титана-железа. В системе Т13О — TiFe2 образуется
соединение TiiFe2O, кристаллизующееся в кубической сингонии
(а = ИЗО пм). В системе Ti3O—Ti2Fe—TiFe образуется соединение
Т1бРе2О.
В системе Ti3O— TiCo2 образуется соединение Т14Со2О, а в си-
стеме Т13О—Ni — соединение!i3Ni3O. Известно также соединение
Ti4Ni2O, кристаллизующееся в кубической сингонии (гранецентри-
рованная решетка, а = 1130 пм).
ТЕХНИЧЕСКИЕ СПЛАВЫ ТИТАНА
Известны технические двойные сплавы титана с железом, алю-
минием, медью, хромом, марганцем, кобальтом, никелем, молибде-
ном, вольфрамом, ванадием, оловом и другими металлами. Добав-
ки различных металлов к титану, как уже было показано, по-раз-
ному влияют на температуру полиморфного превращения a-Ti-*
-> p-Ti. К металлам, стабилизирующим a-фазу, относится алюми-
ний. р-Фазу стабилизируют ванадий, ниобий, тантал, молибден. До-
бавка же таких металлов, как марганец, железо, никель, медь, по-
нижает температуру перехода a-Ti -> p-Ti, но сплавы титана с эти-
ми металлами при определенной, так называемой эвтектоидной
температуре, претерпевают превращения и при дальнейшем охлаж-
дении p-фаза полностью распадается, образуя a-фазу и промежу-
точную у-фазу, обогащенную легирующим металлом. Соответствен-
но этому титановые сплавы подразделяют на группы, а именно,
сплавы типа а, типа р и типа а-p. В этом разделе рассматриваются
только те сплавы титана, которые имеют большое значение в технике.
Титано-алюминиевые сплавы20' 158~162
Сплавы титана с алюминием, лишенные недостатков как чистого
титана, так и чистого алюминия, должны сыграть важную роль,
особенно в такой отрасли промышленности, потребляющей легкие
металлы, как самолетостроение.
Легирование титана алюминием. Как уже указывалось, до-
бавка алюминия повышает температуру превращения ос-Ti в p-Ti.
Из стабилизаторов a-фазы алюминий является единственной леги-
рующей добавкой, которая увеличивает прочность, но не умень-
шает резко пластичности и вязкости титанового сплава. Алюминий
значительно повышает и сопротивление титановых сплавов ползу-
чести, что обусловливает существенное повышение жаропрочности,
особенно в присутствии стабилизаторов p-фазы. Введение алюми-
ния в титановые сплавы повышает также их упругие характери-
стики, bl частности, модуль нормальной упругости, что важно, по-
скольку этим устраняется существенный недостаток титана.
21§
Введение алюминия в титановые сплавы улучшает не только их
механические свойства при различных температурах, но и значи-
тельно увеличивает их коррозионную стойкость и уменьшает взры-
воопасность при работе деталей из титановых сплавов в азотно-
кислотных средах.
В двойных сплавах на основе титана содержание алюминия до-
водят обычно только до 7%, так как более высокое содержание
алюминия вызывает горячеломкость сплавов выше 850° С.
Введение алюминия в сплавы титана с другими металлами
улучшает их свариваемость,
Легирование алюминия титаном. Добавление незначительного
количества титана к алюминию существенно улучшает механиче-
ские качества последнего; возрастает сопротивление разрыву и
увеличивается предел упругости. Наилучшими механическими свой-
ствами обладает алюминиевый сплав, содержащий 2% титана.
Сопротивление его разрыву увеличивается в три раза по сравнению
с сопротивлением алюминия, а эластичность приближается к эла-
стичности пружинной бронзы. Но этот сплав очень неустойчив
к действию кислорода воздуха. Электропроводность алюминия при
легировании его титаном уменьшается. Введение более 2% титана
повышает химическую стойкость алюминия; в частности, умень-
шается коррозия алюминия под напряжением. Титан улучшает
также свариваемость алюминия.
Сплавы АТ. Так обозначают обычно титано-алюминиевые спла-
вы, причем добавляемое к обозначению АТ число указывает содер-
жание алюминия в сплаве в процентах. Сплавы АТ, кроме алюми-
ния и титана, содержат кремний, а также хром, железо и иногда
другие металлы. Так, коррозионнрстойкие высокопрочные и жаро-
прочные сплавы на основе титана, разработанные в Институте ме-
таллургии им. Байкова и названные АТЗ, АТ4, АТ6 и АТ8, содер-
жат, соответственно, 3, 4, 6, 8 ± 0,5% алюминия; кроме того, каж-
дый из этих сплавов содержит 0,4—0,9% Сг, 0,25—0,6% Fe, 0,25—
0,6% Si и 0,01 % В. Значения различных свойств сплавов АТЗ, АТ4,
АТ6 и АТ8 приведены в Приложении 38. С увеличением содержа-
ния алюминия в сплавах АТ температуры плавления их несколько
снижаются, однако механические свойства значительно улучшают-
ся. Сплавы АТ сохраняют высокую прочность до 600° С. По мере
увеличения содержания алюминия температура разупрочнения
сплавов повышается. Чем больше алюминия в сплаве, тем выше
модуль нормальной упругости и тем менее заметно он снижается
при нагревании.
Титано-железные сплавы 20’158' 1вз—165
Ферротитан. Практическое значение в черной металлургии име-
ют сплавы титана с железом, или ферротитан, содержащие титана
не больше 23%. Таким образом, ферротитан представляет собой
твердый раствор TiFe2 в a-железе, или же двухфазную систему,
.217
Рис. 50. Диаграмма твердости
Ti — Fe сплавов.
творимости и малой плотности
содержащую, кроме указанного твердого раствора, кристаллы
TiFe2.
Присутствие титана (в виде TiFe2) в железных сплавах суще-
ственно повышает их твердость, так как твердость TiFe2 в шесть
раз больше твердости чистого железа. Зависимость твердости ти-
тано-железных сплавов от содержания титана приведена на
рис. 50. Резкое увеличение твердости сплава происходит при повы-
шении содержания титана до 7%; с дальнейшим повышением со-
держания титана твердость увеличивается уже не так заметно. Зна-
чения твердости (по Бринеллю)
титано-железных сплавов с раз-
личным содержанием титана при-
ведены в Приложении 39.
Наряду с ферротитаном в чер-
ной металлургии широко исполь-
зуют титано-железные сплавы, со-
держащие углерод (феррокарбо-
титан) и с кремнием (ферроси-
ликотитан). Первый содержит
74—75% Fe, 16-17% Ti и
7—9% С, второй — ~50% Fe,
30% Ti и 20% Si.
Облагораживающее действие
титана на обычную сталь. Титан
или ферротитан при прибавлении
к расплавленной стали легко
окисляются содержащимся в ней
кислородом, и образующийся
оксид титана вследствие нерас-
всплывает и уходит в шлак. Таким
образом, металл освобождается от включений воздуха. Титан яв-
ляется одним из наиболее активных раскислителей стали. По силе
раскисляющего действия он значительно лучше кремния и марган-
ца, но несколько уступает алюминию. Однако титан обладает пе-
ред алюминием преимуществом: его оксид легче отделить от
металла. Для раскисления могут быть применены ферротитан,
феррокарботитан и ферросиликотитан. При прибавлении 5 кг фер-
ротитана (10% Ti) к 1 т рельсовой стали содержание в ней кисло-
рода снижается с 0,005% до нуля.
Вредное действие азота на сталь в значительной степени исклю-
чается введением в нее ферротитана, что объясняется образованием
нерастворимого в стали нитрида титана. Азот, связанный с тита-
ном, действует на сталь аналогично шлаковым включениям. При
продолжительном выдерживании стали в печи нитрид титана,
вследствие небольшой плотности, переходит в шлак. Если нитрид
не успевает всплыть и остается в металле, то влияние нитридных
включений оказывается все же менее вредным, чем влияние сво-
бодного азота.
218
Облагораживающее действие титана на сталь выражается
в удалении из нее кислорода, оксидов железа и марганца, пузырь-
ков азота и шлаковых включений, в предупреждении сегрегации
структурных составляющих металла и вредных примесей. Дости-
гается полное восстановление, и остатки углерода, фосфора и серы
распределяются более равномерно и тонкодисперсно. Вследствие
этого сталь приобретает мелкозернистую структуру с более рав-
номерным рассеянием карбидов, фосфидов и сульфидов и боль-
шую плотность при наименьшем количестве пор, оксидов и шла-
ковых включений. Получение однородного компактного безпузы-
ристого слитка выгодно отличает эти стали от стали, полученной
без очистки титаном.
Раскисленные титаном стали обладают повышенными механическими каче-
ствами: прочностью, пределом упругости, сопротивлением разрыву, растяжению
и сжатию, ковкостью, способностью к обработке и сварке. Уменьшается количе-
ство брака и повышается качество литья и проката, При изготовлении рельсов
из раскисленной титаном бессемеровской стали количество брака снижается на
15—20%, предел упругости удваивается, а продолжительность службы возрастает
в два — три раза. Добавка к листовой стали феррокарботитана повышает каче-
ство отделочных листов, придает им ровную, гладкую поверхность без пор и
пятен.
Титановые стали. Присадка к стали до 3% титана значительно
повышает ее твердость. Большая твердость карбидов титана
была использована для изготовления сверхтвердых сплавов, что
дало возможность получить титановые быстрорежущие стали.
Титан сообщает стали повышенное сопротивление коррозии и
улучшает свойства стальных отливок. Присадка титана к нержа-
веющим сталям повышает их свариваемость.
Титановые стали кроме железа содержат обычно от 0,3 до 9% Ti, 0,1—0,8% С,
0,1—0,5% Мп, 0,04—0,5% Si, 0,01—0,03% Р и до 0,025% S. Механические свой-
ства стали зависят не только от содержания титана, но и от содержания угле-
рода и марганца. Так, с повышением содержания титана и углерода увеличи-
ваются твердость и прочность стали, с повышением же содержания марганца
твердость и прочность уменьшаются, хотя во многих случаях влияние содержа-
ния марганца сказывается не так резко.
Механические свойства титановых сталей различных составов приводятся в
Приложении 40.
Сплавы титана с другими металлами 20’158’!®5-ifi7
Медные сплавы. Легирование титановых сплавов медью повы-
шает их стабильность в процессе эксплуатации, а также увеличи-
вает жаропрочность. Твердый раствор р-титановых сплавов с медью
не фиксируется при закаливании, вследствие чего исключается
процесс, увеличивающий хрупкость сплава, что возможно при рас-
паде раствора, и повышается термическая стойкость.
Богатые медью сплавы называются купротитаном. Купротитан
применяют при очистке расплавленной меди, действуя как раскис-
литель и деазотатор и способствуя удалению шлаков. Для этой
цели применяют купротитан, содержащий титан от 5 до 12%. Его
219
добавляют в количестве 1 кг на 1 т расплавленной меди при ее
отливке. Легирование медных сплавов целесообразно только не-
большими количествами титана. Установлено, что медные сплавы,
содержащие больше 5% Ti, нековки, а содержащие больше 25%
Ti — слабы и неплотны. Это объясняется сильным поглощением
кислорода и азота из воздуха.
Марганцовые сплавы. Легирование титановых сплавов марган-
цем оказывает эффективное упрочняющее действие, при этом плас-
тичность не уменьшается и не ухудшается обрабатываемостью при
прокатке. В связи с этим, а также с дешевизной и недефицит-
ностью марганца последний успешно применяется как легирующая
добавка к титановым сплавам, особенно сплавам, предназначен-
ным для листовой прокатки. Известны отечественные сплавы с со-
держанием 1,5% Мп и зарубежные с содержанием до 8% Мп.
Богатые марганцем сплавы называются манганотитаном. Ман-
ганотитан, содержащий 70% Мп и 30% Ti, применяют для очи-
стки меди и бронзы при отливках, так как он совмещает действие
двух таких энергичных раскислителей, как титан и марганец.
Хромовые и молибденовые сплавы. Легирование титановых
сплавов хромом повышает их прочность и жаропрочность, а также
сообщает способность упрочняться при термической обработке; ле-
гирование молибденом повышает жаропрочность титана и его
сплавов с алюминием. ।
Титано-хромовые сплавы термически нестабильны и делаются
хрупкими в процессе выдерживания при повышенных температу-
рах, что объясняется эвтектоидным распадом остаточной р-фазы,
фиксирующейся при закаливании. Молибден повышает термиче-
скую стабильность титано-хромовых сплавов; при этом услож-
няется кристаллическая решетка p-твердого раствора, затруд-
няется взаимная диффузия компонентов и задерживается эвтек-
тоидный распад.
Введение хрома в титановые сплавы приводит к существен-
ному увеличению прочности с сохранением достаточно высокой
пластичности. Это позволяет подвергать сплавы холодной обра-
ботке в довольно широком диапазоне составов. Твердость кованых
сплавов возрастает с увеличением содержания хрома до 9%; уве-
личивается при этом и предел прочности при растяжении.
Сплавы на основе карбида титана. В настоящее время большое
значение приобрели жаростойкие керамикометаллические мате-
риалы, из которых в промышленном масштабе используются лишь
такие, в основе которых лежит карбид титана. В этих материалах
совмещаются твердость, тугоплавкость и химическая стойкость
карбида титана с пластичностью и сопротивлением тепловому
удару цементирующих металлов. Металл, играющий роль связки
для кристаллов карбида титана, должен хорошо смачивать их
поверхность и распространяться по ней, растворимость же кар-
бида в металле должна быть небольшой, и при взаимодействии
карбида с металлом не должно образовываться новых хрупких
22Q
фаз. Лучшими металлами для цементирования карбида титана ока-
зались никель и кобальт.
Свойства сплавов карбида титана с никелем или кобальтом
значительно улучшаются при введении легирующих добавок, ко-
торые могут влиять или на карбидную основу, или на цементирую-
щий металл, или на межфазную границу. Стойкость карбида ти-
тана против окисления, а, следовательно, и жаропрочность сплава
повышается при введении добавок ниобия или тантала. Соответст-
вующее свойство никеля или кобальта улучшается при введении
добавок хрома. Связь между карбидом и цементирующим метал-
лом улучшает добавка молибдена. В соответствии с этим и под-
бирают составы твердых жаропрочных сплавов на основе кар-
бида титана.
Наряду с карбидом титана основой твердых жаростойких спла-
вов могут служить карбид вольфрама и сочетание карбидов ти-
тана и вольфрама. Сплавы на основе карбидов титана и вольф-
рама, цементированные кобальтом, обладая 'большой прочностью
и твердостью, весьма сильно окисляются при высокой темпера-
туре. Увеличение содержания карбида титана в этих сплавах при-
водит к повышению стойкости против окисления, но, одновременно,
и увеличению хрупкости.
ГЛАВА VIII
ТИТАНОВЫЕ КИСЛОТЫ, ТИТАНАТЫ
Титан в степени окисления +4 в щелочных средах склонен к об-
разованию анионов (см. гл. I). Так, двуокись титана и ее водные
соединения, т. е. гидроксиды и оксидгидроксиды титана(IV), обла-
дают амфотерными свойствами, а в определенных условиях могут
проявлять себя как кислоты, правда, очень слабые. Этим кислотам
соответствует большое число солей — оксотитанатов.
Галиды титана (IV) являются типичными кислотообразующими
соединениями с явно выраженными ковалентными связями. По-
этому и галиды, и халькогениды титана (IV) используются для
получения многочисленных титанатов.
ОКСОТИТАНОВЫЕ КИСЛОТЫ
Водные соединения двуокиси титана, в зависимости от условий
получения, содержат переменное количество воды и имеют неоди-
наковые свойства. Так, обычно щелочи осаждают из кислых рас-
творов, содержащих соединения титана (IV), ортотитановую кис-
лоту— H4TiO4, причем чаще всего в виде аквасоединений, напри-
мер H4TiO4-H2O. Часто образуется также метатитановая кис-
лота — Н2ТЮз. Однако при некоторых условиях сушки ортотита-
новой кислоты выделены формы, промежуточные по содержанию
воды между мета- и орто-кислотой, а. также формы, обводненные
меньше, чем метатитановая кислота. Но эти промежуточные
формы образуются редко, и большинство солей — оксотитанатов
соответствует мета- и-ортотитановым кислотам.
Метатитановая кислота ’.2.168-170
Метатитановая кислота, или р-титановая кислота,—Н2ТЮ3
(мол. вес 97,915) является устойчивой формой, в которую пере-
ходит орто-кислота при кипячении 'с водой, промывании и даже
просто при долгом хранении.
222
Получение. Метатитановая кислота образуется при обработке
элементарного титана 40 %-ной азотной кислотой:
Ti + 4HNO3 = H2TiO3 + 4NO2 + Н2О
или перекисью водорода в аммиачной среде:
Ti + 5Н2О2 + 2NH3 = H2TiO3 4- 7Н2О 4- N2
а также (в виде маленьких блестящих пластинок) при внесении
в кипящую воду сухого тетрахлорида титана, смешанного с кар-
бонатом бария:
TiC 14 4- ЗН2О.= H2TiO3 4- 4НС1
Подобно этому, метатитановая кислота получается при гидролизе
кипящей водой кислых растворов сульфата титана (IV).
Образование метатитановой кислоты происходит также при
высушивании ортотитановой кислоты при 140° С или в вакууме.
Мета-кислота образуется также при окислении двугидроокиси
титана при нагревании ее на воздухе:
2Ti(OH)2 4- О2 = 2H2TiO3
Теплота образования метатитановой кислоты равна
306,7 ккал/моль. Энергия Гиббса образования Н2Т1О3 равна
253 ккал/моль.
Физические свойства. Метатитановая кислота представляет со-
бой белый порошок, желтеющий при нагревании. Плотность ее
при 25° С составляет 4,3 г/см3. Кислота Н2ТЮ3 не проводит элек-
трического тока.
Химические свойства. Метатитановая кислота в воде не раство-
ряется и, по существу, никаких кислотных свойств не проявляет.
Она не растворяется также в разбавленных кислотах и растворах
щелочей, но растворима в горячей концентрированной серной кис-
лоте. Кислотные свойства мета-кислоты проявляются лишь при
высоких'"температурах и выражаются в способности ее при спека-
нии с оксидами, гидроксидами и карбонатами различных метал-
лов образовывать соответствующие титанаты; подобным образом
метатитановая кислота способна реагировать даже с галидами,
правда, сравнительно малоактивных металлов. В этих реакциях
наряду с образованием титаната металла выделяется галоводо-
род. Характерно, что подобные реакции с безводной двуокисью
титана не идут. Метатитановая кислота взаимодействует с рас-
плавленными гидросульфатами (а также дисульфатами) и гидро-
фосфатами щелочных металлов, образуя соответствующие суль-
фате» и фосфатотитанаты.
При прокаливании метатитановая кислота разлагается:
H2TiO3 = TiO2 4- Н2О — 23,4 ккал-, AG = 4- 14 ккал
Отделение паров воды начинается при 200°С и происходит интен-
сивно при 300° С, но полное освобождение от воды происходит
лишь при температуре красного каления.
223
Ортотитановая кислота 1,2,168-170
Ортотитановая кислота, или а-титановая кислота, — H4TiO4
(мол. вес 115,93) является менее устойчивой формой, существую-
щей только в определенных" условиях, с изменением которых она
переходит в мета-кислоту.
Получение. Ортотитановая кислота образуется при действии
на раствор двуокиси титана в серной или соляной кислоте рас-
творами гидроксидов или карбонатов щелочных металлов. Выпа-
дающий при этом осадок следует высушивать без повышения тем-
пературы.
Ортотитановая кислота образуется при вливании тетрахлорида
титана в большое количество воды:
TiC 14 + 5Н2О = Н4ТЮ4 • Н2О + 4НС1
а также при взаимодействии порошкообразного элементарного ти-
тана с кипящей водой:
Ti + 4Н2О = H4TiO4 + 2Н2
Теплота образования орто-кислоты 373 ккал/моль.
Физические свойства. Ортотитановая кислота представляет со-
бой объемистый белый порошок. Она находится обычно в аморф-
ном состоянии, однако при нагревании до определенной темпера-
туры аморфная орто-кислота начинает быстро кристаллизоваться
с выделением большого количества теплоты, в результате чего она
внезапно самопроизвольно раскаляется. Причинами этого инте-
ресного явления можно считать значительную величину теплоты
кристаллизации ортотитановой кислоты и способность ее аморф-
ной формы к перегреванию.
Химические свойства. При нагревании или даже при длитель-
ной сушке в вакууме ортотитановая кислота перехрдит в мета-
кислоту. Орто-кислота не растворяется в воде и спиртах, но спо-
собна легко переходить в коллоидный раствор. На холоду она
хорошо растворяется в минеральных и сильных органических кис-
лотах. В сильных щелочах растворима при нагревании, притом
только в концентрированных растворах. Таким образом, ортоти-
тановая кислота на самом деле является амфотерным гидрокси-
дом с некоторым преобладанием основных свойств.
В водных средах ортотитановая кислота обычно акватирована,
и при pH = 7 имеет структуру нейтрального комплекса — диаква-
тетрагидроксотитана(1У) —[Ti(OH)4(H2O)2]. В кислых средах, т. е.
при pH < 7, могут происходить следующие обратимые превра-
щения:
[Ti(OH)4(H2O)2] + OHJ [Ti(OH)3(H2O)3]+ + Н2О
[Ti(OH)3(H2O)3]+ + он+ «=> [Ti(OH)2(H2O)4]2++ Н2О
а также
[Ti(OH)2(H2O)4]2+ + Он: [Ti(OH)(H2O)5]3+ + H2O
224
В щелочных средах, т. е. при pH > 7, возможны следующие обра-
тимые превращения:
[Ti(OH)4(H2O)2] + ОН' [Ti(0H)5(H2O)]- + Н2О
[Ti(OH)5(H2O)]- + OH- 5=± [Ti(OH)e]2- + H2O
При образовании гидрозоля ортотитановой кислоты происхо-
дит полимеризация указанных комплексов, т. е. превращение их
в многоядерные комплексы, в которых атомы титана соединены
между собой через гидроксо-группы. При длительном стоянии
гидрозолей орто-кислоты наблюдается медленное уменьшение зна-
чения pH. Этот факт объясняется тем, что при действии воды на
частицы золя происходит замена гидроксо-групп в многоядерном
комплексе на оксо-группы, что сопровождается отщеплением про-
тона.
Колоидные частицы ортотитановой кислоты могут быть поло-
жительно или отрицательно заряжены. Изоэлектрическая точка
отрицательных золей при pH = 6,7. При действии электролитов по-
ложительно и отрицательно заряженные золи подвергаются гелеоб-
разованию и желатинизации.
Высушенные гели ортотитановой кислоты обладают большой
адсорбционной способностью по отношению как к газам, так и
к растворенным веществам.
ОКСОТИТАНАТЫ
Оксотитанатами, или просто титанатами, называются соли ти-
тановых оксокислот. В основном их подразделяют на два типа:
метатитанаты с анионом ТЮз" и ортотитанаты с анионом TiO4~
Кроме этих двух главных типов известны еще полититанаты —
соли с анионами, содержащими больше одного атома титана
и имеющими формулу TinOln+m-
Оксотитанаты щелочных металлов2 ,71-176
Из титанатов щелочных металлов лучше всего изучены мета-
титанаты, получаемые при сплавлении двуокиси титана с соответ-
ствующими гидроксидами или карбонатами. В большинстве слу-
чаев титанаты щелочных металлов при растворении в воде под-
вергаются гидролизу.
Титанаты лития. Метатитанат лития — ЫгТЮз (мол. вес
109,78) образуется при нагревании смеси двуокиси титана и кар-
боната лития до 950°С или при спекании смеси TiO2 и ЫОН-НгО
в вакуумной (1 мм рт. ст.) электропечи при 650° С. Теплота обра-
зования метатитаната лития равна 399,3 ккал/моль-, энергия Гибб-
са образования 377,59 ккал/моль.
Метатитанат лития представляет собой белые, мелкие, изо-
тропные зерна или октаэдры; кристаллизуется в кубической
8 Зак, 1128 2 25
Сингонии, решетка Типа NaCl (а = 413,6 пм для неупорядоченной
структуры и 828,5 пм — для упорядоченной). Плотность при 20°С
равна 3,418 г/см3. При 1210° С переходит в p-форму; теплота
полиморфного превращения 2,76 ккал/моль (или 25,1 кал/г). Тем-
пература плавления 1550° С; теплота плавления 26,35 ккал/моль
(или 240 кал/г).
Теплоемкость метатитаната лития при 25°С составляет
26,26 кал//град-моль)- зависимость теплоемкости от температуры
в интервале от 298 до 1480° К выражается уравнением:
Ср = 33,09 + 0,004367 - 723 000/ Г2
а в интервале 1500 ч- 1800° К — уравнением:
Ср = 30,2 + 0,0087
Теплоемкость расплавленного метатитаната лития составляет
48 ккал//град моль). Энтальпия при 25° С равна 3942 кал/моль.
Стандартная энтропия Ы2ТЮ3 равна 21,93 кал//град моль). При-
веденная энергия Гиббса составляет —8,71 кал//град-моль).
Диэлектрическая проницаемость метатитаната лития 18,2. По-
казатель преломления изотропных кристаллов равен 2,087.
Метатитанат лития очень устойчив к действию воды и кислот;
он разлагается лишь при нагревании с концентрированной серной
кислотой или, лучше, со смесью серной и соляной кислот.
Дититанат лития — Li2Ti20s— образуется при нагревании
смеси двуокиси титана с сильно высушенным карбонатом лития,
взятых в мольном соотношении 2:1, в токе двуокиси углерода;
при 650° С за 15 мин реакция проходит на 60% • Дититанат лития
представляет собой кристаллы кубической сингонии, подобные
кристаллам метатитаната лития. Плотность при 15° С равна
3,50 г/см3. Химически очень устойчив.
Существуют также тетратитанат — ЫгТДОд, пентатита-
нат — ЫДиО 12 и гептатитанат — ЫДДО^.
Титанаты натрия. Метатитанат — Na2TiO3 (мол. вес 141,88)
образуется в системах Na2O — TiO2, Na2O — TiO2 — H2O и Na2O —
TiO2 — CO2. Практически метатитанат получают путем сплавления
двуокиси титана или метатитановой кислоты с гидроксидом или
карбонатом натрия. В последнем случае реакция идет с выделе-
нием двуокиси углерода. Если двуокись отводить, то реакция пой-
дет до конца, если же она останется в замкнутом пространстве, то
присутствие ее вызывает обратную реакцию. При 900° С и давле-
нии двуокиси углерода 1 атм равновесие установится при следую-
щих соотношениях:
0,29TiO2 + 0,29Na2CO3 = 0,71Na2TiO3 + хСО2
Образование метатитаната натрия происходит также при сплав-
лении элементарного титана с гидроксидом и нитратом (или хло-
ратом) натрия:
3Ti + 2NaOH + 4NaNO3 = 3Na2TiO3 + 4NO + H2O
226
Теплота образования NaTiO3 составляет 379,5 ккал/моль. Энергия
Гиббса образования 356,8 ккал/моль.
Безводный метатитанат представляет собой короткие, призма-
тические, прочные, оптически очень активные белые кристаллы
кубической сингонии (а = 760 пм). Плотность при 20°С равна
3,195 г/см3. При 290° С происходит полиморфное превращение
(теплота превращения 397 кал/моль). Температура плавления (по
кривой нагревания) 1030° С. Температура затвердевания по кри-
вой охлаждения лежит между 1010 и 970° С. Теплота плавления
равна 16,9 ккал/моль (или 119 кал/г).
Теплоемкость метатитаната натрия при 25° С составляет
30,02 кал/(град-моль).
Зависимость теплоемкости от температуры в интервале от 50
до 300° К выражается уравнением:
Ср = 0,0031272 -0,0727- 1,6- 10-sT3 + 2,7- 10-874 -6,5- 10~1275
в интервале от 300 до 560° К — уравнением:
Ср = 25,18 + 0,020727
а в интервале от 570 до 1300° К — уравнением:
Ср = 25,95 + 0,0177
Теплоемкость расплавленного метатитаната натрия составляет
46,9 кал/(град-моль).
Энтальпия метатитаната натрия при 25°С равна 4919 кал/моль.
Зависимость энтальпии от температуры в интервале от 290 до
560° К выражается уравнением:
- Z/° = 25,187 + 0,0103672 - 3510
а в интервале от 570 до 1300° К — уравнением:
Н°т - Н°о = 25,957 + 0.008572 - 2960
Стандартная энтропия ЫагТЮз равна 29,06 кал/град-моль. За-
висимость энтропии от температуры в интервале от 290 до 560° К
выражается уравнением:
Sy В 29,52 + 0,05287 - 4830/7
а в интервале от 570 до 1300° К — уравнением:
S°T = 52,0 + 0,03237 - 10710/7
Приведенная энергия Гиббса Na2TiO3 при 25° С составляет
—12,56 кал/(град-моль).
Значения термодинамических свойств метатитаната натрия
при различных температурах приведены в Приложении 41.
Диэлектрическая проницаемость Na2TiO3 равна 12,2; показа-
тель преломления— 1,804.
8’
227
Метатитанат натрия водой гидролитически разлагается. Разла-
гается он также растворами кислот.
Ортотитанат натрия — Na4TiO4— образуется при пятичасо-
вом выдерживании при 800° С смеси двуокиси титана и гидроокиси
натрия, взятых в мольном соотношении 1 :8. Он представляет со-
бой бесцветные гигроскопичные призматические кристаллы, рас-
творимые в водных растворах гидроокиси натрия.
Дититанат натрия — Na2Ti20s (мол. вес 221,78) — полу-
чается при длительном нагревании от 900 до 1100° С смеси дву-
окиси титана и карбоната натрия в мольном соотношении 2:1.
Он представляет собой призматические кристаллы. Плотность при
15° С равна 3,422 г/см3. Температура плавления 985° С; теплота
плавления 26,4 ккал/моль (или 119 кал/г)*.
Теплоемкость при 25° С равна 41,68 кал/ (град • моль); значения
теплоемкости при различных температурах приведены в Приложе-
нии 42. Теплоемкость расплавленного дититаната натрия равна
68,5 кал/ (град • моль). Энтальпия при 25° С составляет 6895 кал/моль.
Стандартная энтропия равна 41,54 кал/(град• моль). Приведённая
энергия Гиббса при 25°С составляет —18,41 кал/(град моль).
В воде дититанат не растворяется. Разлагается соляной кисло-
той (трудно — в холодной, легко — в кипящей). Разлагается также
при сплавлении со смесью сульфатов калия и натрия.
Трититанат натрия — Na2Ti3O7 (мол. вес 301,675) обра-
зуется при сплавлении двуокиси титана и карбоната натрия, сме-
шанных с вольфраматом натрия и трехокисью вольфрама, и при
термическом разложении дититаната натрия (£> 800°С). Трити-
танат натрия представляет собой белые, блестящие, призматиче-
ские иглообразные кристаллы моноклинной сингонии с сильным
двойным лучепреломлением. Плотность при 18° С равна 3,5077 г/см3
(мелкие иглы) и 3,4925 г/см3 (грубый порошок). При 1120° С ин-
конгруэнтно плавится; теплота плавления 37,11 ккал/моль (или
123 кал/г).
Теплоемкость при 25°С равна 54,85 кал/(град-моль)-, значения
теплоемкости при различных температурах приведены в Приложе-
нии 42. Теплоемкость расплавленного трититаната натрия
94,15 кал (град моль). Энтальпия при 25°С равна 9175 кал/моль.
Стандартная энтропия 55,9 кал/(град-моль). Приведенная энер-
гия Гиббса при 25°С равна —25,14 кал/ (град-моль). В воде и со-
ляной кислоте трититанат натрия не растворяется; горячей серной
кислотой легко разлагается.
Ортотрититанат натрия — Na^isOs— получается при две-
надцатичасовом выдерживании смеси из 1 части двуокиси титана,
2 частей карбоната натрия и 5 частей вольфрамата натрия при
800° С; после промывания плава водой получают короткие приз-
матические кристаллы моноклинной сингонии, частично прозрач-
ные, частично молочно-белые и сильно преломляющие свет. В хо-
* При плавлении дититаиат натрия разлагается на NajTUO? и ЫааТцОц.
228
лодной концентрированной соляной кислоте медленно, в кипя-
щей — быстро растворяется с разложением.
Известны также тетратитанат натрия — Na2Ti4O9, пента-
титанаты натрия — Ыа2Т150ц и NaeTisOu. Последний получают
при нагревании до 1100°С смеси двуокиси титана и карбоната
натрия, взятых в мольном соотношении Г: 2, и медленном охлаж-
дении сплава. Он представляет собой мелкозернистые призматиче-
ские кристаллы моноклинной сингонии с показателем преломле-
ния больше 1,74. В атмосфере двуокиси углерода плавится с раз-
ложением при 956—990° С.
Существует также гексатитанат натрия — Na2TieO13, кото-
рый образуется (вместе с трититанатом) при спекании двуокиси
титана с гидроокисью натрия в мольном отношении 3:2 и пла-
вится при 1245° С.
Титанаты калия. Метатитанат калия — К2ТЮ3 (мол. вес
174,10) образуется в системах К2О — ТЮ2, К2О — TiO2— Н2О и
К2О— TiO2 — СО2. Практически метатитанат калия получают
сплавлением двуокиси титана или метатитановой кислоты с гидр-
оксидом или карбонатом калия. В последнем случае реакция при
накапливании двуокиси углерода обратима, как и реакция с нат-
риевой солью, но идет с меньшим выходом титаната. Равновесие
устанавливается при 900° С, давлении двуокиси углерода 1 атм
при соотношениях:
0,65ТЮ2 + 0,6бК2СОэ = 0,35К2ТЮ3 + *СО2
Образование метатитаната калия происходит также при сплавле-
нии элементарного титана с гидроксидом и нитратом (или хлора-
том) калия:
3Ti + 2КОН + 4KNO3 = 3K2TiO3 + 4NO + Н2О
Теплота образования К2ТЮ3 равна 384,6 ккал/моль.
Безводный метатитанат калия представляет собой желтовато-
белую кристаллическую массу. Кристаллизуется в тетрагональной
сингонии (а = 547, с = 1660 пм). Плотность при 20°С равна
3,58 г/см3. Температура плавления 816° С. Диэлектрическая прони-
цаемость 16,5; показатель преломления 1,910.
Водой и растворами кислот разлагается.
Дититанат калия — К2Т12О5 (мол. вес 254,00)—образуется
при нагревании смеси двуокиси титана и карбоната калия в моль-
ном соотношении 2:1. Дититанат калия представляет собой бле-
стящие иглообразные кристаллы. Плотность при 15° С равна
3,485 г/см3. Температура плавления 980° С. Показатель преломле-
ния больше 1,74. Кристаллы дититаната калия на воздухе вывет-
риваются. В воде дититанат не растворяется; кислотами разла-
гается.
Гексатитанат калия—Кг’ПбО^ — бесцветные волокнистые
кристаллы с температурой плавления 1370° С.
Существует также додекатитанат калия — K2Tii2O25.
229
Титанаты рубидия. Метатитанат рубидия — Rb2TiO3 (мол.
вес 266,84) образуется при нагревании смеси эквимолекулярных
количеств двуокиси титана и карбоната рубидия до 1200°С или
при спекании ее в вакуумной (1 мм рт. ст.) электропечи при 600°С.
Метатитанат рубидия представляет собой желтоватую кристалли-
ческую массу; плотность при 20° С равна 3,01 г/смъ. Кристалли-
зуется в тетрагональной сингонии (а = 526, с — 3150 пм). Темпе-
ратура плавления 760° С. Диэлектрическая проницаемость 13,5.
Показатель преломления 1,818.
Дититанат рубидия — Rb2Ti2O5 (мол. вес 346,74)—получают
при нагревании до 1200°С смеси двуокиси титана и карбоната ру-
бидия, взятых в мольном соотношении 2:1. Дититанйт представ-
ляет собой желтоватые, сильно преломляющие свет кристаллы
ромбической сингонии. Плотность при 15° С равна 3,888 г!см3. Тем-
пература плавления 870° С. Разлагается кислотами. Дититанат ру-
бидия сплавляется с фторидом рубидия; из диаграммы плавкости
системы Rb2Ti20s— RbF следует, что в системе образуется соеди-
нение 3Rb2Ti2O5-2RbF. Существует также тетратитанат руби-
дия — Rb2Ti4O9 и гексатитанат рубидия Rb2Ti6O13.
Титанаты цезия. Метатитанат цезия — Cs2TiO3— образу-
ется при нагревании смеси эквимолекулярных количеств двуокиси
титана и карбоната цезия до 1200° С или при спекании ее в ваку-
умной электропечи при 650° С. Метатитанат цезия представляет
собой белую гигроскопичную массу. Кристаллизуется в тетраго-
нальной сингонии (а = 526, с = 3150 пм). Плотность при 20°С
равна 3,39 г!смъ. Температура плавления 710° С. Диэлектрическая
проницаемость 8,8. Показатель преломления 1,812. Водой и раство-
рами кислот разлагается.
Дититанат цезия — Cs2Ti2O5 (мол. вес 441,61) образуется
при нагревании до 1200°С смеси двуокиси титана и карбоната це-
зия, взятых в мольном соотношении 2:1. Дититанат цезия пред-
ставляет собой белые кристаллы. Температура плавления 890° С.
Разлагается водой и кислотами. Сплавляется с фторидом цезия;
из диаграммы плавкости системы Cs2Ti20s — CsF следует, что в си-
стеме образуется соединение 3Cs2Ti2O6-2CsF. Существует также
тетратитанат цезия — Cs2Ti4O9 — в виде волокнистых кристал-
лов, собранных в агрегаты.
Оксотитанаты щелочноземельных
металлов ,177—1вз
Титанаты магния. Путем сплавления или спекания окиси маг-
ния с двуокисью титана могут быть получены сплавы, содержащие
различные титанаты магния. На рис. 51 представлена диаграмма
плавкости системы MgO—TiO2. Кривая ликвидуса проходит через
четыре эвтектические точки и расположенные между ними три
дистектических максимума, которые соответствуют составам
2MgO-TiO2, MgO-TiO2 и MgO-2TiO2, т. е. ортотитанату, метати-
23Q
танату и дититанату магния. Кроме этих трех титанатов в системе
MgO—ТЮг образуются сесквититанат — 2MgO-3TiO2 и тетрати-
танат— MgO-4TiO2, которые, очевидно, менее стойки и никак не
отмечаются на кривой ликви-
дуса.
Ортотитанат магния —
Mg2TiO4 (мол. вес 160,52) об-
разуется в системе MgO—TiO2;
практически он может быть полу-
чен при нагревании смеси из 1 ча-
сти окиси магния, 2 частей дву-
окиси титана и 10 частей хлорида
магния, который, легко распла-.
вляясь, служит растворителем для
реагентов и при достаточно высо-
кой температуре улетучивается.
Теплота образования ортотитана-
та магния равна 517,0' ккал/моль-,
энергия Гиббса образования
489,1 ккал/моль.
Ортотитанат магния представ-
ляет собой блестящие белые кри-
сталлы, имеющие форму пра-
вильных октаэдров; кристаллизу-
ется в кубической сингонии (а =
= 842 ши). Плотность 3,52 г/смъ\
по твердости превосходит стекло.
При 1732°С конгруэнтно плавит-
ся; теплота плавления 13,53
ккал/моль, или 84,3 кал/г.
Теплоемкость при 25° С равна
30,76 кал/ (град • моль). Зависи-
мость теплоемкости ортотитаната
магния от температуры в интер-
вале от 298 до 1800° К выра-
жается уравнением: Ср = 35,96 +
Рис. 51. Диаграмма плавкости
системы MgO—ТЮ2.
+ 0,008547—689 000/7’2.
Энтальпия Mg2TiO4 при 25° С
равна 4478 кал/моль. Стандарт-
ная энтропия ортотитаната маг-
ния равна 27,52 кал/град-моль).
Значения теплоемкости и энтропии ортотитаната магния при раз-
личных температурах приведены в Приложении 43. Приведенная
энергия Гиббса при 25°С равна —12,50 кал/(град• моль).
В воде ортотитанат магния нерастворим. Кислотами (азотной,
соляной) разлагается при длительном нагревании.
Метатитанат магния.— AlgTiO3 (мол. вес 121,21) обра-
зуется при нагревании до 1500° С смеси двуокиси титана е
231
магнием:
2TiO2 + Mg = MgTiO3 + TiO
а также сМесй двуокиси титана с хлоридом магния:
2TiO2 + MgCI2 = MgTiO3 + TiOCl2
Практически метатитанат магния может быть получен сплавлением
в платиновом тигле 1 части двуокиси титана-и 10 частей хлорида
магния с небольшим количеством хлорида аммония; образую-
щийся при этом дихлороксид титана вместе с избытком хлорида
магния улетучивается. Стандартная теплота образования метати-
таната магния 375,5 ккал!моль. Энергия Гиббса образования
MgTiO3 равна 354,37 ккал/моль.
Метатитанат магния представляет собой блестящие, правильно
образованные кристаллы гексагональной сингонии (а = 545 пм,
а = 55°), имеющие форму табличек. Плотность равна 3,91 г/см?.
По твердости превосходит стекло. При 1630° С метатитанат магния
конгруэнтно плавится.
Теплоемкость метатитаната магния при 25° С составляет
21,92 кал/(град- моль). Зависимость теплоемкости от температуры
в интервале от 50 до 300° К выражается уравнением:
Ср = 0,00148т2 - 5,81 • 10“673 + 7 • 10~9Т4 - 0,0377
а в интервале от 300 до 1800° К — уравнением:
Ср = 28,29 + 0,003287 - 653 000/Т2
Значения теплоемкости метатитаната магния при различных тем-
пературах приведены в Приложении 43. Энтальпия метатитаната
магния при 25° С равна 3255 кал/моль. Энтропия при 25° С со-
ставляет 17,8 кал/(град-моль). Приведенная энергия Гиббса при
25° С равна —6,88 кал/ (град- моль). Диэлектрическая проницае-
мость метатитаната магния колеблется от 14 до 17.
В токе водорода при 1050°С метатитанат магния восстанавли-
вается до оксо-(III)титаната магния; при нагревании смеси мета-
титаната магния с углеродом до 1400°С происходит аналогичное
восстановление. Метатитанат магния медленно растворяется в раз-
бавленной и быстро — в концентрированной соляной кислоте. Рас-
творяется также в расплавленном гидросульфате аммония.
Дититанат магния — MgTi2O5 (мол. вес. 200,11) образуется
в системе MgO — TiO2. Теплота образования дититаната магния
599,2 кал/моль. Энергия Гиббса образования MgTi2O5 566 ккал/моль.
Дититанат магния представляет собой белые кристаллы, имею-
щие формы табличек. Плотность составляет 3,58 а/сж3. При тем-
пературе 1652° С конгруэнтно плавится, теплота плавления 79 кал/г.
Теплоемкость дититаната магния при 25°С составляет
35,15 кал/(град-моль). Зависимость теплоемкости от температуры
в интервале от 200 до 1500° С выражается уравнением: Ср =
= 40,68 + 0,0092т — 735 000/Т2,
232
Энтальпия при 25° С равна 5340 кал/моль. Энтропия при 25° С
составляет 33,2 кал/(град-моль). Приведенная энергия Гиббса
при 25°С равна —15,29 кал/(град• моль).
При нагревании смеси дититаната магния с углеродом до
1400°С происходит образование диоксо-(Ш)титаната:
MgTi2Os + С — Mg(TiO2)2 + СО
В воде и разбавленных кислотах дититанат магния нерастворим.
Сесквититанат, или ортотрититанат магния,—
Mg2Ti30s— образуется при спекании стехиометрических количеств
карбоната магния и метатитановой
кислоты. Сесквититанат магния пред-
ставляет собой белый кристаллический
порошок с большой диэлектрической
проницаемостью.
Титанаты кальция. Сплавлением
или спеканием окиси кальция с дву-
окисью титана могут быть получены
сплавы, содержащие различные тита-
наты кальция. На рис. 52 представ-
лена диаграмма плавкости для систе-
мы СаО—TiO2. Кривая ликвидуса про-
ходит через две эвтектические точки,
между которыми расположены дистек-
тический максимум и перитектическая
точка, соответствующие составам
СаО-Т1О2 и ЗСаО-2ТЮ2, т. е. метати-
танату и ортодититанату кальция.
Метатитанат кальция — CaTiO3
(мол. вес 135,98) встречается в
природе в виде минералов первоскита
и кнопита. Искусственно (в виде
мелких кристаллов) может быть полу-
чен спеканием при нагревании экви-
молекулярных количеств окиси каль-
ция и двуокиси титана. В виде крупных
кристаллов (так называемого синтети-
ческого перовскита) образуется при
охлаждении раствора смеси СаО +
Рис. 52. Диаграмма плавкости
системы СаО—TiO2.
+ ТЮ2 в щелочно-карбонатном, щелоч-
но-силикатном или хлоридно-кальцие-
вом расплаве. Теплота образования
метатитаната кальция составляет
395,9 ккал/моль. Энергия Гиббса образования СаТЮз равна
376,5 ккал/моль. Изменение энтропии при образовании метатита-
ната кальция из окиси кальция и двуокиси титана (рутил) состав-
ляет 0,5 кал/(град моль),
233
Метатитанат кальция представляет собой желтоватые кри-
сталлы, имеющие вид табличек с маслянистым блеском; кристал-
лизуется в моноклинной (псевдокубической) сингонии (а =
= 762,9 пм). Плотность 4,02 г/см\ При 1260°С происходит поли-
морфное превращение; теплота превращения 551 кал/моль. При
температуре 1980°С метатитанат кальция конгруэнтно плавится
(размягчается при 1650°С). Теплоемкость при 25°С составляет
23,34 кал/{град-моль). Зависимость теплоемкости от температуры
в интервале от 50 до 300° К выражается уравнением:
Ср = 0,00101 Т2 -2,33- 10“87’4 + 5- 10-11Г5
а в интервале от 300 до 1530° К — уравнением:
Ср = 30,47 + 0,001367 - 669 000/ Т2
Значения теплоемкости метатитаната кальция при различных тем-
пературах приведены в Приложении 44. Энтальпия при 25° С равна
3804 кал/моль, энтропия при 25° С — 22,4 кал/{град-моль). Приве-
денная энергия Гиббса при 25°С равна —9,62 кал/ {град-моль).
Диэлектрическая проницаемость метатитаната кальция колеблется
от 115 до 165.
В воде метатитанат не растворяется. Концентрированными со-
ляной и серной кислотами при нагревании легко разлагается. Раз-
лагается также при сплавлении с гидросульфатами щелочных ме-
таллов или с сульфатом аммония.
Ортоди титанат к а л ь ц и я — Ca3Ti2O7 (мол. вес 328,04)
образуется, как уже указывалось, в системе СаО — ТЮ2. Теплота
образования 944,1 ккал/моль-, энергия Гиббса образования
896,4 ккал/моль. Представляет собой желтоватые кристаллы. При
1770°С инконгруэнтно плавится с выделением кристаллов мета-
титаната кальция. В воде не растворяется; разлагается при на-
гревании концентрированными кислотами или гидросульфатами
щелочных металлов.
Титанаты стронция. Метатитанат стронция — SrTiO3 (мол.
вес 183,52) образуется при длительном нагревании эквимолеку-
лярных количеств двуокиси титана и карбоната стронция до
1000°С:
TiO2 + SrCOg = SrTiO3 + СО2
Теплота образования SrTiO3 составляет 399 ккал/моль. Энергия
Гиббса образования — 379 ккал/моль.
Метатитанат стронция представляет собой желтовато-коричне-
вый мелкокристаллический порошок. Кристаллизуется в кубической
сингонии {а = 391 пм). Плотность 5,11 г/смг. Конгруэнтно плавится
при 2020° С. Теплоемкость при 25° С 23,51 кал/ {град • моль).
Энтальпия при 25° С 4119 кал/моль. Энтропия при 25° С
равна 25,99 кал/{град-моль). Приведенная энергия Гиббса
—12,2 кал/{град • моль). Диэлектрическая проницаемость метати-
таната стронция очень велика: она колеблется от 250 до 275. В воде
не растворяется; разлагается горячими кислотами.
234
Ортотитанат стронция — Sr2TiO4 — образуется при спекании
смеси 1 части двуокиси титана и 4 частей карбоната стронция при
1270° С. Теплота образования 545,6 ккал/моль. Ортотитанат строн-
ция представляет собой красновато-коричневый порошок; конгру-
энтно плавится при 1860° С. Плотность 4,7 а/с#3. Теплоемкость при
25° С равна 34,34 кал/(град • моль). Энтальпия 6068 кал/моль, эн-
тропия 38,0 кал/(град-моль). При нагревании растворяется в раз-
бавленной соляной кислоте.
Сескви титанат стронция, или о р т о т р и т и т а н а т строн-
ция— Sr2ThO« (мол. вес 446,935), образуется при сплавлении сте-
хиометрических количеств карбоната стронция и двуокиси титана.
Практически сесквититанат стронция может быть получен путем
нагревания до температуры красного каления 4 частей карбоната
стронция и 3 частей двуокиси титана в хлоридно-стронциевом рас-
плаве и разложения полученного плава слегка подкисленно?! (со-
ляной кислотой) водой.
Сесквититанат стронция представляет собой желтовато-бурый
кристаллический порошок^ Плотность 5,1 г/см?. Кристаллам свой-
ственно очень слабое двойное лучепреломление. Сесквититанат
стронция не растворяется в во-
де и очень разбавленных кис-
лотах; растворяется с разложе-
нием в концентрированной со-
ляной кислоте.
Метатитанат бария. Из всех
титанатов по своим исклю-
чительным диэлектрическим
свойствам резко выделяется
метатитанат бария — BaTiO3
(мол. вес 233,24), который яв-
ляется в настоящее время наи-
более известным сегнетоэлек-
трическим материалом.
Метатитанат бария сущест-
вует в четырех кристалличе-
ских модификациях, отличаю-
щихся друг от друга по своим
электрическим и оптическим
свойствам. При температуре
выше 122° С устойчива кубиче-
ская форма; в этой форме ме-
татитанат бария становится
Рис. 53. Элементарные ячейки четырех
кристаллических форм метатитаната
бария:
а — кубическая: б — тетрагональная; в — ромби-'
ческая; г — ромбоэдрическая.
уже не сегнетоэлектриком, а обычным диэлектриком. Таким обра-
зом, температура 122°С для метатитаната бария является точкой
Кюри. Кубическая форма метатитаната бария имеет структуру пе-
ровскита. В интервале от 5 до 120°С устойчива тетрагональная
форма, которая является полярной. Элементарная ячейка образует-
ся в результате искажения исходной кубической ячейки (рис. 53);
235
одно ребро кубической ячейки удлиняется и становится осью с
тетрагональной ячейки, а два других ребра кубической ячейки со-
кращаются и становятся осями а тетрагональной ячейки. Так как
в кристалле кубической сингонии имеется шесть эквивалентных
направлений [100], направление спонтанной поляризации *, или по-
лярная ось, может быть параллельным любому из них. Наиболее
изучена тетрагональная форма метатитаната бария, так как в
структурном отношении она наиболее проста и устойчива при обыч-
ной температуре. В интервале от +5 до —90°С устойчива ромби-
ческая форма, также полярная (сегнетоэлектрик). Эта форма обра-
зуется в результате такого искажения исходной кубической ячейки,
при котором одна из диагоналей грани удлиняется и становится
осью а ромбической ячейки, а другая диагональ сокращается и ста-
новится осью b ромбической ячейки (рис. 53,в). Так как в кристал-
ле кубической сингонии имеется 12 эквивалентных направлений
[НО], в кристалле ромбической системы возможны 12 направлений
спонтанно?! поляризации. При температуре ниже 290° С устойчива
ромбоэдрическая форма, ячейка которой образуется при растяже-
нии одной из пространственных диагоналей исходной кубической
ячейки (рис. 53, а). В этой форме есть восемь направлений спон-
танной поляризации.
Получение. Порошкообразный метатитанат бария получают
нагреванием эквимолекулярных количеств двуокиси титана и окиси
или карбоната бария до 1200—1500° С. Кристаллический метатита-
нат бария с перовскитовой структурой образуется при длительном
(не менее 12 ч) охлаждении расплава, полученного нагреванием
смеси двуокиси титана, карбоната и хлорида бария, взятых в моль-
ном соотношении 1:1,4: 3,3. Для освобождения от примеси окиси
бария полученный плав промывают водой, слегка подкисленной
азотной кислотой. Теплота образования метатитаната бария (тетра-
гональная форма) 397,6 ккал!моль. Энергия Гиббса образования
ВаТЮз равна 376,4 ккал/моль.
Для получения монокристаллов метатитаната бария обычно
применяют метод выращивания их из расплава. В качестве раство-
рителей используют смеси карбонатов натрия и калия или, лучше,
хлорид бария. Наиболее удачный способ выращивания монокри-
сталлов метатитаната бария основан на применении в качестве
растворителя расплавленного фторида калия и сводится к следую-
щему. В платиновый тигель загружают 7 частей поликристалличе-
ского (порошкообразного) метатитаната. бария, 0,03 части полу-
тораокиси железа и 4 части фторида калия. Закрытый тигель
нагревают в печи до 1150—1200° С, выдерживают при этой темпе-
* Спонтанной поляризацией называется такое состояние кристалла, при- ко-
тором группы образующих его структуру ионов представляют собой электриче-
ские диполи, направленные в одну сторону. Спонтанная поляризация измеряется
в единицах дипольного момента на единицу объема. Кристаллы, обладающие
спонтанной поляризацией, называются пироэлектриками, а направление спонтан-
ной поляризации — полярной осью.
236
ратуре около восьми часов и затем медленно охлаждают до 850—
900° С. Жидкий при этой температуре растворитель сливают, и кри-
сталлы медленно охлаждают до обычной температуры. В этом слу-
чае монокристаллы получаются, как правило, в виде треугольных
пластинок размером (в зависимости от скорости охлаждения) по
гипотенузе 2—3 см и толщиной до 1 см.
Физические свойства. Параметры решеток и температу-
ры фазовых превращений кристаллических форм метатитаната ба-
рия приведены в табл. 8.
Таблица 8. Характеристики кристаллических модификаций
метатитаната бария
Сингония Параметры решетки, пм Темпера- тура превра- щения, °C Теплота превраще- ния, кал/моль
а Ь с
Ромбоэдрическая 399,8 (при —100° С) -90 14
Ромбическая . . 568,2 (при —10° С) 566,9 399,0 +5 16
Тетрагональная . 399,-2 (при 20° С) — 403,6 122 47
Кубическая . . . 400,9 (при 120° С) — — 1460 * —
401,2 (при 200° С) — — — —
Гексагональная . 573,5 — 1405 1618 —
При 1618°С метатитанат бария конгруэнтно плавится. Плот-
ность его 6,08 г/см3. Теплоемкость при 25° С равна 24,49 кал/(град-
• моль). Зависимость теплоемкости метатитаната бария от темпера-
туры в интервале от 298 до’1500°К выражается уравнением: Ср =
= 29,03 + 0,00204Т — 458 000/Г2. Энтальпия метатитаната бария
при 25° С составляет 4521 кал!моль. Энтропия при 25° С равна
25,84 кал/ (град моль). Зависимость энтропии от температуры в ин-
тервале от 298 до 1500°К выражается уравнением: St = 0,10867’—•
—6,95- 10~5Т’2 + 2 • 10~8Т’3. Приведенная энергия Гиббса при 25° С
равна —10,66 кал!(град-моль). Значения теплоемкости и термоди-
намических функций метатитаната бария при различных темпера-
турах приведены в Приложении 45.
Химические свойства. Метатитанат бария при нагрева-
нии в атмосфере водорода восстанавливается с образованием оксо-
(III)титаната бария голубоватого цвета. В воде метатитанат не
растворяется. Разлагается при нагревании в концентрированных
кислотах и при сплавлении с гидросульфатами щелочных металлов.
Метатитанат бария обладает способностью образовывать непре-
рывные ряды твердых растворов с изоморфными ему метатитана-
тами, а также цирконатами, гафнатами и станнитами других, пре-
имущественно двухвалентных металлов. Эти твердые растворы об-
ладают интересными сегнетоэлектрическими свойствами.
Другие титанаты бария. Ортотитанат б а р и я — Ba2TiO«
(мол.вес 386,58) образуется при спекании смеси 1 части двуокиси
237
титана и 5 частей карбоната бария (1270°С). Теплота образования
538 ккал/моль. Энергия Гиббса образования равна 511 ккал/моль.
Ортотитанат бария представляет собой серовато-красные анизо-
тропные кристаллы с сильным лучепреломлением. Температура
плавления I8600 С. Плотность при 20° С равна 5,8 г/см3. Зависи-
мость теплоемкости ортотитаната бария от температуры в интер-
вале от 298 до 1800° К выражается уравнением: Ср = 43,00 +
+ 0.00160Т — 711 500/Т2.
Энтальпия при 25° С равна 6858 кал/моль. Энтропия Ва2ТЮ4
47,0 ккал/(град-моль). В воде ортотитанат бария не растворяется.
Разбавленная соляная кислота разлагает его на хлорид бария и
ортотитановую кислоту.
Существует также другой ортотитанат бария — ВазТЮ5.
Сесквититанат, или о р т о т р и т и т а н а т бария,—1
Ва2Т1зО8 (мол. вес 546,375) образуется при сплавлении стехиоме-
трических количеств двуокиси титана и карбоната бария. Прак-
тически сесквититанат может быть получен нагреванием до темпе-
ратуры красного каления 1 части двуокиси титана и 2 частей
карбоната бария в хлоридно-бариевом расплаве и разложения по-
лученного плава слегка подкисленной (соляной кислотой) водой.
Сесквититанат бария представляет собой желтые, блестящие
псевдокубические кристаллики с сильным двойным лучепреломле-
нием. Плотность 5,91 г/см^. В воде и очень разбавленных кислотах
сесквититанат не растворяется; растворяется с разложением в кон-
центрированной соляной кислоте. Из сесквититаната бария может
быть изготовлен керамический материал с большой диэлектриче-
ской проницаемостью.
Дититанат бария — BaTi2O5— кристаллы с плотностью
5,3 г/см5.
Трититанат бария — BaTi3O7 — образуется при сплавлении
равных количеств двуокиси титана и карбоната бария и представ-
ляет собой желтые кристаллы.
Существует также тетратитанат бария — BaTi4Og, который
образуется при сплавлении шихты состава ВаО + 4TiO2. Это —
кристаллы моноклинной сингонии (а = 767, b = 1402, с — 752 пм,
Р = 98° 20'); плотность 4,58 г/см3.
Оксотитанаты металлов III группы 2> 184—iss
Титанаты алюминия. На диаграмме плавкости системы А12О3 —
ТЮ2 отмечается только одно соединение., соответствующее составу
А12О3-ТЮ2, т. е. метатитанатоксид алюминия; однако кроме него
известен также и нормальный метатитанат алюминия состава
А120з-ЗТЮ2, не отмечающийся на диаграмме плавкости.
Метатитанат диоксид алюминия — А12О2 (ТЮ3) (мол.
вес 181,86) образуется при сплавлении эквимолекулярных количеств
окиси алюминия и двуокиси титана. Метатитанатдиоксид алюми-
ния представляет собой призматические кристаллы ромбической
сингонии с параметрами решетки: а = 940, b = 336, с = 995 пм,
238
плотность при 25° С равна 3,67 г1смг. Температура плавления
I8600 С, Коэффициент теплового расширения очень мал, в связи
с чем метатитанатдиоксид алюминия представляет интерес как огне-
упорный материал. Зависимость теплоемкости от температуры в
интервале от 25 до 1500° С выражается уравнением: Ср = 43,63 +
+ 0,0053 Т — 1121 000/Т2. Энтропия при 25° С равна 26,2 кал/(град-
•моль). Метатитанатдиоксид алюминия образует с дититанатом
магния непрерывный ряд твердых растворов.
Метатитанат алюминия—А12(ТЮ3)3— образуется при на-
гревании 2 частей окиси алюминия и 5 частей двуокиси титана в
криолитовом расплаве.
Титанаты редкоземельных металлов. Титанаты скандия.
В процессе обезвоживания осажденных совместно гидроксидов
скандия и титана образуется твердый раствор оксидов, кристалли-
зующийся в кубической сингонии, который при дальнейшем нагре-
вании выше 800° С распадается на два соединения: ортотитанат
скандия — Sc4(TiO4)3 и диортотитанатпентоксид скандия —
SceO5(TiO4)2. Кристаллы ортотитаната скандия относятся к ромбо-
эдрической (искаженной кубической) сингонии (а = 909,4, с ~
= 1707 пм). При 1350° С ортотитанат скандия распадается, снова
переходя в твердый раствор оксидов скандия и титана. Диортоти-
танатпентоксид скандия распадается подобным образом при 1150°С.
Титанаты иттрия входят в состав некоторых минералов.
Искусственно ортодититанат иттрия — Y2Ti2O7 — получается при
нагревании выше 1000°С смеси окиси иттрия и двуокиси титана,
взятых в мольных соотношениях 1 : 2. Он может быть получен также
при нагревании смеси совместно осажденных из растворов ги-
дроксидов иттрия и титана(IV). Ортодититанат иттрия кристалли-
зуется в кубической сингонии (а — 1009,1 пм). Получен также мета-
титанатдиоксид иттрия — Y2O2(TiO3) — путем термического разло-
жения NaYTiOi при 1500° С на воздухе. Параметры ромбической
решетки: а = 1035, b = 370, с = 1125 пм\ плотность 4,73 г)см3.
Титанаты лантана. При сплавлении окиси лантана с
двуокисью титана образуются метатитанатдиоксид лантана —
La2O2(TiO3) и ортодититанат лантана — La2Ti2O7. Метатитанат-
диоксид лантана представляет собой кристаллы ромбической син-
гонии (а = 1097, b = 1137, с = 393,7 пм)-, плотность 5,4 г/см3. Су-
ществуют также метатитанат лантана — La2(TiO3)3 и трититанат
лантана — ЕаДПзС^з.
Титанаты церия, празеодима и неодима. Обычно
при сплавлении сесквиоксидов церия, празеодима или неодима с
диоксидом титана образуются ортодититанаты состава Me2Ti2O7.
При сплавлении диоксидов церия и титана образуется ортотитанат
церия (IV)— CeTiO-i-
Титанаты самария и европия. Из сесквиоксидов сама-
рия или европия и диоксида титана образуются титанаты различ-
ного состава. При прокаливании смеси совместно осаждаемых
гидроксидов самария и титана образуется ортодитатанат сама-
239
рия — Sm2Ti2O7. Из моноксида европия и диоксида титана обра-
зуется черный метатитанат европия(П)—EuTiO3, кристаллизую-
щийся в кубической сингонии (а = 390 пм).
Титанаты гадолиния. В системе Gd2O3— TiO2 образуют-
ся два соединения: метатитанатдиоксид — Gd2O2(TiO3) (моноклин-
ная решетка с параметрами а = 1575, b =533, с= 1573 пм), ин-
конгруэнтно плавящийся при 1775° С, и ортодититанат — Gd2Ti2O7,
конгруэнтно плавящийся при 1820° С. Последний относится к куби-
ческой сингонии (а = 1018,1 пм).
Титанаты тербия идиспрозия. При сплавлении сескви-
оксидов тербия или диспрозия с диоксидом титана обычно обра-
зуются ортодититанаты Tb2Ti2O7 и Dy2Ti2O7. Существует также
метатитанатдиоксид диспрозия — Dy2O2(TiO3).
Титанаты эрбия и тулия. При сплавлении полутораоки-
сей эрбия и тулия с двуокисью титана образуются ортодиТитана-
ты—Er2Ti2O7 и Tu2Ti2O7. Ортодититанат эрбия кристаллизуется в
кубической сингонии с параметром решетки а — 1007,6 пм.
Титанаты актиноидов. При спекании эквимолекулярных коли-
честв диоксидов тория и титана образуется ортотитанат тория —
ThTiO4. При спекании шихты ThO2 + 2TiO2 образуется метатита-
нат тория — Th(TiO3)2. Низкотемпературная модификация (а),
устойчивая при температуре до 1300° С, кристаллизуется в ромби-
ческой сингонии; параметры решетки: а = 1670, b = 1495, с = 410 пм.
При температуре выше 1300° С устойчива высокотемпературная
модификация (р), кристаллизующаяся в тетрагональной системе
с параметрами решетки а = 758, с = 1045 пм.
При спекании диоксидов урана и титана образуется трититанат
урана — U (Ti3O8).
Оксститанаты переходных металлов 2’171 •177 189’190
Многие переходные металлы, т. е. элементы групп IVB — VI IB,
семейства железа, групп IB и ПВ образуют титанаты. Говоря о ти-
танатах элементов группы IVB, следует указать, что и титан(III)
дает титанат. Образующееся в системе Ti2O3 — TiO2 соединение
Т15О5, называемое третьпятиокисью титана, по существу представ-
ляет собой метатитанатоксид титана(Ш)—(TiO)2TiO3. Свойства
этого соединения описаны в гл. V.
Титанаты циркония и гафния. Орто тит ан ат цир ко-
ни я(1У)— ZrTiOi (мол. вес 203,12) образуется в системе ZrO2 —
TiO2; он практически может быть получен спеканием эквимолеку-
лярных количеств диоксидов циркония и титана при 1800° С. Кри-
сталлы титаната циркония кристаллизуются в ромбической син-
гонии (а = 480,6, Ь = 503,2, с = 544,7 пм). При 1820°С титанат
циркония инконгруэнтно плавится с выделением кристаллов твер-
дого раствора титаната в двуокиси циркония. Растворимость тита-
ната в твердой двуокиси циркония достигает 66 мол. %, а раство-
римость титаната циркония в твердой двуокиси титана не превы-
шает 20 мол.°/о. Титанат циркония обладает большой диэлектриче-
24Q
ской проницаемостью. При высоких температурах взаимодействует
с большинством оксидов и оксосолей с выделением двуокиси цир-
кония; химически не взаимодействует лишь с окисью бериллия, ти-
танатом магния и некоторыми минералами, но образует с ними
механические смеси.
Диортотитанаттетрагидроксид циркони я (IV) —
Zr(OH)4(TiO4)2 — встречается в природе в виде минерала оливей-
раита.
Ортотитанат г а ф н и я — HfTiO4 (мол. вес 291,39) обра-
зуется при сплавлении двуокисей гафния и титана. Кристаллизует-
ся в ромбической сингонии (а = 475,8, Ь = 561,0, с = 507,2 пм).
Плотность HfTiO4 равна 7,2 г/см3.
Титанаты хрома. Ортодититанат хрома(III) — CraTiaO? —
образуется в системе Сг2О3—ТЮ2 и практически может быть полу-
чен путем спекания при 1440°С смеси полутораокиси хрома и дву-
окиси титана, взятых в мольном соотношении 1 :2. Ортодититанат
хрома(III) представляет собой серо-зеленый кристаллический по-
рошок. Плотность 4,54 г/см3. Температура конгруэнтного плавления
1980° С; теплота плавления 90 кал/г. С двуокисью титана образует
твердый раствор. Обнаружен также метатитанатдиоксид
хрома(Ш)— Cr2O2(TiO3).
Титанаты марганца. Метатитанат марганца — МпТЮ3(мол.
вес 150,84) встречается в природе в виде минерала пирофанита.
Искусственно может быть получен при сплавлении смеси дихлорида
марганца с метатитановой кислотой. Метатитанат марганца пред-
ставляет собой кристаллы гексагональной сингонии, имеющие вид
табличек; плотность 4,84 г/см3. Температура инконгруэнтного плав-
ления 1390 °C.
Ортотитанат марганца (II)—Мп2ТЮ4 (мол. вес 221,77)
образуется при нагревании смеси 5 частей дихлорида марган-
ца и 2 частей метатитановой кислоты в хлоридно-натриевом
расплаве. Он получается также при спекании смеси аморф-
ной двуокиси титана и карбоната марганца (II), взятых в мольном
соотношении 1:2, при 1000° С в атмосфере водорода или азота.
При медленном охлаждении смеси образуются кристаллы
a-формы ортотитаната марганца (тетрагональная сингония; а =
= 872,6, с = 856,6 пм); плотность 4,49 г/см3. При быстром охла-
ждении смеси образуется p-форма (кубическая сингония, гране-
центрированная решетка, а = 867,9 пм). Температура полиморф-
ного превращения ортотитаната марганца 770° С; температура пла-
вления 1455° С. Обе формы ортотитаната марганца при низких
температурах обладают ферромагнитными свойствами.
Титанаты железа. В системах FeO—TiO2 и Fe2O3—TiO2 обра-
зуются различные титанаты, железа (II) и железа (III). Некоторые
из них встречаются в природе в виде минералов.
Ортотитанат ж е л ез а (II)—Fe2TiO4 (мол. вес 223,59) об-
разуется в системе FeO—TiO2; практически может быть получен
после многочасового сплавления смеси 5 частей дифторида железа
?41
и 2 частей метатитановой кислоты в среде хлоридно-натриевого
расплава. Ортотитанат железа (II) представляет собой красные бле-
стящие кристаллы ромбической сингонии; плотность 4,37 а/сти3;
температура плавления 1375° С. Теплоемкость при 25° С равна
34,01 кал/(град моль). Зависимость теплоемкости от температуры
в интервале от 25 до 1300° С выражается уравнением: Ср = 33,34 +
+ 0,015087’ — 340 000/74
Энтальпия при 25° С равна 3995 кал/моль. Энтропия при 25° С
составляет 40,38 кал/(град-моль). Приведенная энергия Гиббса
равна —27,0 кал/(град-моль). Ортотитанат железа(П) немаг-
нитен.
Метатитанат железа(П) — FeTiO3 (мол. вес 151,745)
встречается в природе в виде минерала кричтонита. Искусственно
он может быть получен спеканием эквимолекулярных количеств
одноокиси железа и двуокиси титана при 700° С или же сплавле-
нием эквимолекулярных количеств дихлорида железа и метати-
тановой кислоты. Теплота образования метатитаната железа
295,55 ккал/моль. Энергия Гиббса образования 277 ккал/моль.
Метатитанат железа представляет собой железно-черные кри-
сталлы гексагональной сингонии плотностью 4,75 г/см3. Темпера-
тура плавления 1365° С; теплота плавления 21,7 ккал/моль (или
143 кал/г). Зависимость теплоемкости от температуры в интервале
от 25 до 1360° С выражается уравнением: Ср — 27,87 + 0,00436Г —
— 479 100/74 Теплоемкость расплавленного метатитаната железа
(1370—1500° С) составляет 47,60 кал/(град моль). Энтальпия при
25° С равна 4044 кал/моль. Энтропия при 25° С составляет
25,32 кал/(град-моль). Приведенная энергия Гиббса при 25°С со-
ставляет —11,76 кал/ (град • моль).
Химически метатитанат железа довольно стоек. При действии
водорода (1000—2000° С) происходит восстановление только поло-
вины железа и образование дититаната:
2FeTiO3 + Н2 = Fe + FeTi2O5 + Н2О
Вода и разбавленные кислоты на метатитанат железа не дейст-
вуют, а концентрированной серной кислотой и смесью хлороводо-
рода и кислорода он разлагается при нагревании.
Дититанат железа(П) — FeTi2O5— образуется в системе
FeO — TiO2 только в восстановительной среде (водород, углерод,
окись углерода). Температура плавления дититаната железа(II)
выше 1450° С. Теплоемкость при 25° С равна 39,26 кал/(град • моль).
Стандартная энтропия 37,4 кал/(град моль).
Метатитанат диоксид желез а(Ш)—Fe2O2(TiO3)
(мол. вес 239,59) встречается в природе в виде минерала псевдо-
брукита. Искусственно может быть получен спеканием эквимоле-
кулярных количеств полутораокиси железа и двуокиси титана. Ме-
татитанатдиоксид железа(III) представляет собой красно-коричне-
вые кристаллы. Теплоемкость при 25°С равна39,26кал/(град-моль).
Зависимость теплоемкости от температуры в интервале от 25 до
1400° С выражается уравнением: Ср = 46,03 + 0,005267' — 741 000/74
242
Энтальпия при 25° С равна 4069 кал/моль. Энтропия при 25° С
составляет 37,4 кал/ (град • моль). Приведенная энергия Гиббса
—23,8 кал/(град-моль). В воде метатитанатдиоксид железа(Ш)
нерастворим; разлагается концентрированными кислотами.
Ортотитанат железа(Ш)—Fe4(TiO4)3— образуется при
сплавлении смеси 4 частей полутораокиси железа и 3 частей дву-
окиси титана в среде хлоридно-натриевого расплава; представляет
собой коричневые призматические кристаллы.
Метатитанат желез а(Ш) — Fe2(TiO3)3 — встречается в
природе в виде минерала аризонита. Искусственно может быть по-
лучен путем прокаливания трисульфатометатитаната железа(III).
Термодинамические функции титанатов железа приведены в При-
ложении 46.
Титанаты кобальта и никеля. Метатитанат кобаль-
та (II)— СоТЮз (мол. вес 154,83) образуется при сплавлении ди-
хлорида кобальта с титановой метакислотой:
СоС12.+ Н2ТЮ3 = С0ТЮ3 + 2НС1
Теплота образования метатитаната кобальта составляет
288,5 ккал/моль-, энергия Гиббса образования 269 ккал/моль.
Метатитанат кобальта представляет собой кристаллы ромбо-
эдрической сингонии (а = 548,5 пм, а = 55°OF); плотность 5,4 г/см3.
Температура конгруэнтного плавления 1470° С. Стандартная энтро-
ния 23,8 кал/ (град-моль'
Ортотитанат кобальта — Со2ТЮ4 — образуется при спе-
кании одноокиси кобальта с двуокисью титана при высокой темпе-
ратуре. Он представляет собой кристаллы с плотностью 5,07 г./см3
и температурой конгруэнтного плавления 1575° С.
В системе СоО — TiO2 образуется также дитит.ан ат кобаль-
та— СоПгОз, инконгруэнтно плавящийся при 1505° С с выделением
кристаллов двуокиси титана.
Метатитанат никеля — NiTiOg (мол. вес 154,61) обра-
зуется при сплавлении дихлорида никеля с титановой метакисло-
той. Теплота образования его 288 ккал/моль. Метатитанат никеля
представляет собой зеленоватые кристаллы; плотность 5,07 г/см3.
В воде нерастворим.
Ортотитанат никеля—Ni2TiO4 — зеленые кристаллы;
плотность 4,7 г/см3.
Титанаты меди и серебра. Метатитанат меди — CuTiO3—
образуется при спекании окиси меди с двуокисью титана или при
сплавлении дихлорида меди с титановой метакислотой.
Ортотитан атоксид меди — Cu3O(TiO4)— получают на-
греванием смеси ЗСпО + TiO2 до 1000—1100° С с последующим бы-
стрым охлаждением. Кристаллы его тетрагональной сингонии (а =
= 810, с = 660 пм). Диэлектрическая проницаемость при 30°С
равна 30.
Метатитанат серебра — Ag2TiO3 — получают спеканием
эквимолекулярных количеств окиси серебра и двуокиси титана.
243
Известны также дититанат — AgaTbOs, трититанат —
AggTisO? и тетратитанат серебра — Ag2Ti4O9.
Титанаты цинка. В системе ZnO — ТЮ2 образуются шесть ти-
танатов различного состава, из которых наиболее хорошо изучены
орто- и метатитанат.
Ортотитанат цинка — Zn2TiO4 (мол. вес 242,64) образует-
ся при нагревании смесей двуокиси титана с окисью или нитратом
цинка, взятых в мольном соотношении 1 :2. Порошкообразный
ортотитанат цинка получается также при нагревании смеси мета-
титановой кислоты с гидроокисью цинка, взятых в том же мольном
отношении. Кристаллический ортотитанат цинка образуется после
3—4 часового нагревания смеси оксидов титана и цинка в хлорид-
но-натриевом расплаве. Теплота образования Zn2TiC>4 составляет
391,6 ккал!моль.
Ортотитанат цинка представляет собой белые кристаллы в фор-
ме правильных октаэдров кубической сингонии (а = 846 пм).
Плотность при 0°С равна 5,29 г/см3, при 25° С — 5,12 г/см3. Темпе-
ратура плавления 1549° С. Теплоемкость Zn2TiO4 при 25° С равна
32,8 кал!(град-моль). Энтропия 34,2 кал/ (град моль). Диэлектри-
ческая проницаемость 26. В воде нерастворим. Разлагается соля-
ной кислотой.
Метатитанат цинка — ZnTiO3 (мол. вес 161,27) образуется
при нагревании смеси эквимолекулярных количеств окиси цинка
и двуокиси титана. После высушивания с последующим прокали-
ванием смеси гидроксидов цинка и титана, полученной совместным
осаждением аммиаком из растворов, содержащих эквивалентные
количества Zn и TiIV, также образуется метатитанат цинка. Теп-
лота образования ZnTiO3 равна 309,1 ккал/моль.
Метатитанат цинка представляет собой белые кристаллы гекса-
гональной сингонии (а = 508, с = 1392 пм) типа ильменита. Плот-
ность при 25°С равна 3,17 г/см3. Диэлектрическая проницае-
мость 30. При облучении катодными лучами проявляет синюю
люминесценцию. При восстановлении в токе водорода образует
одноокись титана. В воде нерастворим.
Дититанат цинка — ZnTi2O5 — образуется при спекании
смеси оксидов титана и цинка, взятых в мольном соотношении 2 : 1.
Плотность при 25°С 4,3 г/см3.
Трититанат цинка — ZnTi3O7 — образуется при нагревании
смеси 5 частей окиси цинка и 7 частей двуокиси титана во фто-
ридно-калиевом расплаве. Он представляет собой серо-стальные
иглообразные кристаллы; плотность 4,92 г/см3. В воде нерастворим.
Из титанатов цинка более сложного состава известны орто ди-
титанат — Zn3Ti2O7, пентатитанат — Zn4Ti50i4 и ортотри-
титанат— Zn2Ti30s. Первый образуется при нагревании 1 части
двуокиси титана, 3 частей сульфата цинка и 2 частей сульфата ка-
лия. Это — желтый кристаллический порошок; плотность 3,83 г/см3.
Второй — образуется при нагревании 3 частей двуокиси титана,
12 частей сульфата цинка и 1 части сульфата калия. Это — кри-
244
сталлы в виде табличек кофейного цвета; плотность 3,68 г/см3.
Третий также кристаллический; плотность 3,9 г/см3.
Титанаты кадмия. Метатитанат кадмия — CdTiO3 (мол.
вес 208,30) образуется при нагревании смеси эквимолекулярных
количеств окиси кадмия и двуокиси титана сначала до 950° С,
а затем до 1250° С. Метатитанат калия при обычной температуре
представляет собой светло-желтые кристаллы ромбической синго-
нии (а = 1083,4, 6 = 1069,5, с = 761,5 пм). Плотность 6,5 г/см3.
Диэлектрическая проницаемость 250. При высокой температуре
метатитанату кадмия свойственна структура типа перовскита.
В воде метатитанат кадмия нерастворим.
Дититанат кадмия — CdTi2Os— образуется при спекании
смеси окиси кадмия и двуокиси титана, взятых в мольном соотно-
шении 1 :2. Дититанат представляет собой желтоватые кристаллы;
плотность 7,4 г/см3. В воде не растворяется.
Метатрититанат кадмия — CdTi3O7 — образуется при
спекании смеси окиси кадмия и двуокиси титана, взятых в мольном
соотношении 1 :3. Кристаллическое вещество плотностью 7,9 г/см3.
Ортотитанат кадмия — Cd2TiO4— образуется лишь в не-
котором количестве при спекании метатитаната кадмия с избыт-
ком окиси кадмия при 1300—1400° С.
Существует также ортотрититанат кадмия — Cd2Ti3o8 —
кристаллы; плотность 7,1 г/см3.
Оксотитанаты бериллия, свинца
И висмута 2,171,177,179
Титанаты бериллия. Сплавлением или спеканием окиси берил-
лия с двуокисью титана могут быть получены сплавы, содержащие
различные титанаты бериллия. На рис. 54 представлена диаграмма
плавкости системы ВеО— ТЮ2. Кривая ликвидуса проходит через
три эвтектические точки и расположенные между ними два дистек-
тических максимума. Максимумы соответствуют составам
2ВеО-ТЮ2 и ВеО-ТЮ2, т. е. ортотитанату и метатитанату бе-
риллия.
Ортотитанат бериллия — Ве2ТЮ4 (мол. вес 129,92) мо-
жет быть получен спеканием смеси гидроокиси бериллия и дву-
окиси титана, взятых в мольном соотношении 2:1. Ортотитанат
бериллия представляет собой светло-желтый кристаллический по-
рошок. При 1780°С конгруэнтно плавится. Диэлектрическая про-
ницаемость 30. Разлагается кипящей соляной кислотой.
Метатитанат бериллия — ВеПО3 (мол. вес 104,91) об-
разуется, как уже отмечалось, в системе ВеО — ТЮ2. Он представ-
ляет собой желтоватый кристаллический порошок. При 1720° С
конгруэнтно плавится. Диэлектрическая проницаемость 70. В воде
нерастворим. Разлагается кипящей соляной кислотой.
Титанаты свинца. Метатитанат свинца — РЬТЮ3 (мол.
вес 303,09) является важным сегнетоэлектрическим материалом.
Существенным отличием его от метатитаната бария является то,
245
что он сегнетоэлектрически активен до температуры 490е С, кото-
рая является для него точкой Кюри.
Метатитанат свинца(II) образуется при сплавлении одноокиси
свинца и двуокиси титана, причем первая в связи с ее относитель-
ной летучестью должна быть взята в некотором избытке; однако
при этом трудно получить метатитанат свинца в более или менее
чистом виде. Метатитанат образуется также при спекании дву-
окиси титана с карбонатгидроксидом свинца(II). Чистый метати-
танат свинца можно получить при
Рис. 54. Диаграмма плавкости
системы ВеО—ТЮ2.
прокаливании триоксалатотитаната
свинца(П)— РЬ[Т1(С2О4)з]. Монокри-
сталлы метатитаната свинца можно
вырастить из его расплава, однако
этот процесс сложнее, чем аналогич-
ный процесс^для метатитаната бария,
из-за сравнительной летучести окиси
свинца при высоких температурах; в
качестве растворителей при выращи-
вании монокристаллов метатитаната
свинца используют оксид или метабо-
рат свинца(II), фторид калия, мета-
силикат натрия.
При обычной температуре метати-
танат свинца кристаллизуется в тет-
рагональной сингонии; он изоморфен
тетрагональной форме метатитаната
бария (а = 390,4, с = 415,0 пм). Плот-
ность метатитаната свинца при 25° С
составляет 8,05 г/см3. Температура ин-
конгруэнтного плавления 818° С.
В воде метатитанат свинца не рас-
творяется. Разлагается при нагрева-
нии с концентрированными кисло-
тами.
Метатитанат свинца(II) способен
давать непрерывные ряды твердых
растворов с изоморфными ему метати-
танатами, метацирконатами, метастаннатами других двухвалент-
ных металлов, а также другими солями, имеющими формулу типа
МеЭО3 (например, КМЬОз, ЬаАЮз). Эти твердые растворы обла-
дают интересными сегнетоэлектрическими свойствами.
Трехводное соединение метатитаната свинца, или гексагид-
роксотитанат с в и н ц а (II)—Pb[Ti (ОН)6]— образуется в виде
осадка при смешении растворов соли свинца(II) и титаната ще-
лочного металла.
Трититанат свинца — PbTi3O7 — образуется при сплавле-
нии одноокиси свинца и двуокиси титана, взятых в мольном со-
отношении 1:3. Трититанат свинца кристаллизуется в моноклин-
246
ной сингонии (а = 1073,2, & = 381,2, с — 657,8 пм и (3 = 98° 05z).
Плотность 5,79 г!смъ. При температуре выше 850° С трититанат
распадается на метатитанат свинца и двуокись титана (рутил).
Титанаты висмута. В системе Bi2O3— TiO2 образуются три со-
единения: Bi8O]0(TiO4) — ортотитанатдекоксид, 2Bi2O3-3TiO2— ор-
тотитанат и Bi2O3-4TiO2— дититанатметатитанат висмута.
Ортотитанатдекоксид висмута — Bi8O10(TiO4) — ин-
конгруэнтно плавится при 865°С с выделением кристаллов орто-
титаната висмута, с полутораокисью висмута образует эвтектику,
кристаллизующуюся при 835° С.
Ортотитанат висмута — Bi4(TiO4)3 (мол. вес 1219,51) —
является сегнетоэлектриком с точкой Кюри (обратимое фазовое
превращение) при 670°С. При 1210°С инконгруэнтно плавится
с выделением кристаллов дититанатметатитаната висмута.
Дититанатметатитанат висмут а—Bi2(TiO3)2(Ti2O5) —
инконгруэнтно плавится при 1275° С с выделением кристаллов дву-
окиси титана.
Существует также метатитанат висмута — В12(Т10з)з, не
отмечаемый на диаграмме состояния системы Bi2O3 — TiO2.
ПЕРЕКИСНЫЕ СОЕДИНЕНИЯ ТИТАНА
Среди перекисных соединений титана наибольшее значение
имеют пероксотитановые кислоты и пероксотитанаты. Так назы-
ваются продукты замещения кислородных лигандов в титановых
оксокислотах и оксотитанатах на пероксо-группы —О—О—. Из
этих соединений лучше всего изучены монопероксосоединения, т. е.
продукты замещения одного кислородного лиганда на одну перок-
со-группу. Встречаются ди-, три- и даже тетрапероксотитанаты.
Кроме кислородных пероксокислот и их солей существуют пере-
кисные соединения титана, в которых наряду с пероксо-группами
содержатся атомы галогенов или другие кислотные остатки.
Пероксотитановые кислоты '> 191~195
Для титана характерны перекисные кислоты, которые обра-
зуются при действии перекиси водорода на кислые или нейтраль-
ные растворы соединений титана(IV). Раствор при образовании
в нем перекисных соединений титана окрашивается в интенсивный
оранжевый цвет. Из концентрированного раствора при действии
аммиака выпадает аморфный светло-коричневый осадок пероксо-
ти^ановой кислоты. Эта кислота обычно образует гель с пере-
менным содержанием воды. При обезвоживании геля ацетоновой
сушкой при 0° С получают остаток состава H4TiOs. В этом соеди-
нении на один атом титана приходится одна гидропероксо-группа
—О—О—Н, обусловливающая восстановление перманганата в
разбавленном сернокислотном растворе в количестве, эквивалент-
ном восстанавливаемому одной молекулой перекиси водорода.
247
Пероксотитановая кислота образуется также при обработке све-
жеосажденной ортотитановой кислоты нейтральным раствором пе-
рекиси водорода.
Полученная тем или иным путем пероксотитановая кислота
представляет собой соединение вполне определенного состава; при-
сутствие в ней гидропероксо-группы усиливает кислотные свойства,
в связи с чем она в отличие от условно называемых титановых
оксокислот действительно является кислотой. Ее строение может
быть представлено формулами:
При обезвоживании этой пероксоортотитйновой кислоты выдержи-
ванием ее над концентрированной серной кислотой она переходит
в пероксометатитановую кислоту — H2TiO4, строение которой мо-
жет быть представлено в виде
Н
/ОН’
о—о—т/
или
О—О—Ti
О’
о
Пероксотитановые (орто- и мета-) кислоты представляют собой
оранжевые порошки. Уже при обычной температуре они медленно
разлагаются с отделением кислорода, постепенно обесцвечиваясь.
В чистой воде они не растворяются; пероксоортотитановая кислота
в водной среде легко образует коллоидные растворы.
Пероксометатитановую кислоту можно рассматривать так же
как пероксиддигидроксид титана — Ti(OH)2O2. Это соединение об-
разуется обычно при действии перекиси водорода на элементар-
ный титан:
Ti + ЗН2О2 = Ti(OH)2O2 + 2Н2О
Обезвоживание ее должно было бы приводить к образованию
оксидпероксида титана — Ti(O2)O. Однако на самом деле это со-
единение выделить не удается.
Пероксотитанаты 2’ 194-196
Пероксотитанатами называются соли перекисных кислот ти-
тана. Их можно рассматривать как продукты замещения атомов
кислорода в титанатах на пероксо-группы. В зависимости от числа
замещенных пероксо-группами кислородных атомов могут обра-
зовываться моно-, ди-, три- и тетрапероксотитанаты. Пероксотита-
наты в отличие от нормальных титанатов устойчивы в водных рас-
творах. Все пероксотитанаты окрашену в оранжевый цвет и яв-
243
ляются сильными окислителями. Лучше всего изучены пероксоти-
танаты щелочных металлов.
Пероксотитанаты лития. Известно одноводное соединение пер-
оксометатитаната лития — Li2Ti(O2)O2-H2O, или ди оксо-
гидро к сот и дропероксотитанат лития (мол. вес 143,79) —
Li2[Ti (ООН) (ОН) О2], которое образуется при обработке мета-
титаната лития водным раствором перекиси водорода. Диоксо-
гидроксогидропероксотитанат лития представляет собой оранжевые
кристаллы тетрагональной сингонии; плотность при 20°С равна
2,26 г/с.и3 Растворим в воде; нерастворим в спирте, эфире, бензоле.
Способен ко всем реакциям, свойственным пероксо-группе, в том
числе к окислению раствором перманганата с выделением молеку-
лярного кислорода.
Пероксотитанаты натрия. Пероксомета титанат нат-
ри я — Na2Ti(О2)О2 (мол. вес 157,88) образуется при сплавлении
двуокиси титана с перекисью натрия:
NajO2 + ТЮ2 = Na2[T i (О2)Оа]
Пероксометатитанат натрия представляет собой оранжево-крас-
ные кристаллы. В воде, а также в растворах кислот растворим.
Используется для приготовления стандартного раствора для коло-
риметрического определения титана по пероксидному методу. Не-
обходимый для приготовления такого раствора сплав получают
путем сплавления 1 части двуокиси титана с 5 частями перекиси
натрия; при этом двуокись титана количественно переходит в пе-
роксометатитанат натрия.
Одноводное соединение пероксометатитаната натрия — Na2TiO4-
• Н2О, или иначе диоксоги дроксоги д р о п е р о ксот ита н ат
натрия — Na2[Ti (ООН) (ОН)О2] (мол. вес 175,90) образуется при
обработке метатитаната натрия водным раствором перекиси водо-
рода. Диоксогидроксогидропероксотитанат натрия представляет со-
бой оранжевые кристаллы тетрагональной сингонии; плотность при
20° С равна 2,49 г!см\ Растворим в воде; нерастворим в спирте,
эфире, бензоле.
Трехводное соединение пероксометатитаната натрия — Na2TiO4-
• ЗН2О, или пента г и др о ксоги д р опер о к с о т и т а н а т нат-
рия— Na2[Ti(OOH) (ОН)5] образуется в растворе при нейтрали-
зации пероксотитановой кислоты гидроокисью натрия в присут-
ствии перекиси водорода. В кристаллическом состоянии выделяется
при высаливании спиртом из раствора пероксометатитаната нат-
рия. Пентагидроксогидропероксотитанат натрия представляет со-
вой желтый порошок.
Тетрапероксотитанат натрия — Na4[Ti (О2)4]-2Н2О —
образуется при взаимодействии перекиси натрия с пероксотита-
новой кислотой. Структура этой соли может быть представлена
формулой Na4[Ti(OOH)4O2], Таким образом, это диоксотетрагид-
ропероксотитанат натрия. Соль представляет собой белую мелко-
249
кристаллическую массу; при высушивании, а также при растворе-
нии в воде разлагается с выделением кислорода.
Пероксотитанаты калия. Одноводное соединение пероксоме-
татитаната калия — К2ТЮ4-Н2О, или диоксогидроксогид-
ропероксотитанат калия — K2[Ti(ООН) (ОН)О2] — обра-
зуется при обработке метатитаната калия водным раствором пере-
киси водорода и представляет собой оранжевые кристаллы тетра-
гональной сингонии; плотность при 20°С равна 2,29 г)см3. Раство-
рим в воде; нерастворим в спирте, эфире, бензоле.
Тетрапероксотитанат калия — K4[Ti (О2)4]-6НгО — об-
разуется при нейтрализации раствора пероксотитановой кислоты
гидроокисью калия в присутствии перекиси водорода. Из раствора
соль выделяется в виде белой кристаллической массы при добав-
лении спирта.
Пероксотитанаты рубидия и цезия. Пероксометатитанат
рубидия — Rb2Ti(O2)O2— образуется при обработке метатита-
ната рубидия раствором перекиси водорода и представляет собой
оранжевые кристаллы тетрагональной сингонии; плотность при
20° С равна 2,72 г/см3.
Диоксогидроксогидропероксотитанат цезия —
Cs2[Ti(OOH) (ОН)О2]— образуется при обработке метатитаната
цезия раствором перекиси водорода и представляет собой оран-
жевые кристаллы; плотность при 20°С 3,11 г/см3.
ГАЛОТИТАНОВЫЕ КИСЛОТЫ.
ГАЛОТИТАНАТЫ
Комплексные соединения, образующиеся при взаимодействии
ионных галидов металлов и кислотообразующих галидов, назы-
ваются галосолями, а комплексные кислоты, от которых они могут
быть произведены, — галокислотами.. Подобно тому, как основные
и кислотные оксиды обладают в известной степени противополож-
ными свойствами, взаимно нейтрализующимися при их соедине-
нии в соли оксокислот, аналогичные различия в химических свой-
ствах обнаруживают также галиды металлических и неметалличе-
ских элементов. Мы можем назвать галид металла, играющий ту
же роль, что и основные оксиды, основным галидом. Тогда любой
из тетрагалидов титана (который в степени окисления +4 можно
рассматривать как элемент, образующий кислоты) может быть
назван кислотообразующим галидом, а галосоли можно рассмат-
ривать как продукты взаимодействия основных и кислотообразую-
щих галидов. Тетрагалиды титана, являющиеся кислотообразую-
щими галидами, способны при взаимодействии с основными гали-
дами образовывать большое число галосолей, называемых галоти-
танатами и имеющих общую формулу Ме2Т1Ге. Общая формула
кислот, соответствующих этим солям, т. е. титановых галокислот,
очевидно, Н2[ПГб].
250
Фторотитанаты 66 197.198
Титановая фторокислота в свободном состоянии не выделена.
Так, сухой фтороводород не действует на тетрафторид титана. Од-
нако в водных растворах, содержащих TiF4 и HF, обнаружены
гексафторотитанат-ионы TiF^~ (rTi_F=192 run). Это указывает на
существование гексафторотитановой кислоты H2TiF6, многочислен-
ные соли которой, называемые гексафторотитанатами, хорошо из-
вестны. Образование гаксафторотитановой кислоты наблюдается
также при растворении элементарного титана в нагретой смеси
азотной и плавиковой кислот. Теплота образования H2TiF6 в рас-
творе составляет 555,1 ккал/моль.
Гексафторотитанаты щелочных металлов. Общая формула гек-
сафторотитанатов щелочных металлов — Me2TiF6. Эти соли в боль-
шинстве случаев изоморфны с фторосиликатами и фторостанна-
тами, а в некоторых случаях — с фтороцирконатами. В отличие от
оксотитанатов гексафторотитанаты щелочных металлов устойчивы
в водных растворах. Последние бесцветны вследствие бесцветности
аниона TiFe-. Общим способом получения гексафторотитанатов яв-
ляется растворение гидроксида или карбоната соответствующего
металла в концентрированном растворе диоксида или тетрафто-
рида титана в плавиковой кислоте. Ниже приводятся сведения
о некоторых представителях этого ряда солей.
Гексафторотитанат лития — Li2[TiF6] (мол. вес 175,77)
представляет собой бесцветные кристаллы с температурой плав-
ления 480° С. При плавлении происходит частичное разложение
с улетучиванием тетрафторида титана:
Li2[TiF6] = 2LiF + TiF4
Этот процесс начинается уже при 430° С. В воде 'гексафторотита-
нат лития легко растворим; при 22° С растворимость составляет
32%. С водой гексафторотитанат лития образует двуводное соеди-
нение Li2TiF6-2H2O— маленькие, блестящие, иглообразные кри-
сталлы тетрагональной сингонии, которые медленно выветриваются
на воздухе при обычной температуре и быстро — при нагревании.
Полное обезвоживание происходит при 105° С. Растворимость гек-
сафторотитаната лития в 98 %-ном спирте при 22° С составляет
0,04%.
Гексафторотитанат н а т р и я — Na2TiFe (мол. вес
207,87)—представляет собой маленькие гексагональные призмы
с температурой плавления 700° С. При плавлении частично разла-
гается с улетучиванием тетрафторида титана.. Кристаллизуется
в гексагональной сингонии (« = 921, с = 515 пм). Растворимость
гексафторотитаната натрия в воде при 20° С составляет 6,1%; рас-
творимость в 98%-ном спирте — 0,004%.
Гексафторотитанат калия—K2TiF6 (мол. вес 240,095,
теплота образования 695,4 кал/моль) — представляет собой малень-
кие блестящие пластинки тригональной сингонии (« = 571, с =
251
= 465 пм), которые при 300—350°С переходят в кубическую
(я = 832 пм). Плотность гексафто.ротитаната кадия при 15°С
равна 3,012 г/см3. При 780° С гексафторотитанат калия плавится
с частичным разложением, сопровождающимся улетучиванием тет-
рафторида титана. Полное разложение происходит при 865° С.
В токе водорода при температуре красного каления восстанавли-
вается до IvHFg. В воде гексафторотитанат растворим сравни-
тельно плохо. Зависимость растворимости (в %) от температуры
в интервале от 0 до 100° С выражается уравнением:
/ = 0,55 + 0,037/— 2 • IO-"1 F. +4,4 • 10-6/3 + 3 • 10“а7*
Растворимость гексафторотитаната калия в 98 %-ном спирте
при 22°С составляет 0,006%.
С водой гексафторотитанат калия образует одноводное соедине-
ние КУПРв-НгО — крупные пластинки моноклинной сингонии, кото-
рые при высушивании становятся молочно-белыми. Давление дис-
социации одноводного соединения гексафторотитаната калия при
30° С составляет около 20 мм рт. ст. В связи с этим кристаллы одно-
водного соединения легко обезвоживаются при выветривании на
воздухе со средней относительной влажностью уже при 30° С. Из
насыщенных водных растворов безводная соль кристаллизуется при
температуре выше 30° С; при обычной температуре безводная соль
кристаллизуется из растворов, содержащих плавиковую кислоту.
В водных растворах гексафторотитанат калия реагирует с ги-
дроксидами щелочных металов по уравнению:
К2 [TiFe] + 4КОН = 6KF + H4Tt О4
Таким образом, раствор гексафторотитаната калия может быть
оттитрован щелочью, хотя сам он не имеет кислой реакции.
Гексафторотитанат рубидия — RbafTiFe] (мол. вес
332,83) образуется при взаимодействии ацетата рубидия с рас-
твором двуокиси титана в плавиковой кислоте. Он представляет
собой маленькие блестящие пластинки, плавящиеся при 750° С
с частичным разложением на фториды рубидия и титана (IV). Тем-
пература полного разложения 810° С. Растворимость в воде при
22° С составляет 0,8%; в спирте нерастворим. Кристаллизуется
в тригональной сингонии (а = 588, с = 478 пм), а при 300—350° С
переходит в кубическую (а = 849 пм).
Гексафторотитанат цезия — Cs2TiF6 (мол. вес 427,70) —
кристаллизуется в тригональной сингонии (а = 615, с = 496 пм)-,
при 300—350° С переходит в кубическую (а = 896 пм). При 690° С
плавится. Разлагается при 750° С. Растворимость в воде при 22° С
равна 2,4%, в спирте — 0,0025%.
Известен также октафторотитанат цезия — Cs4TiF8.
Фторотитанаты щелочноземельных, переходных и прочих метал-
лов. Щелочноземельные металлы — магний, кальций,
стронций и барий — образуют гексафторотитанаты с общей фор-
мулой MeTiFe преимущественно в виде водных соединений. Гек-
252
сафторотитанаты щелочноземельных металлов изоморфны соответ-
ствующим гексафторосиликатам. Общим способом их получения
является взаимодействие карбоната соответствующего металла с
концентрированным раствором диоксида или тетрафторида титана
в плавиковой кислоте. Известные гексафторотитанаты щелочно-
земельных металлов перечислены в табл. 9,
Таблица 9. Гексафторотитанаты щелочноземельных металлов
Формула Мол. вес Внешний вид, свойства
Mg [TiFJ • 6Н2О 186,20 + 108,09 Иглообразные кристаллы гексагональной сингонии (о = 977, с = 985 пм)
Са [TiF6] • 2Н2О Са [TiF6] • ЗН2О 201,97 + 36,03 201,97 + 54,05 Призматические кристаллы, растворимы в воде, содержащей HF; чистой водой гидролизуются
Sr [TiF6] • 2Н2О 249,51 + 36,03 Маленькие блестящие кристаллы моно- клинной сингонии, растворимы в холод- ной воде
Ba [TiFe] • 0,5Н2О 299,23 + 9,01 Кристаллы, мало растворимы в холодной воде
Многие переходные металлы—марганец, железо, ко-
бальт, никель, медь, цинк, кадмий — также образуют гексафтороти-
танаты преимущественно в виде гексаквасоединений (табл. 10).
Известны также двойные фторотитанаты с некоторыми переход-
ными металлами, например гептафторотитанат калия — тетраква-
меди — K[Cu (OH2)JTiF7.
Таблица 10. Гексафторотитанаты переходных металлов
Формула Мол. вес Внешний вид, свойства
[Мн (Н2О)6[ TiF6 216,83+ 108,09 Кристаллы гексагональной сингонии
[Fe (H2O)eJ TiF6 217,74+ 108,09 Зеленовато-желтые призматические кристаллы
[Co (H2O)e] T1F6 220,82+ 108,09 Кристаллы гексагональной сингонии
[Ni (H2O)e[ TiF6 220,60+ 108,09 Зеленые кристаллы гексагональной сингонии
[Cu (H2O)4] TiF6 225,435 + 72,06 Сине-голубые иглообразные кристаллы моноклинной сингонии (а = 550,9, 6=982, с = 741,3 пм, 0 = 104° 27'); плотность 2,22 г/сл3.
[Zn (H2O)e] TiF6 227,26+ 108,09 Кристаллы гексагональной сингонии, призмы; плотность 2,106 г/см3.
[Cd (H2O)6J TiFe 274,29 + 108,09 Кристаллы гексагональной сингонии
233
Из фторотитанатов прочих металлов следует отметить гекса-
фторотитанат таллия(1) — Tl2TiFe (мол. вес 570,63), кри-
сталлизующийся в тригональной сингонии (а = 592, с = 484 пм)
с переходом при 300—350°С в кубическую (а = 846 пм), и гекса-
фторотитанат свинца — PbTiFe-3H2O (мол. вес 369,08 +
+ 54,045), кристаллизующийся в моноклинной сингонии (призмати-
ческие кристаллы).
Фторотитанаты аммония и других азотистых оснований. Гекса-
фторотитанат аммония—(NH^aTiFe (мол. вес 197,97)
образуется в растворе при взаимодействии фторидов аммония и
титана (IV) или при нейтрализации аммиаком раствора гексафто-
ротитановой кислоты. Гексафторотитанат аммония представляет
собой блестящие чешуйчатые кристаллы тригональной сингонии
(а = 596, с = 482 пм). При нагревании распадается с выделением
фторида аммония (вернее, аммиака и фтороводорода). Раствори-
мость гексафторотитаната аммония в воде при 22° С составляет
20%, растворимость в 98%-ном спирте при 22° С — 0,005%. Данные
о растворимости в воде нельзя считать точными, так как гексафто-
ротитанат аммония в водных растворах, а также на влажном воз-
духе гидролизуется. Серной кислотой гексафторотитанат аммония
разлагается.
Гептафторотитанат аммония — (NH4) 3TiF7 — обра-
зуется вместе с гексафторотитанатом при нейтрализации аммиаком
растворов гексафторотитановой кислоты; кристаллизуется также
из растворов гексафторотитаната аммония после добавления к нему
избытка фторида аммония и аммиака. Гептафторотитанат аммония
представляет собой кристаллы с двойным лучепреломлением, изо-
морфные с гептафторосиликатом аммония. Известна также
двойная соль гептафторотитанат аммония — тетраквамеди —
NH4[Cu(OH2)4]TiF7.
Гексафторотитанат гидразония состава (N2H5)2TiF6-
• 2Н2О — образуется при смешении водных растворов гидразина и
гексафторотитановой кислоты при охлаждении. При высушивании
в вакууме над серной кислотой гексафторотитанат гидразония вы-
деляется в виде бесцветных прозрачных кристаллов.
Гексафторотитанат гидроксоаммония—
(NH3OH)2TiFe-NH2OH — образуется при смешении водных рас-
творов гидроксиламина (20%-ного) и гексафторотитановой кисло-
ты. При высушивании в вакууме над серной кислотой образуется
масса, из которой путем перекристаллизации из метанола выде-
ляют маленькие белые кристаллы гексафторотитаната гидроксо-
аммония.
Хлоротитановые кислоты 84- 199-202
Хлоротитановые кислоты, т. е. комплексные кислоты, в анионах
которых все лиганды являются хлорид-ионами (полные, или пре-
дельные, хлорокислоты), должны, очевидно, образовываться при
264
взаимодействии тетрахлорида титана с хлороводородом. Кроме та-
ких полных хлоротитановых кислот могут образовываться комп-
лексные кислоты, в анионах которых только часть лигандов являет-
ся хлорид-ионами, а остальными лигандами могут быть оксид- или
гидроксид-ионы. Такие неполные хлоротитаиовые кислоты могут
получаться при взаимодействии хлороводорода с диоксидом или
дихлороксидом титана или же воды с тетрахлоридом титана. Не-
полный гидролиз тетрахлорида титана приводит к образованию
ряда хлорогидроксокислот, а присоединение хлороводорода к ди-
оксиду или дихлороксиду титана — к образованию хлороксокислот.
Система TiCl4—НС1. Как уже отмечалось, жидкий тетрахло-
рид титана смешивается во всех отношениях с жидким хлороводо-
родом (под давлением) и растворяет газообразный хлороводород;
Рис. 55. Диаграмма кристаллизации системы TiCl4—НС1.
в свою очередь, твердый тетрахлорид титана растворяется в жид-
ком хлороводороде. Значения температуры начала кристаллизации
(ликвидуса) смесей тетрахлорида титана с хлороводородом при-
ведены в Приложении 47.
На рис. 55 представлена диаграмма кристаллизации системы
TiCU — НС1. Кривая ликвидуса проходит через три эвтектические
точки и через расположенные между ними два дистектических
максимума, соответствующих соединениям TiCl4-2HCl, т. е. H2TiCle
и TiCl4-6HCl, т. е. H6TiCl10.
Гексахлоротитановая кислота — H2TiCle (мол. вес
262,64) образуется в системе TiCl4— НС1; практически может быть
получена путем смешения 4 частей хлороводорода и 21 части
тетрахлорида титана при сильном охлаждении или же путем на-
сыщения охлажденного (до —25° С) тетрахлорида титана газо-
образным хлороводородом. В водном (вернее, солянокислотном)
255
растворе гексахлоротитановая кислота получается в виде ярко-жел-
той жидкости при растворении тетрахлорида титана в концентри-
рованной соляной кислоте с одновременным пропусканием сухого
хлороводорода, причем выделяется большое количество теплоты.
Температура кристаллизации —30,8° С. Кислота достаточно устой-
чива при температурах ниже 0° С; выше 0° С она заметно разла-
гается на тетрахлорид титана и хлороводород. Гексахлоротитано-
вая кислота может быть растворена только в очень концентриро-
ванной соляной кислоте (около 45% НС1) при t < 0° С. В таких
растворах установлено наличие комплексного аниона [TiCle]2-
с межатомным расстоянием Ti—Cl, равным 235 пм. При разбавле-
нии таких растворов водой или при повышении температуры гекса-
хлоротитанат-ион подвергается гидролизу, в процессе которого про-
исходит последовательное замещение атомов хлора на гидроксо-
группы; гидролиз сопровождается обесцвечиванием раствора. Гек-
сахлоротитановой кислоте соответствуют сравнительно неустойчи-
вые соли — гексахлоротитанаты.
Декахлоротитановая кислота — H6TiClio (мол.
вес 408,48) также образуется в системе TiCl4 — НС1; практически
может быть получена путем смешения 4 частей хлороводорода и
7 частей тетрахлорида титана при сильном охлаждении. Декахло-
ротитановая кислота представляет собой желтую жидкость. Темпе-
ратура кристаллизации —86° Q Кислота достаточно устойчива
только в кристаллическом состоянии; в жидком состоянии, особен-
но при температуре выше —50° С, она заметно разлагается на гек-
сахлоротитановую кислоту и хлороводород. Естественно, что о су-
ществовании декахлоротитановой кислоты в водных растворах ни-
чего неизвестно. Солей декахлоротитановой кислоты — декахлоро-
титанатов— очень немного.
Хлорооксотитановые кислоты. При обработке двуокиси титана
жидким или газообразным хлороводородом образуется дихлоро-
диоксотитановая кислота — Н2[ТЮ2С12]. Это же вещество
образуется в результате гидролиза тетрахлорида титана малым
количеством воды при низких температурах. Дихлородиоксотитано-
вая кислота представляет собой желтоватый гигроскопичный поро-
шок. В отсутствие влаги достаточно устойчива. При растворении
в воде подвергается гидролизу с образованием ортотитановой кис-
лоты.
При обработке дихлороксида титана жидким хлороводородом
образуется пентахлорооксотитановая кислота —
НзГПОСЬ], которая представляет собой желтые листочкообразные
кристаллы, растворимые в концентрированной соляной кислоте, а
также тетрахлорооксотитановая кислота — Н2[ТЮС14].
Хлорогидроксотйтановые кислоты. В эту группу входят кислоты
с общей формулой Н2[П(ОН)пС1б-.п], где п= 1-ь5. Из этих кис-
лот дихлоротетрагидро к сотитановая — H2[Ti (ОН)4С12],
трихлоротригидро к сотитановая — H2[Ti(OH)3Cl3] и
тетрахлородигидро к сотитановая.— H2[Ti (ОН2) С14]
256
образуются в солянокислотных растворах тетрахлорида титана в
результате последовательного гидролиза первоначально образо-
вавшейся гексахлоротитановой кислоты. При определенных усло-
виях (концентрация, температура) эти кислоты могут быть выде-
лены из системы TiCU—НО—Н2О. Дихлоротетрагидроксотитано-
вая и трихлоротригидроксотитановая кислоты могут быть выделены
также из первичных продуктов гидролиза тетрахлорида титана,
а тетрахлородигидроксотитановая кислота, по существу, является
двуводным соединением тетрахлорида титана. При насыщении рас-
твора тетрахлородигидроксотитановой кислоты хлороводородом об-
разуется пентахлорогидро ксотитановая кислота —
H2[Ti(OH)Cl5], которая при дальнейшем действии хлороводорода
переходит в гексахлоротитановую кислоту.
Хлоротитанаты 84’ 198’ 203-206
Соли хлоротитановых кислот образуются обычно при действии
ионных хлоридов, например хлоридов щелочных металлов, на тет-
рахлорид титана. Чаще всего эти соли имеют состав Me^[TiCl6], т. е.
являются гексахлоротитанатами. Все они очень неустойчивы. Так,
гексахлоротитанат натрия если и образуется при дей-
ствии газообразного тетрахлорида титана на расплавленный хло-
рид натрия, то только в крайне незначительных количествах; в вод-
ных растворах его образования не отмечено.
Гексахлоротитанат калия образуется в незначитель-
ном количестве при взаимодействии газообразного тетрахлорида
титана с хлоридом калия:
2КС1 + TiCU = K2[TiCl6] + 26,4 ккал
Он представляет собой кристаллы кубической сингонии (а = 978лгл«),
устойчивые только в атмосфере хлороводорода. Диссоциация гек-
сахлоротитаната калия начинается при 300° С; зависимость давле-
ния его диссоциации от температуры выражается уравнением:
IgP = 10,12 — ЬПЩТ, из которого следует, что давление диссоциа-
ции достигает 1 атм при 525° С.
Сравнительно устойчивыми являются гексахлоротитан а-
т ы наиболее активных щелочных металлов — рубидия, и осо-
бенно цезия. Они образуются по реакциям:
2RbCl + TiCl4 = Rb2[TiCle] + 32,7 ккал
2CsCl + T1CI4 = Cs2[TiCl6] -f- 37,8 ккал
Эти реакции могут быть проведены как в отсутствие растворителя,
гак и в концентрированных солянокислотных растворах.
Гексахлоротитанат рубидия представляет собой свет-
ло-желтые кристаллы кубической сингонии (гранецентрированная
решетка, а = 992,2 пм). Плотность 2,914 г)см3. При 658° С гекса-
хлоротитанат рубидия инконгруэнтно плавится. Зависимость
давления его диссоциации от температуры выражается уравнением:
9 Зак. 1128 257
IgP = 10,66 —7144/T2, из которого следует, что давление диссоциа-
ции достигает 1 атм при 645° С. Во влажном воздухе неустойчив и
при растворении в воде разлагается.
Гексахлоротитанат цезия представляет собой желтые
(при высокой температуре красновато-бурые) кристаллы кубиче-
ской сингонии (гранецентрированная решетка, а = 1021,9 пм)\плот-
ность 3,253 г/см3. При 650° С гексахлоротитанат цезия плавится,
а при 685° С — диссоциирует. Зависимость давления диссоциации от
температуры выражается уравнением: IgP = 11,515 — 8270/Г. Не-
устойчив во влажном воздухе и при растворении в воде.
Гексахлоротитанаты щелочноземельных ме-
таллов крайне неустойчивы, и выделить их в заметных количе-
ствах не удается.
Выделен г е к с а х л ор от ит а н а т т а л л и я(1) — Т12[Т1С1б]. Он
образуется при насыщении солянокислотного раствора гексахло-
ротитановой кислоты карбонатом таллия(I), а также по реакции:
2Т1С1 + TiCI4 = Tl2[TiCle] + 33,6 ккал!моль
Гексахлоротитанат таллия(I) представляет собой кристаллы ку-
бической сингонии (а = 985 пм). Диссоциирует при 521°С. Зави-
симость давления диссоциации от температуры выражается урав-
нением: IgP = 12,122 — 7349/7’. Давление диссоциации гексахло-
ротитанатов К, Rb, Cs, TI приведены в Приложении 48.
Гексахлоротитанат аммония — (NH4) 2[Ti С 1е] — обра-
зуется при продолжительном встряхивании хлорида аммония
с тетрахлоридом титана, взятых в Тиольном соотношении 2:1,
в концентрированном солянокислотном растворе; из этого раствора
гексахлоротитанат аммония выделяется в виде желтых кристаллов
.двуводной соли (МН4)2[Т1С1б]-2Н2О. Безводный гексахлоротитанат
аммония получается при очень длительном (5 суток) нагревании
в автоклаве хлорида аммония с тетрахлоридом титана при 280,
а затем при 410° С. Образуется также в смеси с другими продук-
тами при сильном нагревании хлорида гексамминтитана (IV) —
[П(МНз)б]Си—в токе аммиака.
Безводный гексахлоротитанат аммония представляет собой
желтые октаэдрические кристаллы кубической сингонии (гране-
центрированная решетка). Очень гигроскопичен; при нагревании
без доступа влаги разлагается на аммиак, тетрахлорид титана
и хлороводород.
Двуводный гексахлоротитанат аммония представляет собой
желтую гигроскопичную кристаллическую массу. Водой полностью
разлагается с образованием ортотитановой кислоты, хлорида ам-
мония и соляной кислоты. Во влажном воздухе гексахлоротитанат
аммония как безводный, так и двуводный разлагается с выделе-
нием хлороводорода. При этом соль белеет, превращаясь в смесь
хлортригидроксида титана и хлорида аммония. В концентрирован-
ной соляной кислоте гексахлоротитанат аммония труднорастворим.
258
Предполагали, что существуют другие хлоротитанаты аммония: гепта-
хлоротитанат— (NH<) з[Т!С17], о к т а х л о р о т и т а н а т—(NH4) «[TiCle] и
д ек а х л о р о т и т а н а т—(NH«)6[TiClio], которые представляют собой желто-
вато-белые кристаллы, разлагающиеся при растворении в воде. На самом же
деле эти соединения являются смесями гексахлоротитаната и хлорида аммония.
Из хлоротитанатов других азотистых оснований известны гексахлороти-
танаты диметиламмония — [NH2(СНз)aJaTiClg и диэтиламмония —
[NH2(C2Hs)2]2TiCl6, которые образуются при взаимодействии хлороформных рас-
творов тетрахлорида титана и хлоридов соответственно диметил- и диэтиламмо-
ния. Известны также гексахлоротитанаты анилиния, пиридиния
и хинолиния.
Бромо- и иодотитанаты 2-198
Гексабромотитановая кислота. При растворении тетрабромида
титана в водном растворе бромоводорода с одновременным про-
пусканием сухого бромоводорода образуется кроваво-красная
жидкость, содержащая гексабромотитановую кислоту:
TiBr4 + 2НВг = H2[TiBr6]
Гексабромотитановая кислота достаточно устойчива при тем-
пературах ниже 0°С; при _ более высоких температурах она за-
метно разлагается на тетрабромид титана и бромоводород. Гек-
сабромотитановая кислота может быть растворена только в очень
концентрированном водном растворе бромоводорода при /<0°С.
При разбавлении таких растворов водой или при повышении тем-
пературы красный гексабромотитанат-ион гидролизуется; при этом
происходит последовательное замещение атомов брома на гидр-
оксо-группы; гидролиз сопровождается обесцвечиванием раствора.
Бромооксо- и бромогидроксотитановые кислоты. При гидроли-
зе тетрабромида титана в качестве промежуточного продукта об-
разуется бромотриоксотитановая кислота — H3[TiO3Brl.
При обработке дибромоксида титана жидким бромоводородом об-
разуется пентабромооксотитановая кислота—
H3[TiOBr5], которая представляет собой рранжево-красные кри-
сталлы, растворимые в концентрированном водном растворе бро-
моводорода.
В бромоводородных растворах тетрабромида титана в резуль-
тате гидролиза первоначально появившейся гексабромотитановой
кислоты образуются дибромотетрагидроксотит а но-
вая— Н2ГП(ОН)4Вг2] и трибромотригидро к сотитано-
вая— H2[Ti(H)3Br3]—кислоты. Эти кислоты могут быть выде-
лены также из первоначальных продуктов гидролиза тетрабро-
мида титана.
Бромохлоротитановые кислоты. При растворении тетрабромида
титана в концентрированной соляной кислоте с одновременным
пропусканием сухого хлороводорода образуется оранжево-красная
жидкость, содержащая тетрабромодихлоротитановую
кислоту — H2[TiCl2Br4]. Другие бромохлоротитановые кислоты
9'
259
образуются при действии хлороводорода на бромхлориды титана.
В частности, при растворении дибромдихлорида титана в концен-
трированной соляной кислоте с одновременным пропусканием хло-
роводорода образуется дибромотетрахлоротит а новая
кислота — H2[TiCl4B г2]-
Гексаиодотитановая кислота. При растворении тетраиодида ти-
тана в водном растворе иодоводорода образуется темно-коричне-
вая жидкость, содержащая гексаиодотитановую кислоту — Н2[ТПе].
Кислота эта неустойчива, однако соли ее известны. Известна также
иодопентагидро к сотитановая кислота — H2[Ti (ОН) 51],
которая представляет собой кристаллы ромбоэдрической сингонии.
Темно-красные гексаиодотитанаты неустойчивы.
Гексабромотитанаты. Соли гексабромотитановой кислоты обра-
зуются обычно при действии ионных бромидов на тетрабромид ти-
тана. Все они, как правило, очень неустойчивы.
Гексабромотитанаты рубидия и цезия — Rb2[TiBг6]
и Cs2[TiBr6] — образуются при действии тетрабромида титана на
бромиды рубидия и цезия. Теплота образования Сз2[Т1Вгб] равна
392,8 ккал/'моль.
Гексабромотитанат аммония — (NH4)2[TiBre]— обра-
зуется при продолжительном встряхивании бромида аммония при
сильном охлаждении в растворе тетрабромида титана с дымящим
водным раствором бромоводорода. Гексабромотитанат аммония
представляет собой темно-красные кристаллы кубической сингонии
(а = 1041 tut). Из водных растворов кристаллизуется обычно дву-
водное соединение (NH4)2[TiBre]-2H2O.*
Известны также гексабромотитанаты диэтиламмония. —
(NH2(C2Hs)2]2TiBr6 и пиридиния—(C5HsNH)2TiBre; первый образуется при
взаимодействии хлороформных растворов тетрабромида титана и бромида ди-
этиламмония, второй — при взаимодействии бромидов титана(IV) и пиридиния.
Бромохлоротитанаты. Бромохлоротитанатами называются соли,
в комплексных анионах которых в качестве лигандов присутствуют
одновременно хлорид- и бромид-ионы. Известны дибромотетрахло-
ро- и тетрабромодихлоротитанаты.
Дибромотетрахлоро- и тетрабромодихлороти-
танаты аммония—(NH4)2[TiC14Br2] и (NH4)2[TiCl2Br4]— обра-
зуются: первый — при взаимодействии тетрахлорида титана с бро-
мидом аммония, второй — при взаимодействии тетрабромида ти-
тана с хлоридом аммония.
Дибромотетрахлоротитанат диэтиламмония —
[NH2(C2H6)2]2TiCl4Br2 — образуется при взаимодействии бромида диэтиламмо-
ния с тетрахлоридом титана или хлорида диэтиламмония с дибромдихлоридом
титана.
Тетрабромодихлоротитанат диэтиламмония —
[NH2 (С2Н5)2]2[Т1С12ВгД — образуется при взаимодействии бромида диэтиламмо-
ния с дибромдихлоридом титана или хлорида диэтиламмония с тетрабромидом
титана.
260
Га л оксо- и галопероксотитанаты 2-66205
Фторооксотитанаты. Из фторооксотитанатов известны только
тетрафторооксотитанаты щелочных металлов и бария.
Тетрафторооксотитанат калия — Кг[Т1Р4О] — обра-
зуется при нагревании одноводного соединения гексафторотита-
ната калия на воздухе до 500° С. Вместе с метатитанатом калия
тетрафторооксотитанат калия образуется также при спекании смеси
двуокиси титана с фторидом калия (700°С). Тетрафторооксотита-
нат калия представляет собой кристаллы, растворимые в воде; при
растворении в воде подвергается гидролизу по уравнению:
2K2[TiF4O] + 2Н2О = К2 [ TiF6] + H4TiO4 + 2KF
Фторооксотетратитанаты калия образуются при
взаимодействии гексафторотитаната калия с водным раствором
аммиака; так, выделены октафторогексоксотетратитанат калия —
K4[Ti4F8O6]-3H2O и гексадекафторотриоксотетратитанат калия —
Ks[Ti4FieO3]-4H2O.
Тетрафторооксотитанаты рубидия — Rb2[TiF4O] и
цезия — Cs2[TiF4O] — образуются при длительном (8-часовом)
выдерживании гексафторотитанатов рубидия или цезия на воздухе
при 500° С и при 410° С соответственно. Образуются также при
взаимодействии оксдифторида титана с фторидами соответствую-
щих щелочных металлов. Тетрафторооксотитанаты рубидия и це-
зия представляют собой кристаллы, устойчивые при нагревании до
600° С, при более высокой температуре превращаются в дифторо-
диоксотитанаты — Rba[TiF2O2] и Cs[TiF2O2], а затем в тетратита-
наты и фториды соответствующих металлов.
Тетрафторооксотитанат бария — Ba[TiF4O] — обра-
зуется при взаимодействии оксдифторида титана с фторидом ба-
рия, а также при нагревании тетрафторопероксотитаната бария
до 150—160° С. Тетрафторооксотитанат бария представляет собой
кристаллы, при сильном нагревании разлагающиеся на метатита-
нат и гексафторотитанат бария; растворим в разбавленных кис-
лотах.
Дифтородиоксотитанат калия — K2[TiF2O2] — обра-
зуется при нагревании тетрафторооксотитаната калия на влажном
воздухе до 700° С. При 830°С разлагается на тетратитанат и фто-
рид калия.
Фторопероксотитанаты. Из фторопероксотитанатов известны
тетрафторопероксо- и пентафторопероксотитанаты натрия, калия,
бария и аммония.
Пентафторопероксотитанат натрия — Na3[TiF5O2]—
образуется при сплавлении гексафторотитаната натрия с пере-
кисью натрия или при обработке раствора гексафторотитаната на-
трия перекисью водорода (30%-ной) и гидроокисью натрия. Пен-
тафторопероксотитанат натрия представляет собой желтые хорошо
образованные кристаллы е сильным двойным лучепреломлением.
281
Тетрафторопероксотитанат калия — K^TiF^a] —
образуетря при обработке гексафторотитаната калия в водном
растворе перекисью водорода и гидроокисью калия, а также при
реакции обмена между тетрафторопероксотитанатом аммония и
хлоридом калия, проводимой в водном растворе при охлаждении.
Тетрафторопероксотитанат калия представляет собой желтый кри-
сталлический порошок, растворимый в воде; этот раствор обесцве-
чивает раствор перманганата с выделением кислорода.
Пентафторопероксотитанат калия — Кз[Т1Р5О2] —
образуется вместе с тетрафторопероксотитанатом калия в раство-
рах, содержащих пентафторопероксотитанат аммония и большой
избыток фторида калия. Пентафторопероксотитанат калия предста-
вляет собой желтый кристаллический порошок; в чистом виде оа
не выделен.
Тетрафторопероксотитанат бария — Ba[TiF4O2] —
осаждается из растворов тетрафторопероксо- или пентафторопер-
оксотитаната аммония барий-ионами (любой растворимой солью
бария). Тетрафторопероксотитанат бария представляет собой устой-
чивый на воздухе желтый порошок. В воде нерастворим, легко рас-
творяется в кислотах. При действии серной кислоты в осадке обра-
зуется сульфат бария, а в растворе тетрафторопероксотитановая
кислота— H2[TiF4O2], окрашивающая его в желтый цвет. С гидро-
окисью калия в растворе идет реакция обмена с образованием
тетрафторопероксотитаната калия. При нагревании до 160° С тет-
рафторопероксотитанат бария отщепляет кислород и переходит в
тетрафторооксотитанат бария.
Пентафторопероксотитанат бари я—Ваз[ПР5О2]2—
образуется вместе с тетрафторопероксотитанатом при осаждении
последнего из растворов барий-ионами. Пентарфтороопероксотита-
нат бария представляет собой светло-желтые кристаллы, нераство-
римые в воде, но растворимые в разбавленных кислотах.
Пентафторопероксотитанат аммония (мол.
вес 229,01) — (NH4)3[TiF5O2] является наиболее устойчивым из фто-
ропероксотитанатов. Он образуется в результате различных реак-
ций. Например, при обработке водно-аммиачного раствора гекса-
фторотитаната аммония перекисью водорода и фторидом аммония,
при нейтрализации раствора тетрафторопероксотитановой ^кислоты
аммиаком в присутствии фторида аммония или при окислении кис-
лородом фторидно-аммониевого раствора гексафторо-(III)титаната
аммония.
Пентафторопероксотитанат аммония представляет собой кана-
реечно-желтые октаэдрические кристаллы кубической сингонии
(гранецентрированная решетка, четыре молекулы в элементарной
ячейке; а = 920 пм). Кристаллы пентафторопероксотитаната аммо-
ния изоморфны кристаллам гептафтороцирконата аммония и обра-
зуют с последним непрерывный ряд твердых растворов. Следова-
тельно, пероксо-группа занимает два координационных места.
Плотность пентафторопероксотитаната аммония 1,95 в/см3.
262
Пентафторопероксотитанат аммония вполне устойчив на воз-
!духе. Он хорошо растворим в воде, образует желтый раствор, изме-
нения электропроводности которого показывают, что соль поя-
сностью диссоциирует на четыре иона; комплексный анион [TiF5O2]3-
в водном растворе вполне устойчив. Растворимость соли резко
^уменьшается при введении в раствор фторида аммония. Водные
растворы пентафторопероксотитаната аммония обесцвечивают рас-
,творы перманганатов, при этом выделяется кислород. В растворах
-могут быть проведены реакции обмена с калий- и барий-ионами.
-При'действии фтороводорода раствор приобретает золотистую окра-
ску, причем в нем образуются гексафторотитанат аммония и сво-
бодная перекись водорода. При нагревании сухой соли происходит
(.отделение аммиака и фтороводорода, сопровождающееся обесцве-
чиванием.
Тетрафторопероксотитанат аммония —
(NH4)2[TiF4O2] — образуется при нейтрализации тетрафтороперо-
; ксотитановой кислоты аммиаком.
Гептафтородипероксодититанат аммония —
(NH4)3[Ti2F7(O2)2 — образуется как побочный продукт при получении пентафторо-
пероксотитаната аммония и представляет собой желтые, блестящие, иглообраз-
ные кристаллы. Состав этой соли установлен недостаточно точно.
Хлорооксо- и хлорогидроксотитанаты. Из хлорооксотитанатов
известны пентахлорооксотитанаты, которые образуются
при взаимодействии дихлороксида титана с ионными хлоридами.
В частности, в солянокислотных растворах, содержащих дихлорок-
сид титана и хлориды аммония или пиридиния, образуются пен-
тахлорооксотитанаты аммония—(NH^ITiOCls], тет-
р а м е т и л а м м о н и я — [N(CH3)4][TiOCl5] и пиридиния--
(CsHsNH^TiOClBj. Известны также тетрахлорооксотитана-
ты рубидия — Rb2[TiOCl4] и цезия — Cs2[TiOCl4], которые об-
разуются при обезвоживании соответствующих хлорогидроксотита-
натов, а также путем синтеза из дихлороксида и хлоридов рубидия
и цезия. Тетрахлорооксотитанаты рубидия и цезия плавятся без
разложения при 590 и 535° С соответственно. Из тетрахлорооксоти-
танатов известны также соли аммония— (NH4)2[TiOCl4] и тет-
р аэт и л а м мо н и я — [N(C2H5)4]2[TiOC14], кристаллизующиеся в
-тетрагональной сингонии.
Из хлорогидроксотитанатов известны тетрахлородигид-
роксотитанаты рубидия — Rb2[Ti(OH)2C14] и цезия —
Cs2[Ti(OH)2Cl4], которые образуются в результате гидролиза соот-
ветствующих гексахлоротитанатов в солянокислотном растворе.
При гидролизе гексахлоротитаната аммония в солянокислотном
растворе образуется смесь тетрахлородигидроксотита-
ната— (NH4)2[Ti(OH)2C14]-H2O и а кв а т р и х л о р о д и г и д р-
оксотитаната аммония — NH4[Ti(ОН) 2С13(Н2О). При на-
гревании тетрахлородигидроксотитанаты рубидия и цезия обезво-
263
живаются при 175 и 200°С с образованием тетрахлороксотйтана-
тов. Нагревание хлорогидроксотитанатов аммония уже при 152° С
приводит к разложению их на титановую метакислоту, аммиак и
хлороводород.
Хлоропероксотитанаты. Из хлоропероксотитанатов известен
тетрахлоропероксотитанат натрия — Na2[TiO2ClJ. Он
образуется при введении в солянокислотный раствор гексахлороти-
тановой кислоты перекиси водорода и хлорида натрия. После ней-
трализации избытка соляной кислоты гидроокисью натрия и при-
бавления спирта из раствора выделяется оранжевое масло, при
высушивании которого в эксикаторе с применением эфира выде-
ляется девятиводная соль. Тетрахлоропероксотитанат натрия пред-
ставляет собой оранжевый аморфный порошок. Гигроскопичен;
чистой водой разлагается; с подкисленной водой образует раствор,
из которого при нагревании выделяется ортотитановая кислота.
Бромооксититанаты. Из бромооксотитанатов известен пента-
бромооксотитанат пиридиния—(С5Н5ИН)з[Т1ОВг5], ко-
торый образуется при взаимодействии бромида пиридиния с ди-
бромоксидом титана.
ТИОТИТАНОВЫЕ КИСЛОТЫ, ТиОТИТАНАТЫ
НИТРИДОТИТАНАТЫ
Тиотитановые кислоты 67 207•208
Из тиотитановых кислот известны мета- и орто-кислоты. Могут
быть получены также продукты неполного замещения атомов кис-
лорода в титановых оксокислотах на атомы серы, т. е. тиооксотита-
новые кислоты.
Тритиотитановая кислота, или метатиотитан о-
вая кислота, — H2TiS3 (мол. вес 146,11)—образуется при обра-
ботке дисульфида титана жидким сероводородом:
TiS2 + H2S = H2TiS3
Она представляет собой желтые кристаллы.
Тетратиотитановая кислота, или тиоортотита-
новая к и с л о т а — H4TiS4 (мол. вес 180,19) —образуется как
конечный продукт тиололиза тетрахлорида титана при действии на
последний жидким сероводородом:
TiCI4 + 4H2S = H4TiS4 + 4НС1
Тетратиотитановая кислота представляет собой желтые кристаллы,
растворимые в водном растворе сероводорода, а также в растворах
гидросульфидов щелочных металлов или аммония.
264
Пертиосоединения титана
При обработке дисульфида титана тиосульфидом водорода про-
исходит образование пертиотитановой кислоты:
TiS2 4* H2S2 == H2TiS4
Подобным образом при действии тиосульфида водорода на тетра-
тиотитановую кислоту образуется пертиоортотитановая
кислота:
H4TiS4 + H2S2 = H4TiS5 + H2S
В молекулах этих кислот содержится пертио-группа (—S—S—)?
их строение может быть представлено так:
Н—S—S\ Н—S—S. /S—Н
XTi=S
н—s/ Н—s/ ^S—Н
мета-кислота орто-кислота
Пертиотитановые мета- и орто-кислоты не выделены, однако
хорошо известен соответствующий им тиодисульфид тита-
на — S = TiS2, также содержащий в молекуле пертио-группу.
Трисульфид, или тиодисульфид, титана — ТiS2S (мол. вес
144,09) — образуется при сплавлении дисульфида титана с серой.
Теплота образования TiSs равна 83,7 ккал/моль. Практически три-
сульфид титана получают путем нагревания до 600° С в запаянной
трубке смеси 4 частей дисульфида титана и 3 частей серного цвета
в течение 3—4 ч. Для очистки от избытка серы и других летучих
примесей плав длительное время выдерживают в вакууме при
100—110° С. Полученный продукт представляет собой темную гра-
фитоподобную массу; совершенно чистый трисульфид титана — кри-
сталлы желтого цвета моноклинной сингонии (а = 497, b — 342 пм,
Р = 97°10'), причем на одну ячейку приходится две молекулы. За-
висимость плотности трисульфида титана от температуры (0 -+
ч-50°С) выражается уравнением: р = 2,932 — 0,006431 +0,000116 t2.
При нагревании он диссоциирует на дисульфид титана и пары
серы, содержащие три вида молекул: S2, Se и 58. Зависимости пол-
ного и парциальных давлений диссоциации трисульфида титана от
температуры в интервале от 480 до 560° С выражаются уравне-
ниями:
1g р = 18,23- 12 600/Т; lg pS2 = 15,75 - 10970/Т
lg PSe = 19,22-13 625/7; lgp5a = 20.35 - 15 010/7
Значения полного и парциальных давлений диссоциации трисуль-
фида титана при различных температурах приведены в Приложе-
нии 49. Теплоты диссоциации трисульфида титана, рассчитанные
по различным уравнениям при 525° С:
2TiS3 = 2TiS2 + S2 — 38 ккал; 6TiS3 = 6TiS2 + Se — 47 ккал;
8TiS3 = 8TiS2 + S3 — 52 ккал
?65
На воздухе трисульфид сравнительно устойчив. В воде не раство-
ряется, растворяется в концентрированной серной кислоте и горя-
чих растворах щелочей.
Тиотитанаты металлов 2’207’208
Различные тиотитанаты металлов образуются при взаимодей-
ствии дисульфида титана с сульфидами металлов; в зависимости
от соотношения реагентов могут быть получены тритиотитанаты
или тетратиотитанаты. При взаимодействии дисульфида титана с
оксидами или гидроксидами металлов могут образовываться сме-
шанные тиооксотитанаты, причем в зависимости от соотношения
реагентов получаются мета- или орто-соли.
Тритиотитанаты щелочных металлов образуются
также при действии соответствующих дитиосульфидов на элемен-
тарный титан при высокой температуре, например:
Na2S3 + Ti = Na2TiS3
Тритиотитанаты натрия и калия представляют собой кристал-
лические массы буро-зеленого цвета. При сплавлении с сульфи-
дами щелочных металлов они переходят в тетратиотитанаты:
K2TiS3 + K2S = K4TiS4
Тритиотитанат бария — BaTiS3 (мол. вес 281,43)— обра-
зуется при спекании сульфида бария и дисульфида титана.
Нитриде-, имидо- и амидотитанаты209-212
Нитридотитанаты образуются при взаимодействии нитридов ак-
тивных металлов с нитридами титана. Таким образом могут быть
получены, например, нитридотитанаты лития.
Тринитридотитанат лития — Li5TiN3 (мол. вес 124,62)
образуется при взаимодействии нитрида лития и мононитрида ти-
тана в присутствии азота:
10Li3N + 6TiN + N2 = 6Li5TiN3
Пентанитридотрититанат лития — Li3Ti3Ns — обра-
зуется при взаимодействии нитрида лития с нормальным нитридом
титана (IV):
Li3N + Ti3N4 = Li3Ti3Ng
Имидотитанаты образуются при взаимодействии имидов актив-
ных металлов с диимидом титана:
Me2NH + Ti(NH)2 = Me2[Ti(NH)8]
Существуют также нитридоимидотитанаты, которые образуются
при взаимодействии имидов активных металлов с динитридимидом
титана:
Me2NH + Ti2(NH)N2 = 2Me[Ti(NH)N]
Из таких нитридоимидотитанатов известна калиевая соль.
266
Нитридоимидотитанат калия — K[Ti(NH)N] (мол. вес
116,02) образуется при взаимодействии имида калия с динитрид-
имидом титана, а также амида калия с бромнитридом титана:
KNH2 + TiNBr = K[Ti(NH)N] + HBr
Нитридоимидотитанат калия представляет собой коричнево-крас-
ный кристаллический порошок. Очень реакционноспособен. На воз-
духе разлагается (при прокаливании образуется дититанат калия).
С водой бурно реагирует по уравнению:
KITi(NH)N] + 5Н2О = КОН + Ti(OH)4 + 2NH3
Метанолом и этанолом также разлагается. В аммиаке и неполяр-
ных органических веществах не растворяется. С аммонийными со-
лями и амидами металлов не реагирует.
Действием амида калия на амидоксид титана получен имидо-
оксотитанат калия — Кг[Т1О(МН)2]. Он представляет собой
оранжево-коричневую массу, загорающуюся при соприкосновении
с воздухом или водой.
Амидотитанаты образуются при взаимодействии амидов актив-
ных металлов с тетрамидом титана:
2KNH2 + Ti(NH2)4 = K2[Ti(NH2)e]
Существуют также амидофторотитанаты, которые обра-
зуются при взаимодействии амидов активных металлов с тетрафто-
ридом титана:
2MeNH2 + TiF4 = Me2[TiF4(NH2)2]
Из таких амидофторотитанатов известны рубидиевая, цезиевая и
аммониевая соли.
Диамидотетрафторотитанат аммония —
(NH4)2[TiF4(NH2)2] — образуется при действии на холоду газооб-
разного аммиака на тетрафторид титана:
4H3N + TiF4 = (NH4)2fTiF4(NH2)2J
При нагревании разлагается на исходные вещества. Водой гидро-
лизуется.
ГЛАВА IX
АЦИДОСОЕДИНЕНИЯ ЧЕТЫРЕХВАЛЕНТНОГО ТИТАНА
Подобно тетрагалидам титана, такие, казалось бы, солеобраз-
ные соединения титана (IV), как перхлорат, сульфат, нитрат, фос-
фат и тому подобные соединения (комплексатЫ), по своему
отношению к воде тоже не являются типичными солями, а носят
кислотообразующий характер. Этот кислотообразующий характер
выражается в том, что при взаимодействии указанных соединений
с перхлоратами, сульфатами, нитратами, фосфатами и т. п. соеди-
нениями активных металлов (т. е. типичными солями с ионной
связью) образуются устойчивые комплексные соли. Характерным
признаком комплексатов титана(IV) является ковалентная связь
атома титана с соответствующим кислотным остатком. Это, в свою
очередь, отражается на типе кристаллических решеток комплекса-
тов и на поведении их при растворении в воде, при котором они
подвергаются сильному гидролизу, но не электролитической дис-
социации.
ГАЛАТОСОЕДИНЕНИЯ
Перхлоратосоединения 212!3’2,4
Перхлоратосоединения представляют собой производные хлор-
ной кислоты, т. е. хлора(VII). Перхлоратосоединений титана(IV)
немного. Нормальный перхлорат — T^ClCXh — неизвестен. Извест-
ны лишь некоторые смешанные перхлоратооксо-, а также перхло-
ратооксопероксосоединения титана(IV).
Диперхлоратоксид THTaHa(IV)— TiO(Cli4)2 (мол. вес 262,80)
образуется в растворе при медленном приливании тетрахлорида
титана к 70%-ной хлорной кислоте:
TiC 14 + 2НСЮ4 + Н2О = Ti0(C104)2 + 4НС1
Из желтого раствора при медленном выпаривании в вакууме при
температуре 30—40° С выпадают бесцветные табличкообразные
кристаллы водного соединения диперхлоратоксида титана(IV) гек-
сагональной сингонии с неопределенным содержанием воды. Одно-
268
водное соединение, по-видимому, представляет собой не диперхЛо-
ратодиоксотитановую кислоту — Н2[ТЮ2(СЮ4)2], а нейтральный ди-
перхлоратдигидроксид титана — Ti(0H)2(C104)2, на что указывает
отсутствие электропроводности раствора этого соединения. Трех-
водное соединение, по-видимому, представляет собой нейтральный
комплекс диаквадиперхлоратодигидроксотитан — [Ti (ОН)2(С1О4)2-
•(Н2О)2. Выделено также шестиводное соединение Ti0(C104)2-
• 6Н2О, которое представляет собой гигроскопичные кристаллы
ромбической сингонии (а = 766, b = 1227 и с = 1469 пм); плотность
1,722 г) см3. Растворяется в этаноле, ацетоне; не растворяется в
бензоле, диоксане и хлорпроизводных углеводородов.
Диперхлоратооксопероксотитановая кислота — H2[TiO2O (С1О4) 2]
(мол. вес 296,815) образуется при взаимодействии эквимолеку-
лярных количеств перекиси водорода и диперхлоратоксида тита-
на(ТУ) в сильно концентрированном растворе; из оранжево-крас-
ного раствора после 3—4-часового выдерживания в вакууме над
полупятиокисью фосфора выпадает кислота в виде бесцветного
мелкокристаллического осадка, который хорошо отфильтровывается
и может быть легко перекристаллизован. Диперхлоратооксопе-
роксотитановая кислота представляет собой бесцветные пластинча-
тые кристаллы гексагональной сингонии. Гигроскопична; растворы
в воде окрашены в оранжево-красный цвет. В ацетоне и эфире не
растворяется.
Иодатосоединения 2>213
Иодатосоединения представляют собой производные йодноватой
кислоты, т. е. иода(У). Иодатосоединений титана (IV) известно
больше, чем перхлоратосоединений. Известны нормальный иодат
титана (IV), а также некоторые иодатооксо- и иодатогидроксосое-
динения титана (IV). Хорошо известны также гексаиодато- и иода-
тогидроксотитановые кислоты и соли — гексаиодатотитанаты ще-
лочных металлов.
Иодаты титана(1У). Нормальный иодат титана(1У)—Ti(IO3)4
(мол. вес 747.51) образуется при высушивании тетраиодатодиги-
дроксотитановой кислоты при 100° С. Иодат титана(IV) —кристал-
лическое вещество; плотность при 32° С 4,0798 г/см3.
При высушивании дииодатотетрагидроксотитановой кислоты до
95°С образуется дииодатдигидроксид титана — Т1(ОН)2(Юз)2, а
выше 100°С — дииодатокспд титана(1У) —ТЮ(Юз)2.
Титановые иодатокислоты. Иодатокислотами являются ком-
плексные кислоты, содержащие в качестве лигандов иодат-ионы.
Таким образом, титановые иодатокислоты можно рассматривать
как продукты замещения оксид-ионов в оксотитановых кислотах
на иодат-ионы.
Гексаиодатотитановая кислота — Н2[Т1(Ю3)б]-2Н2О
(мол. вес 1099,33 + 36,03) образуется при взаимодействии рас-
творов титановой кислоты в плавиковой с избытком раствора
269
йодноватой кислоты в азотной при охлаждении. Гексаиодатотита-
новая кислота представляет собой белые иглообразные кристаллы;
плотность при 32° С равна 3,991 г/см?.
Тетраиодатодигидроксотита новая кислота —
H2[Ti(OH)2(IO3)4 (мол. вес 783,54) образуется при действии рас-
твора определенного количества йодноватой кислоты в азотной на
раствор титановой кислоты в плавиковой при охлаждении. Тетра-
иодатотитановая кислота представляет собой белые кристаллы;
плотность при 32°С 3,703 г/см3. При высушивании (100° С) теряет
2 молекулы воды и переходит в иодат титана (IV):
Н2[Тi(OH)2(Юэ)4] - 2Н2О + Ti(IO3)4
Дииодатотетрагидроксотитановая кислота —
Нг[Т1(Н)4(103)2] (мол. вес 467,75) образуется при приливании рас-
твора титановой кислоты в крепкой азотной кислоте к раствору
йодноватой кислоты в 25 %-ной азотной кислоте. Дииодатотетра-
гидроксотитановая кислота представляет собой белые кристаллы,
при высушивании которых идут реакции:
до 95° С’
Н2[Т1(ОН)4(Юз)2] = 2Н2О + Ti(OH)2(IO3)2
выше 100° С
Н 2[Т 1(ОН) 4 (Ю3) 2] = ЗН2О + TiO(IO3)2
Гексаиодатотитанаты. Гексаиодатотитановая кислота образует
соли со щелочными металлами и аммонием. Гексаиодатотитанаты
лития, натрия и цезия образуются при взаимодействии растворов
гексафторотитаната соответствующего металла в 50%-ной азотной
кислоте с раствором йодноватой кислоты и нитрата соответствую-
щего металла. Гексаиодатотитанаты калия, рубидия и аммония об-
разуются при взаимодействии раствора титановой кислоты в 35%-
ной азотной с раствором йодноватой кислоты и соответствующего
нитрата. Гексаиодатотитанаты щелочных металлов представляют
собой белые мелкозернистые кристаллы. Известные гексаиодато-
титанаты перечислены в табл. 11.
Таблица 11. Характеристики некоторых гексаиодатотитанатов
щелочных металлов и аммония
Формула Мол. вес Плотность при 32° С, г/слеЗ
Li2 [Ti (IO3)e) 1111,19 4,155
Na2 [Ti (IO3)0J 1143,315 3,955
К2 [Ti (IO3)e] 1136,42 4,392
Rb2 [Ti (IO3)e] 1268,25 4,432
Cs2 [Ti (IO3)6] 1363,12 4,623
(NH4)2 [Ti (IO3)e] 1133,39 4,131
270
Периодатосоединения21213
Периодатосоединения представляют собой производные орто-
иодной кислоты, т. е. иода (VII). Из периодатосоединений титана-
(IV) известен смешанный периодатоксид.
Дипериодатоэннеаоксид титана(Г/)—Ti7O9(IOe)2 (мол. вес
925,1) образуется при взаимодействии раствора дигидропериодата
натрия в разбавленной азотной кислоте с раствором гексафтороти-
таната аммония:
7(NHJ2TiFe + 2Na3H2IO6 + 9Н2О = Ti7Oe(IO6)2 + 6NaHF2 + 14(NH4)HF2 +2HF
СУЛЬФАТОСОЕДИНЕНИЯ
Сульфаты титана(1¥) '2-170’215-217
Система TiO2 — SO3. При взаимодействии двуокиси титана с
трехокисыо серы можно было бы ожидать образования ряда сое-
динений, являющихся сульфатами титана(IV). Однако двуокись
титана, как вещество полимерное, в непосредственное взаимодей-
ствие с трехокисыо серы вступает с большим трудом. Известен
только один продукт такого взаимодействия — соединение TiO2 • 4SO3.
Кроме этого соединения, которое можно рассматривать как
дисульфат титана(1У)—Ti(S2O7)2, известен еще ряд соединений
двуокиси титана с трехокисыо серы, в том числе нормальный суль-
фат титана(IV) и четыре сульфатоксида титана(IV) различного
состава. Все эти соединения образуются в системе TiO2 — SO3 не
непосредственно, а в присутствии подходящих растворителей или
вообще косвенным путем.
Всего в системе ТЮ2 — SO3 образуется шесть определенных
соединений: I) 7TiO2-SO3, которое может рассматриваться как
сульфаттридекаоксид титана — ThOiaSOr, 2) 2TiO2-SO3, или суль-
фаттриоксид титана — Ti2O3SO4; 3) 4TiO2-3SO3, или трисульфат-
пентоксид титана — TiiOstSO^s; 4) TiO2-SO3, или сульфатоксид ти-
тана— TiOSO4; 5) TiO2-2SO3, или нормальный сульфат титана —
Ti(SO4)2; 6) TiO2-4SOs, или дисульфат титана — Ti(S2O7)2.
Все эти соединения носят ковалентный кислотообразующий ха-
рактер и при взаимодействии их с водой легко образуются соответ-
ствующие им кислоты.
Нормальный сульфат титана(1У)—Ti(SO4)2 (мол. вес 240,02)
образуется при действии большого избытка трехокиси серы на тет-
рахлорид титана. Реакция, которую проводят в среде хлордвуокиси
серы, идет в несколько стадий. Когда к раствору тетрахлорида ти-
тана в хлордвуокиси серы приливают по каплям раствор трехокиси
серы в хлордвуокиси серы, то идет бурная реакция с образованием
желтого кристаллического осадка, состоящего главным образом из
дихлоросульфатдихлорида титана. После длительного (12-часо-
вого) кипячения (в колбе с обратным холодильником) образовавше-
гося продукта с избытком трехокиси серы происходит превращение
§71
его, сопровождающееся обесцвечиванием раствора!
TiC 12(SO3C 1)2 + 4SO3 = Ti(SO4)2 + 2S2O5C12
После охлаждения белый осадок отфильтровывают, промывают
чистой хлордвуокисью серы и освобождают от последней в токе
совершенно сухого азота. Образование нормального сульфата ти-
тана происходит также при окислении дисульфида титана горячей
азотной кислотой:
TiS2 + 8HNO3 = Ti (SO4)2 + 8HNO2
Теплота образования нормального сульфата титана (IV)
552 ккал/моль.
Нормальный сульфат титана (IV) представляет собой белый
очень гигроскопичный кристаллический порошок. При нагревании
выше 150°С начинает разлагаться с отделением трехокиси серы:
Ti(SO4)2 = TiO(SO4) + SO3 — 10,5 ккал
Разложение проходит полностью при температуре красного кале-
ния. В воде сульфат титана растворяется с выделением теплоты,
что указывает на протекание гидролиза, а также, на образование
титановых сульфатокислот. Растворяется также с разложением
в спирте, эфире и ацетоне. Взаимодействует с сульфатами актив-
ных металлов с образованием трисульфатотитанатов. В токе водо-
рода при 100—200° С сульфат титана восстанавливается с образо-
ванием дисульфида:
Ti(SO4)2 + 8Н2 = TiS2 + 8Н2О — 9,6 ккал
Дисульфат титана — Ti(S2O7)2 (мол. вес 400,15)—образуется
при действии паров трехокиси серы на нагретую до 100° С двуокись
титана, а также при обработке жидкой трехокисью серы нормаль-
ного сульфата титана (IV). Дисульфат титана (IV) представляет
собой белые кристаллы. Весьма гигроскопичен. На влажном воз-
духе образует тетрасульфатотитановую кислоту:
Ti(S2O7)2 + 2Н2О = H4[Ti(SO4)4]
Сульфатрксид титана(1У), называемый иногда сульфатом ти-
танила, — TiO(SO4) (мол. вес 159,96) —образуется при нагревании
(500—550° С) нормального сульфата титана(IV), а также при на-
гревании (225° С) титановой сульфатокислоты, получаемой при
растворении двуокиси титана в концентрированной серной кислоте.
Из растворов двуокиси титана в концентрированной серной кис-
лоте сульфатоксид титана кристаллизуется при £> 150°С; при
t > 275° С из таких растворов кристаллизуется только сульфат-
оксид титана. К образованию сульфатоксида приводит также дей-
ствие трехокиси серы на элементарный титан:
Ti + 3SO3 = TiO(SO4)+2SO2
Теплота образования сульфатоксида титана(IV) 447 ккал/моль,
т
Сульфатоксид титана (IV) представляет собой белые кристал-
лы ромбоэдрической сингонии с сильным двойным лучепреломле-
нием, хотя чаще встречается в виде аморфного порошка. При на-
гревании сульфатоксид разлагается с отделением паров трехокиси
серы; зависимость давления диссоциации от температуры в интер-
вале от 450 до 580° С выражается уравнением: lg Р = 23,649 —
— 17 710/7’. Температура разложения (т. е. температура, при кото-
рой давление диссоциации достигает 760 мм рт. ст.) составляет
579° С.
Сульфатоксид титана растворяется в холодной воде с образова-
нием соответствующих сульфатокислот. Горячей водой гидроли-
зуется с образованием метатитановой кислоты:
TiO(SO4) + 2Н2О = H2TiO3 + H2SO4 - 82,3 ккал
Растворение сульфатоксида титана в серной кислоте также сопро-
вождается образованием сульфатокислот; сульфатоксид титана
растворим в соляной кислоте. Разлагается растворами щелочей и
аммиака.
Сульфатоксид титана (IV) способен каталитически окислять дву-
окись серы; эта способность основана на том, что двуокись серы
поглощается нагретым сульфатоксидом титана(IV) с образованием
среднего сульфата титана(III):
2TiO(SO4) + SO2 = Ti2(SO4)3 — 156 ккал
а последний при действии на него кислорода снова образует суль-
фатоксид титана (IV) с выделением трехокиси серы:
2Ti2(SO4)3 + О2 = 4TiO(SO4) + 2SO3 + 359 ккал
Другие сульфатоксиды титана(1У). Трисульфатпенток-
сид титана—^С^ЗО^з —образуется при нагревании раствора
чистой двуокиси титана в концентрированной серной кислоте в те-
чение 18 ч до постоянной массы (температура при этом достигает
340° С). Он представляет собой белый порошок.
Сульфаттриоксид титана — Т12О.з (SO.-,) — образуется
при термическом разложении сульфатоксида титана (579° С) или
трисульфатпентоксида титана (420—430°С). Сульфаттриоксид ти-
тана представляет собой белый порошок; при 618° С разлагается
с выделением трехокиси серы.
Сульфаттридекаоксид титана — Ti70i3(SO4) — обра-
зуется при термическом разложении сульфаттриоксида титана. Он
представляет собой белый порошок; при 635° С разлагается на дву-
окись титана и трехокись серы.
Сульфатхлориды титана. Из смешанных сульфатхлоридов ти-
тана(ГУ) известны лишь сульфатдихлорид и дисульфатдихлорид.
Сульфатдихлорид титана (IV) — T1C12SO4 — образует-
ся при действии концентрированной серной кислоты на тетрахлорид
титана:
TiCh + H2SC>4 = TiCl2(SO4) + 2НС1
273
Сульфатдихлорид титана представляет собой желтую кристалличе-
скую массу. Водой разлагается с обесцвечиванием и образованием
моносульфатоортотитановой кислоты:
TiCl2(SOJ + ЗНаО = H4[TiO3(SO4)] + 2НС1
Дисульфатдихлорид титан а (IV) — TiCl2(S20z) — об-
разуется при действии на тетрахлорид титана двусерной кислоты:
TiCl.t + H2S2O7 = TiCl2(S2O7) + 2НС1
Дисульфатдихлорид титана представляет собой желтую кристалли-
ческую массу. Водой разлагается.
Хлоросульфаты титана. Из хлоросульфатов, т. е. производных
хлоросерной кислоты, известны лишь смешанные хлоросульфатхло-
риды титана(IV).
Дихлоросульфатдихлорид титана — TiCl2 (SO3C1) 2
(мол. вес 349,84) образуется при взаимодействии трехокиси серы
с тетрахлоридом титана:
TiCl4 + 2SO3 = TiCl2(SO3Cl)2
Дихлоросульфатдихлорид титана представляет собой желтый кри-
сталлический порошок; плотность при 20° С равна 2,012 г/см3. При
нагревании диссоциирует на тетрахлорид титана и трехокись серы.
Водой легко гидролизуется, обесцвечиваясь, причем образуется ди-
сульфатотитановая метакислота:
TiCl2(SO3Cl)2 + ЗН2О = H2[TiO(SO4)2] + 4НС1
При действии большого избытка трехокиси серы на тетрахлорид
титана может в некотором количестве образоваться и трихлоро-
сульфатхлорид титана — TiCl(SO3C1)з- Он представляет
собой желтый кристаллический порошок; ведет себя подобно ди-
хлоросульфатдихлориду титана.
X л о р о с у л ь ф а т т р и х л о р и д титана — TiCl3 (SO3C1) —
образуется при действии на тетрахлорид титана хлоросерной кис-
лоты, а также при действии сложных эфиров хлоросерной кислоты,
например метилхлоросульфата на тетрахлорид титана:
TiCl4 + CH3SO3C1 = TiCI3(S O3CI) + СНЭС1
Хлоросульфаттрихлорид титана представляет собой желтый кри-
сталлический порошок, разлагающийся при нагревании и при дей-
ствии воды.
Селенитосоединения титана
Из селенсодержащих соединений титана здесь можно отметить селенит-
оксид титана — TiO(SeOs), который образуется при осторожном обезвожи-
вании селенитометатитановой кислоты. Селенитоксид титана представляет собой
белый аморфный порошок.
Известен также тетрахлороселенит титана — Ti(SeOCl4)2, который
образуется при взаимодействии тетрахлорида титана с хлородноокисью селена.
274
СульфатотитЭновые кислоты 1,2,218-220
Сульфатокислотами являются комплексные кислоты, содержа-
щие в качестве лигандов сульфат-ионы. Таким образом, титановые
сульфатокислоты можно рассматривать как продукты замещения
оксид-ионов в оксотитановых кислотах на сульфат-ионы.
Система TiO2—SO3 — Н2О. Титановыми сульфатокислотами
являются соединения сульфатов титана(IV) с водой или двуокиси
титана с серной кислотой, т. е. титановые сульфатокислоты — это
Рис. 50. Система Т1О2—SO3—Н2О:
I - TiO2-2SO3.9H2O; 2-TiO2-SO3-5H2O; 3-TiO2-2SO3-4H2O; 4-TiO2-3SO3-5H2O;
5 - TiO2-SO3-2H2O; 6 - 2T1O2 • 3SO3 5H2O; 7 - T1O2-2SO3-3H2O;
«- TiO2-4SO3.4 -I. H2O’ 9 - 5T1O2-SO3-5H2O; 10 - 2T1O2-5SO3.5H2O;
11 - 2TiO2.3SO3-3H2O; 12 - TiO2.SO3-H2O; 13 - Ti02-4S03.2H2O;
14 - 6T102-5S03-4H20; 15 - 2TiO2-S03-H2O; 16 - 7T1O2-2SO3-H2O.
соединения, образующиеся в системе TiO2—SO3—Н2О. Исследова-
ния этой системы показали, что в ней существуют шестнадцать
определенных соединений, содержащих TiO2, SO3 и Н2О в различ-
ных соотношениях. Однако непосредственно могут быть выделены
только немногие из этих соединений.
Для выяснения состава титановых сульфатокислот, их взаимной
связи, отношения к титановым оксокислотам, серной, а также мно-
госерным кислотам на рис. 57 изображен концентрационный
треугольник для системы TiO2—SO3 — Н2О. Состав системы на
этом треугольнике выражен в мольных процентах. Точками обо-
значены составы тройной системы, соответствующие определенным
275
соединениям. На стороне треугольника ТЮ2—Н2О располагаются
титановые оксокислоты, на стороне SO3—Н2О — серная и много-
серные кислоты, а также водные соединения серной кислоты (суль-
фаты гидроксония) и на стороне TiO2—SO3 — сульфаты тита-
на (IV). Таким образом, титановые сульфатокислоты, расположен-
ные на площади треугольника, можно рассматривать как водные
соединения сульфатов титана(IV), или как соединения трехокиси
серы с титановыми оксокислотами, или как соединения двуокиси
титана с серной и многосерными кислотами (а также с сульфатами
гидроксония). Следовательно, титановые сульфатокислоты можно
представить как продукты замещения в полититановых кислотах
части молекул двуокиси титана на молекулы трехокиси серы.
Моносульфатотитановые кислоты. Из моносульфатотитановых
кислот, являющихся водными соединениями сульфатоксида тита-
на (IV), известны как мета-, так и орто-кислота.
Моносульфатометатитановая кислота —
H2[TiO2(SO4)] (мол. вес 177,98)—образуется при нагревании рас-
твора двуокиси титана в 67%-ной серной кислоте от 90 до 130° С,
после чего она выпадает в виде осадка. Моносульфатометатитано-
вая кислота, которую можно рассматривать как одноводное соеди-
нение сульфатоксида титана (IV), представляет собой белые мелко-
зернистые призматические кристаллы ромбической сингонии (а =
= 979, b = 512 и с = 860 пм). В холодной воде растворяется хо-
рошо, но медленно; в концентрированных водных растворах на
холоду гидролизу не подвергается; в теплой (50—60° С) воде,
а также в соляной кислоте растворяется быстрее. В этаноле не рас-
творяется. ' ,
Моносульфатоортотитановая кислота — H4[TiO3(SO4)] (мол. вес
195,99) является двуводным соединением сульфатоксида тита-
на (IV). Она образуется при нагревании раствора двуокиси титана
в 50%-ной серной кислоте до 100°С, из которого по охлаждении
выпадает в виде длинных иглообразных кристаллов. Моносульфа-
тоортотитановая кислота представляет собой бесцветные прозрач-
ные иглообразные кристаллы с сильным двойным лучепреломле-
нием. Хорошо, но медленно растворяется в воде; нерастворима
в спирте и эфире. Кипящей водой гидролизуется.
Существует также пятиводное соединение сульфатоксида тита-
на (IV)— H4[TiO3(SO4)]-3H2O, которое образуется в виде белого
аморфного осадка из раствора двуокиси титана в смеси серной кис-
лоты со спиртом.
Дисульфатотитановые кислоты. Из дисульфатотитановых кис-
лот, являющихся водными соединениями нормального сульфата
титана (IV), также известны и мета-, и орто-кислоты.
Ди сульфа тометатитано в а я кислота —
H2[TiO(SO4)2]-2H2O (мол. вес 258,04 + 36,03)—образуется при
окислении сульфата титана (III) азотной кислотой и выделяется
при выпаривании полученного раствора с серной кислотой. Дисуль-
фатометатитановая кислота представляет собой желтую смолооб-
276
разную гигроскопичную массу. При нагревании отделяет воду, а за-
тем трехокись серы и переходит в сульфатоксид титана (IV).
Дисульфа тоортотитано в а я кислота —
H4[TiO2(SO4)2]• 2Н2О (мол. вес 276,05 + 36,03)—образуется при
нагревании гексафторотитаната калия с концентрированной серной
кислотой, взятых в мольном отношении 1 :2. После выделения па-
ров трехокиси серы образуется стеклообразная масса, из которой
путем растворения в холодной воде и последующего обезвоживания
выделяют продукт. Дисульфатоортотитановая кислота представ-
ляет собой бесцветный мелкокристаллический порошок. Раство-
ряется в подкисленной воде; в спирте, эфире, ацетоне, бензоле, пи-
ридине не растворяется.
Существует также девятиводное соединение сульфата титана,
которое может быть символизировано формулой H4[TiO2(SO4)2] •
• 7НгО.. Оно представляет собой белый мелкокристаллический по-
рошок.
Полисульфатотитановые кислоты. Трисульфатометати-
тановая кислот а — H2[Ti(SO4)3] • 4Н2О— образуется при раство-
рении нормального сульфата титана(IV) в 50%-ной серной кислоте
и может быть выделена из раствора после упаривания его в ва-
кууме. Трисульфатометатитановая кислота представляет собой
хрупкую стеклообразную массу; растворяется в воде (без гидро-
лиза) и метаноле. В водных растворах с сульфатами щелочных ме-
таллов образует комплексные сульфато-соли.
Тетрасульфатоортотитановая кислота —
H4[Ti(SO4)4] — образуется при действии влаги на дисульфат титана,
а также при нагревании двуокиси титана с двусерной кислотой до
100° С:
TiO2 + 2H2S2O7 = H4[Ti(SO4)4]
Известно водное соединение тетрасульфатотитановой кислоты
H4[Ti(SO4)4]-2,5H2O.
Сульфатополититановые кислоты. Мо носу л ь ф ато д ву м е-
татитановая кислота — H2[Ti2O4(SO4)] — образуется при на-
гревании до 100° С раствора 2 частей двуокиси титана в 13 частях
30 %-ной серной кислоты и представляет собой белый аморфный
порошок.
Трисульфатодвуортотитановая кислота —
Н4[Т125з(5О4)з-Н2О — образуется при нагревании до 120° С раство-
ра двуокиси титана в концентрированной серной кислоте и выпа-
дает из него в виде блестящих мелкозернистых кристаллов. Рас-
творяется в воде, подкисленной соляной кислотой. Существует так-
же трехводное соединение трисульфатодвуортотитаноцой кислоты.
Пентасульфатотетрагидроксодвутитановая
кислота — H6[Ti2(OH)4(SO4)6] — образуется при нагревании до
150°С раствора двуокиси титана в концентрированной серной кис-
лоте.
Моносульфатопятиортотитановая кислота —
Hio[Ti50i4(S04)] — образуется при сильном разбавлении на холоду
277
раствора двуокиси титана в серной кислоте и представляет собой
белый аморфный порошок.
Пентасульфатошестиметатитановая кислот а—
Н2[Т1бО8(5О4)5-ЗН2О — образуется при нагревании моносульфато-
двуметатитановой кислоты с двусерной кислотой до 150° С:
3H2[Ti2O4(SO4)J + H2S2O7 = H2[Ti6O8(SO4)5] • ЗН2О
Дисульфатосемиметатитановая кислота —
H2[Ti7Oi3(SO4)2] — образуется при нагревании до 130° С раствора
2 частей двуокиси титана в 13 частях 30°/о-ной серной кислоты и
выпадает из него в виде белого аморфного осадка.
Сульфатопероксотитановые кислоты. При действии перекиси во-
дорода на водные растворы сульфатов титана (сернокислотные рас-
творы двуокиси титана) или при растворении пероксотитанатов ще-
лочных металлов в серной кислоте образуются сульфатопероксоти-
тановые кислоты, окрашенные в оранжевый цвет. В частности,
известна дисульф атопероксометатитановая кисло-
та— НгГЩОг) (SO4)2], которая существует только в водном рас-
творе и придает ему интенсивную оранжевую окраску. Получена
также красная моносульфатопероксоортотитановая
кислота — H4[Ti(O2)O2(SO4)]-H2O, хорошо растворимая в воде
и этаноле.
Селенато- и селенитотитановые кислоты
Известны селенсодержащие аналоги моносульфатотитановой и моносульфато-
двутитановой метакислот.
Селенатометатитановая кислота — H2[TiO2(SeO4)] — образуется
в виде рыхлого осадка при смешении сернокислатного раствора двуокиси титана
с водным раствором селеновой кислоты при мольном отношении [TiO2]: [H2SeO4] =
= 1:1; осадок при нагревании растворяется, а при охлаждении снова выпадает;
его отфильтровывают и сушат над серной кислотой. Селенатометатитановая кис-
лота представляет собой белый тонкодисперсный порошок; слабо растворима в
воде и хорошо — в минеральных кислотах.
Селеиатодвутитановая кислота — Н2[Т i2O4 (SeO4) ] — образуется
аналогично предыдущей, только при мольном отношении [ТЮг]: [H2SeO4] = 2:1.
Это — белый тонкодисперсный порошок, также растворяющийся в воде и кис-
лотах. Отщепляет молекулу воды лишь при нагревании до 130° С.
Селенитометатитановая кислота — Н2[ТЮ2 (ЭеОз) ] — образуется
при смешении сернокислотного раствора двуокиси титана с водным раствором
селенистой кислоты при мольном отношении [ТЮ2]: [Н25еОз] =1:1. Она пред-
ставляет собой белый мелкокристаллический порошок, плохо растворимый в воде
и хорошо — в кислотах.
Существует также селенитодвутитановая кислота —
Н2[Т12О4(8еОз)], образующаяся аналогично.
Селенитотитановые кислоты при нагревании сначала теряют воду, образуя
в качестве промежуточного продукта селенитоксид титана; при более интенсив-
ном нагревании происходит отщепление двуокиси селена и в остатке оказывается
двуокись титана.
Сульфатотитанаты ’2’220’221
При взаимодействии сульфатов титана (IV) с сульфатами ак-
тивных, например щелочных, металлов образуются многочисленные
сульфатосоли, называемые сульфатотитанатами. В присутствии
278
сильных катионов стабильность комплексного сульфатотитанат-
аниона повышается, и сульфатотитанаты активных металлов
являются уже достаточно устойчивыми веществами. Сульфатотита-
нат-анионы можно подразделить на три основных типа: 1) моно-
сульфатометатитанат-ионы — [TiOa (SO4)]2-; 2) дисульфатометати-
танат-ионы — [TiO(SO4)2]2- и 3) трисульфатометатитанат-ионы —
; [Ti (SO4)3]2“. Кроме них существуют еще сульфатотитанат-анионы
более сложного состава.
Моносульфатометатитанаты, или сульфатодиоксотитанаты. Из
моносульфатометатитанатов известны калиевая и аммониевая соли.
Моносульфато метатитанат калия — KatTiOa (SO4)] •
• НгО — образуется при взаимодействии сульфатоксида титана
с гидроокисью калия.
, Г идромоносу льфатометатитанат аммония —
(NH4)H[TiO2)SO4)]- Н2О — образуется при смешении разбавленно-
го раствора двуокиси титана в серной кислоте с малым количест-
вом аммиака. При выпаривании раствора в вакууме образуются
правильные кристаллы гидромоносульфатометатитаната аммония,
которые медленно разлагаются при действии воды.
Дисульфатометатитанаты, или дисульфатооксотитанаты. Из ди-
сульфатометатитанатов известны соли натрия, калия и аммония.
Дисульфатометатитанат натрия — Na2[TiO(SO4)2]—
образуется при сплавлении титановой кислоты с гидросульфатом
натрия или же при добавлении сульфата натрия к раствору дву-
окиси титана в серной кислоте (из расчета 1 моль Na2SO4 на
1 моль TiO). Для выделения соли растворы (в том числе получен-
ный обработкой сплава 10%-ной серной кислотой) фильтруют,
а фильтрат упаривают. Дисульфатометатитанат натрия представ-
ляет собой мелкие иглообразные кристаллы, очень трудно раство-
римые в холодной воде; легко растворяется в воде, подкисленной
серной или щавелевой кислотами. Горячей водой разлагается.
Дисульфатометатитанат калия — K2[TiO(SO4)2] —
образуется при сплавлении титановой кислоты с гидросульфатом
калия; из полученного плава соль выделяют путем обработки его
10 %-ной серной кислотой и упаривания отфильтрованного раство-
ра. Дисульфатометатитанат калия представляет собой бесцветные
кристаллы, растворимые в подкисленной воде.
Ди сульфатометатитанат аммония —
(NH4)2[TiO2(SO4)2]-H2O— образуется при смешении концентриро-
ванного раствора сульфата аммония с насыщенным раствором дву-
окиси титана в концентрированной серной кислоте. Из раствора
одноводная соль кристаллизуется при температуре не выше 30°С.
Одноводный дисульфатометатитанат аммония представляет србой
белые тетраэдрические кристаллы кубической сингонии (а =
= 1757 пм)-, плотность кристаллов при 15° С равна 2,005 г/см3. На
воздухе кристаллы устойчивы до температуры 110° С. При нагрева-
нии же до 200° С кристаллы обезвоживаются, переходя в р-моди-
фикацию (NH4)2[TiO(SO4)2]. «-Модификация безводного дисульфа-
S79
тометатитаната аммония может быть получена кристаллизацией из
сернокислотного раствора при температуре выше 40° С в виде бе-
лых иглообразных кристаллов. Безводный дисульфатометатитанат
аммония на влажном воздухе переходит в одноводную соль. Как
безводный, так и одноводиый дисульфатометатитанат аммония хо-
рошо растворим в воде. Безводный дисульфатометатитанат аммо-
ния при нагревании выше 300° С разлагается с отделением сначала
аммиака, а затем трехокиси серы.
Трисульфатометатитанаты. Из трисульфатометатитанатов, ко-
торые являются довольно прочными соединениями, известны соли
щелочных, щелочноземельных и переходных металлов.
Трисульфатометатитанат натрия — Na2[Ti(SO4)3]-
•ЗН2О — образуется при нагревании тетрахлорида титана с из-
бытком гидросульфата натрия с последующим растворением в во-
де; соль отделяется от побочных продуктов путем фракционной
кристаллизации из водного раствора. Существует также гидро-
трисульфатометатитанат натрия — NaH[Ti(SO4)3]-
•яН2О.
Трисульфато метатитанат калия — Ka[Ti (SO4)3] —
образуется при растворении двуокиси титана в расплавленном ди-
сульфате или гидросульфате калия. При растворении полученного
плава в водном растворе сульфата калия образуется трехводное
соединение трисульфатометатитаната калия — К2ГП (БО4)3] • ЗНаО.
Последнее образуется также при взаимодействии эквимолекуляр-
ных количеств сульфатов калия и титана(IV) в водной среде,
а также при действии раствора сульфата калия на дисульфатоме-
татитановую кислоту.
H2[TiO(SO4)2] • 2Н2О + K2SO4 = К2[Ti(SO4)3] • ЗН2О
Выделяют трехводное соединение трисульфатометатитаната калия
путем испарения раствора в вакууме над серной кислотой. Соль
представляет собой мелкокристаллический порошок, трудно раство-
римый в холодной воде, при нагревании водой разлагается.
Существует также гидротрисульфатометатитанат
калия — КН[Т1(БО4)з] -пН2О.
Трисульфатометатитанат магния — Mg[Ti(БО4)з]—
образуется при введении нормального сульфата титана (IV) в сер-
нокислотный раствор сульфата магния. Соль представляет собой
белые кристаллы кубической сингонии. При растворении в воде
гидролизуется.
Трисульфатометатитанат кальция — Ca[Ti(SO4)3]—
образуется при смешении 0,4%-ного раствора двуокиси титана
в концентрированной серной кислоте с половинным количеством
3%-ного раствора сульфата кальция в концентрированной серной
кислоте и выделяется при медленном выпаривании смеси. Он обра-
зуется также при обработке метатитаната кальция концентриро-
ванной серной кислотой в виде маленьких белых блестящих псев-
докубических кристаллов. Водой разлагается с выделением тита-
280
новой метакислоты:
Ca[Ti(SO4)3] + ЗН2О = Н2Т1О3 + Ca(HSO4)2 + HZSO4
При нагревании до 600° С разлагается на двуокись титана, сульфат
кальция и трехокись серы.
Трисульфатометатитанат стронци я—5г[П(5О4)з]—
образуется при смешении 2 частей 0,4%-ного раствора двуокиси
титана в концентрированной серной кислоте с 1 частью 2,5%-ного
раствора сульфата стронция в концентрированной серной кислоте
и выделяется из смеси при выпаривании. Соль представляет собой
бесцветные, блестящие, хорошо образованные псевдокубические
кристаллы. Водой разлагается с выделением титановой метакис-
лоты.
Трисульфатометатитанат бария — Ва[Т1 (5О4)з] —
образуется при нагревании двуокиси титана и сульфата бария
с концентрированной серной кислотой. Он представляет собой бе-
лые нитевидные сильно гигроскопичные кристаллы. В отсутствие
влаги устойчив до 550° С. При температуре выше 550° С разла-
гается:
Ba[Ti(SO4) 3] = BaSO4 + TiOSO4 + SO3
Водой разлагается, а при промывании ацетоном заметно не изме-
няется.
Трисульфатометатитанат марганца (II) —
Мп[ТЦ5О4)з] — образуется при нагревании сульфат-оксида титана
и сульфата марганца(II) с серной кислотой. Соль представляет
собой желтые кристаллы. При нагревании до 450° С разлагается на
двуокись титана, сульфат марганца (II) и трехокись серы.
Трисульфатометатитанат желез а (II)—Fe[Ti(SO4)3]
(мол. вес 391,93) образуется при обработке концентрированной
серной кислотой метатитаната железа(II), а также при введении
сульфата железа(II) в горячий раствор двуокиси титана в концен-
трированной серной кислоте. Для получения трисульфатометатита-
ната железа(II) приготовляют смесь 60 г 20%-ного раствора суль-
фата железа(II), 25 г 40%-ного раствора сульфатоксида титана и
550 г концентрированной серной кислоты; смесь нагревают в атмо-
сфере двуокиси углерода, предотвращающей окисление железа (II).
При 160°С смесь приобретает темную окраску, при 210° С из нее
начинают выпадать кристаллы, а при 240° С выделяется практиче-
ски весь образовавшийся трисульфатометатитанат железа (II) в виде
хорошо отделяющихся от жидкости кристаллов, которые промы-
вают ледяной водой.
Трисульфатометатитанат железа (II) представляет собой куби-
ческие кристаллы сиреневого цвета. В холодной воде растворяется
очень медленно; при длительном воздействии холодной воды (более
суток) или же горячей водой (60—70° С) трисульфатометатитанат
железа (II) подвергается гидролизу с образованием дисульфатоме-
281
татитановой кислоты:
Fe [Ti (SO4)3]2 + H2O = H2[TiO(SO4)2] + FeSO4
В спирте и ацетоне трисульфатометатитанат железа (II) не раство-
ряется.
Трисульфатометатитанат железа(Ш) —
Fe2[Ti (SO4)3]3, — образуется при обработке концентрированной сер-
ной кислотой минерала аризонита [метатитанат железа (III)], а так-
же при взаимодействии нормальных сульфатов железа(III) и ти-
тана (IV) в сернокислотной среде. Трисульфатометатитанат желе-
за (III) представляет собой бурую кристаллическую массу. При
прокаливании отделяет трехокись серы и переходит в метатитанат
железа (III):
Fe2[Ti(SО4)з]з = Fe2(TiO3)3 -I- 9SO3
При растворении в воде подвергается гидролизу с образованием
дисульфатометатитановой кислоты и сульфата железа (III).
Трисульфатометатитанат кобальта (II) —
Со[Т1(Б04)з]— образуется при нагревании сульфатоксида титана
и сульфата кобальта(II) с серной кислотой. Соль представляет со-
бой розовые кристаллы. При нагревании до 400° С разлагается на
двуокись титана, сульфат кобальта(II) и трехокись серы.
Трисульфатометатитанат никеля — Ni[Ti(S 6)4)3] —
образуется в аналогичных условиях и представляет собой зеленые
кристаллы.
Трисульфатометатитанат мед и (II) — Cu[Ti(SO4)3]—
образуется при нагревании смеси сульфатоксида титана, безвод-
ного сульфата меди и концентрированной серной кислоты. БелЫй-
порошок. При нагревании до 375°С начинает разлагаться на дву-
окись титана, сульфат меди и трехокись серы.
Трисульфатометатитанат цинка — Zn[Ti(SO4)3]—
образуется при нагревании сульфатоксида титана, безводного суль-
фата цинка и серной кислоты. Белый порошок. Разлагается при на-
гревании до 400° С.
Т р ису л ь ф а т о м е т а т и т а н а т кадмия — Cd[Ti(SO4)3] —
образуется в аналогичных условиях.
Т р ису л ь ф ат о м ет а т и т а н а т аммония —
(NH4)2[Ti(SO4)3]—образуется при нагревании смеси 1 части дву-
окиси титана, 5 частей сульфата аммония и 10 частей концентриро-
ванной серной кислоты. Трисульфатометатитанат аммония пред-
ставляет собой крупные белые блестящие кристаллы. В холодной
воде медленно растворяется; теплой водой гидролизуется. При на-
гревании разлагается.
Сульфатополититанаты. Кроме перечисленных сульфатотитана-
тов существуют еще соли более сложного состава, из которых из-
вестны следующие.
Эннеасульфатоэннеаоксогептатнтанат натрия —
-NaafTirOg (SO4)э] — образуется при смешении водного раствора трисульфатомета-
282
титановой кислоты с насыщенным раствором сульфата натрия. Он представляет
собой белые кристаллы.
Пентасульф атотриоксотрититанат калия — К4[Т13Оз(ЗО4)5] •
• IOH2O — образуется при смешении насыщенного раствора двуокиси титана в
концентрированной серной кислоте с насыщенным водным раствором сульфата
калия. Соль представляет собой белые иглообразные кристаллы. В воде хорошо
растворяется с разложением.
Эннеасульфатоэннеаоксогептатитанат калия —
KstTiyOg (SO4) g]—образуется подобно соответствующей натриевой соли и также
представляет собой белые кристаллы.
Октасульфатотрититанат бария — В a2[Ti3 (SO4) 8] — образуется
’ при смешении растворов двуокиси титана и сульфата бария в концентрированной
1 серной кислоте. Соль представляет собой очень мелкие иглообразные кристаллы.
Разлагается водой (с выделением титановой метакислоты) и спиртом.
'. Дисульфатотриоксодититанат аммония — (NH4)гГПгОз(804)2]•
• ЗН2О — образуется при действии аммиака на разбавленный раствор двуокиси
титана в серной кислоте и выделяется при выпаривании в вакууме. Соль пред-
ставляет собой правильные кристаллы. На влажном воздухе медленно разла-
гается.
Пентасульфатодиоксодититанат железа(П) —
Fe3[Ti2O2(SO4)5] — образуется при смешении растворов сульфата железа(П) и
сульфатоксида титана в 30%-ной серной кислоте. Пентасульфатодиоксодититанат
железа (II) придает раствору желтую окраску, но выделить его кристаллы из
раствора не удается.
Сульфатопероксотитанаты. Известны дисульфатопероксометати-
танаты щелочных металлов и аммония.
Дисульфатоперо к с ометатитанат лития —
Li2[Ti (О2) (804)2]-7Н2О — образуется при взаимодействии сернокис-
лотного раствора двуокиси титана с порошком сульфата лития,
взятых в мольном отношении 1 :0,8, и избытком 30%-ного раствора
перекиси водорода. Из смеси при добавлении спирта выделяется
маслообразный слой, из которого соль выделяется путем добавле-
ния абсолютного спирта. Соль представляет собой аморфный жел-
тый гигроскопичный порошок.
Дисульфатопероксометатитанат калия —
Na2[Ti(O2) (SO4)2] • 10Н2О — образуется подобно литиевой соли.
Кристаллы соли образуются при действии избытка перекиси водо-
рода на сернокислотный (1О°/о-ный) раствор, содержащий 10% ТЮг
и 35% Na2SO4. После выдерживания полученного раствора в экси-
каторе над концентрированной серной кислотой при 15°С из него
сначала кристаллизуется чистый сульфат натрия, а затем и дисуль-
фатопероксометатитанат натрия, представляющий собой оранжевый
кристаллический порошок.
Дисульфатопероксометатитанат калия —
КгГЩОг) (5О4)2]-ЗН2О— образуется при действии перекиси водо-
рода на сернокислотный раствор двуокиси титана в присутствии
сульфата калия. Для получения соли титановую кислоту раство-
ряют в четырехкратном количестве концентрированной серной кис-
лоты и образовавшийся сироп разбавляют равным объемом воды.
К 100 см3 раствора (содержащим 18,36 г ТЮ2) прибавляют 33,4 г
хорошо измельченного сульфата калия и 20 c/t3 30%-ного раствора
перекиси водорода. Из полученного таким образом оранжево-крас-
283
ного раствора спиртом осаждают красный осадок соли, который
промывают спирто-эфирной смесью и сушат в эксикаторе. Соль по-
лучается в виде семиводного соединения. Для быстрого получения
соли растворяют эквимолекулярные количества сульфатоксида ти-
тана (IV) и сульфата калия в возможно малом количестве 20 %-ной
серной кислоты, прибавляют избыток перекиси водорода и осаж-
дают образовавшуюся соль спиртом.
Дисульфатопероксометатитанат калия, представляет собой оран-
жево-красный аморфный порошок. Очень гигроскопичен и легко
растворим в ледяной воде; нерастворим в спирте и эфире. При дей-
ствии большого количества воды происходит гидролиз с образова-
нием желтой нерастворимой в воде пероксотитановой кислоты. При
внесении соли в растворы иодидов выделяется свободный иод. Сер-
нокислотные растворы соли обесцвечивают растворы пермангана-
тов с выделением свободного кислорода. При действии плавиковой
кислоты в растворе соль переходит в гексафторотитанат калия.
ДисульФатопеРоксометатитанат аммония —
r(NH4)2[Ti(O2) (SO4)2]— образуется при введении в сернокислотный
раствор двуокиси титана тонкоизмельчецного сульфата аммония и
избытка 30%-ного раствора перекиси водорода. Из раствора под
действием спирта выделяется оранжевое масло, из которого спир-
то-эфирной смесью осаждают соль в виде аморфной оранжевой
гигроскопичной массы.
НИТРАТО-, ФОСФАТО- И АРСЕНАТОСОЕДИНЕНИЯ
И ИХ АНАЛОГИ
Нитратосоединения 13’ 222-224
Нитрат титана( IV), Нор м ал ьный н и т р а_т т И т а н а (IV)-
TilNOsJi (мол. вес 295,92)—образуется при действии концентри-
рованной азотной кислоты на элементарный титан при температуре
выше 70° С:
Ti + 8HNO3 = Ti(NO3)4 + 4NO2 + 4H2O
Он образуется также при взаимодействии нитратохлора с тетрахло-
ридом титана при —80° С:
TiCl4 + 4CINO3 = Ti(NO3)4 + 4С12
а также при действии полупятиокиси азота на метатитановую кис-
лоту (при нагревании):
H2TiO3 + 3N2O5 = Ti(NO3)4 + 2HNO3
или на тетрахлорид титана (в среде тетрахлорида углерода):
TiCl4 + 4М2О5 = Ti(NO3)4 + 4NO2C1
Образование нитрата титана(IV) происходит также при распаде
хлородигипонитрата титана — Ti(N2O4C1)4, который по-
284
лучается при длительном воздействии получетырехокиси азота на
тетрахлорид титана при низкой температуре (от —20 до —60° С).
Неустойчивый хлородигипонитрат титана при обычной температуре
разлагается, отделяя хлородноокись азота и переходя в нитрат:
Ti(N2O4Cl)4 = 4NOC1 + Ti(NO3)4
Нитрат титана(IV) представляет собой бледно-желтый блестя-
щий кристаллический порошок. Кристаллизуется в моноклинной
сингонии (а = 780, b — 1357 и с = 1034 пм)-, плотность 1,9 г) см3.
Температура плавления 58° С. При разрежении (12 мм рт. ст.) на
холоду не разлагается. В глубоком вакууме при 40° С возгоняется.
На воздухе разлагается с образованием нитратоксида титана(IV),
что, по-видимому, связано с гидролизом его водяными парами:
Ti (NO3)4 + Н2О = TiO(NO3)2 + 2HNO3
В нитрате титана(IV) нитрато-группы связаны с атомом титана
ковалентными связями. Рентгеноструктурное исследование нитрата
титана(IV) показало, что в его молекуле нитрато-группы располо-
жены в двух взаимноперпендикулярных плоскостях. Таким обра-
зом, нитрат титана (IV) является не солью, а типичным кислотооб-
разователем. Он обладает также свойствами сильного окислителя.
Нитратоксид титана(1У)—TiO (NO3)2 —образуется, как уже
отмечалось, при гидролизе нормального нитрата титана(IV) вла-
гой воздуха. Нитратоксид титана(IV) представляет собой белую
гигроскопичную массу. При нагревании разлагается по уравнению:
2TiO(NO3)2 = 2TiO2 + 4NO2 + О2
В воде растворяется с разложением:
TiO(NO3)2 + ЗН2О = H4TiO, -i- 2HNO3
Нитратхлориды титана(1У)—TiCl2(NO3)2 и TiOCl(NO3) —
образуются при взаимодействии тетрахлорида титана с концентри-
рованной азотной кислотой:
TiC 14 + 2HNO3 = TiC 12(NO3)2 + 2НС1
TiC I4 + 2HNO3 = TiOCl(NO3) + NOCI + Cl2 + H2O
Нитратдихлорид и нитратхлороксид титана представляют собой
бледно-желтые кристаллы. Разлагаются при нагревании и при дей-
ствии воды.
Нитраттриамид титана — Ti(NH2)3(NO3) —образуется при дей-
ствии жидкого аммиака на нитрат титана (IV). Оранжево-желтый
порошок, нерастворимый в жидком аммиаке. При нагревании и при
действии воды разлагается.
Тринитраттрифторид титана — TiF3(N3O8)—образуется при
действии избытка нитратохлора на бромтрифторид титана:
TiFsBr + ЗС1(МО3) = TiF3(N3O3) + С12О + ВгС1
285
Тринитраттрифторид титана при нагревании до 180° С переходит
в гексафторотитанат оксотитана (IV):
2TiF3(N3O8) = TiO[TiF6] + 3N2O5
Нитратотитановая кислота. При растворении ортотитановой
кислоты в азотной кислоте и последующем высушивании образует-
ся вязкая желтовато-белая масса, которая после длительного вы-
держивания в эксикаторе над окисью кальция превращается в бле-
стящие белые пластинчатые кристаллы ди нитратопятитит а-
новой кислоты — H12[Ti5Oi5(NO3)2].
Динитратопятититановая кислота при нагревании до 100°С от-
деляет пары азотной кислоты и превращается в метатитановую
кислоту:
Н ia[ TisO isINOala] = 5H2TiO3 + 2HNO3
В холодной воде динитратопятититановая кислота подвергается
гидролизу, образуя очень мутный раствор, из которого при нагре-
вании осаждается ортотитановая кислота:
HI2[Ti5O15(NO3)2] + 5Н2О — 5Н4ТЮ4 + 2HNO3
Динитратопятититановая кислота способна поглощать газооб-
разный аммиак с образованием при этом декагидродинитра-
топентатитаната аммония — (ЫН4)2[Т15О15(ЫОз)2]Ню.
Фосфатосоединения 13’ 225-227
Фосфаты титана(1У). В системе ТЮ2 — Р2О5 образуются два
соединения: дифосфат титана — ТЮг-РгОэ — и диортофосфатоксид
титана — 2Т1О2 • Р2О5.
Дифосфат титана(1У)—TiP2O7 (мол. вес 221,84) обра-
зуется при обезвоживании продукта растворения двуокиси титана
в сиропообразной ортофосфорной кислоте, а также при взаимодей-
ствии тетрахлорида титана с двуфосфорной кислотой. Дифосфат
титана(IV) представляет собой белые мелкие октаэдрические кри-
сталлы, переходящие при 458° С в другую модификацию.
Диортофосфатоксид титан а (IV)—Ti2O(PO4)2 (мол.
вес 301,74) образуется при прокаливании моноортофосфатотитано-
вой кислоты.
Дидихлорофосфатоксид титана(1У)—ТЮ(РО2С12)2 (мол. вес
261,75) образуется при взаимодействии тетрахлорида титана, хлор-
окиси фосфора и полуокиси хлора:
TiC 14 + 2РОС13 + ЗС12О = TiO(PO2Cl2)2 + 6С12
Дидихлорофосфатоксид титана(IV) представляет собой белые кри-
сталлы, термически устойчивые до 250° С; при более высокой тем-
пературе разлагается с выделением паров хлорокиси фосфора. В во-
де гидролизуется. Нерастворим в неполярных растворителях; мало
растворим в хлорокиси фосфора.
286
ОртофосфатотиТановЫе кислоты. Моноортофосфатбм ё-
татитановая кислота — HTiOPO4 (мол. вес 159,88) обра-
зуется при взаимодействии ортофосфорной кислоты с находящи-
мися в растворе соединениями титана (IV), например сульфатокси-
дом:
TiOSO4 + Н3РО4 = HTiOPO4 + H2SO4
Одноводное соединение, т. е. моноортофосфатоортотита-
.новая кислота — Н3ТЮ2РО4 — образуется при взаимодействии
фосфата аммония с солянокислотным раствором двуокиси титана.
Моноортофосфатотитановые кислоты в воде нерастворимы, поэтому
выпадают из раствора в виде белого объемистого студенистого
осадка.
Диортофосфатоортотитановая кислота —
Н4[ТЮ(РО4)2] (мол. вес 257,88) образуется при длительном кипя-
чении с обратным холодильником моноортофосфатотитановой кис-
лоты с раствором ортофосфорной кислоты:
HTiOPO4 + Н3РО4 = H4[TiO(PO4)2]
Диортофосфатотитановая кислота представляет собой белые кри-
сталлы, в воде нерастворимые и не подвергающиеся, гидролизу.
Ортофосфатотрехтитановые кислоты. При взаимодействии рас-
творов соединений титана(IV) и средних фосфатов щелочных ме-
таллов (т. е. в менее кислых средах) выпадает белый аморфный
осадок тетраортофосфатотриоксотрититановой
кислоты — Н6[Т13Оз(РО4)4], которая в водной среде легко под-
вергается гидролизу. При длительной обработке ортофосфорной
кислотой переходит в устойчивую по отношению к воде диортофос-
фатотитановую кислоту.
Диортофосф а’тоге к саоксотрититановая кис-
ло т а — H6[Ti30e(РО4)2] (мол. вес 435,69) образуется в виде трех-
водного соединения (т. е. тригидродиортофосфатотрититаната акво-
ния) при постепенном добавлении раствора ортофосфорной кисло-
ты или ортофосфата к кислому раствору, содержащему не больше
10% TiO2. Она представляет собой белый зернистый легко отфиль-
тровывающийся осадок.
Ортофосфатооксопероксотитановая кислота — Н3[Т1 (О2) О (РО4) ]
(мол. вес 193,89) образуется при действии смеси перекиси водо-
рода с ортофосфорной кислотой на раствор сульфата титана(IV)
(сернокислотный раствор титановой кислоты). Ортофосфатооксо-
пероксотитановая кислота представляет собой аморфный объеми-
стый желтый порошок. В воде и уксусной кислоте не растворяется;
растворяется в минеральных кислотах и щелочах.
Фосфитосоединения. При действии водного раствора фосфори-
стой кислоты, полученного путем гидролиза трихлорида фосфора,
на солянокислотный раствор титановой кислоты образуется фосфит
-титана(IV), или фосфитотитановая кислота; при нейтрализации
смеси аммиаком соединение выпадает в виде осадка белого цвета.
.287
Фосфатотитанаты. При сплавлении двуокиси титана с фосфата-
ми щелочных металлов образуются комплексные соли, называемые
фосфатотитанатами. Некоторые фосфатотитанаты образуются так-
же при взаимодействии растворов фосфатов и соединений тита-
на (IV).
Триортофосфатодититанат натри я—Na[Ti2(PO4)3]—
образуется при растворении двуокиси титана в расплавленном ме-
тафосфате натрия. Он представляет собой кристаллы гексагональ-
ной сингонии (а = 849,2; с = 2177,9 пм) с двойным лучепреломле-
нием. Изоморфен с триортофосфатодистаннатом натрия —
Na[Sn2(PO4)3J.
Октаортофосфатотрититанат натрия —
Nai2[Ti3(PO4)8]— образуется при растворении двуокиси титана в
расплавленном ортофосфате или дифосфате натрия и представляет
собой призматические кристаллы.
Ортофосфатооксотитанат калия — К[ТЮ(РО4)] —
образуется при растворении титановой кислоты в расплавленном
ортофосфате или дифосфате калия. Он представляет собой пра-
вильные октаэдрические или ромбоэдрические кристаллы.
Триортофосфатодититанат калия — К[Т12 (РО4) з] —
образуется при растворении двуокиси титана в расплавленном ме-
тафосфате калия и представляет собой мелкие кристаллы кубиче-
ской сингонии с двойным лучепреломлением.
Диортофосфатооксотитанат бария —
Ва2[ТЮ(РО4)2] (мол. вес 528,52) образуется при спекании смеси
гидроортофосфата бария и двуокиси титана (в мольном отноше-
нии 2:1):
2ВаНРО4 + ТЮ2 = Ba2[TiO(PO4)2] + Н2О
Диортофосфатооксотитанат бария представляет собой белые кри-
сталлы моноклинной сингонии (а = 1657,8, Ь = 543,7, с = 475,6 пм и
а = 94° О7). При 1040° С происходит полиморфное превращение
а-> |3. Кристаллы диортофосфатооксотитаната бария сильно пре-
ломляют свет: показатель преломления 1,671. Диортофосфатооксо-
титанат бария способен к фосфоресценции.
Фосфатопероксотитанаты. Дифосфатопероксотитанат
натрия — Na2[Ti (О2) (Р2О7)] • ЗН2О— образуется при действии
водного раствора перекиси водорода на триортофосфатодититанат
натрия; из получающегося золотисто-желтого раствора соль осаж-
дают путем добавления спирта. Дифосфатопероксотитанат натрия
представляет собой гигроскопичный желтый порошок, растворимый
в воде.
Дифосфатотриоксопероксодититанат нат-
рия— Na2[Ti2(O2)O3(P2O7)] • 24Н2О— образуется при добавлении
перекиси водорода к смеси концентрированных растворов дифос-
фата натрия и дифосфатоксида титана(IV); из желтого раствора
соль осаждают, добавляя спирт. Дифосфатотриоксопероксодитита-
нат натрия представляет собой легкий порошок лимонно-желтого
288
цвета. В воде растворяется без разложения; при подкислении ми-
неральной кислотой лимонно-желтая окраска раствора меняется на
оранжевую.
Арсенатосоединения
Арсенаты титана(1У). При взаимодействии в растворе ортоти-
тановой и ортомышьяковой кислот образуется объемистый аморф-
ный осадок, содержащий арсенаты титана и арсенатотитановые
кислоты.
Диарсенат титана(1У)—TiAs2O7 (мол. вес 309,74) мо-
жет быть получен из аморфного осадка путем нагревания его до
400° С. Диарсенат титана (IV) представляет собой белые кристаллы.
При нагревании выше 600° С распадается на двуокись титана и
полупятиокись мышьяка. В воде нерастворим, но при pH 3,5 под-
вергается гидролизу.
Арсенатотитановые кислоты. При длительном нагревании
аморфного осадка арсенатов титана с раствором ортомышьяковой
кислоты образуется диортоарсенатооксотитановая
кислота — H4[TiO(AsO4)2], представляющая собой белые кри-
сталлы, растворимые в подкисленной (например, ортомышьяковой
кислотой) воде, но при pH > 5,5 подвергается гидролизу. При на-
гревании до 150°С диортоарсенатооксотитановая кислота теряет
молекулу воды, образуя диортоарсенатометатитан о-
вую кислоту—H2[Ti (АзОДг], которая при нагревании до
400° С переходит в диарсенат титана(IV). При гидролизе диарсе-
ната титана(IV) образуются моноортоарсенатооксоти-
тан о в ы е кислоты — H[TiO(AsO4)] и HsfTiC^AsOi)].
Арсенитосоединеиия. При действии гидрометаарсенита калия — KH(AsO2)2 —
на раствор сулыфатоксида титана(IV) образуется тетраортоарсениттетраоксид ти-
тана— TisO^AsOa)^ он выпадает из раствора в виде студенистого осадка, ко-
торый при высушивании превращается в кристаллический порошок, а при силь-
ном нагревании приобретает желтую окраску.
Известна также арсенитотитановая кислота.
Стибатосоединения
Стибатотитанаты образуются при спекании соответствующих оксотитанатов
с полупятиокисью сурьмы. В природе встречается гексаортостибатодити-
танат кальция — CasITia(SbC>4)в] — в виде минерала льюисита. Соль пред-
ставляет собой мелкие желтые кристаллы; плотность 4,95 ejcM3. Ди гекс а-
ф т о р о с т и б а т о к с и д титана(1У)—TiO(SbF6)2 — образуется при раство-
рении дихлороксида титана в избытке пентафторида сурьмы и выдерживании
раствора в глубоком вакууме при 200—210° С в течение 10 ч.
Висмутитосоединения
Тетраоксодифтородивисмутит титана(1У) Ti[Bi2F2OJ — обра-
зуется при сплавлении двуокиси титана с оксомонофторидом висмута BiFO.
ю Зак. 1128
289
КАРБАЦИДОСОЕДИНЕНИЯ
Карбонатосоединения 223
Нормальный карбонат титана(IV) и титановые карбонатокис-
лоты в свободном виде не выделены, однако соли этих кислот —
карбонатотитанаты — известны.
Карбонато-(1У)титанаты. При растворении свежеосажденной
титановой кислоты в растворах карбонатов щелочных металлов
или аммония образуются карбонатометатитанаты —
Ме2[ТЮг(СОз)], а в растворах гидрокарбонатов, соответственно,
дикарбонатометатитанаты — Мег[ТЮ (СОз)г]. В насы-
щенном растворе гидрокарбоната калия растворяется даже дву-
окись титана, причем образуется дикарбонатометатитанат калия:
ТЮ2 + 2КНСО3 = К2[ТЮ(СО3)2] + Н2О
Эти карбонатометатитанаты очень неустойчивы. При нагревании их
водных растворов происходит выделение метатитановой кислоты:
[ТЮ(СО8)2]2- + Н2О = H2TiO3 + СО2- + СО2
[ТЮ2(СО8)]2- + н2о = н2тю3 + со2-
Известен также трикарбонатометатитанат кальция —
Са[Т1(СО3)з], который образуется при обработке свежеосажденной
титановой кислоты раствором гидрокарбоната кальция и двуокисью
углерода. Это белый нерастворимый в воде порошок; кислотами
разлагается с выделением двуокиси углерода.
Карбонатдихлорид титана(1У)—TiCl2(CO3) (мол. вес
178,815) образуется при реакции тетрахлорида титана с тетранитро-
метаном:
2TiCl4 + C(NO2)4 = TiCl2(CO3) + TiCl4 • 2NOC1 + N2O3
Карбонатдихлорид титана(IV) представляет собой белые иглооб-
разные кристаллы.
Карбонатохлоротитанаты. При взаимодействии карбонатдихло-
рида титана(IV) с насыщенными растворами карбонатов калия
или аммония образуются соответствующие дикарбонатоди-
хлоротитанаты:
TiCl2(CO3) + СО2- = [TiCl2(CO3)2]2-
Дикарбонатодихлоротитанаты калия и аммония, которые хотя и
удается выделить из раствора, очень неустойчивы и легко разла-
гаются с выделением соответствующего хлорида, диоксидов титана
и углерода.
При пропускании над карбонатдихлоридом титана(IV) смеси
аммиака и хлороводорода, получаемой сублимацией хлорида ам-
мония, происходит образование карбонатотрихлоротита-
ната аммония:
Ti С12(СО3) + NH3 + НС1 = NH4 [TiCI3 (СО3)]
290
;; Карбонатотрихлоротитанат аммония очень неустойчив, в частности
под действием воды легко гидролизуется.
При обработке сухого карбоната аммония тетрахлоридом ти-
1 тана в некотором количестве образуется дикарбонатотетр а-
1 хлоротитанат аммония:
: 2(МН4)2СОз + TiCl4 = (NH4)4[TiCl4(CO3)2]
Роданосоединения 2
; Нормальный тетрароданид титана Ti(NCS)4 неизвестен.
Роданотитановая кислота, или дироданодиоксо-(IV)титанат во-
дорода — H2[TiO2(NCS)2]-Н2О (мол. вес 198,08 + 18,015) образует-
. ся при концентрировании в вакууме над серной кислотой раствора
титановой кислоты в 10%-ной родановодородной кислоте.
Роданотитановая кислота представляет собой красно-коричне-
вый кристаллический порошок. Растворяется без разложения в хо-
лодной воде. Разбавленные растворы окрашены в желтый цвет,
концентрированные — в красно-коричневый, что указывает на при-
сутствие в растворе титансодержащего аниона, подвергающегося
гидролизу при разбавлении водой; на гидролиз дироданодиоксоти-
танат-иона указывает также то, что раствор роданотитановой кис-
лоты дает реакцию с железо(III)-ионом (образование красного
трироданида железа):
3[TiO2(NCS)2]2- + 6Н2О + 2Fe3+ = 2Fe(NCS)3 + 3H4TIO4
Тетрароданооксотитанаты. При взаимодействии роданотитано-
вой кислоты с роданидами щелочных, щелочноземельных метал-
лов, аммония и других азотистых оснований образуются соли — те-
трароданооксотитанаты. Эти соли соответствуют неизвестной кис-
лоте H2[TiO(NCS)4]. Известны тетрароданооксотитанаты натрия,
калия, бария, аммония, пиридиния, хинолиния.
Тетрароданооксотитанат натрия —
Na2[TiO(NCS)4], образуется при смешении раствора роданида нат-
рия с раствором титановой кислоты в родановодородной кислоте.
При упаривании раствора до сиропообразного состояния из него
выделяются красные иглообразные кристаллы соли, разлагающейся
при растворении в воде.
Тетрароданооксотитанат калия — K2[TiO(NCS)4]-
•Н2О (мол. вес 358,43 + 18,02) — образуется при смешении рас-
твора роданида калия с раствором титановой кислоты в роданово-
дородной кислоте. При обезвоживании образовавшегося красного
раствора над концентрированной серной кислотой выкристаллизо-
вывается сначала избыточный роданид калия, а затем из сиропа
выделяется тетрароданооксотитанат. Тетрароданооксотитанат калия
представляет собой густо-красные кристаллы ромбической синго-
нии. Сильно гигроскопичен. В холодной воде растворяется, причем
образуется желтый раствор, мутнеющий при стоянии или нагрева-
нии, что указывает на гидролиз аниона соли, идущий с образова-
10:
291
нием титановой ортокислоты и роданид-иона. Последнее подтвер-
ждается также тем, что раствор соли дает характерную реакцию
на железо(III)-ион (красное окрашивание).
Тетрароданооксотитанат бария — Ba[TiO(NCS)4] —
образуется аналогично калиевой соли. Это красные иглообразные
кристаллы. Водой разлагается.
Тетрароданооксотитанат аммония —
(NH4)2[TiO(NCS)4] — образуется при смешении растворов родани-
да аммония и роданотитановой кислоты. При обезвоживании выде-
ляется сначала избыточный роданид аммония, а затем из маточной
сиропообразной жидкости выпадают мелкие желтые кристаллы те-
трароданооксотитаната. Водой разлагается.
Тетрароданооксотитанат пиридиния —
(CjHsNH^fTiO(NCS)J -образуется при смешении водного рас-
твора роданотитановой кислоты со спиртовым раствором хлорида
пиридиния. Тетрароданооксотитанат пиридиния представляет собой
вишневые кристаллы ромбической сингонии.
Тетрароданооксотитанат хинолиния —
(C9H7NH)2[TiO(NCS)4] • 4НгО — образуется при смешении титано-
вой роданокислоты и хлорида хинолиния в водном или спиртовом
растворе. Тетрароданооксотитанат хинолиния представляет собой
желто-коричневые кристаллы.
Формиато-, ацетате- и пропионатосоединения 2-228
Титановые производные низших предельных одноосновных кар-
боновых кислот образуются главным образом при взаимодействии
тетрагалидов титана с соответствующими кислотами или солями
их и щелочных металлов. При этом преимущественно образуются
смешанные ацидатгалиды или ацидатгидроксиды (или -оксиды)
титана (IV).
Формиатхлориды титана(1У). При кипячении тетрахлорида ти-
тана с муравьиной кислотой происходит последовательное замеще-
ние атомов хлора на формиат-группы; в течение получаса происхо-
дит замещение трех атомов хлора, и процесс на этом заканчивается.
В результате этих реакций, таким образом, получаются формиат-
трихлорид титана — TiCl3(HCOO), д и ф о р м и а т д и х л о-
рид титана — TiCI2(HCOO)2 — и триформиатхлорид
титана — TiCl (НСОО) 3.
Ацетатхлориды титана(1У). Как уже указывалось, при взаимо-
действии уксусной кислоты с тетрахлоридом титана образуются
два ацетатхлорида титана. Ацетатдихлорид титана —
TiC12(CH3COO)2 (мол. вес 295,90) образуется при медленном вве-
дении тетрахлорида титана в смесь 4 частей ледяной уксусной кис-
лоты и 1 части уксусного ангидрида:
TiC Ц + 2НСН3СОО = TiCl2(CH3COO)2 + 2НС1
Реакция идет с выделением теплоты. Ацетатдихлорид титана пред-
292
ставляет собой желтовато-белые кристаллы, нерастворимые в угле-
водородах, их хлорпроизводных и других органических растворите-
лях. Водой и спиртом разлагается. Применяется как катализатор
полимеризации алкенов.
Ацетаттрихлорид титана — TiCl3(CH3COO) (мол. вес
212,295) — образуется обычно при введении уксусной кислоты в
тетрахлорид титана. Это бледно-желтые кристаллы. Разлагается
водой.
Ацетатоксиды титана(1У). При обработке ацетаттрихлорида
титана 1 н. водным раствором уксусной кислоты образуется аце-
татхлороксид титана — TiOCl(СН3СОО). При обработке
ацетатдихлорида титана разбавленным (0,01 и.) водным раствором
уксусной кислоты образуется диацетатоксид титана —
TiO(CH3COO)2. Ацетатхлороксид и диацетатоксид титана пред-
ставляет собой бесцветные кристаллы.
При кипячении ацетатдихлорида титана в смеси уксусной ки-
слоты и уксусного ангидрида образуется гемигексаацетат-
гемиоксид титана — ТЪО(СН3СОО)3. При кипячении тетра-
хлорида титана и уксусного ангидрида в бензольной среде обра-
зуется гемитетраацетатгемидихлоргемиоксид ти-
тана — Ti2OCI2(CH3COO)4. При кипячении последнего с уксусным
ангидридом образуется гемигексаацетатгемиоксид ти-
тана. Гемитетраацетатгемидихлоргемиоксид титана на воздухе
более устойчив, чем ацетатдихлорид.
Ацетатгидроксиды титана(1У). В результате взаимодействия
1 моль тетрахлорида титана с раствором 4 моль ацетата калия
в безводном этаноле при 0—15°С образуется ацетаттригидр-
оксид титана — Ti(OH)3(CN3COO) (мол. вес 156,96) — в виде
белых кристаллов. При определенных условиях могут быть также
выделены диацетатдигидроксид титана —
Ti(OH)2(CH3COO)2 и триацетатгидроксид титана —
Ti(OH) (СН3СОО)3.
Нормальный ацетат титана(1У)—Ti(CH3COO)4 — образуется
при взаимодействии уксусной кислоты с дисульфидом титана, од-
нако он неустойчив и изолировать его не удается.
Пропионатосоединения титана. При кипячении тетрахлорида ти-
тана с пропионовой кислотой (140° С) происходит последовательное
замещение атомов хлора на пропионат-группы с образованием про-
пионатхлоридов титана — TiCl3(С2Н5СОО),
TiCI2(C2H5COO)2 и TiCl(C2H5COO)3; конечным продуктом этой ре-
акции (после полуторачасового кипячения) является нормальный
пропионат титана(IV) — Ti(С2Н3СОО)4-
При взаимодействии 1 моль тетрахлорида титана с этанольным
раствором 4 моль пропионата калия образуются пропионат-
гидроксиды титана — TiOH(C2H5COO)3, Ti(OH)2(C2H5COO)2
и Ti(OH)3(C2H5COO). Аналогичные продукты образуются при взаи-
модействии тетрахлорида титана с бутиратом, валератом и капро-
натом калия.
293
Оксалатосоединения2
Остатки щавелевой кислоты (оксалат-ионы) также обладают
способностью замещать в титановых кислотах атомы кислорода,
образуя при этом оксалатотитановые кислоты, которым соответ-
ствуют многочисленные соли.
Оксалатоксиды титана(1У) и оксалатотитановые кислоты. Све-
жеосажденная титановая кислота очень легко растворяется в кон-
центрированном водном растворе щавелевой кислоты. При насы-
щении раствора титановой кислотой образуется зеленовато-желтая
жидкость, содержащая монооксалатометатитановую
кислоту — H2[TiO2(C2O4)], которая не способна кристаллизовать-
ся, а в виде сиропообразной массы, получающейся при упаривании
раствора, содержит переменное количество воды. После обезвожи-
вания этой массы, которое достигается длительной сушкой в ва-
куум-эксикаторе над серной кислотой, получают оксалатоксид
титан а (IV) — TiO(C2O4) — в виде желтого порошка.
Диоксалатотитановая кислота может, в зависимо-
сти от содержания воды, существовать в двух формах: мета-кисло-
та— H2[TiO(С2О4)2] и орто-кислота— Н^ТЮг^О^г]. Диоксалато-
титановая кислота образуется при разложении бариевой соли
в растворе серной кислотой. Из фильтрата от осадка сульфата ба-
рия, после упаривания в вакууме, выделяется орто-кислота в виде
длинных иглообразных кристаллов. Она хорошо растворима в воде
и спирте; водные растворы имеют сильно кислую реакцию.
Оксалатодвутитановая кислота — НарПгОДСгОД]—
образуется при смешении концентрированного раствора щавелевой
кислоты с раствором двуокиси титана в 25%-ной соляной кислоте.
Из полученного раствора кислоту высаливают спиртом в виде бе-
лого аморфного осадка. Оксалатодвутитановая кислота нераство-
рима в воде, трудно растворима в разбавленных кислотах и хоро-
шо — в концентрированной соляной кислоте. После обезвоживания
кислоты путем длительной сушки в вакуум-эксикаторе над серной
кислотой получают гемиоксалатсесквиоксид тита-
на (IV) — Ti2O3(C2O4) —в виде желтовато-белого порошка.
Оксалатоксидпероксид титана и оксалатопероксотитановая ки-
слота. При действии на раствор щавелевой кислоты, насыщенный
свежеосажденной титановой кислотой, перекисью водорода с до-
бавкой спирта и эфира образуется оранжевое масло, которое после
пятичасового стояния с абсолютным спиртом превращается в твер-
дую массу, содержащую
тановую кислоту:
диоксалатодиоксопероксоти-
О=С—с=о
о
Н2
О
Т‘\
(У
О. .О
О хо
о=с—с=о
294
После обезвоживания этой кислоты путем длительного выдер-
живания в вакуум-эксикаторе над серной кислотой получают ди-
оксалатоксидпероксид титана:
ч
с—с
/°
о = т/
ю
Оч /О
/Т1\|
о о
с—с—о
в виде желто-оранжевого порошка. Он очень гигроскопичен, в воде
) легко растворяется с частичным гидролизом.
Оксалатотитанаты. Соли монооксалатометатитановой кислоты
’ не получены. Из диоксалатотитанатов известны соли щелочных и
щелочноземельных металлов, а также аммония. Из триоксалатоти-
танатов получена соль свинца(П).
Диоксал атотита н ат натрия — ЫагрПО (€264)2] — об-
разуется при насыщении концентрированного водного раствора
гидрооксалата натрия свежеосажденной титановой кислотой:
2NaHC2O4 + H4TiO4 = Na2[TiO(C2O4)2] + ЗН2О
Дигидродиоксалатоортотитанат калия образу-
ется при насыщении концентрированного водного раствора гидро-
оксалата калия свежеосажденной титановой кислотой и упарива-
нии полученного раствора:
2КНС2О4 + H4TiO„ = K2H2[TiO2(C2O4)2] • Н2О + Н2О
Он представляет собой бесцветные мелкие иглообразные кристал-
лы триклинной сингонии (а : b : с = 1,707 : 1 : 0,818). В воде рас-
творяется без разложения; в спирте нерастворим. Разлагается ще-
лочами, а аммиак из водных растворов соли осаждает титановую
кислоту. При. нагревании выше 100° С обезвоживается, переходя
при этом в диоксалатометатитанат калия:
K2H2[TiO2(C2O4)2] • Н2О = К2[ТЮ(С2О4)2] + 2Н2О
Диоксалатотйтанат калия применяется в качестве протравы при
крашении кожи и тканей.
Дигидродиоксалатоортотитанат аммония обра-
зуется при растворении свежеосажденной титановой кислоты в на-
сыщенном водном растворе гидрооксалата аммония (на водяной
бане) и выдерживании в вакуум-эксикаторе над серной кислотой!
2NH4HC2O4 + H4TiO4 = (NH4)2H2 [TiO2(C2O4)2] • H2O + H2O
Это бесцветные прозрачные иглообразные кристаллы моноклинной
сингонии. В воде растворяется без разложения; аммиак из водных
295
растворов соли осаждает титановую кислоту. Диоксалатотитанат
аммония применяются в качестве протравы при крашении кожи и
тканей.
Диоксалатотитанат ы щелочноземельных ме-
таллов. В водных растворах дигидродиоксалатоортотитанат-ион
может осаждаться кальций-, стронций- и барий-ионами, причем об-
разуется дигидродиоксалатоортотитанаты кальция, стронция или
бария с общей формулой МеНгЦПС^СгО^гМНгО, представляю-
щие собой белые иглообразные кристаллы, малорастворимые в
воде. Практически они могут быть получены при смешении раство-
ров дигидродиоксалатотитаната калия и хлорида щелочноземель-
ного, металла. При нагревании выше 100° С дигидродиоксалатоти-
танаты кальция, стронция и бария обезвоживаются, переходя при
этом в диоксалатометатитанаты:
СаН2[ТЮ2(С2О4)2] • 4Н2О = Са[TiO(C2O4)2] + 5Н2О
При прокаливании диоксалатометатитанатов кальция, стронция и
бария они разлагаются, переходя в соответствующие метатита-
наты:
Ba[TiO(C2O4)2] = BaTiO3 + 2СО2 + 2СО
Дигидротриоксалатоортотитанат свинца(П) —
PbH2[TiO(C2O4)3]-4H2O — осаждается при взаимодействии в вод-
ных растворах оксалатотитанат-ионов со свинец(П)-ионами в при-
сутствии щавелевой кислоты. При нагревании до t > 100° С эта
соль обезвоживается и переходит в триоксалатометатита-
нат свинца:
РЬН2[Т10(С2О4)з] • 4Н2О = Pb[Ti(C2O4)3] 4- 5Н2О
При прокаливании триоксалатометатитанат свинца разлагается и
переходит в метатитанат свинца:
Pb[Ti(C2O4)3] = РЬТЮ3 + ЗСО2 + ЗСО
Оксалатопероксотитанаты. Известны триоксалатопероксотита-
наты натрия, калия и бария.
Триоксалатопероксотитанат натрия имеет фор-
мулу Na4[Ti(O2) (С2О4)з]-4Н2О. Он образуется при растворении ти-
таната натрия, полученного сплавлением соды и двуокиси титана,
в соответствующем количестве щавелевой кислоты с добавлением
перекиси водорода при мольном отношении [TiO2]: [Н2О2] = 1:1. До-
бавив шести-семикратный объем спирта, отделяют слой коричнево-
красного масла, из которого после многократной экстракции спир-
том может быть выделена соль. Триоксалатопероксотитанат натрия
представляет собой оранжевый порошок. Очень гигроскопичен и
легко растворяется в холодной воде; раствор окрашен в оранжево-
296
красный цвет. В абсолютном этаноле нерастворим. Водные рас-
творы соли разлагаются при нагревании и при действии щелочей.
Триоксалатопероксотитанат калия имеет формулу
K4Ti(O2) (С2О4)з]-2Н2О и образуется при смешении спиртового рас-
твора диоксалатотитановой кислоты с Н2О2 и добавлении к полу-
чившемуся оранжево-красному раствору спиртового раствора окса-
лата калия. Триоксалатопероксотитанат калия представляет собой
аморфный желтый порошок. Гигроскопичен и растворяется в холод-
ной воде. Не растворяется в спирте и эфире. Разлагается при на-
гревании и при действии аммиака.
Триоксалатопероксотитанат бария имеет формулу
Ba2[Ti(O2) (С2О4)3] и образуется при смешении водных растворов
триоксалатопероксотитаната натрия и хлорида бария; из смеси
соль может быть осаждена ацетатом аммония. Она представляет
собой желтый порошок.
Тартратосоединения2
Тартратотитановые кислоты. Титановая кислота легко растворя-
ется в концентрированном водном растворе винной кислоты; при
насыщении раствора титановой кислотой он окрашивается в зелено-
ватый цвет. При упаривании на водяной бане раствор превращает-
ся (без кристаллизации) в сиропообразную массу. После высуши-
вания последней образуется белый порошок, представляющий со-
бой, растворимую в воде дитартратоортотитановую кис-
лоту— H4[TiO2(C4H4O6)2]'2H2O.
Существует еще тартратодвутитановая кислота —
H2[Ti2O4(C4H4O6)]-6H2O, которая образуется при смешении концен-
трированного раствора винной кислоты с раствором двуокиси ти-
тана в 25%-ной соляной кислоте; из полученного раствора кислоту
высаливают спиртом в виде белого аморфного осадка. Тартрато-
двутитановая кислота нерастворима в воде и растворима в разбав-
ленных кислотах и водном растворе аммиака.
Тартратотитанаты. Существует два типа тартратотитанатов —
дитартратоортотитанаты, из которых лучше всего изуче-
ны кислые соли—Me2H2[TiO2(C4H4Oe)2], итритартратодити-
т а н а т ы —Ме4{Т{2Оз(С4Н4О6)3].
Дигидродитартратоортотитанаты образуются при
растворении титановой кислоты (1 моль) в кипящем водном рас-
творе гидротартрата щелочного металла (2 моль). Титановая кис-
лота при этом переходит в раствор медленно. После фильтрования
полученной жидкости и упаривания ее на водяной бане из нее вы-
падает соль, которую для очистки перекристаллизовывают из
водного раствора. Известны соли: Иа2Н2[ТЮ2(С4Н4Об)2]• 7Н2О,
K2H2[TiO2(C4H4O6)2] • з|н2О, (NH4)2H2[TiO2(C4H4O6)2] • 2у Н2О.
297
Они представляют собой тонкие белые призмы. Растворимы в воде
и нерастворимы в спирте. Дигидродитартратоортотитанат бария —
ВаНгЕТК^СДДОбЬ]’ 4Н2О— в воде нерастворим; он образуется в
виде белого порошкообразного осадка при смешении растворов ди-
гидродитартратотитаната калия и хлорида бария.
Три тартратодититанаты образуются при смешении го-
рячего насыщенного раствора гидротартрата щелочного металла с
концентрированным раствором двуокиси титана в соляной кислоте.
После длительного стояния в эксикаторе образуется студнеобраз-
ная масса, при высушивании которой выделяются белые порошко-
образные соли. Из тритартратодититанатов известны соли натрия —
Ыа^ТЪОз^ГДОф]-10Н2О, калия — К4[Т12Оз(С4Н4О8)3]-6Н2О, ам-
мония— (МН4)4[П2Оз(С4Н4О6)з]-10Н2О. Все они легко растворяют-
ся в воде и кислотах. Щелочи и аммиак при нагревании осаждают
из растворов солей студнеобразную титановую кислоту.
Тартратопероксотитанаты. Из них известен тритартратопероксо-
титанат калия — K2H2[Ti(O2) (С4Н4Ов)з]-9Н2О, который образуется
при действии перекиси водорода на раствор титановой кислоты
в водном растворе гидротартрата калия. Из золотисто-желтого си-
ропа соль осаждается спиртом. Это желтый гигроскопичный поро-
шок; медленно растворяется в воде с частичным разложением и
выделением метатитановой кислоты. При действии минеральных
кислот раствор из светло-желтого становится красно-оранжевым.
Прочие карбацидосоединения229
Помимо перечисленных карбацидосоединений титан образует
соединения и с другими органическими кислотами — предельными
одноосновными (масляной, валериановой, капроновой, лауриновой,
пальмитиновой, стеариновой), непредельными одноосновными
(акриловой, метакриловой, кротоновой, олеиновой, линолевой),
предельными и непредельными двухосновными оксикислотами (мо-
лочной, яблочной, лимонной), ароматическими (бензойной, фтале-
вой, салициловой).
Титановые соединения предельных одноосновных кислот обра-
зуются главным образом при взаимодействии соответствующих
кислот или их солей с тетрагалидами или тетраалкоксидами ти-
тана. При этом могут получаться карбацидаты — Ti(RCOO)4, карб-
ацидатоксиды — TiO(RCOO)2, а также карбацидатгидроксиды —
Ti (OH),„(RCOO)n, где т + п = 4, кроме того более сложные со-
единения. Так, при взаимодействии тетрахлорида титана с эта-
нольными растворами бутирата, валерата или капроната ка-
лия получаются бутират-, валерат- или капронатгидроксиды титана.
При действии тетрахлорида титана с лауратом триэтиламмония
в гептановом растворе образуется лауратоксидгидроксид —
Т1(ОН)О(СцН23СОО). При действии пальмитиновой кислоты на
тетраэтоксид титана образуется дипальмитатоксид титана —
TiO(Ci5H3iCOO)2, а также гемигексапальмитатгемиоксид титана-
298
Ti2O(Ci5H3iCOO)6- При действии тетрахлорида титана на стеарат
натрия образуется стеарат титана — Ti(Ci7H35COO)4; со стеарино-
вой кислотой в гептановом растворе тетрахлорид титана образует
титановое мыло более сложного состава.
Из производных органических оксикислот следует отметить
лактатосоединения титана. При взаимодействии тетра-
, хлорида титана с лактатом натрия образуется лактат титана —
" Ti(CaH5O3)4. При растворении метатитановой кислоты в растворе
* молочной кислоты образуется тетралактатоортотитановая кисло-
!, та — H4[TiO2(C3H5O3)4], представляющая собой сироп, а после вы-
сушивания — растворимую в воде массу. Известны соли этой кис-
лоты — л акт атот ит а н аты.
При взаимодействии бензойной кислоты с тетрахлоридом титана
! образуются бензоатхлориды титана: бензоатдихлорид —
TiC12(C6H5COO)2 и бензоаттрихлорид — Т1С13(СбН5СОО). При
сплавлении фталевой кислоты с дисульфидом титана образуется
фталаттитан а (IV) — Ti[(COO)2CeH4]2.
Салициловая кислота взаимодействует с тетрагалидами титана,
причем обычно функционирует ее гидроксо-, а не карбоксо-группа.
При этом образуются преимущественно трисалицилатмоно-
галиды титана-, например хлорид — TiCl(OCSH4COOH)3 и бро-
мид— Т1Вг(ОСбН4СОО)3, которые с галоводородами и с ионными
галидами дают комплексные кислоты и соли — трисалицилато-
ди х л о р о (или дибром о) титанаты.
Приведенный перечень карбацидосоединений титана далеко не
полный.
БОРАТО-, СИЛИКАТО-, ГЕРМАНАТО-
И МЕТАЛЛАТОСОЕДИИЕНИЯ
Боратосоедикекия
Борато-, или боротитанаты содержат комплексные анионы,
имеющие в качестве лигандов борат-ион. Таким образом, боратоти-
танаты можно рассматривать как продукты замещения оксид-
ионов в титанатах на борат-ионы. При сплавлении окиси бора
с двуокисью титана никаких боратов титана не образуется. Сво-
бодные боратотитановые кислоты также неизвестны.
Ортоборатометатитанаты щелочных металлов образуются при
сплавлении соответствующих метатитанатов и метаборатов. Они
представляют собой белые стеклообразные массы.
Диортоборатоортотитанаты образуются при сплавлении орто-
титанатов с метаборатами соответствующих металлов.
Д и о р т о б о р а т о о р т о т и т а н а т натрия —
Nae|TiO2(BO3)2—представляет собой белую стеклообразную массу.
Разлагается при длительном нагревании с концентрированными
минеральными кислотами.
299
Д и о р т р б о р а т о о р т о т и т а н а т магния —
М§з[Т1О2(ВОз)2] — также представляет собой белую стеклообраз-
ную массу; концентрированными минеральными кислотами разла-
гающуюся лишь при длительном нагревании.
Диортоборатоортотитанат железа(И) —
Ее3[Т1О2(ВОз)2.] — представляет собой бурую стеклообразную массу.
Известны также двойные диортоборатоортотитанаты магния-
железа(Н)—Mg2Fe[TiO2(BO3)2] и MgFe2[TiO2(BO3)2, которые
встречаются в природе, составляя основу минерала варвикита.
Фтороборатосоединения. При взаимодействии тетрафторида ти-
тана и трифторида бора в газообразном состоянии образуется тет-
рафтороборат титана(1У)—Ti(BF4)i, представляющий со-
бой белые кристаллы. При растворении двуокиси титана во фторо-
борной кислоте образуются тетрафтороборатотитановые
кислоты, состав которых еще нельзя считать установленным.
При сплавлении двуокиси титана с тетрафтороборатами щелочных
металлов могут образовываться тетрафтороборатотитанаты соот-
ветствующих металлов различного состава, представляющие собой
белые кристаллические массы, растворимые в воде.
Силикате- и германатосоединения 2’230
Силикатосоединения титана. Диоксиды титана и кремния при
сплавлении не образуют соединений; силикаты титана(IV) не из-
вестны. Известен гексафторосиликат титана (IV)—Ti[SiF6]2, кото-
рый образуется при взаимодействии тетрафторидов титана и крем-
ния в газообразном состоянии и представляет собой белые кри-
сталлы, расплывающиеся на влажном воздухе в сиропообразную
массу. Известны также вполне устойчивые силикато- или силико-
титаиаты щелочных н щелочноземельных металлов.
В силикатотитанатах в качестве лигандов содержатся силикат-
ионы. Таким образом, силикатотитанаты можно рассматривать как
продукты замещения в титанатах оксид-ионов на силикат-ионы
или, в полититанатах, одного (или больше) атома титана на атом
кремния. Общаяформула силикатотитанатов — Me’TCSi О х.
х т п 2(m+n)+ —
Многие из них встречаются в виде природных минералов.
Силикатотитанаты натрия. Известны четыре силикатотитаната
натрия различного состава.
Силикатометатитанат натрия — Na2[TiO2(SiO3)] (мол.
вес 201,96) образуется при нагревании смеси карбоната натрия
и диоксидов титана и кремния, взятых в соответствующих отноше-
ниях, до 1200° С. Силикатометатитанат натрия представляет собой
белую стеклообразную массу. Температура плавления около
1400° С. На воздухе достаточно устойчив.
Дисиликатодититанат натрия — Na2[Ti2O3(SiO3)2]
(мол. вес 341,95) встречается в природе в виде минерала рамза-
ита. Искусственно его получают путем сплавления карбоната нат-
300
рия, диоксидов титана и кремния. Дисиликатодититанат натрия
представляет собой в чистом состоянии белые иглообразные кри-
сталлы, природный и технический — черная прочная масса. Плот-
ность 3,37 г/см’. Температура плавления 630° С.
Трисиликатодититанат натрия — Na2[Ti2O2(SiO3)3] —
образуется при сплавлении смеси дититаната натрия с двуокисью
кремния в присутствии вольфрамата натрия. Это бесцветные приз-
матические кристаллы, сильно преломляющие свет.
Тетрасиликатотитаноортотитанат натрия—
Na4[Ti (TiSiOs)4] — образуется аналогично соли, описанной выше.
Это — бесцветные стеклообразные призмы, очень твердые (режут
стекло); плотность 2,88 г/см3.
Силикатотитанаты щелочноземельных металлов. Известны два
силикатотитаната кальция различного состава: силикатометатита-
нат и дисиликатодититанат, и трисиликатометатитанат бария.
Силикатометатитанат кальция — Са[ТЮ2(5Юз)]
(мол. вес 196,06) встречается в природе в виде минерала сфена,
или титанита. Искусственно может быть получен сплавлением экви-
молекулярных количеств карбоната кальция и диоксидов титана
и кремния при 1300° С, а также нагреванием смеси хлорида каль-
ция, метатитановой' кислоты и двуокиси кремния до сплавления и
полного отделения хлороводорода. Теплота образования силикато-
метатитаната кальция 647,5 ккал/моль.
Силикатометатитанат кальция представляет собой медово-жел-
тые призматические кристаллы моноклинной сингонии (а = 656,7,
b = 872,3 и с = 745,4 пм)-, плотность 3,497 г/см3. При 1385°С кон-
груэнтно плавится. Разлагается при действии концентрированной
серной кислоты и при сплавлении с гидросульфатом аммония.
Дисиликатодититанат кальция — Са[Т120з(5Юз)2] —
образуется при сплавлении карбоната кальция и диоксидов титана
и кремния, взятых в мольном отношении 1:2:2. Дисиликатодити-
танат кальция представляет собой желтые призматические кри-
сталлы.
Трисиликатометатитанат бария — Ba[Ti (SiOs) 3] —
встречается в природе в виде минерала бенитоита. Искусственно
может быть получен сплавлением карбоната бария и диоксидов
титана и кремния, взятых в мольном отношении 1:1:3. Он пред-
ставляет собой бесцветные кристаллы; плотность 3,65 г/см3.
В природе встречается также много двойных и более сложных
силикатотитанатов: натрия — кальция (моленграафит), натрия —
бария (лейкосфен), калия — натрия — марганца (нептунит), нат-
рия— стронция — кальция — церия (ловчоррит), редкоземельных
металлов (чевкинит) и многие другие.
Германатотитанаты. Из германатотитанатов получены соли
натрия, кальция и бария.
Германатометатитанат кальция — Са[Т1Ог(ОеОз)]
(мол. вес 240,56) образуется при сплавлении оксида (или карбо-
ната) кальция, диоксидов титана и германия. Германатотитанат
301
кальция представляет собой призматические кристаллы моноклин-
ной сингонии (а = 665, b = 892 и с = 749 пм).
Тригерманатометатитанат бария — Ba[Ti(GeO3)3]
(мол. вес 361,765) образуется при взаимодействии оксида бария,
диоксидов титана и германия при высокой температуре. Чтобы по-
лучить однородный тригерманатотитанат бария, из очень тонко из-
мельченных карбоната бария и диоксидов титана и германия, взя-
тых в мольном отношении 1:1:3, приготовляют тесную смесь, кото-
рую прессуют под давлением 420 Мн!м2\ полученную пасту нагре-
вают до 600°С, а затем до сплавления (1000°С). Тригерманато-
метатитанат бария образует кристаллы тригональной сингонии
(а = 672 и с — 970 пм). Порошкограмма вполне аналогична триси-
ликатометатитанату бария (бенитоиту).
Металлатосоединения 231-233
К металлато-, или металлосоединенням, относятся соединения,
содержащие в своем составе комплексные гетерополианионы, ли-
гандами которых являются металлат-ионы. Металлатосоединений
титана сравнительно немного.
Станнатотитанаты. Гетерополисоединения титана, содержащие
в качестве лигандов станнат-ионы, образуются при сплавлении ди-
оксидов титана и олова с оксидами соответствующих активных ме-
таллов. Известный среди этих соединений тристаннатотита-
нат бария — Ba[Ti(SnO3)3] — получается при сплавлении оксида
или карбоната бария с диоксидами титана и олова.
Ванадатотитанаты. Гетерополисоединения с ванадат-ионами об-
разуются при сплавлении титанатов с полупятиокисью ванадия
или ванадатами соответствующих металлов.
Ниобатосоединения. В системе TiO2—Nb2O3 образуется ди-
ниобат титана — TiNb2O7, который представляет собой кри-
сталлы моноклинной сингонии; плотность 4,25 г/см3. Синтетическим
путем получены пол иниобаты титана — TiNb2nO5n+2, а также
Ti2Nb2nO5n+4, где п = 3, 5, 7. Из синтетических ниобатотитанатов
известны соли, содержащие анионы [Ti(NbO4)2]2-, [TiO2(NbO4)]3-,
[TiO(NbO4)2]4- и [Ti3O(NbO4)4]2“, например, ниобатотитанат
калия — бария KBa[TiO2(NbO4)J. В частности, из ниобатотита-
натов свинца, получаемых при сплавлении одноокиси свинца, дву-
окиси титана и полупятиокиси ниобия, известны ди орто ниоба-
тотитанат — Pb[Ti (NbO4) 2] — иглообразные пьезоэлектрические
кристаллы тетрагональной сингонии (а — 1266 и с = 778 пм)-, ди-
ортониобатооксотитанат — Pb^[TiO(NbO4)2]; т е т р а о р -
тониобатооксотрититанат — Pb[Ti3O (NbO4) 4] — в двух
модификациях — иглообразные кристаллы моноклинной сингонии
(а = 4516, b = 389 и с = 1037 пм) и пластинчатые — ромбической
сингонии (а = 658, b — 658 и с = 300 пм).
Обширную группу ниобатотитанатов составляют природные ми-
нералы— титанониобаты, среди которых известны лопарит, пиро-
хлор и др,
302
Танталатотитанаты также иногда входят в состав смешанных
минералов; образуются при сплавлении титанатов с полупяти-
". окисью тантала.
Хроматотитанаты. При растворении двуокиси титана в концен-
трированном растворе хромовой кислоты (на 1 часть Т1О2 следует
; брать 4 части СгО3) образуется трихроматометатитан о-
. вая кислота — H2[Ti(СгО4)з], которая существует только в кон-
' центрированном растворе. При разбавлении раствора происходит
гидролиз трихроматометаитановой кислоты:
3H2[Ti (CrO4)3] + 5Н2О = H2[Ti3O5(CrO4)2] + 7Н2СгО4
г"
7 2Н2[Т1(СгО4)3] + 5Н2О = H4[Ti2OB(CrO4)J + 5Н2СгО4
* 3H2[Ti(CrO4)3] + 8Н2О = H6[Ti3O8(CrO4)] + 8Н2СгО4
; Образующиеся дихроматотрехметатитановая кисло-
га, хроматодвуортотитановая и хроматоортотитановая
. кислоты в воде нерастворимы и выпадают в осадок.
Из солей трихроматометатитановой кислоты известен трихро-
j матометатитаыат аммония—(NH4)2[Ti(СгО4)3], который
образуется при взаимодействии в растворе трихроматометатитано-
? вой кислоты и хромата аммония.
Молибдатотитанаты. Сравнительно давно (в 1893 г.) получены
молибдотитановая кислота и ее соли — молибдато- или молибдоти-
а танаты.
Т е тратримо л и бдато ортотитано в а я кислота —
;• H4[Ti(Mo3Oio)4]- 20Н2О— образуется при разложении ее калиевой,
аммониевой или ртутной солей соляной кислотой и представляет
t собой желтые октаэдрические кристаллы.
Тетр атр и мол и бда тот ит а на т калия —
К4[Т1(МозО10)4]-16Н2О — получается при взаимодействии в рас-
творе хлорида калия с молибдатотитанатом аммония. Тетратри-
молибдатотитанат калия представляет собой желтые призматиче-
ские кристаллы, легко выветривающиеся на воздухе; оптически
активен; растворим в горячей воде.
Тетратримолибдатотитанат аммония —
(NN4)2[Ti(M.o3Oio)4j-ЮН2О — образуется в растворе при взаимо-
действии гексафторотитаната и молибдата аммония. Из концентри-
рованного раствора тетратримолибдатотитанат аммония осаждает-
ся при прибавлении соляной кислоты. Тетратримолибдатотитанат
аммония представляет собой мелкие Хелтые октаэдрические кри-
сталлы. Растворим в воде и нерастворим в растворах солей ам-
мония.
Вольфраматотитанаты. Давно получены и вольфрамотитановые
кислоты, и их соли — вольфраматотитанаты. Существует два ряда
вольфраматотитанатов: насыщенные, или гексадивольфраматоти-
танаты, и ненасыщенные, или пентадивольфраматооксотитанаты.
доз
Гексадивольфраматоортотитановая кислота —
НвГЩХУгОу^'-кНгО — образуется при разложении ее солей (калие-
вой, аммониевой, ртутной) соляной кислотой и представляет собой
желтоватые псевдокубические кристаллы тетрагональной сингонии.
Пентадивольфраматооксоортотитановая кис-
лота— H8[TiO(W2O7)5]-xH2O— образуется при разложении ее
ртутной соли соляной кислотой и представляет собой желтоватые
октаэдрические кристаллы.
Тетрагидрогексадивольфраматотитанат ка-
лия — K4H4[Ti(W2O7)6]-nH2O — образуется в растворе при взаимо-
действии гексафторотитаната и вольфрамата калия; из концентри-
рованного раствора тетрагидрогексадивольфраматотитанат калия
осаждается при добавлении соляной кислоты. Он представляет со-
бой мелкие желтоватые октаэдрические кристаллы; растворим
в воде.
Уранатосоединения. Известен уранатоксид титана(1У) —
TiO(UO4), который образуется при выдерживании тесной смеси
порошкообразных двуокиси титана и трехокиси урана в течение
получаса при 800—1100° С под давлением 30 тыс. атм. Он образу-
ется также при медленном нагревании на воздухе до 700° С измель-
ченного гидроксида титана(IV)-диоксоурана (VI):
Ti(UO2)(OH)6 = TiO(UO4) + ЗН2О
который, в свою очередь, образуется при добавлении избытка вод-
ного раствора аммиака к смеси растворов сульфатов титана (IV)
и диоксоурана(VI):
Ti(SO4)2 + UO2SO4 + 6NH4OH = Ti(UO2)(OH)6 + 3(NH,)2SO4
Выпавший осадок центрифугируют, промывают разбавленным вод-
ным раствором аммиака и сушат при 105° С.
Уранатоксид титана(IV) представляет собой порошок светло-
зеленого цвета. При нагревании до 1100° С разлагается с выделе-
нием кислорода:
3TiO(UO4) = 3TiO2 + U3O8 + уО2
В воде и холодных кислотах не растворяется; при 85° С растворя-
ется в концентрированных кислотах; слабо — в азотной, лучше —
в соляной, еще лучше — в серной.
Манганатотитанаты. При взаимодействии свежеосажденной ти-
тановой кислоты с кислым раствором перманганата аммония обра-
зуется соль состава (NH4)2[TiO2(M.nO4)2].
Ферратосоединения. При взаимодействии растворов, содержа-
щих соединение титана(IV) и гексациано-(II)феррат-ионы, обра-
зуются осадки различного состава, в зависимости от количествен-
ных соотношений реагирующих TiIV и [Fe(CN)s]4-. При избытке
TiIV состав осадков может быть выражен общей формулой
Ti,1O2,i-2[Fen(CN)6], где н=1ч-10. Осадки обладают ионообмен-
304
ними свойствами. Наилучшими ионообменными свойствами обла-
дает гексациано-(II) феррат оксотитана (IV) — (TiO)2[Fe(CN)e],
представляющий собой бурый аморфный порошок.
Нормальный ге к с а ц и а н о - (II) ф е р р а т титана (IV) —
Ti[Fe(CN)e] — образуется при взаимодействии растворов, содержа-
щих эквивалентные количества TiIV и [Fe(CN)6]4". Он представляет
собой нерастворимый в воде бурый аморфный порошок. При из-
бытке [Fe(CN)6]4- гексациано-(II) феррат титана (IV) способен по-
глощать их из раствора с образованием бурых нерастворимых ком-
плексных солей вероятного состава Me* [Ti [Fe(CN)6]2|.
Ге кс аци а но - (Ш)фер р а т титан а (IV)— Ti3[Fe(CN)6]4—
образуется при взаимодействии растворов, содержащих соединения
титана(IV) и гексациано-(III)феррат-ионы. Гексациано-(III)фер-
рат титана представляет собой желтый аморфный порошок, нерас-
творимый в воде. Способен поглощать из раствора гексациано-
(III) феррат калия с образованием желтой нерастворимой ком-
плексной соли вероятного состава K2Ti[Fe(CN)6]2.
ГЛАВА X
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ ТИТАНА
Органические соединения титана могут иметь различный хими-
ческий характер. Некоторые из них, например соли органических
кислот двух- и трехвалентного титана и органические ацидосоеди-
нения четырехвалентного титана, а также титанаты органических
оснований, уже были рассмотрены в предыдущих главах. В этой
главе рассматриваются органические соединения титана трех клас-
сов: 1) алкоксиды и ароксиды титана (IV), т. е. сложные эфиры
различных титановых кислот, или алкил (арил) титанаты; 2) титан-
органические соединения, т. е. соединения, в которых атом титана
непосредственно связан с углеродными атомами органических ра-
дикалов; 3) комплексы титана с органическими лигандами.
АЛКОКСИДЫ И АРОКСИДЫ ТИТАНА
Алкоксиды титана, или алкилтитанаты 23’ 229> 234-242
Из различных алкоксидов титана, или алкилтитанатов, наиболее
изучены тетраалкоксиды, или алкилортотитанаты. Известны также
алкилметатитанаты и алкилдититанаты.
Тетраалкоксиды титана, или алкилортотитанаты. Тетраалкокси-
ды титана, т. е. полные сложные эфиры ортотитановой кислоты, по-
лучают при взаимодействии тетрахлорида титана с соответствую-
щими алкоксидами натрия:
TiCl4 + 4NaOR = Ti(OR)4 + 4NaCl
Реакции обычно проводят в среде соответствующего безводного
спирта. Тетраалкоксиды титана образуются также при взаимодей-
ствии тетрахлорида титана со спиртами в присутствии аммиака
или аминов:
TiCl4 + 4ROH + 4NH3 = Ti(OR)4 + 4NH4C1
Тетраалкоксиды титана представляют собой сравнительно лету-
чие бесцветные вещества в кристаллическом или жидком состоянии.
При действии галогенов они образуют алкоксидгалиды титана. При
действии воды легко гидролизуются с образованием ортотитановой
кислоты и соответствующего спирта:
Ti(OR)4 + 4Н2О = H4TiO4 + 4ROH
306
Тетраметоксид титана, или метилортотитанат —
1 Ti(OCH3)4 (мол. вес 187,07) получают, приливая по каплям опре-
'• деленное количество тетрахлорида титана к кипящему раствору
.? такого же количества метилата натрия в метиловом спирте.
Тетраметоксид титана представляет собой белые кристаллы
триклинной сингонии (а = 909, b = 1062 и с = 1062 пм)\ плотность
1 1,496 г/см\ Температура плавления 176° С. Зависимость давления
пара от температуры в интервале от 450 до 600° К выражается
!’ уравнением: 1g Р= 13,438 — 6050/Т. Температура кипения 300° С.
Тетраметоксид титана легко, даже под действием влаги воздуха,
гидролизуется с образованием метанола и ортотитановой кислоты.
, Растворим в горячем метаноле, а также в этаноле и высших спир-
;i тах. Нерастворим в углеводородах, эфире, тетрагидрофуране.
Тетраэтоксид т и т а н а, или этилортотитанат—ТЦОСгНз^
(мол. вес 228,14) получают, приливая по каплям 135 а тетрахло-
рида титана к 1 л нагретого 20%-кого раствора этилата (этоксида)
i натрия в абсолютном этиловом спирте. Теплота образования
[ 347,0 ккал/моль.
Тетраэтоксид титана— бесцветная жидкость; плотность .при 20° С
равна 1,105 s/cmz. В жидком состоянии молекулы ассоциированы
в тример. Вязкость при 25°С 0,4445 пз.
Зависимость давления пара от температуры в интервале от 370
до 520° К выражается уравнением: 1g 7’ = 12,186— 4734/7’. Темпе-
ратура кипения 236° С. Теплота испарения 22,0 ккал/моль
(96,5 кал/г). Давление пара при различных температурах приве-
дено в Приложении 50. Показатель преломления (при 35° С) 1,5051.
При действии натрия на тетраэтоксид титана получается три-
этоксид титана:
Ti(OC2H5)4 + Na = Ti(OC2H5)3 + NaOC2H5
С метиловым спиртом тетраэтоксид вступает в реакцию обмена,
или переэтерификации:
Ti(OC2H5)4 + 4СН3ОН = Ti(OCH3)4 + 4С2Н5ОН
С этиловым спиртом, циклогексаном и бензолом тетраэтоксид сме-
шивается. Альдегиды восстанавливает до спиртов. С этиленхлор-
гидрином при длительном нагревании реагирует, давая тетрахлор-
этоксид титана:
Ti(OC2H5)4 + 4С1С2Н4ОН = Ti(OC2H4Cl)4 + 4С2Н5ОН
Тетрапропоксиды титана, или пропил(н- и изо-)ортоти-
танаты— Ti(OC3H7)4 (мол. вес 284,255) получают, приливая тетра-
хлорид титана к двойному количеству соответствующего пропилата,
(пропоксида) натрия, растворенного в («- или изо-) пропаноле.
Теплота образования тетра-н-пропоксида титана 372, тетра-изо-
пропоксида титана — 377 ккал/моль.
Тетрапропоксиды титана представляет собой бесцветные
жидкости; температура кипения н-тетрапропоксида 265° С, нзо-тет-
рапропоксида — 220° С. Значения давления пара при различных
температурах приведены в Приложении 50,
307
Тетрабутоксиды титана, или бутилортотитанаты —
Ti(OC4Ho)4 (мол. вес 340,36). Нормальный бутоксид титана полу-
чают, смешивая тетрахлорид титана с «-бутанолом в бензольной
или толуольной среде и пропуская через смесь ток сухого аммиака.
Теплота образования 399 ккал/моль.
Тетра-н-бутоксид титана представляет собой светло-желтую
вязкую жидкость с фруктовым запахом; температура кипения при
давлении 4 мм рт. ст. равна 160° С, при нормальном давлении —
291°С.
Кроме указанных известны тетраалкоксиды титана, содержащие
в своем составе углеводородные радикалы с числом углеродных
атомов больше четырех. При этом известны как однородные тетра-
алкоксиды, так и разнородные, т. е. содержащие в своем составе
различные алкилы. Известны также галогензамещенные (лучше
Таблица 12. Характеристики некоторых тетраалкоксидов титана
Формула Название Мол. вес Температура, °C Плот- ность, a/cjw3
плавле- ния кипения
Ti (ОСН2С2Н5)4 Тетра-н-пропоксид 284,255 265 1,033
Ti [ОСН (СН3)2]4 Т етра-нзо- пропоксид 284,255 20 220 0,967
Ti (ОСН2С3Н7)4 Т етра-н-бутоксид 340,36 <-40 291 0,996
Ti [ОСН2СН(СН3)2]4 Тетра-изо-бутоксид 340,36 30 269 0,980
Ti [ОСН(СН3)С2Н6]4 Т етраэтилметилмет- оксид 340,36 — 248 0,920 (35° С)
Ti [ОС(СН3)з]4 Тетратриметилмет- оксид 340,36 — 228 0,883
Ti [О(СН2)4СНз]4 Т етра-н-пентокснд 396,47 — 314 0,974
Ti [ОСН2С(СНз)з]4 Т етратрнметилэт- оксид 396,47 64 131 (при 1 мм рт. ст.)
Ti [О(СН2)5СН3]4 Т етра-н-гексокснд 452,58 — 336 0,950
Ti [О(СН2)6СНз]4 Т етра-н-гептоксид 508,69 — 354 0,936
Ti [ОС(С2Н5)з]4 Т етратриэтилмет- оксид 508,69 140 166 (при 0,1 мм рт. ст.) —
Ti [О(СН2)7СН3]4 Т етра-н-октоксид 564,80 — 371 0,925
Ti [О(СН2)8СНз]4 Тетра-н-нон оксид 620,9 — 386 0,915
Ti (ОСН2СНСН2)4 Т етрааллилоксид 276,19 — 185 (при 12 мм рт. ст.) 1,114
Ti(OC2H4Cl)4 Т етрахлорэтокснд 365,93 •— 180 (при 2 мм рт. ст.) —
308
всего изучены хлорзамещенные) тетраалкоксиды титана, т. е. та-
кие, в углеводородном радикале которых один (или более) атом
водорода замещен на атом галогена. Примером такого галогенза-
мещенного тетраалкоксида может быть тетрахлорэтоксид
титана, или хлорэтилортотитанат — ТЦОСгЩС!)^
Сведения о различных тетраалкоксидах титана приведены в
табл. 12.
Алкоксотитаиаты. Различные тетраалкоксиды титана могут
вступать в реакции с алкилатами (алкоксидами) щелочных и ще-
лочноземельных металлов, присоединяя их с образованием своеоб-
разных комплексных солей — г е к с а а л ко к с от ит а н а т о в —
с общей формулой Me2[Ti(OR)6]. Эти комплексные соединения обра-
зуются при взаимодействии алкоксидов титана и активного метал-
ла в среде соответствующего спирта. Известны следующие гекса-
алкоксотитанаты: гексаэтоксотитанат натрия — Na2[Ti (ОСгНДб];
гексаэтоксотитанат калия — КгГП (ОС2Н5)б]; гексаэтоксотитанат
кальция — Са[Т1(ОС2Нэ)в]; гексабутоксотитанат лития— (н- и изо)
Li2[Ti(OC4H9)6]; гексабутоксотитанат натрия — Иа2[Т1(ОС4Н9)б];
гексабутоксотитанат магния — Mg‘[Ti(OC4H9)6j; гексабутоксотита-
нат стронция — Sr[Ti(ОС4Н9)6]. В некоторых случаях к алкоксиду
титана наряду с молекулой алкоксида активного металла присо-
единяется и молекула соответствующего спирта; тогда образуются
комплексные гидросоединения, из которых известны сле-
дующие: гидрогексаметоксотитанат калия — K[Ti(OCH3)6] Н;
гидрогексаметоксотитанат магния — Mg[Ti(OCH3)6]2H2; гидро-
гексаэтоксотитанат натрия — Па[Т1(ОС2Нз)б] Н; гидрогексаэток-
сотитанат лития — Li[Ti(OC2H5)6]H; гидрогексабутоксотитанат
натрия — Na[Ti(OC4H9)6]H; гидрогексабутоксотитанат магния —
Mg[Ti(OC4H9)6]2H2; гидрогексагексоксотитанат магния —
Mg[Ti(OC6H13)6]2H2. Эти комплексные гексаалкоксотитанаты ис-
пользуются в качестве катализаторов при конденсации эфиров ди-
карбоновых кислот и полиоксисоединений.
Соответствующие этим гексаалкоксотитанатам гекса алкок-
сотитановые кислоты — H2[Ti(OR)6]— образуются при рас-
творении тетр а алкоксидов титана в соответствующих спиртах; эти
кислоты могут существовать только в спиртовых растворах, в кото-
рых дают кислую реакцию по тимолфталеину.
Диалкоксидоксиды титана, или алкилметатитанаты. Из слож-
ных эфиров метатитановой кислоты известны этиловые средний и
кислый эфиры В 1954 г. А. Н. Несмеянов и сотрудники получили
дипропоксид- и дибутоксидоксиды титана. По данным этой работы,
общим способом получения диалкоксидоксидов титана(IV) явля-
ется окисление триалкоксидов титана(III) кислородом по урав-
нению:
2Ti(OCH2R)3 + О2 = 2TiO(OCH2R)2 + RCH2OH + RCHO
Д иэтоксидоксид титана, или д и э т и л м е т а т и т а-
нат — TiO(OC2H5)2 — образуется при окислении кислородом три-
309
этоксида титана; он образуется также в качестве побочного про-
дукта при взаимодействии тетраэтоксида титана с метанолом. Ди-
этоксидоксид титана представляет собой светло-желтую вязкую и
клейкую массу.
Этоксидоксидгидроксид титана, или этилгидро-
метатитанат — Ti(OH)O(OC2Hs)—образуется при обработке
метанолом тетраэтоксида титана. Это соединение представляет со-
бой светло-желтую гигроскопичную массу.
Д и - н - п р о п о к с и д о к с и д титана, или ди-н-про-
п и л м е т а т и т а н а т — ТЮ(О-н-СзН7)2— образуется при окисле-
нии кислородом три-н-пропоксида титана (III). Дипропоксидоксид
титана представляет собой светло-желтый порошок с температурой
плавления 108—112°С; гигроскопичен и легко гидролизуется; легко
растворяется в органических растворителях.
Д и - н - б у т о к с и д о к с и д титана, или ди-н-бутил-
метатитанат — TiO(O-H-C4H9)2—образуется по аналогичному
способу. Он представляет собой желтоватый порошок с температу-
рой плавления 115° С; гигроскопичен и легко гидролизуется; легко
растворяется в бензине, бензоле, спирте, эфире, диоксане.
Алкилполититанаты и полимерные алкоксиды титана. Из алкил-
дититанатов известны производные двуортотитановой кислоты—
(RO)3Ti—О—Ti(OR)3, где R — этил, пропил, бутил и т. д. Все они
получаются при действии воды на соответствующие тетраалкоксиды
титана:
2Ti(OR)4 + Н2О = (RO)3Ti—О— Ti(OR)3 + 2ROH
Однако в реальных условиях при этом могут получаться и более
сложные продукты, а именно, алкилтрититанаты:
OR
I
3Ti(OR)4 + 2Н2О = (RO)3Ti — О—Ti— О—Ti (OR)3 + 4ROH
OR
алкилтетратитанаты:
OR OR
I I
4Ti(OR)4 + 3H2O = (RO)3Ti—O—Ti—O—Ti—O—Ti(OR)3 + 6ROH
OR OR
и другие.
Все указанные алкилполититанаты легко подвергаются полиме-
ризации. Так, при гидролизе тетраэтоксида титана вместо гекса-
этилдититаната — (C2H5O)3Ti—О—Ti(OC2H5)3 — образуется обычно
Т1бО4(ОС2Н5)1б. Вместо диэтоксидоксида титана — ТЮ(ОС2Н5)2,
также получаемого при гидролизе тетраэтоксида титана, образуется
обычно Ti12Oi2(OC2H5)24, что подтверждено непосредственным эбу-
лиоскопическим определением молекулярного веса этого вещества.
При гидролизе тетрабутоксида титана, в зависимости от усло-
вий, получаются различные полимерные продукты, среды которых
310
доказано существование тетрамера дибутоксидоксида титана (ди-
бутилметатитаната) циклического строения:
С4Н9О ОС4Н9
I I
С4Н9О—Ti—О—Ti—ОС4Н9
I I
О о
I I
С4Н9О—Ti—О—Ti—ОС4Н9
I I
С4Н9О ОС4Н9
Получены и другие полимерные алкоксиды титана. Они пред-
ставляют собой вязкие смолообразные жидкости или гелеобразные
вещества. На способности алкоксидов титана к полимеризации
основано их применение в качестве средств для придания водоне-
проницаемости различным тканям, бумаге, коже, древесине.
Алкоксидгалид титана 23’229'2341243
Все алкоксидгалиды титана получаются при действии спиртов
на тетрагалиды (чаще тетрахлорид) титана. При этом происходит
замещение в тетрагалиде титана части атомов галогена на алко-
ксильные группы, причем образуются продукты с общей формулой
TiClm(OR)„, где т + п = 4. Алкоксидгалиды титана образуются
также при действии галогенов на соответствующие тетраалко-
ксиды титана.
Триалкоксидмоногалиды титана. К образованию триалкоксид-
моногалидов титана могут приводить различные реакции: действие
галогенов, галогенангидридов органических кислот, галидов пири-
диния на соответствующие тетраалкоксиды титана, действие соот-
ветствующих спиртов на тетрагалиды титана (конечные продукты)
и некоторые другие. Однако эти реакции не являются общими
методами получения триалкоксидмоногалидов титана. Последние
часто получаются не в свободном состоянии, а в виде комплексов,
загрязненных побочными продуктами, или даже как побочные про-
дукты. Наиболее плодотворным методом получения различных три-
алкоксидмоногалидов титана явилась исследованная А. Н. Несмея-
новым с сотрудниками реакция переэтерификации, протекающая
при действии различных спиртов на триэтоксидмонсбслорид титана,
способ получения которого в чистом виде был разработан ими же.
Т р и м е т о к с и д х л о р и д титана, или триметилхло-
ро т р и о к с о т и т а н а т— Т1С1(ОСН3)з (мол. вес 176,46) обра-
зуется как конечный продукт цепи реакций замещения, происходя-
щих при действии метанола на тетрахлорид титана:
Т1С14 + ЗСН3ОН —> TiCl4-3CH3OH —> TiCl3(OCH3) • 2СН3ОН +
+ НС1 —> TiC12(OCH3)2-CH3OH + HCl —> TiCl(OCH3)3 +НС1
311
Он образуется также при действии хлорида ацетила на тетра-
метоксид титана.
Триметоксидхлорид титана представляет собой белые кристал-
лы. Водой легко гидролизуется:
TiCl(OCH3)3 + 5Н2О = Ti(OH)3Cl • 2Н2О + ЗСН3ОН
В метаноле легко растворяется; по характеру электропроводности
метанольные растворы триметоксидхлорида титана аналогичны
растворам истинных солей; электропроводность сильно увеличива-
ется с разбавлением. С метоксидом натрия (в- метанольном рас-
творе) реагирует с образованием тетраметоксида титана.
Тр иэ т о кс и д х л о р и д титана, или триэтилхлоро-
триоксотитанат — TiCl(OC2H5)3 (мол. вес 218,54) образует-
ся при действии хлора или хлорида ацетила на тетраэтоксид тита-
на, а также как конечный продукт цепи реакций замещения, про-
исходящих при действии этанола на тетрахлорид титана. Однако
легче всего триэтоксидхлорид титана образуется при взаимодей-
ствии эквимолекулярных количеств тетраэтоксида титана и хло-
рида пиридиния в бензольной среде при 60—70° С:
Ti(OC2H6)4 + CSHSN • НС1 = TiCl(C2H5)3 + С2Н5ОН + CSHSN
На основе этой реакции разработан способ получения триэтоксид-
хлорида титана, исходными веществами для которого являются
гетрахлорид титана, этанол и пиридин. При смешении этих веществ
на холоду в бензольной среде происходит образование тетраэток-
сида титана и хлорида пиридиния, которые при нагревании до
60—70°С вступают в реакцию по приведенному выше уравнению.
Из полученной смеси триэтоксидхлорид титана выделяют дробной
разгонкой в вакууме. Этот способ получения делает триэтоксид-
хлорид титана вполне доступным веществом.
Чистый триэтоксидхлорид титана представляет собой белые
кристаллы (температура плавления 146°С), а с примесями — очень
вязкую светло-желтую жидкость. Давление пара при 150° С равно
2 мм рт. ст., при 176° С — 18 мм рт. ст.
Водой легко гидролизуется. Со спиртами, в том числе с мети-
ловым, вступает в реакцию переэтерификации. В этаноле легко
растворяется; электропроводность этанольных растворов сильно
увеличивается с разбавлением. С этоксидами щелочных металлов
(в этанольном ра'Ртворе) реагирует с образованием тетраэтоксида
титана. Отделение атома хлора происходит также при действии
щелочных металлов в эфирной среде.
Трипропоксидхлориды титана — TiCl (ОСзН7)3 — об-
разуются как конечные продукты при действии пропанолов на тет-
рахлорид титана. Три-н-пропоксидхлорид титана образуется при
взаимодействии тетра-н-пропоксида титана с хлоридом пиридиния.
Трибутоксидхлориды титана — TiCl (ОС4Н9)3 — обра-
зуются при действии бутанолов как на тетрахлорид титана (конеч-
312
ные продукты), так и на триэтоксидхлорид титана (реакция пере-
этерификации) .
Действием соответствующих спиртов на триэтоксидхлорид ти-
тана А. Н. Несмеянову с сотрудниками удалось, кроме трибуток-
сидхлоридов титана, получить трипентоксидхлориды, три-н-гексо-
ксидхлорид, трихлорэтоксидхлорид, триэтоксоэтоксидхлорид титана.
Сведения о различных триалкоксидхлоридах титана приведены
в табл. 13.
Таблица 13. Характеристики некоторых триалкоксндхлоридов титана
Формула Название Мол. вес Температура кипения, °C Плотность, г/см3
TiCl (OC2HS)3 Триэтоксидхлорид 218,54 176 (при 18 мм рт. ст.) —
TiCl (ОС3Н7)3 Т ри-н-пропоксидхло- рид 260,62 168 (при 12 мм рт. ст.) 1,135
TiCl [О (СН2)3 СН3]3 Три-н-бутоксидхло- рид 302,70 199 (при 13 мм рт. ст.) 1,098
TiCl [ОСН2СН (СНэ)2]з Три-изо-бутоксид- хлорид 302,70 166 (при 11 мм рт. ст.) 1,104
TiCl [О (СН2)4 СН3]з Т ри-н-пентоксидхло- рид 344,78 214 (при 20 мм рт. ст.) —
TiCl [ОС2Н4СН (СНз)2]з Т ридиметилпроп- оксидхлорид 344,78 174 (при 2 мм рт. ст.) 1,060
TiCl (ОС6Н13)з Три-н-гексоксидхло- рид 586,86 233 (при 18 мм рт. ст.) 1,003
TiCl (ОС2Н4С1)з Т рихлорэтоксидхло- рид 321,87 180 (при 2 мм рт. ст.) —
Диалкоксиддигалиды титана. К образованию диалкоксиддига-
лидов титана также могут приводить реакции галогенов с тетраал-
коксидами титана и соответствующих спиртов с тетрагалидами ти-
тана (промежуточные продукты). Характерно, что при этих реак-
циях в конечном итоге получаются не чистые диалкоксидгалиды
титана, а продукты их соединения с одной молекулой соответствую-
щего спирта. Образование диалкоксиддигалидов титана происхо-
дит также при действии галогенов на триалкоксидмоногалиды ти-
тана. К образованию диалкоксиддигалидов титана приводит также
взаимодействие галогенангидридов органических кислот с триал-
коксидмоногалидами титана. Среди диалкоксиддигалидов титана
313
могут быть как однородные, например дихлориды, дибромиды, так
и смешанные, например бромхлориды.
Сведения с различных диалкоксиддигалидах титана приведены
в табл. 14.
Таблица 14. Характеристики некоторых диалкоксиддигалидов титана
Формула Название Мол. вес Температура, °C
плавления кипения
Т1С12 (ОСН3)2 Диметоксиддихлорид 180,87 209 —
TiCl2 (ОС2Н6)2 Диэтоксиддихлорид * 208,93 48 14218
TiCl2 (ОС3Н7)2 Ди-н-пропоксиддихлорид 236,98 — 16018
TiCl2 (ОС4Н9)2 Дибутоксиддихлорид 265,04 — 18217
TiBr2 (ОСН3)2 Диметоксиддибромид 269,78 — —
TiBr2 (OC2HS)2 Диэтоксиддибромид 297,83 49 1005
TiCIBr (OC2HS)2 Диэтоксидбромхлорид 253,38 — —
* Диэтоксиддихлорид титана представляет собой белые кристаллы моноклинной синго-
нии (а = 591, 5 = 1019 и с = 1390 пмУ, плотность 1,69 г/см?.
Таблица 15. Характеристики некоторых
моноалкоксидтригалидов титана
Формула Название Мол. вес Температура, °C
плавле- ния кипения
TiCl3 (ОСН3) Метоксидтрихлорид 185,29 — —
TiCl3 (OC2HS) Этоксидтрихлорид 199,32 81 185
TiCl3 (ОС3Н7) н-Пропоксидтрихлорид 213,35 65 101 (при 23 мм рт. ст.)
TiCl3OCH(CH3)2 «зо-Пропоксидтрихлорид 213,35 79 65 (при 1 мм рт. ст.)
TiCl3 (OC4H9) изо-Бутоксидтрихлорид 227,37 82 93 (при 9 мм рт. ст.)
TiCl3 (ОС6Нн) «зо-Пентоксидтрихлорид 241,40 50 НО (при 17 мм рт ст.)
TiCl3 (ОС„Н1Э) н-Г ексоксидтрихлорид 255,43 48 121 (при 8 мм рт ст.)
TiBr3 (OC2H6) Этоксидтрибромид 332,67 — —
314
Моноалкоксидтригалиды титана. К образованию моноалкоксид-
тригалидов титана может приводить взаимодействие тетрагалидов
титана с соответствующими спиртами (промежуточные продукты),
а также с некоторыми простыми эфирами (например, изопропило-
вым). Моноалкоксидтригалиды титана образуются также при дей-
ствии галогенов на диалкоксиддигалиды титана.
Сведения о различных моноалкоксидтригалидах титана приве-
дены в табл. 15.
Ароксиды и ароксидхлориды титана 23'229’234'236’244
Тетраароксиды титана. Этих соединений сравнительно немного;
они образуются преимущественно при взаимодействии тетраалко-
ксидов титана с соответствующими фенолами или ароматическими
спиртами.
Тетрафеноксид титана, или фенилортотитанат —
Т1(ОСбН5)4—образуется при взаимодействии тетраэтоксида тита-
на с фенолом в уксуснокисдотной среде. Он представляет собой
оранжевые кристаллы с температурой плавления 153° С.
Тетрафенилметоксид титана, или бензилортотита-
нат— ТЦОСНгСбЩ^ — образуется при взаимодействии тетра-н-
бутоксида титана с бензиловым спиртом. Он представляет собой
вязкую жидкость; при нагревании в вакууме до 250° С разлагается.
Тетра-о-хлорфен оксид титана, или о-хлорфенилорто-
титанат — Ti(OCeH4Cl-o)4—образуется при взаимодействии тетра-
хлорида титана с избытком о-хлорфенола:
TiCl4 +4о-С1С6Н4ОН = Ti(OC6H4Cl-o)4 +4НС1
Эта реакция обратима, на что указывает превращение тетра-о-хлор-
феноксида титана в тетрахлорид титана при действии сухого хлоро-
водорода.
Тетра-о-нитрофеноксид титана, или о-нитрофенил-
ортотитанат — Ti(OC6H4NO2-o)4— образуется при взаимодействии
тетраэтоксида титана с о-нитрофенолом в уксуснокислотной среде.
К этим соединениям близок по своим свойствам дифен ди-
ске ид титана — ТЦОгСбН^г, продукт соединения которого с пи-
рокатехином — трифенилдиоксометатитановая кис-
лота— Н2[Т1(О2СбН4)3] — образуется при взаимодействии тетра-
хлорида титана с пирокатехином в бензольной среде. Известны
соли этой кислоты — трифендиоксометатитанаты натрия, бария,
магния, аммония, никеля, цинка, анилиния, гуанидиния, пиридиния,
пиперидиния.
Триароксидмонохлориды титана. Этих соединений известно так-
же немного; они образуются при взаимодействии триэтоксидхло-
рида титана с соответствующими фенолами.
Трифеноксидхлорид, тит а н а — TiCl(ОСбН5)3 — обра-
зуется при взаимодействии триэтоксидхлорида титана с фенолом и
представляет собой красновато-бурые кристаллы.
315
Т р и ф е н и л м е т о к с и д х л о р и д титана —
ПС1(ОСН2С6Н5)з— образуется при взаимодействии триэтоксид-
хлорида титана с бензиловым спиртом.
Диароксиддихлориды титана. Эти соединения образуются при
взаимодействии тетрахлорида титана с соответствующими фено-
лами в бензольных растворах. Их можно рассматривать как слож-
ные эфиры соответствующих фенолов и дихлородиоксотитановой
кислоты — Н2[Т1О2С12].
Дифеноксиддихлорид титана — ПС12(ОСбН5)2— обра-
зуется при постепенном введении 1 моль тетрахлорида титана
• в 2 моль расплавленного или растворенного (например, в бензоле
или хлорпроизводных углеводородов) фенола при температуре
выше 90°С (в растворе — при 60°С). Дифеноксиддихлорид титана
представляет собой красные кристаллы моноклинной сингонии
(а = 982,1, Ь = 1400,6 и с = 983,6 пм)\ в кристаллах димерен;
плотность 1,49 г/см3. Температура плавления 133° С. При разреже-
нии (1 мм рт. ст.) может быть перегнан. Водой легко гидроли-
зуется. Растворяется в бензоле и хлорпроизводных углеводородов.
Известны также дикрезоксиддихлорид титана —
Т1С12(ОСбН4СНз), д и х л о р ф е н о к с и д д и х л о р и д ы тита-
на— TiC12(OCeH4Cl-o)2 и TiC12(OC6H4Cl-n)2- Последние два со-
единения могут быть получены и при непосредственном взаимодей-
ствии о- или n-хлорфенолов с тетрахлоридом титана; они пред-
ставляют собой темно-красные пластинчатые кристаллы, легко
гидролизующиеся с обесцвечиванием:
TiCl2(OC6H4Cl)2 + 4Н2О = H4TiO4 + 2НС1 + 2СвН4(ОН)С1
Вследствие гидролиза эти вещества на влажном воздухе слегка
дымят.
К диароксиддихлоридам титана близок альдфениловый
эфир дихлородиоксотитановой кислоты, имеющий состав
TiCl2(OCfiH4COH)2. Он образуется в виде красно-фиолетового кри-
сталлического порошка при реакции салицилового альдегида
с тетрахлоридом титана.
Моноароксидтрихлориды титана. К образованию этих соедине-
ний может приводить взаимодействие тетрахлорида титана с со-
ответствующими фенолами и ароматическими спиртами.
Феноксидтрихлорид титана — Т1С1з(ОС6Н5) — обра-
зуется при бурной реакции тетрахлорида титана с фенолом. Он
представляет собой темно-красные кристаллы, слегка дымит на
влажном воздухе. Водой гидролизуется:
TiCl3OCeH5 + 4Н2О = Н4Т1О4 + ЗНС1 + СвН5ОН
При нагревании (120—150° С, 1 мм рт. ст.) диспропорционирует
с образованием дифеноксиддихлорида и тетрахлорида:
2TiCl3OCeH6 = TiCl2(OC6H5)2 + TiCl4
316
Крезоксидтрихлориды титана — Ti CI з (ОСбН4СН3) —
образуются при взаимодействии тетрахлорда титана с крезо-
лами. 1,3,5-Э т и л м е т и л ф е н о к с и д т р и х л о р и д титана —
Т1С13(ОСбНзСН3С2Н5)—образуется при взаимодействии тетрахло-
рида титана с 1,3,5-этилметилфенолом в бензольном растворе.
ТИТАНОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Долгое время все попытки получить титанорганические соеди-
нения действием металлоорганических соединений главным обра-
зом на тетрахлорид титана оказывались безуспешными. Вместо
образования ожидаемых титан(IV)-органических соединений про-
исходило восстановление титана до более низких степеней окис-
ления. Это объяснялось вообще невозможностью существевания
титанорганических соединений, причем положение о нестабильно-
сти ковалентной связи между атомом переходного металла (обра-
зованной d-электронами) и атомом углерода органического ради-
кала обосновывалось теоретически. Допускалось, однако, что
возможно существование титан(II)-органических соединений, обра-
зованных за счет валентных s-электронов. И только в середине
XX века были получены и исследованы алкилгалиды, а затем ал-
килалкоксиды и другие титан(IV)-органические соединения. Эти
соединения, особенно титантетраалкилы, оказались очень нестой-
кими. Интерес к титанорганическим соединениям сильно возрос
в связи с их способностью (в смеси с алюминийорганическими со-
единениями) оказывать каталитическое влияние на реакции поли-
меризации олефинов.
Титаналкилы 229,245-251 звэ
Алкилгалиды титана(1У). Из титан(IV)-органических соеди-
нений первоначально были получены и исследованы алкилхлориды
типа TiClnR4_n, где R— метил, этил, бутил. В настоящее время из-
вестны также соответствующие бромиды и иодиды, а также соеди-
нения с другими алкильными радикалами. Все эти соединения по-
лучаются при взаимодействии соответствующего тетрагалида ти-
тана с алкильными производными лития, цинка, алюминия, свинца
и других металлов. Легче всего получаются моноалкилтригалиды
титана, затем — диалкилдигалиды.
Моноалкилтригалиды титана. К образованию моноалкилтрига-
лидов титана — TiF3R— приводит обменное взаимодействие тет-
рагалида титана с алюминийалкилами.
Метилтрихлорид титана — TiCl3(CH3)—был получен
путем медленного приливания диметилхлорида алюминия к из-
бытку тетрахлорида титана в гексановой среде при комнатной
температуре:
TiCl4 + А1С1(СН3)2 = Т1С1а(СН3) + А1С12(СН3)
317
В гексановом растворе метилтрихлорид титана может быть полу-
чен также при взаимодействии тетрахлорида титана с метилхло-
ридом магния (не содержащим эфира) при —20° С.
Метилтрихлорид титана представляет собой темно-фиолетовые
кристаллы, плавящиеся при 28,5° С в желтую жидкость; растворим
в углеводородах и их галогенпроизводных. В растворах легко под-
вергается термическому распаду по уравнению:
2TiCl3CH3 = 2TiCl3 + C2He
Выделяющийся трихлорид титана, в свою очередь, катализирует
процесс термораспада. Метилтрихлорид в растворах легко окис-
ляется кислородом с образованием метоксидтрихлорида титана.
Метилтрихлорид титана легко реагирует с жидкими алкенами,
причем происходит образование комплексов и отщепление свобод-
ных метил-радикалов. С тетрагидрофураном метилтрихлорид ти-
тана реагирует с образованием комплекса, который легко распа-
дается также с выделением свободных метил-радикалов.
При добавлении дипиридила к гексановому раствору метил-
трихлорида титана образуется нейтральный комплекс состава
[TiChCHa (NC5H4)2]. Это — дипиридил метил тр ихл о р от и-
т а н; он представляет собой красновато-фиолетовые кристаллы,
сравнительно мало чувствителен к кислороду и влаге, а в атмо-
сфере азота при 20° С может сохраняться, не разлагаясь, в течение
месяца; термическому распаду подвергается лишь при 160° С. Хо-
рошо растворим в тетрагидрофуране и нитробензоле, плохо —
в эфире.
Этилтрихлорид титана — TiCl3(C2H5)— образуется при
взаимодействии тетраэтилсвинца с избытком тетрахлорида титана
в гексановом растворе при —80°С:
2TiCl4 + Pb(C2H5)4 = 2T1C13(C2Hs) + РЬС12 + С4Н10
Этилтрихлорид титана представляет собой (при 20° С) краснова-
тую жидкость, распадающуюся за 24 ч, т. е. значительно менее
устойчивое соединение, чем метилтрихлорид. Легко окисляется
кислородом с образованием этоксидтрихлорида титана.
Пропилтрихлорид титана — TiC 13 (С3Н7) и из о б у т и л-
тр их лор ид—TiCI.3 (U30-C4H9)—образуются аналогично метил-
трихлориду, но только при более низкой температуре.
Сведения о различных моноалкилтригалидах титана приведены
в табл. 16.
Диалкилдигалиды титана. К образованию диалкилдигалидов
титана приводит дальнейшее алкилирование моноалкилтригалидов:
Диалкилдигалиды титана образуются также при взаимодей-
ствии соответствующего тетрагалида титана с избытком алкилга-
лида алюминия. Диалкилдигалиды титана менее устойчивы, чем
моноалкилтригалиды.
Диметилдихлорид титана — Т1С12(СНз)2 — образуется
при действии триметилалюминия на охлажденный до —80°С рас-
318
Таблица 16. Характеристики некоторых моноалкилтригалидов титана
Формула Название Мол. вес
TiCl3 (СН3) * Метилтрихлорид 169,29
TiCl3 (С2Н5) Этилтрихлорид 183,32
TiCl3 (С3Н7) «-Пропилтрихлорид 197,35
TiCl3CH(CH3)2 «зо-Пропилтрихлорид 197,35
TiC 13 (С4Н9) н-Вутилтрихлорид 211,37
TiCl3CH2CH (СН3)2 «зо-Бутилтрихлорид 211,37
TiBr3 (СН3) Метилтрибромид 302,64 ,
TiBr3 (С2Н5) Этилтрибромид 316,67
TiBr3 (С4Н9) Бутилтрибромид 344,72
Til3 (СН3) Метилтрииодид 443,55
Til3 (С2н3) Этилтрииодид 457,58
* =28,5° С; = 37° С (при 1 мм рт. ст.).
11JI Ixtlll
твор метилтрихлорида титана в гексане:
ТЮ3СН3 + А1(СН3)3 = TiCl2(CH3)2 + А1С1(СН3)2
Диметилдихлорид титана представляет собой черно-фиолетовые
кристаллы, растворимые в углеводородах (например, гексане). Рас-
творы окрашены в желтый цвет.
Диэтилдихлорид титана — Т1С1г (С2Н5) 2 — образуется
при приливании гексанового раствора тетрахлорида титана к из-
бытку диэтилхлорида алюминия:
TiC 14 + А1С1(С2Нб)2 = TiCl2(C2H6)2 + А1С13
Триалкилмоногалиды титана. Действием избытка триметилалю-
миния на диметилдигалиды или монометилтригалиды титана мо-
гут быть получены триметилхлорид и триметилбромид
титана:
TiCl2(CH3)2 + А1(СН3)3 = TiCl(CH3)3 + А1С1(СН3)2
TiBr3(CH3) + А1(СН3)3 = TiBr(CH3)3 + А1Вг2(СН3)
Триметилиодид титана образуется при реакции между
тетраметилтитаном и иодтрифторидом углерода:
Ti(CH3)4 + CF3I = TilfCH3)3 + Н3С - CF3
Триметилиодид титана представляет собой желтые иглообразные
кристаллы; устойчив при низких температурах и в отсутствие
кислорода.
Титантетраалкилы. Тетраметилтитан — Ti(CH3)4 (мол.
вес 108,04) образуется при действии метиллития или метилгалида
319
Магния На тетрахлорид титана в эфирном растворе:
TiCl 4 + 4LiCH3 = Ti(CH3)4 + 4LiC I
TiC 14 + 4MgCl(CH3) = Ti(CH3)4 + 4MgCl2
Тетраметилтитан представляет собой блестящие желтые иглооб-
разные кристаллы. Может быть перегнан вместе с эфиром в ва-
кууме при температуре ниже 0° С. Устойчив лишь при низких
температурах; при температуре выше 0° С спонтанно разлагается
с образованием черных пирофорных продуктов. При разложении
тетраметилтитана в эфирном растворе первоначально желтая
окраска переходит в зеленую, затем в черную; выделяется метан и,
наконец, выпадает черный осадок, представляющий собой в основ-
ном диметилтитан Ti(CH3)2 с примесью элементарного титана и
других продуктов. Диметилтитан диамагнитен. Термически он зна-
чительно более устойчив, чем тетраметилтитан: разлагается при на-
гревании до 250° С с выделением углеводородов (в основном ме-
тана) и образованием смеси (возможно, твердого раствора)
элементарного титана с диметилтитаном. Соляной кислотой диме-
тилтитан разлагается с выделением водорода, метана и образова-
нием трихлорида титана. При действии воды гидролизуется с обра-
зованием ортотитановой кислоты и метана:
Ti(CH3)4 + 4Н2О = Н4ТЮ4 + 4СН4
Кислородом тетраметилтитан легко окисляется. При действии га-
логенов, даже иода, легко разрушается с образованием тетрага-
лида титана и соответствующего галогенметана:
Ti(CH3)4 + 4I2 = TiI4 + 4CH3I
С тетрахлоридом титана дает метилтрихлорид титана:
Ti(CH3)4 + 3TiCl4 = 4TiCl3(CH3)
В предельных углеводородах тетраметилтитан растворяется без
разложения и из гексана может быть перекристаллизован. В эфир-
ном растворе со многими органическими соединениями азота и
фосфора (амины, фосфины, гетероциклические соединения) тетра-
метилтитан образует нейтральные комплексы в виде кристаллов
желтого или красного цвета. Все эти комплексы очень неустойчивы
и разлагаются при температуре около 0°С.
Т е т р а э т и л т и т а н — Ti(C2H5)4 (мол. вес 164,15) образуется
при действии этиллития на этилтрихлорид титана в эфирном или
гексановом растворе:
TiCl3(C2H5) + 3LiC2Hs = Ti(C2H5)4 + 3LiCl
Тетраэтилтитан представляет собой оранжево-желтые кристаллы.
Он чрезвычайно неустойчив и при выделении из раствора, даже
при низкой температуре, моментально разлагается.
320
Т ет р а п р о п и л т и т а н — Ti(C3H7)4— образуется при дейст-
вии пропиллития на пропилтрихлорид титана в гексановом рас-
творе:
TiCl3(C3H7) + 3LiC3H7 = Ti(C3H7)4 + 3L1CI
Тетр а-изо-б утилтитан -Ti(U30-C4H9)4 — образуется при
действии «зо-бутиллития на ызо-бутилтрихлорид титана.
Тетрапропилтитан и тетра-пзо-бутилтитан— вещества крайне
неустойчивые.
Титанциклоалкадиенилы 229,245,252-259
Из циклоалкадиенильных соединений титана известны главным
образом производные циклопентадиена.
Циклопентадиенилгалиды титана(1¥). Из циклопентадиениль-
ных соединений титана наиболее просто получаются тригалиды.
Так, при действии дициклопентадиенилмагния на тетрахлорид ти-
тана образуется циклопентадиенилтрихлорид титана:
TiCl4 + Mg(C5H5)2 = TiCI3(C5H5) + MgCl(C6H3)
Циклопентадиенилтрихлорид титана представляет собой оранже-
вые кристаллы. В некотором количестве при этой реакции обра-
зуется и темно-красный дициклопентадиенилдихлорид
титана (/пл = 289° С):
Ti С Ц + Mg(CsH5)2 = TiCl2(C5H3)2 + MgCl2
который может быть получен также при действии циклопентадие-
нилнатрия на циклопентадиенилтрихлорид титана:
Т1С13(С5Н5) + Na(CsHs) = TiCl2(CsHs)2 + NaCl
Циклопентадиенилтрихлорид титана взаимодействует при
—36° С с избытком жидкого аммиака или метиламина:
TiCl3(C3H3) + 6NH3 = (NH4)2[Ti(NH2)3Cl2(C5H3)] + NH4C1
TiCl3(C5H3) + 6CH3NH2 = (NH3CH3)2[Ti(NHCH3)3Cl2(C3H5)] + (NH3CH3)C1
Образовавшиеся комплексные соли в вакууме при 50° С разла-
гаются с отщеплением четырех молекул аммиака или метиламина.
При нагревании циклопентадиенилдихлоротриамидотитаната ам-
мония в вакууме до 210°С получается оранжевый возгон, содер-
жащий циклопентадиенилтрихлорид титана и хлорид аммония,
и коричневый остаток циклопентадиенилдихлорамида титана. При
взаимодействии циклопентадиенилтрихлорида титана с аммиаком
или метиламином при 0°С в течение нескольких суток образуется
желтый диамагнитный осадок, состоящий из смеси дихлордиамида
и хлортриамида титана. При растворении циклопентадиенилтри-
хлорида титана в пиридине с последующим упариванием раствора
в вакууме получается твердый дипиридинциклопентадие-
нил т р и х л о р о т и т а н — {TiCl3 (С5Н5) (NCsHsh]- С диметилсуль-
н Зак. 1128
321
фидом, трифенилфосфином и дипиридилом в бензольном растворе
циклопентадиенилтрихлорид титана не взаимодействует.
При соответствующих реакциях с тетрабромидом титана
могут быть получены циклопентадиен и лтрибромид —
Т1Вгз(С.5Н5) и дициклопентадиенилдибромид титана —
TiBr2(C,5H5)2— кристаллическое вещество с температурой плавле-
ния 314° С и плотностью 1,92 г/см^
Известны также соответствующие фтор- и иод-производные (ди-
циклопентадиенилдииодид титана — кристаллы с /Пл = 319°С).
Если циклопентадиенилтригалиды титана более или менее
устойчивы, то дициклопентадиенилдигалиды очень реакционноспо-
собны: они легко подвергаются окислению*, а при действии со-
ответствующего тетрагалида титана легко переходят в циклопен-
тадиенилтригалиды. Посредством подобных реакций могут быть
получены смешанные циклопентадиенилтригалиды титана.
Замещение третьего, а тем более четвертого атома галогена
в тетрагалиде титана на циклопентадиенилрадикал представляет
уже значительные трудности. Однако вполне возможно замещение
в дициклопентадиенилдигалиде титана одного или даже двух ато-
мов галогена на алкилрадикалы; например, при действии алкил-
лития на дициклопентадиенилдихлорид титана идут реакции:
TiCl2(C5H5)2 + LiR = TiC 1 (С5Н5) 2R + LiCl
TiCI2(C5Hs)2 + 2LiR = Ti(CsHs)2R2 + 2LiCi
Титанциклопентадиенилалкилы. Из алкилциклопентадиенилга-
лидов титана можно указать на метилдициклопе нтадиенил-
хлорид — Т1С1 (С5Н5)2(СНз), который представляет собой красно-
оранжевые кристаллы, плавящиеся при 169° С и растворимые без
разложения в холодной воде. Вещество устойчиво лишь в темноте;
на прямом солнечном свету быстро и необратимо разлагается. .
Диметилдициклопентадиенилтнт ан —
Т1(С5Н5)2(СНз)2 — представляет собой оранжевые иглообразные
кристаллы с характерным запахом. В темноте устойчив к действию
кислорода и воды; на свету быстро разлагается. Неустойчив к дей-
ствию галогенов, даже к иоду; с иодом реакция идет по уравнению:
Ti(CsHs)2(CH3)2 + 2I2 = TiI2(C6H5)2 + 2CH3I
Характерным является действие водорода на диметилдициклопен-
гадиенилтитан: при обычной температуре в углеводородной среде
(алкановой или циклоалкановой) он моментально восстанавли-
вается с образованием дициклопентадиенилтитана:
Ti(CsH3)2(CH3)2 + Н2 = Ti(CsHg)2 + 2СН4
* Эфирный раствор дициклопентадиенилдихлорида титана (содержащий так-
же MgBrC2H6) способен поглощать азот,
322
Рис. 57. „Сэнд-
вичевая" струк-
тура молекулы
дициклопента-
диенилтитана.
Три метилциклопентадиенилтитан-
Ti (С5Н5) (СН3)з — очень неустойчив: он распадается уже при обыч-
ной температуре на свету (темнеет). Кислородом окисляется очень
бурно с воспламенением.
Диметилдиметилциклопентадиенилтитан —
Ti (С5Н4СНз)2(СН3)2—представляет собой желтые кристаллы.
При обычной температуре устойчив на воздухе и в воде; при на-
гревании или сильном освещении разлагается.
Известны также этилдициклопентадиенилхлорид
титана —TiCl (С5Н5) 2 (С2Н5) и д и этилдициклопе нтадие-
нилтитан— Ti(С5Н5)2(С2Н5)2 — неустойчивые ве-
щества, а также пропилдициклопентади е-
нилхлорид титана — TiCl (С5Н5)2(СзН7), об-
разующийся при взаимодействии дициклопента-
диенилдихлорида титана с пропиллитием и разла-
гающийся только при нагревании до 160° С.
Дициклопентадиенилтитан, или титаноцен —
Ti(CsH5)2 (мол. вес 178,09) образуется при взаимо-
действии дихлорида титана с циклопентадиенил-
натрием:
TiC 12 + 2Na(C5H5) = Ti(C5Hs)2 + 2NaCl
Как указано выше, к его образованию приводит
также восстановление диметилдициклопентадиенил-
титана водородом. Таким образом, он является
соединением титана (II) и относится к классу л-цик-
лопентадиенилов, или так называемых «ценов» с
характерной «сэндвичевой» структурой молекулы
(рис. 57).
Дициклопентадиенилтитан представляет собой
кристаллы, возгоняющиеся в вакууме (0,001 мм
120—180° С. Чрезвычайно легко окисляется кислородом воздуха.
С концентрированной соляной кислотой образует дициклопентадие-
нилдихлорид титана. Труднорастворим в жидких алканах, цикло-
алканах и тетрагидрофуране. По свойствам дициклопентадиенил-
титан, как это видно, сильно отличается от аналогичного ему
«ферроцена», химически очень устойчивого. Характерным свойством
дициклопентадиенилтитана является его способность образовывать
соединение с окисью углерода — дицикл one нтадие ни л ди-
карбонил титана — Ti (СО)2(С5Н5)2.
Циклопентадиенилалкоксиды титана. Известно несколько сме-
шанных циклопентадиенилалкоксидов титана, в том числе и цик-
лопентадиенилалкоксидгалиды.
Циклопентадиенилдибутоксидхлорид титана —
TiCl(ОС4Н9)2(С2Н5)—образуется при взаимодействии тетрахло-
рида титана, тетрабутоксида титана и циклопентадиена в бензоль-
ной среде. Присутствие основания (например, пиперидина) пред-
отвращает полимеризацию продукта.
темно-зеленые
ст.
11
323
Циклопентадиенилдибутоксидбромид титана —
TiBr(OC4H9)2(C3H5)—образуется при взаимодействии тетрабут-
оксида титана с циклопентадиенилбромидом магния.
Д и ц и к л о п е н т а д и е н и л д и б у т о кс и д титана —
Ti(ОС4Н9)2(С5Н5)2— образуется при взаимодействии тетрабуток-
сида титана с циклопентадиениллитием.
Титанарилы 22> 245>24s, гео, звэ
Многочисленные попытки получить титанарилы также в тече-
ние почти ста лет оставались безуспешными. Так, при действии
дифенилртути на тетрахлорид титана не получили фенилтитана;
реакция шла до трихлорида титана:
2TiCl4 + 2Hg(C6H5)2 = 2TiCl3 + 2HgCl(C6H5) + (C6H5)2
Образование дифенила и трихлорида титана могло свидетельство-
вать, однако, о распаде первоначально образующегося-нестойкого
фенилтрихлорида титана. Действие фенилнатрия или реактива
Гриньяра (фенилгалида магния) не привело к образованию титан-
фенильного соединения. Проверив эти реакции, Разуваев и Бог-
данов в 1933 г. пытались синтезировать тетрафенилтитан также по
методу Полиса:
TiCl4 + 4С6Н5С1 + 8Na = Ti (C6HS)4 + 8NaCl
Однако при этом взаимодействии получился не тетрафенилтитан,
а опять-таки дифенил и трихлорид титана.
Арильные соединения титана впервые были получены только
в 1952 г.
Титантетраарилы. Тетрафенилтитан — Т1(СбНб)4 (мол.
вес 308,33) образуется при взаимодействии фениллития с тетра-
хлоридом титана в эфирном растворе:
Ti С14 + 4LiC6H5 = Ti (C6HS)4 + 4LiC 1
Тетрафенилтитан представляет собой довольно устойчивые при
низкой температуре (—70° С) желто-оранжевые кристаллы. С по-
вышением температуры до —30°С тетрафенилтитан разлагается
с отщеплением дифенила и образованием дифенилтитана:
Ti(C6H5)4 = Ti(C6H5)2 + (С6Н6)2
Дифенилтитан представляет собой термически более устой-
чивое (по сравнению с тетрафенилтитаном) вещество черного
цвета, однако кислородом воздуха окисляется так быстро, что при
этом воспламеняется. Растворим в бензоле и тетрагидрофуране.
В бензольном растворе окисляется кислородом спокойно с образо-
ванием фенола и дифенила. Разлагается в вакууме при 200—250° С
324
на элементарный титан и дифенил. С разбавленной соляной кис-
лотой реагирует:
Ti(C6H6)2 + 2НС1 = TiCI2 + 2С6Н6
Со спиртами также реагирует с образованием бензола.
Т ет р а б е н з и л т и т а и — ТЦСНгСбНэ^ (мол. вес 364,44)—
образуется при взаимодействии бензилхлорида магния с тетрахло-
ридом титана в эфирном растворе. При осторожном выпаривании
раствора продукт взаимодействия выделяется в виде красных кри-
сталлов. Тетрабензилтитан довольно устойчив при 0°С. При 71° С
плавится с частичным разложением. Растворяется в гептане и то-
луоле; в горячих (80—90° С) растворах разлагается за несколько
часов. Водными растворами кислот разлагается с образованием
ортотитановой кислоты и толуола.
Фенилгалиды титана. Из этих соединений получены и исследо-
ваны лишь некоторые хлориды,
Фенилхлориды титана образуются как промежуточные продук-
ты при взаимодействии тетрахлорида титана с дифенилртутью при
температуре около 90° С в различных органических средах. Все
они очень нестойки. Фенилтрихлорид титана способен дис-
пропорционировать на тетрахлорид и дифенилдихлорид титана *:
2TiCl3(C6H5) = TiCl4 + TiCl2(C6H5)2
а дифенилдихлорид титана распадается на дихлорид ти-
тана и дифенил:
TiCl2(C6Hs)2 = Ti Cl2 + (С6Н5)2
Трибензилхлорид титана — TiCI (СН2С6Н5)з — обра-
зуется при действии хлороводорода на тетрабензилтитан в толу-
ольном растворе. Трибензилхлорид титана представляет собой
красные кристаллы, плавящиеся при 100° С с разложением.
Арилалкоксиды титана. Первым из арилсоединений титана был
получен ф е н и л т р и-нзо-п р о п о к с и д титана посредством взаи-
модействия тетра-изо-пропоксида титана с фениллитием:
Ti(OC3H7)4 + LiC6Hs = Ti(OC3H7)3(C6Hs) + Li(OC3H7)
В действительности эта реакция идет более сложным путем. Фе-
нилтри-ызо-пропоксид титана образуется также при взаимодей-
ствии фениллития с трипропоксидхлоридом титана в эфирном рас-
творе:
TiCl(OC3H7)3 + LiC6H5 = Ti(OC3H7)3(C6H5) + LiCl
Фенилтри-изо-пропоксид титана представляет собой бесцветные
кристаллы, плавящиеся при 90° С и устойчивые в отсутствие кис-
лорода и влаги; кислородом легко окисляется. При дальнейшем
замещении изо-пропоксогрупп на фенилрадикал получаются со-
единения (дифенилди-пзо-пропоксид и трифенил-изо-пропоксид ти-
тана), термически значительно менее устойчивые. Фенилтрибу-
* Присутствие кислорода ускоряет это разложение.
325
токсид титана — T^OCziHg^CeHs)—легко окисляется кисло-
родом.
Толилтрибутоксид титана образуется при взаимодей-
ствии тетрабутоксида титана с n-толилбромидом магния
Ti(OC4Hg)4 + MgBr(n-CH3CeH4) = Ti(OC4Hg)3(n-CH3C6H4) + MgBr(OC4H9)
Аналогичным путем образуется нафтилтрибутоксид ти-
тана — Т1(ОС4Н9)з(а-С1оН7).
Дибензилдиэтоксид титана — ТЦОСгНб^СНгСбНДз—
образуется при взаимодействии тетрабензилтитана и этанола. Ве-
щество, димерное в кристаллическом состоянии, устойчиво при
—20° С в отсутствие кислорода и влаги. При 103° С плавится с раз-
ложением.
Титанциклопентадиениларилы. Из смешанных соединений этого
типа наиболее известны дициклопентадиенилдиарилы.
Дифенилдициклопентадиенилтитан —
Ti (С5Н5)2(С6Н5)2— образуется при взаимодействии дициклопента-
диенилдихлорида титана с фениллитием. Дифенилдициклопента-
диенилтитан представляет собой желто-оранжевые кристаллы
с температурой плавления 148° С. Сравнительно устойчив (при ком-
натной температуре может быть сохранен в течение нескольких
суток). Хорошо растворим в органических растворителях; в бен-
зольном растворе мономолекулярен. При нагревании в растворах,
до 90° С разлагается с отщеплением фенильных радикалов и по-
следовательным образованием фенилдициклопентадиенилтита-
на(Ш) и дициклопентадиенилтитана (II). Кислородом в растворе
легко окисляется. Бурно окисляется перекисями. При действии на
дифенилдициклопентадиенилтитан избытка фениллития происхо-
дит присоединение его с образованием темно-окрашенных комп-
лексных солей: трифенилдициклопентадиенилтитаната лития
Li2[Ti (С5Н5)г(СбН5)з] и тетрафенилдициклопентадиенилтитаната ли-
тия Li2[Ti (С5Н5) 2 (CeHs) 4].
Дитолил(л- и п-) д иц и к л о пе нт а д и е н и л т и т а н —
Т1(С5Н5)2(СНзСбН4)2 — образуются при взаимодействии дицикло-
пентадиенилдихлорида титана с м- или n-толиллитием и представ-
ляют собой желто-оранжевые кристаллы, плавящиеся с разложе-
нием; хорошо растворим в органических растворителях; термиче-
ски неустойчив.
Трифен илциклопентадиенилтитан —
П(СбН5) (С6Н5)3 — образуется при взаимодействии циклопентадищ
нилтрихлорида титана с фениллитием. Он представляет собой ве-
щество желтого цвета, устойчивое в растворах при —70° С; с повы-
шением температуры до комнатной на свету разлагается (темнеет)
с образованием фенилциклопентадиенилтитана(II):
Ti(C6H6)(C6Hs)3 = Ti(C6Hs)(C6Hs) + (С6Н6)2
326
При термическом распаде дифенилдициклопентадиенилтитанй
и трифенилциклопентадиенилтитана отрываются две фенил-группы
и образуются, соответственно, дициклопентадиенилтитан и фенил-
циклопентадиенилтитан. Строение последнего подтверждается ря-
дом реакций. Фенилциклопентадиенилтитан термически сравни-
тельно устойчив. Он медленно распадается в вакууме при нагре-
вании до 170—200°С с выделением элементарного титана.
КОМПЛЕКСЫ С ОРГАНИЧЕСКИМИ ЛИГАНДАМИ
Ранее уже были описаны соединения с комплексными анио-
нами, содержащими титан(IV) в качестве центрального атома и
различные органические лиганды. Лигандами в таких комплекс-
ных анионах являются, прежде всего, анионы органических кис-
лот, образующие многочисленные карбацидотитанаты. Да-
лее, такими лигандами могут быть алкоксо- и ароксо-группы, об-
разующие ал ко кс о- и ар.оксотита наты. Наконец, известны
титанаты, содержащие в качестве лигандов углеводородные ради-
калы (циклопентадиенил и фенил). Здесь будут рассмотрены ней-
тральные и катионные комплексы, образуемые титаном (III) и ти-
таном (IV) с нейтральными органическими лигандами.
Комплексы с углеводородами и их
галогенопроизводными8496
Комплексы, образуемые титаном с углеводородами, немного-
численны и нехарактерны. Наибольший интерес представляет свое-
образное комплексное соединение, которое образуется при сме-
шении тетрахлорида титана с бензолом. Это соединение имеет
состав 3TiC14-C6H6 и представляет собой кристаллы желтого цвета,
конгруэнтно плавящиеся при —36° С. Структура этого комплекс-
ного соединения может быть представлена формулой
Атомы углерода являются донорами трех л-электронных пар,
а каждый из трех атомов титана — акцептором одной такой
пары.
Комплексы с галогенопроизводными углеводородов также не-
многочисленны. Сравнительно устойчивые продукты присоединения
327
образуют хлорид и бромид этила и хлорид пропила и «зо-пропила
с тетрахлоридом и тетрабромидом титана. Состав этих продуктов
присоединения выражается формулами Tir4-2RT. Эти комплексные
соединения можно рассматривать как сложные эфиры титановых
галогенокислот, например гексахлоротитановой R2[TiCl6], гекса-
бромотитановой R2[TiBr6]. Этил-, пропил- и ызо-пропилгексахлоро-
титанаты представляют собой белые аморфные вещества, раство-
римые в тетрахлориде титана и нерастворимые в хлорпроизводных
углеводородов. Гексабромотитанаты представляют собой желтые
аморфные массы.
Комплексы с кислородсодержащими
соединениями S4’961229
Многие из кислород-, а также серусодержащих органических
соединений входят в качестве лигандов в состав нейтральных или
катионных титановых комплексов. К этим соединениям относятся
простые эфиры, альдегиды, кетоны, карбоновые кислоты и их про-
изводные (например, сложные эфиры), соответствующие тиопро-
изводные, гетероциклические соединения.
Соединения с простыми эфирами. Многочисленные простые эфи-
ры (диметилоксид, диэтилоксид, пропил- и бутилоксиды, анизол,
фенетол и многие другие) образуют с тетрахлоридом и тетрабро-
мидом титана продукты присоединения состава TiT4-OR2 и TiT4-
•2OR2. Они получаются посредством простого смешения компо-
нентов и представляют собой кристаллические вещества желтого,
оранжевого или красноватого цветов, хорошо растворимые в со-
ответствующих эфирах.
Структуру эфирных соединений тетрагалидов титана можно
представить двояко: или в виде нейтральных комплексов —
[Tir4OR2] и [Tir4(OR2)2], или в виде сложных эфиров комплекс-
ных смешанных алкоксогалотитановых кислот — R[Tif4(OR)] и
R2[TiT4 (OR) 2].
Аналогично эфирным соединениям образуются соединения с ор-
ганическими сульфидами. Например, известны соединения тетра-
хлорида титана с органическими сульфидами двух видов: TiCI4-SR2
и TiCl4-2SR2, где R — этил, бутил, бензил. Кроме того, известны
соединения тетрахлорида титана с более сложными органическими
сульфидами типа TiCl4-RS(CH2)„SR, где R — этил, бутил, а п = 2,
3, 6.
Существуют также соединения тетрахлорида титана с хлорза-
мещенными эфирами и сульфидами.
Соединения с альдегидами и кетонами. Альдегиды, преимущест-
венно ароматические, образуют с тетрахлоридом и тетрабромидом
титана продукты присоединения. Так, хорошо известны соединения,
с бензальдегидом— TiCl4-2OCHC6H5 —желтого и с коричным аль-
дегидом — TiCl4-2OCHCH = CHC6H5 — красного цвета. В этих и
328
подобных соединениях кислородные атомы альдегидов являются
донорами электронной пары, а центральный атом титана — их ак-
цептором.
Многочисленные кетоны (ацетон, метилэтилкетон, ацетофенон,
метилтолилкетон, этилтолилкетон, пропилтолилкетон и другие) об-
разуют с тетрахлоридом и тетрабромидом титана продукты присо-
единения преимущественно состава TifrOCRR'. Они образуются
при простом смешении компонентов и представляют собой кри-
сталлические вещества желтого, оранжевого или красного
цвета.
Клешневидные продукты присоединения образуют алкоксике-
тоны и дикетоны с тетрахлоридом титана. Так, с ацетиланизолом
образуются багрово-красные призмы состава А, а с ацетилацето-
ном — желтые иглы состава В.
А
Ацетилацетонтетрахлоротитан в эфирном растворе отделяет хло-
роводород и превращается в ацетилацетонаттрихлорид титана:
[TiC]4(OCCH3)2CH2] = НС1 + TiCl3(CH2COCH2COCH3)
При обработке последнего ацетил ацетоном в эфирном растворе
происходит дальнейшее замещение атомов хлора на ацетилацето-
нат-остатки.
Известны также комплексы титана с галогензамещенными ке-
тонами и тиокетонами.
Соединения с производными органических кислот. Многочислен-
ные комплексы с анионами органических кислот в качестве лиган-
дов были рассмотрены ранее. Здесь будут упомянуты комплекс-
ные соединения с ангидридами, хлорангидридами и сложными
эфирами органических кислот.
Ангидриды органических кислот образуют с тетрагалидами ти-
тана продукты присоединения двух типов: TiR4-O(OCR)2 и
TiR4-2O(OCR)2.
Многочисленные хлорангидриды органических кислот (уксус-
ной, пропионовой, н- и «зо-масляной, бензойной и других) обра-
зуют с тетрахлоридом и тетрабромидом титана продукты присо-
единения, из которых хорошо известны, например TiCI4- CH3COCI,
TiCl4-C2H5COCI, TiCl4-C3H7COCl, TiCI4-C6H5COCl. Перечислен-
ные вещества представляют собой желтые легкоплавкие кри-
сталлы.
329
Из комплексов титана со сложными' эфирами хорошо известны
три соединения тетрахлорида титана с диметилфумаратом:
СНэ Л
С1 ' Г1
с> 1/С1
«?н>2 Ji
cQ, о-с-о J, а
сн3
о । о=с-о-сн3
>i . (СН)2
С1 о=с-о-сн3
С1 *»
! /О=С-О-СН,\
С (<м )
\ о=с-о-сн,/
\ J/2
С12
Комплексы с азотсодержащими
соединениями 2.94.96,229
Из различных азот-, а также фосфорсодержащих органических
соединений наибольшее значение в качестве лигандов титановых
комплексов имеют амины (а также амиды кислот) и фосфины. Ли-
гандами могут также выступать гетероциклические, цианистые,
нитро- и другие азотсодержащие соединения. Сюда, естественно,
не относятся различные титанаты азотистых органических основа-
ний, которые рассматривались ранее, а также замещенные амиды
титана.
Соединения с аминами. Многочисленные органические амины
образуют комплексные соединения с тетрагалидами и тетраалко-
ксидами (а также с алкоксидгалидами) титана. Характер этих
комплексных соединений различен. В большинстве случаев обра-
зуются продукты присоединения, причем атомы азота аминов яв-
ляются донорами электронных пар. Моноамины присоединяются
преимущественно по две молекулы, образуя нейтральный комплекс
[TiXJNFKR)?.], где X — галоген или алкоксо-группа. Диамины или
триамины, занимающие два координационных места, присоеди-
няются по одной молекуле; известен, например, нейтральный ком-
плекс [Ti (ОС4Н9) 4NH2C2H4NH2] — этилендиаминтетрабутоксотитан
В некоторых случаях к одной молекуле тетрагалида титана при-
соединяется четыре, а иногда и более молекул амина. При
этом происходит либо перераспределение атомов водорода в моле-
кулах амина, а также распределение молекул аминов во внут-
ренней и внешней сферах комплексного соединения, например
(RNH3)2[Ti(NHR)2r4], либо внедрение молекул амина с вытеснени-
ем атомов галогена во внешнюю сферу, например [Tir2(NH2R)4]2+n--
Соединения с карбамидом. Карбамид (амидоксид углерода,
или мочевина) входит в качестве лиганда в состав комплексов,
образуемых как титаном(III), так и титаном(IV). К атомам ти-
330
тана амидоксид углерода присоединяется через атом кислорода,
который является донором электронной пары.
Из карбамидных соединений титана(III) известен перхлорат
гексакарбамидтитана(Ш) — [Ti(OCN2H4)6](C1O4)3, который
образуется при взаимодействии в водном растворе гидросульфата
титана(III), амидоксида углерода и перхлората натрия и предста-
вляет собой фиолетовые мелкие призматические кристаллы, раство-
римые в воде.
Из карбамидных соединений титана (IV) известны комплексные
соединения, образующиеся при действии карбамида на тетрахлорид
титана. Сначала при этом происходит присоединение амидоксида
углерода с образованием нейтральных комплексов: монокарб-
амид те т р а х л о р о т и т а н а — [TiCl^OCNaHi)] и дикарб-
амидтетрахлоротитана — [TiC14(OCN2H4)2]. Затем проис-
ходит внедрение карбамида с вытеснением атомов хлора во внеш-
нюю сферу и образованием хлорида трикарбамидтрихлоротита-
на (IV)— [TiCl3(OCN2H4)3]+Ch и хлорида тетракарбамиддихлоро-
титана (IV) — [TiCl2(OCN2H4)4]2+Cl22~.
Из соединений с амидами других кислот можно указать на
комплексы с ацетамидом и бензамидом. Известны также соедине-
ния с имидами кислот, примером которых может служить образую-
щийся при взаимодействии сукцинимида с тетрахлоридом титана
комплекс:
С1
CI |azNH(CH2CO2)2
/Ti
Cl I^NH(CH2CO2L
коричневого цвета.
Комплексы с цианистыми соединениями. Синильная кислота,
хлорциан, бромциан, алкилцианиды образуют с тетрахлоридом и
тетрабромидом титана продукты присоединения преимущественно
состава TiI'4-2HCN, Tir4-2CNr, Tif4-2RCN. По структуре и харак-
теру эти соединения являются нейтральными комплексами. Суще-
ствуют соединения тетрагалидов титана с синильной кислотой, га-
лоцианами, алкилцианидами и другого состава. Все эти соединения
образуются при простом смешении соответствующих цианистых
соединений с тетрагалидами титана или при поглощении парооб-
разного цианистого соединения соответствующим тетрагалидом.
Шесть молекулярных соединений тетрахлорида титана с этилциани-
дом различного состава могут быть выделены также из бензольных
растворов.
Комплексы с нитросоединениями. Различные нейтральные ком-
плексы тетрахлорид и тетрабромид титана образуют с аромати-
ческими нитросоединениями. Так, с нитробензолом тетрахлорид
титана образует молекулярное соединение TiCU-CeHsNC^ с темпе-
ратурой плавления 77,5° С. При смешении тетрахлорида титана
331
с л-динитробензолом (МДНБ) как непосредственно, так и в бен-
зольных растворах, могут быть выделены шесть продуктов присо-
единения различного состава: 4Т1С14-МДНБ, 3TiCl4-ЗМДНБ,
2Т1С14-МДНБ, ЗТЮ14-2МДНБ, TiCU-МДНБ и 2ТЮ14-ЗМДНБ.
С n-динитробензолом (ПНДБ) тетрахлорид титана образует три
продукта присоединения состава: 2Т1С14-ПДНБ, TiCU-ПНДБ и
TiCh-ЗПДНБ.
Комплексы с азотсодержащими гетероциклическими соединени-
ями. Из азотсодержащих гетероциклических соединений комплек-
сы с титаном образуют индолы, пиридины, хинолины, пиперидин.
Образование комплексов происходит при взаимодействии соответ-
ствующего гетероциклического соединения с тетрахлоридом или
тетрабромидом титана. Комплексы образуются преимущественно
двух видов: нейтральные, содержащие две молекулы гетероцикли-
ческого соединения, и анионные, содержащие четыре молекулы,
среди которых происходит перераспределение водородных атомов,
причем два остатка без водорода переходят во внутреннюю сферу,
а две другие молекулы с присоединенными протонами образуют
внешнесферные катионы. Так, с пиридином тетрахлорид титана
образует два соединения: [TiCl^NCsHs^] — дипиридинтетрахлоро-
титан и (C5H5NH)2[TiCl4(C5H4N)2] — дипиридилотетрахлоротитанат
пиридиния. Однако пиперидин образует соединение, содержащее
лишь одну его молекулу, а индол и трииндол образуют лишь ней-
тральные комплексы.
ГЛАВА XI
ТИТАН В ПРИРОДЕ
ГЕОХИМИЯ ТИТАНА
В природе титан встречается главным образом в виде двуокиси
или солей титановой кислоты—титанатов. Титан содержится во
всех изверженных и осадочных горных породах, в почве, во многих
растениях, а также в крови животных. Известно более ста минера-
лов с большим или меньшим содержанием титана. Многочисленные
титановые минералы в большинстве случаев состоят из соединений
двуокиси титана — ее полимеров и солей титановых кислот (тита-
натов). Титан обладает ярко выраженной способностью к изо-
морфному замещению некоторых элементов в различных минера-
лах и образованию твердых растворов. Для титана характерно
образование смешанных минералов с железом, ванадием, ниобием,
танталом и редкоземельными металлами. Однако породы с высо-
ким содержанием титана встречаются сравнительно редко.
Распространенность титана в земной коре 261~269
Титан является одним из самых распространенных химических
элементов земной коры. Количество титана, находящегося на на-
шей планете, по крайней мере вдвое превышает общее количество
углерода, вчетверо — количество серы и значительно превышает
количество хлора, фтора, фосфора и марганца. По своей распро-
страненности титан сдедует непосредственно за породообразую-
щими элементами. Весовой кларк титана для земной коры (т. е.
содержание титана в земной коре в вес. %) определялся рядом ис-
следователей, получивших для него значение около 0,6 (1923—
1932 гг.). Наиболее точным считается определение Гевеши
(1932 г.), согласно которому весовой кларк титана составляет 0,61
и атомный 0,22. Таким образом, из всех атомов, составляющих зем-
ную кору, 0,22% приходится на долю титана. По весовому содер-
жанию в земной коре титан стоит на десятом, а по атомному — на
одиннадцатом месте среди химических элементов.
Распространенность титана в биосфере. Если теперь обратить-
ся к рассмотрению содержания титана в различных частях земной
333
коры, то можно видеть, что титай содержится уже в поверхностном
слое земной коры — в биосфере.
В обычной атмосфере титан отсутствует; он может находиться
лишь в составе некоторых пылей, образующихся в результате рас-
пыления титансодержащих минералов, а также в составе дымов,
возникающих вблизи действующих вулканов и некоторых промыш-
ленных объектов.
В гидросфере содержание титана чрезвычайно мало. Так, в реч-
ной воде содержание титана не превышает 4- 10-е%, а в морской —
5-10“8%. В воде минеральных источников содержание титана так-
же невелико, в лучшем случае КТ-%.
В более или менее значительных количествах титан находится
в илах, глинах, почве. Титан находится также в живом веществе:
в растительных тканях, тканях низших животных (моллюсков),
мускульной ткани и крови позвоночных животных, а также в таких
продуктах жизнедеятельности, как молоко коров и моча (а также
мочевые камни) человека. В организме человека содержание ти-
тана достигает наибольшей величины в селезенке, надпочечниках
и щитовидной железе. Ниже приведены кларки титана для различ-
ных частей биосферы:
Морской ил...........................
Норвежская глина.....................
Ил Нила..............................
Ил оз. Черствец......................
Ил Онежского оз......................
Ил оз. Иван Большое..................
Песок Миссисипи......................
Песок Онежского оз...................
Почва (в среднем)....................
Пахотная земля.......................
Живое вещество (в среднем)...........
Водоросль кладофора..................
Моллюски.............................
Вещество человеческого организма . . .
0,35 атомн. кларк
0,20. атомн. кларк
0,8—1,5 вес. кларк
0.63 вес. кларк
0,50 вес. кларк
0,44 вес. кларк
0,35 вес. кларк
0,048 вес. кларк
0,1 вес. кларк
0,5 вес. кларк
0,0005 вес. кларк
0,03 вес. кларк
0,0006 (на живой вес)
0,00003 (иа живой вес)
Таблица 17. Содержание титана в магматических породах
Породы Весовой кларк Атомный кларк Породы Весовой кларк Атомный кларк
Магматическая сфе- Диориты 0,56 0,25
ра в целом .... 0,63 0,27 Эклогиты 0,62 0,47
Г раннты 0,23 0,10 Перидотиты .... 0,53 0,23
Плато-базальты . . 1,49 0,66 Нефелиновые сие-
Океанические ба- НИТЫ 0,52 0,23
зальты 1,18 0,52 Сиениты 0,40 0,18
Эссекситы 1,12 0,49 Гранодиориты . . . 0,32 0,14
Нефелиновые ба- Трахиты 0,23 0,10
зальты 0,90 0,40 Гранитные пегма-
Диабазы 0,87 0,39 ТИТЫ 0,05 0,02
Г аббро 0,58 0,26
334
Распространение титана в горных породах. Содержание титана
в осадочных породах сравнительно невелико. Так, в глинистых по-
родах и сланцах содержится 0,39% Ti, в песках и песчаниках —
0,15%, в известняках — 0,036%. Кларк титана для осадочных по-
род в целом составляет 0,34%.
Значительно больше титана содержится в магматических, т. е.
изверженных кристаллических породах. Кларки титана для этих
пород приведены в табл. 17.
Что касается глубинных сфер и центрального ядра Земли, то,
вероятно, титан в них отсутствует. Именно этим объясняется то,
что кларк титана для Земли в целом должен быть невелик. По рас-
четам академика А. Е. Ферсмана, он составляет 0,15—0,19%.
Геохимическая история титана 251-257,269,270
Распределение титана в различных зонах земной коры происхо-
дит очень сложно. Законы, которым подчиняется распределение
титана при кристаллизаций жидкого расплава, еще сравнительно
мало изучены. Подобно редким элементам, титан часто скапли-
вается в пегматитах. Однако здесь он встречается не в кислых, а
в более основных сиенитовых, нефелино-сиенитовых и, особенно,
в габбровых пегматитах. При этом наиболее распространенными
формами являются двуокись титана и силикотитанат кальция.
В главной кристаллизации титан играет важную роль при обра-
зовании более ранних железисто-магнезиальных силикатов. Авгит
базальтовых пород так же, как и биотит гранитовых и слюдяных
сиенитовых пород, всегда очень богат титаном. В кристаллизации
полевых шпатов титан совсе-м не участвует. Титан имеет большое
значение в первичной кристаллизации основных и умеренно кислых
пород. Преимущественно же титан встречается там, где в основных
породах при первичной кристаллизации произошло выделение
окисленных железных руд в виде единичных микроскопических
кристаллов и в виде больших масс. При выветривании титан под-
вергается лишь слабому все время прерываемому обменному рас-
творению. Титановая пыль широко распространена в выветриваю-
щихся горных породах, но в осадочных породах титан встречается
большей частью в форме мельчайших кристалликов рутила. Лишь
там, где горные породы быстро разрушаются и образуются рос-
сыпные месторождения еще не разложившихся минеральных ком-
понентов, встречаются и зерна титанистого железняка. Обычно
много титана содержат россыпи магнитного железняка.
В основном титан является элементом ранней кристаллизации
и ранних геохимических фаз в кристаллизации гранитных и нефе-
лино-сиенитовых пород; с этим связано то, что титан при кристал-
лизации подтягивает ниобий и редкоземельные металлы, образуя
с ними ниоботитанаты, лопариты, перовскиты, титаниты и др.
Геохимическая связь титана с другими элементами ясно видна
из рассмотрения так называемой геохимической звезды титана
335
(рис. 58). Здесь стрелками показано тяготение к титану различных
элементов в горных породах. Такими элементами являются ана-
логи титана и элементы групп соседних с группой титана: кремний,
цирконий, скандий, иттрий, лантаноиды, тантал, ниобий, ванадий.
С последним связь выражена слабее (показано на рисунке пункти-
ром). С непосредственными соседями титана это тяготение
взаимно. Некоторое тяготение у титана наблюдается к алюминию.
Однако следует отметить, что вхождение титана в силикоалюми-
наты затруднено, в то время как в силикатах замещение на титан
Рис. 58. Геохимическая звезда
титана.
происходит часто и известны много-
численные силикотитанаты. В процес-
сах кристаллизации силикатов титан
накапливается преимущественно с маг-
нием и железом в так называемой габ-
броидной геофазе. Поведение титана в
гранитных магмах определяется тем,
что выпадение ильменита и титанита
в ранние геофазы обычно связано с по-
глощением железа и кальция из боко-
вых пород. В щелочных породах про-
исходит явное и значительное накоп-
ление титана, в связи с чем в нефели-
новых сиенитах встречаются значи-
тельные скопления многочисленных
силикотитанатов.
Следует отметить, что титану в
его природных соединениях свойствен-
но преимущественно окислительное
число + 4. Однако в минералах, образовавшихся при высоких
температурах, могут содержаться соединения титана, в которых
его окислительное число равно +3. Это связано с протеканием
реакции:
2FeO + 2Т1О2 “ FCgOg + TlgOg
равновесие которой с повышением температуры сдвигается вправо.
Титан в космических телах 2 266 267
Титан присутствует в различных космических объектах. Он об-
наружен во многих метеоритах, на Солнце, других звездах и на
Луне.
Титан в метеоритах. Титан был найден во многих каменных и
железных метеоритах. В них титан находится в виде различных
минералов, основой которых являются двуокись титана, титанаты
железа, силикотитанаты (хондрит, ильменит, октаэдрит, ахондрит
и др.). Среди прочих в метеоритах был найден минерал осборнит,
представляющий собой нитрид титана.
Для содержания титана в каменных метеоритах супруги Под-
дан дают величину весового кларка 0,21%, а в железных метеори-
336
тах — 0,004%. Гевеши для кларка титана в метеоритах дает сред-
нюю величину 0,19%, с которой сходится новая величина Ишибаши
для каменных метеоритов — 0,14%. В исследованиях Ишибаши со-
держание титана в железных метеоритах колебалось от 0,0034 до
0,182%; средней величиной Ишибаши считает 0,036%- Для чистых
железных метеоритов среднее содержание титана следует считать
равным 0,01%. В некоторых случаях наблюдаются значительные
отклонения величины содержания титана от средней. Так, в одном
из силикатных метеоритов Ишибаши обнаружил 1,4% титана.
В каменном метеорите, упавшем на Украине (Червоный Кут), ока-
залось 0,48% титана.
Титан на Солнце и других звездах. Спектроскопически титан
обнаружен на Солнце, где он находится в более глубоких частях
хромосферы, в тонком обращающем слое и в пятнах фотосферы.
По спектральным данным, содержание титана, приходящееся на
1 м2 излучающей поверхности Солнца, составляет 0,8 г. Спектраль-
ный анализ показал, что в солнечных пятнах титан находится
главным образом в виде одноокиси. Основное, количество титана
располагается на Солнце в слое его на расстоянии 6000 км от цен-
тра. Титан обнаруживается также в редких, так называемых ме-
таллических, протуберанцах. Согласно спектральным исследова-
ниям, изотопный состав титана на Солнце следующий:
Изотоп.............46Ti 47Ti 48Ti 49Ti 50Ti
Содержание, вес. % . . 7,95 7,75 73,45 5,41 5,34
Как видно, этот состав близок к изотопному составу титана на
Земле.
Спектральное исследование звездного света обнаруживает ти-
тан на многих звездах, где он находится, главным образом в виде
одноокиси (имеются также сведения о присутствии титана на зве-
здах в виде моногидрида). Эти сведения относятся к звездным
атмосферам, в составе которых титан является одним из преобла-
дающих элементов. О нахождении же титана в составе внутренних
частей звезд ничего неизвестно.
Титан на Луне. Присутствие титана обнаружено на поверхности
Луны. В образцах лунных пород, доставленных на Землю экспеди-
цией американского космического корабля «Аполлон-11», согласно
предварительным сообщениям, содержание титана составляет 4—
7%, т. е. значительно превышает среднее содержание его в земной
коре. Однако в образцах, доставленных кораблем «Аполлон-12»,
титана уже оказалось меньше, а именно: в породе базальтового
типа — 2,2% и в тонкозернистом материале—1,8%. В образце
лунного грунта, доставленном автоматической станцией «Лупа-16»,
оказалось: в породе базальтового типа — 2,9% и в тонкозернистом
материале — 2,03%. В лунных породах титан содержится в виде
двуокиси, соединенной с оксидами других металлов и кремния,
т. е., по-видимому, в форме силикотитанатов различных металлов,
преимущественно железа (II), алюминия, кальция, магния.
337
ТИТАНОВЫЕ МИНЕРАЛЫ
Известно свыше ста минералов с большим или меньшим содер-
жанием титана. Многочисленные титановые минералы в большин-
стве случаев представляют собой кристаллические видоизменения
двуокиси титана или различных титанатов, т. е. солей титановых
кислот.
Природная двуокись титана 271~275
Двуокись титана встречается в природе в виде нескольких по-
лиморфных модификаций, из которых наиболее стойкой и часто
встречающейся является рутил. Природные минералы из двуокиси
титана отличаются тем, что, во-первых, они имеют полимерный со-
став, а, во-вторых, они всегда за-
грязнены железом и поэтому окра-
шены.
Рутил — один из наиболее рас-
пространенных титановых минера-
лов. Он кристаллизуется в тетраго-
нальной сингонии. По химическому
составу рутил представляет собой
двуокись титана, но с удвоенным
молекулярным весом, т. е. это ди-
мер Ti2O4, строение которого может
быть представлено формулой:
/°\
от/ тю
/о /
метатитанат оксотнтана
Рис. 59. Кристаллы рутила. Рутил содержит 60% титана, а так-
же примесь одноокиси и полуто-
раокиси железа (до 10%), а иногда и метатитаната железа (II).
Присутствие последнего в природном минерале объясняется тем,
что рутил может изоморфно замещаться метатитанатом желе-
за (II). Рутил может содержать также до 1,5% соединений других
металлов (олова, ванадия, ниобия, тантала).
Кристаллы рутила (рис. 59) обычно призматические, вертикаль-
но исштрихованные или бороздчатые, часто тонкоигольчатые. Цвет
рутила красновато-коричневый, переходящий в красный, иногда
желтоватый, синеватый, фиолетовый черный, редко — травянисто-
зеленый; кристаллы прозрачны и в проходящем свете кажутся ярко
красными. Рутил хрупок; излом неясно раковистый. Плотность
обычного рутила от 4,18 до 4,28 г/см\ но некоторые разновидности,
в зависимости от состава и содержания изоморфных примесей, мо-
гут иметь большую плотность — до 5,2 г/см3. Твердость рутила по
шкале Мооса от 6 до 6,5. На бумаге рутил оставляет бледно-корич-
338
невую черту. Рутил обладает алмазно-металлическим блеском. По-
казатель преломления высокий.
Рутил встречается в виде столбчатых, иглообразных и волосо-
видных кристаллов или же в виде отдельных бесформенных зерен
и скоплений различной величины главным образом в магматиче-
ских горных породах (диоритах, сиенитах, реже — в диабазах и ба-
зальтах), а также в динамо-метаморфических породах (гнейсах,
слюдяных сланцах, амфиболитах), в жилах, на контакте извержен-
ных и осадочных пород и в пегматитовых жилах. При разрушении
коренных пород, содержащих рутил, последний скапливается в ал-
лювиальных россыпях. Игольчатые или волосовидные кристаллики
рутила иногда густо пронизывают кварц; дымчатый кварц, прони-
занный иголочками рутила, называется волосатиком (или воло-
сами Венеры).
Известно, несколько разновидностей рутила, отличающихся друг
от друга цветом и прозрачностью (табл. 18).
Таблица 18. Свойства разновидностей рутила
Название Цвет Плотность (в г/смя) и другие особенности
Обыкновенный рутил Сагенит Ннгрин Изерин Криспит Паредрит Коричнево-красный Светло-бурый, прозрач- ный Черный, непрозрачный Красно-бурый Темно-бурый Бурый 4,20—4,25 Сетчатые двойниковые (в виде палочек) срастания тонких игольчатых кристалликов 4,6 — 5,?; содержит железо Содержит титановую кислоту
Анатаз, или октаэдрит, кристаллизуется в тетрагональной син-
гонии. По химическому составу он представляет собой двуокись
титана с учетверенным молекулярным весом, т. е. тетрамер—Ti4Og;
содержит 59,4% титана; в качестве примеси содержит одноокись
железа.
Кристаллы анатаза октаэдрические, красно-коричневые или си-
ние; обычно прозрачные. Анатаз хрупок; излом неясно раковистый.
Плотность от 3,82 до 3,92 а/с.м3. Твердость по шкале Мооса от 5,5
до 6,0. Анатаз обладает алмазно-металлическим блеском. В кисло-
тах нерастворим; разлагается при сплавлении с гидросульфатом
калия. Анатаз применяется как детектор.
Брукит кристаллизуется в ромбической сингонии. По химиче-
скому составу брукит представляет собой двуокись титана с уше-
стеренным молекулярным весом, т. е. гексамер — TifiO12.
Кристаллы брукита имеют красно-коричневый цвет и алмазно-
металлический блеск. Плотность 4,0 zJcm3. Твердость по шкале
Мооса от 5,5 до 6,0.
339
Струверит кристаллизуется в тетрагональной сингонии. Содер-
жит 71% двуокиси титана; в качестве примесей содержит оксиды
железа и ниобия или тантала.
Природные титанаты железа272-276
Различные титанаты железа встречаются в природе в виде
многочисленных минералов, имеющих общие названия ильме-
нитов и титаномагнетитов. К ильменитам, называемым
также титанистыми железняками, относятся собственно ильменит,
кричтонит, аризонит, гейкилит и другие минералы. К титаномагне-
титам относится обширная группа минералов, представляющих
собой иногда твердые растворы, а чаще — механические смеси
ильменита и магнетита (магнитного железняка, т. е. третьчеты-
рехокиси железа — Fe3O4). Титаномагнетиты (точнее, ильменито-
магнетиты) встречаются как в виде механической смеси довольно
крупных зерен ильменита и магнетита, так и в виде тонких прора-
станий магнетита пластинками ильменита. Ильмениты и титано-
магнетиты неизменно входят почти во все известные магматиче-
ские горные породы — диабазы, диориты, габбро и во многие ме-
таморфические — гнейсы, слюдяные сланцы и амфиболиты.
Ильменит — минерал тригональной сингонии. По химическому
составу он представляет собой соединение метатитаната желе-
за (II) с оксидом железа (III), или гематитом, бертоллидного типа,
т. е. твердый раствор. Состав ильменита может быть представлен
формулой mFcTiO;;-иРегОз, где т и п — переменные величины. Со-
держание титана в ильмените может колебаться (в зависимости
от происхождения) от 25 до 35%.
Ильменит встречается в виде толстотаблетчатых кристаллов,
острых ромбоэдров, тонких пластинок или листочков, а также в
виде отдельных зерен и включений. Цвет ильменита меняется от
бурого до железно-черного. Ильменит обладает слабым полуме-
таллическим блеском. Излом его раковистый. Плотность от 4,5 до
5,0 г/см3-, твердость по шкале Мооса от 5 до 6.
Кричтонит — минерал тригональной сингонии. Он представляет
собой метатитанат железа (II)—FeTiO3. Содержит 31—31,5% ти-
тана. Цвет кричтонита в массе черный. Плотность 4,7 г)см3-, твер-
дость по шкале Мооса от 5 до 6.
Аризонит — минерал моноклинной сингонии. По химическому
составу представляет собой метатитанат железа (III) — Ре2(ТЮз)з.
Содержит 35—36% титана. Цвет аризонита темно-серый. Плот-
ность 4,25 г1см3', твердость 5,5. Излом раковистый.
Гейкилит — минерал тригональной сингонии. Это метатитанат
магния-железа—(Mg, Fe)TiO3. Цвет багряно- и коричнево-чер-
ный. Плотность 4 e/c.iF; твердость 6.
Псевдобрукит — минерал ромбической сингонии. Он является
метатитанатгемидиоксидом железа (III) —Fe2O2(TiO3). Образует
мелкие кристаллы от красно-коричневого до черно-бурого цвета
с алмазным блеском. Плотность 4,6 г/c.ir; твердость 6.
340
Сенаит — минерал тригональной сингонии. Это метатитанат
марганца-железа(П)-свинца— (Мп, Fe, Pb)TiO3. Цвет черный. Плот-
ность 5,3 а/с.«3; твердость 6.
Лейкоксен — продукт выветривания ильменита или других при-
родных титанатов железа. В результате этого процесса, называе-
мого лейкоксенизацией, происходит вынос части железа из ре-
шетки ильменита и минерал постепенно превращается в рутил.
Хёгбомит — минерал тригональной сингонии. Это — ортотита-
нат магния-алюминия-железа(III)—M.gAlFe(TiO4)2. Цвет черный.
Плотность 3,81 г!смг.
Титаномагнетиты. Наиболее часто встречается ильменитомагне-
тит, представляющий собой твердый раствор FeTiO3 — Fe3O4; реже
встречается гематитоильменит, представляющий собой твердый
раствор FeTiO3 — Fe2O3. Титаномагнетиты образуют неправильные
массы или резко отграниченные полосы в основных породах (габ-
бронорптах). Титаномагнетиты встречаются в виде отдельных
вкраплений, в виде мощных штоков, шлиров и жил или же как
составная часть так называемого полосатого габбро. Наиболее
распространены две разновидности титаномагнетита: 1) богатый,
с содержанием титана 6—12% (в отдельных случаях может дости-
гать 20%) и 2) бедный, с содержанием 3—5% Ti (иногда сни-
жается до 1%). Богатые титаномагнетиты отнесены к габбродио-
ритам, бедные—к пироксенитам, горнблендитам, перидотитам, а
иногда и к оливинитам. Титаномагнетиты содержат небольшое ко-
личество примесей, наиболее важными из которых являются со-
единения ванадия и хрома. Ниже приведен средний химический
состав титаномагнетита, взятого из руды главных жил Кусинского
месторождения:
Компоненты Fe3O4 TiO2 SiO2 MgO A12O3 СаО Cr2O3 V2O5 MnO S P
Содержание
вес. % 73,73 13,77 3,31 3,05 2,93 0,72 0,67 0,64 0,41 0,12 0,01
Некоторые титаномагнетиты содержат также весьма незначи-
тельные количества примесей соединений натрия, калия и меди.
В Приложении 51 приведены составы титаномагнетитов раз-
личных месторождений.
Природные титанаты кальция 272~275’277.278
Из различных титанатов кальция в природе встречаются глав-
ным образом метатитанат в виде минералов перовскита и кнопита
и силикотитанат в виде минерала, известного под названием сфен,
пли титанит.
Перовскит кристаллизуется в псевдокубической сингонии (гра-
нецентрированная решетка). В месторождениях контактного типа
кристаллы перовскита имеют преимущественно форму куба; ино-
гда они достигают значительных размеров. В изверженных поро-
дах перовскит обычно встречается в виде октаэдров.
341
По химическому составу различные перовскиты довольно одно-
образны. Они состоят из метатитаната кальция — СаПОз — с не-
большой (около 1%) примесью соединений железа (II). Содержа-
ние титана в перовските 35—36%. Перовскит некоторых место-
рождений содержит также следы марганца, магния, иттрия, нио-
бия и тантала.
Цвет перовскита серовато-черный или красно-бурый; иногда
встречается желтый перовскит. Перовскит обладает алмазным
блеском. Плотность от 3,95 до 4,04 г)см3\ твердость по шкале Мо-
оса 5,5. Кислоты на перовскит действуют слабо; он разлагается
лишь кипящей серной или плавиковой кислотой. Перовскит пол-
ностью разлагается при сплавлении с сульфатами или гидросуль-
фатами щелочных металлов.
Кнопит — минерал псевдокубической сингонии, сходен с перов-
скитом. Химически он представляет собой также метатитанат
кальция, но с примесью около 2% (а иногда даже до 5%) полу-
тораокиси церия. Содержит от 33 до 35% титана и незначитель-
ные количества натрия, калия
Рис. 60. Кристаллы сфена.
и магния. Цвет кнопита черный.
Плотность от 4,11 до 4,29 г/см3-,
твердость по шкале Мооса от 5,2
до 5,6.
Сфен, или титанит. Химически
сфен представляет собой сили-
котитанат кальция и имеет со-
став, выражающийся формулой
CaTiSiO5. Содержание титана в
нем колеблется от 22 до 26%.
В качестве незначительных при-
месей сфен содержит магний, мар-
ганец, железо и редкоземельные
металлы.
Сфен кристаллизуется в мо-
ноклинной сингонии. Кристаллы
(рис. 60) могут быть разнообраз-
ной формы, часто клинообразные и призматические, иногда сплю-
щенные. По виду кристаллы сфена разделяются на две группы:
1) свободно образованные в породе магматического происхожде-
ния; 2) образованные при сравнительно низких температурах пу-
тем выращивания из растворов.
Плотность сфена колеблется от 3,40 до 3,56 г!см3-, твердость по
шкале Мооса от 5 до 5,5. Температура плавления 1220° С.
В воде сфен нерастворим, однако порошок его при взбалтыва-
нии с водой придает ей щелочную реакцию. В горячей соляной
кислоте сфен растворяется с трудом. Концентрированная серная
кислота полностью разлагает его.
Разновидности сфена отличаются друг от друга цветом и со-
держанием примесей: яблочно-зеленый лигурит, бурый ледерит,
мелкие удлиненные желтые кристаллы семелина, мелкие желтые
342
кристаллы спинтера, белый зернистый титаноморфит, розовый гри-
новит, который содержит около 3% марганца. Разновидностями
сфена, содержащими редкоземельные металлы (иттрий и церий),
являются гротит, алшедит, аспиделит, эвколит и кейльгауит.
Прочие природные титанаты 273’ 279-286
Из прочих встречающихся в природе титанатов можно отме-
тить титанат марганца (минерал пирофанит), различные силико-
титанаты (кроме железа и кальция), а также боротитанаты и нио-
ботитанаты.
Пирофанит — минерал тригональной сингонии, по химическому
составу представляющий собой метатитанат марганца (IJ) —
МпТЮз. Содержит примесь метатитаната железа (II). Цвет в мас-
се темно-красный. Плотность 4,58 г/см2.
Оливейраит — аморфный минерал, по химическому составу
представляющий собой ортотитанатоксид циркония—/ГзС^ТЮ^г'
•2НгО. Цвет желто-зеленый.
Иттрокразит—минерал ромбической сингонии. Представляет
собой водный титанат редкоземельных металлов (иттровой груп-
пы) и тория. Черного цвета со смолистым блеском. Плотность
4,8 г/см2-, твердость по шкале Мооса 5,5—6. Не плавится.
Таблица 19. Силикотитанаты металлов
(кроме железа и кальция)
Название минерала Химический состав Внешний вид Содержание титана, %
Моленграафит Силикотитанат Na, Са; содержит Mg, Al, Мп и Fe Желтовато-коричневые кристаллы моноклин- ной сингонии 17
Ловчоррит Силикотитанат Na, Sr, Са и Се Аморфный —
Нарзарзукит Полисиликотитанат Na и Fe1'1; содержит F Желтые таблетчатые кристаллы тетраго- нальной сингонии 8,5
Бенитоит Силикотитанат Ва Голубого цвета 12
Лейкосфен Силикотитанат Na и Ва Белые клинообразные кристаллы 8
Нептунит Силикотитанат К, Na и Мп; содержит Fe Темно-красные приз- матические кристал- лы моноклинной син- гонии 11
Астрофилит Близок к нептуниту Желтого цвета 8
Чевкииит Силикотитанат Се; со- держит Са, Al, Fe Черного цвета 12
Линозит Силикотитанат Mg; со- держит Са — —
Лоренценит Силикотитанат Na Минерал ромбической сингонии —
343
Браннерит — призматические кристаллы или зерна. По составу
это титанатоксид урана. Цвет черный, иногда темно-оливковый.
Плотность 4,5—5,4 г/см3; твердость 4,5.
Боротитанаты. Из сравнительно немногочисленных боротитана-
тов известен варвикит—минерал ромбической сингонии, представ-
ляющий собой по химическому составу диортоборатоортотитанат
магния-железа(II). Цвет темно-бурый до матово-черного. Плот-
ность 3,36 г/см3; твердость 3—4.
Прочие силикотитанаты. Из силикотитанатов, или титаносили-
катов, кроме сфена, джоакинита, дизаналита, шерломита, изве-
стны минералы, состав и свойства которых приводятся в табл. 19.
Существуют и другие смешанные силикотитанаты, встречающиеся
в природе в виде различных минералов.
Ниоботитанаты. Обширную группу составляют минералы, со-
держащие титан наряду с ниобием и называемые также титано-
ниобатами. Из них прежде всего следует отметить лопарит —
минерал кубической сингонии, по химическому составу представ-
ляющий собой ниоботитанат натрия, кальция и церия. Содержит
23% титана. Мелкие кристаллы черного цвета; образует псевдоку-
бические двойники. Плотность 4,77 г/см3; твердость 5,5.
Таблица 20. Ниоботитанаты
Название минерала Химический состав Внешний вид Плот- ность, г!см? Содержа- ние тита- на, %
Пирохлор Ниоботитанат Na, Са и редкоземельных ме- таллов; содержит F Темно-бурый, кубиче- ской сингонии; окта- эдры 4,3 6-8
Дисанилнт Ниоботитанат Са и Fe; содержит Na и С1 Кубические кристаллы железно-черного цвета 4,15 30
Эшинит Ниоботитанат редко- земельных метал- лов; содержит Th Ниоботитанат Y, Се, Er, U Призматические кри- сталлы черного или бурого цвета 5,0 13
Эвксинит Буровато-черный мас- сивный или таблет- чатый минерал ром- бической сингонии 4,5 15-17
Поликраз Сходен с эвксинитом Черные тонкопризма- тические кристаллы 5,0 15-17
Эпистол ИТ Ниоботитанат Na; со- держит Si и F Прямоугольные пла- стинки сероватого цвета 2,8 4,2
Состав и свойства других ниоботитанатов приведены в табл..20.
К нйоботитанатам относятся также нуолаит, полимигнит, линдо-
кит, бетафит, писекит и некоторые другие. Аналогами ниоботита-
натов являются сравнительно малораспространенные танталоти-
танаты, например микролит — танталотитанат натрия-кальция.
344
ТИТАНОВЫЕ РУДЫ И ИХ МЕСТОРОЖДЕНИЯ
Типы месторождений титановых руд 287-291
Из предыдущих разделов этой главы видно, что титан очень
широко распространен в природе и, в частности, входит в состав
многочисленных минералов. Однако, как уже указывалось, тита-
новые минералы редко образуют большие скопления и далеко не
всегда пригодны для промышленного извлечения титана. Промы-
шленное значение имеют в основном три вида титановых руд:
1) руды на основе двуокиси титана (главным образом, рутила);
2) руды на основе титанатов железа — ильмениты и титаномагне-
титы и 3) руды на основе силикотитанатов (и титанатов), глав-
ным образом, кальция, из которых наиболее существенную роль
играют сфен, перовскит и лопарит.
Месторождения титановых руд считаются крупными, если за-
пасы их составляют несколько. миллионов тонн. Однако содержа-
ние титана в рудах может сильно колебаться и в зависимости от
этого определяется целесообразность извлечения титана. Ценность
руд значительно повышается, если попутно с титаном из них из-
влекаются и другие химические элементы. Кроме коренных тита-
новых руд, промышленное значение могут иметь также россыпные
месторождения. Россыпи разрабатываются, если составляющие их
пески содержат не менее 0,5% титана; целесообразность разра-
ботки россыпей, естественно, увеличивается, если из них добывают
и другие минералы.
В Советском Союзе разведаны значительные запасы титановых
руд. Эти запасы представлены как коренными месторождениями,
так и россыпями. По запасам титановых руд СССР занимает в
мире одно из первых мест.
Оксиднотитановые руды 287'29i’292
Из руд на основе двуокиси титана главное значение имеют ру-
тиловые руды.
Давно известные богатые месторождения рутила находятся на Скандинав-
ском полуострове и в Альпах, В Норвегии значительное месторождение рутила
находится вблизи Крагеро; оно образовано породой, называемой рутиловым
аплитом. Рутил здесь распределен равномерно в виде зерен; местами встречаются
шлиры, состоящие почти исключительно из рутила. Рутил встречается в других
местах Норвегии (Снарум, Рисер) и Северной Швеции в жилах, в основном со-
стоящих из апатита. Альпийские месторождения рутила находятся в Модриах
(Австрия), Зальцбурге, Тироле, в долине Тавеч (Швейцария).
На Американском континенте месторождения рутила имеются в США (шта-
ты Виргиния, Коннектикут, Массачузетс, Нью-Йорк, Северная Каролина, Техас),
Канаде (Квебек), Мексике (Оахака), Бразилии (Рио-де-Жанейро). Рутил встре-
чается и в Африке (Камерун, Мадагаскар). В настоящее время главным постав-
щиком рутила является Австралия, где имеются прибрежные рутиловые россыпи
(у границы Квиислэнда и Нового Южного Уэльса).
В Советском Союзе месторождения рутила встречаются на Урале в виде
включений отдельных зерен и игл в различные горные породы, в кварц и горный
345
хрусталь (волосатик) и в россыпях (золото- и платиноносные пески). Месторо-
ждения находятся в районе Кыштымской, Каслинской, Северской и Вер.хне-Уфа-
лейской дач, в русловых россыпях рек Сугомак, Б. Кыштым и в сланцах. Верхне-
Уфалейское месторождение (Теплые Горы) имеет вид каменной россыпи. Рутил
здесь встречается совместно с бесцветным апатитом в виде прожилок или круп-
нокристаллических скоплений. Кристаллы кровяно-красного цвета развиты очень
хорошо. В Каслинском месторождении рутил встречается в самой породе и в ее
пустотах в виде мелких и тонких кристаллов, соединяющихся иногда в звездча-
тые друзы.
Руды, содержащие анатаз, встречаются во Франции и Бразилии. В Советском
Союзе анатаз встречается в Карельской АССР; он найден также на Южном
Урале (Атлянская россыпь) и на Украине.
Месторождения брукита найдены в США (Арканзас) и в СССР на Урале
(окрестности Миасса, русла рек Сапарки и Каменки).
Месторождения струверита имеются на Мадагаскаре.
Титано-железные руды 287’293'294
Из руд на основе титанатов железа главное значение имеют
ильменитовые и титаномагнетитовые.
Месторождения ильменитов и титаномагнетитов известны на
всех материках земного шара. Все эти месторождения можно раз-
делить на три группы: 1) собственно магматические коренные ме-
сторождения, связанные с теми или иными горными породами;
2) осадочные месторождения типа ископаемых россыпей различ-
ного возраста, пески и песчаники; 3) современные прибрежно-мор-
ские россыпи и дюны. При этом резкой границы между чисто иль-
менитовыми и титаномагнетитовыми месторождениями провести
нельзя.
В Европе наиболее богатые месторождения ильменитов и титаномагнетитов
находятся на Скандинавском полуострове. Так, в Норвегии встречаются место-
рождения ильменита в виде больших кристаллов в жилах и гнездах в диорите
(Крагеро, Снарум, Арендаль, Эгерсунд). Титаномагнетитовые пески встречаются
на океанском побережье Франции, Испании, Португалии, Тирренском побережье
Италии и Черноморском — Болгарии.
В Азии находятся многочисленные и богатые месторождения ильменитов и
титаномагнетитов. Магматические месторождения ильменитов встречаются в Ин-
дии (Мадрас) и на Цейлоне. В прибрежных районах Индии (Траванкор) и Цей-
лона находятся богатые россыпи титаномагнетитовых песков. Титаномагнетитовые
пески встречаются и в прибрежных районах всех стран Юго-Восточной Азии —
Японии, Кореи, Китая, Филиппин, Индонезии, Малайи, Вьетнама, Лаоса, а также
в береговой полосе Сирии и Турции.
В Африке во многих странах находятся месторождения ильменитовых и ти-
таномагнетитовых руд. В прибреткных районах имеются россыпи титаномагнети-
товых песков,
На Американском континенте месторождения ильменитовых и титаномагнети-
товых руд имеются в Канаде (Квебек, Онтарио, Северо-Западная территория,
Нью-Фаундлэнд), Соединенных Штатах (Нью-Йорк, Арканзас, Оклахома, Вайо-
минг, Аризона, Колорадо, Нью-Мексика), Мексике (Оахака), Колумбии, Брази-
лии. В Гвиане, Аргентине, Чили находятся россыпи титаномагнетитовых песков.
В Австралии имеются россыпи титаномагнетитовых песков — очень богатые
на побережье провинций Квинслэнд и Новый Южный Уэльс. Подобные месторо-
ждения есть также в Новой Зеландии (Северный остров) и Тасмании.
В СССР ильменит широко распространен в пределах Хибинской и Ловозер-
ской тундры. В большинстве случаев он входит в состав различных щелочных
пород. Ильменит встречается также на Урале. Месторождение у Каслинской
346
дачи представляет собой своеобразное включение доломита, содержащего ильме-
нит, среди змеевиковых пород. В окрестностях Ильменских гор встречается много
ильменита, который входит здесь в состав миаскитов и жильных миаскитовых
пегматитов. Из миаскитов ильменит попадает в россыпи вместе с цирконием и'
другими минералами. Ильменит найден также на юге Донецкой области УССР.
В Советском Союзе имеются многочисленные месторождения
титаномагнетитов, причем многие из них весьма богаты и заслу-
живают особого внимания.
В Карельской АССР месторождение титаномагнетита находится при выходе
реки Суны из Вишкозера (Кайкарское месторождение). Темная рудоносная по-
рода диабазового типа. Рудные выделения местами очень обильны. Пудожгорские
титаномагнетиты, залегающие на берегу Онежского озера, содержат 5—6,6%
титана. Установлены запасы в трех залежах: на Див-горе, Пат-горе и в Му-
равьев-кряже. Значительное месторождение титаномагнетита расположено на се-
веро-западном берегу Ладожского озера (Веллимяки). Титаномагнетит входит
также в состав различных щелочных пород Кольского полуострова.
Довольно значительная пластообразная залежь титаномагнетита находится
около Кировабада (Азербайджанская ССР); содержание титана здесь колеблется
от 0,6 до 8,5%.
В области выходов габбро-норитовых пород восточного склона Уральского
хребта, тянущейся с крайнего Севера почти до Свердловска, известны весьма
многочисленные месторождения титаномагнетитов, представляющие магматиче-
ские шлировые выделения среди пород габбро-норитового семейства. На Южном
Урале наиболее значительно Кусинское, или Магнитное, месторождение в Назям-
ских горах. Руда здесь залегает в габбровых породах гнездами, полосами, жило-
образными массами; среднее содержание титана в руде 9%. Из других уральских
месторождений более или менее значительны: 1) Качканарское; валунчатые руды
содержат 1,2% титана; 2) Копайское; пластообразные залежи руды, содержащей
8% титана; 3) Первоуральское у Шайтанской дачи; титаномагнетиты образуют
здесь мощные залежи, содержание титана в руде 3%; 4) самое северное место-
рождение горы Юбрышка; руда содержит 4% титана.
Помимо коренных титаномагнетитовых руд в СССР известны также титано-
магнетитовые пески, образовавшиеся’ в результате размыва гор, заключавших
вкрапления титаномагнетитов, и сноса отсортированного тяжелого материала
к подножию гор. Такие горные пески занимают порой большие площади. Они
простираются по всему Черноморскому побережью от Гагры до Батуми. Наибо-
лее богатый участок лежит между устьями рек Супса и Нотанеби, Мощным россып-
ным месторождением ильменитового (вернее, лейкоксенового) песка является Са-
мотканское. В 1954 г. открыто Тобольское месторождение (ильменитовая рос-
сыпь) в Зауралье.
Силикотитанатные руды 287’2931295>296
Из руд на основе силикотитанатов и титанатов кальция и про-
чих металлов наибольшее значение имеют сфеновые руды, осо-
бенно для СССР, где большие залежи сфена найдены в Хибинской
тундре. Из других титанатов промышленное значение имеют пе-
ровскит, лопарит, пирофанит.
Месторождения сфена встречаются в Канаде, Соединенных Штатах Америки
и на Мадагаскаре.
В Советском Союзе сфен чрезвычайно распространен. В Хибинских тундрах
сфен входит в виде породообразующего минерала в состав различных нефелино-
вых сиенитов как в шлировых выделениях, так и в разнообразных пегматитовых
жилах, которыми так богаты Кольские щелочные массивы. Из восьми различных
347
типов хибинских сфенов наиболее распространены бурый и золотистый сфен. Хи-
мический состав этих хибинских сфенов (в %) приведен ниже:
тю2
Бурый сфен . . . 39,3
Золотистый сфен 39,5
SIO2 CaO Na2O Fe2O3 FeO
29,9 27,6 0,6 0,7 0,3
30,0 26,2 1,3 0,5 0,4
SrO AI2O3 MnO K2O
0,3 0,3 0,05 0,05
0,4 0,3 0,15 0,06
Крупные скопления сфенов найдены на Ловчорре. Сфены залегают также на
склонах гор Кукисвумчорр и Юкспор и в долине Лопарской между этими горами,
Сфен встречается также в северной части Карельской АССР, он входит в незна-
чительных количествах в пегматитовые жилы.
Сфен найден во многих местах Среднего и Южного Урала. Известен также
сфен из копей Назямских, Чувашских и Шишимских гор. Ахматовская копь наи-
более богата сфеном.
Сфен найден на юге Донецкой области. В виде небольших кристалликов
темно-бурого цвета он встречается в пегматитовых жилах Зангезура, содержится
в контактной породе на восточном берегу Большого Чебачьего озера (Казахская
ССР). В Алтайском крае сфен найден в двух пегматитовых жилах Колыван-
ского озера. Сфен содержится в пегматитах Восточных Саян (Бурятская АССР),
а также в пегматитах Майского района Иркутской области.
Перовскит встречается на Урале, Алтае, Кавказе, Кольском полуострове. Он
является основной составной частью в гнейсах Прибайкалья и обнаружен в не-
фелиновом базальте на острове Вилькицкого в Северном Ледовитом океане.
Месторождения кнопита находятся в Швеции.
Моленграафит встречается в Трансваале. Нарзарзукит, нептунит и лейкосфен
встречаются в Южной Гренландии.
Значительные месторождения лопарита, вместе с эвдиалитом, эгирином, рам-
заитом и другими минералами, имеются в Хибинской и Ловозерской тундрах
(Мурманская область).
Месторождения пирохлора имеются в Южной Норвегии. Пирохлор встре-
чается также на Урале (Ильменские и Вишневые горы).
ГЛАВА XII
ПРОИЗВОДСТВО ТИТАНА И ЕГО СОЕДИНЕНИЙ
ИЗВЛЕЧЕНИЕ ТИТАНА ИЗ РУД
Обогащение титанового сырья 297-зо<
Обогащение титанового сырья состоит прежде всего в отделе-
нии титансодержащих пород от железного сырья й от пустой по-
роды. При этом получают титановый концентрат, который
уже с большим успехом может быть использован для извлечения
из него различных соединений титана. Как правило, предвари-
тельное обогащение тцтановых руд проводят па месте добычи.
Обогащение может быть произведено различными методами, в за-
висимости от свойств руд.
Обогащение титаномагнетитов. Титаномагнетиты представляют
собой смеси ильменита и магнетита, причем магнитная проницае-
мость составных частей руды различна. Если принять магнитную
проницаемость (по Дэвису) железа за 100, то магнитная прони-
цаемость магнетита окажется равной 40,2, ильменита — 24,7, ру-
тила — 0,4 и силикатов — меньше 0,2. Используя это, ильменит
можно отделить как от магнетита, так и от пустой-породы. Одна-
ко, если зерна ильменита мелки, структура смеси чрезвычайно
тонка или раскристаллизация обоих минералов не происходит и
они выделяются в виде твердого раствора, то магнитная сепара-
ция применена быть не может.
Процесс магнитного обогащения состоит из следующих опера-
ций. Вначале руду подвергают крупному дроблению, затем вто-
ричному дроблению и, наконец, тонкому измельчению, причем
тонина помола определяется микроанализом образцов. Измельчен-
ную до необходимой тонины руду пропускают через электромаг-
нитный сепаратор, в котором создается слабое магнитное поле.
Сначала отделяют от магнетита относительно слабомагнитную
фракцию, содержащую ильменит и пустую породу, а затем эту
фракцию снова обрабатывают для получения ильменитового кон-
центрата.
На рис. 61 изображена схема ленточного сепаратора Болл-Нортопа. Загрузка
гонко измельченной руды производится питателем 1 на ленту 2, над которой
с большей скоростью двигается лента 4, снабженная электромагнитом 3. Обмотки
электромагнитов расположены таким образом, что соседние полюсы являются
разноименными. Частицы магнетита притягиваются к нижней поверхности лен-
ты 4. Вследствие разноименпости полюсов частицы магнетита переворачиваются,
а приставшие к ним частицы ильменита и пустой породы отсеиваются. Магнетит
уносится лентой 4, пока не выйдет из магнитной зоны, после чего он падает
349
в приемник 5, Ильменит и пустая порода как с ленты 2, так и с ленты 4 падают
в приемник 6. Таким образом, применяя слабое магнитное поле, можно почти
полностью сосредоточить титан в немагнитной фракции; однако при недостаточ-
ной тонине помола руды часть титана может оставаться и в магнитной фракции,
Фракция, содержащая ильменит и пустую породу, может быть подвергнута по-
вторной магнитной сепарации с применением
Рис. 61. Магнитный ленточный сепаратор
Болл-Нортона:
/ — питатель; 2, 4 — ленты; <3 — электромагниты;
5 —приемник магнитной фракции; б1 —приемник не-
магнитной фракции.
более сильного магнитного поля;
тогда в приемник 5 попадает иль-
менит (магнитная фракция), а в
приемник 6 пустая порода (немаг-
нитная фракция, хвосты).
Получение ильменитово-
го концентрата. Удаление
пустой породы из ильмени-
товой руды или из немаг-
нитной фракции после сепа-
рации титаномагнетитов до-
стигается обогащением мок-
рым путем на концентра-
ционных, или сотрясатель-
ных, столах. Концентрацион-
ные столы представляют со-
бой машины, состоящие из
плоскостей, поставленных
с небольшим уклоном, ка-
чающихся в направлении
длинной оси и омываемых
тонким слоем воды в напра-
влении поперечного сечения.
Каждое зерно, находящееся на наклонной поверхности работаю-
щего качающегося стола, подвергается действию силы трения ме-
жду декой стола и зерном и действию давления движущейся воды.
При действии этих двух сил зерно движется в направлении их
равнодействующей. Благодаря сотрясательным движениям стола
происходит расслоение поступающего на стол материала: тяжелые
зерна располагаются внизу, а легкие — наверху. Благодаря разли-
чию плотностей ильменита (4,6—5,1 г/см3) и силикатов (пустой по-
роды, 2,2—2,6 г/см3) их удается разделять.
Одним из недостатков обработки руды на концентрационных
столах является значительный вынос минералов в шламы, пони-
зить который в некоторой мере удается лишь при условии, что
размер зерен будет достаточно большим.
Ниже приведен примерный состав (в %) ильменитовых кон-
центратов различного происхождения:
тю2
Советский
из уральского тита-
иомагнетита . . . 42,8
из россыпей .... 52,8
Норвежский............42,3
Индийский (Траванкор) 54,3
FeO Fe2O3 А12О3 SiO2 MgO
31,4 16,9 2,5 2,0 2,5
27,8 15,2 1,5 1,3 0,6
33,9 12,9 1,8 3,5 1,6
26,0 15,5 1,1 1,4 0,85
СаО MnO V2O5
1,1 0,7 0,1
0,02 0,5 0,2
0,2 0,35 0,4
0,08 0,4 0,2
350
Обогащение сфено-апатитовой породы. Сфено-апатитовая по-
рода представляет собой очень твердую кристаллическую массу,
состоящую в основном из длинных желтовато-бурых кристаллов
сфена, зеленоватых включений апатита и включений нефелина
бутылочного цвета. Кроме того, в породе имеются черные пятна
темных минералов, изредка — розоватые включения эвдиалита.
Примерный состав сфено-апатитовой породы (в %) приведен
ниже:
Сфен................. 35,0
Нефелин.............. 26,3
Апатит............... 20,0
Эгёрин ............... 6,5
Роговая обманка .... 4.0
Арфведсонит........... 2,3
Полевой шпат.......... 1,5
Эвдиалит.............. 1,0
Антофилит............. 1,0
Слюда................. 0,5
Титаномагнетит........ 0,5
Магнетит.............. 0,4
Твердость всех компонентов породы колеблется в очень узких
пределах, от 5 до 6 по Моосу. В связи с этим методы обогаще-
ния, основанные на различии твердости компонентов, в данном
случае применены быть не могут. Близкие значения плотности
компонентов затрудняют также обогащение методами мокрой об-
работки на столах.
Процесс обогащения сфено-апатитовой породы основан на ис-
пользовании различия формы кристаллов отдельных компонентов
породы и состоит из следующих операций: 1) подготовка исход-
ного сырья дроблением до определенной крупности; 2) концентра-
ция на столах измельченного продукта, предварительно подверг-
нутого сухой классификации на ситах, и 3) магнитная сепарация
и флотация.
Концентрат, который получается при обогащении сфено-апати-
товой породы, содержит от 18 -до 20% титана.
Восстановительная плавка железо-титановых
руд 297,301,302,304-309
Уже давно металлурги отмечали влияние титана на чугун, вы-
плавляемый из титановых руд, причем присутствием титана объ-
яснялось улучшение механических свойств некоторых сортов чу-
гуна. Повышение качеств чугуна объясняли способностью титана
поглощать азот, что должно было увеличить прочность чугуна.
Проблема непосредственной металлургической переработки же-
лезо-титановых руд давно привлекала к себе внимание.
Долгое время титансодержащие руды считались непригодными
для доменной выплавки чугуна в связи с большим расходом топ-
лива и образованием в печах тугоплавких слитков («козел»), на-
рушающих ход процесса. Однако большие запасы титаномагнети-
тов, доступность их, отсутствие вредных примесей (сера, фосфор,
мышьяк), а также почти постоянное присутствие ванадия, что де-
лает выплавляемый чугун особенно пригодным для бессемерова-
ния, заставили обратить на них серьезное внимание. Как в СССР,
351
так и за рубежом, были разработаны способы промышленного
получения титансодержащих чугунов.
В настоящее время главной целью восстановительной плавки
железо-титановых концентратов является обычно получение тита-
новых шлаков и одновременно титансодержащего чугуна. При
известных условиях одним из продуктов восстановительной плавки
может быть также карбид титана.
Физико-химические основы метода. Восстановление железа из
железо-титановых руд сложнее, чем восстановление его из свобод-
ных оксидов железа — гематита и магнетита. При постепенном
нагревании ильменитового концентрата с углеродом в первую оче-
редь (1000° С) происходит восстановление железа из твердых ге-
матита и магнетита, а затем из метатитаната железа, причем в не-
металлическую часть выходит твердый дититанат железа (II):
2FeTiO3 + С = Fe + FeTi2O5 + СО
Затем, когда температура достигает 1150°С, а содержание дити-
таната железа — 70%, образуется эвтектика, состоящая из мета-
титаната и дититаната железа, которые начинают плавиться.
Таким образом, при 1100—1150°С восстановление оксидов же-
леза в ильмените протекает в твердой фазе с нарастающей ско-
ростью; выше этой температуры наступает начальное шлакообра-
зование, которое отрицательно влияет на восстановительный про-
цесс. Наряду с этим начинается и восстановление титана; при тем-
пературе 1150—1250° С восстановительный процесс в основном
протекает по уравнению:
3FeTi2O5 + 5С = 3Fe + 2Ti3O5 + 5СО
В интервале .1250—1400°С восстановление титана идет до по-
лутораокиси:
FeTi2O5 + 2С = Fe + Ti2O3 + 2СО
а в интервале 1400—1600° С — до одноокиси ТЮ. При избытке
углерода и при более высоких температурах появляется также
карбид титана.
С появлением в процессе восстановления титанатов железа
легкоплавких эвтектик возникает возможность образования слож-
ных соединений, кристаллизующихся в виде твердых растворов,
содержащих оксиды железа и титана различных степеней окисле-
ния. Среди этих соединений наибольшее значение имеет так назы-
ваемый аносовит, состав которого может быть выражен форму-
лой m(Mg, Ti11, Fen)Ti2O5 • и (Al, Ti111, Feni)2O2TiOs. Соотношение
между тип зависит от температуры: чем выше температура (т. е.
чем интенсивнее образование Ti11), тем больше значение т. Ано-
совит имеет ромбическую структуру; плотность его больше
4,19 а/см3.
Кроме этих сложных титанатов и карбида титана, в шлаках
могут присутствовать также карбнитроксиды титана — Ti(О, N, С),
которые образуются при температуре выше 1600° С и при избытке
352
углерода. Присутствие всех этих соединений (особенно карбнитр-
оксидов титана) повышает температуру плавления и вязкость шла-
ков. Снизить температуру плавления и вязкость шлаков можно
было бы введением в качестве флюсов оксидов кальция, магния
или алюминия, что, однако, может привести к уменьшению содер-
жания титана в шлаках.
Из рассмотренного видно, что важнейшим условием, опреде-
ляющим ход процесса восстановительной плавки, является соот-
ношение скоростей восстановления оксидов железа и плавления
шихты. Если в состав шихты входит порошкообразный ильмени-
товый концентрат, скорость плавления всегда окажется больше
скорости восстановления в связи с тем, что температура плавления
ильменита значительно ниже, чем температура плавления образую-
щихся в результате восстановления шлаков.
Восстановительная плавка с выделением титановых шлаков.
Богатые титаном шлаки получаются при восстановительной плавке
железо-титановых концентратов- и отстаивании их в жидкой ванне
для отделения чугуна. В связи с тем, что титановым шлакам свой-
ственны высокая температура плавления и большая вязкость, вос-
становительную плавку железо-титаповых руд нельзя вести в до-
менных печах. Для этой цели оказались пригодными электродуго-
вые печи.
Для восстановительной плавки используется шихта, составляе-
мая из ильменитового концентрата и углеродистого восстанови-
теля. Для обеспечения большой скорости восстановительного про-
цесса стараются применять углеродистый восстановитель повы-
шенной активности с пониженной электропроводностью и, как
можно, меньшим содержанием золы и серы. В качестве восста-
новителя вполне пригодны кокс, антрациты, а также молодые
каменные угли или угольные концентраты с малой зольностью.
Шихту составляют таким образом, чтобы содержание углероди-
стого восстановителя в ней колебалось от 8,5 до 13%. Для луч-
шего использования составных частей шихты, уменьшения пыле-
ния и снижения расхода электроэнергии целесообразно работать
с брикетированной шихтой. Однако применение брикетированной
шихты вызывает дополнительные затруднения, в связи с чем на
практике используют обычно комбинированную (брикетированную
с порошкообразной) шихту.
Для проведения восстановительной плавки используют обычно трехфазные
электродуговые печи, которые представляют собой ванны, футерованные магнези-
товым огнеупорным кирпичом. В каждой ванне установлено по три вертикальных
графитированных электрода таким образом, что они, не доходя до пода ванны,
оказываются глубоко погруженными в шихту, т. е. при работе печи электри-
ческие дуги закрыты шихтой. Процесс плавки проводится периодически. Обра-
зующиеся в результате процесса чугун и шлак выпускают через летку в из-
ложницы.
В результате восстановительной плавки брикетированной шихты
основные элементы распределяются (в %) между шлаком и
12 Зак, 1128
353
чугуном следующим образом!
Шлак Чугун
Титан.................... 98,5 0,8-1,2
Железо.................... 3,5 96—97
Кремний................... 72,0 10—12
Часть кремния улетучивается в виде субоксида.
Состав получаемого шлака зависит от состава исходного иль-
менитового концентрата, причем особое значение имеет соотно-
шение содержания в нем оксидов различных элементов. В среднем
гцлак может содержать 82—86% TiO2; 6—6,5% FeO; 5,5—6% SiOo;
2,5—3% MgO; 1,5—2%А120з; 0,5—0,8% CaO.
Состав и свойства получаемого чугуна также зависят от при-
роды и состава ильменитового концентрата, восстановителя, флю-
сов и от условий плавки. Чугун может содержать от 1,8 до 3,2% С,
0,4—2% Ti, 0,2—1% Si и отличается большой твердостью.
Восстановительная плавка с выделением карбида титана. При
нагревании шихты из ильменитового концентрата и угля до тем-
пературы 1900—2000° С происходит образование, наряду с чугу-
ном, карбида титана:
FeTiO3 + 4С = TiC + Fe + ЗСО
который всегда содержит примесь карбоксида титана, а в связи
с тем, что восстановительная плавка происходит в присутствии
азота, — также карбонитрида и карбнитроксида титана, которые
с карбидом образуют твердые растворы.
Процесс восстановительной плавки с выделением карбида ти-
тана (так называемая карбидизация) проводится в печах со-
противления.
Печь представляет собой по форме корыта, в торцовые стенки которых вмон-
тированы электроды. Между электродами располагается так называемый керн
(сердечник) из кускового кокса, вокруг которого засыпается шихта. При пропу-
скании электрического тока керн служит нагревателем примыкающих к нему
слоев шихты, температура которых повышается до 1900—2000° С. Удаленные от
керна слои шихты не нагреваются до столь высокой температуры; в них обра-
зование карбида титана не происходит и они служат лишь теплоизоляцией. По
окончании процесса образовавшуюся вокруг керна сплавленную массу карбида
тйТана измельчают и подвергают электромагнитной сепарации для отделения
железа.
Полученный таким способом карбид титана содержит, как
указано выше, примесь карбнитроксида титана и имеет следующий
примерный элементарный состав: 68—72% Ti; 9—12% С; 7—12% О;
2—2,5% Fe; 0,4—0,5% N.
Плавка титаномагнетитов на чугун. В СССР в 1932 г. были
произведены опыты выплавки чугуна из титаномагнетитов на со-
леном коксе (под руководством акад. Э. В. Брицке) и на древес-
ном угле и коксе с магнезиальным флюсом (под руководством
акад. М. А. Павлова).
Трудность ведения доменной плавки титаномагнетитов объяс-
няется тем, что титановые шлаки густы и тугоплавки. При изуче-
854
нии возможности применения легкоплавких доменных шлаков
было установлено, что введением небольших количеств поваренной
соли можно понизить температуру плавления титановых шлаков
и значительно разжижить их. Соль вводилась в печь в виде со-
леного кокса. Проведенные опыты подтвердили возможность
плавки сырых титаномагнетитов на соленом коксе; полученные чу-
гуны додержали 0,1—0,2% титана.
Предположение, что введение магнезиальных флюсов при до-
менной плавке титаномагнетитов должно способствовать получе-
нию жидкотекучих шлаков с нормальной температурой плавления,
было использовано при проведении опытных плавок титаномагне-
титов на древесном угле и коксе. Опыты доказали осуществимость
плавки титаномагнетитов на древесном угле с применением доло-
мита в качестве флюса; чугун содержал 0,5% титана. В резуль-
тате плавки титаномагнетитов на коксе получился чугун с содер-
жанием 0,4% титана.
Хлорирование титанового сырья 84'304’ 310~31в
Среди способов извлечения титана из руд хлорирование яв-
ляется весьма удобным и перспективным. Это обусловлено тем,
что хлорирование позволяет вскрыть титановое сырье, даже не
поддающееся обработке другими средствами, причем титан по-
лучается в форме тетрахлорида — продукта, легко подвергающе-
гося очистке, благодаря чему титан просто отделяется от других
элементов. К тому же тетрахлорид титана является основным ис-
ходным материалом для производства металлического титана.
Сырье и продукты хлорирования. Для извлечения титана хло-
рированию подвергают различное титансодержащее сырье: руд-
ные концентраты, шлаки и т. п. Все эти виды сырья содержат ти-
тан в окисленной форме (окислительное число Ti в основном +4),
т. е. главным образом в виде диоксида, свободного или соединен-
ного с другими оксидами. Хлорирование таких материалов нельзя
проводить действием одного хлора (см. гл. V) ввиду того, что не-
обходимо связывать и кислород. Хлорирование окисленного титана
с хорошим выходом тетрахлорида осуществляют при высокой тем-
пературе хлором, но в присутствии восстановителей или веществами,
в которых хлор связан с элементами-восстановителями. В качестве
восстановителей, как уже было указано, применяют углерод и неко-
торые углеродсодержащие материалы. В таких случаях побочными
продуктами реакции хлорирования будут двуокись (при недостатке
углерода) или окись углерода (при избытке его). Наличие в реак-
ционной смеси окиси углерода, которая может быть и непосред-
ственно использована в качестве восстановителя, может привести
к образованию с избытком хлора хлорокиси углерода (фосгена).
При хлорировании двуокиси титана или титанатов наряду с тетра-
хлоридом может образоваться в некотором количестве и дихлор-
оксид титана, а также сложные хлороксиды титана. Поскольку
13'
355
отдельные реагенты и побочные продукты растворимы в тетрахло-
риде титана, последний будет загрязнен даже при получении его
хлорированием чистой двуокиси титана (в присутствии углероди-
стого восстановителя).
Оксиды металлов, являющиеся компонентами титанатов, на-
пример одноокись и полутораокись железа, также подвергаются
хлорированию, причем образуются трихлорид железа и хлориды
других сопутствующих титану металлов. Хлорированию подвер-
гается также двуокись кремния, входящая в связанном виде в со-
став титаносиликатов и силикатов пустой породы, в результате
чего получается тетрахлорид кремния.
Титановые шлаки являются лучшим сырьем для хлорирования,
чем титановые рудные концентраты. Во-первых, это связано с мень-
шим содержанием в них оксидов посторонних элементов и, следо-
вательно, с меньшим бесполезным расходом хлора. Во-вторых,
скорость хлорирования титановых шлаков больше скорости хлори-
рования двуокиси титана и титанатов, так как в титановых шла-
ках содержатся низшие оксиды титана — одноокись и полутора-
окись, а иногда и карбоксид титана, которые взаимодействуют
с хлором значительно интенсивней, чем двуокись титана. Эти со-
единения интенсивно хлорируются даже в отсутствие восстано-
вителей.
Технология процесса хлорирования. Химизм процесса образова-
ния тетрахлорида титана при хлорировании смеси двуокиси
титана с углеродом описан в гл. V. В составе газовой смеси, полу-
чающейся при действии хлора на смесь двуокиси титана и угле-
рода, находятся, кроме тетрахлорида титана, окись, двуокись и
хлорокись углерода, Для определения парциальных давлений ко-
торых используются следующие уравнения реакций:
TiO2 (т) + 4С12 (г) + 2С (т) = TiCl4 (г) + 2СОС12 (г)
СОС12 (г) = СО (г) + С12 (г)
2СО (г) = СО2 (г) + С (т)
Этим уравнениям соответствуют три выражения для констант рав-
новесия Кр'.
4 2
„ Pci2 „ Pcoci2 „ Рсо
л 1-------- ; А 2 — ; Аз--------
РТ1С14 ’ Pcoci2 Рсо2 Рш2 Рсо2
а также
2Рт:с14 = Рсос12 + Рсо + 2Рсо2
Суммарное давление газовой смеси:
Р = Pci2 + РТ1СЦ + Рсосц + Рсо + Рсо2
Значения констант равновесия К\, К.2 и К3 реакции хлориро-
вания двуокиси титана хлором в присутствии углерода, вычислен-
ные по приближенной формуле Нернста, приведены в табл. 21,
356
Таблица 21. Средние значения констант равновесия реакции
хлорирования двуокиси титана в присутствии углерода
t, °C Ki /<2 Кз
400' 4,25 - 10“12 23,3 5,38- 10“5
600 3,03- ю-7 0,222 8,30- 10“2
800 3,61 • ю-4 0,011 7,53
1000 4,91 10-2 1,13 • ю-8 160,4
В табл. 22 приведены значения парциальных давлений состав-
ных частей газовой смеси при 400—1000° С и общем давлении
1 атм, определенные графическим путем для Ki, Л'г и Кз-
Таблица 22. Значения парциальных давлений (в атм) составных частей
газовой смеси при хлорировании двуокиси титана в присутствии углерода
' t, °C РС12 РТ|С14 PCOCJ2 рсо РСО2
400 1,38 10-7 0,500 2,3- 10“8 0,0054 0,4346
600 1,47- 10“3 0,455 5,7- 10“7 0,175 0,370
800 7,4' 10-5 0,353 4,9- 10“7 0,600 0,047
1000 1,12- Ю“4 0,335 9,9- 10-8 0,6623 0,0027
Как видно из табл. 21 и 22, с повышением температуры в смеси
газов увеличивается доля окиси углерода; выше 800° С хлориро-
вание двуокиси титана должно протекать преимущественно с обра-
зованием окиси углерода. С этим связано увеличение удельного
расхода углерода и общего объема газов с повышением темпера-
туры хлорирования. Однако на практике при хлорировании равно-
весие обычно не достигается и в связи с этим двуокись углерода
содержится в газах даже при 900° С. Соотношение в смеси газов
между окисью и двуокисью углерода зависит от условий процесса
хлорирования.
Для производства тетрахлорида титана в настоящее время мо-
гут быть использованы три способа: 1) хлорирование окускован-
ной шихты в шахтных печах в неподвижном слое; 2) хлорирова-
ние измельченной шихты в среде солевого расплава; 3) хлориро-
вание измельченной шихты в кипящем слое.
Процесс хлорирования окускованной шихты в неподвижном слое проводят
в шахтных электропечах, имеющих стальной кожух и плотную шамотовую или
динасовую футеровку. Шихту составляют из измельченных титанового сырья
(75—80%) и нефтяного кокса (20—25%). Для брикетирования шихты применяют
сульфитно-целлюлозпый щелок, каменноугольные пек или смолу. Шихту подают
в печь сверху через герметизированное загрузочное отверстие; хлор подают через
фурмы в нижней части печи. Печь обогревают электрическим током, подводимым
через графитовые электроды к угольной насадке, заполняющей нижнюю часть
357
Рис. 62, Схема аппарата
для хлорирования в ки-
пящем слое:
/ — бункер; 2 — сливная
трубка; 3 - распределитель-
ная решетка; 4 — кипящие
слои; 5 —приемник для неле-
тучих продуктов.
TiCI4
печи. Газообразные продукты хлорирования удаляют через трубу в верхней части
печи в систему конденсации; жидкие остатки от хлорирования стекают вниз и
периодически выпускаются из печи.
Процесс хлорирования измельченной шихты в среде солевого расплава про-
водят в специальной вание при температуре 750—800° С. Средой служит рас-
плавленная смесь хлоридов натрия и калия. Сухую измельченную шихту, со-
стоящую из титанового шлака и кокса (или угля), подают в расплав при помощи
сжатого воздуха (или азота). Хлор подают в расплав снизу; он равномерно рас-
пределяется по всему объему ванны. Процесс хло-
рирования проходит весьма интенсивно, и за счет его
экзотермичности поддерживается температура ван-
ны (кроме того, отводится избыточное тепло). Обра-
зующийся тетрахлорид титана в газообразном со-
стоянии, вместе с другими летучими продуктами хло-
рирования, уносится в систему конденсации, а ра-
сплав постепенно загрязняется нелетучими продукта-
ми, в связи с чем его приходится периодически за-
менять новым.
Процесс хлорирования измельченной шихты в
кипящем слое проводят в цилиндрических шахтах,
снабженных распределительными решетками для по-
ступающего хлора; эти решетки образуют в шахте
отдельные камеры для хлорирования в кипящем слое.
Схема аппарата для хлорирования (трехкамерной
шахты) показана на рис. 62. Сухую измельченную
шихту, состоящую из титанового шлака и кокса, по-
дают из бункера 1 в верхнюю камеру, где происхо-
дит частичное хлорирование поступающим снизу хло-
ром. Через сливную трубку 2 шихта пересыпается в
нижележащую камеру. Образующийся газообразный
тетрахлорид титана, вместе с другими летучими про-
дуктами хлорирования, поступает через верхнее от-
верстие в систему конденсации, а непрохлорирован-
ный материал и нелетучие продукты хлорирования
собираются в приемнике 5.
Образовавшийся в процессе хлорирова-
ния газообразный тетрахлорид титана, за-
грязненный примесями, находящимися в
парообразном и аэрозольном состояниях,
поступает сначала в пылеуловительную ка-
меру, охлаждаемую снаружи воздухом.
Здесь происходит осаждение большей час-
ти пыли, механически увлеченной из аппа-
рата для хлорирования, и конденсация из
паров трихлорида железа; последний, перейдя уже в аэрозольное
состояние, также в значительной степени осаждается в пылеулови-
тельной камере. Выходящие из камеры пары тетрахлорида титана
имеют температуру 160—180° С; они еще содержат некоторое ко-
личество пыли, а также паров и аэрозоля трихлорида железа. Эта
паро-газовая смесь поступает в последовательно соединенные кон-
денсаторы, представляющие собой полые скрубберы, орошаемые
холодным тетрахлоридом титана. Здесь происходит конденсация
паров тетрахлорида титана и других хлоридов и окончательное
улавливание пыли и других аэрозолей. Вытекающая из ороситель-
858
„ ных конденсаторов пульпа поступает в герметичные сгустители,
, в которых происходит отделение пыли и нерастворимых в тетра-
хлориде титана хлоридов в виде шлама, а осветленный тетрахло-
- рид титана переводится в сборный бак. Газы, выходящие из оро-
: сительных холодильников, содержат пары тетрахлорида титана,
>. для улавливания которых их пропускают через трубчатые холо-
дильникй, охлаждаемые до —15° С, и после них — через санитар-
ный скруббер, орошаемый известковым молоком. Только после
; этого освобожденные от хлорсодержащих веществ газы выбрасы-
;; ваются в атмосферу.
Очистка тетрахлорида титана. Технический тетрахлорид титана
обычно загрязнен. Содержание примесей зависит от состава ис-
; ходного сырья и условий осуществления процессов хлорирования
г и конденсации. Обычно в техническом тетрахлориде титана раство-
рены хлор, фосген, дихлороксид титана, хлориды и хлороксиды со-
' путствующих титану элементов,— кремния, алюминия, железа, ва-
надия, ниобия и других, органические хлорпроизводные. В неболь-
ших количествах возможно присутствие хлоридов и хлороксидов
серы и фосфора. Помимо растворенных примесей в техническом
! тетрахлориде титана обычно содержатся примеси хлоридов алю-
миния, железа, магния, кальция и других металлов, а также дву-
окиси титана и угля в виде тонкодисперсной взвеси. Окраска тех-
нического тетрахлорида титана зависит от содержания примесей
и может изменяться от светло-желтой до темно-бурой.
От содержащихся примесей как механически взвешенных, так
и растворенных, технический тетрахлорид титана должен быть
освобожден. К тетрахлориду титана, идущему на производство ме-
таллического титана или титановых белил, предъявляются высокие
требования. Так, содержание в нем кремния, ванадия, железа, алю-
миния не должно превышать 0,01% каждого.
Сначала производят очистку от механически взвешенных приме-
сей. Для этой цели применяют фильтрацию через стеклянную
ткань, пористые керамические фильтры, асбестовую набивку, кис-
лотостойкие ткани из искусственного волокна и т. п.
От растворенных примесей тетрахлорид титана освобождают
ректификацией, что возможно благодаря разнице в летучести при-
месей и тетрахлорида титана. К летучести тетрахлорида титана
близка лишь летучесть трихлороксида ванадия, в связи с чем по-
следний отделить от тетрахлорида титана ректификацией довольно
трудно. Для отделения трихлороксида ванадия его восстанавли-
вают (путем введения в смесь медного порошка) до дихлор-
оксида — VOC12, который отличается меньшей летучестью; при
этом восстановлении образуется также в некотором количестве
двуокись ванадия. Медным порошком из возможных примесей вос<
станавливаются до низших хлоридов (также менее летучих) и ди-
хлордиоксид хрома, и тетрахлорид олова. Трихлороксид ванадия
можно восстановить и сероводородом; при введении сероводорода в
тетрахлорид титана, содержащий трихлороксид ванадия, последний
359
переходит в сесквисульфид — V2S3, выпадающий в осадок, ко-
торый может быть легко отфильтрован. Перед ректификацией тех-
нический тетрахлорид титана стараются освободить от растворен-
ного в нем хлорида алюминия, который может весьма агрессивно
действовать на материал ректификационной аппаратуры; для этой
цели к техническому тетрахлориду титана прибавляют рассчитан-
ное количество воды, причем трихлорид алюминия переходит в не-
растворимый хлороксид — А1ОС1, осадок которого отфильтровы-
вают.
Ректификационная очистка тетрахлорида титана основана на различии в тем-
пературах кипения примесей и тетрахлорида титана (135,9° С); температуры ки-
пения смесей тетрахлоридов титана и кремния приведены в Приложении 21.
Ректификацию осуществляют в специальных колоннах из нержавеющей стали с
дырчатыми тарелками; в такой колонне по высоте поддерживается различная
температура, от температуры кипения одного из компонентов в нижней части до
температуры кипения другого — в верхней. Исходную жидкую смесь вводят в
колонну в средней части, а из верхней и нижней частей отводят очищенные,
соответственно, низкокипящий и высококипящий компоненты смеси. Процесс
ректификационной очистки тетрахлорида титана проводят в две стадии. На пер-
вой стадии от тетрахлорида титана отделяют тетрахлорид кремния, поддерживая
в верхней части колонны температуру его кипения (58° С). Остаток, состоящий
из тетрахлорида титана с примесями высококипящих хлоридов и хлороксидов,
направляют во вторую колонну, в которой, поддерживая в верхней части темпе-
ратуру кипения тетрахлорида титана (136° С), отгоняют последний от более вы-
сококипящих примесей. В отгоне собирается чистый тетрахлорид титана, содер-
жащий не больше 0,01% примесей. Потери титана при очистке тетрахлорида со-
ставляют около 5%.
Нашел применение также солевой способ очистки тетрахлорида
титана, основанный на способности хлорида натрия и хлоридов
других щелочных и щелочноземельных металлов образовывать
с растворимыми в тетрахлориде титана трихлоридами алюминия
и железа нерастворимые комплексные соли.
Солевую очистку тетрахлорида титана осуществляют пропусканием его па-
ров, загрязненных парами трихлоридов алюминия и железа, через колонну с на-
садкой из кусков плавленого хлорида натрия или брикетов хлорида натрия с
углистой массой или же через легкоплавкую смесь хлоридов натрия и алюминия
или железа.
Сернокислотная переработка титановых
nun 103,297,301,302,304
руд
Старейшим способом извлечения двуокиси титана из природ-
ных руд является обработка их серной кислотой. Этот способ осно-
ван на том, что природные двуокись титана или титанаты после
обработки серной кислотой переходят в растворимые сульфатосо-
единения титана (IV). При этом другие элементы, входящие в со-
став титановых руд, в частности железо, также могут переходить
в растворимое состояние. Титан отделяют от других металличе-
ских элементов специальными методами очистки растворов. Ис-
ходным материалом для сернокислотной переработки является ти-
тановый концентрат (ильменитовый, реже — сфеновый). Процесс
860
переработки состоит из следующих операций: 1) разложение кон-
центрата серной кислотой; 2) выщелачивание сульфатосоедине-
ний титана из полученного плава; 3) очистка полученного раствора
от соединений железа и других элементов.
Разложение титановых концентратов серной кислотой. Посту-
пающий на сернокислотную переработку титановый концентрат
подвергают тонкому и равномерному измельчению, для чего кон-
центрат предварительно высушивают при сравнительно невысокой
температуре (в барабанной сушилке, обогреваемой дымовыми
газами).
Разложение титанового концентрата серной кислотой производят в реакто-
рах, которые представляют собой стальные цилиндрические баки, имеющие кони-
ческое дно, футерованное кислотоупорными плитками, и крышку. В дно вмонти-
рованы две трубы, одна из которых служит для ввода воздуха, пара и воды,
другая — для выпуска готового раствора. В крышку реактора вмонтированы люк
для загрузки титанового концентрата, штуцер для ввода кислоты и вентиляцион-
ная труба, соединяющая реактор с атмосферой.
Процесс разложения проводят следующим образом. В реактор через штуцер
вводят 92%-ную серную кислоту (купоросное масло), через трубу — сжатый воз-
дух и при постоянном перемешивании загру?кают через люк титановый концен-
трат. Затем, вводя через трубу пар под давлением 3—4 атм, в течение 20—30 мин
реакционную массу нагревают до 125—135° С, после чего продолжают перемеши-
вание массы сжатым воздухом. При этом начинается реакция, которая протекает
очень бурно, с выделением большого количества теплоты, образованием паров и
сильным вспениванием; температура повышается до 180—200° С, и объем реак-
ционной массы увеличивается. По окончании бурной реакции масса, которая
представляет собой уже смесь сульфатотитанатов железа, оседает и в течение
нескольких минут может затвердеть; для того чтобы при этом она получилась
пористой, через массу продувают сильную струю воздуха. Затем массу охла-
ждают, и в течение 2—3 ч она «вызревает». За это время происходит превра-
щение в сульфатотитанат железа остававшейся еще неразложенной массы
(примерно 10%) концентрата. В результате процесса в реакторе остается плав,
который в основном состоит из сульфатотитанатов железа с примесями иеразло-
женного титанового концентрата и избыточной серной кислоты.
Кроме описанного периодического способа разложения титанового концентра-
та, существует еще и непрерывный способ. Аппарат для непрерывного разложе-
ния титанового концентрата серной кислотой представляет собой обогреваемый
смесительный шнек. Титановый концентрат и серная кислота непрерывно посту-
пают с одного конца шнека, а готовая масса сульфатотитанатов железа выходит
с другого конца.
Выщелачивание сульфатосоединений титана из плава. Полу-
ченный в реакторе плав после охлаждения его до 90—110° С вы-
щелачивают горячей водой. Для этой цели через трубу, вмонти-
рованную в коническое дно бака, вводят воду, которая проходит
через толшу плава. Затем воду вводят через трубу, вмонтирован-
ную в крышку бака, при интенсивном перемешивании массы сжа-
тым воздухом. Температуру массы во время выщелачивания необ-
ходимо поддерживать в пределах 55—65° С. При более низкой
температуре выщелачивание замедляется. Обычно операция вы-
щелачивания продолжается от трех до четырех часов.
При выщелачивании плава водой указанной температуры про-
исходят реакции неполного гидролиза сульфатотитанатов железа
с образованием сульфатотитановых кислот и сульфатов железа»
361
эти реакции могут протекать, например, по уравнениям:
Fe[T i (SO4)3j + Н2О = H2[TiO(SO4)2] + FeSO4
Fe2[Ti(SO4)3]3 + 3H2O = 3H2[TiO(SO4)2] + Fe2(SO4)3
Если температура раствора будет выше 65° С, то гидролиз может
идти еще дальше, т. е. ему может подвергнуться и образовав-
шаяся в растворе дисульфатометатитановая кислота, а также и
сульфат железа (III).
Таким образом, в результате выщелачивания получаются рас-
творы, содержащие сульфатотитановые кислоты, сульфаты желе-
за (II) и железа (III), а также свободную серную кислоту.
Очистка сульфато-титановых растворов от соединений железа.
Поскольку полученные сульфато-титановые растворы содержат
соединения железа, они не могут быть непосредственно использо-
ваны для получения титанового пигмента. Для успешного выделе-
ния титанового пигмента необходимо, с одной стороны, уменьшить
общее содержание соединений железа в растворе, а с дру-
гой— полностью исключить из раствора соединения железа(III),
так как именно они при гидролизе увлекаются осадком метати-
тановой кислоты и сильно загрязняют получаемый титановый
пигмент. Между тем, если находящийся в растворе сульфат желе-
за (II) может быть в значительной мере удален из него при охлаж-
дении вследствие кристаллизации в виде железного купороса, то
сульфат железа(III) удалить таким путем из раствора невоз-
можно. В связи с этим находящийся в растворе после выщелачи-
вания сульфат железа (III) восстанавливают до сульфата желе-
за (II) с использованием в качестве восстановителя металличе-
ского железа.
Для восстановления железа (III) в чан с раствором после выщелачивания
вводят в специальной корзине из нержавеющей стали железо с сильно развитой
поверхностью, например в виде стружки или обрезков тонкого листа (скрапа).
Количество железа, необходимого для восстановления, зависит от содержания
железа(Ш) в растворе. Восстановление продолжается 2 ч; для ускорения про-
цесса раствор нагревают до 50° С и перемешивают воздухом. Процесс контро-
лируют пробой с раствором роданида и заканчивают его, когда проба уже не
дает красного окрашивания. При этом некоторое количество титана (IV) перехо-
дит в титан(III); наличие в растворе некоторого количества титана (III) (около
3—5 г/л) устраняет возможность образования в растворе железа (III) при всех
дальнейших операциях, вплоть до окончания гидролиза.
После восстановления железа раствор очищают от примесей, находящихся
во взвешенном состоянии (шлама), состоящих из кремниевой кислоты и нераз-
ложенной руды. Примеси, находящиеся в грубодисперсном состоянии, легко от-
стаиваются; для осаждения тонкодисперсных примесей применяют специальные
коагуляторы — сульфид натрия и медный купорос. Образующийся сульфид меди
коагулирует тонкодисперсную взвесь. Иногда для коагуляции используют суль-
фид сурьмы. После коагуляции взвешенных примесей их отделяют от раствора
путем отстаивания и фильтрации.
Следующей операцией является выделение из раствора сульфата железа(П).
Для этого очищенный раствор, имеющий температуру около 50° С, заливают в
специальные кристаллизаторы, в которых его охлаждают до 10—5° С. При этом
из раствора выделяется сульфат железа (II) в виде семиводных кристаллов (т. е.
железного купороса). Выделившиеся кристаллы легко отделяются от раствора
362
Центрифугированием Или вакуум-фильтрацией. В связи с тем что с кристаллами
железного купороса из раствора выводится вода, содержание ТЮ2 в растворе
увеличивается со НО—120 до 140—160 г!л. Отделенные кристаллы железного
купороса промывают холодной водой и высушивают, а сульфато-титановый рас-
твор направляют на гидролиз для получения метатитановой кислоты.
Разложение сфена серной кислотой. Разложение сфенового
концентрата серной кислотой проводят в деревянных баках, выло-
женных изнутри свинцовыми листами и оборудованных освинцо-
ванными мешалками и свинцовыми змеевиками для поддержа-
ния необходимой температуры. В бак заливают воду и загружают
серную кислоту, так чтобы смесь содержала 50% H2SO4. Смесь
нагревают до 100° С и загружают в нее размолотый сфеновый кон-
центрат. Процесс разложения при температуре 110° С длится 32—
36 ч.
В результате разложения сфена серной кислотой получаются
трисульфатометатитанат кальция и ортокремниевая кислота:
CaTiSiOj + 3H2SO4 = Ca[Ti(SO4)3] + H4SiO4 + H2O
По окончании процесса в бак доливают воду. При этом происходит непол-
ный гидролиз трисульфатометатитаната кальция с образованием сульфатотитано-
вой кислоты и сульфата кальция:
Са[Ti(SO4)3J + Н2О - H2[TiO(SO4)2] + CaSO.,
Полученную суспензию направляют на фильтрацию, которую производят на нутч-
фильтрах; фильтрующим материалом служат песок и гравий. Отфильтрованный
сульфато-титановый раствор перекачивают в мерник, а содержащуюся в нем при-
месь сульфата железа (III) восстанавливают до сульфата железа (II) добавле-
нием гидросульфита натрия. Содержание сульфата железа(II) в растворе незна-
ч’ительно, и в дальнейшем его из раствора не выделяют. Таким образом, при
разложении сфенового концентрата серной кислотой в качестве побочного про-
дукта, вместо железного купороса, получают сульфат кальция.
ПРОИЗВОДСТВО ТИТАНА ТЕРМИЧЕСКИМ
ВОССТАНОВЛЕНИЕМ
Пирометаллургия титана связана с рядом очень существенных
затруднений, вызываемых необычайно большой химической актив-
ностью элементарного титана при высоких температурах. Это ска-
зывается в том, что титан очень трудно восстановить из его соеди-
нений, в частности из оксидов. Восстановленный же титан очень
легко поглощает не только кислород, но и азот с образованием
оксидов и нитридов, легкорастворимых в элементарном титане и
ухудшающих его потребительские качества. Титан очень чувстви-
телен к углероду, а также к элементам, входящим обычно в состав
конструкционных материалов пирометаллургической аппаратуры.
Все эти обстоятельства вызывают необходимость тщательно вы-
бирать исходные материалы и восстановители. При этом надо учи-
тывать, что наименее пригодны как исходные материалы оксиды
титана, а восстановители — углерод (а также водород). Кроме того,
необходимо изолировать процесс восстановления от атмосфер-
ного воздуха, что может быть достигнуто только тщательной
363
герметизацией аппаратуры и проведением процесса в вакууме или
в среде благородного газа. Наконец, следует специально подбирать
материал для производственной аппаратуры. В связи с этими об-
стоятельствами в настоящее время из различных методов техниче-
ского получения элементарного титана в промышленности предпо-
читают металлотермическое восстановление галидов титана, преи-
мущественно его тетрахлорида.
Восстановление тетрахлорида
титана 19>20,297 >301.302’ 317—322,368
Тетрахлорид титана в настоящее время является основным ис-
ходным материалом для промышленного производства металличе-
ского титана. В качестве восстановителей титана из его тетрахло-
рида применяют такие металлы, которые, будучи с одной стороны
весьма активными, с другой — не загрязняли бы получающийся
титан. Такими являются щелочные и щелочноземельные металлы,
которые, как известно, не образуют с титаном ни твердых раство-
ров, ни соединений. Из щелочных и щелочноземельных металлов
практическое значение как восстановители тетрахлорида титана
имеют магний и натрий. В соответствии с этим были разработаны
и внедрены в промышленность магние- и натриетермические спо-
собы получения металлического титана.
Магниетермический способ. В основе магниетермического спо-
соба производства металлического титана лежит реакция между
газообразным тетрахлоридом титана и жидким магнием (см. гл. V).
В производственных условиях магниетермический способ полу-
чения титана осуществляется в герметичных реакторах, изготов-
ленных из мягкой стали. В реактор загружают чистый магний,
после чего из реактора откачивают воздух и заполняют его арго-
ном или гелием и создают давление несколько больше атмосфер-
ного. Затем реактор нагревают до расплавления всего магния,
после чего из напорного бака в него с регулируемой скоростью
вводят тетрахлорид титана, который, равномерно распределяясь
в массе магния, испаряется и в газообразном состоянии восстанав-
ливается жидким магнием до металлического титана. Последний
в виде губки тонет в слое образовавшегося жидкого хлорида маг-
ния. Поскольку реакция очень экзотермична, выделяющейся теп-
лоты вполне достаточно для поддержания хлорида магния в рас-
плавленном состоянии (^пл = 714°С).
Еще не вступивший в реакцию магний должен был бы в
жидком состоянии всплывать на поверхность расплава хлорида маг-
ния; при этом поверхность жидкого магния должна быть открыта
для соприкосновения с газоообразным тетрахлоридом титана и вос-
становление последнего могло бы беспрепятственно продолжаться.
В действительности, однако, процесс осложняется тем, что непро-
реагировавший еще жидкий магний впитывается образовавшейся
титановой губкой и увлекается ею на дно реактора. При доста-
364
точном накоплении расплава хлорида магния непрореагировавший
жидкий магний, таким образом, изолируется от газообразного тет-
рахлорида титана, и скорость процесса восстановления умень-
шается. Для того чтобы этого избежать, накапливающийся
жидкий хлорид магния периодически выпускают, отчего поверх-
ность губки, поглотившей жидкий магний, обнажается, рабочий
объем реактора становится больше, благодаря чему скорость про-
цесса восстановления увеличивается. Для поддержания равномер-
ной скорости процесса восстановления магний целесообразно за-
гружать в реактор не сразу, а догружать его периодически, по
мере израсходования. Это способствует также образованию более
однородной титановой губки.
Температура процесса поддерживается в пределах 800—900°С..
Она регулируется скоростью подачи тетрахлорида титана в реак-
тор и, если необходимо, внешним обогревом. Снижение темпера-
туры нежелательно из-за опасности затвердевания расплава хло-
рида магния. Повышение же температуры недопустимо из-за воз-
можности сплавления при этом титана с железом, составляющим
основу материала стенок реактора. При температуре выше 900° С
может идти также восстановление тетрахлорида титана железом,
что может повести к привариванию титановой губки к стенкам
реактора, загрязнению титановой губки железом и быстрому вы-
ходу реактора из строя.
Продуктами магниетермического процесса восстановления тет-
рахлорида титана являются, таким образом, титановая губка и
шлак—хлорид магния. Последний используется для получения из
него (путем электролиза расплава) магния и хлора, возвращав-
мых на производство тетрахлорида титана и его восстановление.
Титановая губка представляет собой спекшуюся Массу, содер-
жащую 55—65% титана, 20—30% хлорида магния и 10—20% ме-
таллического магния. Эта губка должна быть подвергнута очи-
стке. Простой способ очистки заключается в том, что губку дро-
бят, обрабатывают разбавленной соляной кислотой, промывают
водой и сушат. Однако в обработанной таким образом губке
титан загрязнен продуктами его окисления и водородом. Другой,
более сложный, способ сводится к тому, что губку нагревают в глу-
боком вакууме до 900° С; при этой температуре магний и его
хлорид, будучи сравнительно летучими, легко испаряются. Рафини-
рованная таким способом губка содержит следующие примеси:
0,13% Fe; 0,1 % С; 0,08% Mg; 0,07% Cl; 0,05% О; 0,03% Si; 0,002% N
и 0,0016% И.
Натриетермический способ. Восстановление тетрахлорида ти-
тана натрием проходит более эффективно и его можно осуще-
ствить при более низких температурах. Натриетермический про-
цесс можно проводить при трех температурных вариантах:
1) ниже 800° С, когда в результате реакции между жидким нат-
рием и газообразным тетрахлоридом титана образуется масса из
твердых титана и хлорида натрия; 2) в интервале от 800 до 880° С,
365
когда наряду с титаном образуется жидкий хлорид натрия; 3) вы-
ше 880° С, когда реакция протекает уже с парами натрия, т. е. це-
ликом в газовой фазе. На практике осуществляют обычно второй
вариант.
Процесс проводят в реакторах из нержавеющей стали. Из ре-
актора эвакуируют воздух, заполняют реактор аргоном, нагревают
до 700° С и подают из мерных баков одновременно расплавленный
натрий и тетрахлорид титана в стехиометрическом соотношении.
Температуру в дальнейшем поддерживают за счет экзотермично-
сти процесса на уровне 850° С.
Вначале тетрахлорид титана восстанавливается парами натрия
в газовой фазе, причем образуется тонкодисперсный металличе-
ский титан, который, в свою очередь, реагирует с тетрахлоридом
с образованием дихлорида и трихлорида титана. Эти низшие хло-
риды титана растворяются в расплавленном хлориде натрия и
в растворе подвергаются восстановлению жидким натрием, причем
титан образуется уже в виде кристалликов, которые оседают на
дно реактора. В конце процесса, чтобы добиться укрупнения тон-
кодисперсного титана и полноты восстановления дихлорида и три-
хлорида, температуру реактора повышают до 950° С.
В последнее время разработан двухстадийный натриетермиче-
ский процесс. Первая стадия — восстановление до образования эв-
тектического расплава NaTiClg + NaCl (^л = 605°С). Вторая ста-
дия— восстановление титана из NaTiCl3 в расплаве с выделением
чистых крупнокристаллических дендритов.
Восстановление других галидов
титана 297, зо1,302
Восстановление тетрабромида титана водородом. Тетрабромид
титана сравнительно легко восстанавливается водородом при вы-
сокой температуре, причем получается очень чистый металличе-
ский титан. Основанный на этой реакции способ получения титана
осуществлялся в Германии во время второй мировой войны, од-
нако широкого промышленного использования не нашел.
Процесс получения титана заключается в следующем. Через
расплавленный тетрабромид титана, находящийся в специальном
испарителе, продувают чистый водород. Образовавшуюся смесь
водорода с парами тетрабромида титана направляют в кварцевую
трубу, по оси которой натянута вольфрамовая проволока, нагре-
ваемая электрическим током до 1200—1400° С. На вольфрамовой
проволоке осаждается совершенно чистый титан:
TiBr4 + 2Н2 = Ti + 4НВг
Из отходящего бромоводорода может быть регенерирован бром.
Недостатками этого способа являются большой расход чистого
водорода и трудность регенерации брома.
366
, Термическая диссоциация тетраиодида титана. Тетраиодид ти-
тана способен при высокой температуре разлагаться, что и исполь-
зуется на практике для рафинирования титана.
Схема процесса так называемого иодидного рафинирования
титана представляется таким образом:
' , , 100—200° О „ . , , 1300—1500° о
Ti (черновой) + 212 (пар) --> Т114 (пар) -----
—>- Ti (чистый) + 212 (газ)
в
7
Сущность иодидного рафинирования заключается в том, что
образующийся при взаимодействии иода с черновым титаном тет-
раиодид значительно более летуч, чем большинство примесей к
титану (в том числе и их иодиды). Газооб-
разный тетраиодид титана при высокой тем-
пературе, соприкасаясь с раскаленной ме-
таллической (титановой или вольфрамовой)
нитью полностью разлагается на титан
и иод. Титан в чистом и компактном виде
осаждается, а иод снова используется для
взаимодействия с черновым титаном. Та-
ким образом, титан очищается от большин-
ства примесей, в том числе от кислорода и
азота; последнее объясняется тем, что окси-
ды и нитриды титана не реагируют с иодом
при сравнительно низкой температуре об-
разования тетраиодида.
' Процесс иодидного рафинирования ти-
тана в промышленных условиях осуществ-
ляют в металлических аппаратах. Схема
одного из таких аппаратов представлена на
рис. 63. Черновой титан располагают в коль-
цевом пространстве 3 между стенкой аппа-
рата и сетчатым молибденовым экраном 4.
Аппарат закрывают крышкой, на которой
имеются вводы для питания электриче-
ским током титановой нити 7, натянутой в
рабочем пространстве аппарата. Аппарат
эвакуируют и нагревают до 200° С. Затем
в аппарат вводят иод в запаянной ампуле 2,
которую разбивают. После этого электриче-
ским током нагревают титановую нить до
1400° С; на нити происходит диссоциация
тетраиодида и осаждение металлического
титана, а освободившийся иод проникает обратно через экран и
взаимодействует с черновым титаном. Процесс продолжается до
полного израсходования чернового титана или до такого утолще-
ния титановой проволоки, что уже затрудняется нагревание ее
до нужной температуры, Рафинированный титан получается, в
Рис. 63. Схема аппарата
для иодидного рафини-
рования титана:
— кран; 2 — ампула с иодом;
£ — кольцевое пространство,
заполняемое черновым тита-
ном; 4 — сетчатый экран;
$ — груз; 0 —изолятор; 7 —ти-
тановая нить; 8 — вольфрамо-
вый ввод.
867
зависимости от режима процесса, в виде плотных прутков или
крупнокристаллических отложений.
Общее содержание примесей в рафинированном титане не пре-
вышает 0,1%.
Представляет интерес способ иодидного рафинирования сплава, получаемого
алюминотермическим восстановлением двуокиси титана. Такой сплав содержит
70% Ti и 10% А1. Его обрабатывают раствором иода в сероуглероде (кипячение
с обратным холодильником), причем образующиеся тетраиодид титана и три-
иодид алюминия переходят в раствор. Раствор отделяют от примесей оксидов
титана и алюминия, прибавляют к нему иодид калия и отгоняют от него серо-
углерод. При последующем нагревании остатка из него отгоняется тетраиодид
титана, а иодиды алюминия и калия соединяются, образуя нелетучий тетраиодо-
алюминат калия. Отогнанный тетраиодид титана подвергают термической диссо-
циации и получают чистый титан (содержание алюминия не больше 0,01%). Из
оставшегося тетраиодоалюмината калия иод легко регенерируется воздухом при
температуре красного каления.
Восстановление двуокиси
19, 20, 297, 301, 302, 317
Несмотря па трудность восстановления двуокиси титана, ее
все-таки можно использовать для производства металлического
титана. Для восстановления двуокиси титана могут применяться
лишь самые активные восстановители, из которых практическое
значение имеют лишь кальций и его гидрид. Однако при восстано-
влении двуокиси титана гидридом кальция получается гидрид ти-
тана, а не свободный металл.
Кальциетермический способ. Процесс восстановления двуокиси
титана кальцием до металла связан с рядом трудностей. Выделяю-
щейся при реакции теплоты недостаточно для ее самопроизволь-
ного протекания, в связи с чем необходим подогрев извне. Для
обеспечения достаточно полного протекания реакции необходимо
применять большой избыток восстановителя (25—50%). Кальций
должен быть достаточно чист и его необходимо тщательно предо-
хранять от соприкосновения с воздухом.
Процесс восстановления ведут в герметичных реакторах из
жаростойкой стали в атмосфере аргона при температуре 1000—
1100° С. Исходные материалы загружают в реактор в брикетиро-
ванном виде, причем к двуокиси титана и кальцию (в виде струж-
ки или мелких кусочков) добавляют еще хлорид кальция, что
способствует укрупнению кристаллов образующегося титана. По
окончании процесса охлажденную реакционную массу измельчают,
промывают сначала большим избытком воды, затем разбавленной
кислотой, снова водой и сушат в вакууме.
Порошкообразный продукт содержит около 99% Ti. В связи
с повышенным содержанием кислорода (0,2—0,4%) кальциетер-
мический титан, полученный этим способом, по пластичности усту-
пает полученному магниетермическим способом.
Гидридно-кальциевый способ. Процесс восстановления двуокиси
титана гидридом кальция проводят в реакторах из жаростойкой
368
стали. В реактор загружают брикетированную шихту из исходных
материалов, эвакуируют и заполняют сухим водородом. После
этого реакционную смесь нагревают до 900—1100° С. Полученную
реакционную массу, состоящую из гидрида титана, окиси кальция
и избытка гидрида кальция (а также металлического кальция),
промывают водой, разбавленной кислотой, снова водой и сушат.
Полученный порошок гидрида титана при спекании превращается
в металлический титан, который отличается тем, что практически
не содержит кислорода.
ЭЛЕКТРОМЕТАЛЛУРГИЯ ТИТАНА
Значительные трудности при получении металлического титана
методом термического восстановления заставили искать другие
спосцбы, в частности электролитические. Попытки получить метал-
лический титан электролизом растворов титановых соединений в
воде или в органических веществах не приводили к хорошим ре-
зультатам. В связи с электрохимическими особенностями титана
оказалось необходимым изыскивать особые условия электролити-
ческого восстановления титана из его соединений.
Основы процесса электролитического
получения титана 20>297-323-326
Процесс электролитического выделения титана характери-
зуется рядом особенностей, которые в основном определяются
своеобразием химической природы титана. В связи с высокой тем-
пературой плавления титана его невозможно получить в жидком
состоянии. В связи с большой электрохимической активностью ти-
тана его при электролизе водных растворов соединений невоз-
можно получить в виде плотных кристаллических образований.
Из значений стандартных электродных потенциалов титана
в водных растворах следует, что выделить титай путем электро-
лиза водных растворов его соединений, подобно алюминию, невоз-
можно.
В результате многочисленных исследований были получены ве-
личины напряжения разложения хлоридов титана. Ниже приве-
дены величины стандартных потенциалов титана в хлоридах и по-
тенциалов окислительно-восстановительных реакций, полученных
на основании измерений и термодинамических расчетов; потен-
циал хлорного электрода условно принят равным нулю:
Процесс . . Т1/ТР+ Ti3+/Ti4+ Ti2+/Ti4+
ф°, в ... -1,987 + 3,84-10~4 Г -1,473 + 5,86- 10“5 Т - 1,592 + 2,85 • 10~4 Т
Процесс . . Ti2+/Ti3+ Ti/Ti3+ Ti/Ti2+
(р°, в ... -2,710+ 1,7 • 10“6 Т -2,158 + 3,16- Ю“4 Т -2,382 + 4,83 • 10“4 Г
369
Значения электродвижущей силы разложения хлоридов титана
и их окисления-восстановления при 800° С следующие:
Т1С13 ± е~ = TiCl2 + -1 С12; £=1,34 в
TiCl3 ±3e-=Ti + 1-i Cl2j £=1,69 в
TiCl2 ± 2e“ = Ti + Cl2; £=1,80 в
В связи с тем что в соединениях титана окислительное число
его может быть + 2, + 3 и + 4, при электролизе без полного диа-
фрагмирования на аноде может начаться процесс окисления ионов
Ti2+ и Ti3+, а на катоде — процесс неполного восстановления ионов
Ti3+. В связи с этим при электролизе хлоридов титана должны
приниматься меры, обусловливающие выделение на катоде только
металлического титана и исключающие доступ ионов Т12+ и Ti3+
к аноду. Следствием выделения на катоде соединений титана(П)
является не только бесполезное затрачивание электрической энер-
гии и титансодержащего сырья, но и, что более существенно, за-
грязнение продукционного металлического титана одноокисью или
другими соединениями титана(II). Окисление же ионов Ti2+ и Ti34
на аноде также уменьшает степень использования электрической
энергии и титансодержащего сырья.
Во многих расплавленных солях-галидах элементарный титан
растворяется с образованием соответствующих двойных субгали-
дов и дигалидов титана. Это растворение происходит более интен-
сивно в присутствии кислорода. Так, растворимость титана в хло-
риде натрия в присутствии кислорода может достигать 6%. Од-
нако растворение титана в расплавленных солях пресекается ка-
тодной поляризацией.
При электролизе элементарный титан выделяется в виде губки
или порошка с сильно развитой поверхностью. В таком состоянии
титан при температуре выше 300°С способен интенсивно реагиро-
вать с кислородом, азотом и водой, а при более высокой темпера-
туре титан может взаимодействовать и с материалом электролити-
ческой ванны. Все эти обстоятельства требуют принятия специаль-
ных мер для предотвращения загрязнения титана.
Особенностью процесса электролитического получения титана
является малая скорость растворения соединений титана (IV),
имеющих ковалентные химические связи, в хлоридных расплавах.
Электролиз оксидов титана 20’297 327
Из оксидов титана в качестве исходного материала для получе-
ния металлического титана электролизом наибольший интерес пред-
ставляет двуокись титана.
Электролиз двуокиси титана. В связи с тем что температура
плавления двуокиси титана очень высока, для осуществления ее
370
'электролиза необходимо подобрать подходящий растворитель. Пер-
воначально в качестве такового использовали, по аналогии с окисью
-алюминия, расплавленный криолит. При электролизе раствора дву-
окиси титана в расплавленном криолите выделяется некоторое ко-
личество элементарного титана, однако его не удается отделить
'от алюминия и криолита.
Затем в качестве растворителя двуокиси титана был предложен
"расплавленный хлорид кальция. Однако при электролизе распла-
. вленных смесей двуокиси титана с хлоридом кальция не получается
^хороших результатов: катодные осадки состоят главным образом
(уиз низших оксидов титана и содержат не более 89% Ti. Введение
::в расплав хлорида натрия не улучшает результатов электролиза,
f Позднее в качестве составных частей электролита были исполь-
тзованы фосфаты, бораты, фториды, а также смеси этих солей схло-
s ридами и друг с другом. Пытались также использовать для рас-
творения двуокиси титана расплавленные гексафторотитанаты
р; натрия и калия. Однако все эти 'попытки изменения состава элек-
?- тролита не привели к получению достаточно чистого металличе-
ского титана. Результаты улучшались при проведении электролиза
i в атмосфере благородного газа.
Электролиз одноокиси титана. Для электролитического разло-
жения одноокиси титана требуется меньше электроэнергии, чем
для разложения двуокиси. Однако это обстоятельство не имеет су-
щественного значения, так как в связи со столь же высокой темпе-
ратурой плавления одноокиси титана электролизу можно подвер-
гать лишь довольно разбавленные растворы ее в расплавленных
солях.
Разработан процесс электролиза раствора одноокиси титана в хлоридно-
кальциевом расплаве. Оптимальная концентрация одноокиси титана в расплаве
4—5%. Электролиз ведется при температуре 900° С, напряжении от 4 до 8 в и
плотности тока 3 а/слг2. Механизм электролиза раствора одноокиси титана в рас-
плавленном хлориде кальция еще недостаточно ясен. Получаемый титан не отли-
чается высокой чистотой. Предполагают, что при электролизе данного расплава
сначала происходит выделение элементарного кальция, который затем реагирует
с растворенной одноокисью титана по уравнению:
TiO + Са = Ti + СаО
Лучшие результаты получаются при электролитическом выделении титана из
раствора одноокиси титана в расплавленной смеси хлорида натрия и гексафторо-
титаната калия.
Электролиз галидов титана 2°.297. зоцзог, 310,323,324, зге, заэ
Применение в качестве исходных материалов для электролити-
ческого получения титана его галидов более перспективно. Интерес
в этом отношении могут представлять, прежде всего, хлориды ти-
тана, хотя следует иметь в виду, что широко доступный тетрахло-
рид, являясь неионным соединением, не способен диссоциировать
871
в каких-либо расплавах. Однако при восстановлении он может слу-
жить источником получения низших хлоридов, которые уже спо-
собны диссоциировать на ионы. На этом и могут быть основаны
способы электролитического получения титана.
Электролиз продуктов восстановления тетрахлорида титана.
Установлено, что трихлорид титана в расплавах солей частично
диссоциирует на титан(Ш)- и хлорид-ионы. В качестве ионизирую-
щих растворителей могут служить расплавленные эвтектические
смеси хлоридов щелочных и щелочноземельных металлов. Интерес-
но, что при растворении трихлорида титана в расплавленной эвтек-
тической смеси хлоридов лития и калия образуется система из двух
жидких фаз, более тяжелая из которых содержит 45, а легкая —
15% трихлорида титана. Дихлорид титана в таких расплавах так-
же, причем в большей степени, подвергается электролитической
диссоциации с образованием титан(II)- и хлорид-ионов. Оба эти
низших хлорида титана можно получить в указанных расплавах
путем электролитического восстановления первоначально вводи-
мого в раствор тетрахлорида титана. Механизм восстановления
тетрахлорида титана может быть, в зависимости от условий элек-
тролиза, двояким: либо непосредственное катодное восстановление:
TiCl4 + e- = TiCl3 +Cl-
либо выделение на катоде щелочного металла, восстанавливающего
затем тетрахлорид титана:
TiCl4 + Na = TiCl3 + NaCl
Восстановление и в первом, и во втором случае может идти и даль-
ше— до дихлорида титана.
На практике для получения металлического титана используется
метод электролиза продуктов восстановления тетрахлорида титана
с нерастворимым графитовым анодом. Так как тетрахлорид титана
очень мало растворим в расплавленных хлоридах, в процессе элек-
тролиза его непрерывно подают в электролит, где он и расходуется.
Процесс ведут в электролизерах, представляющих собой цилиндри-
ческие кожухи из жаропрочной стали, в которые вделана цилин-
дрическая кладка из графитовых блоков, имеющая ложное дно;
эта кладка служит анодом, а металлический катод расположен
по оси цилиндра. Электролизер герметизируется и заполняется
аргоном.
Основой электролита является в настоящее время смесь 50%
хлорида натрия, 30% хлорида калия и 20% фторида натрия. Про-
цесс проводится при температуре 700° С. Вводимый в электролит
тетрахлорид титана восстанавливается на катоде до низших хлори-
дов, которые диффундируют в электролит. Одновременно на катоде
происходит восстановление титан(III)- и титан(II)- ионов до ме-
талла:
Ti3+ + Зе" = Ti; Ti2+ + 2е~ = Ti
372
На аноде хлорид-ионы окисляются до элементарного хлора. На-
чальная плотность тока па катоде составляет 8 а1см2. При повы-
шенной плотности тока восстановление тетрахлорида титана про-
исходит преимущественно выделяющимся на катоде щелочным
металлом или его суб-ионом, например NaJ:
TiC 14 + Na* - TiCl3 + 2Na* + СГ
Процесс электролиза продуктов восстановления тетрахлорида
титана проходит, при благоприятных обстоятельствах, с достаточно
высоким выходом по току. Выделяющийся на катоде металличе-
ский титан содержит некоторое количество углерода, попадающего
в него из графитовых анодов. Недостатком является и то, что ка-
тодный осадок имеет мелкокристаллическую форму, а это затруд-
няет его дальнейшее использование. Причиной этого являются
происходящие, параллельно с выделением на катоде металличе-
ского титана, реакции перезарядки ионов, которые нарушают нор-
мальный рост кристаллов.
Электролиз гексафторотитаната калия. При электролизе рас-
плавленных гексафторотитанатов, элементарный титан, естествен-
но, выделяться не может. Однако элементарный титан выделяется,
если электролизу подвергается смешанный расплав, состоящий из
гексафторотитанатов и хлоридов щелочных металлов. Собственно
электролизу при этом подвергается лишь хлорид щелочного метал-
ла. Разложение же гексафторотитаната происходит в результате
восстановления его выделившимся щелочным металлом. Это вос-
становление проходит в две стадии. Сначала двухзарядный гекса-
фторо-(IV) титанат-ион восстанавливается до трехзарядного гек-
сафторо- (Ш)титанат-иона:
TiFjT + Ме = TiF|~ + Me*
а затем гексафторо-(Ш)титанат-ион восстанавливается щелочным
металлом до элементарного титана:
TiF®“ + ЗМе = Ti + ЗМе* + 6F“
6
Естественно, что на аноде выделяется хлор.
Характерные особенности электролитического выделения тита-
на существенно осложняют данный процесс. При проведении про-
цесса в присутствии воздуха получить элементарный титан вообще
не удается. На катоде выделяется продукт, состоящий в основном
из одноокиси титана. Катодный осадок, состоящий из дендритов
титана, удается получить лишь в инертной атмосфере при 850° С
и плотности тока (катодного) 0,3—1 а!см2.
Электролитическое рафинирование
титана 20,297,301,302’319,328,329
Для получения чистого титана электролитическому рафиниро-
ванию могут быть подвергнуты различные содержащие титан
материалы: бракованная титановая губка, отходы плавки и
373
Рис. 64. Схема аппарата для электро-
литического рафинирования титана:
/ — разгрузочный поддон; 2 — стальной катод;
3 — верхняя камера; 4 — катодный осадок;
5 — перфорированная корзина; 6 — анодный ти-
тан; 7 — электролит.
механической обработки титана, сплавы, полученные металлотер-
мическим восстановлением титановых шлаков, легированные тита-
новые сплавы и т. п.
Электролитическое рафинирование титана проводится в распла-
вленном электролите с растворяемым анодом. В качестве анода
используется загрязненный примесями титан. Электролитом явля-
ется расплав хлорида натрия или его смеси с хлоридом калия, со-
держащий низшие хлориды титана. Процесс электролиза осуще-
ствляется при постоянном содержании хлоридов титана в расплаве
и, таким образом, сводится к переходу анодного титана в расплав
и выделению его на стальном катоде.
Процессы, протекающие при электролитическом рафинировании
титана, обусловлены различием электродных потенциалов титана
и примесей. Основными приме-
сями к рафинируемому титану
являются кислород, азот, угле-
род, кремний, железо, содер-
жащиеся в нем в виде окси-
дов, нитрида, карбида, силици-
да, интерметаллидов; кроме
них могут присутствовать так-
же различные цветные метал-
лы. Все эти примеси являются
электропроводными, но с бо-
лее положительным, чем титан,
электродным потенциалом. На
аноде в первую очередь будет
протекать реакция с наибо-
лее отрицательным потенциа-
лом:
Ti + 2е“ = Ti2+
По мере увеличения поляриза-
ции и плотности тока будет
происходить образование и ти-
тан (III) -ионов. Оксиды титана
с повышением относительного
содержания в их составе выс-
ших оксидов теряют способ-
и накапливаются в анодном
остатке. Нитрид титана частично остается в анодном шламе, ча-
стично разлагается с выделением титан(III)-ионов в раствор и
азота — с анодными газами. Карбид титана также частично оста-
ется в анодном шламе, а частично разлагается с выделением сво-
бодного углерода на поверхность электролита. Силицид титана
разлагается, причем кремний удаляется с анодными газами в виде
тетрахлорида. Железо и более благородные металлы накапли-
ваются в анодном остатке. Алюминий и другие металлы, электрод-
ность растворяться в электролите
374
ные потенциалы которых близки к электродному потенциалу тита-
на, переходят в хлоридный расплав. Если их концентрация достиг-
‘ нет определенного значения, эти металлы будут выделяться на
г. катоде вместе с титаном. Очевидно, что освобождение титана от
примесей этих металлов возможно лишь при повторном рафиниро-
вании.
; Процесс электролитического рафинирования титана проводят
в электролизерах с насыпным анодом. Схема одного из таких
: электролизеров представлена на рис. 64. Электролизер заполняют
? электролитом, который приготовляют путем пропускания паров
тетрахлорида титана через расплавленный хлорид натрия в при-
/ сутствии титановой губки или титанового скрапа. Анодом служит
: подлежащий рафинированию титан, который в форме стружки или
зерен насыпают в перфорированные корзины 5 из нержавеющей
стали. Катодом служит стальной стержень 2. Электролизер гер-
метизируют и заполняют аргоном. Электролиз ведут при темпера-
туре 850° С, напряжении на ванне 8—11 в, плотности анодного
тока до 0,5 а/см2 и начальной плотности катодного тока 0,5—
1,5 ajcM2. По мере прохождения тока катод обрастает осадком
крупнокристаллического титана 4\ после наращивания осадка ка-
тод поднимают в верхнюю камеру 3, подводят под него разгру-
зочный поддон 1 и снимают в него осадок специальным ножом.
Снятый с катода осадок обрабатывают подкисленной дистиллиро-
ванной водой, промывают, сушат в вакууме и подвергают рассеву
по степени дисперсности.
Выход по току составляет около 90%. Расход энергии постоян-
ного тока на 1 кг металла составляет около 50 Мдж; помимо этого
на нагревание электролизера расходуется энергия переменного
тока.
МЕТАЛЛУРГИЯ КОВКОГО ТИТАНА И ЕГО СПЛАВОВ
Металлический титан, получаемый в виде губки или порошка,
не может быть непосредственно использован для технических це-
лей. Для практического применения титан должен быть предвари-
тельно переработан в компактный плотный материал. Это дости-
гается различными методами. Титановая губка перерабатывается
в компактный титан посредством плавки, выполняемой по специ-
альному режиму. Титановый порошок перерабатывается методами
порошковой металлургии: спеканием или же прокаткой в специ-
альной оболочке.
Плавка титановой губки го, го/, зо!, зоа, ззо, зев
Особенности процесса плавки титановой губки, в результате
которого могут быть получены крупные (от 1 до 4 т) слитки титана,
определяются способностью расплавленного титана активно взаи-
модействовать с газами атмосферы и почти со всеми известными
375
огнеупорными материалами. В связи с этим плавку титановой
губки приходится проводить в вакууме или в атмосфере бла-
городных газов (аргона, гелия) и тщательно подбирать материал
для плавильных тиглей. Существуют различные методы плав-
ки титановой губки: дуговой, индукционной. В настоящее время
наиболее распространенным является способ плавки в дуговых
печах.
Огнеупоры для плавки титана. Как уже указывалось, титан при
высокой температуре, особенно в расплавленном состоянии, взаи-
модействует с большинством огнеупорных материалов. В связи
с этим применяемые обычно огнеупорные материалы на силикат-
ной основе совершенно непригодны для плавки титана. При раз-
работке способов промышленного производства титана было уста-
новлено, что огнеупорными материалами при плавке титана мо-
гут служить только плотный графит, рекристаллизованная окись
кальция и двуокись тория. Первоначально плавку титана прово-
дили в графитовых тиглях. Однако при этом наблюдался переход
углерода в состав выплавляемого металла в количестве до 0,8%,
что уже достаточно резко ухудшает его механические свойства.
В связи с этим велись усиленные поиски материалов, пригодных
для использования в титаноплавильных печах, и тщательные ис-
следования их. С этой целью были испытаны главным образом
многочисленные тугоплавкие оксиды, а также некоторые металлы.
Эти испытания показали, что лучшими огнеупорными материа-
лами для плавки титана являются сплав двуокиси циркония с ме-
таллическим титаном (10 атомн. %) и двуокись тория. Однако
применению этих материалов препятствует их дороговизна, а так-
же некоторое загрязнение ими титана.
В настоящее время плавку титана проводят в медном охлаж-
даемом тигле в атмосфере аргона или в вакууме.
Плавка титана в дуговой печи. Для плавки титановой губки
применяются главным образом дуговые печи с расходуемым элек-
тродом. Чаще всего электрод необходимой длины изготовляют вне
печи путем прессования титановой губки (или порошка) на гидрав-
лических прессах в стальных пресс-формах в цилиндрические
брикеты, которые сваривают до нужной длины. Иногда отдельные
брикеты соединяют в расходуемый электрод спеканием при кон-
тактном нагревании в самой дуговой печи.
Приваренный к электрододержателю расходуемый электрод по-
мещают в печь, имеющую длинную медную изложницу, охлаждае-
мую водой. Дуговая печь монтируется в камере с толстыми железо-
бетонными стенами и перекрытиями. Для образования дуги приме-
няют преимущественно постоянный электрический ток, причем ка-
тодом является электрод, а анодом — расплав.
При проведении плавки в вакууме (остаточное давление
0,01 мм рт. ст.) горение дуги обусловливается образованием в про-
странстве между электродом и расплавом ионизированных паров
титана и примеси магния (давление паров 0,1 мм рт. ст.). Длина
376
дуги поддерживается в пределах 3—4 см при напряжении от 27 до
32 в и силе тока 5400 а.
После окончания плавки полученный слиток титана постепенно
охлаждается в течение 2—3 ч.
Качество слитков, получаемых при дуговой плавке, зависит от
технологического режима процесса. Повторная плавка, которая
применяется в настоящее время, улучшает качество слитка. Однако
следует отметить, что структура слитка металлического титана,
полученного методом дуговой плавки, не всегда однородна.
Плавка титана в индукционной печи. Индукционная плавка ти-
тана, которая осуществляется в закрытом тигле из графита, отли-
чается рядом преимуществ. Во-первых, благодаря возможности
перемешивания расплавленного титана в процессе плавки полу-
чается слиток однородного химического состава. Во-вторых,
имеется возможность переплавлять крупные куски титановых от-
ходов.
При проведении индукционной плавки тигель с титановой губ-
кой помещают в кварцевую реторту, па дне которой устанавливают
толстостенную медную изложницу, засыпанную с боков кварцевой
крупкой. В дне графитового тигля имеется отверстие, закрываемое
титановой пробкой. В пространство между стенками индукцион-
ной печи и графитовым тиглем ставят экраны и засыпают корун-
довый порошок. В печи создают разрежение, после чего ее запол-
няют аргоном. При плавке сначала расплавляется находящаяся
в дне тигля титановая пробка, а затем плавятся брикеты из тита-
новой губки, и расплавленный титан перетекает через отверстие
в дне тигля в медную изложницу, где и кристаллизуется. В ре-
зультате индукционной плавки получаются плотные слитки ти-
тана, отличающиеся высоким содержанием углерода (до 0,6%),
что является недостатком.
Переработка титанового порошка 20’297-302’330
Получение титанового порошка. Титановый порошок, перераба-
тываемый способами порошковой металлургии, получают кальцие-
гидридным методом или же путем измельчения титановой губки.
В последнем случае пластичную и, таким образом, трудно измель-
чаемую титановую губку обрабатывают водородом, в результате
чего она превращается в гидрид титана, приобретая при этом хруп-
кость. Эту обработку губки производят в стальном герметично за-
крытом реакторе, в котором губку сначала нагревают в вакууме
до 800° С, затем охлаждают до 400—450° С и только после этого
подают в реактор водород. Последний должен быть совершенно
свободен от кислорода и азота. Вначале поглощение водорода идет
очень бурно с выделением большого количества теплоты. В связи
с этим водород в реактор вводят постепенно или же разбавляют
его на первых порах инертным газом. При достижении содержания
водорода 3—4% получается очень хрупкий материал, который
377
дроблением в шаровых мельницах превращают в порошок с раз-
мерами частиц 50—120 мкм.
Спекание титанового порошка. Титановый порошок подвергают
сначала прессованию, -а затем спеканию при температуре 1000—
1300°С в вакууме (остаточное давление КН мм рт. ст.). При такой,
сравнительно низкой, температуре хорошее спекание обусловлено
отчасти протекающими процессами полиморфного превращения
титана и диссоциации гидрида титана, усиливающими подвижность
атомов. Основная масса водорода при спекании титанового порош-
ка выделяется при температуре до 800° С; в связи с этим темпера-
туру сначала повышают медленно, а уже после выделения водо-
рода — быстрее.
Путем спекания можно также получать однородные титановые
сплавы. С этой целью перед прессованием титановый порошок тща-
тельно перемешивают с порошками легирующих металлов.
Прокатка титанового порошка в оболочке. В этом способе по-
лучения компактного титана совмещаются операции прессования,
спекания и последующей механической обработки давлением. Пре-
имуществом этого способа является возможность обходиться без
создания вакуума. Способ сводится к следующему. Титановым по-
рошком плотно набивают стальной контейнер, герметизируемый
при помощи сварки. Контейнер с порошком нагревают до 900° С
и подвергают при этой температуре прокатке. Стальная оболочка
защищает титановый порошок от действия кислорода и азота и
обеспечивает деформацию и хороший контакт между отдельными
частицами его. Повышение температуры сверх 900° С недопустимо
из-за возможности прободения оболочки и приплавления к ней
титана. По окончании прокатки оболочку легко снимают с прока-
танного титана, так как поверхностный тонкий и хрупкий слой,
титано-железного сплава не препятствует этому.
Технология обработки титана
и его сплавов 19,20’ 33i•332
Механическая обработка. Компактный плотный титан может
быть подвергнут механической обработке как давлением, так и ре-
занием.
Обработка давлением. Титан и его сплавы могут подвергаться
всем известным видам обработки давлением: ковке, прокатке в хо-
лодном и нагретом состояниях, штамповке, обжиму. Наиболее рас-
пространенной операцией обработки титана давлением является
ковка слитков. Ковку титана осуществляют при температуре
не выше 1000° С, а прокатку и прессование — при температуре не
выше 950° С, т. е. на 300 градусов ниже, чем соответствующую об-
работку стали. В связи с этим обработка титана давлением произ-
водится на более мощном оборудовании. В настоящее время успеш-
но применяется теплая и холодная прокатка слитков титана
непосредственно в лист. Применение ленточной (рулонной) холод-
378
ной прокатки листов тоньше 3 мм является более прогрессивным
методом изготовления листов по сравнению с теплой прокаткой;
к тому же она обеспечивает большую производительность и более
высокое качество листов. Листы толще 5 мм изготовляют путем
теплой или горячей прокатки. Рациональным является комбиниро-
ванный способ прокатки листов: теплая прокатка до получения
листов толщиной 2—3 мм, затем холодная прокатка для изгото-
вления листов толщиной 0,5—1,5 мм. Прессование имеет боль-
шое значение при обработке титана и его сплавов. Для прессования
титана и его сплавов применяют матрицы из материалов типа кар-
бидов. Одной из наиболее важных технологических особенностей
прессования титана и его сплавов является предотвращение пря-
мого контакта обрабатываемого металла с матрицей.
Обработка резанием. Поведение титана и его сплавов при
обработке резанием обусловливается значительной химической
активностью, сравнительно малым модулем упругости, малой теп-
лопроводностью и способностью образовывать вязкую ненавиваю-
щуюся стружку. Несмотря на сильную склонность титана к накле-
пу, при обработке резанием титан наклепывается только с поверх-
ности и значительно меньше, чем нержавеющие стали. Это
объясняется исключительным упрочнением титана его третьокисью.
Местный нагрев, возникающий при обработке резанием, является
достаточным для упрочнения при окислении. Вероятно, заметной
диффузии не происходит, упрочненная область ограничивается по-
верхностным слоем, который хотя и очень тонок, но затрудняет
обработку резанием. Для этого вида механической обработки свой-
ства титана особенно неблагоприятны. Форма стружки обусловли-
вает лишь очень малую контактную поверхность между стружкой
и инструментом, в связи с чем на конце инструмента возникают
высокие давления, в то же время перед инструментом не образуется
нароста, который облегчал бы охлаждение, как при обработке дру-
гих металлов. Все это вместе взятое обусловливает взаимодействие
титана с материалом инструмента, в результате чего происходят
сварка и налипание. Тем не менее обработка титана и его сплавов
резанием применяется во многих отраслях промышленности, при
этом учитываются и преодолеваются указанные специфические
трудности. Особенностями процесса резания титана и его сплавов
является применение малых скоростей и образование толстой
стружки. Для охлаждения титана и его сплавов при резании пред-
ложены различные составы смазочно-охлаждающих жидкостей.
Термическая и химическая обработка. Термическая обработка
титана и его сплавов затруднена в связи с очень высокой химиче-
ской активностью титана при высоких температурах. Тем не менее
в особых условиях удается осуществлять отливки из титана.
Лить?^ По литейным свойствам титан является материалом,
вполне пригодным для получения сложных и тонкостенных отли-
вок. Одним из наиболее перспективных является, по-видимому,
применение титанового литья' в судостроении для изготовления
379
деталей, длительно работающих в быстро протекающей морской
воде. Широкое применение отливки из титана могут найти в хими-
ческом машиностроении для изготовления деталей, соприкасаю-
щихся с различными агрессивными средами.
Химико-термическая обработка. Поверхностное упрочнение ти-
тана и его сплавов может быть достигнуто путем химико-термиче-
ской обработки, в частности диффузионным насыщением азотом,
бором, кремнием, металлами.
Азотирование титана достигается нагреванием его в атмо-
сфере аммиака или азота, соответственно, при 870 и 980° С. После
16-часовой обработки достигается максимальное поверхностное
упрочнение титана. Азотирование изделий из титана повышает их
твердость и износостойкость. Однако азотирование в аммиаке
ухудшает такие механические свойства титана, как прочность, пла-
стичность и вязкость, что связано с образованием на поверхности,
наряду с нитридным, также и гидридного слоя.
Борирование титана значительно повышает его твердость
и износостойкость, однако сопровождается также появлением хруп-
кости.
Силицирование титана придает ему большую твердость,
износостойкость и способность сопротивляться газовой коррозии
при высоких температурах.
Жароупорность титана может быть повышена путем диффузион-
ного насыщения его поверхностного слоя металлами, в частности
хромом, молибденом.
Электрохимическая обработка. Электрохимическими способами
может быть осуществлена полировка титана и его сплавов, а также
анодное окисление их. Электролитом при электрохимической поли-
ровке служит 5%-ный раствор хлорной кислоты в уксусном ангид-
риде, а катодом — стальной цилиндр. Полировка осуществляется
периодическим включением тока на 45—60 сек-, плотность тока
0,3 а/см2 при напряжении от 40 до 60 в. За каждый цикл титан рас-
творяется с поверхности на глубину 10—12 мкм.
Анодное окисление проводят при плотности тока 0,01 ajcM2,
Способы соединения. Для титана и его сплавов могут быть
использованы все обычные способы соединения, применяемые для
других металлов, за исключением пайки мягким припоем. Поведе-
ние титана в процессах соединения обусловливается такими его
свойствами, как значительная химическая активность, малая элек-
тро- и теплопроводность и наличие полиморфного превращения.
Сварка плавлением является наиболее широко применяе-
мым способом соединения титана. В связи с тем что титан при
взаимодействии с кислородом, азотом, углеродом, водородом ста-
новится хрупким, газовая сварка исключается. Для титана приме-
нима дуговая сварка в атмосфере инертного газа, например
аргона. В процессе дуговой сварки необходимо тщательно защи-
щать от соприкосновения с кислородом и азотом не только распла-
вленный титан, но и все сильно нагретые участки, в том числе об-
880
ратную сторону шва. Титан при сварке легко течет, и для получе-
ния плотного и ковкого шва препятствий не встречается.
Пайка титана может быть осуществлена только тугоплавкими
> припоями с нагревом изделий известными способами. Наиболее
подходящим припоем для титана является серебро. Кроме чистого
' серебра в качестве припоев применяются также сплавы на о.снове
серебра (с добавками марганца или меди и кадмия) и никеля.
'L В качестве флюсов в последнее время стали применять сложные
составы на основе хлоридов и фторидов щелочных металлов, со-
держащие также хлорид серебра или меди. Состав такого флюса
подбирается так, чтобы обеспечить необходимую температуру пла-
вления и растворимость хлорида благородного металла. При сопри-
косновении расплавленного флюса с элементарным титаном про-
исходит восстановление благородного металла, который, покрывая
. тончайшей пленкой поверхность титана, защищает его от окис-
ления.
ТИТАНОВЫЕ БЕЛИЛА
Двуокись титана широко применяется в качестве белого пиг-
мента. Из всех белых пигментов титановый имеет наибольшие
перспективы для широкого применения вследствие богатой сырье-
вой базы, с одной стороны, и хороших технических качеств — с дру-
гой. Кроме того, титановый пигмент не ядовит.
Производство титанового пигмента
из сульфатов титана юз, ззз-ззв
Основным промышленным методом производства титанового
белого пигмента является гидролиз растворов сульфатотитановых
кислот и прокаливание полученных гидроксидов титана (титано-
вых кислот).
Гидролиз сульфато-титановых растворов. Для производства ти-
танового пигмента используются растворы, полученные в резуль-
тате сернокислотной обработки титановых руд. Эти растворы ха-
рактеризуются содержанием TiO2 и SO3. На гидролиз обычно
поступают растворы, содержащие 150—200 г/л ТЮ2 и соответствен-
но 250—320 г/л SO3, а также 2—3 г/л Tiin. Кроме того, в этих рас-
творах могут содержаться примеси 120—130 г/л сульфатов желе-
за (II), 28—30 г/л алюминия, 20—22 г/л магния, 3—6 г/л мар-
ганца^!).
Гидролиз сульфато-титанового раствора проводят кипячением
его в присутствии зародышей (суспензий). Однако в некоторых
случаях гидролиз осуществляют без участия зародышей; тогда его
проводят в автоклаве под давлением до 10 атм при температуре
до 160° С или же при нормальном давлении, но при сильном раз-
бавлении водой. При гидролизе образуются метатитановая кисло-
та, которая выпадает в осадок, и серная кислота, которая вместе
831
с примесями (сульфатами железа, алюминия, магния и др.) оста-
ется в растворе. Следовательно, при гидролизе сульфато-титано-
вого раствора происходит выделение в осадок нерастворимой мета-
титановой кислоты, почти полностью свободной от всех при-
месей.
В настоящее время зародыши получают двумя способами:
1) путем использования зародышей, изготовленных в отдельном
баке осаждением из сульфато-титанового раствора щелочью, и
2) путем постепенного разбавления водой более концентрирован-
ного сульфато-титанового раствора.
По первому способу к сульфато-титановому раствору указанной
выше концентрации, находящемуся в баке, оборудованном мешал-
кой и змеевиками для нагрева и охлаждения, прибавляют раствор,
содержащий зародыши в количестве 1% (считая на TiO2) от коли-
чества TiO2, содержащегося в растворе, перемешивают в течение
15—20 мин, нагревают до 109° С и кипятят до тех пор, пока вся
титановая кислота не выпадет в осадок. Процесс проходит за
3—4 ч.
По второму способу зародыши получают в самом сульфато-
титановом растворе путем вливания его в горячую воду. Воду в ко-
личестве одной трети от объема сульфато-титанового раствора
помещают в реактор и нагревают до 91° С. Сульфато-титановый
раствор, содержащий 240—260 г/л TiO2 и, соответственно, 390—
420 г/л SO3, нагревают до 94—97° С и вводят в реактор с водой
в течение 16 мин при постоянном перемешивании и поддержании
температуры на уровне 101,5° С. После введения всего сульфато-
титанового раствора температуру смеси повышают до 109° С и ки-
пятят смесь 3 ч, поддерживая постоянным объем раствора, регу-
лярно добавляя воду.
В результате гидролиза образуются микрокристаллы метатита-
новой кислоты размером от 3 до 10 нм. Эти микрокристаллы, опре-
деленным образом ориентируясь, по два-три десятка соединяются
в мицеллы, имеющие пластинчатую форму; длина мицелл от 45
до 90 нм, толщина — 25 нм. Мицеллы, в свою очередь, соединяются
в агрегаты размером 0,5—1 мкм. В связи с очень большой удель-
ной поверхностью мицеллы адсорбируют воду и большие количе-
ства сульфат-ионов, присутствие которых на поверхности мицелл
способствует соединению последних в агрегаты.
В результате процесса гидролиза в метатитановую кислоту,
выпадающую в осадок, переходит около 95—96% титана, содер-
жавшегося в сульфато-титановом растворе.
Обработка осадка метатитановой кислоты. Полученный после
гидролиза осадок метатитановой кислоты отстаивается, после чего
его отфильтровывают на кислотостойкой перхлорвиниловой ткани
в системе из 3—4 барабанных вакуум-фильтров. На первом филь-
тре осадок отделяется от маточного раствора, называемого гидро-
лизной кислотой и содержащего 20% серной кислоты, 15%
382
еульфата железа(II), 6% сульфату магния, 4% сульфата алюми-
ния, 1,5—2,5% моносульфатоортотитановой кислоты и некоторое
количество сульфатов хрома, марганца и других металлов *. Соби-
рающийся, на первом фильтре осадок метатитановой кислоты со-
держит довольно значительную примесь моносульфатометатитано-
вой кислоты (около 10%) и адсорбированного сульфата железа(II).
На остальных фильтрах осадок промывают чистой водой и таким
образом освобождают от примеси соединений железа. Для более
полной очистки осадка от железа его подвергают так называемой
отбелке, заключающейся в обработке осадка серной кислотой
в присутствии восстановителя (цинковой пыли) с последующей
промывкой чистой водой на вакуум-фильтре.
Промытый осадок метатитановой кислоты очень влажен (содер-
жит около 50% воды) и его сушат горячим воздухом. Высушенный
осадок прокаливают.
Прокаливают осадок метатитайовой кислоты для отщепления
воды от метатитановой кислоты и отщепления трехокиси серы и
воды от моносульфатометатитановой кислоты, в результате чего
образуется двуокись титана. Разложение метатитановой кислоты
происходит в интервале температур от 200 до 300° С, а моносуль-
фатометатитановой кислоты — от 500 до 800° С, но полное удаление
трехокиси серы из прокаливаемого материала достигается лишь
при 900° С.
Прокаливание проводят при доступе воздуха и температуре от
850 до 950° С в муфельных или трубчатых печах. Иногда процессы
сушки и прокаливания ведут совместно в одном аппарате. Для
этого применяют длинные трубчатые печи. С одного конца бара-
бана, где температура сравнительно низка, вводят сырую массу;
здесь происходйт испарение воды. Передвигаясь вдоль барабана,
белила постепенно нагреваются и прокаливаются в самой горячей
части печи.
Прокаленный продукт представляет собой почти чистую дву-
окись титана, которую после охлаждения и размола можно при-
менять в качестве пигмента. Прокаленные белила подвергают очень
мелкому размолу в сухом состоянии. Мельницы снабжены обычно
воздушным сепаратором.
Прокаленный продукт часто подвергают ряду дополнительных
операций для удаления из Herq крупных спекшихся частиц и вве-
дения добавок, улучЩающих пигментные свойства. К таким допол-
нительным операциям относятся мокрый помол в присутствии пеп-
тизаторов, гидросепарация, коагуляция и введение добавок, оса-
ждающихся на поверхности частиц двуокиси титана, сушка и по-
вторный сухой размол. Для сухого тонкого размола применяют
роликовые мельницы.
* Важной проблемой, связанной с производством титановых белил, является
утилизация гидролизной кислоты.
383
Производство титанового пигмента
из тетрахлорида титана 103’337’338
В настоящее время в промышленности осваиваются методы
производства титанового белого пигмента из тетрахлорида титана
или путем сжигания его паров в кислороде, или же гидролизом во-
дяным паром. .
Сжигание тетрахлорида титана в кислороде. Как указывалось
(см. гл. V), пары тетрахлорида титана могут реагировать с кисло-
родом:
T1CI4 + Og = TiOg + 2CI2
При определенных условиях (высокая температура, отсутствие
влаги) удается при этой реакции избежать образования хлорокси-
дов титана и других побочных продуктов и получить двуокись ти-
тана только пигментного сорта. На основе этой реакции был раз-
работан процесс промышленного производства титанового пигмента.
Процесс этот сводится к тому, что пары тетрахлорида титана,
полученные в специальном испарителе, смешивают с равным объ-
емом азота и смесь вместе с нагретым воздухом пропускают через
трубку, нагретую снаружи до 1100° С. В трубке происходит ука-
занная выше реакция, и образовавшийся дым, дисперсной фазой
которого является двуокись титана, а дисперсионной средой —
смесь азота и хлора, направляют на разделение фаз. Последнее
может быть осуществлено путем осаждения в пылевой камере,
в электро-или мешочном фильтре. Во избежание спекания частиц
образующейся двуокиси титана и ухудшения при этом ее пигмент-
ных качеств очень важно не допустить осаждения двуокиси на стен-
ках реакционной трубки. Это достигается быстрым пропусканием
горячей реакционной смеси через трубку, для чего предварительно
нагревают поступающие в реакционную смесь газы до температуры
реакции; это ускоряет протекание реакции и дает возможность
быстрее удалить образующуюся двуокись титана из трубки. Время
пребывания частиц двуокиси титана в зоне высоких температур
оказывает решающее влияние на дисперсность образующегося
продукта.
Побочным продуктом процесса производства титанового белого
пигмента является отходящий газ с высоким содержанием хлора.
Гидролиз паров тетрахлорида титана. При взаимодействии па-
ров тетрахлорида титана и воды при температуре 300—400° С про-
исходит гидролиз, продуктами которого являются двуокись титана
и хлороводород:
Т i С14 + 2Н2О = TiO2 + 4НС1
Условием для получения в результате этой реакции двуокиси ти-
тана, свободной от примеси хлороксидов и пригодной для примене-
ния в качестве белого пигмента, является достаточно высокая тем-
пература.
384
' Процесс производства титанового пигмента, разработанный нй
, основе этой реакции, сводится к тому, что пары воды и чистого
'’ тетрахлорида титана раздельно нагревают до 400° С и направляют
в реакционную камеру, где поддерживается та же температура (во
избежание нежелательной низкотемпературной реакции). В камере
происходит указанная выше реакция, в которой как бы совме-
;! щаются операции гидролиза тетрахлорида титана и обезвоживания
образующегося продукта. Получающийся в результате реакции
i дым, дисперсная фаза которого состоит из двуокиси титана, а ди-
? сперсионная среда содержит хлороводород, направляют на разде-
ление фаз. Серьезные затруднения представляет выбор материалов
для аппаратуры, стойких к действию хлороводорода при высокой
' температуре.
Если этот процесс вести при температуре 300° С и ниже, то по-
лучается продукт с довольно сильной желтизной.
Свойства и применение титановых
белил 103,333—335,339
.Состав титановых белил. В качестве белого пигмента двуокись
титана применяется главным образом в смеси с наполнителями,
в качестве которых используют сульфат бария (бланфикс), без-
водный сульфат кальция, силикат магния (тальк). Соответственно
различают титано-бариевые, титано-кальциевые и титано-магние-
вые смешанные пигменты. Иногда к титановому пигменту доба-
вляют цинковые белила.
В смешанных титановых пигментах обычно содержится от 25
до 40% двуокиси титана и от 60 до 75% наполнителя. Смешанные
титановые пигменты получают или путем механического смешива-
ния двуокиси титана с наполнителем, или же путем совместного
гидролиза, при котором частицы наполнителя используются в ка-
честве зародышей.
Механическое смешивание титанового пигмента с наполнителем
производят в сухом или мокром виде. В последнем случае посред-
ством мокрого помола приготовляют пасты титанового пигмента
и наполнителя. Разбавлением водой из паст получают суспензии,
которые смешивают в необходимых соотношениях. Затем дисперс-
ную фазу смешанной суспензии отфильтровывают, сушат и измель-
чают.
При совместном гидролизе в сульфато-титановый раствор вво-
дят пасту наполнителя, например сульфата бария, смесь тщательно
перемешивают и ведут гидролиз (кипячение). На частицы напол-
нителя, которые находятся во взвешенном состоянии, осаждается
метатитановая кислота, причем получается очень тесная и одно-
родная смесь.
Тертые титановые белила, или титановая белая масля-
. ная краска, получаются размешиванием и растиранием сухих
13 Зак, 1128
385
белил (пигмента) с маслом или олифой. При этом получается
однородная масса нужной степени густоты. Различают густотер-
тые краски и краски, готовые к употреблению. Густотертые краски
содержат масла столько, сколько нужно для получения однородной
пасты. Их перед употреблением разбавляют олифой. Готовые кра-
ски достаточно жидки и могут наноситься кистью на окрашивае-
мую поверхность. Густотертые титановые белила содержат 18—22%
масла; готовая к употреблению краска содержит 36—48% масла.
Хорошая масляная краска должна быть вполне однородна. Не
должно быть крупинок и сгустков, и масло не должно отделяться
от пигмента.
Первой операцией при получении тертых титановых белил яв-
ляется грубое смешение пигмента с маслом, необходимое для того,
чтобы получить более легко растирающуюся массу. Эту операцию
проводят при помощи механических мешалок. Определенное коли-
чество титанового пигмента и масла заливают в смеситель и пере-
мешивают. По окончании перемешивания получается однородная,
но грубая масса, которую затем направляют в специальные ма-
шины— краскотерки, где происходит растирание и окончательное
смешение пигмента с маслом.
Свойства титановых белил. По основным показателям титано-
вые белила вполне удовлетворяют требованиям, предъявляемым
вообще ко всяким белилам. Ниже приведены некоторые из этих
показателей для титановых белил.
Кроющая способность, иначе называемая укрывистостью
краски, выражается в способности краски маскировать собствен-
ный цвет поверхности окрашиваемого предмета. Измеряется крою-
щая способность площадью поверхности, которую можно покрыть
до маскировки собственного цвета определенной массой краски.
По величине кроющей способности титановые белила превосходят
другие белые краски, в частности свинцовые белила — в два
раза.
Красящая способность, или интенсивность окраски, за-
ключается в способности краски придавать свой цвет составляемой
смеси красок и окрашиваемым материалам. Измеряется красящая
способность величиной, обратной массе белил, придающей опреде-
ленной массе сажи одинаковый светлый оттенок. По величине кра-
сящей способности титановые белила превосходят свинцовые в два
с половиной раза.
Химическая стойкость титановых белил весьма значи-
тельна. На них не действуют ни кислоты, ни щелочи. Сероводород
также не действует на титановые белила, благодаря чему белила
с течением времени не темнеют. От действия света покраски тита-
новыми белилами также не изменяют цвета.
Плотность титановых белил 3,97 а/слД. Показатель преломления
2,67. Дисперсность, или степень измельчения, титановых белил мо-
жет быть весьма высокой. В связи с этим и со сравнительно малой
плотностью титановые белила образуют с маслом прочные суспен-
386
зии. Но, в отличие от свинцовых белил, титановые белила не обра-
зуют с высыхающими маслами прочных химических соединений
(мыл). В результате красочный слой, содержащий в качестве пиг-
мента титановые белила, через некоторое время после высыхания
начинает при легком механическом воздействии (например, при
проведении рукой) осыпаться с поверхности. Это свойство, назы-
ваемое мелением, устраняется или, хотя бы, ослабляется вве-
дением различных веществ, главным образом цинковых белил.
Необходимость введения примесей вызывается еще тем, что чистые
титановые белила образуют при высыхании мягкую пленку, что
также объясняется неспособностью их образовывать с маслом, на
котором они растираются, прочные системы.
Применение белил. Положительные технические качества тита-
новых белил, устойчивость покраски и неядовитость дают возмож-
ность широко применять их как для наружных, так и для внутрен-
них покрасок. Титановые белила употребляются как масляная и
эмалевая краска для металлов и дерева. Недостатком титановых
белил является их большая маслоемкость. Вследствие того что мас-
ляная титановая краска сохнет медленно, необходимо прибавлять
к маслу сиккативы. Отрицательным свойством титановых покрасок
является, как уже указывалось выше, их способность к мелению;
однако, осыпаясь, краска оставляет поверхность, вполне пригодную
для повторного окрашивания. Выше уже отмечалась устойчивость
титановых покрасок к воздействию света; однако в затененных по-
мещениях титановые покраски с течением времени меняют свой
чисто-белый цвет на светло-желтый.
Хорошие антикоррозийные свойства титановых белил дают воз-
можность употреблять их для окраски мостов и других сооруже-
ний. Водонепроницаемость пленки и устойчивость ее к действию
морского воздуха и морской воды дают возможность употреблять
титановые белила для окраски корпусов кораблей и, в том числе,
их подводной части.
Анилиновые красящие вещества, смешанные с титановыми бе-
лилами, выцветают, что объясняется каталитическим воздействием
титановых белил. Поэтому пигменты, получаемые на основе орга-
нических красителей, нельзя употреблять в смеси с титановыми
белилами.
Согласно действующему стандарту (ГОСТ 9808—65), пигмент-
ная двуокись титана выпускается в СССР шести марок:
А-1 — анатазной формы, необработанная, применяемая в кра-
сках и эмалях для покрытий внутри помещения и др.;
АВ — анатазной формы, необработанная, для матирования хи-
мических волокон;
А-01 — анатазной формы, обработанная соединениями алюми-
ния и кремния, применяемая в высококачественных эмалях для
покрытий внутри помещения, в полиграфических красках, эмалях
для кожи и др.;
13:
387
P-1—рутильной формы, необработанная, применяемая в кра-
сках и эмалях для неответственных наружных покрытий и дорож-
ных знаков;
Р-01—рутильной формы, обработанная соединениями алюми-
ния и кремния, применяемая в красках и эмалях для покрытий
средней атмосферостойкости, в полиграфических красках и др.;
Р-02 — рутильной формы, обработанная соединениями алю-
миния, кремния и цинка, применяемая в красках и эмалях для на-
ружных покрытий высокой атмосферостойкости с высокими деко-
ративными свойствами.
ГЛАВА XIII
АНАЛИТИЧЕСКАЯ ХИМИЯ ТИТАНА
Бурное развитие производства и широкое применение в технике
титана, его сплавов и соединений, возрастающий из года в год объ-
ем добычи титановых руд заставляют химиков-аналитиков совер-
шенствовать старые и искать новые методы определения титана.
Часто возникает необходимость определять титан в материалах,
содержащих его в малых количествах и в присутствии других ме-
таллов, поэтому методы отделения и определения титана имеют
в настоящее время большое значение.
КАЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ТИТАНА
Для открытия титана в сплавах, рудах, шлаках, красках и дру-
гих материалах последние переводят в раствор действием кислот
или сплавлением с гидросульфатом или дисульфатом натрия или
калия. Растворы, получающиеся при этом, содержат соединения
титана(IV). Соединения титана(II) и титана(III) очень легко пе-
реводятся в соединения титана (IV). Поэтому качественные реакции
на титан(IV) являются, по существу, реакциями на титан вообще.
Групповые реакции на титан 340’341
Титан относится к элементам, объединяемым третьей аналити-
ческой группой, т. е. группой сульфида аммония. Сероводород при
пропускании через раствор соединений титана(IV) не выделяет
никакого осадка. При действии же сульфида аммония на холоду
выделяется ортотитановая, а при нагревании — метатитановая кис-
лота:
TiIV + 2(NH4)2S + 4Н2О = H4TiO4 + 4NH| + 2H2S
TiIV + 2(NH4)2S + 3H2O = H2TiO3 + 4NH4 + 2H,S
Подобно сульфиду аммония, гидроксиды и карбонаты щелочных
металлов и аммония осаждают на холоду белую студенистую орто-
титановую кислоту, нерастворимую в избытке осадителей и
389
легкорастворимую в минеральных кислотах. При нагревании же
осаждается метатитановая кислота, которая в разбавленных кис-
лотах очень трудно растворима. Ацетаты щелочных металлов осаж-
дают при температуре кипения весь титан в виде метатитановой кис-
лоты:
Tilv + 4[СО2СН3]“ + ЗН2О = Н2ТЮ3 + 4Н[СО2СН3]
Все растворимые соединения титана (IV) претерпевают под
влиянием воды гидролитическое расщепление. Этим свойством
пользуются для отделения титана от алюминия, хрома, железа
н других элементов, для чего оксиды этих металлов переводят в
растворимое состояние сплавлением с дисутьфатом калия; полу-
ченный плав растворяют в холодной воде и раствор нагревают до
кипения. Весь титан при этом осаждается в виде зернистой, легко
отфильтровывающейся метатитановой кислоты:
K2[Ti(SO4)3] + ЗН2О = H2TiO3 + 2К+ + 4Н+ + 3SO*-
Все остальные металлы остаются в растворе в виде ионов вместе
с сульфат-ионами. Присутствие щавелевой, винной и лимонной
кислот и других органических оксисоединений препятствует этой
реакции. В таких случаях органическое вещество необходимо раз-
рушить, например, окислением его перманганатом калия.
Специальные реакции на титан(1У) 17’ 341—З4в
Неорганические реактивы. Соединения титана (IV) не окраши-
вают шарика буры или фосфорной соли в окислительном пламени;
после продолжительного нагревания в восстановительном пламени
шарик, еще будучи горячим, окрашивается в желтый цвет, а по
охлаждении — в фиолетовый. В присутствии небольших количеств
олова фиолетовая окраска появляется быстрее. При добавлении
железа шарики окрашиваются в бурый, красный и промежуточные
цвета.
Перекись водорода окрашивает нейтральный или кислый
раствор соединений титана (IV) в оранжево-красный цвет, а в ма-
лом количестве — в светло-желтый. Эта реакция окрашивания, за-
висящая от образования перекисного соединения титана, очень
чувствительна, и ею очень удобно пользоваться для открытия сле-
дов титана. Ванадий дает с перекисью водорода такую же реакцию.
Если к раствору соединения титана (IV) прибавить большой избы-
ток перекиси водорода и затем прилить раствор гидроокиси калия,
то образуется осадок, растворяющийся в большом избытке гидро-
окиси калия, причем раствор окрашивается в желтоватый цвет.
Полученный таким образом раствор остается долгое время про-
зрачным, но затем из него выделяется ярко-желтый осадок перокси-
титановой кислоты.
Если сплавить какое-либо соединение титана (IV) с пере-
кисью натрия, то при обработке сплава водой титан переходит
390
в раствор. При сильном подкислении полученного раствора серной
кислотой появляется оранжево-красная окраска дисульфатоперо-
ксотитановой кислоты. При одновременном присутствии в иссле-
дуемом веществе железа последнее остается при обработке водой
в остатке, титан же переходит в раствор.
Открытию титана при помощи этой реакции мешает присут- -
ствие ванадия, хрома, молибдена, железа (III) и фторидов.
Гексациано -(II)ферраты в слабокислых растворах соеди-
нений титана(IV) дают аморфный бурый осадок: '
TiIV + [Fe(CN)0]4- = Ti[Fe(CN)6]
Гексациано -(III)ферраты образуют желтый осадок:
3TiIV + 4[Fc(CN)a]3- = Ti3 [Fe(CN)s] 4
Тиосульфаты дают осадок метатитановой кислоты:
TiIV + 2SO3S2~ + Н2О = H2TiO3 + 2SO2 + 2S
Органические реактивы. Многие органические вещества дают
цветные реакции с титаном (IV) в сернокислотных растворах. К ним
относятся некоторые фенолы, оксикислоты, азотсодержащие и не-
которые’ другие вещества.
Фенол в крепком сернокислотном растворе дает красную
окраску.
Пирокатехин в слабокислых растворах дает желтую
окраску.
Тимол (мзо-пропил-.и-крезол) в крепком сернокислотном рас-
творе дает ярко-красную окраску. В аналогичных условиях крас-
ную окраску'Дает гидрохинон.
Диоксималеиновая кислота в сильно разбавленных
растворах дает красно-бурую окраску. В концентрированных рас-
творах появляется окраска шоколадного цвета или выпадает жел-
тый осадок, неустойчивый лишь по отношению к плавиковой кис-
лоте.
Салициловая кислота дает красную окраску. Для от-
крытия титана в исследуемом материале последний сплавляют
с гидросульфатом калия в платиновом ушке и сплав после измель-
чения смачивают раствором салициловой кислоты в концентриро-
ванной серной кислоте.
Хромотроповая кислота дает красно-бурую окраску;
открытию титана мешает присутствие железа(III), которое может
быть удалено восстановлением (например, дихлоридом олова).
Аналогичную реакцию дает 2,7-д ихлор хромотроповая кис-
лота.
Аскорбиновая кислота в слабокислых растворах дает
желто-оранжевую окраску.
Та ннин в слабокислых растворах дает объемистый бурова-
тый осадок, становящийся вскоре оранжевым.
391
Ализариновый красный в нейтральном растворе дает
вишнево-красную окраску; в присутствии соляной кислоты окраска
не появляется.
Купферон (нитрозофениламинооксид аммония) дает в кис-
лых растворах желтый осадок. Подобного рода осадок образует
оксихинолин. Микрокристаллоскопическим исследованием ти-
тан может быть открыт с дибромоксихинолином.
Диантипирилметан в солянокислотных растворах обра-
зует желтую окраску; реакция специфична и весьма чувствительна.
Морин дает красновато-коричневую окраску.
Реакции на титан(Ш) и титан(П) 17 341
Растворы солей титана (III) окрашены в фиолетовый цвет. При
действии гидроксидов щелочных металлов или аммония из раство-
ров солей титана(III) выпадает темно-бурый студенистый осадок
трехгидроокиси титана:
Ti3+ + 3OH“ = Ti(OH)3
Осадок не растворяется в избытке реактива, но легко растворяется
в разбавленных минеральных кислотах. В присутствии тартрата
калия-натрия осадок не выпадает, но появляется интенсивное си-
нее окрашивание, а при малых концентрациях — постейенно исче-
зающее зеленое окрашивание.
Характерной для титан(Ш)-ионов является их восстановитель-
ная способность; она превышает восстановительную способность
олово(II)-ионов. В связи с этой способностью растворы солей ти-
тана (III) при стоянии на воздухе обесцвечиваются. Соли тита-
на (III) восстанавливают сернистую кислоту до элементарной серы
в растворе при кипячении. Из нейтральных растворов соединений
серебра, золота и ртути титан(III)-ионы выделяют соответствую-
щие металлы. Железо(III)- и медь(II)-ионы восстанавливаются
титан(Ш)-ионами до железо(П)- и медь(I)-ионов.
При действии ацетатов на растворы солей титана (III) появ-
ляется темно-зеленое окрашивание, а при нагревании выделяется
серовато-голубой осадок. При действии концентрированных рас-
творов роданидов на растворы солей титана (III) появляется интен-
сивное фиолетовое окрашивание.
Из растворов солей титана(II) гидроксид, карбонат и сульфид
аммония выделяют коричневый осадок двугидроокиси титана.
Специфическим реактивом на титан(П) является роданид-ион.
При приливании раствора роданида к раствору соли титана(II)
образуется зеленый роданид титана:
Ti2+ + 2NCS“ = Ti(NCS)2
Окраску роданида титана(II) легче обнаружить, приливая эфир,
которым роданид извлекается из водного раствора.
392
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ТИТАНА
Для количественного определения титана могут быть исполь-
зованы весовые, объемные, колориметрические, полярографические
и другие методы.
Весовые методы 17’ 347~351
Для весового определения титана используются методы оса-
ждения аммиаком, селенистой кислотой, фосфатами, оксихиноли-
ном, купфероном, таннином, антипирином, оксифениларсоновой
кислотой.
Аммиачный метод. Осаждение аммиаком используется при
определении больших количеств титана. Титан выделяют из кислых
растворов его соединений путем прибавления аммиака или кипяче-
ния с раствором ацетата аммония. При этом выпадает осадок
метатитановой кислоты; его отфильтровывают, промывают и про-
каливанием превращают в двуокись титана, которую и взвеши-
вают.
Часто приходится определять титан вместе с железом, цирко-
нием, алюминием, ниобием, танталом, которые (в виде гидрокси-
дов) также могут присутствовать в осадке, образовавшемся при
добавлении к анализируемому раствору аммиака.
Отделение титана от железа в отсутствие алюминия и фосфор-
ной кислоты осуществляют следующим образом. Осадок еще влаж-
ным растворяют в соляной кислоте. К солянокислотному раствору
прибавляют винную кислоту в трехкратном (по сравнению с осад-
ком) количестве и пропускают сероводород до насыщения, после
чего прибавляют в небольшом избытке аммиак. При этом железо
количественно осаждается в виде моносульфида, а титан остается
в растворе, который фильтруют от сульфида железа и упаривают
в фарфоровой чашке до небольшого объема. По охлаждении к рас-
твору добавляют концентрированную серную кислоту и жидкость
нагревают на песочной бане до обильного выделения паров трех-
окиси серы. Далее к охлажденной жидкости добавляют дымящую
азотную кислоту и смесь снова нагревают до получения прозрач-
ного раствора, который разбавляют водой и нейтрализуют содой.
Выпавший осадок растворяют в разбавленной серной кислоте и
раствор нагревают до кипенйя, причем весь титан выпадает в виде
метатитановой кислоты. Осадок отфильтровывают, промывают го-
рячей водой и прокаливают в платиновом тигле до двуокиси ти-
тана, которую и взвешивают.
Отделение титана от алюминия производят по методу Гуча,
который заключается в том, что осадок гидроксидов растворяют
в концентрированной (10—15%-ной) уксусной кислоте и раствор
кипятят в присутствии ацетата щелочного металла. При этом весь
титан выпадает в осадок, а алюминий остается в растворе.
393
Условия отделения титана от других элементов осаждением
аммиаком метатитановой кислоты могут быть улучшены, если оса-
ждение проводить в присутствии сульфосалициловой кислоты.
В концентрированном аммиачном растворе, содержащем сульфо-
салициловую кислоту, титан выпадает в осадок, а алюминий, хром,
марганец, кобальт, никель, цинк и уран целиком остаются в рас-
творе. Железо должно быть предварительно отделено каким-либо
иным методом.
Селенистокислотный метод. Для определения применяется раз-
бавленный холодный солянокислотный раствор соединения титана.
К раствору добавляют водный раствор аммиака до тех пор, пока
концентрация кислоты не станет меньше 0,2 н., затем при помеши-
вании приливают 5%-ный раствор селенистой кислоты до сверты-
вания осадка. После выдерживания раствора с осадком в течение
нескольких часов к нему прибавляют бумажную массу, которую
получают взбалтыванием мелких кусочков беззольного фильтра
в горячей воде до превращения в кашицу. Осадок отфильтровы-
вают при слабом отсасывании и промывают холодной водой. Воз-
душно-сухой осадок представляет собой двуводное соединение
селенитометатитановой кислоты. Использовать это соединение
в качестве конечной весовой формы не представляется возможным,
так как оно всегда содержит некоторое количество адсорбирован-
ного осадителя. В связи с этим осадок высушивают над маленьким
пламенем, прокаливают до улетучивания всего селена и взвеши-
вают в виде двуокиси титана. Этот метод может быть применен
для определения титана в присутствии бериллия, щелочноземель-
ных металлов, алюминия, марганца, кобальта, никеля, которые не
осаждаются селенистой кислотой; хром(III), железо(III), цинк и
уран хотя и не осаждаются, но при слишком быстром прибавлении
селенистой кислоты могут захватываться осадком. В условиях оса-
ждения титана полностью или частично выпадают в осадок также
цирконий, гафний, серебро, ртуть, галлий, висмут, церий (IV) и то-
рий. Присутствие в растворе перекиси водорода полностью предот-
вращает осаждение селенитометатитановой кислоты.
Фосфатный метод. Из кислого раствора титан может быть ко-
личественно выделен в виде ортофосфатотитановой кислоты доба-
влением ортофосфорной кислоты или дигидрофосфата аммония
в присутствии уксусной кислоты. Ортофосфатотитановая кислота
при прокаливании переходит в диортофосфатоксид титана
Ti2O(PO4)2. Следует отметить, что состав выпадающего осадка не
является постоянным и зависит от условий осаждения; состав про-
каленного осадка зависит от температуры прокаливания и стано-
вится постоянным лишь при 1000° С, когда содержание титана
в нем становится равным 32,0% (теоретическое содержание титана
в диортофосфатоксиде 31,7%). При осаждении по этому методу
титан отделяется от алюминия, марганца и железа(II); вместе
с титаном количественно осаждаются цирконий, олово и торий.
394
Присутствие перекиси водорода полностью предотвращает осажде-
ние титана.
Купфероновый метод. Купферон (нитрозофениламинооксид ам-
мония) количественно осаждает титан из разбавленного сернокис-
лотного раствора. Анализируемый раствор должен быть свободен
от кремниевой кислоты, редкоземельных металлов, циркония, ва-
надия, ниобия, тантала, молибдена, вольфрама, железа, металлов
сероводородной аналитической группы; очень большого содержа-
ния фосфора, щелочных и щелочноземельных металлов следует
также избегать, иначе осадок будет до некоторой степени загряз-
нен ими. Раствор разбавляют до объема 200 см3, приливают столь-
ко серной кислоты, чтобы общее содержание ее было равно 20—
30%, и затем приливают раствор перманганата до неисчезающей
слабо-розовой окраски (если отсутствует винная кислота) или до
тех пор, пока не будет уверенности, что все элементы достигли выс-
шей степени окисления. Раствор охлаждают до 10° С, после чего
медленно и при перемешивании .прибавляют холодный 6%-ный
раствор купферона до прекращения осаждения. Примешивают не-
много бумажной массы, дают осесть в течение 2—3 мин и отфиль-
тровывают осадок, осторожно отсасывая его через бумажный
фильтр с платиновым конусом в приемник, содержащий немного
чистого купферона, для проверки полноты осаждения. Осадок про-
мывают холодной 10%-ной серной или соляной кислотой, содержа-
щей 1,5 г купферона в 1 л, жидкость отсасывают с осадка насколь-
ко возможно, переводят осадок в фарфоровый тигель достаточной
величины, осторожно высушивают и затем нагревают до тех пор,
пока бумага не начнет обугливаться. Осадок имеет тенденцию
разжижаться и вскипать, поэтому нагревать его следует осторожно.
Нагревание постепенно усиливают до тех пор, пока не исчезнет
уголь, прокаливают и взвешивают осадок в виде двуокиси титана.
Этот метод широко применяется при определении титана в различ-
ных материалах.
Оксихинолиновый метод. Оксихинолин осаждает титан из сла-
бокислых и слабощелочных растворов в виде двуводного соедине-
ния оксихинолинатоксида титана TiO(C9H6ON)2-2H2O. Осаждение
титана проходит полностью при pH = 5,2-н 8,6; при pH < 3,5 и
pH >12 осадка совсем не образуется. Для определения титана
к 150 см3 раствора соединения титана прибавляют 0,5—1 г винной
кислоты и 0,5 г ацетата натрия, приливают аммиак до нейтральной
реакции (по фенолфталеину) и затем 1,5 см3 ледяной уксусной кис-
лоты. Раствор нагревают до 60° С, вводят при постоянном помеши-
вании избыток 2%-ного раствора оксихинолина и затем кипятят
10 мин, чтобы осадок оксихинолинатоксида титана стал зернистым.
Осадок отфильтровывают через стеклянный нутч-тигель, промы-
вают горячей водой, высушиванием при НО—130°С обезвоживают
и взвешивают в виде безводного оксихинолинатоксида. Осадок
можно также прокалить и взвесить уже в виде двуокиси титана.
Щелочные, щелочноземельные металлы, бериллий, рений, платина
395
и свинец не мешают применению этого метода. Присутствие пере-
киси водорода препятствует осаждению титана.
Для осаждения титана предложено использовать также производные окси-
хинолина: 5,7-Дихлор-8-оксихинолин и 5,7-дибром-8-оксихинолин. В осадок выпа-
дают аналогичные соединения, которые и взвешивают после высушивания при
140° С. Осаждение можно осуществлять и из более кислых растворов. Определе-
нию титана не мешают бериллий, магний, кальций, алюминий, хром, марганец,
кобальт, никель, цинк, уран. Совместно с титаном осаждаются цирконий, вана-
дий, железо и медь.
Таннино-антипириновый метод. Этот метод удобен тем, что по-
зволяет отделять титан от алюминия, хрома, марганца, железа, ко-
бальта, никеля и цинка, и притом он вполне осуществим в присут-
ствии фосфорной и кремниевой кислот. Кроме того, этим методом
можно определять малые количества титана (от 2 до 50 мг). К сер-
нокислотному или солянокислотному раствору, содержащему мень-
ше 0,1 г титана, прибавляют аммиак до появления запаха. Затем
приливают 10 см3 концентрированной серной кислоты и 40 см3
10%-ного раствора таннина. Раствор разбавляют до 400 см3, охла-
ждают, хорошо перемешивают и приливают 20%-ный водный рас-
твор антипирина до образования оранжево-красного хлопьевид-
ного осадка. Перемешивание прекращают, а прибавление антипи-
рина продолжают до тех пор, пока помимо красного не образуется
творожистый белый осадок. Красный осадок является продуктом
взаимодействия таннина и антипирина. Жидкость вместе с осад-
ком кипятят, затем прибавляют 40 г сульфата аммония и охла-
ждают, изредка перемешивая. Объемистый осадок собирают на
плотный фильтр и промывают при слабом отсасывании. Для про-
мывания используют специальную жидкость, которую пригото-
вляют растворением 3 см3 концентрированной серной кислоты, 10 г
сульфата аммония и 1 г антипирина в 100 см3 воды. Промытый
осадок высушивают в сушильном шкафу, а затем медленно и осто-
рожно прокаливают и взвешивают в виде двуокиси титана. Непо-
средственное прокаливание влажного осадка приводит к спеканию
его, что мешает полному окислению органических веществ. Если
первоначально содержались щелочные металлы, то прокаленный
осадок промывают горячей водой, отфильтровывают и снова про-
каливают.
Определение титана оксифениларсоновой кислотой. Титан мо-
жет быть выделен из кислого раствора путем добавления окси-
фениларсоновой кислоты, которая первоначально была предложена
как реактив на цирконий и олово. Образующийся осадок отфиль-
тровывают, промывают, прокаливают при 900—1000° С и взвеши-
вают в виде двуокиси титана. В присутствии плавиковой, щавеле-
вой и винной кислот осаждение титана из раствора замедляется.
В присутствии перекиси водорода осаждения титана в отличие от
циркония не происходит; этим пользуются для отделения титана
от циркония.
396
Объемные методы 345>347 > 348>350'351
Объемные методы количественного определения титана осно-
ваны на восстановлении титана(IV) до титана(III) и титровании
последнего растворами подходящих окислителей.
Восстановление титана(IV) удобно проводить в приборе, на-
зываемом редуктором Джонса (рис. 65). В нижней части длинной
I ф Ь,5см
s
ф 16 мм
Фбмм
Рис. 65. Редуктор
Джонса.
трубки помещена перфорированная фарфоро-
вая пластинка, на нее положен слой асбес-
та, как в тигле Гуча, а сверху насыпан тол-
стый слой зерен амальгамированного цинка.
При пропускании раствора, содержащего ти-
тан (IV), через эту трубку происходит восста-
новление титана (IV) и в приемную колбу по-
падает уже титан(III). Чтобы предохранить
титан(Ш) от окисления воздухом, в приемную
колбу налит раствор сульфата аммония-же-
леза(Ш), с которым титан(III) тотчас реаги-
рует, восстанавливая эквивалентное количе-
ство железа(Ш) в железо(П), достаточно
устойчивое на воздухе. Если в испытуемом
растворе нет хлорид-ионов, то образующиеся
под действием титана (III) железо(II)-ионы
можно прямо титровать раствором перман-
ганата; если же хлорид-ионы присутствуют,
следует предпочесть титрование раствором
бихромата; 1 см3 0,1 н. раствора окислителя
соответствует 4,79 мг титана. Весьма важно,
чтобы раствор не содержал органических
веществ.
Титрование раствора, содержащего ти-
тан (III), в условиях, исключающих окисление
кислородом воздуха, например в атмосфере
двуокиси углерода, может быть осуществлено
раствором сульфата аммония-железа (III)
(индикатор — роданид) или метиленовой
синыо.
Титан(IV) может быть быстро и количественно восстановлен до
титана (III) в сернокислотном растворе свинцом в присутствии
сульфат-ионов. Выпадающие р осадок соли свинца не мешают тит-
рованию раствором соли железа(III). Сильным восстановителем
титана(IV) в горячем солянокислотном растворе является также
элементарное железо. Медленно действующим восстановителем
в горячем соляно- или сернокислотном растворе является алюми-
ний. Для восстановления титана (IV) в редукторе Джонса весьма
активным восстановителем является элементарный кадмий.
Для объемного определения титана может быть применен элек-
тролитический метод восстановления. Анализируемый сернокис-
397
лотный раствор, содержащий титан (католит), отделяют от ано-
лита (10%-ная серная кислота) коллодиевой диафрагмой. В ка-
честве катода и анода применяют платиновые электроды Винклера.
Восстановление титана(IV) проводят электрическим током силой
в 1 а при напряжении на клеммах 3 в. Во время электролиза
и при титровании через католит пропускают ток двуокиси угле-
рода, не содержащей кислорода. Восстановленный раствор, содер-
жащий титан(Ш), титруют 0,05 н. раствором перманганата. Этот
способ позволяет определять титан в присутствии меди, которую
выделяют на предварительно взвешенном катоде. Определению ти-
тана мешает молибден, вольфрам, железо и другие металлы с пе-
ременной степенью окисления.
К другой группе объемных оксидиметрических методов опреде-
ления титана относятся методы, основанные на непосредственном
титровании раствором восстановителя. В связи с низким окис-
лительно-восстановительным потенциалом системы TiIV|TiIn един-
ственно пригодным для данной цели является раствор соли хро-
ма (II), так как потенциал системы Сгш|Сгп составляет — 0,4 в.
Этот метод дает возможность при потенциометрическом контроле
процесса определять титан в присутствии не только железа, но
и других металлов, например алюминия, хрома, марганца, ни-
келя.
Помимо оксидиметрических методов определения титана еще
известны лишь два объемных метода. Один из них, косвенный,
сводится к осаждению титана в виде оксихинолинатоксида и
последующему определению его в осадке броматометрическим тит-
рованием. Другой метод заключается в трм, что раствор соедине-
ния титана титруют раствором гидроокиси калия (по бромкре-
золовому пурпурному), а затем добавляют избыток фторида
калия и 0,1 н. раствора соляной кислоты; избыток кислоты оттит-
ровывают щелочью.
Колориметрические методы 345<348’ 352-356
Пероксидный метод. При добавлении перекиси водорода к сер-
нокислотному раствору соединения титана возникает оранжевое
окрашивание. Веллер предложил использовать это для колоримет-
рического определения малых количеств титана. Концентрация
раствора перекиси водорода, которая может составлять не больше
3%, должна быть приблизительно определена титрованием рас-
твором перманганата при вскрытии нетронутой склянки и затем
проверяться через известные промежутки времени, иначе могут
произойти серьезные ошибки вследствие разложения реактива. Пе-
рекись водорода иногда содержит фтор, и предварительно следует
убедиться в отсутствии этого элемента. Окисление следует прово-
дить в присутствии по меньшей мере 5% серной кислоты (по
объему), чтобы обеспечить полное окисление титана. Интенсив-
ность окраски возрастает с повышением температуры, и, следова-
398
тельно, сравниваемые растворы должны иметь одинаковую темпе-
ратуру (предпочтительно 20—25°С).
Помехи при колориметрическом определении титана перекисью
водорода, вызванные примесями к испытуемому раствору, могут
быть трех видов. Во-первых, некоторые примеси могут мешать
своей собственной окраской; это соединения хрома, железа, никеля
и др. Во-вторых, ионы некоторых металлов мешают тем, что об-
разуют с перекисью водорода окрашенные соединения: вана-
дий^), молибден(У1), вольфрам(У1), церий(1У) дают с пере-
кисью водорода желтую окраску, хром (VI) — сине-фиолетовую.
Сильнее всего сказывается влияние ванадия. В-третьих, некоторые
примеси (фториды, фосфаты) обесцвечивают окраску, образуемую
титаном с перекисью водорода. Большие количества окрашенных
соединений должны быть удалены перед определением титана. Ва-
надий, молибден, вольфрам и фосфаты легко удалить осаждением
титана гидроокисью натрия в присутствии небольшого количества
железа. Церий должен быть предварительно удален осаждением
в виде оксалата. Фтор может быть легко удалей повторным выпа-
риванием с серной кислотой. Определение титана в присутствии
ванадия, хотя и с небольшой точностью, можно проводить или пу-
тем введения соответствующего количества титана в стандартный
раствор, или путем определения содержания ванадия после связы-
вания титана в комплекс фторидами и внесения поправки в сум-
марное количество титана и ванадия.
Для приготовления стандартного раствора чистую двуокись
титана сплавляют с перекисью натрия, растворяют плав в воде
и прибавляют достаточное количество серной кислоты для получе-
ния раствора, содержащего 5% кислоты при разбавлении до же-
лаемого содержания титана. В качестве исходного вещества для
приготовления стандартного раствора подходит также гекеафторо-
титанат калия. Навеску многократно перекристаллизованного гек-
сафторотитаната калия обрабатывают серной кислотой в плати-
новой чашке, несколько раз выпаривают досуха и сухой остаток
растворяют в 5%-ной серной кислоте.
'%Для приготовления постоянной стандартной^ шкалы рекомен-
дуют употреблять в качестве имитации растворьГ метилового оран-
жевого, которые легко приготовить и которые не обесцвечиваются
при хранении. Для приготовления растворяют 1 г метилового
оранжевого в 400 см3 воды; 10 см3 этого раствора разбавляют до
200 см3. Стандартизуют эти растворы по стандартному раствору
титана, который получается цри окислении соединения титана пе-
рекисью водорода.
Раствор, подлежащий колориметрированию, должен содержать
по крайней мере 5% серной кислоты. К определенному объему
(20—50 см3) испытуемого раствора прибавляют 5 см3 раствора
перекиси водорода. Раствор перекиси готовят десятикратным раз-
бавлением 30%-ного раствора перекиси водорода (пергидроля)
5 %-ной серной кислотой. Стандартный раствор приготовляют
399
в таких же объемах и интенсивность окраски сравнивают в коло-
риметре. Содержание титана определяют по формуле;
ЦАУ
Х = /0 • Ю00
где Ц и /0 — интенсивность окраски испытуемого и стандартного растворов; А —
содержание титана в 1 л стандартного раствора; V — объем колориметрируемой
жидкости.
Раствор для колориметрирования можно приготовить и иначе.
Навеску испытуемого вещества тщательно смешивают с десяти-
кратным количеством перекиси натрия и нагревают в железном
тигле до полного сплавления. Сплавленную массу охлаждают,
растворяют в 200 см3 воды и, не фильтруя, прибавляют 15 см3
50%-ной серной кислоты' и 6 см3 50 %-ной фосфорной кислоты,
после чего раствор разбавляют до 250 см3. Окраску сравнивают
с окраской стандартного раствора, содержащего такое же количе-
ство фосфорной кислоты. Присутствие перекиси натрия в сплаве
делает ненужным прибавление перекиси водорода, так как послед-
няя образуется при подкислении раствора.
В присутствии брома или бромидов окраска раствора, обрабо-
танного перекисью водорода, обусловлена наличием не только ти-
тана, но и свободного брома. Колориметрируемую жидкость осво-
бождают от брома, экстрагируя его хлороформом.
Пероксидный колориметрический метод определения титана
очень прост и надежен. Следует отметить, что благодаря строгому
подчинению интенсивности окрас.кшзакону Ламберта — Бэра (мак-
симум светопоглощения для волны(436 нм можно точно определять
титан пероксидным методом не тольЮТв малых, но и в больших
концентрациях.
Хромотроповокислотный метод. Соединения титана (IV) обра-
зуют с хромотроповой кислотой (1,8-диоксинафталин-З, 6-дисуль-
фокислота) окрашенные соединения. Цвет соединений зависит от
кислотности среды. Так, окраска среднекислых растворов (pH =
= 1+3) красно-бурая, слабокислых (pH = 4 + 6) — желтая, в рас-
творе ацетата “натрия (pH = 7 + 9)—оранжево-красная, в среде
концентрированной серной кислоты — красно-фиолетовая. Для ко-
лориметрического определения титана чаще используют красно-
бурый комплекс как более прочный. Интенсивность окраски про-
порциональна концентрации титана в интервале от 0,1 до 4 мг/л\
оптимальная концентрация титана находится в пределах от 0,2
до 0,5 мг)л. Определению титана мешают железо(Ш), уран(У1),
а также фторид-, нитрит-, нитрат- и оксалат-ионы. Железо(III)
и уран(VI) удаляют путем восстановления их сульфитом или гид-
росульфитом до Fe11 и UIV, анионы удаляют выпариванием с сер-
ной кислотой. Стандартный раствор титана приготовляют раство-
рением сплава навески чистой двуокиси титана с дисульфатом ка-
лия в 10 %-ной серной кислоте. Хромотроповая кислота быстро
400
окисляется; в связи с этим необходимо применять свежеприготов-
ленные растворы и строго контролировать pH среды.
В качестве реактива для колориметрического определения ти-
тана по этому методу используется также водный раствор хромо-
тропата натрия (60 а/л).
Для колориметрического определения титана используются также и некото-
рые аналоги и производные хромотроповой кислоты. Так, 2,7-дихлорхромотропо-
вая кислота в кислой среде дает с соединениями титана (IV) малиновое окраши-
вание. Оптимальные значения pH от 1,5 до 2,5; при такой кислотности данная
реакция в 14 раз чувствительнее реакции с перекисью водорода.
В качестве реактива на титан предложена также 1,2-диоксибензол-3,5-ди-
сульфокислота (вернее, ее натриевая соль, называемая тайроном), которая дает
с кислыми растворами соединений титана (IV) желтое окрашивание.
Тимоловый метод. Соединения титана(IV) дают с тимолом
в растворе концентрированной серной кислоты яркое оранжево-
красное окрашивание. Интенсивность окраски пропорциональна
содержанию титана в растворе. Этот метод применим только для
определения малых количеств титана, так как чувствительность
тимоловой реакции в 25 раз больше, чем реакции с перекисью во-
дорода. Стандартный раствор титана приготовляют из чистой дву-
окиси титана, 0,1 г которой растворяют в небольшом количестве
серной кислоты, разбавляют до 1 л концентрированной серной кис-
лотой и тщательно перемешивают раствор; 1 см3 этого раствора
содержит 0,1 мг ТЮг- Отмеренный объем этого раствора может
быть еще разбавлен концентрированной серной кислотой, если тре-
буется приготовить более слабые стандарты. Тимоловый реактив
приготовляют растворением 5 г тимола в 5 'см3 разбавленной
уксусной кислоты, прибавляют к раствору 95 см3 концентрирован-
ной серной кислоты и перемешивают. Раствор следует предохра-
нять от действия солнечного света.
Исследуемый образец, содержащий от 0,5 до 5 мг титана, точно отвешивают
и растворяют в концентрированной серной кислоте или, если необходимо, сплав-
ляют с гидросульфатом калия и сплавленную массу растворяют в концентриро-
ванной серной кислоте. Раствор переносят в несслеровский цилиндр, прибавляют
тимоловый реактив с таким расчетом, чтобы тимола было в 100 раз больше, чем
титана, и разбавляют до метки концентрированной серной кислотой. Прибавляют
такое же относительное количество тимола к отмеренному объему стандартного
раствора титана и сравнивают окраску испытуемого раствора с окраской стан-
дарта. Растворы следует сравнивать при комнатной температуре. В случае
необходимости приготовляют серии стандартов с различным содержанием ти-
тана. Если же применяют метод разбавления, то используют 80%-ную серную
кислоту.
Другие колориметрические методы. Для колориметрического
определения титана находит применение диантипирилметан, ко-
торый образует с титаном(IV) соединение желтого цвета. Опреде-
ление ведут в кислой среде. Метод позволяет открывать 0,01 мг
титана в 1 л. Окраска развивается через 45 мин и устойчива не-
сколько месяцев. Определению мешают железо(Ш) и ванадий^),
которые удаляют путем восстановления их гидроксиламином.
401
Предложен колориметрический метод определения титана при
помощи реакции с оксихинолином. Метод основан на возникнове-
нии желтой окраски при экстракции раствора соединения тита-
на (IV), содержащего перекись водорода, 1%-ным раствором окси-
хинолина в хлороформе; экстракцию проводят при pH = 3. Такую
же окраску в этих условиях дают цирконий и ванадий. Алюминий,
молибден и железо определению не мешают.
Предложен колориметрический метод определения титана сульфосалициловой
кислотой, основанный на возникновении интенсивной желтой окраски. К слабо-
кислому раствору соединения титана в мерной колбе на 100 см3 приливают 5 см3
20%-ного раствора сульфосалициловой кислоты. При этом в присутствии желе-
за (III) появляется красное окрашивание. Затем приливают 10%-ный раствор
аммиака до появления желтой окраски и немедленно — 20 сд? ацетатного бу-
фера (pH = 3,8), который готовят растворением 6,44 г ацетата натрия и 10,45 см3
96%-ной уксусной кислоты в 1 л воды. Окрашенный раствор перемешивают, при-
ливают для разрушения окраски, возникшей от присутствия железа, 5 см3
42%-ного раствора тиогликолевой кислоты разбавляют до метки и через 10 мин
фотометрируют.
Желтую окраску в растворах соединений титана в широком интервале pH
(от 4 до 10) дает тайрон (2,3-диоксибензол-3,5-сульфонат натрия). Мешают опре-
делению, давая такую же окраску, соединения ванадия(V), молибдена (VI) и
железа (III). Влияние железа (III) можно устранить восстановлением его до же-
леза (II) или связыванием в комплекс с этилендиаминтетрауксусной кислотой.
Полярографические методы 345’350’357
В последние годы приобрели значение также и полярографи-
ческие методы определения титана. Ценность полярографических
методов заключается в том, что они дают возможность определять
титан в присутствии других элементов, являющихся помехой при
определении химическими методами.
В солянокислотных, сернокислотных и азотнокислотных раство-
рах титан восстанавливается на ртутном капельном катоде при по-
тенциале —0,98 в, который соответствует переходу TiIr —> Tim.
Полярографическая волна титана получается также и в щелочном
растворе в присутствии комплексообразователя.
При изучении возможности применения полярографического
метода для определения титана было установлено, что при pH =
= 0,3 -г 1 высота волны титана строго пропорциональна концент-
рации его в растворе.
Предложен метод полярографического определения титана и
железа из одной навески на фоне 15%-ного раствора трехзамещен-
ного цитрата натрия.
Для полярографического определения титана может быть ис-
пользовано образование комплексного соединения титана с Тай-
роном в ацетатном буферном растворе. В присутствии раствора
тайрона, который сам не восстанавливается на ртутном капельном
электроде, потенциал восстановления титана сдвигается в сторону
более положительных значений. Комплексное соединение титана
с тайроном дает хорошо выраженную волну с потенциалом Еуг —
= —0,45 в.
402
Разработан осциллографический вариант полярографического
определения содержания титана без предварительного отделения
его от железа и других примесей.
АНАЛИЗ ТИТАНОВЫХ СОЕДИНЕНИЙ, СПЛАВОВ И РУД
Технический анализ соединений титана 84’ 339>345
Из различных соединений титана наибольшее значение в тех-
нике имеют двуокись титана и тетрахлорид титана. В связи с этим,
в первую очередь представляют интерес методы технического ана-
лиза этих титансодержащих продуктов.
Анализ технической двуокиси титана. Согласно ГОСТ 9808—65
в пигментной двуокиси титана нормируется содержание двуокиси
титана, а в сортах марок Р — также и содержание рутильной
формы Т1О2; кроме того, нормируется содержание влаги: водорас-
творимых солей и pH водной вытяжки.
Для определения содержания двуокиси титана 0,1 г продукта
и 3 а сульфата аммония помещают в стакан (40—50 сл3), прили-
вают 2,5 см3 концентрированной серной кислоты, закрывают ста-
кан часовым стеклом и нагревают до растворения двуокиси ти-
тана, после чего раствор охлаждают, добавляют постепенно 30 сл3
воды и перемешивают. Содержащееся в растворе соединение ти-
тана (IV) восстанавливают в редукторе Джонса до соединения
титана(Ш), которое титруют раствором сульфата аммония-же-
леза(Ш), применяя в качестве индикатора роданид аммония до
появления.красной окраски. Содержание двуокиси .титана в про-
дукте (в %) вычисляют по формуле:
v VT -100
х-----G
где V—объем раствора сульфата аммония-железа(Ш), пошедшего на титрова-
ние, с .и3; Т — титр раствора сульфата аммония-железа (III) по двуокиси титана,
г/см3; G — навеска, г.
Для установления титра раствора сульфата аммония-желе-
за (111) по двуокиси титана 0,05—0,1 г чистого элементарного ти-
тана помещают в термостойкий стакан (100 с.и3), приливают 25 сл3
воды, 10 см? концентрированной соляной кислоты, 5 см? концент-
рированной серной кислоты, закрывают стакан часовым стеклом
и нагревают до полного растворения титана. После охлаждения
раствор пропускают через редуктор Джонса и титруют продукт
восстановления раствором сульфата аммония-железа(III), как
указано выше. Титр раствора сульфата аммония-железа (III) вы-
числяют по формуле:
r... 1.67g
V
где g— навеска элементарного титана, г; V—объем раствора сульфата аммония-
железа(Ш), пошедшего на титрование, см3.
403
Для определения содержания рутильной формы используют
рентгеновский аппарат для структурного анализа (типа УРС)
с медным излучением и никелевым фильтром. Содержание рутиль-
ной формы в испытуемом образце двуокиси титана определяют
сравнением с контрольными образцами, которые приготовляют
смешением 100%-ных анатаза и рутила в различных соотноше-
ниях.
Анализ технического тетрахлорида титана. Для анализа техни-
ческого тетрахлорида титана навеску в запаянной ампуле вносят
в закрытую склянку с водой, подкисленной серной кислотой, и
разбивают ампулу, встряхнув склянку. Через 1 ч раствор перено-
сят в мерную колбу, откуда отбирают аликвотные части пипеткой
и определяют в них общее содержание титана (например, перо-
ксидным колориметрическим методом) и хлора (аргентометриче-
ским методом). Общее содержание хлора, естественно, склады-
вается не только из тетрахлоридного хлора, по и из хлора свобод-
ного, а также из входящего в состав примешанных хлоридов. Таким
образом, общее содержание хлора всегда будет превышать
величину, рассчитанную по общему содержанию титана (Ti:4С1).
Однако по общему содержанию титана не всегда может быть рас-
считано содержание свободного тетрахлорида, так как в составе
технического продукта могут находиться дихлороксид титана и
другие титансодержащие вещества. В связи с этим в отдельных
пробах следует определять содержание свободного хлора и рас-
творенных хлоридов других элементов.
С большими затруднениями связан отбор навески тетрахлорида
титана, так как он чрезвычайно гигроскопичен. В частности, при
отборе навески в ампулу не всегда может быть обеспечена над-
лежащая точность. Представляет интерес способ отбора навески,
предложенный Дзиковским и Новаком. Тетрахлорид титана шпри-
цем вводят в предварительно взвешенный сухой флакон для сы-
воротки, который снова взвешивают; затем в флакон вводят также
шприцем последовательно н-гептан и 20%-ную серную кислоту.
После часовой выдержки давление в флаконе уравнивают с атмо-
сферным и переводят жидкость в коническую колбу для ана-
лиза.
Для количественного определения содержания свободного тет-
рахлорида в техническом тетрахлориде титана могли бы быть ис-
пользованы колориметрические реакции образования комплексных
соединений тетрахлорида титана с некоторыми органическими ве-
ществами. Такие реакции удобно проводить в растворах неполяр-
ных растворителей (например, в гептане). Однако для техни-
ческого анализа тетрахлорида титана более пригоден способ,
основанный на последовательном определении содержания при-
месей, суммировании их и сопоставлении полученных результа-
тов с результатами определения общего содержания титана и
хлора.
404
Анализ титановых сплавов 345’355’ 358-360
В связи с развитием производства металлического титана
. и его сплавов появилась необходимость в точном определении со-
става этих сплавов. В сплавах необходимо определять содержание
£ титана, а в металлическом титане крайне важно определять со-
держание водорода, азота, кислорода, от которых зависят пласти-
р ческие свойства металла, а также железа, магния, фосфора, мо-
? либдена, вольфрама. Для анализа необходимо перевести сплав
в раствор, пригодный для определения содержания в нем титана
Г и других элементов. Титан можно определять методами, описан-
? ными выше. Для определения примесей существуют специальные
методы, особенности которых связаны часто с необходимостью от-
; делять эти примеси от титана.
; Перевод сплавов в раствор. Одно из затруднений, которое воз-
; никает при анализе металлического титана или его сплавов, свя-
i зано с переводом металла в раствор и со способами предотвраще-
ния возможного гидролиза растворенных соединений титана. Титан
можно перевести в раствор обработкой сплава кислотами. Титан
сравнительно хорошо растворяется в разбавленных минеральных
кислотах, но скорость растворения его может быть значительно
увеличена введением фторид-ионов в виде плавиковой кислоты
или фторида аммония. Присутствие фторид-ионов вызывает в про-
цессе растворения образование фторотитанатного комплекса и тем
самым хорошо предохраняет раствор от гидролиза титанового
соединения. Методы сплавления металлического титана для пере-
вода его в раствор не нашли широкого применения в связи с боль-
шой стойкостью титана к плавням. Из исследованных плавней бо-
лее или менее пригодной для растворения металлического титана
оказалась лишь перекись натрия.
Малые количества титана от больших количеств железа, мо-
либдена, ванадия рекомендуется отделять путем осаждения титана
аммиаком в присутствии этилендиаминтетраацетата натрия.
Качественное открытие титана в стали и чугуне. Для количе-
ственного открытия титана 2 г стали или чугуна растворяют в азот-
ной кислоте, раствор выпаривают в фарфоровом тигле досуха
и остаток прокаливают. Содержимое тигля сплавляют в 30 г гид-
росульфата калия. Охлажденный плав выщелачивают холодной
водой и раствор кипятят в течение часа. Если при этом выпадет
белый осадок метатитановой кислоты, его отфильтровывают через
плотный фильтр, тщательно промывают горячей водой и прокали-
вают в тигле. Образовавшуюся двуокись титана сплавляют в ушке
платиновой проволоки с фосфатом натрия в восстановительном
пламени. В присутствии титана перл окрашивается в горячем со-
стоянии в желтый цвет, который при охлаждении переходит в фио-
летовый. При загрязнении двуокиси титана железом перл окраши-
вается в кроваво-красный цвет.
405
В присутствии вольфрама плав с гидросульфатом натрия вы-
щелачивают 5°/о-ной серной кислотой и отфильтровывают осадок
вольфрамовой кислоты. К фильтрату приливают 5—10 см3 80%-ной
фосфорной кислоты и 2—3 см3 перекиси водорода. Появление жел-
той окраски указывает на присутствие титана.
Весовое определение титана в стали. Для количественного опре-
деления титана 1 г стали помещают в фарфоровый стакан ем-
костью 250 см3 и растворяют в 15 см3 концентрированной соляной
кислоты или в 20 см3 30%-ной серной кислоты. Вначале раство-
рение ведут без нагревания, затем стакан ставят на песочную баню
и осторожно нагревают. После того как растворение закончится,
снимают стакан с бани, приливают небольшими порциями 3 см3
67%-ной азотной кислоты и вновь нагревают смесь до удаления
бурых паров оксидов азота, после чего выпаривают раствор до-
суха (если растворитель — соляная кислота) или до появления па-
ров трехокиси серы. Охладив стакан, осторожно приливают 15 см3
концентрированной соляной кислоты, дают смеси постоять 10 мин,
приливают 150 см3 горячей воды и нагревают еще в течение 10 мин.
Выпавший осадок отфильтровывают, промывают, вместе с фильт-
ром помещают в платиновый тигель, осторожно высушивают и
озоляют фильтр, после чего прокаливают его 15 мин. По охлажде-
нии тигля смачивают содержимое его тремя каплями воды, при-
ливают три капли концентрированной серной кислоты и 2 см3
40%-ной плавиковой кислоты и нагревают сначала на водяной,
а затем на песочной бане до полного удаления паров трехокиси
серы. После этого содержимое тигля снова прокаливают 15 мин
и сплавляют с 3 г соды. Плав выщелачивают горячей соляной
кислотой, присоединяют раствор к фильтрату и смесь выпари-
вают до объема 100 см3.
К концентрированному раствору прибавляют 10 г винной кис-
лоты, нейтрализуют аммиаком, приливают 3 см3 50%-ной серной
кислоты, нагревают до 50° С и пропускают в течение получаса
струю сероводорода. Нейтрализовав раствор избытком аммиака,
продолжают пропускать сероводород еще 15 мин до полного оса-
ждения сульфида железа. Отфильтровывают и промывают вы-
павший осадок. Фильтрат подкисляют серной кислотой и осто-
рожно нагревают до температуры не выше 80° С до удаления всего
сероводорода, после чего выпавший осадок серы отфильтровывают
и промывают. К раствору приливают 50%-ную серную кислоту,
охлаждают до возможно низкой температуры и приливают при
постоянном помешивании свежеприготовленный холодный раствор
купферона. Находящийся в растворе титан выпадает в виде мел-
кого желтого осадка, который быстро коагулирует. Для проверки
полноты осаждения осторожно приливают дополнительное коли-
чество раствора купферона. Появление белого, быстро исчезаю-
щего осадка указывает на полное осаждение титана. Полученный
осадок отфильтровывают на беззольный фильтр и промывают
10 раз сильно охлажденной разбавленной соляной кислотой, после
406
чего остаток жидкости в осадке осторожно отсасывают водоструй-
ным насосом. Промытый осадок помещают в тигель, высушивают,
осторожно озоляют фильтр и прокаливают.
Колориметрическое определение титана в стали. Содержание
титана в сталях может быть определено одним из следующих ко-
; лориметрических методов.
Способ Мак-Кейба (с перекисью водорода). При анали-
зах стали окраска, образуемая железо-ионами в серной кислоте,
обычно более интенсивна, чем окраска перекисного соединения
j титана. Сравниваемая окраска, таким образом, представляет со-
бой смесь двух цветов, причем окраска, образуемая титаном, яв-
ляется в этой смеси второстепенной. Если одно и то же количество
железа присутствует в стандарте и в исследуемом образце, то
в равных объемах растворов окраска, обусловливаемая железом,
1 должна быть одинаковой. Поэтому остается только уравнять
окраску исследуемого раствора с окраской раствора стали, не со-
; держащей титана, прибавляя к последнему отмеренное количе-
ство стандартного раствора титана. Разумеется, оба раствора при
этом должны быть приведены к одинаковому объему.
Если сталь содержит больше 0,02% титана, то по 2 г титановой и не содер-
жащей титана стали помещают в конические колбы емкостью 300 см3, наливают
в каждую колбу ио 80 см3 35%-ной серной кислоты и нагревают до растворения.
К каждому раствору прибавляют по 4 см3 33%-пой азотной кислоты, продол-
. ' жают кипячение до исчезновения паров и охлаждают раствор. Переносят оба
раствора в колориметрические пробирки, используя для промывания минимальное
количество воды. Затем выясняют, имеют ли оба раствора окраску и оттенки
одинакового характера. Если растворы в равных объемах имеют одинаковую
окраску, то в каждый прибавляют по 2 см3 3%-ного раствора перекиси водорода
и наблюдают, усиливается ли окраска исследуемого раствора; если присутствует
титан, то она явно усиливается. Тогда к раствору стали, не содержащей титана,
приливают из бюретки требуемое количество стандартного раствора титана
(одновременно к исследуемому раствору приливают такое же количество 25%-ной
серной кислоты) до совпадения окрасок обоих растворов.
Если сталь содержит меньше 0,02% титана, применяется более точный метод,
основанный на отделении железа путем тщательного извлечения его эфиром.
Отвешивают по 2 г исследуемой стали и стали, не содержащей титана. Поме-
щают навески в чашки и растворяют их (при нагревании) в 50 с.и3 концентри-
рованной соляной кислоты. К каждому раствору прибавляют по 4 см3 33%-ной
азотной кислоты для окисления железа и упаривают каждый раствор до объема
10 см3. Охлаждают растворы и взбалтывают их в делительных воронках с 50 см3
эфира, не содержащего спирта. Затем водно-кислотный слой отделяют, извлече-
ние железа повторяют еще раз, к отделенным от эфирного слоя растворам при-
ливают перекись водорода и колориметрируют, как в пепвом случае. Окраска
бывает явно выраженной уже при содержании в стали 0,001% титана.
Хромотроповокислотный способ. К 0,5—1,0 г стали
(0,1—1,0% титана) прибавляют 30 см3 соляной кислоты и нагре-
вают до прекращения выделения пузырьков водорода. Раствор
разбавляют водой до объема 200 см3, охлаждают до 5—10° С, при-
бавляют 6%-ный раствор купферона для осаждения титана, вана-
дия и части железа, проверяют полноту осаждения и, часто пе-
ремешивая, оставляют при той же температуре па 1,5—2 ч. Вы-
павший осадок отделяют на фильтре «белая лента», промывают
407
50—100 см3 0,6%-ного раствора купферона, переносят в кварце-
вый или платиновый тигель, осторожно озоляют и прокаливают.
Остаток сплавляют в 3—4 г дисульфата калия при постепенном
повышении температуры. Тигель с однородным плавом переносят
в стакан емкостью 200 см3, прибавляют туда же 30 см3 воды, затем
1—2 капли раствора роданида аммония и несколько кристалликов
сульфита или дисульфита натрия до обесцвечивания раствора.
Прибавляют 30 см3 раствора щавелевой кислоты, разбавляют во-
дой до метки в мерной колбе емкостью 200 см3 и перемешивают.
Отбирают пипеткой 5 см3 раствора, переносят в мерную колбу ем-
костью 50 см3, в которую добавляют 2 см3 водного раствора
аммиака, 2 см3 2,5%-ного раствора хромотроповой кислоты, 10 см3
5%-ного раствора хлоруксусной кислоты, доводят водой до метки,
хорошо перемешивают и колориметрируют, сравнивая окраску
с окраской стандарного раствора.
2,7-Дихлорхромотроповокислотный способ. Бе-
рут 0,25 г стали (0,02—0,1% титана), растворяют ее при нагрева-
нии в термостойком стакане на песочной бане в 20 см3 20%-ной
серной кислоты, прибавляют 1 см3 67 %-ной азотной кислоты, ки-
пятят до удаления оксидов азота, раствор переносят в мерную
колбу емкостью 50 см3, доводят водой, до метки и хорошо переме-
шивают. В две делительные воронки емкостью 50 см3 вводят пи-
петкой по 5 см3 полученного раствора и в одну из них — 5 см3
1%-ного раствора гексамера метафосфата натрия. В обе воронки
приливают по 10 см3 2%-ного раствора аскорбиновой кислоты и по
2 см3 1 %-ного раствора 2,7-дихлорхромотроповой кислоты. Рас-
творы перемешивают и через 5 мин вводят в воронки по каплям
по 4 см3 20%-ного раствора хлорида дифенилгуанидиния, хорошо
перемешивают, приливают по 10 см3 н-бутилового спирта, кото-
рым после двухминутного встряхивания извлекают окрашенное
соединение. Экстракты колориметрируют, сравнивая с раствором,
полученным в холостом опыте.
Роданидно-диантипирилметановый способ. Ис-
следуемую сталь (0,1 г) растворяют при нагревании в 8%-ной со-
ляной кислоте. Прибавляют (при нагревании) азотную кислоту
для окисления карбидов. Раствор разбавляют водой до объема
40—50 см3, кипятят для удаления оксидов азота, охлаждают, пе-
реносят в мерную колбу емкостью 100 см3 и доводят водой до
метки. Затем 5 см3 раствора переносят в делительную воронку,
прибавляют 5 см3 20%-ного раствора роданида аммония и по-
степенно 20%-ный раствор тиосульфата натрия до исчезновения
окраски, обусловленной присутствием трироданида железа. К рас-
твору прибавляют 5 см3 5%-ного раствора диантипирилметана
в 2 н. соляной кислоте и 2 см3 концентрированной соляной кис-
лоты. Образовавшееся соединение титана извлекают хлороформом
в два приема порциями по 10 см3. Экстракты фильтруют через
сухой фильтр в мерную колбу емкостью 25 см3, доводят хлорофор-
мом до метки и колориметрируют с синим светофильтром.
408
Анализ ферротитана. Содержание титана в ферротитане может
быть определено одним из следующих способов.
Способ Ц и очи на. Навеску (0,5 г) тщательно измельчен-
ного ферротитана обрабатывают в стакане 20 см3 царской водки,
приливают через некоторое время 20 см3 65 %-ной серной кислоты,
кипятят до появления белых паров трехокиси серы, осторожно
прибавляют при взбалтывании жидкости несколько капель плави-
ковой кислоты, при этом растворяются последние крупинки не-
разложившегося сплава. По охлаждении разбавляют раствор
50 см3 воды, фильтруют, если осталась неразложившаяся крем-
ниевая кислота, нейтрализуют содой, прибавляют 2 см3 65%-ной
серной кислоты и 6 г тиосульфата натрия для восстановления же-
леза; жидкость становится совершенно бесцветной. Осторожно вли-
вают раствор при частом взбалтывании в 400 см3 кипящей воды
и кипятят 1—2 мин. При этом в виде белых хлопьев выпадает
метатитановая кислота. Осадок после отстаивания отфильтровы-
вают вместе с кашицей через беззольный фильтр, промывают го-
рячей водой, подкисленной уксусной кислотой, прокаливают и
взвешивают в виде двуокиси титана.
Способ Торнтона. К 0,5 г ферротитана, растертого в тон-
кий порошок, прибавляют 50 см3 30 %-ной серной кислоты, затем
через некоторое время 15 см3 25 %-ной соляной кислоты и 10 см3
67 %-ной азотной кислоты и нагревают. По окончании растворения
и по охлаждении раствор разбавляют водой, отфильтровывают вы-
делившуюся кремниевую кислоту, прибавляют раствор ацетата
натрия и кипятят. При этом титан выпадает в осадок, а железо
остается в растворе. Осадок отфильтровывают, промывают, про-
каливают и взвешивают.
Способ Циглера. Измельченный ферротитан (0,5 г) сплав-
ляют в платиновом тигле с 8 г гидросульфата калия. Охлажден-
ную сплавленную массу растворяют в холодной воде и выде-
лившуюся кремниевую кислоту отфильтровывают. Фильтрат раз-
бавляют водой до 1 л, нейтрализуют аммиаком и прибавляют вод-
ный раствор сернистой кислоты. Затем медленно нагревают до
кипения и, накрыв сосуд, кипятят два часа, добавляя воду. Вы-
делившуюся метатитановую кислоту отфильтровывают и промы-
вают 4%-ной уксусной кислотой (фильтрат должен быть совер-
шенно прозрачным). Для полноты осаждения к фильтрату при-
бавляют еще немного аммиака, чтобы нейтрализовать кислоту,
сернистой кислоты и кипятят раствор в течение часа. Выпавшую
метатитановую кислоту отфильтровывают и присоединяют к глав-
ному осадку. Весь осадок с фильтром сжигают в платиновом
тигле, сплавляют еще раз с гидросульфатом калия и сплавленную
массу обрабатывают так же, как в первый раз. Полученную таким
образом чистую метатитановую кислоту прокаливают с добавкой
карбоната аммония и после охлаждения взвешивают.
Определение титана в алюминиевых сплавах. Для определения
титана в сплавах на алюминиевой основе пользуются колоримет-
409
рическими методами с использованием в качестве реактивов пере-
киси водорода, хромотроповой кислоты или 2, 7-дихлорхромотро-
повой кислоты.
Способ с перекисью водорода. Около 2—3 з сплава
помещают в стакан емкостью 500 с.н3, прибавляют 80—100 см3
10%-ной соляной кислоты и к концу растворения — 30 см3 65%-ной
серной кислоты, кипятят, разбавляют водой до 250—300 см3
и охлаждают. К охлажденному раствору прибавляют немного бу-
мажной массы и затем при перемешивании приливают тонкой
струей 10—15 см3 свежеприготовленного 6%-ного раствора купфе-
рона. Осадок после получасового отстаивания раствора отфиль-
тровывают и промывают 8—10 раз 15%-ной серной кислотой, со-
держащей небольшое количество купферона. Фильтр с осадком
помещают в платиновый тигель, осторожно высушивают, озоляют
и прокаливают. Прокаленный осадок смешивают с 3—4 г дисуль-
фата калия и сплавляют при 500—600° С. По охлаждении плав
растворяют в 40—50 см3 15%-ной серной кислоты. Раствор филь-
труют в мерную колбу емкостью 100 см3 и фильтр промывают
2—4 раза 15 %-ной серной кислотой. К раствору прибавляют 2 см3
80%-ной фосфорной кислоты, 2 см3 3%-кого раствора перекиси
водорода, доводят до метки 15%-ной серной кислотой, перемеши-
вают и колориметрируют с синим светофильтром.
Можно пользоваться пероксидным способом без отделения ти-
тана от сопутствующих элементов. Навеску сплава растворяют
в смеси соляной и серной кислот. Нерастворившийся остаток от-
фильтровывают, сплавляют с дисульфатом калия, плав растворяют
в 15%-ной серной кислоте, раствор присоединяют к главной части
и определяют титан колориметрическим пероксидным методом
в присутствии сопутствующих элементов.
Способ с хромотроповой кислотой. Сплав (1—2 з)
помещают в стакан емкостью 500 см3, постепенно прибавляют 40—
60 см3 10%-ной соляной кислоты и к концу растворения — 25 см3
65 %-ной серной кислоты, кипятят, разбавляют водой до 250 см3
и охлаждают. Далее отделяют титан купфероном и сплавляют
осадок с дисульфатом калия так же, как в способе с перекисью
•водорода. Охлажденный плав растворяют в 25 см3 15%-ной сер-
ной кислоты. Раствор фильтруют в мерную колбу емкостью 100 см3,
фильтр промывают 3—4 раза 15%-ной серной кислотой и ею же
доводят объем до метки и перемешивают. Затем 10 см3 раствора
помещают в мерную колбу емкостью 100 см3, прибавляют 1 —
2 капли 5%-ного раствора роданида аммония, нагревают до
50—60° С и прибавляют по каплям 18%-ный раствор сульфита
натрия до обесцвечивания. Прибавляют 30 см3 5%-ного раствора
щавелевой кислоты, 5 см3 свежеприготовленного 6%-ного раствора
хромотроповой кислоты, разбавляют водой до метки, перемеши-
вают и колориметрируют с синим светофильтром.
Способ с 2, 7-д и х л о р х р о м отр о п о в о й кислотой.
Сплав (1 з) растворяют в смеси 20 см3 40%-ной серной кислоты
410
и 2 см3 25%-ной соляной кислоты, раствор разбавляют водой до
объема 30 см3 и фильтруют в мерную колбу; фильтр тщательно
промывают горячей водой, раствор в мерной колбе охлаждают,
доводят до метки водой и перемешивают. Затем 10 или 5 см3 рас-
твора помещают в мерную колбу емкостью 100 см3, разбавляют
немного водой, прибавляют 5 см3 раствора, содержащего 5% хло-
рида гидроксиламмония и 5% аскорбиновой кислоты [для восста-
новления железа (III) и ванадия (V)] и нейтрализуют 50%-ным рас-
твором ацетата натрия до фиолетового окрашивания бумаги конго.
Прибавляют 10 см3 1 н. соляной кислоты, 5 см3 0,5%-пого раствора
2, 7-дихлорхромотроповой кислоты (натриевой соли), доводят до
метки водой, перемешивают и колориметрируют с голубым свето-
фильтром.
Анализ титансодержащих руд и минералов 347’361’362
При открытии и определении титана в горных породах, мине-
ралах, рудных концентратах и шлаках необходимо перевести ги-
тан в раствор. Для анализа можно применять методы, описанные
выше.
Разложение титансодержащих минералов. Все титановые мине-
ралы являются, как известно, соединениями в значительной степени
окисленного титана. Они, как правило, не полностью разлагаются
кислотами, за исключением плавиковой, применение которой, ра-
зумеется, исключает определение кремния. Плавиковая кислота
обычно применяется для разложения титановых минералов в смеси
с серной и азотной кислотами, и избыток ее следует удалять вы-
париванием раствора. Чтобы убедиться в полноте удаления, необ-
ходимо разбавить охлажденный раствор, перевести в раствор все
твердые частицы и еще раз выпарить его. При этих операциях надо
учитывать, что соединения титана легко гидролизуются, и следить
за тем, чтобы во всех случаях, когда титан должен быть в рас-
творе, последний был достаточно кислым.
Для разложения минералов обычно применяется сплавление
с гидроксидами, карбонатами, пероксидами, гидросульфатами или
фторидами щелочных металлов. При выборе того или иного плавня
следует иметь в виду состав образца и цель анализа, так как при-
менение некоторых плавней исключает возможность определения
отдельных элементов.
Методы определения титана в горных породах. Если порода не
содержит (кроме титана) металлов III, IV и V (сероводородной)
аналитических групп, то титан лучше всего определять осаждением
его аммиаком. Колориметрический пероксидный метод также дает
хорошие результаты, но он удобен лишь при содержании титана
в породе меньше 1%. На результатах колориметрического опреде-
ления неблагоприятно сказывается присутствие больших количеств
железа и фосфора, солей щелочных металлов и даже следов
фтора; эти примеси необходимо предварительно удалить.
411
При содержании титана в породе больше 4% можно применять
весовые методы, например купфероновый. Купфероновый метод
можно применять для анализа любого раствора горной породы,
не содержащего металлов IV (сероводородной) аналитической
группы, кремния и больших количеств фосфора.
Из объемных методов наиболее точны те, в которых восстанов-
ление проводят в редукторе Джонса, собирают восстановленный
раствор под избытком раствора сульфата железа(III) и титруют
его раствором перманганата. Определению этим методом мешают
ванадий, хром, железо и азотная кислота, которые также восстана-
вливаются. Поэтому метод следует применять после отделения ука-
занных примесей от титана.
Качественное открытие титана в железной руде. Если проба
содержит более 0,5% титана, присутствие его в фосфатном перле
можно установить с помощью паяльной трубки. С этой целью рас-
творяют достаточное количество пробы в фосфате и некоторое
время нагревают полученный перл в восстановительном пламени.
В присутствии титана перл после охлаждения окрашивается в ко-
ричнево-красный цвет. При незначительном содержании титана
образец сплавляют в платиновом тигле с 15-кратным количеством
гидросульфата калия в течение получаса при температуре крас-
ного каления. После охлаждения сплава вынимают его из тигля
и растворяют, растирая его в фарфоровой ступке с большим коли-
чеством холодной воды. Раствор переливают в стакан или в про-
бирку, прибавляют несколько капель 50 %-ной серной кислоты и
5 с/f3 раствора перекиси водорода. Раствор в присутствии титана
окрашивается в желтый цвет. Мешают определению ванадиевая,
хромовая и молибденовая кислоты, так как они с перекисью во-
дорода также дают окрашивание. В присутствии этих веществ
плав растворяют в холодной воде, прибавляют карбонат натрия
до тех пор, пока раствор не помутнеет от выпадения титановой
кислоты, затем прибавляют по каплям серную кислоту, пока оса-
док не растворится, разбавляют раствор 100—200 см3 воды и кипя-
тят в течение получаса. Выпавшую метатитановую кислоту от-
фильтровывают, промывают, фильтр сжигают в платиновом тигле
и остаток исследуют с помощью фосфатного перла. Чистая тита-
новая кислота окрашивает перл в восстановительном пламени
в фиолетовый цвет.
Количественное определение титана в железной руде. Железную
руду, содержащую титан, прокаливают в струе водорода; при
этом содержащееся в руде железо восстанавливается до металла.
Полученный плав растворяют в разбавленной серной кислоте,
а- оставшийся осадок, состоящий главным образом из титановой
и кремниевой кислот, обрабатывают для удаления последней пла-
вйковой кислотой. Оставшуюся титановую кислоту сплавлением
с гидросульфатом калия переводят в растворимое состояние. На-
ходящуюся в растворе титановую кислоту определяют весовым
или колориметрическим методом.
412
В трубку из тугоплавкого стекла помещают в фарфоровой лодочке 2—5 а
' железной руды и нагревают ёе в печи, постоянно пропуская ток водорода. Перед
нагреванием руды следует убедиться в том, что воздух из трубки совершенно
вытеснен водородом. Водород перед поступлением в трубку должен быть высу-
5 шен концентрированной серной кислотой. После того как воздух из трубки
< вытеснен, ее постепенно нагревают до температуры красного каления и выдержи-
; вают при этой температуре в течение часа. Вследствие реакции руды с водоро-
: дом образуется вода, которая собирается в виде капель на холодной части труб-
ки; эти капли необходимо время от времени удалять, осторожно подогревая их.
Когда на холодной части трубки перестанет собираться вода, это будет озна-
чать, что восстановление руды закопчено. Руде дают остыть, продолжая пропу-
скать водород. Восстановленную руду переносят в стакан достаточной емкости,
; обрабатывают разбавленной (30%-ной) серной кислотой и осторожно кипятят,
пока не прекратится выделение водорода. После этого остаток, состоящий глав-
ным образом из титановой и кремниевой кислот, отфильтровывают и промывают
горячей водой до тех пор, пока промывная жидкость не перестанет давать реак-
цию на железо. Фильтр еще влажным переносят в платиновый тигель и прока-
ливают. Для удаления кремниевой кислоты остаток слегка смачивают водой,
прибавляют 1—2 капли концентрированной серной кислоты и затем 5 см3 чистой
плавиковой кислоты. Тигель ставят на горячую водяную баню и нагревают до
тех пор, пока не перестанет выделяться тетрахлорид кремния, после чего тигель
в наклонном положении постепенно нагревают, не давая массе разбрызгиваться, и
прокаливают. После охлаждения добавляют 5—6 г гидросульфата калия и на-
гревают накрытый тигель в течение получаса до полного сплавления содержи-
мого. Охлажденный плав переносят в фарфоровую чашку, осторожно разбивают
его и растворяют при частом помешивании и растирании в холодной воде, под-
кисленной серной кислотой. В совершенно прозрачном растворе нейтрализуют
кислоту аммиаком и пропускают сероводород до насыщения. После этого
жидкость в конической колбе, накрытой маленькой воронкой, нагревают до ки-
пения и кипятят в течение часа, компенсируя испаряющуюся воду сероводород-
ной водой. Осадок отфильтровывают и промывают подкисленной водой, содер-
жащей сероводород. Ножку воронки закрывают маленькой пробкой, наполняют
фильтр свежеприготовленной хлорной водой и накрывают часовым стеклом. Через
10 мин удаляют пробку и промывают фильтр горячей подкисленной водой до
полного удаления хлора. После обработки хлорной водой титановая кислота
остается на фильтре в чистом виде. Фильтр сжигают в платиновом тигле, при-
бавляют карбонат аммония и снова прокаливают.
Анализ титаномагнетита. Для проведения анализа отвешивают
2 г тонкоизмельченного титаномагнетита. Навеску сплавляют
в платиновом тигле с 9 г карбоната натрия и 1,5 г нитрата калия.
При этом удобно, приготовив смесь руды с плавнем в отдельной
чашечке, перенести в тигель для сплавления сначала половину
всего количества. Сплавление достигается постепенным повыше-
нием температуры, после чего прибавляют вторую половину смеси,
покрывают все слоем плавня и плавят. Тигель с расплавленной
массой нагревают 40 мин на обыкновенной, а затем полчаса — на
паяльной горелке.
Охлажденный плав переносят в стакан и растворяют его в го-
рячей воде, часто помешивая стеклянной палочкой. Приливают
к раствору несколько капель спирта, осторожно кипятят его в те-
чение 10 мин, дают выделившемуся осадку осесть и отфильтровы-
вают его. После этого, убрав из-под воронки стакан с основными
фильтратом, подставляют другой стакан и промывают осадок го-
рячей водой, содержащей карбонат натрия. Если вторая часть
фильтрата совершенно прозрачна, то ее соединяют с основной
413
частью. Если же фильтрат непрозрачен, его концентрируют на во-
дяной бане до половины объема, отфильтровывают осадок и при-
соединяют его к главному осадку. В результате в осадке будут
находиться весь титан, железо и часть кремния и алюминия;
в фильтрате останутся весь ванадий, хром и остальная Часть
кремния и алюминия.
Для определения титана осадок, содержащий титан, железо и часть кремния
и алюминия, растворяют при умеренном нагревании и частом помешивании
в 50 см3 концентрированной соляной кислоты. Раствор выпаривают на водяной
бане досуха; выпаривание досуха повторяют 2 раза, прибавляя по 10 см3 соля-
ной кислоты; сухой остаток смачивают 30 слР концентрированной соляной кис-
лоты, дают постоять 15 мин, затем приливают 100 см3 воды и нагревают, поме-
шивая, 15 мин. После этого отфильтровывают осадок кремниевой кислоты и
тщательно промывают его горячей 20%-ной соляной кислотой. Фильтрат, содер-
жащий весь титан и железо, переносят в мерную колбу, добавляют до метки
10%-ную соляную кислоту, тщательно перемешивают, берут для определения ти-
тана одну пятую часть раствора, нагревают его до 90° С и приливают аммиак.
Выпавший осадок отфильтровывают и промывают несколько раз горячей водой,
затем помещают его вместе с фильтром в тигель емкостью 20 см3 и, осторожно
высушив фильтр, сжигают его, после чего прокаливают золу в течение получаса.
Охладив тигель, прибавляют к осадку 14-кратное количество гидросульфата ка-
лия, покрывают тигель крышкой, осторожно нагревая, расплавляют содержимое
тигля и прокаливают плав в течение часа. После охлаждения тигля плав раство-
ряют в 100 см3 10%-ной серной кислоты при нагревании до 70° С. Охлажденный
раствор пропускают небольшими порциями через редуктор Джонса, наполненный
амальгамированным цинком. Раствор должен стекать в раствор сульфата же-
леза(Ш), который предварительно наливают в колбу (400 см3). Раствор в колбе
тщательно перемешивают, вынимают пробку с редуктором и титруют раствором
перманганата (из числа кубических сантиметров раствора, израсходованных на
данное титрование, вычитают число кубических сантиметров, пошедших ранее на
титрование железа).
ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ТИТАНА
В АНАЛИТИЧЕСКОЙ ХИМИИ
Использование восстановительной способности
соединений титана(Н) и титана(Ш) 347’363
За последние годы соединения титана нашли широкое приме-
нение в лабораторной практике для анализа различных неоргани-
ческих и органических соединений. Применение в аналитической
химии соединений титана(II) и титана (III) обусловлено их исклю-
чительно большой восстановительной способностью. Так, трихло-
рид титана давно уже стал ценным материалом в аналитической
практике. Пользуясь титрованным раствором трихлорида титана,
особенно удобно проводить определение содержания железа в раз-
личных рудах и промышленных продуктах. Реакция сводится к вос-
становлению железа(Ш) до железа(II).
Определение железа при помощи солей титана(Ш). Для ко-
личественного определения железа(III) Кнехт предложил метод
титрования с применением трихлорида титана. Можно применять
для титрования и растворы сульфата титана(III). Титрование рас-
414
творами этих соединений отличается тем, что железо (III) восста-
навливается титрующим раствором. Конечную точку титрования
находят, применяя в качестве индикаторов метиленовую синюю,
обесцвечивающуюся при прибавлении избытка раствора соли ти-
тана (III), или роданид-ион, окрашивающий раствор в красный
цвет, если в нем еще есть железо(III). Обычно предпочитают по-
следний индикатор.
Этим методом можно определить общее содержание железа
или содержание только железа (III). В первом случае перед титро-
ванием железо(II) следует окислить до железа(III), лучше всего
перманганатом в сернокислотном растворе. Определению ме-
шают азотная и плавиковая кислоты, ванадий, вольфрам, платина,
медь, сурьма и некоторые органические соединения.
Для приготовления титрованного раствора трихлорида титана
концентрированный раствор его кипятят с равным объемом соля-
ной кислоты и разбавляют водой. Приготовленный раствор сле-
дует оберегать от действия солнечного света и соприкосновения
с воздухом, так как он легко окисляется. Титр раствора можно
установить по чистой соли Мора. Навеску соли Мора растворяют
в разбавленной серной кислоте, титруют раствор раствором пер-
манганата до обычной конечной точки и кипятят для удаления
растворенного в жидкости кислорода и разложения .незначитель-
ного избытка перманганата. Затем раствор охлаждают, приливают
10 см3 10%-ного раствора роданида аммония и титруют смесь рас-
твором трихлорида титана до полного обесцвечивания.
При определении содержания железа титрование следует вести
при комйцтной температуре; раствор должен составлять 100—
500 см3; растворы должны содержать серную или соляную кис-
лоту и 10 см3 10%-ного раствора роданида аммония.
Определение перекиси водорода. Если к кислому раствору
перекиси водорода приливать раствор трихлорида титана, то рас-
твор будет окрашиваться сначала в желтый, а затем в темно-
оранжевый цвет. Как только окраска достигнет максимальной
интенсивности, дальнейшее прибавление трихлорида титана вызо-
вет ослабление ее и, наконец, полное обесцвечивание раствора; это
указывает на конец восстановления.
Реакция протекает в две фазы. Сначала образуется перекисное
соединение титана, которое затем восстанавливается в обычное
соединение титана (IV). Вся реакция суммарно выразится сле-
дующим условным уравнением:
2Ti(OH)3 + Н2О2 = 2Ti(OH)4
В связи с изменяемостью титра раствора трихлорида титана его
устанавливают перед каждым титрованием, как указано выше,
по соли Мора.
Путем титрования раствором трихлорида титана можно также
определять содержание пероксосульфатов и хлоратов. К раствору
415
пероксосульфата или хлората прибавляют трихлорид титана и из-
быток его оттитровывают раствором железных квасцов в атмо-
сфере двуокиси углерода.
Использование образования перекисных
соединений титана в анализе 347,364-366
В связи с тем что различные перекисные соединения титана
имеют в растворах устойчивую оранжевую окраску, соединения
титана могут быть использованы в качестве индикаторов на раз-
личные перекисные соединения, присутствующие в растворе (пере-
кись водорода, пероксосульфаты, пероксофосфаты, пероксокар-
баты, пероксобораты и др.). Сущность определения заключается
в том, что раствор, содержащий перекисное соединение, оттитровы-
вают раствором окислителя или восстановителя; в конце титрова-
ния из титруемого раствора отбирают каплю и вводят ее в раствор
индикатора. Титрование повторяют по крайней мере 2 раза, отби-
рая пробные капли по возможности в самом конце титрования.
В качестве индикаторов могут быть использованы концентри-
рованные растворы гексафторотитаната калия, трисульфато- и
дисульфатотитанатов аммония и других титансодержащих солей.
В простейших случаях такие индикаторы могут быть изготовлены
путем растворения чистой двуокиси титана или метатитановой
кислоты в концентрированной серной кислоте или же введения
тетрахлорида титана в 20%-ный раствор серной кислоты.
При спектрофотометрическом определении некоторых элемен-
тов в качестве фотометрического реагента предложен фторидный
комплекс TiIV в присутствии перекиси водорода. Действие реагента
основано на образовании более прочных фторидных комплексов
определяемых элементов (например, бора, кремния) с одновремен-
ным освобождением эквивалентного количества TiIV, образующего
с перекисью водорода интенсивно окрашенный пероксидный комп-
лекс.
Использование соединений титана в анализе
органических веществ 365’367
Соединения титана образуются с многими органическими ве-
ществами окрашенные комплексы. Это обстоятельство во многих
случаях может быть использовано для определения содержания
органических соединений.
Фенол с тетрахлоридом титана в среде органического раство-
рителя дает сильное красное окрашивание, интенсивность которого
пропорциональна количеству введенного фенола. Эта реакция мо-
жет быть применена для количественного колориметрического
определения фенола (чистого и с примесями), находящегося в рас-
творах.
416
Для проведения анализа совершенно необходимо добиться пол-
ного отсутствия воды (применяемый для растворения хлороформ
должен быть абсолютно сухим). Определению мешают другие фе-
нолы и их производные. Нежелательно присутствие спирта и эфира.
Определение ведут следующим образом. Испытуемый объект из-
влекают хлороформом. Если в нем присутствуют нерастворимые
в хлороформе вещества, то экстракцию следует повторить не-
сколько раз. Все экстракты соединяют и разбавляют в мерной
колбе хлороформом до метки. Раствор должен быть разбавлен на-
столько, чтобы содержание фенола в нем не превышало 3 г/л. Из
колбы отбирают пипеткой 10 см3 раствора и смешивают его
с 10 см3 1%-ного раствора тетрахлорида титана в хлороформе.
Последний раствор лучше всего дозировать из бюретки, снабжен-
ной хлоркальциевой трубкой. Окрашенную смесь вливают в кю-
вету колориметра и сравнивают ее окраску с окраской стандарта.
Стандарт готовят из титрованного раствора фенола подобно испы-
туемому раствору. Удобно применять в качестве стандартного рас-
твора водный раствор фуксина, соответствующим образом проко-
лориметрированный по феноловому стандартному раствору.
Этим методом можно также определять хлорфенолы и нитро-
фенолы, пользуясь стандартами.
1/214 Зак. H2S
ПРИЛОЖЕНИЕ
1. Простые соединения титана
Формула Название Молеку- лярный вес Температура, °C
плавления кипения
TiF2 Дифторид титана 85,90 1280 2150
T1F3 Трифторид титана 104,895 1200 1500 (разл.)
TiF4 Тетрафторид титана 123,89 400 (при 22,75 атм) 284 (субл.)
TiO Одноокись титана 63,90 1170 2850
TiO2 Двуокись титана 79,90 1842 2670
Ti2Os Полутораокись титана 143,80 1880 3200
Ti3O Третьокись титана 159,70 1940 разл.
TiFO Оксмоиофторид титана 82,90 —
TiF2O Оке дифторид титана 101,90 — 450 (разл.)
TiN Мононитрид титана 61,91 2930
TisN Субнитрид титана 157,71 1050 (раз л.) —
Ti3N4 Нитрид титана (IV) 199,73 2860 —
TiCl2 Дихлорид титана 118,81 1030 1515
TiCl, Трихлорид титана 154,26 920 разл.
TiCl4 Тетрахлорид титана 189,72 -23,22 135,9
TiF3Cl Хлортрифторид титана 140,35 — —
TiF2Cl2 Дихлордифторид титана 156,81 — —
TiFCl3 Трихлорфторид титана 173,26 — —
TiOCl Монохлороксид титана 99,35 — 650 (субл.)
TiOCl2 Дихлороксид титана 134,805 180 (разл.)
Ti2OCl, Г емигексахлоргемиоксид ти- тана 324,52 73 (разл.) —
1 12O3C12 Гемидихлорсесквиоксид титана 214,705 п —
TiNCl Хлорнитрид титана 97,36 — 300 (разл.)
TiBr2 Дибромид титана 207,71 950 1200
TiBrs Трибромид титана 287,61 1260 разл.
TiBr4 Тетрабромид титана 367,52 38,25 232,6
TiF3Br Бромтрифторид титана 184,80
418
П родолжение
Формула Название Молеку- лярный вес Температура, °C
плавления кипения
TiF2Br2 Дибромдифторид титана 245,71
TiFBi-з Трибромфторид титана 306,61 — —
TiOBr2 Дибромоксид титана 223,71 146 —
(разл.)
TiNBr Бромнитрид титана 141,81 разл.
TiCl3Br Бромтрихлорид титана 234,16 -19,4 155
Т1С12Вгг Дибромдихлорид титана 278,62 -5,7 175,5
TiClBr3 Трибромхлорид титана 323,06 13,4 202
Til2 Дииодид титана 301,71 750 1150
Til3 Трииодид титана 428,61 900 разл.
Til4 Тетраиодид титана 555,52 155 377
TiF3I Иодтрифторид титана 131,80 — —
TiF2I2 Дииоддифторид титана 339,71 — —
TiOI Моноиодоксид титана 190,805 — —
TiOI2 Дииодоксид титана 317,71 125 —
(разл.)
TiNI Иоднитрид титана 188,81 — разл.
T1CI3I Иодтрихлорид титана 281,16 -4.0 181
TiCl2I2 Дииоддихлорид титана 372,615 34,4 236
T1CH3 Трииодхлорид титана 464,06 85 301
TiBr3I Иодтрибромид титана 414,52 55,2 260
TiBr2I2 Дииоддибромид титана 461,52 79,5 293
HBrI3 Трииодбромид титана 508,52 110 330
FiAt4 Тетраастатид титана 887,9 — —
ns Моиосульфид титана 79,96 1780 —
liSj Дисульфид титана 112,03 1300 —
(разл.)
112^3 Сесквисульфид титана 191,99 — —
TiOS Сульфидоксид титана 95,96 — —
TiCl2S Тиохлорид титана • 150,87 — —
TiBr2S Тиобромид титана 239,77 — —
TiSe Моноселенид титана 126,86 — —
TiSe2 Диселеннд титана 205,82 — —
Ti2Se3 Сесквиселенид титана 332,68 — —
TiCl2Se Селенидхлорид титана 197,77 — —
TiTe Монотеллурид титана 175,50 — —
TiTe2 Дителлурид титана 303,10 —
Ti2Te3 Сесквителлурид титана 478,60 —
TiH Моногидрид титана 48,91 — 640
(разл.)
TiH2 Днгидрид титана 49,915 — 900
• (разл.)
TiD2 Дидейтерид титана 51,93 — —
TiT2 Дитритид титана 53,94 — —
TiH4 Тетрагидрид титана 51,93 — —
TiC Карбид титана 59,91 3140 4300
Ti2OC Карбоксид титана 123,81 — —
TiP Монофосфид титана 78,87 — —
Ti2P Гемифосфид титана 126,77 — —
TiAs Аренд титана 122,82 —
V214*
419
Продолжение
Формула Название Молеку- лярный вес Температура, °C
плавления кипения
TiSb Моностибид титана 169,65
Ti4Sb Субстибид титана 313,35 — —
Ti3Bi Субвисмутид титана 362,68 1340 (разл.) —
TiB Моноборид титана 58,71 2060 (разл.) —
Ti2B Гемиборид титана 106,61 — —
TiSi Моносилид титана 75,985 1760 (разл.) —
TiGe Моногермаиид титана 120,49 — —
Ti2Sn Титан-олово (2:1) 214,49 1500 (разл.) —
Ti3Sn Титан-олово (3:1) 262,39 1663 —
Ti2Pb Титан-свинец (2:1) 302,99 1260 —
Ti.Pb Титан-свинец (4:1) 398,79 1305 (разл.) —
TijGa Титан-галлий (2: 1) 165,52 1562 —.
Ti3Ga Титан-галлий (3:1) 213,42 1030 (разл.) —
Ti3In Титан-индий (3:1) 253,52 — —
TiBe Монобериллид титана 56,91 1500 —
TiBe2 Дибериллид титана 65,925 1300 —
TiZn Титан-цинк (1:1) 113,27 — —
TiZn2 Титан-цинк (1 : 2) 178,64 — —
TiHg Титан-ртуть (1 : 1) 248,49 разл. —
Ti3Hg Титан-ртуть (3:1) 344,29 760 (разл.) —
TiCu Титан-медь (1 : 1) 111,45 1000 —
TiAg Титан-серебро (1:1) 155,77 1045 (разл.) 1490 —
TiAu Титан-золото (1:1) 442,87 —
TiAu2 Титан-золото (1:2) 441,835 1455 —
Ti3Au Титан-золото (3:1) 340,67 1392 —
TiNi Титан-никель (1:1) 106,61 1240 —
TiCo Титан-кобальт (1 :1) 106,83 1450 —
TiCo2 Титан-кобальт (1 : 2) 165,77 1260 —
TiFe Титан-железо (1 : 1) 103,75 1500 —
TiFe2 Титан-железо (1:2) 159,595 1480 —
TiRu Титан-рутений (1 : 1) 148,97 — —
TiPt Титан-платина (1:1) 242,99 1830 —
TiOs Титан-осмий (1:1) 238,1 — —
Tilr Титан-иридий (1 : 1) 240,1 — —
TiMn Титан-марганец (1 : 1) 102,84 1200 (разл.) —
TiMn2 Титан-маргаиец (1 :2) 157,78 1330 —
TiCr2 Титан-хром (1:2) 151,89 1350 (разл.) —
AlTi Алюминий-титан (1:1) 74,88 1460 (разл.)
420
2. Плотность и термическое расширение твердого титана
Коэффициенты расширения, град-1
tt °C Плотность, 3/СЛ43 Удельный объем, см^а объемного X 105 линейного (истинн.)Х 10е
средний (интегр.) ИСТИННЫЙ (диффер.) по оси а по оси с
-200 4,5352 0,22051 1,920 1,014 3,06 3,70
-150 4,5318 0,22066 2,109 1,560 4,70 5,70
-120 4,5295 0,220775 2,202 1,821 5,49 6,65
-100 4,5277 0,22086 2,259 1,965 5,92 7,18
-80 4,5258 0,220955 2,286 2,091 6,30 7,64
-70 4,5249 0,22100 2,318 2,150 6,49 7,83
-60 4,5239 0,22105 2,336 2.202 6,64 8,04
-50 4,5228 0,22110 2,349 2,250 6,78 8,22
— 40 4,5218 0,22115 2,370 2,295 6,92 8,38
-30 4,5208 0,22120 2,398 2,334 7,03 8,53
-20 4,5197 0,22125 2,404 2,372 7,15 8,66
-10 4,5186 0,22131 2,421 2,406 7,25 8,79
0 4,5175 0,22136 2,436 2,436 7,34 8,90
5 4,5169 0,22139 2,443 2,450 7,38 8,95
10 4,5164 0,221415 2,451 2,463 7,42 9,00
15 4,5159 0,22144 2,458 2,476 7,46 9,05
20 4,5153 0,22147 2,465 2,488 7,50 9,09
25 4,5147 0,22150 2,472 2,500 7,54 9,13
30 4,5142 0,22152 2,478 2,511 7,57 9,17
35 4,5136 0,22165 2,484 2,520 7,60 9,21
40 4,5130 0,22158 2,490 2,529 7,62 9,24
50 4,5119 0,22164 2,501 2,547 7,67 9,31
60 4,5107 0,221695 2,511 2,562 7,72 9,36
70 4,5096 0,22175 2,521 2,576 7,76 9,41
80 4,5084 0,22181 2,531 2,589 7,80 9,46
00 4,5072 0,22187 2,541 2,599 7,83 9,49
100 4,5060 0,22193 . 2,551 2,607 7,86 9,52
120 4,5037 0,22204 2,570 2,622 7,90 9,58
150 4,5001 0,22222 2,595 2,637 7,95 9,63
200 4,4940 0,22252 2,612 2,658 8,01 9,70
250 4,4881 0,22281 2,629 2,694 8,12 9,84
300 4,4819 0,22312 ' 2,646 2,769 8,35 10,12
350 4,4759 0,22342 2,662 2,805 8,46 10,26
400 4,4697 0,22373 - 2,679 2,84 8,56 10,39
500 4,4565 0,22439 2,737 3,18 9,59 11,6
600 4,4414 0,22515 2,854 3,80 11,5 13,9
too 4,4228 0,22610 3,058 4,82 14,6 17,6
8Q0 4,3987 0,22734 3,377 5,72 17,3 20,9
880 4,3738 0,22863 - 3,732 7,09 21,3 25,9
882,5а 4,3730 0,22867 3,744 7,13 21,5 26,1
882,50 4,3221 0,23137 4,12 3,98 13,3
000 4,3191 0,23153 4,12 3,97 13,2
1000 4,3020 0,23245 4,12 3,96 13,2
1100 4,2851 0,23337 4,12 3,94 13,1
1200 4,2682 0,23429 4,12 3,93 13,1
14 Зак. 1128
421
3. Упруго-прочиостные свойства а-титана
л °C Предел текучести а0,2’ Мн[JU? Предел прочности МнАм2 Относитель- ное удлинение, % Сужение площади поперечного сечения, % Твердость по Бринеллю, Мн!м2
х. ч. техн.
-200 436 628 11,4 28,0 2280
-150 343 517 25,0 55,8 1990
-100 268 420 36,0 70,4 1740 —
-50 209 337 44,4 76,5 1525 2710
0 165 268,5 50,0 78,7 1353 2470
20 151 245 51,5 78,0 1294 2372
50 134,5 214 53,0 77,0 1221 2235
100 115 173,5 53,2 72,7 1123 2001
150 105 186 49,4 69,0 1059 1765
200 101 184,5 38,3 66,0 1010 1559
250 102 169 39,2 55,0 990 1373
300 102 156 35,3 51,7 971 1201
350 101 143 30.7 51,5 942 1059
400 96,1 129,5 26,7 55,4 902 961
450 86,8 123 23,3 62,0 833,5 892
500 57,9 125,5 20,5 73,8 726 863
550 42,9 97,9 23,0 73,5 549 843
600 38,2 80,4 35,0 72,5 461 824
4. Термодинамические свойства твердого титана
Т. °К О О ит~ну кал/г-атом СР о Sy -ф*
кал/(град‘г-атом)
2 0,00006 0,0017 0,00004 0,00001
3 0,00022 0,0025 0,00010 0,00003
4 0,00076 0,0040 0,00025 0,00006
5 0,0019 0,0053 0,0005 0,00012
10 0,029 0,018 0,0038 0,0009
15 0,15 0,040 0,013 0,003
20 0,42 0,086 0,029 0,008
25 0,93 0,157 0,054 0,017
30 2,03 0,248 0,094 0,026
50 15,31 1,136 0,414 0,108
75 56,35 2,447 1,106 0,355
100 133,7 3,434 1,963 0,626
125 229,1 4,195 2,811 0,978
150 339,9 4,684 3,652 1,386
175 461,9 5,043 4,403 1,764
200 591,5 5,321 5,095 2,137
225 727,3 5,539 5,735 2,502
250 868,0 5,713 6,328 2,856
273,15 1001,9 5,854 6,841 3,172
275 1012,8 5,864 6,879 3.196
298,15 1149,3 5,978 7,329 3,474
300 1159,5 5,985 7,356 3,491
350 1444,7 6,15 8,257 4,104
400 1777 6,38 9,129 4,688
450 ' 2106 6,425 9,896 5,216
500 2445 6,62 10,600 5,71
422
Продолжение
Т, “К О о яг-я0, кал/г-атом СР О ST "ф*
кал/(град • г-атом)
600 3 084 6,92 11,78 6,64
700 3 875 7,12 12,85 7,31
800 4 487 7,30 13,80 8,19
900 5 229 7,55 14,73 8.92
' 1000 5 993 7,94 15,46 9,47
1100 6 840 8,30 16,29 10,07
1155 7311 30,0 16,70 10,37
1156 8 192 7,49 17,47 10,38
1200 8 547 7,52 17,76 10,64
1300 9 284 7,58 18,35 11,21
1400 10017 7,63 18,89 11,74
1500 10 785 7,68 19,43 12.24
1600 11 584 7,73 19,94 12,70
1700 12415 7,78 20,44 13,14
1800 13 284 7,82 20,94 13,56
1900 14 250 7,87 21,45 13,95
5. Термодинамические свойства газообразного титана
Т, °К кал/г-атом СР Sy -Ф*
кал/(град-атом)
10 49,68 4,9680 23,856 18,888
50 253,47 5,4630 31,972 26,903
100 555,78 6,4471 36,125 30,567
150 , 883,23 6,5555 38,779 32,891
200 11 205,6 6,3302 40,637 34,607
250 1 515,6 6,0600 42,020 35,958
298,15 1 801,8 5,8385 43,068 37,024
300 1 812,7 5,8310 43,104 37,062
350 2 099,8 5,6530 43,986 37,991
400 2 378,9 5,5218 44,735 38,788
450 2 652,3 5,4210 45,379 39,485
500 2 921,4 5,3441 45,946 40,104
600 3 450,0 5,2373 46,910 41,160
700 3 970,1 5,1700 47,712 42,041
800 4 484,8 5,1276 48,400 42,794
900 4 996,3 5,1040 49,002 43,451
1000 5 506,1 5,0963 49,539 44,033
1100 6016,1 5,1060 50,025 44,556
1200 6 527,8 5,1324 50,471 45,031
1300 7 043,1 5,1760 50,883 45,465
1400 7 563,6 5,2369 51,269 45,866
1500 8 090,0 5,3130 51,633 46,239
1600 8 626,7 5,4027 51,978 46,587
1800 9 727,9 5,6164 52,627 47,222
2000 10 875 5,8630 53,231 47,793
2500 13 976 6,5530 54,611 49,021
3000 17 435 7,2801 55,871 50,059
4000 25 424 8,6660 58,160 51,804
5000 34 660 9,7080 60,214 53,283
6000 44 680 — 62,041 . . 54,594
14’
423.
6. Теплопроводность титана
т, °к Теплопроводность, кал/(м-сек-град) Г, °к Теплопроводность, кал/(м-сек-град}
X, ч. техн. х, ч. техн.
1 0,26 0,05 150 7,78 3,52
2 0,52 0,10 200 7,12 4,08
3 0,78 0,15 250 6,58 4,18
4 1,04 0,20 273,15 6,40 4,20
5 1,30 0,25 300 6,20 4,17
10 2,60 0,50 350 5,90 4,12
15 3,90 0,75 400 5,70 4,09
20 5,20 0,99 500 5,39 4,04
25 30 6,50 7,80 1,22 1,44 Ж 5,26 5,20 4,04 4,09
40 8,62 1,84 800 5,19 4,20
50 8,80 2,16 900 5,21 4,33
75 8,68 2,78 1000 5,27 4,63
100 8,42 3,08 1100 5,41 4,99
7. Электропроводность и магнитная восприимчивость титана
Зависимость от температуры Зависимость от давления
t, °C а, Мсим/м X-106 Р, Мн/мЪ {t = 20° С) О’20> Мсим/м
X. ч. техн.
-200 11,90 8,00 2,96 0 1,80
-150 8,20 5,71 3,00 100 1,8?
-100 4,76 3,45 3,05 200 1,85
-50 3,36 2,50 3,10 300 1,87
-20 2,86 2,15 3,13 400 1,89
0 2,60 1,96 3,15 500 1,92
+ 10 2,49 1,89 3,16 600 1,94
20 2,38 1,80 3,17 700 1,96
25 2,33 1,75 3,18 800 1,98
50 2,12 1,61 3,20 1000 2,04
100 1,790 1,370 3,26 1500 2,17
150 1,550 1,183 3,32 2000 2,27
200 1,362 1,053 3,38 2500 2,44
250 1,222 0,943 3,44 3000 2,63
300 1,106 0,862 3,51 3500 2,78
400 0,937 0,738 3,65 4000 2,98
500 0,822 0,654 3,80 4500 3,28
600 0,744 0,599 3,96 5000 3,57
700 0,6935 0,559 4,13
800 0,6675 0,535 4,31
882 0,665 0,525 4,46
883 0,741 0,588 4,44
900 0,739 0,5865 4,50
950 0,734 0,583 4,73
1000 0,730 0,581 5,03
1050 0,726 0,580 5,25
1100 0,721 0,578 5,26
1200 0,717 0,575 5,25
424
8. Отражательная способность титана
Длина волны излучения» мкм Коэффициент отражения, % Длина волны излучения, мкм Коэффициент отражения, %
чистая напылен- ная пленка окислен- ная поверх- ность * полиро- ванная поверх- ность ** чистая напылен- ная пленка окислен- ная поверх- ность * полиро- ванная поверх- ность **
о,1 18 1,5 59 53,5 52
0,2 29,5 — 13,0 2,0 63 58 56
0,3 44 — 13,0 2,5 67 60 58
0,4 51,5 15.0 30,5 3,0 72 63 61,5
0,5 54 3.5 37,0 4,0 82 68,5 70
0,6 58 17,5 42,5 5,0 87 74 76,5
0,65 59 23,5 44,5 6,0 89,5 80 80
0,7 59 29,0 46,0 7,0 90,5 83 81,5
0,8 59 32,5 49,5 8,0 91 85 82
0,9 58,5 42,0 50,5 9,0 91,5 87 85
1,0 57,5 46,0 10,0 91,5 88 88
* Выдержана 3 ч при 300° в.
** Титан марки ВТ-1.
9. Температуры фазовых превращений в системе титан — кислород
Содержание кислорода Температура, °C
атомн. % вес. % Твердофазных превращений солидуса ликвидуса
0,0 0,0 882,5 1668 1668
3,0 1,0 920-1085 1700 1740
5,5 2,0 980-1740 1740 1770
10,0 3,5 1190 1740 1825
13,5 5,0 810 1740 1860
14,3 5,25 830 1770 1865
20,0 7,5 670 1900 1910
25,0 10,0 (Т13О) * 1940 1940
30,0 12,5 (Т13О) * 1890 1915
34,0 14,7 925-1700 1820 1890
36,0 15,8 925 1770 1870
40,0 18,2 925 1770 1835
43,0 20,0 925 1770 1805
46,0 22,1 925 1770 1770
48,0 23,5 925 1765 1775
50,0 25,0 991 1770 1770
54,0 28,0 700-780 1710 1740
56,0 30,0 200-650 1700 1700
59,0 32,4 200 - 650 1700 1860
60,0 33,3 200 1880 1880
62,5 35,7 177 1850 1850
64,0 37,2 177-642 1750 1800
64,8 38,0 177-642 1750 1750
66,7 40,0 642 1842 1842
‘ Твердая фаза на основе TijO неизменна.
425
10. Термодинамические свойства дихлорида титана
Г, °К О о кал/моль СР О -Ф*
калЦград'Молъ)
298,15 3 783 17,368 25,30 12,61
300 3816 17,384 25,39 12,67
400 5 580 18,043 30,17 16,22
500 7 400 18,50 33,94 19,14
600 9 260 18,88 37,31 21,88
700 11 170 19,22 40,07 24,11
800 13 100 19,54 42,97 26,60
900 15 080 19,84 45,48 28,72
1000 17 090 20,14 47,91 30,82
1100 19 115 20,44 50,42 33,04
1200 21 135 20,73 52,42 34,81
11. 1 Термодинамические сиойства одноокиси титана
о о СР О S у» -Ф*
Г, “к Нт~ Н ,
Т 0 кал/моль ка л/ {гр ад • моль)
50 12 0,744 0,285 0,045
60 19 1,065 0,50 0,18
70 , 27 1,438 0,64 0,25
80 42 1,858 0,87 0,34
100 98 2,814 1,48 0,50
120 169 3,768 2,10 0,69
140 265 4,845 2,87 0,98
160 364 5,890 3,49 1.21
180 485 6,788 4,22 1,53
200 626 7,430 4,91 1,78
220 781 7,965 5,65 2,10
240 946 8,395 6,38 2,44
260 1 123 8,713 7,07 2,75
280 1 306 9,190 7,77 3,11
298,15 1 473 9,556 8,33 3,39
300 1 490 9,592 8,38 3,42
350 1 976 10,318 9,87 4,17
400 2 553 10,851 11,44 5,04
500 3 693 11,627 13,98 6,58
600 4 884 12,296 16,15 8,01
700 6 112 12,868 18,02 9,29
800 7 383 13,167 19,74 10,51
900 8 703 13,651 21,27 11,60
1000 10 070 13,893 22,73 12,64
1100 11 493 14,183 24,08 13,63
1200 12 963 14,617 25,36 14,55
1300 15310 15,75 27,25 15,45
1400 16 900 16,05 28,41 16,33
1500 18 520 16,35 29,52 17,17
1600 20 170 16,65 30,59 17,98
1800 23 560 17,25 32,59 19,50
2000 27 070 17,85 34,47 20,90
426
12, Термодинамические свойства трихлорида титана
О нт- О СР о ~ф?
т, °к кал/молъ кал/(град‘молъ)
т г т г т г т г
298,15 4 994 3 721 23,22 16,91 33,40 76,25 16,63 63,76
300 5 040 3 760 23,23 16,93 33,55 79,35 16,7 63,8
400 7 390 5 500 23,71 17,8 40,3 81,4 21,7 67,3
500 9 780 7310 24,07 18,2 45,7 84,8 25,4 71,2
600 12 200 9 220 24,39 18,4 50,05 88,9 28,7 73,5
700 14 650 11 060 24,68 18,6 53,75 91,8 31,6 76,0
800 17 140 13 050 24,97 18,7 57,15 94,4 34,3 78,1
900 19 650 15 015 25,24 18,75 59,9 96,7 37,4 80,0
1000 22 180 16 955 25,52 18,8 62,8 98,8 40,6 81,9
1100 24 750 18 970 25,8 18,9 64,6 100,7 42,1 83,5
1200 — 20 880 — 18,9 — 102,4 — 85,0
1300 — 22 900 — — — 104,0 — 86,4
1400 — 24 810 — — — 105,4 — 87,7
1500 — 26 830 — — — 106,8 — 88,9
1600 — 28 760 — — — 108,0 — 90,0
1800 — 32 710 — — — 110,35 — 92,2
2000 — 36 670 — — 112,4 — 94,1
13. Магнитная восприимчивость трихлорида
и трибромида титана
t, °C X-I06 t, °C x-ioe
TiCl3 TiBr3 TiCI3 TiBrs
-200 0,775 0,37 20 7,00 2,08
-150 1,49 0,79 50 6,70 1,61
-100 2,07 1,36 100 6,23 1,53
-80 2,76 1,60 150 5,82 1,46
-60 4,18 1,83 200 5,49 1,38
-50 5,41 1,93 250 5,25 —
-40 7,19 2,02 300, 5,05 —
-30 7,46 2,09 350 4,74 —
-20 7,40 2,15 400 4,11 —
0 7,20 2,18 450 2,81 —
427
14. Термодинамические свойства полутораокиси титана
Г, °к О б нт -”<> Ср sT -Ф*
кал/(град-моль}
16 — 0,01 0,004
25 1.1 0,17 0,06 0,016
50 16 1,26 0,45 0,13
100 193 6,30 2,74 0,81
150 661 12,30 6,32 1,91
200 1 410 17,26 10,43 3,38
298,15 3 435 23,254 18,83 7,31
400 6 040 28,70 26,32 11,22
470 8 230 32,44 31,31 13,46
475 8 628 30,80 32,11 14,05
50Q 9 370 31,25 33,70 14,96
600 12 575 32,68 39,54 18,57
700 15 880 33,51 44,62 21,94
800 19 265 34,13 49,14 25,06
900 22 700 34,59 53,19 27,97
1000 26 180 34,96 56,85 30,67
1100 29 700 35,27 60,21 33,21
1200 33 240 35,53 63,29 35,59
1300 36 800 35,77 66,13 37,82
1400 40 380 35,98 68,79 39,95
1500 44 000 36,18 71,29 41,96
1600 47 620 36,38 73,62 43,86
1700 51 260 36,57 75,83 45,68
1800 54 920 36,74 77,93 47,42
2000 62 300 37,02 81,82 50,67
15. Термодинамические свойства тетрафторида титана
Г, °к О о нт-нг кал/моль СР sr -ф*
калКград-моль)
10 0,82 0,329 0,110 0,028
20 9,33 1,440 0,656 0,189
30 30,44 2,819 1,494 0,479
8 66,24 4,345 2,513 0,857
117,43 5,898 3,649 1,300
60 184,20 7,453 4,862 1,792
70 266,39 8,968 6,126 2,320
80 363,30 10,41 7,418 2,877
00 474,36 11,78 8,725 3,454
100 598,5 13,03 10,031 4,046
120 882,5 15,35 12,614 5,260
140 1 210,3 17,37 15,137 6,492
, 160 1 575,7 19,14 17,574 7,726
180 1 974,4 20,70 19,921 8,952
200 2 402,3 22,08 22,173 10,161
220 2 856,5 23,32 24,337 11,353
240 3 334,4 24,44 26,416 12,523
260 3 833,6 25,47 28,413 13,668
273,15 4 173,0 26,13 29,690 14,410
280 4 353,1 26,47 30,337 14,790
298,15 4 841,0 27,31 32,020 15,780
300 4 891,4 27,39 32,195 15,889
4ии (тв) 7 697 29,29 40,25 21,005
400 (г) 6617 22,50 80,90 62,905
600 11 241 — 90,25 71,515
800 16 107 — 97,25 79,616
428
16. Давление пара и теплота испарения тетрахлорида титани
t, °C Давление пара, ММ рт. ст. Теплота испарения, кал! г /, °C Давление пара, мм рт. ст. Теплота испарения, кал/г
-60 0,014 59,15 (субл.) 40 25,65 47,06
-50 0,045 59,15 (субл.) 50 40,1 46,94
-40 0,13 59,15 (субл.) 60 61,1 46,80
-30 0,36 59,15 (субл.) 70 90,8 46,64
-25 0,57 59,15 (субл.) 80 131,9 46,46
-23,22 0,67 47,35 90 187,7 46,26
-20 0,83 47,35 100 262 46,04
-10 1,65 47,35 НО 360 45,80
0 3,09 47,35 120 486 45,54
+ 10 5,55 47,30 130 646 45,26
15 7,30 47,28 135,9 760 45,09
20 9,57 47,25 140 852 44,97
25 12,45 47,21 150 1112 44,68
30 15,93 1 47,16
17. Плотность
и термическое расширение тетрахлорида титана
t, °C Плотность, a/C-w3 Удельный объем, см$/г Коэффициент расширения X 104 град""1
средний истинный
-273 2,2000 0,4545 2,900 0,290
-200 2,1730 0,4602 3,370 3,375
-150 2,1290 0,4697 3,210 4,645
-100 2,0780 0,4812 2,445 4,625
-80 2,0600 0,4854 2,035 4,135
-60 2,0445 0,4891 1,486 3,324
-50 2,0383 0,4906 1,175 2,842
-40 2,0331 0,49186 0,835 2,154
-30 2,0294 0,49275 0,515 1,424
-25 2,0282 0,49305 0,379 1,014
-23,22 (т) 2,0279 0,49312 0,335 0,852
-23,22 (ж) 1,7993 0,55577 9,081 —
-20 1,7943 0,55732 9,169 —
-15 1,7861 0,55988 9,342 9,341
-10 1,77785 0,56248 9,390 9,388
-5 1,7696 0,56510 9,439 9,437
0 1,7613 0,56776 9,489 9,489
+5 1,7530 0,57044 9,541 9,544
10 1,7446 0,57318 9,595 9,603
15 1,7363 0,57594 9,649 9,665
20 1,7279 0,57875 9,704 9,730
25 1,7195 0,58158 • 9,759 9,799
30 1,7110 0,58445 9,817 9,871
35 1,7026 0,58735 9,876 9,946
40 1,6941 7,59029 9,937 10,025
45 1,6856 0,59326 9,999 10,107
50 1,6770 0,59630 10,064 10,192
60 1,6599 0,60246 10,197 10,374
70 1,6426 0,60880 10,334 10,569
80 1,6251 0,61533 10,480 10,777
90 1,6076 0,62206 10,633 10,998
100 1,5898 0,62901 10,794 11,234
429
Продолжение
Л °C Плотность, г/см3 Удельный объем, см3/г Коэффициент расширения X 104 град"1
средний истинный
но 1,5719 0,63619 10,963 11,483
120 1,5537 0,64358 11,139 11,745
130 1,5354 0,65130 11,326 12,020
140 1,5168 0,65924 11,520 12,310
150 1,4980 0,66751 11,720 12,613
18. Вязкость и поверхностное натяжение тетрахлорида титана
t, °C Кинематическая ВЯЗКОСТЬ X 107, м2/сек Динамическая ВЯЗКОСТЬ, пз Поверхностное натяжение, н/м
-20 7,180 0,01290
-10 6,410 0,01140 0,03654
0 5,750 0,01012 0,03528
10 5,230 0,00912 0,03403
20 4,780 0,00826 0,03279
30 4,420 0,00756 0,03156
40 4,145 0,00702 0,03034
50 3,847 0,00645 0,02914
60 3,513 0,00583 0,02795
70 3,142 0,00516 0,02678
80 2,942 0,00478 0,02562
90 2,794 0,00449 0,02448
100 2,656 0,00422 0,02337
ПО 2,515 0,00395 —
19. Термодинамические свойстиа тетрахлорида титана
Т, °К О о ”т~н<у кал/моль СР О
калЦград'Молъ}
Жидкий
250 7514 34,58 58,90 28,84
290 8 899 34,68 60,06 29,37
298,15 9 182 34,70 60,31 29,51
300 9 246 34,71 60,36 29,54
310 9 593 34,74 60,68 29,73
320 9 941 34,76 61,00 29,93
330 10 288 34,79 61,33 30,15
340 10 636 34,81 61,66 30,38
350 10 985 34,84 62,00 30,62
360 11 232 34,87 62,35 31,15
380 12 032 34,92 63,08 31,42
400 12 730 34,97 63,85 32,03
Г азообразный
250 4 040 21,66 77,335 61,18
298,15 5 120 22,815 84,186 67,01
300 5 160 22,84 84,41 67,21
400 7510 24,04 91,07 72,40
500 9 960 24,60 96,86 76,94
600 12 420 24,92 101,02 80,32
700 14 940 25,12 104,65 83,31
430
Продолжение
т, °к 0 о яг-я0, кал/моль СР о -Ф*
кал/(град-молъ)
Г азообразный
800 17 460 25,27 108,25 86,45
900 19 990 25,37 111,45 89,24
1000 22 540 25,45 113,93 91,39
1100 25 090 25,52 116,40 93,59
1200 27 650 25,57 118,59 95,55
1300 30 210 25,62 120,70 97,46
1400 32 780 25,67 122,54 99,13
1500 35 350 25,71 124,35 100,78
1600 37 920 25,75 125,97 102,27
1700 40 480 25,78 127,50 103,69
1800 43 060 25,82 129,00 105,08
1900 45 640 25,85 130,40 106,38
2000 48 210 25,88 131,71 107,60
3000 74 400 — 142,16 117,36
20. Температура кристаллизации в системах Т1С14—С12,
Т1С14—Вг2 и Т1С14—12
Температура, °C
Содержание TiCl4, мол. % Т1С14—С12 Т1С14—Вг2 Т1С14-12
ликвидуса солидуса ликвидуса । солидуса ликвидуса солидуса
100 -23,22 -23,22 -23,22 -23,22 -23,22 -23,22
99,8 -23,35 — -23,35 — -23,4 -23,4
99 -23,8 — -23,8 — +3,3 -23,4
98 -24,4 — -24,4 — 23,2 -23,4
97 -24,9 — -24,9 — 35,9 -23,4
96 -25,5 -108- —25,5 -47,6 45,0 — 23,4
95 -26,1 -108 -26,2 -47,6 51,7 -23,4
90 -28,9 -108 -29,6 -47,6 75,8 -23,4
85 -31,8 -108 -34,1 -47,6 91,1 -23,4
80 -34,8 -108 -40,2 -47,6 100,2 -23,4
75,2 -37,8 -108 -47,6 -47,6 106,0 -23,4
70 -41,2 -108 -42,9 -47,6 109,7 -23,4
66,7 -43,6 -108 -41,9 -41,9 111,1 -23,4
66 -44,1 -108 -43,0 -44,2 111,3 -23,4
65,2 — 44,7 -108 — 44,2 -44,2 111,6 -23,4
60 -48,8 -108 -38,4 -44,2 112,7 -23,4
55 -53,4 -108 -35,0 -44,2 113,2 -23,4
50 -58,6 -108 -32,4 -44,2 113,5 -23,4
45 -64,6 -108 -29,8 -44,2 —
40 -71,7 -108 -26,8 . -44,2
35 -79,9 -108 -22,2 -44,2
33,3 -83,0 -108 -20,3 -20,3
30 -89,5 -108 -22,5 -24,0
28,3 -93,1 -108 -24,0 -24,0 —
25 -100,8 -108 -21,2 -24,0 —
22,2 -108 -108 -19,2 -24,0 —
20,0 -107,5 -108 -17,8 -24,0
15 -106,5 -108 -14,9 -24,0
10 -105 -108 -12,4 -24,0 — —.
5 -104 -9,9 — — —
0 -102,4 -102,4 -7,3 -7,3 113,7 113,7
431
432
21. Температуры кристаллизации и кипения в системах
TiCl4—СС14, TiCI4—SiCl4, TiCl4—GeCl4 и TiCl4—SnCl,
Содержа- ние T1CI4, Температура, °C
TiCI4-CCl4 Т1С14—S1C14 -TiCl4-GeCl4 TiCI4-SnCi 4
мол. % солидус ликвидус | кипения солидус | ликвидус | кипения солидус | ликвидус | кипения солидус | ликвидус | кипения
100 —23,2 — 23,2 135,9 —23,2 -23,2 13519 -23,2 -23,2 135,9 -23,2 -23,2 135,9
99 — -23,9 135,1 -24,0 -23,7 134,0 -24,8 -23,55 135,1 -24,3 -23,8 135,6
98 — -24,6 134,3 -24,8 -24,1 132,2 -26,3 -23,9 134,4 -25,2 -24,4 135,35
95 -66,1 -26,6 132,0 -27,0 -25,5 126,8 -30,0 -25,0 132,1 -27,4 -25,9 134,6
90 -66,1 -30,0 128,1 -30,5 -27,8 118,4 -34,4 -26,7 128,5 -29,4 -27,3 133,6
80 -66,1 -36,8 120,3 -36,8 -32,5 103,9 -38,2 -30,0 121,6 -31,6 -28,3 131,3
70 -66,1 -43,6 112,8 -42,5 -37,2 92,4 -43,1 -33,2 115,1 -33,9 -29,7 129,2
60 -66,1 -50,5 105,6 -47,8 -42,0 83,9 -46,2 -36,3 109,1 -34,5 -31,2 127,0
50 -66,1 -57,8 98,9 -52,8 -47,0 78,4 -47,8 -39,2 103,6 -34,8 -31,6 125,1
42 -66,1 -66,1 94,0 -56,6 - 51,1 76,2 -48,6 -41,5 99,6 -35,0 -32,2 123,6
40 -66,1 -65,6 92,9 -57,5 -52,1 75,2 -48,7 -42,0 98,6 -35,0 -32,3 123,2
30 -66,1 -58,2 87,7 -61,9 -57,3 70,1 -49,0 -44,6 94,0 -35,1 — 32,8 121,1
20 -66,1 -47,2 83,3 -65,6 -62,1 65,9 -49,4 -47,1 89,4 -35,2 -33,5 119,3
10 -66,1 -34,8 79,6 -68,4 -66,4 60,5 -50,15 — 49,45 86,3 -35,4 -34,8 117,4
5 -66,1 — 28,8 78,1 -69,3 -68,2 58,8 -50,8 -50,6 84,65 -35,4 -35,1 116,5
4 — -27,6 77,8 -69,4 -68,5 58,5 -50,8 -50,8 84,3 -35,4 -35,15 116,3
3 — -26,4 77,5 -69,5 -68,8 58,2 -50,7 -50,25 84,0 -35,4 -35,15 116,2
2 — -25,2 77,2 -69,6 -69,1 57,8 -50,4 -49,8 83,7 -35,4 -35,2 116,0
1 — -24,0 76,9 -69,6 -69,4 57,5 -50,0 -49,6 83,4 -35,4 -35,3 115,8
0 -22,9 -22,9 76,6 -69,6 -69,6 57,2 -49,5 -49,5 83,1 -35,4 -35,4 115,6
22. Температура растворения в системе Т1С14—SO2
Содержание SO2, мол. %
1, °C в кристаллизую- в равновесных ЖИДКИХ слоях в кристаллизую-
щейся жидкости на основе Т1СЦ на основе Т1СЦ на основе SOa щейся жидкости на основе S62
12,0 11,9 11,8 11,5 11,0 10 8 6 4 0 -5 -10 -15 -20 -25 -28 -30 -31,4 -35 -40 -45 -50 -55 60 3,7 9,6 13,4 16,0 66,0 64,8 61,0 58,3 54,5 51,3 47,7 44,2 40,8 34,0 28,9 25,5 23,1 21,2 19,1 17,6 16,3 16,0 68,2 69,8 72,6 76,1 79,3 84,3 89,2 89,9 90,4 91,2 92,5 93,8 94,6 95,4 96,2 96,7 97,2 97,5 97,5 98,3 98,9 99,2 99,4 99,5 99,6
23. Температура кристаллизации в, системе Т1С14—С0Н0
Содержание СбНа в жидкой фазе, мол. % Температура, °C Состав кристаллов
ликвидуса солидуса
0 -23,22 -23,22 TiCl4
10 -27,3 -38,7 То же
20 -36,8 -38,7
21,5 -38,7 — 38,7 Эвтектика
TiCl4 + С0Н9 • ЗТ1С14
25 -35,9 -35,9 ' С0Н0 • ЗТ1С14
30 -37,9 -38,9 C9H9-3TiCl4
31,5 -38,9 -38,9 Эвтектика
С0Н0 • 3TiCI4 + С0Н9
40 -33.2 -38,9 С6Н6
50 -26,4 -38,9 С6Н6
60 -19,7 -38,9 с9н9
70 -13,2 -38,9 с0н9
75 -10,0 —1 с.нв
80 -6,8 —• с9н0
90 -0,6 — с9н.
100 +5,5 +5,5 С»н9
433
24. Физические свойства тетрабромида титана
,t. °с Давление пара, Плотность, Вязкость, Теплоемкость,
мм рт. ст. г!см$ спз кал/е^град
25 0,13 3,370 тверд. 0,0855
40 0,74 2,953 1,915 0,0994
50 1,31 2,9305 1,723 0,0999
60 2,22 2,908 1,566 0,1003
70 3,65 2,8855 1,439 0,1007
80 5,84 2,863 1,331 0,1011
90 9,12 2,8405 1,240 0,1016
100 13,9 2,818 1,162 0,1020
ПО 20,7 2,7955 1,096 0,1024
120 30,2 2,773 1,041 0,1028
130 43,4 — — 0,1033
140 61,1 — — 0,1037
150 84,3 — — 0,1041
160 114,5 —
170 150,8
180 206
190 269
200 350 — —
210 449 — —
220 571- — — —
25. Температура растворения в системе TiBr4—SO2
Содержание SO2, мол. %
t, °C в кристаллизую- щейся жидкости в равновесных жидких слоях в кристаллизую- щейся жидкости
на основе Т1Вг4
на основе TiBr< на основе SO2 на основе SOa
103,8 73,9 75,6
103,5 70,0 76,9
103 68,8 78,9
102 66,4 81,1
100 62,05 84,6
95 53,3 88,1
90 48,4 90,1
85 44,5 91,6
80 40,9 92,9
70 34,8 94,9
60 29,6 96,2
50 25,0 97,0
45 22,8 97,35
40 20,2 97,7
35 6,3 17,5 98,0
32 10,1 15.8 98,2
30 13,3 14,5 98,3
29,4 14,2 14.2 98,3 98,3
25 98,7
20 99,0
15 99,28
10 99,46
5 99,58
0 99,66
-5 99,71
-10 99,75
-15 99,79
-20 99,83
434
26. Температуры кристаллизации и кипения в системе TiCl4—TiBr4
Содержание TiBr4, мол. % Температура, °C Содержание TiBr4 в парах при кипе- нии, мол, %
солидуса ликвидуса кипения
0 -23,22 -23,22 135,9 0,00
5 -23,2 -23,0 139,6 0,32
10 -23,1 -22,7 143,4 0,73
15 -22,8 -21,8 147,0 1,27
20 -21,8 -19,8 151 1,96
25 -19,4 -19,4 155 2,84
30 -19,3 -15,0 159 3,95
35 -18,8 -11,5 163 5,33
40 -16,9 -8,7 167 7,03
45 -13,0 -6,7 171 9,06
50 -5,7 -5,7 175,5 11,50
55 -5,5 + 1,4 180 14,49
60 -4,8 6,6 185 18,59
65 -3,1 10,6 190 23,31
70 + 2,6 12,8 196 29,29
75 13,4 13,4 202 36,11
80 14,9 20,6 208 44,61
85 18,9 25,9 214 54,45
90 25,1 30,4 220 66,97
95 31,6 34,5 226 81,49
100 38,25 38,25 232,6 100,00
27. Некоторые физические свойства тетраиодида титана
t, °C Давление пара, мм рт. ст. Плотность, г/см3
160 3,3 3,405
170 4,8 3,383
180 6,9 3,361
190 9,6 3,339
200 13,2 3,317
210 18,0 3,295
220 23,8 3,273
230 32,0 3,251
240 42,0 3,229
250 55,0 3,2075
260 71,5 3,186
270 90,5 3,164
280 112 3,142
290 143 3,120
300 177 3,098
310 218,5 —
320 261 —
330 310 —
340 398 —
350 472 —
360 565 —
435-
28. Термодинамические свойства двуокиси титана
О нг- О -Яп, с р 5 О т -ф*
т, °к кал!молъ калЦград-моль}
рутил анатаз рутил анатаз рутил анатаз рутил анатаз
50 19 18 1,45 1,17 2,25 2,23 1,87 1,87
100 163 163 4,43 4,52 4,39 4,36 2,76 2,73
150 464 472 7,57 7,62 6,40 6,40 3,31 3,25
200 912 919 10,05 10,00 8,24 8,34 3,68 3,75
250 1 465 1 467 11,80 11,56 10,08 10,16 4,18 4,29
273,15 1 746 1 746 12,43 12,28 11,13 11,03 ' 4,74 4,63
298,15 2 072 2 070 13,20 13,23 12,01 11,93 5,06 4,99
300 2 096 2 094 13,25 13,28 12,11 11,98 6,08 6,01
400 3612 3 610 15,21 15,24 16,44 16,36 7.41 7,34
500 5 172 5 170 16,18 16,20 19,96 19,84 9,62 9,50
600 6 807 6 805 16,74 16,78 22,90 22,82 11,55 11,48
700 8512 8510 17,12 17,17 25,56 25,45 13,14 13,29
800 10 230 10 240 17,41 17,47 27,82 27,75 15,03 14,45
900 11 970 12 000 17,63 17,71 29,91 29,82 16,61 16,49
1 000 13 720 13 790 17,82 17,91 31,71 31,71 17,99 17,92
1 100 15 490 15 600 17,98 18,09 33,44 33,44 19,36 19,26
1 200 17 270 17 420 18,13 18,25 34,95 35,02 20,56 20,50
1 300 19 070 19 250 18,27 18,40 36,43 36,48 21,76 21,67
1 400 20 890 — 18,40 — 37,74 22,82
1 500 22 730 — 18,53 — 39,05 23,96
1 600 24 610 — 18,65 40,21 24,83
1 700 26 510 — — — 41,41 25,82
1 800 28 410 — 18,88 — 42,45 26,67
2 000 32 320 — — — 44,51 — 28,05 —
29. Термодинамические свойства дисульфида титана
т, °к Q О НТ ~ Н0' кал/моль СР 3° -ф*
кал/(моль-град)
50 48 2,86 1,32 0,36
100 322 7,98 4,93 1,71
150 825 11,83 8,95 3,45
200 1 480 14,11 12,68 5,28
250 2 220 15,40 15,97 7,09
298,15 2 983 16,23 18,73 8,72
300 3015 16,28 18,84 8,79
350 3 843 17,65 21,48 10,43
400 4 783 19,02 23,89 11,94
450 5 633 17,30 25,94 13,39
500 6 523 17,56 27,78 14,74
600 8 333 18,07 31,08 17,20
700 10 193 18,59 33,95 19,39
800 12 073 19,10 36,46 21,37
900 13 983 19,62 38.71 23,18
1 000 15 953 20,18 40,78 24,83
1 100 18 003 20,64 42,73 26,37
436
30. Температуры фазовых превращений в системе
титаи—водород
Содержание водорода Температура, °C
атоми. % вес. % твердофазных превра- щений диссоциации (рН2=1 атм)
0,0 0,00 882,5 (а - ₽)
7,8 0,18 319-790 —
10 0,23 319-760 1150
15 0,37 319-700 1105
20 0,52 319-635 1060
30 0,89 319-505 960
40 1,38 319-370 835
44 1,62 319 770
49 1,98 319-640 640
50 2,06 280-350 640
60 3,06 640 640
66,7 4,04 400 400
70 4,68 — 280
31. Термодинамические свойства дигидрида титана
О о СР О со -ф*
т, °к п0’
кал!моль калКград'Моль)
25 1,10 0,153 0,065 0,021
30 2,07 0,237 0,099 0,030
40 5,64 0,495 0,197 0,056
50 12,33 0,850 ' 0,339 0,092
60 22,96 1,282 0,528 0,145
70 38,22 1,780 0,761 0,215
80 58,32 2,235 1,028 0,299
90 82,89 2,665 1,315 0,394
100 111,4 3,030 1,612 0,498
120 178,7 3,685 2,223 0,734
140 258,0 4,227 2,834 0,991
160 347,0 4,640 3,427 1,258
180 443,8 5,037 3,999 1,534
200 548,4 5,430 4,551 1,809
220 661,0 5,827 5,087 2,082
240 781,6 6,240 5,611 2,354
260 910,6 6,673 6,129 2,627
273,15 1000,4 6,994 6,466 2,804
280 1049,0 7,190 6,641 2,895
298,15 1181,7 7,191 7,101 3,138
300 1195,0 7,232 7,146 3,163
320 1344 7,665 7,624 3,424
340 1502 8,100 8,100 3,684
360 1668 8,535 8,574 3,941
380 1841 8,956 9,046 4,201 ;
437
32. Термодинамические свойства нитрида титана
Г, °к О о " Н0' кал/моль ср , ST -ф*
кал/(гр ад’ моль)
50 6 0,56 0,15 0,03
100 78 2,58 1,07 0,29
150 263 4,75 2,53 0,79
200 546 6,58 4,14 1,43
250 908 7.87 5,72 2,12
298,15 1 311 8,966 7,193 2,80
300 1 330 9,00 7,24 2,82
350 1 800 9,90 8,69 3,56
400 2 310 10,49 10,07 4,34
450 2 850 10,91 11,34 5,06
500 3 400 11,23 12,51 5,71
600 4 540 11,67 14,57 7,05
700 5 720 11,98 16,38 8,23
800 6 920 12,21 17,97 9,40
900 8 150 12.40 19,40 10,43
1 000 9 400 12,56 20,75 11,40
1 100 10 650 12,71 21,91 12,31
1 200 11 940 12,83 23,03 13,16
1 300 13 230 12,96 24,08 13,96
1 400 14 530 13,08 25,06 14,72
1 500 15 850 13,19 25,97 15,45
1 600 17 170 13,30 26,82 16,13
1 700 18510 13,41 27,62 16,79
1 800 19 840 13,51 28,38 17,41
2 000 22 570 13,72 29,83 18,54
33. Термодинамические свойства карбида титана
т, °к О о НТ ~ Н0’ СР О зг -фт
кал/моль кал/(град-моль)
50 3 0,22 0,08 0,02
100 48 1,76 0,64 0,16
150 186 3,77 1,69 0,45
200 420 5,57 3,07 0,97
250 736 7,03 4,48 1,54
298,15 1 102 8,11 5,80 2,105
300 1 118 8,15 5,86 2,13
350 1 544 9,18 7,17 2,76
400 2 043 9,97 8,42 3,31
450 2510 10,47 9,60 4,02
500 3 028 10,85 10,69 4,63
600 4124 11,35 12,68 5,81
700 5 280 11.69 14,46 6.92
800 6 463 11,93 16,04 7,96
900 7 680 12,12 17,47 8,94
1 000 8 920 12,28 18,77 9,85
1 100 10170 12,41 20,02 10,77
1 200 И 430 12,54 21,06 11,54
1 300 12 690 12,66 22,12 12,36
1 400 13 960 12,77 23,02 13,05
1 500 15 230 12,87 23,90 13,75
1 600 16 500 12,97 24,71 14,40
1 700 17 770 13,07 25.47 15,02
1 800 19 040 13,16 26,20 15,62
2 000 21 570 — 27,54 16,76
438
34. Температуры фазовых превращений в системе
титаи — хром
Содержание хрома Температура, °C
атомн. % вес. % твердофазных превращений солидуса ликвидуса
0,0 0,0 882,5 (а - Р) 1668 1668
0,5 0,5 670-870 1662 1664
10 10,7 670 1560 1590
20 21,3 670-895 1480 1520
30 31,7 670-1190 1430 1460
40 41,9 670-1240 1410 1415
48 50,0 670-1320 1400 1400
50 52,0 670-1330 1400 1400
60 61,9 1345 1400 1455
66,7 68,4 1350 1405 1535
70 71,7 1345 1410 1575
80 81,3 1325 1535 1685
90 90,7 1190 1705 1785
100 100,0 — 1875 1875
35. Температуры фазовых превращений в системе
титан — марганец
Содержание марганца Температура, °C
атоми. % вес. % твердофазных превращений солидуса ликвидуса
0,0 0,0 882,5 1668 1668
0,5 • 0,5 550-876 1665 1665
5,0 5,7 550-813 1545 1630
10,0 11,3 550-726 1440 1590
18,0 20,0 550 1305 1500
20,0 22,2 550-655 1275 1480
25,0 27,6 550 - 920 1220 1415
30,0 33,0 550 1175 1340
39,3 42,5 550 1175 1175
40.0 43,3 550 1175 1185
42,0 45,4 550 1175 1200
50,0 53,4 (TiMn) * ' 1200 1270
58,8 62,0 (TiMn + TiMn2) * 1200 1315
60,0 63,2 1100 1220 1320
66,7 69,6 (TiMn2) * 1330 1330
70,0 72,7 1185 1325
80,0 82,2 | (TiMn2 + та. р-р Мп) * 1185 1215
81,5 83,5 1185 1185
90,0 91,2 730 1185 1245
100,0 100,0 727-1095-1133 1243 1243
Твердые фазы данного состава неизменны.
439
36. Температуры фазовых превращений в системе титаи — железо
Содержание железа Температура, °C
атомн. % | вес. % твердофазных превращений солидуса ликвидуса
0,0 0,0 882,5 1668 1668
0,25 0,3 520-595-878 1655 1665
5,0 5,8 520-595-793 1475 1575
10,0 11,5 520-595-665 1320 1475
12,3 14,1 |520-595 1260 1430
19,0 21,4 520-595-1000 1135 1295
20,0 22,5 520-595-1000-1040 1125 1275
22,0 24,7 520-595-1000 1100 1235
28,5 31,8 520-595-1000 1100 1100
30,0 33,5 520-595-1000 1100 1140
33,3 36,8 520-1000 1100 1225
40,0 43,8 520-1000 1100 1360
50,0 53,8 (TiFe) * 1500 1500
57,5 60,0 61,2 63,6 ) (TiFe + TiFe2) * 1280 1280 1280 1375
66,7 70,0 TiFe2 1480 1480
70,0 73,1 690 1298 1460
78,5 81,0 690 1298 1298
80,0 82,3 690 1298 1310
84,0 86,0 690 1298 1345
90,0 91,3 690-1110 1370 1405
96,5 97,0 690 1470 1485
100,0 100,0 769-908-1390 1534 1534
* Твердые фазы данного состава неизменны.
37. Температуры фазовых превращений в системе титан — медь
Содержание меди Температура, °C
атомн. % | вес. % твердофазных превращений солидуса ликвидуса
0,0 0,0 882,5 (а-р) 1668 1668
1,6 2,1 798-860 1590 1640
5,5 7,1 798 1395 1570
10,0 12,8 798-920 1170 1490
13,4 17,0 798 990 1425
20,0 24,8 798 990 1295
30,0 36,3 798 990 1095
33,3 40,0 (Ti2Cu) * 990 1025
35,0 41,7 955 990
40,0 47,0 955 970
43,0 50,0 — 955 955
50,0 57,0 (TiCu) * 1000 1000
60,0 66,6 (Ti2Cu3)* 920 920
66,0 72,0 850 850
68,0 73,8 850 875
70,0 75,6 — 850 900
75,0 80,0 (TiCu3) * 875 960
80,0 84,1 875 1005
90,0 92,3 875 1065
93,5 95,0 875 1075
100,0 100,0 — 1083 1083
‘ Твердые фазы данного состава неизменны.
440
38. Свойства сплавов АТ*
АТЗ АТ4 АТэ АТ6
Плотность, г!см? ......... 4,50 4,46 4,40 4,36
Предел текучести, Л4«/л2 ......... 680—860 820—920 930 — 1030 980 — 1080
Предел прочности, Л4«/л2 ......... 730 — 880 880 — 980 980—1080 1080—1170
Относительное удлинение, % . 14—18 12 — 16 10—15 10 — 15
Относительное сужение, °/о .... 40—50 30—50 25—35 25—40
Твердость по Бринеллю, Гн/л2 . . . 2,5—3 3—3,5 3,1—4 3,5—4
Модуль упругости, Г«/л2................ НО 123 125 130
Теплопроводность, калЦм • сек град) 1,8 1,8 1,7 1,7
Удельная электропроводность,
KcumIm................................ 770 730 625 620
39. Твердость титано-железных сплавов
Содержание Ti, % . . Твердость по Бринеллю, Мн!мг 0,0 941 0,5 1167 1,0 1363 1 2,0 .696 1 3,0 4,0 986 2246 5,0 2501 6,0 27,36 7,0 2952
Содержание Ti, % • 8,0 9,0 10,0 11,0 12,0 13,0 14,0 15,0
Твердость по Бринеллю, Мн/м2 • 3089 3118 3158 3193 3256 3324 3399 3481
Содержание -Ti, % . . 16,0 17,0 18,0 19,0 20,0 21,0 22,0 23,0
Твердость по Бринеллю, Мн/м2 3579 3677 3795 3962 4207 4560 5008 5491
40. Механические свойства титановых сталей
Состав кованой стали. % Предел текучести, Мн/м2 Твердость по Бринеллю, Мн/М2 Коэффици- ент сопротивления разрыву, Мн/м2
Т1 С Мп Si р S
0,325 0,760 0,230 0,292 0,015 0,015 538 2030 922
0,415 0,122 0,180 0,047 0,018 0,015 332 971 399
0,640 0,695 0,240 0,256 0,025 0,024 516 2030 922
0,720 0,624 0,230 0,350 0,021 0,011 523 2080 860
0,879 0,106 0,140 0,163 0,020 0,015 369 1030 443
1,398 0,137 0,170 0,105 0,020 0,007 354 990 472
2,570 0,135 0,310 0,140 0,010 0,017 339 883 443
2,575 0,611 0,270 0,411 0,015 0,025 577 2080 886
4,630 0,635 0,315 0,346 0,013 0,018 567 2080 880
8,710 0,650 0,450 0,163 0,016 0,011 613 2430 1150
15 Зак. 1128
441
41. Термодинамические свойства метатитаиата натрия
т, °к о о ср О Sp _Ф* т
кал/моль кал/(град-моль)
50 50 3,18 1,29 0,29
100 420 11,56 6,15 1,95
150 1 187 18,80 12,23 4,32
200 2 259 23,73 18,34 7,04
250 3 538 27,28 24,04 9,89
298,15 4919 30,02 29,06 12,56
300 . 4 974 30,06 29,27 12,69
400 8 220 33,47 38,57 18,02
500 11670 35,54 46,26 22,92
600 15 670 36,15 53,54 27,42
700 19 370 37,85 59,24 31,57
800 23 240 39,55 64,40 35,35
900 27 280 41,25 69,16 38,85
1,000 31 490 42,95 73,59 42,10
110Q 35 870 44,65 77,77 45,16
2150 40 420 46,35 81,73 48,04
3100 45140 48,05 85,50 50,78
4100 66 640 46,9 101,88 54,28
lotto 71 330 46,9 105,12 57.57
42. Теплоемкость и энтропия ди- и трититаната натрия
т, °к СР О Sy
кал/{зрад’Моль)
МаяТТгОд NaaTijOy NaaTIgO?
50 100 1Й0 298,15 Зоо 400 Зоо 600 700 800 900 1000 1100 1200 1300 1400 1500 4,83 16,55 26,40 33,18 38,Об 41,68 41,75 49,27 51,01 52,28 53,32 54,25 55,11 55,92 56,71 57,47 68,50 68,50 68,50 7,23 22,27 34,75 43,62 50,06 54,85 54,90 64,19 66,52 68,28 69,76 71,0Э 72,34 73,54 74,70 75,84 7б,96 78,07 94,15 2,32 9,43 17,97 26,58 34,55 41,54 41,83 55,60 66,80 76,21 84,35 91,53 97,97 103,82 109,19 114,18 139,98 145,06 149,78 3,70 13,62 25,02 36,80 46,74 55,91 56,29 74,23 88,82 101,11 111,75 121,15 129,60 137,28 144,35 150,93 157,01 162,75 195,72
-442
43. Теплоемкость и энтропия титанатов магния
Г, °к СР О Sp
калЦгра З'моль}
М8зТ1О4 MgTlO3 MgT^Ofi Mg2T104 MgTiO3 MgTiaOs
50 1,66 1,17 2,70 0,63 0,40 1,06
100 8,33 6,00 11,00 3,78 2,71 5,48
150 16,13 11,71 19,62 8,81 6,20 11,84
200 22,55 16,29 26,40 14,81 10,19 18,91
250 27,33 19,64 31,46 21,69 14,18 26,59
298,15 30,76 21,92 35,15 27,52 17,82 33,21
300 30,87 22,02 35,27 27,73 17,96 33,46
400 35,07 25,52 39,77 37,13 25,01 44,08
500 37,47 27,32 42,34 45,26 30,87 53,29
600 39,17 28,44 44,16 52,29 35,92 61,27
700 40,53 29,25 45,62 58,44 40,37 68,27
800 41,72 29,89 46,89 63,90 44,31 74,56
900 42,80 30,44 48,05 68,83 47,85 80,03
1000 43,81 30,92 49,14 73,38 51,07 85,00
1100 44,78 31,36 50,19 77,65 54,04 89,77
1200 45,73 31,77 51,21 81,65 56,76 94,13
1300 46,65 32,17 52,21 85,40 59,29 98,26
1400 47,56 32,55 53,18 88,93 61,66 102,21
1500 48,46 32,92 54,15 92,24 63,91 105,96
44. Теплоемкость и энтропия метатитанатов кальция
и стронция
CP 0 Sj,
Г, °C кал/(град‘Молъ)
CaTlOj SrTlOs CaTlO» SrTiO3
50 2,50 4,12 0,98 2,02
100 8,71 10,74 4,55 6,95
150 14,37 15,71 9,21 12,36
200 18,42 19,22 13,97 17,42
250 21,36 21,74 18,44 22,04
298,15 23,34 . 23,51 22,38 25,99
300 23,44 23,58 22,54 26,15
400 26,83 26,02 30,11 33,27
500 28,47 27,25 36,24 39,16
600 29,43 27,99 ' 41,47 44,17
700 30,06 28,51 46,03 48,53
800 30,51 28,91 50,05 52,39
900 30,87 29,24 53,63 55,85
1000 31,16 29,52 56,86 58,99
1100 31,41 29,78 59,82 61,85
1200 31,64 30,02 62,56 64,47
1300 31,84 30,24 65,11 66,89
1400 32,03 30,46 67,48 69,13
1500 32,21 30,66 69,72 71,23
15*
443
45. Термодинамические свойства метатитаната бария
Г, °К -° О кал/моль СР О Sji -Ф* т
кал/(град‘Моль)
50 61 3,46 1,67 0,45
100 405 10,24 6,22 2,17
150 1 068 16,03 11,55 4,43
200 1 983 21,50 16,77 6,85
250 3 139 22,83 21,60 9,04
298,15 4521 24,49 25,82 10,66
300 4 566 24,55 25,99 10,77
400 7 220 26,98 33,58 15,53
500 9 970 28,22 39,72 19,78
600 12810 28,98 44,90 23,55
700 15 720 29,52 49,38 26,92
800 18 680 29,95 53,33 29,98
900 21 690 30,30 56,88 32,78
1000 24 730 30,61 60,08 35,35
1100 27 800 30,90 63,00 37.73
1200 30 900 31,16 65,70 39,95
1300 34 030 31,41 68,21 42,03
1400 37 180 31,65 70,54 43,98
1500 40 360 31,89 72,74 45,83
46. Теплоемкость и энтропия титанатов железа
ср О S?
т, °К калЦград'Моль)
Ре2ПТЮ4 FeHTiO3 Fe”IO2TiO3 FePTiO4 FeHTIO3 Fe”rO2TiOs
50 7,51 6,50 4,26 3,57 1,97 1,87
100 17,78 9,75 14,35 11,76 7,13 8,02
150 22,18 14,77 23,60 19,31 12,00 15,62
200 27,36 18,79 30,52 27,52 16,82 23,44
250 31,28 21,73 35,60 34,18 21,35 30,87
298,15 34,01 23,78 39,26 40,38 25,32 37,44
300 34,08 23,85 39,40 40,62 25,49 37,71
400 37,25 26,62 43,50 50,78 32,78 49,90
500 39,52 28,13 45,70 59,38 38,88 59,73
600 41,44 29,15 47,13 66,72 44,10 68,04
700 43,20 29,94 48,20 73,21 48,60 75,30
800 44,87 30,61 49,08 79,04 52,65 81,79
900 46,49 31,20 49,85 84,36 56,29 87,67
1000 48,08 31,75 50,55 89,67 59,66 93,04
400 49,65 32,27 51,16 93,85 62,70 97,97
1200 51,20 32,77 51,83 98,18 65,54 102,49
1300 52,74 33,25 52,43 101,32 68,19 106,67
1400 54,28 33,73 53,02 105,33 70,64 110,56
1500 55,81 34,20 53,59 109,25 72,99 114,20
444
47. Равновесие твердой и жидкой фаз в системе TiCI4—HCI
Содержание НС1 в жидкой фазе, мол. % Температура кристаллизации, °C Состав кристаллов
0,0 -23,22
5,0 -23,6
10,0 -24,25
15,0 -25,9
20,0 -28,7
25,0 -32,8 ; Tici4
30,0 -38,5
35,0 -46,1
40,0 -55,7
44,0 -65,1
48,0 -76,2
49,8 -81,7 Эвтектика Т1С1.! + Н2Т1С1в
50,0 -80,5
52,0 -69,2
55,0 -55,0
60,0 -38,8
65,0 66,67 -31,6 -30,8 Н2Т1С1в
70,0 -32,4
75,0 -42,7
78,0 -55,2
80,0 -66,9
82,8 -88,7 Эвтектика
Н2Т1С16 + Н6Т1С110
85,7 -86,0
88,0 -86,8
90,0 -89,0 H6TiCl10
95,0 -99,0
98,0 -109,0
99,34 -114,6 Эвтектика He,TiCll0 + НС1
100,0 -112,0 НС1
48. Давление диссоциации гексахлоротитанатов калия,
рубидия, цезия и таллия
t, °C Давление диссоциации, мм рт. ст. t, °C Давление диссоциации, мм рт. ст.
К2Т1С16 RbsTiClg Сз2Т1С10 Т12Т1С1в К2Т1С16 Rb2TiCl6 CsaTiClg Tl2TiCl6
300 1,1 0,015 0,2 500 451 26,5 6,6 417
325 2,9 0,05 — 0,7 525 760 51,2 14,2 820
350 7,1 0,16 0,02 2,1 550 1270 95,7 28,8 —
375 16,2 0,4 0,06 6,1 575 — 173,0 58,2 —
400 34,7 1,1 0,17 16,0 600 — 303 111,0 —
425 70,8 2,7 0,5 39,6 625 — 512 204,0 —.
450 135,0 6,0 1,2 90,8 645 — 760 323 —
475 251 12,9 2,8 198,0 685 — — 760 —
446
49. Давление диссоциации трисульфида титана
t, °C Полное и парциальные давления паров серы, мм рт. ст. t, °C Полное и парциальные давления паров серы, мм рт. ст.
р рс S2 Ч Зб р рс 32 Рс Зб PQ S3
480 33 15,5 16 2,5 530 347 123 178 46
490 52 24 25 4.8 540 542 180 285 77
500 84 36,5 39 8,5 547,5 760 240 406 114
510 137 55 67 15 550 840 260 452 128
520 219 83 ПО 26 560 1285 370 706 209
50. Давление паров тетраалкоксидов титана
Давление пара, мм рт. ст.
t, °C мет- оксид эток- сид пропоксиды бутоксиды w-пент- оксид «-гекс- оксид
н- изо- Н' изо- втор‘ трет-
100 0,3 0,9 7,2 5,8
110 — 0,7 1.6 14 — — 1,7 11,8 —
120 — 1,4 2,7 22 — 1,8 3,0 18
130 — 2,8 4,7 34 3,0 5,4 27
140 — 5,4 7,8 52 1,5 5,1 9,3 41,5
150 — 10 13,5 77 2,5 8,2 16 62
160 — 18 20 113 4,2 13 25 89
170 — 32 31 161 6,7 20 40 126 1,4
180 1,2 55 47 227 10,5 31 63 182 2,6 —
190 2,4 93 69 310 16,5 48 93 250 4,6 —
200 4,5 150 100 426 25,5 71 139 342 8
210 8,2 244 140 566 40 104 200 458 14 —
220 15 382 200 760 62 150 289 617 23 1,8
230 26 594 273 1000 92 215 415 815 35,5 3,4
240 43 912 377 1320 132 300 580 1055 54 6,1
250 74 1368 500 — 193 413 800 1360 80 10,8
260 122 — 665 — 279 580 1090 — 122 19
270 199 — 875 — 388 775 1500 — 172 32
280 316 — 1140 — 535 1030 — — 250 55
290 483 — 1460 — 740 1380 — — 344 91
300 760 — — — 1000 — —- 483 150
310 1153 — — — 1345 — — — 680 239
320 — — — — — — — — 900 381
830 — — — — — — — — 1235 600
340 — — — — — — — 900
350 — — — 1470
446
51. Состав различных титаномагнетитов (в %)
Составные части Содержание в тиганомагнетитовых месторождениях
Гусинского Копайского Первоуральского Качканарского
Fe3O4 69,0 -78,5 68,8 76,73 75,9
TiO2 13,0 -14,6 14,0 4,9 5,5
SiO2 3,0 - 3,6 3,6 3,3 2,7
MgO 0,01- 3,8 3,5 3,4 3,7
2,7 - 3,3 3,5 3,43 8,2
CaO 0,25- 3,3 2,5 0,24 3,1
0,03- 1,3 0,06 0,14 0,18
V2o6 0,12- 1,1 0,63 0,68 0,55
MnO 0,23- 0,6 0,75 0,47 0,5
S 0,03- 0,2 0,15 0,08 0,3
P След — 0,05 0,04 0,01 0,05
ЛИТЕРАТУ РА
1. Химия редких и рассеянных элементов, т. I. Под ред. К. А. Большакова,
Изд. «Высшая школа», 1965.
2. Gmelin’s Handbuch d. anorg. Chem., 8 Aufl. Verlag Chemie, GMBH, Wein-
heim, S. 41, 1951.
3. Агеев H. В., Кристаллохимия титана, его соединений и сплавов, в сб. «Ито-
ги науки. Технические науки», 2. Металлургия и металловедение, Изд. АН
СССР, 1959.
4. Б ок ий Г. Б., Введение в кристаллохимию, Изд. МГУ, 1954.
5. В гаи пег В., Atomgewichte des Titan, Abbegg’s Handbuch d. anorg. Chem.,
B. III.
6. Table Internationale des poids atomiques, IUPAC, 1969.
7. Несмеянов Ан. H., Лапицкий А. В., Руденко Н. П., Таблица изо-
топов, гл. 6 в кн. «Получение радиоактивных изотопов», Госхимиздат, 1954.
8. Aston F. W„ Nature, 137, 357, 613 (1936); 141, 1096 (1938).
9. Савицкий Е. М., Ты л кин а М. А., Свойства титана и его сплавов, в сб.
«Итоги науки. Технические науки», 2. Металлургия и металловедение, Изд.
АН СССР, 1959.
10. Facetti J., Flegenheimer J., Trabal E., Radiochim. acta, 5, № 3,
141 (1966).
11. Aldridge A. M., Plendl H. S., Aldridge J. P., Nucl. Phys., 98, № 2,
323 (1967).
12. Лучинский Г. П. и др., Курс химии, ч. II, Изд. «Высшая школа», 1967.
13. В а г k s d а 1 е J., Titanium, New York, 1949.
14. Блюменталь У. Б., Химия циркония, Издатинлит, 1963.
15. Паул инг Л., Природа химической связи, Госхимиздат, 1947.
16. Реми Г., Курс неорганической химии, т. II, Изд. «Мир», 1966.
17. Т о г n t о n, Titanium, New York, 1927.
18. Мороз Л. С. и др., Титан и его сплавы, т. I, Технически чистый титан,
Судпромгиз, 1960.
19. Макквиллэн А. Д., Макквиллэн М. К., Титан, перев. с англ., Метал-
лургиздат, 1958.
20. Еременко В. Н., Титан и его сплавы, Изд. АН УССР, Киев, 1960.
21. Герасимов Я. И., Крестовников А. Н., Шахов А. С., Химическая
термодинамика в цветной металлургии, т. III, Металлургиздат, 1963.
22. Несмеянов Ан. Н., Давление пара химических элементов, Изд. АН
СССР, 1961.
23. Rossini F. D. et al., Properties for Titanium Compound and related sub-
stances, Carnegie Institute of Technology, 1956.
24. Кубашевский О., Эванс Э., Термохимия в металлургии, Издатинлит,
1954.
25. Dear dor ff D. К., Hayes E. T., J. Metals, 8, № 5, 509 (1956).
26. Met. Handbook, ASM, Cleveland, Ohio, 1948, p. 1143.
27. S t u 11 D. K-, S i n k e G. C., Thermodynamic properties of the elements,
Advances in Chemistry. Ser. № 18, Washington, 1956.
28. Елютин В. П. и др., Изв. вузов. Цветная металл., № 1, 60 (1967).
448
29. Корнилов И. И., ЖНХ, 3, № 2, 360 (1958).
30. Корнилов И. И., Глазова В. В., Диаграмма состояния системы Ti—СЬ
и некоторые свойства сплавов этой системы, в сб. «Металловедение ти-
тана», Изд. «Наука», 1964.
31. Ревякин А. В., К вопросу о кинетике окисления титана, в сб. «Титан и
его сплавы», вып. VIII, Изд. АН СССР, 1962.
32. Ливанов В. А., Б у х а н о в а А. А„ К о л а ч е в В. А., Водород в титане,
Металлургиздат, 1962.
33. К о р н и л о в И. И. и др., Металлохимические свойства элементов перио-
дической системы, Изд. «Наука», 1966.
34. Е р е м е н к о В. Н., Л и с т о в н и ч и й В. Е., Структура и свойства спла-
вов титана с серой, в сб. «Халькогениды», Изд. «Наукова думка», Киев,
1967.
35. Бардин И. П., Ревякин А. В., Взаимодействие титана с водяным па-
ром, в сб. «Титан и его сплавы», вып. II, Изд. АН СССР, 1959.
36. Мир очников В. С., Резниченко В. А., Взаимодействие титана с вла-
гой при 400—600° С, в сб. «Титан и его сплавы», вып. IX, Изд. АН СССР,
1963.
37. Дубровская Г. Н., Порошковая металлургия, № 9, 6 (1965).
38. Верейкина Л. Л., Самсонов Г. В., ЖНХ, 5, № 8, 1888 (1960).
39. Э в е р х а р т Д. Л., Титан и его сплавы, Металлургиздат, 1956.
40. Глазунов С. Г., Соболев В. Н., Титан и его сплавы, Оборонгиз, 1958.
41. Томашов Н. Д., Альтовскнн Р. М., Коррозия и защита титана, Маш-
гиз, 1963.
42. Т о м а ш о в Н. Д. и др., Коррозионная стойкость титана и его сплавов,
в сб. «Коррозия н защита конструкционных материалов», Машгнз, 1961.
43. Андреева В. В., Коррозионная стойкость титана в агрессивных раство-
рах. Информация о научно-исследовательских работах, Изд. ИТЭИ АН
СССР, 1956.
44. Томашов Н. Д. и др., Исследование электрохимического поведения ти-
тана, в сб. «Коррозия металлов и сплавов», № 2, 80, Изд. «Металлургия»,
1965.
45. Андреева В. В., Казарин В. И., Новые конструкционные химически
стойкие металлические материалы, Госхимиздат, 1961. .
46. Шварц Г. Л., Макарова Л. С., Акшенцева А. П., Таблицы корро-
зионной стойкости титана и его сплавов в различных агрессивных средак,
изд. НИИХиммаш, 1961.
47. Абковиц С., Бурке Дж., Хилц Р., Титан в промышленности, Оборон-
гиз, 1957.
48. Корнилов И. И., Металлохимия титановых сплавов и дальнейшие задачи
исследования, в сб. «Титан и его сплавы», вып. VII, Изд. АН СССР, 1962.
49. Ш в а р ц Г. Л III свел к п в Б. Н., Торопов В. А., Журн. ВХО
им. Д. И. Менделеева, 8, № 3, 317 (1963).
50. Zmbov К. F., Margrave J. L., J. Phys. Chem., 71, № 9, 2893 (1967).
51. Ehrlich P., Hein II. .1., К it h n 1 TI., Z. anorg. allg. Chem., В 282, № !-“•
3, 139 (1957).
52. Ko mar ek K-, Herasymetiko P., J. Electrochem. Soc., 105, Ns 4, 216
(1958).
53. Skinner G. B., Rtiehrwein R. A., J. Phys. Chem., 59, № 2, 113 (1955).
54. Ehrlich P., К ii h п 1 H., Z. anorg. allg. Chem., B292, № 1—3, 146 (1957).
55. Подзоров Б. II., Василькова И. В., Сандлер Р. А., ЖНХ, 12,
№ 1, 34 (1967).
56. К о р о л ь к о в Д. В., Заха ржевская В. О., ЖНХ, 12, № 11, 2951
(1967).
57. Ehrlich Р., Gutsche W., Seifert Н. J., Z. anorg. allg. Chem., 312,
№ 1—2, 80 (1961).
58. Агеев H. В. и др., О низших окислах титана, в сб. «Титан и его сплавы»,
вып. И, Изд. АН СССР, 1959.
59. Р е з н и ч е н к о В. А., Халимов Ф. Б., Уколова Т. П., Окислы ти-
тана, в сб. «Титан и его сплавы», вып. IX, Изд. АН СССР, 1963.
449
60. Кубашевский О., Гопкинс Б., Окисление металлов и сплавов, Из-
датинлит, 1955.
61. Гельд П. В. и др., ЖНХ, 12, № 8, 2001 (1967).
62. Глазова В. В., Корнилов И. И., ЖНХ, 12, № 11, 3159 (1967).
63. Ч и ж и к о в Д. М., Счастливый В. П., Селен и селениды, Изд. «На-
ука», 1964.
64. Чижиков Д. М., Счастливый В. П., Теллур и теллуриды, Изд. «На-
ука», 1966.
65. S t a h 1 е г A., W i г t h w е i и Н., Вег., 38, 2619 (1905).
66. Рысс И. Г., Химия фтора и его неорганических соединений, Госхнмиздат,
1956.
67. Ключников Н. Г., Руководство по неорганическому синтезу, изд. 2-ое,
Изд. «Химия», 1965.
68. Бирюкова Л. В,, Журн. ВХО им. Д. И. Менделеева, 7, № 1, 119 (1962).
69. Б е л о в С. Ф„ С к л я р е н к о С. И., ЖНХ, 6, № 3, 754 (1961).
70. Морозов И. С., Топтыгина Г. М., Липатова Н. П., ЖНХ, 6,
№ 11, 2528 (1961).
71. Stabler А., Вег., 37, 4405 (1904).
72. Naylor В. F., J. Am. Chem. Soc., 68, 370, 1077 (1946).
73. Н u т р h г е у G. L., J. Am. Chem. Soc., 73, 1587 (1951).
74. Милютина M. И., Штин А. П., Шарова А. К., Изучение взаимодей-
ствия сульфата трехвалентного титана с серной кислотой, в сб. «Титан и
его сплавы», вып. V, Изд. АН СССР, 1961.
75. Семенова Е. И., ДАН СССР, 143, № 6, 1368 (1962).
76. Семенова Е. И., ЖНХ, 11, № 9, 2158 (1966).
77. Euler R. D., West rum Е. F., J. Phys. Chem., 65, № 1, 132 (1961),
78. Murray R. W., Haendler H. M., J. Inorg. a. Nucl. Chem., 14, № 1—2,
1355 (1960).
79. Vanderbeck N. F., J. Less-common Metals, 3, № 4, 293 (1961).
80. Cagli oti V. et al., J. Inorg. a. Nucl. Chem., 15, № 1—2, 115 (1960).
₽1. Latham R., Drago R. S, J. Polymer. Sci„ 56, № 163, 267 (1962).
82. Machin J. S., Dea dm ore D. L., Nature, 189, № 4760, 223 (1961).
83. Dehnicke K-, Naturwiss., 52, № 24, 666 (1965).
84. Л у ч и н с к и й Г. П., Четыреххлористый титан, Оборонгиз, 1939.
85. Г о д н ев И. Н., П а м ф и л о в А. В., ЖОХ, 7, 1264 (1937).
86. П а м ф и л о в А. В., Ш т а н д е л ь Е. Г., ЖОХ, 7, 258 (1937).
87. Памфилов А. В., Ш и х е р М. Г., ЖОХ, 7, 2760 (1937).
88. Schafer Н., Z ер per nick F., Z. anorg. allg. Chem., 272, 274 (1953):
276,325 (1954).
89. Л у ч и н ск и й Г. П., ЖФХ, 40, № 3, 593 (1966).
00. Menzer W., Naturwiss., 45, № 6, 126 (1958).
91. Clabaugh W. S., Leslie R. T., Gilchrist R., J. Res. Nat. Bur. Stand.,
55, №5, 261 (1955).
02 M a t h e w s J. H., J. Phys. Chem., 9, 641 (1905).
93 Л у я и н с к и й Г. П., ЖФХ, 6, 607 (1935).
94. НИсельсон Л. А., Третьякова К. В., ЖНХ, 12, № 4, 857 (1967).
95. Л у я и н с к и й Г. П„ ЖФХ, 63, № 5 1120 (1969).
96 Ctjjllnane N. М., Chard S. J., Leyshon D. М., J. Chem. Soc., 1952
4106.
97. Blocher J. M., Rolsten R. F., Campbell I. E., J. Electrochem. Soc
104, № 9, 553 (1957).
98 R a e d e r M. G., Z. anorg. allg. Chem., 210, 145 (1933).
99 Olsen J. C., Ryan E. P., J. Am. Chem. Soc., 54, 2215 (1932).
100 Rolsten R. F., Sisler H. H., J. Am. Chem. Soc., 79, 5891 (1957).
101. Blocher J. M., Campbell I. E., J. Am. Chem. Soc., 69, 2100 (1947')-
71,4040 (1949).
102. Кричевский И. P„ Ивановский Г. Ф„ Сафронов Е. К. ЖФХ
39, № 11, 2684 (1965).
103. Беленький Е. Ф., Р и с к и н И. Ф., Химия и технология пигментов, Гос-
химиздат, 1960.
450
104. У г а й Я. А., Введение в химию полупроводников, Изд. «Высшая школа»,
1965.
105. Brauer G., Littke W., J. Inorg. a. Nucl. Chem., 16, № 1—2, 67
(1960).
106. Machin J. S., Deadmore D. L., Nature, 189, № 4760, 223 (1961).
107. Г а ничем ко Л. Г., Киселев В. Ф., ДАН СССР, 138, № 3, 608
(1961).
108. Hock L., Knauff W., Z. anorg. allg. Chem., 228, 200 (1936).
109. Ehrlich P., Engel W., Naturwiss., 48, № 23, 716 (1961).
110. Ehrlich P., Waite E., Z. anorg. allg. Chem., 317, 21 (1962).
112. Feltz A., Grohmann H., Zeits. f. Chemie, 6, № 10, 388 (1966).
113. D e h n i c k e K.> Z. anorg. allg. Chem., 338, № 5—6, 272 (1965).
114. Biltz W., Ehrlich P., Mei sei K., Z. anorg. allg. Chem., 234, 97
(1937).
115. Todd S. S., Coughlin I. P., J. Am. Chem. Soc., 74, № 2, 525 (1952).
116. Михеева В. И., Гидриды переходных металлов, Изд. АН СССР, I960.
117. Антонова М. М., Свойства гидридов. Справочник, Изд. «Наукова Дум-
ка», Киев, 1965.
118. Софьина В. В., Павловская Н. Г., ЖФХ, 34, № 5, 1104 (1960).
119. Галактионова Н. А., Водород в металлах, Металлургиздат, 1958.
120. Stalinski В., Bieganski Z., Bulletin de i’Academie Polonaise des
sciences. Serie des sciences chimiques, 8, № 5, 243 (1960).
121. Маккей К., Водородные соединения металлов, Изд. «Мир», 1968.
122. Молчанова Е. К., Атлас диаграмм состояния титановых сплавов, Изд.
«Машиностроение», 1964.
123. Nielsen J. Р., Titanium Symposium US Office on Naval Research, 1949,
p. 153.
124. Бретер A. X., ЖФХ, 13, 372, 1483 (.’939).
125. Самсонов Г. В., ДАН СССР, 86 (2), 329 (1952).
126. Попова О. И., Кабаи ник Г. Т„ ЖИХ, 5, № 4, 930 (1956).
127. Dehnicke К , J. Inorg. a. Nucl. Chem., 27, № 4, 809 (1965).
128. Верейкина Л. Л., Самсоиов Г. В., ЖНХ, 5, № 8, 1888 (1960).
129. Курнаков Н. Н, Тронева М. Я., ЖНХ, 6, № 6, 1347 (1961).
130. Уманский Я- С., Карбиды твердых сплавов, Металлургиздат, 1947,
131. Fuji shir о S., Gokee n N. A., J. Phys. Chem., 65, № 1 161 (1961).
132. Еременко В. H„ ЖНХ, 1, № 9, 2131 (1956).
133. Nikolaiski E„ Z. phys. Chem. (BRD), 24, № 5—6,. 405 (1960).
134. Кушнир С. B., BicHHK Льв1вськ. политехи. iHCT., № 10, 76 (1966).
135. Пивоваров Л. X. и др., ЖНХ, 12, № 7, 1743 (1967).
136. Голубцов а Р. Б., ДАН СССР, 137, № 4, 858 (1961).
137. Крестовников А. Н., Вендл их М. С., Изв. вузов. Цветная металл.,
№ 2, 54 (1959).
138. Самсонов Г. В., Характер взаимодействия боридов титана, циркония и
вольфрама с их карбидами, в сб. «Вопросы порошковой металлургии и
прочность материалов», вып. 7, Изд. АН УССР, Киев, 1959.
139. Пешев П., Получение кристаллического диборида титана из газовой
фазы, Изв. Инет, обща и неорган. химия (болгар.), 4, 53 (1966).
140. Корнилов И. И., Б у д б е р г П. Б., Диаграммы состояния систем иа ос-
нове титана, в сб. «Итоги науки. Технические науки», 2. «Металлургия и
металловедение», Изд. АН СССР, 1959.
141. Будберг П. Б., Корнилов И. И., Диаграммы состояния титановых си-
стем, Изд. ВИНИТИ АН СССР, 1961.
142. Сборник «Металловедение титана», Изд. «Наука», 1964.
143. Сборник «Титан и его сплавы», вып. VH, Изд. АН СССР, 1962.
144. Hansen М., Constitution of Binary Allays, New York, 1958.
145. May ku th D. J., Ogden H. R., Jaffee R. I., J. Metals, 5, № 2, 225
(1953).
146. Куприна В. В. и др., Вести. МГУ, Сер. Хим., № 5, 69 (1966).
147. Корнилов И. И., Борискина Н. Г., ДАН СССР, 108, № 6, Ю83
(1956),
451
148. Joukainen A, Grant N. J., Ploe C. F„ J. Metals, 4, № 6, 766 (1952).
149. Bumps E. S., Kessler H. D., Hansen M., J. Metals, 4, № 6, 609
(1952).
150. Грум-Гржнмайло H. В., Химические связи в металлах и сплавах,
Изд. АН СССР, 1959.
151. Агеев Н. В., Химия металлических сплавов, Изд. АН СССР, 1941.
152. Голубцов а Р. Б., ДАН СССР, 137, № 3, 593 (1961).
153. Gross К. A., Lamborn I. R., J. Inst. Metals, 88, № 9, 416 (1960).
154. Голубцов а Р. Б., ДАН СССР, 118, № 1, 89 (1958).
155. Purdy G. R., Рагг J. G., Trans. Metallurg. Soc., AIME 218, Ns 2, 225
(I960).
156. Самсонов Г. В., Синельников? В. С., Цветные металлы, № 11, 92
(1962).
157. Борискина Н. Г., Корнилов И. И., ЖНХ, 4, № 2 (1959).
158. Пульцнн Н. М. Титановые сплавы и их применение в машиностроении,
Машгиз, 1962.
159. Сборник «Титан и его сплавы», вып. VII, Изд. АН СССР, 1962.
160. Еременко В. Н., Натанзон Я. В., Вопросы порошковой металлур-
гии и прочности материалов, Изд. АН УССР, VII, 1959.
161. Еременко В. Н., Труды семинара по жаростойким материалам, Изд. АН
УССР, 1958, 3, 27.
162. Канторович И. Е., Семенченков А. Т., Изв. вузов. Цветная ме-
талл. Ns 6, 144 (1960).
163. Павлов И. М., Суворов И. К., Фоменко Ю. Е., Изв. вузов. Черная
металл. Ns 6, 11 (1960).
164. Гуревич Ю. Г., Изв. вузов. Черная металл. № 6, 6 (1960).
165. Агеев И. В., Петрова Л. А., ЖНХ, 4, № 5, 1092 (1959).
166. Агеев Н. В., Смирнов а 3. М„ ЖНХ, 4, № 5, 1100 (1959).
167. Агеев Н. В., Рогач ев ска я 3. М„ ЖНХ, 5, Ns 3, 615, 619 (1960).
168. Лащенко П. Н., Компановки Д. И., ЖПХ, 8, № 6, 628 (1935).
169. Amphlett С., McDonald L., Redman М., J. Inorg. a. Nukl. Chem., 6,
220 (1958).
170. Бобыренко Ю. А., ЖНХ, 12, № 7, 1771 (1967).
171. Беляев И. Н., Физико-химические свойства титанатов щелочных’и неко-
торых двухвалентных металлов, докт. диссертация, Ростов н/Дону, 1959.
172. С и г и д а Н. П., Физико-хнмическне исследования взаимодействия титана-
тов щелочных металлов с другими солями в расплавах н в твердом со-
стоянии, канд. диссертация, Ленинград, 1959.
173. Anderson S., Wads ley A. D., Acta Chem. Scand., 15, Ns 3, 663 (1961).
174. Батыгин В. Г., ЖНХ, 12, Ns 6, 1442 (1967).
175. Wefers K-, Naturwiss., 54, № 1, 18 (1967).
176. К утолин С. А., В ул их А. И., Метатитанаты щелочных металлов, в сб.
«Методы получения хим. реактивов и препаратов», вып. 16, Изд. «Химия»,
1967, 14.
177. Валеев X. С., Гай И. А., Исследования некоторых процессов образо-
вания титанатов н цирконатов, Труды Гос. научно-нсслед. электрокерам,
инет., вып. 2, 39 (1957).
178. Борисенко А. И., Широкова П. В., ЖНХ, 1, Ns 4, 615 (1956).
179. Иона Ф., Ширане Д., Сегнетоэлектрические кристаллы, Изд. «Мир»,
1965.
180. Сборник «Рост кристаллов», Изд. АН СССР, 3, 421, 447, 460 (1961).
181. Черепанов А. М„ ЖТФ, 27, № 10, 2280 (1957).
1&2. МисароваА. ФТТ, 2, Ns 6, 1276 (1960).
183. S t г u р 1 е г N., Rev. chim. miner., 3, № 3, 697 (1966).
184. Б р о и В. А., ДАН СССР, 91, Ns 4, 825 (1953).
185. Waring J. L„ Schneider S. J., J. Res. Mat. Bur. Stand., A69, Ns 3, 255
(1965).
186. Suillen M., Bert ant E. F., Bull. Soc. franc, ceram., № 72, 5 (1966).
187. Комиссарова Л. H., Покровский Б. И., Нечаева В. В. ДАН
СССР, 168, № 5, 1076 (1966).
452
188. Леонов А. И., Пирютко М. М., Келер Э. К-, Изв. АН СССР, Сер.
хим., № 5, 787 (1966).
189. Н а г d у A. et al., Compt. rend., 259, № 2, 3462 (1964).
190. Бережной А. С., Гулько Н. В., ДАН УРСР, Б, № 3, 250 (1968).
191. Шамб У., Сеттерфилд Ч., Вентворс Р., Перекись водорода, Издат-
инлит, 1958.
192. Бабко А. К., Улько Н. В., Укр. хим. ж., 27, № 1, 101 (1961).
193. Макаров С. 3., Ладейнова Л. В., Изв. АН СССР, ОХН, № 6, 958
(1961).
194. Jere G. V., Patel С. С., J. Inorg. a. Nucl. Chem., 20, № 3—4, 343 (1961).
195. Richardson £., J. Less-common Metals, 2, № 6, 458 (I960).
196. Кутолин С. А., Шаммасова A. E., В ул их А. И., ЖНХ, 11, № 10,
2202 (1966).
197. Сох, S h а г р е, J. Chem. Soc., 1953, 1783.
198. Drake J. E., Fowles G. W. A., J. Inorg. a. Nucl. Chem., 18, 130 (1961).
199. S h r e t i e n A., Varga G., Compt. rend., 201, 558 (1935).
200. Schwarz R., Meyer G., Z. anorg. allg. Chem., 166, 190 (1927).
201. Л у чн некий Г. П„ ЖОХ, 10, № 9, 769 (1940).
202. Топтыгина Г. М., Морозов И. С., ЖНХ, 6, № 7, 1685 (1961).
203. Смирнов М. В., Максимов И. С., Хайме нов А. П., ЖНХ, И,
№ 8, 1765 (1966).
204. Морозов И. С., Топтыгин Д. Я., ЖНХ, 5, № 1, 88 (1960).
205. Морозов И. С„ Топтыгина Г. М., ЖНХ, 5, № 11, 2518 (1960).
206. Elen gas S. N., Ingraham T. R., Can. J. Chem., 38, № 6, 813 (1960).
207. Biltz W., Ehrlich P., Meisel K-, Z. anorg. allg. Chem., 234, 97 (1937).
208. J e a n n i п V., В e n a r d J., Compt. rend., 246, 614 (1958).
209. Wenger P., Ouparc L., Urler C., Helv. Chim. Acta, 13, 193 (1931).
210. Ruff 0., Treidel O., Ber., 45, 1364 (1912).
211. F r a n k 1 i n E. С., H i n e T. B., J. Am. Soc., 34, 1497 (1912).
212. S c h m i t z - D u m о n t O., Simons P., Broja G., Z. anorg. allg. Chem.,
258, 307 (1949).
213. R а у P. R-, S a h a H., Z. anorg. allg. Chem., 208, 100 (1932).
214. Шумахер И., Перхлораты, Госхимиздат, 1963.
215. Hayek Е., Engelbrecht A., ATonatsh., 80, 640 (1949).
216. Ч у х л а н ц е в В. Г., ЖНХ, 2, № 9, 2014 (1957).
217. Л учинский Г. П„ ЖОХ, 6, № 8, 1108 (1936).
218. Белокосков В. И., ЖНХ, 6, № 6, 1443 (1961).
219. Белокосков В. И., ЖНХ, 7, № 2, 379 (1962).
220. Н а б и в а н е ц Б. И., ЖНХ, 7, № 3, 690 (1962).
221. Горощенко Я- Г., Сикорская Э. К., ЖНХ, 11, № 7, 1591 (1966).
222. G а г п е г С. D., W а 11 w о г k S. С., J. Chem. Soc., 1966, 1496.
223. Reihlen Н, Hake A., Ann., 452, 47 (1927).
224. Partington J. R., Whynes A. L., J. Chem. Soc., 1949, 3135.
225. Невская IO. А. и др., Изв. АН КазССР, Сер. хим., № 5, 10 (1968).
226. Broun J., Madden IT. Т., J. Am. Chem. Soc., 42, 36 (1920).
227. Harrison D. E., Shlrane G., J. Electrochem. Soc., 108, № 8, 788 (1961).
228. Ш и а й д e p м а и С. Я., Калинченко И. E., ДАН СССР, 139, 910
(1961).
229. С и и x a p а И., Шварц В. Т. мл., Пост X. В., Усп. хим., 34, № 1, 44
(1965).
230. R о b b i п s С. R., J. Am. Ceram. Soc., 43, № 11, 610 (1960).
231. Никитина Е. А., Гетерополисоедннения, Госхимиздат, 1962.
232. Marshall R. Н., Hoekstra Н. R., J. Inorg. a. Nucl. Chem., 27, № 9,
1947 (1965).
233. Lieser К. Н. et al., J. Inorg. a. Nucl. Chem., 29, № 3, 815, 827 (1967).
234. Несмеянов A. H., Избранные труды, т. 2, Изд. АН СССР, 1959.
235. Несмеянов А. Н. и др., Изв. АН СССР, ОХН, № 7, 1206 (1960).
236. Несмеянов А. Н., Ногина О. В., Дубовицкий В. А., Изв. АН
СССР, ОХН, № 3, 437 (1961).
237, Deluzarche A., Ann. chim., 6, № 7—8, 661 (1961).
453
238. Неорганические полимеры. Сборник Переводов, Издатинлит, 1961, стр. 343,
354, 367.
239. Суворов А. Л., Титанорганические полимеры, в сб. «Успехи в области
синтеза элементоорганических полимеров», Изд. «Наука», 1966.
240. Bradley D„ Hi Hye М., Trans. Faraday Soc., 62, № 9, 2367, 2374 (1966).
241. Борисов С. H., Воронков М. Г., Лукевиц Э. Я., Кремнеэлементо-
органические соединения, Изд. «Химия», 1966.
242. Андрианов К: А., Усп. хим., 27, 1257 (1958).
243. А и д р и а н о в К. А., Астахин В. В., Суханова И. В., ЖОХ, 31,
№ 1, 232 (1961).
244. Watenpaugh К., Caughlan Ch. N., Inorg. Chem., 5, № 10, 1782
(1966).
245. Разуваев Г. А., Латяева В. Н., Усп. хим., 34, № 4, 589 (1965).
246. Р а з у в а е в Г. А., Б о г д а и о в И. Ф„ ЖОХ, 3, 367 (1933).
247. Плец В. М„ ЖОХ, 8, № 9, 1298 (1938).
248. Taylor, Chem. d’Agroc, 43, № 8, 555 (1960).
249. Разуваев Г. А., Бобннова Л. М„ ДАН СССР, 150, 325 (1963),
250. 3 е ф и р о в а А. К., Тихомирова Н. Н., Шилов А. Е„ ДАН СССР,
132, № 1, 1082 (1960).
251. Разуваев Г. А., Латяева В. Н., Малышева А. В., ЖОХ, 37, Ns 10,
2339 (1967).
252. Несмеянов А. Н., Ногина О. В., Берлин А. М., Изв. АН СССР,
ОХН, 1961, 804.
253. Gorsich R. О., J. Am. Chem. Soc., 82, № 16, 4211 (1960).
254. Giddings S. A., Best R. J., J. Am. Chem. Soc., 83, Ns 10, 2393 (1961).
255. Giannini U., Cesca S., Tetrahedron Letters, № 14, 19 (1960).
256. Rohl H., Angew. Chem., 74, № 4, 155 (1962).
257. Разуваев Г. А., Латяева В. H., Вышинская Л. И., ЖОХ, 31,
№ 8, 2667 (1961).
258. А п a g п о s t о р о u 1 о s A., Nichol is D., J. Inorg. a. Nucl. Chem., 28,
Ns 12, 3045 (1966).
259. Salzmann J. J., Mosimann P., Helw. chim. acta, 50, Ns 7, 1831
(1967).
260. Разуваев Г. А. и др., ЖОХ, 36, № 8, 1491 (1966).
261. Ферсман А. Е., Геохимия, т. I, ОНТИ, 1934; Геохимия, т. IV, Геохим-
издат, 1939.
262. Берг Г., Геохимия месторождений полезных ископаемых, ОНТИ, 1937.
263. Гевеши Г., Химия и геохимия группы титана. Основные идеи геохимии,
вып. II, ОНТИ, 1937.
264. Ферсман А. Е., Избранные труды, т. II, Изд. АН СССР, 1953.
265. Сауков А. А., Геохимия, Госгеолтехнздат, 1951.
266. Гольдшмидт В. М., Усп. хим., 6, № 10, 1360 (1937).
257. Г ольдшмидт В. М., Усп. хим., 7, № 2, 288 (1938).
268. Вернадский В. И., Заметки о титане в биосфере. Труды Биогеохимиче-
ской лаборатории АН СССР, т. IV, 247 (1937).
269. Знаменский Е. Б., Геохимия, № 2, 109 (1957).
27р. Знаменский В- Б., Геохимия, Ns 1, 90 (1958).
27-1. Вернадский В. А., История минералов земной коры, Научи. Хим.-техн.
Изд., 1925.
272. Qoelter, Handbuch d. Mineralchemie, В. Ill, 33, Dresden — Leipzig.
273. Дана Э. С., Описательная минералогия, ОНТИ, 1937.
274. Уоттон В. О., Каген Э., Минералогия редких металлов, ОНТИ, 1933.
275. Штрунц X., Минералогические таблицы, Госгортехиздат, 1962.
276. Титаномагнетнты, Сборник работ, ОНТИ, 1935.
277. Б-онштедт Э. М., Титанит (сфен), Изд. АН СССР, 1934.
278. Бонштедт Э. М., Перовскит, Изд. АН СССР, 1935.
279. Тихоненков И. П., Казакова М. Е., Ниоболопарнт — новый минерал
из группы перовскита, Записки Всес. минералог, общ., 86, Ns 6, 641 (1957).
280. Готман Я. Д., Записки Всес. минералог, общ., 87, № 2, 197 (1958).
281. П я т е н к о Ю. А., Кристаллография, 4, Ns 2, 204 (1958).
454
282. Е_Р о ф е е в а Е. А., Физические свойства титано-тантало-ниобатов, в сб.
«Геология месторождений редких элементов», вып. 10, Госгеолтехиздат,
1960.
283. Гинзбург А. И., Ерофеева Е. А., Классификация титано-тантало-
ниобатов, в сб. «Геология месторождений редких элементов», вып. 10, Гос-
геолтехиздат, 1960.
284. Сидоренко Г. А., Структурные типы титано-тантало-ниобатов, в сб.
«Геология месторождений редких элементов», вып. 10, Госгеолтехиздат,
1960.
285. Ситнин А. А., Леонова Т. Н„ ДАН СССР, 140, № 6, 1407 (1961).
286. Франк-Каменецкий В. А., Весельский И., Геохимия, № 5, 372
(1961).
287. Малышев И. И., Закономерности образования н размещения месторож-
дений титановых руд, Госгеолтехиздат, 1957.
288. Дорохин И. В. и др., Месторождения полезных ископаемых н их раз-
ведка, Госгортехиздат, 1961.
289. Магакьян И. Г., Рудные месторождения, Изд. АН АрмССР, 1961.
290. Курс месторождений полезных ископаемых. Под ред. П. М. Татаринова
и А. Г. Бетехтина, Изд. «Недра», 1964.
291. Малышев И. И., Разведка и охрана недр, № 1, 37 (1955); ДАН СССР,
112, № 2, 311 (1957).
292. Вертушков В. Н., Разведка и_охрана недр, № 8, 1 (1957).
293. Хибинские редкие элементы и пирротипы. Сборник под ред. акад. А. Е. Ферс-
мана, Ленинград, 1933.
294. Русаков М. П., Бурдуков Г. П., Изв. АН КазССР, Сер. геол., вып. 1
(26), 46 (1957).
295. Хазанов Е. И., Олейникова Г. В., Силлиманитовые руды Кяхтин-
ского месторождения — комплексно^ титансодержащее сырье, в сб. «Ти-
тан и его сплавы», вып. II, Изд. АН СССР, 1959.
296. Исаков М. Г., Минералогический состав титансодержащих песчаников,
в сб. «Титан и его сплавы», вып. V, Изд. АН СССР, 1961.
297. Основы металлургии, т. III, Легкие металлы, Металлургиздат, 1963.
298. В е р н г о К. Н., Техника обогащения титановых руд в зарубежных стра-
нах. Обзор иностранной периоднкн за 1942—1954 годы. Бюллетень ЦИИН
МЦМ, № 10 (1954).
299. Соболев М. Н., Извлечение ванадия и титана из уральских титаномаг-
нетитов, ОНТИ, 1936.
300. Титаномагнетиты. Сборник работ, ОНТИ, 1935.
301. Кисляков И. П., Металлургия редких металлов, Металлургиздат, 1957.
302. Зеликман А. Н., К рей и О. Е., Самсонов Г. В., Металлургия ред-
ких металлов, Изд. «Металлургия», 1964.
303. Фишман М. А., Соболев Д. С., Практика обогащения руд цветных
и редких металлов, т. IV, Госгортехиздат, 1963.
304. Сборник «Титан и его сплавы», вып. V, Металлургия н химия титана, Изд.
АН СССР, 1961.
305. Резниченко В. А., Рапопорт М. Б., Ткаченко В. А., Металлур-
гия титана. Исследование электроплавки титановых шлаков, Изд. АН СССР,
1963.
306. Крамиик В. Ю„ Цветн. мет., № 5, 49 (1960).
307. Брицке Э. В., Тагиров К. X., Ш маненков И. В., Изв. АН СССР,
ОТН., № 1, 13 (1941); № 2, 9 (1941).
308. Тагиров К. X., К вопросу применения щелочных соединений прн плавке
в доменных печах титаномагнетитов, в сб. «Советская металлургия», «Ме-
таллургиздат», 1939.
309. Сборник «Титан и его сплавы», вып. II, Металлургия титана, Изд. АН
СССР 1959
310. Топтыгин Д. Я., Морозов И. С., ЖПХ, 34, № 4, 713 (1961).
311. Годнее И. Н„ Памфилов А. В., ЖОХ, 7, № 7, 1264 (1937).
312. Р б б е р т с о н А., Баннинг Л., Получение и хлорирование титановых
шлаков, в сб. «Проблемы современной металлургии», № 5, 51 (1956).
455
313. Зеликман А. Н., Сэгаргану Т., ЖОХ, 26, № 3, 652 (1956).
314. Морозов И. С., Топтыгин Д. Я., ЖНХ, 2, № 8, 1951 (1956).
315. Заварицкая Т. А., Пустовалова С. С., Цвети, мет., № 10, 50
(1958).
316. Серяков Г. В., Мастерова А. П., Рязанова Н. М., Очистка четы-
реххлористого титана от примесей твердых хлоридов, сб. научных трудов
Гнредмет, т. I, Металлургиздат, 1959.
317. Му сиенко В. Т., Металлотермия титана, Бюллетень ЦИИН МЦМ, 1958.
318. Гуляннцкий Б. С., Получение титана натриетермическим способом,
Бюллетень ЦИИН МЦМ, 1959.
319. Сборник «Тнтан и его сплавы», вып. VI, Металлотермия и химия титана,
Изд. АН СССР, 1961.
320. Огурцов С. В., Резниченко В. А., Дедков А. И., К вопросу
о стандартизации, интенсификации и автоматизации магниетермического
процесса, в сб. «Титан и его сплавы», вып. VIII, Изд. АН СССР, 1962.
321. Дедков А. И., Восстановление тетрахлорида титана магниевым конден-
сатом при низких температурах (250—400° С) в вакууме, в сб. «Титан
и его сплавы», вып. VIII, Изд. АН СССР, 1962.
322. Савин В. Д., Резниченко В. А., Изучение кинетики и механизма вос-
становления четыреххлористого титана натрием, в сб. «Титан и его спла-
вы», вып. IX, Изд. АН СССР, 1963.
323. Баймаков Ю. В., Ветюков М. М„ Электролиз расплавленных солей,
Изд. «Металлургия», 1966.
324. Скляренко С. И., Липкенс Я. М„ ЖПХ, 13, № 1, 51 (1940).
325. Колотыркин Я. М., Петров П. С., ЖФХ, 31, № 3, 659 (1957).
326. Сиберт М. Ф., Стейнберг М. А., Проблемы современной металлургии,
№ 3 (1957).
327. Казани А. А., Механизм процесса электролиза двуокиси титана в хло-
ридно-фторндном расплаве, в сб. «Тнтан н его сплавы», вып. VIII, Изд.
АН СССР, 1962.
328. Иванов А. И., Кухарева И. Г., Исследование анодного процесса при
электролизе четыреххлорнстого титана в расплавленных хлористых солях,
в сб. «Тнтан и его сплавы», вып. VIII, Изд. АН СССР, 1962.
329. Му сиенко В. Т., Орлов В. Т., Получение титановых сплавов электро-
литическим методом, в сб. «Титан и его сплавы», вып. IX, Изд. АН СССР,
1963.
330. С е р г е е в В. В., Галицкий Н. В., Киселев В. П., Металлургия ти-
тана, Изд. «Металлургия», 1964.
331. Сборник «Итоги науки. Технические науки», 2. «Металлургия и металлове-
дение», Химия, металловедение н обработка титана, Изд. АН СССР, 1959.
332. Сборник «Титан и его сплавы», вып. I, Металлургия и металловедение,
Изд. АН СССР, 1958.
333. Липке с я., Титан и его применение в технике, Оборонгиз, 1945.
334. Р а м л о в А., Титановые белила, Госжелдориздат, 1933.
335. Шампетье Г., Рабатэ Г., Химия лаков, красок и пигментов, т. 2,
Госхимиздат, 1962.
336. Хазин Л. Г., Хим. пром., 3, 189 (1958).
337. М е л е н т ь е в Б. Н., Мойнов С. Г., Резниченко В. А., Получение
двуокиси титана взаимодействием четыреххлористого титана с кислородом,
в сб. «Титан и его сплавы», вып. 111. Изд. АН СССР, 1962.
338. Мойнов С. Г., Резниченко В. А., Изучение процессов кристаллиза-
ции двуокиси титана при взаимодействии четыреххлористого титана с кис-
лородом, в сб. «Титан и его сплавы», вып. IX, Изд. АН СССР, 1963.
339. Титана двуокись пигментная, ГОСТ 9808—65 (взамен ГОСТ 9808—61),
Группа Л18.
340. Лисецкая И. С. и др., Зав. лаб., 33, № 3, 282 (1967).
341. Нойес А., Брэй В., Качественный анализ редких элементов, ОНТИ, 1936.
342. Коренман И. М., Фрум Ф. С., Рыжкова Л. В., Производные хро-
мотроповой кислоты как реактивы на титан, Ученые записки Горьковск. го-
сударств. университета, вып. 32, 113 (1958).
456
343. Фрум Ф. С., Трушина Е. П., Ученые записки Горьковск. государств,
университета, вып. 32, 119 (1958).
344. Тищенко И. Г., Скороход О. Р., Г р у ч е н к о в Р. Г„ Ученые записки
Белорусск. государств, университета, вып. 42, 173 (1958).
345. Мелентьев Б. Н., Пономарев А. И., Методы анализа титана и ти-
тановых продуктов, в сб. «Итоги науки. Технические науки, 2. Металлургия
и металловедение». Изд. АН СССР, 1959.
346. Толмачев В. Н. н др., ЖАХ 22, № 6, 950 (1967).
347. Гнллебранд В. Ф. и др., Практическое руководство по неорганическому
анализу, Госхимиздат, 1957.
348. М н т ч е л А. Д., УордА. М., Новые методы количественного химического
анализа, ОНТИ, 1933.
349. Дымов А. М., Технический анализ руд и металлов, Металлургнздат, 1949.
350. Г о р ю ш н н а В. Г., Зав. лаб., 19, № 3, 300 (1953).
351. Шар л о Г., Методы аналитической химии. Количественный анализ неорга-
нических соединений, Изд. «Химия», 1965, стр. 826.
352. И о у Д., Фотометрический химический анализ, т. I, Колориметрия, ОНТИ,
Главн. редакция химич. литературы, 1935.
353. Бабко А. К., Пилипенко А. Т., Колориметрический анализ, Госхим-
издат, 1951.
354. Сен дел Е., Колориметрическое определение следов металлов, Изд. «Мир»,
1964.
355. Б у с е в А. И., Т и п ц о в а В. Г., Иванов В. М., Практическое руковод-
ство по аналитической химии редких элементов, Изд. «Химия», 1966.
356. Васильев В. П., Воробьев П. Н., ЖАХ, 22, № 5, 718 (1967).
357. Церковницкая И. А., Янь Бао-чжень, Применение тирона в ка-
честве реагента в полярографии титана, в сб. «Вопросы аналитической хи-
мии минеральных веществ», Изд. ЛГУ, 1966.
358. Мухина 3. С., Никитина Е. И., Ускоренные методы анализа титана
и его сплавов, Оборопгиз, 1961.
359. Яковлев П. Я-, Федоров А. А., Буянов Н. В., Анализ материалов
металлургического производства, Металлургнздат, 1961.
360. Степин В. В. и др., Анализ цветных металлов и сплавов, Изд. «Метал-
лургия», 1965.
361. Дымов А. М., Технический анализ руд н минералов, Металлургнздат
1949.
362. Методы химического анализа минерального сырья, ВИМС, Госгеолтехиздат,
вып. 1 (1955); вып. 3 (1957).
363. Галлай 3. А., Шеина II. М„ ЖАХ, 16, № 6, 706 (1961).
364. Скан а ви М. Д., Зав. лаб., 24, № 6, 683 (1958).
365. RuziCka Е., Mlkrocliirn. acta, № 2, 277 (1967). w
366. Fukamauchi II., Z. analyt. Chem., 229, № 6, 413 (1967).
367. Лучииский Г. П., Зав. лаб., 5, 233 (1936).
368. Гармата В. А. и др., Металлургия титана, Изд. «Металлургия», 1968.
369. Филд Р., Коув П., Органическая химия титана, перев. с англ, под ред.
О. В. Ногиной, Изд. «Мир», 1969.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Указатель в основном включает соединения титана, поэтому для упрощения
названия соединений даны без слова «титана» (например, вместо «дихлорид ти-
тана» приведен термин «дихлорид»). На слово «Титан» дана подборка терминов,
обобщающих те или иные понятия или разделы химии титана и его соединений,
а также все, что относится непосредственно к элементарному титану.
Аквагидроксидтрифторид 108
Аквапентахлоротнтанаты 84
Акватрихлородигидроксотитанат 264
Алкилгалиды 317
Алкилметатитанаты 309, 310
Алкилортотитанаты 306 сл.
Алкилполитнтанаты 310, 311
Алкилснлоксититан 131
Алкилтетратитанаты 310
Алкилтитанаты 22, 306 сл.
Алкилтриноднды 141
Алкилтрититанаты 310
Алкилхлориды 131, 317 сл.
Алкоголяты 128
Алкоксидбромнды 136, 314
Алкоксидгалиды 311 сл.
Алкоксндноднды 141
Алкоксидхлориды 128, 311 сл.
Алкоксиды 159, 306 сл.
полимерные 310, 311
Алкоксотитанаты 22, 309
Амид оксиды 173
Амидотитанаты 21, 267
Амидофторотитанаты 267
Амиды 172 сл.
Анализ 389 сл., 409 сл.
аммиачный метод 393
весовой 393 сл.
способ Мак-Кейба 407
— Торнтона 409
— Циглера 409
— Циочииа 409
Анатаз 10, 144, 145, 339, 346
Аносовит 352
Антимониды, см. Стибиды
Аплит рутиловый 345
Аризонит 340
Арил алкоксиды 325, 326
Арилтитаиаты 22, 324
Ароксидхлориды 315 сл.
Ароксиды 315 сл.
Ароксотитанаты 22
Арсенатосоединения 289
Арсенатотитановые кислоты 289
Арсенаты 289
Арсенитосоединения 289
Арсенитотитановая кислбта 289
Аренд (арсенид) 176, 419
Астрофилит 343
Ацетаты 45, 74, 75, 101, 293
Ацетатгидр оксиды 293
Ацетатдихлорид 101, 292
Ацетатоксиды 293
Ацетатосоединения 292 сл.
Ацетаттригидроксид 293
Ацетатрихлорид 129, 2$3
Ацетатхлориды 292, 293
Ацетатхлороксид 293
Ацидосоединения 268 сл.
Ацидотитанаты 21
Базальты 334
белила 10
анатазная форма 387
рутильная форма 388
Бензилортотитаиат 315
Бензоатхлориды 299
Бенитоит 302, 343
Боратосоединения 299 сл.
Боратотитановые кислоты 299
Бориды 11, 39, 186 сл.
Боротитанаты 22, 344
458
Браннерит 344
Бремнитрид 175, 419
Бромогидроксотитановые кислоты 259
Бромоксиды 154 сл.
Бромооксотитанаты 264
Бромооксотитановые кислоты 259
Вромотитанаты 259 сл.
Бромотриоксотитаиовая кислота 259
Вромохлоротитаиаты 260
Бромохлоротитановые кислоты 259,
260
Бромтриамид 173
Вром трифторид 109, ПО, 418
Бромтрихлорид 137 сл., 419
Вромфториды 62, 109, ПО
Бромхлориды 137 сд.
Брукит 144, 145, 339, 346
«-Бутилат 93
Бутилтрибромид 319
Вутилтрихлориды 318, 319
Бутоксиды 446
Вутоксидтрихлорид 314
Ванадатотитаиаты 302
Висмутид 38
Висмутитосоединения 289
Вольфрамат 73
Вольфраматотитанаты 303, 304
Габбро 334
Габбро-норитовые породы 347
Галатосоединения 268 сл.
Галиднитриды 172 сл.
Галиды 54 сл., 76 сл., 103 сл.
восстановление 366 сл.
смешанные 42, 43, 62, 78, 82, 86,
120 сл., 132 сл., 137 сл., 142,
143
электролиз 371 сл.
Галогениды, см. Галиды
Галогеноксиды 93 сл., 152 сл.
Галоксотитанаты 261 сл.
Галпероксотитанаты 261 сл.
Галотитанаты (галогенотитанаты) 21,
250 сл.
Галотитановые кислоты 250 сл.
Гейкилит 340
Гексаалкоксотитинаты 309
Гексаалкоксотитановые кислоты 309
Гексабромотитанаты 87, 134, 260
Гексабутоксотитанаты 309
Гексагидроксотитанат 246
Гексадивольфриматоортотитановая
кислота 304
Гексаиодатотитанаты 270
Гексаиодотитановая кислота 141, 260,
269
Гексакарбамидтитаи-катион 21
Гексакарбамидтитана(Ш) перхлорат
96, 331
Гексакватнтана
бромид 86
иодид 88
перхлорат 96
хлорид 83
Гексакватитан-катион 21
Гексаммиититана хлориды 84, 258
Гексамминтитан-катион 21
Гексаортостибатодититанат 289
Гексародаио-(Ш) титанаты 102
Гекса титана ты 229, 230
Гексафторотитанат-анион 21
Гексафторотитанаты 76 сл., 251 сл.,
373
Гексахлоротитанат-анион 21
Гексахлоротитаиаты 84, 85, 127, 257 сл.
455
Гексахлоротитановая кислота 255, 257
Гексацианоферраты 305, 391
Гексаэтилдититанат 310
Гексаэтокеотитанаты 309
Гексоксид 446
Гвксоксидтрихлорид 314
Гемиборид 420
Гемивисмутид 177
Гемигексаацетатгемиоксид 293
Гемигекеабромгемиоксид 155, 156
Гемигексахлоргемиоксид 153, 154, 418
Гемигексапальмитатгемиоксид 298
Гемидихлорсесквиоксид 153, 154, 418
Гемиоксалатсесквиоксид 294
Гемипентаборид 188
Гемисульфид 70
Гемитетраацетатгемиднхлоргемиок-
сид 293 '
Гемифосфпд 419
Гептвтитяшгг 226
Гепгафтородипероксодитнтаиат 263
Гептафторотнтанаты 253, 254
?ептахлоротитапаты 259
ерманатометатитанат кальция 301
Германатссоединения 300 сл.
Германатотитанаты 301, 302
Германиды 38, 183 сл.
ГетерополитИтанатц! 22
Гидриды 38, 46, 76, 150, 162 сл.
ГйдридФрихлорид тцтайа 166
Гидрогексабутоксотитанаты 309
Гидрогексаметоксотитанаты 309
Гидрогексаэтоксотитанаты 309
Гидрокарбонат 74
Гидроксидтрифторид 108
'Гидроксидфториды 108
Гидромоносульфатометатитанат 279
Гидронитриды 172 сл.
Гидроокиси 43, 60, 83, 87, 92, 93, 101,
124, 175
Гидропероксо-группа 247
409
ГидросульфаТометатитанат 280
Гидросульфиты 73, 98, 99
Гидротрнсульфатометатитанат 280
Граниты 334
Гранодиориты 334
Двугидроокись 62, 64, 69 сл.
Двуокись 34, 43, 45, 46, 62, 64, 68, 69,
72, 73, 74, 82, 86, 88 сл., 109,
120, 124, 126, 134, 140, 143 сл.,
147 сл., 153, 155, 158, 159,
170, 172, 181, 182, 223, 403,
418
взаимодействия 147 сл.
восстановление 368 сл.
пигментная 387
природная 338 сл.
свойства 144 сл., 436
способы получения 143, 144, 381 сл.
хлорирование 356 сл.
электролиз 370, 371
Двуортотитановая кислота, производ-
ные 310
Декагидродинитратопентатитаиат 286
Декахлоротитанаты 259
Декахлоротнтановая кислота 256
Диабазы 334
Днакваднперхлоратодигидроксотитан
269
Диакватетрагидроксотитан 224
Диалкилднбромиды 137
Диалкилднгалиды 318, 319
Диалкоксиддигалнды 313 сл.
Дналкоксиды 309, 310
Диамид 174
Днамидотетрафторотитанат 107, 267
Диаммннтетрафторотитанат 107
Диароксндднхлориды 316
Диарсенат 289
Днарсид 177
Диацетатгидроокнсь 101
Днацетатднгидр оксид 293
Диацетатдихлорид 129
Диацетатоксид 293
Дибернллнд 420
Диборнд 187, 188
Дибромднфторид 109, НО, 419
Днбромднхлорнд 137 сл. 419
Дибромид 61 сл., 86, 134, 418
Дибромоксид 154, 155, 419
Днбромотетрагидроксотнтановая кис-
лота 259
Дибромотетрахлоротитанаты 260
Дибром отетрахлоротнтановая кисло-
та 260
Дибутилметатитанат 310, 311
Дибутоксиддихлорид 314
Дибутоксидоксид 310
Днбензнддиэтоксид 326
Дигексафторостибатоксид 289
460
Дигерманид 184 сл.
Дигндрнд 164 сл., 419, 437
Днгндрнддихлорнд 166
Дигидродиоксалатоортотитанаты 295
Днгидроднтартратоортотнтанаты 297
Днгидрсксид 69
Дигидроксиддифторид 108
Дигндротриоксалатоортотитанат 296
Дидейтернд 166, 419
Днднхлорофосфатокснд 286
Дннмнд 174
Дниодатдигидроксид 269
Динодатоксид 269
Динодатотетрагидроксотитановая кис-
лота 269, 270
Дииодбромхлорнд 142
Дииодид 63 сл., 88, 140, 419
Дииоддибромид 142, 143, 419
Диноддифторид ПО, 419
Дииоддихлорид 123, 142, 143, 419
Дииодоксид 140, 156, 419
Днкарбамидтетрахлоротитан 331
Дикарбонатодихлоротитанаты 290
Днкарбонатометатитанаты 290
Дикарбонатотетрахлоротитанат 291
Дикрезоксидднхлорид 316
Днметилдиметилцнклопентадненилти-
тан 323
Днметнлдихлорид 318
Диметнлднцнклопентадиеннлтитан 322
ДиметилЦианидтетрабромотнтан 156
Днметокснддибромид 314
Днметоксндднхлорнд 314
Днниобат 302
Динитратопятнтитановая кислота 286
Динитрнд 172
Диннтридимид 174
Дноксалатодноксопероксотнтановая
кислота 294
Дноксалатоксидперокснд 295
Диоксалатометатитанаты 295, 296
Диоксалатотнтанат натрия 295, 296
Диоксалатотитановая кислота 294
Диоксид титана, см. Двуокись
Диоксогндроксогидропероксотитанат
249, 250
Диоксотнтанаты 92
Диориты 334
Диортоарсенатометатитановая кисло-
та 289
Днортоарсенатооксотнтановая кисло-
та 289
Диортоборатоортотнтанаты 299, 300
Диортониобатооксотитанаты 302
Диортоннобатотитанаты 302
Днортотитанатпентокснд 239
Днортотнтанаттетрагндроксид 241
Диортофосф атогексаоксотрититано-
вая кислота 287
Днортофосфатоксид 286
Диортофосфатооксотитанат 288
Диортофосфатоортотитановая кисло-
та 287
Дипальмитатоксид 298
Дипериодатэннеаоксид 271
Диперхлоратдигидроксид 269
Диперхлоратодиоксотитановая кисло-
та 269
Диперхлоратоксид 268
Диперхлоратооксопероксотитановая
кислота 269
Дипиридилметилтрихлоротитаиат 318
Дипиридилтетрахлоротитанат 332
Дипиридинтетрахлоротитанат 332
Дипиридинциклопентадиенилтрихло-
ротитан 321
Дипропилметатитинат 310
Дипропоксид 310
Дипропоксиддихлорид 314
Дироданид 60, 75
Дироданодиоксотитанат 291
Дисанилит 344
Диселенид 160, 419
Дисиликатодититанат 300, 301
Дисилицид 183, 185
Дистибид 177
Дисульфат 271, 272
Дисульфатдихлорид 274
Дисульфатометатитанат 279
Дисульфатометатитановая кислота
276
Дисульфатооксотитанаты 279
Дисульфатоортотитановая кислота
277
Дисульфатопероксометатитанаты 283,
284
Дисульф атопероксометатитаповая кис-
лота 278
Дисульфатосемиметатитаповая кисло-
та 278
Дисульфатотитаповые кислоты 276,
277
Дисулъфатотриоксодититапнт 283
Дисульфатхлорид 125
Дисульфид 37, 44, 46, 70, 107, 126,
153, 156 сл„ 265, 419, 436
Дитартратоортотптапиты 297
Дитартратоортотнтипоппя кислота 297
Дителлурид 160, 419
Дититанаты 21, 226, 228 сл., 238, 242,
244 сл., 442
Дитритид 419
Йитолилдипнклонептпднепилтитан 326
ифенилдиокспд 31В
Диренилдиииклопептадиенилтитан 326
Дифенилтнтап 324
Дифенилхлорид 325
Дифеноксиддпхлорид 316
Диформиатдихлорид 292
Дифосфат 286
Дифосфатопероксотитанат 288
Дифосфатотриоксопероксодититанат
288
Дифторид 54, 55, 418
Дифтородиоксотитанаты 261
Дихлордифторид 109, 122, 418
Дихлорид 55 сл., 60, 79, 82, 118, 119,
124, 418, 426
Дихлородиоксотитаиовая кислота 149,
256
альдфениловый эфир 316
Дихлороксид 44, 152, 153, 155, 418
Дихлоросульф атдихлорид 125, 274
Дихлортетрагидроксотитановая кис-
лота 256
Дихлорфеноксиддихлориды 316
Дихроматотрехметатитановая кисло-
та 303
Дицианид 60, 182
Дициклопентадиенилбромиды 137,322
Дициклопентадиенилдибромид 322
Дициклопентадиенилдибутоксид 324
Дициклопентадиенилдикарбонил 323
Дициклопентадиенилдихлорид 321
Дициклопентадиенилтитан 61, 323, 326
Диэтилдихлорид 319
Диэтилдициклопентадиенилтитан 323
Диэтилметатитанат 309
Диэтоксидбромхлорид 314
Диэтоксиддибромид 314
Диэтоксиддихлорид 314
Диэтоксидоксид 309, 310
Додекаборид 188
Додекатитанат 229
Изерип 339
Ильмениты 340, 346, 347
Ильменитовый концентрат 350
Имидооксотнтниат 267
Имндотитанаты 21, 266
Имиды 174
Интерметаллиды 39, 210 сл., 215 сл.
Иодатосогдинения 269, 270
Иодаты 269
Иодбромдихлорид 142
Иодбромиды 62, 142, 143
Иоддибромхлорид 142
Иоднитрид 175, 419
Иодпеитагидроксотитановая кислота
260
Иодотитанаты 259 сл.
Иодтрибромид 142, 143, 419
Иодтрифторид ПО, 419
Иодтрихлорид 141 сл., 419
Иодфториды НО, 142, 143
Иттрокразит 343
Карбацидосоедипеппя 290 ел.
Карбацидотнтапаты 21, 298
401
Карбид 11, 38, 45, 47, 127, 177 сл.,
179 сл., 354, 419, 438
смешанные 182, 183
сплавы 220, 221
Карбидизация 354
Карбоксиды 182, 419
Карбонат 74
Карбонатгидроокись (гидроксид) 84,
100
Карбонатдихлорид 290
Карбонатометатитанаты 290
Карбонатосоединения 290, 291
Карбонатотитанаты 290
Карбонатотрихлоротитанат 290
Карбонатохлоротитанаты 290
Карбонитриды 38, 47, 82, 170
Кнопит 342
Комплекса™ 19, 21, 71 сл., 96 сл.
Комплексные соединения с органиче-
скими лигандами 327 сл.
Крезоксидтрихлориды 317
Криспит 339
Кричтонит 340
Лактат 299
Лактатосоединения 299
Лактатотитанаты 299
•Лауратоксидгидроксид 298
Лейкосфен 301, 343
Лекоксен 341
Линозит 343
Ловчоррит 301, 343
Лопарит 302, 347, 348
Лоренценит 343
Манганатотитаиаты 304
Менакэнит 9
Менахин 9
Металлатосоедииения 302 сл.
Металлотитанаты 22
Метатитанат-анион 21
Метатитанат
алюминия 239
бария 11, 235, 237, 444
бериллия 245
висмута 247
железа 242, 243
европия 240
кадмия 245
калия 149, 229
кальция 233, 443
кобальта 243
лантана 239
лития 225
Магния 231
Марганца 241
Меди 243
Натрия 226 сл., 442
Никеля 243
Метатитанат
оксотитана 338
рубидия 230
свинца 245
серебра 243
стронция 234, 443
тория 240
цезия 230
цинка 244
Метатитанатдиоксиды 238 сл.
Метатитановая кислота 70, 93, 94, 124,
153, 222, 223, 382, 383
Метафосфат 99
Метилат 93
Метилдициклопентадиенилхлорид 322
Метилтрибромид 319
Метилтрииодид 319
Матилтрихлорид 317, 319
Метоксиды 93, 446
Метоксидтрихлорид 314
Моленграафит 301, 343, 348
Молибдат 73
Молибдатотитанаты 303
Моноалкилтригалиды 317, 318
Моноалкоксидтригалиды 314, 315
Моноароксидтрихлориды 316, 317
Монобериллид 420
Моноборид 187, 420
Моногерманид 184, 185, 420
Моногидрид 164, 419
Моноиодоксид (моноиодокись) 94, 419
Монокарбамидтетрахлоротитан 331
Монокарбид 179 сл.
Мононитрид 168 сл., 418
Моиооксалатометатитановая кислота
294
Моноксид, см. Одноокись
Моноортоарсенатооксотитановые кис-
лоты 289
Моноортофосфатометатитановая кис-
лота 287
Моноортофосфатоортотитановая кис-
лота 287
Моноселенид 71, 419
Моносилицид (моносилид) 183, 185,
420
Моностибид 177, 419
Моносульф атодвуметатитановая кис-
лота 277
Моносульфатометатитанат 279
Моносульфатометатитановая кислота
276
Моносульфатоортотитановая кислота
276
Моносульфатопероксоортотитановая
кислота 278
Моносульф атопятиортотнтановая кис-
лота 277
Моносульф атотитановые кислоты 2.76
Моносульфид 70 сл., 158, 159, 419
462
Монотеллурид 71, 419
Моиофосфид 47, 176, 419
Моиохлороксид 82, 83, 93, 418
Нарзарзукит 343
Нафтилтрибутоксид 326
Нептунит 301, 343
Нефелины 334
Нигрин 339
Ниобатосоединения 302
Ниобатотитанаты 3(12, 344
Нитраты 44, 73, 284, 285
сплавление с титаном 46
Нитратоксид 285
Нитратосоединеиия 284 с,и.
Нитратотитаповая кислота 286
Нитраттриамид 285
Нитратхлориды 285
Нитридоимидотитанаты 266, 267
Нитридоксиды 172 сл.
Нитридотитанаты 21, 172, 266
Нитриды 11, 38, 46, 47, 60, 91, 127,
149, 166 сл., 171, 172, 175, 418, 438
Нитрит 73, 74
о-Нитрофенилортотитаплт 315
Обогащение руд 349 сл.
Огнеупоры для плавки титана 376
Одноокись 35, 36, 65 сл., 147, 148, 151,
418, 426
получение 65
свойства 66 сл., 418, 426
электролиз 371
Оксалаты 75, 101, 102
Оксалатодвутитановая кислота 294
Оксалатоксиды 294, 295
Оксалатоксидперокснд 294
Оксалатопероксотитапаты 296
Оксалатопероксотитапопая кислота
294, 295
Оксалатосоединепия 294 сл.
Оксалатотитапаты 295 сл.
Оксалатотитаповые кислоты 294, 295
Оксид-гидрокеид 43
Оксиддифторид 55, 108, 248, 418
Оксидперокснд 248
Оксиды 11, 34 сл.
двойные 91
электролиз 370, 371
Оксмонофторид 418
Оксотетрафторотитлнвт 149
Оксотитан 20
Оксотитанаты 21, 91, 92, 225 сл.,
230 сл.
Оксотитановые кислоты 222 сл.
Октасульфатотрититанат 283
Октафторотитаиат 252
Октахлоротитаиат 259
Октаэдрит 339
Оливейраит 343
Ортоборатометатитанаты 299 сл.
Ортодититанаты 239, 240, 244
Ортотитанат-анион 21
Ортотинанат
бария 237, 238
бериллия 245
висмута 247
гадолиния 240
гафния 241
диспрозия 240
железа 241, 243
кадмия 245
кальция 234
кобальта 243
магния 231
марганца 241
натрия 228
никеля 243
скандия 239
стронция 235
тория 240
хрома 241
церия 239
цинка 244
циркония 240
Ортотитанатдекоксид 247
Ортотитанатоксид 243
Ортотитановая кислота 93, 141, 224,
225, 264
Ортотритптпппт
барии 238
кадмия 245
мнения 233
натрия 228
стронция 235
цинка 244
Ортофосфптооксопероксотитановая
кислота 287
Ортофосфатотрехтитановые кислоты
287
Ортофосфатотитановые кислоты 287
Октаортофосфатотрититанаты 288
Паредрит 339
Пегматиты 334
Пеитабромооксатитанаты 264
Пентабромооксотитановая кислота
259
Пентагидроксогидропероксотитанат
249
Пеитадивольфраматооксоортотита-
новая кислота 304
Пентанитридотрититанат 266
Пентасульфатодиоксидититанат 283
Пентасульфатотетрагидроксодвути-
тановая кислота 277
Пентасульфатотитанаты 99
Пеитасульфатотриоксотрититанат 283
Пентасульф атошестиметатитановая
кислота 278
Пентатитанаты 226, 229, 244
403
Пентафторопероксотитанаты 261, 262
Пентафторотитанаты 78
Пентахлорогидроксотитановая кисло-
та 257
Пентахлорооксотитанаты 153, 263
Пентахлорооксотитановая кислота 256
Пентахлоротитанаты 84
Пентоксид 446
Пентоксидтрихлорид 314
Перовскит 341, 347, 348
Перекись-двугидроокись 43
Перидотиты 334
Периодатосоединения 271
Пернитрид 148, 172
Пероксо-группа 21
Пероксометатитанат 249, 250
Пероксометатитановая кислота 149,
248
Пероксоортотитановая кислота 248
Пероксотитанаты 21, 248 сл.
Пероксотитановые кислоты 247, 248
Пертиоортотитановая кислота 265
Пертиосоединения 265, 266
Пертиотитановая кислота 265
Перренат 72
Перхлораты 72, 96
Перхлор атосоединения 268, 269
Пирофанит 343, 347
Пирохлор 302, 344, 348
Плавка 375 сл.
восстановительная 351 сл.
на чугун 354
Плюмбиды 38
Поликраз 344
Полиниобаты 302
Полисульфатотитановые кислоты 277
Полититанаты 21
Поляризация спонтанная 236
Полутораокись 88 сл., 94, 147, 148, 418
получение 88, 89
свойства 89 сл., 428
Пропилят 93
Пропилдициклопентадиенилхлорид
323
Пропилтрихлорид 318, 319
Пропионаты 129, 293
Пропионатгидроксиды 293
Пропиоиатосоединения 292 сл.
Пропионатохлориды 293
Пропоксид 446
Пропоксидтрихлориды 314
Рамзаит 348
Рафинирование 373
Реактивы на титан 390 сл., 396, 410
Редуктор Джонса 397
Роданосоединения 291, 292
Роданотитановая кислота 291
Руды 345
анализ 403, 411 сл.
Руды
обогащение 349 сл.
оксиднотитановые 345, 346
сернокислотная переработка 360 сл.
силикотитанатные 347, 348
титано-железные 346, 347
восстановительная плавка 351
Рутил 10, 144, 145, 338, 339, 345
Сагенит 339
Селенат 73
Селенатодвутитановая кислота 278
Селенатометатитановая кислота 278
Сел'енатотитановая кислота 278
Селенидхлорид 83, 161, 419
Селениды 11, 37, 95
Селенитодвутитановая кислота 278
Селенитоксид 274
Селенитометатитановая кислота 278
Селенитосоединения 274
Селенитотитановые кислоты 278
Сенаит 341
Сепаратор ленточный 350
Сесквиселенид 95, 419
Сесквисулъфиды 94, 158, 419
Сесквителлурид 95, 419
Сесквититанаты 233, 235, 238, 419
Сиениты 334
Силикатометатитанат 300, 301
Силикатосоединения 300 сл.
Силикатотитанаты 22, 300, 301
Силикотитанаты природные 343, 344
Силициды 11, 38, 119, 183 сл.
Системы
—титан — азот 166 сл.
—титан — водород 162 сл., 437
титан — дейтерий 164
титан — кислород 34 сл., 65, 88
425
титан — металл, двойные 190 сл.
не содержащие твердых рас-
творов 210
перитектического типа 189
202 сл., 210
с образованием соединений 189,
193 сл,, 195
-----твердых растворов 189,
190 сл., 204
тройные 204 сл.
эвтектического типа 189, 195 сл
210
а-титан — металл с .образова-
нием соединений 193 'сл.
с неограниченной растворимо-
стью 180, 181
с ограниченной растворимостью
191
fl-титан — металл с ограниченной
растворимостью 195
Ti—Ag 200
464
Системы
TI—Al 202, 203
TI—As 176
Ti—Au 201, 202
TI—В 186 сл.
TI—Bi 177
Ti—C 177 сл.
Ti—Co 197, 198
Ti—Cr 193 сл., 439
Ti—Cu 199, 200, 440
Ti—Fe 196, 197, 440
Ti—Ga 183 сл.
Ti—Hf 191
Ti—Mn 195, 196, 439
Ti—Mo 193
Ti—Nb 192, 193
Ti—NI 198, 199
Ti-P 176
Ti—Pb 202, 204
Ti—Pt 200, 201
Ti-Re 203
Ti—S 37
Ti—Sb 177
Ti—Sc 191
Ti—Se 37, 191
Ti—Si 183 сл.
Ti—Ta 192, 193
Ti—U 194, 195
Ti—V 191, 192
Ti—W 203, 204
Ti—Zr 190
Ti—Al—C 210
Ti—Al-Cr 207
Ti—Al—Fe 209, 210
'Ч—Al—Mn 209, 210
Tj—Al—N 210
TI—Al—o 210
Ti—Cr—C 207
Ti—Cr—Fe 207
TI—Hf—C 207
ti—Mn—Fe 210
Ti—Mo—Al 207
T|—Mo—C 207, 208
Ti—Mo—Cr 204
Ti—Mo—Mn 207
Ti—Nb—Mo 204
Ti—Ta—C 207, 208
Tl-V—Al 207
Ti—V—Fe 207
Ti—V—Mo 204
Tl-V—Nb 204 сл.
Ti-Zr-B 207
Ti—Zr—Hf 204
Ti—Zr—Nb 204, 205
TI—Zr—V 204, 206
TiBr3—CsBr 87
TiBr3—KBr 87
TiBr3—RbBr—Rb3[TiBr3] 87
TiBr4—Br2 135
TiBr4—HBr 134, 259
Системы
TiBr4—SO2 135, 434
TiC—TiN—TiO 183
T1C12—KC1 58, 59
TiCl2—NaCl 58, 59
TiCh-RbCl 58
TICU—AsCla 123
TiCl4—Br2 121, 431
TiC l4—CCU 127, 432
TiCU—CeHe 128, 433
TiCU—Cl2 120, 431
TiCU—GeCU 124, 432
TiCU—HC1 122, 255, 445
TiCU—b 122, 431
TiCU—NOCI 126
TiCU—PC13 123
TiCU—PC15 123
TiCU—POC13 126
TiCU— SC14 123
TiCU—SO2 125, 433
TiCU—SO2C12 125
TiCU—SbCl3 123
TiCU-SbCls 123
TiCU—SbFs 123
TiCU—Sbl3 123
TiCU—SeOCl2 126
TiCU—SiCU 124, 432
TiCU—SnCU 124, 432
TiCI4—TiBr3 123
TiCI4—TiBr4 138, 435
TlCr2—TiFe2 215
TiF4—F-—H2O 107
TIFe—V 215
TiMn2—TiFe2 215
TiO—TiCo2 216
TiO—TUOa 36
TiO2—AlsOa 238
T1O2—BeO 246
TiOs—Bi2O3 247
TiOj—CaO 233
TiO2—FeO 241
TiO2—Fe2O3 241
TiQ2—Gd2O3 240
T1O2—K2O 229
TiOs—MgO 231
TiOs—Na2O 226
T|02—P20s 286
Ti02-Ti2O3 240
TiO2—ZnQ 244
TiO2—ZrO2 240
TiO2—KaO—CO8 229
TiOs—КгО—H,0 229
TiO2—Na2O—CO2 226
TiO2—Na2O—H2O 226
TiO2—SOa—HsO 275, 276
TiO3-SO3 271
Ti2(SO4)3—H2SO4—IBO 98
Ti3O—Cr 215
Ti3O—Ni 216
T13O—TiCr2—Cr 215
405
Системы
Ti3O—TiFe2 216
Ti3O—Ti2Fe—TiFe 216
Соли титана 69
двойные 58, 62
Сплавы титана 39, 53, 189 сл., 375 сл.
анализ 403, 405 сл.
инструментальные 11
марганцовые 219, 220
медные 219, 220
молибденовые 220
на основе карбида титана 220, 221
технические 216 сл.
титано-алюминиевые 216, 217
титано-железные 217 сл., 441
АТ 217, 441
Т1—Сг 220
Ti—Си 219
Т1—Мп 220
Т1—Мо 220
Сталь(и)
облагораживание титаном 218
раскисление титаном 219
титановые 219, 441
— анализ 405 сл.
Станнатотитанаты 302
Станниды 38
Стеарат 299
Стибатосоединения 289
Стибиды 38
Струверит 340, 346
Субвисмутид 177, 420
Субгерманид 184
Субкомплексные соединения 22
Субнитрид 171, 418
Субоксиды 215 сл.
Субсилициды 184
Субстибид 177, 420
Субсульфид 70
Сульфаты 44, 45, 68, 72, 91, 96, 97,
125, 135, 271 сл., 381 сл.
Сульфатодиоксотитанаты 279
Сульфатдихлорид 273
Сульф атоксид 45, 97, 98, 136, 271,
272, 273, 276
Сульфатопероксотитанаты 283 сл.
Сульф атопероксотитановые кислоты
278
Сульфатополититанаты 282, 283
Сульфатополититановые кислоты 277,
278
Сульф атосоединения 271 сл., 361 сл.
Сульфатотитанаты 99, 278 сл.
Сульф атотитановые кислоты 275 сл.
Сульфаттридекаоксид 271, 273
Сульфаттриоксид 271, 273
Сульфатхлориды 125, 273
Сульфиды 11, 37, 44, 71, 94, 95,
156 сл., 160, 161
двойные 71
Сульфиды
смешанные 160, 161
соединения с эфирами 328
Сульфидоксид 45, 160, 419
Сулъфидхлорид 83, 160
Сфен 342, 347, 348, 351, 363
Сфено-апатиты, обогащение 351
Сэндвичевая структура 323
Танталатотитанаты 303
Тартраты 102
Тартратодвутитановая кислота 297
Тартратопероксотитанаты 298
Тартратосоединения 297, 298
Тартратотитанаты 297, 298
Тартратотитановые кислоты 297
Теллуриды 11, 37, 71, 95, 160
Тетраалкоксиды 306 сл., 446
Тетрйаллилоксид 308
Тетраароксиды 315
Тетраастатид 419
Тетрабензилтитан 325
Тетрабромид 34, 40, 42, 62, 64, 85, 86,
122, 132 сл., 149, 175, 418
амминсоединения 136
аммонолиз 136
восстановление 61, 366
получение 132
свойства 133 сл., 434
соединения 136 сл.
Тетрабромодихлоротитанат 260
Тетрабромохлоротитановая кислота
259
Тетрабутилтитаны 321
Тетрабутоксиды 308, 310
Тетрагалиды, соединения с эфирами
328
Тетрагексоксид 308
Тетрагептоксид 308
Тетрагидрид 166, 419
Тетрагидридоборат 100
Тетрагидридоборатхлорид 100
Тетрагидрогексадивольфраматотита-
нат 304
Тетрадифениламид 173
Тетрадиэтиламид 173, 174
Тетраиодатодигидроксотитановая кис-
лота 270
Тетраиодид 11, 34, 40, 63, 64, 88, 122,
134, 139 сл., 419
восстановление 367
получение 139 сл.
свойства 139 сл., 435
соединения 142
Тетракарбамиддихлоротитана (IV)
хлорид 331
Тетраквахлоротитан-катион 83
Тетралактатоортотитановая кислота
299
Тетраметафосфат 99
466
Тетраметилтитан 319, 320
Тетраметоксид 306
Тетрамид 172
Тетрамминдихлортитан 60, 171
Тетрамолибдатоортотитановая кисло-
та 303
Тетранитрофеноксид 315
Тетраноноксид 308
Тетраоксодифтородивисмутид 289
Тетраоктоксид 308
Тетраортоарсениттетраоксид 289
Тетраортоииобатооксотрититанат 302
Тетраортофосфатотриоксотритита-
новая кислота 287
Тетрапентоксид 308
Тетрапероксотитаиаты 249, 250
Тетрапропилтитан 321
Тетрапропоксиды 307, 308
Тетрароданид 291
Тетрароданооксотитанаты 291, 292
Тетрасиликатотитаноортотитанат 301
Тетрасульфатодититанат 99
Тетрасульфатоортотитановая кислота
277
Тетратиотитанат-анион 21
Тетратиотитановая кислота 264
Тетратитанат
бария 238
лития 226
натрия 229
рубидия 230
серебра 244
цезия 230
Тетраалкилсилоксититан 131
Тетратриметилметоксид 308
Тетратриметилэтоксид 308
Тетратримолибдатотитаиаты 303
Тетратриэтилметоксид 308
Тетрафенилметоксид 315
Тетраоенилтитан 324
Тетрафеноксид 315
Тетрафторид 34, 39, 41, 42, 55, 57, 62,
64, 68, 76 сл., 82, 86, 103 сл., 109,
122, 123, 141, 148, 153, 155, 159, 170
получение 103 сл.
свойства 105 сл., 428
соединения 105 сл.
Тетрафторобораты 100, 300
Тетрафтороборатотитановые кислоты
300
Тетрафторооксотитанаты 261
Тетрафторопероксотитанаты 263
Тетрахлорид 11, 34, 40, 41 сл., 44, 45,
57, 58, 62 сл., 79 сл., 86, 94, ПО сл.,
134, 135, 141, 148 сл., 159, 170, 175,
384, 418
аквасоединения 124
анализ 404
взаимодействия 119 сл.
восстановление 117 сл., 364 сл.
Тетрахлорид
очистка 359 сл.
получение 111 сл.
производство пигментов 384
физические свойства 115 сл.,
429 сл.
химические свойства 117 сл.
электролиз 372
Тетрахлоридгидроксотитаиат 263
Тетрахлородигидроксотитановая кис-
лота 256
Тетрахлороксотитанаты 153, 263
Тетрахлороксотитановая кислота 256
Тетрахлоропероксотитанат 264
Тетрахлороселенит 274
Тетрахлоротитанаты 84, 85
Тетрахлорфеноксид 315
Тетрахлорэтоксид 308, 309
Тетраэтилметилметоксид 308
Тетраэтилтитан 320
Тетраэтоксид 307, 310
Тиобромид 62, 161, 419
Тиодисульфид 265
Тиоиодид 64
Тиометатитановая кислота 264
Тиоортотитановая кислота 264
Тиотитанаты 21, 46, 266
Тиотитановые кислоты 44, 264
Тиохлориды 57, 125, 160, 419
Тиоцианаты 75, 102
Титан 9, 64, 106, 118, 119
азотирование 380
активность 16 сл., 33
аналитическая химия 389 сл.
анализ, дихлорхромотроповокис-
лотный метод 408, 410
— качественный 489 сл.
— количественный 393 сл.
— колориметрический 398 сл.
— купфероновый метод 395
— объемный 398 сл.
— оксихинолиновый метод 395
— пероксидный метод 398 сл.
— полярографический 402
— родаиидно-диантипирилмета-
новый метод 408
— селенистокислый метод 394
— таннино-антипириновый метод
396
— тимоловый метод 401
— фосфатный метод 394
— хромотроповокислотпый метод
400, 407, 410
атом, строение 13 сл.
атомный вес 14
борирование 380
в:1 а нмодейстнне с члгмеп ui|iiti,iMH
веществнмн 33 сл,, 111 ел.
е cdi'iuiiii'iiiiiiMii 311 ел., 113 ел,
1шсеткп<>ллс1111п 303 ел,
407
Титан
в природе 9, 333 сл.
геометрия деформации 24
геохимия 333 сл.
гетерополисоединения 22
двухвалентный 19, 20, 54 сл., 64 сл.
— аналитические реакции 392
— комплексаты 71 сл.
диффузия углерода в нем 179
— водорода в нем 163
жароупорность 380
извлечение из руд 349 сл.
изотопия 14 сл.
Интернеталлиды 18 сл.
ионизационные потенциалы 14
испарение 25
кислотообразование 16
ковка 378
ковкий 375 сл.
как плакировочный материал 53
— технический материал 47 сл.
конструкционно-технологическая
характеристика 47 сл.
коррозионная стойкость 49 сл.
коррозия 40
коэффициент сухого трения 48
критические константы 25
легирование 210, 217
листовой 53
литье 379
металлический 52 сл.
металлургия 11
механическая прочность 48
обработка 49, 378 сл.
окислительно-восстановительные
потенциалы 49
открытие 9
пассивация 50
плавление 25
плавка 351 сл., 375 сл.
плоскость скольжения и двойни-
кования 23, 24
плотность 25 сл.
поглощение азота 167
— водорода 38
— кислорода 37
полиморфизм 23 сл.
положение в периодической табли-
це 16 с л.
получение в чистом виде 10
прессование 379
применение 52 сл.
прокатка 378
рафинирование 373 сл.
сварка 380
свойства магнитные 32
— механические 27, 422
— оптические 425
— термодинамические 27 сл.,
422 сл.
Титан
— термоэлектрические 31 сл.
— упруго-прочностные 26 сл.
— физические 23 сл., 421 сл., 424,
425
— фотоэлектрические 33
— фрикционные 47
— химические 33 сл.
— электромагнитные 424
силицирование 380
соединения 18 сл.
— анализ 403 сл.
— интерметаллические 210 сл.
— комплексные 19 сл., 153, 327 сл.
— органические 22, 136, 306
--- анализ 416
— перекисные 17, 21, 247 сл.
— — анализ 416
— полупроводниковые 11
— применение в анализе 414 сл.
— простые 19 сл., 418 сл.
сплавы 53, 189 сл., см. Сплавы ти-
тана
способы соединения 380, 381
стандартный электродный потен-
циал 49
степень окисления 18
строение электронных оболочек 17
сублимация 25
оптические характеристики 32
твердые растворы 47
теплопроводность 29 сл.
трехвалентный 19, 20, 70, 74, 76 сл.
— анализ 392
— комплексаты 96 сл.
— органические производные 93,
100 сл.
— соли 93, 100 сл., 414
— халькогениды 88 сл.
четырехвалентный 19, 20, 103 сл.
— ацисоединения 268 сл.
— галиды 103 сл., 132 сл., 137 сл.,
142, 143
удельная прочность 52
фазовые превращения 24 сл.
электрометаллургия 369 сл.
электропроводность 30 сл.
элемент 13 сл.
элементарный 23 сл.
эрозионная стойкость в воде 52
а-Титан 23
0-Титан 23, 35
Титаналкилы 317 сл.
Титанарилы 324 сл.
Титанаты 11, 21, 170, 172, 222 сл.,
238 сл.
актиноидов 240
алюминия 238, 239
бария 235 сл., 444
бериллия 245
468
Титанаты
висмута 247
гадолиния 240
гафния 240, 241
диспрозия 240
европия 239
железа 241, 340, 341, 444
иттрия 239
кадмия 245
калия 229
кальция 233 сл., 341 сл., 443
кобальта 243
лантана 239
лития 225, 226
магния 230 сл., 443
марганца 241
меди 243, 244
натрия 226 сл., 442
неодима 239
никеля 243
празеодима 239
природные 343, 344
редкоземельных металлов 239
рубидия 230
самария 239
свинца 245, 246
скандия 239
стронция 234 сл.
тербия 240
хрома 241
цезия 230
церия 239
цинка 244
циркония 240, 241
Титанил 20
Титанит, см. Сфен
Титаниты 46, 92, 342
Титановая
губка 375
земля 9
промышленность 11
-фольга 53
Титановое мыло 299
Титановые
белила 10, 381 сл., 385 сл.
квасцы 99
кислоты 93, 136, 155, 222 сл.
минералы 338 сл., 411 сл.
руды 345 сл.
стали 219
шлаки 352, 353
Титановый
концентрат 349, 361
пигмент 381 сл., 384, 385
порошок 377 сл.
Титаномагиетиты 340, 341, 346, 347,
447
анализ 413
обогащение 349
плавка на чугун 354
Титанорганические соединения 317 сл.
Титаносиликаты природные 344
Титаноцен 323
Титантетраалкилы 319 сл.
Титантетраарил'ы 324, 325
Титанциклоалкодиенилы 321 сл.
Т итанциклопентадиенилалкилы 322,
323
Титанциклопентадиеииларилы 326,
327
Толилтрибутоксид 326
Трахиты 334
Третьокись 68, 418
Третьпятиокись 150
Триалкилмоногалиды 319
Триалкоксидмоногалиды 311 сл.
Триамид 174
Триароксидмонохлориды 315, 316
Триацетатгидроксид 293
Трибензилхлорид 325
Трибромгидроксид 87
Трибромид 40, 62, 85 сл., 134, 418
получение 85, 86
свойства 86 сл.
Трибромидмоноиодид 86
Трибромотригидроксотитановая кис-
лота 259
Трибромфторид ПО, 419
Трибромхлорид 137
Трибутоксидхлориды 312, 313
Тригексоксидхлорид 313
Тригерманатометатитанат 302
Тригидридхлорид 166
Тридиметилпропоксидхлорид 313
Трииодид 40, 63, 87 сл., 419
получение 87
свойства 87 сл.
Трииодбромид 142, 143, 419
Трииоддихлорид 419
Трииодхлорид 142, 143
Трикарбамидтрихлоротитана(IV) хло-
рид 331
Трикарбонатометатитанат 290
Триметилат 84
Триметилбромид 319
Триметилиодид 319
Триметилхлорид 319
Триметилхлоротриоксотитанат 311
Триметилциклопентадиенилтитан 323
Триметоксидхлорид 311
Тринитраттрифторид 285
Тринитридотитанат 266
Триоксалатопероксотитанат 296, 297
Триоксалатотитанат 246, 295, 296
Триоксотитанаты 92
Триортофосфатодититанаты 288
Трипентоксидхлорид 313
Трипропоксидхлориды 312, 313
Трисалицилатодихлоро(дибромо)ти-
танаты 299
469
Трисалицилатомоногалиды 299
Трисиликатодититанаты 301
Трисиликатометатитанаты 301, 302
Тристаннатотитанат 302
Трисульфатодвуортотитановая кисло-
та 277
Трисульфатометатитанаты 279 сл.,
Трисульфатометатитановая кислота
277
Трисульфатпентоксид 271, 273
Трисульфид 44, 265, 446
Тритартратодититанаты 297, 298
Тритартратопероксотитанаты 298
Тритиотитанаты 266
Тритиотитановая кислота 264
Трититанат
бария 238
натрия 228, 442
свинца 246
серебра 244
ураиа 240
цинка 244
Трифендиоксометатитанаты 315
Трифенилдиоксометатитановая кисло-
та 315
Трифенилдициклопентадиенилтитана-
ты 326
Трифенилметоксидхлорид 316
Трифенилциклопентадиенилтитан 326
Трифёноксидхлорид 315
Триформиатхлорид 129, 292
Трифторид 39, 76 сл., 83, 106, 418
получение 76
свойства 77 сл.
Трихлоразид 175, 176
Трихлорид 40, 58, 60, 68, 79 сл., 118,
119, 123, 124, 418
безводный 80
получение 79, 80
свойства 81 сл., 427
Трихлороамидотитанат 84
Трихлоротригидроксотитановая кис-
лота 256
Трихлоросульфатхлорид 274
Трихлорфенолят 128
Трихлорфторид 109, 418
Трихлорэтоксидхлорид 313
Трихроматометатитанат 303
Трихроматометатитановые кислоты
303
Триэтилат 84
Триэтилхлоротриоксотитанат 312
Триэтоксидхлорид 312, 313
Уранатоксид 304
Уранатосоединения 304
Фенилгалиды 325
Фенилдициклопентадиенилтитан 326
Фенилортотитанат 315
Фенилтрибутоксиды 325
Фенилтрипропоксид 325
Фенилтрихлорид 325
Феноксидтрихлорид 128, 316
Ферратосоединения 304, 305
Ферротитан 217, 409
Формиатосоединения 292 сл.
Формиаттрихлорид 292
Формиатхлориды 292
Формиаты 45, 74, 101
Фосфатопероксотитанаты 288
Фосфатосоединения 286 сл.
Фосфатотитаиаты 288
Фосфаты 99, 286
Фосфиды 38, 127, 176 сл.
Фосфитосоединения 287
Фталат 299
Фториды 103 сл., 108 сл.
Фторобор а тосоединения 300
Фтороксид 42, 55, 107
Фторооксотетратитанаты 261
Фторооксотитанаты 261
Фторопероксотитанаты 261 сл.
Фторотитанаты 78, 79, 251 сл., 254
Халькогениды И, 64 сл., 88 сл.
Хегбомит 341
Хлораты 72
Хлоргидроксиды 124
Хлоргидроксотитанаты 263 сл.
Хлоргидроксотитаиовые кислоты 256
Хлордигипонитрат 284
Хлорид-оксид 82
Хлорирование
аппарат 358
двуокиси 356 сл.
титанового сырья 355 сл.
Хлорнитрид 120, 171, 174, 418
Хлороксиды 120, 153 сл.
Хлороксотитанаты 263 сл.
Хлороксотитановые кислоты 256
Хлоропероксотитанаты 264
Хлоротитаиаты 85, 257 сл.
Хлоротитановые кислоты 254 сл.
Хлорсульфаттрихлорид 126, 274
Хлоросульфаты 274
Хлортриамид 173
Хлортрифторид 108, 109, 418 -
Хлорфенилортотитанат 315
Хлорфториды 57, 109
Хроматоортотитановая кислота 303
Хроматотитанаты 303
Цены 323
Циклопентадиенилалкоксиды 323, 324
Циклопентадиенилгалиды 321, 322
Циклопентадиеиилдибутоксидбромид
324
470
Циклопентадненнлдибутоксндхлорид
323
Циклопентадиенилтрнбромид 322
Циклопентадиенилтрихлорид 321
Чевкинит 301, 343
Чугун
анализ на титан 406 сл.
плавка 353, 354
Эвдиалит 348
Эвксинит 344
Эгирин 348
Эклогиты 334
Электролиз 370 сл.
Электрометаллургия 369 сл.
Эннеасульфатоэннеаоксогептатнта-
наты 282, 283
Эпистолит 344
Эссекситы 334
Этилат 93
Этилгидрометатитанат 310
Этилендиаминтетрабутоксотитан 330
Этилтрибромид 319
Этилтрииодид 319
Этилметилфеноксидтрихлорид 317
Этилтрихлорид 318, 319
Этилдициклопентадиенилхлорид 323
Этоксиды 93, 446
Этоксидоксидгидроксид 310
Этоксидтрибромид 314
Этоксидтрихлорид 314
Эшииит 344
Георгий Павлович Лучинский
Химия титана
Издательство „Химия", М., 1971 г.
472 с. УДК 546.821
Редактор Г. В. Левит, Н. Ф. Цветкова
Технический редактор В. В. Коган
Художник Юр. Сигов
Корректоры Г. А. Артемова, М. С. Хрипунова
Т-14526. Подписало к Печати 21/IX 1971 г. Формат бумаги 60X90'/,». Печ. л. 29,5.
Уч,-ц^Д. л. 81,54 Типогр. бум. № 2 Тираж 2500 эка. Цена 3 р. 39 к. БЗ № 38 — 1971 г,-
№ 14 ЗаК. 1128.
Ордена Трудового Красного Знамени
Ленинградская типография № 2 имени Евгении Соколовой Главполнграфпрома Комитета
по печати при Совете Министров СССР, Измайловский проспект, 29