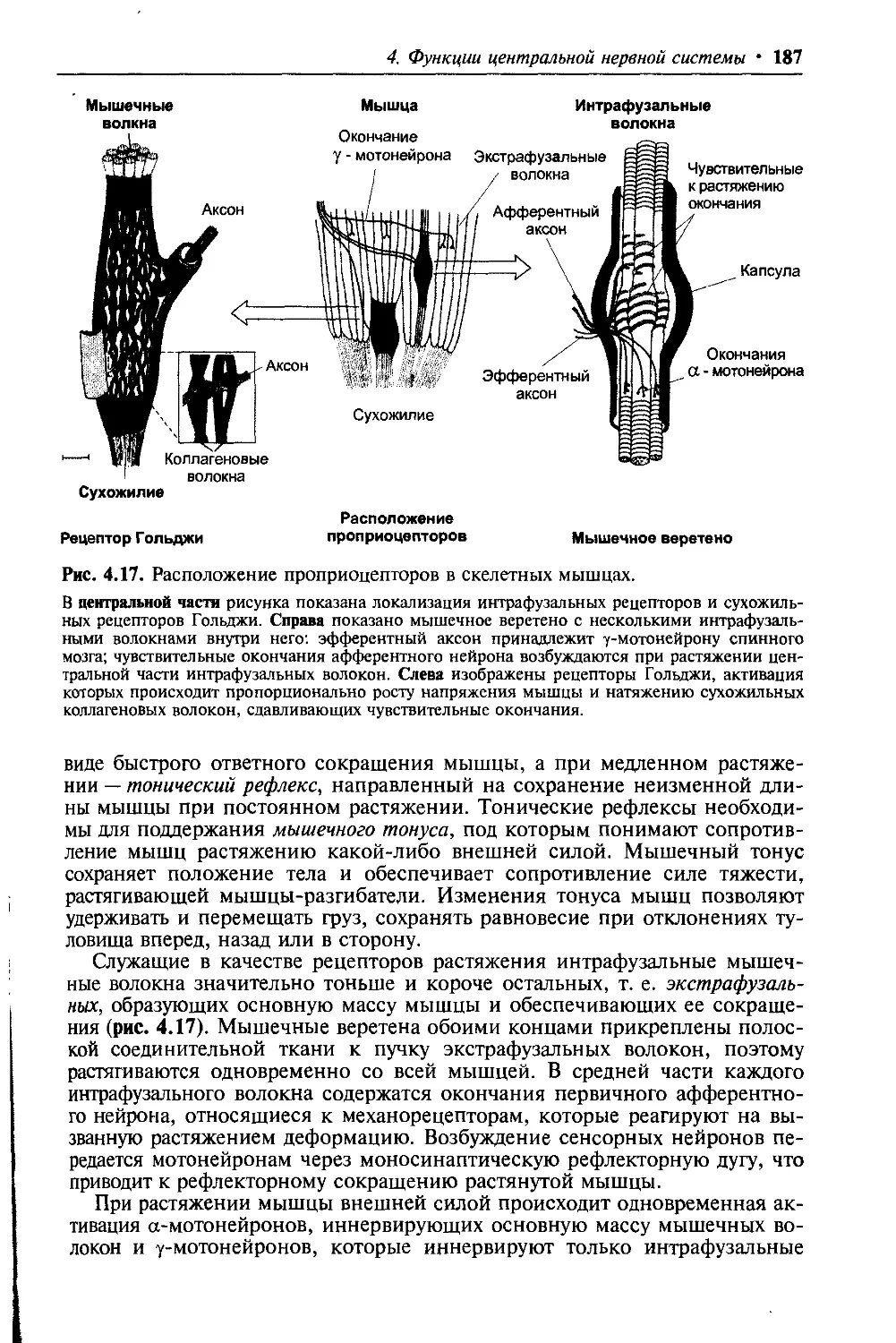
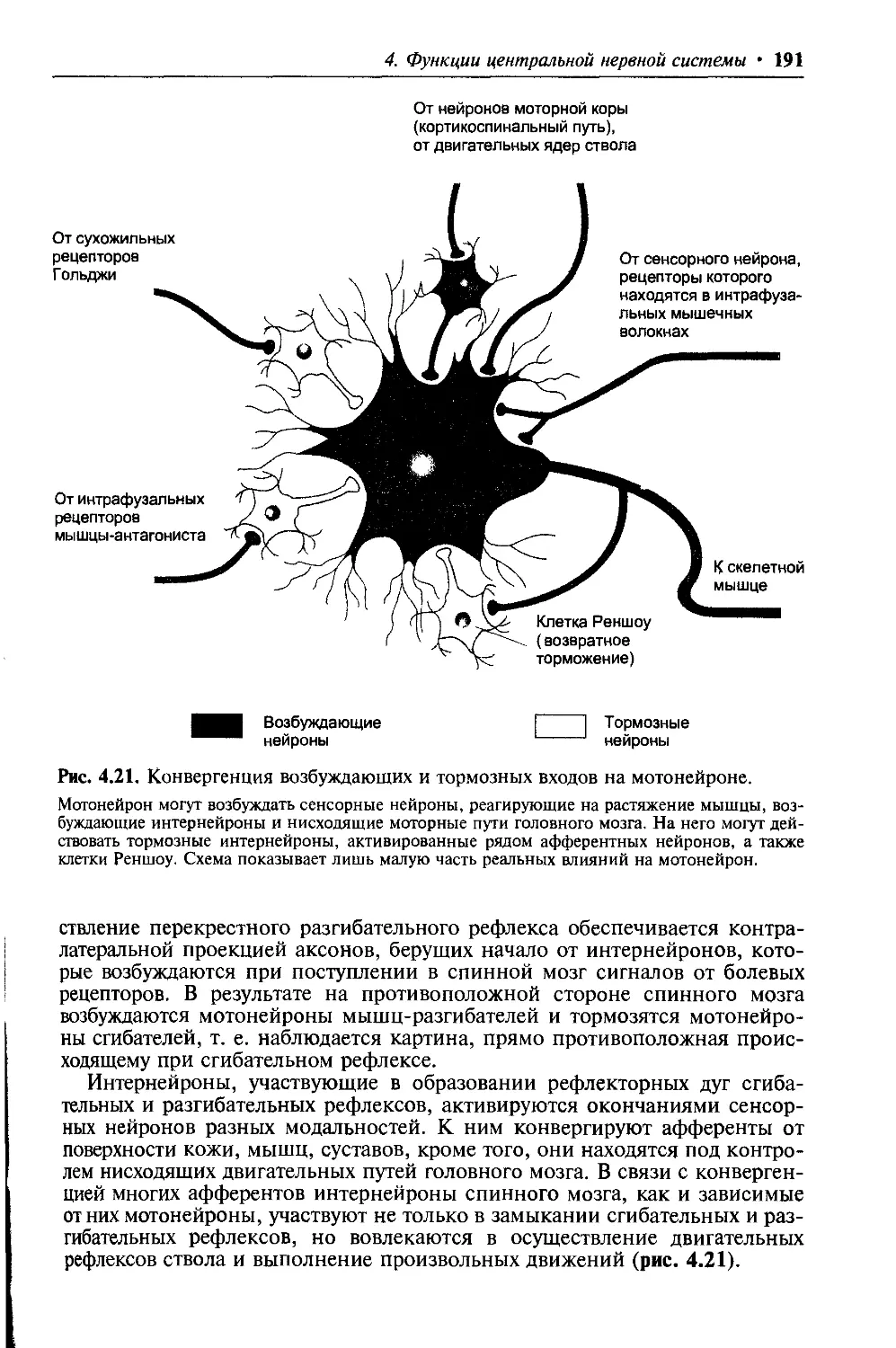
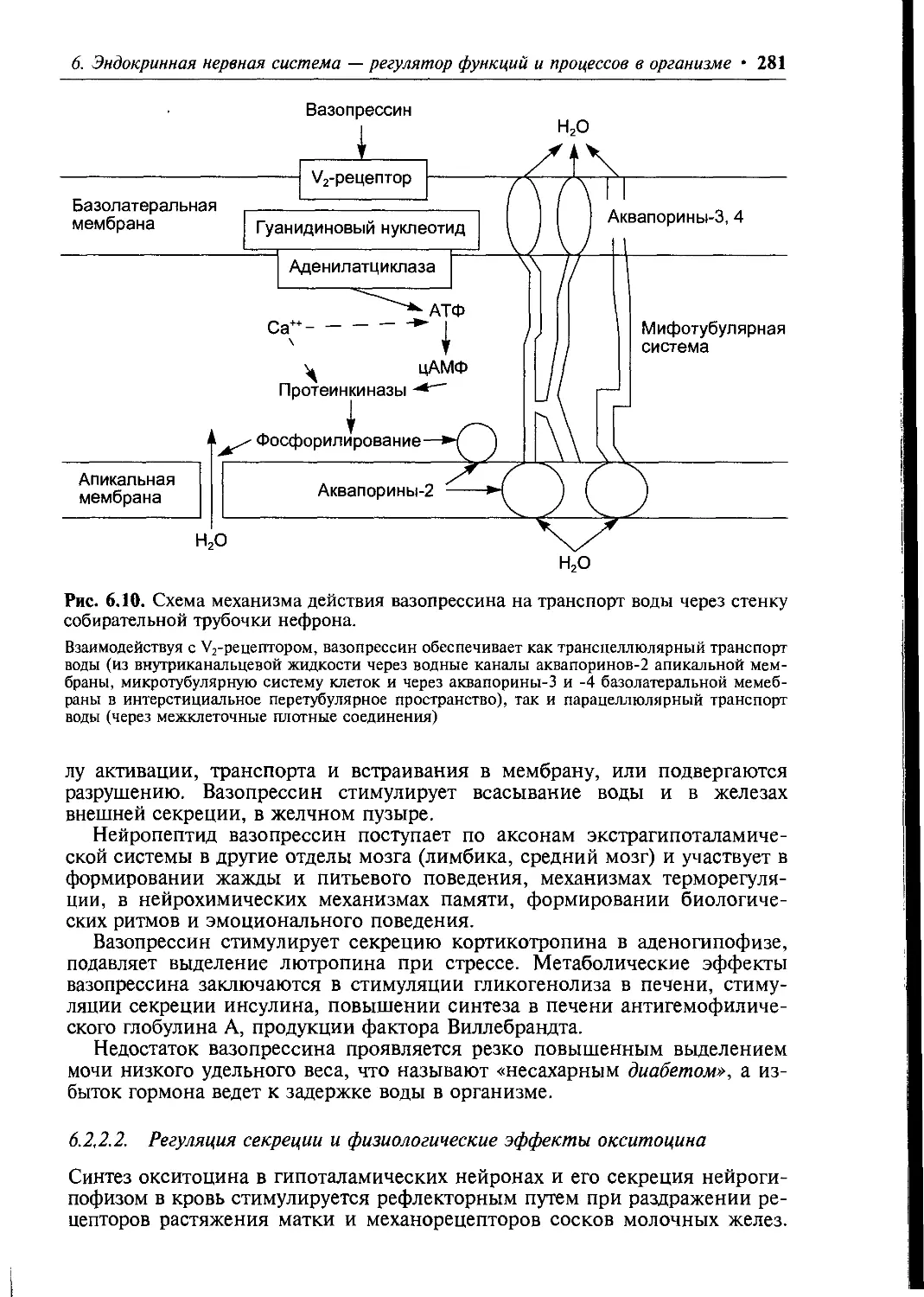
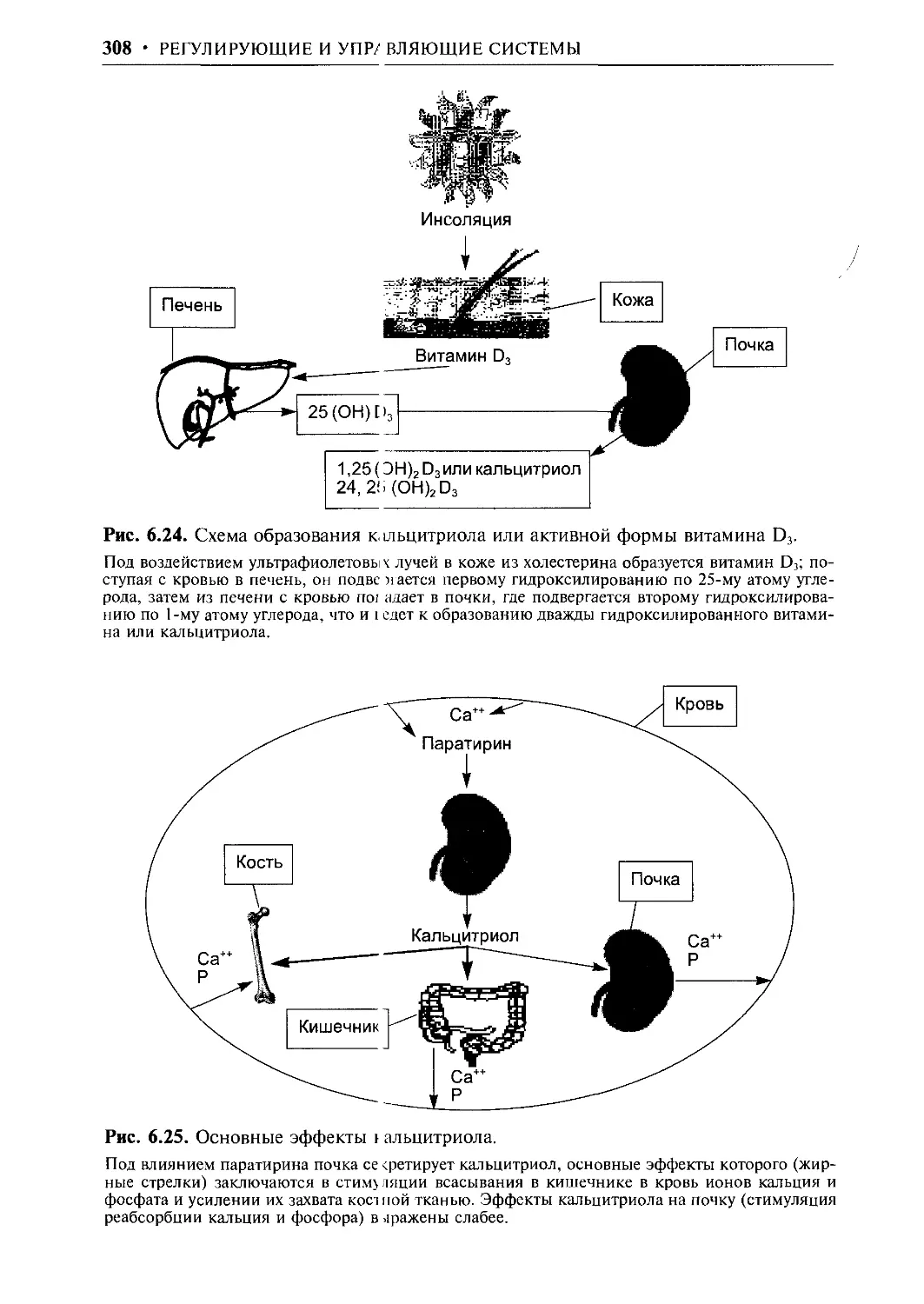
Author: Ткаченко Т.
Tags: медицина физиология практическая медицина народная медицина физиология человека
Year: 2005
Text
ГЛАВА 1
Жидкие среды организма
Жизнедеятельность многоклеточного организма полностью зависит от ок-
: ружающей среды, ее газового, водного, солевого состава, питательных
веществ, температуры среды, в которой он эволюционировал и обитает, и т.
д. Именно внешняя среда в ходе эволюции сформировала видовые
особенности обмена веществ между организмом человека, животных и внешней
средой: алиментарного (обмен питательными веществами и продуктами их
метаболизма), газового, водно-солевого и др. Этот обмен между
организмом и внешней средой прямого влияния на клетки тканей организма не
оказывает, так как жидкость в межклеточных пространствах является той
промежуточной средой, через которую из внешней среды в клетки
поступают кислород, энергетические и пластические ресурсы, и, напротив, в
нее из клеток поступают продукты белкового, жирового, углеводного,
солевого обмена и др. Из жидкости межклеточных пространств последние, с
кровью и лимфой в ходе кровообращения и лимфообращения,
перемещаются к органам, обеспечивающим выведение этих веществ из организма
(желудочно-кишечный тракт, почки, легкие, кожные покровы и др.).
Таким образом, для клеток организма человека и животных «внешней
средой» обитания является внеклеточная жидкость, которую Клод Бернар
назвал «внутренней средой организма» и рассматривал ее существование как
необходимое условие жизни клеток организма, не зависящей от изменений
внешней среды.
1.1. Внутренняя среда организма
К внутренней среде организма относят все жидкости внеклеточного
пространства: интерстициальную, или тканевую, жидкость, кровь, лимфу,
i трансцеллюлярные жидкости, заполняющие полости организма и
некоторых органов, — спинномозговую, внутриглазную, внутрисуставную
(синовиальную) жидкость, жидкости серозных пространств (плевральную, пери-
кардиальную, перитонеальную). Жидкости внутренней среды организма
характеризуются постоянством физико-химических показателей — осмо-
1 лярности, рН, концентрации различных ионов и органических
соединений, температуры Постоянны объемы, занимаемые различными
жидкостями внеклеточного пространства. Для каждого показателя внеклеточной
жидкости эмпирически установлены средняя величина и границы ее
нормальных отклонений (табл. 1.1), а также крайние сдвиги границ величины
показателей внеклеточной жидкости, при которых может нарушаться
жизнедеятельность клеток или организма в целом.
Показатели внутренней среды организма, диапазон границ отклонения
которых от средней величины мал (концентрация Na+, K+, рН), относят к
жестким константам. Показатели, границы отклонений которых от
средних величин имеют более значительный диапазон (концентрация глюкозы,
белки плазмы крови), относят к пластическим константам. Отклонения
20 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
Таблица 1.1. Средние величины некоторых показателей внеклеточной жидкости и
границы их нормальных отклонений
Показатель внеклеточной
жидкости
Na+, ммоль/л
К+, ммоль/л
Бикарбонат натрия, ммоль/л
рН
Са, ммоль/ л
02, мм рт. ст.
С02, мм рт. ст.
Нормальная
средняя величина
показателя
142
4,2
28
7,4
1,2
40
40
Нормальные
границы отклонения
показателя от
средней величины
138-146
3,8-5,0
24-32
7,35-7,45
1,0-1,4
35-45
35-45
Крайние, опасные
для жизни границы
сдвига показателя
115-175
1,5-9,0
8-45
6,9-8,0
0,5-2,0
10-1000
5-80
средних величин показателей внеклеточной жидкости к их верхним или
нижним нормальным границам (см. табл. 1.1) могут быть обусловлены
возрастом организма, социальными и профессиональными условиями, в
которых находится человек, а также временем года и суток, географическими
и природными условиями, половыми и индивидуальными особенностями
организма (см. главу 23).
Выход за нормальные границы физико-химических и биологических
жестких констант внутриклеточной жидкости является или причиной,
или следствием заболевания организма. Поэтому для врача исследование
показателей внеклеточной жидкости (крови, спинномозговой жидкости
и др.) и их отклонений от нормальных величин имеет большую
диагностическую ценность, поскольку используется врачом при постановке
диагноза заболевания, позволяет по изменению этих показателей
анализировать течение заболевания, оценивать эффективность применяемого
лечения.
Отклонения от нормальных границ физико-химических показателей,
объемов или давления жидкостей внутренней среды организма
воспринимаются рецепторами (осмо-, хемо-, волюмо- и барорецепторами),
улавливающими изменение ионного, газового, антигенного состава жидкостей,
их объема, оказываемого ими механического давления на стенки
кровеносных сосудов, что приводит к включению нервной, гормональной и
иммунной систем в организацию биохимических, биофизических и
физиологических регуляторных реакций, реализуемых различными системами
организма (дыхания, кровообращения, крови, выделения, иммунной
системой и др.), которые и устраняют сдвиги, возникшие во внутренней среде
организма.
При этом показатели внутренней среды контролируются в организме
механизмами, реализуемыми на уровне генома клеток, клеточном,
тканевом, органном, системном, и организменном. Например, сниженное
содержание кислорода в крови уменьшает поступление его в клетки почек,
являющихся высокочувствительными к недостатку кислорода, что
приводит к активации в них участка генома, ответственного за синтез эритропо-
этиновой и-РНК. Биосинтез эритропоэтина клетками почек резко
усиливается, костный мозг, стимулированный эритропоэтином, воспроизводит
больше эритроцитов, и с увеличением массы гемоглобина в крови
возрастает количество переносимого кровью кислорода. На данном примере
можно видеть, что изменение физиологической константы — содержания
кислорода в крови — включило механизмы, контролирующие этот пара-
1. Жидкие среды организма • 21
метр внутренней среды организма на уровне генома клеток почек, на
тканевом уровне — в костном мозге и в системе крови — в целом.
У. Кэннон предложил обозначать постоянство внутренней среды
организма, обеспечиваемое совокупностью физиологических реакций систем
организма, возникающих при действии на него внешних и внутренних
возмущающих влияний, термином «гомеостазис» («гомеостаз» — от греч.
homoios — подобный, stasis — неподвижность).
Гомеостазис есть состояние относительного и динамического
постоянства показателей внутренней среды организма, отклонение от которого
устраняется регуляторными механизмами.
1.2. Биологические свойства жидкостей, составляющих
внутреннюю среду организма
1.2.1. Вода как составная часть жидкостей организма
Основу жидкостей внутренней среды организма составляет вода. Общее
содержание воды в организме взрослого человека составляет около 60—
65 % от массы его тела. При этом на долю внутриклеточной (интрацеллю-
лярной) воды приходится 7з> т- е- 40—45 % от массы тела, а остальное
количество воды, составляющее 20—23 % от массы тела, распределено во
внеклеточном пространстве. Из них около 16 % содержится в составе
межклеточной жидкости (интерстициальная жидкость), 5 % — внутри сосудов,
т. е. интравазально, в составе плазмы крови, 2 % — в лимфатических
сосудах, в составе лимфы, 1—3 % воды от массы тела — в составе трансцеллю-
лярных жидкостей.
Между всеми водными секторами организма осуществляется
постоянный водный обмен (рис. 1.1)
Вода является растворителем всех органических и неорганических
веществ, поступающих из внешней среды в организм и всасывающихся в
желудочно-кишечном тракте. Вода, входящая в состав крови, интерстициаль-
ной жидкости и лимфы, переносит растворенные в ней питательные
вещества к клеткам тканей и продукты обмена — к органам выделения. В воде,
входящей в состав клеток организма, осуществляются все процессы обмена.
Вода, благодаря высокой теплоемкости и теплопроводности, участвует в
терморегуляции, обеспечивая
выведение тепла из организма
(теплоотдачу) с помощью потоотделения,
испарения пота, тепловой одышки.
В крови, лимфе, трансцеллю-
лярных жидкостях,
пищеварительных соках вода находится в
свободном, т. е. не связанном с
органическими соединениями
состоянии. В интерстициальном
пространстве и клетках организма
большая ее часть находится в
связанном состоянии, т. е. связана с
белками (например, с молекулами
коллагена), другими
органическими соединениями. Поэтому вода
не вытекает при рассечении
тканей органов.
А
5%
а
—*•
ч-
Б
16%
/ '
Г
2%
1
—*-
-<—
В
40—45 %
t"
Д
1—3 %
Рис. 1.1. Распределение и обмен воды
между разными секторами тела взрослого
человека (в процентах от массы тела).
А — вода плазмы крови; Б — интерстициальная
вода; В — внутриклеточная вода; Г — вода
лимфы; Д — трансцеллюлярная вода. В процентах
указан объем воды, находящейся в секторе,
рассчитанный по отношению к массе тела.
22 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
Суточная потребность человека с массой тела 70 кг в воде составляет
2,5 л, из них 1,2 л поступает в организм человека в виде питьевой воды,
1 л с пищей, 0,3 л образуется при окислении жиров, белков и углеводов.
Такое же количество воды (2,5 л) ежесуточно выводится из организма: с
мочой до 1,5 л, с потом 0,5 л, с выдыхаемым воздухом 0,4 л, с калом 0,1 л.
Вода в организме человека обновляется за 1 мес, а внеклеточная — за
1 нед. Недостаточное поступление воды в организм человека (например,
если поступление воды в организм меньше ее объема, интенсивно
выделяемого с потом на жаре) приводит к уменьшению воды в крови, интер-
стициальном пространстве. Это состояние называется дегидратацией.
Дегидратация вызывает сгущение крови, повышение ее вязкости и, как
следствие, нарушение кровообращения. Дегидратация, достигающая 20 % от
массы тела, может привести к летальным последствиям.
1.2.2. Гистогематические барьеры
Между кровью и внеклеточным пространством находятся образования,
получившие название гистогематических барьеров, отделяющие плазму
крови от внеклеточной жидкости разных тканей организма. Последняя
отделяется от внутриклеточной жидкости мембранами клеток.
Гистогематические барьеры и мембраны клеток обладают избирательной
проницаемостью для ионов и органических соединений. Поэтому электролитный и
органический составы плазмы крови, внеклеточной и внутриклеточной
жидкости различаются между собой.
По особенностям проницаемости для белков на уровне кровь — ткань
все гистогематические барьеры делят на три группы: изолирующие,
частично изолирующие и неизолирующие. К изолирующим барьерам относят
гематоликворный (между ликвором и кровью), гематонейрональный, гема-
тотестикулярный (между кровью и тестикулами), гематоэнцефалический
(между кровью и мозговой тканью) и гематоофтальмический (между
кровью и внутриглазной жидкостью), барьер хрусталика глаза. К частично
изолирующим относятся барьеры на уровне желчных капилляров печени, коры
надпочечников, пигментного эпителия глаза между сосудистой и сетчатой
оболочками, щитовидной железы, концевых долек поджелудочной железы
и гематоофтальмический барьер на уровне цилиарных отростков глаза.
Неизолирующие барьеры хотя и позволяют белку проникать из крови в интер-
стициальную жидкость, однако ограничивают его транспорт в
микроокружение и цитоплазму паренхиматозных клеток. Такие барьеры существуют
в миокарде, скелетных мышцах, мозговом слое надпочечников,
околощитовидных железах.
Структурным элементом гистогематических барьеров является стенка
кровеносных капилляров. Морфологические и функциональные
особенности клеток эндотелия капилляров — размер пор в их мембране, наличие
фенестр, наличие межклеточного основного вещества, цементирующего
щели между эндотелиоцитами капилляров и толщина базальной мембраны
определяют проницаемость барьера для воды и растворенных в ней
молекул веществ различных размеров и строения. Содержащиеся в крови
вещества (вода, кислород, С02, глюкоза, аминокислоты, мочевина и др.) могут
проникать через барьер двумя путями (рис. 1.2): трансцеллюлярно (через
клетки эндотелия) и парацеллюлярно (через межклеточное основное
вещество).
Трансцеллюлярный транспорт веществ может быть пассивным (т. е. по
концентрационному или электрохимическому градиенту без затрат энер-
1. Жидкие среды организма • 23
Трансцеллюлярный обмен Парацеллюлярный обмен
Рис. 1.2. Транспорт веществ через стенку капилляров.
Эр — эритроциты, ЭК — эндотелиальные клетки, Л — лейкоциты.
гии) и активным (против градиента с затратами энергии).
Трансцеллюлярный перенос веществ осуществляется и с помощью пиноцитоза, т. е.
процесса активного поглощения клетками пузырьков жидкости или
коллоидных растворов. Парацеллюлярный транспорт, или перенос веществ через
межклеточные щели, заполненные основным веществом, окутывающим
волокнистые структуры фибриллярного белка, возможен для молекул
разных размеров (от 2 до 30 нм), поскольку в капиллярах размеры
межклеточных щелей неодинаковы. Базальная мембрана капилляров разных органов
имеет неодинаковую толщину, а в некоторых тканях прерывиста. Эта
структура барьера играет роль молекулярного фильтра, пропускающего
молекулы определенного размера. В состав базальной мембраны входят гли-
козаминогликаны, способные уменьшать степень полимеризации и
адсорбировать ферменты, повышающие проницаемость барьера. Снаружи в
базальной мембране располагаются отростчатые клетки — перициты. Точных
сведений о функции этих клеток нет, предполагается, что они выполняют
опорную роль и продуцируют основное вещество базальной мембраны.
Основные функции гистогематических барьеров — защитная и регуля-
торная. Защитная функция заключается в задержке барьерами перехода
вредных веществ эндогенной природы, а также чужеродных молекул из
крови в интерстициальную среду и микроокружение клеток. При этом не
только сама сосудистая стенка с ее избирательной проницаемостью, но и
ячеисто-коллоидные структуры интерстиция, адсорбируя такие вещества,
24 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
препятствуют их поступлению в микросреду клеток. Если же произошло
проникновение крупномолекулярных чужеродных веществ в интерстици-
альное пространство и они не подверглись здесь адсорбции, фагоцитозу и
распаду, то такие вещества поступают в лимфу, а не в клеточное
микроокружение. Лимфа в этом плане представляет собой как бы «вторую линию
обороны», поскольку содержащиеся в ней антитела, лимфоциты и
моноциты обеспечивают обезвреживание чужеродных веществ.
Благодаря регуляторной функции гистогематические барьеры
контролируют состав и концентрацию молекул различных соединений в интерсти-
циальной жидкости, изменяя проницаемость барьеров для ионов,
питательных веществ, медиаторов, цитокинов, гормонов, продуктов метаблиз-
ма клеток. Таким образом гистогематические барьеры регулируют
поступление различных веществ из крови в интерстициальную жидкость и
своевременный отток продуктов клеточного обмена из межклеточного
пространства в кровь.
Проницаемость гистогематических барьеров изменяется под влиянием
вегетативной нервной системы (например, симпатические влияния
уменьшают их проницаемость). Изменяют проницаемость
гистогематических барьеров в сторону как увеличения, так и уменьшения
циркулирующие в крови гормоны (например, кортикостероиды уменьшают
проницаемость гематоэнцефалического барьера), тканевые биологически
активные вещества (биогенные амины — серотонин, гистамин, гепарин и др.),
ферменты (гиалуронидаза и др.), образуемые как самими эндотелиальны-
ми клетками, так и клеточными элементами интерстициального
пространства. Например, гиалуронидаза — фермент, вызывающий
деполимеризацию гиалуроновой кислоты основного вещества межклеточных
пространств. Поэтому при его активации резко повышается проницаемость
барьеров; серотонин — снижает их проницаемость, гистамин повышает
ее; гепарин — ингибирует гиалуронидазу и в результате уменьшения ее
активности снижает проницаемость барьеров; цитокиназы —
активизируют плазминоген, и усиливая растворение фибриновых волокон,
повышают проницаемость барьера. Повышают проницаемость барьеров
метаболиты, вызывающие сдвиг рН в кислую сторону (например, молочная
кислота).
Проницаемость гистогематических барьеров зависит и от химического
строения молекул переносимых веществ, их физико-химических свойств.
Так, для растворимых в липидах веществ гистогематические барьеры более
проницаемы, поскольку такие молекулы легче проходят через липидные
слои мембран клеток.
1.2.3. Внутриклеточная жидкость
Во внутриклеточной жидкости преобладающими катионами являются
калий (150 мэкв/л) и магний (40 мэкв/л), содержится большое количество
ионов НРО4 (100 мэкв/л) и белков анионпротеинатов (т. е. молекул белка,
имеющих отрицательный заряд) (55 мэкв/л). Столь высокие концентрации
ионов калия во внутриклеточной жидкости связаны с их участием в
биосинтезе белков и углеводов, магния — участием более чем в 300 энзимных
внутриклеточных реакциях. Фосфатные ионы и анионпротеинаты входят в
состав основных буферных систем, поддерживающих рН внутриклеточной
жидкости. Осмотическое давление во внутриклеточной и внеклеточной
жидкости примерно равно, что поддерживает постоянство объемов воды в
этих секторах. Поэтому важнейшим следствием поддержания постоянства
1. Жидкие среды организма • 25
осмотического давления внеклеточной жидкости являетсй стабильность
объема воды, содержащейся в клетках организма.
В отличие от внеклеточной жидкости, физико-химические показатели
которой строго поддерживаются на постоянном уровне регуляторными
механизмами, что и обеспечивает оптимальные условия для деятельности
клеток организма, физико-химические показатели внутриклеточной
жидкости характеризуются весьма широким диапазоном колебаний, которые
обусловлены уровнем функциональной активности клеток. Так, при
переходе клетки из ее нормального состояния в состояние возбуждения или
торможения ее активности концентрация ионов — К, Mg, Ca — в жидкой
среде цитоплазмы резко изменяется. Например, концентрация ионов
калия, являющаяся «жесткой» константой внеклеточной жидкости во
внутриклеточной жидкости во время активации клеточной функции может
изменяться от 115 до 150 мэкв/л. Концентрация ионов кальция в цитоплазме
клетки, находящейся в состоянии физиологического покоя, составляет
Ю-7—10"8 моль/л, а при действии возбуждающего активность клетки
сигнала (медиатора, гормона) концентрация Са++ в цитоплазме возрастает до
10~5—10~6 моль/л, т. е. в 20 раз. В то же время даже незначительное
увеличение концентрации ионов Са во внеклеточной жидкости — с 1,2 до
1,4 ммоль/л, включает регуляторные механизмы, восстанавливающие
нормальную концентрацию Са++ во внеклеточной жидкости.
1.2.4. Интерстициальная, или тканевая, жидкость
Около '/б объема тела человека составляет пространство, расположенное
между клетками организма, стенками кровеносных и лимфатических
сосудов. Оно называется интерстициальным, или интерстициумом, а жидкость,
заключенная в границах, образованных с одной стороны мембранами
клеток, с другой — стенками кровеносных и лимфатических капилляров,
называется интерстициальной, или тканевой, жидкостью. Как заметил К.
Бернар, это «внутреннее море», в котором живут клетки.
Структура интерстиция представлена сетью коллагеновых и
эластических волокон, филаментов протеогликанов. Коллагеновые волокна
представляют собой белок, образуемый фиброцитами соединительной ткани.
Масса коллагеновых волокон составляет 6 % массы тела, а общая
поверхность этих волокон превышает 1 000 000 м2. Сеть этой своеобразной кол-
лагеновой «губки» накапливает в интерстиции воду и электролиты,
особенно натрий. Пучки волокон коллагена простираются вдоль всего
интерстиция и обеспечивают механическую прочность (сопротивление) тканей.
К плотным структурам интерстиция относятся также филаменты
протеогликанов, очень тонкие и едва различимые в световом микроскопе. Их
свернутые спиралью молекулы на 98 % состоят из гликозаминогликанов —
гиалуроновой кислоты, хондроитинсульфатов А, В и С, а также белка.
Молекулы протеогликанов и гликозаминогликанов имеют отрицательный
заряд (анионы), благодаря чему поддерживается ионное равновесие с
катионами интерстициальной жидкости.
Интерстициальная жидкость заключена в основном в мельчайших
пространствах между филаментами протеогликанов и имеет характер геля.
Поэтому ее еще называют тканевым гелем. Таким образом, филамент
протеогликанов интерстиция формирует первую, коллоидную, или гелеподобную,
фазу интерстиция, которая благодаря высокой гидрофильности связывает
или освобождает воду под влиянием ферментов и биологически активных
веществ (гиалуронидаза, гепарин, гистамин и др.). Быстрый транспорт мо-
26 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
лекул воды, 02, С02, электролитов, питательных веществ, экскретов клеток
между кровеносными капиллярами и клетками тканей обеспечивается
простой диффузией через гель этих соединений. Скорость диффузии
указанных веществ от стенок капилляров до клеток на расстоянии до 50 мкм
осуществляется за несколько секунд. Вторая фаза интерстиция — водная, в
виде свободной жидкости, «текущей» по тонким «каналам» вдоль коллагено-
вых волокон, составляет не более 1 % интерстициальной жидкости. При
развитии отека (т. е. скопления воды и электролитов в межклеточном
пространстве) содержание свободной жидкости в интерстициальном
пространстве резко увеличивается, а «каналы» оказываются резко расширенными.
В обеих фазах интерстициального пространства у взрослого человека
содержится в среднем 11 — 12 л жидкости, т. е. около 16 % массы тела (см.
рис. 1.1).
В ионном составе интерстициальной жидкости преобладают ионы
натрия (142—144 мэкв/л) и ионы хлора (120 мэкв/л). Высокая суммарная
концентрация данных ионов определяет величину осмотического давления
интерстициальной жидкости. Поэтому при уменьшении концентрации Na
в плазме крови и интерстициальной жидкости (например, при
недостаточности коры надпочечников уменьшается секреция гормона альдостерона,
усиливающего реабсорбцию Na+ в канальцах почек и Na+ в больших
количествах с мочей выводится из организма) в интерстициальной жидкости
появляется «осмотически свободная вода», которая выводится из
организма через почки, а также по осмотическому градиенту диффундирует в
клетки и вызывает их набухание. При увеличении же концентрации Na+ в
интерстициальной жидкости (например, вследствие избыточного
поступления NaCl в организм с соленой пищей) ее осмотическое давление
повышается, вода задерживается в интерстициальном пространстве, что приводит
к развитию отеков. Концентрация К+ в интерстиции (3,8—5 ммоль/л) в
30 раз меньше, чем во внутриклеточной жидкости. Это «жесткая»
константа интерстициальной жидкости, и ее сдвиги вызывают нарушение
функций клеток. Так, например, увеличение концентрации К+ в
интерстициальной жидкости миокарда (следствие гиперкалиемии — увеличения
концентрации К+ в плазме крови) уменьшает соотношение концентраций —
К+ внутриклеточный / К внеклеточной жидкости, что приводит к
деполяризации мембраны, нарушает восстановление мембранного потенциала
клеток миокарда. В результате замедляется проведение возбуждения в
сердечной мышце, что может вызвать остановку сердца. Жесткими
константами являются и содержание Mg++ (0,75—1,2 ммоль/л) и Са++ (0,8—1,2
ммоль/л) во внеклеточной жидкости. Оба иона участвуют в поддержании
нервно-мышечной возбудимости. Например, ионы Mg++ влияют на
транспорт К+ через мембрану клетки и увеличение их концентрации во
внеклеточной жидкости (следствие гипермагниемии) угнетает возбудимость
нервной системы, скелетных мышц. Напротив, уменьшение концентрации
Mg++ или Са++ в крови вызывает повышение нервно-мышечной
возбудимости.
В интерстициальной жидкости содержится кислород, большое
количество питательных веществ для клеток — глюкозы, аминокислот, жирных
кислот, в ней содержится и С02, поступающий из клеток и диффундирующий
из интерстиция в кровь для удаления из организма, продукты белкового
метаболизма клеток (мочевина, креатин, креатинин и др.). Из
интерстициальной жидкости продукты обмена поступают в кровь и транспортируются ею
к органам выделения — желудочно-кишечному тракту, почкам, которыми и
выводятся из организма. Через поры капилляров соматического типа — их
1. Жидкие среды организма • 27
стенка представлена непрерывной базальнои мембраной и эндотелиальным
слоем, в которых имеются поры, шириной от 6 до 7 нм (в легких, коже) —
в интерстиций способно выходить небольшое количество белков плазмы
крови. Много большее количество их поступает в интерстициальное
пространство через стенку капилляров синусоидного типа, представленных,
например, в печени и имеющих эндотелиальный слой с фенестрами, базаль-
ную мембрану — с перерывами и в результате такой структурной
организации — прерывистую стенку с большими просветами. Поэтому содержание
белка неодинаково в интерстициальной жидкости разных тканей: оно
низкое в подкожной ткани, в легких — 0,5—2 г/л. Однако в лимфе, оттекающей
от интерстиция печени, в который из капилляров синусоидного типа
поступает большое количество белка, содержание последнего достигает 55—60 г/л.
Общее количество белка во всем объеме интерстициальной жидкости
организма (в 11—12 л) достигает 330—360 г. Отсюда, концентрация белка в
1 л интерстициальной жидкости составляет около 30 г/л и создает
коллоидно-осмотическое (онкотическое) давление, равное 8 мм рт. ст.,
являющееся силой, удерживающей жидкость в интерстиций.
Все белки из интерстициальной жидкости возвращаются обратно в
кровь только через лимфатическую систему. По пути кровь—лимфа—кровь
за сутки рециркулирует от 50 до 100 % белка.
Давление интерстициальной жидкости оказывается на 3 мм рт. ст.
меньше атмосферного. Причиной отрицательного давления
интерстициальной жидкости по отношению к атмосферному давлению является
постоянный отток жидкости из интерстиция по лимфатическим сосудам.
Интерстициальное пространство содержит клетки соединительной
ткани — фибробласты и фиброциты, тучные клетки, макрофаги и лимфоциты,
которые секретируют в микросреду клеток биологически активные
соединения (ферменты, гепарин, биогенные амины, простагландины, лейко-
триены, цитокины и др.), поддерживающие нормальное функциональное
состояние интерстиция. Клетки интерстициального пространства
осуществляют фагоцитоз, иммунную защиту интерстиция.
Микросреда клеток — это часть интерстициального пространства,
непосредственно прилегающего к поверхности клеток, толщиной порядка 10—
20 нм, играет основную роль в обмене веществ через ее мембрану.
Микросреда клеток отличается от среды общего интерстициального
пространства более высокой концентрацией поступающих из крови в
интерстиций аминокислот и жирных кислот, используемых в пластических и
энергетических процессах в клетке; медиаторов, гормонов и антигенов,
регулирующих клеточные функции (пролиферацию, дифференциацию,
метаболизм, синтез и секрецию антител и др.). Обмен воды и молекул между
микросредой клеток и общим интерстициальным пространством
происходит под влиянием градиентов сил гидростатического, онкотического и
осмотического давления, электрокинетических и электростатических
потенциалов. В создании последнего участвуют гликозаминогликаны,
формирующие отрицательный заряд на поверхности мембран клеток.
Находящиеся в микросреде гуморальные факторы — нейромедиаторы,
гормоны, метаболиты, цитокины, связываясь с их мембранными
клеточными рецепторами, осуществляют физиологическую регуляцию различных
функций клеток: процессов пролиферации и дифференцировки клеток, их
метаболизма, например синтеза и продукции ими белков, гликопротеидов,
липидов и других продуктов, что поддерживает постоянство структуры
органов и тканей организма, обеспечивает приспособительную реакцию
клеток к изменениям внешней среды.
28 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
1.3. Плазма крови как внутренняя среда организма
Кровь состоит из плазмы и клеток (форменных элементов) — эритроцитов,
лейкоцитов и тромбоцитов, находящихся во взвешенном состоянии в
плазме крови (см. главу 7). Плазма крови состоит из воды (около 90 % массы),
солей или электролитов (0,9 %), углеводов, липидов (1,1 %), органических
кислот и оснований, промежуточных продуктов обмена, витаминов и
белков (8 % массы плазмы). Плазма является для клеток крови жидкой
средой, обеспечивающей их нормальную жизнедеятельность.
Функции плазмы крови. Транспортная функция (дыхательная,
питательная, интегративно-регуляторная и экскреторная) — обеспечивает перенос
газов 02 СОь а также веществ, необходимых для жизнедеятельности как
клеток крови, так и других тканей организма (глюкозы, аминокислот,
витаминов и др.) или регуляции их функций (гормоны, цитокины)
обеспечивает перенос веществ, подлежащих удалению из организма (например,
продуктов белкового обмена — креатина, креатинина, мочевины и др.).
Защитная функция — связывает и нейтрализует токсичные вещества,
попадающие в организм или образующиеся в нем, связывает и разрушает
инородные белковые молекулы и чужеродные клетки, в том числе и
инфекционного происхождения. Клетки крови (лейкоциты, тромбоциты) секрети-
руют в плазму пептидные молекулы — цитокины, активирующие
регенерацию различных тканей организма (кроветворной, костной, кровеносных
сосудов и др.).
Объем циркулирующей крови, включающий форменные элементы и
плазму крови, у взрослого человека (нормоволемия) составляет 6—8 % от массы
тела (4—6 л) или 62,4 ± 7,8 мл/кг массы тела. Из них на долю
циркулирующей плазмы крови приходится 34,2 ± 4,5 мл/кг массы тела,
форменных элементов крови — 28,2 ± 4,0 мл/кг. После избыточного приема воды
объем плазмы крови может повышаться (гиперволемия), а при тяжелой
физической работе (например, в жарких цехах металлургического
производства) и связанном с ней избыточным потоотделением — снижаться (гиповоле-
мия). Процентная часть объема, занимаемая клетками крови, от общего
объема крови называется гематокритом. Гематокрит в норме (при нормо-
цитемии, т. е. при нормальном содержании форменных элементов в
крови) у мужчин равен 44—48 %, у женщин — 41—45 %.
Электролиты и белки плазмы крови формируют ее осмотическое и он-
котическое давление, коллоидную стабильность, влияют на процесс
свертывания крови и фибринолиза, на агрегатное (т. е. жидкое) состояние
крови, ее суспензионную устойчивость (т. е. поддержание клеток крови во
взвешенном состоянии), удельный вес и вязкость.
1.3.1. Электролитный состав плазмы крови
Электролитный состав плазмы крови (он соответствует таковому и в
сыворотке крови — под последней понимают плазму крови, лишенную
фибриногена) представлен катионами Na+, K+, Ca++, Mg++, Fe+++, Zn++ и Cu++,
анионами СГ, HCOJ, HPO4, HSO7 органических кислот и анионпротеина-
тами (1 г белков плазмы соответствует 0,208 мэкв/л) (табл. 1.2).
Суммарная величина анионов и катионов в плазме крови, выраженная
в мэкв/л, примерно одинакова. Нарушение этого равновесия может
возникать при расстройствах кислотно-основного баланса.
Содержание натрия, калия и кальция в плазме крови относится к
жестким гомеостатическим константам. Содержание электролитов в плазме
1. Жидкие среды организма • 29
Таблица 1.2. Содержание основных электролитов и некоторых микроэлементов (Fe, Zn
и Си) в плазме крови (средняя величина)
Катионы
Na+
К+
Са++
Mg++
Fef++
Zn++
Cu++
Общее количество
мг/л
3260
190
100
21
1
3
1
мэкв/л
142
4,8
5
1,8
0,05
0,09
0,03
154
Анионы
СГ
HCOJ
ро;
Протеины
Органические кислоты
Другие анионы
Общее количество
мг/л
3600
1500
100
72 000
270
—
мэкв/л
101,5
24,6
1,9
15
5
5
154
крови зависит от величины их поступления в организм с пищей и водой и
выведения из него с мочой, калом и потом, а также перераспределения
ионов между клетками и внеклеточной средой. Гомеостазис катионов натрия
и калия поддерживается изменением пищевого поведения человека
(большее или меньшее потребление соли), ренин-ангиотензин-альдостероновой
системой (усиливает реабсорбцию натрия в почках и выведение К+ с
мочой) и натрийуретическим гормоном предсердий (усиливает выведение
Na+ с мочой). На уровень ионизированного кальция в плазме крови
влияют гормоны: околощитовидных желез (паратирин — задерживает
выведение Са++ с мочой, повышает уровень Са++ в крови), щитовидной железы
(кальцитонин и его аналоги — усиливают выведение с мочой Са++), почек
(кальцитриол — усиливает всасывание Са++ в кровь из кишечника).
Минимум 15 микроэлементов содержатся в плазме крови (железо, медь,
кобальт, марганец, цинк, хром, стронций и др.). Они необходимы для
обеспечения нормального метаболизма клеток и их функций, поскольку
входят в состав ферментов, катализируют их действие. Ионы меди, цинка
участвуют в процессах образования клеток крови (гемопоэзе), а ионы
кобальта, железа — в синтезе гемоглобина.
1.3.2. Осмотическое и онкотическое давление плазмы крови
Концентрация ионов, выраженная в мэкв/л (или ммоль/л), позволяет
рассчитать осмотическое давление раствора (в данном случае плазмы крови),
создаваемое растворенными в ней ионами. Один ион-грамм вещества
создает 6,023 • 1023 частиц в растворе (число Авогадро) и формирует в 1 л воды
осмотическое давление в 1 осмоль. Следовательно, одна тысячная ион-
грамма (милли-ион-грамм) создает давление, равное 1 миллиосмолю
(мОсм). Отсюда:
Осмотическое давление в милиосмолях = Количество вещества в мэкв/Ва-
лентность.
Например, концентрация Na+ в плазме равна 142 мэкв/л, его
валентность — 1, создаваемое им осмотическое давление — 142:1 = 142 мОсм/л.
Концентрация СГ в литре плазмы составляет 101,5 мэкв.
Следовательно, его осмомолярность равна около 102 мОсм/л плазмы. Отсюда следует,
что величина осмотического давления плазмы, равная 304 мОсм/л,
создается в основном ионами Na и С1 и изменение их концентрации в плазме
крови наиболее выраженно изменяет ее осмомолярность.
Неионизированные вещества в плазме крови также поддерживают ос-
30 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
мотическое давление. Так, каждый грамм глюкозы в литре плазмы создает
давление в 5,6 мОсм.
Хотя содержание белков в плазме крови достигает 70—80 г/л, их
концентрация в ней весьма невелика, около 0,8 ммоль/л, поэтому
осмотическое давление, формируемое белками, равно 0,8 мОсм/л или 14 мм рт.ст.
В плазме содержится 42 г альбуминов, т. е. 0,0006 моля, и 28 г глобулинов,
что составляет 0,0002 моль/л. Однако плазма крови с указанным
количеством белков создает осмотическое давление, эквивалентное 25—28 мм рт.ст.
Объясняется это тем, что белки, будучи отрицательно заряженными
ионами, удерживают вблизи своих молекул большое число положительно
заряженных ионов (катионов, в основном ионов натрия). Эти добавочные
катионы увеличивают величину осмотически активных веществ в плазме
крови и делают ее осмотическое давление примерно на 50 % больше, чем
создаваемое только белками (эффект равновесия Даннона). Осмотическое
давление, создаваемое белками плазмы, получило название
коллоидно-осмотического или онкотического давления. В основном оно создается
альбуминами плазмы. Онкотическое давление белков плазмы крови
обеспечивает постоянное поступление воды в кровеносные капилляры из тканей,
так как интерстициальная жидкость имеет более низкое онкотическое
давление (8 мм рт.ст.), чем плазма крови (25—28 мм рт.ст.). При заболеваниях
почек, при которых имеет место потеря альбуминов с мочой
(альбуминурия), онкотическое давление плазмы крови резко снижается, жидкость
задерживается в тканях, у больного возникают отеки.
1.3.3. Обмен воды между плазмой крови и интерстициальной
жидкостью
В организме человека между плазмой крови и интерстициальной
жидкостью имеет место постоянный обмен водой. Он возможен благодаря тому,
что в артериальном конце капилляра гидростатическое давление крови
(сила, выталкивающая воду из сосуда,— Ркапил.) равно 30 мм рт.ст. и
превосходит онкотическое давление плазмы (т. е. силу, удерживающую воду в
сосуде, равную 25—28 мм рт.ст.). Выходу жидкости из капилляра в интерсти-
ций способствуют также отрицательное давление интерстициальной
жидкости, равное —3 мм рт. ст., и притягивающее воду в интерстиций
коллоидно-осмотическое давление этой жидкости, равное 8 мм рт.ст. Таким
образом, общее давление сил, движущих жидкость из сосуда в интерстици-
альное пространство (фильтрационное давление), составляет 41 мм рт.ст. и
преодолевает силу, удерживающую жидкость в сосуде, равную 25—28 мм
рт.ст. Следовательно, фильтрационное давление, перемещающее жидкость
из капилляра в ткань, составляет:
* фильтрационное "* ММ рт. СТ. V г капил> ~т- ^интерстиц. жидкости *колл-осм. интерстиц. жидкости
— Рколл.-осм. плазмы) = 13—16 ММ рТ.СТ.,
где
Ркапил. = ЗОММрТ. СТ.,
^интерстиц. жидкости ^ MM pi. С1.,
*колл-осм. интерстиц. жидкости " MM pi. С1.,
Рколл.-осм. плазмы = 25—28 ММ рТ. СТ.
В результате в артериальной части капилляра имеет место выход воды,
составляющий 0,5 % плазмы крови, в интерстициальное пространство.
Напротив, в венозной части капилляра, где гидростатическое давление крови
1. Жидкие среды организма • 31
ГС
га
х
га
s
zx
S
о.
ф
I-
X
Артериальная
часть капилляра
Венозная часть
капилляра
Отток интерстициальной
жидкости по капилляру
Лимфатический
капилляр
Рис. 1.3. Обмен воды между плазмой крови в капилляре и интерстициальной
жидкостью.
1 — сила, направляющая движение воды из сосуда в интерстициальное пространство; | —
сила, удерживающая воду в сосуде; 7*\ — направление движения воды. 1 — Ргшцюстаг. в
артериальном конце капилляра =30 мм рт.ст.; 2 — Р,
-3 мм рт.ст.; 4 — Р,
= 10 мм рт. ст.
К.ПЛЦХМЫ КРОВИ
Lo MM pi.Cl., J д интсрстиц. жидкости
колл,- осм. интсрстиц. жидкости
8 мм рт. ст.; 5 — Ргщростат. в венозной части капилляра
снижается до 10 мм рт.ст и становится меньше онкотического, т. е. силы,
возвращающей жидкость в сосуд (25—28 мм рт. ст.), вода
интерстициальной жидкости диффундирует в капилляр (см. рис. 1.3). Таким образом,
сила, возвращающая жидкость в сосуд из интерстиция, составляет:
"колл.-осм. плазмы \^ ^° ММ рТ.СТ.^ \*капил. \1" MM pT.CT.j > г интсрстиц .жидкости
(-3 ММ РТ.СТ.) + РКОлл.-осм. интсрстиц. жидкости (8 ММ рТ.СТ.) = 4—7 ММ рТ. СТ.
Возврат воды из интерстиция в капилляр составляет 90 % от объема
жидкости, профильтровавшейся в артериальной части капилляра.
Остальное количество жидкости возвращается из интерстиция в кровоток по
лимфатическим сосудам.
Осмотическое давление влияет на распределение воды не только между
кровью и интерстициальной жидкостью, но и между последней и клетками
организма. Это положение демонстрирует влияние гипертонического и
гипотонического растворов поваренной соли на гидратацию эритроцитов.
Так, эритроциты, помещенные в гипертонический раствор, в результате
дегидратации сморщиваются, а в гипотоническом растворе они набухают и
лопаются, что используется для определения их осмотической
резистентности. Разрушение эритроцитов называется гемолизом. Концентрация Na-
С1, при которой начинается гемолиз единичных эритроцитов,
характеризует их минимальную осмотическую резистентность (обычно 0,5—0,4 %
NaCl), а концентрация NaCl (обычно 0,34—0,3 % NaCl), лизирующая все
эритроциты, — максимальную осмотическую резистентмость.
32 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
1.3.4. Продукты белкового обмена, углеводы и липиды плазмы
крови
Остаточный, или белковый, азот крови — это азотсодержащие продукты
белкового катаболизма (мочевина, мочевая кислота, креатин, свободные
аминокислоты, индикан). Величина остаточного азота (в норме 14,3—
28,6 ммоль/л) отражает эффективность выделения продуктов белкового
обмена через почки. Повышение остаточного азота и его компонентов в
крови является важным диагностическим показателем нарушения их
экскреторной функции.
Концентрация мочевины в плазме крови в норме составляет 300 ± 75 мг/л,
т. е. около 50 % небелкового азота плазмы. Мочевина — это конечный
продукт деградации белков, который подлежит выведению из организма.
Увеличение ее концентрации в плазме крови, так же как и креатинина
(в норме 9—11 мг/л плазмы), отмечается при почечной недостаточности.
Мочевая кислота — это конечный продукт расщепления основных
белков. В норме ее концентрация составляет 50 мг/л плазмы. Ее увеличение в
плазме крови характерно для подагры.
Содержание свободных аминокислот достигает 500 мг/л плазмы.
Уменьшенное их содержание в сыворотке или плазме крови имеет место у
больных с анемиями и объясняется усиленным использованием аминокислот в
костном мозге для синтеза гемоглобина.
Углеводы плазмы крови — более 90 % приходится на глюкозу — главный
источник энергии для клеток. Глюкоза растворима в воде, способна к
мембранному транспорту (она свободно проходит через мембрану эритроцита,
поэтому ее концентрация в единице объема воды в плазме и в
эритроците — одинакова). Глюкоза используется клетками для обеспечения их
энергией, образуемой при аэробном или анаэробном гликолизе. Глюкозы
больше в плазме артериальной крови, чем в венозной, так как она непрерывно
используется клетками тканей. В целом, ее уровень зависит от всасывания
из желудочно-кишечного тракта, поступления из депо (гликоген печени),
новообразования из аминокислот и жирных кислот (глюконеогенез),
утилизации тканями и депонирования в виде гликогена.
У человека содержание глюкозы определяют натощак в цельной крови.
В норме ее количество составляет 0,8—1,2 г/л цельной крови. Гомеостазис
глюкозы регулируется вегетативной нервной системой и многочисленными
гормонами (инсулин, глюкагон, адреналин, глюкокортикоиды и др.).
Например, увеличение концентрации глюкозы в плазме крови активирует
секрецию инсулина, стимулирующего ее утилизацию клетками тканей,
использование глюкозы при синтезе молекул гликогена и жира. Увеличение
глюкозы в плазме крови (гипергликемия) характерно для сахарного
диабета, при заболевании которым в организме больного имеет место
недостаточность инсулина.
Общее содержание липидов в плазме крови достигает 5—8 г/л.
Разделенные с помощью электрофореза (или ультрацентрифугированием), они
обнаруживают на липидограмме гетерогенный состав и включают
холестерин, фосфолипиды, триглицериды, жирные кислоты. Взаимодействие этих
липидов с белками — апопротеинами формирует липопротеины высокой
плотности (ЛПВП), состоящие на 50—60 % из белков; липопротеины
низкой плотности (ЛПНП), очень богатые жирами и лишь на 20—25 %
состоящие из белков и, наконец, липопротеины очень низкой плотности
(ЛПОНП), на 90 % состоящие из липидов. ЛПНП и ЛПОНП переносят от
печени к другим тканям липиды, а ЛПВП транспортируют избыточный
1. Жидкие среды организма • 33
холестерин из тканей в печень, где он и его эфиры превращаются в
желчные кислоты и выводятся с желчью в кишечник, а затем — из организма.
Среди органических кислот в плазме крови в наибольших количествах
представлены молочная (80—100 мг/л), пировиноградная (3—8 мг/л) и
лимонная (9—13 мг/л) кислоты. Рост уровня молочной кислоты в крови,
например, свидетельствует об усилении анаэробного гликолиза, что имеет
место в организме после интенсивной физической работы.
1.3.5. Белки плазмы крови
Белки плазмы крови (их около 200 видов) обеспечивают: 1)
коллоидно-осмотический и водный гомеостаз; 2) агрегатное состояние крови и ее
реологические свойства (вязкость, свертываемость, суспензионные свойства);
3) кислотно-основный гомеостаз; 4) иммунный гомеостаз; 5)
транспортную функцию крови; 6) питательную функцию крови как резерва
аминокислот; 7) детоксикационную функцию.
Общее количество белков в плазме крови в норме составляет 57—81 г/л,
в том числе фибриногена — 2—4 г/л. С помощью электрофореза белки
плазмы разделяются на следующие фракции: преальбумин, альбумин, а,-,
а2-, Р- и у-глобулины. Преальбумины выполняют в основном
транспортную функцию, перенося гормон тироксин, ретинол (производное
витамина А). В норме их количество составляет 0,18—0,37 г/л сыворотки.
Недостаток белка или цинка в рационе человека нарушает синтез и уменьшает
концентрацию преальбумина в сыворотке крови.
Альбумины — это низкомолекулярные белки с молекулярной массой,
равной 69 000. Они, как и преальбумины, образуются в печени, поэтому
при ее заболевании количество этих белков в плазме крови уменьшается.
Примерно '/з общего количества альбуминов (200—300 г) в организме
взрослого человека находится в плазме крови (37—55 г/л сыворотки
крови), а 2/з— вне сосудистого русла, во внеклеточной жидкости. Между
плазмой крови и внеклеточной жидкостью происходит непрерывный обмен
альбумина. Альбумин выполняет несколько функций в плазме крови и
тканях — участвует в формировании коллоидно-осмотического (онкотиче-
ского) давления (на его долю приходится 80 % величины этого показателя
в крови), что позволяет ему участвовать в поддержании транскапиллярного
обмена жидкости, тургора тканей и объема жидкости во внутрисосудистом
и внеклеточном пространствах. Альбумин легко соединяется с
органическими (билирубин, свободные жирные кислоты) и неорганическими
веществами (ионы Mg, Ca и др.), стероидными гормонами (прогестерон и др.),
лекарственными средствами (антибиотики, сердечные гликозиды),
доставляя их с током крови в ткани, и, напротив, транспортирует многие
продукты метаболизма от тканей к районам их выведения из организма
(например, билирубин, образовавшийся в ходе разрушения гемоглобина) — к
печени, почкам, легким, желудочно-кишечному тракту, способствуя деток-
сикационной функции организма. Альбумин является компонентом
буферной системы плазмы крови, регулирующей кислотно-основное
равновесие. Как легкоусвояемый белок альбумин легко расщепляется в тканях
до аминокислот, используемых клетками в качестве пластических и
энергетических ресурсов.
Глобулины имеют высокую молекулярную массу (105 000—900 000). Их
концентрация составляет около 30 % от общей массы белков в сыворотке
крови.
Отношение фракции альбумины/глобулины в сыворотке крови у взрос-
2 - 6095
34 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
лого человека колеблется от 1,3 до 2,3. На долю глобулинов приходится
15—18 % величины поддержания коллоидно-осмотического давления
крови. В этой группе белков при электрофоретическом их разделении
различают арглобулины (4 %), а2-глобулины (8,5 %), р-глобулины (12 %) и
у-глобулины (18 %).
а-Глобулины: гликопротеины, связанные с углеводами (2/з всей глюкозы
плазмы циркулирует в составе гликопротеинов); они являются
транспортными белками для гормонов, витаминов и микроэлементов; а-глобулины
осуществляют транспорт липидов, участвуя в образовании липопротеид-
ных комплексов, в составе которых переносятся триглицериды, фосфоли-
пиды, холестерин и сфингомиелины.
^-Глобулины — богатая липидами фракция белка, которая содержит 3/4
всех липидов плазмы крови, в том числе фосфолипиды, холестерин и
сфингомиелины.
Выполняя функцию белков-переносчиков различных соединений
(например, а- и р-глобулины — так называемые транскобаламины —
участвуют в переносе витамина В12 с кровью от кишечника к тканям;
^-глобулин — трансферрин — связывает и переносит железо), а- и р- глобулины
участвуют в формировании «острофазных белков крови» (название связано
с выявлением этих белков в крови при остром начале заболевания; сц-
глобулины содержат а,-антитрипсин и а,-кислый гликопротеин; а2-глобу-
лины — содержат гаптоглобин, а2-макроглобулин, церулоплазмин, р,-глобу-
лин — гемопексин). У взрослых людей физиологическая концентрация
острофазных белков крови создает наряду с иммунной системой и грануло-
цитарно-моноцитарной линиями кроветворной ткани надежный барьер
против инфекций или поступления (образования) в организме токсичных
веществ (табл. 1.3). В последних случаях формирование острофазных
белков в печени компенсаторно возрастает и их уровни в крови резко
увеличиваются. Физиологические функции острофазных белков
характеризуются следующими свойствами. С-реактивный белок связывает соматический
пневмококковый полисахарид, активирует комплемент по классическому
и альтернативному пути, активирует комплементзависимую цитотоксич-
ность, а также фагоцитарную активность нейтрофилов и макрофагов,
тормозит агрегацию тромбоцитов. Фибронектин обладает опсонизирую-
щей функцией, способствует фагоцитозу бактерий нейтрофилами и
моноцитами/макрофагами. Амилоид А очищает плазму от токсичных
субстанций; а, антитрипсин и а2-макроглобулин — ингибиторы протеаз,
регулирующие иммунологические и воспалительные реакции; а!-антитрипсин
тормозит протеолиз, особенно выражено угнетение активности трипсина,
хемотрипсина, плазмина, тромбина и протеаз, высвобождающихся при
разрушении лейкоцитов и клеток тканей. На долю сц-антитрипсина
приходится до 90 % всей антитрипсиновой активности сыворотки крови; а,-
кислый гликопротеин модулирует функции Т- и В-лимфоцитов (синтез
антител, активность Т-киллеров, антителозависимую цитотоксичность).
Гаптоглобин связывает антигены макрофагов, участвует в угнетении
активности образующихся в избытке протеолитических ферментов.
Церулоплазмин связывает и транспортирует ионы меди к тканям. На его долю
приходится 80 % антиокислительной активности крови, он угнетает пере-
кисное окисление липидов, предупреждая накопление их токсичных
перекисей. Церулоплазмин ускоряет очищение и заживление ран, является
антиагрегантом. Таким образом, острофазные белки крови выполняют
важную функцию, связанную с повышением резистентности организма
человека к инфекции, токсичным соединениям, перекисному окислению
1. Жидкие среды организма • 35
Таблица 1.3. Физиологический уровень острофазных белков плазмы крови у лиц
молодого возраста (*, ** — по разным источникам)
Острофазные белки плазмы крови
а,-Кислый гликопротеин
Гаптоглобин
Церулоплазмин
а,-Антитрипсин
а2-Макроглобулин
С-реактивный белок
Содержание в плазме крови, г/л
0,4-1,05*
0,6-1,42**
0,4-2,9*
1,2-2,6**
0,2-0,4*
0,2-0,6**
2,0-4,0*
1,4-4,0**
1,5-3,5
0,47-1,34
липидов мембран клеток, усиливающемуся, например, при стрессе, что
является частью компенсационного интегрального ответа систем
организма на действие чрезвычайных раздражителей, повышающего его
выживаемость при болезнетворном воздействии среды. Снижение в крови
одного из острофазных белков— а,-антитрипсина, тормозящего протеолиз
при разрушении лейкоцитов и тканей, предрасполагает к бронхопульмо-
нальным заболеваниям (легочная эмфизема, хронический бронхит, брон-
хоэктатическая болезнь).
До 10 % глобулинов (значительная часть р-глобулинов) сыворотки
крови поддерживают функцию системы комплемента — комплекс системы
белков крови, обеспечивающий защиту организма человека от инфекции,
инициирующий воспаление и участвующий в поражении многих бактерий
и вирусов. Система комплемента состоит из И в физиологических
условиях неактивных белков плазмы крови, обозначаемых CI, C2 и т. д.
Активация системы комплемента происходит при иммунологической реакции,
реже под влиянием полисахаридов и при обязательном участии ионов
магния, ведет к лизису клетки.
К белковой защитной системе плазмы крови относят пропердиновую
систему, состоящую из собственно пропердина (белок Р), фактора В (В-гли-
копротеид, богатый глицином) и профермента (протеаза D). Система
активируется при обязательном участии ионов магния следующим образом:
вначале активируется пропердин (зимозаном дрожжей, эндотоксином
бактерий и другими липополисахаридами, гормоном инсулином); пропердин
активирует фактор D, который в свою очередь активирует фактор В, а
фактор В — систему комплемента, разрушающую клетки.
Другие гуморальные факторы, защищающие плазму крови от
инфекции, — лейкины, плакины и р-лизины плазмы крови и тканевой жидкости.
Лейкины (выделяются лейкоцитами) и плакины (секретируются в плазму
крови тромбоцитами) оказывают отчетливое бактериологическое действие.
Например, нейтрофильные лейкоциты при дегрануляции выделяют в
кровь, интерстициальную жидкость противомикробные пептиды — дефенси-
ны и кателицидины, низкомолекулярные катионные пептиды, поражающие
грамположительные микроорганизмы, грибки, вирусы. Выраженным лити-
ческим эффектом на стафилококки и анаэробные микроорганизмы
обладают fi-лизины плазмы крови, секретируемые тромбоцитами. Ныне они
идентифицированы как тромбоцитарные антибактериальные катионные
белки. Ферментативную активность микроорганизмов и вирусов подавляют
2'
36 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
Таблица 1.4. Иммуноглобулины, содержащиеся в сыворотке крови здорового человека
Свойства и функции
иммуноглобулинов
Концентрация в сыворотке
крови (мг/дл)
Величина ежедневного
синтеза (мг/кг массы тела в день)
Продолжительность
полужизни (сут)
Способность проникать в
организм плода через плаценту
Способность связывать и
активировать тучные клетки и
базофильные лейкоциты
Способность связываться и
активировать клетки — моно-
нуклеары
Молекулярная масса (кДа)
IgGl
90
3
1
+
—
+
46
IgG2
0
3
0
+
—
—
46
lgG3
0
3
7
+
—
+
70
IgG4
0,5
3
1
+
—
46
IgM
5
3
0
+
—
70
IgAl
30
4
6
60
lgA2
0,5
4
6
60
IgD
0,3
0,4
3
—
94
IgE
0,0005
0,002
2
—
+++
—
199
ингибиторы гиалуронидазы, фосфолипаз, коллагеназы, плазмина и
интерферон лейкоцитов.
Значительная часть белков плазмы (р-глобулины) представлена белками
свертывающей, антисвертывающей и фибринолитической систем крови,
являющихся составными частями системы гемостаза, т. е. системы,
сохраняющей жидкое состояние крови, поддерживающей целостность стенки
сосудов и останавливающей кровопотерю образованием тромба в месте
повреждения сосуда (см. главу 7).
Главной функцией у-глобулинов является обеспечение гуморального
иммунитета. С помощью иммунологического метода у-глобулины
разделяют на 5 классов иммуноглобулинов (Ig): IgG, IgA, IgM, IgD, IgE,
являющихся антителами (т. е. специфическими веществами, образующимися
при поступлении в организм человека чужеродных веществ — бактерий,
вирусов, токсинов — и нейтрализующих их) (табл. 1.4).
Около 75 % всех иммуноглобулинов в крови представлены IgG. Их
общая концентрация в сыворотке крови взрослого человека составляет 6,32—
14,79 г/л. IgG образуют антитела против подавляющего числа возбудителей
инфекций и в свою очередь представлены еще четырьмя субклассами —
IgGl, IgG2, IgG3, IgG4 (см. табл. 1.4). Все субклассы IgG могут проникать
через плаценту к плоду из организма матери и обеспечивать
новорожденному иммунную защиту против инфекции.
Содержание IgA в сыворотке крови составляет 20 % от общей массы
иммуноглобулинов (0,89—3,14 г/л). IgA-антитела обильно представлены в
различных секреторных жидкостях организма — слюне, кишечном соке,
трахеобронхиальных и мочеполовых секретах, молоке — и обеспечивают
секреторный иммунитет.
IgM-антител содержится 0,59—2,91 г/л. Эти антитела могут
активировать систему комплемента.
IgE-антитела участвуют в антипаразитарной защите организма,
аллергических реакциях. IgE прикрепляются к специфическим рецепторам на
мембране тучных клеток и базофильных лейкоцитов и, связываясь с
антигенами (чужеродные вещества, на которые вырабатывались данные
антитела), вызывают высвобождение из этих клеток биологически активных
веществ.
1. Жидкие среды организма • 37
IgD-антитела выполняют функцию мембранных рецепторов для
антигенов на поверхности В-лимфоцитов, участвуя таким образом в регуляции
иммунного ответа.
Поскольку продолжительность жизни иммуноглобулинов не велика
(особенно иммуноглобулинов A, D —см. табл. 1.4), то и в здоровом
организме человека интенсивность их синтеза значительна. Например, имму-
нокомпетентными клетками кишечника за сутки синтезируется 3 г IgA.
В плазме крови имеются белковые молекулы, представляющие собой
«плавающие» рецепторы многих гемопоэтических гормонов и цитокинов
(эритропоэтина, тромбопоэтина, интерлейкинов, колониестимулирующих
факторов) — биологически активные вещества, секретируемые клетками
крови, фибробластами и др. и регулирующие различные функции
организма (кроветворение, регенерацию тканей и др.). Клетки, продуцирующие
цитокиновые рецепторы, производят их в двух формах — в растворимой,
секретируемой в плазму крови, и в виде белковых компонентов,
встраиваемых в мембрану клетки. Растворимые формы рецепторов действуют как
белки, соревнующиеся с рецепторами клеток за связывание лиганда,
регулируя таким образом действие цитокинов на клетки-мишени.
1.4. Факторы, обеспечивающие жидкое состояние крови
Жизнедеятельность клеток организма, транспорт питательных веществ,
продуктов обмена и газов кровью, протекающие в ней биохимические и
иммунные реакции могут осуществляться только при сохранении жидкого
состояния крови. Поэтому они нарушаются при агрегации (склеивании
друг с другом) клеток крови. Поддержание крови в жидком состоянии
обеспечивается системой гемостаза (сбалансированным соотношением
компонентов свертывающей, антисвертывающей и фибринолитической
систем крови — см. главу 7), электрохимическими свойствами клеток и
белков крови. Электрохимические заряды расположены на поверхности
или вокруг этих структур крови и сохраняют эритроциты, другие клетки
крови во взвешенном состоянии в кровеносном русле, обеспечивают
устойчивость дисперсии белков в плазме крови. Поэтому поток крови в
сосудах представляет собой движение отрицательно заряженных частиц
(клеток крови, белков плазмы), что приводит к формированию
электростатического распора, обеспечивающего расстояние между клетками и
коллоидными элементами крови, препятствующее их агрегации. Препятствуют
агрегации клеток в потоке крови также силы поверхностного натяжения
мембран клеток, гидродинамические (механические) силы, перемещающие
клетки в направлении тока крови. Солидизации (соединению клеток крови
в агрегаты различной величины) способствуют снижение энергии
движущейся по сосудам крови, например в результате ухудшения работы сердца,
нарушение межмолекулярных отношений в мембранах эритроцитов,
снижение их деформабельности (способности клеток изменять и
восстанавливать форму), силы гравитации. При непродолжительном замедлении
кровотока агрегация эритроцитов обратима: при восстановлении кровотока
образовавшиеся агрегаты эритроцитов — «монетные столбики» —
распадаются на функционально полноценные клетки.
Коллоидная стабильность плазмы крови обусловлена гидратацией
белковых молекул и наличием поверхностного электрокинетического
«^-потенциала («^-потенциал — часть ср-потенциала, создаваемого двойным
электрическим слоем ионов на поверхности белковых молекул), т. е. потенциала
поверхности скольжения частицы в коллоидном растворе, который создает
38 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
одноименные заряды и силы электростатического отталкивания белковых
молекул и клеток крови. Это препятствует агрегации клеток и
поддерживает коллоидную устойчивость крови. Величина «^-потенциала выше у
альбуминов, чем у других белков плазмы крови. Поэтому альбумины, которые
адсорбируются на поверхности эритроцитов, поддерживают клетки в плазме
крови во взвешенном состоянии (т. е. поддерживают суспензионные
свойства крови). Крупнодисперсные белки (фибриноген, глобулины) снижают
суспензионные свойства крови. Эти свойства крови оценивают по
скорости оседания эритроцитов (СОЭ) в ее неподвижном объеме, которая у
мужчин равна 4—10 мм/ч, у женщин — 5—12 мм/ч. У новорожденных
скорость оседания эритроцитов замедлена в сравнении с ее значениями у
взрослых людей: она равна 1 мм/ч. Объясняется это низким (по
сравнению со взрослыми) содержанием у-глобулинов в плазме крови
новорожденных.
Скорость оседания эритроцитов возрастает при увеличении в крови
уровней фибриногена, а2,- р- и у-глобулинов, получивших в силу этого
свойства название агломеринов. Агломерины уменьшают отрицательный
заряд эритроцитов («^-потенциал). Уменьшение последнего приводит к
формированию агломератов эритроцитов, которые оседают быстрее, чем
отдельные клетки крови. Альбумины плазмы крови, содержащийся в ней
лецитин замедляют СОЭ. Нарастание в плазме крови содержания холесте-
рола, снижение соотношения в ней фракции альбуминов и глобулинов
(белкового коэффициента альбумины/глобулины, в норме равного 1,3—
2,3) увеличивают СОЭ. На величину СОЭ влияет и масса формирующихся
клеточных агломератов. Она оказывается тем больше, чем больше площадь
поверхности эритроцита, поэтому макроциты (эритроциты с большим, чем
в норме, диаметром) увеличивают и СОЭ. Увеличение СОЭ имеет место
при гиперфибриногенемии, при воспалительных заболеваниях оно связано
с гиперглобулинемией.
Вязкость определяют как свойство жидкости оказывать сопротивление
при смещении ее слоев относительно друг друга.
Вязкость плазмы или цельной крови — это сопротивление течению
жидкости при взаимном перемещении ее слоев и частиц за счет
внутреннего трения. Вязкость цельной крови создается взаимодействием воды
плазмы крови, макромолекулярных коллоидов (белков плазмы, липопро-
теидов и др.) и форменных элементов крови. Вязкость воды составляет
1,008 сантипуаз (сПз). Вязкость плазмы колеблется между 1,7 и 2,2 сПз,
цельной крови — от 4 до 5 сПз, т. е. вязкость плазмы в 1,8—2,5 раза, а
цельной крови — в 4—5 раз выше, чем воды. Повышению вязкости крови
способствуют: увеличение в ней содержания фибриногена, липопротеинов;
повышение концентрации углекислоты (поэтому вязкость артериальной
крови ниже, чем венозной); рост гематокрита (при повышении гематокри-
та до 60—70 вязкость крови возрастает в 10—20 раз по сравнению с
вязкостью воды); снижение суспензионных свойств крови за счет агрегации
эритроцитов. При этом рост вязкости крови всегда усиливает агрегацию
эритроцитов. Величина, обратная вязкости, называется текучестью,
поэтому с увеличением вязкости крови ее текучесть уменьшается.
Ток крови в сосудах с диаметром меньше 1,5 мм характеризуется
меньшей вязкостью, чем в сосудах более крупного диаметра (эффект Фареуса—
Линдквиста). Этот эффект связан с перемещением эритроцитов к центру
движущейся струи крови («центровкой» эритроцитов) при прохождении ее
через сосуд с диаметром меньше 1,5 мм и с формированием пристеночных
слоев плазмы крови. Пристеночные же слои плазмы обладают низкой вяз-
1. Жидкие среды организма • 39
костью. Вязкость крови резко возрастает, как только снижается скорость
ее тока. Так, при снижении скорости тока крови в мелких сосудах ниже 1
мм/с, вязкость крови возрастает почти в 10 раз, что связано с
увеличивающейся агрегацией эритроцитов и смещением их к стенке сосуда.
Удельный вес плазмы крови колеблется от 1024 до 1030. Удельный вес
эритроцитов составляет 1094—1107. Поэтому удельный вес цельной крови в
норме варьирует от 1052 до 1064, так как он зависит от количества
эритроцитов, содержания в них гемоглобина и состава плазмы. Например,
повышение гематокрита увеличивает удельный вес крови.
1.5. Лимфа как внутренняя среда организма
Лимфа образуется из жидкости, оттекающей из интерстициального
пространства в кровь по лимфатическим сосудам. В лимфатических сосудах
она проходит через лимфатические узлы, где ее состав меняется за счет
поступления в лимфу в основном лимфоцитов. Поэтому различают
периферическую (до лимфатических узлов), промежуточную (прошедшую через
лимфатические узлы) и центральную лимфу грудного лимфатического
протока.
Основные функции лимфы: 1) поддержание постоянства состава и
объема интерстициальной жидкости и микросреды клеток; 2) возврат белка из
интерстициальной жидкости в кровь; 3) участие в перераспределении
жидкости в организме; 4) обеспечение гуморальной связи между тканями и
органами, лимфоидной системой и кровью; 5) всасывание и транспорт из
желудочно-кишечного тракта в кровь продуктов гидролиза пищи, особенно
липидов; 6) транспорт антигенов и антител, перенос из лимфоидных
органов плазматических клеток, иммунных лимфоцитов и макрофагов в кровь.
Количество, состав и свойства лимфы. В теле человека в среднем
циркулирует 1,5—2,0 л лимфы. Лимфа состоит из лимфоплазмы и форменных
элементов белой крови. В центральной лимфе отношение объема форменных
элементов к общему объему (лимфокрит) менее 1 %. Удельный вес лимфы
колеблется от 1010 до 1023; рН находится в диапазоне 8,4—9,2.
Осмотическое и онкотическое давление и вязкость лимфы ниже благодаря
меньшему, чем в плазме крови, содержанию белка и ионов Na+.
Химический состав периферической лимфы зависит от ее источников.
Лимфа, оттекающая от кишечника, содержит от 30 до 40 г/л белка, богата
жирами (до 40 г/л), оттекающая от печени — содержит больше белков (до
60 г/л) и углеводов (до 1,3 г/л).
Центральная лимфа имеет следующий белковый и ионный состав:
Белковые фракции
Альбумины (г/л)
Глобулины (г/л)
а,-Глобулины (%)
а2-Глобулины (%)
р-Глобулины (%)
у-Глобулины (%)
Фибриноген (г/л)
Протромбин (%)
Общий белок (г/л)
Содержание
15,0-40,0
10,0-16,1
2,9-9,1
5,2-11,0
6,7-17,7
10,0-23,8
1,5-4,6
30,0-78,7
25,0-56,1
Ионы
Na+
К+
Са++
Mg++
сг
Концентрация (ммоль/л)
114,3-137,5
3,6-5,8
2,0-3,1
0,6-1,5
92,0-140,7
Альбуминоглобулиновый коэффициент лимфы приближается к 3, что
отражает значительно большую долю содержащихся в лимфе альбуминов,
чем глобулинов, по сравнению с плазмой крови — в последней
альбуминоглобулиновый коэффициент равен 1,3—2,3.
40 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
Клетки лимфы представлены, прежде всего, лимфоцитами (от 1 до 22
на 109/л) и моноцитами. Гранулоцитов в лимфе мало, а эритроциты у
здорового человека в лимфе отсутствуют. Появление эритроцитов в
лимфе — диагностический признак повышенной капиллярной
проницаемости.
Соотношение отдельных видов лейкоцитов в лимфе получило название
лейкоцитарной формулы лимфы. Она выглядит следующим образом:
лимфоцитов — 90 %, моноцитов — 5 %, сегментоядерных нейтрофилов — 1 %, эо-
зинофилов — 2 %, других клеток —2%. В лимфе могут формироваться
тромбы благодаря присутствию в ней тромбоцитов (5—35 • 109/л),
фибриногена и других белковых фракций. Время свертывания — 10—15 мин.
Образование фибриновых тромбов в лимфатических сосудах предупреждает
распространение по ним инфекции из очага воспаления.
1.6. Механизм образования лимфы
Большая часть жидкости, профильтровавшейся в артериальном конце
капилляров в интерстициальное пространство, реабсорбируется в их
венозном конце, перенося из интерстиция в кровь продукты конечного обмена,
ионы и др. Однако около '/io объема этой жидкости возвращается из ин-
терстициума в кровь через лимфатическую систему. Возможность возврата
интерстициальной жидкости по лимфатическим путям в кровь крайне
важна, так как содержащиеся в ней белки, в небольшом количестве
поступающие из артериальной части капилляров в межклеточное пространство,
не могут возвращаться в капилляр в его венозной части, но
беспрепятственно поступают в начальный отдел лимфатической системы —
лимфатические капилляры. Лимфатические капилляры начинаются слепыми
концами, «погруженными» в интерстиций (см. рис. 1.3). Выстилающие стенку
лимфатического капилляра эндотелиальные клетки прикреплены коллаге-
новыми волокнами, филаментом к окружающей капилляр соединительной
ткани, благодаря чему просвет лимфатического капилляра остается
открытым. «Конструкция» стенки лимфатического капилляра организована так,
что в местах соединения соседствующих эндотелиальных клеток край
одной клетки прикрывает свободно свисающий в просвет капилляра край
другой клетки, формируя маленький клапан. Под давлением
интерстициальной жидкости клапан открывается внутрь капилляра и жидкость вместе
с содержащимися в ней молекулами белка, другими суспензированными в
ней частицами поступает в лимфатический капилляр. Размер пор,
прикрываемых краями таких клапанов, позволяет проходить через них крупным
молекулам белков плазмы, вышедшим из крови в интерстициальное
пространство. Жидкость не может покидать капилляр через эту же щель между
эндотелиальными клетками, так как ее обратное движение закрывает
створку клапана. Лимфа из лимфатического капилляра оттекает в более
крупные лимфатические коллекторы, в которых также имеются клапаны,
располагающиеся в нескольких миллиметрах один от другого по току
лимфы и препятствующие ее обратному движению.
На отток лимфы по лимфатическим капиллярам влияют: 1) величина
давления интерстициальной жидкости, 2) автоматические сокращения
гладких мышц стенок лимфатических коллекторов и больших
лимфатических сосудов, 3) ритмические сдавления лимфатических сосудов
внешними тканями, 4) допускается также, что перекачиванию жидкости из
лимфатических капилляров способствует сокращение их эндотелиальных
клеток, содержащих сократительный филамент актомиозин.
/. Жидкие среды организма • 41
На отток лимфы влияет величина давления интерстициальнои
жидкости. Отток лимфы из капилляров, слабый при давлении интерстициальнои
жидкости, меньшем атмосферного на 6 мм рт. ст. (в нормальных условиях
давление интерстициальнои жидкости на 3 мм рт.ст. ниже атмосферного),
при нарастании интерстициального давления до 0 мм рт. ст. возрастает в
20 раз. Когда же давление интерстициальнои жидкости становится на 1—2
мм рт. ст. выше атмосферного нарастание оттока лимфы из тканей
прекращается, поскольку возросшее давление интерстициальнои жидкости
сдавливает лимфатические сосуды.
Поэтому факторы, увеличивающие давление интерстициальнои
жидкости, такие как повышенное гидростатическое давление крови в капилляре,
уменьшенное онкотическое давление плазмы крови, повышенная
концентрация белка в интерстициальнои жидкости, увеличивая объем и давление
последней на лимфатические капилляры, одновременно усиливают отток
из них лимфы. Другие факторы, регулирующие отток лимфы,
рассматриваются в главе 9.
1.7. Трансцеллюлярные жидкости организма
Состав этих жидкостей имеет отличие от состава плазмы крови, что
отражает разные функциональные задачи, выполняемые этими жидкостями в
различных полостях организма, о чем можно судить на примере
спинномозговой и синовиальной жидкостей.
Спинномозговая жидкость (цереброспинальная жидкость, ликвор)
образуется секрецией сосудистыми сплетениями головного мозга, мягкой
мозговой оболочкой, глией, эпендимой желудочков мозга. За сутки ее
формируется до 600 мл. Однако количество спинномозговой жидкости у
взрослого человека составляет 100—150 мл благодаря постоянному обратному
всасыванию жидкости арахноидальными грануляциями и оттоку ее по
венозным синусам подпаутинного пространства.
Спинномозговая жидкость заполняет пространства между паутинной и
мягкой оболочками мозга, все желудочки мозга, четвертый из которых
соединяется с центральным каналом спинного мозга. Спинномозговая
жидкость бесцветна, прозрачна, на 90 % состоит из воды, плотность ее
составляет 1,002-1,008; рН 7,35-7,8.
В составе ликвора представлены белки, аминокислоты, углеводы
(глюкоза, фруктоза), ионы натрия и хлора, гормоны, олигопептиды, ферменты,
С02. Спинномозговая жидкость содержит белков в 200—400 раз меньше
(15—33 мг%), чем сыворотка крови (60—80 г%), благодаря низкой
проницаемости для белковых молекул гематоэнцефалического барьера.
Увеличение содержания белка в спинномозговой жидкости указывает на
органическое заболевание нервной системы (менингиты, компрессии спинного
мозга). Содержание глюкозы в ликворе несколько ниже, чем в крови, — 70
мг%. Ее увеличение в ликворе отмечено при диабете.
Спинномозговая жидкость защищает мозг от внешних механических
воздействий, играя роль своеобразной «подушки» (мозг оказывается как
бы взвешенным в ликворе, который играет по отношению к нему роль
гидравлического амортизатора). Ликвор поддерживает метаболизм нервной
ткани, питая ее глюкозой, аминокислотами, кислородом и устраняя
метаболиты — С02, избыток воды. В ликворе содержатся клетки крови,
представленные только лимфоцитами (не более 3 в 1 мкл), обеспечивающими
защиту ликвора и мозга от чужеродных веществ, микроорганизмов в
случае их проникновения через гематоэнцефалический барьер. Увеличение
42 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
содержания лейкоцитов в ликворе (плеоцитоз) является признаком
заболевания центральной нервной системы (менингиты, полиомиелиты).
Синовиальная жидкость представляет собой водный раствор,
заполняющий полости суставов, синовиальные влагалища сухожилий, синовиальные
сумки и содержащий многие из входящих в состав плазмы крови веществ.
Но синовиальная жидкость, в отличие от плазмы крови, содержит и очень
важный для функции суставов биополимер — гликозаминогликан-гиалуро-
новую кислоту, входящий в состав белково-полисахаридного комплекса
суставной жидкости. Синовиальная жидкость вырабатывается
синовиальными клетками — синовицитами. Ее количество в суставах (даже
крупных — коленном, тазобедренном) не превышает 4 мл. На 95 % эта
жидкость состоит из воды, ее рН равен 7,7. Присутствие гиалуроновой
кислоты обеспечивает вязкоупругие свойства синовильной жидкости, формирует
защитный слой на поверхности хряща суставов, при движении
предотвращающий от повреждения их трущиеся поверхности. Уменьшение
содержания гликозаминогликана в суставной жидкости, например при
ревматических заболеваниях суставов (ревматоидном артрите, деформирующем ос-
теоартрозе), ухудшает ее вязкоупругие и защищающие суставную
поверхность свойства, приводит к микротравматизации хрящей и их
механическому разрушению. Синовиальная жидкость, благодаря содержащимся в
ней глюкозе, белкам, поддерживает трофику лишенных кровеносных
сосудов хрящей суставов. Содержащиеся в суставной жидкости небольшие
количества лимфоцитов, моноцитов — макрофагов поддерживают ее гомео-
стаз. Количество лейкоцитов в синовиальной жидкости возрастает при
заболевании суставов, в связи с чем имеет важное диагностическое значение.
1.8. Обмен жидкостей между водными секторами в организме
человека
Внеклеточные жидкости организма являются транспортной системой,
обеспечивающей постоянный обмен между различными водными
секторами организма — из желудочно-кишечного тракта вода с растворенными в
ней веществами поступает в плазму крови, из нее — во внеклеточный и
далее — во внутриклеточный сектор. Из клеток вода с растворенными в ней
продуктами обмена, С02 поступает во внеклеточный сектор, затем в кровь
и лимфу, которая доставляет ее к органам выделения —
желудочно-кишечному тракту, почкам, легким, потовым железам кожи.
Исследования, проведенные с использованием «тяжелой» воды (D20)
или воды, меченной по тритию, которые при введении в организм
равномерно распределяются во всех водных секторах организма, показали, что
интенсивность ее обмена может изменяться. Она увеличивается, например,
выше нормального уровня у человека, выполняющего физическую работу
на жаре: скорость обмена воды в организме, определенная у таких
обследованных с помощью меченной по тритию воды, демонстрирует
возрастание скорости ее полного обмена с 27 сут, регистрируемой в норме, до 16
сут. В организме человека имеет место и непрерывное перемещение
различных ионов с водой из плазмы крови в интерстициальную жидкость, из
нее — во внутриклеточную, а затем наоборот — из клеток в
интерстициальную жидкость и далее — в плазму крови и лимфу, доставляющие их к
органам выделения. Использование изотопов К, Mg, т. е. химических
элементов, в наибольших концентрациях содержащихся во внутриклеточном
секторе (см. раздел 1.2.3 данной главы), обнаружило, что скорость их обмена
зависит от функционального состояния клеток. Например, в ответ на по-
/. Жидкие среды организма • 43
вышение возбудимости нервных клеток скорость обмена ионов К, Mg
возрастает.
Обмен между внеклеточной и внутриклеточной жидкостями
осуществляется через клеточные мембраны. В основе обмена воды и растворенных
в ней веществ через мембраны клеток лежат разные формы
трансмембранного транспорта — пассивного (простая диффузия, облегченная диффузия,
фильтрация) и активного.
Простая диффузия зависит от толщины мембраны клеток (их толщина
варьирует от 5 до 13,5 нм), размеров пор мембраны, разницы величины
электрического заряда между внутренней и наружной поверхностью
мембраны, величины химического градиента для веществ по разные стороны
мембраны, величины гидрофобных участков мембраны (они обеспечивают
быстрое прохождение через мембрану более жирорастворимых веществ —
например, С02 более жирорастворим, чем 02 и молекулы С02 быстрее
проходят через мембраны клеток, чем 02). Величина пассивной диффузии
зависит от наличия положительных зарядов в гидрофильных порах
мембран клеток, которые облегчают прохождение через мембрану анионов и
ограничивают — катионов (например, через поры мембраны эритроцитов
легко проходят СГ, HCOJ и много труднее — Na+). На величину пассивной
диффузии влияет гидростатическое давление жидкости на мембрану
клетки (например, в почках гидростатическое давление крови в капиллярах
клубочка на мембраны клеток, образующих стенку капсулы Боумона,
является главной силой, обеспечивающей фильтрацию до 170 л воды в сутки
с растворенными в ней веществами из плазмы крови в просвет капсулы
Боумона).
Облегченная диффузия характеризуется большей, чем при простой
диффузии, скоростью прохождения молекул вещества через мембрану клетки с
помощью специальных белков — переносчиков. Например, молекулы
глюкозы в три раза быстрее проходят через мембрану эритроцита человека,
чем это следовало бы из механизма простой диффузии, связанной с
разницей концентрации глюкозы в плазме крови и эритроците. В мембране
эритроцита перенос глюкозы из плазмы крови внутрь этой клетки
осуществляют около 800 тыс. участков, ответственных за ее перенос, и каждый
из них за секунду переносит 180 молекул глюкозы.
На направление движения воды между внеклеточным и
внутриклеточным секторами влияет не общее осмотическое давление внеклеточной
жидкости, а ее эффективное осмотическое давление, которое создается в
ней концентрацией плохо проходящих через клеточную мембрану веществ.
Так, внеклеточная жидкость содержит большое количество Na+, поскольку
Na+ плохо проходят через клеточную мембрану в клетку из внеклеточной
жидкости. Кроме того, в нее благодаря непрерывной работе Na+-K+-ATO-
азе (т. е. с помощью активного транспорта) переносятся из клетки ионы
натрия.
Во внутриклеточной среде эффективное осмотическое давление
создается внутриклеточными белками-протеинатами — анионами, которые,
благодаря эффекту Даннона (см. раздел 1.3.2), увеличивают концентрацию
одновалентных катионов вокруг их молекул, создавая осмотическую силу для
движения воды в клетку. Увеличение во внеклеточной жидкости
концентрации ионов натрия повышает ее эффективное осмотическое давление,
что приводит к выходу воды из клетки. Напротив, уменьшение
эффективного осмотического давления внеклеточной жидкости, связанное с
уменьшением в ней концентрации Na+ вызывает перемещение воды в клетку.
Таким образом, Na+ является основным внеклеточным катионом, опре-
44 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
деляющим объем внеклеточной жидкости в организме человека. Поэтому
механизмы осморегуляции, контролирующие осмотическое давление
внеклеточной жидкости, контролируют и объем внеклеточной жидкости в
организме, поддерживая в ней концентрацию Na+ на постоянном уровне
(142 ммоль/л), позволяя отклоняться этой величине в норме в узких
пределах—от 138 до 146 ммоль/л. Так, увеличение концентрации Na+ выше
нормальной величины во внеклеточной жидкости, воспринимаемое осмо-
рецепторами, вызывает у человека чувство жажды, а почки концентрируют
мочу, уменьшая выведение воды из организма. Выпитая человеком вода
поступает во внеклеточное пространство и возвращает концентрацию Na+
к его нормальному содержанию во внеклеточной жидкости. Возбуждение
осморецепторов уменьшается, в результате чувство жажды у человека
устраняется, выведение воды с мочой становится нормальным.
ГЛАВА 2
Физиология возбудимых тканей
Действие внешней среды на биологические системы — организмы, органы,
ткани и клетки — всегда вызывает в них физико-химические изменения.
Способность живой системы реагировать на внешнее воздействие
процессом изменения физико-химических свойств является универсальным
проявлением жизнедеятельности всех без исключения биологических систем и
называется раздражимостью. Некоторые живые ткани и клетки при
действии на них внешней среды отвечают проявлением определенной
специфической для данной живой системы функции, или возбуждением. Если
живая система способна приходить в возбуждение при изменении состояния
внешней среды, она обладает возбудимостью, а ткани и клетки, имеющие
такое свойство, относятся к возбудимым.
Возбудимыми тканями организма человека являются нервная и
мышечная, которые в ответ на воздействие внешней среды переходят из
состояния покоя в состояние возбуждения (генерация нервного импульса,
сокращение и др.). Такой сложный физиологический процесс, как сокращение,
а равно вызывающий его нервный импульс, называются возбуждением.
Основной структурой возбудимых тканей (равно как секреторной или
эпителиальной) является клетка. Клеточные компоненты (цитоплазма, ор-
ганеллы) окружены единой клеточной мембраной, или плазмолеммой. Эта
мембрана представляет собой барьер между возбудимой клеткой и интер-
стициальной средой возбудимой ткани. Через мембрану возбудимой
клетки осуществляются все процессы, обеспечивающие ее жизнедеятельность,
и одновременно мембрана сохраняет состав внутриклеточной среды на
относительно постоянном уровне, несмотря на изменения в окружающей
интерстициальной среде. Клетки возбудимых тканей через свою мембрану
могут взаимодействовать с окружающей их средой и обе эти клеточные
функции — обмена и взаимодействия — обусловлены наличием белков в
пределах мембраны возбудимых клеток.
2.1. Строение и физиологические функции мембраны клеток
возбудимых тканей
Клетки возбудимых тканей отделены от интерстициальной среды
клеточной мембраной. Мембрана нервной и мышечной клетки представляет
собой эластичную структуру, толщиной 6—8 нм, состоящую из липидов и
белков. Липиды мембраны возбудимых клеток представлены различными
фосфолипидами: фосфатидилхолин, фосфатидилэтаноламин, фосфатидил-
серин, сфингомиелин и фосфатидилинозит. Фосфолипиды образуют
двойной слой, который состоит из фосфолипидных молекул. Полярные
головки этих молекул обращены наружу. К каждой полярной головке
прикреплены две углеводородные цепочки, которые погружены в толщу мембраны
(рис. 2.1). Обращенные наружу полярные головки фосфолипидных
молекул клеточных мембран придают им гидрофильные свойства, а удерживаю-
46 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
Интегральные белки
Ионный канал Ионный насос
Наружная
поверхность
Мембрана
6—8нм
Полярные головки
фосфолипидных
молекул
Углеводородные
Периферический белок
Внутренняя
поверхность
Рис. 2.1. Схематическое изображение мембраны клетки возбудимых тканей.
Мембрана представляет собой двойной липидный слой, в который погружены интегральные
белки, функционирующие как ионные насосы и ионные каналы. Ионные насосы за счет
энергии АТФ перекачивают ионы К+, Na+, Ca2+ против их концентрационного градиента.
Наличие градиентов концентрации указанных ионов на мембране возбудимых клеток является
основой возникновения на мембране клеток электрического потенциала и возбудимости
нервной и мышечной ткани. Ионные каналы мембраны возбудимой клетки в зависимости от их
зактытого или открытого состояния обусловливают возникновение возбуждения в нервной и
мышечной ткани и его распространение по поверхности мембран клеток. Периферические
белки расположены, как правило, на внутренней поверхности мембраны и являются
энзимами, участвующими в регуляции метаболических процессов в возбудимых клетках.
щие их довольно жестко связи углеводородных цепей — гидрофобные.
Белки мембран возбудимых клеток подразделяются на два типа: интегральные
и периферические. Молекулы интегральных белков погружены в толщу
мембраны на большую или меньшую глубину. Этот тип белков
обеспечивает взаимодействие (интеграцию) между клетками возбудимых тканей.
Интегральные белки выполняют функцию специальных ионных насосов в
мембране клеток. Например, с помощью ионных насосов различные ионы
(Na+, K+, Са2+ и др.) перемещаются через мембрану между интерстициаль-
ной и внутриклеточной средами, что лежит в основе формирования
электрических явлений в возбудимых клетках. Периферические белки
расположены, как правило, с внутренней стороны мембраны. Они являются
катализаторами протекающих в клетке химических реакций, т. е. являются
энзимами. Периферические белки формируют цитоскелет клеток, который
придает мембране клеток прочность и одновременно гибкоэластические
свойства.
Мембрана клеток возбудимых тканей имеет функции избирательной
проницаемости для ионов и веществ, межклеточного взаимодействия, а
также экзо- и эндоцитоза, благодаря которым в нервной и мышечной
ткани осуществляются физиологические процессы возбуждения, проведения
возбуждения и сокращения.
2.1.1. Транспорт веществ через клеточную мембрану
Клеточная мембрана является разделительным барьером между
цитоплазмой и внеклеточной средой. При этом важнейшая функция подобного
барьера связана с транспортом воды, различных ионов (Na+, K+, СГ, Са2+
и др.) и питательных веществ (например, глюкозы) между этими средами с
целью обеспечения жизнедеятельности клеток.
2. Физиология возбудимых тканей • 47
2.1.1.1. Движение воды через мембрану клеток
Вода довольно свободно проникает через мембрану большинства клеток,
так как внутри клеточной мембраны имеются свободные пространства,
обусловленные временными дефектами или кинками в СН2 цепях фосфо-
липидов. Кинки и связанные с ними пространства свободно диффундируют
в пределах мембраны. Вода, заключенная в свободно диффундирующие
пространства, способна проникать с их помощью через биологические
мембраны. Благодаря кинкам и свободным пространствам внутри мембран
их «водная» проницаемость примерно в три раза выше, чем в мембранах,
организованных только из кристаллической липидной фазы. Однако
движение воды через мембрану внутрь клетки и из клетки наружу
регулируется осмотическим давлением растворов по обе ее стороны.
2.1.1.2. Осмос
Вода диффундирует через мембрану из области меньшей в область
большей концентрации растворенного вещества. Этот процесс называется
осмосом. Наименьшее гидростатическое давление, которое необходимо
приложить к раствору для того, чтобы предотвратить перетекание
растворителя через полупроницаемую мембрану в раствор с большей
концентрацией вещества называется осмотическим давлением. Концентрация
осмотически активных молекул в единице массы воды называется осмолярно-
стью или осмотическим коэффициентом. Осмотическое давление
обусловливает поступление воды в клетку, формирует ее объем и упругость (тур-
гор) ткани.
Тоничность раствора представляет собой осмотическое давление,
производимое раствором через проницаемую мембрану, отделяющую его от
плазмы крови. Терминами изо-, гипо- и гипертонический характеризуют
растворы, осмолярность которых соответственно равна, меньше или выше,
чем таковая в плазме крови.
2.1.1.3. Диффузия
Процесс свободного движения молекул вещества в пределах раствора
называется диффузией. Большие молекулы движутся в растворе медленнее,
чем маленькие, а движение молекул вещества в воде происходит быстрее,
чем в среде с более высокой вязкостью. Молекулы биологически важных
веществ (медиаторы, гормоны), 02 и С02 при температуре окружающей
среды 30 °С преодолевают расстояние 1 мкм в течение 1 мс, 100 мкм — в
течение 10 с, а расстояние 1 см — в течение 24 ч. В клетках возбудимых
тканей диффузия молекул в цитоплазме лимитирована их размером. В ин-
терстициальной среде расстояние диффузии молекул веществ ограничено
дистанцией между клетками либо между клетками и капиллярами. Так, в
среднем расстояние между капиллярами и клетками тканей у
млекопитающих животных составляет 30 мкм. Поэтому небольшие по размерам
молекулы 02 и С02 преодолевают это расстояние в течение двух-трех десятков
миллисекунд, что обеспечивает обмен газами между кровью и тканями
организма.
Диффузия молекул вещества через проницаемую мембрану
осуществляется по концентрационному градиенту вещества и описывается первым
законом Фика. Подобная диффузия носит название простой и ее величина
тем больше, чем выше температура раствора. Первый закон диффузии Фи-
48 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
ка, который отражает скорость диффузии вещества через мембрану в
зависимости от разницы концентраций вещества по обе ее стороны,
выражается следующей формулой:
Скорость диффузии = —(С/— Се),
х
где D — коэффициент диффузии, А — площадь мембраны (см2), х —
толщина мембраны (см), С — концентрация вещества по обе стороны
мембраны (i — внутри, е — снаружи). С помощью простой диффузии большинство
субстанций не проникают через мембрану клетки. Поэтому, наряду с
простой диффузией, имеет место движение веществ через мембрану с
помощью облегченной диффузии. Облегченная диффузия происходит при
участии специфических белковых молекул-переносчиков. Скорость облегченной
диффузии лимитируется количеством транспортных белковых молекул и
их подвижностью в пределах мембраны. Этот вид мембранного транспорта
имеет более высокую скорость в сравнении с простой диффузией. Перенос
веществ через мембрану с помощью облегченной диффузии обусловлен
строением переносимых молекул, которые связываются с
белком-переносчиком. Ингибиторы способны подавлять этот вид транспорта. Для
облегченной диффузии характерна специфичность белков-переносчиков к типу
молекулы переносимого вещества и количеством транспортных белков в
мембране клетки. Например, перенос глюкозы или аминокислот
осуществляется строго специфичными белками-переносчиками. Вещества, которые
транспортируются через мембрану одним и тем же белком-переносчиком,
конкурируют за переносчик {явление конкуренции). Если все
белки-переносчики заняты транспортируемыми молекулами или ионами, то
увеличение фадиента концентрации вещества по обе стороны мембраны не
приведет к росту диффузии — явление насыщения.
2.1.1.4. Первично-активный транспорт
Перенос ионов через клеточную мембрану может происходить против их
фадиента концентрации за счет энергии макроэргических соединений
(АТФ). Транспорт ионов через мембрану возбудимых клеток против
концентрационного фадиента, обусловленный функцией транспортных
АТФаз называется первично активным. Первично активный транспорт
характерен для переноса через мембрану возбудимых клеток ионов Na+, K+
или Са2+. Транспортные АТФазы — это интефальный тип белков
клеточной мембраны, поэтому ионы могут активно транспортироваться,
например, из внеклеточной среды в цитоплазму (ионы К+) или наоборот (ионы
Na+).
В клетках возбудимых тканей первично активный транспорт
осуществляется с помощью трех типов АТФаз: натрий-калиевой, кальциевой и
протонной помпы.
Транспорт ионов Na+ и К+ через мембрану. В мембранах всех клеток
организма человека и животных локализована №+/К+-АТФаза, или
натрий-калиевый насос (рис. 2.2). Функция этого насоса заключается в поддержании
фадиента концентрации ионов Na+ и К+ между цитозолем клетки и
внеклеточной средой. В возбудимых клетках создание и поддержание
подобного фадиента является основным условием возникновения потенциала
покоя на мембране клеток, а также последующей генерации и
распространения потенциала действия по мембране нервного волокна и мышечной
клетки.
2. Физиология возбудимых тканей • 49
NaVIC-АТФаза состоит из а-
и (3-белковых субъединиц, а-
Субъединица содержит места
связывания для АТФ, ионов Na+ и
К+. р-Субъединица
обусловливает транспортные свойства
АТФазы и играет основную роль
во встраивании ее молекулы в
мембрану клетки. Схематически
цикл активности №+/К+-АТФазы
представлен на рис. 2.3. Na+/
К+-АТФаза существует в двух
конформационных формах — Е, и
Е2. В конформации АТФ Е,
участки насоса, связывающие катионы,
обращены в цитоплазму и
способны связываться с ионами Na+. В
конформации АТФ Р-Е2 участки
связывания катионов обращены
во внеклеточную среду и
преимущественно связываются с ионами
калия. Места связывания
локализованы в специальном углублении
Наружная
сторона
мембраны
АТФаза
АТФ
Цитоплазма
АДФ
Рис. 2.2. Натрий-калиевый насос (Na+/
К+-АТФаза) в мембране возбудимой
клетки.
Натрий-калиевый насос за счет гидролиза
одной молекулы АТФ выводит 3 иона натрия из
клетки и аккумулирует 2 иона калия внутри
клетки, чем создается градиент концентрации
этих ионов по обе стороны возбудимой
мембраны.
3№Е,-АТФ
Рис. 2.3. Схематическое изображение цикла работы электрогенного
натрий-калиевого насоса.
Конформации Е, насоса обращена в цитозоль и имеет на поверхности два отрицательно
заряженных места, с которыми у внутриклеточных ионов Na+ и К+ имеется различное сродство.
Третье электрически нейтральное место связывания ионов натрия находится внутри молекулы
насоса. После связывания ионов с насосом они погружаются внутрь его молекулы. Фосфори-
лирование насоса с помощью АТФ вызывает «закупорку» ионов натрия (Na3ErP). Переход к
конформации Е2 открывает «карман» во внеклеточную среду. После связывания двух ионов
калия процесс повторяется в обратной последовательности, только ионы калия выводятся из
клетки.
50 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
канала, поэтому во время
транспорта ионов Na+ и К+ через мембрану
клетки они окружены молекулой
насоса и не могут
взаимодействовать с другими ионами. За один
цикл активности насоса три иона
натрия выводятся из клетки, а
внутрь транспортируются два иона
калия.
Транспорт ионов Са1* через
мембрану. В мембране саркоплазмати-
ческого ретикулума всех типов
мышечных клеток локализована Са2+-
АТФаза (рис. 2.4). Функция этого
насоса заключается в поддержании
низкой концентрации ионов
кальция в цитоплазме мышечных
клеток за счет депонирования ионов в
саркоплазматический ретикулум. Поддержание низкой концентрации
ионов Са2+ в саркоплазме является основным условием расслабления
мышечных клеток (менее 10~7 моль/л, против 10~3—10~2 моль/л в ретикулу-
ме). Са++-АТФ-аза функционирует следующим образом. В присутствии
АТФ после присоединения со стороны цитоплазмы иона кальция к
кальций-связывающему участку Са2+-АТФаза фермент изменяет свою конфор-
мацию, и область связывания ионов Са2+ оказывается внутри саркоплаз-
матического ретикулума. При этом сродство ионов к Са2+-АТФазе
уменьшается, и ионы Са2+ высвобождаются во внутриретикулярное
пространство. Под действием ионов Mg2+ саркоплазматического ретикулума
фермент Са2+-АТФаза дефосфорилируется и кальций-связывающий участок
вновь оказывается снаружи мембраны. В такой последовательности
повторяется цикл работы кальциевого насоса. В саркоплазме мышечных
клеток ионы кальция принимают участие в механизме мышечного
сокращения либо выполняют функцию вторичного посредника (описаны
ниже).
Транспорт протонов через мембрану. Протонная помпа (Н+-АТФаза)
транспортирует протоны через внутренние мембраны митохондрий.
Протонная помпа в митохондриях увеличивает градиент электрохимического
потенциала ионов водорода на мембране до порогового или критического
уровня, который необходим для синтеза АТФ. Протонная помпа
увеличивает электрическую и концентрационную составляющую
электрохимического потенциала на мембране митохондрий.
2.1.1.5. Вторично-активный транспорт
В возбудимых клетках имеет место активный транспорт веществ через
мембрану клеток против их концентрационного градиента, если
эквивалентное количество энергии высвобождается в результате движения
другого вещества по его концентрационному градиенту. Этот вид
трансмембранного транспорта называется вторично активным. Вторично активный
транспорт называется также сопряженным транспортом, поскольку более
одного вещества транспортируется через мембрану клетки с помощью
интегрального белка-переносчика. При этом виде транспорта молекулы
веществ конкурируют между собой за белок-переносчик. Например, если ве-
Внешняя сторона
АТФ ► АДФ+ф
Мембрана
саркоплазматического
ретикулума
2Са++
Внутренняя сторона
Рис. 2.4. Первично активный
транспорт ионов кальция через мембрану.
При гидролизе одной молекулы АТФ
кальциевый насосактивно переносит два иона
кальция через мембрану, например,
саркоплазматического ретикулума против их
концентрационного градиента.
2. Физиология возбудимых тканей • 51
щество А равномерно распределено по обе стороны мембраны, а вещество
Б создает более высокую концентрацию по одну стороны мембраны, то
конкуренция вещества Б за переносчик по сравнению с веществом А будет
тем больше, чем выше будет градиент концентрации вещества Б. При
этом, если белок-переносчик переносит две субстанции, то это называется
котранспортом. Если два вещества переносятся через мембрану
одновременно в одном направлении, то это называется симпортом. Если вещества
переносятся через мембрану одновременно, но в противоположных
направлениях, это называется антипортом. Как правило, натрий-калиевый
насос создает градиент концентрации ионов натрия и калия по обе
стороны от мембраны клеток, который обеспечивает сопряженный или
вторично активный транспорт.
Этот вид активного транспорта широко представлен в физиологических
процессах различных органов. В скелетных мышцах, кардиомиоцитах и
гладкомышечных клетках с функцией №+/К+-АТФазы связан транспорт
ионов Са2+ через плазматическую мембрану при участии Na*/Ca2+-обменни-
ка. Этот белок транспортирует ионы Са2+ через мембрану клеток в обмен
на ионы натрия и за счет энергии №+/К+-АТФазы. Кроме того, в
мембранах клеток имеется белок, обменивающий внеклеточные ионы натрия на
внутриклеточные протоны, — Иа+/Н+-обменник, который поддерживает
постоянство рН внутриклеточной среды. Скорость обмена ионов при участии
Na+/Ca2+- и Ка+/Н+-обменников пропорциональна электрохимическому
градиенту ионов Na+ по обе стороны мембраны. В невозбудимых клетках,
например, слизистой оболочки тонкой кишки глюкоза транспортируется в
эпителиоциты лишь в том случае, если ионы Na+ одновременно с
глюкозой связывается с белком-переносчиком.
2.1.1.6. Эндоцитоз и экзоцитоз
Молекулы некоторых веществ, например химических передатчиков
возбуждения в нервной системе (медиаторов) или гормонов, не способны
проходит через мембрану клеток. Поэтому их движение через клеточную
мембрану осуществляется путем эндоцитоза и экзоцитоза. При эндоцитозе
субстанции первоначально адсорбируются специальными рецепторами на
внешней стороне мембраны. С помощью мембранного белка клатрина,
расположенного на внутренней поверхности мембраны клетки, в мембране
^ формируется углубление, а затем образуется везикула и везикулярный
комплекс «рецептор—клатрин—белок» оказывается внутри клетки. Комплекс
утрачивает рецептор, белок клатрин вновь возвращается на внутреннюю
поверхность клеточной мембраны, а поступивший внутрь белок метаболи-
зируется в клетке.
i Путем экзоцитоза из клетки выводятся крупные белковые молекулы,
которые инкапсулируются мембранами эндоплазматического ретикулума в
форме везикул. Подобные везикулы, а для многих клеток они
представляют собой секреторные гранулы, транспортируются вдоль внутриклеточной
микротрубулярной системы к мембране клеток, сливаются с клеточной
мембраной в строго определенных местах мембраны, содержащей
специальный белок синапсин. Процесс слияния секреторных гранул
активируется ионами Са++. Мембрана секреторной везикулы соединяется с мембра-
' ной клетки, и секретируемые субстанции оказываются во внеклеточной
среде.
52 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
2. /. 1.7. Внутриклеточный транспорт молекул
Внутри клеток везикулы и
различные субстанции
также транспортируются с
помощью специальных
белков. Например, в нервных
клетках имеет место аксон-
ный транспорт везикул как в
направлении нервных
окончаний (антероградно), так и
в направлении тела
нейронов (ретроградно).
Внутриклеточные транспортные
процессы осуществляются
вдоль цитоплазматических
микротрубочек при участии
специфических белков кинезина и динеина (рис. 2.5). При этом кинезин
транспортирует везикулы по микротрубочкам аксона в направлении тер-
миналей нейронов, а динеин — в направлении их сомы.
2.2. Возбудимость как основное свойство нервной и мышечной
ткани
Возбудимые ткани организма человека в ответ на действие раздражителей
способны переходить из состояния покоя в состояние возбуждения. Так,
живая нервная ткань при внешних воздействиях, достигающих определенного
уровня по силе раздражения, переходит в состояние возбуждения,
генерируя нервный импульс. Возбудимая мышечная ткань под влиянием внешних
раздражителей или нервного импульса производит сокращение. Свойство
возбудимых тканей приходить в возбуждение при изменениях внешней или
внутренней среды организма называется возбудимостью. Возбудимые ткани
способны распространять возникшее в них возбуждение, например по
поверхности мембран мышечных клеток или по нервным волокнам нейронов.
Это свойство возбудимых тканей называется проводимостью. Наконец,
мышечная ткань обладает проводимостью (как и нервная), а также
сократимостью, поскольку способна сокращаться в ответ на раздражение.
2.2.1. Понятие о раздражении и раздражителях
Процесс возбуждения нервной и мышечной ткани возникает при их
раздражении факторами, или раздражителями, внешней и внутренней среды
организма. Процесс воздействия раздражителя на возбудимые ткани
называется раздражением. Раздражители различаются по их биологической
значимости, а также по качественному и количественному признаку. По
биологической значимости раздражители относят к адекватным и
неадекватным. Адекватным считается раздражитель, к восприятию которого данная
живая ткань приспособилась в процессе эволюции. Например, для органа
слуха адекватным раздражителем являются упругие механические
колебания среды. К неадекватным раздражителям относят факторы внешней или
внутренней среды, которые в естественных условиях жизнедеятельности
организма не являются источником возбуждения живой ткани. Все типы
адекватных и неадекватных раздражителей по силе их действия на возбу-
неирона l
Кинезин
Рис. 2.5. Внутриклеточное движение органелл с
помощью белков, связанных с
микротрубочками: динеин перемещает органеллы нейронов в
направлении их сомы, а кинезин — в
направлении нервной терминали.
2. Физиология возбудимых тканей • 53
димые ткани подразделяются на пороговые, подпороговые, максимальные,
субмаксимальные и супермаксимальные. При действии внешних
раздражителей на клетки возбудимых тканей они способны возбуждаться в том
случае, если сила раздражения достигает определенной, а именно
пороговой, величины. Минимальная сила раздражителя, необходимая для
возникновения возбуждения нервной или мышечной ткани, называется
порогом возбуждения. Раздражители, сила которых ниже порога возбуждения,
являются подпороговыми. Если сила раздражения превосходит порог
возбуждения, то величина ответной реакции возбудимых тканей возрастает
вплоть до определенного для каждой возбудимой ткани предела. При этом
дальнейшее увеличение силы раздражителя не приводит к росту ответной
реакции ткани. На этом основании минимальная сила раздражителя,
вызывающего максимальный ответ возбудимой ткани, называется
максимальной силой раздражения. Раздражители, сила которых меньше или больше
максимальной, называются, соответственно, субмаксимальными и
супермаксимальными.
2.2.2. Зависимость возникновения возбуждения от длительности
и силы раздражения
Для возникновения возбуждения в нервной или мышечной ткани
необходимо, чтобы сила внешнего раздражения изменялась с достаточной
скоростью в единицу времени. Поэтому возникновение возбуждения
обусловлено не действием абсолютной силы внешнего раздражителя, а скоростью ее
изменения от одной величины до другой. Это называется законом
раздражения Дюбуа-Реймона. Однако для возникновения возбуждения нервной и
мышечной ткани недостаточно только скорости изменения силы
раздражения в единицу времени, нужно, чтобы время действия внешнего
раздражителя было не меньше определенной (пороговой) величины. Минимальное
время, которое необходимо для того, чтобы сила раздражителя вызвала
возбуждение в нервной или мышечной ткани, называется полезным
временем. Продолжительность полезного времени зависит от возбудимости
живой ткани, которая обусловлена различными факторами. Например, к
этим факторам относятся тип мышц (гладкая или поперечно-полосатая),
интенсивность обмена веществ в нервной и мышечной ткани или вид
животного. Например, полезное время m. biceps человека составляет 1—2 мс,
a m. gastrocnemius лягушки — около 3—7 мс. Более того, различные нервы
и иннервируемые ими мышцы, например мышцы-сгибатели или
разгибатели у одного животного или человека, имеют также разную возбудимость.
Поэтому факторы, которые обусловливают возбудимость живой ткани,
обусловливают величину полезного времени.
При действии внешнего раздражителя на возбудимую ткань она
способна возбуждаться в том случае, если сила раздражителя достигает
определенной, а именно — пороговой величины. Минимальная сила
раздражителя, необходимая для возникновения возбуждения нервной или мышечной
ткани, называется порогом возбуждения. Величина порога возбуждения
является мерой возбудимости нервной и мышечной ткани. Когда
возбудимость нервной или мышечной ткани в результате каких-либо причин
понижается, то сила порогового раздражения возрастает, т. е. порог
возбуждения становится выше. Напротив, когда возбудимость нервной или
мышечной ткани в результате каких-либо причин повышается, то сила
порогового раздражения уменьшается и в этом случае, как говорят, порог
возбуждения ткани становится ниже.
54 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
Сила
раздражения
3,0-
Реобаза
Хронаксия 0,5
1,0 1,5
Время (мс)
2,0
Рис. 2.6. Кривая зависимости силы раздражения возбудимой ткани от длительности
действия раздражителя (кривая сила—длительность).
Мембрана клеток возбудимых тканей является высокочувствительной к действию
электрического тока. Для того, чтобы электрический ток вызвал возбуждение клетки, его сила должна
быть достаточной силы. Сила тока, которая вызывает возбуждение нервной и мышечной
ткани, называется реобазой. Время, необходимое для того, чтобы ток силой удвоенной реобазы,
вызвал возбуждение в ткани, называется хронаксией. Кривая сила—длительность отражает тот
факт, что для достижение порога возбуждения в возбудимых тканях необходима пороговая
скорость нарастания силы раздражения.
Хронаксия как мера возбудимости. Поскольку возникновение
возбуждения в нервной или мышечной ткани обусловлено силой и
продолжительностью раздражения, то величина полезного времени не является точной
мерой функционального состояния возбудимых тканей. Это обусловлено
следующими обстоятельствами. Взаимодействие между силой и
длительностью стимула, вызывающего возбуждение нервной или мышечной ткани
характеризуется кривой «сила-длительность» (рис. 2.6). Для определения
величины полезного времени возбудимых тканей необходимо построение
подобной кривой, что требует многочисленных воздействий
электрическим током на возбудимые ткани и проведения многократных измерений
этого показателя. Однако при минимальной силе раздражения, способного
вызвать возбуждение в нервной или мышечной ткани, значение полезного
времени соответствует, как показано на рисунке, точке Р. Вправо от точки
Р кривая становится параллельной оси абсцисс, а следовательно,
возбуждение в нервной или мышечной ткани может возникать при любой
длительности действующего раздражителя (закон раздражения) и становится
невозможным по полезному времени точно определить функциональное
состояние возбудимых тканей. Поэтому французским ученым Лапиком
экспериментально был выработан способ получения более точной
характеристики возбудимости нервной или мышечной ткани как функции
времени. Согласно этому предложению, минимальная сила электрического
раздражения (названа реобазой), которая способная вызвать возбуждение тка-
2. Физиология возбудимых тканей • 55
ни независимо от длительности действия электрического тока, должна
быть удвоена, чтобы установить полезное время. Минимальное время, в
течение которого ток силы, равной двум реобазам, должен действовать на
возбудимую ткань, чтобы вызвать минимальный эффект возбуждения,
было названо хронаксией. Хронаксия (обозначается буквой о) является мерой
возбудимости нервной или мышечной ткани и отражает скорость
возникновения возбуждения в этих тканях. Значение хронаксии, как показано на
кривой рисунка, находится в области больших значений длительности
раздражения (восходящая часть кривой). Так, у мышц человека хронаксия
составляет 0,1—0,7 мс. При этом хронаксия мышц-сгибателей (0,08—0,16 мс)
равна вдвое меньше, чем хронаксия мышц-рагибателей (0,16—0,32 мс).
Указанные величины продолжительности хронаксии мышц-сгибателей и
разгибателей у человека обусловлены возбудимостью нервных волокон,
иннервирующих эти мышцы. От возбудимости нервной или мышечной
ткани, как это будет изложено в разделах настоящей главы, зависит,
например, скрытый период появления возбуждения в возбудимых тканях,
длительность и интенсивность возникающего в них возбуждения. Поэтому,
в наиболее общем виде, чем меньше хронаксия, тем сильнее в ткани
процесс возбуждения, тем меньше скрытый период возникновения
возбуждения. Определение хронаксии производится в клинической практике для
оценки функционального состояния мышц при их повреждении. При этом
чем больше хронаксия, тем хуже функциональное состояние
поврежденных мышц человека.
2.2.3. Возбудимость и возбуждение при действии постоянного
тока на нервную и мышечную ткань
Постоянный ток действует как раздражитель возбудимых тканей только
при замыкании и размыкании цепи электрического тока и в том месте, где
на ткани расположены катод и анод. Дюбуа-Реймоном в XIX в. было
установлено, что в момент замыкания раздражение возбудимой ткани
происходит на катоде, а в момент размыкания — на аноде. Эти явления
называются полюсным действием постоянного тока на возбудимую ткань.
2.2.3.1. Физиологический электроток
Впервые Пфлюгер (1859) показал, что при раздражении нерва постоянным
током возбудимость на нерве или мышце при замыкании электрической
цепи повышается в месте расположения катода и понижается в месте
расположения анода. Эти изменения возбудимости на катоде называются катэ-
лектротоном, а на аноде — анэлектротоном. Наряду с изменением
возбудимости в нервной и мышечной ткани под катодом повышается
проведение возбуждения, а под анодом — понижается.
В момент размыкания электрической цепи постоянного тока
возбудимость и проводимость нервной и мышечной ткани меняются в обратном
направлении. Так, при размыкании цепи постоянного тока возбудимость
понижается под катодом, а на участке возбудимой ткани в области анода
она повышается. Соответственно проводимость понижается под катодом и
повышается под анодом.
При действии постоянного тока на нервную или мышечную ткань,
наряду с появлением кат- и анэлектротона, возбудимость ткани изменяется
за пределами участков электротонических изменений возбудимости. Так,
за пределами катэлектротона на участке нерва возбудимость ткани пони-
56 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
жается, а за пределами анэлектротона, напротив, повышается. Эти
электротонические проявления были открыты Н. Е. Введенским и названы пе-
риэлектротоническими явлениями (периэлектротоном). Периэлектротониче-
ское изменение возбудимости всегда противоположно соответствующему
физиологическому электротону и выражено настолько, что может
препятствовать (катпериэлектротон) или способствовать (анпериэлектротон)
проведению возбуждения по нерву от места его возникновения к мышце.
При длительном действии постоянного тока подпороговой силы на
нерв в последнем развивается снижение возбудимости под катодом вплоть
до полного ее исчезновения. Это изменение возбудимости называется ка-
тодической депрессией.
2.2.3.2. Закон полярности раздражения нервной и мышечной ткани
Возбуждение от места его возникновения в нервном волокне способно
распространяться на мышцу, что вызывает ее сокращение. Особенностью
полюсного действия постоянного тока на возбудимую ткань является то,
что при одной и той же силе постоянного тока его замыкательное действие
на возбудимую ткань проявляется сильнее, чем размыкательное.
Раздражение нерва замыканием или размыканием цепи постоянного тока вызывает
строго определенную реакцию иннервируемой мышцы в зависимости от
силы постоянного тока и расположения катода и анода на нерве
относительно мышцы. В целом проявление действия постоянного тока на
возбудимые ткани получало название закона полярности раздражения Пфлюгера
(табл. 2.1).
Очень слабый по силе (подпороговый) постоянный ток вызывает
сокращение мышцы только при замыкании, независимо от расположения
катода и анода на нерве относительно мышцы. Постоянный ток пороговой
(средней) силы вызывает сокращение мышцы при замыкании и
размыкании также независимо от расположения катода и анода на нерве
относительно мышцы. Эффекты подпорогового и порогового постоянного тока
на нерв и возникающее при этом сокращение мышцы обусловлены
полюсным действием постоянного тока. Проявления действия сверхпорогового
постоянного тока на нерв и возникающее при этом сокращение мышцы
обусловлены электротоническими изменениями возбудимости на катоде и
аноде при замыкании или размыкании цепи постоянного тока. Например,
если анод расположен на нерве между катодом и мышцей, то при
замыкании цепи постоянного тока мышца не ответит сокращением, поскольку
катодзамыкательное возбуждение нерва не способно распространиться
через участок анэлектротонического понижения возбудимости. Напротив, в
этих условиях анодразмыкательное возбуждение нерва вызывает сокраще-
Таблица 2.1. Проявление закона полярности раздражения и физиологического
электротона
Расположение электродов на нерве относительно мышцы
ближе к мышце катод
ближе к мышце анод
Сила
постоянного тока
Подпороговая
Пороговая
Сверхпороговая
замыкание
Сокращение
»
»
размыкание
Нет сокращения
Сокращение
Нет сокращения
замыкание
Сокращение
»
Нет сокращения
размыкание
Нет сокращения
Сокращение
2. Физиология возбудимых тканей • 57
ние мышцы, возбуждение беспрепятственно распространяется от участка
нерва между анодом и мышцей. В этом случае участок катэлектротониче-
ского понижения возбудимости нерва не может препятствовать
распространению возбуждения по нерву.
В отношении мышечной ткани явления физиологического электротона
и закона сокращения Пфлюгера проявляются в описанной выше
закономерности.
2.2.3.3. Электродиагностический закон
При действии постоянного электрического тока на ткани человека ток
проходит не только по нерву, но и по окружающим нерв тканям. В этом
случае проявление закона полярности раздражения развивается по иному,
так называемому электродиагностическому, закону.
Суть этого закона заключается в возникновении возбуждения в нерве
под катодом и анодом в момент замыкания и размыкания в соответствии с
полюсным действием постоянного тока и явлением физиологического
электротона. Однако при прохождении постоянного тока через нерв
(физический электротон) в нем возникает по обеим сторонам полюсов постоянного
тока поляризация осевого цилиндра нервного волокна (так называемый
физиологический катод и анод) (рис. 2.7). Физиологические катод и анод при
пороговой величине поляризации нервных волокон также способны
вызывать в нерве возбуждение. Для электродиагностического закона
характерным является возникновение такой последовательности возбуждения в
нерве под катодом и анодом и появление сокращения в иннервируемой нервом
мышце: катодзамыкательное сокращение (действие катода) — анодзамыка-
тельное сокращение (действие физиологического катода) — анодразмыка-
тельное сокращение (действие анода) — катодразмыкательное сокращение
(действие физиологического анода). Возбуждение в нерве при действии
физиологического катода и анода возникает при силе тока, как правило,
большей, чем при действии на нерв постоянного тока под полюсами.
Указанные законы обосновали применение в медицине
терапевтического эффекта анэлектротона для прерывания проведения по нерву
импульсов, в том числе болевых, при судорогах и невралгии у больных.
-Поверхность кожи конечности
Физиологический г 1"^___ _— г\ Физиологический
анод / ^—~^Z-— /~~~~\ / \ ^ катод
Физический Катод Анод Физический
катод анод
Рис. 2.7. Схематическое изображение распределения силовых линий между катодом
и анодом в области нерва, окруженного тканями.
Электродиагностический закон проявляется в том, что при замыкании цепи постоянного тока
сокращение мышцы возникает в области действия на нерв физического катода и
физиологического катода в области действия на нерв физического анода. При размыкании цепи
постоянного тока сокращение мышцы возникает в области действия на нерв физического анода и
физиологического катода в области действия на нерв физического анода.
58 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
2.2.4. Понятие о функциональной подвижности возбудимых
тканей
Возбудимые ткани при их раздражении электрическим током отвечают
определенным числом возбуждений в единицу времени. Способность
возбудимых тканей отвечать максимальным числом возбуждений в единицу
времени на их электрическое раздражение называется функциональной
подвижностью, или лабильностью (Н. Е. Введенский). Лабильность
возбудимых тканей измеряется количеством волн возбуждения в единицу времени.
Лабильность и хронаксия возбудимой ткани взаимосвязаны между собой.
Эта взаимосвязь проявляется в том, что возбудимая ткань (нервная или
мышечная), имеющая высокую скорость возникновения возбуждения в
единицу времени, имеет и высокую скорость протекания процессов
возбуждения, и наоборот. Поэтому чем больше волн возбуждения может
воспроизвести нерв или мышца в единицу времени при их ритмическом
раздражении электрическим током, тем выше их лабильность. Эта взаимосвязь
лабильности и хронаксии возбудимой ткани позволяет в клинической
практике оценивать функциональную подвижность и контролировать,
например, процесс восстановления лабильности поврежденных нервной и
мышечной тканей.
Лабильность нервного волокна специфическим образом снижается при
воздействии на нерв, например, анестетиков. Снижение лабильности
нерва начинается с уравнительной стадии, когда сильные и слабые по силе
раздражения нерва вызывают сходный по амплитуде сократительный ответ
мышцы. Дальнейшее снижение лабильности проявляется в парадоксальной
стадии ответа мышцы, когда слабое по силе раздражецие нерва вызывает
большее по силе сокращение, и наоборот. Исчезновение лабильности
нерва свидетельствует об отсутствии в нем возбудимости и проводимости, что
характерно для тормозящей стадии, когда сокращение мышцы отсутствует
при любой силе раздражения нерва. Это явление было названо парабиозом
(Н. Е. Введенский). Оно объяснялось появлением сильного утратившего
способность распространяться возбуждения в участке нерва, находящемся
под действием длительного раздражения. С позиций современной
физиологии утрата нервом возбудимости и проводимости при парабиозе
обусловлена блокадой потенциалзависимых натриевых ионных каналов (см.
ниже).
2.3. Электрические явления в возбудимых клетках
Мембраны возбудимых клеток имеют ионные каналы, которые могут
находиться в двух состояниях: закрытом и открытом. Когда ионный канал
открыт, то ионы свободно диффундируют через мембрану по градиенту их
концентрации. Проницаемость мембраны для иона, диффундирующего
через определенный тип канала, взаимосвязана с величиной мембранного
потенциала. Процесс закрытия или открытия ионного канала обусловлен
потенциалзависимыми воротными эффектами, которые возникают в
ионном канале очень быстро и сохраняются кратковременно (1—2 мс). К
такому типу потенциалзависимых ионных каналов относятся калиевые
ионные каналы. Более медленные потенциалзависимые воротные эффекты
имеют место в ионных каналах, которые могут находиться в трех
состояниях: открытом, инактивированном и закрытом. Механизм инактивирова-
ния ионного канала принципиально отличается от такового, который
имеет место при открытии или закрытии (например, калиевого ионного кана-
2. Физиология возбудимых тканей • 59
ла), тем, что канал вначале открывается, а затем инактивируется, и
остается в таком состоянии некоторое время. К такому типу потенциалзависи-
мых ионных каналов относятся натриевые ионные каналы мембраны
возбудимых клеток, обусловливающие генерацию потенциала действия.
Потенциал действия нервной и мышечной клетки является основным
проявлением в них процесса возбуждения. В состоянии покоя потенциал-
зависимые ионные каналы мембраны клеток возбудимых тканей закрыты,
но сама мембрана находится в поляризованном состоянии, т. е. имеет
мембранный потенциал.
2.3.1. Мембранный потенциал покоя
Мембранный потенциал покоя, или потенциал покоя, является результатом
разности потенциалов между внутренней и наружной сторонами мембраны
клетки (Ет). В покое внутренняя сторона мембраны клетки заряжена
отрицательно по отношению к наружной, т. е. клеточная мембрана
поляризована. Поляризация мембраны клеток заключается в следующем (рис. 2.8).
Если мембрана клетки проницаема только для одного типа ионов, то в
случае, когда концентрация этого типа ионов по обе стороны мембраны
различна, они способны путем диффузии переходить через мембрану из
среды с большей концентрацией (С7) в среду с меньшей концентрацией
ионов (С2). В случае, если ионы заряжены положительно (см. рис. 2.8)
как, например, ионы калия, то на стороне С2 мембраны накапливаются
только положительно заряженные ионы. Положительный заряд ионов на
стороне С2 мембраны будет препятствовать дальнейшему проникновению
одноименных ионов, так как возникшее электрическое поле
уравновешивает движущую силу концентрационного градиента положительных ионов
на мембране. Электрические силы положительных ионов на стороне С2
мембраны будут притягивать отрицательные ионы со стороны С/
мембраны, для которых она непроницаема. При достижении равновесия
концентрационные потенциалы ионов по обе стороны мембраны будут равны по
величине, но противоположны по знаку их электрическому потенциалу. В
результате по обе стороны мембраны возникает разность потенциалов.
Возникновение на мембране разности потенциалов (Ет) описывается
уравнением Нернста, которое позволяет рассчитать равновесный
электрический потенциал для любого иона:
Ет = Щ.Ъ&,
zF С/
где С, и С2 — концентрации ионов после достижения
равновесия по обе стороны мембраны, z — валент-
Рис. 2.8. Механизм возникновения потенциала Нернста.
Положительные ионы диффундируют из области высокой
концентрации (С1) в область низкой концентрации (С2). В результате
одна сторона мембраны заряжается положительно, что препятствует
дальнейшей диффузии положительных ионов на сторону С2.
Между сторонами С1 и С2 возникает электрическое поле, которое
уравновешивает движущую силу концентрационного потенциала, и
устанавливается динамическое равновесие. Со стороны О на
мембране формируется отрицательныйй заряд, а со стороны С2 —
положительный. В целом, на мембране возникает разность
потенциалов.
Мембрана
60 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
ность ионов, F = 96 500 Кл/моль — постоянная Фарадея, R = 8,31 Дж/
мольёК — универсальная газовая постоянная, Т— абсолютная температура
системы, zF— заряд одного моля ионов, переносимых через мембрану.
Рассмотренный на рис. 2.8 пример свидетельствует о том, что
потенциал на мембране клетки обусловлен ионами в том случае, если она для них
проницаема. В отношении возбудимых клеток потенциал на их мембране
может быть обусловлен ионами Na+, K+ и СГ. В случае, если бы
потенциал на мембране определялся только ионами калия, то его величина,
согласно уравнению Нернста, должна равняться —90 мВ, принимая во
внимание значение температуры тела человека (37 °Q, валентность иона (z —
— 1), постоянную Фарадея (F = 96 500 Кл/моль) и универсальную газовую
постоянную (Я = 8,31Дж/мольК):
nF [К,]
где К* и К+т — наружная и внутренняя концентрация ионов калия вне и
внутри нейрона. В нейронах теплокровных животных отношение [К*\ к
[К+н] составляет порядка '/28.
В случае, если бы мембрана клеток была пассивно проницаема только
для ионов Na+ или только для ионов С1~, то на ней устанавливался бы
потенциал, равный +60 мВ и —80 мВ соответственно. При этом для хлора
величина потенциала Нернста близка к реальной величине потенциала
покоя нейрона, т. е. примерно —80 мВ. Однако в норме потенциал покоя на
мембране нейронов составляет порядка -60 мВ. Причина отклонения
потенциала на мембране нейрона от потенциала, рассчитанного по
уравнению Нернста для каждого из названных ионов, заключается в том, что
через мембрану нейрона постоянно движутся встречные потоки ионов К+,
Na+ и СГ, каждый из которых имеет разный коэффициент проницаемости.
Потенциал покоя в возбудимых клетках. В возбудимых клетках между
цитозолем и внеклеточной средой существует концентрационный градиент
для ионов Na+ и К+, который поддерживается работой натрий-калиевого
насоса, функционирующего за счет гидролиза энергии АТФ. Активность
натрий-калиевого насоса создает разность потенциалов на мембране
порядка —4 мВ, поэтому его называют электрогенным насосом. Основной
функцией натрий-калиевого насоса является поддержание градиента
концентрации ионов Na+ и К+ на мембране нейрона. В результате активности
натрий-калиевого насоса концентрация ионов К+ с внутренней стороны
мембраны клеток в 20—50 раз выше, чем с внешней стороны мембраны, а
с внешней стороны мембраны в 8—10 раз выше концентрация ионов Na+.
Поэтому ионы калия стремятся выйти из клетки, а ионы натрия —
проникнуть внутрь. В покое мембрана возбудимых клеток проницаема в разной
степени для нескольких ионов, т. е. ионов К+, Na+ и СГ. Это является
причиной отклонения потенциала на мембране от потенциала,
рассчитанного по формуле Нернста для каждого из этих ионов. В этом случае
мембранный потенциал может быть описан уравнением Гольдмана—Ходжки-
на—Катца:
Ет = RT[n PkjK] + PNANa„+] + Pa[Clm]
F Рк[С]+РмЛКав,;]+Рс,1С1„-]'
где ^„ — мембранный потенциал; R — газовая постоянная; Т — абсолютная
температура; F— число Фарадея; Рк, PNn и Ра— константы проницаемости
2. Физиология возбудимых тканей • 61
мембраны для ионов К+, Na+ и СГ; //СУ, [Ke+J, [Naf], [Nae+H], [CI;] и
[Clml — концентрации ионов К+, Na+ и СГ снаружи (н) и внутри (вн)
клетки.
Согласно формуле Гольдмана—Ходжкина—Катца концентрационный
градиент каждого из ионов обусловливает величину мембранного
потенциала. В покое величина мембранного потенциала пропорциональна
проницаемости мембраны для ионов К+, Na+ и СГ, которая составляет —
Рк : PNa : Ра = 1 : 0,04 : 0,45. Величина коэффициента проницаемости
ионов калия свидетельствует о том, что концентрационный градиент
положительно заряженных ионов калия направлен из клетки во внеклеточную
среду. По своему характеру проницаемость ионов калия через мембрану
i нейрона носит диффузионный характер (ток утечки ионов калия) и
потенциал покоя определяется, в основном, этим ионом. Во внутриклеточной
среде возбудимых клеток содержатся различные анионы, которые не могут
проникать через мембрану (белки, аминокислоты, органические кислоты,
фосфаты, сульфаты). В результате избыток отрицательных ионов внутри
< клетки создает отрицательный заряд на поверхности мембраны с ее
внутренней стороны. Выход ионов калия через мембрану из клетки создает
избыток положительных ионов на внешней поверхности мембраны.
Концентрация ионов хлора по обе стороны мембраны возбудимых
клеток находится в равновесном состоянии. Поэтому ионы хлора могут
двигаться через мембрану в обоих направлениях с одинаковой скоростью. На
этом основании ионы хлора могут не входить в уравнение Гольдмана—
, Ходжкина—Каца. Лишь при быстром нарушении равновесного состояния
ионы хлора могут оказывать влияние на величину потенциала на мембране
возбудимых клеток.
2.3.2. Потенциал действия возбудимых клеток
Потенциал действия возбудимых клеток представляет собой
кратковременное фазное изменение знака потенциала на внутренней поверхности
мембраны и проницаемости мембраны для ионов, вызванное внешним
раздражением мембраны возбудимых клеток. Потенциал действия состоит из фаз
деполяризации, реполяризации и следовых потенциалов.
Фаза деполяризации возникает в результате открытия в мембране потен-
циалзависимых натриевых ионных каналов (рис.2.9). При этом коэффици-
\ ент проницаемости мембраны для ионов Na+ возрастает в сотни раз, т. е. с
PNa+ = 0,04 до PNa+ = 20. Потенциал действия возникает по закону «все или
Рис. 2.9. Натриевый воротный
ионный канал. При
деполяризации мембраны канал находится в
открытом или инактивированном
состояниях (закрыты h-ворота).
При поляризованной мембране,
т. е. когда внутренняя поверхность
мембраны имеет отрицательный
заряд относительно наружной,
ионный канал находится в закрытом
состоянии (m-ворота закрыты).
Д — деполяризация мембраны, П —
поляризация мембраны в состоянии
покоя.
Открытый ионный
канал
Инактивированный
ионный канал
крытый ионнный
канал
62 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
Равновесный потенциал
2.10. Потенциал дейст-
Пороговое раздражение
мембраны нейрона
Положительный следовый
потенциал
Отрицательный следовый
потенциал
1 мс
Ток ионов калия
внутрь клетки
Ток ионов калия
из клетки
Рис.
ВИЯ.
Изменения мембранного
потенциала (А), которые называются
потенциалом действия нервов и
мышц, являются результатом
изменения ионной проницаемости
мембраны для Na' и К' (Б). В
зависимости от иона, участвующего
в генерации потенциала действия,
изменение ионной проницаемости
мембраны происходит в результате
открытия, закрытия или инакти-
вирования ионных каналов.
Большинство потенциалзависимых
натриевых ионных каналов
открывается, когда деполяризация
достигает порогового уровня (Ек).
После спонтанной инактивации этих
каналов открываются калиевые
ионные каналы, что вызывает ре-
поляризацию мембраны. В
период, когда натриевые ионные
каналы находятся в инактивированном
состоянии, мембрана клетки
является рефрактерной. Натриевые
ионные каналы функционируют
примерно в 10 раз быстрее, чем
калиевые.
ничего». Согласно этому
закону величина
потенциала действия остается
постоянной, независимо от силы
вызвавшего его стимула.
Стимулом для генерации
потенциала действия
является быстрая
кратковременная деполяризация мембраны возбудимой клетки, которая называется
критическим уровнемдеполяризащи (Ек). Величина потенциала на
мембране (Ет), необходимая для достижения критического уровня
деполяризации, называется порсговым потенциалом (Ет—Ек), или порсгом генерации
потенциала действия (рис. 2.10). Амплитуда критического уровня деполя-
ризациии мембраны нервного волокна и мышечной клетки в среднем
меньше величины потенциала покоя на 15—20 мВ. Пороговый сдвиг
мембранного потенциала возникает лишь в том случае, если натриевый ток
(/»„), направленный внутрь клетки начинает превышать противоположно
направленный калиевый ток (/,). £сли уменьшение мембранного
потенциала происходит медленно в течение нескольких миллисекунд, то инак-
тивационные ворота в натриевых ионных каналах инактивируются раньше,
чем произойдет открывание достаточного количества активационных
ворот. В результате натриевый ток (1Па) будет недостаточным для открытия
потенциалзависимых натриевых каналов. Подобное явление называется
аккомодацией мембраны В этом случае не будет возникать потенциал
действия. Деполяризация мембраны начинается с активации инактивирован-
ных потенциалзависимых натриевых ионных каналов, и только после
этого натриевые каналы открываются. Ионы т * через открытые потенциал-
2. Физиология возбудимых тканей • 63
зависимые натриевые каналы устремляются по концентрационному
градиенту внутрь клетки (натриевый ток INa), заряжая внутреннюю поверхность
мембраны положительным зарядом. При этом отношение коэффициентов
проницаемостей мембраны для ионов калия и натрия составляет иную
величину относительно состояния покоя: Рк: PNa = 1 : 20, а генерация
потенциала действия обусловлена высокой проницаемостью мембраны для
ионов Na+. Деполяризация мембраны клетки увеличивает число открытых
потенциалзависимых натриевых каналов, что существенно повышает
натриевую проницаемость. В результате потенциал на мембране возбудимой
клетки за 1—2 мс стремится достичь величины натриевого равновесного
потенциала. При этом потенциал на внутренней поверхности мембраны
меняет знак и его величина достигает +40 мВ (явление реверсии заряда
мембраны).
Реполяризация. Во время реверсии заряда мембраны величина
потенциала Нернста для ионов натрия приближается к их равновесному
потенциалу, что вызывает через 1—2 мс после начала деполяризации инактивацию
потенциалзависимых натриевых ионных каналов. При этом инактивацион-
ные ворота натриевых ионных каналов не открываются до тех пор, пока
мембранный потенциал покоя не восстанавливается до своего исходного
уровня. В результате прекращается входящий натриевый ток.
Одновременно под влиянием деполяризации мембраны открываются потенциалзави-
симые калиевые ионные каналы и увеличивается выходящий калиевый
ток, который стремится сместить мембранный потенциал в сторону
калиевого равновесного потенциала и, таким образом, реполяризует мембрану
(рис. 2.11). Мембранный потенциал приближается к величине потенциала
покоя, но в мембране еще
остаются открытыми
калиевые ионные каналы и
инактивироваными —
натриевые ионные каналы.
Следовые потенциалы.
В возбудимых клетках фаза
реполяризации переходит в
следовые потенциалы,
которые подразделяют на
следовую деполяризацию и
следовую
гиперполяризацию. Следовые
потенциалы обусловлены тем, что
натриевые и калиевые
ионные каналы не
возвратились к своему исходному
состоянию после быстрых
фаз деполяризации и
реполяризации. При этом чем
медленнее в фазу
деполяризации открываются по-
тенциалзависимые
калиевые ионные каналы, тем
длительнее будет следовая
гиперполяризация и тем
медленнее в мембране
клетки будет восстанавли-
3Na*
Ik
+ + +
Na+/K+
АТФаза
2К+
+ +
ПД I
Внешняя поверхность
+ мембраны клетки
Мембрана клетки
Внутренняя поверхность
мембраны клетки
Активный
транспорт
Диффузия
по градиенту
концентрации
Рис. 2.11. Генерация потенциала действия.
Ионы натрия по градиенту концентрации проникают
внутрь клетки (lNo) и заряжают внутреннюю
поверхность мембраны положительным зарядом до величины
потенциала действия (ПД). После открывания
натриевых ионных каналов соотношение PNa : РК = 20 : 1.
Коэффициент проницаемости для ионов натрия
меняется с диффузионного на канальный. Открывание
потенциалзависимых калиевых ионных каналов (IK)
восстанавливает отрицательный заряд на внутренней
поверхности мембраны. Увеличение концентрации ионов
натрия внутри клетки активирует работу
натрий-калиевого насоса.
64 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
ваться ее нормальная возбудимость. Величина потенциала покоя
мембраны нейронов составляет —60 мВ, а мембраны нервного волокна и
скелетной мышечной клетки —90мВ, что свидетельствует о более высокой
возбудимости сомы нейронов, чем их аксонов и, тем более, скелетных
мышечных волокон.
При этом амплитуда потенциала действия в нервных волокнах
составляет ПО мВ, что на +20 мВ превышает величину потенциала покоя. В
скелетных мышечных клетках во время фазы деполяризации величина
потенциала на мембране достигает максимального значения +30—40 мВ.
Поэтому амплитуда потенциала действия в клетках скелетных мышц составляет
120—130 мВ. Эти различия в амплитуде реверсии заряда мембраны
нервных и мышечных волокон обусловливают большую скорость протекания
возбуждения в нервных волокнах, а следовательно, более высокую их
лабильность по сравнению с мышечными волокнами.
2.2.3. Рефрактерный период в возбудимых клетках
В фазу деполяризации потенциала действия потенциалзависимые
натриевые ионные каналы кратковременно открываются, но затем инактивиру-
ются h-ворота (см. рис. 2.9). В период инактивации натриевых ионных
каналов возбудимые клетки не способны реагировать повышением
натриевой проницаемости на повторный стимул. Поэтому во время фазы
деполяризации мембрана не может генерировать потенциал действия в ответ на
действие пороговых или сверхпороговых раздражителей. Это состояние
называется абсолютной рефрактерностью, время которой составляет в
нервных волокнах 0,5—1,0 мс, а в скелетных мышечных клетках —в среднем 2
мс. Период абсолютной рефрактерности заканчивается после того, как
снижается количество инактивированных натриевых каналов и постепенно
увеличивается количество натриевых каналов, находящихся в закрытом
состоянии. Происходят эти процессы во время фазы реполяризации, когда
уменьшению количества потенциалзависимых натриевых ионных каналов,
находящихся в состоянии инактивации, соответствует период
относительной рефрактерности. Период относительной рефрактерности
характеризуется тем, что лишь некоторая часть потенциалзависимых натриевых
ионных каналов переходит в закрытое состояние, а в силу этого порог
возбудимости мембраны клетки имеет более высокие значения, чем в исходном
состоянии. Поэтому возбудимые клетки в период относительной
рефрактерности могут генерировать потенциалы действия, но при воздействии на
них раздражителей сверхпороговой силы. Однако из-за небольшого
количества потенциалзависимых натриевых ионных каналов, находящихся в
закрытом состоянии, амплитуда генерируемых при этом потенциалов
действия будет меньше, чем в условиях исходной возбудимости нервной или
мышечной клетки.
В клетках возбудимых тканей максимальное количество генерируемых
потенциалов действия в единицу времени обусловлено двумя факторами:
длительностью потенциала действия и длительностью периода абсолютной
рефрактерности после каждого импульса. На этом основании в
физиологии формулируется современное понятие лабильности: чем меньше период
абсолютной рефрактерности при возбуждении возбудимой ткани, тем
выше ее функциональная подвижность или лабильность, тем больше в ней
генерируется потенциалов действия в единицу времени.
При непрерывной стимуляции нерва электрическим током лабильность
нерва зависит от частоты и силы раздражения. В зависимости от частоты и
2. Физиология возбудимых тканей • 65
силы раздражения нерва сокращение иннервируемои им мышцы может
быть максимальной или минимальной амплитуды. Эти явления были
названы соответственно оптимумом и пессимумом (Н. Е. Введенский).
Максимальное (оптимально большое) сокращение мышцы возникает в том
случае, если каждый последующий электрический стимул действует на
нерв в периоде его состояния супернормальной возбудимости после
предыдущего потенциала действия. Минимальное (или пессимальное)
сокращение мышцы возникает в том случае, если каждый последующий
электрический стимул действует на нерв, находящийся в периоде
относительной рефрактерности после предыдущего потенциала действия. Поэтому
значения оптимальной частоты раздражения нерва всегда меньше, чем
значения пессимальной частоты раздражения.
2.3.4. Локальный ответ мембраны
возбудимых клеток
При действии электрического стимула подпороговой силы уменьшение
мембранного потенциала оказывается недостаточным для того, чтобы
натриевый ток (INJ стал больше, чем сумма калиевого выходящего тока или
тока утечки ионов калия. При этом мембранный потенциал уменьшается
на несколько милливольт, но в результате реполяризации
восстанавливается до величины мембранного потенциала покоя. Подобные пассивные или
электротонические изменения потенциала на мембране, которые не
достигают критического уровня деполяризации под действием деполяризующего
электрического тока подпороговой величины, называются локальным
ответом. Для локального ответа характерны следующие физиологические
проявления на мембране нервной
клетки или нервного волокна:
амплитуда локального ответа не
имеет линейной зависимости от
силы подпорогового
электрического раздражения; отсутствует
проявление закона «все или
ничего»; в период локального ответа
мембрана клетки или нервного
волокна не только сохраняет, но
и имеет повышенную
(супернормальную) возбудимость.
Следовательно, локальный ответ не имеет
четкого порога возникновения, а
в период его развития отсутствует
абсолютная рефрактерность
нервного волокна. Во время
локального ответа мембрана нервной
клетки имеет высокую способность к
регенеративному увеличению
ионной натриевой
проницаемости, поскольку амплитуда
мембранного потенциала снижается
электротонически. Локальные
электротонические изменения
потенциала на мембране нервного
волокна после прекращения дей-
3 - 6095
Рис. 2.12. Влияние подпорогового
электрического раздражения возбудимой
мембраны на степень ее деполяризации.
При раздражении мембраны возбудимых
клеток электрическим током подпороговой силы
происходит электротоническое уменьшение
потенциала на мембране и/или активация по-
тенциалзависимых натриевых каналов.
Процесс является обратимым, и мембранный
потенциал возвращается к исходному уровню, не
достигая критического уровня деполяризации
(Ек). В период локальных изменений
мембранного потенциала мембрана возбудимых клеток
имеет супернормальную возбудимость.
66 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
ствия кратковременного импульса электрического тока подвергаются
обратному самостоятельному развитию. При действии на возбудимую
мембрану серией подпороговых электрических стимулов происходит
суммирование амплитуды локального ответа. Если амплитуда локального ответа
достигает порога возбудимости мембраны, то потенциалзависимые
натриевые ионные каналы открываются по закону «все или ничего» и происходит
генерация потенциала действия. На рис. 2.12 показано суммирование
амплитуды локального ответа по типу деполяризации при действии на
мембрану нервного волокна серией подпороговых электрических стимулов.
Локальный ответ нервного волокна всегда сопровождается повышением
возбудимости мембраны клеток.
2.4. Проведение импульса по нервным волокнам
Потенциал действия или нервный импульс может возникать в любой точке
возбудимой мембраны нервного или мышечного волокна и способен
распространяться вдоль ее поверхности. При этом роль потенциала действия
заключается в передаче информации по нервным волокнам от тела
нейрона к нервному окончанию. Когда потенциалы действия достигают терми-
налей аксона, то информация передается на другие нейроны благодаря
выделению из нервных окончаний молекул медиаторов. В мышечных клетках
потенциалы действия распространяются по сарколемме и активируют
механизм сокращения мышц. Проведение нервного импульса от тела
нейрона к окончанию аксона различается в немиелинизированных и миелини-
зированных нервных волокнах.
2.4.1. Немиелинизированные волокна
Проведение потенциала действия по немиелинированному нервному
волокну происходит путем активации потенциалзависимых натриевых
ионных каналов участка мембраны волокна, прилегающего к тому месту, где
возник потенциал действия. При этом между возбужденным и
невозбужденным участками мембраны нервного волокна возникают локальные
электрические токи, которые вызывают деполяризацию мембраны
невозбужденного участка до критического уровня, и только после этого в мем-
участок участок возбудимость
Рис. 2.13. Распространение
потенциала действия по немиелинизированно-
му нервному волокну.
При деполяризации мембраны нервного
волокна возникают продольные токи, которые
распространяются по аксоплазме и
направлены от активного участка генерации
потенциала действия в обе стороны нервного
волокна. Продольные токи (1а) вызывают
открытие натриевых потенциалзависимых
ионных каналов в участке мембраны,
который имеет нормальную возбудимость и
вызывают в этом месте генерацию потенциала
действия. Рефрактерный участок
невозбудим, поскольку натриевые ионные каналы
находятся в инактивированом состоянии. В
результате потенциал действия генерируется
на соседнем участке мембраны и движется
по нервному волокну в одном направлении.
2. Физиология возбудимых тканей • 67
бране нервного волокна мгновенно открываются потенциалзависимые
натриевые каналы. Потенциал действия, таким образом, генерируется в
последующем участке нервного волокна (рис. 2.13).
2.4.2. Миелинизированные волокна
В миелинизированном нервном волокне потенциалы действия
генерируются только в области перехвата Ранвье, т. е. той части мембраны, которая
не покрыта шванновскими клетками. С одной стороны, это обусловлено
тем, что цитоплазма шванновской клетки содержит липид — сфингомиелин,
который уменьшает поток ионов через мембрану нервного волокна
примерно в 5000 раз и снижает ее емкость в 50 раз. С другой стороны, в
области перехвата Ранвье в мембране нервного волокна имеется наибольшее
число потенциалзависимых натриевых ионных каналов, а сама мембрана
обладает нормальным уровнем возбудимости. При нанесении точечного
раздражения на миелинизированное нервное волокно потенциал действия
генерируется в зоне перехвата Ранвье и возникают электрические токи,
которые текут вдоль силовых линий от плюса к минусу потенциала на
мембране (рис. 2.14). Одновременно в аксоплазме нервного волокна
возникают продольные токи, которые направлены от места генерации потенциала
действия в обе стороны (1а). Продольные токи вызывают открывание
потенциалзависимых натриевых ионных каналов, а следовательно, движение
ионов Na+ через мембрану и генерацию потенциала действия в соседних
перехватах Ранвье, минуя часть нервного волокна, покрытого
шванновскими клетками. Поскольку потенциалы действия передаются
(перепрыгивают) от одного перехвата Ранвье к другому, то механизм проведения
потенциалов действия в миелинизированных нервных волокнах получил назва-
Перехват,
Ранвье
Миелин
Перехват
Ранвье
Перехват
Ранвье
'iiuiiiiiiiiiiiitiiiiiim
r'^!^^f^^^^fffHH»ff:fWtfpf^H^H^>^![fe:.
Рефрактерный
участок
Активный ,
участок
Нормальная
возбудимость
Рис. 2.14. Распространение потенциала действия по миелиновому нервному
волокну.
При деполяризации мембраны активного перехвата Ранвье продольные токи (1а) направлены
от активного участка в обе стороны волокна. Движение ионов, обусловленное продольными
токами, вызывает открытие потенциалзависмых натриевых ионных каналов мембраны
перехвата Ранвье, имеющей нормальную возбудимость. Аналогичный процесс не возникает на
мембране рефрактерного участка, натриевые каналы которого находятся в инактивированном
состоянии. В результате потенциал действия распространяется сальтаторно в одном
направлении. Стрелками обозначено направление токов из возбужденного перехвата вдоль нервного
волокна.
3'
68 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
ние сальтаторного. В миелинизированных нервных волокнах реполяриза-
ция мембраны после потенциала действия происходит с очень высокой
скоростью. В результате нервные волокна имеют высокую
функциональную лабильность и способны проводить значительное число потенциалов
действия в единицу времени. Скорость распространения потенциалов
действия в зависимости от диаметра и типа миелинизированных нервных
волокон чрезвычайно высока и варьирует от 6 до 120 м/с. В толстых
миелинизированных нервных волокнах скорость проведения возбуждения
пропорциональна диаметру волокна, а проводимость нервного волокна имеет
обратную зависимость от его диаметра.
2.4.3. Законы проведения возбуждения по нервному волокну
Проведение возбуждения по нервному волокну возможно при условии его
структурной целостности и физиологической непрерывности {закон
физиологической непрерывности). Физиологическая непрерывность нерва может
быть нарушена, например, при сдавлении нерва без его структурного
повреждения, что препятствует проведению потенциалов действия. При
проведении возбуждения по нервному волокну потенциал действия не
распространяется с одного волокна на другое, например рядом расположенное
{закон изолированного проведения). Несмотря на то что нервные волокна
проводят потенциалы действия либо в направлении тела нейрона
(центростремительно), либо от тела нервной клетки к окончаниям аксона (цен-
тробежно), отдельное нервное волокно обладает двусторонней
проводимостью {закон двустороннего проведения). При искусственном электрическом
раздражении в любой точке по ходу нервного волокна может возникать
потенциал действия и распространяться как центростремительно, так и
центробежно.
2.5. Проведение возбуждения через синапс
Передача возбуждения с отростка одной нервной клетки на отросток или
тело другой нервной клетки возможна двумя способами: электрическим и
химическим. Электрический способ передачи возбуждения
осуществляется с помощью щелевых контактов (нексусов) в том случае, если
мембраны клеток отделены щелью размером примерно 2 нм. Щелевые контакты
распространены, например, в миокарде и гладких мышцах
пищеварительного тракта и представляют собой межклеточные тубулярные белковые
гидрофильные каналы, состоящие их шести молекул интегральных белков-
коннексонов. Передача возбуждения электрическим способом
осуществляется аналогично его проведению по нервным волокнам с помощью
местных токов, возникающих между деполяризованным участком мембраны
нервного волокна и поляризованным участком мембраны нервной клетки.
Локальные токи деполяризуют мембрану нейрона до критического
уровня, после чего возникает спонтанный процесс регенеративной
деполяризации. Электрическая передача возбуждения осуществляется с высокой
скоростью, близкой к скорости проведения возбуждения по нервным
волокнам.
Основным способом передачи возбуждения между нейронами, а также
между нервными и мышечными клетками является химический, который
реализуется с помощью синапсов. Синапс — это специализированное по
структуре и функции место контакта мембран между двумя возбудимыми
клетками, которое обеспечивает передачу импульсов от одной возбудимой
2. Физиология возбудимых тканей • 69
клетки к другой с помощью молекул химических веществ, или медиаторов.
Проведение возбуждения между нервом и мышцей осуществляется через
нервно-мышечный синапс, который представляет собой место контакта
окончания аксона нейрона с мембраной мышечного волокна. Функцией
такого соединения является передача сигналов возбуждения от а-мотоней-
ронов спинного мозга к скелетным мышечным волокнам, вызывающих
сокращение мышцы.
2.5.1. Проведение возбуждения через нервно-мышечный синапс
Нервно-мышечный синапс образован мембраной терминали аксона, или
пресинаптического окончания мотонейрона спинного мозга, и мембраной
мышечного волокна, или постсинаптической мембраной, между которыми
имеется синоптическая щель (рис. 2.15). Постсинаптическая мембрана
нервно-мышечного синапса называется концевой пластинкой, поскольку
представляет собой специализированную часть мембраны мышечного
волокна, имеющую складчатый вид, что существенно увеличивает площадь
мембраны, контактирующей с аксолеммой нервной терминали. Кроме
того, постсинаптическая мембрана содержит N-холинорецепторы и фермент
ацетилхолинестеразу, которая разрушает медиатор ацетилхолин. Исходя
из структурной организации нервно-мышечного синапса, передачу
возбуждения с нерва на мышцу можно разделить на два физиологических
механизма: пресинаптический и постсинаптический. Функция
нервно-мышечного синапса заключена в передаче очень небольших по амплитуде
потенциалов действия, достигающих двигательных нервных окончаний,
на мышечные волокна и инициации, таким образом, сокращения во всей
скелетной мышце.
Синаптические Пресинаптическая Терминаль аксона
пузырькич мембрана / Складчатая
Синаптическая \Ч У постсинаптическая
щель \ \\ ] ~^^~^-^ мембрана
Митохондрии
Ядоо ^__^ , i -ч Саркоплазматический
волокна ^^^^^
Миофибриллы
Рис. 2.15. Схема нервно-мышечного синапса.
Функцией соединения является трансформация энергии нервного импульса в кванты ацетил-
холина, который выделяется из терминали в синаптическую щель с последующим
превращением химического сигнала в электрический на мембране мышечного волокна. На складчатой
постсинаптической мембране находятся ионотропные холинорецепторы, которые, связываясь
с ацетилхолином, открывают натриевые ионные каналы постсинаптической мембраны.
Деполяризация постсинаптической мембраны электротонически открывает потенциалзависимые
натриевые ионные каналы сарколеммы и, таким образом, в ней генерируются
распространяющиеся потенциалы действия.
70 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
2.5.1.1. Пресинапти ческий механизм
Пресинаптический механизм передачи возбуждения с нерва на мышцу
осуществляется в двигательных нервных окончаниях и его функция
заключается в трансформации числа нервных импульсов в количество
выделяющегося из нервной терминали медиатора. Проведение возбуждения через
нервно-мышечный синапс связано с функцией активных зон пресинапти-
ческой мембраны, которые представляют собой комплекс рядами
расположенных Са2+-каналов, синаптических везикул, специализированных
белков экзоцитоза или выделения медиатора и элементов цитоскелета (акти-
новые филаменты и микротрубочки), объединенные вокруг так
называемых плотных тел синапса. Последние представляют собой участки
утолщения пресинаптической мембраны, в области которых происходит секреция
медиатора. В синаптическом окончании содержится примерно от 1 до 5
активных зон, которые имеют непосредственное отношение к выделению,
или экзоцитозу, медиатора в синаптическую щель.
В синаптических пузырьках
терминали аксона, иннерви-
рующего мышцу, содержится
медиатор ацетилхолин. Ацетил-
холин синтезируется
непосредственно в нервном окончании
из холина и ацетш-Ко-А при
участии фермента ацетил-
трансферазы. Наряду с
медиатором в везикулах содержатся
различные ионы, АТФ,
ферменты и другие вещества,
участвующие в выделении
медиатора в синаптическую щель. В
каждом синаптическом
пузырьке содержится примерно 1(Г4
молекул ацетилхолина.
Количество ацетилхолина,
высвобождаемое из одной везикулы,
принято называть квантом
медиатора. Без ресинтеза
ацетилхолина в двигательном нервном
окончании запаса его молекул
в синаптических пузырьках
достаточно для проведения
примерно 10 000 импульсов.
Везикулы пресинаптической
терминали находятся в
активной и депонированной формах.
Активные везикулы
непосредственно участвуют в передаче
возбуждения через
нервно-мышечное соединение, т. е. в
выделении медиатора в
синаптическую щель. Молекулы
медиатора депонированной формы
везикул постоянно пополняют
Концевая
пластинка
Переносчик
холина
Ацетат
Рецептор
Рис. 2.16. Высвобождение и рециркуляция
ацетилхолина в нервно-мышечном синапсе.
Ацетилхолин (АЦХ) синтезируется в нервных
окончаниях ацетилированием холина ферментом
ацетилхолинтрансферазой (АХТ) из ацетил-КоА
как источника ацетиловой группы и холина.
Образующийся ацетилхолин накапливается в
везикулах с помощью механизма активного
транспорта с использованием АТФ и высвобождается
в синаптическую щель с помощью экзоцитоза во
время генерации потенциалов действия в
нервном окончании. После связывания ацетилхолина
с холинорецептором концевой пластинки
медиатор подвергается гидролизу ферментом холин-
эстеразой до ацетата и холина до того, как
медиатор успеет связаться с другими холинорецептора-
ми. Примерно половина холина захватывается
нервным окончанием и используется в синтезе
ацетилхолина.
2. Физиология возбудимых тканей • 71
пул активной формы
медиатора по мере их
использования в синаптиче-
ской передаче. Число
везикул является
постоянной величиной
пресинаптической терминали и
обусловливает
функциональную лабильность
синапса (рис. 2.16).
После того как
нервный импульс достигает
пресинаптического
окончания в фазу
деполяризации потенциала действия,
в мембране окончания
открываются потенциалза-
висимые кальциевые
ионные каналы, и ионы Са2+
пассивно по градиенту
концентрации поступают
внутрь нервного
окончания из внеклеточной
среды. Движение ионов Са2+
обусловлено тем, что в
покое их концентрация в
цитоплазме нервного окончания составляет порядка 1(Г7 М, а на внешней
поверхности его мембраны, благодаря активности Са2+-АТФазы,
поддерживается более высокая концентрация ионов кальция, чем внутри. В
момент открытия кальциевых ионных каналов в активных зонах
пресинаптической мембраны формируются микродомены (рис. 2.17). Микродомен
представляет собой область высокой концентрации ионов Са2+ вблизи
устья кальциевого ионного канала. В момент появления микродомена
белки мембраны везикулы способны связывать везикулярную мембрану с
активной зоной пресинаптического окончания. При этом образуется
специфический белковый комплекс, состоящий из везикулы и элементов
активной зоны пресинаптической мембраны, которые связаны между собой
специализированными белками экзоцитоза. Этот комплекс называется сек-
ретосомой. Формирование секретосомы является основным процессом,
обеспечивающим экзоцитоз ацетилхолина в нервном окончании.
Белки экзоцитоза локализованы как на мембране везикул (синапсин,
синаптотагмин, синаптобревин), так и на пресинаптической мембране
(синтаксин, синапсоассоциированный белок). Белок синаптотагмин
является кальциевым рецептором. После связывания ионов Са2+ с синаптотаг-
мином и последующего взаимодействия синаптобревина с синаптосомас-
социированным белком и синтаксином пресинаптической мембраны
происходит связывание везикулы с активной зоной пресинаптической
мембраны. Экзоцитоз медиатора обеспечивается за счет АТФазной активности
специфического цитозольного белка. При высвобождении ацетилхолина в
синаптическую щель мембрана везикулы полностью сливается с
пресинаптической мембраной и медиатор выходит в синаптическую щель через так
называемую пору. Белки экзоцитоза в синапсах периферической нервной
системы являются мишенями для токсинов при их действии на организм
^»»^? -ж
Медиатор
Белковый
комплекс __
экзоцитоза'
Везикула
Кальциевый
микродомен
Пресинаптическая
мембрана
Активная зона Са
▼v. Потенциалзависимый
^ кальциевый канал
« ++ ++
Са са
Рис. 2.17. Схема формирования кальциевого
микродомена и секретосомы.
В фазу деполяризации потенциала действия в активных
зонах пресинаптической мембраны открываются потен-
циалзависимые кальциевые ионные каналы. Ионы
кальция по градиенту концентрации поступают внутрь
терминали и образуют облако ионов (кальциевый
микродомен). В зоне кальциевого микродомена происходит
формирование секретосомы и связывание везикулы с
активной зоной пресинаптической мембраны.
72 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
человека и животных. Например, ботулиновый, столбнячный и другие
токсины способны нарушать процессы формирования секретосомы, что
обусловливает появление специфического симптомокомплекса при
отравлении.
2.5.1.2. Диффузия ацетилхолина через синоптическую щель
нервно-мышечного синапса
Синаптическая щель нервно-мышечного синапса заполнена аморфной
сетью соединительной ткани, в которой находится фермент ацетилхолин-
эстераза. Молекулы этого фермента синтезируются в мышечной клетке и
фиксируются к ее сарколемме со стороны синаптической щели.
Ацетилхолин путем экзоцитоза поступает в синаптическую щель и
затем диффундирует к постсинаптической мембране в течение 1 мс. Во
время диффузии ацетилхолина через синаптическую щель примерно '/3 от
выделившегося количества медиатора разрушается ферментом ацетилхолин-
эстеразой на ацетат и холин, а 2/з молекул ацетилхолина достигает
постсинаптической мембраны и связывается с N-холинорецепторами.
Ацетилхолин после отделения от рецептора расщепляется ацетилхолинестеразои на
холин и ацетат. Синтез, хранение и высвобождение ацетилхолина в
нервно-мышечном соединении показаны на рис. 2.16. Активность ацетилхоли-
нэстеразы столь высока, что период полураспада молекул ацетилхолина не
превышает 1 мс. Инактивация ацетилхолина в синаптической щели
исключает многократное связывание одних и тех же молекул медиатора с хо-
линорецепторами постсинаптической мембраны, что предотвращает
возможность непрерывного сокращения мышц или так называемой мышечной
тетании.
2.5.1.3. Постсинаптический механизм
Постсинаптический механизм передачи возбуждения через
нервно-мышечный синапс представляет собой трансформацию количества
выделившегося ацетилхолина в число потенциалов действия, которые генерирует
сарколемма мышечного волокна. В постсинаптической мембране
нервно-мышечного соединения расположены ионотропные N-холинорецепторы
(чувствительны к никотину). Плотность этих рецепторов выше, чем в
постсинаптической мембране любого синапса нервной системы (1 • 104 на
1 мкм2). Молекулы ацетилхолина кратковременно (не более 2 мс)
взаимодействуют с N-холинорецепторами, в результате в постсинаптической
мембране открываются натриевые и калиевые ионные каналы. Ионы Na+
по электрохимическому градиенту перемещаются из синаптической щели
внутрь мышечного волокна, а ионы К+ — в обратном направлении.
Трансмембранный ток для этих ионов рассчитываются по закону Ома:
1к = Ек(Ет - Ек); /Na = gNa(Em - £Na),
где 1К и INa — трансмембранный ток ионов калия и натрия, gK и gNa —
проницаемость постсинаптической мембраны соответственно для ионов калия
и натрия, Ет — потенциал покоя постсинаптической мембраны, Ек и
ENa — равновесный калиевый и натриевый потенциалы.
Поскольку gNa = gK, а электродвижущая сила {Em — ENa) для натрия
больше (равновесный потенциал для натрия +60 мВ, а для калия — 90 мВ),
входящий ток ионов натрия преобладает над выходящим калиевым током,
в результате происходит деполяризация постсинаптической мембраны
2. Физиология возбудимых тканей • 73
нервно-мышечного синапса, которая называется потенциалом концевой
пластинки. Продолжительность потенциала очень мала — не более 1—2 мс,
а его амплитуда варьирует в зависимости от количества
высвобождающегося ацетилхолина. При этом между амплитудой потенциала концевой
пластинки и количеством высвобождающегося ацетилхолина имеется прямая
зависимость.
Потенциал концевой пластинки электротонически распространяется
вдоль мышечного волокна. При этом, если потенциал концевой пластинки
достигает по величине порога возбуждения мышечной мембраны (—15—
20 мВ), то он вызывает в ней генерацию распространяющихся
потенциалов действия. В результате возбуждение с нервного окончания передается
на мышечную клетку. Если пресинаптического окончания достигает один
потенциал действия, то в синаптическую щель нервно-мышечного синапса
высвобождается в среднем 100 квантов ацетилхолина. В этом случае
возникает потенциал концевой пластинки, величина которого достаточна для
того, чтобы вызвать генерацию потенциалов действия в мышечной
мембране, прилегающей к концевой пластинке. Даже при снижении
амплитуды потенциала концевой пластинки на 75 % он способен вызывать
возбуждение в мышечном волокне, что является фактором высокой надежности
процесса передачи возбуждения в нервно-мышечном синапсе. Надежность
функции нервно-мышечного синапса обусловлена также значительным
количеством высвобождаемого из нервного окончания ацетилхолина и
высокой плотностью N-холинорецепторов на концевой пластинке.
Как только потенциалы действия, распространяясь по мембране
мышечного волокна, достигают t-системы, а ионы Са2+ высвобождаются из
саркоплазматического ретикулума, в мышце начинается сокращение.
2.5.1.4. Восстановительные процессы структуры мембраны и функции
нервно-мышечного синапса после передачи возбуждения
После завершения синаптической передачи в нервно-мышечном синапсе
ионы Са2+ с помощью Са2+-АТФ-азы первично активным транспортом
выводятся из цитоплазмы нервного окончания во внеклеточную среду.
Процесс восстановления исходного градиента концентрации ионов Са2+ между
аксоплазмой нервной терминали и внеклеточной средой осуществляется с
помощью вторично активного транспорта при участии белка Na+/Ca2+ об-
менника. Молекулярная структура пресинаптической мембраны
восстанавливается в результате эндоцитоза везикул, участвовавших в синаптической
передаче возбуждения. В нервном окончании образовавшиеся везикулы
заполняются вновь синтезированными молекулами ацетилхолина. На пост-
синаптической мембране, благодаря работе Na+/K2+-ATOa3bi,
восстанавливаются ионные градиенты Na+ и К+, в результате возбудимость постси-
наптической мембраны возвращается к исходному уровню.
2.5.2. Проведение возбуждения через аксосоматический синапс
В нервной системе проведение возбуждения осуществляется между
отростками нейронов и между отростками и телами нервных клеток. Так,
проведение возбуждения с аксона одного нейрона на аксон другого происходит
при участии аксо-аксональных синапсов. Передача импульсов от аксона
нейрона на на дендриты другой нервной клетки осуществляется аксоденд-
ритными синапсами, а от одних дендритов на другие — с помощью денд-
ро-дендритных синапсов. К наиболее часто встречающемуся в нервной
74 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
Микротрубочки
Рис. 2.18. Схема строения и функции химического синапса.
Предшественник медиатора попадает в терминаль нейрона из крови или ликвора, под
действием специализированного фермента превращается в медиатор и активным транспортом
накапливается в синаптических везикулах. Медиатор после экзоцитоза или после выделения ко-
медиатора (КМ) взаимодействует с ионотропным (И) или метаботропным (М) рецептором
постсинаптическои мембраны. В результате изменяется проницаемость этой мембраны для
ионов Na+, K+, Са2+, СГ и возникает локальная де- или гиперполяризация путем
непосредственного изменения ионной проницаемости, либо при участии вторичного посредника.
Медиатор разрушается ферментом в синаптическои щели, захватывается активным транспортом в
пресинаптическое окончание либо в клетки нейроглии (пунктирные стрелки).
системе пути передачи импульсов между нейронами относится аксосома-
тический синапс, т. е. от аксона одного нейрона на тело другого.
Количество синапсов на дендритах и теле одного нейрона достигает нескольких
тысяч. В качестве примера может быть рассмотрен аксосоматический
синапс, т. е. синапс между окончаниями одной нервной клетки и телом
другой (рис. 2.18).
Аксосоматический синапс образован пресинаптическим окончанием
аксона, синаптическои щелью, за которой расположена постсинаптическая
мембрана. Передача импульсов в аксосоматических синапсах
осуществляется с помощью медиаторов, которые называются нейротрансмиттерами.
В химической передаче возбуждения между нейронами участвуют
различные типы нейротрансмиттеров: глутамат, ацетилхолин, дофамин, норадре-
налин, адреналин, серотонин, гамма-аминомасляная кислота (ГАМК),
нейропептиды. При передаче возбуждения через аксосоматический синапс
в постсинаптическом нейроне возникает два типа ответных реакций:
быстрые и медленные. Быстрые реакции в постсинаптических нейронах
возникают в случаях, если медиатор связывается с рецепторами ионных каналов
постсинаптическои мембраны и, непосредственно вызывая их открытие, в
миллисекундный интервал передает возбуждение на постсинаптический
нейрон. При этом возникают быстрые реакции постсинаптическои
мембраны в виде увеличения ионной проницаемости и ее деполяризации. К
быстрым реакциям увеличения ионной проницаемости постсинаптическои
2. Физиология возбудимых тканей • 75
мембраны аксосоматических синапсов относится открытие ионных
каналов постсинаптическои мембраны после образования внутриклеточных
вторичных посредников (описаны ниже). При этом типе быстрой реакции
нейротрансмиттеры (адреналин, норадреналин, дофамин, гистамин,
серотонин) связываются на постсинаптическои мембране с рецепторами
системы G-белков. В результате активации системы G-белков в постсинаптиче-
ском нейроне образуются внутриклеточные вторичные посредники,
которые через рецепторы ионных каналов открывают их и увеличивают таким
образом ионную проницаемость постсинаптическои мембраны
аксосоматических синапсов. При передаче возбуждения через аксосоматический
синапс возникают медленные или нейромодуляторные реакции постсинап-
тических нейронов. Они также обусловлены взаимодействием нейротранс-
миттеров с рецепторами системы G-белков постсинаптическои мембраны,
но в этом случае при участии внутриклеточных вторичных посредников
возникают медленные, а именно — метаболические реакции постсинапти-
ческих нейронов. Данный способ передачи информации через синапсы
нервной системы присущ большой группе нейротрансмиттеров, которые
называются нейропептидами.
По аналогии с нервно-мышечным синапсом в аксосоматическом
синапсе импульс предается с помощью пре- и постсинаптического
механизмов.
2.5.2.1. Функция пресинаптического окончания нейронов
В нервных терминалях локализовано два типа везикул — мелкие и
крупные. Мелкие везикулы терминалей нейронов центральной и
периферической нервной системы содержат разные группы медиаторов: амины (аце-
тилхолин, дофамин, норадреналин, серотонин и гистамин), аминокислоты
(глютамат, глицин, гамма-аминомасляная кислота) и пурины (АТФ, адено-
зин). Мелкие везикулы в пресинаптической терминали находятся в
активной и депонированной формах. Активные везикулы непосредственно
участвуют в экзоцитозе медиатора, депонированная форма везикул пополняет
пул активной по мере ее использования в синаптической передаче
(рис. 2.19). Медиаторы накапливаются в везикулах с помощью механизма
активного транспорта. Крупные или пептидные везикулы нервных
терминалей центральной и периферической нервной систем содержат нейроак-
тивные пептиды (субстанция Р, вазопрессин, окситоцин, кортиколиберин,
тиреолиберин, соматолиберин, гонадолиберин, энкефалины, ангиотензин-
2 и др.). В отличие от мелких везикул пептидные синтезируются в соме
нейронов, наполняются молекулами пептидов и транспортируются с
помощью аксотока в нервное окончание. Функции медиаторов мелких и
крупных везикул взаимосвязаны между собой в процессе синаптической
передачи: первые обеспечивают химическую передачу возбуждения через
синапс, а вторые — модулируют, т. е. усиливают или уменьшают этот
процесс. Генерация потенциала действия на мембране пресинаптической
терминали активирует кальцийзависимый процесс освобождения или экзоци-
тоза медиатора. Быструю, кратковременную (доли миллисекунды) и
локальную передачу возбуждения между нейронами обеспечивает экзоцитоз
классических нейротрансмиттеров, содержащихся в мелких везикулах
нервной терминали. Экзоцитоз нейропептидов из нервных терминалей
может осуществляться в течение многих секунд и минут при активации
различных внутриклеточных энзимных систем. Благодаря этой
особенности экзоцитоза нейропептидов, они могут модулировать экзоцитоз класси-
76 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
Пептиды
Рис. 2.19. Везикулярный механизм
экзоцитоза медиатора из нервной
терминала
Везикулы (1) формируются в теле нейрона,
транспортируются в нервное окончание, где
заполняются медиатором (2). При экзоци-
тозе, с помощью механизма полного
слияния и с последующим образованием
покрытых везикул (3), запасы медиатора
пополняются через стадию эндосом. При неполном
слиянии и повторном заполнении
медиатором везикулы сразу могут участвовать в эк-
зоцитозе (4). Крупные везикулы
заполняются пептидами в теле нейрона (5), их эк-
зоцитоз происходит в других зонах
нервного окончания (6).
«••^» ческих неиротрансмиттеров в
нейронах на протяжении
продолжительного интервала времени,
усиливая или замедляя передачу импульсов через аксосоматический синапс. В
аксосоматическом синапсе экзоцитоз классических медиаторов
осуществляется в активных зонах пресинаптического окончания. Функциями
активных зон в нервных терминалях (как и в нервно-мышечном синапсе)
является мобилизация медиатора из депонированной формы в активную
при участии элементов цитоскелета. В пределах активной зоны пресинап-
тической мембраны происходит взаимодействие между везикулами и
местом экзоцитоза медиаторов. При участии активных зон пресинаптической
мембраны экзоцитоз происходит только в момент повышения
концентрации ионов кальция в цитоплазме пресинаптической терминали. Наконец,
активные зоны нервной терминали участвуют в процессах восстановления
целостности синаптических пузырьков, заполнения их молекулами
медиаторов, что обусловливает число везикул, находящихся в активной и
депонированной формах.
2.5.2.2. Пресинаптический механизм проведения возбуждения
Пресинаптический механизм проведения возбуждения осуществляет
трансформацию энергии нервных импульсов в кванты выделяющегося
медиатора. В фазу деполяризации потенциала действия в мембране нервной
терминали открываются потенциалзависимые кальциевые ионные каналы,
и ионы кальция по концентрационному градиенту поступают из
внеклеточной среды внутрь нервного окончания. Ионы Са2+ вблизи внутренней
поверхности пресинаптической мембраны образуют микродомен (см.
рис. 2.17) и связываются со специфическим везикулярным белком
кальциевым сенсором — синаптотагмином. Последовательное взаимодействие
специфических белков экзоцитоза, локализованых на мембране везикул
(синапсин, синаптотагмин, синаптобревин) и на пресинаптической
мембране (синтаксин, синапсоассоциированный белок) связывает везикулу с
активной зоной пресинаптической мембраны, формируя секретосому. При
этом мембрана везикулы полностью сливается с пресинаптической
мембраной, и медиатор освобождается в синаптическую щель через пору. В
синапсах нервной системы экзоцитоз медиаторов может проходит через
постоянную или временную пору. В первом случае происходят полное слия-
2. Физиология возбудимых тканей • 77
ние мембран везикулы и пресинаптического окончания и высвобождение
всего количества молекул медиатора из везикул. Во втором случае не
происходит полного слияния мембран везикулы и пресинаптической термина-
ли. При образовании временной поры освобождается только часть
медиатора в синаптическую щель, а затем везикула отделяется от активной зоны
и возвращается в цитоплазму нервной терминали. Этот механизм
позволяет одной и той же везикуле без пополнения запаса медиатора
неоднократно участвовать в экзоцитозе.
После высвобождения молекулы нейротрансмиттера диффундируют от
мест экзоцитоза к постсинаптическои мембране. Во время диффузии часть
медиатора может подвергаться ферментному разрушению в синаптической
щели или захватываться обратно внутрь нервного окончания.
Постсинаптическои мембраны могут достигать все или только часть молекул ней-
ротрансмиттеров, что обусловливает соответственно большее или меньшее
количество передаваемых через аксосоматический синапс импульсов.
2.5.2.3. Пресинаптическая регуляция экзоцитоза медиаторов
Пресинаптическая регуляция экзоцитоза медиаторов осуществляется с
помощью специфического типа ионного канала, который идентичен
калиевым ионным каналам мембран возбудимых клеток, но открываются
ионами кальция. Такие ионные каналы пресинаптической мембраны
называются кальцийзависимыми калиевыми каналами. Эти ионные каналы
расположены в активных зонах пресинаптической мембраны нервной
терминали в непосредственной близости от кальциевых ионных каналов.
Физиологические свойства подобного типа ионных каналов заключается в том, что
они быстро активируются при увеличении концентрации ионов кальция
на внутренней поверхности пресинаптической мембраны, т. е. в момент
формирования микродомена. При открытии кальцийзависимых калиевых
ионных каналов происходит выход из нервного окончания ионов калия по
концентрационному градиенту. Это локально реполяризует пресинаптиче-
скую мембрану нервной терминали, что ограничивает длительность фазы
деполяризации в тех участках пресинаптической мембраны, где
происходит высвобождение медиатора. В результате уменьшения длительности
фазы деполяризации пресинаптической мембраны нервной терминали
расположенные в ней кальциевые ионные каналы открываются на меньший
отрезок времени. Это ведет к уменьшению количества ионов кальция,
поступающих внутрь нервной терминали, а следовательно, уменьшаются
количество высвобождаемого экзоцитозом медиатора и передача сигналов через
синапс.
Освобождение медиаторов из нервных терминалей изменяется
(модулируется) субстанциями, содержащимися в интерстициальной жидкости,
окружающей терминалы Механизм регуляции экзоцитоза медиаторов из
нервных терминалей осуществляется через рецепторы, локализованные на
пресинаптической мембране. Эти рецепторы (N-холинергические, глюта-
матные, ГАМК-ергические и пуринергические Р2-рецепторы)
ассоциированы с ионными каналами и могут активироваться медиатором, который
выделяется из этого же нервного окончания, либо медиаторами,
высвобождающимися из близлежащих нервных окончаний.
Вещества, которые оказывают модуляторный эффект на передачу
импульсов в синапсах нервной системы, в результате которой увеличивается
или уменьшается частота потенциалов действия постсинаптических
нейронах, называются нейромодуляторами.
78 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
Экзоцитоз ацетилхолина из нервной терминали стимулируется
связыванием выделившегося в этом же синапсе ацетилхолина с N-холинорецепто-
рами пресинаптической мембраны аксосоматического синапса. Глютамат-
ные рецепторы пресинаптической мембраны аксосоматического синапса
(NMDA, агонист N-метил-О-аспартат; АМРА, агонист альфа-амино-3-
гидрокси-5-метил-4-изоксазолпропионовая кислота и каинатные —
агонист каиновая кислота) участвуют в разных синапсах в стимуляции или
торможении экзоцитоза других медиаторов. Например, NMDA-рецепторы
пресинаптической мембраны нервных терминалей, оканчивающихся на
нейронах коры головного мозга, стимулируют процесс экзоцитоза
медиатора ацетилхолина, а в нервных терминалях гиппокампа — медиатора но-
радреналина.
На пресинаптической мембране нервных терминалей нейронов
центральной нервной системы распространен А, тип аденозиновых
рецепторов, которые связываются с нейромодулятором аденозином.
Концентрация аденозина во внеклеточной среде возрастает по мере активации пост-
синаптического нейрона. Функцией типа А! аденозиновых рецепторов
пресинаптической мембраны нервной терминали является уменьшение
экзоцитоза медиаторов (ацетилхолина, дофамина), что снижает
активность постсинаптических нейронов, из которых в окружащую их
внеклеточную жидкость поступает аденозин. Тип А2А-аденозиновых рецепторов
локализован на пресинаптической мембране нейронов тех отделов мозга,
которые регулируют движения человека при участии медиатора дофамина
(хвостатое ядро и подушка таламуса). Активация А2А рецепторов
пресинаптической мембраны стимулирует высвобождение ацетилхолина из
нервных терминалей и вызывает усиление функции постсинаптического
нейрона.
2.5.2.4. Постсинаптический механизм проведения возбуждения
Постсинаптический механизм проведения возбуждения в аксосоматиче-
ском синапсе нервной системы осуществляет передачу нервного импульса
на постсинаптический нейрон {быстрые реакции). Передача нервного
импульса от одного нейрона к другому осуществляется в течение короткого
отрезка времени (мс). Этот процесс на этапе постсинаптического
механизма передачи возбуждения осуществляется при участии ионотропных
рецепторов постсинаптической мембраны аксосоматического синапса. Ионо-
тропные рецепторы представляют собой часть молекулярной структуры хе-
мозависимых ионных каналов (натриевых, калиевых, кальциевых)
постсинаптической мембраны нейронов. Количество ионотропных рецепторов на
постсинаптической мембране нейронов является регулируемой величиной:
оно повышается в ответ на длительное воздействие на мембрану нейрона
малой концентрации молекул медиаторов {явление сенситизации).
Напротив, число рецепторов на постсинаптической мембране понижается в
ответ на длительное воздействие на постсинаптическую мембрану
медиаторов в высокой концентрации {явление десенситизации). Вещества, которые
связываются с рецепторами хемозависимых ионных каналов
постсинаптической мембраны, называются лигандами. Лиганды подразделяются на аго-
нисты и антагонисты. Первые активируют, а вторые блокируют
активность рецепторов хемозависимых ионных каналов постсинаптической
мембраны.
Результатом взаимодействия медиаторов с ионотропными рецепторами
постсинаптической мембраны является ее кратковременная деполяризация
2. Физиология возбудимых тканей • 79
или гиперполяризация постсинаптической мембраны. Деполяризация
постсинаптической мембраны в области одного синапса называется
возбуждающим постсинаптическим потенциалом (ВПСП). Химические
синапсы, в которых при передаче возбуждения возникают ВПСП, называются
возбуждающими. По аналогии медиатор, вызывающий возникновение
ВПСП, называется возбуждающим медиатором. Возникновение ВПСП
обусловлено открытием преимущественно натриевых ионных каналов.
При ВПСП происходит деполяризация постсинаптической мембраны и
уменьшение порога ее возбудимости. Амплитуда ВПСП прямо зависит от
количества молекул медиатора взаимодействующих с рецепторами
постсинаптической мембраны, а также последовательностью выделения квантов
i медиатора из пресинаптического окончания.
Результатом взаимодействия медиаторов с ионотропными рецепторами
хемозависимых ионных каналов постсинаптической мембраны может быть
ее кратковременная гиперполяризация. В результате понижается
возбудимость постсинаптического нейрона и в нем не происходит генерация по-
• тенциала действия. Гиперполяризация постсинаптической мембраны в
области одного синапса называется тормозным постсинаптическим
потенциалом (ТПСП), такие химические синапсы называются тормозными. По
аналогии медиаторы, вызывающие ТПСП, называются тормозными
медиаторами. Взаимодействие тормозного медиатора с рецепторами
постсинаптической мембраны открывает хлорные и калиевые ионные каналы, что
резко повышает ионную проводимость постсинаптической мембраны для
ионов хлора (1а) или калия (1К). В соответствии с электрохимическими
градиентами ионов калия и хлора по обе стороны от постсинаптической
мембраны, ТПСП представляет собой сдвиг потенциала на
постсинаптической мембране в сторону увеличения его величины. В результате
происходит гиперполяризация постсинаптической мембраны и увеличение порога ее
i возбудимости.
При передаче возбуждения через аксосоматические синапсы на
мембране одного нейрона одновременно возникают ВПСП и ТПСП. При этом
происходит сложение (суммация) амплитуды ВПСП и ТПСП многих
синапсов. Если в условиях суммации ВПСП и ТПСП суммарная амплитуда
ВПСП достигает критического уровня деполяризации, то в мембране ак-
сонного холмика нейрона электротонически открываются потенциалзави-
симые натриевые ионные каналы и генерируется потенциал действия. В
\ результате возбуждение передается от нервных терминалей
пресинаптического нейрона на постсинаптический нейрон.
При передаче возбуждения через аксосоматический синапс с
пресинаптического нейрона на постсинаптический происходит синаптическая
задержка скорости проведения электрического импульса. Синаптическая за-
i держка в возбуждающих аксосоматических синапсах представляет собой
время от момента прихода потенциала действия к пресинаптическому
окончанию до начала деполяризации постсинаптической мембраны, т. е.
ВПСП. Время синаптической задержки в возбуждающих синапсах в
среднем составляет 0,5 мс, и оно прямо зависит от скорости процессов экзоци-
тоза медиатора из нервного окончания, диффузии медиатора через синап-
тическую щель к постсинаптической мембране, соединения медиатора с
рецепторами постсинаптической мембраны и последующего увеличения
ионной проницаемости постсинаптической мембраны. Время
синаптической задержки обусловливает функциональную подвижность или
лабильность химического синапса. Лабильность химического синапса ниже, чем
нервного волокна, но выше, чем мышечного.
80 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
2.5.2.5. Функции метаботропных рецепторов постсинаптической мембраны
аксосоматического синапса
На постсинаптической мембране аксосоматических синапсов нервной
системы локализованы хемозависимые метаботропные рецепторы. Функция
хемозависимых метаботропных рецепторов постсинаптической мембраны
состоит в регуляции метаболической активности постсинаптических
нейронов при передаче возбуждения через химический синапс (медленная
реакция). Эта функция метаботропных рецепторов постсинаптической
мембраны обусловлена свойствами нескольких высокомолекулярных семейств
G-белков (Gs, Gi и Gq) либо низкомолекулярных семейств G-белков (ras,
rho, rab и др.), с которыми ассоциированы метаботропные рецепторы
постсинаптической мембраны (рис. 2.20).
Как показано на рис. 2.20, метаботропный рецептор постсинаптической
мембраны находится на стороне молекулы G-белка, обращенной в синап-
тическую щель. Соединение нейротрансмиттера с хемозависимым
метаботропным рецептором постсинаптической мембраны вызывает активацию
G-белков. При этом тример G-белков, состоящий из а-субъединицы,
ассоциированной с Ру-димером, диссоциирует на а-субъединицу и Ру-димер
с последующим образованием комплекса гуанинтрифосфат-Ga и Gpy-ди-
мер. Функция этих двух соединений состоит в активации внутриклеточных
энзимов постсинаптической мембраны, например фосфолипазы А2, фос-
фолипазы С, при участии которых в постсинаптических нейронах
образуются основные внутриклеточные регуляторы их метаболической
активности — вторичные посредники.
Функция вторичных посредников в постсинаптическом нейроне.
Основными вторичными посредниками в постсинаптических нейронах
являются циклический аденозинмонофосфат, инозитол-3-фосфат/диацилглицерол и
ионы кальция. Циклический АМФ образуется в цитоплазме клеток при
участии активированной аденилатциклазы из АТФ. Посредник
диффундирует в пределах постсинаптической клетки, активирует протеинкиназы,
Рис. 2.20. Схема активации G-белка при взамодеиствии лиганда с метаботропным
рецептором постсинаптической мембраны.
Связывание лиганда с рецептором G-белка вызывает диссоциацию G-белка на гуанозинтри-
фосфат, связанный с a-субъединицей, и на ру-димер. a-Субъединица и ру-димер могут
взаимодействовать в клетке с эффекторными молекулами, такими как ионные каналы или
связанные с мембраной энзимы, и изменять их активность.
2. Физиология возбудимых тканей • 81
Рецептор,
связанный с
G-протеином
Ga-белок
Сигнальная
молекула Фосфолипид
^ДАГ
~*ИФЗ
Вторичные
посредники
ИФЗ-воротный
кальциевый
канал
Вторичный ^^
посредник *^^
Реакции клетки
Активация
различных
протеинов
Рис. 2.21. Схема образования вторичных посредников инозитол-3-фосфата/диа-
цилглицерола и ионов кальция при активации системы G-белка сигнальной
молекулой. Инозитол-3-фосфат/диацилглицерол, а также ионы кальция являются
вторичными посредниками сигнальных молекул в возбудимых клетках.
Фс — фосфолипаза С, ИФЗ — инозитол-3-фосфат, ЭР — эндоплазматический ретикулум, Ga-
белок — активированный G-белок, ДАГ — диацилглицерол.
вызывающие фосфорилирование внутриклеточных ферментов, которые
обусловливают метаболический эффект клеток. Системы
внутриклеточных посредников на основе фосфоинозитида включают активацию
энзима фосфолипазы С и образование двух метаболитов: инозитол-3-фосфата
и диацилглицерола (рис. 2.21). Диацилглицерол функционирует в
пределах клеточной мембраны и активирует киназы, открывающие ионные
каналы постсинаптической мембраны нейрона, а инозитол-3-фосфат
взаимодействует с рецепторами кальциевых ионных каналов эндоплазматиче-
ского ретикулума и вызывает выход ионов Са2+ в цитоплазму клеток.
Ионы Са^+ в качестве вторичного посредника активируют в нейронах мозга
процессы нейросекреции, а в возбудимых мышечных клетках — их
сокращение.
Примерно 60 % медикаментов, которые применяются в современной
медицине, оказывают свой терапевтический эффект на клетки, связываясь
с мембранными метаботропными рецепторами, ассоциированными с
системой G-белков.
2.5.3. Проведение возбуждения в основных типах синапсов
центральной нервной системы
В нервных терминалях нейронов центральной и периферической нервной
системы в зависимости от типа нейротрансмиттера, с помощью которого
возбуждение проводится через синапс и/или регулируется метаболическая
активность постсинаптического нейрона, различают холинергический, до-
фаминергический, серотонинергический, гистаминергический, глутаматер-
гический, ГАМКергический и глицинергический синапсы центральной
нервной системы.
}
82 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
2.5.3.1. Холшергический синапс (рис. 2.22)
Ацетилхолин является нейротрансмиттером в нервной системе. Медиатор
синтезируется в нервных окончаниях из ацетил-коэнзима А при участии
фермента ацетилтрансферазы или холинацетилазы. Фермент синтезируется
в теле нейрона и транспортируется аксоплазматическим током в нервные
окончания. Холин накапливается в нервных окончаниях в результате его
захвата из интерстициальной жидкости. При этом количество холина,
захватываемого нервными окончаниями, обусловливает количество
синтезируемого ацетилхолина в нервных окончаниях. Ацетилхолин накапливается
в везикулах нервных окончаний и высвобождается квантами в синаптиче-
скую щель во время генерации потенциалов действия в нервных
окончаниях. Физиологический эффект ацетилхолина на постсинаптический
нейрон является результатом действия нейротрансмиттера на рецепторы пост-
синаптической мембраны. На постсинаптической мембране холинергиче-
ского синапса имеются N- и М-типы (подтипы М,—М4) рецепторов
ацетилхолина. N-тип рецепторов чувствителен к никотину, а М-тип — к мус-
карину, что послужило основанием для обозначения буквами N и М этих
двух типов холинорецепторов постсинаптической мембраны.
Связывание ацетилхолина с ионоторопными N- холинорецепторами
открывает ионные каналы Са2+ и Na+, ионы поступают внутрь клетки,
вызывая быструю деполяризацию (ВПСП) постсинаптической мембраны.
Связывание ацетилхолина с ионотропаными М-холинорецепторами
постсинаптической мембраны открывает кальциевые и калиевые ионные
каналы постсинаптической мембраны через систему вторичных
посредников инозитол-3-фосфата и диацилглицерола (М,-тип рецепторов) и
циклического АМФ (М2-тип рецепторов) соответственно: ионы Са2+
поступают через кальциевые каналы постсинаптической мембраны холинергиче-
ского синапса внутрь нейрона, а ионы К+ выходят из него, вызывая ги-
Мускариновый
Система пресинаптический t<*>**»43»
обратного рецептор \ / ¥.. # '^Ацетилхолин
транспорта +
д
Пресинаптическая
мембрана
Синаптическая
щель
мембрана
Мускариновый
Na Na + постсинаптический
+ ма
постсинаптический Na +
рецептор Na ма+
Никотиновый
постсинап
рецептор
Рис. 2.22. Схематическое изображение холинергического синапса.
На постсинаптической мембране локализованы хемозависимые ионотропные и метаботроп-
ные рецепторы, при участии которых не только возбуждение проводится через синапс
(ионотропные рецепторы), но и может регулироваться метаболическая активность постсинаптиче-
ского нейрона (М-холинорецептор).
2. Физиология возбудимых тканей • 83
перполяризацию мембраны. Эффекты изменения ионной проницаемости
постсинаптической мембраны при участии ацетилхолина, М-холиноре-
цепторов и вторичных посредников во времени являются более
длительными и отставлены, чем при активации ионотропных N-холинорецепто-
ров. Благодаря долговременному механизму действия ацетилхолина на
постсинаптические нейроны, этот нейротрансмиттер участвует в
механизмах памяти и обучения в нейронах гиппокампа и коры больших
полушарий мозга.
2.5.3.2. Адренергический синапс
Адренергический синапс осуществляет передачу возбуждения при участии
медиаторов адреналина или норадреналина как в центральной нервной
системе, так и в периферических тканях. В мозге норадренергические
нейроны, в нервных терминалях которых высвобождается медиатор норадре-
налин, сконцентрированы, в основном, в голубом пятне моста.
Ответвления аксонов этих нейронов встречаются во всех отделах ЦНС и норадре-
налин модулирует активность различных по функции нервных клеток. В
ЦНС и периферических тканях адренергические синапсы функционируют
при участии а (подтипы а„ а2) и р (подтипы (р„ р2 и р3) типов адренерги-
ческих рецепторов.
оц-Адренорецепторы ЦНС (гиппокамп, кора головного мозга) и
периферической нервной системы осуществляют возбуждающую функцию,
увеличивая ионную проницаемость хемозависимых ионотропных
кальциевых каналов.
а2-Адренорецепторы выполняют тормозную роль в ЦНС и
периферической нервной системе. В ЦНС а2-адренорецепторы расположены на
постсинаптической мембране, представляющей собой мембрану нервной тер-
минали, из которых высвобождаются нейротрансмиттеры норадреналин и
серотонин. Торможение высвобождения в нервных терминалях
норадреналина и серотонина при участии а2-адренорецепторов осуществляется путем
модуляции ионной проницаемости кальциевых и калиевых каналов при
участии системы G-белков, аденилатциклазы/цАМФ. Прямое увеличение
проницаемости калиевых ионных каналов мембраны нервной терминали
гиперполяризует пресинаптическую мембрану и тормозит экзоцитоз
медиатора. Это, в свою очередь, уменьшает количество высвобождающегося
медиатора (норадреналина или серотонина) в адренергических или серото-
нинергических синапсах ЦНС, модулируя функцию постсинаптических
нейронов.
В центральной нервной системе представлены р,-адренорецепторы,
которые идентифицированы на мембранах нейронов полосатых тел базаль-
ных ганглиев мозга. Взаимодействие норадреналина с р,-адренорецептора-
ми через систему вторичных посредников (система G-белков, аденилат-
циклаза/цАМФ) ведет к модуляции ионной проницаемости кальциевых и
калиевых ионных каналов постсинаптической мембраны. Активация
системы G-белков непосредственно увеличивает проницаемость кальциевых
ионных каналов и повышает возбудимость и функцию нейронов
полосатых тел.
Наиболее важная функция норадреналина в ЦНС заключается в
регуляции пробуждения в цикле «сон—бодрствование» (совместно с серотони-
нергическими структурами ядер «шва» ствола мозга).
84 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
2.5.3.3. Дофаминергический синапс
Дофаминергический синапс нервной системы осуществляет передачу
возбуждения от нервной терминали на постсинаптический нейрон с помощью
медиатора дофамина. Постсинаптическая мембрана синапсов, в которых
химическим передатчиком возбуждения является медиатор дофамин,
содержит D,—D5 типы рецепторов, каждый из которых связан с системой
внутриклеточных посредников аденилатциклаза — цАМФ (рис. 2.23).
Взаимодействие дофамина с D, рецепторами постсинаптической
мембраны через стимулирующий Gs-белок активирует аденилатциклазу,
которая приводит к повышению уровня цАМФ. Функция вторичного
посредника цАМФ заключается в открытии кальциевых ионных каналов
постсинаптической мембраны. Диффузия ионов кальция внутрь нейрона по их
концентрационному градиенту деполяризует постсинаптическую мембрану
и повышает возбудимость нейрона.
Взаимодействие дофамина с D2 рецепторами постсинаптической
мембраны через тормозящий Gi-белок прямо или опосредованно путем
уменьшения внутриклеточного уровня цАМФ модулирует калиевые ионные
каналы и опосредованно — кальциевые ионные каналы постсинаптической
мембраны, вызывая ее гиперполяризацию и уменьшение возбудимости
нейрона. Например, при активации нейронов дофаминергической системы
мозга дофамин в нейронах передней доли гипофиза уменьшается
содержание внутриклеточных вторичных посредников. Это вызывает уменьшение
внутриклеточной концентрации ионов кальция, что является основным
механизмом ограничения секреции из клеток передней доли гипофиза
гормона пролактина, а следовательно, лактации молока. Блокада D2
рецепторов нейронов мозга специфическимии агонистами используется в медици-
Система
обратного
транспорта
дофамина
D,-DB
^^SUS^ Дофамин
пресинаптические ;|рг <
рецепторы ''""_"'
lit »i. «iiiiiiiiiiiiiiiiiiii.h'ii
II, 11 1 ШП1 ШИВШИ!».".
таз т.
Pi-Рч
постсинаптические
квн'язад
Sim пни!) ниш i
Понижение
проницаемости
кальциевых каналов
G-протеин
©
Повышение
Пресинаптическая
мембрана
Синаптическая
щель
Постсинаптическая
мембрана
проницаемости
калиевых каналов
Рис. 2.23. Схематическое изображение дофаминергического синапса!
Дофамин через метаботропные рецепторы постсинаптической мембраны и систему G-протеи-
нов регулирует активность различных хемозависимых ионных каналов. Дофамин после
взаимодействия с рецепторами постсинаптической мембраны транспортируется в пресинаптиче-
ско окончание. D|—D5 — различные типы дофаминовых рецепторов.
2. Физиология возбудимых тканей • 85
не при лечении шизофрении. Напротив, при нарушении функции дофами-
нергической системы мозга и ограничением синтеза в ее нейронах
медиатора дофамина, в связи с деградацией нейронов «черной субстанции»
среднего мозга, у человека возникают ограничение произвольных
движений и дрожание конечностей в покое (синдром Паркинсона).
Рецепторы к дофамину располагаются на мембране пресинаптического
окончания, из которого выделяется этот нейротрансмиттер. После экзоци-
тоза дофамина в дофаминергическом синапсе его молекулы диффундируют
не только к постсинаптической мембране, но и действует на дофаминовые
рецепторы мембраны пресинаптического окончания. При участии
вторичного посредника цАМФ на пресинаптической мембране дофаминергическо-
го синапса открываются калиевые ионные каналы, что вызывает выход этих
ионов из цитоплазмы нервной терминали в интерстициальную среду. В
результате развивается гиперполяризация пресинаптической мембраны, что
тормозит генерацию потенциалов действия в нервном окончании и снижает
экзоцитоз дофамина из пресинаптической терминали, а следовательно,
уменьшает влияние медиатора на функцию постсинаптического нейрона.
2.5.3.4. Серотонинергический синапс
Серотонин является нейротрансмиттером как для центральной нервной
системы, так и для клеток периферических тканей. На постсинаптической
мембране серотонинергических синапсов нейронов мозга локализовано
семь типов рецепторов к серотонину — 5-НТ,_7. Основными являются
типы 5-НТ,_4. Рецепторы на постсинаптической мембране к серотонину
относятся к ионотропному (5-НТ3) и метаботропному типам (остальные).
Время действия серотонина при передаче возбуждения через
серотонинергический синапс обусловлено обратным захватом медиатора в нервную
терминаль, где серотонин разрушается ферментом моноаминоксидазай.
Подтипы семейства рецепторов 5-НТ, (5-HTIA, 5-HT1B, 5-HT1D, 5-HT1E,
5-НТ,р), ассоциированные с G-белками, широко представлены в нейронах
ЦНС (лимбическая система, лобная кора, базальные ганглии). При
взаимодействии серотонина с 5-НТ, рецепторами при участии аденилатцикла-
зы и вторичного посредника цАМФ повышается проводимость калиевых
ионных каналов постсинаптической мембраны и уменьшается ионная
проницаемость кальциевых каналов. В результате происходит
гиперполяризация постсинаптической мембраны и понижение возбудимости нейронов и
торможение их функции.
Рецепторы 5-НТ2 представлены в периферических тканях и участвуют в
сокращении гладких мышц сосудов, кишечника, мочевыводящих путей,
агрегации тромбоцитов и увеличении проницаемости капилляров.
Действие серотонина на 5-НТ2 тип метаборецепторов постсинаптической
мембраны обусловлено образованием через активацию системы G-белков
внутриклеточного вторичного посредника — инозитол-3-фосфата. Инози-
тол-3-фосфат вызывает открытие кальциевых ионных каналов саркоплаз-
матического ретикулума, что повышает внутриклеточную концентрацию
этих ионов. В результате ионы кальция вызывают мышечное сокращение.
5-НТ3 рецепторы имеются в ядрах продолговатого мозга (ядро
одиночного пучка, ядра тройничного и блуждающего нервов), а также в нейронах
сенсорных и энтеральной нервных систем, на пре- и постганглионарных
нейронах вегетативной нервной системы. Действие серотонина на 5-НТ3
тип рецепторов избирательно повышает проницаемость катионных
каналов (Na+ и Са2+), вызывая деполяризацию постсинаптической мембраны
86 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
нейронов, повышение возбудимости нервных клеток и активацию их
функции. Это приводит к усилению сократительной функции миокарда,
расширению сосудов, стимуляции легочной и интестинальных функций,
возникновению болевых ощущений.
Рецепторы 5-НТ4 распространены в структурах мозга, в которых
основным медиатором является дофамин (базальные ганглии, прилегающее ядро
лимбической системы). Рецепторы локализованы также на пресинаптиче-
ской мембране ГАМКергических интернейронов, в которых они облегчают
высвобождение основного тормозного медиатора центральной нервной
системы гамма-аминомасляной кислоты. Однако в нервных окончаниях
этот же тип рецепторов пресинаптической мембраны холинергических
интернейронов тормозит высвобождение ацетилхолина.
В мозге серотонинергические нейроны концентрируются в участке
среднего мозга, который называется «шов». Аксоны серотонинергических
нейронов ядер «шва» имеют нервные терминали на нейронах переднего
мозга и мозжечка. Функцией этих связей является регуляция цикла «сон-
бодрствование».
2.5.3.5. Глутаматергический синапс
Глутамат является основным возбуждающим нейротрансмиттером в
центральной нервной системе. После выделения из нервного окончания
глутамат действует на ионотропные и метаботропные рецепторы постсинап-
тической мембраны. Ионотропные рецепторы представлены двумя типами:
NMDA- и АМРА-рецепторами (рис. 2.24). Название рецепторов связано с
их способностью связываться с синтетическими аналогами глутамата —
Метаботропный
пресинаптический
глутаматный рецептор
Система
обратного
транспорта
глутамата
Глутамат
Са++ Na+
He-NMDA
Метаботропный
постсинаптический
глутаматный
рецептор
.. + Na+ Na+ +
Na Na
Na
NMDA
Пресинаптическая
мембрана
Синаптическая
щель
Постсинаптическая
В*"КН1-!ШЙ мембрана
Са"
Na+
Са
Рис. 2.24. Схематическое изображение возбуждающего глутаматергического
синапса.
На постсинаптической мембране локализованы хемозависимые NMDA и не-NMDA
ионотропные рецепторы, при участии которых возбуждение проводится через синапс.
Метаболическая активность постсинаптического нейрона регулируется метаботропными рецепторами
постсинаптической мембраны. Медиатор после взаимодействия с рецептором
постсинаптической мембраны транспортируется в пресинаптическое окончание.
2. Физиология возбудимых тканей • 87
ТЧ-метил-Б-аспартатом (NMDA) и альфа-амино-3-метил-изоксазол-про-
пионовой кислотой (АМРА). Оба типа рецепторов, как правило,
расположены на постсинаптической мембране одного нейрона и их основной
функцией является деполяризация постсинаптической мембраны. Глутамат
связывается с АМРА-рецепторами потсинаптической мембраны.
Активация АМРА-рецепторов снимает блокирование ионами Mg2+ NMDA-рецеп-
торов, которые ассоциированы с кальциевым ионным каналом. Это
приводит к открытию кальциевого ионного канала и поддерживает
кальциевый ток через постсинаптическую мембрану в течение нескольких
миллисекунд. Физиологически важной особенностью нейронов, имеющих
NMDA-рецепторы на мембране, является то, что глутаматные синапсы
способны поддерживать повышенную возбудимость нейронов
(долговременная потенциация) в течение длительного времени (дни, недели и
месяцы), что является основой механизмов долговременной памяти.
2.5.3.6. ГАМКергический синапс
Гамма-аминомасляная кислота (ГАМК) является основным тормозным
медиатором в ЦНС. При действии ГАМК на хлорные ионотропные
рецепторы (ГАМКА-тип) постсинаптической мембраны эти каналы открываются
и ионы хлора поступают внутрь нейрона, вызывая гиперполяризацию
постсинаптической мембраны и понижая, таким образом, возбудимость
нейрона. ГАМКБ рецепторы постсинаптической мембраны выполняют
иную функцию. Комплекс ГАМКБ-рецептор функционирует через систему
G-белков, уменьшая концентрацию вторичного посредника цАМФ, что
приводит к снижению кальциевой ионной проводимости и увеличению
калиевой. В результате происходят гиперполяризация постсинаптической
мембраны, снижение возбудимости постсинаптического нейрона и
торможение его функции.
В нейронах мозга ГАМКергические синапсы повсеместно
взаимодействуют с нервными терминалями глутаматергических синапсов, выполняя
функцию торможения экзоцитоза глутамата из нервных окончаний. Это
взаимодействие прекращает возбуждающее действие глутамата на постси-
наптический нейрон, что обеспечивает точность исходящего количества
сигналов, которыми управляются другие нейроны ЦНС.
2.5.3.7. Глицинергический синапс
В мозге глицин является вторым после ГАМК тормозным медиатором.
Глициновые рецепторы локализованы на постсинаптической мембране
нейронов древних отделов мозга — ствол мозга, спинной мозг, сетчатка. В
этих участках ЦНС глицин и ГАМК выделяются из одних и тех же
нервных терминалей. Глицин после экзоцитоза из нервной терминали
взаимодействует (как и ГАМК) с хлорными ионотропными рецепторами
постсинаптической мембраны. В результате открытия хлорных ионных каналов
ионы хлора поступают внутрь постсинаптического нейрона,
гиперполяризуют постсинаптическую мембрану (возникает ТПСП) и, таким образом,
понижают возбудимость нейрона. Глицин понижает возбудимость
постсинаптического нейрона не только за счет генерации ТПСП, но и за счет
уменьшения сопротивления постсинаптической мембраны. Этот эффект
глицина в комплексе с возникновением ТПСП уменьшает амплитуду
ВПСП постсинаптического нейрона ниже порога возбуждения, что
препятствует генерации в нейроне потенциалов действия.
88 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
2.6. Функции мышечной ткани
Мышцы в организме человека представлены двумя группами:
поперечнополосатыми и гладкими. К поперечно-полосатому типу мышц относятся
скелетная и сердечная мышцы (сердце). Функцией скелетных
поперечнополосатых мышц является движение скелета, а в целом — тела человека.
При этом скелетные поперечнополосатые мышцы называются
произвольными, поскольку человек по своей воле может управлять их действиями.
Сокращение сердечной мышцы не может возникать произвольно, т. е. по
воле человека, и в этом отношение сердце, как поперечнополосатая
мышца, представляет исключение.
В гладких мышцах отсутствует поперечно-полосатая исчерченность. Эти
мышцы образуют основную массу стенок внутренних органов
(пищеварительный канал, кровеносные сосуды, внутренние полые органы, выводные
протоки желез внешней секреции и дыхательные пути). Гладкие мышцы
организма человека называются непроизвольными, поскольку человек по
своей воле не способен контролировать их сократительную способность и
функцию.
Скелетная, сердечная и гладкие мышцы имеют как структурные, так и
функциональные различия образующих их мышечных волокон и, в свою
очередь, подразделяются на следующие подтипы.
Скелетные мышцы подразделяются на белые и красные: первые по
функции являются быстро сокращающимися мышцами, а вторые — медленно
сокращающимися. Большинство мышц тела человека являются
смешанными и их функция обусловлена быстрыми и медленными мышечными
волокнами.
Гладкие мышцы подразделяются на два разных по строению и функции
типа: унитарные и мультиунитарные. Первые образованы большим числом
связанных между собой гладкомышечных клеток — так называемыми
плотными контактами , а вторые состоят из отдельных гладкомышечных
волокон. В унитарной гладкой мышце возбуждение отдельного гладкомышеч-
ного волокна способно распространяться на всю мышцу. Напротив, в
мультиунитарной мышце каждое гладкомышечное волокно имеет
собственную иннервацию, через которую управляется сократительная
способность мышцы.
Сердечная мышца подразделяется на сократительные клетки, которые
образуют предсердия и желудочки (миокард), и клетки, которые не
обладают сократительной способностью, способны спонтанно генерировать
электрические импульсы и проводить их к сократительным клеткам сердца.
2.6.1. Скелетная мышца
Скелетная мышца представляет собой комплекс отдельных многоядерных
мышечных клеток или волокон, которые состоят из функциональных
единиц — миофибрилл, осуществляющих механизм сокращения в результате
взаимодействия белковых филаментов миозина и актина. Основной
характеристикой скелетной мышечной ткани является ее способность под
контролем со стороны нервной системы развивать силу сокращения и
укорочение. Степень механического напряжения и укорочения мышцы
обусловлена активацией числа двигательных единиц, образующих целую мышцу.
Двигательной единицей скелетной мышцы называется количество
двигательных (моторных) мышечных волокон, которые иннервируются одним
двигательным нейроном спинного мозга.
2. Физиология возбудимых тканей • 89
Рр
^Сарколемма
ДРНч^Г "Ha7
-СПР
птЯттлгтггштт tfTRirr i rrmrfi
«а *-"||1"|Ог1"т*4" ■■■■■■ ■—' ■
■^
-ДР
Л*
Миозин'
/,
о о о о а « а о
Актин
и
о»о«о
б
Н
~А
i
О'О'О
(ОН О О
0«0 офоО
еоо ооооо
0*0 *ОоО*<
оооооооо
о«о*о*о
0 0 0 во 0
О» 0«0
В
Скелетное мышечное
волокно представляет собой
вытянутую многоядерную
клетку, которая содержит
сократительные элементы,
или миофибриллы. В
каждом мышечном волокне
содержится до 1000 миофиб-
рилл и более, толщиной 1 —
3 мкм. Отдельная миофиб-
рилла состоит, в свою
очередь, из множества толстых
и тонких миофиламентов —
нитей белка миозина и белка
актина соответственно.
Взаимодействие между
толстыми и тонкими миофила-
ментами является
физической основой мышечного
сокращения. Миофиламен-
ты окружены цитоплазмой,
называемой саркоплазмой.
Кроме того, в состав нитей
актина входят белки — тро-
понин и тропомиозин,
которые необходимы для
развития процессов сокращения
и расслабления мышцы.
Каждая миофибрилла
содержит примерно 1500 миози-
новых и около 3000 актино-
вых миофиламентов.
По всей длине
мышечной клетки миофиламенты
миофибриллы разделены на
структурно-функциональные единицы, которые
называются саркомерами
(рис. 2.25). Саркомеры
отделены друг от друга Z-мем-
бранами, к которым прикреплены тонкие актиновые филаменты.
Расположены толстые и тонкие филаменты в саркомере гексамодально, т. е. вокруг
каждого толстого миозинового филамента расположено шесть тонких ак-
тивновых филаментов.
Нити миозина лежат в центре саркомера и выглядят в световом
микроскопе как темная полоска, которая называется анизотропным А-диском.
По обе стороны от А-диска лежат тонкие нити актина, которые в световом
микроскопе образуют светлые изотропные диски. Нити актина, которые
образуют в саркомере два изотропных диска, тянутся до Z-мембран.
Рис. 2.25. Схематическое изображение
саркомера скелетной мышцы.
I. Саркомер является структурно-функциональной
единицей скелетного мышечного волокна, включает в
себя сократительные белки миозин и актин,
расположенные между белковыми Z-мембранами. Саркомер
состоит из анизотропных (А) дисков, в пределах
которых перекрываются между собой тонкие актиновые и
толстые миозиновые филаменты. Изотропные (И)
диски саркомера заключают в себе только филаменты
актина. В средней части анизотропного диска
расположена полоса Н, в пределах которой находятся
филаменты миозина. СПР — саркоплазматический ретику-
лум. Рр и ДР — рианодиновый и дигидропиридино-
вый рецепторы или кальциевые ионные каналы
сарколеммы и СПР соответственно. II —
пространственное гексамодальное расположение актиновых
филаментов в пределах изотропных дисков (а, г) и миози-
новых и актиновых филаментов в пределах
анизотропного диска по обе стороны от полосы Н (б, в).
90 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
2.6.1.1. Функции миофиламентов
Поперечный
мостик —►
миозина
Субъединица С
Субъединица Т
Актин
Тропомиозин
Сократительная способность скелетной мышцы обусловлена функцией
мышечных белков актина и миозина, взаимодействие которых между
собой является основой механизма сокращения скелетной мышцы.
Актиновые филаменты представляют собой двойные белковые спирали
F-актина, каждая из которых образована примерно 200 единицами
(мономерами) глобулярного G-актина. Каждый G-актин состоит из четырех
субдоменов. Два больших субдомена (3-й и 4-й) актина выполняют функцию
связывания между собой белковой спирали F-актина, а два маленьких (1-й
и 2-й), локализованные на периферии глобулярного G-актина, являются
местами взаимодействия каждого мономера G-актина с толстым филамен-
том. Основную роль в
связывании актина с миозином во время
сокращения мышцы выполняет
субдомен 1, содержащий NH2
СООН терминали актина. Этот
субдомен актина выполняет
функцию связывающего центра.
Поэтому каждый глобулярный
G-актин представляет собой
место связывания с миозином при
сокращении мышцы. В
состоянии покоя скелетной мышцы
центры связывания на каждом
глобулярном G-актине закрыты
белками тропонином и тропо-
миозином. Эти белки
функционально связаны между собой и
образуют тропонин-тропомиози-
новый комплекс, который
расположен вдоль всей двойной
белковой спирали F-актина (рис. 2.26).
Тропомиозин представляет
собой молекулу длиной 42 нм,
образованную двумя белковыми ?-
цепями по типу спирали.
Тропомиозин связан электростатически
с актиновым филаментом.
Однако элетростатическая связь между
актиновым филаментом и тропо-
миозином является плотной
только во время расслабления
скелетной мышцы. В
присутствии ионов Са2+ эта связь
становится менее плотной,
тропомиозин становится подвижным и
способен открывать места
связывания на актиновом филаменте
для поперечных мостиков
миозина, что происходит во время
сокращения.
В разных типах мышечной
Субъединица
Поперечный
мостик v
миозина^
Субъединица
Актин
Тропомиозин
Рис. 2.26. Схематическое изображение
пространственного расположения актина,
миозина, тропомиозина и тропонина.
Субъединица С тропонина является мио-
фибриллярной молекулой, при
соединении с которой ионы кальция активируют
механизм актомиозинового
взаимодействия.
А — пространственная организация
сократительных белков в состоянии расслабления
мышцы. Б — организация сократительных
белков после связывания двух ионов кальция с
доменом NH2. После этого тормозная область и
домен СООН субъединицы I тропонина
освобождаются от соединения с актином. Это ведет
к взаимодействию головки поперечного
мостика миозина с актином. Благодаря конформаци-
онным изменениям толстого филамента
развивается усилие, и толстый филамент скользит к
центру саркомера.
2. Физиология возбудимых тканей. • 91
ткани тропомиозин имеет различную подвижность относительно актина.
Например, в скелетной мышце тропомиозин более подвижен, чем в
сердечной мышце, что обусловливает отличие в сократительных свойствах этих
двух типов поперечно-полосатых мышечных тканей. Подвижность тропо-
миозина относительно актинового филамента регулируется тропонином.
Тропонин состоит из трех белковых субъединиц: С, I и Т. Субъединица
С тропонина является своеобразным сенсором для ионов Са2+ в регуляции
сокращения как в скелетной, так и в сердечной мышцах. Тропонин С
имеет две глобулярные области — NH2 и СООН терминали. В скелетном
мышечном волокне каждая из этих концевых областей тропонина С содержит
два возможных места связывания ионов Са2+. Функция субъединицы I
тропонина заключается в связывании тропонина с актином. Субъединица Т
тропонина прочно удерживает вместе тропонин-тропомиозиновыи комплекс
на нитях актина.
В присутствии ионов Са2+ связь тропонина Т и тропомиозина
относительно тонкой нити актина становится подвижной. Это приводит к
открытию мест связывания на актиновом филаменте, с которым способны
связываться поперечные мостики толстого филамента с началом процесса
мышечного сокращения.
Толстый филамент представляет собой биполярный полимер белка
миозина, который способен взаимодействовать с актином и развивать в
результате этого взаимодействия силу и укорочение мышцы.
Двигательный белок миозин состоит из двух тяжелых и четырех легких
полипептидных цепей. Тяжелые полипептидные цепи образуют спираль
миозина. Глобулярные концевые NH2 области называются головками, с
помощью которых происходит взаимодействие между центрами связывания
на актиновом филаменте с миозином во время сокращения мышцы. Одна
пара легких полипептидных цепей связана с каждой головкой. Основа
толстого филамента представлена миозиновым стержнем, который скручен из
множества белковых нитей. Образование миозинового стержня происходит
в период развития мышечной ткани, благодаря функции белка С саркоме-
ра, который является антителом для белка миозина.
В скелетных мышцах от миозинового стержня по его окружности отходят
с равным интервалом в 14,3 нм пары головок поперечных, а расстояние
между головками по одной линии толстого филамента составляет 43 нм. При
этом каждая пара головок на филаменте миозина ориентирована на 180"
относительно другой. Подобная «геометрия» расположения поперечных
мостиков на толстом филаменте обусловливает их взаимодействие с любой из
шести окружающих его тонких филаментов с интервалом в 14,3 нм.
Важным внутриклеточным элементом эластичности мышечных волокон
является высокоэластичный белок титин, который формирует
своеобразную сеть вокруг нитей актина и миозина в пределах каждого саркомера и
придает ему механические свойства как в покое, так и при мышечном
сокращении. Благодаря наличию белка титина в саркомере, в состоянии
покоя сократительные элементы развивают напряжение при растяжении
мышцы.
2.6.1.2. Механизм сокращения скелетной мышцы
Во время укорочения мышцы уменьшается длина саркомеров. При этом
филаменты актина и миозина, входящие в состав саркомеров, не изменяют
своей длины. Уменьшение длины соркомеров происходит в результате
движения (скольжения) тонких филаментов с двух сторон саркомера к его
92 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
центру относительно толстых мио-
зи новых филаментов (рис. 2.27).
Молекулы актина и миозина
способны взаимодействовать между
собой как в условиях in vivo, так и
in vitro. В мышце эта связь миози-
новых головок с актиновым фила-
ментом является циклической и
представляет собой
многочисленные укорочения миозиновых
поперечных мостиков, что
поддерживает постоянство сокращения в
целой активной мышце.
Цикл поперечного мостика во
время сокращения мышцы — это
связывание, укорочение,
высвобождение и вновь связывание
поперечного мостика миозина с
актиновым филаментом, что весьма
напоминает собой человека,
который на руках поднимается вверх
по канату. В саркомере каждый
миозиновый филамент находится
в окружении шести актиновых
филаментов. Миозиновые фила-
менты вращаются во время
взаимодействия с окружающими их
шестью филаментами актина, а их
поперечные мостики связываются
лишь с тремя случайными
тонкими миофиламентами. Согласно
теории скольжения филаментов
мышечного сокращения
поперечные мостики миозина взаимодействуют с актином асинхронно, т. е. одни
находятся «в захвате», в то время как другие «изменяют свой захват».
Миозиновые головки, которые образуют поперечные мостики, расположены
только на концах миозиновых филаментов. Поэтому при максимальном
увеличении длины саркомеров, несмотря на раздражение мышцы,
полностью отсутствует сокращение мышцы.
Активность актомиозиновых мостиков, с помощью которых актиновые
филаменты прикрепляются к миозину, представляет собой процесс, в ходе
которого химическая энергия АТФ превращается в сокращение мышцы.
Каждый отдельный поперечный мостик имеет структурные особенности,
которые вовлечены в сокращение мышцы. Эти особенности включают
двойную головку миозина, которая содержит АТФазную активность
поперечного мостика, и способность связываться плотно с актином, и в то же
время вращается наподобие шарнира относительно стержня поперечного
мостика. В свою очередь стержень поперечного мостика также наподобие
шарнира связан с миозиновым стержнем и обладает эластическими
свойствами, заключающими в себе энергию, необходимую при развитии
напряжения во время вращении головки поперечного мостика.
Поперечные мостики отходят от миозинового стержня таким образом,
что образуют спираль вдоль толстного филамента с интервалом 14,3 нм
^Сарколемма рр
Рис. 2.27. Миозиновые поперечные
мостики связываются с любым из шести ак-
тивновых филаментов, которые
окружают миозиновый филамент. В результате
актомиозинового взаимодействия
происходит «скольжение» активновых
филаментов относительно миозиновых. При
этом длина саркомера уменьшается за
счет сближения Z-мембран без
изменения длины сократительных белковых
филаментов.
СПР — саркоплазматический ретикулум. И,
А — изотропный и анизотропный диски. Рр,
Др — дигидропиридиновый и рианодиновый
рецепторы или кальциевые ионные каналы.
2. Физиология возбудимых тканей • 93
QGOOOOOOOOO
*~~Щ Актин
Д=^Г
Шарнир
ооооооосюоо
Актин
-размыкание» поперечного мостика мио-
Рис. 2.28. Цикл «замыкание—сокращение-
зина.
Стадия 1 — в саркоплазме низкая концентрация ионов кальция (менее 10~7 М), места
связывания на филаменте актина блокированы тропонин-тропомиозиновым комплексом. Стадия 2 —
коцентрация ионов кальция в саркоплазме возрастает до порогового уровня, поперечный
мостик миозина связывается с актином. Связывание ускоряет гидролиз АТФ примерно в 200
раз с образованием АДФ и фосфата (Ф). Стадия 3 — энергия гидролиза АТФ вызывает
движение головки поперечного мостика и одновременно растягивается эластичный компонент
поперечного мостика. Стадия 4 — эластический компонент поперечного мостика укорачивается,
что вызывает перемещение актинового филамента — это является «шагом» укорочения сарко-
мера. Стадия 5 — с головкой поперечного мостика связывается новая молекула АТФ и
поперечный мостик миозина высвобождается от связи с атином. При высокой концентрации
ионов кальция в саркомплазме цикл «замыкание—сокращение—размыкание» будет
неоднократно повторяться, а при удалении ионов кальция в саркоплазматическии ретикулум скорость
гидролиза АТФ резко снижается и тормозится прочное актомиозиновое взаимодействие.
между мостиками. Этот интервал столь мал, что каждой мостик должен
многократно взаимодействовать с актином по мере продвижения вдоль
актинового филамента, чтобы произошло существенное укорочение длины
всей мышцы.
В состоянии покоя поперечный мостик расположен параллельно мио-
зиновому стержню (рис.2.28), а его головка — перпедикулярно
относительно последнего, и не прикреплена к актиновому филаменту (стадия 1).
После того, как ионы Са2+ высвобождаются из саркоплазматического ретику-
лума (описано ниже) и активируют сокращение мышцы, активновый фи-
ламент может связываться с миозиновой головкой (стадия 2). После
связывания головка наклоняется (стадия 3), используя энергию, заключенную
в миозин-АТФазном комплексе головки. Это является основной силой
поперечного мостика, которая растягивает его эластический компонент для
того, чтобы произвести энергию движения вдоль активного филамента
(стадия 4). В результате головка мостика совершает движение на 40° к
центру саркомера и перемещает при этом на 10 нм нить актина, В это время
от головки высвобождаются АДФ и монофосфат, что необходимо для
захвата головкой миозина новой молекулы АТФ. Только после этого головка
94 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
миозина отделяется от молекулы актина, необходимой для размыкания
поперечного мостика с актином (положение 5).
Цикл будет продолжаться до тех пор, пока концентрация ионов Са++ в
межфибриллярном пространстве не снижается до подпороговой величины,
т. е. 10~* М, что приведет к расслаблению мышцы, или пока не будут
исчерпаны запасы АТФ. В последнем случае в мышце возникает спазм или
мышечная контрактура (rigor), при которой в течение нескольких секунд
или минут отсутствует расслабление мышцы. При трупном окоченении
(rigor mortis), возникающем после смерти человека, значительный процент
поперечных мостиков остается в связанном с актиновыми филаментами
положении, что придает мышцам необычно высокую плотность.
Таким образом, функция АТФ проявляется в двух точках процесса
сокращения мышцы. Во-первых, АТФ является источником энергии для
сокращения. Во-вторых, АТФ отсоединяет поперечной мостик для того,
чтобы повторялся цикл поперечных мостиков
«замыкание—сокращение—размыкание».
2.6.1.3. Активация мышечного сокращения
Процесс, при котором потенциалы действия, генерируемые на сарколемме
в области нервно-мышечного синапса, активируют сокращение мышцы,
называется электромеханическим сопряжением (рис. 2.29). Центральным
процессом в электромеханическом сопряжении является взаимодействие
ионов Са2+ с тропонином, когда изменяется положение тропомиозина,
закрывающего места связывания на активном филаменте для поперечных
мостиков миозина.
В состоянии покоя мышечного волокна Са2+-АТФаза саркоплазматиче-
ского ретикулума активно закачивает ионы Са2+ из саркоплазмы в его
цистерны, где большинство ионов находится в обратимо связанном состоянии
с белком кальсеквестрином. В саркоплазме мышечного волокна
концентрация ионов Са2+ снижена до уровня порядка 0,1 мкМ/л или Ю-7 М, при
котором тропонин-тропомиозиновыи комплекс закрывает места связывания
актина с головками поперечных мостиков миозина.
Тем не менее даже при столь низкой концентрации ионов Са2+ в
саркоплазме отдельные места на концевых субдоменах актина могут
осуществлять слабое электростатическое взаимодействие с миозином. В этом случае
имеет место прямое связывание головки миозина с актином. Благодаря
этому в состоянии покоя мышечного волокна тонкие филаменты в сарко-
мере находится не в свободном, а в зафиксированном положении, что
поддерживает упорядоченное пространственное расположение тонких и
толстых миофиламентов между собой в саркомерах мышц.
Для того чтобы вызвать сокращение, потенциал действия мышцы, вы-
зваемый двигательным нервом, распространяется по сарколемме
мышечной клетки и внутрь поперечных трубочек (t-система), открывая
кальциевые ионные каналы мембраны. В фазу деполяризации потенциала
действия сарколеммы в области t-системы открывается L-тип
потенциалзависимых кальциевых ионных каналов, которые, в свою очередь, вызывают
открытие кальциевых ионных каналов саркоплазматического ретикулума.
Это обусловлено тем, что L-тип потенциалзависимых кальциевых ионных
каналов сарколеммы в области t-системы, или дигидропиридиновый
рецептор (агонист—дигидропиридин), прямо структурно связан с рианодиновым
рецептором (агонист — рианодин) или кальциевым ионным каналом
саркоплазматического ретикулума. Функцией структурного взаимодействия этих
2. Физиология возбудимых тканей • 95
Т-трубочка мембраны мышечной клетки
Na+/K+- Na++/Ca++- Дигидропиридиновый
АТФаза обменник рецептор (Са++- канал)
Рис. 2.29. Схема механизма электромеханического сопряжения в скелетных
мышечных клетках во время начала их сокращения.
А. Механизм представляет собой последовательную цепь деполяризации сарколеммы в
области Т-трубочки мышечного волокна, активации дигидропиридинового рецептора и
сопряженного с ним рианодинового рецептора мембраны саркоплазматического ретикулума. Б. В
результате активации обоих ионных каналов концентрация ионов кальция в цитозоле
повышается за счет поступления ионов кальция из внеклеточной среды, а также из
саркоплазматического ретикулума. В. Повышение концентрации ионов кальция в области сократительных
белков и их связывание с субъединицей С тропонина вызывает мышечное сокращение. СПР —
саркоплазматический ретикулум. Рр — рианодиновый рецептор (высвобождающий ионы
кальция канал).
двух рецепторов является открытие кальциевых каналов
саркоплазматического ретикулума и выход ионов Са2+ в саркоплазму. Когда концентрация
ионов Са2+ в межфибриллярном пространстве, т. е. в саркоплазме между
нитями актина и миозина, увеличивается до 10 мкМ/л (10~5 М) и более,
ионы Са2+ начинают связываться с тропонином С. Активация тропонина С
при связывании с ионами Са2+ вызывает смещение тропонин-тропомиози-
нового комплекса примерно на 25° вокруг поверхности актинового фила-
мента и погружение молекул тропомиозина вглубь между белковыми
цепями актина. В результате на актиновых филаментах открываются места
связывания для головок поперечных мостиков миозина и начинается цикл их
сокращения. При этом начинается сокращение всей скелетной мышцы,
которое будет продолжаться до тех пор, пока концентрация ионов Са2+ в
саркоплазме не станет пороговой или сверхпороговой для поддержания
сократительного процесса.
96 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
2.6.1.4. Расслабление скелетной мышцы
Расслабление скелетной мышцы начинается только после того, как
концентрация ионов Са2+ в саркоплазме мышечных клеток снижается ниже
порогового уровня, т. е. ниже 10 мкМ/л, или Ю-5 М. Расслабление мышцы
обусловливают три процесса: 1. Отсоединение (диссоциация) ионов Са2+
от субъединицы С тропонина. 2. Диффузия ионов Са2+ в сторону сарко-
плазматического ретикулума. 3. Активный транспорт ионов Са2+ внутрь
саркоплазматического ретикулума при участии Са2+-АТФазы.
В начальный момент расслабления длина мышцы остается постоянной.
Это происходит из-за того, что первоначально происходит расслабление
саркомеров, находящихся на концах мышц, в то время как центральные
саркомеры остаются укороченными. Это состояние характерно лишь для
начального момента мышечного расслабления, а именно фазы
изометрического расслабления. Процесс расслабления во всех саркомерах усиливается
после того как сила сокращения мышцы уменьшается примерно на 20—
30 %. Это обусловлено тем, что во время расслабления мышцы
уменьшается подвижность тропомиозина по поверхности белковых цепей актина
примерно с той же скоростью, что и сила сокращения. В результате чем
меньше сила сокращения мышцы, тем меньше открыто мест связывания
на актиновых филаментах для поперечных мостиков миозина
2.6.1.5. Типы мышечных сокращений
Скелетные мышцы развивают сокращение под влиянием нервных
импульсов, поступающих от двигательных нейронов, расположенных в передних
рогах спинного мозга. Мышечные волокна, иннервируемые одним
мотонейроном спинного мозга, образуют двигательную единицу. В зависимости
от количества потенциалов действия, которые поступают к двигательным
единицам, в мышце могут возникать несколько типов сокращения:
одиночное мышечное сокращение, тетаническое, изометрическое,
изотоническое и смешанное. Сокращение мышцы в целом является результатом сум-
мации одиночных мышечных сокращений.
Одиночное мышечное сокращение. Сократительный ответ мышечного
волокна или отдельной мышцы на одно раздражение называется одиночным
сокращением (рис. 2.30). Одиночное сокращение имеет латентный период,
фазу развития напряжения, или укорочения, и фазу удлинения, или
расслабления. Длительность каждой фазы зависит от морфофункциональных
свойств мышечных волокон: у быстро сокращающихся волокон глазных
мышц фаза напряжения составляет 7— 10 мс, а у волокон камбаловидной
мышцы — 50—100 мс. Фаза укорочения в одиночном мышечном
сокращении всегда меньше по времени, чем фаза расслабления. Одиночное
мышечное сокращение возникает в том случае, если интервал времени между
последовательными разрядами мотонейронов, вызывающими подобный тип
сокращения, равен или превышает время одиночного сокращения. Так,
волокна глазодвигательных мышц имеют режим одиночного сокращения при
частоте импульсации мотонейрона менее 50 Гц, а волокна камбаловидной
мышцы человека — при частоте менее 10 Гц. В режиме одиночного
сокращения мышца способна работать длительное время без развития утомления.
Тетаническое мышечное сокращение. Тетаническим называется
сокращение мышцы, при котором происходит суммация одиночных мышечных
сокращений в результате ее раздражения частыми (тетаническими)
стимулами. Различают зубчатый и гладкий тетанусы. Зубчатый тетанус возникает
2. Физиология возбудимых тканей • 97
д Латентный Фаза Фаза Б
период укорочения расслабления
Момент
раздражения
мышцы ч
Ill I I I I I I I l l I I l
Время 0,01 с Одиночное сокращение | Время 0,01 с
Зубчатый тетанус
Гладкий тетанус
Раздражение электрическим током
Рис. 2.30. Одиночное и суммированные типы мышечного сокращения.
Одиночное сокращение мышцы (А) подразделяется на латентный период, фазу укорочения и
расслабления. Суммированными типами мышечного сокращения (Б) являются зубчатый и
гладкий тетанусы, которые возникают в результате суперпозиции (наложения) одиночных
мышечных сокращений. Стрелками обозначены моменты нанесения электрического
раздражения.
в том случае, если мышца раздражается серией электрических стимулов с
частотой, при которой каждый из последующих импульсов приходится на
фазу расслабления. При тетаническом сокращении мышцы фаза
напряжения сменяется фазой неполного расслабления в течение всего периода
раздражения. Сила сокращения, развиваемая мышцей при зубчатом тетанусе,
больше, чем при одиночном мышечном сокращении. Гладкий тетанус
возникает в том случае, если нерв или мышцу раздражать серией
электрических импульсов с частотой, при которой каждый последующий импульс
приходится на фазу напряжения. При гладком тетаническом сокращении
мышца не расслабляется и в ней поддерживается постоянное напряжение.
Это происходит в результате суперпозиции или наложения фазы
укорочения мышцы, возникающей в мышце после каждого последующего
раздражения. В результате при гладком тетанусе мышца развивает силу в 2—4
раза больше, чем при одиночном мышечном сокращении.
В разных мышцах сокращение по типу гладкого тетануса возникает при
различной частоте раздражения. Гладкий тетанус быстрой
глазодвигательной мышцы проявляется при частотах свыше 150—200 Гц, а у медленной
камбаловидной мышцы — при частоте около 30 Гц.
Изометрическое сокращение. Если мышца развивает напряжение в
условиях чрезмерной нагрузки, то ее длина не изменяется и такое сокращение
называется изометрическим. Согласно теории скольжения, при
изометрическом мышечном сокращении укорачивается длина саркомеров. Однако
общая длина мышцы не изменяется, поскольку на такую же величину
удлиняется последовательно связанный с сократительными филаментами
эластический компонент мышцы.
Изотоническое сокращение. Если мышца до начала сокращения
отягощена грузом, а масса груза и развиваемое мышцей напряжение во время
сокращения не изменяются, то такое сокращение называется изотоническим.
Во время перемещения тела в пространстве имеет место смешанный, или
А
t тт t
4-6095
98 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
ауксотонический, или анизотонический тип сокращения, при котором
мышца развивает напряжение и укорачивается. Изотонический и
анизотонический типы сокращения лежат в основе динамической работы
локомоторного аппарата человека.
Если внешняя нагрузка на мышцу меньше, чем развиваемое во время
сокращения напряжение, то мышца укорачивается и совершается
движение (концентрический тип сокращения). Если при чрезмерной внешней
нагрузке мышца, напрягаясь, все же растягивается (удлиняется), то такой тип
сокращения называется эксцентрическим.
2.6.1.6. Тип ы скелетных мышечных волокон
Сокращение в одних скелетных мышцах происходит быстро, и такие
мышцы быстро утомляются, а другие мышцы сокращаются медленно и так же
медленно утомляются. Эта физиологическая особенность сократительной
способности мышц зависит от двух типов мышечных волокон,
образующих мышцу: медленно и быстро сокращающихся (рис. 2.31).
Медленные неутомляемые мышечные волокна скелетных мышц, или тип I,
развивают небольшую силу при сокращении, поскольку в них мало мио-
фибрилл. Низкая скорость сокращения этого типа мышечных волокон
обусловлена невысокой активностью миозиновой АТФазы, медленным
выходом ионов кальция из саркоплазматического ретикулума и, наконец, их
медленным связыванием с тропонином. Мышечные волокна медленных
двигательных единиц способны выполнять работу умеренной мощности
длительное время без утомления, если хорошо развита капиллярная сеть и
достаточно количество поступающего к ним 02. Например, мышцы
туловища, обеспечивающие поддержание положения тела в пространстве,
содержат в основном медленные мышечные волокна. Поэтому данные
мышцы могут находиться в состоянии сокращения длительное время,
поддерживая позу и положение тела человека в пространстве.
Быстрые мышечные волокна скелетных мышц (тип II) приспособлены
для выполнения мощной, но кратковременной работы, так как богаты
миофибриллами и имеют высокую скорость сокращения благодаря
активности миозиновой АТФазы. Мышечные волокна этого типа мышц
содержат много гликолитических ферментов (быстро освобождается большое
количество энергии), в них мало митохондрий и миоглобина, они
окружены небольшим количеством капилляров. Например, мышцы рук и ног
имеют в своем составе преимущественно быстрые мышечные волокна, что
обусловливает силу, быстроту и точность движения верхних и нижних
конечностей человека.
У человека быстрые мышечные волокна подразделяют на тип ПА (легко
утомляемые) и ИХ (устойчивые к утомлению). Тип ИХ приспособлен для
выполнения мощной работы, обладает большой аэробной выносливостью
благодаря использованию энергии как аэробных, так и анаэробных
процессов.
Соотношение числа медленных и быстрых двигательных единиц в
одной мышце определено генетически. Например, у человека в
четырехглавой мышце бедра процент медленных волокон варьирует от 40 до 98.
Причем если в мышце больше медленных волокон, то такая мышца
приспособлена к работе на выносливость. Если в составе мышцы выше процент
быстрых волокон, то такая мышца развивает большую скорость и силу
сокращения. При нарастающей работе мышц активируются первоначально
медленные мышечные волокна, а затем быстрые. Это обусловлено тем, что
2. Физиология возбудимых тканей • 99
Рис. 2.31. Двигательные единицы (ДЕ) скелетной мышцы и их типы.
1 — медленные, слабые, неутомляемые мышечные волокна. Низкий порог активации
мотонейрона; 2 — промежуточный тип ДЕ; 3 — быстрые, сильные, быстроутомляемые мышечные
волокна. Высокий порог активации мотонейрона.
медленные неутомляемые мышечные волокна иннервированы
мотонейронами спинного мозга, которые имеют низкие пороги возбуждения и
невысокую, но постоянную на протяжении длительного времени частоту
генерации потенциалов действия (в среднем 6—10 Гц). Повышение силы
сокращения медленных неутомляемых мышечных волокон лишь
незначительно увеличивает частоту генерации потенциалов действия в
мотонейронах этого типа мышечных волокон. Кроме того, нервные терминали
аксонов этих мотонейронов оканчиваются на небольшой группе мышечных
волокон. При силе мышечного сокращения более 20—25 % от максимальной
произвольной силы активируются быстрые мышечные волокна. Это
обусловлено тем, что иннервирующие их мотонейроны спинного мозга имеют
высокий порог возбуждения, их частота генерации потенциалов действия
нарастает по мере увеличения силы сокращения мышечных волокон, но
сохраняется на постоянном уровне не продолжительное время.
Спортивная физическая нагрузка у человека не может изменить один
тип мышечных волокон на другой, а также число медленных и быстрых
мышечных волокон в мышце. В результате физических упражнений
изменяются масса мышечной ткани, а также сила, выносливость и скоростные
качества мышц тела человека.
4'
100 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
2.6.1.7. Физиологические показатели сокращения скелетной мышцы
Основными физиологическими параметрами сокращения скелетных мышц
человека являются сила, скорость развития силы и укорочения мышцы,
мощность и работа
Скорость укорочения скелетной мышцы находится в обратной
зависимости от величины нагрузки. Эта взаимосвязь описывается классическим
уравнением Хилла. Укорочение мышечных волокон обусловливает силу
мышцы во время сокращения. При этом чем больше укорочение мышцы,
тем меньшую она развивает силу. Уменьшение силы мышцы по мере
уменьшения ее длины во время сокращения связано с ростом
концентрации ионов Са2+ в саркоплазме. Чем ближе к максимальной становится
активация ионами Са2+ взаимодействия актина и миозина, тем меньшую
силу развивает мышца при сокращении. Основными причинами снижения
силы мышцы при ее укорочении является увеличение скорости
отсоединения поперечных мостиков от актина. Этот фактор, в свою очередь,
снижает сродство ионов Са2+ с местами связывания на тропонине С и
высвобождает ионы Са2+ из тропонина. В результате снижается активность тропо-
нин-тропомиозинового комплекса и тропомиозин блокирует места
связывания на активновых филаментах для поперечных мостиков миозина. В
результате снижается сила мышцы при сокращении. Скелетная мышца
тела человека способна поднять груз определенной величины. Максимальная
сила, которую мышца развивает при мышечном сокращении в случае, если
она не в состоянии поднять груз, называется абсолютной силой мышцы.
Измеряется абсолютная сила мышцы величиной минимального груза,
который она не способна поднять.
Работа мышц равна произведению силы, развиваемой мышцей, на путь
перемещения груза, либо механическая работа мышц равна произведению
поднятого груза на величину укорочения мышцы. Между величиной
нагрузки мышцы и ее укорочением нет пропорциональной зависимости. При
постепенном увеличении нагрузки мышцы, которая при сокращении
развивает максимальную силу, величина работы мышцы сначала растет, а
затем уменьшается. В основе изменения мышечной работы при увеличении
нагрузки лежат следующие физиологические процессы (рис. 2.32). При
максимальном исходном растяжении мышцы (максимальная длина сарко-
меров) в ней осутствует оптимальное число поперечных мостиков, которые
могут сокращаться (положение 1) и развивать мышечное напряжение. При
постепенном уменьшении исходного растяжения мышцы поперечные
мостики миозина во все большей степени перекрываются с тонкими филамен-
тами актина, что ведет к увеличению укорочения мышцы и росту работы
мышцы (положение 2). Оптимальная скорость укорочения скелетной
мышцы зависит от оптимальной исходной длины саркомеров перед началом
сокращения, которая в среднем составляет 1,7—2,7 мкм. Однако при
минимальной исходной длине саркомеров, когда миозиновые филаменты
занимают всю их длину (положение 3), вновь отсутствует оптимальное число
поперечных мостиков, которые могут сокращаться, развивать мышечное
напряжение, а следовательно, совершать работу.
Величина мышечной работы зависит от количества мышечных волокон
в мышце. При этом чем больше поперечное сечение мышцы с
параллельным расположением мышечных волокон, тем большую она совершает
работу. В мышцах человека не всегда мышечные волокна расположены по
оси мышцы. В мышцах перистого строения, что имеет место в
большинстве случаев расположения мышечных волокон относительно продольной
2. Физиология возбудимых тканей • 101
40 60 80 100 120 140 160
Длина мышцы (%)
Рис. 2.32. Изменение изометрического тетанического напряжения скелетной
мышцы как функция от длины саркомера.
Максимальное напряжение развивается при длине мышцы L0 = 100 %. Затененная полоса
показывает предел изменения длины (от 70 до 130 %), который возможен в организме, если
мышцы связаны со скелетом.
оси мышцы, длина мышечных волокон нередко составляет лишь '/3— 'А
часть всей мышцы. В таких мышцах величина укорочения относительно
мала, но они развивают значительную абсолютную силу и выполняют
большую работу, чем мышцы с параллельным расположением мышечных
волокон. Это обусловлено тем, что в перистых мышцах величина работы
пропорциональна площади сечения, проходящего через все мышечные
волокна, а не через анатомический поперечник мышцы в случае
параллельного расположения мышечных волокон.
Наконец, мощность мышечной работы как физиологический параметр
сокращения мышцы измеряется произведением величины силы мышцы на
скорость укорочения мышцы при сокращении.
2.6.2. Утомление скелетной мышцы
Утомлением называется временное снижение способности мышцы
развивать усилие в результате предшествующей физической активности. При
этом происходит снижение всех физиологических параметров сокращения:
скорости нарастания и снижения силы мышцы, скорости укорочения
мышцы, работы и мощности. Снижение мощности, наряду с другими
параметрами, является наиболее значимым для изменения количественных
параметров способности мышцы выполнять движение. Как показано на
рис. 2.33, во время сокращения скелетной мышцы максимальная
изометрическая сила непрерывно уменьшается (тонкая линия) от начала
сокращения, что отражает процесс утомления мышцы. Мощность мышцы
(толстая линия): после начала сокращения мышцы мощность первоначально
возрастает, а затем уменьшается, если мышца не способна поддерживать
заданную интенсивность работы.
102 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
Сила
сокращения
Мощность
Утомление
Истощение —
Утомление
— Истощение
Сокращение
отсутствует
Скорость
укорочения (м/с"1)
Рис. 2.33. Общие понятия утомления, истощения и прекращения возбуждения
мышцы при изометрическом и динамическом сокращениях.
Максимальную изометрическую силу мышца имеет при нулевой скорости укорочения. При
сокращении максимальная сила мышцы (тонкая линия) снижается в большей степени, чем
скорость ее максимального укорочения, а максимальная мощность мышцы (толстая линия)
снижается в большей степени, чем оба этих параметра. Во время периода сокращения
максимальная изометрическая сила постепенно уменьшается от начала сокращения и динамика
уменьшения силы отражает то, как мышца утомляется. Если мышца активируется, достигнув
точки, ниже которой она не способна больше развивать силу, то ее возбуждение
прекращается.
Человек прекращает физическую работу в результате утомления, как
правило, еще до потери способности мышцы поддерживать сокращение.
Прекращение физической работы может происходить также в результате
дискомфортных или даже болевых ощущений, которые ассоциируются у
человека с утомлением. Эти ощущения возникают у высокотренированных
людей, когда утомление при чрезмерных нагрузках на мышцы является
результатом неспособности метаболических и сократительных процессов
поддерживать мышечное сокращение. У нетренированных людей при
физической нагрузке развитие утомления не является результатом дефицита
метаболических и сократительных процессов.
По механизму возникновения утомления различают центральный и
периферический процессы. Центральное утомление представляет собой
процессы, происходящие во время мышечной работы на различных уровнях
нервной регуляции движения, однако среди причин утомления оно
составляет не более 10 %. При этом показана относительная неутомляемость
нервных волокон при проведении по ним потенциалов действия.
Периферическое утомление обусловлено процессами, происходящими на уровне
нервно-мышечного синапса t-системы мышечных клеток, и ему
принадлежит основная роль в снижении силы, скорости укорочения и
расслабления, а также работы и мощности сокращающихся мышц.
Снижение возбудимости сарколеммы является основной причиной в
механизме периферического утомления. В области t-системы медленных и
быстрых скелетных мышечных волокон локализованы Са2+-АТФаза и Na+/
Са2+-обменник, а также Na+/K+-ATOa3a, энергия которой используется
для осуществления вторично активного транспорта ионов Са2+ через
сарколемму. При мышечной работе в наибольшей степени снижается актив-
2. Физиология возбудимых тканей • 103
ность Na+/K+-Hacoca, что существенным образом уменьшает
сократительные свойства мышечных волокон. Основными факторами, снижающими
активность Na+/K+-Hacoca, являются изменение концентрационного
градиента ионов Na+ и К+ по обе стороны мембраны мышечного волокна в
области t-системы сарколеммы в результате генерации потенциалов
действия на мембране. Так, во время мышечного сокращения увеличивается
внеклеточная и уменьшается внутриклеточная концентрация ионов К+.
Одновременно происходит снижение концентрации ионов Na+ на
внешней поверхности мембраны мышечной клетки и повышение с внутренней
стороны. Это приводит к деполяризации сарколеммы до величины
мембранного потенциала, равной в среднем — 60 мВ. При величине
мембранного потенциала миоцитов порядка — 60 мВ происходит снижение силы
мышечного сокращения более чем на 20 %. Однако наиболее
существенное уменьшение силы мышечного сокращения происходит, когда
мембранный потенциал уменьшается до —60—55 мВ. При этой величине
мембранного потенциала мышечные волокна утрачивают возбудимость и в
мышечных клетках прекращается генерация потенциалов действия, а
следовательно, человек не способен выполнять физическую работу.
Во время физической работы у человека в плазме крови повышается
концентрация адреналина и норадреналина. Эти гормоны стимулируют
работу Na+/K+-Hacoca, который эффективнее восстанавливает нормальную
величину градиентов ионов К+ и Na+ в области t-системы сарколеммы и,
таким образом, препятствует развитию утомления.
В развитии мышечного утомления у человека важное значение
придается роли метаболизма как фактору, лимитирующему сокращение мышц
при физической работе из-за истощения энергетических субстратов и
накопления продуктов метаболизма. Однако при развитии мышечного
утомления реально не обнаруживается недостатка АТФ. Так, в миоцитах даже
при максимальном произвольном мышечном сокращении запасы АТФ не
снижаются до нуля, как это имеет место у человека при мышечной
контрактуре или непосредственно после смерти человека при трупном
окоченении.
2.7. Гладкая мышца
Функции гладкой мышцы связаны с деятельностью внутренних органов
(пищеварительный канал, кровеносные сосуды, внутренние полые органы,
выводные протоки желез внешней секреции и дыхательные пути),
радужной оболочки глаза и кожи. В состав гладкомышечной клетки входят мио-
филаменты актин, миозин и тропомиозин (тропонин отсутствует), однако
нити актина и миозина более тонкие, чем в поперечно-полосатых
мышечных клетках, они имеют несколько отличный химический состав от
последних, саркоплазматический ретикулум слабо развит, а t-система
отсутствует.
Эти факторы обусловливают низкую возбудимость гладкой мускулатуры
по сравнению с поперечно-полосатой, процесс возбуждения в гладкомы-
шечных клетках может продолжаться несколько секунд, они способны
находиться в активном тоническом сокращении без видимого внешнего
процесса укорочения мышцы. Процесс сокращения гладкой мышцы (как и
поперечно-полосатой) зависит от диффузии ионов Са2+ через кальциевые
каналы мембраны гладкомышечных клеток из интерстициальной среды,
которая выполняет роль депо этих ионов. При этом кальциевые ионные
каналы локализованы только в местах погружений мембраны гладкомы-
104 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
шечных клеток, которые называются кавеолами. Эти структурные
особенности мембраны гладкомышечных клеток и интерстициальное депо ионов
Са2+ обусловливают относительно низкую скоростью развития сокращения
и расслабления.
Уникальные сократительные свойства гладкомышечных клеток
обусловлены структурами, которые называются плотными тельцами. Они
образованы ос-актином и представляют собой скопление молекул актина на
концах тонких миофиламентов. Роль плотных телец идентична таковой Z-дис-
ка в саркомерах скелетного мышечного волокна, т. е. они удерживают
нити актина в процессе их скольжения между толстыми филаментами и тем
самым обеспечивают укорочение мышечного волокна. Плотные тельца,
расположенные на мембране гладкомышечных клеток, присоединены к
микрофибриллам, которые выходят за пределы клеток, и соединяются с
коллагеновыми волокнами окружающей соединительной ткани. Таким
образом, отдельные гладкомышечные клетки объединяются в единую
мышцу.
Между актиновыми филаментами, связанными с их плотными
тельцами, разрозненно расположены толстые филаменты, которые в 2,5 раза
толще, чем актиновые филаменты, но составляют примерно '/12 часть от
общего числа нитей актина. Несмотря на то, что в гладкой мышце меньше
миозина, она способна развивать такое же напряжение, как
поперечно-полосатая идентичного поперечного сечения. Это обусловлено тем, что
актиновые филаменты в гладкомышечных клетках длиннее, чем в клетках
скелетной мышцы, и поэтому могут продвигаться на большую длину
относительно миозиновых филаментов.
2.7.1, Типы гладких мышц
Организация гладкой мышцы в пределах органа существенным образом
предопределена выполняемой им функцией. На основании организации
гладкой мышцы в виде единичных глакдкомышечных клеток или пучков
из многочисленных гладкомышечных клеток, они классифицируются на
два типа: унитарные и мультиунитальные.
Унитарная гладкая мышца (рис. 2.34) называется висцеральной, так как
она окружает полые органы — желудок, кишечник, мочевой пузырь — и
некоторые сосуды. Гладкомышечные клетки унитарной мышцы
взаимодействуют между собой с помощью различных молекулярных соединений
(нексусы, десмосомы, щелевые соединения, адгезия), однако
большинство клеток осуществляют межклеточное взаимодействие с помощью
щелевых соединений. Щелевые соединения выполняют две важные функции —
образуют единый гладкомышечный синтиций, в пределах которого
потенциалы действия через эти же контакты передаются от одной клетки к
другой, вызывая сокращение во всей гладкой мышце. Каждое щелевое
соединение состоит из двух белковых гексамеров, соединенных между
собой коннексонами. При этом один гексамер начинается в клетке и
выходит в межклеточное пространство, где соединяется с гексамером
другой клетки. Поэтому изменение потенциала на мембране одной гладко-
мышечной клетки посредством щелевого контакта электротонически
вызывает аналогичное изменение потенциала на мембране другой, что
является основной распространения возбуждения в этом типе гладкой
мышцы.
В унитарной мышце только некоторые гладкомышечные клетки
получают импульсы от нервного волокна и после возбуждения инициируют со-
2. Физиология возбудимых тканей • 105
Варикозные расширения
А нервных волокон
Рис. 2.34. Схематическое изображение структурного взаимодействия
гладкомышечных клеток унитарной мышцы.
Унитарная гладкая мышца представляет собой синцитий гладкомышечных клеток (А),
объединенных между собой плотными контактами (Б). Функцией плотных контактов в унитарной
мышце является распространение медленных волн колебания мембранного потенциала и
потенциалов действия от одной гладкомышечной клетки к другой. Отдельная мышечная клетка,
иннервируемая вегетативным волокном в области варикозного расширения, является пейсме-
кером для рядом расположенных гладкомышечных клеток унитарной мышцы.
кращение в других гладкомышечных клетках. Такие клетки в унитарной
гладкой мышце называются пейсмекерами, или водителями ритма их
сокращения.
Унитарные гладкие мышцы имеют два типа автоматической
активности: ауторитмическую и тоническую. Ауторитмическую, или фазную,
активность имеют клетки пищеварительного тракта, а их ритмичность
возбуждения модулируется нервной активностью. Гладкие мышцы с ауторитми-
ческой активностью способны развивать быстрое, но проходящее (транзи-
торное) сокращение. Гладкие мышцы, имеющие тоническую активность,
способны поддерживать постоянный мышечный тонус на фоне их
частичного укорочения или расслабления. Тоническая активность унитарной
гладкой мышцы поддерживает мышечный тонус сфинктеров
пищеварительного тракта, которые находятся большую часть времени в состоянии
непрерывного сокращения и расслабляются лишь при эвакуации
содержимого из проксимального
отдела кишечника в дис-
тальный, например из
желудка в
двенадцатиперстную кишку.
Мулътиунитарная
гладкая мышца образована
отдельными гладкомышеч-
ными клетками, каждая
из которых иннервирова-
на отдельным нервным
волокном вегетативной
нервной системы.
Поэтому электрическая
активность и сокращение муль-
тиунитарной мышцы
возникают под влиянием
импульсов, поступающих к
Рис. 2.35. Схематическое изображение
гладкомышечных клеток мультиунитарной мышцы.
Мультиунитарная мышца состоит из отдельных
гладкомышечных клеток, каждая из которых иннервируется
нервным волокном. Медиаторы, которые выделяются из
варикозных расширений нервных волоки вызывают
медленные волны деполяризации мембраны клеток, что
инициирует их сокращение.
I
106 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
отдельным гладкомышечным клеткам (рис. 2.35). К такому типу гладких
мышц относятся цилиарная мышца глаза, мышца радужной оболочки,
гладкие мышцы сосудов.
2.7.2. Электрическая активность клеток гладкой мышцы
Мембранный потенциал в гладкомышечных клетках в условиях
физиологической нормы варьирует от —35 до -70 мВ. Подобное колебание величины
мембранного потенциала обусловлено физиологическими условиями
тканей, в которых производится измерение мембранного потенциала.
Например, мембранный потенциал продольных и циркулярных мышечных
клеток миометрия может существенно изменяться под действием гормонов во
время беременности и после родов. Кроме того, потенциал покоя
различается на мембране гладкомышечных клеток, расположенных в разных слоях
гладких мышц одного и того же органа. Например, мембранный
потенциал в гладкомышечных клетках продольного слоя пищеварительного тракта,
как правило, на несколько милливольт меньше, чем циркулярного. Это
обусловливает более высокую возбудимость гладкомышечных клеток
продольного слоя и их сократительные свойства.
Гладкие мышцы сокращаются как при медленных изменениях
величины мембранного потенциала, так и при генерации потенциала действия.
Амплитуда колебаний медленных волн мембранного потенциала составляет
—20—30 мВ. В том случае, если деполяризация мембраны в гладкомы-
шечной клетке достигает критического уровня деполяризации, в них
генерируются единичные импульсы либо серии потенциалов действия,
которые вызывают сокращение гладкой мышцы. В унитарных гладких
мышцах медленные волны колебания величины мембранного потенциала
обусловлены спонтанным изменением проницаемости мембраны ионов
Na+ и Са2+. Медленные волны мембранного потенциала сами по себе не
приводят к генерации потенциалов действия в этом типе гладких мышц.
Возбудимость гладких мышц к каждому типу раздражителей обусловлена
типом гладкой мышцы. Гладкомышечные клетки унитарной гладкой
мышцы генерируют потенциалы действия, которые распространяются по
всей мышце через плотные контакты (продольные гладкие мышечные
клетки пилорического отдела желудка, тощей кишки, пилорической
области уретры, миометрия, полой вены), либо потенциалы действия
генерируются в ответ на возбуждение периферических нервов (продольные
гладкомышечные клетки дна желудка, гладкие мышечные клетки сосудов,
а также трахеи). Поэтому унитарная гладкая мышца реагирует на
раздражение по закону «все или ничего», как поперечно-полосатая мышца.
Серия потенциалов действия, генерируемых в гладкомышечных клетках
унитарной мышцы, поддерживает в ней постоянное сокращение (рис.
2.36, А). Медленные изменения мембранного потенциала ведет к
спонтанным изменениям мембранной проницаемости ионов Na+ и Са2+, что
также вызывает генерацию потенциалов действия, инициирующих
сокращение мышцы (рис. 2.36, Б). В унитарной гладкой мышце медленные
изменения мембранного потенциала сами по себе не вызывают
сокращения. Такой тип активности занимает промежуточное положение между
медленными волнами мембранного потенциала и потенциалом действия,
имеющего плато (рис. 2.36, В). Это плато, которое продолжается около
одной секунды, ведет к тому, вызывает длительное сокращение,
например, в гладких мышцах матки.
Мембрана гладкомышечных клеток унитарных мышц способна деполя-
2. Физиология возбудимых тканей • 107
Мембранный потенциал (мВ)
0-
Напряжение
О
Мембранный потенциал (мВ)
О-
-50-"
Напряжение
О
Мембранный потенциал (мВ)
0-
Нвпряжение
О
Мембранный потенциал (мВ)
0-
-50-1
-W^-
Напряжение
0-
Рис. 2.36. Мембранный потенциал и напряжение гладкой мышцы.
А — генерация потенциалов действия вызывает суммацию сокращения гладкой мышцы. Б —
медленные изменения мембранного потенциала гладкомышечной клетки приводят к
генерации потенциалов действия. В — плато потенциала действия способствует длительному
сокращению гладкомышечного волокна. Г — деполяризация мембраны клеток гладких мышц
сопровождается увеличением напряжения их волокон без генерации потенциалов действия.
ризоваться при ее растяжении. Возникающая при этом деполяризация
может комбинироваться с амплитудой медленных волн деполяризации,
вызывать генерацию серии потенциалов действия и, как следствие, мышечное
сокращение. Подобный тип активности характерен для пищеварительного
тракта при растяжении его стенок пищей.
В мультиунитарных гладких мышцах (образуют стенку многих
кровеносных сосудов), состоящей из отдельных гладкомышечных клеток,
электрическая активность не передается от одной клетки к другой. В
данном типе гладких мышц степень сокращения пропорциональна
степени деполяризации мембраны гладкомышечной клетки даже в отсутствие
генерации потенциалов действия (рис. 2.36, Г). Отсутствие генерации
потенциалов действия в мультиунитарной мышце обусловлено тем, что
клетки имеют незначительный размер (20—200 мкм в длину и 5—10 мкм
в диаметре) и для генерации потенциалов необходимо вызвать
деполяризацию значительного количества клеток (50 и более), прежде чем в
мультиунитарной мышце возникнет распространяющийся потенциал
действия. Отсутствие потенциалов действия в мультиунитарной гладкой
мышце не исключает реакцию гладкомышечных клеток мультиунитарных
мышц на ацетилхолин или норадреналин. Эти нейротрансмиттеры при
связывании с рецепторами мембраны глакдомышечной клетки вызывают
ее локальную деполяризацию, которая распространяется электротониче-
ски на все волокно, вызывая его сокращение. Например, окончания нер-
108 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
вов, иннервирующих радужку, пиломоторные подкожные мышцы, секре-
тируют ацетилхолин или норадреналин, которые вызывают
деполяризацию мембраны гладкомышечных клеток и последующее их быстрое
сокращение.
2.7.3. Нервно-мышечный синапс гладкой мышцы
Унитарные и мультиунитарные типы гладких мышц иннервируются тремя
категориями нервов: нервы вегетативной нервной системы (симатиче-
ские — артерии, и парасимпатические — цилиарная мышца и
пищеварительный тракт); нервы собственных сплетений в пределах гладкой мышцы
(преимущественно пищеварительный тракт); нервы афферентных
чувствительных нейронов, которые рефлекторно активируют гладкие мышцы.
Значение иннервации гладкой мышцы иллюстрируется тем фактом, что
иннервация гладких мышц пищеварительного тракта осуществляется
большим количеством нейронов, чем скелетной мускулатуры.
Нервные волокна распространяются по поверхности мышечного слоя
и образуют при этом не концевые пластинки (как в скелетной мышце), а
многочисленные расширения (варикозы) по ходу нервных волокон. В
среднем варикозы в нервных волокнах, иннервирующих, например,
гладкими мышцами артерий и вен, имеют размеры порядка 2 мкм в длину и
1 мкм в диаметре и встречаются с интервалом 5—10 мкм. В местах вари-
козов нервное волокно не имеет слоя шванновских клеток, и химические
субстанции путем простой диффузии высвобождаются из варикозных
расширений нервных волокон. В варикозах содержится два типа везикул,
наполненных медиаторами. Маленькие плотные везикулы, в которых
содержится ацетилхолин, норадреналин и АТФ, и большие плотные
везикулы, содержащие норадреналин, АТФ и нейропептиды (кальцитонин-ген-
связанный пептид, нейропептид Y и вазоактивный интестинальный
пептид). Ацетилхолин и норадреналин являются медиаторами,
высвобождающимися в гладкой мышце. Возбуждающий и тормозный эффект этих
медиаторов обусловлен типом адрено- и холинорецепторов на мембране
конкретной гладкой мышцы. Процесс высвобождения медиатора
идентичен таковому в нервно-мышечном синапсе, однако такой синапс в
гладкой мышце нередко называется контактным соединением. Так, в муль-
тиунитарной гладкой мышце щель между мембраной гладкомышечной
клетки и нервом очень мал (порядка 20—30 мкм) и в эта мышца имеет
такой же латентный период реакции на действие медиатора, как в
скелетной мышце. В случае, если расстояние для диффузии
высвобождаемого в варикозах медиатора является большим (диффузионный контакт), то
в ответ на возбуждение нерва сокращение гладкой мышцы начинается
через 0,2—30 с.
Рецепторы на мембране гладкой мышцы связываются с субстанциями,
которые циркулируют и крови или образуются локально в самих тканях.
В результате гладкая мышца способна реагировать открытием ионных
каналов в мембране гладкомышечных клеток, что вызывает эффекты
сокращения или расслабления гладких мышц, обусловливающие функции
внутренних органов: моторики и секреции в пищеварительном тракте,
увеличение или уменьшение силы и частоты сокращения сердца, расслабление
или сокращение гладких мышц кровеносных сосудов.
2. Физиология возбудимых тканей • 109
2.7.4. Молекулярный механизм сокращения гладкой мышцы
Сокращение гладкой мышцы активируется так же, как и в скелетной
мышце, увеличением внутриклеточной концентрации ионов кальция. В
гладкомышечных клетках, в которых отсутствует саркоплазматический ре-
тикулум, ионы Са2+ диффундируют через кальциевые ионные каналы из
интерстициальной среды. Деполяризация мембраны гладкомышечных
клеток и/или генерация потенциалов действия открывает потенциалзависи-
мые натриевые и кальциевые ионные каналы, вызывая входящий внутрь
клетки натриевый и кальциевый ток. Большинство ионов Са2+
диффундируют внутрь гладкомышечных клеток в результате открытия потенциалза-
висимых кальциевых ионных каналов саркоплазмы. Открытие каналов
происходит в течение 200—300 мс после деполяризации мембраны,
поэтому в гладкой мышце длительный латентный период начала сокращения
после раздражения гладкой мышцы.
Некоторые гладкомышечные клетки содержат умеренно развитый
саркоплазматический ретикулум, который соприкасается с углублениями, или
кавеолами, сарколеммы (рис. 2.37). В этом случае потенциалы действия
распространяются на мембрану кавеол, что вызывает выход ионов Са2+ из
цистерн саркоплазматического ретикулума и повышение концентрации
этих ионов в цитоплазме гладкомышечных клеток, что инициирует их
сокращение. Высвобождение ионов Са2+ из саркоплазматического
ретикулума гладкомышечных клеток может происходить в результате открытия
кальциевых ионных каналов при участии системы G-белков, фосфолипазы
С и вторичных посредников (инозитол-3-фосфата). В этом случае концен-
Плотное тельце
Мембрана клетки
Тонкие
филаменты
Кальциевый
канал
Саркоплазматический
ретикулум
Са- N*a+/Ca
od обменник
Са +-АТФаза
Кальциевый канал
Рис. 2.37. Схематическое изображение кавеолы мембраны гладкомышечной клетки.
В гладкомышечных клетках, в которых саркоплазматический ретикулум слабо
развит и представлен лишь небольшими трубочками, мембрана образует
специфические углубления, или кавеолы. Кавеолы наряду с небольшими размерами
гладкомышечных клеток уменьшают расстояние диффузии ионов кальция из внеклеточного
депо до сократительных филаментов, что связано с относительно медленной
скоростью процессов сокращения и расслабления гладкой мышцы.
В мембране кавеол имеются потенциалзависимые кальциевые ионные каналы (Пк), хемозави-
симые ионные каналы, через которые ионы кальция поступают внутрь гладкомышечных
клеток и вызывают их сокращение. Ионы кальция из саркоплазмы гладкомышечных клеток с
помощью вторично активного транспорта выводятся в интерстициальную среду, что
сопровождается расслабление гладкой мышцы. ИФЗ — инозитол-3-фосфат, Ац — ацетилхолин, М — хо-
линорецептор.
?
ПО • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
трация ионов Са2+ в саркоплазме увеличивается без увеличения
проницаемости этих ионов через клеточную мембрану, что также сопровождается
сокращением гладкой мышцы.
В условиях покоя в цитоплазме гладкомышечных клеток концентрация
ионов кальция в среднем составляет незначительную величину — 100—
150 нМ/л. В покое концентрация ионов кальция в саркоплазме
гладкомышечных клеток зависит от ионного состава цитозольной и внеклеточной
сред, температуры тканей. Так, в цитозоле гладких мышц сосудов
концентрация ионов кальция равна в среднем 79 нМ/л, а в сердечных — 155 нМ/л.
Напротив, минимальная концентрация ионов кальция в цитозоле гладких
мышечных клеток, при которой начинается мышечное сокращение, в
среднем составляет 200 нМ/л, а максимальное сокращение гладкие
мышцы развивают при концентрации в саркоплазме ионов Са2+ 0,8—1,0 мкМ/л.
В зависимости от указанных концентраций ионов кальция в цитозоле
прямо пропорционально изменяется сила сокращения гладкомышечных
клеток. При этом в гладких мышцах увеличение концентрации ионов Са2+
может происходить под действием различных факторов (растяжение
мембраны, спонтанная электрическая активность, действие нейротрансмиттеров,
гормонов).
В гладкомышечных клетках отсутствует белок тропонин, с которым в
скелетных мышечных клетках связываются ионы Са2+, инициируя их
сокращение. В гладких мышцах функцию, аналогичную тропонину,
выполняет белок кальмодулж. После повышения концентрации ионов Са2+ в
саркоплазме гладкомышечных клеток выше пороговой величины они
связываются с белком кальмодулином, и комплекс «ионы Са2+—кальмодулин»
активирует фермент миозиновую киназу, который фосфорилирует одну из
легких цепей головок миозина. После этого головки поперечных мостиков
миозина приобретают способность циклически связываться с актином по
типу «замыкание—сокращение—размыкание» (как в скелетной мышце).
АТФ является источником энергии для актомиозинового взаимодействия в
гладкой мышце и необходима для отсоединения поперечных мостиков
миозина от актинового филамента. Это обусловливает повторение цикла
поперечных мостиков «замыкание—сокращение—размыкание».
Гладкая мышца в отличие от поперечно-полосатой имеет значительно
больший латентный период в связи с медленной диффузией ионов Са2+
через мембрану гладкомышечных клеток из интерстициальной среды.
Поэтому после распространения потенциалов действия по сарколемме
гладкомышечных клеток они начинают сокращаться через 50—100 мс.
Максимум сокращения достигается примерно через 500 мс после его начала, а
затем в течение 1—2 с в гладких мышечных клетках медленно
уменьшается сила сокращения, и они полностью расслабляются через 1—3 с. В
разных группах гладких мышц период сокращения гладких мышц может
варьировать от 0,2 до 30 с, например в гладкой мышце матки. Медленное
начало и окончание мышечного сокращения в гладких мышцах
обусловлено низкой скоростью работы цикла «замыкание—размыкание»
поперечных мостиков и низкой скоростью процесса электромеханического
сопряжения. Кроме того, цикл «замыкание—сокращение—размыкание»
поперечных мостиков миозина в гладких мышечных клетках совершается с
частотой примерно в 10—300 раз меньшей, чем в скелетной мышце.
Наконец, поперечные мостики миозина могут находиться длительное время
в замкнутом состоянии с нитями актина, что обусловлено низкой АТФаз-
ной активностью головок поперечных мостиков миозина, медленным
гидролизом АТФ.
2. Физиология возбудимых тканей • 111
В гладкой мышце взаимодействие сократительных филаментов актина и
миозина имеет свою физиологическую особенность. Это проявляется в
том, что в гладкой мышце после развития максимального напряжения
происходит снижение степени активации сократительного аппарата,
которое проявляется в замедлении процесса размыкания в циклической работе
поперечных мостиков миозина. Подобный феномен получил название
механизма «замка». Механизм «замка» дает возможность гладкой мышце не
снижая силу сокращения, осуществлять процесс сокращения при низких
энергетических затратах. Функциональное значение механизма «замка»
заключается в поддержании длительного, на протяжении многих часов,
тонического сокращения гладкой мышцы, как при минимальных затратах
энергии, так и при незначительной активности нервов, иннервирующих
гладкомышечные клетки. Низкий расход АТФ в процессе сокращения
гладкомышечных клеток обусловлен тем, что миозиновых филаментов
примерно в 15 раз меньше, чем тонких актиновых нитей. Поэтому
скорость сокращения волокон гладких мышц и скорость расщепления в них
АТФ в 100—1000 раз меньше, чем в скелетных мышцах. Считается, что для
развития одного и того же по величине напряжения гладкой мышце
требуется от '/,о до '/зоо части энергии скелетной мышцы. Это обусловлено
низкой скоростью работы поперечных мостиков в цикле
«замыкание—размыкание», на один цикл которого независимо от его длительности
расходуется энергия одной молекулы АТФ. Этот механизм сокращения гладкой
мышцы чрезвычайно экономичен для энергетики организма, поскольку в
организме человека гладкие мышцы кишечника, мочевого пузыря и других
полых органов находятся в практически постоянном тоническом
сокращении.
2.7.5. Молекулярный механизм расслабления гладкой мышцы
Расслабление гладкомышечных клеток осуществляется при участии
фермента — миозиновой фосфатазы, от концентрации которой в саркоплазме
зависит скорость расслабления гладкой мышцы. Прекращение генерации
потенциалов действия на мембране гладкомышечной клетки вызывает
снижение концентрации ионов Са2+ в ее саркоплазме ниже порогового
уровня путем активного транспорта ионов кальция в саркоплазматический
ретикулум при участии Са2+-АТФазы и выведения ионов кальция из цито-
золя через сарколемму с помощью Са2+-АТФазы, а также путем
облегченной диффузии при участии Ма+/Са2+-обменника. При низкой
концентрации ионов Са2+ в цитозоле фермент миозиновая фосфатаза дефосфорили-
рует легкую белковую цепь головки поперечного мостика миозина; в
результате прекращается цикл «замыкание—размыкание» и гладкая мышца
расслабляется до исходной длины мышечных волокон.
2.7.6. Физиологические параметры сокращения гладкой мышцы
По аналогии с поперечно-полосатой мышцей, основными
физиологическими параметрами сокращения скелетных мышц человека являются сила,
скорость развития силы и укорочения мышцы, мощность и работа гладкой
мышцы.
При сокращении гладкая мышцы развивает максимальную силу,
которая нередко больше (4—6 кг/см2), чем сила сокращения скелетной мышцы
(2—3 кг/см2). Гладкая мышца способна укорачиваться во время
сокращения на 2/3 ее максимальной длины (скелетная мышца — не более 1/г—'/4
112 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
Кавеола
Плотные тельца i
Актиновые
филаменты
Рис. 2.38. Особенности сократительных свойств гладкой мышцы. Гладкая мышца
может укорачиваться до меньших размеров относительно ее исходной длины, чем
скелетная мышца. Это обусловлено тем, что из-за разной длины актиновых фила-
ментов они могут продвигаться на большее расстояние относительно миозиновых
филаментов, чем в скелетной мышце. Благодаря этому свойству гладкая мышца
сфинктеров пищеварительного канала способна полностью «перекрывать» просвет
пищеварительной трубки.
А — исходная длина гладкомышечной клетки при расслаблении, Б — длина глакдомышечной
клетки существенно уменьшается при ее сокращении. СПР — саркоплазматический ретику-
лум.
своей длины). Эта особенность гладких мышечных клеток делает
возможным гладкомышечным висцеральным органам изменять свой диаметр в
широком диапазоне. Объясняется это свойство тем, что в гладкомышной
клетке актиновые филаменты имеют разную длину. Поэтому во время
сокращения актиновые и миозиновые филаменты имеют оптимальную длину
перекрывания, несмотря на изменение длины мышцы. Кроме того,
широкий диапазон изменения диаметра висцеральных органов обусловлен тем,
что актиновые филаменты в гладкомышечных клетках длиннее, чем в
клетках скелетной мышцы, и поэтому могут продвигаться на большую
длину относительно миозиновых филаментов (рис. 2.38). Гладкие мышцы
полых висцеральных органов способны восстанавливать в течение
нескольких секунд или минут начальную силу своего сокращения после
укорочения или, наоборот, растяжения мышечных волокон. Это обусловлено
наличием феномена в полых висцеральных органах так называемой
стресс-релаксации. Суть феномена стресс-релаксации состоит в том, что
механизм «замка» первочально препятствует растяжению стенки полых
висцеральных органов. Затем в гладкомышечных волокнах совершается
новый цикл «размыкание—замыкание» поперечных мостиков миозина с
нитями актина. В результате длина гладкой мышцы может непрерывно
изменяться, а напряжение стенки полых висцеральных органов остается
постоянным. Благодаря этому феномену внутри них давление сохраняется на
постоянном значении, несмотря на изменение их объема.
Например, увеличение объема жидкости в мочевом пузыре вызывает
2. Физиология возбудимых тканей • 113
растяжение его стенок и повышает внутрипузырное давление. В среднем
через 15—60 с путем стресс-релаксации происходит увеличение длины
гладкомышечных клеток и давление внутри мочевого пузыря
восстанавливается до начального уровня.
2.8. Функции мышечных клеток сердца
Клетки сердечной мышцы подразделяется на сократительные кардиомиоци-
ты, которые образуют предсердия и желудочки (миокард), и клетки
синусного узла и проводящей системы сердца, которые генерируют и проводят
электрические импульсы в сердце к кардиомиоцитам и не обладают
сократительной способностью.
Мембрана кардиомиоцита
Рис. 2.39. Электромеханическое сопряжение в кардиомиоците. Плотность ионных
каналов в мембране t-трубочек кардиомиоцитов выше, чем в других участках
сарколеммы.
Дигидропиридиновый рецептор сарколеммы и рианодиновый рецептор мембраны саркоплаз-
матического ретикулума представляют собой кальциевые ионные каналы и непосредственно
связаны между собой кальмодулином (СаМ). Деполяризация сарколеммы t-трубочек вызывает
последовательное открытие потенциалзависимых кальциевых ионных каналов сарколеммы и
при участии кальмодулина — саркоплазматического ретикулума. Открытие ионных каналов
ретикулума вызывает выход ионов Са2+ в саркоплазму, что является триггером механизма
сокращения кардиомиоцитов.
114 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
Сердечная мышца является поперечно-полосатой, однако ее
сократительная способность, в отличие от скелетной мышцы, характеризуется
синхронностью сокращения и расслабления всего миокарда. Синхронность
сокращения и расслабления сердечных мышечных клеток обусловлена
наличием специализированных плотных контактов между ними, или так
называемых нексусов. Плотный контакт представляет собой участок
мембраны двух кардиомиоцитов, в пределах которого мембраны прилегающих
кардиомиоцитов сливаются между собой, эти плотные контакты является
местом низкого электрического сопротивления между клетками и
представляют, таким образом, путь электротонического распространения
потенциала действия от одного кардиомиоцита к другому. Эта структурная
особенность сердечной мышцы способствует быстрому распространению
электрической активности, т. е. потенциала действия в миокарде. Понятие
функциональный синцитий обычно относят к сердечной мышце, чтобы
показать, что сердце является единым в функциональном отношении
органом в результате взаимодействия отдельных сердечных мышечных клеток.
Кардиомиоциты объединены в функциональный синцитий благодаря
низкому сопротивлению нексусов, с помощью которых осуществляются
контакт между миоцитами и передача потенциала действия от одного миоцита
к другому. В результате потенциал действия из центра синоатриального
узла достигает всех сердечных мышечных клеток, вызывая сокращение
предсердий и желудочков
Кардиомиоциты имеют как сходные черты в своем строении со
скелетными мышечными клетками, так и отличия. Взаимное расположение фи-
ламентов актина и миозина в саркомерах придает поперечную исчерчен-
ность сердечным мышечным клеткам. Рядом расположенные миоциты
отделены друг от друга на их концах вставочными дисками. Диски являются
местом проведения потенциала действия в сердечной мышце. Сердечная
мышечная клетка содержит одно ядро; t-система ее сарколеммы примерно
в два раза шире, чем в скелетном мышечном волокне, и t-трубочки
локализованы ближе к Z-линии саркомеров, саркоплазматический ретикулум
контактирует с t-системой и с сарколеммой (рис. 2.39).
Саркоплазматический ретикулум представляет собой замкнутую систему трубочек,
ветвящихся в пределах кардиомиоцита и содержащих ионы кальция.
Саркоплазматический ретикулум кардиомиоцитов, как депо ионов Са2+, играет
основную роль сопряжения процессов возбуждения и сокращения в
сердечной мышце.
2.8.1. Электрическая активность клеток сердечной мышцы
2.8.1.1. Потенциал покоя
Потенциал покоя в разных типах сердечных мышечных клеток изменяется
в пределах от —60 до —90 мВ: он меньше в атипических клетках
проводящей возбуждение системы сердца и больше в сократительных сердечных
клетках предсердий и желудочков. Механизм происхождения мембранного
потенциала покоя в сердечных мышечных клетках является таким же, как
и для всех клеток организма, и зависит от высокой внутриклеточной и
низкой внеклеточной концентрации ионов калия, а также низкой
проницаемости саркоплазмы для ионов натрия. Мембранный потенциал
сердечных мышечных клеток приближается к равновесному калиевому
потенциалу (Ej<). Однако потенциал покоя большинства кардиомиоцитов равен —80
мВ. Мышечные клетки синоатриального узла и клетки проводящей систе-
2. Физиология возбудимых тканей • 115
мы сердца имеют меньший, чем кардиомиоциты мембранный потенциал,
амплитуда которого находится в пределах —60—70 мВ. Поэтому клетки си-
ноатриального узла имеют более низкий порог возбудимости, чем
кардиомиоциты, что обусловлено так называемыми внутренними свойствами
мембраны синоатриальных клеток.
Электрогенный Na+/K+-Hacoc в кардиомиоцитах участвует в
формировании 5—10 % нормальной величины потенциала покоя на мембране
клеток сердца, что составляет в среднем —10—11 мВ. Это обусловлено тем,
что плотность Na+/K+-ATOa3bi в области t-трубочек мембраны кардиомио-
цитов выше, чем в других участках их сарколеммы. В отличие от
скелетных мышечных клеток, в кардиомиоцитах физиологическая роль Na+/K+-
насоса является ведущей в поддержании постоянной величины потенциала
покоя на мембранах клеток и, следовательно, физиологического уровня их
возбудимости. Данное обстоятельноство обусловлено тем, что инактивация
натриевых (а также кальциевых) ионных каналов и их способность
участвовать в генерации потенциала действия в сердечных мышечных клетках
зависит от величины максимального потенциала покоя сердечных клеток в
диастолу. В клетках сердца одной из важных функций Na+/K+-Hacoca
является создание максимальной величины потенциала на мембране
сердечных мышечных клеток в диастолу, что исключает колебания потенциала
покоя кардиомиоцитов и формирует у клеток постоянный исходный
уровень возбудимости.
2.8.1.2. Молекулярный механизм потенциала действия в типичных сердечных
мышечных клетках
Потенциал действия кардиомиоцитов имеет большую продолжительность:
до 200 мс в миоцитах предсердий, до 400 мс в клетках желудочков сердца.
Потенциал действия кардиомиоцитов состоит из фазы деполяризации,
фазы плато и фазы реполяризации (рис. 2.40). Изменение мембранного
потенциала сердечных мышечных клеток во время генерации в них
потенциала действия обусловлено трансмембранными токами ионов Na+, Ca2+
иК+.
Фаза деполяризации потенциала действия в кардиомиоците. Потенциал
действия на мембране кардиомиоцита возникает под влиянием
возбуждения атипичных мышечных клеток проводящей системы сердца. При этом
потенциал действия распространяется по проводящей системе сердца до
волокон Пуркинье. Между мембранами волокон Пуркинье и кардиомио-
цитами имеются плотные вставочные диски, или нексусы. Реверсия
потенциала на мембране волокон Пуркинье электротонически при участии
вставочных дисков вызывает деполяризацию мембранного потенциала
кардиомиоцита до порога возбуждения (Ек), который для кардиомиоцитов
составляет —60 мВ. С этого момента по закону «все или ничего» в мембране
кардиомиоцитов открываются быстрые потенциалзависимые натриевые
ионные каналы. Ионы натрия через открытые каналы по
концентрационному градиенту устремляются внутрь кардиомиоцита, сдвигая его
мембранный потенциал в сторону равновесного натриевого потенциала (Е^а
составляет +70 мВ) и происходит перезарядка мембраны сердечных
сократительных клеток. Деполяризация сердечных мышечных клеток
развивается чрезвычайно быстро, и на мембране кардиомиоцитов за 2 мс потенциал
достигает +30 мВ. В фазу деполяризации при открытых быстрых
натриевых ионных каналах мембраны кардиомиоциты утрачивают свою
возбудимость (абсолютная рефрактерность), и сократительные клетки миокарда не
116 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
Мембранный
потенциал (мВ)
+50
Деполяризация
Реполяризация
Кардиомиоцит
200
400
Время (мс)
600
800
Рис. 2.40. Потенциал действия кардиомиоцтита. В происхождении потенциала
действия кардиомиоцита участвуют натриевые, кальциевые и калиевые ионные токи.
В фазу деполяризации (1) открываются потенциалзависимые натриевые каналы и
мембранный потенциал резко уменьшается за счет входящего натриевого тока. Натриевые каналы
через несколько миллисекунд закрываются и открываются потенциалзависимые калиевые
ионные каналы, что вызывает начало реполяризации мембраны кардиомиоцита (2). Поскольку
под влиянием деполяризации открываются потенциалзависимые кальциевые ионные каналы,
то входящий кальциевый ток в фазу реполяризации уравновешивает выходящий калиевый ток
и возникает фаза плато (3). После закрытия кальциевых ионных каналов выходящий
калиевый ток реполяризует (4) мембранный потенциал до исходного уровня (Em).
способны реагировать даже на сверхпороговое раздражение.
Деполяризация в сердечных мышечных клетках прекращается под влиянием двух
процессов: 1) быстрые натриевые каналы закрываются через несколько
миллисекунд после открытия; 2) открываются потенциалзависимые калиевые
ионные каналы. В результате на мембране кардиомиоцитов начинает
доминировать калиевый ток (1к). Оба фактора — закрытие быстрых
натриевых ионных каналов и открытие калиевых каналов — вызывают
уменьшение положительного потенциала на мембране кардиомиоцитов, и
начинается фаза реполяризации мембранного потенциала. В кардиомиоцитах в
отличие от скелетных мышечных клеток фаза реполяризации имеет
отличительную особенность — она прерывается фазой плато потенциала
действия, длительность которой обусловливает общее время периода
абсолютной рефрактерности сердечной мышцы.
Фаза плато потенциала действия в кардиомиоцитах является
уникальной особенностью потенциала действия кардиомиоцитов. Фаза плато
потенциала действия в кардиомиоцитах представляет собой задержку
процесса реполяризации положительного потенциала, обусловленную
появлением в этот момент генерации потенциала действия кардиомиоцита
входящего кальциевого тока. Основной причиной возникновения входящего
кальциевого тока является деполяризация потенциала на мембране сердечных
сократительных клеток. Деполяризация потенциала на мембране
кардиомиоцитов открывает L-тип потенциалзависимых кальциевых ионных
каналов. В результате в мембране клеток увеличивается проницаемость для ио-
2. Физиология возбудимых тканей • 117
нов Са2+, которые по концентрационному градиенту входят внутрь кардио-
миоцитов. Кальциевые ионные каналы в мембране кардиомиоцитов
остаются открытыми в среднем 200 мс (варьирует от 150 до 400 мс) и, таким
образом, обусловливают длительность фазы плато. Мембранный
потенциал в фазу плато сохраняется на относительно постоянной величине,
поскольку входящий кальциевый ток уравновешивается выходящим
калиевым. Время фазы плато обусловливает продолжительность периода
абсолютной рефрактерности сердечной мышцы, которая у человека является
невозбудимой структурой на протяжении порядка 270 мс. Кардиомиоциты
имеют абсолютную рефрактерность на протяжении почти всей систолы
(0,3 с). Это создает идеальные физиологические условия для проявления
сократительных свойств всей сердечной мышцы, которая в этих условиях
сокращается по типу одиночного мышечного сокращения и осуществляет,
таким образом, выброс крови в аорту и легочные артерии из желудочков
сердца.
Фаза реполяризации потенциала действия в кардиомиоцитах. Фаза плато
оканчивается в результате закрытия кальциевых ионных каналов и
увеличения калиевого тока. Поэтому выходящий калиевый ток (1К) снижает
потенциал на мембране кардиомиоцитов в течение порядка 50 мс до — 90 мВ.
В фазу реполяризации в кардиомиоцитах уменьшается количество инакти-
вированных натриевых ионных каналов и они способны реагировать на
сверхпороговые раздражения. Это состояние сердечной мышцы называется
относительной рефрактерностью. Когда потенциал на мембране
кардиомиоцитов уменьшается до своей исходной величины, закрываются потен-
циалзависимые калиевые ионные каналы, а натриевые потенциалзависи-
мые ионные каналы переходят в закрытое состояние. С этого момента
кардиомиоциты имеют исходный уровень возбудимости и способны
реагировать на очередной импульс, исходящий от клеток проводящей системы
сердца.
2.8.1.3. Механизм возникновения пейсмекерной активности в клетках
синоатриального узла
Частота сокращения сердечных мышечных клеток предсердий и
желудочков сердца обусловлена частотой генерации потенциалов действия
клетками синусного узла. Синоатриальный узел расположен в задней стенке
правого предсердия в месте его соединения с верхней полой веной и состоит
из небольших сердечных мышечных клеток, которые не способны
сокращаться.
Пейсмекерные потенциалы. Мембранный потенциал клеток
синоатриального узла равен примерно —60 мВ. В интервале времени между генерацией
потенциалов действия (в фазу диастолы сердца) мембранный потенциал
синоартриальных мышечных клеток постепенно уменьшается до
критического уровня деполяризации (порядка —40 мВ). Медленная деполяризация
мембранного потенциала синоатриальных мышечных клеток, поскольку
она совершается в фазу диастолы сердца, называется спонтанной диастоли-
ческой деполяризацией и заканчивается генерацией пейсмекерного
потенциала при достижении критического уровня деполяризации этих клеток
(рис. 2.41).
Механизм возникновения пейсмекерного потенциала в синоатриальных
мышечных клетках связан с ролью натриевого, калиевого и кальциевого
ионных токов. Два ионных тока (INa+ и 1Са2+) направлены внутрь клеток
синоатриального узла и вызывают деполяризацию их мембраны. Наибольшее
118 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
Мембранный
потенциал (мВ)
+50
Клетка
синусного узла
-100-
♦ i * l T i iCa'T!Ca
Na+ Na+ Na+
200
400
Время (мс)
600
800
Рис. 2.41. Основные ионные токи калия, натрия и кальция, участвующие в
генерации пейсмекерного потенциала и потенциала действия клеток синоатриального
узла.
Внутренним свойством мембраны пейсмекерных клеток синоатриального узла является ее
спонтанная деполяризация, которая, достигая критического уровня (Ек), вызывает на ее
мембране генерацию потенциала действия. Стрелками обозначено направление входящих токов
(натрия, кальция) и выходящего калиевого тока в период спонтанной деполяризации
мембраны и генерации потенциала действия клетки синоатриального узлаатри. Длина стрелок
условно отражает величину трансмембранных токов этих ионов. СДД — спонтанная диастолическая
деполяризация.
значение в появлении пейсмекерного потенциала имеет входящий
натриевый ток через специфические натриевые каналы, которые открываются ре-
поляризацией мембраны синоатриальных мышечных клеток. Финальная
фаза пейсмекерного потенциала, т. е. приближение его амплитуды к
критическому уровню деполяризации мембраны в клетках синоатриального
узла, связана с открытием Т-типа потенциалзависимых кальциевых
ионных каналов и появлением входящего кальциевого тока. Входящие
натриевый и кальциевый токи (спонтанная деполяризация) противодействуют
выходящему калиевому току, который гиперполяризует мембрану
синоатриальных мышечных клеток (см. рис. 2.41). В этих условиях под
влиянием токов ионов Na+ и Са2+ деполяризация мембраны синоатриальных
мышечных клеток достигает критического уровня деполяризации и в клетках
синоатриального узла генерируется очередной потенциал действия,
который распространяется по проводящей системе сердца и является
раздражителем для сократительных сердечных клеток сердца.
Частота генерации потенциалов действия в синоатриальных мышечных
клетках зависит от скорости деполяризации пейсмекерного потенциала. В
отсутствии влияний со стороны вегетативной нервной системы на клетки
2. Физиология возбудимых тканей • 119
синоатриального узла, частота генерации потенциалов действия составляет
в среднем 2 в секунду (120/мин).
Клетки, расположенные в центре синоатриального узла, имеют
большую скорость развития пейсмекерного потенциала и высокую частоту
генерации потенциалов действия. Клетки периферических областей узла
имеют более медленные изменения пейсмекерных потенциалов, но
большее число миофиламентов. Таким образом, это обусловливает
постепенный переход в свойствах миоцитов от пейсмекерных клеток центральной
области синоатриального узла к свойствам, присущим сократительным
предсердным мышечным клеткам. Частота сокращения сердца в покое
(порядка 70 в минуту) обусловлена тормозным действием блуждающего
нерва на пейсмекерные клетки центральной области синоатриального узла.
2.8.2. Молекулярный механизм сокращения кардиомиоцитов
Механизм сокращения сердечных мышечных клеток в основном
идентичен таковому в скелетных мышечных клетках. Ионы Са2+ являются
«ключом» к сокращению миокарда, поскольку они выполняют связующую
функцию между деполяризацией мембраны кардиомиоцитов, вызванной
распространяющимся потенциалом действия по их поверхности, и
укорочением саркомеров в сократительных клетках сердца. Концентрация ионов
Са2+ в саркоплазме невозбужденного кардиомиоцита составляет 0,1 пМ/л
(менее Ю-7 М/л). Во время деполяризации мембраны сарколеммы и t-сис-
темы кардиомиоцитов внутриклеточная концентрация ионов Са2+
достигает 1—10 мкмМ/л (более Ю-6 М/л) в результате появления входящего
кальциевого тока.
Увеличение ионов кальция в саркоплазме кардиомиоцитов активирует
так называемую сократительную машину сердца. Взаимодействие ионов
Са2+ с тропонином, когда изменяется положение тропомиозина,
закрывающего места связывания на актиновом филаменте для поперечных
мостиков миозина, является центральным процессом в электромеханическом
сопряжении, как в скелетной мышце, так и в сердечной. В кардиомиоцитах
ионы кальция связываются с субъединицей С тропонина тропомиозиново-
го комлекса. Связывание ионов Са2+ с тропонином С уменьшает плотность
электростатической связи тропонина Т и тропомиозина относительно
тонких филаментов и тропомиозиновый комплекс, смещаясь с
периферической части глобулярного актина в зону контакта двух белковых нитей
спирали актинового филамента, открывает на нем места связывания головок
поперечных мостиков миозина с актином. В отличие от скелетной
мышцы, в кардиомиоцитах концевая 1ЧН2-область тропонина С содержит
только одно место связывания ионов Са2+. Поэтому, даже при максимальной
концентрации ионов Са2+ в цитозоле кардиомиоцитов, не происходит
полной активации ионами Са2+ тропонина С, что не приводит к открытию
всех мест связывания поперечных мостиков с актиновыми филаментами.
Это создает потенциальные условия в кардиомиоцитах для
дополнительной активации сократительной способности сердечной мышцы уже
непосредственно в процессе сокращения миокарда. Например, под влиянием
циклических процессов «замыкание—сокращение—размыкание»
поперечных мостиков миозина дополнительно увеличивается связывание ионов
Са2+ с тропонином С. Сила сокращения, генерируемая поперечными
мостиками миозина в кардиомиоцитах сердца, прямо зависит от
внутриклеточной концентрации ионов Са2+ во время фазы плато потенциала
действия.
120 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
В электромеханическом сопряжении сердечных мышечных клеток
участвуют два рецепторных белка: потенциалзависимый дигидропиридиновый
рецептор мембраны t-трубочек и рианодиновый рецептор мембраны сарко-
плазматического ретикулума. Оба белка являются медленными
кальциевыми ионными каналами. Деполяризация мембраны кардимиоцитов при
распространении по их мембране потенциала действия открывают потенциал-
зависимые кальциевые ионные каналы мембраны t-трубочек. Ионы
кальция по концентрационному градиенту поступают внутрь кардиомиоцитов и
связываются с кальмодулином, расположенным на рианодиновом рецепторе
или кальциевом ионном канале саркоплазматического ретикулума. Белок
кальмодулин открывает кальциевые ионные каналы саркоплазматического
ретикулума, и концентрация ионов Са2+ в саркоплазме повышается до
пороговой (примерно 1 мкМ/л). Кальмодулин осуществляет взаимодействие в
кардиомиоцитах между дигидропиридиновыми рецепторами мембраны t-
трубочек и рианодиновыми рецепторами мембраны саркоплазматического
ретикулума, за счет его активации внеклеточными ионами Са2+. Поэтому в
сократительных клетках сердца процесс элеткромеханического сопряжения
обусловлен ионами Са2+ внеклеточной среды. Электромеханическое
сопряжение в кардиомиоцитах отсутствует при пониженной концентрации ионов
Са2+ в интерстициальной среде, несмотря на нормальное их содержание в
саркоплазматическом ретикулуме кардиомиоцитов.
Открытие кальциевых ионных каналов саркоплазматического
ретикулума в кардиомиоцитах при участии белка кальмодулина вызывает выход
этих ионов в межфибриллярное пространство кардиомиоцитов.
Наибольшая активация сокращения кардиомиоцитов происходит при
концентрации ионов Са2+ в саркоплазме порядка 10 мкМ/л. В
кардиомиоцитах имеет место так называемое Са2+-индуцированное высвобождение
ионов Са2+, проявляющееся в том, что во время фазы плато потенциала
действия ионы Са2+ входят в саркоплазму кардиомиоцитов через медленный
кальциевый ионный канал дигидропиридинового рецептора. Далее ионы
Са2+ связываются с медленным рианодиновым рецептором мембраны
саркоплазматического ретикулума. При этом открытие одного Са2+-канала
является сигналом для открытия других кальциевых каналов эндоплазмати-
ческой сети. В результате из саркоплазматического ретикулума в
цитоплазму кардиомиоцитов поступает нарастающее количество ионов Са2+, что
существенно увеличивает силу сокращения сердечной мышцы.
2.8.3. Молекулярный механизм расслабления кардиомиоцитов
Их расслабление происходит во время фазы реполяризации потенциала
действия и вызывается снижением внутриклеточной концентрации ионов
Са2+. Процесс расслабления кардиомиоцитов обусловлен остановкой
входящего кальциевого тока и прекращением высвобождения ионов Са2+ из
саркоплазматического ретикулума. Основным механизмом расслабления
миокарда является первично активный транспорт ионов Са2+ из
саркоплазмы клеток в саркоплазматический ретикулум при участии Са2+-АТФазы
кардиомиоцитов. Ионы Са2+ выводятся из саркоплазмы кардиомиоцитов в
интерстициальную среду с помощью Ка+/Са2+-обменника. В результате их
концентрация в межфибриллярном пространстве становится ниже порога
активации тропонина С и тропонин-тропомиозиновый комплекс
закрывает места связывания на актиновых филаментах для поперечных мостиков
миозина. Миокард расслабляется, что соответствует фазе диастолы
сердечного цикла.
2. Физиология возбудимых тканей ■ 121
Ключевым регулятором расслабления миокарда является белок
мембраны саркоплазматического ретикулума фосфоламбан. Фосфорилирование
фосфоламбана при участии вторичного посредника цАМФ ускоряет
гидролиз АТФ, активирует кальциевый насос саркоплазматического ретикулума,
повышает сродство ионов Са2+ к Са2+-АТФазе, увеличивая скорость
активного транспорта ионов Са2+ из саркоплазмы внутрь саркоплазматического
ретикулума. Благодаря функции фосфоламбана сродство ионов кальция и
кальциевого насоса в кардиомиоцитах идентично таковому в быстрых
скелетных мышечных волокнах, в которых отсутствует этот белок.
Фосфоламбан увеличивает кальциевую чувствительность Са2+-АТФазы
саркоплазматического ретикулума при взаимодействии адреналина или норадреналина
с р,-адренорецепторами мембраны кардиомиоцитов. Положительный ино-
тропный эффект, возникающий при стимуляции этого типа рецепторов
адреналином или норадреналином, проявляется в активации как
сокращения миокарда, так и расслабления. Сила сокращения сердечной мышцы
возрастает при увеличении скорости выхода ионов Са2+ из
саркоплазматического ретикулума в саркоплазму и связывания с тропонином С.
Расслабление миокарда прямо зависит от скорости депонирования ионов Са2+ в
саркоплазматический ретикулум при участии фосфоламбана.
2,8.4. Медиаторный контроль сокращения кардиомиоцитов
В физиологических условиях механизмы сокращения сердечных
мышечных клеток контролируются адрено- и холинорецепторами,
расположенными на мембране кардиомиоцитов.
Из трех типов агадренорецепторов (сцд, аш и аш) в сердце человека
доминирует а1А тип, а также р-адренорецепторы. Стимуляция а,-адреноре-
цепторов увеличивает сократимость кардиомиоцитов и в целом — силу
сердечных сокращений. Влияние стимуляции адренорецепторов на силу
сокращения сердечной мышцы называется инотропным эффектом (лат.
inos — сила). Молекулярный механизм инотропного эффекта
норадреналина, вызванный стимуляцией агадренорецепторов, опосредован активацией
системы G-белков (семейство Gq/n, обозначаемое как семейство Gh для
сердца человека) с последующим образованием в кардиомиоцитах инози-
тол-3-фосфата и диацилглицерола. Эти вторичные посредники через риа-
нодиновые рецепторы мембраны саркоплазматического ретикулума
увеличивают активность кальциевых ионных каналов, что повышает
концентрацию ионов кальция в саркоплазме кардиомиоцитов и усиливает силу их
сокращения. Кроме того, стимуляция агадренорецепторов увеличивает
кальциевый ток через сарколемму внутрь кардиомиоцитов из
внеклеточной среды, а также чувствительность сократительных миофиламентов к
ионам Са2+. Функция а2-адренорецепторов в контроле физиологических
свойств кардиомиоцитов человека связана с пресинаптическим
торможением выделения норадреналина из нервных окончаний, иннервирующих
сердце.
Из трех типов р-адренорецепторов в сердце человека
идентифицированы р,- и р2-адренорецепторы. Молекулярный механизм стимуляции
сокращения миоцитов в сердце человека при участии рг и р2-адренорецепторов
осуществляется при участии семейства Gs-белка, который повышает
внутриклеточное содержание аденилатциклазы и вторичного посредника
цАМФ. Это ведет к стимуляции фосфорилирования внутриклеточных
белков при участии протеинканазы А, включая L-тип кальциевых ионных
каналов мембран t-системы. В результате открытия кальциевых ионных ка-
122 • БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
налов увеличивается содержание этих ионов в саркоплазме и, как
следствие, возрастает сократимость сердечной мышцы (положительный инотроп-
ный эффект). В различных тканях организма человека идентифицировано
пять генов, контролирующих синтез мускариновых М,—М5 рецепторов. При
этом в сердце человека, локализован М2 тип холинорецепторов.
Взаимодействие ацетилхолина с М2 (а также М4) типом холинорецепторов через
семейство Gi/Go белков угнетает аденилатциклазу миоцитов и уменьшает
активность калиевых и кальциевых ионных каналов, активируя фосфоли-
пазу А2, фосфолипазу D и протеинкиназы. В результате снижается
скорость развития пеисмекерного потенциала в клетках синоатриального узла
и уменьшается сократимость миокарда. Ацетилхолин через М2 холиноре-
цепторы уменьшает сократимость кардиомиоцитов, если исходный
уровень их сократимости был повышен под влиянием стимуляции р-адрено-
рецепторов.
II РЕГУЛИРУЮЩИЕ
И УПРАВЛЯЮЩИЕ
СИСТЕМЫ
124 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Организм человека представляет собой сложную саморегулирующуюся
иерархическую систему, которая обменивается с окружающей средой
веществом, энергией и информацией. В ходе непрерывного взаимодействия
со средой организм проявляет себя как реактивная система,
приспосабливающая свои физиологические процессы к меняющимся условиям среды
для уравновешивания с ней (гомеостазис), и одновременно как активная
система, изменяющая среду в собственных целях и для удовлетворения
своих потребностей (поведение). Как в том, так и в другом случае
необходима интеграция всех иерархических уровней организации живой системы:
молекулярного, субклеточного, клеточного, тканевого, органного.
Согласование биофизических, биохимических и физиологических процессов,
происходящих в тканях и органах, а также приспособление этих процессов
к изменяющимся условиям внешней среды осуществляют регулирующие и
управляющие системы организма: нервная и эндокринная.
Под регуляцией в физиологии понимается активное управление
функциями биологической системы (вплоть до организма в целом и его
поведения) с целью поддержания оптимального уровня ее жизнедеятельности и
приспособления системы к меняющимся условиям внешней среды.
Изменение параметров функций при поддержании их в границах гомео-
стазиса происходит на каждом уровне организации или в любой
иерархической системе за счет саморегуляции, т. е. внутренних для системы
механизмов управления жизнедеятельностью. Так, например, уменьшение
кровоснабжения ткани ведет к образованию в ней химических веществ,
расширяющих артерии и восстанавливающих тем самым приток крови. Такие
механизмы саморегуляции получили название местных.
Для осуществления функций организма в целом необходимы
взаимосвязь и взаимозависимость функций составляющих его систем. Поэтому
наряду с внутренними механизмами саморегуляции систем в организме
должны существовать и внешние для каждой из них механизмы регуляции,
соподчиняющие и координирующие деятельность систем. Например, для
реализации функции перемещения тела человека в пространстве
необходимо изменение деятельности не только скелетных мышц, но и
кровообращения, дыхания, обмена веществ и т. п. Изменения параметров этих
функций реализуются под влиянием сформировавшейся в процессе
эволюции специализированной системы регуляции функций.
Однако и организму в целом присуща саморегуляция жизненных
процессов, позволяющая осуществлять приспособление к меняющимся
условиям существования. Организм является самоорганизующейся системой,
т. е. сам выбирает и поддерживает значения огромного числа параметров
функций, меняет их в зависимости от собственных потребностей, что
позволяет ему обеспечивать наиболее оптимальный характер
функционирования. Так, например, при низких температурах внешней среды организм
снижает температуру поверхности тела (чтобы уменьшить теплоотдачу),
повышает скорость окислительных процессов во внутренних органах и
мышечную активность (чтобы увеличить теплообразование).
Одновременно реализуется и адаптивное поведение — человек утепляет жилище,
меняет одежду (для увеличения теплоизолирующих свойств), причем делает это
даже заранее, опережающе реагируя на изменения внешней среды.
Основой физиологической регуляции является передача и обработка
информации. Под термином «информация» следует понимать все, что несет в
себе отражение фактов или событий, которые произошли, происходят или
могут произойти. Информация содержит количественные характеристики
определенных параметров внешней и внутренней среды организма, поэто-
2. Физиология возбудимых тканей • 125
му особую важность имеет ее объем. Примером способа количественного
выражения информации, принятого в информатике как науке и
используемого в организме, является двоичная система. Единицей количества в
таком случае является бит, характеризующий информацию, получаемую
при выборе одного из двух одинаково вероятных состояний, например
да—нет, все—ничего, быть—не быть и т. п. Материальным носителем
информации является сигнал, в форме которого и передается информация.
Это могут быть как физические, так и химические сигналы, например
электрические импульсы, форма молекулы, концентрация молекул и т. д.
В тех случаях, когда регуляторным сигналом являются электрические
импульсы (нервные потенциалы), регуляция функций осуществляется
нервной системой. В случаях, когда регуляторный сигнал представлен
химическими молекулами, находящимися в жидкостях внутренней среды,
регуляцию называют гуморальной. Она осуществляется либо тканевыми
метаболитами, либо специальной эндокринной системой.
Центральная нервная система обеспечивает согласованное
взаимодействие органов и частей организма, участвующих в той или иной его реакции
на воздействие среды, и формирует поведение, направленное на
удовлетворение потребностей и преобразование среды. Центральная нервная
система постоянно получает информацию об изменениях среды и может
немедленно запускать в ответ на них врожденный комплекс стандартных
приспособительных реакций — рефлексов, проявляющихся мышечными
сокращениями или секрецией желез.
Сокращениями скелетных мышц управляет соматическая нервная
система, посредством которой регулируются не только рефлекторные
мышечные реакции, но и произвольные сокращения мышц, необходимые для
активного взаимодействия человека со средой. Вегетативная нервная система
иннервирует гладкие мышцы внутренних органов, сердце и железы
внешней секреции; она осуществляет нервную регуляцию параметров
внутренней среды организма. Регуляторная функция вегетативной нервной
системы в отличие от соматической непосредственно не контролируется
сознанием и осуществляется непроизвольно. Однако нервные центры головного
и спинного мозга координируют активность соматической и вегетативной
нервной системы и согласуют друг с другом их ответные реакции.
Эндокринные железы, или железы внутренней секреции, выделяют в
кровь гормоны — химические вещества, предназначенные для передачи
специфических управляющих сигналов другим клеткам. Специфичность
действия гормонов определяется рецепторами, расположенными на
мембранах клеток-мишеней и принимающих адресованные им сигналы, под
влиянием которых происходят изменения функциональной активности
управляемых клеток. Нервные клетки тоже используют химические
вещества для передачи сигналов, такие вещества называются нейромедиатора-
ми. Нейроны могут действовать только на такие клетки, которые образуют
с ними функциональные соединения — синапсы, а поэтому действие
медиаторов проявляется немедленно и только в синапсе. Гормоны поступают
в общий кровоток и поэтому способны влиять на большое количество
клеток, имеющих специфические рецепторы для связывания гормонов.
Гормональная регуляция осуществляется значительно медленнее, чем нервная,
однако гормональные влияния проявляются гораздо дольше, чем
изменения, происходящие под влиянием нейромедиаторов. Нервная и
гормональная регуляция функций взаимно дополняют друг друга и осуществляются
согласованно.
Следует в то же время подчеркнуть, что как нервная, так и эндокринная
126 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
системы являются функциональными системами и находятся в организме
в ряду других систем (см. раздел III) с присущими им специфическими
функциями. И только чисто в дидактических целях — чтобы подчеркнуть
их особую значимость в общеинтегративных, регуляторных процессах
организма — эти системы вьщелены в особый раздел управления и контроля
физиологических функций и процессов в организме.
ГЛАВА 3
Общие принципы и механизмы
регуляции физиологических функций
3.1. Общие принципы организации системы регуляции
Обработка информации осуществляется управляющей системой, или
системой регуляции. Она состоит из отдельных структурных элементов,
связанных информационными каналами (рис. 3.1). Управляющее устройство
(например, центральная нервная система) получает информацию о
деятельности системы, обрабатывает ее в соответствии с имеющейся
программой оптимизации функций (врожденной или приобретенной на основе
жизненного опыта) и посылает управляющие сигналы к исполнительным
органам и системам. Входные каналы связи (нервы, жидкости внутренней
среды) передают нервные импульсы или информационные молекулы
веществ, сигнализирующие о состоянии внутренней среды и параметрах
функций, в управляющее устройство, а выходные каналы связи — от
управляющего устройства к исполнительным органам. Датчики (сенсорные
рецепторы) воспринимают информацию из внешней или внутренней
среды на входе системы. Сигналы, идущие по выходным каналам связи из
управляющего устройства и предназначенные для изменения функции,
воспринимаются образованиями, располагающиеся на исполнительных
клетках (клеточные рецепторы). Часть управляющего устройства,
служащая для хранения информации, называется запоминающим устройством, \
или аппаратом памяти. Характер переработки поступающих сигналов
зависит от той информации, которая записана в аппарате памяти
управляющего устройства системы регуляции.
3.1.1. Уровни организации системы регуляции
Система регуляции физиологических функций организма представляет
собой иерархическую структуру трех уровней.
Первый уровень системы регуляции состоит из относительно
автономных местных систем, поддерживающих физиологические константы,
задаваемые собственными метаболическими потребностями. Так
поддерживаются, в частности, осмотическое давление крови, вентиляционно-перфузи-
онные отношения в легких, тканевой кровоток. Например, при активации
деятельности скелетной мышцы возникает относительно недостаточное ее
кислородное обеспечение, в результате начинает накапливаться не
успевающая окисляться молочная кислота, способствующая расширению арте-
риол и увеличению кровоснабжения и кислородоснабжения работающей
мышцы. Для реализации механизмов этого уровня не обязательны сигналы
из управляющего устройства центральной нервной системы, они
обеспечиваются местными реакциями метаболической природы и носят поэтому
название «местная саморегуляция».
Возмущающий раздражитель
(фактор среды)
Сенсорные рецепторы —*■
Входной сигнал (нервный импульс,
сигнальные молекулы)
Входной канал (нервный
проводник, кровь, лимфа)
Возмущающий
раздражитель (фактор среды)
—>■
Сенсорные
рецепторы
—*•
Входной сигнал (нервный
импульс, сигнальные молекулы)
—*•
Входной канал (нервный
проводник, кровь, лимфа)
Управляющее
устройство
(нервный центр)
Выходной сигнал (нервный импульс, сигнальные молекулы)
т
Выходной канал (нервный проводник, кровь, лимфа и др.)
Клеточные рецепторы на эффекторе
Эффект регуляции (изменение параметров функции) -
rD . h
. Входной канал .
' обратной связи '
. Входной сигнал ,—>
' обратной связи '-*-i
г --"-."- -л I
I Сенсорный рецептор , j
!_обратной связи
Рис. 3.1. Схематическое изображение системы регуляции.
Жирным шрифтом и стрелками выделен выходной канал прямой регуляторной связи — канал управления.
Обычным шрифтом, рамками и сплошными стрелками обозначена регуляция по возмущению, включаемая в результате действия фактора среды
на сенсорные рецепторы. Обычным шрифтом, пунктирными стрелками и рамками выделен канал обратной связи, осуществляющий регуляцию по
отклонению при изменении параметров физиологической функции.
3. Общие принципы и механизмы регуляции физиологических функций • 129
Второй уровень системы регуляции осуществляет приспособительные
реакции в связи с изменениями внутренней среды. Этот уровень может
быть представлен низшими этажами центральной нервной системы
(спинной, продолговатый мозг) или отдельными эндокринными железами
(околощитовидные железы секретируют гормон паратирин при снижении
уровня кальция в крови, (3-клетки островков Лангерганса поджелудочной
железы секретируют гормон инсулин при повышении уровня сахара в
крови). На этом уровне задается величина физиологических параметров,
которые в дальнейшем могут поддерживаться системами первого уровня. Здесь
подбирается оптимальный режим работы физиологических систем для
адаптации организма к внешней среде. Например, выполнение
физической работы или даже подготовка к ней требует увеличенного снабжения
мышц кислородом, что обеспечивается усилением внешнего дыхания,
поступлением в кровь депонированных эритроцитов и повышением
артериального давления.
Третий уровень системы регуляции, представленный, как правило,
образованиями головного мозга (гипоталамус, лимбическая система, кора
больших полушарий), обеспечивает выработку критериев оценки
состояния внутренней и внешней среды, настройку режимов работы первого и
второго уровней, гарантирующих в итоге изменение вегетативных фунций
и поведения организма с целью оптимизации его жизнедеятельности.
3.1.2. Типы и механизмы регуляции
На всех трех уровнях структурной организации системы регуляции
возможны 3 типа регуляции: 1) по возмущению, или адаптивная регуляция,
2) по отклонению, или гомеостатическая регуляция, 3) по упреждению или
опережающая регуляция. Регуляция по возмущению (саморегуляция по
входу) системы возможна для систем, имеющих связи с внешней для них
средой (см. рис. 3.1). Этот тип регуляции включается в тех случаях, когда на
живую систему оказывает воздействие внешний для нее фактор,
меняющий условия ее существования. Например, регуляция дыхания обычно
обеспечивает оптимальную для метаболизма клеток взаимосвязь процессов
газообмена в легких, транспорта газов кровью и газообмена крови с
клетками в тканях. Физическая же нагрузка, не являющаяся частью структуры
приведенной системы (внешняя для нее), представляет собой
возмущающее воздействие и, поскольку физическая нагрузка ставит новые условия в
виде повышенной потребности мышц в кислороде, реализуется регуляция
по возмущению, меняющая интенсивность составляющих дыхание
процессов. Или регуляция постоянства температуры тела подразумевает
взаимосвязь процессов образования тепла в организме и его отдачи в
окружающую среду. Изменение температуры окружающей среды, например
повышение ее, является возмущающим раздражителем, воспринимается
терморецепторами кожи и слизистых оболочек. От рецепторов по входному
каналу связи (нервным проводникам) сигнал поступает в управляющее
устройство (нервный центр), меняющее путем выходных сигналов процессы
образования и отдачи тепла так, чтобы поддерживать температуру тела на
постоянном уровне. Этот тип регуляции получил название адаптивной
регуляции, так как она способствует быстрому приспособлению организма к
изменившимся условиям среды.
Регуляция по отклонению (саморегуляция по выходу системы) возникает
при отклонении параметров функции за пределы диапазона
физиологических колебаний (см. рис. 3.1). Регуляция обеспечивается сравнением
5-6095
130 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
имеющихся параметров реакции физиологических систем с требующимися
в конкретных условиях, определением степени рассогласования между
ними и включением исполнительных устройств для устранения этого
рассогласования. Частным примером регуляции по отклонению является
поддержание физиологических констант внутренней среды. Стоит только
отклониться от заданного уровня и повыситься в крови напряжению
углекислого газа из-за недостаточного его удаления через легкие или
повышенного образования в тканях, как начнут реализовываться регуляторные
механизмы, направленные на восстановление и поддержание гомеостазиса.
Этот тип регуляции поэтому называется гомеостатической регуляцией, ее
реакции направлены, например, на устранение описанного сдвига
содержания С02: образование углекислоты и бикарбоната натрия, связывание
водородных ионов буферными системами, повышение выведения
протонов через почки, активация дыхания для выведения углекислого газа во
внешнюю среду.
Регуляция по отклонению требует наличия канала связи между выходом
системы регуляции и ее центральным аппаратом управления и даже между
выходом и входом системы регуляции. Этот канал связи получил название
механизма обратной связи (см. рис. 3.1). Именно обратная связь позволяет
регуляции по отклонению работать в двух режимах: компенсационном и
слежения. Компенсационный режим обеспечивает быструю корректировку
рассогласования реального и оптимального состояния физиологических
систем при внезапных влияниях среды, т. е. оптимизирует реакции
организма. При режиме слежения регуляция осуществляется по заранее
заданным программам, а обратная связь контролирует соответствие параметров
деятельности физиологической системы заданной программе. Если
возникает отклонение — реализуется компенсационный режим.
По конечному эффекту регуляции механизм обратной связи может быть
положительным и отрицательным.
Механизм положительной обратной связи означает, что выходной сигнал
системы регуляции усиливает входной, активация какой-либо функции
вызывает усиление механизмов регуляции, еще больше ее активирующих.
Такая обратная связь усиливает процессы жизнедеятельности, например
прием пищи и поступление ее в желудок усиливают отделение
желудочного сока, необходимого для гидролиза веществ (рис. 3.2). Появляющиеся в
желудке и частично всасывающиеся в кровь продукты гидролиза в свою
очередь стимулируют сокоотделение, что ускоряет и усиливает дальнейшее
переваривание пищи. Однако положительная
обратная связь нередко приводит систему в
неустойчивое состояние, способствует
формированию «порочных кругов», когда реакция
организма на вредное воздействие среды
усиливает следствия этого воздействия, что
лежит в основе многих патологических
процессов в организме.
Рис. 3.2. Пример механизма положительной
обратной связи в регуляции секреции желудочного сока.
Прием пищи вызывает секрецию желудочного сока,
расщепление пищевого белка и всасывание продуктов его
гидролиза в кровь. Последние в свою очередь еще больше
стимулируют секрецию желудочного сока (положительная
обратная связь).
Прием белковой пищи
'
'
Увеличение секреции
желудочного сока
1
'
Гидролиз белка в
желудке и кишечнике
'
'
Всасывание продуктов
гидролиза в кровь
+
3. Общие принципы и механизмы регуляции физиологических функций • 131
Рис. 3.3. Пример механизма
отрицательной обратной связи в
регуляции уровня глюкозы в
крови.
Прием сахара с пищей и
последующий его гидролиз до глюкозы ведут
к повышенному поступлению
глюкозы в кровь. Рост содержания
глюкозы в крови стимулирует секрецию
инсулина р-клетками островков
Лангерганса поджелудочной
железы. Под влиянием инсулина растет
захват глюкозы из крови клетками
мышечной и жировой ткани,
уровень глюкозы в крови снижается,
что тормозит секрецию инсулина
(отрицательная обратная связь).
Прием сахара с пищей
Всасывание глюкозы в кровь
Увеличение секреции инсулина
Транспорт глюкозы в клетки
Снижение глюкозы в крови
г — *- — -\
I Подавление >
секреции
I инсулина '
L -_т -J
i
Механизм отрицательной обратной связи (рис. 3.3) означает, что
выходной сигнал уменьшает входной, активация какой-либо функции подавляет
механизмы регуляции, усиливающие эту функцию. Отрицательные
обратные связи способствуют сохранению устойчивого, стационарного
состояния системы. Благодаря им возникающее отклонение регулируемого
параметра уменьшается и система возвращается к первоначальному состоянию.
Например, под влиянием паратирина (гормона околощитовидных желез) в
крови возрастает содержание ионизированного кальция. Повышенный
уровень кальция тормозит секрецию паратирина, усиливает поступление в
кровь кальцитонина (гормона щитовидной железы), под влиянием
которого уровень кальция снижается и его содержание в крови нормализуется.
Отрицательные обратные связи способствуют сохранению стабильности
физиологических параметров внутренней среды при возмущающих
воздействиях внешней среды, т. е. поддерживают гомеостазис. Они работают и в
обратном направлении, т. е. при уменьшении параметров включают
системы регуляции, повышающие их и тем самым обеспечивающие
восстановление гомеостазиса.
В условиях, когда воздействия среды относительно неизменны,
возмущающие сигналы слабы или отсутствуют, основную роль играет система
гомеостатической регуляции, тогда как адаптационная регуляция мало
активна. Но стоит только в окружающей среде возникнуть изменению, т. е.
новому фактору, как сразу же активируется адаптационная регуляция и
ослабляется гомеостатическая.
Эффект обратной связи всегда запаздывает, так как она включает
компенсационный режим уже после того как произошло рассогласование
имеющихся и должных параметров. Например, при низкой температуре
окружающей среды, включение механизмов поддержания температуры
тела после того, как снизилась температура крови, т. е. отклонилась
гомеостатическая константа, является слишком поздней регуляторной реакцией.
Если человек выходит раздетым на сильный мороз, включаются
механизмы поддержания постоянства температуры тела благодаря холодовому
воздействию и адаптивной регуляции, но эффект низкой температуры может
привести к простуде. Необходимой в таких случаях является регуляция по
упреждению, в результате которой перед выходом на мороз человек надева-
132 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
ет теплую одежду, а в его организме опережающе активируются механизмы
образования тепла. В центральном аппарате управления системы
регуляции заложен механизм контроля, позволяющий получать информацию не
об уже достигнутых параметрах деятельности, а осуществляющий
сравнение сигналов, посылаемых к исполнительным устройствам, с
хранящимися в памяти сигналами, требуемыми для заданной программы. Этот
механизм опережающей регуляции свойствен третьему уровню системы
регуляции.
3.1.3. Реактивность и эффект регуляции
Необходимым свойством живой системы, влияющим на эффективность
механизмов регуляции, является ее реактивность. Реактивность — это
способность живой системы отвечать (реагировать) изменениями функции на
раздражители внешней или внутренней среды. Характер ответной реакции
любой живой системы определяется не только качественными и
количественными характеристиками раздражителя, но и реактивностью самой
системы. Соответственно величина и характер эффектов регуляторных
сигналов (нервных импульсов, молекул химических веществ) зависят не только
от характеристик этих сигналов, но и от реактивности регулируемого
объекта, т. е. эффектора.
Одним из свойств реактивности является «правило исходного
состояния», согласно которому величина и направленность эффекта регуляторно-
го сигнала зависят от особенностей метаболизма и функции, имевшихся в
регулируемой системе перед действием этого сигнала. Так, если функция
клетки, ткани, органа или физиологической системы находятся в
активированном состоянии, то на стимулирующий регуляторный сигнал
отмечается или слабый эффект, или отсутствие его, или даже противоположный
эффект, а на тормозящий регуляторный сигнал, напротив, возникает
адекватный или максимально возможный эффект. Если же в исходном
состоянии функция или метаболизм снижены, то стимулирующий регулятор
вызывает максимальный эффект, а действие подавляющего регулятора
ослаблено или даже приводит к стимуляции эффектора.
3.1.4. Механизмы регуляции жизнедеятельности
Различают нервные и гуморальные механизмы регуляции жизнедеятельности
организма. Первые используют для передачи и переработки информации
структуры нервной системы (нейроны, нервные волокна) и импульсы
электрических потенциалов, вторые — жидкости внутренней среды и
молекулы химических веществ.
Нервная регуляция осуществляет быструю и направленную передачу
сигналов, которые в виде нервных импульсов по нервным волокнам
поступают к объекту регуляции. Быстрая передача сигналов (до 80—120 м/с) без
затухания и потери энергии обусловлена свойствами проводящих
возбуждение структур, преимущественно состоянием их мембран. Нервной
регуляцией обеспечены как соматические (деятельность скелетной
мускулатуры), так и вегетативные (деятельность внутренних органов) функции.
Нервная регуляция функций включает в себя как произвольную, так и
непроизвольную, реализуемую в ответ на раздражение нервных сенсорных
рецепторов, т. е. рефлекторную.
Гуморальная регуляция — способ передачи информации к эффекторам
через жидкости внутренней среды организма с помощью молекул химиче-
3. Общие принципы и механизмы регуляции физиологических функций • 133
ских веществ, выделяемых клетками или специализированными для
регуляции эндокринными железами. Этот вид регуляции жизнедеятельности
осуществляется на двух уровнях: 1) обеспечивая относительно автономный
местный межклеточный обмен информацией об особенностях метаболизма
и функции клеток и тканей, 2) представляя системный эфферентный
канал информационной связи, находящийся в большей или меньшей
зависимости от нервных процессов восприятия и обработки информации о
состоянии внешней и внутренней среды. Соответственно гуморальную
регуляцию подразделяют на местную клеточно-тканевую, и систему
гормональной регуляции, обеспечивающую генерализованные эффекты в организме с
помощью гормонов. Местная гуморальная регуляция (тканевая
саморегуляция) практически не управляется нервной системой, тогда как система
гормональной регуляции составляет часть единой нейрогуморальной
системы.
Деление механизмов регуляции жизнедеятельности организма на
нервные и гуморальные условно и может использоваться только для
дидактических целей как способ изучения. В организме нервные и гуморальные
механизмы регуляции неразделимы и представляют собой единую нейрогу-
моральную систему регуляции. Так, во-первых, информация о состоянии
внешней и внутренней среды воспринимается почти всегда элементами
нервной системы {сенсорные рецепторы), обрабатывается в нервной
системе, где может трансформироваться в сигналы исполнительных устройств
либо нервной, либо гуморальной природы. Следовательно, для второго и
третьего уровней системы регуляции физиологических функций
управляющим устройством является, как правило, нервная система. Во-вторых,
сигналы, поступающие по управляющим каналам нервной системы,
передаются в местах окончания нервных проводников в виде химических
молекул — нейромедиаторов, поступающих в микроокружение клеток, т. е.
гуморальным путем, как было показано в главе 2. На мембранах одних и тех
же эффекторных клеток имеются рецепторы и к нейромедиаторам, и к
гормонам, и к тканевым факторам саморегуляции. Специализированные
для гормональной регуляции железы внутренней секреции управляются
нервной системой.
3.2. Рефлекторная регуляция функций организма
Рефлекс — стереотипная реакция организма в ответ на раздражитель,
реализуемая с помощью нервной системы. Вызывающие рефлексы
раздражители могут иметь как физическую (механические, электрические,
температурные, звуковые, световые и т. п. раздражители), так и химическую
природу. Структурной основой рефлекса является рефлекторная дуга,
представляющая собой совокупность морфологически взаимосвязанных
образований, обеспечивающих восприятие, передачу и переработку сигналов,
необходимых для реализации рефлекса.
Рефлекторная дуга по своему строению и назначению элементов
представляет собой описанный выше контур регуляции. Она включает
следующие звенья (рис. 3.4):
1) сенсорные рецепторы (датчики), воспринимающие стимулы внешней
или внутренней среды,
2) афферентные, или чувствительные, нервные проводники (каналы
сигналов входа),
3) нервные центры (аппарат управления), состоящие из афферентных,
промежуточных, или вставочных, и эфферентных нейронов, т. е. по-
134 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Афферентный нейрон
спинального ганглия
Вставочный
нейрон
Нервный центр
спинного мозга
Двигательный
нейрон
Рис. 3.4. Схема рефлекторной дуги.
Раздражение рецептора ведет к поступлению нервного импульса по афферентному
проводнику к афференнтному нейрону спинального ганглия, а от него к вставочному и двигательному
нейронам спинного мозга (нервный центр рефлекса). От двигательного нейрона передних
рогов спинного мозга по эфферентному проводнику нервный импульс передается к
эффектору — скелетной мышце. Сокращение последней вызывает раздражение расположенных в
мышце рецепторов и по афферентным проводникам информация о сокращении поступает
обратно в нервный центр (канал обратной связи)
лучающих, обрабатывающих и выдающих информацию нервных
клеток,
4) эфферентные, или двигательные, нервные проводники (каналы
выхода),
5) эффекторы, или исполнительные органы (объекты управления).
Однако для оптимальности регуляции необходима информация о
реакциях эффектора на управляющие сигналы, в связи с чем обязательным
звеном рефлекторного акта является канал обратной связи. Таким
образом, структурную основу рефлекса лучше называть не рефлекторной дугой,
а рефлекторным кольцом.
Рецепторами называют специализированные образования,
предназначенные для восприятия клетками или нервной системой различных по
своей природе стимулов или раздражителей. Различают два типа
рецепторов — сенсорные, т. е. обеспечивающие восприятие нервной системой
различных раздражителей внешней или внутренней среды, и клеточные
химические рецепторы — специальные структуры мембран, обеспечивающие
восприятие информации, переносимой молекулами химических веществ —
медиаторов, гормонов, антигенов и т. п.
3. Общие принципы и механизмы регуляции физиологических функций • 135
3.2.1. Сенсорные рецепторы
Сенсорные рецепторы в зависимости от их структурной организации и
функции могут быть первично или вторично чувствующими (рис. 3.5).
Первично чувствующие рецепторы — это нервные окончания отростков
чувствительных нейронов. Они имеются в коже и слизистых оболочках,
скелетных мышцах, сухожилиях и надкостнице, а также барьерных структурах
внутренней среды — стенках кровеносных и лимфатических сосудов, ин-
терстициальном пространстве, в оболочках головного и спинного мозга,
ликворной системе. По характеру воспринимаемых раздражителей
первично чувствующие рецепторы делят на механорецепторы (восприятие
растяжения или сдавления, линейного или радиального сдвига ткани), хеморе-
цепторы (восприятие химических раздражителей), терморецепторы
(восприятие температуры). В особую группу выделяют ноцицепторы, т. е.
рецепторы, воспринимающие боль, хотя их существование признается не
всеми.
Вторично чувствующие рецепторы — это специализированные на
восприятии определенных раздражителей рецепторные клетки, как правило
эпителиальной природы, входящие в состав органов чувств — зрения,
слуха, вкуса, равновесия. После восприятия раздражителя эти рецепторные
клетки передают информацию на окончания афферентных проводников
чувствительных нейронов. Таким образом, афферентные нейроны нервной
системы получают информацию о раздражителе, уже обработанную в ре-
цепторных клетках (что и определило название этих рецепторов).
Все виды рецепторов в зависимости от источника воспринимаемого
раздражения делят на экстероцепторы (воспринимающие стимулы из
внешней среды) и интероцепторы (предназначенные для раздражителей
внутренней среды). Среди интероцепторов выделяют проприоцепторы,
т. е. собственные рецепторы опорно-двигательного аппарата, ангиорецеп-
торы, расположенные в стенках сосудов, и тканевые рецепторы,
локализованные в интерстициальном пространстве и клеточной микросреде.
Особое место среди проприорецепто-
ров занимают мышечные
веретена, представляющие собой
образования, реагирующие на растяжение
мышцы и способные менять свою
чувствительность под влиянием
импульсов, приходящих к ним из
центральной нервной системы. Эти
рецепторы участвуют в регуляции
мышечного тонуса.
Общим функциональным
свойством всех видов сенсорных
рецепторов является способность
преобразовывать один вид энергии в
другой: механическую, тепловую,
света, звука и т. п. энергию
раздражителей в электрическую энергию
биопотенциалов, т. е. нервных
импульсов.
Поскольку рецепторы
специализированы для восприятия
определенного вида раздражителей, их
А. Тельце Пачини Б. Окончание Руффини
В. Тельце Мейснера Г. Диски Меркеля
Рис. 3.5. Виды рецепторов кожи.
А, Б, В — первично чувствующие
рецепторы — окончания чувствительных нервных
проводников; Г — вторично чувствующие
рецепторы — специализированные
рецепторные клетки.
136 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
чувствительность для таких раздражителей оказывается наибольшей.
Величина минимальной силы раздражителя, способной вызвать возбуждение
рецептора, носит название абсолютного порога раздражения. В связи с этим
раздражители, для которых рецептор обладает наивысшей чувствительностью,
т. е. минимальной величиной порога, получили название адекватных. В то
же время некоторые рецепторы могут реагировать и на несоответствующие
их специализации раздражители (например, рецепторы органа зрения на
механическое раздражение), порог для таких раздражителей, называемых
неадекватными, оказывается очень высоким и требуется значительная сила
раздражителя для возбуждения рецептора («искры из глаз» при ударе).
Если первично чувствующие рецепторы образованы разветвлениями
отростка одного сенсорного нейрона, они формируют рецептивное поле
сенсорного нейрона. Обычно рецепторы образуют в тканях скопления
различной плотности. В случаях, когда эти скопления дают начало
определенному рефлексу, их называют рецептивными полями рефлекса. Если в
скоплении представлены разные по характеру раздражителей рецепторы, дающие
начало разным рефлексам, их называют рефлексогенными зонами.
Примером являются сосудистые рефлексогенные зоны (дуги аорты, каротидного
синуса), где расположены и механо- и хеморецепторы, раздражение
которых вызывает различные рефлекторные реакции сердечно-сосудистой,
дыхательной и других систем организма.
3.2.2. Афферентные и эфферентные нервные проводники
Основной функцией нервов является проведение сигналов к нервному
центру от рецепторов {афферентные проводники) или от нервного центра к
эффектору {эфферентные проводники). Собственно проводниками являются
нервные волокна, входящие в состав периферических нервов или белого
вещества головного и спинного мозга.
В зависимости от диаметра, наличия или отсутствия миелиновой
оболочки и скорости проведения нервных импульсов нервные волокна делят
на три класса: А (четырех типов), В и С (табл. 3.1). Миелинизированные
волокна более толстые, скорость проведения сигналов по ним существенно
больше. Так, волокна А-типов обеспечивают проведение сигналов при
Таблица 3.1. Характеристика нервных волокон периферических нервов
Тип
волокон
Д.
\
\
А,
В
С
Диаметр
волокон
(мкм)
13-22
8-13
4-8
1-4
1-3
0,5-1.5
Скорость
проведения
(м/с)
70-120
40-70
15-40
5-15
3-14
0,5-2
Назначение
Эфферентные волокна скелетных мышц, афферентные
волокна рецепторов — мышечных веретен
Афферентные волокна от рецепторов давления и
прикосновения
Эфферентные волокна рецепторов — мышечных веретен,
часть афферентов от рецепторов давления и прикосновения
Афферентные волокна от кожных рецепторов температуры и
боли, частично давления
Преганглионарные эфферентные волокна вегетативной
нервной системы
Постганглионарные эфферентные волокна вегетативной
нервной системы, афференты кожных рецепторов боли и тепла
3. Общие принципы и механизмы регуляции физиологических функций • 137
рефлекторной регуляции скелетных мышц. Немиелинизированные тонкие
волокна С-типа участвуют в проведении сигналов, регулирующих
деятельность внутренних органов, скорость проведения сигнала по ним — самая
низкая.
3.2.3. Возбуждение и торможение в рефлекторной дуге
При огромном количестве раздражителей, действующих одновременно на
многочисленные рецепторные образования организма, наличии множества
взаимосвязанных информационных каналов, в виде рефлекторных ответов
реализуются лишь некоторые из воздействий. Целесообразность такого
ограничения очевидна, поскольку в противном случае одновременно
осуществляемые противодействующие рефлексы сделали бы просто
невозможной не только регуляцию, но и саму жизнедеятельность. Поэтому,
наряду с процессом возбуждения, т. е. возникновения активной деятельности,
распространение которого лежит в основе всех рефлексов, существует
второй процесс, ограничивающий и подавляющий возникновение и
распространение возбуждения в элементах нервной системы и тем самым не
позволяющий реализовываться рефлекторным актам. Этот второй основной
процесс в нервной системе называется торможение. Под торможением
понимают активный нервный процесс, возникающий при действии
распространяющихся нервных импульсов и проявляющийся в ослаблении или
подавлении возбуждения. Процесс торможения не способен
распространяться, он возникает и проявляется локально.
3.2.4. Механизмы связи между звеньями рефлекторной дуги
Передача возбуждения с отростка одной нервной клетки на отросток или
тело другой нервной клетки возможна двумя способами: электрическим
(электротоническим) и химическим. Электрический способ передачи
возбуждения осуществляется благодаря тесным контактам передающей и
воспринимающей структур (щель между мембранами меньше 2 нм).
Передача возбуждения в таком случае осуществляется аналогично его
проведению по нервным волокнам с помощью местных токов. Электрическая
передача возбуждения осуществляется с высокой скоростью, близкой
скорости проведения возбуждения по нервным волокнам и, так же как нерв,
практически неутомляема.
Основным способом передачи информации между нервными клетками
является химический, реализуемый с помощью специальных образований,
получивших название синапсов. Синапсы — это специализированная
форма контакта между отростками нейронов и любыми возбудимыми
образованиями (нейронами, мышечными или секреторными клетками),
обеспечивающая передачу сигнала с помощью молекул химических веществ,
называемых медиаторами. В нервной системе находятся центральные
синапсы, которые образуются между отростками разных нейронов, а также
между отростками и телами клеток. Соответственно их называют аксо-аксо-
нальными, аксодендритными, аксосоматическими, дендросоматическими,
дендро-дендритными. Количество синапсов на нейроне очень большое и
достигает нескольких тысяч (рис. 3.6). В качестве примера может быть
рассмотрен аксосоматический синапс (между аксоном одной нервной клетки
и телом другой), структура которого показана на рис. 3.7. Аксон, подходя к
телу другого нейрона, образует расширение, называемое пресинаптическим
окончанием, или терминалью. Мембрана такого окончания называется пре-
138 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Рис. 3.6. Множество синапсов на теле и
отростках нейрона.
1 — ядро, 2 — аксонный холмик, 3 — дендриты,
4 — миелиновая оболочка аксона, 5 —
синапсы, 6 — тело нейрона.
синоптической. Под ней
располагается синоптическая щель,
ширина которой составляет 20—40 нм.
За синаптической щелью лежит
мембрана тела нейрона,
называемая в области синапса постсинап-
тической.
Передача информации в
синапсах осуществляется с
помощью молекул специальных
химических веществ — медиаторов,
т. е. посредников передачи,
образуемых в терминали и выводимых
через пресинаптическую
мембрану в синаптическую щель.
Медиатор содержится в пресинаптиче-
ской терминали в пузырьках и его
выход происходит порциями
(квантами), равными
содержимому каждого пузырька.
Выделившиеся через
пресинаптическую мембрану кванты
медиатора диффундируют через
синаптическую щель к постси-
наптической мембране, где связываются со специальными химическими
клеточными рецепторами, специфическими для молекул медиатора. В
зависимости от химической природы медиатора и особенностей клеточных
рецепторов на постсинаптической
мембране возможны два эффекта
синаптической передачи сигнала:
возбуждение и торможение.
Соответственно и синапсы делят на
два типа: возбуждающие и
тормозные. Передача информации
через синапсы осуществляется
значительно медленнее, чем по
нервам или через тесные
контакты, поскольку для процессов
выведения медиатора, диффузии
через синаптическую щель,
связывания с рецепторами
постсинаптической мембраны требуется
больше времени. Прекращение
действия медиатора и
соответствующее завершение передачи
нервного импульса
осуществляется за счет удаления медиатора из
синаптической щели. Это
происходит в результате трех
процессов — обратного «захвата»
медиатора пресинаптическим
окончанием, разрушения медиатора
специальными ферментами, находя-
- 3 .v'Na* ca ::7
Рис. 3.7. Структура аксосоматического
синапса.
1 — аксон, 2 — синаптическая пуговка, 3 —
пресинаптическая мембрана, 4 — постсинапти-
ческая мембрана, 5 — рецепторы
постсинаптической мембраны, 6 — синаптические
пузырьки с медиатором, 7 — кванты медиатора в
синаптической щели, 8 — митохондрии, СаСб —
калыдийсвязывающий белок.
3. Общие принципы и механизмы регуляции физиологических функций • 139
Рис. 3.8. Структура нервно-мышечного синапса.
1 — пресинаптическая концевая пластинка, 2 — синаптические пузырьки с медиатором, 3 —
митохондрии, 4 — синаптическая щель с квантами медиатора, 5 — складчатая постсинаптиче-
ская мембрана, 6 — рецепторы постсинаптической мембраны, 7 — саркоплазматический рети-
кулум, 8 — сократительный аппарат (миофибриллы) мышечной клетки.
щимися у рецепторов постсинаптической мембраны, и диффузии
медиатора из синапсов в микроокружение клетки.
Энергетическое и субстратно-ферментативное обеспечение синаптиче-
ской передачи сигналов осуществляется с помощью аксонного транспорта
из тела клетки в пресинаптическое окончание белков и ферментов, орга-
нелл, в частности митохондрий, низкомолекулярных веществ и уже
синтезированных медиаторных веществ. Транспорт происходит с помощью ней-
рофибрилл или микротрубочек, тянущихся внутри аксона по всей его
длине. Аксонный транспорт требует обязательного участия ионов кальция, а
энергия для его реализации черпается из непрерывно ресинтезируемои в
аксоне АТФ. Помимо транспорта веществ по аксонам из тела нейрона к
синаптическому окончанию, существует и ретроградный аксонный
транспорт, обеспечивающий поступление от пресинаптического окончания в
тело клетки веществ, регулирующих в ней синтез белка.
Периферические синапсы. Периферические синапсы расположены между
окончаниями эфферентного нерва и мембраной эффектора. Для
соматических рефлексов это синапсы между двигательным нервом и скелетной
мышцей, поэтому их еще называют нервно-мышечными синапсами (рис. 3.8).
140 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Благодаря форме синаптического образования они получили название
концевых пластинок. Строение и основные свойства концевых пластинок в
общих чертах подобны центральным синапсам, однако постсинаптическая
мембрана у них имеет многочисленные складки, существенно
увеличивающие поверхность взаимодействия медиатора с рецепторами.
3.2.5. Нервные центры и их свойства
Нервным центром называют функционально связанную совокупность
нейронов, расположенных в одной или нескольких структурах центральной
нервной системы и обеспечивающих регуляцию определенных функций
организма. В более узком понимании применительно к рассматриваемой
структуре рефлекторного акта нервный центр как аппарат управления
представляет собой функциональное объединение разных нейронов,
обеспечивающее реализацию конкретного рефлекса. Основные общие свойства
нервных центров определяются тремя главными факторами: 1) свойствами
нервных клеток, входящих в состав центра, 2) особенностями структурно-
функциональных связей нейронов, 3) свойствами синапсов между
нейронами центра.
Функциональные свойства нервных клеток зависят от их строения,
локализации и связей, устанавливаемых отростками. С позиций
функционального предназначения различают 3 типа нейронов: афферентные, или
чувствительные, эфферентные и интернейроны (промежуточные).
Афферентные нейроны не входят в состав центра, по количеству отростков они
обычно униполярны, биполярны или псевдоуниполярны (т. е. имеют один
Т-образно делящийся отросток). Эти клетки получают сенсорную
информацию от рецепторов и осуществляют ее передачу нейронам центра.
Эфферентные нейроны обычно мультиполярны, т. е. имеют один аксон и
несколько дендритов, они осуществляют передачу информации из нервного
центра к эффекторам, например, мышцам. Наибольшую по количеству
группу нервных клеток в центральной нервной системе составляют
интернейроны, или ассоциативные нейроны, которые по своей форме обычно
мультиполярны, причем отростки клеток не покидают пределов
центральной нервной системы и их основной функцией является обеспечение
взаимосвязей между разными группами нейронов. Интернейроны могут быть
возбуждающими или тормозными, в зависимости от выделяемых на
окончаниях их отростков медиаторов. Тело и дендриты нервных клеток
являются структурами, которыми осуществляется интеграция поступающих к
нейрону многочисленных сигналов.
Функция нервных клеток связана с особенностями их метаболизма, в
частности, с высоким уровнем энергетических и пластических процессов.
Наиболее существенным отличием нейронов от других видов клеток
организма является интенсивный обмен нуклеиновых кислот и очень высокий
уровень транскрипции, т. е. синтеза молекул информационной РНК на
матрицах ДНК генома. Интенсивность транскрипции в нейронах
превышает более чем в 5 раз ее уровень в других клетках организма. Имеется
четкая взаимосвязь уровня синтеза белка в нейронах и характера их
электрической активности. Образуемые в нейронах специфические белки и
пептиды участвуют в регуляции эффективности синаптической передачи
сигналов и хранении информации, и, в конечном счете, реализации
рефлекторных актов и особенностей поведения.
Схематизировано наиболее простой формой связи нейронов центра
является нервная цепь (рис. 3.9, А), в которой возбуждение последовательно
3. Общие принципы и механизмы регуляции физиологических функций • 141
Рис. 3.9. Особенности распространения возбуждения в нейронных сетях.
А — нервная цепочка, Б — дивергенция возбуждения в нервной сети, В — конвергенция
возбуждения, Г — реверберация возбуждения в кольцевой цепи Лоренто де Но. Стрелки
показывают направление распространения возбуждения.
передается от одного нейрона к другому. Нервная цепь может содержать
всего два нейрона с одним синапсом между ними, соответственно
рефлекс, реализуемый через такой нервный центр, носит название моносинап-
тического. С увеличением числа нейронов и синапсов между ними время
рефлекторной реакции на раздражитель увеличивается, поскольку каждый
синапс имеет синаптическую задержку проведения. Такие рефлексы
называются полисинаптическими. Сигналы по нервным цепям
распространяются в одну сторону — от афферентного входа к эфферентному выходу —
благодаря одностороннему проведению в синапсах.
Нейроны нервного центра за счет структурно-функциональных связей
(ветвления отростков и установления множества синапсов между разными
клетками) объединяются в нервные сети. Связи между нервными клетками
являются генетически детерминированными.
Различают 3 основных типа нервных сетей: иерархические, локальные и
дивергентные с одним входом. Иерархические сети обеспечивают
постепенное включение нейронных структур более высокого уровня. В тех
случаях, когда афферентная информация поступает к увеличивающемуся
числу нейронов, принято говорить о дивергенции возбуждения (рис. 3.9, Б).
Если, напротив, от многих возбужденных клеток информация
(возбуждение) сходится к меньшему числу нейронов, то такой принцип
распространения сигналов называется конвергенцией (рис. 3.9, В). Так, например,
конвергенция в эффекторном пути двигательных спинальных рефлексов
ведет к тому, что малое число двигательных клеток (мотонейронов)
спинного мозга получает импульсы возбуждения от различных эфферентных
путей многих рефлекторных дуг. Изучая этот механизм на уровне
спинного мозга, Ч. Шеррингтон сформулировал принцип общего конечного пути,
согласно которому мотонейроны спинного мозга являются общим
конечным путем многочисленных рефлексов (мотонейроны, управляющие
сгибателями правой руки, участвуют в многочисленных двигательных
рефлекторных реакциях — почесывании, жестикуляции при речи, переносе пищи
в рот и т. п.). Соответственно на уровне многочисленных синапсов
конвергентных путей возникает конкуренция за общий конечный путь.
Однако конвергенция существует и для афферентной информации, когда на
ограниченном числе нейронов конвергируют сигналы, приходящие от
разных сенсорных систем (слуха, обоняния, зрения и т. п.), что позволяет
формировать в нервных центрах полноценный образ воспринимаемого
объекта.
142 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Нервные сети обеспечивают реализацию принципа субординации, когда
деятельность ниже расположенных нейронных структур подчинена выше
расположенным. «Выше» и «ниже» здесь означает уровень расположения в
отделах мозга, например, нейроны спинного мозга подчинены влияниям
со стороны головного мозга.
Локальные сети нервных центров содержат нейроны с короткими
аксонами, осуществляющие взаимосвязи в пределах одного уровня. Они
обеспечивают задержку информации в пределах этого уровня, что играет роль в
механизмах памяти. Примером такой локальной сети являются кольцевые
нейронные цепочки Лоренто де Но, возбуждение в которых циркулирует
по замкнутому кругу (рис. 3.9, Г). Возврат возбуждения к «первому»нейро-
ну кольцевой цепи получил название реверберации возбуждения.
Локальные сети обеспечивают надежность нервной регуляции за счет
дублирования элементов, так как многие нейроны локальных сетей имеют
одинаковые синаптические связи и функционируют попеременно, т. е. являются
взаимозаменяемыми.
Дивергентные сети с одним входом представляют собой нейронные
ансамбли, в которых один нейрон образует выходные связи с большим
количеством других клеток разных иерархических уровней и, главное, разных
нервных центров. Максимально выраженная дивергенция связей разных
нервных центров свидетельствует о том, что эти нервные сети не являются
специфическими для реализации определенных рефлексов, а обеспечивают
интеграцию разных рефлекторных актов и общее состояние активности
многочисленных нейронов разных отделов мозга.
Поскольку в нервных сетях включено огромное число интернейронов,
они могут, передавая нервные импульсы другим нейронам центра, реали-
зовывать как их возбуждение, так и торможение. Различают следующие
типы тормозных процессов в нейронных сетях:
• реципрокное торможение (рис. 3.10, В), т. е. процесс, основанный на
том, что сигналы по одним и тем же афферентным путям
обеспечивают возбуждение одной группы нейронов, а через вставочные
тормозные клетки вызывают торможение другой группы нейронов. Этот тип
торможения называют иначе сопряженным. Проявляется реципрокное
торможение, например, на уровне мотонейронов спинного мозга, ин-
нервирующих мышцы-антагонисты (сгибатели-разгибатели)
конечностей. Передача возбуждения к мотонейронам мышц-сгибателей
одновременно через вставочные тормозные нейроны тормозит
мотонейроны мышц-разгибателей, благодаря чему только и возможно
осуществление сгибательного рефлекса;
• возвратное торможение (рис. 3.10, Г), т. е. процесс торможения
эфферентных нейронов сигналами, возвращающимися к ним по колла-
тералям аксонов через вставочные тормозные клетки. Возбуждение от
одних нейронов поступает через ответвления на аксонах к
вставочным тормозным нейронам, а аксоны этих клеток в свою очередь
образуют тормозные синапсы на телах первых нейронов. Примером
является торможение Реншоу в спинном мозге, где импульсы от
двигательных нейронов посылаются по аксонам не только к скелетной
мышце, но поступают через аксонные коллатерали к тормозным
интернейронам Реншоу, а от них назад к двигательным нейронам,
приводя к их торможению. Таким образом осуществляется короткая
отрицательная обратная связь, не позволяющая возникнуть
избыточному возбуждению мотонейронов спинного мозга;
• латеральное торможение (рис. 3.10, Б), т. е. процесс торможения
3. Общие принципы и механизмы регуляции физиологических функций • 143
Рис. 3.10. Тормозные процессы в нейронных сетях центра.
А — окружающая тормозная зона, Б — латеральное торможение, В — реципрокное
торможение в центрах спинного мозга, управляющих сокращениями мышц-сгибателей (С) и
-разгибателей (Р) нижних конечностей, Г — возвратное торможение (Реншоу) в спинном мозге. Знаки
(+) и (—) — соответственно возбужденное и заторможенное состояние нейронов, стрелки —
направление распространения возбуждения.
группы нейронов, расположенной рядом с группой возбужденных
клеток. Этот вид торможения распространен в сенсорных системах,
где ответвления аксонов возбужденных нейронов образуют синапсы
на вставочных тормозных нейронах, а аксоны последних
оканчиваются тормозными синапсами на соседних, рядом расположенных
клетках, получающих информацию от другого афферентного входа.
Благодаря явлению латерального торможения удается различать контраст
в освещенности объектов, звуковые тоны и другие различия
воспринимаемых раздражителей;
• тормозная зона, т. е. процесс торможения нескольких групп
нейронов, расположенных рядом с возбужденными клетками. Сигналы от
возбужденных нейронов по коллатералям аксонов поступают к
вставочным нейронам, а аксоны последних образуют тормозные синапсы
на группах клеток, получающих информацию по другим
афферентным входам (рис. 3.10, А). Если эта группа заторможенных клеток
располагается вокруг возбужденных нейронов, тормозную зону
называют окружающей;
• нисходящее торможение, т. е. процесс торможения ниже
расположенных или эволюционно более древних структур нервной системы
выше расположенными или эволюционно более новыми нейронными
структурами головного мозга. Реализация нисходящего торможения
способствует реализации принципа субординации нервных центров.
144 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
3.2.6. Взаимодействие различных рефлексов. Принципы
координации рефлекторной деятельности
Поскольку в организме одновременно или последовательно реализуется
обычно несколько рефлексов, простейшие связи между ними
характеризуются тремя вариантами взаимодействия. Во-первых, рефлексы могут
взаимно содействовать друг другу, облегчая реализацию требуемого эффекта.
Такие рефлексы называют аллиированными, или союзными. Примерами ал-
лиированных рефлексов являются рефлексы мигания и слезоотделения,
слюноотделения и глотания. Во-вторых, рефлексы могут оказывать друг на
друга тормозящее влияние, и тогда их называют антагонистическими.
Например, рефлекс глотания тормозит рефлекс вдоха, рефлекс разгибания
тормозит рефлекс сгибания конечности. В-третьих, взаимодействие между
рефлексами может быть последовательным, когда один рефлекс, а вернее
его результат, вызывает возникновение другого рефлекса. Такие рефлексы
называют цепными, причем в цепи может быть взаимосвязано большое
число разных рефлексов. Простейшими цепными рефлексами являются,
например, шагательный рефлекс, когда сгибательный рефлекс (сгибание
ноги) становится причиной следующего за ним разгибательного, а он в
свою очередь вызывает сгибательный рефлекс и т. д.
При реализации сложных рефлекторных реакций, обеспечивающих
регуляцию жизнедеятельности и приспособление организма к меняющимся
условиям среды, необходимым условием является координация рефлексов, в
основе которой лежит согласованное формирование и взаимодействие
процессов возбуждения и торможения в центральной нервной системе.
Основными принципами координации являются: принцип сопряженного
торможения (реципрокности), принцип доминанты, принцип общего
конечного пути, принцип субординации нервных центров, принцип
обратной афферентации.
• Принцип сопряженного торможения, или реципрокности, базируется на
описанном выше одноименном виде торможения и означает
возникновение при возбуждении одного центра одновременного
торможения другого центра для обеспечения цепных рефлексов и сложной
функции. Примером реципрокности может быть регуляция спинным
мозгом противоположных по функциональному назначению мышц
конечностей (рис. 3.11). Так, при возбуждении мотонейронов, иннер-
вирующих мышцы-сгибатели правой ноги, реципрокно тормозятся
мотонейроны мышц-разгибателей этой ноги и возбуждаются
мотонейроны мышц-разгибателей левой ноги. Формирующийся цепной
характер рефлексов вслед за этим вызывает возбуждение
мотонейронов разгибателей правой ноги и реципрокно — торможение
мотонейронов сгибателей правой ноги и возбуждение мотонейронов
сгибателей левой ноги. Таким образом реципрокные взаимоотношения
между указанными рефлексами обеспечивают цепной шагательный
рефлекс.
• Принцип доминанты основан на открытом А. А. Ухтомским свойстве
нервных центров. Доминантой называют общий принцип
деятельности нервной системы, проявляющийся в виде господствующей в
течение определенного времени системы рефлексов, реализуемых
доминирующими центрами, которые подчиняют себе или подавляют
деятельность других нервных центров и рефлексов. Нейроны доминини-
рующих центров становятся более возбудимыми и способны
эффективнее осуществлять пространственную и временную суммацию
3. Общие принципы и механизмы регуляции физиологических функций • 145
Молекула гормона (первичный посредник)
Рецептор клеточной мембраны
Рис. 3.11. Принцип реципрокности в рефлекторной регуляции мышц-антагонистов.
Возбуждение мотонейронов (1) мышцы-сгибателя тормозит через тормозные интернейроны
(2) мотонейроны мышцы-разгибателя (3). Знаки (+) и (-) — соответственно возбуждение и
торможение.
нервных импульсов. Синаптическое проведение к этим нейронам
облегчено, и поэтому они могут возбуждаться и за счет «посторонних»
импульсов от не имеющих прямых связей с доминирующими
центрами информационных каналов. Вследствие суммации многочисленных
сигналов возбуждение нейронов, как и число возбужденных клеток в
доминирующем центре, нарастает и осуществляемые им
рефлекторные реакции легко реализуются. Преобладание рефлексов
доминирующего центра над другими рефлекторными актами становится
особенно выраженным, поскольку через систему вставочных нейронов
доминирующий центр сопряженно тормозит другие центры и
текущие рефлексы. Принцип доминанты позволяет концентрировать
внимание и строить поведение для достижения определенной
намеченной цели.
Принцип общего конечного пути, описанный Ч. Шеррингтоном,
рассматривался при изложении процесса конвергенции возбуждения.
Принцип субординации нервных центров (принцип подчинения)
Проявляется в виде регулирующего влияния выше расположенных нервных
центров на ниже расположенные. Так, двигательные центры
головного мозга управляют спинальными мотонейронами. Примером такого
влияния является феномен центрального торможения спинальных
рефлексов, открытый И. М. Сеченовым и получивший название
сеченовского торможения. В эксперименте И. М. Сеченова
раздражение зрительных бугров лягушки с помощью кристаллика поваренной
соли (т. е. раздражение ретикулярной формации среднего мозга) при-
146 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
водило к торможению спинальных двигательных рефлексов,
вызываемых погружением лапки лягушки в слабый раствор кислоты.
Следовательно, торможение центров спинного мозга явилось следствием
возбуждения центров среднего мозга. Прекращение этого тормозного
контроля при перерыве цереброспинальных проводящих путей
вызывает резкое повышение возбудимости спинальных центров и
гиперрефлексию.
• Принцип обратной афферентации заключается в рецепторном
восприятии результатов рефлекторного акта и проведении информации
обратно в структуры нервного центра, где она обрабатывается и
сравнивается с сохраняющимися параметрами возбуждения. Обратная аффе-
рентация реализуется в виде механизмов положительной или
отрицательной обратной связи. Таким образом, с помощью обратной
афферентации нервные центры осуществляют непрерывный контроль
эффективности, целесообразности и оптимальности рефлекторной
деятельности.
3.2.7. Рефлекторная регуляция висцеральных функций
Висцеральными функциями называют физиологические процессы,
осуществляемые внутренними органами, железами, сердцем, кровеносными и
лимфатическими сосудами, гладкой мускулатурой, клетками крови и
направленные на поддержание обмена веществ, роста, развития и
размножения. Регуляция висцеральных функций осуществляется вегетативной
нервной системой, реализующей эфферентные сигналы рефлексов,
получивших название вегетативных. Так, например, при растяжении желудка
пищей происходит раздражение механорецепторов, заложенных в его стенке
и являющихся окончаниями блуждающего нерва. По афферентным
волокнам этого нерва импульсы от рецепторов поступают в нервный центр
продолговатого мозга, а из него по эфферентным волокнам того же
блуждающего Нерва посылаются к сердцу, вызывая замедление ритма его
сокращений. Таким образом, структурной основой вегетативных рефлексов, как и
соматических, является рефлекторная дуга (или с обратной связью —
кольцо).
3.3. Произвольная (волевая) регуляция физиологических функций
В отличие от автоматической непроизвольной рефлекторной регуляции,
при которой регуляторный эффект является следствием действия
раздражителя, т. е. ответной реакцией организма на воздействия внешней или
внутренней среды, произвольная нервная регуляция осуществляет
изменение функции под влиянием волевой команды, т. е. нервных импульсов,
формирующихся в высших отделах головного мозга, в том числе в коре
больших полушарий. Так, например, помимо рефлекторной регуляции
дыхания, обеспечивающей возникновение вдоха, его смену выдохом,
изменения частоты и глубины дыхания, человек может произвольно задерживать
дыхание, дышать чаще или реже. Наряду с автоматическим рефлекторным
разгибанием ноги в коленном суставе при ударе молоточком по
сухожилию коленной чашечки, человек может произвольно осуществлять то же
движение. Однако произвольная регуляция свойственна не всем
физиологическим системам. Как правило, произвольная регуляция направлена на
осуществление поведения, т. е. психической деятельности, регулирующей
взаимоотношения организма и окружающей среды. В основе произволь-
3. Общие принципы и механизмы регуляции физиологических функций • 147
ной регуляции лежит потребность в изменении функции и образование
мотивации, т. е. побуждения к деятельности.
Многообразие потребностей организма определяет и множество
мотиваций, среди которых выделяют 3 основные группы: биологические,
социальные и творческие. Биологические мотивации есть результат наличия
потребностей в пищевых веществах, воде и солях, продолжении рода и т. п.
Значительная часть биологических мотиваций обусловлена
необходимостью поддержания гомеостазиса. Социальные мотивации — трудовые,
познавательные, эстетические, нравственные. Мотивации, возникающие в
результате ориентировочных потребностей, обеспечивают стремление к
познанию непонятных или новых явлений (познавательная мотивация),
регулирование своих действий в зависимости от эмоционального отношения к
ним других людей (мотивация эмоционального контакта), стремление
соотносить ценность своей личности с коллективными и общечеловеческими
ценностями (мотивация смысла жизни). Творческие мотивации, или
идеальные потребности, возникают как в результате необходимости создания
эстетически или познавательно ценных новых вещей, так и как следствие
потребности в признании, успехе.
Благодаря мотивациям поведение направлено на достижение
определенной цели и может становиться приспособительным. Так, в условиях
низкой температуры окружающей среды наряду с рефлекторными
автоматическими реакциями приспособления (ограничение теплоотдачи,
усиление образования тепла в тканях) произвольно реализуется
приспособительное поведение — человек утепляет жилище, надевает сохраняющую
тепло одежду и т. п.
3.4. Гормональная регуляция функций организма
Генерализованные специализированные эффекты гуморальной регуляции
осуществляются с помощью особых химических регуляторов внутренней
среды — гормонов. Гормонами называют химические вещества,
образующиеся и выделяющиеся специализированными эндокринными клетками
(например, р-клетки островков Лангерганса секретируют гормон инсулин),
тканями и органами (щитовидной железой, надпочечниками и др.) во
внутреннюю среду для регуляции обмена веществ и физиологических
функций организма, гуморального обеспечения координации и интеграции
процессов жизнедеятельности. Гормоны отличают от других биологически
активных веществ, например метаболитов и медиаторов, по двум
основным критериям: 1) гормоны образуются специализированными
эндокринными клетками, 2) гормоны оказывают свое влияние через внутреннюю
среду на удаленные от секретирующей их ткани клетки-мишени, т. е.
обладают дистантным действием.
Гормоны являются чрезвычайно высокоактивными химическими
соединениями, их концентрации в крови выражаются в нанограммах и даже в
пикограммах. Согласно расчетам, 1 г адреналина способен активировать
100 миллионов сердец лягушки, 1 г фолликулина может вызвать течку у 10
миллионов кастрированных мышей, 1 г инсулина — снизить уровень
глюкозы в крови у 125 тысяч кроликов. Гормоны оказывают выраженное
положительное влияние на эмоциональную сферу, интеллектуальную и
физическую активность, выносливость организма, половое поведение.
Эндокринные клетки, образующие гормоны, получили свое название
благодаря наличию у них специализированной функции внутренней
секреции (инкреции), т. е. активного выведения образовавшихся информацион-
148 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
ных молекул — гормонов — во внутреннюю среду. Эти
специализированные клетки образуют эндокринную систему, т. е. функциональное
объединение всех инкреторных клеток организма, осуществляющее
гормональную регуляцию.
Гормональная регуляция, как и любая система регуляции, имеет аппарат
управления, каналы прямой и обратной передачи информации, сигналы,
которыми информация передается, исполнительные органы или объекты
управления. Эти элементы системы названы звеньями и составляют
структурно-функциональную организацию системы гормональной регуляции.
3.4.1. Общая характеристика звеньев гормональной системы
регуляции
Звенья управления. Деятельность эндокринных клеток управляется
(регулируется) нервными центрами и гормонами других эндокринных
образований, т. е. нейроэндокринным путем. Для некоторых эндокринных клеток
основным путем управления является местная саморегуляция за счет
механизма обратной связи (например, секреция сахаррегулирующих гормонов"
островками Лангерганса регулируется уровнем глюкозы в крови, секреция
кальцийрегулирующих гормонов — паратирина и кальцитонина — уровнем
кальция в крови), а звенья нейро гуморального управления обеспечивают
лишь усиление или ослабление эффекта местной саморегуляции.
Нервная система (рис. 3.12) осуществляет регуляцию деятельности
эндокринных клеток двумя путями. Первый из них реализуется структурами
центральной нервной системы, непосредственно передающими нервные
импульсы к эндокринным структурам, синтезирующим и секретирующим
гормоны. Этот путь управления получил название нервного, или парагипо-
физарного, т. е. реализуемого мимо гипофиза. Так регулируется
деятельность практически всех эндокринных клеток. Второй путь управления
эндокринными клетками нервная система реализует через гипофиз,
обозначаемый в этом случае как гуморальное звено управления; этот путь
регуляции получил название гипофизарного. Таким путем регулируется деятель-
Цереброгландулярный, или парагипофизарный, путь регуляции
Рис. 3.12. Основные пути регуляции эндокринной системы.
Пунктирные стрелки — обратные связи регуляции.
3. Общие принципы и механизмы регуляции физиологических функций • 149
ность тех желез, для которых в гипофизе секретируются специальные
тропные гормоны или тропины, например щитовидная железа или кора
надпочечников.
Центральной для регуляции эндокринных функций структурой нервной
системы является гипоталамус. Этот отдел осуществляет оба пути
управления, т. е. и нервный, и гипофизарный. Управляющая функция
гипоталамуса связана с наличием здесь групп нейронов, обладающих способностью
синтезировать и секретировать специальные регуляторные пептиды — ней-
рогормоны. Таким образом, гипоталамус является одновременно и
нервным, и эндокринным образованием, играя ключевую роль в интеграции
нервных и гуморальных механизмов регуляции, осуществляя нейрогумо-
ральное управление функциями. Свойство нейронов гипоталамуса
синтезировать и секретировать регуляторные пептиды получило название нейро-
секреции. В принципе, этим свойством обладают все нервные клетки,
поскольку нейроны транспортируют синтезированные в них белки,
ферменты и другие молекулы с помощью аксонального тока. У нейронов
гипоталамуса эта способность приобрела специфические свойства регуляторов
эндокринной системы.
Нейросекрет, образующийся в теле гипоталамического нейрона,
хранится в нем в виде гранул и путем аксонального транспорта переносится в
структуры мозга, ликвор или гипофиз. Соответственно направлению
транспорта, в гипоталамусе человека выделены 3 нейроэндокринные
системы.
1) Гипоталамо-экстрагипоталамная система представлена нейросекре-
торными клетками, аксоны которых уходят за переделы гипоталамуса в
другие структуры головного мозга — таламус, лимбику, продолговатый
мозг — и выделяют нейропептиды, выполняющие медиаторную и
модуляторную роль: вазопрессин, эндогенные опиоиды, нейротензин, вещество
Р, соматостатин, киоторфин и др.
2) Гипоталамо-аденогипофизарная (переднегипофизарная) система
образована пептид- и моноаминергическими нейросекреторными клетками
мелкоклеточных ядер заднего гипоталамуса. Аксоны этих клеток образуют
контакты в области срединного возвышения на капиллярах (аксовазальные
контакты) первичной сети портальной системы гипофиза, в которую и
поступают нейропептиды, стимулирующие (либерины) или подавляющие
(статины) синтез и секрецию тропных гормонов аденогипофиза. Таким
образом, связь гипоталамуса с аденогипофизом осуществляется нейроге-
мальным путем (через кровь).
3) Гипоталамо-нейрогипофизарная (заднегипофизарная) система
представлена нейросекреторными клетками крупноклеточных ядер переднего
гипоталамуса — супраоптического и паравентрикулярного. Аксоны этих
клеток опускаются в нейрогипофиз, по ним в заднюю долю гипофиза
поступают и депонируются нейропептиды вазопрессин и окситоцин,
связанные со специфическими белками нейрофизинами.
Гипоталамические нейропептиды в зависимости от места реализации
регуляторного эффекта делят на три группы: 1) висцерорецепторные ней-
рогормоны, обладающие преимущественным действием на висцеральные
органы (вазопрессин, окситоцин), 2) нейрорецепторные нейрогормоны
или нейромодуляторы и медиаторы, обладающие выраженными
эффектами на функции нервной системы (эндорфины, энкефалины, нейротензин,
вазопрессин, ангиотензин и др.), 3) аденогипофизрецепторные
нейрогормоны, регулирующие деятельность железистых клеток аденогипофиза
(кортиколиберин, соматостатин, тиреолиберин и др.).
150 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Звенья общего и гуморального управления имеют многочисленные
обратные связи, контролирующие процессы синтеза и секреции, уровень
гормонов в крови и реализацию их эффектов в органах и тканях.
Звено синтеза и секреции гормонов. Особенности синтеза гормонов в
эндокринных клетках зависят от химической структуры гормонов. По
химической природе все гормоны подразделяют на три группы: 1) производные
аминокислот — тиреоидные гормоны, адреналин, гормоны эпифиза;
2) пептидные гормоны, простые (протеины) и сложные (гликопротеиды)
белки — гипоталамические нейропептиды, гормоны гипофиза, островково-
го аппарата поджелудочной железы, околощитовидных желез; 3)
стероидные гормоны, образующиеся из холестерина гормоны коры
надпочечников, половых желез, гормон почечного происхождения кальцитриол.
Синтез гормонов эндокринными клетками происходит непрерывно, его
интенсивность зависит не только от регуляторных сигналов звена
управления, но и от величины секреции. Известный в биохимии принцип
торможения синтеза конечным продуктом обусловливает подавление
образования гормонов при сниженном их удалении из клеток и, напротив,
активация секреции повышает синтез гормонов. Таким образом, звенья синтеза и
секреции гормонов взаимосвязаны.
Звено депонирования связано с синтезом и секрецией гормонов,
поскольку гормоны обычно депонируются в тех же клетках тканей, где
образуются. Депонирование гормонов эндокринной тканью может осуществляться в
специализированных гранулах (мозговое вещество надпочечников) или в
специализированных структурах железы (коллоид фолликулов щитовидной
железы). Гормоны депонируются в виде связанных форм с белками, мак-
роэргическими фосфатами, нуклеопротеидами или металлами. Однако
некоторые гормоны могут депонироваться и в несекреторных тканях,
клетками которых они захватываются из крови. Так, например, могут
депонироваться катехоламины.
Звено транспорта представлено жидкостями внутренней среды,
например кровью, переносящими гормоны как в свободной, так и в связанной
формах. Связывание гормонов происходит как с мембранами клеток крови
(эритроциты, тромбоциты), так и с белками плазмы крови, при этом
активность таких связанных форм крайне низкая, поскольку они плохо
проходят через гистогематические барьеры и не могут взаимодействовать со
специфическими для них клеточными рецепторами. Свободные (т. е.
несвязанные) формы гормонов являются активными, поскольку проходят
через барьеры, взаимодействуют с мембранными рецепторами и вызывают
физиологические эффекты. Вместе с тем физико-химическая связь
гормонов с клетками крови и белками плазмы является формой их
депонирования во внутренней среде, поскольку удаление связанных гормонов во
внешнюю среду через органы выделения затруднено, а при необходимости
гормоны могут освобождаться из связанных форм, переходить в свободную
активную форму и вызывать регуляторные эффекты без дополнительной
активации их синтеза и секреции.
Транспорт гормонов кровью участвует в реализации механизма
обратной связи со звеном управления, поскольку содержащиеся в крови
гормоны могут прямо воздействовать на гипоталамус или гипофиз.
Звено метаболизма гормонов требуется не только для разрушения
образовавшихся гормонов, но и для уменьшения числа информационных
молекул и ослабления их регуляторного эффекта. Метаболические
превращения гормонов приводят к образованию новых информационных молекул с
отличающимися от основного гормона свойствами, метаболическими и
3. Общие принципы и механизмы регуляции физиологических функций • 151
физиологическими эффектами. Метаболизм гормонов осуществляется под
влиянием ферментов в самих эндокринных тканях, печени, почках и в
тканях-эффекторах. Образование при метаболизме гормонов новых
информационных молекул в тканях-эффекторах обеспечивает в них
реализацию и новых биохимических и физиологических эффектов. Так,
например, дейодирование тироксина в клетках-мишенях ведет к образованию
трийодтиронина, обладающего значительно более сильным
физиологическим эффектом; метаболизм аланиновой боковой цепи тиреоидных
гормонов приводит к образованию тироуксусных кислот с более выраженным
эффектом на энергетический обмен клеток. В то же время снижение
метаболической деградации молекул гормонов в печени влечет за собой
избыточный эффект гормонов на ткани, несмотря на то что эндокринные
клетки не повышают секреции гормонов. Многие метаболиты гормонов
выделяются из организма с мочой и их концентрации в моче исследуются для
оценки функции железы.
Звено выделения гормонов представлено в организме почками, потовыми
железами, слюнными железами, желчью и пищеварительными соками.
Выведение информационных молекул гормонов и их метаболитов из крови
происходит в наибольшей степени через почки с мочой. Выведение
гормонов, наряду с депонированием и метаболическим разрушением, защищает
организм от избыточности гормональных эффектов.
В звене эффектора гормонов осуществляется реализация биохимических
и физиологических эффектов гормональной регуляции. Поступая через
жидкую внутреннюю среду к клеткам эффекторов, гормоны связываются
со специфическими для них клеточными рецепторами. В связи с этим
влияния гормонов не диффузные, предназначенные всем клеткам
организма, а строго специфичные, адресованные конкретным клеткам,
содержащим рецепторы к определенному гормону. Соответственно, и
чувствительность разных тканей к гормональному регулирующему воздействию
неодинакова, так как определяется наличием и количеством специфических
рецепторов. Ткани, имеющие большое количество рецепторов с высоким
сродством к определенному гормону, называют тканями- или органами-
мишенями этого гормона. В зависимости от локализации в клетках
рецепторы делят на плазматические (расположенные на плазматической
мембране клеток), цитозольные (находящиеся в цитоплазме), и ядерные
(локализованные в ядре).
3.4.2. Виды и пути действия гормонов
Различают пять видов действия гормонов на ткани-мишени:
метаболическое, морфогенетическое, кинетическое, корригирующее и реактогенное.
• Метаболическое действие гормонов вызывает изменение обмена
веществ в тканях. Оно происходит за счет трех основных гормональных
влияний. Во-первых, гормоны меняют проницаемость мембран
клетки и органоидов и транспорт через них субстратов, ферментов, ионов
и метаболитов. Во-вторых, гормоны меняют активность ферментов в
клетке. В-третьих, гормоны изменяют синтез ферментов, индуцируя
или подавляя их образование за счет влияния на генетический
аппарат ядра клетки, как прямо вмешиваясь в процессы синтеза
нуклеиновых кислот и белка, так и опосредованно через энергетическое и
субстратно-ферментное обеспечение этих процессов. Сдвиги
метаболизма, вызываемые гормонами, лежат в основе изменения функций
клеток, ткани или органа.
152 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Молекула гормона (первичный посредник)
Рецептор клеточной мембраны
Мембранный фермент
Вторичный посредник
Внутриклеточные эффекты
Изменение метаболизма
Изменение функции
Рис. 3.13. Схема действия пептидных гормонов на клетки-эффекторы с участием
вторичных посредников.
Молекула гормона, называемая также первичным посредником регуляции функции)
связывается со специфичным для нее рецептором клеточной мембраны. Образование гормон-ре цеп-»
торного комплекса приводит к активации мембранного фермента (например, аденилатцикла-
зы), под влиянием которого в клетке происходит образование молекул вторичного посредника
(например, циклической АМФ). Вторичный посредник ведет к активации внутриклеточных
ферментов (протеинкиназ), способствующих фосфорилированию субстратов, что и
обеспечивает формирование внутриклеточных эффектов в виде изменения проницаемости клеточных
мембран, изменения метаболических процессов и активации генома. Следствием этих
внутриклеточных эффектов вторичного посредника регуляторного сигнала является изменение
функции клетки.
Морфогенетическое действие — это стимулирующее влияние
гормонов на процессы формообразования, дифференцировки и роста
структурных элементов. Осуществляются эти процессы за счет
активации генетического аппарата клетки и обмена веществ.
Примерами может служить влияние соматотропина на рост тела и
внутренних органов, половых гормонов — на развитие вторичных половых
признаков.
Кинетическое действие — способность гормонов запускать
деятельность эффектора, включать реализацию определенной функции.
Например, окситоцин вызывает сокращение мускулатуры беременной
матки; адреналин запускает распад гликогена в печени и выход
глюкозы в кровь, вазопрессин включает обратное всасывание воды в
собирательных трубочках нефрона, без него не происходящее.
Корригирующее (исправляющее) действие — изменение деятельности
органов или процессов, которые осуществляются независимо от
наличия гормона. Примером корригирующего действия гормонов
является влияние адреналина на частоту сердечных сокращений, актива-
3. Общие принципы и механизмы регуляции физиологических функций • 153
У
Синтез белков
\
Рис. 3.14. Схема классического пути действия стероидных гормонов на
клетки-эффекторы.
Благодаря липофильности молекула гормона проникает через клеточную мембрану и в
цитоплазме взаимодействует с плазматическим рецептором. Гормон-рецепторный комплекс
проникает в ядро клетки, где после связывания с ядерным рецептором гормон вызывает
активацию процессов транскрипции и трансляции, приводящих к стимуляции синтеза белков, в том
числе ферментов и, таким образом, изменяя метаболизм и функцию клетки.
ция окислительных процессов тироксином, уменьшение обратного
всасывания ионов калия в почках под влиянием альдостерона.
Разновидностью корригирующего действия является нормализующий
эффект гормонов, когда их влияние направлено на восстановление
измененного или даже нарушенного процесса. Например, при
исходном превалировании анаболических процессов белкового обмена
глюкокортикоиды вызывают катаболический эффект, но если
исходно преобладает распад белков, глюкокортикоиды стимулируют их
синтез.
• Реактогенное действие гормонов — способность гормона менять
реактивность ткани к действию того же гормона, других гормонов или
медиаторов нервных импульсов. Так, например, избыток кальцийре-
гулирующих гормонов снижает чувствительность дистальных отделов
нефрона к действию вазопрессина, тиреоидные гормоны усиливают
эффекты катехоламинов. Разновидностью реактогенного действия
гормонов является пермиссивное действие, означающее способность
одного гормона давать возможность реализоваться эффекту другого
гормона. Так, например, глюкокортикоиды обладают пермиссивным
действием по отношению к катехоламинам, т. е. для реализации
эффектов адреналина необходимо присутствие малых количеств корти-
I
154 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
зола, инсулин обладает пермиссивным действием для соматотропина
(гормона роста) и др. Особенностью гормональной регуляции
является то, что реактогенное действие гормоны могут реализовать и в тех
тканях и органах, где имеется лишь небольшое число рецепторов к
гормону.
Пути действия гормонов на эффекторы рассматриваются в виде двух
возможностей: 1) действия гормона (первичного посредника регуляции) с
поверхности клеточной мембраны после связывания со специфическим
рецептором, что ведет к активации мембранного фермента, образованию
химического вторичного посредника и запуска тем самым цепочки
биохимических превращений в мембране, цитоплазме и ядре клетки
(преимущественно эффекты пептидных гормонов и катехоламинов) (рис. 3.13);
2) действия гормона, путем проникновения через мембрану благодаря
растворимости в липидах и связывания с рецептором цитоплазмы (рис. 3.14),
после чего гормон-рецепторный комплекс проникает в ядро и органоиды
клетки, где и реализует свой регуляторный эффект (преимущественно,
стероидные гормоны, гормоны щитовидной железы). Однако эти
возможности не альтернативны, так как для многих гормонов существуют оба пути
действия на эффектор. В частности, для стероидных гормонов
установлены два пути действия на клетку: 1) классический, ядерный или геномный
(проникновение в ядро и активация процессов транскрипции, трансляции
и синтеза) и 2) альтернативный негеномный (связывание с мембранным
рецептором и активация вторичных посредников).
3.5. Местная гуморальная регуляция функций клеток
Физиологический контроль процессов пролиферации и дифференцировки
клеток, синтеза и продукции ими белков, гликопротеидов, липидов и
других веществ, жизнедеятельности клеток вплоть до их гибели
осуществляется с помощью взаимодействия многочисленных внеклеточных регулятор-
ных молекул (называемых лигандами) с различными классами рецепторов
клеточных мембран.
Местная регуляция функций клеток обеспечивается тремя основными
способами, в основе которых лежит передача химических сигналов в
пределах одной ткани или органа с помощью: 1) креаторных связей клеток,
2) простейших метаболитов и 3) более сложных продуктов обмена —
биологически активных веществ.
Понятие креаторные связи обозначает обмен между клетками
макромолекулами, несущими информацию, необходимую для направленного
регулирования внутриклеточного синтеза молекул белка и других процессов с
целью объединения клеток в ткань, обеспечения дифференцировки, роста
и развития и, в конечном счете функционирования отдельных клеток
ткани как единой многоклеточной системы. Межклеточное взаимодействие
через микрокружение клеток является одним из наиболее эволюционно
старых способов регуляции, возникших с появлением многоклеточных
организмов.
Межклеточное взаимодействие обеспечивается, преимущественно,
следующими факторами: 1) адгезивными молекулами клеточных мембран,
2) внеклеточным матриксом с содержащимися в нем макромолекулами,
3) растворимыми медиаторами межклеточного взаимодействия, 4)
сверхслабым свечением (биохемилюминесценция) типа митогенетического
излучения в короткой ультрафиолетовой области, 5) онкогенами, 6)
электрическими потенциалами.
3. Общие принципы и механизмы регуляции физиологических функций • 155
Наиболее тесное взаимодействие между однотипными клетками
осуществляется в области десмосом.
На поверхности клеток расположены многочисленные мембранные гли-
копротеины, обеспечивающие взаимодействие клеток. Ключевую роль во
взаимодействии клеток между собой и с экстрацеллюлярным матриксом
играют несколько классов мембранных рецепторных молекул: селектины,
иммуноглобулины, кадгерины, интегрины, адрессины. Описано 3 вида се-
лектинов: L, Р и Е. Являясь рецепторами клеточной адгезии (прилипания),
они обеспечивают задержку лимфоцитов в лимфатических узлах (L-селек-
тин), адгезию тромбоцитов и лейкоцитов в места поврежденного
эндотелия и участки тромбообразования (Р-селектин) и адгезию активированных
клеток эндотелия к нейтрофилам (Е-селектин). Иммуноглобулиновые
рецепторы представлены в клеточных мембранах как минимум 11 видами
молекул, обеспечивающими адгезию лейкоцитов и эндотелия, рост и диффе-
ренцировку в эмбриогенезе эктодермы, особенно нервной ткани, в том
числе формирование синапсов, миелинизацию, морфогенез мезодермы и
ее производных, адгезию нейрон—нейрон и нейрон—глия, адгезию Т-лим-
фоцитов с клетками-мишенями и реакции иммунитета, адгезию клеток
мышц, красной пульпы селезенки, гемопоэтических клеток и т. д. Класс
кадгериновых рецепторов включает три вида (Е, Р и N). Эти молекулы
обеспечивают Са++-зависимый процесс межклеточной адгезии в процессах
эмбриональной дифференцировки, морфогенезе, образовании клеточных
пластов в тканях мускулатуры, мозга, хрусталика, плаценты,
эпителиальных и мезодермальных клетках развивающихся организмов. В зрелом
возрасте они представлены в эпителиальных тканях — базальном слое кожи,
эпителии урогенитального тракта, дыхательных путей, в лимфоидных
органах и экзокринных железах.
Взаимодействие клеток с внеклеточным матриксом обеспечивается
мембранными рецепторами класса интегринов. К этому классу
принадлежат три группы поверхностных гликопротеинов, получивших название по
особенностям с-субъединиц молекул (с,-, с2- и сг). Эти рецепторы
обеспечивают реакции внутриклеточного цитоскелета на лиганды внеклеточного
матрикса. Они участвуют в агрегации тромбоцитов, иммунологических
процессах. Интегриновые рецепторы взаимодействуют с многочисленными
белками внеклеточного матрикса, обеспечивая реакции клеток в ответ на
измененное микроокружение. Вместе с тем интегрины могут существовать
в активной и неактивной формах в зависимости от внеклеточных
сигналов, а также менять, подобно другим мембранным рецепторам, сродство к
лигандам. Образование лиганд-интегринового комплекса ведет к передаче
информации внутрь клетки с изменением в ней не только метаболизма
(например, рН), но и процессов экспрессии генов.
К числу медиаторов межклеточного взаимодействия относят цитокины
(интерлейкины, опухольнекротизирующие факторы, хемокины, интерфе-
роны) и факторы роста, метаболиты арахидоновой кислоты (простагланди-
ны и лейкотриены), регуляторные метаболиты клеток (эндотелии, бради-
кинин, аденозин, оксид азота и др.), протеолитические ферменты и др.
Цитокины и факторы роста в мембраноассоциированной или диффузной
форме связываются либо с рецепторами на одноименных
клетках-продуцентах, вызывая эффект аутокринного регулирования, либо на соседних
клетках ткани (эффект паракринного регулирования), либо на клетках за
пределами мест синтеза (эффект «эндокринного» регулирования).
Цитокины связываются и с внеклеточным матриксом, регулируя продукцию его
компонентов.
156 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
К числу медиаторов межклеточного взаимодействия относится и адено-
зин, выделяемый клетками, особенно в условиях функционального
напряжения, и играющий роль местного регулятора их функций по принципу
обратной связи. Аденозиновая саморегуляция клеточных функций
представлена в тканях центральной нервной, сердечно-сосудистой, иммунной и
гемопоэтической систем, в желудочно-кишечном тракте и легких. Адено-
зин является регуляторным метаболитом, его высвобождение клетками
зависит от реакций потребления и генерирования АТФ, т. е. от
метаболического статуса клеток.
К числу медиаторов аутокринного взаимодействия относят простаглан-
дины и лейкотриены, образующиеся практически во всех видах клеток,
выделяющиеся во внеклеточную микросреду и оказывающие регуляторное
влияние через мембранные рецепторы разных типов. Среди медиаторов
такого рода взаимодействия описаны также трансформирующий фактор
роста, тканевые ингибиторы металлопротеаз, инсулиноподобный фактор
роста и др.
В органах, имеющих клетки и ткани разных видов, существенную роль
в местной саморегуляции функций играют медиаторы гетерогенных клеток.
Так, например, в регуляции функционального состояния гладкомышечных
клеток кровеносных сосудов принимают участие гуморальные вещества,
выделяемые эндотелиальными клетками — эндотелиальные релаксирую-
щий и констрикторный факторы. Чем больше гетерогенность клеточных
популяций в органе, тем большее количество местных внутриорганных
гуморальных факторов используется для регуляции функций. При этом
внутриорганные гуморальные регуляторы обеспечивают изменение не
только функции клеток, но и их метаболического обеспечения, меняя,
например, условия кровоснабжения. Типичным примером наличия такого
рода многообразия гуморальных внутриорганных регуляторов является
почка, клеточными структурами которой образуются как гормональные
(ренин-ангиотензин, кальцитриол), так и местные метаболические (про-
стагландины, нейтральные липиды, кинины и т. п.) регуляторы. Мощное
гуморальное регуляторное взаимодействие существует между тканевыми
(в том числе эндотелиальными) клетками и клетками крови. Только в
почечном клубочке взаимодействие клеток крови, сосудистого эндотелия,
мезангиальных клеток и подоцитов обеспечивается следующим, далеко не
полным, перечнем гуморальных факторов: реактивно-оксилительные
вещества, интерлейкины, тромбоксан, простациклин, лейкотриены,
эндотелии, фактор активации тромбоцитов, тромбоцитарный фактор роста, мо-
ноцитарный гемоаттрактный белок, фактор роста фибробластов, эпидер-
мальный фактор роста, основной фактор роста фибробластов, фибронек-
тин, ламинин, тромбосподин, нидоген/энтактин, протеогликаны и т. п.
Простейшие метаболиты нередко являются регуляторами обменных
процессов и функции клеток органов по механизму обратной связи.
Например, образование избытка метаболитов с кислотными свойствами
(молочной кислоты, пировиноградной кислоты) при интенсивной
деятельности мышц, создающей относительный дефицит кислорода, активирует
метаболические пути их использования, ведет к расширению артериол и пре-
капилляров для увеличения притока крови и кислорода. В то же время в
связи с накоплением Н-ионов сократительная способность мышц
ослабевает. Регуляторные эффекты простейших метаболитов, как правило,
неспецифичны, поскольку для них не существует мембранных рецепторов.
Метаболиты более сложного химического строения носят название
биологически активных веществ, или тканевых «гормонов». К их числу отно-
3. Общие принципы и механизмы регуляции физиологических функций • 157
сятся, например, биогенные амины (гистамин, серотонин), кинины и про-
стагландины. Эти вещества оказывают регулирующее влияние на функции
клеток и ткани в целом за счет изменения их биофизических свойств
(проницаемости мембран, величины мембранного заряда и т. п.), процессов
обеспечения функции — энергетического обмена, клеточной рецепции,
ферментативных реакций, образования вторичных посредников и сдвигов
кровоснабжения ткани. Биологически активные вещества меняют
чувствительность клеток (количество и сродство клеточных химических
рецепторов) к нервным и гормональным влияниям, почему их называют также
модуляторами регуляторных сигналов. Образуясь преимущественно в тканях,
большинство из биологически активных веществ могут проникать из
клеточной микросреды в кровь, а некоторые (кинины) — даже образовываться
из предшественников в самой плазме крови. Таким образом, наряду с
основным местным регуляторным действием эти вещества способны
оказывать и регионарное регуляторное влияние, и даже генерализованные
эффекты, подобно гормонам. Однако образование этих веществ, в отличие от
гормонов, осуществляется неспециализированными, т. е. неэндокринными
клетками.
3.6. Системный принцип организации механизмов регуляции
физиологических функций
Рассмотренные выше нервные и гуморальные принципы регуляции
функционально и даже структурно (примером чему является гипоталамус)
объединены в единую систему нейрогуморальной регуляции. При этом
начальным звеном такого регуляторного механизма, как правило, является
афферентный нервный сигнал на входе системы, а эффекторные каналы
информационной связи являются либо нервными, либо гуморальными.
Следовательно, принципом реализации механизмов нейрогуморальной
регуляции является рефлекс, имеющий два типа путей передачи эфферентной
информации — нервный и гуморальный (рис. 3.15). Вместе с тем, каким
бы сложным ни был рефлекс, какие бы сложные информационные каналы
при этом ни использовались, он представляет собой только базисный,
относительно простой, уровень нейрогуморальной регуляции
жизнедеятельности. Даже в случаях более сложных рефлекторных механизмов,
например приобретенных условных рефлексов, регуляторные реакции
охватывают лишь некоторые, причем весьма узкие стороны жизнедеятельности или
поведения. Однако, благодаря тому что организм является целостной
сложной системой, регуляция его жизнедеятельности носит системный
характер, т. е. не определяется простой арифметической суммой
рефлекторных регуляций составляющих его элементов, а проявляется перестройкой
всех взаимоотношений и взаимосвязей внутри системы для обеспечения
полноценного оптимального приспособления к меняющейся среде
обитания.
Сказанное отнюдь не отвергает большую биологическую значимость
рефлекторного принципа нейрогуморальной регуляции, напротив,
рефлекторные реакции организма являются начальным звеном более сложного
целостного реагирования, конечной целью которого является
приспособление живой системы к внешней среде, т. е. оптимизирование
жизнедеятельности. Механизмы реализации системного принципа регуляции
являются сложными и многообразными, особенно принимая во внимание
динамичность, т. е. постоянство изменчивости организации и функций жи-
' вой системы. В самом деле, ведь регуляция жизнедеятельности организма
158 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Афферентное звено
Нервный центр
Эфферентные звенья
1 Л
Эндокринная железа
Нерв
Рецептор
Обратная связь
Л-1
Гормон
Эффектор
Рис. 3.15. Схема рефлекторной нейрогуморальной регуляции.
Раздражение рецептора через афферентное звено (нервные проводники) вызывает активацию
нервного центра. Регуляторные влияния последнего передаются к эффектору по эфферентным
звеньям, которыми могут быть как нервные проводники (нервная регуляция), так и
выделяемые эндокринными железами гормоны (гуморальная регуляция). Происходящие изменения
функции эффектора (например, повышение тонуса мышцы) воспринимаются его
рецепторами (например, мышечными веретенами), от которых по механизму обратной связи через
афферентное звено информация об эффекте поступает вновь в нервный центр.
в условиях, например, низкой температуры окружающей среды не может
быть сведена только к рефлекторным реакциям поддержания температуры
тела. Динамическая перестройка метаболизма и функций затрагивает все
без исключения органы и физиологические системы организма, меняется
и характер питания, и образ жизни, и поведение. Изменения затрагивают
не только биологическую, но и социальную сущность человека.
Системный характер регуляции физиологических функций проявляется
и во взаимосвязи между нейроэндокринными и иммунными процессами.
Так, на мембранах и в ядрах клеток, обеспечивающих реакции
иммунитета, локализованы рецепторы ко многим гормонам (коры надпочечников,
щитовидной железы и др.). В результате взаимодействия с ними
гормональный сигнал вовлекает в регуляторную реакцию иммунные клетки,
выделяющие во внутреннюю среду многочисленные гуморальные
регуляторы — цитокины, мембранные рецепторы к которым существуют и у
нервных, и у эндокринных клеток организма. Наличие в организме единой
нейрогуморально-иммунной системы регуляции функций способствует
удалению из организма генетически чужеродных агентов — антигенов.
Одним из установленных механизмов системной организации
процессов регуляции жизнедеятельности является общий адаптационный
синдром, или стресс, представляющий собой совокупность неспецифических
и специфических реакций систем нейрогуморальной регуляции,
метаболизма и физиологических функций, приводящих к повышению
устойчивости организма к действия неблагоприятных факторов среды. Основы
учения о стрессе были заложены канадским физиологом и патологом Гансом
3. Общие принципы и механизмы регуляции физиологических функций • 159
Селье (Selye). Системный уровень нейрогуморальной регуляции
жизнедеятельности проявляется при стрессе в виде увеличения энергообеспечения
клеток, что способствует повышению устойчивости организма в целом к
действию факторов окружающей среды, в том числе и вредных для
организма.
Другой механизм системной организации регуляции функций был
установлен отечественным физиологом П. К. Анохиным и сформулирован им
в виде учения о функциональной системе. По автору, классическое
представление о рефлексе всегда означает ответную реакцию организма на
раздражитель, т. е. действие. Например, рефлекс чиханья, сгибательный
рефлекс, сосуд од вигательный рефлекс и т. п. Но для организма важным
является не само действие, не процесс, а результат этого действия. Рефлекс
чиханья возникает как реакция приспособления не ради самого процесса, а
для удаления посторонних частиц, раздражающих слизистую оболочку
носа. Удалены раздражающие частицы — результат достигнут, не удалены —
рефлекторное чиханье продолжается. Функциональной системой, по
П. К. Анохину, называют динамически складывающиеся единицы
интеграции целостного организма, избирательно объединяющие специальные
центральные и периферические образования и направленные на
достижение результатов приспособительной деятельности. Иначе говоря,
функциональная система есть временное объединение разных уровней
организации (клеток, тканей, органов, физиологических систем) и механизмов их
регуляции для достижения конкретного, полезного для организма в целом,
результата. Системогенез — это процесс формирования функциональных
систем, обеспечивающих возможность приспособления организма к
условиям окружающей среды. Причиной, ведущей к образованию
функциональной системы, или системообразующим фактором является
потребность в конкретном результате приспособительной деятельности. При этом
параметры получаемого результата постоянно анализируются за счет
обратной афферентации.
ГЛАВА 4
Функции центральной нервной
системы
Нервная система регулирует совершаемые человеком движения,
деятельность его внутренних органов и обеспечивает осуществление
психических процессов. Она воспринимает изменения внешней среды и
внутреннего состояния организма, организует ответные реакции на эти
изменения, координирует деятельность физиологических систем и органов и
формирует целенаправленное поведение. Центральная нервная система
образована спинным и головным мозгом, в периферическую нервную систему
включают периферические нервы и нервные сплетения, или ганглии.
В каждом отделе центральной нервной системы существуют два типа
клеток: нервные клетки, или нейроны, и вспомогательные клетки нейроглии,
образовавшиеся в процессе эмбриогенеза из общих для них стволовых
клеток. В головном мозге человека содержится приблизительно 10й
различающихся по морфофункциональным признакам нейронов, клеток нейроглии
больше примерно в 10—50 раз и они занимают около половины объема
мозга. Нейроны вступают в контакт друг с другом в синапсах, численность
которых в мозгу человека равна 1014 (по некоторым данным — 1018).
Специфическая функция нейронов заключается в их способности
возбуждаться, т. е. генерировать и проводить электрические сигналы. Таким способом
возбуждающие нейроны передают состояние возбуждения другим нейронам
или рабочим органам. Одновременно тормозные нейроны после своего
возбуждения избирательно тормозят этот процесс и, тем самым,
ограничивают его распространение в пределах функционально необходимых
контактов между клетками.
Нервные клетки являются структурными и функциональными
единицами ЦНС, а их объединение в упорядоченные нервные сети осуществляют
постоянные синапсы между нейронами. Эффективность синаптических
переключений может изменяться, что лежит в основе пластичности
нервной системы, т. е. способности перестраивать свои функциональные
свойства в зависимости от длительных изменений среды и характера
деятельности. Модификация синаптических переключений происходит на
протяжении всей жизни, она позволяет приобретать индивидуальный
поведенческий опыт и приспосабливаться к изменяющимся условиям
существования.
4.1. Основы функционирования нейронов и глии
4.1.1. Общая характеристика нейронов
Нервная ткань превосходит все другие ткани по количеству генов,
вовлеченных в развитие клеток, и по количеству видов информационной РНК.
В мозге существует примерно 200 000 отличающихся друг от друга молекул
4. Функции центральной нервной системы • 161
Окончания Т
возбуждающего Постсинаптические
нейрона нейроны
Рис. 4.1. Основные структуры типичного нейрона
Дендриты — ветвящиеся отростки нейрона, представляющие область формирования входных
сигналов. Аксон — отросток тела нейрона, служащий для проведения возбуждения от него,
имеет постоянный диаметр (большинство аксонов в ЦНС окружены миелиновой оболочкой)
и заканчивается пресинаптическими окончаниями. Аксонныи холмик — конически расширенный
участок начала аксона, представляющий наиболее возбудимую часть плазматической
мембраны нейрона. Показаны окончания тормозного нейрона на теле клетки и возбуждающего
нейрона на одном из дендритов.
иРНК, что в 10—20 раз больше, чем в печени или почках. Поэтому
нервные клетки представлены многими популяциями нейронов, резко
различающихся морфологическими признаками (строение тела, дендритов и
аксонов) и синтезируемыми в них нейромедиаторами. В то же время
активность любого нейрона, независимо от выполняемой функции, проявляется
только в его возбуждении, т. е. генерации потенциалов действия,
приводящей к выделению в синапсе нейромедиатора.
Выполняемая нейроном функция всецело определяется
специфичностью его синаптических соединений с другими нейронами. Некоторые
популяции нейронов образуют компактные ядра, предназначенные для
переработки информации, которая передается из одного отдела мозга в другой.
Другие популяции нейронов представлены небольшими скоплениями
клеток, обладающих длинными разветвленными отростками, направленными
сразу к нескольким регионам мозга для регуляции их активности.
Четыре морфологически различаемые области нейрона (тело, дендриты,
аксон и пресинаптические окончания — рис. 4.1) отличаются друг от друга
и в функциональном отношении. Тело нейрона является центром
происходящих в ней обменных процессов. В теле нейрона находится ядро, где
происходит переписывание генетической информации с ДНК на иРНК.
Дендриты представляют собой разветвленные отростки нервной клетки,
служащие для проведения нервных импульсов к телу нейрона. Степень
разветвленности и общее количество дендритов коррелируют с
количеством синапсов между нейроном и другими нервными клетками,
способными повлиять на его активность и определяемыми как пресинаптические
нейроны. Так, например, на дендритах мотонейронов спинного мозга в
среднем существует около 8000 синапсов, а на дендритах клеток Пуркинье,
находящихся в коре мозжечка, — 150 000. Если одни пресинаптические
нейроны оказывают возбуждающее действие, а другие — тормозное, актив-
6-6095
162 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
ность постсинаптического нейрона будет определяться тем, какое из этих
влияний преобладает.
Нейроны имеют один аксон, в большинстве случаев самый длинный
отросток клетки, предназначенный для проведения нервных импульсов от ее
тела. Обычно аксоны разделяются на несколько ветвей, или коллатералей,
позволяющих нейрону активировать или тормозить с помощью своего
медиатора сразу несколько клеток, с которыми он образует синапсы. В
плазматической мембране аксона содержится большое количество потенциал-
зависимых каналов для ионов натрия, необходимых для генерации и
проведения потенциалов действия. Наибольшая плотность таких каналов
характерна для аксонного холмика — суживающегося начального участка аксона,
отходящего от клеточного тела. Это наиболее возбудимый участок
мембраны центральных нейронов, где легче всего достигается критический уровень
деполяризации. Именно поэтому потенциалы действия обычно возникают в
аксонном холмике, представляющим собой наиболее чувствительную к
возбуждению область клетки.
Пресинаптические окончания аксонов свободны от миелинового покрытия
и предназначены для хранения и выделения медиаторов в химических
синапсах. К выделению медиаторов приводит входящий ток ионов кальция
через быстро инактивирующиеся каналы, плотность которых в пресинап-
тических окончаниях высока. Аксоны возбуждающих нейронов в
большинстве случаев образуют синапсы с дендритами и реже с телом постси-
наптических нейронов. Аксоны тормозных нейронов чаще всего образуют
синапсы на теле постсинаптического нейрона, их действие создает
препятствие проведению возбуждения от дендритов к аксонному холмику. Аксо-
аксональные синапсы, которые могут быть как возбуждающими, так и
тормозными, не влияют непосредственно на зону возникновения
электрического сигнала. Их функция заключается в модуляции выходной активности
постсинаптического нейрона, т. е. в увеличении или уменьшении
количества выделяемого в окончаниях его аксона медиатора.
4.1.2. Функциональная модель нейрона
Функция нейрона заключается в его способности возбуждаться и, действуя
через синапсы на другие клетки, генерировать возбуждение в них, что
приводит к распространению этого процесса от одного нейрона к другому.
Возбуждение тормозного нейрона сопровождается подавлением процесса
возбуждения в клетках, на которые он действует. Процесс возбуждения
включает в себя возникновение нескольких типов электрических сигналов,
образование и распространение которых происходит по единым правилам
во всех нервных клетках: сенсорных, моторных, вставочных и нейросекре-
торных. Это позволяет рассмотреть закономерности возникновения и
распространения электрических сигналов на основе единой функциональной
модели нейрона, пригодной для характеристики любого типа нервных
клеток.
Функциональная модель нейрона предусматривает выделение в нем
четырех функциональных областей, каждая из которых предназначена для
формирования одной из четырех разновидностей сигналов,
характеризующих процесс возбуждения: 1) входного (постсинаптический и рецепторный
потенциалы), 2) объединенного (потенциал действия), 3) проводящегося и
4) выходного (выделение медиатора) (рис. 4.2).
4. Функции центральной нервной системы • 163
4.1.2.1. Входные сигналы
Входные сигналы представляют собой изменения величины мембранного
потенциала в результате действия химических медиаторов на мембраны
постсинаптических нейронов (постсинаптические потенциалы), а в
чувствительных окончаниях сенсорных нейронов они возникают в ответ на
действие адекватных раздражителей (рецепторный потенциал). В
возбуждающих синапсах ЦНС входной сигнал представляет собой деполяризацию
постсинаптической мембраны на 0,2—0,3 мВ, в тормозных синапсах —
столь же незначительную гиперполяризацию, соответственно этому
различают возбуждающие постсинаптические потенциалы (ВПСП) и тормозные
постсинаптические потенциалы (ТПСП).
Постсинаптические потенциалы могут распространяться на очень малое
расстояние от места возникновения и в связи с этим определяются как
местные, или локальные, потенциалы. Их амплитуда пропорциональна
количеству молекул нейромедиатора, связавшегося с постсинаптическими
рецепторами, такая зависимость является градуальной, а поэтому и входные
сигналы градуальны. Назначение возбуждающих входных сигналов состоит
в том, чтобы деполяризовать мембрану нейрона до критической величины,
достаточной для генерации потенциалов действия, а тормозные входные
сигналы предназначены для того, чтобы этому препятствовать.
Одиночные ВПСП электротонически, т. е. пассивно, распространяются
от места возникновения (дендриты или тело нейрона) к аксонному
холмику, служащему интегративной зоной или местом генерации потенциалов
действия. Изначально малая амплитуда одиночных ВПСП при пассивном
проведении становится еще меньше (рис. 4.3), поэтому для достижения
Функциональные
области:
Типы нейронов
Объединенная
модель
Вид
сигнала
Сенсорный Мотонейрон Интернейрон Нейроэндокринная
клетка
Входная
Интегративная
Проводящая
Выходная
+
Возбуждающий
входной
-К
-\ Объединенный
Мышца
Капилляр
Медиатор
Проведение
объединенного
сигнала
Выходной
сигнал
Рис. 4.2. Функциональная модель нейрона
Различные по выполняемой функции нейроны (сенсорные, моторные, интернейроны, нейро-
секретирующие клетки) имеют четыре функционально сопоставимые области: входную, инте-
гративную, проводящую и выходную. Эти области предназначены для возникновения или
проведения электрических сигналов, среди которых различают: входной (рецепторный или
постсииаптический потенциалы), интегративный (объединенный сигнал или потенциал
действия), проводящийся сигнал и выходной сигнал.
164 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
?••
***&
Дендриты
Миелин
Тело (сома
MB
-35
-45
-55
-65
Порог 1
Ч^^ ПСП \ /
— \ \
Потенциал покоя
Потенциал действия
Время
Рис. 4.3. Уменьшение амплитуды постсинаптического потенциала (ПСП) при
распространении его по мембране клетки
А. В результате возбуждения окончаний пресинаптических нейронов и выделения из них ней-
ромедиатора на дендрите постсинаптического нейрона образуется возбуждающий постсинап-
тический потенциал (ВПСП). Амплитуда ВПСП уменьшается по мере его распространения от
дендрита к телу нейрона.
Б. Величина потенциала покоя постсинаптического нейрона составляет —65 мВ, порог
возбуждения (уровень критической деполяризации) на теле нейрона соответствует —35 мВ, а в области
аксонного холмика — около —50 мВ. Несмотря на уменьшение амплитуды
распространяющегося по мембране ВПСП, в области аксонного холмика деполяризующий сдвиг достигает
критического значения.
критической деполяризации мембраны необходима пространственная или
последовательная (временная) суммация ВПСП.
Если постсинаптические потенциалы возникнут одновременно в разных
синапсах на дендритах и теле нейрона, то их общая сумма может оказаться
достаточной для деполяризации мембраны интегративной зоны до
критического уровня. Эта разновидность суммации называется
пространственной, она возникает при одновременной возбуждающей активности группы
нейронов, аксоны которых конвергируют к одной общей постсинаптиче-
ской клетке (рис. 4.4). Средняя величина мембранного потенциала покоя у
4. Функции центральной нервной системы • 165
А. Пространственная суммация
Б. Последовательная суммация
О—<
Е кр.
1+2+3
Через 100 мс Через 10 мс
Рис. 4.4. Суммация возбуждения в центральных синапсах
А. Пространственная суммация возникает при одновременном возбуждении нейронов,
конвергирующих к общей постсинаптической клетке.
Б. Последовательная суммация происходит вследствие ритмического возбуждения пресинапти-
ческого нейрона с достаточно высокой частотой генерации потенциалов действия (через
каждые 10 мс).
центральных нейронов составляет —65 мВ, а среднее значение критической
деполяризации —55 мВ, исходя из этого, для возбуждения постсинаптиче-
ского нейрона необходима сумма ВПСП, превышающая 10 мВ.
Деполяризующий сдвиг, превышающий это значение, приводит к возбуждению
постсинаптического нейрона.
Последовательная или временная суммация ВПСП происходит
вследствие продолжительного возбуждения пресинаптического нейрона,
генерирующего потенциалы действия, которые следуют друг за другом через
короткие промежутки времени. Если 50—100 нервных импульсов достигнут
пресинаптического окончания непосредственно друг за другом, то общего
количества выделившегося медиатора окажется достаточно для получения
амплитуды ВПСП, превышающей уровень критической деполяризации,
что вызовет возбуждение постсинаптического нейрона. В центральных
синапсах ЦНС оба вида суммации, пространственная и последовательная,
обычно происходят одновременно, что способствует возбуждению постси-
наптических нейронов.
На дендритах, но чаще на теле клетки существуют тормозные синапсы,
расположенные между возбуждающими синапсами и интегративной зоной.
Их функция состоит в том, чтобы помешать деполяризующим ВПСП
достичь интегративной зоны. В тормозных синапсах активируются хемозави-
симые каналы для ионов калия или хлора, что ведет к гиперполяризации
мембраны, представляющей тормозной постсинаптический потенциал.
Если на пути распространения деполяризующих ВПСП окажутся гиперполя-
ризованные действием тормозных медиаторов участки мембраны, то
суммарная амплитуда ВПСП не сможет достичь значения критической
деполяризации, необходимой для возникновения потенциала действия
166 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
А. Постсинаптическое
торможение
1СЧ
* o-V'
I
Б. Пресинаптическое
торможение
:0<
Е кр.
1+2+3
впсп тпсп
Раздельное действие возбуждающих
и тормозного нейронов
Е кр.
Суммация ВПСП и ТПСП
1 2 3
ВПСП до действия
тормозного нейрона
ВПСП после действия
тормозного нейрона
Е кр.
Екр.
Рис. 4.5. Торможение возбуждения в центральных синапсах
А. Постсинаптическое торможение обусловлено гиперполяризацией мембраны постсинапти-
ческой клетки, в результате которой возникающие в ее входной зоне ВПСП (возбуждающие
постсинаптические потенциалы) не могут достичь критического уровня деполяризации.
Б. Пресинаптическое торможение вызывается действием тормозного нейрона на аксон
возбуждающего пресинаптического нейрона. Мембрана аксона деполяризуется, а вследствие этого
уменьшается входящий ток ионов кальция в его окончание и выделение медиатора из этого
окончания.
1, 2, 3 — возбуждающие нейроны; Т — тормозной нейрон, Екр. — уровень критической
деполяризации.
(рис. 4.5). В этом случае способность нейрона к генерации потенциалов
действия в целом окажется заторможенной, несмотря на сохраняющуюся
активность возбуждающих пресинаптических клеток.
4.1.2.2. Объединенный сигнал — потенциал действия
Объединенным сигналом в нервной клетке является потенциал действия,
который возникает по принципу «все или ничего» при уменьшении
мембранного потенциала до порогового значения. Если же величина
деполяризующего сдвига мембранного потенциала продолжает увеличиваться над
критическим уровнем, то амплитуда потенциала действия остается
неизменной, составляя в среднем около 100 мВ. Объединенный сигнал
возникает в тех участках мембраны, где наиболее высока плотность потенциал-
зависимых каналов (аксонный холмик), и поэтому критический уровень
деполяризации здесь оказывается самым низким. Это интегративная, или
триггерная, зона, в которой суммируются все деполяризующие сдвиги
ВПСП. У нейронов с длинными дендритами на них имеются добавочные
триггерные зоны, наличие которых повышает эффективность
возбуждающих синапсов, расположенных далеко от клеточного тела.
4. Функции центральной нервной системы • 167
JmwIW
у
ш
к^лл
тпсп тпсп
тпсп
Рис. 4.6. Изменение спайковой активности нейрона в результате его постсинапти-
ческого торможения
А. Исходная активность постсинаптического нейрона, регулярная генерация потенциалов
действия.
Б. Действие тормозного нейрона вызывает возникновение тормозных постсинаптических
потенциалов (ТПСП) и в это время генерация потенциалов действия прекращается.
Отдельные нейроны различаются характерной, специфической для них
частотой и ритмом генерации потенциалов действия. Эти особенности
возбуждения определяются биофизическими свойствами нейронов:
индивидуальным набором потенциалзависимых каналов и их распределением в
разных областях клеточной мембраны. Характер спайковой активности
нейрона в каждом конкретном случае зависит от соотношения
деполяризующих и гиперполяризующих входных сигналов (рис. 4.6) и биофизических
свойств самого нейрона. В результате изменений спайковой активности
нейрона изменяется и выходной сигнал, т. е. количество нейромедиатора,
выделяющегося в пресинаптическом окончании его аксона.
4.1.2.3. Проводящийся сигнал
Проведение возбуждения от интегративной зоны к окончаниям аксона
осуществляют проводящиеся сигналы. Это потенциалы действия, которые
последовательно возникают на мембране аксона в результате действия на
нее локальных электрических токов, образующихся между возбужденным
и невозбужденным участками. В отличие от дендритов, тела нейрона и ак-
сонного холмика, где представлено большое разнообразие ионселективных
каналов, в мембране аксона такие каналы однотипны во всех перехватах
Ранвье или на всем протяжении немиелинизированного аксона. Поэтому
при действии локального электрического тока на мембрану
невозбужденных участков в них открываются однотипные потенциалзависимые каналы
для ионов натрия, что вызывает стандартную саморегенерирующую
деполяризацию с возникновением типичного для данного нейрона потенциала
действия.
При таком способе проведения возбуждения амплитуда и длительность
потенциалов действия одинаковы на всем протяжении аксона вне
зависимости от его длины. Постоянство параметров потенциалов действия
обеспечивает передачу электрических сигналов другим нервным клеткам или
168 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
исполнительным органам без искажения передаваемой информации. Если
потенциалы действия возникают в триггерной зоне с определенной
частотой, образуя «пачку», или серию, импульсов, то и к окончанию аксона они
распространяются без изменения рисунка спайковой активности, а это
значит, что цифровая информация о характере возбуждения нейрона при
проведении полностью сохраняется. По существу аксон является простым
и надежным проводником сигналов от своего начального сегмента до
окончания, а сами проводящиеся сигналы высоко стереотипны и
принципиально не различаются у разных нейронов. Только два признака
проводящихся сигналов определяют характер передаваемой информации: число
потенциалов действия и временные интервалы между ними.
4.1.2.4. Выходной сигнал
Выходным сигналом нейронов является выделение медиатора в
окончаниях аксона, т. е. преобразование электрических процессов в другую форму
активности нервной клетки. Выходной сигнал градуален: его величина
определяется количеством выделяющегося медиатора, которое, в свою
очередь, зависит от общего числа и частоты потенциалов действия,
пришедших к окончанию аксона. Выходной сигнал адресуется одной или
одновременно нескольким постсинаптическим клеткам, имеющим
специфические рецепторы для связывания медиатора.
Выделение медиатора происходит в результате повышения свободной
концентрации ионов кальция в окончании с Ю-8—Ю-7 моль/л"1 до
приблизительно Ю-5 моль/л-1. Даже при незначительной деполяризации мембра-
А. Пресинаптический Гиперполяризация Деполяризация
нейрон , ,
||
Ёб (ёА)
•65
JJJ
Б. Постсинаптический
нейрон
25
Время — *.
10
МП (мВ)
впсп
1\.
Время
./>^.
Рис. 4.7. Изменения величины возбуждающего постсинаптического потенциала в
зависимости от значения мембранного потенциала пресинаптического аксона
А. Незначительная гиперполяризация пресинаптического окончания уменьшает входящий ток
ионов кальция. Соответственно этим изменениям уменьшается или увеличивается количество
нейромедиатора, выделяющегося из пресинаптического окончания.
Б. Амплитуда возбуждающего постсинаптического потенциала снижается при
гиперполяризации пресинаптического окончания и возрастает при его деполяризации.
4. Функции центральной нервной системы • 169
А. Пресинаптическое торможение
Тормозной
нейрон
Пресинаптический
ПД
Пресинаптический Постсинаптический
нейрон нейрон
Б. Пресинаптическое усиление
Пресинаптический
ПД
Пресинаптический Постсинаптический
нейрон нейрон
ВПСП
Входящий ток
кальция а
пресинаптическом
окончании
_/у^_
Входящий ток
кальция в
пресинаптическом
окончании
Рис. 4.8. Пресинаптическое торможение и усиление
А. Пресинаптическое торможение в результате действия тормозного нейрона на окончание
пресинаптического нейрона в аксо-аксональном синапсе приводит к уменьшению входного
тока ионов кальция в пресинаптическое окончание. В результате уменьшается количество
выделяющегося из окончания медиатора и, соответственно, уменьшается амплитуда
возбуждающего постсинаптического потенциала.
Б. Пресинаптическое усиление происходит под влиянием медиатора возбуждающего аксо-аксо-
нального синапса, что приводит к повышению входного тока кальция в пресинаптическое
окончание, увеличенному выделению из него нейромедиатора и увеличению амплитуды
возбуждающего постсинаптического потенциала.
ны пресинаптического окончания в ней открываются потенциалзависимые
каналы для ионов кальция, и тогда его концентрация в окончании быстро
повышается, что вызывает выход медиаторов. И наоборот, даже небольшая
гиперполяризация пресинаптической мембраны приводит к уменьшению
тока ионов кальция в окончание аксона и снижает вероятность выхода
медиатора (рис. 4.7).
Величину выходных сигналов могут регулировать тормозные или
возбуждающие нейроны, действующие своими медиаторами на
пресинаптическое окончание в аксо-аксональных синапсах (рис. 4.8). Медиаторы
тормозных нейронов гиперполяризуют мембрану пресинаптического
окончания аксона, что уменьшает ток ионов кальция в это окончание, поэтому
выделение медиатора из него тоже уменьшается. Пресинаптическое
торможение предназначено для временного уменьшения выходной активности
нейрона и не распространяется на интегративную зону, где происходит
генерация потенциалов действия.
Если в образовании аксо-аксонального синапса участвует
пресинаптический возбуждающий нейрон, то действие его медиатора приведет к депо-
170 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
ляризации мембраны аксона постсинаптического нейрона. Следствием
этого становится повышение тока ионов кальция в это окончание и,
соответственно, увеличение количества выделяемого из него медиатора. В
результате управляемое окончание возбужденного нейрона станет
эффективнее действовать на постсинаптическую мишень. Этот эффект получил
название пресинаптического усиления.
4.1.3. Функциональная характеристика нейроглии
Клетки нейроглии расположены между нервными клетками: они
способствуют объединению элементов нервной системы и, одновременно,
изолируют друг от друга отдельные группы нейронов, а также большую часть их
аксонов.
4.1.3.1. Астроциты
Астроциты с помощью многочисленных ветвящихся отростков образуют
пространственную сеть, занимающую около половины межклеточного
пространства серого вещества. Отростки соседних астроцитов
расширяются на концах и смыкаются друг с другом на поверхности кровеносных
капилляров, изолируя снаружи более 90 % их поверхности. Это способствует
формированию гематоэнцефалического барьера, препятствующего
проникновению из крови крупных молекул, большинства продуктов
патологических процессов и лекарств.
Остальные отростки астроцитов почти целиком обертывают нервные
клетки; вместе с синапсами, находящимися на теле и дендритах, они
выполняют функцию опоры и создают окружающую нейроны микросреду.
Астроциты поглощают избыток ионов калия, выходящих из нейронов при
возбуждении; тем самым они выполняют буферную функцию,
обеспечивающую постоянство ионного состава с наружной стороны нейронов.
Стабильная концентрация ионов калия на наружной мембране нейронов
позволяет сохранять возбудимость нейронов неизменной при разных
условиях их функционирования.
При поглощении калия астроциты деполяризуются и возникает ток этих
ионов через щелевые контакты между соседними астроцитами. Однако это
не приводит к возбуждению астроцитов, поскольку в их мембране для
возбуждения недостаточно потенциалзависимых каналов. В состоянии покоя
мембрана астроцитов проницаема только для ионов калия, которые
диффундируют из клетки по градиенту концентрации, пока не установится
значение равновесного потенциала для калия (—75 мВ). Несмотря на то что
повышение концентрации ионов калия при поглощении их излишков ведет
к изменению некоторых свойств астроцитов, в переносе нервных
импульсов они не участвуют, эта функция возложена исключительно на нейроны.
Помимо опорной и буферной функции астроциты участвуют в
регуляции энергетического обмена нейронов, перекисного окисления липидов,
регуляции обмена нейромедиаторов; они секретируют нейротрофические
факторы, цитокины и иммуномодуляторы, а некоторые разновидности
астроцитов участвуют в фагоцитозе. Специфическую функцию выполняют
астроциты, сосредоточенные вокруг глутаматергических синапсов. Глуша-
мат, самый распространенный возбуждающий нейромедиатор, в высокой
концентрации оказывается токсичным для многих нейронов, имеющих к
нему рецепторы. Повышенная концентрация глутамата стимулирует ток
кальция в клетки, а при высокой концентрации кальция повышается ак-
4. Функции центральной нервной системы • 171
тивность ферментов, способствующих усилению перекисного окисления
липидов (подобная ситуация возникает, например, вследствие
кровоизлияний и некоторых заболеваний мозга). Астроциты обладают высокой
способностью к захвату молекул глутамата и содержат ключевой фермент (глу-
таминсинтетазу), с помощью которого захваченный глутамат преобразуется
в лишенный нейротоксической активности глутамин.
4.1.3.2. Олигодендроциты
Основной функцией олигодендроцитов является синтез миелина и
образование миелиновых оболочек вокруг аксонов. Расположенные возле тел
нейронов и вдоль аксонов олигодендроциты своими отростками
многократно обертывают аксоны, обеспечивая им изолирующий миелиновый
футляр. Обычно отростки одного олигодендроцита участвуют в миелиниза-
ции нескольких соседних аксонов, однако они могут миелинизировать не
только аксоны, но некоторые нейроны, например клетки обонятельной
луковицы, гранулярные клетки мозжечка. В периферической нервной
системе миелинизацию аксонов осуществляют шванновские клетки, являющиеся
аналогами олигодендроцитов.
4.1.3.3. Эпендимная глия
Различают типичные эпендимные клетки, выстилающие поверхности
желудочков мозга и центральный канал спинного мозга, а также танициты,
расположенные преимущественно в области гипоталамуса и на дне IV
желудочка, в стенках водопровода и в спинном мозге. Эпендимные клетки
участвуют в трансцеллюлярном транспорте, с помощью своих ресничек
приводят в движение цереброспинальную жидкость и обладают
секреторной функцией. Танициты участвуют в транспорте веществ из
спинномозговой жидкости к аденогипофизу и в обратном направлении.
4.1.3.4. Микроглия
Клетки микроглии происходят от моноцитов, проникших из кровяного
русла, они могут фагоцитировать значительные объемы разрушенных клеток
и нервных волокон, бактерии и вирусы. Это самые мелкие и самые
немногочисленные среди клеток глии (около 5 % глиальных клеток); диффузно
распределенные в сером и белом веществе мозга, они обладают
подвижностью и выраженной способностью захватывать и перерабатывать продукты
обмена. При повреждениях мозга наблюдается пролиферация микроглии, а
кроме того, их популяцию увеличивают вновь проникшие из крови
моноциты. Клетки микроглии вырабатывают цитокины для активации астроци-
тов и Т-лимфоцитов.
4.2. Общие принципы функционального объединения нейронов
В соответствии с выполняемой деятельностью разные классы нейронов
объединены в функциональные системы: сенсорные, моторные или мотива-
ционные. Даже такая простая деятельность, как, например, перелистывание
страниц этого учебника, требует нескольких видов сенсорной
информации: о расположении книги, о положении туловища, рук, пальцев, о
контакте кончиков пальцев с бумагой. Воспринимающие эту информацию
сенсорные системы перерабатывают ее и доставляют к ассоциативным об-
172 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Моторные системы
/\
■Я
^
Мотивационные системы
V
Сенсорные
системы
Г>
Рабочие органы
V
Изменения внешней
или внутренней
среды
С
Поведение, направленное
на уравновешивание
со средой
Рис. 4.9. Схема взаимодействия функциональных систем ЦНС.
Сенсорные системы осуществляют непрерывное слежение за состоянием внешней и
внутренней среды и немедленно оповещают об изменениях параметров среды. Моторные системы
обеспечивают действия, направленные на уравновешивание с меняющимся состоянием среды.
Мотивационные системы получают сенсорную информацию, регистрируют прежний опыт
приспособления к условиям среды и побуждают к действиям, направленным на
удовлетворение возникающих потребностей.
ластям коры, создающим замысел последующих действий. В соответствии
с этим замыслом моторные системы формируют программы движений.
Само решение о начале, как и об окончании, действий принимает мотива-
ционная система, влияющая на выходную моторную активность, а через
гипоталамус — и на состояние вегетативных функций.
Таким образом, сенсорные системы предоставляют информацию об
изменениях внешней или внутренней среды, моторные системы
обеспечивают ответные действия, направленные на приспособление к изменившимся
условиям. Мотивационные системы активируются при возникновении
каких-либо потребностей и побуждают к совершению действий,
направленных на удовлетворение потребности. Функциональные системы постоянно
взаимодействуют друг с другом: сенсорные системы активируют
мотивационные, а они побуждают моторные к созданию оптимальных для
сложившейся ситуации двигательных программ (рис. 4.9).
4.2.1. Общие принципы организации функциональных систем
мозга
В любой из функциональных систем соблюдаются единые принципы ее
организации.
4.2.1.1. Существование нескольких уровней переработки информации
Передача сигналов от одних нейронов к другим происходит в
переключательных ядрах, находящихся в спинном и головном мозге. Каждое
переключательное ядро представляет собой, во-первых, распределительную
4. Функции центральной нервной системы • 173
систему, образующую проекции на другие структуры мозга для передачи
им информации. Во-вторых, в любом переключательном ядре происходит
переработка информации, заключающаяся в изменениях параметров
электрических сигналов. Переключательные ядра образованы разными типами
нервных клеток, которые, в зависимости от выполняемой функции,
подразделяются на два класса: проекционные и локальные интернейроны.
Проекционные нейроны имеют достаточно длинные аксоны, с
помощью которых переносят электрические сигналы от одного
переключательного ядра к другому, передавая информацию на следующий уровень ее
переработки. Короткие аксоны возбуждающих и тормозных локальных
интернейронов не выходят за пределы переключательного ядра. Функция
локальных интернейронов состоит в облегчении передачи одних сигналов и
подавлении других, что способствует передаче на следующий уровень
наиболее значимых сигналов и подавлению «информационного шума».
4.2.1.2. Топографическая упорядоченность проводящих путей
В переключательных ядрах и в проводящих путях сенсорных систем
электрические сигналы распространяются упорядоченно от каждого
рецептивного поля, например в сетчатке глаза или коже, к соответствующей именно
ему проекционной области коры. Благодаря этому проекционная кора
представляет собой своего рода нейронную карту, отражающую
пространственные характеристики действующих стимулов. Нейроны моторной коры тоже
расположены топографически упорядоченно и могут влиять только на
иерархически подчиненные им нейроны головного и спинного мозга для
передачи команд строго определенным мышцам.
4.2.1.3. Наличие параллельных проводящих путей
В каждой функциональной системе мозга существуют независимые
параллельные пути переработки специализированной информации. Например, в
зрительной сенсорной системе независимо и параллельно
перерабатывается информация о форме, цвете и движении каждого объекта, оказавшегося
в зрительном поле. В двигательных системах существуют раздельные
специализированные пути, по которым информация поступает от высших
двигательных центров к мотонейронам спинного мозга: одни пути служат
для контроля положения тела, рефлексов спинного мозга, другие — для
управления точными движениями кистей рук и пальцев.
4.2.2. Типы нейронных сетей
Специфические функциональные соединения нервных клеток друг с
другом образуют нейронные сети, в зависимости от характера межнейронных
соединений различают три типа сетей: иерархические, локальные и
дивергентные.
Иерархический тип нейронной сети характерен для сенсорных и
моторных систем, он включает несколько уровней переработки информации,
представленных переключательными ядрами. В сенсорных системах
информация от первичных сенсорных нейронов передается вторичным
сенсорным нейронам, от них — нейронам третьего порядка и далее до
проекционной зоны коры. В моторных системах существует нисходящая
иерархия: созданные в двигательных областях коры команды поступают к
переключательным ядрам ствола, оттуда — в спинной мозг, а из него — к мыш-
174 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
цам. Передача сигналов в синапсах иерархических сетей происходит с
помощью возбуждающих нейромедиаторов. На каждом уровне иерархической
организации имеются локальные сети, образованные возбуждающими и
тормозными интернейронами. Функция нейронов локальной сети состоит
в сужении или расширении передаваемого потока информации и ее
контрастировании путем усиления информационно значимых сигналов и
подавления шума.
Дивергентные сети образованы небольшими компактными группами
нейронов, тела которых находятся в нескольких ядрах ствола, а
многочисленные ветви их длинных аксонов распространяются диффузно ко многим
структурам мозга, включая кору. Области проекции таких нейронов
предназначены для выполнения разных функций, поэтому дивергентные сети
принято связывать с неспецифической деятельностью мозга. Наиболее
изученные дивергентные сети в головном мозге образованы норадренерги-
ческими, серотонинергическими, дофаминергическими и холинергически-
ми нейронами моста, продолговатого и среднего мозга. Действие
медиаторов дивергентных систем модулирует передачу сигналов, т. е. облегчает
или затрудняет ее, что изменяет характер интегративной деятельности
мозга (чередование сна и бодрствования, формирование внимания,
возникновение мотиваций и эмоций).
4.2.3. Нейрохимические классы нейронов
Разные популяции нейронов синтезируют различные нейромедиаторы:
синтез конкретного медиатора обусловлен имеющимся в клетке набором
ферментов, который, в свою очередь, определяется экспрессией тех или
иных генов. Многие нейроны используют комбинацию из одного
низкомолекулярного и одного или нескольких пептидных нейромедиаторов,
способных усилить или ослабить действие низкомолекулярного медиатора. В
первом случае они действуют на общую постсинаптическую мишень как си-
нергисты (например, ацетилхолин и вазоинтестинальный пептид), во
втором как — антагонисты (глутамат и дайнорфин в гиппокампе, где глутамат
возбуждает, а опиоидный пептид дайнорфин уменьшает активность пост-
синаптической клетки).
Нейроны, синтезирующие определенный медиатор, образуют
популяции, распределение которых в разных регионах мозга строго упорядочено.
Эта упорядоченность позволяет выделить глутаматергическую, холинергиче-
скую, дофаминергическую, ГАМКергическую и т. п. системы нейронов.
4.2.3.1. Глутаматергическая система
Глутамат является медиатором большинства сенсорных нейронов,
пирамидных клеток коры, многих нейронов гиппокампа, мозжечка, ствола и
спинного мозга. Это самый распространенный в головном мозге
возбуждающий медиатор, для которого существуют ионотропные и метаботропные
рецепторы. Ионотропные рецепторы подразделяют в зависимости от
чувствительности к NMDA (N-метил-ГЗ-аспартату), АМРА (аминометилпропио-
нату) и каиновой кислоте (рис. 4.10). Метаботропные глутаматные
рецепторы после присоединения к ним медиатора изменяют чувствительность к
глутамату у ионотропных рецепторов, расположенных на общей постси-
наптической мембране.
Самые быстрые возбуждающие процессы в глутаматергических
синапсах происходят в результате активации АМРА-рецепторов. Они содержат
4. Функции центральной нервной системы • 175
Инозитол- Диацил-
трифосфат глицерол
Рис. 4.10. Схема постсинаптических рецепторов глутаматергической системы
A. Ионотропные АМРА-рецепторы: присоединение глутамата (Глу) приводит к открытию
канала для ионов натрия; рецепторы чувствительны к бензодиазепинам (2,3-БДЗ).
Б. Ионотропные NMDA-рецепторы представляют собой белковую молекулу, содержащую
канал для ионов кальция, который при значении мембранного потенциала покоя блокирован
ионами магния. Для открывания канала с последующим током через него ионов кальция
необходимо присоединение глутамата к рецептору и деполяризация мембраны, после которой
ионы магния освобождают канал. Рецепторы чувствительны к концентрации глицина (Гли) в
окружающей среде.
B. Ионотропные рецепторы для глутамата, одновременно чувствительные к каиновой кислоте
(КА); содержат канал для ионов натрия и калия.
Г. Метаботропные рецепторы для глутамата: после присоединения нейромедиатора
происходит активация вторичных посредников. Рецепторы чувствительны к квискулату (КВИС).
катионные каналы для ионов калия и натрия и используются для
получения сигналов от афферентных нейронов. Рецепторы NMDA-типа имеют
катионные каналы, пригодные для тока не только ионов калия и натрия,
но и кальция, однако ток ионов возможен только при условии
предварительной деполяризации мембраны, поскольку при значении мембранного
потенциала покоя каналы блокированы ионами магния. При достаточно
длительной деполяризации постсинаптической мембраны, обусловленной
активацией нечувствительных к NMDA рецепторов, ионы магния
уступают вход в канал ионам кальция, которые поступают в постсинаптический
нейрон.
При низкой активности пресинаптического нейрона и соответственно
малом выделении глутамата постсинаптический потенциал возникает
преимущественно за счет активации нечувствительных к NMDA ионотропных
рецепторов, например АМРА. Если же ритмическая активность
пресинаптического нейрона будет продолжаться, то произойдет ток ионов кальция
через каналы NMDA рецепторов. Повышение концентрации ионов
кальция в постсинаптическом нейроне вызовет активацию нескольких систем
вторичных посредников: протеинкиназы С, кальций-кальмодулин-зависи-
мой протеинкиназы и тирозинкиназы. Активация вторичных посредников
приведет к длительному возбуждению постсинаптического нейрона,
сохраняющемуся часами или сутками (долговременная потенциация).
Вторичные посредники обеспечивают открытое состояние каналов
NMDA рецепторов, и, кроме того, в ходе происходящих в
постсинаптическом нейроне процессов в нем образуются и выделяются оксиды азота и
углерода. Эти низкомолекулярные вещества диффундируют к пресинапти-
176 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
ческому нейрону и вызывают в нем активацию посредников,
способствующих длительному выделению нейромедиатора. Длительная, а тем более
повторяющаяся долговременная потенциация в одних и тех же синапсах
приводит к экспрессии генов и синтезу белков, необходимых для структурной
перестройки синапсов. Перестройка заключается в увеличении количества
дендритных шипиков постсинаптического нейрона и вступающих с ними в
контакт терминальных окончаний пресинаптического нейрона. Эти
изменения происходят в синапсах, которые активируются при часто
повторяющемся действии одних и тех же внешних раздражителей, а также при
совпадении действующих стимулов друг с другом во времени. Возникшие в
синапсах преобразования являются материальной основой энграмм
(следов) долговременной памяти.
4.2.3.2. Холинергическая система
Ацетилхолин в качестве нейромедиатора используется в ядрах
черепно-мозговых нервов, мотонейронах спинного мозга и нейронах вегетативной
нервной системы. В головном мозге холинергические нейроны представлены
компактными популяциями в базальных ядрах, перегородке и ядрах
диагонального пучка Брока. Их аксоны образуют проекции к структурам
переднего мозга, гиппокампу и коре, на которые ацетилхолин действует через
М-холинорецепторы. Ацетилхолин используется в качестве
нейромодулятора, повышающего эффективность переработки сенсорной информации и
ассоциативных процессов в коре. Большое число холинергических
нейронов имеется в полосатом теле, где они выполняют функцию локальных
интернейронов.
Помимо переднего мозга холинергические нейроны имеются в
ростральном отделе ствола: они связывают средний мозг с таламусом и корой
больших полушарий. Активация этих нейронов у спящих ведет к
пробуждению и одновременно обусловливает изменения ритма
электроэнцефалограммы, который становится характерным для состояния бодрствования.
В коре преобладают холинорецепторы мускаринового типа, а в некоторых
подкорковых структурах (голубое пятно, супраоптическое ядро
гипоталамуса, отдельные ядра таламуса) существуют Н-холинорецепторы, с участием
которых осуществляются быстрые синаптические процессы. Таким
образом, ацетилхолин в головном мозге может действовать через мускаринчув-
ствительные рецепторы в качестве нейромодулятора и выполняет функцию
классического нейромедиатора при действии на никотинчувствительные
рецепторы.
4.2.3.3. Системы нейронов, использующих биогенные амины
К биогенным аминам относят катехоламины {дофамин, норадреналин,
адреналин) и серотонин.
Синтезирующие дофамин нейроны находятся, в основном, в среднем и
промежуточном мозге, образуя нигростриатную, мезолимбическую (мезокор-
тикальную) и гипоталамо-гипофизарную дофаминэргические системы. Ниг-
ростриатная система представлена дофаминергическими нейронами
компактной части черной субстанции среднего мозга, их аксоны достигают
полосатого тела; они необходимы для осуществления произвольных движений
человека. Мезолимбическую (мезокортикальную) систему представляют
локализованные вне черной субстанции нейроны среднего мозга, аксоны
которых оканчиваются в лимбических структурах мозга (миндалины, перего-
4. Функции центральной нервной системы • 177
Тирозин
Y
L-ДОФА
Y
Дофамин
Обратный
захват
Пресинаптическое окончание
Постсинаптическая мембрана
Д4
5шд<5х=хрСл:
Ионные каналы
Вторичные посредники
Рис. 4.11. Схема дофаминергического синапса.
На постсинаптической мембране находятся рецепторы Д, и Д5, связанные с G-белками,
которые используются для активации или инактивации (+ или —) вторичных посредников.
На пресинаптической мембране расположены рецепторы Д2 и Д3, используемые в качестве ау-
торецепторов для регуляции количества медиатора, освобождаюшегося из пресинаптического
окончания.
родка, обонятельный бугорок), а также в лобных долях, поясных извилинах
и энторинальной области коры. Эта система участвует в формировании
мотиваций и эмоций, а ее чрезмерная активность рассматривается как один из
главных механизмов нарушения деятельности мозга при шизофрении. До-
фаминергические нейроны промежуточного мозга проецируют свои аксоны
на ядра гипоталамуса, влияя на синтез некоторых либеринов.
Метаботропные рецепторы для дофамина образуют два рецепторных
семейства: к первому относят рецепторы подтипов Д, и Д5, а ко второму —
Д2, Д3, и Д4 (рис. 4.11). Рецепторы Д, и Д5 связаны с Gs-белком,
активирующим цАМФ-зависимое фосфорилирование протеинкиназ А и С, они
сосредоточены преимущественно в полосатом теле, прилежащем ядре,
обонятельном бугорке, также в лобной и височной областях коры, гиппо-
кампе и некоторых ядрах таламуса. Рецепторы второго семейства связаны
с Gj-белком, их характерная особенность состоит в угнетении активности
аденилатциклазы вслед за присоединением медиатора. Высокая плотность
рецепторов Д2 и Д3 характерна для полосатого тела, черной субстанции,
лимбических структур, вентральной покрышки и гипофиза, где они
используются в качестве ауторецепторов, т. е. участвуют в пресинаптической
регуляции высвобождения нейромедиатора. Действие многих
психотропных препаратов (нейролептиков, психостимуляторов, антидепрессантов)
основано на модуляции дофаминергических синапсов.
Самое большое скопление норадренергических нейронов представлено
в голубых пятнах (locus coeruleus). Образующие многочисленные, широко
ветвящиеся коллатерали аксоны этих нейронов оканчиваются в спинном
мозге и стволе, мозжечке, таламусе, миндалинах, гиппокампе и образуют
диффузную дивергентную проекцию к коре больших полушарий. Норадре-
нергические нейроны голубого пятна совместно с дофаминергическими
178 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
нейронами среднего мозга своими аксонами образуют медиальный пучок
переднего мозга, с возбуждением которого связано возникновение эмоций.
Норадренергические нейроны голубого пятна активируются при стрессе,
причем их модулирующее действие направлено не на стимуляцию, а на
уменьшение активности иннервируемых ими областей мозга.
Серотонин (5-гидрокситриптамин) используется в качестве медиатора
нейронами ядер срединного шва продолговатого мозга, а также
отдельными группами нейронов среднего мозга и гипоталамуса. Дивергентные
проекции серотонинергических нейронов достигают гипоталамуса, таламуса,
гиппокампа, миндалин, полосатого тела и коры больших полушарий. Серо-
тонинергические нейроны регулируют восходящую активность
ретикулярной формации, связанную с управлением цикла сон—бодрствование, их
влияние на переключательные ядра таламуса связано с распределением
внимания и фильтрацией сенсорных сигналов. Проекция
серотонинергических нейронов на структуры лимбической системы, полосатое тело и
лобные области коры определяет эмоциональное состояние человека: сниженное
содержание серотонина ведет к развитию депрессии, страха и проявлению
немотивированной агрессивности, в особенности если сниженный уровень
серотонина сочетается с повышенной активностью катехоламинэргических
нейронов. При низкой активности серотонинергической системы
увеличивается риск возникновения алкоголизма. Коррекция угнетенного
психического состояния с помощью некоторых антидепрессантов основана на том,
что они повышают уровень серотонина в синаптической щели путем
блокады его обратного захвата пресинаптическими окончаниями.
Количество серотонинергических нейронов в мозге мало, в то же время
серотонинергическая система отличается разнообразием рецепторов,
чувствительных к серотонину: в настоящее время в ЦНС известно 16 типов
таких рецепторов, различающихся своим строением и свойствами.
Серотонин препятствует проявлениям агрессивного поведения, оказывая тормоз-
но-модулирующее действие на рецепторы типа 1А и 1В нейронов лобной
коры, полосатого тела и лимбических структур. Нисходящая проекция
серотонинергических нейронов ядер шва на интернейроны задних рогов
спинного мозга служит для торможения передачи сигналов от болевых
рецепторов и является частью антиноцицептивной системы, понижающей
порог болевого восприятия.
Серотонинергические нейроны участвуют в регуляции вегетативных и
эндокринных процессов посредством модуляции активности
соответствующих центров гипоталамуса. Они регулируют нейронные переключения в
холинергических и норадренергических структурах ствола мозга, где
действие серотонина может быть опосредовано как метаботропными, так и ио-
нотропными рецепторами, управляющими постсинаптическими
мембранными каналами для ионов калия (постсинаптическое торможение).
Действие серотонина не обязательно является тормозным и при активации
некоторых разновидностей серотонинергических рецепторов происходит
возбуждение постсинаптических структур: подобное происходит, например, в
гиппокампе и способствует регистрации новой информации и извлечению
следов памяти.
4.2.3.4. ГЛМКергическая система
ГАМК (гамма-аминомасляная кислота) является важнейшим и самым
распространенным тормозным медиатором нейронов коры, базальных
ганглиев, мозжечка, гиппокампа, некоторых интернейронов спинного мозга. Су-
4. Функции центральной нервной системы • 179
ГАМК
CI-
сг
ГАМК
ГАМК
Барбитураты
Бензодиазепины
ГАМК
Рис. 4.12. Схема ионотропного рецептора ГАМКА.
Рецептор образован пятью субъединицами, способными связывать ГАМК (все субъединицы),
а также бензодиазепины и барбитураты (альфа-субъединицы), которые усиливают связь
рецепторов с ГАМК. В результате связывания ГАМК с рецептором открывается ионный канал
для хлора, после вхождения ионов хлора в клетку возникает ее гиперполяризация.
ществует два типа ГАМКергических рецепторов: ионотропные ГАМКА
(открывают каналы для ионов хлора) и метаботропные ГАМКВ Метаботроп-
ные ГАМКВ рецепторы ассоциированы с G-белком, после присоединения
медиатора они активируют систему вторичных посредников, которые
открывают каналы для ионов калия. Эти рецепторы находятся на пресинап-
тических окончаниях неГАМКергических нейронов и служат для
регуляции количества выделяющихся из таких окончаний возбуждающих нейро-
медиаторов, например глутамата или катехоламинов.
У постеинаптических рецепторов ГАМК имеются отдельные центры
связывания (рис. 4.12) ряда фармакологических веществ (бензодиазепинов
и барбитуратов), являющихся агонистами ГАМК и усиливающих ее
действие. Такие вещества тормозят процесс возбуждения, сопровождающегося
реакцией страха и повышением тонуса мышц, они обладают снотворным и
успокаивающим действием. В окончаниях многих ГАМКергических
нейронов помимо основного медиатора происходит одновременное выделение
нейропептидов, обладающих нейромодулирующим действием. Некоторые
эндогенные белки и пептиды (кальретинин, сериновая протеаза-нексин),
модифицируя чувствительность тормозных ГАМК-рецепторов,
способствуют улучшению процессов научения и памяти.
4.2.3.5. Пептидергические нейроны
Около 50 пептидов синтезируются в различных нервных клетках и затем
используются в качестве нейромедиаторов. Они образуются только в
клеточном теле в ходе ферментативного преобразования крупных молекул
белков-предшественников в эндоплазматическом ретикулуме и аппарате
Гольджи, а затем в секреторных пузырьках доставляются в окончание
аксона быстрым аксонным транспортом. Разные пептиды служат в качестве
возбуждающих или тормозных медиаторов в соответствующих синапсах,
180 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
они также могут использоваться в качестве нейромодуляторов,
усиливающих или ослабляющих действие низкомолекулярного медиатора.
Некоторые нейроны способны одновременно синтезировать низкомолекулярный
медиатор и пептидный нейромодулятор для него. Нейропептиды могут
секретироваться в кровяное русло, и в таких случаях рассматриваются в
качестве нейрогормонов: классическим примером такой ситуации можно,
например, считать поступление в кровоток вазопрессина и окситоцина,
синтезируемых нейронами паравентрикулярных и супраоптических ядер
гипоталамуса.
По одинаковой последовательности аминокислот в достаточно длинных
участках молекул нейроактивных пептидов они разделены на несколько
семейств, среди которых наиболее изучены опиатные пептиды. Они
состоят из разного количества аминокислот, от 5 до 31, но обязательно
включают участок с последовательностью аминокислот: Тир-Гли-Гли-Фен. К
семейству опиатных пептидов принадлежат лейцин-энкефалин, метионин-эн-
кефалин, альфа-эндорфин, гамма-эндорфин, бета-эндорфин, дайнорфин, алъ-
фа-неоэндорфин. Указанные вещества взаимодействуют с опиатными
рецепторами, которые представлены не менее чем пятью разновидностями,
различающимися своими функциональными свойствами. Опиатные
пептиды модулируют переключения в синапсах, использующих в качестве
медиаторов дофамин, ГАМК, глутамат и ацетилхолин. Опиатные рецепторы
активируют систему вторичных посредников пАМФ-аденилатциклазы, эти
рецепторы кроме эндогенных пептидов могут связывать вводимые в
организм для подавления боли производные морфина, а также налоксон —
искусственно синтезированный антагонист морфина, применяемый для
борьбы с наркозависимостью.
Воздействие опиатных пептидов на нейронные переключения в
гипоталамусе, гипофизе и лимбических структурах регулирует характер
мотиваций и эмоций, пищевое и сексуальное поведение, ответные реакции
организма на действие стрессоров. При повышенном образовании энкефалина
в полосатом теле и прилегающем ядре у человека возникает эйфория.
Опиаты участвуют в регуляции локомоторной активности и осуществлении
стереотипных поведенческих реакций. При участии опиоидных пептидов
изменяется порог болевой чувствительности, они существенно притупляют
ощущение боли, действуя на нейронные переключения в спинном мозге,
стволе, лимбических структурах, таламусе и соматосенсорной коре. Опио-
идные пептиды препятствуют выделению ГАМК из интернейронов гиппо-
кампа, что облегчает возникновение долговременной потенциации в этом
регионе и последующее образование следов долговременной памяти об
индивидуальном поведенческом опыте.
Опиатные пептиды могут секретироваться в цереброспинальную
жидкость, например, их концентрация в ликворе повышается при
обезболивании с помощью акупунктуры и при эффекте плацебо (положительный
клинический эффект от приема полученного под видом лекарства, но не
содержащего активного начала вещества). Образование бета-эндорфина
возрастает вследствие занятий марафонским бегом или аналогичными
видами интенсивной физической деятельности, оно повышается во время
беременности и достигает максимума за 3—4 нед перед родами, что
необходимо не только для уменьшения болевой чувствительности, но и для
формирования так называемого материнского поведения.
Остальные семейства нейроактивных пептидов представляют тахикини-
ны (вещество Р, используемое в качестве медиатора при проведении
болевой чувствительности, а также бомбезин, физалемин, кассинин, упероле-
4. Функции центральной нервной системы • 181
ин, эледоизин, вещество К), пептиды нейрогипофиза (вазопрессин, оксито-
цин, нейрофизин), секретины (секретин, глкжагон, вазоактивный интести-
нальный пептид, соматолиберин), инсулины (инсулин, инсулиноподобные
ростковые факторы 1 и 2), семейство панкреатического полипептида
(нейропептид РР, нейропептид Y, пептид YY, участвующие в формировании
пищевого поведения, смене биологических ритмов и возникновении
эмоций), соматостатины (соматостатин, полипептид поджелудочной железы)
и гастрины (гастрин, холецистокинин).
4.3. Функции спинного мозга
Функции спинного мозга состоят в осуществлении двигательных и
вегетативных рефлексов, в проведении сенсорных сигналов от рецепторов кожи,
мышц и внутренних органов к головному мозгу, и в передаче информации
от головного мозга, служащей для координации деятельности мышц и
внутренних органов. Спинной мозг разделен на ряд участков — сегментов,
каждый сегмент связан только со своей областью иннервации (рис. 4.13).
В каждом сегменте спинного мозга центрально расположено серое
вещество, образованное нейронами, их дендритами и клетками нейроглии.
Две симметричные половины серого вещества соединены перешейком, в
центре которого находится спинномозговой канал. На периферии
расположено белое вещество, образованное преимущественно миелинизированны-
ми волокнами нисходящих и восходящих путей, обеспечивающих
взаимодействие спинного и головного мозга. От каждого сегмента отходят два
дорсальных корешка, образованных центральными отростками первичных
афферентных нейронов спинальных ганглиев, и два вентральных корешка,
состоящих из волокон мотонейронов и преганглионарных вегетативных
нейронов. Таким образом, дорсальные или задние корешки состоят из
чувствительных афферентных волокон, а вентральные или передние — из
эфферентных; их функциональное взаимодействие обеспечивают интернейроны
серого вещества (рис. 4.14).
4.3.1. Функциональная организация спинного мозга
Компактные скопления нейронов серого вещества образуют ядра, как
правило, вытянутые вдоль спинного мозга на протяжении нескольких
сегментов и образующие столбы или колонны. Поэтому афферентные и
эфферентные волокна, связанные с одним ядром, входят и выходят в составе
нескольких корешков, принадлежащих соседним сегментам.
В верхушках дорсальных рогов сосредоточены клетки с короткими, густо
ветвящимися и переплетающимися отростками: они образуют студневидное
вещество, которое тянется непрерывно вдоль спинного мозга.
Интернейроны студневидного вещества получают афференты первичных сенсорных
нейронов, проводящих сигналы от рецепторов кожи, а также от некоторых
висцерорецепторов и проприоцепторов. Переработку сенсорных сигналов
регулируют нисходящие к интернейронам из ствола волокна моноаминер-
гических нейронов голубого пятна, ядер шва и моста. Они образуют
синапсы с интернейронами, а около 60 % окончаний норадренергических и
серотонинэргических нейронов имеют варикозные расширения, поэтому
выделяющийся из них медиатор распространяется диффузно на
значительном протяжении и модулирует передаваемые от сенсорных нейронов
сигналы.
В основании заднего рога находятся переключательные релейные ней-
т
182 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Рис. 4.13. Схема топографически организованной иннервации поверхности тела
(дерматомы).
На схеме показаны области иннервации кожи, соответствующие определенным сегментам
спинного мозга (С — шейные, Т — грудные, L — поясничные, S — крестцовые). Кожу лица
иннервирует тройничный нерв (на схеме не показан).
роны, на которых образуют синапсы аксоны сенсорных нейронов,
передающих болевую и температурную чувствительность. Аксоны релейных
нейронов переходят на противоположную сторону, где образуют
восходящие спиноталамический и спиноретикулярный тракты, по которым
афферентная информация поступает в головной мозг. Другая часть
афферентных окончаний сенсорных нейронов образует синапсы с интернейронами
студневидного вещества, причем во всех сенсорных волокнах в качестве
медиаторов используются глутамат и вещество Р. Интернейроны
студневидного вещества способны тормозить передачу болевых импульсов с
помощью ГАМК и энкефалина, а их тормозная активность регулируется нис*
ходящими моноаминоергическими волокнами ствола.
Переработка сенсорной чувствительности разных модальностей
происходит параллельно: в проведении тактильной, болевой и температурной
4. Функции центральной нервной системы • 183
Рис. 4.14. Поперечный разрез спинного мозга (схема).
Рефлекторную функцию спинного мозга обеспечивают сенсорные нейроны, интернейроны
серого вещества, образующие ядра спинного мозга, и мотонейроны. Стрелками показано
направление распространения возбуждения при осуществлении рефлекторной деятельности.
чувствительности участвуют нейроны студневидного вещества и
собственного ядра заднего рога. Переработку висцеральной чувствительности
осуществляют нейроны промежуточной зоны, а для передачи проприоцептив-
ной чувствительности используется ядро Кларка, нейроны которого
образуют спиномозжечковый путь, а также тонкое и клиновидное ядра,
находящиеся в продолговатом мозге.
В вентральных рогах спинного мозга расположены мотонейроны, тела
которых образуют моторные ядра, вытянутые вдоль спинного мозга в виде
колонн. Медиально сосредоточены мотонейроны, управляющие мышцами
туловища, необходимыми для сохранения равновесия и поддержания
нужного положения тела. Активность этой группы мотонейронов определяет
нисходящий из головного мозга медиальный путь, предназначенный для
контроля за положением тела. В латеральной области передних рогов
сосредоточены мотонейроны, управляющие мышцами дистальных отделов
конечностей и контролирующие движения кистей и пальцев рук и ног. Их
активность регулируется посредством нисходящего из головного мозга
латерального пути. Топографическая упорядоченность распределения
мотонейронов проявляется еще и в том, что мотонейроны, служащие для
иннервации мышц-разгибателей, расположены вентрально по отношению к
мотонейронам, контролирующим мышцы-сгибатели.
Все мотонейроны подразделяются на два типа: альфа-мотонейроны, ин-
нервирующие основную массу мышечных волокон, и гамма-мотонейроны,
служащие для иннервации особой разновидности мышечных волокон,
находящихся внутри мышечных веретен и необходимых для изменения их
чувствительности к растяжению мышцы. У альфа-мотонейронов диаметр
тела достигает 80 мкм, от него отходят 10—15 первичных дендритов,
которые благодаря многократному ветвлению заполняют окружающее
мотонейрон пространство радиусом 2—3 мм. На всем этом протяжении
мотонейрон формирует несколько тысяч синапсов с нервными окончаниями:
184 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Мотонейрон
9-ч
Клетка
Реншоу
Мышца
Рис. 4.15. Схема
возвратного торможения в спинном
мозге.
Тормозной нейрон Реншоу
возбуждается коллатералью
мотонейрона и после этого
уменьшает его активность.
1) нейронов головного мозга, образующих
нисходящие двигательные пути; 2)
интернейронов спинного мозга, расположенных в
промежуточном ядре между задним и передним
рогом; 3) первичных сенсорных нейронов,
образующих моносинаптические рефлекторные
дуги с мотонейронами. Таким образом,
мотонейрон представляет собой общий конечный
путь, используемый как при осуществлении
элементарных рефлекторных реакций,
вызванных раздражением различных рецепторов,
так и при выполнении произвольных
движений, связанных с первоначальной
активностью моторных областей коры.
Активность мотонейронов регулируется
при участии возбуждающих и тормозных
интернейронов спинного мозга, благодаря
которым координируется работа мышц,
участвующих в совершении того или иного движения;
при этом одни мышцы должны сокращаться, а другие — расслабляться.
Особую популяцию тормозных нейронов представляют клетки Реншоу,
которые активируются возвратными коллатералями аксонов мотонейронов,
после чего тормозят деятельность самих мотонейронов: такое торможение
называется возвратным (рис. 4.15). Возвратное торможение мотонейронов
посредством клеток Реншоу стабилизирует частоту потенциалов действия,
возникающих в мотонейронах. В норме она варьирует между 8 и 15
импульсами в секунду, и лишь при самых сильных сокращениях мышц
достигает 25 Гц.
Осуществление сильных или слабых сокращений одних и тех же мышц
происходит вследствие активации разных мотонейронов. Каждый альфа-
мотонейрон иннервирует в мышце определенное количество мышечных
волокон, образуя вместе с ними двигательную единицу. Двигательные
единицы подразделяются, во-первых, на большие и малые в зависимости от
количества мышечных волокон, получающих иннервацию от одного
мотонейрона. Во-вторых, они различаются в зависимости от типа мышечных
волокон как: 1) быстрые утомляемые; 2) медленные мало утомляемые;
3) быстрые мало утомляемые. Мотонейроны, иннервирующие мышечные
волокна первого типа, отличаются большим размером тела и высоким
порогом возбуждения. Мотонейроны для волокон второго типа, напротив,
являются мелкими и наиболее возбудимыми, а мотонейроны третьего типа
занимают промежуточное положение. При относительно слабом
афферентном возбуждении активируются мотонейроны второго и третьего типа,
при этом сила мышечных сокращений оказывается достаточной,
например, для стояния или спокойной ходьбы. Сильные афферентные стимулы
возбуждают мотонейроны первого типа, при этом сила мышечных
сокращений возрастает настолько, что позволяет бежать или прыгать.
Группы дендритов соседних мотонейронов образуют между собой
электрические синапсы, что способствует синхронизации электрической
активности этих клеток. Гамма-мотонейроны отличаются от
альфа-мотонейронов не только малой величиной, но и тем, что они иннервируют только
интрафузальные мышечные волокна, связанные с чувствительными к
изменениям длины мышцы проприоцепторами. Вместе с интрафузальными
волокнами гамма-мотонейроны образуют так называемую фузимоторную сие-
4. Функции центральной нервной системы • 185
тему, тогда как альфа-мотонейроны вместе с экстрафузальными
волокнами составляют скелетомоторную систему, первая используется лишь для
регуляции мышечного тонуса, вторая — обеспечивает сократительную
функцию мышц.
На протяжении от верхнего шейного до II—III поясничного сегментов
располагается латеральное ядро промежуточной зоны, в котором
содержатся преганглионарные нейроны симпатического отдела вегетативной
нервной системы, объединенные друг с другом внутриспинальными
проводящими путями. К этому ядру поступают сигналы от окончаний сенсорных
нейронов, несущих информацию, во-первых, от висцерорецепторов
внутренних органов (нейромедиаторами являются глутамат и вещество Р), во-
вторых, от интернейронов медиального ядра промежуточной зоны
(медиаторы: холецистокинин, соматостатин и ВИП) и, в третьих, нисходящие
волокна норадренергических нейронов голубого пятна и серотонинергиче-
ских нейронов ядер шва. Симпатические нейроны, контролирующие
потовые железы, сосуды кожи и скелетных мышц располагаются латерально по
отношению к нейронам, регулирующим деятельность внутренних органов.
Парасимпатические преганглионарные нейроны входят в состав
медиального ядра промежуточной зоны на уровне II поясничного — III крестцового
сегментов. Латерально расположены нейроны, иннервирующие мочевой
пузырь, медиально — иннервирующие толстый кишечник.
4.3.2. Рефлексы спинного мозга
Рефлексы спинного мозга осуществляются благодаря упорядоченному
распространению возбуждения от рецепторов сенсорного нейрона до рабочего
органа по рефлекторной дуге. Представление о собственной рефлекторной
деятельности спинного мозга сложилось на основе изучения рефлекторных
реакций у животных, наблюдающихся после экспериментального
отделения спинного мозга от головного хирургическим путем или
фармакологической блокадой проводящих путей между спинным и головным мозгом.
После разрыва спинного мозга возникает спинальный шок,
проявляющийся обратимым угнетением двигательных и вегетативных рефлексов.
Утративший связь с головным мозгом спинной мозг определяют как
изолированный, а рефлексы, которые могут осуществляться с его помощью,
называют спинномозговыми или спинальными. Изоляция спинного мозга или
его части может произойти в результате травматического разрыва у
человека, и тогда сохраняющаяся рефлекторная деятельность сводится
исключительно к спинальным рефлексам. Спинномозговые рефлексы являются
врожденными, их осуществление не требует осознания, но в естественных
условиях, т. е. при сохраненных связях спинного мозга с головным, спи-
нальные рефлексы включаются в более сложные программы поведения.
Нисходящие влияния головного мозга могут изменять или даже
прекращать те или иные виды рефлексов, дуга которых замыкается через
спинной мозг, например, болевой сгибательный рефлекс можно сознательно
подавить усилием воли.
4.3.2.1. Сухожильные рефлексы
Сухожильные рефлексы вызываются легким ударом по сухожилию и
проявляются резким сокращением мышцы, прикрепленной к этому сухожилию.
Сенсорным стимулом для возникновения сухожильных рефлексов служит
растяжение мышцы в момент удара по ее сухожилию (рис. 4.16), при этом
186 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Растяжение
четырехглавой
мышцы бедра
Афферентный
нейрон
III — IV сегменты поясничного
отдела спинного мозга
Надколенник
Удар
молоточком
по
сухожилию
Рефлекторное сокращение
четырехглавой мышцы бедра,
разгибание ноги в коленном суставе
Рис. 4.16. Схема воспроизведения коленного рефлекса.
Удар молоточком по сухожилию четырехглавой мышцы бедра вызывает ее растяжение и
ответное рефлекторное сокращение, приводящее к разгибанию ноги в коленном суставе. Моноси-
наптическая рефлекторная дуга замыкается на уровне III—IV сегментов поясничного отдела
спинного мозга.
мышца не должна напрягаться, чтобы не препятствовать растяжению.
Сухожильные рефлексы можно вызвать в разных мышцах, например
трехглавой мышце голени (ахиллов рефлекс), двуглавой и трехглавой мышцах
плеча, мышцах нижней челюсти и т. д. Воспроизведение сухожильных
рефлексов применяется в неврологической практике для диагностики
уровня поражения двигательных функций.
При растяжении мышцы в момент удара по ее сухожилию
возбуждаются проприоцепторы, находящиеся в небольших мышечных волокнах,
окруженных капсулой из соединительной ткани. Такие капсулы называют
мышечными веретенами, а заключенные в них мышечные волокна — интрафу-
зальными (от лат. fusus — веретено). При увеличении длины мышцы интра-
фузальные волокна растягиваются, и тогда в проприоцепторах возникает
рецепторный потенциал, а вслед за ним и потенциал действия.
Возникающие потенциалы действия распространяются вначале по периферической,
а затем по центральной ветви аксона первичного сенсорного нейрона,
расположенного в спинальном ганглии. В составе заднего корешка
афферентные глутаматергические волокна этого нейрона входят в спинной мозг и
оканчиваются непосредственно на мотонейронах, образуя моносинаптиче-
скую рефлекторную дугу. В дуге коленного рефлекса каждый мотонейрон
имеет от 2 до 6 синаптических контактов с единичным сенсорным
нейроном, а каждый сенсорный нейрон посредством многочисленных термина-
леи своего аксона вступает в контакт с 500—1000 гомонимных (т. е.
относящихся к той же мышце) мотонейронов, находящихся во II—IV
поясничных сегментах. Возбуждение этих мотонейронов приводит к сокращению
четырехглавой мышцы.
4.3.2.2. Рефлекс растяжения мышцы
Сухожильные рефлексы представляют собой частный случай рефлексов
растяжения, являющихся физиологическим механизмом регуляции длины
мышц. При быстром растяжении мышцы возникает фазический рефлекс в
4. Функции центральной нервной системы • 187
Мышечные Мышца Интрафузальные
волкна волокна
Рецептор Гольджи проприоцепторов Мышечное веретено
Рис. 4.17. Расположение проприоцепторов в скелетных мышцах.
В центральной части рисунка показана локализация интрафузальных рецепторов и
сухожильных рецепторов Гольджи. Справа показано мышечное веретено с несколькими интрафузаль-
ными волокнами внутри него: эфферентный аксон принадлежит у-мотонейрону спинного
мозга; чувствительные окончания афферентного нейрона возбуждаются при растяжении
центральной части интрафузальных волокон. Слева изображены рецепторы Гольджи, активация
которых происходит пропорционально росту напряжения мышцы и натяжению сухожильных
коллагеновых волокон, сдавливающих чувствительные окончания.
виде быстрого ответного сокращения мышцы, а при медленном
растяжении — тонический рефлекс, направленный на сохранение неизменной
длины мышцы при постоянном растяжении. Тонические рефлексы
необходимы для поддержания мышечного тонуса, под которым понимают
сопротивление мышц растяжению какой-либо внешней силой. Мышечный тонус
сохраняет положение тела и обеспечивает сопротивление силе тяжести,
растягивающей мышцы-разгибатели. Изменения тонуса мышц позволяют
удерживать и перемещать груз, сохранять равновесие при отклонениях
туловища вперед, назад или в сторону.
Служащие в качестве рецепторов растяжения интрафузальные
мышечные волокна значительно тоньше и короче остальных, т. е. экстрафузаль-
ных, образующих основную массу мышцы и обеспечивающих ее
сокращения (рис. 4.17). Мышечные веретена обоими концами прикреплены
полоской соединительной ткани к пучку экстрафузальных волокон, поэтому
растягиваются одновременно со всей мышцей. В средней части каждого
интрафузального волокна содержатся окончания первичного
афферентного нейрона, относящиеся к механорецепторам, которые реагируют на
вызванную растяжением деформацию. Возбуждение сенсорных нейронов
передается мотонейронам через моносинаптическую рефлекторную дугу, что
приводит к рефлекторному сокращению растянутой мышцы.
При растяжении мышцы внешней силой происходит одновременная
активация а-мотонейронов, иннервирующих основную массу мышечных
волокон и у-мотонейронов, которые иннервируют только интрафузальные
188 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Растяжение
мышцы-сгибателя
Рефлекторное сокращение
мышцы-сгибателя
Мотонейроны
сгибателей
Чувствительный
нейрон
Мышечное
веретено
Рис. 4.18. Схема рефлекса растяжения.
А. Мышца-сгибатель растягивается внешней силой, что вызывает активацию рецепторов ин-
трафузальных волокон и возбуждение афферентного нейрона, действующего непосредственно
на мотонейроны сгибателей (синергистов) и уменьшающего активность мотонейрона мышцы-
разгибателя (антагониста) посредством тормозного интернейрона.
Б. Рефлекторный ответ на растяжение мышцы заключается в ее сокращении, приводящем к
сгибанию конечности в суставе.
волокна. Оба типа мотонейронов возбуждаются разными коллатералями
одного и того же сенсорного нейрона, поэтому сокращения обоих типов
мышечных волокон тоже происходит одновременно. Другие ветви
афферентного аксона активируют тормозные интернейроны спинного мозга,
которые реципрокно подавляют активность мотонейронов для
мышц-антагонистов (рис. 4.18). Таким образом, в механизме рефлекса растяжения
запрограммирована одновременная согласованная деятельность нескольких
мышц, необходимая для совершения или предотвращения движения в
определенном суставе.
Чувствительность интрафузальных волокон к растяжению изменяется
при повышении или понижении активности у-мотонейронов. Чем чаще
они возбуждаются, тем больше сократятся концевые участки
интрафузальных волокон, в то время как их центральная часть, лишенная
сократительных белков, будет вынуждена растягиваться. Небольшое ее растяжение
существует в условиях физиологического покоя, что поддерживает
возбуждение рецепторов мышечных веретен и тоническое сокращение мышц.
Изменения активности у-мотонейронов, приводящие к изменениям тонуса
4. Функции центральной нервной системы • 189
мышц, происходят под влиянием двигательных центров головного мозга. В
зависимости от конкретной функциональной задачи избирательно
активируются у-мотонейроны, иннервирующие разные группы мышц, например
сгибатели или разгибатели. Соответственно этому тонус одних групп
мышц будет повышаться, тогда как другие группы мышц останутся в
прежнем состоянии или даже расслабятся, если произойдет торможение
активности соответствующих у-мотонейронов.
4.3.2.3. Рефлекторная регуляция напряжения мышц
Сокращения мышцы сопряжены с изменениями не только ее длины, но и
напряжения. Рефлекторная регуляция напряжения осуществляется с
помощью сухожильных рецепторов Гольджи — немиелинизированных
окончаний афферентного нейрона, которые расположены между коллагеновыми
пучками сухожильных волокон в области их прикрепления к мышечным
волокнам (см. рис. 4.17). Если интрафузальные волокна — датчики длины
лежат параллельно экстрафузальным волокнам, составляющим основу
мышцы, то сухожильные рецепторы соединены с ними последовательно.
При нарастании напряжения в мышце коллагеновые волокна сухожилий
натягиваются тем сильнее, чем большим становится напряжение.
Пропорционально ему деформируются сухожильные рецепторы и возрастает
частота потенциалов действия в афферентном нейроне. Окончания
афферентных нейронов образуют синапсы с тормозными интернейронами,
действующими на гомонимные (относящиеся к этой же мышце) мотонейроны
(рис. 4.19). Такой механизм регуляции по принципу отрицательной
обратной связи предупреждает
неадекватное нарастание
мышечного напряжения.
Тормозные
интернейроны, контролирующие
возбуждение мотонейронов, а
значит, и силу мышечных
сокращений, получают
афферентную информацию не
только от сухожильных
рецепторов Гольджи, но также
от суставных рецепторов,
высокочувствительных
кожных рецепторов и
нисходящих двигательных путей.
Конвергенция кожных аф-
ферентов на тормозных
интернейронах требуется в тех
случаях, когда происходит
ощупывание хрупких или
мелких объектов и силу
мышечных сокращений нужно
согласовать с характером
тактильных ощущений.
Тормозной
интернейрон
Сухожильные
рецепторы
Гольджи
Уменьшение
возбуждения мотонейрона
Рост напряжения мышцы
без изменения ее длины
Рис. 4.19. Схема рефлекторной регуляции
напряжения мышцы.
Нарастание напряжения в мышце при неизменной ее
длине приводит к раздражению сухожильных
рецепторов Гольджи и активации афферентного нейрона,
который уменьшает возбуждение мотонейрона с
помощью тормозного интернейрона.
190 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
4.3.2.4. Сгибательные и разгибательныерефлексы
Сгибательный рефлекс состоит в немедленном сгибании руки или ноги в
ответ на болевое раздражение кожи (укол, ожог). Он обеспечивает
удаление конечности от источника болевой стимуляции и по своему
биологическому значению относится к категории защитных рефлексов. Сгибание
конечности происходит одновременно в нескольких суставах, причем
выраженность сгибательного рефлекса пропорциональна силе раздражителя.
Чем сильнее оказывается действующий стимул, тем больше мышц
вовлекается в ответную реакцию.
Рефлекторные дуги всех сгибательных рефлексов являются полисжап-
тическими: разветвленные окончания сенсорных нейронов проецируются
на возбуждающие и тормозные интернейроны, которые действуют на
мотонейроны для мышц сгибателей и разгибателей (рис. 4.20). Мотонейроны
мышц-сгибателей подвергаются действию возбуждающих интернейронов,
что приводит к сокращению этих мышц. Одновременно тормозные
интернейроны реципрокно угнетают активность мотонейронов,
контролирующих мышцы-разгибатели.
Многие суставы способны
производить движения в двух или даже
трех плоскостях, а для этого
требуются согласованные сокращения
одних групп мышц при
одновременном расслаблении других.
Механизм сгибательного рефлекса
включает взаимодействие
возбуждающих и тормозных
интернейронов спинного мозга с
мотонейронами мышц-синергистов и
антагонистов. Такое взаимодействие
предусматривает решение трех задач:
1) непосредственный контроль
каждой мышцы; 2) координация
деятельности мышц, управляющих
одним суставом; 3) координация
деятельности мышц, необходимых для
управления несколькими
суставами.
Рефлекторное сгибание
конечности часто сопровождается
одновременным разгибанием контрала-
теральной конечности, которое
тоже происходит рефлекторно
{перекрестный разгибательный рефлекс).
Так, например, человек,
наступивший босой ногой на колючку,
рефлекторно сгибает эту ногу, что
приводит к росту нагрузки на
опорную ногу. Немедленное
рефлекторное повышение тонуса
мышц-разгибателей на опорной
ноге позволяет справиться с
возросшей нагрузкой на нее. Осуще-
Рис. 4.20. Схема возникновения
сгибательного рефлекса.
При действии болевого раздражителя,
вызвавшего рефлекторное сгибание ноги, на
другой ноге повышается тонус
мышц-разгибателей (+) и уменьшается тонус
мышц-сгибателей (—), что позволяет опорной ноге
удерживать массу тела. Тормозные
интернейроны на схеме темные, возбуждающие —
светлые.
4. Функции центральной нервной системы • 191
От нейронов моторной коры
(кортикоспинальный путь),
от двигательных ядер ствола
От сухожильных
рецепторов
Гольджи
От сенсорного нейрона,
рецепторы которого
находятся в интрафуза-
льных мышечных
волокнах
От интрафузальных
рецепторов
мышцы-антагониста
К скелетной
мышце
Клетка Реншоу
(возвратное
торможение)
Возбуждающие
нейроны
Тормозные
нейроны
Рис. 4.21. Конвергенция возбуждающих и тормозных входов на мотонейроне.
Мотонейрон могут возбуждать сенсорные нейроны, реагирующие на растяжение мышцы,
возбуждающие интернейроны и нисходящие моторные пути головного мозга. На него могут
действовать тормозные интернейроны, активированные рядом афферентных нейронов, а также
клетки Реншоу. Схема показывает лишь малую часть реальных влияний на мотонейрон.
ствление перекрестного разгибательного рефлекса обеспечивается контра-
латеральной проекцией аксонов, берущих начало от интернейронов,
которые возбуждаются при поступлении в спинной мозг сигналов от болевых
рецепторов. В результате на противоположной стороне спинного мозга
возбуждаются мотонейроны мышц-разгибателей и тормозятся
мотонейроны сгибателей, т. е. наблюдается картина, прямо противоположная
происходящему при сгибательном рефлексе.
Интернейроны, участвующие в образовании рефлекторных дуг сгиба-
тельных и разгибательных рефлексов, активируются окончаниями
сенсорных нейронов разных модальностей. К ним конвергируют афференты от
поверхности кожи, мышц, суставов, кроме того, они находятся под
контролем нисходящих двигательных путей головного мозга. В связи с
конвергенцией многих афферентов интернейроны спинного мозга, как и зависимые
от них мотонейроны, участвуют не только в замыкании сгибательных и
разгибательных рефлексов, но вовлекаются в осуществление двигательных
рефлексов ствола и выполнение произвольных движений (рис. 4.21).
192 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
4.3.2.5. Ритмические рефлексы
Ритмический чесательный рефлекс вызывается слабым раздражением кожи
и включает два компонента: 1) обнаружение раздраженного участка
(ползающие насекомые, зуд) и 2) ритмичные чесательные движения,
заключающиеся в повторных сгибаниях-разгибаниях конечности, которая
занимает при этом определенное положение по отношению к кожной
поверхности за счет повышения тонуса приводящих мышц. Комплекс подобных
движений направлен на устранение нежелательных ощущений.
Чесательный рефлекс сохраняется у собак с изолированным от головного спинным
мозгом, что свидетельствует о спинальном механизме этого рефлекса и его
относительной независимости от супраспинальных центров.
Правильные чередования активности сгибателей и разгибателей при
осуществлении ритмических рефлексов обеспечиваются с помощью
интернейронов, которые поочередно тормозят мотонейроны то сгибателей, то
разгибателей (рис. 4.22). Чередуемые движения регулирует двигательный
центр спинного мозга, составленный из двух «полуцентров»: сгибательного
и разгибательного, которые реципрокно тормозят друг друга.
Продолжительность торможения в каждом выполняемом цикле зависит от свойств
самих тормозных синапсов, в которых происходит динамическое
повышение порога возбуждения постсинаптических нейронов.
4.3.2.6. Участие спинного мозга в локомоции
Под локомоцией понимают совокупность координированных движений, с
помощью которых человек активно перемещается в пространстве. Его шаг
представляет собой цикл движений, в котором участвуют обе конечности,
и в каждой из них совершаются ритмические сокращения
мышц-сгибателей и разгибателей. Выполняемые каждой ногой попеременно движения
представляют собой чередование двух фаз: 1) мах, при котором нога
сгибается и отрывается от пола; 2) упор, при котором нога касается пола и
разгибается. При этом движения ног синхронизированы так, что одна из них
находится в фазе маха, а другая — упора.
Тонический
нисходящий
афферентный
вход
информации
Интернейрон
Мотонейрон
сгибателя
Интернейрон
Мотонейрон
разгибателя
Рис. 4.22. Схема осуществления ритмического рефлекса.
Активность мотонейронов, иннервирующих мышцы-антагонисты, проявляется попеременно
благодаря включению в рефлекторную дугу тормозных интернейронов, обеспечивающих ре-
ципрокное торможение.
4. Функции центральной нервной системы • 193
В управлении координированной деятельностью мышц при ходьбе и
беге участвуют интернейроны и мотонейроны, находящихся в разных
сегментах спинного мозга. Согласованное чередование их циклической
активности обеспечивается топографически упорядоченными связями между
собой, сформировавшимися еще в процессе развития мозга и
позволяющими реализовать врожденную программу движений. Спинномозговые
центры локомоции контролируются двигательными ядрами ствола,
моторной корой и мозжечком, для осуществления контроля используется
сенсорная информация (проприоцептивная, вестибулярная, зрительная),
переработка которой происходит в головном мозге. Активность спинальных
локомоторных центров у человека полностью подчинена супраспинальным
отделам и самостоятельно не проявляется.
4.3.2.7. Спинальные вегетативные рефлексы
В зависимости от локализации рецепторов и расположения рабочих
органов различают висцеро-висцеральные, висцеродермальные и дермовисцераль-
ные рефлексы. Рефлекторные дуги всех этих рефлексов относятся к поли-
синаптическим, рефлекторные реакции происходят при участии гладких
мышц внутренних органов и кровеносных сосудов, сердечной мышцы и
желез внешней секреции, которые реагируют на раздражение интероре-
цепторов или рецепторов кожи.
Висцеро-висцеральные рефлексы вызываются раздражением рецепторов
внутренних органов и проявляются изменениями деятельности этих же
(например, кардио-кардиальные, кишечно-кишечные, эвакуаторные
рефлексы) или других внутренних органов. Висцеродермальные рефлексы
возникают при раздражении рецепторов внутренних органов и проявляются
изменениями кожной чувствительности, потоотделения и электрического
сопротивления кожи. Область рефлекторного ответа определяется
сегментарной организацией вегетативной иннервации: афферентные сигналы от
рецепторов внутренних органов поступают в определенные сегменты
спинного мозга, а кожные изменения обнаруживаются только в тех дерма-
томах, которые иннервируются из этих же сегментов. Изменения кожной
чувствительности или так называемая отраженная боль в ограниченных
участках кожи, получивших название зон Захарьина—Геда, указывают на
поражение определенного органа и имеют диагностическое значение.
Сегментарная организация рефлекторных дуг характерна и для дермо-
висцеральных рефлексов, которые вызываются раздражением рецепторов
кожи, после чего происходит рефлекторное изменение деятельности
определенных внутренних органов и возникают реакции сосудов. На
сегментарном принципе организации рефлекторных дуг дерматовисцеральных
рефлексов основано терапевтическое действие согревания, охлаждения или
иного раздражения кожи (точечный массаж, акупунктура, горчичники).
Нисходящий контроль рефлекторных дуг спинальных вегетативных
рефлексов осуществляют вегетативные центры ствола мозга и гипоталамус.
Окончания серотонинергических, норадренергических и пептидергических
нейронов головного мозга проецируются на преганглионарные нейроны и
интернейроны, участвующие в замыкании рефлекторных дуг вегетативных
рефлексов.
7-6095
f
194 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
4.3.3. Функциональная организация проводящих путей спинного
мозга
Проводящие пути спинного мозга образованы топографически
упорядоченными пучками длинных аксонов нейронов, входящих в состав задних,
передних и боковых канатиков белого вещества спинного мозга. В
соответствии с источником и адресатом передаваемой информации они
подразделяются на восходящие (чувствительные), нисходящие (двигательные) и
собственные, или проприоспинальные, проводящие пути. Собственные
проводящие пути образованы аксонами интернейронов и служат для
установления межсегментарных связей в пределах самого спинного мозга.
Восходящие пути задних столбов образованы длинными ветвями
аксонов чувствительных нейронов спинальных ганглиев, которые следуют к
головному мозгу без перекреста и оканчиваются на нейронах ядер задних
столбов продолговатого мозга. Они передают сенсорные сигналы от
мышечных и сухожильных проприоцепторов и от тактильных рецепторов
кожи. Восходящие пути болевой и температурной чувствительности
образованы аксонами нейронов задних рогов спинного мозга, которые
возбуждаются соответствующими сенсорными нейронами. Аксоны клеток задних
рогов проходят через переднюю комиссуру на противоположную сторону и
направляются к головному мозгу в составе переднебокового канатика, в
котором различают спиноталамтеский и спиноретикулярный тракты. Спи-
ноталамический тракт служит для проведения сенсорных сигналов от
рецепторов в проекционную область коры, а спиноретикулярный тракт
проводит нервные импульсы от рецепторов в ретикулярную формацию,
которая неспецифически активирует обширные регионы коры. Дорсальный и
вентральный спиномозжечковые тракты, расположенные в боковых
столбах, передают информацию от механорецепторов кожи, мышц и суставов к
мозжечку: это канал обратной связи, необходимой мозжечку для
коррекции совершаемых движений.
Нисходящие пути спинного мозга, вестибулоспинальный, руброспиналь-
ный и ретикулоспинальный, предназначены для регуляции тонуса скелетных
мышц и координации рефлекторной деятельности спинного мозга. Они
образованы аксонами нейронов вестибулярного, красного ядер и
ретикулярной формации. Берущий свое начало от нейронов покрышки среднего
мозга тектоспинальный путь служит для перераспределения тонуса
скелетных мышц при совершении ответных реакций на зрительные и слуховые
раздражители. Кортикоспинальный путь берет начало от нейронов
моторных областей коры, он предназначен для регуляции произвольных
движений.
4.4. Функции ствола мозга
К стволу мозга относят продолговатый мозг, мост и средний мозг, эти три
отдела мозга функционально связаны друг с другом. Ствол содержит ядра
И —XII черепных нервов (табл. 4.1), которые обеспечивают афферентную и
эфферентную иннервацию тканей головы и внутренних органов, в нем
находятся нервные центры двигательных и вегетативных рефлексов. Нервные
центры ствола программируют циклическую деятельность (ходьба,
жевание, дыхание). Через ствол проходят сенсорные и двигательные пути,
обеспечивающие взаимодействие головного и спинного мозга,
переключательные ядра ствола являются обязательным звеном для многих из них.
Ствол мозга содержит популяции нейронов, которые образуют восходящие
4. Функции центральной нервной системы • 195
и нисходящие проекции, оказывающие модулирующее влияние на
осуществление рефлекторной деятельности, поведенческих реакций и
психических процессов.
4.4.1. Функциональная организация ствола мозга
Афферентные сигналы поступают к чувствительным ядрам ствола от
сенсорных нейронов, тела которых расположены в чувствительных узлах
черепно-мозговых нервов. Афферентные волокна образуют синапсы с
интернейронами чувствительных ядер, аксоны которых проецируются на
двигательные или вегетативные ядра ствола. Эти ядра образованы
эфферентными нейронами, их аксоны иннервируют скелетные и гладкие мышцы
головы, шеи и внутренних органов, экзокринные железы, которые являются
рабочими органами для стволовых рефлексов. В замыкании большинства
рефлекторных дуг принимает участие ретикулярная формация, занимающая
промежуточное положение между расположенными дорсально
чувствительными ядрами и находящимися вентрально двигательными ядрами.
В стволе мозга расположены сегментарные нервные центры
собственных рефлексов, которые возникают при активации чувствительных волокон
черепно-мозговых нервов и проявляются ответными сокращениями
различных групп мышц головы или вегетативными реакциями (например,
слюноотделительный, зрачковый рефлексы). Наряду с ними в стволе
имеются координационные центры системных рефлексов, возникающих в
результате возбуждения чувствительных волокон черепно-мозговых нервов,
затем их ядер, от которых оно распространяется по восходящим или
нисходящим путям, приводя к цепи моторных и вегетативных рефлексов
ствола. Системные рефлексы могут проявляться последовательными
сокращениями мышц языка, глотки, гортани, секреторными реакциями,
изменениями частоты сокращений сердца, величины артериального давления,
частоты дыхания (например, глотание, кашель).
Комплексы ответных рефлекторных реакций на сенсорный стимул,
характеризующиеся запрограммированными (автоматическими) действиями,
определяются как центральные программы, например программа ходьбы,
жевания, дыхания. Под программой понимают заданную генетически
последовательность активации нервных центров, которая вызвана пусковым
влиянием какого-либо раздражителя. Запущенная центральная программа
реализуется автоматически, без дополнительного участия внешних
стимулов, однако порядок запрограммированных действий может изменяться в
зависимости от характера сенсорной информации (обратная связь).
4.4.1.1. Черепные нервы
В соответствии с основной выполняемой функцией выделяют группу
высоко специфических сенсорных черепно-мозговых нервов (II пара —
зрительный нерв, VIII пары — слуховой и вестибулярный нервы, I пара —
обонятельный нерв). Другую группу представляют смешанные
черепно-мозговые нервы, образованные соматическими и висцеральными афферентами
и эфферентами: V пара — тройничный нерв, VII пара — лицевой нерв, IX
пара — языкоглоточный нерв, X пара — блуждающий нерв. В третью
группу включают черепно-мозговые нервы, иннервирующие мышцы головы, в
составе которых, помимо аксонов мотонейронов, содержится небольшое
количество афферентных волокон от проприоцепторов соответствующих
мышц.
?
196 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
4.4.1.2. Функциональная специализация ядер ствола
В ядрах задних столбов продолговатого мозга происходит переключение
восходящих сенсорных путей тактильной и проприоцептивной
чувствительности. Аксоны получивших афферентную информацию нейронов ядер
задних столбов переходят на противоположную сторону, образуя
характерные симметричные структуры продолговатого мозга, которые называются
лемнисками (от лат. lemnisci — ленты для почетных венков). От этого
термина происходит название лемнисковой системы, предназначенной для
передачи специфической информации соматосенсорной коре.
Восходящие пути температурной и болевой чувствительности относятся
к экстралемнисковой системе, они проходят через ствол без
перекрещивания к таламусу, отдавая возбуждающие коллатерали к нейронам
ретикулярной формации ствола. Все виды сенсорной информации от
специальных органов чувств, за исключением обоняния, проецируются на
соответствующие ядра ствола, нейроны которых перерабатывают полученную
информацию и передают ее следующему иерархическому уровню
(проводниковая функция), представленному ядрами таламуса. Помимо этого
афферентные сигналы используются для осуществления собственных или
системных рефлексов ствола (рефлекторная функция).
Моторные ядра черепных нервов участвуют в осуществлении
рефлекторной деятельности ствола, но в то же время находятся под контролем
Таблица 4.1. Функциональная специализация черепных нервов
Пара
I
II
III
IV
V
VI
VII
VIII
IX
X
XI
XII
Название
Обонятельный
Зрительный
Глазодвигательный
Блоковый
Тройничный
Отводящий
Лицевой
Слуховой
Вестибулярный
Языкогло-
точный
Блуждающий
Добавочный
Подъязычный
Афферентный,
эфферентный
Афферентный
Афферентный
Эфферентный
Афферентный
Эфферентный
Афферентный
Эфферентный
Афферентный
Эфферентный
Афферентный
Эфферентный
Афферентный
Афферентный
Афферентный
Афферентный
Эфферентный
Афферентный
Эфферентный
Эфферентный
Афферентный
Эфферентный
Афферентный
Специфическая функция
Обоняние
Зрение
Движения глаз, сужение зрачка, изменение формы
хрусталика
Передача информации от глазодвигательных мышц
Движения глаз
Передача информации от глазодвигательных мышц
Жевание
Чувствительность лица
Движения глаз
Передача информации от глазодвигательных мышц
Движения мимических мышц лица, выделение
слюны и слез
Вкусовая чувствительность передних 2/3 языка
Слух
Чувство равновесия
Вкусовая чувствительность задней '/э языка, неба,
сведения о газовом составе артериальной крови
Выделение слюны, глотание
Передача сигналов от внутренних органов
Регуляция сокращений гладких мышц, сердца;
секреция экзокринных желез
Движения головы, шеи, плеч
Передача информации от мышц шеи
Движения языка
Передача информации от мышц языка
4. Функции центральной нервной системы • 197
двигательных областей коры. Берущий начало в этих областях кортико-
бульбарный тракт регулирует выходную активность двигательных ядер
черепно-мозговых нервов и участвует в управлении сокращениями лицевой
мускулатуры. Волокна кортикобульбарного тракта оканчиваются также на
нейронах координационных центров ствола: красного ядра, вестибулярных
ядер, ядер шва, голубого пятна. Эти ядра образуют нисходящие проекции к
интернейронам и мотонейронам спинного мозга, посредством которых
обеспечивают контроль рефлекторной деятельности спинного мозга и
регулируют распределение тонуса скелетных мышц, необходимого для
поддержания позы и выполнения движений. Красное и вестибулярное ядра,
ядра шва и голубого пятна получают также коллатерали волокон корти-
коспинального тракта — прямого пути от двигательной коры к спинному
мозгу. Таким образом, моторные ядра ствола участвуют в его собственной
рефлекторной деятельности и одновременно являются иерархическим
уровнем моторной системы мозга: двигательная кора—ствол—спинной
мозг.
При осуществлении двигательной функции ЦНС ядра ствола
взаимодействуют с мозжечком: нейроны таких ядер активируются сенсорными
системами (вестибулярная, проприоцептивная, зрительная),
возбуждающимися в процессе движения, а затем передают информацию мозжечку,
который, в свою очередь, регулирует выходную активность
координационных центров ствола, в первую очередь, вестибулярных ядер. У мозжечка
нет прямых связей с корой, и все его афферентные и эфферентные связи с
ней осуществляются посредством нескольких ядер ствола (ретикулярные
ядра продолговатого мозга, ядра нижней оливы и моста).
В регуляции жизненно важных вегетативных функций
(кровообращение, дыхание, пищеварение) участвуют относительно небольшие, сложно
организованные группы нейронов ретикулярной формации,
координирующие активность симпатического и парасимпатического отделов
вегетативной нервной системы. Большинство нейронов ретикулярной формации
являются полимодальными: они получают разные виды сенсорной
информации, а также проекции нейронов гипоталамуса и лимбической системы
мозга. Гипоталамус координирует деятельность вегетативных центров
ствола, а лимбическая система изменяет их активность при возникновении
эмоций.
Компактно сгруппированные в нескольких ядрах ствола моноаминерги-
ческие нейроны (ядра шва, голубого пятна, среднего мозга) образуют
дивергентные восходящие и нисходящие проекции, способные повлиять на
процесс передачи нервных импульсов в различных регионах мозга (таламус,
лимбические структуры, полосатое тело, кора). Нейромодулирующее
действие моноаминергических нейронов используется при регуляции
циклических процессов (чередование сна и бодрствования, распределение
внимания), возникновении мотиваций и эмоций.
4.4.2. Рефлекторная функция ствола мозга
Рефлексы ствола участвуют в осуществлении функций пищеварения
(выделение слюны, жевание, глотание), защиты от повреждающих
воздействий (рвота, чиханье, кашель, слезоотделение, мигание) и приспособлении
к меняющимся условиям среды (ориентировочные, сторожевые рефлексы).
Слюноотделительный рефлекс возникает при раздражении вкусовых
рецепторов и механорецепторов полости рта, афферентная импульсация
проводится по чувствительным волокнам лицевого и языкоглоточного, а так-
198 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
же тройничного и блуждающего нервов. Слюноотделительный центр
продолговатого мозга представляет функциональное объединение нейронов,
расположенных в ретикулярной формации, которые активируются при
раздражении вкусовых и обонятельных рецепторов. Это координационный
центр, который связан не с одним, а с несколькими вегетативными
ядрами. В частности, рефлекторное выделение слюны происходит в результате
одновременной активации парасимпатических волокон лицевого и языко-
глоточного нервов, а также симпатических нейронов из II—IV грудных
сегментов спинного мозга. Стимуляция слюноотделения одним лишь
запахом, видом пищи или воспоминаниями о ней указывает на возможность
активации слюноотделительного центра нисходящими корковыми
проекциями.
Рецептивные поля глотательного рефлекса находятся в корне языка,
небе, гортани и надгортаннике, где расположены механорецепторы
тройничного и языкоглоточного нервов, а также верхнегортанной ветви
блуждающего нерва. Они раздражаются пищевым комком, проглатываемой
жидкостью или слюной, после чего афферентная импульсация поступает к ядрам
тройничного и солитарного трактов и достигает глотательного центра
ретикулярной формации, находящегося между ядром лицевого нерва и
нижней оливой. Эфферентная импульсация, обеспечивающая
координированные сокращения мышц рта, глотки и пищевода, поступает к ним по
волокнам подъязычного и лицевого нервов, а также при посредстве
мотонейронов первых трех шейных сегментов спинного мозга. Глотательный центр
функционально связан с дыхательным центром, эта связь обеспечивает
задержку дыхания при глотании и перекрытие надгортанником входа в
дыхательные пути во избежание поступления в них пищи.
Жевательные рефлексы (открывания и закрывания рта) осуществляются
в соответствии с центральной программой жевания. Она запускается
стимуляцией механорецепторов при изменениях давления на твердое небо, зубы,
десны. Афферентная информация поступает в продолговатый мозг по
чувствительным волокнам тройничного нерва, двигательное ядро которого
осуществляет эфферентную иннервацию жевательных мышц.
Представление о жевании как о рефлексе описывает этот процесс в виде чередования
двух реципрокных фаз: открывания и закрывания рта. В современном
представлении центр жевания функционирует как центральный генератор
ритмических мышечных сокращений, который зависит от сенсорных
сигналов (поступление твердой пищи в ротовую полость) и от влияния
центральных структур (жевание можно начать и прекратить произвольно).
Нисходящий контроль центра жевания осуществляют двигательные ядра
ствола, моторные области коры, мозжечок и базальные ганглии.
Рвотный рефлекс является результатом раздражения механо- и хеморе-
цепторов, расположенных в корне языка, глотке, слизистой оболочке
желудка, кишечника, брюшины, а также стимуляцией обонятельных,
вкусовых рецепторов (при резко неприятном запахе или вкусе пищи) и
вестибулярных рецепторов внутреннего уха (вследствие укачивания).
Афферентные импульсы поступают в ретикулярную формацию продолговатого мозга
по волокнам блуждающего, языкоглоточного и других чувствительных
нервов. Рвотный центр осуществляет сложную координацию соматических и
висцеральных двигательных реакций, приводящих к извержению
содержимого желудка, а иногда и кишечника, через рот. При расслаблении дна
желудка и сфинктера между желудком и пищеводом происходит
непроизвольное сокращение диафрагмы и брюшной стенки одновременно с сокра^
щением привратника, что приводит к выталкиванию содержимого желудка
4. Функции центральной нервной системы • 199
в пищевод. Повышение внутриплеврального давления способствует
продвижению содержимого желудка из пищевода в ротовую полость.
Рефлекторный подъем мягкого неба предупреждает попадание рвотных масс в
носовую часть глотки, а рефлекторное закрытие голосовой щели и
прекращение дыхания предотвращают аспирацию содержимого желудка в легкие.
Эфферентные пути рвотного рефлекса представлены волокнами
блуждающего и языкоглоточного нервов, а также мотонейронами, иннервирующи-
ми мышцы брюшной стенки и диафрагму. Рвотный центр находится под
контролем кортикальных центров мозга.
Чихательный рефлекс обеспечивает удаление инородных веществ,
попавших в полость носа, и возникает при механическом раздражении
чувствительных окончаний тройничного нерва. Сначала происходит глубокий
вдох, а затем форсированный выдох при открытой голосовой щели.
Поднимающийся к небу язык закрывает путь в ротовую полость, и поток
выходящего воздуха идет через нос, освобождая его полость от инородных
частиц. Чихательный рефлекс представляет собой сложный моторный акт
с жестко запрограммированной последовательностью действий, которой
управляет центральный генератор, связанный с дыхательным центром.
Возбуждение чувствительных волокон передается нейронам дыхательного
центра и эфферентным волокнам языкоглоточного, блуждающего,
подъязычного нервов; в акте чиханья участвуют и мотонейроны дыхательных
мышц. Запущенный механизм чихательного рефлекса всегда приводит к
его завершению вне зависимости от поступления сенсорных сигналов.
Кашлевой рефлекс возникает при раздражении находящихся в
носоглотке, гортани и трахее чувствительных окончаний тройничного,
языкоглоточного, верхнего гортанного и блуждающего нервов. Механическими
раздражителями этих чувствительных окончаний являются вдыхаемые с
воздухом твердые частицы или продукты воспалительных процессов,
химическими раздражителями служат вдыхаемые газы. Вследствие раздражения
чувствительных окончаний происходит глубокий вдох, закрывается
голосовая щель, расслабляется диафрагма, а скелетные дыхательные мышцы
сокращаются, что в итоге приводит к повышению внутригрудного давления,
которому противодействует закрытая голосовая щель. При открытии
голосовой щели возникает быстрый выдох, способствующий удалению
инородных тел или воспалительной слизи. При кашлевом рефлексе происходит
согласование активности дыхательного центра с нейронами,
управляющими деятельностью мышц гортани и скелетных мышц. Эфферентное звено
рефлекса включает возвратный гортанный нерв, регулирующий закрытие
голосовой щели, и спинномозговые нервы, контролирующие сокращения
грудных и брюшных мышц.
Слезный рефлекс обусловлен подсыханием роговицы или попаданием на
нее инородных тел, рефлекторный механизм защищает роговицу и
конъюнктиву от высыхания и от раздражения инородными телами,
смываемыми слезной жидкостью. Афферентная импульсация от роговицы
осуществляется по волокнам слезной ветви тройничного нерва, в переключении
сигналов, следующих к слезным железам, участвуют чувствительные ядра
тройничного тракта и ретикулярная формация. Эфферентное звено
представляют парасимпатические нейроны, стимулирующие выделение слезной
жидкости. Преганглионарные парасимпатические нейроны расположены в
области моста, они могут возбуждаться и вызывать повышенное выделение
слезной жидкости при чиханье, кашле, рвоте, жевании, действии яркого
света, а также при переживании эмоций. Сопутствующее указанным
реакциям слезотечение объясняется стимуляцией парасимпатических нейронов
200 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
из чувствительного ядра тройничного нерва, гипоталамуса и лимбической
системы. Активация симпатического отдела вегетативной нервной системы
приводит к уменьшению количества выделяемой слезной жидкости.
При раздражении роговицы помимо слезного возникает мигательный
рефлекс, связанный с раздражением чувствительных окончаний
тройничного нерва. Рефлекторное опускание века происходит вследствие
сокращения орбикулярной мышцы, получающей иннервацию от лицевого нерва.
При движении века инородное тело удаляется с роговицы и уносится
слезной жидкостью, а сама слезная жидкость равномерно распределяется по
роговице и конъюнктиве.
В верхнем отделе ствола, представленном структурами среднего мозга,
расположен центр зрачкового рефлекса, который служит для регуляции
потока света, поступающего в глаз: на ярком свету зрачок суживается, а в
темноте — расширяется. Афферентные импульсы от сетчатки глаза
поступают к верхним буграм четверохолмия, где находятся нейроны,
осуществляющие замыкание рефлекторной дуги в зависимости от характера
афферентной импульсации. При ярком освещении центр зрачкового рефлекса
активирует вегетативные ядра глазодвигательных нервов, которые иннер-
вируют мышцы, суживающие зрачок. В темноте характер афферентной
импульсации изменяется, в связи с этим рефлекторная дуга замыкается на
симпатические нейроны, находящиеся в нижнем шейном и верхнем
грудном сегментах спинного мозга. Происходит активация этих нейронов, что
ведет к сокращению расширяющих зрачок радиальных мышц.
Если верхние (передние) бугры четверохолмия получают афферентные
сигналы от сетчатки, то нижние (задние) — от слуховых рецепторов. При
действии новых зрительных или слуховых раздражителей здесь замыкаются
рефлекторные дуги ориентировочных рефлексов, проявляющихся поворотом
головы и глаз в сторону раздражителя и одновременным
перераспределением тонуса скелетных мышц так, чтобы получилась поза, из которой
легче начать движение. Указанные реакции получили название сторожевых
или стартовых рефлексов. Физиологическая основа их возникновения
описана в следующих разделах этой главы.
4.4.2.1. Статические и статокинетические рефлексы
Статические и статокинетические рефлексы обеспечивают степень
тонического напряжения мышц, фиксирующих неподвижное положение
суставов, которое необходимо для поддержания позы и сохранения равновесия
и ориентации конечностей во время движения. Статические рефлексы
подразделяются на позные, или рефлексы положения, благодаря которым
сохраняется вертикальная поза, и установочные (выпрямления) рефлексы,
проявляющиеся при смене одной позы на другую, например при вставании из
положения сидя или лежа. Статокинетические рефлексы вызываются
действием на организм прямолинейного или углового ускорения.
Одним из источников афферентной импульсации, требующейся для
возникновения обеих разновидностей рефлексов, служат рецепторы
вестибулярного аппарата, реагирующие на изменения положения тела, наклоны
и повороты головы. Еще одну рефлексогенную зону образуют проприоцеп-
торы шейных мышц, возбуждающиеся в связи с наклонами головы. В
соответствии с источником афферентной импульсации различают
вестибулярные (или лабиринтные) и шейные тонические рефлексы. Определение
рефлексов как тонических указывает на перераспределение тонуса мышц,
требуемого для сохранения равновесия и необходимой позы при смещении
4. Функции центральной нервной системы • 201
Шея
Отклонение
дорсально
Нормальное
отклонение
Отклонение
вентрально
Лабиринт
голова вверх
А
71
7
ш
нормальное
положение
головы
Б
Д
1 1
3
голова вниз
В
Л/
Е
И
1 Г
Рис. 4.23. Схема лабиринтных и шейных рефлексов: распределение тонуса мышц
конечностей.
Тонус мышц, сгибающих или разгибающих конечности, изменяется рефлекторно в
соответствии с положением головы относительно горизонта (афферентные сигналы поступают от вес-
тибулорецепторов) и наклонами головы (афферентные сигналы поступают от проприоцепто-
ров мышц шеи). Окончательный вариант распределения тонуса мышц на конечностях зависит
от характера афферентной информации, поступившей из обоих источников.
центра тяжести тела. Для удержания равновесия необходимо повысить
тонус мышц, противодействующих силе гравитации. К таким мышцам
относятся разгибатели туловища и проксимальных отделов конечностей
(рис. 4.23).
Рефлекторные дуги вестибулярных и шейных рефлексов замыкаются в
соответствующих сенсорных ядрах продолговатого мозга, нейроны
которых образуют проекции на стволовые центры нисходящих двигательных
путей, оканчивающихся в сером веществе спинного мозга. Двигательные
центры ствола представлены крупными нейронами красного ядра (его маг-
ноцеллюлярная часть), вестибулярными ядрами, медиальной частью
ретикулярной формации и покрышкой среднего мозга. Нейроны этих ядер образуют
202 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
нисходящие проекции на интернейроны спинного мозга и
гамма-мотонейроны, что позволяет им координировать активность мотонейронов,
непосредственно управляющих мышечными сокращениями.
Позные рефлексы проявляются при подготовке к любому движению,
поскольку для его выполнения требуется определенная исходная поза:
например, для того, чтобы встать из положения сидя, вначале необходимо
чуть наклонить вперед корпус и голову. Подъем с постели тоже начинается
с опережающего изменения положения головы, при котором возбуждаются
вестибулярные рецепторы, проприоцепторы шеи и происходит
рефлекторное перераспределение тонуса мышц туловища и конечностей,
необходимое для того, чтобы подняться.
Примером статокинетического рефлекса может служить сохранение
равновесия у стоящего в транспорте пассажира, когда это равновесие
нарушается при резком начале движения или внезапной остановке. При
смещении центра тяжести рефлекторно повышается тонус разгибателей на той
стороне, в которую отклоняется тело, а выставленная рефлекторно в эту
сторону прямая нога помогает удержать равновесие. При вертикальных
ускорениях имеют место лифтные рефлексы: в момент начала движения
лифта вверх у находящегося на лифтной площадке человека снижается тонус
разгибателей, и поэтому его ноги подгибаются, а при опускании площадки
тонус разгибателей увеличивается и ноги фиксируются в положении
максимального разгибания.
Во время ходьбы и бега возникает смещение центра тяжести тела
вперед. Если его уже нельзя вернуть в исходное положение, не оторвав
конечность от опоры, то для сохранения равновесия приходится сделать шаг
вперед. В том случае, если поскользнувшийся человек начинает падать, на
стороне падения рефлекторно повышается тонус разгибателей. Этот эво-
люционно древний рефлекторный механизм приводит к повышению
тонуса разгибателей не только ноги, выставленной в сторону падения, но и
руки, что нередко приводит к типичному перелому лучевой кости, когда при
падении на нее приходится вся сила удара. Спортсмены, чья деятельность
предполагает частые падения, учатся это делать безопасно, а овладение
новой техникой указывает на возможность перепрограммирования
статокинетического рефлекса, что связано с участием двигательных центров
мозжечка и моторных областей коры.
В клинической практике статические и статокинетические рефлексы
называют постуральными и исследуют их электромиографически.
4.4.2.2. Нисходящие двигательные пути ствола мозга
Связь двигательных центров ствола с интернейронами и мотонейронами
спинного мозга обеспечивается двумя различающимися в функциональном
отношении нисходящими путями: медиальным и латеральным (рис. 4.24).
Медиальный путь образуют волокна вестибулоспинального, ретикулоспи-
нального и тектоспинального трактов, которые оканчиваются билатерально
на медиальных колоннах вентральных рогов спинного мозга, где находятся
интернейроны и мотонейроны, управляющие мышцами туловища и
проксимальных отделов конечностей. Основная функциональная задача этого
пути состоит в управлении деятельностью мышц-разгибателей,
обеспечивающих сохранение равновесия и вертикального положения тела. Еще
одна его функция заключается в модулировании активности возбуждающих и
тормозных интернейронов спинного мозга, что проявляется торможением
или облегчением спинальных рефлексов. Специфической задачей текто-
4. Функции центральной нервной системы • 203
А. Латеральный Б. Медиальный
путь путь
Рис. 4.24. Схема нисходящих двигательных путей ствола к спинному мозгу.
А. Латеральный путь начинается от крупноклеточных нейронов красного ядра и оканчивается
на противоположной стороне спинного мозга.
Б. Медиальный путь образован аксонами нейронов вестибулярного ядра, ретикулярной
формации и покрышки среднего мозга; в спинном мозге представлен передним канатиком,
оканчивается билатерально.
спинального тракта является координация поворотов головы и следящих
движений глаз с изменениями позы.
Латеральный путь от ствола к спинному мозгу представлен руброспи-
нальным трактом, волокна которого переходят на противоположную
сторону и после прохождения ствола спускаются в спинной мозг, где
образуют синапсы с интернейронами и мотонейронами, расположенными лате-
рально и контролирующими деятельность дистальных мышц конечностей.
Эти мышцы предназначены для выполнения сложных движений,
связанных, например, с захватом предметов рукой и пальцами.
После перерезки руброспинального пути у экспериментальных
животных возникает стойкое повышение тонуса разгибателей туловища и
конечностей, что получило название децеребрационной ригидности. Она исчезает
после дополнительной перерезки вестибулоспинального и ретикулоспи-
нального путей. Сопоставление этих фактов дало повод к выводу о
необходимости красных ядер для противодействия стволовым
антигравитационным центрам, т. е. вестибулярным ядрам и ретикулярной формации.
Однако у человека после изолированного поражения красного ядра повышение
тонуса разгибателей выражено незначительно, а иногда повышения их то-
204 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
нуса и вовсе не наблюдается. Только при массивных очагах повреждения в
области верхнего двухолмия, когда страдает и кортикоспинальный путь,
обнаруживается повышенный тонус разгибателей в нижних конечностях,
но одновременно с этим в верхних конечностях преобладает тонус
сгибателей. Возможно, это обстоятельство обусловлено изменением
функционального назначения верхних конечностей у человека по сравнению с
четвероногими.
4.4.2.3. Глазодвигательные центры ствола
Движения глазного яблока осуществляют четыре прямые мышцы
(наружная, внутренняя, верхняя, нижняя) и две косые мышцы (верхняя и
нижняя). Они поворачивают глаз внутрь или наружу, вверх или вниз, чтобы
сфокусировать рассматриваемые объекты в центральной ямке сетчатки,
обеспечивающей максимальную остроту зрения; при этом движения
глазных яблок происходят содружественно. Сокращения мышц определяются
влиянием глазодвигательных и блоковых нервов, ядра которых
расположены в ростральной части среднего мозга, а также ядер отводящих нервов,
содержащихся в каудальной части моста. Различают очень быстрые
движения глаз {саккады) и плавные следящие движения. Саккады, происходящие
около трех раз в секунду, обеспечивают перемещение изображения по
рецепторам сетчатки, которые не реагируют на стабильное изображение, а
отвечают на его движение. Плавные следящие движения глаз возникают в
связи с перемещением наблюдаемых объектов и при движении головы и
тела наблюдателя. Следящие движения позволяют удерживать
изображение в пределах центральной ямки сетчатки.
Афферентная информация к мотонейронам глазодвигательных мышц
поступает от зрительных, вестибулярных, слуховых рецепторов, а также от
проприоцепторов мышц глаза. В зависимости от характера афферентной
информации дуги глазодвигательных рефлексов замыкаются на разных
уровнях ствола. Стволовые центры, осуществляющие замыкание
рефлекторных дуг и обеспечивающие определенное положение взора,
расположены в парамедианной ретикулярной формации и ретикулярной формации
среднего мозга. Уровень возбуждения глазодвигательных центров
регулируют нейроны верхних бугров четверохолмия, вестибулярные ядра и
мозжечок, кора больших полушарий.
4.5. Функции ретикулярной формации
Ретикулярная формация расположена во внутренней части ствола на
протяжении от нижних отделов промежуточного мозга до продолговатого
мозга, где она проходит между двигательными и чувствительными ядрами.
Собственные ядра ретикулярной формации имеют низкую плотность
нейронов, относительно высокий процент клеток нейроглии и слабо
выраженные границы ядер, количество которых измеряется несколькими
десятками. Большинство нейронов ретикулярной формации принимает коллатера-
ли от нескольких сенсорных путей {полисенсорная конвергенция) и обладает
тонической активностью покоя (5—10 импульсов в секунду), растущей в
связи с поступлением афферентных сигналов. Аксоны нейронов
ретикулярной формации обычно делятся на две ветви, следующие в восходящем
и нисходящем направлениях. Восходящие влияния ретикулярной
формации регулируют возбудимость нейронов коры в связи с циклом
сон—бодрствование, они необходимы для сохранения сознания и восприятия сенсор-
4. Функции центральной нервной системы • 205
ных сигналов. Нисходящие влияния осуществляются посредством ретику-
лоспинального тракта, входящего в состав медиального пути к спинному
мозгу и регулирующего его двигательную функцию. Координационные
центры ретикулярной формации обеспечивают согласование афферентной и
эфферентной систем, участвующих в регуляции вегетативных функций
(кровообращение, дыхание, пищеварение).
4.5.1. Особенности нейронной организации ретикулярной
формации
Афферентные сенсорные входы представлены волокнами спиноретикулярно-
го тракта, образованного отростками нейронов задних рогов спинного
мозга, коллатералями от аксонов интернейронов чувствительных ядер
(тройничного, блуждающего, языкоглоточного, вестибулярного и
слухового нервов), а также небольшим количеством волокон от других сенсорных
проводящих путей, следующих через ствол. Остальные проекции на
нейроны ретикулярной формации представлены окончаниями нейронов ядер
мозжечка, гипоталамуса и коры, они регулируют активность нейронов
ретикулярной формации. Разные области и ядра ретикулярной формации
образуют синаптические контакты между собой, как, например, каудальная
область с ростральной, и могут реципрокно влиять друг на друга.
В дорсальном отделе продолговатого мозга находится ядро солитарного
или одиночного тракта, получающее сенсорную информацию от
внутренних органов. В составе волокон языкоглоточного и блуждающего нервов
сюда поступают сигналы от периферических баро- и хеморецепторов. От
нейронов ядра солитарного тракта отходят аксоны к парасимпатическим
нейронам черепно-мозговых нервов (дорсальные ядра блуждающих нервов
и обоюдные ядра) и к рострально-вентролатеральной области
продолговатого мозга, регулирующей активность симпатических нейронов спинного
мозга.
Вегетативные центры ретикулярной формации продолговатого мозга
находятся под контролем гипоталамуса, который изменяет активность
симпатического и парасимпатического отделов соответственно
возникающим задачам, например поддержанию температуры тела, осуществлению
оборонительного, пищевого или полового поведения. Гипоталамус
обеспечивает функциональное объединение вегетативных центров ствола и
спинного мозга в целостные системы, регулирующие функции кровообращения
и дыхания, температуру тела. Гипоталамус подвержен влиянию лимбиче-
ских структур мозга, обеспечивающих формирование эмоциональных
реакций, при возникновении которых происходит комплексное изменение
активности вегетативных центров, приспосабливающее внутренние
процессы организма к решению текущих поведенческих задач.
В ретикулярной формации моста и продолговатого мозга располагаются
структуры сосудодвигателъного центра, состоящего из прессорного и депрес-
сорного отделов. Прессорный отдел находится в рострально-вентральной
области продолговатого мозга, где сосредоточены нейроны, имеющие
решающее значение в повышении общей выходной активности
симпатического отдела вегетативной нервной системы. Депрессорный отдел
расположен в медиокаудальных отделах ствола, его активация сопровождается
понижением тонуса симпатических нервов и одновременным повышением
тонуса блуждающего нерва.
Поблизости от ядер одиночного тракта билатерально расположен
дыхательным центр, состоящий из дорсальной и вентральной групп нейронов.
206 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
В зависимости от выполняемой функции нейроны дыхательного центра
подразделяются на инспираторные, экспираторные, преинспираторные и
постинспираторные. Инспираторные нейроны генерируют ритм дыхания,
их нисходящие в спинной мозг аксоны возбуждают мотонейроны
диафрагмы и наружных межреберных мышц, при сокращении которых происходит
вдох. Экспираторные нейроны регулируют активность мотонейронов
внутренних межреберных мышц, сокращения которых происходят при
активном выдохе. Преинспираторные и постинспираторные нейроны
регулируют активность инспираторных нейронов. Смена вдоха выдохом и наоборот
происходит при участии нейронов пневмотаксического центра,
расположенного в передней части моста.
4.5.2. Нисходящие и восходящие влияния ретикулярной формации
Нисходящие влияния ретикулярной формации предназначены для
регуляции рефлекторной деятельности спинного мозга (см. раздел 4.2.2).
Восходящие дивергентные проекции ретикулярной формации к другим отделам
головного мозга образованы ветвящимися аксонами моноаминергических
нейронов среднего мозга, голубого пятна и ядер шва, а также холинергиче-
ских нейронов. Метаботропное действие моноаминергических медиаторов
влияет на биохимические процессы нейронов-мишеней, это действие
проявляется медленно по сравнению с распространением сигналов,
передающихся через синапсы с помощью ионотропных рецепторов. Результатом
такого действия является модуляция функций многих нервных клеток,
участвующих в формировании мотиваций, эмоций и целенаправленного
поведения.
Норадренергические нейроны голубого пятна обладают фоновой
активностью, изменяющейся в зависимости от сенсорной афферентации разных
модальностей, а также под влиянием других центров ретикулярной
формации, гипоталамуса и мозжечка. Аксоны нейронов голубого пятна
проецируются почти во все области мозга и заканчиваются варикозными
расширениями, из которых выделяется норадреналин, диффундирует через
межклеточное пространство и через него действует на большие популяции
нейронов. Активность норадренергических нейронов необходима для
поддержания бодрствования, при физиологическом повышении этой
активности формируются двигательные и вегетативные компоненты
стресс-реакции, чрезмерное повышение активности нейронов голубого пятна
приводит к развитию панического синдрома, а при сниженной активности
возникает депрессия.
Проекция нейронов черной субстанции среднего мозга к полосатому
телу {нигростриатныи путь) необходима для регуляции его активности при
осуществлении произвольных движений. Дегенеративное поражение
нейронов черной субстанции приводит к развитию болезни Паркинсона,
проявляющейся возникновением ригидности мышц и тремором. Еще одна
проекция дофаминергических нейронов направлена к структурам лимбиче-
ской системы и фронтальной коре {мезолимбическии и мезокортикальныи
пути), участвующим в образовании мотиваций и эмоций. Влияние
дофамина на эти структуры усиливается при удовлетворении биологических
потребностей, а переживание в этот момент положительных эмоций
побуждает людей к повторению действий, приводящих к подобному результату.
Роль дофамина состоит в модуляции возбудимости нейронов-мишеней
лимбических структур и коры, чтобы их взаимодействие становилось
оптимальным при создании программы поведения, а сами дофаминергические
4. Функции центральной нервной системы • 207
нейроны являются необходимым звеном образующихся поведенческих
программ. При избытке дофамина вследствие патологически повышенной
активности дофаминергических нейронов возникают грубые нарушения
поведения и мышления, проявляющиеся, например, при заболевании
шизофренией.
Нейроны ядер шва, синтезирующие серотонин, образуют проекции в
спинной мозг, кору мозжечка, ядра таламуса и кору больших полушарий,
что в совокупности создает восходящую и нисходящую системы, каждая из
которых принимает участие в регуляции циклических процессов сна и
бодрствования. Активация холинергических нейронов рострального отдела
среднего мозга и гигантоклеточной области покрышки моста, образующих
проекции к зрительному бугру и коре, необходима для поддержания
сознания, переработки сенсорной и ассоциативной информации в коре и
обеспечения познавательной интеллектуальной деятельности. Активность
холинергических, норадренергических и серотонинергических нейронов в
цикле сна и бодрствования периодически изменяется под влиянием супра-
хиазмальных и вентромедиалъных ядер гипоталамуса, играющих роль
основных водителей суточной ритмики физиологических процессов.
4.6. Функции мозжечка
Функция мозжечка состоит, в первую очередь, в формировании
двигательных программ, необходимых для поддержания равновесия тела, регуляции
силы мышц и объема совершаемых с их участием движений. Он не является
составной частью иерархической сети двигательных систем, но имеет
связи со всеми ее уровнями: моторной корой, двигательными центрами
ствола и спинным мозгом. Благодаря этим связям мозжечок может сравнивать
моторные программы коры с их исполнением, а затем корректировать
движения, не соответствующие намеченной программе. Мозжечок способен
накапливать опыт двигательной активности, сохраняя его в
долговременной моторной памяти.
4.6.1. Функциональная организация мозжечка
В мозжечке имеются три области, различающиеся спецификой своих
соединений с головным и спинным мозгом и выполняемыми функциями:
1) вестибулоцеребеллум (червь с примыкающими к нему областями старой
коры); 2) спиноцеребеллум (примыкающие к червю медиальные области
полушарий мозжечка); 3) цереброцеребеллум, включающий в себя латеральные
области полушарий мозжечка (рис. 4.25). Вестибулоцеребеллум получает
афферентную информацию от вестибулярных ядер и к ним же посылает
эфферентные сигналы: его основная задача состоит в сохранении
равновесия при стоянии и ходьбе, а также в управлении движениями глаз.
Спиноцеребеллум основную часть сенсорной информации получает от
проводящих афферентных путей спинного мозга — двух спиномозжечковых
трактов, несущих импульсы от проприоцепторов мышц и сухожилий.
Эфферентная информация от ядер этой части мозжечка поступает к
двигательным центрам ствола, относящимся как к медиальному, так и к
латеральному нисходящим путям. Спиноцеребеллум контролирует правильность
начинающихся движений ног и рук. Цереброцеребеллум получает при
участии ядер моста информацию о планирующемся движении из сенсомотор-
ных областей коры и посылает эфферентные сигналы к первичной и
вторичной моторной коре, участвуя в планировании движений.
208 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
_ Управление
движениями
I Планирование
Г движений
"1 Сохранение
I равновесия
Г и движения
I глаз
От зри- От вес- От спинного От коры
тельных и тибуляр- мозга и ядра
слуховых ных тройничного
путей ядер нерва
Рис. 4.25. Схема афферентных и эфферентных связей трех функциональных
областей мозжечка.
Вестибулоцеребеллум (функция сохранения равновесия и управления движениями глаз)
получает зрительную и слуховую информацию, входные сигналы от вестибулярных ядер, ядер
тройничного нерва и спинного мозга. Основной эфферентный выход к вестибулярным ядрам
ствола.
Спиноцеребеллум (управление движениями конечностей) получает афферентную информацию
от проприоцепторов посредством спиномозжечковых трактов; эфферентный выход к
первичной и вторичной моторной коре.
Цереброцеребеллум (формирование двигательных программ) получает афферентную
информацию при посредничестве ядер моста от сенсомоторных областей коры; основной
эфферентный выход к первичной и вторичной моторной коре.
Таким образом, мозжечок постоянно получает информацию о
планирующихся движениях от коры, о положении головы и глаз, о тонусе
мышц, необходимом для совершения движения,— от двигательных
центров ствола, а от спинного мозга к нему поступают сведения о характере
уже совершаемых движений. Располагая всей полнотой информации о
движении — от замысла до исполнения, мозжечок постоянно сравнивает
совпадение замысла с исполнением. При несоответствии хода движения
намеченному плану мозжечок немедленно исправляет возникающие
ошибки. Он может вносить коррективы как в двигательную программу,
благодаря своим связям с моторной корой, так и в исполнение движения,
действуя на двигательные центры ствола, на медиальные и латеральные
нисходящие пути.
При выполнении запрограммированных произвольных движений
выходная активность нейронов зубчатых ядер мозжечка регистрируется
приблизительно на 10 мс раньше, чем она обнаружится в моторной коре. Это
опережение имеет особенное значение при выполнении быстрых движе-
Спиноцеребеллум
к медиальным
>. нисходящим
системам
к латеральным
нисходящим
системам
к моторной и
>- премоторной
коре
к вестибулярным
ядрам
4. Функции центральной нервной системы • 209
ний, когда из-за дефицита времени кора не может исправить ошибку. В
таких случаях мозжечок влияет на другие двигательные центры, определяя
наиболее рациональную последовательность активации их нейронов, для
того чтобы необходимые движения были выполнены максимально точно, а
ошибочные, лишние движения исключались. Мозжечок не может
инициировать движение, он лишь обеспечивает необходимый баланс действующих
мышц, причем его участие особенно необходимо в заключительной стадии
движений, когда замысел сопоставляется с результатом. При мозжечковом
поражении пациент, например, промахивается, когда его просят быстро
прикоснуться к кончику своего носа указательным пальцем.
4.6.2. Взаимодействие нейронов коры и ядер мозжечка
Афферентная информация, адресованная мозжечку, распределяется между
его ядрами и корой. Под влиянием афферентных сигналов нейроны ядер
мозжечка создают основную часть его выходной активности, и лишь самая
старая часть коры — клочок имеет непосредственную связь с
вестибулярными ядрами. Функция коры мозжечка состоит в непрерывной модуляции
выходной активности ядер тормозными нейронами Пуркинье,
использующими в качестве медиатора ГАМК (рис. 4.26).
Во внутреннем слое трехслойной коры мозжечка расположены
зернистые клетки, являющиеся входными нейронами коры, а также тормозные
по отношению к ним клетки Гольджи. Афферентные моховидные волокна,
образованные нейронами
нескольких ядер ствола и спинного
мозга, передают информацию
зернистым клеткам от проприо-
цепторов скелетных мышц,
вестибулярного аппарата и коры.
Аксоны зернистых клеток направлены
в наружный слой коры мозжечка,
где они Т-образно делятся на
длинные волокна, которые
возбуждают нейроны Пуркинье и
одновременно тормозные
интернейроны, сдерживающие активность
клеток Пуркинье. Нигде в ЦНС
больше не встречается столь
выраженное, как в коре мозжечка,
преобладание торможения над
возбуждением, поэтому
поступающее в кору мозжечка
возбуждение прекращается уже через
100 мс: так быстро «стирается»
информация об осуществлении
актов движения — она не должна
мешать поступлению новых
оперативных данных.
Грушевидные нейроны
Пуркинье формируют средний слой
коры, они имеют аксоны,
образующие синапсы с нейронами ядер
мозжечка. Каждая клетка Пурки-
Г
+
+
г
Возбуждающие
интернеироны
Тормозные
интернейроны
т
+>
_
►
+*
Афферентная Эфференп
информация информац
Клетки
Пуркинье
'
' -
Нейроны
ядер
мозжечка
гная
ия ,
'
Рис. 4.26. Схема взаимодействия коры и
ядер мозжечка.
Афферентная информация, поступающая в
мозжечок, распределяется между его ядрами и
корой. Тормозные нейроны Пуркинье
контролируют эфферентные пути мозжечка,
начинающиеся от нейронов ядер, поэтому
эфферентная активность мозжечка зависит от
возбуждающих афферентных сигналов и тормозных
влияний клеток Пуркинье.
210 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
нье получает сигналы от приблизительно 200 000 параллельных волокон
зернистых клеток, а каждая зернистая клетка собирает афферентные входы
от десятка моховидных волокон. Еще один афферентный вход в мозжечок
представлен лазающими волокнами, которые образованы нейронами
нижнего оливарного ядра продолговатого мозга и доставляют информацию от
коры и от спинного мозга. Лазающие волокна обертывают тела и дендриты
клеток Пуркинье, образуя с ними многочисленные синапсы, причем
каждое лазающее волокно контактирует с несколькими (от одного до десяти)
нейронами Пуркинье, но каждая клетка Пуркинье получает возбуждение
только от одного лазающего волокна. Синапс между окончанием
лазающего волокна и нейроном Пуркинье является одним из наиболее
эффективных в ЦНС потому, что в ответ на одиночный потенциал действия,
проведенный лазающим волокном, в нем возникает высокоамплитудный ВПСП.
Результатом этого становится высокочастотный залп потенциалов
действия клетки Пуркинье, направленный на нейроны ядер мозжечка и
тормозящий их активность. Этот тормозной выход из коры мозжечка является
конечным и единственным результатом ее деятельности.
Нейронная сеть коры мозжечка организована по принципу
функциональных модулей, каждый из которых занимает сагиттальную зону шириной
1—2 мм. В каждый модуль входит лазающее волокно из определенной
части оливы, а каждой клетке Пуркинье достается обособленная информация
от моховидных и лазающего волокон. Лазающие волокна модулируют
активность моховидных волокон, они могут усиливать их влияние, но могут
и ограничивать эффективность определенных входов. В функциональном
отношении это означает, что активность одного пути будет изменяться в
зависимости от активности другого пути. Соотношение активности
отдельных лазающих и моховидных волокон может меняться вследствие
приобретаемого двигательного опыта — в результате подобной модуляции синап-
тических переключений повышается эффективность совершаемых
действий.
4.6.3. Эфферентные связи мозжечка с моторными структурами
мозга
Клетки ядер мозжечка представляют собой обычные переключательные
нейроны: в ответ на поступающую по коллатералям моховидных и
лазающих волокон афферентную информацию они возбуждаются и отправляют
эфферентные сигналы двигательным ядрам ствола. Клетки Пуркинье
ограничивают их активность таким образом, что выполнение одних моторных
программ допускается, а других — отменяется в соответствии с характером
афферентной информации и организацией связей между корой мозжечка и
ядрами.
Эфферентное влияние зубчатых и промежуточных ядер мозжечка на
сенсомоторную кору больших полушарий осуществляется при участии
моторных вентролатеральных ядер таламуса, которые служат узловым
пунктом нейронной сети, связывающей сенсомоторную кору не только с
мозжечком, но и с базальными ганглиями. Аксоны таламических нейронов
способны изменять активность пирамидных клеток, образующих корти-
коспинальный путь, что позволяет мозжечку корректировать двигательные
программы, создаваемые в моторных областях коры.
Еще одним пунктом переключения моторных систем мозга являются
красные ядра, служащие источником образования руброспинальных путей.
Здесь оканчиваются аксоны возбуждающих нейронов промежуточных ядер
4. Функции центральной нервной системы • 211
мозжечка и моторной коры, оказывающей тормозное влияние. От ядер
шатра эфферентные волокна идут к вестибулярным ядрам и моторным
ядрам ретикулярной формации ствола мозга, что позволяет мозжечку
контролировать нисходящую активность вестибулоспинальных и ретикулоспи-
нальных путей. Действие мозжечка на стволовые двигательные центры
позволяет исправлять ошибки уже запущенной двигательной программы,
если они возникают в процессе ее осуществления.
4.7. Функции промежуточного мозга
К промежуточному мозгу относят две структуры: зрительные бугры (тала-
мус), расположенные с обеих сторон III желудочка мозга, и гипоталамус
(подбугорье), находящийся книзу от III желудочка. Функция таламуса
состоит в распределении потоков афферентной информации, следующей к
коре больших полушарий. Таламус участвует в восприятии сенсорных
сигналов и формировании целенаправленного поведения. Гипоталамус
является высшим центром регуляции вегетативных функций.
4.7.1. Функции таламуса
Таламус расположен между большими полушариями и мозговым стволом,
в нем происходят переключение и переработка афферентных сигналов,
поступающих к коре. В таламусе насчитывают до 120 ядер, среди которых
различают специфические, или релейные, ядра (подразделяются на сенсорные
и моторные), неспецифические ядра, а также ассоциативные ядра.
Специфические ядра таламуса содержат две основные группы клеток. Во-первых,
релейные нейроны с ветвящимися в пределах ядра дендритами и длинным
аксоном, образующим моносинаптическую проекцию на нейроны IV и III
слоев коры. Во-вторых, локальные возбуждающие и тормозные
интернейроны, аксоны которых не выходят за пределы ядра и участвуют в
образовании локальной сети. Ассоциативные ядра имеют такую же нейронную
организацию, а в неспецифических ядрах основная масса нейронов похожа
на клетки ретикулярной формации ствола.
Основной характеристикой всех релейных ядер является специализация
афферентных входов от периферических рецепторов и чувствительных
ядер ствола и высокоточная передача нервных импульсов к проекционной
области коры с минимальным искажением входного сигнала. Так,
например, наружные коленчатые тела получают информацию от сетчатки и
передают ее в первичную зрительную кору (затылочные доли). Медиальные
коленчатые тела относятся к слуховой сенсорной системе и образуют
проекции на первичную слуховую кору (височные доли), а вентробазальные ядра,
получающие афферентную информацию от поверхности тела и от мышц,—
на соматосенсорную кору (постцентральные извилины).
При переключении сигналов в сенсорных ядрах сохраняется
топографическая разграниченность проекций. Каждому рецептивному полю сетчатки
соответствуют определенные переключательные нейроны латерального
коленчатого тела (ретинотопическая организация). Так, например, нейроны
вентральной части латерального коленчатого тела получают афферентную
информацию от наружных участков сетчатки, а дорсальные нейроны — от
внутренней области сетчатки. После этого таламические нейроны в том же
порядке передают информацию в проекционную зрительную кору, в
которой пространственное распределение возбужденных нейронов повторяет
топографическую организацию сетчатки и действующих на нее зрительных
212 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
стимулов. Это соответствие создает в зрительной коре нейронную карту
зрительного поля.
Рецептивные поля разных участков тела соматотопически представлены
на нейронах вентробазального ядра. Каждый участок поверхности лица,
туловища, конечностей имеет сенсорный путь к определенным нейронам
этого ядра. По тому же принципу осуществляется проекция от разных
участков кортиева органа внутреннего уха на определенные нейроны
внутреннего коленчатого тела. Такая организация называется тонотопической, она
позволяет передавать независимо друг от друга сигналы от слуховых
рецепторов, различающихся по своей чувствительности к звукам разной высоты.
Передача информации о разных качествах одного стимула происходит
параллельно и осуществляется разными нейронами сенсорного ядра. Так,
например, магноцеллюлярный путь от больших рецептивных полей
периферии сетчатки используется для передачи информации о положении
объектов в зрительном поле и об их движении, а парвоцеллюлярный путь от
малых рецептивных полей центральной ямки сетчатки предназначен для
передачи информации о форме и цвете объектов. В наружном коленчатом
теле переключение сигналов каждого параллельного пути происходит
независимо. По такому же принципу, т. е. параллельно, с участием разных
нейронов вентробазального ядра передается соматосенсорная
чувствительность от тактильных рецепторов кожи и проприоцепторов мышц,
сухожилий и суставов. Нейроны таламуса не объединяют эту информацию,
переправляя ее в разные регионы проекционной области, которой является
соматосенсорная кора.
Моторные ядра таламуса, среди которых самым крупным является вен-
тролатералъное ядро, обеспечивают переключение афферентации от ба-
зальных ганглиев и мозжечка к коре, что необходимо для создания
двигательных программ. В оральном отделе вентролатерального ядра
переключаются импульсы, следующие от внутренних областей бледного шара к
вторичной моторной коре, а в каудальном отделе проецируются афферен-
ты от ядер мозжечка и красного ядра, которые переключаются на
релейные нейроны, связанные с первичной моторной корой. В медиокаудальной
части вентролатерального ядра переключаются сигналы, следующие от
вестибулярных ядер и мышечных веретен во вторичную моторную кору, а в
ростральном отделе афференты от наружных областей бледного шара
проецируются на нейроны, имеющие выход в первичную и во вторичную
моторную кору.
Ассоциативные ядра отличаются от специфических релейных ядер тем,
что не относятся к какой-либо одной сенсорной системе, а большую часть
своих афферентов получают от других ядер таламуса, как релейных, так и
неспецифических. Функциональная связь проекционных и ассоциативных
ядер способствует интеграции всех этапов переработки сенсорной
информации, необходимой для комплексного восприятия сенсорных стимулов.
Интегративная функция ассоциативных ядер состоит в объединении
деятельности всех ядер таламуса с ассоциативными областями коры. Каждое
ассоциативное ядро имеет проекцию на определенную ассоциативную
область коры: медиодорсальное ядро образует проекцию на орбитофронталь-
ную кору, группа латеральных ядер — на теменную кору, а группа задних
ядер — на височную. Упорядоченное распределение информационных
потоков отражает функциональную специализацию указанных областей
коры.
Характерным признаком ассоциативных ядер является полимодальная
(полисенсорная) конвергенция афферентных входов от двух и более сенсор-
4. Функции центральной нервной системы • 213
ных систем, а также от гипоталамуса и структур лимбической системы
мозга. Среди нейронов ассоциативных ядер имеются клетки, которые
возбуждаются только в ответ на действие определенного сочетания сенсорных
стимулов. Полисенсорная конвергенция позволяет объединять в таламусе
разные виды сенсорной информации для комплексного восприятия
окружающего мира, а включение в этот процесс лимбических структур
формирует субъективное эмоциональное отношение к полученной информации.
Неспецифические ядра получают афферентные сигналы
преимущественно из двух источников: ретикулярной формации и спиноталамического
тракта. Помимо этого неспецифические ядра получают афферентные
входы от гипоталамуса, лимбических структур, базальных ганглиев,
специфических и ассоциативных ядер таламуса. В результате неспецифические
ядра оказываются морфологически и функционально связанными со
многими системами, что определяет их активность, зависящую не столько от
определенной модальности, сколько от общей суммы афферентных сигналов.
При такой организации точность проекции неспецифических ядер на кору
не имеет значения, их проекции диффузно распространяются практически
на все области коры, а также на лимбическую систему и гипоталамус.
Влияние неспецифических ядер на кору состоит в модуляции активности
ее нейронов, т. е. прямо не возбуждает и не тормозит, но изменяет их
возбудимость при получении специфической афферентации. Этот механизм
используется для регуляции функциональной активности мозга, которая
изменяется на протяжении суток.
Таламус, благодаря организации своих связей с другими регионами
мозга, вовлекается в осуществление различных функций: формирование
эмоций (совместно с лимбической системой), чувственное восприятие
(совместно с сенсорными областями коры), осуществление психической
деятельности (совместно с ассоциативными регионами коры).
4.7.2. Функции гипоталамуса
Гипоталамус является высшим центром регуляции вегетативных функций,
он координирует деятельность симпатического и парасимпатического
отделов вегетативной нервной системы и согласует ее с двигательной
активностью человека. Одновременно гипоталамус управляет секрецией
гормонов гипофиза, и тем самым контролирует эндокринную регуляцию
внутренних процессов. Ядра гипоталамуса являются центрами регуляции водно-
солевого баланса, температурного гомеостазиса, чувства голода и
насыщения, полового поведения, выполняют функцию координатора
биологических ритмов. Будучи важнейшей мотивационной структурой мозга,
гипоталамус участвует в формировании биологических мотиваций, эмоций и
организации целенаправленного поведения.
4.7.2.1. Роль гипоталамуса в регуляции вегетативных функций
Гипоталамус оперативно получает информацию от интерорецепторов
внутренних органов, сигналы от которых поступают через ствол мозга, кроме
того в гипоталамус поступает часть сенсорных сигналов от поверхности
тела и некоторых специализированных сенсорных систем (зрительная,
обонятельная, слуховая). Некоторые нейроны гипоталамуса имеют
собственные осмо-, термо- и глюкорецепторы, которые воспринимают сдвиги
осмотического давления, температуры и уровня глюкозы в ликворе и крови.
В отличие от периферических рецепторов они называются центральными, а
214 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
их наличие именно в гипоталамусе связано со слабой выраженностью ге-
матоэнцефалического барьера.
Гипоталамус имеет двусторонние связи с лимбической системой мозга,
ретикулярной формацией и корой больших полушарий, что позволяет ему
координировать вегетативные функции с определенным поведением,
например с переживанием эмоций. Гипоталамус образует проекции на
вегетативные центры ствола и спинного мозга, что позволяет ему осуществлять
прямой контроль деятельности этих центров. Он регулирует ключевые
механизмы эндокринной регуляции вегетативных функций, осуществляя
управление секрецией гормонов гипофиза.
Необходимые для вегетативной регуляции переключения осуществляют
нейроны ядер гипоталамуса, в разных классификациях их насчитывают от
16 до 48. Искусственное раздражение гипоталамуса электрическим током
через вживленные электроды у экспериментальных животных
сопровождается разными комбинациями ответных вегетативных и поведенческих
реакций в зависимости от того, какая область гипоталамуса подвергалась
раздражению. Так, например, при стимуляции задней области
гипоталамуса происходит повышение кровяного давления, увеличение частоты
сокращений сердца, учащение и углубление дыхания, расширение зрачков.
Одновременно с этим поднимается шерсть, выпускаются когти, изгибается
горбом спина и оскаливаются зубы. Вегетативные сдвиги свидетельствуют
об активации симпатического отдела, а поведение является аффективно-
оборонительным. Эта область гипоталамуса получила название эрготроп-
ной, т. е. способствующей мобилизации энергии.
Раздражение ростральных отделов гипоталамуса и преоптической
области вызывало у тех же животных пищевое поведение: они начинали
поглощать пищу, даже если были досыта накормлены. У них увеличивалось
выделение слюны, усиливалась моторика желудка и кишечника, а частота
сердечных сокращений и дыхания уменьшалась, становился меньшим и
мышечный кровоток, что характерно для повышения парасимпатического
тонуса. Эта область гипоталамуса была названа трофотропной.
Таким образом, активация разных областей гипоталамуса запускает
запрограммированные комплексы поведенческих и вегетативных реакций.
Задача гипоталамуса заключается в том, чтобы оценить поступающую к нему
из разных источников информацию и на ее основе выбрать тот или иной
комплекс ответных реакций, объединяющий поведение с определенной
активностью обоих отделов вегетативной нервной системы. Следует
обратить внимание, что не только уже произошедшие отклонения параметров
гомеостазиса, но и любое потенциально угрожающее ему событие может
активировать деятельность гипоталамуса (опережающее реагирование).
Так, например, при внезапном возникновении опасной ситуации,
угрожающей жизни, вегетативные сдвиги у человека (увеличение частоты
сокращений сердца, повышение кровяного давления и т. п.) происходят
быстрее, чем он обратится в бегство, т. е. такие сдвиги уже учитывают
характер последующей мышечной активности.
Непосредственный контроль тонуса вегетативных центров, а значит и
выходной активности вегетативной нервной системы, гипоталамус
осуществляет с помощью эфферентных связей с тремя важнейшими областями
(рис. 4.27). Во-первых, он регулирует активность нейронов ядра солитар-
ного тракта, которое является главным адресатом сенсорной информации
от внутренних органов, участвует в контроле температуры,
кровообращения, дыхания и взаимодействует с ядром блуждающего нерва и других
парасимпатических нейронов. Во-вторых, гипоталамус определяет актив-
4. Функции центральной нервной системы • 215
Афферентная
информация
от висцероре-
цепторов
Ядра
гипоталамуса
/^^<\ /^ /
Ядро \f /
солитарного 1 /2
тракта J /
X J \
Ядра
ствола
^
3
Преганглио-
нарные нейроны
вегетати
нервной а
внои
гстемы
V
Эндокринная
регуляция
Вегетативная
регуляция
А
*
Эффекторы
Рис. 4.27. Схема гипоталамического контроля вегетативных функций.
1. Эфферентный путь от гипоталамуса к ядру солитарного тракта.
2. Эфферентный путь от гипоталамуса к ростральной вентральной области продолговатого
мозга.
3. Эфеерентный путь от гипоталамуса к вегетативным нейронам спинного мозга.
ность ростральной вентральной области продолговатого мозга, имеющей
решающее значение в повышении общей выходной активности
симпатического отдела. Эта активность проявляется в повышении кровяного
давления, увеличении частоты сокращений сердца, секреции потовых желез,
расширении зрачков и сокращении мышц, поднимающих волосы. В
третьих, некоторые нейроны гипоталамуса образуют прямые проекции на
вегетативные нейроны спинного мозга, что позволяет быстро изменять характер
их активности.
4.7.2.2. Роль гипоталамуса в регуляции эндокринных функций
Группы мелкоклеточных нейронов гипоталамуса способны действовать как
нейроэндокринные преобразователи, трансформирующие кратковременные
нервные импульсы в длительные гуморальные влияния. В области воронки
мозга секретируемые мелкоклеточными нейронами гипоталамуса пептиды
по системе портальных вен поступают в аденогипофиз (рис. 4.28) и
регулируют образование его гормонов. Гипофизотропные нейроны гипоталамуса
получают информацию от разветвленной афферентной сети волокон,
передающих сигналы от лимбической системы, ствола, зрительной, слуховой и
обонятельной сенсорных систем. В результате интеграции этой обширной
информации формируется выходной сигнал в виде необходимой порции
нейрогормонов.
Две разновидности крупноклеточных нейронов гипоталамуса,
находящиеся в супраоптическам и паравентрикулярном ядрах, синтезируют вазо-
прессин и окситоцин. Эти нейропептиды доставляются аксонным
транспортом к окончаниям нейронов в задней доле гипофиза, где депонируются и
216 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Верхняя
артерия
гипофиза
Портальные
вены
Секретирующие
гормоны клетки
аденогипофиза
Капилляры
Поступление
нейросекретов
в капилляры
Адено-
гипофиз
Нейро-
гипофиз Нижняя
артерия
гипофиза
Рис. 4.28. Схема гипоталамического контроля деятельности гипофиза.
1. Нейроны супраоптического и паравентрикулярного ядер гипоталамуса образуют вазопрес-
син и окситоцин, которые выделяются в задней доле гипофиза в кровь.
2 и 3. Нейроны, секретирующие либерины и статины в кровеносные капилляры; через
портальные вены эти пептиды поступают к эндокринным клеткам аденогипофиза.
4 и 5. Нейроны, регулирующие деятельность нейросекреторных клеток гипоталамуса.
откуда выделяются в кровь, чтобы действовать в качестве гормонов.
Крупноклеточные нейроны гипоталамуса выполняют функцию нейроэндокрин-
ного преобразователя, в котором количество выделяемых нейрогормонов
увеличивается пропорционально электрической активности таких клеток.
4.8. Функции лимбической системы мозга
Лимбическая система участвует в формировании целенаправленного
поведения: она определяет возникновение мотиваций (побуждений к действию)
и эмоций, способствует научению и образованию следов долговременной
памяти. Структуры мозга, входящие в эту систему, объединены пучками
нервных волокон в кольцо, охватывающее верхнюю часть ствола
(рис. 4.29). Мамиллярные тела, миндалины, гиппокамп, свод и перегородка
соединены несколькими пучками аксонов так, что нервные импульсы
распространяются от одной лимбической структуры к другой. Гипоталамус
соединен с гиппокампом и перегородкой волокнами свода, а терминальной
полоской (stria terminalis) и вентральным амигдалофугальным путем — с
миндалиной. В лимбическую систему включают также обонятельный мозг,
гипоталамус и соседние области древней и старой коры мозга:
прилегающие к гиппокампу грушевидные доли и поясные извилины, которые занимают
медиальную поверхность больших полушарий непосредственно над
мозолистым телом и, как пояс, огибают таламус.
4. Функции центральной нервной системы • 217
Передние
ядра таламуса
Терминальная
полоска
Свод _.
Таламус
От мамиллярного
тела к таламусу"
Передняя
комиссура
Обонятельная
луковица
Продольный
дорсальный
пучок
К медиальной части
переднего мозга
К гипоталамусу
Миндалина"
Мамиллярное"'
Гиппокамп тело
Рис. 4.29. Схема взаимодействия отдельных структур лимбической системы.
Стрелки показывают преимущественное направление распространения возбуждения,
возникшего в лимбической системе. Однако возбуждение может передаваться и в обратном
направлении, поскольку связи между лимбическими структурами являются бидирекциональными.
Входящие в лимбическую систему структуры имеют двусторонние связи
с вентральной покрышкой среднего мозга и благодаря этому способны
изменять характер управления вегетативными и двигательными реакциями,
контролируемыми ретикулярной формацией, а ретикулярная формация, со
своей стороны, регулирует активность лимбической системы. С помощью
передних ядер таламуса лимбическая система имеет связь с лобной корой,
контролирующей активность лимбической системы. Гиппокамп и
миндалины, расположенные в височных долях, непосредственно сообщаются с
височной корой, через которую получают переработанную в ней
информацию от зрительной, слуховой и соматосенсорной коры.
Ассоциативные области коры, функционально взаимодействующие с
лимбической системой, относят к лимбической коре и включают в нее
медиальные и вентральные поверхности лобных долей, часть медиальной
поверхности затылочных долей, а также обращенную кпереди поверхность
височных долей. Лимбическая кора совместно с лимбической системой
организует мотивационные и эмоциональные аспекты поведения,
участвует в образовании долговременной памяти и формировании научения. Она
интегрирует информацию, полученную одновременно от лимбической
системы и регионов вторичной сенсорной коры, после чего оказывает
влияние на ассоциативные области коры, создающие план предстоящих
действий. Взаимодействие лимбических структур и коры является
физиологической основой для формирования субъективных переживаний
эмоций, а связи между лимбической системой и стволом служат для возникно-
218 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
вения вегетативных и двигательных реакций, являющихся еще одним
компонентом эмоций.
Во время проведения стереотаксических операций некоторым
категориям больных была установлена зависимость между искусственной
электрической стимуляцией различных лимбических структур и субъективным
переживанием приятных ощущений (радость, комфорт, покой) или,
напротив, неприятных (тревога, беспокойство, уныние). К позитивным эмоцио-
генным зонам принадлежат латеральный и перивентрикулярный
гипоталамус, перегородка, покрышка среднего мозга. Негативных эмоциогенных
зон в мозгу гораздо меньше, чем позитивных, а многие структуры (и в том
числе, по-видимому, гиппокамп) нейтральны — их стимуляция не
сопровождается приятным или неприятным ощущением. В мозгу человека
больше областей, стимуляция которых вызывает приятные ощущения.
Естественное возбуждение эмоциогенных структур и соответствующее
ему возникновение эмоций происходит в результате модуляции их
деятельности дофаминергическими нейронами вентральной покрышки
среднего мозга. Волокна дофаминергических нейронов идут в составе
медиального пучка переднего мозга и образуют диффузные проекции на
перегородку, обонятельные луковицы, миндалины, прилегающее ядро переднего
мозга и фронтальную лимбическую кору. Субъективные ощущения,
переживаемые человеком как эмоции, фиксируются в памяти, и поэтому он
стремится к повторению своих действий, если они вели к переживанию
положительных эмоций, и избегает совершать действия, связанные с
возникновением отрицательных эмоций.
4.8.1. Функции миндалин
Миндалевидный комплекс ядер находится в глубине передней части
височной доли, его базолатералъные ядра получают афферентные проекции
из двух источников: 1) от сенсорных ядер таламуса и 2) от височной и ор-
битофронтальной коры (рис. 4.30). Эмоциогенные стимулы, действующие
на организм, активирует миндалины с помощью короткого прямого пути
передачи сигналов от сенсорных ядер таламуса, лишь после этого к ним
поступает информация о том же раздражителе, предварительно
переработанная в коре. Миндалины сопоставляют сенсорную информацию,
поступившую от таламуса, с информацией, пришедшей из коры, чтобы
выделить сигналы опасности. Сличение информации происходит в базолате-
ральном ядре миндалины, а затем в ее центральном ядре формируется
эфферентный ответ. Нейроны центрального ядра образуют прямые и
непрямые проекции на другие лимбические структуры, гипоталамус, ствол,
поясную извилину, орбитофронтальную кору и ассоциативные области
коры.
В угрожающей ситуации нейроны базолатеральных ядер миндалин
немедленно активируются, что происходит, например, при вызывающем
боль действии электрического тока. Если пришедшая чуть позже
информация из коры подтверждает наличие опасности, нейроны центрального ядра
генерируют эфферентный ответ миндалин. Миндалины сохраняют следы
долговременной памяти об эмоциональном значении стимула, и поэтому
после их удаления или искусственной блокады синапсов исчезают не
только врожденные реакции на угрожающие стимулы, но и приобретенная
ранее способность оценивать ситуацию как угрожающую по косвенным
признакам.
После двустороннего удаления части височных долей, включая минда-
4. Функции центральной нервной системы • 219
Г
Первичная
слуховая кора
Возбуждающие холинергические связи
п
Т
Пластичность
Вторичная
слуховая кора
Пластичность
Таламус
Полимодальная
ассоциативная
кора
Внутренняя
капсула
Миндалина
_Ц Базолатеральное
V ядро
Центра-
~*ч льное
ядро
Медиальное коленчатое тело
( Г 1
Поведение Вегетативные Эндокринные
эмоциональные реакции
Лемнисковый
путь слуховой
системы
Экстра-
лемнисковыи
путь
Рис. 4.30. Схема вовлечения миндалин мозга в ответную реакцию на угрожающие
слуховые раздражители.
Миндалины получают прежде всего афферентную информацию от сенсорных ядер таламуса, а
затем к ним поступают сигналы о том же раздражителе, но после переработки информации о
нем в коре. В базолатеральном ядре происходит сличение информации, поступившей из обоих
источников, на этой основе нейроны центрального ядра создают выходные сигналы.
лины и гиппокамп, у обезьян возникает комплекс поведенческих
расстройств, определяемый как синдром Клювера—Бьюси и
характеризующийся прожорливостью, или гиперфагией, гиперсексуальностью и
исчезновением чувства страха. Все проявления этого синдрома обусловлены
нарушением способности оценивать значение информации, поступающей из
окружающей среды, и связывать ее со своим собственным состоянием. После
двустороннего удаления только миндалин нарушается социальное
поведение обезьян, что проявляется замкнутостью, покорностью, постоянным
стремлением к уединению.
Миндалины участвуют и в возникновении положительных эмоций,
например удовольствия, связанного с определенной пищей (ее видом, вкусом
и запахом), они определяют предпочтение той или иной жидкости для
питья, определенного места обитания, выбор полового партнера. Некоторые
нейроны миндалин чувствительны к действию половых гормонов, и,
благодаря своим связям с обонятельными луковицами, способны изменять
активность под влиянием феромонов — веществ, выделяемых особями
противоположного пола во внешнюю среду. При возникновении конкурирую-
220 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Безусловный
угрожающий
раздражитель
Условный
угрожающий
раздражитель
Анатомическая структура
Латеральный пычналамус
Дорсальное ядро
блуждающего нерва
Двойное ядро
Парабрахмальное ядро
Покрышка.
Голубое пятно
Квудальная часть
ретикулярной формации моста
Ц. \ Г1Н1,— -, - «I- J-i IL<
V -, . I'.', I", .■И.лД I
Ядро тройничного нерва
Паравентрикулярное ядро
гипоталамуса
Эффект, обусловленный
раздражением миндалин
Симпатическая активация
i парасимпатическая активация
Усиленное дыхание
Внешние проявления
Тахикардия, повышение АД,
расширение эраччо*.
побледнечие нвки
\ Брад
/ Деф«
Брадикардия, мочеиспускание,
1екация, язвы желудка
Одьш«а,-гЮческЛа»*е
Активация дофаминергических. ч
юрадренергических и \ Активное бодрствование^
«олинергических структур
/
десинхронизация ритма ЭЭГ
Усиление рефлекторных
реакций
i „•fttnl I— lJ- l.'h* i Mbil li>
/
Мимика
Ьыделение кортикотропина
,ЛКТГ)
)
Настороженность, пугливость
■Ц-Ч'-НГИИ! '«LII 1-ЧН ' М + 1.
Открытие рта, цвижаниа
челюсти, выражения страха
на лице
Выделение кортикостероидов
(стресс)
Рис. 4.31. Схема эфферентных путей от миндалин к гипоталамусу и стволу, при
активации которых наблюдаются внешние проявления страха.
При активации миндалин возникает комплекс поведенческих реакций, возникновение каждой
реакции обусловлено проведением электрических сигналов от миндалин к нескольким
структурам мозга, каждая из которых определяет разные проявления поведения.
щих мотиваций миндалины обеспечивают выбор доминирующей
потребности, определяя ее на основе зафиксированной предшествующим опытом
эмоциональной оценки событий. В результате такой оценки миндалины
могут переключать цели поведения с второстепенных на наиболее
значимую. После удаления миндалин такое переключение становится почти
невозможным.
Выходная активность миндалин адресована лимбической коре, а также
гипоталамусу и стволу мозга. Активация эфферентного пути от миндалин
к орбитофронтальной коре и поясной извилине приводит к осознанию
переживаемых эмоций. Одновременная передача информации от миндалин к
латеральному гипоталамусу и стволу мозга активирует центры регуляции
вегетативных и эндокринных реакций, сопровождающих, например,
возникновение страха: увеличение частоты сокращений сердца, учащение
дыхания и т. д. (рис. 4.31). Эти периферические реакции способствуют
мобилизации энергии для реакций борьбы или бегства.
4.8.2. Функции гиппокампа
Гиппокамп расположен в медиальной части височной доли, афферентную
информацию он получает от близлежащей энторинальной области коры, в
которой происходит переключение сигналов, приходящих из нескольких
источников. Это, во-первых, сенсорные и ассоциативные области коры, в
которых перерабатывается информация обо всех действующих сенсорных
стимулах. Во-вторых, это мотивационные структуры мозга, прежде всего
гипоталамус, перегородка и миндалины. В третьих, это фронтальная
ассоциативная кора, определяющая стратегию поведения. В четвертых,
ретикулярная формация, регулирующая активность корковых нейронов и связан-
4. Функции центральной нервной системы • 221
ная с гиппокампом волокнами свода. Функция гиппокампа состоит в
регуляции распределения всех поступающих информационных потоков,
классификации таких потоков и создании условий для образования энграмм
(следов) памяти.
Двустороннее удаление гиппокампа у человека приводит к антероград-
ной амнезии — утрате способности образовывать новую долговременную
память при сохранении памяти о событиях, предшествовавших операции.
Двустороннее удаление гиппокампа у экспериментальных животных не
позволяет им вырабатывать новые поведенческие навыки. После
кратковременной стимуляции входящих в гиппокамп волокон обонятельного тракта
его пирамидные нейроны начинают разряжаться необычно долго, на
протяжении нескольких суток и даже недель, что было названо долговременной
потенциацией. Она возникает в глутаматергических синапсах при участии
NMDA-рецепторов, связанных с мембранными каналами для ионов
кальция. Ток этих ионов в постсинаптический нейрон вызывает активацию
вторичных посредников и последующее изменение метаболической
активности не только постсинаптического, но и пресинаптического нейрона.
При повторяющейся активации одних и тех же афферентных входов,
конвергирующих к гиппокампу, в таких синапсах происходит структурная
перестройка, которая повышает эффективность синаптической передачи и
является основой долговременной памяти.
В то же время гиппокамп не является единственным регионом мозга,
где происходит долговременная потенциация, как не является и
единственным местом хранения следов о предшествующем индивидуальном
опыте. Память о прежних событиях сохраняется и после удаления гиппокампа,
а некоторые разновидности долговременной памяти могут образоваться и
без него.
4.9. Функции базальных ганглиев (стриопаллидарная система)
К базальным ганглиям относят хвостатое ядро и скорлупу, вместе
образующие полосатое тело (corpus striatum, а также neostriatum), бледный шар
(globus pallidus, pallidum) и субталамическое ядро (рис. 4.32). С базальными
ганглиями функционально связана черная субстанция среднего мозга,
состоящая из ретикулярной части, сходной по происхождению с внутренним
сегментом бледного шара, и компактной части, образующей дофаминерги-
ческую проекцию на полосатое тело. Наиболее изученная функция
базальных ганглиев заключается в их участии в планировании и инициации
произвольных движений. Наряду с этим базальные ганглии участвуют в
познавательной деятельности мозга, а также в формировании эмоций.
4.9.1. Взаимодействие базальных ганглиев с другими
структурами мозга
Афферентная информация поступает к базальным ганглиям из нескольких
регионов коры: префронтальной ассоциативной коры, первичной и
вторичной моторной коры, соматосенсорной коры, теменных и височных
областей ассоциативной коры. Все афферентные волокна оканчиваются на
нейронах полосатого тела, которые объединяются в функциональные
модули, однотипные по способу переработки информации. Соматотопически
организованные волокна нейронов моторных и сенсорных регионов коры
направляются к соответствующим им модулям, в результате пучки волокон
распределяются в виде отдельных полосок, из-за которых полосатое тело
222 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Добавочный
моторный ареал
Первичная моторная кора
компактная ретикулярная
Черная субстанция
Рис. 4.32. Схема циркуляции возбуждения между системой базальных ганглиев и
корой больших полушарий.
Базальные ганглии включают хвостатое ядро и скорлупу, вместе образующие полосатое тело,
бледный шар и субталамическое ядро; с базальными ганглиями взаимодействует черная
субстанция среднего мозга. Базальные ганглии взаимодействуют с корой при планировании и
инициации произвольных движений, при этом образуются две цепи нейронных
переключений: 1) кора—полосатое тело—бледный шар—таламус—кора; 2) кора—полосатое
тело—бледный шар—таламус—полосатое тело.
получило свое название. Окончания волокон кортикальных нейронов
образуют с нейронами полосатого тела возбуждающие глутаматергические
синапсы.
В базальных ганглиях входящие сигналы распределяется независимо
друг от друга по параллельным путям переработки информации. Эти пути
образуют несколько самостоятельных функциональных кругов,
включающих в себя помимо базальных ганглиев разные регионы коры. В
зависимости от того, какая область коры включена в функциональный круг,
определяется и специфическая роль каждой структуры базальных ганглиев.
Скорлупа участвует преимущественно в координации движений тела, одни
регионы хвостатого ядра необходимы для регуляции движений глаз,
другие — для формирования побуждений к конкретным действиям, выбора
стратегии поведения или осуществления когнитивных (познавательных)
4. Функции центральной нервной системы • 223
функций. Вентральные отделы полосатого тела участвуют в формировании
эмоций.
Скелетомоторный круг нейронных переключений используется при
планировании и осуществлении контроля произвольной двигательной
активности человека. Вначале активируются премоторная и моторная
лобные области коры, которые возбуждают топографически соответствующие
им модули полосатого тела. Выходная активность полосатого тела
распределяется между внутренней частью бледного шара и ретикулярной частью
черной субстанции среднего мозга, для которых характерна спонтанная
фоновая активность. Под влиянием преобладающих в полосатом теле
эфферентных тормозных ГАМКергических нейронов эта активность
уменьшается. Значительно меньшая часть выходных нейронов полосатого тела
использует в качестве медиатора вещество Р, оказывающее возбуждающее
действие. Одновременно с этим многие нейроны полосатого тела
синтезируют энкефалин, действующий в качестве нейромодулятора, и суммарный
итог действия полосатого тела на бледный шар и черную субстанцию
оказывается тормозно-модулирующим.
Находящаяся под контролем полосатого тела выходная активность
нейронов бледного шара и черной субстанции адресуется клеткам моторных
вентролатеральных ядер таламуса. Эти нейроны образуют проекцию на
премоторные области коры, замыкая большой круг нейронных
переключений: премоторные и моторные области коры—полосатое тело—бледный
шар или ретикулярная часть черной субстанции—таламус—премоторная
кора. Нейроны моторных ядер таламуса кроме премоторной коры
образуют проекцию на клетки полосатого тела: так замыкается малый круг
переключений между полосатым телом — бледным шаром или черной
субстанцией — таламусом — и вновь полосатым телом. Субталамическое ядро
получает топографически организованные сигналы сигналы от премоторной
и моторной коры, в соответствии с которыми оно регулирует выходную
активность бледного шара.
Распространение возбуждения по этим кругам нейронных
переключений происходит до того момента, пока базальные ганглии не выберут из
предложенного корой ряда моторных программ наиболее приемлемую для
конкретной ситуации, а затем инициируют ее реализацию. Конечным
результатом такого взаимодействия нейронов является создание в моторной
коре двигательных программ, предназначенных для исполнения
двигательными центрами ствола и нейронами спинного мозга.
Окуломоторный круг, образующийся при участии базальных ганглиев,
используется для регуляции произвольных движений глаз, связанных с
привлечением внимания к одному из объектов, находящихся в зрительном
поле. Этот круг объединяет афферентную информацию от заднетеменной
области коры (поле 7) и небольшого по площади фронтального глазного
поля (поле 8 по Бродману). В поле 7 коры создается нейронная карта
окружающего зрительного пространства, а поле 8 необходимо для регуляции
движений глаз, фиксирующих определенную часть этого пространства.
Входные сигналы от обоих полей поступают к соответствующим им
модулям хвостатого ядра, которое в зависимости от характера сигналов
определяет активность нейронов бледного шара и ретикулярной части черной
субстанции. Выходная активность последних адресована тем нейронам
таламуса, которые связаны с фронтальным глазным полем и влияют на
активность его нейронов.
Активность одиночных нейронов базальных ганглиев повышается еще
до начала произвольных движений контралатеральных конечностей, что
224 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
указывает на их участие в планировании и формировании начальной стадии
произвольных движений. Базальные ганглии не имеют непосредственного
выхода к моторным ядрам ствола и спинного мозга и поэтому не влияют
на исполнение уже начавшихся движений, а их электрическая активность
не коррелирует с активностью и силой сокращения отдельных мышц.
Наличие в составе нейронных кругов переключения возбуждающих и
тормозных нейронов позволяет сбалансировать выходную активность
двигательных систем так, чтобы обеспечить необходимую плавность движений.
Базальные ганглии облегчают одни и угнетают другие движения, что
способствует чередованию тонических и фазных компонентов движения, т. е.
сначала формированию позы, требующейся для совершения конкретного
движения, а затем и самого движения.
Одним из источников афферентной информации, доставляемой к ба-
зальным ганглиям, являются нейроны лобных ассоциативных областей
коры: префронтальной и орбитофронтальной, причастных к
программированию поведения и эмоционально окрашенному прогнозу возможных
результатов предстоящих действий. Их глутаматергические аксоны
оканчиваются на нейронах полосатого тела, далее формируется большой круг
нейронных переключений, в образовании которого участвуют бледный
шар и ретикулярная часть черной субстанции, а затем ассоциативные ядра
таламуса, замыкающие круг в ассоциативной коре. С этим кругом
нейронных переключений связаны формирование мотиваций поведения,
прогнозирование его результатов, познавательная деятельность и
возникновение эмоций.
4.9.2. Модуляции нейронных переключений в базальных ганглиях
Помимо кортикостриатной проекции полосатое тело получает
афферентную информацию от нескольких ядер таламуса, черной субстанции
среднего мозга, миндалин, ядер шва продолговатого мозга и нейронов голубого
пятна. В результате в каждом модуле полосатого тела создается сложная
сеть переключений из возбуждающих глутаматергичеких окончаний
корковых нейронов, модулирующих дофаминергических окончаний нейронов
компактной части черной субстанции, серотонинергических окончаний
нейронов ядер шва и норадренергических окончаний нейронов голубого
пятна. В переработке информации участвуют также локальные
интернейроны полосатого тела, синтезирующие ацетилхолин и несколько
пептидных нейротрансмиттеров.
Дофаминергические нейроны компактной дорсальной части
ретикулярной формации образуют диффузную нигростриатную проекцию на нейроны
полосатого тела. Эта проекция топографически не организована и
предназначена для модуляции кортикостриатных глутаматергических
переключений. При дегенерации дофаминергических нейронов черной субстанции
нарушается необходимый баланс активности нейронов полосатого тела,
что приводит к характерным двигательным нарушениям.
Дисфункция, вызванная потерей дофаминергических нейронов,
проявляется в виде болезни Паркинсона и характеризуется мышечной ригидностью
(значительным повышением тонуса мышц), резким ограничением
сопутствующих движений, или акинезией, а также появлением
крупноразмашистого тремора — дрожания конечностей во время покоя. Указанные
нарушения двигательной функции возникают в связи с уменьшением влияния
дофаминергических нейронов и изменением баланса активности в пользу
остальных нейронов полосатого тела. Если же этот баланс нарушается вслед-
4. Функции центральной нервной системы • 225
ствие поражения холинергических или ГАМКергических нейронов
полосатого тела, то возникает другая разновидность двигательных расстройств,
проявляющихся появлением непроизвольных и нежелательных для
человека насильственных движений — гиперкинезов.
Модулирующее влияние на нейронные переключения в базальных
ганглиях оказывают не только дофамин, но и другие биогенные амины (серо-
тонин, норадреналин), а также многочисленные пептидные нейротранс-
миттеры. Столь сложный контроль деятельности базальных ганглиев
отражает важность выполняемых ими функций.
4.10. Функции коры больших полушарий
Складчатая наружная поверхность полушарий достигает 1700—2500 см2,
толщина серого вещества варьирует между 1,5 и 5 мм, а находящиеся в
нем нейроны образуют шесть слоев, различающихся между собой по
составу клеток. В зависимости от выполняемых функций области коры
подразделяются на сенсорные, моторные и ассоциативные (рис. 4.33). К
сенсорным областям относят: соматосенсорную кору, занимающую задние
центральные извилины, зрительную кору, находящуюся в затылочных
долях, и слуховую кору, занимающую часть височных долей. Моторная кора
находится в передних центральных извилинах и в примыкающих к ним
спереди регионах лобных долей. Ассоциативная кора занимает всю осталь-
Премоторная
кора
Первичная
моторная
кора
Первичная
соматосенсорная
кора
Префронтальная
ассоциативная
кора
Заднетеменная
ассоциативная
кора
Вторичная
зрительная
кора
Лимбическая
ассоциативная
кора
Первичная вторичная
слуховая кора слуховая
кора
Первичная
зрительная
кора
Теменно-
височно-
затылочная
ассоциативная
кора
Рис. 4.33. Схема функциональных областей коры.
На рисунке обозначены примерные границы функциональных областей коры на боковой
верхности левого полушария.
по-
8-6095
226 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
ную поверхность мозга и подразделяется на префронтальную кору лобных
долей, теменно-височно-затылочную (парието-темпорально-окципиталь-
ную) и лимбическую, к которой относят внутренние и нижние
поверхности лобных долей, внутренние поверхности затылочных долей и нижние
отделы височных долей.
Различные области коры взаимодействуют друг с другом посредством
внутрикортикальных ассоциативных связей или с помощью подкорковых
структур (таламус, базальные ганглии). Регионы коры, находящиеся в
разных полушариях, связаны друг с другом волокнами мозолистого тела, что
позволяет передавать информацию из одного полушария в другое.
4.10.1. Функциональное распределение нейронов в коре
Дендриты пирамидных нейронов коры образуют синапсы с очень большим
количеством афферентов, а их аксоны направляются в белое вещество и
своими разветвленными коллатералями образуют 3/4 всех синапсов
кортикальных нейронов. Большинство пирамидных нейронов используют в
качестве медиаторов возбуждающие аминокислоты (глутамат или аспартат),
но одновременно могут секретировать несколько комедиаторов (нейропеп-
тиды, АТФ), модулирующих синаптический перенос сигналов.
Непирамидные нейроны (корзинчатые и звездчатые клетки) в большинстве случаев
синтезируют ГАМК в разных комбинациях с нейропептидами и обладают
тормозным действием, однако часть непирамидных клеток использует
возбуждающие медиаторы. В отличие от пирамидных нейронов все виды
непирамидных клеток образуют не выходящие за пределы коры аксоны и
играют роль внутрикортикальных интернейронов.
Нейроны расположены в коре упорядоченными слоями, специфика
которых отражает их роль в переработке информации. В наружном
молекулярном слое проходят соединительные нервные волокна, осуществляющие
внутрикорковые связи соседних нейронов. В наружном зернистом II слое
и в наружном пирамидном III слое содержатся мелкие и средней
величины пирамидные нейроны, аксоны которых служат для связи региона с
другими областями коры. Во внутреннем зернистом IV слое имеются
небольшие звездчатые клетки, получающие афферентные волокна таламиче-
ских нейронов и выполняющие функцию входных нейронов. Наряду с
ними в этом слое содержится много пирамидных нейронов,
использующихся для передачи эфферентных сигналов. Во внутреннем пирамидном
V слое сосредоточены крупные пирамидные нейроны (клетки Беца),
аксоны которых служат для передачи информации к базальным ганглиям,
стволу и спинному мозгу (кортикоспинальный тракт). Во внутреннем
полиморфном VI слое, граничащим с белым веществом, встречаются разной
формы нейроны, а в подслое Via обнаружен самый большой процент
пирамидных нейронов (97 %), которые осуществляют передачу информации
к таламусу.
4.10.2. Модульная организация коры
Каждый релейный нейрон таламуса возбуждается в ответ на раздражение
собственного рецептивного поля, после чего активирует звездчатые клетки
IV слоя коры в кортикальной колонке, получающей проекцию от этого та-
ламического нейрона. Каждая кортикальная колонка представляет
ориентированный перпендикулярно поверхности цилиндр диаметром 300—500
мкм. Нейроны одной колонки получают сходные афферентные сигналы и
4. Функции центральной нервной системы • 227
образуют синапсы преимущественно друг с другом. В колонках
проекционной коры имеются две разновидности пирамидных нейронов, которые
получили название простых и сложных.
Простые нейроны расположены поблизости от входного IV слоя и
выполняют функцию детекторов элементарных признаков раздражителя.
Например, простые нейроны зрительной коры сильнее всего реагируют на
линейный зрительный стимул в виде полосы или грани между светлой и
темной плоскостью, т. е. реагируют на контраст. Друг от друга они
отличаются по чувствительности к разным углам наклона линейного стимула.
Аксоны нескольких однотипных простых нейронов конвергируют к сложным,
или комплексным, нейронам, поэтому комплексные нейроны реагируют на
стимул позже простых клеток. Рецептивное поле сложных нейронов
состоит из небольших рецептивных полей простых нейронов, а эффективными
раздражителями для комплексных нейронов становится уже не линейный
раздражитель определенной ориентации, а характер и направление его
движения через рецептивное поле. Так осуществляется переход от
детекции простых сигналов к абстрагированию, обобщению. В этом процессе
участвуют интернейроны локальной сети кортикальной колонки, а итогом
преобразования становится уровень активности выходных нейронов, аксоны
которых покидают колонку, чтобы обеспечить ее взаимодействие с
другими колонками.
Аналогичная нейронная организация имеет место в слуховой и
моторной коре, что послужило поводом для гипотезы о модульном строении как
общем принципе организации нейронных ансамблей в коре. Подобный
нейронный ансамбль представляет собой функциональную единицу коры,
для которой используют термины «кортикальная колонка» или
«микромодуль». С помощью горизонтальных связей они взаимодействуют с
соседними колонками (микромодулями), образуя вместе с ними гиперколонку, или
модуль. Если микромодули предназначены для распознания элементарных
признаков раздражителя или образа, то модуль служит для комплексного
объединения элементарных признаков.
Разные модули могут быть связаны друг с другом ассоциативными
волокнами, образованными преимущественно пирамидными нейронами II—
III слоев. Если модули находятся на большом расстоянии друг от друга,
такие волокна проходят в составе белого вещества. Модули, расположенные
в разных полушариях, могут передавать информацию посредством волокон
мозолистого тела. Волокна пирамидных нейронов обычно группируются, и
аксоны направляются к клеткам-мишеням в виде пучка волокон. В
модулях ассоциативной коры отсутствуют клетки, реагирующие на
элементарные раздражители, но имеются нейроны, разряжающиеся только в ответ
на определенный сложный комплекс стимулов. Например, в нижней
височной доле существуют нейроны, которые активируется только при
зрительном восприятии человеческого лица.
4.10.3. Электрическая активность коры
Нейроны коры обладают спонтанной ритмической фоновой активностью,
характер которой изменяется в ответ на стимуляцию периферических
рецепторов (вызванные потенциалы). Обе эти разновидности электрической
активности можно зарегистрировать с помощью электродов, помещенных
на поверхности коры (электрокортикограмма) или на коже головы
(электроэнцефалограмма, ЭЭГ). ЭЭГ отражает суммарную активность большого
количества одновременно возбуждающихся и тормозимых нейронов, нахо-
8'
228 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Бета-ритм
.^^«и**Л/>ч\Л^%4\^
Альфа-ритм
flyMV^
50 мк»
Тета-ритм
.Оельта-ритм
Рис. 4.34. Основные ритмы электроэнцефалограммы.
Бета-ритм — электрические колебания малой амплитуды с частотой 13—26 Гц, наиболее
выраженные в лобных областях и характерные для активного бодрствования. Альфа-ритм —
характеризуется близкими к синусоидальным волнами с амплитудой 50—100 мкВ и частотой 8—
12 Гц, наблюдается при пассивном бодрствовании и монотонной деятельности. Тета-ритм
отличается волнами, имеющими амплитуду до 100 мкВ и более с частотой 4—7 Гц, возникает
при переходе ко сну, а также при некоторых формах измененного сознания. Дельта-ритм
представлен волнами с большой амплитудой и малой частотой, 0,3—0,5 Гц, он характерен для
глубокого сна.
дящихся в поверхностных и глубоких слоях коры (рис. 4.34).
Регистрируемые разности потенциалов примерно в сто раз слабее, чем в ЭКГ, а
частотные характеристики сигналов легли в основу классификации ритмов
ЭЭГ, где различают альфа-волны, следующие с частотой 8—12 Гц, бета-
волны (13—26 Гц), твта-волны (4—7 Гц) и дельта-волны (0,3—0,5 Гц).
Изменения ритмов ЭЭГ связаны с активностью таламуса и восходящих
проекций некоторых ядер ствола. После перерезки ствола мозга между
верхними и нижними буграми четверохолмия у кошки на
электроэнцефалограмме постоянно регистрируются низкочастотные волны, обычно
характерные для картины сна. Замедленная фоновая активность ЭЭГ имеет
место у человека во время комы, характеризующейся утратой сознания
вследствие поражения верхних отделов моста или диффузных поражений
коры. Активация холинергических нейронов гигантоклеточной области
покрышки моста и ростральных отделов ретикулярной формации среднего
мозга приводит к десинхронизации ЭЭГ, т. е. переходу от низкочастотных
волн к бета-ритму. Блокада альфа-ритма происходит в связи с
привлечением внимания к новому раздражителю, а смена альфа-волн ЭЭГ в такой
ситуации на бета-ритм обусловлена восходящим активирующим влиянием
норадренергических нейронов голубого пятна.
4. Функции центральной нервной системы • 229
4.10.4. Функции сенсорных областей коры
Сенсорные области коры являются пунктом назначения передающейся в
сенсорных системах информации. Все сенсорные системы организованы
по единому иерархическому принципу. В их рецепторах энергия внешних
стимулов преобразуется в электрохимическую энергию нервных
импульсов, которые от чувствительных нейронов передаются нейронам второго
порядка, находящимся в ЦНС. После преобразования сигналов на низшем
переключательном уровне с помощью релейных нейронов информация
сообщается следующему уровню переключения и переработки, пока не
поступит в первичную проекционную кору. Почти все проводящие пути
включают проекционные ядра таламуса, распределяющего информационные
потоки к разным проекционным областям коры (табл. 4.2).
Топографическая упорядоченность нейронных переключений
обеспечивает пространственное представительство или проекцию рецептивных
полей в коре в виде нейронной карты. Например, каждый квадратный
миллиметр поверхности кожи любого из пальцев имеет собственное
представительство в строго определенной области постцентральной извилины
противоположного полушария. Принцип строго упорядоченной
топографической организации в соматосенсорной системе называется соматотопией, в
зрительной системе — ретинотопией, в слуховой системе — тонотопией.
Сенсорные системы создают ощущения и восприятие окружающего мира,
контролируют правильность совершаемых человеком движений,
используются в качестве обратной связи для регуляции физиологических процессов
и поддерживают необходимую для бодрствования активность мозга.
В формировании восприятия участвуют первичная и вторичная
сенсорная кора, а также ассоциативные области. Первичная сенсорная кора
получает афферентную информацию преимущественно от мономодальных
нейронов специфических ядер таламуса. Проекционный нейрон таламуса,
получивший информацию от своего рецептивного поля, возбуждает входные
звездчатые нейроны преимущественно одной кортикальной колонки: этот
Таблица 4.2. Уровни обработки информации в сенсорных системах
Модальность
Осязание
Зрение
Слух
Равновесие
Вкус
Обоняние
Боль
Локализация
рецепторов
Кожа
Палочки и
колбочки сетчатки
Волосковые
клетки улитки
Волосковые
клетки
вестибулярного аппарата
Вкусовые почки
языка
Биполярные
клетки носовой пазухи
Ноцицепторы
кожи
Первое
переключение
Продолговатый мозг
Сетчатка
глаза
Улитка,
спиральный
ганглий
Вестибулярные ядра
Продолговатый мозг
Обонятельная луковица
Задние рога
спинного
мозга
Повторные переключения
Таламус
Таламус, верхнее
четверохолмие
Мост, оливы, нижнее
четверохолмие, таламус
Глазодвигательные ядра,
ствол, спинной мозг,
мозжечок, таламус
Таламус
Пириформная кора
Таламус, ретикулярная
формация
Проекционные
области коры
Постцентральная извилина
Затылочные
доли, поле 17
Поперечная
височная
извилина, поле 41
Постцентральная извилина
Постцентральная извилина
Лимбическая
система
Постцентральная извилина,
передняя
поясная извилина
230 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
принцип соединений обеспечивает топографическое соответствие
рецептивных полей определенным кортикальным колонкам. Большинство
нейронов первичных областей коры имеют очень небольшую спонтанную
активность и возбуждаются сильнее всего в ответ на действие элементарного
и специфического именно для них сенсорного стимула.
Вторичная сенсорная кора отличается от первичной тем, что большую
часть афферентной информации получает не напрямую из таламуса, а из
первичной сенсорной коры, а также из других вторичных областей этой же
сенсорной системы. Благодаря конвергенции входных сигналов из разных
источников здесь происходит поэтапная интеграция информации,
поступившей по параллельным путям ее переработки, каждый из которых
активируется каким-то одним, элементарным признаком комплексного
раздражителя. Во вторичной коре нейроны сильнее всего реагируют на
определенный комплекс признаков, а не на один из них, что присуще нейронам
первичной коры.
4.10.4.1. Функция соматосенсорной коры
Центральные отростки первичных сенсорных нейронов, передающих
сигналы от тактильных рецепторов кожи и от проприоцепторов мышц,
сухожилий и суставов, входят в спинной мозг через задние корешки и
образуют коллатерали, которые в составе задних столбов спинного мозга
достигают продолговатого мозга. Поступающие сигналы принимают нейроны
ядер задних столбов, аксоны которых немедленно переходят на
противоположную сторону продолговатого мозга в составе медиальной петли или
медиального лемниска (благодаря этому термину весь путь получил название
лемнискового) и направляются к
заднему вентролатеральному ядру
таламуса. К этому же ядру
таламуса поступает информация от кожи
противоположной стороны лица,
переданная по ветвям
тройничного нерва. Нейроны вентролате-
ральных ядер таламуса образуют
проекцию на заднюю
центральную извилину, представляющую
собой проекционную соматосен-
сорную область S,. Часть
информации поступает также во
вторичную соматосенсорную область S,,,
которая расположена на верхней
стенке боковой борозды,
разделяющей теменную и височную
доли, и имеет билатеральное
представительство поверхности
тела. Она участвует в
координации одновременных движений
обеих рук (ног).
Карта соматосенсорного
представительства в коре — сенсорный
гомункулус, т. е. человечек (рис.
4.35), не соответствует
пропорциям человеческого тела, она отра-
8еР*«яягуба
Нижняя губа
Зубы, десны, челюсть
Язык
1^- Глотка
Внутренности
Стопа'
Пальцы/
Половые
органы
«С
Рис. 4.35. Пространственное
представительство тела в соматосенсорной коре.
Соматотопическая проекция тела в
постцентральной извилине отражает плотность
чувствительной иннервации периферии: чем выше
она на периферии, тем больше
представительство этой области в соматосенсорной коре.
4. Функции центральной нервной системы • 231
\
\
Центральная Постцентральная
борозда ^^^^^__ борозда \
Поперечный разрез постцентральной извилины
Рис. 4.36. Регионы соматосенсорной коры в области представительства руки.
Формирование ощущений, а затем и восприятия происходит в несколько этапов. Четыре
региона постцентральной извилины (За, 36, 1 и 2) получают афферентную информацию от
разных видов рецепторов, расположенных в одной области тела: За — от интрафузальных
рецепторов, 36 — от поверхностных рецепторов кожи, 1 — от быстро адаптирующихся рецепторов,
2 — от рецепторов, реагирующих на сильное давление. В полях За и 36 осуществляется первый
элементарный этап переработки информации, в полях 1 и 2 — следующий этап с участием
комплексных нейронов, реагирующих на несколько элементарных признаков. В полях 5 и 7
заднетеменной области осуществляется дальнейшая переработка информации, в результате
которой возникает целостное восприятие действующего раздражителя.
жает относительную плотность чувствительной иннервации
противоположной половины тела. Соматосенсорная кора разделяется на четыре области
(рис. 4.36), занимающие поля За, 36, 1 и 2. В поле За поступает
информация от рецепторов мышц и суставов, в поле 36 — от поверхностных
рецепторов кожи: эта информация содержит самые элементарные
характеристики стимула. В поле 1 происходит дальнейшая переработка информации,
поступившей от рецепторов кожи, а в поле 2 она комбинируется с той,
которая содержит сведения о мышцах и суставах. Таким образом, если в
полях За и 36 формируются элементарные представления о стимуле, то в
полях 1 и 2 — комплексные.
Большую часть входов во вторичную сенсорную кору образуют клетки
232 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
областей S, от обоих полушарий, а поэтому в областях Sn представлены обе
половины тела. Выходы из первичной сенсорной коры, а также из
вторичной — Sn, направлены к прилежащим регионам теменной коры — это
ассоциативные области, которые интегрируют сенсорную информацию. Кроме
того, от поля 2 есть выход к первичной моторной коре, он имеет большое
значение для осуществления точных движений.
Представительство различных частей тела в соматосенсорной коре
основано на генетически предопределенном характере нейронных
переключений на разных иерархических уровнях. Однако при изменении характера
поступающей информации с периферии представительство разных частей
тела в коре может измениться у взрослых животных и у людей. Замена
коркового представительства руки после ее ампутации была обнаружена у
людей, продолжавших ощущать отсутствующую конечность и даже
чувствовать в ней боль: такие боли называют фантомными. В одних случаях
место руки на пространственной карте соматосенсорной коры заняли
отдельные участки лица. Вследствие этого прикосновение к таким участкам
воспринималось, как прикосновение к отсутствующим пальцам. В других
случаях представительство кисти руки занимали другие смежные области:
предплечье, плечо, верхняя часть туловища. Подобные перестройки сома-
тотопического представительства определяются как перекартирование.
Карту представительства руки в коре у людей можно с точностью до
1 мм исследовать с помощью магнитоэнцефалограммы. У людей этим
методом обнаруживаются четкие границы полей всех пяти пальцев. При
врожденном сращении пальцев (такой дефект обозначается термином
синдактилия) их отдельное представительство в коре не обнаруживается. Но
спустя несколько недель после хирургического разделения пальцев
начинают выявляться промежутки между отдельными представительствами
пальцев в коре.
4.10.4.2. Функция зрительной коры
Информация от сетчатки глаз передается по волокнам зрительных нервов
и поступает к нейронам латеральных коленчатых тел, относящихся к тала-
мусу. Релейные нейроны латеральных коленчатых тел образуют ретиното-
пическую проекцию на кортикальные колонки 17-го поля (в литературе
оно чаще обозначается как V[). Это поле занимает около четверти
поверхности затылочной области преимущественно на внутренней стороне
каждого полушария. 17-е поле является первичной зрительной корой, в которой
каждый участок соответствует определенной точке сетчатки, причем
область центральной ямки представлена с наибольшим разрешением и
занимает около половины всей поверхности первичной зрительной коры.
В зрительной коре существует около 20 популяций простых нейронов,
каждая из которых возбуждается линейным стимулом, отличающимся по
своему наклону от остальных минимум на 10°. Комплексные нейроны
отличаются от простых большей величиной рецептивного поля и обычно
возбуждаются в момент движения стимула в строго определенном
направлении, тогда как линейная ориентация имеет для них меньшее значение,
чем для простых нейронов. Многие комплексные нейроны бинокулярны,
т. е. способны реагировать на стимуляцию обоих глаз, в то же время им
присуща глазодоминантность, т. е. большая реакция на стимуляцию одного
из глаз.
Простые и комплексные нейроны, сходные по своей чувствительности
к стимулу определенной линейной ориентации, образуют вертикальную
4. Функции центральной нервной системы • 233
Угол наклона линейного
зрительного стимула
IV слой [
Капли—blobs
IV слой [
Доминирующая
информация
Рис. 4.37. Схема формирования кортикальных колонок первичной зрительной
коры.
Ориентационные колонки имеют вид узких полосок шириной 25—30 мкм, в каждой колонке
содержатся нейроны с одинаковой ориентацией рецептивных полей.
А. Группа ориентационных колонок, различающихся наибольшей чувствительностью к
определенной ориентации линейных стимулов и поступлению информации от определенного
глаза.
Б. Каждая группа ориентационных колонок содержит регулярно повторяющиеся скопления
клеток в виде капель (blobs), которые отсутствуют в IV слое коры. Эти клетки осуществляют
переработку информации о цвете наблюдаемых объектов.
ориентационную колонку. Соседние колонки различаются систематическим
изменением оси линейной ориентации стимула, которая от одной колонки
к другой смещается приблизительно на 10° (рис. 4.37). На площади
примерно в 1 мм2 размещается комплект ориентационных колонок,
рассчитанный на регистрацию наклона линейных стимулов в пределах 360°.
Помимо этого в комплект входят две глазодоминантные колонки, одна из
которых получает информацию только от левого, а другая — только от правого
глаза. Еще одним обязательным компонентом такого набора колонок
является несколько скоплений клеток, предназначенных для восприятия
цвета и расположенных в виде вставок или капель (blobs) между ориентаци-
онными колонками. Полный комплект, включающий ориентационные,
глазодоминантные колонки и воспринимающие цвет вставки-blobs,
получил название гиперколонки, которая является элементарным модулем
переработки зрительной информации.
Вторичная зрительная кора примыкает к первичной зрительной коре и
занимает 18-е и 19-е поля затылочных долей. В них, однако, процесс
переработки зрительной информации не завершается, и у человека в нем
участвует свыше 30 регионов, связанных между собой приблизительно 300
соединительными путями, образующими сложную сеть нейронных переклю-
234 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
чений. Эти регионы различаются
между собой по выполняемой
функции, например, регион Vv,
или МТ (медиотемпоральный)
осуществляет переработку
информации о движении объекта в
зрительном поле, а регион VIV,
расположенный на стыке теменной и
височной областей, обеспечивает
восприятие формы и цвета
объекта.
Существуют два пути,
начинающихся в первичной
зрительной коре и предназначенных для
раздельной переработки
зрительной информации: вентральный и
дорсальный (рис. 4.38).
Вентральный путь проходит к нижней
височной извилине, где обнаружены
нейроны, имеющие очень
большие рецептивные поля. В этой
области отсутствует ретинотопи-
ческая организация, в ней
происходит опознание зрительных
стимулов, устанавливается их
форма, величина и цвет. Здесь
имеются лицеспецифические нейроны, избирательно реагирующие на
появление в зрительном поле лица человека, причем одни нейроны
активируются, если лицо повернуто в профиль, а другие реагируют на поворот в фас.
При поражении этой области может возникнуть прозопагнозия, при
которой человек перестает узнавать знакомые ему лица. В средней, а также в
верхней височной извилинах находятся нейроны, необходимые для
восприятия движущихся объектов и для фиксации внимания на неподвижных
объектах.
Дорсальный путь из первичной зрительной коры ведет к заднетеменным
областям. Его функциональное значение заключается в определении
взаимного пространственного расположения всех одновременно действующих
зрительных стимулов. Повреждение этой области коры приводит к дефекту
пространственных ощущений и нарушению зрительно-моторной
интеграции: человек видит предмет и может правильно описать его форму и цвет,
но при попытке взять этот предмет рукой промахивается. Для удобства
запоминания вентральный путь принято ассоциировать с вопросом, «что»
представляет собой объект, а дорсальный путь — с вопросом, «где» этот
объект находится.
4.10.4.3. Функция слуховой коры
Первичная слуховая кора получает сенсорную информацию от релейных
нейронов таламуса, она расположена в глубине латеральной борозды (поле
41), отделяющей височную долю от лобной и передних отделов теменной
доли. Вторичная слуховая кора получает большую часть афферентных
сигналов от первичной коры и располагается вокруг нее. К первичной
слуховой коре поступает тонотопически организованная информация от слухо-
Рис. 4.38. Схема двух основных
направлений переработки зрительной информации
за пределами первичной сенсорной
области.
Вентральный путь из зрительной коры
проходит к нижней и средней извилинам височной
коры, объединяя структуры, обеспечивающие
восприятие формы и цвета наблюдаемых
зрительных объектов.
Дорсальный путь ведет из зрительной коры к
структурам, функция которых состоит в
формировании пространственного представления
о наблюдаемом объекте.
4. Функции центральной нервной системы • 235
вых рецепторов, предварительно переработанная в переключательных
ядрах слухового тракта. В передних областях слуховой коры находятся
колонки, предназначенные для получения и переработки высокочастотных
акустических сигналов, позади них — колонки, получающие информацию
о низкочастотных звуковых раздражителях. Параллельно с обработкой
информации о высоте тона происходит оценка интенсивности звука и
временных интервалов между отдельными звуками. Для некоторых нейронов
слуховой коры наиболее сильными стимулами являются звуки
определенной длительности, для других — повторяющиеся звуки, для третьих —
шумы, имеющие широкий диапазон частот.
Нейроны такого рода относятся к категории простых, наряду с ними
существуют комплексные нейроны, реагирующие на определенные
частотные или амплитудные модуляции звуков. Наличие простых и комплексных
нейронов свидетельствует о соблюдении общего принципа переработки
информации в сенсорной коре, когда этап регистрации элементарных
признаков раздражителя и определения различных составляющих звукового
сигнала предшествует следующему этапу, на котором возникает
комплексный образ.
4.10.5. Функции ассоциативных областей коры
Ассоциативная кора организована подобно сенсорным областям: ее
нейроны объединены в вертикальные колонки. Она интегрирует активность
сенсорных областей коры и осуществляет их функциональное объединение с
моторной корой при выполнении целенаправленных и осознаваемых
действий человека. Три ассоциативные области коры участвуют в реализации
разных когнитивных (познавательных) функций.
4.10.5.1. Функции теменно-височно-затылочной коры
Здесь происходит интеграция сенсорных функций, прежде всего сомато-
сенсорной, зрительной и слуховой, эта ассоциативная область связана с
когнитивными процессами — мышлением и речью, хотя и то, и другое
требует совместной деятельности многих регионов коры, а не одних лишь
ассоциативных полей.
Задняя часть коры теменных долей (поля 5 и 7) получает информацию от
соматосенсорной, зрительной (дорсальный путь) и слуховой коры
(рис. 4.39). Объединение информации дает пространственное ощущение
окружающего мира, позволяющее ориентироваться в нем и соотносить его с
собственным телом, а также с отдельными частями тела, при этом
функциональное значение левой и правой заднетеменных областей не
одинаково. Если повреждение левого полушария у большинства людей приводит к
нарушениям речи и письма, то при правостороннем повреждении
нарушений речи, как правило, нет, но почти утрачивается сенсорная связь с
левой половиной тела, хотя там и сохраняется чувствительность. Такие
больные обычно игнорируют свою левую половину, например, когда одеваются
или когда умываются, иногда они не в состоянии воспринимать левую
руку или ногу как собственную. Причина игнорирования левой половины тела
у людей с повреждением правой заднетеменной области заключается в
утрате сознательного контроля и характерном изменении памяти, когда
больной пренебрегает не только реальными предметами слева, но и
воспоминаниями об этих предметах.
Распределение внимания у здоровых людей связано с активацией задне-
236 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Вторичная
моторная -<
кора
Добавочный
моторный
ареал
Премоторная
кора
Дорсолатеральная
префронтальная
ассоциативная
кора
Область,
контролирующая
следящие
движения
глаза
Первичная
моторная
кора Соматосенсорная
кора
Заднетеменная
ассоциативная
кора
Первичная
зрительная
кора
Первичная
слуховая
кора
Рис. 4.39. Последовательность переработки информации в коре при формировании
комплексного восприятия окружающего мира и определении стратегии поведения.
Ассоциативная кора теменной, затылочной и височной областей интегрирует полученные из
сенсорных зон сигналы, используя их для осуществления когнитивной деятельности.
Префронтальная кора получает информацию от теменно-височно-затылочной ассоциативной
области и использует ее для создания поведенческих программ.
теменной, а также фронтальной коры. Однако каждая из этих областей
решает разные задачи. Теменная область активируется, когда происходит
только переключение внимания с одних сенсорных сигналов на другие. В
отличие от этого, лобная кора становится активной только в том случае,
если переключение внимания сопровождается связанным с ним движением.
Правое полушарие позволяет фиксировать внимание на объектах,
находящихся как в левом, так и в правом поле зрения, тогда как левое
полушарие способно это делать только в правом поле зрения. Таким образом, при
удержании внимания на объектах, расположенных в правом поле зрения,
активны оба полушария, а при переносе его на объекты, представленные в
левое поле зрения, сознательный контроль осуществляет одно лишь правое
полушарие. В правой заднетеменной области имеются два отдельных
региона для пространственного восприятия, а в левой — только один.
Височные доли участвуют в восприятии зрительных (в нижних
извилинах) и слуховых (в верхних извилинах) стимулов: они сопоставляют новую
информацию, полученную от первичных сенсорных областей, со старой,
поступавшей прежде и зафиксированной в долговременной памяти.
Повреждения нижних областей височных долей затрудняют процесс научения
при решении задач, связанных со зрительным восприятием, а вследствие
повреждения верхних областей височных долей нарушается запоминание
информации, предоставляемой слуховой сенсорной системой. Переработка
информации в височной коре связана с использованием памяти о
прошлом опыте. После двустороннего удаления некоторых областей височной
коры и гиппокампа (с целью устранения эпилепсии) у пациентов
утрачивается способность к образованию долговременной памяти (за исключени-
4. Функции центральной нервной системы • 237
ем неосознаваемой моторной памяти, образование которой не требует
участия височных долей). Функция левой и правой височной областей не
совсем одинаковы, что свидетельствует о функциональной асимметрии
больших полушарий мозга. При повреждении только левой височной области
больные хуже, чем до операции, могли вспомнить предъявленный им
список существительных, а при повреждении правой височной области
вербальная память почти не изменялась, но хуже запоминались образцы
рисунков, геометрических фигур, человеческих лиц.
4.10.5.2. Функции префронтальной ассоциативной коры
Префронтальная ассоциативная кора занимает дорсолатеральную
поверхность лобных долей, ее основная функция состоит в создании плана
произвольных действий. Большую часть информации префронтальная область
получает от заднетеменной ассоциативной коры, с которой она связана
многочисленными внутрикортикальными и субкортикальными связями.
Благодаря этим связям префронтальная кора получает полную
пространственную карту находящихся в поле зрения предметов. Сведения о внешнем
пространстве здесь объединяются с информацией о положении тела и
отдельных его частей, причем префронтальная кора включает все эти данные
в кратковременную рабочую память. На этой основе создается план
предстоящих действий, т. е. из множества возможных вариантов деятельности
выбираются необходимые и в наиболее рациональной последовательности.
Прежде всего, программируется положение глаз, направляемых на нужный
объект, Предусматривается координация действий обеих рук и т. д.
Большая часть выходящих из префронтальной коры сигналов поступает в пре-
моторную кору, создающую конкретные программы моторных действий.
Префронтальная область коры отличается изобилием заканчивающихся
в ней дофаминергических окончаний. Дофамин здесь выполняет роль
модулятора, необходимого для сохранения кратковременной рабочей памяти.
После локальной инъекции в префронтальную область обезьяны вещества,
избирательно нарушающего дофаминергическую передачу, ухудшается
выбор правильных действий, которые она должна совершать, чтобы
добраться до корма. С нарушениями в дофаминэргической системе связывают
развитие шизофрении: у большинства шизофреников величина лобных
долей меньше, чем у здоровых людей.
4.10.5.3. Функции лимбической коры
Лимбическая кора связана с лимбической системой мозга и занимает
медиальные и вентральные поверхности лобных долей, часть медиальной
поверхности затылочных долей, поясные извилины, находящиеся в глубине
межполушарной щели, а также передние полюса височных долей.
Лимбическая кора получает информацию от вторичных сенсорных областей и
играет важную роль в формировании мотиваций, эмоций и образовании
долговременной памяти, она влияет на создание плана будущих действий. Ор-
битофронтальная кора имеет прямые связи с миндалинами, от
эффективности использования этой связи в значительной мере зависят
эмоциональные аспекты поведения. Взаимодействие орбитофронтальной и дорсолате-
ральной областей лобных долей необходимо при планировании
предстоящих действий, которое определяется полученными сведениями об
окружающем мире, с одной стороны, и субъективным отношением к нему — с
другой. При поражении лобных долей часто нарушается формирование
238 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
мотиваций и затрудняется прогнозирование результатов действий, такие
больные отличаются вспыльчивостью, грубы в общении с другими людьми
и одновременно легкомысленны, не способны критически оценивать свое
состояние.
4.10.6. Функции моторных областей коры
Моторные области коры занимают часть корковой поверхности лобных
долей и подразделяются на первичную и вторичную моторную кору.
Первичная моторная кора (прецентральные извилины мозга или поле 4) получает
афферентную информацию преимущественно от соматосенсорной коры и
непосредственно управляет двигательными центрами ствола и спинного
мозга, контролирующими сокращения скелетных мышц. Вторичная
моторная кора (поле 6) получает большую часть афферентной информации от
ассоциативной коры и на ее основе создает программы предстоящих
движений, которые отправляет для исполнения первичной моторной коре. В
функциональной иерархии моторных систем вторичная моторная кора
главенствует над первичной.
'<>?\.
4.10.6.1. Функция первичной моторной коры
Соматотопическое распределение ее нейронов соответствует регулируемым
мышцам лица, тела и конечностей пропорционально объему движений,
совершаемых с их помощью (рис. 4.40). Пропорции двигательного
гомункулуса, искаженные, по сравнению с реальным человеком, отражают не
объем регулируемых мышц, а объем
и степень сложности движений,
которые они выполняют, поэтому
кисти рук, пальцы, лицо
(мимические мышцы) и язык имеют
большее представительство, чем,
например, мышцы спины.
Относящиеся к каждому участку тела
кортикальные колонки содержат
популяции нейронов, активация
которых вызывает изменение
положения управляемого сустава в
одном определенном направлении
в результате согласованных
сокращений мышц-синергистов при
одновременном расслаблении
антагонистов. Для изменения
положения этого сустава в
противоположном направлении необходима
активность других колонок.
Каждая соматотопическая
область моторной коры имеет
обратную связь с управляемой
частью тела. Связь обеспечивается
поступлением информации от
проприоцепторов управляемых
мышц и от тактильных
рецепторов кожи в соматосенсорную ко-
Рис. 4.40. Схема соматотопической
организации первичной моторной коры.
Первичная моторная кора занимает область
передних центральных извилин и организована
соматотопически. Непропорциональное
представительство отдельных частей тела отражает
степень сложности движений, осуществляемых
под контролем соответствующей
соматотопической области.
4. Функции центральной нервной системы • 239
ру, а из нее — в моторную. Например, в область представительства рук
сенсорная информация поступает от рецепторов кожи, что позволяет
тонко регулировать движения пальцев при ощупывании предметов руками
или пальцами. С другой стороны, сами движения пальцев или рук по
поверхности предмета активируют находящиеся в них проприоцепторы, а
поступающая от этих рецепторов информация помогает установить форму
предмета на ощупь. Такая деятельность рук называется стереогностиче-
ской.
4.10.6.2. Функция вторичной моторной коры
Вторичная моторная кора создает план предстоящих движений,
исполнение которого осуществляет первичная моторная кора. При электрической
стимуляции первичной моторной коры возникают сравнительно простые
сокращения мышц, а при стимуляции вторичной коры — целые
комплексы движений, но чтобы их вызвать, необходима более сильная и
продолжительная электрическая стимуляция, чем та, которая способна
активировать первичную моторную кору. При повреждениях вторичной моторной
коры нарушается выполнение комплексов автоматизированных, заученных
движений.
Вторичная моторная кора состоит из двух соматотопически
организованных областей: премоторной коры и добавочного моторного ареала,
расположенного на верхней стороне лобных долей. Каждая из этих областей
получает афферентную информацию от префронтальной ассоциативной
коры, а выходную активность адресует первичной моторной коре и
моторным ядрам ствола. Некоторые аксоны ее нейронов входят в состав волокон
кортикоспиналъного пути, спускающегося в спинной мозг и
осуществляющего управление мотонейронами мышц туловища и конечностей.
Кроме того, премоторная область получает от заднетеменных областей
переработанную сенсорную информацию о комплексе зрительных
ощущений. Эфферентный выход из премоторной области к стволу
осуществляется с участием медиального пути, в основном ретикулоспинального тракта.
С помощью медиального пути премоторная область коры управляет
мышцами туловища и проксимальных отделов конечностей, которые
сокращаются в начальной фазе выпрямления тела или движения руки к
намеченной цели.
Добавочный моторный ареал принимает непосредственное участие в
переработке соматосенсорной информации, в соответствии с которой
программирует последовательность движений, которые выполняются
билатерально. При экспериментальном повреждении этой области коры у обезьян
отдельные движения могут выполняться правильно, но координировать их
в общем потоке действий животные уже не могут, особенно в тех случаях,
когда необходимы согласованные движения обеих рук.
4.11. Регуляция движений
Каждое из движений, выполняемых человеком, содержит два
регулируемых компонента: тонический, который обеспечивает необходимую для
начала движения позу и на время фиксирует в стабильном положении
суставы, и фазный, определяющий направление и скорость движения. В
зависимости от степени сложности выполняемых движений и участия сознания в
их регуляции они подразделяются на рефлекторные, ритмические и
произвольные.
240 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Рефлекторные движения представляют собой наиболее простые
моторные действия, которые выполняются быстро, стереотипно и не нуждаются
в сознательном контроле. Примером могут быть защитные сгибательные
рефлексы, осуществляемые при участии спинного мозга в ответ на болевое
раздражение кожи. Статические и статокинетические рефлексы ствола
осуществляются тоже стереотипно в соответствии с полученной сенсорной
информацией от вестибулярных, проприоцептивных, зрительных и
слуховых рецепторов.
Двигательные структуры спинного мозга и ствола участвуют в
формировании ритмических движений, таких как ходьба, бег, жевание. Эти
движения относительно стереотипны и могут повторяться почти автоматически,
без осознаваемого контроля. Осознание и произвольный контроль необхо- i
димы лишь в самом начале, т. е. при запуске ритмических движений, и в
конце — при остановке движений.
Произвольные движения — это сложные комбинированные действия,
необходимые, например, для набора текста на клавиатуре компьютера или
игры на фортепьяно. Их отличительными признаками являются
направление движений к определенной, заранее намеченной цели и
совершенствование координации в связи с приобретаемым опытом. Спинной мозг и
ствол необходимы при всякой моторной деятельности, при совершении
произвольных движений они участвуют в качестве исполнителей
двигательных команд моторных областей коры.
4.11.1. Иерархическая организация моторных систем
Любое движение человека возникает при сокращении одних мышц (синер-
гистов) и одновременном расслаблении других мышц (антагонистов), что
зависит только от активности управляющих ими мотонейронов. Порядок
возбуждения мотонейронов определяют действующие на них
возбуждающие и тормозные интернейроны. Функциональное объединение
мотонейронов с соседними интернейронами образует низшую моторную систему
или локальный моторный аппарат, предназначенный для управления
определенной частью тела. В любой низшей моторной системе у взрослого
человека запрограммированы все варианты последовательности возбуждения
мотонейронов, представляющие программы возможных движений
управляемой части тела.
Возбуждение мотонейронов в ходе стереотипной рефлекторной реакции
происходит в результате действия на них возбужденных афферентных
нейронов и интернейронов, объединенных синапсами в общую рефлекторную
Дугу. Двигательные центры головного мозга могут усилить или затормозить
осуществление рефлекторного ответа, и тогда выполняемое движение
будет исполнено с большей или меньшей амплитудой либо совсем не
возникнет (рис. 4.41). Выбор конкретной двигательной программы зависит от
наиболее значимой сенсорной информации и чаще всего состоит в
предпочтении наиболее эффективных действий.
Командные двигательные центры расположены в стволе мозга и
моторных областях коры, их нисходящие пути могут оканчиваться
непосредственно на мотонейронах спинного мозга, но чаще регулируют их
активность опосредованно, с помощью соседних интернейронов. Существует
несколько параллельных нисходящих путей, которые участвуют в решении
разных функциональных задач. Так, например, намеренное движение руки
к находящемуся на уровне головы предмету может напоминать по своей
траектории нечаянный взмах при попытке сохранить равновесие. При
4. Функции центральной нервной системы • 241
Ассоциативные |ч->
области коры |"
.. 1
V V
ВМК <-^ВМК *«-> ВМК -«-1
1МГ
V у, М
Ассоциативные
области коры
1
► ВМК
и
Первичная
моторная кора
V ▼ 1Г
Ствол
1 НиСХОДЯЩ>
не
моторные v
If пути
а Сенсорная
i информация
! (обратная
связь)
1
..,
длинной мозг
Покальные
моторные
Ротоне
эйронь
г
|
Ь
'
ВМК
«4---Г. Мь
+...FL Мь
i
Г. Мь
1ШЦЫ -
1ШЦЫ -
+—1
1
1
1
1
1
1
1
1
1
1
1
t
I
1
1
1
1
1
1
1
J
1
1
1
1
1
1
[
f
Рис. 4.41. Иерархическая организация двигательных структур мозга.
Иерархия моторных центров отражает эволюционное развитие двигательной системы (спинной
мозг—ствол—моторная кора), способствующее решению все более сложных задач и
одновременной передачи управления от низших отделов к высшим. Иерархические уровни
соединяются несколькими параллельными путями, каждый уровень получает необходимую сенсорную
информацию. ВМК — вторичная моторная кора (премоторная и дополнительная области).
внешнем сходстве этих движении, осуществляющие их механизмы
оказываются разными, так как в них участвуют разные двигательные центры и
нисходящие пути.
Все двигательные центры, на каком бы уровне иерархии они ни
находились, организованы соматотопичвски. Они специализируются на
управлении только определенными группами мышц, от которых постоянно
получают сенсорную информацию. Непрерывное поступление сенсорной
информации на всех уровнях организации моторных систем своевременно
обеспечивает каждую двигательную структуру оперативной обратной
связью, т. е. сведениями о том, как выполняется то или иное движение,
достигается или нет намеченная цель: в соответствии с этими данными
выполняемые движения постоянно корректируются.
242 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Иерархия двигательных центров состоит в том, что высшие из них могут
отменить команды низших или поручить им выполнение собственной
команды. Так, например, стволовые двигательные центры способны
подчинять себе активность низших моторных систем спинного мозга, но в то же
время сами подчиняются моторным областям коры. Вторичная и
первичная моторная кора создают конкретную программу движений, т. е.
выбирают из множества существующих вариантов наиболее подходящие
сочетания. Ассоциативная кора готовит общий план действий. Многочисленные
обратные связи между разными иерархическими уровнями моторной
системы предоставляют им возможность взаимодействовать и в рамках
отношений субординации, и в качестве партнеров, согласованно решающих
общие задачи.
Важную роль как в формировании движений, так и в контроле их
исполнения играют мозжечок и базальные ганглии. Они не имеют прямого
выхода к мотонейронам и поэтому их нельзя отнести к какому-то
определенному иерархическому уровню. Мозжечок и базальные ганглии
взаимодействуют с несколькими уровнями организации моторной системы и
координируют их активность.
4.11.2. Нисходящие пути моторной коры
Моторные области коры определяют наиболее сложную моторную
деятельность и регулируют ее посредством двух нисходящих путей: кортико-
спиналъного и кортикобульбарного, объединяемых под названием
пирамидный тракт. Кортикоспинальный путь, необходимый для управления
мышцами туловища и конечностей, заканчивается либо прямо на
мотонейронах, либо на интернейронах спинного мозга, а часть аксонов этого пути
образует синапсы с нейронами красных ядер среднего мозга (рис. 4.42).
Кортикобульбарный путь осуществляет контроль двигательных ядер
черепно-мозговых нервов, управляющих мышцами лица и движениями глаз.
Помимо этого он проецируется на сеть двигательных ядер ствола,
связанных со спинным мозгом.
Прямой кортикоспинальный тракт является самым большим
нисходящим моторным путем, он образован приблизительно одним миллионом
аксонов, больше половины которых принадлежат нейронам V слоя
первичной моторной коры (поле 4). Приблизительно '/з волокон кортикоспиналь-
ного пути происходит от нейронов премоторной коры (поле 6), а остальные
начинаются в соматосенсорной коре (поля 3, 2, 1) и осуществляют перенос
сенсорной информации.
Кортикоспинальный путь проходит через внутреннюю капсулу мозга, а
в продолговатом мозге образует характерные утолщения на вентральной
поверхности — они называются пирамидами (от этого термина произошло
название: пирамидный тракт). На границе между продолговатым и
спинным мозгом большая часть волокон, приблизительно 3/4> переходит на
противоположную сторону. Вместе с ними на противоположную сторону
переходят волокна руброспинального пути, в результате этого объединения
образуется дорсолатералъный нисходящий путь. Он заканчивается на
интернейронах и мотонейронах спинного мозга, контролирующих дистальные
мышцы конечностей на противоположной, по отношению к моторной
коре, стороне тела.
Не перешедшая на другую сторону часть волокон кортикоспинального
пути совместно с медиальными путями двигательных центров ствола
образует вентромедиальный путь, оканчивающийся синапсами с медиальным
4. Функции центральной нервной системы • 243
А. Латеральный кортико- Б. Вентромедиальный
спинальный путь кортикоспинальный путь
Рис. 4.42. Схема нисходящих двигательных путей коры к спинному мозгу.
А. Латеральный кортикоспинальный путь предназначен для управления дистальными группами
мышц конечностей, он начинается от моторных полей 4 и 6, сенсорных полей 3, 2, 1 и
оканчивается в медиальной части заднего рога спинного мозга на противоположной стороне.
Переход волокон этого пути на противоположную сторону происходит на уровне пирамид
продолговатого мозга; ниже они идут вместе с волокнами руброспинального пути.
Б. Вентромедиальный кортикоспинальный путь предназначен для управления мышцами
туловища и проксимальными мышцами конечностей, он образован аксонами пирамидных нейронов
моторной и премоторной коры, которые оканчиваются в спинном мозгу билатерально.
Перекреста волокон не происходит, в спинном мозге они проходят параллельно медиальным путям
двигательных центров ствола.
столбом нейронов спинного мозга, которые контролируют мышцы
туловища и проксимальных отделов конечностей, участвующие в формировании
позы и приспособлении ее к совершаемым движениям. Такое управление
осуществляется билатерально, т. е. относится к обеим половинам спинного
мозга и, соответственно, к обеим половинам тела.
244 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
4.11.3. Контроль выполняемых движений
Контроль совершаемых движений осуществляют одновременно спинной
мозг, ствол и моторная кора. Каждая из этих структур получает свою
порцию сенсорных сигналов {обратная связь) и может непосредственно влиять
на локальные моторные аппараты {прямая связь), каждая из них способна
осуществлять независимый контроль, однако высшие центры могут
ограничивать выбор программ низшими центрами или предлагать им свои
команды. Сенсорная информация о положении тела и отдельных его частей
в пространстве используется для определения силы сокращения мышц,
регуляции точности и скорости движений. Контролирующая роль
двигательных центров состоит в том, чтобы обеспечить: 1) точность и
своевременность доставки команд одновременно к нескольким (многим) группам
мышц; 2) адекватное совершаемым движениям положение тела; 3)
динамическую оценку механических свойств мышц, костей и суставов.
4.12. Межполушарная функциональная асимметрия
Каждое из больших полушарий мозга получает большую часть
информации от тактильных рецепторов и проприоцепторов противоположной
половины тела и одновременно контролирует двигательные функции
противоположной половины тела. Полушария соединены несколькими пучками
нервных волокон, самый крупный из них — мозолистое тело, функция
которого состоит в обмене информации между полушариями. Сравнение
сенсорных и двигательных функций обоих полушарий свидетельствует, на
первый взгляд, об их симметрии. Однако речевая деятельность у
большинства людей определяется левым полушарием, асимметричной является и
способность к пространственному восприятию, в большей степени
зависящая от работы правого полушария. Асимметрично представительство ряда
других функций, что выражается, например, в функциональном
превосходстве одной руки, ноги, глаза, уха.
4.12.1. Функциональные возможности изолированных полушарий
Полушария изолируются друг от друга после комиссуротомии —
хирургического пересечения мозолистого тела (к такому вмешательству прибегали,
чтобы ограничить распространение возбуждения у больных эпилепсией
при локализации патологического очага в одном из полушарий). Мозг
человека с искусственно разделенными полушариями в литературе
определяют как расщепленный мозг. Функциональные возможности каждого из
разделенных полушарий были определены с помощью тахистоскопии —
метода раздельного введения зрительной информации в каждое из полушарий
(рис. 4.43). Люди с сохраненным мозолистым телом при подобных
исследованиях способны называть предметы и читать демонстрируемые им
слова независимо от того, в каком поле зрения они появляются, поскольку их
полушария через мозолистое тело обмениваются информацией.
При демонстрации изображения предмета или обозначающего его слова
в правом поле зрения испытуемый с расщепленным мозгом воспринимает
информацию только левым полушарием. Он правильно называет предмет,
а слово — читает: изолированное левое полушарие справляется с
поставленными задачами точно так же, как и целый мозг. Когда же изображение
появляется в левом зрительном поле, испытуемый может левой рукой
выбрать на ощупь среди нескольких предметов продемонстрированный ему,
4. Функции центральной нервной системы • 245
Комиссуротомия
Рис. 4.43. Схема тахистоскопического исследования людей, перенесших комиссуро-
томию.
Слева: пациентка перед экраном тахистоскопа, в левом и правом полях которого появляются
изображения предметов или слова; за экраном находятся предметы, опознать которые можно
только на ощупь.
Справа показана схема переработки зрительной информации: если пациентка смотрит на
точку в центре экрана тахистоскопа, то информация из правого зрительного поля поступает в
левое полушарие мозга, а из левого зрительного поля — в правое.
но не способен его назвать. Правое полушарие может воспринимать
только относительно простые слова. Если, например, испытуемому показывали
для обработки в правом полушарии слово D-O-G (собака) или A-P-P-L-E
(яблоко), то он правильно выбирал из предъявленных предметов
игрушечную собачку или яблоко, но назвать слово не мог. Правое полушарие
способно перерабатывать простую входящую лингвистическую информацию,
но не может обеспечить языковый выход.
В других видах деятельности, например в формировании
пространственного ощущения, правое полушарие превосходит левое, и его нельзя
считать лишь копией левого минус речевая деятельность.
4.12.2. Выявление функций неразделенных полушарий
После кратковременной наркотизации только одного из полушарий (путем
введения амитала натрия в левую или правую сонную артерию) можно
определить, в каком из них расположены центры речи. Приблизительно у
96 % правшей речевые центры находятся в левом полушарии и только у
4 % — в правом, однако и у большинства левшей, приблизительно у 70 %,
речевые центры также находятся в левом полушарии и лишь у 15 %
левшей — в правом, а еще у 15 % — в обоих полушариях. Если в левое и пра-
246 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
вое ухо через стереофонические наушники поступает различающаяся
речевая информация (произносимые диктором слова или числа), то правши в
большинстве случаев лучше воспринимают информацию, поступившую в
правое ухо. Этот феномен получил название «эффекта правого уха»,
который принято объяснять более эффективным проведением информации в
левое «речевое» полушарие от контрлатерального уха.
На функциональную специализацию регионов мозга указывает уровень
их функциональной активности во время речевой деятельности. Так,
например, при чтении вслух функционально активны речевые центры
доминантного левого полушария, что удалось обнаружить с помощью позитрон-
но-эмиссионной томографии (ПЭТ) и ядерно-магнитного резонанса (ЯМР).
При проведении ПЭТ в сонную артерию вводят меченную короткоживу-
щим изотопом фтора 2-дезоксиглюкозу, которая включается в обменные
процессы наиболее активных нейронов. Ее присутствие в функционально
активных участках мозга можно зарегистрировать по радиомаркеру с
помощью компьютерной томографии. Другой вариант ПЭТ основан на том, что
чем активнее функционируют нейроны, тем большим становится кровоток
в этом регионе, а для оценки кровотока вводят помеченную короткоживу-
щим изотопом (кислород-15) воду. Поскольку применяемые при ПЭТ
изотопы существуют очень недолго, их надо получать непосредственно перед
проведением исследования с помощью циклотрона, что делает всю
процедуру ПЭТ очень дорогой. В отличие от ПЭТ исследование с помощью
ЯМР не требует предварительной инъекции пациенту. Оно регистрирует
электромагнитное излучение, возникающее в связи с влиянием внешнего
магнитного поля на вращающиеся ядра атомов, например ядра атома
водорода в составе воды. Электромагнитное излучение можно регистрировать в
любой плоскости и на этой основе получать представление о
пространственной характеристике слоя толщиной 5—10 мм. При повышенном
потреблении нейронами кислорода картина ЯМР характерным способом
изменяется, что и представляет основу для применения этого метода с целью
определения функциональной активности отдельных регионов мозга.
4.12.3. Функциональная специализация полушарий мозга
Левое полушарие доминирует в формальных лингвистических операциях,
обеспечивает фонетическое представление и синтаксический анализ,
однако правое полушарие может узнавать звучащие слова и ассоциативное
значение отдельных слов, а также определяет эмоциональную окраску речи
(табл. 4.3). Правое полушарие значительно лучше левого обеспечивает
пространственное ориентирование человека и пространственное
расположение зрительных сигналов, ориентацию линий и их кривизну,
многоугольники неправильной формы. Однако с задачей обнаружения
минимальных различий в таких фигурах лучше справляется левое полушарие.
Встретив хорошо знакомого человека, мы узнаем его мгновенно благодаря
правому полушарию, воспринимающему целостный образ («гештальт»).
Левое полушарие в таких случаях последовательно оценивает все
характерные признаки: волосы, лоб, глаза, нос, уши, подбородок, губы (вербальное
кодирование).
Два полушария могут функционировать независимо и поочередно
доминировать в зависимости от характера решаемых задач. Например, в
восприятии или узнавании знакомых мелодий доминирует правое полушарие,
воспринимающее мелодию как целостный образ, с его гармонией и
тембром. Но при сравнении двух мелодий, отличающихся всего одной нотой,
4. Функции центральной нервной системы • 247
Таблица 4.3. Латерализация функций у правшей
Доминирование левого полушария
Восприятие устной речи и ритма
музыки
Понимание значения букв и слов,
чтение и письмо
Арифметический счет
Вербальное мышление
Аналитическое и последовательное
восприятие
Контроль сложных движений
Конструирование временных
отношений
Доминирование правого полушария
Восприятие интонации речи, гармонии и
тембра музыки
Восприятие сложных геометрических фигур,
узнавание лиц
Пространственная ориентация
Невербальное мышление
Целостное и одновременное восприятие («геш-
тальт»-образ)
Передвижение в пространстве
Конструирование пространственных отношений
компетентнее оказывается левое полушарие; оно же оценивает
ритмический рисунок мелодии, причем эта функция хорошо коррелирует с
речевой деятельностью.
Левое полушарие упорядочивает и программирует события во времени,
тогда как правое представляет и конструирует пространственные
отношения. При этом не имеет значения, являются ли сами стимулы акустико-
временными или же зрительно-пространственными. Левое полушарие
действует логически и аналитически, т. е. подобно компьютеру: оно
последовательно выделяет детали и снабжает их словесными определениями.
Правое полушарие функционирует синтетически: определяет общую
конфигурацию стимула и перерабатывает информацию как единое целое.
Накоплен большой фактический материал, свидетельствующий о доминировании
правого полушария в эмоциональной сфере. Пациенты с расщепленным
мозгом при демонстрации им в левом зрительном поле картин
эмоционального содержания реагировали на них так же, как и здоровые люди, что
демонстрирует возможность невербального возникновения эмоций.
Выражение левой половины чужого лица (информация обрабатывается в
правом полушарии) оказывается более важным для здоровых людей при
оценке эмоционального значения этого выражения. Эмоциональная окраска
голоса, плач или смех, эмоциональная окраска музыкальных фрагментов
воспринимаются лучше, если звуковые сигналы попадают в левое ухо: при
этом перекрещивающиеся и проводящие сигналы в правое полушарие
нервные волокна играют более важную роль, чем неперекрещивающиеся.
Большая способность правого полушария к объединению сложных
сигналов в целостный образ играет решающую роль в эмоциональных
переживаниях, в то время как преимущество левого полушария при анализе
временных отношений и отдельных деталей дает ему возможность
контролировать и ослаблять эмоциональные реакции. Таким образом,
эмоциональное преимущество правого полушария и когнитивное — левого
уравновешивают и дополняют друг друга.
ГЛАВА 5
Вегетативная нервная система *
5.1. Строение вегетативной нервной системы
Вегетативная нервная система [синонимы: автономная, висцеральная
нервная система] представляет собой комплекс центральных и периферических
нервных структур, участвующих в регуляции деятельности внутренних
органов, кровеносных и лимфатических сосудов, гладкой и отчасти
поперечно-полосатой мускулатуры.
В стволе головного мозга и спинном мозге расположены четыре центра
вегетативной нервной системы:
1) мезэнцефалический, из которого вегетативные нервные волокна
выходят в составе глазодвигательного нерва;
2) бульварный, из которого нервные волокна выходят в составе
лицевого, языкоглоточного и блуждающего черепных нервов;
3) тораколюмбальный — ядра боковых рогов СУШ—L,„ сегментов;
4) сакральный — ядра боковых рогов Sn—SiV сегментов.
Из двух последних центров волокна выходят в составе передних
корешков спинномозговых нервов.
Эффекторные импульсы, исходящие из стволовых и спинномозговых
центров, достигают внутренних органов и сосудов по двухнейронному
пути. Первые нейроны располагаются в головном или спинном мозге, их
отростки направляются к периферическим узлам вегетативной нервной
системы {ганглиям) и оканчиваются на телах вторых нейронов, отростки
которых разветвляются в иннервируемых органах (рис. 5.1). Отростки первых
нейронов называются преганглионарными, а отростки вторых — постганг-
лионарными волокнами.
По морфологическим и функциональным свойствам в вегетативной
нервной системе различают симпатический и парасимпатический отделы.
Тораколюмбальные спинномозговые центры, выходящие от них преганг-
лионарные волокна, соответствующие им ганглии и постганглионарные
волокна составляют симпатический отдел вегетативной нервной системы.
По выходе из позвоночного канала в составе передних корешков преганг-
лионарные волокна вступают в виде белых соединительных ветвей (гг.
communicantes albi), которые расположены двумя цепочками, лежащими по
обе стороны позвоночного столба, и образуют симпатические стволы
(trunci sympathici).
Симпатические ганглии содержат нейроны, отростки которых
(постганглионарные волокна) направляются непосредственно к внутренним
органам и кровеносным сосудам либо входят в состав спинномозговых нервов в
виде серых соединительных ветвей (rr. communicantes grisei), вместе с ними
достигая кровеносных сосудов, гладких мышц и желез тела и конечностей.
Центры, расположенные в стволе головного мозга и крестцовых сегмен-
* Глава написана доцентом Л. В. Надежкиным.
5. Вегетативная нервная система • 249
<@>
©
Варолиев
МО0Т
Продолговатый
мозг
Потовые
железы
Кровеносные
J Верхний
г* брыжеечный
Бурая ' ' ганглий Нижний
жировая Паравертебральная брыжеечный'
ткань симпатическая ганглий
цепочка
Репродуктивные органы
Рис. 5.1. Схема строения вегетативной нервной системы.
Центры вегетативной нервной системы в стволе головного мозга и спинном мозге: М — ме-
зэнцефалический (преганглионарные нервные волокна выходят в составе глазодвигательного
нерва); Б — бульбарный (преганглионарные нервные волокна выходят в составе лицевого,
языкоглоточного и блуждающего нервов); Т — торако-люмбальный — ядра боковых рогов
CVIII-LIII сегментов спинного мозга; С — сакральный — ядра боковых рогов SII-SIV
сегментов спинного мозга.
Из Т и С центров преганглионарные волокна выходят в составе передних корешков
спинномозговых нервов.
max спинного мозга, выходящие из них преганглионарные волокна, а также
ганглии с постганглионарными волокнами составляют парасимпатический
отдел вегетативной нервной системы. Парасимпатические ганглии
располагаются вблизи или в стенке иннервируемых органов, поэтому постганг-
лионарные парасимпатические волокна короткие.
Ганглии и нервные волокна в стенках полых органов (в составе подсе-
розных, межмышечных, подслизистых сплетений) составляют энтеральную
часть вегетативной нервной системы.
5.2. Функции вегетативной нервной системы
Функция вегетативной нервной системы — регуляция физиологических
процессов, обеспечивающих поддержание гомеостазиса в организме. Для
обеспечения этой основной функции вегетативной нервной системой
осуществляется:
1. Управление деятельностью висцеральных органов:
а) пусковая функция — активация специфической для органа функции
(например, сокращения гладкой мышцы, секреции железы);
б) корригирующая функция — усиление (или ослабление) деятельности
органа в соответствии с меняющимися потребностями организма.
2. Влияние на процессы обмена веществ в органах (трофическая
функция), особенно во время приспособления их к изменяющимся
условиям деятельности:
250 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
а) усиление функциональных ответов на раздражители за счет
использования энергетических ресурсов (эрготропная функция);
б) коррекция и поддержание процессов восстановления и сохранения
резерва энергии для дальнейшей деятельности органов (трофо-
тропная функция).
3. Участие в регуляции деятельности всех органов путем изменения
кровоснабжения.
При возбуждении симпатических эфферентов усиливаются сокращения
сердца и увеличивается их ритм, возрастает скорость проведения
возбуждения по мышце сердца, возникает констрикция кровеносных сосудов,
повышающая артериальное давление, расширяются бронхи и зрачки,
увеличивается секреция мозгового слоя надпочечников, снижается тонус глад- \
ких мышц желудочно-кишечного тракта, повышаются скорость
свертывания крови, активность ферментов, увеличивается в крови содержание
глюкозы и свободных жирных кислот.
Активность парасимпатических нервов уменьшает силу и частоту
сокращений сердца и за счет этого понижает артериальное давление,
увеличивает секрецию инсулина, снижает концентрацию глюкозы в крови, приводит
к усилению моторной и секреторной функций желудочно-кишечного
тракта (табл. 5.1).
Вегетативная нервная система способна изменять функциональную
реактивность или адаптационные свойства тканей иннервируемых органов
путем изменения биохимических характеристик их клеток. Например,
скелетная мышца, доведенная до утомления длительным возбуждением ее
моторного нерва, под влиянием дополнительного возбуждения
симпатических волокон начинает вновь отвечать интенсивными сокращениями
{феномен Орбели—Гинецинского). Возбуждение симпатических волокон не
вызывает сокращение скелетной мышцы, но при утомлении мышцы
повышает ее возбудимость и ускоряет протекающие в ней биохимические
процессы, оказывая адаптационно-трофическое влияние.
Адаптационно-трофические влияния вегетативной нервной системы
существуют помимо ее воздействия на тонус и проницаемость стенок
сосудов. За счет такого влияния симпатической и парасимпатической
иннервации создаются условия для улучшения функциональных свойств не только
нервно-мышечных приборов, но и рецепторов, а также всей центральной
нервной системы.
Специальных нервов, оказывающих только адаптационно-трофические i
влияния на иннервируемые ткани, не найдено. Эти влияния
осуществляются не импульсами передачи возбуждения в синапсах, а гуморальными
факторами, например действием не разрушившегося в синапсе медиатора
или продуктов его обмена. В механизме адаптационно-трофического
влияния на иннервируемые ткани существенная роль принадлежит
непрерывному проксимально-дистальному медленному (со скоростью около 1 мм в
сутки) току аксоплазмы по нервному волокну, благодаря которому в аксо-
нальные терминали доставляются нуклеотиды и продукты метаболизма
нуклеиновых кислот, которые синтезированы в ядре нервной клетки. При
диффузии из аксональных терминалей эти биологически активные
вещества достигают клеток эффекторных органов и оказывают на них
адаптационно-трофическое воздействие.
5. Вегетативная нервная система • 251
5.3. Функции периферических отделов вегетативной нервной
системы
5.3.1. Симпатический и парасимпатический отделы
Практически ко всем органам подходят постганглионарные
симпатические и преганглионарные парасимпатические волокна, при этом влияния
отделов вегетативной нервной системы имеют свои особенности:
парасимпатический отдел осуществляет в основном мощные локальные
воздействия на иннервируемые органы, а симпатический вовлекает в реакцию
сразу несколько органов и систем.
В вегетативном ганглии клеток нейронов в несколько раз больше, чем
подходящих к нему преганглионарных волокон. Разветвляясь внутри
ганглия, каждое из этих волокон образует синапсы на телах до 30 ганглионар-
ных нейронов, а на каждом из них оканчиваются синапсами несколько
преганглионарных волокон. В связи с этим возбуждение преганглионарно-
го волокна в ганглии способно оказывать влияние на большое число пост-
ганглионарных нейронов, и, следовательно, на еще большее число эффек-
торных клеток иннервируемого органа. Поэтому возбуждения,
поступающие, например, из спинного мозга по симпатическим волокнам, при
передаче в ганглиях получают значительное пространственное распространение.
Передача возбуждения в синапсах вегетативной нервной системы
осуществляется исключительно с помощью биологически активных
веществ — медиаторов. В передаче возбуждения с преганглионарных на
постганглионарные нейроны в ганглиях симпатического и парасимпатического
отделов медиатором служит ацетилхолин, который связывается с Н-(нико-
тиночувствительными) холинорецепторами.
Медиатором передачи возбуждения с постганглионарных
парасимпатических нейронов на иннервируемую ткань является ацетилхолин, а с
постганглионарных симпатических — норадреналин. Принято называть нервные
клетки и волокна вегетативной нервной системы по выделяемому их тер-
миналями медиатору. Поэтому все парасимпатические и
преганглионарные симпатические нейроны, с медиатором ацетилхолином называют хо-
линергическими, а симпатические постганглионарные нейроны, у которых
основной медиатор норадреналин, — адренергическими.
Не каждая клетка внутренних органов непосредственно контактирует с
волокнами вегетативной иннервации. В скелетных мышцах, например, не
все гладкомышечные клетки кровеносных сосудов имеют прямой контакт
с волокнами симпатических нервов. Однако симпатический нерв вызывает
констрикторную реакцию сосудов, поскольку выделяющиеся при его
возбуждении медиаторы, кроме влияния на иннервируемые клетки, широко
диффундируют и воздействуют также и на соседние группы гладкомышеч-
ных клеток, вызывая их сокращение.
Передача возбуждения с постганглионарных нейронов на эффекторы
происходит в контактах, которые отличаются от «классических» синапсов
в соматической нервной системе. Так, симпатические постганглионарные
нейроны образуют синапсы на эффекторных клетках не только пресинап-
тическими окончаниями, но и имеют особые синаптические контакты в
варикозах (расширениях) периферических участков симпатических
волокон в области иннервируемых тканей. Количество варикозов в этих
участках достигает 15—30 на 100 мкм длины пресинаптической терминали и
нарастает по мере уменьшения ее диаметра. В варикозах имеются скопления
везикул, которые содержат медиатор норадреналин.
252 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
В синаптических контактах варикоз щель очень широкая. Из-за
относительной «открытости» этих контактов осуществляется обмен медиатором
терминали с окружающей тканевой жидкостью. Медиатор, выделившийся
в одной варикозе, путем диффузии достигает нескольких эффекторных
клеток, а медиатор разных варикоз может воздействовать на одну и ту же
клетку. Кроме того, в вегетативных синапсах выражен механизм так
называемого обратного захвата медиатора {re-uptake) Благодаря ему,
например, симпатические терминали поглощают катехоламины из экстрацеллю-
лярного пространства и крови, восстанавливая запасы медиатора за счет
циркулирующих в крови катехоламинов, выделенных мозговым слоем
надпочечников
Передача возбуждения симпатических нервов на эффекторы
осуществляется, как правило, катехоламинами: адреналином и в большей степени
норадреналином. Тела нервных клеток и нетерминальная часть их аксонов
содержат от 10 до 100 мкг норадреналина на 1 г ткани, а пресинаптические
терминали — до 10 000 мкг на 1 г. Катехоламины синтезируются в теле
нервной клетки, переходят в состав цитоплазматических гранул и в этой
форме медленно транспортируются по аксону в направлении концевых
разветвлений.
В пресинаптических терминалях катехоламины депонированы в
везикулах или синаптических пузырьках. В терминалях норадреналин существует
в двух пулах (депо): малом, лабильном, легко высвобождающем медиатор
под действием нервного импульса, и большом, стабильном, прочно
связанном с белком. В цитоплазме аксона катехоламины быстро разрушаются
ферментом моноаминоксидазой, а длительно сохраняться они могут
только внутри гранул. Для механизма переноса катехоламинов из цитоплазмы
в гранулы необходимы АТФ и ионы Mg2+.
В ответ на нервный импульс катехоламины лабильного пула
освобождаются из гранул и выходят в синаптическую щель, где часть медиатора
разрушается ферментом катехол-метил-трансферазой, другая — реабсорбиру-
ется аксонной терминалью, а третья — вступает в контакт с белками
рецепторами постсинаптической
мембраны, участвуя в передаче
нервного импульса эффектору
(рис. 5.2).
На постсинаптических мембра-
4 \ МАО \ нах норадреналин связывается с
Рис. 5.2. Симпатический синапс и
его регуляция.
1 — варикоза симпатической терминали,
2 — синаптическая везикула, 3 — синапти-
ческая щель, 4 — постсинаптическая
мембрана, 5 — рядом расположенный холинер-
гический синапс. АХ — ацетилхолин, НА —
норадреналин, МАО — моноаминоксидаза,
КОМТ — катехол-О-метилтрансфераза
(разрушающие норадреналин ферменты),
вторичные посредники а-рецепторов: ФЛ-ИФ3
(фосфолипаза-С—инозитол-3-фосфат);
вторичные посредники р-адренорецепторов:
АЦ-цАМФ
(аденилатциклаза—циклический аденозинмонофосфат), а,, а2, р — ад-
ренорецепторы, (+) — стимуляция, (—) —
подавление освобождения медиатора.
5. Вегетативная нервная система • 253
альфа- и р-адренорецепторами, с образованием медиатор-рецепторных
комплексов.
а-Рецепторный комплекс активирует метаболизм мембраны клеток, что
приводит к появлению внутриклеточных вторичных посредников медиа-
торного эффекта, которыми являются инозитол-3-фосфат и
ионизированный кальций. Под их воздействием повышается проницаемость для ионов
постсинаптической мембраны и происходит ее локальная
деполяризация — возбуждающий постсинаптический потенциал (ВПСП).
а,-Адренорецепторы — находятся в гладких мышцах органов. Их
возбуждение приводит к сужению сосудов, расслаблению кишечника,
расширению зрачка и сокращению миометрия.
а2-Адренорецепторы расположены на пресинаптической мембране вари-
коз, их возбуждение приводит к уменьшению дальнейшего выделения
медиатора.
Стимуляция (3-адренорецепторов активирует другую систему вторичных
посредников. Действие катехоламинов на (З-адренорецепторы увеличивает
активность фермента аденилатциклазы с образованием из АТФ
циклического 3',5'-аденозинмонофосфата (цАМФ). Последний активирует проте-
инкиназу, что в свою очередь приводит к росту концентрации фосфопро-
теидов в мембране с последующим увеличением ее проницаемости.
РгАдренорецепторы находятся в сердечной мышце (их возбуждение
увеличивает силу и частоту сердечных сокращений) и в жировой ткани
(увеличение липолиза жира и калоригенеза).
Р2-Адренорецепторы имеются в гладких мышцах артериальных сосудов,
особенно скелетных мышц, коронарных артерий, бронхов, матки,
мочевого пузыря. Их стимуляция вызывает тормозной эффект в виде
расслабления гладких мышц.
В вегетативных синапсах выделившиеся в ответ на нервные импульсы
медиаторы активируют рецепторы не только постсинаптической, но и
пресинаптической мембраны, оказывая влияние на дальнейшее
высвобождение медиаторов из нервных окончаний. При действии норадреналина на
а-адренорецепторы выделение медиатора снижается, а на
(З-адренорецепторы — возрастает.
Поэтому при сильном возбуждении постганглионарных нейронов
значительное повышение концентрации норадреналина в синаптической
щели приводит к торможению выделения медиатора вследствие активации
пресинаптических ос-адренорецепторов {отрицательная обратная связь).
Напротив, при низкой концентрации норадреналина (в условиях слабого
возбуждения нейронов) выброс этого медиатора увеличивается в результате
возбуждения (3-адренорецепторов {положительная обратная связь).
В парасимпатических постганглионарных синапсах ацетилхолин
содержится в аксоплазме и синаптических пузырьках пресинаптических
окончаний в трех основных пулах или фондах. Это: 1) стабильный пул медиатора,
прочно связанный с белком и не готовый к освобождению; 2) мобилизиро-
ванный пул, менее прочно связанный с белком и пригодный к
освобождению; 3) готовый к освобождению спонтанно или активно выделяемый пул. В
пресинаптическом окончании постоянно происходит перемещение пулов и
пополнение активного пула путем продвижения синаптических пузырьков
по направлению к пресинаптической мембране, так как медиатор
активного пула содержится в тех пузырьках, которые непосредственно прилежат к
этой мембране.
В отсутствие импульсного возбуждения из пресинаптической терминали
спонтанно освобождаются единичные кванты медиатора. Но с приходом
254 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Рис. 5.3. Парасимпатический синапс и
его регуляция.
1 — пресинаптическое окончание, 2 — си-
наптическая везикула, 3 — синаптическая
щель, 4 — постсинаптическая мембрана эф-
фекторной клетки, 5 — рядом
расположенный адренергический синапс. НА — норад-
реналин, АХ — ацетилхолин, М — мускари-
новый холинорецептор, Н — никотиновый
холинорецептор, ХЭ — холинэстераза,
вторичные посредники: ГЦ-цГМФ (гуанилат-
циклаза — циклический гуанозинмонофос-
фат), (+) — стимуляция, (—) — подавление
освобождения медиатора.
импульсов, деполяризующих пре-
синаптическую мембрану,
спонтанное фоновое выделение
единичных квантов сменяется
активным выбросом групп квантов.
Процесс освобождения медиатора является кальцийзависимым. Вызванная
импульсом деполяризация пресинаптической мембраны открывает в ней
каналы, по которым ионы кальция входят внутрь окончания, обеспечивая
выделение медиатора в синаптическую щель.
Высвобождение ацетилхолина в синаптическую щель зависит от:
1) связывания ацетилхолина с холинорецепторами пресинаптической
мембраны, относящимися к М- (мускариночувтвительному) типу,
что оказывает тормозящее влияние на дальнейший выход
медиатора — отрицательная обратная связь (рис. 5.3);
2) взаимодействия ацетилхолина с Н-холинорецептором
пресинаптической мембраны, что усиливает освобождение ацетилхолина —
положительная обратная связь;
3) поступления в синаптическую щель парасимпатического синапса
норадреналина из рядом расположенного симпатического синапса,
что тормозит освобождение ацетилхолина;
4) выделения в синаптическую щель под влиянием ацетилхолина из
постсинаптической клетки большего числа молекул АТФ, которые
связываются с пуринергическими рецепторами пресинаптической
мембраны и подавляют освобождение медиатора — ретро-ингибиро-
вание.
Выделившийся в синаптическую щель ацетилхолин удаляется из нее
несколькими путями. Во-первых, часть медиатора связывается с
холинорецепторами пре- и постсинаптической мембраны; во-вторых, он
разрушается ацетилхолинэстеразой с образованием холина и уксусной кислоты,
которые подвергаются обратному захвату пресинаптической мембраной и
вновь используются для синтеза ацетилхолина; в-третьих, медиатор путем
диффузии выносится в межклеточное пространство и кровь, причем этот
процесс происходит после связывания медиатора с рецептором.
Последним путем инактивируется почти половина выделившегося ацетилхолина.
На постсинаптической мембране ацетилхолин связывается с М-холино-
рецепторами нескольких типов, что и определяет различия в характере
реакций органов на этот медиатор. По чувствительности к различным
фармакологическим препаратам выделяют М,—М4-холинорецепторы, которые
локализуются:
5. Вегетативная нервная система • 255
Mj-холинорецепторы — в вегетативных ганглиях и ЦНС;
М2-холинорецепторы — в сердце, в гладких мышцах
желудочно-кишечного тракта;
М3- холинорецепторы — в гладких мышцах, в большинстве экзокринных
желез.
М4-холинорецепторы изучены мало.
На постсинаптической мембране ацетилхолин образует с М-ходиноре-
цепторами медиатор-рецепторный комплекс, который активирует
натриевые каналы и возбуждает гладкомышечные и секреторные клетки
желудочно-кишечного тракта, клетки гладких мышц бронхов, мочевого пузыря и
мочеточника.
Возбуждение М-холинорецепторов вызывает: сужение бронхов,
увеличение слюноотделения и слезоотделения, увеличение моторики и секреции
соков в желудочно-кишечном тракте, а также сужение зрачка. Этому
способствует активация вторичных посредников — инозитол-3-фосфата и
ионизированного кальция.
В клетках проводящей системы сердца и гладких мышц сосудов
половых органов ацетилхолин активирует калиевые каналы и выходящий ток
калия, что приводит к гиперполяризации постсинаптических мембран. В
результате этого происходят торможение ритма сердца, снижение
проводимости и возбудимости в миокарде, расширение артерий половых органов.
Одновременно в клетках активируется система вторичных посредников —
цГМФ. М-холинорецепторы блокирует атропин, который тормозит
парасимпатическую стимуляцию сокращения гладких мышц и
парасимпатическое торможение деятельности сердца.
Как правило, передача возбуждения с симпатических нервов на эффек-
торные органы осуществляется медиаторами катехоламинового ряда.
Однако имеются и симпатические холинергические волокна, например, ин-
нервирующие сосуды скелетных мышц, потовые железы.
Освобождающийся в синаптических структурах этих волокон ацетилхолин расслабляет
гладкие мышцы сосудов, действуя через так называемый эндотелиальный
релаксирующий фактор (N0), а также вызывает секрецию потовых желез.
К медиаторам в вегетативной нервной системе относят также
серотонин. При этом различают три типа его рецепторов: D, М, Т.
D-серотонинергические рецепторы локализуются в гладких мышцах.
Действуя на эти рецепторы, серотонин вызывает сокращение гладких
мышц.
М-серотонинергические рецепторы расположены в основном в
вегетативных ганглиях. Влияя на эти рецепторы, серотонин облегчает синапти-
ческую передачу в ганглии за счет повышения возбудимости Н-холинерги-
ческих структур.
Т-серотонинергические рецепторы обнаружены в сердечной и легочной
рефлексогенных зонах.
Эффективность синаптической передачи нервных импульсов на
эффектор зависит от количества активных рецепторов на постсинаптической
мембране. Число мембранных рецепторов возрастает при интенсивной
работе синапса. Перерезка вегетативного нерва в эксперименте на животных
(прекращение выделения медиатора) увеличивает число мембранных
рецепторов, что повышает чувствительность денервированных структур к
медиатору (явление сенситизации).
В органах, имеющих двойную вегетативную иннервацию (табл. 5.1),
эффекты от изолированного раздражения парасимпатических или
симпатических нервов могут быть противоположными. Так, под влиянием парасим-
256 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
патических нервов замедляется ритм и уменьшается сила сокращений
сердца, тогда как симпатические нервы учащают ритм сердца и
увеличивают силу его сокращений. Вместе с тем взаимосвязь влияний
симпатической и парасимпатической иннервации в процессе регуляции функций
имеет сопряженный характер благодаря близкому расположению
симпатических и парасимпатических синапсов. Во-первых, медиатор одной
системы подавляет через рецепторы пресикаптической мембраны выделение
медиатора другой системы. Во-вторых, в постсинаптических структурах
взаимодействие медиаторов осуществляется за счет вторичных
посредников цАМФ, цГМФ и кальция. При этом, например, тормозной эффект
возбуждения парасимпатической иннервации в миокарде тем сильнее, чем
выше уровень симпатической активности (так называемый
акцентированный антагонизм).
Противоположный характер влияний симпатического и
парасимпатического отделов нервной системы проявляется еще и в том, что один из них
может иннервировать железу внутренней секреции, вызывающую
изменения состояния организма в одном направлении, а второй иннервирует
другую железу, которая изменяет состояние организма в противоположном
направлении. Так, симпатические нервы стимулируют мозговой слой
надпочечника и увеличивают секрецию адреналина, что приводит к
увеличению сахара в крови — гипергликемии, а парасимпатические блуждающие
нервы, иннервируя островки поджелудочной железы, увеличивают
продукцию инсулина, который вызывает снижение содержание сахара в крови —
гипогликемию.
Однако взаимодействие симпатической и парасимпатической систем
может осуществляться и по пути синергизма. Последний проявляется во
влиянии этих отделов вегетативной нервной системы на трофику тканей и
особенно при адаптивных реакциях, когда симпатическая нервная система
обеспечивает быструю «аварийную» мобилизацию энергетических ресурсов
и активирует функциональные ответы на раздражители, а
парасимпатическая — поддерживает гомеостазис, обеспечивая резервы для аварийной
регуляции, т. е. симпатические влияния обеспечивают эрготропную
регуляцию приспособления, а парасимпатические — трофотропную.
5.3.2. Энтеральная нервная система
Органы, обладающие собственным миогенным моторным ритмом (сердце,
желудок и кишечник, желчный пузырь и желчевыводящие протоки, матка,
мочевой пузырь и мочеточники), продолжают осуществлять свои
моторные функции и после перерезки подходящих к ним симпатических или
парасимпатических нервных волокон и даже после извлечения этих органов
из организма. Относительную функциональную автономию этих органов
обеспечивает энтеральная часть вегетативной нервной системы.
Энтеральная нервная система содержит вегетативные ганглии,
расположенные в стенках внутренних органов (интрамурально). Под ее контролем
находятся гладкие мышцы, всасывающий и секретирующий эпителий,
локальный кровоток, местные эндокринные элементы, иммунные структуры.
Ганглии энтеральной нервной системы по своей структурной
организации сходны с ЦНС. В этих ганглиях имеется большинство медиаторов
ЦНС: ацетилхолин, норадреналин, дофамин, гистамин, ГАМК, субстанция
Р, простагландины, гастроинтестинальные гормоны, пуриновые нугслео-
тиды.
Ганглии энтеральной нервной системы содержат весь набор структур,
5. Вегетативная нервная система • 257
которые характеризуют интегративную функцию нервной системы:
сенсорные элементы, промежуточные нейроны, моторные нейроны, а также
собственные нейрогенные водители ритма.
Нейроны ганглиев имеют синаптические контакты с волокнами
симпатического и парасимпатического отделов нервной системы. Действуя на
структуры энтеральной системы, эти волокна модулируют активность
желудочно-кишечного тракта. Тормозное влияние волокон симпатических
нервов на моторные функции кишечника, в частности, осуществляется
через аксосоматические и аксо-аксональные синапсы, образованные этими
волокнами внутри интрамуральных ганглиев на клетках и терминалях
постганглионарных парасимпатических нейронов.
Сенсорные элементы ганглия энтеральной нервной системы дают
информацию о состоянии стенки органа или химическом составе
содержимого его полости. Получая эту сенсорную информацию, связующие внутри-
ганглионарные интегративные цепи нейронов перерабатывают ее и
генерируют возбуждающий (или тормозный) поток импульсов к эффекторным
нейронам и далее к гладкой мускулатуре, железам, сосудам стенки органа.
Ганглии энтеральной нервной системы выполняют функции низших
центров интеграции висцеральных функций. Поэтому внутренние органы с
разрушенными (или выключенными с помощью ганглиоблокаторов)
ганглиями утрачивают способность к координации ритмической моторной
функции.
5.4. Рефлексы вегетативной нервной системы
Вегетативные рефлексы, возникающие при возбуждении рецепторов
внутренних органов, подразделяются на сегментарные, реализуемые спинным
мозгом и стволовыми структурами, и надсегментарные, которые
обеспечиваются высшими центрами вегетативной регуляции.
Передачу импульсов от интерорецепторов в головной мозг
осуществляют аксоны вставочных нейронов спинного мозга, на которые передается
возбуждение и от висцеральных (спинальных и интрамуральных) сигналы
и от соматических (кожных, мышечных) афферентов.
Совмещение афферентной импульсации, поступающей от рецепторов
внутренних органов и кожи, является основой для появления так
называемых отраженных болей. При некоторых процессах во внутренних органах
болевые ощущения как бы проецируются в участки наружных покровов.
Вместе с тем возбуждение от рецепторов внутренних органов в любом
сегменте спинного мозга передается не только на вегетативные, но и на
соматические эфферентные нейроны. Поэтому раздражение внутренних
органов может вызвать возникновение двигательных реакций (напряжение
скелетных мышц, вынужденные позы).
Поскольку рефлекторные процессы в вегетативной и соматической
нервной системе тесно связаны, в организме существуют сопряженные
рефлексы, когда рецептор и эффектор расположены в разных органах и
даже разных системах.
Такие рефлексы разделяют на висцеро-висцеральные, висцеросоматиче-
ские, соматовисцеральные, висцеросенсорные.
Висцеро-висцеральный рефлекс — раздражение рецепторов в одном
внутреннем органе приводит к изменению деятельности другого внутреннего
органа. Так, механическое раздражение брыжейки вызывает уменьшение
частоты сердечных сокращений (рефлекс Гольца); раздражение рецепторов
аортальной или каротидной зон влечет за собой изменение глубины и час-
9-6095
258 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
тоты дыхания, уровня артериального давления и частоты сокращений
сердца; надавливание на глазные яблоки вызывает снижение ритма сердца
(рефлекс Данини—Ашнера).
Висцеросоматический рефлекс — возбуждение рецепторов некоторых
внутренних органов способно изменить тонус скелетной мускулатуры.
Раздражение, например, рецепторов желудочно-кишечного тракта (в
частности — брюшины) вызывает сокращение мышц передней брюшной стенки.
Соматовисцеральный рефлекс — раздражение экстерорецепторов
приводит к изменению деятельности внутренних органов. Так, действие ряда
раздражителей (тепло, холод, некоторые физиотерапевтические
процедуры) на рецепторы кожи вызывает сосудистые реакции в органах грудной
или брюшной полости.
Висцеросенсорный рефлекс — раздражение рецепторов внутренних
органов приводит к изменениям чувствительности кожи. Зона повышенного
восприятия в этом случае ограничивается участком кожи, иннервируемым
сегментом, к которому поступают импульсы от раздражаемого внутреннего
органа. Эти зоны называют зонами Захарьина—Геда. При недостаточности
коронарного кровотока (приступ стенокардии) характерна иррадиация
болей в левое плечо, левую руку, левую половину шеи и головы, нижнюю
челюсть, межлопаточное пространство, а иногда в верхнюю часть живота.
Иррадиация болей в этом случае обусловлена повышенной
чувствительностью кожи к болевым ощущениям в зонах, которые иннервируются VII
шейным и I—V грудными сегментами спинного мозга. Раздражение желче-
выводящих путей вызывает повышенную чувствительность (гиперестезию)
кожи в области проекции желчного пузыря, в эпигастральной области, в
плечевой зоне, в точке лопаточного угла, в паравертебральных точках
справа от VIII до XI грудного позвонка, в точке диафрагмального нерва —
болезненность при надавливании между передними ножками правой гру-
дино-ключично-сосцевидной мышцы (положительный френикус-симптом,
симптом Мюсси—Георгиевского).
5.5. Высшие центры вегетативной регуляции
Группа центров головного мозга, расположенных в продолговатом мозге и
подбугорной области, осуществляет регуляцию гомеостазиса в условиях,
которые характеризуются некоторым постоянством, например в покое. В
стволе мозга располагаются сердечно-сосудистый и дыхательный центры,
центры глотания, слюноотделения, чиханья, рвоты.
Ретикулярная формация, способная осуществлять как активирующие,
так и тормозящие влияния на различные отделы центральной нервной
системы, регулирует уровень активности также и нервных центров
вегетативных функций организма. Специализированным образованием
ретикулярной формации является бульварный сосудодвигательный центр,
который поддерживает тонус и интегрирует деятельность сосудодвигательных
центров спинного мозга.
Главным центром поддержания постоянства внутренней среды
организма, является гипоталамус, в котором расположены центры регуляции
температуры тела и водного баланса, а также пищевого и полового поведения.
Более 40 пар ядер гипоталамуса через симпатический и
парасимпатический отделы вегетативной нервной системы обеспечивают регуляцию
большинства висцеральных функций. Возбуждение заднегипоталамических
ядер повышает системное артериальное давление, учащает ритм сердца,
увеличивает содержание сахара в крови. При возбуждении переднегипота-
5. Вегетативная нервная система • 259
ламических ядер происходит снижение артериального давления,
замедление ритма сердца, а также усиление перистальтики кишечника. Ядра
средней части гипоталамуса (латеральные и вентромедиальные) регулируют
аппетит и пищевое поведение. Раздражение ядер заднего и среднего
гипоталамуса способно вызывать агрессивное поведение и эмоции удовольствия.
Благодаря нервным и гуморальным связям с передней и задней долями
гипофиза, гипоталамус также участвует в регуляции эндокринных функций
и тем самым влияет практически на все виды обмена веществ.
Регулируя функции симпатической и парасимпатической нервной
системы и эндокринных желез, гипоталамус обеспечивает вегетативный
компонент всех реакций организма. В свою очередь функции гипоталамуса
контролируются высшими отделами центральной нервной системы —
подкорковыми ядрами и корой больших полушарий, с которыми гипоталамус
связан как прямыми нервными путями, так и через посредство
ретикулярной формации мозгового ствола.
На функции органов, иннервируемых вегетативной системой, влияет
также мозжечок. Последствия его удаления не ограничиваются только
расстройствами движений скелетных мышц, но охватывают и ряд
вегетативных функций. У животных с удаленным мозжечком обнаружены
различные нарушения функций внутренних органов: угнетение моторной
функции и секреции желез желудка и кишечника, изменения возбудимости со-
судодвигательного центра. После удаления мозжечка все основные
вегетативные функции сохраняются, но протекают менее совершенно
(например, механизмы терморегуляции, предохраняющие организм от
перегревания, включаются позже, чем у нормальных животных; уровень глюкозы в
крови оперированного животного в меньшей степени снижается после
введения инсулина).
В регуляции деятельности внутренних органов существенна роль
структур переднего мозга, входящих в состав так называемой лимбической
системы, или «висцерального мозга»: гиппокамп, поясная извилина,
миндалевидные ядра. Лимбическая система во многом определяет поддержание гомео-
стазиса в организме, оказывая регулирующее влияние на функции
органов, иннервируемых вегетативной нервной системой. Она также участвует
в организации мотиваций, эмоций и поведенческих реакций с
выраженными вегетативными компонентами.
Об участии коры больших полушарий головного мозга в регуляции
висцеральных функций свидетельствует выработка условных рефлексов с
рецепторов внутренних органов при изменении их деятельности. В
образовании таких условных рефлексов важная роль принадлежит передним
корковым отделам, в первую очередь области сигмовидной и коронарной
извилин. После удаления у животных в эксперименте этих участков коры
возникают нарушения условных рефлексов, выработанных с рецепторов
органов сердечно-сосудистой системы, желудочно-кишечного тракта, почек, а
также других висцеральных систем.
ГЛАВА 6
Эндокринная нервная система —
регулятор функций и процессов
в организме
Эндокринная система представляет собой функциональное
объединение специализированных для внутренней секреции клеток, тканей и
органов. Основной их функцией является синтез и секреция во внутреннюю
среду организма (инкреция) молекул гормонов. Таким образом,
эндокринная система осуществляет гормональную регуляцию процессов
жизнедеятельности. Эндокринной функцией обладают: 1) органы или железы
внутренней секреции, 2) эндокринная ткань в органе, функция которого не
сводится лишь к внутренней секреции, 3) клетки, обладающие наряду с
эндокринной и неэндокринными функциями. Эти три вида структур и
образуемые ими гормоны приведены в табл. 6.1.
6.1. Химическая природа и общие механизмы действия гормонов
Гормоны подразделяют по химической природе на три группы: 1)
производные аминокислот — тиреоидные гормоны, адреналин, гормоны
эпифиза; 2) пептидные гормоны, простые (протеины) и сложные (гликопротеи-
ды) белки — гипоталамические нейропептиды, гормоны гипофиза, остров-
кового аппарата поджелудочной железы, околощитовидных желез; 3)
стероидные гормоны, образующиеся из холестерина гормоны коры
надпочечников, половых желез, гормон почечного происхождения кальцитриол.
6.1.1. Механизмы действия пептидных, белковых гормонов
и катехоламинов
Молекулу гормона обычно называют первичным посредником регулятор-
ного эффекта, или лигандом. Молекулы большинства гормонов
связываются со специфическими для них рецепторами плазматических мембран
клеток мишеней, образуя лиганд-рецепторный комплекс. Для пептидных,
белковых гормонов и катехоламинов его образование является основным
начальным звеном механизма действия и приводит к активации мембранных
ферментов и образованию различных вторичных посредников
гормонального регуляторного эффекта, реализующих свое действие в цитоплазме,
органоидах и ядре клетки. Среди ферментов, активируемых лиганд-рецептор-
ным комплексом, описаны: аденилатциклаза, гуанилатциклаза, фосфолипа-
зы С, D и А2, тирозинкиназы, фосфаттирозинфосфатазы, фосфоинозитид-3-
ОН-киназа, серинтреонин-киназа, синтаза N0 и др. Вторичными
посредниками, образующимися под влиянием этих мембранных ферментов,
являются: 1) циклический аденозинмонофосфат (цАМФ); 2) циклический гуано-
зинмонофосфат (цГМФ); 3) инозитол-3-фосфат (ИФЗ); 4) диацилглицерол;
6. Эндокринная нервная система — регулятор функций и процессов в организме • 261
Таблица 6.1. Органы, ткани и клетки с эндокринной функцией
№
Органы
1.
2.
3.
4.
5.
ГИПОФИЗ
а) аденогипо-
физ
б) нейроги-
пофиз
Надпочечники
а) корковое
вещество
б) мозговое
вещество
Щитовидная
железа
Околощитовидные железы
Эпифиз
6.
7.
Поджелудочная
железа
Половые железы
а) семенники
б)яичники
8.
9.
10.
11.
12.
13.
Желудочно-кишечный тракт
Плацента
Тимус
Почка
Сердце
Кровеносные
сосуды
Ткань, клетки
Гормоны
1. Эндокринные железы
Кортикотрофы
Гонадотрофы
Тиреотрофы
Соматотрофы
Лактотрофы
Питуициты
Клубочковая зона
Пучковая зона
Сетчатая зона
Хромаффинные клетки
Фолликулярные тиреоциты
К-клетки
Главные клетки
К-клетки
Пинеоциты
Кортикотропин
Меланотропин
Фоллитропин
Лютропин
Тиреотропин
Соматотропин
Пролактин
Вазопрессин
Окситоцин
Эндорфины
Минералокортикоиды
Глюкокортикоиды
Половые стероиды
Адреналин (Норадреналин)
Адреномедуллин
Трийодтиронин
Тетрайодтиронин
Кальцитонин
Паратирин
Кальцитонин
Мелатонин
2. Органы с эндокринной тканью
Островки Лангерганса
альфа-клетки
бета-клетки
дельта-клетки
Клетки Лейдига
Клетки Сертолли
Клетки гранулезы
Желтое тело
Глюкагон
Инсулин
Соматостатин
Тестостерон
Эстерогены
Ингибин
Эстрадиол
Эстрон
Прогестерон
Прогестерон
3. Органы с инкреторной функцией клеток
Эндокринные и энтерохром-
аффинные клетки желудка и
тонкого кишечника
Синцитиотрофобласт
Цитотрофобласт
Тимоциты
ЮГА
Перитубуляерные клетки
Канальцы
Миоциты предсердий
Эндотелиоциты
Регуляторные пептиды
Хорионический гонадотропин
Пролактин
Эстриол
Прогестерон
Тимозин, Тимопоэтин, Тимулин
Ренин
Эритропоэтин
Кальцитриол
Атриопептид
Соматостатин
Ангиотензин-И
Эндотелины
N0
Гиперполяризующий фактор
Простагландины
Регуляторы адгезии
262 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
5) олиго (А) (2,5-олигоизоаденилат); 6) Са2+ {ионизированный кальций);
7) фосфатидная кислота; 8) циклическая аденозиндифосфатрибоза; 9) N0
(оксид азота). Многие гормоны, образуя лиганд-рецепторные комплексы,
вызывают активацию одновременно нескольких мембранных ферментов и,
соответственно, вторичных посредников.
Значительная часть гормонов и биологически активных веществ
взаимодействуют с семейством рецепторов, связанных с G-белками
плазматической мембраны (андреналин, норадреналин, аденозин, ангиотензин,
эндотелии и др.).
6.1.1.1. Основные системы вторичных посредников
1. Система аденилатциклаза—цАМФ (рис. 6.1). Мембранный фермент
аденилатциклаза может находиться в двух формах — активированной и
неактивированной. Активация аденилатциклазы происходит под влиянием
гормон-рецепторного комплекса, образование которого приводит к
связыванию гуанилового нуклеотида (ГТФ) с особым регуляторным
стимулирующим белком (GS-белок), после чего GS-белок вызывает присоединение
Mg к аденилатциклазе и ее активацию. Так действуют активирующие аде-
нилатциклазу гормоны — глюкагон, тиротропин, паратирин, вазопрессин
(через V-2-рецепторы), гонадотропин и др. Ряд гормонов, напротив,
подавляет аденилатциклазу — соматостатин, ангиотензин-II и др. Гормон-ре-
цепторные комплексы этих гормонов взаимодействуют в мембране клетки
с другим регуляторным ингибирующим белком (GI-белок), который
вызывает гидролиз гуанозинтрифосфата (ГТФ) до гуанозиндифосфата (ГДФ) и,
соответственно, подавление активности аденилатциклазы. Адреналин через
р-адренорецепторы активирует аденилатциклазу, а через а,-адренорецепто-
ры ее подавляет, что во многом и определяет различия эффектов
стимуляции разных типов рецепторов.
Под влиянием аденилатциклазы из АТФ синтезируется цАМФ,
вызывающий активацию двух типов протеинкиназ в цитоплазме клетки,
ведущих к фосфорилированию многочисленных внутриклеточных белков. Это
повышает или снижает проницаемость мембран, активность и количество
ферментов, т. е. вызывает типичные для гормона метаболические и,
соответственно, функциональные сдвиги жизнедеятельности клетки.
В табл. 6.2 приведены основные эффекты активации цАМФ-зависимых
протеинкиназ.
Кроме активации протеинкиназ внутриклеточные эффекты цАМФ
реализуются также через другие механизмы: систему кальций—кальмодулин,
трансметилазную систему, аденозин-5-монофосфат — аденозин, тирозин-
киназы. О роли системы кальций—кальмодулин сказано ниже.
Таблица 6.2. Некоторые эффекты фосфорилирования белков клетки цАМФ-зависимой
протеинкиназой
Виды белков
Компоненты мембран
Ферменты, лимитирующие скорость
метаболического процесса
Белки рибосом
Ядерные белки
Белки микротрубочек
Эффекты фосфорилирования
Изменения проницаемости
Активация или подавление
Активирование или подавление трансляции
Активация или подавление транскрипции
Секреторный, двигательный эффекты или
изменение конфигурации клетки
6. Эндокринная нервная система — регулятор функций и процессов в организме • 263
Гормон
Гормон
Рецептор
Рецептор
GS-белок
ГТФ
Gl-белок
Мд
ГТФ—ГДФ
Активация аденилатциклазы
АТФ + Н,0
Подавление аденилатциклазы
Фосфодиэстераза
цАМФ
Активация
протеинкиназ
Кальций—
кальмодулин
Активация
трансметилаз
Фосфорилирование
белков
Аденози н-5-монофосфат
Аденозин
Метелирование соединений
Подавление метилирования
Метаболизм и функции клетки
Рис. 6.1. Опосредование гормонального сигнала системой аденилатциклаза—
цАМФ.
Образование гормон-рецепторного комплекса приводит к связыванию гуанилового нуклеоти-
да (ГТФ) с регуляторным стимулирующим белком (GS-белок), последний вызывает
присоединение Mg к аденилатциклазе и ее активацию (слева вверху). Так действуют активирующие
аденилатциклазу гормоны — глюкагон, тиротропин, паратирин и др. Гормон-рецепторные
комплексы соматостатина, ангиотензина-И и других подавляющих аденилатциклазу гормонов
взаимодействуют в мембране клетки с другим регуляторным ингибирующим белком (GI-бе-
лок), который вызывает гидролиз ГТФ до ГДФ и, соответственно, подавление активности
аденилатциклазы (вверху справа). Под влиянием аденилатциклазы из АТФ синтезируется цАМФ,
вызывающий активацию протеинкиназ в цитоплазме клетки и фосфорилирование
многочисленных внутриклеточных белков. Это меняет проницаемость мембран, активность и
количество ферментов, т. е. вызывает типичные для гормона метаболические и, соответственно,
функциональные сдвиги. Внутриклеточные эффекты цАМФ реализуются также через другие
механизмы: систему кальций-кальмодулин, трансметилазную систему, аденозин-5-монофосфат —
аденозин, тирозинкиназы.
264 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Трансметилазная система обеспечивает метилирование ДНК, всех типов
РНК, белков хроматина и мембран, ряда гормонов на уровне тканей, фос-
фолипидов мембран. Это способствует реализации многих гормональных
влияний на процессы пролиферации, дифференцировки, состояние
проницаемости мембран и свойства их ионных каналов и, что важно
подчеркнуть особо, влияет на доступность мембранных рецепторных белков
молекулам гормонов.
Прекращение гормонального эффекта, реализуемого через систему аде-
нилатциклаза—цАМФ, осуществляется с помощью специального фермента
фосфодиэстеразы цАМФ, вызывающей гидролиз этого вторичного
посредника с образованием аденозин-5-монофосфата. Однако этот продукт
гидролиза превращается в клетке в аденозин, также обладающий эффектами
вторичного посредника, так как подавляет в клетке процессы
метилирования.
2. Система гуанилатциклаза-цГМФ. Активация мембранной гуанилат-
циклазы происходит не под непосредственным влиянием гормон-рецеп-
торного комплекса, а опосредованно через ионизированный кальций и ок-
сидантные системы мембран. Определяющая эффекты ацетилхолина
стимуляция активности гуанилатциклазы также осуществляется
опосредованно через Са2+. Через активацию гуанилатциклазы реализует эффект и на-
трийуретический гормон предсердий — атриопептид. Путем активации пе-
рекисного окисления стимулирует гуанилатциклазу гормон эндотелия
сосудистой стенки оксид азота — расслабляющий эндотелиальный фактор.
Под влиянием гуанилатциклазы из ГТФ синтезируется цГМФ,
активирующий цГМФ-зависимые протеинкиназы, которые уменьшают скорость
фосфорилирования легких цепей миозина в гладких мышцах стенок сосудов,
приводя к их расслаблению. В большинстве тканей биохимические и
физиологические эффекты цАМФ и цГМФ противоположны. Примерами
могут служить стимуляция сокращений сердца под влиянием цАМФ и
торможение их цГМФ, стимуляция сокращения гладких мышц кишечника
цГМФ и подавление цАМФ. цГМФ обеспечивает гиперполяризацию
рецепторов сетчатки глаза под влиянием фотонов света. Ферментативный
гидролиз цГМФ, а следовательно, и прекращение гормонального эффекта,
осуществляется с помощью специфической фосфодиэстеразы.
3. Система фосфолипаза С — инозитол-3-фосфат (рис. 6.2). Гормонре-
цепторный комплекс с участием регуляторного G-белка ведет к активации
мембранного фермента фосфолипазы С, вызывающей гидролиз фосфоли-
пидов мембраны с образованием двух вторичных посредников: инозитол-
3-фосфата и диацилглицерола. Инозитол-3-фосфат вызывает выход Са2+ из
внутриклеточных депо, в основном из эндоплазматического ретикулума,
ионизированный кальций связывается со специализированным белком
кальмодулином, что обеспечивает активацию протеинкиназ и фосфорили-
рование внутриклеточных структурных белков и ферментов. В свою
очередь диацилглицерол способствует резкому повышению сродства
протеинкиназы С к ионизированному кальцию, последний без участия кальмоду-
лина ее активирует, что также завершается процессами фосфорилирования
белков. Диацилглицерол одновременно реализует и другой путь
опосредования гормонального эффекта за счет активирования фосфолипазы А-2.
Под влиянием последней из мембранных фосфолипидов образуется арахи-
доновая кислота, являющаяся источником мощных по метаболическим и
физиологическим эффектам веществ — простагландинов и лейкотриенов. В
разных клетках организма превалирует один или другой путь образования
вторичных посредников, что в конечном счете и определяет физиологиче-
6. Эндокринная нервная система — регулятор функций и процессов в организме • 265
1
'
Диацилглицерог
"
г
Гормон
Рецептор
G-белок
'
)
Фосфолипаза-С
'
Фосфолипиды мембраны
1
Протеинкиназа-С
Фосфолипаза А-:
Арахидоновая
кислота
'
Простаноиды
?
"
_
Инозитол-3-фосфат
"
- Мобилизация Са
"
Кальмодулин + Са
"
К-зависимость протеинкиназа
'
г
jutfi
^н
Рис. 6.2. Опосредование гормонального сигнала системой фосфолипаза С—инози-
тол-3-фосфат.
Образование гормон-рецепторного комплекса при участии регуляторного G-белка активирует
мембранную фосфолипазу С, вызывающую гидролиз фосфолипидов мембраны с
образованием двух вторичных посредников: инозитол-3-фосфата и диацилглицерола. Инозитол-3-фосфат
ведет к выходу Са2+ из внутриклеточных депо. Связывание ионизированного кальция со
специализированным белком кальмодулином активирует протеинкиназы и вызывает фосфорили-
рование внутриклеточных структурных белков и ферментов. Диацилглицерол повышает
сродство протеинкиназы С к Са2+, способствуя ее активации, что также завершается процессами
фосфорилирования белков. Диацилглицерол одновременно реализует другой путь
опосредования гормонального эффекта, активируя фосфолипазу А-2 и образование простаноидов.
ский эффект гормона. Через рассмотренную систему вторичных
посредников реализуются эффекты адреналина (при связи с альфа-адренорецепто-
ром), вазопрессина (при связи с V-1-рецептором), ангиотензина-И, сома-
тостатина, окситоцина.
4. Система кальций—кальмодулин. Ионизированный кальций поступает
в клетку после образования гормон-рецепторного комплекса либо из
внеклеточной среды за счет активирования медленных кальциевых каналов
мембраны (как это происходит, например, в миокарде), либо из
внутриклеточных депо под влиянием инозитол-3-фосфата. В цитоплазме
немышечных клеток кальций связывается со специальным белком-кальмодули-
ном, а в мышечных клетках роль кальмодулина выполняет тропонин С.
Связанный с кальцием кальмодулин изменяет свою пространственную ор-
266 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
ганизацию и активирует многочисленные протеинкиназы,
обеспечивающие фосфорилирование, а следовательно изменение структуры и свойств
белков. Кроме того комплекс кальций—кальмодулин активирует фосфо-
диэстеразу цАМФ, что подавляет эффект циклического соединения как
вторичного посредника. Вызываемое гормональным стимулом
кратковременное увеличение в клетке кальция и его связывание с кальмодулином
является пусковым стимулом для многочисленных физиологических
процессов — сокращения мышц, секреции гормонов и выделения медиаторов,
синтеза ДНК, изменения подвижности клеток, транспорта веществ через
мембраны, изменения активности ферментов.
6.1.1.2. Взаимосвязи вторичных посредников
В клетках организма присутствуют или могут образовываться
одновременно несколько вторичных посредников. В связи с этим между вторичными
посредниками устанавливаются различные взаимоотношения: 1)
равнозначное участие, когда разные посредники необходимы для полноценного
гормонального эффекта; 2) один из посредников является основным, а
другой лишь способствует реализации эффектов первого; 3) посредники
действуют последовательно (например, инозитол-3-фосфат обеспечивает
освобождение кальция, диацилглицерол облегчает взаимодействие кальция
с протеинкиназой С); 4) посредники дублируют друг друга для
обеспечения избыточности с целью надежности регуляции; 5) посредники являются
антагонистами, т. е. один из них включает реакцию, а другой — тормозит
(например, в гладких мышцах сосудов инозитол-3-фосфат и кальций
реализуют их сокращение, а цАМФ — расслабление).
6.1.2. Механизм действия стероидных гормонов
Стероидные гормоны (рис. 6.3) обладают двумя путями действия на
клетки: 1) классическим геномным или медленным и 2) быстрым негеномным.
6.1.2.1. Геномный механизм действия
Геномный механизм действия на клетки-мишени начинается
трансмембранным переносом молекул стероидных гормонов в клетку (благодаря их
растворимости в липидном бислое клеточной мембраны), с последующим
связыванием гормона с цитоплазменным белком-рецептором. Эта связь с
рецепторным белком необходима для поступления стероидного гормона в
ядро, где происходит его взаимодействие с ядерным рецептором.
Последующее взаимодействие комплекса гормон—ядерный рецептор с хромати-
новым акцептором, специфическим кислым белком и ДНК влечет за
собой: активацию транскрипции специфических мРНК, синтез
транспортных и рибосомных РНК, процессинг первичных РНК-транскриптов и
транспорт мРНК в цитоплазму, трансляцию мРНК при достаточном
уровне транспортных РНК с синтезом белков и ферментов в рибосомах. Все
эти явления требуют длительного (часы, сутки) присутствия гормон-рецеп-
торного комплекса в ядре.
6.1.2.2. Негеномный механизм действия
Эффекты стероидных гормонов проявляются не только спустя несколько
часов, что требуется для ядерного влияния, часть из них проявляется очень
6. Эндокринная нервная система
— регулятор функций и процессов в организме • 267
быстро, в течение нескольких минут. Это такие эффекты, как повышение
проницаемости мембран, усиление транспорта глюкозы и аминокислот,
освобождение лизосомальных ферментов, сдвиги энергетики митохондрий.
К числу быстрых негеномных эффектов стероидных гормонов относятся,
например, увеличение в течение 5 мин после введения человеку альдосте-
рона общего периферического сосудистого сопротивления и артериального
давления, изменение транспорта натрия через мембрану эритроцитов
(вообще лишенных ядра) под влиянием альдостерона в опытах in vitro,
быстрый вход Са2+ в клетки эндометрия под влиянием эстрогенов и др.
Механизм негеномного действия стероидных гормонов заключается в
связывании на плазматической мембране клетки со специфическими рецепторами
и активации каскадных реакций систем вторичных посредников, например
фосфолипазы С, инозитол-3-фосфата, ионизированного Са2+, протеинки-
назы С. Под влиянием стероидных гормонов в клетке может увеличиваться
содержание цАМФ и цГМФ. Негеномный эффект стероидных гормонов
Молекула стероидного гормона
Мембранный
рецептор
Клеточная мембрана
Рис. 6.3. Схема путей действия стероидных гормонов.
1 — классический геномный путь действия (гормон проникает через клеточную мембрану и
цитоплазму в ядро, где после взаимодействия с ядерным рецептором воздействует на
гены-мишени, активируя их). 2а и 26 — негеномные пути действия через мембранные рецепторы: 2а —
пути, связанные с мембранным ферментом и образованием вторичного посредника, ведущего
к активации протеинкиназ. Последние через фосфорилирование в ядре белка-коактиватора
(БКА) активируют гены-мишени; 26 — пути, связанные с ионными каналами клеточной
мембраны, в результате чего гормон-рецепторный комплекс активирует ионные каналы, меняя
возбудимость клетки. 3 — альтернативный негеномный путь действия (молекула гормона,
проникая через мембрану в цитоплазму, взаимодействует с цитозольным рецептором, что
приводит к активации цитозольных киназ.
268 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
может быть реализован и после их связывания с цитоплазматическими
рецепторами. Часть негеномных эффектов стероидных гормонов
осуществляется благодаря их взаимодействию с рецепторами, связанными с
воротным механизмом ионных каналов мембран нервных клеток, являясь тем
самым модуляторами, например, глицин-, серотонин- или гамма-аминобу-
тиратергических нейронов. Наконец, растворяясь в липидном бислое
мембраны, стероидные гормоны могут менять физические свойства мембраны,
такие как ее текучесть или проницаемость для гидрофильных молекул, что
также является негеномным эффектом.
Таким образом, механизмы действия гормонов разной химической
структуры имеют не только различия, но и общие черты. Как и стероиды,
пептидные гормоны обладают способностью избирательно влиять на
транскрипцию генов в ядре клетки. Этот эффект пептидных гормонов
может быть реализован не только с поверхности клетки при образовании
вторичных посредников, но и путем поступления пептидных гормонов внутрь
клетки за счет интернетизации гормон-рецепторного комплекса.
6.1.3. Саморегуляция чувствительности эффектора
к гормональному сигналу
Изменение характера и интенсивности регуляторных сигналов,
поступающих к клетке, ведет к адаптивной перестройке ее рецепторных структур за
счет специальных механизмов саморегуляции, изменяющих
чувствительность клетки к этому сигналу. Так, при избыточности внеклеточного
гуморального сигнала формируется десенситизация соответствующего
рецептора, т. е. уменьшение его чувствительности к гуморальному регулятору из-за
ослабления сродства рецептора к молекуле лиганда или числа рецепторных
молекул. Механизм десенситизации рецепторов, реализующих регулятор-
ный эффект через системы вторичных посредников, представлен на
рис. 6.4. При наличии во внеклеточной среде избыточного гуморального
сигнала и/или увеличении времени связывания лиганда с рецептором
активируемая лиганд-рецепторным взаимодействием протеинкиназа
плазматической мембраны фосфорилирует рецептор, в результате его аффинность
к лиганду уменьшается в 2—5 раз, что предотвращает чрезмерность регуля-
торного эффекта. Если этого снижения чувствительности рецептора
недостаточно, рецептор фосфорилируется другой протеинкиназой,
активируемой соответствующим вторичным посредником. Следствием такого фос-
форилирования является нарушение сопряжения рецепторов с G-белками
и нарушение эффектов G-белков (активирующих или ингибирующих) на
системы вторичных посредников и ионные каналы. Наконец, в случаях
недостаточной эффективности двух указанных механизмов десенситизации
гормон-рецепторные комплексы интернализуются внутрь клетки с
образованием рецепторосомы (вакуоль с рецептором). В последующем, если
уровень гуморального регулятора во внеклеточной микросреде снизится в
течение 2—3 ч, интернализированный рецептор может вновь встроиться в
мембрану, а если повышенная концентрация регулятора сохраняется —
рецепторосомы сливаются с лизосомами и рецепторы разрушаются.
Десенситизация рецепторов может быть гомологической, проявляющейся в
снижении чувствительности только к тому гуморальному регулятору, избыток
которого ее вызвал, и гетерологической, заключающейся в снижении
чувствительности и к другим гуморальным факторам регуляции, но также
реализующим эффект через связанные с G-белком рецепторы и те же
вторичные посредники.
6. Эндокринная нервная система — регулятор функций и процессов в организме • 269
1
2
Рецептор мембраны
"
Лиганд-рецепторный
комплекс на мембране
(-)
'
Протеинкиназа мембраны
'
'
Фосфорилирование
рецептора мембраны
1
Н
Падение сродства
*— рецептора мембраны к
лиганду
_
ИЗбЫТОЧпиш d
1
3
"
-*■ Рецептор мембраны
Ч
'
Лиганд-рецепторный
комплекс на мембране
1
'
G-белок мембраны
1
Рецептор мембраны
,г
Лиганд-рецепторный
комплекс на мембране
'
Система вторичных
посредников
1'
Протеинкиназа клетки
"
Фосфорилирование
рецептора мембраны
'
Нарушение связи
и активами
посредник
и вторичных
ов
Н
"
Интернализация
1
'
Рецепторосома
1
'
Лизосома
"
Разрушение
(-)
Рис. 6.4. Схема трех путей десенситизации клетки к избыточному внешнему
регуляторному сигналу.
1. Снижение сродства рецептора к лиганду из-за фосфорилирования рецептора мембранной
протеинкиназой. 2. Нарушение связи молекулы рецептора с G-белком при фосфорилирова-
нии рецептора цитоплазматическими протеинкиназами. 3. Интернализация лиганд-рецептор-
ного комплекса и разрушение рецептора ферментами лизосом. Стрелками со знаком (—)
обозначено подавление процесса взаимодействия.
Чувствительность клеток к внешним регуляторным сигналам зависит
также и от числа так называемых свободных, или резервных, рецепторов,
т. е. доступных для лиганда. Увеличивая синтез этих мембранных структур
или их «всплывание» на поверхность мембраны, клетка способна
повышать чувствительность к регуляторному сигналу (сенситизация), например
в случаях недостаточного количества молекул гуморального регулятора во
внеклеточной микросреде. Повышение чувствительности к регуляторному
сигналу является также следствием возросшего сопряжения рецепторов с
G-белком и системой вторичных посредников.
Клетки организма, как правило, используют не один, а несколько путей
реализации одного гуморального регуляторного сигнала, в связи с чем для
каждого лиганда (например, молекул одного гормона) на мембранах
существуют несколько типов рецепторов. Так, для ацетилхолина, гистамина,
катехоламинов, опиоидных пептидов, серотонина, вазопрессина иденти-
270 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
фицировано два (вазопрессин), три (опиоиды), четыре (мускариновые для
ацетилхолина) и более (катехоламины, серотонин) мембранных
рецепторов. Соответственно, меняя за счет саморегуляции чувствительность
рецепторов одного типа, клетка изменяет характер функционирования и
способна компенсировать неадекватные сдвиги в регуляторных влияниях.
Одним из регуляторных эффектов, реализуемых внутри клетки с
помощью систем вторичных посредников мембранного лиганд-рецепторного
взаимодействия, является изменение функционального состояния генома
клетки и биосинтеза белка. Но и ядро клетки способно менять состояние
плазматической мембраны, ее чувствительность к сдвигам внеклеточной
среды, в том числе и изменению в ней количества и характера
регуляторных сигналов. В клетках под контролем генома происходит синтез
специальных белков — инверторов, оказывающих различное влияние на
функциональное состояние мембраны в зависимости от
адаптивно-компенсаторных потребностей клетки — изменение активности рецепторов,
состояния ионных каналов и насосов. Эти белки могут вести к
гиперполяризации клеточной мембраны, ослаблению функциональной активности
клетки, с одновременным повышением синтеза белка и процессов регенерации
внутриклеточных структур.
6.2. Регуляторные функции гормонов гипофиза
Гипофиз представляет собой эндокринный орган, объединяющий три
железы, соответстветствующие его отделам, или долям. Передняя доля
гипофиза получила название аденогипофиза. По морфологическим критериям это
железа эпителиального происхождения, содержащая несколько типов
эндокринных клеток, составляет 3Д общей массы гипофиза. Задняя доля
гипофиза, или нейрогипофиз, образуется в эмбриогенезе как выпячивание
вентрального гипоталамуса и имеет общее с ним нейроэктодермальное
происхождение. В нейрогипофизе локализованы веретенообразные
клетки — питуициты и аксоны гипоталамических нейронов. Третья, или
промежуточная, доля гипофиза, как и передняя, — эпителиального
происхождения, у человека практически отсутствует, но отчетливо выражена у
многих животных. У человека ее функцию выполняет небольшая группа
клеток передней части задней доли, эмбриологически и функционально
связанных с аденогипофизом.
Кровоснабжение аденогипофиза и нейрогипофиза. Передняя доля
гипофиза прямого артериального снабжения не получает, а кровь в нее поступает
из срединного возвышения через воротную систему гипофиза. Эта
особенность кровоснабжения играет основную роль в регуляции функций
передней доли, поскольку аксоны нейросекреторных клеток гипоталамуса в
области срединного возвышения образуют аксовазальные контакты и нейро-
секрет с регуляторными пептидами через воротные сосуды поступает в
аденогипофиз. Задняя доля гипофиза получает артериальную кровь из
нижней гипофизарной артерии. Наиболее интенсивный кровоток имеет
место в аденогипофизе, при этом его уровень (0,8 мл/г/мин) выше, чем в
большинстве других тканей организма.
Венозный отток из гипофиза осуществляется в пещеристый венозный
синус твердой мозговой оболочки (меньшая часть). Большая часть крови
оттекает ретроградно в срединное возвышение, что, благодаря транспорту
кровью гипофизарных гормонов, играет определяющую роль в реализации
механизмов обратной связи между гипофизом и гипоталамусом.
6. Эндокринная нервная система — регулятор функций и процессов в организме • 271
6.2.1. Гормоны аденогипофиза и их эффекты в организме
Структура передней доли гипофиза представлена 8 типами клеток, из
которых секреторная функция присуща хромафильным клеткам. Выделяют
5 типов хромафильных клеток: 1) ацидофильные красные клетки с
мелкими гранулами или соматотрофы — вырабатывают соматотропин (СТГ,
гормон роста); 2) ацидофильные желтые клетки с крупными гранулами или
лактотрофы — вырабатывают пролактин; 3) базофильные тиреотрофы —
вырабатывают тиреотропин (тиреотропный гормон — ТТГ); 4)
базофильные гонадотрофы — вырабатывают гонадотропины: фоллитропин (фоллику-
лостимулирующий гормон — ФСГ) и лютропин (лютеинизирующий
гормон — ЛГ); 5) базофильные кортикотрофы — вырабатывают
кортикотропин (адренокортикотропный гормон — АКТТ). Кроме того, так же как и в
клетках промежуточной доли, в базофильных кортикотрофах образуются
бета-эндорфин и меланотропин, поскольку все эти вещества происходят из
единой общей молекулы предшественника липотропинов.
Кортико-
либерин
Тирео-
либерин
Кортикотропин Тиреотропин
Кора
надпочечников
О
Глюкокортикоиды
Половые гормоны
Пролактостатин?
(дофамин)
i
I
I
Пролактин
Щитовидная
железа
/,
Т3иТ4
Половые железы
Ткани органов-мишеней
Андрогены
Эстрогены
Прогестерон
Рост тела Ткани органов-мишеней
Молочные
железы
Рис. 6.5. Основные гормоны аденогипофиза (кортикотропин, тиреотропин,
соматотропин, гонадотропины, пролактин), регуляция их секреции гипоталамическими
нейропептидами и основные эффекты.
Сплошные стрелки — стимуляция, пунктирные стрелки — подавление секреции.
272 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Таким образом в аденогипофизе синтезируются и секретируются пять
гормонов: кортикотропин, гонадотропины (фоллитропин и лютропин), ти-
реотропин, пролактин и соматотропин. Первые три из них обеспечивают
гипофизарную регуляцию периферических эндокринных желез (коры
надпочечников, половых желез и щитовидной железы), т. е. участвуют в
реализации гипофизарного пути управления. Для двух других гормонов (сома-
тотропина и пролактина) гипофиз является периферической эндокринной
железой, поскольку эти гормоны сами действуют на ткани-мишени
(рис. 6.5). Регуляция секреции аденогипофизарных гормонов
осуществляется с помощью гипоталамических нейропептидов (либеринов и статинов),
приносимых кровью воротной системы гипофиза.
6.2.1.1. Регуляция секреции и физиологические эффекты кортикотропина
Кортикотропин является продуктом расщепления крупного (239
аминокислот) гликопротеина проопиомеланокортина, образующегося базофильны-
ми кортикотрофами. Этот белок делится на две части, одна из которых
при расщеплении служит источником кортикотропина и меланотропина, а
вторая, называемая липотропином,— расщепляясь, дает, кроме
меланотропина, пептид эндорфин, обладающий морфиноподобным действием и
играющий важнейшую роль в антиноцицептивной (антиболевой) системе
мозга и в модуляции секреции гормонов аденогипофиза.
Секреция кортикотропина происходит пульсирующими вспышками с
четкой суточной ритмичностью. Наивысшая концентрация гормона в
крови отмечается в утренние часы (6—8 часов), а наиболее низкая — с 18 до 2
часов ночи. Механизм регуляции секреции представлен прямыми и
обратными связями. Прямые связи реализуются кортиколиберином гипоталамуса
и вазопрессином. Усиливают эффекты кортиколиберина адреналин и ан-
гиотензин-И, ацетилхолин, норадреналин, адреналин, серотонин, холеци-
стокинин, бомбезин, атриопептид, а ослабляют — опиоидные пептиды,
гамма-аминомасляная кислота. Глюкокортикоиды, циркулирующие в
крови (кортизол), в гипоталамусе тормозят секрецию кортиколиберина, а в
гипофизе — секрецию кортикотропина (обратная связь). Обратная связь
имеет отрицательную направленность и замыкается как на уровне
гипоталамуса (подавление секреции кортиколиберина), так и гипофиза
(торможение секреции кортикотропина). Продукция кортикотропина резко
возрастает при действии на организм стрессорных раздражителей, например
холода, боли, физической нагрузки, повышения температуры тела,
эмоций, а также под влиянием гипогликемии (снижение сахара в крови), при
этом суточная ритмика секреции изчезает.
Физиологические эффекты кортикотропина принято делить на надпо-
чечниковые и вненадпочечниковые. Надпочечниковое действие гормона
является основным и заключается в стимуляции (через системы аденилат-
циклаза—цАМФ и Са2+ с последующей активацией протеинкиназы А)
клеток пучковой зоны коры надпочечников, секретирующей
глюкокортикоиды (кортизол и кортикостерон). Значительно меньший эффект
кортикотропин оказывает на продукцию минералокортикоидов и половых
стероидов клетками клубочковой и пучковой зон коры надпочечников. Под
влиянием кортикотропина не только усиливается стероидогенез (синтез
гормонов) за счет повышения образования и активности ферментов, но и
синтез белков ткани за счет избирательной активации транскрипции
генов, что при избытке гормона вызывает гипертрофию и гиперплазию
ткани коры надпочечников. При этом происходит и перестройка структуры
6. Эндокринная нервная система — регулятор функций и процессов в организме • 273
Гипоталамус
Кортиколиберин
Вазопрессин
Аденогипофиз
Кора надпочечников
Кортикотропин
II
Кортизол
Рис. 6.6. Гипоталамо-аденогипофизарно-надпочечниковая ось регуляции.
Сплошные стрелки — стимуляция, пунктирные стрелки — отрицательная обратная связь.
Основным стимулятором секреции кортикотропина аденогипофизом является гипоталамический
нейропептид — кортиколиберин, слабый стимулирующий эффект на секрецию
кортикотропина оказывает вазопрессин. Кортикотропин стимулирует секрецию глюкортикоидов (кортизо-
ла) корой надпочечников. Содержание в крови кортизола по механизму отрицательной
обратной связи подавляет секрецию кортикотропина аденогипофизом и кортиколиберина
гипоталамусом.
коры, с преимущественным увеличением массы клеток пучковой зоны, в
ткани уменьшается содержание холестерина и аскорбиновой кислоты,
опосредующей синтез гормонов. Таким образом, кортикотропин является
основным звеном гипоталамо-аденогипофизарно-надпочечниковой регуля-
торной оси (рис. 6.6).
Вненадпочечниковое действие кортикотропина заключается в прямых
эффектах гормона: 1) липолитическом действии на жировую ткань, 2)
повышении секреции инсулина и соматотропина, 3) гипогликемии из-за
стимуляции секреции инсулина, 4) увеличении захвата аминокислот и глюкозы
мышечной тканью, 5) повышенном отложении меланина с
гиперпигментацией из-за родства молекулы гормона с меланотропином.
Избыток секреции кортикотропина сопровождается развитием гипер-
кортицизма с преимущественным увеличением секреции надпочечниками
кортизола и носит название болезни Иценко—Кушинга. Дефицит
кортикотропина ведет к недостаточности синтеза и секреции в кровь глюкокор-
тикоидов с выраженными метаболическими сдвигами и снижением
устойчивости организма к стрессорным влияниям среды.
6.2.1.2. Регуляция секреции и физиологические эффекты гонадотропинов
Секреция гонадотропинов из специфических гранул аденогипофизарных
клеток имеет четко выраженную суточную и месячную цикличность как у
мужчин, так и, особенно, у женщин. Молекулы гонадотропинов секрети-
руются с прикрепленными на конце углеводных цепей гликопротеида сиа-
ловыми кислотами, что защищает их от разрушения в печени. Фоллитро-
пин и лютропин образуются и секретируются одними и теми же клетками,
и активация их секреции обеспечивается единым гонадолиберином
гипоталамуса. Эффект последнего на секрецию фоллитропина и лютропина зави-
274 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
сит от циклических изменений содержания в крови половых гормонов —
эстрогенов, прогестерона и тестостерона (отрицательная обратная связь).
Секреция гонадолиберина стимулируется катехоламинами, а подавляется
эндогенными опиоидными пептидами, гастрином, холецистокинином и
соматостатином. Главный тормозной эффект на продукцию фоллитропина
оказывает по механизму обратной связи гормон семенников — ингибин.
Тормозят секрецию гонадотропинов гормон аденогипофиза пролактин и
мелатонин эпифиза; секрецию лютропина угнетают и глюкокортикоиды.
Основное действие на половые железы гонадотропины реализуют через
систему аденилатциклаза—цАМФ, причем они влияют не только на
образование и секрецию половых гормонов, но и на функции яичников и
семенников. Фоллитропин связывается с рецепторами клеток примордиаль-
ного фолликула в яичниках и клеток Сертоли в семенниках. Следствием
является рост фолликулов яичника и пролиферация клеток гранулезы у
женщин, рост яичек, пролиферация клеток Сертоли и сперматогенез у
мужчин. В продукции половых гормонов фоллитропин оказывает
вспомогательный эффект, готовя секреторные структуры к действию лютропина и
стимулируя ферменты биосинтеза половых стероидов. Лютропин вызывает
овуляцию и рост желтого тела в яичниках, стимулирует клетки Лейдига в
семенниках. Он является ключевым гормоном стимуляции образования и
секреции половых гормонов: эстрогенов и прогестерона в яичниках, анд-
рогенов в семенниках. Для оптимального развития гонад и секреции
половых гормонов необходимо синергичное действие фоллитропина и
лютропина, поэтому их часто объединяют единым названием гонадотропины.
Таким образом, гонадотропины гипофиза являются основным звеном ги-
поталамо-аденогипофизарно-гонадной регуляторной оси.
6.2.1.3. Регуляция секреции и физиологические эффекты тиреотропина
Тиреотропин — гликопротеидный гормон аденогипофиза — секретируется
непрерывно, с ритмичными колебаниями в течение суток, при этом
максимум содержания в крови приходится на вечерние часы. Секреция
тиреотропина стимулируется тиреолибержом гипоталамуса, а подавляется
соматостатином. По механизму отрицательной обратной связи повышение
содержания в крови гормонов щитовидной железы (трийодтиронина и тет-
райодтиронина), секрецию которых тиреотропин усиливает, ведет к
подавлению секреции тиреотропина. Замыкание обратной связи возможно и на
уровне гипоталамуса в виде подавления продукции тиреолиберина. Таким
образом, тиреотропин является ведущим звеном гипоталамо-аденогипофи-
зарно-тиреоидной регуляторной оси. Тормозят секрецию тиреотропина
дофамин, глюкокортикоиды и соматотропин, а стимулируют — вазопрессин
и антагонисты дофаминовых рецепторов. Тиреотропин секретируется в
повышенных количествах при действии на организм низкой температуры,
другие же воздействия — травма, боль, наркоз — секрецию гормона
подавляют.
Тиреотропин связывается со специфическим рецептором
фолликулярных клеток щитовидной железы и вызывает метаболические реакции с
помощью четырех вторичных посредников: цАМФ, инозитол-3-фосфата,
диацилглицерола и комплекса Са2+—кальмодулин. Под влиянием
тиреотропина в клетках фолликулов щитовидной железы меняются все виды
обмена веществ, ускоряется захват иода и осуществляется синтез тиреоглобу-
лина и тиреоидных гормонов. Тиреотропин увеличивает секрецию
гормонов щитовидной железы активацией гидролиза тиреоглобулина. Благодаря
6. Эндокринная нервная система — регулятор функций и процессов в организме • 275
увеличению синтеза пурина и пиримидина, РНК, белка и фосфолипидов
тиреотропин вызывает увеличение массы щитовидной железы.
Внетиреоидное действие тиреотропина проявляется повышением
образования гликозаминогликанов в коже и подкожной клетчатке, что ведет к
так называемому слизистому отеку, или микседеме. Это происходит,
например, при дефиците йода и недостаточной продукции гормонов
щитовидной железы, когда по механизму обратной связи возрастает секреция
тиреотропина.
Избыточная секреция тиреотропина приводит к развитию зоба,
гиперфункции щитовидной железы с эффектами избытка тиреоидных гормонов
(тиреотоксикоз), пучеглазию (экзофтальм), что в совокупности называют
«базедова болезнь».
6.2.1.4. Регуляция секреции и физиологические эффекты соматотропина
Соматотропин секретируется аденогипофизарными клетками непрерывно
и «вспышками» через 20—30 мин и 3—5 ч с отчетливой суточной
ритмикой — повышение секреции соматотропина происходит во время глубокого
сна, на ранних его стадиях (народная мудрость гласит: «человек растет,
когда спит»). Секреция соматотропина стимулируется гипоталамическим
нейропептидом соматолиберином, в механизме действия которого
основным вторичным посредником является Са2+. Подавляется секреция
соматотропина гипоталамическим соматостатином, приводящим к снижению
концентрации ионов кальция в соматотрофах аденогипофиза.
Увеличивается секреция гормона после мышечных нагрузок, под влиянием травм,
инфекций, голодания. Стимулируют продукцию соматотропина вазопрес-
син, глюкагон, эстрогены (увеличивая число рецепторов соматолиберина
на соматотрофах), дофамин, норадреналин, эндорфин и серотонин,
причем последний обеспечивает рост секреции гормона в начале глубокого
сна, а также изменения обмена веществ. Так, гипогликемия активирует
секрецию соматолиберина и соматотропина, а гипергликемия — тормозит;
избыток аминокислот и снижение свободных жирных кислот в крови
активируют их секрецию. Эти влияния реализуются через специальные ре-
цепторные нейроны гипоталамуса, воспринимающие сдвиги
биохимического состава крови и участвующие в регуляции обмена веществ. Угнетает
синтез и секрецию гормона повышение в крови содержания прогестерона
и свободных жирных кислот. Механизм отрицательной обратной связи в
саморегуляции уровня гормона в крови реализуется стимуляцией сомато-
тропином нейросекреции соматостатина.
Механизм действия соматотропина на клетки-эффекторы заключается в
его связывании с двумя молекулами мембранных рецепторов, активации
тирозинкиназы — протеинкиназы С, фосфорилировании и активации ци-
топлазматических белков. Гормон-рецепторный комплекс активирует и
мембранную фосфолипазу С, что ведет к образованию диацилглицерола,
мобилизации внутриклеточного кальция и активации протеинкиназы С.
Следствием является фосфорилирование и активация цитоплазматических
белков, стимулирование транскрипции генов и синтез новых белков.
Специфические рецепторы к гормону имеются на клетках жировой,
мышечной, хрящевой и лимфоидной ткани, клетках печени, поджелудочной
железы, кишечника, половых органов, мозга, легких, сердца и почек.
Соматотропин участвует в регуляции роста и развития организма.
Повышая синтез хрящевой ткани в эпифизарных отделах костей, гормон в
детском возрасте стимулирует рост тела в длину, а активирование пери-
276 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
остального роста увеличивает толщину и ширину костей. Возрастание
массы тканевых структур происходит в мышечной и соединительной ткани,
растет масса и внутренних органов. Основные эффекты соматотропина
связаны с его влияниями на обмен веществ, приводящими к: 1) усилению
липолиза и уменьшению массы жировой ткани; 2) повышению усвоения
аминокислот и синтеза белков, в результате чего масса тела возрастает за
счет нежировой ткани; 3) увеличению глюконеогенеза и повышению
уровня сахара в крови. Вместе с тем большинство ростовых эффектов гормона
опосредуется специальными гуморальными факторами (гормонами)
печени, почек и костной ткани, получившими название соматомедины
(рис. 6.7). Поскольку эффекты соматомединов на обмен веществ во
многом сходны с эффектами инсулина, а их структура имеет сходство с
молекулой проинсулина, их еще называют инсулиноподобные факторы роста
(ИФР). Химическая структура и основные эффекты установлены для двух
факторов (ИФР-1 и ИФР-2). ИФР-1 обладает большим, чем ИФР-2,
влиянием на рост, а также является основным фактором, реализующим
отрицательную обратную связь в виде угнетения секреции соматолиберина и
соматотропина, увеличения продукции соматостатина. Действие на
хрящевую ткань инсулиноподобных факторов проявляется в виде стимуляции
включения сульфата в синтезируемые протеогликаны, стимуляции
включения тимидина в образуемую ДНК, активации синтеза РНК и белка. Эти
эффекты выражены у ИФР-1 и ИФР-2 в 100 раз больше, чем у инсулина, а
влияние на обмен глюкозы у них в 50 раз слабее, чем у инсулина. В то же
время дифференцировка прехондроцитов, повышение транспорта
аминокислот через их клеточную мембрану обеспечиваются не соматомединами,
а самим соматотропином. Несмотря на то что соматомедины называют ин-
сулиноподобными факторами роста, рецепторы клеточной мембраны для
них отличаются от рецепторов инсулина. Рецепторы инсулиноподобных
факторов находятся не только в хрящевой ткани, но и в мышечной и
соединительной тканях, где эти регуляторы также стимулируют митогенез и
синтез белка.
При длительной и чрезмерной секреции соматотропина хотя и
сохраняется действие соматомединов на хрящевую ткань, но в целом эффекты
соматотропина приобретают четкие контринсулярные черты. Они
проявляются в изменениях углеводного и жирового обмена в тканях. Так, сомато-
тропин вызывает гипергликемию из-за распада гликогена в печени и
мышцах и угнетения утилизации глюкозы в тканях, благодаря повышению
секреции глюкагона островками Лангерганса поджелудочной железы. Сомато-
тропин увеличивает и секрецию инсулина островками Лангерганса, как за
счет прямого стимулирующего действия, так и благодаря гипергликемии.
Но в то же время соматотропин активирует инсулиназу печени — фермент,
разрушающий инсулин, и вызывает инсулинорезистентность тканей.
Подобное сочетание стимуляции секреции инсулина с его разрушением и
подавлением эффекта в тканях может вести к сахарному диабету, который по
происхождению называют гипофизарным. Как антагонист инсулина
соматотропин проявляет свои эффекты и в метаболизме липидов. Гормон
оказывает пермиссивное (облегчающее) действие по отношению к влияниям
катехоламинов и глюкокортикоидов, следствием чего являются
стимуляция липолиза жировой ткани, повышение уровня свободных жирных
кислот в крови, избыточное образование кетоновых тел в печени (кетоген-
ный эффект) и даже жировая инфильтрация печени.
Инсулинорезистентность тканей может быть связана и с этими сдвигами жирового обмена.
Избыточная секреция соматотропина и, соответственно, возросший под
6. Эндокринная нервная система — регулятор функций и процессов в организме • 277
Соматотропин
Усиление транспорта
аминокислот и ускорение
синтеза белка
Соматотропин
Рецептор соматотропина
Тирозинкиназа
Соматомедины
(ИПФ-1 и ИПФ-2)
Рис. 6.7. Механизм действия
соматотропина. Секретируемый аде-
ногипофизом соматотропин
оказывает эффект на рост,
стимулируя транспорт в клетку
аминокислот и синтез белка. Эффект
соматотропина опосредуется сомато-
мединами или инсулиноподобны-
ми факторами роста (ИПФ-1, в
большей степени, и ИПФ-2),
образуемыми в печени.
В нижнем квадрате показан
клеточный механизм действия гормона.
Связывание соматотропина с одной из
двух молекул специфического
мембранного рецептора вызывает
активацию ассоциированной с ней тирозин-
киназы, что ведет к фосфорилирова-
нию и активации митогенактивируе-
мой протеинкиназы (МАПК),
вызывающей транскрипцию генов и синтез
новых белков. Вторая молекула рецептора после связывания с соматотропином через G-белок
активирует мембранную фосфолипазу С, ускорение метаболизма фосфоинозитидов ведет к
образованию диацилглицерола, мобилизации внутриклеточного кальция, активации
протеинкиназы С. Последняя вызывает фосфорилирование белков, активацию ферментов и
метаболические эффекты, в том числе активирует транспорт аминокислот в клетку. Протеинкиназа С
также вызывает фосфорилирование и активацию МАПК и других индукторов транскрипции
генов, способствуя синтезу белка.
Фосфолипаза С
п *
Диацилглицерол
Протеинкиназа С
Фосфорилирование ~* i
МАПК\^ Фосфорилирование
белков
{
Метаболические
эффекты
Синтез новых белков
его влиянием уровень ИФР-1, возникающие в раннем детстве, ведут к
развитию гигантизма с пропорциональным развитием конечностей и
туловища. В юношеском и зрелом возрастах избыток гормона усиливает рост
эпифизарных участков костей скелета, зон с незавершенным
окостенением, что получило название акромегалия. Растут кисти и стопы, нос,
подбородок и т. д. Увеличиваются в размерах и внутренние органы, что
называют спланхомегалия. Появляются утолщение кожи, повышенная потливость,
ущемление нервов, резистентность к инсулину. При врожденном дефиците
соматотропина, особенно при нечувствительности тканей к нему (при
278 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
этом в организме имеет место низкий уровень ИФР-1 при высоком уровне
соматотропина), формируется карликовость, называемая «гипофизарный
нанизм». После выхода в 1726 г. романа Дж. Свифта «Путешествия
Гулливера» таких карликов стали называть лилипутами. Приобретенный
дефицит гормона в зрелом возрасте выраженного морфогенетического эффекта
не вызывает.
6.2.1.5. Регуляция секреции и физиологические эффекты пролактина
Синтез и секреция аденогипофизом пролактина в основном регулируется
гипоталамическим ингибитором дофамином (пролактостатин), а также
стимуляторами пролактолиберином и тиреолиберином (рис. 6.8). Образование
дофамина происходит в тубероинфундибулярных нейронах дугообразного
и перивентрикулярного ядер гипоталамуса. На лактотрофах аденогипофиза
выявлено 2 типа дофаминовых рецепторов: D, и D2 Первые стимулируют
аденилатциклазу, а вторые, напротив, ингибируют ее активность. Пролак-
толиберин образуется в нейронах переднего гипоталамуса и срединного та-
ламуса. Пролактолибериновой активностью обладают также окситоцин,
серотонин и вазоинтестинальный пептид. Секреция пролактина зависит и
от уровня в крови эстрогенов, глюкокортикоидов и тиреоидных гормонов,
изменяющих число рецепторов пролактолиберина и тиреолиберина на
Гипоталамус
Тиреолиберин
(пролактолиберин)
+
Рост молочных желез,
лактация
Инстинкт материнства г+
Иммунорегуляция
Послеродовое ожирение
Эритропоэз
Водно-солевой обмен
Рис. 6.8. Регуляция секреции и основные эффекты пролактина. Раздражение
рецепторов матки при беременности и сосков молочных желез при кормлении
(обозначены пунтиром) вызывает рефлекторное повышение секреции пролактина. Гипотала-
мическая регуляция секреции пролактина осуществляется стимуляцией
тиреолиберином (пролактолиберином), что обозначено знаком «+», и подавлением секреции
дофамином (обозначено знаком «-»). Внизу показаны основные эффекты
пролактина в организме.
6. Эндокринная нервная система — регулятор функций и процессов в организме • 279
лактотрофах. Повышается секреция пролактина при беременности,
кормлении грудью, во время сна, физической нагрузки, стресса.
Одним из органов-мишеней пролактина является молочная железа, где
гормон стимулирует развитие секреторной ткани, рост желез и лактацию,
оказывая свой эффект после связывания со специфическим рецептором и
образования вторичного посредника цАМФ. В молочных железах пролак-
тин влияет на процессы образования молока, а не на его выделение. При
этом гормон стимулирует синтез белка — лактальбумина, а также жиров и
углеводов молока. В регуляции роста и развития молочных желез синерги-
стами пролактина являются эстрогены, но при начавшейся лактации
эстрогены выступают в роли антагонистов пролактина. Эффект пролактина
на лактацию во многом опосредуется образованием в печени лактогенного
фактора.
Пролактин способствует поддержанию секреторной активности желтого
тела в яичниках и образованию прогестерона. Он является одним из
регуляторов водно-солевого обмена организма, уменьшая экскрецию воды и
электролитов, повышает в крови содержание альдостерона и вазопрессина,
стимулирует рост внутренних органов, эритропоэз, способствует
появлению инстинкта материнства (см. рис. 6.8). Помимо усиления синтеза
белка, пролактин увеличивает образование жира из углеводов, способствуя
послеродовому ожирению.
6.2.2. Гормоны нейрогипофиза и их эффекты в организме
В нейрогипофизе не образуются, а лишь накапливаются и секретируются в
кровь нейрогормоны супраоптического и паравентрикулярного ядер
гипоталамуса — вазопрвссин и окситоцш. Оба гормона находятся в гранулах в
связанном состоянии со специальными белками — нейрофизинами. В
процессе секреции содержимое гранул путем экзоцитоза поступает в кровь.
6.2.2.1. Регуляция секреции и физиологические эффекты вазопрессина
Секреция вазопрессина зависит от его синтеза в гипоталамических
нейронах и регулируется тремя типами стимулов: 1) сдвигами осмотического
давления и содержания натрия в крови, воспринимаемыми интероцепто-
рами сосудов и сердца (осмо-, натрио-, волюмо- и механорецепторы), а
также непосредственно гипоталамическими нейронами (центральные ос-
морецепторы); 2) активацией гипоталамических ядер при эмоциональном
и болевом стрессе, физической нагрузке, 3) гормонами плаценты и ангио-
тензином-П, как содержащимся в крови, так и образуемым в мозге.
В крови вазопрессин не связывается белками плазмы, но ассоциирован
с тромбоцитами, выполняющими по отношению к гормону транспортную
функцию.
Эффекты вазопрессина реализуются за счет связывания пептида в
тканях-мишенях с двумя типами мембранных рецепторов — V, и V2.
Стимуляция V]-рецепторов, локализованных на мембране эндотелиаль-
ных и гладкомышечных клеток стенки кровеносных сосудов, через
вторичные посредники инозитол-3-фосфат и кальций-кальмодулин вызывает
сужение сосудов, что соответствует названию «вазопрессин». Это влияние в
физиологических условиях выражено слабо из-за низких концентраций
гормона в крови, но играет существенную роль в изменениях
кровообращения при стрессе, шоке, артериальной гипертензии. Через У,-рецепторы
вазопрессин повышает чувствительность механорецепторов в каротидных
280 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Экзоцитоз ^Ч
Аквапорины-2 <Xj Рециркуляция^^
Г/
Микротубула^-^ Протеин киназаАN
р J7 ^*~-s. | У2-рецептор^^Вазопрессин
|цАМ
Экскреция
с мочой.
Эндоцитоз
^__Л2^ Син
) сО G-белок
АТФ"^ 1
Деградация
Рис. 6.9. Механизм действия вазопрессина на клетку эпителия собирательной
трубочки нефрона.
Связывание вазопрессина с У2-рецептором на базолатеральной мембране через мембранный
G-белок активирует аденилатциклазу (АЦ), что ведет к образованию вторичного
посредника — цАМФ. Последний через активацию протеинкиназы А вызывает фосфорилирование
молекул аквапоринов в агрефорах, их взаимодействие с белками микротубул и путем экзоцитоза
встраивание аквапоринов в апикальную мембрану. Протеинкиназа А путем активации генома
повышает синтез агрефор с аквапоринами. Аквапорины из апикальной мембраны путем эндо-
цитоза интернализуются и повергаются рециркуляции или деградации, особенно в
отсутствие вазопрессина, а также экскретируются с мочой.
синусах к изменениям артериального давления и этим способствует баро-
рефлекторной регуляции артериального давления.
Стимуляция У2-рецепторов базолатеральной мембраны клеток дисталь-
ных отделов почечных канальцев через вторичный посредник цАМФ
вызывает повышение проницаемости стенки канальцев для воды, ее реаб-
сорбцию и концентрирование мочи, что соответствует второму названию
вазопрессина — «антидиуретический гормон». Вазопрессин является
единственным гормоном, способным стимулировать канальцевую реабсорбцию
воды без задержки натрия. Эффект вазопрессина на транспорт воды связан
с особыми транспортными белками «аквапоринами». Только аквапорины
2-го типа являются вазопрессинозависимыми. При наличии в крови
гормона вазопрессина (рис. 6.9), он связывается на базолатеральной мембране
клеток эпителия почечного канальца с У2-рецептором, следствием чего
является активация аденилатциклазы, образование цАМФ, активация
протеинкиназы А. Последняя вызывает фосфорилирование молекул аквапори-
на-2 в цитоплазматических пузырьках (агрефорах), их транспорт с
помощью микротубулярных белков динеина, динактина и миозина-1 к
апикальной мембране, где специальные рецепторные молекулы (синтаксин-4,
рецепторы-мишени пузырьков и др.) обеспечивают встраивание молекул ак-
вапорина-2 в мембрану и формирование водных каналов. Протеинкиназа
А является также регулятором синтеза белка аквапорина 2 в ядре клеток
эпителия. Поступающая в клетки через водные каналы молекул аквапори-
на-2 вода по микротубулярной системе клеток перемещается к
базолатеральной мембране, где постоянно встроены вазопресин-независимые
белки аквапорины 3-го и 4-го типа. Через них вода выходит в интерстициаль-
ную жидкость по осмотическому градиенту (рис. 6.10). В отсутствие
вазопрессина молекулы аквапорина-2 подвергаются эндоцитозу (интернализа-
ция) в цитоплазму, где вновь способны к рециркуляции, т. е. новому цик-
6. Эндокринная нервная система — регулятор функций и процессов в организме • 281
Базолатеральная
мембрана
Апикальная
мембрана
АТФ
\
v цАМФ
Протеинкиназы -*"""
Фосфорилирование
Аквапорины-2
Н,0
Рис. 6.10. Схема механизма действия вазопрессина на транспорт воды через стенку
собирательной трубочки нефрона.
Взаимодействуя с У2-рецептором, вазопрессин обеспечивает как трансцеллюлярный транспорт
воды (из внутриканальцевой жидкости через водные каналы аквапоринов-2 апикальной
мембраны, микротубулярную систему клеток и через аквапорины-3 и -4 базолатеральной мемеб-
раны в интерстициальное перетубулярное пространство), так и парацеллюлярный транспорт
воды (через межклеточные плотные соединения)
лу активации, транспорта и встраивания в мембрану, или подвергаются
разрушению. Вазопрессин стимулирует всасывание воды и в железах
внешней секреции, в желчном пузыре.
Нейропептид вазопрессин поступает по аксонам экстрагипоталамиче-
ской системы в другие отделы мозга (лимбика, средний мозг) и участвует в
формировании жажды и питьевого поведения, механизмах
терморегуляции, в нейрохимических механизмах памяти, формировании
биологических ритмов и эмоционального поведения.
Вазопрессин стимулирует секрецию кортикотропина в аденогипофизе,
подавляет выделение лютропина при стрессе. Метаболические эффекты
вазопрессина заключаются в стимуляции гликогенолиза в печени,
стимуляции секреции инсулина, повышении синтеза в печени антигемофиличе-
ского глобулина А, продукции фактора Виллебрандта.
Недостаток вазопрессина проявляется резко повышенным выделением
мочи низкого удельного веса, что называют «несахарным диабетом», а
избыток гормона ведет к задержке воды в организме.
6.2,2.2. Регуляция секреции и физиологические эффекты окситоцина
Синтез окситоцина в гипоталамических нейронах и его секреция нейроги-
пофизом в кровь стимулируется рефлекторным путем при раздражении
рецепторов растяжения матки и механорецепторов сосков молочных желез.
282 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Усиливают секрецию гормона эстрогены. Болевой стресс резко повышает
секрецию окситоцина, а этиловый спирт ее угнетает. Возрастает секреция
окситоцина и при повышении осмотического давления внеклеточной
среды. Несмотря на то что мембранный рецептор окситоцина в
клетках-мишенях относится к той же группе, что и У2-рецептор вазопрессина,
связывание гормона со специфическим рецептором вызывает снижение в
клетках уровня цАМФ. Образование окситоцин-рецепторного комплекса
повышает в клетках содержание Са2+ (вторичный посредник) и активирует
ионные каналы мембраны, приводя к ее деполяризации.
Основные эффекты окситоцина состоят в стимуляции сокращения
матки при родах (чему способствуют высокие концентрации эстрогенов в
крови), сокращении гладких мышц протоков молочных желез, что вызывает
выделение молока, а также в регуляции водно-солевого обмена и
питьевого поведения. Окситоцин является одним из дополнительных факторов
регуляции секреции гормонов аденогипофиза, наряду с либеринами. В
структурах мозга окситоцин может выступать в роли медиатора или
модулятора синаптических процессов, участвовать в механизмах памяти,
стимулируя процессы забывания. Окситоцин активирует клеточный иммунитет,
оказывает инсулиноподобное действие на жировую ткань. Повышенные
количества окситоцина в крови могут вызывать снижение артериального
давления.
6.2.3. Гормоны промежуточной доли
Меланотропин у взрослого человека, в отличие от животных с обильным
волосяным покровом, практически не синтезируется. Функции этого
гормона, заключающиеся в синтезе меланина, его дисперсии в отростках ме-
ланоцитов кожи, увеличении свободного пигмента в эпидермисе и, в
конечном счете, повышении пигментации кожи и волос, выполняют у
человека кортикотропин и липотропин. Эти гормоны, как и меланотропин,
образуются из единого предшественника, в связи с чем при избыточной
секреции кортикотропина усиливается пигментация кожи. Этому
способствуют и близкие гормону пептиды плаценты. Меланотропин тем не
менее играет роль как мозговой пептид в нейрохимических процессах
памяти.
6.2.4. Эндогенные опиаты
Гипоталамо-гипофизарная система является основным местом синтеза и
секреции эндогенных опиатов — полипептидов эндогенного
происхождения, обладающих морфиноподобным аналгезирующим действием.
Выделяют четыре семейства эндогенных опиатов: эндорфины (а-, /3- и у-),
динорфины А и В, неоэндорфины аир, метионин- и лейцин-энкефалины. В аденоги-
пофизе образуются эндорфины, динорфины и неоэндорфины, тогда как
энкефалины синтезируются нейронными структурами разных отделов
мозга, прежде всего таламуса и гипоталамуса, и клетками слизистой оболочки
кишечника. Опиатные пептиды в центральной нервной системе
выполняют роль медиаторов и модуляторов синаптической передачи, обеспечивают
функцию противоболевой системы мозга. На мембранах клеток выявлены
специфические опиатные рецепторы трех основных типов: ц, 8 и к.
Морфин и бета-эндорфин взаимодействуют преимущественно с ц-рецептора-
ми, энкефалины — с 8-рецепторами, а динорфины — с к-рецепторами,
однако существует и перекрестное взаимодействие. Помимо подавления бо-
6. Эндокринная нервная система — регулятор функций и процессов в организме • 283
левых ощущений эндогенные опиаты участвуют в регуляции адаптивного
поведения и реакций организма на стресс, модулируют секрецию гормонов
адено- и нейрогипофиза (соматотропина, пролактина, гонадотропинов, ва-
зопрессина). Опиоидные пептиды регулируют процесс всасывания в
желудочно-кишечном тракте, угнетают секрецию панкреатического сока и
соляной кислоты в желудке. Опиоидные рецепторы выявлены на окончаниях
аксонов в мозговом слое надпочечников и симпатических ганглиях, где
опиоидные пептиды выполняют роль модуляторов синаптической
передачи.
6.3. Регуляторыые функции гормонов надпочечников
Надпочечники являются парной железой внутренней секреции,
морфологически и функционально состоящей из двух разных по эмбриональному
происхождению тканей — коркового и мозгового вещества. Кора
надпочечников — производное мезодермы, синтезирует три вида гормонов
стероидной природы, или кортикостероидов. Мозговое вещество называют также
хромаффинной тканью, которая имеет общее с нервной системой
происхождение и развивается из эмбриональных симпатических клеток. Кроме
надпочечника хромаффинная ткань, образующая катехоламины, имеется в
составе симпатического пограничного ствола, брюшном и солнечном
сплетении.
Кровоснабжение надпочечника осуществляется тремя группами артерий,
отходящих от диафрагмальной и почечной артерий и аорты, а также
нескольких добавочных артерий. Ветви этих сосудов образуют раздельные
корковые и мозговые артерии, дающие обильные капиллярные сети.
Венозный отток крови осуществляется по многочисленным венам в систему
нижней полой вены и бассейн воротной вены печени. Как в корковом, так
и в мозговом веществе имеется большое количество нервных волокон.
Особое значение имеют ветви чревного нерва, несущие пре- и постганг-
лионарные волокна к хромаффинным клеткам мозгового вещества и
обеспечивающие поступление к ним регуляторных стимулов.
6.3.1. Гормоны коры надпочечников и их эффекты в организме
Кора надпочечников, занимающая по объему 80 % всей железы, состоит
из трех клеточных зон: наружной клубочковой зоны, образующей минера-
локортикоиды, средней пучковой зоны, образующей глюкокортикоиды, и
внутренней сетчатой зоны, в небольшом количестве продуцирующей
половые стероиды. Все кортикостероиды образуются из холестерина крови и
синтезируемого в самих корковых клетках. При синтезе кортистероидов
образуется порядка 50 различных соединений, однако секретируются в
кровь в физиологических условиях лишь 7—9 из них.
6.3.1.1. Регуляция секреции и физиологические эффекты
минералокорт икоидов
У человека единственным минералокортикоидом, поступающим в кровь,
является алъдостерон. Регуляция синтеза и секреции альдостерона
осуществляется преимущественно ангиотензином-П, что дало основание считать
альдостерон частью ренин-ангиотензин-алъдостероновой системы или регу-
ляторной оси (рис. 6.11), обеспечивающей регуляцию водно-солевого
обмена и гемодинамики. Регуляции секреции альдостерона может осуществ-
284 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Печень
Ангиотензиноген
Почка
Ангиотензин-1
Ангиотензин-И
Надпочечник
Альдостерон
Рис. 6.11. Ренин-ангиотензин-альдостероновая система.
Секреция юкстагломерулярными клетками почек в кровь фермента ренина вызывает
отщепление пептида ангиотензина-1 от белка плазмы крови ангиотензиногена, образуемого в печени.
В сосудистом русле почек, печени, легких, мозга ангиотензин-1 подвергается воздействию
превращающего фермента, вызывающего образование из ангиотензина-1 ангиотензина-2. Ан-
гиотензин-2 стимулирует секрецию альдостерона клубочковой зоной коры надпочечников.
Пунктирной стрелкой обозначена отрицательная обратная связь — подавление секреции
ренина ангиотензином-2.
ляться и под влиянием собственной адренокортикальной ренин-ангиотен-
зиновой системы, что объясняет частое несоответствие уровней
активности ренина в плазме крови и секреции альдостерона. Поскольку
альдостерон регулирует содержание в крови ионов Na+ и К+, обратная связь в
регуляции его секреции реализуется прямым влиянием ионов К+ на клубочко-
вую зону коры надпочечников. В ренин-ангиотензин-альдостероновой
системе обратные связи включаются при сдвигах содержания Na+ в моче
дистальных канальцев, объема и давления крови.
Механизм действия альдостерона, как и всех стероидных гормонов,
состоит в прямом влиянии на генетический аппарат ядра клеток со
стимуляцией синтеза соответствующих РНК, активации синтеза
транспортирующих катионы белков и ферментов, а также повышении
проницаемости мембран для аминокислот. Негеномные эффекты гормона
реализуются через системы вторичных посредников. Механизм действия
альдостерона на клетки почечных канальцев представлен на рис. 6.12.
Стимуляция всасывания натрия под влиянием альдостерона происходит не только
в нефроне, но и в желудочно-кишечном тракте, протоках желез внешней
секреции, желчном пузыре. Негеномные эффекты альдостерона
обусловлены стимуляцией мембранного антипорта Na+/H+ в клетках разных
типов (гладкие мышцы матки, эпителий дистальных канальцев почек,
гладкие мышцы артерий и артериол, клетки крипт кишечника). Эти эффекты
обусловлены образованием вторичного посредника диацилглицерола и
активацией протеинкиназы С. Повышение уровня внутриклеточного
кальция в эндотелиальных и гладкомышечных клетках сосудов под
влиянием альдостерона обусловлено активацией вторичного посредника ИФЗ.
Альдостерон вызывает в клетках и двукратное повышение уровня цАМФ,
модулируя геномные эффекты стероидных гормонов. Быстрые
негеномные эффекты альдостерона проявляются и со стороны
сердечно-сосудистой системы в виде: повышения сосудистого сопротивления и артери-
6. Эндокринная нервная система — регулятор функций и процессов в организме • 285
Рис. 6.12. Геномный и внегеномный механизмы действия альдостерона на клетку
почечного канальца.
Геномный механизм: проникновение молекулы гормона через мембрану внутрь клетки,
связывание с цитоплазматическим рецептором, транспорт в ядро, связывание с ядерным
рецептором, активация синтеза белков (Na-транспортирующего белка-переносчика) и №+-К+-анти-
порта через люминальную мембрану. Внегеномный механизм: связывание молекулы гормона
с мембранным рецептором, образование вторичных посредников (ИФЗ), фосфорилирование и
активация Ыа+-протонного антипорта через люминальную мембрану.
ального давления при снижении сердечного выброса, противодействия
повышению в гладких мышцах сосудов уровня цАМФ и увеличения
чувствительности к прессорным эффектам катехоламинов и ангиотензина-Н,
что дало основание считать альдостерон циркуляторным гормоном
стресса.
Альдостерон поддерживает оптимальный водно-солевой обмен между
внешней и внутренней средой организма. Одним из главных
органов-мишеней гормона являются почки, где альдостерон вызывает усиленную ре-
абсорбцию натрия в дистальных канальцах с его задержкой в организме и
повышение экскреции калия с мочой. Под влиянием альдостерона
происходит задержка в организме хлоридов и воды, усиленное выведение Н-ио-
нов и аммония, увеличивается объем циркулирующей крови, формируется
сдвиг кислотно-основного состояния в сторону алкалоза. Действуя на
клетки сосудов и тканей, гормон способствует транспорту натрия и воды
во внутриклеточное пространство.
Минералокортикоиды являются жизненно важными гормонами, гибель
организма после удаления надпочечников можно предотвратить, вводя
гормоны извне. Минералокортикоиды усиливают воспаление и реакции
иммунной системы. Избыточная их продукция ведет к задержке в
организме натрия и воды, отекам и повышению артериального давления, потере
калия и водородных ионов, вследствие чего возникают нарушения возбу-
286 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
димости нервной системы и миокарда. Недостаток альдостерона у
человека сопровождается уменьшением объема крови, гиперкалиемией, гипотен-
зией, угнетением возбудимости нервной системы.
6.3.1.2. Регуляция секреции и физиологические эффекты глюкокортикоидов
Клетки пучковой зоны секретируют в кровь у здорового человека два
основных глюкокортикоида: кортизол и кортикостерон, причем кортизола
примерно в 10 раз больше. Секреция глюкокортикоидов регулируется кор-
тикотрошном аденогипофиза. Избыток кортизола в крови по механизму
обратной связи угнетает секрецию кортиколиберина в гипоталамусе и кор-
тикотропина в гипофизе. Секреция глюкокортикоидов происходит
непрерывно с отчетливой суточной ритмикой, повторяющей ритмику секреции
кортикотропина: максимальные уровни гормона в крови у человека
отмечаются в утренние часы, а минимальные — вечером и ночью (рис. 6.13).
Поступающие в кровь гормоны транспортируются к тканям в свободной и
связанной (до 95 %) с ос2-глобулином плазмы (транскортин) формах.
Механизм действия глюкокортикоидов на клетки-мишени представлен на
рис. 6.14.
Благодаря растворимости в липидах кортизол проникает через
мембрану клетки-мишени и взаимодействует с цитоплазматическим рецептором,
образуя лиганд-рецепторный комплекс, что обеспечивает транспорт
молекулы гормона в ядро, где кортизол связывается с ядерным рецептором,
активируя синтез новых белков и ферментов, тем самым обеспечивая
метаболические эффекты. Молекула кортизола может образовывать
лиганд-рецепторный комплекс и с мембранными рецепторами. Хотя роль этого
процесса в реализации эффектов гормона еще изучается, тем не менее
известны быстрые негеномные эффекты гормона на возбудимость нервных
клеток, связанные с изменением ионного трансмембранного транспорта,
обусловливающие изменение поведения.
Среди синтезированных под влиянием кортизола белков в
клетке-мишени важнейшую роль для реализации опосредованных эффектов гормона
играет семейство липокортинов. Последние, выходя из клетки,
связываются со специфическими липокортиновыми рецепторами клеточной
мембраны (аутокринный путь влияния), что вызывает подавление активности
фосфолипазы-А. Липокортины способны ингибировать фосфолипазу-А и
непосредственно, следствием чего является подавление синтеза в клетках
простагландинов и лейкотриенов, ослабление их метаболических и регуля-
торных эффектов. Уменьшение проницаемости клеточных мембран и
противовоспалительный эффект кортизола обусловлены ингибированием
синтеза лейкотриенов.
Глюкокортикоиды прямо или опосредованно регулируют практически
все виды обмена веществ и физиологические функции. Метаболические
эффекты глюкокортикоидов проявляются, прежде всего, со стороны
углеводного, белкового и жирового обменов. Обобщенно эти сдвиги можно
свести к распаду белков и липидов в тканях, после чего метаболиты
поступают в печень, где из них синтезируется глюкоза, использующаяся как
источник энергии. Эффекты на углеводный обмен в целом противоположны
инсулину, поэтому глюкокортикоиды называют контринсулярными
гормонами. Гипергликемия под влиянием гормонов возникает за счет
усиленного образования глюкозы в печени из аминокислот — глюконеогенеза и
подавления утилизации ее тканями. Гипергликемия является причиной
активации секреции инсулина. Чувствительность тканей к инсулину глюкокор-
6. Эндокринная нервная система — регулятор функций и процессов в организме • 287
_J I I I I I
20 24 4 8 12 16
Рис. 6.13. Суточный ритм секреции кортикотропина и кортизола. Максимум
концентрации гормонов в крови приходится на утренние часы, при этом прирост
уровня кортикотропина опережает рост содержания кортизола.
тикоиды снижают, а контр инсулярные метаболические эффекты могут
вести к развитию стероидного сахарного диабета. На белковый обмен
гормоны оказывают катаболический и антианаболический эффекты, приводя
к отрицательному азотистому балансу. Распад белка происходит в
мышечной, соединительной и костной тканях, снижается уровень альбумина в
крови, уменьшается проницаемость клеточных мембран для аминокислот.
Однако синтез некоторых белков в печени, например ос2-глобулинов, глю-
кокортикоиды повышают. Со стороны жирового обмена имеют место липо-
литический эффект в тканях, гиперлипидемия и гиперхолестеринемия,
активация кетогенеза в печени, угнетение липогенеза в печени, стимуляция
липогенеза и перераспределения жира в жировой ткани центральной оси
туловища и лица, стимуляция аппетита и потребления жира
Влияние глюкокортикоидов на реактивность тканей проявляется не
только в виде подавления чувствительности к инсулину, но и в
повышении чувствительности адренорецепторов к катехоламинам. Глюкокорти-
коиды вызывают снижение в крови количества лимфоцитов, эозинофилов
288 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Кортизол
Эффект через
рецепторы
липокортина
Мембрана Ядро
Подавление фосфолипазы-А
— n
Мембранные липиды
Арахидоновая кислота
f
Синтез простагландинов
и лейкотриенов
f
Эффекты
Ферменты-
Эффекты
Рис. 6.14. Схема механизма действия кортизола на клетку-мишень.
Проникая внутрь клетки через мембрану, молекула гормона последовательно взаимодействет с
цитозольным, а затем с ядерным рецептором. Следствие геномного влияния — активация
синтеза новых белков, в том числе являющихся внутриклеточными ферментами, что вызывает
изменения обмена веществ. К числу синтезируемых под влиянием кортизола белков относятся
липокортины. Последние либо выводятся из клетки и взаимодействуют со специфическими
для них мембранными рецепторами, либо действуют внутриклеточно. Основной эффект липо-
кортинов — ингибирование мембранного фермента фосфолипазы-А и образования из арахи-
доновой кислоты простагландинов и лейкотриенов.
и базофилов, повышение чувствительности сенсорных структур и
возбудимости нервной системы, обеспечение оптимальной симпатической
регуляции сердечно-сосудистой системы. Почечные эффекты глюкокортикоидов
состоят в стимуляции диуреза путем снижения реабсорбции воды и
повышении клубочковой фильтрации; подобно минералокортикоидам, они
могут вызывать задержку натрия при потере калия. Глюкокортикоиды
повышают синтез ангиотензиногена в печени и тем самым способствуют
большему образованию в крови ангиотензина-И и секреции альдостерона,
увеличивают синтез катехоламинов в мозговом веществе надпочечников.
Гормоны повышают устойчивость организма к действию чрезмерных
раздражителей, подавляют сосудистую проницаемость и воспаление (поэтому их
называют адаптивными и противовоспалительными), из-за катаболизма
белка в лимфоидной ткани и угнетения иммунных реакций они оказывают
антиаллергические эффекты. Физиологическое влияние кортизола на им-
мунокомпетентные клетки носит защитный, регуляторный характер
(рис. 6.15).
Избыток гормонов в крови вызывает активацию желудочной секреции,
выделения НС1, уменьшение числа мукоцитов и продукции слизи, что
способствует возникновению язвы желудка — ульцерогенный эффект.
6. Эндокринная нервная система — регулятор функций и процессов в организме • 289
Кортиколиберин
Вазопрессин
Интерлейкины (ИЛ-1)
Кортикотропин
Иммунологический стимул
ФИО и другие токсичные соединения
\
Рис. 6.15. Физиологическое значение влияния кортизола на иммунокомпетентные
клетки (на примере макрофага).
Кортизол тормозит выделение макрофагом фактора некроза опухолей (ФНО) и других
токсичных для клеток организма макрофагальных цитокинов. Под влиянием иммунологического
стимула макрофаг выделяет кортикотропин, что усиливает продукцию кортизола
надпочечниками и ослабляет выделение макрофагом цитотоксические соединений. Кроме того
выделяемые макрофагом интерлейкины, в частности интерлейкин-1, стимулируют гипоталамо-адено-
гипофизарно-надпочечниковую ось регуляции, что также повышает продукцию кортизола,
снижающего цитотоксические эффекты макрофага.
Повышенная секреция глюкокортикоидов, не связанная с описанной
выше усиленной секрецией кортикотропина, вызывает развитие синдрома
Иценко—Кушинга. Его основные проявления близки болезни Иценко-Ку-
шинга, однако, благодаря механизму обратной связи, избыток
глюкокортикоидов угнетает секрецию кортикотропина и усиленную пигментацию.
Среди проявлений повышенной секреции гормонов: антиростовые
эффекты (подавление действия кальцитриола и митоза фибробластов, деградация
коллагена вплоть до остеопороза; подавление заживления ран из-за
угнетения пролиферации фибробластов и редукции соединительной ткани;
подавление секреции соматотропина и синтеза ИФР-1; мышечная атрофия и
слабость), склонность к сахарному диабету, гипертензия, нарушения
половых функций, лимфопения, пептические язвы желудка, изменения
психики, предрасположенность к инфекциям. Дефицит глюкокортикоидов
вызывает гипогликемию, снижение чувствительности сердечно-сосудистой
системы к симпатической регуляции, замедление сердечного ритма, гипо-
тензию, нейтропению, эозинофилию и лимфоцитоз, снижение
сопротивляемости организма инфекциям.
10-6095
290 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
6.3.1.3. Регуляция секреции и физиологические эффекты половых стероидов
коры надпочечников
Клетками сетчатой зоны у человека секретируются в кровь мужские
половые гормоны или андрогены: андростендион, дегидроэпиандростерон и
существенно меньше — 11-бета-гидроксиандростендион. Наиболее
высокий уровень этих гормонов отмечается в 6 часов утра, а наиболее
низкий — в 19 часов. Секреция андрогенов регулируется кортикотропином
гипофиза.
Андрогены надпочечника стимулируют окостенение эпифизарных
хрящей, повышают синтез белка (анаболический эффект) в коже, мышечной
и костной ткани, а также формируют половое поведение у женщин.
Гормоны являются предшественниками основного андрогена семенников —
тестостерона и могут превращаться в него при метаболизме в
тканях-мишенях. Андрогены надпочечников способствуют развитию оволосения по
мужскому типу, а их избыток у женщин — к вирилизации, т. е. появлению
мужских черт. Ранний избыток андрогенов ведет к преждевременному
проявлению вторичных половых признаков у мальчиков и вирилизации
женских половых органов. Нарушения секреции андрогенов коры
надпочечников получили название адреногенитальных синдромов.
6.3.2. Гормоны мозгового вещества надпочечников и их эффекты
в организме
Мозговое вещество надпочечников содержит хромаффинные клетки,
названные так из-за избирательной окраски хромом. По происхождению и
функции они являются постганглионарными нейронами симпатической
нервной системы, однако, в отличие от типичных нейронов, клетки
надпочечников: 1) синтезируют больше адреналина, а не норадреналина
(отношение у человека между ними 6:1); 2) накапливая секрет в гранулах, после
поступления нервного стимула они немедленно выбрасывают гормоны в
кровь. Регуляция секреции гормонов мозгового вещества надпочечников
осуществляется благодаря наличию гипоталамо-симпатоадреналовой оси,
при этом симпатические нервы стимулируют хромаффинные клетки через
холинорецепторы, выделяя медиатор ацетилхолин.
Хромаффинные клетки являются частью общей системы нейроэндо-
кринных клеток организма, или APUD-системы (Amine and amine
Precursors Uptake and Decarboxylation), т. е. системы поглощения и декарбокси-
лирования аминов и их предшественников. К этой системе относятся ней-
росекреторные клетки гипоталамуса, клетки желудочно-кишечного тракта
(энтериноциты), продуцирующие кишечные гормоны, клетки островков
Лангерганса поджелудочной железы и К-клетки щитовидной железы.
Гормоны мозгового вещества — катехоламины — образуются из
аминокислоты тирозина поэтапно: тирозин—ДОФА—дофамин-норадреналин—
адреналин. Хотя надпочечник и секретирует значительно больше
адреналина, тем не менее в состоянии покоя в крови содержится в четыре раза
больше норадреналина, так как он поступает в кровь и из симпатических
окончаний. Секреция катехоламинов в кровь хромаффинными клетками
осуществляется с обязательным участием Са2+, кальмодулина и особого
белка синексина, обеспечивающего агрегацию отдельных гранул и их связь
с фосфолипидами мембраны клетки.
Катехоламины называют гормонами срочного приспособления к
действию сверхпороговых раздражителей среды.
6. Эндокринная нервная система — регулятор функций и процессов в организме • 291
Физиологические эффекты катехоламинов обусловлены различиями в
адренорецепторах (альфа и бета) клеточных мембран, при этом адреналин
обладает большим сродством к бета-адренорецепторам, а норадреналин —
к альфа. Чувствительность адренорецепторов к адреналину увеличивают
гормоны щитовидной железы и глюкокортикоиды. Основные
функциональные эффекты адреналина проявляются в виде: 1) учащения и
усиления сердечных сокращений, 2) сужения сосудов кожи и органов
брюшной полости, 3) повышения теплообразования в тканях, 4) ослабления
сокращений желудка и кишечника, 5) расслабления бронхиальной
мускулатуры, 6) стимуляции секреции ренина почкой, 7) уменьшения
образования мочи, 8) повышения возбудимости нервной системы, скорости
рефлекторных процессов и эффективности приспособительных реакций.
Адреналин вызывает мощные метаболические эффекты в виде
усиленного расщепления гликогена в печени и мышцах из-за активации фосфо-
рилазы, а также подавление синтеза гликогена, угнетение потребления
глюкозы тканями, что в целом ведет к гипергликемии. Адреналин
вызывает активацию распада жира, мобилизацию в кровь жирных кислот и их
окисление. Все эти эффекты противоположны действию инсулина,
поэтому адреналин называют контринсулярным гормоном. Адреналин
усиливает окислительные процессы в тканях и повышает потребление ими
кислорода.
Таким образом, как кортикостероиды, так и катехоламины
обеспечивают активацию приспособительных защитных реакций организма и их
энергоснабжение, повышая устойчивость организма к неблагоприятным
влияниям среды.
В мозговом веществе надпочечников, кроме катехоламинов, образуется
и пептидный гормон адреномедуллж. Кроме мозгового вещества
надпочечников и плазмы крови он выявлен в тканях легких, почек и сердца, а
также эндотелиальных клетках сосудов. Этот пептид состоит у человека из 52
аминокислот. Основное действие гормона заключается в мощном
сосудорасширяющем эффекте, в связи с чем его называют гипотензивным
пептидом. Второй физиологический эффект гормона заключается в подавлении
продукции альдостерона клетками клубочковой зоны коры надпочечников.
При этом пептид подавляет не только базальный, фоновый уровень
образования гормона, но и его секрецию, стимулированную высоким уровнем
калия в плазме крови или действием ангиотензина-П.
6.4. Регуляторные функции гормонов щитовидной железы
Щитовидная железа — орган эпителиального происхождения, который
закладывается в эмбриогенезе вначале как типичная экзокринная железа, и
лишь в процессе дальнейшего эмбрионального развития она становится
эндокринной. Кровоснабжение щитовидной железы очень интенсивное,
осуществляется через 2 пары артерий, берущих начало от выходящих из
аорты крупных артериальных стволов. Капилляры окружают фолликулы,
тесно прилегают к эпителиальным клеткам. Иннервация железы
осуществляется ветвями симпатических шейных узлов и блуждающего нерва.
Интенсивный лимфоотток, наряду с венозным оттоком, обеспечивает
транспорт тиреоидных гормонов в общую циркуляцию. Эндокринные функции
присущи А-клеткам или тироцитам, образующим фолликулы и
способным захватывать йод и синтезировать йодсодержащие тиреоидные
гормоны, и парафолликулярным К-клеткам, образующим кальций-регулирую-
щий гормон кальцитонин.
10"
292 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
6.4.1. Регуляция секреции и физиологические эффекты
йодсодержащих тиреоидных гормонов
Тироциты образуют фолликулы, заполненные коллоидной массой тирео-
глобулина. Базальная мембрана тироцитов тесно прилежит к кровеносным
капиллярам, и из крови эти клетки получают не только необходимые для
энергетики и синтеза белка субстраты, но и активно захватывают
соединения йода — йодиды. В тироцитах происходит синтез тиреоглобулина,
окисление иодидов до образования атомарного йода. Тиреоглобулин содержит
на поверхности молекулы значительное количество остатков
аминокислоты тирозина (тиронины), которые и подвергаются йодированию. Через
апикальную мембрану тироцита тиреоглобулин выделяется в просвет
фолликула. При секреции гормонов в кровь ворсинки апикальной мембраны
окружают и поглощают путем эндоцитоза капельки коллоида, которые в
цитоплазме подвергаются гидролизу лизосомальными ферментами, и два
продукта гидролиза — трийодтиронин (Т3) и тетрайодтиронин {тироксин,
Т4) секретируются через базальную мембрану в кровь и лимфу. Все
описанные процессы регулируются тиреотропином аденогипофиза. Наличие
столь многочисленных процессов, регулируемых одним тиреотропином,
обеспечивается за счет включения многих внутриклеточных вторичных
посредников. Существует и прямая нервная регуляция щитовидной железы
вегетативными нервами, хотя для активации секреции гормонов она играет
меньшую роль, чем эффекты тиреотропина. Механизм отрицательной
обратной связи в регуляции функции щитовидной железы реализуется
уровнем тиреоидных гормонов в крови, что подавляет секрецию тиреолиберина
гипоталамусом и тиреотропина гипофизом. Интенсивность секреции
тиреоидных гормонов влияет на объем их синтеза в железе (механизм
местной положительная обратная связь).
Транспорт Т3 и Т4 в крови осуществляется с помощью специальных
белков, однако, в такой связанной с белком форме гормоны не способны
проникать в клетки-эффекторы. Значительная часть тироксина
депонируется и транспортируется эритроцитами. Дестабилизация их мембран,
например под воздействием ультрафиолетового облучения, ведет к выходу
тироксина в плазму крови. При взаимодействии гормона с рецептором на
поверхности клеточной мембраны происходит диссоциация
гормон-белкового комплекса, после чего гормон проникает внутрь клетки.
Внутриклеточными мишенями тиреоидных гормонов являются ядро и органоиды
(митохондрии). Механизм действия тиреоидных гормонов представлен на
рис. 6.16. Т3 в несколько раз активнее Т4, и в тканях происходит
превращение Т4 в Т3 В связи с этим основная часть эффектов тиреоидных гормонов
обеспечивается Т3.
Основными метаболическими эффектами тиреоидных гормонов
являются: 1) усиление поглощения кислорода клетками и митохондриями с
активацией окислительных процессов и увеличением основного обмена,
2) стимуляция синтеза белка за счет повышения проницаемости мембран
клетки для аминокислот и активации генетического аппарата клетки,
3) липолитический эффект и окисление жирных кислот с уменьшением их
уровня в крови, 4) активация синтеза холестерина в печени и его
экскреции с желчью, 5) гипергликемия за счет активации распада гликогена в
печени и повышения всасывания глюкозы в кишечнике, 6) повышение
потребления и окисления глюкозы клетками, 7) активация инсулиназы
печени и ускорение инактивации инсулина, 8) стимуляция секреции инсулина
за счет гипергликемии. Таким образом, избыточные количества тиреоид-
6. Эндокринная нервная система — регулятор функций и процессов в организме • 293
Трийодтиронин (Т3)
Мембранной
рецептор
Ядерный
рецептор
Эффекты на мембранный
транспорт (аминокислот и др.)
Т4
Дейодирование
Митохондрии
Повышение обмена веществ
Ядро
Рис. 6.16. Геномный и внегеномный механизмы действия тиреоидных гормонов на
клетку.
Эффекты гормонов реализуются как после проникновения гормонов внутрь клетки (влияние
на транскрипцию в ядре и синтез белка, влияние на окислительно-восстановительные
реакции и освобождение энергии в митохондриях), так и после связывания гормона с
мембранным рецептором (образование вторичных посредников, увеличение транспорта в клетку
субстратов, в частности аминокислот, необходимых для синтеза белка).
ных гормонов, стимулируя секрецию инсулина и одновременно вызывая
контринсулярные эффекты, могут также способствовать развитию
сахарного диабета.
Основные физиологические эффекты тиреоидных гормонов,
обусловленные перечисленными выше сдвигами обмена веществ, проявляются в
следующем: 1) обеспечении нормальных процессов роста, развития и диффе-
ренцировки тканей и органов, особенно центральной нервной системы, а
также процессов физиологической регенерации тканей, 2) активации
симпатических эффектов (тахикардия, потливость, сужение сосудов и т. п.),
как за счет повышения чувствительности адренорецепторов, так и в
результате подавления ферментов (моноаминоксидаза), разрушающих норад-
реналин, 3) повышении энергообразования в митохондриях и
сократимости миокарда, 4) повышении теплообразования и температуры тела, 5)
повышении возбудимости центральной нервной системы и активации
психических процессов, 6) предотвращении стрессорных повреждений миокарда
и язвообразования в желудке, 7) увеличении почечного кровотока, клубоч-
ковой фильтрации и диуреза при угнетении канальцевой реабсорбции в
почках, 8) поддержании репродуктивной функции.
Избыточная продукция тиреоидных гормонов носит название гиперти-
реоза. При этом проявляются характерные метаболические (повышение
основного обмена, гипергликемия, гипертермия, похудание) и
функциональные признаки повышенного симпатического тонуса (тахикардия,
потливость, повышение артериального давления и др.). Врожденная
недостаточность тиреоидных гормонов, из-за наследственных дефектов или дефицита
294 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Поступление 500 мкг I
у Кал 15 мкг I
Выделение
Рис. 6.17. Баланс йода в организме.
В сутки поступает в организм с пищей и водой 500 мкг йода. Всасываясь в кровь, йодиды
доставляются к щитовидной железе, где депонирован основной тиреоидный пул йода. Его
расходование при секреции тиреоидных гормонов восполняется из резервного пула крови.
Основное количество йода выделяется через почки с мочой (485 мкг), часть теряется с калом (15
мкг), следовательно, экскреция йода равна его поступлению в организм, что и составляет
внешний баланс.
йода в организме матери, нарушает рост, развитие и дифференцировку
скелета, тканей и органов, особенно центральной нервной системы, что
ведет к умственной отсталости («кретинизм»). Приобретенная
недостаточность щитовидной железы (дефицит йода в воде и пище, нарушение
продукции гипофизом тиреотропина, повреждения ткани щитовидной
железы — механические или химическими веществами) проявляется в
замедлении окислительных процессов и снижении основного обмена,
гипогликемии, падении возбудимости нервной системы и психической деятельности,
снижении температуры тела, накоплении гликозаминогликанов и воды в
подкожно-жировой клетчатке и коже (гипотиреоз, микседема или
слизистый отек).
Одной из наиболее частых причин врожденной или приобретенной ти-
реоидной недостаточности является дефицит йода в пище и воде или
нарушения его захвата из крови и утилизации железой. Основные показатели
обмена йода приведены на рис. 6.17. При снижении количества йодида в
крови щитовидная железа быстро компенсирует этот дефицит, усиливая
захват йода. Запасы тиреоидных гормонов в щитовидной железе
значительно превышают суточную потребность в них организма, поэтому
кратковременные и нерезкие уменьшения потребления йода не вызывают
нарушений функции железы. Если дефицит йода более выражен и длителен,
синтез и секреция тиреоидных гормонов начинает отставать от
потребностей организма, активируется секреция тиреолиберина гипоталамуса и
тиреотропина аденогипофиза, развивается гипертрофия и гиперплазия
железы, получившая название зоба. В таких случаях нередко увеличенная масса
железы более эффективно поглощает и утилизирует йодид, что компенси-
6. Эндокринная нервная система — регулятор функций и процессов в организме • 295
рует йодную недостаточность и поддерживает нормальную секрецию
тиреоидных гормонов. Недостаточность этой компенсаторной реакции ведет
к тому, что несмотря на развитие зоба железа не в состоянии
синтезировать и секретировать адекватные потребностям количества тиреоидных
гормонов и возникает тиреоидная недостаточность. Особенно часто начало
ее развития совпадает с повышением потребности организма в тиреоидных
гормонах, например при охлаждении.
6.4.2. Регуляция секреции и физиологические эффекты
кальцитонина
Кальцитонин является пептидным гормоном парафолликулярных К-кле-
ток щитовидной железы, но образуется также в тимусе и в легких. В
организме существует ряд близких по химической структуре гормонов, поэтому
они получили собирательное название гормонов семейства кальцитонина.
К ним относятся также катакалъцин и мозговой пептид, родственный гену
кальцитонина, причем последний, наряду с близкими кальцитонину
эффектами, рассматривается в роли возможного медиатора сосудистых
нервных регуляторных влияний, так как показано его выделение на
окончаниях сосудодвигательных нервов. Обнаружен гормон и в спинном мозге, где
также, вероятно, играет роль медиатора или модулятора синаптической
передачи.
Кальцитонин относится к кальцийрегулирующим гормонам, и
регуляция его секреции осуществляется уровнем ионизированного кальция
плазмы крови по механизму обратной связи. Стимуляция секреции
кальцитонина происходит при значительном повышении кальция в крови, тогда
как обычные физиологические колебания концентрации кальция мало
сказываются на секреции кальцитонина. Мощным регулирующим
секрецию кальцитонина эффектом обладают нейропептиды и пептидные
гормоны желудочно-кишечного тракта, особенно гастрин. Повышение секреции
Рис. 6.18. Основные эффекты кальцитонина на органы-мишени.
Гипокальциемический гормон кальцитонин усиливает выведение почками из крови (угнетая
реабсорбцию) кальция и фосфата, одновременно с увеличением реабсорбции магния
повышает поступление кальция и фосфата в кости, увеличивая их минерализацию. Возможен слабый
эффект кальцитонина, угнетающий всасывание кальция.
296 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
кальцитонина после перорального приема кальция обусловлено
выделением в кровь гормона желудка — гастрина.
Кальцитонин оказывает эффекты в результате взаимодействия с
рецепторами органов-мишеней (почка, желудочно-кишечный тракт, костная
ткань) через вторичные посредники цАМФ и цГМФ. Гормон снижает
уровень кальция в крови {гипокалъциемический гормон) за счет облегчения
минерализации и подавления резорбции костной ткани, а также путем
снижения реабсорбции кальция в почках (рис. 6.18). Кальцитонин вызывает
фосфатурию в результате подавления реабсорбции фосфата в почечных
канальцах. Гормон оказывает слабое диуретическое и натрийуретическое
действие, он способен тормозить секрецию гастрина в желудке и снижать
кислотность желудочного сока (эффект механизма отрицательной
обратной связи).
6.5. Регуляторные функции гормона околощитовидных желез
Околощитовидные железы (у человека в среднем 4 железы) эпителиального
происхождения, кровоснабжаются из щитовидных артерий и, так же как
щитовидная железа, иннервируются симпатическими и
парасимпатическими волокнами. Гормон околощитовидных желез — паратирин — является
кальцийрегулирующим гормоном, повышающим уровень кальция в плазме
крови, в связи с чем его называют гиперкальциемическим гормоном.
Регуляция секреции паратирина происходит по механизму отрицательной
обратной связи уровнем ионизированного кальция плазмы крови. Низкая
концентрация кальция стимулирует секрецию паратирина при
одновременном повышении уровня цАМФ в клетках. Стимулируют продукцию
паратирина и симпатические влияния на клетки околощитовидных желез
через бета-адренорецепторы, также приводящие к возрастанию в клетках
железы содержания цАМФ. Подавляют секрецию паратирина высокий
уровень кальция в крови и почечный гормон кальцитриол.
Основные эффекты паратирина проявляются со стороны
органов-мишеней гормона — костной ткани, почек и желудочно-кишечного тракта
(рис. 6.19). Реализация действия паратирина осуществляется через цАМФ,
и повышение уровня этого вторичного посредника в моче является
важным диагностическим критерием избыточной секреции паратирина.
Эффект гормона на костную ткань обусловлен стимуляцией активности и
увеличением количества остеокластов, резорбирующих кость. Под
влиянием паратирина в костной ткани накапливаются лимонная и молочная
кислоты, вызывающие местный ацидоз. Кислая реакция среды в костной
ткани тормозит активность щелочной фосфатазы — фермента,
необходимого для образования основного минерального вещества кости —
фосфорнокислого кальция. Избыток лимонной и молочной кислот ведет к
образованию растворимых в воде солей кальция — цитрата и лактата, вымыванию
их в кровь, что приводит к деминерализации кости. Избыток цитрата
выводится с мочой, что является важным диагностическим признаком
повышенного уровня секреции паратирина. В почках гормон снижает реабсорб-
цию кальция в проксимальных канальцах, но резко усиливает ее в дис-
тальных канальцах, что предотвращает потери кальция с мочой и
способствует гиперкальциемии. Реабсорбция фосфата в почках под влиянием
паратирина угнетается, это приводит к фосфатурии и снижению содержания
фосфата в крови — гипофосфатемии. Почечные эффекты паратирина
проявляются также в диуретическом и натрийуретическом действии,
угнетении канальцевой реабсорбции воды, снижении эффективности действия
6. Эндокринная нервная система — регулятор функций и процессов в организме • 297
Рис. 6.19. Регуляция секреции и основные эффекты паратирина.
Снижение уровня кальция в крови является стимулом для околощитовидных желез (ОЩЖ),
секретирующих паратирин. Основные эффекты паратирина проявляются со стороны органов-
мишеней: почек (подавление реабсорбции кальция и его выведение с мочой, повышение реаб-
сорбции фосфата), кишечника (стимуляция всасывания кальция, в основном через
стимуляцию синтеза в почках кальцитриола) и костной ткани (вымывание кальция в кровь). Эти
эффекты ведут к повышению в крови уровня кальция (паратирин является гиперкальциемиче-
ским гормоном).
на канальцы вазопрессина. В кишечнике паратирин прямо, но главным
образом опосредованно через кальцитриол, стимулирует всасывание
кальция, что также способствует гиперкальциемии.
Паратирин повышает поступление кальция во внутриклеточную среду
и транспорт иона из цитозоля во внутриклеточные депо, увеличивает
удаление свободного кальция из клеток. Благодаря этому изменяется
возбудимость и реактивность клеток к нейрогенным и гуморальным регулятор-
ным стимулам. Паратирин вызывает повышение образования в почках
кальци-триола, стимулирует секрецию соляной кислоты и пепсина в
желудке.
Повышенная секреция паратирина при гиперплазии или аденоме
околощитовидных желез сопровождается деминерализацией скелета с
деформацией длинных трубчатых костей, образованием почечных камней,
мышечной слабостью, депрессией, нарушениями памяти и концентрации
внимания.
6.6. Регуляторные функции гормонов эпифиза
Эпифиз представляет собой структуру эпиталамуса межуточного мозга и
расположен по срединной плоскости глубоко между полушариями. Будучи
железой нейроглиального происхождения, эпифиз связан с многослойным
участком эпендимы задней стенки III желудочка, называемым субкомиссу-
ральным органом. Кровоснабжение эпифиза осуществляется из ветвей
передней, средней и задней мозговых артерий. Основными секреторными
клетками эпифиза являются пинеалоциты. Ими образуется и секретирует-
298 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Глаз
Ретикулогипоталамический тракт
Симпатические нервы
Гипоталамус
Верхний шейный
симпатический ганглий
Норадреналин
Клетки крови, кишечника,
слезных желез, сетчатки
Эпифиз
Мелатония
Аденогипофиз
Эндокринные
ткани
Модулирование
секреции
гонадотропинов,
кортикотропина,
соматотропина,
пролактина и
тиреотропина
Кишечник
Подавление
секреции
инсулина и
прогестерона
Почки
Повышение
сократимости
гладких
мышц,
подавление
секреции
пептидных
гормонов
Диуретический
эффект
Иммунная
система
Активация
гуморального
и клеточного
иммунитета
Рис. 6.20. Схема механизма регуляции секреции мелатонина эпифизом и основные
эффекты гормона.
Свет, воспринимаемый глазом, тормозит секрецию мелатонина, а в темноте нервные
импульсы через ретикулогипоталамический тракт, гипоталамус, верхний шейный симпатический
ганглий приводят к освобождению на симпатических терминалях в эпифизе медиатора норад-
реналина, стимулирующего секрецию гормона эпифизом.
ся в кровь и цереброспинальную жидкость гормон мелатонин (название
получил благодаря способности менять окраску кожи и чешуи у
земноводных и рыб, у человека на пигментацию не влияет). Мелатонин является
производным аминокислоты триптофана, он обеспечивает регуляцию
биоритмов эндокринных функций и метаболизма для приспособления
организма к разным условиям освещенности. Эпифиз имеет нервные связи со
структурами лимбики, однако основная регуляторная информация
поступает в эпифиз из верхнего шейного узла пограничного ствола по
симпатическим волокнам, которые формируют шишковидный нерв.
Синтез и секреция мелатонина зависят от освещенности — избыток
света тормозит его образование. Путь регуляции секреции (рис. 6.20)
начинается от сетчатки глаза ретиогипоталамическим трактом, из межуточного
мозга по преганглионарным волокнам информация поступает в верхний
шейный симпатический ганглий, затем отростки постганглионарных
клеток возвращаются в мозг и доходят до эпифиза. Снижение освещенности
повышает выделение на окончаниях симпатического шишковидного нерва
6. Эндокринная нервная система — регулятор функций и процессов в организме • 299
норадреналина и, соответственно, синтез и секрецию мелатонина. У
человека на ночные часы приходится 70 % суточной продукции гормона.
Основной физиологический эффект мелатонина заключается в
торможении секреции гонадотропинов как на уровне аденогипофиза, так и
опосредованно через угнетение нейросекреции либеринов гипоталамуса.
Кроме того, снижается, но в меньшей степени, секреция и других гормонов
аденогипофиза — кортикотропина, тиреотропина, соматотропина.
Секреция мелатонина подчинена суточному ритму (циркадианный ритм),
определяющему ритмичность гонадотропных эффектов и половой функции, в
том числе продолжительность менструального цикла у женщин.
Деятельность эпифиза называют «биологическими часами» организма, так как
железа обеспечивает процессы адаптации организма к смене часовых поясов.
Введение мелатонина человеку вызывает легкую эйфорию и сон. В
экспериментальных условиях экстракты эпифиза оказывают инсулиноподобный
(гипогликемический) и паратиреоподобный (гиперкальциемический)
эффекты, что, по-видимому, связано не только с мелатонином, но и с
другими биологически активными веществами эпифиза — серотонином, адре-
ногломерулотропином, гиперкалиемическим фактором и др. Проявляется
и диуретическое влияние экстрактов эпифиза, что позволяет считать его
ответственным за ритмическую регуляцию водно-солевого обмена.
Показана способность экстрактов эпифиза тормозить апоптоз (естественную
гибель клеток) и старение, выявлен противоопухолевый эффект эпифизар-
ных гормонов.
6.7. Регуляторные функции гормонов эндокринных тканей
в органах, обладающих неэндокринными функциями
6.7.1. Регуляторные функции гормонов поджелудочной железы
Эндокринную функцию в поджелудочной железе выполняют скопления
клеток эпителиального происхождения, получившие название островков
Лангерганса и составляющие всего 1 —2 % массы поджелудочной железы —
экзокринного органа, образующего панкреатический пищеварительный
сок. Количество островков в железе взрослого человека очень велико и
составляет от 200 тысяч до полутора миллионов. В островках различают
несколько типов клеток, продуцирующих гормоны: альфа-клетки образуют
глюкагон, бета-клетки — инсулин, дельта-клетки — соматостатин, джи-
клетки — гастрин и РР- или F-клетки — панкреатический полипептид.
Помимо инсулина в бета-клетках синтезируется гормон амилин, обладающий
противоположными инсулину эффектами. Кровоснабжение островков
более интенсивно, чем основной паренхимы железы. Иннервация
осуществляется постганлионарными симпатическими и парасимпатическими
нервами, причем среди клеток островков расположены нервные клетки,
образующие нейроинсулярные комплексы.
Инсулин синтезируется в эндоплазматическом ретикулуме бета-клеток
вначале в виде пре-проинсулина, затем от него отщепляется 23-аминокис-
лотная цепь и остающаяся молекула носит название проинсулина. В
комплексе Гольджи проинсулин упаковывается в гранулы, в них
осуществляется расщепление проинсулина на инсулин и соединительный пептид (С-
пептид). В гранулах инсулин депонируется в виде полимера и частично в
комплексе с цинком. Количество депонированного в гранулах инсулина
почти в 10 раз превышает суточную потребность в гормоне. Секреция
инсулина происходит путем экзоцитоза гранул, при этом в кровь поступает
300 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Ацетилхолин
Катехоламины (альфа-адренорецепторы)
Са2+, аминокислоты, желудочно-
кишечные гормоны
Аминокислоты
Желудочно-
кишечные
гормоны
./
Глюкагон
>-
оматостатин
-. _ „Инсулин
Р-клетка ;
8-клетка
Соматостатин
Катехоламины (Р-
адренорецепторы)
Аминокислоты ЖИП
Ацетилхолин
Катехоламины (а-адренорецепторы)
Рис. 6.21. Функциональная организация островков Лангерганса как «мини-органа».
Сплошные стрелки — стимуляция, пунктирные — подавление гормональных секретов.
Ведущий регулятор — глюкоза — при участии кальция стимулирует секрецию инсулина р-клетками
и, напротив, тормозит секрецию глюкагона а-клетками. Всасывающиеся в желудке и
кишечнике аминокислоты являются стимуляторами функции всех клеточных элементов
«мини-органа». Ведущий «внутриорганный» ингибитор секреции инсулина и глюкагона — соматостатин,
активация его секреции происходит под влиянием всасывающихся в кишечнике аминокислот
и гастроинтестинальных гормонов при участии ионов Са2+. Глюкагон является стимулятором
секреции как соматостатина, так и инсулина.
эквимолярное количество инсулина и С-пептида. Определение содержания
последнего в крови является важным диагностическим тестом оценки
секреторной способности (3-клеток.
Секреция инсулина является кальцийзависимым процессом. Под
влиянием стимула — повышенного уровня глюкозы в крови — мембрана бета-
клеток деполяризуется, ионы кальция входят в клетки, что запускает
процесс сокращения внутриклеточной микротубулярной системы и
перемещение гранул к плазматической мембране с последующим их экзоцитозом.
Секреторная функция разных клеток островков взаимосвязана, зависит
от эффектов образуемых ими гормонов, в связи с чем островки
рассматриваются как своеобразный «мини-орган» (рис. 6.21). Выделяют два вида
секреции инсулина: базальную и стимулированную. Базальная секреция
инсулина осуществляется постоянно, даже при голодании и уровне
глюкозы крови ниже 4 ммоль/л.
Стимулированная секреция инсулина представляет собой ответ бета-
клеток островков на повышенный уровень D-глюкозы в притекающей к
бета-клеткам крови. Под влиянием глюкозы активируется энергетический
рецептор бета-клеток, что увеличивает транспорт в клетку ионов кальция,
активирует аденилатциклазу и пул (фонд) цАМФ. Через эти посредники
глюкоза стимулирует выброс инсулина в кровь из специфических
секреторных гранул. Усиливает ответ бета-клеток на действие глюкозы гормон
двенадцатиперстной кишки — желудочный ингибиторный пептид (ЖИП).
В регуляции секреции инсулина определенную роль играет и вегетативная
нервная система. Блуждающий нерв и ацетилхолин стимулируют секрецию
инсулина, а симпатические нервы и норадреналин через
альфа-адренорецепторы подавляют секрецию инсулина и стимулируют выброс глюкагона.
Специфическим ингибитором продукции инсулина является гормон
дельта-клеток островков — соматостатин. Этот гормон образуется и в кишеч-
6. Эндокринная нервная система — регулятор функций ч процессов в организме • 301
нике, где тормозит всасывание глюкозы и тем а мым уменьшает ответную
реакцию бета-клеток на глюкозный стимул. Образование в поджелудочной
железе и кишечнике пептидов, аналогичных мосговым, например сомато-
статина, подтверждает существование в организд* е единой APUD-системы.
Секреция глюкагона стимулируется снижением уровня глюкозы в крови,
гормонами желудочно-кишечного тракта (ЖИП гастрин, секретин, холе-
цистокинин-панкреозимин) и при уменьшении в крови ионов Са2+.
Подавляют секрецию глюкагона инсулин, сомато патин, глюкоза крови и
Са2+. В эндокринных клетках кишечника образуется глюкагоноподобный
пептид-1, стимулирующий всасывание глюкозы и секрецию инсулина
после приема пищи. Клетки желудочно-кишечного тракта, продуцирующие
гормоны, являются своеобразными «приборами раннего оповещения»
клеток панкреатических островков о поступлении пищевых веществ в
организм, требующих для утилизации и рас пределе шя участия
панкреатических гормонов. Эта функциональная взаимосвязь нашла отражение в
термине «гастро-энтеро-панкреатическая система».
6.7.1.1. Физиологические эффекты инсулина
Действие инсулина на клетки-мишени начинается после его связывания со
специфическими димерными мембранными рецепторами (рис. 6.22), при
этом внутриклеточный домен рецептора обладае г тирозинкиназной
активностью. Инсулин-рецепторный комплекс не только передает сигнал внутрь
клетки, но и частично путем эндоцитоза поступит внутрь клетки к лизо-
сомам. Под влиянием лизосомальной протеазы инсулин отщепляется от
рецептора, при этом последний либо разрушается, либо возвращается к
мембране и вновь встраивается в нее. Многокргтное перемещение
рецептора от мембраны к лизосомам и обратно к мембране носит название ре-
циклизация рецептора. Процесс рециклизации вакен для регуляции колич-
ства инсулиновых рецепторов, в частности обес течения обратной
зависимости между концентрацией инсулина и количеством мембранных
рецепторов к нему.
Образование инсулин-рецепторного комплекса активирует тирозинки-
назу, запускающую процессы фосфорилирован ля внутриклеточных
белков. Происходящее при этом аутофосфорилирование рецептора ведет к
усилению первичного сигнала. Инсулин-рецепторный комплекс вызывает
активирование фосфолипазы С, образование вторичных посредников
инозитолтрифосфата и диацилглицерола, актипацию протеинкиназы С,
ингибирование цАМФ. Участие нескольких систем вторичных
посредников объясняет многообразие и различия эфф( ктов инсулина в разных
тканях.
Инсулин оказывает влияние на все виды обмгна веществ, способствует
анаболическим процессам, увеличивая синтез ггикогена, жиров и белков,
тормозя эффекты многочисленных контринсуля рных гормонов
(глюкагона, катехоламинов, глюкокортикоидов и соматотэопина). Все эффекты
инсулина по скорости их реализации подразделяют на 4 группы: очень
быстрые (через несколько секунд) — гиперполяризация мембран клеток (за
исключением гепатоцитов), повышение проницаемости для глюкозы,
активация Na-K-АТФазы, входа К+ и откачивания Na , подавление Са-насоса и
задержка Са2+; быстрые эффекты (в течение нес кольких минут) —
активация и торможение различных ферментов, подав.г яющих катаболизм и
усиливающих анаболические процессы; медленные процессы (в течение
нескольких часов) — повышенное поглощение ами -юкислот, изменение син-
302 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Молекула инсулина
Внеклеточный домен реце птора
Трансмембранный домеь
рецептора
Внутриклеточный домен рецептора
\^
\ j; Молекулы
\ / ГПЮТ-4
Активация тирозинкиназы
\
Фосфорилирование
Аутофосфорилирование-
Активация внутри! лет'очных белков, биологические эффекты
у у у у у
Синтез липидов Синтез гликогена Рост и экспрессия Синтез белков Транспорт
генов глюкозы
Рис. 6.22. Схема механизма i ействия инсулина на клетку-мишень.
цифическим рецептором вызывает активацию тирозинкина-
Взаимодействие инсулина со сш
зы, связанной с внутриклеточны
ние внутриклеточных белков, в т
рецептора инсулина, усиливают
клеточных белков ведет к актива)
ле и переносчиков ГЛЮТ-4, обе<
« доменом рецептора. Следствием является фосфорилирова-
ом числе и аутофосфорилирование внутриклеточного домена
^e тирозинкиназную активность. Фосфорилирование внутри-
щи ферментов, увеличению синтеза новых белков, в том чис-
печивающих транспорт в клетку молекул глюкозы.
теза РНК и белков-ферме «ов; очень медленные эффекты (от часов до
суток) — активация митогенсза и размножения клеток.
Важнейшим эффектом инсулина в организме является увеличение в
20—50 раз транспорта глю созы через мембраны мышечных и жировых
клеток путем облегченной диффузии по градиенту концентрации с помощью
чувствительных к гормон) мембранных белковых переносчиков,
называемых ГЛЮТ. В мембранах разных видов клеток выявлены 6 типов ГЛЮТ
(рис. 6.23), но только один из них — ГЛЮТ-4 — является инсулинозависи-
мым и находится в мембранах клеток скелетных мышц, миокарда,
жировой ткани.
Инсулин влияет на угле водный обмен, что проявляется:
1) активацией утилизации глюкозы клетками,
2) усилением процессов фосфорилирования;
3) подавлением распад; и стимуляцией синтеза гликогена;
4) угнетением глюконеогенеза;
5) активацией процессов гликолиза;
6) гипогликемией.
Действие инсулина на белковый обмен состоит в: 1) повышении
проницаемости мембран для ам шокислот; 2) усилении синтеза иРНК; 3)
активации в печени синтеза av инокислот; 4) повышении синтеза и подавлении
распада белка.
Na-глюкозный
котранспорт
Переносчик 1-го
типа
Сосудистый
эндотелий гематоэнце-
фалического
барьера, клетки тканей
в функциональном
покое
Переносчик 2-го
типа
Клетки,
поставляющие глюкозу в
кровь (печень,
базолатеральные
мембраны клеток
эпителия
кишечника, проксимальных
канальцев почки),
(3-клетки островков
Лангерганса
Переносчик 3-го
типа
Переносчик 4-го
типа
Нервные клетки
Мышечные и
жировые клетки
Переносчик 5-го
типа
Эпителий тонкого
кишечника
Переносчик 6-го
типа
Апикальная
мембрана эпителия
тонкого
кишечника, проксимальных
канальцев почек
Переносчик 2-го типа в базолатеральной
мембране проксимальных канальцев
Рис. 6.23. Схема транспорта глюкозы через клеточные мембраны. Переносчики имеют общее название ГЛЮТ-1, 2, 3, 4, 5, 6.
Только ГЛЮТ-4 является инсулинозависимым.
304 • РЕГУЛИРУЮЩИЕ И УП ЯВЛЯЮЩИЕ СИСТЕМЫ
Основные эффекты инс/лина на липидный обмен:
• стимуляция синтеза свободных жирных кислот из глюкозы;
• стимуляция синтеза . шпопротеиновой липазы в клетках эндотелия
сосудов и благодаря этому активация гидролиза связанных с липо-
протеинами крови триглицеридов и поступления жирных кислот в
клетки жировой ткаш ;
• стимуляция синтеза триглицеридов;
• подавление распада ж дра;
• активация окисления кетоновых тел в печени.
Благодаря влиянию на неточную мембрану инсулин поддерживает
высокую внутриклеточную концентрацию ионов калия, что необходимо для
обеспечения нормальной в эзбудимости клеток.
Широкий спектр метаболических эффектов инсулина в организме
свидетельствует о том, что гормон необходим для осуществления
функционирования всех тканей, оргаг ов и физиологических систем, реализации
эмоциональных и поведенческих актов, поддержания гомеостазиса,
осуществления механизмов приспособления и защиты организма от
неблагоприятных факторов среды.
Недостаток инсулина (о гносительный дефицит по сравнению с уровнем
контринсулярных гормоно:!, прежде всего глюкагона) приводит к
сахарному диабету. Избыток HHcyj ина в крови, например при передозировке,
вызывает гипогликемию с эезкими нарушениями функций центральной
нервной системы, использующей глюкозу как основной источник энергии
независимо от инсулина.
6.7.1.2. Физиологические э(, уфекты глюкагона
Глюкагон является мощным контринсулярным гормоном и его эффекты
реализуются в тканях чере} систему вторичного посредника аденилатцик-
лаза—цАМФ. В отличие о' инсулина, глюкагон повышает уровень сахара
крови, в связи с чем его называют гипергликемическим гормоном.
Основные эффекты глюкагона проявляются в следующих сдвигах метаболизма в
организме:
• активация гликогенолиза в печени и мышцах;
• активация глюконеоп неза;
• активация липолиза и подавление синтеза жира в адипоцитах;
• повышение синтеза кетоновых тел в печени и угнетение их
окисления;
• стимуляция катаболи: ма белков в клетках тканей, прежде всего
печени, и увеличение синтеза в ней мочевины.
Образующиеся в острсвках Лангерганса гастрин и панкреатический
полипептид основную рол> играют в регуляции процессов пищеварения,
их эффекты и физиолог* ческая роль рассмотрены в соответствующей
главе.
6.7.2. Регуляторные функции гормонов половых желез
Половые железы (семенники и яичники), наряду с функцией гаметообра-
зования, содержат клетки, синтезирующие и секретирующие половые
гормоны. При этом эндокринная функция присуща и специализированным
для внутренней секреции клеткам (клетки Лейдига семенников, клетки
желтого тела яичников), и клеткам, участвующим в процессах гаметогенеза
(клетки Сертоли семенников, клетки гранулезы яичников). Как семенни-
6. Эндокринная нервная система — регулятор функций i процессов в организме • 305
ки, так и яичники синтезируют и мужские гор\ оны (андрогены), и
женские половые гормоны (эстрогены), являющиеся стероидами —
производными холестерина.
6.7.2.1. Гормоны семенников и их эффекты в орггнизме
Основной структурой семенника, где происходи образование и
созревание гамет — сперматозоидов, — являются извит ые семенные канальцы.
Базальная мембрана изнутри покрыта отростчатыми клетками Сертоли и
располагающимися между ними клетками слерматогенного эпителия,
внутренний слой которых составляют сперматогонии. Клетки Сертоли,
наряду с обеспечением процесса созревания сперматид, поглощения
остатков их цитоплазмы при превращении сперма гиды в сперматозоид,
обладают секреторной и инкреторной функцией. Их секреторная функция
заключается в выделении в просвет канальца жидкости, в которой
плавают сперматозоиды. Инкреторная функция свод! тся к двум процессам: 1)
образованию и секреции с жидкостью в просвет канальца гормона ингиби-
на — основного тормозящего продукцию фоллит ропина механизма
обратной связи с гипофизом и 2) образованию и секэеции в периканальцевую
лимфу эстрогенов. Кровеносные капилляры не проникают в просвет
канальцев, а ветвятся между их петлями. Рядом с кровеносными
капиллярами расположены скопления клеток мезенхимнсго происхождения,
называемых клетками Лейдига. Эти клетки отделены от семенных канальцев
лимфатическими пространствами. Клетки Лейдига являются основными
продуцентами мужских половых гормонов, главным образом
тестостерона. Регуляция продукции гормонов семенниками осуществляется
преимущественно лютропином аденогипофиза, специфи4ески регулирующим
секреторную активность клеток Лейдига и продукц мо тестостерона, и
отчасти фоллитропином, меняющим активность клеток Сертоли и продукцию
ими эстрогенов и ингибина. Функциональная активность клеток Сертоли
и Лейдига регулируется влияниями через лимф} секретируемых ими
гормонов.
Основные метаболические и функциональные эффекты тестостерона:
• обеспечение процессов половой дифферениировки в эмбриогенезе;
• развитие первичных и вторичных половых признаков;
• формирование структур центральной нервной системы,
обеспечивающих половое поведение и функции;
• генерализованное анаболическое действие, обеспечивающее рост
скелета, мускулатуры, распределение подкожнс го жира;
• регуляция сперматогенеза;
• задержка в организме азота, калия, фосфате, кальция;
• активация синтеза РНК;
• стимуляция эритропоэза.
6.7.2.2. Гормоны яичников и их эффекты в организме
Гормонопродуцирующие клетки гранулезы фолликулов являются по
происхождению и функциям аналогом клеток Сертоли семенников, но их
функция регулируется не только гипофизарным фоллитропином, но в большей
мере лютропином. Основным гормоном грануле: ы является эстрадиол,
образуемый из предшественника тестостерона. В меньшем количестве грану-
леза образует эстрон, из которого в печени и пл< центе образуется эстриол.
Клетки гранулезы образуют в малых количества) и прогестерон, необходи-
i
306 * РЕГУЛИРУЮЩИЕ И УГРАВЛЯЮЩИЕ СИСТЕМЫ
мый для овуляции, но пивным источником прогестерона служат клетки
желтого тела, регулируем ле гипофизарным лютропином.
Секреторная активность этих эндокринных клеток характеризуется
выраженной цикличностью, связанной с женским половым циклом.
Последний обеспечивает интеграцию во времени различных процессов,
необходимых для осуществления репродуктивной функции — периодическую
подготовку эндометрия к имплантации оплодотворенной яйцеклетки,
созревание яйцеклетки и овуляцию, изменение вторичных половых признаков.
Эстрогены необходимы для процессов половой дифференцировки в
эмбриогенезе, полового созревания и развития женских половых признаков,
установления женского полового цикла, роста мышцы и железистого
эпителия матки, развития moj очных желез. В итоге эстрогены регулируют
половое поведение, овогенез, процессы оплодотворения и имплантации
яйцеклетки, развитие и дифференцировку плода, нормальный родовой акт.
Благодаря геномному механизму действия эстрогены подавляют
резорбцию кости, оказывают общее анаболическое действие, хотя и более слабое,
чем андрогены. Негеномьый механизм действия эстрогенов ведет к
задержке в организме азота воды и солей. Одним из важных негеномных
эффектов эстрогенов является активация под их влиянием NO-синтетазы
и образование оксида азе та в коронарных сосудах, что профилактирует
развитие у женщин ишемической болезни сердца. Эстрогены модулируют
секрецию инсулина и внутриклеточный гомеостазис кальция.
Распространенность рецепторов эстрогенов на мембранах разных типов клеток
организма (костные, мышечные, секреторные, нервные, соединительной ткани
и крови) и, соответственн э, множественность эффектов гормонов в
организме, объясняют причин 1 многочисленных функциональных изменений,
происходящих в женском организме при климаксе, когда секреция
эстрогенов резко снижается. Введение в организм женщины в этот период
экзогенных веществ с эстроген оподобным действием, в том числе и
растительного происхождения, позволяет существенно уменьшить выраженность и
характер функциональных проявлений климактерического периода.
Прогестерон является гермоном сохранения беременности (гестагеном),
так как ослабляет готовность мускулатуры матки к сокращению. Малые
концентрации гормона необходимы и для овуляции. Большие количества
прогестерона, образующиеся желтым телом, подавляют секрецию гипофи-
зарных гонадотропинов. Прогестерон обладает выраженным антиальдосте-
роновым эффектом, поэтому стимулирует натриурез.
6.8. Регуляторные функции гормонов клеток, сочетающих
выработку гормонов и неэндокринные функции
6.8.1. Регуляторные фткции гормонов плаценты
Плацента тесно анатомичхки и функционально связана с организмами
матери и плода, поэтому принято говорить о комплексе «мать—плацента-
плод», или «фетоплацентаэном комплексе». Синтез в плаценте эстриола
происходит не только из эгтрадиола матери, но и из дегидроэпиандросте-
рона, образуемого надпочечниками плода. Поэтому по экскреции с мочой
матери эстриола можно судить о жизнеспособности плода. В плаценте
образуется прогестерон, действующий преимущественно на мускулатуру
матки. С плацентарным прогестероном, например, связан временной
интервал между рождениями пледов при двойне.
Основная часть гормон эв плаценты у человека по своим свойствам и
6. Эндокринная нервная система — регулятор функщ 'й и процессов в организме • 307
даже строению напоминает гипофизарные гочадотропин и пролактин. В
наибольших количествах при беременности плацентой продуцируется хо-
рионический гонадотропин, оказывающий регул шторные эффекты не только
на процессы дифференцировки и развития п; ода, но и на метаболизм в
организме матери. Гормон обеспечивает в орг шизме матери задержку
солей и воды, необходимых для растущего плоде , стимулирует секрецию ва-
зопрессина, активирует механизмы иммунитет; у матери.
6.8.2. Регуляторные функции гормонов пимуса
Тимус (вилочковая железа) является центральным органом иммунитета,
обеспечивающим продукцию специфических Т-лимфоцитов. Тимоциты
секретируют в кровь гормональные факторь, оказывающие не только
влияние на дифференцировку Т-клеток, но и шзывающие ряд общих р'е-
гуляторных эффектов в организме. Основные эффекты гормонов тимуса
(тимозина, тимопоэтина, тимулина) описаны t главе 8 «Иммунная
система». Гормоны тимуса влияют на процессы синт еза клеточных рецепторов к
медиаторам и гормонам, стимулируют разруше -ше ацетилхолина в нервно-
мышечных синапсах, регулируют состояние уп еводного и белкового
обмена, а также обмена кальция, функции щитовидной и половых желез,
модулируют эффекты глюкокортикоидов, тироксин i (антагонизм) и соматотро-
пина (синергизм). В целом вилочковая железе рассматривается как орган
интеграции иммунной и эндокринной систем с рганизма.
6.8.3. Регуляторные функции гормонов гичек
В почках отсутствует специализированная эндокринная ткань, однако ряд
клеток обладает способностью к синтезу и сек )еции многих биологически
активных веществ, обладающих всеми свойствами классических гормонов.
Установленными гормонами почек являются: 1) кальцитриол — третий
кальцийрегулирующий гормон, 2) ренин — на1 альное звено ренин-ангио-
тензин-альдостероновой системы, 3) эритропозтин.
6.8.3.1. Синтез, секреция и физиологические эффекты калъцитриола
Кальцитриол является активным метаболитом витамина D3 и в отличие от
двух других кальцийрегулирующих гормонов - паратирина и кальцитони-
на —имеет стероидную природу. Синтез кальдитриола происходит в три
этапа (рис. 6.24). Первый этап протекает в кож?, где под влиянием
ультрафиолетовых лучей из провитамина образуется штамин D3 или холекальци-
ферол. Второй — связан с печенью, куда холека льциферол
транспортируется кровью и где в эндоплазматическом ретикул 'ме гепатоцитов происходит
его гидроксилирование по 25-му атому углерода с образованием 25(OH)D3.
Этот метаболит поступает в кровь и циркулирует в связи с
альфа-глобулином. Его физиологические концентрации не влияют на обмен кальция.
Третий этап осуществляется в почках, где в ипохондриях клеток
проксимальных канальцев происходит второе гидроксилирование и образуются
два соединения: l,25-(OH)2-D и 24,25-(OH)2-D. Первое — является
наиболее активной формой витамина D3, обладает мощным регуляторным
влиянием на обмен кальция в организме и называется кальцитриолом.
Образование в почках этого гормона регулируется паратирином, который
стимулирует гидроксилирование по первому атому углерода. Таким же
эффектом обладает и гипокальциемия. При избытке кальция в крови гидрокси-
308 • РЕГУЛИРУЮЩИЕ И УПР/ВЛЯЮЩИЕ СИСТЕМЫ
1,25 (ЭН)2 03или кальцитриол
24, 2!>(OH)2D3
Рис. 6.24. Схема образования к, шьцитриола или активной формы витамина D3.
Под воздействием ультрафиолетовых лучей в коже из холестерина образуется витамин D3;
поступая с кровью в печень, он подвс и ается первому гидроксилированию по 25-му атому
углерода, затем из печени с кровью noi адает в почки, где подвергается второму
гидроксилированию по 1-му атому углерода, что и i едет к образованию дважды гидроксилированного
витамина или кальцитриола.
Рис. 6.25. Основные эффекты \ альцитриола.
Под влиянием паратирина почка се третирует кальцитриол, основные эффекты которого
(жирные стрелки) заключаются в стим} пяции всасывания в кишечнике в кровь ионов кальция и
фосфата и усилении их захвата кост ной тканью. Эффекты кальцитриола на почку (стимуляция
реабсорбции кальция и фосфора) в сражены слабее.
6. Эндокринная нервная система — регулятор функции и процессов в организме • 309
Са+
Са+
Паратирин
■+ р
Кальцитриол
Р
1 Кальцитонин
Паратирин
-< Са+
Кальцитонин
Са++ ►
Кальцитриол
О.
S
ь
го
о.
го
с
Рис. 6.26. Эффекты трех кальцийрегулирующих горм >нов на органы-мишени.
В почке паратирин и кальцитриол активируют реабсорбцик кальция, а кальцитонин ее
угнетает. И паратирин, и кальцитонин подавляют реабсорбцию < юсфата. В кишечнике
кальцитриол и паратирин активируют всасывание кальция и фосфата Кальцитонин и кальцитриол
способствуют отложению кальция в костях, а паратирин акти шрует резорбцию кости и выход
кальция в кровь.
лирование происходит по 24-му атому углерода
единение — 24,25-(OH)2-D, которое обладает сп
цию паратирина по принципу обратной связи,
происходит в печени.
Основной эффект кальцитриола (рис. 6.25)
всасывания кальция в кишечнике. Гормон стал
сывания: захват ворсинчатой поверхностью
транспорт, выброс кальция через базолатеральн
ную среду. Действие кальцитриола на эпители
состоит в индуцировании синтеза энтероцито
связывающих и транспортирующих белков — л
повышает в кишечнике и всасывание фосфато
мона заключаются в стимуляции реабсорбции <
цевым эпителием. Эффекты кальцитриола на
прямой стимуляцией остеобластов и обеспечен!
но всасывающимся в кишечнике кальцием, что
лизацию кости. Эффекты кальцитриола, как и
делятся на геномные и негеномные. Геномти
синтез кальбайндинов, активирование остеоблас
ни. Увеличение транспорта кальция внутрь кле
и сердечной мышцах, в остеобластах, энтерош
и синтезируется второе со-
)собностью угнетать секре-
1нактивация кальцитриола
заключается в активации
улирует все три этапа вса-
клетки, внутриклеточный
'Ю мембрану во внеклеточ-
альные клетки кишечника
vm специальных кальций-
альбайндинов. Кальцитриол
i. Почечные эффекты гор-
оосфата и кальция каналь-
костную ткань связаны с
1ем костной ткани усилен-
активирует рост и минера-
зсех стероидных гормонов,
е эффекты обусловливают
тов и синтеза костной тка-
гок, например в скелетных
тах, гепатоцитах и клетках
310 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
околощитовидных желез, происходит быстро и обусловлено негеномным
действием гормона. Под влиянием гормонрецепторного мембранного
комплекса в клетках происх* >дит образование вторичного посредника диацил-
глицерола и активация г ротеинкиназы С. Кальцитриол меняет в клетке и
уровень цАМФ и цГМФ, что ведет к модификации геномного эффекта.
Наличие специфических рецепторов к гормону у многих клеток тканей (в
молочной железе, эндокринных железах, нервной системе), способность
кальцитриола активировс ть транспорт кальция в большинстве из них
свидетельствуют о широком спектре эффектов этого гормона.
Участие трех кальций] югулирующих гормонов в гомеостазисе кальция и
фосфора показано на рис. 6.26.
Недостаточность кальцитриола проявляется в виде рахита, т. е.
нарушения созревания и кальцификации хрящей и кости у детей, либо
остеомаляции, т. е. падения минер шизации костей после завершения роста скелета.
При этом сдвиги уровня кальция в крови и клетках обусловливают
угнетение нейромышечной возбудимости и мышечную слабость.
6.8.3.2. Образование ренича и основные функции
ренин-ангиотензи н-альдостероновой системы
Ренин образуется в виде г роренина и секретируется в юкстагломерулярном
аппарате (ЮГА) (от латинских слов juxta — около, glomerulus — клубочек)
почек миоэпителиоидны vm клетками приносящей артериолы клубочка,
получившими название юкстагломерулярных (ЮГК). Структура ЮГА
приведена на рис. 6.27. В ЮГА кроме ЮГК также входит прилегающая к
приносящим артериолам час ь дистального канальца нефрона, многослойный
эпителий которого образ} ет здесь плотное пятно — macula densa. Секреция
ренина в ЮГК регулируется четырьмя основными влияниями. Во-первых,
величиной давления крови в приносящей артериоле, т. е. степенью ее
растяжения. Снижение растяжения активирует, а увеличение — подавляет
секрецию ренина. Во-втозых, регуляция секреции ренина зависит от
концентрации натрия в моч« дистального канальца, которая воспринимается
macula densa — своеобразным Na-рецептором. Чем больше натрия
оказывается в моче дистальногэ канальца, тем выше уровень секреции ренина.
В-третьих, секреция ренина регулируется симпатическими нервами, ветви
которых заканчиваются hi ЮГК, медиатор норадреналин через бета-адре-
норецепторы стимулирует секрецию ренина. В-четвертых, регуляция
секреции ренина осуществляется по механизму отрицательной обратной
связи, включаемой уровнем i крови других компонентов системы — ангиотен-
зина и альдостерона, а т 1кже их эффектами — содержанием в крови
натрия, калия, артериальным давлением, концентрацией простагландинов в
почке, образующихся под влиянием ангиотензина.
Кроме почек образование ренина происходит в эндотелии кровеносных
сосудов многих тканей, мюкарде, головном мозге, слюнных железах, клу-
бочковой зоне коры надпочечников.
Секретированный в кр )вь ренин вызывает расщепление
альфа-глобулина плазмы крови — ангиотензиногена, образующегося в печени. При этом в
крови образуется (рис. 6.1-8) малоактивный декапептид ангиотензин-I,
который в сосудах почек, легких и других тканей подвергается действию
превращающего фермента (карбоксикатепсин, кининаза-2), отщепляющего от
ангиотензина-1 две аминокислоты. Образующийся октапептид ангиотен-
зин-П обладает большим числом различных физиологических эффектов, в
том числе стимуляцией ктубочковой зоны коры надпочечников, секрети-
6. Эндокринная нервная система — регулятор функщ и и процессов в организме • 311
Дистальный.
каналец
Юкстагломерулярные
клетки
Приносящая артериола
Мезангиальные
клетки
Капилляры
Рис. 6.27. Схема юкстагломерулярного аппарата пс ек, включающего
юкстагломерулярные клетки стенки приносящей артериолы, ь тетки плотного пятна (macula
densa) стенки дистального канальца и мезангиальньк клетки. Основное место
выработки ренина — юкстагломерулярные клетки принос идей артериолы клубочка.
Симпатическая активация
1
АД
югк
т
-*—Macula -*—NaCI
densa
Ренин
Ангиотензиноген 1 2 3 4 5 6 7 8
Asp-Arg-Val-Tyr-lle-His-Prc—Phe-Hs-Leu-Leu-Val-Tyr-Ser-R
10 111 12 13 14
Ангиотензин-I
Ангиотензин-Н
1 2 3 4 5 6
8
9
10
Asp-Arg-Val-Tyr-lle-His-Pro-PhefH's-Leu
*— Зипептидкарбоксилаза (ПФ)
1 2 3 4 5 6 7 8
Asp-Arg-Val-Tyr-lle-His-Pro-Phe
Рис. 6.28. Активация секреции ренина и образовани■■• в крови ангиотензина-И.
Показаны три вида стимулов для секреции ренина юкск
снижение АД в приносящей артериоле клубочка, повып
влияния macula densa, вызванные сдвигами уровня натрия,
молекулы белка ангиотензиногена отщепляется декапеги
подвергается воздействию превращающегося фермента (П
эндотелия сосудов легких, почек и др., отщепляющей две a^
пептид является ангиотензином-Н.
гломерулярными клетками почек:
ение симпатической активности,
Лод влиянием фермента ренина от
ид — ангиотензин-I. Этот пептид
Ф) дипептидкарбоксилазы клеток
инокислоты. Образующийся окта-
312 • РЕГУЛИРУЮЩИЕ И УПР ЧВЛЯЮЩИЕ СИСТЕМЫ
рующей альдостерон, что и
гиотензин-альдостероновой.
альдостерона, обладает след
• вызывает сужение арте
• активирует симпатиче«
так и способствуя сип
сах,
• повышает сократимое!
• увеличивает реабсорбь
цию в почках,
• способствует формиро
Таким образом, ренин-а
в регуляции системного и
рующей крови, водно-солев
гало основание называть эту систему ренин-ан-
\нгиотензин-П, кроме стимуляции продукции
. ющими эффектами:
риальных сосудов,
кую нервную систему как на уровне центров,
гезу и освобождению норадреналина в синап-
ь миокарда,
ию натрия и ослабляет клубочковую фильтра-
!анию чувства жажды и питьевого поведения.
1Гиотензин-альдостероновая система участвует
почечного кровообращения, объема циркули-
)го обмена и поведения.
6.8.4. Регуляторные эф ренты гормонов сердца
Миоцитами предсердий (пр
гормон с установленной х
предсердный натрийуретиче
ливается в специфических i
ся в кровь под влиянием f
сердий объемом крови, уро
симпатических нервов, соде
Физиологические эффо
многих органах и тканях о
ные рецепторы (рис. 6.29).
слаблении гладких мышц с
нии артериального давлен!
."имущественно правого) образуется пептидный
омической структурой, получивший название
ский гормон, или атриопептид. Гормон накап-
ранулах саркоплазмы миоцитов и секретирует-
яда регуляторных стимулов: растяжения пред-
шя натрия в крови, эффектов блуждающего и
ржания в крови вазопрессина.
гы атриопептида многообразны, так как во
жаружены специфические для него мембран-
Сосудистые эффекты гормона состоят в рас-
>судов и вазодилатации (через цАМФ), сниже-
1Я. Кроме того, гормон повышает проницае-
Повышение коронарного
тонуса, падение
сердечного выброса
Расслабление
мышц кишки
Уменьшение секреции
соматотропина
Снижение секреции
альдостерона
Увеличение фильтрации,
подавление реабсорбции
Na++, диурез и натрий-
урез, снижение секреции
ренина
Расширение артериол
Рис. 6.29. Основные эффекты атриопептида — вазодилатирующего и натрийурети-
ческого гормона. Атриопептид является полным антагонистом ренин-ангиотензин-
альдостероновой системы, так как подавляет и образование каждого элемента
системы, и вызываемые ими эфф( кты.
6. Эндокринная нервная система — регулятор функций и процессов в организме • 313
мость гистогематических барьеров и увеличивает транспорт воды из крови
в тканевую жидкость.
Почечные эффекты атриопептида включают: 1) повышение экскреции
натрия (до 90 раз) и хлора (до 50 раз) в связи с подавлением их реабсорб-
ции в канальцах. Гормон — в 1000 раз более эффективный натрийуретик,
чем фуросемид; 2) выраженное диуретическое действие за счет увеличения
клубочковой фильтрации и подавления реабсорбции воды; 3) подавление
секреции ренина, ингибирование эффектов ангиотензина-П и альдостеро-
на, т. е. гормон является полным антагонистом РААС.
Атриопептид, кроме того, расслабляет гладкую мускулатуру кишечника,
уменьшает величину внутриглазного давления, объема и давления ликвора
в желудочках мозга.
Близкий по натрийуретическому эффекту гормон выявляется и в ткани
головного мозга.
Помимо атриопептида в предсердиях образуются атриопептины,
повышающие артериальное давление и обладающие антидиуретическим
эффектом. Атриопептины участвуют в регуляции питьевого поведения, солевого
аппетита и жажды. В малых количествах в сердце образуются соматоста-
тин, ангиотензин-Н и релаксин, обладающие хронотропным влиянием на
миокард.
6.8.5. Регуляторная функция гормонов сосудистого эндотелия
Клетки сосудистого эндотелия синтезируют и выделяют через апикальную
и базальную мембраны три группы гормонов: сосудосуживающие (эндоте-
лины, тромбоксаны), сосудорасширяющие (оксид азота, гиперполяризую-
щий фактор, простагландины) и факторы адгезии и агрегации клеточных
элементов.
Эндотелшы (ЭТ) являются крупными полипептидами (21
аминокислота), образуются путем частичного гидролиза молекулы предшественника
или «большого эндотелина», состоящей из 38 аминокислот, под влиянием
связанного с мембраной клетки и находящегося в цитоплазматических
везикулах эндотелинпревращающего фермента. Этот фермент локализован в
эндотелии сосудов легких, сердца, почек, плаценты, поджелудолчной
железы, надпочечников, головного мозга и даже в сосудистых гладких
мышцах. Наличие двух форм эндотелинпревращающего фермента (мембрано-
связанной и внутриклеточной) определяет и два места образования эндоте-
линов — в цитоплазме и на поверхности клеточной мембраны. Эндотелин-
превращающий фермент ведет не только к образованию молекул
эндотелина, но способен вызывать гидролиз и инактивацию на поверхности эн-
дотелиоцитов ряда регуляторных пептидов и гормонов (инсулина, бради-
кинина, нейротензина и др.). Активация эндотелинпревращающего
фермента происходит под влиянием цитокинов.
Эффекты эндотелинов обусловлены их взаимодействием со
специфическими мембранными рецепторами двух типов — ЭТ-А и ЭТ-В. Следствием
специфического связывания эндотелина с рецептором является активация
систем вторичных посредников (фосфолипаза С, ИФЗ, диацилглицерол,
цГМФ и цАМФ, фосфолипазы D и А2). Различают прямые и
опосредованные сосудистые эффекты эндотелинов. Прямые эффекты заключаются в
действии на гладкие мышцы сосудов. Связывание эндотелина с
рецепторами гладких мышц сосудов вызывает их сокращение и вазоконстрикцию
(через образование ИФЗ и повышение внутриклеточного Са2+), а также
стимуляцию митогенеза и пролиферации клеток {через активацию тиро-
314 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
зинкиназы и фосфорилирование тирозина). Взаимодействие эндотелинов с
рецепторами клеток эндотелия вызывает реализацию опосредованных
эффектов, в виде высвобождениД из эндотелия вазоактивных факторов,
приводящих к расширению сосудов (N0, гиперполяризующий фактор, про-
стагландины). Кроме сосудистых эффектов эндотелины изменяют
секрецию гормонов гипофиза и надпочечников, стимулируют секрецию атрио-
пептида миокардом, угнетают эффекты вазопрессина в почках,
способствуя диурезу и натрийурезу, увеличивают реакции сердца на симпатические
стимулы.
Среди сосудорасширяющих гормонов эндотелия основное место по
выраженности и распространенности эффекта занимает оксид азота (N0),
постоянно образующийся из L-аргинина под влиянием фермента NO-син-
тетазы. Одним из стимулов, активирующих фермент и образование оксида
азота, является механическое растяжение стенки сосудов. Активация
фермента и синтез оксида азота происходят при действии на мембранные
рецепторы эндотелиоцитов ацетилхолина, адреномедуллина, гистамина, бра-
дикинина, АТФ, а также в результате повышения в клетке эндотелия
концентрации ионизированного Са2+. NO-синтетаза помимо образования
оксида азота стимулирует синтез некоторых цитокинов: интерлейкина — 1(3,
альфа-интерферона, тогда как другие цитокины: ИЛ-4, ИЛ-8, ИЛ-10,
напротив, подавляют активацию фермента.
Вазодилатирующий эффект N0 опосредуется активацией образования в
гладкомышечных клетках цГМФ. Оксид азота также подавляет вазоконст-
рикторное действие ангиотензина-Н. Синтезированный клетками
эндотелия оксид азота выделяется не только через базальную мембрану в сторону
гладкомышечных клеток кровеносных сосудов, но и через апикальную
мембрану, где тормозит адгезию тромбоцитов и лейкоцитов крови к эндо-
телиальной выстилке стенки сосуда. Антиагрегантное действие оксида
азота отчасти опосредовано простациклином, образующимся в эндотелии.
В нервной системе N0 является модулятором синаптической передачи,
так как выявлено его поступление в синаптическую щель и показано инги-
бирующее влияние на выделение медиаторных аминокислот.
Эндотелиалъный гиперполяризующий фактор также вызывает дилатацию
артериальных и венозных сосудов, но отличается от N0 механизмом
действия — способностью активировать ионные каналы (К+,СГ) и снижать
возбудимость эндотелиальных клеток.
К числу факторов регуляции адгезии и агрегации клеток относятся
многочисленные интегрины и селектины, образуемые клетками эндотелия.
6.8.6. Регуляторная функция гормонов желудочно-кишечного
тракта
Клетки эпителия желудка и двенадцатиперстной кишки обладают
способностью секретировать большое количество пептидных соединений, многие
из которых выявляются также в головном мозге. Это дало основание
рассматривать продуцирующие пептиды клетки в качестве единой APUD-сис-
темы организма. Основной функцией гастроинтестинальных гормонов
является регуляция процессов пищеварения, а мозговых пептидов —
пищевого поведения. В связи с этим гастроинтестинальные гормоны, их природа
и регуляторные эффекты представлены в главе 15 «Функции
пищеварительной системы».
6. Эндокринная нервная система — регулятор функций и процессов в организме • 315
6.9. Роль эндокринной системы в неспецифических
приспособительных реакциях
6.9.1. Гормональное обеспечение общего адаптационного
синдрома, или стресса
Примером неспецифического участия эндокринной системы в
приспособительных реакциях организма являются изменения ее деятельности при
стрессе. Состояние стресса возникает как следствие действия на организм
любых сильных, в том числе экстремальных и повреждающих,
раздражителей. При действии на организм экстремальных факторов неспецифические
реакции стресса прежде всего направлены на стимуляцию энергетического
обеспечения приспособительных процессов. Ведущую роль в этих
неспецифических реакциях играют катехоламины и глюкокортикоиды, в
значительных количествах мобилизуемые в кровь (рис. 6.30). Активируя катабо-
лические процессы, эти гормоны ведут к гипергликемии — одной из
начальных реакций субстратного энергообеспечения. Как следствие
гипергликемии на некоторое время повышается в крови уровень инсулина.
Метаболические перестройки при таком гипергормональном профиле
связаны, прежде всего, с активацией в печени фосфорилазы и гликогенолизом,
а поступающая в кровь глюкоза под влиянием инсулина интенсивно
утилизируется тканями, прежде всего скелетными мышцами, что увеличивает
их работоспособность и
повышает теплообразование в
организме. Жиромобили-
зующий эффект глюкокор-
тикоидов и катехоламинов
способствует повышению в
крови второго важнейшего
энергетического субстрата —
свободных жирных кислот.
Однако подобный
«форсированный» режим функцио-
Стрессорное воздействие
Нервные рецепторы
Афферентная информация
Рис. 6.30. Схема участия
эндокринной системы в
компенсаторных реакциях при стрессе.
Чрезмерные, часто повреждающие
воздействия среды, раздражая
рецепторы, вызывают мощный поток
афферентных импульсов в
центральную нервную систему, что
ведет к активации гипоталамических
центров. Быстрым следствием этих
процессов является симпатическая
активация и поступление в кровь из
надпочечников катехол-аминов, что
вызывает срочные адаптивные
реакции. Одновременно возрастает ней-
росекреция коргиколиберина,
обусловливающая повышение
активности гипоталамо-аденогипофизарно-
надпочечниковой оси регуляции,
способствующей реализации
компенсаторных реакций за счет
активации их энергообеспечения.
Гипоталамус
Кортиколиберин
Активация
симпатической нервной системы
Кортикотропин
Кора
Мозговое вещество
надпочечников
Кортикостероиды
Катохоламины
Адаптивные реакции
316 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
нирования эндокринной системы из-за ограниченности функциональных
резервов не может длиться долго, вскоре содержание инсулина в крови
уменьшается, что носит название «функциональный транзиторный
диабет». Это необходимое условие для усиления жиромобилизующего эффекта
глюкокортикоидов и активации глюконеогенеза. Важнейшим источником
глюкозы как энергетического материала в этот период становится глюко-
неогенез, но на образование глюкозы расходуется дефицитный
пластический материал — аминокислоты. Необходимым условием длительно
повышенного энергоснабжения является переключение энергетического обмена
с углеводного типа на липидный, тем более что углеводные резервы в виде
гликогена достаточно быстро оказываются практически исчерпанными.
Постепенно снижается продукция глюкокортикоидов, устанавливается
новое гормональное соотношение: нерезко повышенный уровень
глюкокортикоидов при более значительном снижении уровня инсулина. Этот новый
уровень функционирования эндокринной системы способствует
восстановлению равновесия между катаболическими и анаболическими
процессами, расходы белка на энергетические нужды снижаются. Жиромобили-
зующий эффект гормональной перестройки и образование транспортной
формы эндогенного жира — липопротеинов очень низкой плотности —
приводят к тому, что растет использование клетками липидов как
источников энергии. Жирные кислоты интенсивно окисляются в скелетных
мышцах, миокарде и печени. Образующиеся при этом кетоновые тела
усиленно окисляются в мышечной ткани, почках, а также сердце и мозге.
Особенно резко ограничивается потребление углеводов мышечной и
жировой тканью, что экономит глюкозу для углеводзависимых тканей —
головного мозга, кроветворной ткани и эритроцитов, в некоторой степени —
миокарда. Таким образом, происходящие при стрессе гормональные и
метаболические перестройки обеспечивают длительное неспецифическое
повышение энергообеспечения приспособительных процессов.
Стресс как неспецифическая реакция приспособления и компенсации
нарушенных функций может при резкой выраженности сопровождаться и
активацией гипоталамо-гипофизарно-тиреоидной системы, приводя к
росту в крови уровня тиреоидных гормонов. Физиологический стресс,
например эмоциональное напряжение, напротив, характеризуется снижением
гормональной активности щитовидной железы. Гиперфункция
щитовидной железы в ответ на повреждение тканей является неспецифической
реакцией компенсации, поскольку тиреоидные гормоны, благодаря
стимуляции синтеза белков, способствуют клеточным регенеративным процессам
и репарации поврежденных структур. Активация гипоталамо-гипофизарно-
тиреоидной системы может носить и черты специфической компенсации,
например в условиях холодового стресса, как компенсация термического
угнетения метаболизма. Стресс при экстремальных состояниях
сопровождается активацией и других гормональных систем — гипоталамо-гипофи-
зарно-андрогенной и гипоталамо-нейрогипофизарной. Повышение
активности системы гонадолиберины—гонадотропины—андрогены (одним из
проявлений является повышение либидо) и избыточно секретируемые при
этом андрогены за счет анаболического эффекта способствуют репаратив-
ным процессам.
При хирургическом и эмоциональном стрессе повышается секреция
вазопрессина. Компенсаторное значение активации секреции вазопрессина
заключается в облегчении консолидации процессов памяти, формирования
аналгезии, потенцировании эффектов кортиколиберина на секрецию кор-
тикотропина, восстановлении нарушенной при кровопотере гемодинами-
6. Эндокринная нервная система — регулятор функций и процессов в организме • 317
ки. Избыточная секреция вазопрессина при травмах является примером
опережающей перестройки эндокринных механизмов компенсации,
реализующей избыточный гормональный сигнал для предотвращения
возможности потери организмом воды при кровотечении. Реакция гипоталамо-
нейрогипофизарной системы может быть и специфической компенсацией
возникших в организме нарушений водно-солевого и осмотического го-
меостазиса (осмотический стресс).
6.9.2. Гормональная регуляция местных компенсаторных реакций
Происходящие при стрессе гормональные перестройки, помимо активации
энергетического обеспечения тканей и, соответственно, функциональной
активации органов, способствуют местным тканевым компенсаторным
реакциям — регенерации и репарации, равно как и развертыванию
воспалительной реакции. Изменения кровообращения в участках повреждения,
мобилизация в поврежденные ткани пластического материала, регуляция
процессов клеточного деления и пролиферации, утилизации материала
поврежденных клеток — далеко не полный перечень компенсаторных
процессов, обеспечиваемых неспецифическими эффектами гормонов. Даже
используемые как липидный источник энергии липопротеиды низкой и
очень низкой плотности, проникая в клетки с помощью специального ре-
цепторного аппарата, подвергаются в них лизосомному расщеплению с
образованием аминокислот, холестерина, фосфолипидов и др., идущих на
пластические цели и способствующих регенерации. Важнейшую роль в
организации тканевых компенсаторных реакций (регенерации, воспаления)
играют местные «тканевые гормоны», образование которых во многом
зависит от эндокринных влияний на клетки. Среди таких «тканевых
гормонов» важнейшую роль играют продукты перекисного окисления арахидо-
новой кислоты, биогенные амины и кинины.
Образование арахидоновой кислоты происходит из мембранных
фосфолипидов при активации фосфолипазы А2, чему способствуют многие
пептидные гормоны через вторичный посредник диацилглицерол, а также
нейромедиаторы, химические и физические повреждающие факторы.
Одним из наиболее мощных ингибиторов фосфолипазы является кортизол.
Из арахидоновой кислоты под влиянием специфических ферментов
происходит образование трех основных групп соединений: лейкотриенов (при
действии липоксигеназы), эпоксидов (при действии эпоксигеназы) и про-
стагландинов (под влиянием циклооксигеназы). В дальнейшем, в
зависимости от наличия в тканях определенного типа ферментов, происходит
образование простагландинов (PGE, PGF, тромбоксана, простациклина и др.)
и лейкотриенов (LTB, LTC, LTD, LTE). В механизме действия
простагландинов на клетки важное место занимает изменение активности аденилат-
циклазы и уровня цАМФ. Простагландины участвуют в регуляции многих
физиологических процессов — тонуса артериальных сосудов, сокращения
гладких мышц матки, овуляции, агрегации тромбоцитов и свертывания
крови, моторики кишечника и секреции соляной кислоты в желудке,
терморегуляции, проницаемости сосудов, модуляции функций лейкоцитов,
тонуса гладких мышц бронхов и др. Простагландины способны
индуцировать и усиливать воспалительную реакцию тканей. Благодаря реализации
эффектов через цАМФ и Са2+, простагландины способны менять секрецию
гормонов, а в органах-мишенях модулировать их эффекты. Так,
увеличивая уровень цАМФ после связи с собственным мембранным рецептором,
простагландины имитируют и модулируют эффекты тиротропина, корти-
318 • РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
котропина, лютропина, паратирина, а снижая уровень цАМФ в других
тканях — ослабляют гормональные эффекты, например липолитическое
действие гормонов на жировую ткань, антидиуретическое действие вазопрес-
сина в почечных канальцах. Очевидно, что эти эффекты простагландинов
могут обусловливать как приспособительные реакции к действию
неблагоприятных факторов среды, так и компенсаторные неспецифические
реакции в условиях патологии. Приток в мышцы жирных кислот повышает
синтез простагландинов, что благодаря активации аденилатциклазы
повышает содержание цАМФ в клетках. Результатом является стимуляция
РНК-полимеразной активности и повышение синтеза РНК в ядрах
мышечных клеток, а соответственно и синтеза белков, что обеспечивает
физиологическую регенерацию сократительного аппарата клеток и их
гипертрофию. Простагландины ускоряют включение аминокислот в белки,
оснований в РНК и ДНК, активируют синтез коллагена и стимулируют
заживление ран.
В клетках, например, эндотелия артериол при оксидативном
превращении арахидоновой кислоты с участием цитохрома Р-450 и эпоксигеназы
происходит образование эпоксида, получившего название эндотелиального
гиперполяризующего фактора, способствующего активации калиевых и
хлорных каналов гладкомышечных клеток и падению их возбудимости.
Нередко повреждение тканей (прежде всего иммунной природы)
сопровождается образованием лейкотриенов. При этом лейкотриены не только
способствуют развертыванию патологического процесса, но и ведут к
реализации клеточных, тканевых и внутриорганных компенсаторных реакций.
Так, например, снижение коронарного кровотока под влиянием
лейкотриенов сочетается с отрицательным инотропным эффектом, причем
уменьшение сократимости миокарда выражено сильнее, чем ограничение
коронарного кровотока, что не позволяет развиться кислородному
голоданию миокарда (кислородэкономящая реакция). Лейкотриены являются
мощными стимуляторами лейкоцитов, усиливающими их хемотаксис,
аттракцию, дегрануляцию и высвобождение лизосомальных ферментов, т. е.
способствуют реализации защитной функции лейкоцитов в очаге
воспаления. Выделяемые клетками и образуемые в очагах повреждения биогенные
амины (гистамин, серотонин) и кинины ведут к сосудистым, гемореологи-
ческим и метаболическим эффектам, играющим неспецифическую роль в
компенсации структурных и функциональных нарушений.
Ill ФУНКЦИИ СИСТЕМ
ЖИЗНЕОБЕСПЕЧЕНИЯ
ОРГАНИЗМА
320 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
В основе всех проявлений жизнедеятельности организма лежат
процессы обмена веществ и энергии в клетках органов и тканей. Интенсивность
этих процессов поддерживается на определенном уровне, необходимом для
осуществления многообразных функций организма в различных условиях
его существования. Для поддержания жизнедеятельности клеток на
нормальном уровне организм обеспечивает относительное постоянство (гомео-
стазис) внутренней среды (ее состав, осмотическое давление,
кислотно-основное равновесие, температуру).
Способность поддерживать постоянство количественного и
качественного состава внутренней среды организма является необходимым условием
его нормальной жизнедеятельности. Гомеостазис организма нарушается
под действием факторов внешней и внутренней среды и быстро
восстанавливается благодаря функционированию и надежному регулированию
физиологических систем. Под физиологической системой понимают
генетически детерминированную совокупность клеток, тканей и органов,
которые выполняют общие функции в организме (например, системы
кровообращения, дыхания, пищеварения, выделения и т. д.). В результате
физиологические системы позволяют клеткам организма существовать и
выполнять свои функции в относительно постоянных (стабильных) условиях.
При изменениях параметров внешней среды, например при перепадах
температуры, влажности, атмосферного давления, освещения, при
недостаточном поступлении питательных веществ и т. д., поддержание гомеостазиса
осуществляется за счет включения механизмов регуляции соответствующих ]
физиологических систем.
Обеспечение метаболических потребностей клеток осуществляется
благодаря функции кровообращения. Движущаяся по сосудам кровь доставляет
тканям поступившие из желудочно-кишечного тракта органические и
неорганические вещества, а из легких — кислород, без которого не могут
проходить окислительные процессы в клетках. Одновременно кровью к
органам выделения переносятся продукты обмена, подлежащие удалению из
внутренней среды организма. С кровью к тканям доставляются также
гуморальные регуляторы функции клеток — гормоны, олигопептиды,
медиаторы, биологически активные промежуточные продукты обмена.
Для обеспечения защиты внутренней среды организма от
проникновения чужеродных веществ и болезнетворных агентов (микробов и их
токсинов) система крови находится в тесном функциональном взаимодействии с
иммунной системой, продуцирующей клеточные и гуморальные факторы
иммунитета.
Указанные физиологические процессы должны протекать при
постоянстве температуры организма, постоянстве рН крови и отделов желудочно-
кишечного тракта, так как их отклонение вызовет нарушение гомеостазиса
и, следовательно, необходимость корригирующего управления со стороны
одной или нескольких физиологических систем.
Огромную роль в обеспечении жизнедеятельности организма играют
сенсорные системы, поскольку зрение, слух, все виды чувствительности
организма, обоняние, вкус являются непременными контролирующими
деятельность организма или способствующими его адаптации к факторам
окружающей среды системами.
Что касается репродуктивной функции человека, то она определяет и
продолжение рода, и получение удовольствия от физического общения с
партнером.
Взаимодействие компонентов сложных процессов жизнеобеспечения
физиологических систем крови, дыхания, пищеварения, выделения, вод-
• 321
но-солевого обмена, кислотно-основного равновесия, теплопродукции и
теплоотдачи, иммунной, сенсорной систем, в конечном счете обеспечивает
метаболические потребности организма.
Из дидактических соображений функции каждой анатомо-физиологи-
ческой системы и механизма ее регуляции рассматриваются отдельно.
Закономерности интеграции деятельности различных систем на организмен-
ном уровне изложены в IV разделе учебника.
ГЛАВА 7
Функции клеток крови. Гемостаз.
Регуляция кроветворения. Основы
трансфузиологии
Цельная кровь состоит из жидкой части (плазмы) (см. главу 1) и форменных
элементов, к которым относят эритроциты, лейкоциты и кровяные
пластинки — тромбоциты.
Функции крови: 1) транспортная — перенос газов (02 и С02),
пластических (аминокислот, нуклеозидов, витаминов, минеральных веществ),
энергетических (глюкоза, жиры) ресурсов к тканям, а конечных продуктов
обмена — к органам выделения (желудочно-кишечный тракт, легкие, почки,
потовые железы, кожа); 2) гомеостатическая — поддержание температуры
тела, кислотно-основного состояния организма, водно-солевого обмена,
тканевого гомеостаза и регенерации тканей; 3) защитная — обеспечение
иммунных реакций, кровяного и тканевого барьеров против инфекции;
4) регуляторная — гуморальной и гормональной регуляции функций раз-
личньгх систем и тканей; 5) секреторная — образование клетками крови
биологически активных веществ.
7.1. Функции эритроцитов
7.1.1. Функции и свойства эритроцитов
Эритроциты переносят 02 содержащимся в них гемоглобином от легких к
тканям и С02 от тканей к альвеолам легких. Функции эритроцитов
обусловлены высоким содержанием гемоглобина (95 % массы эритроцита),
деформируемостью цитоскелета, благодаря чему эритроциты легко
проникают через капилляры с диаметром меньше 3 мкм, хотя имеют диаметр от
7 до 8 мкм. Глюкоза является основным источником энергии в
эритроците. Восстановление формы деформированного в капилляре эритроцита,
активный мембранный транспорт катионов через мембрану эритроцита,
синтез глютатиона обеспечиваются за счет энергии анаэробного гликолиза в
цикле Эмбдена—Мейергофа. В ходе метаболизма глюкозы, протекающего
в эритроците по побочному пути гликолиза, контролируемого ферментом
дифосфоглицератмутазой, в эритроците образуется 2,3-дифосфоглицерат
(2,3-ДФГ). Основное значение 2,3-ДФГ заключается в уменьшении
сродства гемоглобина к кислороду.
В цикле Эмбдена—Мейергофа расходуется 90 % потребляемой
эритроцитами глюкозы. Торможение гликолиза, возникающее, например, при
старении эритроцита и уменьшающее в эритроците концентрацию АТФ,
приводит к накоплению в ней ионов натрия и воды, ионов кальция,
повреждению мембраны, что понижает механическую и осмотическую
устойчивость эритроцита, и стареющий эритроцит разрушается. Энергия глюко-
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология •
323
зы в эритроците используется
также в реакциях восстановления,
защищающих компоненты
эритроцита от окислительной
денатурации, которая нарушает их
функцию. Благодаря реакциям
восстановления атомы железа
гемоглобина поддерживаются в
восстановленной, т. е.
двухвалентной форме, что препятствует
превращению гемоглобина в метге-
моглобин, в котором железо
окислено до трехвалентного,
вследствие чего метгемоглобин
неспособен к транспорту
кислорода. Восстановление
окисленного железа метгемоглобина до
двухвалентного обеспечивается
ферментом — метгемоглобинре-
дуктазой. В восстановленном
состоянии поддерживаются и серу-
содержащие группы, входящие в
мембрану эритроцита,
гемоглобин, ферменты, что сохраняет
функциональные свойства этих
структур.
Эритроциты имеют дисковид-
ную, двояковогнутую форму, их
поверхность — около 145 мкм2, а
объем достигает 85—90 мкм3.
Такое соотношение площади к
объему способствует деформабильно-
сти (под последней понимают
способность эритроцитов к
обратимым изменениям размеров и
формы) эритроцитов при их
прохождении через капилляры.
Форма и деформабильность
эритроцитов поддерживаются липидами
мембран — фосфолипидами (гли-
церофосфолипидами, сфинголи-
пидами, фосфотидилэтанолами-
Рис. 7.1. Схема модели изменений цито-
скелета мембраны эритроцита во время
его обратимой деформации.
Обратимая деформация эритроцита изменяет
лишь пространственную конфигурацию
(стереометрию) эритроцита, следующую за
изменением пространственного расположения
молекул цитоскелета. При этих изменениях
формы эритроцита площадь поверхности
эритроцита остается неизменной,
а — положение молекул цитоскелета мембраны
эритроцита при отсутствии его деформации.
Молекулы спектрина находятся в свернутом
состоянии;
б —деформация эритроцита, вызванная
изменением положения молекул его цитоскелета.
Молекулы спектрина раскручены и растянуты,
но площадь мембраны эритроцита остается
прежней (пояснения в тексте).
Обозначения:
ч\Л ~ Молекулы спектрина, обозначенные
двойными извитыми лентами.
О — Спектрин-спектриновые взаимодействия
^ — Участки взаимодействия белка полосы
4.1, актина и спектрина.
\\\ — Внутренняя поверхность мембраны
эритроцита.
ном, фосфатидилсирином и др.), гликолипидами и холестерином, а также
белками их цитоскелета. В состав цитоскелета мембраны эритроцита
входят белки — спектрин (основной белок цитоскелета), анкирин, актин,
белки полосы 4.1, 4.2, 4.9, тропомиозин, тропомодулин, адцуцин. Основой
мембраны эритроцита является липидный бислой, пронизанный
интегральными белками цитоскелета — гликопротеинами и белком полосы 3.
Последние связаны с частью белковой сети цитоскелета — комплексом
спектрин—актин—белок полосы 4.1, локализованным на цитоплазматиче-
ской поверхности липидного бислоя мембраны эритроцита (рис. 7.1).
Взаимодействие белкового цитоскелета с липидным бислоем мембраны
обеспечивает стабильность структуры эритроцита, поведение эритроцита
1Г
324 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
как упругого твердого тела при его деформации. Нековалентные
межмолекулярные взаимодействия белков цитоскелета легко обеспечивают
изменение размеров и формы эритроцитов (их деформацию) при прохождении
этих клеток через микроциркуляторное русло, при выходе ретикулоцитов
из костного мозга в кровь — благодаря изменению расположения молекул
спектрина на внутренней поверхности липидного бислоя. Генетические
аномалии белков цитоскелета у человека сопровождаются появлением
дефектов мембраны эритроцитов. В результате последние приобретают
измененную форму (так называемые сфероциты, элиптоциты и др.) и имеют
повышенную склонность к гемолизу. Увеличение соотношения
холестерин—фосфолипиды в мембране увеличивает ее вязкость, уменьшает
текучесть и эластичность мембраны эритроцита. В результате снижается
деформируемость эритроцита. Усиление окисления ненасыщенных жирных
кислот фосфолипидов мембраны перекисью водорода или
супероксидными радикалами вызывает гемолиз эритроцитов (разрушение эритроцитов с
выходом гемоглобина в окружающую среду), повреждение молекулы
гемоглобина эритроцита. Постоянно образующийся в эритроците глютатион, а
также антиоксиданты (ос-токоферол), ферменты — глутатионредуктаза, су-
перо ксиддисмутаза и др. защищают компоненты эритроцита от этого
повреждения.
До 52 % массы мембраны эритроцитов составляют белки гликопротеи-
ны, которые с олигосахаридами образуют антигены групп крови. Глико-
протеины мембраны содержат сиаловую кислоту, которая придает
отрицательный заряд эритроцитам, отталкивающий их друг от друга.
Энзимы мембраны — Ка+/К+-зависимая АТФаза обеспечивает
активный транспорт Na+ из эритроцита и К+ в его цитоплазму. Са2+-зависимая
АТФаза выводит Са2+ из эритроцита. Фермент эритроцита карбоангидраза
катализирует реакцию: Са2+ Н20 <-» Н2С03 о Н+ + НСО^, поэтому
эритроцит транспортирует часть углекислого газа от тканей к легким в виде
бикарбоната, до 30 % С02 переносится гемоглобином эритроцитов в форме
карбаминового соединения с радикалом NH2 глобина.
7.1.2. Гемоглобин
Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс.,
окрашивающий эритроцит в красный цвет после связывания молекулы 02 с
ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г
гемоглобина, у женщин—138 (123—153) г. Молекула гемоглобина состоит
из четырех субъединиц гема, связанных с белковой частью молекулы —
глобином, сформированной из полипептидных цепей. Синтез гема
протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется
на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема
синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин,
содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г
гемоглобина А-типа связывает 1,34 мл 02. В первые три месяца жизни
плода человека в крови содержатся эмбриональные гемоглобины типа
Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется
гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и
двумя В. Гемоглобин F обладает на 20—30 % большим сродством к 02, чем
гемоглобин А, что способствует лучшему снабжению плода кислородом.
При рождении ребенка до 50—80 % гемоглобина у него представлены
гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F
снижается до 2 %.
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • 325
Глицин + янтарная кислота - коэнзим А
J-*— АЛК-синтетаза
а-Амино-р-кето-адипиновая кислота
\
8-Аминолевулиновая кислота
J-*— АЛК-дегидрогеназа
Порфобилиноген
\*— ПБГ-дезаминаза
q J Уропорфириноген III
\*— Декарбоксилаза
Копропорфириноген III
\*— КПГ-оксидаза
Протопорфириноген IX иРНК<-Хромосома 16 иРНК<- Хромосома 11
(ген а-цепи) (ген р, у, 8-цепей)
Протопорфирин IX Полирибосомы Полирибосомы
г<— Гемсинтетаза
J-*— Оксидаза
фибосомы Полири
Fe -» ГЕМ 2 а-цепи 2 р-цепи
Н * \
Глобин (2 а-цепи и 2 Р-цепи) -<
Гемоглобин А
Рис. 7.2. Схема синтеза гемоглобина у человека в эритроидной клетке.
Указаны ферменты, контролирующие этапы синтеза молекулы гема в митохондриях, а также
хромосомы, ответственные за синтез цепей глобина А (р-цепи) и гемоглобинов плода (у- и 5-
цепи). Пояснения в тексте.
Соединение гемоглобина с молекулой 02 называется оксигемоглобином.
Сродство гемоглобина к кислороду и диссоциация оксигемоглобина
(отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения
кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее
температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают
увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-
ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ,
снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и
температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым
облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина,
облегчая отсоединение 02 от молекулы гемоглобина. Увеличение
концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной
физической работе, адаптированных к длительному пребыванию в горах. Окси-
гемоглобин, отдавший кислород, называется восстановленным, или дезок-
сигемоглобином. В состоянии физиологического покоя у человека
гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на
70 %. Чем выраженней потребление кислорода тканями, тем ниже насы-
326 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
щение венозной крови кислородом. Например, при интенсивной
физической работе потребление кислорода мышечной тканью увеличивается в
несколько десятков раз и насыщение кислородом оттекающей от мышц
венозной крови снижается до 15 %. Содержание гемоглобина в отдельном
эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины
свидетельствует о гипохромном (т. е. пониженном), увеличение — о гипер-
хромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот
показатель имеет диагностическое значение. Например, гиперхромия
эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для желе-
зодефицитной анемии.
7.1.3. Старение и разрушение эритроцитов в организме
Эритроциты у человека функционируют в крови максимум 120 дней, в
среднем 60—90 дней. Старение эритроцитов связано с уменьшением
образования в эритроците количества АТФ в ходе метаболизма глюкозы в этой
клетке крови. Уменьшенное образование АТФ, ее дефицит нарушает в
эритроците процессы, обеспечиваемые ее энергией, — восстановление
формы эритроцитов, транспорт катионов через его мембрану и защиту
компонентов эритроцитов от окисления, их мембрана теряет сиаловые
кислоты. Старение эритроцитов вызывает изменения мембраны эритроцитов:
из дискоцитов они превращаются в эхиноциты, т. е. эритроциты, на
поверхности мембраны которых образуются многочисленные выступы,
выросты (рис. 7.3).
Причиной формирования эхиноцитов помимо уменьшения
воспроизводства молекул АТФ в эритроците при старении клетки является
усиленное образование лизолецитина в плазме крови, повышенное содержание в
ней жирных кислот. Под влиянием перечисленных факторов изменяется
соотношение поверхности внешнего и внутреннего слоев мембраны
эритроцита за счет увеличения поверхности внешнего слоя, что и приводит к
появлению выростов на мембране.
По степени выраженности изменений мембраны и формы эритроцитов
различают эхиноциты I, И, III классов и сфероэхиноциты I и II классов.
При старении эритроцит последовательно проходит этапы превращения в
эхиноцит III класса, теряет способность изменять и восстанавливать дис-
ковидную форму, превращается в сфероэхиноцит и разрушается.
Устранение дефицита глюкозы в эритроците легко возвращает эхиноциты I—II
классов к форме дискоцита. Эхиноциты начинают появляться, например,
в консервированной крови, сохраняемой в течение нескольких недель при
4°С, или в течение 24 ч, но при температуре 37 °С. Это связано с
уменьшением образования АТФ внутри клетки, с появлением в плазме крови
лизолецитина, образующегося под влиянием лецитин-холестерол-ацетилтранс-
ферразы, ускоряющих старение клетки. Отмывание эхиноцитов в свежей
плазме от содержащегося в ней лизолецитина или активация в них
гликолиза, восстанавливающей уровень АТФ в клетке, уже через несколько
минут возвращает им форму дискоцитов.
Стареющие эритроциты становятся менее эластичными, вследствие чего
разрушаются внутри сосудов (внутрисосудистый гемолиз) или же
становятся добычей захватывающих и разрушающих их макрофагов в селезенке,
купферовских клетках печени и в костном мозге (внесосудистый или
внутриклеточный гемолиз). Внутриклеточным гемолизом в сутки разрушается
80—90 % старых эритроцитов, содержащих 6—7 г гемоглобина, из которых
освобождается в макрофагах до 30 мг железа. После отщепления от гемо-
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • 327
О *©
рН 4,5 6 7,2 8 9,5
Рис. 7.3. Схема формирования эхиноцитов и стоматоцитов из дискоцита (нормоци-
та) при разных значениях рН, создаваемых in vitro.
I — сферостоматоцит, II — стоматоцит, III — дискоцит, IV — эхиноцит, V — сфероэхиноцит.
глобина гем превращается в желчный пигмент билирубин, который
поступает с желчью в кишечник и под влиянием микрофлоры кишечника
последовательно превращается в уробилиноген, а затем в стеркобилиноген.
Оба соединения выводятся из организма с калом и мочой, под влиянием
света и воздуха превращаясь в стеркобилин и уробилин. При метаболизме
1 г гемоглобина образуется 33 мг билирубина.
Внутрисосудистым гемолизом разрушается 10—20 % эритроцитов. При
этом гемоглобин поступает в плазму, образует с плазменным гликопротеи-
ном гапто глобином комплекс гемоглобин—гапто глобин. В течение 10 мин
50 % комплекса поглощается из плазмы паренхиматозными клетками
печени, что предупреждает поступление свободного гемоглобина в почки и
тромбирование им их нефронов. У здорового человека в плазме
содержится около 1 г/л плазмы гаптоглобина, что оставляет несвязанным с ним в
плазме крови не более 3—10 мг гемоглобина. Молекулы гема,
высвобождающиеся из связи с глобином при внутрисосудистом гемолизе,
связываются белком плазмы — гемопексином, транспортируются им в печень и
также поглощаются паренхиматозными клетками печени, где подвергаются
ферментному разрушению до билирубина.
7.1.4. Роль ионов железа в эритропоэзе
В организме содержится 4—5 г железа в виде резервного (1/А) и
функционально-активного железа (3/4). 62—70 % железа находится в гемоглобине
эритроцитов, 5—10 % — в миоглобине, остальное — в тканях, где оно участвует
во многих метаболических процессах: в составе металсодержащих
энзимов—цитохромов обеспечивают митохондриальный транспорт электронов,
синтез ДНК и деление клеток, метаболизм гормонов мозгового вещества
надпочечников, детоксикационные механизмы, снижающие активность
токсичных веществ под влиянием цитохрома Р450, в состав которого входит
железо; поддерживают активность глицерол-3-фосфатдегидрогеназы в
поперечно-полосатых мышцах, что сохраняет физическую работоспособность
328 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
человека. Например, у людей, страдающих дефицитом железа, физическая
работоспособность резко снижается, но восстанавливается после приема
препаратов железа.
Резервное железо постоянно переходит в функциональное и обратно.
Так, за счет повторного использования костный мозг получает ежесуточно
20—25 мг железа. Ионы железа (Fe++) ежедневно всасываются в
кишечнике из пищи. Fe2+ в кишечном содержимом вначале связывается с белком-
рецептором на поверхности эпителия слизистой оболочки кишки (р3-ин-
тегрином), что необходимо для перехода его через мембрану клетки
слизистой в цитозоль. Далее, образовав комплекс с цитозольным транспортным
белком- мобилферрином, Fe2+ пересекает клетку эпителия слизистой
кишечника оставаясь в этом комплексе вплоть до поступления Fe2+ в
капиллярную сеть кишечника. С выходом в кровоток двухвалентное железо
окисляется до трехвалентного белком плазмы крови церрулоплазмином и
присоединяется к трансферрину, гликопротеину плазмы крови. Трансфер-
рином Fe3+ доставляется к тканям и используется в митохондриях эритроб-
ластов для синтеза гема, депонируется в макрофагах в виде резерва.
Плазма содержит от 1,8 до 2,6 мг/л трансферрина, 1 мг которого связывает
1,25 мкг Fe. В общем объеме плазмы содержится около 3 мг Fe2+. В норме
лишь '/з трансферрина плазмы насыщена железом. Количество железа,
которое может быть связано трансферрином, называется общей железосвязы-
вающей способностью крови и в норме составляет 250—400 мкг % (45—
72 мкмоль/л). Концентрация железа в сыворотке крови у взрослых людей
обоего пола колеблется от 50 до 160 мкг % (9—29 мкмоль/л). С мочой
выводится за сутки 60—100 мкг железа.
Комплекс трансферрин—железо фиксируется на рецепторах мембран
эритробластов. Количество этих рецепторов уменьшается за счет
торможения их синтеза в ходе созревания эритроидных клеток и исчезает после
созревания ретикулоцитов, поэтому в зрелые эритроциты железо не
включается. Освобождение железа из комплекса трансферрин — железо
обеспечивается энергией молекул АТФ, образуемых в эритробластах. Молекула
трансферрина, отдавшая железо, смещается с мембранного участка
молекулами трансферрина, связанными с железом, поскольку их сродство к
рецепторам более сильное. Железо, поступившее в эритробласт,
используется в митохондриях для синтеза гема и депонируется в эритробласте в виде
резерва. В макрофагах печени и костного мозга резервное железо
депонируется в молекуле ферритина. Внутри лизосом молекулы ферритина
образуют большие аморфные нерастворимые агрегаты — гемосидерин. Таким
образом, ферритин и гемосидерин — это формы резервного железа в
клетках. Из клеточного резерва железо освобождается в двухвалентном
состоянии (благодаря энзиму ксантиноксидазе, аскорбиновой кислоте и др.),
затем церулоплазмин окисляет Fe2+ до трехвалентного состояния, Fe3+
соединяется с трансферрином и транспортируется с плазмой крови к эритробла-
стам.
Абсорбции железа эпителиальными клетками желудочно-кишечного
тракта способствуют сниженное насыщение трансферрина железом и
повышенная эритропоэтическая активность крови. Абсорбция снижается при
увеличении концентрации железа в клетках слизистой оболочки
кишечника. В кишечнике более эффективна абсорбция Fe2+, чем Fe3+. Поэтому
аскорбиновая кислота, фруктоза, аминокислоты (цистеин, метионин)
поддерживают двухвалентную форму железа и ускоряют его абсорбцию. В
кишечнике лучше абсорбируется биодоступное железо, входящее в состав
гема (мясные продукты, кровяная колбаса), чем железо из пищи раститель-
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • 329
ного происхождения. Абсорбция Fe2+ в желудочно-кишечном тракте
зависит от возраста человека, функционального сотояния его организма. Она
наиболее высокая у детей первых месяцев жизни и достигает 57 %, у 7—
10-летних —7,75—17,75 %, у взрослых мужчин и женщин — 1,1—11,2 % и
у беременных женщин — 20 % от поступившего в желудочно-кишечный
тракт железа. Отсюда ежедневная потребность в железе, абсорбируемом из
пищи в организме человека, составляет: у детей от 0 до 4 мес жизни — 0,5
мг/день, от 1 года до 12 лет— 1,0 мг/день, женщины детородного
периода — 2,8 мг/день (во время менструации потери железа составляют от 5 до
45 мг), молодые мужчины — 1 мг/день, старики — 0,9 мг/день, беременные
женщины — 3—3,5 мг/день. В организм последних за время беременности
должно поступать до 1 г железа (500 мг железа используется для синтеза
дополнительного количества гемоглобина в организме беременной, 300 мг
Fe2+ необходимо формирующемуся плоду и 200 мг Fe2+ компенсируют
естественные потери металла организмом беременной женщины). Дефицит
железа в организме человека приводит к развитию гипохромной анемии.
7.1.5. Эригпропоэз
Эритропоэз — процесс образования эритроцитов в костном мозге. Первой
клеткой эритроидного ряда, образующейся из колониеобразующей клетки
эритроцитарной (КОК-Э) — клетки-предшественницы эритроидного ряда,
является проэритробласт, из которого в ходе 4—5 последующих удвоений и
созревания образуется 16—32 зрелых эритроцита. Схема процесса: 1
проэритробласт (удвоение) -» два базофильных эритробласта I порядка -» 4
базофильных эритробласта II порядка -» 8 полихроматофильных эритро-
бластов I порядка -» 16 полихроматофильных эритробластов II
порядка -> 32 полихроматофильных нормобласта -» 32 оксифильных нормобла-
Рис. 7.4. Эритробластический островок костного мозга человека.
1 — эритробласт, 2 — цитоплазма макрофага.
330 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ста -> денуклеация нормобластов -> 32 ретикулоцита -> 32 эритроцита.
Эритропоэз до формирования ретикулоцита занимает 5 дней.
Эритропоэз у человека и животных (от проэритробласта до
ретикулоцита) протекает в эритробластических островках костного мозга, которых в
норме содержится до 137 на 1 мг ткани костного мозга (рис. 7.4).
Макрофаги эритроцитарных островков играют основную роль в физиологии
эритроидных клеток, влияя на их пролиферацию и созревание. Макрофаги
фагоцитируют вытолкнутые из нормобластов ядра, обеспечивают эритро-
бласты ферритином и пластическими веществами, секретируют
эритропоэтин и гликозаминогликаны, последние повышают концентрацию
ростковых факторов в островках. Эти благоприятные условия для развития эрит-
робластов макрофаги создают благодаря наличию рецепторов к эритроид-
ным клеткам-предшественницам.
Из костного мозга ретикулоциты выходят в кровь и в течение суток
созревают в эритроциты. По количеству ретикулоцитов в крови судят об
эритроцитарной продукции костного мозга и интенсивности эритропоэза.
У человека их количество составляет 5— 10%о. За сутки в 1 мкл крови
поступает 60—80 тыс. эритроцитов. В 1 мкл крови у мужчин содержится 5,21
(4,52—5,9) млн, а у женщин — 4,6 (4,1—5,1) млн эритроцитов. Уменьшение
количества эритроцитов в единице объема крови называется анемией,
увеличение — эритрощтозом. Последний может носить физиологический,
приспособленный для организма человека характер (например, при
подъеме человека в горы, на высоту более 3000 м над уровнем моря).
7.1.6. Регуляция эритропоэза
Эритропоэтин, секретируемый тубулярными и перитубулярными клетками
почек, является гуморальным регулятором эритропоэза. Небольшое
количество гормона (10—15 %) вырабатывается в макрофагах костного мозга,
купферовских клетках и гепатоцитах. В почках синтез и секреция
эритропоэтина определяются уровнем обеспечения кислородом их тканей.
К уровню кислорода в почечной ткани чувствителен гемсодержащий
белок- цитохром b , входящий составной частью в НАДФ-зависимую окси-
дазу пери- и тубулярных клеток. При нормальном уровне р02 в ткани
почки радикалы кислорода, продукцируемые оксидазой, прежде всего
перекись водорода, препятствуют формированию в почечной ткани
«индуцируемого гипоксией фактора-1 (ИГФ-1)», стимулирующего транскрипцию
эритропоэтиновой иРНК и синтез эритропоэтина. При снижении
кислородного обеспечения ткани почек (р02 до 20—40 мм рт. ст.) продукция
оксидазой перекиси водорода уменьшается. Нарастает активация ИГФ-1 в
цитозоле и его перемещение в ядро клетки, где ИГФ-1 специфически
связывается с ДНК, вызывая экспрессию гена эритропоэтина. Гипоксия
почечных структур активирует также ферменты (фосфолипаза А2),
ответственные за синтез простагландинов (Ej и Е2), которые через систему «аде-
нилатциклаза—цАМФ» также усиливают синтез эритропоэтина в пери- и
тубулярных клетках почек. Адреналин и норадреналин через (32-адреноре-
цепторы синтезирующих эритропоэтин клеток почек и систему вторичных
посредников в них — цАМФ и цГМФ — вызывают усиление синтеза и
секреции эритропоэтина в кровь. При гипоксии почечной ткани количество
эритропоэтина возрастает в 1000 раз и более при норме 0,01—0,08 ME
(международных единиц)/мл плазмы. При гематокрите, равном 40—45,
количество эритропоэтина составляет 5—80 мМЕ/мл, а при гематокрите,
равном 10—20 (его уменьшение может быть вызвано острой кровопотерей, ге-
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • 331
молизом эритроцитов),— 1—8 МЕ/мл плазмы. Эритропоэтин тормозит
апоптоз, регулирует пролиферацию и дифференциацию КОК-Э, про- и
эритробластов, ускоряет синтез гемоглобина в эритроидных клетках и ре-
тикулоцитах, «запускает» в чувствительных к нему клетках синтез эритро-
поэтиновой иРНК и энзимов, участвующих в формировании гема и
глобина, цитоскелета эритроцитов, увеличивает кровоток в эритропоэтической
ткани костного мозга и выход в кровь ретикулоцитов. Наконец, катехола-
мины через р-адренорецепторы КОК-Э также усиливают пролиферацию
эритроидных клеток-предшественниц. Продукция эритропоэтина почками
угнетается при повышенном образовании в организме человека опухоль-
некротизирующего фактора а, интерлейкинов-1а и 1(3, интерферонов а, (3
и у, что имеет место, например, у больных с хроническими паразитарной и
бактериальной инфекциями, при ревматоидном артрите, так как
перечисленные вещества тормозят синтез эритропоэтина в клетках почек. В
результате у больных развивается анемия вследствие сниженной продукции
почками эритропоэтина.
Половые гормоны и эришропоэз. Андрогены, а точнее продукты их 5-(3-ре-
дуктазного превращения — 5-р-Н-метаболиты, увеличивают
чувствительность клеток-предшественниц эритроидного ряда к эритропоэтину, что
делает эритропоэз более интенсивным. Эстрогены обладают
противоположным действием на эритропоэз, снижая его интенсивность. Поэтому после
полового созревания у мужчин устанавливаются более высокие значения
эритроцитов и гемоглобина, чем у женщин.
7.2. Лейкоциты
Лейкоциты формируют мощный кровяной и тканевый барьеры против
микробной, вирусной и паразитарной (гельминтной) инфекции,
поддерживают тканевый гомеостазис и регенерацию тканей. У взрослого человека
в крови содержится 4—10-109/ л лейкоцитов. Увеличение их количества
называется лейкоцитозом, уменьшение — лейкопенией. Лейкоциты,
имеющие в цитоплазме зернистость, называются гранулоцитами, а не
содержащие зернистости — агранулоцитами. Процентное отношение в крови
лейкоцитов, происшедших из разных линий кроветворения, называется
лейкоцитарной формулой (табл. 7.1).
7.2.1. Функции нейтрофильных гранулоцитов
Функцией зрелых нейтрофильных лейкоцитов является уничтожение
проникших в организм инфекционных агентов. Осуществляют ее они, тесно
взаимодействуя с макрофагами, Т- и В-лимфоцитами. На важность функ-
Таблица 7.1. Лейкоцитарная формула*
Общее
число
лейкоцитов в 1 л
крови
4-10 -10'
Показатели
в 1 мкл
(%)
Гранулоциты
базофилы
1-75
0,25-0,75
эозино-
филы
100-250
1-4
нейтрофильные
палочко-
ядерные
180-400
1-5
сегменто-
ядерные
3065-5600
55-68
Агранулоциты
лимфоциты
1200-2800
25-39
моноциты
200-700
1-9
'Количество и процентное содержание лейкоцитов в 1 мкл крови.
332 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ционального вклада нейтрофилов в защиту организма от инфекции
указывает, например, тяжесть течения инфекционных заболеваний у больных,
страдающих сниженной продукцией или качественными нарушениями
этих клеток. Нейтрофилы фагоцитируют поврежденные клетки
собственного организма, секретируют бактерицидные вещества и способствуют
регенерации тканей, удаляя из них поврежденные клетки, а также секрети-
руя стимулирующие регенерацию тканей вещества (нейтрофилокины).
Зрелый нейтрофил содержит сегментированное на 2—5 долей ядро,
уплотненный хроматин, а в цитоплазме — многочисленные мелкие секреторные
гранулы трех типов. Часть гранул, дающих положительную окраску на
фермент миелопероксидазу, представлена лизосомами, которые содержат
лизоцим (повреждает стенку бактерий), низкомолекулярные катионные
белки — дефенсины и кателицидины (нарушают дыхание и рост
микроорганизмов и грибков; дефенсины повышают проницаемость сосудов микро-
циркуляторного русла), протеазы и кислые гидролазы — позволяют ней-
трофилам легко переваривать фагоцитированные объекты. Гранулы 2-го
типа содержат лактоферрин, обладающий бактериостатическим действием,
транскобаламины I и III — переносчики витамина В12 в крови и лизоцим.
Вещества гранул 3-го типа содержат кислые гликозаминогликаны,
участвующие в процессах размножения, роста и регенерации тканей, благодаря
их способности концентрировать факторы роста в тканях костного мозга.
Гранулы 2-го и 3-го типов, содержащиеся в цитоплазме нейтрофилов,
постоянно секретируют биологически активные вещества даже вне
фагоцитоза. К ним относятся опухольнекротизирующий фактор а, интерлейкин-1,
интерлейкин-6, интерлейкин-11. Вместе с такими же цитокинами, секре-
тируемыми макрофагами в острой фазе заболевания, вызванного
инфекцией, травмой (например, ожоговой), они стимулируют синтез и секрецию в
кровь из печени так называемых белков острой фазы (с-реактивный белок,
сц-антитрипсин, а,-кислый гликопротеин, церулоплазмин), повышающих
устойчивость организма к инфекции, токсичным соединениям,
образуемым микроорганизмами (см. главу 1).
Нейтрофилы осуществляют свои функции благодаря способности
быстро мигрировать и накапливаться в инфицированном или поврежденном
участках организма, фагоцитировать, т. е. захватывать и разрушать в
фагоцитарных вакуолях внутри клетки поглощенные бактерии и поврежденные
клетки. Их способность к миграции связана с хорошо развитым аппаратом
движения, выбор направления их движения к воспаленным или
инфицированным тканям обусловлен появлением в этих тканях вазоактивных и
хемотакстеских факторов. Вазоактивные факторы (дефенсины, гистамин,
секретируемый под влиянием дефенсинов тучными клетками тканей)
повышают проницаемость капилляров, что способствует миграции
нейтрофилов в ткань. Хемотаксические факторы взаимодействуют с рецепторами
на поверхности гранулоцитов, образуя лиганд-рецепторный комплекс,
определяющий движение нейтрофилов к воспаленному участку. Мощным хе-
мотаксическим эффектом обладают N-формилпепетиды бактериального
происхождения и лейкотриены, производные метаболизма арахидоновой
кислоты в мембране клеток. Лейкотриены секретируются
активированными Т-лимфоцитами и макрофагами после воздействия на них
бактериальных веществ. Помимо лейкотриенов эти клетки секретируют другие хемо-
аттрактанты — эндотоксины. Важными хемотакическими факторами
являются продукты активации комплемента — фрагменты его молекул С3в и
С5а. Некоторые из этих факторов, особенно С3в, функционируют как опсо-
нины, т. е. вещества, облегчающие фагоцитоз бактерий (от греческого ор-
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • 333
КОК-Г
миелобласты
у I Количество делений — 4
промиелоциты f Продолжительность развития клеток — 5—7 дней
S У
С миел
х \
метамиелоциты
т I Деление клеток отсутствует
палочкоядерные ^ продолжительность развития клеток — 5—7 дней
Т
сегментоядерные
выход в кровь
Продолжительность жизни клеток в крови — 1—16
дней
Рис. 7.5. Развитие нейтрофильных гранулоцитов.
КОК-Г— колониеобразующая единица гранулоцитарная; КСФг — колониестимулируюший
фактор гранулоцитарный. Выделены отделы способных к делению (КОК-Г-миелоциты) и не-
размножающихся клеток (метамиелоциты—сегментоядерные) нейтрофильной линии
лейкоцитов. КСФг активирует деление и усиливает функциональную активность нейтрофилов.
sonein — делать съедобным). Недостаточность хемотаксической активности
нейтрофилов препятствует накоплению этих лейкоцитов в очаге
воспаления, что способствует распространению инфекции в организме. К таким
последствиям приводит, например, нарушение хемотаксиса нейтрофилов у
больных при ожоговой болезни, диабете, при низком содержании белка в
рационе человека.
Бактерицидный эффект нейтрофилов. Через 30—60 с после контакта
мембраны нейтрофила с бактерией в нем возникает «вспышка
метаболизма» с образованием перекиси водорода и суперокисных ионов, которые
поражают поглощенные нейтрофилом бактерии, окисляя галогены (СП, Г)
мембраны бактерий. Одновременно нейтрофилы секретируют лизоцим,
лактоферрин, катионные белки, кислые и нейтральные гидролазы,
поражающие фагоцитированные бактерии.
Нейтрофильный гранулопоэз в костном мозге представлен
одновременно пролиферирующими и созревающими клетками — от миелобластов до
миелоцитов включительно, и только созревающими (неделящимися)
клетками — от метамиелоцитов до сегментоядерных нейтрофилов (рис. 7.5).
Зрелые сегментоядерные нейтрофилы поступают из костного мозга в кровь
и составляют в ней до 50—70 % всех лейкоцитов.
В небольшом количестве (1—5 %) в кровь поступают и палочкоядерные
нейтрофилы. Их увеличение в крови — важный признак нарастания
интенсивности нейтрофильного гранулопоэза, а также остроты воспалительного
процесса. Под гранулоцитозом понимают увеличение количества
нейтрофильных лейкоцитов в крови выше 10* 109/л, под нейтропенией —
снижение их числа ниже 1,5 • 109/л крови.
В костном мозге в 20—25 раз больше зрелых сегментоядерных
нейтрофилов, чем в крови. Это костномозговой резерв нейтрофилов. У взрослого
334 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
человека он составляет 7,7 ± 1,2 • 109/кг массы тела. Гранулоцитарный ко-
лониестимулирующий фактор (КСФ-Г), бактериальный эндотоксин,
N-формилпептиды бактериального происхождения, лейкотриены, катехол-
амины вызывают выброс из костного мозга резервных гранулоцитов в
кровь. В крови часть гранулоцитов циркулирует, а часть — оседает у
сосудистой стенки малых вен и капилляров, образуя пристеночный нециркули-
рующий резерв. Выброс адреналина и КСФ-Г в кровь возвращает
пристеночные гранулоциты в циркулирующую кровь. За адгезию нейтрофилов и
моноцитов к поверхности эндотелиальных клеток ответственны
поверхностные рецепторы этих лейкоцитов — интегрины СД18, СДПа, СДПв,
СДПс, а также синтезируемые в эндотелиоцитах селектины СД62 (селек-
тин Р) и СД62Е (селектин Е). Последние представляют собой молекулы
адгезии на поверхности эндотелиальных клеток, с которыми связываются
интегрины нейтрофилов. При нарушении функций этих рецепторов ней-
трофилы оказываются неспособными прикрепляться к эндотелию
капилляра, а затем мигрировать из сосуда в инфицированную
микроорганизмами ткань. Указанный дефект нейтрофилов способствует развитию тяжелых
гнойных инфекций, что наблюдается, например, при врожденном
заболевании — «синдроме недостаточности лейкоцитарной адгезии», связанном
со слабым представительством (или отсутствием) интегрина СД18 на ней-
трофилах. Пристеночный резерв нейтрофилов равен 0,17 ± 0,08* 109 ней-
трофилов/кг массы тела, циркулирующий — 0,22 ± 0,05 • 109 кг/массы.
Средний полупериод жизни циркулирующих гранулоцитов составляет 6—
8 ч, а полный — не более 30 ч.
7.2.2. Функции базофильных гранулоцитов
Функции базофильных гранулоцитов крови и тканей: поддержание
кровотока в мелких сосудах; трофика тканей и рост новых капилляров;
обеспечение миграции других лейкоцитов в ткани; защита кишечника, кожи и
слизистых оболочек при инфицировании гельминтами и клещами; участие
в формировании аллергических реакций. Базофильные гранулоциты
способны к фагоцитозу, миграции из кровеносного русла в ткани и
передвижению в них.
Цитоплазма зрелых базофилов содержит гранулы неравных размеров,
окрашивающиеся в филолетово-розовые тона при окраске по Романовскому—
Гимзе. Базофилы могут синтезировать и накапливать в гранулах
биологически активные вещества, очищая от них ткани, а затем и секретировать их.
Постоянно присутствуют в клетках: а) кислые гликозаминогликаны — хон-
дроитинсульфат, дерматансульфат, гепарансульфат и гепарин — основной
антикогуляционный фактор; б) гистамин — антагонист гепарина, активатор
внутрисосудистого тромбообразования и стимулятор фагоцитоза, оказывает
про воспалительное действие на ткань. В каждом базофиле содержится: 1—
2 пг гистамина; «фактор, активирующий тромбоциты» (вещество,
вызывающее агрегацию тромбоцитов и освобождение их содержимого); «эозино-
фильный хемотаксический фактор анафилаксии» и лейкотриен С4,
способствующие выходу эозинофилов из сосудов в места скопления базофилов.
При повышении чувствительности организма к аллергенам в базофилах
образуется «медленно реагирующая субстанция анафилаксии», лейкотриен С4,
вызывающие спазм гладкой мускулатуры мелких бронхов, что наблюдается,
например, при бронхиальной астме. Базофилы способны мигрировать из
крови в ткани, активировать микроциркуляцию инфицированного района
ткани, выход других лейкоцитов через стенку капилляров в зону накопле-
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • 335
ния паразитарного антигена. Так, в местах локализации гельминтов (в
кишечнике) или клещей (в коже) наблюдается инфильтрация тканей
базофилами, способствующими уничтожению и изгнанию этих паразитов.
Основные хемотаксические факторы движения базофилов — лимфоки-
ны, секретируемые лимфоцитами в присутствии аллергена, а также кал-
ликреин, фактор комплемента С567. Базофилы и тучные клетки,
окружающие мелкие сосуды печени и легких, интенсивно секретируют гепарин,
препятствующий образованию тромбов, что поддерживает нормальный
кровоток в сосудах этих органов. Активаторами выброса веществ из гранул
базофилов являются иммуноглобулин Е и аллергены — вещества
антигенной природы.
Базофильные гранулоциты образуются из КОК базофильной, а тучные
клетки из КОК тучноклеточной. Продукция базофилов активируется ин-
терлейкинами -3 и -4, стимулирующими пролиферацию и
дифференциацию КОК базофильной. В лейкоцитарной формуле доля базофилов
составляет 0,25—0,75 %, или около 0,04 • Юул крови.
7.2.3. Функции эозинофильных лейкоцитов
Это защита организма от паразитарной инфекции (шистосомы,
трихинеллы, гельминты, аскариды и др.); инактивация биологически активных
соединений, образующихся при аллергических реакциях; препятствуют
длительному действию биологически активных веществ, секретируемых
тучными клетками и базофилами; обладают фагоцитарной и бактериоцидной
активностью. Зрелый эозинофил имеет 2- или 3-дольчатое ядро и два типа
гранул в цитоплазме. Большие гранулы содержат специфический основной
белок, токсичный для паразитов; вещества, нейтрализующие гепарин,
медиаторы воспаления и секретируют ферменты — (3-глюкуронидазу, рибо-
нуклеазу, фосфолипазу Д. Так, фосфолипаза Д инактивирует «фактор,
активирующий тромбоциты», синтезируемый базофилами, что
предупреждает агрегацию тромбоцитов. Маленькие гранулы содержат кислую фосфата-
зу и арилсульфатазу В, нейтрализующую «медленно реагирующую
анафилактическую субстанцию».
Хемотаксический фактор «эозинофильный хемотаксический фактор
анафилаксии» кислый пептид (MB 500), секретируемый тучными клетками
и базофилами, обусловливает выход эозинофилов в места скопления
тучных клеток и базофилов. Хемотаксис эозинофилов усиливают фрагменты
молекул комплемента СЗа, С5а и С567, гистамин и активированный
паразитарным антигеном секрет лимфоцитов. Хемотаксис позволяет эозинофи-
лам накапливаться в инфицированном участке ткани и участвовать в
антипаразитарной защите организма. Например, эозинофилы повреждают
шистосомулу (молодая форма шистосомы), секретируя в нее токсичные в
микроконцентрациях белки своих гранул: спецефический основной белок,
эозинофильный катионный белок и эозинофильный нейротоксин,
мигрируют в ее интерстициальную ткань и вызывают гибель паразита. Однако
при аллергических заболеваниях, например при бронхиальной астме, эти
токсичные белки эозинофилов накапливаются в тканях, участвующих в
аллергических реакциях (перибронхиальная ткань легких при бронхиальной
астме) поражают бронхиальные эпителиальные клетки, вызывая их слущи-
вание, что делает более тяжелым течение заболевания.
В костном мозге эозинофилы образуются из КОК эозинофильной и
представлены пулом пролиферирующих и созревающих клеток — от эози-
нофильного миелобласта до миелоцита, а также пулом созревающих кле-
\
336 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ток, начиная от метамиелоцита. Продолжительность развития первого
составляет 5,5 дня, второго — 2,5 дня. Стимулируют эозинофилопоэз в
костном мозге ИЛ-5, а также ИЛ-3 и КСФ-ГМ.
В крови человека содержится 1—4 % эозинофилов или 0,15—0,25 • 109/л
крови. Увеличение их количества (эозинофшшя) свидетельствует о
возможной паразитарной инфекции или аллергическом заболевании. Эозинофилы
накапливаются в тканях, которые контактируют с внешней средой (легкие,
желудочно-кишечный тракт, кожа, урогенитальный тракт), формируя
тканевый барьер против паразитарной инфекции. В этих тканях их
количество в 100—300 раз превышает содержание в крови. По параметрам
плотности и функциональной активности эозинофилы в крови и тканях
подразделяются на три последовательно формирующиеся субпопуляции:
неактивированные эозинофилы нормальной плотности; активированные,
нормальной плотности эозинофилы; активированные, низкой плотности
эозинофилы, что является следствием фенотипических изменений зрелых
эозинофилов, возникающих под влиянием цитокинов (ИЛ-3, ИЛ-5, КСФ-
ГМ). Наиболее активно секретирует токсичные белки субпопуляция
активированных эозинофилов низкой плотности. Именно накопление в тканях
этой субпопуляции эозинофилов делает успешной защиту организма при
паразитарной инфекции, а при аллергических заболеваниях обусловливает
повреждение тканей легких, кожи, слизистых оболочек.
7.2.4. Функции моноцитов-макрофагов
Функции моноцитов-макрофагов (система фагоцитирующих мононуклеа-
ров): фагоцитарная защита организма против микробной инфекции;
токсический эффект метаболитов макрофагов на паразитов в организме
человека; участие в иммунном ответе организма и воспалении; регенерация
тканей и противоопухолевая защита; регуляция гемопоэза; фагоцитоз
старых и поврежденных клеток крови, регуляция продукции острофазных
белков печенью.
В тканях моноциты дифференцируются в тканевые макрофаги.
Моноциты-макрофаги имеют аэробный гликолиз, обеспечивающий энергией их
фагоцитарную активность. Макрофаги функционируют также в
анаэробных условиях (например, в полости абсцесса), используя для генерации
энергии гликолитический путь. Макрофаги распознают микроорганизмы,
поврежденные клетки, медиаторы, гормоны, лимфокины с помощью
рецепторов своей плазменной мембраны.
Цитотоксическое действие на опухолевые клетки, токсоплазмы (кокци-
дии, паразитические простейшие), лейшмании и возбудителей малярии
макрофаги оказывают супероксидом, перекисью водорода, гидроксильным
радикалом и др.
Макрофаги человека секретируют в кровь и тканевую жидкость более
100 биологически активных веществ с молекулярной массой от 32 (анион
супероксида) до 440 000 (фибронектин). Функция этих веществ:
стимуляция пролиферации остеобластов и лимфоцитов, продукции фибробластами
КСФ-ГМ (интерлейкин-1); регуляция гемопоэза и механизмов воспаления
(КСФ-ГМ, КСФ-Г, эритропоэтин, простагландины, лейкотриены В, U, С,
D, Е, тромбоксан); цитотоксический и цитостатический эффекты на
опухолевые клетки (опухольнекротизирующий фактор — ОНФ). Наконец,
интерлейкин-1 и ОНФ повышают температуру тела через терморегуляторные
центры гипоталамуса.
В костном мозге взрослого человека число моноцитов составляет около
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • ЪЪ1
7,3 • 109 клеток. В крови человека циркулирует 1,7 • 109 моноцитов, которые
распределяются на циркулирующий (25 %) и краевой пулы (75 %). Из
крови в ткани выходит 1,6 • 107 клеток в час. Средний полупериод пребывания
моноцитов в крови колеблется от 36 до 104 ч. Продолжительность жизни
моноцитов-макрофагов в тканях человека составляет не менее 3 нед. Под
моноцитозом понимают увеличение абсолютного их количества свыше 800
клеток/мкл.
7.2.5. Регуляция грануло- и моноцитопоэза
Гранулоцитопоэз стимулируют гранулоцитарные колониестимулирующие
факторы (КСФ-Г, КСФ-ГМ) макрофагов и Т-лимфоцитов, а угнетают —
секретируемые нейтрофилами кейлоны (тканевоспецифические
ингибиторы синтеза ДНК в клетках предшественницах) и лактоферрин —
ингибитор, угнетающий секрецию КСФг, а также простагландины серии Е,
образуемые моноцитами и макрофагами.
Моноцитопоэз стимулируют моноцитарный колониестимулирующий
фактор (КСФ-М) и катехоламины через а-адренорецепторы КОК-ГМ.
Моноцитопоэз тормозят простагландины Е, а- и (3-интерфероны. Продукцию
КСФ-М ослабляет также лактоферрин нейтрофилов. Выходу моноцитов из
костного мозга в кровь препятствуют большие дозы гидрокортизона.
7.3. Функции тромбоцитов
Кровяные пластинки препятствуют внезапной потере крови, мгновенно
закупоривая место повреждения кровеносных сосудов вначале временной,
а затем постоянной тромбоцитной пробкой. Установлена также
антипаразитарная активность тромбоцитов. При инфецировании организма
человека шистосомами, трематодами (долгоживущие паразиты, вызывающие
поражение внутренних органов человека — легких, печени и др.) тромбоциты
оказывают на них цитотоксический эффект и поражают их.
7.3.1. Структура и функции тромбоцитов
Тромбоциты имеют дисковидную форму, диаметр от 2 до 5 мкм, объем 5—
10 мкм3 (рис. 7.6). В тромбоците выделяют несколько зон:
периферическую, золя-геля,
внутриклеточных органелл. На наружной
поверхности периферической
зоны располагается покров
толщиной до 50 нм, содержащий
Рис. 7.6. Ультраструктурная
организация тромбоцита. Сечение тромбо- ЕС
цита, параллельное горизонтальной
плоскости.
ЕС — периферическая зона тромбоцита, му -
СМ — трехслойная мембрана, SMF —
субмембранный филамент, МТ —
микротрубочки, Gly — гликоген. Зона opra- DB
нелл: М — митохондрии, G — гранулы,
DB — плотные гранулы, DTS — система
плотных трубочек, CS — система
открытых канальцев.
3
338 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
плазматические факторы свертывания крови, энзимы, рецепторы,
необходимые для активации тромбоцитов, их адгезии (приклеивания к суб-эндо-
телию) и агрегации (приклеивания друг к другу).
Периферическая зона. Мембрана тромбоцитов содержит «мембранный
фосфолипидный фактор 3» — «фосфолипидную матрицу», формирующую
активные коагуляционные комплексы с плазменными факторами
свертывания крови. Мембрана богата арахидоновой кислотой, из которой
фермент мембраны — фосфолипаза А2 образует свободную арахидоновую
кислоту для синтеза простагландинов. Метаболиты простагландинов
формируют короткоживущий агент — тромбоксан А2, вызывающий мощную
агрегацию тромбоцитов. Фосфолипаза А2 активируется при контакте с
адгезивным белком субэндотелия — коллагеном, обнажающемся при повреждении
эндотелия, и с фактором Виллебранда, адгезирующемуся к субэндотелию
после повреждении эндотелия сосудов.
В липидный бислой мембраны тромбоцита «встроены» гликопротеины I
(субъединицы la, lb, Ic), II (субъединицы Па, lib), III (субъединицы Ша,
1ПЬ), ГУ, V, VI, которые обусловливают адгезивные и агрегационные
функции тромбоцитов.
Функции гликопротеинов. 1а — рецептор адгезии (прилипание,
приклеивание) тромбоцитов к коллагену субэндотелия. Комплекс «lb — фактор
свертывания крови IX» обеспечивает рецепцию фактора Виллебранда, что
необходимо для адгезии пластинок на поврежденный субэндотелий. 1с —
взаимодействуя с адгезивным белком субэндотелия фибронектином,
обеспечивает адгезию пластинки к субэндотелию. Па и ПЬ — необходимы для
всех видов агрегации тромбоцитов. Ша с гликопротеином ИЬ образуют
Са2+-зависимый комплекс, связывающий на тромбоцитах фибриноген, что
обеспечивает дальнейшую агрегацию тромбоцитов и ретракцию
(сокращение) сгустка. V — гидролизуется тромбином, поддерживает агрегацию
тромбоцитов. Недостаток в мембране тромбоцитов различных субъединиц
гликопротеинов I—V вызывает повышенную кровоточивость.
Зона золя-геля гиалоплазмы прилегает к нижнему краю периферической
зоны тромбоцита и, в свою очередь, отделяет зону внутриклеточных орга-
нелл. В указанной зоне вдоль края клетки располагается сократительный
аппарат тромбоцита — краевое кольцо микротрубочек, контактирующее с
микрофиламентом. При стимуляции тромбоцита кольцо микротрубочек,
сокращаясь, смещает гранулы к центру тромбоцита («централизация
гранул»), сжимает их, вызывая секрецию содержимого гранул через систему
открытых канальцев в плазму крови. Сокращение кольца микротрубочек
позволяет тромбоциту образовывать псевдоподии (выросты цитоплазмы),
что увеличивает его способность к агрегации.
Зона плотных и а-гранул I и II типа. Плотные гранулы содержат АДФ,
АТФ, кальций, серотонин, норадреналин и адреналин. Кальций участвует
в регуляции адгезии, сокращения, секреции тромбоцитов, активации его
фосфолипаз и, следовательно, продукции в мембране тромбоцитов
простагландинов, необходимых для образования тромбоксана А2. При адгезии
тромбоцитов к поврежденной стенке сосуда плотные гранулы начинают
секретировать в больших количествах АДФ, которая усиливает
приклеивание циркулирующих тромбоцитов к адгезированным, т. е. агрегацию
тромбоцитов, поддерживая тем самым и рост тромбоцитарного агрегата.
Реакция «освобождения гранул» усиливает секрецию серотонина, вызывающего
вазоконстрикцию в районе поврежденного участка ткани, что уменьшает
кровотечение из нарушенных травмой сосудов.
а-Гранулы I типа содержат и секретируют антигепариновый фактор
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • 339
тромбоцитов 4, тромбоцитарный ростовой фактор, тромбоспондин (глико-
протеин G). АДФ, тромбин, адреналин вызывают секрецию
антигепаринового фактора тромбоцитов 4, что усиливает агрегацию тромбоцитов.
Тромбоспондин, взаимодействуя с фибриногеном, образует на поверхности
активированных тромбоцитов комплекс, необходимый для формирования
тромбоцитарных агрегатов. Тромбоцитарный ростовой фактор —
полипептид, стимулирующий рост гладких мышц сосудов и фибробластов,
восстановление сосудистой стенки и соединительной ткани. Благодаря его
свойствам тромбоциты поддерживают целостность сосудистой стенки. У
больных тромбоцитопенией имеется сниженная устойчивость стенки
капилляра, поэтому петехии (точечные кровоизлияния в коже) появляются вслед
за легкими травмами или изменениями давления крови. Петехии
вызываются слущиванием эндотелия капилляров. В нормальных условиях
возникающий дефект в стенке капилляров устраняется тромбоцитами, секрети-
рующими тромбоцитарный ростовой фактор.
а-Гранулы II типа содержат лизосомальные энзимы (кислые
гидролазы). После адгезии или агрегации большая часть гранул в тромбоците
исчезает. Данный феномен получил название «реакции освобождения
гранул». Он имеет место после активации тромбоцитов тромбоксаном А2,
АДФ, адреналином, тромбином, протеолитическими энзимами,
бактериальными эндотоксинами, коллагеном.
7.3.2. Тромбоцитпопоэз и его регуляция
Тромбоцитопоэз (образование тромбоцитов в организме) протекает в
костном мозге и включает следующие этапы: колониеобразующая клетка мега-
кариоцитарная (КОК-мег) -» промегакариобласт -> мегакариобласт ->
промегакариоцит -> зрелый мегакариоцит -» тромбоцитогенный мегака-
риоцит -> тромбоциты (рис. 7.7). Истинные митозы, т. е. деление клеток,
присущи только КОК-мег. Для промегакариобластов и мегакариобластов
характерен эндомитоз, т. е. удвоение ДНК в клетке без ее деления. После
остановки эндомитоза, в основном после 8-, 16-, 32-, 64-кратного
удвоения ДНК, мегакариобласт начинает дифференциацию до тромбоцитарного
мегакариоцита, образующего тромбоциты
Митоз и дифференциацию КОК-мег активирует гемопоэтический цито-
кин — тромбопоэтин (тромбоцитопоэтин) при взаимодействии с интерлей-
кином-3. Этот гуморальный фактор стимулирует также эндомитоз мегака-
риоцитов, он необходим для нормального созревания цитоплазмы
мегакариоцита и формирования в ней тромбоцитов. Стимулируют образование
тромбоцитопоэтина уменьшение мегакариоцитов и их предшественников в
костном мозге, а также тромбоцитопения, вызванная усиленным
использованием тромбоцитов при формировании тромба (воспаление,
необратимая агрегация тромбоцитов). Активированные тромбоциты и селезенка
выделяют в кровь гуморальный ингибитор пролиферации КОК-мег, а также
немитотической стадии развития мегакариоцитов (эндомитоза) и
созревания цитоплазмы мегакариоцитов. Это гликопротеин, массой 12—17 кДа.
В костном мозге тромбоцитарные мегакариоциты локализованы на
поверхности синусного эндотелия. Часть их цитоплазматических отростков
на 1—2 мкм проникает в просвет синусоида костного мозга через
эндотелий и фиксирует мегакариоцит на эндотелии, выполняя функцию «якоря».
Вторая часть отростков, представленных цитоплазматическими лентами до
120 мкм в длину и числом 6—8, проникает через эндотелий в просвет
синусоида костного мозга. Эти отростки называются протромбоцитами. В
340 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
СКК—*► КОКгммэ —*► КОКмег —♦►КОКмег-1 —^КОКмег-2
(митозы)
0,07 0,48 0,74
I \ \
Промегакариобласт: 2N
\
Мегакариобласты: 4N—>■ 8N —»H6N—»-32N—*-64N—»H28N
1 I I \
(эндомитоз)
i I I I
Промегакариоциты
\
Зрелые мегакариоциты
\
Тромбоцитогенный мегакариоцит
\
Протромбоциты —► Тромбоциты
Рис. 7.7. Схема дифференцировки клеток мегакариоцитарной серии.
СКК — стволовая кроветворная клетка, КОКгммэ — КОКмегакариоцитарная (КОКмег-1
менее дифференцированная, а КОКмег-2 — более дифференцированная клетка).
Цифрами 0.07; 0.48; 0.74 обозначена вероятность вовлечения клетки-предшественницы в мега-
кариоцитарную дифференциацию, т. е. по мере снижения пролиферативного потенциала
КОКмег возрастает вероятность ее дифференциации в мегакариобласт.
просвете синусоида цитоплазма протромбоцита после локальных
сокращений разрывается и он образует до 1000 тромбоцитов, поступающих с
кровью из просвета синусоидов в русло циркулирующей крови. Однако сами
протромбоциты или их фрагменты, содержащие до 100 тромбоцитов, также
могут выходить из синусоида костного мозга в кровь. Они достигают мик-
роциркуляторного русла легких, где из них освобождаются тромбоциты.
Поэтому количество тромбоцитов оказывается более высоким в легочных
венах, чем в легочной артерии. Количество тромбоцитов, образовавшихся
в легких, может достигать 7—17 % от массы тромбоцитов в крови.
Костный мозг человека содержит около 15 • 106 мегакариоцитов на 1 кг
массы тела. Дневная продукция тромбоцитов у человека 66 000 +14 600 в
1 мкл крови. В среднем мегакариоцит высвобождает до 3000 тромбоцитов.
Количество тромбоцитов в крови взрослого человека достигает 150—
375 • 109/л; у детей — 150—250 • 109/л. Общая популяция тромбоцитов
представлена циркулирующими в крови (70 %) и находящимися в селезенке
(30 %). Накопление тромбоцитов в селезенке возникает из-за их
медленного движения через извилистые селезеночные корды, занимающему до 8
мин. Сокращение селезенки (например, вызванное адреналином)
освобождает депонированные тромбоциты в общий кровоток. Удаление селезенки
у человека, устраняющее депонирование тромбоцитов, повышает число
тромбоцитов в крови у спленэктомированных индивидуумов. Напротив,
увеличение селезенки (спленомегалия) вызывает рост селезеночного депо
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • 341
тромбоцитов у больных и, как следствие этого, тяжелую тромбоцитопе-
нию. В результате у таких больных имеет место повышенная
кровоточивость. Тромбоцитопенией называют содержание тромбоцитов в крови
взрослого ниже 150 • 109/л. Продолжительность жизни тромбоцитов 6,9—
9,9 дня. Стареющие клетки разрушаются макрофагами в костном мозге и,
в меньшей степени, в селезенке и печени.
7.4. Механизмы свертывания крови (гемостаза)
7.4.1. Тромбоцитарный гемостаз
Тромбоцитарная реакция, т. е. реакция тромбоцитов на нарушение
целостности сосудистой стенки, формируется параллельно реакции самих
сосудов на повреждение — их сокращение в месте повреждения, вызывающее
шунтирование крови выше поврежденного участка сосуда. Данная
сосудисто-тромбоцитарная реакция на повреждение сосудистой стенки первой
останавливает кровотечение из микрососуда и поэтому называется сосуди-
сто-тромбоцитарным, или первичным, гемостазом. Формирование и
закрепление тромбов с помощью плазменных факторов свертывания называют
вторичным коагуляционным гемостазом. Первая волна агрегации
тромбоцитов начинается с приклеивания тромбоцитов рецепторами гликопротеинов
I и II к фактору Виллебранда, фибронектину и коллагену субэндотелия
поврежденных тканей. Вторая волна агрегации тромбоцитов вызвана
высвобождением АДФ из плотных гранул тромбоцитов, образованием тромбок-
сана А2 в их мембране, взаимодействием мембранных гликопротеинов lib
и Ша с фибриногеном, а V — с тромбином. Но в основном вторую волну
агрегации тромбоцитов обеспечивают тромбоксан А2 и тромбин. Мощным
стимулом для образования тромбоксана А2 в мембране тромбоцита
являются коллаген и фактор Виллебранда, активирующий фосфолипазу А2.
Сильный агрегационный эффект оказывает тромбин, который образуется
на мембране тромбоцитов при участии фактора V и гликопротеина V. Ад-
гезированные тромбоциты являются основой для агрегации, т. е.
приклеивания к ним тромбоцитов, приносимых с кровью к участку поврежденного
сосуда. В ходе агрегации тромбоцитарный тромб уплотняется и
сокращается. Его формирование усиливается с образованием фибрина (фибринового
тромба) вследствие активации плазменной системы свертывания крови
(рис. 7.8).
7.4.2. Система свертывания крови
Останавливает окончательно кровотечение из поврежденных сосудов
образование фибриновых тромбов, закрывающих их просвет. В плазме крови
содержатся факторы свертывания в виде неактивных форм ферментов,
обозначаемых римскими цифрами: I, И, VIII, IX, X, XI, XII, XIII
(табл. 7.2). Повреждение тканей, эндотелия сосуда или клеток крови
вызывает каскадную реакцию активации этих ферментов, которая приводит к
образованию фибриновых нитей, формирующих сеть тромба (рис. 7.9).
Начало каскадной реакции связано с контактом неактивных форм
факторов свертывания с поврежденными тканями, окружающими сосуды,
(внешний путь активации свертывания крови), а также при контакте крови
с поврежденными тканями сосудистой стенки или с поврежденными
самими клетками крови (внутренний путь активации свертывания крови).
Внешний путь. Мембраны поврежденных клеток тканей выделяют в
342 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Контакт крови с поверхностью субэндотелия
У
Фактор ХИа
Прекалликреин
Высокомолекулярный
кининоген
►XI -г*>Х1а
"Г*
Фактор Х1а
Высокомолекулярный кининоген
Фосфолипиды мембран тромбоцитов
Са++ Zn++
Повреждение клеток тканей
V
Тканевый фактор из
поврежденных
мембран клеток
Факторы Vila
Cat+
-XI —*-Х1в
т
IX
I
1Ха
JL
Фактор 1Ха
Фактор Villa -*
Фосфолипиды мембран тромбоцитов
Са~
Ха ^ »
Фактор Ха
Фактор Vb
Фосфолипиды мембран тромбоцитов
Са++
i
&■
Са
Тромбин (следовые
концентрации в крови)
Протромбин
----- \ ..-
1^ Тромбин - '
\
Фибриноген
\
Фибрин мономер
Y
Фибрин полимер (растворимый)
'1
Фибрин полимер (нерастворимый)
Рис. 7.8. Схема формирования коагуляционного гемостаза.
1 — активация тромбином ф.У; 2 — активация тромбином ф-VIII, высвобождаемого из связи с
ф.Вилленбранта; 3 — активация тромбином ф.Х1. Контакт крови с поверхностью
субэндотелия активирует «внутренний» путь свертывания крови; контакт крови с поврежденными
клетками ткани активирует «внешний» путь активации свертывания крови.
W
фХ1Н-*-фХ1Иа-
плазму крови тканевый фактор — трансмембранный белок. Тканевой
фактор с активированным им фактором свертывания крови VII активируют
фактор X. Фактор Ха (а-активированный) в присутствии ионов кальция
немедленно соединяется с тканевыми фосфолипидами и фактором V. Об-
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • 343
Таблица 7.2. Факторы свертывания крови
Фактор
I — фибриноген
II — протромбин
III — тромбопластин
IV — ионы кальция
V — проакцелерин
VII — проконвертин
VIIIc — антигемофильный фактор А
VIII ФВ — фактор Виллебранда
IX — антигемофильный фактор В
X — фактор Стюарта—Прауэра
XI — антигемофильный фактор В
XII — фактор Хагемана
XIII — фибрин-стабилизирующий фактор
Плазминоген
Прекалликреин
Высокомолекулярный кининоген
Период полу-
"М^ТЛ ООН
AilJHH
3,7 дня
2,8 дня
—
—
15-24 ч
1,2-6
5-12 ч
24-40 ч
20-24 ч
32-48 ч
40-48 ч
48-52
5-12 дней
2,2 дня
—
—
Молекулярная масса
(Да)
340.000
72.500
—
—
330.000
48.000
1.000.000
57.000
59.000
160.000
76.000
320.000
90.000
85.000
150.000
Нормальная
концентрация в
плазме (цг/мл)
1500-4000
150
0
0,9—1,2 ммоль/л
10
менее 1
менее 5
5
8
5
35
20
150
30
80
разовавшийся комплекс через несколько секунд после его формирования
превращает часть протромбина в тромбин. Тромбин начинает действовать
как протеолитический фермент на фибриноген, а также активировать
фактор V, тем самым дополнительно ускоряя превращение протромбина в
тромбин.
Внутренний путь. Разрушение тромбоцитов и эритроцитов или контакт
этих клеток с субэндотелием поврежденного сосуда активирует фактор XII.
Фактор ХПа (а-активированный), взаимодействуя с высокомолекулярным
кининогеном плазмы, превращает фактор XI в фактор Х1а. Реакция
ускоряется прекалликреином плазмы. Х1а активирует фактор IX
(тромбопластин плазмы), образующийся фактор 1Ха формирует комплекс: «фактор
1Ха + фактор VIII (антигемофильный фактор) + тромбоцитарный фосфо-
липид (тромбоцитарный фактор 3) + ионы кальция». Этот комплекс
активирует фактор X. Факторы Ха и Va, взаимодействуя с фосфолипидной
поверхностью клетки в присутствии Са2+, образуют новый комплекс,
называемый кровяной протромбиназой, превращающей протромбин в тромбин.
Особую роль в повышении активности протромбиназы играет
тромбоцитарный фактор 3. Его отсутствие снижает в 1000 раз активность
протромбиназы!
В крови содержатся неферментные белки — акселераторы или факторы
V и VII, которые при взаимодействии с фосфолипидными поверхностями
тромбоцитов и участками мембран других поврежденных клеток ускоряют
во много тысяч раз реакцию свертывания крови. Дефицит тромбоцитарно-
го фактора III приводит к геморрагическому диатезу, дефицит фактора IX
вызывает гемофилию В, а дефицит фактора VIII — гемофилию А.
Фактор VIII циркулирует в крови, будучи связанным со своим белком-
носителем — фактором Виллебранда. Последний стабилизирует молекулу
фактора VIII, увеличивает ее период жизни внутри сосуда и способствует
переносу фактора VIII к месту повреждения сосуда. Активированный
фактор VIII может проявить свое действие, лишь отсоединившись от белка-
носителя. Эта «операция» с комплексом «фактор VIII — фактор
Виллебранда» происходит под воздействием тромбина, следовые количества ко-
344 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Повреждение сосуда
}
Раскрытие субэндотелия
Коллаген
Фибронектин
Фактор Виллебранда
Адгезия пластинок
1—2 с
Фактор ХИа
Фактор Ха
Нарушение дисковидной формы тромбоцитов,
появление «выростов», «шипов» на их
поверхности; реакция освобождения гранул тромбоцитов
АДФ
Тромбоксан А Вазоконстрикция
->- Фактор Va
I
Тромбин
Раскрытие рецепторов фибриногена
Агрегация тромбоцитов
10—20 с
Тромбоцитарный тромб
3—5 мин
■ Фибрин
Гемостатическая пробка
Закрепление тромба
5—10 мин
Рис. 7.9. Последовательность формирования и закрепления тромба с помощью
плазменных факторов свертывания при «внутреннем» пути активации свертывания
крови. Время указывает на продолжительность процесса после контакта крови с
субэндотелием.
торого постоянно образуются в крови как следствие реакции на
разрушение стареющих клеток крови.
Внешний путь активации свертывания крови занимает около 15 с, а
внутренний — 2—10 мин. Оба они завершаются превращением
протромбина в тромбин. Протромбин синтезируется в печени, для его образования,
как и для образования факторов IX, X, VII и II, необходим витамин К,
поступающий в организм с пищей, депонирующийся в печени и
активирующий в ней синтез вышеуказанных факторов свертывания крови. Поэтому
поражение печени или возникающий в организме дефицит витамина К
сопровождаются кровоточивостью. Количество тромбина, образующегося
при активации свертывания крови, прямо пропорционально количеству
активирующих его комплексов.
Тромбин — активный протеолитический фермент, отщепляет от
молекулы фибриногена 4 пептида мономера. Каждый из мономеров имеет 4 сво-
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • 345
бодные связи. Соединяясь ими друг с другом: конец к концу, бок к боку, —
мономеры в течение нескольких секунд формируют сеть волокон фибрина.
Под влиянием фибринстабилизирующего фактора (фактор XIII) в фибрине
образуются дополнительные дисульфидные связи, и сеть фибриновых
волокон становится прочной. В этой сети задерживаются тромбоциты,
лейкоциты, эритроциты и белки плазмы, формируя фибриновый тромб.
После образования сгустка через 30—60 мин начинается его
сокращение, или ретракция. Ретракция происходит за счет сокращения нитей
актина и миозина тромбоцитов, а также нитей фибрина под влиянием
тромбина и ионов Са2+. В результате ретракции фибриновый сгусток сжимается
в плотную массу, тромб уплотняется и становится непроницаемым как для
клеток, так и для плазмы крови. Продолжению свертывания крови в
кровеносном русле после формирования фибринового тромба препятствует
противосвертывающая система крови.
7.4.3. Противосвертывающие механизмы крови
Физиологические антикоагулянты поддерживают кровь в жидком
состоянии и ограничивают процесс тромбообразования. К ним относятся
антитромбин III, гепарин, протеины С и S, а-2-макроглобулин, нити фибрина.
Антитромбин III является ос2-глобулином и создает 75 % всей антикоагу-
лянтной активности плазмы. Он является основным плазменным
кофактором гепарина, ингибирует активность тромбина, факторов Ха, 1Ха, VII,
ХПа. Его концентрация в плазме достигает 240 мкг/мл.
Гепарин — сульфатированный полисахарид — трансформирует
антитромбин III в антикоагулянт немедленного действия, в 1000 раз усиливая его
эффекты.
Протеины С и S— синтезируются в печени. Их синтез активирует
витамин К. Протеин С высвобождает активатор плазминогена из стенки
сосуда, инактивирует активированные факторы VIII и V. Протеин S снижает
способность тромбина активировать факторы VIII и V. Нити фибрина
обладают антитромбинным действием, так как адсорбируют до 80—85 %
тромбина крови. В результате тромбин концентрируется в
формирующемся сгустке и не распространяется по току крови (рис. 7.10).
Регуляция агрегации тромбоцитов сосудистой стенкой. Адгезии
тромбоцитов к неповрежденной сосудистой стенке препятствуют: эндотелиальные
клетки; гепариноподобные соединения, секретируемые тучными клетками
соединительной ткани; синтезируемые эндотелиальными и гладкомышеч-
ными клетками сосудов (рис. 7.11) — простациклин 12, оксид азота (NO),
тромбомодулин, тканевый активатор плазминогена и эктоэнзимы
(АДФаза), ингибитор тканевого фактора (ингибитор внешнего пути
свертывания крови).
Простациклин 12 — мощный ингибитор агрегации тромбоцитов,
образуется в венозных и артериальных эндотелиальных клетках из арахидоновой
кислоты. Между антиагрегационной способностью простациклина и про-
агрегационной субстанцией — тромбоксаном А2 тромбоцитов в
нормальных условиях имеет место динамическое равновесие, регулирующее
агрегацию тромбоцитов. При преобладании эффекта простациклина над
тромбоксаном А2 агрегации томоцитов не происходит. Напротив, сниженная
или утраченная продукция простациклина участком эндотелия может быть
одной из причин агрегации кровяных пластинок к стенке сосуда и
формирования тромба. Синтез простациклинов в эндотелии усиливается при
стрессе под влиянием тромбина.
346 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Адгезия
тканевого
+ УП + Са+
Повреждение сосудистой стенки
Агрегация тромбоцитов _ Активация XII
обратимая
необратимая
Выброс в кровь
тромбопластина
фактора (Хагемана) (фа|СТОр 111)
\
ХИа + Х1 + ТФЗ
| >
1Ха + VIII + ТФЗ + Са++
) ''
+ Va + ТФЗ + Са~ -*
I
Протромбин (II)
■ Антитромбин III +
Гепарин
Ха
Тромбин
Армирование тромба
Фибринстабилизирующиий
фактор XIII
■ Фибрин -*— Растворимые комплексы -^—Фибриноген
фибрин мономера
Консолидация тромба
}
Продукты деградации Плазминоген —*■ Плазмин
фибрина А "*"~—-—_^____^
Тканевый активизатор Активация фактора XII
Белок С
плазминогена
t
Выброс
Тканевый активатор
плазминогена
Повреждение сосудистой стенки
Рис. 7.10. Схема действия компонентов противосвертывающей и фибринолитиче-
ской системы крови на разных этапах образования фибринового сгустка.
Пояснения в тексте. ТФЗ-тромбоцитарный фактор 3.
Тромбомодулин — рецептор тромбина на эндотелии сосудов —
взаимодействует с тромбином и активирует белок С, обладающий способностью
высвобождать тканевый активатор плазминогена из стенки сосуда.
Дефицит белка С повышает свертываемость крови.
N0 образуется в эндотелиальных клетках и угнетает адгезию и
рекрутирование тромбоцитов. Его эффект усиливается взаимодействием с проста-
циклином. Атеросклеротические повреждения сосуда, гиперхолестерине-
мия понижают способность эндотелия к продукции оксида азота, повышая
риск формирования тромбов.
Тканевый активатор плазминогена — это белок, воспроизводимый и
постоянно секретируемый эндотелием сосудов. Обеспечивает прямую
локальную тромболитическую активность в отношении образовавшегося
л
У
Антикоагулянты
Простагландины 12
Эндотелиальный
расслабляющий
фактор (N0)
экто-АДФаза
Тромбоциты
Прокоагулянты
- Фактор Вилленбранда -*-
д Эндотелиальные
у клетки
Простациклин
Формирование
фибринового
сгустка
Тромбин
X
~1—Тромбин
-Тромбомодулин
Белок S, ,
Белок С ———| ]—»-Vllla + Va
Антитромбин
Гепариноподобные^
соединения
|—*Hla, Xa, Xla, IXa -
X
^-ч Ингибитор.
<J тканевого
фактора
|—*Л/Иа/тканевой фактор/Ха -
Дканевый активатор
"плазминогена
Фибринолиз
7-Т
н
Ха<-Х
X
IXa <- IX
>
Villa
Тканевый-
фактор
X
Протромбин
Ингибитор активатора
плазминогена-1 -*-
V
V
Рис. 7.11. Роль эндотелия кровеносного сосуда в свертывании крови.
Под надписью «Антикоагулянты» указаны факторы эндотелия, обладающие антикоагулянтным действием, благодаря ингибиции агрегации
тромбоцитов, формирования фибринового сгустка и активации фибринолиза.
Под названием «Прокоагулянты» указаны факторы эндотелия, участвующие в образовании тромбоцитарного тромба, фибринового сгустка и
подавляющие фибринолиз (-<—I I— показаны ингибирующие действия факторов).
348 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
тромба. В крови поддерживается постоянный уровень этого фактора, что
обеспечивает системную тромболитическую активность крови.
Эктоэнзимы — это образуемые эндотелием АДФаза, АТФаза и адено-
зинконвертирующий фермент. Эндотелиальная АДФаза быстро
расщепляет проагрегант — АДФ, секретируемый активированными тромбоцитами.
Клетки эндотелия сосудов синтезируют и протромботические факторы:
тканевый фактор, ингибиторы активатора плазминогена, фактор Вилле-
бранда.
Тканевый фактор — это сложный белок мембраны клеток массой
46 кДа. Часть его молекулы при повреждении клетки плотно связывается с
фактором коагуляции Vila, поддерживая его функцию ускорителя во
внешнем пути свертывания крови.
Ингибитор активатора плазминогена-1 — это белок массой 52 кДа,
содержащейся в циркулирующей крови. Тесно связываясь с активатором
плазминогена, он инактивирует его, участвуя таким образом в регуляции
фибринолиза в организме.
Фактор Виллебранда — это многомерная молекула массой 1—20 млн Да,
синтезируется эндотелием и хранится в эндотелиальных секреторных
гранулах. Высвобождаясь из них, выполняет функцию адгезивной молекулы
для тромбоцитов, поддерживает их агрегацию. Увеличенное
высвобождение фактора Виллебранда из эндотелия индуцируется тромбином.
Свертывание крови в сосуде предупреждает и гладкая поверхность
эндотелия, препятствующая включению внутреннего пути формирования
активной протромбиназы. Мономолекулярный слой белка, адсорбированный
на поверхности эндотелия, отталкивает факторы свертывания и
тромбоциты, также предупреждает свертывание крови.
Антикоагулянты применяются в клинической практике. Например, для
понижения повышенной свертываемости крови у больных с ишемической
болезнью сердца, для поддержания крови в жидком состоянии при
использовании аппарата искуственного кровообращения, вызывающих трав-
матизацию клеток крови, в результате чего активируется внутренний путь
свертывания крови.
7.4.4. Фибринолиз
Это процесс разрушения (лизиса) сгустка крови и восстановление просвета
сосудов, закупоренных тромбами. Лизис сгустка крови осуществляет
система ферментов, компонентами которой являются плазминоген, плазмин,
активатры плазминогена и их ингибиторы.
В плазме крови содержится неактивный белок плазминоген.
Плазминоген переходит в активный плазмин под влиянием: а) белкового тканевого
активатора плазминогена, высвобождающегося из эндотелиальных клеток
на участке формирующегося кровяного сгустка, особенно активно он
образуется эндотелием капилляров почек, печени, легких; б)
активированного фактора свертывания крови ХПа в комплексе с калликреином,
высокомолекулярным кининогеном; в) лизосомальных ферментов поврежденной
ткани; г) урокиназы почек, которая обеспечивает 15 % общей фибриноли-
тической активности крови, и д) стрептокиназы бактерий. Стрептокиназа
бактерий в инфицированных тканях растворяет плазменный сгусток в
лимфе и тканевой жидкости, что способствует распространению
инфекции.
Активный плазмин расщепляет нити фибрина. Тормозят агрегацию
тромбоцитов и формирование волокон фибрина продукты фибринолиза.
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • 349
Лизис кровяных сгустков продолжается в течение нескольких дней.
Выброс тканевых активаторов фибринолиза происходит в случае выполнения
физических нагрузок, появления в крови адреналина и норадреналина.
Плазмин инактивируют антпиплазмины: а2-антиплазмин (а2-глобулин),
нейтрализующий 2/з плазмина, и ос2-макроглобулин. Возможность
регуляции активности компонентов фибринолитической системы позволяет
предупреждать нежелательные следствия фибринолиза. Например, исходно
высокая локальная активность тканевых активаторов плазминогена в
легких и печени, не в полной мере регулируемая антиплазминами, может
сопровождаться отрывом тромбов от стенки поврежденного сосуда,
вызывающим опасные для жизни человека осложнения — массивные
кровотечения, тромбоэмболию сосудов, т. е. закупорку сосудов кусочками тромба.
7.5. Общие закономерности кроветворения
7.5.1. Кроветворные клетки-предшественницы
Ежечасно в крови человека разрушаются, заканчивая свой жизненный
цикл, и вновь образуются 20 млрд. тромбоцитов, 10 млрд. эритроцитов и 5
млрд. лейкоцитов. В результате количество этих клеток остается в крови на
постоянном уровне. Примерно каждые два года в организме человека
производится масса клеток крови, равная массе его тела. Пролиферативный
потенциал кроветворной ткани заключен в стволовых кроветворных
клетках (СКК)-предшественницах. Согласно одной точке зрения, эти клетки
способны к самообновлению, т. е. производству дочерних СКК, на
протяжении всей жизни человека. Другая точка зрения допускает, что человек
рождается с готовым «запасом» СКК, которые до дифференциации в
определенные клетки-предшественницы костного мозга находятся в состоянии
фазы клеточного покоя — G0. Выход СКК из состояния покоя G0
сопровождается производством дочерних СКК и их дифференциацией в
направлении: 1) клетки-предшественницы всех линий миелопоэза — гранулопоэза,
моноцитопоэза, мегакариоцитопоэза и эритропоэза; 2)
клетки-предшественницы Т-лимфоцитов; 3) клетки-предшественницы В-лимфоцитов. Все
клетки-предшественницы получили название колониеобразующцх клеток
(КОК). В костном мозге имеются: 1) гранулоцитарно-моноцитарно-мега-
кариоцитарно-эритроцитарная колониеобразующая единица (КОК-
ГММЭ), формирующая гранулоциты, макрофаги, мегакариоциты и
эритроциты; 2) пре-КОК-Т, представленная Т-клеточными субпопуляциями; 3)
пре-КОК-В, которая состоит из В-лимфоцитов. КОК-ГММЭ
дифференцируется в би- и унипотентные КОК, которые также классифицируют по
произведенному ими потомству при культивировании in vitro. Нейтро-
фильные гранулоциты и макрофаги образуются из общей КОК, которая
называется КОК гранулицитарно-моноцитарная (КОК-ГМ), а из КОК-
ЭМег образуются колонии из эритроидных клеток и мегакариоцитов. Би-
потентные клетки дифференцируются в направлении каких-либо двух
линий гемопоэза. Формирующиеся из них унипотентные КОК образуют
клетки только одной линии гемопоэза. В связи с этим возникли их
названия — КОК-эритроцитарные, эозинофильные, базофильные,
тучно-клеточные, нейтрофильные, мегакариоцитарные.
Клетки-предшественницы несут на мембране различные антигенные
структуры, по которым эти клетки можно дифференцировать и с помощью
моноклональных антител. Так, определяемая на основании данного
подхода, самая ранняя СКК человека (стадия развития СКК, предшествующая
ИЛ-9 ил"12 ИЛ-2 ил.4
Ч I I /
^ пре-КОК-Т ► Т-лимфоциты
/
КОКлимф.—► пре-КОК-В—т-**- В-лимфоциты
^yf |\ / t \
ИЛ"3 ИЛ-7 ИЛ"5 ИЛ4 ИЛ"11 ИЛ-2
ИЛ-1 ИЛ-11 ИЛ-6
-►{J ►KOK-S = КОК-ГММЭ
ил-з
ФСК связанный
КСФ-ГМ ФСК
КОК нейт. эоз.
КОК-ГМ
КОК эр.эоз.
КОК гр. эр.
КОК эр. мег.
ФСК растворимый
_л
ЭЦМ (фибронектин,
коллаген, гемонектин,
гликозаминогликаны,
' протеогликаны)
КСФтучн.кл.
и™ __ Тучные
КОКтучн.кл.-^^етки
ИЛ-4
\
^ КОКбаз.—► Базофилы
\
Тромбоцитопоэтин
*• КОКмег. —►Тромбоциты
Ц^трф-р '
КСФ-Г
i
*- КОКнейтр.—► Нейтрофилы
I, -I
li^-Изоферритин '
ИЛ-5
*■ КОКэоз. —►Эозинофилы
КСФмон.
t
\ КОКмон.—►Моноциты/макрофаги
in J
1—П роста гл а нд и н ■
Эритропоэтин
t
fel
Рис. 7.12. Регуляция формирования кроветворных клеток.
СКК — стволовая кроветворная клетка; КОК-лимф. —
колониеобразующая клетка лимфоцитарная; пре-КОК-Т — колониеобразующая
клетка- предшественница Т-клеток;
пре-КОК-В — колониеобразующая клетка-предшественница В-клеток;
КОК-ГММЭ — колониеобразующая клетка гранулоцитарно-мегака-
риоцитарно-моноцитарно-эритроцитарная;
КОКнейтр.эоз. — колониеоброзующая клетка нейтрофильно-эозино-
фильная;
КОК-ГМ — колониеобразующая клетка гранулоцитарно-моноцитар-
ная;
КОКэр.эоз. — колониеобразующая клетка эритроцитарно-эозино-
ф ильная;
КОКгр.эр. — колониеобразующая клетка гранулоцитарно-эритроци-
тарная;
КОКэр.мег. — колониеобразующая клетка эритроцитарно-мегакарио-
цитарная;
КОКбаз. — колониеобразующая клетка базофильная;
КОКтучн.кл. — колониеобразующая клетка тучноклеточная;
КОК-мег. — колониеобразующая клетка мегакариоцитарная;
КОК-нейтр. — колониеобразующая клетка нейтрофильная;
КОК-эоз. — колониеобразующая клетка эозинофильная;
КОК-мон. — колониеобразующая клетка моноцитарная;
КОК-эр. — колониеоброазующая клетка эритроцитарная;
ФБ — фибробласт;
ФСК — фактор стволовой клетки; его связанная и растворимая
фракции синтезируются фибробластом;
W
КОКэр. -* Эритроциты
L
I Кейлоны,
1— ингибитор ==
эритропоэза
' КОКмег.
C-kit — рецептор ФСК на мембране стволовой кроветворной клетки,
контролируемый C-kit геном (взаимодействие СКК со связаной
фракцией ФСК делает ее чувствительной к действию растворимой фракции
ФСК, ИЛ-1 и ИЛ-6, вызывающих ее дифференциацию в КОК-
ГММЭ);
ЭЦМ — экстрацеллюлярный матрикс;
ИЛ-1 — интерлейкин-1;
ИЛ-3 — интерлейкин-3;
ИЛ-4 — интерлейкин-4;
ИЛ-5 — интерлейкин-5;
ИЛ-6 — интерлейкин-6;
ИЛ-7 — интерлейкин-7;
ИЛ-11 — интерлейкин-11;
КСФ-ГМ — колониестимулирующий фактор гранулоцитарно-моноци-
тарный;
КСФ-Г — колониестимулирующий фактор гранулоцитарный;
КСФ-мон — колониестимулирующий фактор моноцитарный;
ТРФ-р — трансформирующий рост фактор- (секрет сс-гранул
тромбоцитов).
f| — регуляция на основе отрицательной обратной связи
(направление угнетающего эффекта);
—► — направление дифференциации клеток;
—► — регулирующее влияние.
352 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
КОК-ГММЭ) несет дифференцировочный маркер CD 133 и такие клетки
обозначаются как CD 133+ (положительные); из CD 133+ образуются
клетки, предшествующие КОК-ГММЭ, несущие маркер CD 34, и
обозначаемые как CD 34+. У человека CD 133+ СКК обнаруживают наибольшую
пролиферативную активность из всех распознаваемых с помощью моно-
клональных антител СКК — их пролиферативная активность в несколько
раз выше, чем у CD 34+ клеток. КОКгммэ способна совершать до 21
митоза. Бипотентные КОК также обладают значительной способностью к
размножению. Например, КОК-ЭМег, будучи стимулированной
ростковыми факторами, способна совершать до 13 митозов и образовывать затем
сотни КОК-Э, из которых формируются тысячи эритроидных клеток.
Количество КОК-ГММЭ составляет 2—5 • 105 содержащих ядро клеток
костного мозга, количество КОК-ЭМег достигает 40—120-105 клеток в
костном мозге, а содержание КОК-Э — 200—600 • 105 КОКЭ способна к 2—4
делениям. Из каждой КОК-Э образуется до 50 эритроцитов. КОК-ГМ
способна совершать 5—6 делений, образующиеся из нее КОК-Г и КОК-М —
еще 5—6 делений каждая. Это позволяет одной КОК-ГМ формировать
тысячи зрелых клеток-потомков — гранулоцитов и моноцитов (рис. 7.12).
Дифференциация клеток-предшественниц КОК-ГММЭ до унипотент-
ных КОК сопровождается формированием рецепторов к гемопоэтическим
цитокинам (гормонам) — интерлейкинам (ИЛ), колониестимулирующим
факторам (КСФ), эритропоэтину, тромбоцитопоэтину, к нейромедиато-
рам, катехол-аминам, тиреотропному гормону, производным тестостерона,
поэтому перечисленные гормоны регулируют пролиферацию и
дифференциацию клеток крови.
7.5.2. Регуляция пролиферации и дифференциации КОК
Рост различных КОК в культурах удается получить, добавляя
стимулирующие его факторы. Отсюда факторы, стимулирующие образование грануло-
цитарных колоний, получили название «колониестимулирующие факторы
гранулоцитарные» — КСФ-Г, макрофагальные — КСФ-М, гранулоцитар-
но-макрофагальные — КСФ-ГМ, эозинофильные — КСФэоз (ИЛ-5), мега-
кариоцитарные — КСФмег (тромбопоэтин), стимулирующие развитие
колоний из КОК-ГММЭ — мульти-КСФ или интерлейкин-3 (ИЛ-3).
ИЛ-3 и КСФ-ГМ стимулируют пролиферацию и дифференциацию не
только КОК-ГММЭ, но и бипотентных КОК—КОК-ГМ, КОК-нейтро-
фильно-эозинофильных и др. В связи с этим ИЛ-3 и КСФ-ГМ
рассматриваются как неспецифические факторы, поддерживающие самообновление
и пролиферацию КОК-ГММЭ и бипотентных КОК. Все КСФ гликопро-
теины относятся к полипептидным гормонам, которые регулируют гемо-
поэз. Источниками ИЛ-3 и КСФэоз (ИЛ-5) являются Т-лимфоциты и
спленоциты, КСФ-ГМ — Т-лимфоциты, моноциты, эндотелиальные
клетки и фибробласты, КСФ-Г, КСФ-М-моноциты и фибробласты, а эритро-
поэтина — перитубулярные и тубулярные клетки почек, купферовские
клетки печени. Эти вещества получили общее название «гемопоэтические
цитокины».
Гены, контролирующие синтез ИЛ-3, КСФ-Г и КСФ-М у человека,
находятся на дистальной части длинного плеча 5-й хромосомы, КСФ-Г —
локализованы у человека на 17-й хромосоме, эритропоэтины — на 7-й
хромосоме.
Тяжелые нарушения в системе крови могут возникать при повреждении
участков генома, ответственных за синтез молекулярных регуляторов гемо-
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • 353
поэза, за синтез их рецепторов на КОК. Так, например, причиной тяжелой
наследственной гранулоцитопении (нейтропении детей), приводящей их к
ранней гибели из-за легкой поражаемости микробными и вирусными
инфекциями, является нарушенное воспроизводство КСФ-Г в организме
больных. Гранулоцитопоэз и уровень нейтрофилов в крови быстро
восстанавливается при введении КСФ-Г этим больным. Точечная мутация над-
мембранного района рецепторов эритропоэтина вызывает их резкую
активизацию даже при малых количествах эритропоэтина в крови, что
приводит к усиленной пролиферации эритроидной ткани и развитию эритроци-
тоза. Продукцию КСФ усиливают различные стимулы: гипоксия —
эритропоэтина; тромбоцитопения — тромбопоэтина; микробная инфекция —
КСФ-ГМ, КСФ-Г, КСФ-М; гельминтная инфекция — КСФэоз (ИЛ-5).
Каждый из перечисленных стимулов одновременно вызывает продукцию
неспецифических ростковых факторов ИЛ-3 и КСФ-ГМ. При этом ИЛ-3 и
КСФ-ГМ стимулируют как пролиферацию КОК-ГММЭ и КОК-бипотент-
ных, так и формирование на их мембране рецепторов к КСФ, действие
которых направлено на унипотентные КОК. Поэтому высокие концентрации
КСФ-Г, КСФ-М и т. д. стимулируют пролиферацию и дальнейшую
дифференциацию унипотентных клеток-предшественниц гранулоцитарного,
моноцитарного и других рядов.
На интенсивность продукции КСФ оказывает регулирующее влияние
вегетативная нервная система. Так, введение животным а- и р-адренобло-
каторов значительно уменьшает уровень КСФ в крови. Стимуляторами ге-
мопоэза являются Т-лимфоциты (Т-хелперы). Действие на организм
возбуждающих гемопоэз факторов (кровопотеря, высотная гипоксия и др.)
вызывает миграцию лимфоцитов в костный мозг и активацию ими КОК.
КСФ регулируют функции не только КОК, но и зрелых клеток крови. Так,
КСФ-ГМ усиливает фагоцитарную активность, метаболизм, миграцию в
ткани зрелых нейтрофилов и моноцитов-макрофагов. КСФ-Г стимулирует
бактерицидную, фагоцитарную и цитотоксическую активность этих
клеток. ИЛ-3 также усиливает цитотоксическую активность макрофагов,
увеличивает эозинофильную фагоцитарную активность, а КСФ-М —
бактерицидную и тумороцидную (разрушающую опухолевые клетки) функции
моноцитов и макрофагов. Ответ клеточных линий кроветворной ткани на
стимул внешней среды реализуется через рецепцию не только гемопоэти-
ческих цитокинов, но и медиаторов нервных окончаний, находящихся в
костномозговой ткани. Так, в паренхиме костного мозга представлены
симпатические и пуринергические нервные окончания. Первые из них
секретируют адреналин, норадреналин, дофамин, вторые — нейрокини-
ны — субстанцию Р и др. Рецепторы этих соединений представлены на
КОК-ГММЭ, КОК-ГМ, КОК-Г, КОК-ЭРМЕГ, КОК-Э. Нейрокинины,
связываясь с рецепторами на КОК, могут как усиливать, так и тормозить
эффект гемопоэтических цитокинов на кроветворные
клетки-предшественницы.
Например, связывание субстанции Р с рецепторами
клеток-предшественниц активирует взаимодействие различных гемопоэтических цитокинов
(ИЛ-3, ИЛ-6, КСФ-ГМ, ФСК и др.) с рецепторами этих цитокинов на
указанных клетках-мишенях, вызывая сигнал трансдукции, направленный
к геному клетки с последующей активацией пролиферации и
дифференциации клеток. Напротив, нейрокинин А, секретируемый клетками стро-
мы, связываясь с другими рецепторами этих же кроветворных клеток-
предшественниц, взаимодействует с трансформирующим ростовым
фактором р, снижая пролиферативный эффект кроветворных клеток. Это свиде-
12-6095
354 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
тельствует, что регуляция гемопоэза осуществляется в интересах целого
организма и приспособительные реакции кроветворной ткани
обеспечиваются не только цитокинами, но и передачей к ней нервными волокнами
регулирующих сигналов.
В регуляцию гемопоэза «включен» механизм ингибирования
гуморальной обратной связью клеток-предшественниц продуктами, образуемыми
клетками разных линий на последних этапах их созревания. Кислый изо-
ферритин, продуцируемый зрелыми нейтрофилами, тормозит их
новообразование из КОК-Г; образуемый ос-гранулами тромбоцитов
«трансформирующий рост фактор-р» угнетает развитие КОКмег; простагландины
серии Е, а- и р-интерфероны, продуцируемые макрофагами, тормозят
пролиферацию КОКмон; вещества ядер, вытолкнутых нормобластами, кейло-
ны, образуемые зрелыми эритроцитами, тормозят дифференциацию КОК-
Э. К цитокинам, тормозящим гемопоэз, относят опухольнекротизирую-
щий фактор (ОНФ). Его рецепторы представлены на мембране различных
КОК. Активация рецепторов ОНФ, в частности fas-рецептора опухольнек-
ротизирующего фактора, на КОК вызывает выраженное угнетение
гемопоэза и «запускает» апоптоз-запрограммированную смерть
клетки-предшественницы. Fas-опосредованный апоптоз стволовых кроветворных
клеток лежит в основе ряда наследуемых форм недостаточности костного
мозга.
7.5.3. Роль стромы гемопоэтических органов в регуляции
кроветворения
Строма костного мозга [макрофаги, соединительнотканная оболочка,
выстилающая костномозговую полость (эндост), костномозговые синусоиды,
жировые клетки, соединительная ткань и нервные окончания] создает «ге-
мопоэтическое индуцирующее микроокружение», необходимое для
пролиферации, дифференциации и фиксации СКК в костном мозге, размножения
и созревания миелоидных клеток. Оно включает ростковые факторы, а
также экстрацеллюлярный матрикс, содержащий фибронектин, ламинин,
коллаген и гликозаминогликаны.
Делящиеся КОК взаимодействуют преимущественно с эндостом,
являющимся источником ростовых факторов. Более зрелые клетки
располагаются ближе к костномозговым синусоидам, что облегчает выход
созревающих клеток крови через стенку синусоида в кровь.
СКК, КОК-ГММЭ и малодифференцированые бипотенциальные
клетки постоянно выходят из костного мозга в кровь и транспортируются в
другие участки кроветворной ткани. Это обеспечивает постоянный обмен
клетками между анатомически разделенными участками кроветворной
ткани. Однако пролиферировать и дифференцироваться в клетки крови
кроветворные клетки-предшественницы способны лишь в ткани костного
мозга, и необходимые для этого условия создает ГИМ. Так, адгезивный
гликопротеин — фибронектин выполняет «якорную», фиксирующую
функцию в отношении КОК-ГММЭ и эритроидных КОК и одновременно
увеличивает их пролиферацию. Особые же микроворсинки ретикулярных и
эндотелиальных клеток стромы фиксируют СКК и КОК-ГМ.
Строма костного мозга продуцирует КСФгм, КСФг, КСФмон, ИЛ-6, а
также особый фактор — модулятор, «фактор стволовой клетки», который
не вызывает пролиферации КОК, но резко усиливает пролиферативный
эффект КСФ на эти клетки. При дефекте его воспроизводства стромой
возникает нарушение кроветворения.
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • 355
Нейтральные и кислые гликозаминогликаны увеличивают
концентрацию цитокинов в непосредственной близости от клеток-мишеней, а также
проницаемость мембран гемопоэтических клеток для кальция. Цитокины
активируют в КОК формирование гемопоэтических вторичных
мессенджеров, получивших название «сигнальные трансдукторы и активаторы
транскрипции» (STAT), «ядерные факторы» (NF-E1, NF-E2, NF-kb/REL).
Вторичные мессенджеры обеспечивают быстрое распространение сигнала от
возбужденного цитокином рецептора гемопоэтической клетки к ее
геному, активируют транскрипцию его участков, ответственных за
специализацию клетки-предшественницы, т. е. дифференциацию ее в направлении
определенной клеточной линии — эритроидной, моноцитарной, нейтро-
фильной и т. д. Нарушение формирования вторичных мессенджеров в
КОК, не позволяющее цитокину реализовать регулирующий эффект на
кроветворную клетку-предшественницу, приводит к нарушениям
кроветворения. Так, нарушение, вызванное мутацией в участке генома,
ответственного за синтез одного из транскрипционных факторов — NF-E1
обрывает развитие и влечет гибель эритроидных клеток на стадии проэритроб-
ластов.
7.5.4. Регуляция выхода форменных элементов крови из костного
мозга в кровеносное русло
Сосудистая сеть костного мозга начинается от артерии, проникающей в
кроветворную ткань через костный канал. Ответвления артерии
формируют элементарную морфофункциональную единицу костного мозга —
«синусоидальное дерево». Стенка синусоидов состоит из эндотелиальных клеток и
лежащих на них со стороны гемопоэтической ткани широких мононукле-
арных адвентициальных клеток. Гемопоэтическая ткань распространяется
между синусоидами. Созревающие эритроидные и гранулоцитарные
клетки, мегакариоциты и макрофаги прилегают к наружной поверхности
сосудистых синусов.
Зрелые клетки из костного мозга попадают в кровь через отверстия
между эндотелиальными клетками костно-мозговых синусоидов. Диаметр
этих отверстий — 2,3 мкм, т. е. много меньше проходящих через них в
кровь клеток. Поэтому мигрирующие клетки должны обладать хорошей
деформируемостью, чтобы преодолеть барьер и выйти в кровь. Плохо
деформирующиеся ригидные ядра эритробластов, миелоцитов, промиелоци-
тов не позволяют им мигрировать через отверстия в синусоиде. Напротив,
хорошо деформирующиеся ядра зрелых гранулоцитов, моноцитов и
лимфоцитов дают им возможность пересекать эндотелий.
Важным условием миграции клеток в кровь является способность рети-
кулоцитов и клеток белой крови к движению. Они пересекают узкие
отверстия синусоидов, выпуская в них сначала цитоплазм этические
отростки—псевдоподии. В костномозговых синусоидах края эндотелиальных
клеток тесно прилегают друг к другу и не позволяют клеткам проходить
через отверстия между ними. Однако миграция клеток через них
облегчается ритмичными расслаблениями синусоидов, которые уменьшают
перекрытие этими клетками пор. Поверхность эндотелиальных клеток
частично покрыта адвентициальными клетками, которые легко скользят по ней
благодаря сократительному аппарату, имеющемуся у адвентициальных
клеток. Сокращаясь, адвентициальные клетки уменьшают покрываемую ими
поверхность костномозговых синусоидов и увеличивают возможность
миграции клеток через стенку синусоидов в кровоток.
12'
356 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Выход клеток в просвет синусоида возрастает под влиянием
молекулярных регуляторов гемопоэза. Эритропоэтин стимулирует быстрый
выход ретикулоцитов, КСФ и бактериальный эндотоксин — нейтрофилов.
Эритропоэтин ускоряет «сборку» цитоскелета ретикулоцитов,
находящихся в костном мозге, увеличивает их деформабельность, что облегчает их
выход через отверстия стенки синусоидов в кровь. Регуляторы облегчают
формирование отверстий в эндотелии, уменьшая внешнюю поверхность
эндотелия костномозгового синуса, покрытого адвентициальными
клетками. Например, инъекция животному эритропоэтина резко уменьшает его
адвентициальный покров и ретикулоциты легко пересекают стенку
синусоида.
В норме небольшая часть клеток не достигает стадии созревания,
погибает в костном мозге и подвергается фагоцитозу макрофагами,
располагающимися на наружной поверхности костномозговых синусоидов.
Применительно к эритроидному ряду это явление называется неэффективным
эритропоэзом, применительно к гранулоцитарному — неэффективным гра-
нулопоэзом. Неэффективный гемопоэз охватывает от 2 до 10 % эритробла-
стов и от 10 до 15 % костномозговых гранулоцитов. Их мембраны теряют
сиаловые кислоты, в результате уменьшается отрицательный заряд
мембраны и макрофаги легко фагоцитируют эти клетки. Неполноценные клетки в
кровоток не поступают.
7.5.5. Особенности метаболизма кроветворной ткани
Масса костного мозга у взрослого человека составляет 4,6 % от массы тела,
или 3,4 кг, в том числе масса красного костного мозга — 1,7 кг. Общее
количество ядросодержащих клеток достигает в среднем 8,1 • 109 на кг от
массы тела, а занимаемый ими объем колеблется от 1320 до 4192 мл.
Клетки костного мозга представляют одну из наиболее пролиферирую-
щих тканей организма. Для осуществления митоза клеток используется
энергия макроэргических соединений, образующихся в процессе
окислительного фосфорилирования. Энергообмен в ткани костного мозга
усиливается при повышении пролиферативной активности. Например, усиление
эритропоэза после кровопотери активирует в костном мозге процессы
аэробного окисления, увеличивает скорость потребления кислорода
клетками, интенсивность дыхания и окислительного фосфорилирования в их
митохондриях. Одновременно раскрываются нефункционирующие
синусоиды и увеличивается кровоток в костном мозге, что укорачивает путь
диффузии кислорода от отдельного сосуда к клетке. При активации
гемопоэза в костном мозге возрастает интенсивность синтеза ядерных и мито-
хондриальных ДНК, РНК и белков, увеличивается количество и площадь
поверхности митохондрий, растет общее число рибосом и потребление
свободных аминокислот. Например, усиление регенерации эритроцитов
увеличивает потребление в ткани костного мозга лизина, серосодержащих,
ароматических аминокислот, глутаминовой кислоты. При их дефиците
регенерация красной крови замедляется. Усиление пролиферации гемопо-
этических клеток требует повышения проницаемости их мембран, что
обеспечивается нарастанием интенсивности перекисного окисления липи-
дов. Активации гранулопоэза и, особенно, эритропоэза предшествует
резорбция жировой ткани костного мозга. Высвобождающиеся из нее гемо-
поэтические цитокины- КСФгм, КСФг активируют гемопоэз, а
полиненасыщенные жирные кислоты используются в ходе гемопоэза для
формирования клеток крови.
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • 357
7.6. Роль витаминов и микроэлементов в кроветворении
Витамин В12 и фолиевая кислота (витамин В9) необходимы для синтеза
нуклеопротеинов в разных тканях организма, созревания и деления ядер
эритроидных клеток в кроветворной ткани. При дефиците витаминов В12 и
В9 в наиболее интенсивно делящейся ткани организма — эритроидной —
раньше, чем в других, возникают нарушения, вызывающие анемию. При
дефиците витамина В12 в костном мозге появляются большие ядросодержа-
щие эритроидные клетки — мегалобласты, которые образуют с
замедленной скоростью большие эритроциты — мегалоциты с резко укороченным
периодом жизни. Замедление поступления эритроцитов в кровь и быстрое
их разрушение ведет к анемии. Дефицит витамина В12 возникает в
организме при утрате париетальными клетками желудка способности
продуцировать «внутренний фактор» — гликопротеин (молекулярная масса 60 000).
Фактор связывает витамин В12, поступающий с пищей, и предохраняет его
от расщепления пищеварительными ферментами. Эти нарушения
возникают при атрофии слизистой оболочки желудка, эпителия
двенадцатиперстной кишки, часто наблюдающейся, например, у стариков. И хотя запаса
витамина В12 в печени достаточно взрослому человеку на 1—5 лет,
постепенное его истощение приводит к заболеванию. Суточная потребность в
витамине В,2 — 5 мкг, содержание в плазме крови — 150—450 мкг/л. В
кишечнике комплекс гликопротеин—витамин В12 фиксируется
специальными рецепторами слизистой оболочки тонкого кишечника, далее витамин
поступает в интестинальные клетки, затем в кровь и переносится с
помощью особых молекул — транскобаламинов (I, II, III типов). Транскобала-
мины I и III типа продуцируются лейкоцитами, II — макрофагами.
Поэтому при выраженном лейкоцитозе отмечается гипервитаминоз В12. Витамин
В12 содержится в больших количествах в печени, почках, куриных яйцах.
Фолиевая кислота (витамин В9) поддерживает синтез ДНК в клетках
костного мозга, благодаря обеспечению этого процесса одним из нуклеоти-
дов — диокситимидилатом, образующимся в результате митилирования ди-
оксиуридиловой кислоты в присутствии тетрагидрофолата (одной из
редуцированных форм фолиевой кислоты). При дефиците витамина В9 в пище
у человека уже через 1—6 мес нарушается синтез ДНК и деление
эритроидных клеток, ускоряется разрушение эритроцитов, что ведет к анемии.
Суточная потребность организма человека в фолиевой кислоте 500—700
мкг. Ее резерв в организме равен 5—10 мг, '/3 которого находится в
печени. Фолиевой кислотой богаты овощи (шпинат), дрожжи, молоко.
1,2,5-дигидроксивитамин D3 и ретиноловая кислота (производное
витамина А) участвуют в организме человека в дифференциации кроветворных
клеток до их зрелых форм. Витаминами А и D богаты печень трески,
тунца, сельдь, коровье молоко и сливочное масло.
Витамин В6 (пиридоксин) является кофактором (т. е. дополнительным
фактором активности) фермента — синтетазы 5-аминолевулиновой
кислоты (АЛК-синтетазы), участвующей в образовании гема в эритроидных
клетках в ткани костного мозга (см. рис. 7.2). Дефицит витамина В6 в
организме человека нарушает синтез гемоглобина и вызывает анемию.
Витамином В6 богаты зерна злаков, капуста, картофель, молоко.
Витамин С поддерживает основные этапы эритропоэза, способствуя
метаболизму фолиевой кислоты в эритробластах. Он участвует в метаболизме
железа, повышая как его абсорбцию в желудочно-кишечном тракте, так и
мобилизацию депонированного в клетках железа.
Витамин Е (ос-токоферол) и витамин РР защищают фосфатидилэтанол-
358 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
амин мембраны эритроцитов от усиливающего их гемолиз перекисного
окисления.
Защиту гемоглобина и мембраны эритроцитов от окисления
осуществляет и витамин РР, являющийся одной из составляющих пиридиннуклео-
тидов НАД и НАДФ.
Дефицит витамина В2, участвующего в
окислительно-восстановительных реакциях, вызывает у человека анемию вследствие замедленного
образования эритроцитов в костном мозге.
Микроэлементы: медь способствует всасыванию ионов железа в
кишечнике и мобилизации его резерва из печени и макрофагов; никель и кобальт
способствуют утилизации железа, поддерживая синтез гемоглобина в эрит-
роидных клетках и гемсодержащих молекул в тканях. Кобальт входит в
состав витамина В12. При дефиците кобальта в организме человека возникает
мегалобластическая анемия. Никель индуцирует синтез фосфатидилсери-
на, стабилизирующего мембрану эритроцитов. При дефиците никеля
усиливается выведение ионов железа из организме человека. Селен, тесно
воздействуя с витамином Е, защищает мембрану эритроцита от повреждения
свободными радикалами. Почти 75 % всего цинка в организме человека
находится в эритроцитах в составе фермента карбоангидразы, цинк входит
в состав транскрипционных факторов, регулирующих активность генома
гемопоэтических клеток.
7.7. Основы трансфузиологии
Трансфузиология (от лат. transfusio — переливание) — отрасль медицинской
науки, изучающая способы и средства управления функциями организма
путем воздействия на него переливания цельной крови, ее компонентов
(эритроцитов, лейкоцитов, тромбоцитов, стволовых кроветворных клеток,
плазмы крови) и кровозаменителей.
Переливание крови или ее компонентов от человека человеку
основывается на знании антигенных (иммунных) свойств клеток и белков крови.
7.7.1. Группы крови
Эритроцитарные антигены. Часть из более чем 300 антигенов мембраны
эритроцитов человека объединена в 23 генетически контролируемые
системы групп крови (ABO, Rh-Hr, Дафи, М, N, S, Леви, Диего). Система
антигенов эритроцитов АВО содержит в сыворотке крови естественные анти-А
и анти-В антитела. Генетический локус, контролирующий образование
антигенов этой системы, расположен в длинном плече 9-й хромосомы и
представлен генами Н, А, В и 0. Гены А, В, Н контролируют синтез
ферментов, которые формируют особые моносахариды или антигены
мембраны эритроцита — А, В и Н. Образование антигенов начинается с гена Н,
который через контролируемый им энзим гликолизилтранферазу
формирует из особого вещества-предшественника — церамидпентасахарида —
антиген Н эритроцитов. Далее гены А и В через активность контролируемых
ими энзимов формируют из Н-антигена, являющегося для них исходным
материалом, антигены А или В. Ген «0» не контролирует трансферазу, и Н-
антиген остается неизменным, формируя группу крови 0(1). Таким
образом, на мембране эритроцитов человека присутствуют антигены А, В и Н.
У 20 % людей антиген А имеет антигенные отличия (А, и А2). Антитела
против антигенов А, А,, А2 и В начинают формироваться после рождения
человека иммунной системой в ответ на стимуляцию ее антигенами пищи
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • 359
Таблица 7.3. Группы крови системы АВО
Ген
Н(О)
А,
А2
В
А„ В
А,, В
Антигены на
мембране эритроцита
Н
А,
А2+Н
В
А,+В
А2+В
Антитела (в плазме крови)
Анти-А+ Анти-А2+ Анти-В
Анти-В
Анти-А, у 1 % обследуемых + Анти-В
Анти-А+ Анти-А,
Отсутствуют
Анти-А, у 25 % обследуемых
Группа крови
системы АВО
1(0)
И(А,)
И(А2)
Ш(В)
IV(A„ В)
IV(A2,B)
Таблица 7.4. Определение группы крови системы АВО
Группа крови
исследуемых
эритроцитов
0(1)
А (11)
В (III)
А, В (IV)
Антитела (антисыворотки), добавляемые к исследуемым эритроцитам
анти-А
1 + 1 +
анти-В
+ + 1 1
«—» — агглютинация отсутствует, «+» — агглютинация эритроцитов.
и бактерий, поступающих, например, в организм с вдыхаемым воздухом.
Максимум продукции анти-А и анти-В антител приходится на
8—10-летний возраст. При этом в плазме крови накапливается анти-А больше, чем
анти-В. Антитела анти-А и анти-В называются изоантишелами, или
агглютининами, а соответствующие антигены мембраны — агглютиногенами.
Характеристика групп крови системы АВО представлена в табл. 7.3.
Естественные анти-А- и анти-В-антитела принадлежат к
иммуноглобулинам класса М. Выработанные в процессе иммунизации А или В
антигеном анти-А- и анти-В-антитела являются иммунными и относятся к
иммуноглобулинам класса G. Иммуноглобулины склеивают эритроциты
(явление агглютинации) и вызывают их гемолиз. При несовместимости группы
крови донора (т. е. человека, у которого берут кровь для переливания) и
реципиента (т. е. человека, которому переливают кровь) переливание крови
вызывает гемоконфликт, связанный с агглютинацией и гемолизом
эритроцитов, заканчивающийся гибелью реципиента. Для исключения гемокон-
фликтов человеку переливают лишь одногруппную кровь. Для определения
группы крови по системе АВО смешивают антитела анти- А и анти- В с
исследуемыми эритроцитами и по наличию или отсутствию агглютинации
эритроцитов определяют группу крови (табл. 7.4).
Rh-Hr антигены эритроцитов. Rh-антигены представлены на мембране
эритроцитов тремя связанными участками: антигенами С (rh') или с (hr"),
Е (rh") или е (hr") и D (Rh,,) или d. Из этих антигенов сильным является
D, он способен иммунизировать человека, у которого антиген D
отсутствует. Люди, имеющие D-антиген, называются «резус-положительными» (Rh+),
среди европейцев их 85 %, а не имеющие его — «резус-отрицательными»
(Rh-) (15 %). У некоторых народов, например эвенков, отмечается 100 %
Rh+ принадлежность.
Резус-положительная кровь донора образует иммунные антитела (анти-
D) у резус-отрицательного реципиента. Повторное переливание
резус-положительной крови может вызвать гемоконфликт. Подобная же ситуация
360 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
возникает у резус-отрицательной женщины, беременной
резус-положительным плодом. Во время родов (или аборта) эритроциты плода
поступают в кровь матери и иммунизируют ее организм (вырабатывают анти-D-
антитела). При последующих беременностях резус-положительным плодом
анти-Б-антитела проникают через плацентарный барьер, повреждают
ткани и эритроциты плода, вызывая выкидыш, а при рождении ребенка — ре-
зусную болезнь, одним из проявлений которой является гемолитическая
анемия. Для профилактики иммунизации резус-отрицательной женщины
D-антигёнами плода во время родов или абортов ей вводят
концентрированные анти-Б-антитела. Они агглютинируют резус-положительные
эритроциты плода, поступающие в ее организм, и имммунизации не наступает.
Слабые резусные антигены С и Е при их значительном поступлении в
организм резус-положительного человека могут вызвать антигенные реакции.
Чаще всего антитела к антигенам эритроцитов системы резус являются
иммуноглобулинами класса G. Для выявления этих антител используют анти-
глобулиновую сыворотку крови, содержащую aHTH-IgG-антитела.
Антигенные свойства лейкоцитов и тромбоцитов. В настоящее время
вместе с эритроцитарными антигенами открыто более 500 антигенов
клеток крови и белков плазмы, которые создают свыше 40 различных
антигенных систем крови, сочетания же различных антигенных систем
образуют в человеческой популяции множество антигенных комбинаций.
Поэтому, несмотря на подбор донора и реципиента по системам АВО
эритроцитов, всегда имеется несовместимость в других антигенных структурах их
крови, приводящая к иммунизации организма реципиента.
На мембранах лейкоцитов помимо антигенов системы ABO, MN, Левис
содержатся антигены гистосовместимости HLA (от Human Leucocyte
Antigens), представленные более чем 150 антигенами, а также антигены
нескольких других генетических систем — NA, NB, NC, ND, NE и др.
Антигены гистосовместимости HLA представлены и на поверхности
тромбоцитов. Несовместимость по антигенам HLA комплекса у донора и
реципиента при переливании цельной крови и ее компонентов (лейкоцитарной или
тромбоцитарной массы) приводит к иммунизации реципиента.
Минимальное количество лейкоцитов, вызывающее иммунизацию реципиента,
составляет 1 • 10б. Образовавшиеся в организме реципиента антитела против
антигенов системы HLA или антигенов лейкоцитов NA-NE при повторном
переливании крови реципиенту вызывают различные осложнения
(лихорадку, возникающую в результате освобождения пирогенных веществ из
поврежденных антителами лейкоцитов; антитела вызывают разрушение
донорских лейкоцитов и тромбоцитов и др.). Такие реакции могут
развиваться у реципиентов после повторного переливания цельной крови, эритро-
цитарной или тромбоцитарной массы, плазмы крови, так как
лейкоцитарные антигены находятся в растворимой форме в плазме крови,
присутствуют на поверхности других клеток крови. Из сказанного следует, что
трансфузия цельной крови от донора реципиенту, даже имеющим одну и ту же
группу крови по системе АВО и Rh-Hr, тем не менее, может привести к
осложнениям, связанным с поступлением в организм реципиента
лейкоцитов и тромбоцитов, имеющих разные с лейкоцитами и тромбоцитами
реципиента антигенные характеристики, что вызывает иммунизацию и по-
слетрансфузионную реакцию у реципиента. Поэтому цельную кровь для
переливания используют в клинике крайне редко, лишь по экстренным
жизненным показаниям, например с целью полного восполнения крово-
потери у детей, весьма чувствительных к гипоксии, вызванной острой кро-
вопотерей. Кроме того, переливание цельной свежезаготовленной крови
7. Функции клеток крови. Гемостаз. Регуляция кроветворения. Трансфузиология • 361
несет опасность передачи инфекции реципиенту, если донор находился в
латентном (скрытом), не поддающемся диагностике периоде заболевания
гепатитом В, С, D, СПИДом, сифилисом и малярией. Поэтому больным с
целью восстановления газотранспортной функции крови переливают эрит-
роцитарную массу, отмытую от плазмы крови, обедненную или лишенную
лейкоцитов и тромбоцитов. Так, 5-кратное отмывание эритроцитов
изотоническим раствором NaCl удаляет из эритроцитарной массы до 80 %
лейкоцитов и почти все тромбоциты и эффективно предупреждает
иммунизацию организма реципиента.
7.7.2. Влияние переливаемой крови и ее компонентов на организм
человека
Перелитая пациенту кровь или ее компоненты позволяют восстановить
объем потерянной крови, коллоидно-осмотическое давление крови,
газотранспортную, кроветворную, защитную (иммунную), питательную, регу-
ляторную, гемостатическую функции крови, стимулируют гомеостатиче-
ские механизмы, поддерживающие объем жидкостей различных секторов
организма.
После кровопотери взрослый человек может выжить без переливания
крови или кровозаменителей, если потеря циркулировавших в сосудистом
русле эритроцитов не превысит 2/з> а плазма крови —1/3 от их исходного
количества. Большая потеря объема циркулирующих эритроцитов и
объема циркулирующей плазмы без возмещения их потери приводит организм
человека к гибели. Для получения лечебного эффекта дефицит потерянных
с кровопотерей эритроцитов восполняют на 80%, а плазмы —на 150—
170 %, т. е. объем плазмы крови, переливаемой больному, должен быть
больше утраченного с кровопотерей. Введение избыточного объема плазмы
улучшает реалогические характеристики циркулирующей крови,
способствует вымыванию эритроцитов из депо в циркуляцию. Например, с целью
восстановления газотранспортной функции крови больным, перенесшим
кровопотерю или страдающим анемией с уменьшением гемоглобина ниже
80 г/л крови, переливают одногруппную (по системе АВ0) эритроцитарную
массу, полученную от одного донора, и изотонический раствор NaCl,
устраняя дефицит эритроцитов в организме больного на 80 %, а плазмы
крови — на 130—150 % от нормального уровня.
Переливание одногруппной крови (по системе АВ0) от разных доноров
одному реципиенту может вызвать сильное иммунологическое воздействие
на организм реципиента и синдром «гомологичной крови», связанный с
появлением микроагрегатов клеток крови (до 150—200 мкм), вызывающих
закупорку мелких легочных и мозговых сосудов реципиента, других,
опасных для жизни осложнений.
С целью восстановления тромбоцитарного звена гемостаза (например,
при тромбоцитопении или функциональной недостаточности
тромбоцитов) переливают тромбоцитарный концентрат. Так, при снижении
тромбоцитов у человека ниже 20 • 109/л крови могут возникать самопроизвольные,
внезапные кровотечения в желудочно-кишечном тракте, внутричерепные,
что требует переливания таким больным тромбоцитарного концентрата.
Лечебная доза тромбоцитарного концентрата, обеспечивающая
прекращение кровоточивости, содержит не менее 2,8—3,0 • 10" тромбоцитов.
Трансфузия концентратов лейкоцитов производится с целью
повышения иммунных и защитных сил организма больных (например, с гнойно-
деструктивными заболеваниями легких, при стафилококковом сепсисе,
362 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
гнойном менингите и др.). Концентрат лейкоцитов (состоящий из грану-
лоцитов и лимфоцитов) донора должен быть совместим с лейкоцитами
реципиента по системам ABO, Rh-Hr и лейкоцитарным антигенам. Лечебная
доза концентрата, переливаемая больному, содержит от 10 • 109 до 40 • 109
лейкоцитов. При использовании концентрата лейкоцитов или
тромбоцитов должно строго выполняться правило «один донор — один реципиент».
Переливание плазмы крови производится с целью поддержания плазмен-
но-коагуляционного гомеостаза (например, для остановки кровотечения
больному с гемофилией, страдающему дефицитом VIII фактора); с целью
создания пассивного гуморального иммунитета (например, при инфекции
организма синегнойной палочкой или стафилококками больным
переливают антисинегнойную плазму донора, содержащую антитела против
синегнойной палочки, антистафилококковую — с антителами против
стафилококков, повышая устойчивость организма больных против этих
инфекций); с целью заместительной терапии — например, при ожоговой
болезни, когда имеет место выраженная потеря плазмы, связанная с выходом
плазмы крови из сосудов, вызывающая сгущение крови и ухудшение
кровоснабжения тканей. Так, при ожоговом поражении до 10—15 % площади
тела плазмопотеря достигает 6—8 л в сутки и ее замещение производят
плазмой крови и кровозаменителями. Средняя доза вводимой плазмы —
500 мл.
Переливаемая плазма должна быть одной группы с кровью реципиента
по системе АВ0. В чрезвычайных ситуациях, когда отсутствует одногруп-
пная плазма, переливают плазму донора группы А(П) или В(Ш)
реципиенту с 0 (I) группой крови и плазму АВ (IV) группы реципиентам любой
группы крови.
При дефиците донорской крови и ее компонентов для лечения острой
кровопотери, травматического шока, плазмопотери (при ожоговой травме)
используют кровезаменители, которые восстанавливают объем
циркулирующей крови, нарушенную гемодинамику (повышают до нормального
значения уровень артериального давления, нормализуют
микроциркуляцию), коллоидно-осмотическое давление крови.
В качестве кровозаменителей, восстанавливающих нарушенное крово-
потерей кровообращение, используют, например, декстран —
водорастворимый высокомолекулярный (мол. масса 80 000) полимер глюкозы — и
созданные на его основе полиглюкин, полиглюсоль, реополиглюкин. Кро-
возаменители, благодаря молекулярной массе, препятствующей выходу
молекул через стенку сосудов в интерстиций, поддерживают высокое
коллоидно-осмотическое давление плазмы крови, вследствие чего способствуют
движению тканевой жидкости в кровоток, поддерживают нормальный
объем циркулирующей крови.
ГЛАВА 8
Иммунная система
*
Во внутренней среде организма присутствуют клетки и молекулы,
которые обеспечивают защитную функцию (иммунитет). Часть из них
относятся к факторам врожденного иммунитета, т. е. присутствуют в организме
еще до встречи с каким-либо болезнетворным микроорганизмом или
чужеродной молекулой. К таким факторам защиты относятся
фагоцитирующие клетки крови и тканей, а также большие гранулярные лимфоциты,
получившие название «натуральные (естественные) киллеры». Врожденными
факторами защиты организма являются также молекулы, продуцируемые и
секретируемые вышеназванными клетками, а также лимфоцитами, стро-
мальными и другими клетками. К таким молекулам относятся: белки
системы комплемента, медиаторы межклеточного взаимодействия — цитокины
и др. Белки системы комплемента продуцируются постоянно и
циркулируют в крови, большинство цитокинов начинают продуцироваться и секре-
тироваться клетками только в ответ на сигнал активации (например, на
контакт с микроорганизмом).
Более эффективным способом защиты внутренней среды организма от
проникающих в нее чужеродных агентов (антигенов) является
специфический иммунный ответ, в результате которого организм приобретает
дополнительные защитные механизмы: активированные клетки и
продуцируемые ими молекулы. Защитное действие этих механизмов строго
избирательно (специфично) в отношении того конкретного антигена (например,
патогенного микроорганизма), контакт с которым вызвал иммунный ответ.
Специфический иммунный ответ является функцией клеток и органов
иммунной системы.
Центральные органы
Периферические органы
Рис. 8.1. Рециркуляция лимфоцитов.
Из центральных органов иммунной системы (костного мозга и тимуса) созревающие
лимфоциты поступают в кровь и заселяют периферические органы и ткани иммунной системы,
откуда снова поступают в лимфоток, в кровоток, продолжая рециркуляцию.
*Глава написана членом-корреспондентом РАМН И. С. Фрейдлин.
364 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Главными клетками иммунной системы являются Т- и В-лимфоциты,
которые рециркулируют в системе кровотока и лимфотока, постоянно
перемещаясь из одних органов иммунной системы в другие, обладают
способностью выходить в ткани для выполнения защитных функций
(рис. 8.1).
В защитных реакциях специфического иммунитета кроме Т- и В-лим-
фоцитов участвуют фагоцитирующие клетки (гранулоциты, моноциты,
макрофаги), «естественные киллеры, тучные клетки, эндотелиальные и
эпителиальные клетки, которые играют роль вспомогательных,
взаимодействуя с Т- и В-лимфоцитами.
8.1. Происхождение и функции клеток иммунной системы
Лимфоциты, как и другие клетки крови, ведут свое происхождение из
единой стволовой гемопоэтической клетки. Лимфопоэз имеет черты сходства с
общим гемопоэзом: зависит от контактов клеток-предшественниц со стро-
мальными клетками и от влияния цитокинов. Вместе с тем лимфопоэзу
присущи некоторые особенности: возникновение в процессе
пролиферации клеток-предшественниц широкого разнообразия Т- и В-лимфоцитов с
разными антигенраспознающими рецепторами; гибель путем апоптоза
значительной части пролиферирующих клеток-предшественниц;
избирательное накопление в результате пролиферации клеток — потомков одной
клетки, первоначально активированной при контакте с соответствующим
антигеном, «клона» клеток, все клетки которого несут одинаковые по
специфичности антигенраспознающие рецепторы.
Лимфоциты — это единственные клетки организма, способные
специфически распознавать собственные и чужеродные антигены и отвечать
активацией на контакт с конкретным антигеном. При весьма сходной
морфологии малые лимфоциты делятся на две популяции, имеющие
различные функции и продуцирующие разные белки (табл. 8.1).
Одна из популяций получила название В-лимфоциты, от названия
органа «бурса Фабрициуса», где было впервые обнаружено созревание этих
клеток у птиц. У человека В-лимфоциты созревают в костном мозге. В-
лимфоциты распознают антигены специфическими рецепторами иммуно-
глобулиновой природы, которые по мере созревания В-лимфоцитов
появляются на их мембранах. Взаимодействие антигена с такими рецепторами
является сигналом активации В-лимфоцитов и их дифференцировки в плаз-
Таблица 8.1. Классификация лимфоцитов человека
Свойства клеток
Органы, где
происходит развитие клеток
Морфологические
особенности
Антигенраспознаю-
щий рецептор
Содержание в крови
(% от общего
количества лимфоцитов)
Функции
В-лимфоциты
Костный мозг
Малые лимфоциты
Иммуноглобулин
8-20%
Предшественники
антителопродуцен-
тов (плазмоцитов)
Т-лимфоциты
Костный мозг,
тимус
Малые лимфоциты
Т-клеточный
рецептор — димер
65-80 %
Предшественники
эффекторных и ре-
гуляторных клеток
NK-клетки
Костный мозг,
селезенка
Большие
гранулярные лимфоциты
Отсутствует
5-20 %
Естественные
(натуральные) киллеры
8. Иммунная система • 365
матические клетки, продуцирующие и секретирующие специфические для
данного антигена антитела — иммуноглобулины.
Другая популяция получила название Т-лимфоциты в связи с диффе-
ренцировкой их предшественников в тимусе. Эта популяция включает
разные субпопуляции, среди которых наиболее отчетливо различаются Т-хел-
перы (CD4+) и цитотоксические Т-лимфоциты (CD8+). В отличие от В-лим-
фоцитов, способных распознавать и связывать белковые, полисахаридные
и липопротеидные растворимые антигены, Т-лимфоциты могут
распознавать только короткие пептидные фрагменты белковых антигенов на
поверхности вспомогательных антигенпредставляющих клеток (дендритных,
макрофагов или В-лимфоцитов) в комплексах с собственными молекулами
главного комплекса гистосовместимости. Связывание антигена с антиген-
распознающим рецептором на клеточной мембране индуцирует активацию
Т-лимфоцита, которая проявляется продукцией и секрецией цитокинов,
усиливающих процессы пролиферации и дифференцировки самих Т-лим-
фоцитов, В-лимфоцитов и макрофагов.
Т-лимфоциты выполняют важнейшую функцию специфического
распознавания и связывания антигена, что ведет к их активации, пролиферации
и дифференцировке разных субпопуляций Т-лимфоцитов, участвующих
далее во всех формах иммунного ответа.
Главной функцией В-лимфоцитов также является специфическое
распознавание антигена, которое ведет к их активации, пролиферации и
дифференцировке в плазматические клетки — продуценты специфических
антител — иммуноглобулинов, т. е. к гуморальному иммунному ответу. Чаще
всего В-лимфоциты для развития гуморального иммунного ответа
нуждаются в помощи Т-лимфоцитов в виде продукции активирующих
цитокинов.
Имеется еще один тип лимфоцитов — большие гранулярные
лимфоциты, отличающиеся от меньших по величине Т- и В-лимфоцитов не только
особенностями структуры, но и отсутствием антигенраспознающего
рецептора. Эти клетки получили название «естественные киллеры»: они
способны убивать инфицированные разными вирусами клетки-мишени или
опухолевые клетки (см. табл. 8.1).
Все процессы транспортировки лимфоцитов из первичных во
вторичные органы иммунной системы, из вторичных органов иммунной системы
в ткани зависят от взаимодействия особого типа цитокинов — хемокинов с
соответствующими рецепторами на поверхности клеток. Кроме хемокинов
миграция лимфоцитов зависит от присутствия на их поверхности
адгезионных молекул, которым соответствуют молекулы-лиганды на поверхности
эндотелиальных клеток сосудов, на поверхности макрофагов и дендритных
клеток, на элементах внеклеточного матрикса.
8.1.1. Т-лимфоциты
8.1.1.1. Характеристики Т-лимфоцитов
Решающее событие в развитии Т-лимфоцитов — формирование
антигенраспознающего Т-клеточного рецептора — происходит только в тимусе.
Для обеспечения возможности распознавания любого антигена нужны
миллионы различных по специфичности антигенраспознающих
рецепторов. Формирование огромного разнообразия антигенраспознающих
рецепторов возможно благодаря перестройке генов в процессе пролиферации и
дифференцировки клеток-предшественниц.
366 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Таблица 8.2. Типы молекул на поверхности Т-лимфоцитов
Молекулы
Антигенраспознающий
рецептор: Т-клеточный рецептор
Корецепторы: CD4, CD8
Адгезионные молекулы
Костимулирующие молекулы
Рецепторы иммуноглобулинов
Рецепторы цитокинов
Функции
Распознавание и связывание комплекса: антигенный
пептид + собственная молекула главного комплекса
гистосовместимости
Участвуют в связывании молекулы главного
комплекса гистосовместимости
Адгезия лимфоцитов к эндотелиальным клеткам, к
антигенпредставляющим клеткам, к элементам
внеклеточного матрикса
Участвуют в активации Т-лимфоцитов после
взаимодействия с антигеном
Связывают иммунные комплексы
Связывают цитокины
По мере созревания Т-лимфоцитов на их поверхности появляются ан-
тигенраспознающие рецепторы и другие молекулы, опосредующие их
взаимодействие с антигенпредставляющими клетками. Так, в
распознавании собственных молекул главного комплекса гистосовместимости (см.
раздел 8.3.2) наряду с Т-клеточным рецептором участвуют молекулы CD4
или CD8. Межклеточные контакты обеспечиваются наборами
поверхностных адгезионных молекул, каждой из которых соответствует молекула —
лиганд на поверхности другой клетки. Как правило, взаимодействие Т-
лимфоцита с антигенпредставляющей клеткой не ограничивается
распознаванием антигенного комплекса Т-клеточным рецептором, а
сопровождается связыванием других попарно комплементарных поверхностных
«костимулирующих» молекул.
Сочетание поверхностных молекул лимфоцитов, которые принято
обозначать порядковыми номерами «кластеров дифференцировки» (clusters of
differentiation — CD), обозначается как «поверхностный фенотип клетки», а
отдельные поверхностные молекулы называют «маркерами», так как они
служат метками конкретных субпопуляций и стадий дифференцировки Т-
лимфоцитов. Так, например, на поздних этапах дифференцировки одни Т-
лимфоциты утрачивают молекулу CD8 и сохраняют только CD4, а другие
утрачивают CD4, а сохраняют CD8. Поэтому среди зрелых Т-лимфоцитов
различают CD4+ (Т-хелперы) и CD8+ (цитотоксические Т-лимфоциты).
Среди циркулирующих в крови Т-лимфоцитов клеток с маркером CD4
примерно в два раза больше, чем клеток с маркером CD8.
Зрелые Т-лимфоциты несут на поверхности рецепторы для разных
цитокинов и рецепторы для иммуноглобулинов (табл. 8.2).
При распознавании Т-клеточным рецептором антигена Т-лимфоциты
получают сигналы активации, пролиферации и дифференцировки в
направлении клеток-эффекторов, т. е. клеток, способных непосредственно
участвовать в защитных или повреждающих эффектах. Для этого на их
поверхности резко возрастает количество адгезионных и костимулирующих
молекул, а также рецепторов для цитокинов. Активированные
Т-лимфоциты начинают продуцировать и секретировать цитокины, активирующие
макрофаги, другие Т-лимфоциты и В-лимфоциты.
После завершения инфекции, сопряженной с усиленной продукцией,
дифференцировкой и активацией Т-эффекторов соответствующего клона,
в течение нескольких дней 90 % эффекторных клеток погибают, поскольку
не получают дополнительных сигналов активации. В организме остаются
8. Иммунная система • 367
долгоживущие клетки памяти, несущие соответствующие по
специфичности рецепторы и способные ответить пролиферацией и активацией на
повторную встречу с тем же антигеном.
8.1.1.2. Субпопуляции Т-лимфоцитов
Основная функция CD4+ Т-лимфоцитов — продуцировать цитокины (см.
раздел 8.4.2), активирующие функции других клеток, в связи с этим
данные клетки называют помощниками (helper) и обозначают соответственно
77г. Основной функцией СЕ)8+Т-лимфоцитов является цитотоксичность,
т. е. способность убивать клетки-мишени, инфицированные
соответствующим по специфичности вирусом, поэтому их называют цитотоксическими
Т-лимфоцитами и обозначают CTL (табл. 8.3).
Таблица 8.3. Характеристики трех типов эффекторных Т-лимфоцитов
Типы клеток
Обозначение
Функция
Основные
продуцируемые молекулы
CD8+ Т-клетки
CTL
Цитотоксическое
действие на клетки-мишени
Перфорины, грензимы
CD4+ Т-клетки
ТЫ
Активация
макрофагов
ИФНу, ГМ-КСФ,
ТНФа, CD40 L
CD4+ Т-клетки
Th2
Активация
В-лимфоцитов
ИЛ-4, ИЛ-5,
ИЛ-6, CD40 L
СБ4+Т-лимфоциты после распознавания антигена начинают секретиро-
вать интерлейкины (ИЛ-2, ИЛ-4), гамма-интерферон и дифференцируются
в двух направлениях. Одни — 77? 1 — приобретают способность
активировать макрофаги и участвовать в клеточном иммунном ответе. Другое
направление дифференцировки ведет к формированию 77г2, способных акти-
Интерлейкины 4,10, 13
Интерлейкины 4, 10, 13
Гамма-интерферон
Интерлейкин-12
Гамма-интерферон
Интерлейкин-12
Рис. 8.2. Цитокиновый баланс, от которого зависит преобладание клеточного или
гуморального иммунного ответа. Превалирование Th2 приводит к усилению
гуморального ответа и подавлению ТЫ. Превалирование ТЫ приводит к усилению
клеточного иммунного ответа и подавлению Th2. Эти альтернативные эффекты
опосредованы разными группами цитокинов.
368 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
вировать В-лимфоциты к продукции соответствующих по специфичности
антител, т. е. участвуют в гуморальном иммунном ответе. Каждая из двух
субпопуляций Th продуцирует аутокринно и паракринно действующие ци-
токины, способные помешать дифференцировке и активации
альтернативной субпопуляции (рис. 8.2).
8.1.1.3. Функции Т-лимфоцитов
При развитии специфического иммунного ответа Т-лимфоциты в
лимфатических узлах, селезенке и мукозноассоцииросванных лимфоидных
тканях выполняют секреторные и эффекторные функции.
Активированные Т-лимфоциты продуцируют и секретируют молекулы
цитокинов. Цитокины связываются со специфическими рецепторами на
поверхности клеток-мишеней. Соединение цитокина с его рецептором
порождает сигнал активации, который передается соответствующими
факторами трансдукции к ядру клетки-мишени, где начинают функционировать
определенные гены, контролирующие функции клеток. Таким образом, Т-
лимфоциты своими продуктами цитокинами контролируют процессы
пролиферации, дифференцировки и функциональную активность макрофагов,
дендритных клеток, других Т-лимфоцитов, В-лимфоцитов.
Некоторые цитокины непосредственно участвуют в защите организма:
• интерфероны обладают противовирусным действием,
• туморнекротизирующий фактор (ТНФ) оказывает цитотоксическое
действие на некоторые опухолевые клетки.
Активированные CD8+ Т-лимфоциты выполняют эффекторную
функцию цитотоксических Т-лимфоцитов (CTL): распознают своими
рецепторами и убивают клетки-мишени, несущие на своей поверхности
соответствующий по специфичности антигенный пептид. При непосредственном
контакте CTL с клеткой-мишенью содержимое гранул CTL (цитотоксины:
перфорины и грензимы) проникают в клетку-мишень и вызывают ее
гибель.
8.1.2. В-лимфоциты
8.1.2.1. Характеристики В-лимфоцитов
Предшественники В-лимфоцитов из эмбриональной печени человека на
8—9-й неделе развития плода перемещаются в костный мозг, где они
созревают под влиянием интерлейкина 7, который секретируют стромальные
клетки.
В ранний период созревания в костном мозге формируется и
фиксируется на поверхностной мембране В-лимфоцита иммуноглобулиновый анти-
генраспознающий рецептор. Незрелый В-лимфоцит уже несет мембранные В-
клеточные рецепторы (IgM) определенной специфичности, т. е. способные
распознать и связать конкретный антиген. При встрече незрелых
В-лимфоцитов с аутоантигенами связывание последних с мембранными IgM
ведет к остановке дифференцировки этих В-лимфоцитов, с последующей их
гибелью путем апоптоза. На этой стадии погибают до 90 % незрелых В-
клеток. Часть незрелых В-клеток после контакта с растворимым аутоанти-
геном не погибают, а переходят в состояние анергии по отношению к
данному антигену. Этим объясняется врожденное состояние иммунологической
толерантности (неспособности ответить) на собственные аутоантигены.
Выжившие в этом процессе отбора В-клетки по мере созревания поки-
8. Иммунная система • 369
дают костный мозг, переходя в кровяное русло через венозные синусы, и
поступают в периферические органы иммунной системы, где
превращаются в зрелые В-лимфоциты. В кровяном русле В-лимфоциты включаются в
рециркуляцию и заселяют В-зоны периферических органов и тканей
иммунной системы.
Около 2 • 107 В-лимфоцитов покидают костный мозг ежедневно, что
составляет 5—10 % общей популяции В-клеток периферической крови.
Этого достаточно, чтобы полностью обновить популяцию периферических
В-лимфоцитов за 4—5 дней. Среди сохранившихся и вступивших в
рециркуляцию относительно долгоживущих В-лимфоцитов (с полупериодом
жизни 1—2 мес) значительную часть составляют клетки памяти,
способные быстро ответить пролиферацией, активацией, продукцией и секрецией
специфических антител (иммуноглобулинов) на повторную встречу с тем
же антигеном.
8.1.2.2. Функции В-лимфоцитов
В-лимфоциты с помощью своих иммуноглобулиновых рецепторов могут
распознавать не только пептиды, но и более крупные молекулы белков,
нуклеиновых кислот, углеводов, липидов, полисахаридные и липопротеид-
ные растворимые антигены. Зрелые В-лимфоциты способны
самостоятельно распознавать растворимые антигены, в отличие от Т-лимфоцитов они
не нуждаются в презентации чужеродных антигенов. Более того,
В-лимфоциты сами могут выполнять функцию антигенпредставляющих клеток при
взаимодействии с ТЫ. Для этого В-лимфоциты имеют на своей
поверхности адгезионные и костимулирующие молекулы, рецепторы для
иммуноглобулинов, компонентов системы комплемента и для цитокинов
(табл. 8.4).
Распознавание антигена В-клеточным рецептором служит одним из
сигналов активации В-лимфоцитов, которая проявляется их
пролиферацией и дифференцировкой в продуцирующие иммуноглобулины
плазматические клетки. Дополнительные сигналы активации В-клетки получают при
взаимодействии с 7Ъ2, которые продуцируют и секретируют
соответствующие цитокины: интерлейкины 4, 5, 6, 10.
Синтез и секреция антител (иммуноглобулинов) В-лимфоцитами
является завершающей стадией специфического гуморального иммунного
ответа на конкретный антиген. В динамике иммунного ответа происходит
переключение синтеза антител, который начинается с IgM, на другие изотипы:
Таблица 8.4. Типы молекул на поверхности В-лимфоцитов
Молекулы
Антигенраспознающий рецептор им-
муноглобулиновой природы
Адгезионные молекулы
Костимулирующие молекулы
Рецепторы иммуноглобулинов
Рецепторы компонентов комплемента
Рецепторы цитокинов
Молекулы главного комплекса гисто-
совместимости
Функции
Распознавание и связывание антигена
Адгезия лимфоцитов к эндотелиальным
клеткам, к элементам внеклеточного матрикса
Участвуют в активации В-лимфоцитов после
взаимодействия с антигеном
Связывают иммунные комплексы
Участвуют в связывании иммунных комплексов
Связывают цитокины
Участвуют в презентации антигенов
370 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
IgG, IgA или IgE. Переключение индуцируется разными цитокинами и
взаимодействием костимулирующих молекул (CD40—CD40L),
присутствующих на поверхности В-лимфоцитов и Th2.
8.1.3. Антигенпредставляющие клетки
Способностью представлять (презентировать) антигенные пептиды
Т-лимфоцитам обладают антигенпредставляющие клетки: дендритные клетки,
макрофаги и В-лимфоциты. Презентации антигенных пептидов
предшествуют стадии: 1) захвата поступившего в организм антигена, 2) его
переработки (дезинтеграции), 3) формирования комплексов накопившихся
антигенных пептидов с собственными молекулами главного комплекса гисто-
совместимости, постоянно синтезирующиеся в этих клетках (см. раздел
8.3.2), 4) транспортировки образовавшихся комплексов на мембрану анти-
генпрезентирующей клетки, 5) доставки во вторичные лимфоидные
органы, где и происходит встреча с Т-лимфоцитами и распознавание
образовавшегося комплекса Т-клеточным рецептором.
Дендритные клетки, как и макрофаги и лимфоциты, имеют гемопоэти-
ческое происхождение. Дендритные клетки локализованы в эпителии
кишечника, урогенитального тракта, воздухоносных путей, легких, в
эпидермисе кожи (клетки Лангерганса) и интерстициальных пространствах.
8.2. Структура и функции органов иммунной системы
К органам иммунной системы относятся:
— центральные (первичные): костный мозг и тимус,
— периферические (вторичные): селезенка, лимфатические узлы,
ассоциированная со слизистыми оболочками (мукозно-ассоциированная)
лимфоидная ткань.
В центральных органах иммунной системы постоянно идут процессы
пролиферации клеток-предшественниц Т- и В-лимфоцитов, их созревания
(дифференцировки), их отбора (селекции), сопровождающиеся их
частичной гибелью или транспортировкой созревающих клеток через кровь в
периферические органы.
Периферические органы иммунной системы являются местом встречи Т-
и В-лимфоцитов с поступающими туда антигенами, местом распознавания
антигенов и развития последовательных стадий специфического иммунного
ответа на данный антиген. Распознавание антигена лимфоцитом служит
сигналом его усиленной пролиферации, ускоренной дифференцировки и
активации. В-лимфоциты после активации в периферических органах иммунной
системы дифференцируются в плазматические клетки, продуцирующие и
секретирующие антитела — иммуноглобулины. Активированные Т- и В-
лимфоциты в периферических органах иммунной системы продуцируют и
секретируют межклеточные медиаторы — цитокины, влияющие на
иммунный ответ. Там же, в периферических органах иммунной системы,
накапливаются и сохраняются долгоживущие Т- и В-лимфоциты, ответственные
за поддержание «иммунологической памяти» о встрече с данным антигеном.
8.2.1. Костный мозг
Продолжая функцию эмбриональной печени, костный мозг является
местом гемопоэза (см. главу 7), в том числе лимфопоэза (рис. 8.3). Единая
гемопоэтическая стволовая клетка может дифференцироваться в сторону
8. Иммунная система • 371
ГМ-КСФ, ИЛ-1, ИЛ-3, ИЛ-6, ИЛ-11
ИЛ-3, ИЛ-9,
ГМ-КСФ,
М-КСФ,
ТНФ-ос
-в-
Кроветворная
стволовая клетка
ИЛ-1, ИЛ-6
ИЛ-1.ИЛ-2,
ИЛ-4, ИЛ-6,
ИЛ-7
ГМ-КСФ,
Г-КСФ,
ИЛ-1
Миелобласт Монобласт
ш
ИЛ-1, ИЛ-2,
ИЛ-4, ИЛ-5,
ИЛ-6, ИЛ-7
Миеломоно-
цитарная
клетка-предшественница
Лимфоцитарная
клетка-
предшественница
Тимоцит Пре-В-лимфоцит
Естественный
Промиелоцит Промоноцит
Ju
Гранулоцит
киллер (ЕК) Т-лимфоцит В-лимфоцит
Т-хелпер
CTL
Плазматическая клетка
Макрофаг
Рис. 8.3. Миеломоноцитопоэз и лимфопоэз в общей системе гемопоэза.
Единая стволовая гемопоэтическая клетка является общей клеткой-предшественницей всех
ростков кроветворения. Миеломоноцитарные клетки-предшественницы под контролем
указанных групп цитокинов созревают и дифференцируются в гранулоциты и
моноциты/макрофаги. Клетки-предшественницы лимфоцитов под влиянием указанных групп цитокинов
созревают и дифференцируются в Т- и В-лимфоциты, или в естественные киллеры. Миелоид-
ные и лимфоидные клетки-предшественницы могут дифференцироваться в дендритные
клетки в присутствии указанных цитокинов.
372 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
общей клетки-предшественницы лимфоцитов. Эта клетка дает начало
клеткам-предшественницам В-лимфоцитов, Т-лимфоцитов и естественных
киллеров. Дальнейшая дифференцировка лимфоцитов зависит от влияния
колониестимулирующих факторов, продуцируемых стромальными
клетками костного мозга. Созревающие активированные лимфоциты начинают
продуцировать цитокины, аутокринно влияющие на их пролиферацию и
дифференцировку. Так, интерлейкин-1 и интерлейкин-6 служат синергиста-
ми колониестимулирующих факторов в стимуляции пролиферации клеток-
предшественниц; интерлейкин-2 является ростовым фактором
Т-лимфоцитов; интерлейкины-4, -6, -7 способствуют выживанию, пролиферации и
дифференцировке ранних предшественниц лимфоцитов; туморнекротизи-
рующий фактор (ТНФ), гамма-интерферон, трансформирующий ростовой
фактор-бета (ТРФ-бета), напротив, ингибируют процессы пролиферации
и дифференцировки клеток-предшественниц.
Созревшие в костном мозге клетки-предшественницы Т-лимфоцитов
через кровоток попадают в тимус для дальнейшей дифференцировки. В
отличие от Т-лимфоцитов, местом дальнейшего созревания В-лимфоцитов у
млекопитающих является костный мозг. Один из продуктов стромальных
клеток костного мозга — интерлейкин- 7 преимущественно стимулирует
процесс созревания В-лимфоцитов из костномозговых предшественников.
Созревшие В-лимфоциты выходят в кровь, заселяют лимфоидные органы,
участвуют в рециркуляции, проявляя способность к распознаванию
конкретного антигена. Распознавание антигена служит одним из сигналов
активации В-лимфоцитов и их дальнейшей дифференцировки в
плазматические клетки, продуцирующие и секретирующие антитела
(иммуноглобулины). Иммуноглобулины продуцируются в костном мозге и в
периферических органах иммунной системы, откуда поступают в кровоток.
Таким образом, костный мозг в качестве одного из центральных
органов иммунной системы выполняет следующие функции: является местом
начальной дифференцировки и пролиферации ранних
клеток-предшественниц лимфоцитов; является местом дальнейшей дифференцировки В-
лимфоцитов вплоть до их выхода в кровоток и заселения периферических
органов иммунной системы; является местом продукции и секреции
колониестимулирующих факторов и цитокинов, влияющих на процессы
пролиферации, дифференцировки и транспортировки Т- и В-лимфоцитов;
является одним из мест продукции и секреции антител (иммуноглоблинов).
8.2.2. Тимус (вилочковая железа)
Тимус в качестве одного из центральных органов иммунной системы
является местом созревания Т-лимфоцитов из клеток-предшественниц и
формирования огромного разнообразия зрелых Т-лимфоциов, способных
распознать своими рецепторами любой антиген.
Лимфоциты, находящиеся в тимусе, называют тимоцитами. В тимусе
идут параллельно несколько процессов:
• пролиферация Т-лимфоцитов,
• их созревание (дифференцировка),
• отбор пригодных для данного организма клеток, которому
сопутствует гибель значительной части непригодных клеток.
Ранние клетки-предшественницы Т-лимфоцитов из костного мозга
поступают в корковый слой тимуса. Постепенно они мигрируют из
коркового слоя тимуса в мозговой, контактируя с тимическими эпителиальными
клетками, макрофагами и дендритными клетками. На тимоциты влияют
8. Иммунная система • 373
Дифференцировка
Апоптоз
Апоптоз
Позитивная селекция
Негативная селекция
Рис. 8.4. Этапы отбора тимоцитов.
A. Тимоцит, способный распознать своим рецептором (ТКР) собственные антигены главного
комплекса гистосовместимости (1) на поверхности тимических эпителиальных клеток (ТЭК),
вступает в дальнейшую дифференцировку.
Б. Тимоцит, не способный распознать своим ТКР собственные антигены главного комплекса
гистосовместимости (1) на поверхности ТЭК, получает сигнал апоптоза.
B. Тимоцит, способный распознать своим ТКР пептидный фрагмент аутоантигена (2) на
поверхности антигенпредставляющеи клетки в комплексе с собственными молекулами главного
комплекса гистосовместимости (1), получает сигнал апоптоза.
продуцируемые тимическими эпителиальными клетками гормоны: тиму-
лин, al- и (34-тимозины, тимопоэтин, контролирующие их
дифференцировку. В процессе продвижения в мозговой слой тимоциты созревают
(дифференцируются), поэтапно приобретая характерные для зрелых Т-
лимфоцитов поверхностные рецепторы и антигены.
От стромальных клеток тимуса и продуцируемых ими молекул каждый
тимоцит получает сигналы: усиления пролиферации, изменений
поверхностного фенотипа (сочетания молекул, присутствующих на поверхности
клеток), перестройки («реаранжировки») генов, ответственных за широкое
разнообразие специфических антигенраспознающих рецепторов.
Основная функция зрелых Т-лимфоцитов — это распознавание
чужеродных антигенных пептидов в комплексе с собственными молекулами
главного комплекса гистосовместимости на поверхности антигенпредстав-
ляющих клеток. Для выполнения этой функции Т-лимфоциты
располагают специфическими антигенраспознающими рецепторами.
Отбор тимоцитов идет в два этапа (рис. 8.4). После того как на тимоци-
те формируется Т-клеточный рецептор определенной специфичности, в
следующие этапы развития вступают только те тимоциты, которые
проявили способность распознавать собственные молекулы главного комплекса
гистосовместимости, присутствующие на эпителиальных клетках коры
тимуса данного организма. В отличие от зрелого Т-лимфоцита, который при
встрече с антигенным пептидом, специфичным для его Т-клеточного
рецептора, получает сигнал активации, незрелые тимоциты в тимусе при
распознавании специфичных для их Т-клеточных рецепторов аутоантиген-
374 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ных пептидов получают сигнал генетически программированной гибели —
апоптоза. Таким образом, идет «выбраковка» аутореактивных Т-лимфоци-
тов, 95—98 % тимоцитов ежедневно погибают в тимусе этим путем. Только
2—5 % тимоцитов (1 • 10б) в виде зрелых Т-лимфоцитов ежедневно
покидают тимус, поступая в кровь и расселяясь в лимфоидных органах.
В результате в кровоток и в лимфоидные органы поступают только те
Т-лимфоциты, которые несут рецепторы, распознающие чужеродные
пептиды в сочетании с собственными молекулами главного комплекса гисто-
совместимости.
Тимус представляет собой единственный орган иммунной системы,
подвергающийся быстрой возрастной инволюции, которая у людей
начинается после первого года жизни. Человек ежегодно теряет до 3 % истинно
тимической ткани, которая постепенно замещается жировой и
соединительной тканью. Соответственно снижается и продукция Т-лимфоцитов.
Высокая продукция Т-лимфоцитов сохраняется до двух лет, а затем быстро
снижается. Однако количество Т-лимфоцитов в организме сохраняется на
достигнутом уровне благодаря тому, что значительную часть популяции Т-
лимфоцитов составляют долгоживущие клетки, которые не нуждаются в
постоянном обновлении. Более того, зрелые Т-лимфоциты, распознавшие
«свой» антиген в периферических органах иммунной системы, получают
сигналы активации и избирательной пролиферации, за счет чего их
численность возрастает. Перенесенная взрослым человеком тимэктомия не
приводит к катастрофическому снижению количества циркулирующих Т-
лимфоцитов.
В качестве одного из центральных органов иммунной системы тимус
выполняет следующие функции: а) контролирует пролиферацию, диффе-
ренцировку, отбор и окончательное созревание Т-лимфоцитов, б)
продуцирует тимические гормоны, влияющие на функции Т-лимфоцитов.
8.2.3. Селезенка
Селезенка выполняет функции фильтра крови, удаляющего из крови
попадающие туда чужеродные частицы и молекулы, а также состарившиеся
эритроциты.
В селезенке имеются Т- и В-зоны, заселенные преимущественно Т- или
В-лимфоцитами. В качестве одного из периферических органов иммунной
Слизистые оболочки и мукозно-ассоциированная
лимфоидная ткань
Рис. 8.5. Периферические органы иммунной системы, обеспечивающие
специфический иммунный ответ на антигены, поступающие в организм разными путями.
На антиген, попадающий в кровяное русло (1), специфический иммунный ответ развивается в
селезенке. На антиген, проникающий через кожу (2), отвечают преимущественно лимфоциты
в регионарном лимфатическом узле. Местом ответа на антигены, проникающие через
слизистые оболочки (3), является мукозно-ассоциированная лимфоидная ткань.
8. Иммунная система • 375
системы селезенка является местом: 1) созревания естественных киллеров,
2) распознавания антигена, 3) антигензависимой пролиферации и диффе-
ренцировки Т- и В-лимфоцитов, 4) активации Т- и В-лимфоцитов, 5)
продукции цитокинов, 6) продукции и секреции специфических антител —
иммуноглобулинов.
Селезенка является местом специфического иммунного ответа на
антигены, циркулирующие в крови, а в лимфатических узлах разыгрываются
процессы специфического иммунного ответе на антигены, попадающие
через лимфу (рис. 8.5).
8.2.4. Лимфатические узлы
Лимфатические узлы функционируют в качестве своеобразных фильтров
лимфы, задерживая микроорганизмы, попавшие в лимфу. В качестве
периферических органов иммунной системы лимфатические узлы являются
местом: 1) распознавания антигена, 2) антигензависимой пролиферации и
дифференцировки Т- и В-лимфоцитов, 3) активации Т- и В-лимфоцитов,
4) продукции цитокинов, 5) продукции и секреции специфических
антител — иммуноглобулинов.
Один лимфатический узел имеет массу около 1 г. Каждый час из
лимфоузла выходит в лимфу количество лимфоцитов, эквивалентное его
утроенной массе. Большая часть (90 %) клеток в этой эфферентной лимфе
представляют собой лимфоциты, покинувшие кровяное русло на
территории этого лимфатического узла. Среди клеток лимфатического узла около
10 % составляют макрофаги и около 1 % — дендритные клетки.
В кортикальном (наружном) слое лимфатического узла преобладают
скопления лимфоцитов. В мозговом (внутреннем) слое лимфатического
узла лимфоциты содержатся в сочетании с макрофагами (около 10 %) и
дендритными клетками (около 1 %), которые выполняют функцию
представления антигенов Т-лимфоцитам и продуцируют цитокины. В пределах
лимфатического узла происходит свободная циркуляции лимфоцитов
между лимфой, кровью и лимфоидной тканью.
При развитии специфического иммунного ответа в мозговом слое
лимфатических узлов накапливаются образовавшиеся из В-лимфоцитов
плазматические клетки, продуцирующие и секретирующие соответствующие
антигену по специфичности антитела —иммуноглобулины. Строго
определенное взаимное расположение Т- и В-лимфоцитов, макрофагов,
дендритных клеток в лимфатических узлах обеспечивает последовательное
развитие стадий иммунного ответа: представления антигена, его распознавания
Т-клеточными рецепторами, активации процессов пролиферации и
дифференцировки (созревания) лимфоцитов. В результате в лимфатических
узлах формируются зрелые Т-лимфоциты, которые принимают участие в
защитных реакциях. Там же формируются клоны долгоживущих Т- и В-
лимфоцитов, обеспечивающих поддержание иммунологической памяти о
встрече с конкретным антигеном.
8.2.5. Ассоциированная со слизистыми оболочками лимфоидная
ткань (мукозно-ассоциированная лимфоидная ткань)
Непосредственно под мукозным эпителием слизистых оболочек в тесной
связи с эпителиальными клетками располагаются лимфоциты пейеровых
бляшек кишечника, лимфоидных фолликулов аппендикса, миндалин
глотки, лимфоидных фолликулов подслизистого слоя верхних дыхательных пу-
376 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
тей и бронхов, мочеполового тракта. Все эти лимфоидные скопления
получили собирательное название — мукозно-ассоциированная лимфоидная
ткань.
В лимфоидных тканях, ассоциированных со слизистыми оболочками,
проходят все стадии специфического иммунного ответа в тех случаях,
когда антиген проникает в организм через слизистые оболочки. В мукозно-
ассоциированных лимфоидных тканях активированные В-лимфоциты
дифференцируются в плазматические клетки, продуцирующие
специфические антитела, относящиеся к классу иммуноглобулинов A (IgA).
Иммуноглобулины А, пройдя через эпителиальные клетки, где они
присоединяют секреторный компонент, выходят на поверхность слизистых оболочек в
форме секреторного иммуноглобулина A (SIgA), который обеспечивает
местную антибактериальную и антивирусную защиту.
В качестве одного из периферических органов иммунной системы
мукозно-ассоциированная лимфоидная ткань является местом: 1)
распознавания антигена, 2) антигензависимой пролиферации и дифференцировки
Т- и В-лимфоцитов, 3) активации Т- и В-лимфоцитов, 4) продукции цито-
кинов, 5) продукции и секреции специфических антител —
иммуноглобулинов.
8.3. Стадии и формы иммунного ответа
8.3.1. Ранний защитный воспалительный ответ
Ранний защитный воспалительный ответ призван препятствовать
внедрению и распространению возбудителя, по возможности быстро удалять его
из организма. Ранний защитный воспалительный ответ разыгрывается в
течение первых 4 сут после внедрения возбудителя. Ранний защитный
ответ против внедрившихся в организм патогенных микроорганизмов
обеспечивается факторами врожденного иммунитета, к которым относятся
фагоцитирующие клетки крови и тканей, естественные киллеры,
циркулирующие в крови белковые молекулы, обладающие защитными свойствами
(компоненты системы комплемента и др.), а также межклеточные
медиаторы — цитокины. Ранний воспалительный ответ стимулирует
последующий специфический иммунный ответ, влияет на его форму, способствуя
развитию наиболее эффективного против конкретного микроорганизма
специфического иммунного ответа.
Ранний воспалительный ответ начинается с привлечения лейкоцитов из
кровяного русла в очаг инфекции с последующей их активацией для
удаления возбудителя (рис. 8.6). Мобилизация лейкоцитов в очаг инфекции
стимулируется провоспалительными цитокинами, а опосредуется адгезионными
молекулами на поверхности лейкоцитов и эндотелиальных клеток, а также
молекулами хемокинов и их рецепторами. Провоспалительные цитокины
{туморнекротизирующий фактор—ТИФ, интерлейкин-1 — ИЛ-1)
продуцируются и секретируются макрофагами при фагоцитозе возбудителя. Под
действием этих цитокинов на поверхности эндотелиальных клеток,
появляются адгезионные молекулы вначале для нейтрофилов, а затем для
моноцитов и лимфоцитов, ответственные за прилипание лейкоцитов к
эндотелию сосудов. Кроме того, активированные цитокинами эндотелиальные
клетки продуцируют хемокины, достигающие высокой концентрации на
уровне очага инфекции (рис. 8.7). Этим обеспечивается прочная адгезия
лейкоцитов к эндотелиальным клеткам с последующей их трансэндотели-
8. Иммунная система • 377
Лейкоциты
Адгезия
Эндотелиальные клетки
Трансэндотелиальная
миграция
Внесосудистый матрикс
V
Очаг инфекции
Рис. 8.6. Этапы взаимодействия лейкоцитов крови с эндотелиальными клетками
при воспалении: адгезия и трансэндотелиальная миграция обеспечивают выход
лейкоцитов из кровяного русла и движение к очагу инфекции.
- Провоспалительные
цитокины
Лейкоциты
Эндотелиальная
клетка
Хемокины
Адгезионные
v молекулы
Рис. 8.7. Взаимное влияние макрофагов и эндотелиальных клеток в процессах
воспаления и иммунного ответа. Продукты активированных макрофагов —
провоспалительные цитокины — активируют эндотелиальные клетки, индуцируя появление
на поверхности эндотелиальных клеток адгезионных молекул для лейкоцитов и
продукцию эндотелиальными клетками хемокинов, усиливающих процессы
миграции лейкоцитов.
альной миграцией и выходом в ткани в направлении очага инфекции (см.
рис. 8.6).
Таким образом, ранний воспалительный ответ проявляется
инфильтрацией очага инфекции фагоцитирующими клетками, где эти клетки
получают дополнительные сигналы активации от микробных продуктов и
компонентов (липополисахарид клеточной стенки бактерий), от компонентов
активированной системы комплемента и от провоспалительных цитокинов, в
том числе, от гамма-интерферона, продуцируемого и секретируемого
активированными естественными киллерами. Активированные
фагоцитирующие клетки приобретают повышенную способность убивать захваченных
микробов, что способствует удалению возбудителя. Активированные под
378 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
влиянием провоспалительных цитокинов эндотелиальные клетки
продуцируют молекулы вазодилататоров, под действием которых усиливается
местный кровоток, повышается проницаемость сосудов для макромолекул
фибриногена, который, покидая сосуды, превращается в фибрин, что
способствует ограничению очага инфекции. В случае попадания в организм
небольшого количества низковирулентных возбудителей ранний
воспалительный ответ подавляет очаг инфекции.
Удаление из кровяного русла попавших в кровь единичных
бактериальных клеток является функцией системы комплемента. Большая часть
компонентов комплемента синтезируются гепатоцитами и мононуклеарными
фагоцитами. Компоненты комплемента (О, С2, СЗ, С4, С5, Сб, С7, С8,
С9, факторы В и D) содержатся в крови в неактивной форме. При
попадании в кровяное русло бактерий на их поверхности каскад ферментативных
реакций ведет к последовательной активации компонентов системы
комплемента («альтернативный путь активации») с формированием мембран-
атакующего комплекса (С5—С9), вызывающего лизис бактерий. В
процессе активации системы комплемента накапливаются фрагменты, которые
опосредуют разные биологические эффекты: привлечение лейкоцитов в
очаг инфекции или воспаления (хемотаксис) — фрагмент С5а, усиление
фагоцитоза (опсонизацию) — СЗЬ, индукцию синтеза и секреции
медиаторов воспаления — СЗа, С5а. (При развитии специфического иммунного
ответа и появлении в кровяном русле комплексов антиген—антитело другой
каскад ферментативных реакций ведет к активации системы
комплемента — «классический путь активации», см. раздел 8.3.5.)
8.3.2. Представление и распознавание антигена
В случае неэффективности раннего защитного ответа и факторов
врожденного иммунитета в организме накапливаются микроорганизмы,
содержащие чужеродные антигены. Контакт этих антигенов с клетками иммунной
системы приводит к развитию специфического иммунного ответа, который
начинается с этапа представления и распознавания антигена.
Растворимые антигены в нативной форме связываются антителами и
антигенраспознающими иммуноглобулиновыми рецепторами В-клеток.
Т-лимфоциты своими антигенраспознающими Т-клеточными
рецепторами связывают короткие пептидные фрагменты белковых антигенов в
комплексах с собственными молекулами главного комплекса гистосовме-
стимости I или II классов на мембранах антигенпредставляющих клеток.
Молекулы главного комплекса гистосовместимости на поверхности
лейкоцитов человека, получили название «человеческие лейкоцитарные
антигены» (Human Leukocyte Antigens — HLA). Молекулы главного
комплекса гистосовместимости I класса присутствуют на поверхности всех
типов клеток, кроме эритроцитов и клеток трофобласта. Молекулы главного
комплекса гистосовместимости II класса находятся на поверхности
антигенпредставляющих клеток: дендритных клеток, макрофагов, В-лимфо-
цитов.
Антигенпредставляющие клетки играют важную роль на начальном
(пусковом) этапе специфического иммунного ответа: 1) макрофаги, как
правило, представляют антигены бактериального происхождения —
продукты захвата и внутриклеточной переработки ими бактерий, 2) В-лимфо-
циты представляют микробные антигены, антигены токсинов, связанные
их поверхностными иммуноглобулиновыми рецепторами, 3) наиболее
универсальными антигенпредставляющими клетками являются дендритные
8. Иммунная система • 379
Рецептор
ИЛ-12
Гамма-интерферон
Рецептор
гамма-
интерферона
Рис. 8.8. Взаимодействие Т-хелперов (ТЫ) с антигенпредставляющими
дендритными клетками (ДК) опосредовано цитокинами (ИЛ-12, гамма-интерферон) и кости-
мулирующими молекулами (CD40, CD40L).
В центре «иммунологического синапса» находятся: Т-клеточный антиген распознающий
рецептор (1) и распознаваемый им комплекс антигенного пептида с молекулой главного
комплекса гистосовместимости (2).
клетки, которые необходимы для запуска первичного иммунного ответа,
представляют многие, в том числе опухолевые, антигены.
После захвата чужеродного белка — антигена этими клетками и его
разложения до коротких пептидов внутри клеток происходит комплексирова-
ние отдельных молекул главного комплекса гистосовместимости с
конкретными пептидами. Такие комплексы транспортируются на поверхность
антигенпредставляющих клеток (рис. 8.8).
При встрече антигенпредставляющей клетки с Т-лимфоцитом, несущим
на своей поверхности подходящий по структуре антигенраспознающий
рецептор, замыкается лиганд-рецепторная связь, т. е. происходит
распознавание антигена.
CD4+ T-лимфоциты способны распознавать антигенные пептиды в
комплексах с собственными молекулами главного комплекса
гистосовместимости II класса, a CD8+ Т-лимфоциты — в комплексах с собственными
молекулами главного комплекса гистосовместимости I класса. Связывание
антигена Т-клеточным рецептором служит сигналом усиления
пролиферации данного Т-лимфоцита с последующей ускоренной дифференцировкой
и активацией его клеток-потомков. В результате формируется клон Т-лим-
фоцитов, способных при встрече с тем же антигеном быстро
активироваться для участия в удалении патогенного агента.
8.3.3. Активация Т- и В-лимфоцитпов в иммунном ответе
Передача сигнала активации от антигенраспознающего рецептора в ядро
клетки приводит к активации конкретных генов, ответственных за митоти-
ческую активность клеток, контролирующих продукцию клеткой
биологически активных молекул, участвующих в антимикробной защите (антитела,
цитокины).
В-лимфоцит получает одновременно два сигнала активации: от
антигенраспознающего рецептора при его соединении с антигеном и от
связывания его поверхностных костимулирующих молекул с соответствующими
лигандами на Т-лимфоцитах. После этого В-лимфоцит пролиферирует и
потомки его превращаются в зрелые антителопродуцирующие
плазматические клетки.
380 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Клеточный иммунитет
Синтез антител — гуморальный иммунитет
Рис. 8.9. Основные формы специфического иммунного ответа.
В зависимости от направления дифференцировки ThO в сторону ТЫ или Th2 развивается,
соответственно, клеточный или гуморальный иммунный ответ с активацией либо макрофагов,
либо В-лимфоцитов под влиянием указанных цитокинов. Как Т-, так и В-лимфоциты могут
дать начало долгоживущим клеткам, обеспечивающим поддержание «иммунологической
памяти».
Т-лимфоцит в ответ на контакт с антигеном начинает пролиферировать,
потомки его приобретают способность продуцировать определенные цито-
кины или превращаются в зрелые цитотоксические клетки. В зависимости
от того, какие дополнительные сигналы активации (цитокины, костимули-
рующие молекулы) получает Т-лимфоцит в момент контакта с антигеном,
его потомки дифференцируются в двух разных направлениях, превращаясь
в Т-хелперы, продуцирующие гамма-интерферон (ТЫ), или в Т-хелперы,
продуцирующие интерлейкины-4, -5, -6, -10, -13 (Th2). Количественное
преобладание Thl над Th2 является условием развития клеточного (кле-
точно-опосредованного) иммунного ответа. В случае преобладания Th2
развивается гуморальный иммунный ответ, проявляющийся продукцией
специфических антител (рис. 8.9).
8.3.4. Клеточный иммунный ответ
Клеточный иммунный ответ направлен против внутриклеточно
паразитирующих микроорганизмов, основная защитная роль в нем принадлежит
активированным макрофагам и цитотоксическим лимфоцитам (CD8+
CTL).
Макрофаги, инфицированные микроорганизмами, получают от Thl в
качестве сигналов активации цитокины: гамма-интерферон и туморнекро-
тизирующий фактор (ТНФ), которые действуют через свои рецепторы,
вызывая усиленную продукцию макрофагами супероксидных и нитроксид-
ных радикалов, убивающих внутриклеточные паразиты.
8. Иммунная система • 381
Цитотоксические CD8+ CTL способны убивать зараженные вирусами
клетки при непосредственном контакте с ними. В месте контакта из CTL в
мембрану клетки-мишени проникают порообразующие белки — перфори-
ны, формирующие в мембране микроканалы, через которые в
клетку-мишень проникают ферменты — фрагментины, вызывающие разрушение
ядра клетки и ее гибель.
8.3.5. Гуморальный иммунный ответ
Гуморальный иммунный ответ защищает преимущественно против внекле-
точно паразитирующих микроорганизмов, которые доступны действию
специфических антител. Продуцентами антител (иммуноглобулинов)
являются потомки активированных В-лимфоцитов — плазматические клетки.
В-лимфоцит получает сигнал активации при соединении его антиген-
распознающего рецептора с антигеном. Для активной пролиферации и
дифференцировки в плазматические клетки потомки В-лимфоцита
получают дополнительные сигналы активации — продуцируемые Th2 цитокины:
интерлейкины-4, -5, -6, -10, -13. Те же цитокины усиливают продукцию и
секрецию специфических для данного антигена антител зрелыми
плазматическими клетками.
Специфические антитела — иммуноглобулины против конкретных
антигенов бактерий (стафилококки, стрептококки, возбудители дифтерии,
кишечных инфекций, клостридии и др.), связываясь с бактериальными
токсинами, вызывают их нейтрализацию, т. е. утрату токсического
действия на организм. Сами бактерии, связавшиеся со специфическими
антителами, быстрее и легче захватываются и убиваются фагоцитирующими
клетками или лизируются активированной системой комплемента.
Иммуноглобулины делятся на пять классов (изотипов): IgG, IgM, IgA,
IgE, IgD. В нормальной сыворотке крови 80 % всех иммуноглобулинов
составляют IgG, на долю IgM приходится 6 %, на долю IgA— 13 %, а на
долю IgE и IgD — сотые или тысячные доли процента. Главными защитными
иммуноглобулинами являются IgG. У иммуноглобулинов разных изотипов
различаются защитные свойства (табл. 8.5).
Иммуноглобулин G (IgG) — мономер, доминирующий среди других
изотипов иммуноглобулинов у взрослых в кровяном русле, легко
диффундирующий из крови в ткани, единственный из иммуноглобулинов способен
преодолевать плацентарный барьер и обеспечивать гуморальный
иммунитет новорожденных первых месяцев жизни. Дополнительные порции
материнского, содержащегося в молозиве IgG, поступают в кровоток
новорожденного через слизистую оболочку кишечника. IgG составляют основную
массу антител при иммунном ответе на повторную встречу с тем же анти-
Таблица 8.5. Защитные функции иммуноглобулинов (антител) разных изотипов
Изотипы (классы)
иммуноглобулинов
Иммуноглобулин G
Иммуноглобулин М
Иммуноглобулин А
(секреторный)
Локализация
Кровяное русло и ткани
Только кровяное русло
Секреты на слизистых
оболочках, грудное
молоко
Защитные функции
Нейтрализация токсинов и вирусов,
активация системы комплемента,
усиление фагоцитоза
Активация системы комплемента
Препятствие адгезии бактерий и
вирусов на слизистых оболочках, их
связывание
382 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
геном. IgG обеспечивает наиболее эффективную антибактериальную и
антитоксическую защиту организма, действуя и в крови, и в тканях.
Иммуноглобулин М (IgM) — пентамер, состоящий из пяти четырехцепо-
чечных структур, (называют еще макроглобулином из-за высокой
молекулярной массы). IgM синтезируется раньше других классов в онтогенезе,
может продуцироваться в организме плода в ответ на внутриутробную
инфекцию. К этому классу иммуноглобулинов относятся так называемые
нормальные антитела — изогемагглютинины групп крови: анти-А, анти-В.
У взрослых иммуноглобулины этого изотипа первыми появляются на
самых ранних стадиях гуморального иммунного ответа на инфекцию. Из-за
больших размеров молекулы IgM обычно не покидают кровяного русла, но
играют ведущую роль в антибактериальной защите кровяного русла от
попадающих туда бактерий.
Иммуноглобулин A (IgA) циркулирует в сыворотке крови в виде
мономеров или димеров. Димер IgA может связываться с полиглобулиновым
рецептором на базолатеральной поверхности эпителиальных клеток и в
комплексе с этим рецептором проникать в эпителиальные клетки. Внутри
эпителиальной клетки такой комплекс подвергается протеолизу и через
апикальную поверхность эпителиальной клетки секретируется
образовавшийся комплекс димера IgA с фрагментом полиглобулинового рецептора,
который получил название «секреторный компонент». Основными
местами синтеза и секреции IgA являются: эпителий желудочно-кишечного
тракта, респираторного тракта, лактирующие молочные железы, слюнные
и слезные железы. В организм ребенка IgA попадают с молоком матери
при грудном вскармливании. В составе секретов оболочек слизистых
секреторный IgA — SIgA обеспечивает местный иммунитет слизистых
оболочек. Защитное действие SIgA от проникновения через слизистые оболочки
бактерий и вирусов зависит от его способности связывать микроорганизмы
и препятствовать их адгезии или адсорбции на рецепторах слизистой
оболочки.
В сыворотке крови здоровых людей иммуноглобулин Е (IgE), как
правило, не содержится.
Защитное действие специфических антител реализуется с помощью
нескольких механизмов: 1) усиление фагоцитоза бактерий, 2) нейтрализация
бактериальных экзотоксинов и вирусов; 3) активация системы
комплемента с последующим бактериолитическим действием ее мембранатакующего
комплекса, 4) препятствие колонизации слизистых оболочек патогенными
бактериями и адсорбции вирусов.
В результате гуморального иммунного ответа на бактериальную
инфекцию в сыворотке крови накапливаются специфические антитела классов
IgG и IgM. При взаимодействии этих антител с антигенами на
поверхности бактерий создаются условия активации системы комплемента по
классическому пути, результатом которого становится лизис бактерий
(бактериолиз). Классический путь активации системы комплемента начинается
со стадии соединения Clq с определенным участком молекулы
иммуноглобулина, который становится доступным только после взаимодействия
иммуноглобулина — антитела со своим антигеном. Clq при этом
активируется, приобретая активность сериновой протеиназы (эстеразы), которая
запускает каскадный процесс расщепления и присоединения последующих
фракций: С4, С2, СЗ. После активации СЗ запускается дальнейший каскад
формирования мембранатакующего комплекса (С5—С9), что ведет к
лизису бактерий. Некоторые защитные функции активированных компонентов
системы комплемента были описаны выше (см. раздел-8.3.1).
8. Иммунная система • 383
8.3.6. Иммунологическая память как форма специфического
иммунного ответа
После первой встречи организма с чужеродным антигеном в лимфоидных
органах сохраняются долгоживущие потомки Т- и В-лимфоцитов, проли-
ферировавших в ответ на сигнал активации, полученный от антигенрас-
познающих рецепторов. На мембране этих клеток-потомков сохраняются
специфические для данного антигена рецепторы, способные связаться с
ним при его повторном попадании в организм.
Способность иммунной системы организма ускоренно и усиленно
отвечать активацией на повторную встречу с тем же антигеном характеризуется
как «иммунологическая память».
Особенностями долгоживущих В-клеток памяти являются: 1)
способность быстро отвечать пролиферацией и дифференцировкой в
плазматические клетки на повторную встречу с антигеном, 2) способность быстро
переключаться с синтеза IgM на синтез IgG и IgA, 3) способность быстро
продуцировать и секретировать большое количество специфических
антител с выраженными защитными свойствами.
Некоторые из ответивших пролиферацией на контакт с антигеном Т-лим-
фоцитов не претерпевают дальнейшей дифференцировки, а после
нескольких делений превращаются в клетки, способные сохраняться в органах
иммунной системы более 20 лет и поддерживать состояние иммунологической
памяти в отношении конкретного антигена. Особенностями Т-клеток
памяти являются: 1) повышенная активность связывания антигена антигенрас-
познающими рецепторами, 2) повышенное количество рецепторов интер-
лейкина-2, 3) готовность быстро ответить на повторный контакт с антигеном
активацией, пролиферацией и дифференцировкой в клетки-эффекторы.
8.3.7. Иммунологическая толерантность
Иммунологической толерантностью называют отсутствие специфического
иммунного ответа на собственные антигены организма (аутоантигены).
В период внутриутробного развития фрагменты аутоантигенов могут
заноситься в тимус с током крови. В тимусе происходит встреча
функционально незрелых тимоцитов, уже имеющих антигенраспознающие
рецепторы, с антигенпредставляющими клетками, несущими на поверхности ау-
тологичные пептиды. Для незрелого тимоцита связывание его антигенрас-
познающего рецептора с аутологичным пептидом служит сигналом апо-
птоза (гибели) или превращения в «анергичную» клетку, не способную в
дальнейшем активироваться при контакте с данным антигеном.
Приобретенная во внутриутробный период развития организма иммунологическая
толерантность сохраняется на протяжении всей жизни.
8.4. Механизмы, контролирующие иммунную систему
Количественные характеристики популяций и субпопуляций клеток
иммунной системы и их функциональная активность находятся под
гормональным и цитокиновым контролем.
8.4.1. Гормональный контроль
Влияние нейроэндокринной системы на иммунную систему может быть
прямым или опосредованным. Прямой контроль осуществляется путем свя-
384 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
зывания нейромедиаторов или гормонов с соответствующими рецепторами
на клетках иммунной системы. Контроль может быть опосредован
влиянием нейромедиаторов и гормонов на стромальные клетки органов
иммунной системы. Клетки иммунной системы имеют рецепторы, позволяющие
им получать сигналы от многих гормонов и нейромедиаторов: кортикосте-
роидов, инсулина, гормона роста (соматотропин), эстрадиола,
тестостерона, р-адренергических агентов, ацетилхолина, эндорфинов и энкефалинов.
Секреция глюкокортикоидов в ответ на стресс, который нередко
сопутствует иммунному ответу, играет роль регуляции по механизму обратной
связи. Провоспалительные цитокины ИЛ-1, ИЛ-6, ТНФ-альфа, секреция
которых сопутствует клеточному иммунному ответу, стимулируют продукцию
глюкокортикоидов через гипоталамус-гипофизарно-надпочечниковую
систему. Это ведет к подавлению активности клеточного иммунного ответа.
Глюкокортикоиды, являющиеся физиологическими регуляторами
иммунного ответа, влияют на разные функции лимфоцитов и антигенпрезен-
тирующих клеток: на рециркуляцию лимфоцитов, на адгезию лейкоцитов
к эндотелиальным клеткам, на продукцию цитокинов и количество цито-
киновых рецепторов на клетках.
Глюкокортикоиды действуют на клетки, формируя комплексы с
соответствующими внутриклеточными рецепторами, которые препятствуют
транскрипции отдельных генов, в том числе генов, ответственных за
продукцию цитокинов. В концентрациях, превосходящих физиологический
уровень, глюкокортикоиды блокируют транскрипцию многих цитокинов:
туморнекротизирующего фактора, гамма-интерферона, интерлейкинов-1,
-2, -5, -6, -12. В то же время глюкокортикоиды индуцируют продукцию Т-
лимфоцитами ингибирующих цитокинов: трансформирующего ростового
фактора-бета и интерлейкина-10. С нарушениями продукции и рецепции
цитокинов связаны противовоспалительные и иммуномодулирующие
эффекты глюкокортикоидов.
Глюкокортикоиды способны влиять на характер иммунного ответа:
усиливать синтез цитокинов, характерных для Th2, потенцировать эффекты
интерлейкина-4. Разная чувствительность субпопуляций Thl и Th2 к глю-
кокортикоидам связана с различиями количества гормональных
рецепторов у этих клеток. Под влиянием ИЛ-4 в сочетании с ИЛ-2 у лимфоцитов
повышается количество рецепторов для глюкокортикоидов, а под
влиянием гамма-интерферона количество рецепторов для глюкокортикоидов
снижается. Так, дифференцировка лимфоцитов в отсутствие ИЛ-4, в
присутствии высокой концентрации гамма-интерферона приводит к созреванию
Thl, резистентных к глюкокортикоидам.
У отдельных индивидуумов генетически детерминирован высокий
уровень стресс-индуцированной продукции глюкокортикостероидов.
Повышенная чувствительность этих индивидуумов к внутриклеточно
паразитирующим патогенным агентам объясняется низким уровнем клеточного
иммунного ответа, подавленного в присутствии повышенного уровня
глюкокортикостероидов .
Стимулирующим действием эстрогенов на иммунную систему
объясняют более высокую устойчивость женщин к инфекциям и более высокую
частоту аутоиммунных заболеваний среди женщин по сравнению с
мужчинами. С возрастным снижением продукции андрогенного гормона дегид-
роэпиандростерона, сопряженным с повышением продукции цитокина
ИЛ-6, связывают состояние возрастного иммунодефицита у людей старше
60 лет.
Тироксин стимулирует процессы пролиферации и дифференцировки
8. Иммунная система • 385
Таблица 8.6. Влияние гормонов и нейромедиаторов на иммунную
систему
Угнетение
Кортизол
Кортикотропин
Адреналин
Андрогены
Гестагены
Медиаторы симпатического отдела нервной системы
Стимуляция
Эстрогены
Соматотропин
Тироксин
Инсулин
иммунокомпетентных клеток. Соматотропин оказывает прямое митоген-
ное действие на Т-лимфоциты.
Эффекты многих гормонов опосредованы их влиянием на секрецию
гормонов тимуса: глюкокортикоиды, андрогены и эстрогены подавляют ее,
а пролактин, СТГ и прогестерон — стимулируют (табл. 8.6).
Лимфоциты имеют (3-адренергические рецепторы и получают сигналы
от соответствующих медиаторов: норадреналина и неироксина, которые
угнетают пролиферацию лимфоцитов, стимулируя их дифференцировку.
Ацетилхолин и холинергические стимулы, напротив, усиливают
пролиферацию лимфоцитов. Холинергические влияния в тимусе способствуют
накоплению и эмиграции тимоцитов. Таким образом, проявляется
альтернативный характер адренергических и холинергических эффектов нервной
системы в отношении иммунной системы.
Свидетельствами нейроэндокринной регуляции иммунной системы
могут служить: зависимость иммунологических функций от циркадных
ритмов, иммуномодулирующие эффекты гипноза, возможность
условно-рефлекторной стимуляции или угнетения иммунного ответа.
8.4.3. Цитокиновый контроль
Цитокинами называют белковые и полипептидные молекулы, которые
продуцируются клетками иммунной системы (лимфоцитами, мононукле-
арными фагоцитами, дендритными клетками), а также стромальными
клетками. Цитокины действуют на клетки, соединяясь со своими
поверхностными рецепторами. Связывание цитокина с рецептором служит
источником сигнала активации генов, который передается в ядро клетки.
Чувствительность клеток-мишеней к действию цитокинов изменяется в
зависимости от количества цитокиновых рецепторов на их поверхности.
Время синтеза цитокина, как правило, краткосрочно: лимитирующим
фактором служит нестабильность молекул мРНК. Отдельные цитокины
(например, ростовые факторы) продуцируются спонтанно. Синтез цитокинов
индуцируется: чаще всего, микробными компонентами и продуктами
(например, бактериальным эндотоксином). Кроме того, один цитокин может
служить индуктором синтеза других цитокинов (например, интерлейкин 1
индуцирует продукцию интерлейкинов-6, -8, -12), чем обеспечивается
каскадный характер цитокинового контроля. Для биологических эффектов
цитокинов характерно то, что один и тот же цитокин проявляет разную
биологическую активность, в то же время одну и ту же функцию могут
выполнять разные цитокины. Этим обеспечивается запас прочности системы
цитокинового контроля. При совместном влиянии на клетки цитокины
могут выступать в качестве синергистов или антагонистов.
13-6095
386 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Большинство цитокинов оказывают наиболее выраженное влияние в
ближайшем микроокружении клеток-продуцентов. Местное действие
цитокинов может быть как аутокринное, так и паракринное, в зависимости от
того, связывается ли цитокин с рецептором на самой клетке-продуценте,
или — на соседней клетке. Системное (эндокринное) влияние цитокинов
возможно только в случае интенсивного накопления их в циркулирующей
крови (например, при эндотоксическом шоке). Обычно в крови
присутствуют следовые количества цитокинов, недостаточные для проявления
системных эффектов.
В костном мозге, в тимусе и лимфоидных органах постоянно
происходит спонтанный синтез цитокинов, выполняющих функции ростовых
факторов, которые связываются с рецепторами на клетках-предшественницах,
стимулируя процессы их пролиферации и дифференцировки.
В очаге инфекции бактериальные компоненты и продукты индуцируют
синтез макрофагами так называемых провоспалителъных цитокинов (интер-
лейкины-1, -6, -8, туморнекротизирующий фактор), которые связываются
с рецепторами на других макрофагах, лимфоцитах и эндотелиальных
клетках. Их основные функции: усилить приток лейкоцитов из кровяного
русла в очаг инфекции, активировать синтез фагоцитирующими клетками
бактерицидных молекул — супероксидных и нитроксидных радикалов.
В динамике процесса воспаления те же макрофаги начинают
продуцировать противовоспалительные цитокины—интерлейкины-10, -13,
трансформирующий ростовой фактор, которые связываются со своими
рецепторами на клетках, посылая к ядру сигналы ингибиции функций
фагоцитирующих клеток, в том числе продукции провоспалительных цитокинов.
Цитокины, контролирующие силу и форму специфического иммунного
ответа, продуцируются ТЫ (гамма-интерферон и туморнекротизирующий
фактор бета) или Th2 (интерлейкины-4, -5, -6, -10, -13). Первая группа
цитокинов обеспечивает перевес клеточного иммунного ответа над
гуморальным, а вторая обеспечивает перевес гуморального иммунного ответа
над клеточным. Например, продукт Th2 интерлейкин-4 ингибирует
большинство функций макрофагов, активированных гамма-интерфероном. Ин-
терлейкин-10 ингибирует представление антигена, продукцию
провоспалительных цитокинов, является синергистом ИЛ-4. Продукт Thl
гамма-интерферон ингибирует функции В-лимфоцитов, участвующих в
гуморальном ответе. Таким образом, под влиянием отдельных цитокинов и их
сочетаний может изменяться характер специфического иммунного ответа. Это
значит, что от баланса цитокинов зависит эффективность противоинфек-
ционной защиты, поскольку от внутриклеточно паразитирующих
микроорганизмов эффективна клеточная защита, а против внеклеточно
паразитирующих микроорганизмов эффективнее специфический гуморальный
ответ. Цитокины выполняют функции межклеточных медиаторов,
обеспечивающих передачу сигналов активации или ингибиции от одних клеток к
другим.
ГЛАВА 9
Функции систем кровообращения
и лимфообращения
9.1. Система кровообращения
Основное назначение сердечно-сосудистой системы — обеспечение
кровообращения, т. е. постоянной циркуляции крови из сердца в сосуды и из
них вновь к сердцу. Движущей силой кровотока является энергия,
задаваемая сердцем потоку крови в сосудах, и градиент давления — разница
давлений между последовательными отделами сосудистого русла: кровь течет от
области высокого давления к области низкого давления. Поэтому из аорты
(где среднее давление составляет 100 мм рт. ст.) кровь поступает через
систему магистральных артерий (80 мм рт. ст.) и артериол (40—60 мм рт. ст.) в
капилляры (15—25 мм рт. ст.), откуда продолжает движение в венулы (12—
15 мм рт. ст.), венозные коллекторы — более крупные вены (3—5 мм рт.
ст.) и полые вены (1—3 мм рт. ст.).
Центральное венозное давление — давление в устье полых вен —
составляет около 0 мм рт. ст. В легочной артерии (в которой течет венозная
кровь) кровяное давление равно 18—25 мм рт. ст., в легочной вене — 3—
4 мм рт. ст. и в левом предсердии — 2—3 мм рт. ст.
Благодаря постоянному движению крови в сосудах выполняются
основные функции системы кровообращения: 1) транспорт веществ,
необходимых для обеспечения специфической деятельности клеток организма;
2) доставка к клеткам организма химических веществ, регулирующих их
обмен; 3) отвод от клеток продуктов метаболизма; 4) гуморальная, т. е.
осуществляемая через жидкость, связь органов и тканей между собой;
5) доставка тканям средств защиты; 6) удаление вредных веществ из
организма; 7) обмен тепла в организме. Следовательно, система
кровообращения выполняет одновременно две задачи: обеспечивает циркуляцию крови
в системе и нутритивную (питательную) функцию клеток всех органов и
тканей. При этом к тканям доставляются не только питательные вещества,
но также кислород, физиологически активные вещества, в том числе
гормоны, вода, соли, а из тканей выводятся углекислота и другие продукты
обмена веществ.
Кровоток в организме теплокровных животных осуществляется по двум
кругам, соединенным между собой через сердце. Малый (или легочный)
круг кровообращения осуществляет прямой контакт с внешней средой, а
большой — обеспечивает контакт с органами и тканями.
9.1.1. Функциональные классификации системы кровообращения
Распространено и обосновано деление сердечно-сосудистой системы по
уровню кровяного давления: область высокого и область низкого давления.
К области высокого давления относят левый желудочек сердца, артерии
13'
388 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
крупного, среднего и малого калибра, артериолы; к области низкого
давления — остальные отделы системы (от капилляров до левого предсердия).
В функциональной классификации шведского физиолога Б. Фолкова
предусмотрено деление системы кровообращения на «последовательно
соединенные звенья».
1. Сердце — насос, ритмически выбрасывающий кровь в сосуды.
2. Упруго-растяжимые сосуды, которые превращают периодичный
выброс крови из сердца в равномерный кровоток (аорта с ее отделами,
легочная артерия).
3. Резистивные сосуды (сосуды сопротивления) — прекапиллярный (в
основном артериолы) и посткапиллярный отделы (венулы), которые
вместе создают общее сопротивление кровотоку в сосудах органов.
4. Прекапиллярные сфинктеры — специализированный отдел мельчайших
артериальных сосудов, сокращение гладкомышечных клеток этих
сфинктеров может приводить к перекрытию просвета мелких сосудов.
Эти сосуды регулируют объем кровотока в капиллярном русле.
5. Обменные сосуды, или истинные капилляры, где кровь контактирует с
тканью благодаря огромным поверхностям капиллярного ложа. Здесь
реализуется основная функция сердечно-сосудистой системы —
обмен между кровью и тканями.
6. Шунтирующие сосуды (артериовенозные анастомозы), наличие
которых доказано не для всех тканей.
7. Емкостные сосуды, в которых изменения просвета, даже столь
небольшие, что не оказывают существенного влияния на общее
сопротивление, вызывают выраженные изменения распределения крови и
величины притока ее к сердцу (венозный отдел системы).
Однако разделение на «резистивные» и «емкостные» сосуды весьма
условно, поскольку сопротивлением обладают как артериальные, так и
венозные сосуды, хотя в количественном плане эта функция различна для
указанных отделов. С другой стороны, емкостью обладают как венозные
сосуды, так и артериальные. Весьма расплывчатым является и понятие
«емкостные сосуды», поскольку одни авторы относят к ним все венозное
ложе, другие — только венулы и мелкие вены. Неудачно выделены в
классификации и «прекапиллярные» сфинктеры, поскольку в венозном русле
также существуют сосуды с расположением гладкомышечных волокон типа
сфинктеров или запирательных образований.
Функциональное назначение различных отделов сердечно-сосудистой
системы отражает следующая классификация (Б. И. Ткаченко):
1. Генератор давления и расхода крови — сердце, подающее кровь в аорту
и легочную артерию во время систолы.
2. Сосуды высокого давления — аорта и крупные артериальные сосуды, в
которых поддерживается характерный для индивидуума уровень
кровяного давления.
3. Сосуды — стабилизаторы давления — мелкие артерии и артериолы,
которые путем сопротивления кровотоку и во взаимоотношении с
сердечным выбросом поддерживают оптимальный для системы уровень
артериального давления.
4. Распределители капиллярного кровотока — терминальные сосуды, глад-
комышечные образования которых при сокращении прекращают
кровоток в капилляре или возобновляют его (при расслаблении),
обеспечивая необходимое в данной ситуации число
функционирующих и нефункционирующих капилляров.
5. Обменные сосуды — капилляры и частично посткапиллярные участки
9. Функции систем кровообращения и лимфообращения • 389
венул, функция которых состоит в обеспечении обмена между
кровью и тканями.
6. Аккумулирующие сосуды — венулы и мелкие вены, активные или
пассивные изменения просвета которых ведут к накоплению крови (с
возможностью ее последующего использования) или к экстренному
выбросу ее в циркуляцию. Функция этих сосудов в основном
емкостная, но они обладают и резистивной функцией, хотя и намного
меньшей, чем стабилизаторы давления.
7. Сосуды возврата крови — крупные венозные коллекторы и полые
вены, через которые обеспечивается подача крови к сердцу.
8. Шунтирующие сосуды — различного типа анастомозы, соединяющие
между собой артериолы и венулы и обеспечивающие ненутритивный
кровоток.
9. Резорбтивные сосуды — лимфатический отдел системы
кровообращения, в котором главная функция лимфатических капилляров состоит в
резорбции из тканей белков и жидкости, а лимфатических сосудов —
в транспортировке резорбированного материала обратно в кровь.
9.1.2. Общая характеристика движения крови по сосудам
Отличительной особенностью характеристики сердечно-сосудистой
системы на современном этапе является требование выражать все составляющие
ее параметры количественно. Геометрические (табл. 9.1) и
гидродинамические (табл. 9.2) характеристики системы кровообращения свидетельствуют
о том, что аорта представляет собой трубку диаметром 1,6—3,2 см с
площадью поперечного сечения 2,0—3,5 см2, постепенно разветвляющуюся на
109 капилляров, площадь поперечного сечения каждого из которых равна
5 • 10~7 см2.
Радиус усредненного капилляра может составлять 3 мкм, длина — около
750 мкм (хотя диапазон реальных значений довольно велик). Площадь
поверхности стенки каждого усредненного капилляра равна 15 000 мкм2, а
площадь поперечного сечения — 30 мкм2. Поскольку доказано, что обмен
происходит и в посткапиллярных венулах, можно допускать, что общая
обменная поверхность мельчайшего сосуда большого круга составляет
25 000 мкм2. Общее число функционирующих капилляров у человека
массой 70 кг должно быть порядка 40 000 млн., тогда общая обменная
площадь поверхности капилляров должна составлять около 1000 м2.
В сосудах различают скорость кровотока объемную и линейную.
Объемная скорость кровотока — количество крови, протекающее через
поперечное сечение сосуда в единицу времени. Объемная скорость крово-
Таблица 9.1. Геометрические характеристики сосудистого русла большого круга крово
обращения
Сосуд
Аорта
Большие артерии
Малые артерии, артериолы
Капилляры
Венулы, малые вены
Большие вены
Полые вены
Диаметр, см
1,6-3,2
0,6-0,1
0,1-0,02
0,0005-0,001
0,02-0,2
0,5-1,0
2,0
Общее число в организме
1
103
108
109
109
103
2
Длина, см
80
20-40
0,2-5
од
0,2-1,0
10-30
50
390 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Таблица 9.2. Гидродинамические характеристики сосудистого русла большого круга
кровообращения
Сосуд
Аорта
Магистральные артерии
Ветвящиеся артерии
Терминальные артерии
Артериолы
Капилляры
Венулы
Терминальные вены
Ветвящиеся вены
Венозные коллекторы
Полые вены
Давление, мм
рт. ст.
100-120
100-120
80-90
80-90
40-60
15-25
12-18
10-12
5-8
3-5
1-3
Объем,
см3
30
60
50
25
25
60
ПО
130
270
220
100
Скорость
кровотока, см • с-1
50
13
8
6
0,3
0,07
0,07
1,3
1,5
3,6
33
Сопротивление,
дин • с • см"5
64
3,9 • 103
1,6-10s
1,2-10s
2 • 10'°
3,9-10"
4 • 109
3,2-103
0,5 • 104
250
26
тока через сосуд прямо пропорциональна давлению крови в нем и обратно
пропорциональна сопротивлению току крови в этом сосуде.
Линейная скорость кровотока отражает скорость продвижения частиц
крови вдоль сосуда и равна объемной скорости, деленной на площадь
сечения кровеносного сосуда. Линейная скорость различна для частиц
крови, продвигающихся в центре потока и у сосудистой стенки. В центре
сосуда линейная скорость максимальна, а около стенки сосуда она
минимальна в связи с тем, что здесь особенно велико трение частиц крови о
стенку.
Под сердечным выбросом понимают количество крови, выбрасываемой
сердцем в сосуды в единицу времени.
Исходя из величины сердечного выброса в покое и средней скорости
кровотока в капилляре (см. табл. 9.2) подсчитано, что площадь
поперечного сечения капиллярного ложа должна в 700 раз превышать площадь
поперечного сечения аорты. В покое функционирует только 25—35 %
капилляров и общая площадь их обменной поверхности составляет 250—350 м2.
Давление и скорость кровотока в системе кровообращения
уменьшаются от аорты до венул (см. табл. 9.2), а кровеносные сосуды становятся все
более мелкими и многочисленными. В капиллярах скорость кровотока
замедляется наиболее выраженно, что благоприятствует отдаче кровью
веществ тканям. Для венозного отдела характерны низкий уровень давления
и более медленная по сравнению с артериальным руслом скорость
кровотока.
Сопоставление величин давления, кровотока и сопротивления сосудов в
различных отделах сосудистого русла (табл. 9.2) свидетельствует о том, что
внутрисосудистое давление от аорты до полых вен резко снижается, а
объем крови в венозном русле, наоборот, возрастает. Следовательно,
артериальное русло характеризуется высоким давлением и сравнительно
небольшим объемом крови, а венозное — большим объемом крови и низким
давлением.
Считается, что в венозном русле содержится 75—80 % крови, а в
артериальном — 15—17 % и в капиллярах — около 5 % (в диапазоне 3—10 %).
Исходя из этого в функциональной схеме сердечно-сосудистой системы
(рис. 9.1) выделены 3 области: высокого давления, транскапиллярного
обмена и большого объема.
При функциональном единстве, согласованности и взаимообусловлен-
9. Функции систем кровообращения и лимфообращения • 391
Большого объема
(венозная)
ОБЛАСТИ
Транскапиллярного
обмена (капилляры)
Высокогодавления
(артериальная)
Рис. 9.1. Сердечно-сосудистая
система (функциональная
схема).
Цифры в скобках — величина
кровотока в покое (в % к минутному
объему), цифры внизу рисунка —
содержание крови (в % к общему
объему).
Артериальная часть
сердечно-сосудистой системы (светлая часть
схемы) содержит всего 15—20 %
общего объема крови и характеризуется
высоким (относительно остальных
отделов системы) давлением. В
центре схемы находится область
транскапиллярного обмена, т. е.
капиллярных (обменных) сосудов,
для обеспечения оптимальной
функции которых служит, в
основном, сердечно-сосудистая система.
При этом в виде точек обозначено
большое число капилляров в
организме и огромная площадь их
возможной поверхности во время
функционирования органа или
ткани, хотя цифры внизу указывают
на сравнительно небольшой объем
содержащейся в них крови в
условиях покоя. Наибольшее
количество крови содержится в области
большого объема, которая
обозначена штриховкой. Эта область
содержит в 3—4 раза больше крови,
чем область высокого давления, в
связи с чем и площадь,
обозначенная на схеме штриховкой, больше
площади светлой части схемы.
70—80 %
5—10%
15—20%
ОБЪЕМ СОДЕРЖАЩЕЙСЯ КРОВИ
ности подразделов
сердечно-сосудистой системы и
характеризующих их
параметров в ней условно
выделяют три уровня:
а) системная гемодинамика — обеспечивающая процессы циркуляции
крови (кругооборота) в системе;
б) органное кровообращение — кровоснабжение органов и тканей в
зависимости от их функциональной потребности;
в) микрогемодинамика (микроциркуляция) — обеспечение
транскапиллярного обмена, т. е. нутритивной (питательной) функции сосудов.
9.1.3. Системная гемодинамика
Основными параметрами, характеризующими системную гемодинамику,
являются: системное артериальное давление, общее периферическое
сопротивление сосудов, сердечный выброс, работа сердца, венозный возврат
крови к сердцу, центральное венозное давление, объем циркулирующей
крови к сердцу.
392 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
9.1.3.1. Системное артериальное давление
Внутрисосудистое давление крови является одним из основных
параметров, по которому судят о функционировании сердечно-сосудистой
системы. Артериальное давление есть интегральная величина, составляющими и
определяющими которой являются объемная скорость кровотока (Q) и
сопротивление (R) сосудов. Поэтому системное артериальное давление
(САД) является результирующей величиной сердечного выброса (СВ) и
общего периферического сопротивления сосудов (ОПСС):
САД = СВ • ОПСС.
Давление в крупных ветвях аорты (собственно артериальное)
определяется как:
АД = Q • R.
Применительно к артериальному давлению различают систолическое,
диастолическое, пульсовое и среднее давления. Систолическое — возникает
в артериях в период систолы левого желудочка сердца, диастолическое — в
период его диастолы, разница между величиной систолического и диасто-
лического давлений характеризует пульсовое давление (рис. 9.2). Выделяют
также среднее давление, которое представляет собой среднюю (не
арифметическую) между систолическим и диастолическим давлениями величину,
которая была бы способна при отсутствии пульсовых колебаний давления
крови дать такой же гемодинамический эффект, какой имеет место при
естественном, колеблющемся движении крови. Среднее давление выражает
энергию непрерывного движения крови. Поскольку продолжительность
диастолического давления больше, чем систолического, то среднее
давление ближе к величине диастолического давления и вычисляется как сумма
диастолического давления плюс '/3 пульсового.
Величина внутрисосудистого давления при прочих равных условиях оп-
120 л
Рис. 9.2. Систолическое (3), диастолическое (1), среднее (2) и пульсовое (1—3)
давление в сосудах.
9. Функции систем кровообращения и лимфообращения • 393
ределяется расстоянием места его измерения от сердца. Различают поэтому
аортальное давление, артериальное давление, артериолярное, капиллярное,
венозное (в мелких и крупных венах) и центральное венозное (в устье полых
вен) давление.
В биологических и медицинских исследованиях артериальное давление
выражают в миллиметрах ртутного столба (мм рт. ст.), а венозного — в
миллиметрах водного столба (мм водн. ст.).
У человека в покое наиболее усредненным из всех средних величин
считается систолическое давление 120—125 мм рт. ст., диастолическое 70—
75 мм рт. ст. Эти величины зависят от пола, возраста, конституции
человека, условий его работы, географического пояса проживания и т. д.
Уровень АД не позволяет, однако, судить о степени кровоснабжения
органов и тканей или величине объемной скорости кровотока в сосудах.
Выраженные перераспределительные сдвиги в системе кровообращения
могут происходить при неизменном уровне АД, поскольку изменения
ОПСС могут компенсироваться противоположными сдвигами СВ, а
сужение сосудов в одних регионах — сопровождаться их расширением в других.
Одним из важнейших факторов, определяющих интенсивность
кровоснабжения тканей, является величина просвета сосудов, определяющая их
сопротивление кровотоку.
9.1.3.2. Общее периферическое сопротивление сосудов
Под этим термином понимают общее сопротивление всей сосудистой
системы выбрасываемому сердцем потоку крови. Это соотношение
описывается уравнением:
ОПСС = Q§.
СВ
Как следует из этого уравнения, для расчета ОПСС необходимо
определить величину системного артериального давления и сердечного выброса.
Прямых бескровных методов измерения общего периферического
сопротивления не разработано, и его величина определяется из уравнения
Пуазейля для гидродинамики:
" 4 ,
ЯГ
где R — гидравлическое сопротивление, / — длина сосуда, v — вязкость
крови, г — радиус сосудов.
Поскольку при исследовании сосудистой системы животного или
человека радиус сосудов, их длина и вязкость крови остаются обычно
неизвестными, Франк, используя формальную аналогию между гидравлической и
электрической цепями, привел уравнение Пуазейля к следующему виду:
R = ^~2 • 1332,
где Р/—Рг — разность давлений в начале и в конце участка сосудистой
системы, Q — величина кровотока через этот участок, 1332— коэффициент
перевода единиц сопротивления в систему CGS.
Уравнение Франка широко используется на практике для определения
сопротивления сосудов, хотя оно не всегда отражает истинные
физиологические взаимоотношения между объемным кровотоком, АД и сопротивле-
394 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
I 1 г-^—I р 1 1 1 1 1 1 1 1
Время, (20 с)
Vfyito Аортальное давление
1 Перфуэионное давление в плечеголовной артерии
_ _ Перфуэионное давление в грудной аорте
■^нш Отметка стимуляции
Рис. 9.3. Более выраженная величина повышения сопротивления сосудов бассейна
грудной аорты по сравнению с его изменениями в бассейне плечеголовной артерии
при прессорном рефлексе.
нием сосудов кровотоку у теплокровных. Эти три параметра системы
действительно связаны приведенным соотношением, но у разных объектов, в
разных гемодинамических ситуациях и в разное время их изменения могут
быть в разной мере взаимозависимыми. Так, в конкретных случаях
уровень САД может определяться преимущественно величиной ОПСС или в
основном СВ.
В обычных физиологических условиях ОПСС составляет от 1200 до
1700 дин • с ■ см , при гипертонической болезни эта величина может
возрастать в два раза против нормы и быть равной 2200—3000 дин • с • см-5.
Величина ОПСС состоит из сумм (не арифметических) сопротивлений
регионарных сосудистых отделов. При этом в зависимости от большей или
меньшей выраженности изменений регионарного сопротивления сосудов в
них соответственно будет поступать меньший или больший объем крови,
выбрасываемый сердцем. На рис. 9.3 показан пример более выраженной
степени повышения сопротивления сосудов бассейна нисходящей грудной
аорты по сравнению с его изменениями в плечеголовной артерии. Поэтому
прирост кровотока в плечеголовной артерии будет больше, чем в грудной
аорте. На этом механизме базируется эффект «централизации»
кровообращения у теплокровных, обеспечивающий в тяжелых или угрожающих
организму условиях (шок, кровопотеря и др.) перераспределение крови,
прежде всего, к головному мозгу и миокарду.
9.1.3.3. Сердечный выброс
В клинической литературе чаще используют понятие «минутный объем
кровообращения» (МОК).
Минутный объем кровообращения характеризует общее количество крови,
перекачиваемое правым и левым отделом сердца в течение одной минуты
в сердечно-сосудистой системе. Размерность минутного объема кровообра-
9. Функции систем кровообращения и лимфообращения • 395
щения — л/мин или мл/мин. Чтобы нивелировать влияние
индивидуальных антропометрических различий на величину МОК, его выражают в
виде сердечного индекса. Сердечный индекс — это величина минутного объема
кровообращения, деленная на площадь поверхности тела в м . Размерность
сердечного индекса — л/(мин • м2).
В системе транспорта кислорода аппарат кровообращения является
лимитирующим звеном, поэтому соотношение максимальной величины
МОК, проявляющейся при максимально напряженной мышечной работе,
с его значением в условиях основного обмена дает представление о
функциональном резерве сердечно-сосудистой системы. Это же соотношение
отражает и функциональный резерв сердца в его гемодинамической
функции. Гемодинамический функциональный резерв сердца у здоровых людей
составляет 300—400 %. Это означает, что МОК покоя может быть увеличен
в 3—4 раза. У физически тренированных лиц функциональный резерв
выше — он достигает 500—700 %.
Для условий физического покоя и горизонтального положения тела
испытуемого нормальные величины МОК соответствуют диапазону 4—6 л/
мин (чаще приводятся величины 5—5,5 л/мин). Средние величины
сердечного индекса колеблются от 2 до 4 л/(мин • м2) — чаще приводятся
величины порядка 3—3,5 л/(мин • м2).
Поскольку объем крови у человека составляет только 5—6 л, полный
кругооборот всего объема крови происходит примерно за 1 мин. В период
тяжелой работы МОК у здорового человека может увеличиваться до 25—
30 л/мин, а у спортсменов — до 30—40 л/мин.
Факторами, определяющими величину МОК, являются систолический
объем крови, частота сердечных сокращений и венозный возврат крови к
сердцу.
Систолический объем крови. Объем крови, нагнетаемый каждым
желудочком в магистральный сосуд (аорту или легочную артерию) при одном
сокращении сердца, обозначают как систолический, или ударный, объем
крови.
В покое объем крови, выбрасываемый из желудочка, составляет в норме
от трети до половины общего количества крови, содержащейся в этой
камере сердца к концу диастолы. Оставшийся в сердце после систолы
резервный объем крови является своеобразным депо, обеспечивающим
увеличение сердечного выброса при ситуациях, в которых требуется быстрая
интенсификация гемодинамики (например, при физической нагрузке,
эмоциональном стрессе и др.).
Величина систолического (ударного) объема крови во многом
предопределена конечным диастолическим объемом желудочков. В условиях
покоя диастолическая емкость желудочков сердца подразделяется на три
фракции: ударного объема, базального резервного объема и остаточного
объема. Все эти три фракции суммарно составляют конечно-диастоличе-
ский объем крови, содержащийся в желудочках (рис. 9.4).
После выброса в аорту систолического объема крови оставшейся в
желудочке объем крови — это конечно-систолический объем. Он
подразделяется на базальный резервный объем и остаточный объем. Базальный
резервный объем — это количество крови, которое может быть
дополнительно выброшено из желудочка при увеличении силы сокращений миокарда
(например, при физической нагрузке организма). Остаточный объем — это
то количество крови, которое не может быть вытолкнуто из желудочка
даже при самом мощном сердечном сокращении (см. рис. 9.4).
Величина резервного объема крови является одной из главных детерми-
396 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
л
О
•зс
5
Ф
в:
го
ф
5 s*
с. т
о о
К*1.
го с
<симальнаяди
же
1
s
ф
А
О
>5
3
I
О.
го
>ч
Ъ
X
Максималь
Дополнительный резервный объем
Ударный объем
Базальный резервный объем
Остаточный объем
Конечно-
столический
объем
о
5
ф
ю
о
о
ф
S
ечно-диастол
о
Рис. 9.4. Фракции диастолической емкости левого желудочка.
нант функционального резерва сердца по его специфической функции —
перемещению крови в системе. При увеличении резервного объема,
соответственно, увеличивается максимальный систолический объем, который
может быть выброшен из сердца в условиях его интенсивной деятельности.
Регуляторные влияния на сердце реализуются в изменении
систолического объема путем воздействия на сократительную силу миокарда. При
уменьшении мощности сердечного сокращения систолический объем
снижается.
У человека при горизонтальном положении тела в условиях покоя
систолический объем составляет от 60 до 90 мл (табл. 9.3).
Таблица 9.3. Некоторые параметры системной гемодинамики и насосной функции
сердца у человека (в условиях основного обмена)
Сердечный выброс, л/мин
Частота сердечных сокращений, мин-1
Конечно-диастолический объем, мл
Конечно-систолический объем, мл
Ударный объем сердца, мл
Давление, мм рт. ст.
систолическое
диастолическое
среднее
Общее периферическое сопротивление
сосудов, дин • с • см-5
Давление, мм рт. ст.
конечно-с истолическое
конечно-диастолическое
Давление, мм рт. ст.
конечно-систолическое
конечно-диастолическое
Максимальная скорость прироста давления
(dP/dtmJ, мм рт. ст./с
Работа за систолу, Дж
4,0-
60-
65-
40-
60-
Аорта
110-120
60-75
70-80
Большой круг
1200-1700
Левое предсердие
10-12
0-6
Левый желудочек
110-120
9-12
2000-2500
0,9-1,0
-6,0
-80
-130
-60
-90
Легочный ствол
Ир
Пр
25-30
6-12
9-17
Малый круг
150-350
1вое предсердие
3-7
0-2
1вый желудочек
25-30
6-10
350-400
0,2
9. Функции систем кровообращения и лимфообращения ♦ 397
9.1.3.4. Частота сердечных сокращений (пульс)
Частота сердечных сокращений (пульс) в покое составляет от 60 до 80
ударов в минуту. Регуляторные влияния, вызывающие изменения частоты
сердечных сокращений, называются хронотропными, а изменения силы
сокращений сердца — инотропными.
Повышение частоты сердечных сокращений является важным
адаптационным механизмом увеличения МОК, осуществляющим быстрое
приспособление его величины к требованиям организма. При некоторых
экстремальных воздействиях на организм сердечный ритм может повышаться
в 3—3,5 раза по отношению к исходному.
Важным показателем системной гемодинамики и сердечной
деятельности является работа сердца за систолу.
9.1.3.5. Работа сердца
Миокард желудочков в период изометрического сокращения сообщает
находящейся в них крови потенциальную энергию, которая в период
изгнания крови переходит в кинетическую энергию движущейся крови.
Большая часть последней переходит в сосудистой системе в потенциальную
энергию растянутых эластических стенок аорты и легочной артерии, и
лишь небольшое количество ее (2—5 %) сохраняется в виде кинетической
энергии движущейся крови.
Поскольку вся полезная работа сердца переходит в энергию крови,
полную работу сердца за систолу можно рассчитать как сумму потенциальной
и кинетической энергии крови. Потенциальная часть работы сердца
вычисляется как произведение ударного объема сердца на среднее
артериальное давление. Кинетическая часть работы сердца рассчитывается как
половина произведения массы выбрасываемой из сердца крови за систолу на
квадрат средней скорости изгнания крови из сердца. В покое кинетическая
часть работы сердца составляет лишь 2—5 % от полной работы сердца,
поэтому ее обычно не учитывают при расчетах. Однако при физических
нагрузках кинетическая часть работы сердца у человека может составлять до
30 % от полной работы сердца за систолу. Рассчитанная таким образом
работа характеризует деятельность левой половины сердца. Работа правых
отделов сердца составляет около 25 % от этой величины.
9.1.3.6. Сократимость
Сократимость, т. е. способность сокращаться, характерная для всех
разновидностей мышечной ткани, реализуется в миокарде благодаря трем
специфическим свойствам сердечной мышцы: автоматизм — способность
клеток водителей ритма генерировать импульсы без каких-либо внешних
воздействий; проводимость — способность элементов проводящей системы к
электротонической передаче возбуждения; возбудимость — способность
кардиомиоцитов возбуждаться в естественных условиях под влиянием
импульсов, передаваемых по волокнам Пуркинье (рис. 9.5). Важной
особенностью возбудимости сердечной мышцы является длительный
рефракторный период (полное исчезновение или резкое снижение возбудимости
кардиомиоцитов после их предыдущего сокращения), гарантирующий
ритмический характер последующего сокращения.
398 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
9.1.3.6.1. Автоматизм и проводимость миокарда
В области правого предсердия, а также на границе предсердий и
желудочков располагаются участки, ответственные за возбуждение сердечной
мышцы. Автоматизм сердца имеет миогенную природу и обусловлен
спонтанной активностью части клеток его атипической ткани.
Указанные клетки образуют скопления в определенных участках
миокарда. Наиболее важным в функциональном отношении из них является
синусный, или синоатриалъный, узел, расположенный между местом
впадения верхней полой вены и ушком правого предсердия. В нижней части
межпредсердной перегородки, непосредственно над местом прикрепления
септальной створки трехстворчатого клапана, располагается атриовентри-
кулярный узел. От него отходит пучок атипических мышечных волокон,
который пронизывает фиброзную перегородку между предсердиями и
переходит в узкий длинный мышечный тяж, заключенный в межжелудочковую
перегородку. Он называется атриовентрикулярным пучком, или пучком
Тиса. Пучок Гиса разветвляется, образуя две ножки, от которых
приблизительно на уровне середины перегородки отходят волокна Пуркинье, также
образованные атипической тканью и формирующие субэндокардиальную
сеть в стенках обоих желудочков (см. рис. 9.5).
Функция проводимости в сердце имеет электротоническую природу.
Она обеспечивается низким электрическим сопротивлением щелевидных
контактов (нексусов) между элементами атипического и рабочего
миокарда, а также в области вставочных пластинок, разделяющих кардиомиоци-
ты. В результате сверхпороговое раздражение любого участка вызывает
генерализованное возбуждение всего миокарда. Это позволяет считать ткань
сердечной мышцы, морфологически разделенную на отдельные клетки,
функциональным синцитием.
Возбуждение миокарда зарождается в синоатриальном узле, который
называют водителем ритма, или пейсмекером первого порядка, и далее
Синоатриальный узел
Атриовентрикулярный узел
Пучок Гиса
Правая ножка
- Левая ножка
- Передняя ветвь
- Задняя ветвь
Волокна Пуркинье
Рис. 9.5. Проводящая система сердца.
9. Функции систем кровообращения и лимфообращения • 399
распространяется на мускулатуру предсердий с последующим
возбуждением атриовентрикулярного узла, который является водителем ритма второго
порядка. Скорость распространения возбуждения в предсердиях составляет
1 м/с. При переходе возбуждения на атриовентрикулярный узел имеет
место так называемая атриовентрикулярная задержка, составляющая 0,04—
0,06 с. Механизм атриовентрикулярной задержки состоит в том, что
проводящие ткани синоатриального и атриовентрикулярного узлов
контактируют не непосредственно, а через волокна рабочего миокарда, для которых
характерна более низкая скорость проведения возбуждения. Последнее
распространяется далее по ножкам пучка Гиса и волокнам Пуркинье,
передаваясь на мускулатуру желудочков, которую оно охватывает со
скоростью 0,75—4,0 м/с. В силу особенностей расположения волокон Пуркинье
возбуждение сосочковых мышц происходит несколько раньше, чем оно
охватывает стенки желудочков. Благодаря этому нити, удерживающие
трехстворчатый и митральный клапаны, оказываются натянутыми раньше,
чем на них начинает действовать сила сокращения желудочков. По той же
причине наружная часть стенки желудочков у верхушки сердца
возбуждается несколько раньше участков стенки, прилежащих к ее основанию.
Таким образом, волна возбуждения последовательно охватывает различные
отделы сердца в направлении от правого предсердия к верхушке. Однако
указанные сдвиги во времени крайне невелики и обычно принимается, что
весь миокард желудочков охватывается возбуждением одновременно.
9.1.3.6.2. Мембранная природа автоматии сердца
Возбудимость клеток проводящей системы и рабочего миокарда имеет ту
же биоэлектрическую природу, что и в поперечно-полосатых мышцах.
Наличие заряда на мембране здесь также обеспечивается разностью
концентраций ионов калия и натрия возле ее внешней и внутренней поверхности
и избирательной проницаемостью мембраны для этих ионов. В покое
мембрана кардиомиоцитов проницаема для ионов калия и почти
непроницаема для ионов натрия. В результате диффузии ионы калия выходят из
клетки и создают положительный заряд на ее поверхности. Внутренняя
сторона мембраны становится электроотрицательной по отношению к
наружной.
В клетках атипического миокарда, обладающих автоматией,
мембранный потенциал способен спонтанно уменьшаться до критического уровня,
что приводит к генерации потенциала действия. В норме ритм сердечных
сокращений задается всего несколькими наиболее возбудимыми клетками
синоатриального узла, которые называются истинными водителями ритма,
или пейсмекерными клетками. В этих клетках во время диастолы
мембранный потенциал, достигнув максимального значения, соответствующего
величине потенциала покоя (60—70 мВ), начинает постепенно снижаться.
Этот процесс называют медленной спонтанной диастолической
деполяризацией. Она продолжается до того момента, когда мембранный потенциал
достигает критического уровня (40—50 мВ), после чего возникает потенциал
действия.
Для потенциала действия пейсмекерных клеток синоатриального узла
характерны малая крутизна подъема, отсутствие фазы ранней быстрой ре-
поляризации, а также слабая выраженность «овершута» и фазы «плато».
Медленная реполяризация плавно сменяется быстрой. Во время этой фазы
мембранный потенциал достигает максимальной величины, после чего
вновь возникает фаза медленной спонтанной деполяризации (рис. 9.6).
400 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
мВ
Г)
-20-
-40-
-60 -
-80-
100 мс
1 / \ п 1
Екр / \
' L V
^max /
Уч^,_^х^ ^>^J.L*^
Рис. 9.6. Развитие потенциала действия истинного водителя ритма автоматии
сердца.
Во время диастолы спонтанная деполяризация уменьшает мембранный потенциал (Етах) до
критического уровня (Ек|)) и вызывает потенциал действия.
—— Истинный водитель ритма Латентный водитель ритма
Рис. 9.7. Развитие потенциала действия истинного и латентного водителей ритма
автоматии сердца.
Скорость медленной диастолической деполяризации истинного водителя ритма больше, чем у
латентного.
Частота возбуждения пейсмекерных клеток у человека составляет в
покое 70—80 в минуту при амплитуде потенциала действия 70—80 мВ. Во
всех остальных клетках проводящей системы потенциал действия в норме
возникает под влиянием возбуждения, приходящего из синоатриального
узла. Такие клетки называют латентными водителями ритма. Потенциал
действия в них возникает раньше, чем их собственная медленная спонтан-
9. Функции систем кровообращения и лимфообращения • 401
ная диастолическая деполяризация достигает критического уровня.
Латентные водители ритма принимают на себя ведущую функцию только при
условии разобщения с синоатриальным узлом. Частота спонтанной
деполяризации таких клеток у человека составляет 30—40 в минуту (рис. 9.7).
Спонтанная медленная диастолическая деполяризация обусловлена
совокупностью ионных процессов, связанных с функциями плазматических
мембран. Среди них ведущую роль играют медленное уменьшение
калиевой и повышение натриевой и кальциевой проводимости мембраны во
время диастолы, параллельно чему происходит падение активности
электрогенного натриевого насоса. К началу диастолы проницаемость
мембраны для калия на короткое время повышается, и мембранный потенциал
покоя приближается к равновесному калиевому потенциалу, достигая
максимального диастолического значения. Затем проницаемость мембраны
для калия уменьшается, что и приводит к медленному снижению
мембранного потенциала до критического уровня. Одновременное увеличение
проницаемости мембраны для натрия и кальция приводит к поступлению этих
ионов в клетку, что также способствует возникновению потенциала
действия. Снижение активности электрогенного насоса дополнительно
уменьшает выход натрия из клетки и, тем самым, облегчает деполяризацию
мембраны и возникновение возбуждения.
9.1.3.6.3. Возбудимость сердечной мышцы
Клетки миокарда обладают возбудимостью, но им не присуща автоматия.
В период диастолы мембранный потенциал покоя этих клеток стабилен, и
его величина выше (80—90 мВ), чем в клетках водителей ритма. Потенциал
действия в этих клетках возникает под влиянием возбуждения клеток
водителей ритма, которое достигает кардиомиоцитов, вызывая
деполяризацию их мембран.
Потенциал действия клеток рабочего миокарда состоит из фазы
быстрой деполяризации, начальной быстрой реполяризации, переходящей в
фазу медленной реполяризации (фаза плато), и фазы быстрой конечной
В 50 л
П -
-50 -
-100 ■
Овер-
шут
Потенциал покоя
1
' 5
Потенциал дейст
00 мс
1
'
Пик ПД
Ч Плато
—— Деполяризация \
V— Репопяризация
Рис. 9.8. Потенциал действия клетки рабочего миокарда.
Быстрое развитие деполяризации и продолжительная реполяризация. Замедленная реполяри-
зация (плато) переходит в быструю реполяризацию.
402 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
мВ
гс
3D -
О "
-30-
-60-
-90 J
^"~«ч
г2 ''
■«««■^
4w * >
^^■•••^ * *
^^^**^*»^3 / х
^^^^^^. \
t ^^*^s« ^
1 / у \
\ '«
^* ■
300
1 Потенциал действия — — —Сокращение
7
t, мс
Возбудимость Исходный уровень
Рис. 9.9. Сопоставление потенциала действия и сокращения миокарда с фазами
изменения возбудимости.
1 — фаза деполяризации; 2 — фаза начальной быстрой реполяризации; 3 — фаза медленной
реполяризации (фаза плато); 4 — фаза конечной быстрой реполяризации; 5 — фаза абсолютной
рефрактерности; 6 — фаза относительной рефрактерности; 7 — фаза супернормальной
возбудимости.
Рефрактерность миокарда практически совпадает не только с возбуждением, но и с периодом
сокращения.
реполяризации (рис. 9.8). Фаза быстрой деполяризации создается резким
повышением проницаемости мембраны для ионов натрия, что приводит к
возникновению быстрого входящего натриевого тока. Последний, однако,
при достижении мембранного потенциала 30—40 мВ инактивируется и в
последующем, вплоть до инверсии потенциала (около +30 мВ) и в фазу
«плато», ведущее значение имеют кальциевые ионные токи. Деполяриза-
9. Функции систем кровообращения и лимфообращения • 403
ция мембраны вызывает активацию кальциевых каналов, в результате чего
возникает дополнительный деполяризирующий входящий кальциевый ток.
Конечная реполяризация в клетках миокарда обусловлена постепенным
уменьшением проницаемости мембраны для кальция и повышением
проницаемости для калия. В результате входящий ток кальция уменьшается, а
выходящий ток калия возрастает, что обеспечивает быстрое
восстановление мембранного потенциала покоя. Длительность потенциала действия
кардиомиоцитов составляет 300—400 мс, что соответствует длительности
сокращения миокарда (рис. 9.9).
9.1.3.6.4. Сопряжение возбуждения и сокращения
миокарда
Инициатором сокращения миокарда, как и в скелетной мышце, является
потенциал действия, распространяющийся вдоль поверхностной мембраны
кардиомиоцита. Поверхностная мембрана волокон миокарда образует впя-
чивания, так называемые поперечные трубочки (Т-система), к которым
примыкают продольные трубочки (цистерны) саркоплазматического рети-
кулума, являющиеся внутриклеточным резервуаром кальция (рис. 9.10).
Саркоплазматический ретикулум в миокарде выражен в меньшей степени,
чем в скелетной мышце. Нередко к поперечной Т-трубочке примыкают не
две продольные трубочки, а одна (система диад, а не триад, как в
скелетной мышце). Считается, что потенциал действия распространяется с
поверхностной мембраны кардиомиоцита вдоль Т-трубочки в глубь волокна
и вызывает деполяризацию цистерны саркоплазматического ретикулума,
что приводит к освобождению из цистерны ионов кальция.
Следующим этапом электромеханического сопряжения является
перемещение ионов кальция к сократительным протофибриллам.
Сократительная система сердца представлена сократительными белками — актином и
миозином, и модуляторными белками — тропомиозином и тропонином.
Молекулы миозина формируют толстые нити саркомера, молекулы
актина—тонкие нити. В состоянии диастолы тонкие актиновые нити входят
своими концами в промежутки между толстыми и более короткими миози-
новыми нитями. На толстых нитях миозина располагаются поперечные
мостики, содержащие АТФ, а на нитях актина — модуляторные белки —
тропомиозин и тропонин. Эти белки образуют единый комплекс,
блокирующий активные центры актина, предназначенные для связывания
миозина и стимуляции его АТФазной активности. Сокращение волокон
миокарда начинается со связывания тропонином вышедшего из
саркоплазматического ретикулюма в межфибриллярное пространство кальция.
Связывание кальция вызывает изменения конформации тропонин-тропомиози-
нового комплекса. В результате этого открываются активные центры и
происходит взаимодействие актиновых и миозиновых нитей. При этом
стимулируется АТФазная активность миозиновых мостиков, происходит
распад АТФ и выделяющаяся энергия используется на скольжение нитей
друг относительно друга, приводящее к сокращению миофибрилл. В
отсутствие ионов кальция тропонин препятствует образованию актомиозиново-
го комплекса и усилению АТФазной активности миозина.
Морфологические и функциональные особенности миокарда свидетельствуют о тесной
связи между внутриклеточным депо кальция и внутриклеточной средой.
Так как запасы кальция во внутриклеточных депо невелики, большое
значение имеет вход кальция в клетку во время генерации потенциала
действия (см. рис. 9.10). Потенциал действия и сокращение миокарда совпадают
404 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Начало сокращения
Триггерный эффект
Сарколемма Вход Са2+
Расслабление
Поперечная.
трубочка
Продольная ^
трубочка
Выход Са2+ Актин Миозин
Удаление Са2+
Рис. 9.10. Схема соотношений между возбуждением, током Са2+ и активацией
сократительного аппарата. Начало сокращения связано с выходом Са2+ из продольных
трубочек при деполяризации мембраны. Са2+, входящий через мембраны кардио-
миоцита в фазу плато потенциала действия, пополняет запасы Са2+ в продольных
трубочках.
по времени. Поступление кальция из наружной среды в клетку создает
условия для регуляции силы сокращения миокарда. Большая часть
входящего в клетку кальция, очевидно, пополняет его запасы в цистернах сарко-
плазматического ретикулума, обеспечивая последующие сокращения.
Удаление кальция из клеточного пространства приводит к разобщению
процессов возбуждения и сокращения миокарда. Потенциалы действия
при этом регистрируются почти в неизменном виде, но сокращения
миокарда не происходит. Вещества, блокирующие вход кальция во время
генерации потенциала действия, вызывают аналогичный эффект. Вещества,
угнетающие кальциевый ток, уменьшают длительность фазы плато и
потенциала действия и понижают способность миокарда к сокращению. При
повышении содержания кальция в межклеточной среде и при введении
веществ, усиливающих вход этого иона в клетку, сила сердечных
сокращений увеличивается. Таким образом, потенциал действия играет роль
пускового механизма, вызывая освобождение кальция из цистерн саркоплаз-
матического ретикулума, регулирует сократимость миокарда, а также
пополняет запасы кальция во внутриклеточных депо.
9. Функции систем кровообращения и лимфообращения • 405
9.1.3.6.5. Сердечный цикл и его фазовая структура
Работа сердца представляет собой непрерывное чередование периодов
сокращения (систола) и расслабления (диастола). Сменяющие друг друга
систола и диастола составляют сердечный цикл. Поскольку в покое
частота сокращений сердца составляет 60—80 циклов в минуту, то каждый из
них продолжается около 0,8 с. При этом 0,1 с занимает систола
предсердий, 0,3 с — систола желудочков, а остальное время — общая диастола
сердца.
К началу систолы миокард расслаблен, а сердечные камеры заполнены
кровью, поступающей из вен. Атриовентрикулярные клапаны в это время
раскрыты и давление в предсердиях и желудочках практически одинаково.
Генерация возбуждения в синоатриальном узле приводит к систоле
предсердий, во время которой за счет разности давлений конечно-диастоличе-
ский объем желудочков возрастает приблизительно на 15 %. С окончанием
систолы предсердий давление в них понижается.
Поскольку клапаны между магистральными венами и предсердиями
отсутствуют, во время систолы предсердий происходит сокращение
кольцевой мускулатуры, окружающей устья полых и легочных вен, что
препятствует оттоку крови из предсердий обратно в вены. В то же время систола
предсердий сопровождается некоторым повышением давления в полых
венах. Большое значение имеет обеспечение турбулентного характера потока
крови, поступающего из предсердий в желудочки, что способствует
захлопыванию атриовентрикулярных клапанов. Максимальное и среднее
давление в левом предсердии во время систолы составляют соответственно 8—
15 и 5—7 мм рт. ст., в правом предсердии — 3—8 и 2—4 мм рт. ст.
(рис. 9.11).
С переходом возбуждения на атриовентрикулярный узел и проводящую
систему желудочков начинается систола последних. Ее начальный этап
(период напряжения) продолжается 0,08 с и состоит из двух фаз. Фаза
асинхронного сокращения (0,05 с) представляет собой процесс
распространения возбуждения и сокращения по миокарду. Давление в желудочках при
этом практически не меняется. В процессе начинающегося синхронного
сокращения миокарда желудочков, когда давление в них возрастает до
величины, достаточной для закрытия атриовентрикулярных клапанов, но
недостаточной для открытия полулунных, наступает фаза изоволюмического,
или изометрического, сокращения.
Дальнейшее повышение давления приводит к раскрытию полулунных
клапанов и началу периода изгнания крови из сердца, общая длительность
которого составляет 0,25 с. Этот период состоит из фазы быстрого изгнания
(0,13 с), во время которой давление в желудочках продолжает расти и
достигает максимальных значений, и фазы медленного изгнания (0,13 с), во
время которой давление в желудочках начинает снижаться, а после
окончания сокращения оно резко падает. В магистральных артериях давление
снижается значительно медленнее, что обеспечивает захлопывание
полулунных клапанов и предотвращает обратный ток крови. Промежуток
времени от начала расслабления желудочков до закрытия полулунных
клапанов называется протодиастолическим периодом.
После окончания систолы желудочков возникает диастолический
период желудочков сердца (диастола), длящаяся 0,47 с. Он включает в себя
следующие периоды и фазы (при частоте сердечных сокращений 75 в
минуту):
Период расслабления (0,12 с), состоящий из:
406 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Систола
желудочков
150
0 ■
.
>•....••'.
>s
s
ола
сер
Сист
пред
^fet
1
1
1
1
1
&
с
го
Период н
/ >
ч
Период
, изгнания
t
■
1
t
1
1
V
\
\
"Ч.
Диастола
желудочков
р--—
пения :
ю
го
S
о
m
о.
о.
(U
с
.... _---
г
1
1
/
f
....
— — — Давление в аорте
■ Давление в левом
предсердии
■ Давление влевом
желудочке
Объем левого
желудочка
I
III
IV V
I
Рис. 9.11. Изменения объема левого желудочка и колебания давления в левом
предсердии, левом желудочке и аорте в течение сердечного цикла.
I — начало систолы предсердий; II — начало систолы желудочков; III — момент раскрытия
полулунных клапанов; IV — конец систолы желудочков и момент закрытия полулунных
клапанов; V — раскрытие атриовентрикулярных клапанов.
Опускание линии, показывающей объем желудочков, соответствует динамике их
опорожнения.
— протодиастолического интервала — 0,04 с (время от начала
расслабления миокарда желудочков до закрытия полулунных клапанов);
— фазы изометрического (изоволюмического) расслабления — 0,08 с
(время от закрытия полулунных клапанов до открытия
атриовентрикулярных).
Период наполнения (0,35 с) состоящий из:
— фазы быстрого наполнения — 0,08 с (с момента открытия
атриовентрикулярных клапанов);
— фазы медленного наполнения — 0,18 с;
— фазы наполнения желудочков, обусловленной систолой
предсердий — 0,09 с.
К концу систолы желудочков и началу диастолы (с момента закрытия
полулунных клапанов) в желудочках содержится остаточный, или
резервный, объем крови (конечно-систолический объем). В это же время
начинается резкое падение давления в желудочках (фаза изоволюмического,
или изометрического, расслабления). Способность миокарда быстро
расслабляться является важнейшим условием для наполнения сердца кровью.
Когда давление в желудочках (начальное диастолическое) становится
9. Функции систем кровообращения и лимфообращения • 407
меньше давления в предсердиях, открываются атриовентрикулярные
клапаны и начинается фаза быстрого наполнения, во время которой кровь с
ускорением поступает из предсердий в желудочки. Во время этой фазы в
желудочки поступает до 85 % их диастолического объема. По мере
заполнения желудочков скорость их наполнения кровью снижается (фаза
медленного наполнения). В конце диастолы желудочков начинается систола
предсердий, в результате чего в желудочки поступает еще 15 % их
диастолического объема. Таким образом, в конце диастолы в желудочках
создается конечно-диастолический объем, которому соответствует определенный
уровень конечно-диастолического давления в желудочках.
Конечно-диастолический объем и конечно-диастолическое давление составляет так
называемую преднагрузку сердца, которая является определяющим условием
для растяжения волокон миокарда, т. е. реализации закона
Франка—Стерлинга (см. «Миогенные механизмы регуляции сердца» в разделе 9.1.3.6.7).
Частота генерации возбуждения клетками проводящей системы и
соответственно сокращений миокарда определяется длительностью
рефрактерной фазы, возникающей после каждой систолы. Как и в других возбудимых
тканях, в миокарде рефрактерность обусловлена инактивацией натриевых
ионных каналов, возникающей в результате деполяризации (см. рис. 9.9).
Для восстановления входящего натриевого тока необходим уровень репо-
ляризации около 40 мВ. До этого момента имеет место период абсолютной
рефрактерности, который продолжается около 0,27 с. Далее следует период
относительной рефрактерности (см. рис. 9.9), в течение которого
возбудимость клетки постепенно восстанавливается, но остается еще сниженной
(длительность 0,03 с). В этот период сердечная мышца может ответить
дополнительным сокращением, если стимулировать ее очень сильным
раздражителем. За периодом относительной рефрактерности следует короткий
период супернормальной возбудимости (см. рис. 9.9). В этот период
возбудимость миокарда высока и можно получить дополнительный ответ в виде
сокращения мышцы, нанося на нее подпороговый раздражитель.
Длительный рефрактерный период имеет для сердца важное
биологическое значение, так как он предохраняет миокард от быстрого или
повторного возбуждения и сокращения. Этим исключается возможность тетани-
ческого сокращения миокарда и нарушения нагнетательной функции
сердца.
К тетаническому сокращению и утомлению в физиологическом
понимании этого термина миокард не способен. При раздражении сердечная
ткань ведет себя как функциональный синцитий, и сила каждого
сокращения определяется по закону «все или ничего», согласно которому при
возбуждении, превышающем пороговую величину, сокращающиеся волокна
миокарда развивают максимальную силу, не зависящую от величины над-
порогового раздражителя.
Преждевременное сокращение всего сердца или его частей в результате
дополнительного возбуждения миокарда вызывает экстрасистолу. По
месту возникновения дополнительного возбуждения различают синусовые,
предсердные, атриовентрикулярные и желудочковые экстрасистолы.
9.1.3.6.6. Механические, электрические и физические
проявления деятельности сердца
Запись сокращений сердца, выполненная каким-либо инструментальным
способом, называется кардиограммой.
При сокращении сердце изменяет свое положение в грудной клетке.
408 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Оно несколько поворачивается вокруг своей оси слева направо, плотнее
прижимаясь изнутри к грудной стенке. Регистрация сердечного толчка
определяет механокардиограмму (апекс-кардиограмму), которая находит
весьма ограниченное использование на практике.
Более широко в клинике и в научных исследованиях используются
различные модификации электрокардиографии. Последняя представляет собой
метод исследования сердца, основанный на регистрации и анализе
электрических потенциалов, возникающих при деятельности сердца.
Электрокардиограмма. Метод электрокардиографии основан на том,
что в процессе распространения возбуждения по миокарду поверхность
невозбужденных (поляризованных) кардиомиоцитов несет положительный
заряд, а возбужденных (деполяризованных) — отрицательный. При этом
возникает электрическое поле, которое можно зарегистрировать с
поверхности тела. Поскольку между различными тканями тела создается в этом
случае разность потенциалов, изменяющаяся в соответствии с
колебаниями величины и направления электрического поля сердца, регистрируемые
изменения разности потенциала во времени и составляют суть метода
электрокардиографии. Кривая изменений этой разницы потенциалов,
определяемая с помощью высокочувствительного вольтметра, называется
электрокардиограммой (ЭКГ), а соответствующий прибор для записи этой
кривой — электрокардиофафом. Важно подчеркнуть, что ЭКГ отражает
возбуждение сердца, но не его сокращение.
Для регистрации ЭКГ используют различные схемы наложения
электродов — отведения ЭКГ. К обязательно регистрируемым в клинике
относятся следующие 12 отведений: 3 стандартных (двухполюсные от
конечностей), 3 усиленных (однополюсные от конечностей), 6 фудных
(однополюсные от фудной клетки).
При использовании двухполюсных (биполярных) отведений электроды
регистрируют разность потенциалов между двумя точками тела, потенциал
каждой из которых меняется в течение сердечного цикла. Электроды по
этой схеме накладываются на обе руки и левую ногу, образуя три так
называемых стандартных отведения, обозначаемых римскими цифрами I, II,
III (рис. 9.12).
I отведение: правая рука (—) — левая рука (+);
II отведение: правая рука (—) — левая нога (+);
III отведение: левая рука (—) —левая нога (+).
Правую руку всегда соединяют с отрицательным, а левую ногу — с
положительным полюсом прибора. Левую руку в I стандартном отведении
соединяют с положительным полюсом, а в III стандартном — с отрицательным.
При регистрации ЭКГ в однополюсных (униполярных) отведениях один
из электродов — активный — накладывают на участок тела с меняющимся
электрическим потенциалом и подключают к положительному полюсу
измерительного прибора. Потенциал второго электрода, называемого
индифферентным, остается практически постоянным и условно принимается за
нулевой. Этот электрод подключают к отрицательному полюсу
измерительного прибора.
На теле человека трудно найти участок с постоянным электрическим
потенциалом, поэтому для получения индифферентного электрода
используют искусственные приемы. Один из них состоит в том, что соединяются
вместе провода от трех электродов, наложенных на обе руки и левую ногу.
Полученный таким способом условный электрод называют объединенным,
а производимые с его помощью однополюсные отведения обозначают
латинской буквой V (от англ. Voltage). Этот электрод применяют для регист-
9. Функции систем кровообращения и лимфообращения • 409
X
Рис. 9.12. Двухполюсные (стандартные) отведения электрокардиограммы.
Концы стрелок соответствуют конечностям, соединяемым с кардиографом в I (вверху), II
(посредине) и III (внизу) отведениях. Справа —левые конечности, слева — правые. В правой
части — схематическое изображение электрокардиограммы в каждом из этих отведений.
рации однополюсных грудных отведений (V,—V6).
Другой способ получения индифферентного электрода используется
при регистрации однополюсных отведений от конечностей. В этом случае
его получают, соединяя электроды только от двух конечностей — тех, на
которых не находится активный электрод, и присоединяют к
отрицательному полюсу прибора. Амплитуда ЭКГ при этом способе в 1,5 раза
больше, чем в предыдущем случае. Поэтому эти однополюсные отведения от
конечностей получили название «усиленных» и обозначаются символами
aVR, aVL, aVF (от англ. augmented — усиленный, right — правый, left —
левый, foot — нога).
При графической записи электрокардиограммы в любом отведении в
каждом цикле отмечается совокупность характерных зубцов, которые
принято обозначать буквами Р, Q, R, S и Г (см. рис. 9.12). Считается, что
зубец Р отражает процессы деполяризации в области предсердия, интервал
P—Q характеризует процесс распространения возбуждения в предсердиях и
атриовентрикулярном узле, комплекс зубцов QRS — процессы
деполяризации в желудочках, а сегмент S— Т и зубец Г—процессы реполяризации в
желудочках. Таким образом, комплекс зубцов QRST характеризует
распространение электрических процессов в миокарде или электрическую
систолу. Важное диагностическое значение имеют временные и амплитудные
характеристики составляющих электрокардиограммы. Во втором
стандартном отведении в норме амплитуда зубца R составляет 0,8—1,2 мВ, а
амплитуда Q не должна превышать '/4 этой величины. Длительность
интервала P—Q в норме составляет 0,12—0,20 с, комплекса QRS— не более 0,08 с,
а сегмент S—T— 0,36—0,44 с.
I отведение
R
-aJ^--JJ|^4-.
II отведение
R
Q S
отведение
410 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ЭКГ
ФКГ
Рис. 9.13. Нормальная фонокардиограмма.
Римские цифры — тоны сердца; ЭКГ — синхронно регистрируемая электрокардиограмма.
Тоны сердца. Каждый сердечный цикл сопровождается несколькими
раздельными звуками, которые называются тонами сердца. Первый тон
низкий, он возникает одновременно с началом систолы желудочков и
обусловлен вибрацией створок атриовентрикулярных клапанов, включая их
сухожильные струны, сокращением мускулатуры желудочков и
механическими колебаниями начальных отделов аорты и легочной артерии. Первый
тон называют систолическим, его общая продолжительность составляет
приблизительно 0,12 с, что соответствует фазе напряжения и началу
периода изгнания крови.
Второй тон высокий и продолжается около 0,08 с, его возникновение
связано с захлопыванием полулунных клапанов и происходящей при этом
вибрацией их стенок. Этот тон называют диастолическим. Интенсивность
первого тона зависит от крутизны нарастания давления в желудочках во
время систолы, а второго — от давления в аорте и легочной артерии.
Графическая запись тонов сердца называется фонокардиограммой. Фоно-
кардиография позволяет выявить третий и четвертый тоны сердца: менее
интенсивные, чем первый и второй, и поэтому неслышные при обычной
аускультации. Третий тон отражает вибрацию стенок желудочков
вследствие быстрого поступления крови в начале фазы наполнения. Четвертый
тон возникает во время систолы предсердий и продолжается до начала их
расслабления (рис. 9.13).
Сфигмо- и флебография. Сократительный процесс, протекающий в ходе
сердечного цикла, находит отражение в ритмических колебаниях стенок
9. Функции систем кровообращения и лимфообращения • 411
ДП
Рис. 9.14. Графическая запись
пульсового колебания давления крови в
артерии.
А — анакрота; К — катакрота; ДП — дикро-
тический подъем.
крупных артерий и вен. Методика
графической регистрации
артериального пульса называется
сфигмографией (от греч. sphygmos — пульс), а
венозного пульса — флебографией
(от греч. phleps — вена).
Центральный артериальный пульс чаще
регистрируют над сонными артериями
(каротидная сфигмография), а
центральный венозный пульс — над
яремными венами (югулярная
флебография).
Сфигмограмма сонной артерии
(рис. 9.14) характеризуется
высокоамплитудной главной волной, крутой
восходящий участок которой
называется анакротой (А). Этот участок
отражает ускоренное поступление
крови в артерии из левого желудочка
в начале фазы быстрого изгнания,
что приводит к увеличению давления
в артериях и их растяжению.
Вершина этой волны, отражающая примерное равенство между притоком крови в
магистральной артерии и ее оттоком в периферические сосуды, переходит
в нисходящее колено — катакроту (К). Последняя соответствует по
времени фазе медленного изгнания, когда отток крови из растянутых
эластических артерий начинает преобладать над притоком. В период катакроты
проявляется остроконечный, направленный вниз зубец, который
называется жцизурой (вырезкой) и соответствует окончанию систолы левого
желудочка, когда давление в нем становится ниже, чем в аорте. Самая низкая
точка инцизуры соответствует полному закрытию аортального клапана.
Диастолическая часть сфигмограммы начинается дикротической волной
(дикротическим подъемом — ДП), которая возникает в результате
отражения гидравлической волны от замкнутых кармашков аортального клапана.
Последующий плавный спуск кривой соответствует равномерному оттоку
крови из центральных сосудов в
дистальные во время диастолы.
Косвенная характеристика со- а
кратительных процессов,
происходящих в правых отделах сердца,
может быть получена при помощи
югулярной флебографии,
отражающей динамику оттока крови
из полых вен в правое
предсердие. Каждый сердечный цикл на
югулярной флебограмме (рис.
9.15) представлен тремя
положительными (а, с, v) и двумя
отрицательными (х, у) волнами.
Систола правого предсердия
вызывает замедление оттока
крови из вен, что приводит к
возникновению положительной волны
1/10 сек
Рис. 9.15. Графическая запись венозного
пульса (флебограмма).
Объяснение в тексте.
412 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
флебограммы, обозначаемой символом «а» (от лат. atrium). Следующая
положительная волна возникает в начале систолы правого желудочка при
закрытии трехстворчатого клапана и обозначается символом «с» (от лат. саг-
otis), так как ее появление совпадает с началом подъема каротидной
сфигмограммы. Далее следует отрицательная волна «х», которая отражает
ускоренный отток крови из центральных вен в расслабляющееся предсердие.
Самая глубокая точка этой волны совпадает по времени с закрытием
полулунных клапанов.
Наполнение правого предсердия при закрытом трехстворчатом клапане
приводит к повышению в нем давления и затруднению оттока крови из
вен, что отражается на флебограмме положительной волной «v» (от лат.
ventriculus). Последующее быстрое поступление крови из правого
предсердия в желудочек в период диастолы сердца проявляется в виде
отрицательной волны флебограммы, которая называется волной диастолического
коллапса и обозначается символом «у».
9.1.3.6.7. Общие принципы регуляции сердечного
выброса
От величины сердечного выброса зависят два условия выполнения
адекватной текущим задачам нутритивной функции системы кровообращения:
обеспечение оптимального количества циркулирующей крови и
поддержание (совместно с сосудами) определенного уровня среднего артериального
давления (70—90 мм рт. ст.), необходимого для удержания
физиологических констант в капиллярах (25—30 мм рт. ст.). При этом обязательным
условием нормальной работы сердца является равенство притока крови по
венам и ее выброса в артерии. Решение этой задачи обеспечивается, в
основном, механизмами, обусловленными свойствами самой сердечной
мышцы. Проявление этих механизмов называют миогенной ауторегуляци-
ей насосной функции сердца. Существуют два способа ее реализации: ге-
терометрическая — осуществляется в ответ на изменения исходной длины
волокон миокарда, гомеометрическая — происходит при их сокращениях в
изометрическом режиме.
Миогенные механизмы регуляции деятельности сердца. Изучение
зависимости силы сокращений сердца от растяжения его камер показало, что
сила каждого сердечного сокращения зависит от величины венозного
притока и определяется конечной диастолической длиной волокон миокарда.
Эта зависимость получила название гетерометрическая регуляция сердца и
известна как закон Франка—Старлинга: «Сила сокращения желудочков
сердца, измеренная любым способом, является функцией длины
мышечных волокон перед сокращением», т. е. чем больше наполнение камер
сердца кровью, тем больше сердечный выброс (рис. 9.16). Установлена
ультраструктурная основа этого закона, заключающаяся в том, что
количество актомиозиновьгх мостиков является максимальным при растяжении
каждого саркомера до 2,2 мкм.
Увеличение силы сокращения при растяжении волокон миокарда не
сопровождается увеличением длительности сокращения, поэтому указанный
эффект одновременно означает увеличение скорости нарастания давления
в камерах сердца во время систолы.
Инотропные влияния на сердце, обусловленные эффектом Франка—
Старлинга, играют ведущую роль в увеличении сердечной деятельности
при усиленной мышечной работе, когда сокращающиеся скелетные
мышцы вызывают периодическое сжатие вен конечностей, что приводит к уве-
9. Функции систем кровообращения и лимфообращения • 413
Объем левого желудочка
Центральное венозное давление .
145
Отметка времени, с
Рис. 9.16. Увеличение силы сокращений сердца (амплитуда колебаний верхней
кривой) при его растяжении. Опыт на сердечно-легочном препарате.
личению венозного притока за счет мобилизации резерва депонированной
в них крови. Отрицательные инотропные влияния по указанному
механизму играют существенную роль в изменениях кровообращения при переходе
в вертикальное положение (ортостатическая проба). Эти механизмы имеют
большое значение для согласования изменений сердечного выброса и
притока крови по венам малого круга, что предотвращает опасность развития
отека легких.
Термином «гомеометрическая регуляция» обозначают миогенные
механизмы, для реализации которых не имеет значения степень конечно-диастоли-
ческого растяжения волокон миокарда. Среди них наиболее важным
является зависимость силы сокращения сердца от давления в аорте (эффект
414 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Анрепа) и хроно-инотропная зависимость. Этот эффект состоит в том, что
при увеличении давления «на выходе» из сердца сила и скорость
сердечных сокращений возрастают, что позволяет сердцу преодолевать возросшее
сопротивление в аорте и поддерживать оптимальным сердечный выброс.
Иннервация сердца. Сердце — обильно иннервированный орган. Среди
чувствительных образований сердца основное значение имеют две
популяции механорецепторов, сосредоточенных, главным образом, в предсердиях
и левом желудочке: А-рецепторы реагируют на изменение напряжения
сердечной стенки, а В-рецепторы возбуждаются при ее пассивном
растяжении. Афферентные волокна, связанные с этими рецепторами, идут в
составе блуждающих нервов. Свободные чувствительные нервные
окончания, расположенные непосредственно под эндокардом, представляют
собой терминали афферентных волокон, проходящих в составе
симпатических нервов. Эфферентная иннервация сердца осуществляется при участии
обоих отделов вегетативной нервной системы. Тела симпатических пре-
ганглионарных нейронов, участвующих в иннервации сердца,
располагаются в сером веществе боковых рогов трех верхних грудных сегментов
спинного мозга. Преганглионарные волокна направляются к нейронам
верхнего грудного (звездчатого) симпатического ганглия. Постганглионар-
ные волокна этих нейронов вместе с парасимпатическими волокнами
блуждающего нерва образуют верхний, средний и нижний сердечные нервы,
Симпатические волокна пронизывают весь орган и иннервируют не только
миокард, но и элементы проводящей системы.
Тела парасимпатических преганглионарных нейронов, участвующих в
иннервации сердца, располагаются в продолговатом мозге. Их аксоны идут
в составе блуждающих нервов. После вхождения блуждающего нерва в
грудную полость от него отходят веточки, которые включаются в состав
сердечных нервов.
Отростки блуждающего нерва, проходящие в составе сердечных нервов,
представляют собой парасимпатические преганглионарные волокна. С них
возбуждение передается на интрамуральные нейроны и далее —
преимущественно на элементы проводящей системы. Влияния, опосредованные
правым блуждающим нервом, адресованы, в основном, клеткам синоатриаль-
ного, а левым — клеткам атриовентрикулярного узла. Прямого влияния на
желудочки сердца блуждающие нервы не оказывают.
Иннервируя ткань водителей ритма, вегетативные нервы способны
менять их возбудимость, тем самым вызывая изменения частоты генерации
потенциалов действия и сокращений сердца (хронотропный эффект).
Нервные влияния изменяют скорость электротонической передачи возбуждения
и, следовательно, длительности фаз сердечного цикла. Такие эффекты
называют дромотропными.
Поскольку действие медиаторов вегетативной нервной системы
заключается в изменении уровня циклических нуклеотидов и энергетического
обмена, вегетативные нервы в целом способны влиять и на силу сердечных
сокращений (инотропный эффект). В лабораторных условиях получен
эффект изменения величины порога возбуждения кардиомиоцитов под
действием нейромедиаторов, его обозначают как батмотропный.
Перечисленные пути воздействия нервной системы на сократительную
активность миокарда и насосную функцию сердца представляют собой
хотя и исключительно важные, но вторичные по отношению к миогенным
механизмам модулирующие влияния.
9. Функции систем кровообращения и лимфообращения • 415
9.1.3.6.8. Нейрогенная регуляция деятельности сердца
Влияние на сердце блуждающих нервов. Результатом стимуляции этих
нервов является отрицательный хронотропный эффект сердца (рис. 9.17), на
фоне которого проявляются также отрицательные и дромотропный ино-
тропный эффекты. Существуют постоянные тонические влияния на сердце
со стороны бульбарных ядер блуждающего нерва: при его двусторонней
перерезке частота сердцебиений возрастает 1,5—2,5 раза. При длительном
сильном раздражении влияние блуждающих нервов на сердце постепенно
ослабевает или прекращается, что получило название «эффекта
ускользания» сердца из-под влияния блуждающего нерва.
Различные отделы сердца по-разному реагируют на возбуждение
парасимпатических нервов. Так, холинергические влияния на предсердия
вызывают значительное угнетение автоматии клеток синусного узла и
спонтанно возбудимой ткани предсердий. Сократимость рабочего миокарда
предсердий в ответ на стимуляцию блуждающего нерва снижается.
Рефрактерный период предсердий при этом также уменьшается в результате
значительного укорочения длительности потенциала действия предсердных
кардиомиоцитов. С другой стороны, рефрактерность кардиомиоцитов
желудочков под влиянием блуждающего нерва, напротив, значительно
возрастает, а отрицательный парасимпатический инотропный эффект на
желудочки выражен в меньшей степени, чем на предсердия.
Электрическая стимуляция блуждающего нерва вызывает урежение или
прекращение сердечной деятельности вследствие торможения
автоматической функции водителей ритма синоатриального узла. Выраженность этого
Рис. 9.17. Электрическое раздражение эфферентных нервов сердца.
Вверху — уменьшение частоты сокращений при раздражении блуждающего нерва; внизу-
увеличение частоты и силы сокращений при раздражении симпатического нерва.
Стрелками отмечены начало и конец раздражения.
416 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
эффекта зависит от силы и частоты раздражения блуждающего нерва. По
мере увеличения силы раздражения отмечается переход от небольшого
замедления синусного ритма до полной остановки сердца.
Отрицательный хронотропный эффект раздражения блуждающего нерва
связан с угнетением (замедлением) генерации импульсов в водителе ритма
сердца синусного узла. Поскольку при раздражении блуждающего нерва в
его окончаниях выделяется медиатор — ацетилхолин, при его
взаимодействии с мускариночувствительными рецепторами сердца повышается
проницаемость поверхностной мембраны клеток водителей ритма для ионов
калия. Вследствие этого возникает гиперполяризация мембраны, которая
замедляет (подавляет) развитие медленной спонтанной диастолической
деполяризации, и поэтому мембранный потенциал позже достигает
критического уровня. Это приводит к урежению ритма сокращений сердца.
При сильных раздражениях блуждающего нерва диастолическая
деполяризация подавляется, возникают гиперполяризация водителя ритма и
полная остановка сердца. Развитие гиперполяризации в клетках водителей
ритма снижает их возбудимость, затрудняет возникновение очередного
автоматического потенциала действия и тем самым приводит к замедлению
или даже остановке сердца. Стимуляция блуждающего нерва, усиливая
выход калия из клетки, увеличивает мембранный потенциал, ускоряет
процесс реполяризации и при достаточной силе раздражающего тока
укорачивает длительность потенциала действия клеток водителя ритма.
При вагусных воздействиях имеет место уменьшение амплитуды и
длительности потенциала действия кардиомиоцитов предсердия.
Отрицательный инотропный эффект связан с тем, что уменьшенный по амплитуде и
укороченный потенциал действия не способен возбудить достаточное
количество кардиомиоцитов. Кроме того, вызванное ацетилхолином
повышение калиевой проводимости противодействует потенциалзависимому
входящему току кальция и проникновению его ионов внутрь кардиомио-
цита. Холинергический медиатор ацетилхолин может также угнетать АТФ-
азную активность миозина и, таким образом, уменьшать величину
сократимости кардиомиоцитов. Возбуждение блуждающего нерва приводит к
повышению порога раздражения предсердий, подавлению автоматии и
замедлению проводимости атриовентрикулярного узла. Указанное
замедление проводимости при холинергических влияниях может вызвать
частичную или полную атриовентрикулярную блокаду.
Влияние симпатических нервов на сердце проявлется в виде
положительного хронотропного и положительного инотропного эффекта. Сведения о
наличии тонических влияний симпатической нервной системы на миокард
основываются в основном на хронотропных эффектах.
Электрическая стимуляция волокон, отходящих от звездчатого ганглия,
вызывает увеличение ритма сердца и силы сокращений миокарда (см. рис.
9.17). Под влиянием возбуждения симпатических нервов скорость
медленной диастолической деполяризации повышается, снижается критический
уровень деполяризации клеток водителей ритма синоатриального узла,
уменьшается величина мембранного потенциала покоя. Подобные
изменения увеличивают скорость возникновения потенциала действия в клетках
водителей ритма сердца, повышают его возбудимость и проводимость. Эти
изменения электрической активности связаны с тем, что выделяющийся
из окончаний симпатических волокон медиатор норадреналин
взаимодействует с Pj-адренорецепторами поверхностной мембраны клеток, что
приводит к повышению проницаемости мембран для ионов натрия и кальция,
а также уменьшению проницаемости для ионов калия.
9. Функции систем кровообращения и лимфообращения • 417
Ускорение медленной спонтанной диастолической деполяризации
клеток водителей ритма, увеличение скорости проведения в предсердиях, ат-
риовентрикулярном узле и желудочках приводит к улучшению
синхронности возбуждения и сокращения мышечных волокон и к увеличению силы
сокращения миокарда желудочков. Положительный инотропный эффект
связан также с повышением проницаемости мембраны для ионов кальция.
При увеличении входящего тока кальция возрастает степень
электромеханического сопряжения, в результате чего увеличивается сократимость
миокарда.
Менее изучено участие в регуляции сердечной деятельности интракар-
диальных ганглиозных нервных элементов. Известно, что они
обеспечивают передачу возбуждения с волокон блуждающего нерва на клетки синоат-
риального и атриовентрикулярного узлов, выполняя функцию
парасимпатических ганглиев. Описаны инотропные, хронотропные и дромотропные
эффекты, полученные при стимуляции этих образований в условиях
эксперимента на изолированном сердце. Значение этих эффектов в
естественных условиях остается неясным.
9.1.3.6.9. Механизмы адренергической
и холинергической регуляции деятельности
сердца
Симпатические и парасимпатические нервы оказывают влияние на сердце
посредством высвобождения нейромедиаторов, которые взаимодействуют с
рецепторами, расположенными на наружной мембране миокардиальных
клеток. К основным медиаторам, высвобождающимся из симпатических и
парасимпатических терминалей, относят соответственно норадреналин и
ацетилхолин. Норадреналин взаимодействует с адренорецепторами
миокарда, а ацетилхолин — с холинорецепторами.
Адренергические механизмы. В сердце человека содержатся
преимущественно pi- и в меньшей степени р2-адренорецепторы, а также al- и а2-ад-
ренорецепторы. Поскольку р-адренорецепторы расположены на
поверхности миокардиальных клеток, это делает их легкодоступными как для но-
радреналина, высвобождающегося из симпатических нервных окончаний,
так и для циркулирующего в крови адреналина.
При повышении активности симпатической нервной системы или
концентрации катехоламинов в крови количество р-адренорецепторов на
поверхности миокардиальной клетки уменьшается, тогда как в случае
снижения симпатической активности их количество возрастает. Йодсодержащие
гормоны щитовидной железы, особенно тироксин, а также гормон коры
надпочечников кортизол увеличивают количество р-адренорецепторов в
миокарде, что приводит к усилению эффектов катехоламинов на сердце.
Возбуждение р-адренорецепторов сердца приводит к росту частоты
сокращений сердца, сократимости миокарда, значительному увеличению
потребления им кислорода и уменьшению длительности диастолы.
Физиологические механизмы, связанные с активацией оц-адренорецеп-
торов миокарда, известны в меньшей степени. а2-Адренорецепторы
располагаются на пресинаптических мембранах симпатических и
парасимпатических нервных окончаний, их возбуждение тормозит выделение норадре-
налина и ацетилхолина из нервных терминалей.
Холинергические механизмы. На наружной мембране кардиомиоцитов
представлены, в основном, мускаринчувствительные (М-) холинорецепто-
ры. Доказано наличие в миокарде и никотинчувствительных (N-) холино-
14-6095
418 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
рецепторов, однако их значение в парасимпатических влияниях на сердце
менее ясно. Плотность мускариновых рецепторов в миокарде зависит от
концентрации мускариновых агонистов в тканевой жидкости.
Возбуждение мускариновых рецепторов тормозит активность пейсме-
керных клеток синусного узла и в то же время увеличивает возбудимость
предсердных кардиомиоцитов. Эти два процесса могут привести к
возникновению предсердных экстрасистол в случае повышения тонуса
блуждающего нерва, например ночью во время сна. Таким образом, возбуждение
М-холинорецепторов вызывает снижение частоты и силы сокращений
предсердий, но повышает их возбудимость.
Ацетилхолин угнетает проводимость в атриовентрикулярном узле. Это
связано с тем, что под влиянием ацетилхолина возникает
гиперполяризация клеток атриовентрикулярного узла вследствие усиления выходящего
калиевого тока.
Таким образом, возбуждение мускариновых холинорецепторов
оказывает противоположное, по сравнению с активацией р-адренорецепторов,
действие на сердце. При этом снижается частота сердечных сокращений,
угнетается проводимость и сократимость миокарда, а также потребление
миокардом кислорода. Возбудимость предсердий в ответ на применение
ацетилхолина возрастает, тогда как возбудимость желудочков, напротив,
уменьшается.
Рефлекторные влияния на сердце. Выделены три категории кардиальных
рефлексов: собственные, вызываемые раздражением рецепторов
сердечно-сосудистой системы; сопряженные, обусловленные активностью
любых других рефлексогенных зон; неспецифические, которые
воспроизводятся в ответ на неспецифические влияния (в условиях
физиологического эксперимента, а также в патологии).
Наибольшее физиологическое значение имеют собственные рефлексы
сердечно-сосудистой системы, которые возникают чаще всего при
раздражении барорецепторов магистральных артерий в результате изменения
системного давления. Так, при повышении давления в аорте и каротидном
синусе происходит рефлекторное урежение частоты сердцебиения.
Особую группу собственных кардиальных рефлексов представляют те
из них, которые возникают в ответ на раздражение артериальных хемо-
рецепторов изменением напряжения кислорода в крови. В условиях ги-
поксемии развивается рефлекторная тахикардия, а при дыхании чистым
кислородом — брадикардия. Эти реакции отличаются исключительно
высокой чувствительностью: у человека увеличение частоты сердцебиений
наблюдается уже при снижении напряжения кислорода всего на 3 %,
когда никаких признаков гипоксии в организме обнаружить еще
невозможно.
Собственные рефлексы сердца проявляются и в ответ на механическое
раздражение сердечных камер, в стенках которых находится большое
количество барорецепторов. К их числу относят рефлекс Бейнбриджа,
проявляющийся в виде тахикардии в ответ на быстрое внутривенное введение
определенного объема крови. Считается, что эта реакция сердца является
рефлекторным ответом на раздражение барорецепторов полых вен и
предсердия, поскольку она устраняется при денервации сердца. Отрицательные
хронотропные и инотропные реакции сердца рефлекторной природы
возникают в ответ на раздражение механорецепторов как правых, так и левых
отделов сердца. Значение интракардиальных рефлексов состоит в том, что
увеличение исходной длины волокон миокарда приводит к усилению
сокращений не только растягиваемого отдела сердца (в соответствии с зако-
9. Функции систем кровообращения и лимфообращения • 419
Рис. 9.18. Эфферентная иннервация сердца.
Гф — гипофиз; Гт — гипоталамус; Пм — продолговатый мозг; Цсд — бульбарный центр
сердечно-сосудистой системы; К — кора больших полушарий; Гл — симпатические ганглии;
См — спинной мозг; Th — грудные сегменты.
ном Франка—Старлинга), но и к усилению сокращений других отделов
сердца, не подвергающихся растяжению.
Рефлексы с сердца изменяют функцию других висцеральных систем. К
их числу относят, например, кардиоренальный рефлекс Генри—Гауэра,
который представляет собой увеличение диуреза в ответ на растяжение
стенки левого предсердия.
Собственные кардиальные рефлексы составляют основу нейрогенной
регуляции деятельности сердца, хотя реализация его насосной функции
возможна без участия нервной системы.
Сопряженные кардиальные рефлексы представляют собой эффекты
раздражения рефлексогенных зон, не принимающих прямого участия в
регуляции кровообращения. К числу таких рефлексов относят рефлекс Гольца,
который проявляется в форме брадикардии (до полной остановки сердца) в
ответ на раздражение механорецепторов брюшины или органов брюшной
полости. Возможность проявления такой реакции учитывается при
проведении оперативных вмешательств на брюшной полости, при нокауте у
боксеров и т. д. При раздражении некоторых экстерорецепторов (резкое
охлаждение кожи области живота) может иметь место рефлекторная оста-
14*
420 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
новка сердца. Именно такую природу имеют несчастные случаи при
нырянии в холодную воду. Сопряженным соматовисцеральным кардиальным
рефлексом является рефлекс Данини—Ашнера, который проявляется в
виде брадикардии при надавливании на глазные яблоки. Таким образом,
сопряженные рефлексы сердца, не являясь составной частью общей схемы
нейрогенной регуляции, могут оказывать влияние на его деятельность.
Замыкание большинства кардиорефлекторных дуг происходит на уровне
продолговатого мозга, где находятся: 1) ядро солитарного тракта, к
которому подходят афферентные пути рефлексогенных зон сердечно-сосудистой
системы; 2) ядра блуждающего нерва и 3) вставочные нейроны бульбарно-
го кардиоваскулярного центра. В то же время реализация рефлекторных
влияний на сердце в естественных условиях всегда происходит при участии
вышележащих отделов центральной нервной системы (рис. 9.18).
Существуют различные по знаку инотропные и хронотропные влияния на сердце
со стороны мезэнцефальных адренергических ядер (голубое пятно, черная
субстанция), гипоталамуса (паравентрикулярное и супраоптические ядра,
мамиллярные тела) и лимбической системы. Имеют место и кортикальные
влияния на сердечную деятельность, среди которых особое значение
придают условным рефлексам — таким, например, как положительный хроно-
тропный эффект при предстартовом состоянии. Достоверных данных о
возможности произвольного управления человеком сердечной
деятельностью не получено.
9.1.3.6.10. Гуморальные влияния на сердце
Прямое и опосредованное действие на сердце оказывают практически все
биологически активные вещества, содержащиеся в плазме крови. В то же
время круг фармакологических агентов, осуществляющих гуморальную
регуляцию сердца, в подлинном смысле этого слова, достаточно узок.
Такими веществами являются катехоламины, выделяемые мозговым веществом
надпочечников — адреналин, норадреналин и дофамин. Действие этих
гормонов опосредуется р-адренорецепторами кардиомиоцитов, что и
определяет конечный результат их влияния на миокард. Он аналогичен
симпатической стимуляции и заключается в активации фермента аденилатциклазы
и усилении синтеза циклического АМФ (3,5-циклического аденозинмоно-
фосфата), с последующей активацией фосфорилазы и повышением уровня
энергетического обмена. Такое действие на пейсмекерную ткань вызывает
положительный хронотропный, а на клетки рабочего миокарда —
положительный инотропный эффекты. Усиливающим инотропный эффект
действием катехоламинов является повышение проницаемости мембран
кардиомиоцитов к ионам кальция.
Действие других гормонов (глюкагон, йодсодержащие гормоны
щитовидной железы) на миокард неспецифическое и реализуется
опосредованно, например через влияние на активность симпатоадреналовой системы.
Положительное инотропное действие на сердце оказывают также гормоны
коры надпочечников (кортикостероиды), вазопрессин и ангиотензин.
Вместе с тем прямые положительные инотропные эффекты последних на
сердце скрываются за их непрямыми эффектами, обусловленными
повышением давления в аорте и увеличением объема циркулирующей крови.
В регуляции деятельности сердца принимают участие и местные
гуморальные факторы, образующиеся в миокарде. К таким веществам
относятся аденозин, гистамин и простагландины.
Аденозин, взаимодействуя с аденозиновыми рецепторами кардиомио-
9. Функции систем кровообращения и лимфообращения • 421
цитов, уменьшает пеисмекерную активность клеток синоатриального узла
и снижает скорость проведения возбуждения в атриовентрикулярном узле
и в проводящей системе сердца. Это свойство аденозина используется в
клинической кардиологии — для лечения пароксизмальных желудочковых
тахикардии применяются соли аденозинтрифосфорной кислоты.
В миокарде человека имеются два типа гистаминовых рецепторов: Н, и
Н2. Активация этих рецепторов вызывает повышение сократимости
миокарда. При возбуждении Н,-рецепторов продолжительность потенциала
действия кардиомиоцитов желудочков увеличивается, тогда как при
возбуждении Н2-рецепторов она, напротив, уменьшается. Однако в случае
массивного выброса в кровь гистамина (например, при анафилактическом
шоке) происходит резкое снижение ОПСС, падение АД и, следовательно,
постнагрузки сердца (давление в аорте, против которого происходит
изгнание крови желудочками в систолу). В результате этих гемодинамических
сдвигов сократимость миокарда снижается.
В миокарде синтезируются простагландины, которые могут уменьшать
симпатические влияния на сердце и коронарные артерии. Синтез проста-
гландинов увеличивается при ишемии миокарда и имеет в этом случае
защитный характер.
Сердце проявляет чувствительность и к ионному составу протекающей
крови. Катионы кальция повышают возбудимость клеток миокарда как за
счет участия в сопряжении возбуждения и сокращения, так и за счет
активации фосфорилазы. Повышение концентрации ионов калия по
отношению к норме, составляющей 4 ммоль/л, приводит к снижению величины
потенциала покоя и увеличению проницаемости мембран для этих ионов.
Возбудимость миокарда и скорость проведения возбуждения при этом
возрастают. Обратные явления, часто сопровождающиеся нарушениями
ритма, имеют место при недостатке в крови калия, в частности в результате
применения некоторых диуретических препаратов. Такие соотношения
характерны для сравнительно небольших изменений концентрации катионов
калия, при ее увеличении более чем в два раза возбудимость и
проводимость миокарда резко снижаются. На этом эффекте основано действие
кардиоплегических растворов, которые используются в кардиохирургии
для временной остановки сердца. Угнетение сердечной деятельности
наблюдается и при повышении кислотности внеклеточной среды.
Гормональная функция сердца. Вокруг миофибрилл в клетках миокарда
предсердий обнаружены гранулы, подобные тем, которые имеются в
щитовидной железе или аденогипофизе. В этих гранулах образуется группа
гормонов, которые высвобождаются при растяжении предсердий, стойком
повышении давления в аорте, нагрузке организма натрием, повышении
активности блуждающих нервов. Отмечены следующие эффекты предсерд-
ных гормонов: а) снижение ОПСС, МОК и АД, б) увеличение
гематоКрита, в) увеличение клубочковой фильтрации и диуреза, г) угнетение
секреции ренина, альдостерона, кортизола и вазопрессина, д) снижение
концентрации в крови адреналина, е) уменьшение освобождения норадрена-
лина при возбуждении симпатических нервов. Подробнее см. главу 6.
9.1.3.7. Венозный возврат крови к сердцу
Этим термином обозначают объем венозной крови, протекающей по
верхней и нижней (у животных, соответственно, по передней и задней) полым
венам.
Количество крови, протекающей за единицу времени через артерии и
422 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Таблица 9.4. Комплекс факторов, участвующих в формировании величины венозного
возврата
«Vis a tegro» (действующая сзади)
Сообщаемое сердцем движение крови
по сосудам
Сокращение скелетной мускулатуры
Функционирование венозных клапанов
Величина гидростатического давления
в системе
«Vis a fronte» (действующая спереди)
Присасывающая функция грудной
клетки
Присасывающая функция правого
предсердия
Взаимоотношения встречных потоков
по полым венам
Реакция венозных сосудов
вены, в устойчивом режиме функционирования системы кровообращения
остается постоянным, поэтому в норме величина венозного возврата равна
величине минутного объема крови, т. е. 4—6 л/мин у человека. Однако
вследствие перераспределения массы крови от одной области к другой это
равенство может временно нарушаться при переходных процессах в
системе кровообращения, вызываемых различными воздействиями на организм
как в норме (например, при мышечных нагрузках или перемене
положения тела), так и при развитии патологии сердечно-сосудистой системы
(например, недостаточности правых отделов сердца).
Величина общего или суммарного венозного возврата между полыми
венами как у животных, так и у человека состоит примерно из !/з
объемного кровотока по верхней (или передней) полой вене и 2/3 — п0 нижней
(или задней) полой вене. Величина кровотока у людей в верхней полой
вене составляет примерно 42 %, а в нижней полой вене — 58 % общей
величины венозного возврата.
Факторы, участвующие в формировании величины венозного возврата,
условно делят на две группы (табл. 9.4) в соответствии с направлением
действия сил, способствующих продвижению крови по сосудам большого
круга кровообращения.
Первую группу представляет сила «vis a tergo» (т. е. действующая сзади),
сообщаемая крови сердцем; она продвигает кровь по артериальным
сосудам и участвует в обеспечении ее возврата к сердцу. Если в артериальном
русле эта сила соответствует давлению 100 мм рт. ст., то в начале венул
общее количество энергии, которой обладает кровь, прошедшая через
капиллярное русло, составляет около 13 % от ее начальной энергии. Именно
последняя величина энергии и образует «vis a tergo» и расходуется на приток
венозной крови к сердцу. К силе, действующей «vis a tergo», относят также
9. Функции систем кровообращения и лимфообращения • 423
ряд других факторов, способствующих продвижению крови к сердцу:
сокращения скелетной мускулатуры (так называемый мышечный насос),
способствующие «выжиманию» крови из вен; функционирование
венозных клапанов (препятствующих обратному току крови); влияние уровня
гидростатического давления в системе кровообращения (особенно в
вертикальном положении тела).
Ко второй группе факторов, участвующих в венозном возврате, относят
силы, действующие на кровоток в полых венах «vis a fronte» (т. е. спереди)
и включающие, прежде всего, присасывающую функцию грудной клетки и
сердца. Присасывающая функция грудной клетки обеспечивает
поступление крови из периферических вен в грудные вследствие существования
отрицательного давления в плевральной полости: во время вдоха
отрицательное давление в последней еще более снижается, что приводит к ускорению
кровотока в нижней полой вене, а во время выдоха давление, напротив,
относительно исходного несколько возрастает и кровоток в этой вене
замедляется. Для присасывающей функции правых отделов сердца
характерно то, что силы, способствующие поступлению в него крови, развиваются
не только во время диастолы сердца (вследствие понижения давления в
правом предсердии), но также и во время систолы (в результате смещения
атриовентрикулярного кольца увеличивается объем предсердия и быстрое
падение в нем давления способствует наполнению сердца кровью из полых
вен). Однако не все исследователи разделяют мнение о важной роли
присасывающей функции грудной клетки и правой половины сердца в
формировании величины венозного возврата.
Наряду с этим важное значение имеют взаимоотношения встречных
потоков по полым венам, которые при переходных процессах в системе
могут изменяться неоднократно, а также констрикторные реакции венозных
сосудов, проявляющиеся при действии на систему кровообращения нейро-
генных или гуморальных стимулов; изменения транскапиллярного обмена
жидкости, обеспечивающие ее переход из интерстиция в кровоток вен.
Повышение артериального давления сопровождается возрастанием
величины венозного возврата, что проявляется при прессорных рефлексах
(синокаротидном — вызываемом снижением давления в каротидных
синусах, при стимуляции афферентных волокон соматических нервов),
увеличении объема циркулирующей крови, внутривенном введении вазоактив-
ных веществ (адреналин, норадреналин, простагландин Р2, ангиотензин
II). Гормон задней доли гипофиза вазопрессин вызывает на фоне
повышения артериального давления уменьшение венозного возврата.
Депрессорные системные изменения могут сопровождаться как
уменьшением венозного возврата, так и возрастанием его величины. Совпадение
направленности системной реакции с изменениями венозного возврата
имеет место при депрессорном синокаротидном рефлексе (повышении
давления в каротидных синусах), в ответ на ишемию миокарда, при
уменьшении объема циркулирующей крови. Системная депрессорная реакция может
сопровождаться и возрастанием притока крови к сердцу по полым венам,
как это наблюдается, например, при гипоксии (дыхание газовой смесью с
пониженным до 6—10 % содержанием в ней 02), гиперкапнии (6 % С02),
введении в сосудистое русло ацетилхолина, стимулятора р-адренорецепто-
ров изопротеренола, местного гормона брадикинина, проста-гландина Е,.
Степень увеличения суммарного венозного возврата крови к сердцу при
применении различных препаратов (или нервных влияний на систему)
определяется не только величиной, но и направленностью изменений
кровотока в каждой из полых вен. Кровоток по передней полой вене у животных
424 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
100
Рис. 9.19. Разнонаправленные изменения венозного возврата по передней и задней
полым венам при прессорном рефлексе.
Сверху вниз: системное артериальное давление (мм рт. ст.), кровоток по передней полой вене,
кровоток по задней полой вене, отметка времени (10 с), отметка раздражения. Исходная
величина кровотока по передней полой вене — 52 мл/мин, по задней полой вене — 92,7 мл/мин.
в ответ на введение вазоактивных веществ (любой направленности
действия) или при нейрогенных стимулах всегда увеличивается. Различная
направленность изменений кровотока отмечена только в задней полой вене
(рис. 9.19). Эта разнонаправленность изменений кровотока в полых венах
и является фактором, обусловливающим относительно небольшое
увеличение общего венозного возврата сравнительно с его изменениями при
однонаправленных сдвигах кровотоков в полых венах.
Механизм разнонаправленных сдвигов кровотока в полых венах состоит
в том, что в результате преобладающего влияния вазоконстрикторных
препаратов на артериолы имеет место большая степень увеличения
сопротивления сосудов бассейна брюшной аорты по сравнению с изменениями
сопротивления сосудов бассейна плечеголовной артерии. Это приводит к
перераспределению сердечного выброса между указанными сосудистыми
руслами (увеличение доли сердечного выброса в направлении сосудов
бассейна плечеголовной артерии и уменьшение — в направлении бассейна
брюшной аорты) и вызывает соответствующие разнонаправленные
изменения кровотока в полых венах.
Помимо вариабельности кровотока в задней полой вене, зависящей от
гемодинамических факторов, на его величину оказывают существенное
влияние другие системы организма (дыхательная, мышечная, нервная).
Так, перевод животного на искусственное дыхание почти в 2 раза
уменьшает кровоток по задней полой вене, а наркоз и открытая грудная клетка
еще в большей степени снижают его величину.
Спланхническое сосудистое русло в результате изменений находящегося в
нем объема крови вносит наибольший вклад (по сравнению с другими
регионами системы кровообращения) в величину венозного возврата.
Изменения емкости отдельных сосудистых регионов спланхнического русла
неодинаковы, и их вклад в обеспечение венозного возврата различен.
Например, при прессорном синокаротидном рефлексе имеет место уменьшение
объема селезенки на 2,5 мл/кг массы тела, объема печени — на 1,1 мл/кг, а
кишечника — лишь на 0,2 мл/кг (в целом спланхнический объем
уменьшается на 3,8 мл/кг). Во время умеренной геморрагии (9 мл/кг) выброс крови
из селезенки составляет 3,2 мл/кг (35 %), из печени — 1,3 мл/кг (14 %) и
9. Функции систем кровообращения и лимфообращения • 425
из кишечника — 0,6 мл/кг (7 %), что в сумме составляет 56 % величины
изменений общего объема крови в организме.
Указанные изменения емкостной функции сосудов органов и тканей
организма участвуют в величине венозного возврата крови к сердцу за счет
сдвигов кровотока в нижней полой вене и, тем самым, в преднагрузке
сердца (т. е. конечно-диастолическое давление), и в результате оказывают
влияние на формирование величины сердечного выброса и уровня
системного артериального давления.
9.1.3.8. Центральное венозное давление
Под центральным венозным давлением обычно понимают величину
давления в правом предсердии, которая в норме близка к 0 мм рт. ст. Однако в
действительности центральному венозному давлению соответствует
величина давления в устье полых вен. Между давлением в правом предсердии и
в устье полых вен далеко не всегда существует соответствие, особенно в
фазу переходных процессов в системе кровообращения, когда давление в
правом предсердии нормализуется быстрее, чем центральное венозное
давление. Уровень центрального венозного давления (ЦВД) оказывает
существенное влияние на величину венозного возврата крови к сердцу. При
понижении давления в правом предсердии от 0 до 4 мм рт. ст. приток венозной
крови возрастает на 20—30 %, но когда давление в нем становится ниже —
4 мм рт. ст., дальнейшее снижение давления не вызывает уже увеличения
притока венозной крови, что обусловлено спадением вен, впадающих в
грудную клетку, вызванным резким падением давления крови в этих венах.
Если снижение ЦВД увеличивает приток венозной крови к сердцу по
полым венам, то его повышение на 1 мм рт. ст. снижает венозный возврат
примерно на 14 %. Исходя из сказанного, повышение давления в правом
предсердии до 7 мм рт. ст. должно снизить приток венозной крови к сердцу
до нуля, что привело бы к катастрофическим нарушениям гемодинамики.
Однако в исследованиях, в которых сердечно-сосудистые рефлексы
функционировали, а давление в правом предсердии повышалось медленно,
приток венозной крови к сердцу продолжался и при повышении давления
в правом предсердии до 12—14 мм рт. ст. (рис. 9.20). Снижение притока
i
s ""~———«^^
ш ^^^.
1= 0-1 ■ ■ . . —** 1
-4 0 4 8 12 16
Давление в правом предсердии, мм рт. ст.
Рис. 9.20. Венозный возврат крови к сердцу при медленном подъеме давления в
правом предсердии (когда успевают развиться компенсаторные механизмы).
426 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
крови к сердцу в этих условиях приводит к проявлению в системе
компенсаторных рефлекторных реакций, возникающих при раздражении бароре-
цепторов артериального русла, а также возбуждению сосудодвигательных
центров в условиях развивающейся ишемии центральной нервной
системы. Это вызывает увеличение потока импульсов, генерируемых в
симпатических сосудосуживающих центрах и поступающих к гладким мышцам
сосудов, что определяет повышение тонуса, уменьшение емкости
периферического сосудистого русла и, следовательно, увеличение количества крови,
подаваемой к сердцу, несмотря на рост ЦВД до уровня, когда
теоретически венозный возврат должен быть близким к 0.
Определены минимальные и максимальные пределы изменений ЦВД,
ограничивающие область устойчивой работы сердца. Минимально
допустимое среднее давление в правом предсердии составляет 5—10, а
максимальное — 100—120 мм водн. ст., при выходе за эти пределы ЦВД зависимость
энергии сокращения сердца от величины притока крови не наблюдается
из-за необратимого ухудшения функционального состояния миокарда.
Средняя величина ЦВД у здоровых людей составляет в состоянии
мышечного покоя около 40 мм водн. ст. и в течение дня меняется, нарастая
днем и особенно к вечеру на 10—30 мм водн. ст., что связано с ходьбой и
мышечными движениями. Увеличение внутриплеврального давления,
сопровождаемое сокращением мышц брюшной полости (кашель, натужива-
ние), приводит к кратковременному резкому возрастанию ЦВД, а задержка
дыхания на вдохе — к его временному падению.
При вдохе ЦВД уменьшается за счет падения плеврального давления,
что вызывает дополнительное растяжение правого предсердия и более
полное заполнение его кровью. При этом возрастает скорость венозного
кровотока и увеличивается градиент давления в венах, что приводит к
дополнительному падению ЦВД. Так как давление в венах, лежащих вблизи
грудной полости (например, в яремных венах), в момент вдоха является
отрицательным, их ранение опасно для жизни, поскольку при вдохе в этом
случае возможно проникновение в вены воздуха, пузырьки которого,
разносясь с кровью, могут закупорить кровеносное русло (развитие
воздушной эмболии).
При выдохе ЦВД растет, а венозный возврат крови к сердцу
уменьшается. Это является результатом повышения плеврального давления,
увеличивающего венозное сопротивление вследствие спадения грудных вен и
сдавливающего правое предсердие, что затрудняет его кровенаполнение.
Для увеличения производительности сердца в клинике часто
используют искусственное повышение венозного возврата за счет увеличения
объема циркулирующей крови, которое достигается путем внутривенных
вливаний кровезаменителей. Однако вызываемое этим повышение давления в
правом предсердии эффективно только в пределах соответствующих
величин средних давлений, приведенных выше. Чрезмерное повышение
венозного притока таким способом и, следовательно, ЦВД не только не
способствует улучшению деятельности сердца, но может принести и вред,
создавая перегрузки в системе и приводя, в конечном итоге, к чрезмерному
расширению правой половины сердца.
9.1.3.9. Объем циркулирующей крови
Объем крови у мужчины массой 70 кг составляет примерно 5,5 л (75—
80 мл/кг), у взрослой женщины он несколько меньше (около 70 мл/кг).
Объем крови колеблется в зависимости от пола, возраста, телосложения,
9. Функции систем кровообращения и лимфообращения • 427
условий жизни, степени физического развития и тренированности
организма и составляет от 50 до 80 мл на 1 кг массы тела. У здорового
человека, находящегося в лежачем положении 1—2 нед, объем крови может
снизиться на 9—15 % от исходного.
Из 5,5 л крови у взрослого мужчины 55—60 %, т. е. 3,0—3,5 л,
приходится на долю плазмы, остальное количество — на долю эритроцитов.
В течение суток по сосудам циркулирует около 8000—9000 л крови. Из
этого количества приблизительно 20 л выходит в течение суток из
капилляров в ткань в результате фильтрации и возвращается вновь (путем
абсорбции) через капилляры (16—18 л) и с лимфой (2—4 л). Объем жидкой
части крови, т. е. плазмы (3—3,5 л), существенно меньше, чем объем
жидкости во внесосудистом интерстициальном пространстве (9—12 л) и во
внутриклеточном пространстве тела (27—30 л); с жидкостью этих
«пространств» плазма находится в динамическом осмотическом равновесии.
Общий объем циркулирующей крови (ОЦК) состоит из активно
циркулирующей крови по сосудам и той ее части, которая не участвует в данный
момент в кровообращении, т. е. депонированной (в селезенке, печени,
почке, легких и др.). Последняя может быстро включаться в циркуляцию
при соответствующих гемодинамических ситуациях. Количество
депонируемой крови более чем в два раза превышает объем циркулирующей.
Депонированная кровь не находится в состоянии полного застоя, некоторая
ее часть все время включается в циркуляцию, а соответствующая часть
быстро движущейся крови переходит в состояние депонирования.
Уменьшение или увеличение объема циркулирующей крови на 5—10 % у
человека с нормальным объемом крови компенсируется изменением
емкости венозного русла и не вызывает сдвигов ЦВД. Более значительное
увеличение ОЦК обычно сопряжено с увеличением венозного возврата и при
сохранении эффективной сократимости сердца приводит к увеличению
сердечного выброса.
Важнейшими факторами, от которых зависит объем крови, являются:
1) регуляция объема жидкости между плазмой и интерстициальным
пространством, 2) регуляция обмена жидкости между плазмой и внешней
средой (осуществляется, главным образом, почками), 3) регуляция объема
эритроцитной массы. Нервная регуляция этих трех механизмов
осуществляется с помощью предсердных рецепторов типа А, реагирующих на
изменение давления и, следовательно, являющихся барорецепторами, и типа
В — реагирующих на растяжение предсердий и весьма чувствительных к
изменению объема в них крови.
Существенное влияние на объем крови оказывает инфузия различных
растворов. Вливание в вену изотонического раствора хлорида натрия не
повышает длительно объем плазмы на фоне нормального объема крови,
так как образующийся в организме избыток жидкости быстро выводится
путем усиления диуреза. При дегидратации и дефиците солей в организме
указанный раствор, введенный в кровь в адекватных количествах, быстро
восстанавливает нарушенное равновесие. Внутривенное введение
растворов высокомолекулярных декстранов на длительный период (до 12—24 ч)
повышает объем циркулирующей крови.
9.1.3.10. Соотношение основных параметров системной гемодинамики
Параметры системной гемодинамики — системное артериальное
давление, периферическое сопротивление сосудов, сердечный выброс, работа
сердца, венозный возврат, центральное венозное давление, объем цирку-
428 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Таблица 9.5. Первичные и компенсаторные изменения в системе кровообращения
человека при переходе из горизонтального положения в вертикальное
Первичные изменения
Дилатация сосудистого русла нижней
половины тела как результат повышения
внутрисосудистого давления.
Уменьшение венозного притока к
правому предсердию. Уменьшение сердечного
выброса
Снижение общего периферического
сопротивления.
Снижение систолического, диастоличе-
ского, пульсового и среднего
артериального давления.
Снижение мозгового кровотока
Компенсаторные изменения
Рефлекторная веноконстрикция, ведущая к
уменьшению емкости вен и увеличению
венозного притока к сердцу.
Рефлекторное увеличение частоты
сердечных сокращений, ведущее к увеличению
сердечного выброса.
Повышение тканевого давления в нижних
конечностях и насосного действия мышц
ног, рефлекторная гипервентиляция и
увеличение напряжения брюшных мышц:
увеличение венозного притока к сердцу.
Снижение сопротивления мозговых сосудов.
Увеличение секреции норадреналина, альдо-
стерона, антидиуретического гормона,
вызывающего как увеличение сосудистого
сопротивления, так и гиперволемию.
лирующей крови — находятся в сложных тонко регулируемых
взаимоотношениях, что позволяет системе обеспечивать выполнение своих функций.
Так, снижение давления в синокаротидной зоне вызывает повышение
системного артериального давления, учащение сердечного ритма,
увеличение общего периферического сопротивления сосудов, работы сердца и
венозного возврата крови к сердцу. Минутный и систолический объем
крови могут меняться при этом неоднозначно. Повышение давления в
синокаротидной зоне вызывает снижение системного артериального давления,
замедление частоты сердечных сокращений, снижение общего сосудистого
сопротивления и венозного возврата, уменьшение работы сердца.
Изменения сердечного выброса при этом выражены, но неоднозначны по
направленности.
Переход из горизонтального положения человека в вертикальное
сопровождается последовательным развитием характерных изменений
системной гемодинамики. Эти сдвиги включают в себя как первичные, так и
вторичные компенсаторные изменения в системе кровообращения, которые
схематически представлены в табл. 9.5.
Важным является поддержание постоянного соотношения между
объемом крови, содержащейся в большом круге кровообращения, и объемом
крови, находящейся в органах грудной клетки (легкие, полости сердца). В
сосудах легких содержится до 15 %, а в полостях сердца (в фазе
диастолы)—до 10% всей массы крови; исходя из сказанного, центральный
(внутригрудной) объем крови может составлять до 25 % общего количества
крови в организме.
Растяжимость сосудов малого круга, в особенности легочных вен,
позволяет аккумулировать в этой области значительный объем крови при
увеличении венозного возврата к правой половине сердца. Аккумуляция
крови в малом круге имеет место у людей во время перехода тела из
вертикального положения в горизонтальное, при этом в сосуды грудной полости
из нижних конечностей может перемещаться до 600 мл крови, из которых
примерно половина скапливается в легких. Напротив, при переходе тела в
9. Функции систем кровообращения и лимфообращения • 429
вертикальное положение этот объем крови переходит в сосуды нижних
конечностей.
Резерв крови в легких используется, когда необходима срочная
мобилизация дополнительного количества крови для поддержания должной
величины сердечного выброса. Это особенно важно в начале интенсивной
мышечной работы, когда, несмотря на включение мышечного насоса,
венозный возврат к сердцу еще не достигает уровня, обеспечивающего
сердечный выброс в соответствии с кислородным запросом организма.
Одним из источников, обеспечивающих резерв сердечного выброса,
является также остаточный объем крови в полости желудочков. В
горизонтальном положении человека остаточный объем левого желудочка
составляет в среднем 100 мл, а в вертикальном — 45 мл. Близкие к этим величины
характерны и для правого желудочка. Увеличение ударного объема,
наблюдаемое при мышечной работе или действии катехоламинов, не
сопровождающееся увеличением размеров сердца, происходит за счет мобилизации,
главным образом, части остаточного объема крови в полости желудочков.
Таким образом, наряду с изменениями венозного возврата к сердцу, к
числу факторов, определяющих динамику сердечного выброса, относятся:
объем крови в легочном резервуаре, реактивность сосудов легких и
остаточный объем крови в желудочках сердца.
Совместное проявление гетеро- и гомеометрического типов регуляции
сердечного выброса выражается в такой последовательности: а) увеличение
венозного возврата к сердцу, обусловленное констрикцией артериальных и
особенно венозных сосудов в системе циркуляции, ведет к увеличению
сердечного выброса; б) последнее, наряду с ростом общего
периферического сопротивления сосудов, повышает системное АД; в) это
соответственно ведет к увеличению давления в аорте и, следовательно, кровотока в
коронарных сосудах; г) гомеометрическая регуляция сердца, основанная на
последнем механизме, обеспечивает преодоление сердечным выбросом
возросшего сопротивления в аорте и поддержание сердечного выброса на
повышенном уровне; д) увеличение сократительной функции сердца
вызывает рефлекторное снижение периферического сопротивления сосудов
(одновременно с проявлением рефлекторных влияний на периферические
сосуды с барорецепторов синокаротидных зон), что способствует
уменьшению работы сердца, затрачиваемой на обеспечение необходимого
кровотока и давления в капиллярах.
Увеличение количества циркулирующей крови в организме изменяет
минутный объем крови, главным образом, вследствие повышения степени
наполнения кровью сосудистой системы. Это вызывает усиление притока
крови к сердцу, увеличение его кровенаполнения, повышение
центрального венозного давления и, следовательно, интенсивности работы сердца.
Изменение количества крови в организме влияет на величину минутного
объема крови также путем изменения сопротивления притока венозной
крови к сердцу, которое находится в обратно пропорциональной
зависимости от объема крови, притекающей к сердцу. Между объемом
циркулирующей крови и величиной среднего системного давления существует
прямая пропорциональная зависимость. Однако повышение последнего,
возникающее при остром увеличении объема крови, продолжается около
1 мин, после чего оно начинает снижаться и устанавливается на уровне,
лишь немного превосходящем норму. Если объем циркулирующей крови
уменьшается, величина среднего давления временно падает и
возникающий эффект в сердечно-сосудистой системе прямо противоположен
повышению среднего давления при увеличении объема крови.
430 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Возвращение величины среднего давления к исходному уровню
является результатом включения компенсаторных механизмов. Известны три из
них, которые выравнивают сдвиги, возникающие при изменении объема
циркулирующей крови в сердечно-сосудистой системе: 1) рефлекторные
компенсаторные механизмы; 2) непосредственные реакции сосудистой
стенки; 3) нормализация объема крови в системе.
Рефлекторные механизмы связаны с изменением уровня системного
артериального давления, обусловленным влиянием с барорецепторов
сосудистых рефлексогенных зон. Однако удельный вес этих механизмов
сравнительно небольшой. В то же время при сильном кровотечении возникают
другие очень мощные нервные влияния, которые могут привести к
компенсаторным сдвигам этих реакций в результате ишемии центральной
нервной системы. Так, снижение системного артериального давления
ниже 55 мм рт. ст. вызывает изменения гемодинамики, которые в 6 раз
превышают сдвиги, возникающие при максимальной стимуляции
симпатической нервной системы через сосудистые рефлексогенные зоны. Таким
образом, нервные влияния, возникающие при ишемии центральной нервной
системы, могут играть чрезвычайно важную роль в качестве «последней
линии обороны», предотвращающей резкое снижение минутного объема
крови в терминальных состояниях организма после массивной кровопоте-
ри и значительного падения артериального давления.
Компенсаторные реакции самой сосудистой системы возникают
вследствие ее способности растягиваться при повышении давления крови и
спадаться, когда давление крови снижается. В наибольшей мере этот эффект
присущ венозным сосудам. Считается, что указанный механизм является
более действенным, нежели нервный, особенно при сравнительно
небольших изменениях давления крови. Главное различие этих механизмов
состоит в том, что рефлекторные компенсаторные реакции включаются в
действие через 4—5 с и достигают максимума через 30—40 с, в то время
как расслабление самой сосудистой стенки, возникающее в ответ на
усиление ее напряжения, лишь начинается в этот период, достигая максимума
через минуты или десятки минут.
Нормализация объема крови в системе в случае ее изменений
достигается следующим образом. После переливания больших объемов крови
давление во всех сегментах сердечно-сосудистой системы, включая
капилляры, повышается, что приводит к фильтрации жидкости через стенки
капилляров в интерстициальные пространства и через капилляры клубочков
почек в мочу. При этом величины системного давления, периферического
сопротивления и минутного объема крови возвращаются к исходным
значениям.
В случае кровопотери возникают противоположные сдвиги. При этом
большое количество белка из межклеточной жидкости поступает через
лимфатическую систему в сосудистое русло, повышая уровень белков
плазмы крови. Кроме того, значительно возрастает количество белков,
образующихся в печени, что также приводит к восстановлению уровня
белков плазмы крови. Одновременно нормализуется объем плазмы,
компенсирующий сдвиги, возникающие вследствие кровопотери. Восстановление
объема крови до нормы является медленным процессом, но тем не менее
через 24—48 ч у человека объем крови становится нормальным, в
результате нормализуется и гемодинамика. Долгосрочная нормализация объема
циркулирующей крови осуществляется гормонами эндокринной системы
(ренин-альдостероновая, АДГ).
Следует особо подчеркнуть, что ряд параметров системной гемодинами-
9. Функции систем кровообращения и лимфообращения • 431
< 120 Г| 1 1 1 1 . §■ Ю
50 100 150 200 250 300
Время, с
200
150
100
50
150 200 250
Время, с
150 200 250 300
Время, с
250-1 оремя, и
-ii#yр^ЖИЩ ! 150-,wj ж^*^»*^
0 50 100 150 200 250 300 50+0 6"о 100 150 200 250 300
150 200 250 300
Время, С
Э 4
oil Ди-
О 50 100 1
"Т
100 150 200 250 300
Время, с
70,
60-
50-
40
30
20
~4гЬ~
150
S 100
.*, £
50 100 150 200 250 300
Время, с
100 1
50
150
150 200 250 300
Время, с
50
100 150 200 250 300
5 ЮО
50
50 100 150 200 250 300
Время, с
О 50 100 150 200 250 300
Время, с
Рис. 9.21. Соотношение параметров системной гемодинамики при внутривенном
введении норадреналина (10 мкг/кг).
АД — артериальное давление; ВВ — суммарный венозный возврат; ОПС — общее
периферическое сопротивление; ПГА — кровоток по плечеголовной артерии; ППВ — кровоток по
передней полой вене; ЦВД — центральное венозное давление; СВ — сердечный выброс; УО —
ударный объем сердца; НГА — кровоток по грудной аорте; ЗПВ — кровоток по задней полой вене.
ки или их взаимоотношений у человека в настоящее время практически
невозможно исследовать, особенно в динамике развития реакций в
сердечно-сосудистой системе. Это связано с тем, что человек не может быть
объектом экспериментирования, а число датчиков для регистрации величин
указанных параметров, даже в условиях торакальной хирургии, явно
недостаточно для выяснения этих вопросов, тем более в условиях нормаль-
432 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ного функционирования системы. Поэтому изучение сдвигов всего
комплекса параметров системной гемодинамики и механизмов их регуляции
возможно в настоящее время только у животных.
В результате сложнейших технических подходов, использования
специальных датчиков, применения физических, математических и
кибернетических приемов сегодня можно представить изменения параметров
системной гемодинамики количественно, в динамике развития процесса у одного
и того же животного (рис. 9.21). Как следует из рисунка, однократное
внутривенное введение норадреналина вызывает значительное повышение
артериального давления, не соответствующее ему по длительности —
кратковременное повышение общего периферического сопротивления сосудов
и соответствующее ему увеличение центрального венозного давления.
Сердечный выброс и ударный объем сердца при этом в момент повышения
периферического сопротивления снижаются, а затем — резко возрастают,
соответствуя во второй фазе сдвигам артериального давления. Кровоток в
плечеголовной и грудной аорте изменяется соответственно сердечному
выбросу, хотя в последней эти сдвиги более выражены (очевидно, в связи с
высоким исходным кровотоком). Венозный возврат крови к сердцу,
естественно, соответствует по фазам сердечному выбросу, однако в передней
полой вене он увеличивается, а в задней — вначале снижается, потом
несколько возрастает. Вот эти сложные, взаимоподкрепленные сдвиги
параметров системной гемодинамики и обусловливают повышение ее
интегрального показателя — артериального давления.
Изучение соотношения венозного возврата и сердечного выброса при
применении прессорных вазоактивных веществ (адреналин, норадреналин,
ангиотензин) показало, что при качественно единообразном изменении
венозного возврата, который в этих случаях, как правило, увеличивается,
характер сдвигов сердечного выброса варьирует: он может как
увеличиваться, так и уменьшаться. При этом имеют место два основных варианта
различий между этими параметрами: дефицит величины сердечного
выброса по сравнению с величиной притока крови к сердцу по полым венам
и избыток сердечного выброса над величиной венозного возврата. На
основании данных о депонирующей функции сосудов малого круга
кровообращения можно полагать, что первый вариант различий между сердечным
выбросом и венозным возвратом обусловлен депонированием крови в
малом круге, а второй — дополнительным выбросом крови из малого в
большой круг кровообращения.
9.1.4. Общие закономерности органного кровообращения
9.1.4.1. Функционирование органных сосудов
Под тонусом органа, ткани, сосуда или клетки понимают состояние
длительно поддерживаемого возбуждения, выражающегося специфической
для этого образования деятельностью, без развития утомления.
Сосудистый тонус создается в своей основе периферическими
механизмами, а нервные импульсы корригируют его, обеспечивая
перераспределение крови между различными сосудистыми областями.
Регионарное кровообращение — термин, принятый для характеристики
движения крови в органах и системе органов, относящихся к области тела
(региону). На уровне органа или региона могут быть определены такие
параметры, как величина и скорость кровотока; давление крови в артерии,
капилляре, венуле; сопротивление кровотоку в различных отделах орган-
9. Функции систем кровообращения и лимфообращения • 433
ного сосудистого русла; объем крови в органе. Именно эти параметры,
характеризующие движение крови по сосудам органа, и подразумеваются,
когда используют термин «органное кровообращение».
Согласно формуле Пуазейля скорость кровотока в сосудах определяется
(помимо нервных и гуморальных влияний) соотношением пяти местных
факторов: упомянутого в начале главы градиента давления (который
зависит от артериального давления и венозного давления) и рассмотренного
выше сопротивления сосудов (которое зависит от радиуса сосуда, длины
сосуда, вязкости крови).
Повышение давления в артерии органа ведет к увеличению
градиента давления и, следовательно, к увеличению кровотока в нем.
Снижение артериального давления вызывает замедление кровотока.
Повышение давления в вене влечет за собой уменьшение градиента
давления, в результате чего кровоток уменьшается. При снижении венозного
давления градиент давления увеличится, что будет способствовать
увеличению кровотока.
Изменения радиуса сосудов могут происходить активно и
пассивно. Изменения радиуса сосуда, которые возникают не в результате
изменений сократительной активности их гладких мышц, являются пассивными.
Последние могут быть следствием как интраваскулярных, так и экстравас-
кулярных факторов.
Интраваскулярным фактором, вызывающим в организме пассивные
изменения просвета сосуда, является внутрисосудистое давление.
Повышение артериального давления вызывает пассивное расширение просвета
сосудов, которое может даже нивелировать активную констрикторную
реакцию артериол в случае их малой выраженности. Аналогичные пассивные
реакции могут возникать в венах при изменении венозного давления.
Экстраваскулярные факторы, способные вызвать пассивные изменения
просвета сосудов, присущи не всем сосудистым областям и зависят от
специфической функции органа. Так, сосуды сердца могут пассивно
изменять свой просвет в результате: а) изменений частоты сердечных
сокращений, б) степени напряжения сердечной мышцы при ее сокращениях, в)
изменений внутрижелудочкового давления. Бронхомоторные реакции
влияют на просвет легочных сосудов, а двигательная или тоническая
активность отделов желудочно-кишечного тракта или скелетной
мускулатуры изменит просвет сосудов этих областей. Следовательно, степень
сжатия сосудов внесосудистыми элементами может определить величину их
просвета.
Активными реакциями сосудов обозначаются те из них, которые
возникают в результате сокращения гладкой мускулатуры стенки сосуда. Многие
стимулы вызывают активные изменения просвета сосудов. К их числу
относятся, прежде всего, физические, нервные и химические влияния.
Одним из физических факторов является внутрисосудистое давление,
изменения которого сказываются на степени напряжения (сокращения)
гладкой мускулатуры сосудов. Так, повышение внутрисосудистого
давления влечет за собой увеличение сокращения гладких мышц сосудов, и
наоборот, его снижение вызывает уменьшение напряжения сосудистых
мышц (эффект Остроумова—Бейлисса). Этот механизм обеспечивает ауто-
регуляцию кровотока в сосудах.
Под ауторегуляцией кровотока понимают тенденцию к сохранению его
величины в органных сосудах. Это, конечно, не значит, что при резких
изменениях артериального давления (от 70 до 200 мм рт. ст.) органный
кровоток сохраняется постоянным. Речь идет о том, что указанные сдвиги ар-
434 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Таблица 9.6. Регионарные особенности ауторегуляции кровотока и постокклюзионной
(реактивной) гиперемии
Регион
Мозг
Миокард
Скелетные
мышцы
Кишечник
Печень
Кожа
Ауторегуляция кровотока
при изменениях
артериального давления
Хорошо выражена,
Дс « 80-160
Хорошо выражена,
дс » 75-140
Выражена при высоком
исходном тонусе
сосудов, Дс ~ 50-100
По общему кровотоку не
столь четко выражена.
В слизистой оболочке
выражена полнее,
Де = 40-125
Не обнаружена.
?
Реактивная гиперемия
пороговая
тельность
окклюзии
3-5 с
2-20 с
1-2 с
30-120 с
Не
изучена
0,5-
6 мин
максимальная
кратность увеличения
кровотока
1,5-2
2-3
1,5-4
1,5-2
Слабо выражена.
Гиперемия, вторая
фаза реакции на
окклюзию артерии.
1,5-4
основной фактор
развития
Механизм
реагирования на
растяжение
Аденозин, ионы
калия и др.
Механизм
реагирования на
растяжение,
метаболические факторы,
недостаток 02
Метаболиты.
Местные гормоны
Простагландины
Метаболиты
Примечание. Д.—диапазон величин артериального давления (мм рт.ст.), в котором
стабилизируется кровоток.
териального давления вызывают меньшие изменения кровотока, чем они
могли бы быть в пассивно-эластической трубке.
Ауторегуляция кровотока высокоэффективна в сосудах почек и мозга
(изменения давления в этих сосудах почти не вызывают сдвигов
кровотока), несколько меньше — в сосудах кишечника, умеренно эффективна — в
миокарде, относительно неэффективна — в сосудах скелетных мышц и
весьма слабо эффективна — в легких (табл. 9.6).
Несколько теорий объясняют механизм ауторегуляции кровотока:
а) миогенная, признающая за основу передачу возбуждения по гладкомы-
шечным клеткам; б) неирогенная, предполагающая взаимодействие между
гладкомышечными клетками и рецепторами в сосудистой стенке,
чувствительными к изменению внутрисосудистого давления; в) теория тканевого
давления, основывающаяся на данных о сдвигах капиллярной фильтрации
жидкости при изменении давления в сосуде; г) обменная теория,
предполагающая зависимость степени сокращения гладких мышц сосудов от
обменных процессов (сосудоактивных веществ, выделяющихся в кровоток в
процессе метаболизма).
Физическим фактором, также способным изменять просвет сосудов,
является температура. На повышение температуры крови сосуды
внутренних органов отвечают расширением, но на повышение температуры
окружающей среды — сужением, сосуды же кожи при этом расширяются.
Длина сосуда в большинстве регионов относительно постоянна, од-
9. Функции систем кровообращения и лимфообращения • 435
нако в органах, выполняющих периодическую или ритмичную
деятельность (легкие, сердце, желудочно-кишечный тракт), длина сосуда может
играть роль в изменениях сопротивления сосудов и кровотока в них. Так,
например, увеличение объема легких (на вдохе) вызывает повышение
сопротивления легочных сосудов как в результате их сужения, так и
удлинения. В этом случае изменения длины сосуда участвуют в дыхательных
вариациях легочного кровотока.
Вязкость крови также влияет на кровоток в сосудах. При высоком
показателе гематокрита сопротивление кровотоку может быть
значительным.
Сосуды, лишенные нервных и гуморальных влияний, как оказалось,
сохраняют (хотя и в меньшей мере) способность оказывать сопротивление
кровотоку. Денервация сосудов скелетных мышц, например, увеличивает
кровоток в них примерно в два раза, но последующее введение ацетилхо-
лина в кровоток этой сосудистой области может вызвать дальнейшее
десятикратное увеличение в ней кровотока, свидетельствующее о
сохраняющейся в этом случае способности сосудов к вазодилатации. Для
обозначения этой особенности денервированных сосудов оказывать сопротивление
кровотоку введено понятие «базальный тонус сосудов».
Базальный тонус сосудов определяется структурными и миогенными
факторами. Структурная часть его создается жесткой сосудистой «сумкой»,
образованной коллагеновыми волокнами, которая определяет
сопротивление сосудов, если активность их гладких мышц полностью исключена.
Миогенная часть базального тонуса обеспечивается напряжением гладких
мышц сосудов в ответ на растягивающее усилие артериального давления.
Следовательно, изменения сопротивления сосудов под влиянием
нервных или гуморальных факторов наслаиваются на базальный тонус,
который для определенной сосудистой области более или менее постоянен.
Если нервные и гуморальные влияния отсутствуют, а нейрогенный
компонент сопротивления сосудов равен нулю, сопротивление их кровотоку
определяется базальным тонусом.
Поскольку одной из биофизических особенностей сосудов является их
способность к растяжению, то при активной констрикторной реакции
сосудов изменения их просвета находятся в зависимости от двух
противоположно направленных влияний: сокращающихся гладких мышц сосудов,
которые уменьшают их просвет, и повышенного давления в сосудах,
которое их растягивает. Растяжимость сосудов различных органов значительно
отличается. При повышении артериального давления только на 10 мм рт.
ст. (со ПО до 120 мм рт. ст.) кровоток в сосудах кишечника увеличивается
на 5 мл/мин, а в сосудах миокарда в 8 раз больше — на 40 мл/мин.
На величине реакций сосудов могут сказываться и различия их
исходного просвета. При этом имеет значение отношение толщины стенки
сосуда к его просвету. Чем выше указанное отношение (стенка/просвет), т. е.
чем больше масса стенки находится внутри «линии силы» укорочения
гладких мышц, тем более выражено сужение просвета сосудов. В этом
случае при одной и той же величине сокращения гладких мышц в
артериальных и венозных сосудах уменьшение просвета всегда будет более выражено
в артериальных сосудах, так как структурные «возможности» уменьшения
просвета в большей степени присущи сосудам с высоким отношением
стенка/просвет. На этой основе строится одна из теорий развития
гипертонической болезни у человека.
Изменения трансмурального давления (разность внутри- и внесосудисто-
го давлений) влияют на просвет кровеносных сосудов и, следовательно, на
436 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
их сопротивление кровотоку и содержание в них крови, что особенно
сказывается в венозном отделе, где растяжимость сосудов велика и
значительные изменения объема содержащейся в них крови могут иметь место при
небольших сдвигах давления. Поэтому изменения просвета венозных
сосудов будут вызывать соответствующие изменения трансмурального
давления, что может привести к пассивно-эластической отдаче
крови из этой области.
Следовательно, выброс крови из вен, возникающий при усилении им-
пульсации в вазомоторных нервах, может быть обусловлен как активным
сокращением гладкомышечных клеток венозных сосудов, так и их
пассивно-эластической отдачей. Относительная величина пассивного выброса
крови в этой ситуации будет зависеть от исходного давления в венах. Если
исходное давление в них низкое, дальнейшее его уменьшение может
вызвать спадение вен, ведущее к весьма выраженному пассивному выбросу
крови. Нейрогенная констрикция вен в этой ситуации не вызовет сколько-
нибудь значительного выброса из них крови и в результате может быть
сделано ошибочное заключение, что нервная регуляция этого отдела
незначительна. Напротив, если исходное трансмуральное давление в венах
высокое, то уменьшение этого давления не повлечет за собой спадение вен
и пассивно-эластическая их отдача будет минимальной. В этом случае
активная констрикция вен вызовет значительно больший выброс крови и
покажет истинное значение нейрогенной регуляции венозных сосудов.
Пассивный компонент мобилизации крови из вен при низком давлении
в них очень выражен, но становится весьма малым при давлении 5—10 мм
рт. ст. В этом случае вены имеют циркулярную форму и выброс крови из
них при нейрогенных влияниях обусловлен активными реакциями
указанных сосудов. Однако при подъеме венозного давления выше 20 мм рт. ст.
величина активного выброса крови вновь уменьшается, что является
следствием «перенапряжения» гладкомышечных элементов венозных стенок.
Во время спокойного стояния человека объем вен, расположенных
ниже уровня сердца, увеличивается примерно на 500 мл и даже больше, если
расширены кожные вены. Именно это может быть причиной
головокружения или даже обморока при продолжительном стоянии, особенно в тех
случаях, когда при высокой температуре окружающей среды имеет место
расширение сосудов кожи. Недостаточность венозного возврата при этом
обусловлена не тем, что «кровь должна подниматься вверх», а
повышенным трансмуральным давлением и обусловленным этим растяжением вен,
а также застоем в них крови. Гидростатическое давление в венах тыльной
поверхности стопы в этом случае может достигать 80—100 мм рт. ст.
Однако уже первый шаг создает наружное давление скелетных мышц на вены,
и кровь устремляется к сердцу, так как клапаны вен препятствуют
обратному току крови. Это приводит к опорожнению вен в скелетных мышцах
конечностей и снижению в них венозного давления, которое возвращается
к первоначальному уровню со скоростью, зависящей от кровотока в этой
конечности. Растяжение вен органов брюшной полости в положении стоя
сводится к минимуму в результате того, что при переходе в вертикальное
положение давление внутри брюшной полости повышается.
К числу основных феноменов, присущих органному кровообращению,
помимо ауторегуляции кровотока, зависимости реакции сосудов от их
исходного тонуса, от силы раздражителя, относятся функциональная
(рабочая) гиперемия, а также реактивная (постокклюзионная) гиперемия. Эти
феномены свойственны регионарному кровообращению во всех областях.
Рабочая (или функциональная) гиперемия — увеличение органного кро-
9. Функции систем кровообращения и лимфообращения • 437
вотока, сопровождающее усиление функциональной активности органа.
Так, в сокращающейся скелетной мышце увеличиваются кровоток и
кровенаполнение, саливация также сопровождается резким увеличением
кровотока по расширенным сосудам слюнной железы. Гиперемия возникает в
поджелудочной железе в момент пищеварения, а также в кишечной стенке
в период усиления моторики и секреции. Увеличение сократительной
активности миокарда ведет к росту коронарного кровотока, активация зон
головного мозга сопровождается усилением их кровоснабжения, усиленное
кровоснабжение ткани почки регистрируется при увеличении натрийуреза.
Реактивная (или постокклюзионная) гиперемия — увеличение кровотока
в сосудах органа после временного прекращения кровотока. Она
проявляется в скелетных мышцах и в конечности человека и животных, хорошо
выражена в почке и в головном мозге, имеет место в коже и кишечнике.
Установлена связь изменений кровотока в органе с химическим
составом среды, окружающей внутриорганные сосуды. Выражением этой связи
являются местные вазодилататорные реакции в ответ на искусственное
введение в сосуды продуктов тканевого обмена (С02, лактат) и веществ,
изменения концентрации которых в межклеточной среде сопутствуют
сдвигам функции клеток (ионы, аденозин и др.). Отмечена органная
специфичность этих реакций: особая активность С02, ионов К в
церебральных сосудах, аденозина — в коронарных.
Ауторегуляторная реакция на понижение давления, в принципе,
соответствует «реактивной» гиперемии, вызванной временной окклюзией
артерии. В соответствии с этим данные табл. 9.6 свидетельствуют, что наиболее
кратковременные пороговые окклюзии артерий регистрируются в тех же
самых регионах, где эффективна ауторегуляция.
Функциональная гиперемия органов является веским доказательством
основного постулата физиологии кровообращения, согласно которому
регуляция кровообращения необходима для осуществления нутритивной
функции движения крови по сосудам. Данные табл. 9.7 свидетельствуют о том,
что усиление деятельности практически каждого органа сопровождается
увеличением кровотока по его сосудам.
В большей части сосудистых регионов (миокард, скелетные мышцы,
кишечник, пищеварительные железы) функциональная гиперемия
выявляется как существенное увеличение общего кровотока (максимально до 4—
10-кратного) при усилении функции органа. К этой группе относится и
мозг, хотя общее увеличение его кровоснабжения при усилении
активности «всего мозга» не установлено, но локальный кровоток в зонах
повышенной нейрональной активности существенно возрастает.
Функциональная гиперемия не обнаружена в печени — главном химическом реакторе
тела. Возможно, это связано с тем, что печень не бывает в
функциональном «покое», либо с тем, что она и без того обильно снабжается кровью из
печеночной артерии и воротной вены. В другом химически активном
«органе» — жировой ткани — функциональная гиперемия выражена.
Функциональная гиперемия проявляется также и в мозговом веществе почки,
работающей «безостановочно», где кровоснабжение коррелирует со
скоростью реабсорбции натрия, хотя диапазон изменений кровотока невелик.
Применительно к коже понятие «функциональная гиперемия» не
используется, хотя обусловленные ею изменения кровоснабжения происходят
здесь постоянно. Основная функция теплообмена организма со средой
обеспечивается кровоснабжением кожи, но и другие (не только
нагревание) виды стимуляции кожи (ультрафиолетовое облучение, механические
воздействия) обязательно сопровождаются гиперемией.
438 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Таблица 9.7. Регионарные особенности функциональной гиперемии
Орган
Мозг
Миокард
Скелетные
мышцы
Кишечник
Поджелудочная
железа
Слюнные
железы
Печень
Почка
(мозговое
вещество)
Костный
мозг
Кость
Жир
Кожа
Показатель усиления
функциональной
активности
Локальная
нейронная активность
мозговых зон. Общая
активность коры
Увеличение
частоты и силы
сокращений сердца
Сокращения
мышечных волокон
Усиление
секреции, моторики и
всасывания
Усиление экзосек-
реции
Усиление
слюноотделения
Усиление
обменных реакций
Увеличение реаб-
сорбции натрия
Стимуляция эри-
тропоэза
Ритмическая
деформация кости
Нейрогенное
усиление липолиза через
циклический АМФ
Повышение
температуры, УФ-облуче-
ние, механическая
стимуляция
Изменение кровотока
Локальное
увеличение на 20-60 %. В
коре увеличение в
1,5—2 раза
Увеличение до
6-кратного
Увеличение до
10-кратного в двух
режимах
Увеличение до 2—
4-кратного
Увеличение
Увеличение до
5-кратного
Локальное
увеличение (?)
Увеличение до
2-кратного
Увеличение
Увеличение до
2-кратного
Увеличение
Изменение до
5-кратного
Основной факт(5р (факторы)
механизма
Начальный «быстрый» фактор
(нервный или химический:
калий, аденозин и др.).
Последующий «медленный» фактор
(РС022, рН и др.)
Аденозин, гиперосмия, ионы
калия и другие гистомеханиче-
ские влияния
Ионы калия, водорода. Гисто-
механические влияния
Р02, метаболиты, интестиналь-
ные гормоны, серотонин,
местный рефлекс
Метаболиты, интестинальные
гормоны, кинины
Влияние импульсации
парасимпатических волокон, кинины,
гистомеханические влияния
Мало исследовано
Брадикинин,гиперосмия
Аденозин
Механические влияния
Аденозин, адренергические
влияния
Уменьшение констрикторной
импульсации, метаболиты,
активные вещества из дегранули-
рованных тучных клеток,
ослабление чувствительности к
симпатической импульсации
Табл. 9.7 показывает также, что все известные механизмы регуляции
регионарного кровотока (нервные, гуморальные, местные) могут быть прича-
стны к механизмам функциональных гиперемий, причем в разной
комбинации для различных органов.
9.1.4.2. Нервные и гуморальные влияния на органные сосуды
Нейрогенное сужение сосудов осуществляется путем возбуждения адренер-
гических волокон, которые действуют на гладкие мышцы сосудов путем
высвобождения в области нервных окончаний медиатора адреналина.
Торможение импульсов в симпатических нервных волокнах влияет на гладкие
мышцы сосудов путем снижения их тонуса.
Парасимпатические вазодилататорные волокна холинергической приро-
9. Функции систем кровообращения и лимфообращения • 439
ды доказаны для группы волокон сакрального отдела, идущих в составе п.
pelvicus. В блуждающих нервах отсутствуют сосудорасширяющие волокна
для органов брюшной полости.
В скелетных мышцах доказано наличие симпатических вазодилататор-
ных нервных волокон, которые являются холинергическими. Внутрицен-
тральный путь этих волокон начинается в моторной зоне коры мозга. Тот
факт, что эти волокна могут возбуждаться при стимуляции двигательной
области коры мозга, позволяет предположить, что они вовлекаются в
системную реакцию, способствующую увеличению кровотока в скелетных
мышцах в начале их работы. Гипоталамическое представительство этой
системы волокон указывает на их участие в эмоциональных реакциях
организма.
У теплокровных отсутствует «дилататорный» центр с особой системой
«дилататорных» волокон. Вазомоторные сдвиги бульбоспинального уровня
осуществляются исключительно путем изменения числа возбужденных
констрикторных волокон и частоты их разрядов, т. е. сосудодвигательные
эффекты возникают только путем возбуждения или торможения
констрикторных волокон симпатических нервов.
Адренергические волокна при электрической стимуляции могут
передавать импульсацию с частотой 80—100 в 1 с. Однако в физиологическом
покое частота импульсов в них составляет 1—3 в 1 с и может увеличиваться
при прессорном рефлексе только до 12—15 имп/с. Из сказанного ясно, что
практически весь диапазон величин сосудистых реакций, которые можно
получить при электрической стимуляции нервов, соответствует
увеличению частоты импульсов всего лишь на1—12в1си что вегетативная
нервная система в норме функционирует при частоте разрядов значительно
меньшей 10 имп/с.
Электрическая стимуляция соответствующих симпатических волокон
приводит к достаточно сильному повышению сопротивления сосудов
скелетных мышц, кишечника, селезенки, кожи, печени, почки, жира; эффект
выражен слабее в сосудах мозга, сердца. В сердце и почке этой вазоконст-
рикции противостоят местные вазодилататорные влияния, опосредованные
активацией функций основных или специальных клеток ткани,
одновременно запускаемые нейрогенным адренергическим механизмом. В
результате такой суперпозиции двух механизмов выявление адренергической
нейрогенной вазоконстрикции в сердце и почке составляет более
сложную, чем для других органов, задачу. Общая закономерность все же
состоит в том, что во всех органах стимуляция симпатических волокон вызывает
активацию гладких мышц сосудов, иногда маскируемую одновременными
или вторичными тормозными эффектами.
При рефлекторном возбуждении симпатических нервных волокон, как
правило, имеет место повышение сопротивления сосудов всех изученных
областей (рис. 9.22). При торможении симпатической нервной системы
(рефлексы с полостей сердца, депрессорный синокаротидный рефлекс)
наблюдается обратный эффект. Различия между рефлекторными
вазомоторными реакциями органов в основном количественные, качественные —
обнаруживаются значительно реже. Одновременная параллельная
регистрация сопротивления в различных сосудистых областях свидетельствует о
качественно однозначном характере активных реакций сосудов при нервных
влияниях.
Учитывая небольшую величину рефлекторных констрикторных реакций
сосудов сердца и мозга, можно полагать, что в естественных условиях
кровоснабжения этих органов симпатические вазоконстрикторные влияния на
440 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
£30
со
о
5 25
о
о
о
| 20
ш
с;
со
£15
о
о.
8 ю
ш
S
X
ш 5
ш
2
га
Ем1 Ем
KM h\1 KM hV) KM KM KM N
Hill
1
7 8 9 10 11 12 13 14
Рис. 9.22. Величины изменений сопротивления сосудов (активные реакции) в
различных областях системы кровообращения при прессорном рефлексе у кошки.
По оси ординат — изменения сопротивления (в процентах к исходному); по оси абсцисс: 1 —
коронарные сосуды; 2 —мозговые; 3 — печеночные; 4—таза и задних конечностей; 5 —
задней конечности; 6 — обеих задних конечностей; 7 — мышц таза; 8 — почки; 9 — толстой
кишки; 10 — селезенки; И — передней конечности; 12 — желудка; 13 — подвздошной кишки; 14 —
печени.
них нивелируются метаболическими и общими гемодинамическими
факторами, в результате чего конечным эффектом может быть расширение
сосудов сердца и мозга. Этот суммарный дилататорный эффект обусловлен
сложным комплексом влияний на указанные сосуды, а не только нейро-
генных. Кроме того, эти отделы сосудистой системы обеспечивают обмен
веществ в жизненно важных органах, поэтому слабость вазоконстриктор-
ных рефлексов в этих органах обычно интерпретируют тем, что
выраженные симпатические констрикторные влияния на сосуды мозга и сердца
биологически нецелесообразно, так как это значительно уменьшало бы их
кровоснабжение.
Сосуды легких, обеспечивающих кислородом органы и ткани и
выведение из них углекислоты, т. е. выполняющих функцию, жизненная
важность которой бесспорна, на том же основании не должны подвергаться
выраженным констрикторным влияниям симпатической нервной системы,
поскольку это вело бы к нарушению соответствия их основному
физиологическому значению. Такое суждение относится и к сосудам печени и
почек, функционирование которых определяет жизнеобеспечения организма
менее «экстренно», но не менее ответственно.
В то же время при вазомоторных рефлексах сужение сосудов скелетных
мышц и органов брюшной полости значительно больше, чем
рефлекторные реакции сосудов сердца, мозга и легких (см. рис. 9.22). Аналогичная
величина вазоконстрикторных реакций в скелетных мышцах больше, чем в
чревной области, а увеличение сопротивления сосудов задних конечностей
больше, чем сосудов передних конечностей.
Причинами неодинаковой выраженности нейрогенных реакций
отдельных сосудистых зон могут быть: различная степень симпатической иннер-
вированности; количество, распределение в тканях и сосудах и чувстви-
9. Функции систем кровообращения и лимфообращения • 441
тельность а- и (3-адренорецепторов; местные факторы (особенно
метаболиты); биофизические особенности сосудов; неодинаковая интенсивность
импульсов к различным сосудистым областям.
Применение катехоламинов показывает, что во всех органах активация
а-адренорецепторов сопровождается констрикцией артерий и вен.
Активация [3-адренорецепторов (обычно связь их с симпатическими волокнами
существенно менее тесная, чем у а-адренорецепторов) приводит к вазоди-
латации; для кровеносных сосудов некоторых органов (J-адренорецепция
не обнаружена. Следовательно, в качественном отношении регионарные
адренергические изменения сопротивления кровеносных сосудов первично
однотипны.
Большое количество химических веществ вызывает активные
изменения просвета сосудов. Концентрация этих веществ определяет
выраженность вазомоторных реакций. Небольшое увеличение концентрации ионов
калия в крови вызывает дилатацию сосудов, а при более высоком уровне —
они суживаются, ионы кальция вызывают артериальную констрикцию,
ионы натрия и магния — являются дилататорами, равно как и ионы ртути
и кадмия. Ацетаты и цитраты также являются активными вазодилататора-
ми, значительно меньшим эффектом обладают хлориды, бифосфаты,
сульфаты, лактаты, нитраты, бикарбонаты. Ионы соляной, азотной и других
кислот вызывают обычно расширение сосудов. Прямое действие
адреналина и норадреналина на сосуды вызывает преимущественно их
констрикцию, а гистамина, ацетилхолина, АДФ и АТФ — дилатацию. Ангиотензин
и вазопрессин — сильные местные констрикторы сосудов. Влияние же се-
ротонина на сосуды зависит от их исходного тонуса: если последний
высок — серотонин расширяет сосуды и, наоборот, при низком тонусе —
действует сосудосуживающе. Кислород может быть высокоактивным в органах
с интенсивным обменом веществ (мозг, сердце) и значительно меньшее
действие оказывать на другие сосудистые области (например, конечности).
То же относится и к углекислоте. Снижение концентрации кислорода в
крови и соответственно увеличение углекислоты ведет к расширению
сосудов.
Простагландины (ПГ) относятся к физиологически активным
веществам, связанным происхождением с арахидоновой кислотой, и эту группу
веществ называют эйкозаноидами. ПГ выделяются в процессе тканевого
обмена и отличаются от остальных эйкозаноидов тем, что способны
влиять на тонус сосудов. При этом важно отметить, что вазоактивны такие
же их концентрации, которые образуются во внеклеточной среде,
окружающей кровеносные сосуды в условиях их нормального
функционирования. Дистанционность действия на сосуды веществ рассматриваемой
группы невелика. ПГ типа Е способны в очень малых концентрациях
вызывать снижение сопротивления кровотоку сосудов практически всех
органов. Содержание ПГ в венозной крови интенсивно работающих мышц
повышается, и это дает основание предполагать участие данного фактора
в развитии рабочей гиперемии. Доказана роль ПГ в регуляции выхода
трансмиттера (норадреналин) из нервных окончаний. Так, ПГ группы Е
тормозят как количество освобождающего норадреналина, так и действие
его на рецепторы, а ПГ группы F производят противоположный эффект.
Следовательно, ПГ принимают участие и в нервном контроле тонуса
сосудов.
Кинины (действующее начало калликреин-кининовой системы)
подобно ПГ относят к биологически активным веществам местного действия.
Активным компонентом этой системы является брадикинин. При введе-
442 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
нии в кровоток брадикинин расширяет сосуды большинства органов. Он
вызывает увеличение кровотока в скелетных мышцах в 15 раз более
сильное, чем ацетилхолин в такой же концентрации.
9.1.4.3. Роль эндотелия сосудов в регуляции их просвета
Эндотелий сосудов обладает способностью синтезировать и выделять
факторы, вызывающие расслабление или сокращение гладких мышц сосудов в
ответ на разного рода стимулы. Общая масса эндотелиоцитов, монослойно
выстилающих кровеносные сосуды изнутри (интима), у человека
приближается к 500 г. Общая масса, высокая секреторная способность эндотели-
альных клеток позволяют рассматривать эту «ткань» как своеобразный
эндокринный орган (железу). Распределенный по сосудистой системе
эндотелий, очевидно, предназначен для вынесения своей функции
непосредственно к гладкомышечным образованиям сосудов. Период полужизни
выделяемого эндотелиоцитами инкрета очень мал — 6—25 с (вследствие
быстрого перехода его в нитраты и нитриты), но он способен сокращать и
расслаблять гладкие мышцы сосудов, не оказывая влияния на эффектор-
ные образования других органов (кишечник, бронхи, матка).
Выделяемые эндотелием сосудов расслабляющие факторы (ЭРФ) —
нестабильные соединения, одним из которых является оксид азота (N0). В
эндотелиальных клетках сосудов N0 образуется из а-аргинина при
участии фермента — синтетазы окиси азота.
N0 рассматривается как некоторый общий путь передачи сигнала от
эндотелия к гладким мышцам сосудов. Выделение из эндотелия N0 инги-
бируется гемоглобином и потенцируется ферментом — дисмутазой.
Участие эндотелия в регуляции тонуса сосудов общепризнанно. Для
всех магистральных артерий показана чувствительность эндотелиоцитов к
скорости кровотока, выражающаяся в выделении ими расслабляющего
гладкие мышцы сосудов фактора, приводящего к увеличению просвета
этих артерий. Таким образом, артерии непрерывно регулируют свой
просвет соответственно скорости течения по ним крови, что обеспечивает
стабилизацию давления в артериях в физиологическом диапазоне изменений
величин кровотока. Этот феномен имеет большое значение в условиях
развития рабочей гиперемии органов и тканей, когда происходит
значительное увеличение кровотока, а также при повышении вязкости крови,
вызывающей рост сопротивления кровотоку в сосудистой сети. Повреждение
механочувствительности сосудистых эндотелиоцитов может быть одним из
этиологических (патогенетических) факторов развития облитерирующего
эндоартериита и гипертонической болезни.
9.1.5. Особенности кровоснабжения органов и тканей
9.1.5.1. Головной мозг
Интенсивность кровотока в сосудах мозга высока и составляет в
состоянии покоя человека 55—60 мл/100 г/мин, т. е. около 15 % сердечного
выброса. При относительно небольшой массе (2 % от массы тела) мозг
потребляет до 20 % всего кислорода и 17 % глюкозы, которые поступают в
организм человека. Интенсивность потребления кислорода мозгом
составляет в среднем 3—4 мл/100 г/мин. В отличие от других органов мозг
практически не располагает запасами кислорода.
При относительном постоянстве общего мозгового кровотока локаль-
9. Функции систем кровообращения и лимфообращения • 443
ный кровоток в различных отделах мозга не постоянен и зависит от
интенсивности их функционирования. Так, при напряженной умственной
работе локальный кровоток в коре головного мозга человека может возрастать
в 2—3 раза по сравнению с состоянием покоя.
В условиях герметичности и жесткости черепа общее сопротивление
сосудистой системы головного мозга мало зависит от изменений давления в
его артериях. Так, при повышении АД происходит расширение мозговых
артерий, что ведет к повышению давления ликвора, сжатию вен мозга и
оттоку ликвора в спинальную полость. При этом сопротивление артерий
падает, а вен — возрастает, так что общее сопротивление сосудистой
системы мозга в целом практически не меняется.
Миогенная регуляция мозгового кровотока осуществляется за счет
реакции гладких мышц артериальных сосудов мозга на изменение
давления в них. Повышение АД приводит к возрастанию тонуса миоцитов и
сужению артерий, снижение АД — к снижению тонуса и расширению
артерий. Миогенная регуляция мозгового кровообращения считается
центральным звеном системы ауторегуляции кровообращения в мозге.
Гуморальная регуляция. Мощным регулятором мозгового
кровотока является уровень напряжения углекислого газа в артериальной крови
и связанный с этим уровень рН спинномозговой жидкости. На каждый
миллиметр изменения напряжения С02 величина мозгового кровотока
изменяется примерно на 6 %. Возрастание напряжения С02 в крови (гипер-
капния) сопровождается расширением мозговых сосудов, а гипокапния —
их сужением, столь значительным, что достигается порог кислородной
недостаточности мозга (одышка, судороги, потеря сознания). Увеличение
мозгового кровотока при гиперкапнии обеспечивает быстрое «вымывание»
углекислоты и возвращение уровня напряжения С02 и концентрации
водородных ионов к исходной величине.
Метаболическая реакция клеток мозга играет существенную роль при
локальных перераспределениях крови между областями мозга, имеющими
разный уровень функциональной активности в каждой конкретной
ситуации. Локальное повышение функциональной активности нервных клеток
приводит к росту в межклеточной среде концентрации аденозина и ионов
калия, что ведет к местному расширению сосудов и усилению в них
кровотока.
Поскольку уровень концентрации ионов калия в межклеточной среде
головного мозга может меняться в течение долей секунды от момента
усиления функциональной активности нейронов, описанный механизм
считается быстрым контуром регуляции. Более медленный контур регуляции
мозгового кровотока связан с повышением напряжения С02 в мозговом
веществе вследствие активного потребления кислорода работающими
клетками. Это вызывает локальное снижение рН в межклеточной среде и
приводит к расширению сосудов активно функционирующей области
мозга.
Биологически активные вещества и гормоны могут оказывать как
прямое, так и опосредованное влияние на сосуды мозга. К внутрисосудистым
вазоконстрикторам относятся: вазопрессин, ангиотензин, простагландины
группы F, катехоламины. Сосудорасширяющий эффект оказывают: аце-
тилхолин, гистамин (средние и крупные артерии), брадикинин (мелкие
артерии).
Нейрогенная регуляция сосудов головного мозга менее
эффективна, чем метаболическая. Основной зоной приложения нейрогенных
влияний являются мелкие артериальные мозговые сосуды диаметром до
444 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
25—30 мкм. Доказано существование адренергических, холинергических,
серотонинергических и пептидергических нервных волокон,
обеспечивающих регуляцию тонуса мозговых сосудов, Нервные влияния на стенку
сосудов головного мозга опосредуются через а- и (J-адренорецепторы (норад-
реналин), М-холинорецепторы (ацетилхолин, вазоинтестинальный
пептид), D-рецепторы (серотонин).
Основной источник нервных влияний на сосуды мозга — постганглио-
нарные симпатические волокна, начинающиеся в верхних шейных
ганглиях. Существование парасимпатических влияний на мозговые сосуды не
доказано.
Нейрогенные влияния на кровоснабжение мозга во многом зависят от
выраженности ауторегуляции, исходного тонуса сосудов, напряжения С02,
02, состава и концентрации ионов, присутствия биологически активных
веществ в спинномозговой жидкости и тканях мозга. Именно поэтому
конечный эффект нейрогенных влияний на мозговой кровоток не
однозначен.
9.1.5.2. Миокард
В состоянии покоя у человека через коронарные сосуды протекает 200—
250 мл крови в минуту (60 мл/100 г/мин), это составляет 4—5 % минутного
объема крови. При интенсивной мышечной работе коронарный кровоток
может возрастать до 400 мл/мин на 100 г ткани.
В период систолы желудочков, расположенные в них сосуды частично
пережимаются, кровоток к миокарду резко ослабевает (до 15 %). Во время
диастолы напряжение в стенке миокарда падает и кровоток увеличивается
до 85 %.
Несмотря на резкое снижение кровотока в миокарде во время систолы,
коронарное кровообращение полностью удовлетворяет высокие
метаболические потребности миокарда. Это достигается большой объемной
скоростью кровотока, растяжимостью сосудов сердца, фазными колебаниями
кровотока в коронарных венах (во время систолы ускоряется отток крови
из коронарного синуса, в диастолу он понижается), наличием густой
капиллярной сети (сердечная мышца богато снабжена капиллярами — на
каждое мышечное волокно приходится капилляр; малое диффузное
расстояние от капилляра до кардиомиоцита облегчает доставку кислорода и
питательных веществ к кардиомиоцитам), высокой экстракцией кислорода
миокардом [в состоянии покоя миоглобин сердечной мышцы извлекает из
артериальной крови 60—75% кислорода (в мозге — 25—30 %)]. Миокард
потребляет в покое кислорода до 10 мл/100 г/мин. При интенсивной
мышечной работе экстракция кислорода в миокарде возрастает примерно в
6 раз.
Миогенная регуляция. Для коронарных сосудов характерен
высокий тонус, величина которого находится в обратно пропорциональной
зависимости от интенсивности обменных процессов миокарда.
Гуморальная регуляция. Наиболее мощным регулятором
коронарного кровотока является напряжение кислорода в крови: расширение
коронарных сосудов проявляется при снижении содержания кислорода в
крови на 5 %. Взаимосвязь между потреблением кислорода и уровнем
кровотока осуществляется через метаболические механизмы. «Аденозиновая
теория» метаболической регуляции коронарного кровообращения является
общепризнанной. Аденозин блокирует захват Са2+ гладкими мышцами.
При физической нагрузке имеет место увеличение концентрации ионов
9. Функции систем кровообращения и лимфообращения • 445
калия, водородных ионов, молочной кислоты, повышение концентрации
двуокиси углерода, появление в межклеточной жидкости вазоактивных
веществ (гистамин, кинины, простагландины группы Е, пептиды) что ведет к
расширению сосудов и увеличению кровотока в миокарде. Ацетилхолин
через М-холинорецепторы расширяет коронарные артерии. Адреналин и
норадреналин через а-адренорецепторы вызывают сужение, через (J-адре-
норецепторы — расширение коронарных артерий и вен. Ангиотензин и ва-
зопрессин только в больших дозах приводят к сужению коронарных
артерий. Тироксин, кортизол и другие гормоны усиливают кровоснабжение
миокарда через метаболические посредники.
Нервная регуляция. Нейрогенный тонус сосудов сердца невелик
(около 20 %). Симпатические нервы содержат сосудосуживающие волокна,
тормозные процессы в них вызывают коронародилатацию. Нервные
влияния находятся в конкурентных отношениях с метаболическими, которые
представляют более мощный контур регуляции.
9.1.5.3. Легкие
Легочная артерия и ее ветви, имеющие диаметр более 1 мм, относятся к
артериям эластичного типа, они демпфируют (смягчают) пульсовые толчки
крови, выбрасываемой в момент систолы правого желудочка. Артериолы в
легких тесно связаны с окружающей альвеолярной паренхимой, это
определяет непосредственную зависимость уровня кровоснабжения легких от
режима вентиляции.
В отличие от большого круга кровообращения, капилляры которого
имеют диаметр около 7—8 мкм, в легких имеются два типа капилляров —
широкие (20—40 мкм) и узкие (6—12 мкм). Общая площадь капиллярного
русла легких у человека составляет 35—40 м2. Стенка капилляров легких и
стенка альвеол представляют в совокупности функциональное целое,
обозначаемое как альвеоло-капиллярная мембрана.
Если функциональное значение сосудов малого круга кровообращения
заключается, главным образом, в поддержании адекватного легочного
газообмена, то бронхиальные сосуды обеспечивают питание тканей самих
легких. Венозная бронхиальная сеть дренирует кровь как в систему
большого круга кровообращения (верхняя непарная вена, правое предсердие),
так и малого — в легочные вены и левое предсердие. Только 30 % крови,
поступающей в бронхиальные артерии по системе большого круга
кровообращения, достигает правого желудочка, основная же часть кровотока
направляется через капиллярные и венозные анастомозы в легочные вены.
Указанная особенность бронхиального кровотока формирует так
называемый физиологический дефицит напряжения кислорода в артериальной
крови большого круга. Примесь бронхиальной венозной крови к артериа-
лизированной крови легочных вен понижает на 6—10 мм рт.ст.
напряжение кислорода по сравнению с его напряжением в крови легочных
капилляров, что практически не сказывается на кислородном режиме в процессе
обычной жизнедеятельности организма.
Основным условием, определяющим степень оксигенации крови в
легких, являются величины легочной вентиляции и кровотока, а также
степень их соответствия друг другу. Минутный объем кровообращения через
легкие соответствует МОК в большом круге и составляет в условиях покоя
5—6 л/мин. Сопротивление сосудистого русла малого круга при этом
приблизительно в 8—10 раз меньше, чем в системе большого круга
кровообращения. Легочные сосуды характеризуются высокой растяжимостью, по-
446 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
скольку их сосудистая стенка значительно тоньше, чем у соответствующих
по калибру сосудов скелетной мускулатуры и спланхнической области. Это
определяет роль легочных сосудов как депо крови.
Важной особенностью кровоснабжения легких является то, что сосуды
малого круга кровообращения — это система низкого давления. Среднее
давление в легочной артерии у человека составляет 15—25 мм рт. ст., а
давление в легочных венах — 6—8 мм рт. ст. Таким образом, градиент
давления, определяющий движение крови по сосудам малого круга, составляет
9—15 мм рт. ст., что значительно меньше градиента давления в большом
круге кровообращения. Отсюда понятен физиологический смысл высокой
растяжимости легочных сосудов: значительное увеличение кровотока в
системе малого круга (например, при физической нагрузке) не будет
сопровождаться повышением давления крови в силу указанных свойств
сосудов легких.
Другим следствием низкого градиента давления в малом круге является
неравномерность кровоснабжения легких от их верхушки к основанию.
В вертикальном положении тела кровоснабжение верхних долей несколько
меньше, чем нижних.
Нервная регуляция. Легочные сосуды имеют двойную иннервацию:
вагусную (афферентную) и симпатическую (эфферентную). Основным
источником афферентной иннервации легочных сосудов являются
блуждающие нервы (волокна, идущие от чувствительных клеток узлового ганглия).
Главными источниками эфферентной иннервации являются шейные и
верхние грудные симпатические узлы.
Влияние нервной системы на легочные сосуды, в отличие от сосудов
большого круга кровообращения, выражено намного меньше.
Крупные легочные сосуды (особенно легочная артерия и область ее
бифуркации) являются рефлексогенной зоной, обеспечивающей
рефлекторные реакции сосудов малого круга. Так, повышение давления в легочных
сосудах приводит к рефлекторному падению системного артериального
давления, замедлению ритма сердечных сокращений, увеличению
кровенаполнения селезенки и вазодилатации в скелетных мышцах. Расширение
периферических сосудов уменьшает приток крови в малый круг
кровообращения и, тем самым, «разгружает» легочные капилляры и предохраняет
их от отека. Описанный комплекс рефлекторных реакций с барорецепто-
ров малого круга получил в литературе обозначение как рефлекс Швигка—
Ларина.
Рецепторный аппарат сосудов в малом круге представлен
преимущественно р-адренорецепторами (хотя плотность их распределения
значительно меньше, чем сосудов большого круга), Д-серотониновыми, Н,-гистами-
новыми рецепторами и в меньшей степени М-холинорецепторами.
Гуморальная регуляция. В реализации гуморального контроля
легочного кровообращения катехоламины и ацетилхолин играют
значительно меньшую роль, чем в большом круге кровообращения. Повышение
концентрации ацетилхолина в крови сопровождается умеренной дилатаци-
ей легочных сосудов. Гуморальная регуляция легочного кровотока
определяется серотонином, гистамином, ангиотензином-П, простагландином F.
9.1.5.4. Желудочно-кишечный тракт (ЖКТ)
В состоянии покоя на ЖКТ приходится до 20 % сердечного выброса.
Кровоток в различных отделах ЖКТ неодинаков: в желудке человека он
достигает 40 мл/100 г/мин, в тонкой кишке — 35 мл/100 г/мин, в толстой —
9. Функции систем кровообращения и лимфообращения • 447
20 мл/100 г/мин. При максимальной
дилатации сосудов кишечника
кровоток в нем увеличивается в 8—
10 раз, причем более 90 %
дополнительной крови поступает в слизи-
сто-подслизистую сеть.
В первые минуты после еды
происходит увеличение кровотока в
сосудах ЖКТ (отчасти за счет
выпрямления спиралевидных
артерий), причем лишь в отделах,
функциональная активность которых
усилена. Эта фаза реакции
сосудистой системы ЖКТ на прием пищи
продолжается 5—30 мин. Через
30 мин после приема пищи
кровоток в брыжеечной артерии
значительно возрастает (на 30—130 % по
сравнению с состоянием «натощак»)
и сохраняется на таком уровне в
течение 3—7 ч. Степень увеличения кровотока после приема пищи
определяется ее химическим составом и исходным функциональным состоянием
органов ЖКТ.
Нервная регуляция сосудов ЖКТ осуществляется симпатическими вазо-
констрикторными волокнами. Возбуждение этих волокон вызывает
сужение артериальных (рис. 9.23) и венозных сосудов, а также прекапиллярных
сфинктеров, что приводит к увеличению регионарного сопротивления и
уменьшению кровотока в органе. При снижении частоты импульсов в
симпатических волокнах возникает обратный эффект — расширение сосудов
ЖКТ.
В артериальных сосудах кишечника широко представлены а- и (J-адре-
норецепторы. В венозных сосудах (J-адренорецепторов значительно
меньше. В сосудистом русле ЖКТ при выделении катехоламинов (3-адреноре-
цепторы ограничивают констрикторный эффект, возникающий при
возбуждении а-адренорецепторов. Это служит механизмом обеспечения
необходимого кровоснабжения кишечника при активации симпатоадреналовой
системы. Холинергические сосудорасширяющие волокна в кишечнике и в
желудке не обнаружены. При длительном возбуждении симпатических ва-
зоконстрикторных нервов в кишечнике происходит «ауторегуляторное
ускользание» из-под влияния сосудосуживающих волокон нервной системы.
Значение его в поддержании постоянного кровотока и защите тканей ЖКТ
(например, от ишемии при стрессорных воздействиях) велико.
Гуморальная регуляция. Объектом гуморальных влияний агентов
в сосудах ЖКТ являются, главным образом, артериолы и прекапиллярные
сфинктеры. Велика роль в регуляции кровотока в ЖКТ таких метаболитов,
как С02, Н+ и др. Эти вещества, как и недостаток кислорода, оказывают
вазодилататорное действие. Метаболиты снижают тонус гладких мышц ар-
териол и тем самым понижают сопротивление в системе брыжеечной
артерии, увеличивая кровоток в сосудах ЖКТ. В ЖКТ существует ряд
специфических механизмов вазодилатации, не связанных с изменением
содержания в тканях истинных метаболитов. Так, функциональная гиперемия
ЖКТ после приема пищи обусловлена действием на сосуды ряда гастроин-
тестинальных гормонов, например гастрина и гистамина. Противополож-
Рис. 9.23. Различная величина
изменений сопротивления в сосудах
селезенки и тонкой кишки при прессорном
синокаротидном рефлексе.
Сверху вниз: системное артериальное
давление, перфузионное давление в сосудах
селезенки, тощей кишки, отметка раздражения,
отметка времени (5 с). Шкалы — в мм рт. ст.
448 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ное действие на них оказывают вазопрессин, гастрон, простагландин Е.
Большое значение отводится веществам, высвобождающимся в активно
работающем органе. В тонкой кишке расширение артериальных сосудов и
прекапиллярных сфинктеров вызывают секретин и холицистокинин.
Миогенная регуляция. Сосуды ЖКТ отличаются высокой
способностью к ауторегуляции кровотока. В тонкой кишке проявляется вено-ар-
териолярный рефлекс, который состоит в том, что при локальном
увеличении венозного давления в этом участке повышается тонус прекапиллярных
сфинктеров, что уменьшает местный капиллярный кровоток и создает
возможности для «разгрузки» вен и снижения давления на них.
9.1.5.5. Главные пищеварительные железы
Слюнные железы при активации вырабатывают за 2 мин количество
слюны, равное по массе самим железам. Возбуждение парасимпатических
нервов вызывает гиперемию слюнных желез. При этом артериолы и прека-
пиллярные сфинктеры расслабляются, а проницаемость капилляров
возрастает, что создает благоприятные условия для транспорта веществ в
железистые клетки. При активной работе желез имеющиеся в них артерио-
венозные шунты не функционируют и вся кровь проходит через
капилляры. В создании функциональной гиперемии участвуют: 1) вазодилататор-
ные волокна, которые способствуют выработке сосудорасширяющих кини-
нов, 2) метаболиты, 3) гистомеханический фактор — снижение трансму-
рального давления на стенку сосуда вследствие фильтрации части слюны в
интерстиций. Симпатические влияния на сосуды слюнных желез
вызывают их сужение. Вазоконстрикторный эффект осуществляется через /?-адре-
норецепторы.
Поджелудочная железа. Кровоснабжение эндокринных и экзо-
кринных тканей железы осуществляется через одни и те же сосуды.
Капилляры снабжают кровью а-, а затем В-клетки островков Лангерганса и далее
эндокринные ткани. Железа иннервирована симпатическими и
парасимпатическими нервами, сосуды железы — только симпатическими.
Возбуждение симпатических нервов приводит к сужению сосудов и торможению
секреции. Увеличение кровотока в железе вызывают вещества,
расслабляющие гладкие мышцы сосудов (АТФ, АДФ, брандикинин,
холицистокинин и др.).
Функциональная гиперемия железы, возникающая при приеме пищи,
связана с активацией центров вагуса, выделением соляной кислоты в
желудке и эвакуацией пищи в двенадцатиперстную кишку.
Высвобождающиеся в дуоденум секретин и холицистокинин стимулируют выделение
местных метаболитов, увеличивающих панкреатический кровоток.
Допускают возможность выделения под влиянием парасимпатических нервов
кининов, которые способствуют увеличению кровотока и проницаемости
капилляров в поджелудочной железе.
9.1.5.6. Печень
В печени кровь протекает по печеночной артерии (25—30 %) и воротной
вене (70—75 %). По прохождении капиллярной сети кровь дренируется в
систему печеночных вен, которые впадают в нижнюю полую вену. Важной
особенностью сосудистого русла печени является наличие большого
количества анастомозов между сосудами систем воротной вены, печеночной
артерии и печеночных вен.
9. Функции систем кровообращения и лимфообращения • 449
Давление в печеночной артерии соответствует давлению в других
магистральных сосудах—100—120 мм рт. ст. В воротной вене оно в 10 раз
меньше и составляет около 10 мм рт. ст., в синусоидах — 3—5 мм рт. ст., в
печеночных венах — 2—3 мм рт. ст. Такая небольшая разница между
портальным давлением и давлением в печеночных венах оказывается
достаточной для портального кровотока вследствие низкого сопротивления
портальных сосудов.
Величина кровотока через печень человека составляет около 100 мл/
100 г/мин, т. е. 20—30 % от величины сердечного выброса. На долю
портального кровотока приходится 70—80 % этого объема, а на долю
кровотока в печеночной артерии 20—30 %. При максимальной вазодилатации
кровоток в печени может возрастать до 5000 мл/мин.
Печень является одним из органов, выполняющих функцию депо крови
в организме (в норме в печени содержится свыше 500 мл крови). За счет
этого может поддерживаться определенный объем циркулирующей крови
(например, при кровопотере) и обеспечиваться необходимая каждой
конкретной гемодинамической ситуации величина венозного возврата крови к
сердцу.
Миогенная регуляция обеспечивает высокую степень ауторегуля-
ции кровотока в печени. Даже небольшое увеличение объемной скорости
портального кровотока приводит к сокращению гладких мышц воротной
вены, что ведет к уменьшению ее диаметра, а также включает миогенную
артериальную констрикцию в печеночной артерии. Оба этих механизма
направлены на обеспечение постоянства кровотока и давления в
синусоидах.
Гуморальная регуляция. Адреналин вызывает сужение воротной
вены, активируя расположенные в ней а-адренорецепторы. Действие
адреналина на артерии печени сводится, преимущественно, к вазодилатации
вследствие стимуляции преобладающих в печеночной артерии р-адреноре-
цепторов. Норадреналин при действии как на артериальную, так и на
венозную систему печени приводит к сужению сосудов и повышению
сосудистого сопротивления в обоих руслах, что ведет к уменьшению кровотока
в печени. Ангиотензин суживает как портальные, так и артериальные
сосуды печени, значительно уменьшая при этом кровоток в них. Ацетилхолин
расширяет артериальные сосуды, увеличивая приток артериальной крови к
печени, но сокращает печеночные венулы, ограничивая отток венозной
крови из органа, что приводит к увеличению портального давления и
увеличению объема крови в печени.
Метаболиты и тканевые гормоны (двуокись углерода, аденозин, гиста-
мин, брадикинин, простагландины) вызывают сужение портальных венул,
уменьшая портальный кровоток, но расширяют печеночные артериолы,
усиливая приток артериальной крови к печени (артериализация
печеночного кровотока). Другие гормоны (глюкортикостероиды, инсулин, глюка-
гон, тироксин) вызывают увеличение кровотока через печень вследствие
усиления метаболических процессов в печеночных клетках.
Нервная регуляция выражена сравнительно слабо. Вегетативные
нервы печени идут от левого блуждающего нерва (парасимпатические) и от
чревного сплетения (симпатические). Электрическая стимуляция
блуждающего нерва существенно не влияет ни на скорость печеночного кровотока,
ни на его распределение в органе. Стимуляция печеночных симпатических
нервов повышает сосудистое сопротивление в печеночной артерии и в
воротной вене.
15-6095
450 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
9.1.5.7. Кожа
Кожа в большей степени, чем другие органы, подвержена прямому
действию высоких и низких температур, ультрафиолетовых лучей, механических
факторов и т. д. Кровоток по ее сосудам значительно превышает
собственные нутритивные потребности. Это объясняется тем, что выполнение
важнейшей функции кожи человека — участие в терморегуляции —
определяется не активностью метаболических процессов в ней, а теплопереносящей
функцией кровотока.
В покое при нейтральной температуре внешней среды кожа получает от
5 до 10 % сердечного выброса. Суммарный кожный кровоток взрослого
человека при этом составляет 200—500 мл/мин. В различных частях
поверхности тела кожный кровоток значительно отличается. Например, в коже
спины он составляет 9,5 мл/100 г/мин, на передней поверхности тела
15,5 мл/100 г/мин. Наиболее интенсивный кровоток отмечается в коже
пальцев рук и ног, где находится большое количество артериовенозных
анастомозов.
Диапазон возможного возрастания кровотока в коже велик: отношение
объемной скорости кровотока в покое к максимальной его величине
составляет 1:8. Максимальной величины кожный кровоток у человека
достигает при тепловом стрессе. В условиях высокой внешней температуры он
может возрастать с 200—500 мл/мин до 2,5—3 л/мин, а при
продолжительном нагревании организма человека (температура кожи 42 °С)
увеличивается до 8 л/мин, составляя 50—70 % сердечного выброса.
Нервная регуляция кровоснабжения кожи обеспечивается широко
представленной иннервацией ее сосудов (особенно артериовенозных
анастомозов) симпатическими адренергическими сосудосуживающими
волокнами. Повышение их активности обусловливает сужение кожных сосудов,
а торможение — приводит к вазодилатации.
Главным фактором в регуляции кожного кровотока является
температура тела, снижение которой приводит к рефлекторному сужению как
артериальных, так и венозных сосудов кожи, что способствует перемещению
крови в глубокие вены и сохранению тепла. При общем охлаждении
снижается кровоток как через артериовенозные анастомозы, так и через
капилляры кожи. Эта реакция опосредована через гипоталамус, а эффектор-
ными ее путями являются адренергические нервные волокна. При общем
воздействии на организм высоких температур происходит увеличение
кожного кровотока за счет, главным образом, раскрытия артериовенозных
анастомозов, кровоток через которые увеличивается в 3—3,5 раза.
Раскрытие анастомозов является следствием угнетения сосудосуживающей им-
пульсации к кожным сосудам по симпатическим адренергическим
волокнам, обусловливающим стимуляцию р-адренорецепторов. Медиаторами
активной кожной вазодилатации являются гистамин и допамин.
Гуморальная регуляция. В коже имеется большое количество
тучных клеток — источника вазоактивных веществ. Дегрануляция тучных
клеток и выделение вазоактивных веществ (гистамина, серотонина и др.)
происходит при непосредственном воздействии на кожу ультрафиолетового
облучения, механических и других факторов. В сосудах кожи имеются Н,-
и Н2-гистаминовые рецепторы, опосредующие вазодилататорное действие
эндогенного и экзогенного гистамина. Расширение сосудов кожи вызывает
субстанция Р, оказывая при этом как прямое влияние на гладкую мышцу
сосудов, так и опосредованное — через гистамин, выделяющийся из
тучных клеток. В коже происходит биосинтез простагландинов. Внутрикож-
9. Функции систем кровообращения и лимфообращения • 451
ное введение простагландинов Е2 и Н2 вызывает расширение кожных
сосудов, а простагландина F2a — сужение их.
Температура самой крови является фактором, играющим важную роль в
локально действующих механизмах контроля сосудистых функций в коже.
При локальном нагревании кожи имеет место увеличение капиллярного
кровотока без существенных изменений кровотока через артериовенозные
анастомозы. В механизме вазодилатации при локальном нагревании кожи
большую роль играет освобождение вазоактивных веществ (АТФ,
субстанция Р, гистамин) и накопление метаболитов. Однако большее значение в
развитии гиперемии в этом случае имеет прямое действие тепла на гладко-
мышечные элементы кожных сосудов. При повышении температуры крови
снижается миогенный тонус и уменьшаются реакции гладких мышц
сосудов кожи на симпатическую импульсацию и вазоконстрикторные
вещества, в частности на норадреналин. Снижение адренореактивности гладких
мышц кожных сосудов под влиянием гипертермии связано с уменьшением
чувствительности их ос-адренорецепторов.
При локальном действии на кожу низких температур имеют место вазо-
констрикции и снижение кожного кровотока, что обусловлено как
повышением сосудистого тонуса, так и увеличением вязкости крови.
9.1.5.8. Почка
Почка является одним из наиболее снабжаемых кровью органов — 400 мл/
100 г/мин, что составляет 20—25 % сердечного выброса. Удельное
кровоснабжение коркового вещества значительно превышает кровоснабжение
мозгового вещества почки. У человека через корковое вещество почки
протекает 80—90 % общего почечного кровотока. Медуллярный кровоток
мал только в сравнении с корковым, однако если сравнивать его с другими
тканями, то он, например, в 15 раз выше, чем в покоящейся скелетной
мышце.
Гидростатическое давление крови в капиллярах клубочков значительно
выше, чем в соматических капиллярах и составляет 50—70 мм рт. ст. Это
обусловлено близким расположением почек к аорте и различием
диаметров афферентных и эфферентных сосудов корковых нефронов.
Метаболизм в почках протекает более интенсивно, чем в других
органах, включая печень, головной мозг и миокард. Интенсивность его
определяется величиной кровоснабжения почек. Эта особенность характерна
именно для почек, поскольку в других органах (мозг, сердце, скелетные
мышцы) наоборот — интенсивность метаболизма определяет величину
кровотока.
Гуморальная регуляция. Ангиотензин II (АТИ) является мощным
констриктором для сосудов почек, он влияет на почечный кровоток также
опосредованно, стимулируя выброс медиатора из симпатических нервных
окончаний. АТИ стимулирует также выработку альдостерона и
антидиуретического гормона, которые, в свою очередь, усиливают констрикторный
эффект в сосудах почек.
Простагландины оказывают на сосуды почки выраженное дилататорное
действие. В состоянии покоя простагландины практически не участвуют в
регуляции почечного кровотока, однако их активность резко возрастает
при любых вазоконстрикторных эффектах, что и обусловливает ауторегу-
ляцию почечного кровотока.
Кинины являются местным гуморальным фактором регуляции
коркового кровотока в почках. Действуя на кининовые рецепторы в сосудах, они
15-
452 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
вызывают вазодилатацию, увеличивая почечный кровоток и активируя на-
трийурез.
Катехоламины через а-адренорецепторы сосудов почек вызывают их
констрикцию, преимущественно в корковом слое. Допамин в малых дозах,
воздействуя на допаминовые рецепторы, вызывает в почках
вазодилатацию. При больших концентрациях допамин, влияя на /?-адренорецепторы,
вызывает вазоконстрикцию, наиболее выраженную в корковом слое почки.
Вазопрессин, наряду со специфическим влиянием на канальцы почек,
вызывает констрикцию артериол, усиливает действие катехоламинов,
перераспределяет кровоток в почке, повышая корковый и снижая мозговой
кровоток. Вазопрессин подавляет секрецию ренина и стимулирует синтез
простагландинов. Ацетилхолин, воздействуя на гладкие мышцы артериол и
повышая активность внутрипочечных холинергических нервов,
увеличивает почечный кровоток. Секретин также вызывает увеличение общего
почечного кровотока. Накопление продуктов метаболизма (С02), состояние
гипоксии ведет к снижению кортикального кровотока без изменения
медуллярного кровотока. Аденозин вызывает вазоконстрикцию, уменьшая
общий почечный кровоток, при этом происходит перераспределение
кровотока в пользу мозгового вещества почки.
Нервная регуляция. По сравнению с гуморальными факторами
нервная регуляция почечного кровотока выражена меньше. Постганглио-
нарные симпатические нервные волокна локализованы в перивазальной
ткани основной, междолевых, междольковых артерий и достигают
артериол коркового слоя, реализуя констрикторные эффекты через
а-адренорецепторы. Сосуды почки, особенно мозгового слоя, иннервируются
симпатическими холинергическими нервными волокнами, которые оказывают
вазодилататорный эффект.
Миогенная регуляция обеспечивает в основном ауторегуляцию
кровоснабжения почек. Миогенными реакциями прегломерулярных
сосудов обусловливается относительно постоянный уровень коркового
кровотока в диапазоне колебаний системного артериального давления крови в
пределах от 70 до 180 мм рт. ст.
9.1.5.9. Скелетные мышцы
Большая масса скелетных мышц (около 40 % массы тела) обусловливает
необходимость обеспечения значительного кровотока в мышцах при их
работе. В покое интенсивность кровотока в скелетных мышцах колеблется от
2 до 5 мл/100 г/мин, что составляет 15—20 % величины сердечного
выброса. Функциональный резерв для увеличения кровотока в мышцах при
физической работе обеспечивается высоким исходным базальным тонусом
сосудов скелетных мышц. Кровоток в мышцах при их интенсивной работе
может возрасти более чем в 30 раз, достигая величины 100—120 мл/100 г/
мин (80—90 % сердечного выброса). Потребление кислорода мышцами
при этом увеличивается с 0,3 до 6 мл/100 г/мин. Возросшая интенсивность
метаболических процессов обеспечивается значительным увеличением
числа функционирующих капилляров. В покое открыто 20—30 %
имеющихся в мышце капилляров. При работе скелетных мышц число
функционирующих в них капилляров увеличивается в 2—3 раза.
Миогенная регуляция. Высокий исходный тонус сосудов
скелетных мышцах обусловлен, главным образом, миогенной активностью
сосудистой стенки и в меньшей степени — влиянием симпатических вазокон-
стрикторов (15—20 % тонуса в покое нейрогенного происхождения).
9. Функции систем кровообращения и лимфообращения • 453
Нервная регуляция сосудов скелетных мышц осуществляется через
симпатические адренергические вазоконстрикторы. В артериях скелетных
мышц имеются а- и р-адренорецепторы, в венах — только а-адренорецеп-
торы. Активизация а-адренорецепторов приводит к сокращению миоцитов
и сужению сосудов, активизация р-адренорецепторов — к расслаблению
миоцитов и расширению сосудов. Сосуды скелетных мышц иннервируют-
ся также симпатическими холинергическими нервными волокнами,
возбуждение которых оказывает дилататорный эффект. В покое сосуды
скелетных мышц находятся под тоническим влиянием симпатических вазоконст-
рикторов.
Гуморальная регуляция. Наиболее мощным фактором
гуморальной регуляции тонуса сосудов являются метаболиты, накапливающиеся в
работающей мышце. В межклеточной жидкости и в оттекающей от мышцы
венозной крови при этом резко падает содержание кислорода, растет
концентрация угольной и молочной кислот, аденозина. Среди факторов,
обеспечивающих снижение тонуса сосудов в мышце при ее работе, ведущими
являются быстрое повышение внеклеточной концентрации ионов калия,
гиперосмолярность, а также снижение рН тканевой жидкости.
Серотонин, брадикинин, гистамин оказывают сосудорасширяющее
действие в скелетных мышцах. Адреналин при взаимодействии с а-адреноре-
цепторами вызывает констрикцию, с р-адренорецепторами — дилатацию
мышечных сосудов, норадреналин обладает сосудосуживающим действием
через а-адренорецепторы. Ацетилхолин и АТФ приводят к выраженной
дилатации сосудов скелетных мышц.
9.1.5.10. Сопряженные функции сосудов
Органным сосудам присущи три сопряженные функции: резистивная,
емкостная и обменная. Резистивная функция присуща сосудам всех органов
и тканей и определяет величину сопротивления кровотоку. В естественных
условиях циркуляции изменения резистивной функции гладких мышц
сосудов в регионах определяет степень перераспределения кровотока между
ними.
В артериальном отделе сосудистого русла, играющем наиболее
существенную роль в резистивной функции сосудов, содержится только 15—18 %
циркулирующей крови. В то же время в области большого объема (или, по
другой классификации, — низкого давления) находится 70—75 % крови.
В связи с этим для понимания механизмов и закономерностей органного
кровообращения немаловажное значение имеет емкостная функция
сосудов.
Главной отличительной особенностью венозных сосудов по сравнению
с артериальными является то, что они имеют по крайней мере две четко
выраженные функции: емкостную и резистивную, тогда как артериальным
сосудам присуща лишь резистивная функция, а емкостная практически
сведена к минимуму. Емкостная функция венозных сосудов направлена на
формирование венозного возврата крови к сердцу и объема
циркулирующей крови.
9.1.6. Микроциркуляция (микрогемодинамика)
К микроциркуляторному руслу относят сосуды: распределители
капиллярного кровотока (терминальные артериолы, метартериолы, артериовенуляр-
ные анастомозы, прекапиллярные сфинктеры) и обменные сосуды (капил-
454 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Эндотелиапьные клетки Капиллярная мембрана
Межклеточный цемент Поры
Через поры
Рис. 9.24. Проницаемость капилляров для жидкости, белков и клеток крови.
ляры и посткапиллярные венулы). В месте отхождения капилляров от ме-
тартериол имеются одиночные гладкомышечные клетки, получившие
функциональное название «прекапиллярные сфинктеры».
Стенки капилляров гладкомышечных элементов не содержат. В
капиллярах наиболее благоприятные условия для обмена между кровью и
тканевой жидкостью: высокая проницаемость стенки капилляров для воды и
растворенных в плазме веществ; большая обменная поверхность
капилляров; гидростатическое давление, способствующее фильтрации на
артериальном и реабсорбции на венозном концах капилляра; медленная
линейная скорость кровотока, обеспечивающая достаточный контакт крови с
обменной поверхностью капилляров.
Стенки капилляров образованы расположенными в один слой эндотели-
альными клетками (рис. 9.24). В зависимости от ультраструктуры стенок
выделяют три типа капилляров: соматический, висцеральный, синусоидный.
Стенка капилляров соматического типа образована сплошным слоем эндо-
телиальных клеток, в мембране которых имеется большое количество
мельчайших пор диаметром 4—5 нм. Этот тип капилляров характерен для
кожи, скелетных и гладких мышц, миокарда, легких. Стенка капилляров
соматического типа легко пропускает воду, растворенные в ней
кристаллоиды, но мало проницаема для белка. Клетки капилляров висцерального
типа имеют в мембране эндотелия «окошки» — фенестры, которые
представляют собой пронизывающие цитоплазму эндотелиальных клеток
отверстия, диаметром 40—60 нм, затянутые тончайшей мембраной. Такой
тип капилляров представлен в почках, кишечнике, эндокринных железах,
т. е. органах, в которых всасывается большое количество воды с
растворенными в ней веществами. Капилляры синусоидного типа имеют
прерывистую стенку с большими просветами. Диаметр капилляров — синусоид —
колеблется от 1 до 4 мкм. Такой тип капилляров обеспечивает высокую
9. Функции систем кровообращения и лимфообращения • 455
проницаемость не только для жидкости, но и для белка и клеток крови.
Он имеется в селезенке, печени, костном мозге.
Состояние капиллярного русла характеризуется отношением числа
функционирующих капилляров к нефункционирующим. При увеличении
числа функционирующих капилляров возрастает величина их обменной
поверхности, снижается диффузионное расстояние между капиллярами и
клетками и улучшается кровоснабжение ткани. Несмотря на небольшую
толщину стенки капилляров (0,7—1,5 мкм), растяжимость их мала. Это
обусловлено механическими свойствами окружающей капилляр
соединительной ткани органа.
Гидростатическое давление на артериальном конце «усредненного»
капилляра равно примерно 30 мм рт. ст., на венозном— 10—15 мм рт. ст.
Этот показатель варьирует в различных органах и тканях и зависит от
соотношения пре- и посткапиллярного сопротивления, которое и определяет
его величину. Так, в капиллярах почек он может достигать 70 мм рт. ст., а
в легких — только 6—8 мм рт. ст.
Транскапиллярный обмен веществ обеспечивается путем диффузии,
фильтрации-абсорбции и микропиноцитоза. Скорость диффузии высока:
60 л/мин. Легко осуществляется диффузия жирорастворимых веществ
(С02, 02), водорастворимые вещества попадают в интерстиций через поры,
крупные вещества — путем пиноцитоза.
Второй механизм, обеспечивающий обмен жидкости и растворенных в
ней веществ между плазмой и межклеточной жидкостью,—
фильтрация-абсорбция. Давление крови на артериальном конце капилляра способствует
переходу воды из плазмы в тканевую жидкость. Белки плазмы, создавая
онкотическое давление, равное примерно 25 мм рт. ст., задерживают выход
воды. Гидростатическое давление тканевой жидкости около 3 мм рт. ст.,
онкотическое — 4 мм рт. ст. На артериальном конце капилляра
обеспечивается фильтрация, на венозном — абсорбция. Между объемом жидкости,
фильтрующейся на артериальном конце капилляра и абсорбирующейся в
венозном конце, существует динамическое равновесие.
Линейная скорость кровотока в сосудах микроциркуляторного русла
мала—от 0,1 до 0,5 мм/с. Низкая скорость кровотока обеспечивает
относительно длительный контакт крови с обменной поверхностью капилляров и
создает оптимальные условия для обменных процессов.
Отсутствие мышечных клеток в стенке капилляров указывает на
невозможность активного сокращения капилляров. Пассивное сужение и
расширение капилляров, величина кровотока и количество
функционирующих капилляров зависят от тонуса гладкомышечных структур
терминальных артериол, метартериол и прекапиллярных сфинктеров.
Процессы транскапиллярного обмена жидкости в соответствии с
уравнением Старлинга (рис. 9.25) определяется силами, действующими в
области капилляров: капиллярным гидростатическим давлением (Рс) и
гидростатическим давлением интерстициальной жидкости (Pi), разность
которых (Рс — Pi) способствует фильтрации, т. е. переходу жидкости из внутри-
сосудистого пространства в интерстициальное; коллоидно-осмотическим
давлением крови (Пс) и интерстициальной жидкости (Ш), разность
которых (Пс — Ш) способствует абсорбции, т. е. движению жидкости из тканей
во внутрисосудистое пространство, а — осмотический коэффициент
отражения капиллярной мембраны, который характеризует реальную
проницаемость мембраны не только для воды, но и для растворенных в ней
веществ, а также белков. Если фильтрация и абсорбция сбалансированы, то
наступает «старлинговое равновесие».
456 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Своеобразие строения
терминального сосудистого русла
различных органов и тканей отражает и
зависит от их функциональных
особенностей, прежде всего от уровня
обмена кислорода, интенсивности
процессов метаболизма. Так, в
различных тканях и органах
капилляры образуют сеть определенной
плотности в зависимости от их
метаболической активности. На
основании этих данных введено понятие
«критическая толщина тканевого
слоя» — наибольшая толщина
ткани между двумя капиллярами,
которая обеспечивает оптимальный
транспорт кислорода и эвакуацию
продуктов метаболизма. Чем интен-
AV/At = ± CFG {(Рс - Р,) - а (яс - к)} сивнее обменные процессы в
органе, тем меньше критическая тол-
Рис. 9.25. Транскапиллярный обмен щина ткани, т. е. между этими по-
жидкости (по Старлингу). казателями существует обратно
ИП — интерстициальное пространство. пропорциональная зависимость. В
Остальные обозначения — в тексте. большинстве паренхиматозных
органов величина этого показателя
составляет всего 10—30 мкм, а в
органах с замедленными процессами обмена она возрастает до 1000 мкм.
Для оценки функциональной активности шунтирующих сосудов
(артериовенозных анастомозов) используют возможность перехода частиц,
превышающих по размерам диаметр капилляров, из артериального отдела
сосудистого русла в венозный.
Рассчитано, что кровоток через анастомозы во много раз превышает
кровоток по капиллярам. Так, через анастомоз диаметром 40 мкм может
пробрасываться в 250 раз больше крови, чем через капилляр такой же длины,
но диаметром 10 мкм. Диаметр артериовенозных анастомозов в разных
органах колеблется в широких пределах (например, в сердце — 70—170 мкм, в
почках — 30—440 мкм, в печени — 100—370 мкм, в тонком кишечнике —
20—180 мкм, в легких — 28—500 мкм, в скелетных мышцах — 20—40 мкм).
9.1.7. Центральная регуляция кровообращения
Нервная регуляция сердечно-сосудистой системы является мощным и
быстрым путем изменения кровообращения. Нервные влияния на гладкомы-
шечные клетки сосудов являются высшими по сравнению с влиянием на
сосуды гуморальных веществ, содержащихся в крови, поскольку первые
обеспечивают не только быструю, но и, если необходимо, локализованную
регуляцию.
Нормальное функционирование системы кровообращения в условиях
постоянно меняющихся внешних воздействий осуществляется только при
участии механизмов регуляции (управления, контроля). Непременным
условием рассматриваемого вопроса является цель регуляции (управления).
В физиологии принято употреблять выражение не «цель», а
«физиологическое значение (роль)» регуляторного механизма.
9. Функции систем кровообращения и лимфообращения • 457
Две части системы управления — управляющее устройство и объект
управления — образуют вместе контур управления. В кровообращении в
качестве объекта управления можно выделить капиллярное русло и течение
крови по нему, обеспечивающие питание тканей, тогда управляющими
устройствами являются отделы сердечно-сосудистой системы и свойства
крови, обеспечивающие необходимый кровоток в капиллярном русле в
ходе быстротекущих событий. Однако большинство авторов в качестве
объекта управления в системе кровообращения рассматривают системное
артериальное давление. Поддержание артериального давления на
постоянном уровне является залогом обеспечения нутритивной функции
системой. Другие авторы объектом управления в системе считают сердечный
выброс. В любом из этих случаев на первый план выступает рефлекторная
регуляция кровообращения.
9.1.7.1. Рефлекторная регуляция кровообращения
Роль каротидных синусов в регуляции кровообращения была доказана тем,
что при раздражении ветви языкоглоточного нерва — нерв каротидного
синуса, имело место рефлекторное замедление частоты сердечных
сокращений и независимое от него снижение артериального давления. В
дальнейшем была открыта барорецепторная область не только в каротидном
синусе, но и в дуге аорты, чувствительные волокна от которой проходят в
составе аортального нерва.
При двустороннем повышении давления в изолированных каротидных
синусах на 15 мм рт. ст. происходят снижение системного артериального
давления и замедление частоты сокращений сердца. Снижение давления в
обоих каротидных синусах до 30 мм рт. ст. (пережатие сонных артерий)
сопровождается значительным повышением АД и ростом частоты
сокращений сердца. Степень вовлечения артериальных сосудов различных
регионарных областей в рефлекторную барорецепторную реакцию различна.
Наиболее мощные вазомоторные эффекты отмечены в скелетных мышцах,
менее выражены реакции сосудов брыжейки, кожи и почек. Изменения
сердечного выброса при синокаротидных барорефлексах невелики.
Указанные рефлексогенные зоны чувствительны и к изменениям
напряжения в крови 02, С02 и рН. Стимулятором хеморецепторов этих
областей являются также изменения температуры крови, кровопотеря, а
также некоторые вещества (цианиды, никотин, лобелии, серотонин и др.).
При раздражении каротидных хеморецепторов повышается
сопротивление сосудов, замедляется частота сердечных сокращений и снижается
насосная функция сердца, повышается артериальное давление, кровоток в
коронарных сосудах увеличивается. Наименьшее сужение сосудов при
этом рефлексе отмечено в сосудах почек и мозга, наибольшее — в сосудах
бассейна подвздошной артерии и конечностей.
В ответ на раздражение аортальных хеморецепторов увеличивается
частота сердечных сокращений, повышается АД, суживаются сосуды, причем
более выражено в брыжеечной и почечной областях, менее — в бедренной
артерии.
9.1.7.2. Спинальный уровень регуляции
Эффекторными клетками, осуществляющими регуляцию сердца и сосудов
на уровне спинного мозга, являются симпатические преганглионарные
нейроны. Они обладают спонтанной фоновой импульсной активностью,
458 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
частота которой коррелирует с изменениями частоты сокращений сердца и
пульсовыми колебаниями артериального давления. Спинальные нейроны
представляют собой важное промежуточное звено по пути нисходящих
нейрогенных влияний, адресованных эффекторам в сердечно-сосудистой
системе. Ядра боковых рогов спинного мозга могут обеспечивать
преобразование нервных импульсов по дивергентному и конвергентному типу.
Перерезка в эксперименте на животных спинного мозга на уровне
шейных и верхних грудных сегментов приводит к значительному снижению
(до 60 мм рт. ст.) артериального давления. Однако если перерезка
выполнена в щадящих условиях препаровки (например, при помощи
ультразвукового ножа), уже через несколько часов давление восстанавливается
практически до нормальных величин. В этих же условиях
восстанавливаются и сосудодвигательные рефлексы. Эти факты свидетельствуют о том,
что спинной мозг при определенных условиях может являться уровнем
замыкания рефлексов сердечно-сосудистой системы. В то же время в
естественных условиях рефлексы сердечно-сосудистой системы осуществляются
при обязательном участии бульбарных и гипоталамических образований
головного мозга.
9.1.7.3. Бульварный уровень регуляции
Современные представления о бульбарных механизмах регуляции
кровообращения основаны на исследованиях, в которых показано влияние как
перерезок на разных уровнях, так и стимуляции различных бульбарных
структур на артериальное давление и частоту сердечных сокращений, а
также на импульсации в симпатических и парасимпатических нервах.
Раздражение продолговатого мозга и варолиева моста оказывает либо прес-
сорные, либо депрессорные изменения АД в зависимости от локализации
раздражающих электродов: прессорные зоны располагаются, как правило,
ростральнее и латеральнее депрессорных. При перерезке на уровне ядер
лицевого нерва отделяется расположенная ростральнее часть прессорнои
области, тогда как депрессорная остается интактной. В этом случае
снижается артериальное давление и уменьшается импульсация в эфферентных
вегетативных нервах. Перерезка продолговатого мозга на уровне задвижки
ведет к еще большему снижению давления и полному прекращению
импульсации по вегетативным нервам. Бульбарная медиальная депрессорная
область оказывает угнетающее тоническое влияние на спинальные пре-
ганглионарные нейроны, способные к спонтанной импульсивной
активности.
Латеральные участки бульбарной ретикулярной формации содержат
скопления спонтанно активных нейронов, которые через нисходящие пути
спинного мозга оказывают стимулирующее влияние на спинальные пре-
ганглионарные симпатические нейроны. Эти нейроны образуют
латеральную «прессорную» область продолговатого мозга. Функции этих нейронов
осуществляются в реципрокном взаимодействии с нейронами медиальной
«депрессорной» зоны.
Указанный медуллярный комплекс, реализующий влияния на
сердечнососудистую систему через симпатические нервы, называют бульварным со-
судодвигательным центром. Функционально он включает в себя и
структуры дорсального ядра блуждающего нерва, обеспечивающие тонические
кардиоингибирующие влияния. Поэтому говорят о едином бульбарном
центре сердечно-сосудистой системы, получающем информацию от
различных рецепторных зон и обеспечивающем поддержание циркуляторного
9. Функции систем кровообращения и лимфообращения • 459
гомеостазиса. Это достигается благодаря рещшрокному взаимодействию
симпатических и парасимпатических рефлекторных влияний на сердце, а
также дозировкой тонических констрикторных влияний симпатических
нервов на сосуды.
В вентролатеральных отделах продолговатого мозга сосредоточены
образования, соответствующие по своим характеристикам тем
представлениям, которые вкладывают в понятие «вазомоторный центр». Здесь
сконцентрированы нервные элементы, играющие ключевую роль в тонической и
рефлекторной регуляции кровообращения. В вентральных отделах
продолговатого мозга расположены нейроны, изменение тонической активности
которых ведет к активации симпатических преганглионарных нейронов.
Структуры этих отделов мозга контролируют выброс вазопрессина
клетками супраоптического и паравентрикулярного ядер гипоталамуса.
Доказаны проекции нейронов каудальной части вентральных отделов
продолговатого мозга к клеткам его ростральной части, что
свидетельствует о возможности тонического угнетения активности этих клеток.
Функционально значимы связи структур вентральных отделов продолговатого
мозга с ядром солитарного тракта, которое играет ключевую роль в
обработке афферентации от хемо- и барорецепторов сосудов.
К вентральным отделам продолговатого мозга информация поступает
как от его структур — ядер солитарного тракта, area postrema,
вестибулярных ядер, ядер шва, обоюдного ядра, так и от клеток спинного мозга и
супрабульбарных структур центральной нервной системы. Наиболее
значимыми в функциональном плане для структур ростральной части
вентральных отделов являются их связи с симпатическими преганглионарными
нейронами спинного мозга, а для структур каудальных вентролатеральных
отделов — восходящие проекции к нейросекреторным клеткам
гипоталамуса.
Структуры ростральной части вентральных отделов продолговатого
мозга играют ключевую роль в тоническом контроле уровня артериального
давления. Стимуляция нейронов рострального вентролатерального ядра
вызывает подъем АД, тахикардию, торможение барорецепторных
рефлексов, высвобождение адреналина из надпочечников и аргинин-вазопресси-
на из нейросекреторных клеток гипоталамуса. Возбуждение нейронов
каудальной части вентральных отделов ведет к снижению системного АД.
Структуры вентральных отделов участвуют в контроле сердечной
деятельности и через обоюдное ядро блуждающего нерва.
Нейроны ростральной части вентральных отделов продолговатого мозга
являются звеном дуг собственных и сопряженных сосудистых рефлексов, а
нейроны каудальной части — модулируют реализацию на сосуды
указанных рефлексов.
Сердечно-сосудистый центр продолговатого мозга оказывает
тоническое возбуждающее влияние на преганглионарные симпатические
нейроны тораколюмбального отдела спинного мозга. Однако его влияние
является не единственными связями, конвергирующими на спинальных
вегетативных нейронах. В медуллярной области происходит переключение
путей нисходящих возбуждающих и тормозных кардиоваскулярных влияний,
исходящих из вышележащих отделов центральной нервной системы.
Собственная тоническая активность спинальных нейронов в норме зависит от
нисходящих бульбарных и супрабульбарных влияний, эти нисходящие
влияния полностью доминируют над их спонтанной активностью.
Несмотря на то что сегментарные спинальные вазомоторные рефлексы
(например, побледнение кожи над областью внутрибрюшинной воспалитель-
460 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ной реакции) могут иметь место, замыкание собственных
сердечно-сосудистых рефлексов происходит не ниже, чем на бульбарном уровне.
Однако и бульбарный уровень регуляции в естественных условиях
модулируется сложной совокупностью нисходящих к нему влияний, среди которых
ведущую роль играют нейрогуморальные влияния гипоталамического
происхождения.
9.1.7.4. Гипоталамические влияния
Традиционно гипоталамус делят на передний — депрессорный
(парасимпатический, трофотропный) и задний — прессорный (симпатический, эрго-
тропный), однако это деление весьма условно. Выраженные прессорные
реакции могут быть вызваны и с передних отделов гипоталамуса (супраоп-
тическое ядро). Депрессорные или прессорные эффекты можно получить в
зависимости от частоты подаваемых на структуру импульсов
(депрессорные — при низких частотах — 20—40 имп/с, прессорные — 60—100 имп/с),
функционального состояния центров (вид, глубина наркоза) и от
исходного тонуса сосудов.
Опыты на животных с перерезками, коагуляцией и раздражением гипо-
таламических структур и нисходящих путей показали, что имеются два
основных вазоконстрикторных пути: от переднего гипоталамуса (от супраоп-
тического ядра по срединному пучку переднего мозга и по периферии вен-
тромедиального ядра) и от заднего гипоталамуса (от периферии III
желудочка над маммилярными телами и дорсолатеральнее субталомической
области: неопределенная зона и поля Фореля 1 —2 через перивентрикулярные
безмякотные волокна). Каудальнее оба пути проходят в центральном сером
веществе сильвиева водопровода, в покрышке мозга и в продольном дор-
зальном пучке спускаются к дну IV желудочка. Здесь образуются синапсы
с клетками ядра блуждающего нерва и вазомоторного центра. На
протяжении этих путей отходят многочисленные коллатерали в ретикулярную
формацию ствола мозга. Таким образом, первое симпатическое переключение
имеет место в ретикулярной формации продолговатого мозга, второе — на
вазомоторных нейронах спинного мозга (общий конечный путь сосудодви-
гательных реакций).
Наиболее универсальным механизмом реакции сердечно-сосудистой
системы на возбуждение гипоталамуса является активация симпатической
системы. Типичным результатом возбуждения гипоталамических структур
в этом случае является альфа-адренергическая констрикция
периферических сосудов в сочетании с положительными хронотропными и инотроп-
ными влияниями на сердце.
Симпатические эффекторы, обусловленные гипоталамическими
влияниями, вызывают и дилатацию периферических сосудов. Это достигается
симпатической холинергической или р-адренергической дилатацией, а
также результатом центрального нисходящего гипоталамического
торможения бульбарных сердечно-сосудистых центров.
Гипоталамические влияния на кровообращение реализуются и
гуморальным путем. Возбуждение гипоталамуса сопровождается выделением
вазопрессина в гипофизе и адреналина в надпочечниках с их
последующим действием на сердце и сосуды, а также выделением ренина почками в
результате прямых нейрогенных влияний на их юкстагломерулярный
аппарат. Конечным результатом этого процесса является повышение
артериального давления за счет усиленного образования и нарастания в крови
ангиотензина II.
9. Функции систем кровообращения и лимфообращения • 461
Гипоталамической отдел регуляции кровообращения оказывает
дифференцированное влияние на сердце и некоторые сосудистые бассейны. Так,
раздражение гипоталамических центров «защитных» реакций организма
вызывает увеличение сердечного выброса, повышение артериального
давления, сужение сосудов внутренних органов, но при этом имеет место
расширение артериальных сосудов скелетных мышц. Стимуляция пищевых
центров в латеральном гипоталамусе приводит, наоборот, к расширению
сосудов желудочно-кишечного тракта и их сужению в скелетных мышцах.
Гипоталамические нейроны получают сигналы практически от всех
экстеро- и интероцепторов организма, включая артериальные барорецеп-
торы, импульсы от которых поступают в передний гипоталамус. Кроме
того, гипоталамические нейроны получают информацию об изменениях
внутренней среды организма (температуры, кислотности, осмолярности
и др.). Следовательно, существует еще одна рефлекторная функция
гипоталамуса, физиологический смысл которой заключается в обработке и
интеграции этой информации, и включения в общую реакцию
сердечно-сосудистой системы, направленную на поддержание гомеостазиса. Эта
функция гипоталамуса включает в себя и контроль деятельности
нижележащих бульбарных и спинальных структур, ответственных за регуляцию
кровообращения.
Важная роль гипоталамуса заключается также в координации
кровообращения с другими висцеральными и соматическими функциями. Так,
эмоциональным состояниям человека, связанным с активацией
гипоталамических структур, соответствуют и определенные изменения
гемодинамики. Поэтому считается, что гипоталамус осуществляет координацию сома-
томоторных и вегетативных проявлений эмоционального поведения.
9.1.7.5. Участие лимбических структур
Лимбическая система, или «висцеральный мозг», представляет собой
комплекс структур на медиальной поверхности полушарий мозга. При
электрическом раздражении передних отделов системы имеет место умеренная
гипотензия и брадикардия. Стимуляция переднего отдела лимбической
коры вызывает депрессорную реакцию с верхних участков, а с базальных
(нижних) участков провоцируются прессорные ответы.
Выраженная гипотензия и брадикардия зарегистрированы при
раздражении прозрачной перегородки, функционально относящейся к
лимбической системе. Эта реакция аналогична эффектам раздражения сердечно-
тормозного центра гипоталамуса и является одним из элементов
центрального комплекса экстренного снижения сосудистого тонуса и частоты
сокращений сердца.
Для стимуляции гиппокампа характерны «парасимпатические ответы»
(снимаемые атропином гипотензия и брадикардия). Функционально к
ростральной части гиппокампа примыкает миндалевидно-ядерный (амигда-
лярный) комплекс, имеющий тесные связи с заднелатеральным
гипоталамусом. Амигдалярные влияния модулируют чрезмерные гипоталамические
реакции. Для раздражения самого миндалевидного комплекса характерны
дифференцированные влияния на сердце и тонус сосудов: брадикардия
предшествует позже развивающейся гипертензии, т. е. изменения ритма
сердца не являются вторичными, обусловленными барорецептивными
рефлексами. Через амигдалу и передние отделы гипоталамуса реализуются
рефлекторные изменения кровообращения при раздражении афферентных
волокон блуждающего нерва.
462 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
9.1.7.6. Кортикальные влияния
Изучению роли коры больших полушарий в регуляции кровообращения
уделялось пристальное внимание, но результаты этих исследований до
настоящего времени весьма противоречивы. В экспериментах на животных
удаление обоих полушарий не вызывает каких-либо существенных
изменений кровообращения. Электрическая стимуляция участков лобной и
теменной областей коры ведет к изменениям артериального давления в
результате сужения или расширения сосудов, причем, в зависимости от
параметров раздражения стимуляция одних и тех же точек, может вызвать как
вазоконстрикцию, так и вазодилатацию.
Влияние коры больших полушарий на сердце связано с высшей
нервной деятельностью человека — реализацией эмоциональных,
поведенческих реакций и условных рефлексов. Последние могут образовываться на
основе сопряженных кардиальных рефлексов. Изменения
кровообращения, обусловленные собственными рефлексами сердечно-сосудистой
системы, воспроизвести условнорефлекторным путем не удалось. Условно-
рефлекторные реакции сердца являются составной частью сложных
поведенческих рефлексов. У человека эти реакции могут быть вызваны и
словесными раздражителями (речевыми сигналами). Однако произвольно
изменить параметры сердечной деятельности возможно только косвенно
через заведомо управляемые системы: дыхание или скелетную мускулатуру, а
также в некоторых случаях — изменяя эмоциональное состояние
организма.
Большее значение имеют кортикальные механизмы в реализации
изменений кровообращения при стрессорных и невротических состояниях
человека.
9.1.7.7. Общая схема центральной регуляции
На рис. 9.26 представлена общая схема организации центральных звеньев
нервной регуляции кровообращения. Сердечно-сосудистый центр
продолговатого мозга состоит из двух зон (А и Б) одна из которых определяет
сужение сосудов (А'), ускорение и усиление сердцебиения (АН), тогда как
другая — расширение сосудов (Б') и замедление частоты сокращений сердца
(БП). Тонически активные нейроны зоны А непосредственно или через
промежуточные нейроны возбуждают преганглионарные и ганглионарные
симпатические нейроны, иннервирующие сердце и сосуды, и в то же время
тормозят нейроны зоны Б. Последние активируются сигналами барорецеп-
торов сердечно-сосудистой системы. Через короткие внутрицентральные
пути нейроны зоны Б тормозят нейроны зоны А, а посредством нисходящих
тормозных путей — и преганглионарные симпатические нейроны. Кроме
того, через моторное ядро блуждающих нервов нейроны зоны Б влияют на
ганглионарные парасимпатические нейроны сердца. В результате обе зоны
(А и Б), получая основную сигнализацию от рецепторов
сердечно-сосудистой системы, являются основой поддержания кровообращения, сочетанно
подвергая сердце тоническому контролю тормозных вагусных и
возбуждающих симпатических волокон, тогда как постоянный контроль сосудов
обеспечивается только симпатическими вазоконстрикторными волокнами.
Афферентная нервная система является источником сигналов
собственных и сопряженных рефлексов. Вход первых ограничен продолговатым
мозгом, причем барорецепторы сердечно-сосудистой системы связаны с
зоной Б, а хеморецепторы — с зоной А.
9. Функции систем кровообращения и лимфообращения • 463
Кора
Спинальные центры
Сосуды и сердце
Афферентные входы
Сердце
Рис. 9.26. Схема организации центральных звеньев нервной регуляции
сердечнососудистой системы (объяснение в тексте).
Поскольку сердечно-сосудистый центр продолговатого мозга регулирует
основные параметры системной гемодинамики, даже будучи отключенным
от связей с вышележащими нервными структурами, он функционирует как
истинный «центр», обладающий значительной независимостью.
Следовательно, супрабульбарные структуры признаются несущественными ни для
прямой тонической регуляции кровообращения, ни для осуществления
сердечно-сосудистых рефлексов. В то же время при общих реакциях
организма (поведенческих, эмоциональных, стрессорных и др.) кора мозга,
гипоталамус и другие супрабульбарные структуры могут вмешиваться в
деятельность сердечно-сосудистой системы, изменяя путем нисходящих
(модулирующих) влияний возбудимость бульбарного центра.
Вазомоторные центры спинного мозга самостоятельного значения в
регуляции кровообращения не имеют. Действующими элементами спиналь-
ного уровня являются лишь симпатические преганглионарные нейроны,
которые входят в состав эфферентного звена бульбарных рефлекторных
дуг.
9.2. Лимфообращение
Основной функцией лимфатической системы является резорбция из ин-
терстиция белков и других веществ, вышедших в него из кровеносного
русла и неспособных вновь вернуться в кровоток через кровеносные
капилляры, с последующей транспортировкой этих веществ и жидкости по
лимфатическим сосудам в венозную систему.
464 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Поскольку в указанной системе транспорт жидкости и включенных в
нее веществ осуществляется по пути: кровеносное русло—интерстиций—
лимфатические сосуды (лимфообразование и лимфоток)—кровеносное
русло, это является основанием для использования термина
«лимфообращение».
Физиологическая характеристика интерстиция и лимфообразования
представлена в главе 2, поэтому здесь рассматриваются только вопросы
лимфотока.
У взрослого человека за сутки из кровеносного русла в интерстиций
выходит около 20 л жидкости, из которой 1,5—2,5 л в виде лимфы
возвращается в кровеносную систему по лимфатическим сосудам. Вместе с
жидкостью из крови в интерстиций за сутки мигрирует 50—100 % всех
циркулирующих в плазме белков. Значительная часть их должна возвратиться в
кровеносное русло, что и достигается благодаря функционированию
лимфатической системы, регулирующей экстраваскулярное обращение
плазменных белков. Увеличение объема интерстициальной жидкости ведет к
повышению резорбирующей функции лимфатической системы. При этом
деятельность ее направлена на нормализацию объема интерстициальной
жидкости как путем ускорения вывода избытка ее из тканей в кровь, так и
частичного депонирования в лимфатической системе.
Находящаяся в интерстиций жидкость движется по направлению к
лимфатическим капиллярам по так называемым соединительнотканевым
пре- или паралимфатическим транспортным путям. Примером такого
пути могут служить пространства Диссе в печени, с одной стороны
ограниченные кровеносными синусоидами, а с другой — «балочками» из клеток
печени. Лимфатические капилляры окружают «кольцом» фрагменты сети
кровеносных капилляров и топографически связаны с посткапиллярными
венулами. Это создает предпосылки для возникновения градиентов
давления на границе раздела интерстициальная жидкость — терминальная
лимфа, определяющих в интерстициальном пространстве направление
перемещения жидкости и белка и поступление их в корни
лимфатической системы. Последние сообщаются с интерстициальным
пространством через отверстия в эндотелиальной выстилке лимфатических
капилляров.
Основными путями попадания крупно- и жидкодисперсных частиц в
просвет лимфатических капилляров являются: а) места соединения эндоте-
лиальных клеток, б) пиноцитозные пузырьки, в) цитоплазма
эндотелиальной клетки. Когда гидростатическое давление в тканях становится выше,
чем в лимфатическом капилляре, проникающая в него жидкость
растягивает межэндотелиальные соединения. При этом эндотелиальная клетка, не
связанная с фиксирующими волокнами и контактирующая в обычных
условиях с другой клеткой, свободно отгибается в просвет сосуда, открывая
для крупных молекул доступ в лимфатический капилляр. Этому
содействует приводящее к накоплению интерстициальной жидкости повышение
осмотического давления в интерстиций, при котором набухание тканей
вызывает натяжение фиксирующих волокон и расширение лимфатических
капилляров.
Макромолекулы и частицы диаметром 3—50 мкм проникают в просвет
лимфатических капилляров через эндотелиальные клетки с помощью пи-
ноцитозных пузырьков или везикул. Этим путем в лимфатические
капилляры поступают белки, хиломикроны и ионы.
9. Функции систем кровообращения и лимфообращения • 465
9.2.1. Лимфатические сосуды
Лимфатическая система состоит из мелких внутриорганных
лимфатических сосудов, отводящих лимфу из лимфатических капилляров;
внеорганных лимфатических сосудов, отводящих лимфу из органов в
лимфатические узлы; внеорганных лимфатических сосудов, отводящих лимфу из
лимфатических узлов; крупных лимфатических сосудов — стволов,
протоков, отводящих лимфу в венозную систему.
Форма лимфатических сосудов преимущественно цилиндрическая. Она
отличается от вида артерий и вен чередованием многочисленных,
сменяющих друг друга расширений и сужений, придающих им сходство с
четками, что объясняется наличием в этих сосудах многочисленных клапанов.
Клапаны лимфатических сосудов препятствуют обратному току лимфы.
Благодаря им при сокращении стенки лимфатического сосуда лимфа течет
только в центрипетальном направлении. Клапаны и стенка
лимфатического сосуда в структурном и функциональном отношении составляют единое
целое. Клапаны имеют створки — парные, расположенные друг против
друга полулунные складки интимы. Створки имеют два края, один из них
прикреплен к стенке сосуда в месте его сужения, другой — свободно
свисает в просвет сосуда.
Часть лимфатического сосуда между двумя клапанами называется лим-
фангион, или клапанный сегмент. В лимфангионе различают мышцесодер-
жащую часть, или мышечную манжетку, и область прикрепления клапана,
в которой мускулатура развита слабо или отсутствует.
Поскольку средняя и адвентициальная оболочки не имеют нервных
окончаний, активность лимфангионов считается миогенной.
Лимфатическим сосудам свойственны: фазные ритмические сокращения, медленные
волны, тонус. Фазное ритмическое сокращение представляет собой быстрое
сужение отдельного участка сосуда, сменяемое быстрым расслаблением.
Эта активность может быть спонтанной или вызванной (растяжением,
повышением температуры, гуморальными воздействиями). Фазные
ритмические сокращения следуют с частотой 10—20 в 1 мин.
Медленные волны представляют собой колебания просвета сосуда
неодинаковой продолжительности и амплитуды. Продолжительность медленной
волны может составлять от 2 до 5 мин. Эти волны лимфатических сосудов
непостоянны, появляются спонтанно или в ответ на действие вазоактив-
ных веществ.
Тонус лимфатических сосудов является отражением активности их
тонических клеток, модулируемой местными, гуморальными или нервными
факторами. В естественных условиях тонус гладких мышц лимфатических
сосудов обусловливает определенную жесткость их стенок, препятствуя
перерастяжению последних, создает исходный фон для фазных сокращений,
поддерживает внутрисосудистое давление, необходимое для реализации
фазной активности. Изменения тонуса лимфатических сосудов лежат в
основе регуляции объема лимфатической системы.
9.2.2. Лимфатические узлы
На объем и состав лимфы влияет наличие в системе лимфатических узлов.
У человека их примерно 460. Функции лимфатических узлов — гемопоэти-
ческая, иммунопоэтическая, защитно-фильтрационная, обменная, резерву-
арная, пропульсивная. Лимфатические узлы играют роль не только
механического, но и биологического фильтра, задерживающего поступление в
466 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
кровь инородных частиц, бактерий, клеток злокачественных опухолей,
токсинов, чужеродных белков. К узлу обычно подходят 2—4 приносящих
сосуда, а выходят 1—2 выносящих, поэтому количество послеузловой
лимфы в среднем в 3 раза меньше, чем доузловой. Сопротивление узлов току
перфузата в несколько раз больше, чем в лимфатических сосудах;
возможно, поэтому входящие в узел лимфатические сосуды обладают более
мощным слоем гладкомышечных клеток, чем выходящие. Роль узла
заключается не только в создании сопротивления току лимфы и замедления ее
движения, но и в депонировании лимфы, перераспределении жидкости между
кровью и лимфой. При возникновении венозного застоя лимфатические
узлы увеличиваются на 40—50 %.
Лимфатические узлы содержат гладкомышечные элементы и могут
поэтому сокращаться при нейрогуморальных или местных влияниях: они
обладают сходной с лимфатическими сосудами сократительной активностью.
Лимфатические узлы, кровоснабжение которых очень обильно,
содержат фагоцитарные клетки, разрушающие чужеродные вещества, которые
поступают в узлы с лимфой. Они также вырабатывают лимфоциты и
плазматические клетки и синтезируют антитела. Лимфатические узлы играют
роль мощных защитных барьеров против бактерий, попадающих в
организм.
9.2.3. Лимфоток
Содержимое двух больших терминальных каналов — правого и левого
грудных протоков — поступает, соответственно, в правую и левую
подключичные вены у их соединения с яремными венами. Скорость тока лимфы
варьирует в широких пределах в различных магистральных и органных
лимфатических сосудах. Так, лимфоток в грудном протоке собаки
составляет 0,03—0,4 мл/мин, в кишечнике — 0,06—0,2 мл/мин, в печени — 0,01 —
0,2 мл/мин, в миокарде — 0,01—0,6 мл/мин, в почке и конечности — 0,01—
0,7 мл/мин. У человека лимфоток в грудном протоке колеблется от 0,4 до
1,3 мл/кг/мин.
Скорость движения лимфы по сосудам зависит от ряда факторов: вне-
сосудистых — сокращений скелетных мышц, перистальтики кишечника,
дыхательных экскурсий грудной клетки, пульсаций рядом лежащих
артерий; внутрисосудистых — сил vis a tergo, лимфообразования,
сократительной активности стенок лимфатических сосудов.
Уменьшение онкотического давления белков плазмы или повышение
венозного (и, соответственно, капиллярного) давления ведет к увеличению
объема оттекающей лимфы. Любые водные нагрузки, вызывающие
увеличение объема циркулирующей крови, приводят к увеличению лимфотока.
Повышение венозного давления в портальной системе на 1—2 см водн. ст.
увеличивает лимфоток из печени в 10—12 раз.
9.2.4. Нервные и гуморальные влияния
Существование лимфатических сосудов только у позвоночных является
свидетельством наибольшего совершенства их интерстиция, а сам аппарат
лимфатических сосудов — наисовершеннейшей системой интерстиция,
которая не обязательна для примитивной жизни тканей (она отсутствует у
беспозвоночных).
Нервные волокна достигают лимфатических сосудов по ходу vasa vaso-
rum; степень развития гладких мышц лимфатических сосудов коррелирует
9. Функции систем кровообращения и лимфообращения • 467
с их иннервацией. Там, где мускулатура стенки лимфатических сосудов
достигает большей степени развития, она содержит мышечные и адвенти-
циальные вегетативные нервные сплетения.
Лимфатические сосуды снабжены адренергическими и холинергически-
ми нервными волокнами. Эти волокна из периадвентициальных сплетений
артерий распространяются на сопровождающие их вены и близлежащие
лимфатические сосуды, образуя из них сплетения. Интенсивность
иннервации лимфатических сосудов в 2—2,5 раза слабее, чем артерий. Адренер-
гические и холинергические волокна концентрируются в местах перехода
лимфатических сосудов малого диаметра в более крупные, а также в местах
расположения клапанов.
Возбуждение симпатических нервов вызывает сокращение
лимфатических сосудов, возбуждение парасимпатических — как сокращение, так и
расслабление (зависит от исходного тонуса и ритмической активности
сосуда). Грудной проток, брыжеечные лимфатические сосуды имеют
двойную иннервацию — симпатическую и парасимпатическую (волокна
блуждающего нерва), в то время как крупные лимфатические сосуды
конечностей иннервируются симпатическим отделом нервной системы. В
магистральных и периферических лимфатических сосудах учащение ритма
фазных сокращений достигается активацией а-адренорецепторов.
Торможение ритма спонтанных сокращений лимфатических сосудов
осуществляется двойным тормозным механизмом: посредством выделения АТФ и путем
активации р-адренорецепторов.
Адреналин вызывает усиление тока лимфы и повышение давления в
грудном протоке, увеличивает частоту и амплитуду спонтанных
сокращений лимфатических сосудов брыжейки. Внутривенное введение гистамина
увеличивает ток лимфы в грудном протоке и кишечном стволе, не только
влияя на моторику сосудов, но и повышая проницаемость лимфатических
капилляров. Малые концентрации гистамина стимулируют спонтанный
ритм и повышают тонус лимфатических сосудов, высокие концентрации —
тормозят фазную сократительную активность и увеличивают тоническое
сокращение. Аналогично действует на лимфатические сосуды гепарин.
АТФ тормозит ритмические сокращения грудного протока и брыжеечных
лимфатических сосудов. Серотонин вызывает сокращение просвета
грудного протока и брыжеечных сосудов, величина их сокращения зависит от
дозы серотонина. Спонтанные ритмические сокращения лимфатических
сосудов прекращаются в бескальциевой среде или при блокаде кальциевых
каналов. В отличие от фазных, тонические сокращения этих сосудов в
аналогичных условиях практически не уменьшаются. В низких концентрациях
ионы калия вызывают увеличение частоты фазных сокращений
лимфатических сосудов, в более высоких — увеличение тонических сокращений.
Гиперкальциевый раствор увеличивает амплитуду спонтанных
сокращений, гипокальциевый — подавляет амплитуду и ритм фазных сокращений.
Уменьшение в среде ионов натрия вызывает увеличение частоты
сокращений и снижение амплитуды спонтанных фазных сокращений
лимфатических сосудов. Наркоз подавляет их ритмическую активность.
Лимфу в экспериментальных исследованиях на животных или в
клинической лимфологии у человека забирают не из капилляров, что технически
очень сложно или невозможно, а из крупных доузловых или послеузловых
сосудов грудного протока, через который проходит лимфа, дренируемая от
3/4 тела. Лимфа из лимфатических сосудов существенно отличается от
капиллярной в силу проницаемости стенки лимфатических сосудов для
низкомолекулярных веществ и воды. Проницаемость лимфатических сосудов
468 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
уменьшается от периферии к центру, что связано с наличием у них базаль-
ной мембраны и гладкой мускулатуры, увеличением количества
эластических и коллагеновых волокон, уплотнением межэндотелиальных щелей.
Итак, основной движущей силой лимфотока является собственная
сократительная активность лимфатических сосудов и узлов. При этом
среднее внутрилимфатическое давление колеблется в небольших пределах и
обусловлено фазами сокращений лимфатических ососудов по типу
перистальтической волны. Нейрогуморальные влияния, физические и
фармакологические воздействия влияют на сократительную активность
лимфатических сосудов и узлов, на их емкость и пропускную способность, а также на
обменные процессы в лимфатических узлах.
ГЛАВА 10
Функции дыхательной системы
Дыхание в организме человека и животных представляет собой процесс
использования кислорода клетками тканей в биологическом окислении с
образованием энергии и конечного продукта дыхания — углекислого газа.
Дыхательная система человека обеспечивает газообмен между
атмосферным воздухом и легкими, в результате которого кислород из легких
поступает в кровь и переносится кровью к тканям организма, а
углекислый газ транспортируется от тканей в противоположном направлении.
В состоянии покоя тканями организма взрослого человека потребляется
примерно 0,3 л кислорода в 1 мин и в них образуется несколько меньшее
количество углекислого газа. Отношение количества образующегося в его
тканях С02 к потребляемому организмом количеству 02 называется
дыхательным коэффициентом, величина которого в обычных условиях равна
0,9. Поддержание нормального уровня газового гомеостазиса 02 и С02
организма в соответствии со скоростью тканевого метаболизма (дыхания)
является основной функцией дыхательной системы организма человека. Эта
система состоит из единого комплекса костной, хрящевой,
соединительной и мышечной тканей грудной клетки, дыхательных путей
(воздухоносный отдел легких), обеспечивающих движение воздуха между внешней
средой и воздушным пространством альвеол, а также легочной ткани
(респираторный отдел легких), которая обладает высокой эластичностью и
растяжимостью. В состав дыхательной системы входит собственный
нервный аппарат, управляющий дыхательными мышцами грудной клетки,
чувствительные и двигательные волокна нейронов вегетативной нервной
системы, имеющие терминали в тканях органов дыхания.
Местом газообмена между организмом человека и внешней средой
являются альвеолы легких, общая площадь которых достигает в среднем
100 м2. Альвеолы (порядка 3 • 108) находятся на конце мелких дыхательных
путей легких, имеют диаметр примерно 0,3 мм и плотно контактируют с
легочными капиллярами. Циркуляция крови между клетками тканей
организма человека, потребляющих 02 и продуцирующих С02, и легкими, где
эти газы обмениваются с атмосферным воздухом, осуществляется
системой кровообращения.
В организме человека дыхательная система выполняет дыхательную и
недыхательную функции. Дыхательная функция системы поддерживает
газовый гомеостазис внутренней среды организма в соответствии с уровнем
метаболизма его тканей. С вдыхаемым воздухом в легкие попадают
микрочастицы пыли, которые задерживаются слизистой оболочкой дыхательных
путей и затем удаляются из легких с помощью защитных рефлексов (кашель,
чиханье) и механизмов мукоцилиарного очищения (защитная функция).
Недыхательные функции системы обусловлены такими процессами, как
синтез (сурфактанта, гепарина, лейкотриенов, простагландинов),
активация (ангиотензина II) и инактивация (серотонина, простагландинов, нор-
адреналина) биологически активных веществ, при участии альвеолоцитов,
470 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
тучных клеток и эндотелия капилляров легких (метаболическая функция).
Эпителий слизистой оболочки дыхательных путей содержит иммунокомпе-
тентные клетки (Т- и В-лимфоциты, макрофаги) и тучные клетки (синтез
гистамина), обеспечивающие защитную функцию организма. Через легкие
из организма выводятся с выдыхаемым воздухом пары воды и молекулы
летучих веществ (выделительная функция), а также незначительная часть
тепла из организма (терморегулирующая функция). Дыхательные мышцы
грудной клетки участвуют в поддержании положения тела в пространстве
(позно-тоническая функция). Наконец, нервный аппарат дыхательной
системы, мышцы голосовой щели и верхних дыхательных путей, а также
мышцы грудной клетки участвуют в речевой деятельности человека
(функция речеобразования).
Основная дыхательная функция системы дыхания реализуется в
процессах внешнего дыхания, которые представляют собой обмен газов (02, С02
и N2) между альвеолами и внешней средой, диффузию газов (02 и С02)
между альвеолами легких и кровью (газообмен). Наряду с внешним
дыханием в организме осуществляется транспорт дыхательных газов кровью, а
также газообмен 02 и С02 между кровью и тканями, который называется
нередко внутренним (тканевым) дыханием.
10.1. Внешнее дыхание
Газообмен между атмосферным воздухом и альвеолярным пространством
легких происходит в результате циклических изменений объема легких в
течение фаз дыхательного цикла. В фазу вдоха объем легких
увеличивается, воздух из внешней среды поступает в дыхательные пути и затем
достигает альвеол. Напротив, в фазу выдоха происходит уменьшение объема
легких и воздух из альвеол через дыхательные пути выходит во внешнюю
среду. Увеличение и уменьшение объема легких обусловлены
биомеханическими процессами изменения объема грудной полости при вдохе и выдохе.
10.1.1. Биомеханика дыхания
Грудная
клетка
10.1.1.1. Биомеханика вдоха
Увеличение объема грудной полости при вдохе происходит в результате
сокращения инспираторных мышц: диафрагмы и наружных межреберных.
Основной дыхательной мышцей является диафрагма, которая находится в
нижней трети грудной полости и разделяет
грудную и брюшную полости. При
сокращении диафрагмальной мышцы диафрагма
движется вниз и смещает органы брюшной
полости вниз и кпереди, увеличивая объем
грудной полости преимущественно по
вертикали (рис. 10.1).
Рис. 10.1. Влияние сокращения диафрагмальной
мышцы на объем грудной полости. Сокращение
диафрагмальной мышцы при вдохе (пунктирная
линия) вызывает опускание диафрагмы вниз,
смещение органов брюшной полости вниз и
вперед. В результате увеличивается объем грудной
полости.
10. Функции дыхательной системы • 471
Увеличению объема грудной
полости при вдохе способствует
сокращение наружных
межреберных мышц, которые поднимают
грудную клетку вверх,
увеличивая объем грудной полости. Этот
эффект сокращения наружных
межреберных мышц обусловлен
особенностями прикрепления
мышечных волокон к ребрам —
волокна идут сверху вниз и сзади
кпереди (рис. 10.2). При
подобном направлении мышечных
волокон наружных межреберных
мышц их сокращение
поворачивает каждое ребро вокруг оси,
проходящей через точки
сочленения головки ребра с телом и
поперечным отростком позвонка. В
результате этого движения каждая
нижележащая реберная дуга
поднимается вверх больше, чем
опускается вышерасположенная. Одновременное движение вверх всех
реберных дуг приводит к тому, что грудина поднимается вверх и кпереди, а
объем грудной клетки увеличивается в сагиттальной и фронтальной
плоскостях. Сокращение наружных межреберных мышц не только увеличивает
объем грудной полости, но и препятствует опусканию грудной клетки
вниз. Например, у детей, имеющих неразвитые межреберные мышцы,
грудная клетка уменьшается в размере во время сокращения диафрагмы
(парадоксальное движение).
При глубоком дыхании в биомеханизме вдоха, как правило, участвует
вспомогательная дыхательная мускулатура — грудино-ключично-сосцевидные
и передние лестничные мышцы, и их сокращение дополнительно
увеличивает объем грудной клетки. В частности, лестничные мышцы поднимают
верхние два ребра, а грудино-ключично-сосцевидные — поднимают
грудину. Вдох является активным процессом и требует расхода энергии при
сокращении инспираторных мышц, которая затрачивается на преодоление
эластического сопротивления относительно ригидных тканей грудной
клетки, эластического сопротивления легко растяжимой легочной ткани,
аэродинамического сопротивления дыхательных путей потоку воздуха, а
также на повышение внутриабдоминального давления и возникающего
при этом смещения органов брюшной полости книзу.
10.1.1.2. Биомеханизм выдоха
Выдох в покое у человека осуществляется пассивно под действием
эластической тяги легких, которая возвращает объем легких к исходной величине.
Тем не менее при глубоком дыхании, а также при кашле и чиханье, выдох
может быть активным, и уменьшение объема грудной полости происходит
за счет сокращения внутренних межреберных мышц и мышц живота.
Мышечные волокна внутренних межреберных мышц идут относительно точек
их прикрепления к ребрам снизу вверх и сзади кпереди. При их
сокращении ребра поворачиваются вокруг оси, проходящей через точки их сочлене-
1—1 Ребро Реберная дуга ..
Грудина
Наружные
межреберные
мышцы оси вращения
а реберной дуги б
Рис. 10.2. Направление волокон
наружных межреберных мышц и увеличение
объема грудной полости при вдохе.
а — сокращение наружных межреберных мышц
при вдохе поднимает нижнее ребро больше,
чем опускает вниз верхнее. В результате
реберные дуги поднимаются вверх и увеличивают (б)
объем грудной полости в сагиттальной и
фронтальной плоскости.
472 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ния с позвонком, и каждая вышерасположенная реберная дуга опускается
вниз больше, чем нижерасположенная поднимается вверх. В результате все
реберные дуги вместе с грудиной опускаются вниз, уменьшая объем
грудной полости в сагиттальной и фронтальной плоскостях. При глубоком
дыхании человека сокращение мышц живота в фазу выдоха увеличивает
давление в брюшной полости, что способствует смещению купола диафрагмы
вверх и уменьшает объем грудной полости в вертикальном направлении.
10.1.2. Изменение объема легких во время вдоха и выдоха
10.1.2.1. Функция внутриплввралъного давления
Сокращение дыхательных мышц грудной клетки и диафрагмы при вдохе
вызывает увеличение объема легких, а при их расслаблении во время
выдоха легкие спадаются до исходного объема. Объем легких как при вдохе,
так и при выдохе изменяется пассивно, поскольку благодаря своей
высокой эластичности и растяжимости легкие следуют за изменениями объема
грудной полости, вызванными сокращением дыхательных мышц. Это
положение иллюстрирует следующая модель пассивного увеличения объема
легких (рис. 10.3). В этой модели легкие могут быть рассмотрены в
качестве эластичного баллона, помещенного внутрь емкости, выполненной из
ригидных стенок и гибкой диафрагмы. Пространство между эластичным
баллоном и стенками емкости является герметичным. Эта модель
позволяет изменять давление внутри емкости при движении вниз гибкой
диафрагмы. При увеличении объема емкости, вызванном движением вниз гибкой
диафрагмы, давление внутри емкости, т. е. вне баллона, становится ниже
атмосферного в соответствии с законом идеального газа. Баллон
раздувается, поскольку давление внутри него (атмосферное) становится выше, чем
давление в емкости вокруг баллона.
В приложении к легким человека, которые полностью заполняют объем
грудной полости, их поверхность и внутренняя поверхность грудной
полости покрыты плевральной
мембраной. Плевральная мембрана
поверхности легких (висцеральная
плевра) физически не
соприкасается с плевральной мембраной,
покрывающей грудную стенку
(париетальная плевра), так как между
этими мембранами имеется плевральное
пространство (синоним — внутри-
плевральное пространство),
заполненное тонким слоем жидкости —
плевральной жидкости. Эта
жидкость увлажняет поверхность долей
легких и способствует их
скольжению относительно друг друга во
время раздувания легких, а также
облегчает трение между
париетальным и висцеральным листками
плевры. Жидкость несжимаема и ее
объем не увеличивается при
уменьшении давления в плевральной
полости. Поэтому высокоэластичные
Ригидная
У емкость
Эластичный
баллон
Подвижная
диафрагма
Рис. 10.3. Схема модели,
демонстрирующей пассивное раздувание легких
при опускании диафрагмы. При
опускании вниз диафрагмы давление
воздуха внутри емкости становится ниже
атмосферного давления, что вызывает
раздувание эластичного баллона.
Р — атмосферное давление.
10. Функции дыхательной системы • 473
Отсутствие *^ Вдох ^ Выдох
в дыхательных путях
потока воздуха
Рис. 10.4. Давление в альвеолах и внутриплевральное давление в фазу вдоха и
выдоха дыхательного цикла.
В отсутствии потока воздуха в дыхательных путях давление в них равно атмосферному (А), а
эластическая тяга легких создает в альвеолах давление Е. В этих условиях величина внутри-
плеврального давления равна разнице А — Е. При вдохе сокращение диафрагмы увеличивает
величину отрицательного давления в плевральной полости до —10 см водн. ст., которое
способствует преодолению сопротивления потоку воздуха в дыхательных путях, и воздух движется
из внешней среды в альвеолы. Величина внутриплеврального давления обусловлена разницей
между давлениями А — R — Е. При выдохе диафрагма расслабляется и внутриплевральное
давление становится менее отрицательным относительно атмосферного давления (—5 см
водн. ст.). Альвеолы вследствие своей эластичности уменьшают свой диаметр, в них
повышается давление Е. Градиент давлений между альвеолами и внешней средой сопособствует
выведению воздуха из альвеол по дыхательным путям во внешнюю среду. Величина
внутриплеврального давленния обусловлена суммой A+R за вычетом давления внутри альвеол, т. е.
А + R — Е. А — атмосферное давление, Е —давление в альвеолах, возникающее вследствие
эластической тяги легких, R —давление, обеспечивающее преодоление сопротивления потоку
воздуха в дыхательных путях, Р — внутриплевральное давление.
легкие в точности повторяют изменение объема грудной полости во время
вдоха. Бронхи, кровеносные сосуды, нервы и лимфатические сосуды
формируют корень легкого, с помощью которого легкие фиксированы в
области средостения. Механические свойства этих тканей обусловливают
основную степень усилия, которое должны развивать дыхательные мышцы при
сокращении, чтобы вызывать увеличение объема легких. В обычных
условиях эластическая тяга легких создает незначительную величину
отрицательного давления в тонком слое жидкости внутриплеврального
пространства относительно атмосферного давления. Отрицательное
внутриплевральное давление варьирует в соответствии с фазами дыхательного цикла
от -5 (выдох) до -10 см водн. ст. (вдох) ниже атмосферного давления
(рис. 10.4). Отрицательное внутриплевральное давление способно вызвать
уменьшение (коллапс) объема грудной полости, которому ткани грудной
клетки противодействуют своей чрезвычайно ригидной структурой.
Диафрагма по сравнению с грудной клеткой, является более эластичной, и ее
купол поднимается вверх под влиянием градиента давления,
существующего между плевральной и брюшной полостями.
В состоянии, когда легкие не расширяются и не спадаются (пауза
соответственно после вдоха или выдоха), в дыхательных путях отсутствует
поток воздуха и давление в альвеолах равно атмосферному. В этом случае
градиент между атмосферным и внутриплевральным давлением будет
точно уравновешивать давление, развиваемое эластической тягой легких (см.
рис. 10.4). В этих условиях величина внутриплеврального давления равна
474 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
разности между давлением в дыхательных путях и давлением, развиваемым
эластической тягой легких. Поэтому чем больше растянуты легкие, тем
сильнее будет эластическая тяга легких и более отрицательным
относительно атмосферного является величина внутриплеврального давления.
Так происходит во время вдоха, когда диафрагма опускается вниз и
эластическая тяга легких противодействует раздуванию легких, а величина
внутриплеврального давления становится более отрицательной. При вдохе
это отрицательное давление способствует продвижению воздуха по
дыхательным путям в сторону альвеол, преодолевая сопротивление
дыхательных путей. В результате воздух поступает из внешней среды в альвеолы.
При выдохе диафрагма расслабляется и величина внутриплеврального
давления становится менее отрицательной. В этих условиях альвеолы в
связи с высокой эластичностью их стенок начинают уменьшаться в
размере и выталкивают воздух из легких через дыхательные пути.
Сопротивление дыхательных путей потоку воздуха поддерживает положительное
давление в альвеолах и препятствует их быстрому спадению. Таким образом, в
спокойном состоянии при выдохе поток воздуха в дыхательных путях
обусловлен только эластической тягой легких.
Пневмоторакс. Если воздух входит во внутриплевральное пространство,
например через раневое отверстие, в легких возникает коллапс, грудная
клетка незначительно увеличивается в объеме, а диафрагма опускается
вниз, как только внутриплевральное давление становится равным
атмосферному давлению. Это состояние называется пневмотораксом, при
котором легкие утрачивают способность следовать за изменением объема
грудной полости во время дыхательных движений. Более того, во время вдоха
воздух через раневое отверстие входит в грудную полость и выходит во
время выдоха без изменения объема легких во время дыхательных
движений, что делает невозможным газообмен между внешней средой и
организмом.
10.1.2.2. Легочные объемы воздуха в течение фаз дыхательного цикла
Процесс внешнего дыхания обусловлен изменением объема воздуха в
легких в течение фаз вдоха и выдоха дыхательного цикла. При спокойном
дыхании соотношение длительности вдоха к выдоху в дыхательном цикле
равняется в среднем 1:1,3. Внешнее дыхание человека характеризуется
частотой и глубиной дыхательных движений. Частота дыхания человека
измеряется количеством дыхательных циклов в течение 1 мин и ее величина
в покое у взрослого человека варьирует от 12 до 20 в 1 мин. Этот
показатель внешнего дыхания возрастает при физической работе, повышении
температуры окружающей среды, а также изменяется с возрастом.
Например, у новорожденных частота дыхания равна 60—70 в 1 мин, а у людей в
возрасте 25—30 лет — в среднем 16 в 1 мин. Глубина дыхания определяется
по объему вдыхаемого и выдыхаемого воздуха в течение одного
дыхательного цикла. Произведение частоты дыхательных движений на их глубину
характеризует основную величину внешнего дыхания — вентиляцию
легких. Количественной мерой вентиляции легких является минутный объем
дыхания — это объем воздуха, который человек вдыхает и выдыхает за 1
мин. Величина минутного объема дыхания человека в покое варьирует в
пределах 6—8 л. При физической работе у человека минутный объем
дыхания может возрастать в 7—10 раз.
Легочные объемы воздуха. В физиологии дыхания принята единая
номенклатура легочных объемов у человека, которые заполняют легкие при
10. Функции дыхательной системы • 475
Спирограмма
Глубокий
вдох
Спокойное
дыхание
Глубокий
выдох
Дыхательный
объем
Резервный
объем
выдоха
Остаточный объем
Рис. 10.5. Объемы и емкости воздуха в
легких человека и кривая (спирограмма)
изменения объема воздуха в легких при
спокойном дыхании, глубоком вдохе и выдохе.
ФОЕ — функциональная остаточная емкость.
спокойном и глубоком дыхании
в фазу вдоха и выдоха
дыхательного цикла (рис. 10.5).
Легочный объем, который
вдыхается или выдыхается
человеком при спокойном дыхании,
называется дыхательным
объемом. Его величина при
спокойном дыхании составляет в
среднем 500 мл. Максимальное
количество воздуха, которое
может вдохнуть человек сверх
дыхательного объема, называется
резервным объемом вдоха (в
среднем 3000 мл).
Максимальное количество воздуха,
которое может выдохнуть человек
после спокойного выдоха,
называется резервным объемом
выдоха (в среднем 1100 мл).
Наконец, количество воздуха,
которое остается в легких после
максимального выдоха,
называется остаточным объемом, его
величина равна примерно
1200 мл.
Сумма величин двух легочных объемов и более называется легочной
емкостью. Объем воздуха в легких человека характеризуется инспираторной
емкостью легких, жизненной емкостью легких и функциональной
остаточной емкостью легких. Инспираторная емкость легких (3500 мл)
представляет собой сумму дыхательного объема и резервного объема вдоха. Жизненная
емкость легких (4600 мл) включает в себя дыхательный объем и резервные
объемы вдоха и выдоха. Функциональная остаточная емкость легких
(1600 мл) представляет собой сумму резервного объема выдоха и
остаточного объема легких. Сумма жизненной емкости легких и остаточного
объема называется общей емкостью легких, величина которой у человека в
среднем равна 5700 мл.
При вдохе легкие человека за счет сокращения диафрагмы и наружных
межреберных мышц начинают увеличивать свой объем с уровня
функциональной остаточной емкости, и его величина при спокойном дыхании
составляет дыхательный объем, а при глубоком дыхании — достигает
различных величин резервного объема вдоха. При выдохе объем легких вновь
возвращается к исходному уровню функциональной остаточной емкости
пассивно, за счет эластической тяги легких. Если в объем выдыхаемого
воздуха начинает входит воздух функциональной остаточной емкости, что
имеет место при глубоком дыхании, а также при кашле или чиханье, то
выдох осуществляться за счет сокращения мышц брюшной стенки. В этом
случае величина внутриплеврального давления, как правило, становится
выше атмосферного давления, что обусловливает наибольшую скорость
потока воздуха в дыхательных путях.
476 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
10.1.3. Факторы, влияющие на легочный объем в фазу вдоха
При вдохе увеличению объема грудной полости препятствуют эластическая
тяга легких, движение ригидной грудной клетки, органы брюшной полости
и, наконец, сопротивление дыхательных путей движению воздуха в
направлении альвеол. Первый фактор, а именно эластическая тяга легких, в
наибольшей степени препятствует увеличению объема легких во время
инспирации.
10.1.3.1. Растяжимость легочной ткани
В нормальных физиологических условиях глубина вдоха может быть
ограничена только физическими свойствами легочной ткани и грудной клетки.
Сопротивление раздуванию легких, которое возникает при поступлении в
них воздуха, обусловлено растяжимостью их соединительной ткани и
сопротивлением дыхательных путей потоку воздуха. Мерой эластических
свойств легочной ткани является растяжимость легких, которая
характеризует степень увеличения объема легких в зависимости от степени
уменьшения внутриплеврального давления:
С = AV/ДР,
где С — растяжимость (англ. — compliance), AV — изменение легочного
объема (мл), а ДР — изменение внутриплеврального давления (см водн. ст.).
Растяжимость характеризует количественно степень изменения объема
легких у человека в зависимости от степени изменения при вдохе
внутриплеврального давления. Грудная клетка также обладает эластическими
свойствами, поэтому растяжимость тканей легких и тканей грудной клетки
обусловливает эластические свойства всего аппарата внешнего дыхания человека.
На рис. 10.6 показано изменение легочного объема, которое возникает
при изменениях внутриплеврального давления. Восходящая и нисходящая
линии характеризуют раздувание и спадение легких соответственно.
Фрагмент рис. 10.6 слева демонстрирует, каким образом могут быть измерены
значения легочного объема и внутриплеврального давления, вынесенные
на график. Объем легких не уменьшается до нуля, когда величина
внутриплеврального давления становится равной нулю. Раздувание легких с
уровня их минимального объема требует усилия для того, чтобы раскрыть
спавшиеся стенки альвеол в силу значительного поверхностного
натяжения жидкости, покрывающей как их поверхность, так и поверхность
дыхательных путей. Поэтому кривые, полученные при раздувании и спадении
легких, не совпадают друг с другом, и их нелинейное изменение
называется гистерезисом.
Легкие при спокойном дыхании никогда не спадаются полностью,
поэтому кривая спадения описывает изменения легочного объема при
изменении величины внутриплеврального давления в диапазоне от —2 см. водн.
ст. до —10 см водн. ст. В норме легкие человека имеют высокую
растяжимость (200 мл/см водн. ст.). Эластичность легочной ткани обусловлена
свойствами соединительных волокон легочной ткани. С возрастом эти
волокна, как правило, снижают тонус, что сопровождается увеличением
растяжимости и уменьшением эластической тяги легких. При повреждении
легочной ткани или при избыточном развитии в ней соединительной
ткани (фиброз) легкие становятся плохо растяжимыми, величина их
растяжимости снижается, что затрудняет выполнение вдоха и требует значительно
большего усилия дыхательных мышц, чем в норме.
10. Функции дыхательной системы • 477
Дыхательный
объем
Грудная
клетка
Насос
-20 0
Внутриплевральное
давление (см водн. ст.)
Рис. 10.6. Кривая комплайенса легких человека.
Кривые справа показывают изменение дыхательного объема легких и общей емкости легких,
возникающие при изменениях внугриплеврального давления без учета влияния тканей
грудной клетки. Легкие полностью не спадаются, если внутриплевральное давление становится
равным нулю (точка 1). Кривые комплайенса совпадают в точке 2 при большом объеме в
легких, когда легочная ткань достигает предела эластического растяжения. Вд —
внутриплевральное давление. Слева — схема регистрации изменений внугриплеврального давления и
дыхательного объема легких.
Легочная растяжимость обусловлена не только эластичностью легочной
ткани, но и поверхностным натяжением слоя жидкости, покрывающей
альвеолы. По сравнению с эластической тягой легких, влияние на
величину легочной растяжимости во время дыхания фактора поверхностного
натяжения слоя жидкости, покрывающей альвеолы, имеет более сложную
природу.
10.1.3.2. Поверхностное натяжение слоя жидкости в альвеолах
Тонкий слой жидкости покрывает поверхность альвеол легких. Переходная
граница между воздушной средой и жидкостью имеет поверхностное
натяжение, которое формируется межмолекулярными силами и которое будет
уменьшать площадь покрываемой молекулами поверхности. Однако
миллионы альвеол легких, покрытых мономолекулярным слоем жидкости, не
спадаются, поскольку эта жидкость содержит субстанции, которые в целом
называются сурфактантом (поверхностно активный агент). Поверхностно
активные агенты обладают свойством снижать поверхностное натяжение
слоя жидкости в альвеолах легких на границе фаз воздух—жидкость,
благодаря которому легкие становятся легко растяжимыми.
Альвеолярный эпителий состоит из плотно контактирующих между
собой альвеолоцитов (пневмоцитов) I и II типа и покрыт мономолекулярным
слоем сурфактанта, состоящего из фосфолипидов, белков и
полисахаридов (глицерофосфолипиды 80 %, глицерол 10 %, белки 10 %). Синтез
сурфактанта осуществляется альвеолоцитами II типа из компонентов плазмы
крови. Основным компонентом сурфактанта является дипальмитоилфос-
фатидилхолин (более 50 % фосфолипидов сурфактанта), который
адсорбируется на границе фаз жидкость—воздух с помощью белков сурфактанта
SP-B и SP-C. Эти белки и глицерофосфолипиды уменьшают
поверхностное натяжение слоя жидкости в миллионах альвеол и обеспечивают легоч-
478 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Альвеола
Радиус
Рис. 10.7. Приложение закона Лапласа к изменению
поверхностного натяжения слоя жидкости,
покрывающего поверхность альвеол.
Изменение радиуса альвеол изменяет в прямой зависимости
величину поверхностного натяжения в альвеолах (Т).
Давление (Р) внутри альвеол также варьирует при изменении их
радиуса: уменьшается при вдохе и увеличивается при выдохе.
ной ткани свойство высокой растяжимости.
Поверхностное натяжение слоя жидкости,
покрывающей альвеолы, изменяется в прямой
зависимости от их радиуса (рис. 10.7). В легких сурфактант изменяет степень
поверхностного натяжения поверхностного слоя жидкости в альвеолах при
изменении их площади. Это обусловлено тем, что во время дыхательных
движений количество сурфактанта в альвеолах остается постоянным.
Поэтому при растяжении альвеол во время вдоха слой сурфактанта
становится тоньше, что вызывает снижение его действия на поверхностное
натяжение в альвеолах. При уменьшении объема альвеол во время выдоха
молекулы сурфактанта начинают более плотно прилегать друг к другу и,
увеличивая поверхностное давление, снижают поверхностное натяжение на
границе фаз воздух—жидкость. Это препятствует спадению (коллапсу) альвеол
во время экспирации, независимо от ее глубины. Сурфактант легких
влияет на поверхностное натяжение слоя жидкости в альвеолах в зависимости
не только от ее площади, но и от направления, в котором происходит
изменение площади поверхностного слоя жидкости в альвеолах. Этот эффект
сурфактанта называется гистерезисом (рис. 10.8). Физиологический смысл
эффекта заключается в
200-1
Спадение
легких (выдох)
Т
Т
0 5 10 15 20
Внутриплевральное давление (см водн. ст.)
Рис. 10.8. Эффект поверхностного натяжения слоя
жидкости на изменение объема легких в
зависимости от внутриплеврального давления при
раздувании легких солевым раствором и воздухом. Когда
объем легких увеличивается за счет их наполнения
солевым раствором, то в них отсутствуют
поверхностное натяжение и феномен гистерезиса.
Относительно интактных легких — площадь петли
гистерезиса свидетельствует об увеличении
поверхностного натяжения слоя жидкости в альвеолах при
вдохе и снижении этой величины при выдохе.
следующем. При вдохе по
мере увеличения объема
легких под влиянием
сурфактанта увеличивается
натяжение
поверхностного слоя жидкости в
альвеолах, что препятствует
растяжению легочной
ткани и ограничивает
глубину инспирации.
Напротив, при выдохе
поверхностное натяжение
жидкости в альвеолах под
влиянием сурфактанта
уменьшается, но не
исчезает полностью. Поэтому
даже при самом
глубоком выдохе в легких не
происходит спадения,
т. е. коллапса альвеол.
В составе сурфактанта
имеются белки типа SP-A
и SP-D, благодаря
которым сурфактант
участвуют в местных иммунных
реакциях, опосредуя фа-
10. Функции дыхательной системы • 479
гоцитоз, поскольку на мембранах альвеолоцитов II типа и макрофагов
имеются рецепторы SP-A. Бактериостатическая активность сурфактанта
проявляется в том, что это вещество опсонизирует бактерии, которые
затем легче фагоцитируются альвеолярными макрофагами. Кроме того,
сурфактант активирует макрофаги и влияет на скорость их миграции в
альвеолы из межальвеолярных перегородок. Сурфактант выполняет защитную
роль в легких, предотвращая непосредственный контакт альвеолярного
эпителия с частицами пыли, агентами инфекционного начала, которые
достигают альвеол с вдыхаемым воздухом. Сурфактант способен
обволакивать инородные частицы, которые затем транспортируются из
респираторной зоны легкого в крупные дыхательные пути и удаляются из них со
слизью. Наконец, сурфактант снижает поверхностное натяжение в альвеолах
до близких к нулевым величинам и тем самым создает возможность
расправления легких при первом вдохе новорожденного.
10.1.3.3. Сопротивление дыхательных путей
Растяжимость легких количественно характеризует растяжимость легочной
ткани в любой момент изменения их объема в течение фазы вдоха и
выдоха. Поэтому растяжимость представляет собой статическую характеристику
эластических свойств легочной ткани. Однако во время дыхания возникает
сопротивление движению аппарата внешнего дыхания, обусловливающее
его динамические характеристики, среди которых наибольшее значение
имеет сопротивление потоку воздуха при его движении через дыхательные
пути легких. На движение воздуха из внешней среды через дыхательные
пути к альвеолам и в обратном направлении оказывает влияние градиент
давления: при этом воздух движется из области высокого давления в
область низкого давления. При вдохе давление воздуха в альвеолярном
пространстве меньше, чем атмосферное, а при выдохе — наоборот.
Сопротивление дыхательных путей потоку воздуха зависит от градиента давления
между полостью рта и альвеолярным пространством. Поток воздуха через
дыхательные пути может быть ламинарным, турбулентным и переходным
между этими типами. Воздух движется в дыхательных путях, в основном,
ламинарным потоком, скорость которого выше в центре этих трубок и
меньше вблизи их стенок. При ламинарном потоке воздуха его скорость
линейно зависит от градиента давления вдоль дыхательных путей. В местах
деления дыхательных путей (бифуркации) ламинарный поток воздуха
переходит в турбулентный. При возникновении турбулентного потока в
дыхательных путях возникает дыхательный шум, который может
выслушиваться в легких с помощью стетоскопа. Сопротивление ламинарному
потоку газа в трубе обусловлено ее диаметром. Поэтому, согласно закону Пуа-
зейля величина сопротивления дыхательных путей потоку воздуха
пропорциональна их диаметру, возведенному в четвертую степень. Поскольку
сопротивление дыхательных путей находится в обратной зависимости от их
диаметра в четвертой степени, то этот показатель самым существенным
образом зависит от изменений диаметра воздухоносных путей, вызванных,
например, выделением в них слизи из слизистой оболочки или сужением
просвета бронхов. Общий диаметр сечения дыхательных путей возрастает в
направлении от трахеи к периферии легкого и становится максимально
большим в терминальных дыхательных путях, что вызывает резкое
снижение сопротивления потоку воздуха и его скорости в этих отделах легких.
Так, линейная скорость потока вдыхаемого воздуха в трахее и главных
бронхах равна примерно 100 см/с. На границе воздухопроводящей и пере-
480 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ходной зон дыхательных путей линейная скорость воздушного потока
составляет около 1 см/с, в дыхательных бронхах она снижается до 0,2 см/с, а
в альвеолярных ходах и мешочках — до 0,02 см/с. Столь низкая скорость
воздушного потока в альвеолярных ходах и мешочках обусловливает в них
незначительное сопротивление движущемуся воздуху и не сопровождается
значимыми затратами энергии мышечного сокращения. Напротив,
наибольшее сопротивление дыхательных путей потоку воздуха возникает на
уровне сегментарных бронхов в связи с наличием в их слизистой оболочке
секреторного эпителия и хорошо развитого гладкомышечного слоя, т. е.
факторов, которые в наибольшей степени влияют как на диаметр
воздухоносных путей, так и на сопротивление в них потоку воздуха. В
преодолении этого сопротивления заключается одна из функций дыхательных
мышц.
10.1.3.4. Зависимость «поток—объем» в легких
В легких большинство дыхательных путей представляют собой эластичные
трубки, за исключением трахеи и бронхов, стенки которых «укреплены»
хрящевой тканью. Бронхиолы имеют высокоэластичные стенки, и диаметр
их просвета может изменяться пассивно во время дыхательных движений.
В обычных физиологических условиях при вдохе (как спокойном, так и
глубоком) растяжение легочной ткани вызывает растяжение стенки мелких
дыхательных путей. Согласно закону Пуазейля, незначительное увеличение
радиуса дыхательных путей резко снижает в них сопротивление потоку
воздуха. Поэтому при вдохе сопротивление дыхательных путей потоку
воздуха не оказывает существенного влияния на силу сокращения
дыхательных мышц. Напротив, при выдохе, особенно при глубоком и усиленном
(форсированном) выдохе, диаметр мелких дыхательных путей
уменьшается, что вызывает значительное увеличение сопротивления потоку воздуха в
них. Влияние объема легких при выдохе на поток воздуха в дыхательных
путях количественно характеризуется зависимостью «поток—объем». В
клинической физиологии дыхания оценка этой зависимости является
основным критерием типа и степени нарушения функции дыхательных
путей.
Зависимость «поток—объем» следующим образом характеризует
влияние большого объема воздуха в легких на экспираторный поток воздуха в
дыхательных путях (рис. 10.9). В момент, предшествующий началу выдоха,
после глубокой инспирации в дыхательных путях отсутствует поток
воздуха, а внутриплевральное давление равно —10 см водн. ст. С началом
форсированной экспирации внутриплевральное давление возрастает примерно
до +30 см водн. ст. относительно атмосферного давления, вызывая
уменьшение радиуса как альвеол, так и мелких дыхательных путей. В этих
условиях давление газов внутри альвеол становится выше, чем в плевральной
полости, благодаря действию на стенки альвеол эластической тяги легких.
В результате поток воздуха выходит из альвеолярного пространства по
дыхательным путям во внешнюю среду по градиенту давления, который
постепенно уменьшается в дыхательных путях по мере приближения к
трахее. Спадению эластичных стенок бронхиол препятствует градиент
давления воздуха между дыхательными путями и внутриплевральным
давлением. Однако в некоторой точке дыхательных путей (как правило, в области
бронхиол) этот градиент давления становится равным нулю
(эквипотенциальная точка давления) и стенки дыхательных путей могут частично или
полностью спадаться. В этих условиях продвижение воздуха по дыхатель-
10. Функции дыхательной системы • 481
Полость рта
Трахея
Грудная
клетка
Плевральная
полость
Альвеолярное
пространство
Диафрагма
О Полость рта
ЭТД
Р = 0
Рис. 10.9. Давление в дыхательных путях при выдохе.
Вертикальными стрелками показаны величины давления, возникающие в дыхательных путях
под влиянием комплайенса легких и грудной клетки. Горизонтальными стрелками в области
дыхательных путей показано, что давление, оказываемое на стенки дыхательных путей, может
увеличивать их просвет при спокойном выдохе (а) либо уменьшать их диаметр при глубоком
выдохе (б) в том участке общей площади поперечного сечения мелких дыхательных путей, где
сравниваются величины внутриплеврального и альвол и давления в дыхательных путях
(эквипотенциальная точка — ЭПТ). Р —давление (см водн. ст.), РА — давление в альвеолах.
ным путям может обеспечиваться только за счет увеличения силы
сокращения (работы) внутренних межреберных мышц и мышц живота.
Снижение эластической тяги легких, например при эмфиземе легких,
вызывает смещение ближе к альвеолярному пространству
эквипотенциальной точки давления в дыхательных путях при выдохе, и, таким образом,
блокируется выход воздуха непосредственно из альвеол. Дыхательные
шумы, которые возникают в легких у больных, обусловлены прохождением
воздуха через спавшиеся мелкие дыхательные пути. Увеличение
экспираторного усилия у таких пациентов повышает риск спадения мелких
дыхательных путей и еще больше затрудняет выдох. При бронхиальной астме у
пациентов дыхательные пути уменьшают свой просвет в результате
сокращения гладких мышц стенки бронхиол. В этом случае увеличение
сопротивления потоку воздуха в мелких дыхательных путях вызывает рост
градиента давления вдоль дыхательных путей при вдохе и смещает
эквипотенциальную точку ближе к альвеолярному пространству, вызывая коллапс
дыхательных путей при выдохе. Усиление сокращения экспираторных мышц
в фазу выдоха еще больше затрудняет выдох у пациентов вследствие
уменьшения просвета мелких дыхательных путей.
10.1.4. Работа дыхательных мышц в течение дыхательного цикла
Сокращение дыхательных мышц создает градиент давления по ходу
дыхательных путей. При этом преодолевается эластическое сопротивление
легких и грудной клетки, а также сопротивление дыхательных путей потоку
воздуха. Наряду с этим последние два показателя позволяют измерять
работу дыхательных мышц во время дыхательного цикла. Если принять, что
величина работы (W) представляет собой произведение силы (F) на путь
16-6095
482 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ф
m
is
I
no
о
|2
о
2
2
Ф
к
се
х
х
си
X
со
(х), то получим: W = F х х В
дыхательной системе, в
которой измеряемыми
величинами являются дыхательный
объем и внутриплевральное
давление, сила сокращения
дыхательных мышц
приравнивается к развиваемому ими
давлению (Р), которое они
оказывают на площадь (А).
Поэтому, подставляя
выражение F = Р х А в формулу
работы дыхательных мышц в
течение дыхательного цикла,
получим: W = Р х А хх.
Поскольку величина А,
умноженная на путь (х), в дыхательной
системе представляет собой
аналог дыхательного объема
(V), то общая формула работы
дыхательных мышц имеет вид:
W = Р х V.
Работа дыхательных мышц
при спокойном дыхании. При
спокойном дыхании объем
вдоха достигает максимум 1 л,
а инспираторные мышцы
совершают минимальную
работу (рис. 10.10). Сокращение
инспираторных мышц
обеспечивает вдох, а выдох
осуществляется пассивно за счет
эластической тяги легких. В этих
условиях сопротивление
дыхательных путей при вдохе и
выдохе не оказывает
лимитирующего влияния на процесс
внешнего дыхания.
По мере увеличения глубины дыхания дыхательный объем формируется за
счет объема функциональной остаточной емкости и резервного объема
вдоха, а работа дыхания совершается против существенного нарастания
поверхностного натяжения жидкости на поверхности альвеол. Поэтому
чем глубже инспирация, тем большую работу совершают инспираторные
мышцы. Во время выдоха, когда глубина дыхательных движений
осуществляется в пределах объема жизненной емкости легких, объем легких
возвращается пассивно к уровню функциональной остаточной емкости за счет
эластической тяги легких, а в пределе функциональной остаточной
емкости выдох происходит активно в результате сокращения мышц живота,
которые при этом совершают работу.
Работа дыхательных мышц при глубоком дыхании. При глубоком
дыхании на силу сокращения дыхательных мышц начинает оказывать влияние
изменение диаметра дыхательных путей. Глубокий вдох вызывает
расширение дыхательных путей и снижение сопротивления в них потоку вдыхае-
* -10 -8 -6 -4 -2 0
Внутриплевральное давление (см водн. ст.)
Рис. 10.10. Работа дыхательных мышц при
спокойном дыхании. Изменения
дыхательного объема (вертикальная ось) при вдохе и
выдохе сопровождаются изменениями внутри-
плеврального давления. При одновременной
регистрации этих величин во время
дыхательного цикла общая площадь петель
дыхательный объем — внутриплевральное давление
отражает количественно работу дыхательных
мышц. Работа дыхательных мышц при вдохе
больше, поскольку она затрачивается на
преодоление эластического сопротивления
легких. При выдохе работа дыхания
минимальная, поскольку совершается за счет энергии
эластической тяги легких, т. е. пассивно.
Стрелками показаны изменения внутриплев-
рального давления в течение фаз
дыхательного цикла. Чем больше площадь петли, тем
больше работа дыхательных мышц.
10. Функции дыхательной системы • 483
мого воздуха, поэтому работа инспираторных мышц обусловлена только
величинами комплайенса легких и тканей грудной клетки. При глубоком
выдохе, при котором в вьщыхаемом воздухе оказывается объем воздуха
функциональной остаточной емкости, возникает сдавление мелких
дыхательных путей высоким градиентом давления между дыхательными путями
и внутриплевральным давлением. Существенное увеличение потока газов
через дыхательные пути приводит к росту их сопротивления потоку
воздуха, которое становится основным фактором, обусловливающим величину
работы дыхания. Однако при глубоком дыхании механизмы регуляции
диаметра дыхательных путей при участии вегетативной нервной системы
способны минимизировать величину работы, которые выполняют
дыхательные мышцы. Так, при глубоком дыхании за счет регулирующих
влияний вегетативной нервной системы на гладкие мышцы дыхательных путей
увеличивается их диаметр. В результате на сокращение дыхательных мышц
затрачивается минимальное количество энергии. Например, при астме
дыхание у пациентов становится медленным и глубоким, что снижает затраты
энергии на преодоление сопротивления дыхательных путей потоку воздуха
и уменьшает работу дыхательных мышц.
10.2. Вентиляция и перфузия кровью легких
10.2.1. Вентиляция легких
Вентиляцией легких обозначают процесс обмена воздуха между легкими и
атмосферой. Количественным показателем вентиляции легких служит
минутный объем дыхания, определяемый как количество воздуха, которое
проходит (или вентилируется) через легкие в 1 мин. В покое у человека
минутный объем дыхания составляет 6—8 л/мин. Только часть воздуха,
которым вентилируются легкие, достигает альвеолярного пространства и
непосредственно участвует в газообмене с кровью. Эта часть вентиляции легких
называется альвеолярной вентиляцией. В покое альвеолярная вентиляция
равна в среднем 3,5—4,5 л/мин. Основная функция альвеолярной
вентиляции заключается в поддержании необходимой для газообмена
концентрации 02 и С02 в воздухе альвеол.
Легкие состоят из воздухопроводящей (дыхательные пути) и
респираторной зон (альвеолы). Дыхательные пути, начиная от трахеи и до альвеол,
делятся по типу дихотомии и образуют 23 генерации элементов дыхательного
тракта (рис. 10.11). В воздухопроводящей или кондуктивной зонах легких
(16 генераций) отсутствует газообмен между воздухом и кровью, поскольку
в этих отделах дыхательные пути не имеют достаточной для этого процесса
сосудистой сети, а стенки дыхательных путей, из-за их значительной
толщины, препятствуют обмену газов через них. Этот отдел воздухоносных
путей называется анатомическим мертвым пространством, объем которого
составляет в среднем 175 мл. На рис. 10.12 показано, каким образом
воздух, заполняющий анатомическое мертвое пространство в конце выдоха,
смешивается с «полезным», т. е. атмосферным воздухом и вновь поступает
в альвеолярное пространство легких.
Дыхательные бронхиолы 17—19-й генераций относят к переходной
(транзиторной) зоне, в которой начинается газообмен в малочисленных
альвеолах (2 % от общего числа альвеол). Альвеолярные ходы и
альвеолярные мешочки, непосредственно переходящие в альвеолы, образуют
альвеолярное пространство, в области которого происходит в легких газообмен
02 и С02 с кровью. Однако у здоровых людей и, особенно, у пациентов с
16*
Рис. 10.11. Схема дыхательных путей
легких человека. Дыхательные пути
от уровня трахеи (1-я генерация) до
долевых бронхов (2—4-я генерации
деления) поддерживают свой просвет
благодаря хрящевым кольцам в их
стенке. Дыхательные пути от
сегментарных бронхов (5—11-я генерации)
до терминальных бронхиол (12— 16-я
генерации) стабилизируют свой
просвет с помощью тонуса гладких
мышц их стенок. 1—16-я генерации
дыхательных путей образуют возду-
хопроводящую зону легких, в
которой не происходит газообмена.
Респираторная зона легких имеет длину
порядка 5 мм и включает первичные
дольки или ацинусы: дыхательные
бронхиолы (17—19-я генерации) и
альвеолярные протоки (20—22-я
генерации). Альвеолярные мешочки
состоят из многочисленных альвеол
(23-я генерация), альвеолярная
мембрана которых является идеальным
местом для диффузии 02 и С02.
Вдыхаемый
атмосферный
воздух
Дыхательные пути
(анатомическое мертвое
пространство)
Респираторная
зона (альвеолы)
Рис. 10.12. Эффект воздуха мертвого (вредного) пространства на вдыхаемый воздух
в легкие. В конце выдоха анатомическое мертвое пространство заполняется
выдыхаемым воздухом, в котором пониженное количество кислорода и высокое
процентное содержание углекислого газа. При вдохе «вредный» воздух анатомического
мертвого пространства смешивается с «полезным» атмосферным воздухом. Эта
газовая смесь, в которой меньше, чем в атмосферном воздухе, кислорода и больше
углекислого газа, поступает в респираторную зону легких. Поэтому газообмен в
легких происходит между кровью и альвеолярным пространством, заполненным не
атмосферным воздухом, а смесью «полезного» и «вредного» воздуха.
10. Функции дыхательной системы • 485
заболеваниями легких часть альвеолярного пространства может
вентилироваться, но при этом не участвовать в газообмене, поскольку эти отделы
легких не перфузируются кровью. Сумму объемов таких областей легких и
анатомического мертвого пространства обозначают как физиологическое
мертвое пространство. Увеличение физиологического мертвого
пространства в легких приводит к недостаточному снабжению тканей организма
кислородом и к увеличению содержания в крови углекислого газа, что
нарушает в ней газовый гомеостазис.
10.2.2. Перфузия легких кровью
Эффективность выполнения основной функции дыхательной системы
зависит от соответствия перфузии (кровотока) в регионах легких с их
вентиляцией. Так, хороший кровоток будет недостаточным для газообмена в
регионах легких, если они слабо вентилируются воздухом с низким
содержанием кислорода, при этом незначительный объем вентиляции
легких не позволит удалить из крови углекислый газ. Соответственно, при
слабом кровотоке в регионах легких возрастает объем функционального
мертвого пространства, и перфузия легких кровью будет недостаточной
для транспорта в ней нормального количества газов. Наконец, перфузия
кровью регионов легких с недостаточной вентиляцией этих же отделов
называется шунтированием, и это состояние является неадекватным для
нормального газообмена. При шунтировании венозная кровь в легких не
обогащается кислородом, что снижает его содержание в крови
организма. В нормальных физиологических условиях фактор гравитации
оказывает наиболее выраженный эффект на вентиляцию и перфузию регионов
легких кровью.
10.2.3. Эффект гравитации на вентиляцию и перфузию легких
кровью
Легкие окружены плевральным пространством, отрицательное давление в
котором изменяется от —5 до —10 см водн. ст. в различные фазы
дыхательного цикла. Этот фактор взаимодействует с эффектом гравитации на
жидкие среды, прежде всего кровь, содержащуюся в артериальных и венозных
сосудах тканей легких. В результате под действием силы тяжести на ткань
легких величина внутриплеврального давления на уровне основания
легких у человека в положении стоя менее отрицательная относительно
атмосферного, чем в области верхушек легкого. Поэтому альвеолы верхушек
легких имеют большие размеры, а стенка их растянута и более напряжена,
чем у альвеол нижних участков легких. Альвеолы на уровне основания
легких растянуты в незначительной степени и имеют значительно больше
потенциальные возможности для растягивания и вентиляции, чем в области
верхушек. Поэтому растянутые альвеолы верхушки легких вентилируются
меньше, чем альвеолы основания (рис. 10.13). Эти различия в вентиляции
отделов легких приводят к тому, что вдыхаемый воздух неравномерно
распределяется в отделах альвеолярного пространства. Особенности
распределения воздуха, вдыхаемого в легкие, дополняется разницей в величине
кровотока на уровне верхушек и основания легких. Относительно
положения тела в пространстве кровоток в верхних и нижних отделах легкого
различается под влиянием фактора гравитации.
У человека в вертикальном положении тела величина легочного
кровотока на единицу объема ткани легкого линейно убывает в направлении
486 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Рис. 10.13. Влияние внутриплеврального давления и фактора гравитации на
размеры альвеол верхних и нижних отделов легких. Между верхушками и основанием
легких имеется градиент внутриплеврального давления, возникающий под
влиянием гравитации на массу жидких сред и ткань легких.
В результате размеры альвеол в верхушках легких больше, чем в основании (А). Альвеолы в
нижних отделах легких имеют большие потенциальные возможности для увеличения в них
вентиляции легких при вдохе, чем альвеолы в области верхних отделов легких (Б).
снизу вверх, и меньше всего снабжаются кровью верхушки легких.
Соответственно в положении тела человека на спине кровоток в нижних
(дорсальных) отделах легких становится выше, чем в верхних (вентральных).
Это обусловлено тем, что артериальная кровь, поступающая в легкие из
правого желудочка, проходит по сосудам легких из областей низкого
внутриплеврального давления в области тонкостенных капилляров, которые
окружены альвеолами, содержащими воздух под давлением, близким к
атмосферному. Поэтому в зависимости от соотношения давления в
альвеолах (РА), мелких артериях (Ра) и мелких легочных венах (Pv) легкие
разделены на функциональные зоны Веста (рис. 10.14).
В верхушках легких (зона 1) могут возникнуть области с давлением в
легочных капиллярах (особенно в фазу диастолы) ниже альвеолярного
(Ра > Ра > Pv)- Капилляры в таких зонах могут спадаться, и кровоток
через них становится невозможным. Такие участки легких вентилируются,
но не участвуют в газообмене и формируют альвеолярное мертвое
пространство.
В средних отделах легких (зона 2) под действием гравитации давление в
альвеолах, как правило, превышает венозное (Ра > РА > Pv). Поэтому
величину кровотока в зоне 2 по Весту определяет разность между
артериальным и альвеолярным давлениями. В зоне 2 практически не возникает
альвеолярное мертвое пространство.
В нижних отделах легких (зона 3) давление в легочных венах выше
альвеолярного (Ра > Pv > Ра) и величина кровотока, как и в обычных сосудах,
определяется разницей между артериальным и венозным давлениями.
Величина зон Веста динамично изменяется в зависимости от
положения тела в пространстве или глубины дыхания. При выдохе на уровне
функциональной остаточной емкости примерно 2/з объема легких может
занимать зона 2. После глубокой экспирации (на уровне остаточного
объема) большая часть легких по соотношению перфузии кровью и вентиляции
соответствует зоне 3 Веста. Относительная однонаправленность изменения
градиента внутриплеврального давления и влияния гравитации на
кровоток в легких от верхних отделов легких к нижним теме не менее не
сопряжены в каждом отдельном регионе легких.
10. Функции дыхательной системы • 487
10.2.3. Коэффициент вентиляционно-перфузионных отношений
в легких
Коэффициент представляет собой отношение величины вентиляции
легких (V) к величине их перфузии кровью (Q). При адекватности
вентиляционно-перфузионных отношений (V/Q) величина коэффициента близка к 1.
В обычных физиологических условиях в разных регионах легких, как
правило, коэффициент варьирует: KV/Q >1. Региональные отличия значения
этого коэффициента обусловлены действием гравитации либо в случае
появления в каком-либо регионе легких феномена шунтирования
(рис. 10.15). Однако в целом 97—98 % от общего количества 02 и С02,
участвующих в газообмене в легких, обменивается между альвеолярным
пространством и кровью легочных капилляров в условиях полного
соответствия величины вентиляции и перфузии легких кровью (V/Q =1).
10.3. Газообмен в легких
Обмен газов между кровью и воздухом относится к основной функции
легких. Воздух, поступающий в легкие при вдохе, нагревается и
насыщается водяными парами при движении в дыхательных путях и достигает
альвеолярного пространства, имея температуру 37 °С. Парциальное давление
Рис. 10.14. Модель, связывающая неравномерность распределения легочного
кровотока при вертикальном расположении тела человека с величиной давления,
действующего на капилляры.
В зоне 1 (верхушки легких) альвеолярное давление (РА) превышает давление в артериолах (PJ
и кровоток ограничен. В средней зоне легких (зона 2), где Р„ > РА, кровоток больше, чем в
зоне 1. В основаниях легких (зона 3) кровоток усилен и определяется разностью давления в
артериолах (Ра) и венулах (Pv). В центре схемы легкого — легочные капилляры; вертикальные
трубочки по сторонам легкого — манометры.
488 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
v = o
• Перекрытие
дыхательных
путей
Альвеолярное
мертвое
пространство
Кровоток -
-> Q = 1 Кровоток
*• Q=1
Смешанная венозная
кровь
Кровь,насыщенная
кислородом
V=1
Альвеолярное
пространство
О Q=0.
Отсутствует кровоток
Рис. 10.15. Соотношение вентиляции и перфузии кровью -легких.
При прекращении вентиляции в каком-либо регионе легких увеличивается их
функциональное мертвое пространство (а). При этом венозная кровь перфузирует этот отдел легких и, не
обогащаясь кислородом, поступает в большой круг кровообращения. Нормальное вентиляци-
онно-перфузионное отношение формируется, когда вентиляция регионов легких
соответствует величине их перфузии кровью (б). При отсутствии кровотока в каком-либо регионе легких
(в) вентиляция также не обеспечивает нормальное вентиляционно-перфузионное отношение.
V — вентиляция легких, Q — кровоток в легких.
водяных паров в альвеолярном воздухе при этой температуре составляет
47 мм рт. ст. Поэтому согласно закону парциальных давлений Дальтона
вдыхаемый воздух находится в разведенном водяными парами состоянии и
парциальное давление кислорода в нем меньше, чем в атмосферном
воздухе.
Обмен кислорода и углекислого газа в легких происходит в результате
разницы парциального давления этих газов в воздухе альвеолярного
пространства и их напряжения в крови легочных капилляров. Процесс
движения газа из области высокой концентрации в область с низкой его
концентрацией обусловлен диффузией. Кровь легочных капилляров отделена от
воздуха, заполняющего альвеолы, альвеолярной мембраной, через которую
газообмен происходит путем пассивной диффузии. Процесс перехода газов
между альвеолярным пространством и кровью легких объясняется
диффузионной теорией.
10.3.1. Состав альвеолярного воздуха
Газовый состав альвеолярного воздуха обусловлен альвеолярной
вентиляцией и скоростью диффузии 02 и С02 через альвеолярную мембрану.
В обычных условиях у человека количество 02, поступающего в единицу
времени в альвеолы из атмосферного воздуха, равно количеству 02,
диффундирующего из альвеол в кровь легочных капилляров. Равным
образом количество С02, поступающего в альвеолы из венозной крови, равно
количеству С02, которое выводится из альвеол в атмосферу. Поэтому в
норме парциальное давление 02 и С02 в альвеолярном воздухе остается
практически постоянным, что поддерживает процесс газообмена между
альвеолярным воздухом и кровью капилляров легких. Газовый состав
альвеолярного воздуха отличается от атмосферного воздуха тем, что в нем
10. Функции дыхательной системы • 489
Таблица 10.1. Парциальное давление газов в воздушной среде легких
Газы
N2
02
со2
Н20
Итого...
Атмосферный воздух,
мм рт. ст. (%)
597,0 (78,62 %)
159,0 (20,84%)
0,3 (0,04 %)
3,7 (0,5 %)
760,0 (100,0 %)
Альвеолярный воздух,
мм рт. ст. (%)
573,0 (75 %)
100,0 (13,5 %)
40,0 (5,5 %)
47,0 (6 %)
760,0 (100,0 %)
Выдыхаемый воздух,
мм рт. ст. (%)
566,0 (74 %)
120,0 (16%)
27,0 (4 %)
47,0 (6 %)
760,0 (100,0 %)
меньше процентное содержание кислорода и выше процент углекислого
газа. Состав альвеолярного воздуха отличается от выдыхаемого воздуха
большим содержанием углекислого газа и меньшим содержанием
кислорода (табл. 10.1).
10.3.2. Напряжение газов в крови капилляров легких
Диффузия газов через альвеолярную мембрану происходит между
альвеолярным воздухом и венозной, а также артериальной кровью легочных
капилляров. В табл. 10.2 приведены стандартные величины напряжения
дыхательных газов в артериальной и венозной крови легочных капилляров.
Градиенты парциального давления кислорода и углекислого газа
обусловливают процесс пассивной диффузии через альвеолярную мембрану
кислорода из альвеол в венозную кровь (градиент 60 мм рт. ст.), а
углекислого газа — из венозной крови в альвеолы (градиент 6 мм рт. ст.).
Парциальное давление азота по обе стороны альвеолярной мембраны остается
постоянным, поскольку этот газ не потребляется и не продуцируется
тканями организма. При этом сумма парциального давления всех газов,
растворенных в тканях организма, меньше, чем величина атмосферного
давления, благодаря чему газы в тканях не находятся в газообразной форме.
Если величина атмосферного давления будет меньше, чем парциальное
давление газов в тканях и в крови, то газы начинают выделяться из крови
в виде пузырьков, вызывая тяжелые нарушения в кровоснабжении тканей
организма (кессонная болезнь).
10.3.3. Скорость диффузии 02 и С02 в легких
Скорость диффузии (M/t) кислорода и углекислого газа через
альвеолярную мембрану количественно характеризуется законом диффузии Фика.
Согласно этому закону газообмен (M/t) в легких прямо пропорционален
градиенту (ДР) концентрации 02 и С02 по обе стороны от альвеолярной
мембраны, площади ее поверхности (S), коэффициентам (к) растворимо-
Таблица 10.2. Напряжение дыхательных газов в артериальной и венозной крови
легочных капилляров
Дыхательные газы
Кислород
Углекислый газ
Азот
Вода
Артериальная кровь (мм рт. ст.)
100
40
573
47
Венозная кровь (мм рт. ст.)
40
46
573
47
490 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Альвеолярное Альвеолярная Просвет
пространство мембрана капилляра
Базальная мембрана
АльвеолоцитI порядка
Слой сурфактанта
О = 100 мм рт. ст.
С02 = 40 мм рт. ст.
Мембрана эритроцита
Эндотелиоцит
О2 = 40мм рт. ст.
С02 = 46 мм рт. ст.
Рис. 10.16. Диффузия газов через альвеолярную мембрану. Диффузия газов в легких
осуществляется по градиентам концентрации 02 и С02 между альвеолярным
пространством и кровью капилляров легких, которые разделены альвеолярной
мембраной. При этом диффузия тем эффективнее, чем тоньше альвеолярная мембрана и
области контакта альвеолоцитов и эндотелиоцитов. Поэтому альвеолярная
мембрана образована уплощенными частями альвеолоцитов I порядка (0,2 мкм) и
эндотелиоцитов капилляров легких (0, 2 мкм), между которыми находится тонкая общая
базальная мембрана (0,1 мкм) этих клеток. В состав мембраны входит также
мономолекулярный слой сурфактант а. Мембрана эритроцитов является препятствием
для диффузии газов в легких.
сти 02 и С02 в биологических средах альвеолярной мембраны и обратно
пропорционален толщине альвеолярной мембраны (L), а также
молекулярной массе газов (М). Формула этой зависимости имеет следующий вид:
М
t
АР • S • к
L • JM
Структура легких образует максимальное по величине поле для
диффузии газов через альвеолярную стенку, которая имеет минимальную
толщину (рис. 10.16). Так, количество альвеол в одном легком человека
приблизительно равно 300 млн. Суммарная площадь альвеолярной мембраны,
через которую происходит обмен газов между альвеолярным воздухом и
венозной кровью, имеет огромные размеры (порядка 100 м2), а толщина
альвеолярной мембраны составляет лишь — 0,3—2,0 мкм.
В обычных условиях диффузия газов через альвеолярную мембрану
происходит в течение очень короткого отрезка времени (не более 3/4 с)>
пока кровь проходит через капилляры легких. Даже при физической
работе, когда эритроциты проходят капилляры легкого в среднем за '/4 с,
указанные выше структурные особенности альвеолярной мембраны создают
оптимальные условия для формирования равновесия парциальных
давлений 02 и С02 между альвеолярным воздухом и кровью капилляров легких
(рис. 10.17). В уравнении Фика константы диффузии (к) пропорциональны
растворимости газа в альвеолярной мембране. Углекислый газ имеет
примерно в 20 раз большую растворимость в альвеолярной мембране, чем
кислород. Поэтому, несмотря на существенное различие в градиентах
парциальных давлений 02 и С02 по обе стороны от альвеолярной мембраны,
10. Функции дыхательной системы • 491
Альвеолярный газ
{Р02 = Ю6ммрт. ст.)
8 о.
О- 2
п ~"
се
X
Ра02
97 мм рт. ст.
Альвеолярный газ
{РС02= 106 мм рт. ст.)
РаС02
39 мм рт. ст.
Рис. 10.17. Градиенты парциального давления дыхательных газов в смешанной
венозной крови легочной артерии, альвеолярном воздухе и артериальной крови.
Равновесие парциальных давлений углекислого газа и кислорода между альвеолярным
воздухом и кровью легочных капилляров достигается в течение короткого времени
С/4—3Л с) движения плазмы крови и эритроцитов в капиллярах легких.
диффузия этих газов совершается за очень короткий отрезок времени
движения эритроцитов крови через легочные капилляры.
Газообмен через альвеолярную мембрану количественно оценивается
диффузионной способностью легких, которая измеряется количеством газа
(мл), проходящего через эту мембрану за 1 мин при разнице давления газа
по обе стороны мембраны в 1 мм рт. ст.
Наибольшее сопротивление диффузии 02 в легких создают
альвеолярная мембрана и мембрана эритроцитов, в меньшей степени — плазма
крови в капиллярах. У взрослого человека в покое диффузионная способность
легких 02 равна 20—25 мл • мин-1 • мм рт. ст.-1. С02, как полярная молекула
(0=С=0), диффундирует через указанные мембраны чрезвычайно быстро,
благодаря высокой растворимости этого газа в альвеолярной мембране
Диффузионная способность
рт. ст.-1.
легких С02 равна 400—450 мл ■
мин *•мм
10.4. Транспорт газов кровью
Кровообращение выполняет одну из важнейших функций переноса
кислорода от легких к тканям, а углекислого газа — от тканей к легким.
Потребление кислорода клетками тканей может изменяться в значительных
пределах, например при переходе от состояния покоя к физической нагрузке
и наоборот. В связи с этим кровь должна обладать большими резервами,
необходимыми для увеличения ее способности переносить кислород от
легких к тканям, а углекислый газ в обратном направлении.
492 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
10.4.1. Транспорт кислорода
При 37 "С растворимость 02 в жидкости составляет 0,225 мл • л-1 • кПа"1
(0,03 мл/л/мм рт. ст.). В условиях нормального парциального давления
кислорода в альвеолярном воздухе, т. е. 13,3 кПа или 100 мм рт.ст., 1 л
плазмы крови может переносить только 3 мл 02, что недостаточно для
жизнедеятельности организма в целом. В покое в организме человека за минуту
потребляется примерно 250 мл кислорода. Чтобы тканям получить такое
количество кислорода в физически растворенном состоянии, сердце
должно перекачивать за минуту огромное количество крови. В эволюции живых
существ проблема транспорта кислорода была более эффективно решена
за счет обратимой химической реакции с гемоглобином эритроцитов.
Кислород переносится кровью от легких к тканям организма молекулами
гемоглобина, которые содержатся в эритроцитах. Гемоглобин способен
захватывать кислород из альвеолярного воздуха (соединение называется ок-
сигемоглобином) и освобождать необходимое количество кислорода в
тканях. Особенностью химической реакции кислорода с гемоглобином
является то, что количество связанного кислорода ограничено количеством
молекул гемоглобина в эритроцитах крови. Молекула гемоглобина имеет
4 места связывания с кислородом, которые взаимодействуют таким
образом, что зависимость между парциальным давлением кислорода и
количеством переносимого кислорода с кровью имеет S-образную форму,
которая носит название кривой насыщения или диссоциации оксигемоглобина
(рис. 10.18). При парциальном давлении кислорода 10 мм рт. ст.
насыщение гемоглобина кислородом составляет примерно 10 %, а при Р02 30 мм
рт. ст. — 50—60 %. При дальнейшем увеличении парциального давления
кислорода от 40 мм рт. ст. до 60 мм рт. ст. происходит уменьшение
крутизны кривой диссоциации оксигемоглобина и процент его насыщения ки-
2
о
ч
о
О.
О
О
О.
*
О
X
л
га
s
О.
О)
\-
Q.
га
Я)
S
I
2
о
га
X
90
80
70
60
50
40
30
20
10
РСО2 = 40 / .' /
/ /'
rf^i i i
РС02 = 46
i i I I i
20 мл
артериальная
14 мл
венозная
га
§
о.
о
И
* о
к о
га 5
а. 2
i s
ф Ш
3 Й
х о.
о *
у: ш
0 10 20
30 40 50
венозная
60 70 80
90 100
артериальная
Парциальное давление кислорода, мм рт. ст.
Рис. 10.18. Кривая диссоциации оксигемоглобина. Пределы колебания кривой при
РС02 = 40 мм рт. ст. (артериальная кровь) и РС02 = 46 мм рт. ст. (венозная кровь)
показывают изменение сродства гемоглобина к кислороду (эффект Ходена).
10. Функции дыхательной системы • 493
слородом возрастает в диапазоне от 70—75 до 90 % соответственно. Затем
кривая диссоциации оксигемоглобина начинает занимать практически
горизонтальное положение, поскольку увеличение парциального давления
кислорода с 60 до 80 мм рт. ст. вызывает прирост насыщения гемоглобина
кислородом на 6 %. В диапазоне от 80 до 100 мм рт. ст. процент
образования оксигемоглобина составляет порядка 2. В результате кривая
диссоциации оксигемоглобина переходит в горизонтальную линию и процент
насыщения гемоглобина кислородом достигает предела, т. е. 100. Насыщение
гемоглобина кислородом под влиянием Р02 характеризует своеобразный
молекулярный «аппетит» этого соединения к кислороду.
Значительная крутизна кривой насыщения гемоглобина кислородом в
диапазоне парциального давления от 20 до 40 мм рт. ст. способствует тому,
что в ткани организма значительное количество кислорода может
диффундировать из крови в условиях фадиента его парциального давления между
кровью и клетками тканей (не менее 20 мм рт. ст.). Незначительный
процент насыщения гемоглобина кислородом в диапазоне его парциального
давления от 80 до 100 мм рт. ст. способствует тому, что человек без риска
снижения насыщения артериальной крови кислородом может
перемещаться в диапазоне высот над уровнем моря до 2000 м.
Общие запасы кислорода в организме обусловлены его количеством,
находящимся в связанном состоянии с ионами Fe2+ в составе
органических молекул гемоглобина эритроцитов и миоглобина мышечных клеток.
Один фамм гемоглобина связывает 1,34 мл 02. Поэтому в норме при
концентрации гемоглобина 150 г/л каждые 100 мл крови могут переносить
20,0 мл 02.
Количество 02, которое может связаться с гемоглобином эритроцитов
крови при насыщении 100 % его количества, называется кислородной
емкостью гемоглобина. Другим показателем дыхательной функции крови
является содержание 02 в крови (кислородная емкость крови), которое
отражает его истинное количество, как связанного с гемоглобином, так и
физически растворенного в плазме. Поскольку в норме артериальная кровь
насыщена кислородом на 97 %, то в 100 мл артериальной крови содержится
примерно 19,4 мл 02.
10.4.1.1. Изменение сродства гемоглобина к кислороду
Молекула гемоглобина может находиться в двух формах — напряженной и
расслабленной. Расслабленная форма гемоглобина имеет свойство
насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций
напряженной и расслабленной формы в общем количестве гемоглобина в
крови обусловливает S-образный вид кривой диссоциации
оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду.
Если вероятность перехода от напряженной формы гемоглобина к
расслабленной больше, то возрастает сродство гемоглобина к кислороду, и
наоборот. Вероятность образования указанных фракций гемоглобина изменяется
в большую или меньшую сторону под влиянием нескольких факторов.
Основной фактор — это связывание кислорода с геминовой фуппой
молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина
связывают кислород в эритроцитах, тем более легким становится переход
молекулы гемоглобина к расслабленной форме и тем выше их сродство к
кислороду. Поэтому при низком Р02, что имеет место в метаболически
активных тканях, сродство гемоглобина к кислороду ниже, а при высоком
Р02 — выше. Как только гемоглобин захватывает кислород, повышается
494 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
его сродство к кислороду и молекула гемоглобина становится насыщенной
при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то
кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в
своеобразного депо кислорода — в молекулы миоглобина, из которого
кислород используется в биологическом окислении мышц.
Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена
низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение
кислорода, необходимое для поддержания нормального метаболизма,
составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем
диффузии из капилляров достигает метаболически активных клеток.
Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах
крови, что компенсируется высокой плотностью капилляров на единицу
объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах
может снизиться чрезвычайно быстро во время сокращения. В мышечных
клетках содержится белок миоглобин, который имеет более высокое
сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается
кислородом и способствует его диффузии из крови в скелетную и
сердечную мышцы, где он обусловливает процессы биологического окисления.
Эти ткани способны экстрагировать до 70 % кислорода из крови,
проходящей через них, что обусловлено снижением сродства гемоглобина к
кислороду под влиянием температуры тканей и рН.
Эффект рН и температуры на сродство гемоглобина к кислороду.
Молекулы гемоглобина способны реагировать с ионами водорода, в результате
этой реакции происходит снижение сродства гемоглобина к кислороду.
При насыщении гемоглобина менее 100 % низкое рН понижает
связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина
смещается вправо по оси х. Это изменение свойства гемоглобина под
влиянием ионов водорода называется эффектом Бора. Метаболически
активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН
плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при
сокращении мыщц, то концентрация кислорода в ней будет возрастать
вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы
порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом
снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации
смещается по оси х вправо. В результате насыщение гемоглобина кислородом
падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что
на '/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла.
Повышение температуры тканей при физической работе изменяет соотношение
фракций гемоглобина в эритроцитах и вызывает смещение кривой
диссоциации оксигемоглобина вправо вдоль оси х. В результате большее
количество кислорода будет освобождаться из гемоглобина эритроцитов и
поступать в ткани.
Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к
кислороду. При некоторых физиологических состояниях, например при
понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания
человека на большой высоте над уровнем моря, снабжение тканей кислородом
становится недостаточным. При гипоксии может понижаться сродство
гемоглобина к кислороду вследствие увеличения содержания в эритроцитах
2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к
кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах
легких. Однако при движении крови через капилляры легких эффект 2,3-
10. Функции дыхательной системы • 495
ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская
часть кривой диссоциации оксигемоглобина) выражен в меньшей степени,
чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть
кривой), что обусловливает нормальное кислородное снабжение тканей.
10.4.2. Транспорт углекислого газа
С02 является продуктом метаболизма клеток тканей и поэтому
переносится кровью от тканей к легким. Углекислый газ выполняет жизненно
важную роль в поддержании во внутренних средах организма уровня рН
механизмами кислотно-основного равновесия. Поэтому транспорт углекислого
газа кровью тесно взаимосвязан с этими механизмами (см. глава 15).
В плазме крови небольшое количество С02 находится в растворенном
состоянии; при РС02= 40 мм рт. ст. переносится 2,5 мл/100 мл крови С02,
или 5 %. Количество растворенного в плазме углекислого газа в линейной
зависимости возрастает от уровня РС02.
В плазме крови С02 реагирует с водой с образованием Н+ и HCOJ.
Увеличение напряжения углекислого газа в плазме крови вызывает
уменьшение величины ее рН. Напряжение С02 в плазме крови может быть
изменено функцией внешнего дыхания, а количество ионов водорода или рН —
буферными системами крови и HCOJ, например путем их выведения через
почки с мочой. Величина рН плазмы крови зависит от соотношения
концентрации растворенного в ней С02 и ионов бикарбоната. В виде
бикарбоната плазмой крови, т. е. в химически связанном состоянии, переносится
основное количество углекислого газа — порядка 45 мл/100 мл крови, или
до 90 %. Эритроцитами в виде карбаминового соединения с белками
гемоглобина транспортируется примерно 2,5 мл/100 мл крови С02, или 5 %.
Транспорт углекислого газа кровью от тканей к легким в указанных формах
не связан с явлением насыщения, как при транспорте кислорода, т. е. чем
больше образуется углекислого газа, тем большее его количество
транспортируется от тканей к легким. Однако между парциальным давлением С02 в
крови и количеством переносимого кровью углекислого газа имеется
криволинейная зависимость: кривая диссоциации углекислого газа.
10.4.2.1. Роль эритроцитов в транспорте С02
В крови капилляров тканей организма напряжение С02 составляет 5,3 кПа
(40 мм рт. ст.), а в самих тканях — 8,0—10,7 кПа (60—80 мм рт. ст.). В
результате С02 диффундирует из тканей в плазму крови, а из нее — в
эритроциты по градиенту парциального давления С02. В эритроцитах С02
образует с водой угольную кислоту, которая диссоциирует на Н+ и HCOJ.
(С02 + Н20 = Н2СОэ = Н+ + HCOJ). Эта реакция протекает быстро,
поскольку С02 + Н20 = Н2СОэ катализируется ферментом карбоангидразой
мембраны эритроцитов, которая содержится в них в высокой
концентрации (рис. 10.19). Эта реакция протекает по закону действия масс и в норме
выражается в логарифмической форме, известной как уравнение Гендерсо-
на—Гассельбаха (см. главу 15).
В эритроцитах диссоциация С02 продолжается постоянно по мере
образования продуктов этой реакции, поскольку молекулы гемоглобина
действуют как буферное соединение, связывая положительно заряженные ионы
водорода. В эритроцитах по мере освобождения кислорода из гемоглобина
его молекулы будут связываться с ионами водорода (С02 + Н20 = Н2С03 =
= Н+ + HCOJ), образуя соединение (НЬ-Н+). В целом это называется эф-
496 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
а б
Эритроцит Плазма Клетки Эритроцит Плазма Альвеол.
Рис. 10.19. Роль эритроцитов в транспорте углекислого газа от тканей к легким.
А. Процессы газообмена С02 между клетками тканей и плазмой крови. С02 поступает путем
диффузии в плазму крови из тканей и дифференцирует внутрь эритроцитов. В эритроцитах
С02 превращается при участии фермента карбоангидразы мембраны эритроцитов в НСОз и в
виде этого иона вновь активно транспортируется в плазму крови, в которой в составе
бикарбонатов (NaHC03) переносится к капиллярам легких. Водородные ионы, образующиеся при
реакции дегидратации Н2С03, захватываются молекулами гемоглобина и также
транспортируются кровью от тканей к легким. При транспорте из эритроцитов НСОз-ионное постоянство
внутри эритроцитов поддерживается хлорным сдвигом. Кроме того, С02 в эритроцитах
непосредственно соединяется с Nh2 группами белков гемоглобина.
Б. Процессы газообмена С02 между плазмой крови и альвеолами легких. В капиллярах легких
в эритроцитах под влиянием эффекта Бора происходит диссоциация карбаминовых
соединений и С02 диффундирует через мембрану эритроцитов и альвеолярную мембрану в просвет
альвеол легких.
фектом Холдена, который приводит к сдвигу кривой диссоциации оксиге-
моглобина вправо по оси х, что снижает сродство гемоглобина к
кислороду и способствует более интенсивному освобождению его из эритроцитов в
ткани. При этом в составе соединения НЬ-Н+ транспортируется примерно
200 мл С02 в одном литре крови от тканей к легким.
Диссоциация С02 в эритроцитах может быть лимитирована только
буферной емкостью молекул гемоглобина. Образующиеся внутри
эритроцитов в результате диссоциации С02 ионы НСОз с помощью специального
белка-переносчика мембраны эритроцитов выводятся из эритроцитов в
плазму, а на их место из плазмы крови закачиваются ионы СГ (феномен
«хлорного» сдвига) (рис. 10.19). Основная роль реакции С02 внутри
эритроцитов заключается в обмене ионами СГ и НСОз между плазмой и
внутренней средой эритроцитов. В результате этого обмена продукты
диссоциации углекислого газа Н+ и НСОз будут транспортироваться внутри
эритроцитов в виде соединения (НЬ-Н+), а плазмой крови — в виде
бикарбонатов.
Эритроциты участвуют в транспорте углекислого газа от тканей к
легким, поскольку С02 образует прямую комбинацию с — ТЧН2-группами
белковых субъединиц гемоглобина: С02 + НЬ -> НЬС02 или карбаминовое
соединение. Транспорт кровью С02 в виде карбаминового соединения и
ионов водорода гемоглобином зависит от свойств молекул последнего; обе
реакции обусловлены величиной парциального давления кислорода в
плазме крови на основе эффекта Холдена.
В количественном отношении транспорт С02 в растворенной форме и в
форме карбаминового соединения является незначительным, по сравне-
10. Функции дыхательной системы • 497
нию с его переносом С02 кровью в виде бикарбонатов. Однако при
газообмене С02 в легких между кровью и альвеолярным воздухом эти две
формы приобретают основное значение.
Когда венозная кровь возвращается от тканей к легким, С02
диффундирует из крови в альвеолы и РС02 в крови снижается с 46 мм рт. ст.
(венозная кровь) до 40 мм рт.ст. (артериальная кровь). При этом в величине
общего количества С02 (6 мл/100 мл крови), диффундирующего из крови в
альвеолы, доля растворенной формы С02 и карбаминовых соединений
становится более значительной относительно бикарбонатной. Так, доля
растворенной формы составляет 0,6 мл/100 мл крови, или 10 %,
карбаминовых соединений — 1,8 мл/100 мл крови, или 30%, а бикарбонатов —
3,6 мл/100 мл крови, или 60 %.
В эритроцитах капилляров легких по мере насыщения молекул
гемоглобина кислородом начинают освобождаться ионы водорода, диссоциировать
карбаминовые соединения и НСОз вновь превращается в С02 (Н+ + НСОз =
= Н2С03 = С02 +Н20), который путем диффузии выводится через легкие
по градиенту его парциальных давлений между венозной кровью и
альвеолярным пространством. Таким образом, гемоглобин эритроцитов играет
основную роль в транспорте кислорода от легких к тканям, и углекислого
газа в обратном направлении, поскольку способен связываться с 02 и Н+.
В состоянии покоя через легкие из организма человека за минуту
удаляется примерно 300 мл С02: 6 мл/100 мл крови х 5000 мл/мин минутного
объема кровообращения.
10.5. Регуляция дыхания
Дыхательная система должна обеспечивать полное соответствие между
количеством кислорода, поступающего в кровь через легкие, и скоростью его
потребления в тканях, а так же соответствие между продукцией в тканях
С02 и количеством удаляемого из организма через легкие С02. Эта
функция дыхательной системы достигается за счет приспособления (регуляции)
объема легочной вентиляции к уровню метаболизма в организме.
Приспособление легочной вентиляции к процессам метаболически
обусловленного газообмена в организме человека осуществляется сложной иерархиче-
Центральные
хеморецепторы
Периферические
хеморецепторы
\ZA
| Н + Р02
Дыхательный
центр
Дыхательные
мотонейроны
спинного мозга
Д.
Рецепторы
мышц
Дыхательные
Механорецепторы
легких
^Иышцы
Вентиляция
легких
Мышцы '
верхних
дыхательных
путей ,
Гладкие
мышцы
дыхательных
путей
Рис. 10.20. Регуляция вентиляции легких осуществляется сложной иерархической
системой, включающей механизмы обратных связей при участии хеморецепторных
(центральные и периферические) и механорецепторных (механорецепторы легких и
дыхательных мышц) рефлексов. Местом генерации дыхательного ритма является
дыхательный центр продолговатого мозга.
498 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ской системой регуляции дыхания, состоящей из центральных и
периферических хеморецепторных рефлексов (общий контроль), а также механо-
рецепторных рефлексов (локальный контроль) (рис. 10.20). В этой системе
дыхательный центр генерирует дыхательный ритм, интегрирует
афферентные сигналы, посылает импульсы к дыхательным мышцам грудной клетки
и к гладким мышцам дыхательных путей, обеспечивая приспособление
легочной вентиляции к условиям жизнедеятельности организма.
10.5.1. Дыхательный центр
Величина легочной вентиляции обусловлена частотой и глубиной
дыхательных движений (дыхательного ритма), происхождение которых связано
с функцией дыхательного центра центральной нервной системой. Под
дыхательным центром понимают ограниченный участок ЦНС, где
происходит формирование дыхательного импульса, вызывающего
координированную деятельность дыхательных мышц, обеспечивающих для организма
необходимую величину газообмена в легких. В центральной нервной системе
местом генерации дыхательного ритма, вызывающего ритмические
сокращения дыхательных мышц при вдохе и выдохе, является продолговатый
мозг, в котором расположен дыхательный центр. Дыхательный центр
состоит из нервных клеток (дыхательных нейронов), для которых характерна
периодическая электрическая активность в одну из фаз дыхания. Нейроны
дыхательного центра локализованы двусторонне в продолговатом мозге в
виде двух вытянутых столбов вблизи obex — точки, где центральный канал
спинного мозга впадает в четвертый желудочек. Эти два образования
дыхательных нейронов в соответствии с их положением относительно
дорсальной и вентральной поверхности продолговатого мозга обозначают как
дорсальная и вентральная дыхательные группы (рис. 10.21).
Дорсальная дыхательная группа нейронов образует вентролатеральную
часть ядра одиночного тракта. Дыхательные нейроны вентральной
дыхательной группы расположены в области п. ambiguus каудальнее уровня obex,
п. retroambigualis непосредственно ростральнее obex и представлены
комплексом Бетзингера, который находится непосредственно вблизи п. retrofa-
cialis вентролатеральных отделов продолговатого мозга. В состав
дыхательного центра входят нейроны двигательных ядер черепно-мозговых нервов
(обоюдное ядро, ядро подъязычного нерва), которые иннервируют мышцы
гортани и глотки.
Основным критерием классификации нейронов дыхательного центра
является фаза дыхательного цикла, в которую они активны, т. е.
инспирация или экспирация. По этому критерию дыхательные нейроны
подразделяют на инспираторные и экспираторные. Дорсальная дыхательная группа
состоит полностью из инспираторных нейронов. Вентральная дыхательная
группа образована инспираторными и экспираторными нейронами, а
комплекс Бетзингера образуют только экспираторные нейроны. По паттерну
электрической активности нейронов в пределах фаз дыхательного цикла
инспираторные и экспираторные нейроны подразделяют на нейроны с
нарастающим, постоянным или декрементным типом активности
(рис. 10.22).
По проекции аксонов дыхательные нейроны разделяют на премоторные
или бульбоспинальные нейроны и проприобульбарные. Аксоны премотор-
ных дыхательных нейронов переходят на противоположную сторону
продолговатого мозга, а затем направляются к мотонейронам спинного мозга.
Функция инспираторных премоторных дыхательных нейронов заключается
10. Функции дыхательной системы • 499
т
о
2
is
33
а
с
IV желудочек
Моторное ядро
подъязычного нерва
И
Подъязычные
нервы
Диафрагмальный
нерв
Межреберные
нервы (Т—L)
Рис. 10.21. Схема положения нейронов дорсальной (ДРГ) и вентральной
дыхательных групп (ВДГ) дыхательного центра продолговатого мозга.
Слева — проекция отделов дыхательного центра на дорсальную поверхность продолговатого
мозга. Справа — расположение отделов дыхательного центра на поперечном плане
продолговатого мозга. Диафрагмальные мотонейроны и мотонейроны межреберных мышц являются
«общим конечным путем» моторных команд дыхательного центра, обусловливающих
сокращение дыхательных мышц и вентиляцию легких. NA — п. ambiguus.
J_L_UJ11!|
ЦШЛ
J__Amm.
UUUUULJ
Вдох
шщ
J_L_L
Выдох
Потенциал
действия
Разряд
потенциалов
действия
Спирограмма
Рис. 10.22. Образцы электрической активности основных типов нейронов
дыхательного центра. Наиболее общая классификация типов дыхательных нейронов
основана на связи их электрической активности с фазами вдоха и выдоха
дыхательного цикла и паттерном разряда потенциалов действия.
По этому критерию классифицируют: полные инспираторные с нарастающей активностью (1),
экспираторные нейроны с нарастающей активностью (2), ранние инспираторные нейроны с
декрементной активностью (3), поздние инспираторные нейроны с нарастающей активностью
(4), экспираторные или постинспираторные нейроны с декрементной активностью (5),
полные инспираторные нейроны с постоянной активностью (6).
500 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
в управлении электрической активностью инспираторных мотонейронов
диафрагмы и наружных межреберных мышц во время их сокращения при
вдохе. В обычных условиях экспирация осуществляется пассивно, поэтому
функция экспираторных премоторных дыхательных нейронов реализуется
только при увеличении глубины дыхательных движений. Премоторные
нейроны комплекса Бетзингера выполняют уникальную функцию — они
тормозят все типы инспираторных нейронов дыхательного центра и диа-
фрагмальные мотонейроны. Поэтому их аксоны распределяются
билатерально, т. е. направляются к соответствующим нейронам, расположенным
как ипсилатерально, так и контралатерально.
Аксоны проприобульбарных дыхательных нейронов (ранние инспира-
торные, постинспираторные, поздние инспираторные, экспираторные
нейроны комплекса Бетзингера) оканчиваются на мембране нейронов самого
дыхательного центра, расположенных в вентральной дыхательной группе.
Функция большинства проприробульбарных нейронов заключается в
генерации дыхательного ритма.
10.5.1.1. Происхождение дыхательного ритма
У человека дыхательные движения впервые начинаются у плода (в начале
III триместра беременности). Эти дыхательные движения носят
периодический и нерегулярный характер. Современные исследования
свидетельствуют о том, что дыхательные движения плода инициируются проприобуль-
барными инспираторными пейсмекерными клетками вентральной
дыхательной группы, расположенными вблизи нейронов комплекса Бетзингера
(пребетзингерова область). Эти нейроны обладают двумя уникальными
свойствами. Мембрана нейронов способна к спонтанной деполяризации и,
когда их мембранный потенциал достигает порога возбуждения, нейроны
генерируют короткий залп потенциалов действия. Вторым свойством
мембраны пейсмекерных нейронов дыхательного центра является механизм
аккомодации, т. е. самоограничения электрической активности. Этот
механизм представляет собой гиперполяризацию мембранного потенциала
нейрона под влиянием нарастающего входящего тока ионов хлора и
формирование декрементного паттерна электрической активности. В результате в
течение короткого отрезка времени нейроны способны самостоятельно
прекращать свою электрическую активность. Разряды электрических
импульсов по аксонам дыхательных нейронов распространяется к
мотонейронам спинного мозга и вызывают через них сокращение диафрагмы и
наружных межреберных мышц у плода. Внутриутробные ритмические
сокращения инспираторных мышц у плода способствуют развитию у него
аппарата внешнего дыхания к моменту рождения. Первый вдох
новорожденного и дыхание в первые сутки после рождения по-прежнему обусловлены
спонтанной пейсмекерной активностью проприобульбарных нейронов
вентральной дыхательной группы дыхательного центра.
У взрослых млекопитающих животных происхождение дыхательного
ритма объясняют двумя теориями, которые основаны на пейсмекерной
гипотезе и гипотезе нейронной сети. Согласно первой, дыхательный ритм
возникает в пейсмекерных проприобульбарных дыхательных нейронах
пребетзингеровой области. Затем залпы нервных импульсов от
пейсмекерных нейронов передаются другим типам нейронов дыхательного центра,
при участии которых возникает соответствующий ритм дыхательных
движений.
Происхождение дыхательного ритма при участии нейронной сети дыха-
10. Функции дыхательной системы • 501
тельного центра объясняют функцией синаптических связей между
различными типами дыхательных нейронов. Основным проявлением
синаптических связей является взаимное торможение между группами нейронов
противоположных фаз дыхательного цикла. Вторым свойством ритмгене-
рирующей нейронной сети является наличие в ней хотя бы одного типа
дыхательных нейронов, возбудимая мембрана которых обладает
механизмом аккомодации, т. е. самоограничения электрической активности. В
дыхательном центре взрослых животных имеется два типа дыхательных
нейронов, обладающих аккомодативным механизмом: ранние инспираторные
и постсинспираторные (рис. 10.22). Оба типа нейронов взаимно тормозят
друг друга и все другие типы нейронов дыхательного центра в период,
когда активны либо ранние инспираторные нейроны, либо постинспиратор-
ные нейроны. Ключевая роль в дыхательном ритмогенезе ранних
инспираторных нейронов с декрементным типом активности заключается в
инициации дыхательного ритма, а именно вдоха. С момента начала разряда
этого типа нейронов, благодаря механизму самоограничения активности
ранних инспираторных нейронов, прекращается их тормозное действие на
другие типы инспираторных нейронов дыхательного центра. В результате
происходит активация инспираторных нейронов (полных и поздних) и
возникает фаза вдоха. Как только вдох выключается (функция центров
моста и ядер блуждающего нерва), активируются постинспираторные
нейроны с декрементным типом активности и начинается фаза выдоха.
Благодаря механизму самоограничения активности постинспираторные нейроны
постепенно прекращают тормозное действие на экспираторные нейроны с
нарастающей активностью и на ранние инспираторные нейроны. С
момента активации последних прекращается фаза выдоха и начинается
очередная фаза вдоха.
10.5.2. Влияние нервных центров варолиева моста
на дыхательный ритм
В верхних отделах моста расположены две области — п. parabrachealis medi-
alis и п. Kolliker—Fuse, которые влияют на дыхательный центр
продолговатого мозга и образуют пневмотаксический центр. Нейроны этого центра ре-
ципрокно связаны с инспираторными нейронами дорсальной дыхательной
группы. Функцией пневмотаксического центра моста является уменьшение
периода активности инспираторных нейронов дыхательного центра путем
выключения фазы вдоха и более раннее появление в дыхательном цикле
фазы выдоха. В результате пневмотаксический центр вызывает в
дыхательном центре генерацию большего числа небольших по длительности
инспираций, т. е. увеличивает частоту дыхания.
На уровне нижней трети моста имеется область, определяемая как ап-
нейстический центр. В обычных условиях активность этого центра
заторможена со стороны пневмотаксического центра. Название центра
обусловлено тем, что его отделение от пневмотаксического центра и/или от
тормозных афферентных влияний блуждающего нерва (описано ниже),
вызывает остановку дыхания на вдохе (апнейзис). Эта область оказывает
возбуждающее влияние на нейроны дорсальной дыхательной группы
дыхательного центра и ее роль заключается в увеличении времени фазы выдоха, а,
следовательно, глубины дыхательных движений.
502 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
10.5.3. Функция спинальных дыхательных мотонейронов
При спокойном дыхании в течение фазы вдоха электрические импульсы
инспираторных бульбоспинальных нейронов дыхательного центра
передаются к мотонейронам сегментов спинного мозга: Сш—Cv и Тг—ТХц.
Аксоны мотонейронов Сш—Cv образуют диафрагмальные нервы, а Т,—Тх„ —
межреберные нервы, которые иннервируют соответственно диафрагму и
наружные межреберные мышцы. Активация электрической активности
этих мотонейронов под влиянием нисходящих команд дыхательного
центра вызывает сокращение диафрагмы и наружных межреберных мышц, что
определяет уровень вентиляции легких. При глубоком дыхании фаза
выдоха также становится активной, и нисходящие команды дыхательного
центра начинают включать импульсы к мотонейронам мышц живота и
внутренних межреберных мышц (сегменты Т—L). Активация электрической
активности мотонейронов, которые иннервируют экспираторные мышцы,
обусловливает глубину выдоха.
10.5.4. Рефлекторная регуляция дыхания
10.5.4.1. Хеморецепторный контроль дыхания
Хеморецепторный контроль дыхания осуществляется при участии
центральных и периферических хеморецепторов. Центральные (медуллярные)
хеморецепторы расположены непосредственно в в ростральных отделах
вентральной дыхательной группы, в структурах голубого пятна (locus
coeruleus), в ретикулярных ядрах шва ствола мозга и реагируют на
водородные ионы в окружающей их межклеточной жидкости мозга (рис.
10.23). Центральные хеморецепторы представляют собой нейроны,
которые в определенной степени являются рецепторами углекислого газа,
поскольку величина рН обусловлена парциальным давлением С02, согласно
уравнению Гендерсона—Гасельбаха, а также тем, что концентрация ионов
водорода в межклеточной жидкости
мозга зависит от парциального
давления углекислого газа в артериальной
крови. Увеличение вентиляции легких
при стимуляции центральных
хеморецепторов ионами водорода называется
центральным хеморефлексом, который
оказывает выраженное влияние на
дыхание. Так, в ответ на уменьшение
рН внеклеточной жидкости мозга в
области локализации рецепторов на
0,01 легочная вентиляция возрастает в
среднем на 4,0 л/мин. Однако
центральные хеморецепторы медленно
реагируют на изменения С02 в
артериальной крови, что обусловлено их
локализацией в ткани мозга. У
человека центральные хеморецепторы
стимулируют линейное увеличение
вентиляции легких при увеличении С02 в
артериальной крови выше порог,
равного 40 мм рт. ст.
ои-
I
|40-
<.
^зо-
|го-
£10-
ш
m 0
с
5
i
40
i
45
1
50 5
Артериальное РС02 (мм рт. ст.)
Рис. 10.23. Зависимость вентиляции
легких от степени стимуляции
центральных хеморецепторов
изменениями [Н+]/РС02 в артериальной
крови. Увеличение парциального
давления С02 в артериальной крови
выше порога (РС02 = 40 мм рт. ст.)
линейно увеличивает объем
вентиляции легких.
10. Функции дыхательной системы • 503
Периферические (артериальные) хе-
морецепторы расположены в каротид-
ных тельцах в области бифуркации
общих сонных артерий и в
аортальных тельцах в области дуги аорты.
Периферические хеморецепторы
реагируют как на изменение
концентрации водородных ионов, так и
парциального давления кислорода в
артериальной крови. Рецепторы
чувствительны к анаэробным метаболитам,
которые образуются в ткани каротид-
ных телец при недостатке кислорода.
Недостаток кислорода в тканях каро-
тидных телец может возникнуть,
например, при гиповентиляции,
ведущей к гипоксии, а также при гипо-
тензии, вызывающей снижение
кровотока в сосудах каротидных телец.
При гипоксии (низкое парциальное
давление кислорода) периферические
хеморецепторы активируются под
влиянием увеличения концентрации в
артериальной крови, прежде всего,
ионов водорода и РС02. Действие на
периферические хеморецепторы этих
раздражителей усиливается по мере
снижения в крови Р02
(мультипликативное взаимодействие). Гипоксия
увеличивает чувствительность
периферических хеморецепторов к [Н+] и С02. Это состояние называется
асфиксией и возникает при прекращении вентиляции легких. Поэтому
периферические хеморецепторы называются часто рецепторами асфиксии.
Импульсы от периферических хеморецепторов по волокнам синокаротидного
нерва (нерв Геринга — часть языкоглоточного нерва) и аортальной ветви
блуждающего нерва достигают чувствительных нейронов ядра одиночного
тракта продолговатого мозга, а затем переключаются на нейроны
дыхательного центра. Возбуждение последнего вызывают прирост вентиляции
легких. Вентиляция легких увеличивается линейно в соответствии с
величиной [Н+] и РС02 выше порога (40 мм рт. ст.) в артериальной крови,
протекающей через каротидные и аортальные тельца (рис. 10.24). Наклон
кривой на рисунке, который отражает чувствительность периферических
хеморецепторов к [Н+] и РС02, варьирует в зависимости от степени
гипоксии.
10.5.4.2. Механорецепторный контроль дыхания
Механорецепторный контроль дыхания осуществляется рефлексами,
которые возникают при раздражении механорецепторов дыхательных путей
легких. В тканях дыхательных путей расположено два основных типа
механорецепторов, импульсы от которых поступают к нейронам дыхательного
центра: быстро адаптирующиеся, или ирритантные, рецепторы и
рецепторы растяжения.
Артериальное РС02 (мм рт. ст.)
Рис. 10.24. Зависимость вентиляции
легких от степени стимуляции
периферических хеморецепторов гипок-
сическим стимулом.
При стимуляции периферических
хеморецепторов гипоксией имеет место
мультипликативное взаимодействие
парциального давления С02 в артериальной крови и
гипоксии, в результате которого
происходит максимальное увеличение вентиляции
легких. Напротив, при высоком
Парциальном давлении кислорода в
артериальной крови периферические
хеморецепторы слабо реагируют на увеличение РС02.
Если в артериальной крови парциальное
давление С02 становится ниже порога
(40 мм рт.ст.), то периферические
хеморецепторы также слабо реагируют на
гипоксию.
504 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Быстроадаптирующиеся рецепторы расположены в эпителии и
субэпителиальном слое, начиная от верхних дыхательных путей вплоть до альвеол.
Название рецепторов свидетельствует о том, что они активируются при
раздражении не продолжительно и быстро снижают свою активность при
сохранении действия стимула. Поэтому быстроадаптирующиеся рецепторы
реагируют на изменение силы раздражения. Эти рецепторы инициируют
такие сложные рефлексы, как нюхательный или кашлевой. Они
возбуждаются при попадании на слизистую оболочку трахеи и бронхов
механических или химических раздражителей (пыль, слизь, табачный дым, пары
едких веществ — аммиак, эфир). В зависимости от местоположения ирри-
тантных рецепторов в дыхательных путях возникают специфические
рефлекторные реакции дыхания. Раздражение рецепторов слизистой оболочки
носовой полости при участии тройничного нерва вызывает рефлекс
чиханья; рецепторов эпифарингеальной области — через волокна языкоглоточ-
ного нерва — нюхательный или аспирационный рефлекс; рецепторов
слизистой оболочки гортани и трахеи — через волокна блуждающего нерва —
рефлекс чиханья; рецепторов слизистой оболочки от уровня трахеи и до
бронхиол — при участии блуждающих нервов — парадоксальный рефлекс
Геда (при раздувании легких) и рефлекс выдоха и, наконец, рецепторов
стенки альвеол в месте их контакта со стенкой легочных капилляров —
через волокна блуждающего нерва — вызывает рефлекторную реакцию в виде
частого и поверхностного дыхания.
Медленно адаптирующиеся рецепторы растяжения легких локализованы в
гладких мышцах главных дыхательных путей бронхиального дерева
(бронхи и трахея) и раздражаются в результате увеличения объема легких
(раздувание). Рецепторы связаны с нейронами дорсальной дыхательной группы
дыхательного центра миелинизированными афферентными волокнами
блуждающего нерва. Стимуляция этих рецепторов вызывает рефлекс
Геринга—Брейера, который у животных проявляется в том, что раздувание
легких вызывает рефлекторное переключение фазы вдоха на фазу выдоха.
У человека в состоянии бодрствования этот рефлекторный эффект
возникает при величине дыхательного объема, которая превышает примерно в
три раза его нормальную величину при спокойном дыхании. Во время сна
рефлекторное выключение вдоха с помощью рефлекса Геринга—Брейера
обусловливает смену фаз дыхательного цикла.
Легочные J-рецепторы локализованы в пределах стенок альвеол в месте
их контакта с капиллярами и способны реагировать на стимулы как со
стороны легких, так и со стороны легочного кровообращения. Рецепторы
связаны с дыхательным центром немиелинизированными афферентными
С-волокнами. Эти рецепторы повышают свою активность при увеличении
в плазме крови концентрации ионов водорода, при сдавливании легочной
ткани или легочном отеке. Наибольшую активность легочные J-рецепторы
имеют во время физической активности большой мощности и при
подъеме на большую высоту над уровнем моря. В этих случаях одним из
проявлений изменения давления в сосудах малого круга кровообращения может
быть отек легких разной выраженности. Возникающее при этом
раздражение J-рецепторов вызывает частое, поверхностное дыхание, рефлекторную
бронхоконстрикцию и одышку.
Проприорецепторы. Дыхательный центр непрерывно получает
афферентные входы от прориорецепторов мышц {мышечные веретена и сухожильные
рецепторы Гольджи) по восходящим спинальным трактам. Эти
афферентные входы являются как неспецифическими (рецепторы расположены в
мышцах и суставах конечностей), так и специфическими (рецепторы рас-
10. Функции дыхательной системы • 505
положены в дыхательных мышцах). Импульсация от проприорецепторов
распространяется преимущественно к спинальным центрам дыхательных
мышц, а также к центрам головного мозга, контролирующим тонус
скелетной мускулатуры. Активация проприорецепторов в момент начала
физической нагрузки является основной причиной увеличения активности
дыхательного центра и повышения вентиляции легких. Проприорецепторы
межреберных мышц и диафрагмы рефлекторно регулируют ритмическую
активность дыхательного центра продолговатого мозга в зависимости от
положения грудной клетки в различные фазы дыхательного цикла, а на
сегментарном уровне — тонус и силу сокращения дыхательных мышц.
10.6. Дыхание при физической нагрузке
При физической нагрузке регуляция дыхания не обусловлена
исключительно ролью хеморецепторов, поскольку парциальное напряжение 02 в
альвеолах повышено относительно нормы в связи с увеличенной
вентиляцией, или гиперпноэ, а прирост С02 недостаточен для хеморецепторной
стимуляции внешнего дыхания. При физической нагрузке в мышцах
возрастает продукция молочной кислоты, которая стимулирует
периферические хеморецепторы дыхания, но основное значение в увеличении
вентиляции имеют супрабульбарные входы, которые изменяют активность
дыхательного центра продолговатого мозга.
Увеличение дыхания при физической нагрузке проявляется в виде трех
фаз:
1) первая фаза гиперпноэ возникает в первые 20 с под влиянием
нисходящих двигательных команд от нейронов моторной коры и входов от
проприорецепторов сокращающихся мышц;
2) вторая фаза характеризуется медленным (экспотенциальным)
приростом вентиляции в результате активации под влиянием нисходящих
центральных команд центров варолиева моста, регулирующих
дыхание (например, пневмотаксического);
3) третья фаза проявляется относительно постоянным уровнем
активации механизмов регуляции легочной вентиляции, которые включают
процессы температурного и хеморецепторного контроля внутренней
среды организма при физической нагрузке.
Начальная стадия увеличения вентиляции при физической нагрузке
обусловлена так называемыми нейрогенными стимулами. Механизм нейро-
генной стимуляции вентиляции легких обусловлен афферентными
импульсами от рецепторов работающих мышц, центральных двигательных команд
моторной коры и двигательных центров ствола мозга. Двигательные
команды моторной коры обусловливают специфику вентиляции легких при
разных видах физической активности. Дыхание человека в определенной
степени может находиться под произвольным (корковым) контролем;
человек может прекратить дыхательные движения или, наоборот, увеличить
вентиляцию легких (гипервентиляция). Кора больших полушарий
головного мозга регулирует паттерн дыхательных движений при речи, пении,
занятиях физическими упражнениями, например при плавании, при игре на
духовых музыкальных инструментах. Нисходящие двигательные команды
от соответствующих областей коры поступают к нейронам дыхательного
центра, а по пирамидным трактам в составе боковых столбов —
непосредственно к дыхательным мотонейронам сегментов спинного мозга.
Непроизвольная стимуляция вентиляции легких при физической нагрузке
происходит под влиянием двигательных центров ствола мозга, нисходящие влия-
506 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ния которых в составе бульбоспи-
нальных трактов адресованы
двигательным нейронам дыхательных
мышц в соответствующие сегменты
спинного мозга, с помощью которых
непосредственно осуществляются
регуляция тонуса и сокращение
скелетных мышц организма человека.
Наряду с корковыми влияниями на
прирост вентиляции во время
физической нагрузки важную роль
выполняет таламический «генератор
двигательного паттерна», с помощью
которого частота и амплитуда
дыхательных движений могут быть включены
в определенный ритм движения,
например, при плавании или беге.
Физическая нагрузка низкой и
средней интенсивности. При физической
нагрузке низкой и средней
интенсивности, когда потребление 02 (V02)
составляет менее 55 % от
максимальной скорости этого процесса в
организме, V02 и вентиляция легких
взаимосвязаны между собой
линейно (рис. 10.25). Для обеспечения
потребления 1 л 02 в организме при
физической нагрузке необходимо
увеличение вентиляции легких (VE)
на 20—25 л. Это соотношение называется дыхательным эквивалентом и
оно равно 25 : 1 при физической нагрузке низкой и средней
интенсивности. В этих условиях у человека из крови в ткани экстрагируется 20—25 %
02, поскольку 25 л вдыхаемого воздуха содержит 5 л кислорода. Для
физически тренированных людей максимальная вентиляция легких должна
составить порядка 120 л/мин, чтобы обеспечить необходимое потребление 02
в организме, равное порядка 5 л/мин.
Физическая нагрузка высокой интенсивности. Начиная с так
называемого анаэробного порога, происходит увеличение дыхательного эквивалента
(35—40:1). Интенсивность физической нагрузки, при которой достигается
это изменение, представляет собой так называемый дыхательный порог.
Дыхательный порог проявляется значительным ростом вентиляции легких,
что обусловлено увеличением содержания С02 в плазме крови в результате
его высвобождения из бикарбонатного буфера ионами водорода, что
соответствует так называемому лактатному порогу. Лактатный порог
представляет собой количество потребляемого 02, при котором возрастает
концентрация молочной кислоты в плазме крови (более чем на 1 мМ выше
уровня покоя), а продукция молочной кислоты в мышцах начинает превышать
буферную емкость крови. С этого момента, который соответствует
дыхательной компенсаторной точке, у человека начинается второй прирост
легочной вентиляции.
При анаэробной физической нагрузке увеличение вентиляции легких
вызывают не только центральные двигательные команды и афферентные
обратные связи от работающих мышц, но и стимуляция периферических
Аэробная Анаэробная
РС02
^молочная кислота
Мощность физической нагрузки
Рис. 10.25. Зависимость вентиляциии
легких относительно аэробной и
анаэробной мощности физической
нагрузки.
При аэробной физической нагрузке
вентиляция легких линейно связана с
мощностью физической нагрузки. В этих
условиях активация дыхательного центра и
прирост вентиляции легких обусловлены ней-
рогенными стимулами. При анаэробной
физической нагрузке прирост вентиляции
легких становится не линейным
относительно метаболизма в мышцах. В этих
условиях активация дыхательного центра и
прирост вентиляции легких обусловлены
стимуляцией центральных и
периферических хеморецепторов.
10. Функции дыхательной системы • 507
хеморецепторов снижением рН артериальной крови (молочный ацидоз),
увеличение температуры тела (стимулирует дыхательный центр через центр
терморегуляции гипоталамуса) и, наконец, увеличение в плазме крови
содержания катехоламинов.
Энергетическая стоимость дыхания. В покое дыхательные мышцы
человека потребляют примерно 4 % от общего количества 02, потребляемого
тканями организма. При физической нагрузке V02 дыхательных мышц
возрастает до 8—11 % и более. В этих условиях дыхательные мышцы
совершают работу, равную 50 % от их максимальной способности развивать
силу сокращения. Физическая тренировка вызывает приспособление
вентиляции; при этом максимальная нагрузка линейно увеличивает
вентиляцию легких в зависимости от роста V02 у человека. В результате
физической тренированности человека у него снижается относительная
энергетическая стоимость дыхания за счет увеличения лактатного порога, причем
чем выше физическая тренированность человека, тем меньше в
работающих мышцах продуцируется ионов Н+, которые инициируют
высвобождение С02 из бикарбонатного буфера. Соответственно у тренированных
людей меньше выражена хеморецепторная стимуляция дыхания при
физической нагрузке.
После прекращения физической нагрузки в первые 20—30 с резко
уменьшается вентиляция легких, что обусловлено прекращением
двигательных команд со стороны коры головного мозга и двигательных центров
ствола мозга. Быстрое начальное уменьшение вентиляции легких
переходит в стадию медленного восстановления исходных показателей частоты,
глубины и объема легочной вентиляции. В эту стадию в мышцах
снижаются потребление кислорода и продукция углекислого газа. Благодаря
вентиляции легких происходит нормализация содержания газов в артериальной
крови до физиологических величин состояния покоя.
10.7. Дыхание человека при измененном барометрическом
давлении воздуха
10.7.1. Дыхание человека при пониженном давлении воздуха
Снижение парциального давления кислорода в окружающем воздухе, что в
естественных условиях имеет место при восхождении человека на высокие
горы, вызывает недостаток 02 в крови, что называется артериальной гипок-
семией. Так, на высоте 3000 м над уровнем моря барометрическое давление
воздуха уменьшается на '/3> а на высоте 8500 м — на 2/3- При подъеме
человека на высоту до 3—3,5 км над уровнем моря артериальная кровь
насыщена кислородом в пределах нормы — на 90—95 % (табл. 10.3).
Поскольку насыщение артериальной крови кислородом при подъеме на
высоту до 3000 м над уровнем моря составляет не менее 90 %, то в этих
условиях незначительное снижение напряжения 02 в артериальной крови
человека происходит за счет уменьшения содержания в крови физически
растворенного кислорода. Это, тем не менее, обусловливает появление
слабо выраженной гипоксемии и сопровождается незначительным
увеличением вентиляции легких. Восхождение человека на высокую гору всегда
сопряжено с усиленной мышечной деятельностью, повышением
температуры тела, увеличением в плазме крови содержания катехоламинов. Эти
факторы оказывают комплексное стимулирующее влияние на дыхание
человека при восхождении на горную высоту. В результате слабо выраженная
артериальная гипоксемия при участии периферических хеморецепторов
508 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Таблица 10.3. Парциальное давление кислорода во вдыхаемом и альвеолярном воздухе
и процент насыщения артериальной крови кислородом на различной высоте над уровнем
моря
Высота над
уровнем
моря (м)
0
1000
2000
3000
4000
5000
6000
7000
8000
9000
Барометрическое давление
(мм рт. ст.)
760
680
600
530
460
405
355
310
270
230
Парциальное давление 02 (мм рт. ст)
вдыхаемый воздух
159
140
125
ПО
98
85
74
65
56
48
альвеолярный воздух
105
90
70
62
50
45
40
35
30
<25
Насыщение
артериальной
крови 02 (%)
95
94
92
90
85
75
70
60
50
>40
увеличивает степень гиперпноэ у человека, обусловленное работой мышц.
Повышенное содержание катехоламинов в плазме крови повышает
чувствительность периферических хеморецепторов к гипоксемии и, усиливая
активность периферических хеморецепторов, ведет к росту параметров
внешнего дыхания. Наконец, повышение температуры тела человека при
восхождении на высокие горы в результате мышечной деятельности также
повышает чувствительность периферических хеморецепторов к
гипоксемии. Повышение температуры тела при физической работе может
стимулировать дыхание через усиление скорости метаболизма в организме, через
периферические хеморецепторы и нейроны дыхательного центра. При
этом периферические хеморецепторы являются основными источниками
стимуляции вентиляции легких у человека при гипоксии. Поэтому при
восхождении человека на высокую гору до высоты 3—3,5 км над уровнем
моря усиление вентиляции обусловлено активацией механизмов
гуморальной и нервной регуляции дыхания в пределах физиологической нормы.
Начиная с высоты 3,5 км над уровнем моря в артериальной крови
человека уменьшение напряжения 02 в плазме крови происходит как за счет
падения фракции физически растворенного 02, так и за счет понижения
насыщения гемоглобина кислородом. При снижении насыщения
артериальной крови кислородом до 80—85 % у человека появляются признаки
недостаточности дыхания, которые проявляются головокружением,
увеличением частоты сердцебиений, слабостью, вплоть до потери способности
мышечной деятельности, или обморочным состоянием. Явления
дыхательной недостаточности, как правило, возникают внезапно и исчезают при
отдыхе, но могут вновь появиться при возобновлении восхождения на
высокую гору в результате мышечной деятельности. Указанный комплекс
симптомов получил название горной болезни. При выраженной гипоксии
(4000 м и выше над уровнем моря), когда напряжение кислорода в
артериальной крови достигает 50 мм рт. ст. и менее, возникает метаболический
ацидоз ткани мозга в результате активации анаэробного гликолиза. Как
следствие, уменьшается рН внеклеточной жидкости мозга. Повышение
концентрации водородных ионов во внеклеточной жидкости мозга
стимулирует центральные хеморецепторы, что обусловливает первоначальное
существенное увеличение вентиляции легких. Однако выраженная гипоксия
оказывает угнетающий эффект на вентиляцию легких двумя механизмами.
10. Функции дыхательной системы • 509
Во-первых, гипоксия может прямо угнетать нейронную активность
дыхательного центра и таким образом усугублять степень дыхательной
недостаточности у человека, восходящего на высокую гору. Во-вторых, гипоксия
вызывает усиление кровотока в сосудах мозга под влиянием низкого
напряжения 02 в крови. Этот механизм способствует повышению
кислородного снабжения ткани мозга человека в условиях выраженной гипоксемии.
Однако усиление мозгового кровотока повышает скорость газообмена С02
между межклеточной жидкостью мозга и кровью и вызывает снижение
напряжения С02 в ткани мозга, а следовательно, уменьшение
стимулирующего влияния центральных хеморецепторов на дыхательный центр и
снижение вентиляции легких. Этот механизм вызывает нарастание степени
артериальной гипоксемии, и в условиях пониженного парциального
давления 02 в атмосферном воздухе у человека увеличивается дыхательная
недостаточность. При высокой степени развития горной болезни у человека
ее проявления становятся опасными для жизни. Проявление крайней
физической слабости и угнетение функциональной активности ЦНС могут
быть настолько велики, что пострадавший без посторонней помощи не в
состоянии принять меры защиты против грозящей ему смертельной
опасности. Аналогичные явления дыхательной недостаточности могут
возникнуть у людей при воздушных полетах на большой высоте, если происходит
разгерметизация летательного аппарата. При понижении барометрического
давления до величин, вызывающих снижение насыщения артериальной
крови кислородом до 50—45 %, у человека под влиянием гипоксии
наступает смерть.
10.7.2. Дыхание человека при повышенном давлении воздуха
Дыхание человека при повышенном давлении воздуха имеет место на
значительной глубине под водой при работе водолазов или при кессонных
работах. Поскольку давление одной атмосферы соответствует давлению
столба воды высотой 10 м, то в соответствии с глубиной погружения человека
под воду в скафандре водолаза или в кессоне поддерживается давление
воздуха по этому расчету. Человек, находясь в атмосфере повышенного
давления воздуха, не испытывает каких-либо дыхательных расстройств.
При повышенном давлении атмосферного воздуха человек может дышать в
том случае, если в его дыхательные пути поступает воздух под таким же
давлением. При этом растворимость газов в жидкости прямо
пропорциональна его парциальному давлению. Поэтому при дыхании воздухом на
уровне моря в 1 мл крови содержится 0,011 мл физически растворенного
азота. При давлении воздуха, которым дышит человек, например, 5
атмосфер, в 1 мл крови будет содержаться в 5 раз больше физически
растворенного азота. При переходе человека к дыханию при более низком давлении
воздуха (подъем кессона на поверхность или всплытие водолаза) кровь и
ткани тела могут удержать только 0,011 мл ]Ч2/мл крови. Остальное
количество азота переходит из раствора в газообразное состояние. Переход
человека из зоны повышенного давления вдыхаемого воздуха к более
низкому его давлению должен происходить достаточно медленно, чтобы
освобождающийся азот успел выделиться через легкие. Если азот, переходя в
газообразное состояние, не успевает полностью выделиться через легкие, что
имеет место при быстром подъеме кессона или нарушении режима
всплытия водолаза, пузырьки азота в крови могут закупорить мелкие сосуды
тканей организма. Это состояние называется газовая эмболия. В зависимости
от локализации газовой эмболии (сосуды кожи, мышц, центральной нерв-
510 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ной системы, сердца и др.) у человека возникают различные расстройства
(боли в суставах и мышцах, потеря сознания), которые в целом
называются «кессонной болезнью». Развитие кессонной болезни предотвращается
определенной скоростью декомпрессии, т. е. скоростью перехода человека
от дыхания при повышенном давлении воздуха к дыханию воздухом при
нормальном атмосферном давлении на уровне моря. Например, переход
человека от дыхания при одной добавленной атмосфере к дыханию
атмосферным воздухом на уровне моря должен происходить 5 мин, от двух
добавленных атмосфер — 30 мин, а от четырех — 60 мин. В случае
возникновения кессонной болезни пострадавшего немедленно помещают в
барокамеру, в которой быстро повышают давление воздуха, которое обеспечивает
растворение мелких пузырьков азота в тканях организма. Это приводит к
исчезновению проявлений у человека кессонной болезни. Последующая
декомпрессия давления воздуха в барокамере производится по
специальным нормам времени под наблюдением медицинского персонала за
пострадавшим человеком.
ГЛАВА И
Функции пищеварительной системы
Пищеварительная система включает в себя пищеварительный (желудочно-
кишечный) тракт, имеющий трубчатое строение (пищевод, желудок,
тонкая и толстая кишка), слюнные железы, печень и поджелудочную железу.
Благодаря нервным и гуморальным механизмам регуляции функций
органы пищеварения объединены в единую систему.
Для поддержания обмена веществ и энергии и осуществления
жизнедеятельности организма необходимо поступление из внешней среды
органических и неорганических веществ. Содержащиеся в пище белки, жиры,
углеводы и другие сложные органические вещества не могут быть усвоены
организмом человека и животных без предварительной
физико-химической обработки в желудочно-кишечном тракте, в результате которой
происходит деполимеризация молекул питательных веществ. Образующиеся
под влиянием гидролитических ферментов пищеварительных соков олиго-
меры и мономеры, лишенные видовой специфичности, поступают в кровь,
лимфу и тканевую жидкость и включаются в метаболизм клеток. Комплекс
процессов механической, физико-химической и химической обработки пищи, а
также всасывание в пищеварительном тракте конечных продуктов гидролиза
и называется пищеварением. Пищеварение осуществляется благодаря
реализации функций пищеварительной системы (моторной, секреторной и
всасывательной).
11.1. Состояние голода и насыщения
Пищеварительная система является частью более сложной системы —
функциональной системы питания, обеспечивающей сложное пищедобыва-
тельное поведение и поддерживающей относительно постоянный уровень
содержания питательных веществ в организме.
В процессе метаболизма клеток происходит постоянное потребление ими
питательных веществ. Снижение концентрации питательных веществ в
крови приводит к возникновению у животных и человека неприятного чувства
голода, которое является субъективным выражением потребности организма
в пище. Физиологической основой для чувства голода является возбуждение
центра голода, локализованного в латеральных ядрах гипоталамуса. Чувство
голода является побудительной причиной (мотивацией) целенаправленной
пищедобывательной деятельности (поиска и приема пищи). При
электростимуляции через вживленные электроды (в опытах на животных)
латеральных ядер гипоталамуса возникает чрезмерная потребность в пище (гиперфа-
гия), а при их разрушении — отказ от приема пищи (афагия). Мощным
стимулятором центра голода является кровь с пониженным содержанием
глюкозы, аминокислот, жирных кислот и глицеридов, продуктов метаболизма
цикла Кребса. Она возбуждает ядра латерального гипоталамуса через хемо-
рецепторы сосудов и рецепторы самого гипоталамуса, избирательно
чувствительные к недостатку в крови определенных питательных веществ.
512 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
После приема пищи у животного и человека возникает субъективно
приятное чувство насыщения, сменяющее чувство голода и прекращающее
потребление пищи. Чувство насыщения является следствием возбуждения
центра насыщения, расположенного в вентромедиальных ядрах
гипоталамуса. Между центрами голода и насыщения имеются реципрокные
отношения (возбуждение одного сопровождается торможением другого).
Чувство насыщения, прекращающее прием пищи, имеет нейрогенную
природу и обусловлено поступлением афферентных импульсов от
раздражаемых пищей рецепторов проксимальных отделов пищеварительного
тракта (слизистых оболочек и мускулатуры полости рта, пищевода и
желудка). Эта афферентация возбуждает центр насыщения и тормозит центр
голода. Она является причиной сенсорного насыщения (первичного) и
предшествует увеличению питательных веществ в крови.
Через 1,5—2 ч после приема пищи исходный уровень содержания
питательных веществ в крови восстанавливается за счет их поступления из
органов, в которых они находятся в депонированном состоянии.
Так, превращение гликогена печени в глюкозу приводит к возрастанию
ее концентрации в крови. Это обусловливает гуморальное возбуждение
центра насыщения, что является причиной метаболического (обменного,
вторичного) насыщения.
Поддержание уровня концентрации питательных веществ в крови
осуществляется за счет поступления из желудочно-кишечного тракта
продуктов гидролиза пищевых веществ.
11.2. Общая характеристика функций пищеварительной системы
и механизмов ее регуляции
11.2.1. Секреторная функция
Секреторная функция — деятельность пищеварительных желез,
вырабатывающих секрет (пищеварительный сок), с помощью ферментов которого в
желудочно-кишечном тракте осуществляется физико-химическое
преобразование принятой пищи.
Секреция — процесс образования из веществ, поступивших из крови в
секреторные клетки (гландулоциты), секрета определенного
функционального назначения и выделения его из железистых клеток в протоки
пищеварительных желез.
Секреторный цикл железистой клетки состоит из трех
последовательных и взаимосвязанных этапов — поглощения веществ из крови, синтеза
из них секреторного продукта и секретовыделения. Клетки
пищеварительных желез по характеру продуцируемого секрета подразделяются на
белок-, мукоид- и минералсекретирующие. Пищеварительные железы
отличаются обильной васкуляризацией. Из крови, протекающей по сосудам
железы, секреторные клетки поглощают воду, неорганические и
органические низкомолекулярные вещества (аминокислоты, моносахариды,
жирные кислоты). Этот процесс осуществляется за счет активности ионных
каналов, базальных мембран эндотелиоцитов капилляров, мембран самих
секреторных клеток. Из поглощенных веществ на рибосомах гранулярного
эндоплазматического ретикулума синтезируется первичный секреторный
продукт, который подвергается дальнейшим биохимическим
превращениям в аппарате Гольджи и накапливается в конденсирующих вакуолях глан-
дулоцитов. Вакуоли превращаются в гранулы зимогена (профермента),
покрытые липопротеиновой оболочкой, с помощью которой окончательный
11. Функции пищеварительной системы • 513
секреторный продукт транспортируется через мембрану гландулоцита в
протоки железы.
Гранулы зимогена выводятся из секреторной клетки по механизму экзо-
цитоза: после перемещения гранулы к апикальной части гландулоцита
происходит слияние двух мембран (гранулы и клетки), и через
образовавшиеся отверстия содержимое гранул поступает в ходы и протоки железы.
По характеру выделения секрета этот тип клеток относят к мерокри-
новым.
Для голокриновых клеток (клеток поверхностного эпителия желудка)
характерно превращение всей массы клетки в секрет в результате ее
ферментативной деструкции. Апокриновые клетки вьщеляют секрет с апикальной
(верхушечной) частью своей цитоплазмы (клетки протоков слюнных желез
человека в период эмбриогенеза).
Секреты пищеварительных желез состоят из воды, неорганических и
органических веществ. Наибольшее значение для химической
трансформации пищевых веществ имеют ферменты (вещества белковой природы),
являющиеся катализаторами биохимических реакций. Они относятся к
группе гидролаз, способных присоединять к перевариваемому субстрату Н+ и
ОН", превращая высокомолекулярные вещества в низкомолекулярные. В
зависимости от способности расщеплять определенные вещества
ферменты подразделяются на 3 группы: глюколитические (гидролизующие
углеводы до ди- и моносахаридов), протеолитические (гидролизующие белки до
пептидов, пептонов и аминокислот) и липолитические (гидролизующие
жиры до глицерина и жирных кислот). Гидролитическая активность
ферментов возрастает в известных пределах при повышении температуры
перевариваемого субстрата и наличия в ней активаторов, их активность
снижается под влиянием ингибиторов. Максимальная гидролитическая активность
ферментов слюны, желудочного и кишечного соков обнаруживается при
разном оптимуме рН среды.
Принято различать несколько типов и подтипов пищеварения.
Гидролиз пищевых веществ за счет ферментов, вырабатываемых
пищеварительными железами самого организма, характерен для собственного
типа пищеварения. В результате осуществления собственного типа
пищеварения образуется основное количество олигомеров, поступающих в
кровь и лимфу. Расщепление компонентов пищи ферментами,
синтезируемыми микроорганизмами, которые обитают в пищеварительном тракте,
называют симбионтным типом пищеварения (поскольку он является
следствием симбиоза организмов хозяина и микробов). Так переваривается
клетчатка в толстом кишечнике человека.
Гидролиз пищевых веществ ферментами, поступающими в
пищеварительный тракт вместе с пищей, относят к аутолитическому типу
пищеварения, так как происходит самопереваривание. Аутолитическое пищеварение
играет важную роль у новорожденного, потому что компоненты грудного
молока перевариваются ферментами, входящими в его состав.
В зависимости от локализации процесса гидролиза пищевых веществ
различают два типа пищеварения — внутриклеточное и внеклеточное.
Внутриклеточное пищеварение — расщепление мельчайших частичек
пищевых веществ, поступивших в энтероцит путем эндоцитоза, за счет
клеточных ферментов. Этот тип пищеварения играет важную роль в
кишечном пищеварении в раннем постнатальном периоде развития. По мере
формирования функций пищеварительного тракта у ребенка значение
внутриклеточного пищеварения уменьшается. Внеклеточное пищеварение
А. М. Уголев предложил делить на 2 подтипа — дистанционное и присте-
17-6095
514 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Рис. 11.1. Схема внеклеточного, внутриклеточного и мембранного гидролиза
пищевых веществ.
1 — внеклеточная среда; 2 — перевариваемый субстрат и продукты его гидролиза; 3 —
ферменты; 4 — внутриклеточная среда; 5 — мембрана энтероцита; 6 — ядро; 7 — внутриклеточная
пищеварительная вакуоль, 8 — мезосома.
А — внеклеточное (дистантное) пищеварение. Полимеры и олигомеры пищевых веществ под
влиянием ферментов пищеварительных соков в полости кишки гидролизуются до мономеров,
которые через мембрану энтероцита транспортируются в его цитоплазму. Б —
внутриклеточное цитоплазматическое пищеварение. Олигомеры пищевых веществ проникают через
мембрану энтероцита в его цитоплазму и под влиянием ферментов, находящихся в цитоплазме,
превращаются в мономеры. В — внутриклеточное вакуольное (внеплазматическое)
пищеварение, связанное с эндоцитозом. В мембране энтероцита образуется выпячивание, которое
заполняется перевариваемым субстратом и превращается в вакуоль. Вакуоль соединяется с мезо-
сомой, заполненной ферментами, которые расщепляют субстрат до конечных продуктов
гидролиза, поступающих через мембрану вакуоли в цитоплазму энтероцита. Г — мембранное
пищеварение. Адсорбированные на внешней поверхности мембраны энтероцита ферменты
расщепляют олигомеры пищевых веществ до мономеров, которые затем поступают в цитоплазму
клетки.
ночное. Дистанционное (полостное) пищеварение осуществляется в
полостях пищеварительного тракта, удаленных от мест выработки ферментов.
В процессе полостного пищеварения деполимеризация молекул пищевых
веществ совершается в основном до олигомеров. Пристеночное
пищеварение (контактное, мембранное) совершается в тонком кишечнике — в
пристеночном слое слизи, на поверхности ворсинок и микроворсинок, в гли-
кокаликсе (мукополисахаридных нитях, связанных с мембраной
микроворсинок). В слизи и гликокаликсе содержится много адсорбированных
ферментов пищеварительных соков, выделенных в полость кишки и
расположенных на огромной площади соприкосновения с перевариваемым
субстратом. Поэтому в процессе пристеночного пищеварения значительно
увеличивается скорость гидролиза пищевых веществ, что приводит к
возрастанию объема всасывания продуктов гидролиза.
Схема внеклеточного и мембранного пищеварения представлена на
рис. 11.1. Из этой схемы следует, что при внеклеточном пищеварении (А)
ферменты расщепляют субстрат в полости пищеварительного тракта до
конечных продуктов гидролиза, которые затем проникают в цитоплазму
энтероцита.
В процессе внутриклеточного цитоплазматического пищеварения (Б)
крупные осколки молекул пищевых веществ проникают через мембрану
энтероцита в его цитоплазму и расщепляются ее ферментами до
мономеров. При внутриклеточном вакуольном пищеварении (В) мельчайшие час-
11. Функции пищеварительной системы • 515
тички субстрата захватываются из
полости кишки мембраной энтероцита,
образующей выпячивание, которое
превращается в вакуоль. Вакуоль,
содержащая субстрат, объединяется с
вакуолью (мезосомой), наполненной
ферментом, который и осуществляет
гидролиз субстрата. Мембранное
пищеварение (Г) характеризуется тем,
что интенсивный процесс гидролиза
крупных осколков молекулы
питательных веществ до мономеров
происходит на поверхности энтероцита за
счет ферментов, адсорбированных на
его мембране.
На рис. 11.2 схематически
показано, что на поверхности
микроворсинок энтероцитов и нитей апикального
и латерального гликокаликса
происходит гидролиз частичек пищевых
веществ за счет адсорбированных
ферментов. Поскольку суммарная
площадь, на которой происходит
гидролиз пищевых веществ, очень
большая, то это обусловливает высокую
эффективность мембранного
пищеварения
Заключительные стадии гидролиза
пищевых веществ осуществляют
ферменты, синтезируемые энтероцитами
и встроенные в структуры их
мембран. Образующиеся на поверхности
мембраны энтероцита мономеры
всасываются за счет активности ее
ионных каналов.
Таблица 11.1. Гормоны желудочно-кишечного тракта, место их образования и
вызываемые ими эффекты
Название
гормона
Соматоста-
тин
Вазоактив-
ный инте-
стинальный
Место
выработки гормона
Желудок,
проксимальный
отдел тонкой
кишки,
поджелудочная железа
Во всех отделах
желудочно-кишечного тракта
Типы
кринных
клеток
D-
клетки
D,-
клетки
Эффект действия гормонов
Тормозит выделение инсулина и глюкагона,
большинства известных
желудочно-кишечных гормонов (секретина, ГИПа, мотилина,
гастрина); тормозит активность
париетальных клеток желудка и ацинарных клеток
поджелудочной железы
Тормозит действие холецистокинина,
секрецию соляной кислоты и пепсина желудком,
стимулированную гистамином, расслабляет
Рис. 11.2. Схема деполимеризации
частичек пищевых веществ на
поверхности микроворсинок
энтероцита, апикальном и латеральном глико-
каликсе.
1—3 — перевариваемые субстраты в
полости кишки; 4 — апикальный гликока-
ликс; 5 — латеральный гликокаликс; 6 —
мембрана микроворсинки; 7 —
микроворсинки энтероцита.
Крупные осколки пищевых веществ в
полости кишки под влиянием ферментов
пищеварительных соков расщепляются до
олигометров (1—3). Их гидролиз на
поверхности микроворсинок и нитей
гликокаликса (4—6) завершается образованием
монометров, молекулы которых
проникают в микроворсинку, а затем — в
цитоплазму энтероцита (8).
"17*
516 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Продолжение
Название
гормона
(ВИП)
пептид
Панкреатический
полипептид
(ПП)
Гастрин
Гастрон
Бульбогас-
трон
Дуокринин
Бомбезин
(гастринвы-
свобождаю-
щий пептид)
Секретин
Холецисто-
кинин-пан-
креозимин
(ХЦК-ПЗ)
Энтероглю-
кагон
Мот или н
Гастроинги-
бирующий
пептид
(ГИП)
Нейротен-
зин
Энкефали-
ны (эндор-
фины)
Субстанция
Р
Место
выработки гормона
Поджелудочная
железа
Антральная
часть желудка,
поджелудочная
железа,
проксимальный отдел
тонкой кишки
Антральный
отдел желудка
Антральный
отдел желудка
Антральный
отдел желудка
Желудок и
проксимальный
отдел тонкой
кишки
Тонкий
кишечник
Тонкий
кишечник
Тонкий
кишечник
Проксимальный отдел
тонкой кишки
Тонкий
кишечник
Дистальный
отдел тонкой
кишки
Проксимальный отдел
тонкой кишки и
поджелудочная
железа
Тонкая кишка
Типы
кринных
клеток
D2-
клетки
G-
клетки
G-
клетки
G-
клетки
G-
клетки
Р-клетки
S-клетки
I-клетки
ЕС,-
клетки
ЕС2-
клетки
К-клет-
ки
N-
клетки
L-клетки
ЕС,-
клетки
Эффект действия гормонов
гладкие мышцы кровеносных сосудов,
желчного пузыря
Антагонист ХЦК-ПЗ, усиливает
пролиферацию слизистой оболочки тонкой кишки,
поджелудочной железы и печени; участвует в
регуляции обмена углеводов и липидов
Стимулирует секрецию и выделение пепсина
желудочными железами, возбуждает
моторику расслабленного желудка и
двенадцатиперстной кишки, а также желчного пузыря
Снижает объем желудочной секреции и
выход кислоты в желудочном соке
Тормозит секрецию и моторику желудка
Стимулирует выделение секрета бруннеро-
вых желез двенадцатиперстной кишки
Стимулирует высвобождение гастрина,
усиливает сокращение желчного пузыря и
выделение ферментов поджелудочной железой,
усиливает выделение энтероглюкагона
Стимулирует секрецию бикарбонатов и воды
поджелудочной железой, печенью, железами
Бруннера, пепсина; тормозит секрецию в
желудке
Возбуждает выход ферментов и в слабой
степени стимулирует выход бикарбонатов
поджелудочной железой, тормозит секрецию
соляной кислоты в желудке, усиливает
сокращение желчного пузыря и желчевыделение,
усиливает моторику тонкой кишки
Тормозит секреторную активность желудка,
снижает в желудочном соке содержание К+ и
повышает содержание Са2+, тормозит
моторику желудка и тонкой кишки
Возбуждает секрецию пепсина желудком и
секрецию поджелудочной железы, ускоряет
эвакуацию содержимого желудка
Тормозит выделение соляной кислоты и
пепсина, высвобождение гастрина, моторику
желудка, возбуждает секрецию толстой
кишки
Тормозит секрецию соляной кислоты
железами желудка, усиливает высвобождение
глюкагона
Тормозит секрецию ферментов
поджелудочной железой, усиливает высвобождение
гастрина, возбуждает моторику желудка
Усиливает моторику кишечника,
слюноотделение, тормозит высвобождение инсулина
11. Функции пищеварительной системы • 517
Продолжение
Название
гормона
Вилликинин
Энтерогас-
трон
Серотонин
Гистамин
Инсулин
Глюкагон
Место
выработки гормона
Двенадцатиперстная кишка
Двенадцатиперстная кишка
Желудочно-кишечный тракт
Желудочно-кишечный тракт
Поджелудочная
железа
Поджелудочная
железа
Типы
кринных
клеток
ЕС,-
клетки
ЕС,-
клетки
ЕС,,
ЕС2-
клетки
ЕС2-
клетки
Бета-
клетки
Альфа-
клетки
Эффект действия гормонов
Стимулирует ритмические сокращения
ворсинок тонкой кишки
Тормозит секреторную активность и
моторику желудка
Тормозит выделение соляной кислоты в
желудке, стимулирует выделение пепсина,
активирует секрецию поджелудочной железы,
желчевыделение, кишечную секрецию
Стимулирует выделение секрета желудка и
поджелудочной железы, расширяет
кровеносные капилляры, оказывает активирующее
влияние на моторику желудка и кишечника
Стимулирует транспорт веществ через
клеточные мембраны, способствует утилизации
глюкозы и образованию гликогена, тормозит
липолиз, активирует липогенез, повышает
интенсивность синтеза белка
Мобилизует углеводы, тормозит секрецию
желудка и поджелудочной железы, тормозит
моторику желудка и кишечника
Регуляция секреторной деятельности пищеварительных желез
осуществляется за счет нервных и гуморальных механизмов. Основными
стимулирующими секрецию нервными волокнами являются парасимпатические.
Они представляют собой аксоны постганглионарных нейронов.
Симпатические нервные волокна тормозят стимулированную секрецию
пищеварительных желез и оказывают на железы трофические влияния, усиливая
синтез компонентов секрета.
Стимуляторами, ингибиторами и модуляторами секреции
пищеварительных желез являются гастроинтестинальные регуляторные пептиды
(табл. 11.1).
11.2.2. Моторная функция
Процесс пищеварения во всех отделах пищеварительного тракта
осуществляется при участии двигательной активности его мускулатуры.
Сокращения мышц обеспечивают: прием и измельчение пищи в процессе жевания
в ротовой полости, глотание и продвижение порции пищи по пищеводу,
накопление ее в желудке и эвакуацию его содержимого в кишечник,
сокращение и расслабление желчного пузыря, перемешивание и
продвижение кишечного содержимого, движение ворсинок, переход химуса из
тонкой кишки в толстую, его перемещение по толстой кишке, сокращение и
расслабление сфинктеров, перистальтику выводных протоков
пищеварительных желез и выведение экскрементов.
Гладкая мускулатура пищеварительного тракта состоит из гладкомы-
шечных клеток (миоцитов). Они собраны в пучки и соединены друг с
другом нексусами. Пучок получает нервные терминали, артериолу и
выполняет роль функциональной единицы гладкой мышцы. Миоциты обладают
518 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
способностью к спонтанному ритмическому возбуждению за счет
периодической деполяризации их мембраны. Это возбуждение распространяется
благодаря нексусам от клетки к клетке (как по синцитию). Пучки миоци-
тов образуют гладкомышечные слои пищеварительной трубки —
циркулярный (внутренний), продольный (наружный) и подслизистый (косой).
Растяжение мышц содержимым желудочно-кишечного тракта является
для них адекватным раздражителем, вызывающим деполяризацию мембран
их клеток и сокращение мышечных волокон. Частота и сила сокращений
миоцитов изменяются в широком диапазоне под влиянием нервных
импульсов эфферентных терминалей вегетативных нервных волокон,
гормонов и гастроинтестинальных регуляторных пептидов. Комплексная
нервно-гуморальная регуляция миоцитов обеспечивает соответствие уровня
активности мускулатуры объему и составу содержимого желудка и
кишечника.
Характер сократительной деятельности мускулатуры пищеварительного
тракта зависит от активности водителей ритма, расположенных в желудке
и кишечнике (см. раздел 11.5.2). Они представляют собой
гладкомышечные клетки, более чувствительные к биологически активным веществам и
имеющие более обильную иннервацию, чем другие пучки миоцитов.
На протяжении пищеварительного тракта у человека имеется около 35
сфинктеров. Они состоят из мышечных пучков, расположенных циркуляр-
но (в основном), спирально и продольно. Сокращение циркулярных
пучков приводит к смыканию сфинктера, а сокращение спиральных и
продольных пучков увеличивает его просвет, что способствует переходу
содержимого пищеварительного тракта в нижележащий отдел. Сфинктеры
обеспечивают движение содержимого пищеварительной трубки в каудальном
направлении и временное разобщение функционально различных частей
пищеварительного тракта. Основные из них — кардиальный (на входе в
желудок), пилорический (на выходе из желудка), в основании баугиниевои
заслонки (на входе в слепую кишку), внутренний и наружный анальный
(на выходе из прямой кишки).
Координация сократительной деятельности различных участков
мускулатуры пищеварительной трубки осуществляется за счет регулирующих
влияний периферической и центральной нервной системы.
Парасимпатические нервные волокна в основном усиливают моторику желудка и
кишечника. Однако в составе блуждающих нервов имеются и волокна,
тормозящие моторику миоцитов. Симпатические нервы оказывают
преимущественно тормозные влияния на мышечные пучки.
Миоциты обладают способностью генерировать медленные
ритмические колебания мембранного потенциала. В фазе деполяризации
мембраны происходит накопление ионов Са2+ в клетке, что активирует кальций-
зависимые калиевые каналы. Это вызывает выход К+ из клетки и приводит
к деполяризации мембраны. Если деполяризация достигает критического
уровня, то на гребне медленной волны возникают потенциалы действия,
которые вызывают открытие быстрых потенциалозависимых кальциевых
каналов, что приводит к сокращению миоцита (рис. 11.3). На этом
рисунке приведена синхронная запись медленных и быстрых колебаний
мембранного потенциала миоцита тонкой кишки при внутриклеточной и
внеклеточной регистрации. С появлением серии быстрых потенциалов
возникает сокращение мышечного волокна.
Медленные волны деполяризации возникают в миоцитах наружной
части циркулярного слоя и распространяются как на круговой, так и на
продольный мышечные слои (по мышечным мостикам). Это определяет по-
11. Функции пищеварительной системы • 519
следовательность сокращения
мышечных пучков, расположенных в
разных мышечных слоях.
Мембрана миоцитов в области
расположения водителей ритма
обладает способностью генерировать
медленные волны с более
высокой частотой, чем в соседних
участках. Это способствует
«навязыванию» частоты медленных волн
клеток водителя ритма миоцитам
соседних участков.
Продольный мышечный слой
имеет выраженную холинергиче-
скую иннервацию, а циркулярный
слой испытывает тонические
влияния интрамуральных тормозных
нейронов через их
многочисленные пептидергические окончания.
Нейромедиатор окончаний
парасимпатических нервных волокон
(ацетилхолин), действуя на М-хо-
линорецепторы, вызывает
повышение проницаемости клеточной
мембраны к ионам Са2+, Na+ и К+. При этом увеличивается количество
потенциалов действия, длительность и амплитуда фазного сокращения
гладкой мышцы, что лежит в основе усиления моторики желудка и
кишечника.
При сильном возбуждении парасимпатических постганглионарных
нейронов повышается концентрация ацетилхолина во внеклеточной среде.
Это приводит к непрерывной генерации миоцитами потенциалов
действия, которые сопровождаются слиянием фазных сократительных эффектов
в слитное сокращение.
Катехоламины влияют на миоциты через адренорецепторы двух типов
(альфа и бета), которые подразделяются на четыре подтипа (а, и а2, рг и
р2). Воздействие норадреналина на а- и (3-адренорецепторы окончаний хо-
линергических нейронов миэнтерального и подслизистого сплетений
угнетает выход ацетилхолина из холинергических окончаний, что ослабляет
парасимпатические влияния на миоциты и способствует торможению
гладкой мускулатуры.
При электрическом раздражении симпатических нервных волокон
имеет место торможение сократительной активности кишечника и усиление
тонуса циркулярных пучков сфинктеров.
11.2.3. Функция всасывания
Всасывание — это совокупность физиологических и физико-химических
процессов транспорта питательных веществ, минеральных соединений и
витаминов из полости пищеварительного тракта во внутреннюю среду
организма (кровь, лимфу, тканевую жидкость). Всасывание веществ
осуществляется на всем протяжении пищеварительного тракта. Но интенсивность
этого процесса в разных ее отделах не одинакова. В ротовой полости
всасывание компонентов пищи осуществляется в ничтожно малых объемах.
"i~v> fm \~^
i_ А
Рис. 11.3. Связь между медленными и
быстрыми электрическими волнами мио-
цита и сокращением мышечного волокна
тонкой кишки.
а — внутриклеточная регистрация медленных и
быстрых потенциалов миоцита (потенциалы
действия накладываются на плато волны
деполяризации); б — внеклеточная регистрация
потенциалов миоцита (серия спайковых
потенциалов совпадает с медленной волной,
регистрируемой при внутриклеточном отведении);
в — локальное сокращение гладкого
мышечного волокна.
520 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Практическое значение имеет
всасывание лишь некоторых
лекарственных веществ (например,
нитроглицерина, валидола). В
желудке всасывается небольшое
количество воды, минеральных
солей, аминокислот, глюкозы. В
значительном количестве из
желудка всасывается алкоголь.
Основным местом всасывания
питательных веществ, минеральных
солей и воды является слизистая
оболочка тонкого кишечника. В
толстом кишечнике всасываются
вода, некоторые минеральные
соли и продукты микробного
гидролиза компонентов пищи.
Слизистая оболочка тонкого кишечника
представляет собой
специализированный орган всасывания. За
счет складок, ворсинок и
микроворсинок ее всасывательная
поверхность возрастает в 300—
500 раз (в сравнении с ее
площадью без учета перечисленных ана-
томо-гистологических
образований) и составляет у человека
около 200 м2. На 1 мм2 слизистой
оболочки приходится от 30 до 40
ворсинок. На апикальной
мембране энтероцита, обращенной в
полость кишки, обнаружено от
1700 до 4000 микроворсинок. У взрослого человека имеется около 1010 эн-
тероцитов. Следовательно, на 1 мм2 слизистой оболочки кишки
приходится 50—100 млн. микроворсинок. Высокая интенсивность всасывания из
тонкой кишки тесно сопряжена с высокой эффективностью гидролиза
пищевых веществ, обусловленной механизмом мембранного пищеварения и
пространственной близостью встроенных в мембрану энтероцита молекул
ферментов и транспортных систем продуктов гидролиза.
Процессу всасывания способствует взаимодействие филаментов белка
актина микроворсинки с филаментами белка миозина щеточной каймы
энтероцита (рис. 11.4).
В процессе гидролиза высокомолекулярных веществ и последующего
всасывания продуктов гидролиза принимает участие гликокаликс на
поверхности мембраны микроворсинки. Гликокаликс состоит из мукополи-
сахаридных нитей, образующих слой толщиной около 0,1 мкм. Нити
связаны друг с другом кальциевыми мостиками и образуют сеть, которая
выполняет роль молекулярного сита, препятствующего проникновению к
мембране микроворсинки высокомолекулярных веществ. Гликокаликс
удерживает на поверхности кишечного эпителия слой слизи и образует
единый комплекс, который адсорбирует из содержимого кишки
гидролитические ферменты, продолжающие полостной гидролиз на поверхности
энтероцита. На мембране микроворсинки процесс деполимеризации моле-
Гликокаликс
Филаменты ».w->
актина ^PS
Клеточная
мембрана
Филаменты
миозина
Рис. 11.4. Роль сократительных белков
щеточной каймы энтероцита.
Филаменты актина, расположенные вдоль
микроворсинки, у ее основания приобретают
направление расположения филаментов
миозина. Взаимодействие актина и миозина
вызывает движение микроворсинки, что
способствует транспорту в цитоплазму энтероцита
проникших через мембрану микроворсинки
мономеров пищевых веществ.
П. Функции пищеварительной системы • 521
кул пищевых веществ завершается. Образовавшиеся мономеры через
мембрану микроворсинки поступают в энтероцит.
В транспорте питательных веществ в энтероцит важную роль играют
микроциркуляторная система ворсинок и их сократительная деятельность.
Сеть капилляров располагается непосредственно под базальной мембраной
энтероцитов. Это способствует транспорту веществ через мембрану энте-
роцита в кровь. Эндотелий капилляров имеет большое количество фенестр
значительного размера (45—67 нм), через которые из межклеточных
пространств в кровь проникают крупные молекулы и надмолекулярные
структуры. При сокращении мускулатуры ворсинки из нее выжимается лимфа в
более крупные лимфатические сосуды, а во время ее расслабления
создается присасывающий эффект, так как возврату лимфы препятствуют
клапаны лимфатических сосудов. Снижение давления в лимфатическом сосуде
ворсинки способствует транспорту веществ из энтероцитов и
межклеточных пространств между ними.
Всасывание макромолекул. Крупные молекулы и их агрегаты
всасываются в кишечнике по механизму трансцитоза. В энтероцит они поступают
путем эндоцитоза. В везикуле, образовавшейся из участка мембраны
клетки, вещество транспортируется через цитоплазму энтероцита и выделяется
из него в межклеточное пространство путем экзоцитоза. При этом
мембрана везикулы (вакуоли), содержащей макромолекулы транспортируемых
веществ, «встраивается» в мембрану энтероцита. Сокращения ворсинок
способствуют эндоцитозу. Так в кишечнике транспортируются
иммуноглобулины, витамины, ферменты, а у новорожденных — белки грудного молока.
Всасывание микромолекул энтероцитами осуществляется по механизму
пассивного транспорта (диффузии и осмоса, облегченной диффузии и
фильтрации), а также активного транспорта.
Движение молекул через полупроницаемые биологические мембраны
энтероцитов в процессе диффузии и осмоса происходит вследствие
концентрационных градиентов веществ в цитоплазме клетки и внеклеточной среде.
Для облегченной диффузии необходимо наличие мембранных переносчиков.
Процесс фильтрации растворенных в воде веществ осуществляется в
силу разности давления жидкости над мембраной, выполняющей роль
фильтра, и под ней. О существовании механизма фильтрации при
всасывании веществ в кишечнике свидетельствует увеличение скорости
всасывания изотонического раствора натрия хлорида при повышении внутрики-
шечного давления в процессе осуществления моторики кишки.
Двигательная активность кишечника способствует всасыванию
продуктов гидролиза пищевых веществ еще и потому, что она обеспечивает
перемешивание пристеночного слоя содержимого кишечника.
Процесс всасывания регулируется с помощью нервных и гуморальных
механизмов. При механическом раздражении ворсинок тонкой кишки и
под влиянием продуктов гидролиза пищевых веществ (пептидов,
аминокислот, глюкозы) они резко усиливают и учащают свои сокращения. Этот
эффект сохраняется и после перерезки парасимпатических и
симпатических нервов кишечника в опытах на Животных, что говорит о его
реализации через энтеральную нервную систему.
Редкая и слабая сократительная активность ворсинок кишки голодного
животного значительно оживляется при переливании ему крови сытого
животного. Это свидетельствует о наличии гуморальных регуляторов
всасывания. Установлено, что мощным гуморальным стимулятором
активности ворсинок является гормон вилликин, выделяемый эндокринными
клетками слизистой оболочки двенадцатиперстной кишки.
522 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
П ищеварительн ый
тракт
Алкоголь
Жирорастворимые
витамины
Водорастворимые
витамины
Основания
Желчный проток
Проток
поджелудочной
железы
Моносахариды,
глюкоза
Жиры, жирные кислоты,
моноглицериды
Белки и аминокислоты
Витамин Вг
Соли желчных кислот
Хлориды
Жирные кислоты
и газы
Рис. 11.5. Топография всасывания различных веществ в разных последовательных
отделах пищеварительного тракта.
Стрелки указывают, что перечисленные вещества поступают из полости пищеварительного
тракта во внутреннюю среду организма.
Обобщенная схема, отражающая топографию всасывания различных
веществ, представлена на рис. 11.5.
Из данного рисунка следует, что зоны всасывания различных веществ
частично или полностью перекрываются. В желудке всасываются в
основном вода, соединения меди, алкоголь. Продукты гидролиза белков, жиров
11. Функции пищеварительной системы • 523
и углеводов всасываются в тех же отделах пищеварительного тракта, где
осуществляется их переваривание, т. е. в двенадцатиперстной и тощей
кишке. Жирорастворимые и водорастворимые витамины (кроме витамина
В12) всасываются в тощей кишке. В подвздошной кишке осуществляется
всасывание солей желчных кислот и витамина В,2. Двухзарядные катионы
(цинка, кальция, магния и железа) всасываются в основном в
двенадцатиперстной кишке, а вода, хлориды, основания, жирные кислоты и газы — в
толстой кишке.
11.2.4. Общая характеристика механизмов регуляции функций
пищеварительной системы
Вне периода пищеварения железы и гладкие мышцы
желудочно-кишечного тракта находятся у человека в состоянии относительного покоя,
который на короткие промежутки времени прерывается периодической
(«голодной») активностью (см. раздел 11.3). Прием пищи вызывает
рефлекторное усиление секреции слюнных, желудочных и поджелудочных желез,
выделение желчи из общего желчного протока (что обусловлено
поступлением нервных импульсов из парасимпатических центров регуляции),
кратковременное расслабление мускулатуры желудка (пищевая релаксация) и
ослабление моторики проксимального отдела тонкой кишки (что является
следствием возбуждения симпатических нервных волокон).
Содержимое желудка и кишечника поддерживают вызванную
рефлекторным путем секторную и двигательную активность вплоть до
завершения пищеварения в кишечнике и всасывания продуктов гидролиза
пищевых веществ. Этот эффект является следствием влияния на
рецепторы и эндокринные элементы слизистой оболочки желудка и кишечника
объема химуса, его консистенции, осмотического давления, рН,
температуры, продуктов гидролиза пищевых веществ и экстрактивных
веществ.
Нервная регуляция секреции пищеварительных соков и моторики
желудка и кишечника осуществляется с помощью центральных,
периферических и местных рефлексов. Примером центрального рефлекса является
моторный пищеводно-кишечный эффект, реализуемый через ядро
блуждающего нерва продолговатого мозга (рис. 11.6),
примером периферического — антрофундальная
тормозная реакция, рефлекторная дуга которой
замыкается в симпатическом ганглии
солнечного сплетения (рис. 11.7), примером местного —
изменения моторики желудка через нейроны
миэнтерального сплетения (рис. 11.8).
Начальные отделы пищеварительного тракта
(слюнные железы, мышцы, осуществляющие
жевание и глотание, пищевода, желудка и
Рис. 11.6. Рефлекторная дуга центрального пи-
щеводно-кишечного моторного рефлекса.
1 — механорецепторы пищевода; 2 — афферентный нейрон
ганглия; 3 — чувствительное ядро продолговатого мозга; 4 —
ядро блуждающего нерва (тело преганглионарного нейрона);
5 — преганглионарное парасимпатическое волокно; 6 — ганг-
лионарный парасимпатический нейрон; 7 — гладкомышеч-
ные клетки тонкой кишки.
524 ■ ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
сфинктера Одди, гландулоциты
желудка и поджелудочной железы) в
наибольшей степени подвержены
влияниям УНС. Ее роль в
регуляции тонкого и толстого кишечника
снижается, но значение интраор-
ганной (энтеральной) нервной
системы возрастает. Окончания
аксонов ее нейронов выделяют
различные медиаторы. Возбуждающие
влияния на миоциты и
гландулоциты оказывают холинергические
нейроны, а тормозные —
окончания аксонов постганглионарных
симпатических нейронов.
Тормозной эффект осуществляется также
за счет угнетения терминалей хо-
линергических волокон,
расположенными на них окончаниями
аксонов симпатических нейронов.
Торможение миоцитов и гландуло-
цитов может быть достигнуто за
счет влияния тормозных медиаторов пептидергических нейронов — вазоак-
тивного интестинального пептида (ВИП) и АТФ.
Центральные, периферические и местные рефлексы осуществляются в
тесном взаимодействии с гуморальным механизмом регуляции миоцитов,
гландулоцитов и нервных клеток.
В слизистой оболочке желудочно-кишечного тракта и в поджелудочной
железе имеются эндокринные клетки, которые вырабатывают гастроинте-
стинальные гормоны (регуляторные пептиды, энтерины). Эти гормоны
через кровоток и местно (паракринно, диффундируя через межклеточную
жидкость) оказывают влияние на миоциты, гландулоциты, интрамураль-
ные нейроны и эндокринные клетки. Их выработка запускается рефлек-
торно (через блуждающий нерв) во время приема пищи и длительное вре-
Рис. 11.7. Рефлекторная дуга
периферического антрофундального тормозного
рефлекса.
I — механорецепторы антрального отдела
желудка; 2 — сенсорный нейрон (клетка Догеля
II типа); 3 —симпатический ганглий
солнечного сплетения; 4 — ганглионарный
симпатический нейрон; 5 — гладкомышечные клетки
фундального отдела желудка.
Рис. 11.8. Рефлекторная дута местного моторного рефлекса желудка.
1 — механорецепторы; 2 —продольный мышечный слой; 3, 4 — нейроны миэнтерального
сплетения (3 — сенсорный, 4 — эфферентный холинергический); 5 — циркулярный
мышечный слой.
11. Функции пищеварительной системы • 525
мя поддерживается за счет раздражающего влияния продуктов гидролиза
пищевых веществ и экстрактивных веществ.
Место выработки основных гастроинтестинальных гормонов,
вызываемые ими эффекты и продуцирующие их клетки представлены в табл. 11.1.
В настоящее время обнаружено около 30 регуляторных пептидов. Как
следует из представленной таблицы, они оказывают стимулирующее,
тормозное и модулирующее влияние на секрецию пищеварительных соков,
моторику гладкой мускулатуры желудочно-кишечного тракта, всасывание,
выделение энтеринов эндокринными элементами слизистой оболочки
желудка, кишечника и поджелудочной железы.
Выделение гастроинтестинальных гормонов имеет каскадный характер.
Например, под влиянием гастрина обкладочные клетки желез желудка
увеличивают выработку соляной кислоты, которая в слизистой оболочке
тонкой кишки стимулирует выделение S- и J-клетками секретина и холеци-
стокинна — панкреозимина. Секретин усиливает секрецию воды и
бикарбонатов поджелудочной железой и печенью, а холецистокинин — панкрео-
зимин — возбуждает выделение ферментов поджелудочной железой и
тормозит секрецию соляной кислоты обкладочными клетками, усиливает
моторику тонкой кишки и желчного пузыря.
Регуляторные пептиды, поступая в кровоток, быстро разрушаются в
печени и почках и тем самым создают условия для осуществления эффектов
других гастроинтестинальных гормонов.
Выработка некоторых энтеринов носит циклический характер и может
осуществляться и при отсутствии пищевого раздражителя. Например, мо-
тилин, вырабатываемый ЕС2-клетками проксимального отдела тонкой
кишки, вызывает сокращения мышц желудка и кишечника, совпадающие
с периодами «голодной» активности пищеварительного тракта (см. раздел
11.3).
Обобщенная схема механизмов регуляции функций пищеварительного
тракта представлена на рис. 11.9. Эта схема демонстрирует взаимодействие
нервных и гуморальных механизмов регуляции миоцитов, гландулоцитов и
эндокринных клеток пищеварительного тракта. В ответ на внешние
раздражители, адресованные экстерорецепторам, структуры
пищеварительного тракта через вегетативные нервные волокна получают регулирующие
влияния, причем по парасимпатическим волокнам — возбуждающие, а по
симпатическим — тормозные. При раздражении интерорецепторов
слизистой оболочки желудочно-кишечного тракта компонентами химуса
(продуктами гидролиза пищи, экстрактивными веществами, крупными
фрагментами пищи) рефлекторно изменяется активность мышечных,
секреторных и эндокринных элементов. Рефлекс с интерорецепторов удлиняет во
времени секреторную и моторную реакцию, вызванную раздражением экс-
терорецепторов. Эндокринное звено этого рефлекса подкрепляется
ответом эндокриноцитов на непосредственные химические раздражители,
диффундирующие в слизистую оболочку пищеварительного тракта из химуса,
заполняющего его полость. Гастроинтестинальные гормоны через
кровоток и интерстициальные пространства достигают регулируемых
секреторных, мышечных и эндокринных элементов.
Нервные импульсы от рецепторов желудочно-кишечного тракта по
афферентным путям достигают пищевого центра, доставляя информацию о
состоянии процесса пищеварения. Она дополняется гуморальными
влияниями, обусловленными поступлением в кровь продуктов гидролиза
пищевых веществ и гастроинтестинальных гормонов. Информация,
поступающая в пищевой центр по каналам нервной и гуморальной обратной связи,
526 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Экстерорецепторы
ЦНС
Внешние стимулирующие
и тормозные влияния
Кровоток
■О АН
Секреты
Полость желудочно-кишечного тракта
Стимулирующие и тормозные
влияния из полости желудочно-
кишечного тракта
Рис. 11.9. Схема механизмов регуляции функций желудочно-кишечного тракта.
ПЖ — пищеварительные железы, ГМ — гладкие мышцы, ЭК — эндокринные клетки, Р —
рецепторы, АН — афферентные нейроны, ЭН — эфферентные нейроны, С и П — аксоны
симпатических и парасимпатических преганглионарных нейронов, ПК — паракринные влияния,
ЦНС — центральная нервная система
вызывает его ответную реакцию, направленную на оптимизацию процесса
пищеварения и пищевого поведения животного и человека (см. раздел
11.1).
11.3. Периодическая деятельность пищеварительной системы
Мембрана гладких мышечных волокон пищеварительного тракта обладает
способностью генерировать медленные электрические волны
деполяризации (от 3 до 12 в минуту). Во время деполяризации повышается
проницаемость мембраны к ионам натрия. Если снижение мембранного потенциала
И. Функции пищеварительной системы • 527
достигает критического уровня, то повышается проницаемость к ионам
кальция, и на высоте медленной волны возникает серия потенциалов
действия, которые вызывают сокращение миоцитов, лежащей в основе
перистальтической волны. Этот ритм электрической активности называется ба-
зальным.
Ритмические колебания мембранного потенциала миоцитов желудка
совершаются с частотой около 3 циклов в минуту. Они обусловлены
частотой электрической активности водителя ритма, расположенного в области
малой кривизны рядом с кардиальным сфинктером желудка. В
двенадцатиперстной кишке частота ритма колеблется от 10 до 12 в минуту и
зависит от работы водителя ритма, расположенного в области впадения общего
желчного протока в кишку. Частота медленных волн в подвздошной
кишке уменьшается до 8—6 в минуту, а в толстой кишке — до 6— 1.
На фоне базального ритма (медленных колебаний мембранного
потенциала миоцитов) у человека вне периода пищеварения (в состоянии
относительного покоя) через каждые 45—90 мин возникает так называемая
голодная периодическая деятельность пищеварительного тракта, которая
продолжается 20—50 мин. Она проявляется вначале в нерегулярных
сокращениях гладкой мускулатуры, переходящих в регулярные. Голодная моторика
с желудка и двенадцатиперстной кишки перемещается до конечного отдела
подвздошной кишки. После завершения сокращений подвздошной кишки
начинается новый цикл голодной моторики в желудке и
двенадцатиперстной кишке {мигрирующий моторный комплекс).
В настоящее время установлено, что вне периода пищеварения (в
состоянии физиологического голода) концентрация глюкозы в крови
снижается, что возбуждает хеморецепторы кровеносных сосудов и желудочно-
кишечного тракта, а также глюкорецепторы гипоталамуса. Это вызывает
возбуждение гипоталамического пищевого центра, что инициирует
активность подкорковых и корковых структур, являющихся субстратом
пищевого поведения, а также ядер блуждающих нервов, стимулирующих
пищеварительный тракт.
Поступление эфферентных нервных импульсов по парасимпатическим
нервам к миоцитам пищеварительного тракта и вызывают его
периодическую голодную перистальтику.
Центральный механизм возникновения голодной моторики
дополняется периферическим, лежащим в основе осуществления деятельности энте-
рильной нервной системы. Об этом говорит тот факт, что после перерезки
вегетативных нервов желудка и кишечника периодическая моторика
пищеварительного тракта не прекращается.
Вероятно, ферменты пищеварительных соков поджелудочной железы и
кишечных желез, поступающие в кишечник, готовят его к осуществлению
полостного и пристеночного пищеварения.
Высказывается мнение, что во время периодической перистальтики
пищеварительного тракта из него удаляются остатки химуса и экскретируе-
мые вещества, а также предотвращается проникновение в тонкий
кишечник микроорганизмов из толстой кишки.
В желудочно-кишечный тракт вне периода пищеварения в составе
секретов и слущивающихся эпителиоцитов поступает значительное
количество органических веществ, которые подвергаются гидролизу
выделяющимися во время периодической деятельности ферментами. Продукты
гидролиза усваиваются в кишечнике и тем самым обеспечивают эндогенное
питание организма в условиях физиологического голода (при отсутствии
пищевых веществ в пищеварительном тракте).
528 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
11.4. Пищеварение в ротовой полости и функция глотания
11.4.1. Ротовая полость
Ротовая полость является начальным отделом пищеварительного тракта,
где осуществляется анализ вкусовых свойств веществ и разделение их на
пищевые и отвергаемые, защита пищеварительного тракта от попадания
некачественных пищевых веществ и экзогенной микрофлоры,
измельчение, смачивание слюной пищи, начальный гидролиз углеводов и
формирование пищевого комка. Кроме того происходит раздражение механо-, хе-
мо-, терморецепторов, вызывающее рефлекторное возбуждение
деятельности слюнных желез, желез желудка, поджелудочной железы, печени, желез
двенадцатиперстной кишки.
Защита организма от патогенной микрофлоры, попадающей в ротовую
полость, осуществляется благодаря наличию в слюне бактерицидного
вещества лизоцима (муромидазы), антивирусному действию нуклеазы
слюны, способности иммуноглобулина А слюны связывать экзотоксины, а
также в результате фагоцитоза лейкоцитов, содержащихся в слюне.
Пища находится в ротовой полости 16—18 с, и за это время слюна
смачивает сухие вещества пищи, растворяет растворимые и обволакивает
твердые ее частички, нейтрализует раздражающие жидкости или уменьшает их
концентрацию, облегчает удаление несъедобных (отвергаемых) веществ,
смывая их со слизистой оболочки ротовой полости.
11.4.2. Слюноотделение
У человека имеется три пары больших слюнных желез {околоушные,
подъязычные, подчелюстные) и большое количество мелких желез,
локализованных в слизистой оболочке рта. Слюнные железы состоят из слизистых и
серозных клеток. Первые выделяют мукоидный секрет густой
консистенции, вторые — жидкий, серозный или белковый. Околоушные слюнные
железы содержат только серозные клетки. Такие же клетки находятся и на
боковых поверхностях языка. Подчелюстные и подъязычные содержат как
серозные, так и слизистые клетки. Подобные железы расположены и в
слизистой оболочке губ, щек, на кончике языка. Подъязычные и мелкие
железы слизистой оболочки выделяют секрет постоянно, а околоушные и
подчелюстные — при их стимуляции.
Ежедневно у человека продуцируется от 0,5 до 2,0 л слюны. Ее рН
колеблется от 5,25 до 8,0, а скорость секреции слюны у человека при
«спокойном» состоянии слюнных желез составляет 0,24 мл/мин. Однако
скорость секреции может колебаться даже в состоянии покоя от 0,01 до
18,0 мл/мин, что обусловлено раздражением рецепторов слизистой
оболочки ротовой полости и возбуждением слюноотделительного центра под
влиянием условных раздражителей. Слюноотделение при жевании пищи
возрастает до 200 мл/мин.
Количество и состав секрета слюнных желез меняется в зависимости от
характера раздражителя. Слюна человека представляет собой вязкую, опа-
лесцирующую, слегка мутную (благодаря присутствию клеточных
элементов) жидкость с удельным весом 1,001—1,017 и вязкостью 1,10—1,33.
Секрет смешанных всех слюнных желез человека содержит 99,4—99,5 %
воды и 0,5—0,6 % плотного остатка, который состоит из неорганических и
органических веществ (табл. 11.2). Неорганические компоненты в слюне
представлены ионами калия, натрия, кальция, магния, железа, меди, хло-
11. Функции пищеварительной системы • 529
Таблица 11.2. Состав смешанного секрета всех слюнных желез человека
Вещество
Вода
Белки
Муцин
Холестерин
Глюкоза
Аммоний
Мочевая кислота
Содержание, г/л
994
1,4-6,4
0,9-6,0
0,02-0,50
0,1-0,3
0,01-0,12
0,005-0,030
Вещество
Соли натрия
Соли калия
Соли кальция
Соли магния
Хлориды
Гидрокарбонаты
Мочевина
Содержание, ммоль/л
6-23
14-41
1,2-2,7
0,1-0,5
5-31
2-13
140-750
ра, фтора, йода, роданистых соединений, фосфата, сульфата, бикарбоната
и составляют примерно '/3 часть плотного остатка, а 2/3 приходится на
органические вещества. Минеральные вещества слюны поддерживают
оптимальные условия среды, в которой осуществляется гидролиз пищевых
веществ ферментами слюны (осмотическое давление, близкое к
нормальному, необходимый уровень рН). Значительная часть минеральных
компонентов слюны всасывается в кровь слизистой оболочки желудка и
кишечника (см. раздел 11.2.3). Это говорит об участии слюнных желез в
поддержании постоянства внутренней среды организма.
Органические вещества плотного остатка — это белки (альбумины,
глобулины, свободные аминокислоты), азотсодержащие соединения
небелковой природы (мочевина, аммиак, креатин), лизоцим и ферменты (альфа-
амилаза и мальтаза). Альфа-амилаза является гидролитическим ферментом
и расщепляет 1,4-глюкозидные связи в молекулах крахмала и гликогена с
образованием декстринов, а затем мальтозы и сахарозы. Мальтаза (глюко-
зидаза) расщепляет мальтозу и сахарозу до моносахаридов. Вязкость
и ослизняющие свойства слюны обусловлены наличием в ней мукополиса-
харидов (муцина). Слизь слюны склеивает частички пищи в пищевой
комок; обволакивает слизистую оболочку ротовой полости и пищевода, она
защищает ее от микротравм и проникновения патогенных микробов.
Другие органические компоненты слюны, например холестерин, мочевая
кислота, мочевина, являются экскретами, подлежащими удалению из
организма.
Слюна образуется как в ацинусах, так и в протоках слюнных желез.
В цитоплазме железистых клеток содержатся секреторные гранулы,
располагающиеся преимущественно в околоядерной и апикальной частях
клеток, вблизи аппарата Гольджи. В ходе секреции размер, количество и
расположение гранул изменяются. По мере созревания секреторных гранул
они смещаются от аппарата Гольджи к вершине клетки. В гранулах
осуществляется синтез органических веществ, которые двигаются с водой через
клетку по эндоплазматической сети. В ходе секреции слюны количество
коллоидного материала, находящегося в виде секреторных гранул,
постепенно уменьшается по мере его расходования и возобновляется в период
покоя в процессе его синтеза.
В ацинусах слюнных желез осуществляется первый этап образования
слюны. В первичном секрете содержится альфа-амилаза и муцин, которые
синтезируются гландулоцитами. Содержание ионов в первичном секрете
незначительно отличается от их концентрации во внеклеточных
жидкостях, что говорит о переходе этих компонентов секрета из плазмы крови.
В слюнных протоках состав слюны существенно изменяется по сравнению
с первичным секретом: ионы натрия активно реабсорбируются, а ионы ка-
530 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
лия активно секретируются, но с меньшей скоростью, чем всасываются
ионы натрия. В результате концентрация натрия в слюне снижается, тогда
как концентрация ионов калия возрастает. Существенное преобладание
реабсорбции ионов натрия над секрецией ионов калия увеличивает
электронегативность мембран клеток слюнных протоков (до 70 мВ), что
вызывает пассивную реабсорбцию ионов хлора. Одновременно усиливается
секреция ионов бикарбоната эпителием протоков, что обеспечивает
ощелачивание слюны.
Отделение слюны является сложным рефлекторным актом, вызванным
раздражением рецепторов ротовой полости пищей или другими
веществами (безусловно-рефлекторными раздражителями), а также раздражением
зрительных и обонятельных рецепторов внешним видом и запахом пищи,
видом обстановки, в которой происходит прием пищи
(условно-рефлекторными раздражителями).
Возбуждение, возникающее при раздражении механо-, хемо- и
терморецепторов ротовой полости, достигает центра слюноотделения в
продолговатом мозге по афферентным волокнам V, VII, IX, X пар
черепно-мозговых нервов. Эфферентные влияния к слюнным железам поступают по
парасимпатическим и симпатическим нервным волокнам. Преганлионарные
парасимпатические волокна к подъязычным и подчелюстным слюнным
железам находятся в составе барабанной струны (ветвь VII пары) к
подъязычному и подчелюстному ганглиям, расположенным в теле
соответствующих желез, а постганглионарные — от указанных ганглиев к секреторным
клеткам и сосудам желез. К околоушным железам преганглионарные
парасимпатические волокна идут от нижнего слюноотделительного ядра
продолговатого мозга в составе IX пары черепно-мозговых нервов к ушному
узлу, от которого постганглионарные волокна направляются к
секреторным клеткам и сосудам.
Прегангионарные симпатические волокна, иннервирующие слюнные
железы, являются аксонами нейронов боковых рогов II—VI грудных
сегментов спинного мозга и заканчиваются в верхнем шейном ганглии.
Отсюда постганглионарные симпатические волокна направляются к
слюнным железам. Электрическое раздражение парасимпатических нервов в
экспериментах на животных вызывает обильную секрецию жидкой слюны,
содержащей небольшие количества органических веществ, а в гландулоци-
тах уменьшается количество секреторных гранул. При стимуляции
симпатических нервов из слюнных протоков вьщеляется небольшое количество
густой и вязкой слюны с высоким содержанием ферментов и муцина, а в
гландулоцитах увеличивается количество секреторных гранул. В связи с
этим парасимпатические нервы называют секреторными, а
симпатические — трофическими. При раздражении рецепторов слизистой оболочки
рта пищевыми веществами у животных и человека парасимпатические
влияния на слюнные железы преобладают над симпатическими, что
вызывает обильную секрецию жидкой слюны.
Во время приема пищи раздражаются тактильные, температурные и
вкусовые рецепторы слизистой оболочки полости рта. Афферентные
импульсы от них по чувствительным волокнам тройничного, языкоглоточно-
го, лицевого и блуждающего нервов достигают слюноотделительного
центра продолговатого мозга. При возбуждении верхнего
слюноотделительного ядра центра эфферентные импульсы по преганглионарным
парасимпатическим волокнам барабанной струны достигают подъязычного и
нижнечелюстного ганглиев, где они переключаются на постганглионарные,
парасимпатические волокна подъязычного нерва, иннервирующего подъязыч-
11. Функции пищеварительной системы • 531
ные и подчелюстные слюнные железы. При возбуждении нижнего
слюноотделительного ядра центра эфферентные импульсы по преганглионарным
парасимпатическим волокнам языкоглоточного нерва достигают ушного
ганглия, где они переключаются на постганглионарные волокна ушнови-
сочного нерва, иннервирующего околоушные слюнные железы.
Под влиянием эфферентных импульсов в окончаниях
парасимпатических постганглионарных волокон выделяется ацетилхолин, возбуждающий
гландулоциты и расширяющий кровеносные сосуды железы. Поэтому
секреторный эффект сопровождается повышением уровня кровоснабжения
железы.
Поступающие в продолговатый мозг афферентные импульсы
возбуждают также чувствительные нейроны одиночного пучка, по аксонам которых
сенсорные импульсы достигают ядер таламуса, где они переключаются на
таламокортикальное пути и достигают коркового представительства
вкусовой сенсорной системы (в области роландовой борозды). В коре больших
полушарий сенсорная информация переключается на эфферентные
корковые нейроны, аксоны которых передают эфферентные импульсы на
парасимпатические и симпатические ядра гипоталамуса. Нисходящие влияния
от парасимпатических ядер активируют бульбарный слюноотделительный
центр, а от симпатических ядер — активируют преганглионарные
симпатические нейроны II—V грудных сегментов спинного мозга, где возбуждение
переключается на постганглионарные волокна, в окончаниях которых
выделяется норадреналин.
Центры слюноотделения рефлекторно могут не только возбуждаться, но
и тормозиться. Например, при болевом раздражении, во время
отрицательных эмоций и при умственном напряжении слюноотделение резко
ослабляется или прекращается («пересыхает во рту»).
Фармакологические вещества, относящиеся к группе холиномиметиков
(например, пилокарпин, прозерин), усиливают слюноотделение, так как
способствуют выделению ацетилхолина, а холинолитики — блокируют
(например, атропин). Обильное отделение слюны наблюдается при асфиксии
вследствие раздражения слюноотделительного центра угольной кислотой.
11.4.3. Жевание
Жевание — физиологический акт, заключающийся в измельчении с
помощью зубов пищевых веществ и формировании пищевого комка. Жевание
обеспечивает качество механической обработки пищи и определяет время
ее пребывания в полости рта, оказывает рефлекторное возбуждающее
влияние на секреторную и моторную деятельность желудка и кишечника.
В жевании участвуют верхняя и нижняя челюсти, жевательная и
мимическая мускулатура лица, язык, мягкое небо. Механическая обработка пищи
между верхними и нижними рядами зубов осуществляется благодаря
перемещению нижней челюсти относительно верхней. У взрослого человека в
ряду справа и слева имеются зубы разного функционального назначения —
два резца и один клык (откусывающие пищу), два малых и три больших
коренных, которые раздавливают и растирают пищу, — всего 32 зуба.
Процесс жевания имеет четыре фазы — введения пищи в рот,
ориентировочную, основную и формирования пищевого комка (рис. 11.10).
Регуляция жевания осуществляется рефлекторно. Возбуждение от
рецепторов слизистой оболочки рта (механо-, хемо- и терморецепторов)
передается по афферентным волокнам II, III ветви тройничного,
языкоглоточного, верхнего гортанного нерва и барабанной струны в центр жевания, ко-
532 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Рис. 11.10. Кимограмма жевательного периода.
I — покой жевательной мускулатуры; II — фаза введения пищи в рот; III — ориентировочная
фаза; IV — основная фаза; V — фаза формирования пищевого комка; а—б — опускание
нижней челюсти, б—в — подъем нижней челюсти; о—о, — момент размалывания пищи. Под кимо-
граммой — отметка времени — 1 с.
торый находится в продолговатом мозге. Возбуждение от центра к
жевательным мышцам передается по эфферентным волокнам тройничного,
лицевого и подъязычного нервов. Возбуждение от чувствительных ядер
ствола мозга по афферентному пути через специфические ядра таламуса
переключается на корковый отдел вкусовой сенсорной системы, где
осуществляется анализ и синтез информации, поступающей от рецепторов
слизистой оболочки ротовой полости.
На уровне коры больших полушарий происходит переключение
сенсорных импульсов на эфферентные нейроны, которые по нисходящим
путям посылают регулирующие влияния к центру жевания продолговатого
мозга.
11.4.4. Глотание
Глотание — рефлекторный акт, при помощи которого пища переводится из
ротовой полости в желудок. Акт глотания состоит из трех фаз: ротовой
(произвольной), глоточной (непроизвольной, быстрой) и пищеводной
(непроизвольной, медленной).
Пищевой комок (объемом 5—15 см3) скоординированными движениями
мускулатуры щек и языка продвигается к его корню (за передние дужки
глоточного кольца). Так завершается первая фаза глотания и начинается
вторая. С этого момента акт глотания становится непроизвольным.
Раздражение пищевым комком рецепторов слизистой оболочки мягкого
неба и глотки передается по языкоглоточным нервам к центру глотания в
продолговатом мозге. Эфферентные импульсы от него идут к мышцам
полости рта, глотки, гортани и пищевода по волокнам подъязычных,
тройничных, языкоглоточных и блуждающих нервов. Этот центр
обеспечивает координированные сокращения мышц языка и мускулатуры,
приподнимающей мягкое небо. Благодаря этому вход в полость носа со
стороны глотки закрывается мягким небом, и язык перемещает пищевой
комок в глотку. Одновременно происходит сокращение мышц,
поднимающих нижнюю челюсть. Это приводит к смыканию зубов и
прекращению жевания, а сокращение челюстно-подъязычной мышцы — к
поднятию гортани. В результате осуществляется закрытие входа в гортань
надгортанником. Этим предотвращается попадание пищи в дыхательные
пути. В это же время открывается верхний пищеводный сфинктер,
образованный волокнами циркулярного направления в верхней половине
шейной части пищевода, и пищевой комок поступает в пищевод. Так
начинается третья фаза. Верхний пищеводный сфинктер сокращается после
перехода пищевого комка в пищевод, предотвращая пищеводно-глоточ-
ный рефлюкс (т. е. обратное поступление пищи в глотку). Затем осуще-
11. Функции пищеварительной системы • 533
ствляется прохождение пищи по пищеводу и переход ее в желудок.
Пищевод является мощной рефлексогенной зоной. Рецепторный аппарат
представлен здесь в основном механорецепторами. Вследствие
раздражения последних пищевым комком происходит рефлекторное сокращение
мускулатуры пищевода. При этом последовательно сокращаются
кольцевые мышцы (с одновременным расслаблением нижележащих). Волны
перистальтических сокращений распространяются в сторону желудка,
передвигая пищевой комок. Скорость их распространения 2—5 см/с.
Сокращение мускулатуры пищевода связано с поступлением из продолговатого
мозга эфферентной импульсации по волокнам возвратного и
блуждающего нервов.
Движение пищи по пищеводу обусловлено рядом факторов-, во-первых,
перепадом давления между полостью глотки и началом пищевода — от
45 мм рт. ст. в полости глотки (в начале глотания) до 30 мм рт. ст. (в
пищеводе); во-вторых, наличием перистальтических сокращений мышц
пищевода, в-третьих, тонусом мускулатуры пищевода, который в
торакальном отделе почти в три раза ниже, чем в шейном, и, в-четвертых, силой
тяжести пищевого комка. Скорость прохождения пищи по пищеводу
зависит от консистенции пищи: плотная проходит за 3—9 с, жидкая —за 1 —
2 с.
Центр глотания через ретикулярную формацию связан с другими
центрами продолговатого и спинного мозга. Его возбуждение в момент
глотания вызывает торможение деятельности дыхательного центра и снижение
тонуса блуждающего нерва. Последнее вызывает задержку дыхания и
учащение сердечных сокращений. Задержка дыхания предотвращает
попадание пищи в дыхательные пути.
При отсутствии глотательных сокращений вход из пищевода в
желудок закрыт, так как мышцы кардиального отдела желудка находятся в
состоянии тонического сокращения. Когда перистальтическая волна и
комок пищи достигают конечной части пищевода, тонус мышц карди-
альной части желудка рефлекторно снижается, и комок пищи поступает
в желудок. При наполнении желудка пищей тонус мышц кардиального
отдела желудка повышается и препятствует обратному поступлению
желудочного содержимого из желудка в пищевод (желудочно-пищеводный
рефлюкс).
11.5. Пищеварение в желудке
В желудке пища, смешанная со слюной и слизью, задерживается от 3 до 10
ч для ее механической и химической обработки. Желудок осуществляет
следующие функции: 1) депонирование пищи; 2) секрецию желудочного сока,
обеспечивающего химическую обработку пищи; 3) перемешивание пищи с
пищеварительными соками; 4) ее эвакуацию — передвижение порциями в
двенадцатиперстную кишку; 5) всасывание в кровь небольшого количества
веществ, поступивших с пищей; 6) выделение (экскрецию) вместе с
желудочным соком в полость желудка метаболитов (мочевины, мочевой
кислоты, креатина, креатинина), веществ, поступивших в организм извне (солей
тяжелых металлов, йода, фармакологических препаратов); 7) образование
активных веществ (инкрецию), принимающих участие в регуляции
деятельности желудочных и других пищеварительных желез (гастрина, гистамина,
соматостатина, мотилина и др.); 8) бактерицидное и бактериостатическое
действие желудочного сока; 9) удаление недоброкачественной пищи,
предупреждающее ее попадание в кишечник.
534 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
11.5.1. Секреторная функция желудка
Секреторная функция желудка осуществляется желудочными железами,
продуцирующими желудочный сок. Они состоят из трех видов клеток:
главных, принимающих участие в выработке ферментов; обкладочных
(париетальных), участвующих в выработке хлористоводородной (соляной)
кислоты, и добавочных, выделяющих мукоидный секрет (слизь). В его состав
входит также внутренний фактор кастла (гастромукопротен), участвующий
в регуляции кроветворения. Натощак слизь выделяется также
цилиндрическим эпителием, которым покрыта слизистая оболочка желудка. Железы
кардиального отдела желудка секретируют в основном слизь. В железах
пилорического отдела отсутствуют обкладочные клетки. Поэтому в секрете
желез этого отдела отсутствует соляная кислота и его рН равен 7,8—8,4.
Основную роль в желудочном пищеварении играют железы фундального
отдела, включающего три секректорные зоны: дна, малой кривизны и тела
желудка (рис. 11.11). Эти железы имеют все три типа клеток и выделяют
основное количество желудочного сока.
Состав желудочного сока. В состоянии покоя (натощак) из желудка
человека можно извлечь около 50 мл желудочного содержимого нейтральной
или слабокислой реакции (рН 6,0). Это смесь слюны и желудочного сока.
Общее количество желудочного сока, отделяющегося у человека при
обычном пищевом режиме, составляет 2,0—2,5 л в сутки. Это бесцветная,
Внеклеточная жидкость
Париетальные клетки
Просвет канальцев
СО,
НС03
К+
:со.
- НС03 -« СО, + ОН-+ Н+
ЬГ (155ммоль/л)
Na+
CI"
Ж
к+
н,о-
Na+ -
I ^ /"Ч IN£
s (О 4
Na+ (3 ммоль/л)
Активный транспорт
■ CI" *► СГ
0
■*-С|-
Пассивный транспорт (осмос)
Н,0
Н,0
Рис. 11.11. Образование соляной кислоты желудочного сока. Пояснения в тексте.
Символ ® означает активность ферментных транспортных систем мембраны кислотопроду-
цирующих клеток. Стрелками показано направление движения ионов и воды.
11. Функции пищеварительной системы • 535
прозрачная, слегка опалесцирующая жидкость с удельным весом 1,002—
1,007. В соке могут быть хлопья слизи. Желудочный сок имеет кислую
реакцию (рН 0,8—1,5) вследствие высокого содержания в нем
хлористоводородной (соляной) кислоты (0,3—0,5 %). Содержание воды в соке — 99,0—
99,5 %, а плотных веществ — 1,0—0,5 %. Плотный остаток представлен
органическими и неорганическими веществами: хлоридами (5—6 г/л),
сульфатами (10 мг/л), фосфатами (10—60 мг/л), гидрокарбонатами (0—1,2 г/л)
натрия, калия, кальция и магния, аммиалом (20—80 мг/л). Значительная
часть минеральных веществ всасывается в желудке и кишечнике в кровь и
участвует в поддержании постоянства внутренней среды. Основной
неорганический компонент желудочного сока — соляная кислота (см. ниже).
Органическая часть плотного остатка состоит из ферментов и мукоидов (см.
ниже). В небольшом количестве находятся в остатке азотсодержащие
вещества небелковой природы (мочевина, мочевая кислота, молочная
кислота и др.), подлежащие удалению из организма.
Механизм секреции соляной кислоты. Хлористоводородная кислота
вырабатывается париетальными (обкладочными) клетками желез желудка.
Эти клетки характеризуются богатством митохондрий, расположенных
вдоль внутриклеточных канальцев. Площадь мембраны канальцев и
апикальной поверхности клеток во время стимуляции на высоте секреции
резко возрастает за счет встроенных в мембрану тубовезикул
(трубочек-пузырьков), что сопровождается значительным увеличением клеточных
канальцев, проникающих вплоть до базальной мембраны. Это значительно
увеличивает возможности синтеза гландулоцитом соляной кислоты. Вдоль
канальцев располагается множество митохондрий, площадь внутренней
мембраны которых возрастает в процессе биосинтеза НС1. Соответственно
увеличивается площадь контакта канальцев и апикальной мембраны
клетки. Таким образом, увеличение секреторной активности париетальных
клеток обусловлено увеличением площади секреторной мембраны.
Секреция НС1 является ярко выраженным цАМФ-зависимым
процессом, активация которого протекает на фоне усиления гликогенолитиче-
ской и гликолитической активности, что сопровождается продукцией пи-
рувата. Окислительное декарбоксилирование пирувата до ацетил-КоА. С02
осуществляется пируватдегидрогеназным комплексом и сопровождается
накоплением в цитоплазме НАД • Н2. Последний используется для
генерирования Н+ в процессе секреции НС1. Расщепление триглицеридов в
слизистой оболочке желудка под влиянием триглицеридлипазы и
последующая утилизация жирных кислот создает в 3—4 раза больший приток
восстановительных эквивалентов в митохондриальную цепь переноса
электронов. Как аэробный гликолиз, так и окисление жирных кислот запускаются
посредством цАМФ-зависимого фосфорилирования соответствующих
ферментов, обеспечивающих генерирование ацетил-КоА в цикле Кребса и
восстановительных эквивалентов для электронпереносящей цепи
митохондрий. Са2+ является необходимым элементом секреторной системы НС1.
Процесс цАМФ-зависимого фосфорилирования обеспечивает
активацию желудочной карбоангидразы, которая является регулятором кислотно-
основного равновесия в кислотопродуцирующих клетках. Работа этих
клеток сопровождается длительной и массовой потерей ионов Н+, что
приводит к накоплению в клетке ОН", способных оказать повреждающее
действие на клеточные структуры. Нейтрализация гидроксильных ионов и
является главной функцией карбоангидразы. Образующиеся бикарбонатные
ионы посредством электронейтрального механизма выводятся в кровь, а
ионы СГ входят в клетку.
536 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Кислотопродуцирующие клетки на наружных мембранах имеют две
мембранные ферментные системы, участвующие в механизмах продукции
Н+ и секреции НС1. Ими являются Na+-K+-ATOa3a и Н+-К+-АТФаза.
№+-К+-АТФаза, расположенная в базолатеральных мембранах клеток,
переносит К+ из крови в обмен на Na+, а Н+-К+-АТФаза, локализованная в
секреторной мембране, транспортирует калий из первичного секрета в
обмен на выводимые в желудочный сок ионы Н+. Процесс образования
соляной кислоты кислотопродуцирующими клетками схематически
представлен на рис. 11.11.
В период секреции митохондрии всей массой охватывают в виде муфты
секреторные канальцы, и их мембраны сливаются, образуя митохондри-
ально-секреторный комплекс, где ионы Н+ непосредственно
акцептируются Н+-К+-АТФазой секреторной мембраны и транспортируются из клетки.
Таким образом, кислотообразующая функция обкладочных клеток
осуществляется благодаря процессу фосфорилирования — дефосфорилирова-
ния, наличию митохондриальной окислительной цепи, транспортирующей
ионы Н+ из матриксного пространства, а также активности Н+-К+-АТФазы
секреторной мембраны, перекачивающей протоны из клетки за счет
энергии АТФ.
Вода поступает в канальцы клетки путем осмоса. Конечный секрет,
поступающий в канальцы, содержит НС1 в концентрации 155 ммоль/л,
хлористый калий в концентрации 15 ммоль/л и очень малое количество
хлористого натрия.
Роль соляной кислоты в пищеварении. В полости желудка
хлористоводородная кислота: 1) стимулирует секреторную активность желез желудка;
2) способствует превращению пепсиногена в пепсин путем отщепления
ингибирующего белкового комплекса; 3) создает оптимальную
кислотность для действия протеолитических ферментов желудочного сока; 4)
вызывает денатурацию и набухание белков (что способствует их
расщеплению ферментами); 5) обеспечивает антибактериальный эффект секрета;
6) участвует в осуществлении механизма перехода пищи из желудка в
двенадцатиперстную кишку, раздражая хеморецепторы ее слизистой
оболочки; 7) участвует в регуляции секреции желудочных и поджелудочных
желез, стимулируя образование гастроинтестинальных гормонов (гастрина,
секретина); 8) возбуждает секрецию фермента энтерокиназы энтероцитами
слизистой оболочки двенадцатиперстной кишки; 9) участвует в
створаживании молока; 10) стимулирует моторную активность желудка.
Ферменты желудочного сока и их роль в пищеварении. В полости
желудка под влиянием протеолитических ферментов осуществляется начальный
гидролиз белков до альбумоз и пептонов. Протеолитические ферменты
желудочного сока обладают активностью в широком диапазоне колебаний рН
с оптимумом действия при рН 1,5—2,0 и 3,2—4,0. Это обеспечивает
гидролиз белков в условиях значительных колебаний концентрации соляной
кислоты в желудочном соке, в слоях пищи, прилежащих к слизистой
оболочке желудка, и в глубине содержимого желудка.
В желудочном соке представлены семь видов пепсиногенов,
объединенных общим названием пепсины. Образование пепсинов осуществляется из
неактивных предшественников — пепсиногенов, находящихся в клетках
желудочных желез в виде гранул зимогена. В просвете желудка пепсиноген
активируется НС1 путем отщепления от него ингибирующего белкового
комплекса. В дальнейшем в ходе секреции желудочного сока активация
пепсиногена осуществляется аутокаталитически под действием уже
образовавшегося пепсина.
П. Функции пищеварительной системы • 537
При оптимальной величине рН среды пепсин осуществляет гидролиз
белков, разрывая в белковой молекуле пептидные связи, образованные
группами фениламина, тирозина, триптофана и других аминокислот. В
результате этого белковая молекула распадается на пептоны и пептиды.
Пепсин обеспечивает гидролиз основных белковых веществ, особенно
коллагена — основного компонента волокон соединительной ткани.
К основным пепсинам желудочного сока относятся следующие.
Пепсин А — группа ферментов, гидролизирующих белки при оптимуме
рН 1,5—2,0. Часть пепсиногена (около 1 %) переходит в кровеносное
русло, откуда вследствие небольшого размера молекулы фермента проходит
через клубочковый фильтр в почках и выделяется с мочой (уропепсиноген).
Определение содержания уропепсина в моче используется в лабораторной
практике для характеристики протеолитической активности желудочного
сока.
Гастриксин (пепсин С), гидролизирующий белки при оптимуме рН 3,2—
3,5. Пепсин В (парапепсин) расщепляет желатину и белки соединительной
ткани. При рН 5,6 и выше протеолитическое действие фермента
ослабляется.
Реннин (пепсин Д, химозин) расщепляет казеин молока в присутствии
ионов Са2+.
Желудочный сок содержит ряд непротеолитических ферментов. Среди
них — желудочная липаза, расщепляющая жиры, которые находятся в пище
в эмульгированном состоянии (жиры молока), на глицерин и жирные
кислоты при рН 5,9—7,9. У грудных детей желудочная липаза расщепляет до
59 % жира молока. В желудочном соке взрослых людей липазы мало.
Поэтому основное количество жиров переваривается в тонком кишечнике.
Клетками поверхностного эпителия слизистой оболочки желудка
вырабатывается лизоцим (муромидаза). Лизоцим обусловливает бактерицидные
свойства желудочного сока.
Уреаза расщепляет мочевину в желудке при рН 8,0. Освобождающийся
при этом аммиак нейтрализует соляную кислоту и предотвращает
избыточную кислотность химуса, поступающего из желудка в двенадцатиперстную
кишку.
Желудочная слизь и ее значение. Органическим компонентом
желудочного сока является слизь.
Нерастворимая слизь (муцин) является продуктом секреторной
активности добавочных клеток и клеток поверхностного эпителия. Муцин
выделяется через апикальную мембрану мукоцита, образует слой слизи
толщиной 0,5—1,5 мм, он обволакивает слизистую оболочку желудка и
препятствует повреждающему воздействию соляной кислоты и пепсинов на клетки
слизистой оболочки и раздражающих веществ, поступивших с пищей.
Этими же клетками одновременно с муцином продуцируется и бикарбонат.
Образующийся при взаимодействии муцина и бикарбоната мукозо-бикар-
бонатный барьер предохраняет слизистую оболочку от аутолиза под
воздействием соляной кислоты и пепсинов.
Слой слизи является преградой для обратной диффизии ионов водорода
из полости желудка; он нейтрализует соляную кислоту благодаря
буферным свойствам из-за наличия гидрокарбонатов, а также адсорбирует
ферменты. Под влиянием длительного воздействия желчных кислот (при
забрасывании их из двенадцатиперстной кишки), салицилатов, масляной и
пропионовой кислот, алкоголя происходит нарушение слизистого барьера.
Это приводит к обратной диффизии ионов водорода из полости желудка,
контакту слизистой оболочки с пепсинами и ее повреждению в результате
538 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
аутолиза. Так формируются пептические язвы желудка. Возникновению
язвенного процесса способствуют продукты жизнедеятельности
микроорганизма Helicobacter pylori, которые усиливают секрецию соляной
кислоты.
11.5.2. Регуляция секреции желудочного сока
Железы желудка в состоянии относительного покоя (в условиях отсутствия
процесса пищеварения) выделяют небольшое количество сока нейтральной
или слабощелочной реакции (фоновая секреция). Под влиянием пищевого
раздражения во время приема пищи железы желудка секретируют
значительный объем желудочного сока, богатого протеолитическими
ферментами. Эта реакция желез является рефлекторным ответом на раздражение
пищей рецепторов слизистой оболочки ротовой полости, глотки и желудка
(безусловный рефлекс) и воздействие комплекса раздражителей, влияющих
на другие рецепторы, предшествующих и сопутствующих приему пищи
(условный рефлекс).
Афферентные импульсы с раздражаемых пищей рецепторов
(тактильных, температурных и вкусовых) по афферентным волокнам V, VII, IX и X
черепно-мозговых нервов передаются в бульбарный, таламический, гипо-
таламический и корковый отделы пищевого центра. Нисходящие влияния
коркового представительства пищевого центра активируют
парасимпатические и симпатические ядра гипоталамуса. При возбуждении
парасимпатических ядер их эфферентные влияния активируют клетки бульбарного
отдела пищевого центра, импульсы от которых по преганглионарным
волокнам блуждающего нерва передаются на постганглионарные нейроны ин-
трамуральных ганглиев желудка (клетки Догеля I типа). Выделяемый в
окончаниях их аксонов медиатор ацетилхолин через М-холинорецепторы
мембраны гландулоцитов стимулирует секреторную деятельность главных,
обкладочных и мукоидных клеток желез желудка. Поэтому после
перерезки блуждающих нервов у собак не выделяется желудочный сок при
раздражении пищей рецепторов полости рта, на ее вид и запах.
Ацетилхолин активирует также эндокринные У-клетки слизистой
оболочки антрального отдела желудка, вырабатывающие гастрин, который
через кровоток достигает обкладочных клеток желез и через специальные
рецепторы их мембраны вызывает выработку соляной кислоты.
Ацетилхолин и гастрин в слизистой оболочке фундального отдела
желудка стимулируют активность эндокринных клеток, выделяющих гиста-
мин, который, диффундируя по межклеточным пространствам, через Н2-
рецепторы мембраны обкладочных клеток стимулирует выработку
большого количества кислого желудочного сока, бедного ферментами и мукоида-
ми. После перерезки блуждающих нервов (в экспериментах на животных)
сокогонный эффект ацетилхолина, гастрина и гистамина резко
ослабляется.
Поступление пищи в желудок во время еды усиливает
безусловно-рефлекторное отделение желудочного сока, что обусловлено раздражением ме-
ханорецепторов при растяжении его стенок (особенно антрального отдела)
и хеморецепторов пептидами и экстрактивными веществами пищи. При
этом рефлекс осуществляется с участием бульбарного отдела пищевого
центра, дополняется местной реакцией, реализуемой через холинергиче-
ские нейроны интраорганной нервной системы.
Увеличение концентрации соляной кислоты в желудочном соке
приводит к угнетению выработки гастрина У-клетками и последующим умень-
11. Функции пищеварительной системы • 539
шением кислотности сока. Этот механизм саморегуляции предотвращает
избыточное выделение соляной кислоты. Подавляют секрецию соляной
кислоты соматостатин, ВИП и серотонин (см. табл. 11.1).
При возбуждении симпатических ядер гипоталамуса его нисходящие
влияния стимулируют преганглионарные симпатические нейроны боковых
рогов торакальных сегментов (IV—X) спинного мозга. Их эфферентные
влияния стимулируют постганглионарные нейроны симпатических
ганглиев, аксоны которых в составе чревных нервов достигают желез желудка.
Выделяющийся в их окончаниях медиатор норадреналин тормозит
секрецию желудочного сока, но приводит к накоплению секреторного
материала в гландулоцитах, содержащих пепсиногены и мукоиды.
Поступление в двенадцатиперстную кишку не полностью
переваренного химуса из желудка вызывает дополнительное возбуждающее и
тормозное влияние на железы желудка. Гастрин, вырабатываемый У-клетками
слизистой оболочки кишки, бомбезин (гастрин-рилизинг-гормон),
выделяемый Р-клетками, продукты гидролиза белков гуморально стимулируют
выработку соляной кислоты.
Выделяемые эндокринными клетками двенадцатиперстной кишки холе-
цистокинин, гастроингибирующий пептид, нейротензин и другие пептиды
(см. табл. 11.1) под влиянием продуктов гидролиза жиров в
двенадцатиперстной кишке оказывают тормозной эффект на выработку соляной кислоты
железами желудка.
11.5.2.1. Фазы желудочной секреции
В естественных условиях приема пищи сокоотделение в желудке
начинается под влиянием условных раздражителей — вида и запаха пищи,
привычной обстановки. При попадании пищи в ротовую полость в процессе
жевания и глотания раздражаются рецепторы слизистой оболочки рта, глотки
и пищевода, что вызывает безусловно-рефлекторную секрецию
желудочного сока. Этот комплекс условных и безусловных секреторных рефлексов
составляет сложнорефлекторную первую фазу желудочного сокоотделения,
которая продолжается около двух часов. Выделяющийся при этом сок
отличается высоким содержанием ферментов, что способствует
возникновению второй фазы сокоотделения — нейрогуморальной. Она обусловлена
раздражением рецепторов желудка и кишечника компонентами химуса,
влиянием на железы желудка гастроинтестинальных гормонов (см. табл.
11.1) и продуктов гидролиза пищевых веществ, поступающих в кровоток.
Поэтому секреция желудочного сока (в опытах на собаках) продолжается
6-10 ч.
Нейрогуморальная фаза секреции желудочного сока «наслаивается» на
сложнорефлекторную и состоит из желудочной и кишечной фаз.
Желудочная фаза сокоотделения обусловлена влиянием содержимого желудка на
рецепторы его слизистой оболочки и эндокринные клетки (см. табл. 11.1).
Так, механическое раздражение пищей приводит к выделению гастрина.
Его выделение усиливается под влиянием продуктов гидролиза белков и
экстрактивных веществ.
Кишечная фаза секреции желудочного сока обусловлена раздражением
рецепторов слизистой оболочки двенадцатиперстной кишки кислым
желудочным содержимым, поступающим из желудка, всасыванием в кровь
продуктов гидролиза белков и гастроинтестинальных гормонов, выделяемых
эндокринными элементами слизистой оболочки кишечника (см. табл.
11.1). При осуществлении кишечной фазы возникают и тормозные влия-
540 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Часы
12345678123456789 10 123456
1—I I—г
1—I—I—1—г
Мясо
Хлеб
Молоко
Рис. 11.12. Динамика желудочной секреции на различные пищевые вещества (в
опытах на собаках).
Желудочный сок собирался через фистульную трубку, вставленную в маленький желудочек,
выкроенный из желудка по методике И. П. Павлова (с сохраненной иннервацией).
На белковую пищу (мясо) выделяется наибольшее количество желудочного сока. На хлеб
после всплеска секреции в сложнорефлекторную фазу сокоотделение продолжается длительное
время (около 10 ч) на низких цифрах. После кормления животного молоком секреция сока
медленно достигает максимума (к концу 3-го часа).
ния на железы желудка, вызванные продуктами гидролиза жиров, крахмала
и регуляторными пептидами.
Желудочная секреция при переваривании различных пищевых веществ.
Адаптация секреторного аппарата желудка к характеру пищи обусловлена
ее качеством, количеством, режимом питания. Классическим примером
приспособительных реакций желудочных желез является изученная
И. П. Павловым реакция пищеварительных желез в ответ на прием пищи,
содержащей преимущественно углеводы (хлеб), белки (мясо), жиры
(молоко).
Наиболее эффективным возбудителем секреции является белковая
пища (рис. 11.12). Белки и продукты их переваривания обладают
выраженным сокогонным действием. После приема мяса развивается довольно
энергичная секреция желудочного сока с максимумом на 2-м часу. Она
продолжается около 7 ч. Длительная мясная диета (на протяжении 30—40
сут) приводит к усилению желудочной секреции на все пищевые
раздражители, повышению кислотности и переваривающей силы желудочного
сока. Это говорит о том, что под влиянием сильных возбудителей
секреции происходит устойчивая перестройка в деятельности желез желудка и
механизмов их регуляции.
Углеводная пища (хлеб) — более слабый возбудитель секреции
желудочного сока. Хлеб беден химическими возбудителями секреции, поэтому
после его приема развивается ответная секреторная реакция с максимумом
на 1-м часе (рефлекторное отделение сока), а затем резко уменьшается и
11. Функции пищеварительной системы • 541
на невысоком уровне удерживается продолжительное время (из-за слабой
мобилизации гуморальных механизмов возбуждения гландулоцитов). При
длительном питании человека углеводами кислотность и переваривающая
сила сока снижаются, что является следствием приспособления желез
желудка к пище, содержащей небольшое количество белка, продукты
неполного гидролиза которого стимулируют выработку соляной кислоты и пеп-
синогена.
Жиры молока вызывают желудочную секрецию в две стадии: тормозную
и возбуждающую. Этим объясняется тот факт, что после приема жирной
пищи максимум секреции сока наблюдается только к концу 3-го часа.
Первые порции молока, попав из желудка в двенадцатиперстную кишку,
оказывают тормозное влияние на секрецию желудочного сока. В
результате длительного питания жирной пищей происходит усиление желудочной
секреции на все пищевые раздражители за счет второй половины
секреторного периода. Переваривающая сила сока при использовании в пище
жиров ниже по сравнению с соком, выделяющимся на мясо, но выше, чем
при питании углеводной пищей.
Количество отделяющегося желудочного сока, его кислотность и проте-
олитическая активность зависят также от количества и консистенции
принятой пищи. По мере увеличения объема пищи секреция желудочного
сока.
11.5.3. Сократительная деятельность мускулатуры желудка
Во время приема пищи происходит расслабление мускулатуры фундально-
го отдела желудка, что является рефлекторной реакцией в ответ на
раздражение рецепторов слизистой оболочки полости рта, глотки и пищевода.
Это расслабление получило название рецептивной релаксации, которая
способствует заполнению пищей фундального отдела. Через 5—30 мин после
завершения приема пищи происходит усиление моторики желудка.
Вначале автоматическое возбуждение миоцитов возникает в водителе ритма,
который располагается в области кардии, откуда волна перистальтического
сокращения распространяется в дистальном направлении — на тело
желудка, его антральную часть и пилорический сфинктер. За 1 мин возникает
около трех волн. Скорость распространения перистальтической волны по
мере ее приближения к пилорическому отделу желудка возрастает с 1 до
3—4 см/с. Волна перистальтики представляет собой сокращение участков
(полос) циркулярного слоя мышц по всей окружности желудка. После
сокращения участка циркулярных мышц происходит их расслабление, а
волна сокращения переходит на другой участок.
Перистальтические волны смещают в дистальном направлении слои
химуса, прилежащие к слизистой оболочке желудка, в наибольшей степени
обработанные желудочным соком. На фоне перистальтических волн
возникают сильные и продолжительные сокращения (тонические волны),
которые смещают химус из фундального отдела в пилорический. По мере
накопления содержимого желудка в пилорическом отделе возникают
сильные систолические сокращения его мускулатуры. Они создают значительное
возрастание давления химуса в желудке, что при открытом пилорическом
сфинктере вызывает эвакуацию порции желудочного содержимого в
двенадцатиперстную кишку.
Если с помощью введенного в желудок человека баллона
регистрировать колебания давления желудочного содержимого, то можно выявлять
три типа волн сокращения (рис. 11.13): фазные волны с амплитудой до
542 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Давление,
мм рт. ст.
60
40
20
•4^o>L^M4^^K^V^>
Рис. 11.13. Волны сокращений мускулатуры желудка здорового человека.
I — перистальтические сокращения первого типа, II — волны второго типа, III — волны
третьего типа: на фоне длительного сокращения (в течение 5 мин), повышающего исходное
давление содержимого желудка до 10 мм рт. ст., возникают волны II типа с большей
амплитудой.
5 мм рт. ст., продолжительностью около 20 с, частотой 3 в 1 мин (I тип),
фазные волны той же продолжительности и частоты, но большей
амплитуды (10—50 мм рт. ст. — II тип). На фоне волн I и II типов происходит
возрастание исходного тонуса мускулатуры, что повышает давление на 5—
10 мм рт. ст. в течение 5—6 мин (III тип).
11.5.3.1. Регуляция сократительной деятельности желудка
Регулирующие влияния на мускулатуру желудка передаются из
вегетативных центров по блуждающему и чревному нервам. Возбуждение холинер-
гических волокон блуждающего нерва за счет выделения в его окончаниях
ацетилхолина усиливает моторику желудка, что выражается в увеличении
силы и частоты перистальтических волн, а также скорости их
распространения. Если через парасимпатические волокна блуждающего нерва
возбуждаются тормозные нейроны интрамуральных ганглиев, то наблюдается
эффект релаксации мышц желудка и расслабления пилорического
сфинктера. Это является следствием выделения в окончаниях аксонов этих
нейронов тормозных медиаторов (ВИП и АТФ).
При возбуждении симпатических (адренергических) волокон чревного
нерва наступает торможение мускулатуры желудка (уменьшение силы и
частоты сокращений, уменьшение скорости их распространения), но
активация а- и (3-адренорецепторов постсинаптических мембран миоцитов
пилорического сфинктера вызывает повышение его тонуса.
Координация парасимпатических и симпатических влияний
осуществляется благодаря взаимодействию надсегментарных вегетативных центров
гипоталамуса и корковых представительств пищевого центра. При элекро-
стимуляции ядер передних и средних отделов гипоталамуса через
вживленное электроды (в опытах на животных), как правило, возникает эффект
стимуляции моторики желудка, а при раздражении задних — торможение
его двигательной активности.
11. Функции пищеварительной системы • 543
11.5.3.2. Эвакуация содержимого желудка в двенадцатиперстную кишку
Желудочное содержимое переходит в двенадцатиперстную кишку
порциями. Этот процесс осуществляется благодаря согласованной деятельности
мускулатуры антрального отдела желудка, пилорического сфинктера и
двенадцатиперстной кишки. Скорость эвакуации содержимого желудка
зависит от ряда условий.
1. Чем больше давление в желудке превышает давление в
двенадцатиперстной кишке и чем ниже тонус мышечных волокон
пилорического сфинктера, тем больше скорость эвакуации. Градиент давлений
достигает 20—30 см водн. ст.
2. Жидкая часть желудочного содержимого начинает поступать в кишку
вскоре после приема пищи. Скорость перехода кашицеобразного
химуса из желудка постепенно замедляется. Твердще компоненты пищи
задерживаются в желудке до их измельчения до частичек размером в
2—3 мм. Если человеком была принята средняя по объему порция
смешанной пищи, то она задерживается в желудке на 3,5—4,5 ч.
3. С возрастанием объема принятой пищи продолжительность
эвакуации возрастает. Так, удвоение объема твердой углеводной пищи
удлиняет процесс эвакуации на 17 %, а белково-жировой — на 43 %.
4. При прочих равных условиях быстрее всего покидает желудок
углеводная пища, дольше задерживается в желудке белковая пища и еще
дольше — жирная.
5. Высокое осмотическое давление желудочного содержимого замедляет
процесс его эвакуации.
Важным регулятором сократительной активности пилорического
сфинктера является рН эвакуируемых порций желудочного содержимого.
Раздражение кислым химусом хеморецепторов слизистой оболочки
пилорического отдела рефлекторно способствует открытию сфинктера и
переходу порции химуса в двенадцатиперстную кишку. Раздражение соляной
кислотой хеморецепторов кишки вызывает рефлекторное торможение
мускулатуры желудка (энтерогастральный рефлекс) и сокращение
пилорического сфинктера. Такую же направленность имеет рефлекс с механорецеп-
торов двенадцатиперстной кишки. По мере ощелачивания поступившей в
кишку порции желудочного содержимого панкреатическим и кишечным
соками, а также желчью, описанные рефлекторные реакции с
хеморецепторов слизистой оболочки кишки прекращаются и создаются условия для
эвакуации из пилорического отдела желудка другой порции химуса.
Рефлекторная дуга этих рефлексов замыкается как в центрах мозга, так
и на периферии (в экстраорганных и интраорганных ганглиях).
Рефлекторная регуляция эвакуаторной функции подкрепляется
гуморальными факторами. Так, выделяющиеся эндокринными клетками
кишки под влиянием соляной кислоты секретин и холецистокинин тормозят
моторику желудка и эвакуацию. Но в тоже время они ускоряют
ощелачивание химуса в двенадцатиперстной кишке, стимулируя выработку
панкреатического сока. Другие гастроинтестинальные гормоны (энкефалины
и ГИП) тормозят моторику желудка и эвакуаторную функцию.
11.6. Пищеварение в двенадцатиперстной кишке
В двенадцатиперстной кишке продолжается процесс гидролиза пищевых
веществ, начатый в желудке. Но его объем значительно возрастает, так как
в полость кишки выделяются пищеварительные соки поджелудочной желе-
544 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
зы и кишечных желез, содержащие ферменты для гидролиза белков, жиров
и углеводов. Эти ферменты наиболее активны в щелочной среде, которая
создается пищеварительными соками поджелудочной железы, бруннеро-
вых и либеркюнновых желез, а также желчью.
11.6.1. Пищеварительные функции поджелудочной железы
За сутки поджелудочная железа человека выделяет от 1,5 до 2,5 л сока,
который вырабатывается ацинарными, центроацинарными и
эпителиальными клетками протоков железы. В состоянии относительного покоя
(натощак) железа выделяет небольшое количество сока, а при поступлении
желудочного содержимого в двенадцатиперстную кишку скорость
сокоотделения возрастает до 4,7 мл/мин.
11.6.1.1. Состав и свойства панкреатического сока
Панкреатический сок имеет высокую концентрацию бикарбонатов,
которые обусловливают его щелочную реакцию. Его рН колеблется от 7,5 до
8,8. В соке содержатся хлориды натрия, калия и кальция, сульфаты и
фосфаты. Вода и электролиты выделяются в основном центроацинарными и
эпителиальными клетками выводах протоков. В состав сока входит и
слизь, которая вырабатывается бокаловидными клетками главного протока
поджелудочной железы.
Панкреатический сок богат ферментами, осуществляющими гидролиз
белков, жиров и углеводов. Они вырабатываются ацинарными панкреаци-
тами.
Протеолитические ферменты (трипсин, химотрипсин, эластаза, карбок-
сжептидазы А и В) выделяются панкреацитами в неактивном состоянии,
что предотвращает самопереваривание клеток. Трипсиноген превращается
в трипсин в полости двенадцатиперстной кишки под влиянием фермента
энтерокиназы, который вырабатывается слизистой оболочкой кишки.
Выделение энторокинизы обусловлено влиянием желчных кислот. С
появлением трипсина наступает аутокаталитический процесс активации всех про-
теолитических ферментов, выделяющихся в зимогенной форме.
Трипсин, химотрипсин и эластаза расщепляют внутренние пептидные
связи белковой молекулы и высокомолекулярных полипептидов. Процесс
гидролиза завершается образованием низкомолекулярных пептидов и
аминокислот. Образовавшиеся пептиды подвергаются заключительному
гидролизу карбоксипептидазами А и В, которые расщепляют С-концевые связи
молекул белков и пептидов с образованием аминокислот.
Содержащаяся в панкреатическом соке а-амилаза расщепляет крахмал
на декстрины, мальтозу и мальтотриозу. Ионы кальция, входящие в состав
ос-амилазы, обеспечивают устойчивость фермента при изменении рН
среды и ее температуры, а также препятствуют его гидролизу под влиянием
протеолитических ферментов.
Панкреатическая липаза секретируется в активной форме. Но ее
активность значительно возрастает под влиянием колипазы после ее активации в
двенадцатиперстной кишке трипсином. Колипаза образует комплекс с
панкреатической липазой. В образовании этого комплекса участвуют соли
жирных кислот. Липаза гидролизует жир на моноглицериды и жирные
кислоты. Эффективность гидролиза жира резко возрастает после его
эмульгирования желчными кислотами и их солями.
Под влиянием холестеразы холестериды расщепляются до холестерина и
11. Функции пищеварительной системы • 545
жирных кислот. Фосфолипиды подвергаются гидролизу с помощью
панкреатической фосфолипазы А2, которая активируется трипсином.
Конечными продуктами гидролиза являются жирная кислота и изолецетин. Рибо-
нуклеазы и дезоксирибонуклеазы панкреатического сока расщепляют РНК и
ДНК пищевых веществ до нуклеотидов.
11.6.1.2. Нервная и гуморальная регуляция секреторной функции
поджелудочной железы
Слабое сокоотделение натощак резко усиливается во время (через 2—
3 мин) и после приема пищи. В привычных условиях приема пищи
панкреатическое сокоотделение начинается уже на вид, запах пищи и другие
раздражители, сопутствующие приему пищи, что свидетельствует об
условно-рефлекторном механизме секреции. При раздражении пищевыми
веществами рецепторов слизистой оболочки ротовой полости, глотки и
пищевода возникает безусловно-рефлекторное отделение панкреатического
сока. Нервные импульсы от раздражаемых рецепторов по афферентным
путям достигают бульбарного центра панкреатической секреции, где они
переключаются на преганглионарные нейроны ядер блуждающего нерва, по
эфферентным волокнам которого достигают постганглионарных нейронов.
Их аксоны образуют синаптические окончания на базальных мембранах
панкреацитов. Выделяющийся при возбуждении этих окончаний ацетилхо-
лин активирует М-холинорецепторы постсинаптической мембраны. При
этом освобождаются вторичные посредники (Са++ и ГЦ-цГМФ), которые
и вызывают секреторную деятельность панкреоцитов и эпителиальных
клеток протоков.
При раздражении чревных нервов, осуществляющих симпатическую
иннервацию поджелудочной железы, ее сокоотделение тормозится (за счет
активации р-адренорецепторов медиатором норадреналином). Но
торможение секреции сопровождается накоплением секреторного материала в
панкреацитах.
Поступление пищи в желудок во время приема пищи вызывает
раздражение хемо- и механорецепторов желудка, что приводит к продолжению
безусловно-рефлекторного сокоотделения поджелудочной железой,
вызванного стимуляцией рецепторов ротовой полости.
Поступление в двенадцатиперстную кишку желудочного содержимого
вызывает наряду с дуоденопанкреатическим секреторным рефлексом (с
рецепторов слизистой оболочки) выделение из эндокринных клеток гастро-
интестинальных гормонов, стимулирующих или тормозящих
сокоотделение поджелудочной железой. Роль основных гуморальных регуляторов
выполняют секретин и ХЦК, которые вырабатываются S- и ССК-клетками
слизистой оболочки двенадцатиперстной кишки. Секретин и ХЦК
усиливают влияние друг друга на панкреоциты, особенно на фоне выделения
ацетилхолина в синаптических окончаниях холинергических нервных
волокон, иннервирующих железу. Важным гуморальным возбудителем
панкреатической секреции является гастрин, выделяемый У-клетками
слизистой оболочки антрального отдела желудка. Возбуждающее влияние этих
гормонов подкрепляется бомбезином, серотонином и инсулином.
Тормозят выделение сока соматостатин, глюкагон, энкефалины,
вещество Р, ТИП, ПП (см. табл. 11.1), а также кальцитонн и АКТГ. Но их роль в
комплексной гуморальной регуляции поджелудочной железы изучена
недостаточно.
Секреция сока поджелудочной железой осуществляется в три фазы.
18-6095
546 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Первая называется сложнорефлекторной. Она обусловлена комплексом
условных и безусловных раздражителей, предшествующих и сопутствующих
приему пищи. В первую фазу выделяется около 10—15 % от общего объема
сока за три фазы, а ферментов — около 25 %. Во вторую желудочную фазу
вырабатывается около 10 % сока от общего его объема (с высоким
содержанием ферментов). В третью кишечную фазу выделяется основное
количество сока (около 75 % от общего объема), но менее богатого ферментами.
Его состав отличается большим содержанием бикарбонатов, необходимых
для ощелачивания содержимого двенадцатиперстной кишки.
11.6.2. Пищеварительные функции печени
В пищеварении печень принимает участие благодаря образованию желчи,
которая из общего протока через сфинктер Одди поступает в полость
двенадцатиперстной кишки. Желчь — результат секреторной деятельности ге-
патоцитов и эпителиальных клеток желчных протоков. Секреторные
клетки печени исходный материал для образования желчи получают из крови,
протекающей по капиллярам дольки печени и под базальной мембраной
эпителиальных клеток протоков.
Кровь поступает в печень по воротной вене от пищеварительного
тракта и печеночной артерии (около 1,2 л за 1 мин).
11.6.2.1. Механизм образования желчи
Желчные кислоты синтезируются гепатоцитами из холестерина. Кроме
того, из синусоидного кровеносного капилляра гепатоциты активно
извлекают желчные кислоты, которые с помощью переносчиков выделяются в
желчные капилляры. При этом за желчными кислотами по осмотическому
градиенту следует вода.
Через мембрану гепатоцита осуществляется активный транспорт Na+ в
желчные капилляры; за Na+ по электрическому градиенту перемещаются
анионы СГ и HCOJ. Возникающий осмотический градиент привлекает в
желчный капилляр воду. Механизм транспорта других катионов и
анионов аналогичен описанному. Гепатоциты выделяют также в желчные
капилляры фосфолипиды, холестерин и билирубин. Билирубин образуется
в крови из гемоглобина гемолизированных эритроцитов и в комплексе с
альбумином плазмы поступает в гепатоцит, где образуется прямой
билирубин (после его соединения с глюкуроновой кислотой). Прямой
билирубин через мембрану гепатоцита транспортируется в желчные
капилляры.
В желчных протоках продолжается процесс формирования желчи за
счет деятельности эпителиальных клеток, которые осуществляют реабсорб-
цию электролитов из содержимого протоков, выводят HCOJ и воду.
11.6.2.2. Состав и свойства желчи
За сутки у человека образуется 0,6—1,5 л желчи. Печеночная желчь,
заполняющая желчные протоки, поступая в желчный пузырь, изменяется по
своему составу.
Эпителиальные клетки слизистой оболочки желчного пузыря
осуществляют активную реабилитацию Na+ из его содержимого, что является
причиной реабсорбции анионов СГ, HCOJ и воды. Это приводит к сгущению
пузырной желчи и уменьшению ее рН (с 7,3—8,0 до 6,5).
11. Функции пищеварительной системы • 547
Печеночная и пузырная желчь, поступив в двенадцатиперстную кишку,
принимает участие в пищеварении. Это выражается в следующем.
Снижая кислотность поступившего в кишку желудочного содержимого,
желчь прекращает действие пепсинов и создает среду для проявления
активности ферментов поджелудочного сока.
За счет солей желчных кислот происходит эмульгирование жиров,
крупные капли которых распадаются на мелкие капельки, резко
увеличивающие площадь соприкосновения с липазой панкреатического сока и
эффективность гидролиза жиров. Около 7—20 % желчных кислот выводится из
организма с калом, большая часть всасывается в подвздошной кишке в
кровь воротной вены, откуда гепатоциты повторно извлекают желчные
кислоты.
Желчные кислоты способствуют всасыванию жирных кислот и
жирорастворимых витаминов (D, Е, К).
Желчь является возбудителем моторики кишечника и кишечных
ворсинок, стимулирует пролиферацию энтероцитов, угнетает развитие
кишечной микрофлоры и предотвращает гнилостные процессы в толстом
кишечнике.
11.6.2.3. Регуляция желчеобразования и желчевыведения
Желчеобразование в печени происходит непрерывно. Под влиянием
условных и безусловных раздражителей во время приема пищи образование
желчи усиливается. Продолжительность латентного периода секретного
рефлекса варьирует от 3 до 12 мин. После приема пищи темпы
желчеобразования возрастают и достигают максимума при переваривании
углеводистой пищи через 2—3 ч, белковой — через 3 ч, жирной — через 5—7 ч. Это
зависит от продолжительности пребывания пищевых веществ в желудке,
кислотности порций желудочного содержимого, поступающего в
двенадцатиперстную кишку, образования эндокринными клетками слизистой
оболочки желудка и кишки гастроинтестинальных гормонов (гастрина,
секретина, холецистокинина-панкреозимина, глюкагона), которые стимулируют
желчеобразование.
Рефлекторные стимулирующие влияния на желчеобразование
реализуются через блуждающий нерв в ответ на раздражение рецепторов всех
отделов пищеварительного тракта, а тормозные — через симпатические
нервы.
При отсутствии процесса пищеварения (натощак) желчь поступает в
желчный пузырь, потому что сфинктеры Мирицци (препятствующий
поступлению желчи из общего желчного протока в проток желчного пузыря)
и Люткинса (в шейке желчного пузыря) находятся в расслабленном
состоянии, а сфинктер Одди — в сокращенном. Емкость желчного пузыря у
взрослого человека равна 50—60 мл, но за счет сгущения желчи
резервируется ее объем, выделенный печенью за 12—14 ч.
Начинается желчевыведение в ответ на комплекс условных и
безусловных раздражителей, связанных с приемом пищи. Реализуется этот рефлекс
через эфферентные волокна блуждающего нерва, возбуждение которых
стимулирует моторику желчного пузыря и общего желчного протока, но
расслабляет сфинктер Одди. Продолжается желчевыведение от 3 до 6 ч.
Оно обусловлено не только раздражением рецепторов желудка и
двенадцатиперстной кишки химусом, но и влиянием на мускулатуру желчевыводя-
щего аппарата гастроинтестинальных гормонов (гастрина, секретина,
холецистокинина-панкреозимина, бомбезина), вырабатываемых эндокринны-
18"
548 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ми клетками желудка и двенадцатиперстной кишки под влиянием химуса.
Наибольший сокогонный эффект наблюдается после приема молока,
яичных желтков, жиров и мяса.
Раздражение симпатических нервов вызывает расслабление мышц
желчного пузыря, общего желчного протока и сокращение сфинктера Од-
ди, что приводит к уменьшению и прекращению выделения желчи в
двенадцатиперстную кишку. Торможение желчевыведения наблюдается также
под влиянием ВИП, глюкагона и кальцитонина.
11.6.3. Непищеварительные функции печени
Деятельность печени в большой степени влияет на состояние обмена
веществ организма. В печени синтезируется основное количество белков
плазмы крови — альбумины, глобулины, факторы свертывания крови
(протромбин, фибриноген и др.). В гепатоцитах синтезируется и депонируется
гликоген, из которого образуется глюкоза при возрастании энергетических
затрат организма (например, во время мышечной деятельности) для
поддержания константного уровня ее концентрации в крови. Это происходит
под влиянием нервных импульсов по симпатическим нервам, адреналина
и глюкагона. Гепатоциты также расщепляют жиры до жирных кислот.
Печень оказывает косвенное влияние на обмен веществ, осуществляя
дезактивацию гормонов. Белково-пептидные гормоны дезактивируются протеи-
назами, стероидные — гидроксилазами, катехоламины — моноаминокси-
дазой.
Печень защищает организм от ядовитых продуктов пищеварения,
поступающих из кишечника (индола, скатола, фенола) и чужеродных
веществ. Обезвреживание токсичных веществ гепатоциты осуществляют за
счет их окисления, восстановления, соединения с глюкуроновой и серной
кислотами, глицином и глутамином, что приводит к образованию
неядовитых продуктов.
При дезаминировании промежуточных продуктов белкового обмена в
гепатоцитах образуется токсичный аммиак, который инактивируется за
счет синтеза из него мочевины.
11.7. Пищеварение в тонком кишечнике
В тонкой кишке осуществляются завершающие стадии гидролиза
пищевых веществ, начатого с помощью ферментов слюны, желудочного и
поджелудочного соков. В кишечном соке имеется полный набор ферментов,
расщепляющий поли- и олигомеры пищевых веществ до мономеров,
которые по мере своего образования всасываются слизистой оболочкой
тонкой кишки в кровь и лимфу (см. раздел 11.7.3). Начинается гидролиз
пищевых веществ в тонкой кишке в процессе полостного пищеварения, а
завершается при осуществлении пристеночного (мембранного
пищеварения).
//. 7.1. Секреторная функция тонкой кишки
Кишечный сок является продуктом секреторной активности всей
слизистой оболочки тонкой кишки. В проксимальном отделе
двенадцатиперстной кишки сок вырабатывается бруннеровыми железами. Секрет этих желез
содержит значительное количество слизи, которая защищает слизистую
оболочку двенадцатиперстной кишки от механического и химического раз-
11. Функции пищеварительной системы • 549
дражения. Основная часть кишечного сока выделяется либеркюновыми
железами. Они заложены в криптах у основания ворсинок. В образовании
сока принимают участие все энтероциты. Они обладают высокой пролифера-
тивной активностью, в результате чего происходит их перемещение от
основания ворсинки до ее вершины, где они подвергаются слущиванию (де-
сквамации) и становятся компонентом кишечного сока. В полости кишки
слущенные эпителиальные клетки распадаются, освобождая содержащиеся
в них ферменты.
Мембраны апикальной поверхности эпителиоцитов покрыты большим
числом микроворсинок, связанных с гликокаликсом. Они создают
большую площадь, на которой фиксированы молекулы ферментов. Эти
ферменты транспортируются из эпителиоцита и адсорбируются из
содержимого тонкой кишки. Они обусловливают мембранное пищеварение.
Слизистая оболочка кишки покрыта слоем слизи. Она вырабатывается
бокаловидными клетками. Слизь не только защищает слизистую оболочку от
химического и механического повреждения, но и является субстратом, на
котором абсорбируются ферменты.
Слизистая оболочка тонкой кишки взрослого человека выделяет за
сутки около 2,5 л сока. Он состоит из жидкой и плотной частей. Жидкая
часть содержит небольшое количество ферментов, катионы (Na+, K+, Са2+
и др.), анионы (в основном HCOJ, СГ), белки, аминокислоты, мочевину,
молочную кислоту и др. Ее рН 7,2—7,5. В плотной части кишечного сока
содержится основное количество ферментов, слущенные эпителиоциты и
их фрагменты, лейкоциты и слизь.
В кишечном соке и в энтероцитах имеется около 20 ферментов,
осуществляющих заключительный гидролиз пищевых веществ. Ферменты,
вырабатываемые эпителиальными клетками, вначале проявляют свою
активность в процессе мембранного пищеварения (на поверхности
микроворсинок и нитей гликокаликса, а после слущивания энтероцитов принимают
участие в полостном пищеварении. К этим ферментам относятся лейцин-
аминопептидиза, нуклеаза, нуклеотидаза, липаза, фосфолипаза, щелочная
фосфатаза, холинэстераза.
В кишечном соке содержится энтерокиназа, которая выходит из десква-
мированных эпителиальных клеток и активирует трипсиноген
поджелудочного сока. Лейцинаминопептидаза расщепляет пептиды до аминокислот.
Фосфатазы осуществляют гидролиз моноэфиров ортофосфорной кислоты.
Нуклеаза деполимеризует нуклеиновые кислоты, а нуклеотидиза дефосфо-
рилизует мононуклеотиды.
Ферменты, связанные с мембраной энтероцитов, имеют высокую
активность. Олигосахаридазы и дисахаридазы завершают гидролиз углеводов
превращая их в моносахариды. Аминопептидазы и дипептидазы
осуществляют расщепление пептидов до аминокислот. Моноглицеридлипазы
завершают гидролиз жиров.
Таким образом, в процессе полостного пищеварения в тонкой кишке
образуются олигомеры молекул пищевых веществ. Из полости кишки олиго-
меры разной степени сложности проникают через слой слизи на гликока-
ликс и подвергаются дополнительному гидролизу (за счет ферментов,
адсорбированных в слизи и на глико кал иксе). Заключительный гидролиз
алигомеров происходит на мембране микроворсинок апикальной части
энтероцитов {мембранное пищеварение). Мембранное пищеварение
характеризуется высокой эффективностью, так как происходит на очень большой
площади.
550 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
11.7.1.1. Регуляция секреторной функции тонкой кишки
Основную роль в регуляции сокоотделения слизистой оболочки кишки
играют местные рефлексы, осуществляемые энтеральной нервной системой.
Механическое раздражение усиливает секрецию жидкой части кишечного
сока и не изменяет содержания в нем ферментов. Стимуляция хеморецеп-
торов продуктами переваривания белков и жиров вызывает секрецию сока,
богатого ферментами. При раздражении блуждающего нерва увеличивается
содержание ферментов в кишечном соке. Такой же эффект оказывают аце-
тилхолин и холиномиметики. Раздражение чревного нерва угнетает
отделение сока.
Во время приема пищи наблюдается рефлекторное усиление секреции
бруннеровых желез двенадцатиперстной кишки и рефлекторное
торможение остального железистого аппарата, что предотвращает избыточную
выработку сока и его ферментов (сверх того количества секрета, которое
обусловлено местным раздражением химуса рецепторов кишки).
Гастроинтестинальные гормоны, вырабатываемые эндокринными
элементами слизистой оболочки кишки под влиянием химуса (дуокринин,
энтерокринин, ГИП, ВИП и мотилин), а также гормоны коры
надпочечников (кортизон, дезоксикортикостерон) стимулируют кишечную
секрецию, подкрепляя функцию местных рефлекторных механизмов, и только
один гормон — соматостатин — оказывает тормозное влияние на кишечное
сокоотделение.
//. 7.2. Двигательная функция тонкой кишки
Благодаря сократительной деятельности гладкой мускулатуры тонкой
кишки ее содержимое перемешивается с пищеварительными соками и
перемещается в дистальном направлении. При этом пристеночные слои химуса
смещаются раньше остального содержимого, которое приходит в
соприкосновение со слизистой оболочкой. Моторика тонкой кишки
обеспечивает высокую эффективность гидролиза пищевых веществ и способствует
всасыванию их мономеров.
Миоциты кишки обладают способностью к автоматическому
возбуждению, что является причиной сокращения мышечных пучков. Их
деятельность приобретает упорядоченный характер благодаря энтеральной
нервной системе, которая обеспечивает несколько видов скоординированных
сокращений (ритмическую сегментацию, маятникообразные,
перистальтические и тонические сокращения).
Ритмическая сегментация представляет собой сокращение пучков
циркулярных мышц, которые вызывают в разных участках кишки глубокие
перетяжки шириной 1—2 см.
Содержимое кишки из зоны перетяжки перемещается в соседние участки
(шириной 15—20 см), мускулатура которых находится в расслабленном
состоянии. Через несколько минут сокращенные участки расслабляются, а
перетяжки возникают в ранее расслабленных участках. Чередование
сокращенных и расслабленных участков осуществляется 8—10 раз в 1 мин.
Ритмическая сегментация обеспечивает перемешивание химуса в полости кишки.
Маятникообразные сокращения — это ритмические сокращения в
основном продольных пучков мышечных волокон участка кишки, который,
укорачиваясь, приводит к перемещению химуса «вперед—назад», что
способствует его перемешиванию. Маятникообразные сокращения в одном и том
же участке кишки чередуются с ритмической сегментацией.
11. Функции пищеварительной системы • 551
Перистальтические сокращения подобны волне, распространяющейся в
каудальном направлении и продвигающей химус вдоль по кишке. Эта
волна возникает выше порции химуса в результате сокращения
циркулярных мышц и сокращения продольных мышц ниже образовавшегося
перехвата.
Сужение участка кишки, вызванное сокращением циркулярных мышц,
и расширение рядом расположенного участка, обусловленное
сокращением продольных мышц, создает градиент давления, который и вызывает
перемещение химуса в каудальном направлении. Скорость распространения
перистальтической волны в тонкой кишке 1—2 см/с. Такие волны могут
возникать в любых частях тонкой кишки. Но чаще они начинаются в
двенадцатиперстной кишке. При этом их возникновение совпадает с началом
эвакуации желудочного содержимого в кишку. В процессе кишечного
пищеварения одновременно осуществляется несколько волн перистальтики,
что обеспечивает равномерное перемещение химуса всей тонкой кишки в
каудальном направлении. Слабые перистальтические волны перемещают
только пристеночные слои химуса.
В конце пищеварительного периода возникают сильные
перистальтические сокращения, которые распространяются вдоль всей тонкой кишки.
Они освобождают ее от химуса, который через илиоцекальный сфинктер
переходит в слепую кишку. Скорость распространения таких волн
возрастает в каудальном направлении и достигает в подвздошной кишке 7—
21 см/с. Такая перистальтика называется пропульсивной.
Тонические сокращения возникают на фоне исходного (базального)
тонуса гладких мыщц тонкой кишки, могут распространяться с малой
скоростью и вызывать повышение тонуса кишки, суживая ее на большом
протяжении. Тонические сокращения мускулатуры кишки приводят в
соответствие ее емкость с объемом содержимого и создают давление химуса около
8—9 см водн. ст. Другие виды моторики кишки совершаются на фоне
тонических сокращений. Тонические сокращения характерны также для
гладкомышечных волокон сфинктеров.
Функционально значимыми являются также сокращения и
расслабления ворсинок тонкой кишки, которые осуществляются в течение всего
процесса пищеварения. Благодаря ритмичным сокращениям ворсинок они
постоянно контактируют с новыми порциями химуса, что способствует
всасыванию продуктов гидролиза пищевых веществ и оттоку лимфы по
лимфатическим сосудам.
//. 7.2.1. Регуляция моторики тонкой кишки
Моторная активность тонкой кишки зависит от механических свойств и
химического состава ее содержимого. Если пища содержит грубые частицы
(изделия из муки грубого помола, отруби, овощи, фрукты с высоким
содержанием клетчатки) или жиры, то двигательная активность кишки
возрастает. На моторику кишечника оказывают также стимулирующее
влияние слабые растворы кислот, щелочи и соли.
Регуляция моторики тонкой кишки обеспечивается миогенными
механизмами, нервными интрамуральными влияниями на миоциты,
центральной нервной системой, гормонами энтерального и неэнтерального
происхождения.
В основе миогенного механизма регуляции моторики кишки лежит
способность миоцитов реагировать сокращением на растяжение. Так, при
сокращении продольных мышечных пучков происходит растяжение цирку-
552 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
лярных мышечных волокон, которые реагируют на механическое
воздействие сокращением. Возбуждение с одного миоцита на другой легко
передается с помощью нексусов. Нексусы — участки тесного контакта мембран
рядом находящихся миоцитов, имеющие низкое электрическое
сопротивление. Благодаря этому механизму распространения возбуждения на
частоту генерации «спонтанных» медленных волн и потенциалов действия
миоцитов оказывает влияние электрическая активность мышечных волокон
водителей ритма.
Энтеральный механизм нервной регуляции моторики кишки
реализуется за счет взаимодействия нейронов интрамуральных ганглиев (сенсорных,
промежуточных и эфферентных), являющихся структурной основой
местных рефлексов. Так, при локальном раздражении механо- и хеморецепто-
ров слизистой оболочки кишки возникает сокращение циркулярных мышц
выше места стимуляции и их расслабление ниже места раздражения. Это
способствует перемещению химуса в каудальном направлении. При этом
возбуждение от раздраженных рецепторов передается к сенсорным
нейронам подслизистого сплетения, а по их аксонам — к промежуточным
нейронам межмышечного сплетения. Интернейроны передают возбуждение к
исполнительным (эфферентным) нервным клеткам. Проксимальнее от
места раздражения возбуждаются холинергические нейроны, вызывающее
сокращение циркулярных мышц, а дистальнее от места стимуляции
приводятся в действие пептидергические тормозные нервные клетки, которые
тормозят циркулярные мышечные пучки. В окончаниях аксонов этих
нейронов выделяются тормозные медиаторы (ВИП и АТФ), которые
вызывают гиперполяризацию мембраны миоцитов.
Моторика тонкой кишки регулируется также центральной нервной
системой через парасимпатические и симпатические нервы. Возбуждение хо-
линергических волокон блуждающего нерва вызывает, как правило,
усиление сократительной активности мускулатуры кишки, а возбуждение адре-
нергических волокон чревных нервов — торможение. Электростимуляция
передних и средних ядер гипоталамуса, сигмовидной извилины коры
больших полушарий усиливает моторику кишки, а раздражение задних ядер
гипоталамуса и орбитальной извилины коры — тормозит.
Электростимуляция переднего отдела поясной извилины и миндалевидного комплекса в
зависимости от функционального состояния тонкой кишки либо
активирует, либо тормозит ее моторику. Центры регуляции сократительной
активности тонкой кишки располагаются также в продолговатом и спинном
мозге.
В естественных условиях функционирования пищеварительной системы
центральные структуры регуляции включаются в ответ на раздражение
различных рефлексогенных зон, что и определяет характер вызываемых
рефлексов. Различают две группы рефлексов — моторные и тормозные.
При осуществлении пищеводно-кишечного моторного рефлекса
раздражение механорецепторов пищевода во время глотания вызывает повышение
тонуса и силы волн перистальтики тонкой кишки. Центр этого рефлекса
расположен в продолговатом мозге. Свои влияния на кишку он реализует
через блуждающий нерв. Гастродуоденальный, гастроеюнальный и гастро-
илеоцекальный моторные рефлексы возникают в ответ на раздражение
механорецепторов наполненного пищей желудка. Эти рефлексы имеют две
компоненты: одна из них реализуется через энтеральную нервную систему,
другая — через центр блуждающего нерва. Раздражение механо- и хеморе-
цепторов слизистой оболочки тонкой кишки порцией химуса вызывает ки-
шечно-кишечный моторный рефлекс, который выражается в усилении
11. Функции пищеварительной системы • 553
двигательной активности участников кишки, расположенных каудальнее
места раздражения. Кишечно-кишечный моторный рефлекс тоже имеет
две компоненты — местную и центральную, осуществляемую через ядро
блуждающего нерва. Группа моторных рефлексов обеспечивает ускорение
темпов пищеварения в тонкой кишке.
Тормозные рефлексы выражаются в угнетении моторики тонкой кишки
и других отделов желудочно-кишечного тракта. Так, при сильном
раздражении механорецепторов кишечника возникает ослабление моторики
желудочно-кишечного тракта за счет возбуждения спинальных центров
чревного нерва {кишечно-кишечный тормозной рефлекс). В физиологических
условиях он предотвращает поступление в нижележащие отделы кишечника
недостаточно переработанных порций химуса.
Аналогичный характер имеет прямокишечно-кишечный тормозный
рефлекс, который выражается в угнетении моторики тонкой и толстой
кишки в ответ на раздражение механорецепторов прямой кишки при ее
переполнении каловыми массами. Реализуется этот рефлекс через спи-
нальный центр чревного нерва. Значение описанного рефлекса очевидно:
он уменьшает поступление химуса в конечный отдел толстой кишки до ее
освобождения от каловых масс.
Гуморальная регуляция моторики тонкой кишки осуществляется за счет
комплекса гормонов энтерального и неэнтерального происхождения. Так,
гастрин, мотилин, гистамин, ХЦК, серотонин, вещество Р (см. табл. 11.1),
вазопрессин, брадикинин и окситоцин усиливают электрическую и
двигательную активность миоцитов, а секретин, ВИП и ГИП — тормозят.
Гастроинтестинальные гормоны вырабатываются эндокринными
элементами двенадцатиперстной и тонкой кишки под влиянием
рефлекторного и химического раздражения химуса и действуют не только на
мембранные рецепторы миоцитов, но и на нейроны энтеральной нервной системы.
11.7.3. Функция всасывания тонкой кишки
Общая характеристика процессов всасывания в пищеварительном тракте
изложена в разделе 11.2.3.
Тонкая кишка является основным отделом пищеварительного тракта,
где осуществляется всасывание продуктов гидролиза пищевых веществ,
витаминов, минеральных веществ и воды. Высокая скорость всасывания и
большой объем транспорта веществ через слизистую оболочку кишки
объясняются большой площадью ее соприкосновения с химусом за счет
наличия макро- и микроворсинок и их сократительной активности, густой сети
капилляров, расположенных под базальной мембраной энтероцитов и
имеющих большое количество широких пор (фенестров), через которые
могут проникать крупные молекулы.
Через поры клеточных мембран энтероцитов слизистой оболочки
двенадцатиперстной и тощей кишки вода легко проникает из химуса в кровь и
из крови в химус, так как ширина этих пор равна 0,8 нм, что значительно
превышает ширину пор в других отделах кишечника. Поэтому содержимое
кишки изотонично плазме крови. По этой же причине в верхних отделах
тонкого кишечника всасывается основное количество воды. При этом вода
следует за осмотически активными молекулами и ионами. К их числу
относятся ионы минеральных солей, молекул моносахаридов, аминокислот и
олигопептидов.
С наибольшей скоростью всасываются ионы Na+ (около 500 м/моль за
сутки). Существует два пути транспорта ионов Na+ — через мембрану энте-
554 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
8
Свободные
аминокислоты
• •
се°
Полипептид
2
0)
о;
го
i
5
I
го
2
го
ц.
с
о
• . • #.| Ч г^
Панкреатические
протеазы
Олигопептиды
if
Дипептидазы
Аминополи
пептидазы
Транспорт $
аминокислот %
i ft* 4S й* •;£
Транспорт
пептидов
&: Й
Аминокислоты ^^^ eJ
Цитоплазматические
пептидазы
Рис. 11.14. Схема переваривания и всасывания белков.
Дипептидазы и аминопептидазы мембраны микроворсинок энтероцита расщепляют
олигопептиды до аминокислот и мелких осколков белковой молекулы, которые транспортируются в
цитоплазму клетки, где цитоплазматические пептидазы завершают процесс гидролиза.
Аминокислоты через базальную мембрану энтероцита поступают в межклеточное пространство, а
затем — в кровь.
роцитов и по межклеточным каналам. В цитоплазму энтероцитов они
поступают в соответствии с электрохимическим градиентом. А из энтероцита
в интерстиций и кровь Na+ транспортируется с помощью Na+/K+-Hacoca,
локализованного в базолатеральной части мембраны энтероцитов. Помимо
Na+ по межклеточным каналам по механизму диффузии всасываются ионы
11. Функции пищеварительной системы • 555
Э
s
&
m
о
о
о.
С
го
ь
S
о
Q.
Р
I
m
I
Просвет кишечника
Мицелла
Микроворсинка
Капля жира
Гладкий
эндоплаз-
матический
ретикулум
Аппарат
Гольджи
Панкреатическая
липаза
ш Триглицерид
и Диглицерид
Моноглицерид
Жирная кислота
Соли желчных кислот
Глицерин
О Хи ломи крон
Межклеточное
пространство
Центральный
лимфатический
сосуд
Рис. 11.15. Схема переноса продуктов гидролиза жиров из просвета кишки в
цитоплазму энтероцита и в межклеточное пространство.
Из продуктов гидролиза жиров (моноглицеридов, жирных кислот и глицерина) в гладком эн-
доплазматическом ретикулуме ресинтезируются триглицериды, а в гранулярном эндоплазма-
тическом ретикулуме и аппарате Гольджи формируются хиломикроны. Хиломикроны через
латеральные участки мембраны энтероцита поступают в межклеточное пространство, а
затем — в лимфатический сосуд.
К+ и СГ. Высокая скорость всасывания СГ обусловлена тем, что они
следуют за ионами Na+.
Транспорт HCOJ сопряжен с транспортом Na+. В процессе его
всасывания в обмен на Na+ энтероцит секретирует в полость кишки Н+, который,
взаимодействуя с НСО^, образует Н2С03. Н2С03 под влиянием фермента
556 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
карбоангидразы превращается в молекулу воды и С02. Двуокись углерода
всасывается в кровь и удаляется из организма с выдыхаемым воздухом.
Всасывание ионов Са2+ осуществляет специальная транспортная система,
которая включает Са2+-связывающий белок щеточной каймы энтероцита и
кальциевый насос базолатеральной части мембраны. Этим и объясняется
относительно высокая скорость всасывания Са2+ (в сравнении с другими
двухвалентными ионами). При значительной концентрации Са2+ в химусе объем
его всасывания возрастает за счет механизма диффузии. Всасывание Са2+
усиливается под влиянием паратгормона, витамина D и желчных кислот.
Всасывание Fe2+ осуществляется с участием переносчика. В энтероците
Fe2+ вступает в соединение с апоферритином, образуя ферритин. В составе
ферритина железо и используется в организме. Всасывание ионов Zn2+ и
М^+ происходит по законам диффузии.
При высокой концентрации моносахаридов (глюкозы, фруктозы,
галактозы, пентозы) в химусе, заполняющем тонкую кишку, они всасываются
по механизму простой и облеченной диффузии. Механизм всасывания глюкозы
и галактозы является активным натрий-зависимым. Поэтому при
отсутствии Na+ скорость всасывания этих моносахаридов замедляется в 100 раз.
Продукты гидролиза белков (аминокислоты и трипептиды) всасываются
в кровь в основном в верхнем отделе тонкого кишечника —
двенадцатиперстной и тощей кишке (около 80—90 %). Главный механизм всасывания
аминокислот — активный натрийзависимый транспорт. Меньшая часть
аминокислот всасывается по механизму диффузии. Процессы гидролиза и
всасывания продуктов расщепления белковой молекулы тесно связаны (рис.
11.14). Небольшое количество белка всасывается без расщепления до
мономеров — путем пиноцитоза (см. раздел 11.2.3). Так из полости кишки
поступают в организм иммуноглобулины, ферменты, а у новорожденного —
белки, содержащиеся в грудном молоке.
Процесс всасывания продуктов гидролиза жиров (моноглицериды,
глицерин и жирные кислоты) осуществляется в основном в
двенадцатиперстной и тощей кишке и отличается существенными особенностями.
Моноглицериды, глицерин и жирные кислоты взаимодействуют с фос-
фолипидами, холестерином и солями желчных кислот, образуя мицеллы.
На поверхности микроворсинок энтероцита липидные компоненты
мицеллы легко растворяются в мембране и проникают в его цитоплазму, а соли
желчных кислот остаются в полости кишки. В гладком
эндоплазматическом ретикулуме энтероцита происходит ресинтез триглицеридов, из
которых в гранулярном эндоплазматическом ретикулуме и аппарате Гольджи с
участием фосфолипидов, холестерина и гликопротеинов образуются
мельчайшие капельки жира (хиломикроны), диаметр которых равен 60—75 нм.
Хиломикроны скапливаются в секреторных везикулах. Их мембрана
«встраивается» в латеральную мембрану энтероцита, и через
образовавшееся отверстие хиломикроны поступают межклеточные пространства, а затем
в лимфатический сосуд (рис. 11.15).
11.8. Пищеварение в толстом кишечнике
В толстом кишечнике завершается гидролиз остатков пищевых веществ за
счет ферментов, поступающих с химусом из подвздошной кишки, и
ферментов, вырабатываемых слизистой оболочкой толстой кишки, и энзимов,
выделяемых микрофлорой, населяющей толстую кишку; осуществляется
всасывание воды, продуктов гидролиза пищевых веществ и микробного
разложения остатков пищи; происходит также формирование каловых масс.
11. Функции пищеварительной системы • 557
11.8.1. Перемещение химуса из тощей кишки в слепую
Перемещение химуса из тощей кишки в слепую осуществляется благодаря
ритмической деятельности илеоцекального сфинктера, который
представляет собой утолщение циркулярных пучков мышечных волокон в
конечном отделе подвздошной кишки. Воронкообразная складка слизистой
оболочки кишки в области сфинктера выполняет роль клапана,
пропускающего химус только в дистальном направлении.
При отсутствии пищеварительной деятельности желудочно-кишечного
тракта сфинктер находится в состоянии тонического напряжения и
перекрывает выход из тощей кишки. Через 1—4 мин после приема пищи
сфинктер начинает ритмически сокращаться и расслабляться. Его
расслабление связано с перистальтикой подвздошной кишки, осуществляемой по
механизму местного рефлекса. Когда перистальтическая волна достигает
конечного участка подвздошной кишки, давление химуса в нем возрастает.
При этом сфинктер расслабляется, и химус переходит в слепую кишку до
тех пор, пока не освободится конечный отдел подвздошной кишки. За
1 мин в слепую кишку переходит около 15 мл химуса.
Установлено, что илеоцекальный сфинктер работает синхронно с пило-
рическим сфинктером за счет осуществления бисфинктерного рефлекса. Это
обеспечивает согласование уровней наполнения химусом начальных и
конечных отделов тонкого кишечника.
11.8.2. Сокоотделение в толстом кишечнике
Сокоотделение в толстом кишечнике является в основном реакцией в
ответ на местное механическое раздражение слизистой оболочки химусом.
Сок толстой кишки состоит из плотной и жидкой компонент. Плотная
компонента включает в себя слизистые комочки, состоящие из слущенных
эпителиоцитов, лимфоидных клеток и слизи. Жидкая компонента имеет
рН 8,5—9,0. Ферменты сока содержатся в основном в слущенных эпите-
лиоцитах, при распаде которых их ферменты (пептидазы, амилаза, липаза,
нуклеаза, катепсины, щелочная фосфатаза) поступают в жидкую
компоненту. Содержание ферментов в соке толстой кишки и их активность
значительно ниже, чем в соке тонкого кишечника. Но имеющихся ферментов
достаточно для завершения гидролиза в проксимальных отделах толстой
кишки остатков непереваренных пищевых веществ.
Регуляция сокоотделения слизистой оболочки толстого кишечника
осуществляется в основном за счет энтеральных местных нервных
механизмов.
11.8.3. Двигательная активность толстого кишечника
Двигательная активность толстого кишечника имеет особенности, которые
обеспечивают накопление химуса, его сгущение за счет всасывания воды,
формирование каловых масс и их удаление из организма во время
дефекации.
О временных характеристиках процесса передвижения содержимого по
отделам жулудочно-кишечного тракта судят по перемещению рентгено-
контрастного вещества (например, сернокислого бария). После приема
оно начинает поступать в слепую кишку через 3—3,5 ч. В течение 24 ч
происходит заполнение толстой кишки, которая освобождается от
контрастной массы через 48—72 ч.
558 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Начальным отделам толстой кишки свойственны очень медленные
малые маятникообразные сокращения. С их помощью осуществляется
перемешивание химуса, что ускоряет всасывание воды. В поперечной ободочной
и сигмовидной кишке наблюдаются большие маятникообразные сокращения,
вызванные возбуждением большого количества продольных и
циркулярных мышечных пучков. Медленное перемещение содержимого толстой
кишки в дистальном направлении осуществляется благодаря редким
перистальтическим волнам. Задержке химуса в толстой кишке способствуют
антиперистальтические сокращения, которые перемещают содержимое в
ретроградном направлении и тем самым способствуют всасыванию воды.
Сгущенный обезвоженный химус накапливается в дистальном отделе толстой
кишки. Этот участок кишки отделяется от вышележащего, заполненного
жидким химусом, перетяжкой, вызванной сокращением циркулярных
мышечных волокон, что является выражением сегментации.
При заполнении поперечной ободочной кишки сгущенным плотным
содержимым усиливается раздражение механорецепторов ее слизистой
оболочки на значительной площади, что способствует возникновению
мощных рефлекторных пропульсивных сокращений, перемещающих
большой объем содержимого в сигмовидную и прямую кишку. Поэтому
подобного рода сокращения называются масс-сокращениями. Прием пищи
ускоряет возникновение пропульсивных сокращений за счет осуществления
желудочно-ободочного рефлекса.
Перечисленные фазные сокращения толстой кишки осуществляются на
фоне тонических сокращений, которые в норме продолжаются от 15 с от
5 мин.
В основе моторики толстой кишки, как и тонкой, лежит способность
мембраны гладкомышечных элементов к спонтанной деполяризации.
Характер же сокращений и их координация зависят от влияний эфферентных
нейронов интраорганной нервной системы и вегетативного отдела ЦНС.
Местные рефлексы при раздражении механорецепторов толстой кишки
усиливают ее моторику; раздражение же механорецепторов только прямой
кишки приводит к торможению двигательной активности толстой и
тонкой кишки, предотвращая ее переполнение каловыми массами.
Торможение миогенной активности миоцитов толстой кишки через интраорганную
нервную систему реализуется с помощью тормозных медиаторов (ВИП и
АТФ).
Стимуляция парасимпатических нервов (блуждающего и тазового)
увеличивает частоту и амплитуду сокращений мышц толстой кишки, а
раздражение симпатических нервных волокон, выходящих из верхнего и нижнего
брыжеечного сплетений, оказывает противоположный эффект.
Рефлекторные влияния, реализуемые через экстраорганные нервы,
суммируются с гуморальными. Так, гастрин, ХЦК и кортизон стимулируют
моторику толстой кишки, а адреналин, серотонин, секретин и глюкагон —
тормозят.
11.8.4. Роль микрофлоры толстой кишки в процессе пищеварения
и формировании иммунологической реактивности
организма
Толстая кишка является местом обитания большого числа
микроорганизмов. Они формируют эндоэкологический микробный биоценоз
(сообщество). Микрофлора толстого кишечника состоит из трех групп
микроорганизмов: главной (бифидобактерии и бактероиды — почти 90 % от всех
11. Функции пищеварительной системы • 559
Колонизационная
резистентность
Межмикробный антагонизм, активация иммунной системы
Детоксикационная —>■ Гидролиз продуктов метаболизма белков, жиров, углеводов
Синтетическая
Синтез витаминов, гормонов, антибиотических и других
веществ
Пищеварительная
—*■
Усиление физиологической активности ЖКТ
Рис. 11.16. Функции нормальной микрофлоры кишечника.
микробов), сопутствующей (лактобактерии, эшерехии, энтерококки —
около 10 %) и остаточной (цитробактер, энтеробактер, протеи, дрожжи,
клостридии, стафилококки и др. — около 1 %). В толстой кишке находится
максимальное количество микроорганизмов (по сравнению с другими
отделами пищеварительного тракта). На 1 г кала приходится 1010—1013
микроорганизмов.
Нормальная микрофлора здорового человека участвует в формировании
иммунологической реактивности организма человека, предотвращает
развитие в кишечнике патогенных микробов, синтезирует витамины (фолие-
вую кислоту, цианокобаламин, филлохиноны) и физиологически активные
амины, осуществляет гидролиз токсичных продуктов метаболизма белков,
жиров и углеводов, предотвращая эндотоксинемию (рис. 11.16).
В процессе жизнедеятельности микроорганизмов, относящихся к
нормальной микрофлоре, образуются органические кислоты, которые
снижают рН среды и тем самым препятствуют размножению патогенных,
гнилостных и газообразующих микроорганизмов.
Бифидобактерии, лактобактерии, эубактерии, пропионбактерии и
бактероиды усиливают гидролиз белков, сбраживают углеводы, омыляют
жиры, растворяют клетчатку и стимулируют перистальтику кишечника. Би-
фидо- и эубактерии, а также эшерихии за счет своих ферментных систем
участвуют в синтезе и всасывании витаминов, а также незаменимых
аминокислот. Бактериальные модулины бифидо- и лактобактерии
стимулируют лимфоидный аппарат кишечника, увеличивают синтез
иммуноглобулинов, интерферона и цитокинов, подавляя развитие патогенных микробов.
Кроме того, модулины усиливают активность лизоцима. Анаэробные
бактерии вырабатывают биологически активные вещества (бета-аланин,
5-аминовалериановую и гамма-аминомасляную кислоты), медиаторы,
оказывающие влияние на функции пищеварительной и сердечно-сосудистой
систем, а также на органы кроветворения.
На состав микробного сообщества толстого кишечника оказывают
влияние многие эндогенные и экзогенные факторы. Так, растительная
пища приводит к увеличению энтерококков и эубактерии, животные белки и
жиры способствуют размножению клостридии и бактероидов, но снижают
количество бифидобактерии и энтерококков, молочная пища приводит к
увеличению числа бифидобактерии. Естественным регулятором
микрофлоры кишечника являются антимикробные вещества, продуцируемые
слизистой оболочкой кишечника и содержащиеся в пищеварительных секретах
560 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
(лизоцим, лактоферрин, дефенины, секреторный иммуноглобулин А).
Нормальная перистальтика кишечника, продвигающая химус в дистальном
направлении, оказывает большое влияние на уровень заселенности
микробами каждого отдела кишечного тракта, препятствуя их распространению в
проксимальном направлении. Поэтому нарушения двигательной
активности кишечника способствуют возникновению дисбактериоза (изменению
количественных соотношений и состава микрофлоры).
11.8.5. Акт дефекации
Опорожнение нижних отделов толстой кишки от экскрементов
осуществляется с помощью акта дефекации. Позыв к дефекации вызывает
раздражение рецепторов прямой кишки при ее заполнении каловыми массами и
повышение давления в ней до 40—50 мм водн. ст. Возникает дефекация
благодаря моторной деятельности прямой кишки и ее двух сфинктеров —
внутреннего гладкомышечного и наружного, образованного
поперечно-полосатой мышцей. Как внутренний, так и наружный сфинктеры вне акта
дефекации находятся в состоянии тонического сокращения, что
препятствует выпадению каловых масс. Регуляция непроизвольного процесса
опорожнения прямой кишки осуществляется интрамуральной нервной
системой, парасимпатическими и соматическими нервными центрами
крестцовых сегментов спинного мозга, образующими центр дефекации (S,—S)V).
Афферентные импульсы от механорецепторов слизистой оболочки
прямой кишки по срамным и тазовым нервам поступают в спинальный центр,
откуда по эфферентным парасимпатическим волокнам этих же нервов
передаются к гладкой мускулатуре прямой кишки и ее внутреннего
сфинктера. Тонус наружного анального сфинктера в начале осуществления
рефлекса дефекации повышается, а при достижении надпороговой силы
раздражения механорецепторов прямой кишки тормозится, что
сопровождается дефекацией.
Произвольный акт дефекации осуществляется при участии центров
продолговатого мозга, гипоталамуса и коры больших полушарий головного
мозга. Произвольное управление актом дефекации формируется в течение
первого года жизни. Центр в продолговатом мозге, принимающий участие
в регуляции этого акта, находится вблизи дыхательного и рвотного.
Близостью центров объясняется усиление дыхания и торможение рвотного
рефлекса при растяжении анальных сфинктеров и непроизвольная дефекация
при остановке дыхания.
Естественный акт дефекации является отчасти волевым, отчасти
непроизвольным. При значительном раздражении прямой кишки происходит ее
сокращение и расслабление внутреннего анального сфинктера.
Произвольная часть акта дефекации включает расслабление наружного сфинктера,
сокращение мышц диафрагмы и брюшных мышц. Все это ведет к
уменьшению объема брюшной полости и повышению внутрибрюшного
давления (до 220 см водн. ст.). Рефлекс дефекации полностью исчезает после
разрушения крестцовых сегментов — спинного мозга, где расположен
центр дефекации. При разрушении спинного мозга выше этих сегментов
спинальные рефлексы дефекации сохраняются, однако произвольный
компонент рефлекса дефекации не осуществляется из-за отсутствия
нисходящих влияний центров головного мозга.
Дефекация оказывает рефлекторные влияния на различные органы и
системы. Так, во время дефекации систолическое артериальное давление
повышается примерно на 60 мм рт. ст., а диастолическое — на 20 мм рт.
П. Функции пищеварительной системы • 561
ст., пульс учащается на 20 ударов в минуту. Это обусловлено сокращением
большой мышечной массы и задержкой дыхания при натуживании. В
норме у 70 % здоровых людей акт дефекации совершается 1 раз в сутки, у
30 % — 2 раза и чаще.
11.8.6. Иммунная система пищеварительного тракта
Помимо неспецифических факторов противодействия болезнетворным ан-
тигентам содержимого желудочно-кишечного тракта организм располагает
и специфической системой защиты. Она представляет собой совокупность
структур и элементов лимфоидной ткани, расположенных на протяжении
всего пищеварительного тракта и являющихся частью иммунной системы
организма. Функции иммунной защиты выполняют: лимфоидные
фолликулы, которые образуют скопления (пейеровы бляшки тонкой кишки,
миндалины глоточного кольца), Т-лимфоидные клетки и плазматические
элементы слизистой оболочки, а также малые лимфоидные клетки. Имму-
нокомпетентные клетки пищеварительного тракта осуществляют
распознание антигенов химуса, обеспечивают местный иммунный ответ и
формируют иммунную память (чтобы облегчить реакцию на антиген при
повторном контакте с ним).
Миндалины выделяют на слизистую оболочку глотки
иммуноглобулины, лизоцим, интерферон, простагландины, лимфоциты и макрофаги.
Плазматические клетки, находящиеся в строме ворсинок, продуцируют
иммуноглобулины всех классов (I, M, A, D, Е). Особую роль играет
иммуноглобулин А, который не разрушается протеолитическими ферментами
пищеварительных соков. Выделившись на поверхность эпителиальных
клеток слизистой оболочки, он соединяется с антигенами химуса и
микробов и приобретает способность отталкиваться от эпителиоцитов. Вместе со
слизью этот комплекс включается в состав химуса, подвергается
разрушению протеолитическими ферментами. Степень выраженности и
эффективность местного иммунного ответа зависят от состояния общей иммунной,
нервной и эндокринной систем.
Иммунная система пищеварительного тракта выполняет роль энтероге-
матического барьера, предотвращая поступление в кровь патогенных
микробов, их токсинов и ядовитых веществ пищи.
При ослаблении механизмов неспецифической и специфической,
местной и общей защиты организма от болезнетворного влияния антигенов и
ядовитых компонентов химуса экзогенного и эндогенного происхождения
возникают патологические нарушения функций пищеварительной
системы.
11.8.7. Тошнота и рвота
Тошнота — неприятное ощущение, формирующееся при значительном
повышении возбудимости нейронов ретикулярной формации области
рвотного центра. Это ощущение вызвано раздражением рецепторов желудочно-
кишечного тракта токсинами или метаболитами внутренней среды, а также
возбуждением высших отделов центральной нервной системы (коркового
отдела зрительной и обонятельной сенсорных систем) на фоне
повышенной возбудимости рвотного центра. Тошнота предшествует рвоте и
сопровождается учащением дыхания, тахикардией, саливацией, появлением
мелких глотательных движений, направленных на освобождение полости рта
от избыточного количества слюны, усилением потоотделения и сужением
i
562 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
кожных сосудов. Возникновение этого комплекса реакций объясняется
иррадиацией возбуждения из рвотного центра на центры других рефлексов.
Рвота — защитная сложнокоординированная рефлекторная реакция
гладкой мускулатуры желудочно-кишечного тракта и скелетных мышц,
осуществляющих выбрасывание содержимого желудка и тонкой кишки
наружу через рот. Эта реакция возникает при возбуждении нейронов
рвотного центра ретикулярной формации продолговатого мозга в ответ на
раздражение рецепторов желудочно-кишечного тракта токсичными
метаболитами внутренней среды или вредными веществами, введенными извне,
раздражением рецепторов вестибулярного аппарата. Рвота может быть
обусловлена обонятельными, зрительными, вкусовыми раздражениями,
вызывающими чувство отвращения, а также раздражением нейронов рвотного
центра при повышении внутричерепного давления. Импульсы от
рецепторов желудочно-кишечного тракта поступают в рвотный центр по
сенсорным волокнам блуждающего и языкоглоточного нервов. Эфферентные
влияния по центробежным нервным волокнам в составе блуждающего и
чревного нервов передаются к кишечнику, желудку, пищеводу, а также по
моторным нервам, иннервирующим мышцы брюшной стенки, диафрагмы
и наружных межреберных мышц.
Рвота сопровождается урежением и углублением дыхания, поднятием
подъязычной кости и гортани, что способствует открытию верхнего
пищеводного сфинктера, закрытию глотки, поднятию мягкого неба с закрытием
хоан. Вслед за этим начинается сильное сокращение диафрагмы при
одновременном сокращении всех мышц брюшной стенки. При этом нижний
пищеводный сфинктер расслабляется, позволяя содержимому желудка
пройти через пищевод наружу.
Акту рвоты предшествует возникновение антиперистальтики тонкой
кишки, забрасывающей ее содержимое в желудок.
ГЛАВА 12
Обмен веществ и энергии. Питание
Обмен веществ и энергии лежит в основе всех проявлений
жизнедеятельности и представляет собой совокупность процессов превращения веществ и
энергии в живом организме и обмен веществами и энергией между
организмом и окружающей средой.
Для поддержания жизнедеятельности в процессе обмена веществ и
энергии обеспечиваются пластические и энергетические потребности
организма. Пластические потребности удовлетворяются за счет веществ,
используемых для построения биологических структур, а энергетические —
путем преобразования химической энергии поступающих в организм
питательных веществ в энергию макроэргических (АТФ и другие молекулы) и
восстановленных (НАДФ • Н — никотин-амид-адениндинуклеотидфосфат)
соединений. Их энергия используется организмом для синтеза белков,
нуклеиновых кислот, липидов, а также компонентов клеточных мембран и
органелл клетки, для выполнения деятельности клеток, связанной с
использованием химической, электрической и механической энергии.
Обмен веществ и энергии (метаболизм) в организме человека —
совокупность взаимосвязанных, но разнонаправленных процессов: анаболизма
(ассимиляции) и катаболизма (диссимиляции).
Анаболизм — это совокупность процессов биосинтеза органических
веществ, компонентов клетки и других структур органов и тканей.
Анаболизм обеспечивает рост, развитие, обновление биологических структур, а
также непрерывный ресинтез макроэргических соединений и их
накопление.
Катаболизм — это совокупность процессов расщепления сложных
молекул, компонентов клеток, органов и тканей до простых веществ (с
использованием части из них в качестве предшественников биосинтеза) и до
конечных продуктов метаболизма (с образованием макроэргических и
восстановленных соединений).
Взаимосвязь процессов катаболизма и анаболизма основывается на
единстве биохимических превращений, обеспечивающих энергией все
процессы жизнедеятельности и постоянное обновление тканей организма.
Сопряжение анаболических и катаболических процессов в организме могут
осуществлять различные вещества, но главную роль в этом сопряжении
играют АТФ, НАДФ • Н. В отличие от других посредников метаболических
превращений АТФ циклически рефосфорилируется, а НАДФ • Н —
восстанавливается, что обеспечивает непрерывность процессов катаболизма и
анаболизма.
Обеспечение энергией процессов жизнедеятельности осуществляется за
счет анаэробного (бескислородного) и аэробного (с использованием кислорода)
катаболизма поступающих в организм с пищей белков, жиров и углеводов.
В ходе анаэробного расщепления глюкозы (гликолиза) или ее резервного
субстрата гликогена (гликогенолиза) превращение 1 моля глюкозы в 2
моля лактата приводит к образованию 2 молей АТФ. Лактат — промежуточ-
564 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ный продукт обмена. В химических связях его молекулы аккумулировано
значительное количество энергии. Энергии, образующейся в ходе
анаэробного обмена, недостаточно для осуществления процессов
жизнедеятельности животных организмов. За счет анаэробного гликолиза могут
удовлетворяться лишь относительно кратковременные энергетические потребности
клетки.
В организме животных и человека в процессе аэробного обмена
органические вещества, в том числе продукты анаэробного обмена, окисляются
до конечных продуктов — С02 и Н20. Общее количество молекул АТФ,
образующихся при окислении 1 моля глюкозы до С02 и Н20, составляет 25,5
моля. При окислении молекулы жиров образуется большее количество
молей АТФ, чем при окислении молекулы углеводов. Так, при окислении 1
моля пальмитиновой кислоты образуется 91,8 моля АТФ. Количество
молей АТФ, образующихся при полном окислении аминокислот и углеводов,
примерно одинаково. АТФ играет в организме роль внутренней
«энергетической валюты» и аккумулятора химической энергии клеток.
Основным источником энергии восстановления для реакции
биосинтеза жирных кислот, холестерина, аминокислот, стероидных гормонов,
предшественников синтеза нуклеотидов и нуклеиновых кислот является
НАДФ • Н. Образование этого вещества осуществляется в цитоплазме
клетки в процессе фосфоглюконатного пути катаболизма глюкозы. При таком
расщеплении из 1 моля глюкозы образуется 12 молей НАДФ • Н.
Процессы анаболизма и катаболизма находятся в организме в
состоянии динамического равновесия или временного превалирования одного из
них. Преобладание анаболических процессов над катаболическими
приводит к росту, накоплению массы тканей, а катаболических — к частичному
разрушению тканевых структур, выделению энергии. Состояние
равновесного или неравновесного соотношения анаболизма и катаболизма зависит
от возраста. В детском возрасте преобладают процессы анаболизма, а в
старческом — катаболизма. У взрослых людей эти процессы находятся в
равновесии. Их соотношение зависит также от состояния здоровья,
выполняемой человеком физической или психоэмоциональной деятельности.
12.1. Роль белков, жиров, углеводов, минеральных веществ
и витаминов в метаболизме
Потребность организма в пластических веществах может быть
удовлетворена тем минимальным уровнем их поступления с пищей, который
уравновешивает потери структурных белков, липидов и углеводов. Эти
потребности индивидуальны и зависят от таких факторов, как возраст
человека, состояние здоровья, интенсивность и вид труда.
Человек получает в составе пищевых продуктов заключенные в них
пластические вещества, минеральные вещества и витамины. Суточная
потребность человека в белках, жирах и углеводах представлена в разделе 12.5.
12.1.1. Белки и их роль в организме
Белки в организме находятся в состоянии непрерывного обмена и
обновления. У здорового взрослого человека количество распавшегося за сутки
белка равно количеству вновь синтезированного. Животные существа
могут усваивать азот только в составе аминокислот, поступающих в организм
с белками пищи. Десять аминокислот из 20 (валин, лейцин, изолейцин,
лизин, метионин, триптофан, треонин, фенилаланин, аргинин и гистидин)
12. Обмен веществ и энергии. Питание • 565
в случае их недостаточного поступления с пищей не могут быть
синтезированы в организме. Эти аминокислоты называют незаменимыми. Другие
десять аминокислот (заменимые) не менее важны для жизнедеятельности,
чем незаменимые, но в случае недостаточного поступления с пищей
заменимых аминокислот они могут синтезироваться в организме. Важным
фактором обмена белков организма является повторное использование
(реутилизация) аминокислот, образовавшихся при распаде одних белковых
молекул, для синтеза других.
Скорость распада и обновления белков организма различна.
Полупериод распада гормонов пептидной природы составляет минуты или часы,
белков плазмы крови и печени —около 10 сут, белков мышц — около 180
сут. В среднем все белки организма человека обновляются за 80 сут. О
суммарном количестве белка, подвергшегося распаду за сутки, судят по
количеству азота, выводимого из организма человека. В белке содержится
около 16 % азота (т. е. в 100 г белка— 16 г азота). Таким образом,
выделение организмом 1 г азота соответствует распаду 6,25 г белка. За сутки из
организма взрослого человека выделяется около 3,7 г азота. Из этих
данных следует, что масса белка, подвергшегося за сутки полному
разрушению, составляет 3,7 х 6,25 = 23 г, или 0,028—0,075 г азота на 1 кг массы
тела в сутки {коэффициент изнашивания по Рубнеру).
Если количество азота, поступающего в организм с пищей, равно
количеству азота, выводимого из организма, принято считать, что организм
находится в состоянии азотистого равновесия. В случаях, когда в организм
поступает азота больше, чем его выделяется, говорят о положительном
азотистом балансе (задержке, ретенции азота). Такие состояния бывают у
человека при увеличении массы мышечной ткани, в период роста организма,
беременности, выздоровления после тяжелого истощающего заболевания.
Состояние, при котором количество выводимого из организма азота
превышает его поступление в организм, называют отрицательным
азотистым балансом. Оно имеет место при питании неполноценными белками,
когда в организм не поступают какие-либо из незаменимых аминокислот,
при белковом голодании или при полном голодании.
Белки, использующиеся в организме в первую очередь в качестве
пластических веществ, в процессе их разрушения освобождают энергию для
синтеза в клетках АТФ и образования тепла.
Всемирной организацией здравоохранения рекомендуется потребление
белка не менее 0,75 г/кг в сутки, или для взрослого здорового человека
массой 70 кг не менее 52,5 г легкоусвояемого полноценного белка.
12.1.2. Липиды и их роль в организме
Липиды организма человека — это, главным образом, нейтральные
сложные эфиры глицерина и высших жирных кислот — триглицериды, фосфо-
липиды и стерины. Высшие жирные кислоты, входящие в состав сложных
липидных молекул в виде углеводородных радикалов, бывают
насыщенными и ненасыщенными, содержащими одну и более двойных связей.
Липиды играют в организме энергетическую и пластическую роль. По
сравнению с молекулами углеводов и белков молекула липидов является более
энергоемкой. Поэтому при окислении липидов в организме образуется
больше молекул АТФ и тепла. За счет окисления жиров обеспечивается
около 50 % потребности в энергии взрослого организма. Запасы
нейтральных жиров-триглицеридов в жировых депо человека в среднем составляют
10—20 % массы его тела. Из них около половины локализуется в подкож-
566 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ной жировой клетчатке. Кроме того, значительные запасы нейтрального
жира откладываются в большом сальнике, околопочечной клетчатке, в
области гениталий и между мышцами. Жиры, откладываясь в жировых депо,
служат долгосрочным резервом питания организма.
Жиры являются источником образования эндогенной воды. При
окислении 100 г нейтрального жира в организме образуется около 107 г воды.
Если в удовлетворении энергетических потребностей организма основную
роль играют нейтральные молекулы жира (триглицериды), то пластическая
функция липидов в организме осуществляется, главным образом, за счет
фосфолипидов, холестерина, жирных кислот. Эти липидные молекулы
являются структурными компонентами клеточных мембран (липопротеинов)
и предшественниками синтеза стероидных гормонов, желчных кислот и
простагландинов.
12.1.2.1. Клеточные липиды
В состав клеточных липидов входят фосфолипиды и холестерин,
являющиеся необходимыми структурными компонентами поверхностной и
внутриклеточных мембран. Триглицериды откладываются в клетках в виде
жировых капель, формируя жировые депо. Последние являются не инертной
массой, а активной динамической тканью, в которой запасенные жиры
подвергаются постоянному расщеплению и ресинтезу. При действии на
организм холода, в состоянии голода, при физической или
психоэмоциональной нагрузке происходит интенсивное расщепление (липолиз)
запасенных триглицеридов. Образующиеся при этом неэстерифицированные
жирные кислоты используются в организме как энергодающие или как
пластические вещества, необходимые для синтеза сложных липидных
молекул. В условиях покоя после приема пищи происходят ресинтез и
отложение нейтральных липидов в подкожной жировой клетчатке, брюшной
полости, мышцах.
12.1.2.2. Бурый жир
Такой оттенок жировой ткани придают окончания симпатических нервных
волокон, а также многочисленные митохондрии, содержащиеся в клетках
этой ткани. Поэтому бурый жир легко мобилизуется для обеспечения
энергетических потребностей организма. Он располагается в
межлопаточной области, вдоль крупных сосудов грудной и брюшной полостей, в
затылочной области шеи. Масса бурой жировой ткани достигает у взрослого
0,1 % массы тела. В митохондриях жировых клеток имеется полипептид
молекулярной массой 32 000, способный разобщать идущие здесь
процессы окисления и образования АТФ. Результатом такого разобщения
является образование в бурой жировой ткани в ходе метаболизма жира
значительно большего количества тепла, чем в белой жировой ткани. Бурая
жировая ткань участвует в теплопродукции.
12.1.2.3. Липиды плазмы крови
Липидные молекулы, обладая гидрофобными свойствами, не могут
растворяться в водной среде или образовывать молекулярную взвесь. Попадая в
значительных количествах в кровь при переломе крупных трубчатых
костей или при переливании неустойчивых жировых эмульсий, они
формируют липидные капельки и могут вызвать закупорку сосудов — жировую эм-
12. Обмен веществ и энергии. Питание • 567
болию. В физиологических условиях в эпителиальных клетках тонкого
кишечника и клетках печени из белковых молекул (апопротеинов), фосфоли-
пидов, холестерина, эфиров холестерина и триглицеридов формируются
транспортные частицы, называемые липопротеинами. По показателям
молекулярной массы, размеров и плотности липопротеины крови
подразделяют на классы: хиломикроны, липопротеины очень низкой плотности,
липопротеины низкой плотности и липопротеины высокой плотности.
Липидные молекулы, поступившие из кишечника в эпителиоциты,
упаковываются в транспортные частицы экзогенных липидов, главным
образом в хиломикроны. Хиломикроны через лимфатические сосуды и протоки
поступают в кровоток. Под действием липопротеидлипазы эндотелия
капилляров главный компонент хиломикронов — нейтральные
триглицериды — расщепляются до глицерина и свободных жирных кислот. Часть
жирных кислот может связываться с альбумином, а глицерин и свободные
жирные кислоты поступают в жировые клетки и реэстерифицируются в
триглицериды. Остатки хиломикронов крови захватываются гепатоцитами
по механизму экзоцитоза и разрушаются в лизосомах.
В печени формируются липопротеины для транспорта синтезированных
в ней липидных молекул. Это липопротеины очень низкой и липопротеины
низкой плотности, которые транспортируются из печени к другим тканям.
Как простые, так и сложные липидные молекулы могут синтезироваться
в организме. Исключением являются полиненасыщенные линолевая, ли-
ноленовая и арахидоновая жирные кислоты, синтез которых в организме
не осуществляется, и они должны поступать с пищей. Эти кислоты,
получившие название незаменимых, входят в состав молекул фосфолипидов. Из
арахидоновой кислоты, отщепляемой от молекулы мембранных
фосфолипидов, образуются простагландины, простациклины, тромбоксаны, лей-
котриены. Отсутствие в пищевых продуктах или недостаточное
поступление в организм незаменимых жирных кислот приводит к задержке роста,
нарушению функции почек, заболеваниям кожи, бесплодию.
12.1.3. Углеводы и их роль в организме
Организм человека получает углеводы, главным образом, в виде
растительного полисахарида крахмала и в небольшом количестве в виде животного
полисахарида гликогена. В желудочно-кишечном тракте осуществляется их
расщепление до уровня моносахаридов (глюкозы, фруктозы, лактозы,
галактозы). Моносахариды, основным из которых является глюкоза,
всасываются в кровь и через воротную вену поступают в печеночные клетки. Здесь
фруктоза и галактоза превращается в глюкозу. Внутриклеточная
концентрация глюкозы в гепатоцитах близка к ее концентрации в крови. При
избыточном поступлении в печень глюкозы она фосфорилируется и
превращается в резервную форму ее хранения — гликоген. Количество гликогена
может составлять у взрослого человека 150—200 г. В случае ограничения
потребления пищи или по мере снижения концентрации глюкозы в крови
происходит расщепление гликогена и поступление глюкозы в кровь.
Концентрация глюкозы в крови через 3—4 ч после приема пищи
поддерживается на уровне 0,8—1,0 г/л.
Такой же процесс перехода глюкозы в кровь осуществляется, когда ее
концентрация в клетке повышается за счет глюконеогенеза — синтеза
глюкозы из лактата или аминокислот. В течение первых 12 ч и более после
приема пищи поддержание концентрации глюкозы в крови и обеспечение
потребности организма в углеводах реализуются за счет распада гликогена
L
568 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
в печени. Вслед за истощением запасов гликогена усиливается синтез
ферментов, обеспечивающих глюконеогенез.
Глюкоза, являющаяся источником энергии для процессов
жизнедеятельности и, в частности, главным источником энергии для клеток мозга,
выполняет в организме и пластические функции. Так, в ходе ее окисления
образуются промежуточные продукты — пентозы, которые являются
составной частью молекулы нуклеотидов и нуклеиновых кислот. Глюкоза
необходима для синтеза некоторых аминокислот, синтеза и окисления липи-
дов, полисахаридов.
Следовательно, обмен углеводов является необъемным компонентом
единого метаболизма.
12.1.4. Минеральные вещества и их роль в организме
Минеральные вещества растворены в жидкостях, составляющих
внутреннюю среду организма, а также в цитоплазме клеток. Образуемый ими
полиэлектролит создает необходимые условия для осуществления
многочисленных химических реакций. Минеральные вещества являются
кофакторами ферментативных реакций, создают необходимый уровень
осмотического давления, обеспечивают кислотно-основное равновесие, участвуют в
процессах свертывания крови, создают мембранный потенциал и
потенциал действия возбудимых клеток.
Данные о физиологической роли, суточной потребности и пищевых
источниках минеральных веществ приведены в табл. 12.1.
Таблица 12.1. Физиологическая роль, суточная потребность организма и источник
поступления минеральных веществ
Вещества
Натрий
Кальций
Калий
Хлор
Физиологическая роль, суточная потребность
Содержится в больших количествах во
внеклеточной жидкости и плазме крови. Играет
важнейшую роль в процессах возбуждения,
поддержании осмотического давления, распределении
и выведении воды из организма; участвует в
формировании бикарбонатной буферной
системы. Суточная потребность — 2—3 г, а в
виде NaCl — 5 г
Один из наиболее важных минеральных
элементов организма. Выполняет функцию
структурного компонента в тканях зубов и костей. В этих
тканях содержится около 99 % от общего
количества Са2+ в организме. Необходим для
осуществления процессов свертывания крови,
возбуждения клеток, синаптической передачи,
сокращения мыщц, вторичный посредник в
регуляции внутриклеточного метаболизма и др.
Суточная потребность — 0,8 г
Содержится преимущественно внутри клеток, а
также в жидкостях внутренней среды. Играет
важную роль в процессах реполяризации после
возбуждения в нервных волокнах, сокращении
мышц, в том числе миокарда. Суточная
потребность — 2—3 г
Содержится как во внеклеточной, так и во
внутриклеточной жидкости. Играет роль в процессах
Источник
Поваренная соль, в
составе растительной и
животной пищи, в жидкостях,
потребляемых при питье
Молоко и молочные
продукты, овощи, зеленые
листья
Потребность при
нормальном питании
удовлетворяется за счет
пищевого калия. Наиболее
богаты мясо, овощи, орехи
сухофрукты
Поваренная соль, в
составе растительной и живот-
12. Обмен веществ и энергии. Питание • 569
Продолжение
Вещества Физиологическая роль, суточная потребность
Источник
возбуждения и торможения, в синаптической
передаче, образовании соляной кислоты
желудочного сока. Суточная потребность — 3—5 г
Около 80 % в виде минеральных веществ
содержится в костях и зубах. В составе фосфолипидов
входит в структуру клеточных мембран, липо-
протеидов. В составе АТФ и ее производных
играет большую роль в метаболизме,
осуществлении важнейших физиологических процессов.
Суточная потребность около 0,7—0,8 г
Около 65 % содержится в гемоглобине крови,
находится в скелетных мышцах, печени,
селезенке, костном мозге, в составе ферментов.
Основная функция — связывание кислорода.
Суточная потребность— 10—15 мг
Важнейший компонент гормонов и
предшественников гормонов щитовидной железы.
Суточная потребность —0,15—0,3 мг
Содержится в печени, селезенке. Играет роль в
процессах всасывания железа, образовании
гемоглобина, пигментации. Суточная
потребность — 2—5 мг
Содержится в зубных тканях и необходим для
сохранения их целостности. Суточная
потребность — 1 мг. При пятикратной передозировке
токсичен
Содержится в костной ткани, необходим для ее
образования, а также нормального
осуществления функции мышечной и нервной тканей.
Необходим для синтеза многих коферментов.
Суточная потребность — 250—350 мг
Входит в состав аминокислот, белков (инсулин)
и витаминов (В,, Н), суточная потребность
предположительно равна 1 г
Важный компонент ряда ферментов. Необходим
для нормального роста. Суточная потребность —
10-15 мг
Входит в состав витамина В12 и необходим для
нормального осуществления эритропоэза.
Суточная потребность точно не известна,
предположительно 100—200 мкг
ной пищи; в жидкостях,
потребляемых при питье
Пищевые продукты, в
особенности молоко,
мясо, яйца, рыба, орехи,
злаки
Пищевые продукты, в
особенности мясо,
печень, свежая рыба, яйца,
сухофрукты, орехи
Йодированная
поваренная соль, морепродукты,
рыбий жир, овощи,
выращенные на обогащенных
йодом почвах
Пищевые продукты, в
особенности яйца,
печень, почки, рыба,
шпинат, сухие овощи,
виноград
Пищевые продукты,
фторированная NaCl,
фторированные зубные пасты и
растворы
Мясо, молоко, целые
зерна
Пищевые продукты, в
особенности мясо,
печень, рыба, яйца
Пищевые продукты:
крабы, мясо, бобы, яичный
желток
Печень
Йод, железо, медь, марганец, цинк, фтор, хром, кобальт относятся к
группе микроэлементов; они содержатся в пище и воде в чрезвычайно
малых количествах, но необходимы для осуществления метаболических
процессов, так как входят в состав молекулы ферментов, гормонов и
витаминов. Сведения, приведенные в табл. 12.1, необходимы для анализа
пищевого рациона человека с целью научно обоснованной его коррекции.
570 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
12.1.5. Вода и ее роль в организме — см. раздел 14.3. Водно-солевой
обмен
12.1.6. Витамины и их роль в организме
Витамины — группы разнородных по химической природе веществ, не
синтезируемых или синтезируемых в недостаточных количествах в организме,
но необходимых для нормального осуществления обмена веществ, роста,
развития организма и поддержания здоровья. Эти вещества не являются
непосредственными источниками энергии и не выполняют пластических
функций. Они являются составными компонентами ферментных систем и
играют роль катализаторов в обменных процессах. Сведения об
источниках витаминов, их суточной потребности для взрослого человека и
значении в осуществлении физиологических функций приведены в табл. 12.2.
Таблица 12.2. Физиологическая роль, потребность организма и источник поступления
витаминов
Витамин
А*
(ретинол)
D
циферол)
РР**
тиновая
кислота)
К (фил-
лохино-
ны)
Е
коферолы)
С
корбиновая
Суточная
потребность
взрослого
человека
А,-
0,9 мг,
бета-каротин —
1,8 мг
2,5 мкг
150 мг
До 1 мг
10-12 мг
50-
100 мг
Основные
источники
Животные
жиры, мясо,
рыба, яйца,
молоко
Печень и
мясо
млекопитающих,
печень рыб, яйца
Мясо, печень,
почки, рыба,
дрожжи
Зеленые
листья овощей,
печень
Растительные
масла,
зеленые листья
овощей, яйца
Свежие
фрукты и растения
(особенно ши-
Физиологическая роль
Необходим для синтеза
зрительного пигмента
родопсина; оказывает
влияние на процессы
роста, размножения,
пролиферации и
ороговения эпителия
Необходим для
всасывания из кишечника
ионов кальция и для
обмена в организме
кальция и фосфора
Участвует в процессах
клеточного дыхания
(переносе водорода и
электронов); регуляции
секреторной и
моторной функции
желудочно-кишечного тракта
Участвует в синтезе
факторов свертывания
крови,, протромбина
и др.
Антиоксидант
(ингибитор окисления)
Участвует в гидрокси-
лировании,
образовании коллагена, вклю-
Признаки недостаточности
Нарушаются функции
сумеречного зрения,
роста, развития и
размножения. Развивается сухость
поверхности
конъюнктивы и роговицы,
изъязвление роговицы
Недостаточное
поступление в детском возрасте
приводит к развитию
рахита, что проявляется
нарушением окостенения и
роста костей, их декаль-
цификацией и
размягчением
Воспаление кожи
(пеллагра), расстройства
желудочно-кишечного тракта
(понос)
Замедленное
свертывание крови, спонтанные
кровотечения
Четко определенных
симптомов
недостаточности у человека не
описано
Развивается цинга,
проявлением которой
являются кровоточивость де-
12. Обмен веществ и энергии. Питание • 571
Продолжение
Витамин
кислота)
В,
(тиамин)
В2
(рибофлавин)
В3 (пан-
тотено-
вая
кислота)
В6 (пи-
ридок-
син)
В12 (ци-
аноко-
бала-
мин)
Фолие-
вая
кислота
pj***
(био-
тин)
Суточная
потребность
взрослого
человека
1,4-
2,4 мг
2-3 мг
10 мг
1,5-3 мг
2 мкг
400 мг
150—
200 мкг
Основные
источники
повник,
черная
смородина,
цитрусовые)
Целые зерна,
бобы, печень,
почки,
отруби, дрожжи
Зерновые,
бобы, печень,
молоко,
дрожжи, яйца
Зерновые,
бобы,
картофель, печень,
яйца, рыба
Зерно, бобы,
мясо, печень,
дрожжи,
рыба.
Синтезируется
микрофлорой
кишечника
Печень,
синтезируется
роорганизмами кишечника
Зеленые
листья, овощи,
мясо, молоко,
дрожжи.
Синтезируется
микроорганизмами
кишечника
Молоко,
яичный желток,
печень,
синтезируется
роорганизмами кишечника
Физиологическая роль
чении железа в ферри-
тин. Повышает
устойчивость организма к
инфекциям
Участвует в
энергетическом обмене
(процессах декарбоксили-
рования), является ко-
ферментом пируват-
карбоксилазы
Входит в состав фла-
виновых ферментов.
Осуществляет перенос
водорода и электронов
Перенос ацетильной
группы (КоА) при
синтезе жирных кислот,
стероидов и других
соединений
Кофермент трансам и-
назы, декарбоксилазы,
дегидратазы, десульфо-
гидразы
Компонент ферментов
метаболизма
нуклеиновых кислот и
метилирования. Необходим
для гемопоэза
Необходима для
синтеза пуринов и метиони-
на и метаболизма од-
ноуглеродных
фрагментов молекул.
Стимулирует процесс
кроветворения
Кофермент дезаминаз,
карбоксилаз, трансфе-
раз, осуществляет
перенос С02
Признаки недостаточности
сен, мелкие
кровоизлияния в коже, поражение
стенок кровеносных
сосудов
Развивается заболевание
бери-бери,
сопровождающееся
полиневритом, нарушением
сердечной деятельности и
функций
желудочно-кишечного тракта
Поражение глаз
(светобоязнь), поражение
слизистой оболочки полости
рта и языка
Общая слабость,
головокружение, нейромотор-
ные нарушения,
воспаления кожи, поражения
слизистых оболочек
Повышенная
раздражительность, судороги, ги-
похромная анемия.
Играет важную роль в обмене
аминокислот, белков и
жиров, а также в
процессах кроветворения
Злокачественная анемия
Анемия
Дерматит (воспаление
кожи) с гиперфункцией
сальных желез
*Проявления передозировок: головные боли, эйфория, анемия, изменения со стороны
кожи, слизистых оболочек, костной ткани.
** Проявление передозировки: нарушение функций ЦНС и почек; вымывание Са2+ из
костей и повышение его уровня в крови.
***Гиповитаминоз может развиваться при потреблении больших количеств сырого яичного
белка, связывающего биотин.
572 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Основными источниками водорастворимых витаминов (группы В,
витамин С) являются, как правило, пищевые продукты растительного
происхождения и в меньшей мере животного происхождения. Эти витамины легко
всасываются из желудочно-кишечного тракта в кровь и лимфу.
Основными источниками жирорастворимых витаминов (витамины A, D,
Е, К) являются продукты животного происхождения. Для удовлетворения
потребностей организма в витаминах имеет значение не только
достаточное содержание в пищевом рационе богатых витаминами продуктов
растительного и животного происхождения, но и нормальное осуществление
процессов пищеварения и всасывания веществ в желудочно-кишечном
тракте. Так, при нарушениях пищеварения в тонком кишечнике,
связанных с недостаточным поступлением в двенадцатиперстную кишку желчи
или панкреатической липазы, может наблюдаться недостаточное
всасывание из желудочно-кишечного тракта витаминов при их нормальном
содержании в пище.
Дополнительным источником витаминов К, В6, и В12 является
микрофлора толстой кишки. Микроорганизмы синтезируют эти витамины
(наряду с другими веществами), которые частично усваиваются организмом.
Длительное голодание, питание пищевыми продуктами, не
содержащими или содержащими малое количество витаминов, употребление в пищу
продуктов после их длительного хранения или неправильной переработки,
нарушение пищеварительных функций могут приводить к недостаточному
поступлению витаминов в организм (гиповитаминозу). Гиповитаминоз или
полное прекращение поступления витамина в организм (авитаминоз)
приводят как к неспецифическим изменениям функций (снижению
умственной и физической работоспособности), так и к специфическим
нарушениям в организме, характерным для гипо- и авитаминоза (см. табл. 12.2).
Избыточный прием витаминов может приводить к гипервитаминозу. При
поступлении водорастворимых витаминов в дозах, превышающих суточную
потребность, эти вещества могут быстро выводиться из организма с мочой.
При этом обычно признаков гипервитаминоза не отмечается. Однако,
например, потребление больших количеств витамина В6 может
сопровождаться нарушением функции периферических нервов. Изменения в
организме, возникающие при гипервитаминозах A, D, РР, приведены в
табл. 12.2.
12.2. Роль обмена веществ в обеспечении энергетических
потребностей организма
Количество энергии, поступающей в организм с пищей, должно
обеспечивать подержание равновесного энергетического баланса на фоне
неизменной массы тела, физической активности и соответствующих скоростях
роста и обновления структур организма. Организм человека получает
энергию в виде потенциальной химической энергии питательных веществ. Эта
энергия аккумулирована в химических связях молекул жиров, белков и
углеводов, которые в процессе катаболизма преобразуются в конечные
продукты обмена с более низким содержанием энергии. Высвобождающаяся в
процессе биологического окисления энергия используется, прежде всего,
для синтеза АТФ, которая как универсальный источник энергии
необходима в организме для осуществления механической работы, химического
синтеза и обновления биологических структур, транспорта веществ,
осмотической и электрической работы. Схема процессов превращения энергии
в клетке представлена на рис. 12.1.
12. Обмен веществ и энергии. Питание • 573
Количество синтезированных молей АТФ на моль окисленного
субстрата зависит от его вида (белка, жира, углевода) и от величины
коэффициента фосфорилирования. Этот коэффициент, обозначаемый как Р/О, равен
количеству синтезированных молекул АТФ в расчете на один атом
кислорода, потребленный при окислении восстановленных органических
соединений в процессе дыхания. При переносе каждой пары электронов по
дыхательной цепи от НАД • Н до 02 величина Р/О = 2. Для субстратов,
окисляемых НАД • Н2-зависимыми ферментами, Р/О = 1,3. Эти соотношения
Р/О отражают энергетические затраты клетки на синтез АТФ в
митохондриях и транспорт макроэрга против химического градиента из
митохондрий к местам потребления.
Таким образом, одна часть аккумулированной в химических связях
молекул жиров, белков и углеводов энергии в процессе биологического
окисления используется для синтеза АТФ, другая часть этой энергии
превращается в теплоту. Эта теплота, выделяющаяся сразу же в процессе
биологического окисления питательных веществ, получила название первичной.
Какая часть энергии будет использована на синтез АТФ и будет вновь
аккумулирована в ее химических макроэргических связях, зависит от величины
Р/О и эффективности сопряжения в митохондриях процессов дыхания и
фосфорилирования. Разобщение дыхания и фосфорилирования под
действием гормонов щитовидной железы, ненасыщенных жирных кислот, липо-
протеидов низкой плотности, динитрофенола ведет к уменьшению
коэффициента Р/О, превращению в первичную теплоту большей, чем в
условиях нормального сопряжения дыхания и фосфорилирования, части энергии
химических связей окисляемого вещества. При этом снижается
коэффициент полезного действия синтеза АТФ, количество синтезированных
молекул АТФ уменьшается.
При полном окислении 1 г смеси углеводов пищи выделяется 4 ккал те-
Питательные вещества (белки, жиры, углеводы)
<^ 1 ПИЩА
Аминокислоты, моносахариды
жирные кислоты
Дыхательный
обмен клетки
(«электронный каскад»)
Н,0
СО,
Рис. 12.1. Обмен энергии в клетке.
В процессе биологического окисления аминокислот, моносахаридов и жирных кислот
освобождающаяся химическая энергия используется для синтеза макроэргического соединения
(АТФ). При расщеплении АТФ его энергия реализуется для осуществления всех видов работы
клетки (химической, электрической, осмотической и механической)
574 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
пла. В процессе окисления в организме 1 г углеводов синтезируется
0,13 моля АТФ. Если считать, что энергия пирофосфатной связи в АТФ
равна 7 ккал/моль, то при окислении 1 г углеводов лишь 0,91 (0,13 х 7)
ккал энергии будет запасено в организме в синтезированной АТФ.
Остальные 3,09 ккал будут рассеяны в виде тепла (первичная теплота). Отсюда
можно рассчитать коэффициент полезного действия синтеза АТФ и
аккумулирования в ней энергии химических связей глюкозы:
к.п.д. = (0,91 : 4,0) х 100 = 22,7 %.
Из приведенного расчета видно, что только 22,7 % энергии химических
связей глюкозы в процессе ее биологического окисления используется на
синтез АТФ и вновь запасается в виде химической макроэргической связи,
77,3 % энергии химических связей глюкозы превращается в первичную
теплоту и рассеивается в тканях.
Аккумулированная в АТФ энергия в последующем используется для
осуществления в организме химических, транспортных, электрических
процессов, производства механической работы и в конечном итоге тоже
превращается в теплоту, получившую название вторичной.
В названиях первичная и вторичная теплота отражено представление о
двухступенчатости полного превращения всей энергии химических связей
питательных веществ в тепло (первая ступень — образование первичной
теплоты в процессе биологического окисления, вторая ступень —
образование вторичной теплоты в процессе затраты энергии макроэргов на
производство различных видов работы). Таким образом, если измерить все
количество тепла, образовавшегося в организме за час или сутки, то это тепло
станет мерой суммарной энергии химических связей питательных веществ,
подвергшихся за время измерения биологическому окислению. По
количеству образовавшегося в организме тепла можно судить о величине
энергетических затрат, произведенных на осуществление процессов
жизнедеятельности.
Основным источником энергии для осуществления в организме
процессов жизнедеятельности является биологическое окисление питательных
веществ. На это окисление расходуется кислород. Следовательно, измерив
количество потребленного организмом кислорода за минуту, час, сутки,
можно судить о величине энергозатрат организма за время измерения.
Между количеством потребленного за единицу времени организмом
кислорода и количеством образовавшегося в нем за это же время тепла
существует связь, выражающаяся через калорический эквивалент кислорода
(КЭ02). Под КЭ02 понимают количество тепла, образующегося в
организме при потреблении им 1 л кислорода.
12.2.1. Способы оценки энергетических затрат организма
Прямая калориметрия основана на измерении количества тепла,
непосредственно рассеянного организмом в теплоизолированной камере. При
прямой калориметрии достигается высокая точность оценки энергозатрат
организма, однако из-за громоздкости и сложности способ используется
только для специальных целей.
Непрямая калориметрия основана на измерении количества
потребленного организмом кислорода и последующем расчете энергозатрат с
использованием данных о величинах дыхательного коэффициента (ДК) и
КЭ02. Под дыхательным коэффициентом понимают отношение объема
выделенного углекислого газа к объему поглощенного кислорода.
12. Обмен веществ и энергии. Питание • 575
Таблица 12.3. Значение ДК и КЭ при окислении в организме различных питательных
веществ
Вещества
Углеводы
Белки
Жиры
Энергетическая ценность (ккал/г)
4,0
4,0
9,0
02(л/г)
0,81
0,94
1,96
С02 (л/г)
0,81
0,75
1,39
ДК
1,0
0,80
0,70
КЭ02 (ккал/л)
5,05
4,46
4,69
Сущность непрямой калориметрии видна на примере окисления
глюкозы. Этот процесс описывается следующими превращениями:
С6Н1206 + 602 = 6С02 + 6Н20 + 675 ккал.
При окислении 1 г глюкозы количество выделяющейся энергии
составляет 675:180 (масса 1 моля глюкозы) = 3,75 ккал. На окисление 1 моля
глюкозы затрачивается 6 молей 02 или 134,4 (6 х 22,4) л. Калорический
эквивалент 1 л 02, использованного на окисление глюкозы, равен 675 ккал :
: 134,4 л = 5,02 ккал/л. Так как смесь углеводов пищевых продуктов имеет
более высокую, чем чистая глюкоза, энергетическую ценность, то при
окислении их в организме КЭ02 = 5,05 ккал/л. Из приведенного
уравнения реакции окисления глюкозы видно, что объем выделенного в процессе
окисления углекислого газа равен объему затраченного кислорода.
Следовательно, при окислении глюкозы:
ДК=6С02:602 = 1.
В случае окисления жиров, в которых на 1 атом углерода приходится
меньше атомов кислорода, чем в углеводах и белках, величина ДК имеет
значение 0,7. При окислении белковой, а также смешанной пищи
величина ДК принимает промежуточное значение между 1,0 и 0,7. Поскольку в
организме все питательные вещества одновременно подвергаются
окислению, то, определив величину ДК, можно условно судить о
преимущественном окислении в организме того или иного вида питательных веществ. Так
как для каждого питательного вещества характерна своя энергетическая
ценность, то по величине дыхательного коэффициента можно рассчитать
значение калорического эквивалента кислорода. Величины этих значений
представлены в табл. 12.3.
В условиях интенсивной физической нагрузки и при состояниях, когда
в организме имеет место накопление углекислоты, ДК может принимать
значение > 1,0. В этих случаях по нему нельзя судить о природе
окисляемых веществ.
12.3. Обмен веществ и энергии при различных уровнях
функциональной активности организма
12.3.1. Основной обмен
Под основным обменом понимают минимальный уровень энергозатрат,
необходимых для поддержания жизнедеятельности организма в условиях
относительно полного физического, эмоционального и психического покоя.
В состоянии относительного покоя энергия затрачивается на
осуществление функций нервной системы, постоянно идущий синтез веществ, работу
ионных насосов, поддержание температуры тела, деятельность
дыхательной мускулатуры, гладких мышц, работу сердца и почек.
576 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Таблица 12.4. Уравнения для расчета величины основного обмена.
Пол
М
Ж
м
ж
м
ж
м
ж
Возраст, лет
10-18
18-30
30-60
60
Уравнения
для расчета основного обмена (ккал/сутки)
16,6 мт* + 77Р + 572
7,4 мт + 482Р + 217
15,4 мт - 27Р + 717
13,Змт + 334Р + 35
11,3 мт+ 16Р + 901
8,7 мт - 25Р + 865
8,8 мт + 1128Р-1071
9,2мт + 637Р-302
*Мт — масса тела (кг), Р — рост (м).
Энергозатраты организма возрастают при физической и умственной
работе, психоэмоциональном напряжении, после приема пищи, при
понижении температуры среды. Для того, чтобы исключить влияние
перечисленных факторов на величину энергозатрат, определение основного обмена
проводят в стандартных строго контролируемых условиях: утром, в
положении лежа, при максимальном расслаблении мышц, в состоянии
бодрствования, в условиях температурного комфорта (около 22 °С), натощак
(через 12—14 ч после приема пищи). Полученные в таких условиях величины
основного обмена характеризуют исходный «базальный» уровень
энергозатрат организма.
Для взрослого человека среднее значение величины основного обмена
равно 1 ккал/кг/ч (4,19 кДж). Следовательно, для взрослого мужчины
массой 70 кг величина энергозатрат составляет около 1700 ккал/сут (7117
кДж), для женщин — около 1500 ккал/сут. Интенсивность основного
обмена тесно связана с размерами поверхности тела, что обусловлено прямой
зависимостью величины отдачи тепла от площади поверхности тела. У
теплокровных организмов, имеющих разные размеры тела, с 1 м2 поверхности
тела в окружающую среду рассеивается одинаковое количество тепла. На
этом основании сформулирован закон поверхности тела, согласно
которому энергетические затраты теплокровного организма пропорциональны
величине поверхности тела.
Величины основного обмена определяют методами прямой или
непрямой калориметрии. Его должные величины можно рассчитать по
уравнениям с учетом пола, возраста, роста и массы тела (табл. 12.4).
Нормальные величины основного обмена у взрослого человека можно
рассчитать также по формуле Дрейера:
Н = W/K • А,
где W —масса тела (г), А —возраст, К —константа (0,1015 для мужчин и
0,1129 — для женщин).
Величина основного обмена зависит от соотношения в организме
процессов анаболизма и катаболизма. Преобладание в детском возрасте
процессов анаболической направленности в обмене веществ над процессами
катаболизма обусловливает более высокие значения величин основного
обмена у детей (1,8 и 1,3 ккал/кг/ч у детей 7 и 12 лет соответственно) по
сравнению со взрослыми людьми (1 ккал/кг/ч), у которых уравновешены в
состоянии здоровья процессы анаболизма и катаболизма.
Так как показатели теплопродукции, артериального давления и пульса
12. Обмен веществ и энергии. Питание • 577
взаимосвязаны, то можно рассчитать величину основного обмена и его
отклонения от нормы по следующей формуле:
ПО = 0,75 ■ (ЧСС + ПД • 0,74) - 72,
где ПО — процент отклонения от нормы, ЧСС — частота сердечных
сокращений, ПД — пульсовое давление.
Для каждой возрастной группы людей установлены и приняты в
качестве стандартов величины основного обмена. Это дает возможность при
необходимости измерить его величину у человека и сравнить полученные
у него показатели с нормативными. Отклонение величины основного
обмена от стандартной не более чем на +10 % считается в пределах нормы.
Более значительные отклонения основного обмена могут служить
диагностическими признаками таких состояний организма, как нарушение
функции щитовидной железы; выздоровление после тяжелых и
длительных заболеваний, сопровождающееся активацией метаболических
процессов; интоксикация и шок, сопровождающиеся угнетением
метаболизма.
Интенсивность основного обмена в различных органах и тканях
неодинакова. По мере уменьшения энерготрат в покое их можно расположить в
таком порядке: внутренние органы—мышцы—жировая ткань.
12.3.2. Энергетические затраты организма в условиях физической
нагрузки
Интенсивность обменных процессов в организме значительно возрастает в
условиях физической нагрузки. Объективным критерием для оценки
энергозатрат, связанных с двигательной активностью разных профессиональных
групп, является коэффициент физической активности. Он представляет
собой отношение общих энергозатрат к величине основного обмена. Прямая
зависимость величины энергозатрат от тяжести нагрузки позволяет ис-
Таблица 12.5. Энергетические затраты организма при различной интенсивности
физической работы
Группа
I
11
III
V
V
Вид деятельности
В условиях определения основного обмена
Выполнение работы, не требующей
физических усилий (врачи-терапевты, педагоги,
диспетчеры, секретари и др.)
Физическая нагрузка: легкой тяжести
(работники сферы обслуживания, конвейерных
производств, агрономы, медсестры)
умеренно тяжелая (продавцы
продовольственных магазинов, станочники,
слесари-наладчики, врачи-хирурги, водители транспорта)
тяжелая (строительные и
сельскохозяйственные рабочие, механизаторы, работники
нефтяной и газовой промышленности)
очень тяжелая (шахтеры, сталевары,
каменщики, грузчики)
Пол
м
ж
м
ж
м
ж
м
ж
м
ж
м
Уровень
энергетических затрат
(ккал/сутки)
1700
1500
2300
2000
2800
2500
3300
3000
3800
3700
4800
Коэффициент
физической
активности
1,4
1,6
1,9
2,2
2,5
19-6095
578 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
пользовать уровень энергозатрат в качестве одного из показателей
интенсивности выполняемой работы (табл. 12.5).
Разница между величинами энергозатрат организма на выполнение
различных видов работ и энергозатрат на основной обмен составляет так
называемую рабочую прибавку (к минимальному уровню энергозатрат).
Предельно допустимая по тяжести работа, выполняемая на протяжении ряда
лет, не должна превышать по энергозатратам уровень основного обмена
для данного индивидуума более чем в 3 раза.
Умственный труд не требует столь значительных энергозатрат, как
физический. Энергозатраты организма возрастают при умственной работе в
среднем лишь на 2—3 %. Умственный труд, сопровождающийся легкой
мышечной деятельностью, психоэмоциональным напряжением, приводит
к повышению энергозатрат уже на 11—19 % и более.
Специфически-динамическое действие пищи — это усиление
интенсивности обмена веществ под влиянием приема пищи и увеличение
энергетических затрат организма относительно уровней обмена и энергозатрат,
имевших место до приема пищи. Специфически-динамическое действие пищи
обусловлено затратами энергии на переваривание пищи, всасывание в
кровь и лимфу питательных веществ из желудочно-кишечного тракта, ре-
синтез белковых, сложных липидных и других молекул; влиянием на
метаболизм биологически активных веществ, поступающих в организм в
составе пищи (в особенности белковой) и образующихся в нем в процессе
пищеварения.
Увеличение энергозатрат организма выше уровня, имевшего место до
приема пищи, проявляется примерно через час после приема пищи,
достигает максимума через три часа, что обусловлено развитием к этому
времени высокой интенсивности процессов пищеварения, всасывания и ресин-
теза поступающих в организм веществ. Специфически-динамическое
действие пищи может продолжаться 12—18 ч. Оно наиболее выражено при
приеме белковой пищи, повышающей интенсивность обмена веществ до
30 %, и менее значительно при приеме смешанной пищи, повышающей
интенсивность обмена на 6—15 %.
Уровень общих энергозатрат, как и основного обмена, зависит от
возраста: суточный расход энергии возрастает у детей с 800 ккал (6 мес—
1 год) до 2850 ккал (11—14 лет). Резкий прирост энергозатрат имеет место
у подростков-юношей 14—17 лет (3150 ккал). После 40 лет энергозатраты
снижаются и к 80 годам составляют около 2000—2200 ккал/сут.
В повседневной жизни уровень энергозатрат у взрослого человека
зависит не только от особенностей выполняемой работы, но и от общего
уровня двигательной активности, характера отдыха и социальных условий
жизни.
12.4. Регуляция обмена веществ и энергии
Регуляция обмена организма с окружающей средой теплом обсуждается в
главе 13. Вопросы регуляции водно-солевого обмена описаны в главе 14.
Поэтому в данной главе представлены общие вопросы нейрогумораль-
ной регуляции обмена веществ и энергии в организме и, главным образом,
регуляция метаболизма. Конечной целью регуляции обмена веществ и
энергии является обеспечение потребностей организма, его органов,
тканей и отдельных клеток в энергии и в разнообразных веществах в
соответствии с уровнем функциональной активности. В целостном организме
постоянно существует необходимость согласования общих метаболических
12. Обмен веществ и энергии. Питание • 579
потребностей с потребностями клетки органа, ткани. Такое согласование
достигается посредством распределения между органами и тканями
веществ, поступающих из окружающей среды и синтезированных внутри
организма. '
Обмен веществ, протекающий внутри организма, не связан
непосредственно с окружающей средой. Питательные вещества, прежде чем они
смогут вступить в обменные процессы, должны быть получены из пищи в
желудочно-кишечном тракте в молекулярной форме. Кислород, необходимый
для биологического окисления, должен быть получен из воздуха в легких,
доставлен в кровь, связан с гемоглобином и перенесен кровью к тканям.
Скелетные мышцы, являясь в организме одним из мощных потребителей
энергии, также обслуживают обмен веществ и энергии, обеспечивая поиск,
прием и обработку пищи. Непосредственное отношение к обмену веществ
и энергии имеет выделительная система. Таким образом, регуляция обмена
веществ и энергии является мультипараметрической, включающей в себя
регулирующие системы множества функций организма (например,
дыхания, кровообращения, выделения, теплообмена и др.).
Роль центра в регуляции обмена веществ и энергии играют ядра
гипоталамуса. Они имеют непосредственное отношение к генерации чувства
голода и насыщения, теплообмену, осморегуляции. В гипоталамусе
имеются полисенсорные нейроны, реагирующие на изменения концентрации
глюкозы, водородных ионов, температуры тела, осмотического давления,
т. е. важнейших гомеостатических констант внутренней среды организма.
В ядрах гипоталамуса осуществляется анализ состояния внутренней среды
и формируются управляющие сигналы, которые посредством эфферентных
систем приспосабливают ход метаболизма к потребностям организма.
В качестве звеньев эфферентной системы регуляции обмена
используются симпатический и парасимпатический отделы вегетативной нервной
системы. Вьщеляющиеся их нервными окончаниями медиаторы оказывают
прямое или опосредованное вторичными посредниками влияние на
функцию и метаболизм тканей. Под управляющим влиянием гипоталамуса
находится и используется в качестве эфферентной системы регуляции
обмена веществ и энергии — эндокринная система. Гормоны гипоталамуса,
гипофиза и других эндокринных желез оказывают прямое влияние на рост,
размножение, дифференцировку, развитие и другие функции клеток.
Гормоны принимают участие в поддержании в крови необходимого уровня
таких веществ, как глюкоза, свободные жирные кислоты, минеральные
вещества.
Химическая энергия питательных веществ используется для ресинтеза
АТФ, выполнения всех видов работы (см. рис. 12.1) и процессы,
протекающие внутри клетки. Поэтому важнейшим эффектором, через который
оказывается регулирующее воздействие на обмен веществ и энергии,
являются клетки органов и тканей. Регуляция обмена веществ заключается в
воздействии на скорость биохимических реакций, протекающих в клетках.
Наиболее частыми эффектами регуляторных воздействий на клетку
являются изменения каталитической активности ферментов и их
концентрации, сродства фермента и субстрата, свойств микросреды, в которой
функционируют ферменты. Регуляция активности ферментов может
осуществляться различными способами. «Тонкая настройка» каталитической
активности ферментов достигается посредством влияния веществ —
модуляторов, которыми нередко являются сами метаболиты.
Метаболизм клетки в целом невозможен без интеграции многих биохит
мических превращений. Эта интеграция обеспечивается, главным образом,
19'
580 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
с помощью аденилатов, участвующих в регуляции любых метаболических
превращений клетки.
Интеграция обмена белков, жиров и углеводов клетки осуществляется
посредством общих для них источников энергии. При биосинтезе любых
простых и сложных органических соединений, макромолекул и
надмолекулярных структур в качестве общих источников энергии используется
АТФ, которая поставляет энергию для процессов фосфорилирования, или
НАД • Н, НАДФ • Н, поставляющих энергию для восстановления
окисленных соединений других веществ. За общий энергетический запас клетки,
полученный в ходе катаболизма, конкурируют все анаболические
процессы, протекающие с затратой энергии. Так, например, при осуществлении
печенью синтеза глюкозы из лактата и аминокислот (глюконеогенез) она не
может одновременно синтезировать жиры и белки. Глюконеогенез
сопровождается расщеплением в печени белков и жиров и окислением
образующихся при этом жирных кислот, что ведет к освобождению энергии,
необходимой для синтеза АТФ и НАД- Н, необходимых для глюконеоге-
неза.
Еще одним проявлением интеграции метаболических превращений
белков, жиров и углеводов в клетке является существование общих
предшественников и общих промежуточных продуктов обмена веществ. Общим
промежуточным продуктом обмена является ацетил-КоА. Важнейшими
конечными путями превращений веществ в клетке являются цикл лимонной
кислоты и реакции дыхательной цепи, протекающие в митохондриях. Цикл
лимонной кислоты — главный источник С02 для последующих реакций
глюконеогенеза, синтеза жирных кислот и мочевины.
Одним из механизмов согласования общих метаболических
потребностей организма с потребностями клетки являются нервные и гормональные
влияния на ключевые ферменты. Характерными особенностями этих
ферментов являются: положение в начале того метаболического пути, к
которому принадлежит фермент; приближенность расположения или
ассоциированность со своим субстратом; реагирование не только на действие
внутриклеточных регуляторов метаболизма, но и на внеклеточные нервные
и гормональные воздействия.
Примерами ключевых ферментов являются гликогенфосфорилаза, фос-
фофруктокиназа, липаза. Их роль в процессах регуляции метаболизма
видна, в частности, при подготовке организма к «борьбе или бегству». При
повышении в этих условиях в крови уровня адреналина до Ю-9 М он
связывается с адренорецепторами плазматической мембраны, активирует аде-
нилатциклазу, которая катализирует превращение АТФ в циклический
АМФ. Последний активирует гликогенфосфорилазу, многократно
усиливающую расщепление гликогена в печени.
Процесс гликогенолиза в мышцах может одновременно активироваться
нервной системой и катехоламинами. Этот эффект достигается с участием
ионов Са2+, который связывается с кальмодулином, являющимся
субъединицей фосфорилазы. Она при этом активируется и приводит к
мобилизации гликогена. Нервный механизм мобилизации гликогена осуществляется
через меньшее число промежуточных этапов, чем гормональный. Этим
достигается его быстродействие.
Удовлетворение энергетических потребностей организма посредством
ускорения внутриклеточных процессов расщепления триглицеридов в
жировой клетчатке достигается активацией гормончувствительной липазы.
Повышение активности этого фермента (адреналином, норадреналином,
глюкагоном) приводит к мобилизации свободных жирных кислот, являю-
12. Обмен веществ и энергии. Питание • 581
щихся основным энергетическим субстратом окисления в мышцах при
выполнении ими интенсивной и длительной работы.
Переход органов и тканей с одного уровня функциональной активности
на другой всегда сопровождается соответствующими изменениями их
трофики (питания). Например, при рефлекторном сокращении скелетных
мышц нервная система осуществляет не только пусковое действие, но и
трофическое влияние путем усиления в них местного кровотока и
интенсивности обмена веществ. Увеличение силы сокращений миокарда под
влиянием симпатической нервной системы обеспечивается
одновременным усилением коронарного кровотока и метаболизма в мышце сердца.
О влиянии нервной системы на трофику скелетных мышц свидетельствует
тот факт, что денервация мышцы приводит к постепенной атрофии
мышечных волокон. Важнейшее значение в осуществлении трофической
функции нервной системы играет ее симпатический отдел. Через симпато-
адреналовую систему достигается не только активация обмена веществ и
энергии в клетке.
Норадреналин и адреналин, выброс которых в кровоток возрастает при
возбуждении симпатической нервной системы, вызывают увеличение
глубины дыхания, расширяют мускулатуру бронхов, что способствует
доставке кислорода в кровь. Адреналин, оказывая положительное инотропное и
хронотропное действие на сердце, увеличивает минутный объем крови,
повышает систолическое артериальное давление. В результате активации
дыхания и кровообращения возрастает доставка кислорода к тканям.
Одним из интегральных показателей внутренней среды, отражающим
обмен в организме углеводов, белков и жиров, является концентрация в
крови глюкозы. Она является не только источником энергии для синтеза
жиров и белков, но и субстратом для их синтеза. В печени происходит
новообразование углеводов из жирных кислот и аминокислот.
Нормальное функционирование клеток нервной системы,
поперечнополосатых и гладких мышц, для которых глюкоза является важнейшим
энергосубстратом, возможно при условии, что приток к ним глюкозы
обеспечит их энергетические потребности. Это достигается при содержании в
литре крови у человека в среднем 1 г (0,8—1,2 г) глюкозы (рис. 12.2). Из
схемы на этом рисунке следует, что при нормальном уровне содержания
глюкозы в крови происходит образование гликогена в печени и мышцах,
синтез жиров, ее потребление клетками мозга, мышцами и другими
тканями. В условиях гипергликемии избыточное количество глюкозы удаляется
из крови через почки, увеличивается синтез гликогена. При гипогликемии
усиливается гликогенолиз под влиянием адреналина и глюкагона.
Сдвиги в концентрации глюкозы в крови от «заданного» (константного)
значения воспринимаются глюкорецепторами гипоталамуса, который
реализует свои регулирующие влияния на клетки через симпатический и
парасимпатические отделы вегетативной нервной системы. Эти влияния
обусловливают срочное повышение или снижение выработки инсулина,
глюкагона и адреналина эндокринным аппаратом поджелудочной железы и
надпочечников. Более медленный эффект гипоталамических влияний
осуществляется через гормоны гипофиза. Для поддержания константного
уровня концентрации глюкозы существует и более короткая петля
обратной связи — влияние глюкозы, циркулирующей в крови, непосредственно
на бета-клетки островков Лангерганса поджелудочной железы,
вырабатывающих гормон инсулин.
При снижении содержания глюкозы в литре крови до уровня менее
0,5 г, вызванном голоданием, передозировкой инсулина, имеет место не-
582 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
центральная нервная система
центры
гипоталамус
глюкорецептор
с
S.
еЬ
л. jmemmmmsA
(глиногенез)
ij> -$|.ф44^*и0- р04кем^'Н4#-ЙН
Образование гликогена в
Образование жиров
Потребление мозгом
Рис. 12.2. Схема регуляции концентрации глюкозы в крови.
Положительная направленность физиологических эффектов в ответ на: Щ — гипергликемию;
[] — гипогликемию; отрицательная направленность физиологических эффектов в ответ на:
ф — гипергликемию; Q — гипогликемию
12. Обмен веществ и энергии. Питание • 583
достаточность снабжения энергией клеток мозга. Нарушение их функций
проявляется учащением сердцебиения, слабостью и тремором мышц,
головокружением, усилением потоотделения, ощущением голода. При
дальнейшем снижении концентрации глюкозы в крови указанное состояние,
именуемое гипогликемией, может перейти в гипогликемическую кому,
характеризующуюся угнетением функций мозга вплоть до потери сознания.
Введение в кровь глюкозы, прием сахарозы, инъекция глюкагона
предупреждают или ослабляют эти проявления гипогликемии. Кратковременное
повышение уровня глюкозы в крови (гипергликемия) не представляет
угрозы для здоровья человека.
В крови организма человека обычно содержится около 5 г глюкозы.
При среднесуточном потреблении с пищей взрослым человеком,
занимающимся физическим трудом, 430 г углеводов в условиях относительного
покоя, тканями ежеминутно потребляется около 0,3 г глюкозы. При этом
запасов глюкозы в циркулирующей крови достаточно для питания тканей на
3—5 мин и без ее восполнения неминуема гипогликемия. Потребление
глюкозы возрастает при физической и психоэмоциональной нагрузках. Так
как периодический (несколько раз в день) прием углеводов с пищей не
обеспечивает постоянного и равномерного притока глюкозы из кишечника
в кровь, в организме существуют механизмы, восполняющие убыль
глюкозы из крови в количествах, эквивалентных ее потреблению тканями. При
достаточном уровне концентрации глюкозы в крови она частично
превращается в запасаемую форму — гликоген. При уровне более 1,8 г в литре
крови происходит выведение ее из организма с мочой.
Избыток глюкозы, поступившей из кишечника в кровь воротной вены,
поглощается гепатоцитами. При повышении в них концентрации глюкозы
активируются ферменты углеводного обмена печени, превращающие
глюкозу в гликоген. В ответ на повышение уровня сахара в крови,
протекающей через поджелудочную железу, возрастает секреторная активность бета-
клеток островков Лангерганса. В кровь выделяется большее количество
инсулина — единственного гормона, обладающего резким понижающим
концентрацию сахара в крови действием. Под влиянием инсулина
повышается проницаемость для глюкозы плазматических мембран клеток
мышечной и жировой тканей. Инсулин активирует в печени и мышцах
процессы превращения глюкозы в гликоген, улучшает ее поглощение и
усвоение скелетными, гладкими и сердечной мышцами. Под влиянием
инсулина в клетках жировой ткани из глюкозы синтезируются жиры.
Одновременно выделяющийся в больших количествах инсулин тормозит распад
гликогена печени и глюконеогенез.
Содержание глюкозы в крови оценивается глюкорецепторами переднего
гипоталамуса, а также его полисенсорными нейронами. В ответ на
повышение уровня глюкозы в крови выше «заданного значения» (>1,2 г/л)
возрастает активность нейронов гипоталамуса, которые посредством влияния
парасимпатической нервной системы на поджелудочную железу усиливают
секрецию инсулина.
При понижении уровня глюкозы в крови уменьшается ее поглощение
гепатоцитами. В поджелудочной железе снижается секреторная активность
бета-клеток, уменьшается секреция инсулина. Тормозятся процессы
превращения глюкозы в гликоген в печени и мышцах, уменьшается
поглощение и усвоение глюкозы скелетными и гладкими мышцами, жировыми
клетками. При участии этих механизмов замедляется или предотвращается
дальнейшее понижение уровня глюкозы в крови, которое могло бы
привести к развитию гипогликемии.
584 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
При уменьшении концентрации глюкозы в крови имеет место
повышение тонуса симпатической нервной системы. Под ее влиянием усиливается
секреция в мозговом веществе надпочечников адреналина и норадренали-
на. Адреналин, стимулируя распад гликогена в печени и мышцах,
вызывает повышение концентрации сахара в крови. Норадреналин обладает сла-
бовыраженной способностью повышать уровень глюкозы в крови.
Под влиянием симпатической нервной системы стимулируется
выработка альфа-клетками поджелудочной железы глюкагона, который
активирует распад гликогена печени, стимулирует глюконеогенез и приводит к
повышению уровня глюкозы в крови.
Понижение в крови концентрации глюкозы, являющейся для организма
одним из наиболее важных энергетических субстратов, вызывает развитие
стресса. В ответ на снижение уровня сахара крови глюкорецепторные
нейроны гипоталамуса через рилизинг-гормоны стимулируют секрецию
гипофизом в кровь гормона роста и адренокортикотропного гормона.
Под влиянием гормона роста уменьшается проницаемость клеточных
мембран для глюкозы, усиливается глюконеогенез, активируется секреция
глюкагона, в результате чего уровень сахара в крови увеличивается.
Секретируемые под действием адренокортикотропного гормона в коре
надпочечников глюкокортикоиды активируют ферменты глюконеогенеза и
этим способствуют увеличению содержания сахара в крови.
Регуляция обмена веществ и энергии в организме находится под
контролем нервной системы и ее высших отделов. Об этом свидетельствуют
факты условно-рефлекторного изменения интенсивности метаболизма у
спортсменов в предстартовом состоянии, у рабочих перед началом
выполнения тяжелой физической работы, у водолазов перед их погружением в
воду. В этих случаях увеличивается скорость потребления организмом
кислорода, возрастает минутный объем дыхания, минутный объем кровотока,
усиливается энергообмен.
Развивающееся при снижении в крови содержания глюкозы, свободных
жирных кислот, аминокислот чувство голода обусловливает поведенческую
реакцию, направленную на поиск и прием пищи и восполнение в
организме питательных веществ.
12.5. Питание
Питание — поступление в организм и усвоение им веществ, необходимых
для роста, жизнедеятельности и воспроизводства. От качества и режима
питания зависят его здоровье, работоспособность и продолжительность
жизни.
Недостаточность или избыточность питания приводят к нарушениям
обмена веществ.
Удовлетворение пластических и энергетических потребностей
организма служит критерием для формирования норм питания. В свою очередь,
нормы питания, определяющие величины потребления пищевых веществ,
основываются на данных научных исследований обмена жиров, белков,
углеводов, воды, минеральных веществ, витаминов у различных групп
населения.
При определении физиологических норм питания с учетом
удовлетворения потребностей организма в пластических веществах исходят из того,
что большинство из них может синтезироваться в организме; другие
вещества (незаменимые аминокислоты, незаменимые жирные кислоты, все
минеральные вещества и микроэлементы, витамины) в организме человека не
12. Обмен веществ и энергии. Питание • 585
синтезируются и должны поступать с пищей. Так, источником
аминокислот являются белки пищи, резервом белка или аминокислот организм не
располагает. Это обусловливает необходимость поступления в организм
белка из расчета 0,75—1 г на 1 кг массы тела взрослого человека в сутки.
При этом 55—60 % суточной потребности белка должно обеспечиваться
белками животного происхождения (молоко, молочные продукты, яйца,
мясо, рыба).
Такие необходимые организму вещества, как витамин К и витамины
группы В, организм получает не только с пищей, но и в составе продуктов
жизнедеятельности микрофлоры кишечника (см. раздел 11.8.4).
Соотношение в пищевом рационе белков, жиров и углеводов должно
быть 1:1,2:4,6. В состав пищевого рациона должны входить продукты
животного и растительного происхождения (например, жиров растительного
происхождения должно быть не менее 30 % от общего количества жиров).
Необходимо включение в пищевые рационы свежих натуральных
продуктов питания, являющихся источниками витаминов, ненасыщенных
жирных кислот и минеральных веществ.
При небольших отклонениях в течении короткого времени от
рекомендуемых соотношений количества жиров и углеводов (при условии
поступления в организм белков из расчета 0,75 г/кг/сут) нарушений метаболизма
у человека не происходит. Жиры и углеводы могут заменять друг друга как
энергетические субстраты в соответствии с правилом изодинамии. При
энергетической ценности 1 г жиров, равной 9,0 ккал, и 1 г углеводов — 4,0
ккал, грамм жиров заменяет при окислении в организме 2,25 г углеводов.
Однако прием жиров в количестве, превышающем потребность организма,
ведет к ожирению и риску сердечно-сосудистых заболеваний. Поступление
жиров в организм в количествах ниже его потребности ограничивает
всасывание жирорастворимых витаминов и может быть причиной развития
авитаминозов. Особенно неблагоприятным для пластических процессов
является недостаточное поступление в организм незаменимых жирных
кислот (линолевой, арахидоновой) (см. раздел 12.1.2).
Движущей силой обмена веществ в организме и выполнения любых
видов работы является энергия, освобождаемая при осуществлении катаболи-
ческих процессов. Ее источником служит энергия химических связей
питательных веществ, поступающих с пищей. Поэтому при определении
физиологических норм питания необходимо соблюдать соответствие
энергетической ценности (калорийности) пищевого рациона энергозатратам
конкретного организма. Они складываются из затрат энергии основного обмена,
энергозатрат, связанных со специфически-динамическим действием пищи
и особенностями трудовой деятельности. Взрослое трудоспособное
население в возрасте 18—60 лет может быть отнесено к 5 группам,
дифференцированным в зависимости от величин энергозатрат. Для этих групп
рассчитаны средние величины энергозатрат и потребления питательных веществ.
Рекомендуемые нормы питания для этих групп приведены в табл. 12.6.
Как следует из данных этой таблицы, у взрослых мужчин и женщин
суточная потребность в энергии возрастает в зависимости от коэффициента
физической активности. Так, при коэффициенте 1,9 (III группа) в возрасте
18—29 лет требуется в сутки 3300 ккал мужчинам и 2600 ккал женщинам, а
при коэффициенте 2,2 (IV группа) — соответственно 3850 и 3050 ккал, что
обеспечивается за счет увеличения в пищевом рационе белков, жиров и
углеводов. С возрастом у той же группы населения (например, III)
потребность в энергии снижается (у мужчин до 2950 ккал, у женщин —до
2500 ккал).
t
586 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Таблица 12.6. Нормы суточной потребности в пищевых веществах для взрослого
человека
Группа
Коэффициент
физической
активности
Возраст,
годы
Энергия,
ккал
Белки,г
общее количество
в т.ч. животные
Жиры, г
Углеводы,
I
II
III
IV
V
1,4
1,6
1,9
2,2
2,5
18-29
30-39
40-59
18-29
30-39
40-59
18-29
30-39
40-59
18-29
30-39
40-59
18-29
30-39
40-59
2450
2300
2100
2800
2650
2500
3300
3150
2950
3850
3600
3400
4200
3950
3750
Мужчины
72
68
65
80
77
72
94
89
84
108
102
96
117
111
104
Женщины
40
37
36
44
42
40
52
49
46
59
56
53
64
61
57
81
77
70
93
88
83
ПО
105
98
128
120
113
154
144
137
358
335
303
411
387
366
484
462
432
565
528
499
586
550
524
I
II
III
IV
1,4
1,6
1,9
2,2
18-29
30-39
40-59
18-29
30-39
40-59
18-29
30-39
40-59
18-29
30-39
40-59
2000
1900
1800
2200
2150
2100
2600
2500
2500
3050
2950
2850
61
59
58
66
65
63
76
74
72
87
84
34
33
32
36
36
35
42
41
40
48
46
67
63
60
73
72
70
87
85
83
102
98
289
274
257
318
311
305
378
372
366
462
432
417
Примечание. В I группу входят работники преимущественно умственного труда; II
группа — работники легкого физического труда; III группа — работники среднего по тяжести
физического труда; IV группа — работники тяжелого физического труда; V группа — работники
особо тяжелого физического труда.
Хотя подразделение трудоспособного населения на группы, основанное
на особенностях трудовой деятельности, носит во многом условный
характер, вьщеляют группы лиц, занятых преимущественно умственным или
физическим трудом. У людей преимущественно умственного труда в
процессе этой деятельности развиваются свойственный данному индивидууму
уровень психоэмоционального напряжения, гипокинезия, может
увеличиваться масса тела. Эти состояния являются факторами риска развития
многих заболеваний. Для предупреждения подобных осложнений лица,
занятые преимущественно умственным трудом, должны выполнять
разумный объем физической нагрузки и в случае увеличения массы тела
умеренно ограничить питание. Ограничение питания должно идти лишь по
показателю его энергетической ценности (преимущественно за счет
уменьшения приема углеводов) и не в ущерб его пластической ценности.
Умеренное ограничение питания следует сочетать с введением в пищевой рацион
широкого ассортимента продуктов питания растительного происхождения.
12. Обмен веществ и энергии. Питание • 587
Жиры являются не только энергетическими и пластическими веществами,
но и поставщиками таких необходимых организму компонентов, как
полиненасыщенные жирные кислоты, фосфолипиды, токоферолы, витамины А
и D и др. Для поддержания высокого уровня умственной
работоспособности с пищевым рационом в организм должны поступать в соответствии с
суточной потребностью минеральные вещества, витамины,
микроэлементы.
При выполнении преимущественно физического труда в пищевом
рационе соотношение белков, жиров и углеводов должно составлять примерно
1:1,3:5,1. Пищевой рацион должен содержать разнообразные калорийные
продукты питания, удельный вес животного белка должен составлять в нем
55 % от суточной нормы белка, а жиры растительного происхождения —
30 % от суточной нормы жиров. Чем тяжелее и продолжительнее труд, тем
более витаминизированными должны быть пищевые продукты.
Для восстановления здоровья после заболеваний, профилактики
заболеваний, сохранения высокой работоспособности разработаны особые
режимы и рационы лечебно-профилактического питания. Они при
необходимости рекомендуются работникам как физического, так и умственного
труда.
Уровни энергетических затрат и потребностей организма в
пластических веществах зависят не только от интенсивности труда, но и от
множества других факторов, в частности от возраста, массы тела, физической
активности, функционального состояния организма. Для беременных и
кормящих женщин содержание белка в пищевом рационе должно быть увеличено
до 2 г/кг в сутки. Увеличение белка необходимо для обеспечения роста
тканей развивающегося организма, а у кормящих женщин — для
образования молока. Количество белка в рационе детского питания должно
составлять 1,2—1,5 г/кг в сутки. Большее количество белка необходимо вводить в
рацион питания лицам тяжелого физического труда, у которых потери
белка больше, чем у лиц, выполняющих более легкую физическую нагрузку.
Для скорейшего выздоровления, восстановления массы тканей организма
после тяжелых истощающих заболеваний, перенесенных операций,
обширных ожогов также требуется пищевой рацион с более высоким, чем для
здорового, содержанием белка (1,5—2,0 г/кг в сутки). Общая калорийность
пищевого рациона в расчете на 1 кг массы тела выше у растущего детского
организма в сравнении со взрослым и ниже у стариков (см. табл. 12.7).
Табл ица 12.7. Рекомендуемые средние величины потребления пищевых веществ в зави
симости от возраста
Возраст
1—3 года
4—6 лет
7-10 лет
11—13 лет
14—17 лет
60—74 года
75 лет и
старше
Энергия, ккал
1540
1970
2300
2700 (2450)*
2900 (2600)
2300 (2100)
2000 (1900)
Белки, г/сут
всего
53
68
79
93 (85)
100 (90)
69 (63)
60 (57)
в т.ч.
животные
37
44
47
56 (51)
60 (54)
38 (35)
33 (31)
Жиры, г/сут
всего
53
68
79
93 (85)
100 (90)
77 (70)
67 (63)
в т.ч.
растительные
5
10
16
19 (17)
20 (18)
26 (23)
23 (21)
Углеводы,
г/сут
212
272
315
370 (340)
400 (360)
333 (305)
290 (275)
*В скобках приведены величины, рекомендуемые для женщин.
588 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
При ограниченном поступлении в организм человека питательных
веществ имеет место повышенная утомляемость, снижаются как физическая,
так и умственная работоспособность, замедляется рост и развитие детей,
уменьшается масса тела, могут появляться отеки (при белковой
недостаточности), снижается устойчивость организма к инфекционным
заболеваниям. Переедание приводит к возникновению нарушений функций
желудочно-кишечного тракта, сонливости, ожирению, снижению физической
активности и трудоспособности. Увеличение массы тела и ожирение
являются факторами риска сердечно-сосудистых заболеваний, сахарного
диабета и приводит к уменьшению продолжительности жизни.
К важнейшим физиологическим принципам, которые необходимо
соблюдать при составлении пищевых рационов, относится режим питания,
т. е. приспособление характера питания, частоты и периодичности приема
пищи к суточным ритмам труда и отдыха, к физиологическим
закономерностям деятельности желудочно-кишечного тракта. Принято считать, что
наиболее рациональным является четырехразовый прием пищи в одни и те
же часы суток. Интервал между приемами пищи должен составлять 4—5 ч.
Этим достигается более равномерная функциональная нагрузка на
пищеварительный аппарат, что способствует созданию оптимальных условий
для полной обработки пищи. Рекомендуется вечерний прием
легкоусвояемой пищи не позднее, чем за 3 ч до отхода ко сну.
Общую калорийность суточного пищевого рациона целесообразно
распределять следующим образом: на завтрак —25 %, второй завтрак— 15 %,
обед —35 %, ужин — 25 %. В случае невозможности осуществления четы-
рехразового питания оно может быть трехразовым (30 % калорий
суточного пищевого рациона на завтрак, 45 % — на обед, 25 % — на ужин).
Опасность для здоровья человека могут представлять вещества, которые
содержатся в пищевых продуктах, выращенных или переработанных без
соблюдения санитарно-гигиенических требований к
сельскохозяйственным или промышленным технологиям. Это пестициды, нитраты,
радионуклиды, лекарственные средства, металлы, пищевые добавки,
консерванты. При попадании в организм они могут оказывать на ткани токсическое
воздействие (металлы, радионуклиды), вызывать аллергические реакции
(пищевые добавки, консерванты, лекарственные вещества). Пестициды
могут накапливаться в жировой ткани и, медленно выводясь из организма,
оказывать длительное токсическое влияние.
Условием для эффективного всасывания и усвоения питательных
веществ из желудочно-кишечного тракта является переваривание пищевых
веществ до мономеров при полостном и пристеночном пищеварении.
Часть веществ пищи не подвергается в желудочно-кишечном тракте
гидролизу (например, растительный полисахарид целлюлоза) или расщепляется
не полностью. Степень переваривания пищевых веществ зависит от их
предварительной обработки, в процессе приготовления пищи или
механической обработки при жевании. Таким образом, пищевые продукты не
полностью усваиваются организмом, и при питании смешанной пищей
животного и растительного происхождения ее усвояемость по
калорической ценности составляет около 90—95 %.
Неусваиваемыми веществами пищи являются ее грубоволокнистые
компоненты — пищевые волокна (целлюлоза, гемицеллюлоза, пектин и лег-
нин). Хотя эти вещества снижают калорическую ценность пищевого
рациона, они стимулируют перистальтику кишечника, ускоряют
продвижение в желудочно-кишечном тракте пищевых масс, способствуют
формированию оптимальной для выведения из организма консистенции каловых
12. Обмен веществ и энергии. Питание • 589
масс, способствуют выведению из организма избытка пищевого
холестерина.
Потребность конкретного человека в различных компонентах пищи,
количестве и соотношениях питательных веществ не только индивидуальны,
но и зависят от возраста, выполняемой физической или умственной
нагрузки, состояния покоя или психоэмоционального напряжения. Поэтому
определение норм и характера питания, хотя и должно учитывать общие
физиологические требования и рекомендации, может быть лишь строго
индивидуализированным.
Суточная потребность организма в белках, жирах и углеводах приведена
в табл. 12.6 и 12.7, а его потребность в минеральных веществах,
микроэлементах и витаминах, а также источники их поступления указаны в
табл. 12.1 и 12.2.
12.5.1. Рациональное питание как фактор сохранения и укрепления
здоровья
Рациональным является питание, которое основано на достижениях
научных данных (физиологии, биохимии и гигиены) относительно качества и
количества принимаемой пищи, возможности усвоения ее организмом и
режима ее приема.
От характера питания (биологической полноценности пищевых
продуктов, количества принимаемой пищи и режима ее потребления) в большой
степени зависит состояние здоровья человека и продолжительность его
жизни. Рациональное питание — мощный фактор укрепления здоровья,
неправильное питание — способ его разрушения.
При формировании здорового образа жизни необходимо учитывать
четыре принципа рационального питания: 1) калорийность суточного
рациона питания должна соответствовать энергетическим затратам человека;
2) химический состав пищи должен удовлетворять потребности организма
в белках, жирах, углеводах, минеральных веществах, витаминах,
биологически активных веществах и «балластных» компонентах пищи; 3)
разнообразие пищевых продуктов должно обеспечивать поступление в организм
всех ингредиентов, которые не синтезируются в организме; 4) прием пищи
в течение суток должен подчиняться оптимальному режиму (как по
энергоценности, так и по объему).
Нарушение этих принципов имеет отрицательные последствия для
здоровья. В практике последних лет нередко приходится иметь дело с
последствием избыточного питания — ожирением, являющимся фактором риска
возникновения различных заболеваний. Увеличение массы тела по
отношению к должной ее величине на 6—14 % считается показателем
избыточного питания. Для стандартизованной оценки массы тела используют
индекс массы тела (ИМТ), рассчитываемый по формуле m/рост2 (т —масса
в килограммах, рост — в метрах). При ИМТ более 25 массу тела
расценивают как повышенную, требующую коррекции. При наличии избыточной
массы необходимо сокращение общей калорийности пищи за счет жиров и
углеводов (прежде всего — моносахаридов), а также увеличение
двигательной активности.
Правильный режим приема пищи соответствует фазам суточных
биоритмов и легко «вписывается» в распорядок дня. Более того — этот фактор
в значительной мере определяет режим жизни: человек в определенное
время прерывает работу, чтобы пообедать, ужин ассоциируется со
временем отдыха, вечерний стакан молока — с предстоящим сном и т. д. Вот по-
590 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
чему большой вред здоровью может наносить привычка есть урывками, во
время работы и вообще по принципу «когда придется», вредны и так
называемые перекусы. При этом нарушается не только «схема»
упорядоченности нервно-психической деятельности, но и нормальное
функционирование механизмов регуляции пищеварительной системы (что является
фактором риска заболеваний органов желудочно-кишечного тракта).
Пищевой рацион должен обеспечивать здоровое, сбалансированное
питание взрослого человека. Сбалансированным является питание, которое
включает все необходимые компоненты пищи в оптимальных количествах
и соотношениях. Для обеспечения такого питания необходимо учитывать
следующие требования к составлению рациона питания.
Рацион питания должен включать незаменимые компоненты пищи.
Полиненасыщенных жирных кислот в суточном рационе должно быть около
3—5 г; богатым источником их содержания являются такие продукты, как
подсолнечное и кукурузное масла (53—55 %).
Помимо углеводов, являющихся источником энергии, в пищевом
рационе должны содержаться сложные полисахариды — пищевые волокна;
они обладают способностью связывать воду и набухать, стимулировать
перистальтику кишечника и ускорять транзит кишечного содержимого,
адсорбировать токсичные вещества и выводить их из организма, связывать
желчные кислоты и стерины, снижать содержание холестерина и нормали-
зовывать микрофлору кишечника. Пищевые волокна содержатся в ржаных
и пшеничных отрубях, овощах и фруктах. Они не являются балластом, а
активно участвуют в процессах пищеварения. В сутки организм взрослого
человека нуждается в 30 г пищевых волокон.
Сбалансированное питание в ряде случаев становится мерой
профилактики серьезных заболеваний. Диетические мероприятия, направленные на
снижение уровня холестерина в крови, следующие: уменьшение в рационе
питания количества насыщенных жиров и холестерина, являющихся
основными факторами формирования гиперхолестеринемии, для чего часть
насыщенных жиров, содержащихся в продуктах животного
происхождения, заменяют ненасыщенными, содержащимися в растительных маслах;
увеличение в рационе сложных углеводов, содержащихся в овощах и
фруктах; снижение общей калорийности рациона, избыточной массы тела;
уменьшение количества холестерина в пище до уровня ниже 300 мг в сутки
(для взрослого человека).
Необходимо обратить внимание на бесполезность, а нередко и
вредность различных модных «строгих» диет. Эти диеты обычно бывают
несбалансированными, кроме того, их очень трудно выдержать длительное
время, что в конечном счете сводит на нет огромные нервно-психические
усилия, затраченные на привыкание к такой диете. Выбирая диету, не
следует забывать, что прием пищи должен приносить удовольствие. Из
обычных, традиционно используемых продуктов всегда можно составить такую
диету, которая будет низкокалорийной, содержащей умеренное количество
насыщенных жиров и холестерина. ,
Учитывая традиционные привычки питания, комитет экспертов ВОЗ
выдвинул рекомендации по диете. Согласно им, в диету следует включать
продукты растительного происхождения (бобовые, зерновые злаки, овощи,
фрукты) — в них содержатся белки, мало жира, холестерина, калорий и
много минеральных солей, витаминов, клетчатки; рыбу, птицу и тощие
сорта мяса, которые лучше употреблять небольшими порциями, — эти
продукты содержат полноценные белки и минеральные соли при низком
содержании насыщенных жиров, холестерина, калорий.
12. Обмен веществ и энергии. Питание • 591
При приготовлении пищи и приправ ВОЗ рекомендует меньше
использовать животные жиры, отдавая предпочтение растительным. Необходимо
ограничивать в рационе: жирные сорта мяса, в которых много
насыщенных жиров, холестерина и калорий; жирные молочные продукты (цельное
молоко, сметана, сыры); яйца, если они не являются основным
источником белков (желтки яиц содержат много холестерина); кондитерские
изделия (они содержат много насыщенных жиров); алкогольные напитки, так
как они высококалорийны и содержат мало питательных веществ (при
«сгорании» в организме 1 г 96 % алкоголя выделяется 6,93 ккал).
Эти рекомендации касаются взрослых людей. Потребности в
питательных веществах изменяются в период роста детей и подростков, во время
беременности, кормления, что необходимо учитывать при составлении
диеты.
При ожирении для ограничения энергетической ценности пищи и
создания отрицательного энергетического баланса можно использовать
длительную ограничительную диету, разгрузочные дни и сочетание этих двух
методов. Тактика диетотерапии зависит от возраста индивида.
Диетотерапию у старых и пожилых людей следует применять с известной долей
осторожности, а темпы снижения массы тела должны быть не столь
высокими, как у молодых.
Существует распространенное мнение, что абсолютное воздержание от
еды освобождает организм от вредных веществ, кишечник очищается от
остатков непереваренной пищи и слизи. В процессе голодания —
доказывают приверженцы этого метода — организм «сжигает» для процессов
жизнедеятельности менее ценные белки, освобождаясь прежде всего от
избыточных запасов жира и «шлаков». Однако необходимо учитывать, что с
переходом организма на так называемое эндогенное питание в качестве
источника энергии используются собственные «материалы», в то время как
организм нуждается в поступлении определенного минимума белка (50 г/
сут). При полном голодании организм вынужден кроме жира расходовать
структурные белки клеток и тканей, в первую очередь — мышц. Помимо
этого, при полном голодании неизбежна витаминная недостаточность.
Наконец, голодание является серьезным стрессом, приводящим к
усугублению и без того нарушенного обмена веществ у лиц с избыточной массой
тела; многие люди, похудев в результате голодания, затем быстро
восстанавливают прежнюю массу тела.
ГЛАВА 13
Температура тела и ее регуляция
Основу жизнедеятельности организма составляет обмен веществ и
энергии, сопровождающийся выработкой тепла при биологическом окислении
молекул белков, жиров и углеводов. Существует непосредственная прямая
взаимосвязь между интенсивностью обмена веществ и количеством
образующегося тепла в организме: увеличение скорости обменных процессов
вызывает рост теплообразования, а повышение температуры тела ускоряет
биологическое окисление в организме. Поскольку прирост температуры
тела сопровождается усилением отдачи организмом тепла в окружающую
среду, это препятствует лавинообразному росту скорости обменных
процессов и величины температуры.
Температура тела млекопитающих и человека поддерживается на
относительно постоянном уровне независимо от колебаний температуры
окружающей среды. Такое постоянство температуры тела носит название изо-
термин. Изотермия свойственна только гомойотермным, или теплокровным,
животным, постоянство температуры внутренней среды которых является
необходимым условием для функционирования ферментов, влияющих на
скорость течения метаболических процессов. Температура тела гомойо-
термных организмов обусловливается интенсивностью теплообразования
за счет протекающих внутри них обменных процессов, поэтому они
являются также эндотермными.
Изотермия отсутствует у пойкилотермных, или холоднокровных,
животных, температура тела которых переменна и мало отличается от
температуры окружающей среды (низшие позвоночные и беспозвоночные). Для них
характерен более низкий по сравнению с теплокровными организмами
уровень энергетического обмена. Температура окружающей среды
определяет интенсивность энергетических превращений и уровень активности
холоднокровных животных, поэтому их называют эктотермными. В
условиях пониженной температуры среды их обитания пойкилотермные
животные впадают в состояние анабиоза, характеризующееся низкой
активностью ферментов и минимальной интенсивностью обменных процессов.
Тем не менее такие организмы обладают способностью
противодействовать сдвигам температуры тела при колебаниях температуры окружающей
среды за счет принятия определенной позы, выбора (если есть
возможность) более холодной или более теплой среды, целенаправленного
избегания воздействия более высоких или низких температур.
Кроме гомойотермных и пойкилотермных в природе существует
промежуточная группа — гетеротермные организмы. При благоприятных
условиях существования они обладают способностью к изотермии, а при
внезапном понижении температуры внешней среды, недостатке пищи и воды эти
организмы теряют такую способность и становятся холоднокровными. К
этой группе относятся как млекопитающие (грызуны, летучая мышь), так
и некоторые виды птиц (колибри).
13. Температура тела и ее регуляция • 593
13.1. Нормальная температура тела
Способность теплокровных животных и человека поддерживать
температуру тела на относительно постоянном уровне в изменяющихся условиях
внешней и внутренней среды обеспечивается за счет непрерывной
деятельности физиологической системы терморегуляции. Эта система включает в
себя: 1) температурные рецепторы, реагирующие на изменение
температуры внешней и внутренней среды; 2) центр терморегуляции,
расположенный в гипоталамусе; 3) эффекторное (исполнительное) звено
терморегуляции. Основная функция системы терморегуляции — поддерживать
оптимальную для метаболизма организма, или нормальную, температуру тела.
Полезным для организма приспособительным результатом работы этой
системы является определенная величина температуры крови,
обеспечивающая нормальное течение обменных процессов в организме, с одной
стороны, и определяющаяся интенсивностью этих процессов — с другой.
Обладая высокой теплоемкостью, кровь переносит тепло от тканей с
высоким уровнем теплообразования к тканям с более низким уровнем и, таким
образом, содействует выравниванию уровня температуры в различных
частях тела.
Температура глубоких тканей тела за счет теплопереноса кровью
распределена более равномерно и составляет около 36,7—37,0 "С. Ее суточные
колебания в условиях относительного покоя организма находятся в
пределах 1 °С, поэтому говорят о гомойотермном «ядре» тела человека. В это
понятие включают ткани человеческого тела, расположенные на глубине 1 см
от поверхности кожи и глубже. В тканях печени, мозга, почек температура
несколько выше благодаря их метаболической активности, чем в тканях
других внутренних органов. Температура
поверхности тела и дистальных отделов
конечностей ниже, чем глубоких тканей и
проксимальных отделов конечностей. Она
зависит от интенсивности кровотока в
сосудах органов и тканей и от
охлаждающего или согревающего действия
температуры внешней среды, поэтому говорят о
пойкилотермной «оболочке» тела человека.
Относительное постоянство температуры
сохраняется в большей массе глубоких
тканей человека, если организм находится
в среде с температурой 25—26 °С. Это
значение температуры для легко одетого
человека называют термонейтральной зоной,
или температурой комфорта, потому что
в таком температурном диапазоне
температура организма поддерживается
постоянной без дополнительного участия тер-
морегуляторных механизмов. При
охлаждающем действии внешней среды
температура глубоких тканей уменьшается, а
при согревании организма — возрастает
(рис. 13.1).
Температура тела человека изменяется
в течение суток (рис. 13.2), что является
проявлением суточных (циркадианных)
Рис. 13.1. Температура в
различных областях тела в условиях
холода (А) и тепла (Б).
Колебания температуры тела,
вызванные изменениями внешней
температуры, больше выражены вблизи
поверхности тела и в области
дистальных отделов конечностей (в
«оболочке» тела). В условиях
холодной внешней среды граница гомойо-
термного «ядра» температурой 37 "С
отодвигается в глубь тела.
594 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
В прямой кишке
Тяжелые физические
нагрузки
Активные дети
Эмоции, работа
Норма
Раннее утро
Рис. 13.2. Температура тела человека, измеренная в полости рта и прямой кишке в
различных физиологических состояниях.
В течение дня температура тела человека изменяется, при этом она минимальна во время сна
в предутренние часы (4—6 часов утра), так как в это время отмечается самый низкий уровень
обменных процессов (а значит и теплопродукции) в организме. Под влиянием физических и
психоэмоциональных нагрузок обмен веществ в организме интенсифицируется, увеличивается
теплопродукция, что приводит к увеличению температуры тела человека. Рост температуры
при этом находится в прямой зависимости от интенсивности нагрузок.
В полости рта
Активные дети i—
Эмоции, работа
Норма
Раннее утро
—
40
39
38
37
36
ритмов (см. главу 23). Суточные колебания температуры тела происходят
под влиянием эндогенных ритмов («биологических часов»), которые
синхронизированы с внешними сигналами, например с вращением Земли.
Кроме того, температура тела человека зависит от его физиологического
состояния (сон или бодрствование, покой или физические и психо-эмо-
циональные нагрузки и т. д.). Максимального значения температура тела
человека достигает в 18—20 часов и снижается до своего минимума в
предутренние часы, к 4—6 часам утра. Амплитуда этих суточных колебаний не
превышает 1 °С.
Среднее значение температуры «ядра» тела отражает температура крови
в полостях сердца, аорте и других крупных сосудах. Однако измерение
температуры в этих частях тела человека практически невозможно,
поэтому для клинических целей в качестве показателя температуры глубоких
тканей тела используют такие относительно доступные для ее измерения
значения, как ректальная температура, подъязычная и подмышечная
температура, температура в наружном слуховом проходе у барабанной
перепонки. Очевидно, что подобные измерения в каждом из перечисленных
участков тела имеют свои особенности и ограничения, а полученные
величины температур лишь в большей или меньшей степени отражают
температуру глубоких тканей (см. рис. 13.2).
13.2. Теплопродукция и теплоотдача
У человека и теплокровных животных температура «ядра» тела
поддерживается на относительно постоянном уровне. Это достигается с помощью
процессов эндогенной терморегуляции, результатом которой является
устойчивое равновесие между количеством продуцируемого в организме в
единицу времени тепла (теплопродукцией) и количеством тепла, рассеиваемого
организмом за то же время в окружающую среду (теплоотдачей). Другим
важнейшим процессом в регуляции температуры тела является поведение-
13. Температура тела и ее регуляция • 595
екая терморегуляция, обусловленная изменением характера поведения
человека и животных для поддержания температурного баланса (например,
ношение человеком теплой одежды в холодное время года или
сворачивание животного в «клубок»).
13.2.1. Теплопродукция
Суммарная теплопродукция (теплообразование) в организме состоит из
первичной и вторичной теплоты. Первичная теплота выделяется в ходе
постоянно протекающих во всех органах и тканях реакций обмена веществ.
Вторичная теплота образуется при расходовании энергии макроэргиче-
ских соединений на выполнение человеком определенной мышечной
работы. Уровень теплообразования в организме зависит от величины
основного обмена, «специфически динамического действия» принимаемой
пищи, мышечной активности и интенсивности метаболизма в тканях.
Метаболические процессы осуществляются с неодинаковой
интенсивностью в различных органах и тканях, поэтому вклад в общую
теплопродукцию организма отдельных органов и тканей неравнозначен.
Наибольшее количество тепла образуется в скелетных мышцах при их тоническом
напряжении или сокращении. Образование тепла, наблюдающееся в
мышцах при этих условиях, получило название сократительного термогенеза
(сократительной теплопродукции), который является наиболее значимым
механизмом теплообразования у взрослого человека.
У новорожденных, а также у мелких млекопитающих животных имеется
Мембрана
клетки
Цитозоль
Триацилглицеролы
Митохондрия
G-протеин
цАМФ
►
Протеин-
киназы
ГЛ
t
Жирные
кислоты
Путь транспорта
протонов
н+ Синтез АТФ
Рис. 13.3. Схематичное изображение стимулирующего влияния норадреналина (НА)
на окислительное фосфорилирование жирных кислот в митохондриях бурой
жировой ткани в механизме недрожательного термогенеза.
Норадреналин, высвобождаемый симпатическими нервными окончаниями в условиях холода,
воздействует на р-адренорецепторы (Р) на мембране клеток бурой жировой ткани и через
систему вторичного посредника — циклический аденозинмонофосфат (цАМФ) стимулирует
образование свободных жирных кислот из триацилглицеролов, которые окисляются в
митохондриях. ГЛ — гормончувствительная липаза, НП — несвязанный протеин, Н+ — протоны водорода,
АТФ — аденозинтрифосфат.
596 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
механизм ускоренного теплообразования за счет возрастания
метаболической активности в других тканях и, прежде всего, в буром жире. Бурую
окраску этой ткани придает большое количество окончаний симпатических
нейронов, содержащих медиатор норадреналин. В условиях холодового
воздействия на организм под влиянием выделяющегося из симпатических
нервных окончаний норадреналина происходит интенсивное окисление
жирных кислот. Бурый жир характеризуется избытком митохондрий,
которые окружают мелкие капельки жира в цитоплазме. Окисление жирных
кислот в митохондриях бурой жировой ткани осуществляется без
значимого синтеза макроэргов и, таким образом, с максимально возможным
образованием теплоты. Этот механизм получил название несократительного
термогенеза (несократительной теплопродукции) (рис. 13.3). Посредством
механизмов несократительного термогенеза уровень теплопродукции у
человека может быть увеличен примерно в три раза по сравнению с уровнем
основного обмена.
13.2.2. Теплоотдача
Существуют следующие пути отдачи тепла организмом в окружающую
среду: излучение, теплопроведение, конвекция и испарение.
Излучение — это способ отдачи тепла в окружающую среду
поверхностью тела человека в виде электромагнитных волн инфракрасного
диапазона (а = 5—20 мкм). Количество тепла, рассеиваемого организмом в
окружающую среду излучением, пропорционально площади поверхности
излучения и разности средних значений температур кожи и окружающей
среды. Площадь поверхности излучения — это суммарная площадь
поверхности тех частей тела, которые соприкасаются с воздухом. При температуре
окружающей среды 20 °С и относительной влажности воздуха 40—60 %
организм взрослого человека рассеивает путем излучения около 40—50 %
всего отдаваемого тепла. Теплоотдача путем излучения возрастает при
понижении температуры окружающей среды и уменьшается при ее
повышении. В условиях постоянной температуры окружающей среды излучение с
поверхности тела возрастает при повышении температуры кожи и
уменьшается при ее понижении. Если средние температуры поверхности кожи и
окружающей среды выравниваются (разность температур становится
равной нулю), отдача тепла излучением становится невозможной. Снизить
теплоотдачу организма излучением можно за счет уменьшения площади
поверхности излучения («сворачивания тела в клубок»). Если температура
окружающей среды превышает среднюю температуру кожи, тело человека,
поглощая инфракрасные лучи, излучаемые окружающими предметами,
согревается.
Теплопроведение — способ отдачи тепла, имеющий место при контакте,
соприкосновении тела человека с другими физическими телами.
Количество тепла, отдаваемого организмом в окружающую среду этим способом,
пропорционально разнице средних температур контактирующих тел,
площади контактирующих поверхностей, времени теплового контакта и
теплопроводности контактирующего тела. Сухой воздух, жировая ткань
характеризуются низкой теплопроводностью и являются теплоизоляторами.
Использование одежды из тканей, содержащих большое число маленьких
неподвижных «пузырьков» воздуха между волокнами (например, шерстяные
ткани), дает возможность организму человека уменьшить рассеяние тепла
путем теплопроводности. Влажный, насыщенный водяными парами
воздух, вода характеризуются высокой теплопроводностью. Поэтому пребыва-
13. Температура тела и ее регуляция • 597
Рис. 13.4. Виды теплоотдачи. Пути отдачи тепла организмом во внешнюю среду
можно условно подразделить на «влажную» теплоотдачу, связанную с испарением
пота и влаги с кожи и слизистых оболочек, и на «сухую» теплоотдачу, которая не
связана с потерей жидкости.
ние человека в среде с высокой влажностью при низкой температуре
сопровождается усилением теплопотерь организма. Влажная одежда также
теряет свои теплоизолирующие свойства.
Конвекция — способ теплоотдачи организма, осуществляемый путем
переноса тепла движущимися частицами воздуха (воды). Для рассеяния тепла
конвекцией требуется обтекание поверхности тела потоком воздуха с более
низкой температурой, чем температура кожи. При этом контактирующий с
кожей слой воздуха нагревается, снижает свою плотность, поднимается и
замещается более холодным и более плотным воздухом. В условиях, когда
температура воздуха равна 20 °С, а относительная влажность — 40—60 %,
тело взрослого человека рассеивает в окружающую среду путем теплопро-
ведения и конвекции около 25—30 % тепла (базисная конвекция). При
увеличении скорости движения воздушных потоков (ветер, вентиляция)
значительно возрастает и интенсивность теплоотдачи (форсированная
конвекция).
Отдача тепла организмом путем теплопроведения, конвекции и
излучения, называемых вместе «сухой» теплоотдачей, становится неэффективной
при выравнивании средних температур поверхности тела и окружающей
среды.
Теплоотдача путем испарения — это способ рассеяния организмом тепла
в окружающую среду за счет его затраты на испарение пота или влаги с
поверхности кожи и влаги со слизистых оболочек дыхательных путей
(«влажная» теплоотдача). У человека постоянно осуществляется
выделение пота потовыми железами кожи («ощутимая», или железистая, потеря
воды), увлажняются слизистые оболочки дыхательных путей («неощутимая»
потеря воды) (рис. 13.4). При этом «ощутимая» потеря воды организмом
оказывает более существенное влияние на общее количество отдаваемого
путем испарения тепла, чем «неощутимая».
При температуре внешней среды около 20 "С испарение влаги
составляет около 36 г/ч. Поскольку на испарение 1 г воды у человека затрачивается
0,58 ккал тепловой энергии, нетрудно подсчитать, что путем испарения
организм взрослого человека отдает в этих условиях в окружающую среду
около 20 % всего рассеиваемого тепла. Повышение внешней температуры,
выполнение физической работы, длительное пребывание в теплоизоли-
598 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
рующей одежде усиливают потоотделение и оно может возрасти до 500—
2000 г/ч. Если внешняя температура превышает среднее значение
температуры кожи, то организм не может отдавать во внешнюю среду тепло
излучением, конвекцией и теплопроведением. Организм в этих условиях
начинает поглощать тепло извне, и единственным способом рассеяния тепла
становится усиление испарения влаги с поверхности тела. Такое испарение
возможно до тех пор, пока влажность воздуха окружающей среды остается
меньше 100 %. При интенсивном потоотделении, высокой влажности и
малой скорости движения воздуха, когда капли пота, не успевая
испариться, сливаются и стекают с поверхности тела, теплоотдача путем испарения
становится менее эффективной.
13.2.3. Поведенческая терморегуляция
Наряду с эндогенными процессами для поддержания нормальной
температуры тела важнейшим механизмом является изменение характера
поведения, или поведенческая терморегуляция. Для холоднокровных животных
этот механизм является определяющим. Поддерживающими постоянную
температуру факторами являются изменение позы, поиск укрытия, по
возможности выбор более теплой или холодной среды и т. п. Человек для
поддержания оптимальной температуры тела нередко прибегает к
усиленным мышечным движениям, особенно для согревания на холоде. При
ходьбе теплопродукция увеличивается в 2 раза, а при беге или
интенсивной работе — в 4—5 раз. Повышение температуры тела при этом даже на
несколько десятых градуса способствует ускорению окислительных
процессов, в частности — окислению продуктов белкового катаболизма. Кроме
того, для человека не менее важными факторами поддержания
оптимальной температуры тела является ношение одежды, соответствующей
температуре окружающей среды, и оборудование жилища (утепление жилища
зимой и использование кондиционеров в жаркое время года).
13.3. Регуляция температуры тела
13.3.1. Восприятие организмом температурных воздействий
(терморецепция)
Изменение температуры внутренней среды («ядра») и поверхностных
отделов («оболочки») тела человека воспринимается организмом с помощью
терморецепторов. Температурная рецепция осуществляется окончаниями
тонких чувствительных нервных волокон типа С и А (8), которые
представлены в коже, слизистых оболочках, мышцах, сосудах, во внутренних
органах (периферические терморецепторы). Холодо- и теплочувствительные
нейроны располагаются в медиальной преоптической области переднего
гипоталамуса (центральные терморецепторы).
Восприятие температурных раздражений из внешней среды и
формирование температурных ощущений у человека осуществляется с помощью
терморецепторов кожи и слизистых оболочек, среди которых имеются
холодовые рецепторы (повышают частоту передачи нервных импульсов по
афферентным нервным волокнам к терморегуляторному центру при их
охлаждении и снижают эту частоту при их нагревании) и тепловые
рецепторы (реагируют на изменение температуры тела противоположным
образом). В коже и на слизистых оболочках человека больше Холодовых
рецепторов (около 250 000), чем тепловых (около 30 000). Кроме того, холодовые
13. Температура тела и ее регуляция • 599
рецепторы кожи расположены более поверхностно, на глубине 0,17 мм, а
тепловые — более глубоко, на глубине 0,3 мм. Эта особенность
расположения терморецепторов обусловливает более раннее восприятие организмом
человека холода, чем тепла. Другая особенность терморецепторов — их
неравномерное распределение в коже по площади, что определяет различный
уровень чувствительности к холоду и теплу разных участков тела.
Наибольшей чувствительностью обладает кожа лица, наименьшей — кожа нижних
конечностей.
Афферентный поток нервных импульсов от периферических
терморецепторов поступает через задние корешки спинного мозга к вставочным
нейронам задних рогов. Затем по спиноталамическому тракту этот поток
импульсов достигает передних ядер таламуса и далее проводится в сомато-
сенсорную кору больших полушарий головного мозга. Поступление
нервных импульсов от периферических терморецепторов в соматосенсорную
кору обеспечивает возникновение и топическую локализацию
субъективных температурных ощущений, таких как «тепло», «холодно», «прохладно»,
«жарко», «температурный комфорт» или «дискомфорт». На их основе
формируются поведенческие терморегуляторные реакции. Значительная часть
афферентных импульсов от периферических рецепторов кожи и
внутренних органов поступает из спинного мозга по волокнам спиноталамическо-
го тракта к нейронам гипоталамического центра терморегуляции.
13.3.2. Центральное звено системы терморегуляции
Регуляция теплообмена, а следовательно, и температуры тела человека
осуществляется центром терморегуляции, который расположен в медиальной
преоптической области переднего отдела гипоталамуса и в заднем отделе
гипоталамуса. Разрушение этих отделов гипоталамуса или нарушение их
нервных связей посредством перерезки на уровне среднего мозга в
экспериментах на животных приводит к нарушению контроля за температурой
Термочувствительные нейроны
преоптической области гипоталамуса
Кожа
Эффекторные нейроны
заднего гипоталамуса
Теплоотдача
►
Теплопродукция
Нейроны переднего
гипоталамуса
Эффекторные нейроны
заднего гипоталамуса
Рис. 13.5. Схема взаимодействия различных типов нейронов терморегуляторного
центра гипоталамуса между собой и с кожными терморецепторами.
Стимуляция тепловых рецепторов кожи (Рт) и гипоталамуса активирует процессы теплоотдачи
в организме человека, а Холодовых рецепторов (Рх) кожи и гипоталамуса — теплопродукции.
Ин — интернейроны гипоталамуса.
600 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Заданное ЦНС Термочувст-
значение Гипоталамус вительные
температуры
Дт°С
нейроны
Механизмы нейрогуморальной
регуляции
Гипотермия
Температура
внешней
среды
3
я
X
т
о.
т
-в-
-в-
Терморецепторы кожи, сосудов
внутренних органов, ЦНС
Рис. 13.6. Схема механизмов регуляции теплообмена в организме человека.
Поддержание относительного постоянства температуры тела достигается с помощью баланса
между количеством продуцируемого в единицу времени тепла в организме человека и
количеством тепла, которое организм отдает за то же время в окружающую среду. Тепловой баланс
регулируется нейрогуморальными механизмами, которые активируются в результате
изменения импульсной активности эффекторных нейронов терморегуляторного центра
гипоталамуса. В гипоталамический терморегуляторный центр поступает афферентная информация об
изменениях внешней температуры от периферических терморецепторов и об изменения
температуры «ядра» — от центральных терморецепторов (пояснения в тексте).
тела у гомойотермных организмов. Кроме того, местное нагревание
передней гипоталамической области вызывает усиление потоотделения и
учащение дыхания у экспериментальных животных, охлаждение —
возникновение дрожи и «свертывание в клубок». Регистрация активности отдельных
нейронов гипоталамуса с помощью микроэлектродов показала ее
изменение как в ответ на локальные колебания температуры в самом
гипоталамусе, так и при воздействии раздражителей на терморецепторы кожи,
внутренних органов и сосудов. Вышеперечисленные факты доказывают, что
центр терморегуляции расположен в гипоталамусе.
В терморегуляторном центре гипоталамуса обнаружены различные по
функциям группы нервных клеток: 1) термочувствительные нейроны пре-
оптической области; 2) клетки, «задающие* уровень поддерживаемой в
организме температуры тела («установочная точка» терморегуляции) в
переднем гипоталамусе; 3) вставочные нейроны (интернейроны) гипоталамуса;
13. Температура тела и ее регуляция • 601
4) эффекторные нейроны, управляющие процессами теплопродукции и
теплоотдачи, в заднем гипоталамусе (рис. 13.5).
Термочувствительные нервные клетки преоптической области
гипоталамуса непосредственно «измеряют» температуру артериальной крови,
протекающей через мозг, и обладают высокой чувствительностью к
температурным изменениям (способны различать разницу температуры крови в
0,011 °С). Отношение холодо- и теплочувствительных нейронов в
гипоталамусе составляет 1:6, поэтому центральные терморецепторы
преимущественно активируются при повышении температуры «ядра» тела человека.
На основе анализа и интеграции информации о значении температуры
крови и периферических тканей, в преоптической области гипоталамуса
непрерывно определяется среднее (интегральное) значение температуры
тела. Эти данные передаются через вставочные нейроны в группу нейронов
переднего отдела гипоталамуса, задающих в организме определенный
уровень температуры тела — «установочную точку» терморегуляции. На основе
анализа и сравнений значений средней температуры тела и заданной
величины температуры, подлежащей регулированию, механизмы
«установочной точки» через эффекторные нейроны заднего гипоталамуса
воздействуют на процессы теплоотдачи или теплопродукции, чтобы привести в
соответствие фактическую и заданную температуру. Таким образом, за счет
функции центра терморегуляции устанавливается равновесие между
теплопродукцией и теплоотдачей, позволяющее поддерживать температуру тела
в оптимальных для жизнедеятельности организма пределах (рис. 13.6).
В механизме формирования «установочной точки» имеет значение
уровень спонтанной активности вставочных нейронов гипоталамуса.
Например, если уровень спонтанной активности интернейрона является
высоким, то для усиления термогенеза требуется более высокая активность
кожных Холодовых рецепторов, а значение пороговой температуры для
регулируемой теплопродукции является более низким. И наоборот, если
вставочный нейрон проявляет низкую спонтанную активность, то даже
незначительная афферентация от кожных Холодовых рецепторов может
оказаться достаточной для запуска дополнительного теплообразования в
организме. Уровень спонтанной активности вставочных нейронов зависит от
соотношения концентрации ионов натрия и кальция в гипоталамусе и
некоторых других нетемпературных факторов.
13.3.3. Эффекторное (исполнительное) звено системы
терморегуляции
Система терморегуляции не имеет собственных специфических эффектор-
ных органов, она использует эффекторные пути других физиологических
систем (сердечно-сосудистой, дыхательной, скелетной мускулатуры,
выделительной и др.). Эти эффекторные механизмы усиливают либо ослабляют
процессы теплопродукции и теплоотдачи в организме в зависимости от
температурных условий окружающей среды.
В термонейтральных условиях внешней среды баланс теплопродукции и
теплоотдачи в организме человека для поддержания оптимальной
температуры тела достигается преимущественно за счет изменения просвета сосудов
поверхности тела под влиянием симпатического отдела вегетативной нервной
системы. Увеличение симпатического тонуса вызывает сужение кровеносных
сосудов, а его снижение — расширение сосудов. Это приводит
соответственно к уменьшению или увеличению переноса тепла кровью от «ядра» тела к
«оболочке» и его рассеивания во внешнюю среду физическими способами.
602 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
В условиях высокой внешней температуры для поддержания
оптимального температурного баланса в организме человека включения механизма со-
судодвигательных реакций может быть недостаточно. Если уровень
средней интегральной температуры тела, несмотря на расширение
поверхностных сосудов, превышает величину установочной температуры, происходит
резкое усиление потоотделения. Эта реакция также контролируется
симпатической нервной системой через выделение из окончаний нервных
волокон ацетилхолина. Испарение влаги с поверхности тела и поведенческие
реакции (например, обмахивание веером, включение вентилятора или
кондиционера) приобретают в усилении теплоотдачи ведущее значение.
В условиях низкой внешней температуры основную роль для
поддержания оптимальной температуры тела играет активизация процессов
теплопродукции, особенно когда, несмотря на сужение поверхностных сосудов
и минимальное потоотделение, уровень средней интегральной
температуры тела человека становится ниже, чем величина «установочной точки».
Уровень теплопродукции в организме контролируется нейронами заднего
отдела гипоталамуса и осуществляется посредством соматических и
симпатических нервных волокон, а также при участии ряда гормонов и
биологически активных веществ. Так, при увеличении притока афферентных
нервных импульсов от Холодовых рецепторов кожи в гипоталамус
первоначально усиливается сократительный термогенез. Для этого от нейронов дорсо-
медиальной области гипоталамуса через ядра двигательной системы
среднего и продолговатого мозга поток эфферентных нервных импульсов
поступает к мотонейронам спинного мозга. Последние осуществляют
ритмическую посылку эффекторных нервных импульсов к скелетным мышцам
шеи, туловища, проксимальных отделов конечностей. Первоначально это
проявляется в увеличении амплитуды и частоты электромиографической
активности этих мышц, росте их тонического напряжения, однако
видимых сокращений данные мышцы при этом не совершает. При этом в
терморегуляционный тонус последовательно вовлекаются мышцы
подбородка, шеи, верхнего плечевого пояса, туловища, сгибатели конечностей.
Повышенный тонус мышц придает телу характерную позу «сворачивание в
клубок», которая уменьшает площадь поверхности тела, контактирующей с
внешней средой, и снижает интенсивность теплоотдачи.
При продолжающемся охлаждении организма, когда начинается
снижение его внутренней температуры (температуры «ядра»), повышение тонуса
скелетных мышц переходит в качественно новое состояние — возникают
непроизвольные периодические сокращения скелетной мускулатуры,
получившие название холодовой дрожи. В этом случае совершается
сравнительно небольшая механическая работа скелетных мышц, и почти вся их
метаболическая энергия освобождается в виде тепла. Скорость метаболизма и
теплообразования в мышцах при холодовой дрожи может возрастать в
5 раз по сравнению с метаболизмом и теплообразованием в них в условиях
относительного покоя. В условиях холода благодаря активизации
симпатической нервной системы через ее медиатор норадреналин стимулируется
липолиз в жировой ткани. В кровоток выделяются и в последующем
окисляются с образованием большого количества тепла свободные жирные
кислоты. Под влиянием норадреналина и адреналина происходит быстрое,
но непродолжительное повышение теплопродукции в организме человека.
Более продолжительное усиление обменных процессов достигается под
влиянием гормонов щитовидной железы — тироксина и трииодтиронина
(см. главу 6).
Если, несмотря на активацию обмена веществ, величина теплопродук-
13. Температура тела и ее регуляция • 603
ции организма становится меньше величины теплоотдачи, возникает
понижение температуры тела, получившее название гипотермии.
Противоположное состояние организма, сопровождающееся повышением
температуры тела,— гипертермия, имеет место в том случае, когда интенсивность
теплопродукции превышает способность организма отдавать тепло в
окружающую среду посредством имеющихся у него способов теплоотдачи.
13.4. Гипертермия и гипотермия
Состояние организма человека, при котором температура его тела
поднимается выше 37 °С, принято называть гипертермией. Она легко развивается
в условиях действия на организм внешней температуры, превышающей
37 °С при 100 % влажности воздуха, когда испарение пота или влаги с
поверхности тела становится невозможным. В случае продолжительной
гипертермии может развиваться «тепловой удар». Это состояние организма
характеризуется покраснением кожи в результате расширения
периферических сосудов, отсутствием потоотделения, признаками нарушения
функций центральной нервной системы (нарушение ориентации, бред,
судороги). В более легких случаях гипертермия может проявиться в виде
теплового обморока, когда в результате расширения периферических кожных
сосудов происходит резкое падение артериального давления.
В процессе эволюции теплокровных организмов у них выработана
особая ответная реакция на попадание во внутреннюю среду чужеродных
патогенных микроорганизмов — лихорадка — состояние организма, при
котором центр терморегуляции стимулирует повышение температуры тела. Это
достигается перестройкой механизма «установочной точки» на более
высокую, чем в норме, заданную температуру регуляции. Переход
«установочной точки» на более высокий уровень происходит в результате действия на
соответствующую группу нейронов преоптической области гипоталамуса
эндогенных пирогенов — веществ, вызывающих подъем температуры тела.
Эндогенными пирогенами являются пептиды: интерлейкин-1 в формах а и
р, фактор некроза опухолей, интерлейкин-6, а-интерферон и другие.
Наличие в организме ряда дублирующих друг друга эндопирогенных
факторов свидетельствует о том, что вызываемая ими лихорадка играет для
организма важную защитную роль.
Состояние организма человека, при котором температура его тела
становится ниже 35 °С, называют гипотермией. Наиболее быстро гипотермия
возникает при погружении организма в холодную воду. При этом
происходит возбуждение симпатического отдела вегетативной нервной системы,
рефлекторно ограничивается теплоотдача и усиливается теплопродукция в
первую очередь за счет мышечной дрожи. Если человек находится в воде в
неподвижном состоянии, то через некоторое время температура тела
начинает падать, снижается интенсивность обмена веществ, замедляется
дыхание, урежаются сердечные сокращения, снижается сердечный выброс,
понижается артериальное давление (при температуре тела 24—25 "С оно
может составлять 15—20 % от исходного). Если же человек плавает, то в
результате работы скелетных мышц включается механизм сократительного
термогенеза, который компенсирует усиленную теплоотдачу в холодной
воде. В хирургической практике используется искусственная гипотермия с
охлаждением тела до 24—28 "С при операциях на сердце и ЦНС.
Искусственная гипотермия значительно снижает интенсивность обмена веществ в
ЦНС и, как следствие, потребность ее в кислороде. Больные легче
переносят временное выключение сердечной деятельности и остановку дыхания.
604 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Как при гипотермии, так и при гипертермии в организме человека
имеет место нарушение основного условия поддержания постоянства
температуры его тела — баланса теплопродукции и теплоотдачи. Изменение
температуры тела при этих состояниях осуществляется вопреки «усилиям»
центра терморегуляции и других механизмов системы терморегуляции
удержать нормальную температуру тела.
13.5. Взаимодействие системы терморегуляции с другими
физиологическими системами организма
Система терморегуляции использует для осуществления своих функций
эффекторные компоненты других физиологических систем. Это
обстоятельство обусловливает необходимость постоянного взаимодействия,
сопряжения или конкуренции механизмов, регулирующих теплообмен и
другие гомеостатические функции. Такое сопряжение регуляции теплообмена
и других гомеостатических функций имеет место, прежде всего, в
гипоталамусе, где термочувствительные нейроны преоптической области
гипоталамуса являются одновременно чувствительными к изменению
осмотического давления, артериального давления крови, концентрации ионов Н+,
Na+, Ca2+, С02, глюкозы. Эти нейроны изменяют свою биоэлектрическую
активность при сдвигах температуры тела, под действием эндопирогенов,
половых гормонов, некоторых нейромедиаторов. Таким образом, центр
терморегуляции в гипоталамусе постоянно взаимодействует с другими
расположенными здесь же центрами регуляции гомеостаза.
Используемые организмом в системе регуляции теплообмена нейроме-
диаторы, гуморальные вещества также одновременно принимают участие в
регуляции других функций и показателей гомеостаза. Их примерами могут
быть катехоламины, которые параллельно выполняют функции
медиаторов в центральной и симпатической нервных системах, функции сосудоак-
тивных веществ, активаторов обменных процессов.
13.5.1. Сердечно-сосудистая система и терморегуляция
В качестве эффекторов в реакциях теплообмена используются сосуды
поверхности тела, посредством которых регулируется кровоток в коже, ее
температура и интенсивность теплоотдачи. В термонейтральных условиях,
при действии на организм умеренно низких температур или неглубокой
гипотермии изменение кровотока в поверхностных тканях не оказывает
существенного влияния на деятельность сердца и системную
гемодинамику. При действии же на организм высоких температур, гипертермии,
лихорадке резкое расширение сосудов поверхности тела, влияние высокой
температуры на центральные механизмы регуляции кровообращения могут
привести к падению давления крови, развитию коллаптоидного состояния.
Использование при гипертермии многочисленных поверхностных сосудов,
как общих эффекторов сердечно-сосудистой и терморегулирующей систем,
соподчинено более важной в этот момент времени гомеостатической
потребности организма — поддержанию системного кровотока.
13.5.2. Водно-солевой баланс и терморегуляция
Когда температура поверхности тела достигает величин, равных
температуре окружающей среды, ведущее значение в механизмах теплоотдачи
приобретает уже не повышение кровотока в поверхностных тканях, а потоот-
13. Температура тела и ее регуляция • 605
деление и испарение пота и влаги с поверхности тела. Более существенную
роль начинают играть учащение дыхания и испарение влаги с поверхности
дыхательных путей. Включение в реакции теплообмена потоотделения
является примером использования общих эффекторов для системы
терморегуляции и систем регуляции водно-солевого баланса и осмотического
давления.
Если при подъеме температуры тела в силу потери жидкости за счет
усиленного потоотделения уменьшается объем циркулирующей крови и
повышается ее осмотическое давление, организм стремится сохранить
водный гомеостаз, даже если это идет в ущерб терморегуляторным
реакциям. С развитием гипогидратации и повышением осмотического
давления в организме отдача тепла за счет потоотделения уменьшается и
температура тела устанавливается на еще более высоком уровне. Развивается
чувство жажды, уменьшается диурез. В конкуренции за общие эффектор-
ные механизмы начинают преобладать системы осмо- и волюморегуля-
ции, как более древние и в экстремальных условиях более важные для
сохранения гомеостаза. Сопряжение осмо- и терморегуляции достигается в
нервных центрах медиальной преоптической области гипоталамуса, где
тепло- и холодочувствительные нейроны наделены одновременно высокой
осмочувствительностью. Подтверждением сопряженного протекания в
организме процессов термо- и осморегуляции являются изменения водного
обмена противоположной направленности — при охлаждении организма.
При действии на организм низкой температуры имеют место уменьшение
потребления воды, усиление диуреза и повышение осмолярности плазмы
крови.
Если дегидратация при действии на организм высокой внешней
температуры приводит к торможению терморегуляторных реакций, то при
действии на него низкой температуры дегидратация ведет к торможению теп-
лочувствительных нейронов гипоталамуса и в результате — к снижению
теплоотдачи.
13.5.3. Дыхание и терморегуляция
При действии на организм высокой внешней температуры активация
потоотделения и дыхания ведет к усиленному выделению из организма С02,
некоторых минеральных ионов. Как при гипер-, так и при гипотермии
могут наблюдаться сдвиги кислотно-основного состояния. За счет полип-
ноэ и интенсификации потоотделения развивается дыхательный алкалоз,
сопровождающиейся увеличением рН и снижением рС02 в крови. При
нарастании гипертермии в связи с ухудшением доставки к тканям
кислорода в них развивается метаболический ацидоз. Смена щелочной
реакции крови на кислую при выраженной гипертермии вновь начинает
играть положительную регуляторную роль, как для усиления теплоотдачи,
так и для предупреждения дальнейшего закисления крови и улучшения
оксигенации тканей. Это достигается стимуляцией дыхательного центра
посредством избытка Н2+, увеличения минутного объема дыхания,
усиления испарения влаги с поверхности дыхательных путей, что ведет к
снижению рС02 и увеличению р02. Обратные взаимоотношения между
процессами регуляции теплообмена и дыхания прослеживаются при
гипотермии. Развивающаяся при этом гиповентиляция является общим эффек-
торным механизмом, обеспечивающим снижение теплопотерь,
поддержание на более низком уровне рН крови соответственно сниженной
температуре тела.
ГЛАВА 14
Выделение. Функции почек.
Водно-солевой обмен
Выделение — часть обмена веществ, осуществляемая путем выведения из
внутренней среды организма во внешнюю среду конечных и
промежуточных продуктов метаболизма, чужеродных и излишних веществ для
обеспечения оптимального состава внутренней среды и нормальной
жизнедеятельности организма. Процессы выделения являются неотъемлемым
признаком жизни, поэтому их нарушение неизбежно приводит к нарушениям
гомеостазиса, обмена веществ и функций организма, вплоть до его гибели.
Выделение неразрывно связано с обменом воды, поскольку основная часть
предназначенных для выведения из организма веществ выделяется в
растворенном виде. Основным органом вьщеления являются почки,
образующие и выделяющие мочу и вместе с ней вещества, подлежащие удалению
из организма. Почки являются также основным органом обеспечения
водно-солевого обмена, поэтому в этой главе и рассматриваются функции
почек, выделение и водно-солевой обмен.
14.1. Органы и процессы выделения
Функция вьщеления веществ из внутренней среды организма
осуществляется почками, желудочно-кишечным трактом, легкими, кожей и
слизистыми оболочками, слюнными железами. Реализуемые ими процессы
вьщеления находятся в координированной взаимосвязи и поэтому
функционально эти органы объединяют понятием выделительная система организма
(рис. 14.1). Между органами вьщеления существуют функциональные и ре-
гуляторные взаимосвязи, в результате чего сдвиг функционального
состояния одного из органов вьщеления меняет активность другого в пределах
единой выделительной системы. Так, например, при избыточном
выведении жидкости через кожу путем потоотделения при высокой
температуре — снижается объем мочеобразования, при уменьшении экскреции
азотистых соединений с мочой — увеличивается их выведение через
желудочно-кишечный тракт, легкие и кожу.
14.1.1. Выделительная функция кожи
Выделительная функция кожи, непосредственно контактирующей с
внешней средой большой площадью поверхности, преимущественно
обеспечивается деятельностью потовых и, в меньшей степени, сальных желез.
В среднем у человека за сутки выделяется от 300 до 1000 мл пота, что
зависит от температуры окружающей среды и интенсивности
энергетического метаболизма. Составы пота и плазмы крови отличаются, поскольку пот
является не простым фильтратом плазмы, а секретом потовых желез. С
потом из организма выводится в покое до '/3 общего количества экскретируе-
14. Выделение. Функции почек. Водно-солевой обмен • 607
Внешняя среда
t
Моча
Рис. 14.1. Выделительная система организма.
Органы выделения (кожа, легкие, слюнные железы, печень и желудочно-кишечный тракт,
почки) выводят из внутренней среды организма во внешнюю среду метаболиты и
ксенобиотики в составе секретов и экскретов.
мой воды, 5—7 % всей мочевины, мочевая кислота, креатин, хлориды,
натрий, калий, кальций, органические вещества, липиды, микроэлементы.
Через кожу может выделяться даже больше кальция, чем выводится с
мочой. При недостаточности функции почек или печени возрастает
выделение через кожу веществ, обычно экскретируемых с мочой, — мочевины,
ацетона, желчных пигментов и др. С потом выделяются пепсиноген,
амилаза и щелочная фосфатаза, отражая тем самым функциональное
состояние органов пищеварения.
Регуляция потоотделения осуществляется симпатическими холинерги-
ческими влияниями, а также гормонами — вазопрессином, альдостероном,
гормонами щитовидной железы и половыми стероидами.
Секрет сальных желез на 2/3 состоит из воды, а '/3 составляют неомыляе-
мые соединения — холестерин, сквален (алифатический углеводород), ана-
608 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
логи казеина, продукты обмена половых гормонов, кортикостероидов,
витаминов и ферментов. В выделительной системе сальные железы не имеют
большой значимости, так как за сутки выделяется всего лишь около 20 г
секрета. Регуляция сальных желез осуществляется в основном половыми и
надпочечниковыми стероидами.
14.1.2. Выделительная функция печени и пищеварительного
тракта
Выделительная функция печени реализуется за счет образования и
секреции в ней желчи. За сутки печень секретирует от 500 до 2000 мл желчи, но
большая часть ее объема затем реабсорбируется в желчном пузыре и
кишечнике. С желчью из организма экскретируются конечные продукты
обмена гемоглобина и других порфиринов в виде желчных пигментов,
конечные продукты обмена холестерина — в виде желчных кислот. Несмотря на
всасывание в кишечнике и обратный транспорт в печень с кровью
воротной вены, часть этих веществ покидает организм с фекальными массами.
В составе желчи из организма выделяются тироксин, мочевина, кальций и
фосфор, а также вещества, поступающие в организм: лекарственные
препараты, ядохимикаты и др. В желчном пузыре происходит обратное
всасывание в кровь воды и растворенных в ней веществ, прежде всего
электролитов. Этот процесс приводит к концентрированию желчи и регулируется
гормоном вазопрессином, повышающим проницаемость стенки желчного
пузыря.
Выделительная функция желудка обеспечивает выведение в составе
желудочного сока продуктов метаболизма (мочевины, мочевой кислоты),
лекарственных и ядовитых веществ (ртуть, йод, салицилаты, хинин).
Выделительная функция кишечника состоит, во-первых, в выделении
продуктов распада пищевых веществ, не подвергшихся всасыванию в
кровь и представляющих излишние или вредные для организма
соединения. Во-вторых,, кишечник экскретирует вещества, поступившие в его
просвет с пищеварительными соками (желудочным, поджелудочным) и
желчью. При этом многие из них в кишечнике подвергаются метаболизму и с
калом выделяются не сами вещества, а их метаболиты, например
метаболиты билирубина желчи. В-третьих, стенка кишечника способна экскрети-
ровать из крови ряд веществ, среди которых особое значение имеет
экскреция плазменных белков. При чрезмерности этого процесса возникает
избыточная потеря организмом белка, ведущая к патологии. Из крови
кишечный эпителий экскретирует соли тяжелых металлов, магний, почти
половину всего вьщеляемого организмом кальция. Вместе с экскрементами
кишечником выделяется и некоторое количество воды (в среднем около
100 мл/сут).
14.1.3. Выделительная функция легких и верхних дыхательных
путей
Процессы газообмена, происходящие в легких, обеспечивают удаление из
внутренней среды организма летучих метаболитов и экзогенных веществ —
углекислого газа, аммиака, ацетона, этанола, метилмеркаптана и др.
Кроме того, за счет мерцательного эпителия удаляются продукты обмена
веществ самой легочной ткани и эпителия воздухоносных путей, например
продукты деградации сурфактанта. Легкие выделяют в просвет
дыхательных путей небольшие количества белка, в том числе гамма-глобулинов,
14. Выделение. Функции почек. Водно-солевой обмен • 609
обладающих сродством к легочной ткани, а также входящих в состав
секрета желез бронхиального дерева. Через слизистую оболочку дыхательных
путей испаряется значительное количество воды (от 400 мл в покое до 1 л
при усиленном дыхании), а при повышении проницаемости аэрогематиче-
ского барьера из крови могут в избытке выделяться пурины, аденозин- и
гуанозинмонофосфаты. Гиперсекреция желез слизистой оболочки верхних
дыхательных путей имеет место при нарушениях вьщелительной функции
почек, в этом случае через слизистую' оболочку выделяется много
мочевины, которая, разлагаясь, образует аммиак, определяющий
соответствующий запах изо рта.
14.2. Функции почек
Функции почек многообразны, при этом часть из них связана с
процессами выделения, в которых почки играют ведущую роль, другая же часть
подразумевает невыделительные функции почек. Почки участвуют в
регуляции:
1) водного баланса организма и, соответственно, объемов вне- и
внутриклеточных водных пространств, поскольку меняют количество
выводимой с мочой воды;
2) ионного баланса и состава жидкостей внутренней среды путем
избирательного изменения экскреции ионов с мочой;
3) постоянства осмотического давления жидкостей внутренней среды за
счет изменения количества выводимых осмотически активных
веществ (солей, мочевины, глюкозы и др.);
4) кислотно-основного баланса, путем изменения экскреции
водородных ионов, нелетучих кислот и оснований;
5) метаболизма белков, липидов, углеводов, нуклеиновых кислот и
других органических соединений, во-первых, за счет изменений
экскреции продуктов метаболизма и избытка соединений, поступивших с
пищей или образовавшихся в организме, во-вторых, благодаря
собственной метаболической функции (синтез аммиака и мочевины,
новообразование глюкозы, гидролиз белков и липидов, синтез
ферментов, простаноидов и т. п.);
6) циркуляторного гомеостазиса, путем регуляции обмена
электролитов, объема циркулирующей крови, внутренней секреции гормонов,
регулирующих функции сердечно-сосудистой системы, — ренина,
кальцитриола и др., а также экскреции катехоламинов и других
гормональных регуляторов системы кровообращения;
7) эритропоэза, за счет внутренней секреции эритропоэтина —
гуморального регулятора эритрона;
8) гемостаза, путем образования гуморальных регуляторов свертывания
крови и фибринолиза (урокиназы, тромбопластина, тромбоксана и
простациклина) и участвуя в обмене физиологических
антикоагулянтов (гепарина).
Экскретируя из внутренней среды чужеродные и вредные вещества,
почки выполняют защитную функцию. Таким образом, выделяют
следующие функции почек: экскреторную, гомеостаттескую, метаболическую,
инкреторную и защитную. Основной функцией почек, обеспечивающей
ведущую роль в выделительной системе организма, является образование и
выделение мочи.
20-6095
610 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
14.2.1. Механизмы мочеобразования
Моча образуется в почках из плазмы крови, причем почка относится к
наиболее интенсивно кровоснабжаемым органам — ежеминутно через
почку проходит '/4 всего объема крови, выбрасываемой сердцем, при этом
объем кровотока в коре почки, где происходит фильтрация плазмы крови
и образование первичной мочи, составляет свыше 90 % общего почечного
кровотока. Основной структурно-функциональной единицей почки,
обеспечивающей образование мочи, является нефрон. В почке человека
находится около 1,2 млн. нефронов. Однако не все нефроны функционируют в
почке одновременно, существует определенная периодичность активности
отдельных нефронов, когда часть из них функционирует, а другие нет. Эта
периодичность обеспечивает надежность деятельности почки за счет
функционального дублирования. В связи с этим важным показателем
функциональной активности почки является масса действующих нефронов в
конкретный момент времени.
Нефрон состоит из нескольких последовательно соединенных отделов
(рис. 14.2), располагающихся в корковом и мозговом веществе почки.
Сосудистый клубочек, или мальпигиево тельце, является структурой, где
происходит процесс ультрафильтрации плазмы крови через
фильтрационный барьер и образование первичной мочи (рис. 14.3). Он расположен в
корковом веществе, имеет около 50 капиллярных петель, связанных друг с
другом и подвешенных как на брыжейке с помощью мезангия, состоящего
из волокнистых структур и мезангиальных клеток. Снаружи клубочки
покрыты двухслойной капсулой Боумена—Шумлянского. Висцеральный
листок этой капсулы покрывает капилляры клубочка и состоит из
эпителиальных отростчатых клеток — подоцитов. Отростки подоцитов (большие и
малые), называемые педикулами, покрывают всю поверхность капилляров,
тесно переплетаясь друг с другом и оставляя межпедикулярные
пространства не более 30 нм. Пространства заполнены фибриллярными
структурами, образующими щелевую диафрагму, формирующую решетку или сито с
диаметром пор около 10 нм. Наружный или париетальный листок капсулы
состоит из базальной мембраны, покрытой кубическими эпителиальными
клетками, переходящими в эпителий канальцев. Между двумя листками
капсулы, расположенными наподобие чаши, имеется щель или полость
капсулы, в которую происходит ультрафильтрация плазмы крови. Полость
капсулы переходит в просвет главного или проксимального отдела
канальцев.
Стенка всех канальцев нефрона, где по мере продвижения мочи
происходит обратное всасывание в кровь воды и различных веществ (реабсорб-
ция), а также секреция веществ из крови в мочу, состоит из
эпителиальных клеток, расположенных на базальной мембране (рис. 14.4). По
строению и функции у этих клеток выделяют апикальную, или люминальную,
мембрану, обращенную в просвет канальца, и базолатеральную мембрану.
Канальцевый аппарат нефрона подразделяют на несколько отделов.
Главный, или проксимальный, отдел канальцев, начинающийся от
полости капсулы извитой частью, которая затем переходит в прямую часть
канальца. Клетки проксимального отдела на апикальной мембране имеют
щеточную каемку из микроворсин, покрытых гликокаликсом.
Проксимальный отдел расположен в корковом веществе, где переходит в петлю
Генле.
Тонкий нисходящий отдел петли Генле, который покрыт плоскими
клетками с щелевидными пространствами в цитоплазме шириной до 7 нм,
14. Выделение. Функции почек. Водно-солевой обмен • 611
Рис. 14.2. Типы и структура нефронов.
1 — клубочек интракортикального нефрона; 2 — клубочек юкстамедуллярного нефрона; 3 —
петля Генле интракортикального нефрона; 4 — петля Генле юкстамедуллярного нефрона; 5 —
проксимальные извитые канальцы; 6 —дистальные извитые канальцы; 7 — собирательные
трубочки; 8 — капиллярная сеть интракортикального нефрона; 9 — прямые капиллярные
сосуды юкстамедуллярного нефрона; 10 — артерии и артериолы; 11 — венулы и вены.
Интракортикальные нефроны имеют короткие петли Генле, выносящая артериола клубочка
образует густую капиллярную сеть вокруг канальцев. Юкстамедуллярные нефроны имеют
длинные петли Генле, спускающиеся вглубь мозгового вещества к почечному сосочку и
образующие канальцевую противоточную систему почки, а выносящие артериолы клубочка
формируют в мозговом веществе почки прямые нисходящие и восходящие капиллярные сосуды,
образующие сосудистую противоточную систему.
спускающийся в мозговое вещество почки, где поворачивает на 180° и
переходит в тонкую восходящую часть, соединяющуюся с дистальным
отделом канальцев.
Дистальный отдел канальцев, состоящий из толстой восходящей части
петли Генле или прямого отдела и извитой части. Восходящая часть
покрыта клетками, напоминающими клетки проксимального отдела, но
лишенными щеточной каемки. Восходящая часть дистального канальца
вновь входит в кору почки, подходит к клубочку и обязательно
соприкасается с его полюсом между приносящей и выносящей артериолами. Здесь
эпителий канальца становится цилиндрическим, ядра клеток — гипер-
хромными, этот участок выглядит темным, плотным, что и дало ему
название macula densa — плотное пятно. Поскольку непрерывная базальная
мембрана здесь отсутствует и клетки эпителия канальца имеют тесный
20'
612 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Эфферентная
артериола
Проксимальный каналец
Боуменово пространство
Мочевое пространство капсулы Боумена
Ножки Гликокаликс
подоцита
Афферентная
артериола
Щелевая
диафрагма
Фенестра
Базальная мембрана
Клетка эндотелия
Просвет капилляра клубочка
1000 А
Просвет капсулы Боумена
Отростки ножки подоцита
Базальная мембрана-
В
Просвет капилляра Фенестры
- Отрицвтельно заряженные молекулы
Цитоплазма клетки
эндотелия
Рис. 14.3. Схема строения клубочка.
А — схематическое изображение клубочка в целом, Б — фрагмент трехслойного
фильтрационного барьера, В — увеличенный участок фильтрационного барьера. Отчетливо выявляются три
слоя барьера: эндотелий капилляра клубочка, базальная мембрана и клетки висцерального
листка капсулы Боумена—Шумлянского (подоциты). Фильтрация воды с растворенными в ней
веществами происходит из плазмы крови капилляра клубочка через фенестры эндотелия,
поры базальной мембраны и щелевые диафрагмы между ножками подоцитов. Все эти структуры
фильтрационного барьера имеют отрицательный заряд.
14. Выделение. Функции почек. Водно-солевой обмен • 613
Клетка эпителия Люминальная Плотное
канальца мембрана соединение
1ЛЛЯР
кат
эулярный
иту(
I
•
1
•
._t_J
1
ПРОСВЕТ КАНАЛЬЦА
Интерстициальная
жидкость
/•■
•
Г
•
* V
Базолатеральная
мембрана
лляр /
канальца
капп
!НКИ
улярный
брана стб
s 2
/ Пер
азальная
Рис. 14.4. Схема строения почечного канальца.
Из просвета канальца через люминальную мембрану клеток эпителия канальца происходит
процесс реабсорбции воды и веществ, содержащихся в первичной моче. Поступившие в
клетки вещества далее транспортируются через базолатеральные мембраны. Выведение через базо-
латеральные мембраны натрия в интерстициальную жидкость способствует повышению ее
осмотического давления и обеспечивает осмотический транспорт воды. Из интерстициальной
жидкости вода и вещества всасываются в кровь перитубулярных капилляров. Клетки эпителия
канальцев обладают также способностью захватывать вещества из кровеносных
перитубулярных капилляров и затем секретировать их в просвет канальца через люминальные мембраны.
контакт с гранулированными миоэпителиоидными клетками артериолы
клубочка (юкстагломерулярными клетками), плотное пятно является
структурой юкстагломерулярного аппарата почки. Дистальные извитые
канальцы через короткий связующий отдел впадают в коре почек в
следующий отдел нефрона — собирательные трубки.
Собирательные трубки спускаются из коры почек вглубь мозгового
вещества, где их эпителий из кубического становится цилиндрическим.
Темные цилиндрические эпителиальные клетки дистальных отделов
собирательных трубок богаты карбоангидразой и обеспечивают секрецию ионов
водорода. В глубине мозгового вещества в области вершин пирамид
собирательные трубки сливаются в выводные протоки, открывающиеся в
полость лоханки.
По особенностям локализации клубочков в коре почек, строения
канальцев и особенностям кровоснабжения различают три типа нефронов:
суперфициальные, интракортикальные и юкстамедуллярные (см. рис. 14.2).
Суперфициальные нефроны имеют поверхностно расположенные в
коре клубочки, наиболее короткую петлю Генле, их 20—30 %.
Интракортикальные нефроны, клубочки которых расположены в средней части коры
почки, наиболее многочисленны (60—70 %) и выполняют основную роль в
процессах ультрафильтрации мочи. Диаметр их приносящей артериолы
614 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
больше, чем у выносящей, ветви последней дают густую сеть капилляров в
корковом и мозговом веществе. Юкстамедуллярных нефронов значительно
меньше (10—15 %), клубочки их расположены у границы коркового и
мозгового вещества почки, выносящие артериолы шире приносящих, петли
Генле самые длинные и спускаются почти до вершины сосочка пирамид.
Выносящие артериолы образуют прямые капиллярные нисходящие и
восходящие сосуды, идущие в глубину мозгового вещества параллельно
петлям Генле. Юкстамедуллярные нефроны играют ведущую роль в процессах
концентрирования и разведения мочи.
Механизм мочеобразования складывается из трех основных процессов:
• клубочковой ультрафильтрации из плазмы крови воды и
низкомолекулярных компонентов с образованием первичной мочи;
• канальцевой реабсорбции (обратного всасывания в кровь) воды и
необходимых для организма веществ из первичной мочи;
• канальцевой секреции ионов, органических веществ эндогенной и
экзогенной природы.
14.2.1.1. Клубочковая ультрафильтрация и ее регуляция
Процесс клубочковой ультрафильтрации (далее просто фильтрация)
осуществляется под влиянием физико-химических и биологических факторов
через структуры гломерулярного фильтра, находящегося на пути выхода
жидкости из просвета капилляров клубочка в полость капсулы Боумена—
Шумлянского. Гломерулярный фильтр состоит из 3 слоев: эндотелия
капилляров, базальной мембраны и эпителия висцерального листка капсулы или
подоцитов (см. рис. 14.3). Эндотелий капилляров пронизан отверстиями
диаметром до 100 нм. На поверхности эндотелия находится особая
выстилка отрицательно заряженными молекулами гликопротеинов, мешающая
доступу форменных элементов и крупных молекул, в том числе и белков, к
лежащей под эндотелием базальной мембране. Базальная мембрана
является основной частью фильтра, препятствующей проникновению из плазмы
крови крупномолекулярных соединений (белков). При этом не только
размер пор мембраны (около 2,9 нм), но и их отрицательный заряд
противодействуют прохождению молекул с отрицательным зарядом, например
альбуминов. Базальная мембрана довольно быстро «изнашивается» за счет
непрерывного процесса фильтрации, и ее элементы постоянно
восстанавливаются с помощью мезангиальных клеток, при этом в течение года
происходит полная замена ее основного вещества. Третий слой фильтра
образован отростками подоцитов, между которыми остаются щелевые диафрагмы
с диаметром пор около 10 нм, поры покрыты гликокаликсом,
оставляющим отверстия радиусом около 3 нм. Эта часть фильтра также несет
отрицательный заряд.
Поскольку подоциты содержат внутри отростков — педикул актомиози-
новые миофибриллы, они могут сокращаться и расслабляться, действуя
как микронасосы, откачивающие фильтрат в полость капсулы. Эта
активность подоцитов составляет один из биологических факторов обеспечения
процесса фильтрации, к числу которых относится также сокращение и
расслабление мезангиальных клеток, изменяющих тем самым площадь
поверхности клубочкового фильтра.
Физико-химические факторы обеспечения фильтрации представлены
отрицательным зарядом структур фильтра и фильтрационным давлением,
являющимся основной причиной фильтрационного процесса.
Фильтрационное давление — это сила, обеспечивающая движение жидко-
14. Выделение. Функции почек. Водно-солевой обмен • 615
Приносящая Капилляры Выносящая
артериола клубочка артериола
Рг Норма
Сужение
выносящей
артериолы
Сужение
приносящей
артериолы
Рис. 14.5. Зависимость величины гидростатического давления в капиллярах
клубочка (Рг) от соотношения просветов приносящей и выносящей артериол.
При сужении выносящей артериолы гидростатическое давление растет и скорость клубочко-
вой фильтрации (СКФ) повышается, а при сужении приносящей артериолы гидростатическое
давление и СКФ падают.
сти с растворенными в ней веществами из плазмы крови капилляров
клубочка в просвет капсулы. Эта сила создается гидростатическим давлением
крови в капилляре клубочка. Препятствующими фильтрации силами
являются онкотическое давление белков плазмы крови (так как белки почти не
проходят через фильтр) и давление жидкости (первичной мочи) в полости
капсулы клубочка. Таким образом, фильтрационное давление (ФД)
представляет собой разность между гидростатическим давлением крови в
капиллярах (Рг) и суммой онкотического давления плазмы крови (Ро) и
давления первичной мочи (Рм) в капсуле: ФД = Рг — (Ро + Рм). По ходу
капилляров клубочка от приносящего к выносящему отделу
гидростатическое давление снижается за счет сосудистого сопротивления, а
онкотическое давление плазмы, благодаря потере фильтрующейся воды и
сгущению, возрастает. Гидростатическое давление крови в приносящей части
капилляров клубочка высокое, примерно 50—60 мм рт. ст., т. е. выше, чем
в капиллярах других тканей. Это связано, во-первых, с тем, что капилляры
клубочка находятся близко к аорте (короткие почечные и внутрипочечные
артерии), и, во-вторых,—диаметр приносящих артериол клубочка больше,
чем у выносящих. Гидростатическое давление в выносящей части
капилляров ниже на 2—5 мм рт. ст. Гидростатическое давление увеличивается или
снижается при изменении соотношения диаметров приносящей и
выносящей артериол, что является ведущим механизмом регуляции процесса
фильтрации (рис. 14.5). Онкотическое давление белков плазмы крови в
приносящей части капилляров клубочка около 25 мм рт. ст., а в
выносящей части капилляров, благодаря фильтрации из плазмы воды, оно
возрастает до 35—40 мм рт.ст. Давление первичной мочи в капсуле Боумена—
Шумлянского примерно равно 15—20 мм рт. ст. Таким образом, ФД в
| Рг
616 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
приносящей части капилляров клубочка составляет в среднем: 60 — (25 +
15) = 20 мм рт. ст. В выносящей части капилляров фильтрации
практически не происходит, так как ФД равно: 58 — (40 + 15) = 3 мм рт. ст.
Основной количественной характеристикой процесса фильтрации
является скорость клубочковой фильтрации (СКФ). СКФ —это объем
ультрафильтрата или первичной мочи, образующийся в почках за единицу
времени. Эта величина зависит от нескольких факторов: 1) от объема крови,
точнее плазмы, проходящей через корковое вещество почек в единицу
времени, т. е. почечного плазмотока, составляющего в среднем у здорового
человека массой 70 кг около 600 мл/мин; 2) фильтрационного давления,
обеспечивающего сам процесс фильтрации; 3) фильтрационной
поверхности, которая равна примерно 2—3 % от общей поверхности капилляров
клубочка (1,6 м2) и может изменяться при сокращении подоцитов и мезан-
гиальных клеток; 4) массы действующих нефронов, т. е. числа клубочков,
осуществляющих процесс фильтрации в определенный промежуток
времени.
В физиологических условиях СКФ поддерживается на довольно
постоянном уровне (несмотря на изменения системного артериального
давления) за счет механизмов ауторегуляции. К их числу относятся: 1) миоген-
ная ауторегуляция тонуса приносящих артериол по принципу феномена
Остроумова— Бейлиса; 2) канальцево-клубочковая обратная связь,
приводящая к изменению соотношения тонуса приносящих и выносящих
артериол клубочка. Вовлечение в регуляцию механизма обратной связи
обусловлено изменением доставки с фильтратом в область плотного пятна
(macula densa) ионов натрия и хлора, что ведет к изменению продукции в
ЮГА гуморальных регуляторов: аденозина (суживающий афферентные ар-
териолы фактор), NO (дилатирующий артериолы фактор), ренина и ангио-
тензина-П, кининов и простагландинов (рис. 14.6); 3) изменения числа
функционирующих нефронов. Первые два механизма поддерживают
постоянство кровотока в клубочках и фильтрационное давление,
гуморальные регуляторы могут менять площадь фильтрационной поверхности и
функции подоцитов, третий механизм определяет конечный эффект
ауторегуляции СКФ в органе, что в итоге обеспечивает постоянство объема
образуемой первичной мочи.
СКФ определяют в результате сопоставления концентрации
определенного вещества в плазме крови и моче. При этом используемое вещество
должно выделяться вместе с водой только путем фильтрации и не
всасываться в нефроне обратно в кровь. Таким условиям больше всего
соответствует полисахарид фруктозы инулин. Исходя из концентрации инулина в
плазме [Пин], и, определив его концентрацию в определенном объеме (V)
конечной мочи [Мин], рассчитывают, какой объем первичной мочи
соответствует найденной концентрации инулина. Насколько выросла
концентрация инулина в конечной моче по сравнению с его концентрацией в
плазме, во столько раз больше объем профильтровавшейся плазмы (т. е.
первичной мочи) объема конечной мочи. Этот показатель получил
название «клиренса» инулина или коэффициента очищения и рассчитывается
по формуле:
Син = Мин^Умочи = скф (мл/мин) f
показывающей, в каком объеме плазмы крови в единицу времени
выделилось в мочу найденное количество инулина или какой объем плазмы
«очистился» от инулина. По мере прохождения мочи по канальцам вода всасы-
14. Выделение. Функции почек. Водно-солевой обмен • 617
Клубочек Macula densa
Увеличение гидростатического
давления в капиллярах -*- —
Увеличение сокрости
клубочковой фильтрации
Увеличение объема
первичной мочи и скорости
ее движения по канальцам
Увеличение загрузки канальцев
натрием и хлоридом
Увеличение реабсорбции
натрия и хлорида клетками
macula densa
Снижение сокрости
клубочковой фильтрации
\ f
Снижение гидростатического
давления в капиллярах
t
Сужение приносящей
артериолы
t
\Увеличение синтеза и
секреции в кровь аденозина
Рис. 14.6. Канальцево-клубочковая обратная связь как механизм ауторегуляции
клубочковой фильтрации.
Сплошные стрелки указывают последовательность реакций, штриховые стрелки — участки
нефрона, где происходит соответствующий процесс. В качестве примера приведен случай
первичного повышения гидростатического давления в капиллярах клубочка при расширении
приносящей артериолы. В результате повышенного гидростатического давления растут скорость
клубочковой фильтрации, объем образующейся первичной мочи и скорость ее продвижения
по канальцам. При повышенной скорости тока мочи в проксимальных канальцах не успевает
реабсорбироваться должная часть профильтровавшихся натрия и хлорида, соответственно,
увеличивается загрузка дистальных отделов канальцев натрием и хлоридом и их реабсорбция
клетками macula densa. Последние увеличивают синтез и секрецию в кровь аденозина,
побуждают юкстагломерулярные клетки к активации синтеза и секреции ренина. Поступающий в
кровь аденозин, равно как и образующийся в ней под влиянием ренина ангиотензин,
вызывают сужение приносящей артериолы клубочка, снижение гидростатического давления и
восстановление скорости клубочковой фильтрации.
вается обратно в кровь и концентрация инулина растет, что и находят в
конечной моче.
Поскольку инулин в организме отсутствует, для определения СКФ его
необходимо капельно вводить в кровоток, создавая постоянную
концентрацию. Это затрудняет исследование, поэтому в клинике обычно
используют эндогенное вещество креатинин, концентрация которого в крови
довольно стабильна.
618 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Таблица 14.1. Основные гуморальные влияния на процессы мочеобразовання
Процесс
Клубочковая
фильтрация
Канальцевая
реабсорбция
ВОДЫ
Увеличивают
Простагландины —
Атриопептид
Оксид азота
Прогестерон
Гл юкокорти коид ы
Окситоцин
Глюкагон
Т-3 и Т-4
Паратирин
PGE2 и простациклин
Хорионический гонадотропин
Допамин
Брадикинин
Вазопрессин
Пролактин
Ангиотензин-Н
Инсулин
Эстрогены
Хорионический гонадотропин
Уменьшают
Норадреналин и адреналин
Ангиотензин-Н
Аденозин
Вазопрессин
Тромбоксан А2
Лейкотриены
Эндотелии
Простагландины
Атриопептид
Кинины
Паратирин
Кальцитриол
Т-3 и Т-4
Эпифизарный экстракт
Сравнивая клиренс инулина с клиренсом других веществ, определяют
процессы, участвующие в выделении этих веществ с мочой. Если клиренс
определенного вещества равен клиренсу инулина, значит вещество
выделяется почками только путем фильтрации в клубочках. Если клиренс
вещества больше клиренса инулина, следовательно, вещество выделяется не
только за счет фильтрации, но и секрецией эпителием канальцев. Если
клиренс вещества меньше, чем у инулина,— вещество после фильтрации
реабсорбируется в канальцах.
В норме СКФ составляет у мужчин около 125 мл/мин, а у женщин —
НО мл/мин. В сутки образуется около 180 л первичной мочи, а за 25 мин
фильтруется примерно 3 л плазмы крови, т. е. весь циркулирующий ее
объем. За сутки этот объем плазмы крови фильтруется, т. е. очищается,
примерно 60 раз. Так как объем конечной мочи составляет около 1,5 л в
сутки, очевидно, что из объема первичной мочи за это время всасывается в
канальцах обратно в кровь примерно 178,5 л жидкости.
Поскольку первичная моча (клубочковый ультрафильтрат) образуется
из плазмы крови, по своему составу она близка плазме, почти полностью
лишенной белков. Так, в ультрафильтрате такое же, как в плазме крови,
количество аминокислот, глюкозы, мочевины, креатинина, свободных
ионов и низкомолекулярных комплексов. В связи с тем что белки-анионы не
проникают через клубочковый фильтр, для сохранения мембранного
равновесия Доннана (равенства произведений концентрации противоположно
заряженных ионов электролитов, находящихся по обе стороны мембраны)
в первичной моче оказывается на 5 % больше концентрация анионов
хлора и бикарбоната и пропорционально меньше концентрация катионов
натрия и калия, меньше концентрация одновалентных катионов (натрия и
калия). В первичную мочу проходит небольшое количество наиболее
мелких молекул белка — менее 3 % гемоглобина и 0,01 % альбуминов.
Регуляция СКФ осуществляется за счет нервных и гуморальных
механизмов. Независимо от природы, регулирующие факторы влияют на СКФ
за счет изменения: 1) тонуса артериол клубочков и, соответственно, объем-
14. Выделение. Функции почек. Водно-солевой обмен • 619
ного кровотока (плазмотока) через них и величины фильтрационного
давления; 2) тонуса мезангиальных клеток и фильтрационной поверхности;
3) активности подоцитов и их «отсасывающей» функции. Нервные
влияния реализуются вазомоторными ветвями почечных нервов,
преимущественно симпатической природы, обеспечивающими изменение
соотношения тонуса приносящих и выносящих артериол клубочков. Кроме того,
симпатические влияния на юкстагломерулярные клетки через бета-адрено-
рецепторы стимулируют секрецию ренина и тем самым реализуют ангио-
тензинный механизм регуляции фильтрации (спазм выносящих и/или
приносящих артериол). Гуморальные факторы (табл. 14.1) могут как
увеличивать, так и уменьшать клубочковую фильтрацию через три описанных
выше механизма, причем эффекты вазопрессина реализуются через V,-pe-
цепторы. Важнейшую роль в обеспечении постоянства СКФ играет
местная ауторегуляция коркового кровотока в почке.
14.2.1.2. Канальцевая реабсорбция и ее регуляция
При сравнении состава и количества первичной и конечной мочи
выявляется, что в канальцах нефрона происходит процесс обратного
всасывания воды и веществ, профильтровавшихся в клубочках, что необходимо
для поддержания их внешнего баланса. Этот процесс называется каналь-
цевой реабсорбцией и в зависимости от отдела канальцев, где он
происходит, различают реабсорбцию проксимальную и дисталъную. В процессе ре-
абсорбции вода и вещества из просвета канальцев через люминальную
мембрану поступают в цитоплазму клеток эпителия, затем через базолате-
ральную мембрану выносятся из клеток эпителия в интерстициальное
пространство, после чего поступают в перитубулярные (околоканальце-
вые) капилляры. Такой путь реабсорбции носит название трансцеллюляр-
ного, в его основе лежат общие механизмы транспорта веществ через
плазматические мембраны. Кроме того, возможен путь реабсорбции
через плотные соединения между клетками эпителия посредством простой
диффузии или переносом вещества вместе с растворителем, что носит
название парацеллюлярного пути реабсорбции. Реабсорбция представляет
собой транспорт веществ из мочи в лимфу и кровь, и в зависимости от
механизма вьщеляют пассивный, первично и вторично активный транспорт
(см. главу 2).
Проксимальная реабсорбция обеспечивает полное всасывание ряда
веществ первичной мочи — глюкозы, белка, аминокислот и витаминов.
В проксимальном отделе канальцев всасывается 2/з профильтровавшихся
воды и ионов натрия (рис. 14.7), большие количества ионов калия,
двухвалентных катионов, анионов хлора, бикарбоната, фосфата, а также мочевая
кислота и мочевина. К концу проксимального отдела в его просвете
остается только Уз объема ультрафильтрата, и, хотя его состав из-за
неодинаковой реабсорбции разных компонентов уже существенно отличается от
плазмы крови, осмотическое давление первичной мочи остается таким же,
как в плазме.
Эпителий проксимального канальца хорошо проницаем для воды,
благодаря наличию в апикальной мембране водных каналов, образованных
особыми белковыми молекулами аквапоринами. В структурах нефрона
описано 6 типов аквапоринов, первый из них (AQP-1) имеется в мембранах
клеток проксимальных канальцев (рис. 14.8). Всасывание воды происходит
пассивно путем простой диффузии по осмотическому градиенту и прямо
зависит от реабсорбции ионов натрия хлорида, других осмотически актив-
620 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
СКФ = 180 л/день
[Na] плазмы = 140 ммоль/л
Фильтрационная загрузка Na+ = 25 200 ммоль/день
16 800 ммоль/день
67 % фильтр, загрузки (ф. з.
6300 ммоль/день
25 % ф. з.
1200 ммоль/день
5 % ф. з.
750 ммоль/день
3 % ф. з. ~*-
V мочи = 1500 мл/день
[Na] мочи = 100 ммоль/л
Поступление Na+ в организм = 155 ммоль/день
Экскреция Na = 150 ммоль/день
0,6 % ф. з.
Рис. 14.7. Почечные процессы, обеспечивающие поддержание баланса натрия.
Прямые стрелки и цифры — реабсорбция и экскреция натрия в разных отделах нефрона,
СКФ — скорость клубочковой фильтрации. При поступлени в сутки 155 ммоль натрия в
организм, фильтруется в мочу за сутки 25 200 ммоль, из которых реабсорбируется 25 050 ммоль, в
том числе 2/э (67 %) в проксимальном отделе канальцев, а '/3 (33 %) — в дистальном отделе.
В результате за сутки с мочой выделяется 150 ммоль натрия. Оставшиеся 5 ммоль от
поступившего количества натрия экскретируются из организма с калом и потом.
ных веществ. Благодаря этому содержимое проксимального отдела
остается изоосмотичным плазме крови.
Реабсорбция ионов натрия в проксимальном отделе осуществляется
несколькими механизмами активного и пассивного транспорта (рис. 14.9).
Во-первых, реабсорбция натрия осуществляется первично активным
транспортом. Ионы натрия входит в клетки эпителия через апикальную
мембрану пассивно через натриевые каналы по концентрационному градиенту,
его выведение через базолатеральные мембраны эпителиальных клеток
происходит активно с помощью натрий-калиевых насосов, использующих
энергию АТФ. Именно деятельность этих насосов обеспечивает градиент
концентрации ионов натрия между внутриканальцевой и внутриклеточной
средами. Во-вторых, на апикальной мембране имеется
электронейтральный переносчик, обеспечивающий активный обмен Na+ и Н+, при этом
ион натрия поступает в клетку в обмен на удаляемый из клетки Н-ион.
Такой механизм транспорта носит название антипорта. Этот переносчик
обеспечивает и всасывание бикарбонатного аниона. Профильтровавшийся
бикарбонатный анион вместе с Н-ионом образуют угольную кислоту:
HCOJ + Н+ = Н2С03. Располагающаяся на щеточной каемке эпителия
канальца карбоангидраза катализирует разложение в канальцевой жидкости
угольной кислоты: Н2С03 о Н20 + С02, после чего С02 диффундирует в
клетку по градиенту концентрации. В клетке под влинием цитоплазменной
14, Выделение. Функции почек. Водно-солевой обмен • 621
Дистальный извитой каналец
Клубочек \ Собирательная трубка
Вода
Проксимальный
каналец
Нисходящая
тонкая часть
петли Генле
Вазопрессин
AQP3—■*- Вода
AQP4-
Вода
]
Восходящая тонкая
часть петли Генле
Собирательная
трубка
Вазопрессин
AQP3 _
AQP4 в°Да
Кора
Внешняя
медулла
I
5
о;
о;
х
х
ш
о.
&.
X
CD
Конечная моча
Рис. 14.8. Локализация в нефроне и участие в транспорте воды через эпителий
почечных канальцев аквапоринов (водных каналов) разных типов (AQP 1—4).
AQP1 — водные каналы, постоянно локализованные в проксимальных извитых канальцах и
нисходящем отделе петли Генле, обеспечивают трансэпителиальный транспорт воды из
просвета канальцев, т. е. проксимальную реабсорбцию воды.
AQP2— вазопрессинозависимый тип аквапоринов. Эти водные каналы встраиваются в люми-
нальную мембрану главных клеток собирательных трубочек только при наличии вазопрессина,
обеспечивая зависимую от вазопрессина дистальную реабсорбцию воды и концентрирование
мочи.
AQP3 и AQP4— водные каналы, постоянно локализованные в базолатеральных мембранах
главных клеток эпителия собирательных трубочек, обеспечивают транспорт воды из
эпителиальных клеток в интерстиций мозгового вещества.
карбоангидразы протекает обратная реакция: С02 + Н20 о Н2С03,
угольная кислота диссоциирует: Н2С03 о Н+ + HCOJ. Бикарбонатный анион
(НСОз) пассивно переносится в перитубулярную жидкость по
электрохимическому градиенту, создаваемому активным переносом натрия через ба-
золатеральную мембрану, а Н-ион через апикальную мембрану с помощью
антипорта Na+-H+ выводится в просвет канальца. Таким образом,
сопровождающим всасывающийся ион натрия в начальных отделах
проксимального канальца анионом является бикарбонат. Анионы хлора всасываются в
начальных отделах плохо из-за низкой проницаемости стенки. Объем мочи
в канальце уменьшается из-за пассивной реабсорбции воды, и
концентрация хлоридов в его содержимом растет. В конечных участках
проксимальных канальцев межклеточные контакты уже проницаемы для хлоридов
(концентрация которых повысилась) и они пассивно по градиенту
концентрации всасываются из мочи путем парацеллюлярной диффузии, создавая
электрохимический градиент для натрия. В-третьих, ион натрия реабсор-
622 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Просвет канальца
Na+
Аминокислоты
Люминальная
мембрана
Na+
НРО42
Интерстиций
Аминокислоты,
глюкоза
Базолатеральная
мембрана
Na*, CI
Рис. 14.9. Основные системы транспорта натрия в проксимальном канальце неф-
рона.
Жирной стрелкой выделено поступление натрия в клетку через натриевый канал по
концентрационному градиенту (пассивный транпорт путем простой диффузии). На люминальной
мембране черными кружками обозначены переносчики, осуществляющие вторично активный
котранспорт путем облегченной диффузии (Na+ и глюкоза, Na+ и аминокислоты), либо
пассивный котранспорт (Na+ и фосфат), либо антипорт (Na+ и Н+). На базолатеральной мембране
расположены насосы, обеспечивающие активный транспорт натрия из клетки (Na+-K+-Hacoc).
Черный квадрат — основное вещество плотного межклеточного соединения, при
деполимеризации которого возможен пассивный межклеточный транспорт Na.
бируется пассивно, по электрохимическому градиенту, вслед за анионом
хлора. Такой пассивный транспорт одного иона (натрия) вместе с
пассивным транспортом другого (хлорида) носит название котранспорта.
В-четвертых, на апикальной мембране расположены переносчики-котранспор-
теры натрия и органических веществ (глюкозы, аминокислот), натрия и
фосфата или сульфата.
Проксимальная реабсорбция глюкозы и аминокислот осуществляется с
помощью специальных переносчиков щеточной каемки апикальной
мембраны эпителиальных клеток. Эти переносчики транспортируют глюкозу
или аминокислоту, только если одновременно связывают и переносят
натрий. Пассивное перемещение натрия по градиенту концентрации внутрь
клеток ведет к транспорту через мембрану и переносчика с глюкозой или
аминокислотой. Для реализации этого процесса необходима низкая
концентрация натрия в эпителиальной клетке, создающая градиент концен-
14. Выделение. Функции почек. Водно-солевой обмен • 623
трации между внешней и внутриклеточной средой, что обеспечивается
энергозависимой работой натрий-калиевого насоса базальной мембраны.
Поскольку перенос глюкозы или аминокислоты связан с натрием, а его
транспорт определяется активным удалением натрия из клетки, такой вид
транспорта называют вторично активным, или симпортом, т. е. совместным
пассивным транспортом одного вещества (глюкоза) из-за активного
транспорта другого (натрия) с помощью одного переносчика.
Ввиду того что для реабсорбции глюкозы необходимо связывание
каждой ее молекулы с молекулой переносчика, при избытке глюкозы в
первичной моче может произойти полная загрузка всех молекул переносчиков
и глюкоза уже не сможет всасываться в кровь. Эта ситуация
характеризуется понятием «максимальный канальцевый транспорт вещества» (Тм
глюкозы), которое отражает максимальную загрузку канальцевых переносчиков
при определенной концентрации вещества в первичной моче и,
соответственно, в крови. Эта величина составляет от 303 мг/мин у женщин до 375
мг/мин у мужчин. Величине максимального канальце во го транспорта
соответствует понятие «почечный порог выведения».
Почечным порогом выведения называют ту концентрацию вещества в
крови и, соответственно, в первичной моче, при которой оно уже не может
быть полностью реабсорбировано в канальцах и появляется в конечной
моче. Такие вещества, для которых может быть найден порог выведения,
т. е. реабсорбирующиеся при низких концентрациях в крови полностью, а
при повышенных концентрациях — не полностью, носят название
пороговых. Примером является глюкоза, которая полностью всасывается из
первичной мочи при концентрациях в плазме крови ниже 10 ммоль/л, но
появляется в конечной моче, т. е. полностью не реабсорбируется, при
содержании ее в плазме крови выше 10 ммоль/л. Следовательно, для глюкозы
порог выведения составляет 10 ммоль/л.
Вещества, которые вообще не реабсорбируются в канальцах (инулин,
маннитол) или мало реабсорбируются и выделяются пропорционально
накоплению в крови (мочевина, сульфаты и др.), называются непороговыми,
так как для них порога выведения не существует.
Переносчики апикальной мембраны для симпорта натрия и
аминокислот лишь относительно специфичны, каждый из них способен
транспортировать несколько видов аминокислот. Так, для глутамата и аспартата
существует один вид переносчика, для аргинина, лизина — другой.
Реабсорбция пептидов и белков осуществляется практически полностью в
проксимальных канальцах. Количество профильтровавшегося белка
относительно невелико и составляет около 1,8 г в сутки. Некоторую его часть
составляют альбумины, но фильтрационный барьер клубочков проходят и
полипептиды меньшего размера, и в первичную мочу фильтруются,
например, соматотропин, а также лизоцим и др. В конечную мочу поступает не
более 0,15 г белка в сутки (рис. 14.10). Молекулы альбуминов после
связывания с рецепторами на люминальной мембране клеток эпителия
канальцев подвергаются эндоцитозу, внутриклеточные пузырьки поглощенного
белка сливаются с лизосомами и белковые молекулы гидролизуются пеп-
тидазами (аналог внутриклеточного пищеварения). Продукты гидролиза, в
основном аминокислоты, выводятся в интерстициальную жидкость и
поступают в перитубулярные капилляры. Пептиды, особенно с короткой
цепью, подвергаются гидролизу ферментами щеточной каемки (аналог
мембранного пищеварения), образующиеся аминокислоты реабсорбируются из
просвета канальцев.
Дистальная реабсорбция ионов и воды по объему значительно меньше
624 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Малые белки и пептиды
плазмы, например лизоцим
Отрицательно заряженный
альбумин плазмы
Просвет капилляра
Гломерулярный фильтр, с
отрицательными зарядами
Эндоцитоз, процессинг и
гидролиз белков в
проксимальном канальце
Основные белки мочи
Экскреция белка (г/сут)
Альбумины, лизоцим,
уромукоид и др.
< 0,15
Рис. 14.10. Фильтрация белка и его реабсорбция в проксимальном отделе
канальцев.
Гломерулярный фильтр пропускает в первичную мочу лишь мелкие молекулы белков и
пептидов. В проксимальных канальцах эти молекулы поглощаются клетками эпителия и гидролизу-
ются. Аминокислоты и мелкие пептиды реабсорбируются далее в кровь. С конечной мочой из
организма выделяется не более 0,15 г белка в сутки.
проксимальной. Однако, существенно меняясь под влиянием
регулирующих ее, преимущественно гормональных, воздействий, она определяет
состав конечной мочи и способность почки выделять либо
концентрированную, либо разведенную мочу (в зависимости от водного баланса
организма). В дистальном отделе нефрона происходит активная реабсорбция
ионов натрия. Хотя здесь всасывается всего 10 % от профильтровавшегося
количества катиона, этот процесс обеспечивает выраженное уменьшение
его концентрации в моче и, напротив, повышение концентрации в интер-
стициальной жидкости, что создает значительный градиент осмотического
давления между мочой и интерстицием, необходимый для всасывания из
14. Выделение. Функции почек. Водно-солевой обмен • 625
мочи воды. Анион хлора всасывается в толстой восходящей части петли
Генле благодаря наличию в апикальной мембране клеток эпителия пере-
носчика-котранспортера ионов хлора, натрия и калия, а в дистальных
извитых канальцах и собирательных трубочках анион хлора реабсорбируется
пассивно по электрохимическому градиенту вслед за активным
транспортом натрия. Способность эпителия дистальных канальцев секретировать в
мочу Н-ионы связана с реабсорбцией ионов натрия, этот вид транспорта в
виде обмена натрия на протон получил название «антипорт». Активно
всасывается в дистальном отделе канальцев ионы калия, кальция и фосфатов.
Стенка дистального извитого канальца из-за отсутствия аквапоринов имеет
низкую проницаемость для воды и, несмотря на реабсорбцию здесь ионов
натрия и хлорида, вода почти не всасывается и в собирательные трубки
поступает гипотоническая моча.
Способность почки образовывать концентрированную или разведенную
мочу обеспечивается деятельностью противоточно-множителъной канальце-
вой системы почки, которая представлена параллельно расположенными
коленами петли Генле и собирательными трубочками (рис. 14.11). Моча
двигается в этих канальцах в противоположных направлениях (почему
система и названа противоточной), а процессы транспорта веществ в одном
колене системы усиливаются («умножаются») за счет деятельности другого
колена. Определяющую роль в работе противоточного механизма играет
восходящее колено петли Генле. Его эпителий активно реабсорбирует в
окружающее интерстициальное пространство ионы натрия, поддерживая
гиперосмолярность интерстициальной жидкости. Транспорт натрия
сопряжен с транспортом калия и хлора (Na, К, 2С1-котранспорт) и антипортом с
ионами водорода, осуществляется посредством соответствующих
переносчиков. Проницаемость для воды здесь очень низкая из-за отсутствия
аквапоринов. В результате интерстициальная жидкость становится гиперосмо-
тичной по отношению к содержимому нисходящего колена петли и по
направлению к вершине петли осмотическое давление в окружающей ткани
растет. Клетки эпителия нисходящего колена, содержащие в апикальной
мембране аквапорины 1-го типа (см. рис. 14.8), проницаемы для воды,
которая пассивно уходит из просвета в гиперосмотический интерстиций.
Таким образом, в нисходящем колене моча из-за всасывания воды
становится все более и более гиперосмотичной, т. е. устанавливается осмотическое
равновесие с интерстициальной жидкостью. В восходящем колене из-за
всасывания натрия моча становится все менее осмотичной и в корковый
отдел дистального канальца восходит уже гипотоничная моча. Однако ее
количество из-за всасывания воды и солей в петле Генле существенно
уменьшилось.
Собирательная трубочка, в которую затем поступает моча, тоже
образует с восходящим коленом петли Генле противоточную систему. Если в
собирательных трубочках вода всасывается мало, а натрий, хлориды,
мочевина продолжают реабсорбироваться, то нефрон выделяет большие
количества гипотоничной слабо концентрированной мочи. Этот процесс носит
название разведения мочи. Он реализуется при необходимости выделения
избытка воды из внутренней среды.
Стенка собирательной трубочки становится проницаемой для воды
только в присутствии вазопрессина. Этот эффект вазопрессина обусловлен
тем, что гормон вазопрессин обеспечивает встраивание в апикальную
мембрану эпителия собирательных клеток молекул аквапорина 2-го типа (см.
рис. 14.8), образующих водные каналы, а в отсутствии вазопрессина аква-
порины-2 путем эндоцитоза поглощаются внутрь клеток, что носит назва-
626 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
I 1200
800 1
Na m
Н20 1000 о
-Вазопрессин 2
1200 |
Петля Генле
Собирательная
трубка
Рис. 14.11. Противоточно-множительная канальцевая система мозгового вещества
почки.
Цифрами обозначены величины осмотического давления интерстициальной жидкости и мочи.
В собирательных трубочках цифрами в скобках обозначено осмотическое давление мочи в
отсутствие вазопрессина (разведение мочи), а цифрами без скобок — осмотическое давление
мочи в условиях действия вазопрессина (концентрирование мочи).
Первичная моча, образовавшаяся путем фильтрации плазмы крови в клубочке, поступает в
проксимальный извитой каналец с осмотическим давлением, изотоничным плазме крови.
Здесь реабсорбируются вода и соли и осмотическое давление остается без изменений. В
нисходящем колене петли Генле вода реабсорбируется в гиперосмотичный интерстиций и по мере
продвижения к вершине моча становится все более гипертоничной. Восходящее колено петли
Генле реабсорбирует в интерстиций ионы натрия, тем самым создавая в нем высокое
осмотическое давление, а в моче, теряющей натрий, осмотическое давление снижается.
Гипотетичная моча поступает в извитые дистальные отделы и собирательные трубочки, где
реабсорбируются натрий и, в присутствии вазопрессина, вода. Если действует вазопрессин и реасорбиру-
ется вода, осмотическое давление мочи растет, она концентрируется и ее выделяется мало.
Если вазопрессина нет, вода не всасывается, а за счет реабсорбции натрия осмотическое
давление становится все ниже и ниже, происходит разведение мочи, ее выделяется много с низким
удельным весом.
ние интернализации водного канала. На базолатеральных мембранах
клеток собирательных трубочек постоянно встроены независимые от
вазопрессина аквапорины 3-го и 4-го типов, свободно пропускающие воду в
интерстициальное пространство. По мере продвижения мочи по
собирательным трубочкам вглубь мозгового вещества вода пассивно уходит в
гиперосмотичный интерстиций и моча становится все более
концентрированной.
Под влиянием вазопрессина реализуется еще один важный для
концентрирования мочи механизм: активация переносчика, усиливающая выход
мочевины из собирательных трубочек, расположенных в глубине мозгового
вещества, в окружающий интерстиций. Всасывание воды в верхних отде-
14. Выделение. Функции почек. Водно-солевой обмен ■ 627
Рис. 14.12. Противоточная
сосудистая система мозгового
вещества почки.
Цифрами обозначены величины
осмотического давления плазмы
крови (в просвете капилляров) и
интерстициальной жидкости.
Пассивная диффузия воды (сплошные
стрелки) происходит по градиенту
осмотического давления, в
результате кровь в нисходящем колене
капилляра теряет воду, натрий и
мочевина пассивно по градиенту
концентрации диффундируют из
интерстиция в кровь и она
становится более высоко осмотичной, а
в восходящем колене капилляра из
крови в интерстиций происходит
диффузия натрия и мочевины, а из
интерстиция в кровь — диффузия
воды. В результате к концу
восходящего колена капилляра
осмотическое давление крови
восстанавливается. Таким образом
сосудистая противоточная система
сохраняет высокие концентрации
натрия и мочевины в интерстиций и
его высокое осмотическое
давление.
лах собирательных
трубочек ведет к нарастанию
концентрации мочевины в
моче, а в самых нижних их отделах, расположенных в глубине мозгового
вещества, вазопрессин повышает проницаемость для мочевины и она
пассивно диффундирует в интерстиций, резко повышая его осмотическое
давление. Таким образом, интерстиций мозгового вещества становится
наиболее высоко осмотичным в области вершины почечных пирамид, где и
происходит увеличение всасывания воды из просвета канальцев в
интерстиций и концентрирование мочи.
Мочевина интерстициальной жидкости по концентрационному
градиенту диффундирует в просвет тонкой восходящей части петли Генле и
вновь поступает с током мочи в дистальные канальцы и собирательные
трубочки. Так осуществляется кругооборот мочевины в канальцах,
сохраняющий высокий уровень ее концентрации в мозговом веществе.
Описанные процессы транспорта мочевины осуществляются, в основном, в юк-
стамедуллярных нефронах, имеющих наиболее длинные петли Генле,
спускающиеся глубоко внутрь мозгового вещества почки.
В мозговом веществе почки имеется и другая — сосудистая
противоточная система, образованная кровеносными капиллярами. Кровеносная сеть
юкстамедуллярных нефронов образует длинные параллельные прямые
нисходящие и восходящие капиллярные сосуды (рис. 14.12),
спускающиеся вглубь мозгового вещества. Двигающаяся по нисходящему прямому
капилляру кровь постепенно отдает воду в окружающее интерстициальное
пространство в силу нарастающего осмотического давления в ткани и,
напротив, обогащается натрием и мочевиной, сгущается и замедляет свое
движение. В восходящем капиллярном отделе сосуда по мере движения
—*■ Пассивная диффузия воды
•*— Пассивная диффузия натрия и мочевины
628 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
крови в ткани с постепенно снижающимся осмотическим давлением
происходят обратные процессы — натрий и мочевина по концентрационному
градиенту диффундируют обратно в ткань, а вода всасывается в кровь (см.
рис. 14.12). Таким образом, сосудистая противоточная система не создает,
а лишь способствует поддержанию высокого осмотического давления в
глубоких слоях ткани мозгового вещества почек, обеспечивая удаление
воды и удержание натрия и мочевины в интерстиции.
Деятельность описанных противоточных систем находится в
зависимости от скорости движения находящихся в них жидкостей (мочи или
крови). Чем быстрее будет двигаться моча по трубкам противоточной системы
канальцев, тем меньшие количества натрия, мочевины и воды успеют ре-
абсорбироваться в интерстиции и большие количества менее
концентрированной мочи будут выделяться почкой. Чем выше будет скорость
кровотока по прямым капиллярным сосудам мозгового вещества почки, тем
больше натрия и мочевины унесет кровь из почечного интерстиция, так как
они не успеют диффундировать из крови обратно в ткань. Этот эффект
называют «вымыванием» осмотически активных веществ из интерстиция, в
результате его осмолярность падает, концентрирование мочи уменьшается
и почкой выделяется больше мочи низкого удельного веса (разведение
мочи). Чем медленнее происходит движение мочи или крови в мозговом
веществе почек, тем больше осмотически активных веществ накапливается в
интерстиции и выше способность почки концентрировать мочу.
Регуляция канальцевой реабсорбции осуществляется как нервным, так и, в
большей мере, гуморальным путем.
Нервные влияния реализуются преимущественно симпатическими
проводниками и медиаторами через бета-адренорецепторы мембран клеток
проксимальных и дистальных канальцев. Симпатические эффекты
проявляются в виде активации процессов реабсорбции глюкозы, ионов натрия,
воды и анионов фосфатов и осуществляются через систему вторичных
посредников (аденилатциклаза — цАМФ). Нервная регуляция
кровообращения в мозговом веществе почки увеличивает или уменьшает
эффективность сосудистой противоточной системы и концентрирование мочи.
Сосудистые эффекты нервной регуляции также опосредуются через внутри-
почечные системы гуморальных регуляторов — ренин-ангиотензиновую,
кининовую, простагландины и др.
Основным фактором регуляции реабсорбции воды в дистальных отделах
нефрона является гормон вазопрессин, называвшийся ранее
антидиуретическим гормоном. Этот гормон образуется в супраоптическом и паравен-
трикулярных ядрах гипоталамуса, по аксонам нейронов транспортируется
в нейрогипофиз, откуда и поступает в кровь. Влияние вазопрессина на
проницаемость эпителия канальцев обусловлено наличием рецепторов к
гормону, относящихся к У2-типу, на поверхности базолатеральной
мембраны клеток эпителия. Образование гормон-рецепторного комплекса влечет
за собой через посредство GS-белка и гуанилового нуклеотида активацию
аденилатциклазы и образование цАМФ, активацию синтеза и встраивания
аквапоринов 2-го типа («водных каналов») в апикальную мембрану клеток
эпителия собирательных трубочек. Перестройка ультраструктур мембраны
и цитоплазмы клетки ведет к образованию внутриклеточных
специализированных структур, переносящих большие потоки воды по осмотическому
градиенту от апикальной к базолатеральной мембране, не позволяя
транспортируемой воде смешиваться с цитоплазмой и препятствуя набуханию
клетки. Такой трансцеллюлярный транспорт воды через клетки эпителия
реализуется вазопрессином в собирательных трубочках. Кроме того, в дис-
14. Выделение. Функции почек. Водно-солевой обмен • 629
тальных канальцах вазопрессин обусловливает активацию и выход из
клеток гиалуронидаз, вызывающих расщепление гликозаминогликанов
основного межклеточного вещества, тем самым способствуя межклеточному
пассивному транспорту воды по осмотическому градиенту.
Канальцевая реабсорбция воды регулируется и другими гормонами
(табл. 14.1). По механизму действия все гормоны, регулирующие реабсорб-
цию воды, делятся на шесть групп:
• повышающие проницаемость мембран дистальных отделов нефрона
для воды (вазопрессин, пролактин, хорионический гонад отропин);
• меняющие чувствительность клеточных рецепторов к вазопрессину
(паратирин, кальцитонин, кальцитриол, простагландины, альдосте-
рон);
• меняющие осмотический градиент интерстиция мозгового слоя почки
и, соответственно, пассивный осмотический транспорт воды
(паратирин, кальцитриол, тиреоидные гормоны, инсулин, вазопрессин);
• меняющие активный транспорт натрия и хлорида, а за счет этого и
пассивный транспорт воды (альдостерон, вазопрессин, атриопептид,
прогестерон, глюкагон, кальцитонин, простагландины);
• повышающие осмотическое давление канальцевой мочи за счет нере-
абсорбированных осмотически активных веществ, например глюкозы
(контринсулярные гормоны);
• меняющие кровоток по прямым сосудам мозгового вещества и, тем
самым, накопление или «вымывание» осмотически активных веществ
из интерстиция (ангиотензин-П, кинины, простагландины,
паратирин, вазопрессин, атриопептид).
Канальцевая реабсорбция электролитов, так же как и воды,
регулируется преимущественно гормональными, а не нервными влияниями.
Реабсорбция ионов натрия в проксимальных канальцах активируется
альдостероном и угнетается паратирином, в толстой части восходящего
колена петли Генле реабсорбция натрия активируется вазопрессином, глюка-
гоном, кальцитонином, а угнетается — простагландинами Е. В дистальном
отделе канальцев главными регуляторами транспорта натрия являются
альдостерон (активация), простагландины и атриопептид (угнетение).
Основной активатор реабсорбции натрия — альдостерон — обеспечивает
образование и активацию всех структур, необходимых для транспорта натрия:
компонентов натрий-калиевого насоса базолатеральной мембраны и ферментов
его энергетического обеспечения, структур натриевых каналов апикальной
мембраны и переносчиков иона. Наиболее отчетливо выражена активация
реабсорбции ионов натрия под влиянием альдостерона в корковом отделе
собирательных трубочек. Действие альдостерона имеет место не только в
почках, но также и в желудочно-кишечном тракте, железах внешней
секреции — везде этот гормон способствует всасыванию натрия в кровь. В почках
альдостерон стимулирует также секрецию ионов калия в мочу.
Регуляция канальцевого транспорта ионов кальция, фосфата и частично
магния обеспечивается, в основном, кальций-регулирующими гормонами.
Влияния паратирина отличаются в разных отделах канальцевого аппарата
почки. В проксимальных канальцах (прямой отдел) всасывание кальция
происходит параллельно с транспортом натрия и воды. Угнетение
реабсорбции ионов натрия в этом отделе под влиянием паратирина
сопровождается параллельным снижением реабсорбции ионов кальция. За
пределами проксимального канальца паратирин избирательно усиливает реабсорб-
цию кальция, особенно в дистальном извитом канальце и корковой части
собирательных трубочек. Реабсорбция ионов кальция активируется также
630 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
кальцитриолом, а подавляется кальцитонином. Всасывание анионов
фосфата в канальцах почки угнетается и паратирином (проксимальная реаб-
сорбция), и кальцитонином (дистальная реабсорбция), а усиливается
кальцитриолом и соматотропином. Паратирин активирует реабсорбцию ионов
магния в корковой части восходящего колена петли Генле и тормозит
проксимальную реабсорбцию аниона бикарбоната.
14.2.1.3. Канальцевая секреция и ее регуляция
Канальцевой секрецией называют активный транспорт в мочу веществ,
содержащихся в крови или образуемых в самих клетках канальцевого
эпителия, например аммиака. Секреция осуществляется, как правило, против
концентрационного или электрохимического градиента с затратами
энергии. Путем канальцевой секреции из крови выделяются как ионы К+, Н+,
органические кислоты и основания эндогенного происхождения, так и
поступившие в организм чужеродные вещества, в том числе органического
происхождения. Для ряда чужеродных организму веществ органической
природы (антибиотиков, красителей и рентгеноконтрастных препаратов)
скорость и интенсивность выделения из крови путем канальцевой
секреции значительно превышает их выведение путем клубочковой фильтрации.
Таким образом канальцевая секреция является одним из механизмов
обеспечения гомеостазиса в организме.
Способностью к секреции обладают клетки эпителия проксимального и
дистальных отделов канальцев. При этом клетки проксимальных
канальцев секретируют органические соединения с помощью специальных
переносчиков: один из которых обеспечивает секрецию органических кислот
(парааминогиппуровой кислоты, диодраста, фенолрота, пенициллина
и др.), а другой — секрецию органических оснований (гуанидина,
пиперидина, тиамина, холина, серотонина, хинина, морфина и т. п.). Молекулы
переносчиков, расположенные в базолатеральной мембране эпителиальных
клеток канальцев, обеспечивают поступление органических веществ из
околоканальцевой жидкости и крови в цитоплазму клеток. Перемещаясь
внутри клеток к апикальной мембране, секретируемые вещества затем
проходят через нее в просвет канальца с помощью облегченной диффузии. В
базальной мембране клеток имеются переносчики — котранспортеры,
использующие энергию движения натрия по градиенту концентрации.
Секреция водородных ионов происходит в проксимальных канальцах в
большей мере, чем в дистальных. Однако дистальная секреция водородных
ионов играет основную роль в регуляции кислотно-основного состояния
внутренней среды.
Секреция ионов калия происходит в дистальных канальцах и
собирательных трубочках. Поскольку почти весь профильтровавшийся калий ре-
абсорбируется в канальцах до дистальной извитой их части, то
выделяемый с мочой калий является результатом его секреции в дистальных
извитых канальцах и собирательных трубочках. Регуляция выделения ионов
калия осуществляется альдостероном, усиливающим секрецию К+ и
подавляющим его реабсорбцию. Секреция аммиака, образующегося в самих
клетках эпителия, происходит в проксимальном и в дистальном отделах.
Регуляция канальцевой секреции осуществляется с помощью гормонов
и симпатической нервной системы. Эффекты нервной регуляции
реализуются за счет изменений кровотока в постгломерулярных капиллярах
почки, т. е. транспорта веществ кровью к секретирующим клеткам, и влияния
на энергетический обмен в клетках эпителия канальцев. Гормонами, уси-
14. Выделение. Функции почек. Водно-солевой обмен • 631
ливающими проксимальную канальцевую секрецию органических веществ
за счет метаболических эффектов, являются соматотропин аденогипофиза,
йодсодержащие гормоны щитовидной железы и андрогены.
Процесс секреции некоторых веществ в проксимальных канальцах идет
настолько интенсивно, что за одно прохождение крови через корковое
вещество почек из нее удаляются полностью путем секреции такие вещества,
как, например, парааминогиппуровая кислота или рентгеноконтрастные
препараты. Следовательно, определяя клиренс этих веществ, можно
рассчитать объем плазмы крови, проходящей в единицу времени через кору
почек, или величину эффективного (т. е. участвующего в мочеобразовании)
почечного плазмотока.
14.2.1.4. Состав и свойства конечной мочи
В сутки у человека образуется и выделяется от 0,7 до 2 л мочи. Эта величина
носит название суточного диуреза и зависит от количества выпитой
жидкости, так как здоровым человеком выделяется 65—80 % ее объема с мочой.
Основное количество мочи образуется днем, тогда как ночью оно
составляет не более половины дневного объема. Удельный вес мочи колеблется в
широком диапазоне — от 1005 до 1025, обратно пропорционально объему
принятой жидкости и образовавшейся мочи. Реакция суточной мочи
обычно слегка кислая, однако рН колеблется в зависимости от характера
питания. При растительной пище моча приобретает щелочную реакцию, а при
белковой — становится более кислой. Моча обычно прозрачна, но имеет
небольшой осадок, получаемый при центрифугировании и состоящий из
малого количества эритроцитов, лейкоцитов и эпителиальных клеток. В
осадке мочи, собранной за 12 ночных часов, содержится от 0 до 400 000
эритроцитов, от 300 000 до 1,8 миллионов лейкоцитов. Здесь также могут
присутствовать кристаллы мочевой кислоты, уратов и оксалата кальция (в кислой
моче) или кристаллы мочекислого аммония, фосфорнокислого и
углекислого кальция (в щелочной моче). Белок и глюкоза в конечной моче
практически отсутствуют, содержание аминокислот не превышает 0,5 г за сутки.
Поскольку в канальцах нефрона происходит обратное всасывание основной
части профильтровавшейся воды, солей и других веществ, то выделяется их
с мочой от 45 % (мочевина) до 0,04 % (бикарбонат) от
профильтровавшегося количества. Однако за счет всасывания воды и процессов
концентрирования мочи, а также секреции в канальцах, содержание в конечной моче
ряда веществ превышает их концентрацию в плазме крови: мочевины в 67 раз,
калия в 7, сульфатов в 90, фосфатов в 16 раз, тем самым обеспечивается
эффективность их экскреции из организма. В небольших количествах в мочу
поступают производные продуктов гниения белков в кишечнике — индола,
скатола, фенола. В моче содержится широкий спектр органических кислот,
небольшие концентрации витаминов (кроме жирорастворимых), биогенные
амины и их метаболиты, стероидные гормоны и их метаболиты, ферменты
и пигменты, определяющие цвет мочи. С мочой в разных концентрациях,
зависящих от ее количества, выделяются практически все неорганические
катионы и анионы, в том числе и широкий спектр микроэлементов.
14.2.1.5. Механизмы выведения мочи и мочеиспускания
Образовавшаяся в структурах нефрона моча поступает в почечные
лоханки. По мере их заполнения и растяжения достигается порог раздражения
механорецепторов, приводящий к рефлекторному сокращению мускулату-
632 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ры лоханки и раскрытию мочеточника. За счет перистальтических
сокращений их гладкой мускулатуры моча поступает в мочевой пузырь. Гладкие
мышцы лоханки и мочеточников обладают значительной степенью автома-
тии, в связи с чем их перистальтика вызывается растяжением объемом
поступающей мочи.
Заполняющая мочевой пузырь моча по мере накопления начинает
растягивать его стенки, но при этом напряжение стенок пузыря не
повышается до определенной величины растяжения, обычно соответствующей
объему мочи в пузыре около 400 мл. Появление напряжения стенки мочевого
пузыря вызывает позывы к мочеиспусканию, так как раздражение механо-
рецепторов ведет к поступлению афферентной информации в крестцовые
отделы спинного мозга и формированию сложного рефлекторного акта.
В этом акте участвуют не только спинальные, но и расположенные в
головном мозге центральные структуры, позволяющие осуществлять
произвольную задержку мочеиспускания или его начало, а также
обеспечивающие сенсорно-эмоциональную реакцию. Акт мочеиспускания реализуется
благодаря тому, что эфферентные имупльсы из спинального центра по
парасимпатическим нервным волокнам достигают мочевого пузыря и
мочеиспускательного канала, одновременно обеспечивая сокращение гладкой
мышцы стенки мочевого пузыря и расслабление двух сфинктеров — шейки
мочевого пузыря и мочеиспускательного канала.
14.2.2. Экскреторная функция почек
Экскреторная функция почек состоит в выделении из внутренней среды
организма с помощью процессов мочеобразования конечных и
промежуточных продуктов обмена (метаболитов), экзогенных веществ, а также
избытка воды и физиологически ценных минеральных и органических
соединений. Особое значение для жизнедеятельности организма имеет при этом
выделение продуктов азотистого метаболизма (мочевина, мочевая кислота,
креатинин и др.), Н+-ионов, индолов, фенолов, гуанидинов, аминов и
ацетоновых тел. Их экскреция осуществляется преимущественно почками, а
накопление этих веществ в крови при нарушении экскреторной функции
почек ведет к развитию токсического состояния, называемого уремией.
14.2.3. Метаболическая функция почек
Состоит в обеспечении гомеостазиса обменных процессов в организме,
поддержании во внутренней среде определенного уровня и состава
компонентов метаболизма. При этом участие почки в процессах обмена веществ
в организме обеспечивается не только экскрецией субстратов и
метаболитов, но и протекающими в ней биохимическими процессами. Почка мета-
болизирует фильтрующиеся с мочой пептиды малой молекулярной массы
и денатурированные белки, возвращая в кровь аминокислоты и
поддерживая в крови уровень этих пептидов, в том числе и гормонов. Ткань коры
почки обладает способностью к новообразованию глюкозы — глюконеоге-
незу, причем в расчете на единицу массы органа эта способность у почки
выше, чем у печени. При длительном голодании примерно половина
поступающей в кровь глюкозы образуется почками. Почка является
основным органом окислительного катаболизма инозитола, здесь синтезируются
важный компонент клеточных мембран фосфатидилинозитол, глюкуроно-
вая кислота, триацилглицерины и фосфолипиды, поступающие в
кровоток, а также простагландины и кинины.
14. Выделение. Функции почек. Водно-солевой обмен • 633
14.2.4. Роль почек в регуляции артериального давления
Почки участвуют в регуляции артериального давления благодаря
нескольким механизмам.
1. В почках образуется ренин, являющийся частью ренин-ангиотензин-
альдостероновой системы (РААС), которая обеспечивает регуляцию тонуса
кровеносных сосудов, поддержание баланса натрия в организме и объема
циркулирующей крови, активацию адренергических механизмов регуляции
насосной функции сердца и сосудистого тонуса. Уменьшение уровня
давления крови в приносящей артериоле клубочка, повышение
симпатического тонуса и концентрации натрия в моче дистального канальца активирует
секрецию ренина, что с помощью ангиотензина-Н и альдостерона
способствует нормализации сниженной величины артериального давления.
Неадекватно избыточная секреция ренина и активация РААС может быть
причиной повышенного артериального давления.
2. В почке образуются вещества депрессорного действия, т. е.
снижающие тонус сосудов и артериальное давление. Их образование получило
название «антигипертензивной» функции почек, поскольку ее нарушение
может приводить к артериальной гипертензии.
Антигипертензивные гуморальные факторы почек представлены
несколькими соединениями, образующимися в основном интерстициальны-
ми клетками мозгового вещества: 1) простагландинами — ПГА, ПГЕ, ПГ0,
ПГ,; 2) алкиловыми эфирами фосфатидилхолина (активирующий
тромбоциты фактор); 3) нейтральным липидом мозгового вещества; а также
образующимися в корковом веществе кининами. Активация синтеза почечных
простагландинов происходит при артериальной гипертензии, после ише-
мизации почки, под влиянием норадреналина, вазопрессина,
ангиотензина-Н, почечных кининов и стимуляции почечных симпатических нервов.
Противогипертензивное действие простагландинов заключается как в вазо-
дилатирующем эффекте, так и в стимуляции почечной экскреции ионов
натрия и воды. Большая часть поступающих в кровь простагландинов
разрушается в легких, поэтому в артериальные сосуды не попадает, за
исключением ПП2, почти не деградирущего в малом круге и обладающего
мощным системным вазодилатирующим эффектом. Важное значение для про-
тивогипертензивного действия имеет торможение синаптической передачи
в адренергических синапсах под влиянием ПГЕ. Наличием обратной связи
между простагландинами и ренин-ангиотензин-альдостероновой системой
обусловлен стимулирующий эффект простагландинов на синтез ренина в
юкстагломерулярном аппарате почек.
Алкиловые эфиры фосфатидилхолина и нейтральный липид мозгового
вещества почек в отличие от большинства простагландинов оказывают, в
основном, системное вазодилатирующеее действие и являются поэтому
основными гемодинамическими антигипертензивными факторами почек.
Кининовая система почек проявляет антигипертензивное действие как за
счет системного вазодилатирующего эффекта, так и, в большей мере,
благодаря внутрипочечной вазодилатации, повышению почечного кровотока,
диуретическому и натрийуретическому эффектам.
3. Почка экскретирует воду и электролиты, а их содержание в крови,
вне- и внутриклеточной среде является важным для поддержания уровня
артериального давления. Задержка ионов натрия и воды во внутренней
среде обеспечивает прирост объема циркулирующей крови. Однако
большую роль играет содержание ионов натрия, калия и кальция во вне- и
внутриклеточной среде, поскольку оно определяет сократимость миокарда
634 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
и сосудистый тонус, а также реактивность сердца и сосудов к регулятор-
ным нейрогуморальным влияниям.
4. Почки участвуют в регуляции артериального давления с помощью
феномена «давление—натрийурез—диурез», суть которого заключается в
том, что повышение артериального давления вызывает увеличение
экскреции с мочой ионов натрия, возрастание объема диуреза и, в итоге,
восстановление уровня артериального давления. Четыре основных механизма
лежат в его основе. Во-первых, повышенное артериальное давление тормозит
секрецию ренина, образование в почечной циркуляции ангиотензина-П, и
в результате ослабляется стимуляция ангиотензином реабсорбции ионов
натрия. Во-вторых, повышенное артериальное давление увеличивает
образование в почках натрийуретических веществ: окиси азота и простагланди-
нов Е2, продукции последнего способствует и снижение уровня
ангиотензина-П. В-третьих, повышенное артериальное давление способствует росту
гидростатического давления в почечном интерстиции, что уменьшает реаб-
сорбцию воды и натрия. В-четвертых, повышение артериального давления
ускоряет кровоток по прямым сосудам мозгового вещества почки. Это
приводит к вымыванию осмотического градиента натрия и мочевины, что
снижает реабсорбцию воды, а следовательно, ослабляет
концентрационную способность почки. Таким образом происходит увеличение натрий-
уреза и диуреза, следствием которых является уменьшение объема
циркулирующей крови, снижение прессорной активности сосудов, и в
результате нормализуется артериальное давление.
14.3. Водно-солевой обмен
Водно-солевым обменом называют совокупность процессов поступления
воды и электролитов в организм, распределения их во внутренней среде и
выделения из организма. Жизнедеятельность биологических систем,
являющихся с позиций термодинамики открытыми, требует равновесия или
баланса, общего поступления веществ и энергии (как экзо-, так и
эндогенных) с общим их выведением из системы. Наличие у большинства живых
систем основного циркадианного (суточного) ритма обусловливает баланс
основных веществ и энергии во временнбм промежутке, равном 24 ч.
Отсутствие в системе равенства суточного поступления и выведения веществ
позволяет говорить о нарушении баланса или дисбалансе — основном
признаке нарушения гомеостазиса. При этом обычно выделяют два полярных
состояния — положительный баланс (когда поступление вещества вместе с
его эндогенным образованием превышает выведение из системы) и
отрицательный баланс (выведение превышает сумму поступления и
образования).
14.3.1. Внешний водный баланс организма
Баланс между поступлением веществ из внешней среды и их выделением
из внутренней среды носит название «внешнего баланса». У здорового
человека поддерживается равенство объемов выделяющейся из организма и
поступившей в него за сутки воды, что называют внешним водным балансом
организма. Средние показатели внешнего водного баланса здорового
человека в состоянии покоя показаны в табл. 14.2. Принято рассматривать
также и внешний баланс электролитов — натрия, калия, кальция и других
веществ (табл. 14.3).
Вода является важнейшим неорганическим компонентом организма,
14. Выделение. Функции почек. Водно-солевой обмен • 635
обеспечивающим связь внешней и внутренней среды, транспорт веществ
между клетками и органами. Являясь растворителем органических и
неорганических веществ, вода представляет собой основную среду
развертывания метаболических процессов. Она входит в состав различных систем
органических веществ. Каждый грамм гликогена, например, содержит 1,5 мл
воды, каждый грамм белка — 3 мл воды. При ее участии формируются
клеточные мембраны, транспортные частицы крови, макромолекулярные и
надмолекулярные образования.
В процессе обмена веществ и окислении водорода, отделенного от
субстрата, образуется эндогенная «вода окисления», причем ее количество
зависит от вида распадающихся субстратов и уровня обмена веществ. Так, в
покое при окислении 100 г жира образуется более 100 мл воды, 100 г
белка — около 40 мл воды, 100 г углеводов — 55 мл воды. Повышение
катаболизма и энергетического обмена ведет к увеличению объема образуемой
эндогенной воды.
Однако эндогенной воды у человека недостаточно для обеспечения
водной среды метаболических процессов, особенно выведения в
растворенном виде продуктов метаболизма. В частности, повышение потребления
белков и, соответственно, конечное превращение их в мочевину,
удаляемую из организма с мочой, ведет к абсолютной необходимости
возрастания потерь воды в почках, что требует повышенного ее поступления в
организм. При питании преимущественно углеводной, жировой пищей и
небольшом поступлении в организм NaCl потребность организма в
поступлении воды меньше, так как и эндогенной воды образуется больше, и для
экскреции веществ с мочой воды требуется меньше. У здорового взрослого
человека суточная потребность в воде колеблется от 1 до 3 л.
Общее количество воды в организме составляет у человека от 44 до
70 % массы тела, или примерно 38—40 л. Содержание ее в разных тканях
варьирует от 10 % в жировой ткани до 83—87 % в почках и крови.
Таблица 14.2. Средние величины параметров внешнего водного баланса организма
человека
Потребление и образование воды
Питье и жидкая пища
С твердой пищей
Эндогенная вода «окисления»
Поступление
Количество, мл/сут
1200
1000
300
2500
Выделение воды
С мочой
С потом
С выдыхаемым воздухом
С калом
Выделение
Количество, мл/сут
1500
500
400
100
2500
Таблица 14.3. Среднесуточный баланс обмена некоторых веществ у человека
Вещества
Натрий (ммоль)
Калий (ммоль)
Хлориды (ммоль)
Азот (г)
Кислоты (мэкв)
нелетучие
летучие
Поступление
пища
155
75
155
10
—
—
метаболизм
50
14 000
моча
150
70
150
9
50
—
Выделение
фекалии
2,5
5,0
2,5
1
—
—
пот и воздух
2,5
—
2,5
—
—
14 000
636 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
14.3.2. Внутренний водный баланс организма
Вода организма образует два водных пространства: внутриклеточное (2Д
общей воды) и внеклеточное ('Д общей воды). Небольшое количество воды
входит в жидкости полостей тела: брюшной, плевральной и т. д., а также в
цереброспинальную, внутриглазную, внутрисуставную жидкости.
Внеклеточное водное пространство включает два сектора (рис. 14.13): 1) внутри-
сосудистый водный сектор, т. е. плазму крови, объем которой составляет
около 8 % общей воды организма, и 2) интерстициальный водный сектор,
содержащий 'Д всей воды организма (15 % массы тела) и являющийся
наиболее подвижным, меняющим объем при избытке или недостатке воды
в теле. Вся вода организма обновляется примерно через месяц, а
внеклеточное водное пространство — за неделю.
Таким образом, в организме человека вода распределена неодинаково в
разных водных средах, тканях, клетках и внеклеточном пространстве.
Концентрации ионов различаются в водных пространствах и секторах, причем
перемещения через биологические мембраны клеток одних ионов
вызывают движение, часто в противоположном направлении, других (Na+ и К+; К+
и Н+; и др.). Соответственно, соотношение содержания воды и веществ в
разных средах внутренней среды получило название «внутреннего баланса».
Система регуляции водного баланса обеспечивает два основных гомео-
статических процесса: во-первых, поддержание постоянства общего объема
жидкости в организме и, во-вторых, оптимальное распределение воды
между водными пространствами и секторами организма. К числу факторов
поддержания водного гомеостазиса относятся осмотическое и онкотиче-
ское давление жидкостей водных пространств, гидростатическое и
гидродинамическое давление крови, проницаемость гистогематических барьеров
и других мембран, активный транспорт электролитов и неэлектролитов,
нейроэндокринные механизмы регуляции деятельности почек и других
органов выделения, а также питьевое поведение и жажда.
14.3.3. Электролитный, или солевой, баланс организма
Водный баланс организма тесно связан с обменом электролитов.
Суммарная концентрация минеральных и других ионов создает величину
осмотического давления водных пространств
организма. Концентрация отдельных
минеральных ионов в жидкостях
внутренней среды определяет
функциональное состояние возбудимых и
невозбудимых тканей, а также состояние
проницаемости биологических мембран,—
поэтому принято говорить о
водно-электролитном (или солевом) обмене.
Поскольку синтез минеральных ионов в
Рис. 14.13. Распределение воды по секторам
водных пространств в % от общего
содержания воды в организме. Наибольший объем
воды приходится на внутриклеточное
пространство, а наименьший — на плазму крови
или внутрисосудистый сектор
внеклеточного водного пространства.
8%
67%
^В —Плазма
— Интерстициальная жидкость
tvO — Внутриклеточная жидкость
14. Выделение. Функции почек. Водно-солевой обмен • 637
организме не осуществляется, они должны поступать в организм с пищей
и питьем. Для поддержания электролитного баланса и, соответственно,
жизнедеятельности организм в сутки должен получать примерно 130
ммоль натрия и хлора, 75 ммоль калия, 26 ммоль фосфора, 20 ммоль
кальция и других элементов.
Основным катионом внеклеточного водного пространства является
натрий, а анионом — хлор. Во внутриклеточном пространстве основной
катион — калий, а анионами являются фосфат и белки.
Для обеспечения физиологических процессов важна не столько общая
концентрация каждого электролита в водных пространствах, сколько их
активность или эффективная концентрация свободных ионов, поскольку
часть ионов находится в связанном состоянии (Са2+ и Mg2+ с протеинами,
Na+ в ячейках клеточных органелл и и т. п.). Роль электролитов в
жизнедеятельности организма многообразна и неоднозначна.
Натрий поддерживает осмотическое давления внеклеточной жидкости,
причем его дефицит не может быть восполнен другими катионами.
Изменение уровня натрия в жидкостях организма неизбежно влечет за собой
сдвиг осмотического давления и в результате — объема жидкостей.
Уменьшение концентрации натрия во внеклеточной жидкости способствует
перемещению воды в клетки, а увеличение содержания натрия —
способствует выходу воды из клеток. Количество натрия в клеточной микросреде
определяет величину мембранного потенциала и, соответственно,—
возбудимость клеток.
Основное количество калия (98 %) находится внутри клеток в виде
непрочных соединений с белками, углеводами и фосфором. Часть калия
содержится в клетках в ионизированном виде и обеспечивает их
мембранный потенциал. Во внеклеточной среде небольшое количество калия
находится преимущественно в ионизированном виде. Обычно выход
калия из клеток зависит от увеличения их биологической активности,
распада белка и гликогена, недостатка кислорода. Концентрация калия
увеличивается при ацидозе и снижается при алкалозе. Уровень калия в
клетках и внеклеточной среде играет важнейшую роль в деятельности
сердечно-сосудистой, мышечной и нервной систем, в секреторной и
моторной функциях пищеварительного тракта, экскреторной функции
почек.
Кальций участвует в физиологических процессах только в
ионизированном виде. Этот катион необходим для обеспечения возбудимости нервно-
мышечной системы, проницаемости мембран, свертывания крови.
Ионизация кальция в крови зависит от ее рН. При ацидозе содержание
ионизированного кальция повышается, а при алкалозе — падает. Алкалоз и
снижение уровня кальция во внеклеточной среде ведут к резкому снижению
порога возбуждения, повышению нейромышечной возбудимости и тетани-
ческим судорогам. Влияет на уровень свободного ионизированного
кальция и концентрация белков в плазме крови. Содержание кальция в крови
поддерживается в норме в диапазоне 2,3—2,6 ммоль/л. Внутриклеточный
ионизированный кальций является важнейшим вторичным посредником
нервно-гуморальных регуляторных влияний на клетки, обеспечивает
процессы освобождения медиаторов в синапсах и секрецию гормонов,
энергетику клетки. Основное депо кальция — костная ткань, в которой
содержится 90 % катиона в связанном виде.
Магний, как и калий, является основным внутриклеточным катионом,
его концентрация в клетках значительно выше, чем во внеклеточной среде.
Половина всего количества магния находится в костях, 49 % в клетках
638 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
мягких тканей и лишь 1 % во внеклеточном водном пространстве. Уровень
магния в крови составляет 0,7—1,0 ммоль/л, при этом более 60 % катиона
находится в ионизированном виде. Магний находится в составе более 300
разных ферментных комплексов, обеспечивая их активность. Он
способствует синтезу белков, необходим для поддержания состояния клеточных
мембран. Увеличивая потенциал покоя и порог возбуждения клеток,
катион уменьшает возбудимость нервно-мышечной системы, сократительную
способность миокарда и гладких мышц сосудов, оказывает депрессивное
действие на психические функции.
Главным анионом внеклеточной жидкости является хлор. Его
концентрация в плазме крови в норме колеблется от 90 до 105 ммоль/л. Поступая
в клетку через хлорные каналы, анион участвует в формировании
потенциала покоя возбудимых клеток, а способствуя гиперполяризации
мембран — определяет формирование процессов синаптического и преси-
наптического торможения. Избыток хлора ведет к ацидозу. Анион
необходим для образования соляной кислоты в желудке.
Фосфаты являются основными внутриклеточными анионами,
концентрация их в клетках выше, чем во внеклеточной среде, в 40 раз.
Содержание неорганического фосфата в крови составляет 0,94—1,44 ммоль/л, но
50 % неорганического фосфата находится в костях, где он вместе с
кальцием образуют основное минеральное вещество костной ткани. Фосфаты —
необходимый компонент клеточных мембран, играют ключевую роль в
метаболических процессах, входя в состав многих коферментов, нуклеиновых
кислот и фосфопротеинов, вторичных посредников и макроэргических
соединений.
Сульфаты в большем количестве содержатся во внутриклеточном
пространстве, входят в состав многих биологически активных веществ. В
плазме крови неорганических сульфатов содержится 0,3—1,5 ммоль/л. Они
участвуют в обезвреживании токсичных соединений в печени.
Для гомеостаза электролитов необходимо взаимодействие нескольких
процессов: поступление в организм, перераспределение и депонирование в
клетках и их микроокружении, выделение из организма. Поступление их в
организм зависит от состава и свойств пищевых продуктов и воды,
особенностей их всасывания в желудочно-кишечном тракте и состояния энте-
рального барьера. Однако, несмотря на широкие колебания количества и
состава пищевых веществ и воды, внешний водно-солевой баланс в
здоровом организме неуклонно поддерживается за счет изменений экскреции с
помощью органов выделения. Основную роль в этом гомеостатическом
регулировании выполняют почки.
14.3.4. Общие принципы регуляции водно-солевого обмена
Регуляция водно-солевого обмена включает афферентное, центральное и
эфферентное звенья. Афферентное звено представлено массой рецептор-
ных аппаратов сосудистого русла, тканей и органов, воспринимающих
сдвиги осмотического давления, объема жидкостей и их ионного состава.
В результате в нервных центрах промежуточного мозга (гипоталамус, эпи-
таламус), лимбической системы и коры больших полушарий создается
интегрированная картина состояния водно-солевого баланса в организме.
Следствием центрального анализа является изменение питьевого и
пищевого поведения, перестройка работы желудочно-кишечного тракта и
системы выделения (прежде всего функции почек), реализуемая через
эфферентные звенья регуляции. Последние представлены вегетативной нервной
14. Выделение, Функции почек. Водно-солевой обмен • 639
системой и, в большей мере, гормонами нейрогипофиза (вазопрессин, ок-
ситоцин), миокарда (атриопептид), коры надпочечников (альдостерон),
других эндокринных желез.
Важнейшим элементом регуляции водно-солевого обмена является
осуществляемое осморегулирующими системами организма поддержание
осмотического гомеостазиса. Его основными показателями являются
осмотические давления крови, интерстициальнои жидкости, внутриклеточной
среды. Осмотическое давление любой жидкости внутренней среды,
являющейся сложным раствором, равно сумме парциальных осмотических
давлений содержащихся в ней ингредиентов. Осмотическое давление,
создаваемое каждым из ингредиентов, зависит от его концентрации.
Осмотическое давление принято выражать в миллиосмолях. Для электролитов
величина парциального осмотического давления определяется согласно их
валентности: одновалентные ионы создают число миллиосмолеи, равное их
концентрации в миллимолях, а для двухвалентных ионов количество
миллиосмолеи составляет половину их концентрации в миллимолях.
Осмотическое давление плазмы крови у здорового человека относится к числу
жестких гомеостатических констант и находится в пределах 275—305 моем/
кг, при этом электролиты создают осмотическое давление порядка 270—
300 мосм/кг, а остальная незначительная часть общего осмотического
давления приходится на неэлектролиты — сахар, мочевину, липиды и т. д. В
условиях патологии осмотическое давление плазмы крови может выходить
за пределы нормального диапазона колебаний. Границы осмотического
давления, совместимого с жизнью человека, находятся в пределах 203—
375 мосм/кг.
14.4. Интегративные механизмы регуляции водно-солевого обмена
и гомеостатическая функция почек
Водно-солевой гомеостазис является одной из важнейших констант
внутренней среды организма. От состояния водно-солевого обмена зависят
фундаментальные свойства клеток и тканей (энергетический и
пластический метаболизм, возбудимость, проводимость и сократимость,
секреторная способность и т. п.) и, соответственно, функции практически всех
физиологических систем. Основные характеристики водно-солевого
обмена — количество поступающих в организм жидкости и солей, объемы
внеклеточных и внутриклеточных водных пространств, содержание в них
отдельных электролитов и осмотическое давление, наконец, выделение воды
и солей почками — имеют взаимосвязанные комплексные механизмы
регуляции. Эти механизмы легко проследить на примерах изменения приема
жидкости или ее потерь, сдвигов баланса ионов натрия и калия,
изменения объема крови.
Нарушения баланса веществ могут проявляться в виде положительного
или отрицательного дисбаланса. Положительный водный дисбаланс
получил название гипергидратации, а отрицательный — дегидратации.
Изменения водного баланса могут сопровождаться или не сопровождаться
изменениями электролитного баланса и, соответственно, осмотического
давления. В зависимости от осмолярности виды водного дисбаланса
подразделяют на изоосмотические, гиперосмотические и гипоосмотические. Эти
понятия относят к внеклеточной среде организма, но благодаря механизмам
саморегуляции поддерживается осмотическое равновесие между вне- и
внутриклеточной средой, поэтому изменения осмолярности внеклеточной
среды неизбежно сопровождаются аналогичными сдвигами осмотического
640 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
давления и внутри клеток. Водный дисбаланс может быть и следствием
изменения коллоидно-осмотического (онкотического) давления плазмы
крови.
14.4.1. Гомеостатические механизмы при гиперосмотической
дегидратации
Такой вид водного дисбаланса возникает при дефиците поступления воды
в организм, а также в случаях, когда потери воды превышают потери солей
или при потерях свободной от электролитов воды. Примером этого типа
дисбаланса является пребывание человека в пустыне, когда недостаток
воды для питья сочетается с повышенными перспирационными (через кожу
и дыхательные пути) потерями воды. Недостаточное поступление воды в
организм может быть следствием отсутствия чувства жажды при патологии
диэнцефальной области головного мозга, нарушений режима кормления и
ухода за детьми грудного возраста, больными при потере сознания,
нарушений глотания.
Ограничение приема воды (рис. 14.14) приводит к дегидратации
внутренней среды организма, при этом имеет место повышение осмотического
давления плазмы крови и внеклеточной жидкости, что дало основание
именовать этот вид дегидратации гиперосмотической, или истинной.
Повышение осмотического давления плазмы крови вызывает перераспределение
жидкости и электролитов между кровью, внеклеточной жидкостью и
лимфой, а также между внеклеточной и внутриклеточной средой,
направленное на нормализацию сдвига осмотического давления. Начальные
механизмы регуляции гомеостазиса при этом типе дегидратации заключаются в
буферировании белками и эритроцитами катионов, образовании с ними
сложных химических соединений, с измененными осмотическими
свойствами и гидрофильностью, диффузии осмотически активных веществ из
крови в тканевую жидкость и лимфу, осмотическом токе воды в
противоположном направлении, усилении всасывания воды в кишечнике. При
небольших физиологических уровнях дегидратации этих механизмов может
быть достаточно для обеспечения водно-солевого гомеостазиса.
Повышенное осмотическое давление жидкостей внутренней среды
раздражает осморецепторы, приводя к формированию осморегулирующих
рефлексов и жажды.
Осморегулирующие рефлексы начинаются от периферических и
центральных осморецепторов (рис. 14.15). Периферические осморецепторы
расположены в интерстициальном пространстве тканей и кровеносных сосудах
печени (система воротной вены), сердца, пищеварительного тракта, почек,
селезенки, а также в рефлексогенной зоне каротидного синуса. Поскольку
осмотическое давление связано преимущественно с ионами натрия, часть
осморецепторов являются специализированными натриорецепторами.
Наиболее мощными рецептивными полями для натрия являются интер-
стициальные пространства печени и предсердий. Имеются также тканевые
рецепторы, воспринимающие концентрацию ионов калия, кальция и
магния. Центральные осморецепторы — клетки супраоптического ядра
гипоталамуса, непосредственно воспринимающие сдвиги осмотического
давления притекающей в межуточный мозг крови и концентрацию в ней натрия
(натриорецепторы).
Афферентная информация от тканевых осмо- и натриорецепторов
поступает по волокнам блуждающего нерва и задних корешков спинного
мозга в центральную нервную систему, где направляется в центр осморегу-
14. Выделение. Функции почек. Водно-солевой обмен • 641
Водное голодание
Потери воды
Внеклеточная дегидратация
Уменьшение объема крови и
интерстициальной жидкости
■<->■
Перераспределение
воды и натрия между
внутрисосудистым и
интерстициальным
сектором
Гиперосмия и
Na-гипериония
внеклеточной
среды
Волюморецепторы Осморецепторы Натриорецепторы
Активация
нейросекреции
вазопрессина
Активация
секреции
атриопептида
Повышение
реабсорбции
воды
Подавление
реабсорбции
натрия
Восполнение объемов жидкости
Выведение натрия с мочой
Нормализация объемов и осмотического давления жидкостей внеклеточной среды
Рис. 14.14. Схема компенсаторных реакций при ограничении приема или потерях
воды, т. е. при гиперосмотической дегидратации. Основные реакции направлены на
восполнение объемов воды (жажда, повышение реабсорбции воды в почках) и
выведение избытка натрия с мочой (угнетение реабсорбции катиона в почках).
ляции, локализованный в ядрах переднего гипоталамуса — супраоптиче-
ском и паравентрикулярном. Эфферентное звено осморегулирующих и на-
трийрегулирующих рефлексов включает как вегетативные нервы, так и
гормональные сигналы. Осмо- и натрийрегулирующие рефлексы
увеличивают нейросекрецию и содержание в крови вазопрессина. Избыток ионов
натрия в крови стимулирует секрецию натрийуретического атриопептида.
Вазопрессин повышает в почках проницаемость дистальных канальцев и
собирательных трубочек для воды, и она пассивно реабсорбируется по
осмотическому градиенту, т. е. реализуется механизм концентрирования
мочи. Вазопрессин повышает всасывание воды и в других органах —
кишечнике, желчном пузыре, слюнных и пищеварительных железах. Натрийуре-
тический атриопептид, как и, в меньшей степени, вазопрессин, ведут к
повышенному выведению натрия из крови, что устраняет увеличение
осмотического давления.
21-6095
642 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Сосудистые
осморецепторы
Z
Увеличение осмолярности крови
Центральные
осморецепторы
Вазопрессин
Активация реабсорбции воды, концентрирование мочи, снижение осмолярности крови
Рис. 14.15. Осморегулирующий рефлекс.
Повышение осмотического давления крови при ограниченном поступлении воды в организм
или ее чрезмерных потерях вызывает раздражение сосудистых и центральных (гипоталамиче-
ских) осморецепторов, следствием чего является увеличение секреции в кровь вазопрессина,
активация обратного всасывания воды в канальцах почек и ее поступление в кровь, что ведет
к нормализации осмотического давления крови.
Продукция вазопрессина возрастает и при значительном снижении
объема циркулирующей крови и артериального давления. Это происходит
благодаря механорецептивному рефлексу, берущему начало от
рефлексогенных зон сосудов и сердца.
Важнейшей приспособительной реакцией организма при дегидратации
организма является жажда. Жажда — это субъективное ощущение
человека, возникающее при абсолютном или относительном (к содержанию
натрия) дефиците воды в организме и приводящее к поведенческой реакции
по приему воды. Таким образом, жажда является одной из основных
биологических мотиваций (т. е. побуждений к деятельности), обеспечивающих
поддержание жизнедеятельности человека. Формирование чувства жажды
связано с возбуждением питьевого центра, локализованного в структурах
гипоталамуса и лимбики (рис. 14.16). Возбуждение этого центра
обусловлено несколькими причинами. Во-первых, при повышении осмотического
давления крови и внеклеточной жидкости, уровня натрия в них
происходит раздражение центральных и периферических осморецепторов и
рефлекторное возбуждение центра. Во-вторых, возбуждение центра и
возникновение жажды имеет место и при уменьшении объема циркулирующей
крови без сдвига осмотического давления. В этом случае ее формирование
обусловлено двумя механизмами: 1) волюморефлексом от волюморецепто-
ров правого предсердия и полых вен, возникающим в ответ на уменьшение
растяжения этих областей низкого давления сниженным объемом крови;
14. Выделение. Функции почек. Водно-солевой обмен • 643
Повышение осмотического
давления плазмы
Осморецепторы
ЮГА
Активация РААС
Ангиотензин-П
""*• Гипоталамус -*
■*—
Снижение объема и(или)
артериального давления
крови
"
Механорецепторы
Питьевой центр
t
Жажда
Рис. 14.16. Механизм развития жажды.
Стимуляция гипоталамического питьевого центра и возникновение чувства жажды происходит
под влиянием повышенного осмотического давления крови, образования в крови и ткани
мозга ангиотензина-И, снижении объема крови и артериального давления.
2) уменьшенный объем крови ведет к активации юкстагломерулярного
аппарата почек и секреции ренина, что увеличивает в крови уровень ангио-
тензина-Н. Ангиотензин-И — один из мощных дипсогенных (от греческого
dipsa — жажда) факторов, стимулирующий структуры субфорникального
органа (СФО) межуточного мозга, который является частью питьевого
центра. В-третьих, возбуждение питьевого центра и жажду вызывают ней-
ропептиды, образуемые в самой мозговой ткани. Так, повышение
концентрации натрия в крови при дегидратации влечет образование в мозговой
ткани натрийуретического пептида, подобного атриопептиду, также
относящегося к дипсогенным факторам. Дипсогенными являются и
образуемые в мозговой ткани ангиотензин-И, окситоцин и вазопрессин.
Питьевой центр может возбуждаться и после еды. Механизм жажды в
этих случаях обусловлен гормональными эффектами (рис. 14.17).
Выраженное и продолжительное ограничение приема воды — водное
голодание — ведет к выходу жидкости из клеток во внеклеточную среду и
формированию состояния дегидратации клеток, что вызывает тяжелые
расстройства, особенно со стороны центральной нервной системы, клетки
которой чувствительны к сдвигам водно-солевого гомеостазиса. Как
правило, вместе с водой клетки теряют и К+, что вызывает сдвиги
мембранного потенциала и еще более усугубляет расстройства деятельности нервной
системы и других возбудимых тканей.
Избыточные потери воды (при гипервентиляции легких, обильном
потоотделении при тяжелой физической работе и высокой температуре
среды) также ведут к гипертонической дегидратации, поскольку при этом
потери воды намного превышают потерю электролитов (главным образом,
натрия). Формирующиеся при этом интегративные механизмы регуляции
водно-солевого гомеостазиса аналогичны описанным выше при дефиците
приема жидкости.
21*
644 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Циркумвентрикулярный
сенсорный орган
Рис. 14.17. Механизм жажды после еды.
При поступлении пищи в кишечник двенадцатиперстная кишка и поджелудочная железа сек-
ретируют во внутреннюю среду гормон кальцитонин. Бета-клетки поджелудочной железы,
особенно после сладкой пищи, секретируют гормон амилин. Под влиянием этих гормонов
активируются расположенные в межуточном мозге вокруг III мозгового желудочка структуры,
получившие название циркумвентрикулярного органа, входящего в питьевой центр.
Осмотическое давление плазмы крови (мосм/кг) в норме:
275 280 285 288 290 295 —
I .1. J
300-
Порог роста
секреции
вазопрессина
Водный
баланс
Порог
жажды
305
Нестерпимая
жажда
203-
-^375
Границы выживания
Рис. 14.18. Пороги стимуляции секреции вазопрессина и жажды как факторы
регуляции осмотического гомеостазиса.
При повышении осмотического давления плазмы крови первой регуляторной
приспособительной реакцией является увеличение секреции вазопрессина, а жажда появляется при более
выраженном повышении осмолярности.
Таким образом, основными физиологическими механизмами,
препятствующими повышению осмотического давления жидкостей внутренней
среды, являются повышение секреции вазопрессина и жажда (рис. 14.18).
При этом порог реакции увеличения секреции вазопрессина расположен
на уровне более низких значений осмотического давления, чем порог
жажды; следовательно, в процесс нормализации повышенного осмотического
давления вначале вовлекается прирост секреции вазопрессина, а затем уже
жажда.
14. Выделение. Функции почек. Водно-солевой обмен • 645
14.4.2. Гомеостатические механизмы при изоосмотической
дегидратации
При рвоте и поносах у человека происходит потеря жидкости; изотонич-
ной плазме крови, т. е. теряется не только вода, но и содержащиеся в ней
электролиты, преимущественно ионы натрия и хлорида. Такая
дегидратация носит название изоосмотической и для нее характерен истинный
дефицит натрия в организме. Изотоническая дегидратация сопровождается
уменьшением объема циркулирующей плазмы и крови, что определяет
формирование в организме приспособительных реакций: повышается ней-
росекреция вазопрессина за счет рефлекса с волюморецепторов
предсердий и полых вен (что активирует реабсорбцию воды в почках), усиливается
секреция ренина и повышается в крови содержание ангиотензина и альдо-
стерона (что поддерживает сосудистый тонус и вызывает активацию реаб-
сорбции натрия в дистальных канальцах почек). Поскольку при
изоосмотической дегидратации осмотическое давление внеклеточной и
внутриклеточной жидкости не меняется, жажда может быть мало выраженной.
При этом типе дегидратации происходит потеря и Na+, и воды, а белки
крови и эритроциты сохраняются, поэтому в крови отмечается увеличение
концентрации белка и гематокрита. При выраженной степени
дегидратации и недостаточности компенсаторных механизмов из-за начального
уменьшения объема плазмы крови быстро наступают циркуляторные
нарушения как системной гемодинамики, так и микроциркуляции.
14.4.3. Гомеостатические механизмы при гипоосмотической
дегидратации
При этом виде дисбаланса в организме возникает истинный дефицит Na+,
как правило, связанный с избыточной потерей хлорида натрия при
чрезмерном потоотделении, осмотическом диурезе. Классическим
клиническим примером гипоосмотической дегидратации является потеря натрия
организмом при надпочечниковой недостаточности (дефицит альдосте-
рона).
Поскольку NaCl содержится, в основном, во внеклеточном
пространстве, именно здесь и снижается прежде всего осмотическое давление и вода
начинает перемещаться во внутриклеточное пространство с относительно
более высоким осмотическим давлением. Следствием компенсаторного
перераспределения воды является одновременное уменьшение объема
внеклеточного протсранства (дегидратация) и увеличение объема
внутриклеточного пространства (гипергидратация), а осмолярность в обоих
пространствах оказывается сниженной.
Компенсаторные механизмы при гипоосмотической дегидратации не
всегда эффективны, так как из-за клеточной гипергидратации и
уменьшения осмолярности плазмы крови чувство жажды отсутствует. Если
причиной этого вида дегидратации является не патология надпочечников, а
избыточное потоотделение или осмотический диурез, ведущей
компенсаторной реакцией является повышение секреции альдостерона, вызванное как
снижением Na+ в плазме крови, так и активацией ренин-ангиотензин-аль-
достероновой системы при уменьшении артериального давления.
646 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
14.4.4. Гомеостатические механизмы при гипоосмотической
гипергидратации
Гипоосмотическая гипердегидратация возникает при значительном
поступлении воды в кровь в результате ее всасывания в желудочно-кишечном
тракте или введении в сосудистое русло бессолевых растворов (например,
5 % раствора глюкозы). Возникает этот тип дисбаланса и при почечной
недостаточности, и при циррозе печени. При умеренных физиологических
объемах выпиваемой воды (рис. 14.19), приспособительные реакции
начинаются еще до всасывания воды из желудочно-кишечного тракта в кровь
системной циркуляции, так как снижение осмотического давления слюны
и химуса воспринимаются рецепторами ротовой полости и
пищеварительного тракта, а позднее всасывающаяся в кровь воротной вены вода
уменьшает концентрацию ионов натрия и осмотическое давление крови,
поступающей в печень, где этот сдвиг воспринимается соответствующими осмо-
и натриорецепторами. Возникающее при их раздражении рефлекторное (в
том числе и условно-рефлекторное) подавление нейросекреции вазопрес-
сина и нарастание мочеобразования происходят вскоре после приема жид-
Прием воды
Введение избытка жидкости
Условные и безусловные
рефлексы с рецепторов
ротовой полости и
желудка
Рефлексы с осмо- и
натриорецепторов
кишечника, воротной
вены и печени
Гипергидратация
внеклеточной среды
Снижение
осмотического
давления и
концентрации
натрия
Увеличение
объема
крови
Осморецепторы Волюморецепторы
Натриорецепторы
Подавление нейросекреции вазопрессина
Подавление реабсорбции воды в почках и увеличение диуреза
Выведение избытка жидкости из внутренней среды
Рис. 14.19. Схема компенсаторных реакций, возникающих при гипоосмотической
гипергидратации.
Как при физиологических (прием воды), так и при искусственных условиях (введение избытка
жидкости) в основе компенсации гидратации лежит подавление образования и секреции в
кровь вазопрессина, вследствие чего возрастает выведение избытка воды через почки.
14. Выделение. Функции почек. Водно-солевой обмен • 647
кости. Таким образом, вовлечение систем интегративного контроля водно-
солевого баланса начинается еще до сдвигов уровня натрия и
осмотического давления в крови системной циркуляции, поэтому в обычных
условиях рефлекторная стимуляция почечной экскреции воды и натрия
ограничивает увеличение объема крови из-за всасывания выпитой воды.
Чрезмерный прием воды или введение гипотонических растворов в
сосудистую систему (см. рис. 14.19) вызывают выраженную гипоосмотическую
гипергидратацию, ведут к уменьшению осмотического давления и
концентрации ионов натрия в плазме. Следствием этого является подавление
нейросекреции вазопрессина, стенки дистальных канальцев и
собирательных трубочек в почках остаются непроницаемыми для воды. Поскольку
реабсорбция ионов натрия сохраняется, почки выделяют большие
количества гипотоничной мочи и избыток воды удаляется из крови. В отсутствие
вазопрессина мочевина не реабсорбируется в собирательных трубочках,
что снижает осмолярность интерстиция мозгового вещества почек и тем
самым также ослабляет реабсорбцию воды. Если описанные механизмы
регуляции не обеспечивают выведение объемов воды, адекватных ее
поступившему количеству, устанавливается положительный водный баланс,
вода задерживается в организме. Задержка воды в крови (гидремия) снижает
ее осмотическое давление и вода выходит в ткани — формируются отеки.
14.4.5. Гомеостатические механизмы при изоосмотической
гипергидратации
Это состояние является наиболее частым проявлением у человека
положительного водного баланса с одновременной задержкой NaCl
(недостаточность кровообращения, токсикозы беременности, болезнь Кушинга). При
этом, поскольку ионы Na+ и СГ являются почти исключительно
внеклеточными, имеет место увеличение лишь объема изотонической жидкости
во внеклеточной среде и перемещений воды между вне- и
внутриклеточным пространствами не отмечается. Существенно увеличивается объем ин-
терстициального сектора, где депонируется изотоническая жидкость и
формируются отеки, увеличивается масса тела. Внутриклеточное
пространство остается без изменений. Общее количество воды и натрия в
организме возрастает, но концентрация ионов Na+ остается в пределах нормы.
Несмотря на гипергидратацию возникает потребность в осмотически
свободной воде и нередко появляется жажда. Избыток изотонической жидкости в
системе гемоциркуляции может вести к острой сердечно-сосудистой
недостаточности, острой почечной недостаточности при наличии патологии
почек. Наиболее простым примером этого типа гипергидратации является
внутривенное вливание больших количеств изотонического раствора NaCl.
Следствием гипергидратации внутрисосудистого сектора является
уменьшение гематокрита и концентрации плазменных белков. Избыток
изоосмотической жидкости выводится почками путем увеличения диуреза.
Несоответствие скорости мочеобразования степени гипергидратации ведет к
отекам. В условиях патологии компенсация гипергидратации этого типа
отличается малой эффективностью.
14.4.6. Гомеостатические механизмы при гиперосмотической
гипергидратации
Этот вид водного дисбаланса возникает при первичном альдостеронизме
(синдром Кона), остром гломерулонефрите, введении в организм больших
648 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
количеств гипертонических растворов хлорида натрия, гидрокарбоната в
послеоперационный период, особенно при почечной недостаточности.
Объем и осмолярность внеклеточного пространства увеличиваются из-за
прироста концентрации Na+ и С1+, вода перемещается из
внутриклеточного пространства во внеклеточное до равенства в них осмотического
давления. Вследствие этого объем внутриклеточного пространства уменьшается,
а осмолярность становится повышенной в обоих пространствах. Если не
происходит потерь белка и эритроцитов из плазмы крови, как это бывает
при гломерулонефрите, в крови повышаются гематокрит и концентрация
белка. Компенсация нарушений водно-солевого гомеостазиса при этом
типе дисбаланса осуществляется путем почечного выведения избытка
жидкости и натрия и требует значительного времени. Без устранения причины,
вызвавшей гиперосмотическую гипергидратацию, компенсация
нарушенного гомеостазиса в большинстве случаев не эффективна.
14.4.7. Нарушения баланса электролитов
Нарушения баланса электролитов в организме являются, как правило,
следствием водного дисбаланса. Это прежде всего относится к дисбалансу
ионов натрия, поскольку гиперосмотическая дегидратация и гипоосмоти-
ческая гипергидратация, являясь следствием водного дисбаланса,
неизбежно сопровождаются гипер- или гипонатриемией. Гипер- или дегидратация
внутриклеточного пространства ведут, соответственно, к уменьшению или
повышению содержания внутриклеточных ионов, прежде всего, калия.
Как правило, сдвиги содержания электролитов в плазме крови являются
следствием трех основных механизмов: 1) изменения всасывания в
желудочно-кишечном тракте, 2) перераспределения между вне- и
внутриклеточной средами, в том числе и депонирования, 3) изменения экскреции из
организма, прежде всего через почки. Электролитный гомеостазис
необходим для обеспечения фундаментальных свойств клеток (метаболизм,
регенерация, возбудимость, специфические функции), а также их регуляции и
саморегуляции, поэтому его нарушения ведут к тяжелейшим
расстройствам жизнедеятельности.
ГЛАВА 15
Кислотно-основное состояние
Кислотно-основное состояние (кислотно-щелочное равновесие; кислотно-
щелочной баланс; кислотно-основное равновесие) — одно из важнейших
гомеостатических свойств внутренней среды организма,
характеризующееся относительным постоянством соотношения водородных и гидроксиль-
ных ионов и определяющее оптимальный характер обменных процессов и
физиологических функций.
Основой внутренней среды является вода, молекулы которой при
диссоциации образуют Н+ и ОН- ионы. Соотношение их концентрации
определяет актуальную реакцию жидкостей, прежде всего крови.
Актуальной реакцией называют существующую в организме в
конкретных условиях кислотность или щелочность внутренней среды. От
актуальной реакции среды зависят условия функционирования большинства
белков, так как электронейтральность белковой молекулы определяется ее
изоэлектрической точкой, что напрямую связано с кислотностью среды.
Актуальная реакция среды определяет активность ферментов, для
большинства из которых свойственны свои оптимальные значения реакции
среды. Кислотно-основное состояние внутренней среды определяет в
тканях направление и интенсивность процессов окисления и восстановления,
расщепления и синтеза белков, углеводов и жиров, нуклеиновых кислот,
активность витаминов и микроэлементов. Изменения актуальной реакции
среды помимо метаболизма влияют и на функции клеток, органов и
систем (сердца и сосудов, нервной системы и мышц, легких и почек),
определяют биофизические свойства клеток и молекул, например проницаемость
мембран и возбудимость, степень дисперсности коллоидов и пр.
В свою очередь, кислотно-основное состояние является интегральным
параметром внутренней среды организма и зависит от состояния
клеточного метаболизма, газотранспортной функции крови, процессов питания и
внешнего дыхания, водно-солевого обмена.
Внутриклеточная среда для большинства клеток нейтральна, так как это
обеспечивает оптимальную возможность образования
субстрат-ферментных комплексов. Внеклеточная жидкость и кровь имеют слабую щелочную
реакцию, что способствует нейтрализации и удалению из клеток кислых
метаболитов и Н-ионов.
15.1. Кислоты и основания внутренней среды
Кислотами называют вещества, способные при диссоциации в растворах
выделять ион водорода (донаторы протона), а основаниями или
щелочами — вещества, способные связывать ион водорода (акцепторы протона).
Вода в слабой степени диссоциирована на Н+ и ОН" ионы. При
нейтральной реакции воды в ней имеется одинаковое количество Н+ и ОН"
ионов, при 22 °С составляющее Ю-7 каждого. Произведение Н+ и ОН"
ионов в водном растворе независимо от того, нейтральный, кислый он или
650 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Таблица 15.1. Соотношение величины рН и концентрации водородных ионов ([Н+])
рН
7,7
7,4 (Плазма)
7,3 (Цереброспинальная жидкость)
7,1 (Внутриклеточная жидкость)
7,00
6,9
[Н+] нмоль/л
20
40
50
80
100
126
Таблица 15.2. Актуальная реакция жидкостей организма
Наименование жидкостей
Артериальная кровь
Венозная кровь
Цереброспинальная жидкость
Межклеточная жидкость тканей
Тканевая жидкость мышц
Поджелудочный сок
Желчь печеночная
Желчь пузырная
Слюна
Желудочный сок
Сок тонкой кишки
Сок толстой кишки
РН
7,36-7,42
7,26-7,36
7,24-7,5
7,26-7,38
6,7-6,9
7,8-8,4
7,3-8,0
6,0-7,0
5,8-7,8
1,4-1,8
7,5-8,6
8,0-9,0
щелочной, всегда одинаково и равно: Ю-7 • Ю-7 - Ю-14. Эта величина
называется константой диссоциации воды. Очевидно, что если концентрация
водородных ионов — [Н+] — будет расти, то число ОН" ионов — [ОН-] —
будет уменьшаться.
Поскольку актуальная реакция водного раствора зависит от
соотношения [Н+] и [ОН-], оценивать ее можно по одной из них, т. е., как это
принято, по [Н+]. Таким образом, раствор с нейтральной реакцией имеет
[Н+] = 10, с кислой реакцией — [Н+] >10-7, а со щелочной реакцией —
[Н+] <10-7. Для оценки [Н+] используется отрицательный десятичный
логарифм концентрации, который обозначается рН и называется водородным
показателем. Таким образом, рН = —log[H+]. Следовательно, для
нейтрального раствора рН = 7,0; для кислотного — <7, а для щелочного — >7.
Соотношения величины рН и [Н+] приведены в табл. 15.1.
В норме величина рН в различных жидких средах организма
неодинакова, но ее колебания невелики, рН внутриклеточной, тканевой жидкости
и крови относится к числу жестких гомеостатических констант. В табл.
15.2 приведены значения рН различных сред организма.
Кислоты образуются из принятой пищи и в результате межуточного
обмена веществ. Процессы окисления в клетках обусловливают появление
органических и минеральных кислот. Так, катаболизм серосодержащих
аминокислот вызывает образование серной кислоты; фосфопротеины и
нуклеопротеины ведут к образованию фосфорной и мочевой кислоты; ли-
пиды формируют свободные жирные кислоты; углеводы при окислении и
гликолизе поставляют в кровь пировиноградную и молочную кислоту и
т. п. Углекислый газ, образуемый как конечный продукт процессов
окисления, также является кислотой, поскольку вместе с другим конечным
15. Кислотно-основное состояние • 651
продуктом окисления — водой — дает реакцию: С02 + Н20 -> Н2С03 ->
Н+ + HCOJ
Углекислота является слабой кислотой, но служит в свою очередь
источником углекислого газа, удаляемого через легкие, поэтому она еще
называется летучей кислотой. Другие органические и неорганические
кислоты называют нелетучими. Летучей кислоты образуется в организме намного
больше (до 20 000 ммоль С02), чем нелетучих кислот (около 100 ммоль).
Кислоты, как промежуточный этап метаболизма, являются
биохимической необходимостью, характеризующей процессы жизнедеятельности
клетки. При этом интенсивность образования кислот при метаболизме
является одним из основных факторов, обеспечивающих поступление
протонов во внутреннюю среду. Протоны, поступающие с пищей, играют в рН
внутренней среды существенно меньшую роль. Содержание свободных
водородных ионов в жидкостях зависит от интенсивности их связывания
основаниями и выделения во внешнюю среду.
Основания поступают в организм преимущественно в растительной
пище, богатой щелочными и щелочноземельными солями. Образуются
щелочи и клетками организма, например внешнесекреторными клетками
поджелудочной железы, секрет которых богат ОН-.
Интенсивность образования кислот прямо связана с
окислительно-восстановительными реакциями клеток, обеспечением их кислородом. При
ограничении обеспечения клеток кислородом или наличии кислородного
долга из-за чрезмерной потребности в нем усиливаются или
активизируются процессы анаэробного гликолиза. Появляющиеся в клетках в
избытке пировиноградная и молочная кислоты переходят в тканевую жидкость и
кровь. Так происходит, например, при интенсивной мышечной работе за
счет отставания возможности кислородного обеспечения от потребности в
нем работающей мышцы, в результате для целей энергообеспечения
скорость гликолиза повышается в сотни раз. Образующаяся при этом в
избытке молочная кислота является причиной более низкого рН в тканевой
жидкости скелетных мышц, чем в других тканях.
Однако, несмотря на поступление в кровь пировиноградной и
молочной кислот, так же как и других нелетучих и летучих кислот, рН крови
практически не меняется. Это свидетельствует о наличии в организме
мощных гомеостатических систем, поддерживающих константу рН. К их
числу относят физико-химические (буферные системы внутренней среды,
тканевые обменные процессы) и физиологические гомеостатические
системы (легкие, почки, желудочно-кишечный тракт, костная ткань).
15.2. Физико-химические гомеостатические механизмы
К физико-химическим механизмам кислотно-основного гомеостазиса
относятся буферные системы внутренней среды организма и тканевые
гомеостатические обменные процессы.
15.2.1. Буферные системы внутренней среды организма
Основными буферными системами внутриклеточной, межклеточной
жидкости и крови являются бикарбонатная, фосфатная и белковая буферная
система, причем из последней для крови особо выделяют гемоглобиноный буфер.
Основное значение для поддержания рН межклеточной жидкости и
плазмы крови имеет бикарбонатная буферная система. Угольная кислота в
плазме и межклеточной жидкости присутствует в четырех формах: физиче-
652 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ски растворенного углекислого газа (С02), угольной кислоты (Н2С03),
аниона карбоната (С03) и аниона бикарбоната (гидрокарбонатный анион)
(НС03). В условиях физиологического диапазона рН в плазме крови
больше всего содержание бикарбоната, примерно в 20 раз меньше содержание
растворенного углекислого газа и угольной кислоты, а ион карбоната
практически отсутствует. Бикарбонат представлен в виде натриевых и
калиевых солей. Константа диссоциации (К) есть отношение:
к*со> - 129Шг'адяя бикарбоната - KNoHCO>= [Д"]
Анион НС03 является общим как для кислоты, так и для соли, а соль
диссоциирует сильнее, поэтому данный анион, образуясь из бикарбоната,
будет подавлять диссоциацию угольной кислоты, т. е. практически все
количество аниона HCOJ в бикарбонатном буфере происходит из NaHC03.
Следовательно:
ги пгл [Н*][НСО]] rI7+, K[H2CO}]
КНгС0> = vkcoT* а отсюда: [/П = [ШТсй■
(формула Гендерсона, где К —константа диссоциации угольной кислоты).
В связи с использованием отрицательного логарифма концентрации
формула, названная уравнением Гендерсона—Гассельбаха, для бикарбонатного
буфера приняла выражение:
При физиологических значениях рН отношение концентрации
углекислоты к бикарбонату составляет 1:20 (рис. 15.1).
В условиях взаимодействия бикарбонатного буфера с кислотами
происходит их нейтрализация с образованием слабой угольной кислоты.
Углекислый газ, появляющийся при ее разложении, удаляется через легкие.
Избыток оснований, взаимодействуя с бикарбонатным буфером, связывается
с угольной кислотой и приводит в конечном счете к образованию
бикарбоната, излишки которого удаляются, в свою очередь, из крови через почки.
Другой буферной системой плазмы крови, а в большей мере
внутриклеточной среды, является фосфатная буферная система. Она образована
одно- и двузамещенными слоями фосфорной кислоты, где однозамещенные
соли являются слабыми кислотами, а двузамещенные — имеют щелочные
свойства. Уравнение для фосфатного буфера следующее:
и гл., [NaH2P04]
pH=pK+lg[Na2HP04y
Двухосновной фосфатной соли содержится в плазме в 4 раза больше,
чем кислой одноосновной. Общим анионом в этой системе является
НРО4. Ее буферная емкость меньше, чем бикарбонатной, так как и
фосфатов в крови содержится меньше, чем бикарбонатов. Принцип действия
фосфатного буфера аналогичен бикарбонатному, хотя роль его в плазме
крови мала и, в основном, сводится к поддержанию концентрации
бикарбоната при реакции буфера с избытком угольной кислоты. В то же время в
клетках значение фосфатного буфера велико.
Третьей буферной системой клеток, плазмы крови и межклеточной
жидкости является белковая. Белки выполняют буферную роль из-за их амфо-
15. Кислотно-основное состояние • 653
Рис. 15.1. Кислотно-основное равновесие. Стрелка весов указывает на значения рН
в норме и при смещениях в сторону ацидоза или алкалоза. На чашах весов
помещены Н2С03 (дыхательная компонента) и NaC03 (недыхательная компонента), что
отражает соотношение между ними в норме 1:20.
терности, а характер их диссоциации зависит от природы белка и
актуальной реакции внутренней среды. При этом глобулины обладают более
выраженной кислой диссоциацией, т. е. отщепляют больше протонов, чем гид-
роксильных ионов, и соответственно играют большую роль в
нейтрализации щелочей. Белки, содержащие много диаминокислот, диссоциируют
больше как щелочи и поэтому в большей мере нейтрализуют кислоты.
Буферная емкость белков плазмы крови сравнительно с бикарбонатной
системой невелика, однако в клетках тканей ее роль может быть очень высокой.
Наибольшую буферную емкость крови обеспечивает гемоглобиновая
буферная система. Содержащаяся в гемоглобине человека аминокислота гис-
тидин (до 8,1 %) имеет в своей структуре как кислые (СООН), так и
основные (NH2) группы. Константа диссоциации у гемоглобина ниже, чем
рН крови, поэтому гемоглобин диссоциирует как кислота. Оксигемогло-
бин является более сильной кислотой, чем редуцированный гемоглобин.
При диссоциации оксигемоглобина в капиллярах тканей с отдачей
кислорода появляется большее количество щелочно-реагирующих солей
гемоглобина, способных связывать Н-ионы, поступающие из кислот тканевой
жидкости, например угольной кислоты. Оксигемоглобин обычно
представляет собой калиевую соль. При взаимодействии кислот с калиевой солью
оксигемоглобина образуется соответствующая калиевая соль кислоты и
свободный гемоглобин со свойствами очень слабой кислоты. Гемоглобин в
тканевых капиллярах связывает углекислый газ за счет аминогрупп,
образуя карбогемоглобин:
Hb- NH2+C02 -> Hb- NHCOOH.
654 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Таблица 15.3. Относительная эффективность буферных систем крови
Плазма крови
Бикарбонатная
Белковая
Фосфатная
Общая эффективность буферных
систем
%
35
7
1
43
Эритроциты
Гемоглобиновый
Бикарбонатный
Фосфатный
Общая эффективность буферных
систем
%
35
18
4
57
Для кислотно-основного гомеостазиса важное значение имеет также
обмен анионов СГ и НСОз между плазмой и эритроцитами. Если в плазме
крови увеличивается концентрация углекислоты, то образующийся при
диссоциации NaCl анион С1 входит в эритроциты, где образует КС1, а ион
Na+, для которого мембрана эритроцита непроницаема, соединяется с
избытком HCOJ, образуя бикарбонат натрия, восполняя его убыль в бикар-
бонатном буфере. При снижении концентрации углекислоты в бикарбо-
натном буфере происходит обратный процесс — анионы СГ выходят из
эритроцитов и соединяются с избытком Na+, освободившимся из
бикарбоната, этим, следовательно, предотвращается ощелачивание плазмы.
Буферные системы плазмы крови и эритроцитов имеют разную
относительную эффективность. Так, эффективность буферных систем
эритроцитов выше (за счет гемоглобинового буфера), чем плазмы крови (табл. 15.3).
Концентрация Н-ионов уменьшается в направлении: клетка —
межклеточная среда — кровь. Это свидетельствует о том, что наибольшую
буферную емкость имеет кровь, а наименьшую — внутриклеточная среда.
Образуемые в клетках при метаболизме кислоты поступают в межклеточную
жидкость тем легче, чем больше их образуется в клетках, так как избыток
Н-ионов повышает проницаемость клеточной мембраны. В буферных
свойствах межклеточной среды играет роль соединительная ткань,
особенно коллагеновые волокна, известные как «ацидофильные». На минимальное
накопление кислот они реагируют набуханием, быстро поглощая кислоту и
освобождая от Н-ионов межклеточную жидкость. Эта способность
коллагена объясняется свойством абсорбции.
15.2.2. Тканевые гомеостатические обменные процессы
Кислотно-основное состояние поддерживается в пределах
физиологических значений рН и путем метаболических превращений в тканях. Это
достигается за счет совокупности биохимических и физико-химических
процессов, которые обеспечивают: 1) потерю кислотных и щелочных
свойств продуктов обмена веществ, 2) их связывание в средах,
препятствующих диссоциации, 3) образование новых, более легко нейтрализуемых
и выводимых из организма соединений.
Так, например, органические кислоты могут соединяться с продуктами
белкового обмена (бензойная кислота с глицином) и тем самым терять
кислые свойства. Избыток молочной кислоты ресинтезируется в гликоген,
кетоновых тел — в высшие жирные кислоты и жиры. Неорганические
кислоты нейтрализуются солями калия, натрия, освобождающимися при дез-
аминировании аминокислот аммиаком, образующим аммонийные соли.
После внутривенного введения животным кислоты 43 % ее количества
нейтрализуется бикарбонатом плазмы крови, 36 % нейтрализуются за счет
клеточного натрия, а 15 % — за счет выходящего из клеток калия. Основа-
15. Кислотно-основное состояние • 655
ния нейтрализуются преимущественно молочной кислотой, образуемой из
гликогена при ощелачивании микроокружения клеток.
В поддержании внутриклеточного рН существенную играет роль обмен
производных имидазола и его изомера пиразола. Особенности пятичленно-
го кольца этих соединений определяют их амфотерные свойства, т. е.
способность быть одновременно и донатором, и акцептором протонов. Ими-
задол способен очень быстро образовывать соли с сильными кислотами и
щелочными металлами. Наиболее распространенным соединением
имидазола является сс-аминокислота гистидин, участвующая в кислотном и
основном катализе.
Сильные кислоты и щелочи могут растворяться в липидах, обладающих
низкой диэлектрической константой, что препятствует их диссоциации.
Наконец, органические кислоты могут подвергаться окислению с
образованием летучей слабой угольной кислоты.
15.3. Физиологические гомеостатические механизмы
Эти механизмы, включающие функции легких, почек,
желудочно-кишечного тракта, печени и костной ткани, обеспечивают нейтрализацию,
связывание и выведение из организма Н+ и ОН- ионов в составе различных
соединений, в зависимости от особенностей метаболизма и состояния
буферных систем внутренней среды.
15.3.1. Легкие и кислотно-основное состояние
Процессы газообмена между кровью и окружающим воздухом,
происходящие в легких, обеспечивают регуляцию кислотно-основного состояния,
поскольку внешнее дыхание — это основной путь удаления из крови летучей
угольной кислоты. При физиологических условиях в покое в организме
вырабатывается 10 ммоль/мин угольной кислоты, а выделяется через
легкие 13 000—15 000 ммолей С02 в сутки. Благодаря бикарбонатному буферу
образующиеся при метаболизме кислоты не вызывают закисления крови, а
приводят к увеличению содержания С02 в крови с последующим
удалением через легкие.
Удаленный из плазмы углекислый газ немедленно восполняется за счет
двух механизмов, происходящих в крови легочных капилляров. Во-первых,
образование оксигемоглобина ведет к распаду карбаминовой связи
гемоглобина и освобождению С02 из эритроцитов; во-вторых, под влиянием
карбангидразы, фермента, катализирующего реакцию: Н2С03 -» Н20 +
С02
Количество выводимого из организма углекислого газа зависит от
глубины и частоты дыхания, т. е. от альвеолярной вентиляции. Величина же
альвеолярной вентиляции регулируется дыхательным центром,
деятельность которого зависит или даже определяется парциальным напряжением
С02 в крови и рН внеклеточной жидкости мозга. Таким образом, усиление
дыхания и альвеолярной вентиляции происходит при увеличении
напряжения в крови С02 и уменьшении рН. Нарастающее при этом удаление
углекислоты через легкие приводит ее содержание в крови в соответствие с
концентрацией бикарбоната. Следовательно, легкие выступают в роли
физиологической гомеостатической системы, не только выводящей избыток
летучей кислоты, но и восстанавливающей емкость буферных систем,
прежде всего бикарбонатной и гемоглобиновой.
При быстром поступлении во внутреннюю среду оснований вентиляция
656 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
легких уменьшается и количество выделяемого С02 существенно
снижается. Концентрация углекислоты возрастает и рН поддерживается на
исходном уровне.
15.3.2. Почки и кислотно-основное состояние
Почки осуществляют выведение из внутренней среды организма нелетучих
органических и неорганических кислот. Избыток кислот при этом может
выводиться как в свободном состоянии, так и в виде нейтральных солей.
Сильные неорганические кислоты выделяются из внутренней среды только
через почки и только в связанной форме.
В физиологических условиях почки выделяют кислую мочу, рН которой
колеблется от 5 до 7. Однако, в зависимости от кислотно-основного
состояния внутренней среды, моча может быть более кислой (рН 4,0) или
даже щелочной (рН 8,0).
Участие почек в регуляции кислотно-основного состояния внутренней
среды обеспечивается совокупностью взаимосвязанных процессов,
происходящих в структурах нефрона. К их числу относятся: 1) секреция
водородных ионов в мочу клетками канальцевого эпителия, 2) реабсорбция
(обратное всасывание) профильтровавшихся в мочу оснований, прежде
всего бикарбоната, пополняющих резерв в крови, 3) образование в клетках
эпителия канальцев ионов бикарбоната, больше или меньше всасываемого
в кровь, 4) образование и диффузия в мочу аммиака, создающего катион
аммония, присоединяя Н-ион, 5) фильтрация в первичную мочу из
плазмы крови соединений, обладающих кислыми или щелочными свойствами,
6) обмен ионов СГ, Na+, K+, фосфатов, сульфатов и двухвалентных
катионов (Са2+, Mg2+).
Важнейшую роль в способности почек к выделению кислой мочи
играет секреция водородных ионов клетками эпителия проксимальных и дисталь-
ных канальцев (рис. 15.2). Эта способность обусловлена наличием в
клетках эпителия фермента карбоангидразы, обеспечивающего образование из
С02 и Н20 угольной кислоты, с последующей диссоциацией:
Н20 + С02 -> Н2С03 -> Н+ + HC07.
Ион водорода активно секретируется с затратой энергии через
апикальную мембрану клетки эпителия в просвет канальца, а из канальцевой мочи
в клетку диффундирует ион натрия, обеспечивая равновесие
электрических зарядов. Из клетки, уже через базальную мембрану, Na+ активно с
помощью Na-K-насоса удаляется в интерстиций и кровь, туда же пассивно
по градиенту концентрации поступает HCOJ образуя бикарбонат натрия.
Следовательно, секреция Н-ионов обеспечивает обратное всасывание
бикарбоната и натрия, причем основная часть секретируемых ионов водорода
тратится именно на обеспечение реабсорбции бикарбоната. Так, секрети-
руемый Н-ион в просвете проксимального канальца взаимодействует с
профильтровавшимся в мочу из плазмы ионом бикарбоната (в сутки около
5000 ммоль), образуя угольную кислоту. Под влиянием фермента
карбоангидразы, встроенного в мембрану щеточной каемки клеток эпителия
канальца, угольная кислота разлагается на С02 и воду:
карбоангидраза
Н+ + НСОз -> Н2С03 > С02 + Н20.
Молекулы углекислого газа легко диффундируют в клетки, где
реакция катализируется в обратном направлении. Таким образом, на суточ-
75. Кислотно-основное состояние • 657
ПРОСВЕТ
КАНАЛЬЦА
КЛЕТКА
ЭПИТЕЛИЯ
ПЕРИКнНЯЛЬЦЕВЯЯ
ЖИДКОСТЬ
1)
нсоэ.« н<
Нгсоз
нго ♦ сог»
Н«,НРО.
Рис. 15.2. Основные механизмы участия клеток почечных канальцев в поддержании
кислотно-основного состояния внутренней среды организма.
Кружки обозначают мембранные транспортные системы.
Первый фрагмент (сверху) — секреция Н+-ионов в мочу клетками эпителия проксимальных
канальцев обеспечивает реабсорбцию профильтровавшегося в первичную мочу натрия и
транспорт во внутреннюю среду бикарбоната натрия, что способствует сохранению
нормального значения величины актуального бикарбоната крови. Второй (средний) фрагмент —
секреция водородных ионов в мочу ведет к реабсорбции натрия из диссоциирующих солей
неорганических кислот и появлению титруемых кислот мочи. Третий фрагмент — аммониогенез как
путь выведения избытка Н+-ионов. Секретируемые эпителием в просвет канальца аммиак и
Н-ионы взаимодействуют между собой и с ионом хлора, образуя экскретируемый хлорид
аммония.
ную реабсорбцию до 5000 ммоль бикарбоната расходуется эквивалентное
количество секретированных ионов водорода. Выделяется же с мочой
только 60 ммоль/сут ионов водорода, преимущественно в связанном
виде.
Наибольшая часть секретированных канальцами Н+ (65—75 %)
участвуют в процессе аммониогенеза, обеспечивающего выведение из плазмы
крови анионов сильных неорганических и органических кислот в виде
аммонийных солей. Клетки проксимальных и дистальных почечных канальцев,
благодаря процессам дезаминирования и дезамидирования аминокислот,
образуют аммиак. Основным источником является глутамин, который де-
заминируется под влиянием фермента глутаминазы, 40 % аммиака
образуется из аминокислот аланина и глицина. Аммиак, благодаря высокой
растворимости в липидах, легко диффундирует в просвет канальца, где
присоединяет секретированные Н+ и образует ион аммония; NH3 + Н+ -> NH4.
Ионы аммония вытесняют натрий из соединений с анионами сильных
кислот, натрий реабсорбируется, а анионы кислот в виде аммонийных солей
выделяются с мочой.
Содержащиеся в крови кислые и щелочные компоненты буферных
систем, например одно- и двухосновный фосфаты, бикарбонат, а также
слабые органические кислоты — молочная, лимонная, (3-оксимаслянная и др.,
так же как и анионы сильных неорганических кислот (СГ, SO4),
фильтруются из плазмы крови в первичную мочу. Часть из них реабсорбируется в
658 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
проксимальных канальцах, особенно существенно бикарбонат (до 80—
90 %), мочевая кислота (более 90 %). Но наряду с обратным всасыванием
многие из указанных веществ, особенно органические кислоты и
основания (холин), активно секретируются клетками канальцевого эпителия.
Таким образом, уровень этих веществ в моче определяется соотношением
трех основных процессов: клубочковой фильтрации, канальцевых реаб-
сорбции и секреции.
Секретированные в мочу водородные ионы участвуют в образовании
титруемых кислот мочи. Основную роль при этом играют фосфаты.
Поскольку в плазме крови в 4 раза больше двухосновных фосфатов, поэтому
и в первичную мочу их фильтруется соответственно больше. Под
воздействием секретированного эпителием канальца Н-иона происходит перевод
двухосновного фосфата в одноосновный, путем ионного обмена протона
на натрий: Na2HP04 + Н+ -> NaH2P04 + Na+
Освобождаемый ион Na+ реабсорбируется в канальцах в кровь. Таким
образом, этот процесс способствует сохранению во внутренней среде
натрия и удалению из нее избытка Н+-ионов.
Многие органические кислоты содержатся в плазме крови в виде солей
и, фильтруясь в клубочках, поступают в первичную мочу. Под
воздействием секретированных канальцами Н-ионов в моче происходит образование
свободных слабых, т. е. плохо диссоциирующих, кислот, также
составляющих титруемую кислотность мочи. Титруемой кислотностью мочи
называют сумму Н-ионов слабых кислот и солей, определяемую путем
титрования мочи щелочью до величины рН, равной рН крови. Эта величина
показывает, насколько больше водородных ионов содержится в моче по
сравнению с плазмой крови, т. е. насколько эффективно почки поддерживают
постоянство рН.
В клетках эпителия дистальных отделов нефрона кроме описанной
выше секреции водородных ионов происходит секреция ионов К+, при этом
ионы Н+ и К+ конкурируют в обмене на Na+. В связи с этим выведение
калия и протона может изменяться противоположно друг другу. Так, при
избытке водородных ионов секреция калия снижается, а при недостатке —
возрастает. Напротив, избыток К+ снижает секрецию водородных ионов, а
недостаток К+ повышает ее. Недостаток калия стимулирует и синтез
аммиака в эпителиальных клетках канальцев для выведения избытка
Н-ионов в виде аммонийных солей. Однако секреция протонов и калия связана
с транспортом натрия и меняется пропорционально сдвигам реабсорбции
натрия. При снижении дистальной реабсорбции натрия соответственно
снижается секреция Н+ и К+ ионов, напротив, усиление всасывания
натрия в дистальных канальцах приводит к повышению секреции калия и
водородных ионов.
При поступлении в кровь избытка кислот или оснований компенсация
сдвига кислотно-основного состояния осуществляется прежде всего
буферными системами крови, дыхательная компенсация формируется через 16—
18 ч, а почечная компенсация развивается еще медленнее — спустя 2—
3 сут. При этом почечные механизмы обладают значительной
инерционностью и даже после удаления из организма избытка кислот или оснований
возвращение к исходному кислотно-основному состоянию продолжается
также около 2—3 сут.
15. Кислотно-основное состояние • 659
15.3.3. Желудочно-кишечный тракт, печень, костная ткань
и кислотно-основное состояние
Характер питания человека и особенности пищеварения в значительной
мере сказываются на кислотно-основном состоянии его внутренней среды,
В пищевых продуктах растительного происхождения содержится большое
количество солей органических кислот (щавелевой, яблочной, лимонной,
янтарной и др.), после окисления которых и выведения кислотных
валентностей с углекислотой через легкие остаются и накапливаются связанные с
катионами щелочные валентности. Поэтому растительная пища
способствует ощелачиванию внутренней среды, соответственно, основания в
большем количестве выводятся с мочой, что увеличивает рН мочи и она может
приобретать щелочную реакцию. Белковая пища животного
происхождения способствует закислению внутренней среды, так как в составе
животных белков содержатся сера и фосфор, что приводит к образованию
сильных неорганических кислот. Повышенное выведение их с мочой приводит
к снижению рН мочи и она приобретает резко кислую реакцию.
Всасывание в желудочно-кишечном тракте кислот или щелочей, содержащихся в
различных напитках, в том числе алкогольных и минеральных водах, также
приводит к изменению кислотно-основного состояния внутренней среды.
Сравнительно небольшую роль в регуляции кислотно-основного
состояния играют пищеварительные функции желудка и кишечника.
Париетальные клетки слизистой оболочки желудка секретируют соляную
кислоту. Водородные ионы образуются в клетках под влиянием карбоангидразы,
анион хлора поступает в клетки из хлористого натрия крови путем обмена
на бикарбонат. Однако при этом ощелачивания крови не происходит, так
как СГ желудочного сока в кишечнике всасывается обратно в кровь.
Значительное количество бикарбонатов поступает в кишечник в составе сока
поджелудочной железы и кишечного сока. При этом ионы Н+ всасываются
в кровь. Обратное всасывание претерпевают и бикарбонатные ионы,
поэтому сдвигов кислотно-основного состояния крови не происходит. При
кислой диете увеличивается выделение двухвалентных катионов Са2+ и
Mg2+ а при щелочной — и одновалентных катионов. Хотя значение
желудочно-кишечного тракта в физиологической регуляции
кислотно-основного состояния невелико, тем не менее при изменениях, а тем более
нарушениях функций желудка и кишечника неизбежно происходят сдвиги и
кислотно-основного состояния. Стойкое и резкое повышение кислотности
желудочного сока может вести к увеличение щелочного резерва крови из-
за потерь Н-ионов и избыточного всасывания бикарбоната. Частая рвота,
особенно при непроходимости кишечника, вызывая потерю Н+-ионов и
хлоридов, вызывает гипохлоремию и защелачивание внутренней среды,
что требует обязательной врачебной коррекции.
В печени происходит утилизация молочной кислоты с образованием
гликогена, здесь разрушаются кетоновые тела (ацетоуксусная и бета-окси-
масляная кислоты), происходят метаболические превращения
органических кислот и оснований. Образуя желчь с изменяемой степенью
щелочной реакции, печень способствует удалению из внутренней среды разных
количеств оснований.
В нейтрализации кислот внутренней среды принимает участие костная
ткань, поскольку в ней связано огромное количество катионов и фосфата.
При длительном накоплении в крови кислот и снижении рН внеклеточной
жидкости происходит остеолиз и вымывание из скелета фосфата кальция.
В результате реакции с угольной кислотой образуются бикарбонатный и
660 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
однозамещенный фосфатный анионы, нейтрализующие избыток Н-ионов.
Благодаря огромным запасам в скелете фосфата кальция этот механизм
обладает высокой эффективностью, выход из скелета 1 моль фосфата
кальция нейтрализует и способствует в дальнейшем выведению из организма
через почки 4 эквивалентов кислоты. Однако потеря костной тканью
фосфата кальция вызывает деминерализацию скелета и потерю его прочности.
В костной ткани находится до 45 % всего натрия, содержащегося в
организме, однако выход натрия из костной ткани возможен только при
резорбции кости, например, в условиях кислой реакции среды. В таких
случаях натрий костей, поступая во внеклеточную среду, способствует
нейтрализации кислотного сдвига.
15.4. Основные физиологические показатели кислотно-основного
состояния
Кислотно-основное состояние внутренней среды характеризуют
следующие показатели: актуальный рН; парциальное напряжение углекислоты;
актуальный бикарбонат крови; стандартный бикарбонат крови; буферные
основания крови; избыток или дефицит буферных оснований крови.
Актуальный рН — фактическая величина отрицательного логарифма
концентрации водородных ионов плазмы артериальной крови, измеренная
при 38 °С. Физиологические пределы колебаний от 7,35 до 7,45. Значение
рН крови соответствует рН внеклеточной жидкости.
Парциальное напряжение углекислоты (pCOJ — равно парциальному
давлению над кровью углекислого газа, находящегося в равновесии с
растворенным С02 в артериальной крови при 38 °С. В физиологических условиях
рС02 в покое составляет в среднем 40 мм рт. ст., колеблясь от 35 до 45 мм
рт. ст. Крайние отклонения при патологии составляют диапазон 10—130
мм рт. ст. При произвольной задержке дыхания напряжение углекислоты
может достигать 90 мм, а при произвольной гипервентиляции — снижаться
до 20 мм рт. ст.
Актуальный бикарбонат крови — истинная концентрация бикарбонатно-
го аниона (HCOJ) при фактическом состоянии плазмы артериальной
крови. Этот показатель называют также «щелочной резерв» крови. В
физиологических условиях равен 22—25 ммоль/л.
Стандартный бикарбонат крови — содержание бикарбонатного аниона в
плазме крови при стандартных условиях, т. е. полном насыщении
гемоглобина кислородом, уравновешивании с газовой средой, имеющей рС02 40
мм рт. ст., и 38 "С. Этот показатель важен для клинической диагностики,
так как отражает только метаболические, не связанные с дыханием, сдвиги
кислотно-основного состояния крови. У здоровых людей стандартный
бикарбонат не отличается от актуального.
Буферные основания (БО) крови — это общая сумма концентрации всех
анионов цельной крови, обладающих буферными свойствами при условии
полного насыщения крови кислоррдом, при температуре крови 38 °С и
рС02 40 мм рт. ст. В физиологических условиях величина БО составляет в
среднем 41,7 + 0,043 НЬ ммоль/л, где НЬ — концентрация гемоглобина в г/
л. Пределы колебаний показателя в норме от 46 до 52 ммоль/л.
Дефицит или избыток буферных оснований (ДИБО) — является наиболее
важным для диагностики метаболическим параметром кислотно-основного
состояния крови. Этот показатель характеризует разницу между
фактической величиной буферных оснований крови, найденных у исследуемого
человека, и значением БО, определенным в стандартных условиях. Устано-
75. Кислотно-основное состояние • 661
вить значение этого параметра можно путем титрования крови. Ввиду
технической сложности и трудоемкости такого титрования, на практике этот
параметр определяют по специальным номограммам. Если число
буферных оснований в исследуемой крови выше, чем стандартный показатель
БО, параметр ДИБО обозначается со знаком плюс, а если ниже — со
знаком минус. Физиологический диапазон колебания ДИБО в артериальной
крови составляет от —2 до +2. В условиях патологии пределы сдвига ДИБО
значительно шире: от —30 при резких кислотных сдвигах до +30 при
сдвигах в щелочную сторону.
15.5. Основные изменения кислотно-основного состояния
и их компенсация
Кислотно-основное состояние внутренней среды характеризуют по
содержанию в ней количества водородных ионов, зависящего от их поступления
и выделения, т. е. баланса. В связи с этим выделяют две формы сдвига
кислотно-основного состояния: ацидоз и алкалоз. Ацидоз — это сдвиг
кислотно-основного состояния в связи с положительным балансом водородных
ионов, т. е. при накоплении Н-ионов в крови. Алкалоз — это сдвиг
кислотно-основного состояния в связи с отрицательным балансом водородных
ионов, т. е. при уменьшении Н-ионов в крови.
Концентрация водородных ионов в крови определяется, во-первых,
[Н2С03] или рС02, выводимого в большей или меньшей степени через
легкие, — дыхательная, или респираторная, компонента. Во-вторых,
содержание Н+ определяется концентрацией бикарбоната (HCOJ), не выделяемого
через легкие,— недыхательная, или нереспираторная, компонента.
Таким образом, как ацидозы, так и алкалозы можно представить в двух
видах: 1) дыхательные или респираторные и 2) недыхательные или
нереспираторные (см. рис. 15.1). При дыхательных сдвигах кислотно-основного
состояния изменяется концентрация углекислоты (повышается при
ацидозе и снижается при алкалозе), а при недыхательных — бикарбоната, т. е.
основания (снижается при ацидозе, повышается при алкалозе). Однако
нарушения баланса водородных ионов не обязательно приводят к сдвигу
уровня свободных Н+, т. е. рН, поскольку буферные системы и
физиологические гомеостатические системы компенсируют изменения баланса
водородных ионов. Компенсацией называют процесс выравнивания
нарушения путем изменения в той системе, которая не была нарушена. Таким
образом, дыхательные нарушения компенсируются сдвигами в
недыхательной компоненте и, наоборот, сдвиги уровня бикарбоната
компенсируются изменениями дыхательной компоненты, т. е. выведения
углекислоты.
В зависимости от степени эффективности компенсации возможны три
варианта сдвигов кислотно-основного состояния: некомпенсированные
(сдвиг рН<7,29 или >7,56), частично компенсированные (рН<7,35 или
>7,45, отмечается избыток иди дефицит буферных оснований),
компенсированные (сдвиг рН отсутствует /7,35—7,45/, благодаря полной
компенсации изменившегося баланса водородных ионов) (см. рис. 15.1).
Определение характера сдвига кислотно-щелочного состояния в случаях
компенсированных ацидоза или алкалоза требует специального
расширенного исследования. Выявление частично компенсированных и
некомпенсированных сдвигов может быть осуществлено путем сопоставления трех
параметров: рН, дыхательной и недыхательной компонент баланса, как это
показано в табл. 15.4.
662 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Таблица 15.4. Сдвиги основных параметров кислотно-основного состояния при
ацидозах и алкалозах
Вид нарушения кислотно-основного состояния
Ацидоз недыхательный
Ацидоз дыхательный
Алкалоз недыхательный
Алкалоз дыхательный
Частично компенсированный
Некомпенсированный
Частично компенсированный
Некомпенсированный
Частично компенсированный
Некомпенсированный
Частично компенсированный
Некомпенсированный
Параметры
рн
4
и
4
и
т
ТТ
т
ТТ
ДИБО
4*4*
44
t
=
ТТ
ТТ
4
=
рСО
4
=
ТТ
tt
т
=
44
44
У здоровых людей дыхательный ацидоз может возникать при
длительном пребывании в среде с повышенным содержанием углекислого газа,
например в замкнутых помещениях малого объема, шахтах, подводных
лодках. Недыхательный ацидоз у здоровых людей бывает при длительном
употреблении кислой пищи, углеводном голодании, усиленной мышечной
работе, особенно у нетренированных людей.
Дыхательный алкалоз формируется у здоровых людей при нахождении в
условиях сниженного атмосферного давления и, соответственно,
парциального давления С02, например при пребывании высоко в горах, полетах
в негерметизированных летательных аппаратах, что создает условия для
избыточных потерь С02 кровью. Гипервентиляция легких также
способствует потере двуокиси углерода и дыхательному алкалозу.
Недыхательный алкалоз развивается у здоровых людей при длительном
приеме щелочной пищи или минеральной воды типа боржоми.
15.5.1. Функциональное значение ацидозов и алкалозов
• Физиологические свойства ферментов, транспорт и связывание
белков, обусловленные диссоциацией кислых или основных
аминокислот (особенно гистидина), зависят от рН.
• Ферменты гликолиза, особенно фосфофруктокиназа, зависят от рН.
Внутриклеточный алкалоз стимулирует, а ацидоз подавляет гликолиз
и образование молочной кислоты. Алкалоз подавляет глюконеогенез
и повышает содержание субстратов цикла Кребса, например цитрата.
Ацидоз стимулирует деградацию глюкозы через пентозо-фосфатный
цикл.
• Для синтеза ДНК и пролиферации клеток рН не должен быть
кислым. Легкий алкалоз всегда имеет место при клеточной
пролиферации. Множество регуляторов роста активируют Na/H-обменник
мембраны и приводят к защелачиванию внутриклеточной среды.
Щелочной рН характерен для опухолевых клеток.
• К+-каналы большинства клеток активируются алкалозом и
подавляются ацидозом, что способствует изменению потенциала покоя и
возбудимости клеток.
• Ацидоз ведет к уменьшению входа Са2+ через Са-каналы, приводя,
например, к снижению сократимости миокарда.
• В легочных артериолах Н+-ионы вызывают вазоконстрикцию, а в
сосудах большого круга они способствуют вазодилатации, что в услови-
75. Кислотно-основное состояние • 663
ях кислородного голодания может вести к снижению артериального
давления. Алкалоз способствует вазоконстрикции, особенно мозговых
сосудов.
• Ацидоз снижает, а алкалоз повышает проводимость в плотных
межклеточных контактах, в частности в миокарде, следствием чего могут
быть аритмии сердца.
• Ацидоз снижает, а алкалоз повышает сродство гемоглобина к
кислороду (эффект Бора).
• Алкалоз стимулирует диссоциацию плазменных белков, которые
затем связывают больше Са2+ и снижают его активность в плазме.
Напротив, ацидоз снижает кальций-связывающую активность белков
плазмы. С другой стороны, бикарбонат соединяется с Са2+ и
уменьшает его активность.
Все случаи возникновения сдвигов кислотно-основного состояния у
здоровых людей обычно полностью компенсированы. В условиях
патологии ацидозы и алкалозы у человека бывают значительно чаще и,
соответственно, чаще являются частично компенсированными или даже
некомпенсированными, что требует искусственной коррекции.
15.5.2. Дыхательный ацидоз
Причиной развития дыхательного ацидоза у человека является гиперкап-
ния, т. е. повышение содержания и напряжения С02 в крови (выше 45 мм
рт. ст.) в результате того, что скорость образования С02 в тканях
превышает скорость его выделения легкими. Это одно из наиболее тяжелых
нарушений кислотно-основного состояния. В зависимости от скорости
возникновения и тяжести, выделяют острый и хронический дыхательный ацидоз.
Острое повышение напряжения С02 в плазме крови вызывает рост
содержания Н+-ионов до почти двукратного их увеличения, а также
повышение концентрации НС03 за счет реакции, катализируемой карбоангидра-
зой:
С02 +Н20 -> Н2С03 -> Н+ + НС03
Острая гиперкапния вызывает повышение концентрации Н+-ионов в
соотношении: на каждый мм рт. ст. прироста РС02 увеличение [Н+] на
0,75 нмоль/л.
Компенсаторные реакции организма, возникающие немедленно вслед
за ростом концентрации Н+-ионов, состоят в связывании избытка
водородных ионов протеинами, гемоглобином и фосфатной буферной
системой. Спустя несколько часов включаются почечные компенсаторные
процессы — в канальцах почек активируется обмен Н+-ионов на Na+,
повышается реабсорбция HCOJ, избыток Н+-ионов выводится с солями
аммония, прежде всего в виде NH4C1. Избыточное выведение хлорида аммония
с мочой влечет за собой усиление потерь СГ и истощение его запасов в
организме, что замедляет процессы почечной компенсации ацидоза и
требует экзогенного восполнения хлоридного аниона. Содержание НСО^ в
жидкостях внутренней среды в результате активации реабсорбции в
почках повышается, актуальный бикарбонат крови становится выше
стандартного бикарбоната при неизмененном количестве буферных оснований
крови и, если причина гиперкапнии устранена (например, при
искусственной вентиляции легких), на смену дыхательному ацидозу в результате
роста избытка буферных оснований может формироваться недыхательный
«постгиперкапнический» алкалоз. Избыток Н+-ионов во внеклеточной
664 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
среде приводит к поступлению в клетки не только Н+- ионов, но и ионов
Na+, что вызывает выход из них ионов К+ и развитие гиперкалиемии.
Повышается и концентрация фосфатов в плазме. В то же время при
компенсации ацидоза накопление в плазме HCOJ снижает содержание калия в
плазме крови, а «постгиперкапнический» алкалоз может вести к гипока-
лиемии.
15.5.3. Недыхательный ацидоз
Ацидоз возникает при превышении образования в организме над
возможностями выведения из него нелетучих органических и неорганических
кислот, при повышенной потере организмом оснований и относительном
избытке кислот, а также при поступлении кислот в организм из внешней
среды. Соответственно этому, выделяют четыре типа недыхательного
ацидоза: 1) метаболический — возникающий при повышенном образовании
нелетучих кислот в случаях шока, гипоксии, лихорадки, гипертиреоза,
недостаточности кровообращения, диабета, голодания и усиленной
мышечной работы; 2) выделительный — формирующийся в результате сниженного
выделения нелетучих кислот почками (уремия, дистальный канальцевый
ацидоз, пиелонефрит) или повышенных потерь HCOJ с содержимым
кишечника (кишечные и желчные свищи, диарея); 3) экзогенный —
проявляющийся при введении в организм с лечебной целью нелетучих кислот
(прием салицилатов, хлорида аммония, парентеральное вливание 0,1 моль/
л раствора хлористоводородной кислоты); 4) дилюционный — причиной
которого является разведение внеклеточной жидкости, ведущее к
уменьшению концентрации НС03 (при быстрых и чрезмерных внутривенных
вливаниях изотонического раствора хлорида натрия, в первой фазе действия
осмотических диуретиков типа маннита).
Общие компенсаторные реакции организма при недыхательных типах
ацидоза состоят в буферировании кровью избытка Н+-ионов, прежде всего
бикарбонатной буферной системой, и выведении избытка
освобождающегося из нее С02 через легкие. При ацидозе метаболического типа
важнейшим компенсаторным механизмом является выделение почками избытка
Н+. К числу компенсаторных реакций при недыхательном ацидозе
(главным образом, метаболического типа) также относятся: 1) активация сим-
патоадреналовой системы, повышающая производительность сердца и
вызывающая вазодилатацию за счет стимуляции в условиях ацидоза
преимущественно бета-адренорецепторов сосудов; усиливающийся при этом
тканевый кровоток повышает доставку кислорода и уменьшает тканевый аци-
догенез; 2) смещение кривой диссоциации оксигемоглобина вправо, что
облегчает отдачу кислорода тканям; 3) возбуждение дыхательного центра,
приводящее к гипервентиляции, облегчающей выведение С02.
Наиболее распространенным метаболическим ацидозом у человека
является лактат-ацидоз. При физиологических условиях обмена углеводов
во всех клетках и тканях организма образуется молочная кислота,
поступающая во внеклеточную жидкость. Извлекается при этом лактат из крови
в значительных количествах преимущественно печенью и корковым
веществом почек, где основная его часть превращается в глюкозу, а остаток ме-
таболизирует до С02 и воды. При гипоксии в тканях образуется больше
лактата, чем может превратиться в пируват, и отношение лактат/пируват, в
норме составляющее 10:1, возрастает, т. е. развивается избыток лактата в
крови. К появлению избытка лактата и лактат-ацидозу ведет и чрезмерная
активация симпатоадреналовой системы при стрессе, поскольку адреналин
75. Кислотно-основное состояние • 665
снижает поступление пирувата в цикл трикарбоновых кислот и,
следовательно, повышает образование лактата. Кроме того, возникающая при
симпатической стимуляции констрикция сосудов печени снижает
утилизацию ею избытка лактата. Основными поставщиками лактата в плазму
крови являются эритроциты (до 25 % всего лактата) и активно работающие
скелетные мышцы.
Таким образом, накопление лактата в крови является следствием
изменения как его продукции, так и утилизации. Нормальное содержание
лактата в плазме крови составляет около 1 ммоль/л, но лишь возрастание
концентрации молочной кислоты свыше 4 ммоль/л является
патологическим и ведет к лактат-ацидозу.
Одним из компенсаторных процессов, реализуемых при этом на уровне
образования лактата, является метаболическая ауторегуляция по
механизму обратной связи: ацидоз подавляет активность ключевого фермента
гликолиза в эритроцитах фосфофруктокиназы, в результате скорость
гликолиза падает и образование молочной кислоты снижается.
15.5.4. Дыхательный алкалоз
Дыхательный алкалоз возникает как следствие гипервентиляции, в
результате которой выведение С02 из крови превышает его образование в
организме. В крови при этом снижается РС02, т. е. возникает гипокапния и
уменьшается концентрация водородных ионов.
Остро возникающий дыхательный алкалоз, как правило, в начальный
период декомпенсирован, и рН может повышаться до критических
пределов (7,6-7,8).
Компенсаторные реакции организма при дыхательном алкалозе
начинаются прежде всего в системе крови с буферирования сдвига рН, что
осуществляется пополнением недостатка Н+ путем диссоциации протеинов и
фосфатов, при этом содержание не гидрокарбонатных анионов возрастает.
В эритроцитах при алкалозе увеличивается активность
фосфофруктокиназы, и образуются повышенные количества молочной кислоты,
восполняющей низкую концентрацию Н+-ионов.
Почечная компенсация дыхательного алкалоза формируется медленно,
в течение 2—4 сут. Она проявляется торможением в дистальных отделах
нефрона обмена протонов на Na+, подавлением реабсорбции НС03 и
секреции Н+. При этом повышается экскреция с мочой HCOJ, в крови
уменьшается избыток буферных оснований.
Сниженные концентрации С02 в плазме крови ведут к сужению внут-
риорганных сосудов, гипоксии и активации гликолиза в клетках, что
приводит к увеличению продукции ими молочной кислоты и
компенсации алкалоза. Ослабление тонуса сосудодвигательного центра при
недостатке возбуждающих его Н+ и, как следствие, уменьшение симпатических
эффектов на сосуды способствует артериальной гипотензии, снижению
кровотока в тканях и активации образования в них молочной кислоты, а
снижение почечного и печеночного кровотока ослабляет ее утилизацию
из крови, способствуя тем самым восстановлению [Н+]. Кислородному
голоданию тканей и, соответственно, росту образования в них лактата
способствует и сдвиг при алкалозе кривой диссоциации оксигемоглобина
влево, уменьшающий отдачу кислорода. В то же время в эритроцитах
растет содержание 2,3-дифосфоглицерата, что ограничивает величину
сдвига кривой влево и не позволяет резко снизиться диссоциации
оксигемоглобина.
666 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Следствием алкалоза является изменение внутреннего баланса
электролитов: перемещение К+ из плазмы крови в клетки и гипокалиемия; выход
Na+ из клеток в плазму крови и увеличение его экскреции с мочой;
уменьшается в плазме крови и содержание фосфата.
15.5.5. Недыхательный алкалоз
Различают три основных типа недыхательного алкалоза: 1) выделительный
(при избыточных потерях Н+-ионов в сочетании с потерями СГ или К+);
2) экзогенный или нагрузочный (при поступлении в организм HCOJ или его
предшественников); 3) контракционный (при уменьшении объема
внеклеточной жидкости без соответствующего снижения концентрации HCOJ).
Выделительный алкалоз может быть следствием: потери ионов Н+ и СГ
при частой рвоте; выведения Н+-ионов с мочой при подавлении реабсорб-
ции ионов СГ в почках при назначении диуретиков-хлоруретиков;
избытка глюкокортикоидов; потери Н+-ионов в комбинации с ионами К+ при
альдостеронизме; повышении секреции Н+-ионов канальцами почек;
потери Н+-ионов с калом.
Недыхательный, особенно выделительный, алкалоз сопровождается, как
правило, гипокалиемией, причиной которой является перемещение калия
из плазмы крови в клетки, а также общий дефицит калия в организме.
Наиболее выражен дефицит калия при алкалозе, связанном с гиперкорти-
цизмом. Обмен калия и Н+-ионов имеет положительную обратную связь:
алкалоз усиливает гипокалиемию, но гипокалиемия усиливает
недыхательный алкалоз. Гипокалиемический алкалоз нередко бывает хлоррезистив-
ным, т. е. введение экзогенного СГ не устраняет алкалоз. Дефицит калия
вызывает активацию канальцевой реабсорбции HCOJ в почках,
гипокалиемия стимулирует продукцию NH3 в почках и снижение реабсорбции СГ,
вследствие чего при искусственной компенсации алкалоза введением в
организм кислых валентностей необходимым условием является
восстановление содержания калия.
Недыхательный алкалоз редко бывает компенсированным, чаще он суб-
компенсирован, при этом рН > 7,45. Компенсаторные реакции состоят в
буферировании слабыми кислотами негидрокарбонатных буферных
систем. Как и при дыхательном алкалозе, в этом случае увеличивается
образование молочной кислоты, прежде всего в эритроцитах, благодаря
активации гликолиза.
Компенсация недыхательного алкалоза со стороны легких заключается
в уменьшении вентиляции, что связано со снижением возбудимости
дыхательного центра в условиях уменьшения в плазме крови величины [Н+] и
[С02]. Следствием гиповентиляции является повышение РС02 в плазме
крови. Почечная компенсация недыхательного алкалоза осуществляется за
счет усиленного выведения HCOJ и падения экскреции титруемых кислот.
Контракционный алкалоз усиливается за счет изменений функции
почек, так как уменьшение при нем объема внеклеточной жидкости ведет к
снижению почечной экскреции HCOJ и увеличивает выраженность
алкалоза. Таким образом, искусственная компенсация контракционного
алкалоза достигается уже при восполнении дефицита внеклеточного объема
вводимой жидкостью, что не только снижает концентрацию HCOJ в
крови, но и усиливает экскрецию бикарбоната почками, способствуя тем
самым устранению алкалоза. Однако для более эффективного устранения
контракционного алкалоза необходимо искусственно восполнять
имеющийся в организме дефицит С Г.
75. Кислотно-основное состояние • 667
15.5.6. Общие закономерности компенсации нарушений кислотно-
основного состояния
Как правило, компенсация изменений кислотно-основного состояния в
организме человека является вторичным физиологическим процессом в
ответ на первичное нарушение одной из систем поддержания рН. При
этом отклонение рН восстанавливается благодаря компенсаторным
реакциям ненарушенных систем регуляции рН.
Основные компенсаторные реакции у человека:
• реакция буферных систем внеклеточной жидкости и перемещение
Н+-ионов через клеточные мембраны в направлении,
нормализующем сдвиги рН крови;
• дыхательная компенсация, вызванная изменениями рН крови и
влиянием Н+-ионов на дыхательный центр, что в результате увеличения
или уменьшения альвеолярной вентиляции меняет РС02 в
альвеолярном воздухе и артериальной крови и таким образом противодействует
сдвигам рН. При этом повышение РаС02, является потенциальной
причиной роста [Н+], так как реакция с участием карбангидразы:
С02 + Н20 -> Н2С03 -> Н+ + HCOJ ведет к росту [Н+]. Эта
дыхательная компенсация первичного накопления либо дефицита некарбоно-
вых кислот или оснований, как правило, не восстанавливает рН
крови до нормы;
• компенсация костной тканью: бикарбонатный ион при ацидозе
освобождается из кости для нейтрализации некарбоновых кислот крови, а
Н+ связывается костной тканью;
• почечная компенсация путем увеличения экскреции некарбоновых
кислот или оснований при дыхательных ацидозах или алкалозах,
ведущих к изменениям РС02 в плазме крови, уменьшения или
увеличения выведения Н+ и HCOJ из организма.
ГЛАВА 16
Репродуктивная функция человека
Отличительной особенностью репродуктивной функции человека от
других физиологических функций организма является то, что ее нормальное
функционирование проводит к слиянию половых клеток мужского и
женского организмов в процессе половой репродукции. Ооциты и
сперматозоиды называются женскими и мужскими половыми клетками, или
гаметами. Мужские и женские гаметы в зрелой форме содержат гаплоидное
число хромосом, т. е. половину нормального числа. Гаплоидное число
хромосом в гаметах формируется в процессе сперматогенеза и оогенеза
(рис. 16.1). В мужском организме мейотическое деление сперматогенных
клеток происходит постоянно на протяжении всей жизни после начала
периода полового созревания (пубертатный период). Напротив, в ооците
гаплоидное число хромосом образуется непосредственно перед овуляцией
яйцеклетки из фолликула. В результате способности ооцита и сперматозоида
перматозоид (гаплоидГ
22 +Х или +Y
Первичные сперматоциты
(диплоиды)
Сперматогенез
Сперматиды
(гаплоиды)
Второе
мейотическое
деление
Вторичные
сперматоциты
(гаплоиды)
Первое
мейотическое
деление
Разрыв фолликула
(II)
Второе мейотическое
деление во время
фертилизации
(I)
Вторичный
ооцит (гаплоид)
Первое мейотическое
деление во время
овуляции
Первичный
ооцит (диплоид)
Оогенез
Рис. 16.1. Схема сперматогенеза и оогенеза.
Первичные сперматоциты образуются путем митоза из сперматогоний и содержат диплоидное
число хромосом. В результате первого мейотического деления образуются сперматоциты,
содержащие гаплоидное число двухроматидных хромосом (22 единичные соматические
хромосомы и одна половая — X или Y). После второго мейотического деления образуются
сперматиды, содержащие гаплоидный набор монохроматидных хромосом. Оогенез начинается со
стадии первичного ооцита, содержащего диплоидное число хромосом. Первичный ооцит путем
первого мейотического деления превращается во вторичный ооцит, содержащий гаплоидное
число двухроматидных хромосом (22 единичные соматические хросомы и одна половая Х-хро-
мосома). В процессе оплодотворения ооцита сперматозоидом образуется зигота, содержащая
22 пары соматических хромосом и одну пару половых (XX или XY). Таким образом, в зиготе
восстанавливается диплоидный набор хромосом.
16. Репродуктивная функция человека • 669
соединяться друг с другом во время оплодотворения в женском половом
тракте происходит образование зиготы. Этот процесс называется фертили-
зацией. В зиготе содержится диплоидное число хромосом, как в любой
соматической клетке организма человека и животных. Две хромосомы из
диплоидного числа в зиготе, а именно половые Х- и Y-хромосомы,
обусловливают мужской или женский пол будущей особи в новом поколении.
Женская половая клетка содержит только Х-хромосомы, а мужская — Х- и
Y-хромосомы. Хромосомы заключают в себе гены, которые передают
генетические особенности одного поколения другому.
Способность человека как вида передавать одну половину генетической
информации будущего поколения от отца к матери обеспечивается
физиологическими особенностями репродуктивной функции мужского
организма. Репродуктивная функция женского организма обеспечивает процесс
фертилизации, внутриутробное развитие плода, рождение ребенка и его
вскармливание грудным молоком.
16.1. Половая дифференциация человека
При фертилизации, в зиготе, находящейся в репродуктивном тракте
женского организма, на основе генетической программы первоначально
формируется хромосомный, или генетический, пол человека. Затем в ходе
развития эмбриона формируется гонадный пол, когда
недифференцированные гонады развиваются либо в семенники, либо в яичники. В
зависимости от гонадного пола у плода происходит дифференциация мужских или
женских внутренних и наружных гениталий (формируется фенотипиче-
ский пол). В целом указанные превращения называется половой
дифференциацией человека (рис. 16.2).
Хромосомный пол
Гонадный пол
Стадия индифферентных гонад
XX
Семенники
Сперматогонии
Клетки Сетоли
Клетки Лейдига
Мюллеров
тормозный
гормон
Фнотипический
пол
■ Зародышевые, -
■ эпителиальные, -
• мезенхимальные-
клетки
Андрогены
Внутренние и наружные
мужские половые органы
Оогонии
Гранулезные клетки
Клетки прозрачной
оболочки
Отсутствует
синтез
андро генов
Отсутствует
синтез
Мюллерова
тормозного
гормона
Внутренние и наружные
женские половые органы
Рис. 16.2. Половая дифференциация человека.
Эмбрион имеет мужской (XY) и женский (XX) хромосомный пол. Хромосомный пол
сменяется развитием индифферентных гонад в яичники или семенники. В результате формируется
гонадный пол. Семенники секретируют тестостерон, который обусловливает развитие мужского
фенотипического пола, а отсутствие секреции тестостерона обусловливает развитие женского
фенотипического пола.
670 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
16.1.1. Генетический пол
Половые хромосомы (X и Y) являются единственными из 23 хромосом,
которые определяют пол организма. Половые клетки, продуцируемые
женским организмом, содержат Х-хромосому, тогда как сперматозоиды — X-
или Y-хромосому. Остальные 22 хромосомы предопределяют
характеристики организма, не связанные с полом, и поэтому называются аутосомами.
Во время фертилизации образуется зигота, содержащая 23 пары
хромосом. В зиготе, из которой будет развиваться плод женского пола,
содержится две Х-хромосомы, т. е. по одной из каждой женской и мужской
гаметы. В зиготе, из которой будет развиваться плод мужского пола,
содержится Х- и Y-хромосомы. Развитие гонад и гениталий в мужском
организме обусловлено Y-хромосомой. При отсутствии в генах эмбриона
Y-хромосомы у эмбриона развиваются яичники. Y-хромосома ответственна за
начальный половой диморфизм, т. е. две различные половые формы, мужская
и женская, одного и того же индивидуума.
16.1.2. Гонадный пол
Примерно до 6—7-й недели внутриутробной жизни эмбриона его гонады
развиваются идентично как у мужчин, так и у женщин. Это так
называемая индифферентная стадия развития эмбриона, когда половая система
обоих полов развивается по одной генетической программе. В период
формирования гонадного пола у плода развиваются мужской (вольфов) и
женский (мюллеров,) протоки. Первоначально развитие этих протоков
начинается унипотенциально, т. е. независимо от будущего пола, и только один
из них может развиваться в половой тракт, связанный с конкретным
генетическим полом плода. В частности, вольфов проток превращается в
структуры мужского полового тракта, а мюллеров — женского (табл. 16.1).
Закладка индифферентных гонад происходит у эмбриона в виде
гонадных валиков. В эпителии гонадных валиков обособляются крупные
первичные половые клетки, которые в дальнейшем дают начало развитию
половых клеток. Первичные половые клетки дифференцируются на 5-й день
после фертилизации. По прошествии 3 нед они определяются среди клеток
внезародышевой энтодермы в стенке желточного мешка (часть первичной
кишки, вынесенная за пределы зародыша). От поверхности внутрь
половых валиков прорастают тяжи, состоящие из первичных половых клеток
фолликулярного эпителия, который выполняет для первичных половых
клеток трофическую роль. В течение 3 нед жизни эмбриона в половых
валиках эти клеточные элементы развивается в ткань, которая будет основой
первичных гонад. Первичные половые клетки из вольфова тела мигрируют
в эту ткань, в которой из них будут образовываться половые клетки или
гаметы. В индифферентный период развития первичных гонад в их стро-
мальной ткани содержится два типа клеток. Один тип клеток на гонадной
Таблица 16.1. Особенности формирования гонадного пола у плода
Генетический статус пола
XY хромосомы (мужской)
XX хромосомы (женский)
Развивающиеся
гонады
Семенники
Яичники
Источники развития гонад
женский проток
Регрессия
Развитие
мужской проток
Развитие
Регрессия
Наружные
половые
органы
Мужские
Женские
16. Репродуктивная функция человека • 671
стадии дифференциации пола развивается в гранулезные клетки яичников
или в клетки Сертоли семенных трубочек в яичках. Второй тип клеток на
стадии гонад дифференцируются в клетки прозрачной оболочки (theca pel-
lucida) в яичниках или в клетки Лейдига в семенниках.
У эмбриона мужского пола на 6—7-й неделе эмбриональной жизни
после миграции первичных половых клеток в первичные гонады в
присутствии Y-хромосомы, содержащей SRY-ген, происходит дифференциация
клеток Сертоли. В процессе дифференциации клетки Сертоли
располагаются вокруг первичных половых клеток, в результате начинается развитие
трубочек семенников в первичных гонадах. Дифференциация мезенхи-
мальных (стромальных) клеток гонад в интерстициальные клетки Лейдига,
которые в последующем будут секретировать мужской половой гормон
тестостерон, начинается с 8—9-й недели и заканчивается на 10-й неделе
развития плода.
У женского эмбриона дифференцирование первичных гонад в яичники
начинается с 9-й недели, когда активируются Х-хромосомы. Их активация
приводит к пролиферации первичных половых клеток, деление которых
осуществляется путем митоза. К моменту рождения плода женского пола в
яичниках содержатся первичные ооциты, которые образуются в период
развития плода из первичных половых клеток путем мейотического
деления. Однако уже в периоде внутриутробного развития мейоз первичных
половых клеток блокируется (стадия поздней профазы) после образования
первичного ооцита. В первичном ооците мейоз на стадии поздней
профазы вновь возобновится спустя много лет в одну из будущих овуляций, под
влиянием гонадотропинов гипофиза и гормонов половых желез, в периоде
пубертатного развития женского организма.
16.1.3. Фенотипический пол
Развитие внутренних мужских половых органов у плода происходит под
влиянием тестостерона. Отсутствие его секреции в фетальных клетках
Лейдига приведет к образованию у плода женских половых путей. Секреция
тестостерона клетками Лейдига у плода мужского пола начинается
примерно на 9-й неделе развития, под влиянием хорионического гонадотро-
пина плаценты, секреция которого стимулируется гормоном роста. Под
влиянием тестостерона вольфовы протоки трансформируется в своем
развитии в придатки яичек, семявыносящие протки и семенные пузырьки.
Кроме того, на формирование фенотипического пола оказывает влияние
мюллеров ингибирующий фактор (синоним — анти-мюллеров гормон),
секреция которого начинается в яичках примерно с 7-й недели развития
эмбриона и который вызывает регрессию мюллеровых протоков у плода
мужского пола. Механизм регрессии мюллеровых протоков связан с тем,
что мюллеров ингибирующий фактор связывается с рецепторами
мембраны мезенхимальных клеток, окружающих эти протоки, а те в свою очередь
играют роль посредников в этом процессе.
У плода, развивающегося по женскому типу, гранулезные клетки и
клетки прозрачной оболочки не секретируют мюллеров тормозящий
гормон и тестостерон. При отсутствии аинти-мюллерова гормона мюллеровы
протоки превращается во внутренние женские репродуктивные органы
(маточные трубы, матка, верхняя часть влагалища), и одновременно
происходит регрессия вольфовых протоков в связи с отсутствием секреции
тестостерона у плода.
Развитие наружных половых органов. В отличие от внутренних органов
672 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
мужского и женского репродуктивного тракта, первичные наружные
гениталии у плода могут развиваться либо по мужскому, либо по женскому
типу. У плода, развивающегося по женскому типу, в отсутствии секреции
тестостерона одновременно с уретральными складками и генитальными
выпуклостями развиваются малые и большие половые губы, клитор. У
плода, развивающегося по мужскому типу, клетки Лейдига секретируют
тестостерон, который с этого периода способен превращаться в более
активный метаболит — дигидротестостерон. Этот гормон регулирует
нормальное развитие мужских половых органов, их слияние с уретральными
складками, а также с генитальными выпуклостями. В результате образуется
пенис. Кроме того, слияние генитальных выпуклостей по средней линии
приводит к образованию мошонки, в которую позднее у плода опускаются
яички, а генитальные бугорки развиваются в головку пениса. Клетки
Лейдига секретируют тестостерон под влиянием лютропина аденогипофиза, а
регуляция секреции клеток Лейдига осуществляется при участии
гипоталамуса. Нейроны гипоталамуса примерно на 4-й неделе развития эмбриона
начинают секретировать гонадолиберин, а на 10-й неделе — это
стимулирует в гипофизе секрецию лютропина. Другие фенотипические признаки
женского или мужского пола у индивидуума развиваются в пубертатном
периоде. В периоде детства концентрация гонадотропина, фоллитропина и
лютропина сохраняется на низком уровне, а также не функционирует
механизм отрицательной обратной связи их взаимной регуляции из-за
низкой чувствительности нейронов гипоталамуса к циркулирующим в крови
половым стероидам.
16.2. Репродуктивная функция мужского организма
В пубертатный период в мужском организме происходит развитие и
становление репродуктивной функции, характерной для организма взрослого
мужчины. При этом во время пубертатного периода в коре надпочечников
начинается секреция адреналовых мужских половых гормонов — андроге-
нов. В среднем в 11-летнем возрасте у мальчиков в семенниках начинается
увеличение количества клеток Лейдига и благодаря их функции уровень
секреции тестостерона постепенно достигает плато взрослого мужчины
(порядка 6 нг/мл плазмы крови). В течение пубертатного периода
происходит рост и развитие тела, изменение в регуляции многих функций
организма, в том числе ЦНС и гипоталамуса. Секреция гонадолиберина в
гипоталамусе и гонадотропинов (фоллитропина и лютропина) в гипофизе
постепенно достигает уровня взрослого мужчины и сохраняется на
относительно постоянном уровне в среднем до 50 лет, обусловливая характер
синтеза и секреции тестестерона в мужских половых железах (рис. 16.3).
16.2.1. Функции семенников
Основными функциями мужских гонад являются сперматогенез и
секреция мужских половых гормонов. Активность мужской репродуктивной
функции является непрерывной и не имеет циклических проявлений, как
в женском организме. Семенники развиваются в брюшной полости плода,
но примерно за 2—3 мес до рождения под влиянием нарастающей
концентрации тестостерона в плазме крови семенники опускаются в мошонку. В
мошонке температура составляет примерно 34 °С и ниже, что является
адекватной температурной средой для нормального течения сперматогенеза.
Оптимальная для сперматогенеза температура в яичках регулируется в про-
16. Репродуктивная функция человека • 673
Содержание
тестостерона
в плазме (нг/мл)
7-
Оплодотворение
Рождение
Средний
возраст
I Пубертат
. Старость
Г I I I—I
О 3 6 9 12
I I
Месяцы
Детство
-"■ ^т-//-г-/Л
20
60
Годы
Рис. 16.3. Изменение концентрации тестостерона в плазме крови мужского
организма в различные периоды жизни.
На протяжении жизни мужского организма секреторная функция клеток Лейдига
существенно изменяется. Высокая концентрация тестостерона отмечается в поздний период
внутриутробного развития (4 нг/мл), когда он необходим для регуляции интенсивного развития
наружных половых органов. Низкий уровень тестостерона в плазме крови поддерживается до пред-
пубертатного периода, поскольку отсутствуют клетки Лейдига. Следующий подъем секреции
тестостерона отмечается в 11 лет и удерживается в течение пубертатного периода. По
окончании пубертатного периода секреция тестостерона достигает уровня взрослого мужчины и
сохраняется вплоть до 50 лет жизни.
цессе противоточного температурного обмена между притекающей
артериальной кровью и оттекающей от тканей яичек венозной кровью, а также
при сокращении или расслаблении гладкой мышцы, поднимающей яичко,
что изменяет положение последнего относительно области центральной
температуры тела.
Сперматогенез осуществляется в семенных канальцах, стенки которых
выстланы сперматогенным эпителием, содержащим сперматозоиды и
предшествующие им клетки — сперматогонии, сперматоциты I и II
порядка, а также сперматиды, которые расположены между поддерживающими
клетками Сертоли (рис. 16.4). Плотные контакты между клетками Сертоли
создают надежный барьер с кровью (гематотестикулярный), который
препятствует развитию аутоиммунных реакций организма на антигены,
расположенные на мембране развивающихся половых клеток, а также действию
на сперматогенный эпителий токсичных веществ, попадающих в организм
из внешней среды. Клетки Сертоли выполняют трофическую функцию в
отношении развивающегося сперматозоида, фагоцитируют половые
клетки, утратившие способность к делению, а также остатки цитоплазмы
делящихся половых клеток. Клетки Сертоли синтезируют белок, способный
связывать тестостерон. Это поддерживает высокую концентрацию в спер-
матогенном эпителии гормона, необходимого для стимуляции
сперматогенеза.
Клетки Лейдига синтезируют мужские половые гормоны андрогены и
находятся в соединительной ткани между семенными канальцами.
Высокая активность этих клеток и соответственно высокая секреция
тестостерона имеет место в поздний период развития плода, что необходимо для
22 - 6095
674 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Просвет
семявыносящей
трубочки
Клетка Сертоли
Митохондрия
Ядро клетки
Сертоли
Базальная
мембрана
Сперматозоиды
^ Клетка Сертоли
Сперматида
Сперматоцит II
Сперматоцит I
Плотный контакт
Сперматогония
Рис. 16.4. Расположение сперматогенных клеток в эпителии семявыносящей
трубочки.
Семявыносящая трубочка окружена базальной мембраной, на которой находятся клетки
Сертоли и сперматогенные клетки (сперматогонии, сперматоциты I и II порядка, сперматиды).
Между клетками Сертоли расположены сперматогенные клетки, находящиеся на различной
стадии деления (митоз — сперматогонии и мейоз — сперматоциты I и II порядка) и
морфологической дифференциации (сперматиды). Плотные контакты между клетками Сертоли
представляют эффективный барьер между кровью и внутренней средой семявыносящей трубочки,
препятствуя попаданию вырабатываемых половых клеток в кровь и развитию иммунной
реакции мужского организма на эти клетки.
развития у него наружных половых органов. После рождения, к концу
первого года жизни происходит интенсивная регрессия количества клеток
Лейдига и снижение секреции в гонадах ребенка тестостерона в связи со
снижением секреции лютропина в гипофизе. В результате до начала
пубертатного периода в организме ребенка мужского пола не развиваются
первичные и вторичные половые признаки, которые характерны для
нормального взрослого организма мужчины. Начало пубертатного периода в
развитии мужского организма связано с началом секреции гонадолиберина
в гипоталамусе и лютропина в аденогипофизе. Под влиянием этих
гормонов, клетки Лейдига дифференцируются во взрослый тип и в них
начинается секреция тестостерона и дигидротестостерона, обусловливающих
половое развитие мужского организма (табл. 16.2).
16.2.2. Сперматогенез
В пубертатный период развития мужского организма активируется
продукция сперматозоидов, которая сохраняется на протяжении репродуктивного
периода жизни мужчины вплоть до глубокой старости. При этом
ежедневно продуцируется 200—400 млн. сперматозоидов. Сперматогенез, или
образование зрелых сперматозоидов, происходит в семенных канальцах на
протяжении стадий размножения, развития и созревания. Стадия
размножения начинается с митотического деления сперматогонии (см. рис. 16.1).
Несколько митотических делений сменяются двумя мейозами, во время
16. Репродуктивная функция человека • 675
Таблица 16.2. Роль основных андрогеиов в мужской репродуктивной функции
Гормон
Тестостерон
Дигид-
ротесто-
стерон
Период развития мужского организма
внутриутробный
Стимуляция
дифференциации:
семявынося-
щие протоки
семенные
пузырьки
придатки
яичек
пубертатный
Стимуляция пубертатного
роста организма
Рост пениса, семенных
трубочек
Сперматогенез
Секреция гонадотропинов
Регуляция по механизму
обратной связи: гипоталамус-
гипофиз—половые железы
Формирование вторичных
половых признаков:
развитие голосового аппарата,
мышц, распределение жира
Рост волос по мужскому
типу
Развитие сальных желез,
простаты
взрослый мужчина
Сперматогенез
Секреция гонадотропинов
Половые стимулы
Половое поведение
Регуляция по механизму
обратной связи: гипоталамус-
гипофиз—половые железы
Ткани пениса, семенных
пузырьков
Вторичные половые
признаки: голос, мышцы,
распределение жира
Количество эритроцитов к
крови и содержание в
плазме крови липидов
Сперматогенез
Секреция гонадотропинов
Половые стимулы
Половое поведение
Наружные половые органы
Семенные пузырьки
Регуляция по механизму
обратной связи: гипоталамус-
гипофиз—половые железы
которых диплоидное число хромосом (первичные сперматоциты)
уменьшается наполовину, т. е. становится гаплоидным (сперматоциты I и II
порядка). В стадии развития сперматоциты остаются связанными между собой
цитоплазматическими мостиками, которые исчезают только на финальной
стадии сперматогенеза. Одна первичная сперматогония образует в
результате деления 16 сперматид. В стадии созревания (спермиогенез) одна спер-
матида продуцирует один сперматозоид. Зрелый сперматозоид обладает
способностью транспортировать хромосомы к ооциту, после того как он
окажется в женском репродуктивном тракте. Период превращения сперма-
тогоний в зрелые сперматозоиды продолжается 70—80 сут.
Зрелый сперматозоид состоит из следующих структурных компонентов
(рис.16.5). Головка сперматозоида (2—5 мкм в диаметре) содержит ядро,
две центриоли и акросому. Ядро занимает большую часть головки
сперматозоида и содержит гаплоидный набор хромосом. Акросома головки
содержит ионы Са2+ и энзимы, необходимые для проникновения сперматозоида
в ооцит. Жгутик (хвост) сперматозоида имеет длину порядка 100 мкм и
содержит комплекс микротрубочек, необходимых для движения
сперматозоида. Митохондрии продуцируют энергию для сократительных белков,
осуществляющих волнообразные движения жгутика сперматозоида
16.2.3. Гормональная регуляция сперматогенеза
Сперматогенез стимулирует лютропин аденогипофиза. Под влиянием лю-
тропина интерстициальные клетки Лейдига секретируют мужской половой
гормон тестостерон. Гормон диффундирует через базальную мембрану в
22-
676 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
семенные канальцы,
связывается со специфическим белком,
который секретируется
клетками Сертоли, и, таким образом,
накапливается в сперматоген-
ном эпителии, стимулируя
сперматогенез. Концентрация
тестостерона во внутренней
среде семенных канальцев в 100
раз выше, чем в плазме крови.
Тестостерон, образующийся в
клетках Лейдига, поступает в
клетки Сертоли и в них
превращается в более активный
гормон — дигидротестостерон,
который транспортируется в
жидкость канальцев, и в
присутствии которого происходит
деление сперматогоний.
Тестостерон стимулирует
формирование метаботропных
рецепторов фоллитропина в
клетках Сертоли. Фоллитропин
через эти рецепторы активирует
клетки Сертоли, благодаря
трофической и барьерной функции
которых осуществляются
процессы митотических и мейоти-
ческих делений, а также спер-
миогенез мужских половых
клеток. Гормон роста аденоги-
пофиза через метаботропные
рецепторы мембраны клеток
Сертоли стимулирует их
метаболическую активность, а в
отношении сперматогоний — активирует начало их митотического деления.
Под влиянием фоллитропина в клетках Сертоли тестостерон
ароматизируется в эстрадиол-17(3, который поддерживает нормальное течение спермио-
генеза мужских половых клеток. Фоллитропин и тестостерон являются си-
нергистами стимуляции в клетках Лейдига синтеза белка, который
транспортирует эстрогены и тестостерон от клеток Лейдига в жидкость,
заполняющую семенные канатики, в которых эти гормоны активируют сперма-
тонгенез. На рис. 16.6 представлена общая схема стероидогенеза,
происходящего в клетках Лейдига и Сертоли.
Лютропин контролирует метаболическую активность клеток Лейдига,
связываясь, с мембранными рецепторами системы G-белков, которые
активируют энзимы аденилатциклазу и фосфолипазу С. Вторичным
посредником действия лютропина на клетки Лейдига является цАМФ. При этом
в клетках Лейдига в первые минуты действия гормона возникает быстрый
стероидогенный эффект. Эффект проявляется в резком увеличении
содержания цАМФ и росте продукции тестостерона за счет активации
перемещения холестерина из цитозоля клеток на внутреннюю мембрану
митохондрий. Лютропин оказывает метаботропный {трофический) долговременный
Жгутик
Митохондрии
Постакросомальная
область
Акросома
Рис. 16.5. Схематическое изображение
строения зрелого сперматозоида.
Головка сперматозоида содержит ядро с
гаплоидным набором хромосом и имеет акросому.
Акросома в процессе акросомальной реакции выделяет
энзимы, с помощью которых сперматозоид
проникает через прозрачную оболочку внутрь ооцита
во время его оплодотворения. Средний отдел
сперматозоида содержит митохондрии, которые
производят энергию для двигательных филамент
жгутика. Зрелый сперматозоид способен
доставлять в женском репродуктивном тракте
хромосомы к ооциту благодаря двигательной активности
жгутика.
16. Репродуктивная функция человека • 677
Капилляр
Г
Лт
_bv
Сг
Ацетат
-\ И_> Холестерин 17"-,и^окси-
■"-^ | прогестерон
Ч\
>щ
Прегненолон
Прогестерон
Эстрон -
f
Андростедион
Интерстициальная
клетка Лейдига
Эстрадиол-17р
▲
►Тестостерон
Капилляр
V
Гг
I/
Z
Эстрон < Андростендион Тестостерон
Эстрадиол-17рЧ ^
Дигидротестостерон
Клетка
Сертоли
канальцев
Жидкость просвета канальцев
Рис. 16.6. Схема стероидогенеза в клетках мужских половых желез.
Биосинтез основного мужского полового гормона тестостерона происходит в клетках Лейдига.
Импульсная секреция лютропина (Лт) в аденогипофизе стимулирует в клетках Лейдига
секрецию тестостерона, концентрация которого в плазме крови также имеет незначительные
колебания в течение суток. Лютропин стимулирует секрецию клеток Лейдига путем связывания с
метаботропными рецепторами на их мембране (РЛт). Превращение тестостерона в эстрадиол-
17Ь и дигидротестостерон происходит в клетках Сертоли. Гормон эстрон синтезируется в
клетках Сертоли из андростендиона, образующегося в клетках Лейдига. Тестостерон и другие
мужские половые гормоны транспортируются в кровь и жидкость семенных канальцев, оказывая
физиологические эффекты на ткани мужского организма.
эффект на структуру и функцию клетки Лейдига. Тестостерон, который
синтезируется в клетках Лейдига, под влиянием лютропина диффундирует
через базальную мембрану в семенные канатики, где его нормальная
концентрация необходима для процесса сперматогенеза. Гормон аденогипо-
физа пролактин и фактор роста ингибин, секретируемые в клетках Сертоли
в качестве модуляторов, повышают стимулирующее действие лютропина
на функцию клеток Лейдига.
В клетках Сертоли секретируются так называемые факторы роста
ингибин и активин, которые тормозят по механизму отрицательной обратной
связи секрецию гонадотропинов в аденогипофизе, а следовательно,
сперматогенез.
Функция эстрогенов. Концентрация эстрогенов (эстрон и эстрадиол-17р)
в плазме крови мужского организма поддерживается за счет их
поступления в кровь из клеток Сертоли (ароматизируются из андрогенов), клеток
пучковой и сетчатой зон коры надпочечников.
Эстрогены по механизму отрицательной обратной связи тормозят
синтез тестостерона в клетках Лейдига, в результате уменьшается активность
всех стадий сперматогенеза, а также количество рецепторов фоллитропина
на мембране клеток Лейдига и синтез в них адроген-транспортного белка.
678 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Кроме того, эстрогены через мембранные и ядерные эстрогенные
рецепторы р-типа оказывают влияние на зрелые клетки Лейдига семенников
взрослых мужчин, а также на сперматогонии, сперматоциты и
развивающиеся сперматиды. Однако эстрогены не способны оказывать свое
физиологическое действие на зрелые сперматозоиды, поскольку в их ядре нет эс-
трогеновых рецепторов. С (3-типом эстрогенных рецепторов на мембране
клеток Лейдига способны связываться такие внеклеточные гуморальные
субстанции, как пептидные факторы роста и цитокины, и, таким образом,
стимулировать секреторную функцию этих клеток. Роль эстрогенов
заключается в модуляции образования рецепторов к аквапорину-I на мембране
клеток проксимальных отделов протоков придатков яичек. Под влиянием
аквапорина-1 увеличивается реабсорбция воды из жидкости семенных
канальцев и, таким образом, регулируется нормальное осмотическое
давление в канальцевой среде, окружающей зрелые сперматозоиды.
16.2.4. Мужской половой акт
Половое влечение является биологической мотивацией, формирующейся
на основе наследственно обусловленных механизмов гормональной
регуляции полового поведения и научения в процессе индивидуального
психофизиологического развития человека. Наследственно обусловленные
механизмы полового влечения связаны с функцией структур гипоталамуса как
первичного центра половой мотивации и лимбической системы.
Синхронизация во времени активности ядер лимбической системы (комплекс
ядер: миндалина—гипоталамус—мезенцефальные структуры—миндалина)
формирует функциональное состояние, характерное для сексуального
поведения. Ассоциативные области коры головного мозга и, прежде всего,
префронтальный неокортекс обеспечивают психофизиологическую
регуляцию полового поведения (выбор объекта полового влечения, морально-
этический опыт общения половых партнеров). В мужском организме
физиологические механизмы регуляции репродуктивной функции
поддерживают исходный уровень возбудимости физиологических систем или так
называемое состояние предварительной нейрогуморальной готовности,
которое обусловливает половое поведение.
16.2.4.1. Стадии мужского полового акта
Мужской половой акт подразделяется на стадии возбуждения, оргазма и
разрешения. Психические стимулы существенно увеличивают способность
субъекта выполнять половой акт. Например, эротические переживания
или даже сновидения сексуального характера могут сопровождаться
семяизвержением.
Основным эффектом стадии возбуждения мужчины является эрекция.
Эрекция — это появление механической твердости пениса в результате
увеличения его кровенаполнения, обеспечивающая реализацию мужского
полового акта. Степень эрекции прямо зависит от психических и физических
сексуальных стимулов, действующих на механизмы ее регуляции.
Основным физиологическим механизмом, вызывающим у мужчины
эрекцию пениса, является расслабление гладких мышц артерий пещеристых
тел и губчатого тела уретры с усилением их кровенаполнения. Регуляция
эрекции осуществляется центральными и периферическими нервными
механизмами.
Центральная нервная регуляция эрекции. Центры, регулирующие возник-
16. Репродуктивная функция человека • 679
новение эрекции, находятся в паравентрикулярном ядре и в преоптиче-
ской области гипоталамуса. Глутаматергтеские нейроны медиальной пре-
оптической области гипоталамуса, имеющие на своей мембране NMDA
рецепторы, при участии возбуждающего медиатора глутамата инициируют
эрекцию пениса через парасимпатические центры эрекции II—IV
крестцовых сегментов спинного мозга. Функция NMDA рецепторов на мембране
нейронов гипоталамических центров эрекции усиливается (модулируется)
оксидом азота. Оксид азота увеличивает активность нейронов медиальной
преоптической области и паравентирикулярного ядра гипоталамуса,
имеющих на своей мембране D2 тип дофаминовых рецепторов. Терминали
нейронов аофаминергической системы мозга, проецирующиеся к гипоталамиче-
ским центрам эрекции, выделяют нейротрансмиттер дофамин и
активируют указанные гипоталамические центры. Дофаминергические нейроны
гипоталамуса иннервируют нейроны пояснично-крестцовых сегментов и
через эти нейроны активируют вегетативные и соматические рефлексы
сексуального поведения, в частности, усиливают эрекцию.
Торможение эрекции происходит при участии нейронов
паравентрикулярного ядра гипоталамуса. На мембране нейронов паравентрикулярного
ядра гипоталамуса локализованы рецепторы, агонистом которых является
ГАМК. Активация ГАМКА типа мембранных рецепторов нейронов гипота-
ламического центра эрекции снижает их активность. Нейроны
паравентрикулярного ядра через нисходящие проекции аксонов и при участии
ГАМКВ типа рецепторов мембраны нейронов пояснично-крестцовых
сегментов спинного мозга тормозят эрекцию.
Центральная нервная регуляция эрекции осуществляется медиаторными
системами мозга, которые оказывают нисходящее активирующее влияние
на спинальные центры эрекции — парасимпатические нейроны
крестцовых сегментов спинного мозга. Так, серотонинергическая система мозга,
включающая нейроны вентральной ретикулярной формации
продолговатого мозга, проецирует аксоны своих нейронов к нейронам поясничных и
крестцовых сегментов спинного мозга, которые иннервируют органы
малого таза. Серотонин выделяется из окончаний серотонинергических
нейронов и связывается с рецепторами типа 5-НТ2С, расположенных на
мембранах нейронов спинальных центров эрекции. Снижение активности
серотонинергических нейронов ядер ретикулярной формации
продолговатого мозга уменьшает экзоцитоз серотонина в терминалях нейронов, в
результате увеличивается активность парасимпатических нейронов
поясничных и крестцовых сегментов спинного мозга, что усиливает эрекцию
полового члена. Норадренергические нейроны области голубого пятна ствола
мозга проецируют свои терминали к нейронам крестцовых сегментов
спинного мозга, которые непосредственно регулируют кровенаполнение сосудов
пениса и вызывают его эрекцию.
Периферическая регуляция эрекции осуществляется через
парасимпатические центры II—IV крестцовых сегментов спинного мозга.
Парасимпатические волокна богато иннервируют гладкие мышцы тканей пениса. При
эрекции под влиянием гипоталамических центров ее регуляции и
указанных выше медиаторных систем мозга возрастает активность
парасимпатических центров эрекции спинного мозга. Холинергическая иннервация
оказывает непрямой расслабляющий эффект на гладкие мышцы
кавернозных тел и пещеристых тел уретры, увеличивая их кровенаполнение. Аце-
тилхолин выделяется из нервных окончаний и связывается с М2-холиноре-
цепторами пресинаптических окончаний адренергических нервов, которые
иннервируют гладкие мышцы указанных структур пениса. Активация М2-
680 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Гуанозинтрифосфат
1
Циклический
гуанозинмонофосфат
цГМФ-зависимые
протеинкиназы
Регнуляция активности
ионных каналов
холинорецепторов тормозит
высвобождение адреналина
из окончаний адренергиче-
ских нервов.
Функцией адренергиче-
ской иннервации тканей
пениса является уменьшение
его кровенаполнения при
отсутствии половой
мотивации у мужчины.
Высвобождение норадреналина
стимулирует преимущественно а,-
адренорецепторы мембраны
гладкомышечных клеток
стенки спиральных сосудов
пениса, вызывая их
сокращение. В кавернозных телах
адреналин вызывает
сокращение трабекулярных
гладкомышечных волокон. В
результате активации адренер-
гических нервных волокон
повышается тонус гладких
мышц тканей пениса и
понижается его
кровенаполнение.
Торможение
высвобождения адреналина из
окончаний адренергических
волокон под влиянием ацетилхо-
лина вызывает расслабление
трабекулярных
гладкомышечных волокон, увеличение
кровенаполнения
кавернозных тел и эрекцию полового
члена.
Ацетилхолин при
высвобождении из терминалей хо-
линергических волокон
усиливает эрекцию полового
члена за счет активации М3-холинорецепторов мембраны эндотелия
сосудов пениса и образования в них оксида азота. Основная роль оксида азота
в регуляции эрекции заключается в расслаблении гладких мышц
кавернозных тел и сосудов пениса. Механизм стимуляции эрекции пениса при
участии оксида азота заключается в следующем (рис. 16.7). Фермент гуани-
латциклаза гладких мышечных клеток кавернозных тел является основным
рецептором оксида азота, поскольку активность фермента после
связывания с оксидом азота возрастает примерно в 400 раз. Энзим катализирует
превращение гуанозинтрифосфата в циклический гуанозинмонофосфат,
который вызывает расслабление гладкомышечных клеток кавернозных тел,
открывает в их мембране кальций-зависимые калиевые ионные каналы.
Выход ионов калия из гладкомышечных клеток гиперполяризует их
мембранный потенциал, что вызывает закрытие L-типа потенциалзависимых
Рис. 16.7. Молекулярный механизм действия
N0 на клетки гладких мышц сосудов
кавернозных тел пениса.
Растворимая гуанилатциклаза, представленная в
связанной (с мембраной) и растворимой изоформах,
содержится практически во всех клетках. В гладких
мышцах кавернозных тел растворимая
гуанилатциклаза является основным рецептором для оксида азота.
Активность фермента повышается примерно в 400
раз после присоединения оксида азота. Энзим
катализирует превращение гуанозинтрифосфата в
циклический гуанозинмонофосфат. Циклический
гуанозинмонофосфат в эукариотических клетках путем
изменения активности ионных каналов, фосфодиэсте-
разы и протеинканазы вызывает расслабление
гладких мышц сосудов кавернозных тел. В результате
происходит их кровенаполнение и возникает эрекция
пениса.
16. Репродуктивная функция человека • 681
кальциевых ионных каналов. В результате прекращается диффузия ионов
Са2+ из внеклеточной среды в саркоплазму гладкомышечных клеток и
происходит их расслабление, вызывающее кровенаполнение кавернозных тел
пениса. АТФ в качестве активатора открытия калиевых ионных каналов
мембраны гладкомышечных клеток кавернозных тел также регулирует
тонус их гладких мышц, увеличивая или уменьшая эрекцию пениса.
Во время полового акта у мужчин происходит раздражение механоре-
цепторов головки полового члена. Парасимпатические импульсы от
нейронов сакральных сегментов спинного мозга, наряду с эрекцией, вызывают
секрецию слизи в уретральных и бульбоуретральных железах. Эта слизь
поступает по мочеиспускательному каналу пениса во влагалище и
способствует увлажнению (любрикации) коитуса.
Импульсы от механорецепторов головки полового члена по
афферентным волокнам достигают крестцовых сегментов спинного мозга и
усиливают возбуждение парасимпатических нейронов. При пороговом уровне
афферентных импульсов от механорецепторов головки полового члена реф-
лекторно возбуждаются сегментарные центры спинного мозга (Li-Ln),
вызывающие выброс спермы из придатков яичек, или эякуляцию.
16.2.4.2. Регуляция эякуляции
Эякуляция (семяизвержение) представляют собой заключительную
часть мужского полового акта. Эякуляции предшествует процесс эмиссии.
Он начинается в результате сокращения гладких мышц семявыносящих
протоков. Возбуждение нейронов сегментарных центров эякуляции
активирует преганглионарные симпатические волокна нейронов поясничных
сегментов, которые прерываются в нижнем брыжеечном узле и подчрев-
ном сплетении. Постганглионарные симпатические волокна оканчиваются
на гладких мышцах семенных пузырьков и семявыносящих протоков. Из
терминалей симпатических волокон высвобождается медиатор норадрена-
лин, который активирует ос-адренорецепторы мембраны гладкомышечных
волокон и при участии вторичных посредников открывает кальциевые
ионные каналы, что повышает внутриклеточный уровень ионов Са2+ и
вызывая сокращение гладких мышц семявыносящих протоков придатков.
Сокращение этих мышц выбрасывает сперму из протоков во внутреннюю,
или предстательную, часть уретры. Сокращение гладких мышц этих
протоков усиливается окситоцином, концентрация которого во время эякуляции
в плазме крови у мужчин повышается примерно в пять раз. Окситоцин
действует на гладкие мышцы семявыносящих протоков через окситоцино-
вые рецепторы на мембране гладкомышечных клеток. Внутренняя часть
уретры является рефлексогенной зоной. Раздражение этой зоны спермой
возбуждает парасимпатические нейроны сегментов Sn—S1V, иннервирую-
щие гладкие мышцы предстательной железы. В результате секрет
предстательной железы начинает также поступать в уретру и смешиваться со
спермой, образуя там семенную жидкость. Процесс до момента образования
семенной жидкости является эмиссией. Раздражение спермой
рефлексогенной зоны предстательной части уретры рефлекторно через крестцовые
сегменты спинного мозга вызывает сокращения поперечно-полосатой
мускулатуры луковично-губчатых и седалищно-пещерестых мышц, а также
мышц тазового дна. Ритмическое сокращение этих мышц сдавливает
проксимальные отделы кавернозных тел и губчатое тело мочеиспускательного
канала, способствуя выбросу семенной жидкости из уретры во влагалище
женщины. Этот процесс называется эякуляцией.
682 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
16.2.4.3. Оргазм
Оргазм — эмоционально-психическое ощущение полового наслаждения у
мужчин, которое появляется во время семяизвержения. Интенсивность
оргазма у мужчин напрямую коррелирует с концентрацией окситоцина в
плазме крови. Окситоцин сенсетизирует нейроны крестцового отдела
спинного мозга и головного мозга, участвующих в формировании
сексуального чувства у мужчин. Стадия оргазма мужского полового акта
сменяется стадией разрешения, во время которой в течение 1—2 мин
прекращается эрекция, состоянием рефрактерности в центральной и
периферической регуляции эрекции. Основным проявлением стадии разрешения
является снижение кровенаполнения кавернозных тел пениса, уменьшение
его объема и механической твердости, а также снижение у мужчины
сексуального чувства (период рефрактерности).
Динамика
секреции
гонадотропинов
Доминирует
секреция
лютропина
16.3. Репродуктивная функция женского организма
Женская репродуктивная функция осуществляется в виде двух больших
стадий подготовки организма женщины к оплодотворению яйцеклетки и
гестации. Последняя традиционно обозначается как беременность.
Подготовка женского организма к оплодотворению яйцеклетки
осуществляется в среднем в течение 28 дней, но может варьировать в пределах
21—33 дня. В этот период
женская репродуктивная
функция обеспечивает
созревание яйцеклетки в
яичниках. Созревание
яйцеклетки происходит в
течение овариального цикла.
Подготовка женского
организма к гестации
характеризуется циклическими
физиологическими
процессами, происходящими в
репродуктивном тракте
женского организма, прежде
всего в эндометрии матки, и
называются маточным, или
менструальным, циклом.
Принципиальной
особенностью функциональной
активности женской
репродуктивной функции
является ежемесячная
цикличность секреции
гонадотропинов (рис. 16.8), которая
обусловливает нормальное
течение овариального и
менструального циклов и их
длительность.
Доминирует
секреция
фоллитропина
Доминирует
секреция
фоллитропина
Годы
жизни
12
ri
16-45
Плод
1-11
Детство пУберт'ат
Грудной возраст
46 и более
Старость
Репродуктивный -
период
Рис. 16.8. Динамика секреции концентрации
фоллитропина и лютропина в плазме крови в
различные периоды жизни женского организма.
От момента начала секреции гонадотропинов у плода
и до окончания пубертатного периода секреция
фоллитропина и лютропина в женском организме имеет
сходную динамику с таковой в мужском организме.
В репродуктивный период жизни женщины секреция
гонадотропных гормонов имеет циклический характер
в соответствии с овариальным и менструальным
циклами.
16. Репродуктивная функция человека • 683
16.3.1. Овариальный цикл и оогенез
Овариальный цикл состоит из трех физиологических фаз: фолликулярной,
овуляторной и лютеальной, или фазы желтого тела. Фолликулярная фаза
овариального цикла начинается у женщины с момента начала
менструального кровотечения. Эта фаза варьирует по времени от 9 до 23 дней, но
является относительно постоянной у каждой женщины. Овуляторная фаза
продолжается примерно 1—3 дня й заканчивается овуляцией.
Заключительная фаза овариального цикла, лютеальная, в течение которой
сохраняется гормональная активность желтого тела, длится примерно 14 дней.
16.3.1.1. Фолликулярная фаза
В течение каждого овариального цикла начинается медленное развитие
фолликулов, количество которых нарастает в течение двух последующих
циклов. В этот период примерно 20 фолликулов достигают размера 2—
4 мм и в последующем цикле, благодаря появлению на мембране
фолликулярных клеток рецепторов к фоллитропину, они начинают развиваться под
влиянием этого гормона. Примерно за одну неделю в течение фолликуляр-
Рис. 16.9. Схема стероидогенеза в клетках женских половых желез.
Эффективность развития фолликулов в яичниках зависит от регулирующего влияния на них
гонадотропинов аденогипофиза. Рецепторы, на мембране клеток внутренней оболочки — к
лютропину (РЛт) и на мембране гранулезных клеток — к фоллитропину (РФт), появляются в
преантральной и ранней антральной стадиях развития фолликула. Связывание гормонов с
рецепторами к лютропину и фоллитропину стимулирует в клетках синтез стероидных гормонов.
Лютропин в текальных клетках стимулирует превращение ацетата и холестерина в андрогены
(70 % от циркулирующих в плазме крови). Под влиянием лютропина текальные клетки
синтезируют небольшое количество эстрогенов. Эстрогены и андрогены в небольшом количестве
диффундируют в гранулезные клетки и под влиянием фоллитропина эти гормоны
ароматизируются в эстрогены. Основными эстрогенами являются эстрадиол-17р и эстрон.
684 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Овуляция
I I I I I I I I I М I 1 | | И II I I I I I
Дни 28
Рис. 16.10. Динамика содержания лютропина и фоллитропина в плазме крови в
течение менструального цикла.
Успешное развитие овуляции во время короткой овуляторной фазы зависит от резкого и
быстро проходящего пика секреции лютропина и фоллитропина. Пик секреции гонадотропинов
нарастает в течение примерно 15 ч, достигает относительно постоянного уровня (следующие
15 ч), а затем снижается до исходного уровня в течение последующих 20 ч.
ной фазы один из фолликулов, на мембране которого выше, чем у других
фолликулов, плотность рецепторов к фоллитропину, достигает размеров в
среднем 11 мм и становится доминантным (вторичный фолликул). Это
обусловлено тем, что в нем синтезируется больше, чем в других
фолликулах, эстрадиола-17В. При высокой плотности рецепторов к фоллитропину
на мембране доминантного фолликула, в нем сохраняется способность
синтезировать эстрадиол-17В во время циклического снижения секреции
фоллитропина в аденогипофизе женщины. В этих условиях другие
фолликулы, имеющие низкую плотность рецепторов к фоллитропину на своей
мембране, синтезируют незначительное количество эстрадиола-17(3 и
подвергаются атрезии. Функция фоллитропина в развитии доминантного
фолликула заключается в следующем. Этот гормон связывается с рецепторами
мембраны гранулезных клеток и стимулирует в них синтез ароматазы,
превращающей тестостерон в эстрадиол^178. Тестостерон синтезируется во
внутренних клетках наружной оболочки фолликула (theca) и
диффундирует в гранулезные клетки, где гормон превращается в эстрогены (рис. 16.9).
Количество андрогенов фолликулярного происхождения у женщины
составляет примерно 70 % от их общей концентрации в плазме крови.
Гранулезные клетки содержат эстрогеновые рецепторы, с которыми
связывается образующийся в них эстрадиол и стимулирует пролиферацию этих
клеток, увеличивая размер фолликула. Одновременно эстрадиол-17В через
В-тип эстрогенных рецепторов активирует в гранулезных клетках абразова-
16. Репродуктивная функция человека • 685
ние новых рецепторов к фоллитропину. Поэтому чем больше образуется
гранулезных клеток в фолликуле, тем больше андрогенов ароматизируется
в эстрогены, которые стимулируют продукцию гранулезными клетками
еще большего количества эстрадиола-17(3 (механизм положительной
обратной связи). Нарастающий синтез эстрогенов в гранулезных клетках
приводит к повышению концентрации женских половых гормонов в плазме
крови. Эстрогены вместе с фоллитропином стимулируют образование на
мембране гранулезных клеток рецепторов к лютропину, который является
основным регулятором следующей стадии развития антрального фолликула
(третичный фолликул). Лютропин связывается с рецепторами на мембране
гранулезных клеток и клеток внутреннего слоя наружной мембраны (theca)
и стимулирует накопление в них липидов, желтого пигмента, а также пре-
овуляторное увеличение образования прогестерона, который инициирует
овуляцию. В конце фолликулярной фазы под влиянием нарастающей
секреции эстрогенов в фолликуле и увеличения в плазме крови концентрации
яичникового цитокина ингибина, тормозится секреция фоллитропина в
аденогипофизе по механизму отрицательной обратной связи. При этом
высокий уровень эстрогенов в плазме крови вызывает торможение
секреции гонадолиберина в гипоталамусе и фоллитропина в гипофизе.
Напротив, эти же гормоны (эстрогены и ингибин) по механизму положительной
обратной связи стимулируют резкое повышение концентрации лютропина
в плазме крови за 24—36 ч до начала овуляции (рис. 16.10). Нормальная
овуляция во время короткой овуляторной фазы зависит от выброса, в виде
быстро проходящего пика концентрации в плазме крови гонадотропинов,
прежде всего лютропина.
16.3.1.2. Овуляторная фаза
Овуляция происходит примерно через 15 ч после достижения
концентрацией лютропина в плазме крови максимальных значений (пик
концентрации). Лютропин связывается с рецепторами мембраны фолликулярных
клеток и активирует завершение первого мейотического деления
первичного ооцита (см. рис. 16.1). В результате образуется вторичный ооцит,
имеющий гаплоидное число хромосом, которые во время оплодотворения
яйцеклетки сливаются с гаплоидным числом хромосом сперматозоида.
Кроме того, лютропин, связываясь с рецепторами системы G-белков
фолликулярных клеток, увеличивает в них содержание вторичного
посредника цАМФ. Под влиянием цАМФ в фолликулярных клетках
непосредственно перед овуляцией прекращается фолликулогенез, связанный с
образованием в гранулезных клетках стероидогенных энзимов, рецепторов
фоллитропина, (3-эстрогеновых рецепторов и циклина D2, являющегося
регулятором митоза в фолликулярных клетках.
Под влиянием высокой концентрации лютропина в плазме крови
возрастает кровоток в капиллярах ткани фолликула за счет роста продукции
NO-синтазы и образования вазодилататора оксида азота в гладких мышцах
сосудов, питающих фолликул. Это увеличивает размер фолликула,
стимулируя накопление фолликулярной жидкости, которая своим
гидростатическим давлением истончает слой гранулезных клеток и клеток наружной
оболочки (theca) настолько, что лишь эпителиальный слой, покрывающий
поверхность яичника, отделяет стенку фолликула от перитонеального
пространства. В предовуляторную фазу лютропин стимулирует синтез
рецепторов прогестерона, пептида, активирующего синтез аденилатциклазы в
гипофизе, регуляторного фактора роста, которые вызывают овуляцию.
686 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Преовуляторное увеличение концентрации прогестерона в плазме крови
женщины активирует синтез в фолликуле протеолитических энзимов и
простагландинов (Е и F). Под действием простагландинов, а также тром-
боксанов и лейкотриенов происходит истончение, растяжение и
разрушение стенки фолликула. В результате зрелая яйцеклетка выходит через
стенку лопнувшего фолликула в жидкость перитонеального простраства.
Двигательная активность цилий ампулярного расширения фаллопиевой трубы
направляет движение ооцита в просвет фаллопиевой трубы.
16.3.1.3. Лютеальная фаза
После овуляции на месте лопнувшего фолликула образуется желтое тело,
функцией которого является секреция эстрадиола-17р, эстрона и
прогестерона, регулирующих подготовку эндометрия матки к имплантации
яйцеклетки. Если не происходит оплодотворения яйцеклетки, то желтое тело
функционирует в лютеальную фазу овариального цикла (меструальное
желтое тело). При оплодотворении яйцеклетки желтое тело
функционирует первую половину беременности (желтое тело беременности), а затем его
функция прекращается. Преовуляторное резкое повышение концентрации
лютропина в плазме крови женщины приводит к лютеинизации
гранулезных клеток и клеток theca и изменяет в них стероидогенез таким образом,
что после овуляции в плазме крови из женских половых гормонов
доминирует концентрация прогестерона. Связывание лютропина с рецепторами
системы G-белков на мембране лютеальных клеток увеличивает
содержание в них вторичных посредников, которые стимулируют транспорт
холестерина из плазмы крови в клетки желтого тела, где он используется для
синтеза прогестерона. Концентрация этого гормона в плазме крови
женщины в лютеальную фазу зависит от массы стероидогенной ткани в
желтом теле, интенсивности кровотока и способности стероидогенной ткани
синтезировать прогестерон под влиянием лютропина. Стероидогенез в
клетках желтого тела постепенно увеличивается и достигает пика
примерно на 8—9-й день после овуляции. В этот период концентрация
прогестерона в плазме крови женщины в 5 раз выше, чем в другие фазы
овариального цикла. Повышение в плазме крови эстрогенов и прогестерона в
лютеальную фазу по механизму отрицательной обратной связи тормозит
секреции гонадотропинов в аденогипофизе, увеличивая с 1 до 2—3 ч интервал
времени между периодами импульсного выброса этих гормонов кровь. В
результате не начинается развитие очередного фолликула в яичниках.
Секреция прогестерона в лютеальную фазу контролирует подготовку
(секреторная фаза маточного цикла) эндометрия матки к имплантации
яйцеклетки. В эту фазу происходит функциональное созревание клеток эндометрия,
который полностью подготавливается к имплантации яйцеклетки. Если
яйцеклетка не оплодотворяется, то желтое тело сохраняется около 14 дней
и затем подвергается лютеолизу.
16.3.1.4. Лютеолиз желтого тела
Лизис, или структурное разрушение, желтого тела называется лютеолизом.
В процессе лютеолиза утрачивается способность клеток желтого тела
синтезировать и секретировать прогестерон. Физиологическое значение
прекращения эндокринной функции желтого тела заключается в завершении
овариального цикл, а также менструального цикла, поскольку не
произошло оплодотворения яйцеклетки.
16. Репродуктивная функция человека • 687
Лютеолиз регулируется простагландином nrF2a, который образуется в
клетках основной оболочки (theca) желтого тела. Простагландин nrF2a
связывается со специфическими метаботропными рецепторами,
расположенными на мембране гранулезных стероидогенных клеток желтого тела.
Взаимодействие простагландина nrF^ с рецептором мембраны
стероидогенных клеток через систему G-белков и вторичные посредники инозитол-
3-фосфат и диацилглицерол активирует фосфолипазу С, которая вызывает
в позднюю фазу развития желтого тела гидролиз мембранных фосфолипи-
дов с высвобождением арахвдоновой кислоты. Арахидоновая кислота, в
свою очередь, является источником для синтеза простагландина nrF^, что
приводит к дополнительному росту концентрации простагландина и
активации лютеолиза. Последний усиливается под влиянием эндотелина-1,
секретируемого эндотелиальными клетками кровеносных сосудов желтого
тела. Эндотелии-1 вызывает спазм сосудов желтого тела, прекращение в
лютеальнои ткани кровотока и, как следствие, разрушение стероидогенных
клеток из-за недостатка в них кислорода и питательных веществ.
Удаление разрушенных клеток желтого тела осуществляется клетками
крови (лейкоцитами, эозинофилами и макрофагами). Т-лимфоциты в
желтом теле секретируют у-интерферон, с помощью которого иммунокомпе-
тентные клетки распознают поврежденные клетки желтого тела и удаляют
их из ткани яичника. Макрофаги фагоцитируют дегенеративные лютеаль-
ные клетки, тормозят с помощью цитокинов секрецию прогестерона в
клетках желтого тела и активируют секрецию основного активатора
лютеолиза простагландина nrF2a. Макрофаги продуцируют a-фактор некроза
опухоли, который тормозит секрецию прогестерона клетками желтого тела.
Продукцию прогестерона nrF2a активирует интерлейкин-I, который
высвобождается макрофагами, фибробластами и эндотелиальными клетками
капилляров желтого тела, что также усиливает лютеолиз. При участии
иммунных клеток крови и цитокинов во время лютеолиза регулируется
синтез простагландина nrF2a в клетках желтого тела, в них тормозится сте-
роидогенез и активируется фагоцитоз клеток в период его структурной
инволюции.
16.3.2. Менструальный цикл (маточный цикл)
Подготовка женского организма к гестации характеризуется циклическими
изменениями эндометрия матки, которые состоят из трех
последовательных фаз: менструальной, пролиферативной и секреторной — и называются
маточным, или менструальным, циклом.
16.3.2.1. Менструальная фаза
Менструальная фаза при длительности маточного цикла 28 дней
продолжается в среднем 5 дней. Эта фаза представляет собой кровотечение из
полости матки, которое возникает в конце овариального цикла, если не
происходит фертилизации и имплантации яйцеклетки. Менструация — это
процесс отторжения слоя эндометрия. Пролиферативная и секреторная
фазы менструального цикла включают процессы восстановления
эндометрия для возможной имплантации яйцеклетки в течение следующего
овариального цикла.
688 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
16.3.2.2. Пролиферативная фаза
Пролиферативная фаза варьирует по продолжительности от 7 до 11 дней.
Эта фаза совпадает с фолликулярной и овуляторной фазами яичникового
цикла, в течение которого возрастает уровень эстрогенов, в основном эст-
радиола-17р, в плазме крови. Основная функция эстрогенов в пролифера-
тивную фазу менструального цикла — стимуляция клеточной
пролиферации тканей органов репродуктивной системы с восстановлением
функционального слоя эндометрия и развитием эпителиальной выстилки
слизистой оболочки матки. В эту фазу под влиянием эстрогенов происходит
утолщение эндометрия матки, увеличение в размере его желез, секрети-
рующих слизь, растет длина спиральных артерий. Эстрогены вызывают
пролиферацию эпителия влагалища, усиливают секрецию слизи в шейке
матки. Секреция становится обильной, в ее составе увеличивается
количество воды, что облегчает движение в ней сперматозоидов. Стимуляция
пролиферативных процессов в эндометрии связана с увеличением
количества рецепторов прогестерона на мембране клеток эндометрия, что
усиливает в нем пролиферативные процессы под влиянием этого гормона.
Наконец, увеличение концентрации эстрогенов в плазме крови стимулирует
сокращение гладких мышц и микроворсин фаллопиевых труб, что
способствует продвижению сперматозоидов в направлении ампулярного отдела
фаллопиевых труб, где должно произойти оплодотворение яйцеклетки.
16.3.2.3. Секреторная фаза
Секреторная фаза менструального цикла начинается непосредственно после
овуляции и продолжается до начала менструации (в среднем 12—16 дней).
Основная роль секреторной фазы состоит в подготовке слизистой оболочки
матки к имплантации яйцеклетки. В эту фазу активно функционирует
желтое тело, стероидогенные клетки которого секретируют этсрадиол-17(3, эс-
трон и прогестерон. Основным условием нормального течения секреторной
фазы является высокая концентрация прогестерона в плазме крови.
Прогестерон совместно с эстрогенами действует на клетки желез слизистой
оболочки матки, вызывая в них секрецию. В секрете желез повышается уровень
гликогена, гликопротеинов, гликолипидов, которые необходимы для
поддержания метаболизма оплодотворенной яйцеклетки и способствуют ее
внедрению в слизистую оболочку стенки матки. Если не происходит
оплодотворения яйцеклетки и маточный цикл не завершается беременностью,
менструальное желтое тело подвергается лютеолизу. Это вызывает
снижение секреции клетками желтого тела эстрогенов и прогестерона и, как
следствие, уменьшение концентрации в плазме крови женщины содержания
этих гормонов. Понижение концентрации эстрогенов и прогестерона в
плазме крови вызывает в слизистой оболочке функционального слоя мио-
метрия повышение тонуса гладкомышечных клеток спиральных артерий, их
скручивание и уменьшение просвета. В результате ишемии эндометрия
возникает его некроз с последующим менструальным кровотечением.
16.3.3. Женский половой акт
Женский половой акт, как и мужской, состоит из стадии возбуждения,
эрекции и разрешения. По аналогии с мужчиной, у женщины способность
к осуществлению полового акта зависит от психической сексуальной
стимуляции и от стимуляции эрогенных зон.
16. Репродуктивная функция человека • 689
Половое возбуждение у женщины возникает при эротических
переживаниях, вызванных ментальными процессами или просматриванием
эротических картин или фильмов. Степень сексуального возбуждения варьирует
на протяжении овариального цикла; половое влечение выше накануне
овуляции, когда в крови увеличивается концентрация эстрогенов. Половое
возбуждение у женщины тесно связано с рецептивной направленностью
женской сексуальности, зависящей, от ситуации общения и эротической
стимуляции со стороны мужчины (словесные, а также тактильные ласки,
особенно эрогенных зон). Стимуляция эрогенных зон у женщин,
связанная с раздражением рецепторов наружных половых органов (половых губ,
преддверия влагалища и, особенно, клитора), в том числе во время
полового акта, активирует многочисленные механорецепторы, сигналы от
которых по срамным нервам поступают в парасимпатические центры
крестцовых сегментов спинного мозга. Возбуждение парасимпатических
эфферентных сосудорасширяющих нервов, а также симпатических вазоактив-
ных волокон, идущих от нейронов грудных и поясничных сегментов к
сосудам наружных и внутренних половых органов женщины, вызывает их
кровенаполнение.
Основными проявлениями стадии возбуждения являются эрекция
клитора и секреция слизи. Строение клитора идентично строению ткани
мужского полового члена. Поэтому активация иннервирующих клитор
парасимпатических волокон вызывает расслабление гладких мышц артерий при
участии оксида азота, расширение просвета артерий и увеличение
кровенаполнения ткани клитора. Импульсы по парасимпатическим нервам
достигают также бартолиниевых желез, локализованных в глубине малых
половых губ, и вызывает секрецию слизи. Слизь, секретируемая бартолиниевы-
ми железами и слизистой оболочкой влагалища, а также слизь,
выделяющаяся из желез мужской уретры во влагалище во время полового акта,
способствует увлажнению влагалища и формированию оптимального
сексуального чувства во время движений пениса во влагалище. Во время
полового акта усиление кровенаполнения органов малого таза по мере
нарастания нервного возбуждения изменяет размеры и положение матки,
которая отклоняется к задней стенке влагалища, образуя в области шейки
матки так называемую семяпринимающую полость. Одновременно в нижней
части влагалища в результате застоя крови может формироваться
оргастическая манжетка.
Оргазм. У женщин ощущение оргазма формируется в результате
рефлекторных сокращений внутренних (например, ритмические сокращения
оргастической манжетки влагалища под влиянием симпатических
рефлекторных механизмов) либо наружных половых органов (клитор). При этом
интенсивность мышечных сокращений во время оргазма прямо
взаимосвязана с увеличением концентрации в плазме крови окситоцина. Секреция ок-
ситоцина из клеток нейрогипофиза во время оргазма регулируется
миндалевидным комплексом и гипоталамусом. Ритмические сокращения мышц
промежности у женщины во время оргазма регулируются также рефлек-
торно центрами спинного мозга крестцовых сегментов. У мужчин нейроны
этих же крестцовых сегментов рефлекторно регулируют эякуляцию. Во
время оргазма у женщины рефлекторные сокращения гладких мышц
внутренних половых органов, а также расслабление шейки матки способствуют
продвижению спермы через матку и фаллопиевы трубы.
Интенсивное сексуальное чувство, которое возникает у женщины во
время оргазма, сопряжено с активацией двигательных систем головного
мозга, что сопровождается повышением тонуса скелетных мышц. Во время
690 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
оргазма увеличиваются частота дыхания, системное артериальное давление
и частота сердцебиений. Стадия оргазма у женщины, так же как и у
мужчин, сменяется стадией разрешения, во время которой нормализуются
параметры систем кровообращения и дыхания. Однако у женщин отсутствует
период рефрактерности после оргазма.
16.4. Оплодотворение (фертилизация)
Вероятность фертилизации зависит от времени полового сношения
относительно момента овуляции. Это обусловлено тем, что после эякуляции
сперма сохраняет жизнеспособность 3—5 дней, а ооцит — порядка 24
часов. Оптимальным местом фертилизации являются фаллопиевы трубы,
поскольку это увеличивает возможность имплантации зиготы в наиболее
благоприятное для ее развития место матки — на задней стенке в верхней ее
трети. Сперматозоиды, попавшие во влагалище женщины во время
полового акта, примерно через 30 мин после эякуляции достигают устьев
фаллопиевых труб, а еще через 15 мин —их ампулярной части, где обычно
происходит оплодотворение яйцеклетки.
В репродуктивном тракте мужчины сперматозоиды имеют низкую
оплодотворяющую способность. Нормальная оплодотворяющая способность
сперматозоидов формируется после эякуляции в женском репродуктивном
тракте. Формирование нормальной оплодотворяющей способности
сперматозоидов, или капацитация, происходит в результате образования
спермы, т. е. смешивания сперматозоидов с семенной жидкостью во
влагалище, а также во время продвижения сперматозоидов через слизь шейки
матки. Продвижению сперматозоидов в просвете фаллопиевых труб
способствуют собственная двигательная активность сперматозоидов и
направленные в сторону каудального отдела труб волны сокращения гладких
мышц стенки яйцевода. Двигательная активность сперматозиодов,
находящихся в каудальной части фаллопиевых труб, возрастает через несколько
минут после овуляции. Это свидетельствует о том, что ооцит или
фолликулярные клетки высвобождают сигнальные факторы, которые активируют
подвижность сперматозоидов (хемотаксис) и направляют их в зону
оплодотворения. Только небольшая часть сперматозоидов человека (2—12 %)
обладает хемотаксисом, т. е. реагирует на хемостимуляцию фолликулярными
факторами. Поэтому в оплодотворении ооцита избирательно участвуют
только капацитированные сперматозоиды. Следующим физиологическим
процессом, предшествующим фертилизации, является акросомальная
реакция сперматозодида.
Физиологическая роль акросомальной реакции заключается в слиянии
акросомальной мембраны сперматозоида с наружной мембраной его
головки и формировании в обеих мембранах пор, через которые способны
выходить из сперматозоида акросомальные энзимы. Эти энзимы способны
разрушать контакты между гранулезными клетками холмика (cumulus
oophorus), внутри которого находится^ ооцит, формируя путь
проникновения к нему сперматозоида через толстую прозрачную оболочку (zona pellu-
cida). Основным физиологическим активатором акросомальной реакции
сперматозоида является zona pellucida, гликопротеины которой
связываются с олигосахаридами полипептидов мембраны сперматозоида.
Физиологическим эффектом связывания рецепторов zona pellucida с мембраной
головки сперматозоида является увеличение концентрации ионов Са2+
сперматозоида. Молекулярный механизм этого процесса связан с открытием Т-
типа потенциалзависимых кальциевых ионных каналов в мембране голов-
16. Репродуктивная функция человека • 691
Рис. 16.11. Акросомальная реакция сперматозоида.
Zona pellucida ооцита связывается с рецепторами мембраны головки сперматозоида
(например, спермадгезином — СА). Активированные рецепторы мембраны сперматозоида при
участии Gi-белка стимулируют мембранный белок, транспортирующий Н+-ионы из цитоплазмы
сперматозоидов, что увеличивает в ней рН (1). Активация рецепторов мембраны
сперматозоида стимулирует образование вторичных посредников инозитол-3-фосфата (ИФЗ), а также
циклического аденозин-монофосфата. ИФЗ открывает кальциевые ионные каналы акросомы и
мембраны сперматозоида. В результате в цитоплазме сперматозоида повышается
концентрация ионов Са2+. Вторичные посредники стимулируют образование энзимов, вызывающих
разрушение мембраны акросомы и головки сперматозоида. Акросомальная реакция модулируется
прогестероном и у-аминомасляной кислотой. При этом прогестерон является основным
регулятором проницаемости кальциевых ионных каналов мембраны головки сперматозоида.
Открывание калиевых потенциалзависимых ионных каналов (2) гиперполяризует мембрану
головки сперматозоида и инактивирует потенциалзависимые кальциевые ионные каналы. АР —
акросома, ФИ2 — фосфатидилинозитол, ДАГ — диацилглицерол.
ки сперматозоида в результате ее деполяризации (непрямой эффект
связывания рецепторов zona pellucida с рецепторами мембраны сперматозоида,
действие прогестерона). Прогестерон в наибольшей степени влияет на
увеличение концентрации ионов Са2+ внутри сперматозоида человека, так как
активирует натриевые ионные каналы и, таким образом, вызывает
деполяризацию мембраны сперматозоидов. Прогестерон увеличивает
взаимодействие у-аминомасляной кислоты с ГАМКА-рецепторами мембраны
сперматозоидов, что увеличивает выход ионов хлора из цитоплазмы и также
усиливает деполяризацию их мембраны.
Через открытые каналы ионы Са2+ диффундируют внутрь сперматозоди-
да по концентрационному градиенту из внеклеточной среды. Увеличение
концентрации ионов Са2+ внутри сперматозоида происходит за счет
высвобождения ионов из депо акросомы при участии системы семейства Gi-бел-
ков, вторичного посредника инозитол-3-фосфата, цАМФ и при условии
высокого внутриклеточного рН (рис. 16.11). Инозитол-3-фосфат и цАМФ
изменяют активность соответственно протеинкиназы С и протеинкиназы
А, что приводит к фосфорилированию различных протеинов (протеолити-
ческий фермент акрозин, нейраминидаза и гиалуронидаза), которые
вызывают образование пор в мембране сперматозоида, выходят во
внеклеточную среду и растворяют толстую оболочку ооцита. Проникновение
головки сперматозоида через отверстие в zona pellucida вызывает диффузию ио-
692 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
нов Са2+ из головки сперматозоида во внеклеточную среду, окружающую
ооцит. В присутствии ионов Са2+ из ооцита высвобождаются субстанции,
которые изменяют свойства поверхностных гликопротеинов zona pellucida,
что препятствует проникновению через нее других сперматозоидов.
Изменение свойств поверхностных гликопротеинов zona pellucida называется
зональной реакцией и свидетельствует о том, что ооцит оплодотворен одним
сперматозоидом. В момент зональной реакции из ооцита высвобождается
проядро ооцита (второе полярное тельце) (см. рис. 16.1) с гаплоидным
числом хромосом и происходит его слияние с проядром сперматозоида,
также содержащего гаплоидное число хромосом. В результате образуется
зигота с диплоидным числом хромосом.
16.5. Имплантация оплодотворенной яйцеклетки
После начального периода митотической сегментации зиготы, благодаря
слабым движениям ресничек реснитчатых клеток слизистой оболочки
маточных труб в направлении матки, оплодотворенная яйцеклетка
транспортируется к матке, и оказывается в ней через 5 дней после овуляции (18—
19-й день менструального цикла). К этому времени эндометрий матки под
влиянием эстрогенов и прогестерона полностью сформирован для
имплантации оплодотворенной яйцеклетки.
Оптимальные условия для имплантации яйцеклетки имеют место в
середине лютеальной фазы овариального цикла, когда под влиянием
прогестерона желтого тела полностью сформировался функциональный слой
эндометрия. Процесс имплантации происходит после контакта бластоцисты
со стенкой матки, как правило, в ее верхней задней области. В течение
одного часа после начала имплантации в матке происходят изменения в
стромальной ткани матки, называемые децидуализацией, течение которой
зависит от эстрадиола-17р и прогестерона.
Децидуализация характеризуются ростом проницаемости стенки
сосудов функционального слоя эндометрия, в результате которого возникает
местный тканевой отек, сопровождающийся изменением состава
межклеточного матрикса, структуры стромальных клеток и увеличением
проницаемости капилляров. В этих условиях трофобластные клетки бластоцисты
полностью погружаются в глубину слизистой оболочки эндометрия. Этот
процесс называется интерстициалъной имплантацией. Имплантация
яйцеклетки в эндометрий матки регулируется хорионическим гонадотропином,
который продуцируется в трофобластных клетках бластоцисты после
начала его внедрения в слизистую оболочку матки. С другой стороны,
имплантация зародыша вызывает усиление афферентных импульсов от
рецепторов слизистой оболочки матки в гипоталамус. Постоянный поток этих
афферентных импульсов активирует секрецию либерина в гипоталамусе и
приводит к непрерывной секреции в кровь лютропина аденогипофиза.
Непрерывный характер секреции лютропина тормозит следующий
менструальный цикл у беременной женщины;
16.6. Беременность
По мере того как эмбрион внедряется в слизистую оболочку матки (в
среднем 48 ч), материнские сосуды слизистой оболочки повреждаются, а вновь
развивающиеся фетальные кровеносные сосуды оказываются
погруженными непосредственно в материнскую кровь. В результате образуется гемохо-
риалъная плацента, которая разделяет, по крайней мере, одним слоем эн-
16. Репродуктивная функция человека • 693
дотелиальных клеток капилляров на протяжении всего периода
беременности кровь плода и матери. Это позволяет поддерживать между организмом
матери и плода газообмен и обмен веществ.
16.6.1. Функции плаценты
Плацента является местом диффузии и активного транспорта метаболитов,
дыхательных газов и электролитов между матерью и плодом, за
исключением клеток и больших молекул белков. Проникновение веществ из крови
матери в кровь плода и в обратном направлении регулируется функцией
плацентарного барьера, образованного эпителием ворсинок и эндотелием
погруженных в них капилляров. Функциями плаценты является
дыхательная (обмен 02 из крови матери в кровь плода и С02 в обратном
направлении), питательная (расщепление белков, углеводов и жиров энзимами
плаценты и синтез питательных веществ, поступающих в кровь плода),
экскреторная (выведение продуктов метаболизма из крови плода в кровь
матери), детоксикационная (например, лекарственных препаратов,
принимаемых во время беременности женщиной) и эндокринная. Плацента
выполняет во время беременности роль эндокринного органа,
синтезирующего стероидные, пептидные и белковые гормоны. Функциями гормонов
плаценты являются сохранение беременности, регуляция обмена веществ в
организме матери и плода, структурная и физиологическая подготовка
молочных желез беременной женщины к лактации. В отношении продукции
гормонов плод и плацента функционируют совместно и представляют
собой фетоплацентраную единицу (рис. 16.12).
Диффузия кислорода через плацентарную мембрану является жизненно
необходимым процессом для развития плода. В среднем напряжение 02 в
синусах плаценты составляет 50 мм рт. ст., в крови плода — примерно
30 мм рт. ст. При столь низком градиенте 02 эффективность кислород-
транспортной функции поддерживается за счет фетального гемоглобина,
его высокой концентрации в крови плода (на 50 % выше, чем в крови
матери), а также эффекта Бора. Физиологическая роль последнего состоит в
том, что повышенная концентрация углекислого газа в крови матери
понижает сродство кислорода с гемоглобином и облегчает отдачу 02 из
эритроцитов при газообмене в плаценте и способствует кислородному
снабжению организма плода при низком его содержании в крови матери.
Углекислый газ непрерывно образуется в тканях плода и выводится из его
организма через плаценту в кровь матери. В крови плацентарных синусов
содержание углекислого газа не превышает 40 мм рт. ст. Напряжение С02 в
крови плода на 2—3 мм рт. ст. выше, чем в крови матери. Это достаточно
низкий градиент концентрации С02, но он не препятствует эффективному
выведению из организма плода углекислого газа, поскольку проницаемость
углекислого газа через гемохориальную плаценту в 20 раз выше, чем у
кислорода. В крови небеременной женщины напряжение углекислого газа
выше (46 мм рт. ст.), чем в крови беременной. Понижение содержания
углекислого газа в крови беременной женщины вызвано стимуляцией
дыхательного центра половыми стероидами; эстрогеном и прогестероном. В
результате в крови плода также поддерживается пониженное содержание
С02 — не выше 40 мм рт. ст.
Основным источником углеводов, используемых плодом, является
глюкоза. Перенос через плацентарную мембрану глюкозы осуществляется
путем облегченной диффузии. В мембране трофобластных клеток имеется
белок — переносчик глюкозы, однако в крови плода ее содержание на
694 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Кровообращение в
организме
матери _ _ .
Дегидроэпиандростерон
Холестерол Прогестерон
Эстрогены Эстрадиол Эстриол (основной
гормон беременности)
■t-
Плацента Холестерол-л (♦Прогестерон ДвгиДР°'-^Эстрогены—► Эстрадиол г—* Эстриол
Прегненолон с^Т'Г^ t 16-гидрокси-дегидро-
сг5?Рон Андростендион эпиандростерон сульфат
Плод
Прегненолон ■
-► Дегидро-
-►Дегидро-
-► 16-гидрокси-
эпиандростерон эпиандростерон дегидроэпиандростерон
сульфат (синтезируется в организме
плода)
Рис. 16.12. Схема продукции стероидных гормонов в плаценте и в организме плода.
В начале II триместра берменности, когда желтое тело прекращает свою функцию, основным
источником эстрогенов и прогестерона становится плацента. Оптимальный синтез эстрогена
осуществляется в условиях нормальной функции надпочечников плода. Дигидроэпиандросте-
рон, который синтезируется в надпочечниках матери и плода, транспортируется с кровью в
плаценту, где он ароматизируется в эстрогены. Примерно 50 % дигидроэпиандростерона
синтезируется в надпочечниках плода. Основным эстрогеном, продуцируемым плацентой,
является эстриол; в меньшем количестве продуцируются эстриол-17р и эстрон-17р. Напротив, во
время менструального цикла основным эстрогеном является эстадиол-17р. Синтез В плаценте
эстриола происходит за счет 16о-гидрокси-дегидроэпиандростерона, образующегося в
организме плода. Напротив, эстрадиол и эстрон синтезируются за счет дигидроэпиандростерона
как организма матери, так и плода. В конце беременности концентрация эстриола в плазме
крови равна 400 нМ/л, а эстрадиола — 50 нМ/л.
20—30 % ниже, чем в крови матери. Аминокислоты транспортируются
через плаценту механизмом активного транспорта, и их концентрация в
крови плода выше, чем в крови матери. Жирные кислоты с короткой
цепью и глицерол диффундируют через плацентарный барьер свободно по
концентрационному градиенту. В плаценте или в организме плода они
являются источником синтеза более сложных липидов. Жирорастворимые
витамины свободно диффундируют через плаценту, а водорастворимые —
с помощью механизма активного транспорта. Белки, исключая
материнские белковые и пептидные гормоны, не проникают из крови матери в
кровь плода через плаценту. Исключение составляет иммуноглобулин IgG,
который транспортируется через плацентарный барьер в кровь плода с
помощью специфического белка переносчика. Большинство минеральных
веществ и электролитов свободно диффундирует через плацентарный
барьер. Однако развивающийся плод испытывает повышенные
потребности в минеральных веществах. Поэтому в его крови поддерживается
положительный минеральный баланс (например, ионов Са2+, Fe2+, Na+, K+) за
счет работы специфических мембранных ионных насосов клеток
плацентарного барьера.
Выведение продуктов метаболизма^ образующихся в организме плода,
осуществляется путем диффузии: прежде всего, это касается мочевины,
мочевой кислоты и креатинина. Уровень мочевины в крови плода ниже,
чем в крови матери, так как это вещество диффундирует через
плацентарную мембрану достаточно легко. Напротив, креатинин диффундирует
менее легко, но его диффузия происходит достаточно эффективно из-за
высокого градиента концентрации между кровью плода и матери.
16. Репродуктивная функция человека • 695
16.6.2. Плацентарные гормоны
Клетки трофобласта во время его имплантации в функциональный слой
эндометрия дифференцируются в цитотрофобласт и синцитиотрофобласт
Оба типа клеток секретируют белковые и пептидные гормоны, а син-
цитиотрофобластные — стероидные. Функция гормонов плаценты — это
регуляция нормального течения беременности и развития плода. В
плаценте синтезируются хорионический гонадотропин, хорионический сомато-
маммотропин, плацентарный лактогенный гормон, а также стероиды —
эстрогены и прогестерон
Человеческий хорионический гонадотропин. Секреция этого гормона
начинается на ранних этапах беременности — примерно с 9-го дня гестации.
В течение I триместра беременности концентрация гормона в плазме
крови беременной женщины интенсивно нарастает до максимума на 9—12-й
неделях (рис. 16.13). Появление гормона в моче женщины является тестом
на наличие беременности. Функция хорионического гонадотропина
исключительно важна для продолжения беременности. В течение овариаль-
ного цикла, если оплодотворения не происходит, прогестерон желтого тела
и эстрогены тормозят секрецию лютропина в аденогипофизе, поддерживая
сохранение желтого тела. В период снижения концентрации прогестерона
и эстрогенов в плазме крови беременной женщины происходит меструа-
ция. Во время беременности стабильный уровень концентрации
эстрогенов и прогестерона в плазме крови поддерживает нормальное
функциональное состояние эндометрия. Это обеспечивается регулирующим
эффектом хорионического гонадотропина, который во время беременности
действует как плацентарный гонадотропин. С начала II триместра
беременности плацента способна самостоятельно продуцировать достаточное
количество эстрогенов и прогестерона, при участии которых эндометрий
поддерживается в нормальном функциональном состоянии, независимо от
секреции гормонов в желтом теле. С этого периода концентрация хориониче-
Уровень
гормонов
в плазме
1 триместр
Хорионический
гонадотропин
II триместр
НИ триместр
Прогестерон
*" *\ 500 нмоль/л
Общий
эстроген
400 нмоль/л
\
\
{
о
Дни
100
200
300
Рис. 16.13. Динамика содержания в плазме крови уровня человеческого
хорионического гонадотропина, прогестерона и эстрогенов в различные сроки беременности.
Во время беременности постоянно возрастает уровень эстрогена в плазме крови. В I триместре
его основным источником являются клетки желтого тела. В этот же период беременности
увеличивается концентрация прогестерона в плазме крови, который продуцируется в плаценте. С
началом II триместра, когда желтое тело прекращает функционировать, основным
источником эстрогенов и прогестерона является плацента.
696 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ского гонадотропина в плазме крови беременной женщины постепенно
снижается, а желтое тело может функционировать без регулирующего
влияния хорионического гонадотропина. В этот период развития плода
физиологическая роль гормона заключается в стимуляции секреции
клетками Лейдига фетального тестостерона, а клетками надпочечников — де-
гидроэпиандростерона. Эти гормоны необходимы для нормального
развития наружных половых органов у плода, т. е. становлению фенотипическо-
го пола.
Эстрогены. На протяжении беременности концентрация эстрогенов в
плазме крови беременной женщины постоянно увеличивается (см. рис.
16.13). Основным эстрогеном, синтезируемым в плаценте, является эстри-
ол, в меньшем количестве синтезируются эстрадиол-17(3 и эстрон-17(3.
Например, в поздний период беременности концентрация эстриола в плазме
крови женщины составляет 400 нМ/л, а эстрадиола — порядка 50 нМ/л.
Плацентарный синтез эстриола обеспечивается 16сс-гидрокси-дегидроэпи-
андростероном, который поступает только от плода, в то время как
источником эстрадиола-17(3 и эстрона-17р является дегидроэпиандростерон
матери и плода. Поэтому нормальная концентрация эстрогенов в моче
беременной женщины отражает нормальное функционирование фетоплацен-
тарной единицы. Если снижается функционирование организма плода, то
существенно понижается экскреция с мочой эстриола в общем количестве
выводимых из организма беременной женщины эстрогенов.
Прогестерон. В течение беременности лютропин аденогипофиза
стимулирует рост и гормональную активность материнского желтого тела.
Желтое тело секретирует прогестерон, который является наиболее важным
гормоном в отношении сохранения жизнеспособности плода во время его
развития в полости матки. Примерно с 12-й недели беременности в плазме
крови беременной женщины сохраняется постоянный повышенный
уровень прогестерона, который достигает концентрации порядка 500 нМоль/л
во II и III триместрах беременности (см. рис. 16.13). Гормон существенно
снижает сократительные свойства миометрия во время беременности,
поскольку тормозит функцию всей системы окситоциновых рецепторов в
матке.
К концу беременности, которая продолжается в среднем 9 мес, в крови
беременной женщины уровень прогестерона снижается. Происходит
«смещение» содержания в плазме крови половых гормонов в сторону
эстрогенов, которые резко увеличивают чувствительность миометрия к окситоци-
ну. Под действием окситоцина повышается сократительная активность
мускулатуры матки. К началу родов возрастает концентрация в амниотиче-
ской жидкости некоторых простагландинов (F2, E, и Е2), которые также
стимулируют родовую деятельность. Эффекты окситоцина и
простагландинов на миометрий реализуется через цАМФ, при этом происходит
деполяризация мембранного потенциала клеток за счет повышения
проницаемости мембран миоцитов для ионов натрия. Повышается также
проницаемость мембран миоцитов для ионов кальция, мобилизация которых из
внеклеточной среды необходима для начала активной родовой деятельности.
Человеческий хорионический соматомаммотропин. Нормальная
концентрация этого гормона в плазме крови беременной женщины является
основным индикатором нормального развития плода. Имеется прямая
зависимость нарастания концентрации гормона в плазме крови беременной
женщины по мере увеличения массы плаценты, однако этот феномен не
получил объяснения. По структуре и функции гормон идентичен пролак-
тину аденогипофиза и поэтому имеет другое название — человеческий пла-
16. Репродуктивная функция человека • 697
центарный лактоген. Действие гормона на ткани идентично гормону роста,
поскольку они имеют одинаковую молекулярную структуру. Гормон
стимулирует захват протеинов клетками тканей и усиливает рост тела плода.
Этот гормон обладает также липолитическим действием, что позволяет
организму беременной женщины использовать запасы жира в ее организме
как альтернативный источник энергии при дефиците белков и углеводов.
Хорионический соматомаммотропин оказывает антиинсулиновый эффект,
что сохраняет уровень глюкозы в крови на необходимом для
жизнедеятельности организма плода и матери уровне. На ранних этапах
беременности недостаточная секреция гормона в плаценте может стать причиной
спонтанного аборта, а на поздних — служит показателем недостаточной
секреторной функции плаценты.
Пролактин. В период беременности секреция пролактина в гипофизе
женщины прогрессивно увеличивается, превышая в 10 раз его содержание
в крови небеременной женщины. Функция гормона проявляется в
совместном действии эстрогена и прогестерона на развитие секреторных отделов
молочных желез у беременной женщины. Во время всего периода
беременности высокая концентрация в плазме крови беременной женщины
эстрогенов и прогестерона тормозит в ее молочных железах продукцию молока
под влиянием пролактина, хотя лактогенная функция молочных желез
формируется на четвертом месяце гестации. Пролактин резко усиливает
продукцию молока лишь после снижения в плазме крови эстрогенов и
прогестерона, что имеет место непосредственно перед родами. Высокий же
уровень пролактина в плазме крови у кормящей женщины тормозит в
ранний период после родов начало овариального цикла, что обусловливает
аменорею послеродового периода.
Релаксин в I триместре беременности секретируется клетками желтого
тела, а в поздние сроки — децидуальными клетками эндометрия. Функция
этого гормона в наибольшей степени проявляется в подготовке родовых
путей к родам: расслабление тазовых связок и, особенно, шейки матки. В
течение беременности гормон снижает возбудимость клеток миометрия и
их сократительную способность.
16.7. Роды и лактация
16.7.1. Роды
Физиологический процесс, возникающий в конце беременности, когда
плод через родовые пути женщины изгоняется из матки, называется
родами. Два процесса обеспечивают изгнание плода из матки:
координированные сокращения миометрия и раскрытие шейки матки. Биомеханика
родов состоит из фазы раскрытия шейки матки, изгнания плода и
послеродового периода. Ритмические сокращения миометрия, или схватки,
свидетельствуют о начале родовой деятельности. Во время схваток волна мышечного
сокращения распространяется со дна на тело и далее в сторону шейки
матки. Это укорачивает и расширяет шейку матки, а также повышает
давление в плодном пузыре. Шейка матки постепенно расширяется и
формируется единый родовой канал, через который плод изгоняется из матки.
Оболочка плодного пузыря разрывается под влиянием внутриматочного
давления. Изгнанию плода способствуют потуги — ритмические схватки,
скоординированные с сокращением мышц брюшного пресса. После рождения
ребенка начинается послеродовый период, в течение которого под влиянием
сокращений матки отслаивается плацента.
698 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
На протяжении беременности гладкие мышечные клетки миометрия
повышают чувствительность к стимулирующему действию эстрогенов:
увеличиваются размер и масса гладких мышечных клеток матки, передача
возбуждения между клетками осуществляется через щелевые контакты,
или нексусы. Во время беременности физиологическое действие
прогестерона на мембрану гладкомышечных клеток миометрия проявляется в
гиперполяризации мембранного потенциала. Гиперполяризация блокирует
потенциалзависимые кальциевые ионные каналы в мембране
гладкомышечных клеток и, таким образом, исключается возможность их
сокращения во время беременности.
Гладкие мышцы матки во время родов являются главной
тканью-мишенью для действия гормона нейрогипофиза — окситоцина. Окситоцин
синтезируется во время беременности в тканях матки — амнионе, хорионе и
децидуальной оболочке. Образующийся в клетках этих тканей окситоцин
достигает паракринно с амниотической жидкостью миометрия и способен
стимулировать его сокращение.
Окситоцин на фоне его нормального содержания в плазме крови
беременной женщины вызывает сокращение миометрия во время родов в
результате резкого увеличения концентрации окситоциновых рецепторов в
хориодецидуальной ткани, вызывающего повышение чувствительности
миометрия к действию окситоцина. Физиологический механизм
повышения чувствительности миометрия к окситоцину заключается в следующем.
Во время III триместра беременности концентрация эстрогенов и
прогестерона в плазме крови беременной женщины достигает плато. Однако в
соотношении эстрогены/прогестерон последний доминирует и, таким
образом, тормозит сокращение матки. Синтез окситоцина в децидуальной
оболочке эндометрия стимулирует высвобождение простагландина nrF2a,
который вызывает лютеолиз желтого тела. Прекращение функции желтого
тела приводит к снижению концентрации прогестерона в плазме крови
беременной женщины к концу III триместра беременности. Примерно за
24 ч до начала родов в плазме крови беременной женщины в соотношении
концентрации эстрогены/прогестерон начинают доминировать эстрогены.
Понижение концентрации прогестерона в плазме крови восстанавливает
возбудимость гладкомышечных клеток матки. Эстрогены активируют
продукцию в миометрии простагландинов, увеличение концентрации которых
стимулирует образование в гладкомышечных клетках матки рецепторов
окситоцина. В результате в течение нескольких часов, предшествующих
началу родов, плотность окситоциновых рецепторов на мембране
гладкомышечных клеток матки увеличивается примерно в 200 раз, возрастает
количество нексусов между гладкими мышечными клетками матки. Эти
процессы являются основой механизма повышения чувствительности
миометрия к окситоцину. Пик плотности окситоциновых рецепторов на мембране
гладкомышечных клеток матки приходится на ранний период родовой
деятельности, поэтому с началом родовой деятельности окситоцин начинает
стимулировать сокращение матки при такой его концентрации в плазме
крови, которой недостаточно для активации ее сокращений вне периода
беременности. Во время родовой деятельности потенциалы действия в
клетках миометрия распространяются по гладкомышечному синцитию, что
является источником координированных сокращений отделов матки во
время родов.
После родов концентрация окситоциновых рецепторов в миометрии
интенсивно снижается, только за первые 24 ч концентрация мРНК,
контролирующей синтез окситоциновых рецепторов в гладкомышечных клет-
16. Репродуктивная функция человека • 699
ках матки, снижается примерно в семь раз. Это обусловлено тем, что
отторжение плаценты во время родов вызывает резкое снижение
концентрации эстриола в плазме крови женщины, в результате снижаются
продукция простагландинов и уровень мРНК в клетках миометрия,
контролирующей образование окситциновых рецепторов. Снижение количества оксито-
циновых рецепторов в тканях матки в послеродовый период исключает
активацию ее сокращений во время лактации, когда рефлекторно возрастает
уровень окситоцина в плазме крови.'
16.7.2. Лактация
Во время беременности молочные железы развиваются, что позволяет
матери после родов адекватно обеспечивать питанием новорожденного.
Развитие молочных желез во время беременности регулируется гормонами
пролактином, эстрогенами и прогестероном, под действием которых
стимулируется развитие протоков, долей и альвеол молочных желез, а
следовательно, их подготовка к периоду вскармливания ребенка после родов
материнским молоком. Физиологические эффекты пролактина на молочные
железы включают их рост и развитие (маммогенез), синтез молока (лакто-
генез) и поддержание секреции молока (галактопоэз). Пролактин влияет
на морфогенез молочных желез двумя путями: до первой беременности
гормон контролирует ветвление протоков, во время беременности —
непосредственно контролирует развитие долек и альвеол. Лактогенез и галакто-
генез контролируются пролактином, который секретируется лактотрофами
аденогипофиза. Однако его физиологические действие на молочные
железы осуществляется только в комплексе с другими гормонами и факторами
роста. Например, развитие молочных желез до первой беременности
происходит под влиянием на молочные железы пролактина, эстрогенов,
прогестерона и глюкокортикоидов. В ранние сроки беременности
гипертрофия структурных элементов протоков, долей и альвеол в молочных железах
происходит под влиянием эстрадиола и прогестерона. Пролактин и
инсулин стимулируют рост тканей. В ткани молочных желез во время
беременности синтезируются специфические факторы роста, в частности эпидер-
мальный фактор роста, трасформирующийся в сх-фактор роста. Молочные
железы способны продуцировать молоко с четвертого месяца
беременности, поскольку к этому времени полностью завершается развитие протоков
и долей и происходит дифференциация альвеол. Последние выстланы
кубическим секреторным эпителием, способным к синтезу и секреции
молока при участии миоэпителиальных клеток, которые окружают снаружи
стенку альвеол и выводные протоки секреторных отделов молочной
железы. Основная функция пролактина в процессе лактогенеза — стимуляция
транспорта из плазмы крови в цитоплазму секреторных клеток альвеол
молочной железы аминокислот, синтез секреторными клетками белков
молока (казеин, сх-лактальбумина), транспорт глюкозы внутрь альвеолярных
клеток и синтез молочного сахара лактозы. В период беременности
пролактин не стимулирует секрецию молока в молочных железах, поскольку
эстрогены и, особенно, прогестерон тормозят действие пролактина на
секреторные клетки молочных желез (рис. 16.14). После родов в плазме крови
матери происходит снижение концентрации прогестерона, и пролактин
начинает стимулировать секрецию молока в альвеолярных клетках. Во
время лактации в секреторных отделах секретируются вода, электролиты,
жиры, сх-лактоальбумин, казеин, сывороточный альбумин, лактоферрин, ли-
зоцим, лактоза, антитела IgA.
700 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Оплодотворение Роды
Беременность
Прогестерон
Эстрогены
Прекращение
вскармливания
молоком
Лактация
Базальный уровень
эстрадиола до начала
менструальных циклов
Пролактин
Зрелое молоко
Переходное молоко
Секреция
молока
1 2 3
Недели после рождения
Рис. 16.14. Секреция материнских гормонов, вызывающая лактацию.
До рождения плода эстрогены и прогестерон тормозят секрецию молока в молочных железах,
несмотря на высокую концентрацию этого гормона в плазме крови беременной женщины.
После родов уровень пролактина в плазме крови снижается, но остается более высоким, чем у
небеременной женщины. Этот уровень концентрации пролактина в плазме крови
поддерживается только в течение 3—4 нед, если не начинается грудное вскармливание ребенка, а затем
снижается. После рождения ребенка нормальная секреция пролактина в гипофизе матери
поддерживается за счет нейроэндокринного рефлекса, возникающего у кормящей женщины
во время кормления ребенка грудью.
Во время кормления ребенка грудью рефлекторно возникает
сокращение миоэпитеальных клеток альвеол молочных желез у кормящей
женщины, и молоко выдавливается из них в протоки молочных желез.
Нейроэндокринный рефлекс выделения молока. Рефлекторное выделение
молока у матери из секреторных отделов молочных желез во время
кормления ребенка грудью называется нейроэндокринным рефлексом
(рис. 16.15). Рефлекс возникает, когда ребенок начинает сосать сосок.При
этом происходит стимуляция тактильных рецепторов кожи сосковой
области. Нервные импульсы от рецепторов поступают в спинной мозг, а
затем к нейронам супраоптического и паравентрикулярного ядер
гипоталамуса, которые секретируют окситоцин. Эти нейроны гипоталамуса
генерируют электрическую активность в среднем каждые 5—15 мин в виде
короткого, длительностью 3—4 с, высокочастотного разряда потенциалов дейст-
16. Репродуктивная функция человека • 701
Супраоптическое и
паравентрикупярнае
ядра гипоталамуса
Медиальная пучок
переднего/юзга
Миоэпителиальные
клетки
Альвеолярные
клетки
Рецепторы кожц
сосков
Молочные железы
Сегменты
спинного мозга
Рис. 16.15. Регуляция секреции окситоцина в нейрогипофизе и пролактина в адено-
гипофизе кормящей женщины во время кормления ребенка грудью (нейроэндо-
кринный рефлекс). Раздражение рецепторов кожи сосков во время кормления
вызывает активацию нейронов супраоптического и паравентрикулярного ядер
гипоталамуса, повышает концентрацию окситоцина и пролактина в плазме крови.
вия. Во время каждого залпа активности нейросекреторных клеток
гипоталамуса потенциалы действия достигают терминалей нейронов,
локализованных в нейрогипофизе, и в плазму крови кормящей ребенка женщины
выделяется окситоцин, который с кровью транспортируется к молочным
железам. В мембранах миоэпителиальных клеток молочных желез
локализованы рецепторы к окситоцину. Этот гормон при взаимодействии с
рецепторами мембраны миоэпителиальных клеток секреторных отделов
молочных желез вызывает внутри клеток образование вторичного посредника
инозитол-3-фосфата, который открывает кальциевые ионные каналы сар-
коплазматического ретикулума этих клеток. Высвобождение из депо ионов
Са2+ вызывает сокращение гладкомышечных клеток и продвижение молока
из альвеолярных клеток в протоки и синусы молочных желез. При
кормлении ребенка грудью из синусов молочной железы молоко поступает в
ротовую полость ребенка. У кормящей женщины, в среднем через 30—60 с
после начала кормления ребенка грудью, молоко начинает активно
выделяться в протоки молочной железы.
Для нормальной секреции молока в молочных железах кормящей
женщине необходимо придерживаться постоянного режима кормления
ребенка, что сохраняет секрецию пролактина и препятствует снижению
лактации. Это поддерживает в грудном молоке содержание иммуноглобулинов,
особенно IgA, неспецифических антимикробных факторов (лизоцим, лак-
тоферрин), которые обеспечивают неспецифические защитные реакции в
организме новорожденного в период формирования у него механизмов
клеточного иммунитета.
ГЛАВА 17
Сенсорные системы
Сенсорные системы человека являются частью его нервной системы,
способной воспринимать внешнюю для мозга информацию, передавать ее в
мозг и анализировать. Получение информации от окружающей среды и
собственного тела является обязательным и необходимым условием
существования человека. Термин «сенсорные (лат. sensus — чувство) системы»
сменил название «органы чувств», сохранившееся только для обозначения
анатомически обособленных периферических отделов некоторых
сенсорных систем (как, например, глаз или ухо). В отечественной литературе в
качестве синонима сенсорной системы применяется предложенное
И. П. Павловым понятие «анализатор», указывающее на функцию
сенсорной системы.
Все сенсорные системы состоят из периферических рецепторов,
проводящих путей и переключательных ядер, первичных проекционных областей коры
и вторичной сенсорной коры. Сенсорные системы организованы
иерархически, т. е. включают несколько уровней последовательной переработки
информации. Низший уровень такой переработки обеспечивают первичные
сенсорные нейроны, которые расположены в специализированных органах
чувств или в чувствительных ганглиях и предназначены для проведения
возбуждения от периферических рецепторов в центральную нервную
систему. Периферические рецепторы — это чувствительные
высокоспециализированные образования, способные воспринять, трансформировать и
передать энергию внешнего стимула первичным сенсорным нейронам.
Центральные отростки первичных сенсорных нейронов оканчиваются в
головном или спинном мозге на нейронах второго порядка, тела которых
расположены в переключательном ядре. В нем имеются не только
возбуждающие, но и тормозные нейроны, участвующие в переработке
передаваемой информации. Представляя более высокий иерархический уровень,
нейроны переключательного ядра могут регулировать передачу
информации путем усиления одних и торможения или подавления других сигналов.
Аксоны нейронов второго порядка образуют проводящие пути к
следующему переключательному ядру, общее число которых обусловлено
специфическими особенностями разных сенсорных систем. Окончательная
переработка информации о действующем стимуле происходит в сенсорных
областях коры.
Сенсорные системы человека обеспечивают: 1) формирование ощущений
и восприятие действующих стимулов; 2) контроль произвольных движений;
3) контроль деятельности внутренних органов; 4) необходимый для
бодрствования человека уровень активности мозга. Ощущение представляет
собой субъективную чувственную реакцию на действующий сенсорный
стимул (например, ощущение света, тепла или холода, прикосновения и т. п.).
Однородные сенсорные стимулы активируют одну из сенсорных систем и
вызывают субъективно одинаковые ощущения, совокупность которых
обозначается термином модальность. Самостоятельными модальностями явля-
17. Сенсорные системы • 703
ются осязание, зрение, слух, обоняние, вкус, чувство холода или тепла,
боли, вибрации, ощущение положения конечностей и мышечной нагрузки.
Внутри модальностей могут существовать разные качества, или
субмодальности; например, во вкусовой модальности различают сладкий, соленый,
кислый и горький вкус. На основе совокупности ощущений формируется
чувственное восприятие, т. е. осмысление ощущений и готовность их
описать. Восприятие не является простым отражением действующего стимула,
оно зависит от распределения внимания в момент его действия, памяти о
прошлом сенсорном опыте и субъективного отношения к происходящему,
выражающегося в эмоциональных переживаниях.
Сенсорное восприятие включает следующие этапы: 1) действие
раздражителя на периферические рецепторы; 2) преобразование энергии стимула
в электрические сигналы — потенциалы действия, возникающие в
первичном сенсорном нейроне; 3) последующую переработку передаваемых
сигналов на всех иерархических уровнях сенсорной системы; 4)
возникновение субъективной реакции на раздражитель, представляющей собой
восприятие или внутреннее представительство действующего стимула в виде
образов или словесных символов. Указанная последовательность
соблюдается во всех сенсорных системах, отражая иерархический принцип их
организации.
17.1. Общая физиология сенсорных систем
Человек воспринимает не все изменения окружающей среды, он не
способен, например, ощущать действие ультразвука, рентгеновских лучей или
радиоволн. Диапазон сенсорного восприятия человека ограничен
имеющимися у него сенсорными системами, каждая из которых перерабатывает
информацию о стимулах определенной физической природы. Сенсорная
специфичность каждой системы определяется, прежде всего, свойствами
входящих в нее рецепторов.
17.1.1. Классификации рецепторов
Рецепторы различают по специфической чувствительности к разным
стимулам, по строению и местоположению. Специфическая чувствительность
рецепторов к раздражителям различной природы (механическим,
химическим, температурным и т. д.) обусловлена разными механизмами
управления ионными каналами плазматических мембран, состояние которых
определяет возникновение рецепторного потенциала и переход от
физиологического покоя к возбуждению. Стимулы, к которым рецепторы наиболее
чувствительны, называются адекватными (лат. adaequatus — приравненный).
Механорецепторы возбуждаются сильнее всего вследствие деформации
их клеточной мебраны при давлении или растяжении, к ним относятся
тактильные рецепторы кожи, проприоцепторы мышц и сухожилий,
слуховые и вестибулярные рецепторы во внутреннем ухе, барорецепторы и во-
люморецепторы, находящиеся во внутренних органах и кровеносных
сосудах. Хеморецепторы возбуждаются вследствие присоединения к ним
определенных химических молекул, они представлены обонятельными и
вкусовыми рецепторами, а также хемочувствительными рецепторами
внутренних органов и кровеносных сосудов. Для расположенных в сетчатке глаза
фоторецепторов адекватным раздражителем являются поглощенные ими
кванты света, для терморецепторов (Холодовых и тепловых) — изменения
температуры.
704 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Большинство рецепторов возбуждаются в ответ на действие стимулов
только одной физической природы и поэтому относятся к мономодальным.
Их можно возбудить и некоторыми неадекватными раздражителями,
например фоторецепторы — сильным давлением на глазное яблоко, а
вкусовые рецепторы — прикосновением языка к контактам гальванической
батареи, но получить качественно различаемые ощущения в таких случаях
невозможно. Наряду с мономодальными существуют полимодальные
рецепторы, адекватными стимулами которых могут служить раздражители
разной природы. К такому типу рецепторов принадлежат некоторые болевые
рецепторы, или ноцицепторы (лат. nocens — вредный), которые можно
возбудить механическими, термическими и химическими стимулами.
Полимодальность имеется у терморецепторов, реагирующих на повышение
концентрации калия во внеклеточном пространстве так же, как на повышение
температуры.
В зависимости от строения рецепторов их подразделяют на первичные,
или первичночувствующие, которые являются специализированными
окончаниями чувствительного нейрона, и вторичные, или вторичночувствую-
щие, представляющие собой клетки эпителиального происхождения,
способные к образованию рецепторного потенциала в ответ на действие
адекватного стимула. Первичночувствующие рецепторы могут сами
генерировать потенциалы действия в ответ на раздражение адекватным
стимулом, если величина их рецепторного потенциала достигнет пороговой
величины. К ним относятся обонятельные рецепторы, большинство меха-
норецепторов кожи, терморецепторы, болевые рецепторы или
ноцицепторы, проприоцепторы и большинство интерорецепторов внутренних
органов.
Вторичночувствующие рецепторы отвечают на действие раздражителя
лишь возникновением рецепторного потенциала, от величины которого
зависит количество выделяемого этими клетками медиатора. С его
помощью вторичные рецепторы действуют на нервные окончания
чувствительных нейронов, генерирующих потенциалы действия в зависимости от
количества медиатора, выделившегося из вторичночувствующих рецепторов.
Вторичные рецепторы представлены вкусовыми, слуховыми и
вестибулярными рецепторами, а также хемочувствительными клетками синокаротид-
ного клубочка. Фоторецепторы сетчатки, имеющие общее происхождение
с нервными клетками, чаще относят к первичным рецепторам, но
отсутствие у них способности генерировать потенциалы действия указывает на их
сходство с вторичными рецепторами.
В зависимости от источника адекватных стимулов рецепторы
подразделяют на наружные и внутренние, или экстерорецепторы и интерорецепто-
ры; первые стимулируются при действии раздражителей внешней среды
(электромагнитные и звуковые волны, давление, действие пахучих
молекул), а вторые — внутренней (к этому типу рецепторов относят не только
висцерорецепторы внутренних органов, но также проприоцепторы и
вестибулярные рецепторы). В зависимости от того, действует стимул на
расстоянии или непосредственно на рецепторы, их подразделяют еще на
дистантные и контактные.
17.1.2. Преобразование энергии раздражителя в рецепторах
В результате действия адекватного раздражителя у большинства
рецепторов увеличивается проницаемость клеточной мембраны для катионов, что
приводит к ее деполяризации. Исключением из общего правила являются
17. Сенсорные системы • 705
фоторецепторы, где после поглощения энергии квантов света в связи
особенностями управления ионными каналами (см. раздел 17.3.2.2)
происходит гиперполяризация мембраны. Изменение величины мембранного
потенциала рецепторов в ответ на действие стимула представляет собой ре-
цепторный потенциал — входной сигнал первичных сенсорных нейронов.
Если величина рецепторного потенциала достигнет критического уровня
деполяризации или превысит его, генерируются потенциалы действия, с
помощью которых сенсорные нейроны передают в центральную нервную
систему информацию о действующих стимулах.
Генерация потенциалов действия происходит в ближайшем к
рецепторам перехвате Ранвье миелинизированных волокон или ближайшей к
рецепторам части мембраны безмиелинового волокна. Минимальная сила
адекватного стимула, достаточная для генерации потенциалов действия в
первичном сенсорном нейроне, определяется как его абсолютный порог.
Минимальный прирост силы стимула, сопровождающийся значимым
изменением реакции сенсорного нейрона, представляет собой
дифференциальный порог его чувствительности.
Информация о силе действующего на рецепторы стимула кодируется
двумя способами: частотой потенциалов действия, возникающих в
сенсорном нейроне {частотное кодирование), и числом сенсорных нейронов,
возбудившихся в ответ на действие стимула. При увеличении силы
действующего на рецепторы раздражителя повышается амплитуда рецепторного
потенциала, что, как правило, сопровождается увеличением частоты
потенциалов действия в сенсорном нейроне первого порядка. Чем шире
имеющийся частотный диапазон потенциалов действия у сенсорных нейронов,
тем большее число промежуточных значений силы раздражителя способна
различать сенсорная система. Первичные сенсорные нейроны одинаковой
модальности различаются порогом возбуждения, поэтому при действии
слабых стимулов возбуждаются только наиболее чувствительные нейроны,
но с увеличением силы раздражителя на него реагируют и менее
чувствительные нейроны, имеющие более высокий порог раздражения. Чем
больше первичных сенсорных нейронов возбудится одновременно, тем сильнее
будет их совместное действие на общий нейрон второго порядка, что в
итоге отразится на субъективной оценке интенсивности действующего
раздражителя.
Длительность ощущения зависит от реального времени между началом и
прекращением воздействия на рецепторы, а также от их способности
уменьшать или даже прекращать генерацию нервных импульсов при
продолжительном действии адекватного стимула. При длительном действии
стимула порог чувствительности рецепторов к нему может повышаться,
что определяется как адаптация рецепторов. Механизмы адаптации не
одинаковы в рецепторах разных модальностей, среди них различают
быстро адаптирующиеся (например, тактильные рецепторы кожи) и медленно
адаптирующиеся рецепторы (например, проприоцепторы мышц и
сухожилий). Быстро адаптирующиеся рецепторы сильнее возбуждаются в ответ на
быстрое нарастание интенсивности стимула (фазический ответ), а их
быстрая адаптация способствует освобождению восприятия от биологически
незначительной информации (например, контакт между кожей и
одеждой). Возбуждение медленно адаптирующихся рецепторов мало зависит от
скорости изменения стимула и сохраняется при его длительном действии
(тонический ответ), поэтому, например, медленная адаптация проприо-
цепторов позволяет человеку получать нужную ему для сохранения позы
информацию в течение всего необходимого времени.
23-6095
706 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Существуют сенсорные нейроны, генерирующие потенциалы действия
спонтанно, т. е. при отсутствии раздражения (например, сенсорные
нейроны вестибулярной системы), такая активность называется фоновой. Частота
нервных импульсов в этих нейронах может увеличиваться или
уменьшаться в зависимости от интенсивности действующего на вторичные
рецепторы стимула, кроме того, она может определяться направлением, в котором
отклоняются чувствительные волоски механорецепторов. Например,
отклонение волосков вторичных механорецепторов в одну сторону
сопровождается повышением фоновой активности сенсорного нейрона, которому
они принадлежат, а в противоположную сторону — понижением его
фоновой активности. Указанный способ рецепции позволяет получать
информацию и об интенсивности стимула, и о направлении, в котором он
действует.
17.1.3. Рецептивные поля
Рецептивным полем называется область, занимаемая совокупностью всех
рецепторов, стимуляция которых приводит к возбуждению сенсорного
нейрона (рис. 17.1). Максимальная величина рецептивного поля
первичного сенсорного нейрона определяется пространством, которое занимают
все ветви его периферического отростка, а число рецепторов, имеющихся в
этом пространстве, указывает на плотность иннервации. Высокая
плотность иннервации сочетается, как правило, с малыми размерами
рецептивных полей и, соответственно, высоким пространственным разрешением,
позволяющим различать стимулы, действующие на соседние рецептивные
поля. Малые рецептивные поля типичны, например, для центральной ям-
Рецептивные поля
первичных сенсорных нейронов
Первичные
сенсорные
нейроны
О-
Сенсорный нейрон
второго порядка
проекционный
нейрон
переключательного ядра)
Рис. 17.1. Рецептивные поля первичных сенсорных нейронов и сенсорных
нейронов второго порядка.
А. Рецептивные поля первичных сенсорных нейронов ограничены областью их
чувствительных окончаний. Рецептивное поле переключательного нейрона образуется из суммы
рецептивных полей конвергирующих к нему первичных сенсорных нейронов.
Б. Раздражение центральной или периферической области рецептивного поля сенсорного
нейрона второго и следующих порядков сопровождается противоположным эффектом. Как
видно на схеме, раздражение центра рецептивного поля вызовет возбуждение проекционного
нейрона, а раздражение периферической области — торможение с помощью интернейронов
переключательного ядра (латеральное торможение). В результате контраста, создаваемого
между центром и периферией рецептивного поля, выделяется информация для передачи на
следующий иерархический уровень.
17. Сенсорные системы • 707
ки сетчатки и для пальцев рук, где плотность рецепторов значительно
выше, чем на периферии сетчатки или в коже спины, для которых
характерны большая величина рецептивных полей и меньшее пространственное
разрешение. Рецептивные поля соседних сенсорных нейронов могут
частично перекрывать друг друга, поэтому информация о действующих на них
стимулах передается не по одному, а по нескольким параллельным
аксонам, что повышает надежность ее передачи.
Величина рецептивных полей сенсорных нейронов второго и
следующих порядков больше, чем у первичных сенсорных нейронов, поскольку
центральные нейроны получают информацию от нескольких
конвергирующих к ним нейронов предшествующего уровня. От центра рецептивного
поля информация передается непосредственно к сенсорным нейронам
следующего порядка, а от периферии — к тормозным интернейронам
переключательного ядра, поэтому центр и периферия рецептивного поля
являются реципрокными по отношению друг к другу. В результате сигналы от
центра рецептивного поля беспрепятственно достигают следующего
иерархического уровня сенсорной системы, тогда как сигналы, поступающие от
периферии рецептивного поля, тормозятся (в другом варианте
организации рецептивного поля легче пропускаются сигналы от периферии, а не от
центра). Такая функциональная организация рецептивных полей
обеспечивает выделение наиболее значимых сигналов, легко различаемых на
контрастном с ними фоне.
17.1.4. Переработка информации в переключательных ядрах
и проводящих путях сенсорной системы
Сенсорные нейроны низшего иерархического уровня способны передавать
электрические сигналы одновременно нескольким нейронам следующего
уровня благодаря дивергенции к ним своих аксонов. Это повышает
надежность передачи информации от одного иерархического уровня к другому и
позволяет сохранять чувствительность сенсорной системы при утрате
отдельных нейронов. Возбуждение нейронов более высокого иерархического
уровня определяется не только действием на них нейронов предыдущего
уровня, но и механизмом латерального торможения, существующего в
переключательных ядрах (рис. 17.2).
Латеральное торможение происходит вследствие активации тормозных
интернейронов переключательного ядра коллатералями возбуждающих
нейронов. Чем сильнее возбужден релейный сенсорный нейрон, тем
больше он активирует тормозные нейроны, которые подавляют активность
соседних релейных нейронов. Релейные нейроны, передающие сигналы от
центра рецептивного поля, сильнее других повышают активность
тормозных нейронов, а их влияние на соседние релейные нейроны делает еще
большим контраст между возбужденными и тормозимыми нейронами,
выделяя линию передачи избранных сигналов.
Высшие уровни сенсорной системы регулируют переработку
информации в низших по отношению к ним переключательных ядрах посредством
нисходящего торможения или усиления передаваемых сигналов. Нисходящее
торможение (рис.17.3) происходит вследствие активации тормозных
нейронов переключательного ядра, деятельность которых определяют
нисходящие пути, начинающиеся на более высоком иерархическом уровне
сенсорной системы. В результате нисходящего торможения повышается порог
афферентной синаптической передачи в переключательном ядре низшего
уровня. Нисходящее торможение представляет собой регуляцию сенсорно-
23*
708 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Действие раздражителя
шТш иХ иДш Рецепторы
| | \^ сенсорных
первичных
нейронов
Первые переклю-
£л Yq чательные нейроны
Вторые
переключательные
нейроны
Рис. 17.2. Схема латерального торможения в сенсорных системах.
Тормозные интернейроны (их тела выделены черным цветом) возбуждаются возвратными
коллатералями переключательных сенсорных нейронов: чем сильнее возбужден
переключательный нейрон, тем большее торможение соседних переключательных нейронов он вызовет.
Степень возбуждения переключательных нейронов определяется интенсивностью
раздражения центра или периферии его рецептивного поля. В результате возбуждение будет
передаваться от одной части рецептивного поля на фоне торможения или прерывания сигналов от
другой его части, что создает эффект контрастирования, способствующий различению
действующих стимулов.
го восприятия по механизму отрицательной обратной связи. Тормозные
интернейроны переключательных ядер уменьшают частоту передаваемых
на следующий уровень сигналов, в связи с чем сенсорное ощущение
ослабляется.
Нисходящее усиление происходит с помощью возбуждающих
интернейронов переключательного ядра, которые активируются аксонами нейронов
более высокого иерархического уровня. Вследствие этого в управляемом
по механизму положительной обратной связи переключательном ядре
понижается порог синаптической передачи, что делает возможным
прохождение относительно слабых сигналов на следующий иерархический уровень.
Одновременное использование механизмов отрицательной и
положительной обратной связи позволяет освобождаться от избыточной информации,
подавлять «шум», т. е. нейронную активность, не содержащую
физиологически значимых сообщений, и одновременно выделять и усиливать
сигналы, на которых будет сосредоточено внимание.
Большинство раздражителей, воспринимаемых сенсорными системами,
оказывает на них комплексное действие, поскольку одновременно
возбуждает разные типы рецепторов. Например, прикасающийся к
ограниченному участку кожи предмет может быть гладким или шершавым, теплым или
холодным, сухим или влажным, а его давление на кожу может усиливаться
или ослабевать, он может передвигаться в том или ином направлении.
П. Сенсорные системы • 709
Переключательное
ядро
сенсорной
системы
Латеральное
торможение
Проекционный
нейрон
К другим
областям ЦНС
Афферентные
сигналы
Рис. 17.3. Схема нисходящего торможения в сенсорных системах.
Передачу афферентных сигналов от одного иерархического уровня сенсорной системы к
другому в переключательных ядрах контролируют высшие иерархические уровни. На схеме
показан принцип нисходящего торможения коры, которое осуществляется с помощью тормозных
интернейронов (выделены черным цветом) переключательного ядра. Возбуждение тормозных
интернейронов под влиянием коры препятствует передаче афферентных сигналов в
переключательном ядре.
Зрительные ощущения представляют собой сочетание определенной
формы воспринимаемого предмета, его движения и комбинации различных
цветов, заполняющих ту или иную деталь формы. Сенсорные системы
организованы так, что информация о каждом компоненте комплексного
раздражителя передается одновременно по нескольким параллельным путям,
каждый из которых относится к определенной субмодальности, как,
например, форма, движение или цвет наблюдаемого зрительного объекта.
В каждом из таких путей независимо друг от друга перерабатываются
сигналы, несущие информацию о разных качествах подействовавшего на
рецепторы комплексного раздражителя. При этом разные каналы,
используемые для передачи сенсорной информации, не дублируют друг друга, в чем
проявляется принцип многоканальности, присущий всем сенсорным
системам. Высокая упорядоченность нейронных переключений на каждом
иерархическом уровне обеспечивает поступление информации от каждого
рецептивного поля к соответствующим именно ему кортикальным
колонкам проекционной коры. Необходимое для целостного восприятия
раздражителя объединение информации, относящейся к разным
субмодальностям, происходит в сенсорных регионах коры.
710 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
17.1.5. Субъективное сенсорное восприятие
Каждая сенсорная система воспринимает действие адекватного стимула в
ограниченном диапазоне значений его силы. Наименьший по
интенсивности стимул, способный вызвать ощущение, называется абсолютным
порогом ощущения. Его величина устанавливается опытным путем, она не
одинакова у разных людей и может изменяться у одного и того же человека в
зависимости от функционального состояния, различаясь, например, при
оптимальной работоспособности и утомлении. Величина абсолютного
порога ощущения выше абсолютного порога первичных сенсорных
нейронов, так как возбуждение отдельных чувствительных нейронов или их
небольшой группы не обязательно приводит к возбуждению высших уровней
сенсорной системы вследствие тормозных процессов на предыдущих
иерархических уровнях. Поэтому не каждый стимул, возбуждающий
рецепторы первичного сенсорного нейрона, субъективно ощущается и осознается.
Величина, на которую один стимул надпорогового диапазона должен
отличаться от другого, чтобы их разницу можно было субъективно
различить, получила название дифференциального порога или порога различения.
Ощущаемый прирост интенсивности раздражения (дифференциальный
порог) должен превышать ранее действовавший стимул на определенную и
постоянную величину. Например, человек легко различает по весу гирьки
весом 14 и 15 граммов (разница в 1 грамм), но гирьки весом 29 и 30
граммов кажутся ему одинаковыми, и различия между ними выявляются, если
разница окажется не меньше 2 граммов. Если же гирька составит 60
граммов, то субъективное ощущение большего груза возможно только тогда,
когда его прирост будет не меньше 4 граммов. Таким образом, ощущаемый
прирост силы раздражителя возможен при ее увеличении на постоянную
величину, что сформулировано в законе Вебера как 6S/S = к, где S —
раздражение, 6S — его ощущаемый прирост, к — постоянная величина.
Закон Вебера справедлив для разных модальностей, но лишь в границах
раздражения средней силы, а при слабых и сильных стимулах способность
к различению силы стимулов у человека снижается. Предложена также
ступенчатая шкала интенсивности ощущений, в которой за ноль
принимается величина абсолютного порога, а зависимость между интенсивностью
стимула и ощущением выражается как: E = k x log(S/S0), где Е —
интенсивность ощущения, к — постоянная величина, S — интенсивность
стимула, S0 — абсолютный порог. Эта зависимость, получившая название закона
Вебера—Фехнера, показывает, что линейное увеличение интенсивности
ощущения отражает логарифмический рост интенсивности стимула. Закон
Вебера—Фехнера характеризует субъективную способность человека
различать действующие стимулы (шкала различения), но не оценивает саму
интенсивность ощущений, поскольку этот закон основан на допущении
равенства любых ее приростов, как к слабым, так и к сильным стимулам.
Субъективная оценка интенсивности раздражителя (качественное
различие) возрастает при увеличении разницы между пороговой и
действующей силой стимула (количественное различие). Однако зависимость между
силой стимула и ощущением не одинакова при разной интенсивности
стимулов, а потому имеет не линейный, а степенной характер. Для оценки
интенсивности ощущений всего диапазона используется шкала Стивенса,
устанавливающая зависимость ощущений от силы стимула в виде
степенной функции: Е = k(S — S0)n, где Е — интенсивность ощущения, S —
действующая сила стимула, S0 — абсолютный порог, к — константа шкалы,
п — показатель степени, который зависит от сенсорной модальности (на-
17. Сенсорные системы • 711
пример, для восприятия светового ощущения он составляет 0,33,
громкости звука — 0,6, а для проприоцептивных ощущений — 1,7).
Пространственные характеристики действующих стимулов,
необходимые для их различения, зависят от специфических особенностей каждой
сенсорной системы и величины рецептивных полей. Прикосновение к
коже дистальной фаланги пальца руки двух ножек циркуля с расстоянием
между ними 2 мм ощущается раздельно, но чтобы ощутить раздельное
прикосновение к коже спины, ножки циркуля необходимо раздвинуть до
60 мм. Пространственное восприятие этих тактильных стимулов зависит от
размеров соответствующих рецептивных полей: раздельное ощущение
возможно только при условии раздражения каждой ножкой циркуля
независимого рецептивного поля. Лишь тогда информация о каждом стимуле
будет перерабатываться раздельно на каждом уровне организации сенсорной
системы, включая проекционную область коры. Аналогичная ситуация
имеет место при восприятии двух точек зрительного поля: они не
сливаются в одну, если отражаемые ими световые лучи попадут на разные
рецептивные поля сетчатки. Имеет значение и степень контраста между
действующим стимулом и его фоном: хорошо контрастируемые объекты
(например, черное на белом) различаются легче, чем мало контрастируемые
(черное на сером).
Временная характеристика восприятия действующих стимулов у
человека имеет абсолютный порог различения коротких временных отрезков,
который соответствует примерно '/18 секунды. Например, 18 зрительных
изображений, предъявленных в течение 1 секунды, сливаются в непрерывное
движение, 18 прикосновений к коже за 1 секунду воспринимаются как
одно, а 18 звуковых колебаний в секунду воспринимаются как один очень
низкий звук. Разрешающая способность сенсорных систем для восприятия
действующих через малые промежутки времени стимулов ограничена
рефрактерным периодом, во время которого система не способна реагировать
на предъявленный стимул.
17.2. Соматовисцеральная сенсорная система
Соматовисцеральная система перерабатывает сенсорную информацию
нескольких модальностей, получая ее от кожи, мышц, суставов, внутренних
органов и кровеносных сосудов. Она содержит разные типы рецепторов:
механорецепторы, терморецепторы, хеморецепторы, осморецепторы, но-
цицепторы. Поступающая информация передается по афферентным
волокнам в составе чувствительных и смешанных нервов, перерабатывается
раздельными проводящими путями и переключательными ядрами, а затем
доставляется в соматосенсорную кору, занимающую постцентральные
извилины мозга и организованную топически.
17.2.1. Тактильная чувствительность
Часть соматовисцеральной системы, обеспечивающая чувство осязания,
включает несколько разновидностей механорецепторов кожи,
представленных свободными нервными окончаниями либо инкапсулированными, т. е.
заключенными в капсулу из соединительной ткани или видоизмененных
клеток эпидермиса (рис. 17.4). Свободные нервные окончания иннервиру-
ют волосяные фолликулы пушковых волос, покрывающих большую часть
тела человека, а также грубых волос, растущих на голове, в подмышечных
впадинах, на лобке, а у мужчин еще и на лице. Свободные нервные окон-
712 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Тельце
Руффини
Диски
Меркеля
Свободные
нервные
окончания
Тельце
Пачини
Артерия
Вена
Потовая
железа
Волосяной
фолликул
Жировая ткань
чания волосяных
фолликулов являются механоре-
цепторами и
возбуждаются при смещении волос
или их подергивании.
Другая разновидность
свободных нервных
окончаний имеется в эпидермисе
и в сосочковом слое
дермы, большинство из них
являются ноцицепторами
или терморецепторами, но
некоторые принадлежат к
механорецепторам,
которые специфически
реагируют на слабое
околопороговое раздражение.
Предполагается, что при
раздражении этой
разновидности рецепторов
возникают ощущения
щекотки и зуда.
Среди
инкапсулированных окончаний
различают тельца Пачини, Мейс-
снера, Руффини, диски
Меркеля, тактильные
тельца Пинкуса—Игго, колбы
Краузе. В зависимости от
строения и формы
капсулы нервные окончания
подвержены наиболее
сильному воздействию
либо в результате давления
действующим
перпендикулярно раздражителем,
либо вследствие бокового
смещения капсулы,
которая играет роль
механического преобразователя
энергии внешних стимулов. Большинство инкапсулированных рецепторов
содержится в лишенной волос коже пальцев рук и ног, ладоней и подошв,
лица, губ, языка, сосков и половых органов, где они распределены с
различной плотностью и на разной глубине. Тельца Пачини имеются также в
сухожилиях, связках и брыжейке.
Механорецепторы кожи различаются по скорости адаптации к
действующему раздражителю. Быстроадаптирующиеся (фазные) рецепторы
возбуждаются только в момент смещения кожи и волос и служат датчиками
скорости воздействия стимула. Это свойство присуще тельцам Мейснера,
рецепторам волосяных фолликулов и особенно тельцам Пачини,
способным реагировать на изменения скорости продолжающего свое действие
стимула. Медленно адаптирующиеся (тонические) рецепторы не
прекращают генерировать потенциалы действия при продолжительном действии
Рис. 17.4. Схема распределения механорецепторов
в коже человека.
Свободные нервные окончания имеют высокий порог
раздражения и слабо реагируют на изменение
интенсивности стимула. Быстро адаптирующиеся рецепторы
(тельца Пачини, рецепторы волосяных фолликулов)
служат датчиками скорости действующих стимулов, а
медленно адаптирующиеся рецепторы (диски Меркеля,
тельца Руффини) являются датчиками интенсивности
действующего раздражителя. Наличие нескольких
разновидностей рецепторов позволяет передавать
афферентные сигналы о разных свойствах одного и того же
раздражителя.
17. Сенсорные системы • 713
раздражителя, если он оказывает давление
на кожу: такие рецепторы служат датчиками
интенсивности действующего стимула
(тельца Руффини, диски Меркеля).
Площадь рецептивных полей сенсорных
нейронов, иннервирующих тельца Мейсне-
ра и диски Меркеля, составляет в среднем
около 12 мм2, а у нейронов с окончаниями
в виде телец Пачини и Руффини она на
порядок больше. Рецептивные поля
различающихся своими рецепторами сенсорных
нейронов перекрываются, поэтому при
действии на кожу комплекса стимулов
одновременно возбуждаются разные виды
рецепторов, что позволяет ощущать все
динамические и статические свойства такого
комплекса. Обработка и анализ информации
сигналов от различных рецепторов
происходит на высших уровнях сенсорной системы, формирующих комплексное
восприятие действующих на поверхность тела стимулов. Плотность меха-
норецепторов в разных участках кожи не одинакова, чем определяются
разные показатели пространственного дифференциального порога, т. е.
наименьшего расстояния между двумя точками, раздражение каждой из
которых ощущается раздельно (табл. 17.1). Приведенные в таблице данные не
следует считать эталоном, поскольку дифференциальная чувствительность
различается у разных людей.
Инкапсулированные рецепторы иннервируются миелинизированными
волокнами первичных сенсорных нейронов, которые проводят нервные
импульсы в ЦНС со скоростью около 30—70 м/с. Немиелинизированные
волокна передают потенциалы действия от свободных нервных окончаний
со значительно меньшей скоростью — около 1 м/с, поэтому ощущение
действующего на них стимула возникает относительно позже.
Центральные отростки первичных сенсорных нейронов входят в спинной мозг в
составе задних корешков и разделяются в задних рогах спинного мозга на
коллатерали. Восходящие коллатерали достигают переключательных ядер
заднего столба продолговатого мозга, откуда специфическая информация
передается на противоположную сторону мозга по лемнисковому пути,
поступает к проекционным ядрам таламуса, а затем в соматосенсорную кору,
с участием которой формируется чувство осязания.
17.2.2. Проприоцептивная чувствительность
Проприоцептивные ощущения дают человеку возможность воспринимать
изменения положения отдельных частей тела в покое и во время
совершаемых движений. Информация, поступающая от проприоцепторов,
позволяет ему постоянно контролировать позу и точность произвольных
движений, дозировать силу мышечных сокращений при противодействии
внешнему сопротивлению, например при подъеме или перемещении груза.
Проприоцепторы представлены интрафузальными волокнами мышц
(датчики длины мышцы), сухожильными рецепторами Гольджи (датчики
напряжения мышцы) и механорецепторами суставных капсул, отвечающими
изменениями фоновой активности на сгибание или разгибание в суставе и
морфологически сходными с тельцами Руффини и рецепторами Гольджи.
Таблица 17.1.
Пространственный двухточечный порог в
разных участках тела
Поверхность тела
Кончик языка
Кончик пальца
Кайма губ
Кончик носа
Щека
Скула
Тыл кисти
Надколенник
Предплечье, голень
Область грудины
Плечо
Затылок, спина
Порог (мм)
1
2
4,5
6,8
п,з
15,8
31,6
36,1
40,6
45,1
60
67,7
714 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Афферентная информация от проприоцепторов в составе задних
корешков поступает в спинной мозг и без переключения в нем передается по
восходящим путям к ядрам задних столбов продолговатого мозга.
Расположенные там сенсорные нейроны второго порядка передают информацию
по лемнисковому пути на противоположную сторону мозга к
проекционным ядрам таламуса. Нейроны переключательных ядер таламуса образуют
соматотопическую проекцию на соматосенсорную кору, с помощью
которой формируются проприоцептивные ощущения. Сенсорные сигналы от
проприоцепторов мышц лица и головы следуют в ЦНС по чувствительным
волокнам черепных нервов, а в соматосенсорную кору информация
поступает тем же способом, что и сигналы от мускулатуры тела, т. е. по
лемнисковому пути.
Проприоцептивное восприятие положения тела и движений происходит
в результате объединения в соматосенсорной коре информации от всех
разновидностей проприоцепторов. Порог воспринимаемых изменений
углового положения проксимальных суставов ниже, чем дистальных: 0,2—
0,4" в плечевом суставе и около Г в суставах пальца руки. Порог
возрастает при увеличении угловой скорости движений, в связи с чем уменьшается
точность выполняемых движений. Способность человека
дифференцировать силу произвольных сокращений мышц подчиняется закону Вебера—
Фехнера, эта способность уменьшается при самых слабых и очень сильных
мышечных усилиях, необходимых для выполнения работы.
17.2.3. Температурная чувствительность
Ощущения тепла или холода, вызванные прикосновением к телу человека
нагретых или холодных предметов, теплого или охлажденного воздуха,
возникают вследствие раздражения одной из двух разновидностей
температурных рецепторов, представленных в коже свободными нервными
окончаниями. Среди них различают тепловые и холодовые рецепторы, которым
соответствуют две субмодальности температурного восприятия внешних
воздействий. Температурные рецепторы распределены в коже
неравномерно и образуют специфические тепловые и холодовые точки площадью
около 1 мм2 и менее, с наибольшей плотностью на лице и ладонях, причем
Холодовых точек примерно в десять раз больше, чем тепловых.
Импульсная активность терморецепторов возрастает в зависимости от
направления и скорости изменений температуры поверхности кожи,
составляющей в условиях температурного комфорта около 33 °С. При ее
снижении растет активность Холодовых рецепторов с максимумом в диапазоне
от 26 до 17 °С, что субъективно расценивается как действие на кожу
холода. При повышении температуры кожи от 34 до 45 "С увеличивается
импульсная активность тепловых рецепторов, что субъективно ощущается
как возрастающее по интенсивности действие на кожу тепла. При
уменьшении температуры кожи ниже 17 °С и увеличении выше 45 °С к
температурным ощущениям прибавляются болевые.
Тоническая активность температурных рецепторов при неизменной
температуре сохраняется в течение некоторого времени, а затем постепенно
уменьшается. В таком случае, как и при медленных изменениях
действующей на рецепторы температуры, происходит их адаптация, в связи с
которой постепенно ослабевают ощущения тепла или холода. Но в ответ на
резкие ступенчатые изменения действующей температуры (температурный
контраст) возникает залповая физическая активность терморецепторов,
которая отражает произошедшие изменения температуры. Наличие адапта-
17. Сенсорные системы • 715
ции терморецепторов наряду с их способностью реагировать залповой
активностью на контрастные изменения действующей температуры
проявляются в уменьшении порога тепловой чувствительности при пониженной
температуре кожи и в уменьшении порога холодовои чувствительности при
повышении ее температуры.
Кожные терморецепторы позволяют человеку распознавать нагретые
или холодные предметы и окружающий воздух, прикасающиеся к коже.
Однако субъективное восприятие, определяемое как «мне холодно» или
«мне жарко», возникает в результате суммарной оценки информации,
поступившей не только от кожных рецепторов, но также и от
терморецепторов спинного мозга, внутренних органов и центральных рецепторов
переднего гипоталамуса, где расположен центр терморегуляции. Нервные
импульсы от кожных терморецепторов поступают в спинной мозг, в задних
рогах которого расположены сенсорные нейроны второго порядка. Их
аксоны переходят на противоположную сторону спинного мозга, входя в
состав спиноретикулярного и спиноталамического путей.
Спиноталамический путь ведет к задним вентролатеральным ядрам та-
ламуса, на нейронах которых конвергируют проводящие пути
температурной и тактильной чувствительности. Благодаря такой конвергенции у
человека проявляется способность устанавливать, на какую часть
поверхности тела подействовал температурный стимул. Спиноретикулярный тракт
служит для проведения возбуждения от терморецепторов к ретикулярной
формации и принадлежит к неспецифической части сенсорной системы.
Ретикулярная формация вместе с неспецифическими ядрами таламуса
активирует одновременно многие регионы коры, определяя общую
активность мозга и уровень бодрствования. Поэтому повышение притока
афферентной информации к ней от терморецепторов, например во время
приема холодного душа, оказывает на человека тонизирующее влияние.
17.2.4. Болевая чувствительность
Боль определяется как неприятное сенсорное и эмоциональное
переживание, связанное с истинным или потенциальным повреждением ткани или
описываемое в терминах такого повреждения. В отличие от других
сенсорных модальностей боль всегда субъективно неприятна и служит не столько
источником информации об окружающем мире, сколько сигналом
повреждения или болезни. Болевая чувствительность побуждает к прекращению
контактов с повреждающими факторами среды.
Болевые рецепторы или ноцицепторы представляют собой свободные
нервные окончания, расположенные в коже, слизистых оболочках,
мышцах, суставах, надкостнице и во внутренних органах. Чувствительные
окончания принадлежат либо безмякотным, либо тонким миелинизиро-
ванным волокнам, что определяет скорость проведения сигналов в ЦНС и
дает повод к различению ранней боли, короткой и острой, возникающей
при проведении импульсов с большей скоростью по миелиновым
волокнам, а также поздней, тупой и длительной боли, в случае проведения
сигналов по безмякотным волокнам. Ноцицепторы относятся к полимодальным
рецепторам, поскольку могут активироваться стимулами разной природы:
механическими (удар, порез, укол, щипок), термическими (действие
горячих или холодных предметов), химическими (изменение концентрации
ионов водорода, действие гистамина, брадикинина и ряда других
биологически активных веществ). Порог чувствительности ноцицепторов высок,
поэтому лишь достаточно сильные стимулы вызывают возбуждение первич-
716 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ных сенсорных нейронов: например, порог болевой чувствительности для
механических стимулов примерно в тысячу раз превышает порог
тактильной чувствительности.
Центральные отростки первичных сенсорных нейронов входят в
спинной мозг в составе задних корешков и образуют синапсы с нейронами
второго порядка, расположенными в задних рогах спинного мозга. Аксоны
нейронов второго порядка переходят на противоположную сторону
спинного мозга, где образуют спиноталамический и спиноретикулярный тракты.
Спиноталамический тракт оканчивается на нейронах нижнего заднелате-
рального ядра таламуса, где происходит конвергенция проводящих путей
болевой и тактильной чувствительности. Нейроны таламуса образуют
проекцию на соматосенсорную кору: этот путь обеспечивает осознаваемое
восприятие боли, позволяет определять интенсивность стимула и его
локализацию.
Волокна спиноретикулярного тракта оканчиваются на нейронах
ретикулярной формации, взаимодействующих с медиальными ядрами таламуса.
При болевом раздражении нейроны медиальных ядер таламуса оказывают
модулирующее влияние на обширные регионы коры и структуры
лимбической системы, что приводит к повышению поведенческой активности
человека и сопровождается эмоциональными и вегетативными реакциями.
Если спиноталамический путь служит для определения сенсорных качеств
боли, то спиноретикулярный путь предназначен играть роль сигнала
общей тревоги, оказывать на человека общее возбуждающее действие.
Субъективную оценку боли определяет соотношение нейронной
активности обоих путей и зависимая от нее активация антиноцицептивных
нисходящих путей, способных изменить характер проведения сигналов от ноци-
цепторов. В сенсорную систему болевой чувствительности встроен
эндогенный механизм ее уменьшения путем регуляции порога синаптических
переключений в задних рогах спинного мозга («ворота боли»). На передачу
возбуждения в этих синапсах влияют нисходящие волокна нейронов
серого вещества вокруг водопровода, голубого пятна и некоторых ядер
срединного шва. Медиаторы этих нейронов (энкефалин, серотонин, норадрена-
лин) тормозят активность нейронов второго порядка в задних рогах
спинного мозга, чем уменьшают проведение афферентных сигналов от ноци-
цепторов.
Аналгезирующим (обезболивающим) действием обладают опиатные
пептиды (дайнорфин, эндорфины), синтезируемые нейронами гипоталамуса,
которые имеют длинные отростки, проникающие в другие отделы
головного мозга. Опиатные пептиды присоединяются к специфическим
рецепторам нейронов лимбической системы и медиальной области таламуса, их
образование увеличивается при некоторых эмоциональных состояниях,
стрессе, продолжительных физических нагрузках, у беременных женщин
незадолго перед родами, а также в результате психотерапевтического
воздействия или акупунктуры. В результате повышенного образования опиат-
ных пептидов активируются антиноцицептивные механизмы и повышается
порог болевой чувствительности. Баланс между ощущением боли и ее
субъективной оценкой устанавливается с помощью лобных областей мозга,
участвующих в процессе восприятия болевых стимулов. При поражении
лобных долей (например, в результате травмы или опухоли) порог болевой
чувствительности не изменяется и поэтому сенсорный компонент болевого
восприятия сохраняется неизменным, однако субъективная эмоциональная
оценка боли становится иной: она начинает восприниматься лишь как
сенсорное ощущение, а не как страдание.
77. Сенсорные системы • 717
17.2.5. Висцеральная чувствительность
Большая часть афферентной информации от висцерорецепторов (visceralis —
внутренностный) не осознается и служит для рефлекторной регуляции
вегетативных процессов в организме человека. Висцерорецепторы
расположены во внутренних органах и тканях организма и представляют собой как
свободные, так и инкапсулированные нервные окончания. В зависимости
от чувствительности к адекватным стимулам они подразделяются на меха-
норецепторы, хеморецепторы, терморецепторы, осморецепторы и ноци-
цепторы. Информация от висцерорецепторов поступает в ЦНС двумя
путями: от сенсорных нейронов чувствительных ганглиев и по
чувствительным афферентным волокнам, имеющимся в составе эфферентных
симпатических и парасимпатических нервов.
Висцеральные механорецепторы раздражаются вследствие изменения
давления в полых органах и кровеносных сосудах. Осознаваемые
ощущения, вызванные раздражением такого типа рецепторов, чаще всего
обусловлены изменениями в пищеварительном тракте, поскольку из всех
внутренних органов только он имеет общее эмбриологическое
происхождение с поверхностью тела. Растяжение стенок желудка пищей вызывает
ощущение сытости, растяжение стенок кишечника газами — ощущение
дискомфорта и тяжести в области живота, а растяжение прямой кишки
каловыми массами осознается как позыв к дефекации. Подобно этому им-
пульсация от механорецепторов, расположенных в стенке мочевого
пузыря, ощущается субъективно как позыв к его опорожнению.
Висцеральные хеморецепторы обладают специфической
чувствительностью к действию определенных химических молекул; например,
хеморецепторы, расположенные в дуге аорты и синокаротидной области,
раздражаются изменениями концентрации углекислого газа, кислорода и водородных
ионов. Изменения активности таких рецепторов ощущаются не прямо, а
опосредованно, проявляясь, например, головокружением или удушьем.
Повышение осмотического давления вызывает раздражение периферических
осморецепторов, расположенных в бассейне воротной вены, что, наряду с
информацией от центральных осморецепторов промежуточного мозга,
способствует появлению жажды. Афферентная информация от висцеральных
терморецепторов служит для возникновения ощущений жара или озноба.
Боль, возникающая при раздражении ноцицепторов внутренних
органов, называется висцеральной, в отличие от соматической боли,
вызванной раздражением болевых рецепторов в коже, мышцах, суставах и костях.
Острую висцеральную боль может вызвать сильное растяжение полых
органов вследствие закупорки выходных протоков желчного пузыря,
мочеточников, в результате непроходимости кишечника, а также спастических
сокращений гладких мышц. Плотность ноцицепторов особенно высока в
брюшине, при воспалении которой или при ее сильном механическом
раздражении возникает острая и интенсивная боль. При воспалительных
процессах во внутренних органах выделяются биологически активные
вещества, которые служат химическими раздражителями ноцицепторов и
причиной болевых ощущений.
17.3. Зрительная сенсорная система
Зрительное восприятие оставляет в памяти человека наибольшую часть его
чувственных впечатлений об окружающем мире. Оно происходит в
результате поглощения фоторецепторами сетчатки отраженной от окружающих
718 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
предметов энергии световых лучей или электромагнитных волн в
диапазоне от 400 до 700 нм. Энергия поглощенных квантов света (адекватный
раздражитель) преобразуется сетчаткой в нервные импульсы, поступающие по
зрительным нервам к латеральным коленчатым телам, а от них — в
проекционную зрительную кору. В дальнейшей переработке зрительной
информации у человека участвуют свыше тридцати отделов мозга,
представляющих вторичные сенсорные и ассоциативные области коры.
17.3.1. Проецирование световых лучей на сетчатку глаза
Прежде чем попасть на сетчатку, световые лучи последовательно проходят
через роговицу, жидкость передней камеры глаза, хрусталик и
стекловидное тело, вместе образующие оптическую систему глаза (рис. 17.5). На
каждом из этапов этого пути свет преломляется и в результате на сетчатке
возникает уменьшенное и перевернутое изображение наблюдаемого
предмета, этот процесс называется рефракцией. Преломляющая сила
оптической системы глаза составляет около 58,6 диоптрий при рассматривании
удаленных предметов и возрастает до приблизительно 70,5 диоптрий при
фокусировании на сетчатку световых лучей, отраженных от близко
расположенных предметов (1 диоптрия соответствует преломляющей силе линзы
с фокусным расстоянием 1 м).
17.3.1.1. Аккомодация
Чтобы фокусировать на сетчатке световые лучи, отраженные от близко
расположенных предметов, оптическая система глаза должна преломлять
их тем сильней, чем ближе расположен наблюдаемый объект. Механизм, с
помощью которого глаз настраивается на рассмотрение удаленных или
Рис. 17.5. Оптическая система глаза и проекция световых лучей на сетчатку.
Световые лучи, отраженные от рассматриваемой части наблюдаемого объекта (точка
фиксации), преломляются оптическими средами глаза (роговица, передняя камера, хрусталик,
стекловидное тело) и фокусируются в центральной ямке сетчатки. Проекция световых лучей на
поверхность центральной ямки обеспечивает максимальную остроту зрения благодаря малым
размерам рецептивных полей и отсутствию ганглиозных и биполярных клеток на пути
прохождения световых лучей к фоторецепторам.
17. Сенсорные системы • 719
близких предметов и в обоих случаях фокусирует их изображение на
сетчатку, называется аккомодацией. Аккомодацию обеспечивают изменения
кривизны хрусталика, зависимой от степени натяжения его тонкой и
прозрачной капсулы, которая переходит по краям в циннову связку,
прикрепляющуюся к ресничному телу. Гладкие мышцы ресничного тела,
управляемые парасимпатическими нейронами, регулируют натяжение цинновои
связки: при полном расслаблении мышц связка натягивает капсулу
хрусталика, заставляя его принимать максимально уплощенную форму,
необходимую для рассмотрения далеких предметов. При сокращении ресничных
мышц натяжение цинновои связки уменьшается, хрусталик в силу своей
эластичности принимает более выпуклую форму и поэтому сильнее
преломляет световые лучи, что, например, происходит во время чтения этого
текста.
При максимальном сокращении ресничных мышц кривизна хрусталика
становится максимальной, что позволяет фокусировать на сетчатке
световые лучи, отраженные от ближайшей точки ясного видения. У детей эта
точка расположена примерно в семи сантиметрах от глаза, но с возрастом
эластичность хрусталика уменьшается, что ограничивает возможность
увеличения его кривизны и соответственно преломляющей силы. В связи с
возрастным уменьшением диапазона аккомодации (интервала изменения
преломляющей силы хрусталика) ближайшая точка ясного видения
постепенно удаляется: в 20 лет она располагается на расстоянии около 10 см от
глаза, в 30 лет — 14 см, в 40 лет — 22 см, в 50 лет — 40 см и т. д. Возрастное
уменьшение аккомодационной способности {пресбиопия, или возрастная
дальнозоркость) принуждает человека использовать при чтении очки с
двояковыпуклыми линзами.
17.3.1.2. Аномалии рефракции
У большинства людей глаз имеет шарообразную форму, максимально
приспособленную для того, чтобы световые лучи фокусировались на сетчатке
при любой преломляющей силе хрусталика, изменяющейся в процессе
аккомодации. При нормальной рефракции на сетчатке одинаково четко
проецируются изображения далеких и близких предметов, а проявление такой
универсальной рефракционной способности определяют термином эмме-
тропия. Аномалии рефракции возникают при изменениях формы глаза,
проявляющихся в удлинении его оптической оси (близорукость, или
миопия) или в ее укорочении (дальнозоркость, или гиперметропия).
При удлиненной форме глаза, характерной для миопии, обычная
преломляющая способность его оптической системы оказывается избыточной,
в связи с чем изображение фокусируется перед сетчаткой и субъективно
воспринимается нечетким. Дефект зрительного восприятия ощущается
только при рассматривании удаленных предметов, тогда как световые
лучи, отраженные от близко находящихся предметов, фокусируются точно на
сетчатке благодаря ограничению механизма аккомодации. Например, при
чтении близоруким людям нужна меньшая, чем людям с нормальной
рефракцией, преломляющая сила хрусталика, поэтому нагрузка на ресничные
мышцы у них снижается. Но для ясного видения далеких предметов
близорукому человеку приходится носить очки с двояковогнутыми
рассеивающими линзами, уменьшающими преломление световых лучей. При
характерной для гиперметропии укороченной оптической оси глаза световые
лучи фокусируются за сетчаткой, что принуждает ресничные мышцы к
сокращению даже при рассмотрении далеких предметов. Для компенсации
720 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
этой аномалии рефракции необходимы очки с двояковыпуклыми линзами,
преломляющими световые лучи так, чтобы они фокусировались на
сетчатке.
Наибольшей преломляющей способностью в оптической системе глаза
обладает роговица (около 48,8 диоптрий), которая не участвует в
аккомодации. Поверхность роговицы не идеально сферична почти у всех людей,
ее кривизна по вертикали выражена больше, чем по горизонтали. При
значительном отклонении формы роговицы от идеальной пропорции
возникает аномалия рефракции, которая определяется как астигматизм. В
результате такой аномалии световые лучи, отраженные от наблюдаемых
объектов, преломляются не одинаково, поэтому часть лучей фокусируется на
сетчатке, а остальные — за ее пределами, что ведет к искажению
зрительного восприятия. Для исправления этого дефекта применяются
индивидуально подобранные линзы очков с различной кривизной по вертикальному
и горизонтальному меридианам.
17.3.1.3. Регуляция интенсивности светового потока
Приспособление к изменяющимся условиям освещения происходит с
помощью зрачкового рефлекса. Ширина зрачка уменьшается при ярком свете
благодаря сокращению кольцевых мышц, управляемых
парасимпатическими волокнами глазодвигательного нерва, а при слабом освещении зрачок
расширяется с помощью радиальных мышц, получающих симпатическую
иннервацию. Уменьшая просвет зрачка, глаз защищается от избытка света,
а увеличивая ширину зрачка, он повышает чувствительность зрительной
системы к воспринимаемым стимулам. Сужение зрачков повышает
глубину резкости, что позволяет лучше видеть удаленные предметы. При
расширении зрачков глубина резкости снижается, а вместе с ней снижается
острота зрения, которая характеризуется максимальной способностью глаза
различать две соседние точки зрительного пространства как отдельные.
В норме глаз различает две точки, видимые под углом в одну минуту при
достаточно ярком освещении.
17.3.1.4. Проекция зрительного поля на сетчатку
Благодаря механизму аккомодации глаз представляет собой
самофокусирующуюся оптическую систему, позволяющую получать на сетчатке четкое
изображение приближенных и удаленных предметов. Кроме того, глаз
подвижен, что позволяет ему следить за перемещающимися объектами.
Движения глаза обеспечиваются сокращениями глазодвигательных мышц (двух
косых и четырех прямых), которые позволяют повернуть глаз внутрь или
наружу, вверх или вниз. Оба глаза поворачиваются бинокулярно, т. е.
содружественно, и при рассмотрении близких предметов глазные оси сходятся
{конвергенция глаз), а при рассмотрении далеких предметов — расходятся
{дивергенция). Благодаря бинокулярному зрению каждая точка зрительного
поля проецируется на соответствующие друг другу участки сетчатки обоих
глаз. Изображение одного и того же предмета на сетчатках левого и
правого глаза немного различается, поскольку глаза занимают разную позицию
по отношению к зрительному полю. Разница изображений наблюдаемого
предмета на сетчатке левого и правого глаза обозначается термином
поперечная диспарация, она способствует последующему преобразованию
двухмерного изображения на сетчатке в трехмерное изображение, создаваемое
в процессе переработки зрительной информации в коре.
17. Сенсорные системы • 721
Первичная зрительная кора
Рис. 17.6. Ретинотопическая проекция сетчатки в первичную зрительную кору.
Пространственное соотношение между объектами зрительного поля соблюдается в его
проекции на соответствующие друг другу (корреспондирующие) области сетчатки каждого глаза.
Афферентные сигналы от носовых половин сетчатки благодаря частичному перекресту
волокон зрительных нервов поступают в противоположное полушарие. Афферентные сигналы от
височных половин сетчаток попадают с помощью неперекрещивающихся волокон зрительных
нервов в ипсилатеральное полушарие. В связи с этим в каждое полушарие поступает
зрительная информация о противоположной ему половине зрительного поля и с сохранением его
пространственных координат (принцип ретинотопии). При направленном на определенные
объекты внимании световые лучи, отраженные от них, всегда фокусируются в центральной
ямке. Поэтому центральная ямка и прилегающие к ней области сетчатки имеют наибольшую
площадь представительства в первичной зрительной коре.
Зрительное поле представляет собой область, видимую обоими
глазами в тот момент, когда они и голова неподвижны. При таком условии
левая половина зрительного поля проецируется на носовую половину
сетчатки левого глаза и височную половину сетчатки правого глаза.
Соответственно, правая половина зрительного поля проецируется на
носовую половину сетчатки правого глаза и височную половину сетчатки
левого глаза. Поскольку оптическая система глаза перевертывает
изображение, верхняя половина зрительного поля проецируется на нижнюю
половину сетчатки, а нижняя половина зрительного поля — на верхнюю
половину сетчатки. При дальнейшей переработке информации в наружном
коленчатом теле и первичной зрительной коре сохраняются все
пространственные координаты зрительного поля: каждая область сетчатки
связана с соответствующим представительством в коре, что называется
ретинотопией (рис. 17.6).
722 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
17.3.1.5. Движения глаз
При наблюдении за движущимися в зрительном поле объектами, а также
при движении человека относительно окружающего мира происходят
следящие движения глаз, благодаря которым изображение в одной и той же
области сетчатки сохраняется неизменным. При зрительном восприятии
неподвижных объектов, имеющих многочисленные детали формы, а также
во время чтения происходят быстрые движения глаз, предназначенные для
фиксации наиболее информативных деталей объекта. Например, при
восприятии человеческого лица фиксируются его контуры, но с наибольшим
вниманием рассматриваются глаза и рот, изображения которых глаз
проецирует не вообще на сетчатку, а на ту ее область, которая обладает
максимальной разрешающей способностью. Это центральная ямка, или fovea,
представляющая собой небольшое углубление диаметром около 3 мм в
центре сетчатки.
При рассматривании любых объектов глаза ежесекундно совершают
около трех очень быстрых непроизвольных и субъективно не ощущаемых
движений, которые называются саккадами. Благодаря таким движениям
изображение на сетчатке регулярно смещается, вызывая раздражение
разных фоторецепторов. Необходимость саккад объясняется свойством
зрительной системы сильнее реагировать на изменяющееся раздражение
(появление или исчезновение стимула), тогда как на постоянную стимуляцию
она отвечает слабо. При проецировании на сетчатку постоянного
изображения с помощью миниатюрного проектора, прикрепленного к
контактной линзе, это изображение перестает восприниматься спустя несколько
секунд, и вместо него в зрительном ощущении появляется сплошное серое
поле. По истечении нескольких секунд восприятие проецируемого на
сетчатку изображения восстанавливается, но затем снова исчезает и т. д.
17.3.2. Преобразование энергии света в сетчатке
Задняя стенка глаза выстлана эпителием, содержащим черный пигмент
меланин, который препятствует отражению света и поглощает его
излишки. К пигментному эпителию примыкает слой фоторецепторов, а перед
ним расположены слои горизонтальных, биполярных, амакриновых и
ганглиозных клеток, чьи аксоны образуют зрительный нерв. В связи с
инверсией сетчатки решаются две задачи: 1) обеспечение максимальной
прозрачности клеток, расположенных на пути прохождения света к
фоторецепторам, 2) выделение в слое фоторецепторов промежутка для
прохождения волокон зрительного нерва.
Решение первой задачи заключается в анатомическом устройстве
центральной ямки, где биполярные и ганглиозные клетки сетчатки
располагаются вокруг нее, а их относительно прозрачные безмиелиновые
волокна не мешают прохождению света к фоторецепторам. В других областях
сетчатки световые лучи отчасти рассеиваются при прохождении сквозь
тела клеток, расположенных перед фоторецепторами, но в центральной
ямке кванты света без помех попадают на фоторецепторы,
представленные здесь преимущественно колбочками. При направленном на
определенный объект зрительного поля внимании его изображение всегда
фокусируется в центральной ямке для обеспечения максимальной остроты
зрения.
Сосок зрительного нерва образован аксонами ганглиозных клеток,
отсутствие в этой области фоторецепторов делает ее не чувствительной к
17. Сенсорные системы • 723
свету, в связи с чем она получила название слепого пятна. На соски
правого и левого глаза благодаря диспарации попадают неодинаковые части
проецируемого изображения, поэтому в условиях естественного
зрительного восприятия пробел изображения на сетчатке не осознается. Кроме того,
быстрые движения глаз позволяют получать нужную информацию о любой
области рассматриваемого изображения, и отсутствие сигналов от слепого
пятна замещается информацией, поступившей от ближайших к нему
фоторецепторов.
17.3.2.1. Скотопическая и фотопическая системы сетчатки
Фоторецепторный слой сетчатки человека образован примерно 130
миллионами клеток, из которых около семи миллионов являются колбочками,
основная масса которых сосредоточена в области центральной ямки, а все
остальные фоторецепторы представлены палочками. У обеих
разновидностей фоторецепторов существуют три функциональные области: 1)
наружный, или внешний, сегмент, ориентированный в направлении
эпителиального пигментного слоя и содержащий зрительный пигмент; 2) внутренний
сегмент, в котором расположено клеточное ядро и происходят
биохимические процессы, связанные с жизнедеятельностью клетки; 3) синаптические
окончания, предназначенные для передачи информации от
фоторецепторов к биполярным клеткам с помощью медиатора глутамата.
Зрительный пигмент палочек родопсин состоит из двух компонентов: это
молекула ретиналя, образующаяся из витамина А и способная поглощать
свет, а также крупная белковая молекула опсина, не поглощающая свет.
Молекула опсина представляет собой извитую цепь из 348 аминокислот,
которая семь раз проходит через мембрану зрительного диска,
образованного из клеточной мембраны фоторецептора. В наружном сегменте
фоторецептора имеется большое количество таких дисков, расположенных
подобно стопке поставленных друг на друга монет. Ретиналь существует в
темноте как 11-цис-ретиналь, такая форма изомера идеально соответствует
упорядоченному расположению аминокислот в опсине. Энергия
поглощенных фотонов превращает ретиналь в 11-транс-изомер, что приводит к
конформационным изменениям молекулы опсина и превращению
родопсина в нестабильный метародопсин, который сразу же распадается на
ретиналь и опсин. Таким образом, действие света уменьшает концентрацию
родопсина в фоторецепторе, что приводит к изменениям активности
вторичных посредников и величины мембранного потенциала фоторецептора.
В темноте происходит ферментативный ресинтез расщепленного
родопсина, для которого используется витамин А, поступающий в организм
человека с пищей.
Родопсин наиболее чувствителен к электромагнитным волнам длиной
около 500 нм, но хорошо поглощает и другие волны в диапазоне от 400 до
600 нм. Способность родопсина поглощать волны почти всего светового
диапазона позволяет палочкам обеспечить только ахроматическое, т. е.
черно-белое, зрение и лишает их возможности различать цвет. Высокое
содержание зрительного пигмента в палочках и его способность суммировать
фотоны, поглощенные в течение около 100 мс, делает палочки наиболее
чувствительными фоторецепторами сетчатки. При слабом сумеречном
освещении зрение обеспечивают только палочки, способные возбуждаться
вследствие поглощения всего лишь одного фотона. Палочки образуют ско-
топическую систему, или систему ночного зрения.
Зрительные пигменты колбочек подобны родопсину палочек и состоят
724 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Р 3 К
Й6 531596
ТУТ
ч'\/""х'\
А : \ *
л ''■■ •
* \ \ \
: \ \ •
• \ \ \
\ \ •
\ • '.
\ \ ■.
\ \ •
\ \ \
\ \ •
\ \ *
400 450 500 550 600 650 нм
Рис. 17.7. Спектры поглощения четырех разновидностей фоторецепторов.
Зрительный пигмент палочек родопсин (Р) имеет максимум поглощения световых волн
длиною 496 нм, но способен также к поглощению коротких и длинных волн светового диапазона.
Зрительный пигмент колбочек, чувствительных к синему цвету (С), имеет максимум
поглощения 419 нм и не поглощает длинные волны оптического диапазона. Пигмент колбочек,
чувствительных к зеленому цвету (3), имеет максимум поглощения при 531 нм, а пигмент
чувствительных к красному цвету колбочек (К) максимально поглощает волны длиной 596 нм.
из светопоглощающей молекулы ретиналя и опсина, который отличается
составом аминокислот от белковой части родопсина. Кроме того,
колбочки содержат меньшее, чем палочки, количество зрительного пигмента, и
для их возбуждения требуется энергия нескольких сотен фотонов.
Поэтому колбочки активируются лишь при дневном или достаточно ярком
искусственном освещении, они образуют фотопическую систему, или
систему дневного зрения.
В сетчатке человека существуют три типа колбочек, различающихся
между собой по составу аминокислот в опсине зрительного пигмента.
Различия в белковой части молекулы определяют особенности взаимодействия
каждой из трех форм опсина с ретиналем и специфическую
чувствительность к световым волнам разной длины (рис. 17.7). Колбочки одного из
трех типов максимально поглощают короткие световые волны с длиной
419 нм, что необходимо для восприятия синего цвета. Другой тип
зрительного пигмента наиболее чувствителен к волнам средней длины и имеет
максимум поглощения при 531 нм, он служит для восприятия зеленого
цвета. Третий тип зрительного пигмента максимально поглощает длинные
волны с максимумом при 559 нм, что позволяет воспринимать красный
цвет. Наличие трех типов колбочек обеспечивает человеку восприятие всей
цветовой палитры, в которой существует свыше семи миллионов цветовых
градаций, тогда как скотопическая система палочек позволяет различать
лишь около пятисот черно-белых градаций.
100-
50
t
17. Сенсорные системы • 725
17.3.2.2. Рецепторный потенциал палочек и колбочек
Специфической особенностью фоторецепторов является темновой ток
катионов через открытые мембранные каналы внешних сегментов (рис. 17.8).
Эти каналы открываются при высокой концентрации циклического гуано-
зинмонофосфата, который является вторичным посредником рецепторного
белка (зрительного пигмента). Темновой ток катионов деполяризует
мембрану фоторецептора до приблизительно —40 мВ, что приводит к
выделению медиатора в его синаптическом окончании. Активированные
поглощением света молекулы зрительного пигмента стимулируют активность фос-
фодиэстеразы — фермента, расщепляющего цГМФ, поэтому при действии
света на фоторецепторы в них уменьшается концентрация цГМФ. В
результате управляемые этим посредником катионные каналы закрываются, и ток
катионов в клетку прекращается. Вследствие непрерывного выхода ионов
калия из клеток, мембрана
фоторецепторов гиперполяризуется
приблизительно до —70 мВ, эта
гиперполяризация мембраны
является рецепторным потенциалом. При
возникновении рецепторного
потенциала прекращается выделение
глутамата в синаптических
окончаниях фоторецептора.
Фоторецепторы образуют
синапсы с биполярными клетками
двух типов, различающихся по
способу управления хемозависи-
мыми натриевыми каналами в
синапсах. Действие глутамата
приводит к открытию каналов для ионов
натрия и деполяризации
мембраны одних биполярных клеток и к
закрытию натриевых каналов и
гиперполяризации биполярных
клеток другого типа. Наличие двух
типов биполярных клеток
необходимо для формирования
антагонизма между центром и
периферией рецептивных полей ганглиоз-
ных клеток.
17.3.2.3. Адаптация
фоторецепторов
к изменениям
освещенности
Временное ослепление при
быстром переходе от темноты к яркому
освещению исчезает спустя
несколько секунд благодаря
процессу световой адаптации. Одним из
механизмов световой адаптации
является рефлекторное сужение
ЦГМФ-управляемые
каналы
Каналы для ^
ионов калия
Внешний
сегмент
^ Внутренний
сегмент
#"Na+
\ Активный
транспорт
Внешний
сегмент
В темноте ^^ \ На свету
Na* | Na+
Высокая
концентрация
цГМФ, каналы
открыты
Низкая
концентрация
цГМФ, каналы
закрыты
Рис. 17.8. Ток ионов через мембрану
фоторецептора в темноте и на свету.
Ионы натрия поступают в фоторецепторы
через катионные каналы внешнего сегмента,
которые открываются при высокой
концентрации цГМФ в темноте (темновой ток).
Поступление в клетку ионов натрия вызывает
деполяризацию мембраны фоторецептора до —40
мВ. На свету концентрация цГМФ
уменьшается, что приводит к закрытию катионных
каналов. Непрекращающийся выход ионов
калия ведет к гиперполяризации мембраны,
которая представляет собой рецепторный
потенциал.
726 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
зрачков, другой зависит от концентрации ионов кальция в колбочках. При
поглощении света в мембранах фоторецепторов закрываются катионные
каналы, что прекращает вхождение ионов натрия и кальция и уменьшает
их внутриклеточную концентрацию. Высокая концентрация ионов кальция
в темноте подавляет активность гуанилатциклазы — фермента,
определяющего образование цГМФ из гуанозинтрифосфата. Вследствие снижения
концентрации кальция, обусловленного поглощением света, активность
гуанилатциклазы повышается, что ведет к дополнительному синтезу
цГМФ. Повышение концентрации этого вещества приводит к открытию
катионных каналов, восстановлению тока катионов в клетку и,
соответственно, способности колбочек отвечать на световые раздражители как
обычно. Низкая концентрация ионов кальция способствует десенситизации
колбочек, т. е. уменьшению их чувствительности к свету. Десенситизация
обусловлена изменением свойств фосфодиэстеразы и белков катионных
каналов, становящихся менее чувствительными к концентрации цГМФ.
Способность различать окружающие предметы исчезает на некоторое
время при быстром переходе от яркого света к темноте. Она постепенно
восстанавливается в ходе темновой адаптации, обусловленной
расширением зрачков и переключением зрительного восприятия с фотопической
системы на скотопическую. Темновую адаптацию палочек определяют
медленные изменения функциональной активности белков, приводящие к
повышению их чувствительности. В механизме темновой адаптации
участвуют и горизонтальные клетки, способствующие увеличению центральной
части рецептивных полей в условиях низкой освещенности.
17.3.3. Рецептивные поля клеток сетчатки
Выходные сигналы, передаваемые в ЦНС от сетчатки, возникают только в
ганглиозных клетках, импульсная активность которых зависит от
возбуждения фоторецепторов, а затем биполярных клеток, входящих в округлое
рецептивное поле ганглиозной клетки. Размер рецептивных полей и
количество фоторецепторов, относящихся к одному рецептивному полю,
варьируют от минимального в области центральной ямки до наибольшего на
периферии сетчатки. Малые рецептивные поля служат для различения
мелких деталей наблюдаемых объектов в тех случаях, когда соседние детали
воспринимаются под углом в несколько угловых минут. Большие
рецептивные поля вмещают изображение целого объекта, воспринимаемого под
углом в несколько угловых градусов (Г соответствует рецептивному полю
на поверхности сетчатки с диаметром около 0,25 мм).
Существуют два пути для передачи сигналов от фоторецепторов к
ганглиозной клетке: прямой и непрямой. Прямой путь начинается от
фоторецепторов, расположенных в центре рецептивного поля и образующих
синапс с биполярной клеткой, которая через другой синапс действует на ганг-
лиозную клетку. Непрямой путь берет начало от фоторецепторов
периферии рецептивного поля, которая с центром состоит в реципрокных
отношениях, обусловленных тормозным действием горизонтальных и амакрино-
вых клеток (латеральное торможение).
17.3.3.1. Рецептивные поля с оп-центрами и off-центрами
В сетчатке человека имеются два типа ганглиозных клеток, отличающихся
реакцией на точечные световые стимулы, воздействовавшие на центр или
периферию их рецептивного поля (рис. 17.9). Примерно половина гангли-
17. Сенсорные системы • 727
Биполярные Фоторецепторы
К зрительному клетки (палочки)
нерву
Рис. 17.9. Рецептивные поля ганглиозных клеток сетчатки с on- и off-центрами.
A. Рецептивное поле ганглиозной клетки образуют все фоторецепторы и биполярные клетки,
имеющие с нею синаптические контакты. Ганглиозные клетки постоянно генерируют
потенциалы действия, частота возникновения которых зависит от активности фоторецепторов и
биполярных клеток, входящих в ее рецептивное поле.
Б. Ганглиозная клетка on-типа увеличивает частоту электрических разрядов в ответ на
световое раздражение центра рецептивного поля и снижает свою электрическую активность при
действии светового раздражителя на периферию рецептивного поля.
B. Ганглиозная клетка off-типа тормозится при действии света на центр ее рецептивного поля
и увеличивает частоту нервных импульсов в ответ на раздражение периферии рецептивного
поля.
озных клеток возбуждается действием света на центр рецептивного поля и
тормозится при действии светового стимула на периферию рецептивного
поля. Такие клетки принято называть оп-нейронами. Другая половина
ганглиозных клеток возбуждается действием светового раздражителя на
периферию рецептивного поля и тормозится в ответ на световую стимуляцию
центра рецептивного поля — они получили название off-нейронов.
Рецептивные поля ганглиозных клеток обоих типов в сетчатке
представлены поровну, чередуясь друг с другом. Оба типа клеток очень слабо
отвечают на равномерную диффузную засветку всего рецептивного поля, а
наиболее сильным раздражителем для них является световой контраст,
т. е. различная интенсивность засветки центра и периферии. Именно
контрастирование деталей изображения дает необходимую информацию для
зрительного восприятия в целом, тогда как абсолютная интенсивность
отраженного от наблюдаемого объекта света не столь важна. Восприятие
граней, т. е. восприятие контраста между соседними поверхностями с разной
освещенностью, является наиболее информативным признаком
изображения, определяющим протяженность и позиции разных объектов.
728 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
17.3.3.2. Рецептивные поля цветового восприятия
Восприятие цвета основано на существовании шести первичных цветов,
образующих три антагонистичные, или цветооппонентных, пары: красный —
зеленый, синий — желтый, белый — черный. Ганглиозные клетки,
передающие в центральную нервную систему информацию о цвете,
различаются организацией своих рецептивных полей, состоящих из комбинаций трех
существующих типов колбочек. Каждая колбочка предназначена для
поглощения электромагнитных волн определенной длины, однако сами они
не кодируют информацию о длине волны и способны реагировать на
очень яркий белый свет. И только наличие в рецептивном поле ганглиоз-
ной клетки антагонистичных фоторецепторов создает нейронный канал
для передачи информации об определенном цвете. При наличии только
одного типа колбочек (монохромазия) человек не способен различить ни
один цвет и воспринимает окружающий мир в черно-белой градации, как
при скотопическом зрении. При наличии только двух типов колбочек (ди-
хромазия) цветовое восприятие ограничено, и лишь существование трех
типов колбочек (трихромазия) обеспечивает полноту цветового восприятия.
Возникновение монохромазии и дихромазии у человека обусловлено
генетическими дефектами Х-хромосомы.
Концентрические широкополосные ганглиозные клетки имеют округлые
рецептивные поля on- или off-типа, которые образованы колбочками, но
предназначены для фотопического черно-белого зрения. Белый свет,
попадающий в центр или на периферию такого рецептивного поля, возбуждает
или тормозит активность соответствующей ганглиозной клетки, которая в
итоге передает информацию об освещенности. Концентрические
широкополосные клетки суммируют сигналы от колбочек, поглощающих красный
и зеленый цвет и расположенных в центре и на периферии рецептивного
поля. Поступление сигналов от колбочек обоих типов происходит
независимо друг от друга, а потому не создает цветового антагонизма и не
позволяет широкополосным клеткам дифференцировать цвет (рис. 17.10).
Наиболее сильным раздражителем для концентрических противоцветных
ганглиозных клеток сетчатки является действие антагонистических цветов
на центр и периферию рецептивного поля. Одну разновидность
противоцветных ганглиозных клеток возбуждает действие красного цвета на центр
ее рецептивного поля, в котором сосредоточены колбочки, чувствительные
к красной части спектра, и зеленого цвета — на периферию, где имеются
колбочки, чувствительные к нему. У другой разновидности
концентрических противоцветных клеток в центре рецептивного поля расположены
колбочки, чувствительные к зеленой части спектра, а на периферии — к
красной. Эти две разновидности концентрических противоцветных клеток
различаются ответными реакциями на действие красного или зеленого
цвета на центр или периферию рецептивного поля подобно тому, как on- и off-
нейроны различаются в зависимости от воздействия света на центр или
периферию рецептивного поля. Каждая из двух разновидностей
противоцветных клеток представляет собой нейронный канал, передающий
информацию о действии красного или зеленого цвета, причем передача
информации тормозится действием антагонистического или оппонентного цвета.
Оппонентные отношения при восприятии синего и желтого цветов
обеспечиваются в результате объединения в рецептивном поле колбочек,
поглощающих короткие волны (синий цвет) с комбинацией из колбочек,
реагирующих на зеленый и красный цвет, что при смешении дает
восприятие желтого цвета. Синий и желтый цвет оппонентны по отношению друг
П. Сенсорные системы • 729
Концентрические
широкополосные
клетки (ахроматические)
Концентрические
простые
противоцветные
клетки
Концентрические
простые
противоцветные
клетки
Простые
противоцветные
клетки
Рис. 17.10. Рецептивные поля ганглиозных клеток, образованные колбочками трех
типов.
A. Концентрические широкополосные клетки имеют в своем рецептивном поле колбочки для
восприятия красного (К) и зеленого (3) цветов. Колбочки обоих типов расположены в
рецептивном поле так, что их входные сигналы суммируются независимо друг от друга, поэтому
широкополосные ганглиозные клетки не передают информацию о цвете, а реагируют лишь на
световой контраст между центром и периферией рецептивного поля как on- или off-нейроны.
Б. Простые противоцветные клетки двух разновидностей, отвечающие на стимуляцию
зеленым цветом центра или периферии рецептивного поля (красный цвет действует как
антагонист зеленому).
B. Простые противоцветные клетки двух разновидностей, различающиеся по характеру ответа
на действие красного цвета в центре или на периферии рецептивного поля (зеленый цвет
действует как антагонист красному).
Г. Колбочки, поглощающие короткие волны (синий цвет), находятся в антагонистических
отношениях со входящими в общее рецептивное поле колбочками, поглощающими средние и
длинные волны светового диапазона (зеленый и красный цвет).
к другу, и сочетание в рецептивном поле колбочек, поглощающих эти
цвета, позволяет противоцветной ганглиозной клетке передавать информацию
о действии одного из них. Каким именно окажется этот нейронный канал,
т. е. передающим информацию о синем или желтом цвете, определяет
расположение колбочек внутри рецептивного поля концентрической
противоцветной клетки. В зависимости от этого нейронный канал возбуждается
синим или желтым цветом и тормозится оппонентным цветом.
17.3.3.3. М- и Р-типы ганглиозных клеток сетчатки
Зрительное восприятие происходит в результате согласования друг с
другом различных сведений о наблюдаемых объектах. Но на низших
иерархических уровнях зрительной системы, начиная с сетчатки глаза,
осуществляется независимая переработка информации о форме и глубине объекта,
о его цвете и его движении. Паралелльная переработка информации об
этих качествах зрительных объектов обеспечивается специализацией
ганглиозных клеток сетчатки, которые подразделяются на магноцеллюлярные
(М-клетки) и парвоцеллюлярные (Р-клетки).
730 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
В большом рецептивном поле относительно крупных М-клеток,
состоящем преимущественно из палочек, может проецироваться цельное
изображение крупных объектов: М-клетки регистрируют грубые признаки таких
объектов и их движение в зрительном поле, отвечая на раздражение всего
рецептивного поля непродолжительной импульсной активностью. Клетки
Р-типа имеют малые рецептивные поля, состоящие преимущественно из
колбочек и предназначенные для восприятия мелких деталей формы
объекта или для восприятия цвета. Среди ганглиозных клеток каждого типа
имеются как on-нейроны, так и off-нейроны, дающие наиболее сильный
ответ на раздражение центра или периферии рецептивного поля.
Существование М- и Р-типов ганглиозных клеток позволяет разделить
информацию о разных качествах наблюдаемого объекта, которая перерабатывается
независимо в параллельных путях зрительной системы: о тонких деталях
объекта и о его цвете (пути начинаются от соответствующих рецептивных
полей клеток Р-типа) и о движении объектов в зрительном поле (путь от
клеток М-типа).
17.3.4. Проводящие пути и переключательные центры зрительной
системы
Аксоны ганглиозных клеток образуют зрительный нерв, состоящий
приблизительно из одного миллиона волокон. Войдя через зрительные отверстия
в череп, правый и левый зрительные нервы сходятся друг с другом и
частично перекрещиваются: волокна от носовых половин сетчаток переходят
на противоположную сторону, волокна от височных половин сетчаток
следуют ипсилатерально. В результате частичного перекреста образуются
правый и левый зрительные тракты, передающие информацию от
противоположной половины зрительного поля.
Окончания аксонов ганглиозных клеток на нейронах претектальной
области среднего мозга служат для осуществления зрачкового рефлекса.
Аксоны, следующие к верхним буграм четверохолмия, переносят информацию,
необходимую для осуществления глазодвигательных рефлексов и
ориентировочных реакций. Проводящий путь от сетчатки к гипоталамусу
предназначен для синхронизации эндогенного циркадианного 24-часового ритма с
естественным чередованием светлого и темного времени суток. Собственно
сенсорная функция, т. е. восприятие зрительной информации,
обеспечивается при участии латерального коленчатого тела, принимающего
информацию от сетчатки и передающего ее в зрительную кору.
17.3.4.1. Функциональная организация латерального коленчатого тела
Аксоны ганглиозных клеток образуют топографически организованные
соединения с нейронами латерального коленчатого тела, которые
представлены шестью слоями клеток. Два первых слоя, расположенные вентрально,
состоят из магноцеллюлярных клеток, имеющих синапсы с М-клетками
сетчатки, причем первый слой получает сигналы от носовой половины
сетчатки контралатерального глаза, а второй — от височной половины ип-
силатерального глаза. Остальные четыре слоя клеток, расположенные дор-
сальнее, получают сигналы от Р-клеток сетчатки: четвертый и шестой — от
носовой половины сетчатки контралатерального, а третий и пятый — от
височной половины сетчатки ипсилатерального глаза. В результате такой
организации афферентных входов в каждом латеральном коленчатом теле,
т. е. левом и правом, формируются шесть расположенных точно одна над
17. Сенсорные системы • 731
другой нейронных карт противоположной половины зрительного поля.
Нейронные карты организованы ретинотопически, в каждой из них около 25 %
клеток получают информацию от фоторецепторов центральной ямки.
Рецептивные поля нейронов латерального коленчатого тела имеют
округлую форму с центрами on- или off-типа и антагонистичной по
отношению к центру периферией. К каждому нейрону конвергирует небольшое
количество аксонов ганглиозных клеток, и потому характер передающейся
зрительной коре информации здесь почти не изменяется. Сигналы от пар-
воцеллюлярных и магноцеллюлярных клеток сетчатки перерабатываются
независимо друг от друга и передаются в зрительную кору параллельными
путями. Нейроны латерального коленчатого тела получают от сетчатки не
более 20 % афферентных входов, а остальные афференты образованы в
основном нейронами ретикулярной формации и коры. Эти входы в
латеральное коленчатое тело регулируют передачу сигналов от сетчатки к коре.
17.3.5. Переработка зрительной сенсорной информации в коре
Проекционная зрительная кора расположена в затылочных долях каждого
полушария (поле 17 или VI) и получает организованные ретинотопически
афферентные входы от соответствующего, т. е. левого или правого,
латерального коленчатого тела. Каждый участок проекционной коры
соответствует определенным точкам сетчатки, на которые проецируются
изображения предметов, расположенных в противоположной полушарию
половине зрительного поля. Проекция центральной ямки и ближайших к ней
участков сетчатки занимает около половины первичной зрительной коры.
Информация о форме наблюдаемых объектов, об их цвете и их движении
поступает по параллельным путям в разные слои первичной зрительной
коры. Объединение информации обо всех качествах наблюдаемых объектов
происходит в процессе ее переработки во вторичной зрительной и
ассоциативной коре.
Аксоны нескольких нейронов латерального коленчатого тела передают
информацию входным звездчатым клеткам коры, отростки которых
конвергируют к одному из простых пирамидных нейронов первичной
зрительной коры. Поэтому рецептивное поле последнего имеет форму вытянутого
в длину прямоугольника, составленного из нескольких округлых
рецептивных полей нейронов предыдущего уровня (рис. 17.11). Центральная часть
такого рецептивного поля представляет собой on- либо off-зону,
антагонистичную по отношению к периферии. Наиболее эффективным
раздражителем для простых нейронов является действующая вдоль их рецептивного
поля световая грань (светлая полоса на темном фоне, темная линия на
светлом фоне, контраст между темной и светлой плоскостью). В
первичной зрительной коре имеется около 20 популяций простых нейронов,
различающихся чувствительностью к определенному углу наклона световой
грани.
Наряду с простыми нейронами в первичной зрительной коре имеются
комплексные нейроны, получающие афферентную информацию от
нескольких простых нейронов и от входных клеток коры. Рецептивные поля
комплексных нейронов больше, чем у простых нейронов, а линейная
ориентация стимулов уже не имеет решающего значения для их возбуждения:
самым значимым для них раздражителем служит движение грани или
светового контура через рецептивное поле. Более половины комплексных
нейронов глазодоминантны, т. е. сильнее реагируют на раздражение одного
глаза, каждый из которых поставляет чуть отличающуюся информацию в
732 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Рецептивные поля нейронов
латерального коленчатого тела
Рецептивные поля простых
нейронов зрительной коры
i —i i т - i 1
Звездчатые клетки
/^f /jt IV слоя первичной
%^ ^* зрительной коры
Простой нейрон
зрительной коры
I
Простые
нейроны
зрительной
коры
Комплексный нейрон
зрительной коры
Рис. 17.11. Рецептивные поля нейронов разных иерархических уровней зрительной
системы.
А. Нейроны латерального коленчатого тела имеют округлые рецептивные поля с on- или off-
центрами, подобные рецептивным полям ганглиозных клеток. Конвергенция нейронов
латерального коленчатого тела к простым нейронам проекционной зрительной коры
(опосредованная звездчатыми клетками) формирует их рецептивные поля прямоугольной формы и
максимальной чувствительности к определенному углу наклона линейного стимула.
Б. Конвергенция нейронов зрительной коры к комплексным нейронам создает рецептивное
поле последних, в котором угол наклона линейных стимулов не имеет значения.
связи с поперечной диспарацией (см. раздел 17.3.1.4). Глазодоминантные
нейроны обеспечивают бинокулярное зрение, необходимое для
определения пространственной глубины наблюдаемых объектов.
Ни простые, ни комплексные нейроны не реагируют на монотонные
участки внутри объекта или фона — такие участки не дают информации, и
восприятие внутренних участков зрительного объекта полностью
определяется их границами.
Анализ информации о цвете в первичной зрительной коре
осуществляют сосредоточенные там в виде так называемых капель (blobs) двойные про-
тивоцветные клетки, получающие афферентную информацию от простых
противоцветных клеток сетчатки. Двойные противоцветные клетки
возбуждаются (или тормозятся) при попадании одного цвета в центр
рецептивного поля, а антагонистичного цвета — на периферию. Первичная
зрительная кора не может обеспечить цветовое восприятие, которое
осуществляется на следующей ступени преобразования поступившей информации в
регионах V2 и V4 (последний расположен на стыке теменной и височной
областей).
17. Сенсорные системы • 733
17.3.5.1. Зрительное восприятие
Целостное восприятие окружающего мира происходит в результате
объединения всей информации, поступившей по параллельным путям зрительной
системы. Магноцеллюлярный путь обеспечивает регистрацию движения
объектов, восприятие пространственной глубины и определение
пространственных отношений между объектами. В объединении этой информации
помимо первичной зрительной коры участвуют регионы V2 (поле 18), V3
(поле 19), V5 или МТ (медиотемпоральный), MST (область коры,
проходящая вдоль верхней височной борозды) и заднетеменной коры (поля 5 и 7).
Парвоцеллюлярный путь, берущий начало от on- и off-ганглиозных клеток
сетчатки и служащий для анализа информации о контурах объекта и
линейной ориентации его деталей, после переработки в регионе VI
продолжается в направлении нижних височных долей коры, при участии которых
происходит восприятие формы наблюдаемых объектов. Параллельный
парвоцеллюлярный путь начинается от концентрических противоцветных ганг-
лиозных клеток сетчатки и предназначается для формирования
зрительного представления о цвете объекта. Необходимая информация
последовательно перерабатывается в регионах VI, V2 и V4, где происходит
объединение зрительного восприятия формы и цвета. В регионе V4 расположены
нейроны, воспринимающие определенный цвет, а не длину волн,
соответствующих тому или иному цвету. С активностью этих нейронов связан
феномен цветового постоянства, т. е. способность воспринимать цвет одних
и тех же объектов неизменным, несмотря на естественные изменения
освещенности на протяжении светового дня.
Восприятие образуется из элементарных зрительных ощущений подобно
тому, как музыкальная мелодия складывается из отдельных звуков
определенной высоты и узнается независимо от того, в какой тональности она
сыграна. Процесс зрительного восприятия состоит из нескольких этапов.
Первый из них осуществляется очень быстро и состоит в определении
важнейших контуров объектов, их границ и текстуры поверхности, когда
внимание еще не фиксировано на каких-либо деталях. После этого происходит
фокусирование внимания на деталях, которые, в зависимости от их
важности для целостного восприятия, могут быть просмотрены несколько раз,
тогда как другие, менее информативные остаются незамеченными. Например,
при рассматривании человеческого лица внимание смотрящего помимо
общего контура более всего сосредоточено на таких деталях, как глаза и губы,
тогда как щеки обычно привлекают внимание в меньшей мере. Зрительное
восприятие не сводится к элементарному отражению зрительного поля, оно
складывается и в результате конструктивной и высокопроизводительной
активности всех участвующих в этом процессе регионов мозга: благодаря
этому человек может с первого взгляда узнавать лица, вещи или пейзажи.
17.4. Слуховая сенсорная система
Функция слуховой системы состоит в формировании слуховых ощущений
человека в ответ на действие звуковых волн, представляющих собой
распространяющиеся колебания молекул воздуха (упругой среды).
Периферическая часть слуховой системы включает наружное, среднее и внутреннее ухо,
в котором расположены слуховые рецепторы. Ее центральную часть
образуют проводящие пути, переключательные ядра и слуховая кора, расположенная
в обоих полушариях в глубине латеральной борозды, отделяющей височную
долю от лобной и передних отделов теменной доли (поля 41 и 42).
734 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
17.4.1. Психофизические характеристики звуковых сигналов
Звуковые волны представляют собой передаваемые от источника звука
механические смещения молекул воздуха (или иной упругой среды).
Скорость распространения звуковых волн в воздухе около 343 м/с при 20 "С (в
воде и металлах она значительно выше). Правильно чередующиеся участки
сжатия и разрежения молекул упругой среды можно представить в виде
синусоид, которые различаются частотой и амплитудой. При суперпозиции
звуковых волн с различными частотами и амплитудами они наслаиваются
друг на друга, образуя комплексные волны. Физическим понятиям
амплитуды, частоты и комплексности соответствуют ощущения громкости, высоты
и тембра звука (рис. 17.12). Звук, образованный синусоидальными
колебаниями только одной частоты, вызывает ощущение определенной его
высоты и определяется как тон. Комплексные тоны состоят из основного
тона (самая низкая частота колебаний) и определяющих тембр обертонов,
или гармоник, представляющих более высокие частоты, кратные основной.
В повседневной жизни тоны всегда бывают комплексными, т. е.
составленными из нескольких синусоид. Индивидуальное сочетание
комплексных волн определяет характерный тембр человеческого голоса или
музыкального инструмента. Слуховая система человека способна различать
высоту звука лишь у периодических звуковых сигналов, тогда как звуковые
раздражители, состоящие из беспорядочного сочетания частотных и
амплитудных компонентов, воспринимаются как шум.
Физический
параметр
Амплитуда
Частота
Комплексность
Рис. 17.12. Соотношение физических параметров звуковых раздражителей с
субъективными ощущениями человека.
Уменьшение амплитуды звуковых волн субъективно воспринимается как уменьшение
громкости звука. Увеличение частоты звуковых волн субъективно оценивается как повышение
высоты звука. Комплексные звуковые волны, образованные суперпозицией нескольких волн,
формируют субъективное восприятие тембра звука.
Звуковые волны ! Ощущение
! Громкость
Громко Тихо
ОЛАА/Ш
Высота
Низко Высоко
WWw
Чистый ; Комплексный
тон тон
! Тембр
17. Сенсорные системы • 735
17.4.1.1. Диапазон частотного восприятия
Дети воспринимают звуковые волны в диапазоне от 16 до 20 000 Гц, но
приблизительно с 15—20 лет диапазон частотного восприятия начинает
суживаться в связи с утратой чувствительности слуховой системы к самым
высоким звукам. В норме независимо от возраста человек легче всего
воспринимает звуковые волны в диапазоне от 100 до 2000 Гц, что имеет для
него особенное значение, поскольку человеческая речь и звучание
музыкальных инструментов обеспечиваются передачей звуковых волн именно в
этом диапазоне (табл. 17.2).
Чувствительность слуховой системы к минимальному изменению
высоты звука определяется как разностный порог частоты. В оптимальном для
восприятия частотном диапазоне, приближающемся к 1000 Гц, порог
различения частот составляет около 3 Гц. Это значит, что изменение частоты
звуковых волн на 3 Гц в большую или меньшую сторону человек замечает
как повышение или понижение звука.
Таблица 17.2. Частотная и волновая характеристики некоторых источников звука
Источники звука
Нижняя нота рояля
Низкий певческий бас
Нота «ля» для настройки
Высокий тенор
Альт
Верхнее «до»
Колоратурное сопрано
Самая высокая нота рояля
Частота (Гц)
27,5
80
440
500
650
1048
1350
4186
Длина волны (м)
12,4
2,7
78 • Ю-2
69 • 10"2
53 • 10"2
33 • 10"2
25 • 10"2
8,2 • 10"2
1 7.4.1.2. Громкость звука
Амплитуда звуковых волн определяет величину звукового давления, под
которым понимают силу сжатия, действующую на перпендикулярно
расположенную к ней площадь. Акустическим эталоном, близким к абсолютному
порогу слухового восприятия, принято считать 2 • Ю-5 Н/м2, а сравнитель-
Таблица 17.3. Интенсивность некоторых источников звука
Интенсивность (Вт/м2)
10-11
10-ю
ю-'
ю-8
ю-7
10~6
10"s
10"4
ю-3
ю-2
ю-'
10
Уровень
интенсивности (дБ)
10
20
30
40
50
60
70
80
90
100
ПО
120
Качественная
субъективная оценка
Едва слышно
Очень тихо
Тихо
Умеренно
Умеренно
Умеренно
Умеренно
Шумно
Очень шумно
Очень шумно
Невыносимо
Болевое ощущение
Источник звука
Спокойное дыхание
Шелест листвы
Перелистывание книги
Тихая контора
Домашняя обстановка
Обычный разговор
Лектор
Уличный транспорт
Близко идущий поезд
Пожарная сирена
Взлет авиалайнера
Разрыв артиллерийского снаряда
736 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
ной единицей измерения громкости, выражаемой в логарифмической
шкале, служит децибел (дБ). Громкость измеряется в децибелах как 201g(Px/Po),
где Рх — действующее звуковое давление, а Р0 — эталонное давление. Также
в децибелах принято измерять интенсивность различных источников звука,
понимая под интенсивностью звука мощность или плотность звуковых волн
в единицу времени. Принимая за эталонную интенсивность Ю-12 Вт/м2 (10),
количество децибел для измеряемой интенсивности (1х) определяют по
формуле 101g(Ix/Io). Интенсивность звука пропорциональна квадрату звукового
давления, поэтому 101g(Ix/Io) = 201g(Px/Po). Сравнительная характеристика
интенсивности некоторых источников звука представлена в табл. 17.3.
Субъективно воспринимаемая громкость звучания зависит не только от
уровня звукового давления, но и от частоты звукового стимула.
Чувствительность слуховой системы максимальна для раздражителей с частотами
от 500 до 4000 Гц, при других частотах она снижается.
17.4.2. Периферическая часть слуховой системы
В наружном, среднем и внутреннем ухе происходят необходимые для
слухового восприятия подготовительные процессы, смысл которых состоит в
оптимизации параметров передаваемых звуковых колебаний при
одновременном сохранении характера сигналов. Во внутреннем ухе происходит
преобразование энергии звуковых волн в рецепторные потенциалы волос-
ковых клеток.
17.4.2.1. Функция наружного уха
Движения ушных раковин млекопитающих в направлении источника звука
помогают обнаружить его пространственное расположение, эта функция
определяется как ототопика. Большинство людей не могут изменять
положение ушных раковин, а сохранность такой способности у человека
квалифицируется как атавизм. Функцию ототопики у человека выполняют
рельеф ушных раковин и их расположение на противоположных сторонах
головы, позволяющее различать поступление звука спереди или сзади.
Наружный слуховой проход ведет к барабанной перепонке, представляющей
вогнутую в полость среднего уха перегородку, которая приводится в
колебания распространяющимися звуковыми волнами. Ориентация коллагеновых
волокон барабанной перепонки позволяет ей колебаться с частотой
действующих звуковых волн относительно оси, расположенной вблизи ее
верхнего края.
17.4.2.2. Функция среднего уха
Воздушная полость среднего уха соединяется евстахиевой трубой с
носоглоткой, что позволяет выравнивать давление в среднем ухе по
атмосферному давлению (соприкасающиеся стенки евстахиевой трубы
раскрываются при глотательных движениях). В полости среднего уха имеются три
подвижно сочлененные слуховые косточки {молоточек, наковальня и
стремечко), служащие для передачи колебаний от барабанной перепонки к
овальному окну, которое ведет в вестибулярную часть внутреннего уха. Рукоятка
молоточка прикреплена к барабанной перепонке, а основание стремечка
закрывает овальное окно, подвижную связь между ними обеспечивает
наковальня (рис. 17.13).
Колебания барабанной перепонки сообщаются молоточку, рукоятка ко-
17. Сенсорные системы • 737
Рис. 17.13. Среднее и внутреннее ухо.
A. Строение среднего и внутреннего уха: колебания барабанной перепонки сообщаются
слуховым косточкам, которые передают их во внутреннее ухо через овальное окно.
Б. Улитка показана в развернутом виде: колебания перилимфы вестибулярной лестницы
сообщаются через геликотрему перилимфе барабанной лестницы, заставляя колебаться основную
мембрану.
B. Поперечный разрез кортиева органа: 1) вестибулярная лестница; 2) барабанная лестница;
3) средняя лестница (перепончатый канал улитки); 4) вестибулярная мембрана; 5) основная
мембрана; 6) покровная пластинка; 7) волосковые клетки; 8) первичные сенсорные нейроны.
торого в полтора раза длиннее отростка наковальни; благодаря этому
создается рычаг, повышающий силу колебаний стремечка. Увеличение силы
колебаний необходимо для их передачи из воздушной среды среднего уха в
заполненную жидкостью полость внутреннего уха. Решению этой задачи
способствует и большая площадь барабанной перепонки по сравнению с
площадью овального окна, соотносящихся между собой как 20:1.
При высоких значениях звукового давления амплитуда колебаний
слуховых косточек уменьшается вследствие рефлекторного сокращения двух
мышц, прикрепленных к рукоятке молоточка и стремечку. При
сокращении одной из них (m. tensor tympani) увеличивается натяжение барабанной
перепонки, что ведет к уменьшению амплитуды ее колебаний, а
сокращение другой мышцы (m. stapedius) ограничивает колебания стремечка. Эти
мышцы участвуют в приспособлении слуховой системы к звукам высокой
интенсивности и начинают сокращаться примерно через 10 мс после
начала действия звука, превышающего 40 дБ.
24 - 6095
738 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
17.4.2.3. Внутреннее ухо
В пирамиде височной кости имеется сложной формы полость (костный
лабиринт), составными частями которой являются преддверие, улитка и
полукружные каналы (см. рис. 17.13). Внутри костного лабиринта как в футляре
размещен перепончатый лабиринт, по форме соответствующий костному.
Полость трехслойного (эпителий, базальная мембрана, соединительная
ткань) перепончатого лабиринта заполнена жидкостью (эндолимфа), а сам
он взвешен в наружной жидкости (перилимфа), отличающейся по своему
составу от внутренней.
Слуховой частью лабиринта является улитка, которая представляет
собой спираль из двух с половиной завитков, закрученных вокруг полого
костного веретена. Внутри костного веретена расположены тела
чувствительных нейронов, образующие спиральный ганглий. Периферические отростки
нейронов спирального ганглия образуют синапсы со вторичными
рецепторами улитки (волосковыми клетками), а центральные — составляют
слуховой нерв. Перепончатый лабиринт улитки имеет трехгранную форму, его
дно образовано основной, или базилярной, мембраной, крыша —
вестибулярной, или рейснеровой, мембраной. Заполненная перилимфой полость под
базилярной мембраной называется барабанной лестницей, а полость над
вестибулярной мембраной — вестибулярной лестницей: обе полости
сообщаются у вершины улитки посредством тонкого прохода — геликотремы.
Собственная полость перепончатого лабиринта заполнена эндолимфой и
называется средней лестницей.
На базилярной мембране расположен кортиев орган, состоящий из
нескольких рядов волосковых рецепторных клеток, поддерживаемых
опорным эпителием. Около 3500 волосковых клеток образуют внутренний ряд
(внутренние волосковые клетки), а приблизительно 12—20 тысяч наружных
волосковых клеток образуют три, а в области верхушки улитки пять
продольных рядов. На обращенной внутрь средней лестницы поверхности
волосковых клеток имеются покрытые плазматической мембраной
чувствительные волоски — стереоцилии. Волоски соединены с цитоскелетом, их
механическая деформация ведет к открытию катионных каналов мембраны
и возникновению рецепторного потенциала волосковых клеток. Над кор-
тиевым органом имеется желеобразная покровная, или текториальная,
пластинка, образованная гликопротеином и коллагеновыми волокнами и
прикрепленная к внутренней стенке лабиринта. Верхушки стереоцилии
наружных волосковых клеток погружены в вещество покровной пластинки.
П.4.2.4. Функция внутреннего уха
Вызванные звуковыми волнами колебания барабанной перепонки и
слуховых косточек сообщаются через овальное окно перилимфе вестибулярной
лестницы и распространяются через геликотрему на барабанную лестницу,
которую отделяет от полости среднего уха круглое окно, закрытое тонкой
и упругой мембраной, повторяющей колебания перилимфы. Колебания
стремечка вызывают распространение следующих одна за другой бегущих
волн, которые перемещаются по основной мембране от основания улитки
к геликотреме.
Звуковая волна распространяется по вестибулярной лестнице к
геликотреме практически мгновенно (примерно за 2 • 10-5 секунды). Вызванное
этой волной гидростатическое давление смещает весь улитковый ход в
направлении барабанной лестницы, одновременно с этим покровная пла-
17. Сенсорные системы • 739
стинка сдвигается относительно поверхности кортиева органа. Ось
вращения покровной пластинки расположена выше оси вращения основной
мембраны, и поэтому в области амплитудного максимума бегущей волны
возникает срезающее усилие. В результате покровная пластинка
деформирует пучки стереоцилий волосковых клеток, что приводит к их
возбуждению, передающемуся окончаниям первичных сенсорных нейронов.
Помимо воздушной передачи колебаний с участием барабанной
перепонки движение жидкости внутреннего уха можно вызвать посредством
костного проведения звуковых волн. Так, например, звуковые колебания
камертона можно слышать и при закрытом слуховом проходе, если
поставить его ножку на сосцевидный отросток височной кости или на темя.
Использование костных телефонов, установленных за ушными раковинами,
тоже основано на костном проведении звука.
17.4.2.5. Биоэлектрические процессы в кортиевом органе
Различия ионного состава эндолимфы, содержащей около 155 ммоль/л
ионов калия, т. е. близкой к внутриклеточной, и перилимфы с высокой
концентрацией ионов натрия (около 140 ммоль/л) создают между ними
разность потенциалов около +80 мВ, которая называется эндокохлеарным
потенциалом. Мембранный потенциал покоя волосковых клеток составляет
около —80 мВ, поэтому между эндолимфой и внутриклеточной средой ре-
цепторных клеток существует разность потенциалов около 160 мВ. Столь
значительная разность потенциалов способствует возбуждению волосковых
клеток даже при действии слабых звуковых сигналов, вызывающих
незначительные колебания основной мембраны. При деформации стереоцилий
волосковых клеток в них возникает рецепторный потенциал, что приводит
к выделению медиатора глутамата, действующего на окончания слуховых
нервов и тем самым возбуждающего их.
17.4.2.6. Частотное кодирование
Амплитуда и скорость распространяющихся по основной мембране
бегущих волн зависят от механических свойств этой мембраны. Вблизи
овального окна жесткость основной мембраны приблизительно в 100 раз выше,
чем в завитках улитки, поэтому возле овального окна волны
распространяются с максимальной скоростью и с минимальной амплитудой. Амплитуда
бегущих волн возрастает в менее натянутых участках основной мембраны,
но затем гасится сопротивлением жидкости неподалеку от геликотремы.
Между точкой появления и точкой затухания бегущей волны существует
амплитудный максимум, место возникновения которого зависит от частоты
звуковых колебаний. Это место расположено тем ближе к овальному окну,
чем большей окажется частота звуковых колебаний, и наоборот: чем ниже
частота колебаний, тем дальше от овального окна возникнет амплитудный
максимум.
Звуковые волны разной частоты вызывают наиболее сильные колебания
основной мембраны в разных ее участках, каждый из которых
соответствует определенной частоте слухового диапазона. Ближе к овальному окну
располагаются участки мембраны, настроенные на восприятие высоких
звуков, область вершины улитки предназначена для возбуждения низкими
частотами. Такая структурно-функциональная организация рецепторной
поверхности основной мембраны определяется как тонотопическая. Во-
лосковые клетки сильнее всего возбуждаются в области амплитудного мак-
24'
740 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
симума, при действии комплексных звуковых волн одновременно
активируются рецепторы нескольких участков основной мембраны. Каждый из
них обладает специфической чувствительностью к определенной частоте
звуковых колебаний, на которую он «настроен», и не возбуждается при
отсутствии такой частоты в комплексной звуковой волне. Рецепторные
потенциалы волосковых клеток отражают не только значение амплитуды, но
также крутизну нарастания волн и интервалы между ними, что
предоставляет дополнительные характеристики действующего звукового сигнала.
17.4.2.7. Кодирование сенсорной информации в окончаниях слухового нерва
Информацию о характере колебаний основной мембраны проводят
приблизительно 30—40 тысяч волокон слухового нерва, среди которых 90 %
несут сигналы от внутренних волосковых клеток. Разрушение этих клеток
у экспериментальных животных повышает порог слуховой
чувствительности на 80—100 дБ, что фактически означает глухоту, тогда как разрушение
всех наружных волосковых клеток увеличивает порог только на 40—45 дБ.
Каждый нейрон спирального ганглия контактирует только с одной
внутренней волосковой клеткой, которая, в свою очередь, имеет синапсы
приблизительно с 10—20 сенсорными нейронами, образующими нейронный
канал для передачи информации о собственной характеристической частоте
звука. Такие каналы не активируются другими частотами, поэтому диффе-
ренцировка звуковых раздражителей по частоте осуществляется уже на
уровне преобразования механических процессов в электрическую
активность.
В восприятии каждой характеристической частоты звукового стимула
участвуют приблизительно 150 наружных волосковых клеток, передающих
возбуждение 10—15 сенсорным нейронам. Наружные волосковые клетки
являются не только рецепторами, но также эффекторами, получающими в
составе слухового нерва эфферентные волокна от нейронов верхнеоливарно-
го ядра. Эфферентная активация наружных волосковых клеток происходит
в ответ на действие звукового стимула и состоит в сокращениях актиновых
филаментов этих клеток, происходящих с частотой звукового сигнала.
Повторяя частоту колебаний слабых звуковых сигналов, наружные
волосковые клетки их усиливают и одновременно создают звуковое излучение
кортиева органа (эндокохлеарная эмиссия), которое можно зарегистрировать
с помощью микрофона.
Волокна слухового нерва обладают фоновой активностью в пределах
50—100 импульсов в 1 с, которая увеличивается при повышении уровня
звука, тем самым кодируя информацию об интенсивности звукового
давления. Кроме этого, кодирование информации об уровне звука происходит
за счет возбуждения дополнительного числа сенсорных нейронов,
имеющих относительно высокий порог чувствительности и находившихся ранее
в состоянии фоновой активности. При действии звуковых раздражителей с
частотой до 5000 Гц импульсная активность нейронов отражает
повышение звукового давления в каждой фазе повторяющихся циклов звуковых
колебаний. Максимальная активность возникает во время фазы подъема
звуковой волны, а затем она уменьшается, чем передается информация о
временной структуре сигналов. При продолжительной слуховой стимуляции
частота нервных импульсов постепенно уменьшается вследствие развития
адаптации к действию звуковых стимулов.
17. Сенсорные системы • 741
17.4.3. Проводящие пути и переключательные ядра слуховой
системы
Центральные отростки первичных слуховых нейронов спирального ганглия
образуют две ветви: к вентральному и дорсальному улитковым (кохлеар-
ным) ядрам продолговатого мозга (рис. 17.14). В каждом ядре существует
тонотопически организованное представительство кортиева органа.
Нейроны дорсального улиткового ядра образуют проекцию на верхнее ядро оливы
противоположной стороны, а нейроны вентрального ядра — на ипсилате-
ральные и контралатеральные верхние ядра олив. Перекрест нервных
волокон обеспечивает передачу акустической информации на
противоположную каждому уху сторону мозга.
В ядрах верхних олив большинство нейронов возбуждается бинаурально,
т. е. в ответ на сигналы, поступающие как от ипсилатерального, так и от
контралатерального уха. Однако часть имеющихся в этих ядрах нейронов
реагирует на сигналы, поступившие только от одного уха, и тормозится
сигналами от противоположного уха. Существование таких нейронов
обеспечивает сравнительный
анализ звуковых
сигналов, возникающих с
левой или правой от
человека стороны, что
необходимо для его
пространственной ориентации. „, _ ,,, п
т, „ Vv V Лервичная
Некоторые нейроны ядер уъ/\ J^N/O^ С/7\ слуховая
верхней оливы макси- (J^ r^W^y\ s^J K°pa
Рис. 17.14. Упрощенная
схема проводящих путей и
переключательных ядер
слуховой сенсорной системы.
Сенсорные нейроны второго
порядка расположены в
улитковых (кохлеарных) ядрах, в
каждом ядре имеется собственное
представительство кортиева
органа. Нейроны улитковых ядер
образуют ипсилатеральные и
контралатеральные проекции
на ядра верхней оливы, здесь
происходит бинауральный
анализ звуковых сигналов и
сохраняется тонотопия. В нижних
буфах четверохолмия
существуют нейронные переключения,
необходимые для
ориентировочных реакций на звуковые
сигналы. В медиальном
коленчатом теле фоновая активность
нейронов изменяется в
соответствии с афферентными
сигналами и происходит анализ их
временных характеристик.
Слуховая кора расположена в полях
41 и 42, кортикальные колонки
в ней упорядочены
тонотопически.
Медиальное
коленчатое
тело
Нижние
бугры
четверохолмия
Улитка
742 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
мально активны при расхождении времени поступления сигналов от правого
и левого уха, другие нейроны наиболее сильно реагируют на различную
интенсивность сигналов.
Такие нейроны образуют проекцию на верхние бугры четверохолмия,
куда одновременно поступает зрительная информация, что позволяет
нейронам четверохолмия создавать трехмерную карту слухового пространства и
определять пространственное положение источника звука. Благодаря бинау-
ральному слуху сенсорная система человека определяет источники звука,
находящиеся в стороне от средней линии, поскольку звуковые волны
раньше действуют на ближнее к этому источнику ухо. Слуховая система
реагирует на 1 дБ различий звукового давления, действующего на правое и
левое ухо, и фиксирует временное запаздывание действия звука на
отдаленное от него ухо всего в 3 • Ю-5 с.
Большая часть аксонов верхних оливарных ядер проходит в составе
латерального лемнискового пути к нижним буграм четверохолмия, нейроны
которого участвуют в формировании рефлекторной дуги ориентировочного
рефлекса, а также осуществляют анализ поступающей информации. Он
обеспечивается наличием в нижних буграх четверохолмия нейронов,
которые возбуждаются только частотными модуляциями тона, т. е.
повышением или понижением высоты действующего звукового сигнала. Другие
нейроны этих переключательных ядер активируются только изменениями
амплитуды звуковой волны, т. е. увеличением или уменьшением громкости
звукового сигнала. Большинство переключательных нейронов нижнего
двухолмия образуют проекцию на медиальное коленчатое тело,
представляющее следующий иерархический уровень слуховой системы.
Медиальное коленчатое тело, относящееся к таламусу, является
последним переключательным ядром слуховой системы на пути к коре. Его
нейроны расположены тонотопически и образуют проекцию в слуховую кору.
Некоторые нейроны медиального коленчатого тела активируются в ответ
на возникновение либо на окончание сигнала, другие реагируют только на
частотные или амплитудные его модуляции. Во внутреннем коленчатом
теле имеются нейроны, способные постепенно увеличивать активность при
неоднократном повторении одного и того же сигнала. Большинство
нейронов медиального коленчатого тела обладают спонтанной фоновой
активностью, проявляющейся чередованием серий потенциалов действия и пауз
между ними.
17.4.4. Переработка сенсорной информации в слуховой коре
В первичной слуховой коре (поле 41) кортикальные колонки расположены
тонотопически для раздельной переработки информации о звуках
различной частоты слухового диапазона. Они также содержат нейроны,
которые избирательно реагируют на звуки различной продолжительности, на
повторяющиеся звуки, на шумы с широким частотным диапазоном и т. п.
В слуховой коре происходит объединение информации о высоте тона и его
интенсивности, о временных интервалах между отдельными звуками.
Вслед за этапом регистрации и объединения элементарных признаков
звукового раздражителя, который осуществляют простые нейроны, в
переработку информации включаются комплексные нейроны, избирательно
реагирующие только на узкий диапазон частотных или амплитудных
модуляций звука. Подобная специализация нейронов позволяет слуховой системе
создавать целостные слуховые образы, с характерными только для них
сочетаниями элементарных компонентов слухового раздражителя. Такие со-
П. Сенсорные системы • 743
четания могут быть зафиксированы энграммами памяти, что в дальнейшем
позволяет сравнивать новые акустические стимулы с прежними.
Некоторые комплексные нейроны слуховой коры возбуждаются сильнее всего в
ответ на действие звуков человеческой речи.
17.5. Вестибулярная сенсорная система
Функция вестибулярной сенсорной системы состоит в обеспечении мозга
информацией о положении головы в пространстве, о действии гравитации
и сил, вызывающих линейные или угловые ускорения. Эта функция
необходима для поддержания равновесия, т. е. устойчивого положения тела в
пространстве, и для пространственной ориентации человека.
Вестибулярная система включает в себя периферический отдел, состоящий из
расположенного во внутреннем ухе вестибулярного аппарата, проводящие пути,
переключательные центры, представленные вестибулярными ядрами
продолговатого мозга и таламусом, и проекционную область коры в
постцентральной извилине. Адекватными раздражителями вестибулярной системы
являются гравитация и силы, сообщающие телу линейное или угловое
ускорение. Специфическая особенность вестибулярной системы состоит в
том, что значительная часть перерабатываемой в ней сенсорной
информации используется для автоматической регуляции функций, осуществляемой
без сознательного контроля. Вестибулярная система взаимодействует на
нескольких уровнях своей иерархической организации со зрительной и со-
матосенсорной системами; три эти системы дополняют друг друга в
предоставлении человеку информации, необходимой для его
пространственной ориентации.
17.5.1. Вестибулярный аппарат
Внутри костных лабиринтов, расположенных в пирамидах височных
костей, имеются прикрепленные к ним соединительнотканными тяжами
перепончатые лабиринты, заполненные вязкой жидкостью эндолимфы
(рис. 17.15). Лабиринт образован двумя отолитовыми органами и тремя
полукружными каналами, расположенными в трех плоскостях: горизонтальный
канал, передний вертикальный канал — во фронтальной плоскости и задний
вертикальный канал — в сагиттальной плоскости. Все три канала
соединены в полости преддверия, от латинского определения которого (vestibulum)
происходит само название вестибулярного аппарата. В месте соединения с
преддверием каналы расширены в виде ампул, в которых содержится ре-
цепторный эпителий, выступающий внутрь в форме гребня или кристы.
Каждая криста покрыта купулой, представляющей собой аморфное
желеобразное вещество, скрепленное множеством фибриллярных волокон. При
угловых ускорениях, когда в силу инерции происходит сдвиг эндолимфы,
купула тоже смещается, что приводит к деформации погруженных в нее
вторичных рецепторных клеток с последующим возникновением в них ре-
цепторного потенциала.
В полости преддверия имеются два расширения: мешочек (sacculus) и
маточка (utriculus), сообщающиеся между собой с помощью Y-образного
протока и представляющие собой отолитовые органы. Рецепторный
эпителий маточки и мешочка расположен на небольших возвышениях — маку-
лах, покрытых отолитовой мембраной, которая имеет слоистое строение и
содержит множество мелких, но тяжелых кристаллов карбоната кальция
{отолиты или отокинии). Макула маточки расположена в горизонтальной
744 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Киноцилия
Стереоцилии
ч
Смещение волосков
Т Т IT Т ! Т Т
ИмпульсацИя в афферентных Окончаниях
вестибулярного нерва !
В покое
Возбуждение ; Торможение
Рис. 17.15. Вестибулярная сенсорная система.
А. Схема перепончатого лабиринта, рецепторные области выделены черным цветом: 1)
горизонтальный канал; 2) задний вертикальный канал; 3) передний вертикальный канал; 4)
маточка; 5) мешочек; 6) канал улитки; 7) эндолимфатический мешочек.
Б. Волосковые рецепторные клетки вестибулярного аппарата: показана зависимость между
направлением смещения волосков и активностью клеток.
плоскости (при вертикальном положении головы), а макула мешочка
ориентирована вертикально. При действии силы тяжести или линейного
ускорения отолитовые мембраны сдвигаются относительно макул, а вследствие
этого раздражаются имеющиеся в них вторичные рецепторные клетки.
Таким образом, устройство вестибулярного аппарата обеспечивает
возбуждение вторичных рецепторных клеток благодаря действию силы
тяжести и прямолинейного ускорения (макулы мешочка и маточки) и
вследствие угловых ускорений (купулы полукружных каналов).
17.5.1.1. Свойства рецепторных клеток вестибулярного аппарата
Рецепторы макул и купул представлены волосковыми клетками,
являющимися вторичными механорецепторами и образующими синапсы с
периферическими окончаниями нейронов вестибулярного ганглия (первичные
сенсорные нейроны). Каждый рецептор имеет пучок из 40—80 волосков —
стереоцилии, достигающих в длину 50 мкм, а также расположенный экс-
17. Сенсорные системы • 745
центрично по отношению к стереоцилиям один длинный волосок — кино-
цилию. Если пучок стереоцилий наклоняется под влиянием механического
стимула в сторону киноцилии, рецептор деполяризуется, а при отклонении
стереоцилий от киноцилии происходит гиперполяризация мембраны
рецептора. Вследствие этого при сгибании пучка стереоцилий в одном
направлении волосковая клетка возбуждается, а при сгибании этого же пучка
в противоположном направлении — тормозится, т. е. у каждой волосковой
клетки выявляются два функциональных полюса. Направление
функциональной поляризации изменяется от одной клетки к другой, а рецептор-
ный эпителий в целом содержит полный комплект клеток для регистрации
стимулов, действующих в любом возможном направлении.
Нейроны вестибулярного ганглия, образующие синапсы на основании
рецепторов, обладают спонтанной фоновой активностью, характер которой
меняется под влиянием медиаторов волосковых клеток, которыми
предположительно могут быть глутамат и/или ГАМК. Рецептивные поля
нейронов вестибулярного ганглия включают в среднем три волосковых клетки
ампул полукружных каналов либо 4—6 рецепторов макул маточки или
мешочка.
17.5.1.2. Адекватные раздражители рецепторов отолитовых органов
Рецепторы маточки и мешочка служат датчиками гравитации и линейных
ускорений. При вертикальном положении головы человека макула маточки
расположена в горизонтальной плоскости, при наклоне головы
покрывающая макулу отолитовая мембрана смещается, подчиняясь силе тяжести.
Смещение отолитовой мембраны сгибает стереоцилий рецепторных
клеток, отвечающих на деформацию образованием рецепторного потенциала.
В зависимости от направления и степени наклона головы сильнее
других возбуждаются такие рецепторы, функциональная поляризация которых
соответствует именно этому направлению, прочие рецепторы
возбуждаются слабее или же тормозятся. Изменившееся соотношение возбужденных и
заторможенных рецепторных клеток вызывает в зависимых от них
нейронах вестибулярного ганглия адекватное изменение фоновой активности.
Нейроны вестибулярного ганглия передают полученную от рецепторных
клеток информацию в центральную нервную систему. Указанные
процессы возникают не только при наклоне головы, но и при любом отклонении
положения всего тела от вертикальной оси, например при спортивной или
профессиональной деятельности, случайном падении, использовании
аттракционов (качели, американские горки).
Макула мешочка при вертикальном положении тела и головы
расположена в вертикальной плоскости, и ее отолитовая мембрана сдвигается при
действии линейных ускорений, вызывая раздражение рецепторов. В
зависимости от направления, в котором происходит линейное ускорение,
возбуждаются наиболее чувствительные именно к нему рецепторы. Наличие
нескольких популяций рецепторов, различающихся своей функциональной
поляризацией, позволяет им в целом передавать сенсорным нейронам
информацию о линейных перемещениях в любом направлении.
Чувствительность этих рецепторов позволяет человеку ощутить прямолинейное
ускорение, превысившее 2 см/с2 и наклон головы в сторону всего на Г. Наряду
с этим рецепторный аппарат мешочка высокочувствителен к действию
вибрации.
746 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
17.5.1.3. Адекватные раздражители рецепторов полукружных каналов
Угловые ускорения возникают при вращении тела вокруг одной из трех
пространственных осей, расположенных перпендикулярно друг другу, они
возникают также при поворотах головы и ее наклонах. При вращении
вокруг вертикальной оси кресла с сидящим человеком у него раздражаются
рецепторы горизонтального канала. Раздражение возникает в самом начале
вращения, когда инертная эндолимфа остается неподвижной, что создает
усилие, смещающее купулу в противоположную вращению сторону. При
остановке вращения движение эндолимфы по инерции продолжается, что
вызывает смещение купулы в сторону уже прекратившегося движения.
В результате смещения купулы стереоцилии горизонтального канала
сгибаются сначала в одном направлении, что сопровождается деполяризацией
волосковых клеток, а затем — в противоположном направлении, что
вызывает гиперполяризацию рецепторов. Соответственно этому волосковая
клетка увеличивает или уменьшает выделение медиатора, действующего на
окончание нейрона вестибулярного ганглия, что повышает или понижает
его фоновую активность.
При вращении вокруг осей, перпендикулярных фронтальной или
сагиттальной плоскостям, аналогичные вышеописанным изменения активности
рецепторов происходят в переднем или заднем вертикальных полукружных
каналах. Вращение вокруг какой-либо диагональной оси вызывает
движение эндолимфы в двух каналах одновременно, соответственно реагируют
рецепторы, расположенные в купулах обоих каналов. Наличие трех
полукружных каналов обеспечивает человеку восприятие вращения и
поворотов головы в любой плоскости трехмерного пространства. Сенсорная
чувствительность вестибулярной системы позволяет ощущать угловые
ускорения, достигшие значения 2°/с2.
17.5.2. Центральная часть вестибулярной системы
Центральные аксоны первичных сенсорных нейронов вестибулярного
ганглия оканчиваются на нейронах вестибулярных ядер: верхнего (ядро
Бехтерева), нижнего (ядро Роллера), латерального (ядро Дейтерса) и
медиального (ядро Швальбе). Эти ядра представляют собой единый
функциональный комплекс, в котором объединяется афферентная информация от
вестибулярных ганглиев и от проприоцепторов; эта афферентация
определяет характер активности нейронов вестибулярных ядер. Вестибулярные
ядра являются подкорковыми центрами познотонических и статокинетиче-
ских рефлексов (регуляция равновесия), глазодвигательных рефлексов
(зрительное наблюдение окружающего мира) и опосредованных через
гипоталамус вестибуловисцеральных реакций, с механизмом которых
связаны проявления кинетозов — морской болезни, проявляющейся
головокружением и тошнотой.
Осознаваемое восприятие изменений положения головы происходит в
результате последовательной переработки информации сначала в
вестибулярных ядрах, затем в задних вентральных ядрах таламуса, образующих
проекцию к постцентральным извилинам. Дополнительная информация
поступает в проекционную кору непрямым путем: от вестибулярных ядер в
мозжечок, а из него к вентролатеральным ядрам таламуса и проекционной
коре. Первичная проекционная область вестибулярной чувствительности
размещена в задней центральной извилине преимущественно той стороны
тела, на которой расположен вестибулярный аппарат. Еще одна проекция,
17. Сенсорные системы • 747
отличающаяся двусторонним представительством вестибулярной
чувствительности, имеется во вторичной моторной коре. Осознание
пространственного расположения и схемы тела происходит с участием заднетеменных
регионов коры (поля 5 и 7), где осуществляется интеграция
вестибулярной, зрительной и соматосенсорной чувствительности человека.
17.6. Вкусовая сенсорная система
Функция вкусовой сенсорной системы состоит в оценке качества пищи
или отвергаемых веществ. Адекватным раздражителем вкусовой системы
служат молекулы органических или неорганических веществ, которые
поступают в полость рта при приеме пищи и присоединяются к хеморецеп-
торным клеткам языка и ротовой полости. Эти клетки являются
вторичными рецепторами и обладают высокой химической избирательностью, а
присоединение химических веществ вызывает в них образование рецептор-
ного потенциала, что сопровождается выделением медиатора,
действующего на чувствительные окончания первичных сенсорных нейронов. В
передаче сигналов от рецепторов в
центральную нервную систему
участвуют афферентные волокна IX, VII и
X черепных нервов (рис. 17.16).
Центральный отдел вкусовой
сенсорной системы образуют ядра
одиночных пучков продолговатого мозга
и вентральные ядра таламуса,
образующие проекцию в первичную
проекционную кору. Проекционная
вкусовая кора соответствует области
представительства языка в
постцентральных извилинах.
17.6.1. Вкусовая рецепция
К таламусу
Ядро одиночного
тракта
Блуждающий
нерв
Полость рта
Выпячивания слизистой оболочки
языка (сосочки) содержат у человека
около 2000 вкусовых почек, каждая из
которых образована 30—60
клетками, расположенными в почке
наподобие долек апельсина. Рецепторные
клетки составляют около 5—7 %
всех клеток вкусовой почки, они от- Лицевой нерв
Языко-
глоточный
нерв
Язык
Рис. 17.16. Рецепторы и афферентные
пути вкусовой системы.
Рецепторные клетки вкусовой почки имеют
ворсинки, выступающие во вкусовую пору.
Они реагируют на присоединение химических
веществ изменением количества медиатора,
действующего на афферентные волокна
нейронов первого порядка. Афферентные
сигналы поступают в ЦНС ипсилатерально по
волокнам лицевого, языкоглоточного и
блуждающего нервов к нейронам второго порядка,
расположенным в ядре одиночного пучка.
Афферентные
волокна
Эпителий языка
Вкусовая
почка
Вкусовая
пора
Рецепторные клетки
748 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
личаются от остальных клеток {опорных, базальных) наличием
микроворсинок, выступающих во вкусовую пору — отверстие на вершине вкусовой
почки. Продолжительность жизни рецепторной клетки составляет 10—12
дней, разрушенные клетки заменяются новыми, образующимися из
делящихся базальных клеток и устанавливающими точно такие же, как у своей
предшественницы, синаптические контакты с 1—6 отростками первичного
сенсорного нейрона, поэтому специфичность вкусовой чувствительности
рецепторов после регенерации не изменяется.
17.6.1.1. Рецепторные потенциалы вкусовых клеток
Мембрана микроворсинок вкусовых клеток содержит специфические
участки (рецепторы), предназначенные для связывания растворенных в
жидкой среде полости рта химических молекул. Существует четыре
разновидности вкусовых ощущений, или четыре вкусовые модальности: сладкое,
кислое, соленое и горькое. Строгой зависимости между химической природой
вещества и вкусовым ощущением нет: например, сладким вкусом
обладают не только сахара, но и некоторые неорганические соединения (соли
свинца, бериллия), а самым сладким веществом является не усваиваемый
организмом сахарин. Большинство вкусовых клеток полимодальны, т. е.
могут реагировать на стимулы всех четырех вкусовых модальностей.
Присоединение к специфическим рецепторам молекул, обладающих
сладким вкусом, активирует систему вторичных посредников аденилатцик-
лазы — циклического аденозинмонофосфата, которые закрывают
мембранные каналы ионов калия, и поэтому мембрана рецепторной клетки
деполяризуется. Вещества, обладающие горьким вкусом, активируют одну из
двух систем вторичных посредников: 1) фосфолипазу С — инозитол-3-фос-
фат, что приводит к выходу из внутриклеточного депо ионов кальция с
последующим выделением медиатора из рецепторной клетки; 2)
специфический G-белок гастдуцин, регулирующий внутриклеточную концентрацию
цАМФ, которая управляет катионными каналами мембраны и этим
определяет возникновение рецепторного потенциала. Действие на рецепторы
молекул, имеющих соленый вкус, сопровождается открытием управляемых
натриевых каналов и деполяризацией вкусовой клетки. Вещества,
обладающие кислым вкусом, закрывают мембранные каналы для ионов калия,
что ведет к деполяризации рецепторной клетки.
Величина рецепторного потенциала зависит от вкусового качества и
концентрации химического вещества, действующего на клетку. Возникновение
рецепторного потенциала приводит к выделению вкусовой клеткой
медиатора, действующего через синапс на афферентное волокно первичного
сенсорного нейрона, в котором через 40—50 мс от начала действия стимула
повышается частота потенциалов действия. Возникшие в афферентных
волокнах нервные импульсы проводятся к ядрам одиночных пучков
продолговатого мозга. При повышении концентрации действующего вещества общее
количество реагирующих чувствительных волокон возрастает за счет
вовлечения высокопороговых афферентов в передачу информации от рецепторов.
17.6.1.2. Вкусовая чувствительность
Пороги вкусовой чувствительности выявляются поочередным нанесением
на поверхность языка растворов веществ, обладающих разными вкусовыми
качествами (табл. 17.4). Абсолютным порогом чувствительности считают
появление определенного вкусового ощущения, отличающегося от вкуса
П. Сенсорные системы • 749
Таблица 17.4. Абсолютные пороги восприятия веществ с характерным вкусом
Вкусовое качество
Горькое
Кислое
Сладкое
Соленое
Вещества
Сульфат хинина
Лимонная кислота
Глюкоза
Сахарин
Хлорид натрия
Порог
восприятия (ммоль/л)
0,000008
0,0023
0,08
0,000023
0,01
дистиллированной воды. Вкус одного и того же вещества может
восприниматься по-разному в зависимости от его концентрации в растворе;
например, при малой концентрации хлорида натрия он ощущается сладким, а
при большей концентрации — соленым. Максимальная способность
различать концентрацию растворов одного и того же вещества и,
соответственно, самый низкий дифференциальный порог вкусовой чувствительности
характерны для среднего диапазона концентраций, а при высоких
концентрациях вещества дифференциальный порог повышается.
Абсолютные пороги вкусовой чувствительности индивидуально
различаются, но у подавляющего большинства людей самым низким
оказывается порог определения веществ с горьким вкусом. Эта особенность
восприятия возникла в эволюции, она способствует отказу от употребления в
пищу веществ горького вкуса, к которым принадлежат алкалоиды многих
ядовитых растений. Вкусовые пороги различаются у одного и того же
человека в зависимости от его потребности в тех или иных веществах, они
повышаются вследствие длительного употребления веществ с характерным
вкусом (например, сладостей или соленостей) или курения, потребления
алкоголя, обжигающих напитков. Разные области языка различаются
вкусовой чувствительностью к различным веществам, что обусловлено
особенностями распределения вкусовых рецепторов. Кончик языка более
других областей чувствителен к сладкому, боковые стороны языка — к
кислому и соленому, а корень языка — к горькому. Вкусовые ощущения в
большинстве случаев мультимодальны и основаны не только на избирательной
химической чувствительности вкусовых рецепторных клеток, но и на
раздражении пищей терморецепторов и механорецепторов ротовой полости, а
также действии летучих компонентов пищи на обонятельные рецепторы.
17.6.2. Центральный отдел вкусовой системы
Афферентную иннервацию вкусовых почек передних 2/з языка
осуществляют чувствительные волокна лицевых нервов (барабанная струна), вкусовые
рецепторы задней трети языка и твердого неба образуют синапсы с
чувствительными волокнами языкоглоточных нервов, а передачу сигналов от
небольшого количества вкусовых рецепторов в глотке и надгортаннике
осуществляют чувствительные волокна блуждающих нервов. Волокна
барабанной струны полимодальны и реагируют повышением частоты нервных
импульсов на действие веществ с любым вкусовым качеством. Однако если
одни волокна максимально возбуждаются при действии веществ со
сладким вкусом, то наибольшая активность других волокон возникает в ответ
на действие веществ соленого вкуса, либо кислого или горького вкуса. Если
определить активность одиночного волокна к веществам каждой из четырех
вкусовых субмодальностей, то можно получить «вкусовой профиль» такого
волокна, который будет отличаться от вкусовых профилей других волокон.
750 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Сенсорные нейроны второго порядка содержатся в составе ядра
одиночного пучка, вытянутого вдоль продолговатого мозга. На этих нейронах
оканчиваются чувствительные волокна лицевого, языкоглоточного и
блуждающего нервов, а их аксоны переходят на противоположную сторону в
составе медиального лемниска и оканчиваются на нейронах вентрального
ядра таламуса. Нейроны таламуса образуют проекцию на латеральную
часть постцентральной извилины — корковую проекционную область
вкусовой чувствительности.
Электрическая активность нейронов ядра одиночного пучка
повышается в ответ на действие вкусовых раздражителей разных модальностей, а
также вследствие тактильного и температурного раздражения языка и
ротовой полости. Эти нейроны так же, как и нейроны первого порядка,
мультимодальны, однако каждый такой нейрон отличается своей
индивидуальной активностью. Различия состоят в том, что максимальная или
минимальная активность нейрона проявляется в ответ на действие веществ,
обладающих разным вкусом, что формирует индивидуальный профиль
вкусовой активности данного нейрона. Указанные индивидуальные различия
сохраняются у нейронов вентрального ядра таламуса, и лишь в коре
существуют клетки, реагирующие только на действие вещества с определенным
вкусовым качеством, т. е. обладающие специфической вкусовой
чувствительностью. Наряду с ними в проекционной коре имеются нейроны,
реагирующие не только на действие вкусовых раздражителей, но и на
тактильное и температурное раздражение языка, что способствует целостному
восприятию всех качеств пищи.
17.6.3. Вкусовое восприятие
Вкусовые ощущения отчетливо проявляются уже у новорожденных детей,
а грудной ребенок 4—5 мес хорошо различает вкусовые изменения пищи.
Вкусовое восприятие человека формируется в результате соединения муль-
тимодальных сенсорных ощущений и механизмов памяти, хранящей
индивидуальный опыт и связанной с усвоенными традициями питания.
Изменения вкусового восприятия часто связаны с нарушениями обоняния, а не
собственно вкусовой чувствительности. Ротовая полость сообщается с
носовой, и пахучие вещества пищи достигают обонятельных рецепторов,
поэтому представление о вкусе пищи почти всегда основано не только на
вкусовом, но и на обонятельном восприятии. Гастрономические
предпочтения людей связаны с комплексным действием тех или иных блюд,
включающем не только вкусовые и обонятельные, но также тактильные
температурные и зрительные ощущения.
17.7. Обонятельная сенсорная система
Обонятельные ощущения возникают в результате действия пахучих
химических веществ, попадающих из внешней среды в полость носа вместе с
воздухом во время вдоха или из ротовой полости во время еды. Пахучие
вещества действуют на хеморецепторные клетки обонятельного нейроэпите-
лия (первичные рецепторы) носовой полости. В дальнейшей переработке
сенсорной информации участвуют обонятельные луковицы, лимбические
структуры мозга и кора больших полушарий. В отличие от большинства
млекопитающих, относящихся к макросматикам с высоко развитым
обонянием, человек принадлежит к микросматикам, для которых роль
обоняния в организации поведения значительно меньше.
17. Сенсорные системы • 751
17.7.1. Классификация запахов
Все пахучие вещества должны быть летучими, чтобы поступать в носовую
полость с воздухом, и растворимыми, чтобы проникать к рецепторным
клеткам через слой обонятельной слизи, покрывающей эпителий носовых
раковин. Таким требованиям удовлетворяет огромное количество веществ,
а человек способен различать тысячи всевозможных запахов, при этом
отсутствует строгое соответствие между структурой химической молекулы и
ее запахом. Большинство имеющихся теорий запахов основано на
произвольном вьщелении нескольких запахов в качестве основных (по аналогии с
четырьмя вкусовыми модальностями) и объяснении всех остальных
запахов их различными комбинациями. И только стереохимическая теория
запахов основана на выявлении соответствия между геометрическим
сходством молекул пахучих веществ и присущим им запахом.
Построение трехмерных моделей пахучих молекул на основе их
предварительного изучения с помощью дифракции рентгеновских лучей и
инфракрасной стереоскопии показало, что не только природные, но и
искусственно синтезированные молекулы обладают запахом, соответствующим
определенной форме и отличным от запаха, присущего другой форме
молекул. В связи с этим проверяется гипотеза существования семи
разновидностей хеморецепторов, способных присоединять вещества, которые сте-
реохимически им соответствуют. Среди нескольких сотен
экспериментально исследованных пахучих молекул удалось выявить семь классов, в
которых расположились вещества со сходной стереохимической
конфигурацией молекул и сходным запахом (табл. 17.5). Семь указанных запахов
названы первичными, а все остальные запахи объясняются различными
сочетаниями первичных запахов.
17.7.2. Периферический отдел обонятельной системы
Обонятельный эпителий человека расположен в верхних и отчасти в
средних раковинах носовой полости, он состоит из биполярных хеморецепторных
клеток, а также опорных и базальных клеток. Биполярные клетки являются
первичночувствующими рецепторами (рис. 17.17), их количество у
человека приближается к 10 миллионам (у макросматиков оно на порядок выше).
Биполярные сенсорные нейроны существуют около 60 сут и после их
естественной гибели замещаются новыми рецепторами, образующимися из
базальных клеток. Регенерировавшие сенсорные нейроны восстанавливают
прежние синаптические контакты с центральными отделами обонятельной
системы, а опорные клетки фагоцитируют разрушенные рецепторы.
Дендриты биполярных клеток имеют 10—20 ресничек, выступающих из
Таблица 17.5. Классификация первичных запахов (по Эймуру)
Первичный
запах
Камфарный
Едкий
Эфирный
Цветочный
Мятный
Мускусный
Гнилостный
Известные вещества с таким запахом
(количество)
106
95
53
71
77
69
49
Примеры веществ с первичным
запахом
Камфара, эвкалипт
Уксус, муравьиная кислота
Эфир, груши
Розы
Мята, ментол
Железы ондатры, кабарги
Тухлые яйца
752 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Медиальное
дорсальное
ядро таламуса
Диффузная проекция
обонятельной
чувствительности в
лимбическую систему
ОФК
Обонятельная луковица #- Периформная i
▼ и миндалина
Обонятельная луковица
Решетчатая кость
Обонятельный эпителий
Рецепторы
Рис. 17.17. Обонятельная сенсорная система.
Пахучие молекулы присоединяются к ресничкам рецепторных клеток обонятельного эпителия
(первичные сенсорные нейроны). Сенсорные нейроны второго порядка расположены в
обонятельных луковицах, образующих диффузные проекции к нескольким структурам лимбической
системы. Передача информации от лимбической системы к орбитофронтальной коре (ОФК)
осуществляется с помощью медиального дорсального ядра таламуса.
эпителия в слой обонятельной слизи, они увеличивают рецепторную
поверхность плазматической мембраны и содержат специфические хеморе-
цептивные белки, а также G-белки, активирующие вторичные посредники.
Пахучие вещества вначале абсорбируются на обонятельной слизи,
выделяемой боуменовыми железами, и доставляются к рецепторам
неспецифическими белками-переносчиками. Нарушения транспорта пахучих веществ
к рецепторам возникают вследствие набухания слизистой оболочки и
изменения секреции обонятельной слизи при воспалительных или
аллергических поражениях носовой полости.
17.7.2.1. Механизм возбуждения обонятельных клеток
Присоединение пахучих молекул к хеморецептивным белкам запускает
каскад биохимических реакций, приводящих к возникновению
потенциалов действия рецепторных клеток. После присоединения пахучих молекул
к рецепторам происходит активация G-белков, а затем аденилатциклазы,
что ведет к повышению внутриклеточной концентрации циклического аде-
нозинмонофосфата, который активирует протеинкиназу А. Ее фосфорили-
рующее действие на белки мембранных каналов для катионов приводит к
открытию каналов, току катионов в клетку и деполяризации мембраны,
являющейся рецепторным потенциалом первичного сенсорного нейрона.
При деполяризации мембраны до критического уровня в сенсорном
нейроне возникают потенциалы действия, служащие для передачи
информации на следующий иерархический уровень обонятельной системы.
17. Сенсорные системы • 753
Еще одна разновидность G-белка в мембране хеморецепторных клеток
связана с другим вторичным посредником — фосфолипазой С. При ее
активации образуется инозитол-3-фосфат, способствующий выходу из
внутриклеточного депо ионов кальция, и диацилглицерат, активирующий про-
теинкиназу С. Протеинкиназа С фосфорилирует белки катионных
каналов, определяя тем самым деполяризацию мембраны, а высокая
концентрация ионов кальция повышает выделение химического медиатора
сенсорным нейроном первого порядка.
Все первичные обонятельные нейроны имеют широкий спектр
чувствительности и реагируют на многие пахучие вещества, в то же время разные
рецепторные клетки отличаются индивидуальной чувствительностью к
различным веществам (обонятельный профиль сенсорного нейрона). Каждый
запах возбуждает одновременно большое количество рецепторов,
индивидуальные особенности которых в совокупности создают неповторимую
комбинацию, характерную именно для этого запаха. На этом основана
способность человека к различению сложных запахов, принадлежащих,
например, двум разновидностям духов.
17.7.3. Центральный отдел обонятельной системы
Безмякотные аксоны биполярных рецепторных клеток объединяются в
15—20 пучков, каждый из которых содержит несколько сотен или тысяч
волокон. Такие пучки входят в полость черепа через отверстия решетчатой
кости и объединяются в обонятельные нервы (I пара черепных нервов).
Окончания первичных сенсорных нейронов образуют синапсы с дендрита-
ми митральных клеток обонятельных луковиц. Обонятельные луковицы
расположены в передней черепной ямке над решетчатой костью, их
наружный слой образован сплетениями волокон обонятельных нервов. Чуть
глубже, в клубочковом слое, информация передается митральным клеткам,
причем каждая митральная клетка (сенсорный нейрон второго порядка)
получает в одном клубочке сигналы приблизительно тысячи аксонов
рецепторных клеток. Митральным клеткам свойственна ритмическая
активность, изменения которой обусловлены вдыханием пахучих веществ.
Локальные интернейроны обонятельных луковиц (перигломерулярные и
зернистые клетки) осуществляют латеральное торможение,
способствующее контрастированию передаваемых сигналов. На локальных
интернейронах оканчиваются эфферентные волокна противоположной
обонятельной луковицы, лимбических структур и ретикулярной формации ствола:
эфферентное влияние позволяет контролировать характер выходных
сигналов обонятельной луковицы. Аксоны митральных клеток вместе с
прилегающими к ним аксонами пучковых клеток, которые получают
афферентную информацию от нескольких клубочков одновременно, образуют
латеральный обонятельный тракт к центрам высшего порядка.
Латеральный обонятельный тракт разделяется на несколько частей,
оканчивающихся в лимбических структурах переднего мозга: переднем
обонятельном ядре, перегородке, пириформной и парагиппокампальной
извилинах. Нейроны этих структур возбуждаются при поступлении
афферентной информации от обонятельных рецепторов и передают ее гиппо-
кампу, миндалинам, орбитофронтальной коре и ретикулярной формации
среднего мозга. Большинство областей проекции обонятельного тракта не
принимают непосредственного участия в восприятии запахов, их
физиологическая роль состоит в образовании ассоциативных связей обонятельной
системы с другими сенсорными системами при формировании пищевого,
754 • ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
полового и оборонительного поведения. Активация лимбической системы
создает эмоциональный компонент обонятельного восприятия, который
определяет субъективное отношение к запахам.
17.7.4. Физиологическая роль обоняния у человека
Абсолютные пороги обонятельной чувствительности у человека
определяются с помощью ольфактометров, позволяющих втягивать носом воздух из
емкостей с дозированной концентрацией пахучего вещества.
Дифференциальные пороги, характеризующие способность оценивать изменения
интенсивности запаха, у человека довольно высоки: концентрацию вдыхаемых
веществ необходимо повысить на 30 %, а для некоторых веществ на 60 %,
чтобы почувствовать усиление запаха. При продолжительном действии
пахучих молекул на обонятельные рецепторы происходит их адаптация, в
результате которой человек перестает воспринимать запах не только
действующего вещества, но и всех других веществ со сходным запахом
{гетерогенная адаптация). Нарушения обоняния обусловлены чаще всего
затрудненным доступом пахучих веществ к обонятельному эпителию, а так же
поражениями самого эпителия или проводящих путей. Утрата
обонятельной чувствительности определяется термином аносмия.
17.7.4.1. Физиологические реакции на запахи
Обонятельные ощущения могут сопровождаться возникновением
положительных или отрицательных эмоций, возникающих в результате активации
лимбической системы. На этом свойстве запахов основано применение
благовоний, ароматических эссенций, нюхательных солей, духов, а также
различных поглотителей неприятных запахов. Ароматерапия учитывает
свойства отдельных запахов (например, лимона, жасмина, лаванды,
розмарина и т. п.) и вырабатывает рекомендации их использования для
повышения чувствительности сенсорных систем и работоспособности.
Неприятные запахи (например, сероводорода, сернистого аммония, продуктов
гниения) действуют неблагоприятно на ряд физиологических функций:
они могут вызывать тошноту, раздражительность, изменения
артериального давления и ритма сокращений сердца.
17.7.4.2. Способность к восприятию феромонов у человека
Феромонами называют химические вещества, которые вырабатываются
' специальными железами, выделяются во внешнюю среду и влияют на
поведение других представителей вида. Дистантная хеморецепция играет
существенную роль в формировании полового и агрессивного поведения многих
млекопитающих, но, как считали долгое время, не у человека. В конце XX
века было установлено, что вомероназальный орган, или сошник, описанный
ранее только у новорожденных, сохраняется и во взрослом состоянии
человека. Он расположен у основания носовой перегородки и содержит рецеп-
торные клетки с ворсинками, способными присоединять половые
феромоны, которые выделяются в окружающую среду. Центральные отростки ре-
цепторных клеток сошника образуют вомероназальный нерв, переносящий
сигналы к дополнительным обонятельным луковицам. Присутствие
феромонов во вдыхаемом воздухе большинством людей не осознается,
существуют большие различия индивидуальной чувствительности к ним, но
многие люди способны определить пол другого человека по его запаху.
IV ИНТЕГРАТИВНЫЕ
ФУНКЦИИ ОРГАНИЗМА
756 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
Организм человека является открытой термодинамической системой,
которая постоянно обменивается с окружающей средой веществом и
энергией в соответствии с характером выполняемой работы и изменениями
параметров среды. Центральная нервная система отвечает на изменения
внешней и внутренней среды координированными врожденными
приспособительными реакциями, в осуществлении которых участвуют все
физиологические системы организма. Одновременно с этим физические и
социальные факторы окружающего мира определяют поведение, направляя его
на поиск контактов с одними внешними объектами и избегание контактов
с другими. По ходу такой деятельности происходит интеграция
физиологических процессов, сопряженная с их адаптацией — приспособлением к
изменениям среды.
Поведение человека складывается из последовательности действий,
направляемых на удовлетворение возникающих у него потребностей в пище,
воде для питья, температурном комфорте, безопасности продолжения
рода, социального общения, интеллектуальной деятельности. Направленное
на удовлетворение потребности поведение определяется как мотивация, а
субъективная оценка вероятности удовлетворения потребностей порождает
чувственные переживания, или эмоции.
Определение объектов внешнего мира осуществляется с помощью
сенсорных систем организма, трансформирующих энергию внешних стимулов
в нервные импульсы. Вследствие активации нейрофизиологических
процессов происходит восприятие объектов и явлений внешнего мира,
заключающееся в создании внутреннего образа реальных событий.
Необходимым условием для восприятия является наличие сознания, которым
характеризуется активное состояние человека во время бодрствования. Сознание
отключается во время сна, образующим вместе с бодрствованием
повторяющийся суточный цикл.
Познавательная деятельность человека направлена на установление
связей между воспринимаемыми объектами и явлениями. Процесс познания
сопровождается приобретением индивидуального поведенческого опыта, в
ходе которого активируются физиологические механизмы памяти,
заключающиеся в регистрации приобретенного опыта, его хранении и
воспроизведении. На основе памяти возникают новые формы поведения, которые
представляют как относительно простой результат ассоциативного
научения (условные рефлексы), так и более сложные его формы, связанные с
биографическими сведениями и познанием окружающего мира. На
использовании следов памяти основан и процесс мышления, в ходе которого
создаются символически обобщенные представления объектов и явлений
внешнего мира и формируется стратегия поведения. Результат мышления
может быть передан с помощью речи, являющейся средством общения
между людьми и вовлекающей их в социальную среду. Специфической
особенностью существования человека является его трудовая деятельность,
при осуществлении которой интегрируются механизмы гомеостатического
регулирования и поведения.
ГЛАВА 18
Высшая нервная деятельность
(по И. П. Павлову)
Академик Иван Петрович Павлов (1849—1936) в 1904 г. был удостоен.
Нобелевской премии по медицине за фундаментальные исследования по
физиологии пищеварения. Примерно в то же время он начал изучать в
опытах на собаках условные рефлексы, или индивидуально приобретаемые
реакции организма на различные внешние раздражения. Это научное
направление явилось результатом его наблюдения за слюноотделительным
рефлексом у собак, который нередко возникал у животных на
предшествующие еде раздражители. Научные исследования в этой области
физиологии сделали И. П. Павлова основоположником научного направления,
которое было названо им высшей нервной деятельностью. Высшая нервная
деятельность — это приспособление организма к меняющимся условиям
внешней среды на основе безусловных (врожденных) и условных, или
приобретенных в течение жизни, рефлексов. Высшую нервную деятельность
И. П. Павлов объяснял с позиций созданной им условно-рефлекторной
теории. Согласно классической рефлекторной теории нервная
деятельность животных и человека проявляется в виде врожденных рефлексов,
т. е. безусловных. Однако И. П. Павлов считал, что полноценная жизнь
организма требует формирования у него приспособительных реакций к
внешней среде. Согласно условно-рефлекторной теории формирование
приспособительных поведенческих реакций организма состоит не только в
том, что на него действует бесчисленное количество сигнальных
раздражителей внешней среды, но и в том, что при определенных условиях эти
раздражители, будучи индифферентными, меняют свое физиологическое
значение и становятся условными. Поэтому высшая нервная деятельность
представляет собой взаимодействие врожденных и индивидуально
приобретенных форм реагирования на внешние воздействия с целью
приспособления организма к окружающей среде.
В основе высшей нервной деятельности лежит научение. Научением
называется относительно постоянное изменение поведения, которое является
результатом индивидуального опыта. Научение имеет место только в том
случае, если оно приводит к изменению поведения, а результаты
поведения могут быть как положительными, так и отрицательными. Наиболее
простыми формами научения являются привыкание и сенситизация.
Привыканием, или габитуацией, называется снижение ответной реакции
нервной системы при повторном действии одного и того же раздражителя.
Феномен угасания впервые был открыт И. П. Павловым, и его
физиологический смысл будет описан ниже. Сенситизация проявляется как состояние
повышенной реактивности организма на действие стимула, возникающее
при повторном его предъявлении. Более сложной формой научения
является ассоциативное, которое представлено классическими условными
рефлексами по И. П. Павлову и инструментальными^ или оперантными, ус-
758 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
ловными рефлексами (о них речь пойдет ниже). С помощью классических
условных рефлексах животное научается соотносить, или ассоциировать,
действие на него двух стимулов внешней среды.
18.1. Классические условные рефлексы
Условным рефлексом называется рефлекс, вырабатываемый в организме на
основе временной нервной связи в отделах центральной нервной системы.
Классический условный рефлекс представляет собой научение животного
ассоциировать (связывать) стимул с подкреплением. При изучении
условно-рефлекторной деятельности у животных в лаборатории И. П. Павлова
«сосредоточились»* на пищевом, в частности секреторном, и
оборонительном рефлексах. Секреторный рефлекс оказался более удобным в
исследованиях, учитывая технические возможности физиологической лаборатории
того времени, поскольку имелась возможность определить его
интенсивность по количеству капель слюны у собаки. Для этого животных
подвергали предварительной операции — устье протока околоушной слюнной
железы, вместе с кусочком слизистой оболочки рта, выводили через разрез в
стенке рта и подшивали к коже щеки. В результате можно было
определять количество вытекающей слюны, например через устье специальной
воронки, прикрепленной к коже в месте выхода протока слюнной железы
(рис. 18.1). Если такому животному дается пища, то уже через 1—2 с у него
происходит вьщеление слюны. Пища является безусловным стимулом, а
вызываемая ею слюноотделительная реакция называется
безусловно-рефлекторным ответом, или безусловным рефлексом.
Безусловный рефлекс является закономерной реакцией организма на
внешнее раздражение, которая осуществляется при помощи определенного
отдела центральной нервной системы. В экспериментах И. П. Павлова
собака до того, как получала пищу, всегда слышала звук (условный стимул).
В результате, после нескольких сочетанных действий условного и
безусловного стимулов, у собаки вьщеление слюны начиналось только на
предъявление одного условного стимула (рис. 18.2), т. е. образовался
условный рефлекс. В отличие от безусловных рефлексов, т. е. врожденных,
условные рефлексы указанного типа образуются в процессе
индивидуальной жизни животных.
Образование классического условного рефлекса происходит при
сочетании двух стимулов — условного и безусловного, из которых безусловный
вызывает безусловно-рефлекторный ответ. Стандартной процедурой соче-
танного действия условного и безусловного стимулов при выработке
условного рефлекса является так называемая задержка начала действия
условного стимула относительно начала действия безусловного. Сочетанное
действие условного (например, звук) и безусловного (например, пища)
стимулов формирует условный слюноотделительный рефлекс:
УС + БС => УС -> Условнр-рефлекторный ответ.
При неоднократном сочетанном предъявлении животному двух
стимулов «звук—пища» в ответ на действие только условного стимула, т. е.
звука, появляется безусловно-рефлекторная реакция слюноотделения. Пища
при ассоциативном научении выполняет роль подкрепления. В результате у
подопытного животного выделяется слюна, когда оно только слышит зво-
*В кавычках курсивом приведены слова и фразы из книги И. П. Павлова
«Двадцатилетний опыт исследования высшей нервной деятельности».
нок. Выделение слюны в данном
случае является
условно-рефлекторным ответом. Этот
«удивительный результат», по мнению
И. П. Павлова, был связан с
формированием в ЦНС связи
между центрами,
воспринимающими действие на животное двух
стимулов, которую ученый назвал
временной.
В наиболее общем виде
считается, что временная связь может
формироваться в ЦНС
следующим образом. Звук, как
условный стимул, вызывает так
называемую репрезентацию
безусловного стимула в соответствующем
мозговом центре, т. е. на одну и
ту же структуру мозга
конвергируют импульсы, вызванные
действием условного и безусловного
стимулов. При этом в нервном
Рис. 18.2. Схематическое изображение экспериментальной установки для
выработки классических условных рефлексов по И. П. Павлову. Раздражение
электрическим током участков кожи, рецепторы которых посылают импульсы в сенсомотор-
ную кору, позволило выявить распространение процессов возбуждения и
торможения в коре головного мозга животного.
1 — воронка для сбора и отведения слюны; 2 — система для измерения количества
выделяющейся слюны. На коже собаки закреплены раздражающие электроды: со знаком плюс —
положительный условный стимул, знак минус — отрицательный (тормозный) условный стимул.
Рис. 18.1. Схематическое изображение
последствия операции выведения протока
околоушной слюнной железы у собаки на
кожу щеки. Подсчет количества капель
слюны позволяет контролировать
процедуру выработки классического условного
пищевого рефлекса.
760 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
центре на действие условного стимула возникает такое же возбуждение,
как и на действие безусловного стимула, и это приводит к появлению
условно-рефлекторной реакции слюноотделения. В этом случае животное
«знает», что звонок предполагает получение пищи. Поэтому модель
классического условного рефлекса — сочетанное действие двух раздражителей,
всегда приводит к научению путем образования временнбй связи. С
помощью условных рефлексов животные различных видов научаются
прогнозировать по стимулу либо опасность для организма, либо получение пищи,
либо иные события, обусловливающие жизнедеятельность организма.
18.1.1. Условия, влияющие на ассоциативное научение
Для безусловных рефлексов характерен строго определенный латентный
период ответной реакции, независимо от внешних условий, при которых
действуют на организм животного раздражители. Напротив, в условных
рефлексах как латентный период ответной реакции, так и особенности ее
проявления (например, количество капель слюны у собаки в опытах И. П.
Павлова) полностью зависят от «большого числа условий». Важнейшим
параметром при научении по типу классических условных рефлексов
является интервал времени между началом действия условного и безусловного
стимулов. Временная связь между двумя стимулами легко возникает в том
случае, если условный стимул предъявляется непосредственно (минимум за
100 мс) перед началом действия безусловного. Однако временная связь
образуется медленно, если условный и безусловный стимулы предъявляются
одновременно и, тем более, если предъявление безусловного стимула
начинается через минуту после условного. Функцией ассоциативного научения
в этом случае является предвосхищение будущих событий, поэтому, как
указывал И. П. Павлов, условный раздражитель должен несколько
предшествовать действию безусловного. Например, свет (условный раздражитель)
включается до начала подачи пищи (безусловный раздражитель). В
результате условный раздражитель становится заменителем безусловного и
способен вызывать не свойственную ему биологическую реакцию в организме.
Другим параметром выработки условного рефлекса является сила
безусловного стимула, или подкрепление. Временная связь формируется быстрее,
если сила подкрепления больше, и наоборот. Данная особенность в
формировании временнбй связи позволяет животному предвосхищать более
значимые события среди многих других. Причем важным является не
физическая сила стимула, а его биологическая значимость. Например, условный
слюноотделительный рефлекс легче образуется у голодного животного.
Третьим параметром, оказывающим влияние на ассоциативное
научение, является сила условного стимула. Эта зависимость проявляется в том,
что при предъявлении сильного условного стимула формируется более
прочная временная связь. Среди всего многообразия раздражителей
внешней среды разные виды животных в эволюции приспособились к
восприятию определенных по специфичности стимулов. Следовательно, в
ассоциативном научении имеет значение предрасположенность животных
одного вида реагировать на те или иные стимулы внешней среды. Поэтому у
разных видов животных не все раздражители внешней среды могут
участвовать в научении в качестве условных стимулов. Кроме этого, с фактором
силы условного стимула связана его новизна для животного. Если на
организм животного впервые действует какой-либо условный стимул, то его
организм реагирует на новый раздражитель сильнее (явление сенситиза-
ция), чем ранее встречавшийся.
18. Высшая нервная деятельность (по И. П. Павлову) • 761
IS. 1.2. Рефлекторная дуга классического условного рефлекса
И. П. Павлов полагал, что рефлекторная дуга условного рефлекса состоит
из афферентного, центрального и эфферентного звеньев, т. е. имеет все
составляющие классической рефлекторной дуги. И. П. Павлов считал, что
образование временной связи полностью происходит в коре, а именно
между корковым полем восприятия условного раздражителя и корковым
представительством безусловного рефлекса (рис. 18.3). Доказывалось это
тем, что после удаления у животного коры головного мозга безусловные
рефлексы (слюноотделительные, двигательные и др.) становились более
грубыми и инертными, менее точными и совершенными, хуже
приспособленными к качеству, силе и продолжительности раздражителей. В своих
трудах И. П. Павлов писал, что в основе физиологического механизма
образования временной связи лежит суммационный рефлекс, явление
проторения пути между центрами, воспринимающими действие условного и
безусловного раздражителей или облегчения проведения возбуждения между
нейронами, образующими временную связь, а также доминанта. Эти
предположения И. П. Павлова отчасти остаются гипотетическими.
Классические условные рефлексы является филогенетически наиболее
ранним образцом простого ассоциативного научения, который
представляет собой пример не декларативной (имплицитной) памяти (см. глава 16).
Имплицитная память формируется в пределах различных по иерархической
сложности подкорковых нейронных сетей мозга. В современной нейробио-
логии показано, что в двух наиболее широко изучаемых формах
павловского ассоциативного научения, к которым относится условный рефлекс
страха и защитный мигательный условный рефлекс, временная связь образуется
соответственно в миндалевидном комплексе и в структурах мозжечка.
И. П. Павлов считал, что так называемый суммационный рефлекс (сум-
мационная реакция) является простейшей формой
индивидуально-приспособительной деятельности организма, в основе которой лежит феномен
повышения возбуждения в нейронах коры головного мозга при
неоднократном совпадении во времени условного и безусловного раздражения.
Современные
исследования свидетельствуют о
том, что механизм
длительной циркуляции
возбуждения в нейронных
сетях мозга (явление
долговременной потенциа-
ции) при участии глута-
матергических рецепторов
нейронов
миндалевидного комплекса и гиппокам-
па является основным в
формировании
временной связи классического
условного рефлекса
страха. Многократные
сочетания
«условный—безусловный стимулы» повышают
эффективность синапти-
ческой передачи между
нейронами за счет увели-
Рецепторы
слуха
InS
1 /^ ^Л
r(\yjs
LiV5r^
НФ t*fi
а
ir*
У I
Кора головного
мозга
/ !
+_^2;
Рецепторы
вкуса
Скелетная
мышца
Рис. 18.3. Схематическое изображение
представлений И. П. Павлова о рефлекторной дуге
классического условного слюноотделительного рефлекса.
Ур — корковый центр, воспринимающий действие
условного раздражителя. Бр — центр коры, воспринимающий
действие безусловного раздражителя. 1 — подкорковый
центр ориентировочного рефлекса; 2 — центр пищевого
рефлекса.
762 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
чения пресинаптического высвобождения медиаторов. Повышение
эффективности синаптической передачи при выработке условного рефлекса
лежит в основе феномена проторения или облегчения проведения
возбуждения, о котором говорил И. П. Павлов.
18.1.3. Стадии формирования условного рефлекса
Выработка классического условного рефлекса происходит в условиях
активации различных центров подкорковых образований, как показано в
последующих исследованиях, и состоит из стадий генерализации и
специализации. В стадии генерализации все близкие по физическим параметрам
условные раздражители вызывают одинаковую условную реакцию.
И. П. Павлов полагал, что так называемая генерализация стимула является
следствием распространения возбуждения по коре больших полушарий
головного мозга. Однако современные исследования свидетельствуют о том,
что условный раздражитель заключает в себе несколько параметров.
Например, звук имеет определенную частоту, интенсивность и длительность.
Каждый из этих параметров может быть условным раздражителем.
Поэтому многие компоненты условного раздражителя, на который был
выработан условный рефлекс, способны вызывать условно-рефлекторный ответ.
Например, реакция привыкания к определенному стимулу может
смениться генерализацией при появлении нового раздражителя.
После выработки стойкого положительного условного рефлекса
условно-рефлекторный ответ становится дифференцированным, т. е. возникает
только на строго определенный параметр условного раздражителя. В
результате близкие к условному стимулу по физическим параметрам
раздражители, действующие в пределах одной модальности, становятся
неэффективными и не вызывают условного рефлекса. Это происходит на стадии
специализации условного рефлекса, в основе которой лежит явление диф-
ференцировки, которое будет описано далее.
18.1.4. Условные рефлексы высшего порядка
Классический условный рефлекс, выработанный на основе сочетанного
действия условного и безусловного стимулов, И. П. Павлов назвал
условным рефлексом первого порядка. На основе условного рефлекса первого
порядка может образовываться условный рефлекс второго порядка.
Процедура выработки условного рефлекса второго порядка состоит в следующем.
Вначале вырабатывается классический условный рефлекс первого порядка,
как это описано в разделе 18.1 настоящей главы. Затем новый условный
стимул (например, свет) сочетается с условным стимулом рефлекса
первого порядка (звонок). На этой стадии звонок выполняет функцию
подкрепления. В результате неоднократного сочетанного действия «свет—звонок»,
свет, как новый условный стимул, начинает вызывать
условно-рефлекторную реакцию (условный рефлекс второго порядка). Во время выработки
условного рефлекса второго порядка временная связь образуется между
новым условным стимулом и реакцией, которую вызывает условный
стимул рефлекса первого порядка.
По аналогии со сказанным, условный рефлекс, выработанный на базе
условного рефлекса второго порядка, называется условным рефлексом
третьего порядка. Условные рефлексы этого типа И. П. Павлов назвал
условными рефлексами высшего порядка. В лаборатории И. П. Павлова было
установлено, что условные рефлексы высшего порядка не могут иметь
18. Высшая нервная деятельность (по И, П. Павлову) ■ 763
множественный порядок. Так, например, на основе условного пищевого
рефлекса можно выработать условный рефлекс только второго прядка. На
базе условных оборонительных рефлексов можно выработать условный
рефлекс максимум третьего порядка.
18.1.5. Виды классических условных рефлексов
Разнообразие условий внешней среды, к которым происходит
приспособление организмов, предполагает формирование множества
соответствующих условных рефлексов. Тем не менее все многообразие условных
рефлексов можно классифицировать на несколько групп.
В зависимости от вида сенсорного (безусловного) раздражения
различают: экстероцептивные, интероцептивные и проприоцептивные условные
рефлексы. По эффекторному признаку выделяют вегетативные и сомато-
двигательные условные рефлексы. По соотношению во времени действия
условного и безусловного стимулов различают совпадающие и следовые
условные рефлексы (рис. 18.4). Совпадающие условные рефлексы
формируются при совпадении во времени действия условного и безусловного
стимулов. Следовые условные рефлексы формируются в ситуации, когда
условный и безусловный стимулы следуют во времени один за другим с
некоторым интервалом. В свою очередь совпадающие условные рефлексы
по отставленное™ начала действия условного стимула и подкрепления
относят к строго совпадающим (задержка порядка 500 мс), отставленным
(5—30 с) и запаздывающим условным рефлексам (30 с—3 мин). Условные
рефлексы могут вырабатываться на время. Такие условные рефлексы
образуются при повторении безусловного стимула через строго определенные
интервалы времени. При этом только по истечении интервала времени
проявляется условно-рефлекторная реакция.
18.2. Торможение условных
рефлексов
Деятельность коры больших
полушарий обусловлена не только
процессами возбуждения, но и
торможения. В лаборатории И. П.
Павлова было установлено два типа
торможения условных рефлексов:
1) внешнее, врожденное или
безусловное; 2) внутреннее,
приобретенное индивидуально или условное.
Рис. 18.4. Схематическое изображение
последовательности предъявления
стимулов при выработке различных видов
классического условного рефлекса по
И. П. Павлову.
УС — условный стимул, БС — безусловный
стимул. Стрелками обозначена длительность
предъявления условного и безусловного
стимулов. А — совпадающий условный рефлекс.
Б и В —следовые условные рефлексы. УС-
ЕС — интервал времени между началом
действия условного и безусловного стимулов.
А УС
БС
J
Время
УС—БС;
УС
БС
в ус
БС
J
Время
УС-БС
1 *
Л к
764 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
18.2.1. Внешнее торможение
Внешним безусловным торможением называется снижение или
исчезновение условно-рефлекторной реакции при действии на организм сильного
или даже чрезвычайно сильного безусловного раздражения. Внешнее
торможение возникает без предшествующей выработки. Снижение или даже
прекращение активности нервного центра условного рефлекса происходит
под влиянием другого нервного центра, воспринимающего действие
сильного раздражителя. В естественном поведении животных имеют место
частые проявления внешнего торможения, возникающее в ответ на действие
сильного внешнего раздражения. Однако при действии на организм
животного сильных или даже чрезвычайно сильных раздражителей у них
может проявиться либо агрессивная реакция, либо пассивно-оборонительная.
Только во втором случае речь идет о внешнем торможении. Внешнее
торможение условных рефлексов носит, как правило, временный характер.
Если животное встречается с действием сильного внешнего раздражителя
повторно, которое не сопровождается «для животного никаким дальнейшим
существенным результатом», то они становятся индифферентными для
него, а торможение условного рефлекса прекращается.
По мнению И. П. Павлова, любой новый раздражитель вызывает у
животного исследовательский рефлекс, и животное ориентирует на источник
раздражения свои органы чувств (зрение, слух). В результате появления
ориентировочного рефлекса тормозится условный рефлекс. Безусловный
ориентировочный рефлекс, который И. П. Павлов обозначал термином
рефлекс «что такое?», проявляется в повороте головы, глаз и ушных
раковин животного в сторону источника зрительного или звукового
раздражения.
18.2.2. Внутреннее торможение
Внутренним или условным торможением называется изменение
проявления условно-рефлекторной реакции вплоть до ее исчезновения при
изменении условий, вызывавших конкретный вид ассоциативного научения
(условного рефлекса). Внутреннее торможение возникает в том случае,
если предъявление условного раздражителя не подкрепляется безусловным
рефлексом. Основными видами внутреннего торможения, открытыми и
исследованными в лаборатории И. П. Павлова, являются: угасательное,
условный тормоз, запаздывающее и дифференцировочное.
18.2.2.1. Угасательное торможение
Угасанием называется стирание или подавление приобретенной временнбй
связи между условным стимулом и условно-рефлекторной реакцией при
его повторном предъявлении без сочетания с безусловным подкреплением.
Способность мозга утрачивать научение и временную связь лежит в
основе адаптации организма к меняющимся условиям внешней среды.
Угасание прежде выработанной временнбй связи происходит в результате
повторяющегося предъявления условного стимула без подкреплений.
Начальной поведенческой реакцией животного на отмену подкрепления
является активация ориентировочной реакции, которая постепенно снижает
условно-рефлекторную реакцию на не подкрепляемый условный стимул.
По мере развития угасательного торможения при действии на животное
условного стимула без подкрепления постепенно увеличивается латентный
18. Высшая нервная деятельность (по И. П. Павлову) • 765
период условного рефлекса и уменьшается условно-рефлекторная реакция
вплоть до ее полного исчезновения. Скорость развития угасательного
торможения возрастает при однообразии и постоянстве действия условного
раздражителя, а также при возникновении внешнего торможения.
Напротив, угасательное торможение слюноотделительного условного рефлекса
при натуральных условных рефлексах происходит медленно, особенно
если пища находится вблизи животного. Развитие процесса угасательного
торможения в ЦНС зависит от особенностей типологических
особенностей центральной нервной системы животных — «у одних животных
условные рефлексы угасают быстро, у других очень медленно». Таким образом,
если действие условного стимула связывается с отсутствием подкрепления,
то условный рефлекс тормозится и животное «научается» тому, что за
условным стимулом не последует его подкрепление.
У животных может иметь место феномен спонтанного восстановления
условного рефлекса после его угасания. И. П. Павлов называл это явление
растормаживанием условного рефлекса, которое свидетельствует о том, что
в основе ассоциативного научения лежат механизмы памяти. Растормажи-
вание проявляется в том случае, когда животное вновь начинает научаться
прежде выработанной временной связи. В этом случае восстановление
условного рефлекса происходит очень быстро, в течение буквально
нескольких сочетаний условного и безусловного стимулов. Показателем глубины
угасания условного рефлекса является период времени, в течение которого
может произойти полное восстановление прежнего эффекта условного
рефлекса.
Сходной с угасанием формой научения является привыкание к
неоднократному действию условного стимула. Например, у животных довольно
быстро исчезает ориентировочная реакция на несъедобную пищу. Птицы
довольно скоро привыкают к звуковым средствам их отпугивания в
аэропортах и т. п.
18.2.2.2. Запаздывающее торможение
Запаздывающим торможением условного рефлекса называется задержка
проявления условно-рефлекторной реакции на положительный условный
стимул в результате увеличения интервала времени между началом
предъявления условного стимула и безусловного подкрепления. Запаздывающее
торможение при наличных условных рефлексах проявляется в том, что
задержка условно-рефлекторной реакции у животного может формироваться
по мере увеличения интервала времени между началом действия условного
раздражители и началом сочетанного безусловного подкрепления. При
следовых условных рефлексах запаздывающее торможение формируется по
мере увеличения интервала времени между окончанием действия
условного раздражители и началом сочетанного безусловного подкрепления (см.
рис. 18.4, Б, В). У собак запаздывающее торможение в указанных типах
условных рефлексов возникает в интервале времени задержки не более
3 мин.
Минимальный интервал времени задержки между началом
предъявления условного и безусловного стимулов при наличных и следовых
условных рефлексов составляет порядка 100 мс. Если после выработки
запаздывающего или следового условного рефлексов постепенно увеличивать
интервал времени между началом действия условного и безусловного
стимулов (на 5 с каждый последующий день), то, например,
условно-рефлекторная реакция организма начинает запаздывать, т. е. «отодвигаться от нача-
766 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
ла условного раздражителя». Физиологические значение запаздывающего
торможения условных рефлексов заключается в приспособлении условно-
рефлекторных реакций организма животных к меняющимся условиям со-
четанного действия условных и безусловных раздражителей внешней
среды.
18.2.2.3. Дифференцировочное торможение
Дифференцировочным торможением называется исчезновение условно-
рефлекторной реакции на физические параметры положительного
условного стимула, которые предъявляются животному без сочетанного
действия с безусловным подкреплением.
При выработке нового условного рефлекса условный раздражитель,
действующий на организм животного, «носит обобщенный характер».
Например, если звук с частотой 1000 Гц в процессе выработки условного
рефлекса становится положительным условным раздражителем, то и
другие частоты, т. е. близкие по значению к 1000 Гц, также первоначально
оказывают условное действие. Однако это действие будет тем меньше, чем
больше звук отличается по частоте в ту или иную сторону от условного
раздражителя. «Специализация условного раздражителя», или его
дифференцирование, происходит в условиях многократного сочетания или
повторения подкрепляемого условного раздражителя с близким к нему по
физическим свойствам условным неподкрепляемым раздражителем. В результате,
например, частота звука 1000 Гц сохраняет свое положительное сигнальное
значение, а звуки, отличающиеся по частоте в ту или иную сторону от
условного раздражителя, без подкрепления утрачивают свое первоначальное
сигнальное значение для животного. Таким образом, при помощи диффе-
ренцировочного торможения условных рефлексов в ЦНС осуществляется
различение биологической значимости различных параметров одного и
того же внешнего раздражителя.
18.2.2.4. Условное торможение
Условным торможением называется исчезновение условно-рефлекторной
реакции на положительный условный раздражитель, если он
предъявляется животному в комплексе с новым условным стимулом без сочетанного
их действия с безусловным подкреплением.
После выработки условного рефлекса индифферентный для животного
раздражитель становится условным по отношению к выработанной
условно-рефлекторной реакции. Новый условный стимул может предъявляться
животному в комплексе с положительным условным стимулом, но без
сочетанного их действия с безусловным подкреплением. В этом случае
новый условный раздражитель приобретает тормозные свойства, а его соче-
танное предъявление животному с положительным условным стимулом не
вызовет условно-рефлекторного ответа. Этот феномен И. П. Павлов
назвал условным тормозом, значение которого заключается в том, что в
ассоциативном научении животного один и тот же раздражитель может быть
как условным, так и безусловным. Это способствует более адекватному
приспособлению высшей нервной деятельности животного к условиям
внешней среды.
18. Высшая нервная деятельность (по И. П. Павлову) • 767
18.3. Оперантный условный рефлекс
В то время как И. П. Павловым
было начато исследование
классических условных рефлексов, в
зарубежных лабораториях параллельно
изучались так называемые
инструментальные условные рефлексы,
или оперантные рефлексы (рис.
18.5). Оперантные условные
рефлексы представляют собой
научение методом «проб и ошибок».
Например, голодное животное
помещается в специальный ящик, выход
из которого оно совершенно
случайно, тем не менее, может
обнаружить. Как правило, животное
совершает множество движений по
всему внутреннему пространству
ящика, пытаясь выбраться из него,
прежде чем случайно не нажимает
на задирающий дверь механизм.
При следующих пробах с тем же
ящиком животное концентрирует
свое поведение все ближе к
запирающему механизму, пока не
научается вести себя весьма
целенаправленно, выбираясь из ящика с
минимальными затратами усилий.
Главное отличие между оперантными и классическими павловскими
условными рефлексами заключается в активном, т. е. «произвольном» ответе
животного. Поведение животных на основе оперантных условных
рефлексов может быть усилено через положительное и отрицательное
подкрепление, а также наказанием и угасанием (табл. 18.1).
На основе инструментальных условных рефлексов могут формироваться
новые двигательные реакции. Знания об оперантном научении имеют
большое значение в различных аспектах деятельности человека, в
частности, для содержания и воспитания домашних животных и приручения ди-
Таблица 18.1. Особенности оператного поведения
Характер подкрепления
Положительное
Положительное
наказание
Отрицательное
Отсутствие
Последствие
Реакция приводит к
желаемым последствиям
Ответ приводит к
избеганию последствия
Ответ блокируется или
предупреждается
нежелательное последствие
Ответ блокируется или
предупреждаются
желательные последствия
Результат
Усиливается
в поведении
Уменьшается в
поведении
Увеличивается в
поведении
Уменьшается в
поведении
Пример
Собака сидит,
получает еду
Собаку наказывают,
она убегает
Собака
демонстрирует подчинение и не
получает наказание
Если собака
ошиблась, то не получает
награду
Рис. 18.5. Скиннеровский ящик для
изучения оперантных условных
рефлексов. Случайное нажатие на ключ
магазина с пищей позволяет голубю
получить подкрепление за выполненное
действие. Подкрепление является
стимулом для следующего «произвольного»
действия.
768 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
ких животных. Особенности оперантного научения проявляются в разной
степени у человека. Например, различные группы учащихся реагируют по-
разному на тип поощрения, т. е. обратной связи на свое поведение. В
частности, информирование детей средних классов об успехе их ответа на
уроке повышает успеваемость, но оказывается малоэффективным для
других групп детей.
18.4. Аналитико-синтетическая деятельность коры больших
полушарий
Способность к анализу поступающей в мозг информации о явлениях или
событиях окружающей среды является важным свойством различных
уровней центральной нервной системы и, особенно, коры головного мозга.
При этом огромное количество информации в процессе ее обработки в
мозге разделяется на составляющие ее части. Процесс разложения целого
на составляющие его части по нескольким составляющим называется
анализом.
Вместе с тем для высшей нервной деятельности значимыми являются
не отдельные и конкретные раздражители, а их комплексы или
комбинация. Поэтому в центральной нервной системе происходят процессы
синтеза, т. е. объединения отдельных частей некогда целого процесса по
существенным признакам в единое целое. Поэтому способность центральной
нервной системы и, прежде всего, коры головного мозга объединять
сигнальное значение различных раздражителей в единое целое и на этой
основе формировать приспособительные реакции называется синтезом.
Процессы анализа и синтеза в центральной нервной системе осуществляются
взаимосвязанно, и на этом основании И. П. Павлов эту деятельность мозга
назвал аналитико-синтетической.
Анализ в нервной системе начинается на этапе возбуждения
рецепторов, с помощью которых осуществляется восприятие различных стимулов
окружающей среды. В зависимости от способности рецепторов реагировать
на простые и сложные стимулы их роль в аналитико-синтетической
деятельности мозга относится к категории элементарного анализа и синтеза.
Более сложные процессы анализа и синтеза осуществляются на различных
уровнях (ядрах) сенсорных систем или анализаторов по И. П. Павлову. На
каждом уровне переключения при передаче сигналов от рецепторов до
коры головного мозга происходит обработка передаваемой информации.
Высший уровень анализа и синтеза осуществляется в коре головного
мозга, структурная организация которой приспособлена к анализу простых и
сложных комплексов раздражений и формированию на этой основе
временных связей.
18.5. Динамический стереотип
Временная связь условного рефлекса является результатом синтетической
деятельности центральной нервной системы. Эта деятельность проявляется
в формировании динамического стереотипа. Динамический стереотип —
это зафиксированная в долговременной памяти мозга система
индивидуально выработанных условных рефлексов при определенной
последовательности воздействия условных раздражителей внешней среды на
организм.
В лаборатории И. П. Павлова было установлено, что стереотипное по
последовательности и временнбму интервалу предъявление разных услов-
18. Высшая нервная деятельность (по И. П. Павлову) • 769
ных раздражителей фиксируется в деятельности коры в виде системы
условно-рефлекторных реакций или «динамического стереотипа». После
формирования динамического стереотипа, предъявление животному
только одного из условных стимулов в той же стереотипной
последовательности вызывает условно-рефлекторные реакции, свойственные
предъявлению других раздражителей.
В мозговой деятельности животных и человека формируется система
зафиксированных условных рефлексов под влиянием внешних и внутренних
стереотипно повторяющихся воздействий на организм различных
последовательностей условных стимулов. Многократные повторения определенной
системы действующих на центральную нервную систему условных
стимулов будет фиксироваться в долговременной памяти мозга в виде системы
условных рефлексов, которые затем воспроизводятся в строгой
последовательности. Таким образом, внешний стереотип предъявления
раздражителей обусловливает стереотипный комплекс приобретенных на них
условно-рефлекторных реакций организма.
Формирование динамического стереотипа происходит в течение
определенного интервала времени, но при сформированном динамическом
стереотипе центральная нервная система у животных и человека работает
экономно на фоне автоматически повторяющихся цепей условных
рефлексов. Например, образование динамического стереотипа лежит в основе
выработки профессионального навыка. Динамический стереотип
формируется в течение определенного периода жизни и не может мгновенно
измениться в случае изменения условий внешней среды.
18.6. Фазовые явления в коре больших полушарий головного мозга
И. П. Павлов считал, что высшая нервная деятельность обусловлена
динамикой внутренних процессов возбуждения и торможения в популяциях
корковых нейронов, которая возникает в результате воздействия на
организм стимулов внешней и внутренней среды. Процессы возбуждения и
торможения могут возникать в отделах коры, которые не связаны
непосредственно с анализом и синтезом условного или безусловного
раздражения, т. е. они способны иррадиировать из участков коры, где они
возникают, на другие нейронные популяции коры. Например, на иррадиации
возбуждения в коре головного мозга основана выработка временнбй связи и
стадия генерализации в формировании условного рефлекса. По мнению
И. П. Павлова, «деятельность больших полушарий управляется законами:
законом иррадиирования и концентрирования процессов возбуждения и
торможения, и законом их взаимной индукции».
Явление иррадиации процесса торможения в коре головного мозга было
обнаружено в лаборатории И. П. Павлова при выработке дифференциро-
вочного торможения условного слюноотделительного рефлекса на так
называемое электрокожное раздражение. Условное электрическое
раздражение на участки кожи наносили через близко расположенные между собой
электроды (см. рис. 18.2). В соответствии с соматотопической
организацией сенсомоторной коры, сигналы от рецепторов ограниченного участка
кожи поступают в рядом расположенные центры сенсомоторной коры
животного. Предъявление животному условного электрического раздражения
через один электрод без сочетания с безусловным подкреплением
вызывает торможение в соответствующем центре коры. Последующее
электрическое раздражение через рядом расположенный на коже электрод в
сочетании с безусловным пищевым подкреплением сопровождалось незначитель-
25-6095
770 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
ной по сравнению с фоном условной слюноотделительной реакцией,
которая до применения «тормозного» электрокожного раздражения имела
постоянную величину слюноотделения.
Процесс концентрации торможения, как было установлено И. П.
Павловым, взаимосвязан с иррадиацией торможения на другие отделы коры
головного мозга. Иррадиация нервных процессов обусловлена их силой.
В лаборатории И. П. Павлова было показано, что иррадиация процессов
возбуждения и торможения в пределах ограниченных зон коры больших
полушарий происходит, как правило, при их слабой выраженности.
Напротив, при достаточной силе как процесса возбуждения, так и
торможения, доминирует явление их концентрации в центрах коры,
воспринимающих действие положительного и отрицательного условного раздражений.
При чрезмерной силе процессов возбуждения и торможения доминируют
явления их иррадиации с распространением на обширные отделы коры
головного мозга. Следовательно, нервным процессам возбуждения и
торможения в коре головного мозга характерна определенная динамика, которая
обусловлена многими факторами.
Взаимная индукция нервных процессов возбуждения и торможения.
Динамика процессов возбуждения и торможения в коре головного мозга,
проявляющаяся в возникновении возбуждения вслед за торможением и
наоборот или в их усилении в одном и том же участке коры головного мозга,
была названа И. П. Павловым индукцией. Взаимная индукция процессов
возбуждения и торможения в коре головного мозга связана со сменой
одного процесса другим в ограниченном участке коры головного мозга.
Взаимная индукция процессов обусловлена выраженностью (силой)
возбуждения и торможения, развитием их во времени, с большей или меньшей
степенью их распространения в пределах нервных центров коры,
воспринимающих действие условных и безусловных стимулов, наконец, с
типологическими особенностями центральной нервной системы (описаны ниже).
По И. П. Павлову, взаимная индукция процессов возбуждения и
торможения бывает двух видов: последовательная, или временная, и
одновременная, или пространственная, индукция. Последовательная индукция
характеризуется сменой возбуждения торможением или наоборот либо их
усилением в пределах одного нервного центра коры головного мозга.
Пространственная индукция нервных процессов проявляется в том, что в участках
коры головного мозга, расположенных рядом с корковыми зонами
возбуждения или торможения, развивается противоположный нервный процесс.
С учетом влияния одного нервного процесса на другой явление индукции
классифицируют по знаку. Резкое усиление условного рефлекса при
воздействии на центр коры головного мозга положительным условным
стимулом, находившийся под влиянием процесса торможения (например, диф-
ференцировки), называется положительной индукцией. Напротив,
появление и усиление процесса торможения в нейронах коры головного мозга,
окружающих корковый процесс возбуждения, называется отрицательной
индукцией.
Положительная индукция в участке коры головного мозга, как правило,
имеет место после дифференцировочного торможения условного рефлекса.
Примером проявления отрицательной индукции является внешнее
торможение условных рефлексов. Отрицательная индукция ограничивает
распространение (иррадиацию) возбуждения по коре больших полушарий
головного мозга. В лаборатории И. П. Павлова было установлено, что
индукция нервных процессов, по аналогии с иррадиацией, взаимосвязана с
силой возбуждения и торможения в участках коры головного мозга. При
18. Высшая нервная деятельность (по И. П. Павлову) • 771
слабых и чрезмерно сильных процессах возбуждения и торможения
явление индукции в коре головного мозга не проявляется. При нормальной
активации коры головного мозга, а следовательно, достаточной
выраженности процессов возбуждения и торможения явление индукции не только
возникает, но и может возрастать в своем проявлении. На этом основании
И. П. Павлов пришел к выводу о наличии в коре головного мозга тесного
взаимодействия иррадиации и взаимной индукции нервных процессов
возбуждения и торможения. Экспериментальные модели изучения условно-
рефлекторной деятельности животных позволили проследить
определенную динамику подобного взаимодействия. В наиболее общем виде это
проявлялось в том, что в коре головного мозга первоначально
формируется зона либо возбуждения, либо торможения в зависимости от сигнальных
особенностей раздражителя, и начинает развиваться положительная или
отрицательная индукция. Дальнейшим этапом в динамике возбуждения и
торможения является иррадиация первично вызванного нервного процесса
в другие отделы коры головного мозга с последующим обратным его
движением в начальный пункт. При этом в нейронах коры, в которых
исчезают процессы возбуждения или торможения, индуцированные их же
иррадиацией, также могут происходить явления взаимной индукции.
И. П. Павлов считал, что «закон иррадиации и концентрации и закон
индукции тесно связаны друг с другом, взаимно ограничивая, уравновешивая, и
укрепляя друг друга и, таким образом обусловливая точное соотношение
деятельности организма к условиям внешней среды».
18.7. Типология высшей нервной деятельности
И. П. Павлов, исследуя высшую нервную деятельность животных,
установил, что «нервные задачи», которым подвергали животных, сопровождались
проявлением различий в их высшей нервной деятельности. Эти различия у
одних животных в деятельности коры больших полушарий были выражены
больше, у других меньше, а у некоторых — вообще не наблюдали их
возникновения. Особенности индивидуального проявления у животных
высшей нервной деятельности И. П. Павлов связывал с типами их нервной
системы. Так по описанию И. П. Павлова, один тип животных — это «в
высшей степени суетливые», «быстро реагирующие на малейшие звуки»,
«навязчивые в общении с людьми». Такие животные энергичны при быстрой
смене раздражений, но при их однообразии животные становятся
бездеятельными и вялыми. Другой тип собак — медленно осваивающиеся с
обстановкой опытов, малоподвижные, но как только обстановка опытов
становится однообразной, у них легко вырабатываются условные рефлексы,
особенно тормозные.
Индивидуальные особенности высшей нервной деятельности животных
проявляются в различной скорости образования и закрепления условных
рефлексов, в различной скорости выработки внутреннего торможения.
Типологические особенности высшей нервной деятельности проявляются во
взаимодействии нервных процессов возбуждения и торможения в коре
головного мозга. В основе классификации типов высшей нервной
деятельности по И. П. Павлову лежат врожденные индивидуальные различия
основных свойств нервных процессов возбуждения и торможения. Такими
основными свойствами нервных процессов возбуждения и торможения в
коре головного мозга являются их сила и слабость. Сила нервных
процессов—это свойство нервной системы отвечать на сильные раздражители
сильной реакцией, а также способность длительное время поддерживать
25*
772 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
процесс возбуждения. По И. П. Павлову, в зависимости от врожденных
особенностей нейронов коры головного мозга нервные процессы могут
быть сильными или слабыми; в зависимости от соотношения силы
возбудительного и тормозного процессов они могут быть уравновешенными или
неуравновешенными. Наконец, у нервных процессов есть скорость их
возникновения и прекращения, легкость перехода от одного процесса к другому.
По данному критерию И. П. Павлов разделял нервные процессы на
подвижные и инертные.
И. П. Павлов на основании исследований из достаточно большого числа
сочетания свойств процессов возбуждения и торможения выделил только
четыре типа высшей нервной деятельности у животных: 1) сильный,
неуравновешенный, с резким преобладанием процесса возбуждения над
торможением, «безудержный» тип; 2) сильный, уравновешенный, подвижный
(лабильный) тип; 3) сильный, уравновешенный (инертный) тип; 4) слабый тип.
И. П. Павлов проводил параллель между четырьмя типами высшей нервной
деятельности и их проявлением в поведении, т. е. темпераментом по
Гиппократу. При этом холерический, сангвинический, меланхолический и
флегматический темпераменты обусловлены наличием у животного
соответствующего (порядок указан выше) типа высшей нервной деятельности.
Особенности высшей нервной деятельности человека. У человека, по
сравнению с животными, уровень развития аналитико-синтетических
процессов в коре головного мозга обусловил специфику его высшей нервной
деятельности. По словам И. П. Павлова, эволюционной «прибавкой» к
механизмам корковой деятельности у человека стало слово, что «составило
вторую сигнальную систему действительности». В целом же особенностью
высшей нервной деятельности человека по И. П. Павлову является наличие
двух сигнальных систем. Первая сигнальная система является системой
мозгового обеспечения восприятия непосредственных раздражителей
внешней среды. Вторую сигнальную систему, которая является
специфически человеческой, составляет слово. На физиологическом уровне вторую
сигнальную систему можно определить как систему мозгового обеспечения
вербальной (словесной) деятельности. Вторая сигнальная система является
основой абстрактного мышления, благодаря которому человек имеет
возможность структурировать среду без непосредственного контакта с ней
путем операций с мысленными образами и символами объектов. В результате
у человека аналитико-синтетическая деятельность коры больших
полушарий осуществляется как путем непосредственных ощущений и
представлений, так и путем оперирования словом. Слово, «будучи сигналом первых
сигналов», создает неограниченные возможности для отвлечения процессов
анализа и синтеза от непосредственного восприятия внешнего мира.
И. П. Павлов предполагал, что по соотношению первой и второй
сигнальных систем у людей можно выделить художественный, мыслительный и
промежуточный типы людей. У первых особенно ярко выражена
деятельность первой сигнальной системы. Для мыслительного типа заметно
преобладает деятельность второй сигнальной системы и, наконец, средний
тип, у которого деятельность первой и второй сигнальных систем
проявляются примерно в равной степени. Однако эта точка зрения И. П. Павлова
не получила в последующем научного подтверждения. И. П. Павлов
высказывал также мнение, что типологические особенности высшей нервной
деятельности человека, обусловленные соотношением деятельности двух
сигнальных систем, формируются в процессе индивидуальной жизни под
влиянием многих факторов внешней среды, в том числе воспитания и
образования.
ГЛАВА 19
Мотивации и эмоции
19.1. Мотивации
Слово мотивация происходит от латинского глагола movere, что значит
двигаться, а смысл самого понятия мотивация литературным языком
можно выразить словами «нечто, что движет другим». Мотивации
обеспечивают поведение человека при удовлетворении биологических потребностей.
К биологическим потребностям человека относятся, в основном,
потребность в пище, воде, сне, сексе и т. д. Биологической потребностью
называется изменение гомеостатических параметров внутренней среды
организма — снижение концентрации глюкозы в плазме крови, повышение в ней
осмотического давления, увеличение содержания в плазме крови половых
гормонов либо норадреналина, серотонина или ацетилхолина. В условиях
голода (снижение в плазме крови питательных веществ) или жажды в ЦНС
возникает возбуждение (стимул, драйв — от английского слова управление),
которое инициирует, направляет, интенсифицирует и обусловливает
постоянство целенаправленного поведения человека на удовлетворение
биологических потребностей и которое называется мотивацией.
Целенаправленное поведение человека в процессе удовлетворения биологической
потребности также представляет собой мотивацию.
19.1.1. Понятие о первичных и вторичных мотивациях
Мотивации, которые возникают в организме человека на основе таких
физиологических состояний, как изменение гомеостатических параметров
внутренней среды, называются первичными. Наиболее важными видами
первичных мотиваций, обусловливающих целенаправленное
удовлетворение биологических потребностей в течение суток, являются пищевая и
цикл сон—бодрствование. Первичные мотивации обеспечивают
выживание индивидуума, например в результате восполнения в организме
питательных веществ.
Мотивации, которые могут возникать только в процессе научения
человека, через его индивидуальный жизненный опыт, называются
вторичными. Вторичные мотивации (синоним — мотив) обусловлены
познавательными и социальными потребностями человека. Примерами вторичных
мотиваций человека являются мотивация достижения цели и изменения
поведения. Так, мотивация достижения цели является «повседневной».
В процессе удовлетворения этой мотивации человек стремится к
совершенствованию профессиональной компетенции, либо к овладению
навыками новой профессии, либо к получению положительной оценки за
результаты своей профессиональной деятельности со стороны окружающих.
Мотивация изменения поведения может быть направлена на получение
материальной выгоды либо на расширение количества знаний и
профессиональных навыков (так называемый потенциал мастерства).
774 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
Вторичные мотивации человека представлены также внутренней и
внешней мотивациями. Вторичная внутренняя мотивация возникает у человека
из потребности сделать что-либо для себя. Внутренняя мотивация у
человека связана с высокими успехами в учебе, психологической
совместимостью с одноклассниками, сверстниками и студентами. У взрослых
внутренняя мотивация является источником активной, продуктивной работы,
игры, творчества. Вторичная внешняя мотивация человека направлена на
получение вознаграждения либо обусловлена стремлением избежать
наказания.
19.1.2. Понятие о мотивациях влечения и избегания
На основе аффективной (чувственной) природы сенсорных ощущений
(приятные или неприятные), которые возникают у человека при
первичных и вторичных мотивациях, они могут быть разделены на две категории:
влечения и избегания. Мотивации влечения обусловливают поведение
человека, направленное на получение пищи, взаимодействие с половым
партнером и достижение успехов в работе (достижение победы), и вызывающих у
человека чувство удовольствия. Мотивации влечения обусловлены
получением вознаграждения (положительные подкрепления, положительные
эмоции) и их проявление связывают с функцией систем удовольствия мозга
человека. Мотивации избегания обусловливают поведение человека, при
котором он стремится избежать неприятного состояния, как правило, это
чувство боли или страха (отрицательное подкрепление, наказание,
отрицательные эмоции).
19.1.3. Пищевая мотивация человека
Питание является обязательным условием выживания индивидуума.
Поддержание высокой скорости метаболических процессов в организме
возможно при условии постоянного восполнения энергетических запасов.
Чтобы обеспечить адекватное питание, в мозге человека имеются
нейронные сети, которые регулируют содержание питательных веществ (жиров,
углеводов и белков) в плазме крови и в так называемых депо организма.
Пищевая мотивация проявляется под влиянием гомеостатических
стимулов, которые возникают у человека при дискомфорте, ассоциирующемся с
чувством голода. Наряду с гомеостатическими стимулами пищевая
мотивация у человека обусловлена подкрепляющей ролью пищи
(вознаграждением), поскольку питание всегда сопряжено с возникновением у человека
чувства удовольствия.
19.1.3.1. Гомеостатические механизмы регуляции пищевой мотивации
у человека
Основным фактором формирования пищевой мотивации у человека
является химический состав плазмы крови: концентрация глюкозы, жирных
кислот и аминокислот. Уровень глюкозы в плазме крови контролируется
глюкорецепторами нейронов латеральных отделов гипоталамуса (глюкоста-
тическая теория регуляции голода). Согласно этой теории, ощущение
голода у человека возникает при понижении концентрации глюкозы в
плазме крови, и наоборот. При увеличении содержания глюкозы в плазме
крови увеличивается активность глюкорецепторных нейронов вентромедиаль-
ного гипоталамуса и одновременно снижается чувствительных к глюкозе
19. Мотивации и эмоции • 775
нейронов так называемого центра голода латерального гипоталамуса. При
потреблении пищи увеличивается высвобождение инсулина в плазму крови
из р-клеток островков Лангерганса поджелудочной железы. Инсулин,
стимулируя транспорт глюкозы из плазмы крови через мембраны клеток
тканей, вызывает уменьшение концентрации глюкозы в плазме крови и
увеличивает проявление у человека чувства голода. Уменьшение
концентрации аминокислот и липидов в плазме крови увеличивает электрическую
активность нейронов латерального' гипоталамуса (аминостатическая или
липостатическая теории регуляции пищевой мотивации), что
обусловливает активацию пищевого поведения.
Эти теории были основаны на представлении о мозговых механизмах
регуляции питания при участии двух противоположных по функции групп
клеток — латерального гипоталамуса, регулирующего питание, и вентроме-
диального ядра, тормозящего латеральный гипоталамус в случае пищевого
насыщения. Однако гомеостатические механизмы регуляции пищевой
мотивации в связи с открытием роли гормонов лептина, грелина и ряда
пептидов (меланокортины, нейропептид Y, орексины и др.) в регуляции
инициации и прекращения пищевого поведения включают, наряду с
гуморальными, гормональные и центральные гипоталамические механизмы
пищевой мотивации у человека.
Роль лептина в регуляции пищевой мотивации. Гормон лептин
синтезируется жировыми клетками в организме человека и поступает в плазму
крови. Его концентрация в плазме крови зависит от массы жировой ткани у
человека. Циркулирующий в крови лептин связывается с типом 1 цитоки-
нового рецептора (синоним — лептиновые рецепторы) на мембране
нейронов вентрального отдела гипоталамуса (дуговое, вентромедиальное, дорсо-
медиальное и вентральное премаммилярное ядра). Нейроны медиальной
части дугового ядра гипоталамуса, которые способны связываться с лепти-
ном, содержат нейропептид Y, про-опиомеланокортин и его производные,
включая ос-меланоцитостимулирующий гормон. При этом нейроны,
синтезирующие нейропептид Y, образуют гипоталамическую систему
потребления пищи, а нейроны, содержащие про-опиомеланокортин/производные
кокаина и амфетамина, — систему пищевого насыщения. При активации
системы потребления пищи заторможена активность системы пищевого
насыщения и наоборот.
Физиологический механизм действия лептина заключается в
торможении высвобождения нейропептида Y в нейронах паравентрикулярных ядер
гипоталамуса. В результате уменьшения секреции нейропептида Y в
нейронах системы потребления пищи, активируется нейроны системы
насыщения, синтезирующие про-опиомеланокортини, что вызывает у человека
снижение ощущения голода.
Считается, что гипоталамус регулирует постоянство массы тела
человека, или так называемую установочную точку массы тела, которая
обусловлена размерами и количеством жировых клеток в организме человека, и,
следовательно, содержанием гормона лептина в плазме крови. При этом
чем больше количество жировых клеток в организме, тем выше
установочная точка массы тела человека и наоборот. Установочная точка массы тела
обусловлена генетическими факторами, поскольку каждый человек имеет
индивидуальную скорость метаболизма, при которой пища превращается в
энергию и используется в тканях организма. Например, люди, имеющие
высокую скорость метаболизма, чаще потребляют пищу без существенного
изменения массы тела. Напротив, люди, имеющие низкую скорость
метаболизма, потребляют пищу относительно редко, но имеют избыточный вес.
776 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
Роль грелина в регуляции пищевой мотивации. Гормон грелин
синтезируется в клетках слизистой оболочки желудка и его концентрация в плазме
крови человека становится максимальной при пищевой мотивации
непосредственно перед приемом пищи. Увеличение его содержания в плазме
крови и одновременное снижение в ней уровня лептина являются
стимулами инициации у человека чувства голода. Мишенью для грелина
являются грелиновые рецепторы на мембране нейронов вентромедиального и
дугового ядер гипоталамуса, которые синтезируют нейропептид Y.
Увеличение концентрации грелина в плазме крови вызывает рост синтеза нейро-
пептида Y в нейронах гипоталамуса, что активирует систему регуляции
потребления пищи у человека. Блокада рецепторов этих нейронов
гипоталамуса антагонистами нейропептида Y непосредственно препятствует
действию на них грелина и тормозит пищевую мотивацию. У пациентов,
потерявших примерно 17 % массы тела в результате интенсивной диеты, имеет
место чрезвычайно высокая концентрация грелина в плазме крови
непосредственно перед началом еды. У людей с ожирением и чрезмерным
аппетитом в плазме крови более высокое содержание грелина, чем у
субъектов с ожирением и обычным уровнем питания.
Регуляция пищевой мотивации при участии факторов химического
состава плазмы крови (глюкоза, аминокислоты, жирные кислоты и гормоны)
обеспечивает поддержание постоянства запасов питательных веществ в
организме человека между приемами пиши.
Наряду с этим гастроинтестинальные стимулы выполняют еще одну
роль, — они регулируют оптимальное количество пищи, которое может
принять человек за один прием (завтрак, обед или ужин).
Нейрогормональная регуляция пищевого насыщения. Структуры мозга,
регулирующие пищевую мотивацию человека, получают сенсорные сигналы
от рецепторов желудочно-кишечного тракта через дорсальный комплекс
блуждающего нерва продолговатого мозга. Импульсы, которые передаются
в гипоталамус от механорецепторов афферентных волокон блуждающего
нерва, сигнализируют о степени растяжения стенки желудка пищей, а
также об уровне глюкозы и липидов в печени. Эта информация поступает
первоначально в медиальные и дорсомедиальные ядра одиночного тракта
продолговатого мозга, а далее, через нейроны парабрахиальных ядер
моста, — к паравентрикулярным, дорсомедиальным и дуговым ядрам
гипоталамуса, а также к латеральному гипоталамусу, обусловливая момент
прекращения приема пищи.
Сенсорные сигналы, поступающие от нейронов ядер одиночного тракта
продолговатого мозга через парабрахиальные ядра моста к висцеральным
сенсорным ядрам таламуса, а далее к нейронам висцеральных сенсорных
отделов коры головного мозга, обусловливают формирование у человека
сознательного контроля степени наполнения желудка пищей.
Наконец, сенсорные сигналы, поступающие от нейронов ядер
одиночного тракта продолговатого мозга через парабрахиальные ядра моста к
центральному ядру миндалины, обусловливают возникновение чувства
удовольствия при восприятии вкуса пищи.
Роль гастроинтестинальных гормонов в регуляции насыщения.
Прекращение питания регулируется гормонами гастроинтестинального тракта при
участии нейронов area postrema. Area postrema, или так называемый циркум-
вентрикулярный орган, расположен над ядрами одиночного тракта
продолговатого мозга. Нейроны area postrema не имеют гематоэнцефалического
барьера, поэтому они непосредственно реагируют на циркулирующие в
крови гастроинтестинальные гормоны холецистокинин и глюкагонсвязан-
19. Мотивации и эмоции • 777
ный пептид-1. Повышение содержания этих гормонов в плазме крови
происходит при приеме пищи и поступлении химуса в двенадцатиперстную
кишку, что вызывает их высвобождение из клеток ее слизистой оболочки.
Гормоны активируют нейроны area postrema, от которых сигналы
передаются к ядрам одиночного тракта, а затем через нейроны парабрахиальных
ядер моста в гипоталамус, что вызывает прекращение приема пищи.
Эндокринные клетки тонкой кцшки человека секретируют в плазму
крови пептид YY. Этот гормон тормозит нейроны дугового ядра
гипоталамуса, секретирующие нейропептид Y. Торможение секреции в нейронах
гипоталамуса нейропептида Y активирует нейроны, синтезирующие про-
опиомеланокортин. В результате у человека наступает насыщение и он
прекращает принимать пищу.
Роль механорецепторов стенки пищеварительного канала в регуляции
насыщения. При растяжении пищей стенок желудка и двенадцатиперстной
кишки происходит раздражение чувствительных окончаний блуждающего
нерва. Импульсы достигают нейронов ядер латерального гипоталамуса и,
вызывая торможение их активности, приводят к уменьшению степени
пищевой мотивации.
19.1.3.2. Роль структур продолговатого мозга в регуляции пищевой мотивации
Стволовые центры непосредственно регулируют процесс приема пищи
человеком за один присест. При этом осуществляются секреция слюны,
вкусовая апробация пищи, а также двигательные акты жевания и глотания.
Сигналы от вкусовых рецепторов слизистой оболочки языка и
глоточной области поступают в ядра одиночного тракта продолговатого мозга: от
рецепторов передней 2/3 языка по чувствительным волокнам лицевого
нерва; вкусовые ощущения, возникающие при раздражении рецепторов
сосочков корня языка и других задних областей слизистой оболочки рта, —
по волокнам языкоглоточного нерва; от рецепторов слизистой оболочки
основания языка и глоточной области — по волокнам блуждающего нерва. От
нейронов ядра одиночного пучка волокна направляются к медиальному
ядру таламуса, а затем к структурам сильвиевой борозды: постцентральная
извилина теменной коры и островковой коры. Корковые проекции
вкусовой рецепции обусловливают так называемое вкусовое предпочтение,
которое заключается в том, что человек отдает предпочтение некоторым
видам пищи среди многих. Во вкусовом предпочтении основную роль
выполняют структуры мезолимбической системы мозга, при участии которой у
человека возникают приятные или неприятные ощущения после приема
того или иного типа пищевых веществ. В частности, если человек
испытывает неприятные (например, болезненные) ощущения после приема
определенного типа продукта, то у него возникает так называемое
отрицательное пищевое предпочтение, или вкусовая неприязнь.
Нейроны ядра одиночного тракта синаптически связаны с верхними и
нижними слюноотделительными ядрами ствола мозга, которые регулируют
слюноотделение околоушной, подъязычной и подчелюстной слюнных
желез. Одной из функций слюны является растворение молекул пищевых
веществ, что способствует их доставке к рецепторам вкуса в слизистой
оболочке языка. Нейроны ядер одиночного тракта рефлекторно возбуждают
двигательные центры этого же отдела мозга, которые регулируют процессы
жевания и глотания (двигательные ядра V, VII, X, XI, XII черепных нервов
и CI—CIII). Активация стволовых нейронных механизмов регуляции
жевания, слюноотделения, глотания и рецепции вкуса вызывает торможение
778 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
нейронов гипоталамической системы потребления пиши, что также
обусловливает момент прекращения приема пищи. Однако этот процесс
осуществляется медленно (порядка 20—40 мин), и тормозной эффект
выражен в меньшей степени, чем при действии гастроинтестинальных стимулов
на вентромедиальный отдел гипоталамуса.
19.1.3.3. Роль латерального гипоталамуса в возникновении пищевой
мотивации
Регуляция пищевой мотивации у человека осуществляется нейронными
сетями латерального, вентромедиального и паравентрикулярных ядер
гипоталамуса. Двустороннее повреждение ядер латерального гипоталамуса
вызывает отказ от приема пищи у человека, электрическая стимуляция,
напротив,— приводит к чрезмерному потреблению пищи.
Роль ядер латерального гипоталамуса в мотивации голода обусловлена
началом потребления пищи в результате активации нейронов этого отдела
мозга. Считают, что эта роль латерального гипоталамуса связана с
нейронами, содержащими пептиды — меланинконцентрирующий гормон и орекси-
ны (синоним — гипокретины). Эти нейроны инициируют начало приема
пищи, активируя двигательные системы ствола мозга, регулирующие
жевание, облизывание и глотание при участии нейронов черепных нервов:
тройничного, лицевого и подъязычного ядер.
Нейроны латерального гипоталамуса иннервируют симпатические и
парасимпатические преганглионарные ядра продолговатого и спинного
мозга, которые регулируют процессы слюноотделения, пищеводной и
желудочной моторики, секреции соляной кислоты желудка и регуляцию экзо-
кринной (панкреатический сок) и эндокринной (инсулин и глюкагон)
секреции поджелудочной железы. Нейроны латерального гипоталамуса, сек-
ретирующие меланин-концентрирующий гормон и орексины, через
проекции к моноаминергическим нейронам голубого пятна, серотонинергиче-
ским нейронам дорсального и срединного ядер шва, гистаминергическим
нейронам бугорково-маммилярной области, активирует восходящую
ретикулярную систему мозга. В результате при пищевой мотивации
усиливаются возбуждение организма и его двигательная активность.
Наконец, нейроны латерального гипоталамуса, содержащие
меланинконцентрирующий гормон, проецируют терминали своих аксонов к
нейронам прилегающего ядра (п. accumbens). Увеличение активности нейронов
прилегающего ядра под влиянием нейронов латерального гипоталамуса
обусловливает инициацию и усиление у человека чувства удовольствия
при еде.
При участии нейротрансмиттеров паравентрикулярные ядра
гипоталамуса регулируют так называемое вкусовое предпочтение человека по
отношению к определенному типу питательных веществ. Например, ней-
ротрансмиттеры нейропептид Y, ГАМК и норадреналин увеличивают
вкусовое предпочтение пищи, насыщенной углеводами, а серотонин,
напротив, уменьшает.
19.1.3.4. Роль меланокортиновой системы гипоталамуса в прекращении
пищевой мотивации
Электрическая стимуляция вентромедиальных ядер гипоталамуса вызывает
чувство насыщения и отказ от приема пищи, разрушение, напротив,
приводит к непрерывному и чрезмерному потреблению пищи даже в том слу-
19. Мотивации и эмоции • 779
чае, если масса животного в несколько раз превышает норму. Роль
нейронов ядер вентромедиального гипоталамуса заключается в инициации
момента прекращения потребления пищи. Например, при опухолях
вентромедиального отдела гипоталамуса резко возрастает потребление пищи у
человека. Электрическое раздражение вентромедиального гипоталамуса ведет
либо к прерыванию, либо к полному прекращению потребления пищи.
Прекращение приема пищи осуществляется так называемой меланокорти-
новой системой дугового ядра гипоталамуса, нейроны которого
синтезируют про-опиомеланокортин и производные кокаина и амфетамина. Так, у
человека взаимодействие а-меланоцитостимулирующего гормона с
рецепторами меланокортина на мембране нейронов этого ядра вызывает анорексию
(отказ от пищи) и резкое снижение массы тела в результате прекращения
питания. Рецепторы меланокортина имеются также на мембране нейронов
паравентрикулярного и латерального гипоталамуса. Молекулярный
механизм действия а-меланоцитостимулирующего гормона на нейроны паравен-
трикулярных ядер осуществляется через ГАМК-ергические интернейроны.
Нейроны меланокортиновой системы дугового ядра гипоталамуса имеют
прямые синаптические связи с преганглионарными симпатическими
нейронами в спинном мозге. Изменение активности этого пути под влиянием
лептина или а-меланоцитостимулирующего гормона при взаимодействии
этих гормонов с лептиновыми и меланокортиновыми рецепторами
нейронов меланокортиновой системы может непосредственно регулировать
(увеличивать и уменьшать соответственно) артериальное давление, расход
энергии и секрецию инсулина при пищевой мотивации или при ее
торможении.
19.1.3.5. Роль лимбической системы в регуляции пищевой мотивации
у человека
Если бы пищевая мотивация регулировалась только гомеостатическими
механизмами, то большинство людей имели бы идеальную массу тела.
Однако еда, особенно вкусная, является для человека своеобразным
вознаграждением, как деньги за выполненную работу. Эта особенность пищи
человека при пищевой мотивации модулируется такими качествами пищи,
как ее вкус и запах. Различение вкусовых качеств пищи на молекулярном
уровне осуществляется вкусовыми рецепторами языка, большинство из
которых способны воспринимать более одного первичного вкуса, а многие —
три или все четыре одновременно. Импульсы от вкусовых рецепторов
поступают к нейронам ядра одиночного тракта, затем к парабрахиальным
ядрам моста (второй синаптический уровень) и через релейные ядра таламуса
в латеральные области лобной коры, к центральному ядру миндалины и к
латеральному гипоталамусу. Подкрепляющая роль пищи в пищевом
поведении человека обусловлена нейронами подкорковых областей мозга,
имеющих на мембране. Так, нейроны прилегающего ядра, содержащие на
своей мембране опиоидные рецепторы и дофаминергические входы к этим
нейронам, непосредственно образуют систему пищевого вознаграждения
пищевой мотивации человека. Активация опиоидных и глютаматергиче-
ских рецепторов нейронов прилегающего ядра и дофаминергических
входов к его нейронам увеличивают потребление вкусной пищи: сладкой,
соленой или жирной, а также жидкости. Нейроны прилегающего ядра
лимбической системы взаимосвязаны синаптически с нейронами латеральных,
вентромедиальных и паравентрикулярных ядер гипоталамуса и через них
регулируют выраженность пищевой мотивации у человека в отношении
780 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
специфического типа пищи. Считается, что активность этой нейронной
сети мозга человека обусловливает аппетит. Чувство аппетита ориентирует
человека на определенный состав пищи, которую он употребляет при еде.
Регуляция аппетита происходит при участии обонятельной сенсорной
системы, к которой относится значительная часть миндалевидного комплекса.
У человека двустороннее повреждение миндалины приводит к утрате
выбора типа и качества пищи (потеря аппетита).
Прилегающие ядра при участии ГАМК-ергических нейронов этого
образования реципрокно взаимодействуют с нейронами латерального
гипоталамуса. Роль прилегающего ядра в инициации пищевого поведения
заключается в растормаживании нейронов латерального гипоталамуса.
Активность дофаминергических входов к нейронам прилегающего ядра
обусловливает регуляцию таких процессов, как внимание и/или ожидание
получения пищи при пищевой мотивации.
19.1.4. Половая мотивация человека
Половая мотивация человека имеет многофакторную природу. Эта
мотивация не связана с изменением гомеостатических параметров внутренней
среды организма человека, а является в значительной степени результатом
научения человека, его индивидуального жизненного опыта. Основными
факторами, которые инициируют возникновение у человека половой
мотивации, являются генетически обусловленный половой диморфизм (от
греческого dimorphos — имеющий две формы) центральной нервной системы,
приобретенный в процессе индивидуальной жизни сексуальный опыт
общения с половым партнером и общая культура человека. Половая
мотивация не относится к первичным мотивациям, поскольку она не является
необходимой для выживания организма индивидуума. У человека половая
мотивация не обусловлена физиологическим состоянием внутренней
среды организма человека (уровень половых гормонов в плазме крови) и не
имеет прямой зависимости с депривацией (длительное отсутствие полового
партнера). В отличие от животных, у человека нормальное содержание
половых гормонов в плазме крови лишь усиливает степень проявления
половой мотивации, но не инициирует ее возникновение, а длительное
отсутствие полового партнера не заключает в себе угрозу жизни субъекта, как это
имеет место при пищевой депривации.
19.1.4.1. Генетические, социальные и психологические факторы возникновения
половой мотивации у человека
У человека половая мотивация возникает под влиянием полового
партнера, зрительных стимулов (картина или фильм эротического содержания),
запахов, исходящих от тела человека, или изделий парфюмерии, звуков
(например, ассоциирующихся с половым поведением) илй^других
стимулов (например, сексуальные фантазии), которые способны по типу
ассоциативного научения вызвать половое возбуждение у людей. Сексуальные
фантазии (например, воображение интимного общения с половым
партнером и др.) вызывают у людей обоего пола возникновение полового
возбуждения. Так, фактором половой мотивации могут быть мысли о сексуальной
привлекательности потенциального или реального полового партнера, что
характерно как для мужчин, так и для женщин. Половая самостимуляция
{мастурбация) относится к одному из факторов нередко практикуемой
половой активности у людей.
19. Мотивации и эмоции • 781
Половая ориентация человека. К фактору, оказывающему влияние на
возникновение половой мотивации у человека, относится половая
(сексуальная) ориентация. Половая ориентация человека обусловлена
генетическими, гормональными и социальными факторами. Основную роль в
возникновении половой ориентации у человека играет генетический фактор.
В частности, сексуальная ориентация человека взаимосвязана с половым
диморфизмом преоптического поля переднего гипоталамуса. У человека это
поле состоит из четырех групп нейронов и называется интертициальньши
ядрами переднего гипоталамуса (intestinial nuclei of the anterior hypothalamus —
INAH). Половой диморфизм связан с различием в нейронной организации
одной из ядерных групп NAH-3. Считается, что гетеросексуальная половая
ориентация мужчин обусловлена большим, примерно наполовину,
количеством нейронов TNAH-3, чем это имеет место у гетеросексуальных
женщин и гомосексуальных мужчин. Однако генетическая предопределенность
половой ориентации у мужчин и женщин относится к категории факторов,
предрасполагающих к гетеросексуальное™, бисексуальности или
гомосексуальности.
Половая ориентация человека проявляется в его желании вступить в
сексуальные взаимоотношения с половым партнером и отражает
направленность индивидуального полового влечения в отношении конкретного
полового партнера. Большинство индивидуумов имеют гетеросексуальную
ориентацию, которая проявляется в половом влечении к человеку
противоположного пола. Гомосексуальная ориентация человека выражается во
влечении индивидуума к партнеру того же пола, а бисексуальная — к
партнерам обоего пола.
Гетеросексуальность. Примерно половина женщин до вступления в брак
в период с 15 до 19 лет имеет гетеросексуальный опыт. Такой же опыт
имеет половина мужчин в возрасте до 18 лет, т. е. до вступления в брак, а
в возрасте 20 лет — гетеросексуальный опыт имеют порядка 88 % мужчин.
В период супружеской жизни возникновение половой мотивации у людей
имеет различную частоту. Так, 43 % супружеских пар занимаются сексом
несколько раз в месяц, 36 % — 2—3 раза в неделю. По мере увеличения
стажа супружеской жизни половая активность гетеросексуальных
партнеров постепенно снижается. Частота возникновения половой мотивации и
занятие сексом женатых мужчин и замужних женщин обусловлено также
внебрачными половыми связями. Тем не менее примерно 85 % замужних
женщин и 75 % женатых мужчин сохраняют верность своим супругам, и
возникновение у них половой мотивации обусловлено одним и тем же
половым партнером.
Получение удовольствия. Удовольствие относится к важному фактору,
инициирующему половую мотивацию у людей. Например, дети в возрасте
от 2 до 5 лет спонтанно дотрагиваются до своих гениталий, хотя в этом
возрасте у детей отсутствует какое-либо половое поведение. Тактильные
раздражения наружных половых органов у человека (при мастурбации или
половым партнером) являются для него источником приятных ощущений.
Самостимуляция органов чувств в области гениталий не связана с
репродуктивной функцией человека, а направлена на получение только чувства
удовольствия. Так, взрослые женщины довольно часто достигают
состояния оргазма не в результате движений пениса во влагалище, а за счет
стимуляции чувствительных окончаний тканей клитора, имеющей место при
половом акте.
Познавательный аспект. Мужчины и женщины выполняют различные
тендерные (половые) роли и поэтому по-разному объясняют одни и те же
782 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
факторы, инициирующие у них половую мотивацию. В частности, в
половой мотивации девушек доминирует романтический интерес, в то
время как у юношей половая мотивация обусловлена преимущественно
возможностью осуществления секса. Например, просмотр эротического
фильма, предназначенного для мужчин, вызывает у мужчин и женщин
примерно идентичное физиологическое возбуждение. Однако для мужчин
этот просмотр вызывает чувство полового возбуждения и положительные
эмоции, а у женщин, напротив, чувство отвращения и отсутствие
полового возбуждения. Если же эротический фильм предназначен для женщин,
то женщинам свойственны те же физиологические реакции, что при
просмотре «мужской эротики», но они к тому же испытывают чувство
полового возбуждения, интерес к фильму и положительные эмоции. Поэтому
возникновение у человека половой мотивации обусловлено тем, как
мужчина и женщина понимают эротический «смысл» воспринимаемых
раздражителей.
Влечение к другим людям — это еще один элемент половой мотивации,
обусловленный биологической природой человека и его воспитанием.
Человек от рождения испытывает влечение к окружающим. Способность
взрослого человека выбрать среди окружающих его людей полового
партнера обусловлена его общей культурой и научением.
Научение половому поведению оказывает существенное влияние на
половую мотивацию человека, поскольку человек запоминает и повторяет то,
что ему нравится и доставляет удовольствие. Для большинства людей
половая мотивация ассоциируется с вознаграждением (чувством
удовольствия). С другой стороны, человек стремиться избегать сексуального
поведения, которое приносит ему отрицательные результаты. Поэтому
ассоциативное научение напрямую влияет на половую мотивацию человека,
вызывая усиление или уменьшение ее проявлений. Так, горящая свеча может
стать причиной возникновения половой мотивации у человека, если этому
предшествовала сексуальная встреча, например в виде приятного
романтического ужина при свечах. У человека чрезвычайно выражено влияние
научения на половую мотивацию. Научение относится к ключевому
компоненту, предопределяющему половое влечение, познавательный интерес к
половому поведению, половую ориентацию и, наконец, уровень половой
мотивации человека.
Общая культура человека предопределяет присущее мужчине и женщине
поведение в обществе, а также, какое поведение подразумевает проявление
полового возбуждения. Культура человека приобретается в процессе
научения, поскольку без соответствующего научения индивидуум не сможет
освоить нормы культурного поведения мужчины и женщины. Например,
половое воспитание школьников и социальное равноправие мужчин и
женщин в обществе обусловливают примерно идентичное понимание
представителями обоего пола внешних проявлений половой мотивации людей.
Однако нормальное половое поведение человека, воспитанного на одной
культуре, может не оказывать возбуждающего влияния на человека другой
культуры. Что касается полового поведения, то отношение человека к его
проявлениям со стороны полового партнера обусловлено культурным
уровнем людей.
Роль феромонов в половой мотивации у человека. Феромонами (запахи)
называются химические стимулы, которые обусловливают
физиологические и поведенческие реакции человека (и, в большей степени, животных).
Роль феромонов заключается в повышении степени проявления половой
мотивации человека.
19. Мотивации и эмоции • 783
У человека феромоны продуцируются апокриновыми железами кожи,
их источником также являются микрофлора кожи в отдельных регионах
тела: подмышечные впадины, ротовая полость, ступни ног и гениталии.
Апокриновые железы кожи расположены преимущественно в области
гениталий, вокруг пупка, на грудной клетке, молочных железах, особенно
вокруг сосков. Различные типы желез расположены также в коже головы
вокруг волос. К мужским феромонам, содержащимся в секретах
апокриновых желез, относятся андростенон й андростенол. У человека имеет место
так называемый обонятельный половой диморфизм, который проявляется в
том, что женщины воспринимают андростенон при более низком пороге
концентрации в окружающем воздухе, чем мужчины. Однако восприятие
этого феромона женщинами уменьшает для них сексуальную
привлекательность мужчины. Напротив, восприятие андростенола женщинами
вызывает у них положительные эмоции, в результате чего увеличивается
сексуальная привлекательность мужчины. Восприятие феромонов
обонятельной системой увеличивает выброс гонадолиберина из нейронов
гипоталамуса, что в свою очередь, повышая импульсную секрецию лютропина/
фоллитропина или тестостерона, может усиливать инициацию полового
возбуждения человека.
На пике овуляции у женщин возникает максимум остроты и
чувствительности восприятия мужских феромонов. Это обусловлено тем, что
обонятельная система женщин в этот период под влиянием повышенной
концентрации в плазме крови эстрогенов и лютропина становится наиболее
чувствительной к феромонам. У женщин феромоны содержатся в
вагинальном секрете. Однако запах этого секрета вызывает как у мужчин, так и
у женщин, как правило, неприятные субъективные ощущения и может
негативно влиять на половую мотивацию. В целом феромоны обусловливают
индивидуальный запах тела человека, который позитивно либо негативно
может влиять на половое поведение людей.
Зрительные стимулы, возникающие при зрительном восприятии
полового партнера, рассматривании эротической картины или просмотре фильма
аналогичного содержания, вызывают наиболее сильные проявления
половой мотивации у человека, особенно у мужчин. У мужчин более
выраженная активация структур миндалевидного комплекса, как ключевой
структуры системы удовольствия мозга человека, возникает при рассматривании
красивого женского лица, чем при рассматривании изображения мужского
лица. Мужчины чаще, чем женщины, просматривают порнографические
материалы. Просмотр фильмов с сексуальной тематикой активирует у
мужчин области ассоциативной коры головного мозга, которые
выполняют основную функцию в возникновении половой мотивации у человека:
нижняя височная область ассоциативной зрительной коры, правая орби-
тофронтальная кора, левая передняя поясная кора.
У женщин половая мотивация формируется преимущественно под
влиянием психологических (психогенных) стимулов: романтические слова,
картины и темы из фильмов или историй, следовательно, при участии
зрительных и слуховых ассоциативных областей коры головного мозга.
Основную триггерную роль в увеличении степени полового
возбуждения и инициации полового поведения человека (особенно у женщин)
играет стимуляция рецепторов кожи, прежде всего так называемых
эрогенных зон (рецептивные зоны тканей гениталий) как у мужчин, так и у
женщин при непосредственном общении с половым партнером.
784 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
19.1.4.2. Роль половых гормонов в модуляции половой мотивации человека
Количество женских и мужских половых гормонов в плазме крови
увеличивает или уменьшает у человека степень половой мотивации,
формирующейся под влиянием познавательных и социальных факторов (см. ранее).
У женщин половое влечение увеличивается в предменструальный период,
что обусловлено увеличением концентрации эстрогенов и прогестерона в
плазме крови. Изменения в степени субъективного полового возбуждения
полностью отсутствует у женщин, принимающих оральные
контрацептивы, поскольку в этих условиях в их плазме крови поддерживается
относительно постоянный уровень женских половых гормонов.
У мужчин степень проявления половой мотивации в большей степени,
чем у женщин, зависит от содержания мужских половых гормонов в
плазме крови. Основную роль в усилении половой мотивации у мужчин
выполняет мужской половой гормон тестостерон. Физиологический эффект
тестостерона на половую мотивацию у мужчин зависит от пороговой
концентрации гормона в плазме крови, выше которой он не вызывает
дополнительное увеличение степени половой мотивации. Механизм усиления
половой мотивации у мужчин под влиянием тестостерона в меньшей
степени обусловлен стимулирующим действием гормона на нейроны структур
гипоталамуса, а в большей — стимулирующим эффектом гормона на
нейроны центра эрекции спинного мозга в сегментах Su—S[V (рис. 19.1).
Стероидные гормоны повышают активность нейронов мозга двумя путями:
1. Гормоны увеличивают возбудимость мембраны нейронов и ее
чувствительность к нейротрансмиттерам, а также стимулируют высвобождение
нейротрансмиттеров. Это обусловлено тем, что стероидные гормоны,
прямо связываясь с мембранными рецепторами, увеличивают активность
ионных каналов и рецепторов к нейротрансмиттерам (например, тормозных
Непрямое действие Прямое действие
. Пресинаптическое
Эстрогеновый У/"'Г ^V\A/"T*/ окончание
рецептор \^р^^ ВмГа-^ Постсинаптический
шипик
Дендрит ()
%Тело нейрона
Ядро нейрона
Рис. 19.1. Пути увеличения возбудимости и метаболической активности нейронов
гипоталамуса и сакральных сегментов спинного мозга стероидными гормонами.
Стероидные гормоны изменяют синтез медиаторов и их высвобождение из пресинаптических
окончаний, а также могут связываться с рецепторами медиаторов на постсинаптической
мембране (прямое действие). В результате прямого действия стероидных гормонов на нейроны
мозга изменяется их возбудимость и функциональная активность, например в гипоталамусе и
сегментах спинного мозга (S,,—S,v), что обусловливает формирование физиологического
уровня половой мотивации. Непрямое действие стероидных гормонов на нейроны мозга человека
осуществляется через цитоплазматические или ядерные рецепторы. При этом функции
нейронов мозга регулируются стероидными гормонами в течение длительного времени (минуты или
часы). У женщин варьирование концентрации половых гормонов в плазме крови способно
изменять степень половой мотивации на протяжении менструального цикла, а у мужчин эффект
проявляется в постоянстве половой мотивации, если концентрация тестостерона в плазме
крови достигает порового уровня.
19. Мотивации и эмоции • 785
ГАМКА рецепторов). 2. Стероидные гормоны, проникая внутрь нейронов и
связываясь со специфическими типами стероидных рецепторов
цитоплазмы и ядра, могут усиливать или тормозить транскрипцию специфических
генов в ядре нейронов, обусловливая их метаболическую реакцию на
протяжении многих минут и часов. В результате кастрации у мужчин и
вызванного этим снижения содержания тестостерона ниже порогового
уровня примерно наполовину уменьшаются длина дендритов и размер поля
нейронов в спинальном центре эрекции, что приводит к нарушению
иннервации гладких мышц артерий кавернозных тел пениса и прекращению
эрекции. Снижение концентрации тестостерона в плазме крови у мужчин
в результате кастрации вызывает периодическое уменьшение и даже
исчезновение половой мотивации, однако сексуальный интерес к женскому
полу у таких мужчин сохраняется постоянно.
Усиление половой мотивации у человека под влиянием тестостерона не
связано с полом. Так, у женщин после хирургического удаления яичников
уменьшается степень половой мотивации. Однако введение тестостерона
таким женщинам увеличивает степень полового возбуждения, инициирует
сексуальные фантазии, т. е. усиливает половую мотивацию.
19.1.4.3. Стадии полового возбуждения у человека при половой мотивации
Проявления полового возбуждения у мужчин и женщин в основном
идентичны и зависят от приемов половой стимуляции при мастурбации,
взаимных ласках или половом акте. Сексуальный ответ мужского и женского
организмов при половой мотивации состоит из стадий возбуждения, плато,
оргазма и разрешения.
Стадия возбуждения в мужском и женском организме характеризуется
быстрым увеличением полового возбуждения, при котором возрастают
частота сердцебиений, кровяное давление и параметры дыхания. У мужчин
стадия полового возбуждения инициируется в основном под влиянием
сексуальных зрительных стимулов, которые активируют структуры
зрительной ассоциативной зоны нижней височной коры. Мотивационные и
эмоциональные феномены при половом возбуждении (равно как и при
других мотивациях) при зрительном восприятии сексуальных
раздражителей активируют правую глазолобную кору. Аффективные (чувственные)
реакции организма на сексуальные стимулы обусловлены активностью
левой передней поясной коры, которая активирует проявление эндокринных
и вегетативных реакций организма при половом возбуждении. Зрительное
и соматосенсорное восприятие проявлений полового возбуждения у
мужчин (частое сердцебиение, эрекция пениса и др.) обусловлены активацией
нейронов островковой коры правого полушария. У мужчин в стадию
возбуждения активируются парасимпатические нейроны сегментов S„—S,v,
сигналы от которых достигают нервных терминалей волокон и при
участии оксида азота вызывают расслабление гладких мышц артерий
кавернозных тел и губчатого вещества уретры, обусловливая эрекцию пениса.
Парасимпатические импульсы стимулируют секрецию уретральными и
бульбоуретральными железами слизи, которая способствует движению
пениса во влагалище.
У женщин тактильное раздражение рецепторов тканей клитора и
активация соматосенсорной системы вызывает более быстрое нарастание
степени полового возбуждения, чем тактильное раздражение слизистой
оболочки влагалища или рецепторов других областей тела. Половые реакции в
организме женщин в стадию возбуждения проявляются в некотором увели-
786 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
чении молочных желез, набухании сосков и половых губ, увеличении
размеров клитора, увлажнении (любрикация) слизистой оболочки влагалища.
Любрикация влагалища обусловливается усилением кровотока в его тканях
и увеличением секреции слизи батролиниевыми железами за счет
расслабления гладких мышц артерий вазоактивным интенстинальным пептидом.
Этот гормон вызывает расслабление гладких мышц артерий кавернозных
тел клитора и его эрекцию.
Стадия плато. При продолжающейся непрерывной половой
стимуляции (мастурбация, половой акт) у мужчин и женщин быстрое увеличение
степени полового возбуждения сменяется более медленным ростом
частоты сердцебиений, кровяного давления и параметров дыхания (стадия
плато). У женщин в фазу плато головка клитора выступает над окружающими
тканями, что усиливает тактильное раздражение его рецепторов
мастурбацией или движениями пениса. Стенка влагалища из-за нарастающего
кровенаполнения становится более плотной.
Прекращение половой стимуляции в стадии возбуждения и плато
уменьшает степень полового возбуждения как у женщин, так и у мужчин.
Стадия оргазма. У мужчин и женщин стадия оргазма длится несколько
секунд, во время нее половое возбуждение достигает максимума и затем
резко прекращается. Основной физиологической реакцией у мужчин в
фазу оргазма является эякуляция 3—4 мл спермы, содержащей 300—500 млн.
сперматозоидов, из которых только несколько тысяч достигнут
фаллопиевых труб и лишь один сперматозоид будет участвовать в оплодотворении
яйцеклетки. В женском организме стадия оргазма, которая проявляется в
виде ритмических сокращений гладких мышц влагалища, характеризуется
значительной вариабельностью по интенсивности и длительности. Так,
некоторые женщины способны на протяжении относительно длительного
времени продолжающегося полового акта неоднократно достигать стадии
оргазма. Напротив, мужчины способны достигать следующей стадии
оргазма лишь по прошествии некоторого времени после предыдущего.
При половом возбуждении, особенно в стадию оргазма, у людей в
плазме крови в 3—4 раза повышается концентрация окситоцина, которая
сохраняется и после оргазма. У мужчин гормон стимулирует процесс
семяизвержения, а у женщин — сокращение гладких мышц фаллопиевых труб,
что способствует продвижению спермы в направлении яичников. Эффект
окситоцина на половое возбуждение человека зависит от его количества в
плазме крови. При невысокой концентрации окситоцина в плазме крови
гормон увеличивает половое возбуждение, а при высокой концентрации,
напротив, угнетает его. Механизм действия гормона связан с активацией
окситоциновых рецепторов на мембране нейронов ядер вентромедиально-
го гипоталамуса.
Оргазм является кульминацией полового возбуждения человека. В этот
момент человек испытывает ощущение полового наслаждения, которое
обусловлено активацией нейронных кругов систем удовольствия мозга
(описано ниже). Наиболее интенсивное сексуальное чувство возникает во
время семяизвержения (эякуляции) у мужчин и сокращения гладких мышц
матки у женщин. Одновременно у человека увеличивается напряжение
скелетных мышц и возникает их спазм, увеличиваются частота
сердцебиений, артериальное давление, уровень в плазме крови норадреналина (все
физиологические реакции обусловлены увеличением активности
симпатической нервной системы). Во время оргазма в плазме крови повышается
содержание пролактина, концентрация которого сохраняется на
повышенном уровне в течение 30—60 мин, а также лютропина и тестостерона. Счи-
19. Мотивации и эмоции • 787
тают, что механизм стимуляции секреции гормонов, в частности пролакти-
на, обусловлен стимуляцией рецепторов тканей половых органов,
импульсы от которых направляются в преоптическое поле гипоталамуса.
Увеличение содержания стероидных гормонов в плазме крови повышает
возбудимость мембраны нейронов гипоталамуса и спинальных центров эрекции.
Например, у мужчин в результате повышения возбудимости нейронов
медиального преоптического поля гипоталамуса уменьшается латентный
период времени наступления эякуляции у мужчин во время полового акта.
Стадия разрешения. После оргазма у человека снижается половое
возбуждение, при этом нормализуются частота сердцебиений и параметры
дыхания. У мужчин прекращается эрекция пениса, и в течение некоторого
времени не возникает повторное половое возбуждение на половую
стимуляцию (рефрактерный период). У женщин в стадию разрешения также
нормализуются параметры частоты сердцебиения, дыхания, но отсутствует
рефрактерный период инициации повторного полового возбуждения.
19.1.4.4. Нервная регуляция половой мотивации у человека
Проявление половой мотивации человека регулируется тремя нейронными
сетями ЦНС, которые интегрируют гормональную, сенсорную и
познавательную информацию.
1. Роль спинного мозга и ствола мозга в проявлении полового возбуждения
у человека. Активация парасимпатических и симпатических структур
спинного мозга при половом возбуждении регулирует у мужчин вегетативные
половые реакции во время стадий возбуждения и оргазма (эрекция
пениса, выброс жидкости из бульбоуретральных желез, эякуляция), а у
женщин — набухание сосков, эрекция клитора, усиление кровенаполнения
тканей полового тракта и любрикация влагалища при участии бартоли-
ниевых желез.
Активность спинальных нейронных сетей при половом возбуждении
регулируется нейронами центрального серого вещества вокруг сильвиева
водопровода, которые являются основной непроизвольной двигательной
системой ствола мозга. Нейронами центрального серого вещества вокруг
сильвиева водопровода активируют нейроны позадилицевых ядер
продолговатого мозга, а далее симпатические преганглионарные нейроны
боковых рогов спинного мозга, обусловливая сердечно-сосудистые реакции при
половом возбуждении (увеличение артериального давления и частоты
сердцебиений). Центральное вещество через нейроны позадиобоюдного
ядра продолговатого мозга регулирует активность мотонейронов, иннерви-
рующих мышцы гортани, глотки, мягкого неба и экспираторные мышцы,
обусловливая регуляцию артикуляции при половом возбуждении. Нейроны
центрального серого вещества вокруг сильвиева водопровода через
вентральные каудальные отделы моста (норадренергические ядра моста)
повышают в целом активность симпатической нервной системы при половом
возбуждении. При участии дофаминергической системы мозга (медиальная
покрышка ствола мозга) и центрального серого вещества при половом
возбуждении у человека снижается возбудимость нейронов дорсальных рогов
спинного мозга, при участии которых в ЦНС передаются болевые
сигналы.
Наконец, нейроны центрального серого вещества вокруг сильвиева
водопровода среднего мозга проецируют свои аксоны к нейронам ядер
ретикулярной формации ствола мозга, которые, в свою очередь, синаптически
активируют мотонейроны спинного мозга через ретикулоспинальный
788 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
тракт, обусловливая проявление локомоторных реакций при половом
возбуждении.
2. Роль миндалины в проявлении полового возбуждения человека. При
половом возбуждении (мастурбация, взаимные ласки, слуховые и обонятельные
стимулы, половой акт) нейроны базолатеральной области миндалины
получают сенсорные сигналы всех модальностей (зрительной, соматосенсор-
ной, слуховой, обонятельной), что непосредственно обусловливает степень
полового возбуждения человека. Пресинаптические окончания на
нейронах центрального ядра миндалины являются тормозными и высвобождают
ГАМК. Эфферентным выходом миндалины является ее центральное ядро,
нейроны которого проецируют свои аксоны к нейронам центрального
серого вещества вокруг сильвиева водопровода.
Миндалина в регуляции половой мотивации человека обеспечивает
инициацию и степень проявления полового возбуждения через структуры
гипоталамуса и ствола мозга. Медиальное преоптическое — переднее гипо-
таламическое поле регулирует латентный период времени проявления
эякуляции у мужчин во время полового акта. Так, билатеральное разрушение
этого отдела гипоталамуса у животных увеличивает латентный период
эякуляции, а электрическая стимуляция, напротив, уменьшает количество
движений (интромиссий) пениса во влагалище, в результате которых
возникает семяизвержение.
Нейроны вентромедиального гипоталамического ядра имеют на
мембране высокую концентрацию стероидных рецепторов. Это обусловливает
степень полового возбуждения индивидуумов под влиянием повышенного
содержания стероидных гормонов в плазме крови при половом поведении.
3. Роль лимбической системы мозга в регуляции половой мотивации.
Высший уровень регуляции половой мотивации, как и других форм мотиваци-
онного поведения, осуществляется при участии системы удовольствия
мозга: мезолимбическая система мозга, или лимбическая кора (описана выше).
При этом мотивационные эффекты эмоционально значимых стимулов
осуществляются при участии вентральной части полосатых тел, а именно
нейронных кругов прилегающего ядра (п. accumbens). Структуры
прилегающего ядра при любом виде мотивации, в том числе и половой,
осуществляют взаимодействие между лимбической и двигательной системами
мозга, что обеспечивает проявление сексуально ориентированного
поведения, ассоциирующегося с чувством удовольствия. Ключевой структурой
прилегающего ядра, обусловливающей появление у человека чувства
удовольствия при половом возбуждении (стимуляция рецепторов эрогенных
зон, стадия оргазма полового возбуждения), являются нейроны ракушки,
имеющие на своей мембране опиоидные рецепторы. Опиоид-зависимая
активация нейронов ракушки прилегающего ядра при половом
возбуждении происходит под влиянием импульсов, поступающих из отделов корко-
во-стриато-паллидо-таламо-корковой нейронной «петли», гиппокампа и
глазолобной коры. Проекции дофаминергической системы мозга к
нейронам ракушки прилегающего ядра играет основную роль в усилении
внимания к сексуальной стимуляции различной модальности.
Передняя поясная кора, как часть лимбической системы мозга,
расположена на медиальной поверхности лобных долей (префронтальная кора).
Структуры передней поясной коры интегрирует информацию от
различных входов — мотивации, познавательные процессы и эмоции. В
комплексе с другими отделами мозга осуществляет направленность произвольного
внимания человека на сексуальные стимулы различной модальности
(зрительные, слуховые, тактильные, обонятельные), что обусловливает ини-
19. Мотивации и эмоции • 789
циацию и увеличение степени полового возбуждения человека. У человека
передняя поясная кора всегда активируется при эмоциях (см. ниже),
которые увеличивают степень полового возбуждения человека.
19.2. Эмоции
Слово эмоция происходит от латинского глагола movere, означающего
двигаться. Это означает, что люди всегда реагируют на происходящие вокруг
них события, например, усилением сердцебиений, возбуждением
организма, прекращением деятельности (упадок сил), потоотделением, например
на коже ладоней, напряжением или расслаблением скелетных мышц;
покраснением или моментальной бледностью лица, нахмуренными бровями
или улыбкой. Наряду с этим подавляющее большинство людей
испытывали чувство счастья, например после успешной сдачи экзамена, либо
страдания — при потере любимого человека, или гнева — при
несправедливости. Люди испытывают удовольствие от общения с друзьями, занятия
спортом, в том числе его экстремальными видами, либо испытывают
смущение при поломке взятой у кого-то вещи. Независимо от причин всех
этих чувств, субъективное переживание смысла событий относятся к
категории эмоций.
Чувства, которые посредством физиологических и/или познавательных
процессов изменяют целенаправленное поведение людей, называются
эмоциями. Эмоции проявляются у человека на самых ранних этапах его
жизни, а именно до развития речи. Так, плачущий ребенок быстро обращает
на себя внимание взрослых людей, и они оказывают ему необходимую
помощь и заботу. Жизнерадостный и улыбающийся ребенок вызывает у
взрослых людей чувство заботы и любви. Субъективные проявления
эмоций в интонации голоса человека, выражениях его лица, жестах или позе
изменяет поведение других людей. Так, крик человека при страхе может
вызвать панику у окружающих его людей, а улыбка, напротив, успокоить
испуганных людей. Эти реакции человека обозначают общим понятием
эмоции.
19.2.1. Виды эмоций
Французский ученый, философ-дуалист Р. Декарт (XVII век) описал у
человека шесть базовых, или фундаментальных, эмоций: восхищение, любовь,
ненависть, страсть, радость и страдание. Все эти эмоции Р. Декарт считал
положительными, включив в перечень любовь. В XX веке
классифицировалось семь базовых эмоций: страх, гнев, счастье, ярость, страдание,
отвращение, удивление. В психиатрии и социальной психологии
распространена классификация социальных эмоций, включающая эмоции вины,
гордости, смущения, стыда, материнской любви, сексуальной любви,
увлеченности, восхищения и ревности.
С учетом реакций мимической мускулатуры лица человека или
мимических выражений лица, возникающих при эмоциях, их перечень был
расширен до десяти: интерес, наслаждение, удивление, страдание, гнев,
отвращение, стыд, страх, презрение и вина. Поскольку каждая из перечисленных
эмоций характеризуется однотипным выражением лица у людей, эмоции
были названы базовыми, или врожденными, эмоциями (рис. 19.2). Лицо
человека уникально тем, что из 44 мышц этой области тела — двигательная
функция 40 мышц обусловливает выражение лица при базовых эмоциях, и
только 4 — участвуют в жевательной функции.
790 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
Рис. 19.2. Примеры базовых эмоций человека.
Реакции мимической мускулатуры лица при эмоциях у всех людей проявляется сходными
выражениями лица при одной и той же эмоции: нейтральное выражение лица (1), эмоция
счастья (2), испуг (3), отвращение (4), гнев (5), страх (6), печаль (7).
Эмоции характеризуются интенсивностью, направленностью, качеством
и осознанием. Под интенсивностью эмоций подразумевается, прежде
всего, их выраженность или сила; направленность эмоций связана с их
знаком, т. е. положительная или отрицательная эмоция. К отрицательным
эмоциям относят гнев, страх, страдание и отвращение. Отрицательные
эмоции могут оказывать негативное влияние на отношения между людьми,
препятствовать принятию правильного решения при целенаправленном
поведении. Например, эмоция страха, вызываемая одними и теми же
факторами внешней среды, может стать причиной так называемой фобии
(синоним — боязнь) у человека. Качество эмоций обусловлено степенью
интеллектуального развития человека, т. е. его умственными способностями,
а осознанность эмоций подразумевает, осознает или нет субъект наличие у
него самого или у другого человека эмоций. Эти проявления эмоций
различаются по степени, с которой они воздействуют на индивидуума.
19.2.2. Роль эмоций в поведении человека
В наиболее общей форме роль эмоций характеризуется следующим
образом. Эмоции активируют функции вегетативной и эндокринной систем и
этим способствуют реализации целенаправленного поведения человека
(активационная роль). Отрицательные эмоции, которые возникают при
неприятных болевых ощущениях, приводят к тому, что человек стремится их
предотвратить или избежать возникновения (регулирующая роль).
Подкрепляющая роль эмоций в процессе накопления человеком индивидуального
жизненного опыта усиливает (положительные эмоции) либо снижает (от-
19. Мотивации и эмоции • 791
рицательные эмоции) социальную активность человека. Эмоции человека
проявляются в жестах, мимике лица либо интонации слов и, таким
образом, через эти внешние проявления могут изменить поведение
окружающих его людей {коммуникативная роль). Социальная роль эмоций регулирует
социальные взаимодействия между людьми, способствуя формированию
таковых с одними людьми и игнорирование взаимодействия с другими.
Например, положительные эмоции влияют на привязанность родителей к
своим детям и наоборот, и поэтому они являются важным механизмом
развития внутрисемейных отношений. Познавательная роль эмоций
заключается в том, что эмоции повышают эффективность памяти человека. При
этом мозг человека запоминает не только поведенческие действия, но и
сопутствующие им эмоции.
19.2.3. Нейрофизиологические механизмы проявления эмоций
Проявление эмоций обусловлено активностью, прежде всего, лимбической
системы мозга.
19.2.3.1. Гипоталамус как центр регуляции вегетативных и эндокринных
реакций организма при эмоциях
Гипоталамическая регуляция вегетативных и эндокринных проявлений
при эмоциях осуществляется двумя областями: перифорникальной
областью и медиальной частью латерального гипоталамуса, которая нередко
называется гипоталамическим полем, регулирующим эмоциональные
реакции; паравентрикулярными ядрами гипоталамуса, которые состоят из
взаимодействующих между собой популяции нейронов, и также
регулируют вегетативные и эндокринные реакции организма человека при эмоциях
При эмоциях интегративная функция латерального гипоталамуса в
регуляции вегетативных и эндокринных реакций организма обусловлена тем,
что гипоталамус состоит из специфических нейронных сетей, каждая из
которых обусловливает возникновение одного из конкретных видов
целенаправленного мотивационного поведения — пищевого, питьевого или
репродуктивного. Функциональные состояния голода, жажды и половой
активности возникают и усиливаются под влиянием пептидных гормонов,
которые выделяются из окончаний нервных волокон нейронов
гипоталамуса. Гипоталамические нейроны передают сигналы к вентральным кау-
дальным отделам моста и медиальной покрышке ствола мозга, которые
обусловливают общий уровень активации симпатических преганглионар-
ных нейронов боковых рогов спинного мозга. В результате активации
симпатической нервной системы под влиянием гипоталамуса постганглионар-
ные симпатические нервные волокна высвобождают биогенные амины —
норадреналин и адреналин. Эти гормоны оказывает диффузное и
длительное активирующее влияние на функцию различных систем организма,
вызывая увеличение частоты сердцебиений, рост артериального давления,
увеличение частоты и глубины дыхательных движений, расширение
зрачков, увеличение уровня сахара в крови, снижение произвольного контроля
мочеиспускания и дефекации, блокаду слюноотделения и выброс гормонов
в кровь при эмоциях.
Паравентрикулярные ядра гипоталамуса при эмоциях регулируют
секрецию гормонов гипофиза, щитовидной железы, паращитовидных желез,
коры надпочечников и клеток островков Лангерганса поджелудочной
железы. Так, при отрицательных эмоциях у человека при участии гипоталамо-
792 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
гипофизарно-надпочечниковой оси активируется секреция кортизола,
обусловленная избыточной секрецией кортикотропина или кортиколиберина.
Эти эндокринные реакции возникают в результате понижения секреции
тиреолиберина и тиреотропина, а также снижения чувствительности а2-ад-
ренорецепторов нейронов гипоталамуса к гормону роста, что характерно
для состояния депрессии (эмоциональной подавленности) у человека.
19.2.3.2. Роль миндалины в осуществлении базовых эмоций
Нейроны центрального ядра миндалины непосредственно активируют ядра
латерального гипоталамуса. В результате в организме человека возникают
как вегетативные (симпатические), так и эндокринные реакции при
эмоциях.
Миндалина занимает довольно ограниченный участок мозга в височных
долях переднего мозга. Однако при ее повреждении у человека ухудшается
восприятие эмоций, снижается запоминание эмоций, возникает скудность
эмоциональных выражений лица, снижается память на эмоциональные
события.
Миндалина является входом в сложную нейронную сеть, состоящую из
ядер различных отделов головного мозга, которые обусловливают
возникновение эмоций. Миндалина получает поток афферентных нервных
импульсов от каждой из основных сенсорных систем ЦНС и от
ассоциативных областей коры головного мозга (таламо-кортико-миндалевидные
пути). Сенсорные сигналы миндалина получает непосредственно от ядер та-
ламуса (таламо-миндалевидные пути). Поэтому нейроны миндалины
человека активируются на различные стимулы: при вознаграждении и
наказании в ходе целенаправленного поведения человека, при восприятии им
социально значимых стимулов, при прослушивании приятной музыки,
рассматривании картины, при слуховом восприятии смеха или плача.
Таламо-миндалевидные пути ответственны за формирование эмоций
через короткий промежуток времени после действия на организм
раздражителей внешней среды, таких как громкий звук, свет. Таламо-кортико-
миндалевидные пути, которые являются полисинаптическими и мультимо-
дальными, обусловливают медленное развитие эмоций. Сложный поток
информации, который поступает в миндалину по этим путям, играет
важную роль в понимании человеком эмоций, возникающих под влиянием
различных стимулов внешней среды. Поэтому сложные раздражители,
возникающие, например, при рассматривании картины, вызывают эмоции
под влиянием информации, поступающей в миндалину по таламо-корти-
ко-миндалевидному пути, а простые индифферентные стимулы вызывают
эмоции путем прямой активации миндалины через ядра таламуса.
Миндалина состоит из нескольких субъядерных популяций нейронов,
которые сгруппированы в цитоархитектонические и функциональные
единицы. Две такие единицы миндалины участвуют в контроле эмоций и
представлены базолатеральной областью миндалины, включающей
латеральное, базальное и добавочное ядро, а также центральным ядром.
Большинство сенсорных входов от ядер таламуса конвергирует на
нейронах латерального ядра миндалины, а от высших отделов головного
мозга — на нейронах базального ядра (рис. 19.3). Эти два ядра представляют
собой входные ворота для сенсорной и когнитивной (познавательной)
информации, под воздействием которой возникают эмоции. При этом базо-
латеральная область миндалины имеет обширные реципрокные проекции
с лобной корой, мультимодальными отделами коры головного мозга. Ней-
19. Мотивации и эмоции • 793
Сенсорные
входы
I
Первичная
зрительная
кора
Первичная
слуховая
кора <
Сомато-
сенсорная
кора
Ассоциативная кора
(височные доли)
Ядра вкусовой и
висцеральной
чувствительности
продолговатого
мозга
Гиппокамп
Гипоталамус,
средний мозг,
мост,
продолговатый
мозг
Гипоталамус
Серое вещество вокруг
сильвиеаа водопровода
Обонятельный
мозг
Вентральный
отдел
стриарных тел
Дорсомедиальное
ядро таламуса
Рис. 19.3. Афферентные входы и выходы, а также связи между отделами
миндалины.
Базовые эмоции могут формироваться при участии нескольких нейронных сетей миндалины.
Это достигается за счет последовательной и параллельной организации нейронных сетей и
аналогичной (последовательной и параллельной) обработки сенсорной информации (слева от
рисунка). Эфферентным выходом миндалины является центральное ядро, при участии
которого обеспечивается взаимодействие нейронных сетей миндалины с различными структурами
мозга (справа от рисунка), которые непосредственно или опосредованно регулируют
вегетативные и эндокринные реакции при эмоциях.
роны латеральных и базальных ядер миндалины посылают сигналы,
прежде всего, к нейронам центрального ядра. Центральное ядро миндалины
имеет стриарное строение, благодаря которому от строго определенных
популяций нейронов начинается большинство эфферентных проекций
миндалины. Эти проекции активируют структуры головного мозга,
обусловливающие формирование в организме вегетативных и двигательных
реакций при эмоциях.
В нейронных сетях миндалины на основе оценки поступающей
сенсорной информации возникают специфическая базовая эмоция и характерные
для нее вегетативные и двигательные реакции. Так, в случае «опасности»
для жизнедеятельности организма воздействий внешней среды возникает
эмоция страха — это либо затаивание и мышечная дрожь, либо бегство от
опасности для жизни человека.
От центрального ядра миндалины начинаются проекции нейронов,
которые достигают ядер ствола головного мозга, в частности нейронов
центрального серого вещества вокруг сильвиева водопровода (рис. 19.4).
Центральное серое вещество относится к основной моторной системе мозга,
которая контролирует непроизвольные двигательные реакции при
эмоциях, например реакции крика, смеха и гнева, формируя так называемую
эмоциональную двигательную систему.
Нейроны центрального серого вещества контролируют двигательные
реакции при агрессивном (эмоция гнева) и защитном поведении (эмоция
Серое вещество вокруг сильвиева водопровода
Вентральная часть каудального отдела моста и
медиальная покрышка продолговатого мозга
Симпатические преганглионарные
нейроны боковых рогов спинного
мозга
Общий уровень симпатической
активности
Сенсорные нейроны
дорсальных рогов
спинного мозга
Ноцицептивный
контроль
Мотонейроны и
премоторные
интернейроны
вентральных рогов и
промежуточнойзоны
сегментов спинного
мозга
Локомоция
N. subretrofacialis
r I
Симпатические
преганглионарные
нейроны боковых
рогов спинного мозга
Сердечно-сосудистые
эффекты
N. retroambiguus
Т
Мотонеироны мышц
гортани, глотки, мягкого
неба, экспираторных
мышц
I
Речь
Парасимпатические
преганглионарные
нейроны сакральных
сегментов спинного мозга
Мочеиспускание
Сегменты спинного мозга
Мотонейроны VII и VII
пластины по Рекседу
Защитная поза
Грудные сегменты Т,—~Г„
Преганглионарные
симпатические нейроны
Расширение зрачков
Рис. 19.4. Роль нейронов центрального серого вещества вокруг сильвиева водопровода в регуляции вегетативных и моторных
реакций при эмоциях.
Нейроны центрального серого вещества получают информацию от ядер гипоталамуса, ядра дна терминальных полосок и миндалины,
обусловливая регуляцию базовых реакций, таких как агрессивное, защитное или репродуктивное поведение. Действиям сопутствуют эмоции, которые
состоят из специфических соматических и вегетативных реакций. Так, при агрессивном поведении (эмоция ярости) активируется речевая функция
(через п. retroambiguus), увеличивается артериальное давление (п. subretrofacialis), понижается порог болевой чувствительности (вентральная
покрышка моста и продолговатого мозга), расширяются зрачки (преганглионарные нейроны Ti—Тп).
19. Мотивации и эмоции • 795
страха), которые чрезвычайно важны для сохранения жизни индивидуума.
Каждая из этих реакций состоит из комплекса специфической
двигательной активности и регулируется определенной нейронной сетью
центрального серого вещества.
Активация при эмоциях нейронов вентролатеральной части
центрального серого вещества вокруг сильвиева водопровода вызывает снижение
двигательной активности (пассивность или неподвижность), гипотензию,
брадикардию и опиоид-зависимую аналгезию. Активация системы
обезболивания мозга сигналами, поступающими в центральное серое вещество,
тормозит болевые импульсы, входящие в ЦНС через периферические
нервы, и снижает степень воздействия боли на человека, а также реакции
организма на болевые воздействия.
При защитной реакции, такой как бегство (эмоция страха),
активируются нейроны латерального отдела серого вещества вокруг сильвиева
водопровода. При этом происходит повышение артериального давления,
возникает тахикардия, способствующие усилению кровообращения скелетных
мышц при бегстве.
Нейроны центрального серого вещества вокруг сильвиева водопровода
регулируют двигательную активность через интернейронные группы
клеток (п. reteofacialis, n. retroambiguus). Так, нейроны задней части обоюдных
ядер продолговатого мозга, иннервируют мышцы верхних дыхательных
путей и гортани и, таким образом, влияют на артикуляцию человека при
эмоциях. Под влиянием нейронов центрального серого вещества вокруг
сильвиева водопровода активируется рефлекс мочеиспускания, например
при эмоции страха.
Эфферентный выход центрального ядра миндалины проецируется к
таким структурам ствола мозга, как пневмотаксический центр моста
(увеличение частоты дыхания), нейроны голубого пятна (увеличивают
настороженность), дофаминергическое поле вентральной покрышки мозга
(поведение, обусловленное мотивациями), дорсальное двигательное ядро
блуждающего нерва (изменение парасимпатической активности), ядра
ретикулярной формации ствола мозга (общая активация мозга), а также нейроны
тройничного нерва (мимическое выражение лица при эмоциях).
Роль миндалины в формировании базовых эмоций осуществляется при
участии последовательного и параллельного механизмов взаимодействия ее
структур с афферентными входами и эфферентными выходами.
Последовательный механизм осуществляется путем взаимодействия сенсорных
входов первоначально с нейронами базолатерального ядра миндалины. Затем
сигналы от нейронов базолатерального ядра миндалины поступают к
нейронам центрального ядра, а далее — к структурам-мишеням ствола мозга.
Параллельные механизмы функционирования миндалины при
возникновении базовых эмоций осуществляются нейронными сетями
базолатерального и центрального ядер миндалины. Нейронные сети базолатерального и
центрального ядра миндалины участвует в формировании эмоций при
помощи раздельных афферентных и эфферентных путей. При этом базолате-
ральное ядро миндалины получает сенсорные входы непосредственно из
таламуса и коры головного мозга. Далее проекции нейронов направляются
к структурам вентрального отдела стриарных тел базальных ганглиев
(регуляция эмоционального выражения лица), к префронтальной коре
(передняя поясная извилина, латеральная и медиальная орбитальная кора, лим-
бическая кора), а также к зрительной затылочной и височной коре,
обусловливая эмоции при познавательной деятельности человека.
Центральное ядро получает прямые сенсорные входы из таламуса и коры головного
796 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
мозга и независимо от функции базолатерального ядра миндадины
увеличивает через ядра латерального гипоталамуса активность симпатической
нервной системы, структур промежуточного мозга и ствола мозга,
обусловливая вегетативные и соматические проявление базовых эмоций.
В целом, каждая фундаментальная эмоция осуществляются в
соответствии с жесткой программой конкретной нейронной сети миндалины,
реализация которой обусловливает эмоциональное выражение лица человека.
19.2.3.3. Регуляция положительных эмоций у человека
Под положительной эмоцией понимают осознаваемое человеком чувство
удовольствия. Выражение лица детей при восприятии сладкого вкуса
является типичным примером положительной чувственной реакции на
приятное сенсорное раздражение: расслабление мышц середины лица, а в ряде
случаев —появление улыбки. Хотя у человека на приятные для него
раздражения (вкусовые, обонятельные, тактильные и др.) активируются
области глазолобной коры, инициация положительных эмоций обусловлена
ролью подкорковых мозговых структур.
Впервые «центры удовольствия мозга» были открыты полвека назад в
опытах на животных с самораздражением электрическим током через
вживленные электроды в латеральный гипоталамус и в область
перегородки переднего мозга. Места самораздражения включали также вентральную
покрышку среднего мозга, вентральный отдел бледного шара, вентральный
отдел таламуса, прилегающее ядро (п. accumbens) и предлобную кору.
Поскольку в отношении животных невозможно говорить о чувственной
природе их поведения, то электрическая самостимуляция «центров
удовольствия» или «нейронных кругов удовольствия» рассматривается как получение
вознаграждения (синоним — подкрепление по И. П. Павлову)
подопытным животным при выполнении самораздражения. Лабораторные
животные могли нажимать на рычаг, соединенный с электродами, вживленными
в соответствующие центры удовольствия, с чрезвычайно высокой частотой
(боле 6000 раз в час). В результате экспериментов с самораздражением
основные {первичные) центры удовольствия у животных были локализованы в
латеральном гипоталамусе, а вторичные — в перегородке, миндалине, тала-
мусе, базальных ганглиях и базальной покрышке промежуточного мозга.
У человека «нейронные круги удовольствия», при участии которых
инициируются положительные эмоции, включают ракушку прилегающего ядра
(п. accumbens), латеральное поле перегородки, каудальное вентромедиаль-
ное и базальное ядра Мейнерта лимбической системы, вентральный отдел
бледного шара и парабрахиальные ядра ствола мозга. Каудальная область
ракушки прилегающего ядра (п. accumbens) содержит специфические
опиоидные нейронные круги, активация которых морфином лежит в
основе усиления чувства удовольствия, например при еде. В частности,
нейроны ракушки представляют собой единственную область прилегающего
ядра, которая активируется при положительных чувственных (аффективных)
реакциях человека на приятные вкусовые раздражители. Поэтому нейроны
ракушки прилегающего ядра представляют собой морфологическую основу
возникновения у человека чувства удовольствия на потенциально
приятные раздражения — вкусовые, тактильные или сексуальные.
Нейроны ракушки прилегающего ядра синаптически связаны с
медиальной частью вентрального бледного шара, а затем сигналы направляются
к срединному дорсальному ядру таламуса, а далее непосредственно в
области глазолобной коры коры. Активация этой нейронной сети обусловли-
19. Мотивации и эмоции • 797
Рис. 19.5. Нейронные круги положительных эмоций.
Нейроны ракушки прилегающего ядра имеют на мембране опиоидные рецепторы, активация
которых вызывает у человека положительные эмоции (чувство удовольствия). Прилегающее
ядро является частью мезолимбической системы мозга (парабрахиальные ядра моста, бледный
шар базальных ганглиев, таламус, лобная часть передней поясной извилины, и глазолобная
кора), нейронные сети которой обусловливают возникновение положительных эмоций и
чувства удовольствия при восприятии вкусной пищи, приятных запахов, родительской заботе о
детях, спортивной игре или занятии сексом.
вает появление у человека приятных аффективных или чувственных
реакций.
В целом эти синаптические связи представляют собой один
потенциальный путь формирования у человека положительных эмоций,
вызванного опиоид-зависимой активацией ракушки прилегающего ядра (рис. 19.5).
Отделы глазолобной коры у человека, расположенные в области пре-
фронтальной коры непосредственно над глазными яблоками, выполняют
ключевую функцию в восприятии приятных сенсорных раздражений.
Нейроны глазолобной коры активируется на приятные вкусовые,
обонятельные, тактильные раздражения, прослушивание приятной музыки и даже
при выигрыше денег.
Приятные раздражения могут вызвать положительные эмоции у
человека при участии нейронных кругов ракушки прилегающего ядра, минуя
корковый уровень. Эту роль выполняют прямые восходящие
чувствительные пути к нейронам ракушки прилегающего ядра от нейронов вкусовых
ядер продолговатого мозга — ядер одиночного тракта. Активация нейронов
ядер одиночного тракта происходит при стимуляции рецепторов вкуса на
слизистой оболочке языка.
Нейроны ракушки прилегающих ядер имеют прямые синаптические
связи с восходящей мезолимбической дофаминергической системой мозга.
Электрическое раздражение структур дофаминергической системы мозга
вызывает у человека физиологические эффекты с чувством выраженного
удовольствия, например необычно сильный оргазм.
Нейроны ракушки прилегающего ядра образуют нейронный круг
систем удовольствия мозга с парабрахиальными ядрами верхнего отдела
моста. Нейроны парабрахиальных ядер моста образуют бензодиазепин/ГАМК-
ергический круг нижнего отдела ствола мозга, активация которого
усиливает проявление мотиваций влечения при воздействии на организм челове-
798 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
ка приятных сенсорных раздражений. Функция парабрахиальных ядер
моста обусловлена двумя восходящими путями: один достигает первичной
вкусовой коры головного мозга через переключательные ядра таламуса, а
другой — прямо идет к нейронам в прилегающие ядра. Бензодиазепино-
вый/ГАМК-ергический нейронный круг парабрахиальных ядер в составе
обширных нейронных кругов системы удовольствия мозга, обусловливает
возникновение приятного вкусового сенсорного ощущения у человека
(положительной эмоции) при участии нижнего отдела ствола мозга.
В целом, системы удовольствия мозга человека функционируют на
основе ключевой роли прилегающего ядра и представляют собой
параллельные нейронные пути, которые входят в состав корковых и подкорковых
нейронных кругов. Считают, что в мозге человека функционирует
несколько нейронных кругов положительных эмоций, активирующихся при
пищевой и половой мотивациях, при родительской заботе о детях,
видеоиграх, приеме наркотиков и др.
19.2.3.4. Регуляция отрицательных эмоций у человека
У здоровых субъектов нейроны миндалины в наибольшей степени
активируются при восприятии эмоционального выражения лица при страхе и
гневе, чем радости. Наряду с активацией миндалины при эмоции страха
активируются подкорковые области мозга (таламическая и бугорковая), в
меньшей степени корковые поля. Повреждение миндалины у человека
снижает восприятие эмоционального выражения лица, особенно
выражения эмоции страха, ухудшается также распознавание эмоциональной
интонации голоса. Повреждение миндалины обусловливает уменьшение
имплицитной эмоциональной памяти (см. ниже)
У человека эмоцию страха вызывают стимулы различной модальности.
Основной структурой-мишенью для афферентных входов, вызывающих
отрицательные эмоции у человека, является латеральная область миндалины
(см. рис. 19.3). Нейроны этой области активируются слуховыми, ноцицеп-
тивными сигналами, нейронами таламических полей, получающих
афферентные импульсы от спиноталамического тракта. Структуры латеральной
области миндалины активируются соматосенсорными и ноцицептивными
стимулами, поступающими от сенсомоторных областей коры. Ноцицеп-
тивные стимулы, поступающие от парабрахиальных ядер моста,
непосредственно активируют нейроны центрального ядра миндалины. Аналогичные
стимулы, поступающие от задних отделов таламуса, вызывают активацию
дополнительной базальной области миндалины.
Основным эфферентным выходом миндалины являются нейроны
центрального ядра, которые интегрируют сигналы от нейронов афферентных
отделов миндалины. Активация нейронных сетей центрального ядра
вызывает характерные реакции в организме человека при эмоции страха. Так,
через двигательные ядра ствола мозга инициируется эмоциональное
выражение страха на лице человека. Посредством структур латерального
гипоталамуса регулируются реакции со стороны системного артериального
давления в организме. Нейроны центрального ядра миндалины, активируя
нейроны центрального серого вещества вокруг сильвиева водопровода,
вызывают в организме мышечную дрожь, при возбуждении ядра дна и
терминальных полосок происходит высвобождение стрессовых гормонов оси
гипофиз—кора надпочечников.
Наиболее выраженные отрицательные эмоции у человека возникают
при восприятии боли. Возникновение неприятных ощущений у человека
19. Мотивации и эмоции • 799
при ноцицептивных раздражениях обусловлено ролью в этом процессе
нейронов лобного отдела передней поясной извилины, расположенной на
медиальной поверхности префронтальной коры. Активация этого участка
мозга при болевой стимуляции посредством структур миндалины,
центрального серого вещества вокруг сильвиева водопровода, прилегающего
ядра, гипоталамуса инициирует у человека отрицательные эмоции (страх,
страдание), мотивации избегания и соответствующие им проявления
активности вегетативной и эндокринной систем (описаны выше).
ГЛАВА 20
Физиологические основы
познавательной деятельности
человека
Познавательной деятельностью человека называется получение и
сохранение знаний. Эта деятельность осуществляется на основе базовых
познавательных процессов, к которым относят внимание, восприятие, память,
научение и мышление. Основным результатом познавательной
деятельности человека является знание. В наиболее общей форме знание
определяется как объекты, концепции и взаимосвязи, которые находятся в поле
интереса (деятельности) человека. Знание человека имеет многочисленные
проявления: умение, отношение к чему-либо или к кому-либо,
информация, словарный запас, лексические правила, практические навыки и др.
Физиологической основой познавательной деятельности человека
являются функции ассоциативных областей коры головного мозга. Эти области
коры занимают большую ее площадь и имеют сложную синаптическую
многоуровневую иерархию ядер (рис. 20.1). Иерархия ядер ассоциативных
отделов коры включает в себя первичные сенсорные проекционные поля,
вторичные унимодальные (имеют отношение к определенному виду
чувствительности), гетеромодальные поля коры. В гетеромодальных полях
многочисленные ядра, входящие в их состав, функционируют на основе разных
видов информации. Уникальной функцией этих полей является
связывание многочисленных унимодальных и трансмодальных полей в
распределенные и интегрированные мультимодальные репрезентации, на основе ко-
Рис. 20.1. Схема расположения первичных проекционных и ассоциативных полей
коры головного мозга человека (А) и шимпанзе (Б). У человека по сравнению с
высшими приматами преимушественное развитие получили ассоциативные области
коры, при участии которых осуществляются базовые познавательные процессы
восприятия, научения и мышления.
Первичные проекционные области коры: 1 — двигательная, 2 —слуховая, 3 — обонятельная,
4 — зрительная, 5 — соматосенсорная, 6 — ассоциативная.
20. Физиологические основы познавательной деятельности человека • 801
торого в мозге происходит превращение ощущения в познавательный
процесс. Под репрезентацией (синоним — представление) понимают
активацию нейронной сети ядер как унимодальных, так и гетеромодальных полей
под влиянием поступающих в них сигналов. В познавательной
деятельности человека функцией унимодальных ассоциативных полей коры
головного мозга является восприятие базовых особенностей ощущений цвета,
движения, формы и пространственной локализации стимулов внешней
среды. Более сложное восприятие таких сенсорных признаков, как
объекты, лица, словесные формы, пространственные локализации стимулов и
последовательности звуков, осуществляется на более высоких уровнях си-
наптического переключения (4-й и 5-й уровни) унимодальных полей.
Высшие синаптические уровни обработки сенсорной информации при
познавательной деятельности происходят в гетеромодальных ассоциативных
полях коры головного мозга, а также в паралимбической и лимбической
коре. Эти поля коры головного мозга называются также трансмодальными.
Трансмодальные поля коры головного мозга (средние отделы височной
коры, зона Вернике, гиппокампально-энториальный комплекс, задняя
теменная кора) выполняют в познавательной деятельности функцию
трансформации: восприятия — в распознавание, словесных форм — в мысли,
сцен и событий — в индивидуальный жизненный опыт человека.
Префронтапьная ассоциативная кора в познавательной деятельности
выполняет высшие функции мозга: вероятностное прогнозирование и
программирование познавательной деятельности, анализ поступающей в этот отдел
коры больших полушарий информации с учетом выполняемых результатов
деятельности. Функции префронтальной коры в познавательной
деятельности человека осуществляются на основе эксплицитной рабочей памяти.
Механизмы этого вида памяти, для которой необходима точная и ясно
выраженная или четко наблюдаемая человеком «информация», позволяют
структурам префронтальной коры неоднократно обрабатывать в течение
короткого времени одну и ту же осознаваемую человеком информацию и
на этой основе включать ее элементы в содержание знания.
Познавательная деятельность человека обусловлена его сознанием.
Сознание человека представляет собой психический процесс. Тем не менее
сознание человека коррелирует с проявлениями активности
(электрической или метаболической) в различных расположенных на расстоянии друг
от друга ассоциативных полях коры головного мозга при базовых
познавательных процессах внимания, восприятия, памяти и мышления.
20.1. Внимание
Сенсорные системы мозга человека одновременно воспринимают большое
число влияний внешней среды. Одни из них имеют отношение к
поведению человека в текущий момент времени, а другие — не влияют на
таковое. Мозг человека не может воспринимать одновременно все
многообразие воздействий внешней среды на организм. Поэтому в ЦНС происходят
процессы, которые вычленяют лишь некоторые из стимулов внешней
среды и «фильтруют» их от многих других. Это связано с тем, что организм
человека способен эффективно функционировать во внешней среде, если
происходит отбор или селекция тех стимулов, которые необходимы для
осуществления его приспособления. Процессы отбора информации в мозге
человека обозначаются понятием «внимание». Избирательная или
селективная реакция организма человека на определенный вид сенсорной
информации внешней среды называется вниманием. Внимание человека обу-
26 - 6095
802 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
словлено функциями слуховой, соматовисцеральной, обонятельной,
вкусовой и вестибулярной сенсорных систем. Внимание человека ответственно
за выбор во внешней среде объектов и их локализации, о которых затем
необходимо получить более подробную информацию и, одновременно,
исключить из восприятия объекты другой локализации. Внимание человека
одновременно не способно ориентироваться на несколько стимулов
внешней среды или несколько мыслительных процессов.
20.1.1. Формы внимания
Избирательный отбор одного стимула из множества раздражений внешней
среды происходит у человека на основе непроизвольного (пассивного, или
рефлекторного) и активного, или произвольного, внимания.
Непроизвольное внимание представляет собой автоматическую,
рефлекторную реакцию организма человека (как правило, поворот глаз и/или
головы в направлении источника раздражения) в ответ на действие стимулов
внешней среды. При этом стимулы внешней среды, которые способны
вызвать внимание человека, должны быть очень сильными либо
значительными, либо резкими и неожиданными, и иметь конкретную природу —
световые, звуковые, обонятельные или ноцицептивные (например,
внешняя или внутренняя боль). Непроизвольное внимание возникает
неосознанно и не требует умственных усилий со стороны человека для
направления взгляда или поворота головы в сторону источника раздражения. Как
правило, непроизвольное внимание обусловлено такими качествами
стимулов, как интенсивность или неожиданность их возникновения для
человека, или их новизна.
Произвольное внимание у человека представляет осознаваемое человеком
ориентирование органов чувств, как правило, органа зрения, на
восприятие конкретного объекта или явления внешней среды. Основным видом
произвольного внимания является зрительное произвольное внимание,
которое подразделяется на пространственное и объект-ориентированное.
Пространственное зрительное внимание представляет собой процесс
изменения зрительного внимания с одного объекта на другой. Направленность
зрительного внимания на конкретный объект называется
объект-ориентированным зрительным произвольным вниманием (синоним — фокусное
внимание).
Произвольное внимание возникает в том случае, если человек осознает
действие (поворот глаз и/или головы), направленное на рассматривание,
выслушивание или осязание какого-то объекта или явления внешней сре-
Таблица 20.1. Две формы зрительного внимания человека
Свойства внимания
Пространственная
специфичность
Детальная
специфичность
Продолжительность
Произвольный контроль
Зависимость от задания
Формы внимания
непроизволное
Через поле зрения
Действует в любое время и во всех
пространственных направлениях
Временное
Отсутствует
Не зависит
произвольное
Пространственно
обусловленное (фокусное)
Может избирать
специфичный атрибут
Устойчивое (с
произвольным усилием)
Обязателен
Зависит
20. Физиологические основы познавательной деятельности человека • 803
ды. Произвольное внимание у человека обусловлено предшествующим
научением (ассоциативное научение, инструкция, задание, внутреннее
желание). Произвольное внимание человек может направлять на
мыслительные процессы, обусловливающие, например, принятие решения и
последующие за этим действия. По сравнению с произвольным вниманием,
непроизвольное внимание возникает независимо от инструкций или
внутреннего намерения человека (табл. 20.1).
20.1.2. Нейрофизиологические механизмы внимания
Физиологическая основа внимания состоит в том, что оно обусловлено
увеличением и синхронизацией нейронной активности в тех отделах ЦНС,
которые воспринимают сенсорные стимулы, и увеличением активности
структур теменной и лобной коры мозга человека.
Наиболее полное проявление избирательности, или селективности,
внимания связано с функцией зрения у человека. Зрительное пространство
содержит множество стимулов, специфическая локализация которых
является избирательной для процесса зрительного внимания. Емкость
зрительного внимания ограничена. Своеобразной ценой избирательности
внимания является «слепота» к зрительным стимулам, на которые человек не
обращает внимания. При этом зрительное внимание способно выбирать
наиболее интересный объект в поле зрения или изменять «фокус» внимания с
одного объекта на новый. Наиболее важной функцией непроизвольного и
произвольного зрительного внимания является быстрое направление
взгляда человека на интересующий объект в окружающем зрительном
пространстве. Физиологические механизмы непроизвольного и произвольного
внимания человека тесно взаимосвязаны между собой. У человека
нейронные структуры внимания представлены отделами верхних бугров
четверохолмия, подушки таламуса, зрительной коры, лобного глазного поля,
дополнительного глазного поля лобной коры, задней теменной коры,
нижней височной и префронтальной коры. Все отделы зрительных областей
коры головного мозга играют важную роль в зрительном внимании.
Однако наибольший дефицит зрительного внимания у человека возникает при
повреждениях теменных долей коры. Это проявляется в игнорировании
контралатерального зрительного пространства, которое возникает чаще
при повреждении правой теменной области коры головного мозга и
реже — левой. Поэтому правая теменная область коры головного мозга
выполняет доминирующую функцию во внимании человека.
Физиологические механизмы внимания обусловлены функцией следующих
подкорковых и корковых центров внимания.
20.1.2.1. Функции среднего мозга и моста в контроле внимания
Функция состоит в контроле движения глаз и/или головы человека в
направлении источника раздражения. Этот механизм лежит в основе обеих
форм внимания человека, т. е. непроизвольного (ориентировочный
рефлекс по И. П. Павлову) и произвольного.
Ориентированное движение глаз при внимании осуществляется синер-
гичными сокращениями трех пар глазодвигательных мышц. Нейроны,
которые иннервируют мышечные волокна этих мышц, образуют III
(глазодвигательный), IV (блоковой) и VI (отводящий) черепные нервы (рис.
20.2).
В стволе мозга, на уровне моста, расположена нейронная сеть ретику-
26'
804 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
Верхние бугры четверохолмия
,Z_V-^^ А Мозжечок
Ядро подъязычного нерва
^ Ретикулярная формация
«гаС^^. /продолговатого мозга
Ретикулярная формация
среднего мозга
Рис. 20.2. Нейронный контроль саккадических движений глаз на уровне структур
среднего мозга.
Направление движения глаз (саккад) управляется мотонейронами двух центров взгляда
ретикулярной формации. В парамедианной ретикулярной формации моста расположен центр
горизонтального направления движения вгляда, а в ростральном интерстициальном ядре
ретикулярной формации находится центр вертикального направления движения взгляда. III, IV,
VI — ядра глазодвигательного, блокового и отводящего нервов, которые иннервируют мышцы
глазных яблок человека. Стрелками показано направление регулирующих влияний структур
верхних бугров четверохолмия.
лярной формации, функция которой состоит в регуляции многих аспектов
внимания: генерация быстрых (саккадических) движений глаз (парамеди-
анная ретикулярная формация); участие в произвольной регуляции
направления взгляда человека (ретикулярные нейроны вблизи ядра
отводящего нерва); генерация горизонтального направления движения взгляда
(нейроны ретикулярной формации моста и прилегающие к ядру
подъязычного нерва); содружественное горизонтальное направление движения
взгляда обоих глаз. Последний комплекс ядер в соответствии с его
функцией получил название центр горизонтального направления движения
взгляда человека. Аналогичная нейронная сеть, или центр вертикального
направления движения взгляда, расположен в области интерстициального ядра
Кахала.
Центры горизонтального и вертикального направления движения
взгляда человека регулируют поворот глазных яблок через мотонейроны ядер
III, IV и VI черепных нервов и иннервируемые ими мышцы.
Функция верхних бугров четверохолмия. Верхние бугры четверохолмия
представляют собой область ствола мозга, которая образует основный
выход к ретикулярным нейронным сетям моста и среднего мозга, при
участии которых возникает движение или остановка взгляда человека при
внимании.
Зрительные сигналы от сетчатки глаз поступают к нейронам верхних
слоев верхних бугров четверохолмия. Аксоны этих нейронов направляются
к нейронам глубоких слоев верхних бугров четверохолмия, а также к тала-
мусу и стволовым ядрам. Функция этих «нисходящих» связей заключается
в том, что нейроны глубоких слоев верхних бугров четверохолмия
становятся высокоактивными перед началом движения глаз и головы в
направлении источника раздражения во внешней среде. Высокочастотная
активность нейронов глубоких слоев верхних бугров четверохолмия резко
активирует глазодвигательный механизм человека через нейроны ретикулярных
Таламус
Интерстициальное
ядро Кахала
Ростральное интерстициальное
ядро продольного пучка
Парамедианная ретикулярная
формация моста
Мост
20. Физиологические основы познавательной деятельности человека • 805
ядер ствола мозга при возникновении реакции внимания (поворот глаз и/
или головы человека). Поэтому глаза человека способны в течение
нескольких десятков миллисекунд ориентироваться на объект после
раздражения рецепторов сетчатки.
Функция нейронов глубоких слоев верхних бугров четверохолмия
является мультимодальнои при внимании, поскольку эти отделы получают
сигналы от зрительной коры, от слуховых, соматосенсорных релейных
ядер и других ядер ствола мозга. Глубокие слои нейронов верхних бугров
четверохолмия имеют строгую топографическую организацию в виде
нейронных карт. Это проявляется в том, что при возбуждении нейронов
определенной локализации участков глубоких слоев верхних бугров
четверохолмия возникают строго координированные движения глаз и поворот
головы.
20.1.2.2. Функции корковых центров внимания
Простое произвольное изменение внимания с одной точки зрительного
пространства на другую с помощью движений глаз активирует у человека
большую нейронную сеть коры головного мозга, которая включает
комплекс зрительная кора — средняя теменная область, лобные глазные поля,
дополнительные глазные поля, часть передней поясной извилины, заднюю
затылочную кору (рис. 20.3). Функции этой обширной нейронной сети
при внимании заключаются в контроле движения глаз и головы человека
через верхние бугры четверохолмия. Структуры верхних бугров
четверохолмия и корковых центров внимания функционируют параллельно. В
обычных физиологических условиях возникновение активности в нейронах
верхних бугров четверохолмия находится под контролем лобных
зрительных полей, задней теменной коры и нейронов ретикулярной части черной
субстанции ствола мозга.
Функции комплекса структур стриарной зрительной коры и средней
теменной области (зона МТ) в механизмах внимания состоят в проведении
зрительной информации о направлении и скорости движения стимулов в
зрительном поле к структурам задней теменной коры головного мозга. Из
структур экстрастриарной коры информация передается в лобную кору, а
именно в лобные и дополнительные глазные поля, которые выполняют
основную функцию в планировании и выполнении ориентированных
движений глаз. Структуры первичной зрительной коры выполняют основную
функцию в объект-ориентированном внимании человека и в выборе или
селекции объекта глазодвигательной системой мозга человека с того
момента, как только цель оказалась в сенсорном поле. В ответ на зрительный
стимул стриарная затылочная кора человека активируется довольно
быстро, примерно через 40 мс.
Роль теменной коры человека в механизмах внимания. При внимании
теменные отделы мозга человека, а именно структуры внутритеменной
борозды и нижней теменной доли, повышают уровень метаболической
активности. Эта область коры головного мозга является центром, который
вовлекается в поддержание внимания специфической пространственной
локализации или, как правило, в генерацию сигналов в глазодвигательной
системе мозга при изменении внимания с одной локализации на другую.
Эту функцию отделы задней теменной коры выполняют через структуры
верхних бугров четверохолмия.
Нейроны задней теменной коры реагируют строго топографически на
зрительные стимулы и участвуют в произвольном изменении пространст-
806 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
Двигательные
программы
Произвольное зрительное внимание
(произвольное движение глаз)
Непроизвольное зрительное
внимание
Пространственное зрительное
внимание
Интеграция
пространственной
зрительной
информации
Генератор
саккад
Зрительная
информация
Мозжечок
Структуры
ствола
мозга
Рис. 20.3. Функции высших центров внимания, расположенных в коре головного
мозга человека.
Центры внимания коры головного мозга человека включают зрительную кору (ЗК), которая
направляет зрительную информацию в заднюю теменную кору (ЗТК). Этот корковый центр
внимания регулирует механизм непроизвольного зрительного внимания, осуществляет
интеграцию пространственной зрительной информации. Задняя теменная кора (преимущественно
правая) направляет сигналы в лобное глазное поле (ЛГП) и дополнительное глазное поле
(ДГП). ЛГП функционирует как центр произвольного зрительного внимания человека и
выполняет двигательные программы при участии ДГП. Префронтальная кора включена в
произвольную регуляцию внимания путем коррекции функции центров лобного и дополнительного
зрительного полей. Человек при участии структур префронтальной коры способен тормозить
непроизвольное внимание. Верхние бугры четверохолмия являются основным подкорковым
центром регуляции непроизвольного (рефлекторного) и произвольного внимания при участии
различных сенсорных систем и под влиянием двигательных команд центров внимания коры
головного мозга.
венного внимания. Это проявляется прежде всего в том, что при изменении
направления взгляда на новое положение рецептивные поля нейронов
задней теменной коры также перемещаются на новое положение. Более того,
рецептивные поля задней теменной коры способны занимать новое
положение до начала движения глаз и изменения направления взгляда на
новый объект, а следовательно, нейроны этого коркового центра внимания
получают сигналы из других отделов коры относительно предполагаемого
движения глаз в новом направлении. Поэтому активность нейронов задней
теменной коры как основного высшего центра внимания всегда нарастает
при ориентировании взгляда на объекте, если человек ожидает появления
объекта в зрительном поле или думает о появлении в нем такого объекта.
После начала действия зрительного стимула зрительная информация
достигает теменных отделов коры примерно через 60 мс и передается к этим
структурам от стриарной коры. При этом активация структур стриарной и
20. Физиологические основы познавательной деятельности человека • 807
Рис. 20.4. Функция ретикулярной части
черной субстанции и базальных ганглиев в
контроле внимания.
Ретикулярная часть черной субстанции (ЧС)
ствола мозга получает вход от хвостатого ядра
(ХЯ) базальных ганглиев и функционирует как
«ворота» при произвольном контроле движения
глаз. При отсутствии зрительных стимулов в
поле зрения ЧС тонически тормозит структуры
верхних бугров четверохолмия, что препятствует
возникновению нежелаемых движений глаз и
изменению направления взгляда.
Непосредственно перед началом произвольного изменения
взгляда в черную субстанцию из базальных
ганглиев поступают импульсы, которые снижают
торможение верхних бугров четверохолмия.
Активация базальных ганглиев происходит под
влиянием двигательных команд из центров
внимания коры головного мозга. В результате
становится возможным произвольное изменение
направления взгляда. Знак плюс обозначают
активацию центров регуляции направления
взгляда со стороны верхних бугров четверохолмия и
торможение, а знак минус — торможение
верхних бугров четверохолмия со стороны ЧС.
экстрастриарнои коры под влиянием зрительного стимула не осознается
человеком.
Функция лобных глазных полей заключается в планировании движения
глаз при изменении направления взгляда. Лобные глазные поля
расположены в прецентральной борозде лобных долей мозга человека. Реакции
нейронов этой области коры головного мозга организованы
топографически: нейроны активируются только в том случае, если объект находится в
определенной части зрительного поля. Функция лобных глазных полей
осуществляется при помощи проекций аксонов нейронов этого отдела
коры к структурам верхних бугров четверохолмия и стволовым премоторным
(ретикулярным) нейронам. Лобные зрительные поля являются корковым
премоторным центром в регуляции внимания и обеспечивают выбор целей
для движений глаз и изменения направления взгляда среди многих
зрительных целей в окружающем человека пространстве. Функцией этой
области коры головного мозга является торможение непроизвольных
движений глаз, а также генерация произвольных, не связанных со зрительными
стимулами движений глаз (например, при мышлении).
Функцией дополнительных глазных полей коры является выполнение
движения глаз в направлении объекта внимания. Дополнительные глазные
поля расположены медиальнее лобных глазных полей, вдоль межполушарной
борозды на дорсомедиальной поверхности лобных долей. Нейроны этого
коркового центра внимания обладают пространственной
чувствительностью и регулируют движение глаз таким образом, чтобы объект или его
какая-то часть находились в центре поля зрения. Благодаря функции
структур дополнительного глазного поля у человека осуществляется
объект-ориентированное внимание.
Функция базальных ганглиев. В механизме произвольного внимания
функция базальных ганглиев состоит в активации структур ретикулярной
части черной субстанции среднего мозга (рис. 20.4). Нейроны ретикуляр-
Центры горизонтального и вертикального
направления движения взгляда
808 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
ной части черной субстанции функционируют подобно «воротам»
относительно функции структур верхних бугров четверохолмия при внимании.
Так, при отсутствии в окружающем пространстве вызывающих внимание
зрительных стимулов нейроны черной субстанции тормозят нейроны
верхних бугров четверохолмия и препятствуют, таким образом, случайному
изменению направления взгляда. Под влиянием произвольных двигательных
команд из лобной коры, поступающих к нейронам черной субстанции
через структуры хвостатого ядра базальных ганглиев, тоническое торможение
нейронов верхних бугров четверохолмия снижается, и они приобретают
способность регулировать произвольные движения глаз в направлении
объекта в поле зрения.
Дорсолатеральные области префронтальной коры обеспечивают
произвольный контроль различных форм поведения, в том числе ориентированные
движения глаз и головы на интересующий человека объект в окружающем
пространстве. При участии префронтальной коры осуществляется
произвольная задержка внимания, в результате которой человек осознанно не
производит объект-ориентированное движение глаз и головы в
направлении источника сильного сенсорного раздражения.
20.1.3. Внимание при различных модальностях
Внимание у человека проявляется в отношении стимулов разной
модальности, т. е. зрительных, слуховых, соматосенсорных, обонятельных и
вестибулярных. Слуховые центры ствола мозга взаимодействуют с системой
регуляции зрительного внимания на уровне структур верхних бугров
четверохолмия (ориентировочный рефлекс), а на уровне коры — с теменными
областями коры, преимущественно со структурами нижней теменной доли
в правом полушарии мозга. Активация структур этой области коры
головного мозга происходит при бинауральном и дихотическом звуковом
воздействиях. Соматосенсорная система на подкорковом уровне (через
верхние бугры четверохолмия) и на уровне коры при участии структур сомато-
сенсорной коры также взаимодействуют с системой регуляции внимания
через отделы задней теменной коры.
Наибольшее внимание вызывает стимул одной модальности
(зрительной, слуховой или соматосенсерной), т. е. внимание эффективнее
осуществляется при участии конкретной сенсорной системы. Однако, несмотря
на наличие внимания к различным внешним стимулам, в коре головного
мозга человека имеется одна единая надмодальная (или мультимодальная)
система регуляции внимания. Основным мультимодальным центром
внимания является задняя теменная кора головного мозга. Функция задней
теменной коры при внимании проявляется в том, что пространственное
слуховое или пространственное зрительное внимание у человека всегда
направлены на один и тот же объект в окружающем пространстве. При
произвольном изменении пространственного слухового внимания в
направлении наилучшего восприятия звукового стимула в эту же область
направляется пространственное зрительное внимание, и наоборот. При участии
задней теменной коры каждая сенсорная система вызывает эквивалентное
изменение пространственного внимания у человека, что способствует
увеличению процессов локализации внимания на определенной цели в условиях
активации различных сенсорных систем мозга.
20. Физиологические основы познавательной деятельности человека • 809
20.2. Восприятие
Восприятие — это процесс трансформирования физического раздражения
в физиологическую информацию. Процессы восприятия сенсорной
информации различной модальности осуществляется в первичных и
вторичных проекционных областях коры головного мозга. Наиболее изученными
видами восприятия у человека являются зрительное и слуховое, в меньшей
степени — соматосенсорное. Механизмы восприятия запаха и вкуса
изложены в главе 17 «Сенсорные системы».
20.2.1. Зрительное восприятие
Человек распознает новый объект, появившийся в поле зрения, в течение
долей секунды. При этом зрительное восприятие включает оценку
контраста, лица, объектов, зрительного пространства, а также единого
изображения, воспринимаемого обоими глазами (бинокулярное зрение).
Структуры ЦНС, которые участвуют в «зрительном поведении»
человека, широко представлены в коре головного мозга, однако не все из них
вовлечены в процесс восприятия. Например, двустороннее повреждение
височных долей коры вызывает выраженные нарушения в зрительном
распознавании и памяти, но при этом остается неизмененным зрительное
восприятие. Напротив, повреждение у человека затылочных долей вызывает
слепоту. Небольшой латентный период и длительность реакций нейронов
первичной зрительной коры (порядка 40 мс) на зрительные стимулы
свидетельствуют об основной функции этого отдела зрительной коры в
восприятии зрительной информации.
Левое поле
зрения
Правое поле
зрения
20.2,1.1. Функции стриарной коры в зрительном восприятии
Первичная зрительная кора (стриарная кора, поле VI) является первым
корковым уровнем, на котором конвергируют сигналы от сетчатой
оболочки обоих глаз человека, и последним полем в зрительной системе, нейроны
которого реагируют непосредственно на зрительные стимулы (рис. 20.5).
Первичная зрительная кора представляет собой единственную структуру
коры головного мозга человека, которая получает сигналы непосредственно
от нейронов латеральных коленчатых
ядер таламуса и создает точную ретино-
топическую карту зрительных полей,
которые представляют собой нервный
субстрат зрительного восприятия.
Комплексы нейронов стриарной коры формируют
разнонаправленные мозаичные столбы,
слои и модули, при участии которых
происходит восприятие цвета, стереопсиса
Рис. 20.5. Схема передачи импульсов от
сетчатки к нейронам зрительной коры (поле VI).
Пути от латеральных коленчатых тел (ЛКТ) в
правую и левую области зрительной коры состоят из
относительно равных проекций от сетчатки обоих
глаз. Нейроны первичной зрительной коры
активируются на зрительные стимулы и обеспечивают
функцию зрительного восприятия.
Полушария
головного
мозга
810 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
(глубины), ориентационных стимулов, контуров объектов, движения,
формируется глазодоминантность. Нейроны стриарной коры имеют высокую
чувствительность к световому контрасту, а их реакции прямо
взаимосвязаны с порогами светового контраста (описаны в главе 17 «Сенсорные
системы»). Восприятие освещенности предмета также является функцией
стриарной коры. Структуры полей V1/V2 являются высшими зрительными
центрами восприятия, в которых начинается восприятие бинокулярного
зрения, хотя в этих центрах зрительного восприятия расположено меньше
нейронов с подобными свойства, чем в последующих зрительных полях.
Восприятие стереоопсиса происходит в результате взаимодействия на
нейронах стриарной коры монокулярной зрительной информации,
возникающей в результате перекрытия одного объекта другим в поле зрения.
К своеобразной форме зрительного восприятия относится воображение
человека в отсутствие какой-либо световой стимуляции сетчатки глаз. При
этом у человека активируются ретинотопические поля зрительной коры, а
не ее ассоциативные поля.
20.2.1.2. Зрительное восприятие при участии отделов экстрастриарной коры
Нейроны зрительного поля VI моносинаптически связаны с нейронами
других ретинотопических зрительных областей коры — V2, V3/VP, V3A,
V4v и МТ $ис. 20.6).
При произвольном или непроизвольном внимании активируются
высшие зрительные корковые поля, преимущественно поля V2 и V4.
Лобная кора
Двигательная кора
Соматосенсорная кора
»*Z-^ Теменная кора
, Восприятие движения
Восприятие скорости
I движения
/V7
/V3A
Л/3
Височная кора
Запах
Первичная
зрительная
VP кора (поле V1)
V8 V4v
Восприятие цвета
Восприятие лица
Слуховая кора
Рис. 20.6. Схематическое изображение локализации функций познавательной
деятельности человека в коре головного мозга: восприятие (по данным позитронно-
эмиссионной томографии и функционального магнитного резонансного
исследования).
На рисунке отмечены участки коры головного мозга человека, в которых возрастает локально
мозговой кровоток при выполнении человеком заданий на восприятие. VI, V2, V3, V3A, V/P,
V4v — классические ретинотопические поля зрительной коры человека, функцией которых
является восприятие относительно простых зрительных стимулов, поля V7 и V8 — имеют слабо
выраженную ретинотопическую организацию. За пределами этих полей расположены области
зрительной коры, не имеющие ретинотопической организации и поэтому выполняющие
«глобальные» функции восприятия движения, пространства, цвета и формы объектов внешней
среды. МТ — средняя височная область.
20. Физиологические основы познавательной деятельности человека • 811
После восприятия зрительного раздражения структурами поля VI, далее,
в каждом последующем ретинотопическом поле, происходит копирование
'Д карты поля VI. Поэтому при повреждении полей V2, V3/VP и V4v у
пациентов возникает выпадение восприятия 'Д части зрительного поля (квад-
ранопсия), а поля VI и V3A —половины зрительного поля (гемианопсия).
Структуры полей V2, V3/VP, V3A, V4v и МТ зрительной коры образуют
второй синаптической уровень и относятся к восходящим ассоциативным
зрительным полям, функцией которых является распознавание относительно
простых параметров зрительных сигналов. Кпереди от промежуточных
полей зрительной коры (поля V7 и V8), которые имеют слабо выраженную ре-
тинотопическую карту, расположены структуры зрительной коры, которые
не имеют ретинотопической организации и поэтому выполняют
«глобальные» функции зрительного восприятия движения, цвета, лиц, участков
зрительного поля и кинетику движения граничащих между собой элементов.
В процессе зрительного восприятия у человека функции этих отделов
зрительной коры количественно разделены на теменные и височные
информационные процессы («потоки»). Структуры средней теменной
области (МТ), верхней теменной области, полей V3A и V7 формируют у
человека теменной (дорсальный) путь или поток, который обеспечивает
восприятие движения и пространства.
Вентральный (височный) «поток» информации (структуры полей V8,
лицевого поля веретенообразной извилины) выполняют функцию
восприятия более сложно организованных особенностей зрительной
информации, таких как цвет и форма объектов.
20.2.1.3. Особенности зрительного восприятия индивидуальных лиц и объектов
Зрительное поле, специализирующееся на восприятии лица, расположено
в пределах средней части веретенообразной извилины (поля 37 и 20 по Брод-
ману). Нейроны веретенообразной извилины активируются в большей
степени при рассматривании анатомически нормальных и вертикально
расположенных лиц, чем перевернутых или хаотично расположенных в поле
зрения объектов. В то же время степень активации «лицевого» поля коры
не различается при рассматривании знакомых и незнакомых лиц.
Нейроны «лицевого» поля распознают лица на категориальном или генетическом
уровне, т. е. до стадии индивидуального распознавания лица.
Непосредственно латеральнее веретенообразной извилины расположено
поле, нейроны которого специализируются на распознавании словесных
форм и слов, связанных в последовательный ряд при их написании. У
человека письменный язык является поздним филогенетическим
приобретением, и в онтогенезе он развивается относительно медленно. Поэтому
организация «словесного» поля коры не запрограммирована генетически или
эпигенетически. Четвертый синаптический уровень зрительного
восприятия содержит нейроны, которые избирательно активируются при
рассматривании зданий, предметов домашнего быта (стул, стол).
При восприятии цвета активируются нейроны задней части продольной
и веретеноообразной извилины. Односторонее разрушение этого участка
мозга ведет к контралатеральной потере восприятия цвета (полушарная ах-
ромотопсия), без нарушения восприятия остроты зрения, движения или
идентификации объекта в поле зрения. Дорсальная теменно-затылочная
область (место соединения полей 19 и 37 по Бродману) участвует в
восприятии зрительной информации движения, которая позволяет
идентифицировать целенаправленность перемещения объекта или человека.
812 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
Нейронные популяции зрительных ассоциативных полей обеспечивают
восприятие лиц и объектов путем группового кодирования: один нейрон
способен реагировать на различные лица и в то же время одно лицо
активирует несколько нейронов. Нейроны «лицевого» поля нижней височной
коры избирательно реагируют на категорийно-специфические
особенности, такие как расстояние между глазами на лице, прическа, выражение
глаз, направление взгляда. Нейроны, реагирующие на идентичные
особенности объекта, образуют вертикальные колонки диаметром примерно 400
мкм. Несколько рядом расположенных колонок, реагирующих сходным
образом на воспринимаемую зрительную информацию, взаимосвязаны
между собой и образуют модули размером несколько миллиметров. Группы
подобных взаимосвязанных, но распределенных ансамблей настроены на
восприятие строго определенных особенностей, которые определяют класс
объекта. Восприятие и основанное на этой информации зрительное
распознавание может быть градуальным и основанным на частичной
информации, так как одна и та же информация может проходит через многие
ассоциативные нейронные сети.
20.2.2. Слуховое восприятие
Слуховое восприятие у человека представляет собой процесс восприятия
звука как смыслового феномена. Благодаря процессу слухового восприятия
человек может идентифицировать, объяснить и понять смысл звуков.
Звуковое восприятие осуществляется структурами слуховой коры (см.
рис. 20.6). Проекции слуховой сенсорной системы в кору головного мозга
имеют тонотопическую организацию. Первичная слуховая кора верхнего
отдела височной части коры состоит из трех тонотопических карт: Al, R и
СМ. Нейроны полей А1 и R получают большее количество афферентных
волокон от слуховых релейных ядер таламуса, вентральных медиальных
коленчатых тел и реагируют непосредственно на тональные стимулы.
Нейроны поля А1 настроены на восприятие чистых тонов и силы звука.
Средняя и передняя части верхней височной извилины в большей степени
воспринимают специфические фонетические параметры разговорного
языка. Нейроны верхней височной извилины настроены на восприятие
сегментов и последовательности фонем, так же как и на их когерентность при
восприятии многослоговых и сложных слов. Эти отделы мозга распознают
речь на пресемантическом уровне. Средняя височная извилина у человека
(поле 21 по Бродману) содержит нисходящие слуховые ассоциативные
поля. Примерно половина нейронов этих полей обладает высоко
избирательными реакциями на звуковые стимулы в основном в форме подавления на
понимаемую речь. По аналогии со зрительным восприятием, структуры
восходящих слуховых полей воспринимают элементарные особенности
звука — частоту и силу, а нисходящих слуховых полей — кодируют более
сложную информацию, связанную с идентификацией слов, локализацией
источника звука и характеристикой индивидуального голоса человека.
20.2.3. Соматосенсорное восприятие
Соматосенсорное восприятие обеспечивает восприятие у человека
тактильных, проприоцептивных и висцеральных ощущений. Предметы в
значительной степени отличаются друг от друга по форме и тактильным
свойствам. При восприятии с помощью тактильных рецепторов формы и
поверхностных свойств предметов возникает соответствующая активация полей
20. Физиологические основы познавательной деятельности человека • 813
Рис. 20.7. Активация участков первичной со-
матосенсорной коры при восприятии
тактильных раздражителей.
На схеме показаны поля 1 и 36 (моторные поля 6 и
4 по Бродману), структуры которых воспринимают
все виды тактильных стимулов, и структуры поля 2
(моторное поле 44 по Бродману), которые
воспринимают прикосновение к участку кожной
поверхности. Структуры передней части внутритеменной
извилины и надкраевой извилины активируются
при тактильном восприятии формы предметов.
сенсомотороной коры головного мозга
человека (рис. 20.7). Форма предметов
воспринимается как при активном, так
и при пассивном исследовании предметов при участии структур передней
части внутритеменной и надкраевой извилин. Все виды тактильных
раздражений воспринимаются структурами поля 36 и поля 1. Нейроны сома-
тосенсорной коры, локализованные в пределах поля 2, воспринимают
преимущественно структуру поверхности исследуемых человеком предметов,
другие — скорость движения предмета по поверхности кожи пальцев руки.
Более тонкое отличие формы и поверхностной структуры предметов
воспринимается структурами вторичной сенсомоторнои коры и распознается
при участии нейронных сетей премоторных полей коры головного мозга и
префронтальной коры.
20.3. Сознание
Сознание — специфически человеческая форма идеального отражения и
духовного освоения действительности, она включает в себя и осознание
человеком своей психической деятельности.
Слово «сознание» имеет латинский корень conscio, образованный
приставкой сит, обозначающей «с», и глагола scio, обозначающиего «знать». В
этом оригинальном смысле слова быть сознающим — это значит знать о
чем-то или о ком-то, либо о самом себе.
В нейрологии сознание ассоциируют с состоянием бодрствования,
способностью воспринимать, взаимодействовать и общаться с окружающей
средой и с другими людьми. По объективным критериям состояние
сознания человека определяют как суженное, уменьшенное или
восстанавливающееся; сознание может быть потерянным, подавленным и вновь
восстановленным. В наиболее общей форме быть в сознании — это значит
быть бодрым, активным, бдительным и настороженным.
При нормальном состоянии бодрствования сознание — это, прежде
всего, проявление поведения человека. Сознание является содержанием
жизненного опыта в каждый момент времени. В этом смысле сознание
обращено внутрь человека и касается такой качественной стороны, как
субъективные размеры жизненного опыта. Наряду с этим сознание является
всегда персональным и требует от субъекта определенной точки зрения.
Содержание сознания является стабильным на протяжении коротких
периодов жизни, но, как правило, варьирует в течение длительных интервалов.
Сознание является центральной для человека величиной: продолжение
человеческой жизни, когда его сознание утрачивается необратимо, в
клинической практике рассматривается как напрасное усилие.
814 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
Осознание человеком своей психической деятельности относится к
категории самосознания. Самосознание проявляется в склонности к
замешательству, осведомленности об осведомленности и знании о самом себе.
20.3.1. Нейрофизиологические корреляты сознания
Любым произвольным (субъективным, осознанным) действиям человека
соответствует определенный паттерн нейронной активности в различных
областях мозга. Сознательный жизненный опыт является результатом
взаимодействия значительного количества распределенных областей мозга,
которые вовлечены в процессы внимания, восприятия, памяти и
целенаправленного действия. Поэтому под нервными коррелятами сознания
понимают совпадение паттернов активности (электрической или
метаболической) между разделенными и расположенными на расстоянии друг от
друга полями коры головного мозга при различных состояниях сознания.
Например, сознание тесно коррелирует с состоянием сна и бодрствования,
зрительным осознанием (синоним осведомленность) человека, а также
вниманием, восприятием, памятью и мыслительными функциями мозга
(рис. 20.8).
20.3.1.1. Электрическая активность мозга человека
Электрическая активность мозга может быть физиологической основой
осознаваемого жизненного опыта, но может и не иметь отношения к
таковому. По данным современной нейрофизиологии мозга, поведенческие и
электрофизиологические проявления в деятельности мозга человека в
цикле сон—бодрствование коррелируют с тремя главными состояниями
сознания: бодрствование, быстрое движение глаз и медленные волны сна (см.
главу 21 «Сон и бодрствование»). Состояние сознания во время
бодрствования и быстрых движений глаз характеризуется десинхронизацией ЭЭГ
мозга человека, а в стадии медленных волн сна — электрической
синхронизацией мозга. Однако в у-диапазоне ЭЭГ (35—45 Гц) у человека
синхронизация электрической активности мозга имеет место как при
бодрствовании, так и при быстрых движениях глаз. Электрофизиологическими
коррелятами сознания при этих состояниях являются сенсорные вызванные
потенциалы в сенсомоторных областях коры и огромное разнообразие
«когнитивных» потенциалов (потенциалы готовности), возникающих в
различных участках двигательных полей коры головного мозга примерно за 1 с до
начала выполнения движения. Поэтому все осознаваемые человеком
познавательные процессы имеют определенные электрические корреляты.
20.3.1.2. Активация мозга человека как нейрофизиологическая основа
проявлений состояний сознания
Представление о «восходящей активирующей системе» базируется на
ведущей роли ретикулярных структур ствола мозга в регуляции состояний
сознания. В регуляции состояний бодрствования, а следовательно,
проявлений сознания у человека участвуют: холинергические ядра верхнего отдела
ствола мозга и базального отдела переднего мозга; норадренергические
ядра и особенно голубое пятно (locus coeruleus); гистаминергические
проекции от заднего гипоталамуса; дофаминергические и серотонинергические
пути, начинающиеся в стволе мозга.
В состоянии бодрствования таламокортикальные нейроны тонически
Бодрствование
Верхняя покрышка ствола мозга
Средние и внутренние ядра таламуса
Проекции в кору головного мозга
Осведомленность
Корковые и подкорковые структуры/
структуры таламокортикальных цепей,
связанных с гиппокампом и
префронтальной корой
Внимание
Передняя поясная кора
Дорсолатеральная лобная кора
Передние медиальные и пара-
фасцигуальные ядра таламуса
Ретикулярная формация среднего
мозга
Произвольные функции
Лобная кора
Мотивации
Лимбическая система
Нелимбические структуры
Ощущение/Восприятие
Первичная сенсорная кора (зрительная,
слуховая, обонятельная, соматосенсорная,
вкусовая, вестибулярная, висцеральная)
Взаимосвязанные процессы в коре головного
мозга
Эксплицитная память
Гиппокамп и парагиппокампальная извилина
Энториапьная и периринальная кора
Мамиллярные тела
Дорсомедиальные ядра таламуса
Поясная кора
Свод
Рис. 20.8. «Нервные корреляты сознания». Совпадение паттернов активности (электрической или метаболической) между
распределенными полями коры головного мозга коррелирует с состоянием сознания человека и обусловливает индивидуальную форму
отражения действительности (сознание) и способность осознавать психическую деятельность (самосознание).
816 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
деполяризованы под влиянием холинергических, норадренергических и
гистаминергических входов от структур ствола мозга и гипоталамуса,
блокирующих калиевую гиперполяризацию мембраны нейронов. Это
обусловливает спайковый тип активности таламокортикальных нейронов, что
обеспечивает беспрепятственную передачу сигналов в таламус и далее в
кору головного мозга. Снижение числа деполяризующих входов к
нейронам таламуса вызывает в них гиперполяризацию и инициирует в них
залповый тип активности, что имеет место при медленных волнах сна.
Залповые разряды таламических нейронов на фоне их гиперполяризации
обусловлены низкопороговой кальциевой мембранной проницаемостью, но в
целом этот тип активности таламических нейронов ограничивает
поступление сигналов к таламусу.
Одновременное растормаживание ретикулярных ядер таламуса в начале
сна как следствие снижения торможения холинергических входов от
структур ствола мозга, приводит к синхронизированному ГАМК-ергиче-
скому торможению таламокртикальных нейронов, которое ведет к
увеличению «веретен» ЭЭГ во вторую стадию сна. Дальнейшая
гиперполяризация мембраны таламокортикальных нейронов по мере увеличения глубины
сна обусловливает их участие в медленных волнах сна на ЭЭГ. В
возникновении этого состояния участвуют как индивидуальные, так и сетевые
свойства таламокортикальных, кортикоталамических нейронов и нейронов
ядер ретикулярной формации. Различия между спайковыми и залповыми
реакциями таламокортикальных нейронов совпадают с поведенческими
различиями человека, т. е. способностью реагировать при состоянии
бодрствования и отсутствием таковой во время сна.
Во время бодрствования изменение уровня активации мозга также
коррелирует с активностью структур покрышки ствола мозга и таламуса,
которые регулируют проявления сознания. Так, при переходе от состояния
покоя к выполнению зрительных и соматосенсорных тестов происходит
активация ядер покрышки среднего мозга и интраламинарных ядер таламуса.
Снижение степени активации структур среднего мозга и таламуса
ассоциируется со снижением способности человека выполнять длительное время
распознавание звуковых тестов.
Электрическая активность клеток холинергических и
норадренергических ядер ствола мозга полностью зависит от функционального состояния
мозга и коррелирует с состоянием бодрствования. При этом чем
длительнее период бодрствования, тем сильнее выражено у человека желание
спать. Важнейшую роль в качестве «гипнотоксина» может играть
увеличение внеклеточной концентрации аденозина во время бодрствования. Это
приводит к торможению активных холинергических ядер верхнего отдела
ствола мозга и структур основания переднего мозга, что обусловливает
снижение степени проявления сознания у человека (например, возникает
дремота).
Уровень физиологической активности нейротрансмиттерных систем
влияет на познавательную деятельность человека, находящегося в
состоянии сознания. Так, повреждение норадренергической системы снижает
уровень внимания, повреждение холинергической системы снижает
точность действий человека, нарушение дофаминергической системы
увеличивает длительность латентного периода реакций и длительность самих
реакций, нарушение серотонинергической системы ведет к импульсивным
реакциям человека. Потеря сознания у человека под влиянием некоторых
анестетиков обусловлена избирательным подавлением функций структур
таламуса, которые связаны с механизмами обезболивания и сна.
20. Физиологические основы познавательной деятельности человека • 817
20.3.1.3. Осознание зрительного восприятия (зрительная осведомленность)
Процессы, лежащие в основе содержания элементарного сознания, тесно
связаны, прежде всего, с функцией зрения человека. При этом у человека
между уровнем мозговой активности и зрительным жизненным опытом
имеется высокая степень корреляции. Выше были изложены
представления о функции ретинотопической карты зрительной коры в восприятии
простых зрительных стимулов.
Стриарная кора окружена многочисленными анатомо-функциональны-
ми зрительными полями, к основным из которых относятся затылочно-ви-
сочные и затылочно-теменные. «Потоки» зрительной информации
(вентральный и дорсальный соответственно) через эти поля обеспечивают
восприятие человеком формы, цвета, глубины и движения. При этом
активность зрительных вентральных путей («вентральный поток») является
обязательным условием осознания «зрительного жизненного опыта». Поле в
области червеобразной извилины (вентральный поток) избирательно
реагирует на различные выражения человеческого лица, а структуры парагип-
покампального поля воспринимают локализацию объектов в окружающем
зрительном пространстве.
20.3.1.4. Внимание и сознание
Внимание имеет общее значение для человека. Так, педагог обращается к
своим студентам с фразой «будьте внимательными», когда он просит их
сконцентрироваться, чтобы выслушать его учебное задание. Эта общая
форма внимания зависит от состояния бодрствования и бдительности
человека, когда зрение и слух «настраиваются» на лучшее восприятие, а
умственная деятельность ориентируется на выполнение задания. При
выполнении какого-либо задания на внимание абстрактное знание начинает
управлять вниманием человека. Это называется произвольно
контролируемым вниманием. При этой форме внимания оно направляется в
определенную точку пространства и поэтому обозначается как фокусное внимание.
Фокусное внимание является часовым на воротах осознанного
восприятия. Фокусное внимание, ориентированное на характерные особенности
объекта, всегда является активным, т. е. произвольным. Наиболее важным
нервным коррелятом произвольного внимания является изменение
нейронной активности в специфических областях коры головного мозга при
движении объекта к фокусу зрительного внимания и от него. Этот процесс
называется нейронной экспрессией внимания и в определенной степени
отражает нейронное «сопровождение» сознания. Активность веретенообразной
(восприятие лица) и гиппокампальной (восприятие объектов) областей
коры головного мозга человека с высокой достоверностью изменяется при
переключении внимания с лиц на виды при их одновременной
демонстрации испытуемым. Феномен нейронной экспрессии внимания выражен в
наибольшей степени, если человек осведомлен о содержании воспринимаемого
зрительного стимула.
20.4. Память и научение
Памятью называется способность мозга человека приобретать, сохранять в
мозге полученную в процессе индивидуальной жизни информацию, а
также неоднократно использовать эту информацию в дальнейшем поведении.
Научением называется относительно устойчивое изменение в поведении
818 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
или знании человека, которое возникает в результате жизненного опыта
или тренировки. В результате научения у человека возникает новая форма
поведения, которая позволяет ему полнее приспосабливаться к условиям
окружающей среды. Научение основано на механизмах памяти мозга
человека, поэтому их развитие в процессе индивидуальной жизни человека
неразрывно связаны между собой.
Мозг должен «уметь учиться», добавлять к врожденным механизмам
поведения индивидуальный опыт. Это «умение» основано на пластичности
ЦНС, т. е. на способности к перестройке функциональных свойств и
связей нейронных сетей мозга человека под влиянием внешних воздействий.
Такая перестройка должна обеспечивать адаптивное изменение поведения
благодаря сохранению памяти о приобретаемом опыте. Для образования
энграмм (следов) памяти необходимо изменять эффективность синаптиче-
ских переключений между определенными классами нейронов.
У человека врожденное и приобретенное поведение основано на
реализации имеющихся в распоряжении его клеток генетических программ.
Разница состоит в том, что программы врожденного поведения формируются
еще до рождения человека и обеспечивают стабильный минимум
поведенческих реакций, а программы приобретаемых форм поведения мозг
реализует в соответствии с индивидуальным опытом, приобретаемым в процессе
жизни, т. е. в условиях непрерывного научения.
20.4.1. Формы памяти и научения
Внимание человека привлекает любой новый раздражитель.
Непроизвольный механизм внимания обусловлен врожденным ориентировочным
рефлексом (реакция «что такое?», как определял ее И. П. Павлов). Но если
такой раздражитель не представляет опасности и не связан с какой-либо
биологической потребностью, то он постепенно утрачивает новизну и
ориентировочная реакция исчезает, что получило название привыкания, или
габитуации. Примером привыкания может служить отсутствие реакции на
обычный городской шум за окнами квартиры или учебной аудитории.
Противоположную привыканию форму научения представляет собой сен-
ситизация, проявляющаяся в усилении обычных ответов на прежде
нейтральные раздражители. Так, например, пациент, испытавший боль на
приеме у зубного врача, повышенно реагирует даже на манипуляции, не
вызывающие боли. Привыкание и сенситизация являются простейшими
формами научения, существующими благодаря специальным механизмам
памяти.
Привыкание, сенситизация и условные рефлексы образуются на основе
имплицитной (от англ. implicit — неявный, скрытый) памяти, не
требующей обязательного участия сознания в процессе научения. Благодаря
такой памяти у человека образуется большинство двигательных навыков,
например умение ездить на велосипеде или танцевать, при ее участии все
дети овладевают основами родного языка. Другая форма памяти —
эксплицитная (от англ. explicit — явный, высказанный до конца) — относится к
познанию окружающего мира, других людей; она образуется при активном
участии сознания и подразделяется на эпизодическую и семантическую.
Эпизодическая память содержит биографические сведения, включающие
данные о конкретных людях, времени и окружающем пространстве или
местности, а семантическая включает в себя общие знания об устройстве
мира и общества. Имплицитную память иначе называют процедурной, а
эксплицитную — декларативной. Например, приобретенное умение ездить
20. Физиологические основы познавательной деятельности человека • 819
Память
Имплицитная
(процедурная)
Неассоциативная
Эксплицитная
(декларативная)
Ассоциативная
(условные рефлексы)
Эпизодическая
Семантическая
Рис. 20.9. Основные формы памяти. Наиболее простыми формами памяти являются
габитуация (привыкание) и сенситизация, на основе которых у человека
развиваются различные виды, например, двигательной памяти (развитие речи или
спортивный навык). Познание окружающего мира осуществляется на основе эксплицитной
памяти. Формирование памяти — это последовательные во времени процессы
смены кратковременной памяти на долговременную.
Поступление информации
Воспроизведение информации
Кратковременная память
Долговременная память
Регистрация и извлечение
Рис. 20.10. Схематическое изображение последовательности процессов образования
памяти при ее восприятии, хранении, а также извлечении из долговременной
памяти.
на велосипеде базируется на процедурной, или имплицитной, памяти, а
все остальные знания о велосипеде, равно как и очередное его
изобретение, требуют привлечения декларативной, или эксплицитной, памяти.
Различные формы памяти можно представить в виде следующей схемы
(рис. 20.9).
Образование памяти у человека при восприятии сенсорной
информации представляет собой ступенчатый процесс преобразования одного
физиологического процесса в другой: активация сенсорных систем при
поступлении информации в мозг, реверберация возбуждения в нейронных
кругах мозга (кратковременная память), консолидация следов памяти и
образование энграмм (долговременная память), хранение энграмм памяти в
структурах мозга и процесс извлечения энграмм памяти при научении
(рис. 20.10). Новая информация в течение небольшого отрезка времени
(около 1 мин) сохраняется в кратковременной памяти, емкость которой
незначительна: в среднем 7 ± 2 элементов информации, т. е. семь слов, букв,
цифр или символов (но не более двенадцати). Приблизительно 20—30
секунд мозг обрабатывает эту информацию, решая, насколько она важна и
820 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
стоит ли сохранять ее в дальнейшем. Повторное поступление той же
информации повышает вероятность ее преобразования в долговременную
память, емкость которой практически не ограничена, а длительность
хранения варьирует от нескольких минут до десятилетий.
20.4.2. Нейронные механизмы имплицитной памяти
Поступающее в центральную нервную систему возбуждение способно
некоторое время циркулировать в замкнутых цепях нейронов. При этом
поступившая в мозг информация может циркулировать в структурах мозга и
после того, как прекратилось действие раздражения на органы чувств.
Процесс циркуляции возбуждения в замкнутых нейронных сетях мозга
человека называется реверберацией (рис. 20.11). При реверберации
потенциалы действия возвращаются к одним и тем же нейронам, сохраняя их
возбужденное состояние в течение некоторого времени, этим обеспечивается
кратковременная память. В возбужденных нейронах стимулируется фосфо-
рилирование ферментов, связанных с окислением субстратов, что
способствует кратковременному сохранению активности таких клеток. Если
действие раздражителя на органы чувств повторяется, то одни и те же
синапсы мозга, куда поступает это возбуждение, используются многократно, и в
результате эффективность их деятельности постепенно повышается.
Повышение эффективности синап-
тической передачи лежит в
основе механизма
долговременной памяти.
20.4.2.1. Габитуация
и сенситизация
При габитуации и сенситиза-
ции проявляются две ступени
образования памяти:
кратковременная и долговременная.
Однократное действие серии
слабых стимулов приводит к
непродолжительной
габитуации, а однократно
примененный сильный раздражитель
(однократное действие серото-
нина) вызывает
кратковременную сенситизацию,
отмечаемую на протяжении
нескольких минут. Четыре-пять таких
тренировок, следующих друг за
другом, приводят уже к
долговременной сенситизации,
сохраняющейся в течение суток,
а при дальнейшем повторении
тренировок сенситизация
сохраняется на протяжении 3 нед
и больше.
При повторяющихся
тренировках (повторяющемся дейст-
Замкнутые нейронные сети
Рис. 20.11. Схема реверберации возбуждения
в замкнутых нейронных сетях как основы
кратковременной памяти.
Нервные импульсы от органов чувств, поступая в
замкнутые нейронные сети отделов мозга,
способны циркулировать в них определенное время.
Повторяющиеся раздражения органов чувств
поддерживают циркуляцию (реверберацию) возбуждения
в этих нейронных сетях мозга. Время
реверберации возбуждения соответствует длительности
кратковременной памяти. Результатом длительной
реверберации возбуждения может быть
повышение эффективности синаптической передачи за
счет облегчения экзоцитоза медиаторов и
увеличения количества рецепторов на постсинаптических
мембранах нейронов (компоненты механизма
долговременной памяти). Стрелками на схеме
обозначено направление циркуляции возбуждения в
замкнутых нейронных сетях мозга.
20. Физиологические основы познавательной деятельности человека • 821
.1
5
О
О
СО IS
Б i
и
О *
^ О
Постсинаптический нейрон
Контроль
Габитуация
Сенситизация
Контроль Габи- Сенси-
туация тизация
Сенсорный
нейрон
Рис. 20.12. Изменения в синапсах при длительной габитуации и сенситизации.
Количество терминалей пресинаптического аксона уменьшается при продолжительной
габитуации и возрастает при длительной сенситизации. В первом случае эффективность работы
синапса уменьшается, во втором — увеличивается. Происходящие изменения структуры
синапса являются основой долговременной памяти.
вии серотонина) в клеточное ядро сенсорного нейрона постепенно
перемещается некоторое количество цАМФ-зависимой протеинкиназы, что
вызывает фосфорилирование регуляторных белков, управляющих процессом
транскрипции — считывания информации с молекулы ДНК. В результате
активируются гены, руководящие синтезом белков, необходимых для
дополнительной активации компонентов все той же цАМФ-зависимой
протеинкиназы, и происходит образование новых синапсов на шипиках денд-
ритов нейронов. Последнее увеличивает число синаптических связей
нейрона с другими нервными клетками, участвующими в научении. Этот
процесс является основой постепенного формирования долговременной
памяти в мозге. Сенсорный нейрон может увеличивать количество своих преси-
наптических окончаний, одновременно имеет место увеличение числа
активных зон, из которых непосредственно выделяется медиатор. При этом
образуются дополнительные шипики на дендритах мотонейрона, которые
вступают в синаптические контакты с дополнительными пресинаптически-
ми окончаниями аксона сенсорного нейрона, и таким образом облегчается
проведение возбуждения по нейронной сети, участвующей в научении
(рис. 20.12). При длительной габитуации имеют место противоположные
изменения: количество синаптических связей между сенсорным и
моторным нейронами уменьшается приблизительно на '/3 с одновременным
уменьшением числа активных зон в синапсах. Это является структурным
компонентом снижения физиологической активности нейронной сети и
уменьшения проявления ее реакции на действие внешнего раздражения,
что не приводит к запоминанию информации.
Привыкание и сенситизация являются неассоциативными формами
научения. Изучение механизмов привыкания и сенситизации позволило
822 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
показать, что уменьшение или увеличение тока кальция в пресинаптиче-
ском окончании может быть одним из механизмов кратковременной
памяти. Образование же долговременной памяти оказалось связанным с
использованием вторичных посредников, экспрессией генов и
возникновением дополнительных синапсов. Аналогичные механизмы в принципе
могут быть использованы почти во всех синапсах мозга, поэтому нет
оснований считать, что эти механизмы специфичны лишь для каких-то
особенных «нейронов памяти».
20.4.2.2. Ассоциативное научение (условныерефлексы)
Гипотеза, объясняющая нейронные основы ассоциативного научения,
состоит в том, что между разными видами специфических нейронов в
центральной нервной системе могут существовать малоэффективные и даже
нефункционирующие синапсы. Так, например, естественная реакция на
звуковой раздражитель не связана со слюноотделением, поскольку
возбуждение клеток слуховой коры не передается к нейронам, регулирующим
пищеварительную деятельность, из-за низкой эффективности синаптической
передачи между этими нервными центрами. При частом сочетании
звукового сигнала с вкусовыми ощущениями малоэффективные синапсы
начинают функционировать, благодаря чему один лишь звуковой сигнал
вызывает слюноотделение. Изменения в синапсах могут быть следствием
биохимической модификации или увеличения контактирующих участков
между пре- и постсинаптическими нейронами (рис. 20.13).
Классический условный рефлекс, представляющий собой более
сложную, чем габитуация или сенситизация, форму научения, отличается
необходимостью запомнить значение совпадения во времени двух стимулов:
слабого, обычно не вызывающего никакого ответа вследствие стойкого
привыкания к нему, с сильным, всегда вызывающим закономерную
рефлекторную реакцию. Формирующаяся при образовании условного
рефлекса память оказывается более стойкой, чем при габитуации или сенсити-
зации.
Генетические исследования подтверждают участие связанных с цАМФ
вторичных посредников в процессах научения. Установлено также, что
избирательная блокада одного из регуляторных белков, участвующих в
экспрессии гена для цАМФ, приводит к утрате способности образовывать
долговременную память, но не затрагивает кратковременную. Однако было
бы ошибкой считать, что в основе процессов научения и памяти лежат
только связанные с цАМФ обменные процессы. При других формах науче-
Рис. 20.13. Модификация синаптического
переключения в малоэффективном
синапсе (модель Хебба).
1. Нейрон А всегда возбуждает нейрон X.
2. Нейрон Б не способен возбудить нейрон X.
3. Нейроны А и Б в течение некоторого времени
действуют совместно, нейрон X возбуждается.
4. После этого эффективность синаптической
передачи между нейронами Б и X повышается и
нейрон Б приобретает способность возбуждать
нейрон X. Ек — критический уровень
деполяризации мембраны нейрона X.
МП — мембранный потенциал.
А 2
20. Физиологические основы познавательной деятельности человека • 823
ния могут использоваться иные системы вторичных посредников, а
описанные выше процессы простых форм научения могут комбинироваться с
другими молекулярными процессами, приводя в итоге к образованию
комплексных форм памяти. Имплицитная и эксплицитная формы памяти у
человека нередко оказываются связанными друг с другом.
20.4.3. Механизм образования эксплицитной памяти
В головном мозге человека отсутствует единое место хранения памяти.
Эксплицитная память формируется в тех регионах мозга, которые
необходимы для ее приобретения и участвуют в ее образовании. Такими
структурами памяти могут быть гиппокамп, обонятельный мозг, миндалины, ба-
зальный передний мозг и, конечно, кора больших полушарий. Из
проекционных областей коры больших полушарий в сохранении памяти
участвуют вторичные проекционные области и ассоциативная кора,
осуществляющие распознавание наиболее сложной информации и мыслительные
функции человека. При этом вторичные зрительные области хранят
зрительную память, слуховая кора — слуховую, сенсомоторные области,
наряду с мозжечком и базальными ядрами, используются для фиксации следов
памяти о выработанных двигательных навыках. Префронтальная кора
играет важную роль в хронологической организации событий памяти.
Структурным коррелятом долговременной памяти является энграмма
памяти. Поводом к возникновению процессов, приводящих к
образованию энграмм памяти, могут быть новые, неожиданные воздействия на
организм человека стимулов внешней среды или, напротив, исчезновение
привычных либо ожидаемых событий. Место мозга, в котором происходит
образование энграммы памяти, зависит от модальности сенсорных
воздействий и их сложности, что требует участия в запоминании разных
вторичных сенсорных и ассоциативных областей коры. Место образования новой
энграммы памяти обусловлено участками мозга, где хранятся
образованные ранее энграммы. Новая энграмма памяти образуется при участии
структур, выполняющих функцию внимания в текущий момент времени.
Наконец, энграмма памяти образуется при участии лимбических структур
мозга, от которых зависит эмоциональный фон, ускоряющий или
замедляющий процесс научения.
Однако знание места хранения долговременной памяти в мозге не
позволяет объяснить механизм воспоминания или извлечения следов памяти.
Эту ситуацию можно сравнить с памятью, хранимой на видеокассете: ее
можно извлечь лишь с помощью видеомагнитофона и телевизора. Поэтому
энграмма памяти, хранящаяся в определенных структурах мозга, может
быть извлечена при участии структур других регионов мозга,
непосредственно не участвующих в хранении информации. У человека извлечение
энграммы эксплицитной памяти (семантической или биографической)
связано с процессами осознания информации и речевой деятельностью.
Нейронные механизмы поддержания необходимого уровня бодрствования
и речевой деятельности у человека взаимодействуют с теми регионами
мозга, где зафиксированы следы памяти.
Показано, что удаление гиппокампа приводит к нарушению
образования эксплицитной долговременной памяти, но не влияет на формирование
имплицитной долговременной памяти, что указывает на разные места
образования этих форм памяти. В пользу этого свидетельствуют и
наблюдения, демонстрирующие избирательное нарушение только имплицитной
памяти (например, при поражениях мозжечка).
824 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
В то же время отмечено, что в условиях указанного отсутствия структур
гиппокампа выработанные прежде навыки не исчезают, однако
приобретение новых становится практически невозможным. Эти результаты
свидетельствует о том, что гиппокамп не является местом хранения
долговременной памяти, но он необходим для преобразования кратковременной
памяти в долговременную.
Память связана не с синтезом каких-либо уникальных белков,
специфичных для каждого ее вида. Она зависит не столько от конкретных
биохимических процессов, сколько от того, в каких нейронах и синапсах
происходят эти процессы, где находятся такие нейроны и синапсы и как они
связаны с другими клетками. Если указанные синапсы не активируются на
протяжении длительного времени, то происходит естественное разрушение
белковых молекул, синтезированных для образования энграмм памяти, и
таком случае происходит забывание.
20.5. Речь
Речь представляет собой исторически сложившуюся форму общения
людей, опосредованную языком. Язык является системой звуковых,
словарных и грамматических средств для общения, мышления, передачи
информации от человека человеку, от одного поколения — другому. В
повседневном обиходе эти два термина понимаются как способность говорить. Этой
уникальной способностью человек отличается от всех живых существ. Речь
в узком смысле слова понимают как использование в общении между
людьми голосовых, слуховых, зрительных и мануальных навыков, к
которым относят способность произносить слова, воспроизводить письменные
знаки, улавливать речь на слух и распознавать зрительно печатный или
рукописный текст.
Различают речь экспрессивную (моторную), предназначенную для
коммуникации, или социального общения людей, и внутреннюю речь, «немую»,
используемую для решения мыслительных задач и внутреннего
программирования. Внутренняя речь характеризуется своей фрагментарностью и
краткостью по сравнению с экспрессивной внешней речью. Перевод
человеком внутренней речи во внешнюю происходит путем синтаксического
переструктурирования, т. е. перевода в синтаксически расчлененную,
развернутую и понятную другим людям форму. Особо выделяют письменную
речь, отличающуюся, во-первых, использованием письменной графики, а
во-вторых, специфическими для нее синтаксическими конструкциями и
функциональными стилями. Речь неразрывно связана с мышлением,
памятью, сознанием, эмоциями, вместе с которыми она включается в целостный
поведенческий акт речевой деятельности.
20.5.1. Свойства языка
Среди всех возможных средств коммуникации у людей различают
вербальные, т. е. словесные, невербальные (геометрические фигуры,
математические знаки, рисунки, фотографии), а также паралингвистические (жесты,
мимика, музыкальные мелодии). Представляя собой типично
человеческую форму общения, язык отличается от прочих форм коммуникации
своими свойствами. Во-первых, языку присуща креативность (созидатель-
ность). Уже на стадии овладения родным языком человек не заучивает
наизусть все услышанное, но через неосознаваемые (имплицитные)
процессы переходит к общим правилам построения осмысленных выражений.
20. Физиологические основы познавательной деятельности человека • 825
Словарный запас одного человека содержит большее или меньшее, но все-
таки ограниченное количество слов, из которых он может построить
неограниченное количество предложений, в том числе и такие, которые
раньше никогда не слышал и не говорил. Во-вторых, язык отличается своей
уникальной формой: из сравнительно небольшого числа используемых в
нем звуков создается бесконечное множество комбинаций. Звуки, или
фонемы, являются самыми малыми звуковыми единицами, изменение
которых может привести к изменению значения слова, например: дом — том,
волос — голос и т. п. В-третьих, для языка человека характерна
определенная структура, которая регламентируется грамматикой, включающей
правила комбинации фонем в словах (морфология) и правила комбинации
слов в предложениях и оборотах речи (синтаксис). В-четвертых, в каждом
языке существует возможность абстрагирования, т. е. передачи
информации, не связанной непосредственно с конкретными событиями. Такая
возможность отсутствует у простых символических систем коммуникации:
например, с помощью жестов можно передавать только специфическую
информацию, связанную с текущими обстоятельствами. Но в то же время
речь посредством жестов, мимики, интонации и положения тела может
приобретать нужную или желаемую эмоциональную выразительность.
В-пятых, являясь основным средством социального общения, язык наряду с
коммуникацией способствует образованию индивидуального
эмоционального опыта людей. Он служит способом выражения сознания и самосознания
человека и его индивидуальности. Язык непосредственно связан с
мышлением человека.
20.5.2. Речевой аппарат
В создании звуков человеческой речи участвуют мышцы гортани, языка,
губ, мягкого неба, глотки и дыхательная мускулатура, которые иннервиру-
ются подъязычным, блуждающим, лицевым, диафрагмальным нервами, а
также мотонейронами спинного мозга, регулирующими сокращения
дыхательных мышц. Звуки возникают во время выдоха, когда поток воздуха
проходит через гортань, а ее голосовые связки вибрируют, изменяя тем
самым величину подсвязочного давления. Характер дыхания должен
приспосабливаться к речи, что проявляется в регуляции скорости и
продолжительности выдоха и, соответственно, регуляции глубины вдоха, чтобы
набранного в легкие воздуха было достаточно для произнесения фразы
определенной длины. Произвольное управление дыханием особенно наглядно
проявляется при пении, когда быстрый вдох сменяется продолжительным
контролируемым выдохом, соответствующим длине музыкальной фразы.
Строение лицевого черепа и челюстей человека обеспечивает такое
положение языка, при котором его задняя часть оттеснена в глотку, а
гортань — вниз. Только такая позиция позволяет языку изменять форму
расположенной над гортанью полости и тем самым модулировать звуки,
возникающие в гортани. Во время прохождения воздуха через голосовую щель
происходят правильные вибрации голосовых связок, благодаря которым
возникают гармонические колебания воздушного потока, соответствующие
частоте вибрации. В зависимости от частоты колебаний воздуха возникают
звуки определенной высоты. Частоту вибрации, а следовательно, и высоту
звука, можно произвольно изменять посредством сокращений мышц
гортани, регулирующих натяжение голосовых связок. Рождающиеся при этом
звуки соответствуют частотам с правильным периодом, которые можно
разложить на ряд чистых тонов, а сами звуки можно пропеть; в составе
826 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
языка они называются гласными. Воспроизведение таких звуков гортанью
обозначается термином фонация.
Произведенные гортанью тоны преобразуются в звуки речи
расположенными выше полостями носа и рта, выполняющими функцию
резонаторов. Этот процесс управляется сокращениями мышц языка, губ, мягкого
неба и глотки и определяется как артикуляция. Согласные звуки
возникают в основном с помощью артикуляции; если гортань не участвует в их
произнесении, то получаются глухие согласные, например [т], а при
участии гортани — звонкие согласные [д]. В отличие от гласных согласные
звуки невозможно пропеть.
Самая низкая частота колебаний воздушного столба в гортани
характеризуется наибольшей амплитудой, воспринимается на слух как самая
громкая и называется основной. Одновременно с этой частотой голосовые
связки, а затем и расположенный над ними воздушный столб, колеблются
с большими частотами, кратными частоте основного тона. Они
обусловлены колебаниями независимых сегментов воздушного столба, что образует
обертоны. Сочетание основного тона с обертонами создает индивидуально
узнаваемый тембр голоса. Полости носа и рта в речевой функции
выполняют роль резонаторов и фильтров, поскольку в большой мере поглощают
некоторые частоты, что определяется размером и формой этих полостей в
каждый конкретный момент. В результате при произнесении гласных
сохраняется лишь часть акустической энергии гортани, соответствующая
непоглощенным частотам, которые называются формантами. Формантные
частоты различаются у одной и той же гласной в зависимости от того, с
какой согласной она образовала слог. Распознание речи на слух основано
на различении формант, и, следовательно, наименьшими смысловыми
единицами речи являются слоги.
20.5.3. Речевые структуры мозга
Речевая деятельность присуща только человеку, что почти исключает
экспериментальное изучение ее физиологических основ на животных.
Поэтому в основу представлений о нейрофизиологических механизмах речи
легли клинические наблюдения: это весьма распространенный путь к
пониманию функции, который состоит в анализе причин ее нарушения.
Значительно позже к опыту клинических наблюдений добавились методы пози-
тронно-эмиссионной томографии (ПЭТ) и ядерно-магнитного резонанса
(ЯМР), позволяющие регистрировать динамику активности различных
регионов мозга в процессе речевой деятельности.
20.5.3.1. Нарушения речи при очаговых повреждениях мозга
Утрата экспрессивной речи и/или способности понимать устную речь
вследствие приобретенных поражений мозга обозначается как афазия, для
менее выраженных речевых расстройств используется термин дисфазия. В
подавляющем большинстве случаев поражения мозга, вызывающие
афазию у правшей, имели место в левом полушарии мозга.
При поражении левой нижней лобной извилины (зона Брока,
соответствующая полям 44—45 Бродмана) развивается моторная афазия,
проявляющаяся нарушением разговорной речи, а нередко и письма. Выраженность
нарушений речи пропорциональна размерам очага поражения, но в любом
случае имеют место неудовлетворительные артикуляция и мелодичность
речи, которая становится крайне немногословной (телеграфной).
20. Физиологические основы познавательной деятельности человека • 827
Центральная борозда
Рис. 20.14. Речевые структуры мозга человека в левом полушарии.
При участии зоны Вернике (поле 22) происходит программирование смысла речи человека.
Импульсы из зоны Вернике по дугоообразному пучку передаются в зону Брока (поле 45).
Функцией зоны Брока является создание двигательной программы речи. Эта программа
выполняется через первичную двигательную зону (поле 3). Цифры на рисунке соответствуют
нумерации полей по классификации Бродмана.
Сенсорная афазия отмечается у людей при поражении зоны Вернике,
занимающей заднюю часть левой верхней височной извилины (поле 22 по
Бродману). При сенсорной афазии у человека нарушается понимание
обращенной к нему речи. При попытке говорить больной правильно
произносит звуки, но допускает ошибки в понимании и использовании слов,
может произносить грамматически правильные, но бессмысленные фразы.
Отсюда был сделан вывод о том, что для восприятия и программирования
речи используются разные регионы левого полушария мозга.
Из этого представления возникла первая модель формирования речи,
которая различала сенсорную деятельность, связанную с пониманием смысла
воспринимаемых слов и обеспечиваемую задней третью верхней височной
извилины (зона Вернике), а также моторную деятельность, формирующую
программы движений для мышц артикуляции и находящуюся в зоне
Брока. Две эти анатомические области связаны между собой дугообразным
пучком нервных волокон, что обеспечивает их взаимодействие (рис. 20.14).
20.5.3.2. Модель речевой деятельности Вернике—Гешвинда
На протяжении первой половины XX столетия доминировало
представление об эквипотенциальное™, т. е. функциональной равноценности
различных областей коры, поэтому считалось, что речь не имеет
анатомических коррелят. Однако в дальнейшем были показаны различия в
деятельности речевых центров левого полушария при восприятии устной речи и
чтении написанного текста (рис. 20.15). Звуки голоса воспринимаются
слуховыми рецепторами внутреннего уха человека, где происходит
трансформация энергии звуковой волны в потенциалы действия слуховых
нервов. По слуховым нервам они поступают через медиальное коленчатое
тело таламуса в первичную слуховую кору (поле 41), затем во вторичную
слуховую кору (поле 42), а оттуда в зону Вернике (поле 22), обеспечиваю-
828 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
Двигательная кора
Рис. 20.15. Модель речевой деятельности Вернике— Гешвинда.
Устная речь формируется при поступлении информации в слуховую кору и при
декодировании ее в зоне Вернике, где происходит программирование ответной речи. Из зоны Вернике
информация передается по дугообразному пучку в зону Брока, в которой готовится программа
артикуляции, поступающая в первичную моторную кору. Моторная кора осуществляет
регуляцию деятельности артикуляционных мышц. При письменной речи информация поступает
вначале в зрительную кору, а затем через угловую извилину передается также в зону Вернике,
далее в зону Брока, затем в двигательную кору, регулирующую артикуляцию.
щую понимание значения услышанных слов и конструирование ответных.
Из зоны Вернике информация передается по дугообразному пучку в зону
Брока, где локализована память об артикуляции, на основе которой
создается программа собственной речи. Электрическая активность нейронов
зоны Брока передается в первичную двигательную область коры, которая
регулирует в соответствии в поступающей в нее программой деятельность
мышц артикуляции. Речь человека, которая возникает при этом, содержит
смысловые составляющие, которые являются источником информации для
другого человека.
При чтении текста соответствующие сигналы направляются от сетчатки
глаз по зрительным нервам к наружному коленчатому телу таламуса,
оттуда—в первичную, а затем во вторичную зрительную кору. Далее
переработанная информация попадает в угловую извилину теменной доли (поле
39), где перерабатывается зрительная, слуховая и тактильная афферентная
информация, а оттуда — в зону Вернике. Если текст следует прочесть
вслух, то для этого требуется отправить надлежащую информацию по
дугообразному пучку в зону Брока, а затем активировать первичную моторную
кору.
20.5.3.3. Современная модель речевой деятельности человека
Наблюдения клиницистов показывают, что как при моторной, так и при
сенсорной афазии очаги поражения мозга обычно захватывают довольно
большую территорию, а не ограничиваются лишь зоной Брока или
Вернике. В то же время встречающиеся иногда в клинике ограниченные
повреждения этих областей, как правило, не приводят к типичным афазиям
Брока или Вернике.
20. Физиологические основы познавательной деятельности человека • 829
Применение специально разработанных когнитивных тестов в
комплексе с ПЭТ и ЯМР привело к появлению новой модели речевой
деятельности. Согласно этой модели информация, воспринимаемая на слух и при
чтении, перерабатывается в мозге человека и достигает зоны Вернике не
по общим, а по раздельным (параллельным) нейронным сетям. Поэтому
зрительные и слуховые репрезентации слов в структурах мозга нередко
происходят при участии полей коры головного мозга специфической
модальности, откуда информация непосредственно поступает в зону Брока.
Наконец, слуховая информация может перерабатываться при участии
нескольких параллельных нейронных сетей мозга. Например, восприятие
обычных слов, имеющих значение для понимания содержания речи, и
восприятие бессмысленных в контексте воспринимаемой речи слов
происходят посредством переработки информации разными и независимыми
путями, образующими отдельные входы в зону Брока. Это свидетельствует о
том, что информация о звуке как о средстве языка и информация о
смысловом значении этого звука в воспринимаемой человеком речи
перерабатывается разными нейронными сетями мозга (рис. 20.16).
20.5.3.4. Литерализация речи
Речевая деятельность, как правило, обеспечивается только одним,
доминирующим относительно этой функции полушарием, обычно левым. У
человека левое полушарие в среднем на 1 см3 больше, и следовательно в левом
полушарии содержится больше нейронов. Анатомические различия между
полушариями мозга у человека подтверждаются при сравнении величины
объема зоны Вернике, которая слева больше примерно у 70 % взрослых
людей, а также у плодов, что указывает на врожденное, генетически
запрограммированное происхождение асимметрии мозга. Указанная асимметрия
выявляется и при сопоставлении борозд и извилин лобных долей: в левом
полушарии обычно имеется четкое разделение всех трех лобных борозд,
каждая из которых хорошо выражена и ветвиста, тогда как в правом
полушарии чаще отмечается атипичное расположение борозд и извилин,
нередко прерывающихся и не имеющих общего ствола. Объем зоны Брока в
левом полушарии значительно больше, чем в правом, а количество
пирамидных нейронов в этой зоне слева больше, чем справа, причем различия
отмечены не только у взрослых людей, но и у новорожденных.
Функциональное доминирование левого полушария окончательно
устанавливается лишь после изучения родного языка. Маленькие дети,
перенесшие тяжелые повреждения речевых областей левого полушария, в
последующем способны овладеть языком благодаря вовлечению в эту
функцию правого полушария. Но взрослые люди после необратимых обширных
повреждений речевых областей левого полушария уже не могут
компенсировать утрату речи с помощью правого полушария. Из этого следует, что
анатомическая асимметрия является только необходимой основой, но не
гарантией языковой специализации полушарий, которая происходит на
ранних стадиях развития, когда специфическая функциональная
активность способствует развитию и совершенствованию нейронных
переключений между речевыми структурами левого полушария мозга.
Однако речи человека присущи не только когнитивные, но и
аффективные компоненты: интонация, регулируемая высота голоса, ритм речи.
Считается, что они контролируются зеркально организованными в правом
полушарии структурами мозга. При повреждении правого полушария
больные говорят одинаково ровно, независимо от того, рассказывают они
830 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
Речь Письмо
J L_
Первичная двигательная кора
Левое премоторное поле (поле Брока)
Двигательное программирование артикуляции
При повреждении возникает афазия Брока
6
Передняя нижняя
область левой
лобной доли
Семантические
ассоциации
Височно-теменная кора (поле Вернике)
Фонологическое кодирование
При повреждении возниквет афазия Вернике
■« >
Первичная слуховая кора
Восприятие речи
Вторичная зрительная кора
(поле 18 по Бродману)
Зрительное кодирование
t
Первичная зрительная кора
Зрительное восприятие
Устная речь
Письменная речь
Рис. 20.16. Современная модель нейронных переключений, необходимых для
речевой деятельности.
Восприятие устной и письменной речи у человека осуществляется при участии слуховой и
зрительной коры (первый уровень переработки поступающей в мозг речевой информации). На
втором уровне в структурах зоны Вернике и вторичной зрительной коре происходят процессы
фонологического и зрительного кодирования информации соответственно. Второй уровень
переработки речевой информации представлен гетеромодальными структурами, которые
участвуют в кодировании как устной, так и письменной информации (3). Речевая (устная или
письменная) информация из зоны Вернике и ассоциативной зрительной коры поступает
непосредственно в премоторное поле Брока и одновременно в лобную кору, откуда также
осуществляется контроль формирования программ артикуляции. Результатом последовательной и
параллельной переработки речевой информации является содержание речи и письма.
о радостном событии или печальном; они часто не способны понимать
эмоциональную окраску обращенной к ним речи.
Глухие от рождения дети не могут услышать чужую речь, они усваивают
язык с помощью той или иной системы жестикуляции, в которых тоже
существуют грамматические правила. Овладевающие языком жестов дети
проходят точно такие же этапы развития, что и дети, которые осваивают
обычный разговорный язык. Для овладения языком жестов используются
те же речевые структуры мозга, что и для овладения речью: при
левостороннем поражении речевых структур мозга глухие перестают понимать
20. Физиологические основы познавательной деятельности человека • 831
язык жестов, тогда как при правостороннем поражении эта способность
сохраняется.
Хотя существование речевых структур мозга определено генетически,
это отнюдь не гарантирует последующее овладение языком, поскольку его
познание возможно только в условиях социального межличностного
общения ребенка со взрослыми людьми. Предложена также гипотеза о
существовании критического периода развития, после завершения которого
овладение языком происходит трудно. Доказательства в пользу этой гипотезы
основаны на результатах наблюдения за людьми, изучающими второй
язык. При изучении второго языка критический возраст длится от третьего
года жизни до пубертатного периода. После вхождения в пубертатный
возраст возможность выучить второй язык стремительно уменьшается, и
подростки усваивают его не быстрее и не лучше, чем взрослые люди 30—40
лет, а потому и не овладевают естественным произношением. По другим
данным, второй язык становится родным лишь в том случае, если дети
начали овладевать им до семилетнего возраста, а затем результаты
ухудшаются по мере прибавления возраста первого знакомства с новым языком.
Аналогичная зависимость имеет место и у глухих детей: чем позже глухой
ребенок начинает осваивать язык жестов, тем больше дефектов
применения этого языка обнаруживается у него в последующей практике.
Считается, что окончание критического возраста совпадает с завершением
созревания нейронных соединений речевых структур мозга.
20.6. Мышление
Мышление — психический процесс познавательной деятельности,
позволяющий человеку структурировать внешнюю среду без непосредственного
контакта с ней путем операций с мысленными образами и символами
объектов.
Фундаментальным абстрактным символом, с помощью которого
человек может передавать информацию об окружающем мире или о себе
другому человеку, является слово. С помощью слова у человека осуществляются
словесно-логические мыслительные процессы, результатом которых
являются различные виды смысловых понятий, категорий или гипотез. Наряду
со словесно-логическим человек обладает наглядно-образным мышлением.
Мысли человека, которые являются результатом обоих видов мышления,
характеризуются рядом особенностей. Прежде всего, мысли человека (как
правило, существенные) обладают относительной стабильностью,
несмотря на изменение сознания. Так, после бессознательного состояния,
вызванного действием на мозг человека наркоза, мысли стабилизируются
моментально и самопроизвольно. Человек способен запоминать мысли. При
этом он запоминает стабильные или существенные проявления
какого-либо калейдоскопа событий. В результате человек запоминает наиболее
существенные мысли, а не промежуточные результаты мыслительного
процесса. Это можно подтвердить тем, что человек обычно не запоминает
летящую птицу, а только сидящую. Мысли человека характеризуются
мультимодальностью. Обычно в мышлении человека используются
различные модальности, т. е. мысли человека могут включать словесные,
зрительные или иные компоненты (зрительное воображение или внутреннюю
речь). В мозге человека мысли и обусловливающие их мыслительные
процессы возникают последовательно в разное время, а не одновременно
несколько мыслей в одно и то же время. Наконец, мысли человека имеют
ограниченную емкость. Под этим понимается, что только какая-то и, как пра-
832 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
вило, незначительная часть от общего количества информации, которой
обладает мозг, может быть представлена в мысли человека. Мыслительная
деятельность человека обусловлена функциями ассоциативных областей
коры головного мозга.
20.6.1. Нейрофизиологические основы мыслительной деятельности
человека
Мышление осуществляется преимущественно в ассоциативных отделах
коры больших полушарий, которые являются местом интеграции информации,
поступающей из первичных и вторичных проекционных зон различных
сенсорных систем (рис. 20.17). В ассоциативных областях коры больших
полушарий текущая информация объединяется с таковой, содержащейся в
долговременной памяти (при участии височной коры и гиппокампа).
Интеграция всех сенсорных сигналов со следами долговременной памяти дает
возможность человеку оценивать, например, положение тела или головы в
пространстве. Ассоциативные отделы лобной коры больших полушарий
имеют особое значение в интерпретации явлений и событий. Благодаря
двусторонним связям лобной коры и лимбической системы в систему
оценки ситуации включаются эмоции. Лобная кора ответственна также за
выбор целей и прогнозирование событий. Наконец, использование
языка — основа многих мыслительных процессов человека — возможно только
при совместной работе лобных и височных долей (зоны Брока и зоны Вер-
нике). Сохранение и манипулирование информацией является основным
моментом при процессах мышления человека. Эта функция мозга человека
осуществляется на основе эксплицитной рабочей памяти при участии
ассоциативной префронтальной коры. Указанный отдел коры больших полу-
Лобная
Аналитические и
образные рассуждения
Пространственная
рабочая память
Математические,
аппроксимации
Предчувствие
боли
Объектная
рабочая
память
Точный
математический
счет Приятные
прикосновения
Предчувствие
Двигательная кора
Соматосенсорная кора
Аналитические рассуждения
Теменная кора
Математические
аппроксимации
Первичная
зрительная
кора (поле V1)
имание разговорной речи
Смысловое различение "зрительных" слов
Предчувствие боли
Разговорная речь
Височная кора
Рис. 20.17. Схема локализации функций познавательной деятельности человека в
коре головного мозга: мышление (по данным позитронно-эмиссионной
томографии и функционального магнитно-резонансного исследования). На рисунке
отмечены участки коры головного мозга человека, в которых возрастает локально
мозговой кровоток при выполнении человеком познавательных заданий.
20. Физиологические основы познавательной деятельности человека • 833
шарий мозга человека осуществляет умственные процессы контроля
внимания, выбора между альтернативными реакциями, а также репрезентацию
и сохранение инструкций мыслительного задания. Мышление как процесс
распознавания информации осуществляется при участии ассоциативных
височных и лобных отделов коры больших полушарий. Мышление как поиск
осуществляется при участии задних ассоциативных (теменно-затылочных)
отделов коры мозга. Соответствие решения выработанному критерию
(стратегия) реализуется при участии ассоциативных лобных, височных и
лимбических отделов коры головного мозга.
20.6.1.1. Нейрофизиологические основы абстрактного мышления (рассуждение
человека)
Рассуждение человека (синоним — абстрактное мышление) — это
способность делать некоторые выводы (мысли), что связано с высшими уровнями
человеческого мышления, предполагающего достижение знания и его
использование в повседневном опыте.
Существуют индуктивная и дедуктивная формы абстрактного
мышления. При дедуктивной форме рассуждения человека, когда происходит
выделение части из целого, активируются структуры левого полушария: в
частности, средняя и нижняя лобные извилины (поля 45 и 47 по Бродману)
и область левой верхней затылочной извилины (поле 19 по Бродману).
При индуктивной форме абстрактного мышления, когда часть события
рассматривается в его движении, мыслительный процесс связан с активацией
структур левой медиальной лобной извилины, левой поясной извилины и
левой верхней лобной извилины (поля 8, 9, 24, 32 по Бродману). Кроме
того, индуктивное мышление сопровождается активацией структур левой
верхней затылочной извилины и небольшой области латеральной нижней
височной извилины.
В целом, рассуждение человека обусловлено функцией левого
полушария мозга. Области дорсолатеральных лобных извилин имеют отношение к
рабочей памяти человека, а медиальная префронтальная кора — к
функциям произвольного внимания.
Функции полушарий мозга человека различаются при других видах
мышления. В частности, распознавание координатной информации, для
которого необходима специфическая информация о расстоянии и
локализации, осуществляется структурами правого полушария. Напротив,
категориальное распознавание, связанное с восприятием пространства и
выражаемое с помощью речи, осуществляется левым полушарием мозга.
Распознавание пространственного положения объектов является
функцией структур задней теменной коры при участии дорсальных зрительных
путей.
20.6.1.2. Нейрофизиологические основы умственных арифметических операций
У человека умственные арифметические операции обусловлены функцией
структур теменной коры. Левая и правая внутритеменные области
активируются в случае, если человек производит счет. Степень активации этих
отделов коры головного мозга пропорциональна сложности
арифметического задания (размер чисел, число операций в единицу времени). В
основе физиологического механизма активации (например, теменной коры)
могут лежать процессы, способствующие выполнению математического
задания, такие как манипуляции с клавиатурой и пространственная зритель-
27 - 6095
834 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
ная рабочая память. В области внутритеменной извилины у человека
находятся нейроны, которые воспринимают числа. Так, в результате
поражения в области внутритеменной извилины возникает нарушение счета.
20.6.1.3. Нейрофизиологические основы мышления при чтении
Чтение является важнейшим культурным изобретением человека. При
чтении, даже отдельных слов, у человека активируются структуры областей
мозга, которые участвуют в речевой функции. В левой затылочно-темен-
ной борозде на латеральном краю червеобразной извилины расположено
поле зрительной формы слова, которое имеет высокий уровень активности
при написании человеком слов. Структуры расположены несколько лате-
ральнее структур веретенообразной извилины, которые активируются при
восприятии выражения лица человека, и ниже ретинотопических карт
зрительной коры и поля, участвующего в восприятии преимущественно
объектов внешней среды. Поле зрительной формы слова является ближайшей
областью к стриарной зрительной коре, которая не имеет ретинотопиче-
ской организации. Функцией структур этого поля является извлечение
абстрактной, инвариантной репрезентации последовательности (цепочки)
букв. Структуры левого поля зрительной формы слова включены в
«вентральный поток» зрительной информации и активируются у человека на
зрительно воспринимаемые как левым, так и правым глазом слова, а не
слова при речи. У человека в процессе развития мышления всегда
взаимосвязана активация структур поля зрительной формы слова с навыками
чтения. При нарушении чтения {дислексия) эта область мозга не реагирует при
попытке распознать буквы и слова.
20.6.2. Функции левого и правого полушарий мозга человека
при мышлении
Мышление человека осуществляется в условиях билатеральной (полушар-
ной) организации мозга. При этом языковые и речевые процессы у человека
очень редко представлены в обоих полушариях. Лексическое же знание
(словарный запас человека) широко представлено в коре головного мозга.
При участии структур левого полушария осуществляются все аспекты
продукции и понимания языка. Поэтому общий словарь человека
«расположен» в левом полушарии. Правое полушарие осуществляет только
лексические процессы с весьма ограниченной грамматикой.
Синтаксические мыслительные операции, связанные с пониманием
глаголов, множественными числами, притяжательными местоимениями,
являются функцией правого полушария. Грамматические рассуждения
человека также обусловлены функцией правого полушария мозга. Несмотря на
то, что при участии только правого полушария люди не могут
использовать синтаксис для понимания смысловых высказываний, они, тем не
менее, в состоянии оценить, какое произношение является грамматическим,
а какое не является таковым. Таким образом, как в отношении словаря,
так и грамматики мыслительной способностью правого полушария
является пассивное распознавание звуковых слов без его продуктивного
применения. Последнее проявляется в том, что люди не могут с помощью
правого полушария организовать звуки в слова.
Мозг человека имеет неисчислимую емкость. Однако его способность к
интерпретации генерируемых человеком объяснений и гипотез является
функцией только левого полушария головного мозга. Этот мыслительный
20. Физиологические основы познавательной деятельности человека • 835
процесс осуществляется благодаря тому, что в левом полушарии
сохраняется информация, понимаемая человеком в целом. Осуществление
подобного процесса в левом полушарии мозга основано на аккуратности
распознавания воспринимаемой информации, как словесной, так и зрительной,
при участии правого полушария. Правое полушарие обеспечивает
точнейшую запись событий, которые используются для построения выводов
относительно представленного в него материала. Оба полушария участвуют в
проблемном решении умственных задач, но разными путями: правое
полушарие — на основе простой информации, а левое — на основе образования
вырабатываемых гипотез. Различие участия двух полушарий мозга в
мышлении позволяет человеку видеть мир адаптивно во всем его многообразии.
ГЛАВА 21
Сон и бодрствование
Сон — периодически возникающее функциональное состояние организма
человека, которое проявляется отключением сознания, отсутствием
реакций на внешние раздражители, физической пассивностью и относительной
неподвижностью спящего. Важнейшими признаками бодрствования
являются сознание, мышление и двигательная активность. В течение каждых
суток сон и бодрствование поочередно сменяют друг друга, образуя
генетически детерминированный суточный цикл сна—бодрствования.
Регулярное периодическое повторение во времени характера и
интенсивности жизненных процессов, отдельных состояний или событий
образует биологические ритмы, присущие всем живым организмам, включая
человека. Связанный с естественным чередованием дня и ночи 24-часовой
ритм называется циркадным или циркадианным (от лат. circa — около,
dies —день). Циркадная ритмика характерна для большинства
физиологических функций. Это суточные колебания температуры тела, от минимума
около 6 часов утра до максимума около 6 часов вечера, ритмические
изменения интенсивности обменных процессов, ритмическая секреция
гормонов и т. д. В суточном цикле сна и бодрствования циркадная ритмика
проявляется особенно заметно. Цикл сна—бодрствования синхронизирован с
другими биологическими ритмами, однако он не является причиной их
возникновения.
21.1. Физиологическое значение сна
Несмотря на более чем вековую историю научных исследований
физиологических механизмов и роли сна, его суть остается непонятой. Определить,
в чем заключается функция сна, не менее сложно, чем ответить на вопрос:
в чем состоит функция бодрствования? Восстановительная теория сна
объясняет его физиологическое значение необходимостью восстановления
параметров гомеостазиса, измененных в связи с активной деятельностью при
бодрствовании. Согласно циркадианной теории сна он появился в процессе
эволюции в качестве механизма гомеостатической регуляции,
предупреждающего появление физиологического дефицита функций. Основу
циркадианной теории составляет представление о существовании нервных
центров, выполняющих функцию так называемых биологических часов,
которые ритмически изменяют характер поведенческих реакций и мозговой
деятельности человека на протяжении суток.
21.1.1. Восстановительная теория сна
Восстановительная теория возникла из наблюдений за последствиями
длительного лишения сна (депривации), исчезающими после его
предоставления. В результате депривации сна снижается работоспособность, ухудшается
настроение, повышаются пороги чувствительности к сенсорным стимулам,
21. Сон и бодрствование • 837
а предоставление сна нормализует все указанные функции. Во время сна
происходит снижение мышечного тонуса, интенсивности обменных
процессов и температуры тела, уменьшение частоты сокращений сердца, частоты
и глубины дыхания, что способствует уменьшению потребления энергии,
необходимой для этих процессов. Одновременно с этим во время сна
увеличивается секреция гормона роста, активируются анаболические процессы
и происходит репаративное восстановление белковых молекул в клетках, что
соответствует представлению о восстановительном значении сна.
И. П. Павлов рассматривал сон как распространяющийся в коре
больших полушарий процесс охранительного торможения, цель которого
состоит в предупреждении или уменьшении утомления клеток коры, по мнению
автора, неизбежно развивающегося при их деятельности. Эта концепция
является одним из вариантов восстановительной теории сна,
акцентирующим внимание на необходимости восстановительных процессов, прежде
всего, в нервных клетках и, в первую очередь, в нейронах коры больших
полушарий. И. П. Павлов полагал, что торможение и сон присущи каждой
нервной клетке («мы видим сон каждой клетки») и специфических
центров сна не существует. Он объяснял механизм сна особой
разновидностью торможения, которое начинается с отдельных, наиболее утомленных
клеток, после чего активно иррадиирует и распространяется на большую
часть полушарий мозга.
Однако при регистрации электрической активности нейронов
установлено, что большинство из них во время сна не менее активны, чем во
время бодрствования, и сон нельзя считать результатом только торможения
клеток коры и, соответственно, состоянием нейронного покоя.
Электрическая активность нейронов на протяжении сна неоднократно и ритмически
изменяется, поэтому сон не является однородным состоянием, каким его
традиционно представляла восстановительная теория. Ритмические
изменения электрической активности мозга во время ночного сна позволяют
выделить различающиеся между собой фазы медленноволнового и быстро-
волнового сна, которые вместе образуют один цикл сна. Цикл продолжается
около 90 мин и затем повторяется 4—6 раз на протяжении ночного сна.
Правильный эндогенный ритм с такой длительностью периода называется
ультрадианным (внутрисуточным).
Восстановительная теория сна не подтверждается при сопоставлении его
продолжительности у разных видов млекопитающих с их физической
активностью и скоростью обменных процессов. Если необходимость сна
действительно зависела бы только от накопления продуктов обмена, то у более
активных во время бодрствования млекопитающих продолжительность сна
должна быть большей. Однако животные с малой интенсивностью
обменных процессов и подвижностью (например, ленивцы) спят значительно
дольше, чем гораздо более активные хищники или приматы, и дольше, чем
грызуны, с их высоким уровнем обменных процессов. С позиций
восстановительной теории трудно объяснить, почему кошки спят до 14 час в сутки,
а лошади довольствуются всего лишь двумя. Отмечено также, что для
деятельных и энергичных людей зачастую характерна меньшая
продолжительность сна по сравнению с теми, кто ведет малоподвижный образ жизни.
21.1.2. Циркадианная теория сна
Эта теория рассматривает цикл сна и бодрствования как результат
управления циркадного ритма с помощью эндогенного механизма, который не
зависит от внешних обстоятельств и определяется как внутренние биологи-
838 ■ ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
ческие часы. Эндогенный ритм жизненных процессов синхронизирован с
естественным чередованием дня и ночи, и после перемещении человека в
другой часовой пояс он приспосабливается к местному времени. В
условиях неизменной освещенности сохраняется продолжительность обычного
24-часового цикла, который может лишь немного удлиняться или
укорачиваться. Сохранение правильного характера циркадных ритмов отмечено в
ходе наблюдений за людьми, пребывающими в условиях полярного дня
или ночи. Сходные результаты получены при исследовании добровольцев,
находящихся длительное время в темной пещере или ее искусственном
аналоге без возможности узнавать время суток.
Большинство имеющихся данных указывает на то, что главным
координатором биоритмологических процессов является гипоталамус. Его роль в
происхождении сна стали исследовать после Первой мировой войны,
когда выяснилось что распространившийся в Европе вирусный
летаргический энцефалит, сопровождающийся непомерной сонливостью,
обусловлен повреждением нейронов промежуточного мозга. Позже было
обнаружено, что водителем циркадных ритмов, включая цикл
сна—бодрствования, являются супрахиазмальные ядра (СХЯ) гипоталамуса, расположенные
над зрительным перекрестом. У приматов, в частности у человека,
существуют два первичных синхронизатора биологических ритмов. Один из них
представляют СХЯ, инициирующие возникновение медленноволнового
сна, регулирующие интенсивность секреции гормона роста и скорость
выведения кальция из организма. Другой синхронизатор биологических
ритмов находится в одной из областей вентромедиального ядра (ВМЯ)
гипоталамуса и служит в качестве регулятора быстроволнового сна,
интенсивности секреции кортикостероидов, температуры тела и выведения калия из
организма. Активность обоих компонентов биологических часов
согласуется между собой в естественном цикле сна—бодрствования.
Циркадианную и восстановительную теорию в настоящее время
принято рассматривать не как альтернативные, а как взаимодополняющие. В
соответствии с таким подходом сон следует считать, с одной стороны,
следствием длительного предшествующего бодрствования, а с другой —
проявлением активности эндогенного генератора циркадного ритма,
синхронизированного с чередованием дня и ночи.
21.2. Периодичность физиологических процессов во время сна
Об изменениях глубины сна проще всего судить по тому, как легко
разбудить спящего человека. Иногда для этого достаточно слабых
раздражителей, например негромкого голоса или легкого прикосновения, но по мере
углубления сна порог чувствительности спящего повышается, и чтобы
разбудить его, требуются более сильные раздражители. На протяжении
ночного сна порог пробуждения у спящего человека изменяется неоднократно.
Изменение порогов чувствительности к внешним воздействиям дает повод
характеризовать сон как поверхностный или глубокий. Объективный метод
наблюдения за спящими людьми на протяжении всего ночного сна от
засыпания до пробуждения предоставляет большую информацию об
особенностях нормального сна и его нарушениях, он позволяет выявить
отдельные стадии сна, отражающие ультрадианную ритмику.
Любой отдельно рассмотренный признак сна не является достаточным
для его характеристики, поскольку может встречаться и при других
состояниях человека. Поэтому для изучения сна используется полисомнография,
т. е. одновременная длительная регистрация нескольких физиологических
21. Сон и бодрствование • 839
функций у спящего человека. Полисомнографическое исследование
включает регистрацию электрической активности мозга
(электроэнцефалография, ЭЭГ), электрической активности скелетных мышц
(электромиография, ЭМГ), движений глаз (электроокулография, ЭОГ) с одновременным
измерением частоты и ритма сокращений сердца, артериального давления,
частоты дыхания и газового состава выдыхаемого воздуха, а также
насыщения крови кислородом. Датчики для слежения за указанными процессами
фиксируются на теле человека перед отходом ко сну, проявления которого
исследуют в специально оборудованных центрах изучения сна. Ритмичное
чередование физиологических проявлений сна является его главной
характеристикой, позволяющей отличить нормальный сон от других состояний,
имитирующих отдельные его стадии.
21.2.1. Стадии сна
Наиболее распространенная классификации отдельных стадий сна (по Де-
менту и Клейтману) различает их по изменениям частоты и глубины волн
ЭЭГ (рис. 21.1). Во время активного бодрствования на
электроэнцефалограмме преобладает так
называемый р-ритм,
который характеризуется
низкой амплитудой
колебаний регистрируемых
потенциалов при
сравнительно высокой частоте
электрических
разрядов—от 13 до 26 Гц и
более. При
расслабленном, или пассивном,
бодрствовании, когда
человек лежит с закрытыми
глазами, р-ритм
чередуется с а-ритмом,
отличающимся большей
амплитудой и меньшей частотой
Активное бодрствование, р-ритм
Расслабленное бодрствование
а-волны
1-я стадия сна
2 -я стадия сна
Рис. 21.1. Изменения
электроэнцефалограммы во
время ночного сна.
Активное бодрствование
характеризуется низкоамплитудным
высокочастотным (3-ритмом
(13—26 Гц), на фоне которого
периодически возникают
а-волны (8—12 Гц), особенно
характерные для расслабленного
бодрствования. При переходе ко
сну происходит синхронизация
волн ЭЭГ и повышение их
амплитуды. Характерным
проявлением глубокого сна является
появление высокоамплитудных 8-
волн, которые в 4-й стадии сна
составляют не менее половины
всех волн ЭЭГ.
Сонное
веретено
К-комплекс
3-я стадия сна, появление 5-волн
4 -я стадия сна, преобладание 5-волн
840 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
Таблица 21.1. Характеристики отдельных стадий сна
Стадии
сна
1-я
2-я
3-я
4-я
БДГ
Особенности
ЭЭГ
Низкоамплитудные,
высокочастотные
волны, отдельные
а- и 8-волны
Появление К-
комплексов и
сонных веретен
8-Волны
составляют не менее
20 % ЭЭГ
Минимум 50 %
всех волн ЭЭГ
представляют
8-волны
Десинхрониза-
ция ритма ЭЭГ
Мышечная
активность
Эпизодические
движения, тонус
мышц начинает
уменьшаться
Продолжается
снижение тонуса
мышц
Тонус мышц
низкий, случайные
движения
Низкий тонус
мышц, поза
эмбриона
Гиперполяризация
мотонейронов,
максимальное
расслабление мышц,
раскинутые
конечности, БДГ
Вегетативные
функции
Замедление
работы сердца,
дыхания,
снижение АД и
температуры
Углубление
происходящих
изменений
Примерно то
же, что и во
2-й стадии
Минимизация
функций,
стабильная
картина
Повышение
ЧСС, АД,
частоты дыхания,
эрекция
полового члена или
клитора
Когнитивная
активность
Мимолетные
мысли и
образы, переход
«точки без
возврата» —
засыпание
Характерных
примет нет
Разбуженные
бывают
дезориентированы
Абсолютная
дезориентация
при
пробуждении
Примерно 80 %
разбуженных
рассказывают о
ярких
сюжетных
сновидениях
Порог
пробуждения
Низкий
Чуть
выше, чем в
1-й
стадии
Еще
выше
Высокий
Высокий
(8—12 Гц). Во время медленноволнового сна частота волн ЭЭГ становится
еще меньше, а их амплитуда увеличивается, что объясняется ритмичным
одновременным и согласованным возбуждением большого количества
нервных клеток, т. е. синхронизацией их электрических разрядов.
Синхронизация обусловлена ритмичной восходящей активностью стволовых
нервных центров сна, когда же такая активность прекращается, возбуждение
нейронов коры начинает происходить несогласованно. В это время на ЭЭГ
возникают, как и во время бодрствования, высокочастотные и
низкоамплитудные волны, что обозначают термином десинхронизация.
После засыпания ритм электроэнцефалограммы последовательно
изменяется, что позволило выделить четыре сменяющие друг друга стадии
медленноволнового сна, для которого характерно нарастание синхронной
деятельности нейронов подкорковых центров и коры. Первая стадия сна
характеризуется низкоамплитудной и относительно быстрой электрической
активностью, перемежающейся короткими группами а-волн и 0-волн (4—
7 Гц), а также медленными движениями глаз, выявляемыми с помощью
ЭОГ. Во второй стадии сна амплитуда волн ЭЭГ увеличивается, а их
частота уменьшается, одновременно с этим периодически возникают
характерные именно для этой стадии сна К-комплексы и сонные веретена. К-
комплекс представляет собой острую высокоамплитудную волну (до 300
мкВ), а сонные веретена — серию низко- и среднеамплитудных колебаний
с частотой 12—14 Гц.
Для третьей стадии сна типичны медленные высокоамплитудные
фоновые колебания в 0-ритме (4—7 Гц) и периодически появляющиеся на
этом фоне глубокие 5-волны. В этой стадии сна высокоамплитудные 5-
волны составляют от 20 до 50 % всех регистрируемых проявлений ЭЭГ. В
21. Сон и бодрствование • 841
четвертой стадии преобладают высокоамплитудные (75 мкВ и больше) и
медленные (0,5—2 Гц) 5-волны, составляющие более 50 % всех
регистрируемых колебаний ЭЭГ. Во время первой и второй стадий сна спящего
легко разбудить, что послужило поводом называть такой сон легким, или
поверхностным. Разбудить спящего человека во время третьей стадии
значительно труднее, но самым глубоким сон оказывается во время четвертой
стадии, когда на ЭЭГ преобладают 5-волны, такой сон часто называют
дельта-сном.
Медленноволновой сон внезапно сменяется быстроволновым сном,
проявляющимся десинхронизацией волн ЭЭГ, амплитуда которых резко
уменьшается, а частота увеличивается до 4—8 Гц. Наряду с этим
возникают быстрые периодические движения закрытых глаз, что послужило
поводом назвать эту фазу сном с быстрыми движениями глаз (БДГ-сон; англ.
REM — rapid eye movements). Еще одним характерным признаком БДГ-сна
является уменьшение тонуса скелетных мышц до минимального и
исчезновение сухожильных рефлексов, что обусловлено гиперполяризацией
мотонейронов спинного мозга. Расслабленное состояние скелетных мышц
одновременно с высокой активностью нейронов головного мозга побудило
назвать быстроволновой сон парадоксальным в отличие от ортодоксального
медленноволнового сна. Типичные для сменяющих друг друга стадий сна
изменения функций представлены в табл. 21.1.
21.2.2. Структура сна
После засыпания происходит последовательная смена 1, 2, 3 и 4-1 стадий
медленноволнового сна, после чего спящий возвращается в 3-ю, потом во
2-ю и 1-ю стадию, которую сменяет фаза БДГ-сна, наступающая
приблизительно через 90—100 мин от момента засыпания. Все эти события
составляют один цикл сна, такие циклы повторяются на протяжении ночного
сна 4—6 раз (рис. 21.2). Суммарная продолжительность 1-й стадии у взрос-
БДГ-сон
Максимальное снижение тонуса мышц
Бодрство
вание
Стадии
сна 1
Рис. 21.2. Циклическая смена стадий сна на протяжении ночи.
Первый цикл длится около 100 мин, в течение которых спящий человек последовательно
переходит из 1-й стадии медленноволнового сна во 2, 3 и 4-ю стадии, а затем в 3-ю и 2-ю, после
чего фазу медленноволнового сна сменяет фаза парадоксального сна, завершающего этот
цикл. В последующих циклах уменьшается продолжительность глубокого сна, не возникает
4-я, а затем и 3-я стадии медленноволнового сна, но удлиняются периоды парадоксального
сна с характерной для него утратой мышечного тонуса. В утренние часы возникают
эпизодические пробуждения.
842 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
Таблица 21.2. Возрастные особенности сна
Возраст
Новорожденные
1 год
3 года
После 20 лет
70 лет
Длительность сна
16-18 4
13-14 4
Около 10 ч
7-8 ч
Меньше 6 ч
БДГ-сон (%)
50
35
28-30
24
Около 20
лых людей составляет примерно 5—10 % ночного сна, продолжительность
2-й стадии —около 50%, 3-й —примерно 15%, 4-й —около 5%, БДГ-
сна — 20—25%. Продолжительность эпизодов БДГ-сна увеличивается от
одного цикла к другому и становится наибольшей перед пробуждением. В
то же время 4-я стадия в каждом новом цикле становится все короче или
вообще не достигается. Чем ближе к концу ночного сна, тем чаще
происходят переходы к 1-й стадии, а также эпизодические пробуждения.
Средняя продолжительность ночного сна и его структура зависят от
возраста (табл. 21.2). Начиная приблизительно с пятидесяти лет, люди спят
меньше, чем в молодом возрасте, причем сокращение сна происходит
преимущественно за счет 3-й и 4-й стадий медленноволнового сна, а также
БДГ-сна.
21.2.3. Фаза медленноволнового сна
При засыпании и последующем переходе от поверхностного к глубокому
сну уменьшается тонус большинства скелетных мышц, на электромиограм-
ме регистрируется постепенное понижение амплитуды и частоты
потенциалов действия скелетных мышц. Тонус мышц, закрывающих веки,
напротив, повышается при переходе ко сну и остается высоким на всем его
протяжении. Совершаемые в это время случайные движения обратно
пропорциональны глубине сна, в среднем за ночь человек 8—10 раз меняет
позу, которая во время глубокого сна похожа на эмбриональную.
Реципрокные отношения между симпатическим и парасимпатическим
отделами вегетативной нервной системы во время сна сглажены, а внутри
каждого отдела выявляется функциональная дифференциация, что не
позволяет четко классифицировать происходящие во время сна изменения
как следствие только ваготонии или симпатикотонии. Динамика
показателей вегетативных функций во время медленноволнового сна указывает на
повышение активности парасимпатических центров, и в первую очередь
блуждающего нерва, без отчетливого снижения симпатической активности.
По мере перехода от поверхностного сна к глубокому сужаются зрачки,
уменьшается частота сокращений сердца и вариативность сердечного
ритма, снижается артериальное давление. Самое значительное снижение
кровяного давления отмечено в первых циклах ночного сна, для которых
характерна наибольшая продолжительность стадий дельта-сна.
Одновременно с этим уменьшаются объем циркулирующей крови, мозговой кровоток
и потребление глюкозы клетками мозга, понижаются интенсивность
обменных процессов и выделение катехоламинов мозговым веществом
надпочечников. Средняя частота дыхания в стадиях медленного сна
постепенно снижается и начинает возрастать только в ранние утренние часы в
соответствии с фазой циркадного ритма. Температура мозга в 3-й и 4-й
стадиях медленноволнового сна снижается одновременно с уменьшением по-
21. Сон и бодрствование • 843
требления мозгом кислорода. В то же время сохраняется гомойотермная
регуляция температуры тела, и ее снижение во время медленноволнового
сна сопровождается уменьшением кожного кровотока и снижением
температуры кожи.
Моторика желудка уменьшается по мере углубления медленноволнового
сна, но в ранние утренние часы она снова возрастает, что совпадает с
увеличением продолжительности эпизодов БДГ-сна в это время. Секреция
слюнных желез и выделение соляной кислоты в желудке испытывают
наибольшее торможение в фазе парадоксального сна, а во время
медленноволнового сна секреторная активность хотя и понижена по сравнению с
бодрствованием, но в меньшей степени, чем во время БДГ-сна. Во время
медленноволнового сна увеличиваются образование и секреция гормона роста,
способствующего анаболическим и репаративным процессам в клетках,
восстановлению их работоспособности.
Совокупность физиологических изменений, происходящих во время
медленноволнового сна одновременно с уменьшением кортикальной
активности, побуждает многих исследователей рассматривать эту фазу сна
как состояние, необходимое для восстановления гомеостазиса мозговой
ткани и оптимизации управления внутренними органами.
21.2.4. Фаза парадоксального сна
Для парадоксального сна характерны отсутствие движений и резко
сниженная чувствительность к внешним воздействиям на фоне высокой
активности большинства клеток мозга. В связи с атонией мышц,
обусловленной гиперполяризацией мотонейронов, поза спящего человека
характеризуется распростертыми, «раскинутыми» конечностями. Рефлекторные
реакции резко ослаблены, сухожильные рефлексы не воспроизводятся.
Пороги всех видов чувствительности, как и порог пробуждения, во время
БДГ-сна выше, чем в остальных стадиях сна. Одновременно с этим
происходит десинхронизация электроэнцефалограммы, которая становится
почти такой же, как и во время бодрствования. Повторяющиеся эпизоды
быстрых движений глаз включают от 5 до 50 движений и в целом занимают
около 10 % всей фазы парадоксального сна.
Большинство разбуженных в этой фазе сна, около 80 %, сообщают об
увиденных сновидениях, причем эмоционально насыщенным сновидениям
часто соответствуют наиболее интенсивные быстрые движения глаз.
Однако у некоторых людей сновидения могут возникнуть в любой стадии сна, а
быстрые движения глаз не обязательно сопутствуют сновидениям.
Активация нейронов коры во время парадоксального сна сочетается с блокадой
афферентных сигналов к ним от органов чувств и эфферентных сигналов
от них к мышцам, что происходит на фоне облегченной передачи
афферентной информации от внутренних органов. Считается, что в это время
интенсивно перерабатывается полученная в предшествующем
бодрствовании информация, создаются энграммы памяти и формируются будущие
поведенческие программы (информационная теория сна).
Динамика вегетативных показателей во время парадоксального сна по
контрасту с картиной медленноволнового сна оценивается как
«вегетативная буря». Такое определение отражает крайне переменчивый и
противоречивый характер происходящих изменений. Так, например, в начале
фазы БДГ-сна возникает тахикардия, обусловленная еще ббльшим, чем в
фазе медленного сна, снижением активности блуждающего нерва и
отсутствующая при его блокаде. Затем она сменяется брадикардией, которую
844 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
некоторые исследователи связывают с еще большим усилением
парасимпатической активности и одновременным понижением симпатического
тонуса. По другим данным, в фазе парадоксального сна происходят
периодические повышения симпатической активности с одновременным
увеличением содержания адреналина в периферической крови.
Повышение частоты сокращений сердца часто коррелирует с приятными
сновидениями, тогда как эмоционально напряженные сновидения
сопровождаются высокой вариабельностью сердечного ритма. Изменения артериального
давления в фазе парадоксального сна характеризуются выраженными
индивидуальными особенностями с тенденцией к незначительному
повышению.
Мозговой кровоток в фазе БДГ-сна увеличивается на 3—12 % по
сравнению с активным бодрствованием, наибольшее увеличение кровотока
зарегистрировано в прецентральных регионах коры, ромбовидном мозге и
гипоталамусе: считается, что повышение кровотока определяют местные
механизмы его регуляции. Одновременно с этим мозг увеличивает
потребление кислорода, а его температура повышается на несколько десятых
градуса. В это же время прекращается гомойотермная регуляция, о чем
свидетельствует исчезновение ответных реакций на перепады внешней
температуры (прекращаются потение, мышечная дрожь и обусловленные
наружной температурой изменения кровотока через кожу).
В фазе парадоксального сна возрастает средняя частота дыхания,
которое становится нерегулярным как по частоте, так и по глубине. При
возникновении быстрых движений глаз возможно появление периодического
дыхания и апноэ, причем подобные изменения дыхания совпадают с
наибольшими вариациями сердечного ритма, артериального давления и
сопровождаются нестабильностью показателей газового состава крови. Ряд
исследований указывают на связь между эмоциональным характером
сновидений и возникновением нерегулярного дыхания.
Секреция пищеварительных желез (саливация, секреция соляной
кислоты в желудке) в фазе БДГ-сна угнетена, а моторные проявления в
пищеварительном тракте усиливаются, но вне связи с быстрыми
движениями глаз. У мужчин в этой стадии сна происходит эрекция полового
члена, у женщин — клитора, что не связано непосредственно с половой
активностью или сексуальным содержанием сновидений. Эрекция во время
парадоксального сна регулярно возникает у детей и подростков еще до
появления полового влечения. Она обусловлена активацией
парасимпатических структур крестцового отдела спинного мозга, возбуждение
которых определяется нисходящим влиянием лимбической системы и
гипоталамуса.
Характерные изменения вегетативных функций во время
парадоксального сна не связаны с изменениями окружающей среды, ограничиваются
во времени именно этой фазой сна, а следовательно, определяются
внутренними факторами и отражают направленность происходящих процессов
на осуществление до сих пор не понятых функций сна. Остается
дискуссионным и вопрос о том, что объединяет регулирующие механизмы столь
разных процессов, приводящих к угнетению моторной деятельности и
сенсорного восприятия одновременно с высокой активностью коры и
разнонаправленными изменениями вегетативных функций. Предполагается, что
все происходящее необходимо для деятельности мозга — самого активного
функционально органа в фазе БДГ-сна. В развитие информационной
теории высказываются предположения о том, что во время быстрого сна мозг
настраивается на восприятие и переработку информации, поступающей от
21. Сон и бодрствование • 845
внутренних органов, производит реорганизацию ранее воспринятой
информации, согласует и оптимизирует деятельность всех структур мозга,
участвующих в этих процессах.
21.3. Нейрофизиологические механизмы сна
Переход от бодрствования ко сну определяется, с одной стороны, сменой
фаз эндогенного циркадного ритма, с другой — возникновением
потребности в отдыхе, возрастающей пропорционально продолжительности
бодрствования. В связи с этим механизмы перехода ко сну включают активные
внутренние процессы в центральной нервной системе и ее пассивные
изменения, обусловленные интенсивной предыдущей деятельностью. В
реализации этих механизмов участвуют несколько структур ствола мозга,
регулирующих взаимодействие таламуса и коры в цикле сна—бодрствования и
способных ритмически изменять свою активность, которая управляется
гипоталамусом и одновременно зависит от нисходящего влияния коры и
лимбической системы.
21.3.1. Участие стволовых центров в регуляции цикла
сна—бодрствования
Нервные центры ствола, регулирующие цикл сна—бодрствования,
по-разному проявляют свою активность в обеих фазах этого цикла, что, однако,
не позволяет их классифицировать в качестве специфических центров
только сна или только бодрствования. Скорее это разные звенья единой
системы, образованной несколькими ядрами ретикулярной формации,
нейроны которых образуют восходящие и нисходящие дивергентные
проекции к различным структурам мозга, посредством которых ритмически
изменяют их активность во время сна и бодрствования.
В ростральном отделе ретикулярной формации расположены небольшие
группы нейронов, постоянно активирующие кору во время бодрствования
и получившие название восходящей активирующей ретикулярной системы
(ВАРС). К ней принадлежат холинергические нейроны покрышки среднего
мозга и гигантоклеточной области моста, а также норадренергические
нейроны, самое большое скопление которых в области моста известно как
голубое пятно (рис. 21.3). В результате активирующего действия ВАРС на
неспецифические ядра таламуса и кору во время бодрствования
происходит деполяризация большинства кортикальных нейронов приблизительно
на 10—15 мВ от исходного значения мембранного потенциала покоя (65—
70 мВ). Такая деполяризация получила название тонической, она снижает
порог возбуждения кортикальных нейронов и тем самым облегчает их
ответную реакцию на поступающую афферентную информацию. Спонтанная
активность ВАРС на протяжении бодрствования не одинакова, она
повышается, например, при действии новых сенсорных стимулов, вызывающих
ориентировочные реакции, или при переживании эмоций ярости и гнева,
когда особенно возрастает активность норадренэргических нейронов.
В каудальной области ретикулярной формации расположены серотони-
нергические нейроны, скопления которых образуют ядра шва. Проекции
этих нейронов распространяются на обширные области мозга: кору, где
имеется около 500 000 серотонинергических синапсов, таламус, лимбиче-
скую систему, гипоталамус, мост и продолговатый мозг. Серотонинергиче-
ские нейроны тормозят активность ВАРС, изменяют активность
вегетативных центров ствола и характер нейронных переключений в моторных и
846 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
Базальный Холинергические Норадренергические Серотонин-
передний нейроны РФ нейроны голубого ергические
мозг среднего мозга и пятна нейроны
покрышки моста ядер шва
Рис. 21.3. Нейронные популяции, участвующие в регуляции цикла
сна—бодрствования.
Нейронные популяции, указанные на схеме, обладают спонтанной активностью, характер
которой закономерно изменяется на протяжении ночного сна и во время перехода к
бодрствованию. Активность указанных нейронов во время сна изменяется под влиянием супрахиазмаль-
ных ядер гипоталамуса (СХЯ).
сенсорных ядрах ствола. Повышение их фоновой активности приводит к
гиперполяризации нейронов рострального отдела ретикулярной формации,
в результате снижается активирующее влияние ВАРС на кору больших
полушарий и происходит переход от бодрствования к медленноволновому
сну. Одновременное действие серотонинергических нейронов на
вегетативные центры и переключательные ядра ствола вызывает характерные для
медленноволнового сна изменения вегетативных процессов, сенсорной
чувствительности и моторной деятельности.
В результате торможения ВАРС изменяется характер возбуждения
зависимых от нее неспецифических ядер таламуса, нейроны которых
гиперполяризуются и в них возникают длительные тормозные постсинаптические
потенциалы. Они прерываются пачками или сериями нейронных разрядов,
при этом большинство нейронов постепенно синхронизирует ритм своей
активности, а затем навязывает его коре, нейроны которой тоже переходят
от характерного для бодрствования состояния тонической деполяризации
к состоянию гиперполяризации. Синхронизированная активность талами-
ческих и корковых нейронов коррелирует с постепенным торможением
психической активности.
Переход из фазы медленноволнового сна в фазу парадоксального сна
инициируют вентромедиальные ядра гипоталамуса, которые тормозят
активность серотонинергических нейронов и тем самым прекращают их
тормозное действие на ростральную область ретикулярной формации.
Вследствие этого возобновляется активность холинергических нейронов гиган-
токлеточной области покрышки моста, вызывающих тоническую
деполяризацию нейронов таламуса и коры. В результате в таламусе и коре
исчезает характерная для фазы медленноволнового сна синхронизированная
электрическая активность нейронов, которые начинают разряжаться
независимо друг от друга, что проявляется десинхронизацией
электроэнцефалограммы.
Десинхронизация в фазе парадоксального сна и при бодрствовании от-
21. Сон и бодрствование • 847
личаются мало, но в остальных проявлениях мозговой деятельности между
этими состояниями существуют большие различия. Во время
парадоксального сна резко заторможена активность всех моноаминергических
нейронов ствола, т. е. серотонинергических, норадренергических и дофаминер-
гических, высокоактивных при бодрствовании. Считается, что активность
холинергических и моноаминергических нейронов регулируется во время
парадоксального сна реципрокно, и чем активнее холинергические
нейроны, тем сильнее тормозятся моноаминергические. Из всех восходящих
дивергентных систем ствола, модулирующих во время бодрствования
характер нейронных переключений в других регионах мозга, включая кору, во
время парадоксального сна активны только холинергические нейроны.
Выключение моноаминергической активности сказывается на
переключательной способности сенсорных и моторных ядер, на активности
вегетативных центров ствола, лимбических структур и коры, поскольку
диффузные моноаминергические проекции при бодрствовании модулируют
нейронные переключения в этих регионах. Вследствие тормозного
нисходящего влияния орального ядра ретикулярной формации моста возникает
мышечная атония, характерная для парадоксального сна, во время которого
высокоактивные клетки коры лишаются как афферентной информации от
органов чувств, так и возможности передать информацию мышцам.
Сновидения, возникающие в этой фазе сна, отражают противоречивую
ситуацию, когда высокая активность коры сочетается с ограниченными
возможностями обмена информацией с периферией.
21.3.2. Регуляция циркадного ритма
Эндогенный суточный цикл сна—бодрствования синхронизирован с
естественным чередованием светлого и темного времени суток. Афферентная
информация о характере освещения поступает по волокнам ретиногипота-
ламического тракта от сетчатки к супрахиазмальным ядрам гипоталамуса
(СХЯ), расположенным по обеим сторонам III желудочка мозга
непосредственно над зрительным перекрестом. Активность нейронов СХЯ
ритмично изменяется с периодичностью 24 ч, такой ритм определен генетически
и сохраняется в условиях не меняющегося освещения. Функция супрахиаз-
мальных ядер состоит в согласовании эволюционно древних ритмов
активности—покоя и реализуется при эфферентном действии СХЯ на гипотала-
мические и стволовые центры, регулирующие специфические
физиологические процессы, включая сон и бодрствование, терморегуляцию,
секрецию гормонов, экскрецию метаболитов и т. п. При этом бодрствование
должно соответствовать периодам активности, а сон — покоя.
Афферентная информация от сетчатки служит средством согласования этой
врожденной ритмики с реальным временем суток (рис. 21.4).
Нейроны вентромедиальной области СХЯ являются их входной зоной и
кроме афферентных сигналов от сетчатки получают информацию из ствола
мозга от ядер шва, а также из других ядер гипоталамуса (функция
обратной связи). Нейроны дорсомедиальной области СХЯ образуют ипсилате-
ральные эфферентные связи с другими ядрами гипоталамуса, в
особенности с вентромедиальным ядром, они имеют также эфферентный выход к
нервным центрам ствола, лимбической системе и полосатому телу.
Посредством своих эфферентных путей СХЯ синхронизируют суточные
ритмы активности физиологических процессов.
В управлении циркадным ритмом вместе с супрахиазмальными ядрами
участвует эпифиз, в котором в светлое время суток повышается образова-
848 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
Аргинин-вазотоцин? Мелатонин?
Свет
РГТ
Сетчатка
СХЯ
\sv
м
/".n,
1—1^1
ч н
М
лкт
^
„
^■^^
Эпифиз
Ядра
гипоталамуса
Ствол
Ядра шва
Циркадная
ритмика
Обратная связь
Рис. 21.4. Схема организации циркадной ритмики.
Супрахиазмальные ядра гипоталамуса (СХЯ) состоят из комплекса нейронных осцилляторов,
связанных иерархически и параллельно. Они получают информацию о характере
освещенности непосредственно от сетчатки по волокнам ретиногипоталамического тракта (РГТ) и после
переработки такой информации в латеральном коленчатом теле (ЛКТ). Эта информация
необходима для согласования эндогенного ритма активности СХЯ с периодической сменой дня и
ночи. Активность СХЯ адресована другим ядрам гипоталамуса, стволу и эпифизу, которые
корректируют активность СХЯ по механизму отрицательных обратных связей (пунктирные
линии).
ние серотонина, а ночью из него синтезируется гормон мелатонин. Синтез
мелатонина происходит благодаря повышению в ночные часы активности
ключевого фермента N-ацетилтрансферазы. Ритмику этого процесса
регулируют СХЯ, но не прямо, а опосредованно, с помощью нескольких
нейронных переключений, активирующих симпатические нейроны верхнего
шейного ганглия, которые непосредственно иннервируют эпифиз.
Нейроны СХЯ имеют рецепторы для присоединения мелатонина, а его
содержание в супрахиазмальных ядрах растет в ночные часы. Поэтому
мелатонин рассматривается рядом исследователей как ингибитор активности
СХЯ в ночное время, осуществляющий обратную связь между двумя
звеньями циркадной системы: эпифизом и СХЯ. В соответствии с другой
точкой зрения у человека мелатонин играет роль локального гормона
эпифиза и влияет на синтез пептидов, которые обладают функциональной
активностью и способны проникать в кровь и ликвор. Одним из таких
пептидов является аргинин-вазотоцин, попадающий с током
цереброспинальной жидкости в супрахиазмальные ядра для модуляции активности их
нейронов.
21.3.3. Участие коры и лимбической системы в регуляции цикла
сна—бодрствования
Переход от бодрствования ко сну у человека определяет не только
эндогенный ритм, синхронизированный с реальным временем суток, но и
характер поведенческой активности, связанной с переработкой сенсорной
информации, особенностями трудовой или иной деятельности,
переживанием эмоций и т. п. Не связанный с естественным чередованием дня и
ночи переход ко сну, как и ситуативная бессонница, могут произойти в
результате нисходящего влияния коры или действия лимбической системы
21. Сон и бодрствование • 849
на гипоталамус и стволовые нервные центры, от активности которых
непосредственно зависит поддержание бодрствования или переход ко сну.
В состоянии бодрствования восходящая активность рострального отдела
ретикулярной формации обеспечивает тоническую деполяризацию
корковых нейронов. В таком состоянии фронтальные отделы коры тормозят
активность подкорковых центров, индуцирующих переход к медленноволно-
вому сну. Предполагается, что нисходящая активность фронтальной коры
распространяется при бодрствовании на лимбические структуры (гиппо-
камп, миндалины, перегородку), а они подавляют активность гипоталами-
ческих центров сна. По-видимому, нельзя исключить и нисходящее
торможение каудального отдела ретикулярной формации, где расположены ядра
шва, индуцирующие медленноволновой сон.
Спящего человека можно разбудить, обратившись к нему по имени, он
просыпается от плача своего ребенка, что в таких случаях свидетельствует
о первоначальной активации коры, без участия которой невозможно
распознать эти слабые и сложные стимулы. Механизм пробуждения включает
торможение центров сна с последующей активацией восходящей
ретикулярной формации. Напротив, бессонница, возникающая иногда из-за
мыслей, которые не удается «отключить», вызвана торможением подкорковых
центров сна активно функционирующей корой.
Активность коры при бодрствовании поддерживается тонической
стимуляцией со стороны ретикулярной формации и зависит от характера
поступающей сенсорной информации: возрастает при действии
разнообразных сенсорных стимулов и уменьшается при ограничении сенсорного
притока или при действии однообразных, монотонно повторяющихся
раздражителей. При интенсивной сенсорной стимуляции торможение
подкорковых центров сна со стороны коры будет проявляться сильнее, а при
ограниченном или монотонном притоке сенсорной информации торможение
уменьшается, что ведет к повышению активности центров сна.
Возникновение сонливости при низком уровне сенсорной стимуляции (например,
при монотонной работе) обусловлено снижением активности коры и
последующим «растормаживанием» подкорковых центров, индуцирующих
медленноволновой сон.
Лимбическая система определяет субъективное отношение человека к
действующим стимулам и возникновение эмоций, связанное с его
поведенческой активностью. Сенсорная информация и результаты
деятельности, вызывающие переживание эмоций, способствуют сохранению или
даже возрастанию восходящей активности ретикулярной формации и, тем
самым, поддержанию бодрствования. Отсутствие новизны в сенсорной
информации, монотонная деятельность, скука приводят к снижению
восходящей активности ретикулярной формации и, соответственно, снижению
тормозящего влияния фронтальной коры на подкорковые центры сна.
21.3.4. Гуморальные индукторы и регуляторы сна
Известен ряд гуморальных веществ, индуцирующих сон, и существует
гипотеза, допускающая наличие не только гипногенных, но и
препятствующих возникновению сна гуморальных факторов. Такие вещества были
извлечены из жидких сред организма (ликвор, кровь) экспериментальных
животных и человека в условиях длительного лишения сна или, напротив,
активного бодрствования. Большинство веществ, причастных к регуляции
цикла сна—бодрствования, относится к пептидам.
Путем фракционирования ликвора, полученного от длительно лишае-
850 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
мых сна животных, выделен состоящий из пяти аминокислот пептид,
который обладает снотворным эффектом. Он получил название фактора S
(от англ. sleep — сон), его удалось выделить и у человека. При введении
экспериментальным животным он вызывает медленноволновой сон с
появлением характерных изменений на ЭЭГ. Обнаружены и другие пептиды
эндогенного происхождения, обладающие способностью индуцировать
медленноволновой сон. К ним относятся: вызывающая сон субстанция с
молекулярной массой 70—200 (SPS), дипептид мураминовой кислоты, нона-
пептид, индуцирующий дельта-сон (DSIP). Эти пептиды способны
преодолевать гематоэнцефалический барьер и влиять на метаболизм нейромедиа-
торов, однако после внутривенного введения они быстро разрушаются под
воздействием ферментов. При введении в желудочки мозга DSIP повышает
в головном мозге концентрацию серотонина и ГАМК, а их накопление в
стадии медленноволнового сна способствует уменьшению обменных
процессов и потребления кислорода мозгом.
Наряду с пептидами — индукторами медленноволнового сна, описан
выделенный из ликвора в период парадоксального сна неидентифициро-
ванный эндогенный пептид, вызывающий БДГ-сон при его введении
экспериментальным животным. К этому пептиду получены антитела,
введение которых угнетает парадоксальный сон. У человека сразу после
окончания фазы БДГ-сна в спинномозговой жидкости в несколько раз
повышается уровень аргинина-вазотоцина (АВТ). Его введение даже в очень малом
количестве (около 600 молекул) вызывает сон у кошек, снотворное
действие проявляется и при введении его людям, у которых при этом возникает
фаза БДГ-сна. Содержание АВТ у пожилых людей с нарушениями сна
уменьшено, высказано предположение о регулирующей роли этого
пептида в организации сна у человека. Имеются сведения о том, что
возникновению БДГ-сна способствует также вазоинтестинальный пептид (ВИП).
К пептидам, участвующим в регуляции сна, относят также субстанцию
Р (нормализует сон при стрессе), бета-эндорфин, ангиотензин-П, есть
данные об участии в регуляции сна соматостатина и тиреотропина. Участие
нейропептидов в регуляции цикла сна—бодрствования возможно как в
качестве комедиаторов нейронных переключений, так и в качестве нейрогор-
монов. Мягкое модулирующее действие пептидов состоит в медленных
изменениях нейронной активности мозговых структур, взаимодействующих
во время сна.
Наряду с нейропептидами снотворное действие на человека может
оказывать простагландин Д2, синтез которого стимулируется при воспалении
паутинной оболочки мозга, сопровождающемся повышенной сонливостью.
Мурамилпептиды бактериального происхождения даже в очень малой
концентрации увеличивают продолжительность медленноволнового сна и
угнетают фазу БДГ-сна; одновременно с этим они вызывают повышение
температуры тела у человека. Эти факты дают возможность приблизиться к
пониманию механизма повышенной продолжительности сна,
наблюдающейся у человека при воспалительных и инфекционных заболеваниях.
21.4. Сновидения и физиологическая роль БДГ-сна
Большинство разбуженных во время парадоксального сна людей сообщают
о сюжетно связанных сновидениях, причем это относится и к людям,
утверждавшим, что они никогда не видят сны. Скорее всего, они просто
забывают о сновидениях, если не просыпаются сразу после фазы БДГ-сна.
Установлено, что люди не менее часто видят сновидения и во время мед-
21. Сон и бодрствование • 851
ленноволнового сна: разбуженные во 2-й фазе сна говорят об этом в 60 %
случаев, реже вспоминают сны в случае пробуждения в 3-й или 4-й
стадиях. Но обычно в таких случаях разбуженные рассказывают лишь о
несвязных, обрывочных образах, тогда как после БДГ-сна вспоминаются связные
эпизоды, кажущиеся реальными.
Зигмунд Фрейд создал теорию толкования сновидений, которые он
объяснял прорывом из подсознания вытесненных туда запретных по
соображениям морали сексуальных и агрессивных желаний. В настоящее время
сновидения принято объяснять теорией активационного синтеза,
основанной на том, что во время фазы БДГ-сна одновременно активируются
многие нейронные переключения в центрах ствола мозга, сигналы от которых
поступают в кору, а она осуществляет синтез этих нередко противоречивых
сигналов, пытаясь объединить их и придать им смысл. При этом кора
активно извлекает из памяти поступившую прежде информацию, которой не
приходится, как при бодрствовании, конкурировать с новой информацией,
предоставляемой сенсорными системами. Поэтому интерпретация
информации происходит иначе, чем при сохраненном сознании, она отражает
реальные потребности и конфликты, но не учитывает реальные временные
и пространственные обстоятельства.
На фоне ограниченного поступления информации о внешних
раздражителях освобождается доступ к коре афферентной информации от
внутренних органов. Это обстоятельство имеет особое значение при развитии
патологических процессов, при которых кора начинает получать
необычную информацию, становящуюся причиной столь же необычных
сновидений. Активация сенсорных областей во время БДГ-сна приводит к
зрительным, слуховым, тактильным компонентам сна, а повышение
активности моторных структур ствола сопровождается представлениями о якобы
выполняемых движениях, хотя реальные движения не происходят в связи с
торможением активности мотонейронов ретикулярной формацией. Таким
образом, сновидения представляют собой не случайный, а биологически
значимый и полезный процесс, хотя содержательная сторона сновидений в
большинстве случаев не поддается достоверному истолкованию.
У детей продолжительность БДГ-сна больше, чем у взрослых: считается,
что в этой стадии сна совершенствуется эффективность переключений
между определенными нейронами, представляющая основной механизм
образования долговременной памяти. Возможно, именно поэтому в периоды
решения наиболее сложных жизненных задач или творческих проблем
продолжительность БДГ-сна увеличивается и у взрослых, причем в
большинстве сновидений появляются эпизоды из предыдущей жизни и
профессиональной деятельности.
Отдельную разновидность сновидений представляют люцидные сны (от
лат. lucidus — ясный, очевидный), когда спящий понимает, что он спит, но
видит сон и может управлять событиями сна. Содержание таких снов
приближается к реальной действительности, а электрическая активность
нейронов коры практически не отличается от таковой в состоянии
бодрствования.
21.5. Продолжительность сна и последствия его лишения
Индивидуальная продолжительность сна у здоровых взрослых людей
варьирует в диапазоне от 4 до 10 ч, в связи с чем различают мало и много
спящих, тогда как средняя продолжительность ночного сна составляет 7,5 ч.
Около трети своей жизни человек проводит во сне. Существуют две проти-
852 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
воположные точки зрения по поводу необходимой длительности сна у
человека. Сторонники первой из них демонстрируют примеры пагубных
последствий недосыпания, которые могут отражаться на функциональном
состоянии человека, вызывать снижение уровня внимания и
сосредоточенности при выполнении работы, что, в свою очередь, может приводить к
авариям и катастрофам по вине недосыпающих людей, а также к
психическим нарушениям у них. Альтернативный взгляд на этот вопрос основан
на представлении о том, что многие люди спят гораздо дольше, чем это им
необходимо, и в буквальном смысле слова просыпают свою жизнь, а
единственным следствием недосыпания является лишь повышенная
сонливость.
Во время длительного вынужденного бодрствования у человека
регистрируют регулярные и очень короткие, продолжительностью в 1—2 с,
периоды так называемого микросна, когда «слипаются» веки и понижается
реакция на внешние стимулы. Вследствие длительного лишения сна
возникают нарастающее утомление, ослабление внимания, раздражительность
и уменьшение поведенческой активности, поскольку потребность во сне
начинает доминировать по отношению ко всем остальным биологическим
потребностям. После длительного бодрствования изменяется структура
следующего за ним сна: вскоре после засыпания возникает глубокий мед-
ленноволновой сон и на протяжении всей ночи преобладают 3-я и 4-я
стадии сна. Восстановление обычной структуры сна происходит лишь на
следующую ночь, что послужило поводом к представлению о первоочередной
потребности в медленноволновом сне.
В экспериментах с избирательным лишением БДГ-сна испытуемых
будят, как только они перейдут в эту фазу, а затем предоставляют им
возможность заснуть вновь, в результате БДГ-сон у них появляется чаще, чем
обычно. Длительное лишение БДГ-сна у человека приводит к
возникновению раздражительности, появлению зрительных или слуховых
галлюцинаций и навязчивых идей. Компенсаторное увеличение продолжительности
только этой фазы в ответ на избирательное лишение БДГ-сна указывает на
самостоятельный механизм его управления, различающийся с механизмом
управления медленноволновым сном.
Эксперименты, в которых добровольцы уменьшали продолжительность
ежесуточного сна на 1,5—2 ч в течение нескольких недель не выявили у
них каких-либо выраженных нарушений психики и здоровья, за
исключением сниженной способности длительного сосредоточения внимания.
Изучение возможности человека перейти от 24-часового ритма к 18-, 21-,
28- или 48-часовому ритму проводилось в пещерах или в условиях
полярного дня, чтобы исключить естественное чередование дня и ночи.
Оказалось, что организм человека трудно приспосабливается к искусственным
ритмам, поскольку собственный эндогенный ритм весьма консервативен.
Обстоятельства, нарушающие этот естественный ритм, приводят к так
называемому десинхронозу, проявляющемуся в снижении умственной и
физической работоспособности, настроения, а порой и невротическими
расстройствами. Причинами десинхроноза в повседневной жизни чаще всего
бывают дальние трансмеридиональные перелеты со сменой часовых
поясов, а также нерегулярное чередование дневных и ночных рабочих смен.
До 30 % взрослых людей имеют некоторые проблемы в связи со сном,
причем от 8 до 15 % жалуются на плохой или недостаточный сон, а среди
пожилых людей этот процент значительно выше; от 9 до 11 % взрослых
людей регулярно принимают снотворные средства. Следует, однако,
учесть, что жалобы многих людей на плохой сон, его недостаточность или
21. Сон и бодрствование • 853
многочисленные пробуждения часто не подтверждаются объективными
исследованиями. Так, например, многие люди, жалующиеся на бессонницу,
фактически спят около 6 ч, но считают, что должны спать 8 ч. Поэтому
они проводят в постели больше времени, чем им необходимо для сна, и,
соответственно, испытывают определенные трудности при засыпании.
Постепенно эта проблема усугубляется из-за боязни снова не заснуть быстро,
и чем больше человек думает об этом, тем труднее ему перейти ко сну. В
таких случаях порой помогают очень простые рецепты: соблюдать
постоянный режим сна и ложиться спать лишь тогда, когда возникает усталость.
К основным проявлениям нарушений сна относятся бессонница, или
инсомния, и патологическая сонливость, или гиперсомния. Бессонница у
здоровых людей нередко появляется как результат ситуативной реакции
эмоциональной природы в ответ на различные житейские коллизии.
Другие формы бессонницы связаны с нарушением функции дыхания во время
сна или возникновением ночных гиперкинезов — насильственных и
болезненных мышечных сокращений, появляющихся чаще всего в нижних
конечностях.
Гиперсомнии проявляются повышенной сонливостью в дневное время.
При одной из форм гиперсомнии — нарколепсии — бодрствование внезапно
прерывается на 10—15 мин периодом БДГ-сна с характерной для него
утратой мышечного тонуса, причем произойти это может в самый
неподходящий момент: во время разговора, еды, вождения автомобиля и даже
полового акта. «Сонные атаки» могут повторяться через несколько часов,
тогда как общая продолжительность ночного сна увеличена незначительно,
хотя он и нарушается частым пробуждением. Еще одна форма
гиперсомнии — катаплексия, при которой кратковременные эпизоды потери
мышечного тонуса не сопровождаются утратой сознания. Эти состояния
часто связаны с эмоциональными реакциями, например смехом, страхом или
злостью, когда переживающий эмоции больной теряет мышечный тонус, а
поэтому падает и затем лежит 1—2 мин.
21.6. Бодрствование и сознание
Пробуждение, или переход от состояния сна к бодрствованию,
обусловлено активирующим влиянием на кору больших полушарий со стороны
диффузной системы нейронов верхних отделов мозгового ствола и зрительных
бугров, и, в первую очередь, нейронов, расположенных между
ростральными отделами моста и каудальными отделами промежуточного мозга.
Большинство этих нейронов являются холинергическими, и ацетилхолин
является, по-видимому, важнейшим нейромедиатором, необходимым для
пробуждения от сна. Наряду с ним пробуждению' способствует и активация
норадренэргических нейронов голубых пятен.
Активность ретикулярной формации периодически изменяется на
протяжении суток, подчиняясь, во-первых, генетически предопределенному
суточному ритму эндогенных осцилляторов, синхронно с которым
происходят изменения концентрации гуморальных регуляторов активности (се-
ротонин, катехоламины, нейропептиды) в крови или ликворе. Во-вторых,
высокой активности ретикулярной формации во время бодрствования
способствует поступление новой сенсорной информации. Если же ее приток
уменьшается (темнота, тишина, отсутствие новых тактильных,
температурных и других раздражителей), то и восходящая активность ретикулярной
системы снижается, что приводит к развитию сонливости. В третьих,
активность ретикулярной формации зависит от характера выполняемой дея-
854 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
тельности и субъективного интереса к ней, что, в свою очередь, определяет
эмоциональный подъем или, напротив, состояние скуки: первое
способствует активному бодрствованию, второе — развитию сонливости. Подобные
перепады восходящей активности ретикулярной формации определяются
ее двусторонними связями с корой больших полушарий и лимбической
системой.
Состояние бодрствования у человека характеризуется наличием у него
сознания. Как бодрствование, так и сознание не связаны с активностью
какой-либо одной специфической области мозга, они являются продуктом
взаимодействия обоих его полушарий и ствола мозга и определяются
суммарным количеством активных нейронов и эффективностью нейронных
переключений между ними. Утрата сознания и невосприимчивость к
внешним раздражителям может быть вызвана как метаболическими
нарушениями мозга, так и поражением верхних отделов ствола: такое
состояние обозначается термином кома. Сознание называют спутанным, если
человек оказывается неспособным четко и последовательно мыслить — в
таких случаях могут появиться искаженные зрительные, слуховые или
осязательные ощущения, а также галлюцинации.
21.7. Различные уровни бодрствования
Сознание человека после пробуждения и его сознание во время активной
деятельности различаются быстротой реагирования, способностью
сосредоточить внимание на тех или иных объектах, мобилизовать ресурсы
памяти. Повышенное эмоциональное возбуждение, как и повышенная
сонливость, негативно сказываются на характере поведенческих реакций. В
связи с этим выделяют несколько уровней бодрствования и сознания,
которые отражают различную степень активности мозга (табл. 21.3).
При низкой активности мозга (кома, наркоз) сознание отсутствует, но и
при чрезмерно высокой активности (эпилептический приступ) оно тоже
исчезает. Таким образом, необходимым условием сохранения сознания
является оптимальный, а не самый высокий уровень активности мозга
(рис. 21.5). Для активного бодрствования характерна способность
концентрировать внимание, т. е. сосредоточить познавательную деятельность на
каком-либо одном объекте, наиболее значимом для человека в данный
момент времени, но одновременно с этим обычно ухудшается восприятие
Таблица 21.3. Характеристика различных уровней бодрствования
Физиологическое
состояние
Сильные
эмоции,
возбуждение
Активное
бодрствование
Сонливость
Засыпание
Уровень бодрствования и
внимание
Суженное сознание,
расщепленное внимание,
растерянность
Концентрация
внимания, предугадывание
результата действий
Снижение внимания,
отвлеченные мысли,
неясные мечты
Сильно сниженный
уровень сознания,
повышенный порог раздражения
Поведенческие реакции
Дезорганизация,
дефицит контроля, реакции
страха или паники
Четкая организация,
оптимальная
работоспособность
Нарушенная
координация, низкая
работоспособность
Реакция только на
сильные или
ожидаемые стимулы
Особенности ЭЭГ
Выраженная десин-
хронизация ритма
Избирательная десин-
хронизация, наличие
групп а-волн
Варьирует;
преобладает а-ритм
а- и 9-волны,
эпизодически сонные
веретена
21. Сон и бодрствование • 855
Успешность
деятельности
/ Оптимум
/ , Эмоции \.
у/ Пробуждение I N
уг | I Дезорганизация
Сон ' '
I 1 1
Слабая активация Уровень бодрствования Сильная активация
Рис. 21.5. Зависимость эффективности поведения от активации мозга.
Целенаправленная деятельность наиболее успешна при оптимальной активности мозга,
соответствующей уровню активного бодрствования. При низких уровнях активации готовность к
действиям снижается и развивается сонливость, при усилении активации растет количество
совершаемых ошибок и может произойти дезорганизация поведения.
других объектов. Находясь на шумной вечеринке, человек способен
фокусировать внимание на словах своего собеседника, в то время как все
остальные голоса сливаются в единый фон и не запоминаются.
Избирательность внимания, направляемого на отдельные объекты, выделяемые из
общего фона, сопряжена с ограниченным объемом оперативной памяти, не
способной вместить всю входящую сенсорную информацию.
Появление нового раздражителя привлекает внимание человека по
механизму ориентировочного рефлекса (поворот головы, глаз в сторону
нового объекта), а последующее восприятие такого раздражителя вызывает
изменение ритма электроэнцефалограммы в специфической сенсорной
области коры (зрительной, слуховой, соматосенсорной), где характерный для
пассивного бодрствования ос-ритм сменяется р-ритмом — такая десинхро-
низация получила название блокады а-ритма. Избирательное внимание
человека, направленное на конкретный объект, проявляется активацией не
только первичных, но также вторичных сенсорных и ассоциативных
областей коры, что увеличивает ресурсы для анализа наблюдаемого объекта.
ГЛАВА 22
Физиологические основы труда
Физиология труда представляет собой раздел физиологии человека,
изучающий функции скелетных мышц и физиологических систем,
обеспечивающих их работу, а также механизмы их регуляции при трудовой
деятельности с целью обоснования рациональной организации труда человека и
поддержания высокой работоспособности организма.
В наиболее общем виде труд человека подразделяется на физический и
умственный в зависимости от степени вовлеченности в трудовой процесс
соответственно скелетных мышц и нервно-психических функций. Оба
вида труда характеризуются величиной трудовой нагрузки, отражающей
уровень физиологического напряжения работающего человека. Характер
трудовой нагрузки определяется элементами трудового процесса (мышечная
работа, рабочая поза, нагрузка на зрительную систему,
психоэмоциональное напряжение, монотонность рабочих действий, гипокинезия), которые
оказывают влияние на функции физиологических систем человека.
Величина трудовой нагрузки зависит от характера трудового процесса, от
режима труда и отдыха, от факторов производственной среды и т. д.
Организм человека адаптируется к физическим и нервно-психическим
нагрузкам в зависимости от двух основных факторов. Во-первых, от
работоспособности человека — это способность выполнять работу максимально
возможное время без снижения ее эффективности. Работоспособность
зависит от степени тренированности человека, его склонности к данному
виду деятельности, состояния его здоровья, мотивации, состояния
окружающей среды. Во-вторых, адаптация к нагрузкам зависит от
коэффициента полезного действия, который определяется как отношение величины
затрат энергии на внешнюю (физическую) работу к величине общих
энергозатрат организма человека. Чем ниже коэффициент полезного действия,
тем меньше эффективность работы и тем больше напряжение организма.
Физическая работа может быть динамической и статической.
Динамическая работа выполняется в том случае, когда в физическом смысле
преодолевается сопротивление на определенном расстоянии (например, при
подъеме по лестнице или в гору, при беге или езде на велосипеде) и работа
может быть выражена в физических единицах. При положительной
динамической работе скелетные мышцы укорачиваются и действуют как
«двигатель», а при отрицательной динамической работе напряжение скелетной
мышцы играет роль «тормоза» и уступает весу груза (например, при спуске
с горы). Статическая работа производится при изометрическом
мышечном сокращении (без изменения длины мышцы), при этом не
преодолевается никакое расстояние и в физическом смысле это не работа. Однако
организм реагирует на нее изменениями физиологических функций,
соответствующими нагрузке. Проделанная статическая работа измеряется
произведением силы сокращения скелетной мышцы и его продолжительности.
Умственная работа включает мыслительный и эмоциональный
компоненты. Мыслительный компонент преобладает при работе, требующей прояв-
22. Физиологические основы труда • 857
ления интеллектуальных способностей человека. Примерами служат
решение математических задач, обдумывание конкретных ситуаций и
концентрация внимания, обработка сигналов при работе за компьютером или при
вождении автомобиля. Умственная работа с преобладанием
эмоционального компонента связана с реакциями вегетативной нервной системы и
находит выражение в вегетативных компонентах эмоций человека (например,
ощущение радости, гнева, печали и т. д.).
Наиболее часто в повседневной жизни человек выполняет
комбинированную работу, когда сочетаются элементы физического и умственного
труда (сенсомоторная деятельность). Для этого вида деятельности
характерна не тяжелая мышечная работа, а определенный навык и тренировка, как,
например, при выполнении хирургических операций, сборке машин на
конвейере и т. д.
22.1. Образование энергии в скелетных мышцах при физической
работе
В мышечных клетках человека, как и в любых других видах клеток,
происходит энергетический обмен, при котором богатые энергией питательные
вещества усваиваются и химически преобразуются, а конечные продукты
обмена с более низким содержанием энергии выделяются из клетки.
Высвобождающаяся при этом энергия в мышцах обеспечивает их
сокращение. Основным источником энергии для мышечного сокращения при
физической работе является гидролиз АТФ. Макроэргические фосфатные
связи молекулы АТФ нестойкие и концевые фосфатные группы легко
отщепляются, при этом освобождается энергия (7—10 ккал/моль АТФ).
Присоединение молекул АТФ к головкам миозиновых мостиков и
последующий гидролиз АТФ являются ключевым моментом в процессе
преобразования химической энергии фосфатных связей в механическую энергию
мышечного сокращения. В нормальных физиологических условиях
мышечная активность как низкой, так и высокой мощности не
сопровождается истощением запасов энергии макроэргических соединений. Это связано
с процессами ресинтеза АТФ. Различают аэробный и анаэробный пути ре-
синтеза АТФ.
22.1.1. Анаэробный путь ресинтеза АТФ
При кратковременной физической работе большой мощности ресинтез
АТФ происходит анаэробным путем, в котором выделяют три процесса:
фосфогенный, миозинкиназный и гликолиз.
Фосфогенный анаэробный процесс (креатинфосфокиназная реакция).
В мышцах наряду с АТФ содержится другое макроэргическое фосфорное
соединение — креатинфосфат, являющееся вторым после АТФ по
значимости макроэргическим фосфатным соединением. Креатинфосфат
адсорбируется на сократительных белках миофибрилл и на мембране саркоплаз-
матического ретикулума. С тонким филаментом — актином связан
фермент креатинфосфокиназа, который катализирует реакцию перефосфори-
лирования между креатинфосфатом и аденозидифосфатом (АДФ),
образующимся при гидролизе АТФ.
Креатинфосфат + АДФ > АТФ + Креатин
Креатинфосфокиназная реакция первой включается в процесс
ресинтеза АТФ в момент начала мышечной работы и протекает с максимальной
858 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
скоростью до тех пор, пока запасы креатинфосфата в мышцах не будут
исчерпаны примерно на 30 % (в течение 5—6 с). Затем скорость креатинфос-
фокиназной реакции начинает уменьшаться и в процесс ресинтеза АТФ
вступают гликолиз и аэробный механизм.
Фосфогенный аэробный процесс ресинтеза АТФ играет решающую
роль в энергетическом обеспечении кратковременной физической работы
максимальной мощности (например, подъем и перенос тяжелых грузов), в
процессе быстрого перехода от покоя к работе, во время финишного
ускорения у спортсменов.
Анаэробный гликолиз. Как только в процессе мышечной работы креатин-
фосфокиназная реакция перестает обеспечивать необходимую скорость
ресинтеза АТФ и в саркоплазме мышечных волокон увеличивается
концентрация молекул АДФ, происходит активация ресинтеза АТФ за счет
анаэробного гликолиза. Источником энергии для ресинтеза АТФ являются
запасы гликогена в миоцитах и глюкоза плазмы крови. Повышение
концентрации АДФ в саркоплазме, а также увеличение содержания ионов Са++
активируют ферменты фосфорилазу и гексокиназу. Молекулы этих
ферментов локализованы на мембране саркоплазматического ретикулума, а
также на других внутриклеточных компонентах.
В процессе гликолиза образуется до 2,5 кДж/кг/мин. Гликолиз как
источник энергии мышечного сокращения эффективно обеспечивает
сократительный процесс с 20-30-й секунды после начала сокращения и
способен обеспечивать мышечную активность высокой мощности до 2—2,5 мин.
Скорость гликолиза угнетается под влиянием повышения концентрации
молочной кислоты в миоцитах и уменьшения рН в саркоплазме.
Накопление молочной кислоты при анаэробной работе находится в прямой
зависимости от мощности и общей продолжительности физической работы.
Увеличение количества молочной кислоты в саркоплазматическом
пространстве мышц вызывает рост осмотического давления в саркоплазме,
при этом вода из межклеточной среды поступает внутрь мышечных
волокон и вызывает их набухание. Значительные изменения осмотического
давления в мышцах могут быть причиной болевых ощущений.
Миокиназная реакция. Физическая активность высокой мощности, а
также развитие утомления (фаза истощения) приводят к повышению в
саркоплазме концентрации молекул АДФ, которые являются источником
ресинтеза АТФ:
Аденилатциклаза
АДФ + АДФ > АТФ + АМФ.
Миокиназная реакция, как и креатинфосфокиназная, легко обратима и
используется в организме для уменьшения резких перепадов в скорости
образования и использования АТФ. В случае появления в клетке избытка
АТФ он быстро устраняется с помощью миокиназной реакции.
22.1.2. Аэробный гликолиз
Примерно 90 % запасов АТФ в миоцитах образуется в процессе аэробного
ресинтеза, т. е. при участии кислорода. Ферментные системы аэробного
обмена расположены в основном в митохондриях клеток. К числу
субстратных циклов окисления относятся: гликолитическое расщепление
углеводов, заканчивающееся образованием пировиноградной кислоты,
окислительное декарбоксилирование пировиноградной кислоты, цикл
превращений трикарбоновых кислот, окислительное дезаминирование аминокис-
22. Физиологические основы труда • 859
лот, (3-окисление жирных кислот. Суть химических превращений в
субстратных циклах заключается в постепенном преобразовании исходного
субстрата в форму, доступную действию специфических дегидрогеназ, с
последующим высвобождением энергии в ходе
окислительно-восстановительных реакций, где участвуют дыхательные ферменты. Энергия
окисления, выделяющаяся в реакциях дегидрогенирования, сохранятся в
соединениях водорода с коферментами НАД или ФАД. Для ресинтеза АТФ она
используется при переносе водорода от коферментов НАД и ФАД на
кислород по системе дыхательных ферментов, которая расположена на
внутренней мембране митохондрий.
В дыхательной цепи имеется три пункта сопряжения, где за счет
энергии, высвобождающейся при переносе электронов, может синтезироваться
АТФ. Первый пункт сопряжения находится на участке переноса водорода
от НАД к ФАД. Количества свободной энергии, высвобождаемой в этой
реакции, достаточно для синтеза 1 моля АТФ. Второй пункт сопряжения
локализуется на участке переноса электронов от кофермента Q через цито-
хром к цитохрому с. Третья молекула АТФ синтезируется на завершающем
этапе дыхательной цепи в цитохромоксидазнои реакции, где происходит
перенос электронов с системы цитохромов на кислород. В этом пункте
сопряжения энергии освобождается больше, чем при любой другой реакции
дыхательной цепи. Этой энергии вполне могло бы хватить для образования
нескольких молей АТФ, но, тем не менее, в этом пункте сопряжения, как
и в первых двух, синтезируется только 1 моль АТФ. Излишек энергии,
выделяемой в цитохромоксидазнои реакции, служит главной движущей
силой для всего процесса переноса электронов по дыхательной цепи.
Кислород, акцептирующий электроны, которые поставляет цитохромоксидазная
реакция, служит резервуаром, обеспечивающим постоянный отток
электронов из дыхательной цепи и поддерживающим ее компоненты в
окисленном состоянии, благодаря чему они могут принимать водород от
различных субстратов окисления.
Наряду с обычным путем окисления субстратов на внутренней
мембране мышечной клетки существует также путь окисления, локализованный
на внешней мембране, в котором принимают участие цитохром с, система
ФП5 — цитохром Ь5 и цитохромоксидаза. Активация этого пути приводит
к быстрому окислению внемитохондриального НАД-Н, но он не связан с
синтезом АТФ и ведет к рассеиванию энергии в виде тепла. Этот путь
используется в качестве буферной системы, поддерживающей необходимую
концентрацию окисленной формы НАД в саркоплазме и устраняющей
избыток молочной кислоты, образующейся при гликолизе.
Общая схема, иллюстрирующая взаимосвязь аэробных и анаэробных
превращений в энергетическом обмене скелетной мышцы, представлена
на рис. 22.1.
Общий выход энергии при аэробном процессе более чем в 10 раз
превышает изменение свободной энергии при гликолитическом распаде
углеводов в анаэробных условиях. В качестве субстратов аэробных
превращений в работающих мышцах могут быть использованы не только
внутримышечные запасы гликогена, но и внемышечные резервы углеводов
(например, гликоген печени), жиров, а в отдельных случаях и белков. Поэтому
суммарная емкость аэробного процесса очень велика и трудно поддается
точной оценке. В отличие от гликолиза, метаболическая емкость которого
в значительной степени зависит от изменений внутренней среды
вследствие накопления в организме избытка молочной кислоты, конечные
продукты аэробных превращений — С02 и Н20 — не вызывают каких-либо
860 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
1 АТФ
2СО.
20
Жировое депо
триглицеридов
Печень
гликоген
Липаза
| Фосфорилаза
Свободные
жирные
кислоты
Кровь
Глюкоза
• KoAfL
Жировой
ацетил-коА
1 АТФ
5 атф. "М+
^\^-*ФАД\
0 Адн-н^
2 ФАДН
г КоА*
Саркоплазма
Гексокиназа
Фосфорилаза X
Гликоген 4 *■ Глюкозо-6-
Синтетаза фосфат
1 АТФ
zi
2лактат
Митохондрия
Фосфофруктокиназа |-
6 АТФ ш \ «2НАД+ , 2НАД-1Г,:
Y Лакта
0 д */■* [дела
2НАДН • Н+
4 АТФ •
2CO,
КоА
2 ацетил-
коА
i
Пируват- /
дегидрогеназа "■
2НАДН • Н+
2НАД+
ЗНАДН • Н+ 3Ц*^+
ФАдЦ Ф^Д
1 АТФ
11 АТФ
6 АТФ
Лактат-
дегидрогеназа
2НАДН • Н+
-2 пируват
Рис. 22.1. Общая схема образования энергии в мышечных клетках.
Источниками образования АТФ в мышечных клетках являются окислительное фосфорилиро-
вание, а также фосфогенная система «гликоген—молочная кислота». Аэробное дыхание
является наиболее эффективным, так как из каждой молекулы глюкозы образуется 38 молекул
АТФ, а при анаэробном дыхании — только две.
значительных изменений внутренней среды и легко удаляются из
организма.
Образование 1 моля АТФ в процессе окислительного фосфорилирова-
ния эквивалентно потреблению 3,45 л 02. Столько же кислорода в покое
потребляется в течение 10—15 мин, а при напряженной мышечной
деятельности (например, во время бега на марафонскую дистанцию) — за
1 мин. Однако в самих работающих мышцах запасы кислорода крайне
невелики. Небольшое его количество находится в растворенном состоянии
во внутриклеточной саркоплазме и в связанном состоянии с миоглобином
мышц. Основное же количество кислорода, потребляемого в мышцах для
ресинтеза АТФ, доставляется в ткани через систему легочного дыхания и
кровообращения.
Для бесперебойной работы дыхательной цепи и механизма окислитель-
22. Физиологические основы труда • 861
ного фосфорилирования напряжение 02 в клетках должно поддерживаться
на уровне не ниже 5—10 мм рт. ст. Чтобы обеспечить его, напряжение 02
снаружи (в мышечных капиллярах) должно быть примерно 15—20 мм рт.
ст., поскольку кислород поступает в клетки путем диффузии.
Поддержание критического напряжения 02 на наружной клеточной
мембране независимо от изменений скорости расхода кислорода в тканях
осуществляет сложная система регуляции, в которую наряду с
внутриклеточными механизмами метаболического контроля входят также нервная и
гормональная регуляция внешнего дыхания, центрального и
периферического кровообращения.
Максимальная мощность аэробного процесса в равной мере зависит как
от скорости утилизации 02 в клетках (а она, в свою очередь, от общего
числа митохондрий в клетке, количества и активности ферментов
аэробного окисления), так и от скорости поставки 02 в ткани.
22.1.3. «Кислородный каскад» и эффективность транспорта
кислорода к работающим мышцам
Скорость доставки кислорода к тканям является одним из важнейших
факторов, определяющих возможность обеспечения энергией
работающих мышц. В митохондриях скелетных мышц, где образуется до 90 %
всей необходимой энергии, скорость ресинтеза АТФ находится в
зависимости от достигнутой концентрации или напряжения кислорода в клетке.
Общая скорость ресинтеза АТФ, обеспечиваемая различными
источниками энергии, является функцией напряжения кислорода в клетке. При
низком уровне метаболических превращений в клетке, как это имеет
место в покоящейся мышце, изменения в скорости доставки 02 в ткани не
оказывают влияния на скорость ресинтеза АТФ (зона насыщения).
Однако при снижении р02 в клетке ниже некоторого критического уровня
поддержание скорости ресинтеза АТФ на необходимом уровне возможно
только за счет адаптивных сдвигов клеточного метаболизма, связанных с
природой используемых субстратов, размерами их внутриклеточных
запасов, с состоянием фосфорилирования и величиной внутриклеточного рН,
что с неизбежностью потребует увеличения скорости доставки 02 в ткани.
Максимальная скорость потребления 02 митохондриями скелетных мышц
может быть поддержана только до определенного критического значения
р02 в клетке, которое составляет от 0,5 до 3,5 мм рт. ст. Если уровень
метаболической активности при мышечной работе превысит значение
максимально возможного усиления аэробного ресинтеза АТФ, то
возрастающая энергетическая потребность в этих условиях может быть
компенсирована за счет анаэробного ресинтеза АТФ. Однако этот диапазон
анаэробной метаболической компенсации весьма узок, и выше значения
максимального увеличения скорости ресинтеза АТФ, обеспечиваемого сочетан-
ной метаболической активностью аэробного и анаэробных процессов в
работающей мышце, дальнейшее исполнение ее сократительной функции
становится невозможным. Диапазоны метаболической активности, в
пределах которых текущая поставка 02 недостаточна для поддержания
необходимого уровня ресинтеза АТФ, обычно обозначаются как гипоксиче-
ские состояния (т. е. состояния кислородной недостаточности) разной
тяжести.
Для того чтобы поддерживать напряжение 02 в митохондриях на
уровне, превышающем критическое значение, при котором еще сохраняются
условия для адаптивной регуляции клеточного обмена, напряжение 02 на
862 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
а 150-|—1
2
2
*
О
а
о
о
S
а>
s
X
о
104
Вдыхаемый воздух
Альвеолярный воздух
96- h
Артериальная кровь
^
39-
20
5-
о-1
Смешанная венозная кровь
Рис. 22.2. «Кислородный каскад»
организма.
В обычных условиях процессы
биологического окисления в клетках тканей на уровне
митохондрий обеспечиваются при сохранении
постоянства парциального давления
кислорода на этапах внешнего дыхания
(альвеолярный воздух), транспорта газов кровью
(артериальная и смешанная венозная кровь), а
также в тканях — на мембранах клеток и внутри
митохондрий.
Мембрана клеток
Мембрана митохондрий
наружной клеточной мембране
должно составлять не менее 15—20
мм рт. ст. Для поддержания этого
критического напряжения 02, при
котором возможно нормальное
функционирование мышц,
напряжение 02 в артериолах, доставляющих
кровь непосредственно к работающим мышцам, должно составлять
приблизительно 40 мм рт. ст., а в магистральных артериях —до 80—90 мм рт.
ст. В легочных альвеолах, где осуществляется газообмен между кровью и
атмосферным воздухом, напряжение 02 составляет около 100 мм рт. ст., во
вдыхаемом воздухе оно равняется 150 мм рт. ст.
На рис. 22.2 вышеуказанные значения критических напряжений 02 на
различных этапах транспорта кислорода в организме обозначены в виде
нисходящих ступеней с постепенно понижающимися уровнями р02 и
скоростью доставки 02 к тканям. Этот «кислородный каскад» обеспечивает
постоянную «накачку» 02 в работающие ткани в точном соответствии с их
метаболической потребностью. Сохранение критических напряжений
кислорода на каждом из обозначенных на схеме этапов транспорта кислорода
к тканям обеспечивается совокупной деятельностью всех вегетативных
систем организма.
22.1.4. Потребление кислорода, кислородный дефицит,
кислородный долг и кислородный запрос при мышечной
работе
При переходе от состояния покоя к интенсивной мышечной деятельности
потребность организма в кислороде возрастает во много раз, однако сразу
она не может быть удовлетворена. Нужно время, чтобы усилилась
деятельность систем дыхания и кровообращения и чтобы кровь, обогащенная
кислородом, могла дойти до работающих мышц. По мере усиления
активности системы вегетативного обеспечения мышечной деятельности
постепенно увеличивается потребление кислорода работающими мышцами. При
умеренной работе, если ЧСС не превышает 150 уд/мин, скорость
потребления 02 возрастает до тех пор, пока не наступит устойчивое состояние
метаболических процессов, при котором 02-потребление достигает
постоянного уровня и в каждый данный момент времени точно соответствует
потребности организма в нем. Такое устойчивое состояние называется
истинным. Уровень потребления 02 в устойчивом состоянии зависит от
мощности выполняемой работы (рис. 22.3).
При более интенсивной работе (ЧСС 150—180 уд/мин) устойчивое
состояние не устанавливается и потребление 02 может возрастать до конца
22. Физиологические основы труда • 863
Быстрая ликвидация
"лактатного" кислородного
долга
Медленная ликвидация
"лактатного" кислородного
долга
Потребление О
4 0 12
Время, мин
Рис. 22.3. Потребление кислорода в организме человека при легкой и тяжелой
физической работе. Потребление кислорода резко возрастает в тканях организма с
момента начала физической работы.
Однако для приспособления кровотока к возросшим метаболическим потребностям тканей
требуется некоторое время, что приводит к формированию кислородного дефицита (Кд). При
легкой работе величина кислородного дефицита остается постоянной после достижения
устойчивого состояния. При тяжелой физической работе величина кислородного дефицита
возрастает до момента ее окончания. Поэтому по окончании как легкой, так и тяжелой
физической работы скорость потребления кислорода остается некоторое время выше уровня покоя,
что обеспечивает ликвидацию («выплату») кислородного долга. По окончании тяжелой
физической работы происходит ликвидация не только «алактатного», но и «лактатного»
кислородного долга. Лр — легкая и Тр — тяжелая физическая работа.
работы или до достижения максимально возможного уровня. В последнем
случае может наблюдаться «ложное устойчивое состояние», когда
потребление 02 некоторое время (6—10 мин) поддерживается на постоянном
максимальном уровне не потому, что потребность организма в кислороде
полностью удовлетворяется, а потому, что исчерпаны возможности
сердечно-сосудистой системы по доставке его к тканям. Именно эти
возможности в большинстве случаев ограничивают потребление 02 мышечными
клетками, хотя иногда лимитирующим фактором становится
окислительная способность самих работающих мышечных клеток, в частности
активность дыхательных ферментов в митохондриях.
Максимальный уровень потребления 02 не может поддерживаться
долго. Во время длительной работы он снижается из-за утомления.
Количество кислорода, которое необходимо организму, чтобы
полностью удовлетворить энергетические потребности за счет аэробных
процессов, называется кислородным запросом работы. При интенсивной работе
реальное потребление кислорода — кислородный приход — составляет только
часть кислородного запроса. Разность между кислородным запросом
работы и реально потребляемым кислородом составляет кислородный дефицит
организма (см. рис. 22.3). В условиях кислородного дефицита
активируются анаэробные реакции ресинтеза АТФ, что приводит к накоплению в
организме недоокисленных продуктов анаэробного распада. Во время
работы, при которой возможно установление устойчивого состояния, часть
анаэробных метаболитов может ликвидироваться по ходу работы за счет
усиления аэробных реакций, другая их часть устраняется после работы.
Если устойчивого состояния не наступает или при ложном устойчивом со-
864 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
стоянии количество недоокисленных продуктов все время увеличивается
по ходу работы, они устраняются в восстановительном периоде.
Для этих процессов требуется дополнительное количество кислорода,
поэтому некоторое время после окончания работы потребление его
продолжает оставаться повышенным по сравнению с уровнем покоя. Этот
восстановительный излишек кислородного потребления получил название
кислородного долга. Кислородный долг всегда больше кислородного
дефицита, и чем больше интенсивность и продолжительность работы, тем
значительнее это различие.
В период восстановления после мышечной работы, когда в организме
имеется достаточное количество субстратов биологического окисления и
доставка кислорода к митохондриям клеток не ограничена, уровень
потребления кислорода зависит от количества свободной АТФ,
осуществляющей дыхательный контроль в митохондриях. Субстратами окислительных
энергетических превращений являются накопившиеся во время работы
молочная кислота, янтарная кислота, альфа-глицерофосфат, а на поздних
стадиях восстановления — и жирные кислоты.
Некоторая часть избыточно потребленного в период отдыха кислорода
идет на восстановление его запасов в миоглобиновом и гемоглобиновом
депо. При утомительной работе эффективность использования кислорода
снижается вследствие частичного разобщения процессов окисления и
образования АТФ. Это разобщение может сохраняться и после работы, что
обусловливает увеличение потребления кислорода по сравнению с уровнем
покоя.
При работе различного характера разные факторы становятся ведущими
в образовании 02-долга. Например, при выполнении кратковременной
работы решающую роль в образовании 02-долга играет ресинтез КрФ и
АТФ. С увеличением длительности нагрузки возрастает значение
окисления молочной кислоты, восстановления рН, ионного равновесия и других
процессов.
После работы, в которой возможно установление устойчивого
состояния, снижение потребления 02 происходит быстро. 02-долг наполовину
оплачивается за 27—30 с, а полностью — за 3—5 мин. При более
интенсивной работе в кривой снижения потребления 02 выявляются две фазы —
начальный быстрый спад и более медленный затяжной процесс возвращения
к уровню покоя. Быстрый компонент 02-долга (так называемый алактат-
ный) позволяет приблизительно оценить вклад креатинфосфатного
механизма в энергетическое обеспечение работы. Медленный компонент
кислородного долга (лактатный) при сравнительно кратковременной работе
может служить отражением развития анаэробного гликолитического
процесса. При длительной работе в его образовании значительна доля и
других процессов, оценить которую точно очень трудно. Медленный
компонент кислородного долга уменьшается наполовину за 15—20 мин, а
ликвидируется полностью за 1,5—2 ч (см. рис. 22.3).
22.2. Физиологические основы тренировки двигательного навыка
22.2.1. Развитие силовых качеств мышц
Тренировка двигательного навыка увеличивает произвольную силу мышцы
или группы мышц. Силу мышечного сокращения можно контролировать
по массе груза, который поднимает человек. У нетренированного человека
произвольная активация мышцы может быть недостаточной для того, что-
22. Физиологические основы труда • 865
бы развить максимальную силу сокращения. Развитие силы мышц при
тренировке является результатом так называемой периферической и
центральной адаптации мышцы к физической нагрузке, или «нервным
тренирующим эффектом». Начальный этап развития мышечной силы включает
формирование правильной последовательности активации мышц. Под
этим подразумевается точность выполнения специфического
произвольного задания, например выполнение движения рукой, когда сустав должен
быть согнут под определенным углом и движение выполняется с
определенной скоростью.
Поперечное сечение мышцы. При физической тренировке рост
максимальной произвольной силы мышцы прямо зависит от увеличения
площади ее поперечного сечения. Однако анатомическое поперечное сечение
мышцы, представляющее собой проходящую через середину мышцы
перпендикулярно ее волокнам плоскость, при физической тренировке не
увеличивается в той же степени, как максимальная произвольная сила
мышцы. Способность мышцы развивать силу зависит от ее физиологического
поперечного сечения и напряжения. Так, физиологическое поперечное
сечение (плоскость, пересекающая максимальное количество волокон
мышцы) в мышцах ноги человека в 2—8 раз больше их анатомического
поперечного сечения. На зависимость между силой мышцы и ее
физиологическим поперечным сечением влияют такие факторы, как специфическое
напряжение, изменения типа мышечных волокон, архитектуры мышечных
волокон и сухожилий и т. д.
Максимальная сила мышцы. При физической тренировке максимальная
произвольная сила мышечного сокращения возрастает примерно в три
раза больше, чем максимальная тетаническая сила сокращения мышцы,
которую можно вызвать искусственным электрическим раздражением
двигательного нерва у нетренированного человека. Максимальная
произвольная сила двустороннего сокращения мышц-синергистов меньше, чем сила,
развиваемая при одностороннем максимальном произвольном сокращении
одной группы мышц. При этом в норме отношение билатеральной
максимальной силы к суммарной силе, развиваемой, например, мышцами
правой и левой руки, составляет порядка 90 %. Физическая тренировка
снижает билатеральный дефицит в показателях максимальной произвольной
силы.
22.2.2. Физиологические механизмы формирования трудовых
навыков
В процессе трудовой деятельности человека формируются различные
двигательные умения и навыки, составляющие основу его поведения.
Двигательные умения — способность на двигательном уровне
справляться с новыми задачами поведения. Двигательные навыки — это освоенные и
упроченные действия, которые могут осуществляться человеком без
участия сознания (автоматически) и обеспечивают оптимальное решение
двигательной задачи.
Любые навыки: бытовые, профессиональные, спортивные — не
являются врожденными движениями. Они приобретаются в ходе индивидуального
развития человека. Комплекс нейронов, обеспечивающих формирование
двигательных навыков у человека, располагается в различных отделах
нервной системы, становясь доминантой, т. е. господствующим очагом
возбуждения в центральной нервной системе. Он подавляет деятельность
других нервных центров и, соответственно, «лишних» скелетных мышц.
28 - 6095
866 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
В результате движения выполняются все более экономно, при включении
лишь самых необходимых мышечных групп, и лишь в те моменты,
которые нужны для его осуществления. Происходит экономизация энерготрат.
Порядок возбуждения в доминирующих нервных центрах закрепляется
в виде системы условных и безусловных рефлексов и сопровождающих их
вегетативных реакций, образуя двигательный динамический стереотип.
Каждый предшествующий двигательный акт в этой системе запускает
следующий, облегчает выполнение целостного комплекса двигательных актов
и освобождает сознание человека от контроля за каждым его элементом.
Процесс обучения двигательному навыку у человека начинается с
побуждения к действию, которое задается подкорковыми и корковыми мотива-
ционными зонами. У человека это, главным образом, стремление к
удовлетворению определенной социальной потребности (желание заниматься
данным видом труда, преуспеть в нем и пр.).
На первом этапе формирования двигательного навыка возникает
замысел действия, осуществляемый ассоциативными зонами коры больших
полушарий (переднелобными и нижнетеменными). Вначале это лишь общее
представление о двигательной задаче, которое возникает либо при показе
движения другим лицом, либо после словесной инструкции,
самоинструкции, речевого описания. В сознании человека создается определенный
эталон требуемого действия. Формирование такой наглядно-образной модели
складывается из образа ситуации в целом (задаваемые пространственные и
временные характеристики двигательной задачи) и образа тех мышечных
действий, которые необходимы для достижения цели. Имея представление
о требуемой модели движения, человек может осуществить ее разными
мышечными группами. Так, например, подпись человека имеет
характерные черты, независимо от мышечных групп, выполняющих ее (пальцы,
кисть, предплечье).
На втором этапе обучения двигательному навыку начинается
непосредственное выполнение разучиваемого упражнения. При этом отмечаются
три стадии формирования двигательного навыка: 1) стадия генерализации
(иррадиации возбуждения); 2) стадия концентрации; 3) стадия
стабилизации и автоматизации.
На первой стадии созданная модель становится основной для перевода
внешнего образа во внутренние процессы формирования программы
собственных действий. На ранних этапах онтогенеза, когда речевая регуляция
движений (внешней речью постороннего лица или внутренней
собственной речью) еще не развита, особое значение имеют процессы подражания,
общие у человека и животных. Наблюдая за действиями другого лица и
имея некоторый опыт управления своими мышцами, ребенок превращает
свои наблюдения в программы собственных движений.
Некоторые особенности программирования движений у человека
отражаются в межцентральных взаимосвязях электрической активности мозга.
Можно видеть, например, что при наблюдении за выполнением бега
посторонним лицом в коре больших полушарий у наблюдающего человека
появляются потенциалы в темпе этого бега (своеобразная модель
наблюдаемого движения). При представлении и при мысленном выполнении
движений пространственные взаимосвязи мозговой активности начинают
отличаться от состояния покоя и приближаться к таковым при реальной
работе, появляется небольшая биоэлектрическая активность в нужных для
выполнения реального движения мышцах. Этим объясняется тренирующее
воздействие на формирование двигательного навыка идеомоторного
(мысленного) выполнения упражнений. В создании двигательных программ
22. Физиологические основы труда • 867
принимают участие многие нейроны коры, мозжечка, таламуса,
подкорковых ядер и ствола мозга. Обширное вовлечение множества мозговых
элементов необходимо для поиска наиболее нужных из них. Этот процесс
обеспечивается широкой иррадиацией возбуждения по различным зонам
мозга и сопровождается обобщенным характером (генерализацией)
периферических реакций со стороны скелетных мышц. Стадия генерализации
характеризуется напряжением большого числа активированных скелетных
мышц, их продолжительным сокращением, одновременным вовлечением в
движение мышц-антагонистов. Все это нарушает координацию движений,
делает их закрепощенными, приводит к значительным энерготратам и,
соответственно, излишне выраженным вегетативным реакциям. Например,
подобные реакции можно наблюдать у человека, который впервые сел за
руль автомобиля.
На второй стадии формирования двигательного навыка происходит
концентрация возбуждения в необходимых для его осуществления
корковых зонах. В других зонах коры активность подавляется одним из видов
условного внутреннего торможения — дифференцировочным
торможением. При формировании сложных двигательных программ концентрация
возбуждения происходит в сложной системе различных корковых зон,
заинтересованных в управлении движениями. Между ними устанавливается
высокий уровень пространственной синхронизации электрической
активности (синхронность и синфазность колебаний потенциалов), который
отражает их функциональные взаимосвязи. На этой стадии двигательный
навык уже сформирован. Включаются лишь необходимые мышечные группы
и только в нужные моменты движения. В результате рабочие энерготраты
снижаются. Однако сформированный навык еще очень непрочен и
нарушается при любых новых раздражениях (вождение автомобиля в условиях
интенсивного городского движения сразу после автодрома, появление
внезапной опасности на дороге и т. д.).
На третьей стадии в результате многократного повторения навыка в
разнообразных условиях появляются стабильность и надежность
двигательного навыка, снижается сознательный контроль над его элементами,
т. е. возникает автоматизация навыка. Внешние раздражения на этой
стадии лишь подкрепляют рабочую доминанту данного двигательного навыка,
не разрушая ее. Большая часть посторонних афферентных потоков не
пропускается в спинной и головной мозг: специальные команды из
вышележащих центров вызывают пресинаптическое торможение импульсов от
периферических рецепторов, препятствуя их доступу в спинной мозг и
вышележащие центры. Этим обеспечивается защита сформированных
двигательных программ от случайных влияний и повышается надежность
сформированных навыков.
Процесс автоматизации не означает выключения коркового контроля за
выполнением движения. Однако в этой системе центров снижается
участие лобных ассоциативных отделов коры, что, по-видимому, и отражает
снижение его осознаваемости.
Особое значение в отработке моторных программ имеют обратные
связи между вовлеченными в исполнение двигательных навыков скелетными
мышцами и управляющими ими нервными центрами. Информация,
поступающая в нервные центры при движении, служит для сравнения
полученного результата с имеющимся в этих центрах эталоном. При их
несовпадении в мозговых аппаратах сравнения (лобных долях, подкорковом
хвостатом ядре) возникают импульсы рассогласования и в программу
вносятся поправки — сенсорные коррекции. При кратковременных движениях
28*
868 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
рабочие фазы настолько малы (составляют сотые и тысячные доли
секунды), что сенсорные коррекции по ходу движения вносить невозможно.
В этих случаях вся программа действия должна быть готова до начала
двигательного акта, а поправки могут вноситься при его повторениях.
В системе обратных связей различают «внутренний контур» регуляции
движений, передающий информацию в нервные центры от двигательного
аппарата и внутренних органов (в первую очередь — от рецепторов мышц,
сухожилий и суставных сумок), и «внешний контур», несущий сигналы от
экстерорецепторов (главным образом, зрительных и слуховых). При
первых попытках выполнения движений, благодаря множественному и
неопределенному характеру мышечной афферентации, основную роль в
системе обратных связей играют сигналы «внешнего контура» — зрительный и
слуховой контроль. Поэтому на начальных этапах освоения двигательных
навыков для облегчения процесса обучения так важно использовать
зрительные ориентиры и звуковые сигналы. По мере освоения навыка
«внутренний контур» регуляции движений приобретает все большее значение,
обеспечивая автоматизацию навыка, а значимость «внешнего контура»
снижается.
Большую роль в процессе моторного научения играет речевая регуляция
движений (словесные указания педагога, внутренняя речь обучаемого).
В высших отделах мозга (кора больших полушарий и подкорковые
образования) человека обнаружены специальные «командные» нейроны, которые
реагируют на словесные приказы и запускают нужные действия.
22.2.3. Работоспособность
Работоспособность — это свойство человека на протяжении длительного
времени и с определенной эффективностью выполнять максимальное
количество физической или умственной работы. На работоспособность
человека влияют внешние (характер труда, условия окружающей среды,
режимы труда, отдыха и т. д.) и внутренние факторы (мотивация, степень
совершенства трудовых навыков, функциональные резервы человека).
Работоспособность фазно изменяется на протяжении рабочей смены.
Так, фаза врабатывания характеризуется повышением активности ЦНС и
уровня обменных процессов в организме человека, усилением
деятельности сердечно-сосудистой и дыхательной систем. Фаза врабатывания короче
при физическом труде, чем при умственном.
Фаза относительно устойчивой работоспособности характеризуется
оптимальным уровнем функционирования систем организма и максимальной
эффективностью труда. Время устойчивой работоспособности тем меньше,
чем больше физическая тяжесть и нервная напряженность труда.
Фаза снижения работоспособности связана с развитием утомления.
В конце рабочего дня возникает фаза вторичного повышения
работоспособности, которая обусловлена условно-рефлекторными механизмами и
связана с предстоящим концом работы и отдыхом.
22.3. Функции физиологических систем организма человека
при физической работе
Физическое напряжение вызывает изменения функций практически всех
физиологических систем организма человека, особенно
сердечно-сосудистой и дыхательной. Перестройка функций физиологических систем дает
возможность организму человека адаптироваться к физическим нагруз-
22. Физиологические основы труда • 869
кам и успешно справляться с выполнением трудовой задачи.
Выраженность адаптивных сдвигов в деятельности физиологических систем
служит непосредственно мерой реакции организма на физическую нагрузку
и лежит в основе классификации физического труда по степени его
тяжести.
22.3.1. Кровообращение
При физической работе активируется деятельность сердечно-сосудистой
системы и, таким образом, более полно удовлетворяется увеличенная
потребность работающих мышц в кислороде, а образующееся тепло с током
крови отводится от работающей мышцы в те участки организма, где
происходит его отдача. Через 3—6 мин после начала легкой работы возникает
стационарное (устойчивое) повышение частоты сердечных сокращений,
которое обусловлено иррадиацией возбуждения из моторной зоны коры на
сердечно-сосудистый центр продолговатого мозга и поступлением
активирующих импульсов к этому центру от хеморецепторов работающих мышц.
Активация мышечного аппарата усиливает кровоснабжение в работающих
мышцах, которое достигает максимума уже через 60—90 с после начала
работы. При легкой работе формируется соответствие между кровотоком и
метаболическими потребностями мышцы. По ходу легкой динамической
работы начинает доминировать аэробный путь ресинтеза АТФ с
использованием в качестве энергетических субстратов глюкозы, жирных кислот и
глицерина. При тяжелой динамической работе частота сердечных
сокращений увеличивается до максимума по мере развития утомления.
Кровоток в работающих мышцах возрастает в 20—40 раз. Однако доставка к
мышцам 02 отстает от потребностей мышечного метаболизма, и часть
энергии образуется за счет анаэробных процессов.
Интенсивность трудовой деятельности можно классифицировать по
показателю ответных изменений частоты сердечных сокращений. Различают
легкую работу (без утомления) с устойчивой величиной частоты сердечных
сокращений и тяжелую с развитием утомления на фоне постоянного роста
частоты сердечных сокращений.
При динамической работе минутный объем кровообращения и
систолическое артериальное давление (диастолическое давление меняется мало)
возрастают пропорционально выполняемой работе. Увеличение
систолического давления (до 225 мм рт. ст. и выше) происходит в результате
сокращения времени сердечного выброса. Диастолическое давление отражает
баланс между возросшим сердечным выбросом и пониженным
периферическим сосудистым сопротивлением. При статической работе происходит
значительное повышение и систолического, и диастолического давления,
что способствует лучшему прохождению крови через сжатые
сокращающейся мышцей сосуды и имеет большое значение в увеличении
кровоснабжения работающих мышц. Изменения артериального давления при
физической работе могут быть вызваны тремя основными причинами,
обусловленными возрастанием активности симпатоадреналовой системы. Во-
первых, благодаря повышению частоты сердечных сокращений и
систолического объема происходит увеличение минутного объема
кровообращения. Во-вторых, сужение сосудов в неработающих мышцах увеличивает
сопротивление кровотоку. В-третьих, увеличение объема циркулирующей
крови за счет сужения венозных сосудов способствует повышению
артериального давления. Таким образом, в регуляции системного
кровообращения при физической работе ведущую роль играет повышение активности
870 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
центров симпатической нервной системы в результате воздействия
импульсов, поступающих из моторной зоны коры и от рецепторов
работающих мышц.
22.3.2. Кровь
Во время легкой физической работы в артериальной крови происходят
незначительные изменения парциального давления кислорода и углекислого
газа. Тяжелая работа вызывает отчетливое снижение РС02 без заметных
изменений Р02, что отражает нарастание вентиляции из-за ацидоза (который
возникает в результате накопления молочной кислоты в крови и мышцах).
Насыщение кислородом венозной крови уменьшается при нарастании
физической нагрузки, при этом артериовенозная разница по кислороду
увеличивается в результате улучшения извлечения кислорода из крови
работающей мышцей и ограничения кровотока в неработающих отделах.
При физической работе уменьшается объем циркулирующей плазмы
вследствие ее усиленной фильтрации через стенку капилляров и
происходит выброс эритроцитов из кроветворных органов в кровь {миогенныи
эритроцитов). В результате увеличивается показатель гематокрита.
Количество лейкоцитов в крови также зависит от мощности выполняемой
человеком работы и может достигать 15 000—30 000 клеток в 1 мкл {миогенныи
лейкоцитоз). Это увеличение обусловлено преимущественно нейтрофиль-
ными гранулоцитами, причем происходит изменение соотношения клеток
различных типов. Число тромбоцитов также увеличивается
пропорционально интенсивности работы {миогенныи тромбоцитоз), повышается
концентрация тромбопластина и фибриногена в плазме крови. В результате
время свертывания крови и время кровотечения сокращаются, что
представляет собой защитную реакцию организма.
22.3.3. Дыхание
При тяжелой динамической работе вентиляция легких прямо зависит от
уровня метаболической активности организма. Это связано с накоплением
в крови молочной кислоты (метаболический недыхательный ацидоз
крови), оказывающей рефлекторное стимулирующее воздействие на
дыхательный центр и систему дыхания.
Кислотно-основное состояние изменяется только при тяжелой работе,
при которой развивается метаболический недыхательный ацидоз.
Выраженность ацидоза пропорциональна анаэробной мощности и,
следовательно, скорости образования молочной кислоты.
Потребление 02 организмом человека возрастает как линейная функция
от мощности работы, зависит от тренированности человека и
коэффициента полезного действия данного вида работы. Если при легкой работе
потребление 02 соответствует метаболическим потребностям для аэробных
процессов ресинтеза АТФ, то при тяжелой мышечной работе потребление
02 возрастает до максимально возможного для человека уровня и после
этого больше не увеличивается. Поэтому тяжелая работа не может
продолжаться длительное время.
22.3.4. Эндокринная система
Центральная моторная команда, которая распространяется по
пирамидному тракту от моторной зоны коры больших полушарий к мотонейронам
22. Физиологические основы труда • 871
спинного мозга, передается также на эндокринные железы. Нервная им-
пульсация, сопровождающая центральную моторную команду, достигает
промежуточного мозга (гипоталамуса). В ответ усиливается активность
центральных нервных структур, управляющих симпатоадреналовой
системой, а также нейросекреторными клетками гипоталамуса. Последние
реагируют секрецией нейрогормонов (либеринов), поступающих через
специальную систему кровеносных сосудов в гипофиз и стимулирующих
продукцию тропных гормонов, в первую очередь кортикотропина. Общим
результатом этих регуляторных изменений является то, что уже через 10 с от
начала мышечной работы в крови увеличивается концентрация норадрена-
лина и адреналина, а чуть позже — и кортикотропина. В течение минуты
могут повышаться уровни кортизола и эндорфинов в крови. В дальнейшем
концентрации этих, а также других гормонов устанавливаются на
необходимом уровне под влиянием обратных нервных связей, берущих начало от
проприорецепторов и направляемых к центральным нервным структурам.
Важное значение имеют смещение рН, ионные сдвиги, а также
накопление различных метаболитов. Под влиянием этих воздействий, а также под
прямым воздействием метаболических изменений, отражающихся на
активности эндокринных желез, постепенно нарастают уровни соматотропи-
на, альдостерона и вазопрессина в крови. Более медленно активируется и
щитовидная железа.
В отличие от других гормонов уровень инсулина в крови снижается.
Это изменение наступает через определенный период: снижение уровня
инсулина наблюдается лишь через 10—20 мин работы. В ряде случаев
небольшой латентный период выявляется также до нарастания уровня сома-
тотропина. Продолжительный латентный период (иногда до 60 мин)
предшествует увеличению концентрации глюкагона и кальцитонина.
Активность желез может по-разному изменяться во время мышечной
работы. Большие физические нагрузки, как правило, угнетают продукцию
эстрогенов. При хорошей тренированности угнетение мало выражено или
совсем отсутствует. У мужчин при кратковременной физической работе
уровень тестостерона в крови увеличивается, а при длительной работе,
наоборот, снижается. Силовые упражнения приводят к повышенной
продукции андрогенов.
Окончательное формирование гормональных реакций во время
мышечной работы зависит от ряда модулирующих факторов. Важна
обеспеченность тканей организма углеводами. При ее снижении особенно
увеличивается секреция адреналина, глюкагона, соматотропина и кортизона, а
уровень инсулина в крови значительно понижается. Диета, богатая
углеводами, или прием глюкозы во время физической нагрузки вызывают
повышение уровня инсулина в крови вместо его снижения, что сопровождается
угнетением усиленного выброса адреналина, глюкагона и соматотропина.
Гормональные изменения модулируются также температурой среды,
содержанием кислорода во вдыхаемом воздухе, суточным и сезонным
ритмами и особо значительно — эмоциональным напряжением. При
воздействии гипоксии или эмоционального напряжения подпороговые
интенсивности работы могут вызвать гормональные изменения. В состоянии
утомления активность гормональных механизмов, ответственных за
мобилизацию энергетических и пластических ресурсов организма, падает. В
частности, это выражается в уменьшении уровня адреналина, норадреналина и
глюкокортикоидов в крови. Эти изменения не связаны с истощением
клеток, продуцирующих гормоны, а представляют собой регуляторно
обусловленную защитную реакцию, направленную на предотвращение чрезмерных
872 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
расходов ресурсов организма. При очень длительной мышечной работе эта
защитная реакция может заменяться новым усилением адренокортикаль-
ной активности.
22.4. Физиологические функции при умственном труде
При умственном труде изменения происходят прежде всего в
функциональном состоянии ЦНС, что связано с возрастанием нервного напряжения
(активируются обменные процессы в нервной ткани). Нервное напряжение
при умственном труде могут вызвать следующие факторы: 1) активация
механизмов внимания, памяти и мышления; 2) восприятие и переработка
большого объема разнообразной информации; 3) лимит времени для
переработки информации и принятия решения; 4) выполнение работ в ночное
время; 5) возникновение нештатной и аварийной ситуации, дефицит
времени, отпущенного на ее устранение; 6) степень ответственности за
принимаемые решения.
Нервное напряжение сопровождается активацией как специфических,
так и неспецифических образований мозга. При этом значительная роль в
осуществлении психических функций принадлежит лобным долям мозга.
В лобных долях объединяется обширная информация об эмоциональном
состоянии человека, поступающая из внешнего мира, от внутренней
среды организма, а также нижележащих структур мозга и центров старой
коры.
Кровоснабжение мозга. Активация различных структур головного мозга
при умственной работе повышает уровень обменных процессов и
кровотока в этих структурах. Однако общее кровоснабжение головного мозга и
потребление энергии нервной тканью мало меняется при различных видах
умственной деятельности, так как увеличение поступления 02 и
энергетических веществ усиленно работающими зонами мозга обеспечивается за
счет внутреннего перераспределения поступающего в мозг потока крови.
Так, во время умеренной мышечной работы не меняется общее
кровоснабжение мозга, но кровоток в моторной зоне возрастает на 50 % по
отношению к уровню покоя. При работе, требующей напряжения зрительного
анализатора, усиливается кровоснабжение зрительной области коры.
Эндокринная система. При умственной работе, связанной с
нервно-эмоциональным напряжением, повышается активность симпатоадреналовой и
гипоталамо-гипофизарно-адреналовой систем, что приводит к активации
минерального, углеводного и жирового обменов в организме человека,
повышению возбудимости ЦНС, усилению деятельности
сердечно-сосудистой и дыхательной систем.
В механизме возникновения нервно-психического напряжения
принимают участие следующие медиаторные системы: 1) катехоламины —
адреналин, норадреналин, дофамин; 2) биогенные амины — серотонин; 3) аце-
тилхолин (продуцируется в ЦНС, синапсах парасимпатической нервной
системы); 4) аминокислоты — ГАМК, глицин, глутамат, пролин и т.д.;
5) гипоталамические нейропептиды (рилизинг-гормоны); 6) гипофизарные
пептиды — АКТГ, пролактин и т. д.; 7) медиаторные олигопептиды —
субстанция Р, эндорфин, брадикинин и др. Серотонин, эндогенные
олигопептиды и ГАМК относятся к стресс-лимитирующей системе,
обеспечивающей устойчивость к эмоциональному стрессу.
Нервно-психическое напряжение при умственной деятельности
увеличивает частоту сердечных сокращений, артериальное давление, частоту
дыхания. В условиях психоэмоциональной нагрузки у человека нередко воз-
22. Физиологические основы труда • 873
никают трудноподавляемые двигательные акты (жестикуляция, хождение и
т. д.). При произвольном подавлении этих реакций увеличивается
тоническое напряжение скелетной мускулатуры.
22.5. Работа в условиях зрительного напряжения
Под контролем зрения совершается до 80—90 % трудовых операций.
Зрительное напряжение является важным элементом трудового процесса,
определяющим физиологическую нагрузку на организм работающих при
различных видах труда. В ряде случаев зрительное напряжение (труд
операторов ЭВМ) приводит к развитию зрительного утомления, при котором
наблюдается изменение рефракции и аккомодационной способности глаз,
уменьшение контрастной чувствительности, снижение устойчивости
хроматического и ахроматического видения, уменьшение границ поля зрения,
снижение остроты зрения, скорости восприятия и переработки
информации. Чрезмерная интенсивность зрительного напряжения может привести
к развитию перенапряжения зрительной функции и патологии зрительного
аппарата. Перенапряжение понижает способность глаз фокусировать и
фиксировать объект наблюдения, уменьшает объем аккомодации и
ухудшает бинокулярное зрение. Субъективно человек ощущает затуманенность
объекта наблюдения, размывание его очертаний.
Для предотвращения развития зрительного утомления и
перенапряжения следует соблюдать следующие рекомендации: 1) не допускать резких
изменений уровня освещенности рабочего места, воздействий на зрение
сильных световых и цветовых контрастов, источников яркого света;
2) подбор оптимального светового и цветового режимов работы мониторов
ЭВМ, оптимальной яркости и контрастности изображения, возможность
индивидуального выбора для оператора высоты экрана, расстояния от
экрана до глаз, высоты пульта с клавиатурой и т. д.; 3) соблюдение
правильного режима труда и отдыха, использование сеансов релаксации и
выполнение специальных упражнений для глаз; 4) проведение
профессионального отбора при приеме на работу, требующую зрительного напряжения.
22.6. Утомление при работе
Под влиянием продолжительной или интенсивной работы у человека
временно возникает особое функциональное состояние, приводящее к
снижению его работоспособности и называемое утомлением. Во время работы
утомление проявляется в уменьшении силы сокращения скелетных мышц,
в возрастании энергозатрат при выполнении одной и той же внешней
работы, в снижении скорости переработки информации, ухудшении памяти
и мыслительных функций, в затруднении процессов сосредоточения и
переключения внимания с одного вида деятельности на другой. Утомление
может быть мышечным (физическим) и центральным (нервно-психическим).
Тяжелая физическая работа приводит в первую очередь к мышечному
утомлению, а интенсивная умственная деятельность вызывает утомление
центрального происхождения. При различных видах комбинированного
труда обе формы утомления сочетаются и их нельзя отделить друг от друга.
Субъективно утомление проявляется в виде ощущения усталости,
обусловленного потребностью во сне и вызывающего желание прекратить
работу.
874 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
22.6.1. Утомление человека при физической работе
В процессе выполнения физической работы у человека происходит
постепенное снижение максимальной произвольной силы мышц и
максимальной произвольной скорости укорочения мышц или их мощности.
Максимальная сила, которую способны развивать мышцы человека при их
произвольной активации, называется максимальной произвольной силой
мышц. Под произвольной активацией работающих мышц понимают
двигательные команды от нейронов моторной коры человека, которые
поступают к мотонейронам спинного мозга, а от последних — к иннервируемым
скелетным мышцам. При физической работе начало уменьшения
показателей максимальной произвольной силы мышц и их мощности
обусловлено развитием утомления. Начиная с ранних физиологических
исследований, было установлено, что у человека снижение максимальных
произвольных изометрических сокращений мышц при физической работе, т. е.
развитие утомления не сопровождается уменьшением возбудимости мышц
(рис. 22.4). Поэтому снижение у человека способности произвольной
активации сокращений мышц во время выполнения физической работы
называется центральным утомлением. Наряду с центральным утомлением при
физической работе у человека причиной снижения способности
поддерживать начальную максимальную силу сокращения мышц может быть
периферическое утомление, вызванное изменениями физиологических свойств
самих работающих мышц (см. главу 2).
Физиологический механизм центрального утомления при физической
работе человека обусловлен процессами, возникающими на уровне спи-
Сгибание
Амплитуда движений
^ указательного пальца
Направление
движения
указательного
пальца
Утомление
Исходное положение
груза
Произвольные
сокращения
Произвольные
сокращения
Сокращения
при стимуляции
двигательного
нерва
Рис. 22.4. Примеры утомления мышцы-сгибателя указательного пальца при
максимальных изотонических сокращениях.
Электрическое раздражение нерва, иннервирующего эту мышцу тотчас после ее утомления,
вновь вызывает сокращения, что свидетельствует о центральной природе явления утомления.
В период мышечных сокращенй, вызванных электрическим раздражением двигательного
нерва, двигательные центры головного мозга находятся в состоянии покоя (отдыха). В результате
кратковременного отдыха двигательных центров головного мозга возможны произвольные
сокращения мышцы-сгибателя указательного пальца тотчас после прекращения электрического
раздражения двигательного нерва этой мышцы.
22. Физиологические основы труда • 875
нальных механизмов регуляции мышечных сокращений. Спинальные
механизмы центрального утомления различаются при статической и
динамической физической работе.
22.6.1.1. Утомление человека при статической физической работе
Спинальные механизмы «центрального» утомления человека при
статической физической работе обусловлены снижением функции мотонейронов
спинного мозга. Снижение функции мотонейронов спинного мозга при
физической работе происходит в результате уменьшения возбудимости сс-
и у-мотонейронов передних рогов сегментов спинного мозга. Этот
феномен называется адаптацией. При развитии адаптации мотонейроны
постепенно уменьшают частоту генерации потенциалов действия в процессе
выполнения физической работы, что приводит к снижению физиологических
показателей работоспособности мышц во время статической физической
работы. Различают раннюю и позднюю адаптацию мотонейронов. Ранняя
адаптация мотонейронов возникает в первые секунды после начала
мышечных сокращений, а поздняя — в процессе выполнения физической работы
по мере развития утомления.
Физиологический механизм адаптации при утомлении человека имеет
место в мотонейронах, иннервирующих мышцы как верхних, так и нижних
конечностей. Именно снижение частоты разрядов спинальных
мотонейронов является основной причиной уменьшения силы и мощности
мышечного сокращения. Одновременно при развитии утомления увеличивается
период времени мышечного расслабления. Адаптация мотонейронов
может привести к полному прекращению активности отдельных
двигательных единиц. Это характерно, прежде всего, для низкопороговых
мотонейронов спинного мозга и механизм развивается при участии тормозного
медиатора гамма-аминомасляной кислоты. При этом частота генерации
импульсов в мотонейронах снижается тем быстрее, чем выше скорость
мышечного сокращения, т. е. прямо зависит от мощности выполняемой
мышцами работы.
При развитии физического утомления у человека кроме снижения
электрической активности мотонейронов спинного мозга, у нейронов начинает
варьировать частота генерации импульсов. Эти изменения электрической
активности мотонейронов спинного мозга, как правило, проявляется с
момента снижения показателей произвольной силы мышечного сокращения.
В основе физиологического механизма феномена адаптации
мотонейронов при утомлении у человека лежат такие процессы, как возвратное
торможение при участии клеток Реншоу, рефлекторное уменьшение
возбудимости мотонейронов под влиянием импульсов от рецепторов
сокращающихся мышц, пресинаптическое торможение и, наконец, уменьшение
возбудимости мотонейронов под влиянием нейромодуляторов.
Клетки Реншоу вызывают классическое торможение мотонейронов
спинного мозга, которые иннервируют мышцы-антагонисты с одной
стороны туловища или мышцы-синергисты обеих конечностей, и, таким
образом, усиливают развитие феномена адаптации мотонейронов.
Тормозные интернейроны сегментов спинного мозга, которые получают
нисходящие эфферентные сигналы от двигательных центров ствола мозга
и афферентные волокна от проприорецепторов скелетных мышц, также
уменьшают возбудимость мотонейронов спинного мозга.
В процессе мышечных сокращений к тормозным интернейронам
спинного мозга поступает нарастающий поток импульсов от проприорецепто-
876 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
Группы афферентных волокон
Возбуждающий
интернейрон ~~
Тормозной _
интернеирон
П реси наптическое
торможение
Рефлекторные
входы афферентных
волокон I—IV групп
а-Мотонейрон
у-Мотонейрон
Экстрафузальные
мышечные волокна
Клетка Реншоу
Интрафузальные
мышечные волокна
Рис. 22.5. Афферентные входы к а- и у-мотонейронам мышц антагонистов.
Афферентные входы от проприорецепторов мышц и нисходящие супраспинальные
влияния оказывают активирующее, а также пре- и постсинаптическое торможение при
участии клеток Реншоу на а- и у-мотонейроны спинного мозга. Тормозные влияния
на а- и у-мотонейроны спинного мозга являются основным механизмом адаптации
и снижения электрической активности этих нейронов. В результате происходит
уменьшение физиологических показателей работающих мышц (сила и мощность) и
развитие утомления.
Темные кружки — тормозные входы, светлые — возбуждающие.
ров. В результате как клетки Реншоу, так и тормозные интернейроны
сегментов спинного мозга постепенно повышают свою электрическую
активность и при участии тормозного медиатора гамма-аминомасляной кислоты
гиперполяризуют мембрану а- и у-мотонейронов, снижая их возбудимость.
В результате у мотонейронов снижается частота генерации потенциалов
действия мотонейронов, что обусловливает уменьшение силы и мощности
сокращений мыщц.
Во время мышечного сокращения растяжение сухожильных органов
Гольджи, расположенных на границе перехода соединительнотканных
волокон в мышечные, вызывает генерацию потенциалов действия в
чувствительных нервах. Степень возбуждения сухожильных рецепторов Гольджи
прямо зависит от силы как изометрических, так и изотонических
сокращений скелетных мышц. Нервные импульсы от сухожильных органов
Гольджи поступают в спинной мозг по lb нервным волокнам и конвергируют
на те же мотонейроны сегментов спинного мозга, что 1а тип афферентных
волокон, через которые передаются к мотонейронам импульсы от
мышечных веретен. Классическое действие lb афферентных волокон на
мотонейроны спинного мозга заключается в торможении мышц одной стороны
туловища и одновременно в обширном торможении мыщц-синергистов. При
этом сухожильные органы Гольджи в процессе развития утомления у
человека оказывают влияние на снижение частоты разрядов как а-, так и
у-мотонейронов при участии механизма их пресинаптического торможения.
Свободные нервные окончания, расположенные в скелетных мышцах,
22. Физиологические основы труда • 877
возбуждаются при их растяжении, укорочении, ишемии и гипоксемии
мышечной ткани, что имеет место при физической работе. Нервные
импульсы по афферентным немиелинизированным волокнам III и IV групп
передаются в спинной мозг. Афферентные волокна III группы обильно иннер-
вируют также сухожилия мышц. Механизм взаимодействия афферентных
волокон III и IV групп, и lb типа афферентных волокон на мотонейроны
спинного мозга показан на рис. 22.5. Центральный механизм развития
утомления при участии афферентных волокон la, lb и мышечных веретен
(группа И) осуществляется по типу пресинаптического торможения
электрической активности мотонейронов спинного мозга.
Супраспинальные механизмы утомления человека при статической
физической работе, в частности роль нейронов двигательной коры больших
полушарий головного мозга, не является первичной причиной развития
«центрального» утомления. Только при высокой активности нисходящих
двигательных команд имеет место феномен адаптации спинальных
мотонейронов как причина утомления человека
22.6.1.2. Утомление человека при динамической мышечной работе
Динамическая мышечная работа сопровождается активацией
сердечно-сосудистой, дыхательной, эндокринной систем, двигательных центров
головного и спинного мозга, а также функции многих нейротрансмиттерных
систем ЦНС. Физиологические проявления центрального действия этих
систем при динамической физической работе человека могут быть
компонентами супраспинальных механизмов «центрального» утомления. При
физической динамической работе происходит активация функции серото-
нинергической и норадренергической систем мозга, которые могут
изменять уровень активации мозга, степень мотивации выполнения
физической работы, уровень внимания и устойчивость к дискомфорту и действию
стрессовых факторов. Физическая работа как стрессовый фактор
активирует иммунную систему, включая продукцию таких факторов, как кортизол и
цитокины. Роль этих процессов в качестве «пусковых» факторов
супраспинальных механизмов «центрального» утомления человека требует
уточнения. При этом наиболее распространенная теория супраспинальных
механизмов «центрального утомления» объясняет его природу нарушением
метаболизма аминокислот в нейронах серотонинергической системы мозга.
Так, нарушение метаболизма аминокислот в нейронах этой медиаторной
системы мозга является основной причиной изменений в цикле сна-
бодрствования, гипоталамо-гипофизарной оси регуляции функций
организма, а также регуляции двигательной функции. При физической работе
возрастает проникновение через гематоэнцефалический барьер в мозг
аминокислоты триптофана. Этому способствует активация использования в
работающих мышцах аминокислот и, как следствие, увеличение
концентрации в плазме крови жирных кислот. В результате в плазме крови
возрастает отношение между содержанием свободного триптофана и
аминокислот с короткой цепью. Триптофан в нейронах ЦНС метаболизируется в
серотонин, что повышает его концентрацию в структурах базальных
ганглиев, гиппокампа и ствола мозга. Так, агонисты серотонина снижают
устойчивость организма к утомлению, а антагонисты, напротив,
задерживают развитие этого процесса. У человека блокада обратного захвата
серотонина, выделяющегося из нервных терминалей, что исключает его
повторное использование в синаптической передаче, увеличивает время
физической работоспособности человека (например, при езде на велосипеде или
878 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
во время бега). Аналогичный эффект на сохранение физической работо-
спосбности оказывает уменьшение соотношения свободного триптофана к
аминокислотам в плазме крови путем специальной диеты.
Напротив, активация дофаминергической системы мозга при
физической динамической работе тормозит синтез в нейронах мозга серотонина и
снижает скорость развития «центрального утомления» при участии
супраспинальных механизмов. Однако при длительной динамической
физической работе происходит снижение уровня двигательной активности
человека за счет периферического утомления. Это ведет к снижению
активности дофаминергической системы мозга и, как следствие, увеличивается
активность серотонинергической системы мозга. Серотонин, уменьшая
активность супраспинальных двигательных центров головного мозга,
стимулирует развитие «центрального утомления».
ГЛАВА 23
Адаптация человека к условиям
внешней среды
23.1. Общие принципы и механизмы адаптации
23.1.1. Адаптация
Адаптация — процесс приспособления организма к меняющимся условиям
среды, который создает возможность приспособления человека к новым
для него природным, производственным или социальным условиям.
Адаптация человека к неадекватным условиям среды обеспечивает ему
работоспособность, воспроизведение здорового потомства, нормальный темп
старения организма, максимальную продолжительность жизни, характерную
для популяции, к которой относится индивидуум. Процесс адаптации
обеспечивают компенсаторные механизмы — адаптивные реакции,
направленные на устранение или ослабление функциональных сдвигов в
организме, вызванных неадекватными факторами среды. Это динамические,
быстро возникающие физиологические средства аварийного обеспечения
организма. Они мобилизуются, как только организм попадает в неадекватные
условия, и постепенно затухают по мере развития адаптационного процесса.
Например, под воздействием холода усиливаются процессы производства
и сохранения тепловой энергии, повышается обмен веществ, в результате
рефлекторного сужения периферических сосудов (особенно кожи)
уменьшается теплоотдача. Компенсаторные механизмы служат составной частью
резервных сил организма. Обладая высокой эффективностью, они могут
поддерживать относительно стабильный гомеостазис достаточно долго для
развития устойчивых форм адаптационного процесса, приспособления
строения и функций организма, его органов и систем к изменению
окружающей среды. Все живые системы обладают способностью к
приспособлению, т. е. обладают адаптивностью, или приспособляемостью. Мерой
соответствия адаптации организма к измененным условиям среды является
оценка степени приспособления к ним его жизнедеятельности. Например,
оценка степени приспособления человека к жизни в измененной среде
обитания положительна, если для него характерна высокая
продолжительность жизни, рождение здорового потомства, а в плане социальной оценки
достигнутой адаптации организмом человека к новой среде обитания —
высокая производительность труда. Адаптацию организма человека к
новым климатическим условиям и биологическому окружению обозначают
понятием акклиматизация
Процесс, обратный адаптации, который возникает при воздействии на
организм человека факторов среды, количественно превышающих
возможности адаптирующейся системы, и вызывает нарушение адаптивных
реакций организма, называется дизадаптацией. Дизадаптация приводит к
дисфункции, т. е. нарушению функций системы, органа или тканей организма,
880 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
о.
э
38
L34
г 80
-55
"-30
4
Время,ч
характеризующемуся
неадекватностью ответа данных структур
организма на действие раздражителей.
Организм способен возвращать
вовлеченные в процесс адаптации
системы в исходное положение
после прекращения действия фактора
среды, повлекшего адаптацию к
нему организма, т. е. возможна деа-
даптация организма.
Организм всегда сохраняет след,
память об адаптации к
неадекватным условиям среды (так
называемая вегетативная память), что
делает более быстрым процесс
повторной адаптации {реадаптации) к
этим условиям среды. Например,
такая память о сформировавшейся
адаптации к жаркому, влажному
климату в организме жителя
средних широт, вернувшегося из
тропиков в привычную среду обитания
умеренного климата, сохраняется
от нескольких недель до
нескольких месяцев, облегчая адаптацию
человека при возвращении в
тропики. В основе «вегетативной
памяти» лежат возникшие в ходе
адаптации организма к новым
условиям среды изменения в
нейронах гипоталамических ядер
головного мозга, характеризуемые
увеличением количества РНК и белков в
их цитоплазме.
Адаптация организма к воздействию факторов внешней среды может
идти по пассивному пути, по типу толерантности (выносливость,
терпеливость), который характеризуется снижением, экономизацией
энергетических трат организма, связанных с поддержанием гомеостазиса. Другой,
активный путь — связан с возрастанием энергетических затрат организма на
поддержание гомеостазиса, на компенсацию изменений во внутренней
среде организма, вызванных воздействием факторов внешней среды.
Например, на снижение температуры внешней среды в ночное время суток
организм австралийского аборигена отвечает снижением метаболизма и
температуры ядра тела (пассивный путь адаптации), а организм
европейца — усилением метаболизма и теплопродукции (активный путь
адаптации) (рис. 23.1).
Организм человека обладает устойчивостью, или сопротивляемостью, к
воздействию раздражителей большой силы (стрессоров) — механическая
травма, боль, инфекция, физическая работа большого объема и др., а
также их разновидности — экстремальных факторов, т. е. угрожающих
жизнедеятельности организма факторов окружающей среды (холод, жара,
изменения атмосферного давления). Это свойство организмов называют
резистентностью. Различают специфическую (устойчивость по отношению к
Рис. 23.1. Динамика температуры ядра
тела и метаболической продукции тепла
у австралийских аборигенов и
европейцев в ночные часы в пустыне.
австралийские аборигены;
европейцы.
Метаболическая продукция тепла в ваттах х
м2 поверхности тела.
23. Адаптация человека к условиям внешней среды • 881
определенному фактору) и неспецифическую (по отношению к различным
факторам) резистентность. Резистентность организма обеспечивается его
адаптивными реакциями на раздражитель. Адаптационные реакции
организма также являются неспецифическими, если физиологические системы
организма (нервная, эндокринная, кровообращения и др.) сходно
реагируют при действии на организм человека различных по качеству и силе
раздражителей. Так, при действии на организм сильных, чрезвычайных
раздражителей в ЦНС развивается резкое возбуждение, сменяющееся
запредельным торможением — крайней мерой защиты, проявляющейся в
снижении возбудимости и чувствительности структур ЦНС к сильному
раздражителю, так как адекватный ответ на этот раздражитель мог бы привести
организм к гибели.
23.1.2. Неспецифические адаптивные реакции организма
При адаптации организма человека к действию на него различной силы
раздражителей внешней среды различают по характеру проявлений и
механизмам развития несколько неспецифических адаптивных реакций
организма, «организуемых» нейрогормональными системами: симпатоадреналовую
реакцию, стресс-реакцию, реакцию тренировки и реакцию активации. Все
они повышают неспецифическую резистентность организма к
нарушающим его жизнедеятельность факторам внешней среды.
На действие любых раздражителей большой силы, или стрессоров,
организм отвечает развитием неспецифических адаптивных реакций — симпа-
тоадреналовой и стресс-реакции. Под термином «стресс» (напряжение)
понимают неспецифические психофизиологические проявления
адаптационной активности организма и его систем при действии на него стрессоров.
При воздействии стрессора на организм происходит быстрая активация
симпатоадреналовой системы («запускающая» симпатоадреналовую
реакцию) и системы гипофиз—кора надпочечников («запускающая»
стресс-реакцию), благодаря одновременному возбуждению нервных центров
головного мозга, регулирующих функцию этих систем.
Центр, активация которого возбуждает симпатоадреналовую систему,
расположен в продолговатом мозге — в голубом пятне (locus coeruleus) и
является самым крупным скоплением норадренергических нейронов в
головном мозге человека (см. главу 5).
Центр, активирующий систему гипофиз—кора надпочечников,
локализован в медиодорсальной области паравентрикулярных ядер гипотоламуса
и представлен самым крупным в головном мозге человека скоплением
нейронов, секретирующих кортикотропин-рилизинг-гормон. При
действии на организм стрессора нейроны паравентрикулярных ядер
гипотоламуса секретируют кортикотропин-рилизинг-гормон, активирующий систему
гипофиз—кора надпочечников, а активация симпатоадреналовой системы
осуществляется сигнализацией с терминалей секретирующих
кортикотропин-рилизинг-гормон нейронов паравентрикулярных ядер гипотоламуса
на катехоламинергические нейроны голубого пятна. Активирующий
эффект на катехоламинергические нейроны голубого пятна оказывает и
непосредственно кортикотропин-рилизинг-гормон.
Существует несколько механизмов, активирующих нейроны
медиодорсальной области паравентрикулярных ядер гипотоламуса и секрецию ими
кортикотропин-рилизинг-гормона. Так, стрессоры (психоэмоциональное
напряжение, боль, травма, кровопотеря и др.) вызывают сдвиги величин
показателей внутренней среды организма. Сигнализация об этих наруше-
882 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
ниях гомеостазиса, поступающая от центральных и периферических
рецепторов, контролирующих показатели внутренней среды организма к
гипоталамусу, к коре головного мозга, ретикулярной формации, лимбической
системе (гиппокамп, миндалевидный комплекс), стимулирует образование
в тканях головного мозга нейропептида Y (соединение, относимое к классу
тахикининов). Нейропептид Y активирует нейроны медиодорсальной
области паравентрикулярных ядер гипотоламуса и секрецию ими кортико-
тропин-рилизинг-гормона. При стрессе же, вызванном инфекцией,
макрофаги, фагоцитируя проникшие в организм микроорганизмы,
взаимодействуя с их липополисахаридным комплексом резко усиливают секрецию ин-
терлейкина-1 в тканевую жидкость и кровь (см. главу 7). Интерлейкин-1
проникает в ткань головного мозга человека из плазмы крови через гема-
тоэнцефалический барьер благодаря специфическим механизмам
транспорта для данного цитокина. Интерлейкин-1 стимулирует экспрессию
и-РНК кортикотропин-рилизинг-гормона, его синтез и секрецию в
нейронах медиодорсальной области паравентрикулярных ядер гипотоламуса. В
свою очередь кортикотропин-рилизинг-гормон стимулирует секрецию
АКТГ в гипофизе, который усиливает образование и секрецию в кровь
глюкокортикоидных гормонов корой надпочечников. Рассмотрим
эффекты симпатоадреналовой и стресс-реакции, повышающие устойчивость
организма человека к действию на него стрессоров.
23.1.3. Симпатоадреналовая реакция
Симпатоадреналовая реакция развивается в результате рефлекторного
возбуждения расположенных в области голубого пятна норадренергиче-
ских нейронов, активирующих симпатический отдел вегетативной
нервной системы, при действии стрессора на организм. Активация
симпатического отдела вегетативной нервной системы стимулирует секрецию в
кровь катехоламинов — норадреналина и адреналина — мозговым
веществом надпочечников. Под влиянием адреналина повышается обеспечение
энергетическими ресурсами и кислородом работающих мышц, сердца,
ЦНС: адреналин стимулирует образование глюкозы из гликогена,
свободных жирных кислот из триглицеридов жировой ткани; активирует
функцию систем транспорта кислорода: кровообращения — увеличивая число
и силу сердечных сокращений, сердечный выброс и кровяное давление;
дыхания — увеличивая минутный объем дыхания, уменьшая газовое
сопротивление вентиляции легких (за счет расслабления гладких мышц
бронхиол и увеличения их просвета); эритрона — увеличивая
кислородную емкость крови за счет выброса в нее депонированных эритроцитов.
Под влиянием адреналина повышается свертываемость крови, что
предупреждает значительную потерю крови при повреждении кровеносных
сосудов. Одновременно адреналин стимулирует деятельность ЦНС,
облегчает восприятие сенсорной информации индивидуумом (расширяются
зрачки, увеличивая поля зрения), что способствует развитию адаптивной
поведенческой реакции, направленной на избегание или борьбу с
угрожающей организму опасностью. Активация функций перечисленных выше
систем и метаболизма под влиянием адреналина осуществляется
быстро — уже в первые минуты действия стрессора на организм, т. е. гормон
способствует быстрой мобилизации приспособительных реакций
организма, направленных на восстановление нарушенного действием стрессора
гомеостазиса.
23. Адаптация человека к условиям внешней среды • 883
23.1.4. Стресс-реакция
Ее развитие связано с усилением секреции нейронами медиодорсальной
области паравентрикулярных ядер гипоталамуса кортикотропин рили-
зинг-гормона, резко усиливающего секрецию АКТГ передней долей
гипофиза и активации под влиянием АКТГ секреции кортикостероидов (кор-
тизол, кортикостерон, альдестерон) надпочечниками в кровь. Эти
гормоны усиливают эффекты катехоламинов, направленные на
энергообеспечение тканей: активируют глюконеогенез, стимулируют разрушение части
лимфоидной ткани, в результате которого высвобождаются аминокислоты,
используемые в глюконеогенезе; глюкокортикоиды препятствуют
снижению проницаемости кровеносных сосудов, возникающему под влиянием
биологически активных веществ (лейкотоксин, эксудин и др.),
образующихся в поврежденных тканях; подавляют воспаление; понижают
проницаемость гематоэнцефалического барьера, тем самым препятствуя
поступлению в ЦНС токсичных веществ, эндогенной и экзогенной природы
(наркотиков и др.); усиливают миграцию Т-хелперов в костный мозг,
активирующих гранулоцитопоэз, что увеличивает число нейтрофильных
лейкоцитов в крови и повышает резистентность организма к инфекции,
повреждению тканей. Одновременно АКТГ и кортизон угнетают выработку
антител, что предупреждает аутосенсибилизацию организма (т. е.
иммунизацию организма антигенами собственных поврежденных тканей, в
результате чего антитела начинают повреждать здоровые ткани собственного
организма).
При стрессе могут возникать не только приспособительные, адаптивные
изменения в организме человека, но и выраженные расстройства его
жизнедеятельности, характеризующиеся нарушением функций различных
систем организма, с переходом даже в болезнь. Например, в современном
обществе одной из распространенных форм стресса стал эмоциональный
стресс, под которым понимают психоэмоциональное напряжение
человека, развивающееся на стрессор — конфликтную ситуацию.
Физиологический эмоциональный стресс — это нормальная реакция человека и
животных на конфликтную ситуацию. Механизмы данной реакции развились и
генетически закрепились в ходе эволюции, помогая выживанию
организма, делая его устойчивым к психоэмоциональному напряжению в
конфликтных ситуациях. Однако эмоциональное перенапряжение, длительно
и часто повторяющийся эмоциональный стресс могут нарушать
выработанные в эволюции адаптивные механизмы и приводить к развитию
психосоматических заболеваний — психозов, неврозов;
сердечно-сосудистых — аритмий, инфаркта миокарда, гипертонической болезни; для
тяжелого стресса характерны эрозивные поражения слизистой оболочки
желудка, вызывающие формирование кровоточащих язв. Повышенная секреция
кортикотропин-рилизнг-гормона, при стрессе тормозит секрецию половых
гормонов: под его влиянием снижается секреция люлиберина фолликулин-
стимулирующего и лютеинизирующего гормонов. Поэтому длительный
стресс, снижая уровень продукции половых гормонов, может вызвать у
мужчин нарушение сперматогенеза и, как следствие, бесплодие. Поэтому
различают положительные, физиологические (эустресс — от греч. «эу» —
хороший) и отрицательные, патологические (дисстресс — от лат. «дис» —
плохой) формы стресса. Переходу эустресса в дисстресс препятствуют
антистрессовые механизмы, «нейтрализующие, смягчающие» отрицательные
проявления стресс-реакции в тканях и системах организма.
К антистрессовым механизмам относят секрецию эпифизом гормона
884 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
мелатонина; синтезирующиеся в эмоциогенных зонах гипоталамуса
эндогенные олигопептиды, субстанцию Р, опиатные гормоны ф-эндорфин
и др.), пептид, вызывающий 5-сон; ГАМК-ергическую систему; антиокси-
дантные механизмы (они защищают организм от длительной активации
перекисного окисления липидов); оксид азота, активирующий в тканях
синтез протекторных белков (так называемых белков теплового шока,
защищающих органы от стрессорных повреждений); систему простагландинов
(тормозят взаимодействие катехоламинов с адренорецепторами).
Перечисленные антистрессовые механизмы «включаются» в организме человека
одновременно с началом развития стресс-реакции. Так, молекулы нейро-
пептида Y, усиленно образующиеся в ткани головного мозга под влиянием
стрессора, одновременно активируют как секрецию кортикотропин-рили-
зинг-гормона нейронами медиодорсальной области паравентрикулярных
ядер гипоталамуса, так и секрецию мелатонина эпифизом. Мелатонин, в
свою очередь, угнетает выработку кортикотропин-рилизинг-гормона в
гипоталамусе, АКТТ — в гипофизе и стероидных гормонов — в коре
надпочечников, снижая интенсивность стресс-реакции; повышает продукцию
субстанции Р, также угнетающую секрецию
кортикотропин-рилизинг-гормона в гипотоламусе; активирует ГАМК-ергическую систему и выработку
эндогенных опиоидных гормонов в тканях головного мозга.
Образующийся из ГАМ К тормозной метаболит — гаммаоксимаслянная кислота
(ГОМК) — понижает возбудимость нервных центров, ответственных за
развитие стресс-реакции. Опиоидные гормоны оказывают аналгезирую-
щий эффект.
Если стрессор действует на организм длительно, если сила
раздражителя велика и к его действию полная адаптация организма не происходит
или же активность антистрессовых механизмов оказывается недостаточной
для устранения отрицательных следствий стресса, то эустресс переходит в
дисстресс. Дисстресс резко повышает риск развития заболевания
гипертонической болезнью, ишемической болезнью сердца, психоневрологических
заболеваний, иммунодефицитного состояния организма, в свою очередь
увеличивающего риск развития злокачественных опухолей у человека.
Чрезмерная выраженность стресс-реакции, т. е. дисстресс, вызванный
микробной инфекцией, вызывает мощную секрецию нейтрофильными
лейкоцитами, макрофагами и моноцитами в кровь и тканевую жидкость
супероксидных радикалов. Последние резко усиливают перекисное
окисление липидов мембран Т- и В-лимфоцитов, влекущие снижение
активности их мембранных ферментов (Na+, К+-АТФазы, Са++-АТФазы, аденилат-
циклазы), повышение проницаемости клеточных и субклеточных мембран,
снижение чувствительности лимфоцитов к гормональной и нервной
регуляции. В результате функция данных иммунокомпетентных клеток
нарушается, как следствие — угнетается иммунный ответ организма на
инфекцию, у больных имеет место развитие «суперинфекции», делающий крайне
тяжелым течение инфекционного заболевания. При физиологическом же
стрессе, вызванном умеренной микробной инфекцией, также имеющее
место перекисное окисление липидов мембран иммунокомпетентных клеток
поддерживает обновление мембран, клеточное деление и синтез
биоактивных веществ в лимфоцитах, активирует эти клетки, что способствует
развитию адекватной иммунной реакции организма человека на инфекцию и
последняя уничтожается антителами и клетками иммунной системы (см.
главу 8).
Совокупность защитных реакций организма, возникающих в организме
при состоянии стресса, получила название общего адаптационного синдро-
23. Адаптация человека к условиям внешней среды • 885
Стрессор
Рис. 23.2. Изменение резистентности организма в разные стадии общего
адаптивного синдрома.
N — границы нормального уровня резистентности организма; ] — стадия тревоги; II — стадия
резистентности; III —стадия истощения; а —фаза шока; б — фаза противошока (пояснение в
тексте).
ма, который характеризуется последовательно развивающимися тремя
стадиями (рис. 23.2).
Первая стадия (реакция тревоги) может развиваться до 24—48 ч после
действия стрессора на организм. В ее развитии вьщеляют две фазы — шока
и противошока. Фаза шока характеризуется нарушением функций ряда
систем организма (нервной системы, кровообращения, дыхания,
водно-солевого обмена, теплорегуляции, метаболизма и др.), вызывающих
нарушение гомеостазиса. Поэтому фаза шока характеризуется гипотонией
(понижением кровяного давления), гипотермией (понижением температуры
«ядра» тела), депрессией центральной нервной системы, повышением
проницаемости клеточных мембран, явлениями катаболизма, вызывающими
исхудание, отрицательный азотистый баланс, гипогликемию, лейкопению,
лимфо- и эозинопению, уменьшение массы вилочковой железы и
лимфатических узлов, кровоизлияние в слизистую оболочку тонкого кишечника
и желудка, появление язв в слизистой оболочке этих органов. В результате
резистентность организма к стрессору снижается, что может вызвать
нарушение его жизнедеятельности. Поэтому организм не может длительное
время находиться в фазе шока и погибает в первые часы или дни действия
стрессора на организм, если не развивается фаза противошока,
характеризующаяся мобилизацией приспособительных ответов физиологических
систем организма в ходе симпатоадреналовой реакции и активации
системы гипофиз—кора надпочечников. Фаза противошока характеризуется
повышенным содержанием адреналина, АКТГ и кортизола в крови,
увеличением под влиянием АКТГ массы коры надпочечников, усилением в них
(особенно в пучковой зоне надпочечников) митотической и пролифера-
тивной активности. В результате действия гормонов надпочечников фаза
противошока характеризуется сдвигами, идущими в направлении,
обратном фазе шока: повышается кровяное давление, повышается температура
тела, понижается проницаемость клеточных мембран, развивается
гипергликемия и т. д., которые ведут к восстановлению нарушенного
гомеостазиса и обусловливают переход фазы противошока во вторую стадию —
стадию резистентности, или устойчивости, приспособления, повышения
устойчивости организма к действующему на него стрессору. Стадия
резистентности характеризуется преобладанием анаболических процессов (т. е.
886 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
процессов биосинтеза) в различных тканях организма, что способствует
восстановлению поврежденных под влиянием стрессора тканей. В стадии
резистентности для организма характерно повышение устойчивости не
только к стрессору, вызвавшему развитие общего адаптационного
синдрома, но и к другим сильным раздражителям, т. е. имеют место так
называемая перекрестная резистентность. Стадия резистентности приводит к
поддержанию нормального существования организма в новых для него
условиях.
Если же стрессор продолжает действовать на организм, а его антистрес-
сорные механизмы оказываются недостаточно эффективными, то может
развиться третья стадия — стадия истощения, которая может привести к
заболеваниям организма, к раннему его постарению и даже гибели.
23.1.5. Реакция тренировки и реакция активации
При действии на организм слабых, пороговых раздражителей
(систематические занятия физической культурой, утренняя физическая зарядка,
водные процедуры) организм человека отвечает формированием адаптивной
реакции, получившей название реакции тренировки, в ходе которой в ЦНС
развивается возбуждение, быстро сменяющееся охранительным
торможением, что обеспечивает снижение ее возбудимости, реактивности по
отношению к слабому раздражителю; повышается активность защитных систем
организма (иммунной системы, неспецифических факторов
резистентности); в результате повышается устойчивость организма человека к
простудным заболеваниям. При реакции тренировки умеренно активируется
секреторная функция передней доли гипофиза и контролируемых ее
гормонами периферических эндокринных желез (половых, щитовидной железы),
что повышает половую функцию, усиливает обмен веществ в организме
человека. Реакция тренировки повышает противоопухолевую
резистентность организма. Например, при развитии у экспериментальных животных
реакции тренировки у них быстро рассасываются перививаемые опухоли —
саркома и рак молочной железы.
При действии на организм раздражителей средней силы происходит
развитие «реакции активации» защитных систем организма, которая,
однако, не носит характера их патологической гиперфункции. Реакция
активации возникает, например, под влиянием «адаптогенов» — в результате
приема человеком настойки женьшеня, элеутерококка колючего, золотого
корня, эфедрина и др. Ее главной чертой является резкая активация тими-
ко-лимфатической системы (в противоположность инволюции этой
системы, возникающей в стадию тревоги, вызванной действием стрессора),
следствием которой является гиперплазия лимфоидной ткани, активация
клеточного и гуморального иммунитета (см. главу 8), системы
фагоцитирующих мононуклеаров (см. главу 7), что повышает устойчивость к
инфекции и препятствует развитию опухолей в организме человека. Реакция
активации повышает детоксикационную функцию организма, что
увеличивает его устойчивость к токсичным веществам (рис. 23.3).
23.1.6. Срочная и долговременная адаптация
При кратковременном воздействии экстремальных факторов на организм
они компенсируются резервными возможностями человека (например, в
ответ на жару возрастает секреция пота, усиливающая испарительный
термолиз). При длительном воздействии экстремальных факторов на организм
23. Адаптация человека к условиям внешней среды • 887
Реакция тренировки
Резистентность
ШШ Зона нормы
Реакция тренировки
^^ ш^ ж*"1-^ Резистентность
Зона нормы
Рис. 23.3. Изменения резистентности организма при развитии реакции тренировки
и реакции активации (пояснение в тексте).
человека функциональные перестройки определяются совокупным
включением процессов восстановления нарушенного гомеостазиса, их силой и
продолжительностью. Например, при длительном действии холода на
организм человека повышается продукция катехоламинов и тироксина,
усиливающих жировой обмен, в результате резко активируется
несократительный термогенез, температура ядра тела повышается.
Адаптационные реакции организма осуществляются в виде срочной и
долговременной адаптации.
Срочная адаптация возникает в организме человека как реакция
физиологических систем на действие раздражителя большой силы. Она
развивается на основе ранее сформировавшихся приспособительных механизмов
физиологических систем организма (кровообращения, дыхания, крови
и др.) к среднему по интенсивности действия на организм средовому
фактору, например постоянно выполняемой человеком умеренной по
интенсивности физической работы. Под действием раздражителя большой силы
(например, работы большой интенсивности и объема) органы и системы,
не адаптированные к такой физической нагрузке, функционируют на
пределе их физиологических возможностей, почти при полной мобилизации
функциональных резервов. Однако срочная адаптация не обеспечивает
организму человека оптимальный адаптационный эффект, так как при ней
не успевают развиться приспособительные изменения в клетках тканей
органов (сердце, скелетные мышцы), обеспечивающих организму
выполнение работы большого объема. Так, например, при беге на длительную
дистанцию нетренированного человека у него могут быть зарегистрированы
близкие к максимуму показатели работы физиологических систем —
кровообращения и дыхания. Однако при отсутствии адаптации к данной
физической нагрузке физическая работоспособность нетренированного
человека лимитируется недостаточно быстрым ходом окислительного фосфо-
рилирования в митохондриях скелетных мышц, не обеспечивающим обра-
е
888 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
зования количества молекул АТФ, необходимого для выполнения
скелетными мышцами работы, связанной с длительным бегом.
Долговременная адаптация организма человека к действию раздражителя
большой силы развивается постепенно, в результате длительного,
постоянного или многократно повторяющегося действия на организм факторов
среды большой интенсивности. В ходе ее развития активируются морфо-
генетические, биосинтетические процессы в тканях органов, наиболее
интенсивно функционирующих при адаптации организма к действию
определенного сильного раздражителя. Например, интенсивные физические
тренировки вызывают рабочую гипертрофию сердца, в его ткани
увеличивается масса миоглобина, количество митохондрий, усиливающих процессы
окисления и образования энергии («сердце атлета»), увеличивается
кислородная емкость крови (за счет формирования большей массы новых
эритроцитов и гемоглобина костным мозгом). Увеличение рабочей мощности
систем транспорта кислорода облегчает организму выполнение работы
большого объема на основе возросших функциональных возможностей его
систем. По существу долговременная адаптация к факторам среды
большой интенсивности развивается на основе многократной реализации срочной
адаптации к этим факторам. В результате организм приобретает новое
качество — из неадаптированного превращается в адаптированный, что
делает его способным, например, к выполнению физической работы в объеме
и продолжительности, невозможной для осуществления не тренированным
организмом человека.
23.1.7. Норма адаптивной реакции и дизадаптации
Норма адаптивной реакции — это пределы изменения ответов систем
организма человека, возникающих под влиянием действующих на организм
факторов внешней среды, при которых не нарушаются
структурно-функциональные связи систем организма и их взаимодействие со средой.
Превышение нормы адаптации организма вызывают явления дизадаптации,
которая может вызывать патологические изменения в организме.
Например, у спортсменов, адаптированных к большим физическим нагрузкам
(марафонцы), нередко могут регистрироваться признаки очагового
кардиосклероза (т. е. развития участков соединительной ткани в миокарде),
которые могут вызвать нарушение работы сердца у спортсмена во время
бега.
23.1.8. Генотипическая и фенотипическая адаптация.
Покрывающие адаптации
Под генотипической адаптацией имеется в виду совокупность врожденных
морфофизиологических особенностей организма и адаптивного поведения
особи, направленных на поддержание гомеостаза и позволяющих
организму существовать в экстремальных условиях среды. Фенотипическая
адаптация предусматривает формирование приобретенных адаптивных
реакций под влиянием среды (к ним относится, например, адаптация
организма нетренированного человека к большим физическим нагрузкам).
Генотипическую и фенотипическую адаптацию подразделяют на
эволюционную (филогенетическую) и онтогенетическую, или индивидуальную.
Эволюционная адаптация человеческой популяции прослеживается при
наблюдении генотипических и фенотипических различий у рас и народов.
Например, различия между расами касаются пигментации кожи. Приспособ-
23. Адаптация человека к условиям внешней среды • 889
лению древних людей к условиям севера, где мало ультрафиолетовых
лучей, способствовала светлая кожа, которая лучше их пропускает.
Онтогенетическая адаптация, протекающая с момента рождения
организма и до конца жизни, позволяет организму индивидуально
приспосабливаться к меняющимся факторам среды. Например, у жителя средних
широт основной обмен повышается с понижением температуры воздуха
зимой, и снижается при повышении температуры внешней среды летом.
В жизни человека часто имеют место случаи так называемых
покрывающих форм адаптации, когда организм, адаптированный к одному
экстремальному фактору, подвергается воздействию другого экстремального
фактора, к которому человек не был адаптирован. В этом случае уровень
предшествующей адаптации организма к первому из экстремальных факторов
существенно влияет на устойчивость организма к воздействию второго из
них. Например, у людей, адаптированных к физической работе большого
объема, повышена устойчивость к высотной гипоксии, благодаря
увеличению рабочей мощности систем транспорта кислорода, развившихся в ходе
адаптации организма к физическим нагрузкам.
23.1.9. Обратимость процессов адаптации
Прекращение действия экстремальных факторов вызывает в организме
человека развитие деадаптации, т. е. процесс исчезновения развившихся в
тканях различных систем организма адаптивных морфологических и
биосинтетических изменений, самой адаптации с возвратом функций к
условной норме. Например, при спуске альпинистов с гор на равнину возросшая
у них под влиянием высотной гипоксии кислородная емкость крови (за
счет повышенной продукции эритроцитов и массы гемоглобина,
стимулированной интенсивным образованием эритропоэтина почками под
влиянием гипоксии) возвращается к величинам, регистрируемым у них до подъема
в горы (следствие снижения продукции эритропоэтина до нормальных
величин почками благодаря устранению действия гипоксии на организм).
23.2. Адаптация человека к климатическим факторам
При адаптации к определенным климатическим факторам организм
человека в естественных условиях обитания постоянно подвержен влиянию
сложного комплекса факторов. В результате в организме человека при
адаптации к естественным биоклиматическим факторам (пребывание в горах,
высоких широтах, например Заполярье, в жарком климате) формируются
особенности функционирования различных физиологических систем,
направленных на поддержание гомеостазиса. Рассмотрим особенности
адаптации организма человека к климатическим факторам на примере его
адаптации к жаркому климату.
23.2.1. Биоклиматические факторы жаркого климата
Почти половина населения Земли часть года находится в жарких
естественных условиях. Жаркий и влажный пояс, простирающийся до 10° южной
и северной широт, — это равномерно влажная среда с максимальными
температурами, колеблющимися в течение всего года от +24 до +28 °С.
Ночью относительная влажность в этих районах приближается к 100 %.
Большие пустыни находятся в основном между 10 и 30° северной и южной
широт. Лето здесь сухое, исключительно жаркое, температура достигает
890 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
+57—+58 "С, а зимой снижается до +10—+15 °С, солнечная радиация
составляет 180—220 ккал/см2/год. В пустынях субтропических поясов летом
температура воздуха достигает +22—+35 "С, зимой — от +5 до -5 °С,
солнечная радиация составляет 150—180 ккал/см2/год.
В пустынях сочетается действие на организм высокой температуры,
ультрафиолетового и теплового излучения, крайняя сухость воздуха, к
которым добавляется ветер с пылью. Этот комплекс факторов оказывает
тяжелое, нередко губительное действие на неакклиматизированных людей.
Поступление тепла в организм человека в пустыне под воздействием
горячего воздуха и излучения тепла нагретыми камнями, песком и др. может
превысить теплообразование в организме в 3,5 раза. В дневные же часы
при дополнительном воздействии солнечных лучей поступление тепла в
тело человека в пустыне может в 10 раз превысить его образование в
организме человека, находящегося в состоянии физического покоя. Поэтому
народы, населяющие зоны пустынь, используют одежду из плотной ткани,
предохраняющую тело от радиационного и конвенкционного нагревания.
При этом термическая нагрузка для одетого человека в пустыне на солнце
в 2,4 раза больше, чем во влажных тропиках
Несмотря на жесткие климатические условия тропиков, у их жителей
выработались адаптивные реакции, позволившие им успешно
приспособиться к жизни в этой среде. Однако следствие воздействий тропической
среды обитания на жителей не сводится лишь к приобретению их
организмом повышенной устойчивости к перегреванию. Для влажных тропиков,
где проходило формирование вида Homo, характерно мощное воздействие
на организм человека различных антигенов (широкое распространение
гельминтных инвазий, протозойных и вирусных инфекций, постоянные
укусы кровососущих насекомых), распространенность алиментарного
белкового дефицита и дефицита железа в пище, особенность геохимической
среды тропиков (низкое содержание солей и ряда микроэлементов в
грунтовых водах). Сочетание этих воздействий тропической среды на живущие
здесь популяции за многие тысячелетия сформировали и закрепили
генетические механизмы, определившие устойчивость организма к
гипертермии, тропической биологической агрессии, особенностям пищевого
рациона. В свою очередь, они повлекли значительные функциональные
изменения систем терморегуляции, кровообращения, крови, обмена веществ,
иммунитета и их регуляции.
В умеренной зоне, между 30 и 50° широты, температура летом также
иногда повышается до больших величин, например на Южном Урале, на юге
Сибири —до 40 "С. Тепловую нагрузку на организм в умеренной зоне
может создавать и климат специальных помещений — микроклимат.
Значительным тепловым нагрузкам подвергаются рабочие в металлургической
промышленности, на стекольных заводах, где высоки уровень радиации и
температура воздуха. Например, летом на металлургических заводах
Южного Урала температура воздуха на рабочем месте горнового (доменный
цех) достигает 38 °С при относительной влажности воздуха от 53 до 91 %, а
излучение расплавленного чугуна достигает 2—3 кал/см2/мин. В
мартеновских цехах температура на рабочих местах колеблется от 22 до 43 °С, но
может достигать 53 °С, при наличии инфракрасного излучения до 11—
15 кал/см2/мин. Для ткацких и бумажных фабрик, прачечных, глубоких
шахт характерно сочетание тепла и высокой влажности, двигатели многих
средств передвижения также создают повышенную тепловую нагрузку.
Имеются выраженные различия реакции организма на жару у
адаптированного и неадаптированного к ней жителя средних широт.
23. Адаптация человека к условиям внешней среды • 891
23.2.2. Адаптивные реакции организма человека к жаркой среде
обитания
У находящегося в покое человека высокая тепловая нагрузка за 30 мин
вызывает подъем температуры кожи до 40 "С, а ректальной температуры — до
39 °С. Под действием атмосферного тепла раздражаются температурные
рецепторы кожи, которые вместе с повышающейся температурой
циркулирующей крови активируют центральные термочувствительные структуры (в
гипоталамусе). Активация последних вызывает изменение посылки
симпатической адренергической импульсации к сосудистым регионам оболочки
тела и внутренних органов. При этом симпатическая адренергическая
активность снижается в вазоконстрикторных волокнах кожи, что вызывает
раскрытие артериовенозных анастомозов, снижение тонуса вен, а также
подавляет нейрогенный тонус артериальных сосудов кожи (т. е.
развивается пассивная вазодилатация). При дальнейшем повышении температуры
тела включаются механизмы активной нейрогенной дилатации сосудов
кожи, обусловленные активацией специализированных вазодилататорных
или судомоторных нервов. Активная дилатация сосудов на 90 %
увеличивает кровоток во время тепловой стресса и обеспечивает более
эффективную теплоотдачу в коже, чем пассивная вазодилатация. В результате смены
пассивной вазодилатации на активную возросший кровоток в
артериальных и венозных сосудах кожи, слизистых оболочках верхних дыхательных
путей увеличивает теплоотдачу во внешнюю среду путем теплопроведения,
излучения и снабжения потовых желез кровью. Кожный кровоток при
этом увеличивается до 8 л/мин по сравнению с 0,5 л/мин при
термонейтральном диапазоне (рис. 23.4). Вазодилатация в пальцах и кистях рук
начинается уже при температуре воздуха, равной +22 °С, в стопе — при
+30 °С. При этом кровоток в верхних конечностях повышается в большей
мере, чем в нижних. Так, в сауне у человека кровоток через кисть может
возрастать в 30 раз, а через дистальные фаланги пальцев рук — в 70—
100 раз по сравнению с термонейтральным диапазоном среды.
При тепловом стрессе увеличивается посылка симпатической
адренергической активности от термочувствительных структур гипоталамуса к
сердцу и сосудам внутренних органов, оказывая положительный хроно- и
инотропный эффект, опосредуемый через рУаДРеноРеЦептоРь1 на
сердечную мышцу, и вызывая сокращение а-адренореактивных артериальных и
венозных сосудов чревной области (кишечника, желудка, печени и др.), а
также артериальных сосудов почек. Усиление резистивной функции
сосудов в этих регионах при гипертермии снижает в них кровоток и
компенсирует сдвиг последнего в места теплоотдачи.
Рост кровотока в коже обеспечивается, в основном, увеличением
сердечного выброса и, в меньшей степени, его перераспределением между
«ядром» и «оболочкой» тела. Так, при тепловой нагрузке на организм
человека, находящегося в состоянии физического покоя, снижение
кровотока в сосудах чревной области, почках и скелетных мышцах «освобождает»
до 1 л крови в 1 мин, остальная же часть увеличивающегося кожного
кровотока — до 6—7 л/мин обеспечивается приростом сердечного выброса.
Его увеличение у людей при тепловом воздействии идет параллельно
повышению температуры тела и подчиняется требованиям терморегуляции и
интенсивности реакций, контролирующих транспорт тепла. В основе роста
величины сердечного выброса лежит, главным образом, увеличение числа
сердечных сокращений, являющееся следствием положительных хроно- и
инотропных эффектов симпатических нервов на сердце, аккумуляции в
892 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
мл/мин
О:580С
2
NNNN1400 vVOC
1100
250
\X\X1200 NNSS
500
ж»ж
^™щ
!
§
о
800
6000
кЧЧУ Ш 444^1
___ 300 _^^_,
ГТ^4Ь0^^1
Рис. 23.4. Распределение минутного объема крови в тканях.
I — в условиях покоя в термонейтральном диапазоне, II — в условиях покоя, но в жаркой
среде, III — в жаркой среде, во время физической работы; кровоток: 1 — спланхнический, 2 —
почечный, 3 — церебральный, 4 — коронарный, 5 — в скелетных мышцах, 6 — кожный, 7 — в
других тканях.
миокарде адреналина во время гипертермии. У человека, находящегося в
покое, в условиях высокой внешней температуры прирост числа сердечных
сокращений может достигать 50—80 %. Солнечная радиация, повышающая
температуру кожи, резко усиливает влияние высокой температуры воздуха
на прирост числа сердечных сокращений. Увеличение числа сердечных
сокращений в механизме повышения сердечного выброса является ведущим,
так как ударный объем сердца вначале не меняется или возрастает лишь в
первые минуты действия тепла. При дальнейшем перегревании человека
ударный объем сердца уменьшается, что связано со снижением
сократимости миокарда под влиянием прямого действия повышенной температуры
крови на сердечную мышцу. Вызвано это тем, что увеличивающаяся в
начале перегревания интенсификация аэробных процессов (окислительного
фосфорилирования и гликолиза) в миокарде в последующем отстает от
нарастающей потребности сердечной мышцы в кислороде и в ней возникают
явления гипоксии. Снижение ударного объема связано не только с
метаболическими нарушениями в миокарде, но и с уменьшением венозного
возврата крови к сердцу, что снижает величину давления наполнения сердца.
Высокая температура воздуха, действующая на неадаптированного к
жаре человека, вызывает фазные изменения артериального давления. В пер-
23. Адаптация человека к условиям внешней среды • 893
вую из них, уже при небольшом увеличении температуры тела, снижаются
систолическое и диастолическое давление. Основной причиной снижения
диастолического давления является уменьшение общего периферического
сопротивления сосудов. Снижение последнего начинается при температуре
воздуха, равной +28 °С. Наиболее значимо общее периферическое
сопротивление сосудов снижается при повышении температуры тела до +38 °С,
составляя 40—55 % от исходной величины. Дальнейшее повышение
температуры тела (вторая фаза), напротив, может характеризоваться
повышением общего периферического сопротивления сосудов и диастолического
давления при выраженном снижении систолического давления.
Повышение общего периферического сопротивления сосудов и диастолического
давления является следствием компенсаторных сосудистых реакций,
направленных на поддержание уровня системного артериального давления и
необходимого возврата крови к сердцу. Снижение систолического
давления является следствием понижения ударного объема сердца.
В условиях высокой внешней температуры наиболее ранней реакцией,
вызывающей перераспределение регионарных объемов крови, является
расширение кожных вен, влекущее функциональное депонирование
значительного количества крови, которое практически выключается из общей
циркуляции. Это связано с тем, что в венозных сплетениях кожи кровь
движется в 5—20 раз медленнее, чем в магистральных венах. Увеличение
объема венозного русла кожи компенсируется снижением у людей
центрального и легочного объемов крови (на 11—22 %). Однако в результате
депонирования крови в кожных венах снижается эффективный объем
циркулирующей крови — возникает относительная гиповолемия. Ее
компенсация достигается за счет перемещения части внеклеточной жидкости в
сосудистое русло. Так, уже в первые 30 мин теплового воздействия на
организм человека у него увеличивается объем плазмы крови. Вода поступает в
кровь из межклеточного пространства внутренних органов — печени,
легких и др. Повышенный объем плазмы при гипертермии может сохраняться
долго, если человек не ограничивает потребление воды. Важную роль в
этом процессе играет увеличение коллоидно-осмотического давления
плазмы крови, задерживающего воду в сосудистом русле, а также уменьшение
выведения воды с мочой.
Симпатическое возбуждение, возникающее при действии высокой
температуры на организм, вызывает сужение почечных сосудов и, как
следствие, уменьшение почечного кровотока и скорости клубочковой
фильтрации. В результате выделительная функция почек снижается. Так, диурез
уменьшается в жару до 300—600 мл в сутки (при норме около 1,5 л).
Однако на снижение выделительной функции почек влияет и повышенная
секреция гормонов — вазопрессина и альдостерона. Увеличение секреции
первого связано: 1) с рефлекторным ответом нейрогипофиза на снижение
центрального венозного давления; 2) с раздражением осморецепторов,
вызванным увеличением осмотической концентрации крови и потерями воды
с потом. Возросшая секреция вазопрессина усиливает реабсорбцию воды в
почках, что повышает объем циркулирующей крови. Симпатическое
возбуждение при гипертермии снижает кровоток в почках, активирует ренин-
ангиотензин-альдостероновую систему. Так, у человека 20 мин
пребывания в сауне увеличивает в плазме крови содержание ренина на 95 %, ан-
гиотензина — на 195 % и альдостерона — в 5 раз. Активация ренин-ангио-
тензин-альдостероновой системы, в свою очередь, усиливает почечную и
чревную вазоконстрикцию, дополняя эффект симпатической активации,
адресованной этим сосудистым зонам. Секрецию альдостерона стимулиру-
894 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
ет и уменьшение хлористого натрия в крови, вызванное потерями
последнего с потом.
Увеличение кровотока в коже обеспечивает потовые железы кровью в
количестве, необходимом для повышенного образования ими секрета. У не
адаптированного к жаре человека, находящегося в состоянии физического
покоя, воздействие внешнего тепла, повышая температуру «ядра» тела до
38 "С, повышает секрецию пота до 10—12 мл/мин (при комнатной
температуре она составляет 600 мл/сут). У адаптированного к жаре человека,
также находящегося в состоянии физического покоя, потоотделение
достигает 20 мл/мин. Это связано с более быстрым усилением кровотока в
коже и с повысившейся способностью к потоотделению потовых желез у
адаптированных к жаре людей. Неакклиматизированные к жаре люди в
первые дни действия тепла на организм теряют 15—30 г солей в день с
потом и мочой, но после 4—6 нед их акклиматизации потери солей
уменьшаются до 3—5 г в день. Лучшее сохранение хлористого натрия в организме
связано с повышенной секрецией альдостерона.
При высокой температуре окружающей среды дыхание учащается,
легочная вентиляция увеличивается, в основном за счет глубины дыхания.
Значительная гипервентиляция легких, способствуя вымыванию угольной
кислоты из крови, понижает в ней напряжение С02, что, в свою очередь,
смещает рН крови в щелочную сторону. Поэтому гипокапния и
дыхательный алкалоз являются постоянными признаками перегревания организма
человека. Способность крови связывать С02 снижается и под влиянием
роста ее температуры.
Уменьшение кровоснабжения желудочно-кишечного тракта, вызванное
перераспределением крови к кожным сосудам при повышении
температуры тела, ведет к снижению секреторной, всасывательной и моторной
функций органов пищеварения, понижению аппетита. Так, при
повышении температуры тела уменьшается секреция слюны, в ней повышается
содержание плотного остатка, что связано с потерей воды организмом при
испарительном термолизисе. При потере воды, равной 8 % от массы тела,
слюноотделение прекращается полностью. Гипертермия снижает объем
секреции желудочного сока и содержание в нем соляной кислоты и
пепсина. Это, в свою очередь, уменьшает переваривающую силу
желудочно-кишечного сока. Повышение температуры тела у человека до 37,5 "С угнетает
моторику желудка. В результате замедляется эвакуация из него пищи. Под
влиянием высокой внешней температуры на организм у неадаптированных
людей уменьшается также объем секретируемого панкреатического сока, в
нем снижается содержание протеолитических ферментов. Эвакуация
желчи из желчного пузыря уменьшается вследствие снижения тонуса его
стенок. Это приводит к застою желчи. По-видимому, вследствие указанных
сдвигов у людей при тепловых воздействиях ухудшается аппетит, исчезает
желание принимать пищу животного происхождения. Существующий у
жителей жарких стран обычай выпивать перед едой некоторое количество
жидкости (чая и др.), сопутствующий приему пищи отдых, уменьшение
тепловой нагрузки, по-видимому, не только уменьшают дегидратацию
организма, но и способствуют перемещению части крови к
желудочно-кишечному тракту.
Тепловой стресс, активируя симпатоадреналовую и гипофизарно-адре-
нокортикальную системы, вызывает усиление секреции катехоламинов
мозговым веществом надпочечников и глюкокортикоидов их корой. Под
влиянием этих гормонов в печени усиливается образование глюкозы в ходе
гликолиза, стимулируется глюконеогенез.
23. Адаптация человека к условиям внешней среды • 895
У акклиматизированных к жаре людей реакция нейроэндокринной
системы на тепловые воздействия снижается. В результате уменьшается и
концентрация в плазме катехоламинов, глюкокортикоидов, тироксина.
Поэтому у адаптированных к жаре людей замедляется глюконеогенез, снижается
скорость гликолиза, восстанавливаются запасы гликогена в печени и
скелетных мышцах. В целом перегревание организма приводит к понижению
энергетического обмена.
Снижение кровотока во внутренних органах в условиях нарастающей
гипертермии приводит к уменьшению отношения доставки кислорода к
его потреблению в тонком кишечнике, печени, почках, скелетных
мышцах. В результате, в этих органах возникает тканевая гипоксия, что
активирует образование энергии в ходе анаэробного гликолиза и приводит к
увеличению концентрации недоокисленных продуктов обмена (молочной
кислоты и др.) в этих тканях и крови.
Система крови отвечает на перегревание организма значительными
изменениями. Тучные клетки и базофильные лейкоциты реагируют на
повышение температуры крови быстрой дегрануляцией, секретируя в кровь
гепарин, гистамин и другие биологически активные вещества. При
повышении температуры «ядра» тела уровень гистамина в крови увеличивается в
несколько раз. У адаптированных к жаре людей активируются и
механизмы, препятствующие росту гистамина в крови, нарастает содержание гис-
топексина и активность гистаминазы, понижающих концентрацию в ней
гистамина. Это снижает проницаемость кровеносных сосудов,
повышаемую гистамином, снижает его вазодилататорный эффект на артериолы
брюшной полости и других регионов.
Под действием тепла в клетках тканей внутренних органов, скелетных
мышцах повышается проницаемость мембран лизосом, что вызывает
выход лизосомальных протеиназ в кровь. Однако с адаптацией организма к
жаре в плазме крови повышается уровень aj-антитрипсина — мощного
ингибитора протеолитических ферментов, что предохраняет белки и
клеточные элементы крови от избыточного протеолиза.
У людей — выходцев из умеренной зоны Земли, но живущих в жарких
влажных тропиках, — гематологические сдвиги (лейкопения,
относительная и абсолютная нейтропения, лимфоцитоз) в целом сходны с
изменениями крови у аборигенов тропиков. У европейцев, адаптированных к
тропикам, и у рабочих, многие годы подвергавшихся тепловым воздействиям,
возникают изменения в эритроне: нарастает гемоглобинизация и
гидратация отдельного эритроцита, увеличивается содержание гемоглобина в
крови, эритроцитарный уровень удерживается на значениях,
приближающихся к нижней границе европейской нормы. Уровень эритропоэтина в крови
снижается, и это объясняет, почему у адаптированных к жаркому климату
людей происходит замедление регенерации красной крови, например
после кровопотери.
23.2.3. Особенности адаптации человека к работе в жаркой среде
Потребление кислорода и температура «ядра» тела закономерно нарастают
во время работы возрастающей мощности. Так, работа мощностью до 50 %
от величины максимального потребления кислорода (МПК),
производимая в комфортной температурной среде, увеличивает температуру ядра до
37,4 °С, а работа с 75 % потреблением кислорода от величины МПК
повышает ее до 38,5 "С. Температура кожи при этом остается относительно
неизменной, что обеспечивает эффективную отдачу тепла. Однако при нали-
896 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
чии внешней тепловой нагрузки тепло, образующееся в работающих
мышцах, может еще более увеличивать температуру тела, если нарушится
эффективность охлаждающего испарительного механизма и обеспечивающих
его сосудистых компенсаторных реакций. Работа человека на жаре требует
от системы кровообращения выполнения двух задач: 1) обеспечить мышцы
кислородом, чтобы поддержать в них возросший расход энергии; 2)
обеспечить перенос кровью метаболического тепла от глубоких тканей к
оболочке тела. При этом кровоток в мышцах повышается до 13 л/мин,
кожный — до 2,2 л/мин, а сердечный выброс — до 18 л/мин (см. рис. 23.3), что
обеспечивается за счет уменьшения кровотока в висцеральных органах.
Например, в желудочно-кишечном тракте и почках кровоток снижается в
этом случае соответственно до 300 и 450 мл/мин. Вазоконстрикция в
висцеральных органах повышает общее периферическое сопротивление
сосудов, что поддерживает на оптимальном уровне артериальное давление
крови во время работы на жаре, обеспечивает достаточную перфузию сосудов
головного мозга, препятствует развитию церебральной ишемии и
артериальной гипотензии. Коронарный кровоток при работе на жаре может
возрастать в четыре раза по сравнению с покоем.
Физическая нагрузка, даже хорошо переносимая в жару, выполняется с
нарастанием доли анаэробного метаболизма во внутренних органах, что
приводит к быстрому уменьшению запасов гликогена в этих тканях,
нарастанию в них молочной кислоты. Этому способствует сниженная
экстракция кислорода из крови в мышцах, так как, несмотря на возрастающий в
них кровоток, большое количество крови из мышц шунтируется, не отдав
кислород, к сосудам оболочки тела для рассеивания тепла. Росту уровня
молочной кислоты в крови способствует и сниженное поступление крови в
печень из-за значительного уменьшения печеночного кровотока.
Накапливающиеся в крови кислые метаболиты истощают буферные основания,
создавая условия для развития метаболического ацидоза.
Потери воды при работе в жару, например при очень жаркой погоде в
пустыне, могут достигать 8—12 л/сут с потом, при этом интенсивное
потоотделение в течение нескольких часов может привести к «усталости»
потовых желез, вызванной истощением их секреторной функции. Это резко
нарушает способность регулировать температуру «ядра» тела. Потери
жидкости при потоотделении не столь эффективно охлаждают кожу во время
работы в жару при высокой влажности, когда испарительное охлаждение
кожи снижено высоким давлением водяных паров в окружающем воздухе.
Поэтому интенсивное потоотделение в этих условиях хотя и приводит к
большим потерям жидкости, но сопровождается минимальным
испарением и охлаждением поверхности тела, повышая риск перегревания
организма.
Значительная потеря жидкости с потом уменьшает объем плазмы и
циркулирующей крови, что снижает величины конечного диастолического
объема желудочков и систолического объема сердца, уменьшает кровоток в
коже и, следовательно, потоотделение. Минутный объем не уменьшается
вследствие компенсаторно нарастающего числа сердечных сокращений.
В результате снижения эффективности механизмов, обеспечивающих
выведение тепла из организма, увеличивается температура «ядра» тела.
Следовательно, дегидратация организма уменьшает возможность систем
кровообращения и терморегуляции компенсировать тепловой стресс при
физической нагрузке. Поэтому поддержание на оптимальном уровне объемов
плазмы и внеклеточной жидкости у человека в условиях работы на жаре
сохраняет функции кровообращения и продукцию пота. А это, в свою оче-
23. Адаптация человека к условиям внешней среды • 897
редь, достигается сбалансированием потери и восполнения воды. У
человека, получающего достаточное количество жидкости, работоспособность в
жару сохраняется на более высоком уровне, чем у работающего в
состоянии дегидратации. Употребление дополнительно 400—600 мл воды за 10—
20 мин до мышечной работы на жаре, задерживает развитие дегидратации,
увеличивает потоотделение во время работы и препятствует значительному
повышению температуры «ядра» тела.
Для рабочего, выполняющего работу средней тяжести на открытом
воздухе в условиях Средней Азии, «норма» выпиваемой воды за смену
составляет 4—4,5 л. Большинство людей устойчивы к потерям 3—4 % воды (от
массы тела). При потере же ее 5—8 % возникает чувство усталости в
положении «сидя», сонливость, апатия. Потеря свыше 10 % воды вызывает у
человека физические и психические нарушения. При тяжелой
дегидратации необходимы срочные врачебные меры: вводят внутривенно 5 %
раствор глюкозы, изотонический раствор хлорида натрия (до 1 л/ч в начале
лечения), но не более 4 л в сутки.
Потери пота при работе на жаре могут истощать солевой запас
организма на 13—15 г/сут (2,3—3,4 г/л пота), у неакклиматизированных людей
потери солей могут быть больше. Это значительно превышает их величину в
ежедневном рационе, поэтому необходима добавка в пищу соли ('/3
чайной ложки поваренной соли на литр воды). Потери калия, кальция и
магния при выделении пота невелики и могут быть восполнены богатой ими
диетой. Например, стакан томатного сока возмещает почти весь калий,
кальций и магний, содержащиеся в 2—3 л пота. При значительных потерях
натрия внутривенно вводят изотонический раствор хлорида натрия. При
интенсивных потерях жидкости, связанных с жарой, возникает
гиповитаминоз водорастворимых витаминов С и В,.
Повышение устойчивости организма к действию тепла называется
тепловой акклиматизацией. Обычно акклиматизация организма заканчивается
к концу второй недели теплового воздействия. Для этого требуется от 2 до
4 ч ежедневных тепловых экспозиций. Однако первые тепловые
воздействия должны быть тренирующими, продолжительностью около 15—20 мин.
Их продолжительность и интенсивность должны возрастать постепенно.
Акклиматизация достигается легче, если человек во время работы на жаре
имеет возможность полностью покрывать потребность в воде.
Адаптированные к жаре люди легче переносят ее воздействие, сохраняют большую
работоспособность, другие виды социальной активности.
23.2.4. Предупреждение тепловых поражений организма
Наиболее эффективный путь профилактики поражений организма
перегреванием — это оценка окружающей среды с позиций опасности ее
теплового влияния на организм. Она может быть получена, например, при
расчете величины индекса теплового стресса (ИТС). Этот показатель
учитывает температуру окружающей среды, относительную влажность и уровень
радиации тепла:
ИТС (в °С) = 0,1 • ТСТ+0,7 • ТВТ+0,2 • ТШТ,
где ТСТ — температура «сухого» термометра, т. е. температура воздуха,
регистрируемая обычным ртутным термометром; ТВТ — температура
«влажного» термометра, т. е. температура воздуха, замеренная термометром,
резервуар с ртутью которого покрыт влажной марлей (уровень
относительной влажности влияет на его испарительное охлаждение); ТШТ —темпе-
29 - 6095
898 • ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
ратура шарового термометра, резервуар с ртутью которого заключен в
полый металлический шар с черной матовой поверхностью (адсорбирует
излучаемое тепло из окружающей среды).
На основании величины расчета индекса теплового стресса разработаны
рекомендации для степени физической активности на открытом воздухе.
Так, величина этого индекса, равная 26,5—28,8 "С, должна насторожить
неакклиматизированных людей в отношении перегревания. При значениях
индекса теплового стресса 29,5—30,5 "С адаптированным к жаре лицам
следует избегать большой физической активности на солнце. При индексе
теплового стресса 31,2 °С необходимо резко ограничить физические
нагрузки. Признаком границы предельно допустимой тепловой нагрузки на
организм в условиях физического покоя является увеличение частоты
сердечных сокращений до 140 уд/мин, повышение ректальной температуры
до 38,4—38,6"С. При физической работе на жаре эти показатели
составляют соответственно 170—180 уд/мин и 38,5—38,8 С.
При длительном действии тепла может возникать нарушение
терморегуляции, проявляющееся в различных формах тепловых поражений
организма: тепловые судороги, тепловое истощение организма, тепловой обморок
и тепловой удар.
Тепловые судороги — внезапно наступающее непроизвольное сокращение
мышц (обычно икроножных) во время или после интенсивной физической
работы на жаре. Они связаны с несбалансированностью электролитов в
организме, как результат потери солей (хлорида натрия) с потом. Если эти
потери не восстановлены, то возникает мышечная боль с судорогами. При
тепловых судорогах температура тела может не повышаться. Для их
профилактики достаточно употребления обильного количества воды с
увеличением ежедневных приемов соли за несколько дней, предшествующих
периоду теплового стресса, и во время работы в условиях длительного
перегревания.
Тепловое истощение обычно характеризуется общей слабостью, быстрым
пульсом, низким артериальным давлением в вертикальном положении те-т
ла, головокружением, головной болью. Тепловое истощение организма
развивается у неакклиматизированных людей в первые дни летней жары
или во время работы в жаркий день при недостаточно компенсируемых
потерях воды и солей с потом. Тепловое истощение вызвано
неэффективной регуляцией кровообращения, сочетающейся с уменьшением
внеклеточной жидкости вследствие чрезмерного потоотделения. Кровь при этом
скапливается в дилатированных периферических сосудах, что резко
уменьшает венозный возврат, необходимый для поддержания производительной
работы сердца. Температура тела обычно не повышается до опасных
пределов. Человек с этими симптомами должен переместиться в прохладную
или холодную среду; явления дегидратации устраняются потреблением
жидкости.
Тепловой обморок (или тепловой коллапс) — внезапная кратковременная
потеря сознания, сопровождающаяся резкой бледностью, ослаблением
дыхания и кровообращения. Обморок часто возникает после перехода тела в
вертикальное положение, влекущего ортостатическую гипотензию. Орто-
статическая гипотензия связана с генерализованной вазодилатацией
периферических сосудов, особенно скелетных мышц и кожи нижних
конечностей. Скапливающаяся в них кровь резко уменьшает венозный возврат к
сердцу, в результате снижается сердечный выброс и уменьшается
кровоснабжение головного мозга, возникает его ишемия и кратковременная
потеря сознания. Потере сознания обычно предшествует головокружение.
23. Адаптация человека к условиям внешней среды • 899
Тепловой обморок может наблюдаться у человека во время активной
мышечной работы в очень жаркой среде, когда температура «ядра» тела
достигает 39 "С. Помощь при обмороке: нужно уложить пострадавшего в тень,
в хорошо проветриваемом месте, приведя его в сознание, дать ему
прохладное питье в умеренном количестве. Обморок, как правило,
наблюдается у людей, не акклиматизированных к жаре.
Тепловой удар — болезненное состояние, вызванное общим
перегреванием организма вследствие действия на него тепловых факторов внешней
среды. Тепловой удар возникает вследствие недостаточности деятельности
гипоталамических центров терморегуляции, неадекватности их
регулирующих влияний нарастающей тепловой нагрузке на организм. Это нарушение
терморегуляции связано, прежде всего, с недостаточностью механизмов
образования пота и выведения с ним тепла из организма. Вместе с тем
усиленное потоотделение при перефевании тела вызывает значительную
потерю воды и солей, что, в свою очередь, ведет к уменьшению объема
циркулирующей плазмы крови, увеличению ее вязкости. В результате
нарушается кровообращение, возникает кислородное голодание тканей,
затрудняется перенос тепла от «ядра» к «оболочке» тела. Высокая
температура «ядра» на фоне гипоксии тканей приводит к разрушению клеток,
денатурацию белков, вызывая необратимые изменения в тканях.
В зависимости от тяжести проявлений перефевания организма человека
различают легкую, среднюю и тяжелую формы теплового удара. При
легкой форме теплового удара пострадавший жалуется на головную боль,
тошноту, зрачки расширены, дыхание и пульс учащены, кожа влажная,
температура тела повышена (до 38 "С, иногда и более). Если пострадавшего
перенести в тень, все симптомы теплового удара проходят.
При средней тяжести теплового удара у пострадавшего усиливаются
признаки нервных и ментальных нарушений: головная боль становится
очень сильной, она сопровождается рвотой, нарушается координация
движений, возникают кратковременные обмороки. Кожа горячая, влажная,
потоотделение усилено. Температура тела повышается до 39—40 °С.
Тяжелая форма теплового удара развивается, если температура тела
повышается до 41—42 "С. У пострадавшего возникает психомоторное
возбуждение, нарушение сознания (бред, галлюцинации), он впадает в кому.
Пульс нитевидный, 120—140 уд/мин, дыхание поверхностное, частое. Кожа
становится сухой и горячей. Без оказания немедленной медицинской
помощи пострадавший при средней и тяжелой форме теплового удара
погибает. Помощь: пострадавшего необходимо поместить в тень, желательно в
открытое для ветра место, раздеть до пояса, на голову и шею наложить
смоченную холодной водой ткань или пузыри с холодной водой. Если
позволяют условия, тело обкладывают пакетами со льдом или пофужают в
ванну с холодной водой до понижения ректальной температуры ниже
39 °С.
29*
Предметный указатель
Авитаминоз 572
Агглютинация 359
Агранулоциты 331
Адаптация 875, 880
— генотипическая 888
— долговременная 888
— онтогенетическая 889
— световая 725
— срочная 887
— эволюционная 888
Адгезия 155
Аденилаты 580
Аденогипофиз 270
Аденозин 75
Аденозинмонофосфат
циклический 80
Адреномедуллин 291
Адренорецепторы а, р 83,
253
Аквапорины 280, 619, 625
Акинезия 224
Акклиматизация 879
— тепловая 897
Аккомодация 62, 719
Акромегалия 277
Акт дефекации 560
— полевой женский 688
мужской, стадии 678
Активатор плазминогена
тканевый 346
Активность пейсмекерная
клеток гладкомышеч-
ных 117
синоатриального
узла 117
Алкалоз 661
— дыхательный 665
— значение
функциональное 662
— недыхательный 666
Альбумины 33
Альвеолы 469
Альдостерон 283
Амилин 299
Амилоид А 34
Аминокислоты 75
Аминокислоты
незаменимые 565, 567
Амины 75
Амины биогенные 176
Аммониогенез 657
Анаболиз 563
Ангиотензин I, II 75, 310
Андрогены 290, 684
Анемия 330
Анпериэлектротон 56
Антагонизм
акцентированный 256
Антиген(ы) лейкоцитов
360
— распознавания 378
— тромбоцитов 360
— эритроцитов 358
Антипорт 51, 620
Антитромбин III 345
Анэлектротон 55
Апнейзис 501
Аппарат вестибулярный
743
— памяти 127
— речевой 825
Ароматерапия 754
Астроциты 170
Атриопептид 312
Аутоантигены 383
Афагия 511
Афашия Брока 830
— Вернике 830
— моторная 826
— сенсорная 827
Ахромотопсия полушар-
ная811
Ацетилхолин 75, 82
Ацетилхолин,
высвобождение 254
Ацетилхолинэстераза 72
Ацидоз 661
— дыхательный 663
— значение
функциональное 662
— недыхательный 664
Баланс азотистый 565
— организма водный
внешний 634
внутренний 636
электролитный 636
Барьер(ы) гематоэнцефа-
лический 170
— гистогематические 22
изолирующие 22
неизолирующие 22
частично
изолирующие 22
Белки 564
Белки-коннексоны 68
Белки острофазные крови
34
— кальциевый сенсор 76
— С-реактивный 34
Бикарбонат крови
актуальный 669
стандартный 660
Биомеханика вдоха 470
— выдоха 471
Бледный шар 221
Бодрствование 853
— уровни 854
Болезнь горная 508
— кессоная 510
Боли фантомные 232
Боль 715
Вазопрессин 75, 149, 452
Варикозы 251
Везикулы 75
Вентиляция легких 483
альвеолярная 483
Веретена мышечные 186
Вестибулоцеребеллум 207
Вещества(о) биологически
активные 156
— минеральные 568, 569
— студневидное 181
Вирилизация 290
Висцерфецепторы 717
Витамины 570, 585
— источники 572
— роль в кроветворении
357
Влечение 782
Внимание 801
— зрительное 803
— механизмы
нейрофизиологические 803
— пространственное 806
— фокусное 817
— формы 802
— центры корковые 805
— центр мультимодаль-
ный 808
— экспрессия нейронная
817
Вода 21
Водитель ритма 398
латентный 400
Возбудимость 45
Возбуждение подпорого-
вое 53
Предметный указатель • 901
— порог 53
— проведение аксосомати-
ческое 73
— постсинаптическое 72
пресинаптическое 76
— сигнал выходной 168
проводящийся 167
— сила раздражения
максимальная 53
Волны звуковые 734
Волокна афферентные 181
— интрафузальные 186
— коллагеновые 25
— миелинизированные 67
— мышечные
интрафузальные 187
скелетные 98
экстрафузальные 187
— немиелинизированные
66
— нервные нервов
периферических 136
— эфферентные 181
Восприятие 809
— вкусовое 750
— зрительное 717, 809
функции стриарной
коры 809
— слуховое 812
— соматосенсорное 812
— цветовое
Выделение 606
Габитуация 818, 820
Газ углекислый 655
Газообмен в легких 487
Галактогенез 699
Гаметы 668
Ганглии базальные 221
Гастрин(ы) 181, 304
Гематокрит 28
Гемианопсия 811
Гемоглобин 492
— емкость кислородная
493
— сродство к 02 494
— форма расслабления 493
-А 324
— а, р 324
— F324
— Gower I, II 324
Гемодинамика системная
391
Гемолиз 31
— внесосудистый 326
— внутриклеточный 326
— внутрисосудистый 326
Гемосидерин 328
Гемостаз вторичный 341
— первичный 341
Гепарин 345
Гепатит С хронический
377
Гетеросексуальность 781
Гипервитаминоз 572
Гипергидратация
гиперосмотическая 647
— гипоосмртическая 646
— изоосмотическая 647
Гиперемия ауторегулятор-
ная 437
— рабочая 436
— реактивная 437
— функциональная 437
Гиперкапния 663
Гиперпноэ 505
Гиперполяризация 79
Гипертермия 603
Гипертиреоз 293
Гиперфагия 511
Гиповитаминоз 572
Гипогликемия 583
Гипоксемия артериальная
507
Гипоталамус 149
— область трофотропная
214
эрготропная 214
— регуляция мотиваций
213
поведения 213
пищевого 214
эмоций 213
— ядра вентромедиальные
207
хиазмальные 207
Гипотермия 603
Гипофиз 270
Гипофосфатемия 296
Гиппокамп 83
— функции 221
Гистамин 75
Гистерезис 476, 478
Гликоген 567, 583
Гликолиз анаэробный 858
— аэробный 858
Гликопротеины, функции
338
Глицин 75, 87
Глия эпендимная 171
Глобулины 33
— функции 36
Глотание, фазы 532
Глубина дыхания 474
Глутамат 86, 170
Глюкагон 299, 304
Глюкоза 567, 581
Глюкокортикоиды,
секреция 286
— эффекты 286
Глюконеогенез 580
ГЛЮТ 302
Голодание водное 643
Голубое пятно 206
Гольдмана—Ходжкина—
Катца уравнение 60
Гомеостазис 21
— водно-солевой 639
— поддержание 249
Гомункулус сенсорный 230
Гонадолиберин 75
Гонадотропин(ы) 273
— хорионический 307
человеческий 695
Гормон(ы) 147
— аденогипофиза 271
— белковые 260
Гормоны гастроинтести-
нальные 524, 550, 553
— гипокальциемический
296
— гипофиза 270
— действие кинетическое
152
корригирующее 152
метаболическое 151
морфогенетическое
152
пермиссивное 153
реактогенное 153
— доли промежуточной
282
— железы
околощитовидной 131
щитовидной 131
— желудочно-кишечного
тракта 314, 515, 517
— избыток в крови 288
— коры надпочечников
283
— мозгового вещества
надпочечников 290
— надпочечников 283
— нейрогипофиза 279
— пептидные 260
— плацентарные 695
— половые 331
— почек 307
— предсердный натрийу-
ретический 312
— семенников 305
— сердца 312
— стероидные 260, 266
механизм действия
геномный 266
негеномный 266
— тимуса 307
— тиреоидные йодсодер-
жащие 292
эффекты
метаболические 292
физиологические
293
— тканевые 156
902 • Предметный указатель
— эндотелия сосудистого
313
— яичников 305
Градиент
концентрационный для Na+ и К+ 60
Гранулопоэз
неэффективный 356
Гранулоцитоз 333
Гранулоциты 331
— базофильные, функции
334
— нейтрофильные 331
Громкость звука 735, 736
Давление артериальное
диастолическое 392
пульсовое 392
систолическое 392
среднее 392
— венозное 433
центральное 425
— внутриплевральное 472
— внутрисосудистое 433
— звуковое 735
— осмотическое 47
эффективное 43
— парциальное газов 489,
492
— трансмуральное 435
— фильтрационное 30, 614
Движение(я) контроль,
связь обратная 244
прямая 244
— произвольные 239
— рефлекторные 239
— ритмические 239
Деадаптация 880, 889
Дегидратация
гиперосмотическая 640
— гипоосмотическая 645
— изотоническая 645
Дезоксигемоглобин 325
Действие пищи
специфически-динамическое 578
Деполяризация,
критический уровень 62
— спонтанная диастоличе-
ская 117
Депрессия катодическая 56
Депривация 780, 836
Десенситизация 268
Дефенсины 35, 332
Дефицит организма
кислородный 863
Деятельность нервная
высшая 757
типология 771
человека,
особенности 772
— сенсомоторная 857
— человека
познавательная 756, 800
трудовая 756
Диацилглицерол 81
Дивергенция возбуждения
141
Дизадаптация 879, 888
Диморфизм половой 670,
780
Динеин 52
Диски Меркеля 712
Диспарация 720
Дифференциация половая
669
Диффузия пассивная 488
— явление конкуренции 48
насыщения 48
Долг кислородный 864
Дофамин 75
Дуга рефлекторная 133
возбуждение 137
моносинаптическая
186
полисинаптические
190
связь между
звеньями 137
торможение 137
Дыхание 469, 603
— внешнее 470
— при физической
нагрузке интенсивности
высокой 506
низкой и
средней 506
фазы 505
— регуляция 497
Дюбуа—Реймона закон
раздражения 53
Единица фетоплацентар-
ная 693
Емкость легких
жизненная 475
инспираторная 475
общая 475
остаточная
респираторная 475
— легочная 475
Жажда 642
Жевание 531
Железа(ы) бруннеровы 548
— вилочковая см. Тимус
— желудочные 534
— молочная, влияние про-
лактина 279
— околощитовидные 296
— сальные 607
— слюнные 528
состав смешанного
секрета 529
— щитовидная 291
Железо, потребность
ежедневная 329
— резервное 327
—
функционально-активное 327
Желудок, деятельность
мускулатуры
сократительная 541
регуляция 542
— функции 533
— эвакуация содержимого
543
Желчь, механизм
образования 546
— регуляция образования
и выделения 547
— состав и своства 546
Жидкость внеклеточная,
величины средние 20
отклонения
нормальные 20
— внутриклеточная,
показатели
физико-химические 25
— интерстициальная 25
— обмен в организме 42
Жидкость семенная 681
— синовиальная 42
— спинномозговая 41
— тканевая см. Жидкость
интерстициальная
Жизнедеятельность,
механизмы регуляции 132
Жир бурый 566
Зависимость градуальная
163
— «поток—объем» в
легких 480
Задержка синаптическая
79
Закон Вебера 710
— Вебера—Фехнера 710
— двустороннего
проведения 68
— диффузии Фика 489
Закон Дюбуа—Реймона 53
Закон изолированного
проведения 68
— поверхности тела 576
Закон полярности
раздражения Пфлюгера 56
Закон физиологической
непрерывности 68
Закон Фика первый 47
Закон Франка—Стерлинга
419
Предметный указатель • 903
Закон
электродиагностический 57
Знание 800
Зоб 294
Зона(ы) Брока 828
— Вернике 827
— Веста 486
— золя-геля гиалоплазмы
338
— легких 483
— плотных а-гранул 338
— рефлексогенные 136
Излучение 596
Изотермия 592
Иммуноглобулин А 382
— Е382
-G381
— М382
Ингибин 677, 685
Индукция нервных
процессов 770
Инозитол-3-фосфат 80
Инкряция 261
Инсулин 181, 299
— эффекты
физиологические 301
Интегрины 155
Интернейроны 140
— локальные 173
— проекционные 173
Интерорецепторы 704
Инсулин 616
Испарение 597
Истощение тепловое 898
Кавеолы 109
Кальбайндины 309
Кальсеквестрин 94
Кальмодулин ПО, 120
Кальцитриол 297, 307
Канал(ы) калиевые каль-
цийзависимые 77
спинномозговой 181
Капацитация 690
Капилляры, типы 454
Кардиомиоциты ИЗ
— высвобождение 120
— потенциал действия,
фаза плато 115
реполяризации
117
— расслабление,
механизм молекулярный 120
— сокращение, контроль
медиаторный 121
механизм
молекулярный 119
«Каскад кислородный»
организма 861
Катаболизм 563
Катакальцин 295
Кателицидины 35, 332
Катехоламины 290, 452
Катпериэлектротон 56
Квадранопсия 811
Квант медиатора 70
Кинезин 52
Кинетоды 746
Кинины 157, 451
Кинки 47
Кислота(ы) 650
— арахидоновая 317
— гамма-аминомасляная
75,87
— ретиноловая 357
— соляная, механизм
секреции 535
в пищеварении 536
— фолиевая 357
Кислотность мочи
титруемая 658
Кишечник толстый,
активность двигательная 557
перемещение химуса
557
микрофлоры в
пищеварении 558
сокоотделение 557
Кишка тонкая, регуляция
моторики 551
гуморальная 553
функция всасывания
553
двигательная 550
Классификация запахов
751
Клетки апокриновые 513
— вкусовые 748
— волосковые 736
— ганглиозные 726, 728
сетчатки, типы 729
— голокриновые 513
— колониеобразующие 349
— Лангерганса 370
— Лейдига 304, 673, 676
— мерокриновые 513
— микросреда 27
— пейсмекерные 399
Клетки-предшественницы
349
— противоцветные
двойные 732
— Реншоу 184, 875
— Сертоли 304, 673
— функции,
взаимодействие межклеточное 154
регуляция местная
154
связи креаторные 154
— шванновские 171
— эпендимные типичные
171
Клетки-эффекторы 366
— юкстагломерулярные
310
Кожа, кровоток 450
Колбы Краузе 712
Колориметрия непрямая
574
— прямая 574
Кома гипогликемическая
583
Комплекс тропонин-тро-
помиозиновый 91
Конвекция 596
Конвергенция 141
— полисенсорная 204
Коннексоны 104
Константа(ы) внутренней
среды 19
— диссоциации воды 650
Контрактура мышечная 94
запасы АТФ 103
Контроль дыхания механо-
рецепторный 503
хеморецепторный 502
Кора, активность
электрическая 227
— ассоциативная пре-
фронтальная 237
— зрительная вторичная
233
первичная 233
проекционная 731
— лимбическая 237
— моторная вторичная 239
первичная 238
путь вентральный 242
кортикобульбар-
ный 242
кортикоспиналь-
ный 242
нисходящий дор-
солатеральный 242
— области сенсорные 229
— слуховая вторичная 234
первичная 234
— соматосенсорная,
функция 230
Кортиколиберин 75, 272
Кортикостероиды 283
Кортикотропин 272
Котранспорт 51, 622
Коэффициент вентиляци-
он но- гравитацион ных
отношений в легких 487
— дыхательный 574
— изнашивания по Рубне-
ру 565
— осмотический 47
— физической активности
577
904 • Предметный указатель
— фосфорилирования 573
Креативность языка 824
Кретинизм 294
Кровезаменители 362
Кровообращение 491
Кровообращение, круг
большой 387
малый 387
— объем минутный 394
резервный 395
систолический 395
ударный 395
— при работе 869
— регионарное 432
Кровоток, ауторегуляция
433
Кровь, вязкость 38, 435
— группы 359
— давление
гидростатическое 30
фильтрационное 30
— изменения при работе
870
— иммуноглобулины 36
— переливание 361
— резус-отрицательная 359
резус-положительная 359
— система свертывания
341
путь внешний 341
внутренний 343
— свойства
суспензионные 38
— способность общая же-
лезосвязывающая 328
— текучесть 38
— факторы 343
— функция гомеостатиче-
ская 322
регуляторная 322
секреторная 322
транспортная 322
— циркулирующая, объем
28
гиперволемия 28
нормоволемия 28
Ксенотрансплантаты I, 340
Культура человека общая
782
Лабильность 58,64
стадия
парадоксальная 58
тормозящая 58
уравнительная 58
Лактат-ацидоз 664
Лактация 699
Лактоген плацентарный
человеческий 696
Лактогенез 699
Лактоферрин 332
Легкие, кровоток 445
Лейкопения 331
Лейкоцитоз 331
Лейкотриены 318, 332
— миогенный 870
Лейкоциты 331
— эозинофильные,
функции 335
Либерины 149
Лиганд 260
Лимфа, белки 39
— образование 40
— периферическая 39
— центральная 39
— формула,
лейкоцитарная 40
Лимфангион 465
Лимфообращение 463
Лимфопоэз 364
Лимфоток 466
Лимфоциты В 368
синтез антител 369
функции 369
-Т365
цитотоксические 365
функции 368
Липиды 565
— клеточные 566
— плазмы крови 566
Липокортины 286
Липопротеины 567
— плотности высокой 32
низкой 32
очень низкой 32
Лихорадка 603
Локализация речи 829
Локомоция 192
Лютеолиз 686
Лютропин 672, 675, 685
Маммогенез 699
Мастурбация 780
Медиатор(ы) 137
— возбуждающий 79
— клеток гетерогенных 156
— тормозные 79
Мелатонин 298
Меланотропин 282
Мембрана постсинаптиче-
ская 138
— пресинаптическая 138
Менструация, 687
Метаболизм 563
Метаболиты 156
Механизмы
компенсаторные 879
— мочеобразования 610,
614
Механорецепторы 703
Механорецепторы кожи
711
плотность 713
Микроглия 171
Микродинамика см.
Микроциркуляция
Микродомен 71
Микросон 852
Микроциркуляция 453
Миндалины, выбор
конкурирующих мотиваций
положительных
эмоций 219
— функции 218
сигналы опасности
218
— ядра базолатеральные
218
— ядро центральное 218
Минералокортикоиды 283
Миокард, кровоток 444
— проводимость 398
— сокращение 397, 403
Миофибриллы 88
Миофиламенты 89
Миоциты
пищеварительного тракта 518
Модель речевой
деятельности человека Верни-
ке—Гешвинда 827
современная 828
Модуляторы 579
Мозг головной, кора,
функция 83
— — кровоток 442
— костный 370
островки эритробла-
стические 330
строма 354
— мост 194
— продолговатый, ядро со-
литарного тракта 205
— промежуточный,
гипоталамус 211
таламус 211
— расщепленный 244
— система лимбическая
216
— спинной, мотонейроны
альфа 183
гамма 183
нейроны зоны
промежуточной 183
путь(и) вестибулос-
пинальный 194
кортикоспиналь-
ный 194
латеральный 183
медиальный 183
— проводящие
восходящие 194
нисходящие 194
собственные 194
Предметный указатель • 905
рекутилоспиналь-
ный 194
руброспинальный
194
тектоспинальный
194
рога дорсальные 181
ствол 194
тракт спиноретику-
лярный 194
спиноталамиче-
ский 194
участие в локомоции
192
функции 181
ядра(о) 181
медиальное 185
моторные 183
— средний 194
ростральный 207
покрышка 201
— ствол, путь
латеральный 202
медиальный 202
центры
глазодвигательные 204
ядра вегетативные
195
двигательные 195
■ — чувствительные
195
— структуры лимбические
176
Мозжечок 259
— функции 207
объем движений 207
равновесие тела 207
сила мышц 207
Молекулы, транспорт
внутриклеточный 52
Моноциты-макрофаги 336
Мотивациия(и) 147, 206,
773
— биологические 147
— влечения 774
— вторичные 773
— избегания 774
— ориентировочных
потребностей 147
— первичные 773
— пищевая человека 774
— познавательные 147
— половая человека 780
нервная
регуляция 787
— смысла жизни 147
— творческие 147
Мотонейроны 876
— геномные 186
— дыхательные спиналь-
ные 502
Моча первичная 614
Мускулатура дыхательная
471
Мышление 756, 824
— абстрактное 833
формы 833
функции полушарий
мозга 834
— основы
нейрофизиологические 832
при чтении 834
Мышцы(а) гладкие 88, 103
активность
тоническая 105
электрическая 106
мультиунитарная 105
— — расслабление,
механизм молекулярный 111
синапс
нервно-мышечный 108
сокращение,
механизм молекулярный 109
параметры
физиологические 111
унитарная 104
— сердечная 88
активность
электрическая 114
функции ИЗ
— скелетные 88, 452
белые 88
двигательная
единица 88
длина исходная 101
красные 88
неутомляемость
относительная 102
расслабление 96
регуляция сосудов
гуморальная 453
миогенная 452
нервная 453
сила абсолютная 100
сокращение 91
изотоническое 97
концентрическая
98
укорочение,
скорость 100
утомление 101
периферическое
102
центральное 102
— сокращение
непроизвольные 88
произвольные 88
Навыки двигательные 865
этапы формирования
866
Нагрузка физическая 577
Надпочечник,
кровоснабжение 283
Напряжение углекислоты
парциальное 660
Насос натрий-калиевый 48
— электрогенный 60
Научение 757, 817
— ассоциативное 760, 822
— половому поведению
782
Нейрогипофиз 270
Нейроглия 160
Нейрогормоны 149
Нейромодуляторы 77
Нейрон(ы) 160
— ассоциативные 140
— афферентные 140
— возбуждающие 160
— глазодоминантные 232
— группы дыхательные 498
— классы
нейрохимические 174
— коры мозжечка 209
коры моторной 173
— окончание пресинапти-
ческое, функция 75
— парасимпатические пре-
ганглионарные 185
— пептидергические 179
— полимодальные 197
— простые 731, 742
— Пуркинье 209
— система глутаматергиче-
ская 174
ГАМКергическая 178
мотивационные 171
моторные 171
сенсорные 171
холинергическая 176
— стриарной коры 810
— тормозные 160
— холинергические 176
мозга головного 176
— черной субстанции 206
путь мезокорти-
кальный 206
мезолимбиче-
ский 206
нигростриат-
ный 206
— эфферентные 140
Нейропептиды 75
— гипоталамические 149
Нейросекреция 149
Нейротрансмиттеры 74
Нейтрофилы, эффект
бактерицидный 333
Нексус 68, 114
Неприязнь вкусовая 777
Нервы обонятельные 753
— черепные 195
Нефрон 610
906 • Предметный указатель
— типы 613
Норадреналин 75, 83
эффект инотропный
121
Норма адативной реакции
888
Ноцицепторы 704
Обмен веществ
транскапиллярный 455
и энергии 563, 592
— водно-солевой 634
Обмен водный 21
— жидкости
транскапиллярный 455
— основной 575
формула расчетная
547
— энергии в клетке 573
Обморок тепловой 603, 898
Обоняние 750
— роль физиологическая у
человека 754
Объем(ы) вдоха
резервный 475
— воздуха легочные 474
— выдоха резервный 475
— грудной полости 470
— дыхания минутный 483
— дыхательный 475
объем
циркулирующей крови 426
Окисление питательных
веществ биологическое
574
Оксигемоглобин 325
Оксид азота 314
Окситоцин 75, 180, 281
Олигодендроциты 171
Оогенез 668, 683
Опиаты эндогенные 282
динорфины А, В 282
лейцин-энкефалин
282
метионин-энкефа-
лин 282
неоэндорфины а, р
282
эндорфины 282
Оплодотворение 690
Оргазм 682, 689, 786
Орган(ы) кортиев 738
процессы
биоэлектрические в нем 739
— половые наружные 671
Организм, среда
внутренняя 19
Осведомленность
зрительная 817
Ос моляр ность 47
Основные крови
буферное 660
Основания 650
Островки Лангерганса 299
Ответ иммунный 376
активация Т- и В-
лимфоцитов 379
гуморальный 381
клеточный 380
Ототопика 736
Ощущения проприоцеп-
тивные 713
Память 817, 824
— имплицитная 818
механизмы
нейронные 820
— кратковременная 819,
820
— формы 818
— эксплицитная 818
механизм
образования 823
— энграмм 818, 823
Парабиоз 58
Паратирин 131, 296
Пейсмекеры 105
Пепсины 536, 537
Пептид(ы) желудочный
ингибиторный 300
— мозговой 295
— нейроактивные 75
— нейрогипофиза 181
— опиатные 180, 716
Перехват Ранвье 67
Периэлектротон 56
Перфузия легких кровью
485
Петля Генле 625, 627
Печень, кровоток 448
Пиноцитоз 556
Питание 584, 659
— рациональное 589
Пищеварение 511, 659
— в желудке 533
тонком кишечнике
548
— типы 513, 514
Плазма крови 28, 322
белки 33
давление онктиче-
ское 29
осмотические 29
«плавающие»
рецепторы 37
состав
электролитный 28, 32
стабильность
коллоидная 37
удельный вес 39
функция защитная 28
транспортная 28
Плазмолемма 45
Плазмоток почечный
эффективный 631
Плацента гемохориальная
692
— функции 693
Пневмоторакс 474
Пол генетический 670
— гонадный 670
— фенотипический 671
Поле(я) зрительное 721
— рецептивные 706
Полипептид
панкреатический 304
Половое возбуждение,
стадии 785
Полосатое тело 221
Полость ротовая 528
Полушария 225
— большие 225
кора ассоциативная
225
зрительная 225
моторная 225
сенсорная 225
соматосенсорная
225
— левое 246
— мозолистое тело 244
— правое 246
— речевая деятельность
244
Порог возбуждения 53
— выведения почечный 62
— генерации потенциала
действия 62
— дыхательный 506
— лактатный 507
— ощущения абсолютный
710
Потенциал(ы) вызванные
227
— действия 59, 705
зона интегративная
163
триггерная 166
кардиомиоцита 114
— концевой пластинки 73
мембранный 107
— Нернста 59
— пейсмекерные 117
— покоя возбудимых
клеток 60
мембранный 164
постсинаптические
возбуждающие 79, 163
локальные 163
тормозные 163
— пороговый 62
— рецепторный 163, 705
— следовые 63
Предметный указатель • 907
Потенциация
долговременная 175
Почка 451
— регуляция кровотока
гуморальная 451
миогенная 452
нервная 452
Пресбиопия 719
Пресинаптическое
торможение 169
— усиление 170
Привыкание 757
Принцип обратной аффе-
рентации 146
— общего конечного пути
Шеррингтана 141
— реципрокности 144
— субординации нервных
центров 145
— торможения
сопряженного 144
Проводники нервные
афферентные 136
эфферентные 136
Прогестерон 305, 696
Прозопагнозия 234
Пролактин 278, 677, 697,
699
Проприорецепторы 504
— шейных мышц 200
Простагландин(ы) 157, 317
— Е2 451
— F2a 451, 687
— Н2 451
Простациклин 12 345
Пространство
внеклеточное, жидкости 19
— мертвое анатомическое
483
физиологическое 485
— плевральное 472
Протеины С и S 345
Протромбиназа кровяная
343
Процессы бодрствования
207
Процессы познавательные
базовые 800
— сна 207
Пуазейля формула
433
Пурины 75
Путь(и) лемнисковый 230,
713
— проводящие
параллельные 173
— спинномозжечковый
183
Пучок Гиса 398
Пятно голубое 177
Работа дыхательных мышц
481
— запрос кислородный 863
— комбинированная 857
— мышечная, мощность
101
— умственная 856
изменение
физиологических функций при
ней 872
— физическая 856
формирование
гормональных реакций 871
Работоспособность 868
— человека 856
Раздражитель адекватный
52, 136
— неадекватный 52, 136
Раствор, тоничность 47
Растяжимость легочной
ткани 476
Рацион питания 590
Рвота 562
Реабсорбция аминокислот
и глюкозы 622
— ионов натрия 620, 624,
629
— канал ьцевая 619
воды 629
регуляция 628
— пептидов и белков 623
— проксимальная 619
Реактивность 132
Реакция(и) жидкостей
актуальная 650
— организма адаптивные
неспецифические 881
симпатоадренало-
вая 882
Реверберация
возбуждения 142
Регенерация 317
Регулирование аутокрин-
ное 155
— паракринное 155
— эндокринное 155
Регуляция адаптивная 129
— гомеостатическая 130
— гуморальная 132
местная клеточно-
тканевая 133
Регуляция
кровообращения, влияния гипотала-
мические 460
кортикальные 462
рефлекторная 457
центральная 456
схема общая 462
уровень спинальный
457
бульбарный 458
— нейрогуморальная
рефлекторная 158
— нервная 132
— обмена водно-солевого
578, 605, 638
организма с
окружающей средой 578
— по возмущению 129
отклонению 129
упреждению 131
Режим питания 588
Резистентность
осмотическая максимальная 31
минимальная 31
— организма 880
Рекомендации ВОЗ по
диете 590
Релаксин 697
Ренин 310
Реншоу: торможение 142
Реобаза 54
Репарация 317
Реполяризация 63
Репрезентации слов 829
Ретинопия 721
Рефлекс(ы) аллиирован-
ные 144
— антагонистические 144
— безусловный 758
— Бейнбриджа 418
— вегетативные 257
надсегментарные 257
сегментарные 257
— вестибулярные 200
— висцеро-висцеральный
193, 257
— висцероДермальный 193
— висцеросенсорный 258
— висцеросоматический
258
— выпрямления 200
— Геда парадоксальный
504
— Геда—Брейера 504
— Генри—Гауэра 419
— Геринга—Брейера 504
— глотательный 198
— Гольца 419
— Данини—Ашнера 420
— дермовисцеральные 193
— жевательные 198
— зрачковый 200, 720, 730
— кардиальные 418
— кашлевой 199
— коленный 186
— координация 144
— лабиринтные 200
— лифтные 202
— мигательный 200
— моносинаптический 141
— ориентировочные 200
— осморегулирующие 640
908 • Предметный указатель
— позные 200
— полисинаптические 141
— положения 200
— постуральные 202
— поля рецептивные 136
— разгибательный 190
— растяжения мышцы 186
— рвотный 198
— ритмические 192
— сгибательный 190
— слезный 199
— слюноотделительный
197
— соматовисцеральный
258
— спинальные
вегетативные 193
— спинномозговые 185
— стартовые 200
— статические 200
— статокинетические 200
— суммационный 761
— сухожильные 185
— тонический 187
— условный 756, 758
высшего порядка 762
классический 762,
822
виды 767
оперантный 767
стадии
формирования 762
торможение 763
внешнее 764
дифференцировоч-
ное 766
запаздывающее 765
— — — угасательное 764
условное 766
— установочные 200
— физический 186
— цепные 144
— чихательный 199
— шейные тонические 200
— энтерогастральный 543
Рефрактерность
абсолютная 64
— относительная 64
Рефракция 718
— аномалии 719
Рецепторы 702
— адаптация 705
— аппарата
вестибулярного 200
— болевые 715
— возбуждение, порог
раздражения абсолютный
136
— глютаматные 78
— Гольджи 189
— Гольджи сухожильные
504
— дигидропиридиновый 94
— иммуноглобулиновые
155
— ионотропные 78, 86
— кадгериновые 155
— классификация 703
— клеточные 127
химические 134
— метаботропные 80, 177
— мускариновые М,—М5
122
— отолитовых органов 745
— полилюдальные 715
— растяжения легких бы-
строадаптирующиеся
504
медленно
адаптирующиеся 504
— рианодиновый 94
— сенсорные 133
— — интероцепторы 135
— серотонинергические D,
М, Т 255
— слуховые 733
— сухожильные Гольджи
713
— температурные 714
активность
тоническая 714
экстероцептеры 135
Рецепторы сенсорные
чувствующие
вторично 135
— первично 135
механорецепто-
ры 135
ноцицепторы
135
термоцепторы
135
— V„ V2 279
J-рецепторы легочные 504
Рецепция вкусовая 747
Ригидность децеребраци-
онная 203
— мышечная 224
Ритм дыхательный 500
Роды 697
Русло микроциркулятор-
ное 453
— сосудистое спланхниче-
ское 424
Саккады 204
Саркомер 89Секретосома
71,76
Секреция канальцевая 630
Селезенка, функции 374
Селектины 155
Семенники 672
Сенситизация 78, 757, 812,
820
Сердечный выброс 412
Сердце, возврат венозной
крови 421
— иннервация 414
— работа, цикл 405
экстрасистолы 407
— сокращение, эффектт
батмотропный 414
дромотропный 414
инотропный 414
хронотропный 414
— функция гормональная
421
— Серотонин 75, 85, 178
Сети нейронные
дивергентные 174
иерархические 173
локальные 173
торможение
возвратное 142
латеральное 142
нисходящее 143
реципрокное 142
тормозная зона 143
— нервные дивергентные
141
иерархические 141
локальные 141
принципь!
субординации 142
Сила мышц максимальная
865
Симпорт 51
Симптом
Мюсси—Георгиевского 258
Синапс(ы) 68, 137
— адренергический 83
— аксо-аксональные 137,
162
— аксодендритные 137
— аксосоматические 137
реакции быстрые 74
медленные 75
— ГАМКергический 81, 87
— глицинергический 81,
87
— глутаматергический 86
— дендро-дендритные 137
— дендросоматические 137
— дофаминергический 84
— нервно-мышечный 69,
139
механизм постсинап-
тический 72
пресинаптический
70
— периферические 139
— серотонинергический 85
— тормозные 79
Предметный указатель • 909
каналы хемозависи-
мые 165
— химический 74
— холинергический 82
Синапсин 51
Синдактилия 232
— адаптационный общий,
стадии 885
— Иценко—Кушинга 289
— Клювера—Бьюси 219
Синусоидальное дерево
355
Синцитий
функциональный 114
Система(ы) аденилатцик-
лаза —цАМФ 262, 330
— антиноцицептивная 178
— буферная белковая 652
бикарбонатная
гемоглобиновая 653
фосфатная 652
— гипоталамо-аденогипо-
физарная 149
— гипоталамо-нейрогипо-
физарная 149
— гипоталамо-экстрагипо-
таламная 149
— глаза оптическая 718
— гомеостатические 651
— гормональная, звено
выделения гормонов 151
депонирования 150
метаболизма 150
синтеза и
секреции 150
транспорта 150
эффектора 151
регуляция, путь гипо-
физарный 148
парагипофизар-
ный 148
— гуанилатциклаза —
цГМФ 264
— дофаминергичская ме-
золплебическая 176
нигростриатная 176
— дыхательная 469
функции 470
— зрения дневного 724
ночного 723
— иммунная 363
контроль
гормональный 383
цитокиновый 385
органы 370
— — пищеварительного
тракта 561
— кальций—кальмодулин
265
— мозга дофаминергиче-
ская 679
серотонинергическая
679
— моторные
мышцы-антагонисты 240
мышцы-синергисты
240
— нейрогуморально-им-
мунная 158
— нервная вегетативная
248
функция
корригирующая 249
пусковая 249
трофическая 249
трофотропная
250
эрготропная 250
центр бульварный
248
мезэнцефаличе-
ский 248
сакральный 248
тораколюмбаль-
ный 248
энтеральная 256
ганглии 256
— организма
выделительная 606
— питания
функциональная 511
— пищеварительная,
деятельность
периодическая 526
механизмы
регуляции функций 523, 525
строение 511
функция всасывания
519
макро- и
микромолекул 521
моторная 517
секреторная 512
— пищевого насыщения
775
— потребления пищи 775
— пропердиновая 35
— почки канальцевая про-
тивоточно- множител ь-
ная 625
— противоточная
сосудистая 627
Система регуляции,
механизмы 129
обмена эфферентная
579
типы 129
Система регуляции,
уровни 129
— ренин-ангиотензин-аль-
достероновая 283, 310
— сенсорная 173, 702, 756
вестибулярная 743
вкусовая 747
— — зрительная 717, 733
обонятельная 750
отдел
периферический 751
центральный
753
переработка
информации 707
пути проводящие 173
слуховая 733
диапазон
частотного восприятия 735
физиология 703
— сердечно-сосудистая 387
отделы,
классификация 388
— соматовисцеральная 711
— стриопаллидарная 221
— фосфолипаза С — ино-
зитол-3-фосфат 264
— фузимоторная 185
— функциональная 159
— экстралемнисковая
— эндокринная 148
Системогенез 159
Скорость клубочковой
фильтрации 616
регуляция 618
— кровотока линейная 455
Слизь желудочная 537
Слюноотделение 528
Сновидения 850
Сознание 813, 824, 854
— корреляты
нейрофизиологические 814
Сок желудочный,
регуляция секреции 538
состав 534
фазы секреции 539
-кишечный 548
состав 549
— панкреатический,
регуляция секреции 545
состав и свойства 544
— толстой кишки, состав
557
Сокращение мышечное,
активация 94
одиночное 96
сопряжение
электромеханическое 94
тетаническое 96
типы 96
Соматолиберин 75, 275
Соматомаммотропин хо-
рионический
человеческий 696
Соматомедины 276
Соматостатины 181, 274
Соматотропин 275
Сон 836
910 • Предметный указатель
— быстроволновый 837,
841
— индукторы
гуморальные 849
— медленноволновый 837,
842, 846
стадии 840
— механизмы
нейрофизиологические 845
— парадоксальный 843,
846
— последствия его
лишения 852
— продолжительность 851
— регуляторы 850
— регуляция циркадного
ритма 847
— стадии 839
— структура 841
— теория
восстановительная 836
информационная 843
циркадианная 837
Сопротивление
дыхательных путей 479
Сопряжение
электромеханическое, мышца
гладкая 119
сердечная 120
скелетная 119
Состояние
кислотно-основное 650
изменение при
работе 870
и
желудочно-кишечный тракт 659
легкие 655
печень 659
почки 656
компенсация
нарушений 667
Сосуды лимфатические
465
проницаемость 467
— сопротивление общее
периферическое 393
— шунтирующие 456
Сперматогенез 668, 672,
675
Сперматозоиды 673, 690
Спиноцеребеллум 207
Спланхомегалия 277
Способность легких
диффузионная 491
Среда организма
внутренняя, вода 21
Средства коммуникации у
людей 824
Статины 149
Ствол мозга 194
Стероиды половые 283
Стоимость дыхания
энергетическая 507
Стресс-реакция 883
Стресс-релаксация 112
механизм «замка» 112
— тепловой 891
— участие эндокринной
системы 315
Субстанция Р 75
Судороги тепловые 898
Сурфактант 477, 478
Сфингомиелин 67
Таламус, интернейроны
возбуждающие
локальные 211
тормозные 211
— кора моторная
вторичная 212
первичная 212
— нейроны релейные 211
— путь передачи магно-
целлюлярный 212
парвоцеллюляр-
ный 212
— ядро(а) ассоциативные
211
вентролатеральное
212
моторные 212
неспецифические
211, 213
специфические 211
Танициты 171
Тахикинины 180
Тахистоскопия 244
Тело желтое 306, 683, 686
— полосатое 224
Тельца Мейсснера 712
— Пачини 712
— Руффини 712
— тактильные Пинкуса—
Игго 712
Тембр голоса 826
Температура комфорта
593— тела 592
колебания суточные
594
нормальная 593
Теория диффузионная 488
Теплоотдача 594
— пути 596
Теплопроведение 596
Теплопродукция 594, 595
Теплота вторичная 574
— первичная 573
Терминаль 137
Термогенез
несократительный 596
— сократительный 595
Терморегуляция 605
— поведенческая 595, 598
— эндогенная 594
Терморецепторы 598, 703
Тестостерон 675
Тетанус гладкий 96
— зубчатый 96
Тетрайодтиронин 292
Тимоциты 373
Тимус 372
Тиреолиберин 75, 274
Тиреотропин 274, 292
Тиронины 292
Тироциты 292
Титин 91
Ткань(и) возбудимые 45
свойства 52
— лимфоидная мукозно-
ассоциированная 376
Ткани-мишени 151
— мышечная 88
— раздражимость 45
Ток постоянный,
действие полюсное 55
Тонотопия 212
Точка массы тела
установочная 775
Тошнота 561
Тракт(ы) вестибулоспи-
нальный 202
— желудочно-кишечный,
кровоток 446
— зрительные 730
— ретикулоспинальный
202
— руброспинальный 203
— спиноретикулярный 182
— спиноталамический 182
— тектоспинальный 202
Транскобаламины 34
Транскортин 286
Транспорт веществ через
мембрану 46
движение воды
47
диффузия 47
осмос 47
— вторично-активный 50
— кровью кислорода 492
углекислого газа 495
— парацеллюлярный 22
— первично-активный 48
— трансцеллюлярный 22
активный 23
пассивный 22
Трансферрин 34
Трансфузиология 358
Трансцитоз 521
Трийодтиронин 292
Тромбин 344
Тромбомодулин 346
Тромбопоэтин 339
Предметный указатель ■ 911
Тромбоцитоз миогенный
870
Тромбоцитопоэз 339
Тромбоциты, функции 337
Тропомиозин 89
Тропонин 90
Углеводы 567
Удар тепловой, формы 899
Узел синоатриальный,
клетки, активность
пейсмекерная 117
Узлы лимфатические 375,
465
Ультрафильтрация клубоч-
ковая 614
Умения двигательные 865
Уравнение Гендерсона—
Гассельбаха 652
— Нернста 59
— Хилла 100
Утомление зрительное 873
— центральное 874
— человека при работе
мышечной
динамической 877
физической
статической 875
Фактор(ы) Виллебранда
348
— колониестимулирую-
щий гранулоцитарный
337, 352
моноцитарный 337
— опухольнекротизирую-
щий 336, 354
— роста инсулиноподоб-
ные 276
— тканевый 348
— туморнекротизирую-
щий 380
Феномен Орбели—Гине-
цинского 250
— Остроумова—Бейлиса
616
— эффекта правого уха 246
Ферменты желудочного
сока 536
— пищеварительных
желез 513
— протеолитические 544
Феромоны 219, 754, 783
— роль в половой
мотивации у человека 782
Фертилизация 669
Фибринолиз 348
Фибронектин 34
Физиология труда 856
Филамент(ы) актиновые 90
— толстый 91
Фонокардиограмма 410
Формация ретикулярная
201
входы афферентные
сенсорные 205
стресс-реакция 206
центр(ы)
вегетативные 205
дыхательный 205
пневмотаксиче-
ский 206
Фосфатаза миозиновая 111
Фосфатурия 296
Фосфоламбан 121
Фосфолипаза Д 335
Фосфолипиды 45
Франка уравнение 393
Френикус-симптом 258
Функции(я)
висцеральные, регуляция
рефлекторная 146
— выделительная верхних
дыхательных путей 609
желудка 608
кишечника 608
легких 608
печени 608
— двигательная 205
— печени
непищеварительные 548
пищеварительные 546
— поджелудочной железы
544
— почек 609
метаболическая 632
экскреторная 632
— репродуктивная
женская 682
— сосудов емкостная 453
— уха внутреннего 738
наружного 736
среднего 736
— физиологические,
регуляция произвольная 146
Хеморефлекс
центральный 502
Хеморецепторы
периферические (артериальные)
503, 508
— центральные
(медуллярные) 502
Хемотаксис 690
Хиломикроны 567
Холекальциферол 307
Холин 82
Холинорецепторы М 254
Хромосомы 668
Хронаксия 54
Ценность энергетическая
585
Центр(ы) апнейстический
501
— голода 511
— дефекации 560
— дыхательный 498
— двигательные 201
командные 240
— жевания 531
— насыщения 512
— нервные 140
свойства 140
— пневмотаксический 501
— речи 245
— слюноотделения 530,
531
— терморегуляции 599
Цепочки нейронные Ло-
ренто де Но 142
Цереброцеребеллум 207
Цикл менструальный 687
фаза менструальная
688
пролиферативная
688
секреторная 688
— овариальный 682, 683
фаза лютеальная 686
овуляторная 685
фолликулярная 683
Цикл сон—бодрствование
204
Частота дыхания 474
Часы биологические 836,
838
Черная субстанция 206,
221
Число Авогадро 29
Чувствительность
вкусовая 748
Шкала Стивенса 710
Шок спинальный 185
Шунтирование 485
Эквивалент кислорода
калорический 574
Экзоцитоз 51, 77, 521
— медиаторы, регуляция
пресинаптическая 77
Экстерорецепторы 704
Эктоэнзимы 348
Электрокардиограмма 408
Электротон
физиологический 55
— Эмбдена—Мейергофа
цикл 322
912 • Предметный указатель
Эмболия газовая 509
— жировая 567
Эмбрион 692
Эмоции 206, 789, 824
— механизмы проявления
791
— отрицательные,
регуляция 798
— положительные,
регуляция 796
— роль в поведении
человека 790
Энграммы
долговременной памяти 176
Эндотелины 313
Эндоцитоз 51, 521
Энкефалины 75
Эозинофилия 336
Эпифиз 297
Эпоксид 318
Эритропоэз 329, 456
— неэффективный 356
Эритропоэтин 330
Эритроцитоз 330
— миогенный 870
Эритроциты 494
— роль в транспорте С02
495
— свойства 322
— форма 323
Эстрадиол 305
Эстриол 305
Эстрогены 677, 686, 688,
696
Эстрон 305
Эффект Анрепа 413
— Бора 494, 693
— Остроумова—Бейлисса
438
— равновесия Даннона 30
— ускользания сердца 415
— Фареуса—Линдквиста 38
— Холдена 496
Эхиноциты 326
Эякуляция 681
Ядра(о) вестибулярные 201
— красное 201
— мозжечка 210
зубчатые 210
промежуточные 210
— переключательные 172
— субталамическое 321
— хвостатое 221
— шатра 211
— шва 207
Язык жестов 830
— свойства 825
Оглавление
К читателю (предисловие к 1-му изданию) 5
Предисловие ко 2-му изданию 8
Список сокращений 10
Введение. Физиология как предмет и характеризующие его понятия 12
/ БАЗИСНЫЕ ОСНОВЫ ФИЗИОЛОГИИ ЧЕЛОВЕКА
Глава 1 Жидкие среды организма 19
1.1. Внутренняя среда организма 19
1.2. Биологические свойства жидкостей, составляющих внутреннюю
среду организма 21
1.2.1. Вода как составная часть жидкостей организма 21
1.2.2. Гистогематические барьеры 22
1.2.3. Внутриклеточная жидкость 24
1.2.4. Интерстициальная, или тканевая, жидкость 25
1.3. Плазма крови как внутренняя среда организма 28
1.3.1. Электролитный состав плазмы крови 28
1.3.2. Осмотическое и онкотическое давление плазмы крови .... 29
1.3.3. Обмен воды между плазмой крови и интерстициальной
жидкостью 30
1.3.4. Продукты белкового обмена, углеводы и липиды плазмы
крови 32
1.3.5. Белки плазмы крови 33
1.4. Факторы, обеспечивающие жидкое состояние крови 37
1.5. Лимфа как внутренняя среда организма 39
1.6. Механизм образования лимфы 40
1.7. Трансцеллюлярные жидкости организма 41
1.8. Обмен жидкостей между водными секторами в организме человека . 42
Глава 2 Физиология возбудимых тканей 45
2.1. Строение и физиологические функции мембраны клеток возбудимых
тканей 45
2.1.1. Транспорт веществ через клеточную мембрану 46
2.1.1.1. Движение воды через мембрану клеток 47
2.1.1.2. Осмос 47
2.1.1.3. Диффузия 47
2.1.1.4. Первично-активный транспорт 48
2.1.1.5. Вторично-активный транспорт 50
2.1.1.6. Эндоцитоз и экзоцитоз 51
2.1.1.7. Внутриклеточный транспорт молекул 52
2.2. Возбудимость как основное свойство нервной и мышечной ткани . . 52
2.2.1. Понятие о раздражении и раздражителях 52
2.2.2. Зависимость возникновения возбуждения от длительности и
силы раздражения 53
2.2.3. Возбудимость и возбуждение при действии постоянного тока
на нервную и мышечную ткань 55
2.2.3.1. Физиологический электротон 55
2.2.3.2. Закон полярности раздражения нервной и мышечной ткани . 56
2.2.3.3. Электродиагностический закон 57
2.2.4. Понятие о функциональной подвижности возбудимых тканей 58
2.3. Электрические явления в возбудимых клетках 58
2.3.1. Мембранный потенциал покоя 59
2.3.2. Потенциал действия возбудимых клеток 61
2.2.3. Рефрактерный период в возбудимых клетках 64
2.3.4. Локальный ответ мембраны возбудимых клеток 65
914 • Оглавление
2.4. Проведение импульса по нервным волокнам 66
2.4.1. Немиелинизированные волокна 66
2.4.2. Миелинизированные волокна 67
2.4.3. Законы проведения возбуждения по нервному волокну .... 68
2.5. Проведение возбуждения через синапс 68
2.5.1. Проведение возбуждения через нервно-мышечный синапс . . 69
2.5.1.1. Пресинаптический механизм 70
2.5.1.2. Диффузия ацетилхолина через синаптическую щель
нервно-мышечного синапса 72
2.5.1.3. Постсииаптический механизм 72
2.5.1.4. Восстановительные процессы структуры мембраны и функции
нервно-мышечного синапса после передачи возбуждения . . 73
2.5.2. Проведение возбуждения через аксосоматический синапс ... 73
2.5.2.1. Функция пресинаптического окончания нейронов 75
2.5.2.2. Пресинаптический механизм проведения возбуждения .... 76
2.5.2.3. Пресинаптическая регуляция экзоцитоза медиаторов .... 77
2.5.2.4. Постсииаптический механизм проведения возбуждения ... 78
2.5.2.5. Функции метаботропных рецепторов постсинаптической
мембраны аксосоматического синапса 80
2.5.3. Проведение возбуждения в основных типах синапсов
центральной нервной системы 81
2.5.3.1. Холинергический синапс (рис. 2.22) 82
2.5.3.2. Адренергический синапс 83
2.5.3.3. Дофаминергический синапс 84
2.5.3.4. Серотонинергический синапс 85
2.5.3.5. Глутаматергический синапс 86
2.5.3.6. ГАМКергический синапс 87
2.5.3.7. Глицинергический синапс 87
2.6. Функции мышечной ткани 88
2.6.1. Скелетная мышца 88
2.6.1.1. Функции миофиламентов 90
2.6.1.2. Механизм сокращения скелетной мышцы 91
2.6.1.3. Активация мышечного сокращения 94
2.6.1.4. Расслабление скелетной мышцы 96
2.6.1.5. Типы мышечных сокращений 96
2.6.1.6. Типы скелетных мышечных волокон 98
2.6.1.7. Физиологические показатели сокращения скелетной мышцы 100
2.6.2. Утомление скелетной мышцы 101
2.7. Гладкая мышца 103
2.7.1. Типы гладких мышц 104
2.7.2. Электрическая активность клеток гладкой мышцы 106
2.7.3. Нервно-мышечный синапс гладкой мышцы 108
2.7.4. Молекулярный механизм сокращения гладкой мышцы .... 109
2.7.5. Молекулярный механизм расслабления гладкой мышцы ... Ш
2.7.6. Физиологические параметры сокращения гладкой мышцы . . 111
2.8. Функции мышечных клеток сердца 113
2.8.1. Электрическая активность клеток сердечной мышцы П4
2.8.1.1. Потенциал покоя 114
2.8.1.2. Молекулярный механизм потенциала действия в типичных
сердечных мышечных клетках 115
2.8.1.3. Механизм возникновения пейсмекерной активности в клетках
синоатриального узла 117
2.8.2. Молекулярный механизм сокращения кардиомиоцитов .... 119
2.8.3. Молекулярный механизм расслабления кардиомиоцитов ... 120
2.8.4. Медиаторный контроль сокращения кардиомиоцитов 121
// РЕГУЛИРУЮЩИЕ И УПРАВЛЯЮЩИЕ СИСТЕМЫ
Глава 3 Общие принципы и механизмы регуляции физиологических функций .... 127
3.1. Общие принципы организации системы регуляции 127
3.1.1. Уровни организации системы регуляции 127
3.1.2. Типы и механизмы регуляции 129
3.1.3. Реактивность и эффект регуляции 132
3.1.4. Механизмы регуляции жизнедеятельности 132
Оглавление • 915
3.2. Рефлекторная регуляция функций организма 133
3.2.1. Сенсорные рецепторы 135
3.2.2. Афферентные и эфферентные нервные проводники 136
3.2.3. Возбуждение и торможение в рефлекторной дуге 137
3.2.4. Механизмы связи между звеньями рефлекторной дуги .... 137
3.2.5. Нервные центры и их свойства 140
3.2.6. Взаимодействие различных рефлексов. Принципы
координации рефлекторной деятельности 144
3.2.7. Рефлекторная регуляция висцеральных функций 146
3.3. Произвольная (волевая) регуляция физиологических функций .... 146
3.4. Гормональная регуляция функций организма 147
3.4.1. Общая характеристика звеньев гормональной системы
регуляции 148
3.4.2. Виды и пути действия гормонов 151
3.5. Местная гуморальная регуляция функций клеток 154
3.6. Системный принцип организации механизмов регуляции
физиологических функций 157
Глава 4 Функции центральной нервной системы 160
4.1. Основы функционирования нейронов и глии 160
4.1.1. Общая характеристика нейронов 160
4.1.2. Функциональная модель нейрона 162
4.1.2.1. Входные сигналы -. 163
4.1.2.2. Объединенный сигнал — потенциал действия 166
4.1.2.3. Проводящийся сигнал 167
4.1.2.4. Выходной сигнал 168
4.1.3. Функциональная характеристика нейроглии 170
4.1.3.1. Астроциты 170
4.1.3.2. Олигодендроциты 171
4.1.3.3. Эпендимная глия 171
4.1.3.4. Микроглия 171
4.2. Общие принципы функционального объединения нейронов 171
4.2.1. Общие принципы организации функциональных систем мозга 172
4.2.1.1. Существование нескольких уровней переработки информации 172
4.2.1.2. Топографическая упорядоченность проводящих путей .... 173
4.2.1.3. Наличие параллельных проводящих путей 173
4.2.2. Типы нейронных сетей 173
4.2.3. Нейрохимические классы нейронов 174
4.2.3.1. Глутаматергическая система 174
4.2.3.2. Холинергическая система 176
4.2.3.3. Системы нейронов, использующих биогенные амины .... 176
4.2.3.4. ГАМКергическая система 178
4.2.3.5. Пептидергические нейроны 179
4.3. Функции спинного мозга 181
4.3.1. Функциональная организация спинного мозга 181
4.3.2. Рефлексы спинного мозга 185
4.3.2.1. Сухожильные рефлексы 185
4.3.2.2. Рефлекс растяжения мышцы 186
4.3.2.3. Рефлекторная регуляция напряжения мышц 189
4.3.2.4. Сгибательные и разгибательные рефлексы 190
4.3.2.5. Ритмические рефлексы 192
4.3.2.6. Участие спинного мозга в локомоции 192
4.3.2.7. Спинальные вегетативные рефлексы 193
4.3.3. Функциональная организация проводящих путей спинного
мозга 194
4.4. Функции ствола мозга 194
4.4.1. Функциональная организация ствола мозга 195
4.4.1.1. Черепные нервы 195
4.4.1.2. Функциональная специализация ядер ствола 196
4.4.2. Рефлекторная функция ствола мозга 197
4.4.2.1. Статические и статокинетические рефлексы 200
4.4.2.2. Нисходящие двигательные пути ствола мозга 202
4.4.2.3. Глазодвигательные центры ствола 204
4.5. Функции ретикулярной формации 204
4.5.1. Особенности нейронной организации ретикулярной формации 205
916 • Оглавление
4.5.2. Нисходящие и восходящие влияния ретикулярной формации 206
4.6. Функции мозжечка 207
4.6.1. Функциональная организация мозжечка 207
4.6.2. Взаимодействие нейронов коры и ядер мозжечка 209
4.6.3. Эфферентные связи мозжечка с моторными структурами мозга 210
4.7. Функции промежуточного мозга 211
4.7.1. Функции таламуса 211
4.7.2. Функции гипоталамуса 213
4.7.2.1. Роль гипоталамуса в регуляции вегетативных функций . ... 213
4.7.2.2. Роль гипоталамуса в регуляции эндокринных функций ... 215
4.8. Функции лимбической системы мозга 216
4.8.1. Функции миндалин 218
4.8.2. Функции гиппокампа 220
4.9. Функции базальных ганглиев (стриопаллидарная система) 221
4.9.1. Взаимодействие базальных ганглиев с другими структурами
мозга 221
4.9.2. Модуляции нейронных переключений в базальных ганглиях . 224
4.10. Функции коры больших полушарий 225
4.10.1. Функциональное распределение нейронов в коре 226
4.10.2. Модульная организация коры 226
4.10.3. Электрическая активность коры 227
4.10.4. Функции сенсорных областей коры 229
4.10.4.1. Функция соматосенсорной коры 230
4.10.4.2. Функция зрительной коры 232
4.10.4.3. Функция слуховой коры 234
4.10.5. Функции ассоциативных областей коры 235
4.10.5.1. Функции теменно-височно-затылочной коры 235
4.10.5.2. Функции префронтальной ассоциативной коры 237
4.10.5.3. Функции лимбической коры 237
4.10.6. Функции моторных областей коры 238
4.10.6.1. Функция первичной моторной коры 238
4.10.6.2. Функция вторичной моторной коры 239
4.11. Регуляция движений 239
4.11.1. Иерархическая организация моторных систем 240
4.11.2. Нисходящие пути моторной коры 242
4.11.3. Контроль выполняемых движений 244
4.12. Межполушарная функциональная асимметрия 244
4.12.1. Функциональные возможности изолированных полушарий . . 244
4.12.2. Выявление функций неразделенных полушарий 245
4.12.3. Функциональная специализация полушарий мозга 246
Глава 5 Вегетативная нервная система 248
5.1. Строение вегетативной нервной системы 248
5.2. Функции вегетативной нервной системы 249
5.3. Функции периферических отделов вегетативной нервной системы . . 251
5.3.1. Симпатический и парасимпатический отделы 251
5.3.2. Энтеральная нервная система 256
5.4. Рефлексы вегетативной нервной системы 257
5.5. Высшие центры вегетативной регуляции 258
Глава 6 Эндокринная нервная система — регулятор функций и процессов в организме 260
6.1. Химическая природа и общие механизмы действия гормонов .... 260
6.1.1. Механизмы действия пептидных, белковых гормонов и катехо-
ламинов 260
6.1.1.1.Основные системы вторичных посредников 262
6.1.1.2. Взаимосвязи вторичных посредников 266
6.1.2. Механизм действия стероидных гормонов 266
6.1.2.1. Геномный механизм действия 266
6.1.2.2. Негеномный механизм действия 266
6.1.3. Саморегуляция чувствительности эффектора к гормональному
сигналу 268
6.2. Регуляторные функции гормонов гипофиза 270
6.2.1. Гормоны аденогипофиза и их эффекты в организме 271
Оглавление • 9П
6.2.1.1. Регуляция секреции и физиологические эффекты кортикотро-
пина 272
6.2.1.2. Регуляция секреции и физиологические эффекты гонадотро-
пинов 273
6.2.1.3. Регуляция секреции и физиологические эффекты тиреотропи-
на 274
6.2.1.4. Регуляция секреции и физиологические эффекты соматотро-
пина 275
6.2.1.5. Регуляция секреции и физиологические эффекты пролактина 278
6.2.2. Гормоны нейрогипофиза и их эффекты в организме 279
6.2.2.1. Регуляция секреции и физиологические эффекты вазопресси-
на 279
6.2.2.2. Регуляция секреции и физиологические эффекты окситоцина 281
6.2.3. Гормоны промежуточной доли 282
6.2.4. Эндогенные опиаты 282
6.3. Регуляторные функции гормонов надпочечников 283
6.3.1. Гормоны коры надпочечников и их эффекты в организме . . 283
6.3.1.1. Регуляция секреции и физиологические эффекты минерало-
кортикоидов 283
6.3.1.2. Регуляция секреции и физиологические эффекты глюкокорти-
коидов 286
6.3.1.3. Регуляция секреции и физиологические эффекты половых
стероидов коры надпочечников 290
6.3.2. Гормоны мозгового вещества надпочечников и их эффекты в
организме 290
6.4. Регуляторные функции гормонов щитовидной железы 291
6.4.1. Регуляция секреции и физиологические эффекты йодсодержа-
щих тиреоидных гормонов 292
6.4.2. Регуляция секреции и физиологические эффекты кальцитони-
на 295
6.5. Регуляторные функции гормона околощитовидных желез 296
6.6. Регуляторные функции гормонов эпифиза 297
6.7. Регуляторные функции гормонов эндокринных тканей в органах,
обладающих неэндокринными функциями 299
6.7.1. Регуляторные функции гормонов поджелудочной железы . . . 299
6.7.1.1. Физиологические эффекты инсулина 301
6.7.1.2. Физиологические эффекты глюкагона 304
6.7.2. Регуляторные функции гормонов половых желез 304
6.7.2.1. Гормоны семенников и их эффекты в организме 305
6.7.2.2. Гормоны яичников и их эффекты в организме 305
6.8. Регуляторные функции гормонов клеток, сочетающих выработку
гормонов и неэндокринные функции 306
6.8.1. Регуляторные функции гормонов плаценты 306
6.8.2. Регуляторные функции гормонов тимуса 307
6.8.3. Регуляторные функции гормонов почек 307
6.8.3.1. Синтез, секреция и физиологические эффекты кальцитриола 307
6.8.3.2. Образование ренина и основные функции ренин-ангиотен-
зин-альдостероновой системы 310
6.8.4. Регуляторные эффекты гормонов сердца 312
6.8.5. Регуляторная функция гормонов сосудистого эндотелия ... 313
6.8.6. Регуляторная функция гормонов желудочно-кишечного тракта
314
6.9. Роль эндокринной системы в неспецифических приспособительных
реакциях 315
6.9.1. Гормональное обеспечение общего адаптационного синдрома,
или стресса 315
6.9.2. Гормональная регуляция местных компенсаторных реакций . 317
/// ФУНКЦИИ СИСТЕМ ЖИЗНЕОБЕСПЕЧЕНИЯ ОРГАНИЗМА
Глава 7 Функции клеток крови. Гемостаз. Регуляция кроветворения. Основы транс-
фузнологии 322
7.1. Функции эритроцитов 322
7.1.1. Функции и свойства эритроцитов 322
918 • Оглавление
7.1.2. Гемоглобин 324
7.1.3. Старение и разрушение эритроцитов в организме 326
7.1.4. Роль ионов железа в эритропоэзе 327
7.1.5. Эритропоэз 329
7.1.6. Регуляция эритропоэза 330
7.2. Лейкоциты 331
7.2.1. Функции нейтрофильных гранулоцитов 331
7.2.2. Функции базофильных гранулоцитов 334
7.2.3. Функции эозинофильных лейкоцитов 335
7.2.4. Функции моноцитов-макрофагов 336
7.2.5. Регуляция грануло- и моноцитопоэза 337
7.3. Функции тромбоцитов 337
7.3.1. Структура и функции тромбоцитов 337
7.3.2. ТроМбоцитопоэз и его регуляция 339
7.4. Механизмы свертывания крови (гемостаза) 341
7.4.1. Тромбоцитарный гемостаз 341
7.4.2. Система свертывания крови 341
7.4.3. Противосвертывающие механизмы крови 345
7.4.4. Фибринолиз 348
7.5. Общие закономерности кроветворения 349
7.5.1. Кроветворные клетки-предшественницы 349
7.5.2. Регуляция пролиферации и дифференциации КОК 352
7.5.3. Роль стромы гемопоэтических органов в регуляции
кроветворения 354
7.5.4. Регуляция выхода форменных элементов крови из костного
мозга в кровеносное русло 355
7.5.5. Особенности метаболизма кроветворной ткани 356
7.6. Роль витаминов и микроэлементов в кроветворении 357
7.7. Основы трансфузиологии 358
7.7.1. Группы крови 358
7.7.2. Влияние переливаемой крови и ее компонентов на организм
человека 361
Глава 8 Иммунная система 363
8.1. Происхождение и функции клеток иммунной системы 364
8.1.1. Т-лимфоциты 365
8.1.1.1. Характеристики Т-лимфоцитов 365
8.1.1.2. Субпопуляции Т-лимфоцитов 367
8.1.1.3. Функции Т-лимфоцитов 368
8.1.2. В-лимфоциты 368
8.1.2.1. Характеристики В-лимфоцитов 368
8.1.2.2. Функции В-лимфоцитов 369
8.1.3. Антигенпредставляющие клетки 370
8.2. Структура и функции органов иммунной системы 370
8.2.1. Костный мозг 370
8.2.2. Тимус (вилочковая железа) 372
8.2.3. Селезенка 374
8.2.4. Лимфатические узлы 375
8.2.5. Ассоциированная со слизистыми оболочками лимфоидная
ткань (мукозно-ассоциированная лимфоидная ткань) 375
8.3. Стадии и формы иммунного ответа 376
8.3.1. Ранний защитный воспалительный ответ 376
8.3.2. Представление и распознавание антигена 378
8.3.3. Активация Т- и В-лимфоцитов в иммунном ответе 379
8.3.4. Клеточный иммунный ответ 380
8.3.5. Гуморальный иммунный ответ 381
8.3.6. Иммунологическая память как форма специфического
иммунного ответа 383
8.3.7. Иммунологическая толерантность 383
8.4. Механизмы, контролирующие иммунную систему 383
8.4.1. Гормональный контроль 383
8.4.3. Цитокиновый контроль 385
Оглавление • 919
Глава 9 Функции систем кровообращения и лимфообращения 387
9.1. Система кровообращения 387
9.1.1. Функциональные классификации системы кровообращения . 387
9.1.2. Общая характеристика движения крови по сосудам 389
9.1.3. Системная гемодинамика 391
9.1.3.1. Системное артериальное давление 392
9.1.3.2. Общее периферическое сопротивление сосудов 393
9.1.3.3. Сердечный выброс 394
9.1.3.4. Частота сердечных сокращений (пульс) 397
9.1.3.5. Работа сердца 397
9.1.3.6. Сократимость 397
9.1.3.6.1. Автоматизм и проводимость миокарда 398
9.1.3.6.2. Мембранная природа автоматии сердца 399
9.1.3.6.3. Возбудимость сердечной мышцы 401
9.1.3.6.4. Сопряжение возбуждения и сокращения миокарда . 403
9.1.3.6.5. Сердечный цикл и его фазовая структура 405
9.13.6.6. Механические, электрические и физические
проявления деятельности сердца 407
9.1.3.6.7. Общие принципы регуляции сердечного выброса . 412
9.1.3.6.8. Нейрогенная регуляция деятельности сердца . . . . 415
9.1.3.6.9. Механизмы адренергической и холинергической
регуляции деятельности сердца 417
9.1.3.6.10. Гуморальные влияния на сердце 420
9.1.3.7. Венозный возврат крови к сердцу 421
9.1.3.8. Центральное венозное давление 425
9.1.3.9. Объем циркулирующей крови 426
9.1.3.10. Соотношение основных параметров системной гемодинамики 427
9.1.4. Общие закономерности органного кровообращения 432
9.1.4.1. Функционирование органных сосудов 432
9.1.4.2. Нервные и гуморальные влияния на органные сосуды .... 438
9.14.3. Роль эндотелия сосудов в регуляции их просвета 442
9.1.5. Особенности кровоснабжения органов и тканей 442
9.1.5.1. Головной мозг 442
9.1.5.2. Миокард 444
9.1.5.3. Легкие 445
9.1.5.4. Желудочно-кишечный тракт (ЖКТ) 446
9.1.5.5. Главные пищеварительные железы 448
9.1.5.6. Печень 448
9.1.5.7. Кожа 450
9.1.5.8. Почка 451
9.1.5.9. Скелетные мышцы 452
9.1.5.10. Сопряженные функции сосудов 453
9.1.6. Микроциркуляция (микрогемодинамика) 453
9.1.7. Центральная регуляция кровообращения 456
9.1.7.1. Рефлекторная регуляция кровообращения 457
9.1.7.2. Спинальный уровень регуляции 457
9.1.7.3. Бульварный уровень регуляции 458
9.1.7.4. Гипоталамические влияния 460
9.1.7.5. Участие лимбических структур 461
9.1.7.6. Кортикальные влияния 462
9.1.7.7. Общая схема центральной регуляции 462
9.2. Лимфообращение 463
9.2.1. Лимфатические сосуды 465
9.2.2. Лимфатические узлы 465
9.2.3. Лимфоток 466
9.2.4. Нервные и гуморальные влияния 466
Глава 10 Функции дыхательной системы 469
10.1. Внешнее дыхание 470
10.1.1. Биомеханика дыхания 470
10.1.1.1. Биомеханика вдоха 470
10.1.1.2. Биомеханизм выдоха 471
10.1.2. Изменение объема легких во время вдоха и выдоха 472
10.1.2.1. Функция внугриплеврального давления 472
10.1.2.2. Легочные объемы воздуха в течение фаз дыхательного цикла . 474
10.1.3. Факторы, влияющие на легочный объем в фазу вдоха 476
10.1.3.1. Растяжимость легочной ткани 476
920 • Оглавление
10.1.3.2. Поверхностное натяжение слоя жидкости в альвеолах .... 477
10.1.3.3. Сопротивление дыхательных путей 479
10.1.3.4. Зависимость «поток—объем» в легких 480
10.1.4. Работа дыхательных мышц в течение дыхательного цикла ... 481
10.2. Вентиляция и перфузия кровью легких 483
10.2.1. Вентиляция легких 483
10.2.2. Перфузия легких кровью 485
10.2.3. Эффект фавитации на вентиляцию и перфузию легких кровью 485
10.2.3. Коэффициент вентиляционно-перфузионных отношений в
легких 487
10.3. Газообмен в легких 487
10.3.1. Состав альвеолярного воздуха 488
10.3.2. Напряжение газов в крови капилляров легких 489
10.3.3. Скорость диффузии 02 и С02 в легких 489
10.4. Транспорт газов кровью 491
10.4.1. Транспорт кислорода 492
10.4.1.1. Изменение сродства гемоглобина к кислороду 493
10.4.2. Транспорт углекислого газа 495
10.4.2.1. Роль эритроцитов в транспорте С02 495
10.5. Регуляция дыхания 497
10.5.1. Дыхательный центр 498
10.5.1.1. Происхождение дыхательного ритма 500
10.5.2. Влияние нервных центров варолиева моста на дыхательный
ритм 501
10.5.3. Функция спинальных дыхательных мотонейронов 502
10.5.4. Рефлекторная регуляция дыхания 502
10.5.4.1. Хеморецепторный контроль дыхания 502
10.5.4.2. Механорецепторный контроль дыхания 503
10.6. Дыхание при физической нафузке 505
10.7. Дыхание человека при измененном барометрическом давлении
воздуха 507
10.7.1. Дыхание человека при пониженном давлении воздуха 507
10.7.2. Дыхание человека при повышенном давлении воздуха .... 509
Глава 11 Функции пищеварительной системы 511
11.1. Состояние голода и насыщения 511
11.2. Общая характеристика функций пищеварительной системы и
механизмов ее регуляции 512
11.2.1. Секреторная функция 512
11.2.2. Моторная функция 517
11.2.3. Функция всасывания 519
11.2.4. Общая характеристика механизмов регуляции функций
пищеварительной системы 523
11.3. Периодическая деятельность пищеварительной системы 526
11.4. Пищеварение в ротовой полости и функция глотания 528
11.4.1. Ротовая полость 528
11.4.2. Слюноотделение 528
11.4.3. Жевание 531
11.4.4. Глотание 532
11.5. Пищеварение в желудке 533
11.5.1. Секреторная функция желудка 534
11.5.2. Регуляция секреции желудочного сока 538
11.5.2.1. Фазы желудочной секреции 539
11.5.3. Сократительная деятельность мускулатуры желудка 541
11.5.3.1. Регуляция сократительной деятельности желудка 542
11.5.3.2. Эвакуация содержимого желудка в двенадцатиперстную кишку 543
11.6. Пищеварение в двенадцатиперстной кишке 543
11.6.1. Пищеварительные функции поджелудочной железы 544
11.6.1.1. Состав и свойства панкреатического сока 544
11.6.1.2. Нервная и гуморальная регуляция секреторной функции
поджелудочной железы 545
11.6.2. Пищеварительные функции печени 546
11.6.2.1. Механизм образования желчи 546
Оглавление • 921
11.6.2.2. Состав и свойства желчи 546
11.6.2.3. Регуляция желчеобразования и желчевыведения 547
11.6.3. Непищеварительные функции печени 548
11.7. Пищеварение в тонком кишечнике 548
11.7.1. Секреторная функция тонкой кишки 548
11.7.1.1. Регуляция секреторной функции тонкой кишки 550
11.7.2. Двигательная функция тонкой кишки 550
11.7.2.1. Регуляция моторики тонкой кишки 551
11.7.3. Функция всасывания тонкой кишки 553
11.8. Пищеварение в толстом кишечнике 556
11.8.1. Перемещение химуса из тощей кишки в слепую 557
11.8.2. Сокоотделение в толстом кишечнике 557
11.8.3. Двигательная активность толстого кишечника 557
11.8.4. Роль микрофлоры толстой кишки в процессе пищеварения и
формировании иммунологической реактивности организма . . 558
11.8.5. Акт дефекации 560
11.8.6. Иммунная система пищеварительного тракта 561
11.8.7. Тошнота и рвота 561
Глава 12 Обмен веществ и энергии. Питание 563
12.1. Роль белков, жиров, углеводов, минеральных веществ и витаминов в
метаболизме 564
12.1.1. Белки и их роль в организме 564
12.1.2. Липиды и их роль в организме 565
12.1.2.1. Клеточные липиды 566
12.1.2.2. Бурый жир 566
12.1.2.3. Липиды плазмы крови 566
12.1.3. Углеводы и их роль в организме 567
12.1.4. Минеральные вещества и их роль в организме 568
12.1.5. Вода и ее роль в организме — см. раздел 14.3. Водно-солевой
обмен 570
12.1.6. Витамины и их роль в организме 570
12.2. Роль обмена веществ в обеспечении энергетических потребностей
организма 572
12.2.1. Способы оценки энергетических затрат организма 574
12.3. Обмен веществ и энергии при различных уровнях функциональной
активности организма 575
12.3.1. Основной обмен 575
12.3.2. Энергетические затраты организма в условиях физической
нагрузки 577
12.4. Регуляция обмена веществ и энергии 578
12.5. Питание 584
12.5.1. Рациональное питание как фактор сохранения и укрепления
здоровья 589
Глава 13 Температура тела и ее регуляция 592
13.1. Нормальная температура тела 593
13.2. Теплопродукция и теплоотдача 594
13.2.1. Теплопродукция 595
13.2.2. Теплоотдача 596
13.2.3. Поведенческая терморегуляция 598
13.3. Регуляция температуры тела 598
13.3.1. Восприятие организмом температурных воздействий
(терморецепция) 598
13.3.2. Центральное звено системы терморегуляции 599
13.3.3. Эффекторное (исполнительное) звено системы
терморегуляции 601
13.4. Гипертермия и гипотермия 603
13.5. Взаимодействие системы терморегуляции с другими
физиологическими системами организма 604
13.5.1. Сердечно-сосудистая система и терморегуляция 604
13.5.2. Водно-солевой баланс и терморегуляция 604
13.5.3. Дыхание и терморегуляция 605
922 • Оглавление
Глава 14 Выделение. Функции почек. Водно-солевой обмен 606
14.1. Органы и процессы выделения 606
14.1.1. Выделительная функция кожи 606
14.1.2. Выделительная функция печени и пищеварительного тракта . 608
14.1.3. Выделительная функция легких и верхних дыхательных путей 608
14.2. Функции почек 609
14.2.1. Механизмы мочеобразования 610
14.2.1.1. Клубочковая ультрафильтрация и ее регуляция 614
14.2.1.2. Канальцевая реабсорбция и ее регуляция 619
14.2.1.3. Канальцевая секреция и ее регуляция 630
14.2.1.4. Состав и свойства конечной мочи 631
14.2.1.5. Механизмы выведения мочи и мочеиспускания 631
14.2.2. Экскреторная функция почек 632
14.2.3. Метаболическая функция почек 632
14.2.4. Роль почек в регуляции артериального давления 633
14.3. Водно-солевой обмен 634
14.3.1. Внешний водный баланс организма 634
14.3.2. Внутренний водный баланс организма 636
14.3.3. Электролитный, или солевой, баланс организма 636
14.3.4. Общие принципы регуляции водно-солевого обмена 638
14.4. Интегративные механизмы регуляции водно-солевого обмена и го-
меостатическая функция почек 639
14.4.1. Гомеостатические механизмы при гиперосмотической
дегидратации 640
14.4.2. Гомеостатические механизмы при изоосмотической
дегидратации 645
14.4.3. Гомеостатические механизмы при гипоосмотической
дегидратации 645
14.4.4. Гомеостатические механизмы при гипоосмотической
гипергидратации 646
14.4.5. Гомеостатические механизмы при изоосмотической
гипергидратации 647
14.4.6. Гомеостатические механизмы при гиперосмотической
гипергидратации 647
14.4.7. Нарушения баланса электролитов 648
Глава 15 Кислотно-основное состояние 649
15.1. Кислоты и основания внутренней среды 649
15.2. Физико-химические гомеостатические механизмы 651
15.2.1. Буферные системы внутренней среды организма 651
15.2.2. Тканевые гомеостатические обменные процессы 654
15.3. Физиологические гомеостатические механизмы 655
15.3.1. Легкие и кислотно-основное состояние 655
15.3.2. Почки и кислотно-основное состояние 656
15.3.3. Желудочно-кишечный тракт, печень, костная ткань и
кислотно-основное состояние 659
15.4. Основные физиологические показатели кислотно-основного
состояния 660
15.5. Основные изменения кислотно-основного состояния и их
компенсация 661
15.5.1. Функциональное значение ацидозов и алкалозов 662
15.5.2. Дыхательный ацидоз 663
15.5.3. Недыхательный ацидоз 664
15.5.4. Дыхательный алкалоз 665
15.5.5. Недыхательный алкалоз 666
15.5.6. Общие закономерности компенсации нарушений кислотно-
основного состояния 667
Глава 16 Репродуктивная функция человека 668
16.1. Половая дифференциация человека 669
16.1.1. Генетический пол 670
16.1.2. Гонадный пол 670
16.1.3. Фенотипический пол 671
Оглавление • 923
16.2. Репродуктивная функция мужского организма 672
16.2.1. Функции семенников 672
16.2.2. Сперматогенез 674
16.2.3. Гормональная регуляция сперматогенеза 675
16.2.4. Мужской половой акт 678
16.2.4.1. Стадии мужского полового акта 678
16.2.4.2. Регуляция эякуляции 681
16.2.4.3. Оргазм 682
16.3. Репродуктивная функция женского организма 682
16.3.1. Овариальный цикл и оогенез 683
16.3.1.1. Фолликулярная фаза 683
16.3.1.2. Овуляторная фаза 685
16.3.1.3. Лютеальная фаза 686
16.3.1.4. Лютеолиз желтого тела 686
16.3.2. Менструальный цикл (маточный цикл) 687
16.3.2.1. Менструальная фаза 687
16.3.2.2. Пролиферативная фаза 688
16.3.2.3. Секреторная фаза 688
16.3.3. Женский половой акт 688
16.4. Оплодотворение (фертилизация) 690
16.5. Имплантация оплодотворенной яйцеклетки 692
16.6. Беременность 692
16.6.1. Функции плаценты 693
16.6.2. Плацентарные гормоны 695
16.7. Роды и лактация 697
16.7.1. Роды 697
16.7.2. Лактация 699
Глава 17 Сенсорные системы 702
17.1. Общая физиология сенсорных систем 703
17.1.1. Классификации рецепторов 703
17.1.2. Преобразование энергии раздражителя в рецепторах 704
17.1.3. Рецептивные поля 706
17.1.4. Переработка информации в переключательных ядрах и
проводящих путях сенсорной системы 707
17.1.5. Субъективное сенсорное восприятие 710
17.2. Соматовисцеральная сенсорная система 711
17.2.1. Тактильная чувствительность 711
17.2.2. Проприоцептивная чувствительность 713
17.2.3. Температурная чувствительность 714
17.2.4. Болевая чувствительность 715
17.2.5. Висцеральная чувствительность 717
17.3. Зрительная сенсорная система 717
17.3.1. Проецирование световых лучей на сетчатку глаза 718
17.3.1.1. Аккомодация 718
17.3.1.2. Аномалии рефракции 719
17.3.1.3. Регуляция интенсивности светового потока 720
17.3.1.4. Проекция зрительного поля на сетчатку 720
17.3.1.5. Движения глаз 722
17.3.2. Преобразование энергии света в сетчатке 722
17.3.2.1. Скотопическая и фотопическая системы сетчатки 723
17.3.2.2. Рецепторный потенциал палочек и колбочек 725
17.3.2.3. Адаптация фоторецепторов к изменениям освещенности . . . 725
17.3.3. Рецептивные поля клеток сетчатки 726
17.3.3.1. Рецептивные поля с on-центрами и off-центрами 726
17.3.3.2. Рецептивные поля цветового восприятия 728
17.3.3.3. М- и Р-типы ганглиозных клеток сетчатки 729
17.3.4. Проводящие пути и переключательные центры зрительной
системы 730
17.3.4.1. Функциональная организация латерального коленчатого тела 730
17.3.5. Переработка зрительной сенсорной информации в коре ... 731
17.3.5.1. Зрительное восприятие 733
17.4. Слуховая сенсорная система 733
17.4.1. Психофизические характеристики звуковых сигналов 734
924 • Оглавление
17.4.1.1. Диапазон частотного восприятия 735
17.4.1.2. Громкость звука 735
17.4.2. Периферическая часть слуховой системы 736
17.4.2.1. Функция наружного уха 736
17.4.2.2. Функция среднего уха 736
17.4.2.3. Внутреннее ухо 738
17.4.2.4. Функция внутреннего уха 738
17.4.2.5. Биоэлектрические процессы в кортиевом органе 739
17.4.2.6. Частотное кодирование 739
17.4.2.7. Кодирование сенсорной информации в окончаниях слухового
нерва 740
17.4.3. Проводящие пути и переключательные ядра слуховой системы 741
17.4.4. Переработка сенсорной информации в слуховой коре 742
17.5. Вестибулярная сенсорная система 743
17.5.1. Вестибулярный аппарат 743
17.5.1.1. Свойства рецепторных клеток вестибулярного аппарата . . . 744
17.5.1.2. Адекватные раздражители рецепторов отолитовых органов . . 745
17.5.1.3. Адекватные раздражители рецепторов полукружных каналов . 746
17.5.2. Центральная часть вестибулярной системы 746
17.6. Вкусовая сенсорная система 747
17.6.1. Вкусовая рецепция 747
17.6.1.1. Рецепторные потенциалы вкусовых клеток 748
17.6.1.2. Вкусовая чувствительность 748
17.6.2. Центральный отдел вкусовой системы 749
17.6.3. Вкусовое восприятие 750
17.7. Обонятельная сенсорная система 750
17.7.1. Классификация запахов 751
17.7.2. Периферический отдел обонятельной системы 751
17.7.2.1. Механизм возбуждения обонятельных клеток 752
17.7.3. Центральный отдел обонятельной системы 753
17.7.4. Физиологическая роль обоняния у человека 754
17.7.4.1. Физиологические реакции на запахи 754
17.7.4.2. Способность к восприятию феромонов у человека 754
IV ИНТЕГРАТИВНЫЕ ФУНКЦИИ ОРГАНИЗМА
Глава 18 Высшая нервная деятельность (по И. П. Павлову) 757
18.1. Классические условные рефлексы 758
18.1.1. Условия, влияющие на ассоциативное научение 760
18.1.2. Рефлекторная дуга классического условного рефлекса 761
18.1.3. Стадии формирования условного рефлекса 762
18.1.4. Условные рефлексы высшего порядка 762
18.1.5. Виды классических условных рефлексов 763
18.2. Торможение условных рефлексов 763
18.2.1. Внешнее торможение 764
18.2.2. Внутреннее торможение 764
18.2.2.1. Угасательное торможение 764
18.2.2.2. Запаздывающее торможение 765
18.2.2.3. Дифференцировочное торможение 766
18.2.2.4. Условное торможение 766
18.3. Оперантный условный рефлекс 767
18.4. Аналитико-синтетическая деятельность коры больших полушарий . . 768
18.5. Динамический стереотип 768
18.6. Фазовые явления в коре больших полушарий головного мозга .... 769
18.7. Типология высшей нервной деятельности 771
Глава 19 Мотивации и эмоции 773
19.1. Мотивации 773
19.1.1. Понятие о первичных и вторичных мотивациях 773
19.1.2. Понятие о мотивациях влечения и избегания 774
19.1.3. Пищевая мотивация человека 774
19.1.3.1. Гомеостатические механизмы регуляции пищевой мотивации у
человека 774
19.1.3.2. Роль структур продолговатого мозга в регуляции пищевой
мотивации 777
Оглавление • 925
19.1.3.3. Роль латерального гипоталамуса в возникновении пищевой
мотивации 778
19.1.3.4. Роль меланокортиновой системы гипоталамуса в прекращении
пищевой мотивации 778
19.1.3.5. Роль лимбической системы в регуляции пищевой мотивации у
человека 779
19.1.4. Половая мотивация человека 780
19.1.4.1. Генетические, социальные и психологические факторы
возникновения половой мотивации у человека 780
19.1.4.2. Роль половых гормонов в модуляции половой мотивации
человека 784
19.1.4.3. Стадии полового возбуждения у человека при половой
мотивации 785
19.1.4.4. Нервная регуляция половой мотивации у человека 787
19.2. Эмоции 789
19.2.1. Виды эмоций 789
19.2.2. Роль эмоций в поведении человека 790
19.2.3. Нейрофизиологические механизмы проявления эмоций .... 791
19.2.3.1. Гипоталамус как центр регуляции вегетативных и
эндокринных реакций организма при эмоциях 791
192.3.2. Роль миндалины в осуществлении базовых эмоций 792
19.2.3.3. Регуляция положительных эмоций у человека 796
19.2.3.4. Регуляция отрицательных эмоций у человека 798
Глава 20 Физиологические основы познавательной деятельности человека 800
20.1. Внимание 801
20.1.1. Формы внимания 802
20.1.2. Нейрофизиологические механизмы внимания 803
20.1.2.1. Функции среднего мозга и моста в контроле внимания . . . 803
20.1.2.2. Функции корковых центров внимания 805
20.1.3. Внимание при различных модальностях 808
20.2. Восприятие 809
20.2.1. Зрительное восприятие 809
20.2.1.1. Функции стриарной коры в зрительном восприятии 809
20.2.1.2. Зрительное восприятие при участии отделов экстрастриарной
коры 810
20.2.1.3. Особенности зрительного восприятия индивидуальных лиц и
объектов 811
20.2.2. Слуховое восприятие 812
20.2.3. Соматосенсорное восприятие 812
20.3. Сознание 813
20.3.1. Нейрофизиологические корреляты сознания 814
20.3.1.1. Электрическая активность мозга человека 814
20.3.1.2. Активация мозга человека как нейрофизиологическая основа
проявлений состояний сознания 814
20.3.1.3. Осознание зрительного восприятия (зрительная
осведомленность) 817
20.3.1.4. Внимание и сознание 817
20.4. Память и научение 817
20.4.1. Формы памяти и научения 818
20.4.2. Нейронные механизмы имплицитной памяти 820
20.4.2.1. Габитуация и сенситизация 820
20.4.2.2. Ассоциативное научение (условные рефлексы) 822
20.4.3. Механизм образования эксплицитной памяти 823
20.5. Речь 824
20.5.1. Свойства языка 824
20.5.2. Речевой аппарат 825
20.5.3. Речевые структуры мозга 826
20.5.3.1. Нарушения речи при очаговых повреждениях мозга 826
20.5.3.2. Модель речевой деятельности Вернике—Гешвинда 827
20.5.3.3. Современная модель речевой деятельности человека 828
20.5.3.4. Латерализация речи 829
20.6. Мышление 831
20.6.1. Нейрофизиологические основы мыслительной деятельности
человека 832
926 • Оглавление
20.6.1.1. Нейрофизиологические основы абстрактного мышления
(рассуждение человека) 833
20.6.1.2. Нейрофизиологические основы умственных арифметических
операций 833
20.6.1.3. Нейрофизиологические основы мышления при чтении . . . 834
20.6.2. Функции левого и правого полушарий мозга человека при
мышлении 834
Глава 21 Сон и бодрствование 836
21.1. Физиологическое значение сна 836
21.1.1. Восстановительная теория сна 836
21.1.2. Циркадианная теория сна 837
21.2. Периодичность физиологических процессов во время сна 838
21.2.1. Стадии сна 839
21.2.2. Структура сна 841
21.2.3. Фаза медленноволнового сна 842
21.2.4. Фаза парадоксального сна 843
21.3. Нейрофизиологические механизмы сна 845
21.3.1. Участие стволовых центров в регуляции цикла
сна—бодрствования 845
21.3.2. Регуляция циркадного ритма 847
21.3.3. Участие коры и лимбической системы в регуляции цикла сна-
бодрствования 848
21.3.4. Гуморальные индукторы и регуляторы сна 849
21.4. Сновидения и физиологическая роль БДГ-сна 850
21.5. Продолжительность сна и последствия его лишения 851
21.6. Бодрствование и сознание 853
21.7. Различные уровни бодрствования 854
Глава 22 Физиологические основы труда 856
22.1. Образование энергии в скелетных мышцах при физической работе . 857
22.1.1. Анаэробный путь ресинтеза АТФ 857
22.1.2. Аэробный гликолиз 858
22.1.3. «Кислородный каскад» и эффективность транспорта
кислорода к работающим мышцам 861
22.1.4. Потребление кислорода, кислородный дефицит, кислородный
долг и кислородный запрос при мышечной работе 862
22.2. Физиологические основы тренировки двигательного навыка 864
22.2.1. Развитие силовых качеств мышц 864
22.2.2. Физиологические механизмы формирования трудовых
навыков 865
22.2.3. Работоспособность 868
22.3. Функции физиологических систем организма человека при
физической работе 868
22.3.1. Кровообращение 869
22.3.2. Кровь 870
22.3.3. Дыхание 870
22.3.4. Эндокринная система 870
22.4. Физиологические функции при умственном труде 872
22.5. Работа в условиях зрительного напряжения 873
22.6. Утомление при работе 873
22.6.1. Утомление человека при физической работе 874
22.6.1.1. Утомление человека при статической физической работе . . 875
22.6.1.2. Утомление человека при динамической мышечной работе . . 877
Глава 23 Адаптация человека к условиям внешней среды 879
23.1. Общие принципы и механизмы адаптации 879
23.1.1. Адаптация 879
23.1.2. Неспецифические адаптивные реакции организма 881
23.1.3. Симпатоадреналовая реакция 882
23.1.4. Стресс-реакция 883
23.1.5. Реакция тренировки и реакция активации 886
23.1.6. Срочная и долговременная адаптация 886
23.1.7. Норма адаптивной реакции и дизадаптации 888
Оглавление • 927
23.1.8. Генотипическая и фенотипическая адаптация. Покрывающие
адаптации 888
23.1.9. Обратимость процессов адаптации 889
23.2. Адаптация человека к климатическим факторам 889
23.2.1. Биоклиматические факторы жаркого климата 889
23.2.2. Адаптивные реакции организма человека к жаркой среде
обитания 891
23.2.3. Особенности адаптации человека к работе в жаркой среде . . 895
23.2.4. Предупреждение тепловых поражений организма 897
Предметный указатель 900