Author: Амосова Е.Н.
Tags: патология сердечно-сосудистой системы сердечно-сосудистые заболевания внутренние болезни медицина кардиология
ISBN: 5-311-00891-1
Year: 1998
Text
Е.Н. АМОСОВА
КЛИНИЧЕСКАЯ
КАРДИОЛОГИЯ
В ДВУХ ТОМАХ
ТОМ I
КИ№ «ЗДОРОВ’Я»
«КНИГА-ПЛЮС»
1998
ББК 54.101
А62
УДК 616.1
Амосова Екатерина Николаевна - доктор медицинских наук, профес-
сор, заведующая кафедрой госпитальной терапии № 1 Национального ме-
дицинского университета им. акад. А.А.Богомольца.
В книге изложены современные сведения об этиологии, патогенезе,
клинике, диагностике, лечении и профилактике ряда заболеваний сер-
дечно-сосудистой системы — пороков сердца, атеросклероза, ишемичес-
кой болезни сердца, артериальной гипертензии, сердечной недостаточно-
сти, болезней малого круга кровообращения, перикардитов. Освещение
вопросов клинической кардиологии базируется на кратком изложении ос-
новных положений фундаментальных дисциплин — анатомии, биохимии,
нормальной и патологической физиологии, касающихся сердечно-сосуди-
стой системы. В отдельных разделах представлены основные сведения о
клинических и современных инструментальных методах исследования и
их диагностическом значении, а также клинической фармакологии лекар-
ственных средств, применяемых в кардиологии.
Для кардиологов и терапевтов.
У книз! викладено сучасн! дан! про етюлопю, патогенез, клппку, д!аг-
ностику, лжування та профилактику ряду захворювань серцево-судинно!
системи — вад серия, атеросклерозу, 1шем1чно! хвороби серия, артер!аль-
Hoi ппертензп, серцево! недостатност!, хвороб малого кола кровообиу,
перикардиев. Висвплення питань Kjiini4no'i кардюлогп грунтуеться на ко-
роткому виклад! основних положень фундаментальних дисциплш — ана-
томп, 6ioxiMii, нормально! та патолопчно! ф|з1ологв, шо стосуються сер-
цево-судинно! системи. В окремих роздшах подано основш вщомосе про
клинчи! та сучасн! шструменталып методи дослщження та ix д!агностичне
значения, а також про кл1шчну фармаколопю л!карських засоб!в, шо
застосовуються в кардюлогп.
Для кардюлопв та терапевев.
Рецензент - д-р мед.наук, проф. Я.А.Бецдет
, 4108040100-009 , t
А-----209-97-----« Форм, лист
ISBN 5-311-00891-1
© К.М.Амосова,
1997
СПИСОК СОКРАЩЕНИЙ
АД — артериальное давление
АДФ - аденозиндифосфорная кислота
АЛТ — аланинаминотрансфераза
АпексКГ — апекскардиограмма
АПФ — ангиотензин II превращающий фермент
ACT — аспартатаминотрансфераза
АТФ — аденозинтрифосфорная кислота
БРИТ — блок реанимации и интенсивной терапии
ВПС — врожденные пороки сердца
ГЛП - гиперлипопротеинемия
ГМГ-КоА-редуктаза — p-гидрокси-р-метилглютарил —
коэнзим А-редуктаза
ИБС — ишемическая болезнь сердца
ИВЛ — искусственная вентиляция легких
КДД — конечно-диастолическое давление
КДО - конечно-диастолический объем
КСО — конечно-систолический объем
КФ — креатинфосфат
КФК — креатинфосфокиназа
КОС — кислотно-основное состояние
ЛДГ — лактатдегидрогеназа
ЛПВП — липопротеины высокой плотности
ЛПНП - липопротеины низкой плотности
ЛПОНП - липопротеины очень низкой плотности
ЛППП — липопротеины промежуточной плотности
ЛСС — легочное сосудистое сопротивление
МОС — минутный объем сердца
ОПСС — общее периферическое сосудистое сопротивление
3
ОЦК — объем циркулирующей крови
ОЦП — объем циркулирующей плазмы
ПД — потенциал действия
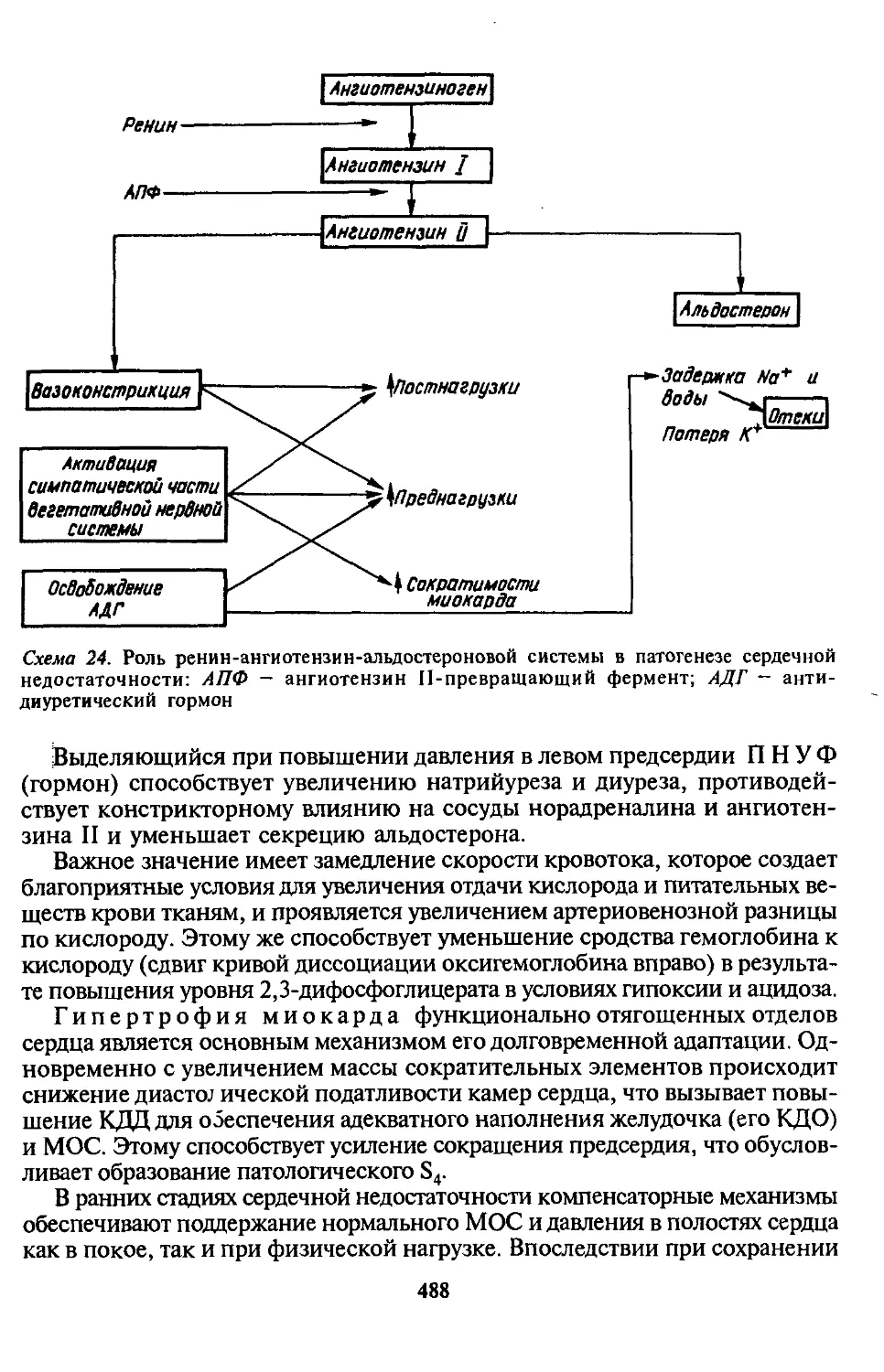
ПНУФ — предсердный натрийуретический фактор
ПП - потенциал покоя
РВГ — радионуклидная вентрикулография
СИ — сердечный индекс
ТАП - тканевый активатор плазминогена
ТЛАП — транслюминальная ангиопластика
ТЭВЛА — тромбоэмболия ветвей легочной артерии
УИ - ударный индекс
УОС - ударный объем сердца
ФВ — фракция выброса
ФКГ — фонокардиограмма
цАМФ — циклический аденозинмонофосфат
ЦВД — центральное венозное давление
ЧАТВ — частично активированное тромбопластиновое время
ЧСС - частота сердечных сокращений
ЭКГ — электрокардиограмма
ЭхоКТ - эхокардиограмма
VCF — средняя скорость циркулярного укорочения
мышечных волокон миокарда
Sp S2, S3, S4 ~ соответственно I, II, III и IV тоны сердца
акд — конечно-диастолическое стеночное напряжение
амс ~ максимальное систолическое стеночное напряжение
ОТАВТОРА
Заболевания сердечно-сосудистой системы являются самыми
распространенными в мире. Ими страдает около 3,5 % населения
земного шара. Занимая первое место среди причин потери трудо-
способности и смерти больных, они служат причинами более тре-
ти летальных исходов.
Современная теоретическая и практическая кардиология явля-
ется, пожалуй, наиболее быстро развивающейся отраслью меди-
цины в настоящее время. Последние годы ознаменовались дости-
жением значительных успехов в раскрытии патогенеза целого ряда
заболеваний и создании более совершенных методов их лечения,
внедрением в практику новых высокоинформативных методов ди-
агностики. Значительно возрос объем информации в периодических
изданиях, количество которых, особенно за рубежом, с каждым
годом резко возрастает. Все это обусловливает важность подго-
товки для практического врача нового руководства, в котором в
сжатом виде было бы обобщено современное состояние кардиоло-
гической науки и представлены четкие практические рекоменда-
ции. Эту цель мы преследовали при подготовке книги.
Для правильного распознавания и квалифицированного лечения
заболеваний сердца и сосудов необходимы фундаментальные зна-
ния основных вопросов клинической анатомии, биохимии, а также
нормальной и патологической физиологии этих органов на разных
уровнях — от системного до субклеточного и даже молекулярного.
Особенно важное значение имеют современные достижения клеточ-
ной физиологии и биохимии миокарда и мембран, которые служат
базой для понимания тонких процессов функционирования сердца и
механизмов действия многих фармакологических средств.
Большое внимание мы стремились уделить обоснованию подходов
5
к оценке функционального состояния сердечно-сосудистой систе-
мы, которые получили широкое распространение в клинике.
В разделе, посвященном методам исследования, сочетаются
сведения об основополагающих методах клинического обследования
больного и новых достижениях инструментальной диагностики в
области электрокардио- и допплерэхокардиографии и других ме-
тодов неинвазивной визуализации сердца (кинокомпьютерная то-
мография, ядерно-магнитный резонанс и др.). Показаны возмож-
ности широкого использования различных методов исследования
для количественной характеристики тех или иных функций сердца
в клинической практике.
В настоящее время инвазивные методы стали неотъемлемой
частью обследования кардиологических больных. Это обусловлива-
ет важность знакомства врачей с их диагностическими возмож-
ностями при всех основных заболеваниях сердца.
В книге рассматриваются основные вопросы этиологии, пато-
генеза, клиники, диагностики, лечения и профилактики части за-
болеваний системы кровообращения — врожденных и приобретен-
ных пороков сердца, атеросклероза, различных форм ИБС и сис-
темной артериальной гипертензии, сердечной недостаточности и
шока, заболеваний малого круга кровообращения —легочной гипер-
тензии, легочного сердца и тромбоэмболии ветвей легочной арте-
рии, а также перикардитов. Остальные заболевания (болезни мио-
и эндокарда, нарушения ритма и проводимости, болезни аорты и
периферических сосудов, опухоли сердца и др.) будут представлены
во втором томе. В него войдет также важный раздел дифферен-
циальной диагностики при основных симптомах и синдромах в кар-
диологической клинике - боли в грудной клетке, одышке, отеках,
кардиомегалии, шуме в сердце и др.
При изложении материала мы старались уделять большое вни-
мание анализу данных расспроса и клинического обследования боль-
ного, которые являются основополагающими для определения даль-
нейшей диагностической и лечебной тактики. При освещении ди-
агностических возможностей специальных методов исследования
при отдельных заболеваниях приведены количественные данные об
6
их информативности, что важно для оценки полученных резуль-
татов. Четко указаны основные критерии постановки диагноза
каждого из рассматриваемых заболеваний и его верификации.
Большое внимание уделяется вопросам лечения и профилакти-
ки с последовательным обсуждением немедикаментозных мето-
дов, средств медикаментозной терапии и хирургического лечения
(по показаниям). В каждом из разделов представлены сведения о
клинической фармакологии основных групп лекарственных препа-
ратов и их представителей с указанием синонимов и форм выпус-
ка, даны конкретные рекомендации в отношении дозировки и диф-
ференцированного применения отдельных препаратов при различ-
ных вариантах течения заболевания. Ценным и новым является
обсуждение результатов многоцентровых плацебоконтролируемых
исследований эффективности отдельных лекарственных средств
и методов лечения у многих тысяч больных в отношении их влия-
ния на выживаемость и развитие основных осложнений. Эти дан-
ные служат основой для современных рекомендаций по использо-
ванию тех или иных методов лечения в клинической практике. Боль-
шое внимание уделяется методам интервенционной кардиологии
— чрескожной транслюминальной ангиопластике, чрескожной бал-
лончиковой вальвулопластике, а также кардиохирургии, без кото-
рых сейчас немыслимо лечение многих сердечно-сосудистых забо-
леваний.
Изложение материала базируется на обобщении новых данных
мировой литературы и опыта клиники Кардиологического центра
Киева.
Мы надеемся, что эта книга окажется полезной для кардиоло-
гов и терапевтов, а также врачей-интернов и студентов стар-
ших курсов медицинских вузов, интересующихся кардиологией.
Автор с благодарностью примет все замечания и пожелания
читателей, направленные на улучшение книги.
ГЛАВА 1.
КЛИНИЧЕСКАЯ АНАТОМИЯ СЕРДЦА И СОСУДОВ
СЕРДЦЕ
Камеры сердца. Желудочки служат основными “насосами” серд-
ца. Они состоят из двух групп мышц: 1) внутренних и наружных
спиральных, сокращение которых приводит к укорочению про-
дольной оси камеры желудочков; 2) располагающихся между ними
констрикторных, которые вызывают укорочение желудочка по
поперечной оси. Первые преобладают в правом желудочке, а вто-
рые — в левом. Благодаря этому изгнание крови из левого желу-
дочка обеспечивается преимущественно укорочением попереч-
ного диаметра камеры, а из правого - укорочением по продоль-
ной оси.
Толщина стенки левого желудочка составляет 10—12 мм, пра-
вого - 2-6 мм.
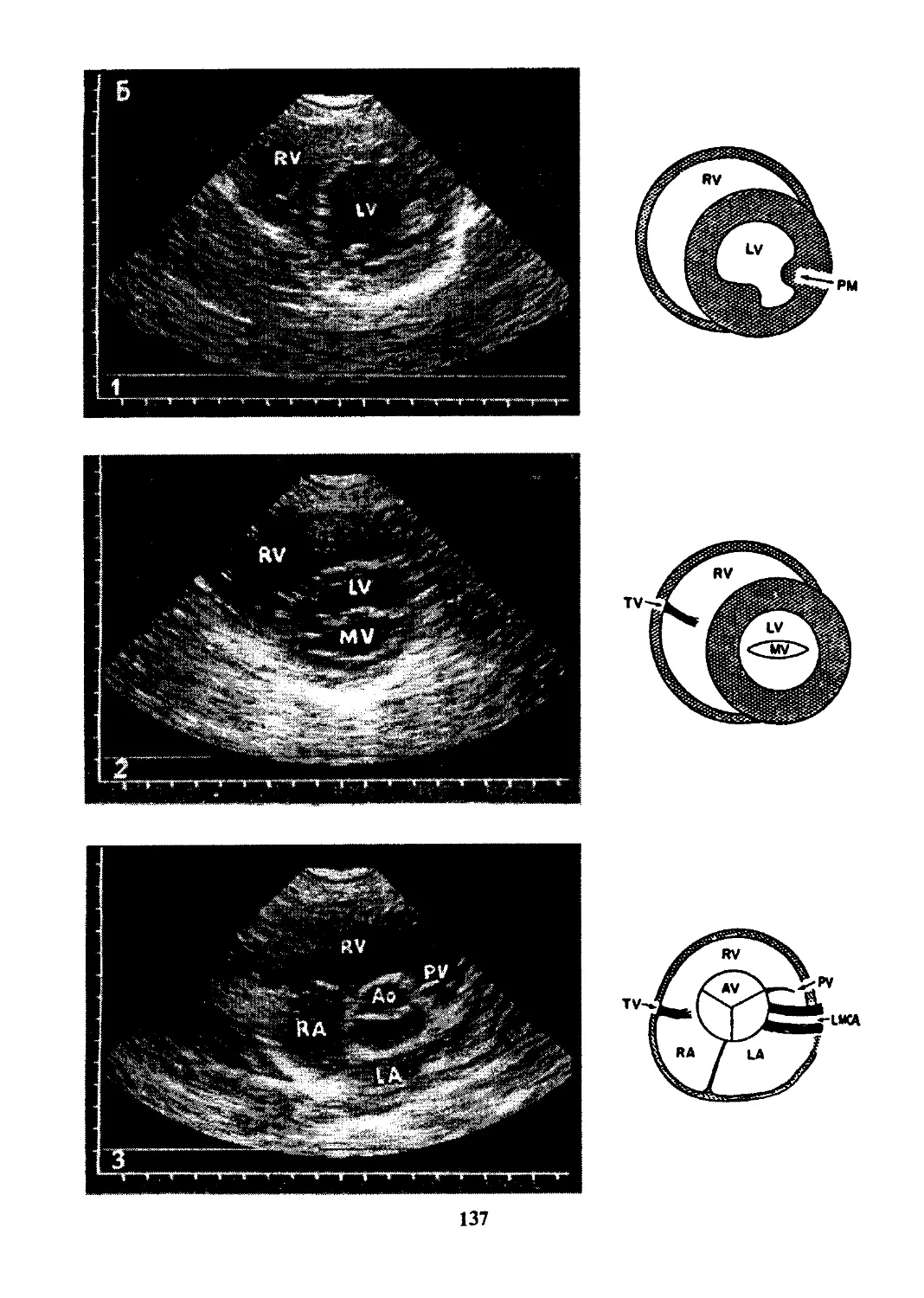
Форма желудочков в норме схематически представлена на
рис. 1 (Я). Камера правого желудочка представляет собой относи-
тельно узкое пространство между двумя широкими поверхно-
стями — межжелудочковой перегородкой и тонкой свободной
стенкой. Таким образом, правый желудочек имеет большую пло-
щадь поверхности на единицу объема, в силу чего он приспособ-
лен к перекачиванию относительно больших объемов крови про-
тив низкого сопротивления при относительно небольшом укоро-
чении мышцы. В отличие от этого, вследствие почти сферической
формы толстостенного левого желудочка, площадь его поверх-
ности на единицу объема невелика, что и определяет его функ-
ционирование как насоса высокого давления.
Поскольку свободная стенка правого желудочка приближает-
ся по своей форме к сегменту сферы с относительно большим
радиусом, желудочек может обеспечить значительное увеличе-
ние ударного объема за счет лишь относительно небольшого ра-
стяже' :ия своей камеры и удлинения отдельных мышечных во-
локон. В то же время, как следует из уравнения Лапласа для тон-
костенной сферы, Р=Т/г, давление (Р) определяется отноше-
нием стеночного напряжения (Т) к радиусу камеры (г). Отсюда
чем больше радиус сферы, тем большее стеночное напряжение
должны развить миокардиальные волокна для обеспечения
8
Рис. 1. Форма и относительные размеры правого и левого желудочков в
норме (А), при дилатации левого (Б) и гипертрофии правого (В)
желудочков: ЛЖ — левый желудочек; ПЖ - правый желудочек
данного давления. Очевидно, что нормальный правый желудочек, имеющий
исходно большой радиус, не в состоянии существенно повысить свое сте-
ночное напряжение, необходимое для сколько-нибудь значительного при-
роста внутриполостного давления. Таким образом, он способен хорошо пе-
реносить перегрузку объемом, но не в состоянии адекватно выполнять свою
насосную функцию при перегрузке сопротивлением, как, например, при
остро возникшей легочной гипертензии. Однако если повышение давления в
легочной артерии развивается постепенно, стенка правого желудочка утол-
щается и его полость приобретает более сферическую форму, свойственную
левому желудочку (рис. 1,5).
Как следует из уравнения Лапласа, возможность левого желудочка в фи-
зиологических условиях развивать большее внутриполостное давление по
сравнению с правым обеспечивается меньшим радиусом и связанной с этим
способностью его волокон развивать более высокое стеночное напряжение.
Очевидно, что и для него дилатация полости является гемодинамически не-
выгодной реакцией на увеличение нагрузки давлением, так как это требует
от растянутых мышечных волокон развития большего напряжения, чем при
меньшем радиусе полости. Наоборот, повышение систолического напряже-
ния эффективно обеспечивается гипертрофией мышечных волокон, которая
является важнейшим механизмом компенсации при перегрузке давлением.
Когда желудочки сокращаются, их основание, образуемое атриовентри-
кулярным кольцом, оттягивается книзу, а сердце поворачивается вправо.
При этом его верхушка перемещается кпереди и приближается к стенке груд-
ной клетки в пятом межреберье, где в результате этого пальпируется так
называемый верхушечный толчок.
Предсердия представляют собой тонкостенные камеры низкого давления.
Они преимущественно выполняют функцию резервуаров крови для соот-
ветствующих желудочков. При этом венозная кровь большого круга
кровообращения поступает в правое предсердие по впадающим в него верх-
ней и нижней полым венам, а также из коронарного синуса, а артериали-
зированная кровь из легких попадает в левое предсердие по 4 легочным
венам. Более 70 % крови поступает из предсердий в желудочки пассивно.
9
Лишь небольшая часть крови, составляющая от 5 до 25 % ударного объема
желудочка, нагнетается активно путем сокращения мускулатуры предсердий
против низкого сопротивления (так называемая предсердная надбавка).
Тонкая стенка предсердий состоит из двух слоев мышечных волокон. Внут-
ренний слой окутывает каждое предсердие в отдельности в продольном на-
правлении и охватывает устья впадающих вен, что, возможно, предотвра-
щает регургитацию в них крови во время систолы предсердий. Наружный
слой, имеющий поперечную направленность, охватывает одновременно оба
предсердия.
В центре межпредсердной перегородки находится углубление - овальная
ямка. Она образуется на месте заросшего овального отверстия плода, кото-
рое обеспечивает поступление оксигенированной в плаценте крови из ниж-
ней полой вены в левые отделы сердца. Незаращение овального отверстия
отмечается у 15 % взрослых, но, поскольку оно функционирует как кла-
пан, пропускающий кровь только в одном направлении - справа налево,
даже в таких случаях при отсутствии патологии межпредсердное сообщение
не действует.
Клапаны сердца, как и механических насосов, обеспечивают однонап-
равленный ток крови.
Атриовентрикулярные клапаны состоят из створок, которые своим осно-
ванием прикрепляются к фиброзному кольцу. Митральный клапан имеет
две створки - заднюю, или муральную, и переднюю, или аортальную, а
трехстворчатый — три: переднюю, заднюю и септальную. К свободным кон-
цам створок прикреплены сухожильные хорды, которые соединяют створки
с сосочковыми мышцами. Во время диастолы желудочков сосочковые мыш-
цы расслаблены, створки свободно провисают в полости желудочков, клапа-
ны открыты. Эффективное закрытие атриовентрикулярных клапанов во вре-
мя систолы желудочков обеспечивается:
1) соприкосновением створок под действием ретроградного потока кро-
ви, который устремляется к атриовентрикулярному отверстию в начале сис-
толы желудочков при повышении в них давления;
2) сокращением сосочковых мышц, которые укорачиваются по мере
уменьшения объема желудочка;
3) сокращением гладкой мускулатуры клапанного кольца (наименее зна-
чимый фактор);
4) турбулентным движением потока крови из предсердия в желудочек во
время систолы предсердий, который, отражаясь от стенок желудочка, ударя-
ет о створки клапана. Чем меньше сила сокращения желудочка, тем больше
вклад этого механизма в закрытие атриовентрикулярных клапанов.
В норме площадь отверстий атриовентрикулярных клапанов составляет
около 5 см. Это обеспечивает максимальную скорость наполнения желудоч-
ков - порядка 500-1000 мл/с без возникновения градиента давления по обе
стороны клапана.
10
Звук, возникающий при закрытии атриовентрикулярных клапанов, об-
разует первый сердечный тон Sp который состоит из митрального и трикус-
пидального компонентов (М^). М, является первым и основным компо-
нентом Sj.
Полулунные клапаны аорты и легочной артерии имеют по три створки в
виде кармашка, прикрепленных своим основанием к клапанному кольцу.
Клапан легочной артерии имеет располагающиеся кпереди правую и ле-
вую створки и заднюю, а аортальный — переднюю (правую коронар-
ную), левую заднюю (левую коронарную) и правую заднюю (некоронар-
ную) створки. В корне аорты им соответствуют расширения - так называ-
емые аортальные синусы, или синусы Вальсальвы. Полулунные клапаны
открываются при сокращении желудочков, когда давление в их полости
превышает давление в соответствующих сосудах. После окончания систо-
лы желудочков, когда внутрижелудочковое давление резко падает и ста-
новится ниже давления в корне аорты и легочной артерии, начальный
ретроградный ток крови вызывает закрытие клапанов.
Звук закрытия полулунных клапанов образует второй сердечный тон,
S2, состоящий из аортального и пульмонального компонентов (А2, Р2).
А2 — первый и основной компонент S3.
Проводящая система сердца представляет собой специализированную
мышечную ткань, обеспечивающую образование и распространение био-
электрического импульса по сердцу.
1. Синоатриальный узел располагается на задней стенке правого пред-
сердия вблизи устья верхней полой вены. Генерируя ритмичные импульсы,
он в норме является водителем ритма сердца. Обильно снабжен симпати-
ческими и парасимпатическими нервными окончаниями и капиллярами.
2. Межузловые предсердные пути, проводящие импульс возбуждения
от синоатриального узла через правое предсердие к атриовентрикулярно-
му соединению, включают три пучка. Они частично состоят из волокон
специализированной проводящей системы, частично из обычных клеток
сократительного миокарда. Это передний межузловой тракт Бахмана, сред-
ний тракт Венкебаха и задний тракт Тореля (рис. 2). Кроме этих специа-
лизированных проводящих путей, исходящий из синоатриального узла
импульс распространяется радиально по мышечным волокнам вначале
правого, а затем и левого предсердия.
3. Межпредсердный пучок Бахмана обеспечивает проведение импульса
от синоатриального узла к левому предсердию.
4. Атриовентрикулярное соединение располагается в межпредсердной и
межжелудочковой перегородках над центральной частью трехстворчатого
клапана. Как и синоатриальный узел, имеет богатую вегетативную ин-
нервацию и кровоснабжение.
Атриовентрикулярное соединение имеет три функциональные области,
или зоны: 1) A—N - переходную между тканью предсердия и собственно
атриовентрикулярным узлом; 2) N — зону собственно атриовентрикуляр-
11
Рис. 2. Проводящая система серд-
ца: 1 — атриовентрикулярный узел;
2— левая ножка Гиса; 3- задняя
ветвь левой ножки пучка Гиса; 4 —
передняя ветвь левой ножки пуч-
ка Гиса; 5- волокна Пуркинье; 6
— правая ножка пучка Гиса; 7 —
ствол пучка Гиса; 8,9,10 - соответ-
ственно задний, средний и перед-
ний межузловые предсердные пути;
11 — синоатриальный узел; 12-
межпредсердный пучок Бахмана
ного узла и 3) N—Н — зону, в
которой волокна атриовентри-
кулярного узла постепенно
сливаются со стволом пучка
Гиса. В зоне N происходит ос-
новная задержка проведения
импульса от предсердий к же-
лудочкам. Благодаря ей обеспе-
чивается оптимальное наполнение желудочков к началу их систолы за счет
предотвращения проведения к желудочкам части патологических предсерд-
ных импульсов, генерируемых с большой частотой.
5. Пучок Гиса, берущий свое начало в атриовентрикулярном соединении,
располагается субэндокардиально в области правой части межжелудочковой
перегородки и примерно через 12 мм делится на правую и левую ножки. Пра-
вая ножка обеспечивает проведение импульса по правой стороне межжелу-
дочковой перегородки к миокарду правого желудочка и является прямым про-
должением пучка Гиса. Спускаясь книзу, она делится на три части — пере-
днюю, латеральную и заднюю, которые, разветвляясь, становятся частью
системы Пуркинье правого желудочка. Левая ножка располагается по субэн-
докардиальной поверхности левой половины межжелудочковой перегородки
и через 1—3 см от своего начала делится на две ветви. Более толстая задняя
(задне-нижняя) ветвь обеспечивает проведение импульса в субэндокарди-
альных отделах базальной и диафрагмальной областей левого желудочка. По
более тонкой передней (передне-верхней) ветви импульс распространяется
по передней субэндокардиальной поверхности левого желудочка. Ствол и ветви
пучка Гиса образованы преимущественно клетками Пуркинье, расположен-
ными параллельно, в отличие от сетчатой структуры атриовентрикулярного
соединения.
У эмбриона и иногда у взрослых лиц имеются также добавочные прово-
дящие пути между предсердиями и желудочками, которые являются мор-
фологическим субстратом синдромов преждевременного возбуждения
желудочков. Это предсердно-желудочковые пучки Кента (право- и лево-
сторонний), межузловой пучок Джеймса между правым предсердием и
стволом пучка Гиса и нодовентрикулярный пучок Махайма, соединяющий
12
атриовентрикулярный узел или ножку пучка Гиса с сократительным мио-
кардом желудочков.
6. Система Пуркинье — это густая сеть волокон, отходящих от дисталь-
ных участков ветвей ножек пучка Гиса. Они располагаются субэндокарди-
ально и обеспечивают распространение импульса на клетки сократитель-
ного миокарда обоих желудочков, что влечет за собой их сокращение и
изгнание крови.
Такое строение проводящей системы сердца обусловливает следующую
последовательность распространения волны возбуждения по миокарду же-
лудочков. Вначале возбуждаются межжелудочковая перегородка, кроме ее
базальной части, и сосочковые мышцы. Наступающее вслед за этим их ран-
нее сокращение позволяет перегородке играть роль якоря для сокращения
остального миокарда желудочков, а сосочковым мышцам обеспечивать зак-
рытие атриовентрикулярных клапанов.
Функциональная анатомия кардиомиоцита. В зависимости от своей основ-
ной функции клетки миокарда разделяются на рабочие, или сократитель-
ные, и клетки предсердно-желудочковой проводящей системы сердца.
Сократительные кардиомиоциты, выполняющие механическую работу
сердца, представляют собой вытянутые клетки длиной около 100 мкм и диа-
метром в среднем 15 мкм, которые напоминают волокна поперечно-полосатой
мускулатуры своей поперечной исчерченностью. Цилиндрическая форма кар-
диомиоцита отражает его устройство — клетка выглядит как пучкообразное
скопление миофибрилл, окруженное оболочкой.
Основные отличия миокарда от скелетной мышцы следующие:
1) мышечные волокна ветвятся, образуя сетчатую структуру — так назы-
ваемый функциональный синцитий. В отличие от истинного анатомического
синцития соседние клетки отделены друг от друга сарколеммой, а их торце-
вые части — плотными вставочными дисками, которые представляют собой
участки низкого сопротивления. Такая структура обеспечивает распростра-
нение волны возбуждения, возникшей при деполяризации одного мышеч-
ного волокна, на все остальные волокна с их последующим одновремен-
ным сокращением (ответ типа все-или-ничего);
2) значительно большее количество митохондрий, что обусловлено специ-
фикой функционирования миокарда;
3) высокая плотность капилляров — примерно в соотношении 1 капилляр на 1
мышечное волокно. Это позволяет значительно уменьшить диффузионное рас-
стояние для кислорода, углекислого газа и субстратов метаболизма. Необходимо
иметь в виду, что не все капилляры открыты одновременно.
Ниже представлены основные компоненты кардиомиоцита и их функцио-
нальное значение.
Сарколемма - мембрана, окружающая мышечную клетку, вклю-
чает собственно плазматическую мембрану толщиной 10 нм и наружный
слой — так называемое поверхностное покрытие толщиной 70 нм. Плаз-
матическая мембрана состоит из двух слоев молекул фосфолипидов, по-
13
Основные структурные единицы клетки миокарда н нх функциональное значение
Структура клетки Функция
Сарколемма:
поверхностная сарколемма Обмен веществ между внутри- н внеклеточной средой (место активного и пассивного транспорта)
вставочные диски Механическая связь между клетками (“каркас”) Распространенно биоэлектрической активности от клетки к клетке
поперечно-продольная канальцевая система Проведение электрического сигнала от сарколеммы внутрь клетки с одновременной активацией всех миофибрилл Обеспечение оптимального соотношения площади поверхности к объему клетки для облегчения обмена веществ между внутри- и внеклеточной средой
Саркоплазматический ретикулум Миофнбрнллы Митохондрии Саркоплазма и ядро Сопряжение возбуждения с сокращением и расслаблением (аккумуляция Са , их освобождение и обратный захват) Сокращение и расслабление клетки Энергообеспечение (синтез макроэргических фосфатов) Гликолиз, синтез белков и другие метаболические процессы
иярные гидрофильные “головки” которых обращены кнаружи, а липидные
“хвостики” — кнутри, вследствие чего при электронной микроскопии она
имеет характерный трехслойный вид. Плазматическая мембрана обладает те-
кучестью. В ней находятся многочисленные белки - рецепторы — для гормо-
нов и фармакологических веществ и каналы для транспорта ионов.
Поверхностное покрытие, или гликокаликс, состоит из гликопротеинов,
гликолипидов и полисахаридов. Считают, что эта оболочка служит для за-
хвата и удержания Са2+, однако вклад этого пула Са2+ в процесс электро-
механического сопряжения, по-видимому, незначителен.
Сарколемма образует множество складок и карманов, что обусловливает
ге разделение на: 1) поверхностную, или периферическую, состоящую из
плоских участков поверхности клетки, 2) внутреннюю, образующую систе-
му поперечно и продольно ориентированных канальцев (так называемые Т-
грубочки и поперечно-продольная тубулярная система); 3) кавеолы — окру-
женные мембраной везикулярные структуры, вдающиеся внутрь клетки. Они
служат местами формирования тубулярной системы.
Т-трубочки, представляющие собой инвагинации клеточной мембраны,
располагаются параллельно на одинаковом расстоянии друг от друга. Каж-
лая Т-трубочка подходит к каждой Z-полосе в каждой миофибрилле. Такое
их расположение обеспечивает поступление электрического сигнала для
сокращения и кальциевого тока максимально близко к Z-полосе (рис. 3).
Видоизмененная сарколемма, ограничивающая торцевые поверхности
мышечных волокон, образует так называемые вставочные диски. Они вклю-
гают в себя три специализированных компонента: 1) fascia adherens —
место прикрепления актиновых нитей к плазматической мембране; 2) macula
iensa, или десмосомы, имеющие выступающие из сарколеммы волокна,
гго обеспечивает прочное соединение клеток и передачу напряжения, разви-
14
Рис. 3. Расположение органелл в кардиомио-
ците: 1 - поверхностное покрытие; 2 - трех-
слойная плазматическая мембрана; 3— сар-
колемма; 4— митохондрия; 5— цистерна; 6-
саркоплазматический ретикулум; 7— толстая
нить (миозин); 8 — тонкая нить (актин)
ваемого ими при сокращении, друг
другу; 3) межклеточные контакты,
или нексусы, которые обеспечивают
электрическое взаимодействие меж-
ду клетками благодаря своему низ-
кому электрическому импедансу.
Саркоплазматический ре-
тикулум представляет собой густую
сеть анастомозирующих друг с дру-
гом канальцев, прилегающих к мио-
фибриллам. Они имеют продольную
ориентацию, не ограничиваются пределами саркомера и не сообщаются с
внеклеточной средой. В местах, где саркоплазматический ретикулум подхо-
дит близко к поверхностной клеточной мембране или Т-трубочкам, он об-
разует мешковидные расширения, так называемые цистерны. Это обеспечи-
вает быстрое распространение импульса возбуждения (деполяризации) Т-
трубочок сарколеммы на мембраны цистерн, что приводит к выходу из сар-
коплазматического ретикулума Са2+.
Миофибриллы диаметром около 1 мкм располагаются пучками вдоль
длинной оси кардиомиоцита. Каждая миофибрилла состоит из отдельных
структурных и сократительных элементов — саркомеров, отграниченных друг
от друга Z-линиями (Z, Zwischen-scheibe, по-немецки — “разделительная
линия”). Длина саркомера в состоянии покоя 1,8-2 мкм. При электронной
микроскопии видно, что саркомер состоит из участков различной плотно-
сти, которые имеют вид чередующихся темных полос А и светлых полос I
(А — анизотропный, I — изотропный в поляризованном свете, рис. 4), что
создает характерную поперечную исчерченность. Такая структура обусловле-
на наличием белковых нитей (протофибрилл) двух типов: толстых, состоя-
щих из миозинг, и тонких, состоящих из актина.
Толстые нити миозина диаметром 15 нм образуют центральную полосу А.
Они состоят из длинных молекул, которые образуются двумя пептидными
цепями легкого меромиозина, свернутыми в двойную спираль (так называ-
емые легкие цепи). На конце каждой молекулы пептида находится головка,
состоящая из двух пептидных цепей тяжелого меромиозина (рис. 5). Эти
головки выступают парами по обе стороны толстой нити через каждые 14 нм
и вступают в соединение с молекулами актина. Головки миозина содержат
миофибриллярную АТФ-азу - фермент, расщепляющий АТФ для обеспе-
15
Рис. 4. Саркомер. Микрофото и схема вза-
имного расположения его элементов
чения энергии сокращения мышцы,
и обладают способностью обратимо
связываться с актином с образовани-
ем актомиозина.
Тонкие нити диаметром 6 нм, об-
разующие полосы I, состоят из акти-
на. Его молекула представляет собой
белок сферической формы, который
полимеризуется с образованием
цепочки молекул (см. рис. 5). Две цепи
молекул актина образуют структуру
спиральной формы. В желобе этой спирали находится молекула тропомиозина.
К каждой 7-й молекуле актина прикреплена молекула тропонина, который
состоит из трех частей. Тропонин С, обладающий высоким сродством к Са2+,
связывает их, и тем самым запускает процесс сокращения. Тропонин I, ин-
гибируя стимулируемую Mg2+ АТФ-азу миозина, препятствует взаимодей-
ствию актина с миозином и находится под контролем тропонина С. Тропо-
нин Т связывает тропониновый комплекс с тропомиозином.
Как видно на поперечном срезе (рис. 6), каждая толстая протофибрилла
окружена 6 тонкими, а каждая тонкая - 3 толстыми.
Сокращение мышцы является результатом скольжения толстых и тон-
ких протофибрилл относительно друг друга благодаря индуцируемому
Рис. 5. Схематическое изображение строения сократительных белков -
миозина (толстые нити) и актина (тонкие нити)
16
Рис. 6. Схематическое изображение взаим-
ного расположения сократительных белков
на поперечном и продольном срезах
Потса А
1,5мкм Полоса I,
1—1 ЗанаН
Актин
мнит!*
MINM№ HMN
Поперечное сечение
i
Миозин
L——i-------।
Саркомер
ЛинияМ
о.
45нм
Линия!
Са2+ многократному образованию и
отсоединению актомиозиновых свя-
зей (мостиков). При этом происходит
уменьшение ширины полос I за счет
более глубокого вдвижения тонких
протофибрилл в полосу А и умень-
шение длины саркомера. Суммирова-
ние усилий, развиваемых мостиками
в каждом саркомере, обеспечивается
последовательно расположенными уп-
ругими образованиями — линиями Z
и вставочными дисками.
Митохондрии занимают 30—
50 % объема кардиомиоцита и обес-
печивают энергию, необходимую для
сокращения сердца, путем синтеза макроэргических фосфатов — АТФ и кре-
атинфосфата (КФ) в цикле трикарбоновых кислот (цикле Кребса) в присут-
ствии кислорода. Благодаря наличию внутри митохондрий анионов фосфата
они способны обратимо связывать большое количество Са2+. В нормальном
миокарде эта их функция не играет никакой роли в процессе сопряжения
возбуждения с сокращением. В то же время при определенных патологичес-
ких состояниях при нарушении функции сарколеммы и саркоплазматичес-
кого ретикулума (например, при ишемии миокарда или миокардиальной
недостаточности) захват митохондриями Са2+ играет важную роль в предот-
вращении кальциевой перегрузки цитоплазмы. Наступающая при этом пере-
грузка митохондрий Са2+ нарушает процесс окислительного фосфорили-
рования из-за их связывания анионами фосфата.
Саркоплазма содержит ферменты гликолиза и ряда других, менее
изученных метаболических процессов, а также запасы субстратов - гранулы
гликогена, капли жира и др.
Ядро является местом активного синтеза белков, необходимых, в част-
ности, для обеспечения процесса непрерывного обновления миофиламен-
тов, мембран и др. Хотя некоторые кардиомиоциты имеют 2 ядра, в постна-
тальный период их митоз прекращается, в силу чего миокарду не свойствен-
на гиперплазия, а увеличение его массы после рождения происходит исклю-
чительно путем гипертрофии.
Клетки атриовентрикулярной проводящей системы сердца (синоатриально-
го узла, атриовентрикулярного соединения, пучка Гиса и волокон Пурки-
нье), ответственные за образование и быстрое распространение импульса
возбуждения по всему сердцу, имеют следующие отличия от миоцитов рабо-
17
чего миокарда: 1) больший диаметр (до 80 мкм); 2) отсутствие системы Т-
трубочек, что обусловливает меньшую величину отношения площади
поверхности к объему и в силу этого меньшее электрическое сопротивле-
ние, что облегчает проведение импульса; 3) меньшее количество миофиб-
рилл; 4) более высокое содержание в цитоплазме гранул гликогена, что обес-
печивает повышенную устойчивость этих клеток к гипоксии.
Перикард представляет собой мембранозный мешок, внутри которо-
го находятся сердце и начальные (1 —2 см) отрезки крупных сосудов —
аорты до места соединения восходящей части с дугой, легочной артерии
до разветвления, а также полых и легочных вен. Перикард состоит из
двух слоев: наружного — фиброзного — и внутреннего — серозного, ко-
торый, в свою очередь, имеет париетальный слой, примыкающий к фиб-
розному перикарду, и висцеральный. Висцеральный перикард представ-
ляет собой наружную поверхность самого сердца и называется также
эпикардом. Полость перикарда в норме содержит до 20-30 мл жидкости,
по своему составу сходную с лимфой, которая продуцируется серозным
листком.
Эндокард представляет собой соединительнотканную оболочку, выстила-
ющую внутреннюю поверхность камер сердца и клапаны.
СОСУДЫ
Основная функция системных сосудов — снабжение тканей кислородом и
питательными веществами и удаление продуктов их жизнедеятельности. Си-
стема кровеносных сосудов состоит из нескольких параллельных цепей, что
обеспечивает возможность перераспределения крови между ними путем ме-
стного изменения сопротивления без изменения среднего давления в аорте
и уменьшает общее сопротивление кровотоку в артериальной системе.
Каждый параллельный контур состоит из нескольких последовательных
сегментов: 1) “эластического резервуара” — артерий эластического типа; 2) со-
судов сопротивления — артериол; 3) прекапиллярных сфинктеров; 4) “об-
менных”, или нутритивных, сосудов — капилляров; 5) емкостных сосудов —
венул и вен. Кроме того, в ряде сосудистых бассейнов имеются артериове-
нозные шунты. В некоторых органах, например в почке, существуют две
последовательные системы капилляров, между которыми находятся сосуды
сопротивления.
Сосудистая стенка состоит из:
1) внутренней оболочки (интимы), которая включает: а) эндотелий; б) со-
единительнотканный субэндотелиальный слой; в) внутреннюю эластическую
мембрану;
2) средней оболочки (медии), состоящей из одного или нескольких
слоев гладкомышечных клеток. Они располагаются по спирали на эласти-
ческой мембране и служат основными продуцентами волокон и основного
18
вещества соединительной ткани в сосудистой стенке, подобно фибро-
бластам в коже;
3) наружной оболочки (адвентиции), представленной соединительной
тканью, в которой на границе со средней оболочкой находятся сплетения
эфферентных нервных волокон, лимфатические сосуды и сосуды сосудов,
питающие стенку.
Эндотелиальные клетки играют важную роль в предотвращении внутри-
сосудистого свертывания крови. Это обусловлено следующими механизма-
ми:
1) отрицательным зарядом покрывающего их поверхность гликокалик-
са, который способствует отталкиванию отрицательно заряженных тром-
боцитов;
2) инактивацией ферментами клеточной мембраны проагрегантов АДФ и
АТФ с образованием тормозящих его агрегацию тромбоцитов аденозина;
3) образованием из арахидоновой кислоты клеточной мембраны под дей-
ствием фермента циклооксигеназы простациклина — простагландина 12, ин-
гибирующего агрегацию тромбоцитов и оказывающего сосудорасширяющее
действие;
4) синтезом эндотелиальными клетками антитромбина III, который инак-
тивирует появляющиеся в кровотоке следы тромбина, и активатора плазми-
ногена, инициирующего тромболизис.
При повреждении эндотелия к нему прилипают тромбоциты и может раз-
виваться тромбообразование, чему способствует выделение эндотелиальны-
ми клетками фактора свертывания VII.
Артерии эластического типа — аорта и ее ветви — благодаря высокому
содержанию эластических волокон обладают значительной растяжимостью,
что дает им возможность выполнять функцию эластического резервуара,
или буфера, обеспечивающего преобразование прерывистого выброса крови
в аорту в непрерывный кровоток в капиллярах. С уменьшением диаметра
артериального сосуда количество мышечных слоев в его медии уменьшается
с 40—60 (грудная часть аорты) до 1 (метартериолы).
Следует отметить, что после рождения количество гладкомышечных кле-
ток в сосудистой стенке не изменяется; может меняться лишь их толщина
(например, гипертрофия при артериальной гипертензии).
Обладающие наиболее толстой по сравнению с просветом стенкой за счет
мышечного слоя артериолы являются основным “запорным краном” систе-
мы кровообращения. Тем самым они: 1) определяют системное сосудистое
сопротивление и вследствие этого уровень АД; 2) путем изменения своего
тонуса (просвета) регулируют регионарное распределение сердечного вы-
броса между различными органами и тканями; 3) определяют среднее гид-
ростатическое давление в капилляре.
Артериолы имеют диаметр от 20 до 50 мкм и дают начало капиллярам и в
некоторых тканях метартериолам (прекапиллярам). Через метартериолы диа-
метром 10—20 мкм кровь либо шунтируется непосредственно в венулы, ми-
нуя капиллярную сеть, либо поступает в капилляры.
19
Снабженные гладкомышечными сфинктерами конечные участки арте-
риального русла — прекапиллярные сфинктеры — лишены, как правило,
центрального вегетативного контроля. Обеспечивая более тонкую, чем
артериолы, регуляцию капиллярного кровотока, то есть величины пло-
щади поверхности капилляров, доступной для обмена веществ, они прак-
тически не участвуют в регуляции регионарного сосудистого сопротив-
ления.
Капилляры состоят из одного слоя эндотелия, расположенного на базаль-
ной мембране. Диаметр капилляров колеблется от 5 до 10 мкм, а длина обыч-
но составляет 0,5—1 мм. Плотность капилляров в различных тканях варьиру-
ет в зависимости от их метаболической активности. Она наибольшая в
миокарде, скелетной мышце и в железах внутренней секреции и наи-
меньшая — в хряще.
Поскольку стенка капилляров лишена гладкомышечных клеток, их диа-
метр определяется главным образом изменениями пре- и посткапиллярного
сопротивления.
Хотя в капиллярах находится лишь 5 % ОЦК, благодаря большой площа-
ди своей поверхности они вполне справляются со своей нутритивной функ-
цией. Ток крови в капиллярах обеспечивает обмен кислорода, углекислоты,
субстратов и продуктов метаболизма, а также воды между плазмой крови и
интерстициальной жидкостью.
Интенсивность транскапиллярного обмена определяется:
1) площадью поверхности функционирующих капилляров (в покое они
составляют 25—35 % от общего количества); 2) проницаемостью капилляров,
которая зависит от количества и размеров их пор. Размеры пор могут увели-
чиваться при сокращении эндотелиальных клеток под действием местных
гуморальных факторов.
Венулы и вены являются емкостными сосудами, содержащими более 65 %
общего объема крови в системе кровообращения. Являясь системой низкого
давления, отличаются от артерий значительно более тонкой мышечной обо-
лочкой, которая совсем отсутствует в стенке посткапиллярных венул. Току
крови в них в существенной мере способствует “венозная помпа” — сокра-
щения соседних скелетных мышц, которые сдавливают вены и перемещают
кровь к сердцу. Этому способствует наличие в венах клапанов, которые пре-
дотвращают ретроградный ток крови.
Небольшие изменения просвета вен, которые не вызывают существен-
ного изменения сосудистого сопротивления, тем не менее, оказывают зна-
чительное влияние на их емкость и тем самым на венозный возврат крови к
сердцу, а следовательно, на сердечный выброс.
Артериовенозные шунты преобладают в коже. Они принимают участие в
процессе терморегуляции. Их функциональное значение не ясно.
Легочный кровоток. Основная функция легочного кровотока — доставка
крови к легким для газообмена в легочных капиллярах: В отличие от большо-
го круга кровообращения малый круг короче, имеет более низкое давление
20
Рис. 7. Кровоснабжение сердца. (Вены заштрихованы, артерии светлые): А - вид
спереди: 1 — левая коронарная артерия; 2 — огибающая артерия; 3 — большая
вена сердца; 4 — передняя нисходящая ветвь левой коронарной артерии; 5 — диа-
гональная ветвь; 6 — передняя желудочковая ветвь; 7 — маргинальная ветвь; 8 -
септальная ветвь; 9 - малая вена сердца; 10 - правая коронарная артерия. Б - вид
сзади: 1 — правая коронарная артерия; 2 - артерия атриовентрикулярного узла; 3
— “крест” сердца; 4 — задняя нисходящая артерия; 5 — средняя вена сердца; 6 -
задняя вена левого желудочка; 7 — коронарный синус
и сопротивление и меньший градиент давления между легочной артерией и
левым предсердием (около 10 мм рт.ст ).
Легкое имеет двойное кровоснабжение: из легочной артерии и брон-
хиальных артерий, которые отходят от аорты. В отличие от системного кро-
вообращения отсутствуют прекапиллярные сфинктеры. Отток крови из сис-
темы бронхиальных артерий через бронхиальные вены идет в легочные вены
и частично, через анастомозы, в систему парной вены.
У плода легочный кровоток составляет 10-30 % выброса правого же-
лудочка, который в значительной степени идет в обход нефункциониру-
ющих легких через овальное окно и открытый артериальный (Боталло)
проток, соединяющий легочную артерию с аортой, к плаценте, где и
происходит газообмен. Это обусловлено высоким сосудистым сопротив-
лением легочных артериол нерасправленных легких вследствие толстой
медии и извитого хода. При расправлении легких с первым вдохом легоч-
ное сопротивление резко падает, и легочный кровоток возрастает в 3—10
раз. К концу 1-го часа прекращается шунтирование крови справа налево
через овальное окно, и по мере повышения парциального напряжения
кислорода закрывается артериальный проток. В первые 2 нед в легочных
сосудах резко уменьшается толщина медии, параллельно снижаются ЛСС и
давление в легочной артерии.
21
Коронарное кровообращение. Коронарные артерии берут свое начало из
синусов Вальсальвы и снабжают кровью сократительный миокард и про-
водящую систему сердца. Их крупные ветви располагаются экстрамураль-
но, то есть по наружной поверхности сердца, и образуют интрамураль-
ные веточки, которые погружаются в толщу стенки желудочков.
Различают три основные коронарные артерии (рис. 7):
1) правая коронарная артерия по венечной борозде дости-
гает задней поверхности сердца и далее проходит по задней межжелудоч-
ковой борозде. Она снабжает кровью синоатриальный узел (в 55 % случа-
ев), атриовентрикулярное соединение (90 %), миокард правого желудоч-
ка и предсердия, нижне-заднюю стенку левого желудочка. В 80 % случаев
терминальной частью правой коронарной артерии является задняя нис-
ходящая (межжелудочковая) ветвь. Располагаясь в задней межжелудоч-
ковой борозде, она снабжает кровью правый и левый желудочки и зад-
нюю часть межжелудочковой перегородки. Маргинальная ветвь правой
коронарной артерии спускается по боковой поверхности сердца к вер-
хушке и снабжает кровью передне-заднюю поверхность левого желудочка.
Левая коронарная артерия на расстоянии около 2 см от ус-
тья делится на две крупные ветви — переднюю нисходящую и огибаю-
щую, которые рассматриваются как отдельные артерии;
2) передняя нисходящая, или передняя межжелудоч-
ковая, артерия является прямым продолжением родительской арте-
рии. Она спускается по передней межжелудочковой борозде к верхушке
сердца, а затем огибает ее и немного поднимается кверху по задней меж-
желудочковой борозде. Эта ветвь снабжает кровью преимущественно ле-
вый желудочек: передние 2/3 межжелудочковой перегородки, переднюю
стенку левого желудочка, правую ножку и передне-верхнюю ветвь левой
ножки пучка Гиса. Мелкие правожелудочковые веточки пересекают меж-
желудочковую борозду и несут кровь к узкой полоске правого желудоч-
ка, анастомозируя с системой правой коронарной артерии;
3) огибающая ветвь левой коронарной артерии пересекает основа-
ние левого желудочка и располагается на задней поверхности сердца в ве-
нечной борозде. Она кровоснабжает: синоатриальный узел (45 % случаев),
атриовентрикулярное соединение (10 %), заднюю поверхность левого желу-
дочка (своей маргинальной ветвью).
От правой коронарной артерии ветви отходят под прямым углом, тогда
как от левой — под острым. Предсердия получают кровь из систем всех трех
коронарных артерий. Наиболее постоянной и важной для их кровоснабжения
является артерия синусового узла.
Анатомическое расположение эпикардиальных артерий сердца может быть
замым разным. В зависимости от их топографии различают три типа крово-
знабжения сердца:
1) правовенечный (правосторонний) тип. Встречается в 50-63 % слу-
яаев. Правая коронарная артерия васкуляризирует не только правые отделы
зердца, но также за счет своей задней нисходящей (межжелудочковой)
22
ветви и заднюю поверхность левого желудочка и межжелудочковой пере-
городки. При этом правая коронарная артерия пересекает так называе-
мый “крест” сердца, то есть участок пересечения венечной и межжелу-
дочковой борозд, прикрытый коронарным синусом;
2) левовенечный (левосторонний) тип. Отмечается у 13-17 % лиц. Ле-
вая коронарная артерия за счет своей задней межжелудочковой ветви
снабжает кровью почти всю заднюю поверхность сердца, всю межжелу-
дочковую перегородку и верхушку, пересекая “крест” сердца;
3) сбалансированный тип. Для этого варианта, встречающегося в 20—
33 % случаев, характерно одинаковое участие правой и левой коронарных
артерий в кровоснабжении передней и задней стенок желудочков. При
этом обе артерии достигают “креста”, но ни одна из них его не пересекает.
Разнообразие вариантов анатомического расположения эпикардиальных
коронарных артерий обусловливает вариабельность клинического течения
и прогноза у больных с одной и той же локализацией окклюзии. Необхо-
димо подчеркнуть, однако, что, независимо от типа кровоснабжения сер-
дца, левая коронарная артерия всегда является функционально доминант-
ной, так как своими ветвями кровоснабжает большую часть массы сердца.
Вены сердца возвращают деоксигенированную кровь в сердце. Основ-
ными из них являются:
1) большая вена сердца. Образуется в результате слияния вен
от передней стенки обоих желудочков, межжелудочковой перегородки,
верхушки и частично левого предсердия. Сопровождает переднюю меж-
желудочковую ветвь левой коронарной артерии;
2) задняя вена левого желудочка. Впадает в большую вену
сердца;
3) средняя вена сердца. Берет начало от вен задней стенки
обоих желудочков, межжелудочковой перегородки и верхушки. Сопро-
вождает заднюю межжелудочковую ветвь правой коронарной артерии;
4) малая вена сердца. Образуется преимущественно из вен пе-
редней поверхности правого предсердия и сопровождает огибающую ветвь
левой коронарной артерии.
Все эти вены впадают в коронарный синус, расположенный на задней
поверхности сердца в левой половине венечной борозды, который от-
крывается в правое предсердие. Кроме того, в сердце имеется система
глубоких вен, которая сообщается непосредственно с полостями сердца
с помощью тебезиевых вен и синусоидов.
Сосуды сердца образуют сеть анастомозов, или коллатералей, к кото-
рым относятся:
1) интрамуральные анастомозы между ветвями правой и левой коро-
нарных артерий, между ветвями одной и той же коронарной артерии и
одной и той же коронарной вены. В здоровом сердце эти анастомозы от-
носительно слабо выражены, и коронарные артерии в функциональном
отношении являются “конечными артериями”. Стимулом к новообразова-
нию и расширению коллатералей является гипоксия миокарда;
23
2) экстракардиальные анастомозы между коронарными артериями й^
артериями, кровоснабжающими перикард, — ветвями внутренних груд-
ных, бронхиальных, межреберных, передних медиастинальных и пище-
водных артерий.
ГЛАВА 2.
БИОХИМИЯ И КЛЕТОЧНАЯ ФИЗИОЛОГИЯ
МИОКАРДА И МЕМБРАН
ОБРАЗОВАНИЕ ЭНЕРГИИ ДЛЯ СОКРАЩЕНИЯ
Основными субстратами для энергообразования в миокарде являются
свободные жирные кислоты, глюкоза и лактат. В покое натощак на мета-
болизм свободных жирных кислот расходуется 60 % поглощаемого мио-
кардом кислорода (27 мл/мин, или 0,09 мл/мин/г), 23 % глюкозы, 11 %
лактата и 1 % пирувата. При физической нагрузке метаболизм свободных
жирных кислот возрастает, в то время как при гипоксии или ишемии
основным субстратом служит либо глюкоза, поступающая в клетки из-
вне, либо внутриклеточный гликоген.
Образование энергии включает 3 основных этапа.
I этап — межуточный обмен, в результате которого происходит образо-
вание субстратов окисления для их последующей метаболизации в цикле
трикарбоновых кислот.
Свободные жирные кислоты транспортируются кровью либо в соедине-
нии с альбумином, либо в виде триглицеридов. В стенке капилляра три-
глицериды расщепляются липопротеинлипазой с образованием свободных
жирных кислот. Свободные жирные кислоты пересекают клеточную мемб-
рану и в цитоплазме взаимодействуют с коэнзимом А (КоА) с образовани-
ем ацетил-КоА. На эту реакцию расходуется 1 молекула АТФ, что является
одной из причин уменьшения утилизации жирных кислот в условиях дефи-
цита АТФ при ишемии. Ацетил-КоА откладывается в цитоплазме в виде
липидных капель либо в соединении с карнитином пересекает мембрану
митохондрий. Жирные кислоты с короткой цепью проходят в митохондрии
в неизмененном виде. В митохондриях жирные кислоты подвергаются р-
окислению с поэтапным отщеплением содержащих 2 атома углерода моле-
кул ацетил-КоА и одновременным освобождением 4 атомов водорода (Н).
Первоначальный захват жирных кислот сердцем в значительной степени
зависит от их содержания в артериальной крови и не имеет порога.
Глюкоза пересекает мембрану кардиомиоцита с помощью переносчи-
ка. Этот процесс зависит от ее вне- и внутриклеточной концентрации.
Пороговый уровень глюкозы в крови — 4 ммоль/л, причем инсулин сни-
жает этот порог и увеличивает поглощение глюкозы клеткой. Путем гли-
колиза из одной молекулы глюкозы в анаэробных условиях образуются 2
24
молекулы пировиноградной кислоты (пирувата), 2 молекулы АТФ и 4
атома Н. Пируват затем подвергается окислительному декарбоксилирова-
нию с помощью пируватдегидрогеназы с образованием ацетил-КоА.
Механизм, с помощью которого лактат попадает в клетку, не ясен.
Лактат превращается в пируват с помощью лактатдегидрогеназы с после-
дующим образованием ацетил-КоА. В норме сердце поглощает лактат. Его
продукция указывает на патологическое усиление анаэробного обмена,
так как в случае отсутствия кислорода пируват, образующийся из глюко-
зы или гликогена путем гликолиза, не способен превращаться в ацетил-
КоА и метаболизироваться в цикле трикарбоновых кислот, а превраща-
ется в лактат.
Регуляция утилизации субстратов миокардом довольно сложна. Основным
субстратом являются жирные кислоты, так как образование из них ацетил-
КоА ингибирует пируватдегидрогеназу и тем самым препятствует метабо-
лизму глюкозы и лактата. Образование цитрата в цикле трикарбоновых кис-
лот ингибирует фосфофруктокиназу, которая является одним из ферментов
гликолиза. В условиях гипоксии и дефицита АТФ, необходимого для обра-
зования ацетил-КоА из жиров, происходит стимуляция гликолиза (эффект
Пастера), который, однако, не в состоянии обеспечить достаточный син-
тез АТФ. Более того, развивающийся ацидоз ингибирует фосфофруктокиназу.
II этапом образования энергии является цикл трикарбоновых кислот (цикл
Кребса), который заключается в аэробном окислении в матриксе мито-
хондрий ацетил-КоА — ключевого промежуточного соединения в метабо-
лизме всех основных питательных веществ. В серии из 10 реакций ацетил-
КоА постепенно окисляется до углекислого газа с одновременным отщеп-
лением дегидрогеназами атомов Н, которые в виде НАДН и ФАДН2 ста-
новятся субстратами (донорами электронов) в реакции дыхательной цепи.
Таким образом, в результате цикла Кребса происходит перенос энергии
связи субстратов в свободную энергию атомов Н. В итоге на 2 молекулы
пировиноградной кислоты, образующихся из каждой молекулы глюкозы,
приходит 2 молекулы углекислого газа, 16 атомов Н и 2 молекулы АТФ.
III этап образования энергии — окислительное фосфорилирование. Обра-
зовавшиеся на предыдущем этапе атомы Н субстрата переносятся с помо-
щью НАДН и системы ферментов внутренней мембраны митохондрий, так
называемой дыхательной цепи, к кислороду. При этом происходит после-
довательное отщепление электронов (е_) и образование Н+, которые по-
парно переходят через мембрану во внутриклеточную среду. Электроны пос-
ледовательно переносятся через ряд окислительно-восстановительных фер-
ментов и переносчиков дыхательной цепи и в конце концов присоединя-
ются к последнему переносчику (цитохрому с3), который окисляется моле-
кулой кислорода. При этом каждый атом О принимает 2 электрона (е~) и
присоединяет 2 протона Н+, образуя молекулу воды (2е_ + 1/2 О2 -> О2~ +
2Н+ -> Н2О). При каждом перемещении Н+ в мембране нарастает электро-
химический градиент протонов, который состоит из 2 составных частей —
разницы в концентрации Н+ (то есть pH) и разницы в электрических
25
потенциалах. Энергия этого градиента является движущей силой процесса
синтеза АТФ, в ходе которого происходит обратное перемещение протонов
Н+ по направлению градиента, то есть внутрь митохондрии. Каждые 2 пере-
несенных протона осуществляют синтез 1 молекулы АТФ. Точный меха-
низм образования АТФ из АДФ и неорганического фосфата неизвестен. Та-
ким образом, синтез АТФ, то есть аэробное фосфорилирование, сопряжен
с реакциями переноса е“ в дыхательной цепи. На синтез АТФ расходуется
44 % энергии, образующейся при реакции водорода с кислородом. Осталь-
ная энергия выделяется в виде тепла. Образующиеся внутри митохондрий
молекулы АТФ переносятся наружу, обмениваясь на молекулы АДФ.
В итоге из 1 молекулы глюкозы, метаболизировавшейся до углекисло-
го газа и воды, образуется 24 атома Н и 38 молекул АТФ, причем 36
(95 %) - исключительно в присутствии кислорода. При метаболизме жир-
ных кислот выход энергии составляет 8 молекул АТФ на 1 атом углерода.
Например, при окислении 1 молекулы стеариновой кислоты образуется
104 атома Н и 138 молекул АТФ.
Кроме АТФ, энергия накапливается также в виде высокоэнергетичес-
ких фосфатных связей молекулы КФ:
КФК
АТФ + креатин КФ + АДФ.
Для ее расходования на сокращение необходимо, однако, обратное пре-
вращение КФ в АТФ. В отличие от скелетной мышцы, в миокарде КФ
содержится относительно мало.
Энергия, аккумулированная в виде АТФ, используется для мышечного
сокращения, поддержания градиентов ионов и целостности клеточных
структур. Эффективность механической работы сердца в целом, то есть
отношение энергии, затрачиваемой на изгнание определенного объема
крови, против сопротивления, создаваемого давлением в аорте, к энер-
гии, освобождающейся при потреблении кислорода, составляет 12 % в
покое и 18—25 % при физической нагрузке.
СОПРЯЖЕНИЕ ВОЗБУЖДЕНИЯ С СОКРАЩЕНИЕМ
И РАССЛАБЛЕНИЕ
При достаточном содержании АТФ сокращение мышечного волокна про-
исходит только при повышении концентрации Са2+ в пространстве между
молекулами актина и миозина с 10~7 М по крайней мере до 10~5 М. Это
происходит за счет (рис. 8):
1) освобожде ния Са2 + , вызываемого С а2 + (триггерная ги-
потеза). Во время деполяризации клеточной мембраны небольшое количе-
ство Са2+ входит в клетку в виде медленного кальциевого тока потенциала
действия. Этого количества ионов недостаточно для активации миофиламен-
26
Рис. 8. Схематическое изображение
сопряжения возбуждения с сокраще-
нием в кардиомиоците. Объяснение
в тексте
тов, но достаточно для “запус-
ка” массового освобождения
Са2+ из саркоплазматического
ретикулума;
2)освобождения С а 2 + ,
вызываемого деполя-
ризацией. Потенциал дей-
ствия распространяется через
мембрану Т-трубочек на терми-
нальные цистерны саркоплаз-
матического ретикулума и вы-
зывает изменение его мембра-
ны, в результате чего повыша-
ется ее проницаемость для Са2+, и они путем пассивной диффузии осво-
бождаются в цитоплазму (так называемый кальциевый залп).
Роль Са2+ в сопряжении возбуждения с сокращением состоит в следующем:
1) вышедший в цитоплазму Са2+ связывается с тропони-
ном С, что вызывает изменение его конформации, которое передается
другим молекулам тропонинового комплекса, в том числе тропонину 1. В
результате его конформационного изменения тропомиозин глубже по-
гружается в бороздку на поверхности молекулы актина, позволяя тем
самым головке молекулы миозина вступить во взаимодействие с моно-
мером актиновой нити с образованием актомиозина. Это в свою очередь
изменяет конформацию глобулярной части молекулы миозина, которая
отклоняется на определенный угол от направления оси и тянет за собой
тонкий аактиновый филамент;
2) повышение концентрации Са2+ в цитоплазме ак-
тивирует Ми2 + -стимулируемую АТФ-азу миозина. Кон-
формационное изменение миозина позволяет его АТФ-азе отщепить от
АТФ фосфатную группу, которая вместе с ЛДФ выделяется в среду. Тем
самым обеспечивается химическая энергия для сокращения, которое осу-
ществляется благодаря скольжению тонких нитей актина вдоль толстых
нитей миозина (гипотеза скользящих нитей Huxley и Hanson). Необходи-
мо отметить, что чем больше Са2+ связалось с тропонином, тем больше
образуется актомиозиновых мостиков и больше развиваемое системой
напряжение, то есть сила сокращения.
Расслабление мышечного волокна обеспечивается благодаря уменьше-
нию концентрации Са2+ в пространстве между миофиламентами (менее
10-7 М) за счет его активного обратного транспорта в саркоплазматичес-
кий ретикулум и внеклеточную среду с помощью:
27
1) кальциевого насоса мембраны саркоплазматического ре-
тикулума и сарколеммы, то есть Са2+—АТФ-азы, которая переносит 2
Са2+ наружу против электрохимического градиента в расчете на 1 рас-
щепляемую молекулу АТФ. В саркоплазматическом ретикулуме Са2+ прочно
связаны с белками — кальсеквестрином и так называемым Са-связываю-
щим белком с высоким сродством;
2) №+-Са2+-обменного механизма клеточной мембраны, обеспечи-
вающего обмен 1 внутриклеточного Са2+ на 2, 3 или 4 Na+ (чаще 3),
находящихся вне клетки. Хотя эта реакция ускоряется в присутствии АТФ,
он при этом не гидролизуется. Источником энергии для выведения Са2+
против электрохимического градиента является электрохимический гра-
диент Na+, так как при этом Na+ перемещается по градиенту, который
обеспечивается работой К+—Na+-Hacoca. Таким образом, К+—Na+-Hacoc,
использующий энергию АТФ для поддержания электрохимического гра-
диента Са2+, косвенно способствует поддержанию электрохимического
градиента Са2+. Необходимо отметить, что повышение концентрации Na+
внутри клетки, как, например, при увеличении ЧСС или ингибировании
К+—Na+Hacoca под действием сердечных гликозидов, приводит к поступ-
лению внутрь клетки некоторого дополнительного количества Са2+ вслед-
ствие замедления реакции его обмена из-за уменьшения электрохими-
ческого градиента для Na+. Кроме того, при повышении внутриклеточ-
ной концентрации Na+ часть переносчиков начинает переносить Na+ и
Са2+ в противоположном направлении. При этом увеличение обратного
захвата Са2+ саркоплазматическим ретикулумом и его освобождения с
каждым импульсом возбуждения вызывает увеличение силы сердечных
сокращений. Na+—Са2+-обменный механизм может участвовать также в
притоке Са2+ внутрь клетки. Функционирование этих систем обеспечива-
ет поддержание значительного градиента концентрации Са2+ между вне-
клеточной (10~3М) и внутриклеточной (10-7 М) средой.
ЭЛЕКТРОФИЗИОЛОГИЯ СЕРДЦА
Трансмембранный потенциал покоя. В состоянии покоя внутренняя по-
верхность мембраны мышечного волокна имеет отрицательный заряд по
отношению к наружной. Этот отрицательный внутриклеточный потенци-
ал, или потенциал покоя (ПП), обусловлен различиями концентрации
К+, Na+, а также Са2+ во внутри- и внеклеточном пространстве. Концен-
трация К+ внутри клетки составляет около 140 ммоль/л и значительно
превышает его внеклеточную концентрацию (4 ммоль/л), тогда как Na+,
наоборот, преобладает во внеклеточной среде (140 против 10 ммоль/л).
Эти градиенты концентраций связаны с различной мембранной прони-
цаемостью для этих ионов и поддерживаются работой K+-Na+-Hacoca
сарколеммы, который затрачивает энергию для выведения К+ и Na+ про-
тив их электрохимических градиентов. Насос расположен в клеточной мем-
бране и, возможно, также в Т-трубочках и сопрягает перенос Na+ из
28
клетки с введением внутрь К+. Его движущим механизмом является мем-
бранная К+—Na+—АТФ-аза, для активации которой необходимы К+, Na+,
а также Mg2+. Коэффициент сопряжения удаляемых Na+ и поступающих
К+ может варьировать от 3:3 до 3:3 и 3:1. Чаще всего он равен 3:2, в
результате чего работа насоса приводит к возникновению некоторой транс-
мембранной разности потенциалов.
В состоянии покоя из всех ионов клеточная мембрана наиболее про-
ницаема для К+, который по градиенту концентрации переходит во вне-
клеточную среду. Так как он имеет положительный заряд, а белковые
анионы остаются в клетке, ее внутренняя поверхность приобретает от-
рицательный заряд. При этом достигается равновесие между электри-
ческими силами, стремящимися задержать К+ в клетке, и тенденцией к
диффузии во внеклеточную среду по градиенту концентрации. Посколь-
ку мембрана значительно менее проницаема для Na+, диффузия этого
иона протекает значительно медленнее, чем К+, в результате чего за
ПП несут ответственность преимущественно К+, и его величина при-
мерно равна калиевому равновесному потенциалу. При расчете равно-
весного потенциала для этого иона с помощью уравнения Нернста ока-
залось, что его величина составляет примерно -95 мВ.
ПП клеток сократительного миокарда и проводящей системы сердца
составляет от —80 до —90 мВ. Небольшое отличие этой величины от рас-
четного равновесного потенциала для К+ обусловлено токами утечки дру-
гих ионов. Определенное значение имеет также коэффициент сопряже-
ния удаляемых из клетки Na+ и транспортируемых внутрь ее Са2+ в Na+-
Са2+-обменном механизме, который обычно равен 3:1, что обусловлива-
ет небольшую деполяризацию внутренней стороны клеточной мембраны.
ПП клеток синоатриального узла и атриовентрикулярного соединения
находится в пределах -60 ... -70 мВ.
Потенциал действия (ПД). При стимуляции мышечного волокна под
воздействием химического, электрического или механического раздра-
жителя внутриклеточный электрод регистрирует потенциал действия. Он
возникает в результате последовательных, быстро сменяющих друг друга
изменений физико-химических свойств клеточной мембраны, которые
приводят к нарушению ее проницаемости для различных ионов и их пе-
реносу, что вызывает изменения мембранного потенциала (так называе-
мая ионная гипотеза Hodgkin—Huxley.
ПД состоит из двух основных фаз: деполяризации и реполяризации
(рис. 9).
Деполяризация, или нулевая фаза ПД, характеризуется уменьшением
электроотрицательности внутренней поверхности клеточной мембраны
до определенного, так называемого порогового, уровня, после чего ее
отрицательный потенциал резко уменьшается, стремясь к 0, и в течение
доли миллисекунды сменяется на положительный, величиной 10 - 25 мВ
(овершут, или реверсия). При этом с наружной стороны мембраны обра-
зуется такой же величины отрицательный потенциал — импульс в о з -
29
Рис. 9. ПД клетки сократительного миокарда желудочка: 0 - деполяризация;
1, 2, 3 - различные фазы реполяризации ПД; ПП - потенциал покоя; АРП
— абсолютный рефрактерный период; ОРП — относительный рефрактерный
период; ПСН - период супернормальности; t - ток ионов внутрь клетки
(входящий), I — ток ионов из клетки наружу (выходящий)
буждения (в остальное время внеклеточная среда нейтральна). Им-
пульс вызывает деполяризацию соседних возбудимых структур с разви-
тием цепной реакции — волны возбуждения , которая охватывает
миокард.
Для всех волокон миокарда, кроме клеток синоатриального узла и атрио-
вентрикулярного соединения, пороговый потенциал составляет от -60 мВ
до —70 мВ. В клетках синоатриального и атриовентрикулярного узлов он ра-
вен -30... —40 мВ.
Быстрая деполяризация внутренней поверхности клеточной мембраны при
возникновении ПД в клетках рабочего миокарда и проводящей системы сер-
дца, подобно нерву и скелетной мышце, обусловлена кратковременным
повышением мембранной проницаемости для Na+. Возникает так назы-
ваемый быстрый входящий ток Na+ по электрохимическому градиенту
через “быстрые” Na-каналы, управляемые потенциалзависимыми и за-
висимыми от времени активационными и инактивационными воротами
(см. ниже).
К концу деполяризации повышается мембранная проницаемость для К+.
Это обстоятельство, а также уменьшение электроотрицательности внутри-
клеточного потенциала позволяют К+ по своему электрохимическому гра-
диенту быстро покидать клетку.
Вслед за овершутом сразу начинается реполяризация, которая имеет три
фазы.
В 1-ю фазу, или фазу ранней быстрой реполяризации,
мембранный потенциал уменьшается почти до 0 вследствие изменения на-
правления ионного тока с входящего на выходящее. Это обусловлено:
1) уменьшением мембранной проницаемости для Na+ и инактивацией
быстрых Ма+-каналов;
30
2) проходящим повышением мембранной проницаемости для СГ с
появлением входящего тока этого иона, который прекращается, как только
мембранный потенциал достигает 0 (этот факт сейчас пересматривает-
ся);
3) транзиторным выходящим током большой амплитуды с малой постоян-
ной времени, который, по-видимому, представляет собой выходящий ток
К+ вследствие кратковременной активации его потенциалзависимых кана-
лов.
Во 2-ю фазу ПД, или фазу плато, мембранный потенциал под-
держивается на практически неизменном уровне благодаря тонкому ба-
лансу между небольшими по величине входящими и выходящими тока-
ми. Лишь к концу фазы равновесие нарушается в пользу выходящего тока
положительно заряженных ионов с внутренней поверхности мембраны к
наружной, что обусловливает продолжение процесса реполяризации.
В основе фазы плато лежат следующие перемещения ионов:
1) медленные входящие токи Са2+ и в меньшей степени Na+, возни-
кающие при активации соответствующих медленных потенциалзависи-
мых каналов — селективных Са2+ и Na+ и неселективных Са2+ и Na+;
2) небольшой выходящий ток К+ через активированные в данном ди-
апазоне потенциалов неселективные каналы, который состоит из двух
компонентов - с малой и большой постоянной времени. Последнее обес-
печивает его участие в завершении процесса реполяризации.
Медленный входящий ток Са2+ имеет важное физиологическое значе-
ние, поскольку: 1) обеспечивает сопряжение возбуждения клеточной мем-
браны с активацией сократительных белков, то есть сокращением; 2) обес-
печивает однонаправленное проведение импульса возбуждения по сердцу.
В то же время этот ток может играть важную роль в возникновении аритмий.
ВЗ-ю фазу,илифазу поздней реполяризации, наблюда-
ется полное восстановление отрицательного внутриклеточного потенци-
ала за счет массового выхода К+. В конце 3-й фазы системы активного
транспорта К+—Na+- и Са2+-насосы обеспечивают поступление К+ внутрь
клетки и удаление Na+, то есть восстановление исходного распределения
ионов между цитоплазмой кардиоциоцита и внеклеточной жидкостью. В
4-ю фазу, соответствующую ПП в клетках рабочего миокарда и системы
Гиса-Пуркинье, восстанавливается мембранная проницаемость для К+.
Возникновение ионных токов обусловлено изменением проводимости
соответствующих ионных каналов. Такой канал представляет собой осо-
бый белок, плавающий в липидном бислойном матриксе клеточной мем-
браны. В этом белке имеется заполненный водой центральный канал для
транспорта ионов. Во время прохождения через такой ион-селективный
канал по направлению электрохимического, то есть электрического плюс
концентрационного, градиента катион, по-видимому, связывается с от-
рицательно заряженными участками.
Потенциалзависимые быстрые натриевые и медленные кальциевые и
натриевые каналы имеют активационные ворота (А) в центральной час-
31
Рис. 10. Модель трех гипотетических
состояний ионного канала клеточной
мембраны: А — активационные во-
рота; 1 — инактивационные ворота
(по Н.Сперелакису, 1990, с сокра-
щениями). Объяснение в тексте
Покой
Наружная поберхность
мембраны
Внутренняя
поберхность
мембраны
Восстановлен ие,
реполяризация
состояние
Деполяризация
Инактибация
Инактибиробанное
состояние
ти канала и инактивационные
(I) на внутренней поверхнос-
ти мембраны (рис. 10).
Деполяризация до уровня
порогового потенциала, кото-
рый для разных каналов име-
ет различную величину, переводит канал в активированное состояние:
А-ворота открываются, а 1-ворота не успевают закрыться. При достиже-
нии мембранным потенциалом определенной величины и по прошествии
определенного времени активированный канал спонтанно инактивиру-
ется в результате закрытия 1-ворот. После реполяризации мембраны ка-
нал реактивируется, то есть переходит в состояние .покоя, которое ха-
рактеризуется закрытыми А-воротами при открытых 1-воротах. Впослед-
ствии он может быть снова активирован.
Медленные каналы кардиомиоцитов получают возможность активи-
роваться при деполяризации лишь при фосфорилировании мембранного
белка, входящего в состав медленного канала, или связанного с ним
регуляторного белка. Это обеспечивается цАМФ-зависимой протеинки-
назой, использующей энергию АТФ, которая активируется при увеличе-
нии внутриклеточного уровня цАМФ. Фосфорилирование вызывает кон-
формационное изменение белков, которое позволяет А-воротам открыться
в ответ на изменение мембранного потенциала.
Благодаря таким особым свойствам медленных каналов поступление
Са2+ в кардиомиоцит, а следовательно, и сила его сокращения могут
регулироваться: 1) внешними факторами — стимуляцией симпатической
части вегетативной нервной системы циркулирующими катехоламина-
ми, гистамином, метилксантинами; 2) внутренними факторами — уров-
нем энергетического обмена в клетке, то есть запасами АТФ, pH, содер-
жанием цАМФ.
Вследствие блокады Са2+-каналов при уменьшении запасов макроэр-
гов и pH в условиях кратковременной локальной ишемии снижается сила
сокращений и работа клетки, что способствует сохранению минималь-
ного уровня АТФ и предотвращает необратимое повреждение клетки.
Другие отличия медленных каналов от быстрого Ъ1а+-канала: 1) более
медленная кинетика открытия и закрытия ворот; 2) менее отрицательные
потенциалы активации (—35 мВ против —55 мВ) и инактивации; 3) спо-
собность блокироваться различными химическими веществами.
В участках, деполяризованных вследствие повышения содержания К+
во внеклеточной среде, вызванного ишемией, “быстрые” ПД могут за-
32
Синоатриальный узел Оту
Порьгобый потенц и ал
Рис. 11. ПД в различных участках сердца: А - миокард предсердий;
Б - атриовентрикулярный узел; В - волокна Пуркинье; Г — миокард
желудочков
пускать “медленные”. При этом низкая скорость распространения “мед-
ленных” ПД создает условия для развития аритмий типа ри-энтри.
Электрофизиологические свойства миокарда включают возбудимость,
автоматизм и проводимость:
1) возбудимость — способность клеток развивать ответ на раздражение
(стимул, импульс). В миокарде это свойство проявляется в форме: а) про-
ведения импульса; б) сокращения мышечных волокон. В различные пе-
риоды сердечного цикла возбудимость неодинакова, что обусловлено нео-
динаковой рефрактерностью.
Рефрактерный период — это часть сердечного цикла, в тече-
ние которой сердце не возбуждается или возбуждение его нарушено.
Различают абсолютный и относительный рефрактерные периоды.
Абсолютный рефрактерный период представляет собой часть
сердечного цикла, когда другой раздражитель, независимо от его силы,
не способен вызвать повторное возбуждение, то есть образование ПД,
возбужденного предыдущим стимулом участка мышцы. Он охватывает ну-
левую, 1-ю, 2-ю и начало 3-й фазы ПД (см. рис. 9).
Относительный рефрактерный период — это часть сер-
дечного кардиоцикла, в которую деполяризацию (ПД) удается вызвать
лишь с помощью очень сильного раздражителя, более сильного, чем тот,
который вызывает ПД в состоянии покоя при наличии ПП. При этом
величина вызываемого ПД и скорость его проведения уменьшены. Отно-
сительный рефрактерный период занимает значительную часть 3-й фазы.
Следует отметить, что электрическая возбудимость восстанавливается
раньше, чем сократительная активность.
За относительным рефрактерным периодом следует период супер-
нормальности, характеризующийся снижением порога возбудимос-
ти, когда подпороговый раздражитель способен вызвать деполяризацию.
Соответствует конечной части 3-й фазы.
33
Рефрактерный период кардиоцикла миокарда значительно длиннее,
чем скелетной мышцы и нерва, что защищает миокард от тетанического
сокращения и обеспечивает чередование периодов сокращения и рас-
слабления, необходимых для надежного обеспечения нормального кро-
вообращения.
Длительность рефрактерного периода прямо пропорциональна продолжи-
тельности предшествовавшего сердечного цикла и силе предшествовавшего
сокращения.
Ионной основой рефрактерности являются: а) инактивация мембран-
ных потенциалзависимых №+-каналов в условиях деполяризации; б) стой-
кое повышение мембранной проводимости для К+;
2) автоматизм, или пейсмекерная активность, — способность клетки
генерировать ПД, то есть импульс возбуждения. Определяется способно-
стью к спонтанной медленной диастолической деполяризации в 4-ю фазу
ПД, которая следует сразу же за 3-й фазой (рис. 11). Пейсмекерный ток
обусловлен постепенным уменьшением проницаемости мембраны для К+.
По мере увеличения мембранного потенциала, то есть уменьшения вели-
чины ее отрицательного заряда, калиевые каналы, управляемые ворота-
ми, постепенно переходят из открытого состояния в закрытое. Динамика
этого процесса определяет скорость, с которой уменьшается суммарный
выходящий трансмембранный ток, которая, в свою очередь, определяет
угол наклона кривой пейсмекерной деполяризации. Спонтанная диасто-
лическая деполяризация, вероятно, частично обусловлена также зависи-
мым от времени входящим током Na+ в результате медленного увеличе-
ния проницаемости для этого иона. Кроме того, некоторые вещества,
например, норадреналин, способны усиливать фоновые входящие токи
(так называемые токи утечки) Na+ и Са2+, что также увеличивает кру-
тизну пейсмекерного потенциала.
Выраженность автоматизма, то есть частота импульсов, генерируемых
пейсмекерными клетками, зависит от: 1) скорости спонтанной диастоли-
ческой деполяризации, то есть наклона кривой в 4-ю фазу; увеличение на-
клона кривой приводит к повышению ЧСС и наоборот; 2) величины поро-
гового потенциала; 3) величины максимального диастолического потенциа-
ла, достигнутой к концу реполяризации.
Приоритет центров (водителей) автоматизма в сердце определяется при-
сущей их клеткам скорости спонтанной диастолической деполяризации. В
норме водителем ритма 1-го порядка является синоатриальный узел, 2-го
порядка — атриовентрикулярное соединение (зонаЫН). Клетки системы
Гиса—Пуркинье являются латентными пейсмекерами, в которых спонтан-
ная диастолическая деполяризация в норме не регистрируется, так как
высокочастотная стимуляция главного водителя ритма угнетает их автома-
тизм, возбуждая эти клетки с более высокой частотой. В клетках рабочего
миокарда предсердий и желудочков автоматизм развивается только в ус-
ловиях патологии, например при локальной ишемии (см. рис. 11);
3) проводимость — свойство клеток рабочего миокарда и проводящей
34
системы сердца распространять импульс возбуждения на окружающие
клетки. Она обусловлена возникновением разности потенциалов вдоль
поверхности волокна между деполяризованным участком и участками,
которые находятся в состоянии покоя. Эта разность потенциалов приво-
дит в движение ионы (в основном К+), которые перемещаются от актив-
ного участка к пассивным, давая начало локальным токам, распростра-
няющим деполяризацию вдоль поверхности клетки.
Скорость проведения возбуждения в разных отделах сердца неодина-
кова. Она максимальна в волокнах Пуркинье (2—4 м/с) и минимальна в
атриовентрикулярном соединении (0,1-0,2 м/с), где задержка проведе-
ния в зоне N играет важную физиологическую роль. В сократительном
миокарде предсердий импульс проводится со скоростью 0,4-0,8 м/с, в
миокарде желудочков — 0,3—0,4 м/с.
Проводимость, то есть скорость проведения возбуждения, зависит от:
А. Анатомических факторов:
1) диаметра мышечных волокон (прямая зависимость), наибольшего в
волокнах Пуркинье (100 мкм против 10—15 мкм у рабочих кардиомиоцитов);
2) геометрического расположения мышечных волокон (скорость про-
ведения вдоль мышечного волокна больше, чем поперек).
Б. Физиологических факторов:
1) амплитуды ПД (прямая зависимость);
2) скорости деполяризации в нулевую фазу (прямая зависимость);
3) амплитуды ПП (уменьшение его отрицательной величины в результа-
те частичной деполяризации замедляет проведение);
4) возбудимости мышечных волокон, по которым проводится импульс.
Доказана возможность неоднородности проведения возбуждения в физио-
логических условиях в атриовентрикулярном соединении, пучке Гиса и его
ножках. Эта так называемая продольная функциональная диссоциация, как
и уменьшение скорости проведения в отдельных участках миокарда, имеет
важное значение для возникновения нарушений сердечного ритма.
ГЛАВА 3.
КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ СЕРДЦА, ПЕРИФЕРИЧЕСКОГО
И КОРОНАРНОГО КРОВООБРАЩЕНИЯ
ИЗМЕНЕНИЯ ОБЪЕМА И ДАВЛЕНИЯ В ПОЛОСТЯХ СЕРДЦА
НА ПРОТЯЖЕНИИ СЕРДЕЧНОГО ЦИКЛА
Последовательные изменения объема желудочков и давления в желу-
дочках, предсердиях и крупных артериях на протяжении сердечного цик-
ла представлены на рис. 12 и в табл. 1.
Сердечный цикл состоит из систолы и диастолы. Систола желудочков
включает две основные фазы — изоволюмицеского, или изометрическо-
го, сокращения и изгнания, а диастола — фазы изоволюмического, или
35
Изометрическое расслабление
Изометрическое Протодиастала
сокращение \ Изгнание 1
быстрое наполнение
Медленное наполнение (диастазис)
/ Систола предсердий
t>
X
X*
120
100
80-
60
40
20
120-
вО'-
Дадление
6 аорте
0L-
160 г
-Открытие
аортального
-клапана
Закрытие
атриовентр
'кулярного
клапана
ЭКГ
ФКГ
Дабление 6
желудочке
/Объем
икелудочко
Систола Диастола
Систола
Закрытие
аортального
клапана
Открытие
\ атриобентрику-
- парного клапана
Давление 6
vXppedcepduu
§
Рис. 12. Изменения показателей внутрисердечной гемодинамики и биоэлектрической ак-
тивности сердца на протяжении сердечного цикла (по A.Guyton, 1981)
изометрического, расслабления, быстрого наполнения, медленного на-
полнения (диастазиса) и систолы предсердий.
Фаза изоволюмического сокращения начинается после
деполяризации желудочков, которая регистрируется на ЭКГ в виде ком-
плекса QRS. Начало повышения напряжения совпадает с зершиной зубца R.
Начальное быстрое повышение внутрижелудочкового давления сопро-
вождается изменением формы полости желудочка без изменения его объе-
ма. При этом происходит захлопывание атриовентрикулярных клапанов,
которое вызывает образование . На флебограмме регистрируется поло-
жительная волна “с”, обусловленная выбуханием трехстворчатого клапа-
на в полость правого предсердия при сокращении правого желудочка.
Последующее смешение клапанного кольца книзу во время систолы вы-
зывает образование отрицательной волны “х”.
36
Таблица 1. Фазы сердечного цикла, их сущность и продолжительность
Фаза Начало фазы Содержание фазы Конец фазы Продол- житель- ность, с
I- изоволюмическое сокращение Начало сокращения желудочков Закрытие атриовентри- кулярных клапанов, быстрое повышение внутрижелудочкового давления без изменения объема Открытие полулунных клапанов 0.05’
II — изгнание Открытие полулунных клапанов Изгнание крови из желудочков и давление в них вначале резко воз- растают, потом умень- шаются Начало расслабления желудочков 0,22
III — изоволюмиче- ское расслабление Начало расслабления желудочков Резкое падение внутри- желудочкового давле- ния, закрытие полулун- ных клапанов, продол- жение расслабления желудочков без изменения их объема Открытие атриовентри- кулярных клапанов 0,12
IV — быстрое наполнение Открытие атриовентрикуляр- ных клапанов Быстрый ток крови из предсердий в желудочки Замедление тока крови в желудочки 0,11
V — медленное наполнение (диастазис) Замедление тока крови из предсердий в желудочки Продолжение медлен- ного поступления крови из предсердий в желу- дочки Начало сокращения предсердий 0,19
IV — наполнение в результате систолы предсердий Начало сокращения предсердий Увеличение тока крови из предсердий в желу- дочки Начало сокращения желудочков 0,11
’ При ЧСС 75 в 1 мин.
Когда давление в полости желудочка начинает превышать давление в
аорте и стволе легочной артерии настолько, что преодолевает инерцию
полулунных клапанов, они открываются, и начинается изгнание . Бы-
строе изгнание крови в аорту сопровождается повышением в ней давле-
ния и резким уменьшением объема полости желудочка. В это время пред-
сердия, закончив свое расслабление, начинают пассивно наполняться, и
давление в них повышается. При прекращении изгнания крови из желу-
дочка давление в нем снижается, что сопровождается уменьшением дав-
ления в аорте и легочной артерии. В фазу изгнания происходит реполяри-
зация желудочков, которая вызывает образование зубца Т на ЭКГ.
37
Таблица 2. Изменения давления и объема полостей желудочков в различные фазы сердечного цикла
Фаза Давление Объем
Систола
Не изменяется
Уменьшается
Изоволюмического сокращения Повышается
Изгнания Повышается, затем снижается
Диастола
Изоволюмического
расслабления Снижается
Быстрого наполнения Снижается
Медленного наполнения Повышается
Систолы предсердий Повышается
Не изменяется
Увеличивается
Увеличивается
Увеличивается
Когда давление в желудочке становится ниже, таким, как в отходя-
щем от него артериальном стволе, начинается изоволюмическое
расслабление желудочка. При этом возникает ретроградное движе-
ние крови из корня аорты и легочной артерии, которое вызывает захло-
пывание полулунных клапанов с образованием дикротической зазубри-
ны на кривых давления в сосудах и II тона сердца - S2 (А2Р2). В фазу
изоволюмического расслабления давление в полости желудочка резко
снижается при неизмененном объеме. На кривой давления в предсердиях
образуется волна “v”, обусловленная притоком в них крови из систем-
ных и легочных вен, которая достигает максимума перед открытием трех-
створчатого клапана.
Когда давление в желудочке становится ниже, чем в предсердии, откры-
ваются атриовентрикулярные клапаны,и начинается период быстрого
наполнения . Вследствие быстрого поступления крови из предсердий в
желудочки по градиенту давления их объем быстро увеличивается. При
этом образуется III тон сердца (S.), который определяется в норме у
детей и лиц молодого возраста. В более старшем возрасте тон S3 свиде-
тельствует о повышении давления наполнения желудочка.
Резкое замедление поступления крови в желудочек означает начало
периода медленного наполнения (диастазиса) . В конце
этого периода происходит электрическая деполяризация предсердий, вы-
зывающая образование зубца Р на ЭКГ, и начинается их сокращение.
Началом последней фазы - систолы предсердий — является
начало повышения давления в них, что приводит к образованию волны
“а” на кривой внутрипредсердного давления и флебограмме. Величина
давления в предсердиях превышает диастолическое давление в полости
желудочков, что вызывает поступление в них крови. В конце этого пери-
ода начинается электрическая деполяризация желудочков с образовани-
ем начальной части комплекса QRS на ЭКГ. При выраженной тахикар-
дии, когда систола предсердий происходит во время быстрого наполне-
ния желудочков, ее вклад может достигать 30—40 % их КДО. Последова-
38
Таблиц J. Давление полостях еердот » крупных сосудах в норме, мм рт.ет.
Место измерения Давление
систолическое конечно-диастоличе- ское среднее
Правое предсердие — — 2-8
Правый желудочек 15-30 2-8 Не используется
Легочная артерия 15-30 4-12 9-18
"Легочные капилляры" 2-10
Левое предсердие — — 2-10
Левый желудочек 100-139 3-12 Не используется
Аорта 100-139 60-90 70-105
тельность изменений давления и объема желудочков на протяжении сер-
дечного цикла представлена в табл. 2.
ОСНОВНЫЕ ПОКАЗАТЕЛИ НАСОСНОЙ ФУНКЦИИ СЕРДЦА В НОРМЕ
О ЦК у взрослых составляет около 5 л (при гематокритном числе 45),
из которых около 1,5 л находятся в сердце и легких, образуя так называ-
емый центральный объем крови. В легочных артериях, капиллярах и венах
находится около 0,9 л крови, из них в легочных капиллярах — лишь око-
ло 75 мл, в сердце — 0,6 л. КДО левого желудочка составляет около 140
мл, ударный объем — примерно 90 мл, так что КСО равен около 50 мл.
Фракция выброса левого желудочка, представляющая собой отношение
ударного объема к конечно-диастолическому, составляет около 50—70 %.
Примерно такая же величина фракции выброса правого желудочка.
Из 3,5 л крови, находящихся в сосудах большого круга кровообраще-
ния, по меньшей мере 60 % находится в венах. Благодаря их растяжимо-
сти небольшие изменения венозного давления вызывают значительные
изменения венозного притока к сокращающемуся сердцу.
Нормальные величины давления в полостях сердца и крупных сосудах
представлены в табл. 3. Нулевым давлением произвольно принято считать
давление, регистрируемое на уровне 5 см книзу от угла грудины в положе-
нии человека лежа.
МОС является произведением УОС и ЧСС. Он обычно выражается в л/мин
на 1 м2 поверхности тела (в среднем 1,73 м2) и называется сердечным ин-
дексом (СИ). СИ в норме составляет в среднем 3,5 л/мин/м2 и колеблется в
диапазоне 2,5—4,2 л/мин/м2. Поглощение кислорода в покое составляет 110—
150 л/мин/м2, в среднем 240 мл/мин, разница в содержании кислорода в
артериальной и смешанной венозной крови (так называемая артериовеноз-
ная разница) — около 40 мл/л. Последняя колеблется в узких пределах — от
35 до 45 мл/л.
ОПСС и ЛСС рассчитывают как частное от деления разности между
средним давлением на “выходе” из сердца (то есть в аорте или легочной
39
Схема I. Взаимосвязь факторов, обеспечивающих регуляцию МОС
артерии) и средним давлением на “входе” (то есть в левом или правом
предсердии соответственно) в миллиметрах ртутного столба на величину
тока крови (л/мин) через соответствующие системы кровообращения,
который в норме и у больных без внутрисердечных шунтов крови равен
МОС,
ОПСС=
АДСр-ЦВД
МОС
*80 и ЛСС=
Рласр—ЦВД
МОС
* 80,
где АД^ — среднее АД, ЦВД - центральное венозное давление, Рла^
— среднее давление в легочной артерии, 80 — коэффициент для перевода
мм рт.ст./л/мин в дин/с/см2. В норме ОПСС составляет 900—1400 дин/с/см2
и всегда меньше 1600 дин/с/см2 (20 мм рт.ст./л/мин), а ЛСС — меньше
160 дин/с/см2 (2 мм рт.ст./л/мин).
Ударная работа, отражающая силу сокращения желудочка, представ-
ляет собой интеграл мгновенных величин произведения давления в же-
лудочке и ударного объема. Ее обычно рассчитывают как произведение
ударного объема и среднего давления, развиваемого желудочком в пери-
од изгнания. Для левого желудочка в норме равна около 6 кГм/мин.
РЕГУЛЯЦИЯ НАСОСНОЙ ФУНКЦИИ СЕРДЦА
Основная функция сердца — насосная, которая направлена на обеспе-
чение тканей оптимальным для их метаболических потребностей количе-
ством крови. Как любой насос, сердце удовлетворяет метаболические по-
требности тканей путем регуляции своего выброса за счет изменений ЧСС,
УОС или того и другого (схема 1).
Основным интегральным показателем насосной функции сердца являет-
ся МОС. Основные факторы, определяющие МОС:
I. Внутренние:
1) преднагрузка, или конечно-диастолическое стеночное напряжение.
Зависит от: диастолической податливости; давления наполнения (КПД); вре-
мени наполнения;
40
Положение
тела
ОЦК
Ударная
работа
(сила
сокращения)
Внутригрудное Тонус
давление / вен
Венозный
Возврат
Конечно -диастолическая
длина Волокна (КДО)
Растяжение миокарда к концу
диастолы-преднагрузка
Диастолическая
податливость
желудочка
Сокращение
предсердий
Длительность
диастолы
Рис. 13. Зависимость Франка-Старлинга и основные факторы, определяющие преднагрузку
2) сократимость. Зависит от: влияния вегетативной нервной системы,
гуморальных факторов (то есть внешних); местных факторов.
II. Внешние:
1) ЧСС. Зависит от влияния вегетативной нервной системы;
2) постнагрузка, или стеночное напряжение желудочка во время из-
гнания. Зависит от: сопротивления крови в аорте; объема левого желудочка.
Преднагрузка. В соответствии с законом Франка-Старлинга сила сокра-
щения сердца (а следовательно, и УОС) прямо пропорциональна длине
мышечного волокна к началу сокращения, то есть к концу диастолы (рис. 13).
Конечно-диастолическая длина волокна миокарда определяется силой, рас-
тягивающей волокна в конце диастолы, то есть преднагрузкой. Преднагруз-
ка представляет собой конечно-диастолическое стеночное напряжение же-
лудочка (а), которое в соответствии с уравнением Лапласа для толстостен-
PV
ной сферы (о=——), прямо пропорционально КДД (Р) и КДО (V) и
обратно пропорционально толщине стенки желудочка (h). В клинике ко-
нечно-диастолическую длину мышечных волокон и преднагрузку можно
ориентировочно оценить по величине КДО желудочка или, что менее
точно, его КДД, которое существенно зависит от податливости камеры.
Зависимость “длина—сила” (КДО-УОС) Франка-Старлинга лежит в ос-
нове так называемой гетерометрической саморегуляции сердца.
Как видно из данных рис. 13, при данном сопротивлении изгнанию
крови (давлении в аорте) и инотропном состоянии миокарда УОС тем
41
о
Положитель ный
инотропный
Эффект
Симпатическая
часть вегетативной
нервной системы и
циркулирующие ктхА
ЧСС
(лестница
Боудича)
Сократимость Эндогенные ве-
миокарда
\^щества с (+) и
(-) инотропным
действием
Отрицательный
инотропный эффект
Конечно- диастолическая
длина волокна (КДО)
Масса
сократительного
миокарда
Физиологические
кардио-
депрессанты
Рис. 14. Влияние сократимости миокарда на функцию желудочка и факторы, от которых
она зависит. КТХА — катехоламины
больше, чем больше исходная длина мышечного волокна к концу диас-
толы. Это обусловлено тем, что в физиологических условиях во время
систолы Са2+ образуют комплексы не со всеми молекулами тропонина и
остается резерв образования актомиозиновых мостиков. С увеличением
исходной длины мышечного волокна количество этих мостиков возрас-
тает без изменения притока Са2+. Когда конечно-диастолическая длина
саркомеров становится больше определенной величины, которой соот-
ветствует максимальное число связей актина с миозином, прирост силы
сокращения прекращается, и на кривой зависимости Франка-Старлинга
образуется плато. Перерастяжение мышечных волокон приводит к их де-
формации, нарушению взаимодействия сократительных белков, умень-
шению амплитуды сокращения и УОС.
Основные факторы, определяющие конечно-диастолическую длину мы-
шечного волокна и преднагрузку желудочка, представлены на рис. 13.
Венозный возврат, кроме абсолютной величины ОЦК, зависит от
его распределения между внутри- и внегрудным отделами, которое опреде-
ляется положением тела, внутригрудным давлением и тонусом вен. В нор-
ме среднее давление в грудной полости отрицательное, что облегчает
венозный приток. При его увеличении, например, при длительном каш-
ле, напряженном пневмотораксе, венозный возврат и УОС снижаются.
Сужение вен под влиянием катехоламинов является важным компенса-
торным механизмом поддержания УОС при физической нагрузке и шоке.
Диастолическая податливость желудочка определяется
рядом факторов, в частности адекватностью активного диастолического
расслабления миокарда (оно нарушается, например, при ишемии), эла-
стической жесткостью самого миокарда, которая в значительной степени
42
зависит от разрастания в нем соединительной ткани (площади интерсти-
циального фиброза и заместительного склероза) и выраженностью ги-
пертрофии миокарда. Чем меньше податливость камеры желудочка (или
больше ее жесткость), тем боольшее требуется давление наполнения
(КДД) для обеспечения данного КДО, а следовательно, и УОС.
Сократимость. Адекватного определения этого понятия пока не суще-
ствует. Сократимость, или инотропное состояние миокарда, характеризу-
ется изменениями силы (ударной работы, или УОС) и скорости сокраще-
ний, которые не связаны с изменениями пред- и постнагрузки. Считают,
что положительные инотропные эффекты опосредованы активацией ме-
ханизма сопряжения возбуждения с сокращением и связаны с увеличени-
ем поступления Са2+ в клетку. При повышении сократимости кривая
Франка-Старлинга смещается влево и кверху, что отражает повышение
силы сокращения при данной конечно-диастоличоской длине волокна, а
при ее снижении - вправо и книзу (рис. 14).
Инотропное состояние миокарда зависит от следующих факторов:
1) активности симпатической части вегетативной
нервной системы и циркулирующих катехоламинов над-
почечников (прямая зависимость). Парасимпатическая часть вегетативной не-
рвной системы практически не оказывает влияния на сократимость же-
лудочков из-за отсутствия в них ее волокон;
2) Ч С С. По мере увеличения до определенного предела ЧСС возрас-
тают сила и скорость каждого очередного сокращения, которые после
нескольких сокращений достигают нового устойчивого состояния. Этот
феномен, называемый “лестницей Боудича”, обусловлен возрастанием
притока в цитоплазму кардиомиоцитов Са2+ в результате увеличения сум-
марной длительности ПД в единицу времени;
3) экзогенных веществ с положительным инотроп-
ным действием (сердечные гликозиды, р-адреностимуляторы, препа-
раты кальция и др.) и с отрицательным инотропным действием
(хинидин, барбитураты, общие анестетики, p-адреноблокаторы и др.);
4) физиологических кардиодепрессантов: гипоксии (на-
сыщение кислородом менее 50 %), гиперкапнии, ацидоза, а также гипо-
натриемии и гиперкалиемии;
5) массы сократительного миокарда. Утрата части функцио-
нально полноценного миокарда (например, временная — при ишемии или
стойкая — при инфаркте миокарда остром или старом) приводит к сниже-
нию сократимости.
Ни один из используемых в клинической практике показателей не может
служить достаточно точным мерилом сократимости, то есть, строго гово-
ря, не позволяет сравнивать ее у разных больных или при разных состоя-
ниях у одного и того же больного, поскольку все они в большей или
меньшей степени зависят от пред-, постнагрузки и ЧСС. Наибольшее
распространение получили индексы фазы изгнания, которые можно опре-
делять неинвазивным путем с помощью эхокардиографии — фракция выб-
43
ДаблениеоЛЖ,
мм рт.ет.
Объем ЛЖ, мл
Рис. 15. Зависимость “давление — объем” левого
желудочка. Один сердечный цикл представлен
пунктирной линией ABCD, Объяснение в тексте.
ЛЖ - левый желудочек
роса ФВ и средняя скорость укорочения
циркулярных мышечных волокон мио-
карда в период систолы (VCF). Следует
помнить, что оба показателя зависят от
постнагрузки. Этого недостатка практи-
чески лишены конечно-систолические
индексы сократимости, самым простым
из которых является отношение КСО и КДД в желудочке (K.Sagawa, 1981).
Постнагрузка — это напряжение (сила), которое должен развить желу-
дочек для изгнания крови. При одной и той же исходной длине волокна и
сократимости скорость и степень укорочения (УОС) миокарда обратно
пропорциональны постнагрузке. При этом ее повышение в результате кон-
стрикции периферических артериол вызывает увеличение ударной рабо-
ты левого желудочка и уменьшение степени укорочения его мышечных
волокон и УОС. Это в свою очередь приводит к снижению АД до исход-
ного уровня. При повышении постнагрузки увеличивается часть сократи-
тельной энергии миокарда, которая тратится на создание напряжения, и
уменьшается ее доля, расходуемая на укорочение миокарда.
В соответствии с законом Лапласа постнагрузка прямо пропорциональна
давлению, которое необходимо развить желудочку для открытия полу-
лунных клапанов и изгнания крови в сосуд (то есть диастолическому
давлению в аорте и легочной артерии), и объему полости желудочка к
этому моменту, то есть КДО. Так, при одном и том же давлении в аорте
постнагрузка на дилатированный левый желудочек больше, чем при нор-
мальных размерах его полости. Давление в аорте, в свою очередь, зависит
от ОПСС и объема крови в артериальном русле к началу изгнания. В кли-
нике постнагрузка приближенно оценивается с помощью ОПСС.
На рис. 15 представлена зависимость “давление-объем” левого желу-
дочка во время диастолы (кривая GH) и в конце систолы (кривая ЕЁ).
Положение кривой GH зависит от диастолической податливости камеры
желудочка, а кривой EF — от сократимости миокарда, которая определя-
ет зависимость “конечно-систолический объем — давление”. При неизме-
ненной постнагрузке УОС (отрезок ВС) определяется исходным растя-
жением мышечного волокна. При снижении постнагрузки аортальный кла-
пан открывается при более низком давлении в левом желудочке (точка
В), что при той же сократимости приводит к увеличению УОС (отрезок
В'С) и более полному систолическому опорожнению левого желудочка
(уменьшению КСО - см. точку D).
Нервная регуляция работы сердца осуществляется симпатической и па-
расимпатической частями вегетативной нервной системы. Симпатичес-
44
кая часть стимулирует деятельность сердца, а парасимпатическая — угне-
тает. Относительные уровни активности симпатической и парасимпати-
ческой частей вегетативной нервной системы регулирует центральная
нервная система по механизму обратной связи, так что при повышении
симпатической активности парасимпатическая снижается и наоборот. В
некоторых отделах сердца, в частности, в атриовентрикулярном соедине-
нии, преобладают парасимпатические влияния, а, например, в миокар-
де желудочков — симпатические.
Симпатическая иннервация сердца берет начало в интермедиолатераль-
ных столбах верхних 5 или 6 сегментов грудного отдела спинного мозга,
где находятся тела преганглионарных симпатических нейронов. Аксоны
этих нейронов выходят из спинного мозга в составе вентральных кореш-
ков, но вскоре покидают двигательные волокна и достигают паравертеб-
ральной симпатической цепочки в составе белых соединительных ветвей.
Здесь они образуют синапсы с телами постганглионарных нейронов, рас-»
полагающихся в паравертебральных ганглиях T,_V1 и CVI|_V1I1. Нейро-
медиатором, освобождающимся из преганглионарных волокон, является
ацетилхолин. Постганглионарные симпатические волокна достигают сердца
в виде верхнего, среднего и нижнего сердечных нервов, которые отходят
соответственно от верхнего, среднего и нижнего шейных ганглиев, а также
в виде отдельных волокон от верхних 5—6 грудных ганглиев. Достигнув
основания сердца, эти волокна образуют эпикардиальное сплетение в
области всех его камер и проникают в миокард, сопровождая веточки
коронарных сосудов. Поступающие по постганглионарным симпатическим
волокнам импульсы возбуждения вызывают освобождение из их окончаний
на клетках рабочего миокарда и проводящей системы сердца медиатора —
норадреналина. Выделившийся в межклеточное пространство норадрена-
лин частично обратно захватывается теми же нервными окончаниями,
частично диффундирует в коронарный кровоток и уносится с кровью.
Парасимпатическая иннервация сердца осуществляется блуждающими
нервами. Тела преганглионарных парасимпатических нейронов располо-
жены в дорсальном двигательном ядре n.vagus в области nucleus ambiquus.
Центр блуждающего нерва находится в состоянии тонической активнос-
ти и осуществляет преимущественно кардиодепрессорную функцию, уг-
нетая деятельность сердца. Его преганглионарные волокна, выйдя из че-
репа, спускаются книзу по шее рядом с общими сонными артериями и
образуют синапсы с постганглионарными парасимпатическими нейро-
нами в ганглиях, расположенных в самой ткани сердца. Большая часть из
этих ганглиев находится вблизи синоатриального и атриовентрикулярно-
го узлов и в миокарде предсердий и лишь единичные — в миокарде желу-
дочков. Нервные окончания парасимпатических волокон выделяют меди-
атор ацетилхолин. Освободившись в межклеточную жидкость, он быстро
подвергается гидролизу с помощью холинэстеразы, которой богаты тка-
ни. Это обусловливает кратковременность парасимпатического эффекта
45
после прекращения стимуляции, в отличие от более длительного дей-
ствия симпатической стимуляции.
Активация симпатической части вегетативной нервной системы сердца,
опосредуемая норадреналином, вызывает два типа эффектов:
I. а,-адренергический, вызывающий сужение артериол;
П. р,-адренергический, который вызывает:
I) увеличение ЧСС вследствие повышения автоматизма синоатриального
узла, то есть увеличение скорости спонтанной диастолической деполя-
ризации пейсмекерных клеток (положительный хронотропный эффект);
2) увеличение силы и скорости сокращения миокарда желудочков и
предсердий (положительный инотропный эффект). При этом увеличива-
ется УОС, укорачивается систола желудочков и ускоряется расслабле-
ние, что улучшает диастолическое наполнение желудочков. Этому спо-
собствует и повышение сократимости предсердий;
3) укорочение рефрактерного периода атриовентрикулярного соедине-
ния и ускорение атриовентрикулярного проведения (положительный дро-
мотропный эффект);
4) укорочение рефрактерного периода миокарда желудочков и повыше-
ние их возбудимости (положительный батмотропный эффект).
Активация парасимпатической части вегетативной нервной системы сер-
дца, то есть блуждающих нервов, опосредуемая ацетилхолином, вызывает:
1) уменьшение ЧСС вследствие уменьшения автоматизма синоатри-
ального узла (отрицательный хронотропный эффект). В норме преоблада-
ют парасимпатические воздействия на синоатриальный узел; ЧСС денер-
вированного сердца составляет около 105 в 1 мин;
2) удлинение рефрактерного периода атриовентрикулярного соедине-
ния и замедление атриовентрикулярной проводимости — интервала А—Н
(отрицательный дромотропный эффект);
3) удлинение рефрактерного периода миокарда желудочков (отрицатель-
ный батмотропный эффект).
Парасимпатическая часть вегетативной нервной системы мало влияет на
сократимость миокарда желудочков. В эксперименте показана возможность
ее отрицательного инотропного действия.
Взаимодействие симпатических и парасимпатических эффектов. Симпати-
ческая и парасимпатическая части вегетативной нервной системы дина-
мически взаимодействуют друг с другом, согласованно регулируя работу
сердца.
1. Верхний уровень их взаимодействия осуществляется в сосудо-
двигательном центре продолговатого м о з г а , куда посту-
пают и где обрабатываются афферентные сигналы из сердечно-сосудис-
той системы и где происходит регуляция эфферентной активности сим-
патической и парасимпатической частей вегетативной нервной системы.
Сосудодвигательный центр имеет 2 области: 1) прессорную, или вазо-
констрикторный центр, и 2) депрессорную. Волокна нейронов вазокон-
46
Таблица 4. Некоторые сведения об адренергических рецепторах
Рецептор Преимущественная локализация Чем стиму- лируется Эффект стимуляции
/3, Рабочий миокард НА, А Т сократимости
Синоатриальный узел Атриовентрикулярное соединение Гладкая мускулатура сосудов А Т автоматизма Т проводимости Расширение
а1 Гладкая мускулатура бронхов Гладкая мускулатура сосудов НА, А Расширение Сужение
А Рабочий миокард? Пресинаптические окончания симпатических волокон сосудов Гладкая мускулатура сосудов (постсинаптические «^-рецепторы) НА, А Т сократимости ? Угнетение освобождения НА из симпатических нервных окончаний —> расширение сосудов Сужение
Примечание. НА - норадреналин (нейромедиатор симпатических нервных окончаний); А
— адреналин (гормон мозгового вещества надпочечников); Т — повышение.
стрикторного центра спускаются в спинной мозг и образуют синапсы с
телами преганглионарных симпатических нейронов в интермедиолатераль-
ных столбах. Депрессорная область дает свой эффект путем прямого тор-
можения активности этих спинномозговых нейронов и (или) путем тор-
можения прессорной области сосудодвигательного центра.
2. Взаимодействие между двумя отделами вегетативной нервной систе-
мы на уровне постганглионарных нервных окончаний,
анатомической основой которого служит близость их расположения в сер-
дце, происходит по типу так называемого акцентированного антагониз-
ма. Его сущность состоит в том, что ингибирующий эффект данного уровня
парасимпатической активности выражен тем сильнее, чем выше уровень
симпатической активности.
Различают следующие возможные механизмы акцентированного ан-
тагонизма:
1) пресинаптический. Ацетилхолин, освобождаемый из нервных окон-
чаний постганглионарных парасимпатических волокон, способен стиму-
лировать мускариновые (М-холинергические) рецепторы, расположен-
ные на окончаниях симпатических волокон, что приводит к угнетению
освобождения из них норадреналина;
2) постсинаптический. Опосредован взаимодействиями на уровне эф-
фекторных клеток миокарда за счет:
а) способности ацетилхолина непосредственно вызывать снижение внут-
риклеточного уровня цАМФ, реализующего положительный инотроп-
ный эффект симпатической стимуляции;
б) способности ацетилхолина повышать уровень цГМФ, который
47
Схема 2. Взаимодействие вегетативных рецепторов с внутриклеточными эффекторами
(по A.Watanabe и J.Lindemann, 1990): катехоламины взаимодействуют с р-адренергиче-
скими рецепторами (p-рец.), что приводит к стимуляции через гуанин-нуклеотидсвязы-
вающий белок каталитической (С) субъединицы аденилатциклазы. Образующийся в
результате цАМФ активирует протеинкиназу ПКН с освобождением ее каталитической
субъединицы ПКЛ, которая катализирует фосфорилирование белков. Мускариновые ре-
цепторы (М-рец.) также сопряжены с аденилатциклазой с помощью ингибиторного белка
№. Фи - фосфатная группа; ФДЭ - фосфоди эстераза; ГТФ — гуанинтрифосфат; ГДФ -
гуаниндифосфат
ускоряет гидролиз цАМФ и тем самым приводит к уменьшению его кон-
центрации в клетке.
Механизмы адренергической и холинергической регуляции сократимости
миокарда. Симпатическая и парасимпатическая части вегетативной не-
рвной системы оказывают свое влияние на работу сердца через катехол-
амины и ацетилхолин, которые взаимодействуют с определенными бел-
ками (гликопротеинами) - рецепторами, расположенными на сарколемме
клеток миокарда. R.Ahlquist (1948) впервые установил, что рецепторы
симпатической части вегетативной нервной системы подразделяются на
два класса — а- и p-рецепторы, каждый из которых делится на 2 подклас-
са — ар а2, рр р2. Сведения об адренергических рецепторах представлены
в табл. 4. Ацетилхолин, освобождающийся из окончаний парасимпатиче-
ских нервных волокон, взаимодействует с мускариновыми рецепторами.
P-Адренергические и М-холинергические рецепторы располагаются на
сарколемме клеток миокарда и представляют собой динамические структу-
ры, плотность которых меняется в зависимости от интенсивности стиму-
ляции. При низком уровне стимуляции их количество возрастает, а при
высоком - уменьшается. Так, при застойной сердечной недостаточности,
сопровождающейся компенсаторной гиперкатехоламинемией, плотность
p-адренорецепторов кардиомиоцитов снижается. Плотность рецепторов
может также изменяться в ответ на прием лекарственных препаратов.
Например, препараты, уменьшающие стимуляцию Р-адренорецепторов
48
путем истощения запасов катехоламина (гуанетидин), или блокаторы 0-
адренорецепторов вызывают увеличение плотности этих рецепторов.
Рецепторы вегетативной нервной системы осуществляют свое влия-
ние на работу сердца главным образом (0-адренорецепторы) или частич-
но (а-адренорецепторы, М-холинорецепторы) благодаря взаимодействию
с аденилатциклазой. Этот фермент находится в сарколемме и состоит из:
1) каталитической субъединицы, катализирующей превращение АТФ в
цАМФ, и 2) регуляторной субъединицы, или N-белка (G-белка). После-
дняя сопрягает рецептор с каталитической субъединицей, активность
которой при этом изменяется. 0-Адренорецепторы стимулируют актив-
ность аценилатциклазы, а а(-адрено- и М-холинорецепторы — угнетают.
Эти эффекты реализуются с помощью 2 субъединиц N-белка. Стимули-
рующая субъединица Ns передает воздействие стимулирующих 0-рецеп-
торов и повышает активность каталитической субъединицы аденилат-
циклазы. Ингибиторная субъединица Ni передает влияние ингибирующих
(а-, М-) рецепторов и вызывает снижение активности каталитической
субъединицы. Ns и Nj связывают гуанинтрифосфат и, обладая ГТФ-аз-
ной активностью, способны гидролизовать гуанинтрифосфат до гуанин-
дифосфата (E.Ross, A.Gilman, 1980).
Когда стимулирующие или ингибирующие рецепторы активированы в ре-
зультате связывания своих агонистов, при посредстве соответствующего N-
белка, который связывается с рецептором, происходит либо увеличение,
либо уменьшение активности каталитической субъединицы аденилатцикла-
зы. Вследствие этого внутриклеточная концентрация цАМФ либо увеличи-
вается, либо уменьшается (схема 2).
Внутриклеточный уровень цАМФ регулируется с помощью 2 фермен-
тов: аденилатциклазы и фосфодиэстеразы. Фосфодиэстераза превращает
цАМФ в 5' АМФ, что приводит к восстановлению уровня цАМФ до ис-
ходного, отмечавшегося до активации аденилатциклазы. Пока нет убеди-
тельных доказательств того, что активация рецепторов к нейромедиато-
рам вегетативной нервной системы изменяет активность фосфодиэстера-
зы, однако ингибирование этого фермента относится к хорошо извест-
ным механизмам действия некоторых лекарственных средств, в частно-
сти метилксантинов и амринона.
цАМФ взаимодействует с регуляторной субъединицей протеинкиназы
(фермента, находящегося как в сарколемме, так и в цитоплазме в ра-
створенной форме), связывая ее, что приводит к освобождению ката-
литической субъединицы, которая катализирует фосфорилирование ряда
белков. К настоящему времени выяснено значение фосфорилирования 2
белков: фосфоламбана и белкового компонента Са2+-канала клеточной
мембраны. Перенос концевой фосфатной группы АТФ на белок мембра-
ны саркоплазматического ретикулума фосфоламбан вызывает повыше-
ние активности Са2+—АТФ-азы саркоплазматического ретикулума и тем
самым способствует увеличению скорости расслабления миокарда. Фос-
форилирование белкового компонента Са2+-канала сарколеммы приво-
49
дит к увеличению числа открытых медленных Са2+-каналов и (или) уд-
линению времени их открытия, что влечет за собой увеличение медлен-
ного тока Са2+ внутрь клеток и в итоге повышает сократимость миокарда.
Рефлекторная регуляция деятельности сердца осуществляется с помо-
щью трех наиболее важных рефлексов: барорецепторного, Бейнбриджа и
хеморецепторного.
Барорецепторный рефлекс. Барорецепторы, воспринимающие
механическое растяжение стенки артерий, расположены в “областях вы-
сокого давления” — в дуге аорты и сонных синусах. Активируются при
повышении среднего АД. Афферентные импульсы от дуги аорты поступа-
ют в сосудодвигательный центр по ветвям блуждающего нерва, а от сон-
ных синусов — через синусовый нерв Геринга по языкоглоточным не-
рвам. Увеличение частоты импульсации в этих нервах через депрессорную
область сосудодвигательного центра вызывает торможение, то есть умень-
шение тонической активности его вазоконстрикторной области, умень-
шение частоты импульсации в эфферентных симпатических волокнах и
увеличение активности в эфферентных парасимпатических волокнах. В
результате уменьшаются ЧСС, сократимость миокарда, УОС и МОС,
снижается тонус артериальных сосудов; расширение вен приводит к уве-
личению депонирования крови в них, уменьшению венозного притока к
сердцу, и, как следствие, и МОС. В итоге АД снижается, стремясь к нор-
мальному уровню.
Снижение АД вызывает уменьшение тонуса блуждающего нерва и пре-
обладание активности симпатической части вегетативной нервной систе-
мы, в результате чего увеличиваются ЧСС, сократимость миокарда, УОС
и МОС, суживаются артерии, что приводит к повышению АД. Этому
способствует также повышение тонуса вен, что влечет за собой умень-
шение депонирования крови в венозной системе, увеличение венозного
возврата к сердцу и увеличение МОС.
Рефлекс Бейнбриджа состоит в увеличении ЧСС при возраста-
нии ОЦК, несмотря на сопутствующее некоторое повышение АД. Вызы-
вается возбуждением рецепторов растяжения в “областях низкого давле-
ния” — в обоих предсердиях и крупных венах — при увеличении венозно-
го притока к сердцу. Афферентная импульсация передается по блуждаю-
щим нервам в сосудодвигательный центр, который вызывает увеличение
эфферентной импульсации по симпатическим волокнам, и в результате
воздействия на синоатриальный узел приводит к повышению ЧСС и МОС.
Такой эффект позволяет сердцу “перекачать” как можно больше крови,
скопившейся на путях притока. Интересно отметить, что при этом прак-
тически не происходит повышения сократимости миокарда, и ЧСС воз-
растает пропорционально МОС, несмотря на повышение АД. Наоборот,
тонус почечных артерий избирательно уменьшается, что совместно с реф-
лекторным снижением секреции антидиуретического гормона задней до-
лей гипофиза способствует увеличению диуреза.
50
При уменьшении О ЦК основное управляющее воздействие на реф-
лекторную регуляцию сердечной деятельности оказывает наступающее
при этом снижение МОС и АД, по мере которого растет ЧСС. Следова-
тельно, в этой ситуации барорецепторный рефлекс преобладает над реф-
лексом Бейнбриджа.
Хеморецепторный рефлекс. Хеморецепторы, расположенные
в дуге аорты и сонных тельцах, окружающих сонный синус, возбуждают-
ся при снижении РО2 и насыщения крови кислородом, повышении РСО2
и (или) уменьшении pH. Усиление афферентной импульсации по ветвям
блуждающего и языкоглоточного нервов стимулирует вазоконстриктор-
ный центр продолговатого мозга и вызывает повышение АД вследствие
сужения периферических сосудов, а также увеличение легочной венти-
ляции за счет частоты и глубины дыхания. Отмечающиеся при этом реф-
лекторные изменения ЧСС зависят от степени увеличения легочной вен-
тиляции. Первичным рефлекторным эффектом стимуляции хеморецепто-
ров, который имеет место при относительно небольшом повышении вен-
тиляции, является угнетение автоматизма синоатриального узла и умень-
шение ЧСС. Вторичный эффект связан со значительной стимуляцией вен-
тиляции, которая вследствие возбуждения рецепторов растяжения в лег-
ких и гипокапнии приводит к увеличению ЧСС.
Дыхательная аритмия. Регулярные колебания ЧСС, связанные с дыха-
нием, обнаруживаются у большинства людей и особенно выражены у детей.
Они характеризуются ускорением ритма сердца во время вдоха и его замед-
лением на выдохе. Дыхательная аритмия опосредуется главным образом блуж-
дающим нервом, и ее выраженность прямо пропорциональна тонусу па-
расимпатической части вегетативной нервной системы.
В происхождении дыхательной аритмии играют роль рефлекторные и
центральные факторы. Снижение внутригрудного давления на вдохе при-
водит к увеличению венозного возврата в правые отделы сердца, что
посредством рефлекса Бейнбриджа вызывает повышение ЧСС. Через не-
которое время, необходимое, чтобы увеличившийся венозный возврат
достиг левых отделов сердца, выброс левого желудочка возрастает, что
влечет за собой повышение АД. Это,в свою очередь, благодаря стимуля-
ции барорецепторов, приводит к уменьшению ЧСС и АД. Сосудистый
тонус периодически изменяется также в зависимости от дыхания, что
вызывает ритмические колебания АД с частотой дыхания, которые по-
средством барорецепторного рефлекса оказывают влияние на ЧСС. ЧСС
может изменяться также при возбуждении рецепторов растяжения в лег-
ких, увеличиваясь на вдохе.
Кроме рефлекторных воздействий, в генезе дыхательной аритмии опре-
деленное значение имеют центральные механизмы - влияние дыхательного
центра ствола мозга на активность сосудодвигательного центра.
Предсердный натрийуретический фактор. Обнаружение в экстракте мио-
цитов предсердий мощных сосудорасширяющих и натрийуретических
свойств имеет важное значение для регуляции гемодинамики. Было уста-
51
новлено, что этими свойствами обладает полипептид, состоящий из 28
аминокислот, который получил название предсердного натрийуретичес-
кого фактора. Он продуцируется специальными гранулами миоцитов пред-
сердий, преимущественно правого, при их растяжении вследствие уве-
личения О ЦК и связывается с рецепторами на поверхности гладкомы-
шечных клеток сосудов, в том числе почечных, почечных клубочков и
канальцев и, возможно, надпочечников. При взаимодействии предсерд-
ного натрийуретического фактора со своими рецепторами происходит
активация гуанилатциклазы плазматической мембраны с накоплением
цГМФ, который активирует цГМФ-зависимые протеинкиназы, осуще-
ствляющие фосфорилирование ряда внутриклеточных белков. Это лежит
в основе биологических эффектов предсердного натрийуретического фак-
тора, которые включают:
1) вазодилатацию путем расслабления гладкой мускулатуры сосудистой
стенки вследствие фосфорилирования легких цепей миозина под влиянием
протеинкиназы и повышения активности Са2+-АТФ-азы, а также ингиби-
рования базальной и стимулируемой катехоламинами и ангиотензином II
активности аденилатциклазы в гладкомышечных клетках сосудов;
2) диуретический и натрийуретический эффекты вследствие увеличе-
ния скорости клубочковой фильтрации и угнетения реабсорбции Na+ в
проксимальных канальцах и собирательных трубках. Благодаря этому до-
стигается уменьшение О ЦК;
3) снижение УОС и МОС в результате угнетения симпатической сти-
муляции сердца путем ингибирования аденилатциклазы и уменьшения
преднагрузки.
Таким образом, предсердный натрийуретический фактор имеет важное
компенсаторное значение при таких патологических состояниях, сопро-
вождающихся увеличением ОЦК, как застойная сердечная недостаточ-
ность, острая и хроническая почечная недостаточность, нефротический
синдром, артериальная гипертензия.
Способностью стимулировать секрецию предсердного натрийуретичес-
кого фактора обладают также глюкокортикостероиды, ускоряющие транс-
крипцию его гена, и эндотелин-биологически активное вещество, кото-
рое вырабатывается эндотелием сосудов и оказывает мощное сосудосу-
живающее действие.
РЕГУЛЯЦИЯ ПЕРИФЕРИЧЕСКОГО КРОВОТОКА
Периферическое кровообращение находится под двойным контролем:
центральным, опосредованным вегетативной нервной системой, и мест-
ным, связанным с изменением гомеостаза в тканях вблизи сосудов. Роль
этих механизмов в различных органах и тканях неодинакова. Так, напри-
мер, кровоток в коже и органах брюшной полости регулируется преиму-
52
Рис. 16. Эффект влияния возбуждения
различных а-адренорецепторов на
гладкомышечную клетку кровеносного
сосуда: НА — норадреналин
щественно вегетативной нерв-
ной системой, а в сердце и моз-
ге — преимущественно местны-
ми механизмами.
1. Местная саморегуляция
обеспечивает изменения местно-
го кровотока в зависимости от уровня метаболизма тканей и их потреб-
ности в кислороде, что реализуется с помощью аксон-рефлекса двумя
основными путями:
а)миогенная регуляция тонуса гладкой мускулатуры сосудис-
той стенки осуществляется в зависимости от ее напряжения, которое
определяется уровнем АД. При повышении АД стеночное напряжение
возрастает, что вызывает сокращение гладких мышц и увеличение со-
противления кровотоку. При уменьшении стеночного напряжения глад-
кая мускулатура расслабляется;
б) метаболическая регуляция опосредуется изменениями содер-
жания в тканях некоторых метаболитов (углекислого газа, Н+, неоргани-
ческого фосфора, аденозина и др.) и ряда других веществ, в частности гис-
тамина, простагландинов, калия. Их накопление при неадекватной доставке
кислорода вызывает расслабление миоцитов артериол и прекапиллярных сфин-
ктеров и местное увеличение кровотока, который уносит эти продукты
метаболизма.
Считают, что между обоими механизмами существует взаимосвязь: мио-
генная вазоконстрикция -> уменьшение притока крови -> местное увеличе-
ние содержания метаболитов -> вазодилатация удаление метаболитов.
2. Нервная регуляция осуществляется преимущественно вегетативной
нервной системой.
Симпатическую адренергическую иннервацию имеют практически все арте-
рии и вены и, вероятно, прекапиллярные сфинктеры. Наибольшая плот-
ность иннервации в мелких артериях и артериолах и наименьшая - в венах.
Все эти сосуды обладают а-адренорецепторами, а сосуды сопротивления —
также р2-адренорецепторами. Артериальные сосуды в скелетных мышцах
и коже иннервируются, кроме того, симпатическими холинергическими
волокнами, нейроны которых находятся в переднем гипоталамусе и дви-
гательной коре головного мозга. Обходя сосудодвигательный центр, эти
волокна спускаются в спинной мозг и образуют синапсы с преганглио-
нарными симпатическими нейронами боковых рогов.
Парасимпатическую иннервацию имеет лишь небольшая часть артериаль-
ных сосудов головы и внутренних органов. Она отсутствует в сосудах скелет-
ных мышц и кожи.
53
В сосудах имеются также нервы, которые не принадлежат ни к адре-
нергической, ни к холинергической системе. Это серотонинергические и
допаминергические нервы.
Возбуждение симпатической части вегетативной нервной системы вы-
зывает три типа эффектов.
1. а-Адренергический эффект, который включает в себя:
а) возбуждение постсинаптических, то есть расположенных в сарколемме
гладкомышечных клеток сосудистой стенки, а,-адренорецепторов и постси-
наптических а2-адренорецепторов, которое вызывает сокращение этих ми-
оцитов, а также артериальных и венозных сосудов (см. табл. 4);
б) возбуждение пресинаптических а 2-адренорецепторов катехоламина-
ми крови и тканевой жидкости, которое вызывает уменьшение освобожде-
ния норадреналина из симпатических постганглионарных нервных оконча-
ний и тем самым расширение артериальных и венозных сосудов (рис. 16);
2. Р2-Адренергический эффект. Проявляется расширением ар-
териальных сосудов.
3. Холинергический эффект. Проявляется расширением мелких
артерий и артериол скелетных мышц и кожи под воздействием импуль-
сации из корковых и подкорковых центров при эмоциональном напря-
жении. Обеспечивает преходящее увеличение кровотока в этих тканях,
предвосхищающее мышечную активность, например, бегство или схват-
ку. Холинергические волокна обычно активируются одновременно с со-
судосуживающими волокнами в других областях.
Возбуждение парасимпатической части вегетативной нервной системы вы-
зывает расширение сосудов. Ввиду того, что парасимпатические волокна ин-
нервируют лишь малую часть артериальных сосудов, их влияние на общее
сосудистое сопротивление невелико. Нервную регуляцию сосудистого тонуса
обеспечивают главным образом симпатические сосудосуживающие волокна,
находящиеся в состоянии тонической активности под воздействием со-
судосуживающего центра, которая “накладывается” на базальный тонус
сосудов, поддерживаемый местными механизмами саморегуляции. При
этом вазодилатация осуществляется преимущественно “пассивно”, пу-
тем уменьшения тонической активности этих волокон.
Нервная регуляция периферического кровообращения осуществляет-
ся: 1) с помощью рефлекторных механизмов; 2) путем воздействия на эти
механизмы высших вегетативных центров и коры большого мозга.
Рефлекторная регуляция обеспечивается:
1) барорецепторным рефлексом от областей высокого (дуга аорты,
сонный синус) и низкого (предсердия, полые вены, легочные артерии)
давления, которые чувствительны к АД свыше 60 мм рт.ст и активируют-
ся при его повышении;
2) хеморецепторным рефлексом: а) от хеморецепторов аорты и сонных
телец; б) от рецепторов самого сосудодвигательного центра, чувствительных
к РСО2 и pH притекающей к нему крови;
3) пульмональными рефлексами.
54
Кроме периферических рецепторов, сосудодвигательный центр нахо-
дится под влиянием высших нервных центров. Возбуждение передних от-
делов гипоталамуса может вызывать снижение АД и брадикардию, а зад-
не-боковых — повышение АД и ЧСС. Возбуждение двигательной коры
большого мозга способно приводить как к прессорной, так и (реже) деп-
рессорной реакции (например, обморок при эмоциональном напряже-
нии).
Нервная система обеспечивает срочную регуляцию АД при относительно
острых изменениях ОЦК, МОС и ОПСС, например, при физической на-
грузке. При хроническом повышении или понижении АД прессорецепто-
ры адаптируются к новому уровню (новой “уставке” регулятора) и под-
держивают его постоянство. Долговременная регуляция сосудистого то-
нуса и периферического кровообращения обеспечивается гуморальными
факторами.
Гуморальная регуляция периферического кровообращения осуществляется
рядом биологически активных веществ, которые оказывают сосудосуживаю-
щее или сосудорасширяющее действие.
А. Факторы с преимущественным сосудосуживающим действием:
1. Адреналин и но рад ренал ин . Гормоны мозгового вещества
надпочечников. Оказывают преимущественно а-адренергическое действие,
вызывая вазоконстрикцию. В скелетных мышцах адреналин в низких кон-
центрациях способен оказывать p-адренергический эффект, расширяя
сосуды сопротивления. Этот факт, однако, может быть вторичным по
отношению к вызываемому адреналином усилению метаболизма и вклю-
чению местных механизмов регуляции. В целом из-за относительно низ-
ких концентраций в крови эффект катехоламинов, выделяемых надпо-
чечниками при стимуляции, значительно уступает влиянию на сосудис-
тую стенку симпатической стимуляции.
2. Ренин-ангиотензиновая система. Ренин — это протеаза,
секретируемая юкстагломерулярным аппаратом почек. Вызывает превра-
щение содержащегося в крови неактивного субстрата - а2-глобулина ан-
гиотензиногена — в ангиотензин I, который затем с помощью АПФ пре-
вращается в активный ангиотензин II.
Секреция ренина стимулируется:
1) при возбуждении рецепторов растяжения в клетках юкстагломеруляр-
ного аппарата, чувствительных к изменениям перфузионного давления в
афферентных почечных артериолах. При снижении АД секреция ренина уве-
личивается, а при повышении — снижается;
2) при стимуляции р(-адренорецепторов афферентных артериол почек;
3) при снижении концентрации Na+ в крови, притекающей к macula
densa дистальных почечных канальцев.
Ангиотензин II является самым мощным из всех известных вазоконст-
рикторов. Он практически не действует на вены и вызывает спазм артериол
и повышение АД путем:
1) усиления активности симпатической части вегетативной нервной
55
системы за счет: а) активации высших адренергических центров; б) улуч-
шения передачи импульсов в ганглиях; в) увеличения освобождения но-
радреналина из симпатических нервных окончаний и угнетения его об-
ратного захвата;
2) стимуляции рецепторов к ангиотензину П в сосудистой стенке;
3) увеличения секреции альдостерона корковым веществом надпо-
чечников, что приводит к задержке Na+ и воды.
Б. Факторы с преимущественно сосудорасширяющим действием:
1. Кинины . Группа активных пептидов, которые освобождаются из
различных тканевых депо и обладают мощным местным сосудорасширя-
ющим эффектом путем воздействия на соответствующие рецепторы ар-
териальных и венозных сосудов.
2. Гистамин. Выделяется практически во всех тканях организма в
ответ на повреждение. Вызывает значительное расширение артериол и
одновременное сужение вен, что при ряде патологических состояний при-
водит к повышению давления в капиллярах и транссудации из них жид-
кости в периваскулярные ткани. По-видимому, не принимает участия в
регуляции сосудистого тонуса в физиологических условиях.
В. Факторы, обладающие как сосудосуживающим, так и сосудорасширя-
ющим действием:
1. Серотонин (5-гидрокситриптамин). Содержится в высоких кон-
центрациях в тромбоцитах, освобождаясь при их агрегации, и в хромаф-
финной ткани кишечника. Может оказывать преимущественно сосудо-
расширяющее или сосудосуживающее действие в зависимости от состоя-
ния кровообращения. Сужение сосудов обусловлено: 1) возбуждением се-
ротонинергических рецепторов в гладкомышечных клетках артерий; 2) уси-
лением вазоконстрикторного ответа на норадреналин и ангиотензин II;
3) стимуляцией постсинаптических а,-адренорецепторов. Эти механизмы
могут вызывать спазм субэпикардиальных коронарных артерий.
Сосудорасширяющий эффект серотонина реализуется путем: 1) инги-
бирования адренергической нейропередачи; 2) активации ингибиторных
серотонинергических рецепторов в гладкомышечных клетках артерий.
Роль серотонина в регуляции кровообращения окончательно не уста-
новлена.
2. Простагландины (ПГ)- короткоживущие метаболиты арахидо-
новой кислоты, образующиеся под действием циклооксигеназы во мно-
гих тканях организма, в том числе в сосудистой стенке. Взаимодействуя с
собственными рецепторами гладкомышечных клеток артерий и вен, пре-
имущественно мелких, простациклин (ПГ12) и ПГЕ2 оказывают мощ-
ное местное сосудорасширяющее действие, а тромбоксан А2 и ПГ F2a -
сосудосуживающее. Сосудорасширяющий эффект ПГ сочетается с анти-
агрегантным, а сосудосуживающий — со способностью усиливать агрега-
цию тромбоцитов. Нельзя исключить также способность этих биологиче-
ски активных веществ играть существенную роль в системной регуляции
кровообращения.
56
Схема 3. Факторы, от которых зависит потребность миокарда в кислороде
Артериальное давление. Уровень этого важнейшего показателя гемоди-
намики зависит от трех основных факторов: 1) МОС; 2) ОПСС; 3) ОЦК.
Второстепенное значение имеют: 1) ЧСС; 2) эластичность стенок арте-
рий; 3) вязкость крови; 4) возраст; 5) площадь поверхности тела.
Кроме систолического и диастолического АД различают пульсовое АД,
которое представляет собой разность этих показателей и определяется
главным образом УОС и емкостью артериальных сосудов. Под средним
гемодинамическим АД понимают среднее давление в аорте и ее крупных
ветвях в течение данного сердечного цикла. Оно зависит от МОС и ОПСС
и рассчитывается по формуле:
АДср. = АДдиаст. + 'А АДпудьс.
Постоянство АД регулируется: 1) вегетативной нервной системой; 2) гу-
моральными факторами, прежде всего ренин-ангиотензин-альдостеро-
новой системой; 3) местными механизмами саморегуляции; 4) почками
посредством регуляции ОЦК. При повышении АД почки выделяют боль-
ше воды, что приводит к уменьшению объема внеклеточной и внутрисо-
судистой жидкости, а следовательно, — ОЦК, МОС и АД. При снижении
АД почки задерживают жидкость, ее внутрисосудистый объем увеличи-
вается, МОС возрастает, и АД нормализуется.
РЕГУЛЯЦИЯ КОРОНАРНОГО КРОВОТОКА
Потребность миокарда в кислороде определяется тремя основными фак-
торами (схема 3): 1) сократимостью миокарда, 2) ЧСС; 3) стеночным на-
пряжением: а) в конце диастолы (преднагрузка); б) максимальным на-
пряжением в период систолы (постнагрузка).
В клинике в качестве показателя потребности миокарда в кислороде в
57
Схема 4. Факторы, от которых зависит коронарный кровоток
покое и при физической нагрузке используют так называемое двойное
произведение — произведение систолического АД и ЧСС, деленное на
100 (в условных единицах).
Потребление миокардом кислорода в состоянии покоя составляет в
норме 8—10 мл/мин на 100 г массы. Миокард экстрагирует большую часть
кислорода артериальной крови — 70 %. При этом артериовенозная разни-
ца по кислороду в сердце составляет около ПО мл/л, что значительно
больше, чем в организме в целом (40 мл/л). По этой причине повышение
потребности миокарда в кислороде может удовлетворяться исключитель-
но за счет увеличения коронарного кровотока. В норме в состоянии покоя
он составляет около 4 % МОС, однако при тяжелой физической работе
может возрастать в 6—7 раз.
Основные факторы, от которых зависит величина коронарного крово-
тока, представлены на схеме 4.
1. Перфузионное давление, обеспечивающее движение крови по коронар-
ным сосудам, представляет собой разность давления на входе, то есть в
аорте, и на выходе, то есть в коронарном синусе или интрамиокардиаль-
ного давления, в зависимости от того, какое из них в данный момент
больше. Интрамиокардиальное давление примерно равно внутрижелудоч-
ковому и повышается во время систолы, снижаясь в период диастолы.
Необходимо иметь в виду, что любое дополнительное увеличение внутри-
желудочкового давления, как, например, при повышении сократимости
миокарда или преднагрузки, может вызывать уменьшение коронарного
кровотока. Чем выше перфузионное давление, тем больше кровоток.
58
В физиологических условиях в аорте поддерживается постоянное дав-
ление в относительно узких пределах благодаря барорецепторному реф-
лексу. По этой причине коронарный кровоток зависит преимущественно
от величины просвета артерий.
2. Сопротивление коронарных артерий. Коронарный кровоток находится
в обратной зависимости от сопротивления коронарных артерий, которое
в свою очередь определяется тремя группами факторов: 1) внешними,
вызывающими пассивные изменения тонуса и просвета сосудов; 2) внут-
ренними, обусловливающими их активные изменения; 3) вязкостью крови.
Миокардиальное внесосудистое с ж а т и е , испытываемое
интрамуральными коронарными артериями, приводит к почти полному
прекращению коронарного кровотока во время систолы. В этой фазе на
короткое время он даже меняет свое направление. Вследствие этого от 67
до 90 % кровотока приходится на диастолу, причем большая часть — на
ее начало, когда миокард желудочков находится в состоянии расслабле-
ния. От систолического сжатия больше всего страдают субэндокардиаль-
ные слои мышцы желудочков, что компенсируется некоторым расшире-
нием просвета питающих их коронарных арториол в состоянии покоя.
Благодаря этому субэндокардиальный кровоток равен субэпикардиаль-
ному. Необходимо, однако, иметь в виду, что уменьшение расширитель-
ного резерва субэндокардиальных артериол в покое, а также испытывае-
мое ими большее внесосудистое сжатие обусловливают уязвимость суб-
эндокардиальных слоев в отношении развития ишемии по сравнению с
субэпикардиальными.
При увеличении ЧСС суммарная продолжительность диастолы умень-
шается, что может приводить к снижению коронарного кровотока. В фи-
зиологических условиях этого не происходит, так как обусловленное та-
хикардией повышение метаболизма миокарда вызывает активное расши-
рение коронарных артерий.
Внутренние факторы, регулирующие тонус коронарных арте-
рий, включают местные механизмы саморегуляции, нервные и гумораль-
ные факторы.
Местным механизмам саморегуляции принадлежит ведущая роль в обес-
печении постоянства коронарного кровотока в широком диапазоне пер-
фузионного давления и его приспособления к меняющимся потребнос-
тям миокарда в кислороде.
Факторы, опосредующие расширение и сужение коронарных артерий
при изменении метаболизма миокарда, окончательно не установлены. Ве-
роятно, существует несколько таких факторов, что обеспечивает этот важ-
нейший регуляторный механизм “запасом прочности”. Имеются сведе-
ния о непосредственном коронародилатирующем эффекте снижения РаО2,
которое вызывает расслабление прекапиллярных сфинктеров и увеличе-
ние количества функционирующих капилляров. Такое же действие ока-
зывает повышение рСО2, концентрации К+ и уменьшение pH.
59
Одним из основных метаболических регуляторов, по-видимому, явля-
ется аденозин, роль которого в сопряжении коронарного кровотока по-
требностям миокарда в кислороде при гипоксии была изучена R.Beme
(1963). Концентрация аденозина отражает скорость утилизации АТФ, а
следовательно, энергетическое состояние клетки. Фермент 5-нуклеотида-
за, осуществляющий дефосфорилирование АМФ до аденозина, распола-
гается в клеточной мембране и Т-трубочках, а также в окружающих ка-
пилляры клетках — перицитах. Поступая через клеточную мембрану в ин-
терстициальную жидкость, аденозин вызывает расширение артериол, что
приводит к увеличению доставки кислорода, и вследствие этого — умень-
шение образования АМФ и аденозина. В физиологических условиях, од-
нако, не удалось обнаружить достаточно тесной корреляции концентра-
ции аденозина с коронарным кровотоком.
К метаболическим регуляторам, возможно, относятся и некоторые
простагландины.
При снижении перфузионного давления ниже 70 мм рт.ст. саморегуля-
ция утрачивается, так как коронарные артерии максимально расширены,
и кровоток становится зависимым исключительно от давления. Об этом
надо помнить при наличии выраженной артериальной гипотензии.
Из гуморальных факторов, оказывающих местное влияние на коро-
нарный кровоток, наибольшее значение имеют два вещества — проста-
циклин и так называемый эндотелиальный фактор расслабления. Они про-
дуцируются клетками эндотелия и обладают мощными сосудорасширяю-
щими свойствами. Простациклин противодействует вазоконстрикторно-
му эффекту тромбоксана А2, который освобождается из тромбоцитов при
их агрегации. Эндотелиальный фактор расслабления выделяется из эндо-
телия под действием вазодилататоров ацетилхолина, субстанции Р, бра-
дикинина и АТФ и подобно простагландину имеет период полужизни
около 1 мин.
Вегетативная нервная система играет меньшую роль в регуляции коро-
нарного кровотока, чем метаболические факторы. Как и в периферичес-
ких сосудах, стимуляция а-адренорецепторов вызывает сужение артерий
сердца, а р2-адрено- и М-холинорецепторов — их расширение. Возбужде-
ние aj-адренорецепторов гладкомышечных клеток крупных коронарных
артерий имеет важное значение в патогенезе их спазма у больных с ИБС.
Роль парасимпатической иннервации, которой обладают относительно
мелкие коронарные артерии, в физиологии и патологии коронарного кро-
вообращения не ясна.
РЕАКЦИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
НА ФИЗИЧЕСКУЮ НАГРУЗКУ
Увеличение доставки кислорода работающим скелетным мышцам в соот-
ветствии с их резко возросшими потребностями обеспечивается:
60
Таблица 5. Изменения основных показателен центральной н периферической
гемодинамики при физической нагрузке у здоровых лнц
Показатель Характер изменения Показатель Характер изменений
УОС п ОПСС II
ЧСС TI АЛам. т
МОС TI т
КДО 0,1,® лее 1
ксо II Систолическое давление
ФВ тт в легочной артерии от
кдд О Коронарный кровоток тт
Артериовенозная разница тт
Примечание. ТТ - значительное повышение; Т - умеренное повышение; II - значитель-
ное снижение; 1 - умеренное снижение; О - без изменений; Ф - при тяжелой физичес-
кой нагрузке умеренно увеличивается.
1) увеличением мышечного кровотока в результате: а) увеличения МОС;
б) выраженной дилатации артериальных сосудов работающих мышц в со-
четании с сужением сосудов других органов, в частности органов брюш-
ной полости (перераспределение кровотока). Поскольку при рабочей ги-
перемии в сосудах мышц аккумулируется 25—30 % ОЦК, это приводит к
уменьшению ОПСС; 2) увеличением экстракции кислорода из притека-
ющей крови и артериовенозной разницы;
3) активацией анаэробного гликолиза.
Увеличение объема крови в сосудах работающих мышц, а также кожи
(для терморегуляции) приводит к временному уменьшению объема эффек-
тивно циркулирующей крови. Оно усугубляется потерей жидкости вслед-
ствие усиления потоотделения, и повышения фильтрации плазмы крови
в капиллярах мышц при их рабочей гиперемии. Поддержание адекватного
венозного возврата и преднагрузки в этих условиях обеспечивается: а) су-
жением вен (основной адаптационный механизм); б) “мышечной пом-
пой” сокращающихся скелетных мышц; в) повышением внутрибрюшно-
го давления; г) снижением внутригрудного давления при форсированном
вдохе.
Увеличение МОС, который у спортсменов может составлять 30 л/мин,
достигается путем повышения ЧСС и УОС. Ударный выброс возрастает вслед-
ствие снижения постнагрузки (ОПСС) и повышения сократимости и со-
провождается увеличением систолического АД. При этом, благодаря более
полному систолическому опорожнению желудочков, КДО либо не изме-
няется, либо несколько снижается. Лишь при тяжелой физической на-
грузке присоединяется механизм Франка—Старлинга в результате значи-
тельного увеличения венозного притока. Изменения основных показате-
лей гемодинамики при физической нагрузке представлены в табл. 5.
Первоначальные адаптационные изменения функционирования сер-
дечно-сосудистой системы в ответ на физическую нагрузку обусловлены
61
возбуждением высших корковых и гипоталамических структур, которые
повышают активность симпатической части вегетативной нервной систе-
мы и выброс в кровь адреналина и норадреналина надпочечниками. Это
приводит к заблаговременной мобилизации системы кровообращения к
предстоящему повышению метаболической активности путем: 1) умень-
шения сопротивления сосудов скелетных мышц; 2) сужения сосудов прак-
тически всех остальных бассейнов; 3) повышения частоты и силы сердеч-
ных сокращений,
С началом физической работы включаются нервные рефлекторные меха-
низмы и метаболическая саморегуляция сосудистого тонуса работающих
мышц.
При легкой и умеренной нагрузке, достигающей 80 % от максималь-
ной физической работоспособности, имеется практически линейная за-
висимость между интенсивностью работы и ЧСС, МОС и поглощением
кислорода. В дальнейшем ЧСС и МОС выходят на “плато”, а дополни-
тельное увеличение потребления кислорода (около 500 мл) обеспечива-
ется повышением его экстракции из крови. Величина этого плато, отра-
жающая эффективность гемодинамического обеспечения нагрузки, за-
висит от возраста и составляет для лиц в возрасте 20 лет примерно 200
уд/мин, 65 лет — 170 уд/мин.
Необходимо иметь в виду, что изометрическая нагрузка (например,
поднятие тяжестей), в отличие от ритмической (бег), вызывает неадек-
ватное повышение АД, отчасти рефлекторное, отчасти вследствие механи-
ческого сдавления сосудов мышцами, что значительно увеличивает пост-
нагрузку.
Определение реакции сердечно-сосудистой системы на нагрузку по-
зволяет дать объективную оценку функции сердца в клинике.
Физические тренировки оказывают благоприятное действие на функ-
цию сердечно-сосудистой системы. В покое они приводят к уменьшению
ЧСС, вследствие чего МОС обеспечивается увеличением УОС за счет боль-
шего КДО. Выполнение стандартной субмаксимальной физической на-
грузки достигается меньшим приростом ЧСС и систолического АД, что
требует меньшего количества кислорода и обусловливает большую эко-
номичность гемодинамического обеспечения нагрузки. В миокарде увели-
чиваются калибр коронарных артерий и площадь поверхности капилля-
ров на единицу массы и возрастает синтез белков, что способствует его
гипертрофии. В миоцитах скелетных мышц возрастает количество мито-
хондрий. Тренирующий эффект дают регулярные физические упражне-
ния продолжительностью 20—30 мин не менее 3 раз в неделю, при кото-
рых достигается ЧСС не менее 60 % от максимальной.
62
ГЛАВА 4.
КЛИНИЧЕСКОЕ ОБСЛЕДОВАНИЕ
ПОДХОД К БОЛЬНОМУ С ЗАБОЛЕВАНИЕМ СЕРДЦА
Симптомы болезней сердца в большинстве своем обусловлены: 1) ише-
мией миокарда; 2) нарушениями сокращения или расслабления миокар-
да; 3) нарушениями сердечного ритма и (или) его частоты. Самым час-
тым проявлением ишемии является боль в грудной клетке. Нарушение
насосной функции сердца приводит к появлению жалоб на слабость и
утомляемость, а при значительной выраженности — на одышку и отеки
вследствие повышения давления и застоя крови на путях притока к желу-
дочку, опорожнение которого нарушено. При этом отмечаются также ци-
аноз и склонность к артериальной гипотензии. Нарушения ритма часто
возникают и исчезают внезапно, проявляясь ощущениями сердцебиения,
одышки, слабости, обмороками и ангинозной болью.
При обследовании больного необходимо помнить, что насосная фун-
кция сердца и коронарное кровообращение могут быть адекватными в
покое, но они неадекватны при физическом напряжении. Поэтому для
органического поражения сердца совершенно не характерны жалобы на
боль в области грудной клетке и одышку в покое при их отсутствии во
время нагрузки. У части больных симптомы отсутствуют как в покое, так
и при физическом напряжении. На заболевание сердца у них указывают
патологические изменения при осмотре (например, повышение АД или
шум в сердце) и инструментальном обследовании.
Из-за распространенности сердечно-сосудистых заболеваний и насто-
роженности в отношении возможности их возникновения больные, а
иногда и врачи, ошибочно расценивают многие “некардиальные” жало-
бы как проявления органических заболеваний сердца. В то же время у
пациентов с установленным диагнозом сердечно-сосудистого заболева-
ния может возникать функциональная кардиальная патология, что зат-
рудняет интерпретацию их симптомов.
Многие жалобы, характерные для органических поражений сердечно-
сосудистой системы, например, боль в грудной клетке, одышка, свой-
ственны также заболеваниям других органов. Это обусловливает важность
проведения дифференциальной диагностики, базирующейся на тщатель-
ном анализе клинических данных и результатов целенаправленного до-
полнительного обследования.
Для оценки прогноза и построения рационального плана лечения кар-
диологического больного особое значение имеет установление не только
правильного, но и полного диагноза. Согласно рекомендациям Нью-Йор-
кской кардиологической ассоциации, полный диагноз заболевания серд-
ца может быть установлен на основании определения:
63
I) этиологии заболевания;
2) его анатомического субстрата (например, какие клапаны пораже-
ны? Вовлечен ли в патологический процесс перикард? Был ли перенесен
ранеее инфаркт миокарда?);
3) нарушения функции сердца (например, имеются ли сопутствующая
аритмия, застойная сердечная недостаточность?);
4) степени нарушения функционального состояния организма в целом
(физическая нагрузка какой интенсивности вызывает появление симпто-
мов?).
Важность установления полного диагноза можно продемонстрировать
на следующем примере. Установлено, что причиной боли в грудной клет-
ке при физической нагрузке является ишемия миокарда. Однако этого
недостаточно для выработки оптимальной тактики лечения и оценки про-
гноза. Необходимо:
а) выяснить этиологию заболевания (коронарный атеросклероз? сте-
ноз устья аорты? гипертрофическая кардиомиопатия?);
б) уточнить его морфологический субстрат (был ли перенесен ин-
фаркт миокарда? В случаях тяжелой стенокардии уточнить, каковы лока-
лизация и выраженность поражения коронарных артерий?);
в) определить выраженность коронарной недостаточности, наличие и сте-
пень нарушения насосной функции сердца, а также факторов, которые мо-
гут способствовать возникновению ангинозных приступов (нарушения рит-
ма, анемия, тиреотоксикоз и др.).
Для установления правильного и полного диагноза заболевания сердца
используют различные методы исследования — клинические (анамнез и фи-
зическое обследование) и дополнительные инструментальные (от сравни-
тельно простых и общедоступных до сложных и инвазивных). Диагности-
ческая ценность лабораторных методов исследования в кардиологии ог-
раничена.
Значение для диагностики тщательного анализа жалоб и анамнеза трудно
переоценить. Основными жалобами при заболеваниях сердечно-сосудистой
системы являются: 1) боль в грудной клетке; 2) одышка; 3) сердцебиение и
перебои; 4) утомляемость; 5) отеки; 6) обмороки. Дифференциальному диаг-
нозу при этих симптомах посвящены специальные разделы в т. 2.
При сборе анамнеза следует уделять внимание семейному анамнезу, т.е.
состоянию здоровья или причине смерти ближайших родственников, что
может помочь установить этиологию заболевания. К наследственным болез-
ням сердечно-сосудистой системы относятся гипертрофическая кардиомио-
патия и синдром Марфана. Менее четкая, но имеющая клиническое значе-
ние наследственная предрасположенность установлена в отношении эссен-
циальной артериальной гипертензии (гипертонической болезни), гипер-
липопротеинемий и заболеваний, связанных с атеросклерозом различ-
ных сосудистых бассейнов и его осложнениями (инсульт, инфаркт мио-
карда, стенозирующий атеросклероз периферических артерий). Кроме ге-
нетических факторов, играют роль существующие в семье привычки в
64
отношении характера питания и поведенческие реакции (избыточное упот-
ребление соли, переедание, курение).
Важное значение имеет “социальный анамнез" — характер работы в на-
стоящее время и в прошлом, курение, употребление алкоголя, характер
питания, уровень физической активности. При сборе анамнеза необходи-
мо уточнить также, какие лекарства больной когда-либо принимал, их
дозы и по какому поводу их назначали.
ФИЗИЧЕСКОЕ ОБСЛЕДОВАНИЕ
По своему значению для постановки диагноза .болезни сердца и оценки
состояния больного физическое обследование уступает только расспросу.
Основными методами физического исследования сердечно-сосудистой
системы в настоящее время являются осмотр, пальпация и аускультация.
Перкуторное определение размеров сердца имеет меньшее значение, так
как многие распространенные патологические изменения грудной клет-
ки и легких значительно ограничивают возможности этого метода. По
своей информативности он значительно уступает обычному рентгеноло-
гическому исследованию.
ОСМОТР
Физическое исследование начинают с общего осмотра. Больной может
выглядеть усталым вследствие низкого МОС при застойной сердечной
недостаточности. Преждевременное старение, сопровождающееся атро-
фией кожи, сединой, полысением и полигландулярной недостаточнос-
тью (синдром Вернера), часто связано с ранним атеросклерозом. Сонли-
вость, плетора и диффузный цианоз у бального с ожирением могут соче-
таться с “необъяснимой” правожелудочковой недостаточностью, что ха-
рактерно для синдрома Пиквика. У таких больных отмечается дыхатель-
ный ацидоз, проявляющийся резким поверхностным дыханием. Сонли-
вость и заторможенность наблюдаются у больных микседемой. Для них
характерны замедленные движения и речь, грубый голос, грубые черты
лица. Важным кардиальным проявлением этого заболевания является кар-
диомегалия, обусловленная выпотом в перикард. Наоборот, больные ти-
реотоксикозом отличаются быстротой движений и речи, мелким тремо-
ром рук, блеском глаз, расширенной глазной щелью. Это заболевание
является частой причиной мерцательной аритмии, стенокардии и зас-
тойной сердечной недостаточности . Лунообразное лицо, ожирение с от-
ложением жира в области туловища с “горбом бизона” при худых конеч-
ностях, гирсутизм, акне, багровые полосы (стрии) внизу живота и на
коже конечностей характерны для синдрома Иценко—Кушинга, при ко-
тором также наблюдается артериальная гипертензия.
65
Весьма своеобразен внешний вид больных с синдромом Марфана. Они
высокие, худые, с длинными руками, длинными тонкими, паукообраз-
ными пальцами (арахнодактилия). Часто отмечаются также сколиоз, ки-
фоз, pectus excavatum или pectus carinatum, genu recurvatum или genu valgum.
Эти признаки сочетаются с врожденными аномалиями сердечно-
сосудистой системы: аневризмой аорты, которая может расслаиваться, и
недостаточностью аортальных клапанов. Напротив, больные с врожден-
ным пороком сердца — коарктацией аорты — чаще невысокого роста, с
хорошо развитыми мышцами плечевого пояса и слабо развитыми тазо-
вым поясом и нижними конечностями.
Румянец щек с цианотичным оттенком (facies mitralis) часто бывает у
больных с митральным стенозом, сопровождающимся высокой легочной
артериальной гипертензией вследствие низкого МОС и значительно уве-
личенной артериовенозной разницы по кислороду. Эпизодические при-
ливы крови к лицу позволяют заподозрить карциноидную опухоль ки-
шечника, которая может сопровождаться недостаточностью трехствор-
чатого клапана, или феохромоцитому. Наконец, весьма характерен вне-
шний вид больного с нейроциркуляторной дистонией (неврозом сердца):
больной напряжен, отмечаются тремор конечностей, дрожь в голосе, уча-
щение дыхания с периодическими “тоскливыми” вздохами. Такой харак-
тер дыхания следует отличать от частого поверхностного вследствие ве-
нозного застоя в легких, которое еще более учащается при физической
нагрузке (ходьбе, наклоне туловища и др.). При остром легочном сердце
тахипноэ резко выражено и не соответствует скудным физикальным из-
менениям в легких. При хроническом легочном сердце у больных с дыха-
тельной недостаточностью вследствие заболеваний, сопровождающихся
бронхообструктивным синдромом, выдох резко удлинен, сопровождает-
ся свистом, в дыхании принимают участие вспомогательные мышцы,
что отличает таких бальных от пациентов с левожелудочковой недоста-
точностью. Дыхание Чейна—Стокса часто возникает во время сна у боль-
ных пожилого возраста с церебральным атеросклерозом и застойной сер-
дечной недостаточностью.
Необходимо обратить внимание на положение тела больного. При при-
ступе сердечной или бронхиальной астмы пациент сидит, упираясь рука-
ми о спинку кровати или стула, что позволяет фиксировать плечевой
пояс и лучше использовать дополнительные дыхательные мышцы. Боль-
ной с тампонадой сердца вследствие экссудативного перикардита прини-
мает положение сидя с наклоном туловища кпереди. Одышка, которая
возникает при определенном положении в постели или сидя, позволяет
заподозрить шаровид] ый тромб или опухоль (миксому) предсердия. При-
саживание на корточки характерно для больных с врожденным пороком
сердца — тетрадой Фалло.
Важное диагностическое значение имеет осмотр кожи и видимых сли-
зистых оболочек. Диффузный цианоз, часто в сочетании с изменениями
концевых фаланг пальцев кистей и стоп в виде барабанных палочек, ука-
66
зывает на шунтирование крови справа налево при врожденных пороках
сердца или на недостаточную оксигенацию крови в легких. При этом, так
называемом центральном цианозе, как правило, отмечается так-
же синюшность языка. Кожа часто теплая на ощупь вследствие гиперки-
нетического состояния — повышенного МОС. “Барабанные палочки” ха-
рактерны также для подострого (затяжного) инфекционного эндокарди-
та, но могут встречаться в некоторых семьях и у практически здоровых
лиц. При врожденных пороках сердца они безболезненны, в отличие от
некоторых заболеваний легких (бронхоэктазы, абсцесс).
Цианоз дистальных отделов конечностей, которые при этом холодные
и влажные на ощупь, носит название периферического цианоза.
Он обусловлен вазоконстрикцией при тяжелой сердечной недостаточно-
сти с низким МОС. У таких больных язык остается розовым.
Бледная кожа с желтушным оттенком (cafe au lait, “кофе с молоком”)
вследствие анемии характерна для инфекционного эндокардита, а ее крас-
новатый оттенок - для артериальной гипертензии, синдрома Иценко—
Кушинга и полицитемии. При гипотиреозе и уремии кожа желтовато-
бледная. Желтуха при болезни сердца обусловлена инфарктом легкого,
застойной печенью или ее кардиальным циррозом.
Ксантомы в области ладонных складок, на коже локтей и коленей
и ксантелазмы на веках свойственны больным с нарушением жиро-
вого обмена, связанным с ранним и тяжелым атеросклерозом. Петехии
на коже и конъюнктиве, болезненные красноватые узелки Ослера на по-
душечках пальцев, а также безболезненные красноватые узелки Джануэя
на коже ладоней и подошв характерны для инфекционного эндокардита.
Экхимозы часто встречаются при синдроме Иценко—Кушинга, а множе-
ственные нейрофибромы у больного с артериальной гипертензией по-
зволяют заподозрить феохромоцитому. Язвы на коже нижней трети голе-
ней могут обнаруживаться при тяжелой эссенциальной артериальной ги-
пертензии, а также серповидноклеточной анемии.
Холодные влажные руки являются признаком невротических состо-
яний, а теплые влажные руки с бархатистой кожей — тиретоксикоза,
которому свойственен повышенный МОС. Сухая грубая кожа отмечается
при микседеме; вследствие низкого МОС она также холодная на ощупь.
Истонченная, гладкая, блестящая и холодная кожа одной из конечнос-
тей характерна для синдрома плеча-руки.
При осмотре важно обратить внимание на нижние конечности: нали-
чие отеков и их симметричности, варикозного расширения вен, призна-
ков тромбофлебита. Необходимо оценить характер пульсации артерий и
вен шеи, а также видимой пульсации в прекардиальной области.
Видимая нормальная и патологическая пульсация. Осмотр шейных вен
позволяет получить представление о давлении крови в правом предсер-
дии и изменениях его объема в различные фазы сердечного цикла. В этих
целях оценивают их наполнение и характер пульсации.
67
Рис. 17. Венный пульс в норме (Л) и различные варианты его измене-
ний при заболеваниях сердца: стенозе трехстворчатого клапана (Б),
полной атриовентрикулярной блокаде (В), констриктивном перикар-
дите (Г) и недостаточности трехстворчатого клапана (Д)
В норме яремные вены обычно хорошо определяются в горизонталь-
ном положении и не видны при приподнимании головы и плеч под уг-
лом 30—45°.
Набухание шейных вен, свидетельствующее о повышении ЦВД, харак-
терно для:
1) правожелудочковой недостаточности;
2) тампонады сердца и констриктивного перикардита. В обоих случаях
отмечается также положительный гепатоюгулярный рефлюкс - повыше-
ние уровня наполнения шейных вен на 1 см и более и усиление их пуль-
сации при надавливании на правый верхний квадрант живота в течение
30-60 с;
3) синдрома верхней полой вены в результате ее сдавления опухолью.
При этом на коже верхней поверхности грудной клетки видны многочис-
ленные венозные коллатерали.
Набухание шейных вен с одной стороны (слева) обусловлено сдавлени-
ем левой безымянной вены между расширенной аортой и грудиной при ате-
росклерозе или аневризме аорты.
Видимые изменения венного пульса оценивают при осмотре правых ярем-
ных вен (лучше внутренней яремной) одновременно с пальпацией сон-
ной артерии с противоположной стороны. Уточнить его характер позво-
ляет регистрация флебограммы (рис. 17).
Диагностическое значение имеют следующие изменения:
1) увеличение выраженности пульсовой в о л н ы , которая оп-
ределяется непосредственно перед пульсацией сонной артерии и I тоном
сердца, так называемой волны “а” (рис. 17,Б). Обусловлено мощным
сокращением правого предсердия при нарушении его опорожнения. Оно
отмечается в следующих случаях: а) при стенозе трехстворчатого клапана;
б) при высокой легочной гипертензии; в) при выраженном стенозе устья
легочной артерии (в последних двух случаях из-за снижения диастоли-
ческой податливости гипертрофированного правого желудочка); г) при
68
ритме атриовентрикулярного соединения или значительном удлинении
атриовентрикулярной проводимости, когда правое предсердие сокраща-
ется при закрытом трехстворчатом клапане;
2) нерегулярные высокоамплитудные волны “а” (’’пу-
шечные” волны) являются одним из наиболее распространенных и на-
дежных признаков полной атриовентрикулярной блокады. Отмечаются в
тех случаях, когда систола правого предсердия совпадает с систолой же-
лудочков, во время которой трехстворчатый клапан закрыт, в результате
чего кровь из правого предсердия изгоняется в шейные вены (рис. 17,й);
3) систолическая пульсация (положительный венный
пульс) характерна для недостаточности трехстворчатого клапана (орга-
нической или относительной) и связана с образованием выраженной
волны регургитации “с - v ”. В этих случаях венный пульс можно спутать
с артериальным (рис. 17,Д). Систолическая пульсация шейных вен часто
отмечается также при неосложненном дефекте межпредсердной перего-
родки и свидетельствует о значительном лево-правом сбросе крови и
нормальном ЛСС;
4) признак Куссмауля — усиление югулярного венного пульса
на вдохе (в отличие от его ослабления в норме) часто встречается при
констриктивном перикардите и реже - при выраженной правожелудоч-
ковой недостаточности.
Видимая пульсация общей сонной артерии на шее усиливается вслед-
ствие повышения артериального пульсового давления при: 1) волнении,
что особенно заметно у худощавых молодых людей; 2) недостаточности
аортальных клапанов, которая является самой распространенной орга-
нической причиной у взрослых (’’пляска каротид”); 3) незаращении ар-
териального протока и других заболеваниях, сопровождающихся шунти-
рованием крови слева—направо, например, прорыве аневризмы синуса
Вальсальвы в правые отделы сердца; 4) гиперкинетических состояниях -
тиреотоксикозе и тяжелой анемии; 5) полной атриовентрикулярной бло-
каде с редким ритмом желудочков; 6) атеросклеротической артериальной
гипертензии вследствие уменьшения эластичности грудной части аорты.
Причины видимой пульсации в прекардиальной области рассматривают-
ся в разделе “Пальпация”.
ПАЛЬПАЦИЯ
Исследование артериального пульса. Производят билатерально и одно-
временно (кроме сонных артерий, в связи с чувствительностью сонных
синусов) на сонных, плечевых, лучевых, бедренных, подколенных, зад-
них большеберцовых артериях и артериях тыла стопы. Пульс на задних
большеберцовых артериях и артериях тыла стопы с одной или с обеих
сторон, изредка — на лучевой артерии может в норме не определяться
из-за их атипичного анатомического расположения.
69
Рис. 18. Артериальный пульс в норме (Л) и его варианты при раз-
личных изменениях кардиогемодинамики в физиологических усло-
виях и вследствие заболеваний сердца: Б — малый пульс; В - боль-
шой пульс; Г — дикротический и альтернирующий пульс; Д - pulsus
bisferiens; с - систола; д - диастола
Нормальная кривая артериального пульса при прямой и непрямой ре-
гистрации характеризуется довольно крутым восходящим коленом, на
котором имеется анакротическая зазубрина, соответствующая достиже-
нию максимальной скорости кровотока в аорте, что предшествует разви-
тию максимального давления (рис. 18,Л). Более пологое нисходящее коле-
но прерывается инцизурой, соответствующей захлопыванию аортально-
го клапана. По мере распространения пульсовой волны к периферии вос-
ходящее колено становится более крутым, анакрота дифференцируется
все хуже, а инцизура сглаживается и превращается в дикротическую за-
зубрину. Вследствие этого пальпация пульса на лучевой артерии часто
позволяет получить меньше информации относительно изгнания крови
из левого желудочка и функции аортального клапана, чем исследование
пульсации сонной артерии. У большинства здоровых лиц дикротическая
волна пальпаторно не определяется.
Свойства пульса зависят от многих факторов, основными из которых
являются: ударный выброс, скорость и продолжительность периода изгна-
ния, ЧСС, растяжимость “сосудов котла”, ОПСС. Основные характеристи-
ки, которые определяют при исследовании пульса, включают: 1) частоту;
2) ритмичность; 3) наполнение, то есть амплитуду; 4) напряжение (на-
сколько легко пульсация исчезает при надавливании); 5) форму пульсо-
вой волны; 6) одинаков ли пульс с обеих сторон по последним трем свой-
ствам; 7) при неправильном ритме - наличие и величину дефицита пуль-
са как разницы между ЧСС по данным аускультации сердца и частотой
пульса на лучевой артерии при их одновременном определении.
Различают следующие изменения свойств пульса.
А. Изменения частоты пульса. Частый и редкий пульс не всегда ощуща-
ется больным и имеет важное диагностическое значение. Тахикардия в
покое наиболее характерна для сердечной недостаточности и гипертире-
70
оза, но может отмечаться также при лихорадке и функциональных забо-
леваниях сердца — нейроциркуляторной дистонии (астении) или синд-
роме Да Коста. В последнем случае она нестойкая. У части таких больных
наблюдается склонность к редкому пульсу, что свойственно также спорт-
сменам. Брадикардия может быть результатом и блокад сердца — атрио-
вентрикулярной и синоатриальной.
Б. Аритмичный пульс. Исследование пульса по своей информативности
в отношении распознавания характера нарушения сердечного ритма значи-
тельно уступает электрокардиографии и даже аускультации сердца. Тем
не менее оно имеет определенное диагностическое значение в трех случаях.
1) синусовая аритмия. Для нее характерны изменения частоты
пульса в зависимости от фаз дыхания — ее увеличение на вдохе и умень-
шение на выдохе. Эта аритмия встречается главным образом у молодых
здоровых лиц, особенно спортсменов, и отсутствует при сердечной не-
достаточности;
2) мерцательная аритмия. Характерны аритмичный пульс без
какой-либо закономерности чередования различных по величине интер-
валов (отсюда название — “полная аритмия”) и неодинаковое наполне-
ние пульсовых волн, которое отражает колебания УОС от цикла к циклу.
Аритмичность возрастает при физической нагрузке;
3) экстрасистолия. На фоне большей частью правильного ритма
определяются преждевременные, “внеочередные”, пульсовые волны либо
выпадения пульса с его дефицитом. При исследовании пульса, как и при
аускультации сердца, частая экстрасистолия неотличима от мерцатель-
ной аритмии.
В. Изменения наполнения и напряжения пульса:
1) малый пульс (pulsus parvus) - слабый, низкоамплитудный
пульс, который наблюдается при уменьшении ударного объема левого
желудочка, среднего артериального и пульсового давления и повышения
ОПСС (рис. 18,Б). Отмечается при: а) митральном стенозе; б) выражен-
ной левожелудочковой недостаточности; в) констриктивном перикарди-
те; г) тампонаде сердца;
2) мягкий пульс (pulsus tardus) обычно сочетается с малым пуль-
сом и характеризуется замедленным подъемом вследствие уменьшения
скорости повышения давления в аорте из-за механического препятствия
изгнанию крови из левого желудочка. Характерен для выраженного кла-
панного стеноза устья аорты.
При регистрации кривой пульсации сонной артерии (сфигмограммы)
на ее восходящем колене определяется ранняя зазубрина — анакрота или
несколько таких зазубрин (кривая в форме петушиного гребня);
3) большой пульс (pulsus magnus) — высокоамплитудный, “скачу-
щий” пульс с крутым восходящим и нисходящим коленом (рис. 18, В).
Обусловлен увеличением ударного объема левого желудочка, пульсового
давления и снижением ОПСС или ускоренным оттоком крови из артери-
71
Рис. 19. Зоны прекардиальной области, подле-
жащие осмотру и пальпации при физическом
исследовании сердца (по J.Hurst и R.Schlant,
1972): / — грудино-ключичная; 2 - аорталь-
ная; 3 — легочная артерии; 4 — правожелудоч-
ковая; 5 — верхушечная; 6 - надчревная; 7 -
прочие (различной локализации)
альных сосудов. Как правило, сопро-
вождается усилением видимой пульса-
ции сонных артерий;
4) альтернирующий пульс
(pulsus alternans) характеризуется че-
редованием пульсовых волн большей
и меньшей амплитудами (рис. 18,Г)
при правильном ритме сердца вслед-
ствие меняющейся силы сокращения левого желудочка при тяжелой
левожелудочковой недостаточности. Может наблюдаться также во время
пароксизма тахикардии или сразу после него;
5) парадоксальный пульс (pulsus paradoxus) характеризуется
более выраженным, чем в норме, снижением систолического АД и амп-
литуды пульсовой волны во время вдоха. Такое снижение систолического
АД в физиологических условиях обусловлено уменьшением притока кро-
ви к левым отделам сердца вследствие ее депонирования в сосудах лег-
ких, несмотря на увеличение венозного притока к правым отделам серд-
ца, и не превышает 10 мм рт.ст. при спокойном, нефорсированном дыха-
нии. Парадоксальный пульс наиболее характерен для констриктивного
перикардита, но встречается также при тампонаде сердца, тяжелом брон-
хообструктивном синдроме и эмфиземе легких.
Г. Изменения формы пульсовой волны-.
1) pulsus bi sfe гien s, имеющий два систолических пика (рис. 18,Д),
характеризуется двумя пульсовыми волнами, которые пальпируются во
время систолы (форма клешни рака). Такой пульс отмечается при недо-
статочности аортального клапана и обструктивной форме гипертрофи-
ческой кардиомиопатии;
2) дикротический пульс (см. рис. 18,£) характеризуется двумя
пульсовыми волнами, одна из которых определяется в период систолы, а
другая - во время диастолы. Увеличение амплитуды дикротической вол-
ны обусловлено значительным снижением сосудистого сопротивления и
диастолического АД. Встречается при тяжелой застойной сердечной не-
достаточности с очень низким ударным выбросом.
Д. Неодинаковое наполнение и напряжение пульса на симметричных учас-
тках артерий (pulsus differens). На сонных артериях может быть обусловле-
но частичной или полной окклюзией одной из них в результате атеро-
склероза, артериита, эмболии или тромбоза, или расслаивающей анев-
72
ризмой восходящей части аорты. При его определении на лучевых арте-
риях возможными причинами являются также синдром передней груд-
ной мышцы, добавочное шейное ребро и митральный стеноз.
Е. Резкое ослабление или отсутствие пульса на обеих бедренных артериях
при его достаточном наполнении на артериях верхних конечностей пато-
гномонично для коарктации аорты. Может наблюдаться также при окклюзии
брюшной части аорты вследствие атеросклероза или тромбоза в месте би-
фуркации (синдром Лериша), реже при ее расслаивающей аневризме.
Пальпация прекардиальной области позволяет определить: 1) пульса-
цию (нормальную — верхушечный толчок — и патологическую); 2) дро-
жание (пальпаторный эквивалент сердечных шумов); 3) шумы трения;
4) нормальные и патологические тоны сердца (редко).
Пальпацию, как и осмотр, производят последовательно в 7 зонах
(рис. 19).
Верхушечный толчок определяют визуально и (или) пальпаторно в об-
ласти верхушки сердца в положении лежа на спине или на левом боку в
среднем у 25 % здоровых лиц. Он локализуется в четвертом или пятом
межреберье кнутри от левой среднеключичной линии, занимая площадь
1—2 см2, и образуется при отдаче сердца во время изгнания крови. Гипер-
трофия левого желудочка вызывает увеличение амплитуды, продолжи-
тельности и иногда площади верхушечного толчка, а его дилатация —
смещение толчка латерально и книзу в шестое или седьмое межреберье.
Высокоамплитудный приподнимающий верхушечный толчок наблюда-
ется при объемной перегрузке левого желудочка и низком ОПСС - при
гиперкинетическом синдроме, недостаточности митрального и аорталь-
ного клапанов и больших лево-правых шунтах крови. Втягивающийся вер-
хушечный толчок характерен для констриктивного перикардита, а также
обширных плевроперикардиальных сращений.
Основными причинами патологической пульсации в прекардиальной
области при осмотре и пальпации являются:
1) гипертрофия правого желудочка . Может вызывать на-
пряженную продолжительную приподнимающую пульсацию в соответству-
ющей области (см. рис. 19), особенно — в четвертом и пятом межреберьях
по окологрудинной линии слева;
2) дилатация правого жел уд о ч ка . Пульсация дилатирован-
ного правого желудочка определяется в надчревной области. В отличие от
свойственной здоровым лицам пульсации брюшной части аорты она уси-
ливается на вдохе в соответствии с законом Франка—Старлинга;
3) зоны дискинезии левого желудочка. Отмечаются у ча-
сти больных с ИБС, особенно перенесших передний трансмуральный
инфаркт миокарда с образованием аневризмы, и могут обусловливать
систолическую пульсацию на 1-2 межреберья выше и медиальнее верху-
шечного толчка;
4) значительная митральная недостаточность. Может сопро-
вождаться систолической пульсацией в парастернальной области слева,
73
которая наступает позже верхушечного толчка одновременно с волной
“у” на кривой давления в левом предсердии. Она обусловлена смещением
кпереди правого желудочка резко увеличенным левым предсердием при
поступлении в него струи крови из левого желудочка (’’симптом коро-
мысла”);
5) аневризма аорты. Может быть причиной пульсации в самых
различных областях передней, а также задней поверхностей грудной клет-
ки, особенно в зоне грудино-ключичных сочленений, и рукоятки грудины;
6) пульсация легочной артерии во втором межреберье слева
у грудины. Может отмечаться у детей и худощавых молодых людей в нор-
ме, а также при дилатации легочной артерии вследствие высокой легоч-
ной гипертензии, увеличения легочного кровотока или в случае ее пост-
стенотического расширения при клапанном стенозе устья.
Дрожание представляет собой низкочастотные вибрации, обусловлен-
ные теми же причинами, что и сердечные шумы. Оно определяется во
всех случаях выслушивания громких шумов сердца в проекции их эпи-
центра. Дрожание особенно характерно для стеноза устья аорты и легоч-
ной артерии, дефекта межжелудочковой перегородки, митрального сте-
ноза, реже отмечается при митральной недостаточности.
ПЕРКУССИЯ ОБЛАСТИ СЕРДЦА
В настоящее время топографическую перкуссию сердца используют для
ориентировочного определения размеров сердца до получения результатов
рентгенологического исследования или при невозможности его выполнения.
Ее значение возрастает в случаях, когда не удается определить верхушечный
толчок.
Точность метода значительно снижается у лиц с толстой или выпук-
лой грудной стенкой, большими молочными железами, при высоком сто-
янии диафрагмы и повышенном содержании газа в желудке. Его использова-
ние практически невозможно при выраженной эмфиземе легких, а также
патологических процессах в прилежащих к сердцу органах, которые вызыва-
ют образование тупости.
Перкуторные размеры сердечной тупости не являются истинными раз-
мерами передней поверхности сердца. Они представляют собой проек-
цию границ сердца на переднюю грудную стенку (относительная сердеч-
ная тупость) либо размеры его ограниченного участка, который распо-
ложен наиболее поверхностно и не прикрыт легкими (абсолютная ту-
пость).
Так как в области границ относительной тупости сердца его передняя
поверхность расположена глубоко под легкими, они определяются с по-
мощью сравнительно громкой перкуссии по переходу ясного легочного
звука в притупленный. Очевидно, что это весьма субъективно, даже при
большом опыте врача.
74
Правая граница относительной тупости сердца образована правым пред-
сердием и в норме располагается по правому краю грудины или на 0,5—
1 см правее. У здоровых нормостеников при высоте стояния диафрагмы
на уровне шестого межреберья по правой среднеключичной линии она
перкутируется по четвертому межреберью. Если сердце не увеличено впра-
во, эта граница определяется не точно из-за удаления правого края сер-
дца от передней грудной стенки. Верхнюю границу образуют ствол легоч-
ной артерии и ушко левого предсердия. По левой пригрудинной линии
она проходит по верхнему краю III ребра. Из-за косого расположения
верхней границы ее топографическое определение весьма условно. Левая
граница относительной сердечной тупости образована узкой полоской ле-
вого желудочка, которая выходит на переднюю поверхность сердца. Она
соответствует верхушечному толчку или по пятому межреберью, где она
перкутируется, располагается кнутри от левой среднеключичной линии.
Расстояние от срединной линии тела до правой границы относитель-
ной тупости сердца (Md) по четвертому межреберью у здоровых лиц со-
ставляет 2—3,5 см, а до ее левой границы в пятом межреберье (Ms) — 6—
10 см. Сумма Md и Ms обозначает наибольший поперечник относитель-
ной тупости сердца, который в норме равен 11,5—13 см. Эти пределы,
однако, весьма относительны и зависят от пола, роста и массы тела. Сер-
дце может быть увеличенным при “нормальных” размерах относитель-
ной тупости и наоборот.
Перкуторное определение границ сосудистого пучка во втором межре-
берье у здоровых лиц очень условно. Принято считать, что правая грани-
ца, образованная правым краем верхней полой вены, соответствует пра-
вому краю грудины или смещена до 0,5 см вправо от него, а левая, обра-
зованная легочной артерией, проходит по левому краю грудины. При этом
поперечник сосудистого пучка над рукояткой грудины составляет 4,5—
5 см. На практике перкуторное определение тупости над магистральными
сосудами удается только иногда при их значительном увеличении, на-
пример, при крупной аневризме аорты. В противном случае достаточно
отметить, что в области сосудистого пучка не обнаруживается патологи-
ческая тупость. Необходимо иметь в виду, что тупость в проекции магис-
тральных сосудов справа и слева от грудины может быть обусловлена
увеличенными лимфатическими узлами в средостении.
Границы абсолютной тупости сердца, которая непосредственно приле-
жит к грудной стенке, определяются с помощью слабой перкуссии при
переходе ясного звука в абсолютно тупой. В норме правая граница прохо-
дит вдоль левого края грудины от IV до VI ребра, верхняя - по нижнему
краю IV ребра от левого края грудины до левой пригрудинной линии и
левая доходит до пятого межреберья немного кнутри от верхушечного
толчка и границы относительной тупости. В норме вся площадь абсолют-
ной тупости образована передней поверхностью правого желудочка. Це-
лесообразность ее определения принято обосновывать тем, что площадь
абсолютной тупости расширяется во всех случаях дилатации сердца, даже
75
Таблица 6. Механизм нормальных и патологических тонов сердца, их связь с элементами
ЭКГ н клиническое значение
Тон сердца Связь с элементами ЭКГ Механизм образования Клиническое значение
IV (S^) Сегмент PQ Вибрация стенок желудочка при резком прекращении диастолического растяжения после окончания систолы предсердий Нормальный тон, кото- рый усиливается при сни- жении диастолической податливости желудочка или его объемной перегрузке
I (S,) Конечная часть комплекса QRS Асинхронное захлопывание митрального (вначале) и трехстворчатого клапанов Звучность зависит от многих факторов; особен- но характерно усиление и Запаздывание при мит- ральном стенозе
Тон изгнания Начальный Резкое растяжение аорты Может определяться при
(ES) отрезок сегмента ST или легочной артерии? Прекращение движения полулунных клапанов при их открытии дилатации аорты или ле- гочной артерии либо при стенозе полулунных кла- панов
Систолический Чаще конечный Чаще внесердечного прайс- В первом случае обуслов-
щелчок (клик) отрезок сегмента хождения, реже — вибрация Лен плевроперикардиаль-
(Q ST, но может варьировать провисающих сухожильных хорд при их резком натяжении ними или перикардио- диафрагмальными сра- щениями, левосторонним пневмотораксом, во вто- ром — пролапсом мит- рального клапана — идио- патическим или при ряде заболеваний (ИБСи др.)
II (S2) Конечная часть зубца Т Асинхронное захлопывание аортального клапана (вначале) и клапана легоч- ной артерии и “отдача” столба крови в крупных сосудах Звучность Aj зависит от Давления в аорте; он мо- жет запаздывать при бло- каде левой ножки пучка Гиса и стенозе устья аор- ты. Звучность Р2 зависит от давления в легочной артерии; он может запаз- дывать при блокаде пра- вой ножки пучка Гиса, стенозе устья легочной артерии и заболеваниях, связанных с увеличением ударного объема правого Желудочка (дефект меж- предсердной перегородки И др.)
76
Продолжение Табл. 6
Тон сердца Связь с элементами ЭКГ Механизм образования Клиническое значение
Щелчок Начальный Вибрация измененных, но Характерен для
открытия (QS) отрезок сегмента ТР (через 0,04— 0,12 с после А2) подвижных створок митрального или (реже) трехстворчатого клапана при резком прекращении их открытия во время диастолы митрального стеноза и, реже, стеноза трехствор- чатого клапана; время возникновения от Aj обратно пропорционально давлению в предсердии
ш (sp Середина сегмента ТР (0,14-0,24 с после А2) Вибрация стенок желудочка при резком прекращении диастолического растяжения при окончании быстрого наполнения Нормальный тон, кото- рый патологически усили- вается при уменьшении податливости или пере- грузке желудочка объемом
Перикард-тон Начальный Видоизмененный S,. Характерен для констрик-
(pericardial knock) отрезок сегмента ТР (через 0,10— 0,12 с после Aj) Вибрация стенок желудочка при резком прекращении быстрого диастолического наполнения, которому препятствует неподатливый перикард тивного перикардита
при увеличении его передне-заднего размера, когда относительная ту-
пость может не изменяться. Это обусловлено отодвиганием передних кра-
ев легких от сердца в результате повышения внутригрудного давления. С
учетом особенностей восприятия изменений перкуторного тона опреде-
ление границ абсолютной тупости считается более надежным, чем отно-
сительной.
Физиологические изменения границ сердечной тупости отмечаются при
глубоком дыхании. Она значительно увеличивается при миогенной дилата-
ции сердца (cor bovinum) и большом выпоте в перикарде. Определить, ка-
кой именно отдел сердца расширен, по перкуторным данным можно лишь
весьма условно. При изолированном увеличении левого желудочка сер-
дечная тупость расширяется преимущественно влево и книзу, а при зна-
чительной дилатации правого желудочка — только влево или влево и кверху.
Определение тупости справа от грудины в большинстве случаев связано
с увеличением правого предсердия.
АУСКУЛЬТАЦИЯ СЕРДЦА
Открытие и закрытие клапанов и мышечные сокращения вызывают
появление турбулентного движения крови или резкого ускорения либо
замедления ее тока, что обусловливает возникновение звуков высокой
или низкой частоты — тонов и шумов сердца. Эти звуки определяются
при выслушивании и регистрируются графически с поверхности грудной
клетки (так называемая пре кардиальная фонокардиография), эпикарда
77
ЭКГ
Q $ Ац i Pt
Рис. 20. Нормальные и патологические
тоны сердца и их связь с элементами ЭКГ:
S), S2, S3, S4 — соответственно I, II, III и
IV тоны сердца; ES — тон изгнания; С —
систолический щелчок; А2 и Р2 — аорталь-
ный и легочный компоненты II тона;
OS — щелчок открытия
ФК Г
St£S С 05 53 (эпикардиальная фонокардиогра-
фия), из пищевода (внутрипище-
водная фонокардиография) и из внутренней поверхности камер сердца
и крупных сосудов (внутрисердечная фонокардиография).
Аускультацию проводят последовательно в 5 основных обязательных
точках: верхушка — основание мечевидного отростка — четвертое межре-
берье слева у края грудины (точка Боткина) — второе межреберье слева у
края грудины — второе межреберье справа. Возможна и иная последова-
тельность. Кроме того, при выслушивании шумов определяют их прове-
дение, для чего проводят аускультацию в подмышечной области, над
яремной вырезкой и на шее над сонными артериями.
Анализ мелодии сердца в норме и диагностическое значение различ-
ных варинатов ее изменений в условиях патологии, которому посвящен
этот раздел, в равной степени касается аускультации и фонокардиогра-
фии. Он предусматривает характеристику следующих элементов: 1) ритма
сердца; 2) тонов; 3) шумов сердца.
Клиническая оценка ритма сердца — см. раздел “Артериальный пульс”.
Клиническая оценка тонов сердца. Тоны сердца, в отличие от шумов,
обусловлены вибрациями камер, клапанов и содержимого полостей сердца
при резком замедлении движения массы крови.
В норме существуют 4 тона: [ и II тоны выслушиваются всегда, в то
время как III и IV чаще не определяются. К патологическим тонам
относятся: 1) щелчок открытия; 2) тон изгнания; 3) перикард-тон; 4) систо-
лический клик; 5) трехчленный или четырехчленный ритм (ритм галопа).
Время возникновения, механизм и клиническое значение сердечных
тонов резюмированы на рис. 20 и в табл. 6.
Первый тон (Sj) возникает в начале систолы желудочков и наиболее
громкий в области верхушки, где он в норме является ведущим. Звуч-
ность (амплитуда) S, зависит от:
1) величины временного интервала между систолой предсердий и же-
лудочков, который определяет положение створок митрального клапана
к началу систолы;
2) силы и скорости сокращения желудочков (скорости повышения
внутрижелудочкового давления);
3) анатомических изменений атриовентрикулярных клапанов;
4) внесердечных факторов — толщины слоя тканей, воздуха или жид-
кости, через который проводится звук.
78
S, усилен в следующих случаях:
1) при тахикардии вследствие укорочения диастолы и увеличения рас-
стояния, которые проходят створки перед захлопыванием;
2) при укорочении атриовентрикулярной проводимости (Р0<О,12с),
так как при этом к началу систолы желудочков, когда систола предсер-
дий только закончилась, створки не успевают “всплыть” в полости желу-
дочков по направлению к клапанному кольцу и находятся на относи-
тельно большом расстоянии друг от друга;
3) при гиперкинетических состояниях вследствие увеличения МОС (ти-
реотоксикоз, лихорадка и др.);
4) при стенозе митрального, реже — трехстворчатого клапанов (точ-
ный механизм не ясен).
S1 ослаблен в следующих случаях:
1) при удлинении интервала P—Q в пределах 0,2-0,24 с;
2) во всех случаях уменьшения силы и скорости сокращения желудоч-
ков (миокардит, инфаркт миокарда, стеноз устья аорты и др.);
3) при недостаточности митрального клапана вследствие несмыкания его
створок;
4) при митральном стенозе с резким уменьшением подвижности ство-
рок из-за грубого фиброза и кальциноза;
5) при ухудшении проведения звука вследствие значительного ожире-
ния, хорошо развитой мускулатуры, эмфиземы легких, значительного вы-
пота в полость перикарда или плевры. Эти внесердечные причины обус-
ловливают уменьшение звучности и всех других тонов сердца.
Расщепление S, обусловлено асинхронным захлопыванием мит-
рального и трехстворчатого клапанов. Физиологическое расщеп-
ление (М,?! 10-30 мс) является вариантом нормы. П ато л оги чес -
кое расщеп лен и е MJ, вследствие увеличения интервала между ком-
понентами чаще всего обусловлено полной блокадой правой ножки пуч-
ка Гиса, которая вызывает запаздывание систолы правого желудочка.
Патологическое парадоксальное (“обратное”) расщепле-
ние Т]М) отмечается при выраженном митральном стенозе (так как в
начале изометрического сокращения митральный клапан остается откры-
тым из-за повышенного давления в левом предсердии), миксоме (опухо-
ли на ножке) гевого предсердия, изредка — при полной блокаде левой
ножки пучкз Гиса.
Второй тон (S2) возникает в конце систолы желудочков. Он наиболее
громкий на основании сердца во втором межреберье по обе стороны груди-
ны, где в норме является ведущим. А2 всегда громче Р2.
Звучность (амплитуды) S2 зависит от следующих связанных с сердцем
факторов:
1) скорости ретроградного тока крови в аорту и легочную артерию;
2) анатомических изменений полулунных клапанов.
S2 усилен при системной или легочной гипертензии и ослаблен
при:
79
Рис. 21. Варианты расщепления II
тона (S2): А — норма; Б — фикси-
рованное патологическое (стой-
кое) расщепление: 1 — дефект
межпредсердной перегородки; 2 -
правожелудочковая недостаточ-
ность с фиксированным ударным
выбросом правого желудочка;
В - парадоксальное (“обратное”)
расщепление. Объяснение в тексте
5
Вдох И.
Выдох
1) системной или легоч-
ной гипотензии (например,
при шоке, стенозе устья ле-
гочной артерии и др.);
2) ревматическом стено-
зе устья аорты из-за резко-
го нарушения подвижности
фиброзно измененных и обызвествленных створок клапана;
3) недостаточности полулунных клапанов вследствие несмыкания их ство-
рок.
Расщепление S2 обусловлено асинхронным захлопыванием полу-
лунных клапанов и лучше выслушивается над легочной артерией.
Для физиологического расщепления А2Р2 как варианта нор-
мы характерно следующее: 1) встречается главным образом у детей и лиц
молодого возраста; 2) часто непостоянно; 3) А2 предшествует Р2 и гром-
че, чем Р2 (А2 > Р2); 4) лучше определяется в положении лежа; 5) появ-
ляется или расширяется на вдохе (рис. 21,Л).
Увеличение интервала между А2 и Р2 на вдохе в норме и при ряде
патологических состояний обусловлено:
1) запаздыванием захлопывания клапана легочной артерии вследствие
увеличения венозного притока к правому желудочку, что приводит к воз-
растанию его ударного объема и тем самым обусловливает удлинение
периода изгнания;
2) более ранним захлопыванием клапана аорты вследствие уменьше-
ния притока к левым отделам сердца из-за увеличения объема крови в
легких. Это приводит к уменьшению ударного объема и укорочению пе-
риода изгнания левого желудочка.
Патологическое расщепление А2Р2, в отличие от физиоло-
гического, стойкое, сохраняется на выдохе, в положении стоя, отмеча-
ется в более старших возрастных группах. Оно бывает фиксированным и
нефиксированным, а также парадоксальным,
1. Для фиксированного патологического (стойкого) расщепле-
ния характерно постоянство величины интервала А2-Р2 в обе фазы
дыхательного цикла (рис. 21, Л). Его наиболее частой причиной является
дефект межпредсердной перегородки. Вследствие больших размеров
80
отверстия приток крови к правому предсердию у таких больных остается
постоянным вне зависимости от фаз дыхания, так как обеспечивается то
преимущественно за счет полых вен, то за счет левого предсердия. При
этом ударный выброс и продолжительность изгнания крови из правого
желудочка практически не изменяются. Этот признак имеет важное диаг-
ностическое значение. Фиксированное расщепление S2 встречается также
при тяжелой правожелудочковой недостаточности, при которой вслед-
ствие выраженной дисфункции миокарда ударный объем правого желу-
дочка фиксирован, то есть не способен увеличиваться при увеличении
венозного подпора.
2. Нефиксированное патологическое (стойкое) расщепление S2
на выдохе, которое увеличивается на вдохе, отмечается при: а) блокаде
правой ножки пучка Гиса вследствие запаздывания начала и окончания
сокращения правого желудочка; б) стенозе легочной артерии; в) заболе-
ваниях, сопровождающихся высокой легочной гипертензией, в силу уд-
линения периода изгнания из правого желудочка; г) тяжелой недоста-
точности митрального клапана в результате преждевременного захлопы-
вания аортального клапана; д) дефекте межжелудочковой перегородки
вследствие укорочения изгнания крови из левого желудочка и удлинения
из правого.
Парадоксальное патологическое расщепление S2(’’обрат-
ное расщепление”) обусловлено запаздыванием закрытия аортального кла-
пана в фазу выдоха вследствие удлинения периода изгнания из левого желу-
дочка, в результате чего Р2 предшествует А2. Во время вдоха ширина рас-
щепления уменьшается с восстановлением нормальной после-
довательности захлопывания клапанов (А2Р2, рис. 21,В). Отмечается при:
1) полной блокаде левой ножки пучка Гиса; 2) выраженном стенозе устья
аорты; 3) выраженной артериальной гипертензии и ИБС, протекающей
с левожелудочковой недостаточностью; 4) значительном сбросе крови из
аорты в легочную артерию через открытый артериальный проток. Лучше
выслушивается в положении больного сидя и стоя.
III и IV тоны (S3 и S4, см. рис. 4, табл. 6) могут возникать либо в
одном, либо в обоих желудочках. Встречаются в норме у детей и юношей,
S3 - чаще, S4 — значительно реже. Отмечаются также при состояниях,
сопровождающихся высоким МОС (тяжелая анемия, тиреотоксикоз и др.),
и при объемной перегрузке желудочка, например, при митральной или
аортальной недостаточности, дефекте межжелудочковой перегородки при
неизмененной диастолической податливости миокарда. Обнаружение у
лиц старше 40 лет, а также усиление громкости в более молодом возрасте
при отсутствии перечисленных выше возможных причин обычно указы-
вает на наличие лево- и (или) правожелудочковой недостаточности. В
подобных случаях трехчленный ритм называют ритмом галопа.
Различают протодиастолический, пресистолический и суммационный
ритм галопа.
Протодиастолический, или желудочковый, ритм галопа
81
обусловлен патологическим усилением физиологического S3. Его меха-
низм образования в целом аналогичен физиологическому S3. Возникает в
фазу быстрого наполнения при резком повышении сопротивления даль-
нейшему поступлению крови в желудочек вследствие его объемной (диа-
столической) перегрузки и уменьшения диастолической податливости.
Характерен для застойной сердечной недостаточности, особенно лево-
желудочковой, и является ее ранним признаком. Левожелудочковый про-
тодиастолический ритм галопа лучше всего выслушивается над верхуш-
кой в положении больного лежа на левом боку и на выдохе; усиливается
после физической нагрузки. Оптимальными условиями выявления право-
желудочкового ритма галопа являются аускультация в третьем и четвер-
том межреберьях у левого края грудины в положении больного лежа на
спине, при задержке дыхания на вдохе.
Пресистолический, или предсердный, ритм галопа обуслов-
лен патологическим усилением физиологического S4. Возникает при по-
вышении сопротивления наполнению желудочка из-за снижения его
диастолической податливости и высокого диастолического давления. Наи-
более характерен для систолической перегрузки гипертрофированного
желудочка, особенно при его систолической дисфункции. Отсутствует
при мерцании предсердий. Часто встречается при следующих
заболеваниях: 1) артериальной гипертензии; 2) стенозе устья аорты; 3) сте-
нозе устья легочной артерии; 4) гипертрофической кардиомиопатии;
5) легочной гипертензии (при наличии гипертрофии правого желудоч-
ка); 6) ИБС, особенно при инфаркте миокарда. В этих случаях является
ранним признаком сердечной недостаточности. Может наблюдаться также
при замедлении атриовентрикулярной проводимости при отсутствии
систолической дисфункции. Левожелудочковый пресистолический ритм
галопа лучше всего выслушивается над верхушкой в положении боль-
ного лежа на левом боку, усиливается на выдохе, а также при небольшой
изометрической (изотонической) нагрузке в положении больного лежа.
Правожелудочковый пресистолический ритм галопа выявляется у лево-
го края грудины в нижней ее части и усиливается на вдохе. Часто сопро-
вождается выраженной пресистолической волной “а” венного пульса.
Суммационный ритм галопа обусловлен слиянием патоло-
гических S3 и S4 в один громкий тон в середине диастолы при тахикардии
или в других случаях, вызывающих укорочение диастолы. Обычно отме-
чается при выраженной сердечной недостаточности.
При достаточной продолжительности диастолы и неизмененной атрио-
вентрикулярной провсци мости может выслушиваться четырехчлен-
ный ритм галопа
Тон изгнания представляет собой резкий, высокий звук в начале систо-
лы вскоре после I тона. Возникает при стенозе одного из полулунных
клапанов и при состояниях, связанных с дилатацией аорты или легочной
артерии: при высокой системной или легочной гипертензии, увеличении
аортального или легочного кровотока, например, при шунтировании крови
82
слева—направо, тиреотоксикозе. Аортальный тон изгнания обычно луч-
ше всего выслушивается в области верхушки и во втором межреберье
справа у грудины. Тон изгнания крови в легочную артерию имеет макси-
мальную амплитуду во втором межреберье слева и, в отличие от других
звуков, образующихся в правых отделах сердца, лучше слышен на выдохе.
Среднесистолический щелчок, или клик, характерен для пролапса од-
ной или обеих створок митрального, реже — трехстворчатого клапана. Его
образование связано с резким натяжением патологически удлиненных
сухожильных хорд. Может быть также проявлением дисфункции сосочко-
вых мышц при других заболеваниях, в частности, ИБС. Лучше всего выс-
лушивается над верхушкой, в третьем и четвертом межреберьях слева у
края грудины. Может возникать в любое время на протяжении систолы,
но обычно позже, чем систолический тон изгнания.
Среднесистолический щелчок может иметь также внесердечное про-
исхождение и определяться при плевроперикардиальных и перикарди-
ально-диафрагмальных сращениях, перикардите, левостороннем пнев-
мотораксе.
Щелчок открытия (0s) представляет собой короткий, высокий звук в
самом начале диастолы. В основе его возникновения лежит резкое прекраще-
ние движения книзу тел створок митрального, реже — трехстворчатого кла-
пана в начале периода быстрого наполнения желудочков из-за их сраще-
ния в области комиссур. Обязательным условием является сохранение под-
вижности клапанного аппарата. Описан щелчок открытия при относи-
тельном митральном стенозе при неизмененном клапане у больных с
дефектом межжелудочковой перегородки, открытым артериальным про-
током и выраженной “чистой” митральной недостаточностью. Его обра-
зование в таких случаях связано с высокой скоростью поступления крови
в левый желудочек в самом начале диастолического наполнения, поток
которой подхватывает створки клапана.
Щелчок открытия митрального клапана лучше всего выслушивается в
четвертом межреборье у левого края грудины и над верхушкой. Продолжи-
тельность интервала А2—Os обратно пропорциональна величине среднего
давления в левом предсердии и колеблется от 0,04 до 0,12 с. Щелчок хорошо
проводится на основание сердца, где его можно принять за пульмональный
компонент S2.
К добавочным тонам внутрисердечного происхождения относятся также
тоны открытия и закрытия протезов клапанов сердца, которые обычно
представляют собой высокочастотные щелчки.
Клиническая оценка сердечных шумов. Шум представляет собой после-
довательность звуков, образующихся при вибрации содержимого сердца
и сосудов, а также их стенок, различной интенсивности (громкости),
высоты, частоты, формы и продолжительности. Образование шумов обус-
ловлено следующими факторами: 1) высокой скоростью кровотока через
неизмененные клапаны; 2) антеградным током крови через суженный или
имеющий неправильную форму клапан, или через неизмененный клапан
83
%
Пансисто-
I лический
I шум
Ранний диастоли-
ческий (протодиа-
столический) шум
S, Б
$г
Ранний
систоли-
ческий шум
1Мезодиастоли-
*
Мезосисто-
лический шум
(шум изгнания)
$г Ж 3,
Мезо- и поздний
диастолический
шум (митраль -
ный стеноз)
Поздний
систоли-
ческий шум
I Поздний диасто-
лический (пресис-
толический) шум
Рис. 22. Различные варианты систолического (А, Б, В, Г) и диастолического (Д, Е, Ж,
3) шумов сердца. Объяснение в тексте
в расширенный сосуд; 3) ретроградным током крови через плохо смыка-
ющийся клапан или через патологическое сообщение между полостями
сердца или артериальными и венозными сосудами.
Для установления анатомической структуры, с которой связано образо-
вание шума, и его вероятной причины определяют:
1) в какой фазе сердечного цикла выслушивается шум. В зависимости от
этого он может быть систолическим, диастолическим и непрерывным
(систоло-диастолическим);
2) эпицентр шума;
3) область проведения. Ввиду того что шум проводится в направлении
тока крови, в зависимости от данных (1) и (2) в ряде случаев проводят
аускультацию также в подмышечной области, в области левой лопатки,
грудинной вырезки, над сонными артериями и реже — в межлопаточном
пространстве;
84
4) в какой части систолы или диастолы выслушивается шум и какова
его продолжительность. Время возникновения и прекращения шума за-
висят от того, в какое время сердечного цикла появляется и исчезает
достаточно большая разница (градиент) давления между соседними от-
делами сердца и сосудов (рис. 22). В зависимости от этого различают сле-
дующие основные варианты систолического шума:
а) пансистолический, или голосистолический. Возникает
одновременно с S,, занимает всю систолу и прекращается с появлением
S2 (рис. 22,А);
б) ранний систолический. Возникает одновременно с S] и пре-
кращается к середине систолы (рис. 22,Б);
в) мезосистолически й, или шум изгнания. Возникает после
окончания S, и прекращается до образования S2 (рис. 22, В);
г) поздний систолический. Возникает примерно в середине
систолы до образования S2 или одновременно с ним (рис. 22,Г).
Варианты диастолического шума включают:
а) ранний диастолический, или протодиастолический.
Возникает вместе с аортальным или пульмональными компонентами S2
(рис. 22,Д);
б) мезодиастолический. Возникает четко после S2 (рис. 22,Е);
в) поздний диастолический, или пресистолический. На-
чинается незадолго перед S, и прекращается с его возникновением
(рис. 22,5);
5) форма шума: а) крещендо (см. рис. 22, Г,3); б) декрещендо (рис. 22,
Б,ДУ, в) крещендо—декрещендо, или ромбовидная (см. рис. 22, В); г) ленто-
видная (см. рис. 22,А);
6) громкость (интенсивность, амплитуда) шума. Выделяют 6 градаций
(степеней) громкости шума (по S.Levine, 1958):
I — выслушивается с большим трудом; II — выслушивается с извест-
ным трудом; Ш — хорошо слышен; IV — очень хорошо слышен и обычно
сопровождается дрожанием; V — очень громкий; VI — настолько гром-
кий, что выслушивается даже при отсутствия плотного контакта стето-
скопа с кожей.
В отечественной фонокардиографической практике принято исполь-
зовать три следующие градации амплитуды шумов: низкоамплитуд-
ный (не превышает половины амплитуды наиболее интенсивного тона),
среднеамплитудный (не превышает амплитуды этого тона) и в ы -
сокоамплитудный (превышает ее);
7) по высоте шум может быть высоко- или низкочастотным. В ряде
случаев шум имеет также особенности тембра и может быть дующим,
музыкальным или грубым.
При затруднении определения происхождения шума на основании этих
данных полезно использовать при аускультации специальные приемы. Вы-
зывая изменения внутрисердечной гемодинамики, они обусловливают
характерные изменения шумов, а также тонов.
85
Усиление шума, а также S3 и S4 во время вдоха, при котором
увеличивается венозный возврат, указывает на их образование в правых
отделах сердца. Шумы и тоны, связанные с левыми отделами сердца,
обычно громче на выдохе. Удлиненный выдох при закрытой голосо-
вой щели при п р о б е Вальсальвы вызывает уменьшение громкости
большинства шумов за счет снижения наполнения как правого, так и
левого желудочков. Исключение составляют систолический шум при об-
структивной гипертрофической кардиомиопатии и поздний систоличе-
ский шум при пролапсе митрального клапана, амплитуда которых при
этом может возрастать. Эти шумы становятся громче и в положении
стоя , когда венозный приток уменьшается. Другие шумы при этом ос-
лабевают. Присаживание на корточки, вызывающее увеличение
одновременно венозного возврата и ОПСС, приводит к возрастанию гром-
кости большинства шумов, кроме систолического при гипертрофической
кардиомиопатии и пролапсе митрального клапана, которые зачастую ос-
лабевают. Длительная изометрическая нагрузка, например, сжа-
тие ручного динамометра, повышая системное АД и ЧСС, сопровожда-
ется усилением шума митральной и аортальной недостаточности, мит-
рального стеноза и дефекта межжелудочковой перегородки, а также гром-
кости левожелудочковых S3 и S4. Шум стеноза устья аорты и обструктив-
ной гипертрофической кардиомиопатии при этом ослабевает. Вдыха-
ние амилнитрита вследствие снижения системного АД и увеличе-
ния кровотока способствует усилению шумов митральной и аортальной
регургитации, а также дефекта межжелудочковой перегородки.
Оказывающий сосудосуживающее действие норадреналин вызы-
вает противоположный эффект. Кратковременно (в течение 5 с) сдавле-
ние обеих плечевых артерий с помощью манжеты тонометра под давле-
нием, превышающим систолическое АД на 20 мм рт.ст., приводит к по-
вышению интенсивности шумов, обусловленных регургитацией крови в
левых отделах сердца при митральной и аортальной недостаточности и
дефекте межжелудочковой перегородки.
Систолические шумы. Голосистолические , или пансистоли-
ческие, шумы образуются вследствие тока крови между двумя камера-
ми, между которыми на протяжении всей систолы отмечается значитель-
ный градиент давления, как, например, левый желудочек и левое пред-
сердие или левый желудочек и правый желудочек. Этот градиент возни-
кает с самого начала процесса сокращения и сохраняется почти до завер-
шения расслабления. Поэтому голосистолический шум появляется еще
до изгнания крови в аорту, практически одновременно с S, и продолжа-
ется еще некоторое время после прекращения изгнания, заканчиваясь
после S2.
Голосистолический шум характерен для недостаточности митрального
и трехстворчатого клапанов и дефекта межжелудочковой перегородки. При
митральной недостаточности и дефекте шум усиливается при нагрузке и
уменьшается при снижении АД с помощью амилнитрита. Голосистоличе-
86
ский шум при недостаточности трехстворчатого клапана усиливается на
вдохе, что имеет важное дифференциально-диагностическое значение.
Мезосистолические шумы, или шумы изгнания, кото-
рые обычно имеют форму крещендо—декрещендо, образуются при выб-
росе крови в аорту или легочную артерию. Шум появляется вскоре после
Sj, когда давление в желудочке поднимается настолько, чтобы смогли
открыться полулунные клапаны. Увеличение кровотока при изгнании в
первую половину систолы и его последующее уменьшение сопровожда-
ются соответствующими изменениями амплитуды шума. Шум прекраща-
ется, когда внутрижелудочковое давление снижается настолько, что дос-
тигает уровня давления в сосудах, то есть до закрытия полулунных кла-
панов. Громкость шума прямо пропорциональна величине кровотока, а
не площади отверстия клапана. Мезосистолический шум отмечается при:
1) наличии препятствия для изгнания крови в области выносящего
тракта левого и правого желудочков: а) стенозе устья аорты (клапанный,
надклапанный и подклапанный при обструктивной форме гипертрофи-
ческой кардиомиопатии); б) стенозе устья легочной артерии (клапанный
и подклапанный — инфундибулярный);
2) неизмененных клапанах: а) изгнании крови в расширенный сосуд
(атеросклероз аорты, артериальная и легочная гипертензия и др.); б) ги-
перкинетических состояниях вследствие увеличения УОС и скорости кро-
вотока через полулунные клапаны (“повышенный кровоток через нор-
мальный клапан”). Это имеет место в физиологических условиях при фи-
зической нагрузке, волнениях, беременности, а также при выраженной
анемии, тиреотоксикозе, лихорадке. Такие шумы некоторые специалис-
ты называют функциональными. Строго говоря, к этой категории отно-
сится шум дефекта межпредсердной перегородки; в) тонкой грудной клетке
вследствие улучшения проведения звука (“нормальный кровоток через
нормальный клапан”). Последние два фактора служат причинами образо-
вания так называемых невинных, или физиологических, шумов, боль-
шинство из которых встречаются в детском и юношеском возрасте.
Среди “невинных” мезосистолических шумов можно выделить: а) шум,
образующийся в выносящем тракте правого желудочка и (или) корне легоч-
ной артерии с эпицентром во втором межреберье слева у края грудины (наи-
более распространенный вариант). Подобный эпицентр имеет и шум при так
называемом синдроме прямой спины; б) шум с эпицентром в третьем и
четвертом межреберье у левого края грудины или над верхушкой (шум Грэ-
ма Стилла), напоминающий звук натянутой струны; в) так называемый над-
ключичный артериальный шум с эпицентром над сонными артериями, ко-
торый может проводиться до основания сердца. Этот шум имеет внесердеч-
ное происхождение. В отличие от шума изгнания органического генеза
все “невинные” шумы, как правило, короткие, в большинстве случаев
ограничиваются первой половиной систолы, тихие, часто музыкальные,
усиливаются при волнениях и других гиперкинетических состояниях,
иногда также при физической нагрузке.
87
Признаками мезосистолического шума стеноза устья аорты, позволя-
ющими отличить его от голосистолического шума митральной недоста-
точности, могут служить усиление шума в сердечном цикле, следующем
за желудочковой экстрасистолой, вследствие увеличения диастолическо-
го наполнения желудочка, а также при снижении давления в аорте, и
ослабление шума при повышении АД.
Ранние систолические шумы, возникающие вместе с S, и
прекращающиеся в середине систолы, отмечаются при: 1) небольшом
дефекте межжелудочковой перегородки или большом дефекте с высокой
легочной гипертензией; 2) значительной остро возникшей недостаточно-
сти митрального или трехстворчатого клапана. Непродолжительность это-
го шума в случаях митральной регургитации обусловлена низкой подат-
ливостью левого предсердия, а при недостаточности трехстворчатого кла-
пана — отсутствием легочной гипертензии.
Поздние систолические шумы обусловлены: 1) поздней мит-
ральной регургитацией при пролапсе двустворчатого клапана; 2) дисфунк-
цией сосочковых мышц вследствие их ишемии, инфарцирования или ди-
латации полости левого желудочка.
Диастолические шумы. Ранние диастолическио шумы возника-
ют одновременно с S2, как только давление в желудочке снизится ниже его
уровня в аорте или легочной артерии. Они характерны для недостаточности
полулунных клапанов аорты и легочной артерии и имеют форму “декрещен-
до” вследствие постепенного уменьшения объема и скорости обратного тока
с течением времени. Для выявления тихого высокочастотного шума аорталь-
ной регургитации необходимо проводить аускультацию, плотно прижимая
мембрану фонендоскопа к коже в области третьего и четвертого межреберий
слева у грудины (эпицентр шума) в положении больного сидя с накло-
ном туловища кпереди с задержкой дыхания на выдохе. Громкость этого
шума возрастает при резком повышении АД, например, при изометри-
ческой нагрузке сжатием ручного динамометра.
Ранний диастолический шум декрещендо недостаточности клапанов
легочной артерии в большинстве случаев связан с его относительной не-
достаточностью вследствие растяжения ствола легочной артерии и кла-
панного кольца при высокой легочной гипертензии (шум Грэма Стилла).
Мезодиастолические шумы обусловлены током крови через атри-
овентрикулярные клапаны. Они возникают после окончания изометричес-
кого расслабления, когда давление в желудочке снижается до меньшего уров-
ня, чем в предсердии, что позволяет клапану открыться. Вследствие этого
мезодиастолический ш 'м всегда отделен от S2 коротким интервалом. По-
скольку градиент давле шя между предсердием и желудочком никогда не
достигает значительной величины, этот шум низкочастотный и относи-
тельно негромкий.
В основе мезодиастолического шума лежит несоответствие между раз-
мерами отверстия атриовентрикулярного клапана, с одной стороны, и
объемом и скоростью кровотока через него в период быстрого диастоли-
88
ческого наполнения — с другой. Поскольку амплитуда шума зависит от
скорости тока крови, он может быть более громким при небольшом су-
жении клапанного отверстия и тихим, вплоть до полного отсутствия,
при его значительном стенозе, когда МОС резко снижен. Более надеж-
ным показателем выраженности стеноза является продолжительность
шума, которая возрастает при увеличении степени сужения.
Основной причиной мезодиастолического шума является стеноз ле-
вого атриовентрикулярного отверстия. Значительно реже
встречается органический стеноз трехстворчатого клапана.
Низкочастотный мезодиастолический шум митрального стеноза воз-
никает вслед за щелчком открытия и лучше всего выслушивается над
верхушкой в области верхушечного толчка в положении лежа на левом
боку. Для увеличения его громкости можно использовать небольшую на-
грузку лежа или вдыхание амилнитрита. Мезодиастолический шум стено-
за трехстворчатого клапана выслушивается на очень ограниченном учас-
тке у левого края грудины в ее нижней части и усиливается на вдохе.
Кроме органического стеноза атриовентрикулярных клапанов мезодиас-
толический шум встречается при:
увеличенном кровотоке через неизмененный атриовентрикулярный кла-
пан. Это имеет место при дефекте межжелудочковой перегородки, открытом
артериальном протоке или недостаточности митрального клапана (функци-
ональный митральный стеноз), а также при дефекте межпредсердной пере-
городки и недостаточности трехстворчатого клапана (функциональный сте-
ноз трехстворчатого клапана);
неизмененном кровотоке через неизмененный митральный клапан из-за
его преждевременного прикрытия в середине диастолы. Этот шум функцио-
нального митрального стеноза (шум Флинта) характерен для недоста-
точности аортальных клапанов и обусловлен: а) смещением передней
створки митрального клапана кверху струей обратного тока крови из аорты;
б) резким повышением КДД в левом желудочке при значительном объе-
ме регургитации, которое начинает превышать давление в левом пред-
сердии. При большом обратном токе крови шум Флинта имеет характер
мезодиастолического с пресистолическим усилением, а при меньшей вы-
раженности аортальной недостаточности — изолированного пресистоли-
ческого шума;
вальвулите митрального клапана вследствие острого ревмокардита (шум
Кори—Кумбса). Он возникает сразу после 111 тона, являясь как бы его
продолжением. Обусловленный воспалительным отеком створок, он не-
стойкий и исчезает с изменением морфологического субстрата. Шум Кум-
бса следует отличать от шума органического митрального стеноза, кото-
рый формируется значительно позже.
Поздние диастолические, или пресистолические, шумы
обусловлены градиентом давления на одном из атриовентрикулярных кла-
панов, обычно небольшим, который резко возрастает во время систолы
предсердий. Поэтому они всегда имеют форму крещендо с максимумом к
89
усиленному S, и образуются только при синусовом ритме. Такой шум
отмечается при: 1) стенозе митрального, реже трехстворчатого клапана,
будучи более характерным для этих пороков, чем мезодиастолический
шум; 2) опухоли на ножке (миксоме) или шаровидном тромбе одного из
предсердий; 3) недостаточности аортального клапана (шум Флинта).
Непрерывные систоло-диастолические шумы возникают к началу систо-
лы, достигают максимума к моменту появления S2 и продолжаются на про-
тяжении всей диастолы или ее части. Они обусловлены непрерывным
током крови через патологическое сообщение между областью высокого
и низкого давления. Самой частой причиной возникновения этих шумов
является открытый артериальный проток, который вызывает образова-
ние такого “машинного” шума до тех пор, пока давление в легочной
артерии остается значительно ниже, чем в аорте. Его громкость возраста-
ет при повышении системного АД и уменьшается при вдыхании амил-
нитрита. С развитием высокой легочной гипертензии диастолическая часть
шума исчезает. Значительно реже систоло-диастоличоский шум встреча-
ется при врожденных или приобретенных артериовенозных фистулах в
большом круге кровообращения или в коронарных сосудах с впадением
коронарной артерии в правые отделы сердца, при разрыве аневризмы
синуса Вальсальвы с образованием сообщения между аортой и правыми
отделами сердца, при стенозе артерий большого, реже малого, круга кро-
вообращения при сохранении значительного градиента давления по обе
стороны сужения как в период систолы, так и во время диастолы. Сосу-
дистый систоло-диастолический шум может быть также “невинным” и
выслушиваться над шейными венами в медиальной части надключичной
ямки справа. Этот так называемый шум волчка, который часто встречает-
ся в детском и юношеском возрасте, более громкий в положении стоя,
чем лежа, и в период диастолы, чем во время систолы. Будучи внесердеч-
ным шумом, он иногда проводится до второго межреберья справа и сле-
ва от грудины, что может приводить к установлению ошибочного диаг-
ноза открытого артериального протока.
Звуки внесердечного происхождения. Кроме сердечных тонов и шумов в
прекардиальной области могут выслушиваться и звуки внесердечного
происхождения: 1) систолические щелчки; 2) сосудистый шум, образую-
щийся над сонными артериями; 3) венозный сосудистый шум волчка;
4) шум трения перикарда. Первые три феномена описаны выше.
Шум трения перикарда может состоять из разного количества
компонентов: трех (пресистолического, систолического и протодиастоли-
ческого); двух (систолического и протодиастолического) и одного — систо-
лического. Он имеет характерный “царапающий” тембр, лучше выслуши-
вается в положении больного сидя с наклоном туловища кпереди и на
вдохе, усиливается при более плотном прижатии стетоскопа и не проводится.
Эти признаки позволяют отличить однотактный систолический шум тре-
ния перикарда от систолических шумов внутрисердечного происхождения.
90
ИЗМЕРЕНИЕ АРТЕРИАЛЬНОГО
И ВЕНОЗНОГО ДАВЛЕНИЯ
Измерение АД по методу Короткова. Определение АД непрямым спосо-
бом производят с помощью сфигмоманометра. Достаточная точность ре-
зультатов обеспечивается только при строгом соблюдении методики из-
мерения. Надувную манжету длиной 12,5 см накладывают на плечо сидя-
щего, желательно у стола, больного таким образом, чтобы она находи-
лась на уровне сердца. Манжета соединяется с ртутным манометром или
анероидом. Измерение рекомендуют выполнять не ранее чем через 30 мин
после курения или употребления кофе и нахождения в покое не менее
5 мин. Манжету надувают выше уровня систолического АД, что проверя-
ют по исчезновению пульса на лучевой артерии. При медленном, со ско-
ростью примерно 2-5 мм рт.ст. в 1 мин, выпускании из нее воздуха отме-
чают уровень давления, при котором на лучевой артерии начинает опре-
деляться пульс. Затем манжету вновь надувают выше этого уровня и изме-
рение производят с помощью аускультации над плечевой артерией. За
систолическое АД принимают уровень давления, при котором выс-
лушиваются первые звуки. По мере дальнейшего выпускания воздуха они
становятся вначале громче, затем постепенно глуше и наконец исчезают.
Давление, при котором звук пропадает (5-я фаза по Короткову), считают
диастолическим АД. Сопоставление с результатами прямого (инва-
зивного) измерения АД показывает достаточно хорошее совпадение, осо-
бенно у здоровых лиц. В отдельных случаях отмечаются значительные раз-
личия, особенно при нарушении методики сфигмоманометрии.
При первичном осмотре больного АД необходимо измерять на обеих
руках, а при последующих — только на правой руке, кроме редких случа-
ев значительного ослабления на ней пульса. При возможной артериаль-
ной гипертензии или гипотензии АД и частоту пульса определяют в по-
ложении больного лежа и стоя.
Значительная погрешность при измерении АД возникает в следующих
случаях.
1. При несоответствии длины манжеты окружности плеча. При его значи-
тельной толщине стандартная манжета не обеспечивает адекватную переда-
чу создаваемого давления на плечевую артерию.
В таких случаях требуется манжета больших размеров, которую обычно
используют для измерения АД на ногах. Оптимальная ширина манжеты -
примерно половина окружности плеча.
2. При недостаточности аортального клапана. Диастолическое АД, из-
меренное по Короткову, значительно ниже истинного.
3. При шоке. Вследствие централизации кровотока давление, измеряе-
мое на периферических артериях, значительно ниже, чем в аорте и ее
крупных ветвях.
4. При “аускультативном провале” у отдельных больных с артериаль-
ной гипертензией, атеросклерозом периферических артерий и стенозом
91
устья аорты. Отсутствие слышимых сосудистых тонов при наличии пуль-
сации может приводить к получению заниженных результатов измерения
систолического АД. По этой причине необходим контроль с помощью
пальпации лучевой артерии.
Непрямое измерение ЦВД. Уровень ЦВД позволяет косвенно судить об
объеме внутрисосудистой жидкости, насосной функции правого желу-
дочка и наличии препятствия к его наполнению. На ЦВД оказывают влия-
ние также положение тела, давление в плевральной полости и тонус вен.
Основной причиной его снижения является гиповолемия. Необходимо
учитывать, однако, что за счет спазма вен ЦВД какое-то время может
практически не изменяться, несмотря на значительное уменьшение объема
внутрисосудистой жидкости. ЦВД повышается при: 1) правожелудочко-
вой недостаточности; 2) наличии препятствия на путях притока к право-
му желудочку, например, жидкости в перикарде; 3) повышении давле-
ния в плевральной полости из-за выпота, препятствия в дыхательных
путях; кашле; 4) сужении вен с помощью вазоактивных препаратов.
ЦВД измеряют в верхней полой вене с помощью катетера, введенного
через подключичную или внутреннюю яремную вену путем пункции или
после венесекции одной из периферических вен. В правильности положения
конца катетера убеждаются с помощью рентгенологического контроля
или по синхронным с дыханием колебаниям столбика жидкости в трубке
подсоединенного к ному манометра. Измеряют давление с помощью жид-
костного манометра, например, аппарата Вальдмана, или электромано-
метра. Прозрачную градуированную трубку жидкостного манометра через
Т-образный переходник присоединяют к венозному катетеру и системе
для внутривенных вливаний. После ее заполнения переливаемым раство-
ром переходник открывают со стороны катетера, и столбик жидкости
понижается до уровня, соответствующего венозному давлению. Нулевой
точкой в системе отсчета принято считать уровень правого предсердия. В
горизонтальном положении больного она находится на уровне 2/5 сагит-
тального размера грудной клетки от грудины, или примерно на 5 см ниже
тела грудины, то есть по средней подмышечной линии. Правильное опре-
деление нулевой точки отсчета чрезвычайно важно для сопоставления
результатов измерений. У здоровых лиц ЦВД составляет 60—90 см вод.ст.
ВНЕСЕРДЕЧНЫЕ ПРИЗНАКИ БОЛЕЗНЕЙ СЕРДЦА
Глаза. Нарушение зрачкового рефлекса с утратой реакции на свет при
сохраненной аккомодации (зрачок Аргайлла-Робертсона) указывает на
сифилис как возможную причину поражения сердечно-сосудистой сис-
темы. Осмотр глазного дна позволяет выявить изменения артериол и
диска зрительного нерва, характерные для артериальной гипертензии и
артериолосклероза. Кровоизлияния и эмболия сосудов сетчатки могут от-
мечаться также при инфекционном эндокардите.
92
Щитовидная железа. Физическое обследование должно обязательно
включать осмотр и осторожную пальпацию щитовидной железы для вы-
явления ее увеличения. Возможность “тиреотоксического сердца” необ-
ходимо иметь в виду при некоронарогенном поражении миокарда, про-
текающем с сердечной недостаточностью, мерцательной аритмией, а
также систолической артериальной гипертензией.
Легкие. При физическом обследовании легких у пациента с болезнью
сердца можно обнаружить влажные хрипы и выпот в плевральную по-
лость (гидроторакс). Крепитация и мелкопузырчатые хрипы над основа-
ниями легких, особенно по задней поверхности, изменяющиеся при пе-
ремене положения тела, указывают на повышенное давление в легочных
венах. Эти признаки непостоянны и достаточно часто отсутствуют. Запол-
нение жидкостью альвеол и бронхиол при развитии альвеолярного отека
легких сопровождается появлением рассеянных звучных разнокалибер-
ных влажных хрипов.
Гидроторакс вследствие сердечной недостаточности чаще бывает дву-
сторонним или образуется с той стороны, на которой больной обычно
лежит. Односторонний выпот или шум трения плевры может быть прояв-
лением инфаркта легкого.
Органы брюшной полости. При их обследовании обращают внимание
на увеличение и болезненность при пальпации печени — важный и по-
стоянный признак системного венозного застоя. У ряда больных отмеча-
ются также отеки нижних конечностей, асцит, реже увеличение селезен-
ки. Определяемая визуально и пальпаторно пульсация печени указывает
на выраженную недостаточность трехстворчатого клапана. Большой асцит
при минимальных периферических отеках характерен для констриктив-
ного перикардита, но может наблюдаться и при длительном применении
мочегонных средств. Увеличение селезенки, не сопровождающееся асци-
том, характерно для инфекционного эндокардита.
ГЛАВА 5.
ИНСТРУМЕНТАЛЬНЫЕ МЕТОДЫ ДИАГНОСТИКИ
Основной задачей инструментальных методов исследования в кардио-
логии является получение точной информации о структуре и функции
сердечно-сосудистой системы. Многие методы, например, эхокардиогра-
фия, позволяют получать и ту, и другую информацию одновременно. В
целом определение характера структурных изменений имеет значение пре-
имущественно для постановки точного диагноза, а данные клинико-фи-
зиологических исследований - для оценки функционального состояния
и выраженности его нарушений.
93
Методы инструментального обследования больного о заболеванием си-
стемы кровообращения можно сгруппировать следующим образом:
1) простые базовые: а) электрокардиография; б) рентгенологическое
исследование;
2) специальные неинвазивные: а) эхокардиография; б) фонокардио-
графия и методы механокардиографии (имеют второстепенное значение);
в) радионуклидные — радионуклидная вентрикулография и сцинтигра-
фия миокарда; г) новые сложные неинвазивные методы визуализации
сердца - компьютерная томография, ядерно-магнитный резонанс и др.;
3) специальные инвазивные - катетеризация сердца и ангиокардио-
графия.
Рутинное клиническое обследование любого кардиологического боль-
ного не может быть полным без регистрации ЭКГ в 12 стандартных отве-
дениях и рентгенологического исследования сердца, магистральных со-
судов и легких. В последние годы в категорию базовых обязательных мето-
дов начинает входить и эхокардиография.
Она позволяет быстро и легко получить неоценимые сведения о струк-
туре и функции сердца, значительно более полные и точные, чем при
рентгенографии грудной клетки. Основное ограничение применения этого
метода связано с том, что, в отличие от регистрации и интерпретации
ЭКГ и данных рентгеновского исследования, он требует от исследователя
более глубокой специальной подготовки и опыта. Независимо от уровня
квалификации УЗИ-специалиста наибольшая диагностическая ценность
эхокардиографии достигается при анализе получаемой информации в со-
вокупности с данными клиники.
Будучи неоценимым инструментом для обучения аускультации, фоно-
кардиография не имеет существенного самостоятельного диагностического
значения. Второстепенная роль принадлежит и методам механокардиогра-
фии — сфигмо-, флебо-, рео- и апекскардиографии. По своей диагностичес-
кой ценности они намного уступают эхокардиографии и в настоящее
время практически вытеснены ею.
Радионуклидные методы высокоинформативны, но имеют относительно
узкую область применения и дорогостоящи. Поэтому они не пригодны для
скрининга и их используют по показаниям в неясных случаях после об-
следования с применением более доступных методов.
Место новых неинвазивных методов визуализации сердца — киноком-
пьютерной томографии, ядерно-магнитного резонанса и других в систе-
ме обследования кардиологических больных пока окончательно не опре-
делено. Они проходят широкую клиническую апробацию, которая в бли-
жайшем будущем позволит уточнить их клиническую ценность, преиму-
щества по сравнению с существующими методами и показания к приме-
нению, оправдывающие высокие затраты.
Специальные инвазивные методы применяют у госпитализированных
больных после адекватного предварительного неинвазивного обследования.
Несмотря на определенный риск для больного, во многих случаях они явля-
94
ются единственно возможным путем получения информации, необходи-
мой для установления диагноза или в спорных ситуациях дополнитель-
ным средством для его подтверждения. Максимально возможная точность
диагностики в первую очередь требуется при определении показаний к
хирургическому вмешательству.
При решении вопроса о назначении того или иного специального об-
следования в каждом случае врач должен иметь четкое представление по
нескольким позициям:
1) что именно позволяет определить данный метод?
2) какова его точность?
3) каковы показатели у здоровых лиц и их “разброс”?
4) какова вероятность получения неверного результата?
5) какова цель его применения у данного больного?
6) изменит ли полученный результат диагноз, лечение или оценку
прогноза?
Необходимо учитывать также степень риска или дискомфорта при дан-
ном обследовании и стоимость его.
Точность метода диагностики в случаях его положительного результата
оценивается показателем чувствительности , который характеризует
вероятность выявления данного заболевания у больных с его наличием, то
есть:
количество истинно положительных результатов „
количество истинно положительных + количество '°
ложноотрицательных результатов
Значимость отрицательного результата исследования характеризует по-
казатель специфичности, который оценивает его надежность в от-
ношении исключения искомого заболевания. Специфичность представ-
ляет собой:
количество истинно отрицательных результатов ..
количество истинно отрицательных + количество * '°
ложноположительных результатов
Понятие “ложноположительные” и “ложноотрицательные” результа-
ты подразумевает сопоставление с “золотым стандартом” — методом ди-
агностики, который является своего рода “истиной в последней инстан-
ции”. Безусловно, это уязвимый момент, поскольку развитие науки и
появление новых технологий постоянно приводит к появлению все более
совершенных эталонных методов, да и грань между “здоровьем” и болез-
нью, особенно в ее начальных стадиях, достаточно условна. На степень
надежности полученного результата влияет также распространенность дан-
ного заболевания или состояния среди группы лиц соответствующего воз-
раста, пола и др. Ценным доказательством в пользу или против возмож-
ного заболевания является совпадение положительных или отрицатель-
ных результатов нескольких методов диагностики, основывающихся на
различных подходах к ней.
95
ЭЛЕКТРОКАРДИОГРАФИЯ
ЭКГ представляет собой графическую регистрацию электрической ак-
тивности сердца путем измерения разности электрических потенциалов
между двумя электродами на поверхности тела.
Клиническое значение электрокардиографии. Как метод регистрации элек-
трической активности сердца электрокардиография позволяет оценить
место образования каждого импульса возбуждения и характер его рас-
пространения в сердце. На этом базируется ее диагностическое зна-
чение, которое состоит в определении:
1) анатомического положения сердца:
2) увеличения его отдельных камер за счет гипертрофии миокарда;
3) нарушений сердечного ритма и проводимости;
4) ишемии и инфаркта миокарда, в том числе локализации, распро-
страненности, глубины и в ряде случаев давности;
5) некоторых нарушений электролитного обмена;
6) некоторых токсических эффектов лекарственных препаратов (в част-
ности, сердечных гликозидов).
К общим ограничениям метода относятся:
1) определенный субъективизм в интерпретации данных вследствие не-
специфичности многих изменений и недостаточной четкости критериев
их интерпретации;
2) выраженность изменений на ЭКГ не является достаточно надеж-
ным критерием глубины поражения сердца. Например, экстрасистолия
или неполная блокада правой ножки пучка Гиса улиц молодого возраста
без клинических проявлений и каких-либо других признаков патологии
сердца практически не имеет клинического значения. С другой стороны,
ЭКГ может быть совершенно не изменена у больных с серьезным заболе-
ванием сердца;
3) электрокардиография — метод регистрации проекции электриче-
ской активности сердца на поверхность тела. Вследствие этого у ряда боль-
ных даже значительное очаговое повреждение миокарда может не отра-
жаться на ЭКГ и, наоборот, небольшие фокусы иногда дают картину
обширного поражения;
4) электрокардиография не позволяет оценить дилатацию полостей и
состояние сократительной способности миокарда;
5) метод в большинстве случаев не дает возможности отличить обра-
тимые изменения в миокарде, например, обусловленные гипоксией или
действием лекарственного препарата, от органических, а также опреде-
лить этиологию поражения сердца.
В целом электрокардиография, как и другие методы исследования, об-
ладает наибольшей информативностью при сопоставлении полученных
данных с клиническими, а также результатами других дополнительных
методов. Это достигается только тогда, когда ее интерпретацию проводит
врач, который перед этим лично осмотрел больного.
96
Рис. 23. Зубцы и интервалы ЭКГ
R
Q RS
(P-Q)
В клинике ЭКГ регистрируется
на специальной миллиметровой
бумаге, что позволяет измерять
временные интервалы и амплиту-
ду (вольтаж) зубцов. При скорос-
ти движения бумаги 50 мм/с 1 мм
по горизонтали равен 0,02 с и 5 мм
равны 0,1 с, а при скорости дви-
жения бумаги 25 мм/с 1 мм по горизонтали равен 0,04 с и 5 мм равны
0,2 с, 1 мм по вертикали равен 0,1 мВ при стандартной калибровке электри-
ческого сигнала (10 мм равны 1 мВ).
Кривая ЭКГ состоит из трех основных отклонений, которые Эйнтховен
произвольно, не зная их генеза, обозначил последовательными буквами
алфавита. К ним относятся: 1) зубец Р; 2) комплекс QRS в составе зубцов
Q, R и S и 3) зубец Т (рис. 23). Для характеристики амплитуды зубцов желу-
дочкового комплекса друг относительно друга используют строчные (q, г,
s) и прописные (Q, R, S) буквы.
ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ ОСНОВЫ ЭКГ
Образование зубцов на ЭКГ согласно теории сердечного диполя мож-
но с достаточной степенью условности представить следующим образом.
В покое мышечное волокно находится в состоянии поляризации: на
внутренней поверхности клеточной мембраны имеется отрицательный
заряд, а на наружной — положительный (рис. 24,Л). При этом на поверх-
ности волокна разность потенциалов отсутствует, и электрод, располага-
ющийся со стороны его эпикардиального “торца” и соединенный с по-
ложительным полюсом гальванометра, регистрирует прямую, так назы-
ваемую изоэлектрическую, линию (изолинию).
При раздражении мембраны происходит возбуждение клетки — ее де-
поляризация, обусловленная быстрым током Na+ внутрь клетки. В резуль-
тате на внутренней поверхности клеточной мембраны в очаге возбужде-
ния возникает положительный заряд, а на наружной — отрицательный.
Между соседними положительными и отрицательными участками поверх-
ности клеточной мембраны возникает разность потенциалов. Таким обра-
зом, мышечное волокно превращается в элементарный диполь с поло-
жительным полюсом, обращенным к положительному электроду. При пе-
ремещении положительных зарядов к положительному электроду вслед-
ствие распространения процесса деполяризации в направлении от эндо-
карда к эпикарду гальванометр регистрирует отклонение сигнала кверху
от изолинии. Это отклонение дает начало направленному кверху, то есть
положительному, зубцу ЭКГ (рис. 24,Б). Так как сила заряда обратно
97
Рис. 24. Схема образования зубцов ЭКГ согласно теории сердечного диполя. Объяснение в тексте
98
1
z
3
Низ
Рис. 25. Системы отведений ЭКГ: А - стандарт-
ные отведения от конечностей (I, II, III) с обо-
значением расположения регистрирующих элек-
тродов (/), равнобедренного треугольника Эйнт-
ховена (2) и осей отведений с указанием поляр-
ности (.?); Б - усиленные однополюсные отве-
дения от конечностей (aVR, aVL, aVF) с обо-
значением расположения электродов (/) и осей
отведений с указанием полярности (2); В - од-
нополюсные грудные отведения (И,^) с обозна-
чением положений грудного электрода на груд-
ной стенке (/) и схемы их регистрации (2), а
также положения осей этих отведений (5); Г -
шестиосевая система осей отведений ЭКГ во
фронтальной плоскости. ПР — правая рука, ЛР —
левая рука, ПН - правая нога, ЛН - левая нога,
Г ~ грудной электрод. Сплошной линией обо-
значена положительная часть оси отведения,
пунктирной - отрицательная
99
пропорциональна квадрату расстояния, при приближении положитель-
ного заряда к электроду амплитуда положительного отклонения (зубца)
резко возрастает (рис.24,В,Г). Когда процесс деполяризации охватывает
все мышечное волокно, разность потенциалов на поверхности клеточ-
ной мембраны становится равной 0, ток исчезает, и положительное от-
клонение возвращается к изолинии (рис. 24,Д). Таким образом, на ЭКГ
образуется зубец R. Изолиния регистрируется на протяжении всего вре-
мени, пока состояние деполяризации клетки сохраняется (рис. 24, Е).
В отличие от поперечно-полосатой мускулатуры, в миокарде процесс
реполяризации начинается с того участка, где закончился процесс депо-
ляризации, то есть со стороны эпикарда, и постепенно распространяется
по направлению к эндокарду. Поскольку в результате реполяризации об-
ращенный к эпикарду участок поверхности клеточной мембраны приоб-
ретает положительный заряд, образующийся диполь не меняет своей ори-
ентации (рис.24,Ж). Таким образом, на положительный электрод дей-
ствует положительный заряд, который находится в максимальной близо-
сти к нему, в связи с чем гальванометр регистрирует резкое отклонение
кривой кверху от изолинии - образуется положительный зубец, так назы-
ваемый зубец Т. Поскольку при реполяризации возникает меньшая элек-
тродвижущая сила, чем при деполяризации, амплитуда зубца Т меньше,
чем зубца R. По мере распространения реполяризации вдоль мышечного
волокна расстояние от положительного заряда до электрода увеличивается,
и величина отклонения кверху регистрируемой кривой постепенно умень-
шается (рис. 24,3,И). Наконец, процесс реполяризации заканчивается,
разность потенциалов на поверхности клеточной мембраны становится
равной 0, и кривая возвращается к изолинии (рис.24, К). Так как реполя-
ризация длится дольше, чем деполяризация, зубец Т шире, чем зубец R.
Каждое возбужденное мышечное волокно можно представить как эле-
ментарный диполь, вызывающий возникновение элементарной электродви-
жущей силы. При суммировании векторов возбуждения всех этих диполей в
каждый данный момент времени можно подучить суммарный вектор элект-
родвижущей силы сердца. Он меняет свое направление и величину на протя-
жении чередующихся фаз деполяризации и реполяризации, составляющих
сердечный цикл, и распространяется на поверхность тела, где может быть
зарегистрирован в виде ЭКГ.
Отведения ЭКГ. Стандартная ЭКГ состоит из 12 отведений: 1) 3 стан-
дартных от конечностей (двуполюсных); 2) 3 усиленных однополюсных
от конечностей и 3) 6 однополюсных грудных. Каждое отведение предус-
матривает непрерывную запись изменений электрического потенциала
сердца на протяжении сердечного цикла между двумя электродами или
между одним электродом и объединенными в один несколькими элект-
родами. Во всех отведениях один электрод (на правой нижней конечно-
сти) является неактивным и обеспечивает заземление.
1. Стандартные отведения I, II и III, предложенные Эйнтховеном,
являются двухполюсными и регистрируют изменения электрического
100
Рис. 26. Последовательные изменения
направления и величины вектора де-
поляризации желудочков во фронталь-
ной плоскости (А, Б) и его проекции
на ось J стандартного отведения (В) с
образованием комплекса QRS (Г);
Д - суммарный вектор деполяризации
желудочков
потенциала во фронтальной пло-
скости. Применение системы
стандартных отведений основы-
вается на допущении, что серд-
це является точечным источни-
ком электрического тока, кото-
рый находится в центре равностороннего треугольника (т.н. треугольника
Эйнтховена), образованного правой и левой верхними и левой нижней
конечностями.
В I отведении регистрируется разность потенциалов между правой верх-
ней конечностью, к которой присоединен отрицательный электрод, и левой
верхней конечностью, на которой находится положительный электрод (ри-
с.25, А); II отведение условно образовано правой верхней (отрицательный
электрод) и левой нижней (положительный) конечностями, а III отведение
— левой верхней (отрицательный электрод) и левой нижней (положитель-
ный) конечностями. Положение положительных и отрицательных электро-
дов во всех трех отведениях было выбрано произвольно таким образом, что-
бы основные зубцы ЭКГ, отражающие деполяризацию и реполяризацию же-
лудочков и предсердий, у большинства людей были представлены поло-
жительными отклонениями.
При соединении положительного и отрицательного полюсов отведения
ЭКГ получают его гипотетическую ось. Перпендикуляры, опущенные из
центра треугольника Эйнтховена, то есть из электрического центра серд-
ца, делят ось каждого отведения на положительную и отрицательную
части (см. рис. 25,Л). Если оси 3 стандартных отведений спроецировать на
центр, образуется трехосевая система отведений, указывающая на по-
ложение в пространстве осей этих отведений с положительной и отрица-
тельной полярностью (см.рис.25,Л).
Если регистрируемый на поверхности тела мгновенный вектор электро-
движущей силы сердца проецируется на положительную часть оси данно-
го отведения, то в этом отведении регистрируется положительное откло-
нение, или зубец (применительно к деполяризации желудочков — зубец
R), если на отрицательную часть оси - то отрицательный зубец (Q). При
этом амплитуда каждого из образующихся зубцов будет тем больше, чем
больше величина их проекции. Эти положения справедливы и для среднего
вектора электродвижущей силы сердца в течение деполяризации (см. ниже).
На рис. 26, Л и £ представлены последовательные изменения направ-
101
Рис. 27. Образование зубцов нормальной ЭКГ в шестиосевой системе координат
при промежуточном (А), горизонтальном (Б) и вертикальном (В) положениях
среднего вектора комплекса QRS и зубца Т
ления и величины вектора электродвижущей силы миокарда желудочков
сердца в процессе деполяризации в пространстве (во фронтальной плос-
кости) и во времени. Проекции этих мгновенных векторов на ось I стан-
дартного отведения изображены на рис. 26, В. Исходя из их полярности и
величины, в I отведении комплекс QRS имеет вид qR (рис. 26,Г). Как
видно из этого рисунка, средний вектор электродвижущей силы желу-
дочков за период деполяризации во фронтальной плоскости у большин-
ства здоровых лиц направлен влево и книзу (рис. 26,Д).
2. Усиленные однополюсные отведения от конечностей aVR, aVL и aVF,
как и стандартные, регистрируют изменения электрического потенциала
во фронтальной плоскости. Запись производится с помощью двух элект-
родов (см.рис.25, Б). Активным электродом, соединенным с положитель-
ным полюсом гальванометра, попеременно служат электроды от правой
верхней (aVR), левой верхней (aVL) и левой нижней (aVF) конечностей.
102
Рис. 28. Расположение точек регистрации
грудных отведений относительно камер сер-
дца: ЛЖ — левый желудочек; ПЖ — правый
желудочек
Индифферентный электрод образу-
ется при объединении электродов от
двух остальных конечностей и при-
соединяется к отрицательному полю-
су гальванометра. Оси этих отведений
образуются при соединении электри-
ческого центра сердца с соответству-
ющими электродами (см.рис.25,Л).
При наложении трехосевой сис-
темы усиленных однополюсных отведений от конечностей на трехосевую
систему Эйнтховена образуется шестиосевая система отведений Бейли
(см. рис. 25, Г). Она удобна для характеристики положения любого мгно-
венного или среднего вектора электродвижущей силы сердца во фрон-
тальной плоскости в градусах. У большинства здоровых лиц средний век-
тор электродвижущей силы желудочков за период деполяризации направ-
лен влево и вниз и проецируется на положительные части осей всех 6
отведений, кроме aVR (рис. 27). Как следствие, в этих отведениях доми-
нирующим зубцом желудочкового комплекса является положительный
зубец Л, а в aVR — отрицательный зубец S.
Рис. 29. Образование зубцов комплекса QRS в грудных отведениях V, (Л) и V6 (Б)
103
Рис. 30. Различные варианты графики комплекса QRS
в грудных отведениях в норме.
Объяснение в тексте
3. Однополюсные грудные отведения VH6 (отведения Вильсона, от V —
Voltage одной точки) регистрируют изменения суммарного вектора элек-
тродвижущей силы сердца в горизонтальной плоскости. Активный элект-
род, соединенный с положительным полюсом гальванометра, последо-
вательно устанавливают в 6 точках грудной клетки, преимущественно
слева: V( — в четвертом межреберье у правого края грудины, V2 — в чет-
вертом межреберье у левого края грудины, V3 — на середине расстояния
между V2 и V4, V4 - в пятом межреберье по левой среднеключичной
линии, V5 — в пятом межреберье или на одном горизонтальном уровне с
V4 по левой передней подмышечной линии, V6 — в шестом межреберье
(или на одном уровне с V4) по левой средней подмышечной линии (см.
рис. 25,В). Второй, индифферентный, электрод образуется путем соеди-
нения электродов от правой и левой верхних и левой нижней конечнос-
тей, благодаря чему он на протяжении всего сердечного цикла остается
практически неактивным, а активный электрод функционирует как од-
нополюсный. Расположение точек регистрации грудных отведений отно-
сительно полостей сердца представлено на рис. 28.
Как видно из рис. 15, В, оси грудных отведений находятся в одной
горизонтальной плоскости. Средний вектор электродвижущей силы же-
лудочков за период деполяризации в этой плоскости направлен влево и
кпереди. На рис. 29 представлены последовательные изменения мгновенно-
го вектора электродвижущей силы миокарда желудочков в процессе
деполяризации в этой плоскости в норме и их проекции на оси отведе-
ний V] (а) и V6 (б). Исходя из полярности и величины этих проекций,
104
Рис. 31. Схема регистрации двухполюс-
ных отведений по Небу и нормальная
графика ЭКГ в них
желудочковый комплекс в от-
ведении V! состоит из невысо-
кого начального положительно-
го зубца, за которым следует
глубокий отрицательный зубец.
В отведении V6 он представлен
тремя зубцами: начальным не-
глубоким отрицательным зубцом, высоким положительным и конечным
маленьким отрицательным зубцами. В целом от V, к V6 амплитуда началь-
ного положительного зубца (г или Л) прогрессивно увеличивается (рис.
ЗО,Л,/>; линия АВ), а отрицательного зубца (S или s) - уменьшается (ли-
ния JI). При этом начальная часть комплекса QRS в отведениях VH3 поло-
жительная, то есть представлена зубцом г, а в отведениях V4_6 - отрица-
тельная вследствие появления зубца q.
Достаточно часто, однако, встречаются варианты этой нормы
(рис. 30, Z»)- Так, высота зубца R в отведении V6 меньше, чем в отведении
V5 (линия CD), и в отведении V5 меньше, чем в отведении V4 (линия EF);
так что амплитуда R часто наибольшая в отведении V4 и постепенно умень-
шается к отведению V6. Амплитуда зубца 5 в отведении V2 может быть
больше, чем в отведении V, (линия GHI, рис. 30,Д).
Грудные отведения, в которых регистрируется комплекс rS, испыты-
вают влияние электрического поля преимущественно правого желудочка,
а отведения с графикой qR — левого (см. рис. 28). Переходная зона между
право- и левожелудочковыми отведениями в норме находится между от-
ведениями V2 и V4. При ее смещении говорят о повороте сердца по часо-
вой стрелке (при отклонении к левым грудным отведениям, например,
между отведениями V5 и V6) и против — при смещении в сторону правых
грудных отведений. Сами по себе эти повороты сердца являются вариан-
тами нормы.
Дополнительные отведения ЭКГ. В дополнение к общепринятым 12 от-
ведениям ино да используют специальные отведения:
А. Разновидности грудных отведений. 1.Отведения от правой по-
ловины грудной клетки . Точки расположения активных электро-
дов симметричны точкам обычных грудных отведений и имеют те же
обозначения, но с добавлением символа “Л” — например, V3R, V4R и др.
2. Задне-левые отведения V7_9. Регистрируются на уровне V6
по задней подмышечной линии (V7), лопаточной линии (V8) и левой
паравертебральной линии (V9).
3. “Высокие” грудные отведе н ия . Активный электрод рас-
полагается на 1 или 2 ребра выше обычных точек отведения (например,
V’,, V",).
105
Таблица 7. Основные характеристики нормальной ЭКГ
Элемент ЭКГ Происхождение Полярность Очертания Амплитуда, мм Продолжитель- ность, с
Зубец р Деполяри- зация предсердий Обычно (+), кроме отведе- ния aVR, в котором (-). Может быть также (-) или двухфазный в отведениях III, aVF. aVL, Ровный, закруглен! пай $2,5 £ 0,1
Сегмент Деполяриза- Изоэлектри- Горизонталь- Изоэлектри- 0,12-0,2 (от
(интервал) PQ ция предсер- дий и прове- дение импуль- са по системе Гиса-Пурки- нье к рабоче- му миокарду чен * ный чен начала Р до начала QRS)
Комплекс Деполяриза- В отведениях Зубцы ров- Q < 25 % R *0,1
QRS ция рабочего от конечное- ные, заост- Зубец R: в от- в том числе
миокарда желудочков тей зависит от электричес- кой оси серд- ца. Обычно (+) в отведе- ниях I, II и (—) в отведе- нии aVR. Преимуще- ственно (—) в отведениях Уц, двухфаз- ный в отведе- ниях VJ4 и (+) в отведе- ниях V56 ренные. До- пускается зазубренность в отведениях III, aVL, aVF, V, ведениях I, II, III - 5-16, aVL - 5-12, aVF-5-19; минимум в одном отве- дении должен быть >8; зубец Л в отведени- ях 27; зубец S' в отве- дениях V^sSO; зубец R в отве- дениях V5^ + S в отведе- ниях Vp $ 35 Q $ 0,03
Сегмент ST Желудочки продолжают находиться в состоянии де- поляризации Обычно изо- электричен; допускается смещение над и под изоли- нию до 1 мм; в отведениях Vj ? при нали- чии высокого зубца Т— подьем до 2 мм Обычно гори- зонтальный, но может быть косовос- ходящим в отведениях Vj 3 и других, где высокий зубец Т См.’’направ- ление”
106
продолжение табл. 7
Элемент ЭКГ Происхождение Полярность Очертания Амплитуда, мм Продолжительн- ость, с
Зубец Т Реполяриза- Обычно Ровный, В отведениях
ция желудоч- конкордантен закругленный, от конечно-
ков направлению но может быть стей — 1—5
САУ; у взрос- и заострен (обычно 1/5
лых обычно зубца Р), в
(+) во всех отведениях
отведениях, V,_6 2-8 мм,
кроме aVR. где от 1/8 до 2/3
(-); обяза- зубца R; мак-
тельно (+) в симальная
отведениях I, амплитуда в
II; допускает- отведениях
ся (-) или Vw
двуфазность в
отведениях III,
aVF, Vu, у
детей — и в
отведении V,
Интервал Электриче- 0,3-0,43 (от
Q-T ская систола начала комп-
желудочков лекса QRS до
конид зубца 7);
Зубец U Следовой Обычно(+) Ровный, Зависит от Варьирует, в
потенциал закругленный амплитуды среднем 0,2
потенциала зубца Г и
действия составляет
5-50 %
от нее
* Может быть слегка смещен под изолинию из-за потенциала, возникающего при репо-
ляризации предсердий.
Примечание. Изолиния - интервал между концом зубца Т и началом зубца Р следую-
щего сердечного цикла. (+) - положительная, (-) - отрицательная полярность.
Б. Двухполюсные отведения Неба. Оси трех отведений системы Неба об-
разуют на грудной клетке в области сердца так называемый маленький
сердечный треугольник. Ось заднего отведения (D — Dorsalis) с полярно-
стью I стандартного отведения образуется между электродом с правой
верхней конечности, который устанавливают во втором межреберье справа
у края грудины, и электродом с левой верхней конечности в проекции
верхушечного толчка на заднюю подмышечную линию слева. Ось пере-
днего отведения (А — Anterior) с полярностью II стандартного отведения
соединяет второе межреберье справа у грудины с точкой V4 (областью
верхушки сердца), в которой устанавливают электрод с левой нижней
конечности. Наконец, ось нижнего отведения Неба (I - Inferior) образу-
ется между электродом над верхушкой сердца и местом ее проекции по
107
Рис. 32. Последовательность и пределы изменений по направлению и величине мгновен-
ных векторов электродвижущей силы, которые образуются при деполяризации миокарда
предсердий (А), желудочков (/>) и реполяризации миокарда желудочков (В). Согласно
принятому допущению, все диполи, образующиеся при деполяризации миокарда, гене-
рируются в одной ее фиксированной точке Е
задней подмышечной линии, то есть имеет полярность III отведения
Эйнтховена (рис. 31). ЭКГ снимают в стандартных отведениях: D — как I,
А — как II и I — как III. Систему Неба широко используют при проведе-
нии проб с физической нагрузкой, а также при записи ЭКГ по радио
(телеэлектрокардиография).
В. Отведение Льюиса используют для усиления волн электрической
активности предсердий. Является биполярным отведением, в котором элек-
трод с правой верхней конечности помещают во второе межреберье у
правого края грудины, а электрод с левой верхней конечности — в
четвертое межреберье у ее правого края. Запись проводят по I стандартно-
му отведению.
Г. Однополюсные пищеводные отведения. Электрод вводят в пищевод
трансназально через дуоденальный зонд и соединяют с грудным элект-
родом или с положительным полюсом гальванометра. ЭКГ, зарегистри-
рованная на уровне 10-35 см дистальнее ноздрей, то есть на уровне пред-
сердий, лучше, чем стандартная ЭКГ, отражает их потенциалы. На уров-
не 35—50 см ЭКГ регистрирует потенциалы преимущественно от задней
поверхности левого желудочка.
Д. Отведения Слапака S,_4 являются биполярными. Электрод с левой
верхней конечности помещают в положение V7, а с правой — во второе
межреберье слева у края грудины (S,) и последовательно перемещают
его по этому межреберью латерально на 1—2 см, что соответствует диа-
метру присасывающегося электрода (S2_4). Запись производят по I стан-
дартному отведению.
ЭЛЕМЕНТЫ ЭКГ В НОРМЕ И ПРИ ПАТОЛОГИИ
Основные характеристики нормальной ЭКГ представлены в табл. 7.
Зубец Р отражает деполяризацию предсердий, причем его начальная
часть — правого, а конечная - левого предсердия. Как видно из последо-
108
вательности изменений мгновенных векторов электродвижущей силы, об-
разующихся при деполяризации миокарда предсердий импульсом из си-
нусового узла (рис. 32,Л), средний вектор зубца Р в норме направлен вле-
во, вниз и вперед. В 6-осевой системе координат Бейли во фронтальной
плоскости у большинства здоровых лиц его положение варьирует между
30 и 60°. Поэтому очевидно, что в норме при синусовом водителе ритма
зубец Р обычно положительный во всех стандартных и однополюсных
отведениях от конечностей, кроме aVR, в котором он отрицательный.
Амплитуда Р< 2,5 мм, продолжительность < 0,1 с (см. рис. 23).
Патологические изменения зубца Р включают:
I. Отсутствие зубца Р. Отмечается, когда водителем ритма пред-
сердий и желудочков является не синусовый узел, а другие структуры.
1. При правильном ритме желудочков (одинаковых интервалах R-R) в
зависимости от его частоты зубец Р может отсутствовать при ритме атрио-
вентрикулярного соединения или пароксизмальной тахикардии из атрио-
вентрикулярного соединения (см. ниже). В этих случаях предсердия воз-
буждаются ретроградно импульсом, образующимся в специализирован-
ных клетках водителя ритма II порядка, который одновременно распро-
страняется и на желудочки по системе Гиса-Пуркинье. При неизменен-
ной скорости распространения ретроградной волны возбуждения депо-
ляризация рабочего миокарда предсердий и желудочков происходит од-
новременно, и зубец Р, накладываясь на более высокоамплитудный ком-
плекс QRS, не дифференцируются.
2. При неправильном ритме желудочков отсутствие зубца Р отмечается
при: а) экстрасистолии из атриовентрикулярного соединения (см. ниже);
б) мерцании и трепетании предсердий. При этом вместо зубцов Р регист-
рируются мелкие частые волны мерцания или более высокие и ред-
кие волны трепетания “F’ (см. ниже).
II. Изменения нормального направления (полярно-
сти) зубцов Р. Как и их отсутствие, отмечаются при несинусовом
водителе ритма сердца.
1. Отрицательный зубец Р во всех отведениях, который предшествует
комплексу QRS, характерен для ритма атриовентрикулярного соедине-
ния, а также пароксизмальной узловой (атриовентрикулярной) тахикар-
дии и экстрасистолии при наличии ускоренного ретроградного проведе-
ния импульса от атриовентрикулярного узла по предсердиям. Вследствие
этого их деполяризация наступает раньше, чем желудочков, имеющих
большую площадь. Образование отрицательных зубцов Р обусловлено ори-
ентацией вектора возбуждения предсердий в направлений, прямо проти-
воположном нормальному. При замедлении ретроградной проводимости
отрицательный зубец Р регистрируется сразу же за комплексом QRS, на-
кладываясь на сегмент ST.
2. Изменение нормальной полярности зубца Р, предшествующего ком-
плексу QRS в ряде отведений. Характерно для эктопических предсердных
ритмов. Его самым распространенным вариантом с наиболее четкими
электрокардиографическими признаками является так называемый ритм
109
Отведение V,
п
/1
Рис. 33. Характерная форма зубцов Р в от-
ведениях II и V, при увеличении правого
(П) и левого (Л) предсердий
Отведение И
коронарного синуса.Это
нижний правопредсердный ритм,
при котором водитель находится в
клетках миокарда нижней части пра-
вого предсердия вблизи коронарного синуса. Образование отрицательных
зубцов Рв отведениях II, III и aVF при обязательном положительном зуб-
це Р в отведении aVR обусловлено изменением нормальной ориентации
вектора деполяризации предсердий, вследствие чего большая часть миокарда
возбуждается ретроградным путем. Изредка можно встретить лево-
предсердный ритм, отличительным признаком которого является
характерное изменение зубца Р в отведениях V, 2. Закругление его начальной
части, отражающей возбуждение левого предсердия, и заострение конеч-
ной (возбуждение правого предсердия) придают зубцу Рвид “щита и меча”.
3. “Нестабильность” полярности, а также формы зубца Рс изменени-
ем от одного сердечного цикла к другому в одном и том же отведении от
нормальной, положительной, до двухфазной (Н—) и отрицательной, ха-
рактерно для м и г р а ц и и водителя ритма по предсердиям вслед-
ствие синдрома слабости синусового узла. При этом может немного коле-
баться также величина интервала Р— Q.
III. Изменение амплитуды и (или) продолжительности зубца Рхарак-
терно для ги п е ртроф и и или перегрузки предсердий.
1. Высокие (> Змм) зубцы Р, наиболее выраженные в отведениях
II, III, aVF и V, (рис. 33), при их неизмененной продолжительности
свидетельствуют об увеличении правого предсердия и называются “Р-
pulmonal е”. При этом в отведении V( они могут быть двухфазными с
более выраженной начальной положительной фазой. Во II отведении зубцы
Р остроконечные, по форме напоминают равнобедренный треугольник.
2. Невысокие, уширенные (> 0,1 с) и двугорбые зубцы Р в отведениях
I, aVL и V4_6, двухфазные в отведении V, с широкой и глубокой конечной
отрицательной фазой (см. рис. 33) свидетельствуют об увеличении левого
предсердия и называются “ Р - m i t г а 1 е ”. Эти изменения, однако, неспеци-
фичны и отмечаются также при нарушениях межпредсердной проводимости.
Интервал Р— Q, или P—R, измеряется от начала зубца Р до начала
комплекса QRS (см. рис. 23). Хотя в течение этого интервала импульс от
минусового узла распространяется по всей специализированной проводя-
щей системе сердца, достигая рабочего миокарда желудочков, большая
засть времени тратится на проведение через атриовентрикулярный узел в
зоне N. Вследствие этого принято считать, что величина интервала Р— Q
отражает величину задержки проведения импульса в атриовентрикуляр-
том узле, то есть атриовентрикулярную проводимость. В норме составляет
эт 0,12 до 0,2 сив определенной степени зависит от ЧСС.
ПО
Рис. 34. Комплекс QRS в норме (Л)
и при различной патологии: Б -
синдром Вольфа-Паркинсона-
Уайта. 1 ->2 - дельта-волна вслед-
ствие изменения начальной части
процесса деполяризации желудоч-
ков; В — блокада правой ножки
пучка Гиса. 1->2 — нарушение ко-
нечной части деполяризации; Г —
блокада левой ножки пучка Гиса.
1—>2 — нарушение средней и 2->3
— конечной части деполяризации;
Д — гипертрофия левого желудоч-
ка. 1->2 - небольшое равномерное
замедление деполяризации; £- ги-
перкалиемия. 1—>2 — значительное
равномерное замедление деполя-
ризации; Ж — крупноочаговый
инфаркт миокарда. 1—>2 - патоло-
гический зубец Q
Патологические изменения интервала P—Q включают:
1)удлинение более 0,2 с. Характерно для нарушений атриовентри-
кулярной проводимости — атриовентрикулярных блокад (см. ниже).
2) укорочение менее 0,12 с. Свидетельствует о проведении пред-
сердного импульса к желудочкам в обход атриовентрикулярного узла че-
рез добавочный проводящий предсердно-желудочковый путь — пучок Кен-
та, Джемса или Махейма, что характерно для синдрома преждевремен-
ного возбуждения желудочков.
Комплекс QRS отражает последовательность и продолжительность де-
поляризации рабочего миокарда желудочков. Преимущественное направ-
ление (полярность) его зубцов в стандартных и однополюсных отведени-
ях от конечностей в норме зависит от положения электрической оси сер-
дца (см. ниже). В большинстве случаев оно положительное в отведениях I
и II и отрицательное — в отведении aVR. В грудных отведениях нормаль-
ная графика комплекса QRS (см. рис. 29) более стабильна. Нормальные
величины амплитуды и продолжительности зубцов представлены в табл. 7.
Патологические изменения комплекса QRS обусловлены диффузным или мест-
ным нарушением процесса деполяризации желудочков и включают (рис. 34):
I. Изменения последовательности и формы зубцов.
Связаны с нарушением последовательности распространения волны воз-
буждения и часто сопровождаются изменением амплитуды и увеличени-
ем продолжительности зубцов. Отмечаются при:
а) синдроме преждевременного возбуждения желудочков, для кото-
рого характерны изменения преимущественно начальной части процесса
деполяризации с появлением дельта-волны;
б) нарушениях проведения по ножкам пучка Гиса, то есть внутри-
111
Рис. 35. Изменения сегмента ST и зубца Т в норме и при различной патологии: А —
синдром ранней реполяризации желудочков. Стрелкой обозначен подъем кверху точки J.
Вариант нормы; Б - косовосходящая депрессия сегмента ST (обозначена стрелками)
при тахикардии. Вариант нормы; В - острое нарушение коронарного кровообращения
при стенокардии Принцметала и в начале развития инфаркта миокарда: 1 — подъем сег-
мента ST, 2 — высокий остроконечный зубец Т, который круто поднимается кверху от
(/); Г ~ крупноочаговый инфаркт миокарда, острая стадия: 1 - патологический зубец Q;
2 — подъем сегмента ST, переходящий в положительный зубец Т; Д — крупноочаговый
трансмуральный инфаркт миокарда, переход в подострую стадию: 1 — патологический
зубец QS; 2 — подъем сегмента ST; 3 - инверсия конечной части зубца Т. Такая графика
отмечается также при аневризме сердца; Е - острый перикардит. Стрелкой обозначен
подъем сегмента ST дугой книзу; Ж, 3 - стенокардия. Стрелками обозначена горизон-
тальная или косонисходящая депрессия сегмента ST, которая часто отмечается при боли
и физической нагрузке; И — влияние сердечных гликозидов: 1 - корытообразное смеще-
ние под изолинию сегмента ST с переходом в положительный зубец Т (2); К, Л, М —
неспецифические изменения сегмента ST и зубца Т при хронических формах ИБС и
других заболеваниях сердца; Н — перегрузка левого желудочка. Вторичные изменения
сегмента ST и зубца Т: 1 — косонисходящая депрессия сегмента ST; 2 — отрицательный
асимметричный зубец Т; О - нарушение внутрижелудочковой проводимости. Вторичные
112
желудочковых блокадах. При этом наблюдаются изменения преимуще-
ственно средней и конечной частей периода деполяризации;
в) возбуждении желудочков импульсом, возникшим в миокарде одного
из желудочков при экстрасистолии и желудочковой тахикардии;
г) гипертрофии или перегрузке желудочков;
д) локальных крупноочаговых изменениях в миокарде вследствие ост-
рого или перенесенного инфаркта.
П.Изменения амплитуды з у б ц о в комплекса QRS.
1. Увеличение амплитуды зубца Q более 25 % высоты зубца R, которое
часто сопровождается увеличением его продолжительности, отмечается при:
а) крупноочаговых изменениях в миокарде при остром или “старом”
инфаркте миокарда. При этом всегда Q равно или больше 0,04 с;
б) гипертрофии или перегрузке левого и правого желудочков;
в) блокаде левой ножки пучка Гиса.
2. Увеличение амплитуды зубцов R и (или) S, которое часто сопро-
вождается увеличением их продолжительности и расширением комплек-
са QRS, отмечается при:
а) гипертрофии или перегрузке желудочков;
б) блокаде ножек пучка Гиса.
3. Уменьшение амплитуды зубцов комплекса QRS неспецифично и может
наблюдаться, в частности, при так называемых диффузных изменениях ми-
окарда, обусловленных его поражением при множестве заболеваний, а так-
же экссудативном и констриктивном перикардите. Уменьшение амплитуды
зубца R в отдельных отведениях, в совокупности с другими электрокарди-
ографическими изменениями, может иметь место при инфаркте миокарда.
III. Увеличение продолжительности комплекса QRS.
1) увеличение зубца Q отмечается при крупноочаговых изменениях в
миокарде,
2) значительное (> 0,12 с) увеличение продолжительности комплекса
QRS в целом наряду с другими изменениями ЭКГ отмечается при: пол-
ной блокаде ножек пучка Гиса; желудочковой экстрасистолии и тахикар-
дии; гиперкалиемии.
Сегмент ST (см. табл. 7), отражающий сохранение желудочками состоя-
ния деполяризации, в норме находится на изолинии или смещен до 1 мм.
Вариантами нормы являются также:
а) подъем сегмента ST в грудных отведениях, особенно правых, более
чем на 1 мм, который сопровождается подъемом точки перехода комп-
лекса QRS в сегмент ST (точки J). Это характерно для так называемого
синдрома ранней реполяризации желудочков, который
встречается чаще в молодом возрасте (рис. 35,Л);
изменения сегмента ST и зубца Т\ П — первичная инверсия зубца Т при ишемии миокар-
да или его некоронарогенных заболеваниях; Р- крупноочаговый трансмуральный инфаркт
миокарда, подострая стадия или стадия рубца: 1 - патологический зубец QS, 2 - сегмент
ST на изолинии; 3 - симметричный отрицательный зубец Т
113
б) косовосходящая депрессия сегмента ST от точки J, смещенной до
2-3 мм ниже изолинии в грудных отведениях при тахикардии. Представ-
ляет собой нормальную реакцию на физическую нагрузку (рис. 35,Д).
Патологические изменения сегмента ST (см. рис. 35):
(.Подъем сегмента ST. Отмечается при субэпикардиальном (транс-
муральном) повреждении и ишемии миокарда в случаях:
1) различных форм ИБС - стенокардии, особенно Принцметала,
остром инфаркте миокарда, острой и хронической аневризме сердца;
2) остром перикардите.
II. Депрессия сегмента ST горизонтальной или косонисходя-
щей формы. Отмечается при:
1) субэндокардиальном повреждении и ишемии миокарда при раз-
личных формах ИБС, особенно стенокардии и остром инфаркте миокарда,
а также некоторых других заболеваниях сердца;
2) перегрузке миокарда желудочков (например, при гипертоническом
кризе);
3) влиянии токсических веществ, например, сердечных гликозидов,
и дистрофии миокарда.
Смещение сегмента ST от изолинии имеет место также при наруше-
нии синхронности деполяризации желудочков вследствие их гипертро-
фии, а также при блокаде ножек пучка Гиса и эктопических желудочко-
вых комплексах (экстрасистолии, пароксизмальной и непароксизмаль-
ной тахикардии). При этом направление смещения сегмента ЗТдискор-
дантно направлению основного отклонения (зубца) комплекса QRS. На-
пример, если он представлен высоким зубцом Л, то, сегмент ST смещен
под изолинию и имеет косонисходящую форму.
Зубец Т отражает процесс реполяризации миокарда желудочков, кото-
рая распространяется от эпикарда к эндокарду. Направление ее мгновен-
ных и среднего векторов в целом сходно с векторами деполяризации
(см. рис. 27, 32), вследствие чего в норме полярность зубца Т в большин-
стве случаев аналогична (конкордантна) основному отклонению (зубцу)
комплекса QRS (см. табл. 7).
Патологические изменения зубца Т включают (см. рис. 35):
I. Отрицательные зубцы Т. Неспецифичны и встречаются при
самых разнообразных патологических процессах в миокарде, в частности
при:
1) субэпикардиальной, или трансмуральной, ишемии при различных
формах ИВС и некото]. ых других заболеваниях;
2) дистрофии миокарда коронарогенного и некоронарогенного гене-
за, в частности при перегрузке желудочка, интоксикациях, нарушении
электролитного баланса (гипокалиемии) и др.; его субстратом может слу-
жить также миокардиосклероз.
П. Высокие остроконечные зубцы Г. Также неспецифичны
114
O'
Рис. 36. Электрическая ось сердца (А), угол а (Б) и варианты положения электрической
оси сердца (В)
-180
-90 „
Резкое
отклонение
-*~^влево
-30°
Умеренное откло-
нение Влево
----0°
★90
вертикальное
отклонение
вправо
★120
' Умеренное
отклонение
вправо
Гзризонтальное
★*0в
Промежуточное
и отмечаются, в частности при: 1) субэндокардиальной ишемии; 2) ги-
перкалиемии.
Оба варианта изменений зубца Т могут быть вторичными и иметь ме-
сто при: 1) нарушении нормальной последовательности реполяризации
миокарда желудочков вследствие их гипертрофии (направление реполя-
ризации гипертрофированного желудочка меняется на противоположное);
2) блокаде ножек пучка Гиса; 3) эктопических желудочковых аритмиях.
При этом полярность зубца Т конкордантна направлению смещения сег-
мента ST, продолжением которого и является зубец Т (см. рис. 35,Н, О).
Продолжительность интервала Q— Т— так называемой электрической
систолы желудочков — примерно соответствует их рефрактерному перио-
ду. Этот интервал измеряется от начала комплекса QRS до окончания
зубца Т (см. рис. 23). Поскольку его величина зависит от ЧСС, целесооб-
разно определять корригированный интервал Q—T (Q—Тк) по формуле
Базетта, в которой сделана поправка на ЧСС:
Q-Tk =
Q-T
J(R-R)
Интервал Q-Тк считается удлиненным, если он равен или больше
0,4 с у мужчин и 0,45 с у женщин.
Изменения величин Q-Tvi Q-Tk, неспецифичны и обусловлены целым
рядом физиологических и патофизиологических факторов и фармакологи-
ческих воздействий. Их измерение имеет определенное значение при оценке
генеза желудочковых эктопических аритмий и коррекции антиаритми-
ческой терапии.
115
Изменения зубца U неспецифичны и практически не имеют диагно-
стического значения.
Электрическая ось сердца представляет собой среднее направление век-
тора электродвижущей силы желудочков в течение всего периода деполя-
ризации, которая является векторной суммой мгновенных векторов
(рис. 36,А). Ее направление во фронтальной плоскости характеризуется
углом а, который она образует с осью I стандартного отведения (рис. 36,2»)-
У здоровых взрослых людей величина угла а колеблется в широких пре-
делах — от —30 до +110°, однако в интервале от +90 до +110° может яв-
ляться также патологической. В зависимости от величины угла а различают
следующие варианты положения электрической оси сердца как варианты
нормы (рис. 36,2?): 1) промежуточное — от +40 до +70°; 2) горизонтальное
— от 0 до +40°; 3) умеренное отклонение влево - от 0 до -30°; 4) вер-
тикальное - от +70 до +90°, 5) умеренное отклонение вправо - от +90 до
+ 120°.
Вертикальное положение обычно отмечается у лиц молодого возраста
и астеников, горизонтальное — у пожилых и гиперстеников. Положение
электрической оси сердца до некоторой степени зависит от наличия гипер-
трофии того или иного желудочка. Так, при гипертрофии левого желудоч-
ка угол а обычно (но не обязательно) находится в пределах 0...—30°, а
правого - от +90 до +120°.
Резкое отклонение влево (более —30°) и вправо (более +120°) являет-
ся патологическим изменением положения электрической оси сердца.
Угол а оценивается по характеру графики комплекса QRS в различных
отведениях с помощью 6-осевой системы координат Бейли. Когда электри-
ческая ось сердца ориентирована в направлении, перпендикулярном или
почти перпендикулярном оси отведения, ее проекция на него приближается
к 0 и величина регистрируемого в этом отведении потенциала, то есть зуб-
цов комплекса QRS или их алгебраической суммы, минимальна. Приме-
ром может служить III отведение на рис. 27,2>. Если же электрическая ось
ориентирована практически параллельно оси отведения, то регистрируе-
мый в нем потенциал будет иметь максимальную амплитуду, как, напри-
мер, I отведение на рис. 27,2>. Таким образом, в данном примере электри-
ческая ось сердца ориентирована перпендикулярно оси отведения III и
примерно параллельна оси I отведения, то есть находится между 0° и
+30°.
Точный расчет величины угла а производят с помощью специальных таб-
лиц, исходя из величин алгебраической суммы амплитуды зубцов комплек-
са QRSотдельно в I и III отведениях.
Подобный подход применим и к определению среднего вектора репо-
ляризации желудочков (зубца 7), который в норме ориентирован при-
мерно так же, как вектор QRS.
Форма комплекса QRS и зубца Т в различных отведениях в зависимо-
сти от положения электрической оси сердца представлена на рис. 21,А,Б,В
и демонстрирует разнообразие их графики в норме.
116
I II III aVR oVL aVF V1 V2 V3 H К V,
Л x j- г -L f Г r L -t L I"
Отведения от конечностей
(фронтальная плоскость)
Грудные от Ведения
(горизонтальная плоскость)
ЛЖ ПЖ
Рис. 37. Положение вектора QRS и зубца Т во фронтальной и горизонтальной плоскостях
и графика ЭКГ в 12 стандартных отведениях при гипертрофии левого (Л) и правого (Б)
желудочков (по R.Myeburg, 1991): ЛЖ - левый желудочек; ПЖ - правый желудочек
ЛЖ ПЖ
Электрокардиографические признаки гипертрофии желудочков сердца. Из-
менения на ЭКГ при гипертрофии желудочков обусловлены:
1) увеличением массы мышечных волокон, что приводит к увеличе-
нию величины образующейся электродвижущей силы и вектора деполя-
ризации соответствующего желудочка, а следовательно, амплитуды зуб-
цов, отражающих его электрическую активность;
2) увеличением продолжительности деполяризации гипертрофирован-
ного желудочка и вследствие этого увеличением времени его активации.
Временем активации обозначают период времени от начала желудочко-
вого комплекса до вершины зубца R или 5 в отведении, которое лучше
всего отражает потенциал желудочка. Это приводит к некоторому увели-
чению продолжительности комплекса QRS в целом, которая, однако, не
превышает 0,11-0,12 с;
3) изменением положения сердца и его отдельных камер в полости
грудной клетки. Следствием этого является изменение положения сред-
него вектора деполяризации, то есть электрической оси, и реполяриза-
ции;
4) изменением направления реполяризации в гипертрофированном же-
лудочке. Из-за удлинения деполяризации реполяризация начинается до
полного окончания деполяризации и распространяется от эндо- к эпи-
карду, так как субэпикардиальные слои к этому времени еще не деполя-
117
ризовались. Таким образом, вектор реполяризации направлен от элект-
родов, преимущественно отражающих потенциалы гипертрофированно-
го желудочка. В этих отведениях регистрируется косонисходящая депрес-
сия сегмента ST, а в отведениях от другого желудочка сегмент ST имеет
косовосходящую форму. В течение всей реполяризации на электроды от
гипертрофированного желудочка действует отрицательный заряд, кото-
рый образуется при суммировании однонаправленных векторов реполя-
ризации обоих желудочков, что обусловливает образование отрицатель-
ных зубцов Т. Наоборот, в отведениях от противоположного желудочка
регистрируются высокие положительные зубцы Т вследствие действия на
эти электроды большего, чем в норме, положительного полюса суммар-
ного вектора электродвижущей силы.
Эти изменения сегмента ST и зубца Т в отведениях, отражающих элект-
рическую активность гипертрофированного желудочка, рассматривают как
признаки его гемодинамической перегрузки. Они могут быть преходящими
и возникать при временном нарастании перегрузки желудочка объемом или
сопротивлением, сопровождаясь усугублением изменений комплекса QRS.
Если нарушения реполяризации стойкие, то они указывают на выражен-
ную гипертрофию и, по-видимому, связаны с вызываемой ею дистро-
фией миокарда.
Гипертрофия левого желудочка приводит к усугублению признаков су-
ществующего в норме преобладания влияния на графику комплекса QRS
потенциала левого желудочка. При этом нарастает отклонение среднего
вектора деполяризации желудочков во фронтальной и горизонтальной
плоскостях влево, кверху и кзади (рис. 37).
Основными электрокардиографическими признаками гипертрофии ле-
вого желудочка являются (см. рис. 37):
1) резкое увеличение амплитуды зубца R (> 27 мм) в отведении V5 или V6;
2) резкое увеличение амплитуды зубца S (> 25 мм) в отведении V] или V2;
3) Rvs<6)+ SvK2) 35 мм;
4) наибольший положительный или отрицательный зубец комплекса
QRS в отведениях от конечностей > 20 мм;
5) угол а < 0°;
6) увеличение времени активации в отведениях V5 6 > 0,04 с;
7) косонисходящая депрессия сегмента ST и (или) асимметричный от-
рицательный зубец Т в отведениях V5 6 (а также в отведениях от конечно-
стей, к которым обращен левый желудочек, чаще I и aVL) как признак
перегрузки желудочка.
Выраженность гипертрофии пропорциональна количеству имеющихся
признаков на ЭКГ. Наиболее чувствительными из них являются вольтажные
критерии, а наиболее специфичным - изменение времени активации. У
молодых людей с тонкой грудной клеткой важное диагностическое зна-
чение имеет наличие вторичных нарушений реполяризации, что повы-
шает надежность заключения о наличии гипертрофии левого желудочка.
118
Гипертрофия правого желудочка приводит к появлению признаков пре-
обладающего влияния на графику комплекса QRS потенциалов правого
желудочка, вместо левого, как в норме, или уменьшению выраженности
его преобладания. При этом происходит отклонение среднего вектора де-
поляризации желудочков вправо, кпереди и кверху (см. рис. 37).
Основными электрокардиографическими признаками гипертрофии пра-
вого желудочка являются:
I) преобладание зубца R в отведении V] (>5 мм) с графикой qR или R
(резко выраженная гипертрофия), rsR’, (выраженная гипертрофия) или
RS (умеренная гипертрофия) при R/S > 1,0 и нормальной продолжитель-
ности комплекса QRS *
2) образование глубоких (>7 мм) зубцов 5 (R/S <1,0) в отведении V5
или V6;
3) RVl + sv5wim6>10,5 мм;
4) угол а >+90°...+110°;
5) увеличение времени активации в отведении V, >0,04 с;
6) отрицательные зубцы Т, часто в сочетании с депрессией сегмента
ST, в отведении V] (а также в отведениях от конечностей — II, III, aVR,
aVF). Высокие положительные зубцы Т в отведениях V5 6.
Дополнительным признаком могут служить изменения комплекса QRS
в отведении V3R, сходные с изменениями в отведении Vr
Изменения на ЭКГ при так называемом синдроме диффузных измене-
ний в миокарде, которые могут отмечаться при самых различных заболе-
ваниях сердца, например, при миокардите, миокардиодистрофии, ИБС,
неспецифичны и весьма вариабельны. Они обусловлены в основном 2
группами причин:
1) изменениями метаболизма миокарда и его дистрофией вследствие
гипоксии, нарушений электролитного обмена, нейрогуморальных влия-
ний, токсических воздействий и др. Они имеют различную выраженность
и часто нестойкие (кроме случаев необратимой дистрофии);
2) характером и степенью развития соединительной ткани, то есть
интерстициального фиброза и заместительного склероза.
Таким образом, изменения на ЭКГ отличаются большей или меньшей
стойкостью при исследовании в динамике и включают (см. рис. 35):
1) депрессию сегмента ST, чаще косонисходящую;
2) разнообразные изменения зубца Т, который может быть уплощен-
ным, двухфазным, отрицательным или высоким остроконечным;
3) уменьшение вольтажа зубцов комплекса QRS.
Эти изменения обнаруживаются чаще в группах отведений (напри-
мер, левых грудных, I и aVL) и значительно реже - в большинстве отве-
дений ЭКГ. Необходимо подчеркнуть, что их выраженность и даже само
Электрокардиографическая диагностика гипертрофии правого желудочка при на-
личии полной блокады правой ножки пучка Гиса ненадежна.
119
Рис. 38. Изменения ЭКГ при некоторых нарушениях электролитного обмена:
гиперкалиемии (Л), гипокалиемии (Б) и гипокальциемии (В)
наличие или отсутствие недостаточно надежно отражают глубину пато-
логических изменений в миокарде и не позволяют судить об этиологии.
Изменение на ЭКГ при некоторых нарушениях обмена электролитов. Элект-
рическая активность сердца особенно чувствительна к изменениям вне-
клеточной концентрации КЛ
Для гиперкалиемии характерны (рис. 38,Л):
а) при ее меньшей выраженности — высокоамплитудные заостренные
узкие зубцы Г в форме “шатра”:
б) при значительной выраженности (К+ плазмы выше 9 ммоль/л): 1) уп-
лощение зубца Р, вплоть до полного исчезновения с периодами синоат-
риальной блокады; 2) удлинение интервала Р— Q; 3) значительное рас-
ширение комплекса QRS, который сливается с зубцом Т. Эти изменения
являются грозными проявлениями тяжелой гиперкалиемии, представля-
ющей непосредственную угрозу жизни больного.
Характерные изменения на ЭКГ вызывает также выраженная гипока-
лиемия (концентрация К+ менее 3 ммоль/л). Они включают (см. рис. 38,2>):
1) уплощение зубцов Г и их инверсию;
2) смещение книзу сегмента ST, который “поглощает” отрицательную
фазу плохо дифференцирующегося зубца Т;
3) заметное увеличение амплитуды зубца U с удлинением интервала
Q—U. Эти изменения могут быть предвестниками тяжелых желудочковых
аритмий, особенно у больных, принимающих сердечные гликозиды.
Изменения на ЭК1 при нарушениях обмена Са2+ включают:
а) признаки гипокальциемии (см. рис. 38, В): 1) удлинение интервала Q—
Т; 2) удлинение сегмента ST, который, в отличие от гипокалиемии, на-
ходится на изолинии. “Отодвинутый” зубец Т поглощает зубец U;
б) признаки гиперкальциемии'. 1) укорочение интервала Q— Т; 2) уко-
рочение, вплоть до отсутствия, сегмента ST.
120
Изменения на ЭКГ при других нарушениях обмена электролитов со-
вершенно неспецифичны и не имеют клинического значения.
Электрокардиографические признаки нарушения сердечного ритма и про-
водимости, ишемии и инфаркта миокарда, интоксикации сердечными
гликозидами рассматриваются ниже в соответствующих разделах.
СПЕЦИАЛЬНЫЕ АСПЕКТЫ МЕТОДА ЭЛЕКТРОКАРДИОГРАФИИ
Электрокардиография при нагрузочных пробах. Важной областью при-
менения электрокардиографии являются различные пробы с физической
нагрузкой или медикаментозные тесты для выявления ишемии миокарда
и диагностики ИБС. Клиническое значение, методика этих проб и крите-
рии их оценки изложены в главе 9.
Компьютерная обработка данных ЭКГ. Ее преимуществами являются
быстрота получения результата и возможность создания больших баз дан-
ных. Недостатки обусловлены ограничениями, присущими методу электро-
кардиографии. Они связаны главным образом с существующей разно-
речивостью оценки ее изменений в ряде случаев, затруднениями при
расшифровке сложных нарушений ритма и невозможностью “машинно-
го” сравнения ЭКГ в динамике. Создание и обработка больших верифи-
цированных баз данных для унификации диагностических критериев и
усовершенствование компьютерных технологий позволят в будущем из-
бавиться от многих недостатков. Тем не менее, очевидно, что даже при
этом ЭВМ вряд ли сможет полностью вытеснить квалифицированного
врача, анализирующего ЭКГ с учетом данных клиники и в комплексе с
другими дополнительными методами исследования.
Эпикардиальное (прямое) и прекардиальное (непрямое) картирование ЭКГ
с помощью множественных отведений используют преимущественно в на-
учных целях. Накопленный опыт свидетельствует о перспективности его
клинического применения для:
1) уточнения локализации и величины зон некроза и ишемического
повреждения при инфаркте миокарда передне-боковой области левого
желудочка по количеству отведений, в которых регистрируются
соответствующие изменения ЭКГ. В этих целях используют различные
системы множественных грудных отведений ЭКГ—35, 49 и даже больше
(электрокардиотопограмма). Они образуются при расположении
точек активного электрода несколькими горизонтальными рядами по меж-
реберьям передне-боковой, а иногда также частично задней поверхно-
стей левой половины грудной клетки, и вертикальными — по линиям
тела. Так, например, система из 35 прекардиальных отведений, предло-
женная P.Maroko и соавторами (1982), состоит из 5 горизонтальных ря-
дов — со второго по шестое межреберье и 7 вертикальных — от правого
края грудины до задней подмышечной линии слева.
Количественная оценка величины зоны некроза и повреждения этим
методом, однако, весьма приблизительная. Результаты в значительной
121
Клиническое применение холтеровского мониторирования
В диагностических целях В лечебных целях
1. Определение происхождения некоторых пре-
ходящих симптомов, которые предположи-
тельно связаны с патологией сердца (голо-
вокружение, обмороки, боль в грудной клетке
и др.)
2. Выявление “немой” ишемии миокарда и ее
количественная оценка
3. Выявление и количественная характеристика
различных нарушений ритма и проводимости
как бессимптомных, так и симптоматичных
4. Оценка функционального состояния при
невозможности адекватного нагрузочного
тестирования
1. Оценка эффективности ангиаритми-
ческой и ангиангинальной терапии
2. Оценка функции постоянного
электрокардиостимулятора
3. Контроль за безопасностью и эффек-
тивностью реабилитации, в частности
при инфаркте миокарда
степени зависят от положения сердца, размеров и толщины грудной клет-
ки, что затрудняет сопоставление данных, полученных при обследова-
нии разных больных;
2) определения локализации пучка Гиса, эктопических очагов и до-
полнительных проводящих путей при синдроме преждевременного воз-
буждения желудочков. В этих целях картирование проводят с эпикарди-
альной поверхности открытого сердца во время операции.
Длительное мониторирование ЭКГ — так называемое холтеровское мо-
ниторирование — используют в стационарных и амбулаторных условиях
для выявления и количественной оценки преходящих изменений ЧСС,
нарушений ритма и проводимости, а также эпизодов ишемии (смещения
сегмента ST), которые не обнаруживаются на ЭКГ в покое и при нагру-
зочных тестах. Необходимо иметь в виду, что в отношении ишемических
эпизодов холтеровское мониторирование является менее чувствительным
и специфичным методом, чем нагрузочные пробы. Регистрация ЭКГ про-
водится на магнитную ленту с отметками времени непрерывно в течение
24 ч или более при повседневной физической активности больного. Элек-
троды фиксируют на грудной клетке в различных позициях. Запись ЭКГ
осуществляется в одном или двух отведениях (чаще II и V5) с помощью
специальных портативных регистрирующих устройств. Одновременно боль-
ной ведет дневник, где отмечает время возникновения боли в грудной
клетке, сердцебиения и других жалоб, а также вид своей деятельности.
Расшифровку ЭКГ с ее количественным анализом (например, определе-
ние количества экстрасистол различных видов или продолжительности
эпизодов смещения сегмента ST за определенный промежуток времени)
проводят с использованием компьютера. Данные ЭКГ сопоставляют с
записями в дневнике больного, для того чтобы установить соответствие
тех или иных симптомов с изменениями на ЭКГ.
Более простым методом, обеспечивающим срочную регистрацию ЭКГ
при возникновении преходящих симптомов для выявления их возможного
122
кардиального генеза, является ее запись по телефону с помощью не-
сложного приспособления, превращающего электрические сигналы в зву-
ковые. При этом можно разговаривать с больным для уточнения жалоб.
Ограничения метода включают невозможность уловить быстропроходящие
аритмии, а также аритмии, которые сопровождаются нарушениями со-
знания, и возможность регистрации ЭКГ лишь в течение 1 мин (при от-
сутствии специальных приспособлений).
Метод усреднения и усиления электрокардиографических сигналов по-
зволяет уменьшить влияние помех (“фона”) и повысить разрешающую
способность ЭКГ в отношении выявления потенциалов очень низкой ам-
плитуды. Его используют в настоящее время преимущественно для реги-
страции так называемых поздних потенциалов желудочков.
Поздние потенциалы, или фрагментированная задержанная электриче-
ская активность миокарда, наблюдаются в последние 40 мс комплекса
QRS. Они отражают запаздывание и дезорганизацию возбуждения отдель-
ных участков миокарда желудочков, участвуя в образовании их следовой
деполяризации. Регистрируются главным образом при остром и перене-
сенном инфаркте миокарда и обусловлены удлинением пути проведения
импульса вследствие разделения слоев миокарда соединительной тканью
и нарушения параллельной ориентации волокон. Считается, что поздние
потенциалы желудочков отражают анатомический субстрат электрической
нестабильности сердца, то есть пароксизмальной желудочковой тахикар-
дии и фибрилляции желудочков, возникающих по механизму обратного
входа - ”ри-энтри”. Благодаря этому предпринимаются попытки их ис-
пользования для выявления больных с повышенным риском развития
этих угрожающих жизни аритмий. Клиническое значение выявления по-
здних потенциалов желудочков пока окончательно не установлено. Их
отсутствие совпадает с невозможностью индуцировать стойкую желудоч-
ковую тахикардию при инвазивном электрофизиологическом исследова-
нии (G.Breithardt, 1991), и, следовательно, указывает на низкий риск
внезапной сердечной смерти.
Поздние потенциалы желудочка можно регистрировать как непосред-
ственно с поверхности сердца (эндо- и эпикарда), так и с поверхности
тела. В основе метода лежит усреднение большого количества комплексов
QRS (до 200) после усиления сигнала в 1500-100 000 раз (до 1 мм/мкВ)
и его фильтрации на частотах 40-250 Гц с последующим компьютерным
анализом.
Внутриполостная электрокардиография позволяет регистрировать потен-
циалы синусового узла, предсердий, желудочков, пучка Гиса и его ножек.
Ее применяют самостоятельно или в сочетании с программируемой элекг-
рокардиостимуляцией (см. ниже) в целях:
I) обнаружения нарушений проводимости в системе Гиса—Пуркинье;
2) оценки функции синусового узла;
3) определения места образования патологических импульсов и путей
проведения, например, при пароксизмальных тахикардиях, атриовен-
123
*М*ммма
Рис. 39. Нормальная электрограмма пучка Гиса (НВЕ): 1 мм -
13 мс; РА — 51 мс; АН — 80 мс; HV — 39 мс
трикулярных блокадах и синдроме преждевременного возбуждения желу-
дочков;
4) определения механизма пароксизмальной тахикардии;
5) оценки электрофизиологических эффектов лекарственных препа-
ратов и оптимизации подбора антиаритмической терапии.
Для уточнения локализации нарушений атриовентрикулярной прово-
димости используют электрограмму пучка Гиса (рис. 39).
Она регистрируется с помощью специального эндокардиального элек-
трода, который вводят трансвенозно и устанавливают в области кольца
трехстворчатого клапана, то есть вблизи наиболее поверхностно распо-
ложенного сегмента пучка Гиса. На электрограмме пучка Гиса измеряют:
1) интервал Р—А - от зубца Р обычной ЭКГ до импульса возбужде-
ния правого предсердия (А) вблизи атриовентрикулярного узла, харак-
теризующий внутрипредсердное проведение;
2) интервал А—Н — от импульса А до потенциала пучка Гиса, харак-
теризующий проводимость через атриовентрикулярный узел и удлиняю-
щийся при блокаде на его уровне:
3) интервал Н~V как показатель проводимости по системе Гиса—Пур-
кинье. Удлиняется при блокаде дистальнее атриовентрикулярного узла на
124
уровне внутрижелудочковой проводящей системы, что имеет относительно
неблагоприятный прогноз.
Векторкардиография представляет собой графическое изображение
последовательности изменения мгновенных векторов электродвижущей
силы сердца в пространстве по направлению и величине. Она имеет вид
петли, которая образуется при соединении свободных концов этих век-
торов, исходящих из одной точки (см. рис. 32). Петля может быть плос-
кой и пространственной. Петли плоскостной ВКГ образуются в каждой
из 3 плоскостей (горизонтальной, фронтальной, сагиттальной) с помо-
щью 2 отведений ЭКГ. Ими могут быть отведения стандартной ЭКГ либо
специальные ортогональные отведения X, Y, Z, оси которых располага-
ются соответственно поперечно, вертикально и сагиттально. Процесс де-
поляризации желудочков на ВКГ отражается петлей QRS. При смещении
сегмента ST от изолинии она незамкнутая. Реполяризация желудочков
образует петлю Т, деполяризация предсердий — петлю Р.
Диагностическое значение векторкардиографии состоит в возможно-
сти определять: 1) гипертрофию желудочков и предсердий; 2) блокаду
ножек пучка Гиса и их ветвей; 3) инфаркт и ишемию миокарда; 4) син-
дром преждевременной деполяризации желудочков. В этих случаях век-
торкардиография более чувствительна, чем электрокардиография, и мо-
жет использоваться в дополнение к ней для уточнения диагноза данной
патологии.
Векторкардиография имеет наибольшие преимущества перед электро-
кардиографией при: 1) диагностике инфаркта миокарда базальной и диаф-
рагмальной локализации; 2) выявлении рубцовых изменений в миокарде в
случаях наличия глубоких зубцов Q и отсутствия роста зубцов Р, особенно
на фоне блокад ножек пучка Гиса; 3) диагностике гипертрофии правого
желудочка. В то же время векторкардиографию нельзя использовать для ди-
агностики аритмий и она не позволяет измерять временные интервалы Р—
О и др.
Клиническое применение векторкардиографии значительно ограничено
в связи с отсутствием до настоящего времени унифицированных систем
отведений и количественных диагностических критериев.
РЕНТГЕНОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
Среди существующих методов рентгенологического исследования при
сердечно-сосудистых заболеваниях в настоящее время наиболее широкое
распространение получили рентгенография и рентгеноскопия грудной
клетки и контрастные исследования — ангиокардиография, ангиопуль-
монография и коронарография. В отдельных случаях используют телерент-
гено- и томографию и исследование сердца с помощью электронно-
оптического преобразователя.
125
Рис. 40. Нормальная рентгенологическая
анатомия сердца в прямой проекции: пра-
вый контур сердца образован 2 дугами: 1 —
верхняя полая вена или после 40 лет — вос-
ходящая часть аорты; 2 — правое предсер-
дие. Находящийся между этими дугами пра-
вый атриовазальный угол (а) располагает-
ся на середине продольной оси сердца, так
что А=Б. Левый контур сердца образован 4
дугами: / - дуга аорты, переходящая в нис-
ходящую часть аорты; 2 — ствол легочной
артерии с ее левой ветвью; 3 — ушко лево-
го предсердия; 4 — левый желудочек. В об-
ласти правого и левого (б) атриовазальных
углов находится "талия” сердца; П — тела
позвонков; в — клапан аорты; г — клапан
легочной артерии; д - трехстворчатый кла-
пан; е — митральный клапан; ПП — правое
предсердие; ПЖ — правый желудочек; ЛЖ
— левый желудочек. По отношению к сре-
динной линии тела справа находится 1/3
поперечника сердца (отрезок В), а слева —
2/3 (отрезок Г); В.Т = 1/3 : 2/3
Основными задачами обзорного
рентгенологического исследования у таких больных являются определение
размеров и формы сердца и отходящих от него крупных сосудов и оценка
состояния легочного артериального и венозного кровотока.
Преимуществами рентгенографии по сравнению с рентгеноскопией
являются простота, большая разрешающая способность, возможность ди-
намического наблюдения и минимальная лучевая нагрузка. Рентгеноско-
пию применяют главным образом для оценки пульсации сердца и круп-
ных сосудов, что невозможно при рентгенографии.
Стандартное рентгенологическое исследование сердца включает рент-
генографию (или рентгеноскопию) в передне-задней (прямой) и боко-
вой проекциях. Для уточнения размеров и формы отдельных камер по
показаниям используют также правую и левую косые проекции.
Нормальная рентгенологическая анатомия сердца в различных проек-
циях представлена на рис. 40 и 41.
Размеры сердца в целом определяют качественно и количественно пу-
тем расчета в прямой проекции кардиоторакального индекса.
Он представляет собой отношение наибольшего поперечного размера
сердца (В+Г на рис. 40) к наибольшему поперечному внутреннему диа-
метру грудной клетки и в норме не превышает 50 %. Увеличение кардио-
торакального индекса отражает увеличение сердца и имеет важное значе-
ние для диагностики, наблюдения за кардиологическим больным в ди-
намике и оценки прогноза.
126
Рис. 41. Расположение ка-
мер, клапанов сердца и
магистральных сосудов в
передне-задней (Л, Б),
боковой (В, Г), правой
передней (Д, Е) и левой
передней косой (Ж, 3)
проекциях (по Р.Соте и
соавт., 1991): AV — непар-
ная вена; SVC — верхняя
полая вена; RA - правое
предсердие; 1VC — ниж-
няя полая вена; TV— трех-
створчатый клапан; RV -
правый желудочек; МРА -
ствол легочной артерии;
RPA — правая легочная
артерия; LPA — левая легочная артерия; Ао — аорта; LA — левое предсердие; LAA —
ушко левого предсердия; LV — левый желудочек; MV — митральный клапан; JVS —
межжелудочковая перегородка; IAS — межпредсердная перегородка; RAA — ушко
правого предсердия
127
Рис. 42. Рентгенограммы грудной клетки при некоторых заболеваниях сердца и сосудов: А
— стеноз устья аорты. Тень сердца увеличена, аортальной конфигурации, левый желудо-
чек расширен, восходящая часть аорты дилатирована; Б - митральный стеноз. Тень сер-
дца митральной конфигурации с увеличением ствола легочной артерии и ушка левого
предсердия; В — отек легких; Г — митральная недостаточность. Определяется дилатация
одновременно левого предсердия и левого желудочка; Д — врожденный дефект межжелу-
дочковой перегородки у больного 40 лет (отношение легочного кровотока к системному
2,5:1). Тень сердца увеличена, митральной конфигурации, признаки легочной артериаль-
ной гипертензии; Е — расслаивающая аневризма аорты. Видно расширение верхней части
средостения
128
Следует отметить, что увеличение размеров сердца в целом и его от-
дельных камер обусловлено дилатацией, а не гипертрофией, которая обыч-
но вызывает утолщение стенок за счет уменьшения размеров полости, в
результате чего величина тени сердца практически не меняется.
Симулировать небольшое увеличение сердца могут: 1) все состояния, свя-
занные с высоким стоянием диафрагмы (например, асцит, беременность);
2) деформации грудной клетки — pectus excavatum и “синдром прямой
спины”, за счет уменьшения ее передне-заднего диаметра;
3) большие опухоли соседних органов — вилочковой железы, средо^
стения; кисты перикарда и др.
Увеличение сердца может быть обусловлено равномерной дилатацией всех
4 камер или преимущественным увеличением некоторых из них.
Увеличение левого желудочка. Самый ранний признак — закругление
верхушки сердца, что предшествует увеличению его размера. Впослед-
ствии отмечается увеличение дуги левого желудочка в прямой проекции
влево и книзу, а в боковой и левой косой - также кзади (рис. 42,4,/).
Обычно увеличивается кардиоторакальный индекс.
Наблюдается при недостаточности клапанов левых отделов сердца,
врожденных пороках, связанных с шунтированием крови на уровне же-
лудочков и крупных сосудов, а также при левожелудочковой недостаточ-
ности различного генеза (ИБС, артериальная гипертензия и др.).
Увеличение правого желудочка. Рентгенологические признаки большей
частью косвенные. К ним относятся:
1) увеличение ствола легочной артерии. Оно практически всегда со-
провождается дилатацией правого желудочка и является наиболее цен-
ным его признаком. Исключение составляет идиопатическое расширение
легочной артерии, которое встречается крайне редко;
2) закругление и приподнимание кверху верхушки сердца в передне-
задней проекции - так называемое сердце в форме сабо, или деревянного
башмачка. Возникает при значительном увеличении правого желудочка, ко-
торый оттесняет левый желудочек кзади;
3) смещение правого предсердия кнаружи и кверху, что сопровождается
увеличением поперечного размера сердца и смещением кверху правого
атриовазального угла в передне-задней проекции;
4) заполнение верхней части ретростернального пространства увели-
ченным правым желудочком в боковой и правой косой проекциях.
Дилатация правого желудочка отмечается при врожденном дефекте меж-
предсердной перегородки, пороках трехстворчатого клапана и чаще все-
го — при правожелудочковой недостаточности различного генеза.
Увеличение левого предсердия из-за тонких стенок и отсутствия клапа-
нов на путях притока может достигать значительной выраженности и имеет
четкие рентгенологические проявления. К ним относятся:
1) отклонение контрастированного бариевой взвесью пищевода в боко-
вой проекции по дуге различного радиуса вследствие увеличения пред-
сердия кзади (самый ранний и важный признак);
129
2) выбухание ушка левого предсердия в прямой проекции (рис. 42,Б)-,
3) образование резко увеличенным левым предсердием дополнитель-
ной нижней дуги правого контура сердца в прямой проекции.
Дилатация левого предсердия достигает наибольшей выраженности при
пороках митрального клапана и менее выражена при врожденных пороках
сердца с шунтированием крови слева направо на уровне желудочков и круп-
ных сосудов, а также при различных заболеваниях левого желудочка с
его недостаточностью.
Рентгенологические признаки увеличения правого предсердия значи-
тельно менее надежны, чем левого, и включают:
1) увеличение выпуклости и выбухания его дуги в прямой проекции,
особенно в сочетании с расширением верхней полой вены;
2) смещение кверху правого атриовазального угла (рис. 42,Д). Увели-
чение правого предсердия отмечается при пороках трехстворчатого кла-
пана, дефекте межпредсердной перегородки, а также при любых заболе-
ваниях, поражающих правый желудочек, с развитием его недостаточно-
сти.
Рентгенография является грубым, скриннинговым, методом оценки раз-
меров отдельных полостей сердца, уточнить которые позволяют другие
методы - эхо-, ангиокардиография и др.
Дилатация крупных сосудов — восходящей части аорты и ствола легоч-
ной артерии — обусловлена:
1) увеличением давления в них, как, например, при гипертензии боль-
шого и малого круга кровообращения;
2) увеличением кровотока: а) в аорте - при открытом артериальном про-
токе, тетраде Фалло, недостаточности аортальных клапанов и в некоторых
других случаях; б) в малом круге кровообращения - при врожденных поро-
ках с шунтированием крови слева направо;
3) постстенотическим расширением сосудов при их стенозе;
4) аневризмой (рис. 42, Е). Умеренная дилатация аорты наблюдается также
при ее атеросклерозе.
Уменьшение восходящей части аорты и ее дуги отмечается во всех слу-
чаях снижения МОС, например, при дефекте межпредсердной перего-
родки, выраженном митральном стенозе.
Изменения формы сердца. Выделяют 3 основных варианта характерных
изменений формы тени сердца при рентгенологическом исследовании.
1. Для митральной конфигурации (рис. 43,Б) характерны:
а) удлинение и увеличение выпуклости дуг ствола легочной артерии, а в
ряде случаев — также ушка левого предсердия: б) сглаженность левого атрио-
вазального угла — “талии” сердца; в) смещение правого атриовазального
угла кверху. Часто отмечается также увеличение левого желудочка в виде
удлинения и смещения кнаружи 4-й дуги слева в прямой проекции. “Митраль-
ное сердце” свойственно митральным порокам (стенозу, недостаточности)
(см. рис. 42, Б, В, Г), врожденным порокам с шунтированием крови, а также
стенозу устья легочной артерии (за счет постстенотического ее расширения).
130
Рис. 43. Различные варианты конфи-
гурации тени сердца в прямой проек-
ции: А - обычная, Б — митральная;
В - аортальная; Г - шаровидная; Д —
треугольная. Объяснение в тексте
2. Для аортальной
конфигурации тени сердца
(рис. 43,5, см. рис.42,Л) харак-
терны: а) увеличение левого же-
лудочка; б) подчеркнутость “та-
лии” сердца между 1-й и 4-й
дугами в прямой проекции. До-
полнительными признаками яв-
ляются: расширение восходящей
части аорты; смещение правого
атриовазального угла книзу за
счет удлинения аорты; расшире-
ние дуги аорты и начальной части ее нисходящего отдела (1-й дуги слева).
Аортальная форма сердца наиболее характерна для аортальных поро-
ков (стеноза и недостаточности), врожденных пороков — тетрады Фалло
и коарктации аорты, а также для артериальной гипертензии. Она иногда
отмечается при поражении аорты и миокарда атеросклеротического генеза.
3. Для шаровидной конфигурации тени сердца (рис.43,/) в
передне-задней проекции характерны: а) увеличение дуг правого пред-
сердия и левого желудочка со смещением кверху атриовазальных углов;
б) сохраненная “талия” сердца; в) уменьшение аорты. При этом отдель-
ные дуги по обоим контурам сердца могут быть уплощены или практи-
чески неразличимы. Такая форма тени сердца свойственна диффузному
поражению миокарда — миокардиту и дилатационной кардиомиопатии,
некоторым врожденным порокам - дефекту межжелудочковой перего-
родки и аномалии Эбштейна, а также может наблюдаться при экссуда-
тивном перикардите. В последнем случае тень сердца может иметь тре-
угольную форму (см. рис. 42,Д) с недифференцируемыми дугами.
Сосуды легких. Основными изменениями сосудов легких при заболева-
ниях сердца являются признаки венозной, или посткапиллярной, и арте-
риальной, или прекапиллярной, легочной гипертензии.
Рентгенологические изменения при венозной легочной гипертензии вклю-
чают (см. рис. 42,5):
1) обогащение легочного сосудистого рисунка вплоть до периферии
легких с расширением легочных вен в верхних долях легких в положении
больного стоя (самый ранний признак);
2) расширение сосудов (артерий и вен) в корнях легких;
3) перегородочные линии Керли в виде горизонтальных параллельных
полосок длиной 0,5—3 см в области легочных полей, чаще вблизи реберно-
131
диафрагмальных углов. Обусловлены дилатацией лимфатических сосудов
и скоплением жидкости в междольковых перегородках. Являются наибо-
лее специфичным признаком венозной легочной гипертензии;
4) расширение корней легких с нечеткими контурами в виде крыльев
бабочки или летучей мыши вследствие скопления жидкости в лимфатиче-
ской системе и периваскулярном пространстве. Характерно для острой
левожелудочковой недостаточности;
5) появление в легочных полях многочисленных теней с нечеткими
границами в виде их “крапчатости” в результате накопления в альвеолах
большого количества жидкости.
Все эти рентгенологические признаки неспецифичны и отмечаются
при левожелудочковой недостаточности любого генеза.
Признаками артериальной легочной гипертензии являются (см. рис. 42, Д):
1) удлинение и выбухание ствола легочной артерии;
2) расширение корней с круглыми тенями дилатированных крупных
ветвей легочной артерии;
3) обрыв артериальных ветвей на уровне сегментарных сосудов и от-
сутствие сосудистого рисунка на периферии легочных полей.
Признаки артериальной легочной гипертензии отмечаются при митраль-
ном стенозе, врожденных пороках сердца с шунтированием крови справа
налево вследствие высокой легочной гипертензии (синдром Эйзенменгера),
при тяжелых хронических обструктивных заболеваниях легких, а также при
так называемой первичной легочной гипертензии неизвестной этиологии.
ЭХОКАРДИОГРАФИЯ
Эхокардиография основана на использовании ультразвука для получе-
ния изображения сердца и крупных сосудов. Ультразвуковые волны час-
тотой 18-20 кГц, превышающей разрешающую способность человечес-
кого уха, распространяются как продольные колебания со скоростью,
которая зависит от физических свойств вещества, через которое они про-
ходят. Они генерируются пьезоэлектрическими кристаллами под воздей-
ствием переменного электрического поля, которые осуществляют преоб-
разование электрической и механической (звуковые колебания) энергии
друг в друга и функционируют одновременно как передатчик звука и
приемник отраженных звуковых волн (эхо-волн). Получение изображе-
ния структур сердца с помощью ультразвука основано на отражении уль-
тразвуковых волн на границе между двумя веществами с разными физи-
ческими свойствами, как, например, кровью и эндокардом. Поскольку
при этом угол падения равен углу отражения, получаемое изображение
является зеркальным.
Эхокардиография позволяет увидеть расположение и характер движе-
ния различных структур сердца (клапанов, стенок полостей и др.), и по-
этому является важнейшим методом изучения многих аспектов анатомии
и физиологии сердца. Ее достоинствами являются неинвазивный характер,
132
относительная дешевизна, возможность применения у постели больно-
го, быстрота получения специфичной, количественной, воспроизводи-
мой и надежной информации, благодаря чему эхокардиография прибли-
жается к идеальному методу диагностики.
Опыт более чем 20-летнего применения не выявил какого-либо неблаго-
приятного влияния метода на организм больного и врача. Основное огра-
ничение эхокардиографии связано с элементами субъективности при по-
лучении и интерпретации эхо-изображения, что предъявляет высокие тре-
бования к квалификации исследователя. Из-за отчасти эмпирического под-
бора интенсивности сигнала отдельные структуры могут не визуализиро-
ваться и, наоборот, могут появляться артефакты. Не является 100 % и вос-
производимость результатов измерений и величин расчетных показателей.
Диагностическое значение эхокардиографии в М-ре-
жиме и двухмерной эхокардиографии:
1) верификация диагноза: выпотного перикардита; стеноза митраль-
ного (и трехстворчатого) клапанов, обструктивной формы гипертрофи-
ческой кардиомиопатии (идиопатического гипертрофического субаорталь-
ного стеноза); опухоли предсердия; пролапса митрального клапана;
2) получение важных данных для диагностики: врожденных и приоб-
ретенных пороков сердца; инфекционного эндокардита; тромбов в поло-
стях сердца; констриктивного перикардита; ИБС; застойной сердечной
недостаточности; кардиомиопатий; легочной гипертензии; аневризмы аор-
ты, в том числе расслаивающей;
3) точное измерение размеров структур сердца: поперечного размера
левого желудочка и левого предсердия; толщины межжелудочковой пе-
регородки и стенок левого желудочка; диаметра корня аорты;
4) анализ движения структур сердца: клапанов; межжелудочковой пе-
регородки; свободных стенок левого и правого желудочков;
5) определение показателей функции и морфологии левого желудоч-
ка: объемов — КДО, КСО, УОС; фракции укорочения, фракции выбро-
са, средней скорости циркулярного укорочения мышечных волокон; массы
миокарда левого желудочка.
Показания к применению допплерэхокардиографии:
локализация шумов сердца; дифференциальная диагностика органичес-
ких шумов с “невинными” (функциональными); количественная оценка
выраженности стеноза клапанов; определение регургитации крови на кла-
пане; определение внутри- и внесердечных шунтов крови; определение
величин давления в полостях сердца; определение величины МОС.
Основными клиническими показаниями к выполнению эхо-
кардиографии являются:
1) шум в сердце;
2) патологические изменения на рентгенограмме грудной клетки: уве-
личение сердца или его отдельных полостей; изменения аорты; кальци-
наты в области сердца;
3) боль в грудной клетке (особенно необъяснимая);
133
Рис. 44. Эхокардиографическое
изображение нормального сердца
(схема по Р.Соте, 1980): А — двух-
мерный вид по длинной оси; Б —
вид при сканировании в М-режи-
ме; СИ7 — грудная стенка; Т - эхо-
кардиографический датчик, S -
грудина; ЛИ — правый желудочек;
LV — левый желудочек; Ао — ко-
рень аорты; AMV — передняя створ-
ка митрального клапана; PMV —
задняя створка митрального клапа-
на; LA — левое предсердие; ЛИИ/ -
стенка правого желудочка; AV —
аортальный клапан; PPM - задняя
сосочковая мышца; LVW — стенка
левого желудочка
4) обмороки и нарушения мозгового кровообращения (особенно у боль-
ных молодого возраста);
5) нарушения ритма;
6) лихорадка неясного генеза;
7) отягощенный семейный анамнез в отношении внезапной смерти, ИБС,
идиопатического гипертрофического субаортального стеноза;
8) наблюдение больных: с ИБС, в том числе с инфарктом миокарда; с
артериальной гипертензией; с приобретенными и врожденными порока-
ми сердца; с кардиомиопатиями; после кардиохирургических операций;
с некардиальной патологией - шоком, хронической почечной
недостаточностью, системными заболеваниями соединительной ткани,
при приеме кардиотоксичных лекарственных препаратов.
Различают три основных варианта эхокардиографии: 1) эхокардио-
графия в М-режиме, или одномерная; 2) секторальное сканирование,
или двухмерная эхокардиография и 3) допплерэхокардиография.
При эхокардиографии в М-режиме (от англ, movement — движение)
ультразвук сфокусирован в узкий пучок, который, проходя через раз-
личные структуры сердца, позволяет получить изображение их движения
во времени в различных “срезах” (рис. 44). При этом по оси абсцисс это-
го изображения находится время, а по оси ординат — расстояние от той
или иной структуры до датчика.
134
Таким образом, метод позволяет: 1) получить одномерное изображе-
ние различных структур сердца в определенной плоскости и измерить их
линейные размеры и 2) оценить характер движения этих структур — кла-
панов и стенок полостей сердца — во времени.
При сканировании сердца в М-режиме ультразвуковой луч
последовательно пересекает сердце по его длинной оси, захватывая различ-
ные структуры от верхушки до основания сердца (см. рис. 44).
В основе двухмерной эхокардиографии лежат движения назад и вперед
ультразвукового луча в пределах более или менее узкого сектора (60-90°)
с большой частотой — около 30 раз в 1 с. В результате внутри сектора
образуется двухмерное изображение структур сердца, от которых отража-
ется луч, движущихся в реальном масштабе времени. Как и при эхокар-
диографии в М-режиме, получение изображения тех или иных структур
сердца зависит от положения датчика на грудной клетке и его наклона к
ней, который определяет направление ультразвукового луча. Позволяя
детально изучать анатомию сердца, что особенно ценно при сложных
пороках, секторальное сканирование открыло новую эру в неинвазивной
кардиологии и в значительной мере заменило инвазивное обследование.
Поскольку легкие образуют практически непроницаемый барьер для уль-
тразвука. эхо-изображение сердца можно получить через небольшое “ульт-
развуковое окно”, внутри которого имеется ограниченное количество пози-
ций датчика. Они включают: 1) парастернальную, 2) апикальную; 3) суб-
костальную (из-под реберной дуги в области надчревного угла); 4) супрас-
тернальную (в области яремной ямки) позиции.
Нормальная эхокардиографическая анатомия сердца в трех взаимно пер-
пендикулярных плоскостях — по длинной оси, короткой оси и в 4-камерном
виде представлена на рис. 44,4 и 45. Первые два изображения получают из
парастернальной позиции, а третье - из апикальной и субкостальной.
Как видно из рис. 44,4 и 45,4, на ЭхоКГ сердца по длинной оси меж-
желудочковая перегородка располагается спереди как продолжение перед-
ней стенки аорты. Своего рода продолжением ее задней стенки является
передняя створка митрального клапана. Позади аорты располагается по-
лость левого предсердия. Виден также аппарат митрального клапана —
хорды и сосочковые мышцы.
При повороте датчика на 90° получают серию срезов сердца по корот-
кой оси на уровне сосочковых мышц (рис. 45,Б, 1) митрального клапана
(рис. 45,5,2) и аорты (рис. 45,5,2). В последней проекции хорошо виден
выносящий тракт правого желудочка. Справа от аорты находится трех-
створчатый клапан и слева - клапан легочной артерии. Выше клапана
можно увидеть бифуркацию легочной артерии с отхождением ее правой
и левой ветвей.
В 4-камерном изображении сердца из апикальной позиции определя-
ются оба желудочка и предсердия, а также атриовентрикулярные клапа-
ны (рис. 45,5). Трехстворчатый клапан находится несколько ближе к вер-
хушке сердца, чем митральный. В этом изображении хорошо видны
135
Рис. 45. Двухкамерная ЭхоКГ в норме: 5 — межжелудоч-
ковая перегородка; LV — левый желудочек; Ао — аорта;
LA — левое предсердие; RV — правый желудочек; RA -
правое предсердие; RM — сосочковая мышца; TV — трех-
створчатый клапан; PV- клапан легочной артерии; LMCA
- ствол левой коронарной артерии; AV - аортальный
клапан; MV - митральный клапан
межжелудочковая и межпредсердная перегородки. Следует отметить, что
в области овального окна может определяться кажущийся дефект ткани
вследствие направления ультразвукового луча параллельно межпредсерд-
ной перегородке.
Субкостальная позиция удобна для эхокардиографического исследо-
вания в случаях затрудненной эхолокации из парастернальной позиции,
в частности, у больных с эмфиземой легких, а также для осмотра вер-
хушки левого желудочка для выявления аневризмы.
136
137
Рис. 46. ДопплерЭхоКГ скорости
кровотока через нормальный мит-
ральный клапан
: Л
1 * । ' ' ' • Л I* 4
< ft i v *f* ‘V
Супрастернальную пози-
цию используют для осмотра
крупных сосудов и, в частно-
сти, для диагностики таких
врожденных пороков, как ко-
арктация аорты и открытый
артериальный проток.
В основе метода допплер-
эхокардиографии лежит изме-
нение частоты звуковых волн, которые отражаются от движущихся объек-
тов (так называемый эффект Допплера), в частности, эритроцитов крови
в полостях сердца и сосудах. Исходя из этого, определяют направление и
скорость движения крови. При перемещении крови по направлению к
датчику частота отраженной волны увеличивается, а при ее движении в
противоположном направлении — уменьшается. При этом величина из-
менения частоты прямо пропорциональна скорости движения крови. Ре-
зультат исследования имеет вид графического изображения величины
скорости кровотока в данной точке сердца во времени (рис. 46), что со-
провождается звуковым эффектом, либо изображения локализации и
направления потоков крови на двухмерной эхокардиографии сердца в
реальном масштабе времени.
Допплерэхокардиография позволяет:
1) определять патологическое направление тока крови в сердце при
регургитации на клапанах и наличии аномальных сообщений между по-
лостями сердца и крупными сосудами;
2) определять турбулентность тока крови при его нормальном направ-
лении, что характерно для клапанов и стеноза, рассчитывать величину
градиента давления на них по уравнению Бернулли (ДР = 4*v* 1 2 3 4, где v —
максимальная скорость кровотока);
3) рассчитывать эффективную площадь отверстия митрального и трех-
створчатого клапанов, что имеет важное значение при их стенозировании;
4) количественно оценивать некоторые показатели кардиогемодинамики:
величины давления в полостях сердца, ударный объем и диастолическую
податливость левого желудочка на основе измерения скорости кровотока.
При разделении допплеровских сигналов в зависимости от направле-
ния — к датчику или от него - их можно окрашивать в разные цвета,
яркость которых прямо пропорциональна скорости кровотока. Такая цвет-
ная допплерэхокардиография повышает точность определения
локализации патологических потоков крови и диагностики врожденных
и приобретенных пороков сердца в целом.
138
Рис. 47. ЭхоКГ в М-режиме митрально-
го клапана в норме. Видны передняя
(/IMP) и задняя (PMV) створки мит-
рального клапана. Se — межжелудочко-
вая перегородка. Описание движения
митрального клапана в тексте
Нормальная ЭхоКГ в М-режи-
ме. ЭхоКГ в М-режиме получают
при фиксированном направлении
ультразвукового луча, точное по-
ложение которого относительно
внутрисердечных структур в со-
временных моделях эхокардио-
графов устанавливают из двух-
мерного изображения сердца. Од-
новременно регистрируют ЭКГ и иногда также ФКГ для оценки количе-
ственных показателей, характеризующих размеры и движение структур левых
отделов сердца. Их определяют по короткой оси сердца на трех стандартных
уровнях: 1) на уровне корня аорты и левого предсердия (см. рис. 44,4); 2) на
уровне передней створки митрального клапана (см. рис. 44,2); 3) полости
левого желудочка на уровне хорд митрального клапана (см. рис. 44,/).
Корень аорты представлен двумя параллельными линиями. Позади него
находится левое предсердие. Во время систолы, когда предсердие напол-
няется кровью, аорта движется кпереди, то есть к датчику, а в период
диастолы, после открытия митрального клапана, — кзади. Внутри корня
аорты видны створки аортального клапана, которые имеют характерный
вид коробочки, открывающейся в период систолы и закрывающейся в
начале диастолы (см. рис. 44,4) одновременно с А2. Верхнюю половину
коробочки образует движение правой коронарной створки, а нижнюю —
движение задней створки. Левая коронарная створка при этом не видна.
Кпереди от аорты находится небольшая часть выносящего тракта пра-
вого желудочка. На этом уровне измеряют диаметр левого предсердия и
корня аорты и оценивают движение створок аортального клапана.
На поперечном срезе сердца на уровне митрального клапана кпереди
от него находится межжелудочковая перегородка, а кзади — задняя стен-
ка левого желудочка. Движение передней створки при открытии клапана
в диастолу имеет характерную М-образную форму (рис. 47). Открытие
клапана с началом диастолического наполнения представлено отрезком
DE, за которым следует среднедиастолическое прикрытие EF, которое
очень характерно для движения передней створки в норме. Оно обуслов-
лено уменьшением притока крови в левый желудочек к концу фазы бы-
строго наполнения. Наклон EF зависит от целостности клапанного аппа-
рата и диастолической податливости левого желудочка. Систола предсер-
дий вызывает повторное движение передней створки кпереди (отрезок
139
FA), после чего при закрытии клапана в конце диастолы она проходит
путь А С. Точка С совпадает с I тоном сердца.
Задняя створка митрального клапана движется в противофазе по от-
ношению к передней и со значительно меньшей амплитудой. В период
систолы желудочков (отрезок CD) обе створки сомкнуты. По мере умень-
шения объема левого желудочка к концу периода изгнания клапанное
кольцо смещается кпереди.
Анализ движения створок митрального клапана к этой проекции име-
ет важное значение для диагностики различных поражений клапанного
аппарата, особенно митрального стеноза (рис. 48).
Аналогичный характер имеет движение трехстворчатого клапана, ло-
кация которого в М-режиме связана с определенными трудностями.
Исследование клапана легочной артерии в М-режиме связано с извест-
ными трудностями. Оно проводится из парастернального доступа с на-
правлением ультразвукового луча кверху и кнаружи. Чаще удается увидеть
только заднюю створку, которая в норме лоцируется только в период ди-
астолы, а при легочной гипертензии - и во время систолы (рис. 49). Во
время диастолы створка движется вначале несколько вперед (отрезок е—
е), а затем назад (e’-f). Скорость движения в этом отрезке, то есть наклон
e'-f, зависит от величины давления в легочной артерии. Волна “а” связана
с систолой правого предсердия. Во время систолы желудочков движение
задней створки при открытии клапана имеет сложную траекторию. В самом
начале она резко смещается кзади (отрезок Ьс), а затем более медленно
движется немного кпереди (отрезок cd). В конце систолы клапан быстро
закрывается, и его задняя створка проходит путь d-е. При легочной гипер-
тензии характер движения этой створки значительно изменяется, что имеет
диагностическое значение. Важную качественную и количественную ин-
формацию о величине давления в легочной артерии дает также оценка
систолического потока в ее устье и выносящем тракте правого желудочка
с помощью допплерэхокардиографии. Исследование производят из пара-
стернального доступа по короткой оси на уровне аорты.
полости левого желудочка (см.
рис. 44,5,/) кпереди, ближе к
датчику, находится межжелу-
дочковая перегородка, кото-
рая располагается между эхо-
свободными полостями право-
го (кпереди) и левого (кзади)
желудочков. Во время систолы
На изображении поперечного среза
Рис. 48. ЭхоКГ митрального клапана
в М-режиме при выраженном мит-
ральном стенозе. Видно характерное
П-образное и параллельное одно-
направленное движение передней и
задней створок
140
Рис. 49. ЭхоКГ в М-режиме кла-
пана легочной артерии в норме.
Видно движение его задней створ-
ки в период диастолы. Объяснение
в тексте
левого желудочка межжелу-
дочковая перегородка и его
задняя стенка движутся
кнутри, навстречу друг дру-
гу, обеспечивая изгнание
крови. При этом происходит
их утолщение. Это изображе-
ние позволяет получить важ-
ную информацию о морфо-
функциональном состоянии
левого желудочка, основные
показатели которого включа-
ют:
I. Показатели на-
сосной функции:
1. Поперечный размер
(диаметр) левого желудочка
в конце диастолы и в конце
систолы (КДР и КСР,
рис.44,Б, /). У взрослых здо-
ровых лиц КДР колеблется в
пределах 4,9-5,5 см, КСР - 3,5-3,8 см (О.В.Атьков и соавт., 1992). Позво-
ляет оценить величину полости желудочка и рассчитать КДО и КСО. Для
этой цели существует несколько формул, основанных на допущениях о
различной по сложности геометрии левого желудочка, самая простая из
которых предусматривает возведение КДР и КСР в куб. Широко использу-
ют методику L.Teicholz и соавторов (1972), согласно которой левый желу-
дочек рассматривается как эллипс, объем которого (V) в период систолы
или диастолы рассчитывают как:
V~ 2 4 + Д 'Д3 (см’ ИЛИ МЛ)’
где Д - поперечный диаметр левого желудочка в конце систолы или
диастолы (см).
2. УОС и МОС. УОС=КДО-КСО (см3 или мл); МОС=УОС • ЧСС (л/мин).
II. Показатели сократимости фазы изгнания:
1. Фракция укорочения поперечного размера (AS):
Д8=кдр-кс2-,оо(./.).
КДР
141
2. ФВ:
УОС
ФВ = ——100 (%).
КДО
3. Средняя скорость циркулярного укорочения мышечных волокон (VCF):
Окружность левого желудочка в конце диастолы —
.. _ — его окружность в конце систолы (см) .
vcf „ Iе )
Период изгнания левого желудочка
Нормальные величины этих индексов находятся в пределах: AS — 30—
40 %, ФВ - 50-75 % и VCF - 0,9-1,45 с_| (В.Б.Зарецкий и соавт., 1979;
Н.М.Мухарлямов и соавт., 1981).
III. Показатели толщины межжелудочковой перего-
родки и задней стенки левого желудочка в конце диастолы. Ха-
рактеризуют наличие гипертрофии миокарда и ее выраженность. На ос-
новании величин этих показателей и КДО по специальной формуле с
учетом удельной плотности миокарда, равной 1,05, рассчитывают массу
левого желудочка в граммах.
Нормальные величины основных показателей ЭхоКТ
(по Н.К.Фуркало и соавт., 1990)
Поперечный размер левого желудочка*:
КДР 5±0,1 см
КСР 3,3±0,04см
Объемы левого желудочка:
КДО
КСО
УОС
Толщина стенок левого желудочка
задней
межжелудочковой перегородки
AS
ФВ
VCF
Диаметр левого предсердия
Диаметр корня аорты
Масса миокарда левого желудочка
119+7 см3
45+3 см3
74+4 см3
в конце диастолы:
0,9±0,04 см
0,9+0,04 см
34+3 %
62+1 %
1,2+0,05 сн
3+0,1 см
3,3+0,2 см
134±5 г
Внутренний, то есть между эндокардом межжелудоч-
ковой перегородки и задней стенки.
Необходимо отметить, что расчет показателей ЭхоКТ в М-режиме,
базирующийся на одном поперечном размере левого желудочка, допус-
тим только при условии равномерного и одинакового утолщения его сте-
нок в период систолы. При нарушениях движения отдельных участков
левого желудочка (асинергии), например, при ИБС, объемы и показатели
142
его функции можно достоверно определить только по двухмерному изоб-
ражению желудочка в плоскости его длинной оси из 4- или 2-камерного
вида. Во всех случаях двухмерная эхокардиография обеспечивает боль-
шую точность результатов.
Определение показателей насосной функции левого желудочка по дан-
ным двухмерной эхокардиографии. Для расчета объемов левого желудочка
используют преимущественно два метода. Метод Н.Dodge (1969) состоит
в определении объема желудочка (V), исходя из его площади по длинной
оси, рассчитываемой планиметрически (А2), и длины этой оси (L) ана-
логично расчетам при ангиокардиографии:
X, 8д2 / 3
V = --— (см-* или мл).
3-n-L
Будучи одноплановым, при регионарных нарушениях сократимости он
недостаточно точен, так как не учитывает все локальные изменения дви-
жения стенок левого желудочка. Этого недостатка лишен биплановый ме-
тод Симпсона, основанный на определении объема левого желудочка по
сумме объемов его последовательных горизонтальных срезов с минималь-
ным расстоянием между ними. Для расчета, который производят на ЭВМ,
достаточно ввести контуры левого желудочка в конце диастолы и систолы.
Компьютерный анализ позволяет также количественно определять регио-
нарную сократимость левого желудочка в двух и более сегментах, на кото-
рые делится его изображение, по длинной оси в проекции 4 или 2 камер и
короткой оси на уровне митрального клапана, сосочковых мышц и верхуш-
ки сердца. Расчет основывается на точном наложении систолического изоб-
ражения на диастолическое и определении процентного уменьшения пло-
щади каждого сегмента в период систолы.
Определение показателей насосной функции левого желудочка по дан-
ным допплерэхокардиографии. УОС рассчитывают как произведение интег-
ральной скорости аортального потока и площади поперечного сечения
аорты. Эта площадь определяется, исходя из результатов измерения внут-
реннего диаметра корня аорты в первой половине систолы с помощью
одно- или двухмерной эхокардиографии. В качестве индексов сократимо-
сти фазы изгнания используют показатели максимальной скорости и ус-
корения кровотока в аорте или выносном тракте левого желудочка. Пос-
ледние более точны, так как не зависят от диаметра аорты и ее клапана.
Характер диастолического наполнения левого желудочка и его подат-
ливость можно оценить при анализе трансмитрального кровотока по от-
ношению максимальной скорости раннего наполнения, то есть в фазу
быстрого наполнения, и позднего — во время систолы предсердий — VE/VA
(A.De Maria и соавт., 1991). При снижении диастолической податливости
вклад предсердий в наполнение желудочков увеличивается, что является
важной компенсаторной реакцией. При этом возрастает скорость поздне-
го диастолического наполнения и уменьшается отношение VE/VA.
Сравнительно новым направлением в развитии эхокардиографии яв-
ляется чреспищеводная двухмерная эхокардиография с использованием
143
миниатюрного датчика, который фиксируется на конце гастроскопа. По
мере его продвижения вниз по пищеводу можно рассмотреть дугу аорты,
ее восходящую и нисходящую части, левое предсердие, левый желудочек
и выносящий тракт правого желудочка, двустворчатый клапан и сосоч-
ковые мышцы. Преимущества метода перед общепринятой эхокардиогра-
фией связаны с максимальным приближением к датчику объекта изуче-
ния и отсутствием между ними ткани легкого. Это дает возможность де-
тально рассмотреть аппарат митрального и аортального клапанов и более
точно установить характер их патологических изменений, в том числе
причину дисфункции протезированных клапанов, а также обнаружить
абсцесс клапанного кольца при инфекционном эндокардите. Возможность
просмотреть восходящую и всю нисходящую части аорты, вплоть до дуги,
повышает точность диагностики ее расслоения. Изображение поперечно-
го среза левого желудочка используют во время кардиохирургических
операций для непрерывного мониторирования его функции. Так, нару-
шение диастолической, а затем систолической функции является ран-
ним признаком ишемии миокарда. Получение при чреспищеводной эхо-
кардиографии цветного допплеровского изображения позволяет еще бо-
лее точно оценить выраженность митральной и аортальной недостаточ-
ности и стеноза. Это имеет важное значение для выбора оптимального
метода коррекции митральной недостаточности — пластики или протезиро-
вания клапана — и определения ее эффективности.
Нагрузочная эхокардиография основана на использовании двухмерной
эхокардиографии для выявления локальных изменений движения стенок
левого желудочка при физической нагрузке или повышении потребности
миокарда в кислороде с помощью инфузии добутамина, начиная с 5
мкг/кг/мин с постепенным увеличением дозы до 10, 20 и 30 мкг/кг/мин.
В норме вследствие повышения активности симпатико-адреналовой сис-
темы это вызывает диффузную гиперкинезию. При клинически значи-
мом стенозе коронарной артерии возникает очаговая ишемия миокарда,
которая выявляется по отсутствию увеличения амплитуды экскурсии сег-
мента стенки желудочка или появлению его гипо-, а- или дискинезии.
Поскольку нарушение сегментарной сократимости является более ран-
ним и надежным проявлением ишемии, чем ангинозная боль и измене-
ния ЭКГ, чувствительность и специфичность нагрузочной эхокардиогра-
фии выше, чем обычных тестов с электрокардиографическим контролем
(P.Marcovitz, W.Armstrong, 1992).
ФОНО- И МЕХАНОКАРДИОГРАФИЯ
ФОНОКАРДИОГРАФИЯ
Фонокардиография представляет собой метод графической регистра-
ции звуковых явлений, возникающих при работе сердца, в спектре час-
тот от 15 до 800 Гц. Метод основан на преобразовании звуковых волн в
электрические сигналы с помощью микрофона на пьезоэлектрических
144
ft ift-1 p~’‘ p-
—1 Н(35ГЦ)
Cl(70^
4 ^^02^140Гц)
I'-i Г-л; £•' kJ
:/* ?v\Z yt/u i'iX«
If !j-в^ЭОГц)
$y Wl 'f’i\- Ч1Л
::A $?' V‘
£—dta—<&—&— — В 2(400 Гц)
Рис. 50. ФКГ больного с митральной недостаточностью, зарегистриро-
ванная с использованием различных фильтров. S3 определяется при ис-
пользовании частот А, Ни С, и не регистрируется на высоких частотах.
Наоборот, высокочастотный пансистолический шум не виден при записи
звуков низкой частоты (//)
кристаллах с их последующим усилением и регистрацией. Поскольку ча-
стотная характеристика звуков имеет определенное диагностическое зна-
чение, используют различные фильтры, обеспечивающие регистрацию
звуков с определенными частотными характеристиками: 35, 70, 140 и
400 Гц (табл. 8).
Пример фонокардиографического изображения тонов и шумов сердца при
использовании различных фильтров представлен на рис. 50.
В целом фонокардиография не имеет существенного самостоятельного
диагностического значения, а лишь дополняет аускультацию. Метод при-
меняют в следующих случаях:
1. Для регистрации и уточнения генеза и последовательности звуковых
явлений на протяжении сердечного цикла. Например, фонокардиогра-
фия позволяет отличить расщепление тонов от добавочных тонов.
145
Таблица 8. Частотные характеристики фильтров, применяемых при фонокардиографии,
н характер преимущественно регистрируемых звуков сердца
Частоты Обозначения Частота, Гц Преимущественно регистрируются
Низкие н 35 III и IV тоны сердца
Средаие С, 70 I и II тоны сердца и шумы
С2 140
Высокие В. 250 Шумы и щелчок открытия
В2 400
Аускультативная А 40-140 Воспроизводятся явления, хорошо
воспринимаемые аускультативно
2. Для сопоставления амплитуды тонов и их компонентов, например,
и S2 или А2 и Р2.
3. Для определения временных отношений между различными звуко-
выми феноменами сердечного цикла:
а) между тонами и их компонентами. Так, например, широко исполь-
зуется измерение интервалов А2 - Р2 при различных маневрах и А2 - OS
(OS — щелчок открытия митрального клапана);
б) между тонами и показателями электрической активности сердца по
данным ЭКГ. Диагностическое значение имеет интервал зубец Q — I тон;
в) между различными моментами сердечного цикла при синхронной за-
писи ФКГ и механокардиографических кривых — сфигмо-, флебо-, апекс-
кардиограммы или ЭхоКГ, что позволяет провести фазовый анализ сер-
дечной деятельности (см. ниже).
4. Для уточнения временных отношений шумов к фазам сердечного
цикла (тонам), а также их формы, морфологии, амплитуды и эпицентра,
что имеет определенное диагностическое значение. Например, чем боль-
ше максимум ромбовидного шума изгнания при стенозе устья аорты или
легочной артерии смещен к концу систолы, тем больше сужение отвер-
стия и градиент давления на клапане.
Анализ данных ФКГ в норме и при патологии представлен выше при
характеристике данных аускультации сердца.
МЕХАНОКАРДИОГРАФИЯ
Механокардиографические методы включают группу методов регистра-
ции с различных участков поверхности тела низкочастотных колебаний,
связанных с механической работой сердца. Их используют как в диагности-
ческих целях, так и для оценки тяжести патологии сердца. Клиническое
значение механокардиографических методов возросло после того, как было
доказано, что морфологические и временные характеристики регистриру-
емых кривых определяются главным образом внутрисердечным и внутри-
сосудистым давлением. Их основные преимущества связаны с неинвазив-
ным характером и низкой стоимостью, а ограничения — с непрямым отра-
146
жением внутрисердечной гемодинамики. По мере распространения эхо-
кардиографии как такого же неинвазивного, но значительно более ин-
формативного и точного метода, клиническое применение механокарди-
ографии все более суживается. Среди методов этой группы в настоящее
время на практике используют в основном сфигмо-, флебо- и апекскар-
диографию.
Флебограмма, или кривая пульса яремных вен, регистрируется с по-
мощью пьезоэлектрического преобразователя в надключичной области
кнаружи от места прикрепления грудино-ключично-сосцевидной мыш-
цы. Ее морфология напоминает морфологию кривой давления в правом
предсердии, но не идентична ей. Она определяется различиями между
объемом крови, поступающей и оттекающей от места регистрации с оп-
ределенной задержкой распространения к нему колебаний давления в
сердце. Оценивается только качественно.
Флебографическая кривая состоит из обращенных вершиной кверху,
то есть “положительных” волн “а”, “с” и “v” и обращенных вершиной
книзу “отрицательных” волн “х” и “у” (см. главу 4, рис. 17).
Пресистолическая волна “а”, которая в норме является самой высо-
кой волной флебограммы, обусловлена растяжением вен вследствие со-
кращения правого предсердия. Ее амплитуда определяется главным обра-
зом сопротивлением, испытываемым при наполнении правого желудоч-
ка, которое возрастает, например, при стенозе правого атриовентрику-
лярного отверстия и при уменьшении диастолической податливости же-
лудочка вследствие его гипертрофии (рис. 17,fi). Высокая волна “а” обыч-
но сопровождается правожелудочковым V4.
Отрицательная волна “х” связана с притоком крови из вен в правое
предсердие, который тем больше, чем более активной была систола пред-
сердий, то есть их опорожнение (волна “а”). В норме она является самым
глубоким отклонением флебограммы.
Волна “с” обусловлена смещением трехстворчатого клапана в правое
предсердие и отчасти передаточной пульсацией сонной артерии. Часто
выражена слабо.
Поздняя желудочковая волна “v “ отражает увеличение объема крови
в полых венах и правом предсердии во время систолы желудочков, кото-
рая в норме происходит при закрытых атриовентрикулярных клапанах.
После их открытия кривая резко отклоняется книзу с образованием от-
рицательной волны “у”, которая, как и все отклонения флебограммы,
регистрируется с определенным запаздыванием. Ее глубина определяется
сопротивлением наполнению правого желудочка: чем оно больше, тем
меньше ее амплитуда.
Значительное увеличение амплитуды волны “v” с последующим рез-
ким спадом волны “у” характерно для регургитации крови на
трехстворчатом клапане. При большом объеме обратного тока
волна “v” сливается с волной “с” с исчезновением разделяющего их отрица-
тельного отклонения “х” (так называемая вентрикулизация флебограммы).
147
Рис. 51. ЭКГ, ФКГ, сфигмограмма
(СФ), апексКГ и ее первая производ-
ная (dD/dt). Объяснение в тексте. 1 —
инцизура СФ
Особенностью флебограммы
при констриктивном пе-
рикардите (рис. 17,/) явля-
ется появление глубоких и уз-
ких отрицательных волн “у”.
АпексКГ представляет собой
регистрацию колебаний грудной
клетки над верхушкой левого
желудочка, обусловленных его
движением. Записывается в ме-
сте наилучшего пальпаторного
определения верхушечного тол-
чка в положении больного лежа
на левом боку с помощью мик-
рофона и пьезоэлектрического
преобразователя одновременно
с ЭКГ и ФКГ. Интерес к этому
методу связан с тем, что морфология левожелудочковой апексКГ опреде-
ляется главным образом динамикой давления в левом желудочке. Доказа-
но также тесное совпадение величин индексов сократимости фазы изово-
люмического сокращения - максимальной скорости повышения внутри-
желудочкового давления AP/Atmax и производных от нее показателей, рас-
считываемых по кривой давления в желудочке, с величинами максималь-
ной скорости подъема кривой апексКГ AD/dtniax и ее производных.
Нормальная апексКГ представлена на рис. 51. Ее начальный небольшой
зубец А связан с движением левого желудочка, во время систолы предсер-
дий. Его амплитуда и крутизна отражают диастолическую податливость
желудочка. Крутой подъем зубца А обычно сочетается с тоном 54. Ампли-
туда зубца А и отношение А/И (в %) возрастают при заболеваниях, сопро-
вождающихся выраженной гипертрофией левого желудочка, — стенозе устья
аорты, артериальной гипертензии, гипертрофической кардиомиопатии и др.
Точка Е указывает на начало изгнания крови из левого желудочка и
совпадает с открытием аортального клапана. Точка О соответствует от-
крытию митрального клапана и началу быстрого наполнения желудочка.
Систолическая пульсация, записанная с помощью апексКГ в точке
эегистрации зубцов QS или Qr на ЭКГ, характерна для аневризмы лево-
'о желудочка.
АпексКГ и ее первую производную (AD/dt) можно использовать также
1ЛЯ расчета показателей сократимости фазы изоволюмического сокращения.
Сфигмография представляет собой метод графической регистрации ко-
148
Рис. 52. Фазовый анализ систолы ле-
вого желудочка: ППИ - период пре-
дызгнания; ПИЛЖ — период изгна-
ния левого желудочка. Пунктиром
обозначен характер изменения кри-
вых при сердечной недостаточнос-
ти, при которой отмечается удлине-
ние ППИ и укорочение ПИ при не-
измененном интервале Q— S2; СФ -
сфигмограмма; ЛЖ — левый желу-
дочек
лебаний стенок артерий при
прохождении пульсовой вол-
ны. Характер образующейся
кривой зависит от силы и ско-
рости сердечных сокращений,
УОС, тонуса и эластичности
стенок артерий.
Регистрируемая на сонных
артериях сфигмограмма центрального пульса имеет выраженное сходство с
кривой давления в аорте, что широко используют для фазового анализа
структуры систолы левого желудочка. В то же время сфигмограмма пери-
ферического пульса определяется главным образом особенностями рас-
пространения пульсовой волны в артериях и эластичностью их стенок.
Качественный анализ морфологии каротидной сфигмограммы имеет
диагностическое значение лишь при отдельных заболеваниях и патологи-
ческих состояниях. К ним относятся:
1) клапанный стеноз устья а о р т ы . Кривая характеризуется за-
медлением анакротического подъема и его зазубренностью в виде петуши-
ного гребня, обусловленной систолическим дрожанием и проведением
шума на сосуды шеи;
2) недостаточность аортального кл апа н а . В связи с боль-
шим УОС и низким ОПСС каротидная сфигмограмма характеризуется
крутым подъемом с последующим быстрым снижением и низко распо-
ложенной мало заметной инцизурой (pulsus magnus), которая при значи-
тельной регургитации исчезает. Систолическая волна часто приобретает
форму, соответствующую pulsus bisferiens (см. рис. 18,Д), и сфигмограм-
ма имеет вид клешни рака. Такая ее форма ярко выражена также при
обструктивной форме гипертрофической кардиомио-
патии (идиопатическом гипертрофическом субаортальном стенозе - 3);
4) тяжелая застойная сердечная недостаточность с
низким УОС. Отмечаются пологость восходящей и нисходящей частей
систолической волны и выраженная дикротическая волна.
Фазовый анализ систолы левого желудочка. Одновременно регистрируют
сфигмограмму сонной артерии, ФКГ и ЭКГ и определяют 2 основных
149
Рис. 53. Общий вид рео-
граммы (слева вверху) и
ее первой производной
(/1) и различные вариан-
ты изменений реограммы
легких при: Б — гиперво-
лемии; В - прекапилляр-
ной (артериальной) и Г
- посткапиллярной (ве-
нозной) легочной гипер-
тензии: С — систоличе-
ская, Д - диастолическая
часть реограммы
интервала: период
предызгнания (ППИ)
и период изгнания левого желудочка (ПИ). ПИ измеряют от начала подъе-
ма систолической кривой сфигмограммы до ее инцизуры, а ППИ вычис-
ляют по формуле: ППИ=(0-/12)-ПИ, где Q~A2, или электромеханиче-
ская систола левого желудочка, — интервал от начала желудочкового комп-
лекса ЭКГ до II тона (рис. 52). При этом ПИ по данным его непрямого
измерения достаточно хорошо совпадает с результатами прямой регистра-
ции на кривой давления в аорте. Более важным показателем фазового ана-
лиза является ППИ, который соответствует средней скорости подъема
внутрижелудочкового давления (dp/dt) в период изоволюмического со-
кращения и относится к индексам сократимости этого периода. Оба пока-
зателя, особенно ППИ, и их отношение ППИ/ПИ отражают инотропное
состояние миокарда, укорачиваясь под воздействием положительных ино-
тропных агентов и удлиняясь под действием отрицательных. Их информа-
тивность как индексов сократимости, однако, ограничена из-за чувстви-
тельности к пред- и постнагрузке (укорачиваются при снижении диасто-
лического давления в аорте и повышении КДД в левом желудочке, боль-
ше ППИ), величине УОС (при его уменьшении ППИ удлиняется, а ПИ
укорачивается), а также ЧСС. Удобны для мониторинга функционального
состояния миокарда у постели больного при отсутствии существенных ко-
лебаний гемодинамических показателей, от которых они зависят. В насто-
ящее время с появлением эхокардиографии применение фазового анали-
за значительно ограничилось.
Реография — метод исследования пульсового кровенаполнения орга-
нов и частей тела, основанный на регистрации изменений тока высокой
частоты во время прохождения через ткани. Эти изменения пропорцио-
нальны меняющемуся электрическому сопротивлению тканей, которое
находится в обратной зависимости от степени кровенаполнения. В насто-
ящее время тетраполярной реографии с помощью двух генераторных (то-
ковых) и двух измерительных электродов как более точному методу от-
дают предпочтение перед биполярной (двухэлектродной).
Реограмма представляет собой пульсовые колебания электрического
150
сопротивления частей тела. Ее принято рассматривать в обратной поляр-
ности, когда снижению сопротивления соответствует подъем кривой, од-
новременно с первой производной и ЭКГ. На ней различают систоличес-
кую часть, которая образуется под влиянием артериального притока кро-
ви, и диастолическую, связанную с венозным оттоком (рис. 53). По реог-
рафической кривой с помощью специальных формул рассчитывают ряд
показателей, косвенно отражающих кровенаполнение артериального рус-
ла, венозный отток, тонус артерий и вен.
В зависимости от зоны исследования различают реографию транстора-
кальную (грудную), легких, сосудов мозга (реоэнцефалографию), сосу-
дов конечностей (реовазографию) и др.
Тетраполярную грудную реографию применяют как про-
стой неинвазивный метод определения УОС и МОС расчетным путем по
данным изменения сопротивления в течение периода изгнания и расстояния
между измеряющими его электродами, которые фиксируются вокруг осно-
вания шеи и грудной клетки на уровне мечевидного отростка. Ее применяют
преимущественно для исследований в динамике, например, при нагру-
зочных пробах, с оценкой изменений УОС и МОС в процентах от исход-
ных величин, так как их абсолютные значения весьма неточные. Из-за
этого в настоящее время грудная реография вытесняется эхокардиографией.
Качественная и количественная оценка биполярных реограмм лег-
ких позволяет косвенно судить о кровенаполнении системы легочной
артерии во время изгнания крови правым желудочком и оттоке крови из
легочных вен в левое предсердие. Увеличение амплитуды и крутизны сис-
толической волны, слабая выраженность инцизуры и диастолической волны
свойственны гиперволемии малого круга кровообращения (рис. 53, Z>). Для
прекапиллярной легочной гипертензии характерно некоторое уменьше-
ние амплитуды и закругление вершины систолической волны, высоко рас-
положенная инцизура и приподнятая диастолическая волна (рис. 53,5).FI-
ри посткапиллярной легочной гипертензии двугорбость реографической
кривой резко выражена за счет значительного увеличения диастолической
волны вследствие затруднения оттока крови из легочных вен в левое пред-
сердие (рис. 53,/)- Как и в случае всех других вариантов реографии, эти
данные носят ориентировочный характер и могут быть использованы при
невозможности применения более сложных и точных методов.
РАДИОНУКЛИДНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ СЕРДЦА
Основными показаниями к выполнению радионуклидных исследова-
ний при сердечно-сосудистых заболеваниях являются:
1) оценка систолической и диастолической функций сердца с помо-
щью радионуклидной вентрикулографии;
2) оценка перфузии миокарда;
3) диагностика острого инфаркта с помощью радиоактивных нуклидов;
4) оценка регионарной перфузии легких путем их сканирования.
151
Радионуклидная вентрикулография основывается на использовании вве-
денного в периферическую вену радиоактивного индикатора для полу-
чения серии (30 и более) изображений камер сердца и крупных сосудов
в течение сердечного цикла. РВГ выполняют на гамма-камере в одной
или двух проекциях с использованием короткоживущих нуклидов, обыч-
но технеция (99п1Тс), которым метят эритроциты. Существует два метода.
При одном из них сцинтилляционная камера регистрирует первое про-
хождение индикатора через правые отделы сердца, легкие и левые от-
делы сердца, а при другом анализируют 300-400 сокращений сердца
после достижения равномерного распределения нуклида в циркулирую-
щей крови. С помощью компьютера в каждом сердечном цикле покадро-
во через равные промежутки времени с использованием в качестве точки
отсчета зубца R на ЭКГ получают изображения пространственного рас-
пределения нуклида, то есть контура желудочков, и “изосчета” крови в
них. Так как количество регистрируемых импульсов после вычитания
фона пропорционально объему крови, можно количественно опреде-
лить КДО, КСО, УОС, ФВ и скорость изгнания и наполнения обоих
желудочков, а также при наличии внутрисердечного шунта его объем.
Диагностические возможности РВГ в целом сходны с рентгеноконтраст-
ной вентрикулографией, однако ее разрешающая способность меньше. РВГ
находит наибольшее применение как точный и воспроизводимый метод оцен-
ки показателей функции левого и правого желудочков, особенно при
нагрузочных тестах, а также для выявления зон асинергий, особенно анев-
ризмы левого желудочка, у больных ИБС. Так, отсутствие увеличения ФВ
более чем на 5 % на последнем этапе нагрузки и появление одного или
более нового участка нарушения движения стенки левого желудочка
позволяют диагностировать ИБС с чувствительностью 90 % и специфично-
стью 60 %.
Перфузионная сцинтиграфия миокарда с 20,Т1. Определение перфузии
миокарда с помощью аналога К+ 201Т1 основывается на способности ин-
тактных кардиомиоцитов активно накапливать нуклид, которая прямо
пропорциональна регионарному кровотоку. 20|Т1 накапливается в мио-
карде так же быстро, как К+, поэтому сцинтиграфическое исследование
на гамма-камере выполняют не позднее чем через 5-10 мин после его
внутривенного введения. В более поздние сроки наступает его перерасп-
ределение с равномерной аккумуляцией во всех кардиомиоцитах с ин-
тактной клеточной мембраной. В участках некроза, фиброза и ишемии
поглощение 20|Т1 уменьшается, и они имеют вид холодных очагов.
Сцинтиграфию миокарда с 201Т1 чаще всего используют для обнаруже-
ния или исключения ишемии миокарда, вызываемой физической нагруз-
кой, электрокардиостимуляцией или дипиридамоловой пробой, для под-
тверждения или исключения ИБС в случаях неинформативных изменений
на ЭКГ при обычном нагрузочном тестировании. Индикатор вводят внутри-
венно на последней ступени нагрузки, после чего через 5—10 мин произ-
водят исследование в 3 проекциях в связи со сферической формой сердца.
152
В норме на сцинтиграмме определяется гомогенное распределение инди-
катора в миокарде левого желудочка. Правый желудочек, имеющий мень-
шую массу, виден только при выраженной гипертрофии и значительной
физической нагрузке. При ишемии или инфаркте миокарда — остром либо
“старом” — виден один или несколько “холодных очагов”. В случаях ишемии
вследствие перераспределения нуклида при повторном исследовании спустя
несколько часов они исчезают и сохраняются лишь в зонах некроза или
склероза. Определение “изосчета” в отдельных сегментах левого желудоч-
ка с помощью компьютера в динамике в виде кривой “время—активность”
позволяет количественно оценить дефекты накопления и их стойкость.
Нагрузочная сцинтиграфия с 201Т1 повышает чувствительность нагрузоч-
ного тестирования с электрокардиографическим контролем с 60 до 80 % и
его специфичность с 80 до 90 %. Количество и распространенность выявля-
емых при исследовании обратимых и необратимых дефектов перфузии име-
ют также важное прогностическое значение в отношении выживаемости
больных. Метод не позволяет отличить острый инфаркт миокарда от “старо-
го” и уступает по информативности в отношении диагностики острого ин-
фаркта миокарда определению кардиоспецифических ферментов в крови.
Благодаря короткому периоду полужизни 201Т1 (72 ч) исследование
можно повторять в динамике.
Сцинтиграфия очага острого инфаркта миокарда с помощью 99п>Тс-пиро-
фосфата основывается на способности этого нуклида накапливаться в очаге
некроза в результате связывания с Са2+ и денатурированными органичес-
кими макромолекулами в кардиомиоцитах, находящихся в состоянии нео-
братимого повреждения. Как известно, гибель клетки сопровождается на-
рушением функции мембранных насосов с притоком Са2+, которые акку-
мулируются в митохондриях, что служит критерием необратимого ише-
мического повреждения. При этом в зоне некроза повышается уровень
радиоактивности, и он имеет вид “горячего очага”.
Индикатор вводят внутривенно. Сцинтиграфическое исследование на
гамма-камере в трех проекциях проводят не ранее чем через 90 мин, ког-
да кровь очищается от нуклида вследствие его поглощения в основном
костной тканью. Условием для получения положительного результата яв-
ляется сохранение остаточного коллатерального кровотока (до 10-40 %).
Очаг инфаркта определяется уже через 24 ч от начала заболевания и
перестает визуализироваться в среднем через 8—10 сут. Включение инди-
катора в более поздние сроки указывает на замедление репаративных про-
цессов и возможное развитие аневризмы сердца.
Метод показан для верификации острого инфаркта миокарда при не-
возможности применения традиционных методов его диагностики или
при их неинформативности, например спустя 48—72 ч, когда уровень
кардиоспецифического фермента КФК нормализуется, или при трудно-
стях интерпретации ЭКГ при наличии блокады левой ножки пучка Гиса
или рубцовых изменений. Он не позволяет точно количественно оценить
размеры инфаркта. Чувствительность и специфичность при трансмураль-
153
ном инфарцировании — 90 %. Положительный результат получают также
при некоронарогенных некрозах миокарда, например, у некоторых боль-
ных с дилатационной кардиомиопатией и нестабильной стенокардией.
Сканирование легких производят на гамма-камере после внутривенно-
го введения частиц альбумина, меченных 99,”Тс. Оно позволяет оценить
регионарную перфузию легких и обнаруживать ее дефекты, характерные
для ТЭВЛА. Подробнее об этом методе см. главу 13.
КИНОКОМПЬЮТЕРНАЯ ТОМОГРАФИЯ, ЯДЕРНО-МАГНИТНЫЙ
РЕЗОНАНС И ДРУГИЕ НОВЫЕ НЕИНВАЗИВНЫЕ МЕТОДЫ
ВИЗУАЛИЗАЦИИ СЕРДЦА
Новые неинвазивные методы визуализации сердца — компьютерная то-
мография, ядерно-магнитный резонанс и другие — обладают высокой
разрешающей способностью и позволяют получить пространственное изоб-
ражение строения сердца и количественно определить размеры и функ-
цию его структур. В этом отношении их информативность не уступает и
даже превышает диагностические возможности инвазивной рентгенокон-
трастной ангиокардиографии. Позитронно-эмиссионная томография и маг-
нитно-резонансная спектроскопия открывают возможности оценки ме-
таболизма миокарда. Эти методы находятся в состоянии разработки, и их
диагностические возможности еще в полной мере не изучены.
С помощью кинокомпьютерной томографии получают множественные се-
рийные “срезы” сердца и окружающих тканей грудной клетки толщиной
от 2 до 20 мм в динамике сердечного цикла с интервалами до 8 мс и
реконструируют его трехмерное изображение в движении, а также изоб-
ражение в других плоскостях, что невозможно осуществить с помощью
ангиокардиографии. Для увеличения удельного веса крови в полостях и
лучшего контрастирования ткани сердца предварительно в периферичес-
кую вену вводят небольшое количество йодсодержащего контрастного ве-
щества. Благодаря четкому изображению границ эндо- и эпикарда путем
планиметрии последовательных тонких срезов сердца с помощью компь-
ютера с высокой степенью точности и воспроизводимости, можно опре-
делять величину объемов полостей и толщину стенок желудочков в дина-
мике сердечного цикла. Все остальные используемые в настоящее время
методы расчета этих показателей менее точны, так как исходят из допу-
щений, базирующихся на использовании различных геометрических мо-
делей и данных нескольких измерений в одной плоскости.
Основными показаниями к применению кинокомпьютернойтомо-
графии являются:
1. Заболевания грудной части аорты: а) расслоение; б) аневризма.
2. Заболевания перикарда: а) констриктивный перикардит; б) кисты и
опухоли перикарда.
3. Внутри- и внесердечные объемные образования: а) опухоли;
б) тромбы.
154
4. Проходимость обходных шунтов коронарных артерий.
5. Осложнения инфаркта миокарда: а) аневризма; б) тромбоз левого
желудочка.
6. Количественная оценка: а) обшей и регионарной функции желу-
дочков (объема, толщины стенок и др.), в том числе в динамике во
время различных вмешательств, например, нагрузочных проб;
б) распределения гипертрофии миокарда при гипертрофической
кардиомиопатии; г) регионарной перфузии миокарда.
Поскольку диагностические возможности метода находятся в процессе
изучения, эти показания будут уточняться. В настоящее время кинокомпью-
терная томография может служить методом выбора при диагностике конс-
триктивного перикардита, прямыми признаками которого являются утол-
щение перикарда свыше 4 мм и обнаружение кальцинатов, а также опухо-
лей перикарда. Она является наиболее информативным методом оценки
проходимости аортокоронарных шунтов у оперированных больных, а так-
же выявления тромбов в полостях сердца, особенно в тонкостенных пред-
сердиях. Метод очень эффективен при диагностике болезней аорты, осо-
бенно расслаивающей аневризмы, сложных анатомических вариантов ги-
пертрофической кардиомиопатии, регионарных нарушений движения сте-
нок левого желудочка при ИБС, а также тромбоэмболии относительно
крупных ветвей легочной артерии с оценкой локализации и величины
тромбов. В то же время при врожденных и приобретенных пороках сердца
кинокомпьютерная томография имеет ограниченную информативность,
уступая допплерэхокардиографии и ядерно-магнитному резонансу.
Ядерно-магнитный резонанс. Получение статического и динамического
изображения различных срезов сердца и сосудов с помощью ядерно-маг-
нитного резонанса базируется на регистрации сигналов высокой частоты,
испускаемых ядрами водорода тканей после их “возмущения” короткими
высокочастотными импульсами в присутствии сильного магнитного поля.
Характер изображения определяется различной плотностью протонов в
тех или иных участках изучаемого объекта и различиями испускаемых ими
сигналов.
Основными показаниями к применению ядерно-магнитного резо-
нанса являются:
1. Заболевания грудной части аорты: а) расслоение; б) аневризма;
в) тромбоз; г) аортит; д) кровотечение.
2. Заболевания перикарда: а) констриктивный перикардит; б) гемор-
рагический и негеморрагический экссудативный перикардит; в)
кисты и опухоли перикарда.
3. Внутри- и внесердечные объемные образования: а) опухоли; б)
тромбы.
4. Гипертрофическая кардиомиопатия (различные анатомические
варианты).
5. Осложнения инфаркта миокарда: а) аневризма; б) тромбоз левого
желудочка.
155
6. Врожденные пороки сердца: а) аномалии грудной части аорты, в
том числе коарктация; б) аномалии легочной артерии (атрезия,
надклапанный стеноз); в) сложные пороки.
7. Оценка функции желудочков: а) объема и массы желудочков;
б) регионарной функции левого желудочка; в) выявление и коли-
чественная оценка регургитации на клапанах.
Поскольку по точности визуализации анатомии сердца и крупных со-
судов ядерно-магнитный резонанс не уступает ангиокардиографии, он
особенно ценен для диагностики сложных врожденных пороков сердца у
маленьких детей.
Ядерно-магнитная спектроскопия позволяет неинвазивным путем оп-
ределять относительное содержание КФ, АТФ и неорганического фос-
фора в единице объема миокарда. Это открывает возможности для изуче-
ния изменения метаболизма миокарда и оценки его жизнеспособности
при ишемии и различных токсических воздействиях. Метод пока не полу-
чил распространения в клинике.
Позитронная эмиссионная томография. В основе получаемого томогра-
фического изображения сердца и других органов и тканей лежит различ-
ная концентрация и локализация в них излучателей позитронов. Позит-
рон — это положительно заряженный электрон, который образуется при
позитронном распаде ядра. После его взаимодействия с соседним элект-
роном образуется пара фотонов, которые излучаются в противополож-
ных направлениях с одинаковой скоростью. Точное место образования
этих фотонов определяется с помощью их детекторов, располагающихся
вокруг испытуемого. Метод позволяет оценить регионарную перфузию,
метаболизм миокарда и его жизнеспособность с помощью различных изо-
топов — излучателей позитронов.
По сравнению со сцинтиграфией с 201Т1 позитронная эмиссионная
томография с меченным по l3N аммонием более точно определяет регио-
нарный коронарный кровоток. Одновременно оценивая регионарное по-
глощение миокардом экзогенной глюкозы, меченной 18F, можно судить
о жизнеспособности отдельных участков миокарда. Дефект накопления в
нем обоих нуклидов характерен для необратимого повреждения кардио-
миоцитов или рубца, в то время как отсутствие перфузии при сохране-
нии поглощения меченной глюкозы указывает на обратимость очагового
ишемического повреждения.
Возобновление утилизации миокардом меченных экзогенных жирных
кислот после тромболизиса позволяет оценить достигаемое им “спасе-
ние” ишемизированного миокарда от необратимого повреждения. В на-
стоящее время начато использование метода в клинике для выявления
ишемизированного миокарда и определения его потенциальной жизне-
способности и регионарной перфузии при острой и хронической ИБС.
156
СПЕЦИАЛЬНЫЕ ИНВАЗИВНЫЕ МЕТОДЫ
КАТЕТЕРИЗАЦИЯ СЕРДЦА И АНГИОКАРДИОГРАФИЯ
Катетеризация сердца и ангиокардиография являются наиболее распрост-
раненными методами инвазивного обследования кардиологических больных.
Они служат “золотым стандартом” для оценки структуры и функции сердца
и сосудов и определения диагностической ценности различных неинва-
зивных методов исследования.
Показания. Диагностическую катетеризацию сердца применяют в целях:
1) подтверждения характера поражения сосудов, клапанов и миокарда,
предполагаемого на основании клинического и неинвазивного об-
следования;
2) уточнения тяжести этого поражения;
3) оценки функции миокарда и патофизиологических механизмов его на-
рушений.
Она показана в первую очередь в случаях, когда предполагается карди-
охирургическое вмешательство, для установления возможно более точно-
го и полного диагноза. В последние годы эта задача часто адекватно реша-
ется с помощью информативных неинвазивных методов — двухмерной
допплерэхокардиографии, кинокомпьютерной томографии и ядерно-
магнитного резонанса. Однако до настоящего времени катетеризация сер-
дца остается незаменимым методом получения точной информации о со-
стоянии коронарных артерий для оценки показаний к хирургическому ле-
чению их поражений, а также о давлении в полостях сердца, прежде всего
КДЦ, и легочной артерии при подозрении на ее гипертензию. Чаще всего
ее применяют у больных ИБС. Не утратила своего значения и оценка выра-
женности стеноза клапанов путем измерения градиента давления на них
для уточнения показаний к хирургической коррекции. Это особенно важно
при “средних” градиентах, точность оценки которых с помощью допплер-
эхокардиографии ограничивается зависимостью результатов измерения от
кровотока. При других приобретенных и врожденных пороках сердца, забо-
леваниях миокарда и перикарда катетеризация сердца позволяет уточнить
состояние кардиогемодинамики, что необходимо для оптимизации такти-
ки лечения и оценки прогноза. Она обязательна во всех случаях решения
вопроса о хирургическом лечении при сомнениях в диагнозе и несоответ-
ствии данных клинического и неинвазивных методов обследования.
Относительными противопоказаниями к катетеризации
сердца и ангиографии являются:
1) некупированная электрическая нестабильность желудочков сердца
в связи с повышенным риском возникновения во время катетеризации
стойкой желудочковой тахикардии и фибрилляции желудочков;
2) некорригированная гипокалиемия и гликозидная интоксикация;
3) некорригированная артериальная гипертензия, которая предраспо-
лагает к развитию ишемии миокарда или острой сердечной недостаточ-
ности во время ангиографии;
157
4) интеркуррентное заболевание, протекающее с повышением темпе-
ратуры тела;
5) декомпенсированная сердечная недостаточность, особенно острая ле-
вожелудочковая;
6) гипокоагуляция крови;
7) аллергия к рентгеноконтрастному веществу;
8) тяжелая почечная недостаточность.
К факторам повышенного риска летального исхода при катетеризации
сердца относятся:
1) возраст до 1 года и старше 70 лет;
2) IV функциональный класс по классификации Нью-Йоркской ассо-
циации кардиологов (NYHA). У таких больных летальность более чем в 10
раз выше, чем при I-П классе;
3) локализация стенозирующего поражения коронарных артерий серд-
ца в области ствола левой коронарной артерии. Сопряжена с 10-кратным
повышением летальности по сравнению с поражением 1~2 сосудов дру-
гой локализации;
4) выраженная дисфункция левого желудочка. Детальность при ФВ < 30 %
более чем в 10 раз выше, чем при ее величине > 50 %;
5) тяжелые сопутствующие заболевания: почечная недостаточность, ин-
сулинзависимый сахарный диабет, тяжелое поражение мозговых и перифе-
рических сосудов, тяжелая легочная недостаточность.
Методика. Катетеризация сердца заключается во введении длинных
полых рентгеноконтрастных трубок — катетеров — в сердце через перифе-
рическую артерию или вену под местной анестезией. Положение конца
катетера при его продвижении определяют с помощью рентгенологичес-
кого контроля, а также регистрации кривых давления в том отделе сер-
дечно-сосудистой системы, где он находится, которые имеют характер-
ную форму и параметры давления.
Катетеризацию правых отделов сердца выполняют обычно по методу
Seidinger через бедренную вену путем чрескожной пункции специальной
иглой. Реже используют доступ через плечевую вену путем венесекции под
контролем зрения. Через иглу в вену вводят металлический проводник, после
чего ее удаляют, а по проводнику проводят катетер, и проводник извлекают.
Катетер последовательно проводят в верхнюю полую вену, правое предсер-
дие, правый желудочек, ствол легочной артерии и одну из ее ветвей до ее
заклинивания, то есть до полного прекращения кровотока по этому сегменту.
Катетеризацию левых отделов сердца в большинстве случаев выполня-
ют чрескожно аналогично зондированию правых отделов через бедрен-
ную артерию (метод Judkins), реже через плечевую по методу Sones с
проведением катетера ретроградно через аорту и левые предсердие и же-
лудочек. Изредка используют транссептальный доступ из правого пред-
сердия путем пункции межжелудочковой перегородки или непосредствен-
ную чрескожную пункцию левого желудочка в области его верхушки. Транс-
септальная катетеризация требует высокой квалификации врача. Основ-
158
Рис. 54. Давление в левом желудочке (ЛЖ), лучевой артерии и “заклинивающее” давле-
ние в легочных капиллярах (ЗДЛК) у больного с нормальной функцией сердечно-сосу-
дистой системы (Л). Видно отсутствие градиента давления между левым желудочком и
лучевой артерией в период систолы и между левым желудочком и легочными капилляра-
ми во время диастолы. Б — давление в левом желудочке и “заклинивающее” давление в
легочных капиллярах у больного с митральным стенозом. Виден диастолический гради-
ент давления (заштрихован)
ными показаниями к ней являются выраженный стеноз устья аорты, ког-
да не проходит катетер из аорты, необходимость выполнения баллончико-
вой ангиопластики митрального клапана при его стенозе и катетеризация
левого желудочка у больного с протезированным аортальным клапаном.
Наличие открытого овального окна или дефекта межпредсердной пе-
регородки позволяет катетеризировать левые отделы сердца через правое
предсердие. Во многих случаях, однако, среднее давление в левом пред-
сердии и примерно равное ему КДД в левом желудочке можно с доста-
точной точностью оценивать косвенно по величине “заклинивающего”
давления в легочной артерии, кривая которого практически идентична
кривой давления в левом предсердии.
Анализ результатов катетеризации сердца и их диагностическое значение.
Используемые в диагностических целях результаты катетеризации включают:
1) измерение давления в каждом отделе сердца и крупных сосудов;
2) измерение насыщения гемоглобина кислородом в пробах крови, взя-
тых через катетер в каждом из этих отделов;
159
3) введение через катетер рентгеноконтрастного вещества и выполне-
ние селективной ангиокардиографии;
4) биопсию кусочков миокарда желудочков.
Давление измеряют с помощью тензиометрического преобра-
зователя давления или, что значительно дороже, высокочувствительного
манометра, который находится на конце специального катетера. Нор-
мальные величины давления приведены в табл. 4.
1.Оценка формы кривой давления позволяет определить ме-
стонахождение катетера — в предсердии, желудочке или артерии (рис. 54).
Изменения формы кривой могут иметь диагностическое значение при
некоторых заболеваниях. Например, для недостаточности атриовентри-
кулярных клапанов характерно увеличение амплитуды волны “v” на кри-
вой давления в предсердии, которая начинает напоминать кривую давле-
ния в желудочке (так называемая вентрикулизация кривой). Констрик-
тивному перикардиту свойственно резкое повышение давления в желу-
дочках в начале диастолы сразу после окончания периода быстрого на-
полнения с последующим плато, вследствие чего кривая диастолическо-
го давления приобретает форму квадратного корня.
2.Оценка абсолютных величин д а в л е н и я . Например, по-
вышение систолического давления в легочной артерии и правом желу-
дочке свидетельствует о легочной гипертензии, а повышение КДД в ле-
вом желудочке — о снижении его насосной функции. Зная величины на-
чального и конечного диастолического давления и объема желудочка,
можно рассчитать показатели диастолической податливости его камеры.
3. Сравнение величин давления в соседних камерах
сердца или крупных сосудах. При синхронной записи кривых
давления видно, что в норме в период систолы давление в левом желудоч-
ке равно давлению в аорте. Во время диастолы оно становится равным
давлению в левом предсердии или “заклинивающему” давлению в легоч-
ной артерии, кривая которого практически идентична кривой давления в
левом предсердии (рис. 54,Я). Более высокий уровень систолического дав-
ления в выносящем тракте левого желудочка, чем в аорте, — так называ-
емый систолический градиент давления на аортальном клапане — обус-
ловлен наличием препятствия изгнанию крови в этой области, что свой-
ственно стенозу устья аорты. Градиент между давлением в левом предсер-
дии, или “заклинивающим” давлением в легочной артерии, и давлением
в полости левого желудочка в период диастолы (рис. 54, Б) характерен для
митрального стеноза и встречается также при миксоме (опухоли на нож-
ке) левого предсердия. Чем больше величина градиента давления, тем
больше выраженность стеноза.
Мониторинг давления в легочной артерии у постели больного с помощью
“плавающего” катетера, постановка которого не требует рентгенологи-
ческого контроля, проводят в отделениях реанимации. Для этого исполь-
зуют специальные венозные катетеры типа Сван-Ганца с баллончиком
на конце. Их вводят через подключичную или внутреннюю яремную вену
160
путем пункции или через периферическую вену путем венесекции. При
раздувании баллончика газом катетер, находящийся в правом предсер-
дии, увлекается током крови, легко попадает в легочную артерию и “зак-
линивает” ее ветви. Положение конца катетера определяют по форме ре-
гистрируемой кривой давления.
Повышение систолического давления в легочной артерии отмечается
при легочной гипертензии, изолированной правожелудочковой недоста-
точности, застойной бивентрикулярной сердечной недостаточности, там-
понаде сердца и констриктивном перикардите. Диастолическое давление в
легочной артерии примерно соответствует среднему давлению в левом пред-
сердии и КДД в левом желудочке и может использоваться для их косвен-
ной оценки при отсутствии заболеваний, которые приводят к развитию
активной легочной гипертензии (митрального стеноза, хронических об-
структивных заболеваний легких, ТЭВЛА и др.), а также тахикардии свы-
ше 130 ударов в 1 мин. В подобных случаях необходимо использовать “зак-
линивающее” давление в легочной артерии. Диастолическое давление в
легочной артерии повышается при нарушении систолического опорожне-
ния левого желудочка при его недостаточности и снижается при гипово-
лемии, разграничение которых очень важно для уточнения генеза систем-
ной артериальной гипотензии при шоке.
Измерение диастолического давления в легочной артерии или “закли-
нивающего” давления в так называемых легочных капиллярах в динами-
ке у постели больного позволяет судить о выраженности нарушения на-
сосной функции сердца и выявить ее причину, например, отличить шок
вследствие ТЭВЛА от острой левожелудочковой недостаточности при ин-
фаркте миокарда. Оно дает возможность оценивать водный баланс и со-
судистый тонус, регулировать инфузию плазмозаменителей, симпатоми-
метиков, периферических вазодилататоров и других препаратов.
Основными показаниями к мониторингу давления в легочной артерии
у постели больного являются острая сердечная и сосудистая недостаточ-
ность у больных инфарктом миокарда и после кардиохирургических опе-
раций, а также все другие случаи нестабильности гемодинамики, требу-
ющие интенсивной патогенетической терапии.
Осложнения венозной катетеризации встречаются редко, менее чем в 1 %
случаев. Они включают инфицирование, тромбофлебит, ТЭВЛА и у еди-
ничных больных инфекционный эндокардит, отрыв катетера, воздуш-
ную эмболию, перфорацию легочной артерии, пневмоторакс и узлооб-
разование. Даже при отсутствии осложнений желательно менять место
катетеризации каждые 72 ч.
Измерение насыщения гемоглобина кислородом. В норме в правых отделах
сердца — полых венах, правом предсердии, правом желудочке и легоч-
ной артерии - оно составляет 60-75 %, а в левых — легочных венах,
левом предсердии, левом желудочке и аорте - 95-99 %. Его измерение
позволяет определить:
161
1) наличие патологического сообщения между полостя-
ми сердца (предсердиями, желудочками) или крупными сосудами (аор-
той и легочной артерией), его локализацию и направление сброса крови.
Например, если в полости правого желудочка насыщение больше, чем в
правом предсердии и полой вене, то имеется дефект межжелудочковой
перегородки с шунтированием крови из левого желудочка в правый;
2)М0С большого круга кровообращения спомощьюпря-
мого метода Фика, исходя из величин насыщения гемоглобина крови кис-
лородом на “входе” и “выходе”, то ость в начале и в конце большого или
малого круга кровообращения, и поглощения организмом кислорода в
1 мин:
мосг / 1 = поглощение кислорода (мл/мин)
(л/мин) артериовенозная разница по кислороду (мл/л)'
При определении МОС большого круга кровообращения, то есть сис-
темного кровотока, артериовенозная разница определяется как разность
содержания кислорода в артериальной крови и смешанной венозной кро-
ви в легочной артерии, а при оценке МОС малого круга кровообращения,
или легочного кровотока, — как разность его содержания в пробах крови
из легочных вены и артерии. В норме системный и легочный кровоток
равны по величине. При наличии шунтирования крови разница между МОС
большого и малого круга кровообращения характеризует его величину.
МОС можно определить также методом термодилюции с ис-
пользованием специального катетера с термистором на конце и компью-
тера для расчетов. Метод основан на регистрации и автоматическом ин-
тегрировании изменений температуры в сосуде, находящемся ниже по
току крови по отношению к месту введения индикатора — охлажденного
ниже температуры крови изотонического раствора натрия хлорида или
5 % раствора глюкозы. Этот интеграл обратно пропорционален объемно-
му кровотоку в области термистора. Для повышения достоверности полу-
чаемых результатов индикатор лучше вводить в правое предсердие, а тер-
мистор располагать в легочной артерии.
В области низких величин МОС точность метода термодилюции усту-
пает методу Фика.
Исходя из величин давления в полостях сердца и сосудах и МОС,
рассчитывают ОПСС и ЛСС (см. выше).
Ангиокардиография заключается во введении рентгеноконтрастного ве-
щества чарез катетер в ту или иную камеру сердца или сосуд вручную
либо с помощью автоматического шприца с последующей регистрацией
его распространения в одной или нескольких проекциях на кино- или
видеопленку (35 мм, скорость до 50 кадров в 1 с).
Йодсодержащее контрастное вещество вводят в дозе до 2 мл на 1 кг
массы тела без риска вызвать серьезные осложнения. Часто это вызывает
преходящее повышение диастолического давления в желудочках, особенно
при исходном нарушении их функции, что несколько искажает результаты
162
Рис. 55. Схематическое изображение
конечно-диастолического (сплошная
линия) и конечно-систолического
(пунктир) силуэтов левого желудоч-
ка при левосторонней вентрикуло-
графии в норме (Л) и при различных
вариантах регионарного нарушения
движения отдельных сегментов стен-
ки желудочка (Б, В, Г): Б - гипо-
кинезия и В — акинезия переднего и
верхушечного сегментов; Г — диски-
незия небольшого сегмента
передней стенки
оценки гемодинамики. Для по-
лучения качественного изобра-
жения требуется высокая кон-
центрация контрастного веще-
ства в сердце, что достигается введением его достаточно большого количества.
При левосторонней вентрикулографии контрастное вещество вводят в
полость левого желудочка, после чего его движущееся изображение за-
писывается на пленку в правой передней косой или других проекциях.
Метод позволяет оценить:
1) форму левого желудочка и движение его стенок. В норме систоличес-
кое движение стенок желудочка кнутри равномерно и симметрично (рис.
55,Л). Различают несколько вариантов локальных нарушений этого движе-
ния в отдельных участках левого желудочка (рис. 55, Б,В, Г): а) гипоки-
незию — уменьшение амплитуды движения, то есть сокращения сег-
мента стенки желудочка; б) акинезию - полное отсутствие движения
во время систолы (сегмент не сокращается); в) дискинезию — пара-
доксальное систолическое выбухание сегмента стенки желудочка. Обнару-
жение дискинезии позволяет диагностировать аневризму левого желудочка;
2) функцию митрального и аортального клапанов и целостность меж-
желудочковой перегородки. Прямым признаком недостаточности митраль-
ного клапана является появление контрастного вещества в левом пред-
сердии во время систолы левого желудочка. По выраженности и скорости
контрастирования предсердия величину обратного тока оценивают полу-
количественно от 1 до 4 баллов. Таким же обазом диагностируют дефект
межжелудочковой перегородки. О стенозе митрального и аортального кла-
панов судят по косвенным признакам — замедлению скорости и ограни-
чению открытия их створок, которые, однако, не дают возможности
определить выраженность стеноза;
3) морфологию левого желудочка — наличие, выраженность и лока-
лизацию его гипертрофии. Выявление асимметричной гипертрофии меж-
желудочковой перегородки, верхушки или других участков желудочка
позволяет диагностировать различные формы гипертрофической кардио-
миопатии. Можно увидеть также тромбы в полости желудочка;
163
4) функцию миокарда левого желудочка путем измерения (расчетным
путем) КДО, КСО, УОС и ФВ.
Введение контрастного вещества в восходящую часть аорты при вы-
полнении аортографии с регистрацией его перемещения на пленку по-
зволяет обнаружить патологию створок аортального клапана, аорты и ее
крупных ветвей. Используют для диагностики: а) недостаточности аор-
тального клапана с полуколичественной оценкой объема регургитации в
баллах; б) патологического сообщения между аортой и легочной артери-
ей при открытом артериальном протоке или правыми отделами сердца
при разрыве аневризмы синуса Вальсальвы; в) коарктации аорты; г) анев-
ризмы аорты и ее расслоения.
Среди ангиокардиографических методов широкое распространение по-
лучила коронарография путем избирательного контрастирования правой и
левой коронарных артерий с помощью специально изогнутых катетеров,
устанавливаемых в области их устья.
Ее выполняют по методике Sones через плечевую артерию или чрес-
кожно по Judkins посредством пункции бедренной артерии. В дополнение
к коронарографии обязательно выполняют левостороннюю вентрикулог-
рафию с определением объемов левого желудочка, ФВ и зон нарушения
сегментарной сократимости.
Коронарография как “эталонный” метод позволяет подтвердить или
исключить диагноз ИБС, установить точную локализацию, распростра-
ненность и выраженность стенозирующего поражения коронарных арте-
рий для оценки тяжести ИБС, показаний и объема хирургического лече-
ния. Она дает возможность также определить проходимость наложенных
шунтов у оперированных больных и диагностировать врожденные анома-
лии коронарного кровообращения.
Интерпретация коронарограмм сопряжена с известным субъективиз-
мом в оценке процентного уменьшения просвета сосуда. Для более точ-
ного его определения регистрацию производят в нескольких проекциях,
что особенно важно при эксцентричных поражениях.
Этого недостатка лишена коронарография с использованием субтрак-
ционной техники на базе ЭВМ. Она основывается на преобразовании рент-
геновского или видеоизображения в набор цифр. Таким образом, из ис-
ходного изображения сосуда до введения контрастного вещества, которое
хранится в памяти компьютера, можно вычесть изображение его просве-
та, полученное при контрастировании. Кроме большей точности количе-
ственной оценки сужения, преимуществами метода являются возможность
введения контрастного вещества в периферическую вену в относительно
небольшом объеме, что позволяет проводить исследование в амбулатор-
ных условиях, и измерения коронарного резерва с помощью различных
проб, например, дипиридамоловой. Для регистрации не требуются рент-
геновская пленка, кино- или видеоаппаратура и оборудование для прояв-
ления, так как вся информация находится в памяти ЭВМ.
164
Возможные осложнения катетеризации сердца и ангиокардио-
графии отмечаются в основном при исследовании левых отделов сердца
и коронарографии. К ним относятся:
1) синусовая брадикардия, атриовентрикулярная блокада и даже оста-
новка сердца, которые часто сочетаются о артериальной гипотензией вслед-
ствие своего вазовагального происхождения. Развиваются в основном при
подведении катетера к устью правой коронарной артерии. Профилактика
состоит во введении атропина сульфата или плановой постановке электрода
для элекгрокардиостимуляции в правый желудочек до начала обследования;
2) отек легких. Может возникать у больных с левожелудочковой недо-
статочностью в связи с длительным, в течение нескольких часов, нахож-
дением в горизонтальном положении и преходящим увеличением внут-
рисосудистого объема жидкости из-за гиперосмолярности вводимого
контрастного вещества;
3) предсердные и желудочковые нарушения ритма. Вызываются меха-
ническим раздражением сердца катетером. Угрожающие жизни желудочко-
вые аритмии — пароксизмальная желудочковая тахикардия и фибрилляция
желудочков - развиваются в 0,5-1 % случаев коронарографий. При немед-
ленном оказании помощи в большинстве случаев успешно купируются;
4) эмболия периферических, в том число мозговых, и коронарных ар-
терий тромбами, образующимися на конце катетера. Для профилактики
этого осложнения исследование проводят на фоне терапии гепарином,
раствором которого также промывают катетер;
5) расслоение артерии при попадании проводника или катетера между
интимой и медией. В коронарной артерии может приводить к инфаркту
миокарда. Механическое раздражение проксимальных отделов коронар-
ных артерий иногда вызывает коронароспазм. Возникающая при этом
трансмуральная ишемия миокарда может сопровождаться тяжелыми же-
лудочковыми аритмиями и артериальной гипотензией. Для профилакти-
ки и лечения используют нитроглицерин;
6) перфорация сердца или крупного сосуда с развитием гемотампонады,
пневмоторакса;
7) местные осложнения со стороны пунктируемых сосудов (кровоте-
чение, окклюзия);
8) острая почечная недостаточность;
9) аллергические реакции на йодсодержащее контрастное вещество.
ДРУГИЕ СПЕЦИАЛЬНЫЕ ИНВАЗИВНЫЕ
МЕТОДЫ ДИАГНОСТИКИ
Нагрузочное тестирование во время катетеризации сердца. Проводят для
углубленной оценки резервов насосной функции путем определения из-
менений КДД в желудочках или “заклинивающего” давления в легочных
капиллярах, КДО и ФВ при ступенчатой нагрузке на велоэргометре в
165
положении лежа. Однако это связано со значительными неудобствами для
больного и исследователя. Иногда используют более простую пробу с объем-
ной нагрузкой путем подъема нижних конечностей.
Нагрузочное тестирование путем предсердной элекгрокардиостимуляции с
катетеризацией коронарного синуса. Позволяет оценить коронарный резерв
по величине частоты навязанного ритма, при которой появляется ише-
мия миокарда, регистрируемая на ЭКГ или по повышению КДД в левом
желудочке. Более точным ее признаком является увеличение уровня лак-
тата в крови коронарного синуса, свидетельствующее о его продукции
при переходе на анаэробное окисление.
Провокация коронароспазма. Используют у больных с болевым синдро-
мом в грудной клетке, особенно напоминающим клинику стенокардии
Принцметала, для доказательства или исключения его спастического генеза.
Видимый при коронарографии спазм коронарной артерии может возни-
кать спонтанно во время катетеризации сердца или вызываться инъекцией
эргометрина малеата. Препарат вводят внутривенно или в аорту дробно,
начиная с 0,0125 мг, с повышением дозы каждые 5—10 мин до появления
боли в грудной клетке или изменений сегмента ST и зубца Т на ЭКГ.
Суммарная доза не должна превышать 0,5 мг. После каждой инъекции вы-
полняют ЭКГ и контролируют давление в левом желудочке. При повыше-
нии систолического или диастолического давления исследование прекраща-
ют. Возникший коронароспазм купируют внутривенным либо внутрико-
ронарным введением нитроглицерина и блокаторов кальциевых каналов.
Показаниями к проведению эргометриновой пробы является боль в груд-
ной клетке при неизмененных при коронарографии коронарных артериях
либо их однососудистом поражении. Она противопоказана при инфаркте
миокарда в анамнезе и выраженной артериальной гипертензии.
Возможными тяжелыми осложнениями являются угрожающие жизни
желудочковые аритмии, атриовентрикулярная блокада, инфаркт миокар-
да и даже внезапная смерть. В связи с этим в настоящее время эргометри-
новую пробу проводят по строгим показаниям в ходе катетеризации серд-
ца, что обеспечивает оптимальный контроль ее безопасности и возмож-
ность быстрого внутрикоронарного введения вазодилататора.
Ограничения теста связаны со способностью эргометрина вызывать ге-
нерализованную вазоконстрикцию и повышение ОПСС, а также спазм
пищевода, которые могут быть причиной загрудинной боли.
Эндокардиальные электрофизиологические исследования. Программируе-
мую элекгрокардиостимуляцию правого предсердия или желудочка с по-
мощью 2—4 внеочередных импульсов используют для оценки возможнос-
ти индуцировать пароксизмальную тахикардию соответствующей локали-
зации. Это свидетельствует о повышенном риске ее спонтанного развития
по механизму “ри-энтри” и тем самым позволяет выявить наиболее угро-
жаемых больных для назначения им профилактического лечения. В усло-
виях лаборатории в остром опыте у таких больных можно также эмпириче-
ским путем осуществлять подбор наиболее эффективного в каждом случае
166
антиаритмического препарата, который предотвращает индуцирование
тахикардии. При возникновении стойкой тахикардии ее обычно легко ку-
пируют с помощью частой элекгрокардиостимуляции или трансторакаль-
ной деполяризации. Подробнее этот метод будет описан ниже.
Эндомиокардиальная биопсия. Выполняют под рентгенологическим кон-
тролем с помощью длинного гибкого биотома, снабженного миниатюр-
ными щипцами, который проводят через специальный катетер. Пробы
берут обычно из правого желудочка в области межжелудочковой перего-
родки. Метод имеет наибольшее клиническое значение для раннего рас-
познавания отторжения трансплантированного сердца и коррекции дозы
иммуносупрессивных препаратов. Гистологическое исследование ткани
миокарда позволяет верифицировать диагноз миокардита и некоторых
других некоронарогенных заболеваний миокарда известной этиологии,
имеющих специфические морфологические признаки, например, ами-
лоидоза и саркоидоза. Можно использовать также для оценки эффектив-
ности противовоспалительного лечения миокардита в тяжелых случаях.
Для большей информативности рекомендуется забирать не менее 3 ку-
сочков ткани из различных участков миокарда. Осложнения отмечаются,
как правило, не чаще, чем при обычной катетеризации сердца. Возмож-
ны нарушения ритма и перфорация желудочка с гемотампонадой.
РЕНТГЕНОХИРУРГИЧЕСКИЕ МЕТОДЫ ЛЕЧЕНИЯ
Чрескожная транслюминальная коронарная ангиопластика (ТЛАП) опи-
сана также в главе 9. Является паллиативным методом лечения стенози-
рующего атеросклероза коронарных артерий. Выполняют при катетериза-
ции сердца под контролем коронарографии. Ее сущность состоит в дози-
рованном расширении суженного просвета артерии с помощью специ-
ального катетера с баллончиком определенного диаметра на конце. При
раздувании в области стеноза он в той или иной степени устраняет суже-
ние. Метод был впервые предложен A.Gnintzig в конце 70-х гг. (A.Gnintzig,
D. Kumpe, 1979). Он требует от оператора значительного мастерства и опыта.
До недавнего времени считалось, что ТЛАП необходимо проводить ис-
ключительно в центрах, где имеются кардиохирургические отделения,
чтобы при возникновении осложнений можно было срочно организовать
аортокоронарное шунтирование. В последние годы это не является строго
обязательным при условии территориальной близости кардиохирургичес-
кого стационара, большой рентгенохирургической активности и прове-
дения дилатации только у наименее тяжелого контингента больных с
низком риском неблагоприятного исхода.
Показания к ТЛАП в настоящее время значительно расширились — от
однососудистого концентрического стеноза до эксцентрического изъязв-
ленного поражения нескольких сосудов. Благодаря совершенствованию
баллонов стало возможным расширять даже часть полностью закрытых
коронарных артерий при давности окклюзии менее 6 мес и поражении,
167
сопровождающемся отложением кальция. Наибольший эффект достига-
ется, однако, при небольшом по протяженности (до 1,5 см) проксимально
расположенном сужении без кальциноза. Дилатацию с успехом выполня-
ют также при стенозе венозного шунта у перенесших аортокоронарное
шунтирование, у больных любого возраста и повторно.
После выявления стеноза при коронарографии для исключения воз-
можности спазма вводят нитроглицерин и блокатор кальциевых каналов.
Операцию проводят в условиях гипокоагуляции полными дозами гепари-
на под местной анестезией. К устью пораженной коронарной артерии
подводят специальный направляющий катетер, введенный через бедрен-
ную артерию, по которому проводят катетер с баллончиком. С помощью
гибкого проводника под контролем контрастирования артерии баллон-
чик устанавливают в месте сужения и раздувают разведенным раствором
контрастного вещества, начиная с 3-6 атм в течение 15-30 с. Адекватное
расширение сосуда обычно достигается в несколько приемов с постепен-
ным повышением давления в баллоне до 10 атм и поэтапным ангиогра-
фическим контролем.
ТЛАП показана 30—40 % больных ИБС и выполнима примерно у 80 % из
них. Причинами неудач являются невозможность введения баллона в про-
свет суженного участка (примерно в 5 % случаев), невозможность его расши-
рения (3—5 %) и закрытие сосуда вследствие спазма, тромбообразования
или значительного расслоения (5-6 %). В последнем случае иногда эффективна
повторная дилатация. При стойкой окклюзии в связи с опасностью разви-
тия инфаркта миокарда прибегают к срочной операции аортокоронарного
шунтирования. Потребность в ней возникает примерно в 2—3 % случаев ТЛАП.
Возможны и такие осложнения, как приступ стенокардии, нарушения рит-
ма вплоть до фибрилляции желудочков, артериальная гипотензия в момент
обтурации просвета артерии раздутым баллоном и инфаркт миокарда, ко-
торый развивается примерно у 2-3 % больных. Летальность у больных сте-
нокардией составляет около 0,5 %, преимущественно за счет нестабильных
форм. Применение ТЛАП при остром инфаркте миокарда как первичной, в
1-е сутки вместо тромболитической терапии, так и отсроченной, в более
поздние сроки с целью “открыть артерию” после тромболизиса, не являет-
ся общепринятым и сопряжено с более высокой летальностью.
Положительный эффект, оцениваемый по повышению толерантности
к физической нагрузке при нагрузочном тестировании, достигается у 70—
80 % оперированных. Однако стойкость этого эффекта ограничивается зна-
чительной частотой рестеноза дилатированного сегмента — до 30 % в пер-
вые 6-12 мес. Он обусловлен гиперплазией интимы вследствие пролифе-
рации и миграции в нее гладкомышечных клеток средней оболочки в
результате “избыточного” заживления после операционной травмы. О
развитии рестеноза свидетельствует возобновление симптомов ишемии,
что обычно наблюдается в первые 6 мес. Их появление в более поздние
сроки чаще связано с прогрессированием стеноза другой локализации. В
168
обоих случаях лечение состоит в повторной ТЛАП, которую удается выпол-
нить у большинства таких больных. Только у 10 % больных в течение 5 лет
после дилатации приходится прибегать к аортокоронарному шунтированию.
Другие, небаллоичиковые, методы рентгенохирургической реваскуляриза-
ции миокарда находятся в процессе изучения. Их место в лечении коронарной
болезни и преимущества перед баллончиковой ТЛАП пока не определены.
Лазерная ангиопластика. Прямая абляция стеноза энергией лазера со-
пряжена с риском перфорации коронарной артерии. Более перспектив-
ным представляется сочетание лазерной ангиопластики с баллончиковой.
Это облегчает прохождение баллоном сужения, а умеренное (до 100 °C)
нагревание сосудистой стенки может оказаться полезным для предотвра-
щения расслоения.
Катетерная атерэктомия обеспечивает механическое иссечение ткани
атеросклеротической бляшки с помощью специальных устройств. Такой
подход оказался эффективным при лечении поражений периферических
сосудов. Ограничения метода связаны с малым калибром коронарных
артерий.
Возможность с помощью термического воздействия и механического
иссечения уменьшить частоту рестенозов, хотя и представляется теорети-
чески обоснованной, пока не доказана.
Баллончиковая вальвулопластика основывается на тех же принципах,
что и ангиопластика коронарных артерий. В последние годы ее все чаще
используют для лечения стенозов клапанов сердца без вскрытия грудной
клетки. Находящийся на конце катетера баллон с помощью металлическо-
го проводника вводят в просвет стенозированного клапана и раздувают
контрастным веществом под давлением от 3-5 до 15 атм. Желаемое расши-
рение просвета достигается последовательным использованием несколь-
ких баллонов возрастающего диаметра и двойных баллонов. Процедура на-
поминает пальцевое расширение суженного клапанного отверстия под кон-
тролем зрения во время операции.
Первоначально вальвулопластику применяли при врожденных стенозах
устья легочной артерии и аорты. В последние годы ее с успехом используют
также при приобретенных пороках — ревматическом митральном стенозе
и стенозе устья аорты ревматического и неревматического генеза - вместо
закрытой и открытой комиссуро- и вальвулотомии. Достигаемое увеличе-
ние эффективной площади отверстия клапанов далеко не полное — мит-
рального клапана в среднем до 2 см2 и аортального — до 1 см2, что значи-
тельно меньше их нормальных величин - соответственно 3,5—5 и 3-4 см2.
Этого, однако, обычно достаточно для получения хорошего клиническо-
го эффекта и ощутимого улучшения переносимости физической нагрузки.
Возможные серьезные осложнения — надрыв створок клапана с разви-
тием травматической недостаточности, эмболия и рестеноз, особенно при
приобретенных аортальных пороках. При тщательном отборе больных и
достаточном опыте оператора они встречаются относительно редко.
169
ГЛАВА 6.
ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА У ВЗРОСЛЫХ
ВПС представляют собой аномалии структуры и (или) функции
сердечно-сосудистой системы, возникающие в результате нарушения ее
эмбрионального развития.
Эпидемиология. ВПС встречаются примерно у 1 % новорожденных, ро-
дившихся живыми. В это число не входят две наиболее распространенные
врожденные аномалии — врожденный нестенозированный двухстворча-
тый аортальный клапан и пролапс митрального клапана. Не учитываются
также значительно недоношенные новорожденные и мертворожденные,
среди которых частота ВПС значительно выше.
ВПС являются наиболее распространенными заболеваниями сердечно-
сосудистой системы у детей. У взрослых они встречаются значительно реже -
примерно у 0,2 %, и на их долю приходится не более 1 % заболеваний
сердца. Это обусловлено смертью многих больных в детском возрасте, с
одной стороны, и успешной хирургической коррекцией - с другой. Так,
многие ВПС несовместимы с жизнью сами по себе или сочетаются с дру-
гими несовместимыми с жизнью тяжелыми уродствами. Такие больные
умирают в первые недели или месяцы жизни. У детей, которые пережива-
ют этот критический период, состояние в какой-то степени компенсиру-
ется и может даже несколько улучшаться. Ухудшение наступает обычно в
возрасте 12—15 лет. Успехи в лечении сердечной недостаточности в после-
дние годы способствовали некоторому продлению жизни таких больных.
Однако и теперь 55—70 % из них умирают на первом году жизни, a SO-
85 % не доживают до 5 лет. Лишь 10—15 % больных, в основном с наиболее
легкими пороками без выраженных нарушений гемодинамики, достигают
юношеского возраста без хирургической коррекции.
Этиология обусловлена взаимодействием генетических факторов и фак-
торов внешней среды. В большинство случаев этиологический фактор ос-
тается неизвестным.
У большинства больных ВПС являются спорадическими. В семейных слу-
чаях заболевания отмечается преимущественно аутосомно-рецессивный тип
наследования, но может встречаться и доминантный. Характер специфи-
ческих хромосомных аберраций пока не установлен. У 20 % больных подрост-
кового возраста и старше отмечаются сопутствующие врожденные анома-
лии других органов — синдром Дауна, микроцефалия, гипогенитализм,
“волчья пасть” и др.
При клинических исследованиях установлена связь возникновения ВПС
со следующими экзогенными факторами, воздействующими на организм
матери во время беременности: а) коревой краснухой, реже другими вирус-
ными инфекциями (корь, ветряная оспа, энтеровирусная инфекция);
б) хроническим злоупотреблением алкоголем и в) употреблением некото-
рых лекарств (талидомида и др.). Коревая краснуха в I триместре беремен-
но
ности повышает риск ВПС в 14 раз и наиболее часто приводит к разви-
тию открытого артериального протока, стеноза устья легочной артерии
или аорты, дефекта межпредсердной перегородки. При употреблении ал-
коголя чаще встречается дефект межжелудочковой перегородки. В экспе-
рименте выявлено тератогенное влияние гипоксии, дефицита и избытка
некоторых витаминов и ионизирующей радиации.
Некоторые пато- и морфогенетические механизмы ВПС у взрослых. У мно-
гих взрослых больных с ВПС жалобы появляются относительно поздно — в
юношеском и даже зрелом возрасте. Это обусловлено тем, что морфологи-
ческие и функциональные изменения сердца и сосудов при ВПС не являются
статичными, а постепенно прогрессируют. Эволюция ВПС в постнатальный
период обусловлена следующими основными общими механизмами:
1) усугублением повышения ЛСС вследствие разрастания в легочных
артериолах соединительной ткани с облитерацией их просвета:
2) превращением гипертрофии миокарда из компенсаторной в пато-
логическую;
3) развитием кальциноза в измененных клапанах и миокарде патоло-
гически измененного выносящего тракта желудочка;
4) разрывом хорд патологически измененных клапанов, что усугубля-
ет их дисфункцию.
Кроме того, такие больные подвержены тромбозам как осложнению
полицитемии и инфекционному эндокардиту.
Легочная гипертензия характерна для многих ВПС. Ее наличие и выра-
женность часто определяют клинические проявления заболевания, его те-
чение и возможность хирургической коррекции. Повышение давления в
легочной артерии обусловлено увеличением легочного кровотока и со-
противления легочных артериол вследствие повышения их тонуса (спаз-
ма) либо, что имеет место в большинстве случаев, в результате прогрес-
сирующего склероза с облитерацией просвета. Причины такого обструк-
тивного поражения сосудов легких не вполне понятны. По-видимому, оно
обусловлено несколькими факторами: увеличением кровотока в легких,
повышением давления в легочной артерии и легочных венах, полиците-
мией, гипоксемией и ацидозом. Высокая легочная гипертензия с резким
повышением ЛСС у больных с ВПС с наличием патологического сообще-
ния между большим и малым кругами кровообращения, которая приво-
дит к возникновению право-левого, то есть веноартериального сброса крови
и появлению цианоза, носит название синдрома Эйзенменгера.
Компенсаторная гипертрофия и недостаточность сердца. Развитие гипер-
трофии миокарда является важнейшим механизмом долговременной адап-
тации сердца к хронической перегрузке объемом или сопротивлением. Ги-
перфункция миокарда при повышении его систолического напряжения Т
(Т=Р • r/2h, где Р — давление, г — радиус желудочка и 11 - толщина его
стенки) активирует генетический аппарат мышечных клеток, в результа-
те чего в них увеличивается синтез белков. Развивающаяся гипертрофия
(увеличение h) устраняет эту гиперфункцию, и стеночное напряжение
171
нормализуется. Таким образом, гипертрофия долгое время компенсирует
перегрузку сердца и предотвращает его недостаточность. Это не означает,
однако, что функциональные возможности гипертрофированной мышечной
ткани действительно нормальны. На определенном этапе гипертрофия из
компенсаторного фактора превращается в патологический, что заложено в
самой ее сущности как несбалансированной формы клеточного роста.
Основными механизмами развития недостаточности гипертрофирован-
ного миокарда являются:
а) на органном уровне: уменьшение плотности симпатической иннерва-
ции и концентрации норадреналина в сердце в связи с отставанием роста
аксонов симпатических нейронов по отношение к увеличению мышечной
массы. Это приводит к уменьшению инотропного и расслабляющего влия-
ния симпатической части вегетативной нервной системы на миокард;
б) на уровне ткани: уменьшение коронарного резерва в покое в связи с
отставанием роста капилляров от увеличения массы кардиомиоцитов и
увеличением диффузионного расстояния для кислорода — расстояния от
капилляра до центра утолщенного мышечного волокна;
в) на уровне клетки: относительное уменьшение площади клеточной
мембраны и, следовательно, мощности систем ионного транспорта, от-
ветственных за сопряжение возбуждения с сокращением и расслаблени-
ем; уменьшение соотношения количества митохондрий и миофибрилл
вследствие более короткого периода жизни митохондрий, что снижает
мощность энергообеспечения гипертрофированного сердца;
г) на молекулярном уровне: увеличение соотношения между легкими
долгоживущими и тяжелыми короткоживущими цепями в головках моле-
кул миозина миофибрилл, что приводит к снижению АТФ-азной актив-
ности и вследствие этого — скорости преобразования химической энергии
АТФ в механическую.
В итоге в гипертрофированном миокарде нарушаются процессы энер-
гообеспечения и утилизации энергии, что приводит к развитию его обра-
тимой, а затем и необратимой дистрофии и разрастанию соединительной
ткани за счет заместительного склероза и интерстициального фиброза.
Эритроцитоз является физиологической реакцией организма на хро-
ническую гипоксемию и особенно характерен для “синих” ВПС. Увеличе-
ние массы эритроцитов способствует улучшению кислородтранспортной
функции крови и доставки кислорода к тканям. Патологические эффекты
компенсаторной полицитемии обусловлены резким повышением вязкос-
ти крови с подверженностью тромбозам в различных органах, а также
уменьшением почечного кровотока и клубочковой фильтрации.
Повышенный риск инфекционного эндокардита у больных с ВПС, как
и с приобретенными пороками сердца, обусловлен хронической травма-
тизацией эндокарда или эндотелия крупного сосуда дистальнее места пато-
логического сужения или отверстия турбулентным током крови с отложе-
нием на нем тромботических масс. Это создает благоприятные условия
172
Врожденные пороки сердца
„ Белые" ' ~~„Синие“
С шунтированием крови —^Без шунта
слева направо'.
I
Л. на уровне предсердий-.
1) дефект межпредсердной
перегородки:
первичный
Вторичный
атриовентрикулярная
коммуникация
А. Пороки левого сердца-.
1)митральная
недостаточность
2)стеноз устья аорты
3) недостаточность
аортального клапана
^коарктация аорты
и др
А. С увеличенным
легочным кровотоком-.
1) полная транспозиция
крупных артерий
2) единый желудочек
и др
2) дефект межпредсердной
перегородки с митральным
стенозом(синдром Лттемваше)
Б. На уровне желудочков
дефект межжелудочковой
перегородки
Б. пороки правего
сердца;
Аномалия
трегстВорчатого
клапана Эбштейна
2) стеноз устья
легочной артерии
Б. С неизмененным или
уменьшенным
легочным кровотоком-.
В. Между корнем аорты и
правым сердцем-.
1) разрыв аневризмы синуса
Вальсальвы
2)коронарная артериовенозная
Фистула
Г. между аортой и легочной
артерией:
открытый артериальный
(Боталло) проток
3) недостаточность
клапана легочной
артерии
4) идиопатическое
расширение ствола
легочной артерии
1)стеноз устья
легочной артерии
с дефектом
межжелудочковой
перегородки
(тетрада Фалло)
2) стеноз устья
легочной артерии
с дефектом
межпредсердной
перегородки
(триада Фалло)
и др.
Д. На нескольких уровнях
Схема 5. Классификация врожденных пороков сердца
для оседания микроорганизмов при транзиторной бактериемии и разви-
тия инфекционного эндокардита (эндартериита).
Классификация ВПС. Разнообразие ВПС огромно. Описано несколько со-
тен различных вариантов и сочетаний сужений, патологических сообщений
между большим и малым кругами кровообращения, атипичных расположе-
ний клапанов, впадений или отхождений сосудов и других сложных анома-
лий. Большинство из них встречается крайне редко и несовместимо с жиз-
нью. Наиболее распространены примерно 10—12 основных пороков, кото-
рые позволяют пережить хотя бы грудной возраст и доступны коррекции.
Анатомические классификации ВПС очень громоздки и не пригодны
для практического применения. Практически удобно распределять боль-
ных с ВПС в зависимости от легочного кровотока на 3 группы (схема 5):
173
Таблица 9. Примерный удельный вес различных ВПС у взрослых н детей, % 1) с неизмененным легоч- ным кровотоком (стеноз устья аорты, коарктация аорты и др.); 2) с увели-
ВПС Взрослые Дети
Дефект межпредсердной перегородки 46 15 Дефект межжелудочковой перегородки 23 19 Стеноз устья легочной артерии 15 8 Открытый артериальный проток 6 16 Коарктация аорты 3 8 Тетрада Фалло 2 6 Прочие, в том числе сложные ВПС 5 28 ченным кровотоком (де- фекты межпредсердной и межжелудочковой перего- родок, открытый артери- альный проток и др.); 3) с уменьшенным легочным кровотоком (стеноз устья
легочной артерии, тетрада
и триада Фалло и др.). Эта классификация, однако, весьма условна. Так,
например, в поздних стадиях дефектов перегородок сердца при развитии
высокой легочной гипертензии направление сброса крови может изме-
ниться, и легочный кровоток уменьшается. У части больных с тетрадой
Фалло при небольшой выраженности стеноза устья легочной артерии кро-
воток в малом круге кровообращения не изменен.
В клиническом отношении важно разделять ВПС на “белые”, ациано-
тичные, и “синие”, сопровождающиеся цианозом. Такая группировка также
достаточно относительна, так как естественное течение некоторых “бе-
лых” пороков предусматривает их трансформацию в “синие”. Примером
может служить развитие синдрома Эйзенменгера при дефектах перегоро-
док сердца и открытом артериальном протоке. Более подробная классифи-
кация наиболее распространенных ВПС с учетом основных клинических
проявлений (наличия или отсутствия цианоза), нарушений гемодинамики
(легочного кровотока) и анатомической локализации представлена выше.
Удельный вес отдельных ВПС у взрослых и детей различен
(табл. 9), что в значительной степени обусловлено особенностями их есте-
ственного течения. Так, у детей наиболее распространены сложные пороки,
при которых отмечается высокая летальность. У взрослых наиболее часто
встречаются дефект межпредсердной перегородки, который обычно имеет
относительно доброкачественное течение, некоторые варианты дефекта меж-
желудочковой перегородки и стеноз устья легочной артерии, реже — от-
крытый артериальный проток, коарктация аорты и пороки группы Фалло.
ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА БЕЗ ЦИАНОЗА
ДЕФЕКТ МЕЖПРЕДСЕРДНОЙ ПЕРЕГОРОДКИ
Дефект межпредсердной перегородки — это патологическое сообщение
между двумя предсердиями. Наиболее распространенный ВПС у взрослых.
Болеют чаще женщины.
Основными анатомическими вариантами дефекта межпредсердной пере-
городки являются: 1) вторичные дефекты, которые располагаются
174
в центральной части межпредсердной перегородки в области овальной
ямки; 2) первичные дефекты, локализующиеся в нижней части
перегородки. Их нижний край образуется гребешком, отделяющим мит-
ральный клапан от трехстворчатого. В большинстве случаев отмечается
расщепление створки митрального и реже — трехстворчатого клапана,
которое сопровождается их недостаточностью, что усугубляет наруше-
ния гемодинамики и отягощает клиническое течение порока.
Наиболее тяжелым вариантом дефекта межпредсердной перегородки
является продолжение дефекта на межжелудочковую перегородку, в ре-
зультате чего возникает общее предсердно-желудочковое сообщение -
так называемая атриовентрикулярная коммуникация с рас-
щеплением и недостаточностью митрального клапана.
Дефект межпредсердной перегородки нередко сочетается с другими
пороками. Его комбинация с ревматическим митральным стенозом носит
название синдрома Лютембаше.
Механизмы нарушения гемодинамики. И е р в и ч н о е нарушение ге-
модинамики связано с шунтированием крови через дефект слева на-
право, в результате чего артериальная кровь из левого предсердия подме-
шивается к венозной крови в правом предсердии. Такое направление сброса
обусловлено: 1) большей диастолической податливостью правого желу-
дочка по сравнению с левым и меньшим сопротивлением сосудов малого
круга кровообращения по сравнению с большим; 2) различием давления
в предсердиях. При небольших дефектах давление в правом предсердии
на 3—5 мм рт.ст. ниже, чем в левом. Однако этот фактор имеет второсте-
пенное значение, так как при больших размерах дефекта среднее давле-
ние в предсердиях практически одинаковое.
Величина шунта зависит от размеров дефекта, различий диастоличе-
ской податливости желудочков и величин ОПСС и ЛСС.
Шунтирование крови происходит главным образом в конце систолы и
начале диастолы желудочков и возрастает во время систолы предсердий. Оно
приводит к: а) диастолической перегрузке (перегрузке объемом) право-
го желудочка и правого предсердия; б) увеличению легочного кровото-
ка, который может в несколько раз превышать кровоток в большом круге
кровообращения; в) уменьшению поступления крови в левые отделы
сердца и аорту.
Несмотря на значительное увеличение легочного кровотока, выражен-
ная гипертензия в малом круге кровообращения в первые 20 лет возникает
очень редко, не более чем у 2 % больных. В более старшем возрасте постепенно
развивающаяся пролиферация интимы и гипертрофия медии легочных ар-
териол приводит к стойкому повышению давления в легочной артерии.
Компенсация первичных нарушений гемодинамики обеспечива-
ется гиперфункцией и гипертрофией правого желудочка. На первых порах
гипертрофия правого желудочка, вызывая уменьшение его диастоличес-
кой податливости, способствует уменьшению объема сброса крови из
левого предсердия в правое. К этому же приводит и повышение давления
175
в легочной артерии вследствие увеличения сопротивления изгнанию крови
из правого желудочка.
Нарушение компенсации наступает относительно поздно и в
значительной мере связано с развитием склеротических процессов в ле-
гочных артериолах и стойкой артериальной (прекапиллярной) легочной
гипертензии. Дистрофические изменения в гипертрофированном миокарде
правого желудочка, особенно в условиях нарастающей перегрузки со-
противлением, приводят к развитию его недостаточности. При этом по-
вышение диастолического давления в правом желудочке и среднего дав-
ления в правом предсердии обусловливают снижение диастолической по-
датливости правого желудочка и выравнивание давления в предсердиях,
вследствие чего величина сброса крови через дефект значительно умень-
шается. В очень редких случаях направление шунта меняется, и венозная
кровь из правого предсердия подмешивается к артериализированной крови
в левом предсердии — возникает центральный цианоз, свойственный син-
дрому Эйзенменгера. Наличие митральной регургитации при первичных
дефектах вызывает увеличение объема лево-правого шунта и в ряде слу-
чаев сопровождается шунтированием крови через расщепленную створку
клапана из левого желудочка в правое предсердие.
Особенностью изменений гемодинамики при дефекте межпредсерд-
ной перегородки у взрослых является развитие недостаточности левого
желудочка. Она обусловлена детренированностью функционально недо-
груженного желудочка и его поражением вследствие сопутствующих за-
болеваний — ИБС, эссенциальной артериальной гипертензии и других, а
при первичных дефектах межпредсердной перегородки - также митраль-
ной регургитацией. Недостаточность левого желудочка, вызывая умень-
шение его податливости, может приводить к увеличению объема лево-
правого шунта. Если правый желудочек вследствие своей дисфункции не
в состоянии “перекачать” возросший приток крови, происходит повы-
шение диастолического давления в обоих желудочках и предсердиях и
появляется или усугубляется застой в венах большого круга кровообра-
щения. Таким образом, левожелудочковая недостаточность у больных с
дефектом межпредсердной перегородки может приводить к увеличению
застоя крови на путях притока к правому желудочку.
Клиника зависит от величины сброса крови и легочной артериальной
гипертензии. При небольших размерах шунта длительное время жалоб нет,
трудоспособность не ограничена, и порок выявляется при случайном об-
следовании. Такие больные подвержены респираторным инфекциям. В боль-
шинстве случаев жалобы появляются в возрасте после 30 лет. Больных
беспокоят одышка при физической нагрузке, а затем и в покое, прогрес-
сирующая слабость и утомляемость, реже сердцебиение и перебои.
При осмотре и пальпации определяют усиленный правожелу-
дочковый сердечный толчок и в ряде случаев пульсацию легочной арте-
рии. При аускультации сердца выслушивают: 1) незвучный мезо-
систолический шум (шум изгнания) во втором межреберье слева у края
176
грудины, обусловленный увеличением кровотока через клапаны легочной
артерии; 2) акцент (Р2 > А2) и расщепление II тона, фиксированное на
вдохе, что является важным диагностическим признаком порока. Может
определяться также тихий мезодиастолический шум у левого края грудины
с эпицентром в четвертом межреберье слева, связанный с относительным
стенозом трехстворчатого клапана вследствие увеличения кровотока через
него. Эти данные регистрируются на ФКГ. У больных с первичным дефек-
том межпредсердной перегородки систолическое дрожание и грубый го-
лосистолический шум в области верхушки указывают на сопутствующую
недостаточность митрального или реже - трехстворчатого клапанов.
При повышении ЛСС и уменьшении лево-правого шунта данные фи-
зического обследования меняются: а) уменьшается звучность шумов, об-
разующихся на клапане легочной артерии и трехстворчатом клапане; б) уве-
личивается акцент Р2 и уменьшается величина расщепления II тона, вплоть
до его исчезновения; в) появляется протодиастолический шум относи-
тельной недостаточности клапанов легочной артерии — так называемый
шум Грэма Стилла. Может определяться также систолический тон выбро-
са крови в легочную артерию. Изменение направления сброса приводит к
появлению обмороков, кровохарканья, центрального цианоза, “барабан-
ных палочек” и нарастанию сердечной недостаточности. В крови опреде-
ляется эритроцитоз.
Диагностика. Для ЭКГ при дефекте межпредсердной перегородки ха-
рактерны: 1) отклонение электрической оси сердца вправо при вторич-
ном дефекте и влево — при первичном; 2) признаки гипертрофии право-
го желудочка и блокады правой ножки пучка Гиса вследствие замедления
возбуждения задне-базальной части межжелудочковой перегородки в виде
появления rSR в правых грудных отведениях (наиболее важный диагнос-
тический признак); 3) признаки гипертрофии правого предсердия.
На рентгенограмме грудной клетки определяются: 1) увеличение правых
желудочка и предсердия; 2) сглаженная “талия” вследствие выбухания ствола
легочной артерии; 3) усиление легочного сосудистого рисунка; 4) умень-
шение дуги аорты. У ряда больных с первичным дефектом межпредсердной
перегородки отмечается также дилатация левого предсердия.
На ЭхоКГ определяются дилатация легочной артерии и правого желу-
дочка с систолическим движением кпереди межжелудочковой перего-
родки (так называемое парадоксальное движение) вследствие его объем-
ной перегрузки. Дефект можно непосредственно увидеть (но не всегда!)
из субкостальной или парастернальной позиции либо на 4-камерном апи-
кальном изображении сердца. Он хорошо определяется с помощью
допплерэхокардиографии. Благодаря этому двухмерная эхокардиография
с допплеровским исследованием постепенно заменяет катетеризацию
сердца как метод верификации диагноза дефекта межпредсердной пере-
городки. К инвазивному обследованию прибегают в неясных случаях, при
наличии признаков высокой легочной гипертензии и при подозрении на
сопутствующие аномалии.
177
При катетеризации сердца для дефекта межпредсердной перегородки
характерно: 1) проведение катетера из правого предсердия в левое; 2)
более высокое насыщение гемоглобина кислородом в крови правого пред-
сердия по сравнению с пробами из полых вен; 3) повышение давления в
легочной артерии.
Дифференциальная диагностика. Вторичный дефект межпредсердной пе-
регородки необходимо дифференцировать с: 1) небольшим стенозом ус-
тья легочной артерии; 2) “невинным” шумом у практически здоровых
лиц; 3) митральным стенозом; 4) хроническим легочным сердцем. Пер-
вичный дефект межпредсердной перегородки дифференцируют с “чис-
той” митральной недостаточностью ревматического и неревматического
генеза; дефектом межжелудочковой перегородки.
Систолический шум изгнания у асимптоматичных больных молодого
возраста с вторичным дефектом межпредсердной перегородки необходи-
мо отличать от сходного шума, характерного для небольшого стеноза
устья легочной артерии, и “невинного” шума.Впользу
дефекта межпредсердной перегородки свидетельствуют фиксированное
на вдохе расщепление II тона и акцент Р2, большая амплитуда конечного
зубца R' по сравнению с начальным зубцом г в отведениях Vj 2 на ЭКГ и
увеличение правых отделов сердца, а также ствола легочной артерии при
рентгенографии и двухмерной эхокардиографии.
У больных зрелого возраста с дефектом межпредсердной перегород-
ки, осложненным мерцательной аритмией, мезодиастолический шум тока
крови через трехстворчатый клапан и широкое расщепление II тона с его
акцентом нужно отличать от мезодиастолического шума и щелчка откры-
тия митрального клапана при митральном стенозе. В обоих случаях
отмечаются также признаки гипертрофии правого желудочка и легочной
гипертензии. Распознать эти заболевания помогает ЭхоКГ, на которой
определяется патогномоничное для митрального стеноза изменение мор-
фологии и характера движения митрального клапана.
В зрелом и пожилом возрасте дефект межпредсердной перегородки не-
обходимо дифференцировать с хроническим легочным серд-
цем, что, учитывая подверженность таких больных бронхолегочным ин-
фекциям и низкую амплитуду шума, бывает подчас сложно. Важное зна-
чение имеют пульмонологический анамнез и обследование, с одной сто-
роны, и настороженность в отношении возможности ВПС - с другой,
что позволяет провести тщательный поиск признаков сброса крови.
Первичный дефект межпредсердной перегородки, сопровождающий-
ся пансистолическим шумом митральной недостаточности, дилатацией
левого предсердия и легочной гипертензией, дифференцируют также с
“чистой” недостаточностью митрального клапана и
дефектом межжелудочковой п ере город ки , которые имеют
сходные проявления. Однако, в отличие от дефекта межпредсердной пе-
регородки, для этих заболеваний характерны признаки гипертрофии ле-
вого желудочка на ЭКГ и его дилатация по данным рентгенологического
178
и эхокардиографического исследований. Уточнить диагноз позволяет двух-
мерная эхокардиография с тщательным изучением аппарата митрального
клапана и перегородок сердца и допплеровским исследованием, а в сложных
случаях - катетеризация сердца.
При выраженной легочной гипертензии, особенно сопровождающей-
ся развитием синдрома Эйзенменгера, определить характер порока чрез-
вычайно сложно. В таких случаях провести дифференциальную диагнос-
тику с дефектом межжелудочковой перегородки, открытым артериаль-
ным протоком и первичной легочной гипертензией позволяет только ка-
тетеризация сердца.
Диагноз ставят на основании: 1) характерной мелодии сердца по дан-
ным аускультации и фонокардиографии в сочетании с 2) наличием rSR'
в правых грудных отведениях ЭКГ; 3) характерной конфигурации тени
сердца при рентгенологическом исследовании. Подтверждают диагноз с
помощью двухмерной эхокардиографии с допплеровским исследовани-
ем, а в неясных случаях — путем катетеризации сердца.
Основными осложнениями и причинами смерти являются: 1) наруше-
ния ритма, чаще всего — мерцательная аритмия, вначале пароксизмаль-
ная, а затем постоянная форма. Встречаются также пароксизмы супра-
вентрикулярной тахикардии; 2) застойная сердечная недостаточность
(право- и левожелудочковая); 3) легочная гипертензия и синдром Эй-
зенменгера, который при этом пороке развивается редко - примерно у
8 % больных; 4) инфекционный эндокардит (крайне редкое осложнение).
Течение. При вторичном дефекте межпредсердной перегородки тече-
ние более благоприятное. Жалобы обычно появляются лишь в зрелом воз-
расте и имеются у большинства больных в возрасте старше 40 лет. К 50-
летнему возрасту примерно 75 % больных страдают от сердечной недо-
статочности, развитию которой способствует мерцательная аритмия. Сер-
дечная недостаточность обусловлена как изолированным сбросом крови
слева направо, значительным по объему, так и выраженной легочной
гипертензией, которая значительно отягощает прогноз.
Течение при первичном дефекте межпредсердной перегородки более
тяжелое, чем при вторичном. Большинство больных начинают предъяв-
лять жалобы к 20-летнему возрасту. Кроме перечисленных осложнений, у
таких больных может развиться полная атриовентрикулярная блокада
вследствие частой травматизации атриовентрикулярного узла, располо-
женного кзади от дефекта, турбулентным потоком крови через него.
Лечение. Для предотвращения осложнений - легочной гипертензии и
сердечной недостаточности, которые, как правило, развиваются после
40 лет, а при первичном дефекте межпредсердной перегородки — раньше,
рекомендуется хирургическая коррекция. Оперативное лечение показано
всем больным с неосложненным заболеванием, даже бессимптомным,
при наличии значительного объема лево-правого шунта, когда минутный
объем малого круга кровообращения в 1,5 раза и более больше, чем боль-
шого, или имеется дилатация правых отделов сердца. Хотя оптимальным
179
возрастом для операции считаются 3 года — 6 лет, отличные результаты
хирургической коррекции получают и позже, даже у больных старше 40 лет,
при условии отсутствия у них высокой легочной гипертензии. Наличие легоч-
ной гипертензии ухудшает результаты оперативного лечения. Хирургическое
вмешательство противопоказано в следующих случаях: 1) при высо-
кой легочной гипертензии с минимальным сбросом или с изменением на-
правления сброса и цианозом (синдроме Эйзенменгера). В таких случаях зак-
рытие дефекта, через который “разгружается” правый желудочек, приводит к
увеличению его перегрузки и нарастанию недостаточности; 2) при значительной
левожелудочковой недостаточности. При умеренной легочной гипертензии она
может вызывать увеличение шунта. При этом закрытие дефекта влечет за со-
бой увеличение притока крови к левому желудочку, что может значительно
усугубить его недостаточность.
Операция заключается в ушивании дефекта или пластике заплатой в
условиях искусственного кровообращения. При первичном дефекте меж-
желудочковой перегородки со значительной митральной недостаточнос-
тью дополнительно ушивают расщепленную створку или производят про-
тезирование митрального клапана. Хирургическая летальность составляет
в последние годы около 3-4 %, преимущественно за счет первичных де-
фектов. При вторичных дефектах летальность менее 1 %. Она повышается
до 10 % при наличии легочной гипертензии.
Медикаментозная терапия симптоматическая и включает: 1) активное
лечение респираторных инфекций: 2) антиаритмическую терапию при
мерцательной аритмии и пароксизмальной суправентрикулярной тахи-
кардии; 3) лечение застойной сердечной недостаточности. Хотя риск ин-
фекционного эндокардита у таких больных очень мал, перед проведени-
ем хирургических манипуляций показана антибиотикопрофилактика.
Прогноз при вторичном дефекте межпредсердной перегородки хоро-
ший даже без хирургического лечения. Небольшие дефекты не оказывают
существенного влияния на продолжительность жизни. Вследствие возмож-
ности увеличения лево-правого шунта, развития мерцательной аритмии
и сопутствующих заболеваний левого желудочка с возрастом желательно
выполнение хирургической коррекции порока до появления признаков
ухудшения функции сердца. При первичном дефекте прогноз хуже. Ос-
новным отягощающим фактором является легочная гипертензия.
Отдаленные результаты оперативного лечения в целом хорошие и луч-
ше, чем при других ВПС. При закрытии больших дефектов в среднем
возрасте могут сохраняться умеренные признаки правожелудочковой не-
достаточности, предсердные аритмии, увеличение сердца, расщепление
S2, систолический шум и rSR' в правых грудных отведениях ЭКГ.
180
ДЕФЕКТ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
Дефект межжелудочковой перегородки — это патологическое сообще-
ние между двумя желудочками. Его размеры варьируют от нескольких
миллиметров до полного отсутствия перегородки с образованием общего
желудочка. Чаще всего располагается в мембранозной части перегородки.
Дефект межжелудочковой перегородки является одним из наиболее
распространенных ВПС у детей. У взрослых он встречается значительно
реже в связи со спонтанным закрытием, даже при наличии значительного
шунта, между 1 и 4 годами жизни в 25 % случаев, гибелью части больных
от сердечной недостаточности и хирургической коррекцией порока в дет-
ском возрасте.
Механизм нарушений гемодинамики. Нарушения гемодинамики зависят
от величины сброса крови, которая определяется размерами дефекта и
сопротивлением сосудов малого и большого кругов кровообращения. Пер-
вичным нарушением гемодинамики является сброс крови че-
рез дефект из левого желудочка в правый по градиенту давления. Это вызы-
вает увеличение легочного кровотока и, следовательно, притока к левым
отделам сердца и объемную перегрузку левого желудочка и предсердия.
Компенсация достигается гиперфункцией и гипертрофией мощ-
ного левого желудочка. При дефектах диаметром менее 4-5 мм с неболь-
шим сбросом крови гипертрофия левого желудочка обеспечивает полную
компенсацию нарушений гемодинамики. При значительной величине
шунта легочный кровоток резко возрастает и в несколько раз превышает
минутный объем большого круга кровообращения. В ответ на переполне-
ние кровью постепенно развивается сужение легочных артериол вслед-
ствие гипертрофии медии и склероза. ЛСС повышается, и нарастает ле-
гочная артериальная гипертензия. Повышенное сосудистое сопротивле-
ние значительно увеличивает нагрузку на правый желудочек и вызывает
его гиперфункцию и гипертрофию.
Время развития и выраженность легочной гипертензии варьируют. Во
многих случаях она появляется рано, в первые месяцы и годы жизни.
Легочная гипертензия определяет тяжесть течения порока. По мере ее
увеличения сброс артериальной крови уменьшается. Когда сопротивле-
ние сосудов малого круга кровообращения начинает превышать сопро-
тивление сосудов большого круга кровообращения, развивается синдром
Эйзенменгера — сброс меняет свое направление, и появляется цианоз.
Нарушение компенсации проявляется развитием недостаточ-
ности функционально отягощенных желудочков - левого и правого (вслед-
ствие легочной гипертензии).
Клиника порока определяется величиной сброса крови и легочной ги-
пертензии. Небольшие дефекты (болезнь Толочинова—Роже) проявляются
лишь типичным грубым систолическим шумом с эпицентром в третьем-
четвертом межреберье у левого края грудины. Жалоб нет, данные ЭКГ и
рентгенологического исследования без изменений. Следует подчеркнуть,
181
что звучность шума не коррелирует с величиной дефекта и объемом сброса
крови (“много шума из ничего”).
При дефекте больших размеров появляются симптомы нарушений ге-
модинамики. При отсутствии легочной гипертензии или ее умеренной
выраженности больные жалуются на одышку при физической нагрузке
и утомляемость. В анамнезе - частые бронхолегочные инфекции. При фи-
зическом исследовании отмечаются бледность кожи и усиленный верху-
шечный толчок, который часто смещается влево. При аускультации
и фонокардиографии характерны: 1) грубый пансистолический
шум с эпицентром в третьем-четвертом межреберье слева у края грудины
и широкой иррадиацией, который сопровождается систолическим дро-
жанием; 2) акцент II тона над легочной артерией (Р2); 3) появление III
тона. Может отмечаться также тихий мезодиастолический шум относи-
тельного митрального стеноза.
При развитии синдрома Эйзенменгера у больных нарастают
одышка и слабость, вначале при нагрузке, а затем и в покое, которые
из-за сниженного миокардиального резерва сопровождаются сердцебие-
нием, изредка ангинозной болью. Часто отмечается кровохарканье, обус-
ловленное либо тромбозом мелких ветвей легочной артерии in situ с раз-
витием инфаркта легкого, либо разрывом мелких капилляров при физи-
ческом и эмоциональном напряжении. При разрыве артериол может раз-
виться легочное кровотечение с летальным исходом. Нарастают признаки
правожелудочковой недостаточности. При физическом обследовании об-
ращают на себя внимание стойкий центральный цианоз кожи в покое
(результат право-левого шунта) и “барабанные палочки”. Появляются на-
бухание шейных вен и периферические отеки. Важно помнить, что с умень-
шением сброса крови звучность шума и его пальпаторного эквивалента —
дрожания - резко ослабевает, что является грозным и прогностически
неблагоприятным признаком. Усиливается акцент Р2 и исчезает расщеп-
ление II тона (в отличие от сохраняющегося фиксированного расщепле-
ния II тона при дефекте межпредсердной перегородки). Часто появляют-
ся систолический тон изгнания крови в легочную артерию, правожелу-
дочковый ритм галопа (S3 или S4), протодиастолический шум относи-
тельной недостаточности растянутых клапанов легочной артерии (шум
Грэма Стилла) вдоль левого края грудины. При выраженной дилатации
правого желудочка вследствие его недостаточности между верхушкой и
мечевидным отростком определяется пансистолический шум относитель-
ной недостаточности трехстворчатого клапана.
Диагностика. На ЭКГ отмечаются признаки гипертрофии левых желу-
дочка и предсердия, а при развитии легочной гипертензии — также пра-
вого желудочка. При рентгенологическом исследовании большой сброс крови
слева направо при отсутствии существенной легочной гипертензии про-
является: 1) увеличением левого желудочка; 2) увеличением левого пред-
сердия; 3) увеличением легочной артерии; 4) усилением легочного сосу-
дистого рисунка; 5) уменьшением дуги аорты. При нарастании прека-
182
пиллярной легочной гипертензии происходит обеднение сосудистого ри-
сунка на периферии легочных полей, в то время как ствол легочной ар-
терии еще больше выбухает и появляется дилатация правых отделов сердца.
Двухмерная эхокардиография, особенно с допплеровским иссле-
дованием,в большинстве случаев верифицирует диагноз, позволяя точ-
но определить локализацию и размеры дефекта, наличие и направление
шунта. К катетеризации сердца и ангиокардиографии обычно прибегают
для уточнения величины и направления сброса крови, состояния сосу-
дов легких и наличия сопутствующих пороков. При умеренной легочной
гипертензии насыщение гемоглобина кислородом в правом желудочке
выше, чем в правом предсердии. Когда давление в легочной артерии при-
ближается к давлению в аорте, в правых отделах оно уравнивается, а в
левом желудочке становится меньшим, чем в левом предсердии.
Дефект межжелудочковой перегородки необходимо дифференцировать
с другими заболеваниями, для которых характерны систолический шум у
левого края грудины, гипертрофия и дилатация левого желудочка и при-
знаки легочной гипертензии: 1) ревматической и неревматической мит-
ральной недостаточностью; 2) обструктивной формой гипертрофической
кардиомиопатии (идиопатическим гипертрофическим субаортальным сте-
нозом); 3) стенозом устья легочной артерии; 4) “белой” тетрадой Фалло
(см. ниже); 5) дефектом межпредсердной перегородки. Диагноз ставят на
основании сопоставления характерной мелодии сердца с электрокардио-
графическими и рентгенологическими данными о том, какие отделы сер-
дца гипертрофированы и дилатированы. Уточнить его позволяют эхокар-
диография и катетеризация сердца с ангиокардиографией.
Осложнения дефекта межжелудочковой перегородки включают: 1) ос-
ложнения, связанные с прогрессированием легочной гипертензии и раз-
витием синдрома Эйзенменгера — тромбозы различной локализации, в
том числе легочной артерии с инфарктами легких, легочное кровотече-
ние, эмболии в большой круг кровообращения, правожелудочковую не-
достаточность, внезапную смерть;
2) инфекционный эндокардит с локализацией вегетаций чаще в пра-
вом желудочке в месте удара струи крови;
3) аортальную недостаточность вследствие пролапса створки клапана в
дефект, которая способствует прогрессированию левожелудочковой недоста-
точности;
4) левожелудочковую недостаточность при наличии больших шунтов.
Основными факторами, определяющими течение и прогноз, в том числе
эффект хирургического лечения, являются величина давления в легоч-
ной артерии и ЛСС.
Лечение хирургическое. Оно показано во всех случаях наличия зна-
чительного лево-правого шунта, когда легочный кровоток превышает си-
стемный в 2 раза и более. Об этом свидетельствуют признаки гипертро-
фии левого желудочка и увеличение сердца при отсутствии или умерен-
ной легочной гипертензии. В последнем случае необходима безотлагатель-
183
ная операция. Как и при дефекте межпредсердной перегородки, неболь-
шие дефекты без нарушения кровообращения и изменений на ЭКГ и
рентгенограммах не требуют коррекции. Хирургическое лечение проти-
вопоказано, когда давление в легочной артерии равно или превыша-
ет давление в аорте и имеется право-левый шунт. При этом дефект имеет
защитное значение, так как обеспечивает гемодинамическую разгрузку
правого желудочка. У взрослых производят только радикальную коррек-
цию порока путем ушивания дефекта или его пластики заплатой в усло-
виях искусственного кровообращения. Ее эффективность тем выше, чем
ниже давление в легочной артерии. При существенной легочной гипер-
тензии, связанной со склеротическими изменениями в сосудах, давле-
ние после операции практически не снижается.
Хирургическая летальность составляет около 3—5 % и зависит в основном
от легочной гипертензии.
Медикаментозная терапия неоперабельных больных с синдромом Эй-
зенменгера симптоматическая. Помимо лечения сердечной недостаточ-
ности, она включает антикоагулянты для предотвращения тромбозов ле-
гочной артерии и других органов и кровопускания при выраженной по-
лицитемии. Необходимо избегать дегидратации и системной артериаль-
ной гипотензии, которые могут вызвать летальный исход в связи с рез-
ким увеличением сброса венозной крови в большой круг кровообраще-
ния. Это обусловливает важность соблюдения осторожности в случае при-
менения периферических вазодилататоров и мочегонных средств при ле-
чении сердечной недостаточности. То же касается и внутривенных инъек-
ций из-за опасности эмболии мозга. Больным противопоказаны диагнос-
тическая катетеризация сердца и ангиокардиография. В крайне тяжелых
случаях можно рекомендовать трансплантацию комплекса “сердце—легкие”.
Прогноз при неосложненном дефекте хороший.
Отдаленные результаты хирургического лечения. Чем в более раннем воз-
расте произведена операция, тем меньше остаточная легочная гипертензия.
При выполнении операции у взрослых органические изменения в сосудах
легких сохраняются. У таких больных даже при отсутствии жалоб может
оставаться повышенным давление в легочной артерии. По данным инст-
рументальных методов исследования функция левого желудочка обычно
не изменена, а правого - несколько снижена. После операции может
сохраняться и прогрессировать аортальная недостаточность.
ОТКРЫТЫЙ АРТЕРИАЛЬНЫЙ ПРОТОК
Открытый артериальный проток представляет собой аномальное сообще-
ние между аортой и легочной артерией, которое стойко сохраняется в
постнатальный период.
Артериальный (Боталло) проток соединяет аорту дистальнее места от-
хождения левой подключичной артерии с легочной артерией в месте ее
184
бифуркации. Через этот проток большая часть ударного объема правого
желудочка плода в обход нерасправленных легких поступает в аорту и
затем — в плаценту, где кровь обогащается кислородом. Этому способ-
ствует высокое сопротивление легочных артериол. Сокращение гладких
мышц стенки протока и его закрытие сразу после рождения связано с
резким повышением РаО2 при легочной вентиляции и ингибированием
синтеза простагландина Е. Полная облитерация протока в результате про-
лиферации интимы и фиброза происходит через несколько недель, од-
нако описаны случаи спонтанного закрытия протока даже в среднем воз-
расте. В целом спонтанное его закрытие после рождения встречается зна-
чительно реже, чем дефекта межжелудочковой перегородки.
Открытый артериальный проток встречается у девочек в 3 раза чаще,
чем у мальчиков. Может сочетаться с дефектами межпредсердной, меж-
желудочковой перегородок, коарктацией аорты и другими ВПС.
Механизмы нарушения гемодинамики. Первичные нарушения ге-
модинамики обусловлены шунтированием артериальной крови из аор-
ты в легочную артерию по градиенту давления между ними, который
сохраняется в течение и систолы, и диастолы. Объем шунта зависит от
диаметра протока и давления в аорте и легочной артерии и может в 4-5
раз превышать минутный объем в большом круге кровообращения. Уве-
личение легочного кровотока вызывает увеличение притока к левым от-
делам сердца и его объемную перегрузку.
Компенсация обеспечивается гиперфункцией и гипертрофией ле-
вого желудочка.
В ответ на увеличение легочного кровотока развиваются склеротиче-
ские процессы в легочных артериолах, что приводит к повышению давле-
ния в легочной артерии и уменьшению сброса крови. При этом, однако,
возникает перегрузка сопротивлением правого желудочка, который гипер-
трофируется. Темп и степень развития легочной гипертензии зависят глав-
ным образом от размеров протока, то есть величины сброса. Чаще легоч-
ная гипертензия развивается в старшем школьном и юношеском возрасте.
Когда давление в легочной артерии и ЛСС повышаются настолько,
что превышают давление в аорте и ОПСС, сброс крови меняет свое на-
правление и появляется цианоз, свойственный синдрому Эйзенменгера.
Нарушения компенсации проявляются также развитием лево- и
правожелудочковой недостаточ ности.
Клиника зависит от величины протока, уровня давления в легочной
артерии и соотношения ЛСС и ОПСС.
Больные жалоб не предъявляют или отмечают одышку при физичес-
кой нагрузке, слабость и утомляемость, которые нарастают с усугубле-
нием легочной гипертензии. В анамнезе частые бронхолегочные инфек-
ции. В случаях отсутствия или невыраженной легочной гипертензии при
осмотре выявляют бледность кожи, высокий быстрый, “скачущий”, пульс,
усиленную пульсацию сонных артерий, увеличение пульсового АД вслед-
ствие снижения диастолического давления. Снижение ОПСС, как и при
185
аортальной недостаточности, является компенсаторным механизмом, об-
легчающим поступление крови на периферию при уменьшении минутного
объема большого круга кровообращения из-за значительного сброса в ле-
гочную артерию. При пальпации определяются усиленный верхушечный
толчок, иногда II тон над легочной артерией. Важное диагностическое зна-
чение имеет аускультация, при которой обращают на себя внимание:
I) грубый непрерывный, так называемый машинный, систоло-диастоличес-
кий шум с эпицентром в первом-втором межреберье слева у края грудины.
Он сопровождается систоло-диастолическим дрожанием, усиливается на вы-
дохе и проводится на сосуды шеи. Как хорошо видно на ФКГ, максимум
шума отмечается к началу II тона; 2) акцент S2 за счет Р2 и его расщепле-
ние; 3) частый, но непостоянный признак — систолический тон изгнания в
легочную артерию.
Легочная гипертензия, как и при дефекте межжелудочковой перего-
родки, наблюдается либо с рождения, при сохранении высокого ЛСС,
характерного для плода (большинство таких больных подвергаются опера-
тивному вмешательству или они умирают в детском возрасте), либо по-
степенно развивается к подростковому возрасту. При выраженной гипер-
тензии и изменении направления сброса появляются признаки синдро-
ма Эйзенменгера. Поскольку большая часть шунтируемой венозной
крови поступает в нисходящую часть аорты, цианоз и “барабанные палоч-
ки” более выражены на нижних конечностях (так называемый дифферен-
циальный цианоз). По этой причине некоторых больных больше беспоко-
ят слабость и утомляемость нижних конечностей, чем одышка. Важным
диагностическим признаком является изменение шума: вследствие умень-
шения сброса крови вначале исчезает его диастолический компонент, а
затем постепенно ослабевает и систолический. При этом отмечаются и
другие аускультативные проявления высокой легочной гипертензии.
Диагностика. На ЭКГ определяются признаки гипертрофии левого же-
лудочка и левого предсердия, а при нарастании легочной гипертензии -
также правого желудочка. При рентгенологическом исследовании выявля-
ют: 1) увеличение левого желудочка и 2) левого предсердия, степень ко-
торого зависит от величины их объемной перегрузки; 3) увеличение ствола
легочной артерии; 4) усиление легочного сосудистого рисунка; 5) в от-
личие от дефектов межпредсердной и межжелудочковой перегородок -
расширение дуги аорты. По мере развития синдрома Эйзенменгера рент-
генологическая картина соответствующим образом меняется.
На ЭхоКГ отмечаются признаки увеличения левых отделов сердца и
легочной гипертензии. Довольно часто удается рассмотреть проток и с
помощью допплеровского исследования определить ток крови через него.
Катетеризацию сердца обычно используют для диагностики только при
развитии синдрома Эйзенменгера, так как при отсутствии существенно-
го повышения давления в легочной артерии неинвазивные методы доста-
точно точны. Она позволяет верифицировать диагноз путем: 1) проведе-
ния катетера через проток из легочной артерии в аорту и 2) установле-
186
ния уровня и направления сброса крови с помощью оксиметрии; 3) ви-
зуализировать проток при ангиокардиографии; 4) измерить давление в
легочной артерии и ЛСС.
Дифференциальную диагностику проводят прежде всего с относительно
часто встречающимися пороками, для которых характерны изолирован-
ные систолический и диастолический шумы на основании сердца: 1) с
дефектом межжелудочковой перегородки, сочетающимся с аортальной
недостаточностью; 2) комбинированным аортальным пороком. При изо-
лированном систолическом шуме во втором межреберье слева у края гру-
дины необходимо проводить дифференциальную диагностику также со
стенозом устья легочной артерии, дефектом межпредсердной перегород-
ки и “невинным” венозным шумом в детском и юношеском возрасте.
Распознавание открытого артериального протока при отсутствии цианоза
не представляет обычно особых трудностей благодаря: 1) характерному
“машинному” непрерывному шуму, который не встречается ни при од-
ном из этих заболеваний, и акценту Р2 в сочетании с 2) данными ЭКГ;
3) рентгенологического и 4) эхокардиографического исследований.
Значительно сложнее дифференциальная диагностика открытого ар-
териального протока и редко встречающейся аномалии — разрыва
врожденной аневризмы синуса аорты (синуса Валь-
сальвы) с образованием сброса крови из аорты в правое предсердие
или правый желудочек. Для нее также характерны систоло-диастоличес-
кий шум, “скачущий” пульс и увеличение пульсового артериального кро-
вяного давления. Отличить эти два порока позволяет острое течение забо-
левания при разрыве аортального синуса, которое проявляется болью в
грудной клетке и быстро прогрессирующей сердечной недостаточностью,
данные эхокардиографии и инвазивного обследования.
“Синий” открытый артериальный проток, осложненный синдромом
Эйзенменгера, дифференцируют с другими причинами этого синдрома:
1) дефектом межжелудочковой перегородки (чаще) и 2) дефектом меж-
предсердной перегородки (реже); 3) тетрадой Фалло. Определенное зна-
чение имеет дифференциальный цианоз, однако уточнить диагноз в та-
ких случаях позволяет только инвазивное обследование.
Осложнения включают: 1) легочную гипертензию; 2) сердечную недо-
статочность: левожелудочковую при больших лево-правых шунтах и пра-
вожелудочковую при изменении направления шунта; 3) инфекционный
эндартериит (в большинстве случаев поражается интима легочной артерии
напротив отверстия протока); 4) кальциноз и аневризму открытого артери-
ального протока с разрывом (редко).
Течение и прогноз зависят главным образом от развития легочной ги-
пертензии.
Лечение открытого артериального протока хирургическое. Оно пока-
зано во всех случаях, кроме “синих” форм со сбросом крови справа
налево. У таких больных тяжесть состояния определяется необратимыми
склеротическими процессами в сосудах малого круга кровообращения, и
187
открытый артериальный проток приобретает компенсаторное значение
для снижения давления в легочной артерии и разгрузки правого желу-
дочка. Оптимальные сроки - 3-4 года, но при развитии легочной гипер-
тензии и других осложнений - раньше. Операция несложная, проводится
без искусственного кровообращения и вскрытия перикарда и состоит в
перевязке или прошивании протока с пересечением или без пересечения.
Летальность менее 0,5 %, однако она значительно повышается у отдель-
ных больных старшего возраста с широким и коротким протоком с ис-
тонченными и местами обызвествленными стенками. Хирургическое зак-
рытие открытого артериального протока в таких случаях представляет труд-
ности из-за опасности разрыва.
Отдаленные результаты хирургического лечения при открытом артери-
альном протоке по сравнению с другими ВПС наилучшие. При отсут-
ствии существенной легочной гипертензии наступает практически пол-
ное выздоровление. При наложении во время операции только одной ли-
гатуры возможна реканализация протока с появлением лево-правого
шунта, который переносится больными значительно хуже, чем при его
существовании с рождения.
КОАРКТАЦИЯ АОРТЫ
Коарктация аорты — врожденное сужение просвета аорты в области пе-
решейка или проксимальнее. Ее следует отличать от сужения нисходящей
или брюшной части аорты, которое обусловлено приобретенным заболе-
ванием - аортитом. У мужчин встречается в 2 раза чаще, чем у женщин.
Механизмы нарушений гемодинамики. Первичные нарушения ге-
модинамики обусловлены снижением АД дистальнее места сужения
аорты, что приводит к недостаточности кровообращения в нижней части
туловища, в том числе ишемии почек. Компенсация осуществляет-
ся: 1) путем гиперфункции и гипертрофии левого желудочка. Этим дос-
тигается повышение систолического давления в левом желудочке, восхо-
дящей части аорты и ее ветвях проксимальнее места сужения с образова-
нием градиента давления; 2) вследствие развития коллатерального кро-
вообращения за счет анастомозирования артерий выше и ниже места су-
жения. Оно обеспечивается межреберными артериями, артериями груд-
ной стенки и внутренними артериями молочной железы.
Нарушения компенсации: 1) артериальная гипертензия верх-
ней половины туловища усугубляется и приобретает признаки злокаче-
ственной под влиянием активации ренин-ангиотензин-альдостероновой
системы как следствия ишемии почек; 2) перегрузка левого желудочка
сопротивлением приводит к его недостаточности.
Клиника определяется артериальной гипертензией верхней половины
туловища и гипотензией — нижней, а также выраженностью коллате-
ралей.
188
Больные длительное время не предъявляют жалоб и порок может об-
наружиться лишь при поиске генеза артериальной гипертензии. Жалобы
появляются обычно в возрасте 20 — 30 лет. Больных беспокоят: 1) одыш-
ка при физической нагрузке; 2) головная боль, головокружение, появ-
ление “мушек” перед глазами: 3) быстрая утомляемость нижних конеч-
ностей, иногда боль в них при физической нагрузке по типу перемежаю-
щей хромоты. В анамнезе повышение АД с детства.
При объективном исследовании обращает на себя внимание выражен-
ное развитие мышц плечевого пояса по сравнению с нижними конечно-
стями. Важнейшим диагностическим признаком является усиление пуль-
сации сонных артерий и повышение АД, преимущественно систоличес-
кого, на верхних конечностях при резком ослаблении или отсутствии
пульсации на бедренных артериях и дистальнее. При этом АД на нижних
конечностях снижено или не определяется. В отдельных случаях, напри-
мер, при хорошем развитии коллатералей, возникновении левожелудоч-
ковой недостаточности или отхождении обеих подключичных артерий
дистальнее сужения аорты в покое АД на верхних конечностях не изме-
нено, но значительно повышается при физической нагрузке. При этом
пульс на бедренных артериях всегда резко ослаблен. Его рутинное опре-
деление при осмотре является обязательным, особенно у больных моло-
дого возраста с артериальной гипертензией. При пальпации определяют-
ся также усиленный верхушечный толчок, который может смещаться вле-
во, и пульсация расширенных коллатералей в подмышечной области по
ходу межреберий и в межлопаточном пространстве.
Данные аускультации и фонокардиографии в отличие от
таковых при других ВПС, не специфичны и не имеют существенного
диагностического значения. К ним относятся: 1) мезосистолический шум
изгнания. Он не интенсивный, не имеет определенного места выслуши-
вания и определяется то в межлопаточном пространстве на уровне Т3_4,
то над ключицами, на сосудах шеи или вдоль левого края грудины. При
значительном сужении просвета аорты шум становится непрерывным,
систоло-диастолическим; 2) акцент II тона (А2) во втором межреберье
справа у края грудины вследствие повышения давления в восходящей
части аорты; 3) непостоянный признак - систолический или систоло-
диастолический шум по ходу межреберных сосудов.
Диагностика. На ЭКГ определяются признаки гипертрофии левого же-
лудочка. При рентгенологическом исследовании отмечается аортальная форма
сердца с увеличением левого желудочка и значительным расширением
восходящей части аорты и ее дуги. Конфигурация левого контура тени
аорты в передне-задней проекции нередко приобретает форму цифры 3.
Ее верхняя половинка образована началом левой подключичной арте-
рии, а нижняя — постстенотическим расширением аорты ниже места су-
жения. Специфичным, но не всегда заметным признаком является узура-
ция нижних краев ребер извитыми расширенными межреберными колла-
теральными артериями.
189
Диагноз верифицируют с помощью двухмерной эхокардиографии, а также
ядерно-магнитного резонанса, которые позволяют определить наличие, ло-
кализацию и протяженность сужения, а допплеровское исследование - опре-
делить градиент давления. Инвазивную аортографию используют лишь в спор-
ных случаях.
Дифференциальную диагностику проводят с артериальной гипертензи-
ей другого генеза. При наличии врачебной настороженности и методич-
ности при проведении объективного обследования диагноз можно поста-
вить при отсутствии жалоб и скудных физикальных данных на основании
сочетания повышенного АД, преимущественно систолического, или уве-
личенного пульсового давления на верхних конечностях с ослаблением
или отсутствием пульса на бедренных артериях. Важным физикальным
диагностическим признаком является также выраженная пульсация аор-
ты в области яремной вырезки. Диагноз верифицируется с помощью двух-
мерной эхокардио- или аортографии.
Основными осложнениями и причинами смерти являются: 1) осложне-
ния, связанные с артериальной гипертензией: а) сердечная недостаточ-
ность; б) инсульт, чаще геморрагический; в) хроническая почечная недо-
статочность; 2) инфекционный эндартериит; 3) расслоение и разрыв истон-
ченной и дистрофически измененной аорты выше и ниже места сужения.
Течение и прогноз даже при отсутствии жалоб у больных юношеского
возраста неблагоприятны. Средняя продолжительность жизни — 35 лет;
60—70 % больных не доживают до 40 лет.
Лечение хирургическое. Операция показана практически всем боль-
ным при отсутствии серьезных осложнений — злокачественной артери-
альной гипертензии, тяжелой почечной и сердечной недостаточности. Оп-
тимальный возраст - 8—10 лет, раньше операцию производить нежела-
тельно, так как диаметр аорты после пластики при дальнейшем росте
ребенка может оказаться недостаточным. Если АД выше 150 мм рт.ст.,
операцию выполняют до 8-летнего возраста. Она заключается во вшива-
нии кругового протеза, заплаты или наложения обходного анастомоза на
пережатой аорте без искусственного кровообращения. Операционная ле-
тальность — менее 1 %. У взрослых она повышается до 10 % из-за дегене-
ративных изменений ткани аорты, высокой артериальной гипертензии и
сопутствующей ИБС. Обычно сразу после операции появляется пульс на
нижних конечностях. Снижение АД на верхних конечностях происходит в
течение нескольких месяцев.
Отдаленные результаты хирургического лечения. У части больных, особен-
но оперированных в возрасте старше 30 лет, АД снижается недостаточно, и
артериальная гипертензия верхней половины тела стойко сохраняется. Такие
больные подвержены инсультам и развитию застойной сердечной недоста-
точности. Возможно также образование рестеноза и аневризмы аорты в месте
операции. В частых случаях сочетания коарктации аорты с врожденным двух-
створчатым аортальным клапаном со временем последний обызвествляется
и развивается аортальный порок.
190
СТЕНОЗ УСТЬЯ ЛЕГОЧНОЙ АРТЕРИИ
Стеноз устья легочной артерии может быть обусловлен либо срастанием
створок клапана по комиссурам (клапанный стеноз), либо образованием
мышечной диафрагмы с небольшим отверстием над или под клапаном. После
35-40 лет в месте сужения может появляться кальциноз и присоединяться
недостаточность клапана. У мужчин встречается вдвое чаще, чем у женщин.
Механизмы нарушения гемодинамики. Первичные нарушения ге-
модинамики обусловлены препятствием на пути оттока из правого же-
лудочка, что приводит к уменьшению минутного объема малого и, сле-
довательно, большого круга кровообращения, и создает повышенную на-
грузку сопротивлением на правый желудочек. Изгнание крови через пре-
пятствие обеспечивает гиперфункция желудочка. При этом систоличес-
кое давление, развиваемое им, значительно превышает систолическое
давление в легочной артерии. Образуется систолический градиент давле-
ния на клапане, по величине которого можно судить о степени стеноза.
Стойкая компенсация порока обеспечивается гипертрофией пра-
вого желудочка. Поскольку бесполезная работа, выполняемая сердцем для
поддержания адекватного ударного выброса, при перегрузке сопротивле-
нием значительно больше, чем при перегрузке объемом, то значительно
большей выраженности достигает и компенсаторная гипертрофия мио-
карда. Вследствие резкого снижения диастолической податливости такого
желудочка до развития декомпенсации гипертрофия не сопровождается
дилатацией. Поэтому по мере утолщения стенки желудочка уменьшается
его полость — развивается так называемое самоудушение сердца, или “син-
дром малого желудочка”. Объем полости правого желудочка может не
превышать 32-40 мл. Следует отметить, что как при любом стенозе, даже
при полной компенсации первичных нарушений гемодинамики в покое,
возможности увеличения МОС при физической нагрузке резко ограниче-
ны, и у больных появляются слабость и одышка.
Нарушение компенсации проявляется развитием недостаточ-
ности гипертрофированного правого желудочка. В результате снижается
МОС в покое, который практически не возрастает при нагрузке, разви-
ваются циркуляторная гипоксия и цианоз. Однако типичная картина пра-
вожелудочковой недостаточности с выраженным венозным застоем в
большом круге кровообращения наблюдается редко.
Клиника определяется не локализацией стеноза, а его выраженностью и
состоянием компенсации. При систолическом давлении в правом желудоч-
ке менее 75 мм рт.ст. и градиенте менее 50 мм рт.ст. большинство больных не
предъявляют жалоб. Основные жалобы сводятся к утомляемости, слабости,
головокружению, обморокам и одышке при физической нагрузке, затем в
покое, которые обусловлены “фиксированным” МОС. Поскольку давление
в легочных венах не повышается, одышка не сопровождается ортопноэ. В
тяжелых случаях отмечается стенокардия вследствие неадекватности коро-
нарного кровообращения резко гипертрофированного желудочка.
191
При объективном исследовании отмечается бледность, при физической
нагрузке в тяжелых случаях возможен цианоз вследствие циркуляторной
гипоксии. Пульс не изменен или малый. Усилена пресистолическая пуль-
сация шейных вен, которая увеличивается на вдохе и при нагрузке. Паль-
пируется систолическая пульсация правого желудочка. Важное диагности-
ческое и прогностическое значение имеют данные аускультации и
фонокардиографии: 1) грубый систолический шум, который имеет
характер шума изгнания с эпицентром во втором межреберье слева у края
грудины (при подклапанном стенозе - во втором—четвертом межреберье).
Он сопровождается систолическим дрожанием в этой области и в области
яремной вырезки, имеет широкую иррадиацию, включая левую половину
шеи, усиливается на вдохе и в положении лежа; 2) ослабление II тона над
легочной артерией, вплоть до отсутствия Р2; 3) широкое расщепление II
тона, увеличивающееся на вдохе; 4) правожелудочковый IV тон вслед-
ствие усиления систолы предсердия для лучшего наполнения малоподатли-
вого желудочка; 5) систолический тон изгнания в легочную артерию (при
небольшом стенозе). Чем больше степень стеноза, тем больше звучность
шума и выраженность систолического дрожания, ближе к А2 максимум
шума, шире расщепление II тона и тише Р2. При развитии правожелудоч-
ковой недостаточности появляются систолический шум относительной не-
достаточности трехстворчатого клапана и положительный венный пульс.
Диагностика. На ЭКГ определяются признаки гипертрофии и перегруз-
ки правого желудочка - от умеренных до резко выраженных, которые
хорошо коррелируют со степенью стеноза. Отмечается также гипертрофия
правого предсердия. При рентгенологическом исследовании в случае неболь-
шого сужения легочной артерии сердце не увеличено, легочный кровоток
не изменен. При клапанном стенозе определяется постстенотическое рас-
ширение ствола легочной артерии и ее левой ветви. При более тяжелом
пороке и развитии правожелудочковой недостаточности выбухание ствола
легочной артерии несколько уменьшается и отмечаются увеличение пра-
вых желудочка и предсердия, обеднение легочного сосудистого рисунка и
уменьшение аорты. На флебограмме выражена волна “а”, а при развитии
относительной недостаточности трехстворчатого клапана — волна “v”.
Двухмерная эхокардиография не всегда помогает установить локализацию
стеноза и оценить его выраженность в связи с частыми затруднениями при
визуализации клапана легочной артерии, который хуже всего доступен ос-
мотру. Допплеровское исследование в большинстве случаев позволяет изме-
рить градиент давления в месте препятствия. В неясных случаях диагноз ве-
рифицируется с помощью катетеризации сердца и ангиокардиографии с оп-
ределением степени и места сужения легочной артерии, градиента давле-
ния и состояния насосной функции правого желудочка (его КДД).
Дифференциальный диагноз. Небольшой стеноз легочной артерии необ-
ходимо дифференцировать с: 1) “невинным” венозным шумом; 2) не-
большим клапанным и подклапанным стенозом устья аорты; 3) дефекта-
ми межпредсердной и 4) межжелудочковой перегородок, которым
192
свойственен сходный шум. В большинстве случаев это несложно с учетом:
1) особенностей шума и II тона; 2) наличия и локализации гипертрофии и
дилатации тех или иных полостей; 3) характера легочного сосудистого рисунка.
При декомпенсации порока и появлении цианоза при малейшей физи-
ческой нагрузке его необходимо отличать от синдрома Эйзенменгера и
тетрады Фалло. Для синдрома Эйзенменгера характерны призна-
ки высокой легочной гипертензии — резкий акцент II тона (Р2) и практи-
чески полное отсутствие его расщепления, часто шум Грэма Стилла. Боль-
ных стетрадой Фалло отличают одышечно-цианотичные приступы
с присаживанием на корточки. Шум обычно менее грубый, сердце не уве-
личивается, независимо от тяжести поражения. При нагрузке или вдыха-
нии амилнитрита насыщение кислородом артериальной крови резко снижа-
ется. Уточнить диагноз помогает двухмерная эходопплеркардиография. В слож-
ных случаях прибегают к катетеризации сердца и ангиокардиографии.
Осложнения. 1. Правожелудочковая недостаточность. Является поздним
осложнением умеренного и выраженного стеноза легочной артерии.
2. Внезапная смерть. Может возникать при выраженной гипертрофии
миокарда и малом желудочке.
3. Инфекционный эндокардит. Отмечается примерно у 5 % больных,
однако значительное разрушение клапана обычно не развивается.
4. Обызвествление клапана и его недостаточность. Могут возникать в
зрелом возрасте.
5. Тромбоз и тромбоэмболия легочной артерии.
Течение и прогноз зависят от выраженности стеноза. При небольшом гра-
диенте симптомы отсутствуют, и порок существенно не ухудшает про-
гноз. Таких случаев, однако, немного. При умеренном и выраженном сте-
нозе прогноз неблагоприятен. Большинство таких больных умирают в воз-
расте до 35 лет.
Лечение. Основное лечение хирургическое. Оно показано при появ-
лении первых жалоб и при бессимптомном течении заболевания, когда
градиент давления превышает 50 мм рт.ст., то есть при умеренном (50-
80 мм рт.ст.) и выраженном (> 80 мм рт.ст.) стенозе. При меньшем гра-
диенте больные не предъявляют жалоб и требуют наблюдения и хирурги-
ческого лечения при ухудшении состояния.
Риск операции значительно повышается при резком стенозе с синд-
ромом “малого желудочка” и у больных старше 20 лет при выраженных
дистрофических и склеротических изменениях в гипертрофированном ми-
окарде. Оптимальный возраст для оперативного лечения — 5—10 лет, од-
нако при выраженном стенозе приходится прибегать к операции раньше.
Хирургическое лечение противопоказано при выраженной право-
желудочковой недостаточности.
Существует два основных метода хирургического лечения:
1) вальвулотомия, то есть рассечение сросшихся комиссур, и инфунди-
булэктомия — иссечение гипертрофированных мышц выходного тракта
правого желудочка с применением искусственного кровообращения;
193
2) баллонная вальвулопластика при катетеризации сердца в после-
дние годы становится методом выбора. Летальность при операциях с при-
менением искусственного кровообращения — около 3 %, при баллонной
вальвулопластике — несколько меньше. После вмешательства на клапане
может наблюдаться небольшая регургитация крови.
Отдаленные результаты хирургического лечения. Самой частой пробле-
мой у таких больных является развитие правожелудочковой недостаточно-
сти. Она связана с остаточным клапанным стенозом, недостаточным иссече-
нием гипертрофированного миокарда в выносящем тракте правого желу-
дочка, образованием на нем обратного тока крови или с глубокой дистро-
фией гипертрофированного миокарда при слишком поздней операции.
АНОМАЛИЯ ЭБШТЕЙНА
Аномалия Эбштейна характеризуется смещением трехстворчатого кла-
пана в полость правого желудочка ближе к верхушке с увеличением за
счет этого путей притока. Такая так называемая атриализация значитель-
ной части желудочка приводит к уменьшению “эффективного” объема
его полости. Обычно вовлекаются септальная и задняя створки трехствор-
чатого клапана, которые прикрепляются позади фиброзного кольца и
деформированы. Увеличена в размерах и патологически изменена и пере-
дняя стенка. Из-за нарушения их смыкания на клапане отмечается обрат-
ный ток крови во время систолы. Стенки атриализированной части желу-
дочка истончены и его полость значительно расширена, вследствие чего
нарушается его опорожнение. Возникновению застоя крови на путях при-
тока к правому желудочку способствует также то, что эта атриализиро-
ванная камера по своей биоэлектрической активности остается частью
правого желудочка, хотя в функциональном отношении превратилась в
продолжение предсердия. “Истинное” правое предсердие гипертрофиро-
вано и расширено. Часто порок сочетается со вторичным дефектом меж-
предсердной перегородки. Это имеет важное клиническое значение, так
как прогрессирование нарушений гемодинамики приводит к развитию
цианоза, тогда как “чистая” аномалия Эбштейна без дефекта межпред-
сердной перегородки всегда “белая”. Легочный кровоток уменьшен.
Аномалия Эбштейна - редкий порок, который, однако, чаще, чем
многие другие ВПС, встречается у взрослых. На его долю приходится ме-
нее 1 % всех случаев ВПС. Мужчины и женщины болеют одинаково часто.
Механизмы нарушен 1я гемодинамики. Первичные нарушения ге-
модинамики обусловлены нарушением диастолического наполнения
уменьшенной в размерах “эффективной” полости правого желудочка. Это
сопровождается повышением его КДД и среднего давления в правом пред-
сердии и снижением МОС. Определенную роль в уменьшении наполне-
ния правого желудочка играет и его атриализированная часть. Кровь, по-
ступившая в нее в результате сокращения правого предсердия, во время
194
систолы желудочков выталкивается назад. Снижение эффективного МОС
усугубляется и недостаточностью трехстворчатого клапана.
При сопутствующем дефекте межпредсердной перегородки в случаях
умеренной выраженности анатомических нарушений, свойственных ано-
малии Эбштейна, кровь шунтируется слева направо. При резко умень-
шенном правом желудочке и значительном повышении давления в пра-
вом предсердии сброс имеет противоположное направление.
Компенсация обеспечивается гиперфункцией и гипертрофией пра-
вого предсердия, что видно по выраженным волнам “а” на кривой дав-
ления в нем.
При нарушении компенсации дилатация правого предсердия и
повышение давления в нем нарастают. Развивается застой крови в систем-
ных венах. Из-за значительного снижения МОС, особенно при нагрузке,
возникает цианоз, обусловленный циркуляторной гипоксией. У части боль-
ных закрытое ранее овальное окно открывается, и появляется право-левый
шунт, который вызывает усугубление цианоза.
Клиника зависит от выраженности анатомических нарушений. Симп-
томы могут появляться как сразу после рождения, так и значительно
позже - в юношеском возрасте. Первыми жалобами являются слабость и
одышка при физической нагрузке, обусловленные фиксированным МОС.
С возрастом появляется и прогрессирует правожелудочковая недостаточ-
ность. Частый симптом — сердцебиение вследствие аритмий, преимуще-
ственно предсердных.
При объективном исследовании может определяться цианоз, который,
однако, не является обязательным признаком заболевания. Он может от-
сутствовать в далеко зашедших случаях и, наоборот, отмечаться при бес-
симптомном течении заболевания. У взрослых пациентов шейные вены
обычно набухшие, ЦВД повышено. Положительный венный пульс недо-
статочности трехстворчатого клапана определяется в основном только
при наличии клинических признаков правожелудочковой недостаточности.
Пульс на лучевых артериях малый, часто аритмичен. При пальпации пре-
кардиальной области пульсация правого желудочка и II тон над легочной
артерией не определяются (так называемая тихая прекардиальная область),
что позволяет заподозрить этот порок у цианотичных больных.
При аускультации сердца тоны приглушены и у взрослых боль-
ных часто определяется аритмия. Характерен добавочный систолический клик,
связанный с пролабированием задней створки трехстворчатого клапана
во время его закрытия в атриализированную часть желудочка. У левого
края грудины в ее нижней части определяется систолический шум, кото-
рый имеет различный характер и обусловлен как регургитацией крови в
правое предсердие, так и препятствием ее изгнанию в выносящем тракте
правого желудочка. При уменьшении легочного кровотока II тон ослаб-
лен. Вследствие запаздывания Р2 из-за блокады правой ножки пучка Гиса
он расщеплен. Определяется звучный III тон, за которым часто следует
короткий мезодиастолический шум относительного стеноза трехстворча-
195
того клапана. В результате образуется четырехчленный ритм, весьма ха-
рактерный для этого порока. Шумы усиливаются на вдохе.
Диагностика. На ЭКГ имеются признаки блокады правой ножки пучка
Гиса и P-pultnonale. Вольтаж снижен, признаки гипертрофии правого желу-
дочка не определяются. Более чем у 20 % больных отмечается синдром
Вольфа—Паркинсона-Уайта, обычно типа В. Кроме мерцательной арит-
мии часто регистрируются самые разные предсердные и желудочковые
нарушения ритма.
При рентгенологическом исследовании сердце увеличено, иногда значи-
тельно, за счет правого предсердия, которое может достигать гигантских
размеров. Тень сердца имеет шаровидную форму, пульсация ее ослаблена.
Легочная артерия и аорта уменьшены. Сосудистый рисунок легких не из-
менен или у цианотичных больных обеднен.
При эхокардиографии в М-режиме определяется пролабирование перед-
ней створки трехстворчатого клапана, запаздывание его закрытия по отно-
шению к митральному клапану и смещение всего клапанного аппарата кни-
зу. Эти изменения неспецифичны. Высокоинформативным и ценным мето-
дом диагностики является двухмерная эхокардиография, при которой
четко видно патологическое расположение трехстворчатого клапана в по-
лости правого желудочка и атриализация большей или меньшей его части.
Допплеровское исследование выявляет обратный ток крови на клапане и
шунтирование крови на уровне предсердий.
Катетеризация сердца и ангиокардиография при аномалии Эбштейна
связаны с повышенным риском фатальных пароксизмальных аритмий и
их выполнение требует особой осторожности. Форма кривых давления в
легочной артерии и правых отделах сердца очень похожа, а уровень дав-
ления примерно одинаков. Подтвердить диагноз позволяет одновремен-
ная запись давления и внутрисердечной ЭКГ. При подтягивании катетера
из верхушки правого желудочка сразу за трехстворчатым клапаном кри-
вая давления меняет свою форму, напоминая предсердную, тогда как
графика ЭКГ остается прежней, “желудочковой”.
На правосторонней вентрикулограмме видно смещение трехстворча-
того клапана с регургитацией крови через него, огромная, медленно опо-
рожняющаяся полость правого предсердия и в ряде случаев — патологиче-
ский межпредсердный шунт. По своей информативности ангиокардиог-
рафия не имеет преимуществ перед двухмерной эхокардиографией.
Дифференциальную диагностику у взрослых проводят с заболеваниями,
сопровождающимися кардиомегалией и застойной сердечной недостаточ-
ностью. Диагностировать экссуд ат и вн ы й перикардит и не ко -
ронарогенные заболевания м ио кард а , в первую очередь, дила-
тационную кардиомиопатию, легко позволяет эхокардиография. Для них
но характерна также блокада правой ножки пучка Гиса. При врожденном
стенозе устья легочной артерии с тяжелой правожелудочко-
вой недостаточностью и цианозом на ЭКГ определяются признаки гипер-
трофии правого желудочка, а при рентгенологическом исследовании —
196
постстенотическое расширение легочной артерии. При наличии относи-
тельной недостаточности трехстворчатого клапана она не сопровождается
изменением его положения в полости желудочка. Для “чистого” дефекта
межпредсердной перегородки, как и для аномалии Эбштейна,
характерна блокада правой ножки пучка Гиса. Отличить этот порок, кроме
данных ЭхоКГ, позволяют митральная форма тени сердца с увеличением
легочного ствола и усиленный легочный сосудистый рисунок, а также
признаки повышения давления в легочной артерии. Ревматическая
недостаточность трехстворчатого клапана, как правило, со-
четается с поражением митрального клапана.
Таким образом, для аномалии Эбштейна, в отличие от этих заболева-
ний, характерны признаки правожелудочковой недостаточности и регур-
гитации крови на трехстворчатом клапане при отсутствии данных за ле-
гочную гипертензию и гипертрофию правого желудочка в сочетании с
блокадой правой ножки пучка Гиса на ЭКГ. Подтвердить диагноз позво-
ляет двухмерная эхокардиография с допплеровским исследованием, а в
особо сложных случаях — катетеризация правого сердца с одновремен-
ной регистрацией внутриполостной ЭКГ.
Осложнения: 1) предсердные аритмии. В возрасте старше 20 лет мерца-
тельная аритмия имеется практически у всех больных;
2) хроническая правожелудочковая недостаточность. Как и наруше-
ния ритма, она настолько распространена, что может считаться проявле-
нием заболевания. Является основной причиной смерти;
3) внезапная смерть. Повышенный риск ее возникновения у таких боль-
ных связан с подверженностью желудочковым аритмиям;
4) парадоксальная эмболия и абсцесс мозга.
Течение и прогноз. Заболевание отличается прогрессирующим течени-
ем, в ходе которого у части больных появляется цианоз. Хотя прогноз в
целом неблагоприятен, продолжительность жизни больных значительно
колеблется. При минимальных анатомических нарушениях она достигает
50 лет, но в среднем составляет 23 года — 26 лет.
Лечение. При прогрессировании сердечной недостаточности и появле-
нии цианоза показана хирургическая коррекция. Она состоит в пластике
правого предсердия для ликвидации его атриализированной части и про-
тезировании или анулоаппликации трехстворчатого клапана при выра-
женной регургитации. В случаях сопутствующего дефекта межпредсерд-
ной перегородки, если позволяет выраженность правожелудочковой не-
достаточности, производят его хирургическую коррекцию. То же касается
и синдрома Вольфа-Паркинсона-Уайта, протекающего с частыми при-
ступами пароксизмальной тахикардии. Оперативное лечение является пал-
лиативным, и его результаты хуже, чем при многих других ВПС. В частно-
сти, оно не предотвращает нарушений ритма, которые являются основ-
ной причиной смерти таких больных. Поэтому при относительно легких
формах порока операция не показана.
197
Медикаментозная терапия направлена на лечение сердечной недоста-
точности и нарушений ритма.
ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА,
СОПРОВОЖДАЮЩИЕСЯ ЦИАНОЗОМ
Основными “синими” ВПС у взрослых являются:
1) пороки с уменьшенным легочным кровотоком, для которых характе-
рен цианоз с рождения. Наиболее распространенным из них у взрослых
является тетрада Фалло;
2) пороки с увеличенным ЛСС, при которых цианоз появляется обычно
в подростковом возрасте или позже. К ним относятся дефект межжелу-
дочковой перегородки и открытый артериальный проток с синдромом
Эйзенменгера. Очень редко этот синдром встречается также при дефекте
межпредсердной перегородки.
ТЕТРАДА ФАЛЛО
Тетрада Фалло включает в себя 4 анатомических признака:
1) стеноз легочной артерии — клапанный и в большинстве случаев
также подклапанный, мышечный (инфундибулярный);
2) высокий больших размеров дефект межжелудочковой перегород-
ки, верхний край которого образован створками аортального клапана;
3) декстропозицию аорты, то есть смещение устья аорты таким обра-
зом, что она как бы сидит верхом на межжелудочковой перегородке, и
получает кровь из обоих желудочков;
4) гипертрофию правого желудочка.
При наличии дополнительно открытого овального окна или дефекта
межпредсердной перегородки с право-левым сбросом крови порок назы-
вается пентадой Фалло.
Механизм нарушений гемодинамики. Характер первичных наруше-
ний гемодинамики определяется выраженностью стеноза легоч-
ной артерии. От него зависит направление сброса крови, но не систоли-
ческое давление в правом желудочке, которое из-за больших размеров
дефекта всегда равно давлению в левом желудочке и аорте.
При выраженном стенозе легочный кровоток снижен. Значительная часть
крови сбрасывается из правого желудочка в аорту, где она подмешивает-
ся к артериальной крови из левого желудочка и обусловливает развитие
цианоза. Сброс крови справа налево особенно увеличивается при физи-
ческой нагрузке, когда венозный приток крови к сердцу значительно
возрастает, а кровоток через легкие практически не увеличивается из-за
стеноза легочной артерии. При этом весь избыток крови, поступающей в
правые отделы сердца, сбрасывается в аорту, что приводит к увеличению
198
доли “венозной примеси”. Насыщение гемоглобина кислородом в арте-
риальной крови может снижаться до 60 %.
Если стеноз легочной артерии умеренный, то в покое сброс крови че-
рез дефект межжелудочковой перегородки происходит слева направо, и
легочный кровоток оказывается увеличенным, а цианоз отсутствует. Та-
кая тетрада Фалло получила название белой. При физической нагрузке
приток крови к сердцу возрастает, а легочный кровоток из-за стеноза
легочной артерии не изменяется. Избыток венозной крови сбрасывается
в аорту, что сопровождается появлением цианоза.
Компенсация нарушений гемодинамики осуществляется прежде все-
го за счет гипертрофии функционально отягощенного правого желудочка.
Из-за широкого сообщения между желудочками и декстропозиции аорты
давление в правом желудочке не может превысить давление в аорте и та-
ким образом не достигает столь высокого уровня, как при изолированном
стенозе легочной артерии. Вследствие этого гипертрофия правого желу-
дочка менее выражена, а полость его не достигает столь малых размеров.
Внесердечная компенсация нарушений гемодинамики включает: а) разви-
тие полицитемии с увеличением количества эритроцитов до (1—8)' 1012/л
и гемоглобина до 250 г/л, что способствует повышению содержания кисло-
рода в крови; б) образование анастомозов между бронхиальными артерия-
ми и системой легочных артерий. В результате в малый круг кровообраще-
ния дополнительно поступает и оксигенируется кровь из аорты.
Нарушения компенсации проявляются: 1) недостаточностью
гипертрофированного правого желудочка; 2) нарушением функции орга-
нов, находящихся в условиях гипоксии, в том числе миокарда желудоч-
ков с развитием застойной сердечной недостаточности; 3) нарушением
функции органов, обусловленным тромбозами вследствие полицитемии.
Необходимо подчеркнуть, что состояние гемодинамики при тетраде
Фалло у каждого больного весьма динамично и может меняться в зависи-
мости от величины ОПСС. Так, при повышении АД систолическое дав-
ление в правом желудочке увеличивается, и легочный кровоток возрас-
тает. Наоборот, снижение ОПСС, как и физическая нагрузка, приводит
к увеличению право-левого шунта. Подвержена колебаниям и выражен-
ность препятствия изгнанию крови из правого желудочка. При инфунди-
булярном (мышечном) стенозе усиление сокращений миокарда правого
желудочка или внезапное уменьшение его наполнения при снижении
венозного притока вызывает еще большее сужение выносящего тракта и
увеличение градиента давления в нем, а следовательно, - сброса веноз-
ной крови в аорту. Полагают, что этот механизм лежит в основе характер-
ных для больных с тетрадой Фалло одышечно-цианотичных приступов,
что подтверждается и эффективностью их лечения р-адреноблокаторами.
Клиника. Проявления заболевания определяются выраженностью сте-
ноза легочной артерии и направлением сброса крови. Основной жалобой
больных является одышка при физической нагрузке вследствие артериаль-
ной гипоксемии. Для “синей” тетрады очень характерны гипоксические,
199
или цианотические, приступы, которые проявляются резкой одышкой,
усугублением цианоза, иногда обмороками и судорогами, и могут закон-
читься летальным исходом. Эти приступы можно предотвратить присажи-
ванием на корточки или переходом в коленно-локтевое положение, чем
регулярно пользуются больные. Присаживание на корточки уменьшает
цианоз вследствие увеличения легочного кровотока путем повышения
ОПСС и системного венозного возврата. В анамнезе — цианоз с раннего
детства, который в большинстве случаев впервые появляется в возрасте
3-6 мес и даже позже.
При осмотре обращают на себя внимание заметное отставание в физи-
ческом развитии, диффузный цианоз, вплоть до “чернильного”, и “бара-
банные палочки”. Время появления и выраженность этих признаков, обу-
словленных артериальной гипоксемией, зависят от степени стеноза легоч-
ной артерии. У левого края грудины пальпируется пульсация гипер-
трофированного правого желудочка, а у части больных также систолическое
дрожание во втором-третьем межреберье. Признаки правожелудочковой не-
достаточности в детстве отмечаются очень редко и начинают появляться у
взрослых, чему способствует развитие недостаточности клапана легочной
артерии и системной артериальной гипертензии.
Основными аускультативными признаками тетрады Фалло
являются: 1) систолический шум с эпицентром во втором-третьем меж-
реберье слева у грудины: 2) резкое ослабление и запаздывание Р2, кото-
рый часто не слышен, и II тон представлен одним А2. Систолический
шум обусловлен подклапанным и клапанным стенозом легочной артерии
и представляет собой относительно короткий шум изгнания. Чем менее
выражен стеноз, тем больше легочный кровоток и громче и продолжи-
тельнее шум. При относительно небольшом стенозе он сопровождается
систолическим дрожанием. Во время цианотических приступов шум ос-
лабевает или исчезает. Вследствие больших размеров дефекта межжелу-
дочковой перегородки при тетраде Фалло он не вызывает появления шума.
У взрослых больных могут определяться также протодиастолический шум
недостаточности клапанов легочной артерии после Р2 вследствие разви-
тия их кальциноза. У части пациентов выслушивается шум аортальной
регургитации (после А2) в правый желудочек. Она способствует развитию
правожелудочковой недостаточности, дилатации правого желудочка и
появлению шума относительной недостаточности трехстворчатого кла-
пана. Отличительные признаки “белой” тетрады представлены в табл. 10.
Диагностика. На ЭКГ определяются признаки гипертрофии правых же-
лудочка и предсердия При рентгенологическом исследовании сердце, как
правило, не увеличено и имеет характерную аортальную конфигурацию в
виде сабо (деревянного башмачка) с приподнятой кверху верхушкой за
счет увеличения правого желудочка и вогнутостью в области легочного
ствола. Так как преобладает подклапанный (мышечный) стеноз легочной
артерии, ее постстенотическое расширение встречается редко. Чем выра-
200
Таблица 10. Отличительные особенности клинических проявлений н данных дополнительных
методов исследования при “синен” н “белой” тетраде Фалло
Признак Тетрада Фалло
"синяя" "белая"
Анатомия Стеноз легочной артерии Выражен Слабо выражен
Легочный кровоток Снижен Не изменен или увеличен
Жалобы Одышка при физической нагрузке Выраженная Умеренная
Одышечно-цианотиче- ские приступы Характерны Отсутствуют
Присаживание на корточки Характерно Отсутствует
Анамнез Цианоз с раннего детства Характерен Отсутствует
Осмотр Отставание в физи- ческом развитии Выраженное Умеренное, реже отсутствует
Диффузный цианоз Выраженный Отсутствует или только при физической нагрузке
"Барабанные палочки" Выраженные Отсутствуют
Аускультация Систолический шум Шум изгнания во Также пансистоли-
сердца втором-третьем межреберье слева у края грудины ческий шум в четвер- том межреберье слева у края грудины
Ослабление Р2 и рас- щепление II тона Резко выражены Умеренные
ЭКГ Гипертрофия Правых желудочка и предсердия В ряде случаев также левого желудочка
Рентгено- Сердце В форме сабо
логическое исследование Легочный рисунок Ослаблен Не изменен или усилен
Катетеризация Давление в легочной Снижено Не изменено
сердца артерии Градиент между и легочной правым желудочком артерией
Сброс крови через дефект межжелудоч- ковой перегородки Справа налево Слева направо
женнее стеноз, тем более заметна дуга аорты. Легочный сосудистый рису-
нок ослаблен или не изменен.
При двухмерной эхокардиографии с допплеровским исследованием хорошо
видны все анатомические признаки порока и увеличение правого желудочка
при малоизмененных размерах правого предсердия.
Подтвердить диагноз позволяет катетеризация сердца, при которой
определяются следующие признаки: 1) градиент систолического давления
201
между правым желудочком и легочной артерией; 2) давление в правом
желудочке равно давлению в аорте; 3) давление в легочной артерии уме-
ренно снижено или не изменено; 4) признаки шунтирования крови на
уровне желудочков. Правосторонняя вентрикулография помогает уточнить
морфологию выносящего тракта правого желудочка, наличие дефекта меж-
желудочковой перегородки и направление сброса крови через него.
При лабораторном обследовании выявляют полицитемию и снижение
насыщения гемоглобина артериальной крови кислородом до 70-90 %.
Дифференциальную диагностику у взрослых при “синей” тетраде Фалло
проводят в основном с синдромом Эйзенменгера и хроническим легоч-
ным сердцем, а при “белой” — с изолированным стенозом легочной ар-
терии и дефектом межжелудочковой перегородки (см. выше).
Диагноз тетрады Фалло ставят на основании характерной “тетрады” при-
знаков: 1) центральный цианоз; 2) систолический шум изгнания над ле-
гочной артерией; 3) II тона, представленного одним А2; 4) гипертрофии
правого желудочка на ЭКГ. Он верифицируется с помощью двухмерной
эхокардиографии и катетеризации полостей сердца.
Основными осложнениями и причинами смерти являются:
1) правожелудочковая недостаточность, которая встречается доволь-
но редко и появляется поздно, обычно при развитии предсердных нару-
шений ритма;
2) осложнения, связанные с артериальной гипоксемией, прежде все-
го повреждение коры большого мозга, вплоть до летального исхода во
время цианотических приступов;
3) осложнения, связанные с полицитемией и повышением вязкости
крови. Наиболее частыми и тяжелыми среди них являются тромбоз моз-
говых вен и парадоксальная тромбоэмболия мозговых артерий. Как и при
синдроме Эйзенменгера, встречаются и абсцессы мозга, в отношении
которых должна быть настороженность при возникновении жалоб на го-
ловную боль и повышение температуры тела. Мозговые осложнения на-
блюдаются у 5 % больных с тетрадой Фалло;
4) инфекционный эндокардит.
Течение заболевания и прогноз зависят от выраженности стеноза ле-
гочной артерии и в основном неблагоприятны. Тем не менее, тетрада
Фалло является самым распространенным “синим” ВПС у взрослых. Хотя
у отдельных больных продолжительность жизни может превышать 40 лет,
подавляющее большинство умирают в возрасте до 20 лет. При “белых”
формах прогноз лучше. С возрастом инфундибулярный стеноз может про-
грессировать вследствие нарастания гипертрофии, что влечет за собой
уменьшение притока крови к легким. Одновременно возрастает право-
левый шунт, приводя к появлению цианоза, “барабанных палочек” и
полицитемии.
Лечение. Идеальной является радикальная коррекция тетрады Фалло в
условиях искусственного кровообращения. Оперативное лечение
показано практически во всех случаях порока. При тяжелых формах
202
(значительное ограничение физической активности, частое присажива-
ние на корточки и цианотические приступы, гемоглобин 200 г/л и бо-
лее), особенно в возрасте до 5 лет, в качестве предварительного этапа
выполняют паллиативную операцию наложения анастомоза между аор-
той и легочной артерией. Существует несколько вариантов таких опера-
ций. Метод Blalock—Taussig состоит в анастомозировании подключичной
и легочной артерий, операция Potts — в наложении анастомоза между
нисходящей частью аорты и левой легочной артерией и операция Watersoil
- в наложении анастомоза между восходящей частью аорты и правой
легочной артерией. Создание такого подобия протока Боталло позволяет
увеличить легочный кровоток, приводит к уменьшению гипоксии, циа-
ноза и улучшению физического состояния больных. В ряде случаев при
сложных анатомических вариантах порока эта операция становится ко-
нечным этапом хирургического лечения.
Взрослым больным показана только радикальная коррекция, так как сам
факт достижения такого возраста свидетельствует об относительной “легко-
сти” порока. Летальность при радикальной коррекции у взрослых ниже, чем
у детей, и составляет в настоящее время около 10 %.
Медикаментозная терапия одышечно-цианотических приступов вклю-
чает придание больным коленно-локтевого положения, введение мор-
фина и ингаляции кислорода. Для предотвращения приступов в плановом
порядке с осторожностью во избежание артериальной гипотензии назна-
чают p-адреноблокаторы. При выраженной полицитемии проводят кро-
вопускания с возмещением ОЦК плазмозаменителями. Показана профи-
лактика инфекционного эндокардита.
Отдаленные результаты хирургического лечения. Даже паллиативная опе-
рация дает разительное клиническое улучшение. Несмотря на исчезнове-
ние жалоб, часто сохраняется систолический шум из-за остаточного ин-
фундибулярного или клапанного стеноза в выносящем тракте правого
желудочка. Могут появляться признаки небольшой недостаточности кла-
пана легочной артерии или аорты.
ГЛАВА 7.
ПРИОБРЕТЕННЫЕ ПОРОКИ СЕРДЦА
Приобретенными пороками сердца страдает примерно 0,5—1 % населения
умеренного пояса, причем они составляют 20—25 % всех органических
заболеваний сердца и по частоте занимают третье место после системной
эссенциальной артериальной гипертензии и ИБС (В.Ионаш, 1963). По
секционным данным, частота приобретенных пороков сердца составляет
4-8 % (И.А.Кассирский, Г.И.Кассирский, 1964, и др.).
По данным Н.М.Амосова и Я.А.Бендета (1983), основанным на опыте
14 752 операций при приобретенных пороках сердца, изолированное
203
поражение левого атриовентрикулярного клапана составляет 71,5 %, кла-
пана аорты — 8,8 %, сочетанное поражение митрального и аортального
клапанов — 12,3 %. Около 7,4 % составляют поражения трехстворчатого
клапана в сочетании с другими пороками.
МИТРАЛЬНЫЙ СТЕНОЗ
Митральный стеноз представляет собой сужение левого предсердно-
желудочкового отверстия, которое препятствует току крови из левого пред-
сердия в желудочек во время диастолы желудочков.
Эпидемиология. Частота митрального стеноза в различных странах зна-
чительно колеблется соответственно распространенности ревматизма. В
нашей стране и странах Востока она значительно выше, чем в Западной
Европе и США, — соответственно 50-80 и 5 на 100 000 населения
(В.Х.Василенко, С.Б.Фельдман, 1983). Поданным Н.М.Амосова иЯ.А.Бен-
дета (1983), “чистый”, или превалирующий, митральный стеноз состав-
ляет 83,2% случаев митральных и 62,4 % всех приобретенных пороков
сердца; 2/3 больных с митральным стенозом — женщины.
К этиологическим факторам митрального стеноза относятся: 1) ревма-
тизм; 2) врожденный порок; 3) кальциноз митрального кольца; 4) опу-
холи левого предсердия. Основной причиной является ревматизм. Очень
редко порок может быть врожденным, так называемый митральный кла-
пан в виде парашюта, для которого характерно прикрепление всех хорд к
одной сосочковой мышце. Приобретенный митральный стеноз описан
при дегенеративном поражении митрального клапана - кальцинозе его
кольца. Сужение митрального отверстия изредка может быть обусловлено
миксомой (опухолью на ножке) левого предсердия, а также вегетациями
на створках клапана при инфекционном эндокардите. Очень редко стеноз
является исходом эндокардита при системных заболеваниях соединитель-
ной ткани, в частности системной красной волчанке.
Патологическая анатомия. Характерны значительные фиброзные измене-
ния клапанного аппарата в виде слияния комиссур, утолщения и кальцино-
за створок и кольца. Часто отмечаются также утолщение, слияние и уко-
рочение сухожильных хорд, вследствие чего клапан приобретает форму
воронки. При ревматическом генезе порока первоначальные изменения
морфологии клапана возникают как исход острого ревмокардита. Впос-
ледствии они постепенно усугубляются из-за постоянной травматизации
клапана током крови в результате нарушений кардиогемодинамики, а
также отчасти вследствие вялотекущего ревматического воспаления. Каль-
циноз стенозированного клапана приводит к полной иммобилизации его
створок и еще большему сужению отверстия.
Механизмы нарушения гемодинамики. Первичным нарушением
гемодинамики является сужение митрального отверстия, которое
образует так называемый 1-й барьер. Когда его площадь составляет
менее половины нормальной величины (4—6 см2 у взрослых), кровь может
204
поступать из левого предсердия в желудочек только под действием зна-
чительного градиента давления. Таким образом, компенсация обес-
печивается: 1) повышением давления в левом предсердии и 2) усилени-
ем и удлинением его систолы, что проявляется соответственно увеличе-
нием волны “а” на флебограмме и удлинением интервала Q—I тон. При
относительно небольшом стенозе давление в левом предсердии повыша-
ется только при физической нагрузке, когда необходимо обеспечить при-
рост МОС. Возникновению диастолического градиента давления при этом
способствует укорочение периода диастолического наполнения вследствие
увеличения ЧСС. Повышение давления в левом предсердии приводит к
увеличению давления в легочных венах и капиллярах, что вызывает сни-
жение податливости легких и появление одышки.
Когда площадь отверстия уменьшается примерно до 1 см2, для сохра-
нения нормального МОС в покое требуется значительное повышение дав-
ления в левом предсердии — примерно до 25 мм рт. ст. Развивается пас-
сивная (венозная, посткапиллярная) легочная гипертензия, что приво-
дит к увеличению давления в легочной артерии и создает повышенную
нагрузку сопротивлением на правый желудочек, вследствие чего разви-
вается его компенсаторная гипертрофия. При возрастании притока крови
к левому предсердию, например, при физическом или эмоциональном
напряжении, в условиях резко ограниченной пропускной способности
митрального отверстия давление в легочных капиллярах повышается на-
столько, что происходит транссудация жидкой части плазмы крови в аль-
веолы, то есть отек легких. Эти эпизоды позволяет предотвратить реф-
лекс Китаева, который состоит в активном сужении легочных арте-
риол в ответ на раздражение барорецепторов при повышении давления в
левом предсердии и легочных венах. Защитный эффект этого механизма
обусловлен уменьшением притока крови к легким и, следовательно, сни-
жением давления в легочных капиллярах и левом предсердии. Вначале
спазм легочных артериол является преходящим, но затем он приобретает
стойкий характер. Постепенно присоединяются органические изменения
в сосудах в виде утолщения медии и склероза с развитием их облитера-
ции. Возникает устойчивая, так называемая активная, артериальная, или
прекапиллярная, легочная гипертензия, которая сопровождается значи-
тельным повышением ЛСС и образует так называемый 2-й барьер.
Защитный эффект “2-го барьера” обеспечивается, однако, за счет сни-
жения и фиксации МОС вследствие резкого ограничения притока крови
к левым отделам сердца, а также значительной перегрузки сопротивле-
нием правого желудочка. Это в конце концов исчерпывает компенсатор-
ные возможности его гипертрофии и приводит к развитию недостаточ-
ности с дилатацией желудочка и застоем крови на путях его притока, то
есть в большом круге кровообращения. Выраженная дилатация правого
желудочка вызывает развитие относительной недостаточности трехствор-
чатого клапана, а высокая легочная артериальная гипертензия — недо-
статочность клапанов легочной артерии.
205
Клиника. Жалобы. 1. Од ы ш ка. Является основной жалобой. Она возника-
ет вначале только при физической нагрузке, а затем, по мере усугубления
стеноза, и в покое, сопровождаясь кашлем. Одышка усиливается в положе-
нии лежа, из-за чего больной вынужден занимать положение полусидя или
сидя (ортопноэ). Она обусловлена увеличением работы дыхания вследствие
уменьшения податливости легких из-за: а) венозного застоя с транссуда-
цией жидкой части плазмы крови из легочных капилляров в интерстици-
альную ткань и альвеолы; б) прогрессирующего фиброза стенок альвеол.
2. Приступы удушья. Появляются при выраженном митральном
стенозе и сопровождаются кашлем. В тяжелых случаях выделяется розовая
пенистая мокрота — развивается отек легких.
3. Кровохарканье. Рецидивирующее кровохарканье после одышки яв-
ляется самым частым первым признаком заболевания. Обусловлено разры-
вом анастомозов между легочными и бронхиальными венами вследствие
легочной венозной гипертензии, поэтому особенно выражено при зна-
чительном повышении давления в левом предсердии при отсутствии сущес-
твенной артериальной гипертензии в малом круге кровообращения. Крово-
харканье может вызываться также инфарктом легкого, отеком легких и ост-
рым бронхитом. При резком повышении ЛСС эпизоды кровохарканья,
как и отека легких, значительно урежаются.
4. Слабость и утомляемость. Обычно резко выражены и обу-
словлены сниженным и фиксированным МОС.
5. Перебои и сердцебиение . Вначале эпизодические, приступо-
образные, затем постоянные. Они связаны в основном с суправентрику-
лярными аритмиями, главным образом мерцательной. Вызывают одышку,
которая беспокоит больных значительно больше, чем перебои, из-за чего
они часто остаются незамеченными больными. Возникновение постоян-
ной формы мерцания предсердий приводит к резкому ухудшению общего
состояния и является поворотным пунктом в течении митрального стеноза.
6. Жалобы, характерные для правожелудочковой не-
достаточности. Появляются при повышении ЛСС. Больные отмеча-
ют периферические отеки, вначале только к вечеру, затем постоянные,
и чувство тяжести в надчревной области и правом подреберье.
Менее характерны нарушения глотания из-за резкого увеличе-
ния левого предсердия и боль в грудной клетке . Она носит харак-
тер неспецифической кардиалгии или (реже) стенокардии, которая обу-
словлена выраженной гипертрофией правого желудочка или сопутствую-
щим коронарным атеросклерозом.
Несмотря на то что ревматический генез порока имеется у подавляю-
щего большинства больных, лишь у части из них в анамнезе можно уста-
новить признаки перенесенной острой ревматической лихорадки (см. ниже).
В этих случаях свойственные митральному стенозу жалобы появляются
постепенно, обычно через 5—20 лет после “атаки”, что необходимо для
формирования гемодинамически значимого сужения клапанного отвер-
стия. Реже начало заболевания бывает острым: развиваются отек легких,
206
тромбоэмболия или пароксизм мерцательной аритмии. Болезнь довольно
быстро прогрессирует и вызывает инвалидизацию в среднем через 2 года
- 5 лет. У больных пожилого возраста, живущих в экономически развитых
странах, темпы прогрессирования болезни более медленные.
Физическое исследование. В стадии развернутых клинических проявлений
заболевания при осмотре больные занимают вынужденное положение
(ортопноэ). Отмечаются акроцианоз и цианоз лица с характерным синюш-
ным румянцем в области скул (facies тйгаП5).При высокой легочной ги-
пертензии может определяться усиленная пресистолическая пульсация шей-
ных вен (волны “а”), которая при мерцательной аритмии и особенно раз-
витии относительной недостаточности трехстворчатого клапана исчезает
и сменяется систолической (положительный венный пульс, волны “с + v“).
Характерен pulsus differens вследствие сдавления левой подключичной
артерии растянутым левым предсердием. Часто пульс малый из-за низко-
го МОС и аритмичный при развитии мерцательной аритмии.
При осмотре и пальпации грудной клетки верхушечный
толчок резко ослаблен или не определяется, так как левый желудочек
оттесняется кзади гипертрофированным правым. Пульсация правого же-
лудочка во время систолы хорошо заметна под мечевидным отростком и
усиливается на вдохе вследствие увеличения его наполнения. Реже она
отмечается в третьем-четвертом межреберье у левого края грудины. При
высокой легочной гипертензии может пальпаторно определяться (лучше
на выдохе) закрытие клапанов легочной артерии (Р2) во втором межре-
берье слева. Характерно диастолическое дрожание - “кошачье мурлыка-
нье” — в области верхушки, которое лучше определяется в положении на
левом боку после физической нагрузки при задержке дыхания на выдохе.
Оно возникает вследствие низкоамплитудных колебаний крови при про-
хождении через суженное митральное отверстие.
Важное диагностическое значение имеют данные аускультации
сердца:
1) усиленный, хлопающий, I т о н . Он обусловлен ограни-
ченным наполнением кровью левого желудочка, вследствие чего находя-
щиеся на значительном расстоянии друг от друга к началу систолы створки
митрального клапана проходят больший путь при смыкании и вследствие
гиперкинетического сокращения желудочка движутся быстрее. Непремен-
ным условием усиления I тона является достаточная подвижность ство-
рок клапан i; если из-за грубого фиброза и кальциноза она утрачивается,
1 тон теряет свою звучность;
2) щелчок открытия митрального клапана (OS). Луч-
ше всего выслушивается над верхушкой сердца или в четвертом межребе-
рье слева у края грудины в положении лежа на левом боку на выдохе. Как
и хлопающий I тон, исчезает при утрате подвижности створок клапана;
3) акцент II тона (Р2) над легочной артерией. Возникает вслед-
ствие легочной гипертензии. При этом из-за удлинения систолы правого
желудочка II тон часто расщеплен. При высокой легочной гипертензии и
207
дилатации ствола легочной артерии может определяться систолический
тон изгнания крови в легочную артерию;
4) диастолический шум. Вначале выслушивается изолированный
пресистолический шум, а при более выраженном стенозе — мезодиастоличе-
ский с пресистолическим усилением. Мезодиастолический шум следует за
щелчком открытия митрального клапана и по мере уменьшения градиента
диастолического давления при опорожнении левого предсердия стихает (’’дек-
рещендо”). Его продолжительность коррелирует с выраженностью стеноза,
однако при низком МОС из-за снижения кровотока через клапанное отвер-
стие он уменьшается. Шум довольно тихий и низкий и лучше всего выслу-
шивается над верхушкой сердца после физической нагрузки в положении
лежа на левом боку при задержке дыхания на выдохе. При развитии мерца-
тельной аритмии в связи с исчезновением систолы предсердий пре-систоли-
ческий компонент исчезает. У небольшой части больных диастолический шум
отсутствует.
Мелодия сердца при сопутствующих митральному сте-
нозу поражениях включает:
1) пансистолический шум относительной недостаточности
трехстворчатого клапана с эпицентром в четвертом межреберье слева у
края грудины. Обусловлен дилатацией правого желудочка у больных с
высокой легочной гипертензией. Щум усиливается на вдохе (симптом
Риверо — Корвальо)и уменьшается при форсированном выдохе или
пробе Вальсальвы, а также при эффективном лечении правожелудочко-
вой недостаточности. Его необходимо отличать от шума митральной не-
достаточности. Против существенной митральной регургитации свидетель-
ствуют усиленный I тон, щелчок открытия и пресистолический шум. Может
сопровождаться правожелудочковым ритмом галопа, который также уси-
ливается на вдохе;
2) протодиастолический шум относительной недостаточности
клапанов легочной артерии - шум Грэма Стилла . Обусловлен дилата-
цией клапанного кольца вследствие высокой легочной артериальной гипер-
тензии. Это высокий дующий шум “декрещендо” вдоль левого края груди-
ны. Необходимо отличать от шума недостаточности аортальных клапанов.
Диагностика. На ЭКГ определяются: 1) признаки гипертрофии левого
предсердия - P-mitrale; 2) при развитии легочной гипертензии — при-
знаки гипертрофии правых желудочка и предсердия; 3) частое осложне-
ние — мерцательная аритмия.
На ФКГ, кроме регистрации характерной мелодии сердца, диагности-
ческое и прогностическое значение имеют следующие данные:
1) удлинение интервала Q~I тон более 0,06 с. Оно обуслов-
лено компенсаторным удлинением систолы левого предсердия и невоз-
можностью закрытия митрального клапана до тех пор, пока давление в
левом желудочке не достигнет уровня давления в левом предсердии, кото-
рый при митральном стенозе повышен. Чем длиннее этот интервал, тем
выше давление в левом предсердии и более выражен митральный стеноз;
208
2) величина интервала Л2— OS. У таких больных она составляет
обычно от 0,06 до 0,12 с. Так как щелчок открытия отмечается при снижении
давления в левом желудочке ниже давления в левом предсердии, то чем ко-
роче этот интервал, тем более выражен стеноз.
При рентгенологическом исследовании при небольшом и умеренном мит-
ральном стенозе размеры сердца не увеличены. Оно приобретает характер-
ную митральную конфигурацию со сглаженной “талией” вследствие: 1) уве-
личения левого предсердия, которое лучше всего определяется в боковой
проекции, где вызывает отклонение контрастированного пищевода по дуге
малого, а затем большого радиуса; 2) выбухания ствола легочной артерии
в связи с легочной гипертензией. При этом определяются усиление легоч-
ного сосудистого рисунка и другие признаки легочной венозной гипер-
тензии, включая характерные линии Керли.
При выраженном митральном стенозе присоединяется увеличение всех
камер и сосудов, находящихся перед суженным клапанным отверстием
правых желудочка, предсердия и верхней полой вены. Легочные поля при-
обретают вид, характерный для артериальной гипертензии. Может опреде-
ляться кальциноз митрального клапана.
Эхокардиография, являясь самым чувствительным и специфичным не-
инвазивным методом распознавания митрального стеноза, обеспечивает
верификацию диагноза. В М-режиме (см. рис. 48) характерно П-образное и
однонаправленное движение передней и задней створок с уменьшением
их сепарации и скорости раннего диастолического прикрытия (наклона
E~F). При этом исследовании, а также двухмерном сканировании опреде-
ляются заметное утолщение створок, их фиброз, кальциноз и выражен-
ная деформация клапанного аппарата, увеличение диаметра левого предсер-
дия, в поздних стадиях - также правых отделов сердца при неизмененных
размерах полости и сократимости левого желудочка. При двухмерном ис-
следовании по короткой оси определяют площадь митрального отверстия.
Допплерэхокардиография позволяет измерить градиент давления на мит-
ральном клапане и уточнить площадь митрального отверстия, определить
давление в легочной артерии, наличие сопутствующей регургитации кро-
ви на митральном, трехстворчатом клапанах и клапане легочной артерии.
Катетеризацию сердца и ангиокардиографию используют для оценки вы-
раженности стеноза, легочной гипертензии и функции желудочков в тех
случаях, когда это затруднено при эхокардиографии, а также для уточнения
характера сопутствующих поражений, в частности митральной регургита-
ции, пороков аортального клапана и атеросклероза коронарных артерий у
больных старших возрастных групп. Для “чистого” митрального стеноза
характерны повышение среднего давления в левом предсердии и “легоч-
ных капиллярах”, систолического и диастолического давления в легочной
артерии, систолического, а также в тяжелых случаях, и КДД в правом
желудочке и особенно — наличие диастолического градиента давления на
митральном клапане. МОС обычно снижен, а ЛСС повышено. Функция
левого желудочка (КДО, ФВ, КДД) обычно не изменена. Встречающаяся
209
у отдельных больных его дисфункция обусловлена ревматическим пораже-
Онием миокарда — миокардитом или миокардитическим кардиосклерозом. В
отличие от эхокардиографии инвазивное обследование не позволяет опреде-
лить характер изменений створок клапана и подклапанного аппарата.
Дифференциальную диагностику проводят с рядом заболеваний, харак-
теризующихся сходными изменениями со стороны сердца и развитием
легочной гипертензии при малоизмененных размерах сердца.
1. При сочетании высокого ЛСС с низким МОС и неподвижностью ство-
рок митрального клапана может наблюдаться картина так называемого
немого митрального стеноза, при котором отсутствуют хлопающий I тон,
щелчок и диастолический шум. У таких больных на первый план выступает
картина легочной гипертензии, что может привести к ошибочному диагнозу
хронического легочного сердца или первичной (идио-
патической) легочной г и п е р т е н з и и . Заподозрить диагноз по-
рока помогают тщательная аускультация в положении больного на левом
боку, выявление дилатации левого предсердия и признаков венозного за-
стоя в легких при рентгенографии, а подтвердить его — эхокардиография.
2. Диагноз митрального стеноза может быть ошибочно поставлен при
тиреотоксикозе, для которого характерны гиперкинетический син-
дром с усиленным I тоном, диастолическим шумом относительного (функ-
ционального) митрального стеноза вследствие увеличения кровотока через
клапан и пароксизмы мерцательной аритмии. Поставить правильный ди-
агноз позволяет выявление других клинических, а также лабораторных
признаков тиреотоксикоза, с одной стороны, и отсутствие данных за
гипертрофию правого желудочка, легочную гипертензию и изменений
морфологии митрального клапана — с другой.
3. Митральный стеноз необходимо дифференцировать с вторичным
дефектом межпредсердной перегородки, осложненным
правожелудочковой недостаточностью. Широкое расщепление и акцент
Р2 при дефекте межпредсердной перегородки нужно отличать от щелчка
открытия митрального клапана. При обоих пороках наблюдаются мерца-
тельная аритмия, выбухание ствола легочной артерии и усиление легоч-
ного сосудистого рисунка при малоизмененном левом желудочке. Рас-
познать эти заболевания помогают тщательный анализ мелодии сердца с
помощью аускультации и фонокардиографии, оценка размеров левого
предсердия при рентгенографии и характерные данные эхокардиографии.
4. Большое сходство с митральным стенозом по клиническим проявле-
ниям и мелодии сердца имеет м и к с о м а левого предсердия . Про-
висая в просвет митртльного отверстия, эта опухоль на ножке частично
обтурирует его, что об /словливает возникновение мезодиастолического и
пресистолического шумов над верхушкой сердца, громкого I тона и в ряде
случаев — щелчка открытия митрального клапана. Эмболии сосудов боль-
шого круга кровообращения кусочками опухолевой ткани напоминают
тромбоэмболические осложнения митрального стеноза, а системные прояв-
ления заболевания - повышение температуры тела, похудание, анемия,
210
увеличение СОЭ и др. — картину активного ревматизма. Сходные данные
отмечаются на ЭКГ и рентгенограммах грудной клетки. Заподозрить мик-
сому позволяет наличие частых обмороков, связанных с периодами суб-
тотальной окклюзии митрального отверстия и прекращения кровотока, и
изменчивость мелодии сердца при тщательной аускультации и фонокар-
диографии в зависимости от положения тела, однако это не всегда надеж-
но. Диагноз ставят с помощью двухмерной эхокардиографии, при кото-
рой хорошо видна опухоль.
5. Мезодиастолический шум, характерный для органического митрально-
го стеноза, необходимо дифференцировать с шумом Флинта той же
локализации при неизмененном митральном клапане у больных с выражен-
ной аортальной недостаточностью. Для них, однако, не характерны выра-
женный цианоз, хлопающий I тон и щелчок открытия, а также гипертрофия
правого желудочка на ЭКГ и мерцательная аритмия. Диастолический щум
аортальной регургитации ослабевает при снижении постнагрузки с помо-
щью амилнитрита, тогда как шум митрального стеноза усиливается. Различ-
ную форму имеет тень сердца. Характер поражения клапанов уточняют с
помощью эхокардиографии.
Диагноз митрального стеноза устанавливают на основании: 1) харак-
терной мелодии сердца (хлопающий I тон, щелчок открытия митрально-
го клапана, акцент II тона над легочной артерией, мезодиастолический
шум с пресистолическим усилением) в сочетании с: 2) гипертрофией
левого предсердия и правого желудочка на ЭКГ; 3) митральной конфи-
гурацией сердца с увеличением левого предсердия и ствола легочной ар-
терии при рентгенологическом исследования. Диагноз подтверждают с
помощью эхокардиографии. Количественно оценить выраженность мит-
рального стеноза позволяют определение градиента диастолического дав-
ления на клапане и площади митрального отверстия.
Основными осложнениями митрального стеноза являются:
1) отек легких. Как результат острой левопредсердной недоста-
точности развивается при резком повышении гидростатического давле-
ния в легочных капиллярах в случаях выраженной легочной венозной
гипертензии. Условиями для его возникновения являются неизмененное
ЛСС и сохраненная насосная функция правого желудочка, что позволяет
временами значительно увеличить выброс крови в малый круг кровооб-
ращения. После надежного формирования “2-го барьера”, утолщения аль-
веолярно-капиллярных мембран в результате склеротических процессов
и развития правожелудочковой недостаточности приступы отека легких
прекращаются;
2) мерцательная аритмия. Основным фактором, вызывающим
ее закономерное возникновение на определенном этапе течения заболе-
вания, является значительная дилатация левого предсердия с морфологиче-
скими изменениями в его миокарде (гибель кардиомиоцитов, фиброз). Мер-
цание предсердий вначале носит характер пароксизмального, затем стано-
вится постоянным. Его возникновение сопровождается резким усугублением
211
одышки, вплоть до возникновения отека легких, слабости и правожелу-
дочковой недостаточности, иногда обмороком;
3)активная легочная гипертензия и правожелудочко-
вая недостаточность;
4) тромбоэмболии большого круга кровообращения.
Их источником являются тромбы, образующиеся в дилатированном левом
предсердии, особенно в его ушке. Эмболическим эпизодам наиболее подвер-
жены больные пожилого возраста с мерцательной аритмией (пароксиз-
мальной или постоянной) и низким МОС. Наблюдаются при незначитель-
ном или, наоборот, выраженном митральном стенозе и часто рецидиви-
руют. В большинстве случаев поражаются сосуды мозга (1-е место по час-
тоте), почек, селезенки, кишечника и конечностей. Отрываются в основ-
ном свежие тромбы. Изредка крупный шаровидный тромб на ножке или
без нее может вызывать обтурацию суженного митрального отверстия. Эти
эпизоды напоминают картину миксомы левого предсердия и проявляются
обмороками, ангинозной болью, одышкой и изменением мелодии сердца;
5) ТЭ В Л А. Отмечается в основном в далеко зашедших стадиях забо-
левания, при правожелудочковой недостаточности и часто рецидивирует.
Источником тромбов являются глубокие вены нижних конечностей, пра-
вое предсердие и желудочек. Повторные тромбоэмболии могут усугублять
легочную артериальную гипертензию и нарушение функционального со-
стояния больных;
6) бронхолегочные инфекции. Подверженность больных с
митральным стенозом бронхитам и пневмониям обусловлена застоем крови
в малом круге кровообращения. Они проявляются усугублением одышки,
кашлем с гнойной мокротой, иногда с прожилками крови, повышением
температуры тела и могут провоцировать отек легких;
7) инфекционный эндокардит. Встречается чаще при комби-
нированном митральном пороке, чем при “чистом” стенозе.
Течение. Развитие и прогрессирование нарушения функционального
состояния больных из-за одышки, слабости и сердцебиения в большин-
стве случаев (но не всегда!) связано со степенью сужения митрального
отверстия. Для оценки тяжести порока и определения показаний к опера-
тивному лечению удобно пользоваться классификацией, разработанной
А.Н.Бакулевым и Е.А.Дамир (1955). Авторы выделяют 5 стадий порока.
I — стадия полной компенсации нарушения кровобращения. Площадь
митрального отверстия превышает 2,5 см2. Компенсация обеспечивается
относительно небольшим - до 10-15 мм рт.ст. - повышением давления в
левом предсердии и усилением его систолы. Заболевание бессимптомное,
трудоспособность больных сохранена. Отмечаются признаки умеренной
гипертрофии и дилатации левого предсердия;
II — стадия субкомпенсации нарушений кровообращения за счет уси-
ления работы правого желудочка. Сужение митрального отверстия дости-
гает 1,5—2 см2 (“1-й барьер”). Для поддержания нормального МОС в по-
кое давление в левом предсердии повышается до 20—30 мм рт.ст. Такого
212
же уровня достигает давление в легочных капиллярах. У больных появля-
ются одышка при умеренной физической нагрузке, кровохарканье, при-
ступы сердечной астмы и отека легких. Трудоспособность их ограничена.
При обследовании определяются признаки пассивной легочной гипер-
тензии и гипертрофии правого желудочка;
III — стадия образования “2-го барьера” со стойкой артериальной ле-
гочной гипертензией и появлением начальных признаков правожелудоч-
ковой недостаточности, которые, однако, относительно хорошо подда-
ются медикаментозной терапии. МОС в покое снижается. Больные не пе-
реносят даже легкой физической нагрузки. Приступы отека легких урежа-
ются и исчезают. Продолжительность жизни больных обычно ограничена
несколькими годами;
IV — стадия выраженных и стойких нарушений кровообращения в ма-
лом и большом круге кровообращения. Глубокие нарушения гемодинами-
ки приводят к резкому и прогрессирующему ухудшению функции мио-
карда. При этом размеры митрального отверстия могут не уменьшаться по
сравнению с предыдущими стадиями. Легочная гипертензия остается на
уровне III стадии, но “закрепляется” органическими изменениями. Рас-
пространение склероза на легочную паренхиму вызывает уменьшение
жизненной емкости легких. Важным отличительным признаком этой стадии
является возникновение мерцательной аритмии. Правожелудочковая недо-
статочность становится стойкой. Развивается относительная недостаточ-
ность трехстворчатого клапана и клапана легочной артерии. Продолжитель-
ность жизни больных исчисляется несколькими годами или даже месяцами;
V — терминальная дистрофическая стадия необратимых расстройств
кровообращения.
Темпы прогрессирования заболевания колеблются в широких преде-
лах. Если симптоматика отсутствует, состояние компенсации может длиться
долгие годы - до 10 лет и даже 20. При наличии симптомов среди боль-
ных, которые отказываются от операции, 50 % погибают в течение 4—5
лет. Хирургическое лечение значительно улучшает прогноз.
Лечение. Медикаментозная терапия при отсутствии симптомов заболева-
ния предусматривает профилактику инфекционного эндокардита, а по пока-
заниям - также бициллинопрофилактику рецидивов ревматизма. Хотя обще-
принятого возрастного ценза не существует, ее обычно проводят у больных
моложе 25-30 лет или при перенесенном активном ревматизме давнос-
тью до 5 лет.
Из общих мероприятий рекомендуют также избегать значительной физи-
ческой нагрузки.
При наличии симптомов рекомендуют ограничение соли и прием мо-
чегонных средств. При их назначении следует, однако, соблюдать осто-
рожность во избежание гиповолемии и снижения МОС. Сердечные глико-
зиды показаны при мерцательной аритмии для уменьшения ЧСС, а при
синусовом ритме — только в случаях выраженной правожелудочковой недо-
статочности.
213
При кровохарканье проводят мероприятия, направленные на сниже-
ние давления в легочных венах: покой, положение полусидя, ограниче-
ние соли и мочегонные средства. Больным, перенесшим тромбоэмболию
большого или малого круга кровообращения, назначают антикоагулянты
— вначале гепарин, потом препараты непрямого действия в течение 1
года и более — и решают вопрос об оперативном лечении.
При возникновении мерцательной аритмии в случаях слабо выражен-
ного митрального стеноза, не требующего хирургического лечения, по-
казана медикаментозная (хинидина сульфат) или электроимпульсная де-
фибрилляция с предварительной антикоагулянтной терапией в течение
2—4 нед. Попытки восстановления синусового ритма обречены на неуда-
чу и нецелесообразны у больных с выраженным митральным стенозом,
особенно при значительном увеличении левого предсердия и давности
аритмии более I года. В таких случаях трансторакальную деполяризацию
выполняют через несколько недель после операции. Для замедления ЧСС
назначают сердечные гликозиды (дигоксин), а при недостаточном эф-
фекте, кроме того, малые дозы |3-адреноблокаторов (пропранолол—об-
зидан по 10—20 мг 3-4 раза в сутки и др.). Всем таким больным при
отсутствии противопоказаний желательно назначать также антикоагулянты
непрямого действия для предотвращения тромбоэмболий.
Поскольку митральный стеноз представляет собой механическое пре-
пятствие кровообращению, наиболее эффективным является хирургиче-
ское лечение. В этих целях используют митральную вальвулотомию (комис-
суротомию) или протезирование митрального клапана. Выбор методики
операции зависит от морфологических изменений клапана по данным
физикального обследования и эхокардиографии, возраста больного и
технических возможностей лечебного учреждения.
Митральная вальвулотомия показана при “чистом” или пре-
валирующем митральном стенозе II, III и IV стадии (по А.Н.Бакулеву и
Е.А.Дамир) без кальциноза клапана, то есть при наличии симптомов
заболевания и при площади митрального отверстия в большинстве слу-
чаев менее 1,2 см2. Она противопоказана при V стадии порока, резком
кальцинозе и значительной сопутствующей митральной регургитации.
Высокая легочная гипертензия сама по себе не является противопоказа-
нием. Вальвулотомия приводит к значительному гемодинамическому
(уменьшение артериальной легочной гипертензии) и симптоматическо-
му улучшению. Ее клинический эффект уменьшается при возникновении
в результате операции существенной митральной регургитации, а также
при наличии сопутствующего гемодинамически значимого поражения
других клапанов или миокарда, на что обращают внимание при предопе-
рационном обследовании больных. Возобновление или сохранение симп-
томов после операции обусловлено неадекватной вальвулотомией, раз-
витием рестеноза митрального отверстия и поражением других клапанов,
прежде всего аортального, или миокардиальной недостаточностью.
214
Митральную вальвулотомию можно выполнять по “закрытой” или “от-
крытой” методике, а также путем чрескожной баллончиковой вальвуло-
пластики.
“Закрытая” митральная комиссуротомия является отно-
сительно простой в техническом отношении операцией, требующей, од-
нако, большого опыта хирурга для получения оптимального результата.
Она особенно эффективна у молодых больных при сохранении синусо-
вого ритма и подвижности передней створки при отсутствии тромбов в
левом предсердии по данным эхокардиографии. Комиссуры разделяют с
помощью двухлопастного расширителя — комиссуротома, который вво-
дят в клапанное отверстие через полость левого желудочка под контро-
лем пальца второй руки, находящегося в левом предсердии. Для профи-
лактики возникновения травматической митральной недостаточности рас-
ширение производят в 3—4 этапа путем постепенного раздвигания бран-
шей расширителя с 25 до 35-40 мм.
“Открытая” вальвулотомия требует применения искусственного крово-
обращения и позволяет под контролем зрения рассечь створки, удалить
небольшие кальцинаты и тромбы в левом предсердии, а при обнаруже-
нии значительной регургитации или неудовлетворительном результате —
произвести протезирование клапана.
Чрескожная митральная вальвулопластика с помощью
баллончика показана больным молодого возраста при отсутствии каль-
циноза и грубой деформации подклапанных структур и тромбов в левом
предсердии. Ее с успехом применяют также у больных пожилого возраста
с тяжелыми внесердечными заболеваниями и повышенным риском опе-
ративного вмешательства. Катетер с баллончиком на конце вводят в ле-
вое предсердие транссептально и устанавливают в суженном отверстии
клапана, после чего баллончик раздувают. При успешной дилатации пло-
щадь митрального отверстия увеличивается до 2 см2 и даже более.
Хирургическая летальность при вальвулотомии обычно не превышает
4 %, а в неосложненных случаях (II—III стадия порока) составляет 1—2 %.
Так как при IV стадии заболевания результаты операции хуже, основным
путем снижения летальности и повышения эффективности вальвулотомии
является своевременное направление больных на хирургическое лечение.
Изредка при попытке адекватного разъединения комиссур, обычно
при “закрытой” операции, возникает значительная митральная регурги-
тация, требующая протезирования клапана. Относительная недостаточ-
ность трехстворчатого клапана в большинстве случаев не нуждается в
специальной коррекции, но изредка выполняют аннулопластику клапана.
Протезирование митрального клапана при митральном
стенозе показано в случаях значительной сопутствующей митральной
регургитации, при грубом кальцинозе и резкой деформации клапана, а
также после предшествовавшей вальвулотомии при ее неудовлетворитель-
ном результате. Хирургическая летальность при протезировании митраль-
ного клапана относительно высока — от 5—8 до 15 % в зависимости от
215
выраженности легочной артериальной гипертензии и правожелудочковой
недостаточности. В отдаленные сроки возможны осложнения, связанные с
имплантированным протезом, - инфекционный эндокардит и нарушение
функции протеза, тромбоэмболии вследствие тромбогенности части кла-
панов и кровотечения, связанные с применением антикоагулянтной тера-
пии. В связи с этим при возможности выполнить “закрытую” или “откры-
тую” вальвулотомию ей следует отдавать предпочтение перед протезирова-
нием клапана. При наличии показаний к имплантации протеза ее выполня-
ют при значительном ограничении обычной физической активности боль-
ного, несмотря на адекватную медикаментозную терапию, — при IH-IV
стадии порока и критическом (менее 1 см2) сужении митрального отверстия.
Используют протезы двух видов — механические (шаровые, типа Старра-
Эдвардса, или дисковые, типа Бьорка-Ширли) и биологические. Все боль-
ные с имплантированным механическим клапаном должны постоянно по-
лучать антикоагулянты непрямого действия для профилактики образова-
ния тромбов на поверхности протеза и тромбоэмболий. Для изготовления
биопротеза используют аортальные клапаны свиньи. При имплантации та-
кого протеза больным с синусовым ритмом не требуется антикоагулянт-
ная терапия, но с течением времени его створки могут кальцифициро-
ваться, перфорироваться и разрываться, в связи с чем в среднем через 10
лет требуется его замена. Биопротезам отдают преимущество в тех случаях,
когда антикоагулянты противопоказаны или нежелательны, например, при
планируемой беременности, а также у больных пожилого возраста, когда
маловероятна необходимость замены. Механическим клапанам отдают пред-
почтение у больных с мерцательной аритмией. Среди разных моделей в
последние годы преимущественно используют дисковые протезы, кото-
рые не занимают столько места в желудочке, сколько шаровые.
Прогноз. Хотя хирургическая коррекция порока не обеспечивает полно-
го излечения, она существенно улучшает прогноз. Наилучший эффект до-
стигается при ранней операции у больных молодого возраста без призна-
ков ревматического поражения миокарда и с небольшой давностью повы-
шения ЛСС. Устранение митрального стеноза приводит к большему или
меньшему обратному развитию изменений легочных артериол в зависи-
мости от эффективности хирургической коррекции и давности легочной
гипертензии, которое может продолжаться до 2 лет после операции.
Отдаленные результаты хирургического лечения. У большинства больных
с относительно подвижными клапанами без изменений сухожильных хорд
и дисфункции левого желудочка удовлетворительный результат вальвуло-
томии сохраняется в течение 5-10 лет и даже более. Тем не менее вальву-
лотомия является пал; нативной операцией. Рано или поздно, как прави-
ло, развивается рестеноз, состояние больных ухудшается и возникает воп-
рос о повторной операции — обычно протезировании клапана.
Десятилетняя выживаемость после замены митрального клапана, не-
зависимо от использованного протеза, составляет около 50 %. Результаты
ухудшаются у больных с дисфункцией левого желудочка вследствие по-
216
ражения миокарда до операции. Ни один искусственный клапан не обес-
печивает нормальную гемодинамическую функцию, и на нем всегда име-
ется некоторый градиент давления. Необходимость замены протеза воз-
никает у 10—15 % больных на протяжении 10 лет после операции. Основ-
ным осложнением в отдаленный послеоперационный период являются
тромбоэмболии. Их частота составляет примерно 5 % в год и в половине
случаев они приводят к значительному ухудшению течения заболевания.
Профилактика всех приобретенных пороков сердца заключается в про-
филактике основного заболевания, являющегося причиной порока.
НЕДОСТАТОЧНОСТЬ МИТРАЛЬНОГО КЛАПАНА
Недостаточность митрального клапана, или митральная недостаточность,
представляет собой регургитацию крови из левого желудочка в левое пред-
сердие во время систолы желудочков вследствие нарушения смыкания
створок митрального клапана.
Эпидемиология. Изолированная митральная недостаточность встречает-
ся примерно в 10 раз реже, чем митральный стеноз (В.Ионаш, 1963). По
данным С. Bailey (1955), на 1004 хирургических вмешательств на митраль-
ном клапане она отмечалась в 5,5 % случаев. Ее удельный вес у умерших
больных с пороками сердца составляет лишь около 2 % (И.А.Кассирский,
Г.И.Кассирский, 1964). Значительно чаще митральная недостаточность со-
четается с митральным стенозом и с пороками аортального клапана.
Этиология. В отличие от митрального стеноза, который почти всегда
имеет ревматическое происхождение, причин митральной недостаточно-
сти много (табл. 11).
Основными этиологическими и способствующими факторами орга-
нической митральной недостаточности, обусловленной первичным по-
ражением клапанного аппарата, являются: 1) ревматизм; 2) инфекцион-
ный эндокардит; 3) врожденный порок; 4) ИБС (хронические формы и
острый инфаркт миокарда); 5) травма; 6) системные заболевания соеди-
нительной ткани — системная красная волчанка, ревматоидный артрит,
системная склеродермия и др.); 7) дегенеративное поражение клапанно-
го аппарата неизвестной этиологии.
Органическую митральную недостаточность необходимо отличать от от-
носительной, или функциональной, которая развивается при различных
поражениях миокарда (миокардиты, дилатационная кардиомиопатия; хро-
нические и острые формы ИБС и др.), вызывающих выраженную дилата-
цию левого желудочка. Эта дилатация приводит ко вторичному растяже-
нию клапанного кольца и смещению в латеральном направлении сосочко-
вых мышц, вследствие чего смыкание неизмененных створок митрального
клапана нарушается. При обструктивной гипертрофической кардиомиопа-
тии митральная регургитация обусловлена втяжением передней створки
217
Таблица 11. Основные причины и механизмы митральной недостаточности
Пораженные структуры Характер поражения Причина
Створки клапана Врожденное расщепление Увеличение в размерах и истончение Перфорация Деформация и склероз Первичный дефект межпредсердной перегородки Идиопатическая миксоматозная дегенерация митрального клапана Синдром Марфана Инфекционный эндокардит Ревматизм
Сухожильные хорды Удлинение, истончение Разрыв Укорочение Идиопатическая миксоматозная дегенерация Синдром Марфана Идиопатическая миксоматозная дегенерация Синдром Марфана Инфекциошпяй эндокардит Ревматизм Травма Ревматизм
Сосочковые мышцы Дисфункция Пролапс створки клапана Разрыв ИБС Миокардиты и кардиомиопатии Идиопатическая миксоматозная дегенерация митрального клапана, различные заболевания Острый инфаркт миокарда
Клапанное кольцо Кальциноз Дилатация' Различные заболевания Выраженное поражение миокарда левого желудочка различного генеза
* Относительная (функциональная) митральная недостаточность
клапана в выносящий тракт гипертрофированного левого желудочка вслед-
ствие его гипердинамического сокращения.
Патологическая анатомия первичной органической митральной недо-
статочности. Ревматическая митральная недостаточность
обусловлена преимущественно поражением створок, которые уменьша-
ются в размерах и деформируются вследствие рубцовых изменений, воз-
никающих при заживлении острого вальвулита. Определенную роль играет
также уменьшение подвижности створок вследствие утолщения или спаи-
вания комиссур. При неревматической митральной недоста-
точности в значительной части случаев отмечается первичное пораже-
ние других отделов клапанного аппарата - сухожильных хорд, сосочковых
мышц и клапанного кольца (см. табл. 11), которое может быть изолиро-
ванным, либо сопровождается вовлечением в патологический процесс ство-
рок. Так, особенностью вальвулита при инфекционном эндокардите явля-
ется частое развитие деструктивных процессов с перфорацией створок и
218
разрывом хорд. Разрыв сухожильной хорды с острым возникновением мит-
ральной недостаточности может иметь также травматическое происхождение.
Для ИБС характерно поражение в первую очередь сосочковых мышц с их
разрывом при остром инфаркте миокарда и дисфункцией вследствие ишемии
или фиброза при хронических формах.
Особыми вариантами неревматической митральной недостаточности
являются миксоматозная дегенерация и пролапс митрального клапана, а
также кальциноз митрального кольца. Они обусловлены неспецифичес-
кими невоспалительными дегенеративными изменениями клапанного ап-
парата неизвестной этиологии или связаны с различными другими забо-
леваниями и будут рассматриваться отдельно ниже. Настоящая глава по-
священа преимущественно ревматической митральной недостаточности.
Механизм нарушений гемодинамики. Поскольку давление в левом пред-
сердии ниже, чем в аорте, оно представляет меньшее сопротивление для
изгнания, что создает благоприятные условия для регургитации значи-
тельного объема крови из левого желудочка в левое предсердие. При этом
общий ударный объем левого желудочка резко возрастает и может значи-
тельно (до 3 раз) превышать норму. Изгнание начинается сразу после
начала сокращения левого желудочка, и ко времени открытия аорталь-
ного клапана до 1/4 УОС поступает в левое предсердие. При быстром
уменьшении объема желудочка его систолическое стеночное напряжение
резко снижается, что облегчает изгнание крови. Увеличение полноты си-
столического опорожнения левого желудочка является самым ранним ме-
ханизмом компенсации нарушений гемодинамики при митральной
недостаточности. Вследствие этого при относительно умеренном увели-
чении КДО левого желудочка его КСО значительно уменьшается. Удель-
ный вес поступательного, или эффективного, и обратного тока крови
зависит от относительных величин сопротивления на аортальном и мит-
ральном клапанах, что важно учитывать при лечении больных. Так, по-
вышение давления в аорте при артериальной гипертензии или сопротив-
ления “на выходе” левого желудочка при выраженном стенозе устья аор-
ты вызывает увеличение обратного тока на митральном клапане и быст-
рое прогрессирование нарушений гемодинамики, вплоть до летального
исхода.
Наполнение левого предсердия одновременно из легочных вен и левого
желудочка приводит к возрастанию давления в нем и растяжению мышц,
что, в соответствии с законом Франка—Старлинга, вызывает увеличение
силы последующего сокращения и объема изгоняемой в левый желудо-
чек крови. Это влечет повышение КДО и прирост ударного выброса же-
лудочка, что поддерживает адекватное поступление крови в аорту.
Увеличение работы левых желудочка и предсердия в условиях хрони-
ческой объемной перегрузки достигается благодаря их компенсаторной
гипертрофии. При этом вследствие повышения диастолической податли-
вости желудочка увеличение его КДО в стадии компенсации не сопро-
вождается ростом КДД.
219
Независимо от этиологии выраженная митральная регургитация “по-
рождает” митральную регургитацию, то есть прогрессирует. Так, при ди-
латации левого предсердия увеличивается натяжение задней створки мит-
рального клапана, которая смещается кзади от митрального отверстия,
что усугубляет дисфункцию клапана. В свою очередь, дальнейшая дилата-
ция полости левого желудочка приводит к увеличению митральной ре-
гургитации вследствие растяжения митрального кольца и ухудшения его
систолического сокращения.
Декомпенсация обусловлена развитием левожелудочковой недо-
статочности, что вызывает увеличение КДД в желудочке и диастоличес-
кого давления в левом предсердии и сопровождается пассивным повыше-
нием давления на путях притока — в легочных венах, капиллярах и легоч-
ной артерии. У большинства больных со значительной по объему хрони-
ческой митральной недостаточностью, в отличие от митрального стеноза,
увеличение ЛСС относительно невелико. Это обусловлено значительным
увеличением диастолической податливости левого предсердия, что при-
водит к его выраженной дилатации при относительно небольшом повы-
шении давления. При значительном объеме регургитации у таких больных
отмечаются снижение МОС при мало выраженном венозном застое в лег-
ких и мерцательная аритмия. В случае неизмененной или сниженной диас-
толической податливости левого предсердия, что свойственно остро воз-
никшей митральной недостаточности, при относительно небольшой ди-
латации полости предсердия давление в нем резко повышается, особенно
волны “v“. Это влечет за собой значительное возрастание давления в ма-
лом круге кровообращения с развитием отека легких. Вскоре благодаря
рефлексу Китаева растет ЛСС и может возникать правожелудочковая не-
достаточность. У таких больных обычно сохраняется синусовый ритм.
В большинстве случаев значительной по объему митральной недоста-
точности гемодинамический профиль занимает промежуточное положе-
ние, то есть наблюдается в той или иной степени выраженная дилатация
левого предсердия в сочетании с большим или меньшим повышением
давления в нем. При этом клинические проявления заболевания обуслов-
лены как снижением МОС, так и венозным застоем в легких. Со време-
нем может присоединяться недостаточность правого желудочка, обус-
ловленная его хронической перегрузкой сопротивлением.
Клиническая картина различна в зависимости от характера патологиче-
ского процесса, выраженности митральной регургитации и наличия со-
путствующего поражения миокарда левого желудочка.
КЛИНИКА, ДИАГНОСТИКА И ЛЕЧЕНИЕ
РЕВМАТИЧЕСКОЙ МИТРАЛЬНОЙ НЕДОСТАТОЧНОСТИ
Клиника. Начало заболевания обычно постепенное. Хотя митральная ре-
гургитация часто развивается при остром ревмокардите, в большинстве
таких случаев она вначале небольшая, и больные обычно не предъявляют
220
жалоб на протяжении многих лет, иногда всю жизнь. Как и при митраль-
ном стенозе, заболевание может начинаться с пароксизма мерцательной
аритмии или острой левожелудочковой недостаточности после повышен-
ной физической нагрузки.
Основными жалобами являются: 1) одышка, обусловленная венозным
застоем в легких; 2) слабость и утомляемость вследствие снижения МОС.
Выраженность одышки варьирует от незначительной, отмечающейся при
повышенной физической нагрузке, до нехватки воздуха в состоянии по-
коя. В отличие от митрального стеноза приступы сердечной астмы и отека
легких бывают очень редко. Мало характерны также кровохарканье и сис-
темные тромбоэмболии.
При объективном исследовании в поздних стадиях наблюдается акроциа-
ноз. Артериальный пульс обычно не изменен или отмечаются признаки
мерцательной аритмии. В далеко зашедших случаях при развитии дилатации
правого желудочка и относительной недостаточности трехстворчатого кла-
пана определяется положительный венный пульс за счет систолической
волны “v”. Обращает на себя внимание усиленный и разлитой верхушечный
толчок, который при дилатации левого желудочка смещается кнаружи и
книзу. При выраженном увеличении левого предсердия последнее смещается
кпереди, и его наполнение кровью пальпаторно ощущается у левого края
грудины в конце систолы желудочков, когда сократившийся левый желудо-
чек перемещается кзади. При этом образуется характерное качательное
движение грудной клетки в прекардиальной области. Над верхушкой сердца
часто пальпируется систолическое дрожание. У больных с высокой легочной
гипертензией может определяться пульсация правого желудочка в третьем-
четвертом межреберье у левого края грудины и в надчревной области.
При аускультации сердца инаФКГ выявляются характерные
признаки порока. К ним относятся:
1) пансистолический шум. Служит наиболее ярким проявлением
митральной недостаточности. Шум имеет эпицентр над верхушкой сердца и
проводится обычно в левую подмышечную область и на спину.
Изредка, при преимущественном поражении задней митральной створ-
ки, струя обратного тока ударяет в стенку левого предсердия рядом с
корнем аорты, что обусловливает проведение шума на основание сердца,
иногда даже на сосуды шеи. В подобных случаях его необходимо отличать
от систолического шума стеноза устья аорты. Шум обычно громкий (III—
IV степени громкости и более), усиливается в положении лежа на левом
боку и часто сопровождается систолическим дрожанием. Чем громче шум,
тем больше выраженность регургитации;
2) ослабление I тона, вплоть до отсутствия. Он часто маскиру-
ется шумом;
3) 111 тон. Обусловлен резким напряжением аппарата митрального кла-
пана и стенок левого желудочка в конце периода быстрого наполнения. S3
является важным аускультативным признаком митральной недостаточ-
ности, и его отсутствие исключает значительную регургитацию;
221
4)акцент II тона над легочной артерией (Р2). Свидетель-
ствует о легочной гипертензии, а расщепление II тона — о раннем захлопыва-
нии аортального клапана при значительном объеме регургитации.
Правожелудочковая недостаточность, проявляющаяся соответствую-
щими признаками, развивается относительно поздно.
Диагностика. На ЭКГ при выраженной митральной недостаточности
определяются: 1) признаки гипертрофии левого предсердия - P-mitrale;
2) признаки гипертрофии левого желудочка. Они обычно умеренные и у
ряда больных могут отсутствовать; 3) при выраженной легочной гипер-
тензии отмечается также гипертрофия правого желудочка и предсердия.
При рентгенологическом исследовании выявляют характерные признаки
- увеличение сердца от небольшого до значительного и его митральную
конфигурацию. При этом отмечается в различной степени выраженная
дилатация левых предсердия и желудочка и относительно менее заметное
увеличение ствола легочной артерии. Левое предсердие может достигать
огромных размеров и образовывать правый контур тени сердца в прямой
проекции. Определяются также признаки легочной венозной гипертен-
зии, которые, как правило, менее выражены по сравнению с митраль-
ным стенозом. В поздних стадиях расширяются и правые отделы. При на-
личии даже небольшого сопутствующего митрального стеноза характе-
рен кальциноз створок митрального клапана.
Двухмерная эхокардиография позволяет уточнить диагноз и имеет важ-
ное значение для определения характера морфологических изменений кла-
панного аппарата и их генеза. При ревматической митральной недостаточно-
сти определяются дилатация левых предсердия и желудочка различной
степени выраженности и гиперкинетичные сокращения его стенок. Видны
неполное смыкание передней и задней створок митрального клапана, их
утолщение, фиброз, реже кальциноз и умеренная гипертрофия левого же-
лудочка. Наличие обратного тока подтверждается при допплеровском ис-
следовании, которое позволяет также оценить его величину.
При катетеризации сердца отмечается повышение давления в левом
предсердии и характерное изменение формы кривой с увеличением вы-
раженности волны “v”. Часто определяется также повышение КДД в ле-
вом желудочке, давления в “легочных капиллярах” и легочной артерии.
Попадание контрастного вещества из левого желудочка в левое предсер-
дие при ангиокардиографии подтверждает диагноз. При этом можно также
количественно оценить объем регургитации как разности общего ударного
объема левого желудочка, рассчитываемого как (КДО-КСО), и его эф-
фективного ударного объема, который определяют по методу Фика.
Дифференциальная диагностика. Интенсивный пансистолический шум
над верхушкой сердца и у левого края грудины в области ее нижней части
характерен также для дефекта межжелудочковой перегородки и недоста-
точности трехстворчатого клапана. В отличие от митральной недостаточно-
сти систолический шум при д е ф е к т е межжелудочковой пере-
городки наиболее громкий в третьем-пятом межреберье слева и хорошо
222
проводится в область правой половины грудной клетки, I тон сохранен.
Для недостаточности трехстворчатого клапана, которая
часто сопровождает другие пороки сердца, например, митральный стеноз,
в отличие от митральной регургитации, характерны положительный венный
пульс за счет систолической волны “с + v”, систолическая пульсация пе-
чени, а также усиление шума на вдохе (симптом Риверо—Корвальо). Вместо
гипертрофии левого желудочка отмечается гипертрофия правого, а также
изолированное увеличение правых отделов сердца на рентгенограмме.
В случаях, когда шум заканчивается до окончания систолы, что иногда
отмечается при органической митральной недостаточности, его необхо-
димо дифференцировать с “невинным” систолическим шумом и с шумом
изгнания при клапанном и подклапанном стенозе устья аорты. “Невин-
ный” систолический шум не связан с I тоном, тихий, и, как
свидетельствуют данные ФКГ, меняет свою форму и продолжительность
от одного сердечного цикла к другому, не сопровождается ослаблением I
тона, усилением и смещением верхушечного толчка, гипертрофией левого
желудочка и предсердия на ЭКГ и их увеличением при рентгенологичес-
ком и эхокардиографическом исследовании. При стенозе устья а о р -
ты , в отличие от митральной недостаточности, систолический шум имеет
характерную ромбовидную форму и не связан с I тоном, эпицентр его
находится на основании сердца или при подклапанном сужении в третьем-
четвертом межреберье слева у края грудины, хотя изредка отмечается на
верхушке. Шум хорошо проводится в яремную вырезку и на сосуды шеи. В
неясных случаях в пользу митральной недостаточности может свидетель-
ствовать уменьшение шума при вдыхании амилнитрита и его усиление
при введении норадреналина, тогда как при стенозе устья аорты эти лекар-
ственные пробы дают обратный эффект. Уточнить диагноз помогают различ-
ная форма тени сердца, а также локализация возможного кальциноза при
рентгенологическом исследовании и особенно данные эхокардиографии.
Трудной задачей является дифференциальная диагностика “чистой” рев-
матической митральной недостаточности и относительной, обусловленной
дилатацией желудочка у больных с кардиомегалией, а также застойной би-
вентрикулярной сердечной недостаточностью. В пользу относительной
митральной недостаточности свидетельствуют отсутствие ревма-
тического анамнеза и доминирование в клинической картине признаков
поражения миокарда. Звучность и продолжительность пансистолического
шума у таких больных может день ото дня изменяться и уменьшается при
регрессе левожелудочковой недостаточности под влиянием лечения, тогда
как шум органической митральной недостаточности при этом становится
более громким. При относительной недостаточности клапана на ЭхоКГ вместо
гипердинамического сокращения стенок левого желудочка отмечается его
диффузная гипокинезия. Эти признаки, однако, довольно относительны, и
надежного способа верификации диагноза не существует.
Отличительные особенности неревматической митральной регургита-
ции различного генеза рассматриваются ниже.
223
В целом диагноз ревматической митральной недостаточности основы-
вается на выявлении: 1) пансистолического шума с эпицентром над вер-
хушкой, который проводится в подмышечную область и сопровождается
ослаблением I тона и III тоном, а также усилением и смещением кнару-
жи и книзу верхушечного толчка; 2) признаков гипертрофии левых же-
лудочка и предсердия на ЭКГ; 3) дилатации этих отделов при рентгено-
логическом и эхокардиографическом исследованиях; 4) митральной ре-
гургитации при допплерэхокардиографии. В неясных случаях диагноз под-
тверждается с помощью ангиокардиографии, которая позволяет также
количественно оценить выраженность регургитации.
Осложнениями ревматической митральной недостаточности являются:
1) бивентрикулярная застойная сердечная недостаточность;
2) мерцательная аритмия, вначале пароксизмальная, затем постоян-
ная. Как и при митральном стенозе, она закономерно развивается при
значительной дилатации левого предсердия;
3) системные тромбоэмболии, особенно при мерцательной аритмии и
инфекционном эндокардите. Их частота достигает 20 %;
4) инфекционный эндокардит. Является частым осложнением митраль-
ной недостаточности, встречается у 20 % больных;
5) легочная артериальная гипертензия. При хронической митральной
недостаточности повышение ЛСС встречается редко и лишь в далеко за-
шедших случаях.
Течение невыраженной митральной недостаточности благоприятное.
Больные долго не предъявляют никаких жалоб, и необходимость в опера-
тивном лечении у большинства из них не возникает. Течение выражен-
ной митральной недостаточности в целом напоминает течение митрального
стеноза, но, в отличие от него, связано с более серьезным прогнозом
после развития сердечной недостаточности в связи с ее быстрым прогрес-
сированием. Ухудшение течения заболевания могут вызывать развиваю-
щиеся с возрастом дегенеративные изменения пораженного клапана и
сопутствующие заболевания сердца - системная артериальная гипертен-
зия, ИБС и др.
Лечение. Консервативное лечение состоит в ограничении физической
нагрузки, антибиотикопрофилактике рецидивов ревматизма по показа-
ниям и инфекционного эндокардита во всех случаях, а также в медика-
ментозной терапии сердечной недостаточности при наличии симптомов.
Она включает ограничение соли и применение мочегонных, сосудорас-
ширяющих средств и сердечных гликозидов. Артериолярные вазодилата-
торы (гидралазин, ингибиторы АПФ и др.), снижая ОПСС, уменьшают
объем регургитации и увеличивают эффективный МОС. Лечение мерца-
тельной аритмии и антикоагулянтную терапию проводят по тем же прин-
ципам, что и при митральном стенозе. Больные, у которых отсутствуют
симптомы, не нуждаются в медикаментозной терапии, но должны нахо-
диться под врачебным наблюдением, так как митральная недостаточность
может прогрессировать.
224
Хирургическая коррекция является лечением выбора при выраженной
митральной регургитации. Она показана, однако, лишь в случаях значи-
тельного нарушения функционального состояния больных, когда они из-
за развития бивентрикулярной сердечной недостаточности не переносят
даже легкой физической нагрузки, связанной с работой по дому, несмот-
ря на оптимальную медикаментозную терапию. У них, как правило, отме-
чается значительное увеличение сердца, и у большинства — мерцательная
аритмия. Для решения вопроса об операции обычно проводят катетериза-
цию сердца и ангиокардиографию в целях подтверждения диагноза пер-
вичной митральной недостаточности, оценки ее выраженности и состоя-
ния насосной функции сердца, а также для выявления других поражений
клапанного аппарата.
При ревматической митральной недостаточности хирургическое лечение зак-
лючается в основном в протезировании клапана, тогда как у значитель-
ной части больных с неревматическим пороком при отсутствии грубого
фиброза и кальциноза производят его реконструкцию. При малейшей воз-
можности пластики клапана ей следует отдавать предпочтение перед проте-
зированием ввиду отсутствия поздних осложнений, которые свойственны
больным с искусственными клапанами (см. Лечение митрального стеноза).
Хирургическая летальность в значительной степени зависит от функции
миокарда левого желудочка и колеблется от 3—5 до 10—15 % у больных со
значительным снижением ФВ. Заметное улучшение достигается в среднем
у 2/3 оперированных. Отсутствие эффекта или ухудшение обычно связаны
с усугублением исходно выраженной миокардиальной недостаточности.
Прогноз. Небольшая и даже умеренная бессимптомная митральная ре-
гургитация существенно не сказывается на выживаемости. Даже при выра-
женной хронической митральной недостаточности в связи с ее относи-
тельно неплохой переносимостью хирургическое лечение зачастую можно
отложить до зрелого возраста. Прогноз обычно ухудшается лишь при раз-
витии инфекционного эндокардита.
Отдаленные результаты хирургического лечения, как и ближайшие, за-
висят от состояния миокарда. После протезирования митрального клалана
ежегодная летальность составляет в среднем 4 %. Ее наиболее частыми при-
чинами являются тромбоэмболии, инфекционный эндокардит и дисфун-
кция протеза клапана. После пластики клапана отдаленные результаты
значительно лучше.
ОСОБЕННОСТИ КЛИНИКИ, ДИАГНОСТИКИ И ЛЕЧЕНИЯ
РАЗЛИЧНЫХ ВАРИАНТОВ НЕРЕВМАТИЧЕСКОЙ
МИТРАЛЬНОЙ НЕДОСТАТОЧНОСТИ
Среди причин неревматической митральной недостаточности наиболь-
шее распространение имеют пролапс митрального клапана и дисфунк-
ция сосочковых мышц. Реже встречаются разрыв сухожильных хорд и каль-
циноз митрального кольца.
225
Пролапс митрального клапана — это клинический синдром, обуслов-
ленный патологией одной или обеих створок митрального клапана, чаще
задней, с их выбуханием и выпадением в полость левого предсердия во
время систолы желудочков. Различают первичный, или идиопатический,
пролапс, являющийся изолированным заболеванием сердца, и вторичный.
Первичный пролапс митрального клапана встречается у 5-8 %
населения. У подавляющего большинства больных имеет бессимптомное те-
чение, являясь наиболее распространенным клапанным пороком. Он обна-
руживается преимущественно у лиц 20—40 лет, чаще у женщин. Вторич-
ный пролапс митрального клапана отмечается при целом ряде болез-
ней сердца — ревматизме, в том числе при ревматических пороках (в сред-
нем в 15 % и более случаев), ВПС, особенно вторичном дефекте межпред-
сердной перегородки (20-40 %), ИБС (16—32 %), кардиомиопатиях и др.
Этиология не установлена. При первичном пролапсе отмечается наслед-
ственная предрасположенность с аутосомно-доминантным типом переда-
чи. Его морфологическим субстратом является неспецифическая, так на-
зываемая миксоматозная дегенерация створок клапана с замещением губ-
чатого и фиброзного слоев скоплением патологических кислых мукополи-
сахаридов, в котором находятся фрагментированные коллагеновые волокна.
Элементы воспаления отсутствуют. Сходные морфологические изменения
характерны для синдрома Марфана. У части больных с пролапсом мит-
рального клапана отмечаются гипермобильность суставов, изменения ске-
лета (тонкие длинные пальцы, синдром прямой спины, сколиоз), изред-
ка дилатация корня аорты. Встречается также пролапс трехстворчатого и
аортального клапанов, иногда в сочетании с аналогичным поражением
митрального клапана. Эти факты позволили высказать предположение о
том, что в основе заболевания лежит генетически обусловленная патология
соединительной ткани с изолированным или преимущественным пораже-
нием створок клапанов сердца, чаще митрального.
Макроскопически одна или обе створки увеличены в размерах и утол-
щены, а прикрепляющиеся к ним сухожильные хорды истончены и удли-
нены. В результате створки куполообразно впячиваются в полость левого
предсердия (’’парусят”) и их смыкание в большей или меньшей степени
нарушается. Клапанное кольцо может растягиваться. У подавляющего боль-
шинства больных митральная регургитация минимальна и не усугубляется
с течением времени, а нарушения гемодинамики отсутствуют. У неболь-
шой части больных она, однако, может увеличиваться. Из-за увеличения
радиуса кривизны створки напряжение, испытываемое сухожильными хор-
дами и неизмененными сосочковыми мышцами, возрастает, что усугуб-
ляет растяжение хорх и может способствовать их разрыву. Напряжение
сосочковых мышц способно приводить к дисфункции и ишемии этих мышц
и соседнего миокарда стенки желудочка. Это может способствовать увели-
чению регургитации и возникновению аритмий.
В большинстве случаев первичного пролапса миокард в морфологиче-
ском и функциональном отношениях не изменен, однако у небольшой
226
части симптоматичных больных описаны “беспричинная” неспецифиче-
ская дистрофия миокарда и его фиброз. Эти данные служат основанием
для обсуждения вопроса о возможности связи пролапса с поражением
миокарда неизвестной этиологии, то есть с кардиомиопатиями.
Клиника. Проявления и течение заболевания очень вариабельны, и кли-
ническое значение пролапса митрального клапана остается неясным. У
значительной части больных патология выявляется лишь при тщательной
аускультации или эхокардиографии. У большинства больных заболевание
остается бессимптомным в течение всей жизни.
Жалобы неспецифичны и включают разнообразные виды кардиалгии,
часто упорной, не купирующейся нитроглицерином, перебои и сердце-
биения, периодически возникающие, в основном в покое, чувство не-
хватки воздуха с “тоскливыми” вздохами, головокружение, обмороки,
общую слабость и утомляемость. Значительная часть этих жалоб имеет
функциональное, неврогенное, происхождение.
Важнейшее диагностическое значение имеют данные аускульта-
ции. Характерен средне- или поздний систолический клик, который
может быть единственным проявлением патологии либо, чаще, сопро-
вождается так называемым поздним систолическим шумом. Как показы-
вают данные фонокардиографии, он отмечается через 0,14 с и более пос-
ле I тона и, по-видимому, обусловлен резким напряжением провисаю-
щих удлиненных сухожильных хорд или выбухающей створки клапана.
Поздний систолический шум может наблюдаться и без клика и свиде-
тельствует о митральной регургитации. Он лучше всего выслушивается
над верхушкой сердца, короткий, чаще негромкий и музыкальный. Клик
и шум смещаются к началу систолы, а шум удлиняется и усиливается
при уменьшении наполнения левого желудочка, что усугубляет несоот-
ветствие между размерами его полости и аппарата митрального клапана. В
этих целях проводят аускультацию и фонокардиографию при переходе
больного в вертикальное положение, пробе Вальсальвы (натуживании),
вдыхании амилнитрита. Наоборот, увеличение КДО левого желудочка при
присаживании на корточки и изометрической нагрузке (сдавлении руч-
ного динамометра) или введении норадреналина гидротартрата вызыва-
ет запаздывание клика и укорочение шума, вплоть до их исчезновения.
Диагностика. Изменения на ЭКГ отсутствуют или неспецифичны. Чаще
всего отмечаются двухфазные или отрицательные зубцы Т в отведениях
II, III и aVF, обычно позитивизирующиеся при обзидановой (индерало-
вой) пробе. Данные рентгенографии без особенностей. Только в случаях
выраженной регургитации отмечаются изменения, свойственные митраль-
ной недостаточности.
Диагноз устанавливают с помощью эхокардиографии. При исследовании
в М-режиме определяется резкое смещение кзади задней или обеих створок
митрального клапана в середине или конце систолы, которое совпадает с
кликом и появлением систолического шума (рис. 56). При двухмерном
сканировании из парастернальной позиции хорошо видно систолическое
227
Рис. 56. ЭхоКГ в М-режиме больного с
пролапсом задней створки митрального
клапана: ЯР — правый желудочек; S -
межжелудочковая перегородка; AMVL —
передняя, PMVL — задняя створки
митрального клапана; MVP — пролапс
митрального клапана
смещение одной или обеих ство-
рок в левое предсердие. Наличие
и выраженность сопутствующей
митральной регургитации оцени-
вают с помощью допплеровского
исследования.
По своему диагностическому
значению эхокардиография не
уступает ангиокардиографии, при
которой также определяется вы-
бухание створок митрального кла-
пана в левое предсердие с забра-
сыванием в него контрастного вещества из левого желудочка. Оба мето-
да, однако, могут давать ложноположительные результаты, и существу-
ющие диагностические признаки требуют верификации.
Течение и прогноз в большинстве случаев благоприятные. Больные, как
правило, ведут нормальный образ жизни, и порок не ухудшает выжива-
емость. Тяжелые осложнения возникают очень редко. Как показали ре-
зультаты многолетних (20 лет и более) наблюдений, их риск повышается
при значительном утолщении створок митрального клапана по данным
эхокардиографии (A.Marks и соавт., 1989, и др.). Такие больные подлежат
врачебному наблюдению.
Осложнения заболевания включают: 1) развитие значительной мит-
ральной регургитации. Отмечается примерно у 5 % больных и в части слу-
чаев связано со спонтанным разрывом хорды (2); 3) желудочковые
эктопические аритмии, которые могут быть причиной сердцебиения, го-
ловокружения и обмороков и в единичных, крайне редких случаях, при-
водить к фибрилляции желудочков и внезапной смерти; 4) инфекцион-
ный эндокардит; 5) эмболию сосудов головного мозга тромботическими
наложениями, которые могут образовываться на измененных створках.
Последние два осложнения встречаются, однако, настолько редко, что
их рутинную профилактику не проводят.
При бессимптомном течении заболевания лечение не требуется. При
кардиалгии довольно эффективны p-адреноблокаторы, которые оказыва-
ют также антиаритмическое действие, хотя их применение в значитель-
ной степени эмпирическое. При наличии выраженной митральной регур-
гитации с признаками левожелудочковой недостаточности показано хи-
рургическое лечение — пластика или протезирование митрального клапана.
228
Рекомендации проводить антибиотикопрофилактику инфекционного
эндокардита не являются общепринятыми в связи со значительной рас-
пространенностью пролапса митрального клапана, с одной стороны, и
редкостью возникновения у таких больных эндокардита — с другой.
Дисфункция сосочковых мышц обусловлена их ишемией, фиброзом,
реже воспалением. Ее возникновению способствует изменение геометрии
левого желудочка при его дилатации. Она довольно часто встречается при
острых и хронических формах ИБС, кардиомиопатиях и других заболева-
ниях миокарда. Митральная регургитация, как правило, невелика и про-
является поздним систолическим шумом вследствие нарушения смыка-
ния створок клапана в середине и конце систолы, которое в значитель-
ной мере обеспечивается сокращением сосочковых мышц. Изредка при
значительной дисфункции шум может быть пансистолическим. Течение и
лечение определяются основным заболеванием.
Разрыв сухожильной хорды или хорд может быть спонтанным или свя-
занным с травмой, острым ревматическим или инфекционным эндокар-
дитом и миксоматозной дегенерацией митрального клапана. Он приводит
к острому возникновению митральной недостаточности, часто значитель-
ной, которая вызывает резкую объемную перегрузку левого желудочка и
развитие его недостаточности. Левое предсердие и легочные вены не ус-
певают расшириться, вследствие чего давление в малом круге кровообра-
щения значительно повышается, что способствует раннему развитию пра-
вожелудочковой недостаточности.
В наиболее тяжелых случаях отмечаются тяжелый рецидивирующий,
иногда некупирующийся, отек легких вследствие высокой венозной ле-
гочной гипертензии и даже кардиогенный шок. В отличие от хронической
ревматической митральной регургитации, даже при значительной лево-
желудочковой недостаточности, у больных сохраняется синусовый ритм.
Шум громкий, чаще пансистолический, но иногда заканчивается до конца
систолы из-за выравнивания давления в левых желудочке и предсердии и
может иметь нетипичный эпицентр. При разрыве хорд задней створки он
иногда локализуется на спине, а передней створки — на основании серд-
ца и проводится на сосуды шеи. Кроме HI тона, отмечается IV тон.
При рентгенологическом исследовании характерны признаки выра-
женного венозного застоя в легких, вплоть до отека, при относительно
небольшом увеличении левых желудочка и предсердия. Со временем по-
лости сердца расширяются.
Подтвердить диагноз позволяет эхокардиография, при которой видны
фрагменты створки и хорды клапана в полости левого предсердия во вре-
мя систолы и другие признаки. В отличие от ревматического порока створки
клапана тонкие, кальциноз отсутствует, поток регургитации при доппле-
ровском исследовании располагается эксцентрично.
Катетеризации сердца для подтверждения диагноза обычно не требу-
ется. Особенностью ее данных является высокая легочная гипертензия.
229
Течение и исход заболевания зависят от состояния миокарда левого
желудочка. Многие больные умирают, а у выживших наблюдается карти-
на выраженной митральной регургитации.
Лечение включает общепринятую терапию тяжелой сердечной недоста-
точности. Особое внимание следует уделять снижению постнагрузки с по-
мощью периферических вазодилататоров, что позволяет уменьшить регурги-
тацию и застой крови в малом круге кровообращения, и увеличить МОС.
После стабилизации состояния выполняют хирургическую коррекцию порока.
Кальциноз митрального кольца является заболеванием пожилых, чаще
женщин, причина которого неизвестна. Он обусловлен дегенеративными
изменениями фиброзной ткани клапана, развитию которых способствуют
повышенная нагрузка на клапан (пролапс, увеличение КДД в левом желу-
дочке) и гиперкальциемия, особенно при гиперпаратиреозе. Кальцинаты
располагаются не в самом кольце, а в области основания створок клапа-
на, больше задней. Небольшие отложения кальция не оказывают влияния
на гемодинамику, тогда как значительные, вызывая иммобилизацию мит-
рального кольца и хорд, приводят к развитию митральной регургитации,
обычно небольшой или умеренной. В единичных случаях она сопровожда-
ется сужением митрального отверстия (митральным стенозом). Часто со-
четается с кальцинозом устья аорты, вызывающим его стенозирование.
Заболевание обычно протекает бессимптомно и обнаруживается при
выявлении грубого систолического шума или отложений кальция в проек-
ции митрального клапана на рентгенограмме. У большинства больных от-
мечается сердечная недостаточность, обусловленная в основном сопут-
ствующим поражением миокарда. Заболевание может осложняться нару-
шениями внутрижелудочковой проводимости вследствие отложений каль-
ция в межжелудочковой перегородке, инфекционным эндокардитом и из-
редка вызывать эмболии или тромбоэмболии, чаще мозговых сосудов.
Диагноз ставят на основании данных эхокардиографии. Кальцифика-
ция клапана в виде полосы интенсивных эхосигналов определяется меж-
ду задней створкой клапана и задней стенкой левого желудочка и дви-
жется параллельно задней стенке.
В большинстве случаев специальное лечение не требуется. При значи-
тельной регургитации производят протезирование митрального клапана.
Показана профилактика инфекционного эндокардита.
КОМБИНИРОВАННЫЙ МИТРАЛЬНЫЙ ПОРОК
Комбинированный митральный порок сердца, то есть сочетание митраль-
ных стеноза и недостаточности, практически всегда имеет ревматическое
происхождение. Нарушения внутрисердечной гемодинамики особенно неблаго-
приятны, так как во время систолы часть крови выбрасывается в левое
предсердие, откуда она должна вновь попасть в желудочек через суженное
отверстие. Вследствие этого митральная регургитация редко достигает
230
Таблица 12 Данные аускультации сердца н ФКГ при комбинированном митральном нороке
в зависимости от характера преобладающего порока
Признак Преобладание
стеноза недостаточности
I тон Усилен Ослаблен
Щелчок открытия митрального клапана Громкий Тихий или отсутствует
Интервал Q—/тон Удлинен Не изменен
Левожелудочковый III тон Отсутствует Звучный
Систолический шум Отсутствует или низкоамплитудный, низкочастотный Громкий, высокочастотный, проводится в подмышечную область
значительной величины, а МОС заметно снижен. Рано присоединяются
мерцательная аритмия и правожелудочковая недостаточность.
Морфологические изменения клапана более выражены, чем при изоли-
рованных пороках. Створки утолщены и их края вывернуты так, что кла-
панное отверстие сужено и не может увеличиваться в размерах. Хорды
часто укорочены и утолщены, выражен кальциноз.
Клиника. Как и при изолированном митральном стенозе, основной жа-
лобой больных является нарастающее снижение переносимости физической
нагрузки из-за одышки, слабости и сердцебиения. Ухудшение состояния
может вызываться бронхолегочной инфекцией или задержкой жидкости.
При объективном исследовании в стадии развернутых клинических про-
явлений отмечаются мерцательная аритмия, набухание шейных вен вслед-
ствие правожелудочковой недостаточности и при наличии относитель-
ной недостаточности трехстворчатого клапана — положительный венный
пульс. При пальпации прекардиальной области, как при “чистом” мит-
ральном стенозе, часто определяется правожелудочковая пульсация под
мечевидным отростком и у левого края грудины. Верхушечный толчок в
большинстве случаев не усилен, так как митральная регургитация и свя-
занная с ней гипертрофия левого желудочка редко бывают значительны-
ми. Типичные данные аускультации сердца в зависимости от характера
преобладающего порока представлены в табл. 12. Определенное влияние
на изменения мелодии сердца оказывает также подвижность створок кла-
пана. Поэтому необходимо иметь в виду, что ослабление I тона и тихий
щелчок открытия не всегда свидетельствуют о выраженности регургита-
ции, а могут быть обусловлены кальцинозом и иммобилизацией пере-
дней створки. Более надежным признаком преобладающей митральной
регургитации является громкий пансистолический шум, который хоро-
шо проводится в подмышечную область. При этом увеличение ударного
выброса левого желудочка может вызывать образование довольно звуч-
ного мезодиастолического шума. У значительной части больных отмеча-
ются признаки правожелудочковой недостаточности.
231
Диагностика. Изменения на ЭКГ зависят от того, какой порок преоблада-
ет. При превалирующей недостаточности часто отмечаются признаки гипер-
трофии левого желудочка, обычно умеренно выраженные, которые иногда,
однако, отсутствуют. При резко выраженной гипертрофии левого желудочка
следует искать другую причину - например, поражение аортального клапа-
на, системную артериальную гипертензию. При синусовом ритме регистри-
руется P-mitrale. Признаки гипертрофии правого желудочка отмечаются редко.
На рентгенограмме грудной клетки определяется увеличенное сердце мит-
ральной формы. Обращает на себя внимание резкая дилатация левого пред-
сердия, которое может достигать гигантских размеров, в отличие от других
изолированных пороков, и вмещать до 3 л крови. Часто отмечается каль-
циноз в проекции митрального клапана. При преобладании недостаточно-
сти расширяется также левый желудочек. Изменения в легких сходны с
таковыми при “чистом” митральном стенозе.
Эхокардиография позволяет подтвердить диагноз и определить прева-
лирующий порок. Характерны патогномоничные для митрального стено-
за замедление раннего диастолического прикрытия передней створки мит-
рального клапана, движение которой приближается к П-образному, и сме-
щение кпереди его задней створки параллельно движению передней. Створ-
ки утолщаются, и амплитуда диастолического открытия клапана умень-
шается. Полость левого желудочка может увеличиваться у размерах в за-
висимости от выраженности регургитации и миокардиальной недоста-
точности. Допплерэхокардиография позволяет оценить диастолический
градиент давления на митральном клапане и величину обратного тока. В
неясных случаях выраженность стеноза и регургитации уточняют при ка-
тетеризации сердца и ангиокардиографии.
Дифференциальную диагностику проводят в первую очередь с дефек-
том межпредсердной перегородки и гипертрофической кардиомиопатией.
У больных среднего возраста сдефектом межпредсердной пе-
регородки, как и при комбинированном митральном пороке, отме-
чаются систолический и диастолический шумы, мерцательная аритмия и
увеличение сердца. Постановку правильного диагноза часто затрудняет
якобы перенесенный в детстве острый ревматизм. Заподозрить дефект меж-
предсердной перегородки позволяют неувеличенное левое предсердие при
рентгенологическом исследовании, что особенно демонстративно в бо-
ковой проекции при контрастировании пищевода, и графика блокады
правой ножки пучка Гиса на ЭКГ с rSK в отведении V,. Диагноз уточня-
ют с помощью двухмерной допплерэхокардиографии. Иногда прибегают
к катетеризации се] дца. Необходимо иметь в виду возможность сочетан-
ной патологии — синдрома Лютембаше, для которого характерна выра-
женная правожелудочковая недостаточность.
Сложность дифференциальной диагностики собструктивной ги-
пертрофической кардиомиопатией связана со свойственным
этому заболеванию нарушением диастолического наполнения левого желу-
232
дочка в сочетании с митральной регургитацией. В отличие от митрального
порока на ЭКГ выражены признаки гипертрофии левого желудочка. Уточ-
нить диагноз позволяет эхокардиография.
Диагноз комбинированного митрального порока, как и изолированных,
ставят на основании характерной мелодии сердца, данных ЭКГ и рентге-
нологического исследования грудной клетки и обычно уточняют с помо-
щью допплерэхокардиографии. Только в редких сложных случаях прихо-
дится прибегать к катетеризации сердца и ангиокардиографии, которые
позволяют более точно, чем ультразвуковое исследование, количественно
оценить выраженность стеноза и регургитации.
Осложнения такие же, как при изолированных пороках:
1) мерцательная аритмия. Развивается настолько часто, что может рас-
сматриваться скорее как проявление заболевания. Сроки ее возникновения
зависят от выраженности порока и ревматического поражения миокарда;
2) системные эмболии тромбами из левого предсердия. Диагностируют
примерно у 20 % больных, но их истинная частота значительно больше в
связи с частым бессимптомным или малосимптомным течением;
3) легочная артериальная гипертензия. Развивается реже, чем при мит-
ральном стенозе, так как среднее давление в левом предсердии у таких
больных обычно ниже.
Лечение сходно с лечением изолированных пороков. Медикаментозная
терапия включает:
1) профилактику рецидива острой ревматической лихорадки по показаниям;
2) профилактику инфекционного эндокардита у всех больных;
3) лечение мерцательной аритмии: а) восстановление синусового рит-
ма с помощью электроимпульсной терапии при относительно небольшом
пороке, не требующем хирургической коррекции, или б) ее перевод в
нормо-брадисистолическую форму с помощью сердечных гликозидов, при
необходимости в сочетании с р-адреноблокаторами или верапамилом;
4) антикоагулянтную терапию у больных с мерцательной аритмией, ко-
торым по тем или иным причинам не проводится оперативное лечение.
Это позволяет значительно снизить частоту тромбоэмболий, хотя и не
обеспечивает их полное предотвращение.
Хирургическое лечение. Из-за грубой деформации клапана производят
только его протезирование. В связи с более высокой летальностью, чем
при комиссур )томии, и худшими отдаленными результатами показания к
операции более строгие и аналогичны таковым при “чистой” ревматичес-
кой митральной недостаточности. Это прежде всего значительное ограни-
чение обычной физической активности, несмотря на адекватную лекар-
ственную терапию, которое соответствует не менее чем III классу NYHA.
У больных с мерцательной аритмией после операции следует попытаться
восстановить синусовый ритм.
Прогноз в значительной мере зависит от состояния миокарда. Даже при
тяжелом пороке и большом сердце больные могут прожить до 10 лет, а
иногда и дольше, без операции.
233
Отдаленные результаты хирургического лечения. Достигаемое улучше-
ние качества жизни и выживаемости значительно меньше, чем у боль-
ных с оперированным митральным стенозом.
СТЕНОЗ УСТЬЯ АОРТЫ
Стеноз устья аорты представляет собой препятствие изгнанию крови
из левого желудочка во время систолы.
Эпидемиология. Сведения о распространенности стеноза устья аорты
весьма противоречивы. Его удельный вес среди всех приобретенных по-
роков сердца варьирует от 5 до 20 % (Б.П.Соколов, 1963; Н.М.Амосов,
Я.А.Бендет, 1983; C.Bailey, 1955); 80 % больных составляют мужчины.
Этиологическими факторами являются: 1) врожденная патология; 2) ревма-
тизм; 3) кальциноз створок аортального клапана неизвестной этиологии.
Патологическая анатомия. Хотя врожденный стеноз устья аорты имеет-
ся с рождения, в последующие 30 лет он усугубляется вследствие про-
грессирующего фиброза и кальциноза. Этому особенно подвержены боль-
ные с врожденным двустворчатым аортальным клапаном, который не
вызывает существенного сужения устья аорты в детстве. Кроме клапанно-
го, врожденный аортальный стеноз может быть под- и надклапанным,
мембранозным, в виде фиброзной диафрагмы. Он может быть обуслов-
лен также резким сужением выносящего тракта левого желудочка вслед-
ствие выраженной гипертрофии, преимущественно в базальной части меж-
желудочковой перегородки, что свойственно обструктивной форме ги-
пертрофической кардиомиопатии.
Ревматический эндокардит приводит к спаиванию комиссур створок кла-
пана, в результате чего, как и при врожденном пороке, они подвергаются
постоянной травматизации током крови с последующим развитием фибро-
за и кальциноза, что постепенно усугубляет сужение устья аорты. В итоге ко
времени развития серьезных нарушений гемодинамики аортальный клапан
настолько фиброзирован и обызвествлен, что установить этиологию поро-
ка (врожденный или ревматический) иногда бывает невозможно.
Идиопатический кальциноз устья аорты с его стенозированием встре-
чается преимущественно у лиц пожилого возраста и обусловлен неспеци-
фическцм дегенеративным поражением клапана. Ему особенно подвер-
жен врожденный двухстворчатый аортальный клапан. Сужение устья аор-
ты при этом относительно невелико.
Механизм нарушений гемодинамики. Первичное нарушение гемодина-
мики обусловлено сужением устья аорты, что создает препятствие изгна-
нию крови, для преодоления которого левый желудочек должен развивать
более высокое систолическое давление. Стеноз прогрессирует относитель-
но медленно, и адекватный МОС обеспечивается за счет постепенного
увеличения систолического градиента давления на аортальном клапане.
При умеренном стенозе он находится в пределах 20—50 мм рт.ст., а при
234
выраженном достигает 50—100 мм рт. ст. и более в покое и до 200 мм рт.ст.
при физической нагрузке.
Вследствие хронической перегрузки сопротивлением и повышения сис-
толического стеночного напряжения развивается гипертрофия левого желу-
дочка. Она является важнейшим механизмом стойкой компенсации на-
рушений гемодинамики и приводит к нормализации стеночного напряже-
ния. Определенное адаптационное значение имеет и удлинение систолы же-
лудочка.
По мере нарастания гипертрофии с увеличением толщины стенок ле-
вого желудочка величина его полости уменьшается. Это обусловлено сни-
жением диастолической податливости желудочка, для более или менее
адекватного наполнения которого требуется более высокое давление. Важ-
ную компенсаторную роль играет усиление систолы левого предсердия.
Все это влечет за собой повышение КДД в желудочке при неизмененном
или несколько уменьшенном КДО и увеличение амплитуды волны “а”
на кривой давления в левом предсердии.
Полная компенсация может сохраняться длительное время — 20—30
лет и даже более. При этом, однако, МОС, неизмененный в покое, не
способен в должной мере увеличиваться при физической нагрузке. По
мере усугубления стеноза и исчерпания компенсаторных возможностей
гипертрофии МОС и систолический градиент начинают снижаться. Раз-
виваются левожелудочковая недостаточность и пассивная венозная ле-
гочная гипертензия. При этом еще больше повышается среднее давление
в левом предсердии, легочных венах, легочных капиллярах и легочной
артерии. Значительного возрастания давления в легочной артерии, одна-
ко, не происходит, и гипертрофия правого желудочка не развивается.
Декомпенсации порока способствует возникновение хроничес-
кой коронарной недостаточности при морфологически неизмененных ко-
ронарных сосудах. Она обусловлена, прежде всего, несоответствием меж-
ду массой миокарда и сетью коронарных артерий, особенно при повы-
шении потребности миокарда в кислороде при физической нагрузке в
условиях фиксированного МОС. Определенную роль играют также ин-
жекторный эффект отсасывания крови из устьев коронарных артерий при
выбросе крови в аорту с большой скоростью через суженное отверстие и
распространение кальциноза на устья коронарных сосудов.
Клиника. Аортальный стеноз становится гемодинамически значимым
при сужении клапанного отверстия примерно до 1/3 нормальной величи-
ны. Даже выраженный стеноз на протяжении многих лет протекает бес-
симптомно благодаря способности гипертрофированного левого желу-
дочка генерировать повышенное внутрижелудочковое давление. У многих
таких больных жалобы появляются после 40 и даже 60 лет.
Начало заболевания постепенное. Наиболее характерна триада симптомов:
1) одышка, вначале при физической нагрузке, а затем и в покое; 2) ангиноз-
ная боль; 3) головокружение и обмороки. Все они являются относительно
поздними симптомами, свидетельствующими о развитии декомпенсации.
235
1. Одышка обусловлена повышением давления в легочных капилля-
рах, которое отражает повышенное КДД в левом желудочке вследствие
снижения его диастолической податливости и нарушения систолическо-
го опорожнения. Изредка заболевание начинается с приступа сердечной
астмы или отека легких при значительной физической нагрузке.
2. Стенокардитическая боль появляется несколько позже и
обусловлена ишемией миокарда в результате несоответствия между по-
вышенной потребностью миокарда в кислороде и уменьшением его дос-
тавки. У больных зрелого возраста боль отчасти связана с сопутствующим
атеросклеротическим поражением коронарных артерий. Боль вначале от-
мечается при физической нагрузке, а затем и в покое и имеет характер,
типичный для стенокардии.
3. Головокружение и обмороки возникают обычно при фи-
зическом напряжении и могут сочетаться с ангинозной болью. Они иног-
да проявляются в виде приступов резкой слабости с потемнением в гла-
зах. В их основе лежит острая ишемия мозга вследствие снижения АД при
дилатации сосудов работающих мышц и неадекватной вазоконстрикции
неработающих в условиях фиксированного МОС. Обмороки в покое име-
ют иной генез и связаны с резким снижением МОС, обусловленным
нарушениями сердечного ритма.
Поскольку МОС в покое долгое время поддерживается на неизменен-
ном уровне, повышенная утомляемость и слабость как признаки снижения
МОС развиваются относительно поздно. В претерминальной стадии присо-
единяются приступы сердечной астмы и отека легких. Легочная гипертен-
зия приводит к быстрому развитию признаков правожелудочковой недо-
статочности и относительной недостаточности трехстворчатого клапана.
Объективное исследование. Изменения кожи (выраженная бледность, ак-
роцианоз) появляются лишь в очень поздних стадиях заболевания. Обра-
щает на себя внимание медленный, малый и платообразный артери-
альный пульс (pulsus tardus, parvus et longus). Отмечается склонность
к брадикардии, способствующей улучшению диастолического наполнения
левого желудочка, и артериальной гипотензии. При снижении УОС пульсо-
вое АД уменьшается. Повышение систолического АД более 200 мм рт.ст.
вследствие сопутствующей симптоматической или эссенциальной артери-
альной гипертензии исключает значительный стеноз аортального клапана.
При пальпации определяется медленно приподнимающийся, вы-
сокий, резистентный верхушечный толчок, который постепенно смеща-
ется влево и книзу. В положении больного лежа на левом боку ему может
предшествовать толчок левого предсердия при его усиленном сокраще-
нии и изгнании крови в неподатливый левый желудочек. В области осно-
вания сердца, яремной вырезки и над сонными артериями определяется
систолическое дрожание (’’кошачье мурлыканье”) с эпицентром во вто-
ром межреберье справа у края грудины. Оно лучше всего определяется в
положении больного сидя с наклоном туловища кпереди при задержке
236
дыхания на выдохе. При развитии левожелудочковой недостаточности со
снижением УОС дрожание резко ослабевает.
Важное диагностическое значение имеют данные аускультации
сердца и фонокардиографии.
1. Систолический шум. Характерный для стеноза устья аорты си-
столический шум грубый и имеет эпицентр во втором межреберье справа
у края грудины. Он хорошо проводится по току крови в область яремной
вырезки и на сонные артерии, а также к верхушке сердца. Шум отличается
характерным скребущим оттенком и лучше слышен в положении больно-
го сидя с наклоном туловища кпереди. На ФКГ он имеет ромбовидную
форму, типичную для шума изгнания, с максимумом примерно в середи-
не систолы. При развитии сердечной недостаточности с уменьшением удар-
ного объема и кровотока через клапан он становится тихим и коротким.
2. Добавочный тон в период систолы — щ е л ч о к открытия аор-
тального клапана. Отмечается на ФКГ через 0,04—0,06 с после I
тона и лучше всего слышен у левого края грудины. Он особенно характерен
в детском и юношеском возрасте при врожденном стенозе устья аорты, и
при развитии кальциноза и малоподвижности створок клапана исчезает.
3. Слияние А2 с Р2 или, при резко выраженном стенозе, парадок-
сальное расщепление II тона (Р2А2) в зависимости от степени
удлинения систолы левого желудочка.
4. Ослабление А2, вплоть до его отсутствия. Обусловлено тугопод-
вижностью фибротизированных и обызвествленных створок клапана.
5. IV тон. Связан с гипертрофией левого желудочка и повышением его
КДД. При дилатации желудочка и развитии левожелудочковой недоста-
точности появляются III тон и акцент Р2.
Диагностика. На ЭКГ выражены признаки гипертрофии левого желу-
дочка и его перегрузки в виде депрессии сегмента ST и появления глубо-
ких отрицательных зубцов Т в левых грудных отведениях, I и aVL. Гиперт-
рофия межжелудочковой перегородки приводит к нарушению роста зуб-
цов R в грудных отведениях, что можно ошибочно расценить как призна-
ки рубцовых изменений после перенесенного крупноочагового инфаркта
миокарда. Изменения деполяризации могут иметь также ишемическое про-
исхождение. При выраженной дистрофии миокарда и распространенном
миокардиосклерозе отмечается блокада левой ножки пучка Гиса или ее
передне-верхней ветви. Распространение кальциноза на межжелудочковую
перегородку и проводящую систему сердца может приводить к развитию
атриовентрикулярной блокады различной степени. В поздних стадиях по-
являются признаки гипертрофии левого предсердия (P-mitrale).
Рентгенография грудной клетки. Вследствие концентрического характера
гипертрофии левого желудочка на протяжении многих лет изменения раз-
меров и формы сердца не происходит. Может отмечаться лишь закругление
гипертрофированной верхушки. При выраженном стенозе развивается пост-
стенотическое расширение восходящей части аорты. Важное диагностическое
значение имеет выявление кальциноза аортального клапана. Его отсутствие
237
у взрослых практически исключает значительное сужение устья аорты. В
поздних стадиях при декомпенсации либо присоединении недостаточности
аортальных клапанов левый желудочек расширяется, и сердце приобретает
характерную аортальную форму. Появляются признаки венозного застоя в
легких, увеличение левого предсердия, легочной артерии и правых отделов
сердца.
Для сфигмограммы характерны замедленный подъем кривой с зазубрен-
ностью ее восходящей части в виде петушиного гребня, платообразная вер-
шина, сглаженность дикротической волны. Отмечается удлинение периода
изгнания (ПИ) из левого желудочка пропорционально выраженности сте-
ноза и укорочение периода предызгнания, т.е. изоволюмического сокраще-
ния (ППИ) с уменьшением их соотношения — индекса ППИ/ПИ, кото-
рый нормализуется только в поздних стадиях порока при развитии левоже-
лудочковой недостаточности. При этом вследствие снижения пульсового дав-
ления амплитуда сфигмограммы уменьшается.
При эхокардиографии определяются признаки выраженной гипертрофии
левого желудочка — увеличение толщины его задней стенки и межжелу-
дочковой перегородки. Очень характерно утолщение, уплотнение и сни-
жение подвижности створок аортального клапана вследствие грубого фиб-
роза и кальциноза, которые являются обязательным признаком порока у
лиц старше 25 лет. При развитии декомпенсации полость левого желудоч-
ка расширяется и систолическая экскурсия миокарда уменьшается. Доп-
плерэхокардиография позволяет измерить систолический градиент дав-
ления на аортальном клапане. Эхокардиография имеет важное значение
для дифференциальной диагностики клапанного стеноза устья аорты от
под- и надклапанного и обструктивной гипертрофической кардиомиопа-
тии, а также для диагностики сопутствующих пороков митрального кла-
пана и аортальной регургитации.
Катетеризация сердца и ангиокардиография показаны всем больным, у
которых по данным клинического и неинвазивного обследования диагно-
стирован выраженный стеноз устья аорты, для окончательного решения
вопроса о целесообразности хирургического лечения. При этом часто вы-
полняют и коронарографию для оценки проходимости коронарных артерий.
Определяют: 1) градиент систолического давления между левым желудоч-
ком и аортой, который уточняет данные допплерэхокардиографии и явля-
ется единственно надежным способом оценки выраженности стеноза; 2)
функциональное состояние левого желудочка (его КДД, КДО, ФВ, УОС,
МОС); 3) точную локализацию препятствия изгнанию крови, диаметр вос-
ходящей части аорты, наличие сопутствующих пороков и их выраженность.
Дифференциальная диагностика. Систолический шум изгнания во вто-
ром межреберье справа или в третьем-четвертом межреберье слева у края
грудины может иметь различное происхождение. В подростковом и юноше-
ском возрасте при бессимптомном течении заболевания прежде всего не-
обходимо проводить дифференциальную диагностику с клапанным сте-
нозом устья легочной артерии, при котором систолический
238
шум хорошо слышен над аортой и часто сопровождается систолическим
тоном изгнания. Его отличительные признаки представлены ниже. У тако-
го же контингента больных систолический шум изгнания над областью
выслушивания аортального клапана может проводиться с сосудов шеи,
где он образуется при гиперкинетическом синдроме вследствие
ускорения кровотока. Установить его причину позволяет тщательная аус-
культация в области шеи, где он более громкий и может исчезать при
прижатии подключичной артерии к I ребру в надключичной ямке.
Необходимо иметь в виду, что у некоторых больных смитральной
недостаточностью, особенно при разрыве хорды его передней створ-
ки, шум может хорошо проводиться на основание сердца и носить харак-
тер раннего систолического шума. Даже при отсутствии данных эхокардио-
графии поставить правильный диагноз помогают тщательная аускульта-
ция, фонокардиография и рентгенологическое исследование.
Систолический шум изгнания в проекции аортального клапана вслед-
ствие его относительного стеноза при дилатации аорты часто определя-
ется при ее атеросклеротическом поражении, артериальной гипертензии,
сифилитическом аортите. Против органического стеноза устья аорты в
подобных случаях свидетельствуют непродолжительность шума, отсутствие
дрожания, характерных для стеноза изменений II тона, пульса и призна-
ков кальциноза клапана.
Значительную сложность для интерпретации представляет иногда сис-
толический шум изгнания с эпицентром ближе к верхушке или в третьем-
четвертом межреберье слева у края грудины. Он может отмечаться при трех
заболеваниях: обструктивной гипертрофической кардиомиопатии и реже
- клапанном стенозе устья аорты и неревматической митральной недо-
статочности (разрыве сухожильной хорды). Дифференциально-диагностиче-
ские признаки обструктивной гипертрофической кардио-
миопатии представлены на с. 240.
Диагноз клапанного стеноза устья аорты ставят на основании: 1) ха-
рактерного систолического шума изгнания с эпицентром во втором меж-
реберье справа, который проводится на сосуды шеи и сопровождается
дрожанием, ослаблением А2; 2) выраженной гипертрофии левого желудочка
на ЭКГ; 3) замедления подъема и зазубренности восходящей части кривой
артериального лульса; 4) кальциноза аортального клапана при рентгено-
логическом исследовании (у взрослых); 5) фиброза и кальциноза аортально-
го клапана и выраженной гипертрофии левого желудочка по данным эхо-
кардиографии. Он подтверждается с помощью допплерэхокардиографии
(градиент давления на аортальном клапане) и при катетеризации сердца.
О выраженности стеноза свидетельствуют: 1) характерные
жалобы; 2) изменения артериального пульса и АД, резкое удлинение
периода изгнания левого желудочка на сфигмограмме; 3) максимум шума
во второй половине систолы на ФКГ; 4) слияние А2 с Р2 или парадок-
сальное расщепление II тона; 5) выраженная гипертрофия левого желу-
дочка или блокада левой ножки пучка Гиса на ЭКГ. Наиболее точным
239
Дифференциальная диагностика стеноза устья аорты
Состояние или заболевание
Отличительные признаки
Относительный стеноз устья
аорты при ее расширении
вследствие атеросклероза,
артериальной гипертензии,
сифилиса и др.
Сосудистый шум на сонной
или подключичной артерии
(’’невинный” надключичный
шум или связанный
со стенозом этих артерий)
Клапанный стеноз
устья легочной артерии
Дефект межпредсердной
перегородки
Недостаточность
митрального клапана
Обструктивная форма
гипертрофической
кардиомиопатии
А2 не изменен или усилен. Систолический шум
короткий
Эпицентр шума на шее или в области надклю-
чичной ямки; может исчезать при сдавлении
подключичной артерии. Шум короткий; А2 не
изменен; гипертрофии левого желудочка по дан-
ным ЭКГ нет
Эпицентр шума во втором межреберье слева;
Р2 ослаблен и далеко отстоит от А2;
А2 не изменен; на ЭКГ - признаки гипертро-
фии правого желудочка вместо левого; на рент-
генограмме — часто постстенотическое расши-
рение легочной артерии
Эпицентр шума во втором-третьем межреберье
слева; II тон усилен за счет Р2, его расщепле-
ние фиксировано на вдохе; на ЭКГ — признаки
гипертрофии правого желудочка и блокады пра-
вой ножки пучка Гиса; на рентгенограмме -
дилатация правых отделов сердца, выбухание
ствола легочной артерии и усиление легочного
сосудистого рисунка
Шум чаще пансистолический с эпицентром над
верхушкой, проводится в подмышечную об-
ласть; уменьшается при вдыхании амилнитрита
и увеличивается при введении норадреналина
(при стенозе устья аорты - наоборот); даже при
отсутствии левожелудочковой недостаточности
I тон всегда ослаблен и выражен III тон; при
рентгенологическом исследовании — митраль-
ная форма сердца, увеличение левых желудочка,
предсердия и ствола легочной артерии
Эпицентр систолического шума в третьем-чет-
вертом межреберье у левого края грудины и над
верхушкой, он не проводится на сосуды шеи и
усиливается при пробе Вальсальвы (при аорталь-
ном стенозе ослабевает); протодиастолический
шум сопутствующей недостаточности аорталь-
ных клапанов не характерен; А2 не изменен; тол-
чкообразный пульс в виде bisferiens, хорошо
заметный на сонных артериях
240
критерием является градиент систолического давления на клапане свыше
50 мм рт.ст. по данным допплерэхокардиографии и катетеризации сердца.
При определении этиологии стеноза устья аорты при отсутствии
убедительного ревматического анамнеза в пользу его ревматического проис-
хождения может свидетельствовать наличие сопутствующих пороков - аор-
тальной недостаточности и поражения митрального клапана.
Осложнениями заболевания являются: 1)нарушения ритма и вне-
запная сердечная с м е р т ь. Не менее 25 % больных со стенозом ус-
тья аорты умирают внезапно. Как правило, это пациенты, у которых имеют-
ся характерные симптомы порока, нередко перенесшие протезирование аор-
тального клапана. В большинстве случаев внезапная смерть обусловлена фа-
тальными желудочковыми аритмиями, возникновению которых способствуют
ишемия и фиброз миокарда;
2) острая и хроническая левожелудочковая недостаточ-
ность. Развивается на относительно поздней стадии заболевания и яв-
ляется самым важным показанием к хирургическому лечению;
3)инфаркт миокарда. Даже при наличии неизмененных коронар-
ных артерий длительная ишемия миокарда может вызывать субэндокарди-
альный инфаркт. При сопутствующем коронарном атеросклерозе может
возникать инфаркт миокарда с зубцом Q;
4) атриовентрикулярная блокада. Возникает сравнительно
редко, но может быть причиной внезапной смерти;
5) инфекционный эндокардит. Встречается значительно реже,
чем при недостаточности митрального клапана, — примерно у 2 % больных;
6) системные эмболии кусочками кальция с клапана. Отмеча-
ются нечасто. Могут вызывать инсульты и нарушения зрения.
Течение. Стеноз устья аорты — наиболее хорошо компенсируемый по-
рок сердца, который десятилетиями протекает бессимптомно, и больные
умирают часто после 60 лет. После возникновения симптомов смерть на-
ступает, однако, в течение нескольких лет в основном от сердечной не-
достаточности.
Лечение. При значительном стенозе даже при бессимптомном течении
заболевания необходимо исключить тяжелую физическую нагрузку. Роль
медикаментозной терапии в лечении этого заболевания относительно не-
велика, так как в легких случаях она не требуется, а в тяжелых неэффек-
тивна. Всем больным показана профилактика инфекционного эндокарди-
та. Терапия симптоматическая. При сердечной недостаточности рекомен-
дуют ограничение соли, сердечные гликозиды, мочегонные средства и
периферические вазодилататоры. Мочегонные средства назначают с
осторожностью во избежание снижения ОЦК и МОС. Венозные вазодила-
таторы — нитраты — оказывают хорошее антиангинальное действие, но
относительно малоэффективны при сердечной недостаточности. Приме-
нение артериолярных вазодилататоров (ингибиторов АПФ, гидралазина и
др.) лимитируется артериальной гипотензией. При стенокардии хороший
241
эффект дают также p-адреноблокаторы и антагонисты кальция. Антикоа-
гулянты применяют только у больных с механическими протезами клапана.
Как и при других пороках, единственно действенным способом лече-
ния является хирургический, который включает: 1) оперативную вальву-
лотомию; 2) чрескожную баллончиковую аортальную вальвулопластику;
3) протезирование аортального клапана. Основным показанием является
наличие выраженного стеноза, то есть градиента систолического давле-
ния на клапане свыше 50 мм рт.ст. при нормальном МОС. Необходимо
учитывать, что с уменьшением МОС при той же площади отверстия гра-
диент давления снижается. Хирургическая коррекция противопоказана при
тяжелой бивентрикулярной сердечной недостаточности.
Вальвулотомия иособенновальвулопластика являютсяпал-
лиативными операциями. Достигаемое клиническое и гемодинамическое
улучшение обычно нестойкое, и в отдаленный период развивается ресте-
ноз, который в течение 10—20 лет требует имплантации искусственного
клапана. Вальвулотомию производят в большинстве случаев по “откры-
той” методике. Она заключается в рассечении сросшихся комиссур кла-
пана под контролем зрения при пережатой аорте в условиях искусствен-
ного кровообращения. Рекомендуется при наличии гемодинамически зна-
чимого стеноза и относительно удовлетворительной функции миокарда,
как при симптоматичном, так и бессимптомном течении заболевания
при отсутствии кальциноза клапана.
У большинства взрослых больных с обызвествленным аортальным сте-
нозом необходимо протезирование аортального клапана. В
связи с тем что у таких больных может сохраняться хорошее самочувствие
неопределенно долго, а также учитывая более высокую хирургическую
летальность и риск поздних осложнений, связанных с протезом, операцию
откладывают до появления клинических проявлений болезни. При бессимп-
томном течении заболевания требуется систематическое клиническое на-
блюдение и обследование с помощью эхокардиографии и других неинва-
зивных методов для своевременного выявления прогрессирования суже-
ния отверстия и усугубления дисфункции левого желудочка. Такая тактика
отличается от принятой у больных с митральным стенозом, когда опера-
цию рекомендуют только при отсутствии эффекта от медикаментозной
терапии. Целесообразность более ранней операции при симптоматичном
течении стеноза устья аорты обусловлена высоким риском внезапной
смерти, быстротой развития необратимого поражения миокарда и лучшими
ближайшими и отдаленными результатами протезирования аортального
клапана, чем митрального. Используют гомо- и гетеропротезы, шаровые
клапаны Старра—Эдвардса, низкопрофильные двухстворчатые клапаны St.
Jude и дисковые. В отличие от искусственных моделей гомо- и гетеропро-
тезы не требуют назначения непрерывной антикоагулянтной терапии после
операции. Хирургическая летальность зависит от выраженности порока и
состояния миокарда и составляет около 6-8 %. Хирургическую коррекцию
242
желательно выполнять до развития выраженной левожелудочковой недо-
статочности, которая значительно повышает летальность (до 15 % и бо-
лее) и ухудшает функциональные результаты в отдаленный период из-за
миокардиальной недостаточности. Тем не менее, в связи с крайне небла-
гоприятным прогнозом при консервативном ведении таких больных часть
из них все же целесообразно оперировать. В случае выявления при корона-
рографии сопутствующей ИБС одновременное протезирование аорталь-
ного клапана и хирургическая реваскуляризация миокарда — аортокоро-
нарное шунтирование — позволяют получить хороший гемодинамический
и клинический эффект.
Чрескожную вальвулопластику производят с помощью зонда
с раздуваемым баллончиком на конце, который вводят в просвет аор-
тального клапана путем пункции бедренной артерии. Она позволяет иногда
значительно уменьшить выраженность симптомов и улучшить переноси-
мость физической нагрузки у больных с критическим (менее 1 см2) сте-
нозом. Баллонная вальвулопластика обеспечивает, однако, относительно
небольшое — около 1 см2 — расширение клапанного отверстия и сопря-
жена с высокой частотой рестеноза — до 40 % к концу первого года. В
связи с этим она показана в качестве паллиативной меры, особенно по-
жилым больным с резким кальцинированным стенозом и высоким рис-
ком радикальной коррекции вследствие тяжелой сердечной недостаточ-
ности или внесердечной патологии, либо больным детского и юношес-
кого возраста с врожденным пороком, чтобы выиграть время перед имп-
лантацией искусственного клапана.
Прогноз. Как показали результаты нескольких неконтролируемых ретро-
спективных исследований (T.Kelly и соавт., 1988; Р.Pellikka и соавт., 1990),
внезапная смерть при бессимптомном течении стеноза устья аорты отме-
чается крайне редко. В связи с этим такие больные, как правило, не под-
лежат хирургическому лечению. После появления симптомов заболева-
ния продолжительность жизни не превышает в среднем 4 лет, причем в
50 % случаев смерть наступает в течение первых 2 лет. Неоперированные
больные умирают в среднем через 3 года после возникновения обморо-
ков и ангинозной боли, через 2 года — после появления одышки и через
4 мес — после первого отека легких. Это является существенным отличи-
ем стеноза устья аорты от митрального стеноза, при котором выживае-
мость после появления жалоб превышает 10 лет.
Отдаленные результаты хирургического лечения по сравнению с проте-
зированием клапанов по поводу всех других пороков сердца наилучшие.
Десятилетняя выживаемость после протезирования аортального клапана
составляет около 60—65 %. Длительные наблюдения свидетельствуют о
надежной работе искусственных клапанов в течение 10—15 лет.
243
НЕДОСТАТОЧНОСТЬ АОРТАЛЬНОГО КЛАПАНА
В основе недостаточности аортального клапана лежит регургитация кро-
ви из аорты в левый желудочек во время его диастолы вследствие нару-
шения смыкания створок аортального клапана.
Эпидемиология. Среди всех приобретенных пороков сердца частота изо-
лированной органической недостаточности аортального клапана состав-
ляет 14 % (В.И.Маколкин, 1986), а среди оперированных больных — 9,4 %
(Н.М.Амосов, Я.А.Бендет, 1983). Значительно чаще — в 55—60 % случаев
— она сочетается со стенозом устья аорты.
Среди больных с недостаточностью аортального клапана более 75 %
составляют мужчины.
Этиология. Основные причины аортальной недостаточности и ее меха-
низмы представлены в табл. 13.
Патологическая анатомия. Аортальная недостаточность может развивать-
ся при остром (20 %) и хроническом (80 %) поражении клапана. Этиоло-
гическими факторами острой аортальной регургитации являются:
1) ин фе кцион ны й эндокардит (самая частая причина). Разви-
ваясь на измененном вследствие ревматизма или врожденного порока, либо,
реже, на интактном клапане, может приводить к острому возникновению
аортальной регургитации в результате изъязвления или перфорации створки;
2) разрыв створки миксоматозно измененного кла-
пана вследствие его неспецифического дегенеративного поражения. Часто
спонтанный;
3) расслоение аорты. При этом надрыв ее интимы распространяется
к створке клапана, вызывая ее повреждение. Основными причинами рас-
слоения являются системная артериальная гипертензия и синдром Марфана;
4) травма. Травматический разрыв створок клапана возникает при
непроникающем ранении сердца и тупой травме грудной клетки при об-
ратном толчке крови в момент их напряжения, например, при ударе в
грудь или падении с высоты.
Хроническая аортальная недостаточность может быть обусловлена по-
ражением либо створок клапана, либо его кольца. К первой группе при-
чин относятся:
1)ревматизм. Примерно у 2/3 больных аортальная недостаточность
имеет ревматическое происхождение. Створки клапана утолщаются, де-
формируются и укорачиваются, их комиссуры срастаются, что нарушает
герметичность смыкания клапана во время диастолы. Часто развивается
обызвествление клапана;
2) ВПС. Аортальная недостаточность может развиваться при врож-
денном двухстворчатом аортальном клапане и иногда сочетается с други-
ми врожденными аномалиями — прежде всего, дефектом межжелудочко-
вой перегородки, тетрадой Фалло, стенозом устья аорты;
3) системные заболевания соединительной ткани. Си-
стемная красная волчанка и другие заболевания этого типа могут приводить
244
Таблица 13. Основные причины недостаточностп аортального клапана
Пораженные структуры Характер поражения Причины
Створки Деформация Ревматизм
клапана Системные заболевания соединительной ткани (системная красная волчанка, ревматоидный артрит) Врожденный порок (двустворчатый аортальный клапан) Идиопатическая миксоматозная дегенерация
Разрушение, Инфекционный эндокардит
перфорация, разрыв Травма
Клапанное Дилатация Сифилис
КОЛЬЦО Атеросклероз аорты
Расслаивающая аневризма аорты
Синдром Марфана
Некроз медии неясной этиологии
Аортит (синдром Такаясу, височный артериит)
Ревматические заболевания (анкилозирующий
спондилоартрит, синдром Рейтера), неспецифический
язвенный колит
к развитию аортальной недостаточности вследствие асептического эндо-
кардита, вызывающего деформацию створок клапана;
4) неспецифическое идиопатическое миксоматозное
дегенеративное поражение.
Вторая группа причин аортальной недостаточности связана с дилата-
цией клапанного кольца вследствие первичного расширения восходящей
части аорты, особенно с образованием аневризмы, при ее воспалитель-
ном или дегенеративном поражении. При этом створки клапана не изме-
няются. Клеточная инфильтрация медии с последующим склерозом ха-
рактерна для с ифилит ич е с ко го мезоаортита, аортитов дру-
гого генеза (болезньТакаясу, височный артериит) и ряда ревматических
воспалительных заболеваний — анкилозирующего спондилоартрита, син-
дрома Рейтера, а также неспецифического язвенного колита. Сифилити-
ческое поражение интимы корня аорты может вызывать сужение устьев
коронарных артерий с развитием ишемии миокарда.
Дегенеративное поражение восходящей части аорты неизвестной эти-
ологии — некроз медии с образованием цист — бывает изолирован-
ным или частью симптомокомплекса синдрома Марфана. К дилатации
восходящей части аорты и ее кольца с прогрессирующей аортальной не-
достаточностью приводят также атеросклероз аорты и ее ретроградное
расслоение. Независимо от степени поражения аортального клапана арте-
риальная гипертензия усугубляет выраженность регургитации, однако сама
по себе, по-видимому, не способна вызвать существенный обратный ток.
Сочетание аортальной недостаточности с гемодинамически значимым
245
стенозом устья аорты почти исключительно имеет либо ревматическое
происхождение, либо обусловлено ВПС.
Механизм нарушений гемодинамики. Из-за нарушения смыкания аор-
тального клапана в период диастолы желудочков под действием градиен-
та давления между аортой, где оно выше, и левым желудочком часть
крови из аорты возвращается обратно в желудочек. Вследствие этого для
обеспечения адекватного эффективного (поступательного) ударного выб-
роса в большой круг кровообращения левый желудочек увеличивает свой
общий УОС на величину обратного тока. Объем регургитации у таких боль-
ных может быть равен эффективному УОС, а при выраженной аорталь-
ной недостаточности общий УОС в 3 или даже 4 раза превышает норму.
Компенсацию нарушения гемодинамики обеспечивают:
1) снижение диастолического давления в аорте, то
есть постнагрузки, что облегчает изгнание крови. Этому способствует реф-
лекторное изменение тонуса артерий — его снижение во время систолы и
повышение в период диастолы — для улучшения перфузии тканей;
2) увеличение КДО левого же л уд оч ка . Приводя к увели-
чению растяжения его мышечных волокон, в соответствии с законом
Франка-Старлинга, она вызывает повышение силы и скорости сокра-
щения. Эта дилатация представляет собой основной механизм компенса-
ции нарушений гемодинамики и, сочетаясь с сохраненной систоличес-
кой функцией, является первичной, адаптационной, или тоногенной, в
отличие от вторичной, миогенной, которая развивается при нарушении
сократимости. Если диастолическая податливость левого желудочка уве-
личивается, что характерно для постепенного прогрессирования аорталь-
ной регургитации, существенного повышения его КДД не происходит;
3) гипертрофия миокарда. Возникает в ответ на повышение
систолического стеночного напряжения, необходимого для развития ди-
латированным желудочком давления, обеспечивающего открытие аор-
тального клапана и изгнание крови в аорту. Как и при любой перегрузке
объемом, например, при митральной недостаточности, увеличение тол-
щины стенки левого желудочка не достигает значительной выраженности;
4) рефлекторное увеличение ЧСС при раздражении бароре-
цепторов аорты и сонного синуса в ответ на снижение диастолического
АД. Оно препятствует усугублению гипотензии, что важно для коронар-
ного кровотока, и способствует поддержанию адекватного МОС;
5) увеличение длительности периода изгнания засчетукоро-
чения изоволюмического сокращения.
Поскольку, как и при митральной недостаточности, в отличие от стено-
за, увеличение МОС при физической нагрузке не сопряжено с суще-
ственным возрастанием бесполезной работы, порок длительное время
остается компенсированным.
При исчерпании возможностей компенсации и ухудшении функции
перерастянутого миокарда поступательный УОС и ФВ снижаются, а КДО
и КДД в левом желудочке повышаются. Определенную роль играет и уве-
246
личение площади интерстициального фиброза в миокарде, которое про-
исходит параллельно с гипертрофией кардиомиоцитов. Это влечет за со-
бой увеличение давления в левом предсердии, легочных венах, капилля-
рах и легочной артерии. Усугублению левожелудочковой недостаточности
способствует и повышение постнагрузки в результате рефлекторной ва-
зоконстрикции в ответ на снижение УОС, которая сменяет рефлектор-
ную вазодилатацию. Это проявляется повышением диастолического дав-
ления в аорте, что маскирует клинические признаки порока, и сопро-
вождается возрастанием объема регургитации на клапане. Легочная ги-
пертензия вскоре приводит к недостаточности правого желудочка, зас-
тою крови в венах большого круга кровообращения и еще большему сни-
жению МОС в покое.
Для выраженной аортальной недостаточности характерно развитие ише-
мии м и о к а р д а. Она обусловлена несколькими причинами: 1)увеличе-
нием потребности миокарда в кислороде вследствие дилатации левого желу-
дочка и повышения систолического стеночного напряжения; 2) снижением
доставки кислорода из-за: а) уменьшения перфузионного давления в коро-
нарных артериях при низком диастолическом давлении в аорте, и (реже)
б) при распространении патологического процесса — воспалительного или
дегенеративного (кальциноза) — на устья коронарных артерий с их сужени-
ем либо сдавлением при расслаивающей аневризме аорты. Определенное зна-
чение имеет также увеличение массы миокарда.
Особенностями нарушений гемодинамики при остро возникшей не-
достаточности аортального клапана, в отличие от хронической, являются:
1) повышение КДД в левом желудочке и малом круге кровообраще-
ния. При остром развитии дилатации левого желудочка из-за неподатли-
вости перикарда давление в его полости повышается, что требует роста
КДД в желудочке для сохранения нормального трансмурального давле-
ния и поддержания его адекватного наполнения. Внезапное повышение
постнагрузки правого желудочка может вызывать его недостаточность. По-
вышению диастолического давления в правых отделах сердца способствует
и препятствие его диастолическому наполнению со стороны перикарда
из-за острого расширения левого желудочка;
2) умеренное снижение диастолического давления в аорте и вслед-
ствие этого стертость многих периферических признаков порока. Обус-
ловлено выраженностью периферической вазоконстрикции в ответ на
уменьшение УОС, а также тем, что диастолическое давление в аорте не
может быть ниже, чем КДД в левом желудочке, которое повышается.
Клиника. Даже выраженный порок длительное время — до 20—40 лет —
может оставаться компенсированным, и у больных при самом активном
образе жизни симптоматика долго отсутствует.
Основными жалобами являются:
1) неприятное ощущение сокращений сердца в виде толч-
ков, сердцебиения или пульсации в голове, особенно в положении на
левом боку или при физической нагрузке. Оно является самым ранним
247
симптомом болезни, который, однако, не зависит от выраженности по-
рока и не принимается во внимание при определении показаний к хи-
рургическому лечению;
2) одышка при физической нагрузке. Является наиболее постоян-
ным, но поздним симптомом и свидетельствует о наступлении деком-
пенсации. Вскоре присоединяются удушье в положении лежа и приступы
острой левожелудочковой недостаточности. Одышка сопровождается рез-
кой слабостью и потливостью вследствие снижения МОС;
3)стенокардитическая боль в области сердца вначале при на-
грузке, а затем и в покое, особенно по ночам. Особенно характерна для
сифилитического порока и пожилых больных с сопутствующей ИБС. Про-
должительность ее постепенно нарастает и она все труднее купируется нитро-
глицерином. Сходная загрудинная боль отмечается при аневризме аорты и
усиливается при ее расслоении.
Реже наблюдаются головокружение и обмороки, особенно при переходе в
вертикальное положение в результате остро возникающей ишемии мозга из-
за резкого перепада давления в сосудах.
Довольно характерным симптомом является повышенная потливость
вследствие увеличения перфузии кожи при низком ОПСС и повышения
активности симпатико-адреналовой системы.
Ухудшение состояния больных с усугублением одышки часто вызыва-
ется лихорадкой, интеркуррентными инфекциями и нарушениями сер-
дечного ритма.
При наличии ревматического анамнеза от начала острой ревматиче-
ской лихорадки (острого ревматизма) до формирования гемодинамичес-
ки значимой недостаточности аортальных клапанов проходит в среднем
7 лет. В течение последующих 10—20 лет при отсутствии жалоб порок по-
степенно усугубляется. В анамнезе могут быть также шум в сердце с дет-
ства, травма грудной клетки или инфекционное заболевание, сопровож-
давшееся длительной и высокой лихорадкой. Изредка заболевание носит
семейный характер, что характерно для синдрома Марфана.
При остром развитии аортальной недостаточности, например, при ин-
фекционном эндокардите левожелудочковая недостаточность появляется
и прогрессирует довольно быстро.
При осмотре выявляют характерные клинические признаки, связан-
ные с резким наполнением и коллапсом аорты и артерий крупного, сред-
него и мелкого калибров:
а) усиленную пульсацию дуги аорты в области яремной вырезки и
брюшной части аорты в надчревной области;
б) выраженную пульса дию сонных артерий на шее (“пляска каротид”),
а также подключичных и подмышечных артерий соответственно в облас-
ти надключичной ямки и латерально и книзу от ключицы;
в) ритмичное покачивание головы с ее отклонением кзади в период
систолы. Этот признак, так называемый признак Мюссе, представляет в
основном исторический интерес;
248
г) пульсацию язычка и миндалин (признак Мюллера);
д) систолическое сужение и диастолическое расширение зрачков (при-
знак Ландольфи);
е) псевдокапиллярный пульс Квинке вследствие патологической пуль-
сации артериол, которые в норме не пульсируют. Он определяется в виде
чередующихся гиперемии и побледнения кожи у основания ногтя при
надавливании на его кончик, а также слизистой оболочки губы при на-
давливании на нее предметным стеклом. Обусловлен увеличением УОС и
периферической вазодилатацией. Конечности теплые и влажные на ощупь.
При осмотре необходимо также обращать внимание на признаки забо-
леваний, которые могут быть причиной аортальной недостаточности:
инфекционного эндокардита, синдрома Марфана, анкилозирующего спон-
дилоартрита, сифилиса и др.
Весьма показательны изменения пульса. Он быстрый, большой
(высокий) и короткий (pulsus celer, altus seu magnus et brevis). Такой пульс,
обусловленный резкими колебаниями давления в аорте, носит название
пульса Корригана. В ряде случаев пульс имеет характер bisferiens. Часто
наблюдается склонность к тахикардии (pulsus frequens). Как и при стенозе
устья аорты, мерцательная аритмия не характерна.
При выраженной левожелудочковой недостаточности или сопутству-
ющем митральном стенозе периферические признаки аортальной регур-
гитации становятся менее заметными.
При значительной аортальной недостаточности очень характерно уве-
личение пульсового АД за счет снижения диастолического (практически
до 0) и в меньшей степени — повышения систолического, которое может
достигать 200 мм рт.ст. и более. При этом систолическое давление на подко-
ленной артерии, которая является прямым продолжением аорты, на 80—
100 мм рт.ст. превышает давление на плечевой (признак Хилла). Необходимо
иметь в виду неточность непрямого измерения диастолического давления
при этом пороке, поэтому его показатели нельзя использовать для оценки
объема регургитации. Так, в действительности оно никогда не может быть
равным 0, как это часто получается при измерении по Короткову. В по-
здних стадиях заболевания значительное повышение КДД в левом желу-
дочке может приводить к некоторому увеличению диастолического АД.
Визуально ипальпаторно определяются колебания всей левой по-
ловины грудной клетки (сердечный толчок). Верхушечный толчок смещен
влево и книзу до шестого-седьмого межреберья. Он расширен по площа-
ди, энергичный, приподнимающий, но относительно непродолжитель-
ный, в отличие от выраженного стеноза устья аорты. В области яремной
вырезки и над сонными артериями в области шеи даже при отсутствии
сопутствующего аортального стеноза иногда определяется систолическое
дрожание вследствие значительного увеличения кровотока через аорту.
Весьма показательны данные аускультации сердца и ФКГ, в
частности:
249
1) протодиастолический шум “декрещендо”. Он имеет дую-
щий характер и начинается сразу же за II тоном с эпицентром обычно в
третьем-четвертом межреберье слева у края грудины. Он хорошо прово-
дится по току крови на верхушку, где изредка определяется его эпицентр.
Продолжительность шума зависит от выраженности порока и податливо-
сти левого желудочка. При небольшой регургитации он короткий и лучше
всего выслушивается в положении больного сидя с наклоном туловища
кпереди при задержке дыхания на выдохе, так как при этом облегчается
патологический ток крови из аорты в левый желудочек. Чем больше кла-
панное отверстие и ниже градиент давления, тем больше объем регурги-
тации и громче шум. Необходимо учитывать, однако, что продолжитель-
ность и громкость шума могут уменьшаться при выраженной регургита-
ции вследствие раннего выравнивания диастолического давления в аорте
и левом желудочке, а также при развитии сердечной недостаточности.
Обнаружение протодиастолического шума имеет важное значение для
диагностики инфекционного эндокардита. При дилатации или аневризме
корня аорты шум лучше слышен справа от грудины;
2) другие сердечные шумы:
а) мезосистолический шум изгнания над аортой с проведением на сон-
ные артерии. Обусловлен ее относительным стенозом при резком увеличе-
нии кровотока через клапан;
б) короткий мезодиастолический или пресистолический шум Флинта
над верхушкой. Образуется при ударе обратного тока крови о стенку же-
лудочка и створки митрального клапана;
в) пансистолический шум относительной митральной недостаточнос-
ти. Возникает при значительной дилатации левого желудочка и проводит-
ся в подмышечную область. Свидетельствует о так называемой митрали-
зации аортального порока;
3) изменения тонов сердца:
а) ослабление II тона (А2) над аортой. Обусловлено нарушением смы-
кания аортального клапана;
б) появление III тона. Тон “раздачи” левого желудочка при одновре-
менном поступлении крови из левого предсердия и аорты. Иногда опре-
деляется и IV тон;
в) непостоянный добавочный систолический тон изгнания крови в аорту
при ее дилатации.
Мелодия аортальной недостаточности становится более отчетливой при
изометрической нагрузке или фармакологических воздействиях, повы-
шающих ОПСС.
При аускультации над бедренной артерией выслу-
шиваются: I) громкий хлопающий систолический тон (“звук пистолет-
ного выстрела”) вследствие резкого растяжения ее стенки при внезапном
повышении внутрисосудистого давления; 2) систоло-диастолический шум
Дюрозье при легком сдавлении артерии стетоскопом. Диастолический
250
компонент обусловлен ретроградным током крови в артерии и характе-
рен для умеренной и выраженной аортальной недостаточности.
Особенностями данных физического обследования при острой недоста-
точности аортального клапана являются отсутствие признаков дилатации
левого желудочка в сочетании с картиной выраженной левожелудочковой
недостаточности с тахикардией, тахипноэ, склонностью к артериальной ги-
потензии, признаками периферической гипоперфузии и застойными хрипа-
ми в легких.
Диагностика. При хронической аортальной недостаточности на ЭКГ
определяются признаки гипертрофии левого желудочка и левого пред-
сердия, в ряде случаев, при диффузном поражении миокарда, — блокада
левой ножки пучка Гиса. Характерны также признаки “перегрузки” лево-
го желудочка в виде депрессии сегмента ST и отрицательного зубца Т в
левых грудных отведениях, I и aVL.
При рентгенографии грудной клетки в случае гемодинамически значи-
мой аортальной недостаточности отмечается увеличение тени сердца и
его аортальная конфигурация за счет дилатации левого желудочка и восхо-
дящей части аорты. Верхушка сердца может смещаться книзу под диафраг-
му. Увеличение левого желудочка кзади и его приближение к позвоночни-
ку заметно также в боковой и левой косой проекциях. Кальциноз аорталь-
ного клапана при изолированной аортальной регургитации встречается
редко. Когда порок обусловлен первичным поражением аорты, ее значи-
тельная дилатация хорошо видна в боковой проекции, где она выполняет
ретростернальное пространство. При остро возникшей регургитации дила-
тация левого желудочка отсутствует, а в легких выражен венозный застой.
На сфигмограмме определяются высокая амплитуда, крутая анакрота и
катакрота пульсовой волны, сглаженность инцизуры и дикротической
волны, вплоть до ее отсутствия. Иногда верхушка волны раздвоена, и ее
форма напоминает клешню рака.
При эхокардиографии заметна дилатация левого желудочка с увеличе-
нием систолической экскурсии его стенок, которая сохраняется до на-
ступления декомпенсации. Специфическим признаком аортальной регур-
гитации является диастолическое дрожание передней створки митраль-
ного клапана, в которую ударяет обратный ток крови из аорты. При зна-
чительной регургитации, особенно острой, характерно преждевремен-
ное закрытие митрального клапана в середине диастолы вследствие зна-
чительного повышения давления в неподатливом левом желудочке, ко-
торое становится равным давлению в аорте. Могут определяться также
дилатация и расслоение корня аорты. При ревматическом генезе порока
заметны фиброз, утолщение и нарушение движения створок аортального
клапана. При инфекционном эндокардите на них видны вегетации.
Допплерэхокардиография позволяет подтвердить наличие регургитации
и оценить ее тяжесть. Восходящая аортография помогает исключить другие
причины быстрого оттока крови из аорты — открытый артериальный проток
и разрыв аневризмы синуса Вальсальвы. Для аортальной недостаточности
251
характерно попадание контрастного вещества из аорты в левый желудо-
чек, по быстроте и выраженности которых судят о величине регургитации.
При этом можно также установить или исключить наличие патологии корня
аорты, а с помощью вентрикулографии - оценить КДО, КСО, ФВ и УОС.
Эти показатели, а также КДД и давление в легочной артерии используют
для оценки функции левого желудочка, что важно для определения пока-
заний к оперативному вмешательству.
Для хронической аортальной недостаточности характерно сочетание зна-
чительного увеличения КДО с неизмененным уровнем КДД, что отража-
ет повышенную диастолическую податливость левого желудочка. ФВ дол-
гое время сохраняется в пределах нормы. Сопоставление общего и эффектив-
ного УОС позволяет количественно оценить величину регургитации. При
тяжелой аортальной недостаточности эта фракция регургитации достигает
50 %, то есть половина УОС возвращается в левый желудочек во время
диастолы. Как и при стенозе устья аорты, многие специалисты практикуют
рутинное выполнение коронарографии во всех случаях ангиокардиогра-
фии, особенно у лиц старших возрастных групп, для определения необ-
ходимости проведения в ходе операции аортокоронарного шунтирования.
При катетеризации сердца определяют также наличие градиента дав-
ления на аортальном и митральном клапанах и наличие и выраженность
легочной гипертензии, которая при хроническом течении порока встре-
чается редко. Характерно увеличение пульсового давления в аорте.
Дифференциальная диагностика. При обнаружении протодиастоличес-
кого шума на основании сердца и вдоль левого края грудины прежде
всего проводят дифференциальную диагностику с шумом Грэма Стилла,
что особенно важно при слабой выраженности периферических призна-
ков аортальной недостаточности. В пользу недостаточности кла-
панов легочной артерии при этом свидетельствуют обнаруже-
ние признаков артериальной легочной гипертензии: акцента Р2, выбуха-
ния ствола легочной артерии при рентгенологическом исследовании,
соответствующих изменений на флебограмме, пульмональной реограмме
и особенностей движения клапана легочной артерии при эхокардиографии.
Наличие при аортальном пороке шума Флинта требует дифференци-
альной диагностики с сопутствующим органическим мит-
ральным стенозом. При выслушивании пансистолического шума
относительной митральной недостаточности необходимо ис-
ключить ее органическое происхождение. Отличительными признаками
такого редко встречающегося сочетанного поражения являются: 1) рез-
кая дилатация левого предсердия, которая не характерна для “чистой”
аортальной недостаточности; 2) сохранение сократительной способнос-
ти дилатированного левого желудочка (при митрализации она всегда сни-
жена, и у больных отмечается выраженная сердечная недостаточность),
3) усиление систолического шума митральной регургитации при умень-
шении выраженности сердечной слабости под влиянием лечения (при
относительной митральной недостаточности он ослабевает).
252
Свойственные недостаточности аортальных клапанов периферические
признаки быстрого оттока крови из аорты характерны также для откры-
того артериального протока и разрыва аневризмы си-
нуса Вальсальвы в правый желудочек. При этих заболеваниях отме-
чаются увеличение пульсового АД и непрерывный шум у левого края гру-
дины и на основании сердца, которые нужно отличать от картины митра-
лизации аортального порока. Помочь установить диагноз позволяют осо-
бенности анамнеза, регистрация непрерывного шума (в отличие от двух
отдельных шумов) при фонокардиографии, выраженность легочной ги-
пертензии и усиление сосудистого рисунка при рентгенологическом ис-
следовании. Эти данные, однако, часто мало информативны, и диффе-
ренциальную диагностику проводят путем инвазивного обследования.
Диагноз аортальной регургитации ставят на основании: 1) выраженной
артериальной пульсации и увеличения пульсового АД; 2) протодиастоличе-
ского шума вдоль левого края грудины особенно в сочетании с резким
ослаблением II тона; 3) признаков гипертрофии левого желудочка на ЭКГ;
4) аортальной формы сердца с дилатацией активно сокращающегося левого
желудочка и восходящей части аорты при рентгенологическом исследовании
и эхокардиографии; 5) дрожания передней створки митрального клапана.
Диагноз подтверждается с помощью допплерэхокардио- и аортографии.
Осложнения. 1. Л евожелудочковая недостаточность . Явля-
ется основным осложнением порока. В отличие от пороков митрального
клапана возникает относительно поздно и внезапно, возможно, вслед-
ствие резкого перехода от периферической вазодилатации к вазоконст-
рикции. Она протекает при сохраненном синусовом ритме и плохо под-
дается лечению в стадии развернутых клинических проявлений.
2. Инфекционный эндокардит. Резко усугубляет аортальную
регургитацию и имеет особенно тяжелое течение.
3. Нарушения атриовентрикулярной проводимости.
Встречаются редко и при воспалительном генезе порока.
Особенности течения острой аортальной недостаточности. Выраженная
острая аортальная регургитация чаще всего обусловлена инфекционным
эндокардитом, расслаивающей аневризмой аорты и травмой. В отличие от
хронического течения заболевания, малоподатливый левый желудочек
существенно не дилатируется, что сопровождается снижением его удар-
ного объема и повышением КДД. Клинически это проявляется значи-
тельным венозным застоем в легких при слабо выраженных перифери-
ческих признаках регургитации. Отмечаются выраженная одышка, вплоть
до отека легких, и артериальная гипотензия. Протодиастолический шум
короткий и тихий, что затрудняет диагностику порока. Ценным эхокар-
диографическим признаком является преждевременное закрытие митраль-
ного клапана на ЭхоКГ.
Лечение. Умеренная аортальная регургитация и бессимптомное тече-
ние заболевания не требуют лечения. Рекомендуют исключить тяжелую
253
физическую нагрузку во избежание усугубления дилатации левого желу-
дочка и проводить профилактику инфекционного эндокардита.
Медикаментозное лечение проводят в основном по поводу застойной
сердечной недостаточности по общим принципам, и в начальных ее ста-
диях оно довольно эффективно. Ограничивают употребление соли, на-
значают мочегонные средства, сердечные гликозиды и периферические
вазодилататоры, среди которых особенно эффективны ингибиторы АПФ,
способствующие уменьшению регургитации. При ангинозной боли при-
меняют нитраты. При сифилитическом аортите показана антибиотикоте-
рапия препаратами пенициллинового ряда.
Основной метод лечения — хирургический. Однако вопрос об оптималь-
ных сроках оперативного вмешательства окончательно не решен вслед-
ствие невозможности достаточно точно оценить прогноз у таких больных.
В большинстве клиник оно считается показанным при появлении клини-
ческих проявлений порока — ангинозной боли и признаков левожелудоч-
ковой недостаточности, в случае бессимптомного течения заболевания —
при наличии выраженной регургитации и прогрессирующей дилатации
левого желудочка, увеличении КСО и уменьшении ФВ, а также значи-
тельном снижении физической работоспособности по данным нагрузоч-
ного тестирования. При острой аортальной недостаточности рекоменду-
ют раннее хирургическое лечение.
При поражении створок аортального клапана производят его протези-
рование механическим или биологическим протезом. В случаях аорталь-
ной недостаточности, обусловленной аневризматическим расширением
корня аорты, производят либо ее пластику с сохранением аутоклапана,
либо иссечение и вшивание сосудистого протеза с одновременным про-
тезированием аортального клапана.
Хирургическая летальность зависит от причины порока и состояния
миокарда. При хронической аортальной недостаточности она составляет
в среднем 2—5 %.
Прогноз при аортальной недостаточности лучше, чем при стенозе ус-
тья аорты, так как объемная перегрузка переносится левым желудочком
лучше, чем перегрузка сопротивлением. При остром течении порока про-
гноз хуже, чем при хроническом.
В случаях бессимптомного течения заболевания прогноз относительно
благоприятный. После появления признаков сердечной недостаточности
он резко ухудшается, и большинство больных умирают в течение 2 лет.
Отдаленные результаты хирургического лечения, как и ближайшие, зави-
сят от функционального состояния миокарда и причины порока. Если
операция произведена поздно, они наихудшие по сравнению с результа-
тами при всех других клапанных пороках. При своевременно выполнен-
ной хирургической коррекции 5-летняя выживаемость составляет около
90 %. Результаты хуже при инфекционном эндокардите в связи с возмож-
ностью смещения протеза и его отрыва из-за воспалительного пораже-
ния ложа клапана. В таких случаях производят повторную операцию.
254
КОМБИНИРОВАННЫЙ АОРТАЛЬНЫЙ ПОРОК
Комбинированный аортальный порок в большинстве случаев имеет рев-
матическое происхождение. Реже он обусловлен врожденной патологией
клапана, его дегенеративным поражением — кальцинозом у пожилых лиц,
а также развитием инфекционного эндокардита на исходно стенозиро-
ванном клапане. С одной стороны, как и при комбинированном митраль-
ном пороке, регургитация обычно не настолько выражена, чтобы вызы-
вать существенную перегрузку левого желудочка объемом. С другой сторо-
ны, вследствие связанного с ней увеличения УОС градиент давления на
клапане возрастает непропорционально больше степени сужения его от-
верстия. При значительной гипертрофии левого желудочка и уменьше-
нии его диастолической податливости повышение УОС достигается за
счет существенного прироста КДД и, следовательно, давления в левом
предсердии, легочных венах и капиллярах. Это обусловливает ряд особен-
ностей клинических проявлений комбинированного аортального порока в
отличие от изолированных: 1) большую выраженность одышки и при-
знаков венозного застоя в легких; 2) относительно меньшую выражен-
ность периферических признаков аортальной регургитации, даже при ее
существенной величине, вплоть до их исчезновения при развитии сер-
дечной недостаточности; 3) характерный признак — pulsus bisferiens.
Данные аускультации сердца, фонокардиографии и других инструмен-
тальных методов исследования в зависимости от характера преобладающе-
го порока приведены в табл. 14. Вопрос о преобладании того или иного
порока, однако, представляет скорее академический интерес, так как
единственно эффективным способом лечения в обоих случаях является
протезирование аортального клапана. Показания к нему аналогичны та-
ковым при “чистом” стенозе устья аорты.
СТЕНОЗ ПРАВОГО АТРИОВЕНТРИКУЛЯРНОГО ОТВЕРСТИЯ
Стеноз правого атриовентрикулярного отверстия является редко встречаю-
щимся пороком и обычно имеет ревматическое происхождение. Изолирован-
ный стеноз практически не встречается и, как правило, сочетается с мит-
ральным (у каждого 10-го больного) или митрально-аортальным стено-
зом. Удельный вес митрально-трехстворчатых и митрально-аортально-трех-
створчатых пороков составляет около 20 % (И.А.Кассирский,
Г.И.Кассирский, 1964). Изредка поражение трехстворчатого клапана свя-
зано с карциноидным синдромом.
Нарушения гемодинамики обусловлены препятствием к наполнению пра-
вого желудочка с образованием диастолического градиента давления, ко-
торый возрастает при увеличении кровотока через клапан на вдохе и умень-
шается при его снижении на выдохе. При клинически выраженном пороке
этот градиент, однако, меньше, чем при митральном стенозе — 4—10 мм
255
Таблица 14. Данные аускультации сердца, фонокардиографии и других
инструментальных методов исследования при комбинированном аортальном пороке
в зависимости от преобладания стеноза или недостаточности
Признак Преобладание
стеноза недостаточности
I тон Ослаблен Чаще не изменен
II тон Ослаблен, представлен Ослаблен только при
одним компонентом или выраженной недостаточности
патологически расщеплен
Систолический шум Очень громкий Громкий шум не исключает
на основании сердца значительную регургитацию
Диастолический шум Короткий и слабый Громкий и продолжительный,
проводится на верхушку
Форма кривой Замедленный подъем с зазубри- Высокая амплитуда, крутой
артериального пульса нами в виде петушиного гребня подъем, анакротическая волна
Дилатация полости Отсутствует или Выражена
левого желудочка' мало выражена
УОС' Не изменен или снижен Повышен
Градиент систолического Значительный Незначительный
давления на аортальном
клапане***
* По данным физического, рентгенологического и эхокардиографического иссле-
дований.
** По данным эхо- или ангиокардиографии.
*“ По данным допплерэхокардиографии или катетеризации сердца.
рт.ст. Повышение давления в правом предсердии приводит к застою крови
в системных венах с развитием периферических отеков, асцита. МОС в
покое снижен и не способен повышаться при физической нагрузке. Это
обусловливает относительно небольшое увеличение давления в левом пред-
сердии и малом круге кровообращения при наличии сопутствующего
митрального стеноза.
В клинической картине преобладают признаки митрального (митрально-
аортального) порока. Присоединение стеноза правого атриовентрикуляр-
ного отверстия можно заподозрить при уменьшении одышки и появле-
нии резко выраженных периферических отеков, асцита, увеличения пе-
чени, сопровождающегося желтухой и развитием фиброза. Отмечается
также резкая общая слабость.
Основным клиническим диагностическим признаком является значи-
тельное набухание шейных вен с их выраженной пресистолической пуль-
сацией (волна “а”) и одновременной пульсацией печени. Спадение вен
(отрицательная волна “у") при этом значительно замедленно. При аус-
культации акцент Р2 отсутствует. Определяется мезодиастолический
шум с пресистолическим усилением при синусовом ритме с эпицентром
в четвертом межреберье слева или над мечевидным отростком. В отличие
256
от шума сопутствующего митрального стеноза этот шум усиливается на
вдохе и ослабевает на выдохе и при пробе Вальсальвы. Иногда здесь же
можно выслушать щелчок открытия.
Диагностировать порок помогает отсутствие у больного с митральным
стенозом, сопровождающимся выраженным венозным застоем в большом
круге кровообращения, признаков гипертрофии правого желудочка на ЭКГ
при наличии P-pulmonale. При рентгенологическом исследовании отмечает-
ся резкое увеличение правого предсердия и верхней полой вены без зна-
чительного выбухания легочной артерии и при относительно мало выра-
женном застое в легких. Подтвердить диагноз позволяет обнаружение утол-
щенного, малоподвижного трехстворчатого клапана и признаков увели-
чения правого предсердия при эхокардиографии и правосторонней
вентрикулографии и особенно - определение градиента давления на нем
путем допплеровского исследования или катетеризации сердца. Сходные кли-
нические проявления имеет миксома правого предсердия, которая хоро-
шо диагностируется с помощью эхокардиографии.
Нераспознанный стеноз правого атриовентрикулярного отверстия после
успешной митральной комиссуротомии, способствующей увеличению кро-
вотока через митральный клапан, может быть причиной усугубления пери-
ферических отеков и появления асцита.
Медикаментозная терапия направлена на уменьшение системного ве-
нозного застоя путем ограничения употребления соли и назначения мо-
чегонных средств, что в целом мало эффективно. Хирургическое лечение
показано при выраженном стенозе с градиентом давления не менее 4 мм
рт.ст. Как и при митральном стенозе, оценивать выраженность градиента
необходимо с учетом МОС, при снижении которого даже в случаях тя-
желого стеноза градиент резко уменьшается. Операция заключается в валь-
вулотомии, чаще “открытой”, либо, в случаях проведенной ранее кор-
рекции митрального порока, баллончиковой вальвулопластики, либо, при
невозможности их выполнения, в протезировании клапана.
НЕДОСТАТОЧНОСТЬ ТРЕХСТВОРЧАТОГО КЛАПАНА
Недостаточность трехстворчатого клапана, как и митрального, может
быть органической или относительной (функциональной). Основными при-
чинами органического порока являются: 1) ревматизм; 2) инфекционный
эндокардит (особенно у наркоманов, делающих себе внутривенные инъек-
ции); 3) аномалия Эбштейна; 4) карциноидный синдром; 5) идио-
патическая миксоматозная дегенерация клапана с пролапсом его створки
во время систолы. При ревматизме недостаточность трехстворчатого кла-
пана часто сочетается с его стенозом, а также с митральным или аорталь-
ным пороком. Комбинированный порок трехстворчатого клапана может
развиваться и при карциноидном синдроме вследствие метастазирования
опухоли кишечника. Характерно фиброзное утолщение створок клапана в
сочетании с общими проявлениями заболеваниями, обусловленными
257
гиперпродукцией опухолевыми клетками серотонина, в виде “приливов”,
телеангиэктазий, бронхоспазма, поноса. В остальных случаях недостаточ-
ность трехстворчатого клапана является изолированной.
Значительно чаще приходится встречаться с относительной недостаточно-
стью трехстворчатого клапана, которая связана с дилатацией полости пра-
вого желудочка вследствие его недостаточности. Она наблюдается при вы-
сокой легочной гипертензии в далеко зашедших стадиях ряда приобре-
тенных и врожденных пороков сердца, при стенозе легочной артерии, а
также коронарогенном и некоронарогенном (миокардит, дилатационная
кардиомиопатия) поражении миокарда правого желудочка. Относитель-
ная недостаточность трехстворчатого клапана часто обратима.
Клинические проявления порока неспецифичны. Его симптомы связа-
ны преимущественно с правожелудочковой недостаточностью, то есть с
застоем крови в системных венах и снижением МОС, что сопровождает-
ся уменьшением одышки и признаков застоя в легких. Основным отли-
чительным клиническим признаком является положительный венный
пульс за счет выраженной систолической волны “c+v”. Отмечаются так-
же гепатоюгулярный рефлюкс, систолическая пульсация увеличенной и
болезненной печени и набухание шейных вен с повышением ЦВД. Выс-
лушиваются пансистолический шум с эпицентром над мечевидным от-
ростком или в четвертом межреберье слева у края грудины и правожелу-
дочковый III тон, которые усиливаются на вдохе (симптом Риверо—Кор-
вальо), в отличие от мелодии митральной недостаточности и дефекта
межжелудочковой перегородки. В то же время у 25—30 % больных шум
отсутствует, возможно, из-за низкого давления в правых отделах сердца.
Часто наблюдается мерцательная аритмия.
Диагностика. При изолированной недостаточности трехстворчатого кла-
пана на ЭКГ регистрируются признаки гипертрофии правого желудочка,
часто в виде блокады правой ножки, и правого предсердия, а на рентге-
нограмме и ЭхоКГ — признаки дилатации этих отделов. Диагноз подтверж-
дается с помощью данных допплерэхокардиографии (обратный ток на кла-
пане), а также правосторонней вентрикулографии и катетеризации сердца.
При этом диагностическое значение имеет повышение давления в пра-
вом предсердии при вентрикулизации его кривой.
Лечение. Изолированная органическая недостаточность трехстворчато-
го клапана при отсутствии легочной гипертензии и тяжелого поражения
миокарда обычно относительно хорошо переносится больными и редко
требует хирургической коррекции. Хирургическое лечение представляет со-
бой пластику (путем аннулоаппликации или другим способом) клапана
или его протезирование, что хуже, так как создает градиент давления.
Относительная недостаточность обычно более или менее уменьшается
при устранении причины перегрузки правого желудочка, например, при
митральной вальвулотомии, или сокращении размеров его полости с
помощью ограничения употребления соли, применения мочегонных
средств и периферических вазодилататоров.
258
ПРИОБРЕТЕННЫЕ ПОРОКИ КЛАПАНОВ ЛЕГОЧНОЙ АРТЕРИИ
Встречаются крайне редко, преимущественно в виде недостаточности кла-
пана, связанной с резкой дилатацией его кольца вследствие высокой ле-
гочной гипертензии, и в отдельных случаях — на почве карциноидного
синдрома. Она проявляется коротким дующим протодиастолическим шу-
мом вдоль левого края грудины, который усиливается на вдохе и сочета-
ется с признаками легочной гипертензии, в отличие от шума аортальной
регургитации (см. выше). Порок, как правило, не имеет существенного
клинического значения и не требует специального лечения.
СЛОЖНЫЕ ПРИОБРЕТЕННЫЕ ПОРОКИ СЕРДЦА
По данным 1200 вскрытий умерших от пороков сердца, многоклапан-
ные поражения составляли 40,9 % случаев, причем наиболее часто — мит-
рально-аортальные (27,2 %), затем митрально-аортально-трехстворчатые
(7,7 %), митрально-трехстворчатые (4,7 %) и, наконец, порок всех 4 кла-
панов (1,3 %) (В.Ионаш, 1963). Вовлечение в патологический процесс 2
или 3 клапанов происходит одновременно или последовательно. Боль-
шинство таких пороков имеет ревматическое происхождение.
Для сложных, то есть многоклапанных, приобретенных пороков серд-
ца, в отличие от изолированных, характерны более выраженные нару-
шения гемодинамики и снижение МОС, что приводит к более ранней
декомпенсации. Диагностика значительно усложняется, так как призна-
ки каждого из пороков оказываются измененными и подчас нивелируют
друг друга. Уточнить их выраженность и решить вопрос о необходимости
и тактике хирургического лечения позволяет лишь инвазивное обследо-
вание. Хирургическая летальность обычно выше.
Наиболее распространенным является митрально-аортальный стеноз,
который в большинстве случаев протекает с преобладанием митрального
стеноза. При этом сужение левого атриовентрикулярного отверстия, со-
здавая препятствие притоку крови в левый желудочек, уменьшает его
нагрузку и тем самым “смягчает” проявления аортального стеноза. В ре-
зультате характерные для стеноза устья аорты патофизиологические из-
менения (гипертрофия и последующая дилатация левого желудочка) и
клинические проявления (ангинозная боль, обмороки) выражены зна-
чительно слабее и развиваются относительно медленно. В поздних стадиях
левожелудочковая недостаточность, протекающая с повышением КДД в
желудочке, значительно отягощает течение порока.
Основные жалобы, данные анамнеза и клинического исследования сход-
ны с таковыми при изолированном митральном стенозе. Выявление призна-
ков аортального стеноза — систолического шума и дрожания — возможно
лишь при тщательной аускультации и пальпации с использованием
специальных приемов (см. выше). Определение ослабления А2 затруднено
259
из-за акцента Р2, а изменения артериального пульса практически отсут-
ствуют. Признаки гипертрофии левого желудочка на ЭКГ и эхокардиогра-
фии слабо выражены.
Диагностика стеноза устья аорты приобретает большое значение при
направлении больных на операцию, так как резкое повышение притока
крови к левому желудочку после изолированной митральной комиссуро-
томии может привести к тяжелой левожелудочковой недостаточности с
некупирующимся отеком легких. По этой причине на операционном столе
вначале устраняют аортальный порок и только затем митральный.
При преобладании стеноза устья аорты течение порока более благо-
приятное. Порок дольше остается компенсированным и при отсутствии
хирургического лечения больные умирают в более старшем возрасте.
С одной стороны, при сочетании митрального стеноза с выраженной
аортальной недостаточностью вызываемое ею повышение КДД в левом желу-
дочке приводит к нарушению опорожнения левого предсердия, что усу-
губляет митральный стеноз. С другой стороны, сужение левого атриовент-
рикулярного отверстия до некоторой степени уменьшает отрицательное
влияние аортальной регургитации на левый желудочек. Это, однако, дости-
гается “ценой” перегрузки слабых левого предсердия и правого желудочка.
При преобладании митрального стеноза единственным признаком аор-
тальной недостаточности является дующий протодиастолический шум вдоль
левого края грудины, который сопровождается ослаблением II тона над
аортой. Этот шум необходимо отличать от шума Грэма Стилла. Перифери-
ческие признаки аортальной регургитации — изменения артериального пуль-
са и давления — могут отсутствовать.
При преобладании аортальной недостаточности на первый план высту-
пают ее проявления - характерные жалобы, периферические признаки и
данные аускультации. При этом диастолический шум органического мит-
рального стеноза следует дифференцировать с шумом Флинта.
Характер оперативной коррекции определяется выраженностью поро-
ков каждого из клапанов с учетом морфологических изменений клапанного
аппарата.
При сложном митрально-аортальном пороке с преобладанием недоста-
точности обоих клапанов неблагоприятное влияние обоих пороков на фун-
кцию левого желудочка суммируется. Это приводит к возрастанию его пе-
регрузки объемом и усугублению выраженности гипертрофии и дилата-
ции. При клиническом обследовании отмечается значительное смещение
разлитого верхушечного толчка влево и книзу, а при рентгено- и эхокар-
диографии — резкое расширение полости левых желудочка и предсердия. В
зависимости от степени аортальной регургитации определяются более или
менее выраженные сосудистые проявления. Мелодию аорто-митральной
недостаточности необходимо отличать от “чистой” аортальной регургита-
ции с митрализацией (см. выше).
При выраженной митральной недостаточности со значительной дилата-
цией сердца проявления умеренного аортального порока могут скрадываться.
260
Для его выявления важное значение имеет тщательная аускультация с
использованием специальных приемов, а также данные эхо- и допплеркардио-
графии.
Оперативное лечение заключается в двухклапанном протезировании.
Показания такие же, как при одноклапанных пороках.
Результаты хирургической коррекции пороков двух клапанов значительно
хуже, чем при одноклапанном протезировании, что связано с большей
выраженностью поражения миокарда из-за более неблагоприятных условий
функционирования. Поэтому при определении показаний и планирования
объема оперативного вмешательства обязательно полное обследование с
определением показателей гемодинамики инвазивными методами.
Отдаленные результаты двухклапанного протезирования в основном та-
кие же, как и одноклапанного. Как показали результаты многолетних на-
блюдений 513 таких больных, при госпитальной летальности 12,5 % у 80 %
выживших больных после операции функциональное состояние соответ-
ствовало I—II классу NYHA, тогда как до нее у 96 % больных отмечался
III—IV класс NYHA. Через 5 лет выжили и сохраняли удовлетворительное
функциональное состояние 72 % больных (A.Galloway и соавт., 1992).
ГЛАВА 8.
АТЕРОСКЛЕРОЗ
Атеросклероз (от греч. athere - кашица и skleros - твердый) представ-
ляет собой одну из форм артериосклероза, то есть утолщения и уплотне-
ния артериальной стенки. Этот термин был предложен F.J.Marchand в
1904 г. для обозначения характерного очагового поражения интимы и медии
артерий крупного и среднего калибра, преимущественно аорты и ее вет-
вей. Другими, неатерогенными, формами артериосклероза являются ло-
кальный кальциноз Менкенберга (при локализации в устье аорты служит
одной из причин его стеноза) и артериолосклероз, который играет важ-
ную роль в патогенезе артериальной гипертензии.
Эпидемиология. Стенозирующий атеросклероз и связанные с ним тром-
боэмболии являются основной причиной заболеваемости и смертности на-
селения экономически развитых стран. Это связано с характером питания,
уменьшением физической активности, а также в определенной мере с гене-
тической предрасположенностью. В некоторых из этих стран, в частности в
США, Финляндии, Бельгии и Австралии, пик этой “эпидемии XX века”
имел место в 60-е годы. Достигнутое в них за последние 20 лет снижение
смертности от связанных с атеросклерозом заболеваний, особенно ИБС,
(более чем на 30 %) доказывает реальность и перспективность модифика-
ции факторов риска в популяционном масштабе в результате осознания их
значения населением. Однако в большинстве стран, в том числе в нашей,
рост заболеваний, связанных с атеросклерозом, продолжается.
261
Рис. 57. Строение фиброзной бляшки.
Ядро содержит пенистые клетки (/)
и кристаллы внеклеточного холесте-
рина (2), а покрышка — гладкомы-
шечные клетки (3) и коллаге-
новые волокна (4)
Патологическая анатомия.
Морфологическим субстратом
атеросклероза являются: 1) жи-
ровое пятно, или полоска;
2) фиброзная бляшка; 3) так называемые осложненные поражения.
Жировые пятна, или липидные полоски, представляют собой началь-
ную стадию атеросклеротического поражения сосуда. Они характеризу-
ются очаговым накоплением в интиме содержащих липиды гладкомы-
шечных клеток и скевенджеров-макрофагов — так называемых пенис-
тых клеток, которые образуются из моноцитов крови. Они имеют вид
желтоватых или белесоватых пятен на поверхности интимы, не вызыва-
ют сужения просвета сосуда и каких-либо симптомов. Первые жировые
пятна появляются в аорте к 10 годам жизни и к 25 годам занимают SO-
SO % ее поверхности. Последующее их распространение, однако, замед-
ляется и в дальнейшем они частично подвергаются полной регрессии,
частично превращаются в фиброзные бляшки.
Фиброзная бляшка (рис. 57) состоит из внутреннего ядра и фиброзной
покрышки. Ядро представляет собой очаг некроза и имеет вид кашице-
образной массы — отсюда и название заболевания. Ядро содержит распо-
лагающиеся внеклеточно кристаллы свободного холестерина и его эфи-
ров, преимущественно гематогенного происхождения, клеточный дет-
рит и кристаллы кальция.
Сверху ядро покрыто фиброзной покрышкой, или “шапочкой”. Она
состоит из нагруженных липидами пролиферирующих гладкомышечных
клеток, которые проникли в интиму через внутреннюю эластическую
мембрану, пенистых клеток и коллагеновых волокон. Именно благодаря
пролиферации гладкомышечных клеток бляшка выступает в просвет со-
суда, вызывая его сужение. Первые бляшки появляются в возрасте стар-
ше 20 лет в брюшной части аорты, затем в коронарных и сонных артери-
ях и позже — в позвоночных, церебральных, почечных, брыжеечных и
магистральных артериях нижних конечностей, преимущественно в обла-
сти устьев бифуркаций и в местах отхождения ветвей. При этом верхние
конечности практически не поражаются. У мужчин бляшки возникают
значительно раньше, чем у женщин.
Осложненные поражения включают: 1) изъязвление покрышки с прили-
панием тромбоцитов, тромбозом либо заживлением язвы с усугублением
сужения артерии; 2) кровоизлияния в результате разрыва истонченной
растрескавшейся покрышки или в основание бляшки; 3) истончение медии
под бляшкой из-за прогрессирующего некроза ее клеток с образованием
262
аневризм. Во внутренней оболочке накапливаются Са2+, которые осво-
бождаются при некрозе гладкомышечных клеток и разрушении тромбо-
цитов. Артериальная стенка между отдельными бляшками обычно интактна.
Клинические проявления атеросклероза возникают в далеко зашед-
шей стадии патологического процесса и связаны со значительным суже-
нием просвета артерии и осложненными атеросклеротическими пораже-
ниями.
Патогенез. В 1912 г. Н.Н.Аничков в Петербурге и С.С.Халатов в Москве
показали, что накопление холестерина в организме кроликов приводит к
образованию атеросклеротических бляшек в аорте и других артериях, куда
холестерин попадает из плазмы крови. Это положило начало знаменитой
холестериновой теории атеросклероза, подтверждением которой могут слу-
жить значительное содержание холестерина в бляшках и раннее развитие
атеросклероза при семейной и некоторых других гиперхолестеринемиях.
Объяснение механизмов прогрессирования атеросклероза дает так на-
зываемая теория реакции на повреждение, основа которой была заложена
Р.Вирховым в XIX в. Она базируется на сходстве изменений сосудистой
стенки, характерных для атеросклероза, с ее реакцией на эксперимен-
тальное повреждение и предусматривает:
1) повреждение эндотелия;
2) освобождение факторов, вызывающих миграцию гладкомышечных
клеток через внутреннюю эластическую мембрану и их пролиферацию в
интиме;
3) синтез мышечными клетками коллагена, эластина и протеогликанов;
4) внутри- и внеклеточное накопление липидов;
5) образование тромба.
Роль повреждения э н д о т е л и я . Эндотелий интимы постоян-
но подвергается воздействию факторов, способных вызывать нарушение
нормального функционирования клеток, их плотного прилегания друг к
другу и к подлежащей соединительной ткани. Основными причинами по-
вреждения эндотелия являются: 1) гиперлипидемия; 2) механические
факторы — повышение стеночного напряжения при артериальной гипер-
тензии, особенно выраженное в местах бифуркации или ветвления арте-
риальных стволов. Именно поэтому атеросклероз редко развивается у лиц
с уровнем холестерина меньше 4 ммоль/л и не поражает вены как сосуды
низкого давления. Повреждение эндотелия может возникать и в участках
спазма артерии вследствие механического воздействия напряжения сдви-
га или сдавления эндотелия из-за сужения сосуда; 3) в эксперименте и
клинике доказанная возможность индуцирования атеросклероза некото-
рыми вирусами, в частности герпеса, цитомегаловирусами и вирусами
Эпштейна—Барр. Активации вирусной инфекции способствуют угнете-
ние иммунологической реактивности при хронических стрессах и куре-
ние; 4) циркулирующие иммунные комплексы; 5) оксид углерода и арте-
риальная гипоксемия при курении; 6) циркулирующие катехоламины при
стрессе путем вазоконстрикции и агрегации тромбоцитов.
В случае повреждения эндотелия происходят его дексвамация с обна-
жением тромбогенного субэндотелиального коллагена и нарушение син-
теза простациклина и проницаемости для макромолекул плазмы крови. В
результате создаются условия для адгезии и агрегации тромбоцитов и
микротромбообразования, а также отложения в сосудистой стенке плаз-
менных липопротеинов и белков.
Роль тромбоцитов. Освобождающиеся из гранул пластинок био-
логически активные вещества включают мощный митогенный фактор —
так называемый фактор роста тромбоцитов, который стимулирует миг-
рацию и пролиферацию гладкомышечных клеток в местах повреждения.
Хемотаксическими свойствами обладает также p-тромбоглобулин плас-
тинок, а тромбоксан А2 усугубляет их агрегацию и местную вазоконст-
рикцию. Протеолитические ферменты тромбоцитов, например, эластаза,
способствуют разрушению базальной мембраны сосуда. Таким образом,
атерогенез тесно связан с активацией тромбоцитов и микротромбообра-
зованием.
Роль гладкомышечных клеток. Пролиферирующие мышеч-
ные клетки являются источником образования волокон и основного ве-
щества соединительной ткани и местом аккумуляции липидов, а также,
как важная составляющая бляшки, вызывают сужение просвета сосуда.
Некоторые авторы высказывают предположение о сходстве атерогенеза с
доброкачественным опухолевым ростом, обусловленным пролифераци-
ей отдельных мышечных клеток в результате мутаций под действием ви-
русов или химических веществ (моноклональная гипотеза атерогенеза).
Роль моноцитов (макрофагов). Моноциты крови, прилипая
к измененному эндотелию и выступая в роли скевенджеров — “мусорщи-
ков”, с помощью соответствующих рецепторов захватывают ацетилиро-
ванные и частично окисленные в результате перекисного окисления Л ПНП
плазмы крови. Превратившись таким образом в так называемые пенистые
клетки, то есть макрофаги, содержащие большое количество эфиров хо-
лестерина, они мигрируют в стенку артерий. Эндотелий, перегруженный
пенистыми клетками, начинает сокращаться, что приводит к наруше-
нию его целостности, обнажению коллагена и прилипанию тромбоцитов.
Кроме того, моноциты выделяют хемотоксический фактор пролифера-
ции мышечных клеток и секретируют эластазу и коллагеназу, участвую-
щие в разрушении внутренней эластической мембраны.
Регрессия атеросклероза. При значительном и стойком сни-
жении содержания атерогенных липопротеинов в крови возможно умень-
шение атеросклеротической бляшки в размерах за счет мобилизации эфи-
ров холестерина пенистых клеток и частично его кристаллов в ядре. Этот
процесс протекает, однако, очень медленно, так как время “круговорота”
холестерина в бляшке составляет примерно 1,5—3 года. Параллельно повы-
шается содержание коллагена в фиброзной покрышке и происходит ее
уплотнение. Поскольку бляшка по крайней мере на 25 % состоит из холе-
стерина, значительное уменьшение его содержания может приводить к
264
Факторы риска атеросклероза
Фактор риска Характеристика фактора риска
Мужской пол Отягощенный семейный анамнез в отношении “ранней” ИБС Инфаркт миокарда или внезапная сердечная смерть в возрасте до 55 лет у родителей, родных братьев или сестер
Г иперлипидемия Курение сигарет Артериальная гипертензия Снижение холестерина ЛПВП Более 10 в день на время обследования < 35 мг/дл, или < 0,9 ммоль/л, более чем в 2 определениях
Сахарный диабет Сосудистые заболевания головного мозга или стенозирующее поражение периферических артерий в анамнезе Выраженное ожирение Избыточная масса тела более 30 %
функционально значимому увеличению просвета артерии при ее резком
стенозе (более 75 %). В то же время стенки сосуда остаются склерозирован-
ными и могут утрачивать способность к дилатации.
Этиология. Клинические и биохимические признаки, которые встреча-
ются значительно чаще среди лиц, у которых развивается атеросклероз,
чем у населения в целом, получили название факторов риска этого
заболевания. Следует подчеркнуть, что статистическая зависимость не обя-
зательно означает причинную связь. Такая связь доказана, например, в от-
ношении повышенного содержания ЛПНП, в то время как точные меха-
низмы подверженности этому заболеванию мужчин неизвестны.
Значение концепции факторов риска для профилактической кардио-
логии трудно переоценить. Их идентификация основывается на много-
численных исследованиях типа опыт - контроль, то есть сравнении час-
тоты тех или иных признаков в больших группах больных ИБС и лиц без
ее явных проявлений, и в проспективных наблюдениях. Такие многолет-
ние наблюдения особенно ценны, так как позволяют определить значи-
мость и независимость отдельных факторов в отношении развития забо-
левания среди лиц, здоровых на начало наблюдения. Эталоном может
служить известное фремингемское исследование, начатое в 1947 г. в США
в небольшом городке Фремингеме и продолжающееся до сих пор. Перво-
начально было обследовано около 5000 человек, у которых впоследствии
определяли частоту ИБС, то есть коронарного атеросклероза, и его фак-
торы риска.
Наличие хотя бы одного фактора риска подразумевает большую вероят-
ность развития клинических проявлений атеросклероза, чем при их отсут-
ствии, причем в более ранние сроки. С увеличением числа факторов риска
эта вероятность возрастает, а сроки укорачиваются.
Наиболее значимыми факторами являются гиперлипидемия, то есть
повышение содержания в плазме или сыворотке крови общего холестерина
265
Схема 6. Роль факторов риска в механизмах атерогенеза: ХС — холестерин; ЛПНП -
липопротеины низкой плотности; ЛПВП - липопротеины высокой плотности
и триглицеридов, артериальная гипертензия и курение. Потенциально об-
ратимы, по крайней мере, частично, курение, артериальная гипертензия,
гиперлипидемия, ожирение и сахарный диабет. Доказано, что коррекция
этих так называемых модифицируемых факторов риска снижает вероят-
ность атеросклероза и ИБС. Большинство факторов риска оказывают свое
неблагоприятное влияние, взаимодействуя друг с другом (схема 6).
Роль нарушений липидного обмена. Распространенность нарушений об-
мена липидов чрезвычайно велика и тесно коррелирует с частотой атеро-
склероза и ИБС. Так, среди мужчин 40-59 лет, жителей экономически
развитых стран Запада, повышение уровня общего холестерина в плазме
крови имеет место в 45-57 % случаев.
Основными липидами плазмы крови являются свободные, то есть не-
этерифицированные, жирные кислоты, триглицериды, фосфолипиды и
эфиры холестерина.
Большая часть жирных кислот образуется в печени из углеводных
предшественников. Лишь линолевая кислота и продукт ее метаболизма —
арахидоновая кислота не синтезируются в организме и являются незаме-
нимыми аминокислотами. Свободные жирные кислоты на самом деле цир-
кулируют в крови в соединении с альбуминами. Они поступают в кровь из
пищи или жировой ткани, где откладываются в виде триглицеридов и
впоследствии мобилизуются с помощью липопротеинлипазы. Скорость
266
обмена свободных жирных кислот очень высока — каждую минуту утили-
зируется 20—40 % их количества в плазме крови. Окисление свободных
жирных кислот является важным источником энергии, в частности в сер-
дце. Ббльшая часть свободных жирных кислот реэтерифицируется в пече-
ни с образованием триглицеридов и фосфолипидов.
Триглицериды представляют собой эфиры жирных кислот и гли-
церина. Экзогенные, “пищевые”, триглицериды ресинтезируются в клет-
ках тонкой кишки из моноглицеридов и поступают через лимфатическую
систему в кровоток в виде хиломикронов. Эндогенные триглицериды син-
тезируются главным образом в печени из свободных жирных кислот, от-
куда они транспортируются кровью в составе ЛПОНП.
Фосфолипиды синтезируются почти во всех тканях, но больше
всего в печени. Как и свободный холестерин, они являются существенны-
ми составляющими клеточных мембран, а в плазме крови играют важную
роль в обеспечении растворимости липопротеиновых частиц.
Холестерин находится в организме в виде как свободного стерина,
так и эфиров одной из жирных кислот. Эфиры холестерина преобладают в
плазме крови и атеросклеротической бляшке. Холестерин частично посту-
пает с пищей в составе хиломикронов и частично синтезируется. Способ-
ностью к синтезу обладает большинство клеток, но главным образом он
осуществляется в печени. Основные метаболиты холестерина — желчные
кислоты, которые образуются исключительно в печени.
Кроме свободных жирных кислот, все липиды, будучи нерастворимы в
воде, находятся в плазме крови в виде комплексов — липопротеи-
нов, которые обеспечивают их транспорт. Липопротеины представляют
собой сферические частицы различного размера, состоящие из свободно-
го и этерифицированного холестерина, триглицеридов, фосфолипидов и
белков, относительные количества которых варьируют. Внутри находится
гидрофобное ядро из плотно “упакованных” молекул триглицеридов и
эфиров холестерина. Снаружи оно покрыто слоем из фосфолипидов, обеспе-
чивающих стабилизацию липопротеиновой частицы в растворенном состоя-
нии, а также небольшого количества свободного холестерина и белков —
аполипопротеинов, или апопротеинов 5 классов — А, В, С, Д и Е. Апо-
протеины выполняют три основные функции: 1) взаимодействуя с фосфо-
липидами, помогают солюбилизировать эфиры холестерина и триглице-
риды; 2) регулируют взаимодействие липидов с ферментами - липопро-
теинлипазой и др.; 3) обеспечивают связывание липопротеинов со специ-
фическими рецепторами клеточной мембраны в местах их усвоения.
С помощью ультрацентрифугирования плазмы крови выделяют 5 основ-
ных классов липопротеинов в зависимости от плотности, которые разли-
чаются также по размерам, относительному содержанию различных липи-
дов, составу апопротеинов и электрофоретической подвижности (табл. 15).
Внутрисосудистый и тканевый метаболизм липидов и липопротеинов
различных классов схематически представлен на схеме 7. Экзогенные
липиды - триглицериды и холестерин (примерно 100 г и 1 г в сутки
267
Таблица 15. Характеристика основных классов липопротеинов плазмы крови
Пдонак 1 хм- лпонп ЛППП лпнп | лпвп
Физические свойства: плотность, г/мл < 0,95 < 1,006 1,006-1,019 1,019-1,063 1,063-1,210
средний диаметр, нм 100-1000 43 27 22 9,5-6,5
электрофоретиче- ская подвижность Не движутся Пре-₽ ₽ ₽ а
Примерный состав, % триглицериды 90 65 28 10 2
холестерин 5 13 38 43 18
фосфолипиды 4 12 20 22 30
белок 1 10 14 25 50
Основные Триглице- Эндогенные Эфиры Эфиры Эфиры
липиды ядра риды пищи триптице- холестерина, холестерина холестерина
Основные AI, АП, В, РИДЫ в, а, сп, тритлицериды в, ап, е в AI, АП
апопротеины а, сп, ап ап, е
Примечание. ХМ — хиломикроны, ЛППП - липопротеины промежуточной плотности.
соответственно) внутри эпителиальных клеток кишечника, где они вса-
сываются, инкорпорируются в крупные липопротеиновые частицы — хи-
ломикроны. Основной функцией хиломикронов является транспорт пи-
щевых триглицеридов, из которых они состоят на 90 %, и холестерина
через лимфу в плазму крови. Попадая в капилляры жировой ткани и мышц,
они взаимодействуют с липопротеинлипазой, которая связана с
гликозаминогликанами на наружной поверхности эндотелия капилляров.
Этот процесс активируется апо-СП хиломикронов. В результате гидролиза
из хиломикронов освобождаются свободные жирные кислоты и моногли-
цериды, которые поступают в адипоциты и мышечные клетки и метабо-
лизируются, а хиломикроны превращаются в так называемые ремнантные
частицы, относительно бедные триглицеридами и богатые эфирами холе-
стерина. РемнантЫ (остатки) захватываются рецепторами печени, распоз-
нающими и связывающими апо-Е, и в результате рецепторопосредован-
ного эндоцитоза поступают внутрь гепатоцита. Таким образом, в результа-
те транспорта хиломикронов пищевые триглицериды доставляются в жи-
ровую ткань, а холестерин — в печень. В физиологическом состоянии хи-
ломикроны присутствуют в плазме крови только после приема пищи, со-
держащей жиры, до 12 ч, но не натощак. В печени холестерин частично
превращается в желчные кислоты, которые выделяются с желчью в тон-
кую кишку, где, выступая в роли детергентов, облегчают всасывание али-
ментарных жиров. В желчь поступает и некоторое количество неметаболи-
зированного холестерина.
268
Схема 7. Транспорт липопротеинов в организме: ХС — холестерин; ХМ - хиломикроны;
ЛПЛ - липопротеинлипаза; Рем. - ремнанты (остатки) хиломикронов; ЛПОНП —
липопротеины очень низкой плотности; ЛППП — липопротеины промежуточной плот-
ности; ЛПНП - липопротеины низкой плотности; ЛПВП — липопротеины высокой
плотности
Эндогенные триглицериды, синтезированные в печени из жир-
ных кислот и глицерина, вместе с небольшими количествами этерифи-
цированного холестерина выделяются в кровь в ядре ЛПОНП. Эти липо-
протеины образуются в печени, содержат те же апопротеины, что и хило-
микроны, и представляют собой короткоживущий (время полужизни —
2—4 ч) промежуточный класс ЛПНП. В капиллярах жировой и мышечной
ткани в них, как и в хиломикронах, под действием липопротеинлипазы
происходит гидролиз триглицеридов с отщеплением жирных кислот, кото-
рые поступают в ткани и используются в них для ресинтеза триглицеридов.
В результате этого богатые триглицеридами ЛПОНП аналогично хиломик-
ронам превращаются в богатые этерифицированным холестерином их рем-
нанты — ЛППП. Последние частично катаболизируются печенью путем
рецептор-опосредованного эвдоцитоза с распознаванием апо-Е и апо-В|00,
частично с помощью печеночной липазы превращаются в Л П Н П в ре-
зультате удаления из них большей части оставшихся триглицеридов с увели-
чением относительного содержания эфиров холестерина. При этом части-
ца утрачивает большую часть апопротеинов. В итоге ядро новообразовав-
шегося ЛПНП состоит преимущественно из эфиров холестерина, а обо-
лочка содержит только апо-В100 и апо-Е. Поскольку в этих липопротеинах
содержится 70 % всего холестерина плазмы крови, их основной функцией
является транспорт холестерина внепеченочным клеткам организма.
269
Таблица 16. Градации содержания общего холестерина и холестерина ЛПНП в плазме крови
Уровень Общий холестерин Холестерин ЛПНП
мг/дл ммоль/л мг/дл ммоль/л
Нормальный < 200 < 5,2 < 130 < 3,4
Погранично высокий 200-239 5,2-6,2 130-159 3,4-4,1
(уровень на грани риска)
Высокий (уровень высокого риска) г 240 >6,2 2 160 >4,1
Катаболизм ЛПНП осуществляется 3 путями: метаболизацией внепе-
ченочными паренхиматозными клетками (основной путь), системой фаго-
цитирующих макрофагов или печенью.
Периферические клетки имеют на своей поверхности рецепторы, “уз-
нающие” апо-В100 и апо-Е. Связавшись с рецептором, ЛПНП поступают
внутрь клетки путем эндоцитоза, после чего рецептор отщепляется. Далее
в лизосомах из ЛПНП освобождается свободный холестерин, который
регулирует скорость собственного синтеза внутри клетки путем ингибиро-
вания фермента р -гидрокси- p-метилглютарил-коэнзим А-редуктазы (ГМГ-
КоА-редуктазы). Этот фермент катализирует превращение ГМГ-КоА в ме-
валоновую кислоту — один из промежуточных продуктов биосинтеза холе-
стерина. Повышение уровня свободного холестерина по механизму обрат-
ной связи приводит к подавлению активности ГМГ-КоА-редуктазы и син-
теза рецепторов ЛПНП. Координированная регуляция экспрессии рецеп-
тора ЛПНП и активности этого фермента обеспечивает гомеостаз обмена
холестерина в клетках. Ингибирование ГМГ-КоА-редуктазы с помощью
фармакологических препаратов, блокируя эндогенный синтез холестери-
на, стимулирует экспрессию рецептора ЛПНП, что приводит к снижению
уровня холестерина ЛПНП в плазме крови.
Часть ЛПНП метаболизируется клетками системы фагоцитирующих мак-
рофагов, главным образом печени — так называемыми клетками-скевенд-
жерами ("мусорщиками”) — благодаря связыванию химически модифи-
цированных ЛПНП, в том числе ацетилированных и окисленных, со специ-
фическими рецепторами. Этот путь предназначен не для обеспечения кле-
ток холестерином, а исключительно для удаления избытка ЛПНП из плазмы
крови. Скевенджеры, захватывая ЛПНП, превращаются в так называемые
пенистые клетки и играют важную роль в атерогенезе. В пользу опосредо-
ванного скевенджер-рецепторами пути образования пенистых клеток сви-
детельствует невозможность обеспечения этого процесса тем относитель-
но небольшим количеством нативных ЛПНП, которые поступают в мак-
рофаги за счет связывания с апо-В и апо-Е рецептором.
Избыток холестерина ЛПНП поступает в печень, взаимодействуя со
специфическими рецепторами, где используется для образования желч-
ных кислот. В патологических условиях, однако, он “запускает” механизмы
формирования атеросклеротической бляшки в артериальной стенке.
Избыток накопившегося в периферических клетках свободного холесте-
рина удаляют ЛПВП путем связывания со специфическими рецепторами
270
клеточной мембраны, которые “узнают” апо-AI. При перегрузке клетки хо-
лестерином экспрессия этого рецептора на мембране увеличивается, однако
его освобождение от холестерина в значительной степени зависит от доступ -
ности ЛПВП. Последние имеют сложное происхождение: липидный компо-
нент включает свободный холестерин и фосфолипиды, освобождающиеся
при липолизе хиломикронов и ЛПОНП, и свободный холестерин, поступа-
ющий из периферических клеток. Основной апопротеин, апо-AI, синтези-
руется и в печени, и в тонкой кишке. В ЛПВП свободный холестерин этери -
фицируется с помощью фермента лецитин-холестерин-ацилтрансферазы.
“Нагруженные” холестерином ЛПВП частично транспортируют его в печень,
где он кагаболизируется с образованием желчных кислот, частично переда-
ют его ЛПОНП посредством так называемого белка, переносящего эфиры
холестерина, в результате чего ЛПОНП превращаются в ЛППП.
Доказана тесная прямая связь развития атеросклероза с содержанием в
плазме или сыворотке крови общего холестерина, холестерина ЛПНП и
его апо-В и менее тесная — уровня триглицеридов и холестерина ЛПВП.
Содержание этих липидов в плазме крови, имеющие клиническое значе-
ние, представлено в табл. 16. Указанные пределы являются в определен-
ной мере условными, так как риск летальных исходов в популяции с уве-
личением уровня холестерина возрастает почти линейно. (Аналогичная си-
туация имеет место при диагностике артериальной гипертензии). Они ба-
зируются на статистическом факте, что при концентрации общего холес-
терина более 240 мг/дл смертность увеличивается почти в 2 раза по срав-
нению с показателями при его уровне 200 мг/дл и при более высоких
значениях холестерина продолжает резко расти. В эту категорию попадает
примерно 25 % взрослого (старше 20 лет) населения США.
При субнормальных величинах общего холестерина (<160 мг/дл) отме-
чено на первый взгляд парадоксальное повышение общей смертности и
даже смертности от ИБС. При детальном анализе материала оказалось,
что такой “J-образный” характер зависимости между уровнем холестери-
на и смертностью не опровергает роли холестерина в развитии атероскле-
роза. Было замечено, что низкое содержание общего холестерина корре-
лирует со смертностью от злокачественных новообразований, хроничес-
кого гепатита, цирроза и геморрагического инсульта, то есть может быть
следствием этих заболеваний. У умерших этой группы значительно чаще
встречались и другие факторы риска ИБС.
Изменения абсолютных и относительных величин общего (то есть суммы
свободного и этерифицированного) холестерина и триглицеридов плазмы
крови позволяют судить об изменениях содержания тех или иных липо-
протеинов и определять типы ГЛП (табл. 17). Тесную связь с возникнове-
нием атеросклероза имеют типы ПА, ПБ и IV и меньшую — III тип. Типи-
рование ГЛП имеет важное значение для выявления атерогенных вариан-
тов нарушений липидного обмена, установления их причины, оценки про-
гноза и проведения дифференцированного лечения.
Для оценки фенотипа ГЛП в большинстве случаев достаточно определить
271
Таблица 17. Классификация гиперлипопротеииемий ВОЗ (1970)
Тип ГЛП Содержание в плазме крови Нарушения обмена липопротеинов
общего холестерина холестерина ЛПНП триглицеридов
I Повышено Понижено или не изменено Повышено Не изменено Избыток хиломикронов
НА Повышено или не изменено Повышено Избыток ЛПНП
ПБ Повышено То же Повышено Избыток ЛПНП и ЛПОНП
III То же Понижено или не изменено То же Избыток ремнан- тов хиломикро- нов и ЛПНП
IV Повышено или не изменено Не изменено Избыток ЛПОНП
V Повышено То же Избыток хило- микронов и ЛПОНП
содержание общего холестерина и триглицеридов плазмы крови, а также
установить расчетным путем концентрацию холестерина ЛПНП по фор-
муле Фридволда:
ХС ЛПНП (мг/дл) = ОХС - ХС ЛПВП - -у , или
ТГ
ХС ЛПНП (ммоль/л) = ОХС - ХС ЛПВП - ~,
где ХС — холестерин, ОХС — общий холестерин, ТГ — триглицериды. Эта
формула базируется на том, что общий холестерин состоит из холестери-
на ЛПНП, ЛПВП и ЛПОНП, а также на двух допущениях:
1) большинство триглицеридов плазмы крови находится в ЛПОНП;
2) весовое соотношение триглицеридов и холестерина в ЛПОНП со-
ставляет 5:1 (молярное — 2,2:1). Она справедлива для всех случаев, когда
уровень триглицеридов не превышает 500 мг/дл (5,5 ммоль/л). При более
высоком содержании триглицеридов уровень холестерина ЛПНП опреде-
ляют с помощью ультрацентрифугирования в специализированных лабо-
раториях. Холестерин ЛПВП определяют после осаждения ЛПОНП и ЛПНП
в надосадочной жидкости, содержащей этот класс липопротеинов.
Изредка для типирования липопротеинов необходимо прибегать к более
сложным исследованиям. Так, в частности, в случае увеличения содержания
холестерина и триглицеридов при подозрении на III тип ГЛП, то есть при
повышении содержания ремнантов, необходимо проводить электрофорез
плазмы крови, при котором они обнаруживаются в виде широкой р -полосы.
Классификация ВОЗ не учитывает двух важных аспектов фенотипиро-
вания ГЛП: 1) содержание холестерина ЛПВП, оказывающих защитное
действие в отношении развития атеросклероза; 2) уровень апо-В ЛПНП,
который может повышаться при неизмененном содержании холестерина
272
Таблица IS. Характеристика наиболее часто встречающихся первичных атерогенных ГЛП
Заболевание Характер наследования Причина ГЛП Содержа- ние обще- го холесте- рина в плазме крови Содержание триглицеридов в плазме крови Повышенное содержание различных липопротеи- нов в плазме крови Фенотип ГЛП Ранний атеро- склероз и ИБС Клинические признаки
Обычная (поли- генная) гипер- холестеринемия Полигонный Неясна т N или немного Т ЛПНП ПА, редко ПВ + Липидная дуга на роговице, ксангелазмы
Семейная ком- бинированная гиперлипидемия Поли-или моногенный Неясна Т или N Т или N ЛПНП и ЛПОНП ПА, ПВ или IV ++ То же
Семейная гипер- холестеринемия Моногенный Дефицит клеточ- ных рецепторов к ЛПНП ТТТ N или f ЛПНП ПА, редко ПВ Ксантомы сухожи- лий, стеноз устья аорты, липидная дуга на роговице, ксангелазмы
Семейная дис- бета-липо- прогеинемия Моноген- ный, а также факторы среды Патологический апо-Е TH НТ ЛППП III +++ Бугристые ксанто- мы, ксантомы на ладонях. Признаки ожирения, сахар- ного диабета
Семейная гипер- триглицеридемия Моногенный Неясна N или Т ТТ ЛПОНП, изредка так- же хиломик- ронов IV, редко V ± Ксантомы, сопро- вождающиеся сы- пью, липемия сосу- дов сетчатки, гепа- тоспленомегалия. Часто ожирение
Примечание: t - увеличение, 4- - уменьшение показателя; N - норма.
Таблица 19. Характеристика наиболее часто встречающихся типов вторичной ГЛП
Заболевание Механизм ГЛП Основное нарушение обмена липидов | липопротеинов Тип ГЛП
I Эндокринные и метаболические заболевания
Сахарный диабет • Дефицит или резистентность к инсулиту -»Т липолиза —4 СЖК —»Т синтеза ТГ и ТТГ ТЛПОНПи изредка также ХМ; IV, редко V
Гипотиреоз образования ЛПОНП ' i ЛПЛ ~*Т катаболизма ЛПОНП и ХМ Ь рецепторопосредованного катаболизма ТОХС ХЛПВП Г ЛПНП ПА, реже ПВ
Синдром Яценко-Кушинга ЛПНП Инсулинорезистеигность с Т образования Т ОХС и ТГ Т ЛПОНП и ЛПНП или III ПА, ИВ или IV
(в том числе ятрогенный) Подагра ЛПОНП и их превращения в ЛПНП Инсулинорезистеигность ТТГ Т ЛПОНП IV
II. Заболевания почек
Нефротический синдром
Хроническая почечная
недостаточность
J- альбуминов -»Т поступления СЖК в
печень —»Т синтеза ТГ, образования
ЛПОНП и ЛПНП и J- их метаболизма
Ингибирование ЛПЛ в уремической
плазме =-4 катаболизма ЛПОНП
Т ОХС и ТГ Т ЛПОНП и ЛПНП ПА или ПВ
ТТГ т ЛПОНП IV
III. Другие заболевания
Синдром холестаза
Эмоциональный стресс
Поступление холестерина и фосфолипидов Т ОХС
желчи в кровь
Т образования и X катаболизма ЛПОНП Т ТГ
ТЛПНПиТЛПВП
ТЛПОНП
IV. Влияние токсических и лекарственных веществ
Алкоголь Торможение окисления и синтеза СЖК в печени -»Т синтеза ТГ, образования ЛПОНП при наличии генетической пред- расположенности к гипертриглицеридемии; Т ЛПОНП -• относительный дефицит ЛПЛ-4 ХМ ТТГ Т ЛПОНП, изредка ТХМ; тлпвп IV, изредка V
Экзогенные эстрогены (пероральные контрацептивы) Т синтеза ТГ и образования ЛПОНП в печени при наличии генетической пред- расположенности к гипертриглицеридемии: ХЛПЛ инсулинорезистенгность ТТГ То же То же
Тиазидовые диуретики 1 толерантности к глюкозе Т ТГ и ОХС Т ЛПОНП и ЛПНП, ТЛПВП ПА, ПВ или IV
/3-Адреноблокаторы Ингибирование аденилатциклазы адипо- цитов —Ц, активности ЛПЛ, особенно при генетической предрасположенности к гипертриглицеридемии ттг Т ЛПОНП, изредка и ХМ; ТЛПВП IV
Примечание. ТГ - триглицериды; СЖ - свободные жирные кислоты; ЛПЛ - липопротеинлипаза; ХМ - хиломикроны; ОХС- общий
холестерин; Т ~ увеличение, J- ~ уменьшение показателя.
ЛПНП вследствие образования более мелких частиц, обедненных эфира-
ми холестерина, но потенциально атерогенных.
Независимое от гиперхолестеринемии влияние гипертриглицеридемии на
возникновение атеросклероза окончательно не установлено. Оно может быть
связано с повышенным содержанием атерогенных ремнантов или сопут-
ствующей гиперкоагуляцией крови.
Необходимо иметь в виду возможность изменения у больного типа ГЛП
под влиянием изменения образа жизни и лекарственных препаратов.
В зависимости от причин различают первичную и вторичную ГЛП. Пер-
вичная ГЛП обусловлена, как правило, генетическими нарушениями об-
мена липидов в результате: 1) мутации одного гена; 2) полигенной пато-
логии со сложным взаимодействием генетических факторов и факторов
среды, в первую очередь диетологических. Так, в различных популяциях
всех регионов мира доказана тесная корреляция между уровнем холесте-
рина в плазме или сыворотке крови и распространенностью ИБС, с од-
ной стороны, и характером питания, в частности, потреблением жиров,
насыщенных жирных кислот и холестерина — с другой. При этом люди,
мигрировавшие в страну с более высоким средним уровнем холестерина
у коренного населения, постепенно меняют характер питания и приоб-
ретают уровень холестерина и частоту ИБС, характерные для населения
нового места жительства. С определенными диетологическими факторами
связаны, по-видимому, и спорадические случаи первичной ГЛП.
Вторичная ГЛП возникает при нарушениях липидного обмена, которые
являются следствием нарушения метаболизма других веществ. Основные
типы первичной и вторичной атерогенной ГЛП и их краткая характерис-
тика приведены в порядке распространенности в табл. 18 и 19.
При клиническом обследовании больных с ГЛП диагностическое зна-
чение имеют:
1) наличие сахарного диабета, гипотиреоза, подагры, заболеваний по-
чек и других возможных причин вторичной ГЛП;
2) отягощенный семейный анамнез в отношении “ранней” ИБС;
3) характер питания — повышенное потребление жиров, сахара, про-
дуктов с высоким содержанием холестерина;
4) низкий уровень физической активности;
5) прием некоторых лекарственных препаратов, способных вызывать
нарушения липидного обмена (см. табл. 19);
6) характерные изменения кожи: липидная дуга роговицы, ксантелазмы
век, обусловленные накоплением в их тканях холестерина, и различные
варианты ксантом. На ладонях можно увидеть ксантомы складок в виде их
желтого окрашивания, а в области ягодиц, коленей и локтей — ксантомы
в виде сыпи. Эта разновидность ксантом представляет собой небольшие
желтоватые папулы на эритематозном основании и связана с отложением
экзогенных триглицеридов в гистиоцитах кожи. Весьма характерны ксан-
томы сухожилий с излюбленной локализацией в области сухожилий разги-
бателей кисти, пяточного сухожилия, бугристости большеберцовой кости
и локтей. Они обусловлены накоплением эфиров холестерина ЛПНП в
макрофагах интерстициальной ткани.
Аккумуляция триглицеридов в клетках системы фагоцитирующих макро-
фагов может вызывать небольшое увеличение печени и селезенки.
При офтальмоскопии белые сосуды сетчатки на бледном фоне образуют
характерную картину lipemia retinalis.
Диагноз ГЛП устанавливают на основании характерных изменений по-
казателей липидного обмена в плазме или сыворотке крови. Поскольку
уровни липидов крови подвержены значительным колебаниям в разные
дни, при выявлении повышенного уровня общего холестерина в первом
анализе для уточнения диагноза необходимо подтверждение результатами
второго исследования. Его проводят через 1—3 нед натощак, не менее чем
через 12 ч после последнего приема пищи. Оно включает определение со-
держания общего холестерина, триглицеридов, холестерина ЛПНП и ЛПВП.
Молочный вид сыворотки или плазмы крови, взятой более чем через 12 ч
голодания, свидетельствует о хиломикронемии (I или V тип ГЛП).
В некоторых случаях, когда этих показателей недостаточно для типиро-
вания ГЛП, в специализированных лабораториях липидных центров про-
водят дополнительные исследования — ультрацентрифугирование плазмы
или сыворотки крови, электрофорез липопротеинов, анализ апопротеи-
нов, исследования ферментов, участвующих в обмене липидов, и рецеп-
торов. Поскольку уровень липидов в плазме крови примерно на 4 % ниже,
чем в сыворотке, для получения сопоставимых результатов необходимо
постоянно использовать один и тот же объект исследования.
Кроме характеристики тяжести и природы ГЛП следует установить ее
причину. Для выявления вторичной ГЛП проводят биохимическое обсле-
дование с определением содержания глюкозы в крови, функции почек,
печени и по показаниям — щитовидной железы. Для установления харак-
тера первичной ГЛП часто необходимо определить наличие и тип ГЛП у
кровных родственников больного.
Распространенность ГЛП и ее клиническое значение обусловливают
актуальность широкомасштабного обследования населения для ее выявле-
ния. Для обследования целесообразно использовать обращение за меди-
цинской помощью по любому поводу, аналогично способу выявления ар-
териальной гипертензии. Целенаправленному выборочному обследованию
подлежат лица с высокой вероятностью нарушений липидного обмена и
наличием других факторов риска атеросклероза и ИБС. Можно ожидать,
что это приведет к выявлению большинства лип с ГЛП, хотя ни одно из
перечисленных показаний для обследования не является специфичным.
Обследованию для выявления ГЛП подлежат следующие категории лиц
при наличии у них: 1) прямых родственников, страдающих ГЛП; 2) ксан-
телазм или ксантом; 3) липидной дуги роговицы (в возрасте до 60 лет);
4) прямых родственников в возрасте до 60 лет, страдающих ИБС; 5) арте-
риальной гипертензии; 6) сахарного диабета; 7) хронических заболева-
ний почек; 8) ИБС, заболеваний периферических и мозговых сосудов, в
277
том числе после аортокоронарного шунтирования и транслюминальной
ангиопластики.
Самой частой причиной повышенного уровня холестерина является
обычная, “полигенная”, гиперхолестеринемия. Она яв-
ляется результатом взаимосвязанных нарушений многих генов, включая
кодирующие апо-Е и апо-В, а также диетологических и других внешних
факторов, и не имеет единой метаболической основы. Ее различная распро-
страненность служит основной причиной вариабельности частоты ГЛП и
ИБС в разных странах. Какие-либо клинические и биохимические особен-
ности заболевания отсутствуют. Ксантомы не характерны. Диагноз уста-
навливают путем исключения других причин легкой или умеренной гипер-
холестеринемии.
Семейная гиперхолестеринемия проявляется значительным
повышением уровня ЛПНП в результате уменьшения синтеза их клеточ-
ных рецепторов или образования функционально дефектных рецепторов,
не способных связывать или обеспечивать эндоцитоз ЛПНП. Заболевание
наследуется по аутосомно-доминантному типу. Различают гомозиготную,
более тяжелую, и гетерозиготную, менее тяжелую, формы заболевания.
Гетерозиготная семейная гиперхолестеринемия, при которой у боль-
ного имеется один нормальный и один патологический ген рецептора
ЛПНП, является одним из наиболее распространенных генетических за-
болеваний и встречается примерно у 1 на 500 человек. У больных, как
правило, отмечаются ксантомы сухожилий и преждевременное, на 4-м и
даже 3-м десятилетии жизни, развитие ИБС. Она имеет место у 5 % пере-
несших инфаркт миокарда в возрасте до 60 лет. Такие же “ранние” инфар-
кты миокарда характерны для родственников больного. Часто встречается
атероматозное поражение корня аорты с его стенозом. Ожирение и сахар-
ный диабет не характерны.
Гомозиготная форма заболевания встречается реже — у 1 человека на
1 млн населения. При отсутствии лечения характерно развитие сухожиль-
ных ксантом, ИБС, в том числе инфаркта миокарда, и стеноза устья аор-
ты в детском и юношеском возрасте и более высокий, чем при гетерози-
готной форме, уровень холестерина — 15—25 ммоль/л. Сходные изменения
обнаруживаются у родителей.
Диагноз ставят на основании: 1) значительно повышенных уровней
общего холестерина и особенно холестерина ЛПНП, как правило, более
7,8 и 4,9 ммоль/л, что свойственно типу ГЛП ПА, изредка ИВ; 2) четкого
семейного наследования аналогичного типа ГЛП с высокими уровнями
холестерина у значительной части родственников, особенно детского воз-
раста. Эти признаки, а также наличие ксантом сухожилий, отличают се-
мейную гиперхолестеринемию от других причин, вызывающих ПА тип
ГЛП — полигонной гиперхолестеринемии, семейной комбинированной
гиперлипидемии и др.
Семейная комбинированная гиперлипидемия являет-
ся другой относительно частой причиной повышения уровня холестерина
278
ЛПНП и встречается примерно у 0,5 % населения, в том числе у 15 %
перенесших инфаркт миокарда в возрасте до 60 лет. Обусловлена генети-
ческим нарушением обмена липидов, которое проявляется в каждом по-
колении и, возможно, имеет полигонный характер. Точный метаболиче-
ский дефект неизвестен. Характерна ранняя ИБС у больных и их родствен-
ников вследствие увеличения содержания ЛПНП и (или) ЛПОНП при
более выраженном повышении уровня апо-В — структурного белка липоп-
ротеинов обоих этих классов, вследствие чего липопротеиновые частицы
имеют относительно небольшие размеры. Проявляется умеренной гипер-
холестеринемией или гипертриглицеридемией либо их сочетанием. Такая
вариабельность фенотипа ГЛП — ПА, ПВ или IV — обусловлена, вероятно,
различной скоростью выведения из кровотока липопротеинов различных
классов, образование которых в печени значительно повышено.
Дифференциально-диагностическим признаком, в отличие от других
первичных ГЛП со сходным фенотипом, является разнообразие типов ГЛП
у родственников. При типе ПВ и отсутствии ксантом сухожилий диагноз
семейной комбинированной ГЛП можно с достаточной надежностью ста-
вить и без обследования членов семьи.
Семейная дисбеталипопротеинемия, или III тип ГЛП, яв-
ляется генетическим заболеванием, характеризующимся накоплением в
крови ЛППП и ремнантов хиломикронов, катаболизм которых нарушен
из-за наличия патологического апо-Е. Это приводит к: 1) нарушению свя-
зывания этих липопротеинов печенью; 2) уменьшению связывания ЛППП
с рецепторами ЛПНП. Хотя заболевание наследуется моногенным путем,
для его клинического проявления, что имеет место у 2 % лиц с дефектной
изоформой апо-Е, обязательны дополнительные факторы среды или ге-
нетические факторы, вызывающие вторичные нарушения липидного об-
мена — ожирение, сахарный диабет, семейная комбинированная гипер-
липидемия и др. В результате накапливаются два вида ремнантов с высо-
ким содержанием одновременно триглицеридов и эфиров холестерина.
Патогномоничным клиническим признаком, в отличие от других типов
ГЛП, является наличие двух видов ксантом: ладонных полосок и бугристых
ксантом размерами от горошины до лимона с излюбленной локализацией в
области локтей и коленей. Несмотря на то что содержание холестерина ЛПНП
понижено из-за замедленного превращения ЛППП в ЛПНП, характерен
тяжелый и ранний атеросклероз с поражением, кроме коронарных артерий,
церебральных и периферических. Это обусловлено атерогенностью ЛППП,
которые интенсивно захватываются макрофагами. Часто отмечаются также
клинические проявления ожирения, сахарного диабета, гипотиреоза.
Диагноз устанавливают на основании: 1) характерных ксантом; 2) зна-
чительного и примерно одинаково выраженного повышения уровня три-
глицеридов и общего холестерина. Она подтверждается при установлении
III типа ГЛП, в частности, по наличию большого количества ремнант-
ных частиц, образующих при электрофорезе липопротеинов широкую р-
полосу между р- и пре-р-липопротеинами (то есть ЛПНП и ЛПОНП).
279
Вторичная ГЛП отмечается при некоторых эндокринных заболе-
ваниях — сахарном диабете, гипотиреозе, синдроме Иценко—Кушинга, а
также подагре, болезнях почек (нефротический синдром, уремия), пече-
ни (синдром холестаза), эмоциональных стрессах и злоупотреблении ал-
коголем (см. табл. 19). ГЛП может иметь также ятрогенное происхождение и
вызываться приемом пероральных контрацептивов, тиазидовых диурети-
ков, р-адреноблокаторов (преимущественно лишенных внутренней сим-
патомиметической активности) и глюкокортикостероидов, что важно учи-
тывать при проведении фармакотерапии. При вторичной ГЛП риск воз-
никновения атеросклероза обычно меньше, чем при первичной, в связи с
меньшей выраженностью ГЛП и ее продолжительностью. В большинстве
случаев эффективное лечение основного заболевания или отмена соответ-
ствующего лекарственного препарата приводят к коррекции ГЛП.
Снижение уровня холестерина ЛПВП. Механизм незави-
симого от других липидных факторов риска и возраста защитного эффекта
высоких концентраций холестерина ЛПВП и его основного белка апо-А1
при развитии атеросклероза не вполне ясен. Возможно, ЛПВП уменьша-
ют накопление холестерина в сосудистой стенке либо предотвращают об-
разование тромбов на поверхности бляшек. Следует подчеркнуть, что атеро-
склероз может развиваться при невысоком уровне холестерина ЛПНП,
если при этом отмечается низкое содержание холестерина ЛПВП.
Артериальная гипертензия повышает риск возникновения атероскле-
роза, главным образом коронарного и церебрального, более чем в 2 раза
при любом уровне холестерина в крови и независимо от возраста. Курение
оказывает несколько меньшее действие. Его влияние, возможно, отчасти
связано с сопутствующим повышением уровня фибриногена и снижени-
ем содержания холестерина ЛПВП в крови. Этот эффект пропорциона-
лен количеству выкуриваемых сигарет и уменьшается с возрастом. Важно
отметить, что прекращение курения уже через 1 год приводит к сниже-
нию риска ИБС до его уровня у некурящих.
Следует подчеркнуть, что при сочетании курения с гиперхолестери-
немией и артериальной гипертензией риск возникновения коронарного
атеросклероза повышается в 9 раз, что значительно превосходит простое
аддитивное действие этих трех факторов риска.
Ожирение, кроме резко выраженного, не является самостоятельным
фактором риска, будучи тесно связанным с ГЛП, сахарным диабетом и
артериальной гипертензией.
Генетическая предрасположенность. Ее роль как важного фактора риска
обусловлена высокой степенью наследуемости уровня общего холесте-
рина, холестерина ЛПНП, различных апопротеинов и клеточных рецеп-
торов к липопротеиновым частицам. Благодаря этому, а также сходному
влиянию среды, особенно характера питания и физической активности,
в семьях и даже в популяциях целых стран формируются сходные наборы
факторов риска и сходная подверженность атеросклерозу и его клини-
ческим проявлениям.
280
Клиника и диагностика. Клинические признаки атеросклероза связаны с кри-
тическим уменьшением кровотока в пораженном сосуде. Наиболее надеж-
ным признаком атеросклероза в клинике и при эпидемиологических иссле-
дованиях является наличие ИБС, включая аритмии. Менее точным крите-
рием служит перенесенный инсульт, поскольку его геморрагический вариант
часто связан с артериальной гипертензией, сахарным диабетом и врожден-
ными аневризмами мозговых сосудов. Реже и обычно позже диагностиру-
ются поражение артерий нижних конечностей, почек и расслаивающая анев-
ризма аорты. Поэтому о распространенности атеросклероза в популяции и
связанной с ним летальности судят преимущественно по наличию ИБС.
Вторая группа признаков включает клинические проявления ГЛП как
частой причины атеросклероза (см. выше).
Среди специальных инструментальных исследований методом выбора,
особенно при бессимптомном течении атеросклероза, является ангиография,
которая позволяет выявить деформацию и уменьшение просвета сосуда. Со-
временные установки обладают высокой разрешающей способностью и обес-
печивают визуализацию артерий диаметром до 0,5 мм. Сужение относитель-
но крупного и доступного для исследования сосуда (например, общей сон-
ной артерии) можно определить также неинвазивным путем по изменению
скорости и величины кровотока с помощью допплерэхокардиографии.
Рентгенологические признаки кальциноза артерий более характерны
для склероза медии, чем для атеросклероза. Изменения артериол сетчатки
при исследовании глазного дна также плохо коррелируют с атероскле-
ротическим поражением крупных и средних артерий. Недостаточно точны
и нагрузочные тесты, базирующиеся на оценке патофизиологических или
метаболических изменений в тканях, связанных с нарушением их перфу-
зии, например, сцинтиграфия миокарда или нагрузочная электрокардио-
графия.
Лабораторных методов диагностики собственно атеросклероза пока не
существует. Важное значение, однако, имеет лабораторное обследование
для выявления наличия и выраженности липидных факторов риска ате-
росклероза, диагностики атерогенной ГЛП и установления ее причины
(см. выше). Ввиду значимости нарушений липидного обмена в возникно-
вении и прогрессировании атеросклероза и его длительного бессимптом-
ного течения, такое обследование желательно проводить у всего населе-
ния в возрасте старше 20 лет. При обнаружении патологических измене-
ний лабораторных показателей, требующих коррекции, в дальнейшем
проводят их контроль в динамике гиполипидемического лечения дли оценки
его эффективности.
В целом, несмотря на появление в последние годы все более тонких
методов исследования, атеросклероз диагностируют, как правило, поздно
— при развитии его клинических осложнений.
Лечение атеросклероза включает: 1) устранение модифицируемых фак-
торов риска, в первую очередь атерогенных ГЛП; 2) лечение поздних кли-
нических проявлений и осложнений атеросклероза, в частности ИБС.
281
Схема 8 Тактика ведения больных в зависимости от уровня общего холестерина в плазме
крови: ОХС - общий холестерин, + - включая мужской пол
Лечение атерогенных ГЛП. Лечение атеросклероза путем коррекции ГЛП
основывается на том, что снижение содержания холестерина в крови до
субнормального уровня способно вызывать его выход из бляшки в кро-
воток и уменьшать стенозирование артерий. Этот эффект наиболее выра-
жен у лиц более молодого возраста с повышенным содержанием холесте-
рина в крови при отсутствии или слабой выраженности других факторов
риска. В то же время у лиц старше 55 лет при наличии зрелых и тем более
осложненных бляшек неблагоприятное воздействие повышенного уров-
ня холестерина на смертность уступает другим факторам риска, особен-
но артериальной гипертензии и сахарному диабету, а его снижение дает
меньший эффект.
В настоящее время лечение ГЛП проводят в соответствии с рекоменда-
циями Европейского общества кардиологов совместно с Обществом по
борьбе с атеросклерозом (1994) и Национальной образовательной про-
граммы по холестерину США (1993) с учетом степени риска заболеваний
сердечно-сосудистой системы, связанных с атеросклерозом. Приведенные
на с. 265 факторы риска влияют на выраженность ГЛП и друг на друга,
повышая опасность возникновения этих заболеваний. При наличии одно-
го и более факторов риска, а также признаков ИБС и перенесенных опе-
раций на сосудах - аортокоронарного шунтирования, ТЛАП-ГЛП требу-
ет более настойчивого лечения, то есть показаны ускоренный переход на
более жесткую диету и использование медикаментозных препаратов.
Цель лечения - свести к минимуму риск заболевания сердечно-
сосудистой системы, связанных с атеросклерозом. Лечение предусматривает:
281
Схема 9. Тактика ведения больных в зависимости от уровня холестерина липопротеинов
низкой плотности (ХС ЛПНП)
1) выявление и коррекцию сопутствующих модифицируемых факто-
ров риска (артериальная гипертензия, курение, сахарный диабет, избы-
точная масса тела и сниженный холестерин ЛПВП);
2) определение и коррекцию причин вторичной ГЛП;
3) определение желательного уровня холестерина ЛПНП плазмы кро-
ви, к которому следует стремиться;
4) объяснение больному цели лечения и риска, связанного с нелече-
ной ГЛП;
5) составление гиполипвдемической диеты и контроль за ее соблюдением;
6) при неэффективности диетотерапии - присоединение медикамен-
тозной терапии. При этом учитывают риск ИБС, возраст больного, со-
стояние его сердечно-сосудистой системы и тип ГЛП, с одной стороны,
и побочные действия фармакологических препаратов, которые необхо-
димо принимать длительно, практически пожизненно, — с другой.
Стратификация больных. В соответствии со стратификацией
больных в зависимости от уровня общего холестерина в плазме крови (см.
табл. 16) рекомендуют следующую тактику (схема 8). При наличии показа-
ний к определению триглицеридов и холестерина ЛПНП это исследование
283
повторяют 2—3 раза после голодания в течение не менее 12 ч с интерва-
лом 1-8 нед. Для принятия решения учитывают средние величины пока-
зателей. Тактика в зависимости от полученных результатов представлена
на схеме 9. Задачей-минимум лечения является снижение холестерина
ЛПНП до уровня менее 160 мг/дл (4,1 ммоль/л) при отсутствии ИБС или
2 факторов риска и менее 130 мг/дл (3,4 ммоль/л) при их наличии. Этим
величинам примерно соответствуют уровни общего холестерина 240 и
200 мг/дл (6,2 и 5,2 ммоль/л), определение которого дешевле, проще и
может проводиться натощак. Если стремиться к регрессии атеросклероза,
которая отчасти возможна, эти уровни должны быть значительно ниже -
соответственно менее 100 и 150 мг/дл (2,6 и 3,9 ммоль/л).
Лечение начинают с диетотерапии, которой может быть до-
статочно для нормализации липидного обмена, в особенности при ГЛП
вследствие неправильного питания или ожирения. Диета может давать
определенный эффект даже при наследственных ГЛП, а если необходи-
мо прибегнуть к медикаментозной коррекции, то ее надо проводить в
дополнение к диетотерапии, а не вместо нее. Очень важно объяснить
больному, что необходимо изменение питания в течение длительного
времени.
Используютдиету с модифицированным соотношением
ж и р о в , то есть с меньшим содержанием как жиров в целом, так и насы-
щенных жирных кислот и холестерина и с большим содержанием полинена-
сыщенных жиров. Количество белков не меняется (10-20 % энергетической
ценности рациона), а углеводов — несколько увеличивается (до 50-60 %
энергетической ценности рациона) за счет сложных - волокон, клетчатки,
что компенсирует уменьшение потребления жиров. Энергетическая ценность
рациона должна быть достаточной для достижения и поддержания оптималь-
ной массы тела.
Модификацию диеты осуществляют в два этапа. Диета № 1 предус-
матривает уменьшение потребления жиров менее 30 % общей энергети-
ческой ценности, в том числе насыщенных жирных кислот — менее 10 %,
и холестерина - менее 300 мг в сутки.
В то же время в рационе населения Москвы, по данным ВКНЦ АМН
СССР (1989 г.), на долю жиров приходится в среднем 40 % энергетичес-
кой ценности рациона, в том числе насыщенных жирных кислот — 17 %,
а суточное потребление холестерина составляет 450-550 мг.
Уменьшение потребления жиров направлено на ограниче-
ние поступления насыщенных жирных кислот и общей энергетической
ценности рациона, что способствует снижению массы тела у больных с
ожирением. Из мясных продуктов, суточное потребление которых огра-
ничивается 200 г, рекомендуют постную говядину или телятину, курицу
или индейку без кожи. При кулинарной обработке следует избегать жаре-
ния. Нежелательны колбаса, сосиски, а также сметана, сыры, мороже-
ное, которые содержат много скрытых жиров. Цельное молоко заменяют
снятым, желательно 1 %.
284
Полиненасыщенными жирными кислотами частичноза-
меняют насыщенные, однако во избежание прибавки массы тела их удель-
ный вес не должен превышать 10 % энергетической ценности рациона.
Существуют две основные категории таких кислот - омега-6 иомега-3.
Основная жирная кислота категории омега-6 - линолевая — содержит-
ся в растительных маслах — подсолнечном, кукурузном, соевом, потребле-
ние которых вместо животных жиров приводит к снижению холестерина в
плазме. Источником жирных кислот категории омега-3 — эйкозапентаеновой
и докозагексаеновой — является рыбий жир. Установлено, что их использо-
вание в больших количествах снижает уровень триглицеридов, но эффект в
отношении холестерина ЛПНП окончательно не доказан. Регулярное по-
требление рыбы, однако, достоверно уменьшает риск ИБС. Рыба может
служить полезной заменой мяса, богатого насыщенными жирными кисло-
тами. Имеются данные, что потребление в среднем 30 г рыбы в день, или 2
рыбных дня в неделю, снижает смертность от ИБС до 50 %.
Мононенасыщенные жирные кислоты, в частности, оле-
иновая, должны составлять 10—15 % энергетической ценности рациона.
Они в изобилии содержатся в оливковом и подсолнечном масле, входят
в состав животных жиров. Достаточное их количество вызывает такое же
снижение уровня холестерина ЛПНП, как линолевая кислота.
Ограничение холестерина в пище достигается уменьшением
потребления яичных желтков до 2 в неделю, включая расход на конди-
терские изделия (1 желток содержит в среднем 250 мг холестерина), а
также мяса и молочных продуктов, содержащих сливочный жир (сыр,
сметана, майонез и др.). Необходимо исключить субпродукты — мозги (в
100 г 2300 мг холестерина), почки (805 мг), печень (438 мг). Много холе-
стерина содержится в рыбной икре (до 300 мг в 1 чайной ложке).
Необходимо включать в рацион 15-25 г водорастворимых раститель-
ных волокон — пектинов и клейковины. Они содержатся в овсяных
хлопьях, бобовых, а также в черной смородине, свекле, яблоках и спо-
собствуют снижению холестерина ЛПНП на 10—15 % за счет усиления
выделения желчных кислот с калом и уменьшения всасывания жиров
пищи. Достаточное количество водорастворимой клетчатки организм по-
лучает при употреблении 1/2 стакана сухих овсяных хлопьев, или 1 ста-
кана бобовых, или 500 г яблок, свеклы, капусты, моркови.
Допускается употребление хлеба, злаков, риса, картофеля с учетом их
довольно высокой энергетической ценности. Употребление в умеренных
количествах алкоголя не является пагубным, хотя и может вызывать не-
большое повышение уровня триглицеридов. При этом часто увеличивает-
ся содержание холестерина ЛПВП. Это, однако, не значит, что алкоголь
рекомендуют употреблять для профилактики ИБС.
Результаты диетотерапии оценивают через 4—6 нед и затем спустя 3 мес.
Если желательные уровни общего холестерина и холестерина ЛПНП не
достигнуты, рекомендуют еще раз пересмотреть рацион в целях выявления
явных и скрытых источников насыщенных жирных кислот и холестерина.
285
Таблица 20. Характеристика основных гнполипидемических препаратов
Препарат Уменьше- ние риска ИБС Безвред- ность длитель- ного примене- ния Снижение содержания холестерина ЛПНП Начальная доза Макси- мальная суточная доза Противопоказания Побочное действие Предосторожности
Холестирамин, Да Да 15-35% 4 г 2 раза в сутки 24-32 г Язвенная болезнь Желудочно- кишечные Нарушают всасы- вание тиазидов,
холестипол 5 г 2 раза в сутки во время еды 30 г нарушения, особенно запор дигоксина, анти- коагулянтов непря- мого действия. Могут повышать уровень триглице- ридов
Никотиновая кислота Да Да 15-30%, а также ЛПОНП до 40% 100 мг 2 раза в сутки во время еды 3—4 г Язвенная болезнь, нарушение функции печени, гепатит, кровоточивость, подагра Приливы, головокружение, сердцебиение, желудочно-ки- шечные наруше- ния, нарушения функции пече- ни, снижение толерантности к глюкозе Контроль содержа- ния глюкозы, мочевой кислоты в крови и функции печени
Ловастатин Да Да 25-45% 20 мг 1 раз в сутки во время еды 80 мг Гепатит, нару- шение функции печени Головная боль, желудочно-ки- шечные наруше- ния, нарушение функции печени, катаракта, миалгия, миозит Контроль функции печени, прозрач- ности хрусталика, КФК в крови
Гемфиброзил Да Да 5-15% 600 мг 2 раза в сутки во время еды 1200 мг Гепатит, нарушение функции печени, желчнокаменная болезнь Желудочно- кишечные нарушения, нарушение функции печени, миозит При гипертригли- церидемии может повышать уровень холестерина ЛПНП. Контроль функции печени, КФК в крови
Пробукол Не верифи- цировано То же 8-15% 500 мг 2 раза в сутки во время еды 1000 мг Удлинение интервала Q—T Желудочно- кишечные нарушения, удлинение интервала Q-T Снижает содержание холестерина ЛПНП до 25 %. В связи с
удлинением
интервала Q—T
нельзя сочетать с
антиаритмичес-
кими препаратами
со сходным
действием.
Контроль
электролитного
баланса (калий,
магний) и ЭКГ
При отсутствии эффекта через 3 мес переходят на диету № 2, в которой
содержание этих веществ сведено до минимума, совместимого с понятием о
вкусной пище. Очень полезна консультация врача-диетолога.
Диета № 2 предусматривает снижение потребления жира до 25 %, а
насыщенных жирных кислот - менее 10 % общей энергетической ценно-
сти, холестерина — менее 200 мг в сутки, то есть до 1 желтка в неделю и
менее и ограничение употребления мяса до 170 г в сутки. Снижение содер-
жания липидов в плазме крови обычно происходит в течение 3 мес, но
даже при отсутствии положительного эффекта необходимо придерживаться
строгой диеты по крайней мере в течение 6 мес, прежде чем ставить воп-
рос о назначении медикаментозной терапии. Этот срок может быть сокра-
щен для больных со значительной ГЛП и наличием ИБС.
При гипертриглицеридемии рекомендуют ограничение потреб-
ления жиров, простых углеводов и алкоголя, а также нормализацию мас-
сы тела и повышение физической активности.
Физические упражнения позволяют снизить содержание три-
глицеридов и холестерина ЛПНП и повысить уровень холестерина ЛПВП
и активность липопротеинлипазы. Их положительная динамика наблюда-
ется через 2 мес при условии регулярных занятий не менее 3 раз в неделю
по 30 мин.
Лекарственная терапия показана при отсутствии эффекта от
диеты № 2, снижения массы тела и физических тренировок, когда уровень
холестерина ЛПНП > 190 мг/дл (4,9 ммоль/л) у больных без ИБС или 2
факторов риска. У больных ИБС или имеющих 2 фактора риска и более,
одним из которых может быть мужской пол, начинать медикаментозное
лечение следует при уровне этого показателя > 160 мг/дл (> 4,1 ммоль/л).
Цели лекарственной терапии аналогичны диетотерапии — снижение содер-
жания холестерина ЛПНП у больных этих двух категорий соответственно
ниже 160 и 130 мг/дл (4,1 и 3,4 ммоль/л), причем желательно добиваться
уменьшения его уровня значительно ниже минимально рекомендованного.
Характеристика основных гиполипидемических препаратов представ-
лена в табл. 20.
Гиполипидемическими препаратами I ряда являются секвестранты желч-
ных кислот (холестирамин, холестипол), никотиновая кислота и новый
класс препаратов — ингибиторы ГМГ-КоА-редуктазы (ловастатин и др.).
Доказаны безопасность их длительного применения и эффективность в
отношении снижения холестерина и риска ИБС.
К препаратам II ряда относятся фибраты (клофибрат, гемфиброзил
и др.) и пробукол. Секвестранты желчных кислот, ловастатин и пробукол
эффективны преимущественно в отношении холестерина ЛПНП, а никоти-
новая кислота и фибраты действуют в основном на липопротеины, бога-
тые триглицеридами. Эффективность терапии оценивают по изменению
уровня холестерина ЛПНП, а также общего холестерина и триглицеридов
через 4—6 нед и повторно через 3 мес. При недостаточном эффекте назна-
чают другой препарат или комбинацию лекарственных средств.
Секвестранты желчных кислот представляют собой нера-
створимые невсасываемые ионообменные смолы, которые связывают жел-
чные кислоты в кишечнике и прерывают их кишечно-печеночную ре-
циркуляцию. Это приводит к увеличению расходования холестерина на
синтез желчных кислот и, тем самым, к возрастанию рецептор-опосре-
дованного поступления ЛПНП в печень и снижению их содержания в
крови. В ряде случаев отмечается компенсаторное повышение уровня триг-
лицеридов и ЛПОНП, в связи с чем при выраженной гипертриглицери-
демии секвестранты противопоказаны.
Представляют собой порошкообразное вещество, которое разводят жид-
костью и принимают 2 раза в сутки во время еды или за 30 мин до или
после еды. Во избежание выраженных побочных эффектов со стороны
пищеварительного канала (см. табл. 20) лечение начинают с малых доз
(холестирамин по 4 г 2 раза в сутки) и постепенно их повышают. При
сопутствующей умеренной триглицеридемии назначают в комбинации с
никотиновой кислотой или гемфиброзилом.
Никотиновая кислота оказываетгиполипидемическоедействие
преимущественно в отношении триглицеридов за счет: 1) уменьшения
мобилизации свободных жирных кислот из жировой ткани; 2) торможе-
ния выделения ЛПОНП из печени в кровь. Она также повышает уровень
холестерина ЛПВП. Переносимость никотиновой кислоты значительно
ограничена в связи с тяжелыми побочными эффектами, опосредуемыми
простагландинами (см. табл. 20). Поэтому лечение начинают с очень ма-
лых доз — по 100 мг 2 раза в сутки с еженедельным повышением дозы
примерно на 300 мг. Приливы и другие побочные эффекты можно умень-
шить с помощью антипростагландиновых средств, в частности ацетилса-
лициловой кислоты. Гиполипидемическое действие оказывают только боль-
шие дозы — не менее 1,5—2 г в сутки. При невозможности их приема из-
за плохой переносимости никотиновую кислоту сочетают с другими пре-
паратами.
Ингибиторы ГМ Г-КоА-ред уктазы — статины (ловастатин-
мевакор, симвастатин-зокор, правастатин, серивастатин-липобай и др.)
представляют собой новый класс высокоэффективных гиполипидемических
препаратов, которые вызывают уменьшение синтеза свободного холестери-
на в клетках паренхиматозных органов и, как следствие, усиление поступ-
ления в них холестерина ЛПНП из крови. Могут также снижать уровень
триглицеридов. Ловастатин (мевакор) назначают по 20 мг 1 раз в сутки во
время ужина, при необходимости увеличивая дозу до 20—40 мг 2 раза в
сутки. Побочные эффекты обычно незначительны и преходящи (см. табл. 20),
однако при лечении необходимо следить за показателями функции печени
(возможно повышение уровня трансаминаз). Используют у больных с тяже-
лой ГЛП и высоким риском ИБС.
Фибраты, активируя липопротеинлипазу, усиливают липолиз
ЛПОНП и тем самым снижают содержание триглицеридов в крови. Кроме
того, они увеличивают выделение холестерина и желчных кислот с желчью
289
и уменьшают секрецию ЛПОНП из печени в кровь. Первый представитель
этой группы клофибрат (мисклерон, атромид) в настоящее время не
используют. Согласно результатам представительного европейского иссле-
дования он, не влияя на смертность от ИБС, существенно повышал
смертность от внесердечных причин, главным образом связанных с
желчнокаменной болезнью (Report from the Committee of Principal
Investigators: A cooperative trial in the primary prevention of ischaemic heart
disease using clofibrate, 1978).
В отличие от клофибрата, гемфиброзил (лопид) значительно снижает риск
возникновения ИБС и ее осложнений, не влияя на смертность в целом. Хотя
и в меньшей степени, чем клофибрат, он все же способствует образованию
желчных конкрементов, может вызывать диспепсический синдром и нару-
шение функции печени (см. табл. 20). Назначают препарат по 600 мг 2 раза в
сутки во время еды. Более выраженным эффектом обладают новые препараты
— безафибрат, фенофибрат и ципрофибрат (липанор).
Пробукол относится к препаратам резерва. Способствует клиренсу
холестерина ЛПНП из крови главным образом в желчь без изменения
уровня триглицеридов. Неблагоприятным является снижение холестерина
ЛПВП. Благодаря своим антиоксидантным свойствам обладает также неза-
висимой от гиполипидемического эффекта антиатерогенной активностью,
так как окисленные ЛПНП легче захватываются клетками-скевенджерами
артериальной стенки. Серьезные побочные эффекты связаны с удлинени-
ем интервала Q—T. Назначают по 500 мг 2 раза в сутки во время еды боль-
ным с гиперхолестеринемией, которые не переносят другие препараты,
или в комбинации с секвестрантами желчных кислот при тяжелой ГЛП.
При недостаточном эффекте монотерапии применяют комбинации пре-
паратов с различным механизмом действия, например, холестирамин и
никотиновую кислоту, или фибрат, или статин. Из-за высокого риска раз-
вития миозита с миоглобинурией и острой почечной недостаточностью
противопоказано сочетание ингибитора ГМГ-КоА-редуктазы с фибрата-
ми и нежелательно их сочетание с никотиновой кислотой. Если и это не
дает эффекта, что часто наблюдается при семейной гиперхолестерине-
мии, или медикаментозная терапия плохо переносится больным, прибе-
гают к экстракорпоральному удалению липопротеинов
и хирургическому лечению. Используют плазмаферез и более дей-
ственные избирательные эфферентные методы — иммуносорбцию с по-
мощью фиксированных на сефарозе бараньих антител против ЛПНП
(W.Stoffel и соавт., 1981) и гемосорбцию на колонках с декстрансульфат-
целлюлозой, также селективно связывающей ЛПНП (Y.Homma и соавт.,
1987). Процедурь повторяют еженедельно или 1 раз в 2 нед.
Хирургическое выключение дистальной трети или 2 м подвздошной
кишки путем анастомозирования ее проксимального конца с толстой
кишкой приводит к 4-кратному увеличению экскреции желчных кислот
и тем самым — катаболизма холестерина ЛПНП (T.Miettinen, M.Lempinen,
1977). При гомозиготной семейной гиперхолестеринемии прибегают к
290
Дифференцированная медикаментозная терапия ГЛП
Тип ГЛП Рекомендации
ПА Секвестрант желчных кислот, или ингибитор ГМГ-КоА-редуктазы, или фибрат
ПВ Секвестрант желчных кислот + фибрат или никотиновая кислота, или ингибитор
ГМГ-КоА-редуктазы + никотиновая кислота (осторожно!)
III Ингибитор ГМГ-КоА-редуктазы или фибрат
IV, V Никотиновая кислота или фибрат
трансплантации печени, что устраняет дефицит печеночных рецепторов
к ЛПНП (T.Starzl и соавт., 1984).
Необходимо подчеркнуть, однако, что четкая связь эффекта того или
иного препарата с типом ГЛП отсутствует, вследствие чего лечение в
известной мере носит эмпирический характер.
При преимущественном повышении уровня холестерина ЛПНП, на-
пример, при полигонной гиперхолестеринемии, медикаментозное лече-
ние обычно начинают с назначения секвестрантов желчных кислот, а
при триглицеридемии — никотиновой кислоты. Препаратами резерва яв-
ляются соответственно ингибиторы ГМГ-КоА-редуктазы и фибраты.
При гетерозиготной семейной гиперхолестеринемии назначают ком-
бинацию из секвестранта и второго препарата или изредка трех препара-
тов (холестирамин, ловастатин и никотиновая кислота). При отсутствии
эффекта прибегают к аферезу или шунтированию подвздошной кишки с
последующим назначением ловастатина. Гомозиготная форма поддается
лечению только аферезом ЛПНП. При семейной комбинированной ги-
перлипидемии применяют никотиновую кислоту, или фибрат, или ста-
тин в качестве монотерапии, либо их комбинацию с секвестрантами.
Эффективность лечения ГЛП при коронарном атеросклерозе в отно-
шении уменьшения заболевааемости и смертности (ИБС) к настоящему
времени четко доказана.
В 1978—1988 гг. были опубликованы результаты 6 крупномасштабных
исследований по первичной (Report from the Committee of Principal
Investigators: A cooperative trial in the primary prevention of ischaemic heart
disease using clofibrate, 1978; L.Hjennann и соавт.: Report from the Oslo Study
Group, 1981; Lipid research clinics program: the Lipid Research Clinics Coronary
Primary Prevention Trial results, 1984; M.Frick и соавт.: Helsinki Heart Study,
1987) и вторичной (P.Canner и соавт., 1986; L.Carlson, G.Rosenhamer:
Stockholm Ischaemic Heart Disease Secondary Prevention Study, 1988) про-
филактике ИБС с помощью гиполипидемической терапии. Как показал
анализ сводных данных, снижение сывороточных уровней общего холес-
терина и триглицеридов в среднем на 12 и 19 %, или на 0,8 и 0,4 ммоль/л
соответственно, сопровождалось уменьшением заболеваемости ИБС на 29 %
(D.Bilheimer, 1988). Большинство исследований свидетельствует о сниже-
нии смертности от ИБС (на 12—36 %), а некоторые — о снижении и общей
смертности (на 11—26 %). Таким образом, относительно небольшие сдвиги
в уровнях сывороточных липидов, которые удается получить с помощью
291
лекарственной или диетотерапии, могут снизить заболеваемость ИБС (а
поэтому и смертность) почти на 1/3 в течение 5—6 лет.
Ряд многоцентровых исследований с использованием коронарографии
в динамике продемонстрировали замедление прогрессирования стенози-
рующего атеросклероза коронарных артерий сердца при 2-4-летнем на-
блюдении больных ИБС с исходно повышенным уровнем холестерина в
крови, принимавших холестипол, никотиновую кислоту и ловастатин,
по сравнению с пациентами, не получавшими гиполипидемическую те-
рапию или принимавшими плацебо (Familial Atherosclerosis Treatment Study
- FATS, G.Brown и соавт., 1990; The Cholesterol-Lowering Atherosclerosis
Study - CLAS, L.Cashin-Hemphill и соавт., 1990, и др.).
Применение ацетилсалициловой кислоты (аспирина) в об-
щепринятых профилактических дозах направлено на блокирование учас-
тия тромбоцитов в атерогенезе. Эффективность ацетилсалициловой кислоты
как антиатеросклеротического препарата в отношении уменьшения смерт-
ности пока убедительно не доказана.
II. Лечение поздних клинических проявлений и осложнений атеросклероза,
в частности ИБС, подробно описано в главе 9. Что касается воздействия
используемых в этих целях препаратов на процесс атерогенеза, то следу-
ет отметить указания на способность блокаторов кальциевых каналов,
особенно нифедипина (коринфара) предотвращать образование новых
бляшек при отсутствии, однако, влияния на выживаемость в целом. По-
лучены предварительные экспериментальные данные об антиатеро-
склеротическом эффекте ингибитора АПФ каптоприла (A.Fleckenstein и
соавт., 1989).
Профилактика атеросклероза заключается в:
1) выявлении отдельных лиц, наиболее угрожаемых в отношении ГЛП
и раннего атеросклероза, определение имеющихся у них факторов риска
и их модификация. Она включает активное лечение артериальной гипер-
тензии и сахарного диабета, нормализацию массы тела и физической
активности, а также, по показаниям, терапию ГЛП;
2) широкое информирование всего населения о пищевых источниках
холестерина и насыщенных жирных кислот, вреде курения и ожирения,
важности оздоровления образа жизни.
Эффективность такой профилактики в масштабах страны доказывает
опыт США, где с 1968 г. достигнуто снижение смертности населения от
сердечно-сосудистых заболеваний, связанных с атеросклерозом, на 30 %.
Одна из причин этого - произошедшее за период с I960 по 1980 гг. умень-
шение содержания холестерина в крови на 0,6—0,8 ммоль/л, что отража-
ет, по-видимому, изменение диетологических привычек (National Center
for Health Statistics: National Heart and Blood Institute Collaborative Lipid
Group, 1987). Сокращение смертности обусловлено не только повышени-
ем выживаемости, но и снижением частоты возникновения ИБС.
292
ГЛАВА 9.
ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
Термин “ишемическая болезнь сердца” был предложен Комитетом
экспертов ВОЗ в 1962 г. для обозначения острых и хронических заболева-
ний сердца, вызванных недостаточным снабжением миокарда кровью. К
ним приводят как морфологические (стеноз), так и функциональные
(спазм) изменения коронарных артерий или нередко их сочетание. В ре-
зультате при определенных условиях развивается несоответствие между
потребностями миокарда в кислороде и величиной коронарного крово-
тока, то есть коронарная недостаточность. ИБС проявляется
симптомами и признаками ишемии миокарда, и, этот термин тождестве-
нен понятию “коронарная болезнь сердца ” (ВОЗ, 1959).
Эпидемиология. ИБС широко распространена во всех странах мира, осо-
бенно индустриально развитых. В бывшем СССР она имела место у 20 %
мужчин в возрасте 50—59 лет и служила причиной 53 % случаев смерти от
сердечно-сосудистых заболеваний, причем в 1/3—1/2 из них смерть на-
ступает внезапно.
Смертность от ИБС колеблется от 103 в Японии до 880 в Финляндии
(на 100 тыс. населения). В Украине показатели заболеваемости и смерт-
ности от ИБС за последние 5 лет имеют тенденцию к росту и в 1993 г.
составили соответственно 815 и 22,2 на 100 тыс. населения (В.А.Бобров,
А.Г.Каминский, 1994). Заболеваемость ИБС у мужчин значительно выше,
чем у женщин, и существенно возрастает с возрастом. Так, по данным
известного Фремингемского исследования в США, частота ИБС у муж-
чин в возрасте 30 лет — 44 года составила 8 %, 55 лет - 62 года — 18 %.
Этот показатель у женщин был равен соответственно 1,3 и 13 %. Таким
образом, у женщин заболеваемость ИБС резко возрастает после мено-
паузы.
В Украине распространенность всех форм ИБС у мужчин наименьшая
в возрасте 20-29 лет — 0,8 % и наивысшая в возрасте 60—69 лет — 24,5 %
(В.А.Бобров, А.Г.Каминский, 1994).
Этиология и патогенез. В 99 % случаев ИБС обусловлена атеросклерозом
коронарных артерий. К остальным, редко встречающимся этиологичес-
ким факторам, относятся: 1) коронарит (при сифилисе, системных забо-
леваниях соединительной ткани, системных васкулитах и др.); 2) амило-
идоз; 3) расслаивающая аневризма аорты; 4) врожденные аномалии ко-
ронарных артерий (отхождение левой коронарной артерии от легочной,
артериовенозные фистулы и др.); 5) эмболия коронарных артерий.
Основные факторы риска заболеваний, связанных с атероскле-
розом коронарных артерий, рассматривались выше (см. с. 265). Меньшее
значение имеют второстепенные факторы: малоподвижный образ жиз-
ни, умеренное ожирение, частые стрессы и тревожное реагирование на
них, гиперурикемия и др.
Рис. 58. Причины ИБС
/Коронарный
атеро -
склероз I
Коронаро-
( спазм
Коронаро-
\тромбоз
Нарушения
/микро -
'циркуляции.
Динамический
стеноз
'коронарной
артерии
Спонтанный
фибринолиз
Основными механизмами
ИБС являются: 1) коронарный
атеросклероз; 2) коронаро-
спазм; 3) нарушения микро-
циркуляции; 4) коронаротром-
боз (рис. 58).
Роль атеросклероза. Эпикар-
диальные сегменты коронарных
артерий являются излюбленной
локализацией атеросклероти-
ческих бляшек. Очень редко ко-
ронарные артерии поражаются
в своей дистальной трети, главным образом при сочетании атеросклеро-
за с сахарным диабетом. Поражение интрамуральных сосудов, которое не
определяется на ангиограмме, но сопровождается типичными клиниче-
скими и электрокардиографическими признаками ишемии, получило
“этапное” название “синдром X”, или “коронарная болезнь сердца
без доказанного заболевания коронарных артерий”. Изменения мелких
интрамуральных сосудов характерны для воспалительного заболевания —
коронарита как проявления системного васкулита.
При прогрессирующем сужении просвета артерии участок дистальнее ме-
ста стеноза расширяется, что уменьшает его сопротивление, увеличивает
градиент давления в месте сужения и тем самым обеспечивает сохранение
адекватного поступления крови и нормальные уровни РО2, РСО2, аденози-
на и других метаболитов в миокарде. С увеличением стеноза возрастает и
выраженность дилатации, которая, однако, не беспредельна. Это приво-
дит к исчерпанию расширительного коронарного резерва с развитием
несоответствия между потребностью миокарда в кислороде и его доставкой
при нагрузке все меньшей и меньшей величины.
Уменьшение площади просвета артерии более чем на 80 % является
критическим и вызывает снижение коронарного кровотока в покое. При
исчерпании коронарного резерва вазодилатация в неизмененных или мало-
измененных участках коронарных артерий приводит к снижению градиента
давления в месте стеноза и тем самым к критическому уменьшению дав-
ления и кровотока в дистальном сегменте и появлению или усугублению
ишемии миокарда в бассейне стенозированной артерии. Этот феномен но-
сит название си нд ром а межкоронарного обкрадывания.
Значительное (более 75 %) сужение коронарной артерии и эпизоды
ишемии миокарда способствуют раскрытию нефункционирующих и об-
разованию новых прекапиллярных анастомозов — коллатералей — между
коронарными артериями, особенно если стеноз развивается постепенно.
Коллатерали обеспечивают минимальный кровоток для сохранения жиз-
294
неспособности скомпрометированного участка миокарда в покое. Не пре-
дотвращая развития инфаркта и ишемии миокарда в условиях повышен-
ной его потребности в кислороде, коллатерали способствуют уменьше-
нию очагов некроза и улучшению выживаемости больных.
Коронароспазм. Ангиокардиографические исследования позволили убе-
дительно доказать роль спазма в патогенезе всех форм ИБС — различных
вариантов стенокардии покоя и напряжения, инфаркта миокарда с внутри-
коронарным тромбозом и без него и внезапной смерти.
Преходящий коронароспазм, купирующийся нитроглицерином, ре-
гистрируется примерно в 5 % коронарографий. В большинство случаев его
субстратом является атеросклероз, особенно при эксцентрическом ха-
рактере стеноза. Возможен спазм и при отсутствии видимого стеноза ко-
ронарной артерии, но чаще в месте повреждения интимы. Однако коро-
нароспазм и сам приводит к нарушению целостности эндотелия, агрега-
ции тромбоцитов и в ряде случаев к тромбозу.
Возможными механизмами спазма являются:
1) повышенная реактивность пораженного участка коронарной арте-
рии на сосудосуживающее воздействие: а) возбуждение а-адренорецеп-
торов, особенно в условиях снижения аэробного обмена в миокарде вслед-
ствие гиподинамии; б) возбуждение Н(-рецепторов гистамина; в) выде-
ление серотонина, оказывающего сосудосуживающее действие за счет
стимуляции серотонинергических рецепторов, которыми богата гладкая
мускулатура эпикардиальных коронарных артерий, постсинаптических аг
адренорецепторов и усиления ответа на другие медиаторы — норадрена-
лин, ангиотензин II;
2) местное уменьшение выделения поврежденным вследствие атеро-
склероза эндотелием гуморальных веществ с сосудорасширяющими и анти-
агрегантными свойствами — простациклина и так называемого эндотели-
ального фактора расслабления;
3) освобождение из тромбоцитарных агрегантов, образующихся на по-
верхности поврежденного эндотелия, мощного вазоконстриктора и про-
агреганта тромбоксана А2, а также серотонина;
4) гипервентиляция при физической нагрузке вследствие уменьше-
ния концентрации Н+, которые действуют как антагонисты кальция;
5) изменение физиологических свойств мембраны гладкомышечных
клеток — рецепторного аппарата и систем ионного транспорта, возмож-
но, Са2+, в среде с высоким содержанием холестерина.
Роль нарушений микроциркуляции. Критическое сужение просвета коро-
нарной артерии с развитием эпизодов ишемии миокарда может возникать
вследствие образования нестойких тромбоцитарных агрегатов, которые уве-
личиваются в размерах за счет выделения тромбоксана А2, однако относи-
тельно быстро подвергаются спонтанной дезагрегации. Этому способству-
ют стенозирование сосуда атеросклеротической бляшкой и его спазм.
Роль коронаротромбоза. Вопрос о первичности или вторичности коронар-
ного тромбоза при ИБС долгое время был предметом дискуссии. Однако
к настоящему времени его патогенетическое значение при инфаркте ми-
окарда и нестабильной стенокардии окончательно установлено. Образо-
вание тромба в большинстве случаев происходит в области относительно
небольшого стеноза коронарной артерии бляшкой с изъязвленной по-
крышкой. Надрыву шапочки и обнажению тромбогенного субэндотелия
способствует также спазм. Начало тромбообразованию в коронарных ар-
териях, в отличие от венозного тромбоза, дают прилипшие тромбоциты.
Стойкость тромбоза в значительной мере зависит от выраженности ха-
рактерных для атеросклероза гиперкоагуляционных изменений плазменно-
клеточного гемостаза. Особенно важное значение имеет местная актив-
ность фибринолитической системы, то есть баланс между тканевыми ак-
тиваторами плазминогена и его ингибиторами. При сохраненной фибри-
нолитической активности спонтанный тромболизис и реперфузия насту-
пают быстро, до развития необратимой ишемии миокарда и некроза.
Таким образом, 4 основных патогенетических механизма ИБС (см.
рис. 58) находятся в тесной взаимосвязи. Коронароспазм, преходящие
нарушения микроциркуляции и коронаротромбоз с ранним спонтанным
фибринолизом обусловливают образование так называемого динами-
ческого, то есть нестойкого, обратимого, стеноза коронарных ар-
терий. Динамическому стенозу принадлежит не менее важная роль в па-
тогенезе ИБС, чем органическому, имеющему чаще всего атеросклеро-
тическое происхождение.
В основе приступа коронарной недостаточности лежит следующая по-
следовательность: физическое напряжение или эмоциональный стресс
-> активация симпатико-адреналовой системы -> повышение ЧСС, АД,
сократимости миокарда -> увеличение потребности миокарда в кислоро-
де. При невозможности адекватного увеличения коронарного кровотока
из-за уменьшения расширительного резерва пораженных атеросклерозом
артерий в покое развивается ишемия миокарда.
Генез приступов коронарной недостаточности в покое различен. Не-
которым из них предшествует увеличение ЧСС и АД, то есть потребности
миокарда в кислороде. При практически полном исчерпании коронарно-
го резерва даже небольшого их повышения достаточно для развития ише-
мии, то есть “покой” в таких случаях относителен. Если же ишемия раз-
вивается в условиях неизмененной работы сердца, в ее основе лежит
первичное уменьшение коронарного кровотока вследствие динамическо-
го коронарного стеноза, преимущественно спазма.
Патогенез ишемического повреждения миокарда и методы выявления ише-
мии в клинике. В отлш ие от гипоксии ишемия обусловлена не только
уменьшением доставк i кислорода тканям, но и нарушением удаления их
метаболитов вследствие снижения перфузии. Она развивается тогда, когда
объем артериального кровотока становится ниже необходимого миокарду
для адекватной функции, то есть когда снижение доставки кислорода вызы-
вает переход пораженных клеток на анаэробный метаболизм. Поскольку
при этом образуется значительно меньше АТФ, быстро развивается дефицит
296
Необратимые изменения i Обратимые изменения
мембран
Схема 10. Патогенез ишемического повреждения миокарда: КТХА — катехоламины; MX —
митохондрии; СЖК — свободные жирные кислоты; ПОЛ — перекисное окисление липидов;
СР — саркоплазматический ретикулум; МФ — миофибриллы
297
Таблица 21. Выявление ишемии миокарда
Принцип Метод Показатели
Образование субстанции Р Клиническое обследование Характерная ангинозная боль
Очаговое уменьшение коронарного кровотока Сцинтиграфия миокарда
Переход на анаэробное окисление Определение лактата в крови Повышение содержания лакта- та в крови коронарного синуса
Нарушение механической Эхокардиография Зоны асинергии. Увеличение
работы сердца Вентрикулография Катетеризация сердца КДО, снижение УОС и ФВ Повышение КДД в левом желудочке
Нарушение электрофизиологи- ческой функции Электрокардиография Нарушения реполяризации Нарушения ритма
энергии (схема 10), который влечет за собой нарушение механической и
электрофизиологической функций миокарда (табл. 21).
Одним из ведущих патогенетических факторов, вызывающих первич-
ные нарушения метаболизма в миокарде с развитием его ишемии, явля-
ется активация симпатико-адреналовой системы. Влияние катехоламинов
на возникновение ишемии миокарда представлено на схеме 11.
Изменения, развивающиеся в клетках при полной ишемии, полнос-
тью обратимы в течение 20 мин. Ко 2-му часу большинство из них пре-
терпевает необратимые изменения.
Выявление ишемии миокарда в клинике основывается на при-
знаках (см. табл. 21), которые определяются при моделировании повышения
потребности миокарда в кислороде с помощью нагрузочных проб, или, в
далеко зашедших случаях, имеют место в покое:
1) характерная ангинозная боль. Ее точный механизм не ясен.
Согласно биохимическим теориям боли, в ишемизированной ткани на-
капливается какое-то вещество — так называемый фактор (или субстан-
ция) Р — от англ, pain — боль, которое вызывает возбуждение периваску-
лярных чувствительных нервных окончаний симпатической части вегета-
тивной нервной системы. Высказывают предположение, что этим веще-
ством являются аденозин, гистамин, брадикинин, протеолитические фер-
менты либо один из простагландинов. Импульсы передаются через 5 груд-
ных симпатических и звездчатый узлы к спинному мозгу и затем по спи-
ноталамическому тракту в таламус, где предположительно находится центр
боли;
2)очаговое уменьшение коронарного кровотока обус-
ловленное сегментарным, локальным характером стенозирования коронар-
ных артерий. Оно определяется с помощью радионуклидной сцинтигра-
фии миокарда и является наиболее точным методом выявления ишемии;
3) переход на анаэробное окисление с увеличением об-
разования лактата, содержание которого в крови коронарного синуса резко
возрастает;
298
Ишемическая Повреждение Разобщение
контрактура миокарда
лизосом и
клеточных мембран
Ишемия
окисления и
щасфолирирования
Схема 11. Роль катехоламинов в возникновении ишемии миокарда: КТХА — катехоламины;
СЖК — свободные жирные кислоты
4) нарушение механической работы сердца: а) диасто-
лического расслабления миокарда из-за нарушения обратного транспорта
Са2+ в саркоплазматический ретикулум и внеклеточную среду; б) сокра-
щения миокарда. Систолическая дисфункция в отличие от диастоличес-
кой развивается при более выраженном энергодефиците и обусловлена:
1) нарушением актомиозинового взаимодействия за счет конкуренции за
рецепторы тропомиозина Н+, содержание которых в клетке резко возрас-
тает, с Са2+; 2) уменьшением доставки Са2+ к сократительным белкам из-
за ухудшения работы ионных насосов при истощении запасов микроэргов.
В связи с локальным характером уменьшения перфузии миокарда и его
ишемии нарушения сократимости, как правило, сегментарные и прояв-
ляются возникновением зон асинергии, которые определяются при двух-
мерной эхокардио- и вентрикулографии (рентгеноконтрастной и радио-
нуклидной). Если ишемия охватывает значительную площадь, что харак-
терно для распространенного стенозирующего атеросклероза с поражени-
ем всех трех эпикардиальных коронарных артерий, развивается систоли-
ческая дисфункция левого желудочка в целом. Она проявляется его ди-
латацией (увеличением КДО), повышением КДД и давления в легочной
артерии, снижением УОС и ФВ. Ослабление сократимости отдельного
участка миокарда препятствует нормальному продвижению крови в ка-
пиллярном и венозном руслах, ухудшает ее реологические свойства, со-
здает условия для стаза и тромбообразования;
5) нарушение электрофизиологической функции прояв-
ляется на ЭКГ в виде: а) нарушения реполяризации; б) нарушений ритма.
Под влиянием ишемии трансмембранный потенциал претерпевает сле-
дующие изменения:
1) частичная деполяризация мембраны ишемизированных клеток в со-
стоянии покоя из-за утечки внутриклеточного К+ и его накопления во
внеклеточном пространстве. Это связано с: а) увеличением выходящего
фонового тока К+, а при более выраженной ишемии — б) угнетением
работы К+—Na+-Hacoca;
2) уменьшение скорости нарастания ПД и амплитуды овершута вслед-
ствие частичной инактивации быстрых №+-каналов. Оно обусловлено:
а) увеличением содержания внеклеточного К+; б) угнетением этих кана-
лов каким-то веществом, накапливающимся в миокарде при ишемии;
3) изменение продолжительности ПД, преимущественно за счет фазы
плато. При острой ишемии она чаще укорачивается вследствие: а) увели-
чения независимого от времени тока К+ из-за повышения мембранной
проницаемости для К+; б) уменьшения медленного входящего тока Na+ и
Са2+ в связи со снижением содержания цАМФ в клетке. Укорочение плато
способствует снижению сократимости ишемизированного миокарда. При
хронической ишемии реполяризация, а следовательно, и рефрактерный
период склонны удлиняться под воздействием ацидоза, накопления лак-
тата и углекислого газа. В итоге развивается гетерогенность продолжительно-
сти рефрактерного периода в различных группах кардиомиоцитов;
4) уменьшение скорости проведения ПД вследствие (2).
Различная продолжительность рефрактерного периода отдельных кар-
диомиоцитов и различные темпы восстановления быстрых №+-каналов
приводят к дисперсии рефрактерных периодов в отдельных участках ише-
мизированного и неишемизированного миокарда. Такая дисперсия, а так-
же вариабельность скорости проведения импульса создают условия для
рециркуляции волны возбуждения по типу “ри-энтри”. Этому способству-
ет также наличие очагов склероза, которые, не обладая электрической
активностью, могут блокировать проведение импульса и отклонять его от
нормального пути.
Увеличение скорости спонтанной диастолической деполяризации в ише-
мизированных клетках, отчасти под влиянием гиперкатехоламинемии, и
появление в них задержанных следовых деполяризаций вследствие повы-
шения внутриклеточного Са2+ создают условия для возникновения экто-
пических очагов.
Самым ранним проявлением ишемии является нарушение диастоли-
ческого расслабления. Затем возникают нарушения реполяризации, сис-
толическая дисфункция миокарда и боль.
Наиболее уязвимы в отношении ишемии субэндокардиальные слои же-
300
Таблица 22. Удельный вес различных форм ИБС среди
мужчин н женщин (Фремннгемское исследование), %
Форма ИБС Мужчины Женщины
Инфаркт миокарда 45 23
Стабильная стенокардия 32 56
Нестабильная стенокардия 12 15
Внезапная коронарная смерть И 6
лудочка. Это обусловлено
прежде всего относитель-
но большим систоличес-
ким сжатием питающих их
интрамуральных артерий,
что приводит к их умерен-
ной компенсаторной ди-
латации в покое. Благода-
ря этому субэндокарди-
альный кровоток равен субэпикардиальному, но расширительный резерв
субэндокардиальных артерий уменьшен. Определенное значение имеет также
большее диастолическое стеночное напряжение субэндокардиальных сло-
ев по сравнению с субэпикардиальным, которое нарастает при дилатации
левого желудочка вследствие его дисфункции и приводит к увеличению их
потребности в кислороде.
Классификация ИБС Комитета экспертов ВОЗ (1979) включает следу-
ющие основные формы:
I. Стенокардия:
1. Стенокардия напряжения: а) впервые возникшая; б) стабильная;
в) прогрессирующая;
2. Стенокардия покоя, в том числе особая стенокардия.
II. Инфаркт миокарда.
1. Острый (определенный, вероятный).
2. “Старый”.
III. Сердечная недостаточность.
IV. Нарушения ритма.
V. Внезапная коронарная смерть.
В бывшем СССР наибольшее распространение получила классифика-
ция ВКНЦ АМН СССР (1984), разработанная на основе классификации
ВОЗ. В ней выделяются следующие основные формы ИБС:
I. Стенокардия.
1. Стенокардия напряжения: а) впервые возникшая; б) стабильная (с
указанием функционального класса от I до IV); в) прогрессирующая.
2. Спонтанная (особая) стенокардия.
II. Инфаркт миокарда.
1. Крупноочаговый (трансмуральный).
2. Мелкоочаговый.
III. Постинфарктный кардиосклероз.
IV. Сердечная недостаточность.
V. Нарушения сердечного ритма (с указанием формы).
VI. Внезапная коронарная смерть (первичная остановка сердца).
Нарушения сердечного ритма и сердечная недостаточность в этой клас-
сификации рассматриваются одновременно как самостоятельные формы
ИБС и как осложнения любой другой ее формы.
Удельный вес каждой из этих форм среди мужчин и женщин имеет
301
определенные особенности (табл. 22). Так, по данным Фремингемского
исследования, мужчины чаще страдают инфарктом миокарда, а женщины —
стабильной стенокардией. Обращает на себя внимание высокий удельный
вес внезапной смерти.
Хотя ИБС обычно считается заболеванием пожилых, результаты ауто-
псий лиц среднего и молодого возраста свидетельствуют о возникновении
коронарного атеросклероза еще до достижения 20 лет. По данным вскрытий
военнослужащих ВВС Великобритании, погибших в результате несчастного
случая, сужение просвета коронарной артерии более чем на 50 % отмеча-
лось у 5 % умерших в возрасте 17—24 лет, у 20 % — в возрасте 25—33 лет и
более чем у половины умерших в возрасте 34—42 лет (J. Mason, 1963).
СТЕНОКАРДИЯ
Стенокардия — это боль или дискомфорт в грудной клетке, связанные с
ишемией миокарда, когда потребность миокарда в кислороде превышает
его доставку. Она одновременно является клиническим синдромом и фор-
мой ИБС. Этот термин был предложен в XVIII в. W.Heberden, который впер-
вые дал наиболее полное описание стенокардии, ставшее классическим.
"У 90 % больных станокардия обусловлена сужением по крайней мере од-
ного сегмента коронарной артерии более чем на 75 % площади ее просвета в
результате атеросклероза. Вместе с тем, стенокардия отмечается лишь у 20—
30 % больных коронарным атеросклерозом. Таким образом, отсутствие ан-
гинозного синдрома ни в коей мере не исключает коронарную болезнь и
ишемию миокарда, которая в подобных случаях носит характер “немой”
ишемии.
Основными этиологическими факторами стенокардии, как и ИБС в це-
лом, являются: 1) атеросклероз; 2) аортит, чаще сифилитический; 3) коро-
нарит. Синдром стенокардии при неизмененных коронарных артериях ха-
рактерен для стеноза устья аорты, недостаточности аортальных клапанов
и гипертрофической кардиомиопатии и может встречаться при высокой
легочной гипертензии и митральном стенозе. Способствующие фак-
торы стенокардии представлены в табл. 23.
Ниже при описании ИБС речь будет идти о коронарной болезни серд-
ца атеросклеротического генеза.
СТАБИЛЬНАЯ СТЕНОКАРДИЯ
Клиника. Постановка диагноза стенокардии часто базируется на выяв-
лении ее патогномоничного симптома — боли. Типичная стенокардити-
ческая боль локализуется за грудиной. Она иррадиирует в плечи, лопатки,
руки, вплоть до кисти - обе или в левую, обычно по их локтевой поверхно-
сти с захватыванием III—IV пальцев и может сопровождаться онемением.
Несколько реже боль отдает в спину, шею, нижнюю челюсть и даже зубы.
Таблица 23. Факторы, способствующие развитию стенокардии
Увеличивают потребность миокарда в кислороде Уменьшают доставку миокарду кислорода
Увеличивают Увеличивают Уменьшают коронарный Уменьшают транспорт
преднагрузку постнагрузку кровоток в период диастолы кислорода кровью
Физическая нагрузка Тахикардия и Анемия
Гипертиреоз Артериальная гипертензия тахиаритмии Условия высокогорья
Застойная сердечная Стеноз устья аорты недостаточность Шок Недостаточность аортальных клапанов Оксид углерода
Боль носит характер жгучей, сжимающей, пекучей или давящей, но
может проявляться и как чувство тяжести, стеснения в груди и даже за-
трудненного дыхания, что необходимо дифференцировать с одышкой. При
описании боли больной часто прижимает сжатую в кулак руку к грудине
или к области нижней части грудной клетки слева, прикасаясь к грудине
пальцами.
Приступ стенокардии напряжения обычно вызывается физическим или
эмоциональным напряжением, причем характерно возникновение боли
именно во время движения или стрессовой ситуации (испуга, страха, вол-
нения и др.), когда вследствие гиперкатехоламинемии происходят изме-
нения гемодинамики и метаболизма, сопровождающиеся повышением по-
требности миокарда в кислороде. Болевой синдром часто развивается при
выходе на улицу в холодную и ветреную погоду вследствие рефлекторной
вазоконстрикции, а следовательно, повышения постнагрузки. Типично его
появление после обильного приема пищи. Некоторые больные, особенно
с левожелудочковой недостаточностью, испытывают боль в горизонталь-
ном положении, когда из-за увеличения венозного притока к сердцу по-
вышается преднагрузка (angina decubitas). К вариантам стенокардии напря-
жения относятся и приступы боли, возникающие ночью во время снови-
дений, обычно эмоционально насыщенных, от которых больной просы-
пается, или при тахисистолических нарушениях ритма. Хотя эти приступы
формально развиваются в состоянии покоя, на самом деле они вызыва-
ются повышением потребности миокарда в кислороде в связи с предше-
ствующей им тахикардией и артериальной гипертензией, что легко можно
установить с помощью холтеровского мониторирования ЭКГ и монито-
ринга АД. Ниже перечислены основные клинические признаки приступов
стенокардии и факторы, с которыми связано их возникновение.
Порог развития ангинозной боли у одного и того же больного часто
меняется. Так, она может возникать при относительно небольшом напря-
жении в утренние часы и не возобновляться при нагрузках значительно
большей интенсивности в дневное время (’’стенокардия первого усилия”).
Ряд больных как бы “проходят сквозь стенокардию”, то есть боль исчезает
при продолжении выполнения физической нагрузки и не возобновляется.
303
Типичные признаки болевого спнарома, характерного для приступа
стабильной стенокардии напряжения
Признак
Характеристика
Локализация Иррадиация Характер Счем связан За грудиной В плечи, лопатки, руки до кисти, шею, нижнюю челюсть (чаще слева) Жгучий, пекучий, сжимающий Физическая нагрузка, эмоциональное напряжение, воздействие холода, обильный прием пищи, горизонтальное положение, сновидения
Продолжительность Чем облегчается 1—5 мин (до 15 мин) Прекращением нагрузки или приемом нитроглицерина (через 1—2 мин)
Объяснения этому факту не найдено. Высказывают предположение, что
причиной такого течения стенокардии является коронароспазм, который
спонтанно проходит при накоплении аденозина или продуктов метаболизма
ишемизированного миокарда, обладающих вазодилататорными свойствами.
Стенокардитическая боль длится в среднем 1—5 мин - всегда больше 1
и меньше 15 мин, причем всегда прекращается значительно быстрее, чем
развивается. Приступ проходит через 1—2 мин после прекращения нагруз-
ки или сублингвального приема нитроглицерина. Наступление облегче-
ния в более поздние сроки вызывает сомнение в отношении его ангиноз-
ного генеза. Для эффекта нитроглицерина при стенокардии характерны
также полнота купирования болевого синдрома и способность повышать
переносимость физических нагрузок.
Ангинозная боль часто сопровождается чувством нехватки воздуха, тош-
нотой, потливостью, иногда сердцебиением и головокружением.
Истинная стабильная стенокардия покоя, или спонтанная стенокар-
дия, обусловлена первичным уменьшением коронарного кровотока вслед-
ствие спазма без предшествующего повышения потребности миокарда в
кислороде. Это можно верифицировать, в частности, по данным холте-
ровского мониторирования ЭКГ по неизмененной ЧСС. В большинстве
случаев она сочетается со стабильной стенокардией Напряжения. Особой
формой изолированной стенокардии покоя является так называемая ва-
риантная стенокардия Принцметала (см. ниже).
В анамнезе у больных стенокардией часто отмечаются факторы риска
ИБС. Могут иметь место и перенесенные ранее инфаркты миокарда.
При клиническом обследовании специфические изменения
отсутствуют. Могут определяться признаки хронической сердечной недо-
статочности (вначале изолированной левожелудочковой, потом тоталь-
ной), кожные проявления ГЛП, атеросклеротическое поражение
периферических артерий, ожирение. Поскольку ишемия может вызывать
диастолическую, а в более тяжелых случаях систолическую дисфункцию
миокарда, во время приступа стенокардии иногда выслушивают прехо-
дящий III или IV тон, систолический шум митральной регургитации и
даже может развиться отек легких.
Для стабильной стенокардии, в отличие от нестабильной (см. ниже),
304
Рис. 59. Изменения фаз ПД и генез
изменений зубцов Т на ЭКГ при
острой субэндокардиальной и суб-
эпикардиальной ишемии миокарда
левого желудочка (ЛЖ)
Эпикард
Эндокард
Полость
ЛЖ
Эндокард
Задняя
стенка
ЛЖ
Норма
Эпикард
характерна примерно одина-
ковая частота и выраженность
ангинозных приступов или их
уменьшение на протяжении
нескольких последних месяцев.
Диагностика. Стандартная
электрокардиография в покое
имеет ограниченное значение.
Так, не менее чем у 50 % боль-
ных ее изменения, свойствен-
ные ишемии, в покое отсут-
ствуют, даже при выраженной
ИБС и на высоте приступа сте-
нокардии. Выявление таких из-
менений также имеет ограни-
ченное диагностическое зна-
чение, так как сходные изме-
нения наблюдаются и при дру-
гих заболеваниях сердца.
Признаками ишемии на
ЭКГ являются преходящие
или изменяющиеся в динами-
ке изменения сегмента ST и
в меньшей степени — зубца Т.
У больных стенокардией мо-
гут отмечаться также: 1) признаки рубцовых изменений после перенесен-
ных инфарктов миокарда; 2) нарушения ритма и проводимости; 3) неспе-
цифические изменения сегмента ST, зубца Т, и как правило, вольтажа
электрокардиографической кривой вследствие так называемых диффуз-
ных изменений в миокарде — мелких очагов склероза и др.
Хотя изменения зубца Т не специфичны для ишемии, определен-
ное диагностическое значение имеют следующие их особенности. В виде изо-
лированных изменений реполяризации они отражают функциональные на-
рушения электрофизиологических свойств миокарда при начальных про-
явлениях ишемии и в динамике либо подвергаются обратному развитию,
либо сменяются изменениями сегмента ST, в ряде случаев сочетаясь с
ними. Ишемические изменения зубца Т обусловлены замедлением репо-
ляризации в зоне поражения за счет 2-й и 3-й фаз ПД.
В толще миокарда ишемия вначале возникает в субэндокардиальных
305
слоях и при нарушении кровотока в достаточно крупном сегменте коро-
нарной артерии распространяется к эпикарду.
При субэндокардиальной ишемии направление волны репо-
ляризации не изменяется. При этом, однако, сохранение частично депо-
ля-ризованными ишемизированными клетками субэндокардиального слоя
своего отрицательного заряда в начале реполяризации приводит к увели-
чению разности потенциалов между ними и уже вышедшими из состоя-
ния возбуждения субэпикардиальными клетками (рис. 59). Это обусловли-
вает регистрацию в однополюсных отведениях, обращенных к эпикарди-
альной поверхности пораженного миокарда, высокоамплитудного
положительного остроконечного зубца Т.
Поскольку ветви коронарных артерий пронизывают миокард по
направлению от эпикарда к эндокарду, субэпикардиальная ишемия по
сути является трансмуральной, то есть охватывает всю толщу миокарда,
так как субэндокардиальные слои находятся в заведомо худших условиях
кровоснабжения. При этом активный электрод регистрирует преимуще-
ственное изменение потенциалов тех участков миокарда, которые нахо-
дятся ближе к нему, а изменения в субэндокардиальной зоне остаются
замаскированными.
При острой субэпикардиальной, то есть трансмуральной,
ишемии реполяризация субэпикардиальных слоев замедляется, вслед-
ствие чего этот процесс начинается в субэндокардиальных слоях. Вектор
реполяризации меняет свое направление на противоположное (см. рис. 59),
и в отведениях от эпикардиальной поверхности измененного миокарда
регистрируется глубокий отрицательный зубец Т.
Вызываемые острой ишемией изменения фаз ПД находят отражение
также на ЭКГ в отведениях от противоположной стенки желудочка (см.
рис. 59). Эти изменения называются дискордантными и не имеют
самостоятельного значения. Так, при ишемии субэндокардиальных слоев,
к примеру, передней стенки левого желудочка, в однополюсных отведе-
ниях от эпикардиальной поверхности задней стенки регистрируется низ-
коамплитудный положительный зубец Т. Снижение амплитуды зубца Т
связано с влиянием противоположно направленного вектора реполяриза-
ции передней стенки, большей, чем в норме, величины. При начальной
ишемии субэпикардиальных слоев передней стенки в отведениях от эпи-
кардиальной поверхности противоположной, задней, стенки появляется
высокий остроконечный зубец Т. Увеличение его амплитуды обусловлено
тем, что векторы реполяризации обеих стенок имеют одинаковое направ-
ление, что приводит к их суммированию (см. рис. 59).
Изменения сегмента ST более специфичны для ишемии, чем
изменения зубца Т, и отмечаются при ее большей выраженности, так
называемом ишемическом повреждении . Развивающиеся при этом
обратимые метаболические и структурные изменения кардиомиоцитов, в
том числе их мембран, приводят, в частности, к частичной деполяриза-
ции клеток из-за утечки из них К+. В результате между ишемизированным
306
----------- J . , Рис. 60. Генез смещения сегмента ST на
/С— 2Х 3 I л I ЭКГ при субэндокардиальном (А) и суб-
/ fl -тт—Г'— эпикардиальном (трансмуральном) - Б
III у' -J.lj'.J ишемическом повреждении миокарда
у'4-) левого желудочка
/ //fas. ч к и неповрежденным миокардом в
(fl (rrir ИцРХ -JEr) течение всего сердечного цикла
\ к \ TLJ V сохраняется разность потенциа-
X. лов, которая служит источником
тока повреждения, вызывающего
смещение изолинии — сегмента ТР, которое создает впечатление откло-
нений сегмента ST. Изменения собственно сегмента ST обусловлены уко-
рочением ПД клеток при тяжелой ишемии.
При субэндокардиальном ишемическом повреждении
ток повреждения покоя направлен от эндокарда к неизмененным субэпи-
кардиальным слоям и регистрируется в виде подъема сегмента ТР в од-
нополюсном отведении над соответствующей областью миокарда (рис.
60). В период возбуждения более ранняя реполяризация ишемизирован-
ных клеток приводит к образованию тока от менее поляризованных субэ-
пикардиальных клеток к более поляризованным субэндокардиальным.
Таким образом, формируется депрессия сегмента ST, для кото-
рой характерны: 1) горизонтальная или косонисходящая форма; 2) амп-
литуда > 1 мм (0,1 мВ); 3) продолжительность > 0,08 с от точки J; 4) ре-
гистрация в одном или более отведениях. Смещение сегмента ST под изо-
линию в пределах 0,5—1 мм имеет меньшее диагностическое значение и
считается вероятным признаком ишемии.
Признаки субэпикардиального ишемического повреж-
дения отражают более глубокие изменения в миокарде, чем субэндо-
кардиального. Они имеют и более серьезный прогноз, так как могут при-
водить к некрозу миокарда.
При субэпикардиальном (трансмуральном) ишемическом повреждении
ток повреждения покоя, направленный от эпикарда к эндокарду, приво-
дит к смещению изолинии кверху (см. рис. 60). В фазе деполяризации уко-
рочение ПД ишемизированных субэпикардиальных клеток вызывает об-
разование тока повреждения, направленного от менее отрицательного
потенциала субэндокардиальных слоев к более отрицательно заряженным
субэпикардиальным, то есть к активному электроду. Таким образом, такое
повреждение проявляется подъемом сегмента ST. V) дугой кверху
или горизонтальной формы; 2) амплитудой > 1 мм; 3) в одном или более
отведениях от соответствующей стенки желудочка. Одновременно в отве-
дениях от противоположной стенки регистрируется дискордантная депрес-
сия сегмента ST. Она обусловлена воздействием на активный электрод на-
правленного к нему через толщу противоположной ишемизированной стен-
ки тока покоя в период диастолы и противоположно направленного тока
307
повреждения в период возбуждения. Таким образом, в случаях дискордан-
тного смещения сегмента ST субэпикардиальная (трансмуральная) ише-
мия локализуется в той области миокарда, электрическая активность ко-
торой характеризуется подъемом сегмента ST. По мере его приближения к
изолинии исчезает и дискордантная депрессия сегмента ST.
Ишемический подъем сегмента ST при “банальной” стабильной стено-
кардии встречается значительно реже, чем депрессия. Он более характерен
для относительно редкой особой формы стенокардии (Принцметала), а
также нестабильной стенокардии и ранней стадии инфаркта миокарда.
Для изменения сегмента ST и зубца Т в покое как признаков ИБС
характерна нестойкость с преходящим появлением или усугублением во
время эпизодов болевой или безболевой ишемии, что хорошо видно при
холтеровском мониторировании ЭКГ. Поскольку схожие нарушения
реполяризации могут быть обусловлены целым рядом других заболева-
ний, при их стабильности на ЭКГ, снятой в динамике, ишемический
генез становится проблематичным и требует уточнения с помощью дру-
гих методов исследования.
Холтеровское мониторирование ЭКГ позволяет регистрировать прехо-
дящие изменения сегмента ST и зубца Т по ишемическому типу и сопо-
ставлять их с наличием или отсутствием ангинозной боли, а также с
характером и выраженностью физической или эмоциональной нагрузки.
Соотнесение этих изменений с ЧСС, предшествовавшей развитию ише-
мии, дает возможность выявить ее спастический компонент, что имеет
важное значение для диагностики спонтанной стенокардии и ее особой
формы. Клиническая оценка общего количества и суммарной продолжи-
тельности ишемических эпизодов за 12—24 ч объективизирует выражен-
ность ИБС и эффект антиангинальной терапии. Метод позволяет также
диагностировать различные нарушения ритма и определять их связь с
ишемией, что важно для выбора лечения.
Нагрузочные, или стресс-тесты, являются самым ценным неинвазив-
ным методом диагностики ИБС. Они основываются на моделировании
под строгим врачебным контролем дозированного повышения потребно-
сти миокарда в кислороде и регистрации признаков ишемии, после по-
явления которых, или других критериев неадекватности нагрузки либо
достижения ее субмаксимального уровня, пробу прекращают. Общепри-
нятыми методами нагрузочного тестирования являются:
1) физические нагрузки на велоэргометре или тред-
милле. Они сопровождаются повышением ЧСС, пред- и постнагрузки
и сократимости миокарда. При этом для оценки потребления организмом
кислорода используют показатель двойного произведения.
2) электрокардиостимуляция — предсердная (из пра-
вого предсердия) или занявшая ее место в последние годы чреспище-
водная. В основе метода лежит повышение потребности миокарда в
кислороде путем практически изолированного увеличения ЧСС без изме-
нения АД и сократимости миокарда;
3) фармакологическая проба с изопротеренолом, вызываю-
щим повышение ЧСС и сократимости миокарда. Другие общепринятые
фармакологические пробы основываются на провокации ишемии путем
изменения тонуса коронарных артерий — их дилатации (дипиридамол)
или сужения (эргометрин).
При каждой из этих методик нагрузочного тестирования могут ис-
пользоваться различные методы регистрации ишемии: 1) электрокарди-
ография; 2) сцинтиграфия миокарда с 20,Т1; 3) двухмерная эхокардио-
графия.
Показаниями к проведению нагрузочных тестов являются: 1) ди-
агностика ИБС при атипичном болевом синдроме, неспецифических из-
менениях ЭКГ и ГЛП при отсутствии типичной ангинозной боли; 2)
количественное определение коронарного резерва и функционального
состояния сердечно-сосудистой системы в целом для оценки прогноза,
тактики лечения, трудовых рекомендаций; 3) оптимизация подбора ан-
тиангинальных препаратов.
Абсолютными противопоказаниями являются: 1) ранние сро-
ки инфаркта миокарда (см. ниже) и нестабильная стенокардия; 2) тяже-
лые нарушения сердечного ритма и проводимости; 3) тяжелая сердечная
и дыхательная недостаточность, а для проб с физической нагрузкой —
также острый тромбофлебит. Основными относительными противопока-
заниями служат: высокая артериальная гипертензия (свыше 200/130 мм
рт.ст.), тахикардия более 100 в 1 мин, тяжелые аритмии и обмороки в
анамнезе. Нагрузочные тесты с электрокардиографическим контролем не-
целесообразны при блокадах ножек пучка Гиса в связи с невозможнос-
тью оценить изменения конечной части желудочкового комплекса.
В клинической практике наиболее широко используют простые пробы
с дозированным увеличением устанавливаемой исследователем мощнос-
ти физической нагрузки на велоэргометре или тредмилле с электрокардио-
графическим контролем. На всем протяжении периодов нагрузки и отды-
ха проводят мониторинг клинических симптомов и признаков, АД и ЭКГ
(ЧСС, нарушения ритма и проводимости, изменения желудочкового ком-
плекса). Велоэргометр представляет собой специально оборудованный
велосипед, а тредмилл — бегущую с различной скоростью дорожку с
меняющимся углом подъема. Ходьба на тредмилле более физиологична,
удобна и легче переносится больным, чем педалирование на велоэрго-
метре в положении сидя и особенно лежа. Используются субмаксималь-
ные или пороговые пробы. Субмаксимальной является нагрузка, состав-
ляющая 75—85 % от максимальной, то есть той, при которой достигается
максимальная аэробная способность, оцениваемая по отсутствию даль-
нейшего прироста поглощения кислорода. Определение субмаксимально-
го уровня нагрузки, который зависит от возраста и пола, базируется на
существовании тесной связи поглощения кислорода с МОС и ЧСС. О нем
судят по достижению определенной ЧСС, которую определяют по спе-
циальным таблицам или номограммам, исходя из возраста и пола или,
309
ориентировочно, как 220 минус возраст для мужчин и 200 минус возраст
для женщин. Если критерии прекращения пробы (см. ниже) появились до
достижения субмаксимального уровня ЧСС, она считается пороговой.
Пробы с физической нагрузкой обычно проводят по ступенчато возраста-
ющей методике при продолжительности каждой ступени 3—5 мин с перио-
дами отдыха между ступенями или без них. Реже при тредмилл-тесте ис-
пользуют протокол с постоянной нагрузкой, то есть ходьбой с одной и
той же скоростью с оценкой времени ее переносимости до появления
критериев прекращения пробы.
Критериями положительной пробы считают следую-
щие признаки ишемического ответа: 1) возникновение во время или сразу
после нагрузки приступа стенокардии; 2) снижение систолического АД
более чем на 15 мм рт.ст.; 3) депрессия сегмента ST горизонтальной или
косонисходящей формы > 1 мм (так называемая депрессия по ишемичес-
кому типу) продолжительностью > 0,08 с, по крайней мере в одном отве-
дении ЭКГ; 4) подъем сегмента ST > 1 мм; 5) продолжительность регист-
рации смещения сегмента ST > 3 мин.
Некоторые авторы относят к признакам ишемии повышение амплитуды
зубца R , обусловленное нарушением движения стенок левого желудочка
либо повышением его КДД и КДО вследствие ишемической дисфункции.
Пробу прекращают также при появлении других критериев не-
адекватности нагрузки:!) клинических — одышки, слабости, голо-
вокружения, цианоза, потливости, резкого повышения АД (свыше 230/130
мм рт.ст.); 2) электрокардиографических — частых (более 1:10) желудоч-
ковых экстрасистол, пароксизмальной тахикардии и тахиаритмии, нару-
шений проводимости, углубления и уширения зубцов Q и QS, снижения
амплитуды зубца R. Эти электрокардиографические изменения считают
неспецифичными для ИБС. Инверсия (образование отрицательных) и
реверсия (позитивизация исходно отрицательных) зубцов Т не являются
основанием для прекращения пробы.
Риск неблагоприятного исхода во время проведения тестов с физиче-
ской нагрузкой очень низкий - примерно 1 летальный исход на 20 000
исследований и 1 инфаркт миокарда на 3000.
Проба считается отрицательной при достижении субмаксималь-
ной ЧСС при отсутствии клинических и электрокардиографических при-
знаков ишемии миокарда и неинформативной (неопределенной)
при ее преждевременном прекращении из-за появления признаков не-
адекватности нагрузки, не связанных с ишемией, а также отказе больно-
го продолжать исследование.
Чувствительность нагрузочного тестирования с электрокардио-
графическим контролем, то есть процент положительных результатов среди
больных с верифицированной по данным коронарографии ИБС, колеблет-
ся от 65 до 75. По сводным данным мета-анализа результатов 150 исследова-
ний (R.Gianrossi и соавт., 1989), при использовании в качестве критерия
депрессии сегмента ST > 1 мм ее чувствительность составляет в среднем
310
68 %. При трехсосудистом поражении чувствительность нагрузочной про-
бы значительно выше, чем при однососудистом. Ее специфичность,
то есть процент отрицательных результатов среди лиц, у которых ИБС
отсутствует, находится примерно в тех же пределах (70—80 %). При оцен-
ке вероятности наличия ИБС в случаях положительного результата теста
необходимо учитывать характер клинических проявлений заболевания. Так,
у больных с типичными приступами стенокардии она составляет 98 %,
при атипичной боли в грудной клетке — 88 %, при неангинозном харак-
тере боли — 44 % и при отсутствии болевого синдрома — 33 %.
Поскольку депрессия сегмента ST при нагрузке не является строго
патогномоничной для коронарной недостаточности и свидетельствует толь-
ко об изменениях метаболизма миокарда, которые могут иметь и некоро-
нарогенное происхождение, возможны ложноположительные ре-
зультаты теста. Их частота достигает 10—15 % и возрастает при нали-
чии исходных изменений сегмента ST и зубца Т в покое, в том числе
связанных с приемом сердечных гликозидов и других препаратов, а так-
же у молодых женщин. Вероятность ложноположительного результата
снижается при большей выраженности ишемической депрессии сегмента
ST — свыше 2 мм. Этот критерий ряд специалистов рекомендуют исполь-
зовать вместо > 1 мм, что, однако, повышая специфичность метода, сни-
жает его чувствительность.
Основными причинами ложноположительных результатов являются:
1) гиперсимпатический синдром при нейроциркуляторной дистонии, про-
лапсе митрального клапана и других состояниях. При этом изменения на
ЭКГ не зависят от ЧСС, возникают в самом начале нагрузки и проходят
при ее продолжении; 2) внутриклеточная гипокалиемия, в том числе
развивающаяся при гипервентиляции вследствие дыхательного алкалоза;
3) тяжелая гипоксемия (например, при анемии); 4) низкий МОС и нару-
шения микроциркуляции при некоронарогенных заболеваниях миокар-
да, пороках сердца и др. При подозрении на ложноположительную нагру-
зочную пробу с электрокардиографическим контролем целесообразно про-
вести более информативное тестирование с 201Т1.
Ложноотрицательные результаты отмечаются в 4—14 % слу-
чаев. Их основными причинами являются: 1) незначительная выражен-
ность коронарного атеросклероза (стеноз < 50 % и хорошее развитие
коллатералей); 2) нивелировка признаков ишемии при их локализации
на противоположных стенках левого желудочка; 3) наличие исходных
изменений сегмента ST и зубца Т; 4) предварительное лечение антианги-
нальными препаратами.
При возникновении сомнений в истинности отрицательного резуль-
тата электрокардиографического теста с физической нагрузкой, а так-
же при его неинформативности следует прибегнуть к другим пробам, в
частности, чреспищеводной электрокардиостимуляции и дипирида-
моловой пробе с электрокардиографическим либо сцинтиграфическим
контролем.
311
Значение проб с дозированной физической нагрузкой при ИБС состо-
ит не только в установлении этого диагноза, но и оценке тяжести пора-
жения и прогноза для определения, в частности, показаний к хирурги-
ческому лечению. Прогностически неблагоприятными являются: низкая
толерантность к нагрузке, прекращение пробы из-за развития стенокар-
дии, снижение АД и выраженная депрессия сегмента ST.
Применение чреспищеводной элекгрокардиостимуля-
ции для диагностики ИБС показано при: 1) сомнительном или неопре-
деленном результате пробы с физической нагрузкой, например, ее пре-
кращении из-за повышения АД; 2) невозможности выполнения физи-
ческой нагрузки из-за заболеваний сосудов, суставов или мышц нижних
конечностей и детренированности больных.
Элекгрокардиостимуляцию проводят с помощью электрода, введенно-
го в пищевод до уровня левого предсердия, с поэтапным увеличением
частоты навязанного ритма на 10 или 20 в 1 мин до достижения 160 или
140 в 1 мин в зависимости от возраста. При появлении признаков ишемии
или неадекватности нагрузки стимуляцию прекращают, и ЧСС, а следо-
вательно, и потребность миокарда в кислороде, мгновенно возвращаются
к исходным показателям. Благодаря такой неинерционности чреспище-
водная элекгрокардиостимуляция является самым безопасным из всех на-
грузочных тестов. Ее чувствительность и специфичность при использова-
нии электрокардиографического контроля такие же, как и проб с физиче-
ской нагрузкой. Недостатком является определенный дискомфорт для боль-
ного, связанный с введением электрода и иногда с самой стимуляцией.
Фармакологические пробы с изопротеренолом (изадрином)
и дипиридамолом применяют для диагностики ИБС в тех же случаях, что
и элекгрокардиостимуляцию. Изадрин (изопротеренол), стиму-
лируя Р] и р2-адренорецепторы, повышает потребление миокардом кис-
лорода, что при стенозирующем атеросклерозе коронарных артерий мо-
жет вызывать его ишемию. Препарат вводят внутривенно капельно, по-
степенно увеличивая скорость инфузии, ориентируясь на повышение ЧСС,
которую при хорошей переносимости доводят до 130-150 в 1 мин в тече-
ние 3 мин, после чего пробу прекращают. При развитии ишемического
ответа его купируют с помощью нитроглицерина и р-адреноблокаторов.
Дипиридамол (курантил, п е р с а н т и н ) вызывает расши-
рение коронарных артерий за счет ингибирования аденозиндезаминазы и
накопления мощного вазодилататора аденозина. При наличии гемодина-
мически значимого стеноза это приводит к “межкоронарному обкрады-
ванию” и развитию и цемии. Препарат вводят внутривенно струйно из
расчета 0,75 мг/кг дробно в 3 приема. Для купирования ишемического
ответа используют нитроглицерин и специфический антагонист дипири-
дамола эуфиллин. Чувствительность обеих фармакологических проб с элек-
трокардиографическим контролем аналогична пробам с физической на-
грузкой, а специфичность несколько выше — 78—93 %.
312
Проба с эргометрином основывается на способности этого алка-
лоида спорыньи вызывать ишемию миокарда путем коронароспазма вслед-
ствие стимуляции серотонинергических и, возможно, а-адренергических
рецепторов. В связи с этим ее используют для диагностики вазоспастичес-
кого генеза, или компонента, стенокардии. Препарат вводят внутривен-
но струйно дробно, обычно по 0,05—0,15—0,3 мг (всего не более 0,5 мг).
Возникновение ангинозного приступа с подъемом сегмента ST расцени-
вают как результат спазма крупной субэпикардиальной коронарной арте-
рии, характерного для стенокардии Принцметала (см. ниже). Ангинозную
боль в сочетании с депрессией сегмента ST объясняют спазмом мелких
коронарных артерий как причины спонтанной стенокардии или компо-
нента стенокардии напряжения. Для купирования спастической реакции
используют нитроглицерин, оказывающий прямое дилатирующее дей-
ствие на крупные коронарные артерии. При спазме мелких сосудов, он,
однако, неэффективен. В связи с тем что вызываемый коронароспазм может
быть резистентным к нитроглицерину, принятому сублингвально, и ис-
чезать лишь после внутрикоронарного введения этого препарата или ни-
федипина (коринфара), эргометриновую пробу рекомендуют выполнять
только во время коронарографии. Проба сопряжена с повышенным риском
развития связанных с ишемией тяжелых осложнений, вплоть до терми-
нальных нарушений ритма и проводимости, а также инфаркта миокарда.
Это препятствует ее расширенному применению, несмотря на более вы-
сокую, по сравнению с другими тестами, диагностическую ценность.
Чувствительность и специфичность всех нагрузочных тестов повышает-
ся до 80-90 % при использовании для выявления очагов ишемии сцин-
тиграфии миокарда с201Т1 (см. главу 5). Исследование проводят дваж-
ды: после введения нуклида непосредственно перед прекращением нагрузки
и спустя 2—4 ч для дифференцирования ишемии, которая обратима, с острым
или “старым” инфарктом миокарда. Метод особенно информативен при
ложноположительных, ложноотрицательных и неопределенных результатах
нагрузочных проб с электрокардиографией, а также в случае невозможно-
сти использовать электрокардиографический контроль при наличии нару-
шений реполяризации (блокад ножек пучка Гиса, изменений сегмента ST и
зубца Тв покое и др.). При наличии множественных распространенных ише-
мических очагов информативность метода несколько снижается.
В случаях невозможности выполнения больным физической нагрузки для
выявления областей гипоперфузии сцинтиграфию с 201Т1 сочетают с дила-
тацией коронарных артерий с помощью внутривенного введения дипири-
дамола или аденозина. Уменьшая сопротивление коронарных артерий, они
вызывают 4—5-кратное увеличение коронарного кровотока в бассейнах неиз-
мененных сосудов и значительно менее выраженное при их стенозировании,
вследствие чего эти участки имеют вид относительно “холодных пятен”.
Изменения при сцинтиграфии с 99т Тс при стенокардии обычно отсут-
ствуют (см. главу 5). Однако в случаях ее тяжелого течения и дестабилизации
313
возможны мелкие очаги накопления нуклида, возможно, обусловленные
необратимым ишемическим повреждением отдельных групп клеток.
Рентгенография грудной клетки. У ряда больных изменения отсутствуют.
Могут определяться увеличение сердца, преимущественно левого желудоч-
ка, и признаки венозного застоя в легких, обусловленные сердечной недо-
статочностью вследствие коронарогенного поражения миокарда. Поражен-
ная атеросклерозом аорта часто развернута и может быть обызвествлена.
Радионуклидная вентрикулография, как и рентгеноконтрастная,и двухмер-
ная эхокардиография показаны для выявления зон асинергий левого желу-
дочка в покое и особенно для регистрации появления новых таких зон вслед-
ствие развития очаговой ишемии при нагрузке. Ценно то, что их возникно-
вение предшествует ишемическим изменениям на ЭКГ и болевому синдро-
му. У ряда больных определяются также признаки систолической и при ис-
пользовании более тонких методов - дистолической дисфункции левого
желудочка в целом, особенно снижение ФВ. Недостатком нагрузочной эхо-
кардиографии является ухудшение качества эхо-изображения полости ле-
вого желудочка при нагрузке из-за тахипноэ и тахикардии, что значительно
ограничивает ее применение. Этого недостатка лишена нагрузочная радио-
нуклидная вентрикулография, чувствительность и специфичность которой
достигают 95 %. Перспективным представляется проведение эхокардио-
графии при инфузии добутамина. При этом в случаях возникнове-
ния ишемии миокарда в пораженных сегментах, в отличие от участков с
адекватной перфузией, не развивается гиперкинезия. Эти методы позволя-
ют также определять количественные показатели кардиогемодинамики в
покое и при нагрузке, а также диагностировать аневризму левого желудоч-
ка, что важно для проведения адекватного лечения и оценки прогноза.
Представляется перспективным совершенствование и внедрение в прак-
тику определения жизнеспособности ишемических очагов с помощью по-
зитронной эмиссионной томографии (см. главу 5) (LDemer и соавт., 1989).
Кинокомпьютерная томография и ядерно-магнитный резонанс (см. гла-
ву 5) хорошо зарекомендовали себя для выявления и количественной
оценки зон кардиосклероза и локальных нарушений движения стенок
левого желудочка, а также определения проходимости наложенных аор-
токоронарных шунтов. В настоящее время, однако, предоставляемый ими
объем диагностически значимой информации при ИБС относительно
немного превышает возможности радионуклидных методов исследова-
ния и двухмерной эхокардиографии.
Лабораторные исследования выполняются для выявления и оценки вы-
раженности факторов риска ИБС и способствующих стенокардии факто-
ров — ГЛП, сахарного диабета, анемии. По показаниям определяют фун-
кцию щитовидной железы и сывороточную активность кардиоспецифи-
ческих ферментов для исключения острого инфаркта миокарда.
Коронарография (см. главу 5) является признанным “золотым стандар-
том” для выявления или исключения коронарной болезни сердца. Она
позволяет определить выраженность сужения коронарных артерий, его лока-
314
лизацию и количество значительно стенозированных коронарных артерий
(критерием такого сужения считается уменьшение площади просвета более
чем на 70 %).
Коронарография показана:
1) в сложных для диагностики случаях при боли в грудной клетке неяс-
ного генеза и сомнительных результатах неинвазивного обследования;
2) при стабильной и нестабильной стенокардии, рефрактерной к меди-
каментозной терапии, для решения вопроса о реваскуляризации — ТЛАП
либо аортокоронарном шунтировании;
3) при признаках выраженной прогностически неблагоприятной ишемии
по данным неинвазивных нагрузочных тестов (см. выше), которые позволя-
ют заподозрить тяжелое трехсосудистое поражение либо стеноз ствола левой
коронарной артерии, независимо от характера симптомов заболевания;
4) при ангинозной или напоминающей стенокардию боли в грудной
клетке у больных с аортальными и митральными пороками сердца для
диагностики сопутствующей ИБС;
5) при возобновлении болевого синдрома и других симптомов у боль-
ных, перенесших хирургическую реваскуляризацию миокарда, для оцен-
ки проходимости шунта или дилатированного с помощью баллончика уча-
стка стеноза.
В сочетании с провокационной внутривенной эргометриновой пробой
коронарографию используют для документального подтверждения коро-
нароспазма, особенно у больных с болью в грудной клетке, напоминаю-
щей ангинозную, и неизмененными либо малоизмененными коронарны-
ми артериями.
При проведении коронарографии выполняют также левостороннюю кон-
трастную вентрикулографию для оценки состояния кардиогемодинами-
ки, наличия и выраженности нарушений сегментарной сократимости и
сопутствующих поражений, например, клапанных пороков.
Классификация. В зависимости от функционального состояния больных
и переносимости ими физических нагрузок, что оценивается клинически,
классификация Канадской ассоциации кардиологов (1976) предусматри-
вает выделение 4 функциональных классов стабильной стенокардии на-
пряжения (табл. 24).
Распределение больных стенокардией на функциональные классы по
клиническим критериям просто и удобно для широкого практического
применения, однако довольно субъективно. Для объективизации оценки
функционального состояния больных, его динамики и эффекта лечения в
бывшем ВКНЦ АМН СССР (1984) была разработана классификация ста-
бильной стенокардии напряжения, базирующаяся на толерантности к фи-
зической нагрузке по данным велоэргометрического теста. В основу разде-
ления больных на функциональные классы положены величины двойного
произведения (ДП) на пороговом уровне нагрузки. К I функциональному
классу относятся больные с ДП > 278 ед., ко II - в пределах 218—277 ед.,
к III — 151—217 ед. и к IV — < 150 ед.
315
Таблица 24. Канадская классификация стабильной стенокардии напряжения
Функцио- нальный класс Условия возникновения стенокардии Ограничение обычной физической активности
I Повышенная физическая нагрузка Не ограничена
II Значительная физическая нагрузка: ходьба по ровному месту более 500 м, подъем более чем на один этаж. Вероятность возникновения приступов стенокардии увеличивается в холодную и ветреную погоду, при эмоциональном возбуж- дении и в первые часы после пробуждения Незначительно ограничена
III Незначительная физическая нагрузка: ходьба по ровному месту в пределах 100—500 м, подъем на один этаж Значительно ограничена
IV Малейшая физическая нагрузка (ходьба до 100 м). Характер- ны приступы стенокардии в покое, обусловленные повыше- нием потребности миокарда в кислороде* Неспособность вы- полнять любую фи- зическую нагрузку
* Редкие приступы стенокардии в покое не являются обязательным критерием отнесения
больного к IV функциональному классу.
Дифференциальная диагностика стенокардии с другими возможными
причинами боли в груди рассмотрена в специальной главе в т. 2.
Диагноз стенокардии и других хронических форм ИБС ставят на осно-
вании: 1) характерного болевого синдрома (стенокардия); 2) преходя-
щей болевой или безболевой депрессии или (реже) подъема сегмента ST
> 1 мм, в том числе в сочетании с изменениями зубца Т, в покое или при
нагрузке; 3) положительных нагрузочных проб (с физической нагруз-
кой, элекгрокардиостимуляцией, фармакологических) по данным сцин-
тиграфии миокарда с 201Т1, радионуклидной вентрикулографии или двух-
мерной эхокардиографии; 4) при отрицательном результате сцинтигра-
фии миокарда с "тТс и неизмененном уровне изофермента МВ КФК в
крови. Он подтверждается с помощью коронарографии.
Варианты течения и осложнения. Атипичные проявления стенокардии на-
пряжения встречаются примерно у 40 % больных и представляют иногда
значительные трудности для диагностики. К ним относятся:
1) атипичная локализация приступообразной боли — в надчревной об-
ласти, правой или левой половине грудной клетки, или изолированная
боль в местах иррадиации — под левой лопаткой, в нижней челюсти,
левой руке, горле и др.;
2) отсутствие иррадиации или ее нетипичная локализация (например,
только в правую руку, горло и др.);
3) отсутствие связи возникновения приступов боли с величиной рабо-
ты левого желудочка. Например, стенокардия может систематически раз-
виваться при относительно небольшой нагрузке — подъеме рук кверху,
одевании и отсутствовать при более тяжелой. Известен и феномен “про-
хождения сквозь боль”;
4) отсутствие эффекта от нитроглицерина;
316
5) приступообразное онемение левой руки как эквивалент боли;
6) приступы одышки без других проявлений сердечной недостаточности
как эквивалент боли.
Бессимптомное течение ИБС диагностируют при выявлении безболе-
вой ишемии миокарда в виде преходящей депрессии или подъема сег-
мента ST при холтеровском мониторировании ЭКГ или нагрузочных те-
стах. Механизм такой “немой" ишемии миокарда не вполне ясен. К воз-
можным причинам относят: 1) уменьшение освобождения медиаторов
боли; 2) нарушения чувствительности, например, нейропатия при сахар-
ном диабете; 3) повышение болевого порога; 4) меньшую выраженность
ишемии и нарушения функции левого желудочка.
Периоды “немой” ишемии миокарда часто сопутствуют болевым и
наблюдаются у 70—95 % больных стенокардией. При этом удельный вес
безболевых эпизодов значительно выше, чем болевых, — 70-90 %. Таким
образом, создается впечатление, что ангинозные приступы представля-
ют собой не более чем вершину ишемического “айсберга”.
Клиническое значение “немой” ишемии окончательно не установле-
но. Отдаленный прогноз у таких больных, по-видимому, такой же, как
при стенокардии. В то же время убедительные доказательства улучшения
выживаемости при ликвидации безболевой ишемии с помощью медика-
ментозной терапии отсутствуют.
В основе особой, или вариантной, формы спонтанной стенокардии —
стенокардии Принцметала — лежит спазм чаще крупной коронарной ар-
терии с развитием субэпикардиальной (трансмуральной) ишемии, в связи
с чем она называется также вазоспастической. В ряде случаев спазмиру-
ются более мелкие артерии, что приводит к субэндокардиальной ише-
мии. Морфологические изменения коронарных сосудов по данным коро-
нарографии весьма вариабельны — от отсутствия изменений просвета до
выраженного фиксированного стеноза. В большинстве случаев артерии мало
изменены. Патогенез спазма описан выше.
Стенокардия Принцметала встречается чаще у женщин в возрасте до
50 лет, которым при отсутствии тяжелой ГЛП, артериальной гипертен-
зии и сахарного диабета не свойственна “банальная” стенокардия напря-
жения. Для классической клинической картины заболевания характерно
возникновение ангинозных приступов в покое, чаще во время сна, но-
чью или под утро, с определенной цикличностью, при хорошей перено-
симости физической нагрузки. Если же стенокардия вызывается нагруз-
кой, это обычно случается по утрам. Она может провоцироваться также
гипервентиляцией. Такие приступы значительно чаще сопровождаются
нарушениями ритма и проводимости. Боль купируется сублингвальным
приемом нитроглицерина и нифедипином (фенигидином, коринфаром).
Инфаркты миокарда в анамнезе не характерны.
Типичными изменениями на ЭКГ являются преходящие подъемы,
изредка — депрессия сегмента ST во время ангинозного приступа. При
этом пробы с физической нагрузкой обычно отрицательные, что свиде-
тельствует о вероятном отсутствии существенного фиксированного стено-
за коронарных артерий. При холтеровском мониторировании ЭКГ опреде-
ляются безболевые эпизоды подъема сегмента ST в покое, возникающие
при неизмененной ЧСС и часто сопровождающиеся желудочковыми арит-
миями. Подтвердить диагноз позволяет эргометриновая проба с электро-
кардиографическим контролем или, что более информативно, демонст-
рацией спазма как обратимого сужения просвета артерии при коронарог-
рафии. Активность КФК и ее изофермента МВ в крови не изменена.
Основными осложнениями стабильной стенокардии являются: 1) не-
стабильная стенокардия; 2) инфаркт миокарда; 3) нарушения ритма; 4) вне-
запная смерть; 5) левожелудочковая недостаточность.
Лечение стабильной стенокардии предусматривает: 1) общие меропри-
ятия по устранению факторов риска ИБС и факторов, способствующих
возникновению ангинозных приступов; 2) купирование и предотвраще-
ние приступов путем медикаментозной терапии; 3) лечение, направлен-
ное на улучшение выживаемости больных.
Устранение факторов риска ИБС включает в себя прекращение куре-
ния, коррекцию повышенного АД, содержания сахара в крови, массы
тела и ГЛП с помощью соответствующей диеты и при необходимости
медикаментозных препаратов (см. главу 8). Последнее рекомендуется глав-
ным образом больным в возрасте до 60 лет, так как в более пожилом
возрасте эффект активных гиполипидемических мероприятий в отноше-
нии уменьшения выживаемости менее выражен.
Устранение факторов, способствующих возникновению приступов сте-
нокардии предусматривает устранение причин увеличения потребности
миокарда в кислороде. Рекомендуют избегать физических нагрузок такого
уровня, который обычно вызывает боль, а также эмоциональных факто-
ров. При этом нельзя стремиться к иммобилизации больного “с запа-
сом”, что отрицательно влияет на другие факторы риска и психологичес-
кое состояние. Важно стремиться избегать физических нагрузок на фоне
других провоцирующих факторов, вызывающих увеличение механичес-
кой работы сердца, - в холодную, ветреную, влажную погоду, после
обильной еды, при волнениях, а также утром сразу после сна. Когда это
нельзя предотвратить, рекомендуют в профилактических целях прини-
мать нитроглицерин. При лечении сопутствующих заболеваний необхо-
димо избегать лекарственных препаратов, способствующих повышению
потребности миокарда в кислороде. По показаниям следует корригиро-
вать анемию, тиреотоксикоз, сердечную недостаточность и аритмии.
При умеренной выраженности стенокардии увеличению переносимо-
сти нагрузок и ишемического порога способствуют регулярные дози-
рованные физические тренировки, которые лучше начинать
по возможности под врачебным контролем. Этот эффект обусловлен дос-
тижением большей экономичности гемодинамического обеспечения на-
грузок, то есть выполнением каждой данной величины работы при мень-
шем приросте ЧСС и АД. Кроме того, физические тренировки оказывают
318
Таблица 25. Влияние амтнаигинальиых препаратов на потребность миокарда
в кислороде и его доставку
Показатель Нитраты р-Адрено- блокаторы Блокаторы кальциевых каналов
Факторы, определяющие потребность миокарда в кислороде. Систолическое АД (о^, посгнагрузка 1 1 II
левого желуцочка) КДО (ощ, преднагрузка левого желудочка) ш ? 1—»
ЧСС ?-> 4» 4- 4-
Сократимость миокард а —) II
Факторы, определяющие доставку кислорода миокарду. Сопротивление коронарных артерий II 4-4*4-
Диастолическое сдавление мелких сосудов 111 —4
миокардом левого желудочка Продолжительность диастолы —4 ттт
Примечание. омс — максимальное систолическое стеночное напряжение; — конечно-
диастолическое стеночное напряжение; * — эффект зависит от препарата: верапамил и
дилтиазем уменьшают ЧСС, а нифедипин увеличивает ее рефлекторным путем; f —
увеличение, 1 — уменьшение показателя; -> - изменения показателя отсутствуют.
гиполипидемическое действие, способствуют снижению массы тела и пре-
кращению курения. Рекомендуют ходьбу, бег трусцой, плаванье, езду на
велосипеде или тренировки на велоэргометре не менее 3 раз в неделю в
течение 30 мин при ЧСС, равной 75 % от ее величины на пороговом уров-
не нагрузки по данным предварительно проведенной нагрузочной пробы.
При этом необходимо избегать приступов стенокардии, а не “проходить
через боль”. Следует отметить, однако, что способность физических тре-
нировок вызывать развитие коллатералей при отсутствии эпизодов ише-
мии миокарда, а также статистически достоверно предотвращать инфаркт
миокарда и улучшать выживаемость больных не доказана.
Важное значение имеет психологическая коррекция, направ-
ленная на более оптимистичное отношение больного к своему будущему.
К рекомендации оставить работу в каждом случае подходят очень взве-
шенно, советуют облегчить условия труда.
Медикаментозная терапия стабильной стенокардии включает купирова-
ние ангинозных приступов и их предотвращегше. Она базируется на изоли-
рованном или сочетанном применении препаратов 3 основных групп: нит-
ратов, р-адреноблокаторов и блокаторов кальциевых каналов. В основе их
ангиангинального эффекта лежит способность оказывать положительное вли-
яние на потребность миокарда в кислороде и (или) его доставку (табл. 25).
Купирование приступа стенокардии. Препаратами выбора для купирования
приступа стенокардии являются нитраты . Их антиангинальный эффект
обусловлен главным образом действием на системную гемодинамику,
319
преимущественно путем дилатации вен, что вызывает увеличение их ем-
кости, уменьшение венозного возврата, КДО и КДД в левом желудочке,
то есть его преднагрузки. Проникая внутрь гладкомышечной клетки, нит-
раты превращаются в нитриты, затем окись азота, которая, действуя по-
добно эндотелиальному фактору расслабления, вызывает увеличение внут-
риклеточного содержания цГМФ. Последний ускоряет выход из клеток
Са2+, и тем самым вызывает их расслабление. Исходно сниженный МОС
благодаря такой гемодинамической разгрузке левого желудочка возраста-
ет, а неизмененный — несколько снижается в соответствии с законом
Франка—Старлинга. Уменьшение овд приводит к улучшению перфузии су-
бэндокардиальных слоев желудочка. Кроме того, нитраты вызывают рас-
ширение коронарных артерий и улучшение коллатерального кровотока,
что при спастическом компоненте стенокардии обеспечивает увеличение
кровотока в ишемизированном миокарде, однако имеет значительно мень-
шее значение у больных с выраженным стенозирующим атеросклерозом
при исчерпании коронарного расширительного резерва. В больших дозах
они способны расширять периферические артериолы, приводя к умень-
шению ОПСС и постнагрузки.
Наряду со снижением венозного притока к сердцу нитраты оказывают со-
судорасширяющее действие на сосуды легких с уменьшением в них давле-
ния, поэтому их применяют при лечении острой и хронической левожелудоч-
ковой недостаточности. Благодаря своему неспецифическому фармакодина-
мическому действию препараты вызывают также расслабление гладких мышц
бронхов, желчевыводящих путей, пищеварительного канала, мочеточников и
матки. Окись азота обладает также способностью ингибировать адгезивность
тромбоцитов.
Побочными эффектами нитратов, обусловленными вазодилатацией, яв-
ляются: 1) головокружение и ортостатический коллапс вследствие резкого
снижения МОС и артериальной гипотензии, чему способствует абсолютная
или относительная гиповолемия. Эго может приводить к уменьшению пер-
фузионного давления в коронарных артериях. Снижение АД на 10 мм рт.ст.
является закономерным; 2) тахикардия из-за рефлекторного повышения сим-
патического тонуса при возбуждении барорецепторов зон низкого и высоко-
го давления; 3) головная боль и ощущение пульсации в голове в результате
дилатации венозных сосудов мозга.
Существенным недостатком является развитие толерантности и синдро-
ма отмены (см. ниже). Препараты противопоказаны при глаукоме, повышении
внутричерепного давления и нарушениях мозгового кровообращения.
Для купирования ангинозных приступов применяют главным образам
нитроглицерин в виде таблеток по 0,5 мг (за рубежом по 0,3, 0,4 и 0,6 мг),
1 % спиртового раствора (3-4 капли соответствуют примерно 0,5 мг для
сублингвального приема, а также аэрозоля для ротовой полости (0,4 мг
препарата в каждой порции), буккальных аппликаций и 1 % водного ра-
320
Таблица 26. Периферические вазодилататоры, используемые при лечении стенокардии,и
их примерные дозы
Препарат Способ введения Разовая доза Частота приема
Нитраты
Нитроглицерин:
2 % мазь Накожно 1—5 см Каждые 3—4 ч
“пластырь” То же 5—10 мг/см2 1 раз в сутки
раствор В вену 0,6—12 мг/ч Капельно
Изосорбида динитрат Внутрь 20-60 мг Каждые 6-8 ч
(нитросорбид) В вену 1,25—5 мг/ч Капельно
Изосорбида мононитрат Внутрь 20 мг Каждые 12 ч
Препараты депо-нитроглице- То же в таблетке Каждые 6—8 ч
рина (сустак-форте, нигронг- 6,4—6,5 мг
форте и др.)
Малсидомин (корватон, 2-4 мг Каждые 8 ч
сцднофарм)
створа в ампулах по 2 мл для внутривенного капельного введения. Кроме
того, имеются различные пролонгированные формы для предотвраще-
ния приступов стенокардии.
При сублингвальном приеме действие начинается через 1 мин, достигает
максимума через 2-5 мин и начинает уменьшаться через 15 мин. Спустя 45 мин
препарат полностью выводится из организма, метаболизируясь в печени. Для
купирования боли часто бывает достаточно 0,3 мг, но при необходимости
разовую дозу можно увеличить в среднем до 0,6 мг. При отсутствии эффекта
прием препарата можно повторить дважды с интервалом 5 мин. Больному
необходимо рекомендовать принимать нитроглицерин при первых признаках
боли, находясь в положении сидя или полулежа, а при отсутствии эффекта
срочно обращаться за медицинской помощью. Поскольку препарат быстро
разрушается, особенно при доступе воздуха и на свету, его следует хранить в
стеклянном флаконе с плотно притертой пробкой в темном месте и менять
запас каждые 6 мес. О сохранении его активности свидетельствуют ощущение
жжения языка, прилива крови клицу и головная боль.
Специальная форма изосорбида динитрата для сублингвального приема в
таблетках по 2,5—5 мг действует более медленно, а скорость всасывания его
формы, предназначенной для разжевывания, весьма непостоянна. В связи с
этим препарат не имеет преимуществ перед нитроглицерином.
При недостаточной эффективности или плохой переносимости нитратов
для сублингвального приема может оказаться полезным нифедипин (фе-
нигидин, коринфар) в дозе 10 мг (под язык или разжевать).
Для предотвращения приступов стенокардии при ее плановом лечении
широко используют различные нитраты с пролонгированным дей-
ствием (табл. 26); 2 % нитроглицериновую мазь дозируют, выдавливая из
тюбика столбик определенной длины. Действие начинается через 15—30 мин
и сохраняется 3—4 ч. Накожные аппликации 5-30 мг препарата в виде пласты-
321
ря обеспечивают его медленное освобождение в течение 12—24 ч, что удобно
для предотвращения ангинозных приступов в ночное время. Среди таблети-
рованных нитратов пролонгированного действия в настоящее время наибо-
лее широко применяют изосорбида ди- и мононитрат (см. табл. 26). Всасыва-
емый в кишечнике изосорбида динитрат превращается в активные моно-
нитраты только после метаболизации в печени. Этого не требуется для изо-
сорбида мононитрата, что обусловливает большую продолжительность его
действия и в ряде случаев более выраженный эффект. Назначают также пре-
параты депо-нитроглицерина сустак-форте, нитронг-форте и др. Длитель-
ность их эффекта зависит от выраженности стенокардии. Нитраты показаны
при частых ангинозных приступах (не реже 1 раза в сутки), особенно при
сочетании стенокардии с левожелудочковой недостаточностью.
Эффективность нитратов пролонгированного действия значительно ли-
митируется развитием толерантности при их непрерывном приеме, что
сопровождается уменьшением их антиангинальной активности и требует
повышения дозы для сохранения прежнего действия. Толерантность обус-
ловлена потреблением в результате длительного взаимодействия с нитра-
тами сульфгидрильных (SH) групп сосудистой стенки, необходимых для
их превращения в нитриты, что приводит к уменьшению образования внут-
риклеточного и цГМФ. Время ее развития, по-видимому, вариабельно (не-
деля?) и находится в обратной зависимости от дозы. Чувствительность
восстанавливается после перерыва в лечении 12-18 ч. Отмечается перекре-
стная толерантность различных нитратов друг с другом. Она не свойствен-
на принимаемому сублингвально короткодействующему нитроглицерину.
При резком прекращении приема нитратов, особенно больших доз,
возможен синдром отмены, характеризующийся учащением ангинозных
приступов, вплоть до развития коронароспазма. Вследствие этого дозу
препаратов следует уменьшать постепенно.
Р - А д р е н о б л о к а т о р ы предотвращают возникновение приступов ста-
бильной стенокардии и повышают ишемический порог благодаря сниже-
нию потребности миокарда в кислороде за счет уменьшения хронотропной
и инотропной реакции на адренергическую стимуляцию путем блокады соот-
ветствующих эффектов катехоламинов и конкуренции с агонистом за взаимо-
действие с рецепторами. Вследствие снижения АД за счет уменьшения МОС
и уровня ренина в крови они вызывают также снижение постнагрузки. Как
и при действии нитратов, уменьшение потребности в кислороде приводит
к метаболически опосредуемой вазоконстрикции в неишемизированных
участках миокарда и перераспределению кровотока через коллатерали в очаг
ишемии в результате образовавшегося градиента давления. Кроме гипотен-
зивного эффекта, к преимуществам p-адреноблокаторов перед другими анти-
ангинальными средствами относятся антиаритмическое действие за счет
мембраностабилизирующей активности и нивелирования проаритмических
эффектов катехоламинов и, возможно, способность предотвращать инфаркт
миокарда и внезапную смерть. Этот факт окончательно не доказан. Необходи-
мо иметь в виду, что при спастическом компоненте или генезе стенокардии
322
ji-Адреноблокаторы
Карвиоселективные j^-адреноблокаторы
Без внутренней С внутренней
симпатомиметической симпатомиметической
активности
активностью
Некардиоселективные^адренодлокаторы
у/ С внутренней
Без внутренней симпатомиметической
симпатомиметической активностью
активности |
АиеВутолол
Атенолол
Метопролол
Бетаксолол
Практолол
наволол
Пропранолол
Согалол
Тимолол
Алпренолол
Окспренолол
Пинволол
Сочетанный a^ji-авреновлокатор-лабеталал
Схема 12. Классификация р-адреноблокаторов
блокада 0-адренергических рецепторов может усугублять ишемию вследствие
превалирования сосудосуживающего влияния на коронарные артерии возбуж-
дения а-адренорецепторов.
Серьезные побочные действия включают провокацию бронхоспазма,
ухудшение периферического кровообращения (по той же причине, что и
возможное ухудшение коронарного), отрицательный инотропный эффект, раз-
витие брадикардии и нарушений атриовентрикулярной (но не внутрижелудоч-
ковой!) проводимости, импотенцию. При длительном приеме препараты могут
давать атерогенный эффект за счет повышения содержания в крови ЛПНП и
триглицеридов, что ограничивает их длительное применение у больных моло-
дого возраста со склонностью к ГЛП. Менее тяжелыми осложнениями являются
слабость, депрессия, снижение умственной работоспособности, задержка соли и
подверженность больных сахарным диабетом гипогликемии. Резкая отмена пре-
паратов может способствовать развитию ишемии миокарда из-за повышения чув-
ствительности к симпатической стимуляции, вплоть до инфаркта, возникнове-
нию нарушений ритма и даже внезапной смерти (синдром отмены), поэтому
дозу следует снижать постепенно.
0-Адреноблокаторы противопоказаны при бронхообструктивных заболе-
ваниях легких, тяжелых заболеваниях периферических артерий (облитериру-
ющий атеросклероз, синдром Рейно), атриовентрикулярной блокаде, выра-
женной брадикардии и артериальной гипотензии. Сердечная недостаточность
в настоящее время считается относительным противопоказанием (см. гла-
ву 11). Нежелательно назначать эти препараты больным, получающим инсу-
лин, а также страдающим язвенной болезнью.
Различные представители 0-адреноблокаторов (схема 12, табл. 27) суще-
ственно не отличаются по своей антиангинальной активности. 0,-Селек-
тивные препараты (метопролол, атенолол) в умеренных дозах практически
не ухудшают бронхиальную проходимость и периферический кровоток,
тогда как в высоких дозах их кардиоселективность утрачивается. Препара-
323
И
Таблица 27. б-Адреноблокаторы, используемые нрн лечении стенокардии, и их примерные дозы
5 О
й и ч
Т
5 S u X.
яиич
и
ччч
ты с внутренней симпатомиметической ак-
тивностью (пиндолол и др.) могут вызы-
вать расширение периферических артерий
и в значительно меньшей степени урежают
ЧСС в покое, что уменьшает вероятность
возникновения брадикардии.
Собственная симпатомиметическая актив-
ность представляет собой парадоксальную спо-
собность некоторых 0 -адреноблокаторов ока-
зывать определенное влияние на те же рецеп-
торы в качестве агонистов. Жиро-
нерастворимые р-адреноблокаторы (атено-
лол, надолол) обладают большей продол-
жительностью действия и хуже проникают
в центральную нервную систему, вызывая
меньше соответствующих побочных эф-
фектов.
Дозу препарата подбирают путем титро-
вания до достижения ЧСС в покое в преде-
лах 55-60 в 1 мин и не более 90—100 в 1
мин при физической нагрузке. Бессимптом-
ная брадикардия в покое не является осно-
ванием для прекращения лечения. Увеличе-
ние дозы повышает как выраженность анти-
ангинального эффекта, так и вероятность
побочных явлений, что требует тщательного
контроля.
Блокаторы кальциевых кана-
лов уменьшают количество функцио-
нирующих каналов и воздействуют на вре-
мя их активации, инактивации и восста-
новления. Это приводит к нормализации
патологически увеличенного трансмемб-
ранного тока Са2+ внутрь гладкомышечных
клеток миокарда и сосудистой стенки и
уменьшению потребления АТФ за счет сни-
жения активности Са2+-зависимой мио-
фибриллярной АТФ-азы. Антиангинальный
эффект этих препаратов обусловлен: 1) от-
рицательным инотропным действием;
2) отрицательным хронотропным действи-
ем вследствие уменьшения автоматизма си-
нусового узла (верапамил, дилтиазем);
3) системной вазодилатацией, вызывающей
уменьшение ОПСС и постнагрузки; 4) ди-
324
Таблица 28. Наиболее распространенные блокаторы кальциевых каналов, их дозы
п влияние на сердце н сосуды
Доза и влияние на сердечно-сосудистую систему Верапамил (изоптин, фииоптин) Дилтиазем (кардил) Нифедипин (адалат, кориифар, кордафен, феннгидни)
Доза:
разовая, мг 80-120 60-90 10-20
суточная (в 2—3 приема), мг 240-360 180-240 40-120
ЧСС 1 1 т
Атриовентрикулярная проводимость ш 11 или 1 0
Системная вазодилатация тт г ттт
Коронарная вазодилатация тг ТГ ттт
Сократимость миокарда 11 1 0
Примечание. Т — увеличение, I - уменьшение показателя.
латацией коронарных артерий и предотвращением коронароспазма. Эти
свойства неодинаково выражены у различных представителей этой груп-
пы (табл. 28).
Согласно классификации A.Fleckenstein, блокаторы кальциевых кана-
лов подразделяются на три большие группы — А, В и С. К группе А отно-
сятся мощные средства с высокой специфичностью действия, которые
блокируют ток Са2+ внутрь клетки на 90—100 % без существенного измене-
ния тока Na+. Они включают верапамил (изоптин, финоптин), дилтиа-
зем (кардил) и производные дигидропиридина: нифедипин (адалат, ко-
ринфар, фенигидин), исрадипин, никардипин и др. Препараты группы В
обладают умеренно выраженными специфическими свойствами, блоки-
руя ток Са2+ на 50-70 %. Наиболее распространенным представителем
этой группы является циннаризин. Наконец, к группе С относят слабые,
неспецифичные блокаторы - пропранолол, индометацин, фентоин и др.
В качестве антиангинальных и антигипертензивных средств используют
исключительно препараты группы А.
Хотя блокаторы кальциевых каналов особенно показаны при вазо-
спастической стенокардии, они эффективны также при стабильной сте-
нокардии напряжения и особенно покоя, в меньшей степени при неста-
бильной стенокардии. Их преимуществами являются также антиагрегант-
ное действие, возможность использования при бронхоспазме, заболева-
ниях периферических сосудов и тяжелом течении сахарного диабета, до-
полнительный гипотензивный и антиаритмический (верапамил) эффек-
ты. При ишемии препараты оказывают также прямое защитное действие
на миокард за счет предупреждения перегрузки клеток Са2+. Представля-
ет интерес их антиатерогенный эффект (нифедипин, исрадипин) за счет
замедления прогрессирования атеросклеротических изменений и тормо-
жения миграции гладкомышечных клеток в поврежденную интиму.
Как видно из данных табл. 28, различные представители блокаторов
кальциевых каналов отличаются своими преимущественными точками
325
приложения. Нифедипин действует главным образом как артериолярный
вазодилататор, что определяет также характер его побочных явлений, к
которым относятся рефлекторная тахикардия, артериальная гипотензия,
“приливы”, головокружение и периферические отеки. Вазодилатирующий
эффект нифедипина полностью нивелирует его отрицательное инотроп-
ное действие и может приводить к повышению МОС. Верапамил и в мень-
шей степени дилтиазем оказывают преимущественное действие на сокра-
тительный миокард, синусовый и атриовентрикулярный узел и обладают
антиаритмическими свойствами. Они могут усугублять застойную сердеч-
ную недостаточность, выраженную синусовую брадикардию и атриовент-
рикулярную блокаду и противопоказаны при наличии этих осложнений,
особенно двух последних.
Основанием для применения дезагрегантов при ИБС является роль
тромбоцитов в развитии атеросклероза и его осложнений. Сведения об их
эффективности при стабильной стенокардии противоречивы. Наряду с дан-
ными об отсутствии влияния на общую летальность больных со стабильной
стенокардией — мужчин по сравнению с плацебо (R.Peto и соавт., 1988)
имеются указания на уменьшение риска развития инфаркта миокарда на
44 % (Steering Committee of the Physicians Health Study Research Group, 1989)
и даже 88 % (P.Rider и соавт., 1991). Результаты мета-анализа 29 000 наблю-
дений свидетельствуют о снижении частоты сосудистых осложнений, вклю-
чая инфаркт миокарда и инсульт, на 30 % и смертности от них на 15 %
(Antiplatelet Trialists’ Collaboration, 1988).При этом ацетилсалициловая кис-
лота (аспирин), дипиридамол и сульфинпиразон (антуран) дают примерно
одинаковый эффект. Наиболее широкое распространение получила ацетил-
салициловая кислота, угнетающая синтез простагландинов и арахидоновой
кислоты путем ингибирования циклооксигеназы. В малых дозах она оказы-
вает действие преимущественно на тромбоциты, препятствуя образова-
нию в них тромбоксана А2, а в очень больших нарушает также синтез
простациклина эндотелием сосудистой стенки, что, однако, не имеет су-
щественного клинического значения. Для получения антитромбоцитарного
эффекта в большинстве случаев рекомендуют назначать по 80-325 мг пре-
парата 1 раз в сутки утром после еды. Применение антикоагулянтов непря-
мого действия у больных со стабильной стенокардией нецелесообразно.
Подход к медикаментозному лечению больных со
стабильной стенокардией. При умеренно выраженной стенокар-
дии лечение начинают с монотерапии с использованием одного из трех
классов антиангинальных препаратов. Выбор осуществляют в известной
мере эмпирически с учетом вероятного ведущего патофизиологического
механизма ишемии (стеноз, спазм), функционального состояния сердеч-
но-сосудистой системы (наличие артериальной гипертензии, сердечной
недостаточности и др.) и сопутствующих заболеваний, с одной стороны,
и особенностей действия каждого из препаратов на гемодинамику — с
другой. При “чистой” стенокардии напряжения предпочтительнее приме-
нять p-адреноблокаторы, а при вазоспастическом компоненте — антаго-
нисты кальция, которые эффективны и при других формах стенокардии.
Из-за тахифилаксии нитраты используют реже, в основном у больных
326
Таблица 29. Побочные эффекты основных аитиангинальных препаратов
Побочный эффект Нитраты р- Адрено- блокаторы Блокаторы кальциевых каналов
Верапамил Дилтиазем Ннфеднпин
Головная боль +++ 0 + + ++
Артериальная гипотензия о, + +++ ++ + +++
Систолическая дисфункция левого 0 ++ ++ + 0
желудочка Синусовая брадикардия 0 +++ ++ 4-4- 0
Нарушение атриовентрикулярной 0 ++ +++ + 0
проводимости Синусовая тахикардия 4- 0 0 0 ++
Толерантность ++ 0 ? ? +
Синдром отмены + + 0 0 0
пожилого возраста в сочетании с ограничением физической активности.
Хотя в адекватных дозах действие этих препаратов примерно одинаковое,
при недостаточном эффекте следует по возможности попытаться заме-
нить одну группу препаратов другой или один блокатор кальциевых кана-
лов другим. К использованию комбинации двух антиангинальных препаратов
прибегают только после попытки применения монотерапии с использо-
ванием достаточно больших доз! С учетом характера влияния на гемодина-
мику рациональны следующие комбинации, дающие аддитивный эффект
и отчасти нивелирующие побочные действия друг друга, которые могут
повышать потребность миокарда в кислороде (табл. 29): а) р-адреноблока-
тор + нитрат; б) верапамил или дилтиазем + нитрат; в) нифедипин + р-
адреноблокатор (очень осторожно дилтиазем + р-адреноблокатор); г) нифе-
дипин + дилтиазем. Нецелесообразно сочетать нифедипин с нитратами из-
за вероятности усугубления тахикардии и головной боли и верапамил с р -
адреноблокаторами из-за опасности развития сердечной недостаточности,
артериальной гипотензии, брадикардии, атриовентрикулярной блокады.
В тяжелых случаях используют комбинацию трех препаратов: р-адрено-
блокатор + нифедипин + нитрат. Важное значение имеет адекватная кор-
рекция АД при артериальной гипертензии, а также нарушений ритма. У
больных с сопутствующей сердечной недостаточностью соответствующее
лечение, способствуя уменьшению дилатации левого желудочка и ЧСС и
улучшению субэндокардиальной перфузии, дает дополнительный анти-
ангинальный эффект. Таким больным, как и перенесшим инфаркт мио-
карда, в первую очередь показана ацетилсалициловая кислота.
В рефрактерных к медикаментозной терапии случаях временный эффект
могут давать эфферентные методы — плазмаферез и гемосорбция, повышаю-
щие чувствительность клеточных рецепторов к лекарственным препаратам.
Кроме клинических данных для оценки эффективности антиангиналь-
ной терапии и оптимизации подбора препаратов целесообразно использо-
вать холтеровское мониторирование ЭКГ и парные нагрузочные тесты.
Необходимо отметить, что, несмотря на симптоматический эффект анти-
ангинальных препаратов, ни один из них не способен увеличивать про-
327
должительность жизни больных со стабильной стенокардией или предотв-
ращать инфаркт миокарда.
Хирургические методы — аортокоронарное шунтирование и чрескож-
ная ТЛАП, обеспечивающие улучшение перфузии миокарда, получили в
настоящее время широкое распространение.
Аортокоронарное шунтирование заключается в наложении
обходных анастомозов между восходящей частью аорты и пораженными ко-
ронарными артериями дистальнее места стеноза с помощью сегментов боль-
шой подкожной вены больного. В качестве шунта используют также внутрен-
нюю артерию молочной железы, которую отсепаровывают от тканей грудной
клетки, пересекают и проксимальный конец соединяют с коронарными ар-
териями передней и боковой поверхностей сердца дистальнее места сужения
(правую артерию молочной железы с ветвью правой коронарной артерии, а
левую — с передней нисходящей). Операцию выполняют в условиях искусст-
венного кровообращения, хотя и без вскрытия сердца. Одновременно накла-
дывают несколько анастомозов. Иногда дополнительно удаляют атероматозные
массы путем эндартерэктомии, что, однако, повышает травматичность ре-
васкуляризации и используется редко.
Аортокоронарное шунтирование обеспечивает значительное клиничес-
кое улучшение у 80—90 % больных, причем у 50—75 % полностью исчеза-
ют симптомы. Хирургическая летальность при стабильной стенокардии в
развитых странах составляет в среднем 2—3 %. Она выше у лиц старше 70
лет, при срочной операции в случаях дестабилизации стенокардии и при
поражении ствола левой коронарной артерии, а также у женщин, отчасти
вследствие более позднего направления на аортокоронарное шунтирова-
ние (S.Khan, J.Matloff, 1991). Примерно у 5 % больных развивается после-
операционный инфаркт миокарда.
Хороший клинический эффект коронарной реваскуляризации и улуч-
шение качества жизни оперированных больных далеко не всегда способ-
ствуют увеличению их выживаемости. Стенокардия возобновляется пример-
но у 5-10 % больных в год. Это связано с прогрессированием коронарного
атеросклероза и окклюзией анастомозов, чему способствуют усиленная
пролиферация и утолщение интимы венозного шунта под воздействием
резкого повышения давления крови в артериальном русле по сравнению с
венозным. Кроме того, после успешной реваскуляризации постепенно пе-
рестают функционировать коллатерали, что при развитии окклюзии шун-
та значительно отягощает прогноз. Как показали результаты кооператив-
ного исследования Администрации ветеранов США (Veterans Administration
Coronary Artery Bypass Surgery Cooperative Study Group, 1992), которое
предусматривало наблюдение оперированных больных в течение 18 лет,
по прошествии более 10 лет после операции ее положительный эффект в
отношении выраженности клинических проявлений стенокардии и выжи-
ваемости нивелируется. Выживаемость в отдаленные сроки зависит от функ-
ции левого желудочка до операции и его повреждения во время нее. По
данным многолетних наблюдений Подкомиссии по аортокоронарному
328
Показания к аортокоронарному шунтированию у больных стенокардией
Показания Улучшение выживаемости
Тяжелая стенокардия, не поддающаяся максимально интенсивной медикаментозной терапии Стеноз ствола левой коронарной артерии Проксимальный стеноз трех основных артерий, особенно при наличии дисфункции левого желудочка (умеренной) Только у отдельных категорий больных Да Да
* По сравнению с больными, получающими медикаментозную терапию.
шунтированию в США (J.Kirklin и соавт., 1991), 5-летняя выживаемость
составляет 88 %, 10-летняя - 75 % и спустя 15 лет и более — 60 %, что
соответствует ежегодной летальности примерно 2—3 %. Ни в ранние, ни в
поздние сроки хирургическая реваскуляризация не предотвращает разви-
тия инфаркта миокарда.
Частота окклюзии анастомозов из аутовены через 5 лет после операции
составляет 20 %, а через 10 — 41 % (E.Fitzgibbon и соавт., 1991). При исполь-
зовании искусственных сосудистых протезов она повышается. Для пред-
упреждения окклюзии анастомозов после операции эффективны ангитром-
боцитарные препараты — ацетилсалициловая кислота, дипиридамол, а так-
же устранение факторов риска, особенно нормализация уровня холесте-
рина. Вместо подкожной вены предпочтительнее использовать в качестве
шунта артерию молочной железы, что сложнее в техническом отноше-
нии, но обеспечивает проходимость 90 % анастомозов через 10 лет после
операции (F.Loop и соавт., 1986).
По данным многочисленных рандомизированных исследований эффек-
тивности аортокоронарного шунтирования, оно обеспечивает улучшение
выживаемости по сравнению с медикаментозной терапией только у некото-
рых категорий больных. К ним относятся симптоматичные случаи стеноза
ствола левой коронарной артерии и трехсосудистое поражение (передней
нисходящей, огибающей ветвей левой коронарной артерии и правой коро-
нарной артерии), особенно при дисфункции левого желудочка (снижении
ФВ, но не ниже 35 %; Coronary Artery Surgical Study - CASS, 1983; J.Kirklin
и соавт., 1991). При стенокардии, поддающейся медикаментозной терапии,
хирургическая ^васкуляризация не имеет существенных преимуществ в от-
ношении выживаемости перед консервативным лечением, даже при множе-
ственном поражении коронарных артерий и перенесенном инфаркте мио-
карда (CASS, J.Kirklin и соавт., 1983). Эффективность хирургического лече-
ния по сравнению с лекарственным тем выше, чем больше количество
проксимальных стенозов коронарных артерий и наложенных анастомозов и
больше (в разумных пределах) выражена дисфункция левого желудочка.
Ангиографическими критериями аортокоронарного шунтирования явля-
ются: 1) стеноз более 75 % площади просвета артерии. При меньшей его
величине реваскуляризация нецелесообразна, так как атеросклероз особен-
но быстро прогрессирует в участках артерии, находящихся проксимальнее
329
и дистальнее места анастомоза; 2) хорошая проходимость дистального
сегмента, диаметр которого должен превышать 1,5 мм; 3) жизнеспособ-
ность миокарда, который васкуляризируется пораженным сосудом.
С распространением чрескожной ТЛАП в последние годы при хирур-
гической реваскуляризации миокарда в большинстве случаев накладыва-
ют 3 анастомоза и более либо прибегают к ней в осложненных случаях.
При необходимости аортокоронарное шунтирование выполняют повтор-
но. Как и любая повторная операция, она сопряжена с большим риском
и результаты операции хуже, чем первичной.
Чрескожную ТЛАП (см. также главу 5) выполняют в лаборатории
катетеризации сердца и ангиокардиографии. Она заключается в проведении
ретроградным путем через аорту и установлении в месте стеноза коронар-
ной артерии специального катетера с баллончиком на конце. При дозиро-
ванном наполнении баллончика фиброзная покрышка бляшки трескает-
ся, отделяя ее от стенки артерии, что приводит к расширению просвета.
Успешная дилатация, то есть уменьшение стеноза до величины менее
50 % площади просвета артерии, в настоящее время достигается в 90 %
случаев. Осложнения связаны с развитием преходящей ишемии при вре-
менной обтурации артерии баллончиком и возможностью ее последующей
окклюзии из-за травматизации вследствие тромбоза или расслоения. Суще-
ственным недостатком является значительная частота рестеноза. Он разви-
вается в среднем в 30 % случаев успешной дилатации, несмотря на тера-
пию вазодилататорами, антикоагулянтами и дезагрегантами обычно в
первые 3 мес, и обусловлен пролиферацией интимы как результата “избы-
точной” репарации. Этому способствует повреждение медии при манипу-
ляции с последующей миграцией в интиму гладкомышечных клеток. При
возникновении рестеноза ангиопластику можно провести повторно.
По сравнению с медикаментозной терапией ТЛАП дает лучший симп-
томатический эффект, но не влияет на выживаемость и риск возникно-
вения инфаркта миокарда. Существенным преимуществом является воз-
можность отсрочить аортокоронарное шунтирование. Как показали ре-
зультаты проспективных наблюдений за 427 больными со стабильной
стенокардией, через 5 лет после ангиопластики у 85 % из них не наблю-
далось возобновления симптомов заболевания (J.Talley и соавт., 1988). К
недостаткам ТЛАП следует отнести большую частоту осложнений и бо-
лее высокую стоимость по сравнению с медикаментозной терапией (ре-
зультаты многоцентрового исследования Angioplasty Compared to Medicine
Study — ACMS; A.Parisi и соавт., 1992).
ТЛАП применяют при неэффективности медикаментозной терапии глав-
ным образом в случаях низкого риска — при ограниченном одно- или
двухсосудистом стенозе проксимальных участков артерий (кроме ствола
левой коронарной!) более 70 % площади просвета без кальциноза при
удовлетворительной функции левого желудочка. Реже ее выполняют у боль-
ных пожилого возраста или в случаях тяжелой внесердечной патологии
при наличии противопоказаний к оперативному вмешательству или его
Вероятная стабильная
стенокардия
(клинически)
Симптомы слабо выражены?
Серьезные сопутствующие заболевания?
Пожилой возраст ?
Да
Медикаментозная
терапия
"-^.Нет
♦
Нагрузочная проба с ЭКГ
Спазм?-*-Отрицательная
Пересмотру^
диагноза
Положительная
ТФН
удовлетворительная
ТФН
низкая
Функция ЛЖ
резка
снижена
функция ЛЖ
удовлетворительная
или умеренно
Коррекция
предрасполагающие
и способствующие
Схема 13. Алгоритм подхода к лечению стабильной стенокардии: ТФН — толерантность к
физической нагрузке; ЛЖ - левый желудочек; Л КА - левая коронарная артерия; АКШ -
аортокоронарное шунтирование; ЧТЛАП - чрескожная транслюминальная ангиопластика
повышенном риске (“ТЛАП спасения”). Ее можно использовать также в
качестве паллиативной меры, которая позволяет отсрочить выполнение
аортокоронарного шунтирования.
В последние годы показания к чрескожной ТЛАП расширяются и в
некоторых центрах при наличии кардиохирургических отделений вклю-
чают эксцентрические стенозы с изъязвленной поверхностью, характер-
ные для нестабильной стенокардии. В “классических” случаях же проведение
ее возможно и в условиях терапевтической кардиологической клиники, од-
нако если она находится на достаточно близком расстоянии от хирургичес-
кой (не более 30 мин езды).
Сразу после ангиопластики для предотвращения тромбоза и спазма
коронарной артерии назначают гепарин, ацетилсалициловую кислоту,
нитраты, а нередко и блокаторы кальциевых каналов.
Накапливается опыт применения различных модификаций ангиопла-
стики с использованием специальных катетеров: лазерной ангиопласти-
ки, атерэктомии (см. главу 5) и ангиопластики с имплантацией в просвет
331
артерии специальных расширителей в виде сетки с металлической осно-
вой (stent). Значение этих методов в реваскуляризации миокарда, их пре-
имущества и дифференцированные показания пока не установлены.
Алгоритм подхода к лечению стабильной стенокардии представлен на
схеме 13.
В случае стенокардии Принцметала при наличии малоизмененных ко-
ронарных артерий назначают нитраты и блокаторы кальциевых каналов, ко-
торые, в отличие от препаратов нитроглицерина, вызывают дилатацию не
только крупных артерий, но и артериол, и в значительно меньшей степени
действуют на вены. Р-Адреноблокаторы не показаны, так как вызывая преоб-
ладание а-адреностимулирующих влияний на коронарные артерии, могут уси-
ливать спазм сосудов. Нервозным больным с тахикардией назначают малые
дозы (пропранолол по 10 мг 2-3 раза в сутки или препараты с внутренней
симпатомиметической активностью) в сочетании с нитратами или блокато-
рами кальциевых каналов. Хирургическое лечение неэффективно. Рекоменду-
ют также избегать воздействия холода и гипервентиляции. Тактика при затя-
нувшемся ангинозном приступе описана ниже.
Прогноз у больных стенокардией зависит от распространенности сте-
нозирующего атеросклероза, наличия и выраженности дисфункции ле-
вого желудочка. Неблагоприятное прогностическое значение имеют пе-
ренесенный инфаркт миокарда, низкая толерантность к физической на-
грузке, развитие ишемии при нагрузочных тестах, поражение ствола ле-
вой коронарной артерии, сопутствующая артериальная гипертензия. В то
же время у 20—40 % больных со стабильной стенокардией наступает спон-
танная ремиссия. Летальность колеблется от 0,3 до 8 % в год, составляя в
среднем 4 % (C.Frank и соавт., 1973); 1/3 летальных исходов приходится
на внезапную смерть.
При стенокардии Принцметала прогноз зависит от наличия фиксиро-
ванного стеноза коронарных артерий и относительно благоприятен при
малоизмененных сосудах. Так, по данным одного из исследований, 7-
летняя выживаемость таких больных после ангиокардиографии составила
97 %, а с минимальным стенозом - 81 %.
Первичная профилактика ИБС (см. таже главу 8) направлена на устра-
нение факторов риска атеросклероза. Она основывается на широкомасш-
табной воспитательной работе с больными, их родственниками и насе-
лением в целом о важности оздоровления образа жизни.
Значение коррекции нарушений липидного обмена наглядно демон-
стрируют результаты мета-анализа S.Yusuf и соавторов (1988), основыва-
ющегося более чем на 40 000 наблюдений, которые показали, что сниже-
ние уровня холестерина в сыворотке крови на 10 % приводит к уменьше-
нию частоты возникновения ИБС на 20 %. Уменьшение содержания холе-
стерина на 5-33 % позволяет отсрочить появление симптомов ИБС на 0,1
года — 5 лет (S.Grover и соавт., 1992).
Вторичная профилактика предусматривает также воздействие на способ-
ствующие факторы стенокардии, ее активную медикаментозную терапию
332
Рекомендации населению по профилактике ИБС
1. Не курить.
2. Регулярно заниматься физическими упражнениями.
3. Стремиться к “идеальной” массе тела.
4. Включать в свой рацион, наряду с мясными и молочными продуктами, достаточно
фруктов и овощей.
5. Ограничить потребление жиров! На их долю должно приходиться не более 30 %
суточной энергетической ценности.
6. Избегать употребления более 30 г алкоголя в день.
и своевременную хирургическую реваскуляризацию миокарда. Статисти-
чески достоверно доказано положительное влияние лекарственных препара-
тов на выживаемость и частоту нефатального инфаркта миокарда лишь в
следующих случаях: а) при коррекции у больных ИБС ГЛП с помощью
холестипола, никотиновой кислоты и статинов (Familial Atherosclerosis
Treatment Study — FATS; G.Brown и соавт., 1990, и др.); б) при применении
p-адреноблокаторов, ацетилсалициловой кислоты, антикоагулянтов непря-
мого действия и статинов у перенесших инфаркт миокарда. Тактика ведения
таких больных, а также профилактика внезапной смерти рассмотрены ниже.
НЕСТАБИЛЬНАЯ СТЕНОКАРДИЯ
Нестабильная стенокардия, которую называют также острой коронар-
ной недостаточностью, предынфарктным состоянием и промежуточным
коронарным синдромом, занимает промежуточное положение между ста-
бильной стенокардией и острым инфарктом миокарда. Согласно наиболее
распространенной классификации С.Conti и соавторов (1973), она включает
в себя: 1) впервые возникшую стенокардию напряжения; 2) прогрессиру-
ющую стенокардию напряжения по типу “крещендо”; 2) стенокардию по-
коя с затяжными ангинозными приступами как проявление острой коро-
нарной недостаточности. Иногда к ней относят также постинфарктную
стенокардию и стенокардию Принцметала с частыми приступами.
Особенности патоморфологии и патофизиологии. Нестабильная стенокар-
дия может развиваться при любой распространенности и выраженности
коронарного атеросклероза. Она обусловлена острым ухудшением притока
крови к миокарду вследствие резкого усугубления сужения коронарной
артерии за счет: 1) скачкообразного роста атеросклеротической бляшки,
например, из-за кровоизлияния в нее; 2) динамического стеноза — спаз-
ма, преходящей окклюзии тромбоцитарными агрегатами или тромбом с
его быстрой реканализацией под действием спонтанного фибринолиза (схе-
ма 14). Обычно эти факторы сочетаются. Как показывают данные ангиос-
копии, морфологическим субстратом нестабильной стенокардии является
эксцентрический стеноз, вызванный так называемой осложненной ате-
росклеротической бляшкой с изъязвленной, растрескавшейся или надор-
ванной покрышкой и наложением тромбоцитарных агрегатов и фибрина
(C.Sherman и соавт., 1986). Менее чем у 10 % больных фиксированное
333
Бляшка
Уменьшение
просвета
артерии
Тромбоцитарные агрегаты
и тромботические наложения
более или менее
быстрая реканализация
нестабильная
стенокардия
интаркт
Вез зубца Q
Местное
угнетение
Фибринолиза
Преходящее
уменьшение
кровотока
Окклюзия
артерии
Инсраркт
с зубцами
Схема 14. Патогенез нестабильной стенокардии и острого инфаркта миокарда
сужение коронарных артерий, однако, не определяется. Причиной появле-
ния спастических реакций, по-вцдимому, являются остро возникшие дефек-
ты эндотелия, которые служат пусковым моментом для развития нестабиль-
ной стенокардии. В свою очередь, спазм сосудов может приводить к надрыву
бляшки. Стабилизация состояния больных наступает по мере “заживления”
поврежденной покрышки, в результате чего возрастает степень стеноза.
Клиника и диагностика. Впервые возникшая стенокардия
считается нестабильной в течение 1 мес после появления выраженных
или частых (более 3 в сутки) ангинозных приступов. Поскольку боль не
всегда связана с нагрузкой, диагностика иногда представляет трудности.
334
Прогрессирующая стенокардия развивается на фоне предшеству-
ющей стабильной стенокардии и характеризуется: 1) постепенным сниже-
нием ишемического порога, то есть возникновением ангинозных присту-
пов при нагрузке все меньшей интенсивности, а затем в покое и иногда во
время сна; 2) нарастанием их частоты и длительности (от 10 до 20—30 мин,
иногда более); 3) изменением характера боли и ее иррадиации, которая обыч-
но становится более распространенной; 4) увеличением интенсивности боли.
Боль не проходит при прекращении нагрузки и труднее купируется нитро-
глицерином, потребление которого возрастает и может достигать 20 табле-
ток и более в сутки. Болевой синдром часто сопровождается слабостью,
холодным потом, тошнотой, снижением АД, одышкой, нарушениями ритма.
У большинства больных во время ангинозных приступов на ЭКГ возни-
кают преходящие ишемические изменения сегмента ST (депрессия в 2/3
случаев или подъем - в 1/3) и инверсия зубцов Т, которые могут сохраняться
после прекращения боли, а также быть безболевыми. В отличие от инфаркта
миокарда без зубца Q (так называемого мелкоочагового инфаркта) эти изме-
нения нестойкие и подвергаются обратному развитию не позже чем в тече-
ние недели. Они свидетельствуют о наличии критического стеноза одной
или более ветви коронарной артерии, причем подъем сегмента ST более
характерен для динамического стеноза, а его депрессия - для преобладания
фиксированного сужения. Отсутствие изменений на ЭКГ при ее однократной
регистрации, даже во время приступа стенокардии, не исключает диагноза.
При этом важное диагностическое значение имеет холтеровское монитори-
рование. До стабилизации состояния нагрузочные тесты противопоказаны.
При сцинтиграфии миокарда с 201Т1 отмечаются нестойкие и диффуз-
ные, в отличие от инфаркта миокарда, дефекты перфузии в покое, отра-
жающие преходящее ухудшение коронарного кровотока. При сцинтигра-
фии с 99тТс и определении активности кардиоспецифических ферментов
(КФК, особенно ее изофермента МВ) в сыворотке крови изменения обыч-
но отсутствуют. В отдельных случаях, однако, возможны умеренное диф-
фузное накопление нуклида и небольшое, не более чем в 1,5 раза, повы-
шение ферментативной активности, что свидетельствует о некротизации
отдельных кардиомиоцитов при развитии необратимой ишемии.
При коронарографии у 40—60 % больных обнаруживается многососудистое
поражение, у 10—15 % — стеноз ствола левой коронарной артерии, у 20—
30 % — поражение одного сосуда, чаще левой передней нисходящей коро-
нарной артерии; у 10 % больных существенные сужения просвета отсутству-
ют (C.Conti и соавт., 1973; D.Weiner и соавт., 1987, по данным регистра
CASS). Характерны эксцентрические стенозы с нависающими краями и
изъеденными контурами (J.Ambrose и соавт., 1986). Такие изменения морфо-
логии коронарных артерий R.Williams и соавторы (1988) выявили у 61 %
больных, а тромбообразование — у 27 %. И те, и другие изменения имеют
неблагоприятное прогностическое значение в отношении повышенного
риска инфаркта миокарда, внезапной смерти и необходимости в хирургиче-
ской реваскуляризации миокарда (R.Bugrardini и соавт., 1991).
335
Диагноз ставят главным образом на основании характерной клинической
картины — изменения характера ангинозных приступов, преходящих призна-
ков ишемии миокарда на ЭКГ в виде изменений сегмента ST и зубца Т и
обратимых дефектов перфузии при сцинтиграфии при отсутствии ЭКГ,
энзимологических и сцинтиграфических признаков некроза миокарда, то
есть инфаркта.
Д лительность периода дестабилизации, на протяжении которого можно ста-
вить диагноз нестабильной стенокардии, принято ограничивать 1 мес от появ-
ления ее симптомов. Этот срок определяется временем, необходимым для раз-
вития коллатерального кровообращения, и достаточно условен.
Возможными исходами нестабильной стенокардии являются: 1) исчез-
новение приступов стенокардии; 2) переход в стабильную стенокардию,
часто более высокого функционального класса, хотя и не обязательно;
3) инфаркт миокарда; 4) внезапная смерть вследствие обусловленных ише-
мией желудочковых аритмий. Инфаркт миокарда и внезапная коронарная
смерть развиваются примерно у 10—15 % таких больных, то есть в среднем
в 3 раза чаще, чем при стабильной стенокардии (R.Mulcaliy и соавт., 1985).
Заболевание может осложняться также различными нефатальными нару-
шениями ритма и проводимости. Приступы острой левожелудочковой не-
достаточности больше характерны для инфаркта миокарда.
Лечение нестабильной стенокардии направлено на купирование и пред-
упреждение ангинозной боли, предотвращение инфаркта миокарда и улуч-
шение выживаемости. Его задачами являются улучшение перфузии ише-
мизированного миокарда (коронародилататоры, дезагреганты, хирурги-
ческая реваскуляризация) и уменьшение потребности миокарда в кисло-
роде (постельный режим, антиангинальные препараты).
Лечение начинают с активной медикаментозной терапии, которая вклю-
чает: 1) гепарин и дезагреганты; 3) p-адреноблокаторы; 3) нитраты.
При неэффективности таблетированного приема или чрескожного вве-
дения нитратов их назначают внутривенно капельно длительно, на
протяжении суток и более под контролем показателей гемодинамики, преж-
де всего АД и ЧСС. Начальная доза нитроглицерина составляет 5 мкг/мин,
затем ее постепенно увеличивают до купирования боли либо снижения
систолического АД на 20 мм рт.ст. Максимальная скорость инфузии обыч-
но не превышает 50 мкг/мин.
При отсутствии противопоказаний назначают р-адреноблокато-
р ы . В тяжелых случаях лечения лучше начинать с титрованного внутривен-
ного струйного дробного или капельного введения для скорейшего дости-
жения критериев блокады р -адренорецепторов - снижения ЧСС пример-
но до 55 в 1 мин, систолического АД до 90 мм рт.ст. при интервале P-Q
< 0,24 с. После этого переходят на пероральный прием.
Блокаторы кальциевых каналов, как и нитраты, обладают спо-
собностью купировать и предупреждать коронароспазм. Их назначают в ком-
эинации с p-адреноблокаторами при недостаточном эффекте лечения, если
дозволяет уровень АД. При этом дилтиазем эффективнее, чем верапамил.
336
Все три класса антиангинальных препаратов оказывают выраженное
симптоматическое действие, но не влияют на исход заболевания (M.Cohen
и соавт., 1989), а блокаторы кальциевых каналов могут даже повышать
летальность.
Многоцентровые рандомизированные плацебоконтролируемые иссле-
дования последних лет показали эффективность ацетилсалицило-
вой кислоты и гепарина в отношении предотвращения инфаркта
миокарда и летального исхода в 50 % случаев нестабильной стенокардии. Аце-
тилсалициловую кислоту обычно назначают по 325 мг в сутки, причем пер-
вую таблетку рекомендуют разжевать. Гепарин применяют в течение 3—5 дней,
желательно в комбинации с ацетилсалициловой кислотой путем непрерыв-
ной внутривенной капельной инфузии под контролем времени свертывания
крови или частично активированного тромбопластинового времени, которые
должны удлиняться в 1,5—2,5 раза. Доказана неэффективность тромболити-
ческих препаратов при использовании их для предотвращения инфаркта мио-
карда (многоцентровое исследование TIMI-3), что объясняется обнажением
тромбогенного дефекта эндотелия, а следовательно, сохранением предпосы-
лок для ретромбоза (J.Ambrose, V.Fuster, 1989).
При отсутствии эффекта от интенсивной медикаментозной терапии в
течение 1—3 сут показана неотложная коронарография и при наличии пока-
заний — ТЛАП либо, при невозможности ее выполнения, аортокоронарное
шунтирование. Такую раннюю хирургическую реваскуляризацию выполняют
по жизненным показаниям у 10-20 % больных, и в большинстве случаев
она дает хороший клинический эффект, что подтверждается результатами
нагрузочного тестирования. Следует учитывать, однако, повышенный риск
тяжелых осложнений. При ТЛАП они отмечаются в 10,5 % случаев. Инфаркт
миокарда развивается у 8 % больных, в 9 % случаев приходится прибегать
к срочному аортокоронарному шунтированию (de Feyter и соавт., 1988). В
связи с этим хирургическую реваскуляризацию желательно отсрочить на
48—72 ч от момента возникновения нестабильной стенокардии.
Ни ТЛАП, ни аортокоронарное шунтирование, произведенные по сроч-
ным показаниям, не улучшают отдаленный прогноз (R.Luchi и соавт.,
1986).
В случаях достижения стабилизации с помощью медикаментозной те-
рапии, учитывая подверженность возобновлению нестабильной стено-
кардии, спустя 7—14 дней перед выпиской из стационара показано на-
грузочное тестирование с электрокардиографическим или сцинтиграфи-
ческим контролем. При положительном результате и низкой толерантно-
сти к нагрузке рекомендуют выполнять коронарографию для решения
вопроса о хирургической реваскуляризации миокарда и ее виде (ТЛАП,
аортокоронарное шунтирование). При отрицательном результате нагру-
зочной пробы и удовлетворительной физической работоспособности про-
должают медикаментозную терапию.
Прогноз наихудший в случаях нестабильной стенокардии, проявляющейся
затяжным ангинозным приступом в покое, и при стенозе ствола левой
337
коронарной артерии. Риск неблагоприятного исхода коррелирует также с
выраженностью и распространенностью стенозирующего атеросклероза.
ИНФАРКТ МИОКАРДА
Инфаркт миокарда представляет собой некроз сердечной мышцы как
исход необратимой ишемии в результате относительного или абсолютно-
го недостатка поступления крови.
Эпидемиология. По данным исследований, проводившихся в 1985 г. по
программе ВОЗ, инфаркт миокарда возникает ежегодно у 0,3 % мужчин
в возрасте старше 40 лет в Москве, у 0,2 % — в Каунасе, у 0,5 % - в
Лондоне и у 0,6 % — в Хельсинки. У женщин инфаркт миокарда встреча-
ется значительно реже, чем у мужчин: в возрасте 40-50 лет - в 5 раз и в
более пожилом — в 2-2,5 раза. Это объясняется более поздним развитием
у них атеросклероза и меньшим распространением курения. Смертность
населения бывшего СССР от инфаркта миокарда в возрасте 35-44 лет в
1985 г. составляла 13 на 100 000, 45—54 лет — 37, 55-64 лет — 82, 65-74 лет
— 160 и старше 75 лет — 187, в том числе у мужчин соответственно 23, 67,
145, 255 и 289, а у женщин - 3, 11, 42, 118 и 153 (Е.И.Чазов, 1992).
В Украине за последние 5 лет (1989—1993 гг.) отмечается небольшая
тенденция к росту заболеваемости инфарктом миокарда — со 110 до 117 на
100 000 населения — при стабилизации уровня смертности - 22,2 на 100 000
(В.А. Бобров, А. Г. Каминский, 1994). В целом умирают примерно 30—50 %
больных инфарктом миокарда, из них более половины на догоспитальном
этапе в результате внезапной смерти (рис. 61). Госпитальная летальность
составляет около 10 % и еще 5-10 % больных умирают в течение последу-
ющего года.
Этиология и патогенез. Инфаркт может захватывать всю толщу миокар-
да от эндо- до эпикарда (трансмуральный инфаркт, или инфаркт с зуб-
цом Q), или ограничиваться его субэндокардиальными слоями (нетранс-
муральный, или субэндокардиальный, инфаркт миокарда, или инфаркт
без зубца Q).
В подавляющем большинстве случаев причиной трансмурального
инфаркта миокарда является тромбоз коронарной артерии в области изъяз-
вленной или растрескавшейся атеросклеротической бляшки. Его возник-
новению способствует динамическое нарушение коронарного кровотока
— спазм и образование тромбоцитарных агрегатов. Со временем тромб
подвергается спонтанному лизису, однако если коронарный кровоток от-
сутствует более 1 ч, в миокарде успевают развиться необратимые ишеми-
ческие изменения. При продолжительности окклюзии до 4 ч коронарный
тромбоз при ангиокардиографии обнаруживают у 87 % больных, от 4 до 6
ч — у 85 %, от 6 до 12 ч - у 68 % и в пределах 12—24 ч — у 65 %. Иногда
причиной трансмурального инфаркта миокарда бывает спазм, что отме-
чается, по-видимому, у больных с морфологически неизмененными ко-
ронарными артериями, или эмболия.
338
Рис. 61. Летальность и различные сроки
инфаркта миокарда. Наибольшая часть
больных умирают в 1-й час заболева-
ния от первичной фибрилляции желу-
дочков
Генез субэндокардиального ин-
фаркта обычно связан с длитель-
ной ишемией вследствие резко-
го повышения потребности мио-
карда в кислороде при невозмож-
ности увеличения его доставки
при выраженном стенозирующем коронарном атеросклерозе, в большин-
стве случаев без полной окклюзии просвета артерии. Его возникновению
способствуют артериальная гипотензия и тахиаритмии. Коронаротромбоз
у таких больных наблюдается относительно редко — в 15-30 % случаев.
Необходимо подчеркнуть, что при хорошем коллатеральном кровообра-
щении даже полная окклюзия может не сопровождаться инфарктом мио-
карда, особенно при ее медленном развитии. Зона некроза может форми-
роваться практически одномоментно либо постепенно в результате не-
скольких последовательных эпизодов некротизации относительно неболь-
ших очагов, что более характерно для субэндокардиального инфаркта,
чем для трансмурального. У 15—20 % больных субэндокардиальный ин-
фаркт трансформируется в трансмуральный.
Патологическая анатомия. Локализация инфаркта миокарда и некото-
рые его клинические проявления определяются локализацией наруше-
ния коронарного кровообращения и индивидуальными анатомическими
особенностями кровоснабжения сердца.
Тотальная или субтотальная окклюзия передней нисходящей
ветви левой коронарной артерии обычно приводит к инфаркту пере-
дней стенки и верхушки левого желудочка, передней части межжелудоч-
ковой перегородки, иногда — сосочковых мышц. В связи с большим объе-
мом инфарцирования может развиваться ишемия ножек пучка Гиса и дис-
тальная атриовентрикулярная блокада, а нарушения гемодинамики часто
выражены в большей степени, чем при заднем инфаркте.
Поражение огибающей ветви левой коронарной артерии в боль-
шинстве случаев вызывает некроз боковой стенки левого желудочка и
(или) его задне-базальных отделов. У 55 % больных нарушение крово-
снабжения синусового узла способствует возникновению предсердных
аритмий и ритма атриовентрикулярного соединения. У 10 % больных при
наличии более обширного бассейна этой артерии ее проксимальная окк-
люзия приводит к инфарцированию также задне-диафрагмальной облас-
ти левого, частично правого желудочков и задней части межжелудочко-
вой перегородки и может осложняться атриовентрикулярной блокадой.
Окклюзия правой коронарной артерии сопровождается
339
Клииико-патологоанатомические параллели при инфаркте миокарда
Локализация окклюзии Клинические проявления инфаркта миокарда (ИМ)
Ствол левой коронарной артерии
Передняя нисходящая ветвь левой
коронарной артерии
Обширный ИМ левого желудочка
Передний ИМ
Септальный ИМ
Верхушечный ИМ
Блокада правой ножки и передне-верхней ветви левой
ножки пучка Гиса
Атриовентрикулярная блокада типа Мобттгц II и полная
Боковой или нижне-боковой ИМ
Задне-базальный (истинно задний) ИМ
Нижний (диафрагмальный) ИМ
ИМ правого желудочка
Рефлекс Бецольда—Яриша
Атриовентрикулярная блокада I—II степени
Огибающая ветвь левой
коронарной артерии
Правая коронарная артерия
инфарктом задне-диафрагмальной области левого желудочка, в 1/3—2/3
случаев, кроме того, инфарктом задней стенки правого желудочка, реже
— задней части межжелудочковой перегородки и задне-медиальной со-
сочковой мышцы. Хотя размеры некротического очага, как правило, от-
носительно невелики, часто развивается ишемия атриовентрикулярного
узла и ствола пучка Гиса и несколько реже — синусового узла с соответ-
ствующими нарушениями проводимости.
Первые морфологические изменения в миокарде обнаруживают при элек-
тронной микроскопии через 15 мин после окклюзии в виде набухания мито-
хондрий и истощения в них гликогена. К концу 1-го часа в митохондриях
определяются преципитаты кальция фосфата, которые начинают разрушать-
ся; хроматин ядра распадается на глыбки, что свидетельствует о необрати-
мости ишемического повреждения клетки. Накопление кальция фосфата в
цитоплазме способствует развитию контрактуры саркомеров. Возобновле-
ние кровотока через 40—60 мин сопровождается еще большей аккумуляцией
Са2+, что может вызывать реперфузионное повреждение кардиомиоцитов.
На светооптическом уровне самыми ранними морфологическими изме-
нениями в очаге инфарцирования, проявляющимися спустя 12—18 ч, яв-
ляются расширение капилляров и отек мышечных волокон, которые со-
храняют свою поперечную исчерченность вследствие ишемической кон-
трактуры. К концу 1-х суток мышечные волокна фрагментируются, и с
периферии некротического очага появляется инфильтрация полиморфно-
ядерными лейкоцитами, которая образует демаркационную зону между
живой и погибшей тканями. Некротизированные клетки начинают уда-
ляться макрофагами с периферии примерно с 5-го дня. При этом в очаг
поражения с его краев постепенно врастают пролиферирующие фиброб-
ласты и капилляры - образуется грануляционная ткань.
Макроскопические изменения начинают определяться лишь спустя 15—24
ч. Очаг поражения вначале бледный и отечный, а на 2-е сутки приобретает
красновато-глинистый цвет и становится дряблым вследствие миомаля-
340
Физикальные признаки инфаркта миокарда
Причины Признаки
Повышение симпатической Потливость, бледность, тахикардия, артериальная
активности
Повышение парасимпатической
активности
Нарушение функции миокарда
Некроз миокарда
гипертензия
Тошнота, рвота, брадикардия, артериальная гипотензия
Смещение верхушечного толчка кнаружи и книзу
Патологическая пульсация во втором—четвергом межреберье
слева у края грудины
Тахикардия
Появление IV или III тона
Ослабление I тона
Крепитация в нижних отделах легких
Повышение температуры тела
Шум трения перикарда
ции. Через 48 ч зона некроза приобретает серый оттенок. Постепенно она
истончается и окружается красной полоской из врастающих капилляров и
фибробластов. К 6-й неделе образование рубца завершается: он становится
плотным, желтовато-серого цвета, сокращается в размерах, из него исче-
зают клетки воспаления. Часто в рубце сохраняются островки жизнеспособ-
ных мышечных волокон, которые вышли из состояния обратимой ишемии.
Исходя из динамики репаративных процессов, инфаркт миокарда условно
считается острым в течение 8 нед от начала заболевания.
Нарушения гемодинамики связаны со снижением сократимости мио-
карда в зоне некроза и повреждения, которое проявляется гипо-, а- или
дискинезией. При этом отмечается компенсаторная гиперкинезия непо-
раженного миокарда за счет механизма Франка—Старлинга и повышен-
ного уровня катехоламинов в крови. Выраженность нарушений насосной
функции левого желудочка зависит от состояния этого миокарда (уровня
коронарного кровотока, наличия кардиосклероза, в том числе рубцов
после ранее перенесенных инфарктов) и распространенности некроти-
ческого очага. Так, при его массе более 10 % левого желудочка отмечается
снижение ФВ, свыше 15 % — повышение КДЦ в желудочке, свыше 28 %
— появление клинических признаков левожелудочковой недостаточности
и более 40 % - кардиогенного шока.
Клиника. У 50—75 % больных за несколько дней или недель до развития
инфаркта миокарда отмечаются нестабильная стенокардия либо неопре-
деленный дискомфорт в грудной клетке, чувство нехватки воздуха, сла-
бость. Эти предвестники отражают, по-видимому, постепенное прогрес-
сирование ишемии.
Клиническая картина неосложненного инфаркта миокарда состоит из:
1) ангинозного приступа; 2) скудных физикальных изменений; 3) признаков
резорбционно-некротического синдрома.
Наиболее характерной жалобой является резкая боль, которая служит
причиной обращения за медицинской помощью. По своему сжимающему
341
жгучему характеру, загрудинной локализации и иррадиации она напомина-
ет ангинозную. Отличительными особенностями являются: 1) возникнове-
ние в покое, иногда во время сна; 2) продолжительность более 30 мин и
даже несколько часов; 3) большая интенсивность, отсутствие эффекта от
приема нитроглицерина и необходимость применения для купирования нар-
котических анальгетиков; 4) более широкая зона иррадиации; 5) сопровожда-
ется тошнотой, рвотой, холодным потом, слабостью, цианозом, реже —
одышкой, ортопноэ, перебоями. Необходимо иметь в виду, что боль может
локализоваться под мечевидным отростком, что в сочетании с диспепсией
может приводить к ошибочному диагнозу острого гастрита, обострения язвен-
ной болезни или другой гастроэнтерологической патологии. Такое типич-
ное начало болевого варианта инфаркта миокарда отмечается у 70—90 %
больных.
В анамнезе у значительной части больных имеются указания на стенокар-
дию и факторы риска ИБС.
При клиническом обследовании изменения неспецифичны и могут от-
сутствовать. Больные, испытывающие сильную боль, часто возбуждены,
беспокойны, мечутся, в отличие от больных стенокардией, которым свой-
ственно “замирание” во время ангинозного приступа. Физикальные при-
знаки в начале неосложненного инфаркта миокарда в значительной сте-
пени связаны с возбуждением вегетативной нервной системы. При преоб-
ладании симпатической активности и гиперкатехоламинемии в связи с
болью и стрессом отмечаются бледность кожи, потливость, тахикардия,
часто преходящая артериальная гипертензия. Выраженное возбуждение па-
расимпатической части вегетативной нервной системы развивается чаще у
больных с задним инфарктом посредством рефлекса Бецольда—Яриша
вследствие раздражения рецепторов, расположенных в задне-диафрагмаль-
ной области миокарда левого желудочка. При этом возникают брадикар-
дия, артериальная гипотензия, вплоть до коллапса, тошнота и рвота.
У ряда больных отмечаются признаки дисфункции миокарда вследствие
исходных изменений в нем, обусловленных хронической ИБС и перене-
сенными ранее инфарктами миокарда — так называемым “атеросклеротиче-
ским и (или) постинфарктным кардиосклерозом” (по номенклатуре ВКНЦ
АМН СССР, принятой в нашей стране). Для острого инфаркта миокарда
наиболее характерен IV тон, который отражает обусловленное ишемией
снижение диастолической податливости левого желудочка. Через несколько
дней он обычно исчезает и не сопровождается признаками сердечной не-
достаточности, с которой, как правило, связано появление III тона. Ишеми-
ческая дисфункция сосочковых мышц сопровождается неинтенсивным
поздним систолическим шумом с эпицентром над верхушкой и максиму-
мом во второй половине систолы. Умеренное смещение верхушечного тол-
чка кнаружи и книзу, ослабление I тона и короткий систолический шум
могут быть обусловлены также исходным хроническим коронарогенным
поражением миокарда. Выраженная ишемическая дискинезия передней
стенки левого желудочка в ряде случаев приводит к появлению патологи-
ческой пульсации во втором—четвертом межреберье у левого края груди-
ны, которая сохраняется при формировании острой аневризмы.
После купирования болевого синдрома, начиная с первых часов инфар-
кта миокарда, может отмечаться тенденция к артериальной гипотензии. Спон-
танная нормализация АД происходит и у значительной части больных с
многолетней стойкой артериальной гипертензией, даже при отсутствии кли-
нических признаков сердечной недостаточности. Предполагают, что она обус-
ловлена “переключением” центрального регулятора тонуса артериол на бо-
лее низкий уровень, причины которого остаются неясными.
В случаях задней локализации инфаркта с распространением на правый
желудочек и его обширным инфарцированием могут определяться набу-
хание шейных вен и повышение ЦВД.
Распространенный инфаркт миокарда левого желудочка часто ослож-
няется острой левожелудочковой недостаточностью (см. ниже).
Для трансмурального инфаркта характерен асептический эпистенокарди-
тический перикардит, который обусловлен некрозом субэпикардиальных слоев
миокарда и обычно развивается между 2-м и 4-м днями болезни. Он может
приводить к изменению характера боли и появлению шума трения перикарда.
Однако в большинстве случаев в связи со слабой выраженностью болевого
синдрома и быстротой исчезновения шума, который обычно выслушивает-
ся в течение считанных часов, перикардит остается нераспознанным.
К концу 1-х суток отмечается повышение температуры тела, как правило,
до субфебрильной, выраженность которой коррелирует с массой инфаркта.
Оно обусловлено резорбцией некротических масс и перикардитом и может
сохраняться в течение 4—7 дней, сопровождаясь неспецифическими воспа-
лительными сдвигами в крови (резорбционно-некротический синдром).
Диагностика. Электрокардиография является чувствительным и специ-
фичным методом диагностики инфаркта миокарда, который позволяет
определить его глубину, локализацию, размеры и давность. Необходимо
подчеркнуть, однако, что отсутствие изменений на ЭКГ, особенно в на-
чале заболевания, не исключает инфаркт.
Электрокардиографическая диагностика глубины ин-
фаркта миокарда (рис. 62). Результаты экспериментальных электро-
физиологических исследований свидетельствуют о том, что ишемия мио-
карда отражается на ЭКГ изменениями зубца Т, ишемическое поврежде-
ние - изменениями сегмента ST, а трансмуральный (крупноочаговый)
некроз — изменениями комплекса QRS в виде появления патологического
зубца Q или QS. Его образование обусловлено утратой некротизирован-
ным миокардом и замещающей его рубцовой тканью электрической актив-
ности, в результате чего зона инфарцирования образует “электрическое
окно”, через которое на поверхности тела регистрируется отрицательный
(в виде зубца QS) внутриполостной потенциал. С позиций векторной теории
исчезновение у находящегося под электродом миокарда способности гене-
рировать возбуждение приводит к тому, что результирующий вектор депо-
ляризации оказывается направленным в противоположную сторону. При
343
Рис. 62. Электрокардиографические признаки инфаркта миокарда в зависимости от глуби-
ны поражения: А - трансмуральный (крупноочаговый) инфаркт миокарда (ИМ) = ”ИМ с
зубцом 0”; Б — субэндокардиальный (мелкоочаговый) ИМ = ”ИМ без зубца Q"
или
этом существует представление о том, что в случае трансмурального некроза
миокарда регистрируется зубец QS а при частично сохранившемся жизне-
способном миокарде желудочковый комплекс имеет вид QR, то есть состоит
из патологического зубца Q и зубца R, амплитуда которого снижена (см.
рис. 62). Уменьшение вольтажа зубца R обусловлено утратой части жизнеспо-
собного миокарда с уменьшением генерируемой им электродвижущей силы.
Ранее разграничению патологического зубца Q и зубца QS придавалось боль-
шое значение, и на этом базировалось разделение инфаркта миокарда на транс-
муральный и крупноочаговый нетрансмуральный (непроникающий). В настоя-
щее время сопоставления с морфологическими данными доказали крайне низ-
кую информативность этого электрокардиографического критерия, в связи с
чем термины “трансмуральный” и “крупноочаговый” в классификациях ВОЗ и
ВКНЦ объединены под одной рубрикой. За рубежом такую разновидность ин-
фаркта миокарда принято называть “инфаркт миокарда с зубцом Q”. Значи-
тельно более точными критериями массы некроза являются количество отведе-
ний ЭКГ с патологическими изменениями комплекса QRS и уровень кардиос-
пецифических ферментов в крови.
Субэндокардиальный инфаркт миокарда охватывает относительно тонкий
слой сердечной мышцы под эндокардом. При такой локализации некроза
патологический зубец Q обычно отсутствует. Это объясняется тем, что воз-
буждение распространяется по субэндокардиальным слоям значительно бы-
стрее, чем по субэпикардиальным, и зубец Q не успевает образоваться. На
ЭКГ у таких больных определяется депрессия сегмента ST в нескольких
отведениях, которая в большинстве случаев сочетается с глубоким отрица-
тельным зубцом Г; инэгда зубец Т двухфазный (—Н) или слабо положи-
тельный. Возможно chi жение амплитуды зубца R в соответствующих отве-
дениях. Эти изменения сохраняются на ЭКГ в течение нескольких недель.
Существует также понятие “интрамуральный инфаркт миокарда”, кото-
рое обозначает некроз, расположенный в толще стенки желудочка и не
достигающий ни эндо-, ни эпикарда. Его наиболее характерным электрокар-
диографическим признаком считаются глубокие отрицательные зубцы Т
344
Услобия Острейший Острый Подострый (текущий, рубцующийся) РубцоВый („старый "ИМ, постинрарктный кардиосклероз)
Транс- муральный (крупно - очагобый) ИМ=пИМ с зубцом Q " Подъем сегмента ST.Зубец Т положи - тельный (.Патологический зубец Q(QS) 2.Уменъшение зубца R ^.Уменьшение подъема сегмен- та ST ^.Появление отрицательной разы зубца Т (Патологиче- ский зубец QIQS) 2.Сегмент ST на изолинии З.Глубокий отрицатель - ный зубец Т (Патологический зубец Q (QS) 2. Возможна пози- тибизация зубца Т
Субэндокар- диальный (мелкооча- гоВый) ИМ=„ИМ без зубца (Г Подъем или депрессия ST Отрицатель ная раза зубца Т Уменьшение зубца R Гпубокий отрицатель- ный зубец Т возможна пози- тибизация зубца Т
Начало Минуты - часы Часы-дни Дни Месяцы-годы
Длитель- ность Часы Дни Дни-меся цы Г1ды
Рис. 63. Динамика ЭКГ при различных вариантах инфаркта миокарда (ИМ)
(“коронарные 7”) в нескольких отведениях, иногда в сочетании со снижени-
ем амплитуды зубца Л Формированию отрицательных зубцов Тмогут предше-
ствовать подъем или депрессия сегмента ST, и они сохраняются в течение
нескольких недель или месяцев. Как и при субэндокардиальном инфаркте
миокарда, эти изменения на ЭКГ обусловлены перинекротической зоной ише-
мии или повреждения и неспецифичны, в связи с чем при их оценке важное
значение имеют клиническая картина и лабораторные данные.
В качестве синонима термина “субэндокардиальный инфаркт” использу-
ют термин “мелкоочаговый”. Этот термин, однако, менее удачный, так как
в подобных случаях некроз может быть значительным по протяженности, а
Рис. 64. Прямые (Л) и реципрокные (Б)
изменения ЭКГ при инфаркте миокар-
да. 1 - “коронарный” зубец Т; 2 - су-
бэндокардиальное ишемиче-ское по-
вреждение; 3 — субэпикардиальное
ишемическое повреждение; 4 — пато-
логический зубец Q
следовательно, по своей массе
существенно не отличаться от
крупноочагового инфаркта ми-
окарда. Это же справедливо для
так называемого интрамурально-
го инфаркта, который не имеет
четких электрокардиографичес-
ких, а также клинических кри-
териев, отличающих его от су-
бэндокардиального инфаркта. В
связи с этим все случаи инфарк-
та миокарда без патологических
изменений комплекса QRS, согласно принятой в настоящее время номен-
клатуре, объединяют под рубрикой “мелкоочаговый”, предусмотренной
классификацией ВКНЦ, или “инфаркт миокарда без зубца Q”.
В связи с недостаточно высокой чувствительностью и специфичностью
электрокардиографических критериев разграничения трансмурального и суб-
эндокардиального инфаркта миокарда следует отдавать предпочтение терми-
нам “инфаркт миокарда с зубцом Q” и “инфаркт миокарда без зубца Q”.
Динамика ЭКГ при инфаркте миокарда. В зависимости от
характера изменений на ЭКГ выделяют острейший, острый, подострый и
рубцовый периоды (стадии) течения инфаркта миокарда (рис. 63). Следует
подчеркнуть, что эти периоды отражают только электрокардиографическую
динамику, не выносятся в диагноз и не полностью соответствуют клини-
ческой номенклатуре, согласно которой инфаркт миокарда считается ост-
рым на протяжении 8 нед от начала заболевания.
При развитии инфаркта миокарда с зубцом Q наиболее ранние изме-
нения на ЭКГ, характерные для так называемой острейшей стадии
(стадии повреждения), возникают через несколько минут или часов пос-
ле острого нарушения коронарного кровообращения. Они проявляются
подъемом сегмента ST в отведениях, отражающих потенциалы соответ-
ствующей стенки желудочка, который обусловлен субэпикардиальным
(трансмуральным) ишемическим повреждением. При этом сегмент ST
имеет характерную форму дугой кверху и сливается с одной стороны с
зубцом R, а с другой — с зубцом Т, образуя монофазную кривую, или
дугу Парди. Эти изменения сходны с наблюдаемыми при стенокардии
Принцметала и потенциально обратимы. Предшествующие субэпикарди-
альному ишемическому повреждению признаки субэндокардиального
346
повреждения и ишемии в виде депрессии сегмента ST и высокого зубца Т
являются быстро проходящими и, как правило, не успевают зарегистриро-
ваться. В отведениях от противоположной стенки определяются реципрок-
ные изменения — дискордантная депрессия сегмента ST (рис. 64). Смещение
сегмента ST под изолинию в качестве прямого электрокардиографического
признака характерно для субэндокардиального инфаркта и наблюдается с
начала развития заболевания. В связи с отсутствием электрокардиографических
признаков некроза и возможностью различного исхода ишемического по-
вреждения (сохранение жизнеспособности кардиомиоцитов, образование
трансмурального или нетрансмурального инфаркта миокарда) с учетом
клиники при подобных изменениях ЭКГ ставят этапный диагноз острого
нарушения коронарного кровообращения. Чем больше величина подъема
сегмента ST, тем больше вероятность развития инфаркта с зубцом Q.
Динамика ЭКГ, свойственная острой стадии, отмечается обыч-
но через несколько часов, у большинства больных — до 1 сут, изредка —
до 3 сут от начала заболевания. Характерно появление патологического
зубца Q или зубца QS и уменьшение амплитуды зубца R, которые свиде-
тельствуют об образовании крупноочагового (трансмурального) некроза.
Приподнятый сегмент ST начинает приближаться к изолинии с форми-
рованием отрицательной фазы (4—) зубца Т. Эти изменения отражают
уменьшение зоны ишемического повреждения за счет его трансформа-
ции частично в некроз, частично в ишемию. При мелкоочаговом инфар-
кте патологический Q не формируется, однако возможно уменьшение
амплитуды зубца R. Свойственные острой стадии изменения на ЭКГ со-
храняются обычно в течение 1 нед, изредка дольше.
Для подострой электрокардиографической стадии ин-
фаркта характерно приближение сегмента ST к изолинии и завершение фор-
мирования глубокого отрицательного зубца Т, напоминающего равнобед-
ренный треугольник. Одновременно постепенно исчезает и дискордантная
депрессия сегмента ST. Такие “коронарные” зубцы Ткак следствие наруше-
ния реполяризации миокарда из-за образования очага некроза сохраняются
в течение многих недель и даже месяцев. Подобная графика ЭКГ не позво-
ляет отличить подострую стадию клинически острого инфаркта миокарда,
то ость инфаркта давностью до 8 нед, от рубцовых изменений в миокарде -
так называемого постинфарктного кардиосклероза. Спустя несколько меся-
цев глубина отрицательных зубцов Т постепенно уменьшается, они стано-
вятся изоэлектричными и наконец позитивизируются. С годами возможно
уменьшение амплитуды патологических зубцов Q с образованием на месте
зубца QS комплекса Qr, что, по всей вероятности, связано с компенса-
торной гипертрофией миокарда вокруг рубца.
Косвенным признаком крупноочаговых (трансмуральных) рубцовых
изменений передней стенки левого желудочка является отсутствие нор-
мального роста зубца R в отведениях V,_4.
Топическая электрокардиографическая диагностика
инфаркта миокарда основывается на выявлении описанных выше прямых
347
Рис. 65. Отношение между отведениями ЭКГ и
сегментами левого желудочка. Сегменты левого
желудочка: передняя стенка - септальный (септ.);
передне-апикальный (пер./апик.), латеральный
(лат.); задняя стенка — латеральный, задний
(задн.), нижний (нижн.)* — реципрокные (зер-
кальные) изменения
изменений на ЭКГ в отведениях, отра-
жающих потенциалы той или иной обла-
сти, или сегмента, левого желудочка (табл.
30, рис. 65). При этом в отведениях от про-
тивоположного по отношению к инфар-
цированному сегмента левого желудочка
регистрируются реципрокные изменения (см. рис. 64). Так, если прямые
изменения определяются в отведениях II, III, aVF, то реципрокные — в
отведениях I, aVL, V,_4, и наоборот. Реципрокным по отношению к пато-
логическому зубцу Q или зубцу QS является увеличение амплитуды зубца
R, обусловленное уменьшением или прекращением влияния на него век-
тора возбуждения сегмента, подвергшегося некрозу. Такое реципрокное
увеличение вольтажа зубца R в отведениях V, 2 имеет особенно важное
значение для распознавания крупноочагового (трансмурального) инфар-
кта собственно задней, то есть задне-базальной, стенки левого желудоч-
ка, так как его прямые признаки не регистрируются ни в одном из 12
общепринятых отведений ЭКГ. Для их обнаружения используют специ-
альные дополнительные отведения по Слапаку (см. главу 5). При оценке
изменений на ЭКГ в этих отведениях диагностическое значение имеет
главным образом ее эволюция в динамике, так как глубокий зубец Q и
отрицательный зубец Т в них могут быть вариантом нормы.
Прямые электрокардиографические признаки инфаркта миокарда
правого желудочка в виде патологического зубца Q с подъемом сег-
мента ST и характерной динамикой при его наиболее частой локализации в
области задней стенки выявляются лишь в отведениях V3R 4R. Возможны ре-
ципрокные изменения в отведениях V7_9. Эти изменения,’ как правило, со-
четаются с признаками инфаркта задней стенки левого желудочка.
Инфаркт миокарда предсердий , который практически не бы-
вает изолированным, можно заподозрить по изменению формы зубца Р,
подъему или депрессии сегмента PQ, которые обычно сопровождаются
предсердными нарушениями ритма и проводимости.
О распространенности инфаркта миокарда судят по ко-
личеству сегментов левого желудочка и соответствующих отведений ЭКГ,
в которых определяются характерные изменения. Для более точного опреде-
ления размеров инфаркта миокарда передней локализации по данным ЭКГ
используют метод записи множественных - 35, 49 и более — прекардиаль-
ных отведений — так называемой электрокардиотопограммы (см. главу 5)
с учетом количества этих отведений, в которых отмечаются патологические
348
Таблица 30. Электрокардиографическая диагностика инфаркта миокарда в зависимости
от локализации
Локализация инфаркта миокарда левого желудочка Прямые изменения в отведениях Реципрокные измеиения в отведениях Прочие измеиения
Передне-перегородочный V,-, V *3R,4R — Отсутствие нормальных перегородочных зубцов q в отведениях I и aVL
Передний (передне- верхушечный) Ill, aVF, V„ Нормальные перегоро- дочные зубцы q в отведе- ниях I и V6 Начальный зубец R в отведениях V„ V3R4R Уменьшение амплитуды зубца R в отведениях V56
Передне-боковой I, aVL,VS6 —
Боковой (высокие отделы боковой стенки) aVL (±1, на 2 ребра выше) —
Нижний (задне- диафрагмальный) II, III, aVF, VM ± I, aVL,
Задний (задне-базальный) ± отведения по Слапаку Vy, V3R
зубцы Q (или QS) и(или) подъемы сегмента ST. Поскольку при этом реги-
стрируется лишь проекция изменений потенциалов различных участков мио-
карда на передне-боковую поверхность грудной клетки, оценка размеров и
глубины зоны некроза и повреждения носит ориентировочный характер.
Трудности интерпретации изменений на ЭКГ при ин-
фаркте миокарда. Довольно часто инфаркт миокарда сочетается с нару-
шениями внутрижелудочковой проводимости. При блокаде правой ножки пуч-
ка Гиса свойственное ей изменение нормальной последовательности рас-
пространения волны де- и ре поляризации не создает помех для формирова-
ния патологических зубцов Q и подъема сегмента ST. В то же время характер -
ные для блокады левой ножки пучка Гиса изменения желудочкового комп-
лекса (зубцы QS) с подъемом сегмента ST в отведениях III, aVF, Vj_3 пол-
ностью маскируют признаки инфаркта миокарда, даже трансмурального.
При этом само внезапное возникновение полной блокады ножки пучка
Гиса следует рассматривать как возможный признак инфаркта. В пользу этого
может свидетельствовать также изменение графики исходно деформи-
рованного желудочкового комплекса при электрокардиографии в динамике.
Кроме инфаркта миокарда и других форм ИБС изменения комплекса
QRST свойственны ряду других заболеваний и состояний. Корытообразная
депрессия сегмента ST отмечается при передозировке сердечных гликози-
дов, а подъем этого сегмента дугой книзу — при остром перикардите. Высо-
кий остроконечный зубец Т характерен для гиперкалиемии. Глубокий зубец
Q в отведениях III и aVF часто регистрируется при повороте сердца по
349
Таблица 31. Динамика содержания в крови при инфаркте миокарда ферментов и миоглобина
Показатель Начало повышения, Пик активности, ч Нормализация
Миоглобин 2 4 1—2 сут
КФК 3-6 24 2—3 сут
Изофермент МВ КФК 4—6 12-20 36—48 час
ACT 6-12 24-48 4—7 сут
ЛДГ 6-24 48-72 7—14 сут
Гидроксибутиратдегидрогеназа (ЛДГ-1) 6-12 48-72 10—14 сут
Примечание. Указано время от начала заболевания.
часовой стрелке в связи с острой перегрузкой правого желудочка (тромбо-
эмболия легочной артерии и др.) и хроническими обструктивными заболе-
ваниями легких. Дифференциальная диагностика с инфарктом миокарда в
этих случаях подчас сложна и базируется на данных клиники, лаборатор-
ных исследований и динамики прямых и дискордантных изменений сег-
мента ST и зубца Т.
Среди лабораторных показателей относительно специфичным признаком
инфаркта миокарда является повышение активности ферментов,
которые находятся в кардиомиоцитах и выходят в кровоток в результате их
некроза. Для диагностики инфаркта миокарда наиболее широко используют
определение уровня КФК — катализатора переноса макроэргических фосфа-
тов от фосфокреатина к АДФ с образованием АТФ, ACT, ЛДГ (катализиру-
ет превращение пирувата в лактат) и их изоферментов: изофермента МВ
КФК и 1-го из 5 изоферментов ЛДГ. Они отличаются различной динамикой
изменения содержания в крови от момента возникновения инфаркта
(табл. 31) и кардиоспецифичностью. При их определении в диагностических
целях учитывают как абсолютные величины, так и динамику нормализации.
Для подтверждения диагноза инфаркта миокарда в ранние сроки — 1-е
сутки от вероятного начала заболевания — используют одно-, двух- или
трехкратное определение активности КФК, изофермента МВ КФК или
(реже) содержания дыхательного белка миоглобина — самого раннего
маркера некроза. На 2-е сутки следует ожидать максимального повыше-
ния уровня ACT и гидробутиратдегидрогеназы, косвенно отражающей
активность 1-го изофермента ЛДГ, а на 3-и — общей ЛДГ, содержание
которой сохраняется повышенным в течение 7—14 сут. Диагностическое
значение большинства этих энзимологических показателей ограничено в
связи с их низкой кардиоспецифичностью. Кроме миокарда, все они, за
исключением МВ КФК, содержатся в скелетных мышцах, попадая в кровь
при их воспалительных заболеваниях, травме и даже внутримышечных
инъекциях (!), а также в печени, легких (ACT, ЛДГ), эритроцитах (ЛДГ)
и в меньших количествах во многих других тканях.
Наибольшей кардиоспецифичностью обладает изофермент МВ КФК,
который находится практически исключительно в кардиомиоцитах и, в
отличие от общей КФК, не выходит в кровь при внутримышечных инъек-
350
Возможные сердечные и внесердечные причины повышения активности изофермента
МВ КФК в сыворотке крови
Причины, связанные
с сердечно-сосудистой системой
Острый инфаркт миокарда
Рецвдив острого инфаркта миокарда
Нестабильная стенокардия
Тяжелая застойная сердечная недостаточность
Острый миокардит
Острый перикардит
Длительные тахиаритмии
Травма сердца
Катетеризация сердца и коронарография
Электроимпульсная терапия и
реанимационные мероприятия
Кардиохирургические операции
Внесердечные причины
Поражение поперечно-полосатых мышц:
травма, миозит, мышечная дистрофия,
глубокие ожоги
Злокачественная гипертермия
Септицемия
Шок
Острый некроз печени
Инфаркт тонкой кишки
Рак предстательной железы
Бронхогенный рак легких
Гипотиреоз
Черепно-мозговая травма
циях. Два других ее изофермента — ММ и ВВ — содержатся соответствен-
но почти исключительно в поперечно-полосатых мышцах и мозге. Содер-
жание изофермента МВ КФК в сыворотке крови начинает нарастать че-
рез 4—6 ч, достигает пика между 12-ю и 20-ю часами и нормализуется
спустя 36~48 ч. Чувствительность и специфичность повышения содержа-
ния этого фермента в интервале 6—24 ч от начала заболевания достигает
95 % (P.Puleo и соавт., 1990). В то же время его нормальный уровень в
более поздние сроки не позволяет исключить инфаркт миокарда. Выше
перечислены другие возможные причины гиперферментемии МВ КФК.
Определение содержания изофермента МВ КФК имеет наибольшее ди-
агностическое значение в случаях низкой информативности данных ЭКГ
— при наличии рубцовых изменений в миокарде, аберрантных желудочко-
вых комплексов в связи с блокадой ножек пучка Гиса, синдромом Воль-
фа—Паркинсона—Уайта, выраженной гипертрофией левого желудочка. Это
наиболее достоверный метод диагностики рецидива или распространения
инфаркта и уточнения диагноза в случаях сочетания сомнительных элект-
рокардиографических признаков с повышением уровня общей КФК.
Использование серийного определения активности изофермента МВ
КФК с интервалом 2—4 ч до нормализации позволяет с помощью матема-
тической модели по площади под кривой “активность—время” рассчитать
массу некроза в грамм-эквивалентах со значительно большей точностью,
чем по данным содержания общей КФК, или электрокардиотопограммы.
Масса очага некроза и коррелирующий с ней уровень ферментативной
активности на пике повышения имеют важное прогностическое значение
в отношении тяжести течения заболевания и его исхода.
Для диагностики инфаркта миокарда спустя 24 ч и более от начала
заболевания используют ЛДГ и особенно ее 1-й изофермент (гидробути-
351
ратдегидрогеназу), который по своей специфичности уступает только изо-
ферменту МВ КФК. Активность этих ферментов начинает увеличиваться
через 12—24 ч, достигает пика на 2-е сутки и сохраняется повышенной в
течение 10—14 сут (см. табл. 31) от начала заболевания. Диагностическая
ЛДГ -1
ценность данных возрастает при отношении свыше 1. Необходимо
ЛДГ - 2
иметь в виду, что уровень ЛДГ возрастает при гемолизе, почечной недо-
статочности и некоторых опухолях.
Вспомогательное диагностическое значение при инфаркте миокарда
имеют лабораторные признаки резорбционно-некроти-
ческого синдрома. Отмечается лейкоцитоз за счет нейтрофилеза со
сдвигом формулы влево, который появляется через несколько часов от
начала заболевания, достигает максимума — до 12—15><106/л — на 2—4-е
сутки и нормализуется обычно к 7-м суткам. Более длительное сохране-
ние лейкоцитоза позволяет заподозрить развитие осложнений. Увеличе-
ние СОЭ наступает с запозданием — начиная со 2—4-х суток болезни — и
достигает максимума на 2-й неделе, когда содержание лейкоцитов прак-
тически возвращается к норме (симптом “перекреста”). При неосложнен-
ном инфаркте миокарда нормализация СОЭ происходит на 3-4-й неделе.
На протяжении 1 мес может сохраняться и повышение содержания ост-
рофазовых реактантов — СРБ, а2- и у-глобулинов.
В 1—2-е сутки отмечается преходящая гипергликемия как результат
стрессорной реакции надпочечников.
Изменения показателей гемостаза неспецифичны и весьма
вариабельны. Отмечаются в различной степени выраженные сдвиги в сто-
рону как гипер-, так и гипокоагуляции, а у части больных — признаки
угнетения фибринолиза и повышение агрегации тромбоцитов. Они могут
играть патогенетическую роль или отражать компенсаторную реакцию
системы гемостаза на тромбоз. Эти показатели не имеют диагностической
ценности и контролируются главным образом при проведении тромбо-
литической и антикоагулянтной терапии.
Степень повышения ферментативной активности и воспалительных сдви-
гов в крови прямо пропорциональна величине некроза, поэтому при
крупноочаговом инфаркте она больше, чем при мелкоочаговом.
Радионуклидная диагностика инфаркта миокарда базируется на сцинти-
графии с 99,пТс, который накапливается в зоне острого некроза в виде четко
очерченного “горячего очага”, начиная с 1—3-х суток, и сохраняется до 7—
10-х суток. Оптимальным является его использование в диагностических це-
лях между 2-ми и 7-ми сутками заболевания для определения локализации
и величины инфаркта. Чувствительность и специфичность метода при транс-
муральном инфаркте достигают 90 %, при мелкоочаговом они снижаются.
Он особенно ценен для диагностики инфаркта миокарда в относительно
поздние сроки — после нормализации энзимологических показателей и при
неинформативных данных ЭКГ (например, при повторном инфаркте, бло-
каде левой ножки пучка Гиса), а также для диагностики инфаркта миокарда
352
правого желудочка. Возможны ложноположительные результаты при хро-
нической аневризме сердца.
При сцинтиграфии миокарда с 201Т1 участки с нарушенной перфузией
определяются в виде “холодных пятен”. Существенным недостатком ме-
тода является невозможность отличить зону некроза от потенциально об-
ратимой ишемии. Его применение в динамике позволяет оценить исход
ишемического повреждения и эффективность “спасения” миокарда с по-
мощью тромболизиса и других методов лечения.
Разработан и находится в стадии апробации новый метод визуализа-
ции очага инфарцирования с помощью специфических антимиозиновых
антител с радиоактивной меткой. Он основывается на фиксации этих ан-
тител в зоне некроза вследствие связывания с внутриклеточным миози-
ном при нарушении целостности плазматической мембраны. Его чувстви-
тельность для диагностики острого инфаркта с зубцом Q составляет 92 %
(L.Johnson и соавт., 1989).
Радионуклидная вентрикулография, как и двухмерная эхокардиография,
позволяют выявлять наличие зон асинергии и характеризовать их распро-
страненность и выраженность, диагностировать развитие острой анев-
ризмы левого желудочка, а также оценивать его функцию в целом. Чув-
ствительность выявления зон нарушения регионарного движения стенки
желудочка как признака острого инфаркта миокарда составляет 92 %,
однако специфичность — лишь 53 %. Столь низкая специфичность связа-
на с тем, что такие локальные изменения характерны также для выра-
женной ишемии и наблюдаются при наличии рубцов в миокарде. Поэто-
му большую диагностическую ценность имеет факт отсутствия наруше-
ний сегментарной сократимости, что позволяет исключить инфаркт ми-
окарда в спорных случаях с точностью до 94 % (С.Peels и соавт., 1990).
Эхокардиографию можно использовать также для обнаружения внутри-
желудочковых тромбов и выпота в перикард и оценки морфологии мит-
рального клапана для уточнения генеза систолического шума.
Предварительные результаты указывают на возможность более точно-
го разграничения зоны острого некроза, неизмененного миокарда и руб-
ца, потенциально жизнеспособного и нежизнеспособного миокарда, а
также определения локализации и размеров инфаркта с помощью раз-
личных методов кинокомпьютерного томографического сканирования и
ядерно-магнитного резонанса (J.Johns и соавт., 1990).
Рентгенография грудной клетки имеет значение только для диагности-
ки осложнений заболевания: сердечной недостаточности, ТЭВЛА, синд-
рома Дресслера и др.
Дифференциальную диагностику инфаркта миокарда проводят с: 1) рассла-
ивающей аневризмой грудной части аорты; 2) ТЭВЛА; 3) нестабильной сте-
нокардией; 4) острым перикардитом; 5) острым миокардитом; 6) спонтан-
ным пневмотораксом. Диагностика заболевания основывается на наличии не
менее 2 из 3 основных критериев: 1) характерной загрудинной боли; 2) ха-
рактерной динамики ЭКГ; 3) повышения активности в крови изофермента
353
МВ КФК или, что менее информативно, других ферментов с относитель-
ной кардиоспецифичностью. Уточнить диагноз помогает сцинтиграфия мио-
карда с "тТс пирофосфатом.
Варианты течения. Атипичное клиническое течение начала инфаркта ми-
окарда отмечается у 6—30 % больных. Различают следующие его варианты:
1) астматический; 2) абдоминальный, или гастралгический; 3) аритмичес-
кий (в том числе внезапная смерть); 4) цереброваскулярный; 5) бессимп-
томный. Своевременное распознавание инфаркта миокарда в таких случаях
иногда представляет значительные трудности, в связи с чем важное значе-
ние имеет настороженность врача в отношении возможности наличия ин-
фаркта миокарда как причины той или иной клинической картины.
Астматический вариант наблюдается у 10—20 % больных, преимуществен-
но с повторным инфарктом миокарда, и проявляется приступом сердечной
астмы или отека легких при отсутствии или незначительной выраженности
боли в области сердца. В связи с этим при внезапном развитии у больного
острой левожелудочковой недостаточности, особенно впервые в жизни и
на фоне нормального или пониженного АД, необходимо помнить о воз-
можности ишемической дисфункции левого желудочка.
Для абдоминального варианта характерно сочетание боли в надчревной
области с диспепсическим синдромом (тошнота, неоднократная, не при-
носящая облегчения рвота) и парезом пищеварительного канала. Боль час-
то иррадиирует в область лопаток, межлопаточное пространство, плечи.
Брюшная стенка в верхних отделах живота напряжена и может быть уме-
ренно болезненной при отсутствии симптомов раздражения брюшины, пе-
ристальтика часто отсутствует. Этот вариант наблюдается в 1—5 % случаев
инфаркта миокарда, обычно при его задне-диафрагмальной локализации,
и иногда расценивается как острый гастрит, панкреатит, обострение язвен-
ной болезни желудка, двенадцатиперстной кишки или холецистита.
При аритмическом варианте в клинической картине превалируют симп-
томы нарушений ритма, чаще пароксизмы желудочковой или суправентрику-
лярной тахикардии, или полной атриовентрикулярной блокады. Единственным
проявлением острого инфаркта миокарда может быть также внезапная смерть.
Цереброваскулярный вариант встречается редко (около 1 %) и проявля-
ется нарушением мозгового кровообращения, в большинстве случаев ди-
намическим, с общемозговыми (головокружение, обморок, рвота) и оча-
говыми неврологическими симптомами. Он наблюдается чаще у больных
старших возрастных групп с выраженным церебральным атеросклерозом
и обусловлен одновременным возникновением тромбоза или спазма ко-
ронарных и мозговых артерий. Нарушению мозгового кровообращения мо-
жет способствова сь резкое снижение МОС вследствие распространенной
ишемической дисфункции левого желудочка, а также гиперкоагуляция.
На долю нефатального бессимптомного (“немого") инфаркта миокарда
приходится до 10—25 % случаев. Его обнаруживают обычно при случайной
регистрации ЭКГ и особенно часто у больных сахарным диабетом, по-ви-
димому, вследствие свойственной им нейропатии.
354
Инфаркт миокарда без зубца Q. Диагноз мелкоочагового инфаркта мио-
карда часто ставят ретроспективно на основании совокупности клиниче-
ских, электрокардиографических и лабораторных изменений при тщатель-
ном динамическом наблюдении за больным. Клинические проявления обыч-
но скудные и включают умеренную ангинозную боль, преходящий ритм
галопа и эпизод “малого субфебрилитета”. Не выражены также изменения
на ЭКГ, которые затрагивают только сегмент ST и зубец Т, а также актив-
ности ферментов и воспалительные сдвиги в крови. Хотя такой инфаркт
по сравнению с крупноочаговым отличается обычно меньшей массой, он
больше подвержен распространению. Вследствие меньшей частоты тяже-
лых осложнений он имеет зачастую более легкое течение.
Инфаркт миокарда правого желудочка можно заподозрить у больных с
инфарктом задней стенки левого желудочка и признаками правожелудоч-
ковой недостаточности, повышенным ЦВД и сниженными МОС и АД при
отсутствии существенных признаков левожелудочковой недостаточности. От-
мечаются набухшие шейные вены, иногда парадоксальный пульс, при аус-
культации часто слышны правожелудочковые III и IV тоны у левого края
грудины при отсутствии застойных хрипов в легких. На ЭКГ определяются
подъем сегмента ST в отведениях от правой половины трудной клетки и
признаки инфаркта задней стенки левого желудочка. При двухмерной эхо-
кардиотрафии обнаруживаются гипо- и акинезия значительной части пра-
вого желудочка и его дилатация. Подтвердить диагноз позволяют катетери-
зация сердца (КДД в правом желудочке равно или превышает КДД в левом
при нормальном или незначительно повышенном “заклинивающем” дав-
лении в “легочных капиллярах”) и сцинтиграфия миокарда с 99тТс.
Основные осложнения острого инфаркта миокарда перечислены ниже.
Нарушения ритма. Пароксизмальная желудочковая тахи-
кардия и фибрилляция желудочков являются основными
причинами смерти от инфаркта миокарда на догоспитальном этапе. У гос-
питализированных больных частота фибрилляции желудочков составляет
Основные осложнения острого инфаркта миокарда
Осложнения Примерная частота, %
Нарушения ритма, в том числе внезапная смерть 60—95
Острая левожелудочковая недостаточность 50—70
Рецидив или распространение зоны инфаркта миокарда 10—40
Нестабильная постинфарктная (периинфаркгная) стенокардия 10—20
Острая аневризма левого желудочка 10—20
Эпистенокардитический перикардит 10—20
Атриовентрикулярная блокада 10—15
Тромбоэмболия 5—15
Разрыв свободной стенки сердца с гемотампонадой 3—5
Разрыв сосочковой мышцы или межжелудочковой перегородки 1—5
Постинфарктный синдром Дресслера 3-4
355
примерно 10 %. Наиболее часто она возникает в первые 2 ч и является ос-
новной причиной внезапной смерти. В целом тяжелые желудочковые арит-
мии в первые 4 ч наблюдаются в 10—20 раз чаще, чем начиная со 2-х суток
до конца госпитального периода. Фибрилляция желудочков у больных без
признаков сердечной недостаточности или шока обусловлена электрической
нестабильностью ишемизированного миокарда, чему способствуют повы-
шенная симпатическая активность и гиперкатехоламинемия. При своевремен-
ном оказании помощи такая первичная фибрилляция желудочков имеет
благоприятный прогноз. Это определяет важность возможно более ранней
госпитализации больных с инфарктом миокарда специализированными
бригадами “Скорой помощи” в блоки (отделения) интенсивной терапии с
проведением контроля ЭКГ. Ранняя диагностика в лечение желудочковых
аритмий в таких условиях сыграли решающую роль в снижении госпитальной
летальности при остром инфаркте миокарда (см. ниже). При вторичной фиб-
рилляции желудочков, развивающейся на фоне сердечной недостаточности
и обусловленной дисфункцией левого желудочка, частота успешных реанима-
ций значительно меньше.
У небольшой части больных фибрилляция желудочков возникает в поздний
госпитальный период, главным образом при передне-перегородочном ин-
фаркте с блокадой левой или правой ножки пучка Гиса. Механизмом такой
“поздней” желудочковой аритмии обычно является “ри-энтри”, а исход и
отдаленный прогноз зависят от выраженности дисфункции левого желудочка.
Связь фибрилляции желудочков с аритмиями-’’предвестниками” — ча-
стой, групповой, политопной и “ранней” желудочковой экстрасистолией
— в последние годы пересматривается.
Эпизоды ускоренного идиовентрикулярного ритма,со-
стоящего из нескольких (в среднем 6—12) желудочковых комплексов с час-
тотой 60—120 в 1 мин, выявляются у 15—25 % больных. Он обычно является
замещающим ритмом при синусовой брадикардии, очень редко переходит
в пароксизмальную желудочковую тахикардию и вследствие этого имеет
относительно благоприятный прогноз. При возникновении в первые часы
инфаркта миокарда его считают проявлением реперфузии — спонтанной
или в результате тромболитической терапии.
Суправентрикулярные тахикардия и тахиаритмии,
включая мерцание и трепетание предсердий, встречаются реже, чем желудоч-
ковые (у 10—15 % больных) и, как правило, обусловлены левожелудочковой
недостаточностью. Они не связаны с повышенным риском развития фибрил-
ляции желудочков и сами по себе обычно не отягощают прогноз. Необходи-
мо иметь в виду, однако, что частый желудочковый ритм может ухудшать
коронарный кровоток и кардиогемодинамику, способствуя снижению МОС.
Брадиаритмии. В первые несколько часов заболевания синусо-
вая брадикардия иэпизоды остановки синусового узла от-
мечаются у 10—20 % больных, в том числе у 80 % с задним инфарктом
миокарда. У таких больных они обусловлены либо рефлексом Бецольда-
Яриша, либо окклюзией правой коронарной артерии проксимальнее от-
356
хождения артерии синусового узла и обычно хорошо переносятся. В ряде
случаев, однако, способствуя усугублению гетерогенности рефрактерных
периодов соседних мышечных волокон, брадикардия может приводить к
развитию желудочковых аритмий.
Высокостепенные атриовентрикулярные блокады
(типа Мобитц II и полная) наблюдаются примерно у 10 % госпитализиро-
ванных по поводу инфаркта миокарда. Нарушения атриовентрикулярной и
внутрижелудочковой проводимости при передних инфарктах имеют зна-
чительно худший прогноз, чем при задних, так как являются следствием
обширного некроза межжелудочковой перегородки с вовлечением пучка
Гиса, который часто сопровождается левожелудочковой недостаточнос-
тью. При этом у большинства больных с атриовентрикулярной блокадой I
степени или блокадой одной из ножек пучка Гиса развивается бифасцику-
лярная блокада с последующим внезапным возникновением полной ат-
риовентрикулярной блокады с локализацией водителя ритма в проводя-
щей системе или сократительном миокарде желудочков. Это обусловлива-
ет выраженность брадикардии, часто менее 30 ударов в 1 мин, подвержен-
ность приступам Морганьи—Адамса—Стокса, тяжелой сердечной недоста-
точности, желудочковой тахиаритмии и стойкой асистолии.
При острых задне-диафрагмальных инфарктах миокарда нарушения атрио-
вентрикулярной проводимости встречаются в 2-4 раза чаще, чем при пере-
дних и, в отличие от них, обусловлены не некротическими изменениями
клеток проводящей системы, а обратимой ишемией. Атриовентрикулярная
блокада высокой степени отмечается у 1/6 таких больных и, как правило,
является проксимальной с ЧСС 45-60 в 1 мин, что обеспечивает достаточ-
ный МОС. Она редко осложняется приступами Морганьи—Адамса—Стокса
и сердечной недостаточностью и обычно не является непосредственной при-
чиной смерти. Обычно степень блокады нарастает постепенно — от I к III.
При эффективном лечении госпитальная летальность больных с полной
атриовентрикулярной блокадой, осложняющей задний инфаркт миокарда,
составляет 25 %, а передний - около 50 %, что обусловлено в основном
различиями величины массы некротизированного миокарда.
Острая левожелудочковая недостаточность. Патофизиологические ме-
ханизмы острой левожелудочковой недостаточности при инфаркте мио-
карда отличаются от механизмов развития хронической сердечной недо-
статочности. К ним относятся:
1) потеря жизнеспособного миокарда;
2) парадоксальная пульсация некротизированного и ишемизированного
миокарда, утратившего способность к сокращению;
3) уменьшение диастолической податливости левого желудочка вслед-
ствие его ишемии, что может приводить к повышению КДД и венозному
застою в легких даже при нормальных размерах полости левого желудоч-
ка и МОС (при ликвидации ишемии эти изменения обратимы);
4) дисфункция сосочковых мышц вследствие их инфарцирования, же-
лудочковой асинергии в местах прикрепления или дилатации полости
357
Таблица 32. Классификация больных с острым инфарктом миокарда T.Killip н J.Kimball (1969)
Класс Определение Удельный вес данной кате- гории больных среди поступивших в БРИТ, % ♦ Госпитальная летальность, % *
I Признаки левожелудочковой недостаточности отсутствуют 30-40 8
II S3 или(и) застойные хрипы менее чем над 50 % поверхности легочных полей 30-50 30
III Застойные хрипы более чем над 50 % поверхности легочных полей, часто отек легких 5-10 44
IV Кардиогенный шок 10 80-100
* Данные авторов.
желудочка. Сосочковые мышцы уязвимы для гипоксии, так как относят-
ся к субэндокардиальной зоне;
5) органические нарушения — разрыв сосочковых мышц или межжелу-
дочковой перегородки (см. ниже);
6) тахи- и брадисистолические нарушения ритма сердца, которые мо-
гут приводить к значительному падению МОС вследствие укорочения вре-
мени диастолического наполнения, уменьшения коронарного кровотока
и исчезновения “предсердной надбавки”;
7) недостаточное компенсаторное повышение функции неповрежденно-
го миокарда вследствие его склероза, ацидоза, гипоксемии.
Основной причиной сердечной недостаточности при инфаркте мио-
карда, в значительной степени определяющей ее тяжесть, является вне-
запное уменьшение массы сократительного миокарда левого желудочка. В
связи с этим у таких больных наблюдается раннее (в первые часы или
дни заболевания) острое развитие или, в ряде случаев, усугубление ле-
вожелудочковой недостаточности, что и отражено в названии этого ос-
ложнения. При отсутствии инфаркта правого желудочка его недостаточ-
ность в наиболее тяжелых случаях присоединяется обычно спустя несколь-
ко недель, когда увеличивается двигательная активность.
Очевидно, что для оценки выраженности острой левожелудочковой не-
достаточности в ранний госпитальный период инфаркта миокарда, когда
больные находятся на постельном или полупостельном режиме, не прием-
лемы существующие классификации сердечной недостаточности (Нью-Йорк-
ской ассоциации кардиологов, Н.Д.Сгражеско и В.Х.Василенко, см. ниже).
В этих целях удобно пользоваться классификацией больных с острым ин-
фарктом миокарда T.Killip и J.Kimball (1969), которая базируется на клиниче-
ских признаках левожелудочковой недостаточности, отмечающихся в пе-
риод нахождения в блоке интенсивного наблюдения, лечения и реанима-
ции. Как видно из данных табл. 32, их выраженность определяет госпиталь-
ную летальность, а также отдаленный прогноз.
358
Таблица 33. Тины изменения гемодинамики у больных с острым инфарктом миокарда нрн разных
вариантах нарушения системного кровообращения
Вариант нарушения системного кровообращения АД СИ ЦВД ЗДЛА ОПСС
Острая левожелудочковая недостаточность II—III класса N, 1 N, 1 N, Т Т N, ?
Острая левожелудочковая недостаточность IV класса (кардиогенный шок) 1 1 N, Т т ?
Гемотампонада 1 1 ? т N, Т
Тяжелый инфаркт миокарда правого желудочка или массивная ТЭВЛА 1 1 ? N, 1 N, Т
Гиповолемия 1 1 1 1 т
Избыточная вазодилатация 1 N, 1 N, 1 N, 1 J.
Гиперволемия N, Г Т Г Г N, 1
Примечание. ЗДЛА - “заклинивающее” давление в легочной артерии
Сердечная недостаточность является причиной 2/3 летальных исходов
у госпитализированных через 4 ч и позже от начала заболевания.
Во всех случаях острой левожелудочковой недостаточности при остром
инфаркте миокарда для индивидуализации лечения необходимо опреде-
лять гемодинамический профиль.Такой гемодинамический
мониторинг приобретает особое значение в тяжелых случаях и при
недостаточной эффективности начатой терапии. Кроме острой левожелу-
дочковой недостаточности, показаниями к его проведению являются ар-
териальная гипотензия, не поддающаяся обычному лечению; необъясни-
мый и (или) выраженный цианоз, тахипноэ, гипоксемия. Весьма желате-
лен также гемодинамический контроль при применении инотропных пре-
паратов и вазодилататоров.
Оптимальным является определение следующих показателей гемоди-
намики: 1) диастолического давления в легочной артерии и (или) “закли-
нивающего” давления в “легочных капиллярах” с помощью катетера Сван-
Ганца, которое примерно равно КДД в левом желудочке; 2) ЦВД (давле-
ния в правом предсердии); 3) АД (при низких величинах у больных с шо-
ком лучше прямым методом); 4) сердечного индекса (лучше методом тер-
модилюции, хуже — по Фику, данным эхо- или реографии); 5) ОПСС
расчетным путем. Обязателен также контроль диуреза, при шоке — поча-
совой с установлением постоянного мочевого катетера.
У больных с острым инфарктом миокарда, протекающим с признака-
ми венозного застоя в легких или нарушения периферического кровооб-
ращения (бледная, холодная, влажная кожа, акроцианоз, снижение АД),
изменения гемодинамики могут быть обусловлены несколькими причина-
ми, которые требуют дифференцированной коррекции (табл. 33).
Тяжесть острой левожелудочковой недостаточности при инфаркте
миокарда определяется главным образом выраженностью венозного зас-
тоя в легких, то есть повышения давления наполнения левого желудочка,
или “заклинивающего” давления в легочной артерии, и снижения МОС,
сопровождающегося клиническими признаками гипоперфузии тканей. В
359
Таблица 34. Госпитальная летальность при различных
гемодинамических вариантах острого инфаркта миокарда,
выделяемых при клиническом исследовании и определении
показателей гемодинамики специальными методами *
Гемодина- мический вариант Венозный застой в легких * ** *** (1) Нарушение перфузии тканей (2) Госпитальная летальность (%) прн оценке (1) и (2) с помощью
общеклк- ннческого обследова- ния специаль- ных методов
I - - 1 3
II + - 11 8
III - + 18 23
IV + + 60 51
зависимости от сочетания их
изменений, которые отра-
жают функцию левого желу-
дочка, можно выделить 4
гемодинамических вариан-
та, тесно коррелирующих с
прогнозом (табл. 34).
Когда в клинической кар-
тине острой левожелудочко-
вой недостаточности при ин-
фаркте миокарда преоблада-
* По J.Forrester, D.Waters (1978).
** “Заклинивающее” давление в “легочных капил-
лярах” >18 мм рт.ст.
*** СИ <2,2 л/мин/м2.
ют артериальная гипотензия,
периферическая вазоконст-
рикция, признаки гипопер-
фузии тканей и олигурия,
это состояние расценивают
как кардиогенный шок. В боль-
шинстве случаев отмечается
значительное повышение
КДД в левом желудочке —
так называемый гипокинетический тип нарушения гемодинамики. В зависимо -
сти от состояния насосной функции правого желудочка кардиогенный шок
может протекать с отеком легких или без него. Изредка при инфаркте, сопро -
вождающемся артериальной гипотензией и периферическими признаками
шока, уровень КДД в левом желудочке, а также ЦВД снижены. Такой “гипо -
волемический” гемодинамический профиль значительно легче корригируется.
Признаки кардиогенного шока могут отмечаться с самого начала воз-
никновения обширного инфаркта миокарда, часто повторного, либо раз-
виваться постепенно в течение нескольких дней. Это осложнение имеет
неблагоприятный прогноз.
Вопросы патогенеза, диагностики и течения кардиогенного шока и
отека легких подробно изложены в специальной главе.
Разрыв инфарцированной сосочковой мышцы и перфорация (разрыв) меж-
желудочковой перегородки проявляются возникновением грубого пансистоли-
ческого шума с соответствующим эпицентром и дрожанием. Одновременно
остро развивается тяжелая сердечная недостаточность с отеком легких и
(или) кардиогенным шоком. Эти осложнения возникают обычно на первой
неделе заболевания, причем перфорация межжелудочковой перегородки, в
силу характера ее васкуляризации, происходит преимущественно при перед-
нем инфаркте миокар; а; 80-90 % больных умирают в течение суток. Диаг-
ноз подтверждается при допплерэхокардиографии и катетеризации сердца.
Наружному разрыву подвергается обычно свободная стенка левого желу-
дочка на границе между инфарцированным и жизнеспособным миокардом
в результате образования расслаивающей гематомы с развитием острого
гемоперикарда и тампонады. Его удельный вес среди причин госпитальной
360
летальности составляет в среднем 10—20 % и уступает только сердечной не-
достаточности и нарушениям ритма. Разрыв отмечается преимущественно в
первые 5—7 сут заболевания, чаще в случаях сохранения артериальной
гипертензии, крайне редко встречается при наличии сердечной недоста-
точности и аневризмы сердца и не связан с антикоагулянтной терапией. В
большинстве случаев он проявляется резкой болью в области сердца с прехо-
дящей брадиаритмией (синусовой, узловой брадикардией или идиовентрику-
лярным ритмом) и быстрым развитием электромеханической диссоциации.
Она проявляется картиной внезапного прекращения кровообращения с от-
сутствием сознания, пульсации на крупных артериях и тонов сердца вслед-
ствие резкого падения МОС при сохранении на ЭКГ редкого сердечного
ритма, часто синусового, с подъемами сегмента ST. Смерть обычно наступает
мгновенно. Такие характерные признаки разрыва сердца позволяют поставить
этот диагноз при жизни и подтвердить его получением крови при пункции
перикарда во время проведения реанимационных мероприятий. Реже над-
рыв развивается более медленно, сопровождается интенсивным рецидиви-
рующим болевым синдромом, обусловленным постепенным накоплением
крови в перикарде, которая видна при эхокардиографии, и картиной шока.
Иногда надрыв стенки может прикрываться перикардом, что препятствует
образованию диффузного гемоперикарда. При организации гематомы обра-
зуется ложная аневризма, которая может развиваться в поздние сроки.
Затяжное течение, рецидивы и распространение инфаркта миокарда.
Обычно при инфаркте продолжительность острого болевого синдрома со-
ставляет несколько часов, от силы до 1—2 сут. При его затяжном те-
чении формирование свежих некротических очагов продолжается свыше
48—72 ч от начала заболевания. Оно сопровождается рецидивирующей анги-
нозной болью, требующей повторного введения наркотических анальгети-
ков, увеличением распространенности зоны некроза по данным ЭКГ и
длительным сохранением повышенной активности КФК и ее изофермента
МВ в крови. Частыми осложнениями являются нарушения ритма и прово-
димости и развитие острой левожелудочковой недостаточности. Причинами
затяжного течения инфаркта являются гибель в зоне первоначального не-
кроза уцелевших островков мышечной ткани, находящихся в наиболее
неблагоприятных условиях, и распространение некроза на периинфаркт -
ную ишемизир званную зону миокарда. Это обусловлено продолжающим-
ся коронаротромбозом или спазмом и недостаточностью коронарного кро-
вообращения в интактных отделах миокарда в условиях их компенсатор-
ной гиперфункции. Затяжному течению инфаркта миокарда способствуют
все ситуации, увеличивающие дисбаланс между потребностью миокарда в
кислороде и коронарным кровотоком: сохранение артериальной гипер-
тензии, или, наоборот, гипотензия, тахикардия и тахиаритмии и др.
Рецидивом или распространением инфаркта миокар-
д а принято считать появление новых участков некроза миокарда в сроки
от 72 ч после развития инфаркта и до окончания основных процессов руб-
цевания, то есть в течение 8 нед, что соответствует определению острого
361
инфаркта ВОЗ. В обоих случаях ему предшествует период клинической стаби-
лизации с положительной динамикой ЭКГ и ферментативной активности. Ре-
цидивом обычно называют появление признаков свежего некроза в зоне пер-
воначального некротического очага (крупно- или мелкоочагового) за счет гибели
уцелевших поначалу кардиомиоцитов внутри него либо в периинфарктной
области. Распространением инфаркта считают образование свежего крупно-
или мелкоочагового некроза в отдаленных отделах левого желудочка. В обоих
случаях такое течение обусловлено тяжелым распространенным стено-
зирующим атеросклерозом, а непосредственной причиной является усугубле-
ние несоответствия “потребность—доставка” кислорода либо новый коро-
наротромбоз. Оно отмечается в среднем у 10—15 % больных с инфарктом
миокарда с зубцом Сиу 35-40 % больных с мелкоочаговым инфарктом,
связано со значительным ухудшением функции левого желудочка, разви-
тием аритмий, включая фибрилляцию желудочков, и повышением госпи-
тальной летальности.
Рецидив и распространение инфаркта миокарда могут возникать в любые
сроки заболевания и развиваются внезапно либо на фоне ранней периин-
фарктной (постинфарктной) стенокардии. Они проявляются характерным для
инфаркта болевым синдромом или изолированными нарушениями ритма и
острой левожелудочковой недостаточностью (аритмический и астматический
варианты) или могут протекать бессимптомно. Варианты изменений на ЭКГ
включают: 1) возникновение признаков свежего некроза миокарда в зоне
первоначального инфаркта (подъем сегмента ST с позитивизацией зубца Т,
трансформация зубца Q в зубец QS либо появление новых патологических
зубцов Q или QS) или в ранее непораженных сегментах; 2) ложноположи-
тельную динамику ЭКГ в виде уменьшения амплитуды или позитивизации
“коронарных” зубцов Г; 3) изолированное возникновение нарушений ритма
или проводимости. Хотя клинические проявления и данные ЭКГ являются
чувствительными признаками рецидива (распространения) инфаркта миокар-
да, они мало специфичны, так как могут быть обусловлены преходящей
ишемией миокарда и отражать его ишемическую дисфункцию. Поэтому наибо-
лее достоверным методом диагностики является повторное повышение актив-
ности кардиоспецифических ферментов, лучше всего изофермента МВ КФК.
Затяжное течение и распространение инфаркта миокарда необходимо
отличать от стойкого непропорционального растяжения и истон-
чения его зоны — так называемого expansion. Оно лежит в основе
раннего и позднего ремоделирования левого желудочка и по патолого-
анатомическим данным отмечается в 54-70% случаев трансмурального ин-
фаркта. В клинике с помощью двухмерной эхокардиографии его диагностиру-
ют 30—44 % таких больных. Expansion развивается в первые часы или дни
заболевания, чаще при передней локализации и значительной распространен-
ности инфаркта и является предшественником острой аневризмы (С.Matsu-
moto и соавт., 1985; G.Ertl и соавт., 1993; B.Jugdutt, 1993). Его возникнове-
нию способствует повышение пред- и особенно постнагрузки левого желудоч-
ка. Локальное истончение инфарцированного сегмента обусловлено растяже-
нием кардиомиоцитов и нарушением правильного расположения саркоме-
ров, а также уменьшением толщины межуточного вещества. Изменение гео-
метрии левого желудочка вызывает его объемную перегрузку и дилатацию, то
есть увеличение КДО. Это играет компенсаторную роль, способствуя под дер-
жанию УОС и гипертрофии миокарда, но при достижении критической вели-
чины приводит к уменьшению МОС и развитию сердечной недостаточности.
Формируя аритмогенный субстрат, expansion связано с повышенной часто-
той тяжелых желудочковых аритмий. В целом expansion оказывает неблаго-
приятное влияние на ближайший и отдаленный прогноз, увеличивая риск
застойной сердечной недостаточности, внезапной смерти и разрыва мио-
карда (H.Weisman и B.Healy, 1987; М.Picard, 1990).
Для неосложненного инфаркта миокарда не характерно возобновление
выраженной ангинозной боли и преходящих ишемических изменений на ЭКГ
в “подострый” период. Неустойчивость коронарного кровообращения, про-
являющаяся нестабильной постинфарктной (периинфарктной) стенокардией,
обусловлена распространенным, обычно трехсосудистым, коронарным ате-
росклерозом с наличием осложненных поражений и связана с повышенным
риском рецидива или распространения инфаркта миокарда и внезапной смерти.
Она встречается при мелкоочаговом инфаркте чаще, чем при трансмураль-
ном, и свидетельствует об угрозе его трансформации в крупно-очаговый.
Системные тромбоэмболии. Их источником являются пристеночные тромбы
в полости левого желудочка. К 5-7-м суткам заболевания они обнаружива-
ются при эхокардиографии почти у 50 % больных, особенно часто при транс-
муральном инфаркте миокарда передней и верхушечной областей левого
желудочка с акинезией этих сегментов. Тромбоэмболия в большом круге
кровообращения встречается примерно у 5 % больных с инфарктом и мо-
жет развиваться в самые различные сроки заболевания. Наиболее распрост-
раненной локализацией являются мозговые артерии.
Флеботромбоз и ТЭВЛА. Специальные исследования показали, что обра-
зование тромбов в глубоких венах голеней начинается с первого дня забо-
левания. В то же время благодаря современной тактике ранней мобилизации
больных с инфарктом миокарда клинические признаки флеботромбоза и
ТЭВЛА встречаются редко — в среднем у 10 % и весьма редко являются
причиной летального исхода.
Острая аневризма левого желудочка представляет собой а- или дискине-
тичный участок инфарцированной стенки желудочка, нередко значительно
истонченный. По окончании острого периода (8 нед) аневризму называют
хронической. Она осложняет инфаркт миокарда с зубцом Q и состоит пре-
имущественно из фиброзной ткани, среди которой могут сохраняться ост-
ровки ишемизированного, но жизнеспособного миокарда. При повышении
внутрижелудочкового напряжения в период систолы, будучи неспособной
к сокращению, она растягивается. В клинике острую аневризму диагности-
руют у 24 % больных с инфарктом миокарда, а по патологоанатомическим
данным — у 12 %. Вызывая изменения геометрии полости левого желудоч-
ка, она способствует развитию дисфункции сосочковых мышц. В полости
аневризмы часто содержатся тромбы, которые обычно организуются и ук-
репляют ее стенку, но могут служить и источником тромбоэмболий.
363
Образование аневризмы обычно сопровождается значительной дисфунк-
цией левого желудочка и часто приводит к развитию тяжелой застойной сер-
дечной недостаточности с низким МОС и стенокардией вследствие повыше-
ния стеночного напряжения миокарда и его потребности в кислороде. Такие
больные подвержены также рефрактерным желудочковым аритмиям по типу
“ри-энтри”, включая рецидивирующие пароксизмальную желудочковую та-
хикардию и фибрилляцию желудочков. При клиническом обследовании, кроме
дилатации сердца, обнаруживают патологическую пульсацию в прекарди-
альной области, чаще в третьем-четвертом межреберье у левого края груди-
ны, S3 и S4, ослабление S, и мезосистолический шум. Заподозрить аневриз-
му левого желудочка позволяет стойкое сохранение на ЭКГ подъемов сег-
мента ST в отведениях с патологическими зубцами Q или QS в сочетании с
отрицательными зубцами Т. Такая графика, как и ритм галопа, особенно
четко выражена при регистрации ЭКГ в зоне патологической прекардиаль-
ной пульсации, однако не специфична. Более надежными методами диагно-
стики являются двухмерная эхокардиография и радионуклидная вентрику-
лография, однако верифицировать диагноз позволяет лишь рентгеноконтраст-
ная вентрикулография.
Эпистенокардитический перикардит обусловлен неспецифическим воспа-
лением перикарда в ответ на некроз субэпикардиальных слоев миокарда при
трансмуральном инфаркте. Он развивается обычно с конца 1 -х суток и по
5-е сутки заболевания. В большинстве случаев перикардит является фибри-
нозным или серозно-фибринозным. Патологический процесс чаще имеет ло-
кальный характер; диффузный перикардит встречается у 10-20 % больных.
Он часто протекает субклинически и не распознается, так как свойственные
ему боль и изменения на ЭКГ маскируются картиной инфаркта миокарда.
Диагноз основывается на выслушивании быстро проходящего шума трения
перикарда. Он характерен для диффузного перикардита, осложняющего об-
ширный инфаркт, и определяется в прекардиальной области независимо от"
локализации некротического очага. Эпистенокардитический перикардит, как
правило, не отягощает прогноз, однако при развитии на фоне тромболити-
ческой и антикоагулянтной терапии сопряжен с небольшим риском воз-
никновения гемоперикарда и тампонады.
Постинфарктный синдром Дресслера наблюдается у 1-4 % больных и вклю-
чает перикардит, плеврит, в ряде случаев пневмонит, которые сопровожда-
ются лихорадкой и воспалительными сдвигами в крови. Заболевание имеет
аутоиммунный генез и связано с образованием антимиокардиальных анти-
тел в ответ на инфарцирование миокарда, которые определяются в сыворот-
ке крови. Время его развития варьирует от 2 (так называемый ранний синд-
ром Дресслера) до 12 нед и даже нескольких месяцев от начала заболевания.
Первыми признаками обычно являются лихорадка, слабость и боль в груд-
ной клетке. У половины больных на ЭКГ определяются изменения, харак-
терные для перикардита. Перикардит и плеврит носят серозный, иногда ге-
моррагический характер. Количество экссудата небольшое, однако на фоне
лечения антикоагулянтами возможно развитие гемотампонады. Необходимо
364
проводить дифференциальную диагностику с рецидивом инфаркта миокар-
да, ТЭВЛА и пневмонией. Прогноз относительно благоприятный. В единич-
ных случаях возможно развитие констриктивного перикардита.
Лечение. Организация медицинской помощи больным с инфарктом миокарда.
Поскольку 2/3 летальных исходов при инфаркте отмечается на догоспиталь-
ном этапе и более половины из них обусловлены первичной фибрилляцией
желудочков, важное значение имеет быстрое оказание неотложной специа-
лизированной помощи и транспортировка больных в стационар. В большин-
стве стран это осуществляется специальными бригадами “Скорой помощи”,
с высококвалифицированным персоналом и соответствующим оснащением
для диагностики и неотложной терапии инфаркта миокарда и его осложне-
ний, в первую очередь для проведения сердечно-легочной реанимации.
Для ранней госпитализации и предотвращения внезапной смерти на до-
госпитальном этапе большое значение имеет разъяснение населению и осо-
бенно больным ИБС или имеющим ее факторы риска важности срочного
обращения к врачу при появлении загрудинной боли или изменении ее ха-
рактера. Много внимания уделяется в последние годы широкомасштабным
программам по обучению населения методам сердечно-легочной реанима-
ции. Не менее важным является постоянное повышение квалификации вра-
чей и среднего медперсонала в целях большей настороженности при появле-
нии начальных симптомов инфаркта миокарда.
В стационаре больных помещают в БРИТ, который располагает всем не-
обходимым для длительного мониторирования ЭКГ с подачей сигнала тре-
воги при нарушениях ритма и проводимости, проведения реанимационных
мероприятий, ИВЛ, рентгенографии, эхокардиографии, временной эндо-
кардиальной элекгрокардиостимуляции, катетеризации правых отделов сер-
дца и легочной артерии и регистрации других показателей гемодинамики,
часто также гемодиализа, гемосорбции, ультрафильтрации крови. В составе
БРИТ имеется лаборатория, которая, кроме общеклинических и биохими-
ческих исследований, осуществляет круглосуточный контроль газового со-
става и КОС крови.
Организация в середине 60-х годов таких блоков (отделений) привела к
снижению госпитальной летальности при инфаркте миокарда с 25—40 до
10—20 % за счет ранней диагностики и лечения тяжелых желудочковых арит-
мий, которые часто переходят в фибрилляцию желудочков, а также мгно-
венного выявления фибрилляции желудочков и проведения реанимацион-
ных мероприятий. Уровень летальности при инфаркте миокарда в настоящее
время определяется главным образом сердечной недостаточностью, разви-
тие и тяжесть которой непосредственно связаны с массой некротизирован-
ного миокарда.
При неосложненном течении заболевания больной находится в БРИТе
3-4 сут. Поскольку 25-50 % летальных исходов в стационаре происходит
после перевода из БРИТа в обычные палаты, целесообразна организация
промежуточного звена - так называемого “постблока”. В нем начинается
двигательная активизация больных под более интенсивным, чем в условиях
365
обычного кардиологического отделения, наблюдением персонала с контро-
лем ЭКГ путем телеметрии или (что хуже) частой регистрации для раннего
выявления электрической нестабильности. В случаях ухудшения состояния
больных опять переводят в БРИТ.
Для более эффективного восстановления трудоспособности или адапта-
ции к самообслуживанию в домашних условиях большое значение имеет
организация постгоспитального этапа восстановительного лечения в специ-
ализированных санаториях или реабилитационных центрах — стационарных
либо амбулаторных. Завершающим этапом является амбулаторное лечение,
желательно под наблюдением специализированного диспансера, важной за-
дачей которого является вторичная профилактика (см. ниже).
Задачами стационарного лечения больных с инфарктом миокарда являют-
ся: 1) купирование боли; 2) раннее выявление, лечение и профилактика же-
лудочковых аритмий и фибрилляции желудочков; 3) защита поврежденного
миокарда с помощью покоя и ограничения физической активности; 4) огра-
ничение зоны некроза и ишемического повреждения миокарда; 5) ранняя
диагностика и активное лечение сердечной недостаточности, предотвращение
распространения инфаркта, а также диагностика, лечение и профилактика
других осложнений; 6) реабилитация больных.
Лечение неосложненного инфаркта миокарда в стационаре. 1.Общие ме-
роприятия. К ним относятся срочная госпитализация в БРИТ, монито-
рирование ЭКГ, контроль диуреза и водного баланса, постельный режим с
последующим его постепенным расширением через 1—3 сут. По показаниям
измеряют ЦВД и определяют другие показатели гемодинамики.
2. Купирование болевого с и н д р о м а. Адекватное и безотлага-
тельное обезболивание снижает потребление миокардом кислорода и уро-
вень циркулирующих катехоламинов, предотвращает развитие болевого шока.
Препаратом выбора является морфин, который сочетает мощное анал-
гезирующее действие с благоприятным гемодинамическим эффектом. Обла-
дая свойствами слабого блокатора а-адренорецепторов, он вызывает дилата-
цию вен и артериол, снижая пред- и постнагрузку, а также уменьшает ЧСС,
что способствует снижению потребности миокарда в кислороде. Назначают
по 1 мг внутривенно струйно, при необходимости повторно через 10—15 мин.
У больных с инфарктом миокарда морфин, как правило, редко угнетает
дыхательный центр и при отсутствии дегидратации не вызывает значитель-
ной артериальной гипотензии. При проявлении его ваготонических эффек-
тов (тошнота, рвота) их купируют атропина сульфатом в дозе 0,3—0,5 мг
внутривенно. Вместо морфина можно использовать так называемую н е й -
ролептаналгезию — комбинацию синтетического наркотического
анальгетика фентанила (2 мл 0,005 % раствора) с нейролептическим сред-
ством, обычно дроперидолом (2 мл 0,25 % раствора). Фентанил обладает
примерно таким же анальгетическим эффектом, как морфин, а добавление
нейролептического препарата позволяет увеличить продолжительность его
действия, которая значительно короче, чем морфина. Применение промедо-
да нецелесообразно ввиду слабости обезболивающего эффекта.
366
При упорном, возобновляющемся болевом синдроме эффективно титро-
ванное капельное введение малых доз морфина в перидуральное простран-
ство. Эффект наркотических анальгетиков можно потенцировать дробным,
каждые 4—6 ч, введением нейролептического средства, лучше дроперидола,
под контролем АД и ЧСС, транквилизаторов (диазепама, седуксена и др.)
которые обладают также седативным эффектом. В единичных случаях
приходится прибегать к внутривенному капельному введению натрия окси-
бутирата.
Анальгетическим свойством обладает также нитроглицерин, который при
отсутствии эффекта от сублингвального приема назначают внутривенно ка-
пельно, как при нестабильной стенокардии, под контролем АД и ЧСС. Во
избежание резкой артериальной гипотензии в случаях вероятной гиповоле-
мии (при низком ЦВД) предварительно следует восполнить ОЦП. АД не
должно снижаться менее 80—90 мм рт.ст. у нормотоников, так как возможно
ухудшение перфузии области ишемии. Вместо нитроглицерина можно ис-
пользовать внутривенную капельную инфузию изосорбида динитрата.
При отсутствии противопоказаний для купирования болевого синдрома
используют также р-адреноблокаторы (см. ниже).
3. Покой. При появлении чувства тревоги, страха, возбуждения, нару-
шении сна применяют седативные препараты (диазепам, седуксен по 2,5—
5 мг каждые 6 ч и др.) или антидепрессанты (амитриптилин).
Ограничение двигательной активности. Пользоваться под-
кладным судном рекомендуют в течение примерно 3 дней. Впоследствии при
переходе в положение сидя больным удобнее пользоваться прикроватным
стульчаком.
В первые 1—2 дня пища должна быть жидкой или полужидкой, а затем -
легкоперевариваемой, низкокалорийной (1200—1800 ккал) с ограничением
соли и продуктов, содержащих в большом количестве холестерин.
4. Антикоагулянты. Тактика плановой гепаринотерапии при остром
инфаркте миокарда не является общепринятой и результаты ее противоре-
чивы. Наряду с указаниями на отсутствие существенного влияния на исходы
заболевания, данные недавнего мета-анализа результатов 20 исследований,
охватывавших около 5700 больных с вероятным инфарктом миокарда, по-
казали, что подкожное или внутривенное введение гепарина приводило к
снижению вероятности летального исхода на 20 % по сравнению с показате-
лями при использовании плацебо. При этом существенно уменьшалась так-
же частота флеботромбоза, ТЭВЛА, инсульта и рецидивов инфаркта мио-
карда (S.Mac Mahon и соавт., 1988).
Гепарин представляет собой естественный гликозаминогликан, прямой
антикоагулянтный эффект которого обусловлен активацией содержащегося
в плазме ингибитора протеаз антитромбина III. Поскольку антитромбин III
ингибирует тромбин и активные формы факторов X, IX и XI, введение
гепарина приводит к удлинению ЧАТВ, тромбинового времени и в меньшей
степени протромбинового. Он может предотвращать также агрегацию тромбо-
цитов. Гепарин не всасывается через слизистую оболочку пищеварительного
367
канала и поэтому его назначают внутривенно или подкожно. Внутримышеч-
ное введение нежелательно, так как образуются болезненные, плохо расса-
сывающиеся гематомы. При внутривенном введении действие наступает че-
рез 1—2 мин. Период полужизни — 1—3 ч и удлиняется при заболеваниях
печени, где препарат метаболизируется. При истощении или потреблении
антитромбина III, которое может наступать при длительной гепаринотера-
пии, антикоагулянтный эффект снижается.
Дозировка гепарина зависит от ЧАТВ, которое для обеспечения полного
гипокоагуляционного эффекта должно удлиняться в 1,5—2 раза. Более про-
стым, но менее информативным показателем, коррелирующим с ЧАТВ,
является время свертывания крови, которое определяют в капле капилляр-
ной крови на предметном стекле (по Бюркеру) или, что более точно, в 1 мл
венозной крови в тонкой пробирке (по Ли Уайту). В норме оно составляет 5—
7 мин (конец свертывания) и должно удлиняться в 2—3 раза.
Основным осложнением, возникающим при использовании гепарина,
является кровоточивость, поэтому при его назначении необходимо следить
за гематокритным числом, признаками скрытой крови в кале и микрогемату-
рии. К основным противопоказаниям относятся: а) кровотечение или кровото-
чивость (например, язвенная болезнь в стадии язвы); б) тяжелая артериаль-
ная гипертензия с ретинопатией; в) недавно проведенная хирургическая опе-
рация или инвазивная манипуляция; г) перикардит.
Антидотом гепарина является протамина сульфат, который используют
при необходимости его срочной нейтрализации. Протамина сульфат сам об-
ладает слабыми антикоагулянтными свойствами, и его доза не должна пре-
вышать 100 мг. Сразу после внутривенного струйного введения гепарина для
нейтрализации каждых 100 ЕД требуется примерно 1 мг протамина сульфа-
та, через 30 мин — 0,5 мг. Если гепарин применяли в виде инфузии, нейтра-
лизации подлежит примерно половина дозы, введенной за предыдущий час.
Малые дозы гепарина (5000—10 000 ЕД подкожно в область живота 2-3
раза в сутки) показаны для профилактики тромбоза глубоких вен, а следо-
вательно, и ТЭВЛА, в случаях повышенного риска - у больных старше 70
лет, с тромбофлебитом в анамнезе, при предполагаемой длительной иммо-
билизации и сердечной недостаточности. Введение препарата продолжают до
значительного расширения двигательного режима.
Гепарин в полной дозе рекомендуют назначать при обширных трансму-
ральных инфарктах миокарда передней стенки левого желудочка, связанных
с повышенной частотой образования муральных тромбов, или во всех слу-
чаях их обнаружения при эхокардиографии, а также после проведения тром-
болитической терапии. Его назначают в виде внутривенной капельной по-
стоянной инфузии со скоростью примерно 1000-1500 ЕД/ч после предвари-
тельного струйного введения в виде болюса в 5000-10 000 ЕД (100 ЕД/кг).
Дозу корригируют вначале каждые 4 ч после определения ЧАТВ или времени
свертывания крови, затем, после стабилизации, — реже. Внутривенное струй-
368
ное введение каждые 4 ч в дозировке, зависящей от показателей свертыва-
ния крови, сопряжено с большей частотой геморрагических осложнений.
Гепаринотерапию продолжают в среднем 5 сут, редко больше, с последу-
ющей постепенной отменой либо, в единичных случаях, при наличии спе-
циальных показаний, с переходом на прием внутрь антикоагулянтов непря-
мого действия.
5. Антиагреганты. Как показали результаты многоцентрового плаце-
боконтролируемого исследования 17 187 больных (ISIS-2: Second International
Study of Infarct Survival: Collaborative Group, 1988), прием ацетилсалицило-
вой кислоты в дозе 160—325 мг в сутки с первого дня инфаркта миокарда к
5-й неделе заболевания приводил к снижению летальности на 23 % и часто-
ты нефатальных рецидивов инфаркта миокарда на 50 %, а в комбинации с
тромболитической терапией усиливал ее эффект. Это обусловливает целесо-
образность его самого широкого использования у таких больных. Первую
дозу желательно принять как можно раньше и разжевать.
6. “Сплошную” рутинную профилактику желудочковых
аритмий у всех без исключения больных с инфарктом миокарда в первые
несколько суток заболевания путем длительной внутривенной капельной
инфузии лидокаина в настоящее время не применяют, так как установлено
ее неблагоприятное влияние на выживаемость больных (данные мета-ана-
лиза К.Тео и соавт., 1992, и др.). Это обусловлено, вероятно, повышенным
риском асистолии и фибрилляции желудочков за счет ятрогенного проарит-
мического эффекта.
7. Ограничение или предотвращение распространения
зоны инфаркта. Эта концепция основывается на следующих положениях:
а) увеличение размеров тромба в коронарной артерии может продолжать-
ся до 72 ч;
б) формирование зоны некроза длится несколько часов или дней;
в) распространение зоны некроза в первые 3 сут заболевания отмечается
более чем у 1/3 больных;
г) при морфологическом исследовании в миокарде часто обнаруживают
участки некроза различной давности.
Существует два основных пути воздействия на ишемизированную пери-
инфарктную зону для ограничения размеров инфаркта и сохранения функ-
ции левого желудочка: реперфузия путем восстановления проходимости ок-
клюзированной артерии и уменьшение потребности миокарда в кислороде.
Реперфузия. Скорейшее восстановление проходимости окклюзирован-
ной коронарной артерии позволяет “спасти” часть миокарда за счет предот-
вращения исхода обратимой ишемии в необратимую. Это способствует умень-
шению выраженности нарушений гемодинамики и улучшению выживаемо-
сти больных в госпитальный и постгоспитальный периоды.
Показано, что в течение 12 ч после окклюзии доля некротизированного
миокарда в бассейне “закрытой” артерии находится в экспоненциальной
зависимости от продолжительности отсутствия кровотока. Некротизация
369
начинается через 40 мин с субэндокардиальных слоев и распространяется к
эпикарду. Через 6 ч погибает большая часть, а к 12 ч - весь находящийся под
угрозой миокард. При субтотальной окклюзии или хорошем развитии колла-
тералей этот процесс протекает медленнее. Таким образом, скорейшее вос-
становление кровотока в миокарде имеет первостепенное значение для по-
вышения эффективности лечения инфаркта миокарда. В этих целях исполь-
зуют тромболитическую терапию, а также срочную ТЛАП и аортокоронар-
ное шунтирование.
Применение тромболитической терапии при остром инфаркте
миокарда основывается на выявлении полной тромболитической окклюзии
коронарной артерии в первые 4 ч заболевания у 87 % больных (M.De Wood и
соавт., 1980). Ее эффективность тем выше, чем раньше начато лечение.
Современные показания (АСС/АНА Task Force, R.Gunnar и соавт., 1990)
включают все случаи вероятного инфаркта, который проявляется ангиноз-
ной болью, длящейся 30 мин и более, в сочетании с подъемом сегмента ST
(> 0,1 мВ) в двух отведениях ЭКГ и более от передней, задней или боковой
стенок левого желудочка, либо остро возникшей полной блокадой левой
ножки пучка Гиса в первые 12 ч от момента возникновения болевого синд-
рома. Следует подчеркнуть, что оптимальным является применение тромбо-
литических средств в первые 6 ч; спустя 6—12 ч их эффективность значи-
тельно снижается. Тромболитические средства можно использовать также у
отдельных больных с большей давностью заболевания при сохранении при-
знаков ишемии — выраженной боли и подъема сегмента ST на ЭКГ, то есть
при затяжном течении инфаркта миокарда. Существовавшее ранее ограниче-
ние возраста 75 годами в настоящее время снято, так как доказано, что у
больных более пожилого возраста эффективность тромболитической терапии
выше, чем у более молодых. Ее эффект сомнителен при давности инфаркта
12—24 ч и изменениях на ЭКГ в виде изолированной депрессии сегмента ST
(кроме задне-базального инфаркта). По данным представительных много-
центровых плацебоконтролируемых исследований (Second International Study
of Infarct Survival — ISIS-2, 1988; Global Utilization of Streptokinaze and tPA
for occluded coronary arteries — GUSTO, 1993), охвативших в общей сложно-
сти свыше 60 тыс. больных, такое позднее применение тромболитических
средств не влияет на выживаемость. Показана, однако, способность
тромболитической терапии даже в столь поздние сроки (через 12—24 ч) пре-
дотвращать раннее ремоделирование левого желудочка за счет предупрежде-
ния растяжения зоны инфаркта и тем самым предупреждать увеличение пред-
и постнагрузки (P.Zardini, 1993). При инфарктах задней стенки эффект тром-
болитической терапии значительно меньше, чем при поражении передней и
боковой стенок.
Основными осложнениями являются кровотечения. Реже встречаются ре-
перфузионные аритмии и аллергические реакции. Последние отмечаются в
основном при применении стрептокиназы.
Основными противопоказаниями к применению тромболитической
терапии согласно рекомендациям АСС/АНА США (R.Gunnar и соавт., 1990)
являются:
абсолютные: 1) активное или недавнее (до 2 нед) внутреннее кровотече-
ние; 2) высокая артериальная гипертензия (АД более 200/120 мм рт.ст.); 3) не-
давнее (до 2 нед) хирургическое вмешательство или травма, особенно че-
репно-мозговая, включая сердечно-легочную реанимацию; 4) активная пеп-
тическая язва желудка; 5) подозрение на расслаивающую аневризму аорты
или перикардит; 6) аллергия к стрептокиназе или АПСАК (можно использо-
вать урокиназу или тканевый активатор плазминогена);
относительные: 1) хирургическое вмешательство или черепно-мозговая
травма давностью более 2 нед; 2) геморрагический диатез в анамнезе или
применение антикоагулянтов в настоящее время; 3) тяжелая печеночная,
почечная недостаточность, сахарный диабет, злокачественные опухоли, ак-
тивные инфекции (сепсис, туберкулез и др.); 4) применение ранее стрепто-
киназы или АПСАК в течение менее 9 мес (это не касается урокиназы и
тканевого активатора плазминогена).
О достижении тромболитического эффекта свидетельствуют:
1) клинические признаки: уменьшение боли, реперфузионные аритмии;
2) электрокардиографические признаки: быстрое снижение сегмента ST и
раннее формирование патологических зубцов Q и отрицательных зубцов Т\
3) лабораторные признаки: а) энзимологические — раннее и быстрое сни-
жение активности КФК и ее изофермента МВ в крови при их определении в
динамике; б) гемостазиологические: увеличение тромбинового времени и
ЧАТВ в 2—3 раза, уменьшение уровня фибриногена в 2-3 раза и увеличение
содержания продуктов деградации фибриногена и фибрина. Нельзя допу-
скать удлинения тромбинового времени более чем в 5 раз и уменьшения
содержания фибриногена ниже 1 г/л, так как это чревато развитием геморраги-
ческих осложнений.
Тромболитические средства можно вводить внутри коронарным или
внутривенным путем. Первый внутрикоронарный тромболизис с ангиокар-
диографической верификацией растворения сгустка был проведен Е.И.Ча-
зовым с сотрудниками в 1976 г. В настоящее время системный, то есть внутри-
венный, тромболизис полностью заменил внутрикоронарный. Будучи более
простым в техническом отношении он может быть начат по меньшей мере
на 1 ч раньше внутрикоронарного, даже на догоспитальном этапе, и не
уступает ему по своей эффективности. В обоих случаях частота успешной
реперфузии зависит от начала лечения и составляет в среднем 60-70 %.
В настоящее время используют следующие препараты: ^стрептоки-
назу. Белок, продуцируемый р-гемолитическим стрептококком, соединя-
ется с плазминогеном крови, образуя комплекс, обладающий выраженной
способностью активировать плазминоген. В результате резко возрастает ско-
рость образования плазмина (фибринолизина) — активного фермента, ко-
торый, разрушая пептидные связи в молекуле фибринполимера, вызывает
растворение тромба. В процессе системного фибринолиза происходит потреб-
ление протромбина, факторов V и VIII, фибриногена и плазминогена. Резкое
371
истощение этих факторов свертывания крови может вызывать развитие ге-
моррагических осложнений. При этом гематомы в местах инъекций отмеча-
ются у 45 % больных, а кровотечения, требующие переливания свежезамо-
роженной плазмы крови и аминокапроновой кислоты, — у 18 %. Будучи про-
дуктом бактериального происхождения, стрептокиназа обладает антигенными
свойствами и вследствие этого может использоваться только однократно. Бла-
годаря отсутствию избирательного литического действия на сгусток стреп-
токиназа может предотвращать реокклюзию вследствие ретромбоза. У неко-
торых больных вызывает артериальную гипотензию за счет быстрого образо-
вания плазмина и брадикинина. Является самым дешевым и распространен-
ным тромболитическим препаратом. Стрептокиназу вводят внутривенно ка-
пельно в дозе 1 500 000 ЕД в течение 1 ч;
2) урокиназу. Это трипсиноподобная протеаза, получаемая из мочи
или культуры почечных клеток человеческих эмбрионов. Она вызывает фиб-
ринолиз путем прямого действия на плазминоген, который превращается в
плазмин. Преимуществом перед стрептокиназой является отсутствие анти-
генности. Урокиназу вводят внутривенно капельно по 1 000 000 - 2 000 000
ЕД в течение 1 ч.
В стадии разработки находится проурокиназа, которая в присутствии
фибрина на поверхности тромба превращается в урокиназу, вызывающую
образование плазмина. Благодаря местному избирательному действию она
практически не представляет опасности в отношении развития геморраги-
ческих осложнений;
3) рекомбинантный тканевый активатор плазминоге-
н а (ТАП). Представляет собой гликопротеин, являющийся продуктом про-
мышленного синтеза. Будучи сам по себе неактивным, он вызывает актива-
цию плазминогена только в присутствии фибрина на поверхности тромба.
Такая относительная избирательность действия и меньший общий литиче-
ский эффект, а следовательно, и меньшая опасность кровотечений являют-
ся его преимуществами перед стрепто- и урокиназой. К ним относятся также
завершение лизиса тромба в течение 1 ч (вместо 2) и крайне редкое возник-
новение аллергических осложнений.
Недостатком является большая частота реокклюзий вследствие короткой
продолжительности действия (период полужизни — 5 мин, стрептокиназы —
15-20 мин). Для их профилактики требуется активная гепаринотерапия. Об-
щая доза — до 100 мг, которую вводят в течение 3 ч: 10 мг внутривенно в
виде болюса, затем 50 мг капельно в течение 1 -го часа и по 20 мг в течение
2-го и 3-го часа. Возможно также более быстрое введение: 15 мг в виде болю-
са, затем 0,75 мг/кг за 30 мин и 0,5 мг/кг в течение 60 мин;
4)анизоилированный плазминогенстрептокиназный
активаторный комплекс (АПСАК, или анистреплаза). Сам
по себе неактивен. Гидролиз анизоловой группы, наступающий после попа-
дания препарата в кровь, приводит к образованию активного комплекса
плазминогенстрептокиназы, который вызывает фибринолиз. Преимуществом
372
по сравнению с другими препаратами является возможность одномомент-
ного струйного введения 30 мг.
Впервые эффективность тромболитической терапии в отношении улуч-
шения выживаемости при остром инфаркте миокарда была продемонстриро-
вана в многоцентровом исследовании GISSI (Gruppo Italiano, 1987). К 21-м
суткам заболевания в группе больных, получавших стрептокиназу, леталь-
ность составила 10,7 %, а в группе получавших плацебо — 13 %. При приме-
нении тромболитического препарата в 1-й час от появления симптомов за-
болевания летальность снижалась на 50 %, в сроки от 1 до 3 ч - на 25 % и от
3 до 6 ч - на 18 %. При введении стрептокиназы в более поздние сроки она
не оказывала существенного влияния на летальность. Эффект отмечался только
при инфаркте миокарда передней стенки левого желудочка и отсутствовал у
больных с острой левожелудочковой недостаточностью III—IV класса по
T.Killip-A.Jimball, а также при инфаркте миокарда без зубца Q.
Последующее многоцентровое исследование ISIS-2 (1988) было посвя-
щено оценке эффективности стрептокиназы, ацетилсалициловой кислоты и
их комбинации по сравнению с плацебо. Подученные результаты показали,
что при применении стрептокиназы в первые 24 ч вероятного инфаркта мио-
карда к 5-й неделе заболевания летальность снижалась на 26 %, ацетилсали-
циловой кислоты — на 21 %, а сочетания этих препаратов — на 40 %. Такое
же снижение летальности достигалось с помощью ТАП и АПСАК (R.Wilcox
и соавт., 1988).
При сравнительной оценке выявлена большая частота реперфузии при
лечении ТАП и АПСАК, чем при использовании стрептокиназы. Так, по
данным коронарографии, спустя 90 мин после введения ТАП реперфузия
отмечалась у 62 % больных, тогда как при применении стрептокиназы -
лишь у 31 % (Thrombolysis in Myocardial Infarction, TIMI—I, J.Chesebro и
соавт., 1988). Несмотря на это ТАП и АПСАК в целом не имеют существен-
ных преимуществ перед стрептокиназой в плане влияния на летальность,
частоту рецидивов и повторных инфарктов миокарда, а также на выражен-
ность нарушения функционального состояния левого желудочка (GISSI-2,
Gruppo Italiano, 1990; International Study Group, 1990; ISIS-3, 1991; иссле-
дования охватили в общей сложности свыше 53 000 больных). Частота ин-
сультов была выше у получавших ТАП (1,3 % по сравнению с 0,9 % при
применении стрептокиназы), а клинически значимых кровотечений - на-
оборот (0,9 против 0,6 %).
Существенное значение имеет способность ранней, в первые 3-4 ч забо-
левания, тромболитической терапии уменьшать выраженность дисфункции
левого желудочка и улучшать остаточную работоспособность больных благо-
даря “спасению” части ишемизированного миокарда.
Важной проблемой при проведении тромболитической терапии является
возможность реокклюзии, которая возникает в течение нескольких дней у
15-17 % больных и связана с сохранением значительного фиксированного
стеноза и остаточного тромбоза. Это теоретически обусловливает целесообраз-
373
ность применения в профилактических целях, помимо ацетилсалициловой
кислоты, гепарина. Единой тактики при назначении гепарина не существует.
В большинстве случаев его назначают во время или сразу после окончания
тромболитической терапии вначале в виде болюса в 100 ЕД/кг, затем путем
постоянной внутривенной капельной инфузии в полной дозе в течение 3—5
сут с постепенным уменьшением дозы перед отменой препарата. Антикоагу-
лянты непрямого действия применяют лишь в отдельных случаях при нали-
чии специальных показаний. При использовании стрептокиназы начинать
введение гепарина можно также через 4—12 ч в виде подкожных инъекций
по 12 500 ЕД 2 раза в сутки. Согласно результатам исследования ISIS-3, гос-
питальная летальность, частота рецидивов инфаркта миокарда и проходи-
мость коронарных артерий при лечении стрептокиназой и АПСАК в сочета-
нии с подкожным введением гепарина существенно не отличались от тако-
вых при изолированной тромболитической терапии без введения гепарина. В
отличие от терапии стрептокиназой и АПСАК при использовании ТАП внут-
ривенная инфузия гепарина в полной дозе является строго обязательной,
так как позволяет существенно — на 10—30 % — уменьшить частоту реок-
клюзий по сравнению с сочетанным применением ТАП и ацетилсалицило-
вой кислоты (Heparin—Aspirin Reperfusion Trial—HART, J.Hsia и соавт., 1990;
European Cooperative Study Group Trial—ECSG-6, 1991).
Пер вичная “ранняя” ТЛАП в первые 4—6 ч заболевания обеспе-
чивает “открытие” инфарктзависимой коронарной артерии в 90 % случаев.
Частота осложнений и летальности при этом не больше, чем при использо-
вании тромболитической терапии. Ее важным преимуществом является од-
новременная ликвидация остаточного стеноза. Существенными недостатка-
ми метода, ограничивающими его применение, являются необходимость
рентгенохирургической лаборатории, круглосуточного дежурства бригады вы-
сококвалифицированных специалистов и высокая стоимость. Учитывая это,
основным показанием к первичной ТЛАП без предшествующей тромболи-
тической терапии является невозможность проведения последней в первые
6—12 ч (лучше в первые 4—6 ч) от начала заболевания, например, из-за на-
личия противопоказаний к ней. Срочная первичная ТЛАП более эффектив-
на, чем тромболитическая терапия, в случаях острого инфаркта миокарда,
осложненного тяжелой острой левожелудочковой недостаточностью и кардио-
генным шоком, когда низкое перфузионное давление в коронарных арте-
риях препятствует действию тромболитических средств. У таких больных она
положительно влияет на ближайшие и отдаленные исходы по сравнению с
тромболитической терапией (TIMI-2, 1989; L.Lee и соавт., 1991) и является
тактикой выбора. Так, госпитальная летальность больных с кардиогенным
шоком, которым была произведена ТЛАП, составила 44 %, в то время как у
получавших медикаментозное лечение - 92 %, а спустя 21 мес - соответ-
ственно 50 и 98 % (A.Moosvi и соавт., 1992). В то же время срочная вторичная
ТЛАП сразу после курса тромболитической терапии для плановой ликвида-
ции остаточного стеноза существенно повышает летальность по сравнению
с отсроченной — спустя 48 ч—10 дней (М.Simoons и соавт., 1988; TIMI
374
Research Group-II, 1988). Более поздние многоцентровые исследования (TIMI
Study Group, 1989; D.Williams и соавт., 1992) убедительно доказали, что даже
такая отсроченная плановая ТЛАП не имеет существенных преимуществ
перед избирательной хирургической реваскуляризацией только в случаях вы-
раженной остаточной ишемии по данным низкой толерантности к физичес-
кой нагрузке при нагрузочном тестировании перед выпиской. В обеих груп-
пах больных отмечались одинаковые летальность, частота рецидивов и по-
вторного инфаркта миокарда, а также величины ФВ при выписке из клини-
ки и спустя 1 год. Таким образом, при хорошем эффекте медикаментозной
терапии больные, получившие тромболитическую терапию, не нуждаются в
плановой коронарографии и ТЛАП.
При наличии показаний “позднюю” чрескожную ТЛАП производят пе-
ред выпиской из стационара или в ближайшие 1—2 мес при нестабильной
постинфарктной стенокардии и низкой толерантности к физической нагрузке
(см. ниже). В таких случаях при соответствующих показаниях альтернативой
является аортокоронарное шунтирование, однако при крупно-
очаговых инфарктах его желательно выполнять через 8 нед. Имеются сторон-
ники и раннего аортокоронарного шунтирования при неосложненном ин-
фаркте с зубцом Q (АСС/АНА Task Force — R.Gunnar и соавт., 1990), что,
однако, учитывая существование других, не менее эффективных и более
безопасных, методов лечения, нельзя признать целесообразным. У больных
с инфарктом миокарда без зубца Q тактика хирургической реваскуляризации
и ее результаты такие же, как при нестабильной стенокардии (T.Ryan, 1990).
Уменьшению потребности миокарда в кислороде спо-
собствуют постельный режим, купирование болевого синдрома и седатив-
ная терапия. В этих целях применяют также p-адреноблокаторы, нитраты и
изредка — блокаторы кальциевых каналов.
Наибольшим эффектом в отношении ограничения зоны инфаркта мио-
карда обладают p-адреноблокаторы. Эффект основан на способности
этих препаратов уменьшать ЧСС, сократимость миокарда и АД. Удлинение
диастолы способствует улучшению перфузии субэндокардиальных слоев мио-
карда. Важное значение имеет также предотвращение и купирование электри-
ческой нестабильности желудочков, связанной с активацией симпатико-
адреналовой системы в первые дни заболевания. Метаболический эффект
препаратов обусловлен важной ролью, которую играют катехоламины в раз-
витии ишемии. Способствуя уменьшению поглощения свободных жирных
кислот ишемизированной зоной и увеличению усвоения ею глюкозы, р-
адреноблокаторы создают условия для перехода от метаболизма жирных кис-
лот к метаболизму глюкозы, что приводит к снижению потребности мио-
карда в кислороде.
Назначение р-адреноблокаторов особенно эффективно при наличии та-
ких признаков повышенной активности симпатико-адреналовой системы,
как тахикардия и склонность к артериальной гипертензии, а также при ре-
цидивирующем болевом синдроме. Они показаны во всех случаях отсутствия
противопоказаний. К последним относятся ЧСС менее 50—55 в 1 мин,
375
систолическое АД ниже 95 мм рт.ст., выраженная атриовентрикулярная бло-
када I степени при PQ > 0,24 с и блокада более высоких степеней, а также
бронхообструктивный синдром. Сердечная недостаточность не является аб-
солютным противопоказанием к назначению p-адреноблокаторов (см. ниже).
Пропранолол (анаприлин, обзидан, индерал) назначают обычно внача-
ле внутривенно по 0,1 мг/кг в 3 приема с интервалом 5—10 мин до достиже-
ния критериев блокады p-адренорецепторов, после чего через 1 ч переходят
на пероральный прием по 20-40 мг 3—4 раза в сутки. Аналогичным образом
назначают метопролол (по 5 мг внутривенно струйно трижды с интервалом
5 мин, затем по 50—100 мг в таблетках 2 раза в сутки), талинолол (корда-
нум), атенолол и другие препараты. Применять p-адреноблокаторы жела-
тельно как можно раньше.
Результаты многоцентровых исследований показали относительно неболь-
шое, но статистически достоверное их влияние на прогноз. Так, по данным
исследования ISIS-1 (1986), охватившего более 16 000 больных, терапия р -
адреноблокаторами позволяла на каждые 200 случаев инфаркта предотвра-
тить 1 летальный исход, 1 рецидив инфаркта и 1 внезапную остановку кро-
вообращения. При использовании в сочетании с тромболитической терапией
они оказывают дополнительное положительное действие (TIMI-2, TIMI Study
Group, 1989).
Нитроглицерин и другие нитраты уменьшают потребность
миокарда в кислороде за счет снижения пред- и в меньшей степени постнаг-
рузки. Расширяя эпикардиальные коронарные артерии, они способствуют
увеличению коронарного кровотока. В острейший период лучше всего при-
менять внутривенную инфузию нитроглицерина или изосорбида динитрата
(изокет). Инфузию нитроглицерина начинают с 10 мкг в 1 мин и увеличива-
ют дозу на 5—10 мкг в 1 мин каждые 5—10—15 мин до купирования боли или
снижения среднего АД на 10-15 %, или увеличения ЧСС не более ПО в
1 мин, или снижения диастолического давления в легочной артерии на 10—
30 %. Во избежание ухудшения перфузии миокарда систолическое АД следу-
ет поддерживать на уровне не меньше 90—95 мм рт.ст. Максимальная доза не
должна превышать 200 мкг в 1 мин. После стабилизации гемодинамики пре-
парат назначают в виде мази или таблеток.
В более ранних сообщениях было показано уменьшение размеров некро-
тического очага и снижение госпитальной летальности на 10 % (B.Jugdutt,
J.Warnica, 1988). В то же время недавние многоцентровые исследования
внутривенного капельного введения нитроглицерина в течение 24 ч с пере-
ходом на накожное и пероральное применение (GISSI-3) и использование
изосорбида мононитра а в таблетках (ISIS-4, 1993) более чем у 72 000 боль-
ных показали отсутствш их существенного влияния на госпитальную и пост-
госпитальную выживаемость по сравнению с плацебо. Вероятно, в отдель-
ной группе больных с инфарктом миокарда, осложненным сердечной недо-
статочностью, нитраты оказывают более выраженное действие. В настоящее
время инфузия нитроглицерина считается показанной больным с
неосложненным течением заболевания при болевом синдроме, а также при
376
сердечной недостаточности. Существенным недостатком нитратов является
развитие толерантности.
Натрия нитропруссид, сочетающий в себе свойства артериального и ве-
нозного вазодилататора, при инфаркте миокарда в настоящее время приме-
няют редко в связи со способностью препарата уменьшать кровоток в зоне
ишемии.
Блокаторам кальциевых каналов принадлежит второстепен-
ная роль в лечении инфаркта миокарда. Имеются данные о том, что при
крупноочаговом поражении их применение связано с повышенной по срав-
нению с плацебо госпитальной и постгоспитальной летальностью, особенно
в случаях низкой ФВ. Это, возможно, обусловлено их тахикардитическим
(нифедипин) либо отрицательным инотропным (верапамил) эффектом. По-
казаниями к назначению блокаторов кальциевых каналов являются первич-
ный инфаркт миокарда без зубца Q (отмечено улучшение выживаемости),
наличие противопоказаний к применению p-адреноблокаторов, при необ-
ходимости достижения дополнительного антиангинального или антиарит-
мического эффекта. Среди препаратов этой группы средством выбора счита-
ют дилтиазем.
8. Предотвращение ремоделирования левого желудочка
является новым направлением в лечении инфаркта миокарда. Оно состоит в
предупреждении развития дилатации левого желудочка вследствие наруше-
ния систолического опорожнения из-за потери значительной части инфар-
цированного миокарда (раннее ремоделирование), и связанной с ней избы-
точной компенсаторной гипертрофии и фибротизации (позднее ремоделирова-
ние). Ремоделированию способствует повышение активности симпатико-
адреналовой и ренин-ангиотензин-альдостероновой систем, которое отме-
чается даже при отсутствии клинических признаков сердечной недостаточ-
ности. Имеются основания считать, что гемодинамическая разгрузка левого
желудочка с помощью нитратов (B.Jugdutt, J.Warnica, 1988) либо, что бо-
лее эффективно, ингибиторов АПФ (N.Sharpe исоавт., 1991)какпре-
имущественно артериолярных вазодилататоров не только снижает потреб-
ность миокарда в кислороде, но и уменьшает выраженность ремоделирова-
ния. Это обусловлено вызываемым этими препаратами уменьшением выра-
женности увеличения КДО, КСО и сохранением ФВ. Показано, что ингиби-
торы АПФ, применяемые начиная с 1-х суток инфаркта миокарда, по сравне-
нию с плацебо способствуют небольшому, но статистически достоверному
улучшению выживаемости в госпитальный период и в течение последующего
года. Так, по сводным данным GISSI-3 и ISIS-4 (1993), их назначение позво-
ляет предотвратить летальный исход в среднем у 5 из 1000 больных и дает
дополнительный эффект в сочетании с тромболитическими средствами,
ацетилсалициловой кислотой и 0 -адреноблокаторами. Как показали результаты
двойного слепого плацебоконтролируемого исследования у более чем 2000
больных с острым инфарктом миокарда, у которых ФВ составляла менее
40 %, но не было выраженных признаков острой левожелудочковой недоста-
точности, SAVE - The Survival and Ventricular Enlargement Trial (L.Moye и
377
соавт., 1991), прием каптоприла, начиная с 3—16-х суток болезни, способ-
ствовал снижению общей летальности на 19 %, смерти от сердечных причин
— на 37 %, уменьшению частоты развития застойной сердечной недостаточ-
ности - на 22 % и рецидива инфаркта миокарда - на 25 %.
Ингибиторы АПФ показаны во всех случаях инфаркта миокарда, кроме
кардиогенного шока и стойкой артериальной гипотензии (систолическое АД
ниже 100 мм рт.ст.), особенно при сердечной недостаточности и обширном
переднем инфаркте. Используют каптоприл по 12,5—50 мг 2—3 раза в сутки,
эналаприл (ренитек) — по 2,5—10 мг 2 раза в сутки, лизиноприл и др. (под-
робнее см. ниже).
Определенное внимание в последние годы уделялось попыткам разработ-
ки эффективных методов метаболической терапии инфаркта мио-
карда, направленной на предотвращение необратимого ишемического повреж-
дения в периинфарктной зоне. Для интенсификации анаэробного гликолиза
и профилактики аритмий использовали “поляризующую” глюкозо-инсулин-
калиевую смесь, классический состав которой включает 20—30 % раствор
глюкозы и 20-60 ммоль/л К+ с соответствующим добавлением инсулина. В
последние годы в этих целях в ряде клиник назначают фосфокреатин (нео-
тон) внутривенно капельно по 4-6 г в течение нескольких первых суток,
который обладает также способностью к стабилизации клеточных и субкле-
точных, в частности лизосомальных, мембран. Теоретически оправдано и
использование ингибиторов ферментов (контрикала). Для предотвращения
отека кардиомиоцитов в ранние сроки заболевания предлагали применять
осмотические диуретики (маннит) и гипертонические растворы глюкозы. Все
эти средства метаболической терапии не получили в настоящее время рас-
пространения из-за их низкой эффективности.
Для предотвращения или ограничения реперфузионного повреждения кар-
диомиоцитов вследствие избыточного образования свободных радикалов кис-
лорода теоретически обоснованным представляется применение антиокси-
дантов как при лечении тромболитическими средствами, так и без них, в
расчете на последствия спонтанного фибринолиза. Для проверки этой гипо-
тезы было проведено многоцентровое плацебоконтролируемое исследование
триметазидина — нового препарата с модулирующим действием на свобод-
но-радикальные процессы, которое получило название EMIP — European
Myocardial Infarct Project — free radicals pilot Study (C.Young и соавт., 1993).
Полученные результаты показали, что как при изолированном примене-
нии, начиная с первых 24 ч заболевания, так и в сочетании с тромболити-
ческими средствами он не оказывал существенного влияния на ближайшие
и отдаленные исходы и основные осложнения инфаркта миокарда.
Лечение осложнений. 1. Тахиаритмии. При желудочковой экс-
трасистолии II-V класса по Лауну используют антиаритмические пре-
параты I класса (см. ниже). Лечение обычно начинают с назначения лидока-
ина, который практически не обладает кардиодепрессивным свойством, по
50-100 мг (или 1 мг/кг) внутривенно в виде болюса, затем по 1—2—4 мг/мин
или 20—50 мкг/кг/мин капельно. У больных пожилого возраста, а также при
сердечной, печеночной и почечной недостаточности, при которых его пери-
од полужизни удлиняется, скорость инфузии не должна превышать 1 мг/мин.
При неэффективности лидокаина назначают новокаинамид по 500-1000 мг
внутривенно струйно очень медленно с переходом на инфузию со скоро-
стью 2-5 мг/мин. Внутривенно вводят также соли калия и магния сульфат. У
больных, получающих 0-адреноблокаторы, частота возникновения желудоч-
ковых аритмий меньше.
При стойкой пароксизмальной желудочковой тахикар-
дии лечение начинают с назначения лидокаина, при неэффективности
которого применяют другие препараты I класса или амиодарон вместе с со-
лями калия и магния. При отсутствии немедленного эффекта производят
трансторакальную деполяризацию. Ее же выполняют при развитии фиб-
рилляции желудочков, в условиях БРИТа, желательно не позднее
чем через 30 с. В связи с повышенным риском рецидива этих аритмий для их
профилактики сразу после электроимпульсной терапии начинают внутри-
венную инфузию лидокаина со скоростью 1-2 мг/мин, которую при хоро-
шем эффекте (отсутствии желудочковых экстрасистол высоких градаций)
продолжают в течение 24—48 ч. Альтернативой являются новокаинамид, мек-
ситил, а также амиодарон. После внутривенного введения переходят на табле-
тированный прием одного из антиаритмических препаратов, включая 0-адре-
ноблокаторы. При рецидивах этих аритмий, несмотря на медикаментозную
терапию, целесообразно использовать временную желудочковую элекгро-
кардиостимуляцию с частотой 100-110 в 1 мин, которая особенно эффек-
тивна в случаях возникновения электрической нестабильности на фоне бра-
дикардии. В случаях “поздних” фибрилляций желудочков или пароксизмаль-
ной желудочковой тахикардии, имеющих худший прогноз, для подбора оп-
тимального антиаритмического препарата для длительного приема лучше
использовать электрофизиологическое исследование.
Ускоренный идиовентрикулярный ритм обычно не требует
лечения.
Суправентрикулярные аритмии. При синусовой тахикар-
дии без выраженной сердечной недостаточности с осторожностью назнача-
ют 0-адреноблокаторы. При пароксизмальной суправентрику-
лярной тахикардии, мерцании или трепетании предсер-
дий с частым желудочковым ритмом используют дигитализацию и (или)
0-адреноблокаторы либо верапамил. Во избежание резкой брадикардии не
следует сочетать 0-адреноблокаторы с верапамилом. В случаях резкого ухуд-
шения гемодинамики проводят электроимпульсную терапию. Для профи-
лактики рецидивов мерцательной аритмии применяют дигоксин, а при по-
вторении пароксизмов решают вопрос о назначении антикоагулянтов не-
прямого действия.
2. Брадиаритмии. Синусовая брадикардия требует лечения
только при наличии нарушений гемодинамики, то есть артериальной гипо-
тензии и сердечной недостаточности, либо эктопических желудочковых арит-
мий. Назначают атропина сульфат по 0,3-0,5 мг внутривенно струйно каждые
379
5 мин до получения эффекта либо достижения общей дозы 1,5 мг. При недо-
статочном эффекте или необходимости повторного введения атропина суль-
фата показана временная эндокардиальная элекгрокардиостимуляция.
При атриовентрикулярных блокадах при заднем инфаркте мио-
карда в случаях адекватной ЧСС (> 50 в 1 мин), отсутствия признаков сердеч-
ной недостаточности и приступов Морганьи-Адамса-Стокса, даже при пол-
ной блокаде больные подлежат только наблюдению. Временную эндокарди-
альную желудочковую элекгрокардиостимуляцию проводят при замедлении
ритма, появлении этих осложнений, а также эктопических желудочковых арит-
мий. В то же время при переднем инфаркте миокарда в связи с низкой ЧСС и
высоком риске внезапной асистолии элекгрокардиостимуляция показана даже
при бессимптомных блокадах типа Мобитц II и полной. По этой причине к
профилактической эндокардиальной установке электрода следует прибегать
при перемежающейся или стойкой двусторонней двухпучковой блокаде но-
жек пучка Гиса, даже при отсутствии удлинения интервала P—Q.
Временную элекгрокардиостимуляцию при инфаркте миокарда проводят
с частотой 60—70 в 1 мин из верхушки правого желудочка электродом, вве-
денным из обычного трансвенозного доступа (см. ниже), лучше в режиме
“по требованию”. Важно убедиться в устойчивости положения электрода при
глубоком дыхании, кашле, во время движений, о чем свидетельствует так-
же обеспечение желудочковых захватов при токе 1 В. При восстановлении
синусового ритма достаточной частоты элекгрокардиостимуляцию прекра-
щают и оставляют электрод в полости сердца еще на 3 сут.
Показаниями к последующей постоянной элекгрокардиостимуляции в
режиме “по требованию” при инфаркте миокарда являются: 1) полная атрио-
вентрикулярная блокада у больных с передним инфарктом; 2) возникшая в
связи с инфарктом любой локализации бифасцикулярная блокада с эпизо-
дом трифасцикулярной (типа Мобитц II и полной).
Показания к временной элекгрокардиостимуляции при остром инфаркте миокарда
А. Показания независимо от локализации инфаркта миокарда
1) Симптоматическая и резистентная к медикаментозной терапии брадикардия вслед-
ствие: а) синусовой брадикардии, временной остановки синусового узла, синоатри-
альной блокады; б) атриовентрикулярной блокады II—III степени.
2) Синдром слабости синусового узла.
3) Рецидивирующая желудочковая тахикардия и фибрилляция желудочков, резис-
тентные к электроимпульсной терапии и медикаментозной терапии.
4) Остро возникшая бифасцикулярная блокада правой ножки и передне-верхней
либо задне-нижней ветви левой, без удлинения интервала Р-Q или с его удлинением
(профилактическая постановка электрода без элекгрокардиостимуляции).
Б. Показания при переднем инфаркте миокарда
1.См. “А”.
2. Атриовентрикулярная блокада типа Мобитц II или полная (все случаи).
В. Электрокардиостимуляция не показана при'.
1) изолированной атриовентрикулярной блокаде I степени;
2) бессимптомной атриовентрикулярной блокаде типа Мобитц II;
3) бессимптомной синусовой брадикардии или ритме атриовентрикулярного соеди-
нения;
380
Схема 15. Влияние нарушений гемодинамики на ишемическое повреждение миокарда
при инфаркте: КТХА — катехоламины
4) изолированных однопучковых блокадах.
3. Острая левожелудочковая недостаточность . Важность
адекватной коррекции нарушений гемодинамики обусловлена способнос-
тью их вызывать усугубление ишемии миокарда и распространение зоны
некроза (схема 15).
При умеренной острой левожелудочковой недостаточности лечение на-
чинают с назначения мочегонных средств, которые, однако, во избежание
гиповолемии и резкого снижения КДД в левом желудочке следует приме-
нять с осторожностью. Назначают гипотиазид по 100 мг в таблетках или фу-
росемид по 20—40 мг внутривенно струйно. При отсутствии эффекта необхо-
дима более интенсивная терапия, которую лучше проводить с учетом харак-
тера изменений показателей гемодинамики (табл. 35).
При невозможности проведения полного гемодинамического мониторинга
“застойный” вариант гемодинамики можно предполагать при сочетании ди-
латации левых отделов сердца и признаков застоя в легких с неизмененным
или мало измененным АД и нормальным или повышенным ЦВД. Лечение
состоит в назначении ингаляции кислорода, значительной дозы фуросемида
(60-80 мг) и внутривенной инфузии нитроглицерина, начиная с 5—10
мкг/мин с постепенным увеличением скорости каждые 5—10 мин во избе-
жание резкой артериальной гипотензии и тахикардии до получения эффекта
или снижения АД. В менее тяжелых случаях, а также при стабилизации со-
стояния после внутривенной инфузии назначают нитроглицерин чрескожно
(2,5—30 мг/24 ч) либо таблетированные нитраты (например, изосорбида ди-
нитрат по 10—30 мг 3—6 раз в сутки), которые обладают более слабым, чем
инфузия нитроглицерина, сосудорасширяющим свойством.
381
Таблица 35. Дифференцированное лечение инфаркта миокарда в зависимости от гемодинамического
профиля
Гемодинамический вариант МОС Диастолическое давление в легочной артерии Терапия
"Гиповолемический” 4. 4. или N Плазмозаменители
"Застойный" N т Мочегонные средства, нитраты
"Гипокинетический" (без кардиогенного шока или с шоком) 4. Т Артериолярные и венозные вазодилататоры, мочегонные средства, симпатомиметические амины
При кардиогенном шоке — внутриаор-
тальная баллончиковая контрпульсация
Примечание. 1 - уменьшение, 1 - увеличение показателя, N — норма.
При склонности к артериальной гипертензии и повышенном ОПСС можно
использовать смешанный вазодилататор натрия нитропруссид, обладающий спо-
собностью вызывать значительную дилатацию артериол. Инфузию начинают с
1—2 мкг/кг/мин. Средняя доза составляет 3—8 мкг/кг/мин. Ее увеличивают до
снижения диастолического давления в легочной артерии на 40—50 %, а при
отсутствии контроля за ним — до снижения системного АД на 15—20 % от
исходного, но не более 15 мкг/кг/мин. Недостатком натрия нитропруссида яв-
ляется способность вызывать межкоронарное “обкрадывание”, из-за чего при
инфаркте миокарда препарат в настоящее время применяют редко.
Нормализация повышенной постнагрузки является важнейшей задачей
терапии острой левожелудочковой недостаточности, так как обеспечивает
одновременно улучшение систолического опорожнения левого желудочка и
снижение его потребности в кислороде. Тактику “управляемой артериальной
гипотензии” применяют не только при повышенном АД, но и при его “нор-
мальных” величинах (систолическое АД более 100-110 мм рт.ст.) и в ком-
бинации с инотропными агентами при так называемом гипокинетическом
гемодинамическом варианте инфаркта миокарда, для которого характерно
снижение МОС в сочетании с повышением ОПСС и признаками гипопер-
фузии тканей. При этом, уменьшая сопротивление изгнанию крови из лево-
го желудочка, вазодилататоры способствуют увеличению УОС без измене-
ния сократимости миокарда, тем самым не увеличивая его потребности в
кислороде. Одновременно достигается снижение КДО и КДД. Во избежание
ухудшения коронарного кровотока не допускают уменьшения систоличе-
ского АД ниже 90—95 мм рт.ст.
В качестве преимущественно артериолярных вазодилататоров можно ис-
пользовать а-адреноблокаторы (фентоламин), ганглиоблокаторы (пента-
мин, триметафан—арфонад), миотропные вазодилататоры (гидралазин-
апрессин). В настоящее время все эти препараты практически вытеснены
ингибиторами АПФ.
382
Фентоламин (0,25—1 мг/мин внутривенно) обладает быстрым и мощ-
ным, однако очень коротким гемодинамическим эффектом, влияя на арте-
риолы не только большого, но и малого круга кровообращения. Его приме-
нение при инфаркте миокарда, однако, значительно ограничено из-за реф-
лекторной тахикардии, особенно выраженной при сочетании препарата с
нитроглицерином, а также резкого снижения АД. Эти же недостатки прису-
щи и ганглиоблокаторам. Менее резким гипотензивным, но существенным
тахикардитическим эффектом обладает гидралазин (апрессин) — по 50—75 мг
каждые 4—6 ч. Препаратами выбора являются ингибиторы АПФ, не вызыва-
ющие рефлекторную симпатическую стимуляцию и тахикардию и улучшаю-
щие почечный плазмоток (см. ниже). Лечение начинают с назначения малых
доз (например, каптоприл по 6,25 мг 2—3 раза в сутки), осторожно повышая
их под контролем АД.
При митральной недостаточности вследствие разрыва или дисфункции
сосочковых мышц артериолярные вазодилататоры, снижая ОПСС, суще-
ственно уменьшают объем регургитации.
При выраженной острой левожелудочковой недостаточности с “гипоки-
нетическим” вариантом нарушений гемодинамики обязательным компонен-
том терапии являются инотропные препараты. У таких больных средством
выбора является синтетический р-агонист добутамин. Он дает одновременно
положительный инотропный эффект, сопровождающийся повышением МОС
и снижением КДД в левом желудочке, и, расширяя периферические артери-
олы, уменьшает ОПСС и улучшает перфузию тканей. При этом, в отличие
от других симпатомиметических аминов, он вызывает значительно меньшее
повышение ЧСС и АД, которое пагубно влияет на размеры инфаркта, и
вызывает меньший аритмогенный эффект. АД может даже снижаться. Инфу-
зию начинают со скоростью 1—2 мкг/кг/мин и постепенно повышают до 10
мкг/кг/мин. В случаях выраженной артериальной гипотензии при кардио-
генном шоке его комбинируют с допамином или малыми дозами норадре-
налина гидротартрата.
Естественный предшественник адреналина и норадреналина допамин в
низких дозах (0,5-4 мкг/кг/мин) оказывает преимущественно мочегонное
действие. В средних дозах (5—10 мкг/кг/мин) он действует преимуществен-
но на сердце, повышая МОС и ЧСС, не влияя, однако, на КДД в левом
желудочке. Большие дозы (более 10 мкг/кг/мин), вызывающие в основном
стимуляцию периферических а-адренорецепторов и вазоконстрикцию сосу-
дов мышц, применяют редко. При гиповолемии симпатомиметические ами-
ны противопоказаны.
При применении инотропных агентов у больных с острым инфарктом
миокарда необходимо иметь в виду, что прямым следствием их кардиостиму-
лирующего эффекта является повышение потребности миокарда в кислоро-
де, что может приводить к увеличению ишемии и в результате — к усугубле-
нию снижения сократимости. Избыточная периферическая вазоконстрикция
при использовании больших доз может усугублять нарушения периферическо-
го кровотока, что обусловливает важность комбинации с артериолярными
383
вазодилататорами. При этом необходимо тщательное титрование доз обоих
препаратов под контролем гемодинамических показателей для получения
оптимального эффекта.
Сердечные гликозиды в ранний период инфаркта миокарда для лечения
острой левожелудочковой недостаточности противопоказаны в связи с от-
сроченным началом и значительной продолжительностью действия, а также
повышением чувствительности к ним ишемизированного миокарда и опас-
ностью возникновения аритмий. Как и р-агонисты, они вызывают повыше-
ние потребности миокарда в кислороде и могут приводить к увеличению
зоны инфарцирования, значительно уступая им по силе инотропного эф-
фекта. Единственным показанием к назначению сердечных гликозидов в
ранний период инфаркта миокарда являются наджелудочковые аритмии с
частым ритмом.
Внутриаортальную баллончиковую контрпульсацию
применяют при кардиогенном шоке при сохранении, несмотря на введение
симпатомиметических средств, выраженной артериальной гипотензии. Сни-
жая давление в аорте во время систолы, она вызывает уменьшение постнаг-
рузки и работы левого желудочка, а повышая давление в аорте в период
диастолы, улучшает коронарную перфузию и тем самым — функцию левого
желудочка. Поскольку этот эффект после прекращения контрпульсации ис-
чезает, она не улучшает прогноз и используется главным образом, чтобы
выиграть время, необходимое для организации и проведения коронарогра-
фии, ТЛАП, аортокоронарного шунтирования или ушивания внутрисер-
дечных разрывов.
Вспомогательное значение при лечении острой левожелудочковой не-
достаточности с “гипокинетическим” типом нарушения гемодинамики имеют
гемокарбоперфузия и плазмаферез, улучшающие реологические свойства
крови и повышающие чувствительность клеток к медикаментозным пре-
паратам.
При наличии артериальной гипотензии и признаков гипоперфузии тка-
ней необходимо иметь в виду, что причиной низкого МОС может быть так-
же гиповолемия (’’гиповолемический” вариант). Она может быть обусловле-
на рвотой, потливостью, лихорадкой, избыточным приемом мочегонных
средств. При этом артериальная гипотензия может усугубляться при введе-
нии вазодилататоров (нитроглицерина внутривенно капельно), наркотиче-
ских анальгетиков и Р-адреноблокаторов. В связи со снижением диастоличе-
ской податливости в острейший период инфаркта вследствие ишемии адек-
ватный сердечный выброс из левого желудочка обеспечивается более высо-
ким давлением наполнения, вследствие чего такие больные особенно уяз-
вимы к уменьшению венозного притока. При невозможности контролиро-
вать показатели кардиогемодинамики (см. табл. 34) “гиповолемический” ва-
риант можно заподозрить в случаях периферической гипоперфузии при низ-
ком ЦВД, спавшихся периферических венах, отсутствии дилатации левого
желудочка и застойных хрипов в легких. Лечение состоит в дробном введе-
нии низкомолекулярных декстранов (реополиглюкина) или изотонического
раствора натрия хлорида по 50-100 мл под контролем АД, ЦВД и этих
клинических показателей. При отсутствии быстрого эффекта, то есть при-
знаков повышения МОС, несмотря на рост ЦВД, усугублении тахикардии
и тахипноэ введение жидкости следует прекратить во избежание развития
отека легких и продолжать лечение, как при “гипокинетическом” типе. При
наличии гемодинамического мониторинга введение плазмозаменителей про-
должают до достижения уровня диастолического давления в легочной арте-
рии 18—20 мм рт.ст., что для “жесткого” желудочка является оптимальным
для реализации механизма Франка-Старлинга.
Инфузия жидкости показана также при наличии синдрома “малого выб-
роса”, развившегося вследствие массивного инфаркта правого желудочка, о
возможности которого надо помнить в случаях высокого ЦВД и артериаль-
ной гипотензии без существенных признаков левожелудочковой недоста-
точности. В такой ситуации следует воздержаться от внутривенной инфузии
нитроглицерина и мочегонных средств. При отсутствии эффекта от нагрузки
объемом и диастолическом давлении в легочной артерии 15—20 мм рт.ст.,
переходят к инотропной поддержке добутамином, желательно под гемоди-
намическим контролем.
Еще одной причиной артериальной гипотензии с признаками перифери-
ческой гипоперфузии в первые часы инфаркта миокарда является ваготони-
ческая реакция по типу рефлекса Бецольда—Яриша. Она возникает у боль-
ных с задней локализацией поражения и сопровождается болевым синдро-
мом, тошнотой, рвотой и, что особенно важно, брадикардией. Состояние
легко корригируется дробным внутривенным введением атропина сульфата
(по 0,3-0,5 мг) и обезболиванием.
4. Разрыв сосочковой мышцы и межжелудочковой пе-
регородки подлежит хирургическому лечению после интенсивной тера-
пии острой левожелудочковой недостаточности и стабилизации состояния
больных с использованием вазодилататоров и внутриаортальной контрпуль-
сации. Однако большинство больных умирают до операции.
5. Наружный разрыв левого желудочка , какправило, закан-
чивается летальным исходом, кроме случаев образования ложной аневриз-
мы. Предотвратить его в определенной степени помогает широкое примене-
ние p-адреноблокаторов. Описаны попытки перикардиоцентеза, срочной внут-
риаортальной контрпульсации и хирургического ушивания. Ложная анев-
ризма подлежит оперативному лечению сразу после установления диагноза.
6. При нестабильной пост (пери-) инфарктной стено-
кардии и первых признаках рецидива илираспространения ин-
фаркта миокарда необходима активная антиангинальная терапия, как
при нестабильной стенокардии. После стабилизации состояния больных же-
лательна коронарография для решения вопроса о “ранней” ТЛАП или аорто-
коронарном шунтировании.
7. Медикаментозное (антикоагулянты и другие средства) и хирурги-
ческое лечение тромбоэмболических осложнений проводят
385
общепринятыми методами в зависимости от локализации. Их профилактика
в случаях повышенного риска состоит в назначении гепарина (см. выше).
8. Единственным радикальным методом лечения острой аневриз-
мы левого желудочка является ее хирургическое иссечение одновре-
менно с аортокоронарным шунтированием всех значительно стенозирован-
ных коронарных артерий. Оно показано в симптоматичных случаях вслед-
ствие застойной сердечной недостаточности и тяжелых рефрактерных желу-
дочковых аритмий при условии сохранения достаточного по объему жизне-
способного миокарда (более 50 % периметра левого желудочка). При тяжелой
сердечной недостаточности с выраженной диффузной гипокинезией левого
желудочка хирургическое лечение нецелесообразно. Его желательно прово-
дить через 8-10нед от начала заболевания, после консолидации рубца и
стабилизации состояния больных путем активного лечения застойной сер-
дечной недостаточности на фоне антикоагулянтной терапии. Хирургическая
летальность составляет 8—15 %. У большинства больных достигают значи-
тельного уменьшения выраженности сердечной недостаточности.
9. Эпистенокардитический перикардит чаще не требует ле-
чения. При упорном болевом синдроме назначают нестероидные противо-
воспалительные препараты, а при их недостаточном эффекте, что бывает
крайне редко, несколько парентеральных инъекций глюкокортикостерои-
дов. Антикоагулянты противопоказаны.
10. При синдроме Дресслера рекомендуют нестероидные противо-
воспалительные препараты (ацетилсалициловую кислоту по 500-750 мг 3-4
раза в сутки, индометацин по 25—50 мг 3—4 раза в сутки и др.). В тяжелых
случаях назначают глюкокортикостероиды, начиная из расчета 1 мг предни-
золона на 1 кг массы тела в сутки перорально с медленным снижением дозы
во избежание синдрома “рикошета” до полной отмены. В связи с опасностью
развития геморрагического перикардита с тампонадой антикоагулянты про-
тивопоказаны.
Реабилитация больных с инфарктом миокарда. Собственно медицинская
реабилитация включает непосредственное лечение инфаркта миокарда и его
осложнений, а также вторичную профилактику прогрессирования ИБС, глав-
ным образом повторного инфаркта миокарда и внезапной смерти. Она пока-
зана всем больным с инфарктом миокарда, независимо от тяжести, и про-
водится дифференцированно с достижением различных уровней физической
активности.
Выделяют 3 фазы реабилитации: больничную (стационарную), выздоров-
ления и поддерживающую. В фазе выздоровления реабилитацию проводят в
соответствующем отделении санатория, а за рубежом — в реабилитационном
центре амбулаторного или стационарного типа. Она продолжается 4—8 нед в
зависимости от тяжести болезни и в идеале заканчивается возвращением
клинического состояния больного к его предынфарктному уровню. В под-
держивающей фазе реабилитацию осуществляют в амбулаторных условиях
под наблюдением кардиолога или участкового терапевта (семейного врача).
Основной задачей физической реабилитации в больничной
386
фазе является восстановление способности к самообслуживанию. Основы-
ваясь на морфологических данных о том, что для замещения некротическо-
го очага фиброзной тканью требуется в среднем 6 нед, на протяжении этого
времени необходимо ограничить физическую активность больных. Еще 30
лет назад больные соблюдали постельный режим в течение всего этого пери-
ода, а 10 лет назад — на протяжении 3 нед. В связи с очевидным неблагопри-
ятным влиянием длительной гиподинамии на сердечно-сосудистую систе-
му, легочную вентиляцию, частоту тромбоэмболических осложнений и пси-
хическое состояние больного, а также убедительными доказательствами бе-
зопасности более ранней активизации в настоящее время ее темпы значи-
тельно ускорились. Установлено, что ранние реабилитационные мероприя-
тия при инфаркте миокарда предупреждают развитие ряда осложнений, спо-
собствуют сокращению сроков временной нетрудоспособности и возвраще-
нию к труду большего числа больных.
Согласно действующим в нашей стране инструктивным документам, боль-
ным с крупноочаговым инфарктом миокарда в возрасте до 60 лет без суще-
ственных осложнений с 1-х суток заболевания разрешают поворачиваться
на бок и двигать конечностями, а со 2—3-х — садиться в постели с опущен-
ными ногами, самостоятельно умываться, чистить зубы, бриться и прини-
мать пищу. С этого же времени больные под руководством методистов начи-
нают заниматься ЛФК. Ходить по палате разрешают с 6-8-х суток. Двига-
тельная активность должна увеличиваться постепенно под контролем кли-
нического состояния и ЭКГ, лучше всего путем телеметрии. При плохой
переносимости нового этапа расширения режима его приостанавливают не
менее чем на 2—3 сут. О неадекватности нагрузки свидетельствуют возник-
новение приступа стенокардии, выраженной одышки, слабости, увеличе-
ние ЧСС более чем на 30 в 1 мин или ее уменьшение более чем на 10 в
1 мин, значительное повышение АД или снижение систолического АД бо-
лее чем на 10 мм рт.ст., а также появление нарушений ритма и признаков
ишемии на ЭКГ.
К концу стационарной фазы реабилитации больных подготавливают к
переводу в реабилитационное отделение санатория: они должны полностью
себя обслуживать, ходить на расстояние 1 км за 1 прием (всего — 2—3 км в
течение дня) и подниматься на 1 этаж лестницы. Достижение такого уровня
физической активности при трансмуральном инфаркте регламентируется не
ранее 26-х суток, а при нетрансмуральном — не ранее 20-х. За рубежом
продолжительность стационарного лечения при неосложненном инфаркте
миокарда короче и составляет в большинстве стран 10—14 дней, а иногда 5—
7. При этом доказана безопасность более быстрой мобилизации (ходьбы по
палате с 3—5-х суток и по коридору с 5-7-х). Дальнейшее расширение дви-
гательного режима и собственно реабилитация, однако, в отличие от уста-
новки, принятой в бывшем СССР, проводится на постгоспитальном этапе.
Большая продолжительность стационарной фазы восстановительного лече-
ния в нашей стране обусловлена большей широтой решаемых в этот период
задач . Они включают не только стабилизацию состояния больного, как за
387
рубежом, но и существенное восстановление его физической работоспособ-
ности, психологическую реадаптацию и решение ряда вопросов воспитательно-
го характера. Согласно методическим рекомендациям Украинского НИИ кар-
диологии, для больных с ограниченным одним сегментом левого желудочка
и практически неосложненным инфарктом миокарда с зубцом Q без пост-
инфарктной стенокардии и тяжелых сопутствующих заболеваний при дальней-
шем переводе в кардиологический санаторий приемлема реабилитация по
ускоренной программе с завершением ее выполнения к 20—23-м суткам.
После освоения программы стационарного этапа перед выпиской для оп-
ределения отдаленного прогноза и дальнейшей лечебной тактики рекомен-
дуют проводить субмаксимальное тестирование на велоэргометре или тред-
милле с электрокардиографическим или сцинтиграфическим контролем до
достижения ЧСС 120—130 в 1 мин, то есть 70 % от должной субмаксималь-
ной ЧСС, или появления симптомов и признаков, требующих прекращения
теста. Этот уровень ЧСС примерно соответствует 4 МЕТ, то есть метаболи-
ческому эквиваленту повседневной бытовой нагрузки. Доказано, что при
тщательном контроле такой “ранний” нагрузочный тест абсолютно безопа-
сен для больных с неосложненным инфарктом миокарда, независимо от
глубины, начиная с 7—10-х суток болезни. Преждевременное прекращение
пробы из-за появления ангинозной боли, электрокардиографических при-
знаков ишемии, желудочковых аритмий либо других критериев неадекват-
ности нагрузки связано с повышенным риском летального исхода, внезап-
ной смерти и повторного инфаркта миокарда в течение ближайших 1 года —
2 лет (D.Mark; 1991; R.Krone, 1992). Таким больным показаны коронарогра-
фия и решение вопроса о возможности хирургической реваскуляризации
(ТЛАП или аортокоронарного шунтирования) для предотвращения неблаго-
приятного исхода. При удовлетворительной толерантности к физической на-
грузке прогноз относительно благоприятный, и такие больные подлежат бы-
строй реабилитации, раннему возвращению к труду и медикаментозной те-
рапии (по показаниям).
Через 3 нед и более от начала заболевания можно проводить пороговое,
то есть без ограничения ЧСС или мощности последнего этапа нагрузки,
нагрузочное тестирование со стратификацией больных в зависимости от физи-
ческой работоспособности. При ее низком и среднем уровне показана коро-
нарография. Хороший результат тестирования повышает уверенность больного
в собственных силах и возможности возобновления привычного образа жизни.
При наличии более или менее серьезных осложнений инфаркта миокар-
да, которые наблюдаются не менее чем у 50 % больных, двигательная акти-
визация проводится более медленными темпами. При тяжелом течении заболе-
вания она осуществляется по индивидуальной программе и ограничивается
уровнем самообслуживания (ходьба по палате, выход в коридор до туалета).
Целью психологической реабилитации является восстановле-
ние личностных и социальных аспектов статуса больного путем психологи-
ческой адаптации к болезни и ее последствиям, профилактики и лечения
развивающихся патологических изменений личности. Она осуществляется с
388
помощью групповых и индивидуальных занятий с больными. Желательно,
чтобы их проводил специалист-психолог.
Вторым этапом реабилитации является восстановительное лече-
ние в местном кардиологическом санатории или приго-
родном реабилитационном центре. В нашей стране его проводят
больным, у которых нет тяжелых осложнений инфаркта, выполнившим всю
программу физической реабилитации стационарной фазы без существенных
неблагоприятных реакций. В ряде зарубежных стран показания значительно
шире и включают практически любое осложненное течение и низкий уро-
вень двигательной активности. Такие санатории (центры) оснащены всем
необходимым для оценки функционального состояния сердечно-сосудистой
системы, вплоть до выполнения коронароангиографии. Больных лучше на-
правлять непосредственно из стационара. Средняя продолжительность сана-
торного лечения — 24 дня.
Реабилитация больных с инфарктом миокарда в санатории является про-
должением больничной и включает дальнейшее расширение физической ак-
тивности и физические тренировки, борьбу с факторами риска ИБС, пси-
хологическую реадаптацию и коррекцию медикаментозной терапии на ос-
нове оценки функционального состояния. Ее основная цель — подготовка
больных для возвращения к труду.
Программа физической реабилитации предусматривает дальнейшее по-
этапное увеличение объема и интенсивности бытовых и тренирующих на-
грузок по различным программам под клиническим и электрокардиографи-
ческим, в том числе телеметрическим, контролем, а также с учетом резуль-
татов повторных велоэргометрических тестов. При хорошей переносимости
больные осваивают тренировочную ходьбу на расстояние 2—3 км в один прием
(7-10 км в день) и подъем по лестнице на 4-5-й этаж с периодическим
увеличением ЧСС до 100—120 в 1 мин в течение нескольких минут.
В ряде санаториев с успехом используют физические тренировки на вело-
эргометре по 30 мин в течение 5 дней в неделю с достижением ЧСС пример-
но 70 % от пороговой, определяемой при предварительном тестировании.
Каждую неделю нагрузку повышают. Тренировки способствуют улучшению
физического и психического состояния больных, однако, как и на постса-
наторном этапе, не оказывают достоверного влияния на прогноз.
Существенное место в системе реабилитации отводят вопросам воспита-
ния больных. Занятия проводит психолог с небольшой группой больных.
Они предусматривают ознакомление с факторами риска ИБС, создание мо-
тивации в отношении важности борьбы с ними и обсуждение путей их кор-
рекции. Программа включает мероприятия по аутотренингу и релаксации. По
показаниям выполняют психологическую коррекцию. В нашей стране такие
занятия с больными и желательно также с их родственниками начинают
проводить в больничной фазе реабилитации. Они имеют важное значение
для подготовки больного к возвращению к труду.
Проведение второй фазы реабилитации в амбулаторных условиях поли-
клинических отделений центров или в “антикоронарных клубах”, хотя и
389
выгодно с экономической стороны, но трудно реализуется из-за проблемы
расстояния между местом жительства и реабилитационным отделением.
Задачи поддерживающей фазы реабилитации включают:под-
держание физической активности больного, определение трудоспособности
и рациональное трудоустройство, вторичную профилактику ИБС. В ряде за-
рубежных стран они решаются путем систематического амбулаторного или
стационарного обследования больных один раз и более в год в реабилитаци-
онном центре с коррекцией рекомендаций по реабилитации. В нашей стране
эти функции чаще осуществляет участковый терапевт с консультативным
участием кардиолога районной поликлиники или, реже, персонала меж-
поликлинического реабилитационного отделения (кардиолог, физиотерапевт,
психолог) хотя бы в течение 1 -го года.
Показано, что современная реабилитация больных инфарктом миокарда
приводит к увеличению физической работоспособности на 15—25 %, что осо-
бенно ценно в случаях ее исходно низкого уровня вследствие начальной
сердечной недостаточности. Она не предотвращает развитие повторного ин-
фаркта миокарда, однако может несколько улучшать выживаемость боль-
ных и способствует лучшему восстановлению трудоспособности. Приступать
к легкой работе можно через 2 мес от начала заболевания. На 1-м году среди
лиц моложе 60 лет в большинстве стран, включая нашу, к труду возвраща-
ются около 70—80 % служащих и 40—50 % лиц, занятых физическим трудом.
Прогноз. Примерно у 25 % больных смерть от инфаркта миокарда насту-
пает внезапно в течение нескольких минут, еще до оказания медицинской
помощи; 50 % летальных исходов приходятся на первые 2 ч и 75-84 % - на
1 -е сутки заболевания. После организации БРИТов госпитальная летальность
снизилась и составляет в нашей стране 12—18 % (в США и Западной Европе
в среднем 10—15 %), а при инфаркте миокарда без зубца Q с неосложнен-
ным течением — менее 5 %. Она в значительной степени зависит от сроков
поступления больных в стационар. Существенно снизить госпитальную ле-
тальность (до 5 %) позволяет проведение тромболитической терапии и в зна-
чительно меньшей степени — раннее применение р-адреноблокаторов.
Ближайший прогноз хуже у больных старше 60 лет с инфарктом
миокарда, высокой артериальной гипертензией, застойной сердечной недо-
статочностью и сахарным диабетом в анамнезе. Госпитальная летальность
тесно связана также с величиной некротического очага и вследствие этого
при переднем инфаркте или блокаде левой ножки пучка Гиса в среднем
выше, чем при заднем. Значительно отягощает прогноз острая левожелудоч-
ковая недостаточность, особенно III-IV класса, по Т. КПП p-J. Kimball, и воз-
никновение рецидива или распространения инфаркта миокарда. При отсут-
ствии этих факторов риска перенесенная первичная фибрилляция желудоч-
ков не оказывает существенного влияния на ближайший исход.
Среди выписавшихся из стационара средняя выживаемость к концу 1-го
года превышает 80 %, 5-летняя составляет около 75 %, 10-летняя — 50 % и
20-летняя — 25 % (A.Moos, 1983).
Основные задачи лечения больных, перенесших инфаркт миокарда
Задачи
1. Предотвращение повторного инфаркта
миокарда
2. Предотвращение внезапной смерти
3. Лечение стенокардии
4. Предотвращение и лечение застойной
сердечной недостаточности
Пути достижения
Предотвращение растрескивания бляшки и
тромбообразования
Борьба с аритмиями
Увеличение отношения “доставка
кислорода/потребность в кислороде”
Уменьшение постнагрузки левого желудочка,
улучшение его функции
Отдаленный прогноз зависит от: 1) количества пораженных коро-
нарных артерий по данным коронарографии, особенно при проксимальных
стенозах; 2) выраженности проявлений ишемии по клиническим данным
(частота ангинозных приступов) и толерантности к физической нагрузке
при раннем нагрузочном тестировании; 3) степени дисфункции левого же-
лудочка — выраженности хронической сердечной недостаточности до раз-
вития инфаркта миокарда, степени острой левожелудочковой недостаточно-
сти в его острый период, снижения ФВ в покое и его усугубления при нагру-
зочном тесте, распространенности зоны нарушения сегментарной сократи-
мости; 4) выраженности электрической нестабильности миокарда желудоч-
ков по данным холтеровского мониторирования ЭКГ перед выпиской. Пока-
зано неблагоприятное влияние на выживаемость желудочковых экстрасис-
тол высоких градаций, особенно групповых, пробежек желудочковой тахи-
кардии и рецидива инфаркта миокарда, особенно без зубца Q. При наличии
этих факторов риска летальность в 1-й год после инфаркта миокарда дости-
гает 30-50 % (A.Moos и соавт., 1987).
Обнаружение в конце острого периода поздних потенциалов желудочков,
как и способности вызывать стойкую желудочковую тахикардию при про-
граммируемой эндокардиальной элекгрокардиостимуляции, само по себе
имеет низкую предсказующую ценность (около 15 %) в отношении вероят-
ного развития внезапной остановки кровообращения. Значительно большее
прогностическое значение имеют отрицательные результаты этих исследова-
ний как предикторы низкого риска потенциально летальных аритмических
эпизодов (R.Dhingra, 1991; J.Steinberg и соавт., 1992).
Сочетание резкого снижения функции левого желудочка (ФВ менее 40 %)
со сложными желудочковыми аритмиями и наличием поздних потенциалов
желудочков указывает на особенно неблагоприятный прогноз.
Вторичная профилактика инфаркта миокарда. Установлена способность
существенно улучшать выживаемость больных, перенесших инфаркт миокар-
да, с помощью следующих методов лечения '.
1) воздействие на факторы риска . Среди этих мероприятий до-
казана эффективность в отношении вторичной профилактики инфаркта ми-
окарда (в отличие от первичной) только отказа от курения и коррекции
ГЛП с помощью диеты либо при отсутствии эффекта — медикаментозной
гиполипидемической терапии (см. выше);
391
2) p-адреноблокаторы. Оценке их влияния на отдаленные исходы
инфаркта миокарда был посвящен ряд многоцентровых плацебоконтроли-
руемых исследований, наиболее крупные из которых были проведены в США
с использованием пропранолола (Beta—Blocker Heart Attack Trial—BHAT,
1981 — около 3800 наблюдений) и в Норвегии с использованием тимолола
(Norwegian Multicenter Study Group, 1981) — около 1900 наблюдений. Как
показали данные мета-анализа результатов 15 таких исследований
(W.Frishman, 1991), применение р-адреноблокаторов, независимо от селек-
тивности, позволяет на протяжении до 6 лет после инфаркта уменьшать об-
щую летальность на 22 % и частоту нефатального повторного инфаркта - на
20 %. Наилучшие показатели выживаемости достигаются при осложненном
течении острого периода вследствие электрической нестабильности миокар-
да или умеренной сердечной недостаточности (S.Yusuf и соавт., 1985). Такая
эффективность p-адреноблокаторов у больных, перенесших инфаркт мио-
карда, обусловлена их способностью снижать потребность миокарда в кис-
лороде и работу сердца, уменьшением влияния на него симпатической сти-
муляции, а также антигипертензивным и антиаритмическим действием.
Применяют пропранолол по 20—80 мг 4 раза в сутки, метопролол - по
100 мг 2 раза в сутки, тимолол — по 10 мг 2 раза в сутки и др. При отсут-
ствии противопоказаний р-адреноблокаторы целесообразно назначать как
можно раньше — с первых часов инфаркта миокарда;
3) ацетилсалициловая кислота. Обоснованием для применения
ацетилсалициловой кислоты у больных, перенесших инфаркт миокарда, яв-
ляется важная роль агрегации тромбоцитов в развитии атеросклероза и ост-
рого тромбоза коронарных артерий. Статистически достоверное, но относи-
тельно небольшое улучшение выживаемости больных, перенесших инфаркт
миокарда, продемонстрировано в 6 из 7 многоцентровых проспективных
плацебоконтролируемых исследований (ISIS-2 Collaborative Group, 1988;
Sferring Committee of the Physicians’ Health Study Research Group, 1989;
W.Frishman, 1991, и др.). Показана также эффективность применения пре-
парата в общепринятой дозе по 325 мг 1 раз в 1-2 сут для предотвращения
инфаркта миокарда и инсульта;
4) антикоагулянты непрямого д е й с т в и я . Их использование
для профилактики повторного инфаркта миокарда и летального исхода яв-
ляется патогенетически обоснованным, а эффективность подтверждается ря-
дом широкомасштабных исследований. В последние 20 лет, однако, их прак-
тически перестали применять в этих целях в связи с риском возникновения
геморрагических осложнений, необходимостью постоянного коагулологи-
ческого контроля и появлением других действенных средств. Показаниями к
длительному назначению антикоагулянтов непрямого действия являются об-
ширный трансмуральный инфаркт передней стенки миокарда, муральный
тромбоз, мерцательная аритмия и застойная сердечная недостаточность.
У отдельных категорий больных прогноз улучшается при использовании
следующих методов лечения:
392
1)антиаритмические препараты. Около 60 % больных ИБС уми-
рают внезапно. Среди факторов риска первостепенное значение имеют пере-
несенный инфаркт миокарда, который служит морфологическим субстра-
том для возникновения фатальных желудочковых аритмий, выраженная дис-
функция миокарда (ФВ левого желудочка ниже 40 %) и сложные желудоч-
ковые аритмии. К последним, наряду с перенесенной стойкой пароксиз-
мальной желудочковой тахикардией и фибрилляцией желудочков, относятся
бессимптомные сложные желудочковые аритмии III—IV класса по Lown, вы-
являемые при холтеровском мониторировании (Multicenter Postinfarction
Research Group, 1983, и др.). Результаты специальных исследований у пере-
несших инфаркт миокарда показали, что к предикторам внезапной смерти
относятся индуцируемая желудочковая тахикардия или фибрилляция желу-
дочков при электрофизиологическом исследовании, поздние потенциалы
желудочков и уменьшение вариабельности сердечного ритма как показателя
вегетативной дисфункции.
В то время как целесообразность профилактической антиаритмической
терапии у перенесших симптоматичную желудочковую тахикардию или фиб-
рилляцию желудочков не вызывает сомнений, возможность предотвраще-
ния внезапной смерти путем лечения бессимптомных желудочковых арит-
мий остается спорной. Проверке этой гипотезы было посвящено несколько
проспективных кооперативных плацебоконтролируемых исследований у пе-
ренесших инфаркт миокарда с различным функциональным состоянием сер-
дечной мышцы.
Как показали результаты применения в профилактических целях анти-
аритмических препаратов классов IA (хинидина), IB (лидокаина, мексиле-
тина) и IC (флекаинида, энкаинида и др.), по классификации E.Vaughan-
Williams (1984), прием каждого из них приводил к статистически достовер-
ному увеличению общей летальности и частоты внезапной смерти, несмот-
ря на эффективное подавление желудочковых аритмий (IMPACT Research
Group, 1984; S.Mac Mahan и соавт., 1988; Cardiac Arrhythmic Suppression
Trial-CAST, 1990; J.Morganroth, J.Goin, 1991, и др.). В связи с этим часть из
этих исследований была прекращена досрочно. По данным мета-анализа К.Тео
и соавторов (1992), базирующегося в общей сложности на результатах 21 780
наблюдений, общая летальность среди больных, получавших один из препа-
ратов I класса, составляла 6 %, в то время как среди получавших плацебо -
5,2 %. Эти данные убедительно показывают, что препараты I класса нельзя
использовать для улучшения выживаемости больных, перенесших инфаркт
миокарда. Это не распространяется, безусловно, на случаи подбора анти-
аритмического препарата с помощью внутрисердечного электрофизиологи-
ческого исследования. Причинами таких отрицательных результатов являют-
ся, по-видимому, значительная частота проаритмического эффекта исполь-
зованных препаратов — более 15 % (CAST, 1990), связанная с удлинением
интервала Q—Ти усилением последеполяризаций, а также усугублением дис-
функции миокарда из-за кардиодепрессивного эффекта.
393
Доказано, что p-адреноблокаторы вызывают уменьшение частоты вне-
запной смерти на 33 % (ВНАТ, 1981; The Norwegian Multicenter Study Group,
1981). При этом их воздействие на эктопические желудочковые аритмии от-
носительно невелико. Следует отметить также, что эффективность р-адрено-
блокаторов определялась лишь у 23—53 % выживших больных, причем с бо-
лее легким течением заболевания. У значительной части остальных пациен-
тов отмечались противопоказания к приему p-адреноблокаторов — выражен-
ная сердечная недостаточность, хронический бронхит, тяжелое течение
сахарного диабета и др.
Обнадеживающие результаты получены при использовании для лечения
бессимптомных желудочковых аритмий и предотвращения внезапной сер-
дечной смерти у перенесших инфаркт миокарда антиаритмического препа-
рата III класса амиодарона. В основе его антифибрилляторного действия ле-
жит способность удлинять рефрактерный период волокон миокарда и интер-
вал Q-Т и уменьшать частоту ритма при желудочковой тахикардии. Несмот-
ря на удлинение интервала Q—Т, препарат оказывает наименьшее по срав-
нению с другими антиаритмическими средствами, в частности, препарата-
ми I класса, ятрогенное проаритмическое действие. Завершившиеся недавно
многоцентровые двойные слепые плацебоконтролируемые исследования эф-
фективности амиодарона у перенесших инфаркт миокарда с бессимптомными
желудочковыми аритмиями III-IVB класса — Швейцарское BASIS (Basel
Antiarrhythmic Study of Infarct Survival, F.Burkart и соавт., 1990), поисковое
канадское CAMIAT (Canadian Amiodarone Myocardial Infarction Arrhythmia
Trial, J.Cairns и соавт., 1991) и польское (L.Ceremuzynski и соавт., 1992),
которые охватывали в общей сложности 1002 больных, продемонстрировали
существенное снижение общей летальности (на 45-61 %), частоты внезап-
ной сердечной смерти и желудочковых аритмий в течение 1 года — 2 лет
наблюдения. Следует подчеркнуть, что такой эффект был достигнут с помо-
щью относительно малых поддерживающих доз препарата — 200—400 мг в
сутки, которые при длительном приеме не вызывали существенных побоч-
ных явлений. Амиодарон назначали эмпирически, начиная с 6—45-х суток
от начала инфаркта миокарда. Результаты этих исследований позволяют сде-
лать предварительный вывод о перспективности предотвращения внезапной
смерти у перенесших инфаркт миокарда путем д лительного лечения бессимп-
томных желудочковых аритмий антиаритмическими препаратами III класса,
что было поколеблено результатами испытаний препаратов I класса. Оконча-
тельно решить этот вопрос позволят результаты дальнейших широкомасш-
табных многоцентровых международных исследований;
2) блокаторы кальциевых канал о в. Дилтиазем по 240—320 мг
в сутки или, что менее желательно, верапамил по 240—360 мг в сутки. Реко-
мендуют применять не ранее 7—15-х суток заболевания в случаях противо-
показаний к p-адреноблокаторам при хорошей насосной функции левого
желудочка, особенно при инфаркте без зубца Q. Препараты не влияют на
отдаленные исходы инфаркта миокарда (С.Yusuf, C.Furberg, 1987);
3) ингибиторы АПФ. Являются препаратами I ряда у перенесших
инфаркт миокарда с застойной сердечной недостаточностью. Они показаны
также при обширных трансмуральных инфарктах передней стенки левого
желудочка даже при его сохраненной функции. Их положительное влияние
на выживаемость в этих случаях обусловлено предотвращением ремоделиро-
вания левого желудочка, то есть увеличения его КДО и КСО;
4) ТЛАП. Эффективна в случаях нестабильной пери- (пост) инфаркт-
ной стенокардии, тяжелой стабильной стенокардии и (или) значительно
сниженной толерантности к физической нагрузке при наличии соответству-
ющих ангиокардиографических показаний (см. выше);
5. То же можно сказать и об аортокоронарном шунтировании
у больных с трехсосудистым поражением в сочетании со снижением функ-
ции левого желудочка или резко сниженной физической работоспособно-
стью либо поражением ствола левой коронарной артерии.
В результате многоцентровых плацебоконтролируемых исследований до-
казано отсутствие влияния на выживаемость длительного приема нитратов,
нифедипина и более новых дигидропиридинов, несмотря на их хорошее симп-
томатическое действие. В последнем случае возможно даже некоторое ухуд-
шение прогноза. То же касается и применения поздней ТЛАП или аортоко-
ронарного шунтирования исключительно с целью “открыть” артерию. От-
сутствуют убедительные доказательства влияния физических тренировок на
частоту повторного инфаркта и прогноз, хотя они, несомненно, дают хоро-
ший психологический эффект, и такие больные обычно раньше возвраща-
ются к труду (Council on Scientific Affairs, 1981; P.Rechnitzer и соавт., 1983).
ВНЕЗАПНАЯ КОРОНАРНАЯ СМЕРТЬ
Согласно определению ВОЗ, к внезапной смерти относят случаи наступ-
ления летального исхода в течение 6 ч от появления признаков заболевания,
ставшего его причиной, у лиц, которые до этого были практически здоро-
выми, или у больных, состояние которых считалось удовлетворительным.
Внезапную смерть, причиной которой является болезнь сердца, называют
внезапной сердечной смертью. Поскольку в подавляющем большинстве (до
90 %) таких случаев отмечаются признаки ИБС, для их обозначения введен
термин “внезапная коронарная смерть”. Под ней подразумевают первичную
остановку сердца, не связанную с признаками, позволяющими поставить
другой диагноз. Как первое и единственное проявление ИБС с “немым”
течением она имеет место у 1/4 таких больных.
При патологоанатомическом исследовании, даже в ранее бессимптомных
случаях, определяются стенозирующий (на 50 % и более) атеросклероз
коронарных артерий, чаще 2—3, с диффузным кардиосклерозом, постин-
фарктные рубцы (в 40—70 % случаев) и гипертрофия миокарда. У 95 % боль-
ных выявляются осложненные атеросклеротические бляшки. “Свежие”
395
тромботические окклюзии коронарных артерий обнаруживаются относительно
редко — у 10—15 % больных, и только среди проживших несколько часов. У
небольшой части больных очевидная причина смерти при патологоанатоми-
ческом исследовании отсутствует. Острый инфаркт миокарда диагностирует-
ся клинически лишь у 20—30 % успешно реанимированных больных.
Внезапной коронарной смерти наиболее подвержены больные с угрожа-
ющим инфарктом миокарда как формой нестабильной стенокардии в пер-
вый час после появления симптомов, а также перенесшие инфаркт, страда-
ющие нарушениями ритма и проводимости, особенно групповой, политоп-
ной и ранней желудочковой экстрасистолией, а также застойной сердечной
недостаточностью.
Непосредственными причинами ее являются: так называемая первичная
фибрилляция желудочков (65-80 %), стойкая пароксизмальная желудочко-
вая тахикардия (5—10 %), брадиаритмии и асистолия желудочков (20-30 %).
К пусковым (’’триггерным”) факторам внезапной коронарной смерти от-
носятся: 1) остро возникшая ишемия миокарда, обусловленная коронаро-
спазмом, тромбозом, в том числе реперфузией, повышением потребности
миокарда в кислороде; 2) дисбаланс вегетативного тонуса с преобладанием
симпатического; 3) нарушения метаболизма миокарда, в частности, выра-
женная гипокалиемия и гипомагниемия; 4) токсические факторы, в том числе
ятрогенный проаритмический эффект антиаритмических препаратов, осо-
бенно I группы, связанный с удлинением интервала Q-T.
Клиника. В большинстве случаев внезапная коронарная смерть не являет-
ся, строго говоря, совершенно неожиданной. У этих больных часто отмеча-
ются в различной степени выраженные признаки ИБС или артериальной
гипертензии. Как показывает расспрос родственников, более чем у полови-
ны больных за 1—2 нед до внезапной смерти отмечались различные “продро-
мальные” симптомы, часто неопределенные - немотивированная слабость,
снижение работоспособности, нарушение сна, одышка. Реже отмечались уси-
ление и учащение ангинозных приступов. У 1/3 больных они служили при-
чиной обращения к врачу.
Большая часть случаев внезапной коронарной смерти происходит в до-
машних условиях (60 %), обычно в покое, без непосредственной связи с
повышенным физическим или эмоциональным напряжением.
Обследование выживших направлено на определение возможных причин,
риска рецидива и оптимизацию его профилактики. Оно включает:
1) эхокардио- или вентрикулографию для оценки насосной функции лево-
го желудочка и диагностики его аневризмы, которая служит морфологиче-
ским субстратом “ри-энтри”;
2) нагрузочные тесты для выявления ишемии и решения вопроса о коро-
нарографии и хирургической реваскуляризации миокарда;
3) холтеровское мониторирование ЭКГ для оценки эффективности подав-
ления сложных желудочковых аритмий, особенно бессимптомных, в резуль-
тате того или иного метода лечения;
4) регистрацию сигналов усредненной ЭКГ для выявления поздних потен-
396
циалов желудочков. Прогностическое значение их отсутствия, однако, зна-
чительно превышает значимость их обнаружения;
5) электрофизиологическое исследование — программируемую эндокардиаль-
ную электростимуляцию. Положительный результат свидетельствует о желу-
дочковой тахикардии или фибрилляции желудочков как наиболее вероятной
причине внезапной смерти. Стойкая или нестойкая желудочковая тахикар-
дия индуцируется примерно у 75 % выживших больных и подавляется с по-
мощью хирургического или медикаментозного лечения у 72 %. При невоз-
можности ее вызвать и при ФВ, составляющей более 40 %,вероятность по-
вторения внезапной смерти в течение ближайших 2 лет составляет 0—4 %, а
при более низкой ФВ — около 40 %. При индуцировании желудочковой тахи-
кардии, подавляющейся тем или иным антиаритмическим препаратом, риск
рецидива колеблется в пределах от 0 до 22 % в зависимости от функции
левого желудочка и повышается до 30-78 % при неэффективности анти-
аритмических средств, даже при отсутствии сердечной недостаточности.
Кроме ИБС к наиболее частым причинам внезапной смерти относятся
заболевания сердца, сопровождающиеся выраженной гипертрофией миокар-
да, особенно стеноз устья аорты и гипертрофическая кардиомиопатия, а
также удлинение интервала Q—Tлюбого генеза. Внезапная смерть — причи-
на 40-60 % летальных исходов при застойной сердечной недостаточности
любой этиологии. Реже она отмечается при расслаивающей аневризме аорты,
массивной ТЭВЛА, любом шоке, нарушении мозгового кровообращения и
аспирации пищи во время еды. Подтвердить диагноз ИБС как причины вне-
запной смерти в случаях успешной реанимации позволяет выявление ише-
мии миокарда при нагрузочных тестах и холтеровском мониторировании
ЭКГ. Диагноз верифицируется с помощью коронарографии.
Неотложное лечение — это сердечно-легочная реанимация. Поскольку фиб-
рилляции желудочков часто предшествует пароксизмальная желудочковая
тахикардия, ее ранняя терапия, включая электроимпульсную, может пре-
дотвращать внезапную остановку кровообращения.
В основе первичной и вторичной профилактики внезапной коронарной смер-
ти лежит профилактика ИБС. При этом особенно важен отказ от курения,
которое увеличивает ее риск в 2—3 раза, вероятно, вследствие повышения
активности симпатико-адреналовой системы. Другие превентивные меры
включают длительное применение р-адреноблокаторов, дезагрегантов и ак-
тивную антиаритмическую терапию. В случаях высокого риска — при рефрак-
терных желудочковых аритмиях, эпизодах стойкой желудочковой тахикар-
дии или фибрилляции желудочков в анамнезе, особенно в сочетании со сни-
жением насосной функции, антиаритмические препараты желательно под-
бирать по данным электрофизиологического исследования или эмпирически
под контролем холтеровского мониторирования ЭКГ, что также достаточно
эффективно. При эмпирическом подборе антиаритмической терапии у пере-
несших стойкую желудочковую тахикардию или внезапную сердечную смерть
наиболее эффективны в отношении купирования желудочковых аритмий,
предотвращения внезапной остановки кровообращения и летального исхода
397
в целом препараты III класса — амиодарон. Как показало многоцентровое
рандомизированное сравнительное исследование CASCADE, проведенное
в г. Сиеттле (США), эффективность эмпирического назначения амиодарона
у 228 больных, перенесших внебольничную внезапную сердечную смерть,
была выше, чем при применении антиаритмических препаратов I класса,
подобранных с помощью электрофизиологического исследования и холтеров-
ского мониторирования. Так, рецидивы стойкой желудочковой тахикардии
или фибрилляции желудочков ко 2-му году лечения отсутствовали соответ-
ственно в 78 и 52 % наблюдений и к 4-му году — в 41 и 20 % (The CASCADE
Investigators, 1993). По данным сходного проспективного исследования CASH,
проведенного в г. Гамбурге (Cardiac Arrest Study Hamburg, J.Siebels и соавт.,
1993), выживаемость больных, получавших после успешной реанимации
амиодарон, была такой же, как при имплантации автоматического дефиб-
риллятора — кардиовертера и значительно выше, чем у принимавших пропа-
фенон. Эмпирическая терапия препаратами класса IC нежелательна, так как
связана с более высокой летальностью, чем при использовании плацебо
(см. выше).
Хирургические методы профилактики внезапной смерти включают анев-
ризмэктомию, реваскуляризацию миокарда и при выявлении эктопического
очага его абляцию.
Независимо от результатов электрофизиологического исследования, наи-
более эффективным средством является имплантация автоматиче-
ского дефибриллятора — кардиовертера, которая показана
больным с неблагоприятным прогнозом (перенесшим внезапную смерть, с
низкой ФВ и сохранением индуцируемой при электрофизиологическом иссле-
довании желудочковой тахикардии, несмотря на медикаментозную терапию).
Прогноз. Вероятность успешной реанимации зависит от сроков начала ее
проведения. Поэтому важное значение имеет обучение населения ее при-
емам и, как показывает зарубежный опыт, организация специальных, воз-
можно, парамедицинских, реанимационных бригад “Скорой помощи”. Эти
бригады приезжают к больному за 2—3 мин, диагностируют аритмию, вво-
дят атропина сульфат или лидокаин и проводят электроимпульсную тера-
пию, а затем для получения дальнейших инструкций связываются с дежур-
ным врачом специального центра. При фибрилляции желудочков вероятность
успешной реанимации значительно выше, чем при асистолии.
Среди успешно реанимированных к концу 1-го года выживаемость дос-
тигает 70 %. Необходимо иметь в виду, что частота рецидивов внезапной
остановки сердца в течение 1-го года у больных, не получавших специаль-
ного лечения, составляет 30 %, а в течение 2 лет — 45 % (L.Cobb и соавт.,
1980). При проведении антиаритмической терапии или хирургической ревас-
куляризации она снижается соответственно до 10 и 15 %, а при импланта-
ции автоматического дефибриллятора составляет менее 1 %.
398
ЗАСТОЙНАЯ СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
КАК ФОРМА ИБС (АТЕРОСКЛЕРОТИЧЕСКИЙ
И ПОСТИНФАРКТНЫЙ КАРДИОСКЛЕРОЗ)
В основе нарушения насосной функции при ИБС лежат диффузные мел-
кие очаги заместительного склероза и интерстициального фиброза в мио-
карде, которые, как правило, сопутствуют распространенному стенозирую-
щему атеросклерозу коронарных артерий. Они являются исходом необрати-
мой дистрофии отдельных групп мышечных волокон в результате эпизодов
ишемии, и, согласно принятой в бывшем СССР номенклатуре, являются
морфологическим субстратом “атеросклеротического кардиосклероза”. Более
крупные очаги склероза, такие как рубцовые изменения после перенесен-
ного инфаркта миокарда, обозначают термином “постинфарктный кардио-
склероз”. Застойную сердечную недостаточность усугубляют хроническая
аневризма сердца, дисфункция сосочковых мышц и нарушения ритма.
В начальных стадиях нарушение насосной функции миокарда является
преходящим и связано с его ишемией. По мере прогрессирования коронар-
ной недостаточности сердечная недостаточность становится стойкой. Для та-
ких больных характерны (но не обязательны!) стенокардия и инфаркт мио-
карда в анамнезе, наличие факторов риска ИБС, особенно артериальной
гипертензии. Сердечная недостаточность прогрессирует медленно и отлича-
ется этапным течением: вначале она протекает по левожелудочковому типу
и лишь в поздних стадиях становится бивентрикулярной. Ей часто сопут-
ствуют мерцательная аритмия, вначале пароксизмальная, затем постоян-
ная, а также цереброваскулярная недостаточность.
Данные физикального обследования не специфичны. В тяжелых случаях
отмечается ортопноэ, возможны приступы сердечной астмы и отека легких,
особенно при повышении АД, реже альтернирующий пульс. Относительно
поздно присоединяются клинические признаки правожелудочковой недо-
статочности. Верхушечный толчок постепенно смещается влево и вниз. При
аускультации тоны сердца ослаблены, особенно I тон на верхушке, появля-
ется ритм галопа, часто выслушивается короткий мезосистолический шум в
проекции митрального клапана. Металлический оттенок II тона и короткий
шум изгнания над аортой обусловлены ее атеросклерозом. В случаях хрони-
ческой аневризмы левого желудочка после перенесенного инфаркта миокар-
да может отмечаться патологическая прекардиальная пульсация, а признаки
сердечной недостаточности обычно более выражены.
На ЭКГ определяются в различной степени выраженные неспецифиче-
ские признаки так называемых диффузных изменений в миокарде, у части
больных — также очаговые изменения после перенесенных инфарктов. Воз-
можны признаки хронической аневризмы левого желудочка, которые, од-
нако, имеют значительно меньшее диагностическое значение, чем данные
эхокардиографии. Часто отмечается гипертрофия левого желудочка, обычно
умеренная, которая носит компенсаторный характер, а также блокады ножек
пучка Гиса. Возможны признаки безболевой субэндокардиальной ишемии в
виде депрессии сегмента ST, в ряде случаев с отрицательным зубцом Т. Их
интерпретация, однако, затруднена из-за неспецифичности. Более надеж-
ной является регистрация преходящей ишемии (безболевой или болевой)
при нагрузочных тестах, а также при холтеровском мониторировании. У ряда
больных отмечается мерцание или трепетание предсердий.
При рентгенологическом исследовании сердце чаще умеренно увеличе-
но, главным образом за счет левых отделов, и по своей форме приближается
к аортальной за счет развернутой аорты, которая удлинена и расширена.
На эхокардиограмме определяется в различной степени выраженная ди-
латация левого желудочка, часто его умеренная гипертрофия. Характерны
локальные нарушения сегментарной сократимости, включая признаки анев-
ризмы. Лишь в далеко зашедших случаях гипокинезия носит диффузный
характер и обычно сопровождается дилатацией всех 4 камер сердца, что пред-
ставляет трудности для дифференциальной диагностики. Определяются так-
же фиброз аортального клапана и уплотнение восходящей части аорты вслед-
ствие атеросклероза. При дисфункции сосочковых мышц отмечается невыра-
женное нарушение движения их створок в период систолы с обратным то-
ком на клапане, преимущественно митральном, при допплеровском иссле-
довании, как правило, небольшим. Его причиной может быть также относи-
тельная недостаточность митрального, а в поздних стадиях и трехстворчато-
го клапана вследствие резкой дилатации полости желудочков. Сходные изме-
нения отмечаются при вентрикулографии.
Сцинтиграфия миокарда позволяет определить стойкие очаги гипоперфу-
зии различных размеров, часто множественные, и преходящую очаговую
гипоперфузию при нагрузочных тестах вследствие ишемии.
При отсутствии клинических или инструментальных признаков ИБС этот
диагноз остается сомнительным, и верифицировать его позволяет только
коронарография. Дифференциальную диагностику проводят с другими забо-
леваниями, вызывающими изолированную левожелудочковую и тотальную
застойную сердечную недостаточность и увеличение сердца.
Лечение и профилактика неспецифичны и соответствуют принятым при
ИБС и хронической сердечной недостаточности.
ГЛАВА 10.
АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Определение и номенклатура. Артериальная гипертензия - это патофизиоло-
гическое и клиническое понятие, объединяющее состояния, которым сопут-
ствует длительное повышение гидростатического давления в артериях большо-
го круга кровообращения. Наиболее характерным для нее является повышение
диастолического АД, в большинстве случаев сопровождающееся повышением
систолического АД выше уровня, который обычно встречается в популяции.
400
Диастолическое АД, мм рт. ст.
Рис. 66. Распределение величин диа-
столического АД у населения эконо-
мически развитых стран (толстая ли-
ния) и связанный с ними риск ле-
тального исхода (тонкая линия). Пунк-
тиром отмечены уровни диастоли-
ческого АД, при превышении кото-
рых, по данных двух широкомасш-
табных исследований (MRC и VA),
проводимая антигипертензивная тера-
пия приводила к снижению леталь-
ности. VA — исследование, организо-
ванное администрацией госпиталя ве-
теранов США (Veterans Administration
Cooperative Study Group on Anti-
hypertensive Agents, 1967). MRC - ис-
следование, проведенное рабочей
группой Медицинского исследова-
тельского совета США (Medical
Research Council Working Party, 1985).
(no P.Pedoe, J.Walker, 1990)
Согласно рекомендациям редакционного отдела БМЭ, терминами “ги-
пертония” и “гипотония” следует пользоваться только для обозначения со-
стояния мышечного тонуса, в том числе сосудистого. Терминами “гипертен-
зия” и “гипотензия” рекомендуется обозначать величину давления крови в
сосудах и полостях сердца.
Поскольку уровень АД у жителей промышленно развитых стран повыша-
ется с возрастом, неодинаков в различных этнических группах и подвержен
значительным колебаниям от одного измерения к другому, в зависимости от
эмоционального возбуждения, физической активности и других факторов,
критерии “нормального” и “повышенного” АД в определенной степени явля-
ются условными. Их установление базируется на результатах обследования
больших групп населения и соотнесении уровня АД с риском возникновения
сердечных, мозговых и почечных осложнений и преждевременной смерти.
Следует отметить, что, поскольку диастолическое АД по сравнению с систо-
лическим менее вариабельно и в меньшей степени повышается с возрастом,
при оценке результатов измерения АД его величина является определяющей.
Как следует из данных, представленных на рис. 66, распределение вели-
чин диастолического АД, как и систолического, среди населения экономи-
чески развитых стран соответствует гауссовскому. При этом резко повышен-
ное АД и, соответственно, риск развития осложнений артериальной гипер-
тензии и смерти имеет место у малой части населения. При его меньших
уровнях этот риск для отдельного индивидуума заметно снижается, однако
за счет большого удельного веса таких лиц среди населения связанные с
ним болезненность и летальность в масштабах популяции оказываются зна-
чительными. При определении уровня АД, требующего лечения на протяже-
нии всей жизни, следует принимать во внимание и масштабы “накопления”
в популяции побочных эффектов и осложнений лекарственной терапии, иног-
да тяжелых. Тем не менее, в результате широкомасштабных исследований
401
последних лет рекомендуемый условный критерий “нормального” АД пре-
терпел изменения и стал более строгим (см. рис. 66).
Ниже представлены градации уровня АД и критерии артериальной гипер-
тензии у взрослых, разработанные Объединенным Национальным Комите-
том США по определению, оценке и лечению высокого АД (Joint National
Committee, 1992).
Согласно этим рекомендациям, систоло-диастолической ар-
териальной гипертензией взрослых следует считать стойкое
повышение АД от 140/90 мм рт.ст. и более. Систолическое АД менее 130—
139 мм рт.ст. и диастолическое давление в пределах 85—89 мм рт.ст. счита-
ется высоким нормальным АД. При диастолическом АД 90 мм
рт.ст. и систолическом в пределах 140-159 мм рт.ст. состояние расценива-
ют как пограничную изолированную систолическую ар-
териальную гипертензию (синонимы: транзиторная артериаль-
ная гипертензия, предгипертония, нейроциркуляторная дистония по
гипертоническому типу). Она обусловлена дисрегуляцией АД, дальней-
шая эволюция которого определяется со временем. Такие больные пред-
ставляют собой неоднородную группу с различными исходами заболева-
ния (нормализация АД; трансформация в стойкую артериальную гипер-
тензию; без перемен), летальность в которой достоверно выше, чем сре-
ди стойких нормотоников.
Критерии артериальной гипертензии Объединенного Национального ко-
митета США (1992) в целом совпадают с критериями Комитета экспертов
ВОЗ (1993), согласно которым повышенным считается АД от 140/90 мм рт.ст.
и больше, а к пограничной артериальной гипертензии относят величины АД
в пределах 140—159 (систолическое) и 90-94 (диастолическое) мм рт.ст.
При диастолическом АД менее 90 мм рт.ст. и систолическом, равном
или более 160 мм рт.ст., состояние классифицируется как изолиро-
ванная систолическая артериальная гипертензия. Она
Классификация уровня АД у лиц в возрасте 18 лет и старше
Объединенного Национального Комитета США (1992)
Категория * Систолическое Диастолическое
АД мм рт. ст. АД мм рт. ст
Нормальное АД < 130 <85
Верхняя граница нормы Артериальная гипертензия: 130—139 85—89
I степени (легкая) 140—159 90—99
II степени (умеренная) 160—179 100—109
III степени (тяжелая) 180—209 110—119
IV степени (очень тяжелая) >210 2 120
По среднему из 2 измерений или более при 2 осмотрах и более.
402
обусловлена снижением податливости аорты и ее крупных ветвей вследствие
атеросклероза или, реже, увеличением МОС, например, при тиреотоксикозе,
недостаточности аортальных клапанов, открытом артериальном протоке, тя-
желой анемии. Уменьшение растяжимости аорты закономерно наступает при
старении, обычно в возрасте старше 40 лет и значительно повышает риск
возникновения ИБС, в том числе инфаркта миокарда, а также инсульта и
сердечной недостаточности.
Классификация артериальной гипертензии в зависимости от этиологии
предусматривает разделение на п е р в и ч н у ю, или эссенциальную,
и вторичную , или симптоматическую. Эссенциальная артериаль-
ная гипертензия — это заболевание, обусловленное повышением АД, причи-
на которого неясна. В отечественной номенклатуре оно носит предложен-
ное Г.Ф.Лангом название “гипертоническая болезнь”. Учитывая значитель-
ную роль повышения сосудистого тонуса в его развитии, редакционный
совет БМЭ считает возможным сохранить это название наряду с термином
ВОЗ “эссенциальная (первичная) артериальная гипертензия”. На долю этого
заболевания приходится около 90 % случаев артериальной гипертензии.
В зависимости от уровня АД эссенциальная артериальная гипертензия
может быть мягкой (легкой), умеренной, тяжелой или очень тяжелой, причем
удельный вес мягкой артериальной гипертензии достигает 80 %. Эти формы
объединяются в рубрику доброкачественной эссенциальной артери-
альной гипертензии (термин не совсем удачен, так как без лечения она
может приводить к тяжелым осложнениям), в отличие от злокачественной.
Злокачественной может быть как первичная, так и любая вторич-
ная артериальная гипертензия. Наиболее характерный ее признак - острое
развитие повреждения сосудистой стенки, которое проявляется прежде всего
тяжелой ретинопатией и почечной недостаточностью вследствие резкого и
стойкого повышения АД, вне зависимости от его величин. При этом уровень
диастолического АД обычно (но не обязательно) превышает 130-140 мм
рт.ст. В большинстве случаев злокачественная артериальная гипертензия от-
мечается с самого начала развития заболевания. Реже такое течение приобре-
тает стойкая доброкачественная артериальная гипертензия, обычно неле-
ченная.
Классификация артериальной гипертензин
в зависимости от этиологии
I. Первичная (эссенциальная): артериальная гипертензия, причина кото-
рой не установлена.
II. Вторичные (симптоматические): артериальные гипертензии с уста-
новленной причиной.
1. Почечные артериальные гипертензии:
а) реноваскулярные: при стенозе почечной артерии (вследствие атеросклероза, фиб-
розно-мышечной дисплазии, эмболии), при артериите;
б) ренопаренхиматозные: при остром и хроническом гломерулонефрите, хрониче-
ском пиелонефрите, поликистозе почек, туберкулезе почек, сахарном диабете, хрони-
ческой почечной недостаточности любого генеза, опухолях почки и др.
403
2. Эндокринные артериальные гипертензии при:
а) феохромоцитоме;
б) гиперкортицизме (болезнь и синдром Иценко-Кушинга, первичный гиперальдос-
теронизм, врожденная гиперплазия коркового вещества надпочечников из-за дефицита
11-бета- или 17-гидроксилазы);
в) гиперпаратиреозе;
г) акромегалии (?).
3. Нейрогенные артериальные гипертензии при:
а) повышении внутричерепного давления (опухоль, травма мозга, инсульт и др.);
б) диэнцефальном синдроме.
4. Сердечно-сосудистые (гемодинамические) артериальные гипертензии при:
а) атеросклерозе аорты (изолированная систолическая артериальная гипертензия);
б) коарктации аорты;
в) открытом артериальном протоке;
г) недостаточности аортального клапана;
д) полной атриовентрикулярной блокаде;
е) застойной сердечной недостаточности;
ж) эритремии;
з) гипертиреозе.
5. Лекарственные артериальные гипертензии (ятрогенные): связаны с приемом со-
держащих эстрогены контрацептивов, глюкокортикостероидов, нестероидных проти-
вовоспалительных препаратов, катехоламинов, амфетаминов или с отменой антиги-
пертензивных препаратов, особенно клофелина.
6. Токсические артериальные гипертензии при:
а) злоупотреблении алкоголем;
б) остром отравлении свинцом и др.
7. Различного генеза: при гиперкальциемии, порфирии, позднем токсикозе бере-
менных и др.
В зависимости от ведущего патогенетического фактора повышения АД
различают: 1) артериальную гипертензию выброса, обусловленную увеличе-
нием УОС и МОС; 2) гипертензию сопротивления как результат преимуще-
ственного повышения тонуса артериол (например, вазоренальная артери-
альная гипертензия); 3) объемную, или гиперволемическую, артериальную
гипертензию, основной причиной которой является увеличение ОЦК
(полицитемия).
Эпидемиология. Данные о распространенности артериальной гипертензии
в разных популяциях весьма вариабельны, так как зависят от их расового и
возрастного состава, потребления соли, уровня физической активности и ряда
других факторов, а также использованных критериев нормального и повы-
шенного АД- По данным эпидемиологических исследований различных стран,
систолическое АД более 140 мм рт.ст. и диастолическое свыше 90 мм рт. ст., то
есть артериальная гипертензия по критериям ВОЗ, встречается у 20-25 %
населения. Как показали результаты фремингемского исследования, АД бо-
лее 160/95 мм рт.ст. отмечалось примерно у 20 % белого городского населения
США, а свыше 140/90 мм рт.ст. — почти у половины.
404
Распространенность артериальной гипертензии увеличивается с возра-
стом, особенно у лиц в возрасте 40—49 лет, у которых она отмечается втрое
чаще, чем в возрастной группе 30—49 лет. При эпидемиологическом иссле-
довании, проведенном в Москве, АД более 160/95 мм рт.ст. обнаружено у
16,6 % лиц в возрасте 50—54 лет и у 25,4 % — в возрасте 55-59 лет (И.К.Шхва-
цабая, 1992).
Почти 20 % случаев артериальной гипертензии относятся к погранич-
ной. Изолированная систолическая артериальная гипертензия имеет мес-
то примерно у 11 % лиц в возрасте старше 75 лет. В слаборазвитых странах
частота эссенциальной артериальной гипертензии значительно ниже, а
повышение АД с возрастом может практически отсутствовать.
ЭССЕНЦИАЛЬНАЯ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
(ГИПЕРТОНИЧЕСКАЯ БОЛЕЗНЬ)
Распространенность. Эссенциальная артериальная гипертензия относится
к числу наиболее распространенных заболеваний сердечно-сосудистой сис-
темы. По данным Комитета экспертов ВОЗ (1984), на ее долю приходится
около 96 % всех случаев артериальной гипертензии.
Этиология и патогенез. Этиология эссенциальной артериальной гипотен-
зии не установлена. Не увенчались успехом и попытки создания ее модели у
животных. Обсуждается роль различных нервных, гуморальных и других фак-
торов, участвующих в регуляции УОС, сосудистого тонуса и ОЦП. По-ви-
димому, эссенциальная артериальная гипертензия является полиэтиологич-
ным заболеванием (мозаичная теория), в возникновении которого играют
роль одни факторы, а в закреплении — другие. Хотя концепция Г.ФЛанга -
А.Л.Мясникова о нозологической обособленности эссенциальной артери-
альной гипертензии (гипертонической болезни) получила широкое призна-
ние и принята ВОЗ, продолжается обсуждение вопроса о возможности неод-
нородности этого заболевания. По мнению сторонников этой точки зрения,
в будущем оно распадется на несколько отдельных нозологических единиц
с различной этиологией. По состоянию вопроса на настоящее время это,
однако, представляется маловероятным.
Классические концепции этиологии и патогенеза эссенциальной артери-
альной гипертензии включают нейрогенную теорию Г.Ф.Ланга, объемно-
солевую — АТайтона и объемную - Б.Фолкова.
Нейрогенная теория Г.ФЛанга (1922): роль центральной нервной
системы. Согласно этой теории, гипертоническая болезнь представляет
собой классическую “болезнь регуляции”, развитие которой связано с
длительной психической травматизацией и перенапряжением отрицатель-
ными эмоциями сферы высшей нервной деятельности. Это приводит к дис-
функции регуляторов АД в коре больших полушарий и гипоталамических
центрах с увеличением симпатической вазоконстрикторной импульсации по
405
I Избыточное потребление соли]
[Генетическая предрасположенность]
-------*-]jadppwra почкой На* и воды]
Нормализация
МОС
Нормализация
оип
Ito и воды
в стенке
артериол
| Стресс |
♦ активности
симпатикс-адреноловои
системы
I выделения
почками На'
и воды
♦
\реакти1 части,
сосудов
Иренина и
ангиотензина И
Ауторегуляция
♦ ОПСС
Сужение
просвета
артерии
^депрессорныл
веществ
1ЙН
Схема 16. Патогенез эссенциальной артериальной гипертензии: концепция первичного
нарушения выделительной функции почек
эфферентным нервным волокнам и, как следствие, — к повышению сосу-
дистого тонуса. Обязательным условием реализации воздействия этих
факторов среды, по мнению Г.Ф.Ланга, является наличие определенных
“конституциональных особенностей”, то есть наследственной предрас-
положенности. Таким образом, развитие гипертонической болезни, по
Г.Ф.Лангу, определяется не одним, а двумя факторами.
Важная этиологическая роль психоэмоциональных воздействий и их ак-
центуации в возникновении этого заболевания подчеркивается и в гипотезе
Б.Фолкова (см. ниже). В эксперименте и клинике убедительно доказано воз-
никновение спазма периферических артериол в ответ на эмоциональные
раздражители, а при их достаточно частом повторении — развитие гипертро-
фии клеток медии с сужением просвета сосудов, которое приводит к стой-
сому повышению ОПСС.
Объемно-солевая теория Л./ай/пона: первичное нарушение вы-
1елительной функции п о ч е к. Согласно этой теории, в основе раз-
штия эссенциальной артериальной гипертензии лежит ослабление выдели-
ельной функции почек, которое приводит к задержке в организме Na+ и
юды, а следовательно, к увеличению ОЦП и МОС (схема 16). При этом
ювышение АД необходимо для обеспечения адекватного натрийуреза и ди-
'реза, то есть играет компенсаторную роль. Нормализация объема внекле-
очной жидкости и АД в результате наступившего “диуреза давления” при-
юдит к еще большей задержке почками Na+ и воды, что, по механизму
юложительной обратной связи, усугубляет первоначальное повышение ОЦП
см. схему 16). В ответ на повышение МОС местные механизмы саморегу-
406
ляции кровотока вызывают миогенное сужение артериол, результатом кото-
рого является нормализация МОС за счет повышения ОПСС и тем самым -
АД. Увеличению выраженности и стойкости этой констрикторной реакции
способствует повышение реактивности сосудов вследствие отека и аккуму-
ляции Na+ в их стенке.
Таким образом, с течением времени “гипертензия выброса” со свойствен-
ным ей гиперкинетическим типом изменений гемодинамики (увеличение
МОС при неизмененном ОПСС) трансформируется в “гипертензию сопро-
тивления” с гипокинетическим гемодинамическим профилем (увеличение
ОПСС при нормальном или сниженном МОС).
Хотя эта теория не раскрывает первичных причин “переключения” почки
на более высокий уровень АД, она объясняет основной механизм поддержа-
ния стабильной артериальной гипертензии любого генеза. Возможными этио-
логическими факторами заболевания являются избыточное потребление соли
и (или) генетически обусловленное повышение чувствительности к ней.
Кроме того, наследственная предрасположенность может играть определен-
ную роль в реализации нарушения выделительной функции почек.
Роль избыточного потребления соли в генезе эссенциаль-
ной артериальной гипертензии подтверждается данными эпидемиологиче-
ских исследований о связи распространенности этого заболевания с “соле-
вым аппетитом” (INTERSALT Cooperative Research Group, 1988). Так, у
некоторых африканских племен и бразильских индейцев, потребляющих ме-
нее 60 мэкв Na+ в сутки (при норме потребления 150—250 мэкв), артериаль-
ная гипертензия встречается редко, а АД практически не повышается с воз-
растом. Наоборот, у жителей Северной Японии, поглощавших до недавнего
времени более 300 мэкв Na+, распространенность эссенциальной артери-
альной гипертензии значительно выше, чем в Европе. Известен факт значи-
тельного снижения уровня АД у больных со стойкой эссенциальной артери-
альной гипертензией при резком ограничении употребления соли. Этот эф-
фект, однако, утрачивается при ее приеме более 0,6 г в сутки. Кроме того, у
разных больных имеется неодинаковая чувствительность к уменьшению по-
требления соли.
Роль наследственной предрасположенности какважного
этиологического фактора эссенциальной артериальной гипертензии не вы-
зывает сомнений. Так, получены специальные линии лабораторных крыс со
спонтанным возникновением артериальной гипертензии у всех без исклю-
чения особей после достижения зрелости. Хорошо известен факт накопления
случаев эссенциальной артериальной гипертензии в определенных семьях.
Механизмы реализации наследственной предрасположенности окончатель-
но не установлены. Применительно к объемно-солевой модели патогенеза
артериальной гипертензии высказывается предположение о генетически де-
терминированном уменьшении количества нефронов и увеличении реаб-
сорбции Na+ в дистальных почечных канальцах.
Объемная теория Б.Фолкова: роль симпатической части веге-
тативной нервной системы . Согласно этой концепции, в основе
Схема 17. Патогенез эссенциальной артериальной гипертензии: концепция
гиперактивности симпатико-адреналовой системы
развития эссенциальной артериальной гипертензии лежит гиперактивация сим-
патико-адреналовой системы, что приводит к гиперфункции сердца с увели-
чением МОС (гиперкинетическому синдрому) и периферической вазоконст-
рикции (схема 17). Возможными этиологическими факторами заболевания
являются: 1) множество стрессовых ситуаций и склонность к их акцентуации;
2) генетически обусловленное нарушение функции высших нервных регуля-
торов АД, что приводит к его избыточному повышению в ответ на физиоло-
гические стимулы; 3) возрастная нейроэндокринная перестройка с инволю-
цией половых желез и повышением активности надпочечников.
Увеличение МОС, ЧСС, концентрации норадреналина в крови и активно-
сти симпатических нервов скелетных мышц по данным микронейрографии
выявлено у больных с пограничной артериальной гипертензией и в ранней
стадии эссенциальной артериальной гипертензии, однако не характерно для
установившейся гипертензии. Предполагают, что на этапе закрепления ги-
пертензии важную роль приобретает локальный эффект усиленной адренер-
гической стимуляции — сужение афферентных почечных артериол — и, как
следствие, повышенное выделение ренина, что не сопровождается суще-
ственным увеличением концентрации норадреналина в общем кровотоке.
Роль гуморальных факторов - ренин-ангиотензин-
альдостероновой системы. Повышение активности ренина в плазме
крови отмечается примерно у 15 % больных с эссенциальной артериальной
гипертензией. Эта так называемая гиперренинная форма заболевания чаше
встречается в относительно молодом возрасте и имеет тяжелое и злокаче-
408
ственное течение. Патогенетическая роль ренин-ангиотензин-альдостероно-
вой системы подтверждается выраженным гипотензивным эффектом инги-
биторов АПФ при этом заболевании. У 25 % больных чаще пожилого возрас-
та активность ренина в плазме крови снижена (гипоренинная артериальная
гипотензия). Причины этого явления остаются неясными.
Роль нарушения транспорта Na+ через клеточную мем-
бра н у. В экспериментальных моделях и у больных с эссенциальной арте-
риальной гипертензией показано снижение активности №+~К+-АТФ-азы
сарколеммы, которое приводит к увеличению содержания Na+ внутри кле-
ток. Посредством Na+—Са2+-обменного механизма это способствует повы-
шению концентрации внутриклеточного Са2+ и в результате — увеличению
тонуса гладкомышечных клеток артериол и венул. Нарушение функции Na+-
К+-насоса является, по-видимому, генетически детерминированным и, как
предполагают, связано с циркуляцией в крови его ингибитора, который,
однако, пока не обнаружен.
Еще одним генетическим маркером и фактором риска эссенциальной ар-
териальной гипертензии является увеличение Na+—Ы+-трансмембранного
обмена, что также приводит к повышению концентрации внутриклеточных
Na+ и Са2+.
Роль ПНУФ. Повышение секреции ПНУФ при нарушении выделения
почками Na+ является важным механизмом, направленным на нормализа-
цию объема внеклеточной жидкости. Ингибируя активность Ка+-К+-АТФ-
азы, этот пептид способствует увеличению содержания внутриклеточного
Na+, а следовательно, и Са2+, что повышает тонус и реактивность сосуди-
стой стенки. Имеются данные о повышении содержания ПНУФ в крови у
больных эссенциальной артериальной гипертензией, однако его роль в па-
тогенезе этого заболевания, по-видимому, второстепенная.
Роль структурных изменений сосудистой стенки.Устой-
чивость повышения сосудистого тонуса определяется развитием гипертро-
фии медии. При увеличении отношения толщины стенки артериолы к ее
внутреннему радиусу относительно небольшое укорочение гладкомышеч-
ных клеток приводит к значительно большему, чем в норме, повышению
сосудистого сопротивления. Иными словами, в подобных случаях резкое по-
вышение сосудистого сопротивления можно получить в ответ на относи-
тельно низкий уровень симпатической импульсации или низкую концент-
рацию вазопрессорного вещества. Имеются основания полагать, что гиперт-
рофия медии сосудистой стенки, как и миокарда левого желудочка, при
соответствующем лечении отчасти обратима.
Патологоанатомическим субстратом артериальной гипертензии являются
сочетание адаптационных и дегенеративных (патологических) изменений
сердца и сосудов. К адаптационным изменениям относятся гипертрофия левого
желудочка, а также гиперплазия и гипертрофия гладкомышечных клеток
медии и интимы сосудистой стенки. Дегенеративные изменения в сердце
связаны с развитием дистрофии гипертрофированного миокарда — “оборотной
стороны” процесса гипертрофии. Важную роль играет также его коронаро-
409
| ♦ АД г/ ОПСс\
^напряжения стенки артериолы
Гиперплазия и гипертрофия
гладкомышечных клеток медии
) проницаемости для
электролитов и воды
Отекли отложение No*.
Саг\ оелкоВ плазмы крови
Сужение просвета
артериол
^реактивности
- к прессорным
Веществам
Схема 18. Патогенез артериолосклероза при эссенциальной артериальной гипертензии:
ОПСС — общее периферическое сосудистое сопротивление
генное поражение вследствие ускоренного развития сопутствующего атеро-
склероза коронарных артерий, которое проявляется диффузным склерозом
и интерстициальным фиброзом. В результате возникает сердечная недостаточ-
ность, которая является одной из основных причин смерти таких больных.
Дегенеративные (дистрофические) изменения артериол связаны с реак-
цией на инфильтрацию сосудистой стенки белками плазмы крови под дей-
ствием повышенного гидростатического давления и развитием распростра-
ненного артериолосклероза (схема 18). Значительное сужение просвета аф-
ферентных и эфферентных почечных артериол вызывает нарушение функ-
ции клубочков и канальцев с постепенным запустеванием и атрофией не-
фронов и разрастанием соединительной ткани. В итоге развивается н е ф р о -
склероз (первично-сморщенная п о ч к а), который является мор-
фологическим субстратом хронической почечной недостаточности.
В головном мозге часто обнаруживаются микроаневризмы мелких арте-
рий, которые являются основной причиной геморрагических инсультов.
Ранним проявлением артериолосклероза сетчатки является сужение всего
артериолярного русла с увеличением соотношения диаметра венозных и ар-
териальных сосудов (более чем 3:2). При более высокой гипертензии калибр
артериол становится неравномерным с чередованием суженных и расши-
ренных участков. Их локальная дилатация обусловлена срывом местной само-
регуляции, то есть констрикторной реакции в ответ на повышение давления
в сосуде. Вокруг артериол появляются экссудаты в виде ваты, а при наруше-
нии целости стенки — кровоизлияния. Экссудаты и кровоизлияния весьма
характерны для гипертонической ретинопатии и являются признаками фиб-
риноидного некроза при ее злокачественном течении. Сходные изменения
могут быть обусловлены также повреждением артериол другого генеза (тя-
желая анемия, уремия, васкулит, инфекционный эндокардит и др.).
Критерием злокачественной артериальной гипертензии является также
410
отек диска зрительного нерва. Механизм его развития не вполне ясен. У
части больных он обусловлен общим отеком мозга вследствие срыва ме-
стной саморегуляции церебральных артериол с развитием гиперперфу-
зии мозга. Наличие кровоизлияний и отека диска зрительного нерва яв-
ляется показанием к неотложному снижению АД.
Морфологическим субстратом синдрома злокачественной артериальной
гипертензии является фибриноидный некроз артериол и мелких артерий. Он
обусловлен нарушением целости эндотелия при резком и значительном по-
вышении гидростатического давления с повреждением клеток медии при
проникновении белков плазмы крови, в том числе фибрина, с которыми и
связано характерное окрашивание при гистологическом исследовании. В ре-
зультате развивается резкий отек сосудистой стенки с сужением просвета,
вплоть до окклюзии.
Клиническое, инструментальное и лабораторное обследование больных с
артериальной гипертензией преследует 3 цели: 1) установить причину гипер-
тензии. Первичную (эссенциальную) артериальную гипертензию диагно-
стируют методом исключения вторичной (симптоматической) — см. т. 2; 2) ус-
тановить влияние, которое повышенное АД успело оказать на наиболее “уяз-
вимые” органы, другими словами, определить наличие и выраженность по-
ражения органов-мишеней - сердца, почек, центральной нервной систе-
мы, сетчатки; 3) установить наличие и выраженность факторов риска, свя-
занных с атеросклерозом.
Клиника. До развития осложнений заболевание часто протекает бессимп-
томно, а единственным проявлением его является повышение АД. Жалобы
отсутствуют или неспецифичны. Больные отмечают периодически возника-
ющую головную боль, чаще в области лба или затылка, головокружение и
шум в ушах. В настоящее время доказано, что эти симптомы не могут слу-
жить индикаторами повышенного АД и, вероятно, имеют функциональное
происхождение. Они встречаются у больных с артериальной гипертензией не
чаще, чем у населения в целом, и не коррелирует с уровнем АД. Исключе-
нием является выраженная головная боль при злокачественной артериаль-
ной гипертензии, обусловленная отеком мозга.
Симптомы и признаки поражения сердца связаны с: 1) ги-
пертрофией левого желудочка, представляющей собой компенсаторную ре-
акцию, направленную на нормализацию повышенного стеночного напря-
жения из-за увеличения постнагрузки; 2) сопутствующей ИБС; 3) сердеч-
ной недостаточностью как осложнением обоих патологических процессов.
Исследования последних лет заставляют усомниться в “доброкачествен-
ности” гипертрофии левого желудочка при артериальной гипертензии. Незави-
симо от уровня АД, она повышает риск возникновения инфаркта миокарда
и внезапной смерти в 3 раза, а сложных желудочковых аритмий и сердечной
недостаточности - в 5 раз. Поскольку степень повышения АД и его давность
не всегда коррелируют с выраженностью гипертрофии, было высказано
предположение о значении в ее развитии, кроме артериальной гипертензии,
каких-то дополнительных факторов. Обсуждается патогенетическая роль
411
генетической предрасположенности, гуморальных агентов - ренин-ангио-
тензин-альдостероновой системы, катехоламинов, простагландинов и др. Эти
обстоятельства послужили основанием для введения термина “гиперто-
ническое (гипертензивное) с е р д ц е ” и обусловливают важность
разработки методов предотвращения обратного развития гипертрофии мио-
карда при артериальной гипертензии.
Клиническое значение “гипертонического сердца” связывают с нару-
шением диастолической функции миокарда вследствие повышения его
жесткости и развитием относительной коронарной недостаточности.
Уменьшение диастолической податливости левого желудочка приводит к
повышению его давления наполнения и венозному застою в легких при
неизмененной систолической функции. Больные отмечают одышку при
физической нагрузке, которая нарастает с присоединением систоличес-
кой миокардиальной недостаточности.
При давно существующей артериальной гипертензии можно обнаружить
симптомы поражения почек — никт- и полиурию.
При неосложненной эссенциальной артериальной гипертензии симп-
томы поражения центральной нервной системы преиму-
щественно обусловлены сопутствующим атеросклерозом черепных и внече-
репных артерий. К ним относятся головокружение, нарушение работоспо-
собности, памяти и др.
Анамнез. Типичны начало заболевания в возрасте от 30 до 45 лет и отяго-
щенный семейный анамнез в отношении эссенциальной артериальной
гипертензии.
При клиническом обследовании наиболее важным диагностическим при-
знаком является повышение АД. Для его как можно более точного не-
прямого измерения необходимо соблюдать ряд правил (см. главу 4). Необхо-
димо иметь в виду, что в положении больного сидя АД может быть выше,
чем в положении лежа. Во избежание расхождений, связанных с атероскле-
розом подключичной артерии, АД следует измерять на обеих руках, а при
выявлении различий впоследствии контролировать на одной и той же руке.
В силу непроизвольной психоэмоциональной реакции “тревоги” во время
процедуры измерения АД медработником в обстановке медицинского уч-
реждения, его результат, особенно при однократном определении, часто
оказывается завышенным по сравнению с данными автоматического из-
мерения в амбулаторных условиях (псевдогипертензия). Это может приводить
к гипердиагностике пограничной или мягкой артериальной гипертензии почти
в 1/3 случаев. Поэтому заключение о повышенном АД должно основываться
на результатах 3 отдельных измерений, произведенных на протяжении 3—4
нед, за исключением случаев, требующих неотложной терапии. При АД более
140/90 мм рт.ст. его измеряют 2—3 раза на каждом приеме и для дальнейшей
оценки берут среднее значение. Измерения АД проводит в домашних усло-
виях сам больной или его родственники. Особенно эффективны в отношении
устранения “реакции тревоги” новые автоматические устройства для непря-
мого измерения и регистрации АД в динамике, которые можно проводить в
412
амбулаторных условиях. Уровни такого “амбулаторного” АД при его мони-
торинге ниже “больничного” в 80 % случаев и служат более надежным кри-
терием диагностики мягкой артериальной гипертензии.
Клинические признаки поражения органов-мишеней.
При физикальном исследовании сердечно-сосудистой системы
можно обнаружить признаки гипертрофии левого желудочка, левожелудоч-
ковой недостаточности и атеросклероза различных сосудистых бассейнов. При
гипертрофии левого желудочка верхушечный толчок часто становится резис-
тентным, а снижение податливости его камеры проявляется появлением над
верхушкой S4, свидетельствующим о его диастолической дисфункции.
Клинические признаки поражения почек с развернутой картиной
хронической почечной недостаточности больше характерны для злокачествен-
ной артериальной гипертензии.
Признаки поражения центральной нервной системы свя-
заны, как правило, с осложнениями артериальной гипертензии и сопут-
ствующим церебральным атеросклерозом.
Гипертоническая ретинопатия. Согласно классификации поражения сосу-
дов сетчатки и сосудистых осложнений артериальной гипертензии Кейта и
Вагенера (N.Keith, Н.Wagener, 1939), существует 4 степени ретинопатии.
Для I степени характерно минимальное сужение артериол и неравно-
мерность их просвета. Соотношение диаметра артериол и венул уменьшает-
ся до 1:2 (в норме 3:4).
При II степени отмечается выраженное сужение артериол (артериоло-
венозное соотношение 1:3) с участками спазма. Характерно растяжение ве-
нул и их сдавление при перекресте с артериолами, с которыми они находят-
ся в одном соединительнотканном влагалище, вследствие утолщения стен-
ки артериол (симптом перекреста Салюса—Гуна).
При III степени на фоне спазма и склероза артериол (артериоло-
венозное соотношение 1:4) определяются характерные множественные кро-
воизлияния в виде языков пламени и рыхлые экссудаты, напоминающие
“взбитую вату”. Эти экссудаты представляют собой участки ишемии или ин-
фарктов сетчатки, в которых определяются отечные нервные волокна. Экс-
судаты бледнеют через несколько недель. Могут обнаруживаться также плот-
ные мелкие четко очерченные экссудаты, обусловленные отложением липи-
дов, которые иногда сохраняются годами. Они имеют меньшее клиническое
значение и не указывают на острое повреждение артериол.
Отличительным признаком ретинопатии IV степени является появле-
ние отека диска зрительного нерва, который присоединяется к любому из
указанных изменений и отражает крайнюю степень выраженности злокаче-
ственной артериальной гипертензии. При этом кровоизлияния и экссудаты
могут отсутствовать.
В ранних стадиях ретинопатии зрение не страдает. Обширные экссудаты и
кровоизлияния могут вызывать появление дефектов полей зрения, а при
поражении макулы - слепоту.
413
Ретинопатия I—II степени характерна для “доброкачественной” эссенци-
альной артериальной гипертензии, a III—IV — для злокачественной. При ост-
ром развитии злокачественной артериальной гипертензии кровоизлияния,
экссудаты и отек диска зрительного нерва определяются при отсутствии из-
менений артериол. При ретинопатии I и II степени изменения сосудов вслед-
ствие артериальной гипертензии практически не отличаются от признаков
их атеросклероза и часто обусловлены сочетанием этих двух процессов.
Лабораторное обследование. Анализы мочи. При развитии нефросклероза
отмечаются гипоизостенурия как признак нарушения концентрационной
способности почек и небольшая протеинурия вследствие нарушения функ-
ции клубочков. Для злокачественной артериальной гипертензии характерны
значительная протеинурия и гематурия, что требует, однако, исключения
возможных воспалительных поражений почек. Исследования мочи имеют
важное значение для дифференциальной диагностики эссенциальной арте-
риальной гипертензии и симптоматических почечных.
Исследования крови проводят для определения азотвыделительной функ-
ции почек и ГЛП как фактора риска ИБС.
Инструментальное обследование. Ценным признаком поражения сердца как
одного из органов-мишеней при выраженной артериальной гипертензии яв-
ляется развитие гипертрофии левого желудочка, которая определяется при
электрокардио- и эхокардиографии. Наиболее ранним ее электрокардио-
графическим признаком является повышение вольтажа зубцов R в левых груд-
ных отведениях, I и aVL. По мере нарастания гипертрофии в этих отведени-
ях появляются признаки “перегрузки” левого желудочка в виде сглаженных
зубцов Т, затем косонисходящей депрессии сегмента ST с переходом в асим-
метричный отрицательный зубец Т. Одновременно в правых грудных отведе-
ниях отмечаются своего рода “зеркальные” изменения: небольшой косовос-
ходящий подъем сегмента ST с переходом в высокий асимметричный зубец
Т. Переходная зона не изменена. При эффективном лечении артериальной
гипертензии нарушения реполяризации, как правило, исчезают или значи-
тельно уменьшаются. При дилатации левого желудочка вольтаж комплекса
QRS снижается. Относительно рано появляются признаки перегрузки и ги-
пертрофии левого предсердия.
Свойственные гипертрофии и перегрузке левого желудочка нарушения
реполяризации необходимо дифференцировать от признаков ишемии как
отражения сопутствующей артериальной гипертензии ИБС. Ее дифференци-
ально-диагностическими электрокардиографическими критериями являют-
ся горизонтальная депрессия сегмента ST, а при инверсии зубцов Т - их
симметричность в виде равнобедренного треугольника. Сходные изменения
сегмента ST и зубца Т часто регистрируются в отведениях V3 4, то есть “пе-
ресекают” переходную зону. По мере развития органических изменений в
миокарде левого желудочка, связанных с его патологической гипертрофией
и распространенным коронарным атеросклерозом (так называемым атеро-
склеротическим кардиосклерозом), часто возникает блокада левой ножки
пучка Гиса или ее передне-верхней ветви.
414
Таблица 36. Классификация эссенциальной артериальной гипертензии (гипертонической болезни)
ВОЗ (1962, 1978, 1993)
По течению По характеру поражения органов По уровню АД, мм рт.ст.
Формы: Стадии: Варианты: Формы: АД:
доброкачественная I с преимущественным поражением: мягкая (легкая) 140-179 90-104
II сердца сосудов головного мозга умеренная 180-199 105-114
III почек с множественным поражением органов тяжелая 2 200 115
злокачественная
На рентгенограмме органов грудной клетки даже при выраженной артери-
альной гипертензии изменения отсутствуют до тех пор, пока не развивается
дилатация левого желудочка. У части больных определяется закругление его
верхушки, особенно заметное в боковой проекции, как косвенный признак
концентрической гипертрофии. О сопутствующем атеросклерозе грудной ча-
сти аорты свидетельствуют ее удлинение, развернутость, расширение и уп-
лотнение дуги. При резко выраженной дилатации следует заподозрить рас-
слоение аорты.
Эхокардиография является наиболее чувствительным методом выявле-
ния гипертрофии левого желудочка и оценки ее выраженности. В далеко
зашедших случаях определяются дилатация левого желудочка и наруше-
ние его систолического опорожнения.
При наличии изменений в моче дифференциально-диагностическое зна-
чение имеет верификация диффузного поражения почечной паренхимы с
одинаково выраженным уменьшением размеров и нарушением функции
обеих почек по данным неинвазивных методов — ультразвукового исследова-
ния, радионуклидной рено- и сцинтиграфии, а также экскреторной урографии.
Другие методы обследования используют при подозрении на ту или иную
форму симптоматической артериальной гипертензии.
Поскольку эссенциальная артериальная гипертензия не имеет ни одного
патогномоничного клинического, инструментального или лабораторного
признака, диагноз ставят только после исключения артериальной гипертен-
зии, связанной с известной причиной. Дифференциальную диагностику арте-
риальной гипертензии — см. ниже и в т.2.
Классификация. Общепринятая классификация ВОЗ (1962, 1978, 1993)
представлена в табл. 36. Согласно этой классификации, в зависимости от
течений различают “доброкачественную” и злокачественную формы заболе-
вания. “Доброкачественная” эссенциальная артериальная гипертензия раз-
деляется на три стадии (I, II, III), которым примерно соответствуют три ее
формы, определяющиеся уровнем АД, прежде всего диастолического. В зави-
симости от преимущественно пораженного органа-мишени различают тот
или иной клинический вариант.
415
Таблица 37. Характеристика стадий эссенциальной артериальной гипертензии (ВОЗ, 1972, 1978, 1993)
Поражение органов-мишеней Центральная нервная система
Почки
Сетчатка
Сердце
Стадия
!
I
8
Q
I
I
<0
к1
§
а
в.
R
S
!
I
ж
а
В основе классификации
эссенциальной артериальной
гипертензии лежит выделе-
ние трех стадий заболевания.
Их характеристика представ-
лена в табл. 37.
I стадия отмечается у
70-75 % больных с эссенци-
альной артериальной гипер-
тензией. У большинства боль-
ных жалобы отсутствуют или
неопределенные, связанные
преимущественно с психо-
эмоциональным состоянием.
Повышение АД, уровень ко-
торого весьма примерно со-
ответствует мягкой (легкой)
форме артериальной гипер-
тензии, не сопровождается
объективными признаками
поражения органов-мишеней.
Характер изменений гемоди-
намики в большинстве слу-
чаев соответствует гиперки-
нетическому типу. Возможна
спонтанная нормализация
АД, особенно по данным ам-
булаторного мониторинга,
но на более короткий срок,
чем при пограничной арте-
риальной гипертензии. У зна-
чительной части больных за-
болевание имеет мало про-
грессирующее течение со
стойкой стабилизацией на
уровне I стадии в течение
15—20 лет и более. Несмотря
на это отдаленный прогноз
неблагоприятен. Как показа-
ли результаты фремингем-
ского исследования, риск
развития сердечной недоста-
точности у таких больных
повышен в 6 раз, инсульта
— в 3—5 раз, фатального ин-
416
фаркта миокарда — в 2—3 раза. В целом летальность при многолетних наблю-
дениях оказалась в 5 раз выше, чем у лиц с нормальным уровнем АД.
II стадия по уровню АД примерно соответствует умеренной артери-
альной гипертензии. Течение заболевания у части больных остается бессим-
птомным, однако при обследовании всегда обнаруживаются признаки пора-
жения органов-мишеней, обусловленные гипертрофией левого желудочка и
артериолярной стенки (см. табл. 37). Характерны гипертонические кризы. В
анализах мочи изменения чаще отсутствуют, но в течение 1-2 сут после
криза можно зарегистрировать небольшую преходящую протеинурию и эрит-
роцитурию. Возможны умеренное уменьшение клубочковой фильтрации и
признаки симметричного снижения функции обеих почек при радионук-
лидной ренографии. Гемодинамический профиль преимущественно соответ-
ствует нормо (эу-) кинетическому.
Для III стадии заболевания характерны сосудистые осложнения, свя-
занные как с артериальной гипертензией, так и в значительной мере с ус-
коренным развитием сопутствующего атеросклероза (см. ниже). Необходимо
иметь в виду, что при развитии инфаркта миокарда и инсульта АД, особен-
но систолическое, часто стойко снижается из-за уменьшения УОС. Такая
артериальная гипертензия получила название “обезглавленной”. При этом
характерен гипокинетический гемодинамический профиль.
Согласно рекомендациям ВОЗ и II съезда кардиологов бывшего СССР
(1974), при развитии у больного эссенциальной артериальной гипертензией
инфаркта миокарда, стенокардии, кардиосклероза и застойной сердечной
недостаточности основным заболеванием, которое ставят на первое место в
клиническом диагнозе, считается ИБС. Таким образом, “сердечной форме”
эссенциальной артериальной гипертензии при III стадии не остается места в
диагнозе.
Следует отметить, что стадиям эссенциальной артериальной гипертензии
по классификации ВОЗ полностью соответствуют градации заболевания,
выделенные Н.Д.Стражеско (1940). Он характеризовал I стадию как функ-
циональную, юношескую, “молчаливую”, II — как органическую, для ко-
торой характерны органические изменения сердечно-сосудистой и других
систем, а III — как дистрофическую.
Давая определение стадийности развития гипертонической болезни (эс-
сенциальной артериальной гипертензии) по патогенетическому принципу,
Г.Ф.Ланг (1947) в своей классификации выделял предгипертоническое со-
стояние, I стадию — нейрогенную, II — переходную и III — нефрогенную. В
названии III стадии отражено представление ученого об обязательном учас-
тии почечных прессорных веществ в закреплении повышенного АД. Факты,
накопленные последующими исследованиями, не подтвердили этого поло-
жения, что побудило ученика Г.Ф.Ланга А.Л.Мясникова предложить новую
классификацию (1951), получившую в тот период широкое распространение
в нашей стране. Эта классификация предусматривает выделение 3 стадий
гипертонической болезни: I - функциональной, II — “гипертрофической” и
III — склеротической. Каждая из этих стадий включает 2 фазы (А и Б), которые
417
Таблица 38. Клинические признаки различных гемодинамических типов эссенциальной артериальной
гипертензии
Признак Тип гемодинамики
Гиперкинетический Эукииетический Гипокинетический
СИ, л/мни/м2 > 4,5 2,8-4,5 < 2,8
Артериальная
гипертензия:
характер
течение
Стадия
Признаки сердечной
недостаточности
Ретинопатия
Признаки ИБС
Чаще лабильная,
систолическая
Доброкачественное
Чаще I—II
Обычно отсутствуют
Чаще отсутствует
Редко
Чаще стойкая, систоло-
диастолическая
Доброкачественное
1-Ш
Чаще при нагрузке, но
могут отсутствовать
Обычно выражена,
иногда отсутствует
Часто
Стойкая, преимуще-
ственно диастолическая
Может быть
злокачественным
Чаще П-Ш
Обычно имеются при
нагрузке или в покое
Выражена
В большинстве случаев
получили следующие названия: IA — латентная, или предгипертоническая;
1Б — преходящая, или транзиторная; ПА — лабильная, или неустойчивая;
ПБ — стабильная; ША — компенсированная и ШБ — декомпенсированная.
Стадии 1Б и IIA соответствуют I стадии классификации ВОЗ, ПБ—IIIA — II
стадии и ШБ — III стадии эссенциальной артериальной гипертензии. Класси-
фикация А.Л.Мясникова предусматривает также выделение кардиального,
церебрального, почечного и смешанного вариантов в зависимости от преиму-
щественного органного поражения, а по характеру течения — быстро про-
грессирующий (злокачественный) и медленно прогрессирующий варианты.
Таким образом, градации гипертонической болезни по А.Л.Мясникову доста-
точно близки современной классификации ВОЗ, которая в настоящее время
является единственно обязательной для практической медицины.
В последние годы принято выделять варианты эссенциальной артериаль-
ной гипертензии в зависимости от гемодинамического и гуморального про-
филей, что, как предполагалось, имеет определенное значение для оценки
прогноза и дифференцированного подхода к лечению. В то же время все эти
варианты в значительной мере условны, так как переходят друг в друга, а
теоретически обоснованные рекомендации в отношении оптимального ле-
чения не всегда оказываются эффективными на практике.
Гемодинамический тип эссенциальной артериальной гипертензии — г и -
пер-,эу- или гипокинетический - определяется на основании чис-
ленных значений МОС(СИ) и ОПСС по данным реографии или эхокардио-
графии либо, косвенным образом, по характеру артериальной гипертензии.
Так, гиперкинетическому типу в основном соответствует систолическая ар-
териальная гипертензия, а гипокинетическому — диастолическая. Клиниче-
ская характеристика каждого из вариантов представлена в табл. 38.
418
Таблица 39. Характеристика вариантов эссенциальной артериальной гипертензии в зависимости от
активности ренина в плазме крови
Признак Форма артериальной гипертензин
гиперреиинная гипоренинная
Удельный вес среди больных с эссенциальной
артериальной гипертензией ~ 15-20 % ~ 20-30 %
ОПСС Т N, J-
Альдостерон ? Г
ОЦП и объем внеклеточной жидкости N, Г т
МОС 4 т
Гематокритное число и вязкость крови Г г
Возраст Чаще молодой Чаще пожилой
Ортостатические реакции Часто Редко
Сосудистые осложнения
Примечание. Т - увеличение, 4 — уменьшение показателя; N - норма.
Учитывая важную роль в патогенезе эссенциальной артериальной гипер-
тензии ренин-ангиотензин-альдостероновой системы, в зависимости от
активности ренина в плазме крови выделяют 3 варианта заболевания — г и -
пер-, нормо- и ги поре ни нный , имеющие определенные особен-
ности клинического течения и лечения. Характеристика крайних вариантов
— гипер- и гипоренинного — представлена в табл. 39.
Предполагают, что гипоренинная, или объемзависимая артериальная ги-
пертензия связана с избыточной секрецией минералокортикоидов. Посколь-
ку она практически не встречается у больных в возрасте до 40 лет и отмеча-
ется более чем у 50 % больных старше 60 лет, предполагают, что этот вари-
ант артериальной гипертензии является определенной стадией естественно-
го течения заболевания. При этом снижение активности ренина может быть
вторичным вследствие “функционального торможения” юкстагломеруляр-
ного аппарата в результате длительного воздействия повышенного АД. Воз-
можно, что различная активность ренина обусловлена неодинаковой чув-
ствительностью надпочечников к ангиотензину II: снижение чувствитель-
ности приводит к увеличению секреции ренина, а повышение — к гипоре-
нине мии. Гиперренинемия может быть вторичной по отношению к повыше-
нию активности симпатико-адреналовой системы.
Пограничная артериальная гипертензия представляет собой функциональ-
ное заболевание, обусловленное главным образом обратимым нарушением
функции центральных регуляторов АД, которое проявляется повышением
симпатического тонуса. Увеличение адренергической импульсации к сердцу
и венам приводит к росту МОС вследствие повышения сократимости мио-
карда, ЧСС и венозного притока, а усиление импульсации к артериолам
препятствует их компенсаторному расширению. В итоге нарушается саморе-
гуляция тканевого кровотока и происходит относительное увеличение ОПСС.
Выделяют следующие критерии диагноза пограничной артериальной
419
гипертензии, которые основываются на результатах трехкратного измере-
ния АД, желательно в амбулаторных условиях:
I) АД ни разу не превышает пограничного уровня, то есть 140-159/
90—94 мм рт.ст. по ВОЗ (1993) или 130-139/85—89 мм рт.ст. по рекоменда-
циям Объединенного Национального комитета США по определению,
оценке и лечению повышенного АД, 1992;
2) не менее чем при 2 измерениях значения диастолического или систо-
лического АД находятся в пограничной зоне;
3) отсутствие органических изменений органов-мишеней (сердца, почек,
мозга, глазного дна);
4) исключение симптоматической артериальной гипертензии;
5) нормализация АД без гипотензивной терапии.
Учитывая роль психоэмоционального фактора, при каждом осмотре боль-
ного рекомендуется измерять АД трижды с короткими интервалами и счи-
тать истинными самые низкие величины.
Пограничная артериальная гипертензия отмечается у 10—20 % населения
и во многих отношениях неоднородна. Хотя она является основным факто-
ром риска развития эссенциальной артериальной гипертензии, этот переход
происходит не более чем у 20—30 % больных. Примерно у такого же процен-
та больных наблюдается нормализация АД и, наконец, у значительной час-
ти больных пограничная артериальная гипертензия сохраняется неопреде-
ленно длительное время.
Неоднороден и гемодинамический профиль таких больных. Наряду с гипер-
кинетическим типом, который отмечается примерно у 50 % больных, у 30 %
определяется эукинетический и у 20 % — гипокинетический. Вариабельность
течения и состояния гемодинамики обусловлена, по-видимому, неоднородно-
стью этиологических факторов пограничной артериальной гипертензии. В насто-
ящее время доказана роль наследственной предрасположенности и патологии
клеточных мембран с увеличением внутриклеточного содержания Na+ и Са2+.
Очевидно, имеются и другие причины возникновения пограничной артериаль-
ной гипертензии и дальнейшего повышения АД, которые пока не установлены.
В зависимости от наиболее подверженных контингентов можно выделить
следующие клинические формы пограничной артериальной гипертензии:
1) юношескую; 2) психоневрологическую; 3) климактерическую; 4) алкоголь-
ную; 5) пограничную артериальную гипертензию спортсменов; 6) при воз-
действии некоторых профессиональных факторов (шума, вибрации и др.).
Факторами повышенного риска развития эссенциальной артериаль-
ной гипертензии у больных пограничной гипертензией являются:
1) отягощенная наследственность. При этом переход в эссенциальную ар-
териальную гипертензию отмечается примерно у 50 % больных, а при отсут-
ствии этого фактора — у 15 %;
2) уровень АД. Чем выше АД, тем больше вероятность перехода в эссен-
циальную артериальную гипертензию;
3) избыточная масса тела;
420
4) возникновение пограничной артериальной гипертензии в возрасте после
30 лет.
Осложнения эссенциальной артериальной гипертензии обусловлены по-
вреждением сосудов собственно гипертензивного и атеросклеротического
генеза. Гипертензивные сосудистые осложнения непосредственно связаны с
повышением АД и могут быть предотвращены при его нормализации. К ним
относятся: 1) гипертензивные кризы; 2) синдром злокачественной артери-
альной гипертензии; 3) геморрагический инсульт; 4) нефросклероз и хрони-
ческая почечная недостаточность; 5) расслаивающая аневризма аорты и от-
части застойная сердечная недостаточность при “гипертензивном сердце”.
По образному выражению Е.М.Тареева (1948), атеросклероз следует за гипер-
тонической болезнью, как тень за человеком. Связанные с ним сосудистые ос-
ложнения весьма характерны для бальных с артериальной гипертензией, однако
не могут быть предотвращены только при одном снижении АД. Они включают:
1) все формы ИБС, в том числе застойную сердечную недостаточность и внезап-
ную смерть; 2) ишемический инсульт; 3) атеросклероз периферических сосудов.
Гипертонический, или гипертензивный, криз — это резкое повышение АД,
сопровождающееся рядом нейрогуморальных и сосудистых нарушений, глав-
ным образом мозговых и сердечно-сосудистых. За рубежом этот термин ис-
пользуют в более узком смысле для обозначения расстройств мозгового кро-
вообращения и он носит название “гипертензивная энцефалопатия”.
Гипертонические кризы более характерны для эссенциальной артериальной
гипертензии, чем для большинства симптоматических, и могут быть первым
клиническим проявлением заболевания. По выражению А.Л. Мясникова, они
являются своего рода “квинтэссенцией”, или “сгустком”, гипертонической
болезни.
Гипертонические кризы могут развиваться в любой стадии заболевания. Их
возникновению способствуют все этиологические и предрасполагающие к
эссенциальной артериальной гипертензии факторы. К ним относятся, в пер-
вую очередь, психоэмоциональное напряжение, злоупотребление соленой
пищей или алкоголем, неблагоприятные факторы внешней среды, в частно-
сти, снижение барометрического давления при повышении температуры и
влажности воздуха. К возникновению кризов может приводить также отсут-
ствие лечения артериальной гипертензии или неадекватная терапия, что часто
происходит, когда больной самовольно нарушает врачебные рекомендации.
В отличие от простого повышения АД для криза характерен срыв местной
саморегуляции с возникновением синдрома гиперперфузии, стаза, повы-
шения гидростатического давления в капиллярах и их проницаемости с оте-
ком ткани и диапедезным кровотечением, вплоть до разрыва мелких сосу-
дов. Эти нарушения наблюдаются преимущественно в мозговом и коронар-
ном кровотоке и реже затрагивают почечный и кишечный бассейны.
Диагностическими признаками гипертонического криза являются: 1) вне-
запное начало (от нескольких минут до нескольких часов); 2) повышение
АД до уровня, обычно не свойственного данному больному (диастоличе-
ское АД, как правило, выше 115-120 мм рт.ст.); 3) жалобы кардиального
421
(сердцебиение, кардиалгия), общемозгового (головная боль, головокруже-
ние, тошнота, рвота, нарушение зрения и слуха) и общевегетативного (оз-
ноб, дрожь, чувство жара, потливость) характера.
Согласно классификации Н.А.Ратнер и соавторов (1956), в зависимо-
сти от клинического течения гипертонические кризы могут быть I типа
(адреналовые), II типа (норадреналовые) и осложненные.
Гипертонические кризы I типа связаны с выбросом в кровь
катехоламинов, преимущественно адреналина, в результате центральной сти-
муляции надпочечников. Их симпатико-адреналовое происхождение определя-
ет преобладание симптоматики общевегетативного характера. АД не достига-
ет очень высоких цифр, отмечается преимущественное повышение систоли-
ческого давления. Кризы такого типа обычно развиваются бурно, но относи-
тельно непродолжительны (до 2—3 ч) и сравнительно быстро купируются,
после чего часто наблюдается полиурия. Осложнения встречаются редко.
Гипертонические кризы II типа наиболее характерны для тяжелой и зло-
качественной артериальной гипертензии. Клинические признаки
гиперактивности симпатико-адреналовой системы отсутствуют. Их основ-
ным проявлением является гипертоническая энцефалопатия вследствие оте-
ка мозга, возникающего на фоне очень значительного повышения АД, пре-
имущественно диастолического (120—140 мм рт.ст. и более). Характерно по-
степенное нарастание общемозговой симптоматики, которая достигает зна-
чительной выраженности, вплоть до ступора и комы. Нередко отмечаются
также очаговые неврологические расстройства. Пульс обычно замедлен. При
исследовании глазного дна обнаруживают экссудаты и начальные признаки
отека диска зрительного нерва. Такие кризы обычно продолжительны, одна-
ко при своевременной гипотензивной терапии симптомы в большинстве слу-
чаев обратимы. Без лечения гипертоническая энцефалопатия может закон-
читься летальным исходом. Во время криза, независимо от его характера, на
ЭКГ часто регистрируется преходящая депрессия сегмента ST с уплотнени-
ем или инверсией зубца /’“перегрузочного” или ишемического генеза. Пос-
ле его купирования могут отмечаться протеинурия, эритроцитурия, иногда
цилиндрурия. Эти изменения более выражены при кризах II типа.
Осложненный гипертонический криз характеризуется раз-
витием острой левожелудочковой недостаточности, острого нарушения ко-
ронарного кровообращения, нарушением мозгового кровообращения по типу
динамического, геморрагического или ишемического инсульта.
В зависимости от гемодинамического профиля выделяют гипер-, эу- и
гипокинетический кризы, которые часто можно различать и без инструмен-
тального обследования на основании особенностей клинического течения
(А.П.Голиков и соавт., 1976).
Гиперкинетический криз наблюдается преимущественно на ран-
ней — 1 стадии эссенциальной артериальной гипертензии и по своей карти-
не чаще соответствует кризу I типа. Характерно внезапное резкое повыше-
ние АД, преимущественно систолического, а также пульсового, с яркой
вегетативной окраской и тахикардией. Кожа влажная на ощупь, в области
лица, шеи и груди нередко появляются красные пятна.
Эукинетический криз развивается чаще при II стадии эссенци-
альной артериальной гипертензии на фоне стойкого повышения АД и по
своим проявлениям представляет собой тяжелый адреналовый криз. Значи-
тельно повышено как систолическое, так и диастолическое АД.
Гипокинетический криз в большинстве случаев развивается при
III стадии заболевания и по клинической картине сходен с кризом II типа.
Характерно постепенное нарастание общемозговой симптоматики — голов-
ной боли, заторможенности, ухудшения зрения и слуха. Частота пульса не
изменена или замедлена. Резко повышается диастолическое АД (до 140—160
мм рт.ст.) и уменьшается пульсовое.
Злокачественная артериальная гипертензия — это синдром, характеризую-
щийся быстрым и значительным повышением АД, особенно диастолического,
которое обычно превышает 130—140 мм рт.ст., и ускоренным развитием органи-
ческих изменений в органах-мишенях вследствие быстрого прогрессирования
некротизирующего артериолита. Злокачественная артериальная гипертензия
может наблюдаться как при эссенциальной, так и при симптоматических
артериальных гипертензиях и имеет место примерно у 1 % больных. Ее возник-
новению способствует отсутствие адекватной коррекции повышенного АД.
Патогенез злокачественной артериальной гипертензии неясен. Принято счи-
тать, что важную роль в ее развитии играет повышенное образование ренина
клетками юкстагломерулярного аппарата, обусловленное значительными из-
менениями почечных артериол. Это приводит к гиперпродукции ангиотензина
II и альдостерона. Вследствие нарушения нормального функционирования от-
рицательной обратной связи, призванной уменьшать образование ренина, уро-
вень ангиотензина и альдостерона сохраняется чрезвычайно высоким, что вы-
зывает значительное и стойкое повышение АД и развитие артериолонекроза. В
то же время возможно возникновение злокачественной артериальной гипер-
тензии и при гипоренинемии. Патогенетическое значение, по-видимому, име-
ет также экстравазация плазменных белков из крови и их отложение в сосуди-
стой стенке, что отмечается при резком повышении АД любого генеза.
В основе клинических проявлений заболевания лежат два независимых про-
цесса - дилатация мозговых артерий и генерализованный фибриноидный не-
кроз артериол. Расширение мозговых артерий обусловлено срывом ауторегу-
ляции мозгового кровотока из-за резкого повышения АД. Возникающая при
этом гиперперфузия мозга вызывает его отек и клинические проявления ги-
пертензивной энцефалопатии. В почках фибриноидный некроз артериол при-
водит к прогрессирующей ишемической атрофии нефронов с уменьшением
клубочковой фильтрации и почечного кровотока, что обусловливает развитие
хронической почечной недостаточности. Ухудшению функции почек может
способствовать также возникновение микроангиопатической гемолитической
анемии.
В большинстве случаев злокачественная артериальная гипертензия раз-
вивается в возрасте около 40 лет, чаще у мужчин. Ее клиника включает:
423
1) признаки гипертензивной энцефалопатии; 2) нарушения функции почек;
3) левожелудочковую недостаточность. Гипертензивная энцефалопатия про-
является резкой головной болью, преимущественно в области затылка, рво-
той, нарушением зрения, вплоть до его временной потери, преходящими
параличами, судорогами. При несвоевременном оказании помощи развива-
ются ступор и кома. Снижение зрения и даже слепота могут становиться
необратимыми. Возможно возникновение геморрагического инсульта и суб-
арахноидального кровоизлияния. Характерно быстро прогрессирующее ухуд-
шение функции почек, причем макрогематурия и олигурия могут быть пер-
выми симптомами заболевания. В течение месяца возможно развитие почеч-
ной недостаточности. АД обычно более 230/130 мм рт.ст.
Диагностика базируется на данных исследования глазного дна. Началь-
ными признаками злокачественной артериальной гипертензии являются
кровоизлияния и экссудаты (ретинопатия III степени). Для развернутой кли-
нической картины характерен отек диска зрительного нерва (ретинопатия
IV степени).
Поражение почек проявляется протеинурией, гематурией, цилиндрури-
ей, гипоизостенурией. При инструментальных исследованиях обе почки оди-
наково уменьшены в размерах, а их функция резко и одинаково снижена.
При отсутствии адекватного лечения в течение 1 года умирают 80 % боль-
ных, а в течение 2 лет - 100 %. Основными причинами смерти являются
геморрагический инсульт, сердечная и почечная недостаточность, инфаркт
миокарда, расслоение аорты. Раннее и активное лечение значительно улуч-
шает прогноз. При этом 5-летняя выживаемость может достигать 50-70 %, а
больные умирают преимущественно от хронической почечной недостаточ-
ности. Тем не менее, предотвращение злокачественной артериальной гипер-
тензии путем адекватной гипотензивной терапии является значительно бо-
лее эффективным, чем ее лечение.
Геморрагический инсульт обусловлен преимущественно разрывом характер-
ных для эссенциальной артериальной гипертензии микроаневризм мелких
артерий мозга — так называемых аневризм Шарко-Бушара. Мелкие инфарк-
ты мозга могут протекать бессимптомно. Их следы обнаруживаются с помо-
щью ядерно-магнитного резонанса почти у 50 % больных старше 70 лет.
Эссенциальная артериальная гипертензия является основной причиной
расслаивающей аневризмы аорты.
Хроническая почечная недостаточность. Хотя при морфологическом ис-
следовании биопсийного и некропсийного материала нефросклероз встреча-
ется при эссенциальной артериальной гипертензии достаточно часто, раз-
вернутая картина хронической почечной недостаточности при “доброкаче-
ственном”, медленно прогрессирующем течении заболевания и адекватном
его лечении является редкой.
Острая и хроническая сердечная недостаточность при “доброкачествен-
ной” артериальной гипертензии является следствием патологической гипер-
трофии левого желудочка и сопутствующей ИБС. Появлению ее признаков
обычно предшествует гипертрофия миокарда. Ранние признаки сердечной
424
Схема 19. Патогенез сердечной недостаточности при эссенциальной артериальной ги-
пертензии: АГ - артериальная гипертензия; ЛЖ — левый желудочек; СИ - сердечная
недостаточность; ОЦП - объем циркулирующей плазмы; КТХА - катехоламины
недостаточности обусловлены диастолической дисфункцией с уменьшени-
ем податливостилевого желудочка, к которой затем присоединяется систоли-
ческая дисфункция. Патогенез нарушений систолической функции у таких
больных представлен на схеме 19. Клинически длительное время отмечаются
признаки хронической левожелудочковой недостаточности, на фоне которых
при повышении АД могут развиваться приступы сердечной астмы и отека
легких. Правожелудочковая декомпенсация присоединяется значительно позже.
До широкого применения антигипертензивной терапии сердечная недо-
статочность являлась причиной более 50 % летальных исходов. В настоящее
время при отсутствии инфаркта миокарда больные эссенциальной артери-
альной гипертензией умирают от сердечной недостаточности редко.
Осложнения атеросклероза. Связь артериальной гипертензии с ускорен-
ным развитием атеросклероза всех сосудистых бассейнов твердо установлена.
При адекватном лечении артериальной гипертензии в современных условиях
основными причинами инвалидизации и смерти больных являются сосудис-
тые осложнения атеросклероза - инфаркт миокарда и ишемический инсульт.
Естественное течение нелеченой эссенциальной артериальной гипертен-
зии представлено на схеме 20.
Лечение. Целью является уменьшение риска возникновения осложнений
и улучшение выживаемости больных. Патологические изменения в сосудах,
которые являются основной причиной осложнений, развиваются как при
первичной (эссенциальной), так и при вторичной артериальной гипертен-
зии, независимо от ее генеза. Как показали многочисленные многоцентро-
вые плацебо-контролируемые двойные слепые исследования, проведенные
в период с 1970 г. по настоящее время (Veterans Administration Cooperative
Study Group on Antihypertensive Agents, 1970; The Oslo Study — A.Helgeland,
1980; Medical Research Council Working Party, 1985; Tire Hypertension Detection
and Follow-up Program, 1988; The European Working Party Trial in the Elderly
— A.Amery и соавт., 1991), снижение АД позволяет уменьшить частоту
425
Возраст, годы
0-30
20-40
30-50
40-50
Наследственность^^ Внешняя среда
Пограничная АГ
1мос
I
Начальная АГ
. 7
\oncc
Устойчивая АГ
Ускоренное развитие атеросклероза
Осложненная АГ
Сердце'
Аорта
Злокачественное
течение
Сердечная Аневризма Нефросклероз Ишемический
недостаточность (первично- и
Инфаркт сморщенная геморрагический
миокарда ГроиЙ6е°^мя почка) инрруМт
Схема 20. Естественное течение нелеченой эссенциальной артериальной гипертензии:
АГ — артериальная гипертензия; ЦНС - центральная нервная система; ХПН - хро-
ническая почечная недостаточность; ОПСС — общее периферическое сосудистое
сопротивление
первичного и повторного геморрагического инсульта, предотвратить или
уменьшить выраженность застойной сердечной недостаточности, злокаче-
ственной артериальной гипертензии и хронической почечной недостаточно-
сти. В результате этого летальность при тяжелой артериальной гипертензии
за последние 20 лет снизилась примерно на 40 %. Так, по данным Коопера-
тивного исследования антигипертензивных препаратов Администрации гос-
питаля ветеранов США, частота осложнений артериальной гипертензии у
лечившихся больных с исходным уровнем систолического АД свыше 160 мм
рт.ст. снизилась с 42,7 до 15,4 %, а среди пациентов с диастолическим АД в
пределах 105—114 мм рт.ст. - с 31,8 до 8 %. При исходно более низких вели-
чинах АД уменьшение частоты развития этих осложнений было менее выра-
женным: при систолическом АД менее 165 мм рт.ст. - на 40 % и при диасто-
лическом АД от 90 до 104 мм рт.ст. - на 35 % (Veterans Administration
Cooperative Study Group on Artihypertensive Agents, 1970).
Данные о влиянии гипотензивной терапии на возникновение и течение
заболеваний, связанных с атеросклерозом, в частности, ИБС, неоднознач-
ны и зависят от уровня АД.
Снижение АД несомненно эффективно при умеренной и тяжелой арте-
риальной гипертензии (Joint National Committee, J.Cutler и соавт., 1989).
Для изучения вопроса о целесообразности назначения медикаментозной
терапии больным с бессимптомным течением мягкой артериальной гипер-
426
тензии к 1985 г. был завершен ряд крупномасштабных многоцентровых пла-
цебоконтролируемых исследований с наблюдением больных в течение 3—5
лет. К ним относятся Австралийское исследование эффективности лечения
мягкой артериальной гипертензии почти у 3500 больных (Australian
Therapeutic Trial, 1980), Программа выявления и наблюдения за больными
с артериальной гипертензией в США с охватом 11 тыс. случаев (The
Hypertension Detection and Follow-up Program, 1988), международное
исследование эффективности воздействия на множественные факторы рис-
ка с охватом 4 тыс. больных (The Multiple Risk Factor Intervention Trial,
1990) и исследование эффективности лечения мягкой артериальной гипер-
тензии Рабочей группы Медицинского исследовательского совета Великоб-
ритании, базирующееся на 17 тыс. наблюдений (Medical Research Council
Working Party, 1985).
Как показали полученные разультаты, лечение мягкой артериальной ги-
пертензии пропранололом и тиазидовыми диуретиками, в отличие от при-
менения плацебо, вызывая уменьшение частоты нефатальных инсультов,
не оказывало существенного влияния на общую летальность, развитие ИБС,
ее осложнений и связанных с ней летальных исходов. Такие результаты,
возможно, обусловлены включением в исследование части больных с ис-
ходно бессимптомным течением ИБС, а также неблагоприятным влиянием
использованных гипотензивных препаратов на уровень липидов в крови. Для
проверки гипотезы о возможности антигипертензивной терапии замедлить
или предотвратить развитие атеросклероза в настоящее время начато несколько
новых проспективных многоцентровых исследований. В них предусмотрено
включение больных более молодого возраста с верифицированным отсут-
ствием ИБС и применение различных медикаментозных препаратов, не ока-
зывающих неблагоприятное действие на метаболизм.
Данные об эффективности терапии при диастолическом АД в пределах
90—95 мм рт.ст. противоречивы. Только в одном из проведенных исследова-
ний, выполненном в США, было показано статистически достоверное сни-
жение летальности, что, возможно, в значительной мере связано с улучше-
нием общего медицинского наблюдения за больными. Важным фактом, вы-
явленным в ходе проведенных исследований, было повышение летальности
среди курящих больных с мягкой артериальной гипертензией вдвое по срав-
нению с некурящими, что значительно превышало различия ее величин у
пациентов опытной и получавших плацебо групп.
Показания к лечению артериальной гипертензии. Прежде чем приступить к
лечению артериальной гипертензии, необходимо убедиться в ее наличии у
больного. Установление этого диагноза обусловливает необходимость пожиз-
ненного медицинского наблюдения и приема медикаментозных препара-
тов, которые при длительном применении могут давать более или менее
серьезные побочные эффекты. Диагноз артериальной гипертензии основы-
вается на результатах не менее чем 3-кратного измерения повышенного АД,
которое производят с интервалом 1—2 нед при умеренной артериальной
гипертензии по данным первого измерения АД и каждые 1—2 мес — при
427
мягкой. Такой подход обусловлен тем, что более чем у 1/3 лиц при последу-
ющих определениях первоначальное повышение АД оказывается нестойким.
Более достоверны результаты измерения АД в амбулаторных условиях.
Единой “отрезной точки” уровня АД, при котором необходимо начинать
лекарственную терапию, не существует. Медикаментозная терапия показана
при умеренной и тяжелой артериальной гипертензии (АД больше 160/100 мм
рт.ст. в возрасте 20 лет или больше 170/105 мм рт.ст. в возрасте 50 лет) либо
при меньших величинах АД, но при наличии начальных признаков пораже-
ния органов-мишеней — гипертрофии левого желудочка и ретинопатии. При
мягкой артериальной гипертензии у больных с бессимптомным течением
заболевания вопрос решается индивидуально. По мнению большинства спе-
циалистов, назначение лекарственных препаратов показано при устойчивом
повышении АД по сравнению с нормой по данным длительного, иногда в
течение нескольких месяцев, амбулаторного мониторинга у больных моло-
дого возраста, особенно у мужчин, при наличии факторов риска развития
ИБС и особенно — признаков артериолосклероза. Согласно рекомендациям
ВОЗ и Международного Общества артериальной гипертензии (1993), актив-
ная лекарственная терапия показана всем больным, у которых диастоличе-
ское АД составляет 90 мм рт.ст. и более и сохраняется на таком уровне в
течение 3—6 мес наблюдения.
При принятии решения о целесообразности применения медикаментоз-
ной терапии ее назначают непрерывно неопределенно долгое время, то есть
пожизненно, наряду с модификацией других факторов риска заболеваний,
связанных с атеросклерозом. Доказано, что при прекращении приема гипо-
тензивных препаратов в течение 6 мес артериальная гипертензия восстанав-
ливается у 85 % больных. Больные с пограничной, лабильной мягкой арте-
риальной гипертензией или изолированной систолической атеросклероти-
ческой гипертензией, у которых было решено воздержаться от назначения
медикаментозных препаратов, должны находиться под наблюдением с кон-
тролем АД не реже чем каждые 6 мес в связи с частым прогрессированием
артериальной гипертензии.
К основным методам немедикаментозного лечения артериальной гипер-
тензии относятся:
1) диета с ограничением: а) соли до 4-6 г в сутки; б) насыщенных жиров;
в) энергетической ценности рациона при ожирении;
2) ограничение употребления алкоголя;
3) регулярные физические упражнения;
4) прекращение курения;
5) снятие стресса (релаксация), модификация условий окружающей среды.
Рекомендуемое больным с артериальной гипертензией ограничение
соли направлено на снижение АД за счет уменьшения ОЦП. Самостоя-
тельным гипотензивным эффектом обладает лишь резкое снижение ее
потребления — до 10—20 ммоль в сутки, что мало реально. Умеренное огра-
ничение соли (до 70—80 ммоль в сутки) слабо влияет на уровень АД, но
потенцирует действие всех антигипертензивных препаратов. В этих целях
428
больным рекомендуют прекратить досаливать пищу и избегать продуктов с
высоким содержанием соли.
Нормализация массы тела оказывает умеренное независи-
мое гипотензивное действие, возможно, вследствие уменьшения симпа-
тической активности. Оно способствует также снижению уровня холесте-
рина в крови, уменьшению риска развития ИБС и сахарного диабета. Та-
кой же эффект дают регулярные физические тренировки (Trials of
Hypertension Prevention Collaborative Research Group, 1992, и др.).
Алкоголь в умеренном количестве не оказывает вреда, так как обла-
дает релаксирующим свойством. В больших дозах он, однако, вызывает ва-
зопрессорное действие и может приводить к повышению уровня триглице-
ридов и развитию аритмий. Курение и артериальная гипертензия оказы-
вают аддитивное влияние на вероятность летального исхода от сердечно-
сосудистых заболеваний. Курение не только повышает заболеваемость ИБС,
но и является независимым фактором риска внезапной смерти, особенно
при наличии гипертрофии левого желудочка и сопутствующей ИБС. Боль-
ным с артериальной гипертензией следует настоятельно рекомендовать бро-
сить курить.
Различные методы релаксации (психотерапия, аутотренинг, йога,
увеличение продолжительности отдыха) улучшают самочувствие больных,
но не влияют существенно на уровень АД. Их можно использовать в каче-
стве самостоятельного метода лечения только при пограничной артериаль-
ной гипертензии, а при наличии показаний к медикаментозной терапии эти
методы не могут ее заменить. Больным с артериальной гипертензией противо-
показана работа, связанная с такими профессиональными факторами, спо-
собствующими повышению АД, как шум, вибрация и др.
Медикаментозная терапия. Ниже приведены основные группы антиги-
пертензивных препаратов.
Классификация антигипертензивных средств
1. Диуретики:
1) тиазидовые (дихлотиазид, гипотиазид и др.);
2) петлевые (фуросемид, этакриновая кислота);
3) калийсберегающие:
а) антагонисты альдостерона (спиронолактон)
б) ингибиторы “натриевого насоса” (амилорид, триамтерен).
2. p-Адреноблокаторы:
1) кардионеселективные (р^ и р2-пропранолол, надолол, тимолол, пиндолол,
окспренолол, алпренолол);
2) кардиоселективные (р^метопролол, ацебутолол, атенолол, практолол),
3) комплексного действия — а-, p-адреноблокаторы (лабеталол).
3. Ингибиторы АПФ (каптоприл, эналаприл, лизиноприл и др.).
4. Блокаторы рецепторов ангиотензина II (лозартан).
5. Блокаторы кальциевых каналов:
1) средства, угнетающие вход Са2+ в миоциты сердца и сосудистой стенки (вера-
памил, дилтиазем);
429
2) средства, угнетающие вход Са2+ в миоциты сосудистой стенки (нифедипин-
адалат, коринфар, никардипин, фелодипин, исрадипин и др.).
6. Анти а дре н ерг и чес к ие средства:
а) центральные а2-адреностимуляторы (клофелин, а-метилдофа);
б) ганглиоблокаторы (пентамин);
в) антиадренергические препараты периферического действия (резерпин, гуане-
тидин).
г) а-адреноблокаторы (фентоламин, феноксибензамин, празозин, теразозин).
7. Вазодилататоры прямого действия (миотропные вазодилататоры —
гидралазин, миноксидил, диазоксид, натрия нитропруссид).
В табл. 40 и 41 дана характеристика антигипертензивных препаратов.
Мочегонные средства. Начальный гипотензивный эффект тиа-
зидовых диуретиков (дихлотиазида-гидрохлортиазидаилигипотиа-
зида; циклотиазида; политиазида и др.) связан с уменьшением ОЦП вслед-
ствие блокады насосов активной реабсорбции Na+ в кортикальном (дисталь-
ном) сегменте восходящего отдела петли Генле, в меньшей степени — в
проксимальном канальце. При длительном приеме происходит стойкое умень-
шение ОПСС, а первоначально сниженный объем внеклеточной жидкости
и УОС практически нормализуются. Механизм этого вазодилатирующего эф-
фекта не ясен. Предполагают, что он обусловлен реакцией на уменьшение
тканевого кровотока или непосредственным действием препаратов на сосуди-
стую стенку, возможно, путем изменения синтеза в ней простагландинов.
Тиазидовые диуретики относятся к препаратам I ряда при лечении арте-
риальной гипертензии и входят в большинство терапевтических программ.
Они действуют в более дистальном отделе нейрона, чем петлевые диурети-
ки, что обусловливает потенцирование мочегонного эффекта при их соче-
танном применении. Продолжительность действия составляет около 12 ч. Гипо-
тензивный эффект начинает проявляться через 3-4 сут и достигает макси-
мума к 2~4-й неделе, в ряде случаев к 12-й, что необходимо учитывать при
решении вопроса о переходе к следующему этапу лечения артериальной ги-
пертензии. При клубочковой фильтрации менее 20 мл/мин их эффект резко
уменьшается. При этом они усугубляют снижение плазмотока. Преимуще-
ствами являются отсутствие изменений МОС, ортостатической артериаль-
ной гипотензии и развития толерантности.
Существенно уменьшая летальность и частоту инсультов у больных с
артериальной гипертензией, тиазидовые диуретики практически не влияют
на развитие ИБС, в том числе инфаркта миокарда. Этот факт объясняют
способностью препаратов, даже в относительно небольших дозах (25 мг),
вызывать ухудшение “профиля факторов риска” вследствие снижения толе-
рантности к углеводам, гиперурикемии, стойкого увеличения уровня обще-
го холестерина (на 5—10 %), холестерина ЛПНП и триглицеридов (на 10—
16 %). Диабетогенный эффект тиазидовых диуретиков связан с токсическим
действием на поджелудочную железу и снижением секреции инсулина при
гипокалиемии. Гиперурикемия обусловлена увеличением реабсорбции моче-
вой кислоты в почечных канальцах, вследствие чего при длительной тера-
пии возможно развитие подагры. У больных подагрой препараты могут отя-
гощать течение заболевания.
430
У 8—10 % больных развивается умеренная гипокалиемия, обусловленная
повышенной секрецией К+ почками вследствие увеличения количества Na+,
поступающего к месту Na+— К+-обмена в дистальных канальцах, и возрас-
тания активности ренин-ангиотензин-альдостероновой системы. В сочета-
нии с вызываемой препаратами гипомагниемией гипокалиемия способству-
ет увеличению частоты возникновения аритмии. Для их профилактики в слу-
чаях повышенного риска — при сердечной недостаточности, особенно при
приеме сердечных гликозидов - в лечение следует включать калий- и маг-
нийсберегающие диуретики, что более эффективно, чем пероральный при-
ем препаратов калия. Исключение составляют случаи приема ингибиторов
АПФ, в которых добавление К+ может приводить к гиперкалиемии.
Представляет интерес способность тиазидовых диуретиков, в отличие от
петлевых, уменьшать выделение с мочой Са2+. Это может способствовать
минерализации костей при остеопорозе, свойственном лицам пожилого
возраста.
В больших дозах мочегонные средства, даже калийсберегающие, иногда
могут вызывать гипонатриемию “разведения”, обусловленную задержкой
воды под действием антидиуретического гормона. Она проявляются слабостью,
тошнотой, сонливостью, алкалозом, судорожным синдромом и развивается
при содержании Na+ в плазме крови ниже 125 ммоль/л. Как и гиповолемия,
гипокалиемия, гипонатриемия и гипохлоремия наиболее выражены в пер-
вые дни приема препаратов, а затем уменьшаются. По данным многоцент-
ровых исследований, относительно частыми побочными эффектами было
развитие импотенции и снижение либидо.
Максимальный мочегонный эффект достигается при однократном при-
еме 100 мг гипотиазида, особенно при соблюдении постельного режима. Та-
кие дозы используют при лечении сердечной недостаточности. Более высо-
кие дозы препарата не повышают мочегонное действие, но усиливают по-
бочные метаболические эффекты.
Для предотвращения побочных эффектов тиазидовых диуретиков у боль-
ных с артериальной гипертензией целесообразно использовать небольшие
дозы — 25 и даже 12,5 мг в сутки, систематически контролировать уровень
К+ в плазме крови и при необходимости сочетать их с калийсберегающими
диуретиками, ингибиторами АПФ, а при выраженной гипокалиемии - с
препаратами калия. В диету желательно включать продукты, богатые солями
калия: помидоры, сливы, цитрусовые и их соки, бананы, фиги, свежие аб-
рикосы, брюссельскую и цветную капусту, картофель “в мундире”, молоко.
При отсутствии отеков и одновременного приема гликозидов лечение уме-
ренными дозами тиазидовых диуретиков обычно не требует восполнения К+.
Тиазидовые диуретики нежелательно сочетать с другими препаратами, ока-
зывающими гиперлипидемическое действие, в частности с р-адреноблока-
торами. Препараты противопоказаны при выраженной хронической почеч-
ной недостаточности, некорригированной гиповолемии и гипокалиемии.
Монотерапия тиазидовыми диуретиками эффективна примерно у 40 %
больных с мягкой артериальной гипертензией. При этом систолическое АД
431
Таблица 40. Выбор антигипертензивной терапин: преимущества и недостатки основных групп препаратов
Препараты Гемодинамический эффект Преимущества Побочные эффекты Противопоказания Ситуации, требующие соблюдения особой осторожности
явные скрытые
Мочегонные Начальное Особо эффективны Слабость, Уменьшение Исходная гипово- Сахарный диабет,
уменьшение при гипоренине- сердцебиение, уровня К+, Mg'\ лемия, первичный подагра, аритмии,
оцп мии, у больных пожилого возраста, а также при сердеч- ной недостаточно- сти. Усиливают эф- фект препаратов других групп. Дешевы. Применя- ются 1 раз в сутки. Не оказывают седа- тивного действия снижение потенции повышение уровня общего холестери- на, холестерина ЛПНП в крови, гипергликемия, гиперурикемия. Для калийсберега- ющих: гиперкалие- мия, гинекомастия гиперальдостеро- низм (для тиази- довых диуретиков) прием гликозидов
/J-Адрено- Снижение МОС Особо эффективны Бронхоспазм, Повышение содер- Бронхиальная Тяжелая сердечная
блокаторы у лиц молодого воз- раста с гиперкине- тическим синдро- мом. Обладают ангиангиальным и антиаритмическим эффектами. Умень- шают проявления беспокойства утомляемость, нарушение сна, снижение ум- ственной рабо- тоспособности, брадикардия, гипогликемия при инсулин- зависимом са- харном диабете, перемежающаяся хромота, похолодание конечностей, синдром жания триглице- ридов, снижение уровня холестери- на ЛПВП в крови, задержка Na+ астма, атриовент- рикулярная блокада П—П1 степени, синдром слабости синусо- вого узла недостаточность, заболевания периферических сосудов, инсулин- зависимый сахар- ный диабет, коронароспазм
отмены, сниже-
ние потенции,
возможно усугу-
бление сердеч-
ной недостаточ-
ности, заложен-
ность носа
Ингибиторы Периферическая Хорошо переносят- Кашель, Нейтропения, Беременность Хроническая
АПФ вазодилатация ся, очень мощные. Особенно эффек- тивны при сопут- ствующей сердечной недостаточности. Обладают ренопро- текторным эффек- том, уменьшают массу миокарда ле- вого желудочка, не вызывают рефлек- торного повышения сосудистого тонуса, не влияют на уро- вень липидов в крови расстройства вкуса, сыпь, ангионевроти- ческий отек мембранозная гло- мерулонефропатия (каптоприл в боль- ших дозах). Могут вызывать острую почечную недоста- точность при дву- стороннем выра- женном стенозе почечных артерий, повышение уровня К+ в крови при хронической почечной недостаточности почечная недостаточность (уменьшить дозу), реноваскулярная артериальная гипертензия
Блокаторы То же Антиангинальный и Гиперемия Замедление атрио- Атриовентрику- Тяжелая сердечная
Са’*- ангиаригмический кожи, отеки, вентрикулярной лярная блокада недостаточность
каналов (верапамил) эффек- ты. Расширяют коронарные и моз- говые сосуды. Уменьшают массу миокарда левого желудочка. головная боль, рефлекторная тахикардия (нифедипин), брадикардия, усугубление сердечной проводимости (верапамил) II—III степени (верапамил) (верапамил). Та- ким больным противопоказано сочетание с 0-адре- ноблокаторами; осторожно сочетать с гликозидами
Продолжение табл. 40
Препараты Гемодинамический эффект Преимущества Побочные эффекты Противопоказания Ситуации, требующие соблюдения особой осторожности
явные скрытые
Эффективны у больных пожилого возраста, при болез- ни периферических сосудов. Не влияют на содержание липидов в крови недостаточ- ности, запоры (верапамил)
Централь- Снижение МОС Не вызывают Седативный эф- Гемолитическая Ортостатическая
ные с^-адре- рефлекторное фекг, сухость во анемия, наруше- артериальная
ностимуля- повышение рту, заложенность ние функции гипотензия,
торы симпатического тонуса и не повышают содержание липидов в крови. Дешевы носа, задержка печени болезни печени жидкости, орто- (а-метилдофа) (а-метилдофа) статическая арте- риальная гипо- тензия, сниже- ние потенции, рибаунд -синд- ром (клофелин)
а-Адрено- Периферическая Не снижают МОС, Ортостатическая Ортостатическая
блокаторы вазодилатация не изменяют содер- жание липидов в крови; менее вы- ражена рефлектор- ная тахикардия по сравнению с дру- гими вазодилата- торами артериальная артериальная гипотензия, гипотензия гипотензия и синкопе "1-й дозы", задержка жидкости, седа- тивный эффект, слабость, "приливы"
Антиядре- То же
нергические
препараты
перифери-
ческого
действия
Дешевы
Миотроп-
ные вазо-
дилататоры
Эффективны при
хронической почеч-
ной недостаточ-
ности (гидралазин).
Полезны в рефрак-
терных случаях
(миноксидил.)
Депрессия, кош-
мары, седатив-
ный эффект,
Пептическая язва
(резерпин); сни-
жение потенции;
ортостатическая
артериальная
гипотензия,
снижение АД
При физической
нагрузке
(гуанетидин)
Задержка жидко-
сти, гирсутизм,
периферические
отеки; рефлек-
торное повыше-
ние симпатиче-
ского тонуса и
ЧСС, "прили-
вы", головная
боль, синдром
системной крас-
ной волчанки
(гидралазин
> 200 мг/сут)
Пептическая язва,
депрессия,
ортостатиче ская
артериальная
гипотензия
Тяжелая
коронарная и
церебральная
недостаточность
Расслаивающая Тяжелая ИБС
аневризма аорты,
системная красная
волчанка
(гидралазин)
Таблица 41. Средства антигипертензивной терапии: дозы, показания
| Группа препаратов | Препарат | Начальная доза, мг | Средняя доза, мг Показания
Диуретики
тиазидовые Гипотиазид 12,5-25 (1 раз) 12,5-50 (1 раз) Монотерапия при мягкой артериальной пшер- тензии, особенно гипоренинной, у больных пожилого возраста, или в сочетании с другими препаратами
петлевые Фуросемид 40-80 (1 раз) 40-80 (1—Зраза) Вспомогательные средства при тяжелой и
Эгакриновая 25-50 (1 раз) 25—50 (1-3 раза) злокачественной артериальной гипертензии,
кислота особенно при хронической почечной недостаточности
калийсберегающие Спиронолактон 25 (1 раз) 50—100 (1 раз) Гиперминералокортицизм. Вспомогательные
Амилорид 5 (1 раз) 5-10 (1 раз) средства при лечении салуретиками, особенно
Триамтерен 25 (1 раз) 50-10 (1 раз) тиазидовыми
/УАдреноблокаторы Некардиоселекгив- Пропранолол 20-40 (2 раза) 40—120 (2 раза) Монотерапия при мягкой и умеренной артери-
ные Надолол 20 (1 раз) 40—80 (2 раза) альной гипертензии, особенно гиперкинети-
Тимолол 5 (2 раза) 10-20 (2 раза) ческого и гиперренинного типа, или в сочета-
Пиндолол 5 (2 раза) 5-20 (2 раза) нии с другими препаратами
Окспренолол 20—40 (2 раза) 40—120 (2 раза)
Кардиоселективные Ацебутолол 400 (1 раз) 400-800 (1 раз)
Атенолол 25 (1 раз) 50-100 (1 раз)
Метопролол 25—50 (2 раза) 25-150 (2 раза)
«'-/З-Адренобло- Лабеталол 100 (2 раза) 100—400 (2 раза)
каторы Ингибиторы АПФ Каптоприл 12,5—25 (2 раза) 50—150 (в 2-3 приема) Монотерапия при умеренной, иногда тяжелой
Эналаприл 2,5-5 (1 раз) 5—40 (в 1—2 приема) артериальной гипертензии; реноваскулярная
Лизиноприл 5-10 (1 раз) 10—40 (1 раз) артериальная гипертензия (односторонний
Рамиприл 2,5(1 раз) 5-10 (1 раз) стеноз)
Блокаторы кальциевых каналов Верапамил 40—80 (3 раза) 120—360 (3 раза) Монотерапия при мягкой и умеренной
Дилтиазем 30 (3 раза) 90—180 (Зраза) артериальной гипертензии
Нифедипин
Фелодипин
Исрадипин
Никар дипин
Антиадренергические
препараты
Центральные Клофелин
адреностимулягоры а-метилдофа
а-Адреноблокаторы периферического действия Празозин Теразозин
Антиадренергиче- ские препараты периферического действия Резерпин
Гуанетидин
Прямые
(миотропные)
вазодилататоры
Гидралазин
Миноксидил
10—25 (2—3 раза) 25—100 (2 раза)
2,5—5 (1 раз) 5—10 (2 раза)
10 (Зраза) 5—10 (1 раз) 2,5 (2 раза) 10 (2 раза) 10—30 (3 раза) 10-20 (1 раз) 2,5-10 (2 раза) 20—40 (2 раза)
0,075 (2 раза) 0,15—0,3 (2—4 раза) Монотерапия при мягкой и умеренной
250 (3 раза) 250—500 (3—4 раза) артериальной гипертензии. а-Метилдофа эффективен при начальной хронической почечной недостаточности в комбинации с другими препаратами
0,5-1 (на ночь) 1-7,5 (2 раза) Мягкая или умеренная артериальная
1 (1 раз) 1—20 (1 раз) гипертензия при неэффективности других стредсгв, эффективны при хронической почечной недостаточности
0,05—0,1 (1 раз) 0,1-0,25 (1 раз) Из-за выраженных побочных эффектов и наличия лучших препаратов в настоящее время практически не используется
12,5(I раз) 25-50 (1 раз) Умеренная и тяжелая артериальная гипертен- зия при неэффективности других средств
Вспомогательное средство при умеренной и
тяжелой артериальной гипертензии.
Эффективен при хронической почечной
недостаточности в комбинации с другими
препаратами. Миноксидил используется редко,
при неэффективности других средств
снижается в среднем на 20 мм рт.ст., а диастолическое — на 10—15 мм рт.ст.
Лечение начинают с назначения 12,5—25 мг гипотиазида 1 раз в сутки. При
отсутствии эффекта к концу 2-й недели дозу постепенно повышают до 50 мг.
Если при этом через 1 мес АД не снижается до желаемого уровня, тактику
лечения меняют. В связи с аддитивным эффектом мочегонных средств по
отношению к другим препаратам при их сочетанном применении во избе-
жание чрезмерного снижения АД дозу мочегонного средства либо другого
препарата следует уменьшить на 50 %.
Петлевые диуретики фуросемид и этакриновую кислоту (урегит)
при артериальной гипертензии используют реже, чем тиазидовые, из-за бо-
лее короткого действия (до 6 ч), большего натрийуретического и меньшего
антигипертензивного эффекта. Уменьшая транспорт Na+, К+, СГ на всем
протяжении восходящего отдела петли Генле, они могут приводить к гипо-
натриемии, гипокалиемии, гипохлоремии, а также, за счет потери Н+, к
метаболическому алкалозу. В отличие от тиазидовых диуретиков “потолок”
дозы этих препаратов довольно высок. Так, дозировка фуросемида составля-
ет от 20—40 мг в сутки при артериальной гипертензии и до 200 мг и более в 2
приема — при сердечной недостаточности. Препарат эффективен при хрони-
ческой почечной недостаточности, когда он может даже несколько увеличи-
вать клубочковую фильтрацию. Поскольку он достигает своего места дей-
ствия в петле Генле только после фильтрации в просвет проксимального
канальца, при снижении клубочковой фильтрации дозу необходимо повы-
сить. В тяжелых случаях она составляет до 1 и даже до 2 г в сутки. Побочные
эффекты зависят от дозы и, кроме нарушений водно-электролитного ба-
ланса и гипохлоремического алкалоза, включают гиперурикемию, повыше-
ние содержания атерогенных липидов в плазме крови и обратимую ототок-
сичность. Гипокалиемия выражена относительно меньше, чем при приеме
тиазидовых диуретиков. Гиповолемия может приводить к преренальной азо-
темии. Снижение концентрации Na+ в провизорной моче проксимальнее macula
densa активирует секрецию ренина.
К калийсберегающим диуретикам относятся прямые и непря-
мые антагомисты альдостерона. Спиронолактон (верошпирон, альдактон),
блокируя действие эндогенных минералокортикоидов путем воздействия на
внутриклеточные рецепторы, тормозит обмен Na+ на К+ в дистальных по-
чечных канальцах и собирательных трубках. Амилорид (модуретик) и три-
амтерен, косвенные антагонисты альдостерона, снижают факультативную
реабсорбцию Na+ в дистальных отделах нефрона вследствие уменьшения про-
ницаемости для него апикальной мембраны клеток канальцев. При этом они
косвенно “экономят” К+ и Mg2+. В отличие от спиронолактона эти препара-
ты эффективны при любом уровне альдостерона. Вследствие слабого моче-
гонного эффекта калийсберегающие диуретики, как правило, не имеют са-
мостоятельного значения при лечении артериальной гипертензии и сердеч-
ной недостаточности, за исключением спиронолактона при первичном ги-
перальдостеронизме и, возможно, в ряде случаев при сопутствующих сахар-
ном диабете и подагре. Во избежание гиперкалиемии их не следует сочетать с
ингибиторами АПФ, а также применять при хронической почечной недо-
статочности. Триамтерен может ухудшать функцию почек и приводить к по-
вышению содержания креатинина в сыворотке крови. Спиронолактон, из-
меняя метаболизм тестостерона, может вызывать гинекомастию, гирсутизм
и снижение потенции.
Р-Адреноблокаторы, как и тиазидовые диуретики, относятся к пре-
паратам I ряда при лечении артериальной гипертензии. Их гипотензивный
эффект обусловлен: 1) уменьшением МОС вследствие блокирования влия-
ния симпатико-адреналовой системы на сердце; 2) снижением опосредуемой
симпатической частью вегетативной нервной системы секреции ренина клет-
ками юкстагломерулярного аппарата за счет блокады их р2-адренорецепторов
и, следовательно, уменьшением ОПСС. Благодаря такому действию они осо-
бенно эффективны в сочетании с периферическими вазодилататорами и мо-
чегонными средствами. Их преимуществами являются дополнительный анти-
аритмический и антиангинальный эффекты, а также “защитное” действие у
больных, перенесших инфаркт миокарда. Препараты практически не изменя-
ют почечный плазмоток и клубочковую фильтрацию. У больных сахарным
диабетом, которые принимают инсулин, они могут маскировать тахикар-
дию, потливость и другие признаки гипогликемии, и обладают рядом других
побочных свойств (см. табл. 40).
Как показали результаты многоцентровых исследований, наиболее частыми
осложнениями фармакотерапии p-адреноблокаторами, которые явились при-
чиной их отмены, были одышка, сонливость и апатия, а у женщин также
похолодание конечностей. Препараты оказывали относительно слабо выражен-
ное отрицательное влияние на уровень общего холестерина в плазме крови и
более значительное - на содержание холестерина ЛПВП и триглицеридов.
Различные препараты, отличаясь продолжительностью действия, раство-
римостью в липидах, внутренней симптоматической активностью и кардио-
селективностью, обладают одинаковой способностью снижать АД. При при-
менении средних терапевтических дозировок препаратов снижение среднего
гемодинамического АД составляет 10—40 (в среднем 20) мм рт.ст. Преиму-
щества некоторых препаратов связаны с меньшей выраженностью побочных
эффектов, и в целом невелики. Так, кардиоселективные p-адреноблокаторы
менее склонны вызывать перемежающуюся хромоту, похолодание конечно-
стей и нарушать мобилизацию глюкозы. Отрицательное влияние на показа-
тели липидного обмена оказывают в большей степени неселективные р -адре-
ноблокаторы, в меньшей — кардиоселективные и оно почти отсутствует у
пиндолола, обладающего наиболее выраженной внутренней симпатомиме-
тической активностью из всех препаратов этой группы. Легче подбирать дозу
при использовании препаратов, которые практически не метаболизируются
в печени, что не изменяет их первоначальный р-адреноблокирующий эф-
фект. К ним относятся атенолол и надолол. Эти средства имеют значительно
большую продолжительность действия — 24 ч.
В силу механизма своего действия р-адреноблокаторы эффективны преж-
де всего при гиперренинной артериальной гипертензии. В то же время по не
439
вполне ясным причинам они дают хороший антигипертензивный эффект и
при гипоренинемии. Хотя продолжительность полужизни большинства пре-
паратов составляет около 6 ч, при артериальной гипертензии их обычно дос-
таточно назначать 2 раза в сутки, а некоторые препараты с большей дли-
тельностью действия (атенолол, надолол) — даже 1 раз. Начинать лечение
следует с малых доз с последующим постепенным их повышением каждые
несколько дней до достаточного снижения АД при сохранении хорошей пе-
реносимости.
При отсутствии противопоказаний с назначения p-адреноблокаторов час-
то начинают лечение артериальной гипертензии, особенно у лиц молодого
возраста при гиперкинетическом типе гемодинамики. Они эффективны так-
же в сочетании с другими препаратами, в частности, мочегонными.
Теоретически обоснованной и в ряде случаев эффективной является блока-
да одновременно а- и р-адренорецепторов. При этом блокада а-адренорецеп-
торов предотвращает компенсаторную вазоконстрикцию, которая может воз-
никать при блокаде p-адренорецепторов, а блокада р-адренорецепторов мо-
жет предотвращать рефлекторную тахикардию и увеличение МОС как след-
ствия вазодилатации. Таким комбинированным действием обладает лабеталол.
Ингибиторы АПФ.В основе гипотензивного эффекта ингибиторов
АПФ лежит их способность тормозить превращение ангиотезина I в актив-
ную форму ангиотезин II. Возбуждая специфические рецепторы гладкомы-
шечных клеток артериол и, в значительно меньшей степени, вен, ангио-
тензин II вызывает повышение ОПСС, а путем увеличения секреции альдо-
стерона — возрастание ОЦП. Кроме этого, он оказывает прямое воздействие
на миокард, повышая его сократимость и ЧСС, и, обладая кининазной
активностью, способствует быстрой инактивации короткоживущих кини-
нов, имеющих вазодилататорные свойства. Таким образом, ингибирование
АПФ приводит одновременно к уменьшению прессорного и увеличению
депрессорного потенциала. При этом практически не изменяются или не-
много повышаются МОС, почечный кровоток и клубочковая фильтрация. В
отличие от других вазодилататоров, препараты не вызывают рефлекторного
повышения активности симпатико-адреналовой системы и задержки Na+ и
воды. К их преимуществам по сравнению с другими антигипертензивными
средствами относятся также отсутствие неблагоприятного влияния на ли-
пидный, пуриновый и углеводный обмен и половую функцию. Тормозя
активность альдостерона, препараты способствуют задержке К+, а при
длительном применении — уменьшают выраженность гипертрофии левого
желудочка.
Учитывая силу антигипертензивного действия, ингибиторы АПФ при-
меняют в случаях умеренной, тяжелой и злокачественной артериальной
гипертензии, при этом, как это ни парадоксально, они эффективны не
только при гипер-, но и при гипоренинном варианте. Целесообразность их
назначения в меньших дозах при мягкой артериальной гипертензии ограни-
чивается высокой стоимостью. Ингибиторы АПФ — препараты выбора при
реноваскулярной артериальной гипертензии с односторонним стенозом
440
почечной артерии, в то же время при выраженном двустороннем пораже-
нии или нефункционирующей второй почке вследствие чрезмерного рас-
ширения эфферентных почечных артериол они способны резко снижать
фильтрационное давление, клубочковую фильтрацию и приводить к ост-
рой почечной недостаточности. Этот эффект, однако, обусловливает не-
фропротекторное действие препаратов и уменьшение альбуминурии при
диабетической нефропатии. Их гипотензивный эффект резко возрастает в
случаях гиповолемии и гипонатриемии, вследствие чего за несколько дней
до их назначения следует отменить мочегонные средства и начинать лече-
ние с малых доз.
Различные представители этой группы отличаются главным образом про-
должительностью своего действия. Оно наиболее короткое (до 24 ч) у пре-
паратов I поколения — каптоприла (капотена, лопирина, тензиамина), ко-
торый назначают 2 раза в сутки, и наиболее длительное у лизиноприла и
рамиприла. Эти препараты достаточно принимать 1 раз в сутки. Эналаприл
занимает промежуточное положение и его назначают 1 или 2 раза в сутки.
В дозах, эквивалентных 75 мг каптоприла в сутки, побочные эффекты,
как правило, отсутствуют. Они могут развиваться при увеличении дозы. Наи-
более распространенные из них связаны с вазодилатацией и включают го-
ловную боль, “приливы” и отеки. У 5—10 % больных отмечается упорный
сухой кашель неясного генеза. Возможны также нарушения вкуса и сыпь,
изредка, преимущественно при приеме каптоприла, — нейтропения и про-
теинурия. Последняя обусловлена мембранозной гломерулопатией и разви-
вается в основном при наличии патологии почек и приеме высоких доз пре-
парата (более 150 мг каптоприла в сутки). Функция почек при этом, од-
нако, не ухудшается. При хронической почечной недостаточности дозу пре-
парата следует уменьшить, так как возможна гиперкалиемия.
В целом, по сравнению с другими средствами, наилучшее самочувствие
больным с артериальной гипертензией обеспечивают ингибиторы АПФ (за
исключением случаев возникновения кашля) и блокаторы кальциевых кана-
лов (за исключением запоров, см. ниже). Эти препараты приближаются к
“идеальным” антигипертензивным средствам. Так, при мягкой артериаль-
ной гипертензии жалобы, связанные с применением ингибиторов АПФ,
отмечаются у 3 % больных, тогда как при приеме мочегонных препаратов
или р-адреноблокаторов — у 10-20 %. Хотя допустимая суточная доза кап-
топрила составляет 200—300 мг, опыт показывает, что максимальный тера-
певтический эффект достигается при значительно меньших дозах — 150 мг и
менее и существенно не возрастает при увеличении дозы. При недостаточ-
ном антигипертензивном действии монотерапии дополнительно можно на-
значить небольшие дозы мочегонного препарата (кроме калийсберегающих
диуретиков) или блокатора кальциевых каналов.
Блокаторы кальциевых каналов. Антигипертензивное действие
блокаторов кальциевых каналов обусловлено дилатацией артериол путем
селективного торможения медленного тока Са2+ в цитоплазму гладко-
441
мышечных клеток сосудистой стенки и, следовательно, уменьшения коли-
чества ионов, участвующих в генерировании сокращения. Они относятся к
препаратам I—II ряда для лечения артериальной гипертензия и приближают-
ся к “идеальным” гипотензивным средствам, так как снижают ОПСС при
всех формах артериальной гипертензии независимо от гемодинамического
профиля и активности ренина, и могут быть использованы в качестве моно-
терапии. Препараты обладают антиатерогенным и антиагрегантными свой-
ствами. Расширяя почечные артериолы и увеличивая кровоток в почках, они
повышают клубочковую фильтрацию и выделение Na+, оказывая тем самым
нефропротекторное действие. Препараты обладают бронходилатирующим
свойством, не изменяют выделение ренина и катехоламинов, не нарушают
умственную работоспособность, углеводный, липидный, пуриновый и элект-
ролитный обмен. Они улучшают диастолическую функцию левого желудоч-
ка и при длительном применении способствуют обратному развитию его
гипертрофии. Они особенно ценны при сочетании артериальной гипертен-
зии со стенокардией, прежде всего, вазоспастической, а также с суправентри-
кулярными аритмиями (верапамил).
Различные представители блокаторов кальциевых каналов одинаково эф-
фективны в лечении артериальной гипертензии, но отличаются своим дей-
ствием на сократимость миокарда, автоматизм и проводимость. Так, произ-
водные дигидропиридина обладают практически исключительным вазодила-
тирующим свойством и не оказывают существенного влияния на сердце. Это
определяет характер их побочных эффектов, связанных с выраженным рас-
ширением артериол (рефлекторная тахикардия, отек стоп из-за местного
снижения тонуса прекапиллярных сфинктеров, головная боль, “приливы”).
Верапамил угнетает автоматизм синусового узла, вызывая брадикардию, а
также атриовентрикулярную проводимость и сократимость миокарда, вызы-
вая соответствующие побочные реакции. Дилтиазем по своим свойствам бли-
же к верапамилу.
В сочетании с дигоксином верапамил повышает его уровень в крови на
50—70 % в течение недели, что способствует развитию интоксикации и тре-
бует снижения величины поддерживающей дозы гликозида. Такая комбина-
ция может усугублять брадикардию и атриовентрикулярную блокаду. Неже-
лательно сочетание верапамила с р-адреноблокаторами из-за отрицательно-
го инотропного и брадикардитического действия обоих препаратов. Все бло-
каторы кальциевых каналов, особенно верапамил, вызывают запоры.
Верапамил (40—80 мг 3 раза в сутки) в качестве монотерапии можно
использовать при мягкой артериальной гипертензии. Нифедипин (10-30 мг
3 раза в сутки) из-за рефлекторной тахикардии редко применяют изолиро-
ванно (только при брадикардии), чаще его используют в качестве препарата
II ряда в сочетании с р-адреноблокаторами. Нифедипин (адалат) и никарди-
пин при внутривенном введении и сублингвальном приеме быстро и значи-
тельно снижают АД, поэтому их назначают при гипертонических кризах.
Для поддерживающей антигипертензивной терапии эффективны медленно
442
освобождающиеся формы, которые имеются для большинства препаратов, и
их можно принимать 1 раз в сутки.
Кантиадренергическим препаратам центрального дей-
ствия относятся клонидин (клофелин, гемитон, катапрессан), а-метилдо-
фа (допегит), а также менее распространенные гуанабенз и гуанфисин. Их
антигипертензивный эффект основан на стимуляции пресинаптических а2-
адренорецепторов депрессорных нейронов сосудодвигательного центра ство-
ла мозга, что приводит к уменьшению симпатической стимуляции на пери-
ферию и снижению АД. При этом барорецепторный рефлекс остается интакт-
ным. Вследствие такого механизма при внутривенном введении препаратов
возможно начальное преходящее адреномиметическое действие с повышени-
ем АД. Гипотензивный эффект этих препаратов,особенно клофелина, в зна-
чительной мере обусловлен также торможением секреции ренина вследствие
уменьшения симпатического тонуса. Предполагают, что они обладают спо-
собностью тормозить синтез и освобождение норадреналина из центральной
нервной системы. В отличие от клонидина, оказывающего преимущественно
центральное действие, а-метилдофа обладает,кроме того, анти-
адренергическим влиянием на периферические нервные окончания в каче-
стве ложного медиатора. Расходуя активность дофаминдекарбоксилазы, кото-
рая обеспечивает превращение ДОФА в дофамин, препарат подвергается де-
карбоксилированию с образованием малоэффективных а-метилированных ка-
техоламинов (а-метилнорадреналина и а-метилдофамина). Эти вещества всту-
пают в конкурентный антагонизм с нейромедиаторами, тем более успеш-
ный, что они резистентны к моноаминоксидазе, переполняют и блокируют
депо, не допуская поступления туда норадреналина. Благодаря наличию у них
некоторой симпатомиметической активности, полный симпатолитический
эффект не наступает.
Гемодинамическое действие препаратов этой группы обусловлено сниже-
нием ОПСС. Их существенными преимуществами являются отсутствие умень-
шения УОС (кроме больших доз клофелина) и редкость возникновения ор-
тостатической артериальной постуральной гипотензии, что обеспечивает бе-
зопасность их применения у больных с сопутствующей коронарной и цереб-
ральной недостаточностью. Имеются сообщения о снижении уровня холес-
терина при лечении клофелином. а-Метилдофа наиболее эффективен при
беременности и у больных с патологией почек, так как благодаря особенно
выраженному расширению почечных артериол он увеличивает почечный кро-
воток и клубочковую фильтрацию, что позволяет применять его при уме-
ренно выраженной хронической почечной недостаточности.
Побочные явления относительно нетяжелые. Чаще всего отмечаются сон-
ливость и вялость. При длительном применении, как и другие препараты,
расширяющие периферические артериолы, они увеличивают реабсорбцию NaT
и воды, повышают ОЦП и могут приводить к появлению отеков. Преобла-
дание парасимпатического тонуса часто вызывает угнетение секреции
слюнных желез и сухость во рту, набухание слизистой оболочки носа и его
443
заложенность, увеличение секреции соляной кислоты в желудке, способ-
ствующее возникновению пептической язвы. Из-за снижения симпатиче-
ского тонуса возможно снижение либидо.
Особенностью действия клофелина является синдром отмены после пре-
кращения его приема, обусловленный резким повышением активности сим-
патической части вегетативной нервной системы. При этом отмечаются уве-
личение АД, головная боль, боль в животе, тошнота, чувство тревоги. Выра-
женность этих проявлений зависит от дозы препарата. Большие дозировки
параллельно со снижением УОС могут вызывать брадикардию.
а-Метилдофа, в отличие от клофелина, иногда вызывает иммунные ре-
акции в виде повышения температуры тела, гемолитической анемии, агра-
нулоцитоза, гепатита, которые обычно исчезают при отмене препарата. У
20—30 % больных отмечается бессимптомный положительный тест Кумбса. В
связи с этим препарат противопоказан при активном гепатите и циррозе
печени, а в процессе лечения необходим контроль гемограммы и показате-
лей функции печени.
В последние годы, учитывая седативный и парасимпатический эффекты
клофелина и а-метилдофа и появление других, более действенных препара-
тов, не имеющих указанных побочных свойств, их используют реже. Исклю-
чение составляет применение а-метилдофа при беременности. Хотя клофе-
лин обладает более сильным антигипертензивным действием, чем а-метил-
дофа, тиазидовые диуретики и препараты раувольфии, в качестве монотера-
пии оба средства можно применять только при мягкой артериальной гипер-
тензии. Наиболее эффективна их комбинация с тиазидовыми диуретиками,
при которой зачастую бывает достаточно небольших доз обоих препаратов.
Клофелин иногда используют также вместо p-адреноблокаторов при проти-
вопоказаниях к ним в трехкомпонентной схеме лечения тяжелой артериаль-
ной гипертензии.
Клофелин назначают обычно начиная с 0,075 мг 2 раза в сутки и посте-
пенно увеличивают дозу. Средняя суточная доза составляет 0,5-0,6 мг, мак-
симальная — 2,4 мг (практически не применяется). В связи с коротким дей-
ствием а-метилдофа назначают 3—4 раза в сутки. Начальная доза составляет
250 мг 3 раза в сутки, максимальная — 2 г в сутки. Оба препарата выпуска-
ются также в ампулах для парентерального введения (клофелин в виде ра-
створа по 1 мл - 0,01 %).
Ганглиоблокаторы (пентамин, триметафанакамсилат, или арфо-
над) блокируют ацетилхолиновую медиацию в ганглиях вегетативной нерв-
ной системы. Нарушение синаптической передачи в ее симпатическом отделе
приводит к уменьшению тонуса артериол со снижением ОПСС и АД и од-
новременно к уменьшению тонуса вен с депонированием крови в органах
брюшной полости и конечностях и снижением эффективно циркулирующе-
го объема крови. Изменения со стороны парасимпатической части вегетатив-
ной нервной системы проявляются нарушением аккомодации, парезом ки-
шечника (метеоризм, запор) и желчного пузыря, задержкой мочи. Препараты
444
вводят только парентерально, в основном внутривенно, при гипертоничес-
ких кризах, противопоказаны при феохромоцитоме.
Блокаторы а-адренорецепторов дают умеренный антигипер-
тензивный эффект вследствие расслабления гладкой мускулатуры сосудис-
той стенки и уменьшения ОПСС, а также тонуса вен. К ним относятся:
а) блокаторы одновременно пресинаптических (а2) и постсинаптических (а.)
адренорецепторов (фентоламин, син. регитин и тропафен); б) блокаторы толь-
ко постсинаптических а ]-адренорецепторов - празозин (пратсиол, мини-
прес), теразозин, доксазозин.
Вследствие развития толерантности за счет блокады пресинаптических ре-
цепторов и кратковременного действия фентоламин используют главным
образом для купирования гипертонических кризов и является препаратором
выбора при феохромоцитоме.
а)-Адреноблокаторы более эффективны, поскольку при избирательной
блокаде постсинаптических а,-рецепторов сохраняется действие пресинап-
тических а2-рецепторов, в результате которого подавляется освобождение
норадреналина нервными окончаниями. Поскольку расширяются и артерио-
лы, и вены, они эффективны при сопутствующей застойной сердечной не-
достаточности. К преимуществам этих препаратов относятся также положи-
тельное влияние на содержание общего холестерина и холестерина ЛПВП в
плазме крови, возможность применения при бронхоспазме, заболеваниях
периферических сосудов и хронической почечной недостаточности. Их
побочными эффектами являются свойственные большинству вазодилатато-
ров задержка Na+ и воды с увеличением ОЦП, рефлекторное повышение
симпатического тонуса (тахикардия) и головная боль. Серьезным недостат-
ком является выраженная ортостатическая артериальная гипотензия. Други-
ми побочными эффектами являются слабость, нарушение половой функции
и вазомоторный ринит, в связи с этим а,-адреноблокаторы редко использу-
ют в качестве монотерапии при мягкой и умеренной артериальной гипер-
тензии. Они находят применение преимущественно в комбинации с моче-
гонными средствами и р-адреноблокаторами при тяжелой артериальной ги-
пертензии. В связи с возможным “эффектом первой дозы” в виде постураль-
ной гипотензии с возникновением синкопе лечение начинают с малой дозы,
которую принимают на ночь (празозин по 0,5 мг, теразозин - по 1 мг).
Постепенно ее повышают и назначают празозин по 6-15 мг в 2 приема и
теразозин по 4 мг в 1 прием. У некоторых больных может развиться толерант-
ность к празозину.
а-Адреноблокирующими свойствами обладают также пирроксан, произ-
водные фенотиазина (аминазин, дроперидол, галоперидол и др.), а также
дигидроэргокристин и эрготоксин, которые вместе с мочегонным средством
входят в состав сложного антигипертензивного препарата бринердина.
К периферическим антиадренергическим препаратам
относятся резерпин (рауседил, серпазил) и гуанетидин (изобарин, исме-
лин, октадин, бетанидин).
Алкалоид раувольфии резерпин наряду с периферическим оказывает
центральное действие. В его основе лежит блокада обратного захвата норад-
реналина в гранулы булавовидных расширений аксона, так называемого ре-
зервного фонда, где он находится в неактивной стабильной форме в соеди-
нении с белками, Са2+, Mg2+. Это приводит к истощению запасов медиатора
в периферических окончаниях симпатических нервов, а также в централь-
ной нервной системе, куда препарат, хорошо растворимый в липидах, про-
никает через гематоэнцефалический барьер, что обусловливает его выра-
женный седативный эффект. При парентеральном введении он влияет также
непосредственно на гладкую мускулатуру сосудистой стенки.
В настоящее время в качестве монотерапии резерпин практически не ис-
пользуют из-за очень узкого диапазона терапевтического действия: его ма-
лые дозы (менее 0,05-0,1 мг в сутки) неэффективны, а большие вызывают
серьезные побочные реакции. К ним относятся депрессия с суицидальными
попытками, тяжелые ночные кошмары, снижение половой функции, уси-
ление паркинсонизма и тремора у больных пожилого возраста. Повышение
тонуса парасимпатической части вегетативной нервной системы вызывает
усиление желудочной секреции, что способствует развитию пептических язв,
а также заложенность носа и понос. Препарат вызывает брадикардию, ухуд-
шение атриовентрикулярной проводимости, задерживает Na+ и воду, а так-
же повышает аппетит, что приводит к увеличению массы тела. При паренте-
ральном применении максимальный гипотензивный эффект наступает по-
здно — через 1—3 ч, что неудобно. В связи с этим при наличии более эффек-
тивных и менее токсичных препаратов резерпин назначают только в малых
дозах (не более 0,1 мг в сутки) в составе сложных препаратов (адельфана и
др.) или в сочетании с мочегонными средствами и гидралазином, преиму-
щественно больным молодого возраста. Он противопоказан при выражен-
ном церебральном атеросклерозе, депрессии, язвенной болезни, брадикар-
дии. Резерпин нежелательно назначать в комбинации с гликозидами, кото-
рые снижают порог его токсического действия, а также с другими препара-
тами, дающими седативный эффект.
В основе антигипертензивного эффекта гуанетидина лежат наруше-
ние обратного захвата норадреналина из синаптической щели в его мобиль-
ный фонд в нервных окончаниях и опустошение этого фонда. В результате
постепенно истощается и резервный фонд медиатора (медленный кумуля-
тивный эффект), развивается “фармакологическая симпатэктомия”. Благо-
даря такой кумуляции при неизмененной дозе гуанетидина ее эффект по-
степенно, в течение 1—2 нед, нарастает и столь же длительно сохраняется
после отмены препарата. Блокирование выхода норадреналина при
адренергической стимуляции препятствует рефлекторной ортостатической ва-
зоконстрикции артериол и вен, вплоть до ортостатического коллапса. По той
же причине действие препарата резко возрастает при физической и эмоцио-
нальной нагрузке, что может оказаться выгодным. При этом, однако, значи-
тельно повышается чувствительность к катехоламинам, вследствие чего гуа-
нетидин может провоцировать кризы при феохромоцитоме. К недостаткам
446
препарата относятся также уменьшение МОС, и, вследствие этого, почеч-
ного кровотока и клубочковой фильтрации с более выраженной, чем при
использования других препаратов, задержкой Na+ и воды, а также сниже-
ние мозгового кровотока, особенно в вертикальном положении. Из всех ан-
тигипертензивных средств гуанетидин обладает наибольшим постуральным
эффектом, чему способствует вызываемое им снижение тонуса вен. При этом
возможно развитие острой ишемии миокарда, вплоть до инфаркта, и нару-
шения мозгового кровообращения. Он угнетает потенцию, вызывает бради-
кардию и осложнения, связанные с повышением парасимпатического тону-
са, а также развитие толерантности.
Гуанетидин является одним из самых мощных антигипертензивных пре-
паратов, который раньше широко применяли для лечения наиболее тяжелых
и злокачественных форм артериальной гипертензии. В настоящее время из-за
опасных побочных эффектов и появления других сильнодействующих средств
его применяют крайне ограниченно, преимущественно как дополнение к
комбинации из 2-3 препаратов (мочегонные средства, вазодилататоры). Гуа-
нетидин назначают 1 раз в сутки утром, начиная с 12,5 мг, постепенно, раз
в 4-7 дней, увеличивая дозу до 25—100 мг. АД начинает снижаться через 4-
7 дней, прежде всего в утренние часы и особенно в вертикальном положе-
нии. При этом ишемия мозга может способствовать рефлекторному повыше-
нию АД в дневное время, вплоть до развития криза. Весьма неудобным
является то, что при передозировке, несмотря на отмену препарата, для его
элиминации необходимо 3-5 дней. Гуанетидин противопоказан при хрони-
ческой почечной недостаточности, тяжелом коронарном и церебральном ате-
росклерозе, язвенной болезни. Его нельзя сочетать с другими антиадренер-
гическими препаратами, особенно а-метилдофа и резерпином.
К прямым миотропным вазодилататорам относятся гидра-
лазин (апрессин), миноксидил, диазоксид и натрия нитропруссид. Гидра-
лазин действует непосредственно на гладкую мускулатуру стенки пери-
ферических артерий и артериол, вызывая ее расслабление и уменьшение ОПСС.
Емкость вен практически не изменяется, благодаря чему ортостатическая
гипотензия не развивается. Действие препарата на ОПСС частично нивели-
руется рефлекторным повышением симпатической активности, что приво-
дит к увеличению ЧСС и МОС. При этом возрастает и регионарный крово-
ток, в том числе почечный, благодаря чему гидралазин можно использовать
при хронической почечной недостаточности. В то же время рефлекторная
тахикардия, которая наблюдается при его приеме, является неблагоприят-
ный фактором, так как вызывает сердцебиение и может способствовать раз-
витию приступов стенокардии. Возникающее при этом повышение секреции
ренина приводит к задержке Na+ и воды, увеличению ОЦП с возможным
появлением отеков. Для нивелировки этих побочных эффектов гидралазин
назначают в сочетании с мочегонными средствами и препаратами, облада-
ющими антиадренергическими свойствами (p-адреноблокаторы, клофелин,
а-метилдофа и др.) и не применяют в качестве монотерапии, тем более, что
по силе своего антигипертензивного действия он занимает промежуточное
447
положение между мочегонными препаратами и алкалоидами раувольфии. Его
специфическим побочным свойством является способность вызывать при
длительном приеме больших доз (более 200 мг в сутки) волчаночноподоб-
ный синдром, обусловленный продукцией антинуклеарных антител. При
прекращении приема препарата эти явления обратимы. К числу возможных
побочных эффектов относятся также головная боль и понос. Начальная доза
гидралазина в комбинации с другими препаратами обычно составляет 10 мг
3—4 раза в сутки. Ее постепенно повышают до 25-50 мг 3-4 раза (или по
100 мг 2 раза) в сутки . Препарат можно назначать также внутримышечно и
внутривенно.
Миноксидил является мощным антигипертензивным препаратом,
который часто эффективен в рефрактерных случаях. Кроме побочных эф-
фектов, свойственных всем вазодилататорам, он особенно сильно задержи-
вает Na+ и вызывает гирсутизм, что ограничивает его применение у жен-
щин. Препарат используют при тяжелой артериальной гипертензии, особен-
но при начинающемся ухудшении функции почек, и только в комплексе с
другими препаратами, обычно мочегонным, р-адреноблокатором или анти-
адренергичееким средством. Начальная доза 2,5-5 мг в сутки в 2—3 приема с
постепенным повышением дозы до 20 мг.
Диазоксид (гиперстат) - производное тиазидов, лишенное, однако,
мочегонных свойств, применяется парентерально. Как и миноксидил, обла-
дает сильным и быстрым гипотензивным эффектом, снижая ОПСС на 25 %
через несколько минут после внутривенного введения в виде болюса. Дей-
ствие продолжается несколько часов. Обладает всеми побочными свойствами
периферических вазодилататоров, и, кроме того, может вызывать гипергли-
кемию. Применяют при гипертонических кризах и злокачественной артери-
альней гипертензии. В этих целях используют и натрия нитропруссид,
который является смешанным (артериолярным и венозным) вазодилатато-
ром. Его действие прекращается сразу после введения, и поэтому его назна-
чают только внутривенно капельно в дозе 0,5—8 мкг/кг/мин. Может вызы-
вать ортостатическую гипотензию из-за уменьшения венозного возврата.
Тактика лечении эссенциальной артериальной гипертензии. Цель лечения —
снижение АД у больных с систоло-диастолической артериальной гипертен-
зией до 140/90 мм рт.ст. и менее на протяжении максимально большей части
дня (при изолированной систолической атеросклеротической артериальной
гипертензии до 160/90 мм рт.ст. и менее).
Общие принципы медикаментозной терапии артериаль-
ной гипертензии:
1) во всех случаях, за исключением гипертонических кризов, АД следует
снижать постепенно. Это позволит предотвратить возможные осложнения
фармакотерапии, в частности усугубление ишемии миокарда и головного
мозга;
2) не следует допускать снижения АД до чересчур низкого уровня, так
как это может приводить к гипоперфузии жизненно важных органов и
способствовать замедлению кровотока и тромбообразованию. Доказано по-
448
вышение частоты инфарктов миокарда и летальности в случаях медикамен-
тозного снижения диастолического АД до 80-85 мм рт.ст. (’’эффект J”). Не-
обходимо иметь в виду, что нижний предел “уставки” уровня АД его регу-
ляторами для поддержания нормальной функции органов при артериальной
гипертензии повышен. У больных молодого возраста с тяжелой церебраль-
ной и коронарной недостаточностью гипотензия и резкие колебания АД
особенно нежелательны. Поэтому для них безопаснее поддерживать диасто-
лическое АД на уровне 100 мм рт.ст.
3) для предотвращения повреждения органов-мишеней или сведения его к
минимуму умеренная и тяжелая артериальная гипертензия требует непре-
рывного пожизненного лечения, так как при прекращении приема лекарств
артериальная гипертензия немедленно возобновляется, часто сопровождаясь
развитием синдрома отмены (рикошета). При мягкой артериальной гипертен-
зии со стойкой нормализацией АД с помощью медикаментозной терапии в
течение нескольких лет у 5-20 % больных АД остается нормальным после
прекращения терапии. Поэтому в таких случаях спустя 1—2 года можно сде-
лать попытку очень постепенно уменьшить дозу или количество принимае-
мых препаратов под контролем АД до отмены. Вероятность стойкой нормали-
зации АД после прекращения лечения низкая. В большинстве случаев продол-
жительность этого периода не превышает 1 года — 2 лет;
4) даже частичное медикаментозное снижение АД по своему влиянию на
течение артериальной гипертензии и ее исходы имеет существенные пре-
имущества по сравнению с полным отсутствием его коррекции;
5) для лучшей “податливости” больного, то есть выполнения им врачеб-
ных рекомендаций, следует стремиться назначать минимальное количество
препаратов с возможно меньшей кратностью их приема.
Подход к лечению различных вариантов артериальной
гипертензии.При пограничной артериальной гипертензии показано пре-
имущественно немедикаментозное лечение — коррекция избыточной массы
тела, диеты, низкой физической активности и пр. Медикаментозную тера-
пию назначают только в симптоматичных случаях, особенно при сохране-
нии тахикардии и низкой толерантности к физической нагрузке при отсут-
ствии эффекта от немедикаментозных методов. У лиц молодого возраста обыч-
но эффективны p-адреноблокаторы, а у пожилых - чаще тиазидовые диуре-
тики. В обоих случаях можно применять блокаторы кальциевых каналов.
Рекомендации ВОЗ (1986) по стратегии лечения больных с мягкой ар-
териальной гипертензией схематически представлены на схеме 21.
Существует две основные стратегии медикаментозной терапии больных
с эссенциальной артериальной гипертензией - поэтапная (ступенчатая) и
альтернативная ей более современная “стратегия замены”.
Поэтапная (ступенчатая) п р о г р а м м а , разработанная Наци-
ональным комитетом США по выявлению и лечению артериальной гипер-
тензии в 1988 г., предусматривает постепенное увеличение дозы (то есть
силы) и разнообразия назначаемых лекарственных препаратов (Joint National
Committee, 1988).
449
Подход к больным с мягкой АГ
Определение-- диастолическое АД (5~я сааза) 90-10А мм рт.ст.
Вез поражения органов-мишеней
Целы снижение диастолического АД<90 мм рт.ст.
Начать немедикаментозное лечение
Мониторировать АД В течение Змее
Рекомендовать бросить курить
Диастолическое АД <100 мм рт.ст.
продолжать немедикаментозное
Диастолическое АД > 100 мм рт. ст.
Начать медикаментозное
лечение
лечение и измерение АД
В течение 6мес
АД < 95 мм рт.ст. АД >95 мм рт. ст.
I I
Продолжить немедикаментозное Начать медикаментозное
лечение и контроль АД
лечение
Схема 21. Подход к лечению больных с мягкой артериальной гипертензией согласно
рекомендациям ВОЗ (1986)
На I этапе назначают тиазидовый диуретик, начиная с минимальной
дозы с постепенным ее повышением по необходимости. Снижение уровня
калия в плазме крови менее 3,3 ммоль/л при одновременном приеме глико-
зидов требует добавления препаратов калия или калийсберегающего диуре-
тика. При недостаточной эффективности или развитии побочных эффектов
препарата, как явных, так и скрытых, выявляемых лишь с помощью специ-
альных методов, переходят ко II и затем к III этапу.
На II этапе добавляют второй препарат - p-адреноблокатор или одно из
антиадренергических средств (а-метилдофа и др.), реже - блокатор кальциевых
каналов с постепенным повышением его дозы. Перед этим возвращаются к
вопросу о возможности симптоматической артериальной гипертензии.
На III этапе в программу лечения включают третий препарат - вазо-
дилататор (гидралчзин, блокатор кальциевых каналов группы дигидропири-
дина, ингибитор 1 Л Ф). В связи с вызываемой вазодилататорами рефлектор-
ной тахикардией их обязательно следует сочетать с симпатолитическим пре-
паратом. Поскольку резистентность к антигипертензивной терапии часто свя-
зана с недостаточным диурезом, необходимо еще больше ограничить по-
требление Na+ и попытаться увеличить дозу мочегонного препарата. Если,
несмотря на все эти меры, эффект лечения остается недостаточным, на IV
450
этапе дополнительно назначают гуанетвдин (или миноксидил) либо пре-
парат II этапа заменяют клофелином или празозином (группа резерва).
Согласно тактике, принятой в Европе, вместо мочегонного препарата на
I этапе лечения часто применяют p-адреноблокатор, которому отдают пред-
почтение у лиц молодого возраста с вероятной гиперренинемией и гиперки-
нетическим типом гемодинамики. На II этапе добавляют тиазидовый диуре-
тик, а на III — вазодилататор.
Широкое использование ступенчатой программы лечения позволило сни-
зить частоту инсультов, застойной сердечной недостаточности и летальность
больных с артериальной гипертензией на 40—50 %. В то же время этот подход
имеет ряд недостатков. Так, препарат I этапа может оказаться неэффектив-
ным, а увеличение его дозы способно усилить побочные явления. Это же
касается препарата II ряда. Сочетание нескольких лекарственных средств в
достаточно больших дозах может значительно расширять спектр осложнений
фармакотерапии и ухудшать качество жизни больных.
Альтернативным подходом к лечение мягкой и части случаев умеренной
артериальной гипертензии является так называемая стратегия замены.
Она базируется на подборе наиболее эффективного средства монотерапии
заболевания эмпирическим путем. Первоначальный выбор проводится с уче-
том многих факторов: возраста больного, гемодинамического и вероятного
ренинового профиля, клинических особенностей (наличие стенокардии, сер-
дечной недостаточности, аритмий, сахарного диабета, подагры, бронхоспазма,
заболеваний периферических сосудов, функции почек и печени и пр.), соци-
ально-психологических факторов (например, работы, связанной с напряжен-
ным умственным трудом или вниманием), а также преимуществ и недостат-
ков отдельных препаратов (см. табл. 40).
Средствами I ряда для проведения монотерапии являются: 1) мо-
чегонные; 2) p-адреноблокаторы; 3) блокаторы кальциевых каналов; 4) ин-
гибиторы АПФ. Последние два класса предпочтительнее благодаря лучшей
переносимости. В случаях побочных эффектов или противопоказаний к пре-
паратам этих 4 основных классов можно попытаться заменить их одним из
препаратов 3 групп резерва — антиадренергическим средством центрального
действия (клофелин), периферическим а-адреноблокатором (празозин) и в
отдельных случаях — прямым (миотропным) вазодилататором. При недоста-
точной эффективности первоначально выбранного препарата или проявле-
ниях нежелательных побочных действий его заменяют другим из иного класса.
Пытаться использовать для замены препараты одного и того же класёа обыч-
но нецелесообразно, так как они обладают примерно равным по силе гипо-
тензивным действием. Исключение составляют случаи замены, позволяю-
щие уменьшить выраженность неблагоприятных побочных эффектов. При
необходимости подбор оптимального препарата продолжают эмпирическим
путем. У большинства больных с мягкой и у части больных с умеренной
артериальной гипертензией монотерапия оказывается эффективной. Такой
подход позволяет свести до минимума количество получаемых больным ле-
карственных препаратов и их побочные эффекты.
451
Существует точка зрения, что среди препаратов I ряда предпочтение сле-
дует отдавать ингибиторам АПФ и блокаторам кальциевых каналов в связи с
меньшим количеством побочных эффектов. Из-за отрицательного влияния
Р-адреноблокаторов на липидный обмен показанием к их назначению явля-
ется повышенная симпатическая активность (например, сочетание артери-
альной гипертензии с тахикардией). Что касается мочегонных препаратов,
то в последние годы в связи с низкой “податливостью” больных (около
80 %), отрицательным влиянием на качество жизни и ряд обменных про-
цессов, увеличением частоты аритмий и значительным повышением сто-
имости лечения при необходимости возмещать потери К+ наметилась тен-
денция ограничить их применение при артериальной гипертензии случаями
гиперволемии.
При неэффективности всех апробированных средств монотерапии II эта-
пом лечения служит добавление второго, а иногда и третьего препарата
другого класса, обычно из числа средств I ряда. При этом выигрышной явля-
ется комбинация всех практически классов с мочегонным препаратом, так
как большинство из этих средств задерживает Na+ и воду. Тиазиды потенци-
руют действие всех трех остальных препаратов, особенно ингибиторов АПФ,
которые также частично нивелируют неблагоприятное побочное влияние мо-
чегонных средств на метаболизм. Наоборот, тиазиды могут потенцировать
отрицательный эффект p-адреноблокаторов в отношении развития ГЛП.
При недостаточном гипотензивном ответе рекомендуется следующая пос-
ледовательность действий: увеличение дозы гипотиазида (как второго пре-
парата) до 50 мг; ограничение соли (менее 5 г в сутки); добавление ингиби-
тора АПФ, если он не использовался ранее (предварительно временно отме-
нить мочегонные препараты во избежание резкой гипотензии).
Центральные а-адреностимуляторы, гидралазин, периферические а-адре-
ноблокаторы и антиадренергические средства относятся к препаратам
резерва.У ряда больных с умеренной и у всех больных с тяжелой артери-
альной гипертензией, у которых монотерапия заведомо неэффективна, ле-
чение первоначально проводят по ступенчатой программе, начиная со II, а
иногда сразу с III этапа.
Перед принятием решения об изменении терапии из-за ее недостаточной
эффективности следует поискать другие возможные причины этого явле-
ния, которые можно устранить.
Этими причинами могут быть:
1) недостаточная “податливость” больного;
2) увеличение ОЦП вследствие: а) избыточного потребления соли; б) при-
ема антигипертензивных препаратов, способных задерживать Na+ и воду;
3) недостаточная доза антигипертензивного препарата;
4) антагонизм лекарственных веществ из-за одновременного приема сим-
патомиметиков, пероральных эстрогенсодержащих контрацептивов, глюко-
кортикостероидов, нестероидных противовоспалительных средств и др.;
5) вторичный (симптоматический) генез артериальной гипертензии.
452
Таблица 42. Особенности лечения больных с артериальной гипертензией в зависимости от типа
гемодинамики и ренинового профиля
Вариант артериальной гипертензии
Эффективны
Неэффективны
ТЬл гемодинамики гиперкинетический Д-Адреноблокаторы, салуретики, Гидралазин, клофе- резерпин лин, а-метилдофа
гипокинетический Гидралазин, клофелин (умеренные Д-Адреноблокаторы, дозы), a-метилдофа салуретики
Рениновый профиль гиперренинная артериальная гипертензия гипоренинная артериальная Д-Адреноблокаторы, клофелин, Салуретики a-метилдофа, резерпин Салуретики, антагонисты Д-Адреноблокаторы
гипертензия
альдостерона
В случаях адекватного медикаментозного снижения АД следует попы-
таться постепенно уменьшить дозу и при возможности отменить один (одни)
из первоначально назначенных препаратов, чтобы отработать минимальную
по объему терапевтическую программу, обеспечивающую поддержание же-
лаемого уровня АД.
Выбор лекарственной терапии. У большинства больных с артериальной
гипертензией можно добиться адекватного снижения АД с помощью мно-
гих препаратов. Учитывая необходимость их многолетнего приема и вероят-
ность проявления побочных свойств, при подборе оптимальной антигипер-
тензивной терапии в каждом случае кроме антигипертензивного эффекта
руководствуются рядом критериев. Очевидно, оптимизировать выбор позво-
ляет учет гемодинамического и ренинового профилей, активности симпати-
ко-адреналовой системы, ОЦП, наличия и выраженности факторов риска
ИБС и влияния на них тех или иных препаратов (табл. 42-44).
Больным молодого возраста .страдающим артериальной гипер-
тензией, обычно свойственны повышенный симпатический тонус, гипер-
кинетический тип гемодинамики, высокая активность ренина и неизме-
ненный или сниженный объем внеклеточной жидкости. Эти факторы обус-
ловливают предпочтительность использования ингибиторов АПФ, блокато-
ров кальциевых каналов, сочетания р- и а-адреноблокаторов и селективных
а,-адреноблокаторов. Хотя монотерапия р-адреноблокаторами также эффек-
тивна, следует учитывать их отрицательное влияние на холестерин ЛПВП,
умственную и физическую работоспособность и потенцию. В таких случаях
лучше назначать кардиоселективные препараты.
У больных пожилого возраста (старше 60лет)часто имеются
сопутствующие заболевания, в частности ИБС, периферическая сосудистая
недостаточность, хроническая почечная недостаточность, хронические об-
структивные заболевания легких, снижение толерантности к углеводам,
которые оказывают влияние на выбор антигипертензивного препарата. Для
них характерны повышенное ОПСС, снижение активности ренина плазмы
453
Таблица 43. Особенности лечения различных клинических вариантов эссенциальной
артериальной гипертензии
Вариант артериальной гипертензии Показаны Не показаны
Молодой возраст Блокаторы кальциевых каналов;
Возраст старше 60 лет а,-адреноблокаторы, ингибиторы АПФ |в-адреноблокаторы (+) Салуретики, -селективные адренобло- каторы, клофелин, блокаторы кальциевых каналов, ингибиторы АПФ Ингибиторы АПФ Резерпин, а-адрено-
Сопутствующий блокаторы, гидрала- зин, гуанетидин Тиазидовые диуретики,
сахарный диабет с нефропатией Сопутствующая 0-адреноблокаторы, гидралазин, празозин, 0-адреноблокаторы Резерпин, гуанетидин,
хроническая почечная фуросемид, ингибиторы АПФ и а-метил- тиазидовые диуретики,
недостаточность дофа в меньших дозах спиронолактон
Сопутствующая язвенная болезнь Сопутствующие болезни печени Стенокардия 0-Адреноблокаторы, блокаторы Резерпин а-Метилдофа Осторожно:
Застойная сердечная кальциевых каналов Салуретики, ингибиторы АПФ, гуанетидин, резерпин, гидралазин Резерпин, гуанетидин,
недостаточность вазодилататоры, клофелин, а-метилдофа сочетание 0-адренобло-
Цереброваскулярная Осторожно: /3-адреноблокаторы Клофелин, тиазидовые диуретики кагоров с верапамилом Гуанетидин, гидрала-
недостаточность Осторожно: 0-адреноблокаторы зин, а-адреноблока-
(выраженная) торы, резерпин
крови и более выраженная, чем у больных молодого возраста, гипертрофия
левого желудочка.
Лечение обычно начинают с назначения тиазидовых диуретиков, ко-
торые, как установлено, снижают частоту инсультов и тяжелой застой-
ной сердечной недостаточности у этой категории больных. В качестве
монотерапии эффективны также селективные [5 -адреноблокаторы и ин-
гибиторы АПФ, которые, в отличие от мочегонных препаратов, обладают
также способностью уменьшать выраженность гипертрофии левого желу-
дочка. Следует избегать препаратов, вызывающих ортостатическую артери-
альную гипотензию, особенно гуанетидина и празозина.
При сопутствующей стенокардии необходимо не допускать
чрезмерного снижения АД, которое, приводя к уменьшению перфузионно-
го давления в коронарной системе, может провоцировать приступы стено-
кардии, а также рефлекторную тахикардию. У таких больных препаратами
выбора являются средства с антиангинальными свойствами — (5-адреноб-
локаторы и блокаторы кальциевых каналов, а из антиадренергических
препаратов — клофелин.
454
Таблица 44. Влияние различных групп антигипертензивных препаратов на факторы риска сердечно-
сосудистых заболеваний, связанных с атеросклерозом
Фактор риска Моче- гонные препараты р-Адрено- блокаторы а-Адрсно- блокаторы Блокаторы кальциевых каналов Ингиби- торы АПФ
Общий холестерин — 0 + 0 0
Холестерин ЛПВП 0 — 0 0 0
Снижение толерантности к глюкозе — — + 0 +
Физическая активность 0 — + 0 0
Гипертрофия левого желудочка — + + + +
Примечание: - отрицательный эффект, “+” - положительный эффект, “0” -
существенный эффект отсутствует.
При сопутствующей застойной сердечной недостаточ-
ности обязательно назначение мочегонных средств, так как большинство
антигипертензивных препаратов задерживает Na+ и воду, со строгим конт-
ролем уровня К+. Эффективны вазодилататоры, особенно ингибиторы АПФ,
которые не вызывают рефлекторной тахикардии, а также клофелин ввиду
отсутствия отрицательного инотропного действия и способности потенциро-
вать сердечные гликозиды.
У больных с хронической почечной недостаточностью
начальное снижение АД может приводить к преходящему уменьшению
клубочковой фильтрации и нарастанию уровня креатинина, что, одна-
ко, не связано с прогрессированием морфологических изменений в поч-
ках. Однако, если уровень сывороточного креатинина повышается при
терапии ингибиторами АПФ, причиной этого может быть двусторонний
стеноз почечных артерий. В таких случаях продолжение приема препарата
приводит к усугублению почечной недостаточности. Поэтому при назна-
чении этим больным ингибиторов АПФ рекомендуется контролировать
показатели функции почек каждые 4—5 дней в течение первых 3 нед ле-
чения. Будучи противопоказанными при билатеральной окклюзии почеч-
ных артерий, препараты этой группы являются средствами выбора при
односторонней окклюзии и нормально функционирующей контралате-
ральной почке, а также, вероятно, у больных с хронической почечной
недостаточностью. Таким пациентам показаны также другие антигипертен-
зивные препараты с минимальным отрицательным действием на почечный
кровоток: гидралазин, празозин, p-адреноблокаторы, блокаторы кальцие-
вых каналов, а-метилдофа (кроме случаев тяжелой почечной недостаточно-
сти), из мочегонных средств — фуросемид в больших дозах. В связи с повы-
шенным накоплением в крови дозы ингибиторов АПФ и а-метилдофа дол-
жны быть снижены. Остальные из перечисленных препаратов быстро выво-
дятся и практически не кумулируют. Эффективная гипотензивная терапия
может приводить к повышению клу-бочковой фильтрации и замедлять про-
грессирование необратимых изменений почечной паренхимы.
455
Особенно трудной задачей является лечение беременных с со-
путствующей либо обусловленной беременностью артериальной гипер-
тензией. Это связано с угрозой снижения плацентарного кровотока и по-
тенциальным токсическим (гипотрофия и др.) и тератогенным влияни-
ем препаратов на плод. В таких случаях показанием к назначению антиги-
пертензивной терапии является стойкое повышение диастолического АД
более 95 мм рт.ст. Не рекомендуются значительное ограничение соли,
мочегонные препараты, ингибиторы АПФ и натрия нитропруссид. Дока-
зана безопасность а-метилдофа, 0-адреноблокаторов (атенолол, метоп-
ролол и др.) и гидралазина (коротким курсом, обычно парентерально в
тяжелых случаях). Безопасность других препаратов изучается. Для лечения
предэклампсии с успехом применяют магния сульфат.
Резкое прекращение антигипертензивной терапии, особенно при уме-
ренной и тяжелой артериальной гипертензии, может вызывать синдром
отмены. Он развивается в течение 24—72 ч и проявляется повышением
АД, иногда до более высокого уровня, чем исходный (так называемый овер-
щут), которое у ряда больных сопровождается признаками повышенной сим-
патической активности. Возможные осложнения включают гипертонический
криз, инсульт, инфаркт миокарда и внезапную смерть. Возникновение син-
дрома отмены чаще всего вызывают антиадренергические препараты цент-
рального действия (клофелин > а-метилдофа > гуанабенз) и 0-адренобло-
каторы (пропранолол > метопролол > пиндолол), и лишь в редких случаях —
мочегонные средства. Такие препараты лучше не назначать “неподатливым”
(non-compliant) больным. При необходимости их замены другими, особен-
но при тяжелой артериальной гипертензии, дозу следует снижать очень мед-
ленно, в течение нескольких дней и даже недель, параллельно повышая
дозу нового препарата.
Для купирования синдрома обычно эффективно возобновление приема
отмененного препарата, причем часто требуются более высокие дозы. В слу-
чаях синдрома отмены, вызванного клофелином и препаратами его группы,
противопоказаны 0-адреноблокаторы, которые могут усугубить артериаль-
ную гипертензию из-за резкого преобладания эффекта стимуляции перифе-
рических а-адренорецепторов.
Лечение злокачественной артериальной гипертензии. Обязательны срочная
госпитализация и постельный режим. Ближайшей целью является снижение
диастолического давления АД на 1/3 от исходного, но не ниже 95 мм рт.ст.
При отсутствии тяжелой энцефалопатии (судороги, кома) и выраженной
сердечной недостаточности обычно перорально назначают 3 различных пре-
парата, например, тиа ладовый диуретик (или при хронической почечной
недостаточности петлевой — фуросемид до 200 мг в сутки) в сочетании с
калийсберегающим, p-адреноблокатор (пропранолол до 300—400 мг в сутки
или др.) и ингибитор АПФ или гидралазин. Эффективны антагонисты каль-
ция, особенно нифедипин (см. ниже), клофелин (до 2—2,4 мг в сутки) и
а-метилдофа (до 2 г в сутки). Применение резерпина и гуанетидина неже-
лательно.
456
АД следует снижать постепенно во избежание усугубления неврологиче-
ской симптоматики, связанной с гипоперфузией мозга, олигурии и ише-
мии миокарда.
При наличии осложнений проводят неотложное лечение (см. ниже).
После адекватного снижения АД с помощью активной, в ряде случаев
парентеральной терапии, артериальная гипертензия нередко вновь приобре-
тает доброкачественное течение на фоне умеренных доз принимаемых внутрь
препаратов. Хотя уровень креатинина обычно снижается, нарушение функ-
ции почек, как правило, сохраняется, и оно тем более выражено, чем позже
было начато лечение.
Лечение гипертонических кризов. Выделяют неотложную и срочную такти-
ку лечения гипертонических кризов. Неотложное лечение показано при тя-
желом поражении органов-мишеней или его реальной угрозе. Его целью яв-
ляется снижение АД в течение 1 ч для предотвращения необратимых изме-
нений. Срочное лечение проводят при отсутствии или минимальной выра-
женности поражения органов-мишеней. Оно предусматривает более медлен-
ное снижение АД с достижением желаемого уровня за несколько часов, но
не более 24 ч. Непосредственной целью неотложного и срочного лечения
является снижение диастолического АД до 100—110 мм рт.ст. После достиже-
ния этого уровня АД очень медленно, в зависимости от индивидуальной
переносимости, снижают до нормальных величин.
Неотложное лечение проводят путем парентерального введения
медикаментозных средств в условиях блока (БРИТа) интенсивного наблю-
дения, лечения и реанимации. Оно показано при гипертонических кризах,
осложненных внутричерепными кровоизлияниями, расслоением аневриз-
мы аорты, острой почечной недостаточностью, эклампсией, острой левоже-
лудочковой недостаточностью, а также при злокачественной артериальной
гипертензии с тяжелым течением. Неотложной парентеральной терапии под-
лежат и больные с артериальной гипертензией, осложненной ишемическим
инсультом, ишемией или инфарктом миокарда или нарастающей сердечной
недостаточностью, когда общепринятая терапия не позволяет снизить АД.
Во всех этих случаях при определении тактики купирования артериальной
гипертензии решающее значение имеют клинические проявления заболева-
ния, а не абсолютный уровень АД. Основные применяемые в этих целях
медикаментозг ые средства и их краткая характеристика представлены в
табл. 45.
Натрия нитропруссид является препаратом выбора в большин-
стве случаев осложненных гипертонических кризов. Он быстро снижает АД,
легко титруется и прекращает свое действие сразу после приостановления
инфузии. Средняя доза препарата 1—3 мкг/кг/мин (не более 10 мкг/кг/мин).
Его лучше вводить с помощью инфузионного насоса. Во избежание резкой
артериальной гипотензии требуется мониторинг АД, что представляет извест-
ное неудобство. Инфузия предельно допустимых доз свыше 24 ч, их пре-
вышение или наличие почечной недостаточности могут вызывать накопле-
ние токсического метаболита - тиоцианата. Это проявляется шумом в ушах,
457
Таблица 45. Основные антигипертензивные препараты, используемые для лечения гипертонических кризов
Препарат Форма выпуска Первоначальная доза и способ введения Начало действия Пнк действия Продолжитель- ность действия Максимальная суточная доза Основные побочные эффекты
Средства для парентерального введения
Вазодилататоры
Натрия нитропруссид (ниприд) Нитроглицерин Флаконы по 50 мг (5 мл) Различная Начиная с 0,5 мкг/ кг/мин, постепенно увеличивая дозу каждые 5-10 мин до 8 мкг/кг/мин внутривенно капельно (средняя доза 1—3 мкг/кг/мин) 0,5-10 мкг/кг/мин внутривенно капельно < 1 мин То же 1—2 мин То же 2-5 мин То же 3-3,5 мг/кг Артериальная гипотензия, тошнота
Диазоксид (гиперстат) Ампулы по 300 мг (20 мл) 150—300 мг внутри- венно струйно 1—3 мин 2-4 мин 5-12 ч 1000 мг Стенокардия, задержка жидкости, гипергликемия
Гидралазин (апрессин) Мочегонные препараты Ампулы по 20 мг (1 мл) 10—40 мг внутривенно струй- но, или капельно, или внутримышечно 15-20 мин 20—40 мин 1—6 ч 200 мг Стенокардия, сердцебиение, головная боль
фуросемид Ампулы по (дазикс) 20 мг (2 мл) Антиадренергические средства 40—120 мг внутри- венно струйно 10-15 мин 15—30 мин 3-12 ч 1000 мг Гипокалиемия
Клофелин Ампулы по 0,1 мг (1 мл) 0,13—0,3 мг внутри- венно струйно или внутримышечно 3—6 мин 30—40 мин 15-20 мин 1-2 ч 2-8 ч 2 мг Сонливость, ортостатическая артериальная гипотензия
а-Метилдофа Ампулы по 250—500 мг внутри- 1-3 ч 3-5 ч 4-12 ч 2000 мг Сонливость,
Триметафана 250 мг (5 мл) Ампулы по 500 венно струйно 1—15 мг/мин < 1 мин 1-2 мин 2—5 мин 450 мт паркинсонопо- добный синдром Артериальная
камсилат (арфонад) Пентамин мг (10 мл) Ампулы по 50 внутривенно капельно 20—100 мг внутри- То же То же То же То же гипотензия, задержка мочи, паралитический
Пропранолол мг (1 мл) Ампулы по 5 мг венно струйно дроб- но или капельно 20—50 мг внутри- мышечно По 1 мг внутри- 10—15 мин 5-10 мин 20-30 мин 20-30 мин 2—6 час 4-6 ч илеус, сонли- вость, тахикардия Артериальная
(обзидан, индерал) Лабеталол (5 мл) Флаконы по венно струйно дроб- но до 5 мг и более 20—80 мг внутри- 5-10 мин 20-30 мин 3—6 ч 2400 мг гипотензия, брадикардия, бронхоспазм См. Пропранолол.
Резерпин 20-40 мг Ампулы по 1 и венно струйно каж- дые 10 мин, затем внутривенно капель- но 2 мг/мин (до 300 мг одноразово) 0,5—1 мт внутри- 1-3 ч 3—4 ч 6—24 ч Змг Ортостатическая артериальная гипотензия. Сонливость,
(раусе дил, серпазил) 2,5 мг (1 мл) венно струйно или внутримышечно паркинсонопо- добный синдром
Средства для перорального приема
Нифедипин (ада- 10 мг 10—20 мг под язык 5—15 мин 30—60 мин 3—6 ч 180 мг
лат, прокардиа) Клофелин 0,075 и 0,15 мг 0,15 мг внутрь 15—20 мин 30-60 мин 6—8 ч 2,4 мг
(катапресан, клонидина гидрохлорид) Каптоприл Различная первоначально, затем по 0,1 мг каждый час; максимальная разовая доза 0,7 мг 25 мг под язык 10—15 мин 3-4 ч 6—24 ч 200 мг
(капотен)
расплывчатостью зрительного изображения, в тяжелых случаях - бредом. Воз-
можна также аккумуляция цианидов с развитием печеночной недостаточ-
ности, проявляющейся рвотой, головокружением, атаксией и синкопе. Для
лечения интоксикации тиоцианатом применяют гемодиализ, а при инток-
сикации цианидами — нитриты и натрия тиосульфат. Преимуществами на-
трия нитропруссида перед ганглиоблокаторами являются отсутствие тахифи-
лаксии и возможность длительного непрерывного введения без существен-
ных побочных эффектов.
Непрерывную внутривенную инфузию нитроглицерина можно при-
менять при наличии относительных противопоказаний к натрия нитропрус-
сиду, например, выраженной печеночной и почечной недостаточности. Бла-
годаря более благоприятному влиянию на коронарный коллатеральный кро-
воток и газообмен в легких, он является препаратом выбора в случаях уме-
ренного повышения АД, сопровождающегося ишемией или инфарктом ми-
окарда. При выраженной артериальной гипертензии у таких больных пред-
почтение отдают натрия нитропруссиду.
Наряду с натрия нитропруссидом препаратом выбора в большинстве слу-
чаев осложненных гипертонических кризов, включая инфаркт миокарда,
считается лабеталол. Внутривенное струйное введение по 20—80 мг каж-
дые 10 мин (максимум до 300 мг) позволяет быстро снизить АД, а последу-
ющая инфузия (1-2 мг в 1 мин, максимальная суточная доза 2400 мг) —
его стабилизировать. При внутривенном введении препарата его 0-адрено-
блокирующий эффект значительно преобладает над а-адреноблокирующим
(7:1), что требует соблюдения соответствующих предосторожностей. Преиму-
ществом лабеталола является отсутствие тахикардии.
Диазоксид в настоящее время применяют реже, так как он не имеет
существенных преимуществ перед натрия нитропруссидом и лабеталолом. Из-
за выраженного связывания с альбумином сыворотки крови его вводят в
виде болюса и он имеет значительную продолжительность действия (5—12 ч).
Его достоинствами являются однократное введение в виде болюса, отсут-
ствие необходимости титровать дозу и проводить мониторинг АД, быстрота
наступления эффекта. Во избежание артериальной гипотензии начинать лече-
ние лучше со 150 мг с повторным введением этой дозы через 5 мин при
недостаточном снижении АД. Через несколько часов, если АД начинает вновь
повышаться, введение препарата повторяют. В связи со способностью диазокси-
ia увеличивать силу сокращений миокарда, ЧСС и МОС его обычно сочетают
с p-адреноблокаторами и не назначают при остром инфаркте миокарда и
расслаивающей аневризме аорты. Серьезными побочными эффектами явля-
ются также способность вызывать ишемию миокарда, гипергликемию и за-
держку Na+ и воды.
Ганглиоблокаторы триметафан и пентамин являются высокоэф-
фективными препаратами, быстро снижающими АД. В то же время кратко-
временность их действия, которое прекращается “на конце иглы”, представ-
ляет большое неудобство и требует тщательного мониторинга, в связи с чем
в настоящее время их использование относительно ограничено. Препараты
460
эффективны при расслаивающей аневризме аорты и не желательны при на-
рушениях мозгового и коронарного кровообращения. Внутримышечное вве-
дение применяют редко из-за трудности регулировать силу гипотензивного
эффекта.
Недостатками парентерального введения клофелина и а-метил-
д о ф а являются относительно меньшее гипотензивное действие в сочета-
нии с сонливостью, сухостью во рту и задержкой жидкости. В связи с по-
здним наступлением эффекта а-метилдофа можно использовать только в
качестве средства срочной терапии неосложненных кризов.
Гидралазин обладает преимуществами перед другими препарата-
ми при патологии почек и почечной недостаточности. Его применение
нежелательно в случаях выраженной церебральной, коронарной и сер-
дечной недостаточности и расслаивающей аневризмы аорты. Можно на-
значать внутривенно струйно дробно по 10 мг каждые 10-15 мин до по-
лучения желаемого эффекта или достижения общей дозы 50 мг.
В связи с выраженным седативным и другими побочными эффектами,
поздним наступлением гипотензивного действия и его слабой выраженно-
стью использование резерпина нецелесообразно.
Вспомогательное значение имеют петлевые диуретики, диба-
зол, нейролептические (аминазин, дроперидол) и седативные (диазепам)
средства. Гипотензивный эффект фуросемида и этакриновой кис-
лоты связан с уменьшением ОЦП, потенцированием действия других ан-
тигипертензивных препаратов и в меньшей степени с непосредственной ди-
латацией периферических артериол. Они особенно показаны при кризах, ос-
ложненных тяжелой энцефалопатией и острой левожелудочковой недоста-
точностью, а также при введении вазодилататоров, способствующих задерж-
ке Na+ и воды.
Дибазол (30-40 мг в виде 0,5 % или 1 % раствора) вводят внутривен-
но или внутримышечно. Оказывает слабый и непродолжительный (2—3 ч)
гипотензивный эффект за счет непосредственного спазмолитического дей-
ствия на гладкую мускулатуру артериол и некоторого уменьшения МОС.
Считают, что препарат улучшает регионарный мозговой кровоток.
Нейролептические средства оказывают слабое а-адреноблоки-
рующее действие, угнетают повышенную возбудимость сосудодвигательно-
го центра и адренореактивную систему. Существенным их недостатком яв-
ляется седативное действие. Аминазин рекомендуют вводить внутримышеч-
но, внутривенно капельно или титрованно внутривенно медленно струйно
под контролем АД. При этом возможна “вторая волна” снижения АД через
20-25 мин после введения, вплоть до развития коллапса. Из-за токсического
эффекта противопоказан при заболеваниях печени и почек.
При выраженном психоэмоциональном возбуждении внутримышечно или
внутривенно медленно вводят диазепам (реланиум, седуксен) по 10-
20 мг, который за счет своего седативного эффекта способствует снижению
АД. Седативным и противоотечным действием обладает магния суль-
фат (2500-5000 мг внутривенно медленно).
461
Таблица 46. Неотложная терапия различных вариантов осложненных гипертонических кризов и
злокачественной артериальной гипертензии
Вариант Препараты выбора Следует избегать
Ишемический инсульт Лечение не требуется или нат- рия нитропруссид, лабеталол |в-адреноблокаторы, клофелин, а-метилдофа
Внутричерепные кровоизлияния То же То же
Ишемия и инфаркт миокарда Нитроглицерин, натрия нитропруссид, лабеталол Диазоксид, гидралазин
Отек легких Натрия нитропруссид, или нитроглицерин, или ганглио- блокаторы в сочетании с фуросемидом Диазоксид, гидралазин, /3-адре- ноблокаторы, лабеталол
Расслаивающая аневризма аорты Натрия нитропруссид и /3-адре- ноблокаторы, ганглиоблока- торы и /3-адреноблокатор или лабеталол Диазоксид, гидралазин
Эклампсия Гидралазин, диазоксид, лабеталол, блокаторы кальциевых каналов' Ганглиоблокаторы, мочегонные препараты, /3-адреноблокаторы
Острая почечная Натрия нитропруссид, лабета- |в-Адреноблокаторы, ганглио-
недостаточность лол, блокаторы кальциевых каналов, фуросемид блокаторы
Злокачественная артериаль- Натрия нитропруссид, |в-Адреноблокаторы, клофелин,
ная гипертензия с тяжелой энцефалопатией лабеталол, блокаторы кальциевых каналов а-метилдофа
Микроангиопатическая То же |в-Адреноблокаторы
гемолитическая анемия
* В рефрактерных случаях, так как не исключен риск для плода.
При подозрении на феохромоцитому при купировании криза противопо-
казаны препараты, которые могут вызвать освобождение дополнительного
количества катехоламинов, — а-метилдофа, резерпин. Для парентерального
введения препаратом выбора является фентоламин.
Дифференцированный подход к неотложному лечению различных вари-
антов осложненных гипертонических кризов приведен в табл. 46.
Наиболее спорным является вопрос о применении гипотензивной тера-
пии при остром инсульте и в его отдаленный период. Существующее ранее
мнение о нежелательности срочной коррекции АД в этих случаях из-за опас-
ности снижения перфузионного давления в стенозированных или окклюзи-
рованных мозговых артериях в настоящее время опровергнуто. Доказано,
что сохранение высокого АД способствует усугублению повреждения мозго-
вых сосудов, срыву саморегуляции мозгового кровотока и ухудшению вы-
живаемости больных. В таких случаях рекомендуется осторожная коррекция
и поддержание АД на уровне примерно 160/100 мм рт.ст.
462
Таблица 47. Дифференцированное лечение гипертонических кризов при эссенциальной артериальной
гипертензии в зависимости от клинического течения (гемодинамического профиля)
Средства Вариант криза
I тип (гиперкинетический) II тип (гипокинетический)
Основные Пропранолол, нифедипин, клофелин Клофелин, нифедипин, натрия нитропруссид, пентамин
Вспомогательные Дибазол, дроперидол, Фуросемид,
аминазин, дибазол,
диазепам эуфиллин
Срочное лечение проводят либо с помощью парентерального
введения препаратов с относительно поздним (более 30 мин) началом
действия с переходом на прием их таблетированных форм, либо с самого
начала путем перорального приема средств с быстрым и сильным дей-
ствием — нифедипина, клофелина, ингибиторов АПФ (см. табл. 45). Ни-
федипин, принятый сублингвально в дозе 10—20 мг, оказывает выражен-
ное гипотензивное действие уже через 30 мин, которое длится 3~6 ч. При
пероральном “насыщении” клофелином первоначальная доза составляет
0,15-0,2 мг, последующие — 0,1 мг каждый час до снижения диастоли-
ческого АД на 20 мм рт.ст. и более либо достижения общей дозы 0,7 мг.
Дифференцированное лечение кризов в зависимости от клинического
течения и гемодинамического профиля представлено в табл. 47.
Диспансерное наблюдение за больными с эссенциальной артериальной ги-
пертензией. До достижения стойкой стабилизации АД на фоне лечения на
оптимальном уровне амбулаторных больных рекомендуется осматривать еже-
недельно с контролем АД и состояния органов-мишеней, а затем — не реже
1 раза в 3—6 мес даже при отсутствии жалоб и сохранении хорошего терапев-
тического эффекта. В случаях немотивированного повышения АД после его
более или менее длительной нормализации перед тем, как корригировать
терапию, следует исключить возможность самовольного прекращения при-
ема лекарств. Один раз в год, а при необходимости чаще, повторяют ЭКГ,
рентгенографию грудной клетки, исследуют функцию почек и проводят эхо-
кардиографию. Если больной получает мочегонные средства, то содержание
калия, мочевой кислоты и глюкозы в плазме крови рекомендуется контро-
лировать не реже чем каждые 6-12 мес.
Прогноз нелеченой эссенциальной артериальной гипертензии зависит от
многих факторов. К основным относятся уровень АД, наличие и выражен-
ность факторов риска развития атеросклероза, в частности ГЛП, и его ос-
ложнений, выраженность ретинопатии и гипертрофии левого желудочка.
Профилактика. Поскольку этиология эссенциальной артериальной
гипертензии неизвестна, ее первичной профилактики не существует. Что
463
касается вторичной профилактики, то важное значение имеют: 1) возможно
более раннее выявление артериальной гипертензии и 2) систематическое
наблюдение за больными, а при наличии показаний — обеспечение непре-
рывного длительного, в большинстве случаев пожизненного, медикамен-
тозного лечения.
В связи с бессимптомным течением и значительной распространенно-
стью артериальной гипертензии, с одной стороны, и эффективностью ее
коррекции — с другой своевременная диагностика заболевания обеспечива-
ется путем сплошного скриннинга населения. Лучшим и наиболее эконо-
мичным методом его проведения считается обязательное измерение АД у
всех обратившихся за медицинской помощью, независимо от причины об-
ращения. Результаты такого подхода свидетельствуют о том, что количество
выявляемых новых случаев заболевания не уступает числу находящихся на
учете больных. В целом же в результате широкомасштабных образовательных
программ, охватывающих как семейных врачей и врачей других специаль-
ностей, так и больных, в странах Западной Европы и США за последние 20
лет число не получающих лечения больных с эссенциальной артериальной
гипертензией значительно уменьшилось, что привело к заметному сниже-
нию летальности при этом заболевании.
ВТОРИЧНАЯ СИМПТОМАТИЧЕСКАЯ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Симптоматические формы артериальной гипертензии — это такие формы
повышения АД, которые связаны с заболеваниями органов, участвующих в
регуляции АД. Их основные причины приведены на с. 403-404. Удельный
вес симптоматических форм артериальной гипертензии среди всех ее случа-
ев, включая мягкие формы, в настоящее время составляет не более чем 5 %,
но он значительно выше при тяжелой артериальной гипертензии. Синдром
злокачественной гипертензии отмечается у 20 % (!) таких больных, тогда
как при эссенциальной артериальной гипертензии — лишь у 1—5 %. Важ-
ность диагностики симптоматических форм артериальной гипертензии обус-
ловлена также значительной распространенностью заболеваний, специфи-
ческое лечение которых позволяет стойко снизить или нормализовать АД,
что особенно важно ввиду существенного удельного веса тяжелых форм. При-
мерами могут служить реноваскулярная артериальная гипертензия, одно-
сторонняя пиелонефритически сморщенная почка, коарктация аорты, фе-
охромоцитома, синдром Иценко—Кушинга, аденома коркового вещества
надпочечников (синдром Конна).
Примерный удельный вес артериальной гипертензии различного генеза
в общей популяции и в специализированной кардиологической клинике пред-
ставлен в табл. 48.
Точно установить их распространенность не представляется возможным,
так как часть из них остается нераспознанной.
464
Таблица 48. Примерный удельный вес разлнчшх форм артериальной гипертензин
Причина артериальной гипертензин Удельный вес, %
в общей популяции в специализиро- ванной клинике
Эссенциальная артериальная гипертензия
(гипертоническая болезнь) Почечная артериальная гипертензия: 92-95 65-85
реноваскулярная 1-3 4-16
ренопаренхиматозная Эндокринная артериальная гипертензия: 1-2 4-5
первичный гиперальдостеронизм “0,3 0,5-12
синдром Иценко—Кушинга <0,1 <0,2
феохромоцитома <0,1 <0,2
РЕНОВАСКУЛЯРНАЯ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Реноваскулярная артериальная гипертензия обусловлена стенозом маги-
стральной почечной артерии. Для возникновения гипертензии достаточно
поражения сосуда одной почки. Наиболее частыми этиологическими фактора-
ми являются атеросклероз (примерно у 80 %) и фиброзно-мышечная дисп-
лазия (около 13 %). Более редкими причинами служат системные васкулиты
— неспецифический аортоартериит (болезнь Такаясу) и узелковый периар-
териит, а также тромбоэмболия, врожденные аневризмы почечных артерий,
травмы и др.
Атеросклеротический стеноз локализуется, как правило, вблизи отхож-
дения почечной артерии от аорты, преимущественно улиц старшего возрас-
та, чаще у мужчин, особенно курильщиков. У 30—50 % больных отмечается
двустороннее поражение. Вследствие генерализованного атеросклеротического
процесса такие больные часто страдают стенокардией, перемежающейся хро-
мотой и нарушениями мозгового кровообращения.
Фиброзно-мышечная дисплазия поражает все слои артерий различной ло-
кализации, чаще медию. В отличие от атеросклероза поражение локализуется
преимущественно в дистальных 2/3 почечных артерий. Наиболее типичен
вид сосуда, напоминающий бусы, в связи с чередованием участков сужения
в местах фиброза медии и аневризматических расширений сегментов, ли-
шенных внутренней эластической мембраны и гладких мышц. Заболевание
отмечается чаще у женщин 20—30 лет и протекает менее тяжело, чем атеро-
склеротическое поражение. В 30 % случаев в процесс вовлекаются обе почеч-
ные артерии. Фиброзно-мышечная дисплазия может локализоваться также в
области сонных, чревных, брыжеечных и подвздошных артерий, не вызы-
вая, однако, серьезных клинических последствий.
В основе патогенеза артериальной гипертензии лежит гиперпродукция ре-
нина вследствие ишемии почки и связанная с ней активация ангиотензина
и альдостерона. Это заболевание является типичной моделью гиперренинной
артериальной гипертензии.
465
В клинической картине нет ни одного специфического признака, который
позволил бы отличить это заболевание от эссенциальной артериальной ги-
пертензии. Заподозрить его и принять решение о проведении углубленного
обследования можно на основании следующих особенностей:
1) острое начало заболевания, которое характеризуется резким повыше-
нием АД у мужчин старше 50 лет или у женщин моложе 30 лет;
2) с самого начала болезни АД устанавливается на уровне, характерном
для тяжелой артериальной гипертензии, отличается устойчивостью, гипер-
тонические кризы отсутствуют;
3) артериальная гипертензия является преимущественно диастолической;
пульсовое давление снижено;
4) артериальная гипертензия резистентна к медикаментозной терапии и
может носить злокачественный характер (в 20 % случаев);
5) склонность к ортостатической гипотензии;
6) эпизод острой боли во фланке, в том числе связанной с травмой, ге-
матурии или тромбоэмболии периферической артерии в анамнезе;
7) отсутствие случаев эссенциальной артериальной гипертензии в семье;
8) сосудистый систолический или реже систоло-диастолический шум в
околопупочной области (в проекции отхождения от аорты почечной арте-
рии), который может иррадиировать во фланк и спину.
Для выраженного одностороннего стеноза почечной артерии весьма ха-
рактерен так называемый гипонатриемический гипертензивный синдром,
который, однако, встречается довольно редко. Он является результатом вто-
ричного гиперальдостеронизма и представляет собой сочетание тяжелой ар-
териальной гипертензии с гипонатриемией, гипокалиемией, полиурией,
полидипсией и похуданием. Наличие гипонатриемии отличает вторичный
гиперальдостеронизм от первичного и обусловлено активным выделением
Na+ непораженной почкой в условиях значительно повышенного АД. Она
приводит к уменьшению ОЦП и сгущению крови.
Следует отметить,однако, что все эти признаки очень относительны и
часто отсутствуют.
При обычном лабораторном обследовании моча, как правило, не изме-
нена. Нарушение азотовыделительной функции почек развивается в основ-
ном в поздней стадии заболевания, преимущественно при двусторонней
окклюзии.
Диагностика реноваскулярной артериальной гипертензии основывается на
выявлении: 1) косвенных признаков ишемии почки с помощью экскретор-
ной урографии или радионуклидной ренографии; 2) повышенной секреции
ренина путем определения его активности в периферической венозной кро-
ви или в крови, взятой из почечной вены; 3) сужения почечной артерии по
данным селективной рентгеноконтрастной ангиографии.
Экскреторную урографию и радионуклидную ренографию используют
главным образом как скриннинговые тесты, выявляющие асимметрию раз-
меров и функции почек, для отбора больных для ангиографии. В последние
годы оба метода применяют все реже из-за значительной частоты ложно-
466
отрицательных (главным образом при урографии) и ложноположительных
(чаще при радионуклидной ренографии) результатов и возможных побоч-
ных реакций (урография). В зависимости от технической базы клиники при-
меняют один из этих методов, так как их сочетание мало повышает инфор-
мативность полученных результатов.
Обнаружение ишемии почки с помощью экскреторной урографии ос-
новывается на запаздывании поступления контрастного вещества в ка-
нальцы и увеличении реабсорбции в них соли и воды. Это приводит к
парадоксальному увеличению концентрации красителя в чашечно-лоха-
ночном аппарате (то есть его контрастности) в более поздние сроки и
снижению продукции мочи на стороне поражения. Диагностическое зна-
чение имеет также уменьшение длинника ишемизированной почки бо-
лее чем на 15 мм. Для выявления этих изменений снимки необходимо
выполнять ежеминутно в течение первых 5 мин после введения контрас-
тного вещества, а затем на 15-й и 30-й минутах.
При радионуклидной ренографии с 1311-гиппураном на возможный стеноз
почечной артерии косвенно указывают уменьшение крутизны сосудистого
сегмента и амплитуды пика кривой, а также растянутость секреторного и
экскреторного сегментов. Однако эти признаки низкочувствительны и ма-
лоспецифичны и могут иметь место, в частности, при поражении почечной
паренхимы и эссенциальной артериальной гипертензии. При одностороннем
стенозе диагностическое значение радионуклидной ренографии повышается
при предварительном приеме ингибитора АПФ (каптоприла или др.). Расши-
ряя эфферентные артериолы, он вызывает еще большее снижение клубоч-
ковой фильтрации в пораженной почке и еще больше уменьшает захват ею
радионуклида.
Информативность обоих скриннинговых методов значительно ограничи-
вается при двустороннем поражении и умеренной выраженности стеноза.
Полученные результаты не позволяют также прогнозировать эффективность
оперативного лечения в отношении снижения АД.
При определении активности ренина в плазме периферической крови диаг-
ностическое значение имеет лишь его низкий уровень, который исключает
существенный стеноз почечной артерии. Более информативным является его
значительное, более чем в 1,5 раза, повышение в крови одной из почечных
вен по сравнению с другой при раздельной ретроградной катетеризации. В
связи с относительно низкой чувствительностью и специфичностью, осо-
бенно при двусторонней или сегментарной окклюзии, технической слож-
ностью, а также невысокой предсказующей ценностью активности ренина в
отношении эффективности хирургической коррекции этот метод в настоя-
щее время имеет ограниченное применение.
Диагноз реноваскулярной артериальной гипертензии можно подтвердить
с помощью чрескожной ретроградной ангиографии почечных артерий. Об-
наруживая анатомическое поражение сосудов, она не дает возможности су-
дить о его функциональном значении, то есть установить, является ли именно
стеноз основной причиной артериальной гипертензии. В пользу этого
467
свидетельствуют тяжесть артериальной гипертензии, значительная асиммет-
рия размеров и функции почек по данным скриннинговых тестов и хоро-
ший гипотензивный эффект ингибиторов АПФ при рефрактерности к дру-
гим гипотензивным средствам. Хотя исследование не противопоказано при
хронической почечной недостаточности, кроме терминальной стадии, вве-
дение рентгеноконтрастного вещества может вызывать временнее усугубле-
ние нарушения функции почки. Возможны также местные осложнения, свя-
занные с катетеризацией.
Лечение включает медикаментозную терапию и реваскуляризацию пу-
тем ТЛАП или оперативного вмешательства.
Медикаментозное лечение применяют при умеренной артериальной ги-
пертензии, недоступности стеноза для хирургической коррекции из-за сво-
ей локализации, а также при противопоказаниях к ней в связи с тяжестью
состояния больного. При проведении терапии важно не допускать значи-
тельного уменьшения клубочковой фильтрации, к чему может приводить
резкое снижение АД и ОЦП из-за ограничения соли и злоупотребления
мочегонными средствами, особенно тиазидовыми диуретиками. При тяже-
лой артериальной гипертензии обычно используют 3-компонентную схему.
Предпочтение отдают препаратам, уменьшающим секрецию ренина (р-адре-
ноблокаторы, а-метилдофа) и образование ангиотензина II (ингибиторы
АПФ). Необходимо иметь в виду, что при значительном двустороннем сте-
нозирующем поражении или при одной нефункционирующей почке инги-
биторы АПФ могут резко усугублять нарушение азотовыделительной функ-
ции. Не эффективны спиронолактон и салуретики.
Реваскуляризация направлена не только на коррекцию артериальной ги-
пертензии и предотвращение ее тяжелых осложнений, но также на сохра-
нение и улучшение функции почки при ее значительном нарушении. Бе-
зотлагательная ТЛАП с помощью баллончика является методом выбора
при выраженном ограниченном проксимальном стенозе, предположитель-
но функционально значимом, особенно у больных с повышенным риском
хирургического вмешательства (пожилого возраста с клинически выражен-
ными ИБС и церебральным атеросклерозом и пр.). Метод высокоэффекти-
вен примерно у 80 % больных с фиброзно-мышечной дисплазией и у 60—
70 % больных с атеросклеротическим стенозом. Осложнения отмечаются в
6—15 % случаев. Наиболее серьезным осложнением является расслоение по-
чечной артерии с инфарктом почки. Возможна преходящая почечная недо-
статочность. Как и при коронарной ангиопластике, в отдаленные сроки
может наблюдаться рестеноз, для коррекции которого требуется повторная
дилатация.
В настоящее время оперативное вмешательство рекомендуют при невоз-
можности выполнить ТЛАП по техническим причинам. Оно включает раз-
личные методы обходного шунтирования и эндартерэктомию. При тяжелой,
угрожающей жизни артериальной гипертензии у больных с односторонним
поражением, выраженным нефросклерозом и нефункционирующей почкой
доказана нефрэктомия. Результаты оперативного лечения сходны с таковыми
468
при ТЛАП, а хирургическая летальность составляет около 2 %; 25—50 % боль-
ных, чаще с атеросклеротическим генезом стеноза, после реваскуляризации
нуждаются в поддерживающей антигипертензивной терапии.
Артериальная гипертензия при системных васкулитах обусловлена ауто-
иммунным воспалением устьев и проксимальных сегментов почечных ар-
терий при неспецифическом аортоартериите или их мелких междолько-
вых ветвей и артериол при узелковом периартериите, которое вызывает
стенозирование этих сосудов и ишемию почки. Генез артериальной ги-
пертензии при узелковом периартериите может быть отчасти связан с
развивающимся при этом заболевании гломерулонефритом.
Неспецифический аортоартериит (болезнь Такаясу) встречается, как пра-
вило, у молодых женщин. Заболевание обычно начинается с неспецифичес-
кого “необъяснимого” общевоспалительного синдрома — лихорадки, поху-
дания, артралгий или артрита, иногда - пульмонита, миокардита, серозита.
Симптомы поражения отдельных сегментов аорты и ее ветвей развиваются
лишь спустя 5—10 лет. Синдром вазоренальной артериальной гипертензии
имеет место у 50 % больных и, как правило, сочетается с другими синдро-
мами, что помогает поставить правильный диагноз. При этом особенно ха-
рактерен синдром дуги аорты с картиной ишемии мозга и верхних конечно-
стей — отсюда образное название заболевания “болезнь отсутствия пульса”.
Причиной артериальной гипертензии может служить и коарктационный син-
дром в результате стенозирования нисходящей части аорты.
При узелковом периартериите артериальная гипертензия развивается при-
мерно в 50 % случаев, часто в самом начале заболевания, и может быть
практически единственным его признаком (так называемый моносиндром-
ный вариант). Тем не менее, тщательный расспрос больного позволяет вы-
явить предшествовавшую лихорадку, боль в суставах и особенно в мышцах,
мышечную слабость, похудание. В крови отмечается лейкоцитоз. Болеют чаще
молодые мужчины. Высокое АД часто приводит к появлению мочевого син-
дрома и сердечной недостаточности. Возможно злокачественное течение ар-
териальной гипертензии с тяжелыми осложнениями.
Эффективное снижение АД возможно только при активном патогенети-
ческом лечении иммунного воспаления с широким применением, помимо
глюкокортикостероидов, цитостатических иммуносупрессантов (особенно
циклофосфамида), а также гепарина и дезагрегантов. При неспецифическом
аортоартериите показана ангиография для решения вопроса о возможности
хирургической реваскуляризации.
РЕНОПАРЕНХИМАТОЗНАЯ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Хронические заболевания почечной паренхимы являются наиболее час-
той причиной симптоматической артериальной гипертензии. Она отмечается
более чем у 50 % больных с острым и хроническим гломерулонефритом,
хроническим пиелонефритом, диабетической нефропатией и поликистозом
469
почек и закономерно развивается при хронической почечной недостаточно-
сти независимо от ее причины. Реже (у 20—50 %) больных артериальная ги-
пертензия возникает при хроническом интерстициальном нефрите, подаг-
рической нефропатии, системной красной волчанке, амилоидозе и опухолях
почек. Она обусловлена значительным уменьшением массы функционирую-
щей паренхимы с развитием нефросклероза — так называемой вторично
сморщенной почки.
Патогенетические факторы артериальной гипертензии включают: 1) вы-
падение депрессорной функции почек вследствие уменьшения образования
в них простагландинов А2, Е2 и кининов, обладающих способностью рас-
ширять прежде всего почечные артериолы, увеличивать почечный кровоток
и выделениеЫа+; 2) увеличение ОЦП вследствие нарушения выделительной
функции почек (объем-зависимая артериальная гипертензия); 3) активацию
ренин-ангиотензин-альдостероновой системы вследствие сосудистых пора-
жений и особенно вторично при развитии сморщивания почек.
Наряду с отеками, олигурией, протеинурией, гематурией артериальная
гипертензия характерна для синдрома острого нефрита. В большинстве случа-
ев она умеренная, появляется с первых дней болезни одновременно с дру-
гими симптомами и исчезает после выздоровления. В тяжелых случаях воз-
можно, однако, развитие злокачественной артериальной гипертензии. По-
ставить правильный диагноз помогают связь заболевания со стрептококко-
вой инфекцией и характерные изменения в моче.
Большие трудности для диагностики и дифференциальной диагностики
представляет гипертензивная форма хронического гломерулонефрита, которая
протекает моносимптомно под маской эссенциальной артериальной гипер-
тензии (гипертонической болезни) и сопровождается минимальными изме-
нениями в моче. К особенностям ее клинических проявлений относятся чаще
молодой возраст, преимущественное повышение диастолического АД при
систолическом обычно не более 180 мм рт.ст., устойчивость артериальной
гипертензии и отсутствие кризов. Важное диагностическое значение имеет
обнаружение при анализе медицинской документации предшествовавших
артериальной гипертензии изменений в моче, а также преходящего повы-
шения АД во время беременности. В отличие от эссенциальной артериальной
гипертензии признаки коронарного и церебрального атеросклероза появля-
ются относительно поздно. При диагностике учитывается устойчивость из-
менений мочевого осадка в виде мочевого синдрома с преобладанием эрит-
роцитов и цилиндрурией. Вследствие диффузного характера поражения па-
ренхимы с одинаковым по выраженности нарушением функции обеих по-
чек и их уменьшением в размерах по данным рентгенологических и радио-
нуклидных методов исследований уточнить генез нефросклероза (эссенци-
альная артериальная гипертензия или хронический гломерулонефрит) по-
зволяет только биопсия почки.
Артериальная гипертензия вследствие диффузного гломерулонефрита и вас-
кулита почечных артерий может встречаться при всех диффузных заболеваниях
соединительной ткани и особенно часто при системной красной волчанке.
Хронический пиелонефрит часто протекает латентно и проявляется лишь
артериальной гипертензией, которая возникает обычно при значительном
уменьшении массы функционирующей паренхимы и развитии нефроскле-
роза. Хотя патологический процесс чаще двусторонний, степень поражения
почек неодинаковая. Заподозрить пиелонефритический генез артериальной
гипертензии позволяет интермиттирующий характер повышения АД на ран-
них стадиях заболевания, связанный с обострениями пиелонефрита, кото-
рые проявляются познабливанием, дизурией, олигурией, одутловатостью
лица, субфебрилитетом, воспалительными сдвигами в крови и моче. Посте-
пенно артериальная гипертензия становится стойкой, отмечается высокий
уровень диастолического АД. В анамнезе характерны обструктивное пораже-
ние мочевыводящих путей (мочекаменная болезнь, аденома предстательной
железы и др.), рецидивирующая уроинфекция, врожденные аномалии почек.
Нередко преходящее повышение АД отмечается во время беременности.
При обследовании характерна стойкая гипоизостенурия в сочетании с
лейкоцитурией и бактериурией, которые, однако, часто слабо выражены.
Обязателен бактериальный посев мочи с определением ее микробного числа.
Может отмечаться анемия, изредка гематурия. Сочетание этих признаков с
деформацией чашечно-лоханочного аппарата, уменьшением размеров по-
чек и нарушением их функции, неодинаково выраженными о обеих сторон
по данным инструментальных методов, обычно позволяет уточнить диагноз.
Артериальная гипертензия при поликистозе почек связана с их ишемией
из-за кистозного перерождения, нефросклерозом или присоединением ин-
фекции (вторичным пиелонефритом). При этом почки значительно увеличе-
ны в размерах и хорошо пальпируются, а множественные кисты определя-
ются при инструментальном обследовании (урографии, УЗИ, компьютер-
ной томографии).
Генез артериальной гипертензии при сахарном диабете сложен. Он может
быть обусловлен: 1) диабетическим нефросклерозом (синдром Киммелстила—
Уилсона); 2) сопутствующей эссенциальной артериальной гипертензией;
3) изолированной систолической артериальной гипертензией вследствие атеро-
склероза аорты; 4) реноваскулярной артериальной гипертензией атероскле-
ротической этиологии; 5) сопутствующим сахарному диабету хроническим
пиелонефритом. Первым признаком диабетического нефросклероза является
относительно стойкая протеинурия, которая предшествует появлению оте-
ков и артериальной гипертензии. Гипертонические кризы не характерны. С
развитием сморщенной почки устанавливаются тяжелая артериальная ги-
пертензия и хроническая почечная недостаточность.
Лечение. Для лечения артериальной гипертензии при остром гломеруло-
нефрите в большинстве случаев достаточно нормализовать ОЦП путем огра-
ничения жидкости, соли и приема фуросемида. При хронических заболева-
ниях почек тактика определяется главным образом наличием и выраженно-
стью хронической почечной недостаточности. При ее отсутствии, аналогич-
но терапии тяжелой эссенциальной артериальной гипертензии, рекомен-
дуется комбинация 2—3 препаратов — салуретика, нейро- и миотропного
471
препарата (вазодилататора). Высокоэффективны ингибиторы АПФ. В случаях
хронической почечной недостаточности I стадии (клубочковая фильтрация
составляет 15—40 мл/мин) при отсутствии отеков во избежание значитель-
ного снижения ОЦП и усугубления уменьшения клубочковой фильтрации
избегают чрезмерного ограничения соли и приема салуретиков, а также
уменьшения диастолического АД ниже 100 мм рт.ст. Тиазидовые диуретики
неэффективны, а калийсберегающие противопоказаны. Комбинируют 3 пре-
парата: фуросемид, p-адреноблокатор (или а-метилдофа) и гидралазин (или
празозин, или блокатор кальциевых каналов, или антагонист АПФ). При
терминальной хронической почечной недостаточности применяют ультра-
фильтрацию и гемодиализ, из медикаментозных препаратов — р-адренобло-
каторы и празозин. При преимущественно одностороннем поражении и смор-
щенной нефункционирующей почке в случаях рефрактерной артериальной
гипертензии прибегают к нефрэктомии. Снижение АД наступает и после
трансплантации почки.
ЭНДОКРИННАЯ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Сидром и болезнь Иценко—Кушинга. Обусловлены гиперкортицизмом —
избыточной продукцией корковым веществом надпочечников глюко- и, в
меньшей степени, минералокортикоидов. Термином “болезнь Иценко—
Кушинга” обозначают двустороннюю диффузную гиперплазию коркового
вещества надпочечников с повышенным образованием кортизола под влия-
нием избыточной продукции АКТГ передней долей гипофиза или (реже)
кортикотропин-рилизинг-гормона гипоталамусом. Заболевание в большин-
стве случаев вызывается доброкачественной базофильной аденомой гипо-
физа, часто микроскопических размеров, реже — эктопическими злокаче-
ственными опухолями, продуцирующими АКТГ или АКТГ-подобные пеп-
тиды с локализацией в бронхах, вилочковой железе, поджелудочной желе-
зе, предстательной железе и пр.
Причиной синдрома Иценко-Кушинга является кортизолсекретирующая
опухоль (аденома, аденокарцинома) одного из надпочечников (так называ-
емый первично-надпочечниковый синдром Иценко-Кушинга) либо дли-
тельное лечение глюкокортикостероидами (экзогенный синдром).
Артериальная гипертензия отмечается у большинства больных, однако ее
патогенез остается неясным. Возможными механизмами являются: 1) увели-
чение синтеза ангиотензина I; 2) повышение реактивности сосудов по отно-
шению к норадреналину и другим прессорным веществам; 3) задержка поч-
ками Na+ и воды с уве/ ичением ОЦП под влиянием избытка кортизола, а
также минералокортикоидов, секреция которых обычно повышается парал-
лельно увеличению продукции кортизола.
Артериальная гипертензия чаще мягкая или умеренная и не является при-
чиной обращения больных за медицинской помощью. Однако при несвое-
временном распознавании она приводит к сосудистым осложнениям, кото-
472
Таблица 49. Характеристика проявлений гиперкортицизма н их генез
I Минералокортикоиды I Глюкокортикостероиды | Андрогены
Дезоксикортикостерон, Гормоны, секретируемые надпочечниками Кортизол, кортикостерон Андростерон,
альдостерон Задержка Na+ и Действие Катаболизм белков, глюконеогенез, синтез андростендиол Образование белка,
выделение К* и накопление жиров половые признаки
Артериальная гипертензия, Проявления гиперпродукции Артериальная гипертензия, ожирение Гирсутизм,
полиурия, полидипсия, туловища, лунообразное лицо, striae вирилизация,
мышечная слабость rubrae, снижение толерантности к глюкозе, акне
Альдостерон остеопороз, полицитемия, лейкоцитоз, лимфопения В какам виде выделяются 17-Оксикетостероиды 17-кетостероиды
Клиническая картина при исключительной или преимущественной гиперпродукции
Синдром Конна Синдром Иценко—Кушинга Адрено-гениталь-
ный синдром
рые могут быть причиной смерти. Артериальная гипертензия носит систоло-
диастолический характер и протекает без кризов.
Заподозрить заболевание позволяют характерные клинические проявле-
ния гиперкортицизма, обусловленные гиперпродукцией глюко- и, в мень-
шей степени, минералокортикоидов и андрогенов (табл. 49). К ним относят-
ся центрйпетальное ожирение, лунообразное лицо, мышечная слабость и
атрофия мышц, багровые полосы, чаще в низу живота (striae rubrae), акне,
гипертрихоз, вирилизация, гирсутизм. При общем лабораторном обследова-
нии отмечаются полицитемия, лейкоцитоз, снижение толерантности к глю-
козе, умеренная гипокалиемия. Уточнить диагноз позволяет повышенная
экскреция 17-оксикетостероидов (17-ОКС) и 17-кетостероидов (17-КС) с
мочой за сутки. Только при положительном результате этого скриннингово-
го теста переходят к установлению причины гиперкортицизма путем опре-
деления уровня АКТГ в крови и дексаметазоновой пробы. Меньшее диагно-
стическое значение имеет увеличение уровня кортизола в крови.
Для гиперкортицизма гипофизарного происхождения, наряду с повыше-
нием уровня кортизола, характерно увеличение содержания в крови АКТГ в
базальных условиях и подавление его секреции после приема 1 мг дексаме-
тазона. При этом снижается также содержание 17-ОКС в крови и их экскре-
ция с мочой. При синдроме Иценко—Кушинга повышенная продукция кор-
тизола угнетает гипоталамо-гипофизарную ось и вызывает снижение уровня
АКТГ, а прием дексаметазона не приводит к уменьшению выработки кор-
тизола и его содержания в плазме крови.
473
Рентгенодиагностика опухолей гипофиза и надпочечников представляет
значительную сложность. В большинстве случаев на обычном снимке черепа
изменения отсутствуют. Более информативной является компьютерная то-
мография или ядерно-магнитно-резонансная визуализация области турец-
кого седла, которая позволяет обнаружить его расширение и разрушение.
Косвенные признаки опухоли надпочечника изредка определяются при экс-
креторной урографии и ультразвуковом исследовании почек. В ряде случаев,
однако, даже компьютерная томография и ядерно-магнитный резонанс не
позволяют обнаружить опухоль, в связи с чем приходится идти на пробную
операцию. При карциноме надпочечника может оказаться полезной селек-
тивная артериография и флебография с раздельным забором проб крови из
обеих надпочечниковых вен.
Радикальное лечение заболевания хирургическое и состоит в удалении
опухоли гипофиза или надпочечников и, по показаниям, в заместительной
терапии. Без такого лечения тяжесть проявлений гиперкортицизма нарастает,
хотя артериальная гипертензия обычно поддается гипотензивной терапии.
Первичный гиперальдостеронизм (синдром Конна) обусловлен гиперсекре-
цией альдостерона аденомой или карциномой коркового вещества надпо-
чечников (в 70—80 %) или, реже, наблюдается при его двусторонней идио-
патической гиперплазии. Причина такой гиперплазии неизвестна. Предпола-
гают ее связь с гиперпродукцией так называемого альдостеронстимулирую-
щего фактора — гликопротеина, выделенного из мочи, плазмы крови и ги-
пофиза. Степень увеличения продукции альдостерона и выраженность про-
явлений заболевания у таких больных обычно меньше, чем при опухоли, и
сходны с таковыми при гипоренинной форме эссенциальной артериальной
гипертензии.
Действуя непосредственно на клеточную мембрану дистальных почечных
канальцев, альдостерон увеличивает реабсорбцию Na+ и одновременно по-
вышает секрецию К+ и Н+. В результате объем внутри- и внесосудистой жид-
кости сначала возрастает. Однако через 3—4 сут в результате так называемого
ускользания почек реабсорбция Na+ устанавливается на новом, более низ-
ком уровне, и первоначально увеличенный ОЦП уменьшается. При этом
выделение К+ остается повышенным. Такое “ускользание”, возможно,
опосредуется ПНУФ и объясняет отсутствие у таких больных отеков.
Артериальная гипертензия отмечается не у всех больных с первичным
гиперальдостеронизмом, и патогенез ее неясен. Так, АД не изменяется при
ряде состояний с высоким уровнем альдостерона в крови, например, при
циррозе печени и беременности, однако может сохраниться повышенным
после удаления надпочечников у больных с идиопатическим гиперальдосте-
ронизмом. Предполагают, что причиной артериальной гипертензии является
возрастание реактивности артериол к прессорным воздействиям, возмож-
но, отчасти вследствие накопления в их стенке Na+. Поскольку повышен-
ный уровень альдостерона подавляет секрецию ренина, артериальная гипер-
тензия носит характер объем (№+)-зависимой.
Клинические проявления первичного гипералвдостеронизма складываются
474
из симптомов артериальной гипертензии и дефицита К+. Болеют чаще жен-
щины моложе 40 лет. Артериальная гипертензия обычно мягкая или умерен-
ная, систоло-диастолическая, отмечается ретинопатия I—II степени, может
наблюдаться постуральная артериальная гипотензия. Осложнения артериаль-
ной гипертензии встречаются редко. Характерно отсутствие отеков. Призна-
ки гипокалиемии у большинства больных выражены слабо, к ним относятся
мышечная слабость, парестезии, полиурия и полидипсия. Заподозрить забо-
левание позволяет наличие стойкой гипокалиемии <3,5 ммоль/л при экс-
креции калия >30 ммоль/сут на фоне рациона с нормальным содержанием
натрия хлорида. Необходимо учитывать, однако, что гипокалиемия не мо-
жет служить надежным критерием первичного гиперальдостеронизма, так
как отмечается также у больных с эссенциальной артериальной гипертензи-
ей при лечении салуретиками, при вторичном гиперальдостеронизме и син-
дроме Иценко-Кушинга. В отличие от них при первичном гиперальдостеро-
низме гипокалиемия сочетается с нормальным или повышенным содержа-
нием Na+ в крови и алкалозом. В таких случаях подтвердить диагноз позво-
ляет выявление повышенного содержания альдостерона в крови и суточной
моче в сочетании со сниженной активностью ренина в плазме крови. Значи-
тельная гипоренинемия обусловлена уменьшением секреции ренина вслед-
ствие увеличения ОЦП и не изменяется в вертикальном положении и после
приема салуретиков, которые в норме ее стимулируют. Обнаружение повы-
шения уровня альдостерона имеет диагностическое значение только при ис-
ключении гипонатриемии, которая усиливает его секрецию.
При исследовании мочи обнаруживается стойкая щелочная реакция вслед-
ствие усиленного выделения Н+. Отмечаются также устойчивая гипоизосте-
нурия и мочевой синдром, обусловленные калийпенической нефропатией с
поражением проксимальных канальцев и нефросклерозом.
Определенное диагностическое значение имеет “доказательство ех
juvantibus” — быстрый, в течение 2-3 дней эффект спиронолактона в виде
снижения АД и уменьшения выделения К+ с мочой при обогащении рацио-
на солью. Такой же эффект может, однако, наблюдаться и при гипоренин-
ной форме эссенциальной артериальной гипертензии.
Артериальная гипертензия и гипокалиемия свойственны также вторич-
ному гиперальдостеронизму. Этот синдром связан с тяжелой эссенциальной
артериальной гипертензией или злокачественной артериальной гипертензи-
ей либо с сужением почечной артерии, которое, вызывая уменьшение по-
чечного кровотока, стимулирует образование ренина и ангиотензина. Для
вторичного гиперальдостеронизма характерны гипонатриемия, подавление
секреции альдостерона с помощью солевой нагрузки и стойко повышенная
активность ренина в плазме крови.
После установления наличия первичного гиперальдостеронизма с помо-
щью лабораторных методов проводят инструментальное исследование над-
почечников для определения его причины (изолированная опухоль или диф-
фузная гиперплазия). Наиболее информативны сканирование надпочечни-
ков с |311-холестерином, компьютерная томография и ядерно-магнитный
475
резонанс. Для идиопатического гиперальдостеронизма характерно также по-
вышение уровня альдостерона в крови в вертикальном положении, свиде-
тельствующее о сохранении надпочечниками ответа на ангиотензин И, ко-
торый при аденоме отсутствует.
При аденоме лечением выбора является экономная резекция надпочеч-
ника с удалением опухоли. Это приводит к нормализации содержания альдо-
стерона и калия в крови, но “излечивает” от артериальной гипертензии лишь
60—70 % больных. Учитывая этот факт, а также необходимость заместитель-
ной терапии после двусторонней адреналэктомии, при идиопатической ги-
перплазии коркового вещества надпочечников проводят медикаментозную
терапию спиронолактоном по 200 мг в сутки, который хорошо корригирует
как артериальную гипертензию, так и гипокалиемию.
Феохромоцитома. Это опухоль, развивающаяся из хромаффинной ткани
нейроэктодермального происхождения, продуцирующая катехоламины -
адреналин и норадреналин. В 90 % случаев ее источником является мозговое
вещество надпочечников. Значительно реже она имеет внеадреналовое про-
исхождение — из органа Цуккеркандля, парааортальных телец, нервных спле-
тений органов брюшной и тазовой полостей с частой локализацией в облас-
ти бифуркации аорты, ворот почки, стенки мочевого пузыря и прямой киш-
ки. Такие вненадпочечниковые опухоли называют также параганглиномами.
Они часто множественные, у 10 % больных двусторонние, у 90 % — добро-
качественные. Весьма характерны семейные случаи заболевания:
Размеры феохромоцитомы варьируют от нескольких миллиметров до круп-
ных образований массой до 3 кг. Для вненадпочечниковых опухолей более
характерна секреция одного норадреналина, тогда как надпочечниковые
опухоли чаще продуцируют оба гормона в разных пропорциях, иногда также
дофамин. Характер преимущественно секретируемого гормона оказывает вли-
яние на клинические проявления заболевания.
Хотя феохромоцитома является редким заболеванием (встречается у 0,5—
1 % больных с артериальной гипертензией), ее ранняя диагностика имеет
важное значение, так как хирургическое лечение обеспечивает полное изле-
чение при доброкачественных опухолях и во всех случаях позволяет предот-
вратить тяжелые осложнения гипертонических кризов и фатальные желу-
дочковые аритмии. Нераспознанная опухоль может быть причиной внезап-
ной смерти и летального исхода во время наркоза, родов и в послеопераци-
онный период.
Клинические проявления заболевания обусловлены действием адренали-
на и норадреналина, которые периодически или постоянно в большом ко-
личестве поступают в кровь. В соответствии с этим выделяют следующие
клинические варианты заболевания: а) пароксизмальную форму, проявляю-
щуюся гипертоническими кризами на фоне нормального АД; б) стойкую
артериальную гипертензию с кризами (самый частый вариант) или без них.
В 30 % случаев артериальная гипертензия носит характер злокачественной.
Пароксизмальная форма свойственна преимущественно адреналовой фео-
хромоцитоме, а устойчивая артериальная гипертензия — норадреналовой.
476
Наиболее характерным клиническим проявлением феохромоцитомы явля-
ются гипертонические кризы, которые сопровождаются резкой головной бо-
лью, потливостью и сердцебиением (“пароксизмальная триада”)- В большин-
стве случаев артериальная гипертензия носит характер систоло-диастоличе-
ской. Изредка, при преимущественном выбросе адреналина, отмечается изоли-
рованная систолическая артериальная гипертензия со снижением диастоличе-
ского АД вследствие преобладания возбуждения 0-адренорецепторов. Больные
возбуждены, часто отмечаются тремор рук, тошнота, иногда рвота. Кожа
бледная, влажная на ощупь. Изредка за счет эффекта адреналина она, наобо-
рот, гиперемирована. Характерны повышение температуры тела до 39 °C,
тахикардия, тахиаритмия. Резкое повышение АД может приводить к развитию
ишемии миокарда, острой левожелудочковой недостаточности или инсульту.
Кризы могут возникать без причины, иногда ночью во время сна или в
связи с увеличением давления на опухоль со стороны соседних тканей при
наклоне туловища, натуживании, пальпации живота. Их могут провоциро-
вать волнение, смех, чиханье, прием пищи и алкоголя, а также наркоз и
такие диагностические исследования, как внутривенная уро- и ангиография.
В связи с этим при назначении больному с возможной симптоматической
артериальной гипертензией инвазивного обследования необходимо исключить
феохромоцитому. Кризы относительно непродолжительные, длятся, как пра-
вило, от 15 мин до 1 ч и часто спонтанно купируются. У большинства боль-
ных они повторяются в среднем 1 раз в неделю, но могут возникать и нео-
днократно в течение дня. После приступа отмечается резкая общая слабость.
В межкризовый период больных могут беспокоить одышка, сердцебие-
ние, перебои, а также боль в животе вследствие сдавления опухолью сосед-
них тканей. Обращает на себя внимание характерный внешний вид больных:
они худощавы, бледны, возбудимы, конечности холодные, иногда циано-
тичные, отмечается тремор пальцев. Иногда потеря массы тела бывает до-
вольно значительной, может отмечаться субфебрилитет. АД стойко повыше-
но или не изменено. Необходимо иметь в виду, однако, что в единичных
случаях при продукции опухолью больших количеств дофамина АД может
быть снижено. Весьма характерна ортостатическая артериальная гипотензия
вследствие уменьшения выраженности рефлекторной реакции симпатиче-
ского тонуса на уменьшение венозного притока в условиях длительной из-
быточной секреции катехоламинов. При наблюдении за больным можно об-
наружить парадоксальное повышение АД после приема 0-адреноблокаторов
или постганглионарных симпатолитиков. При злокачественном течении ар-
териальная гипертензия осложняется застойной сердечной недостаточностью,
иногда со значительной кардиомегалией, тяжелой ретинопатией и хрони-
ческой почечной недостаточностью. Примерно у 15 % больных опухоль оп-
ределяется при пальпации органов брюшной полости.
К неспецифическим лабораторным признакам феохромоцитомы относят-
ся преходящая гипергликемия, изредка - глюкозурия, лейкоцитоз со сдви-
гом формулы влево и альбуминурия после криза. Снижение толерантности к
углеводам может сохраняться и в межприступный период.
477
Специфическая диагностика заболевания основывается на демонстрации
избыточного образования норадреналина, адреналина и (или) дофамина, о
чем свидетельствует повышение их содержания в моче и (или) крови. Более
простым и одновременно информативным является определение суточной
экскреции с мочой продуктов метаболизма катехоламинов: адреналина —
метадреналина и норадреналина - норметадреналина, а также их общего
метаболита ванилилминдальной кислоты. В отличие от адреналина и норад-
реналина содержание в моче этих веществ не зависит от приема медикамен-
тозных препаратов (а-метилдофа, хлорпромазина, ингибиторов моноамин-
оксидазы, тетрациклинов, бронходилататоров и др.), а также злоупотребле-
ния кофе и шоколадом, которые могут быть причиной ложноположитель-
ных результатов исследования.
Следует подчеркнуть, что при наличии характерных клинических при-
знаков отрицательный результат однократного определения не исключает
диагноз, для уточнения которого требуются повторные биохимические ис-
следования. В таких случаях выявить катехоламинемию помогает исследова-
ние мочи, собранной сразу после криза. Определение адреналина и норадрен-
алина в крови, по-видимому, не имеет существенных преимуществ перед
исследованием их в моче, особенно в случаях их интермиттирующей секре-
ции опухолью.
При отрицательных результатах биохимических тестов могут быть полез-
ны фармакологические пробы, диагностическое значение которых, однако,
ограничено вследствие относительно невысокой чувствительности и специ-
фичности (около 75 %). Существует два варианта этих проб: провокацион-
ные и адренолитические. Провокационные тесты стимулируют выброс кате-
холаминов опухолью с развитием гипертонического криза и повышением
содержания катехоламинов в крови и моче. Из-за опасности развития тяже-
лых, потенциально фатальных осложнений - нарушений ритма, ишемии
миокарда, отека легких — в настоящее время применяют преимущественно
глюкагоновый тест, а гистаминовый практически не используют.
Из адренолитических проб наиболее распространенной является клофе-
линовая. Клофелин, как центральный а-адреностимулятор, вызывает умень-
шение уровня норадреналина в плазме крови, секретируемого нервными
окончаниями, но не влияет на выделение катехоламинов феохромоцитомой.
Благодаря этому у таких больных, в отличие от здоровых и пациентов с
другим генезом артериальной гипертензии, после приема этого препарата
содержание катехоламинов в крови существенно не изменяется.
Ввиду более высокой специфичности, но низкой чувствительности глю-
кагонового теста и, наоборот, низкой специфичности и относительно высо-
кой чувствительности клофелинового, перспективным является их сочетан-
ное применение. Отрицательный результат обоих тестов позволяет с уверен-
ностью исключить феохромоцитому.
При положительном результате биохимических методов переходят к
инструментальной диагностике локализации опухоли. При ее локализации в
надпочечниках и больших размерах она визуализируется с помощью ультра-
478
звукового исследования, а косвенные признаки иногда можно выявить при
экскреторной урографии. Для обнаружения надпочечниковых опухолей ис-
пользуют селективную артерио- или флебографию, а вненадпочечниковых
— аортографию. Учитывая возможность провокации секреции катехоламинов
и тяжелого криза при введении контрастного вещества, методами выбора
обычно считаются компьютерная томография и ядерно-магнитный резонанс,
которые позволяют обнаруживать новообразования диаметром до 1 см у 90 %
больных. Наиболее информативным при этом заболевании является специ-
фический метод визуализации адреналовой ткани — сцинтиграфия с мета-
йодбензилгуанидином, меченным 1311, который избирательно захватывает-
ся хромаффинными клетками. Этот метод позволяет обнаруживать опухоли,
не выявленные при компьютерной томографии, особенно параганглиомы,
установить адренергическое происхождение опухоли и ее метастазирование
в злокачественный случаях.
При кризовом течении артериальной гипертензии с вегетативной симп-
томатикой во время приступа (дрожь, покраснение или побеление кожи,
сердцебиение и др.) пароксизмальную форму феохромоцитомы дифферен-
цируют с эссенциальной артериальной гипертензией, протекающей с кри-
зами I типа, диэнцефальным (гипоталамическим) синдромом и пароксиз-
мальной тахикардией. В пользу феохромоцитомы свидетельствуют характер
факторов, провоцирующих криз, его относительно короткая продолжитель-
ность и спонтанное купирование с характерными, хотя и неспецифически-
ми, изменениями в моче и крови после снижения АД. Отличительными
признаками могут служить также парадоксальная реакция АД на прием
Р-адреноблокаторов и склонность к постуральной артериальной гипотензии.
Уточнить диагноз позволяет выявление гиперкатехоламинурии и катехол-
аминемии. В отличие от этого при эссенциальной артериальной гипертензии
развитие кризов связано с иными факторами, они длятся часами и не могут
купироваться самостоятельно. Для кризов при диэнцефальном синдроме ха-
рактерно преобладание субъективных жалоб над объективными изменения-
ми со стороны сердечно-сосудистой системы, нередко спонтанное купиро-
вание с полиурией в конце приступа. Гипертрофия левого желудочка и рети-
нопатия, а также прямые и косвенные признаки патологической гиперкате-
холаминемии отсутствуют. Болеют чаще женщины в молодом возрасте либо
в период климакса.
Значительные трудности могут возникать при дифференциальной диаг-
ностике феохромоцитомы с некоторыми опухолями мозга и карциноидом,
при которых повышение АД сопровождается умеренным увеличением со-
держания адреналина и норадреналина в крови и моче. Уточнить диагноз в
таких случаях позволяют лишь инструментальные методы исследования.
Пароксизмальная тахикардия с вегетативной окраской приступов диаг-
ностируется на основании характерных данных ЭКГ. Необходимо иметь в
виду, что не менее чем у 50 % больных феохромоцитома протекает с высо-
кой, иногда злокачественной артериальной гипертензией без кризов.
479
При лечении методом выбора является хирургическое иссечение опухоли.
При невозможности его выполнения применяют медикаментозную терапию
а-адреноблокаторами — фентоламином, феноксибензамином и празозином.
Снижая АД и нормализуя ОЦП, эти препараты предотвращают не только
подъем, но и последующее резкое снижение АД при различных манипуляциях
и вмешательствах, в том числе при удалении самой опухоли. Фентоламин (ре-
гитин) назначают в таблетках по 10—30 мг каждые 4-6 час, а длительно дей-
ствующий феноксибензамин - по 10-50 мг 2 раза в сутки. При тахикардии и
тахиаритмиях а-адреноблокаторы сочетают с 0-адреноблокаторами, главным
образом с пропранололом в относительно небольших индивидуально подобран-
ных дозах. При этом во избежание вазоконстрикторного действия 0-адреноблока-
торов их назначению обязательно предшествует блокада а-адренергических ре-
цепторов путем применения соответствующих препаратов, желательно за 1—3
дня. Менее эффективен комбинированный а-, 0-адреноблокатор лабеталол
вследствие превалирования блокады 0-ацренорецепторов. Применяют также а-
метилтирозин, обладающий способностью тормозить гидроксилирование тиро-
зина с образованием допа и тем самым снижать синтез как адреналина, так и
норадреналина. Препарат оказывает хорошее гипотензивное и симптоматичес-
кое действие, но обладает нежелательными гастроэнтерологическими и невро-
логическими побочными эффектами и может ухудшать функцию почек.
Для купирования гипертонического криза препаратом выбора является
фентоламин, который вводят по 1-5 мг внутривенно струйно дробно каж-
дые 5—10 мин до стойкой нормализации АД. Эффективна также внутривен-
ная капельная инфузия натрия нитропруссида. Все остальные гипотензив-
ные средства не дают эффекта. Пропранолол (обзидан) применяют при та-
хикардии и тахиаритмиях по 1-2 мг внутривенно струйно дробно только
после введения а-адреноблокатора.
Врожденная гиперплазия коркового вещества надпочечников. Обусловлена
недостатком ферментов, участвующих в синтезе кортизола — 17-а- или
11-0-гидроксилаз. Снижение уровня кортизола по механизму обратной свя-
зи вызывает увеличение секреции АКТГ гипофизом, что влечет за собой
повышение продукции дезоксикортикостерона. Вследствие этого у больных
развиваются объем (натрий-) зависимая артериальная гипертензия, гипока-
лиемия и гипоренинемия. Секреция альдостерона снижена или не изменена.
При дефиците 17-а-гидроксилазы блокируется также синтез андрогенов и
эстрогенов, что препятствует развитию вторичных половых признаков и явля-
ется причиной первичной аменореи. В случаях дефицита 11-0-гидроксилазы
метаболизм андрогенов не страдает. Наоборот, под влиянием АКТГ их синтез
повышается, что приводит к вирилизации. Лечение состоит в приеме кортизола.
СЕРДЕЧНО-СОСУДИСТАЯ (ГЕМОДИНАМИЧЕСКАЯ)
АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Коарктация аорты (см. также главу 6). Причинами артериальной гипер-
тензии служат механическое препятствие в виде стеноза аорты, повышенная
480
активность ренин-ангиотензиновой системы и изменение “уставки” баро-
рецепторов в сторону увеличения симпатического тонуса. Ее особенностями
при этом заболевании являются преимущественное поражение мужчин (4:1),
развитие устойчивой, без кризов, чаще мягкой или умеренной систоло-
диастолической артериальной гипертензии, наблюдаемой с детского или юно-
шеского возраста. Характерна усиленная пульсация сонных артерий при зна-
чительно запаздывающей и резко ослабленной пульсации на бедренных или
при ее отсутствии. В сомнительных случаях различие величин АД на верхних
и нижних конечностях возрастает после физической нагрузки. Иногда в об-
ласти лопаток и на боковых поверхностях туловища визуально и пальпатор-
но определяются расширенные пульсирующие коллатерали. Неспецифичес-
кими признаками являются жалобы на слабость и утомляемость нижних ко-
нечностей и неинтенсивный поздний систолический шум в прекардиальной
области или межлопаточном пространстве. Подтвердить диагноз позволяют
рентгеноконтрастная аортография и компьютерная томография. Лечение
хирургическое.
Изолированная систолическая (атеросклеротическая) артериальная гипер-
тензия. Обусловлена уменьшением податливости аорты вследствие атеро-
склероза. Ее критерием является повышение систолического АД более 140 мм
рт.ст. при неизмененном диастолическом АД (менее 90 мм рт.ст.). Увеличе-
ние систолического АД вследствие сохраненного или несколько повышен-
ного УОС “компенсирует” ригидность аорты. ОПСС практически не изме-
няется, о чем свидетельствует мало измененный уровень среднего АД, ко-
торый является важным показателем преимущественного повышения сис-
толического АД и подтверждает диагноз этого заболевания.
Как показывают эпидемиологические исследования, систолическое АД
обычно начинает повышаться в возрасте старше 55 лет, особенно резко —
после 60, тогда как диастолическое к 60 годам устанавливается на постоян-
ном уровне. Достаточно часто атеросклеротическая артериальная гипертен-
зия присоединяется к эссенциальной, о чем свидетельствует непропорцио-
нальное повышение систолического АД. Вследствие нарушения функции
барорецепторов из-за атеросклеротического поражения сосудистой стенки
больным свойственна постуральная артериальная гипотензия. Диагностиче-
ское значение имеют также признаки атеросклероза аорты и ее крупных
ветвей, в частности усиление II тона и короткий систолический шум над
аортой, ее расширение, уплотнение, развернутость дуги при рентгенологи-
ческом исследовании, признаки фиброза и кальциноза при эхокардиогра-
фии. Может отмечаться неодинаковое наполнение пульса и сосудистый сис-
толический или систоло-диастолический шум над сонными артериями, асим-
метрия АД на верхних конечностях.
Подобно эссенциальной артериальной гипертензии атеросклеротическая
гипертензия может сопровождаться гипертрофией левого желудочка, связа-
на с повышенной частотой сердечно-сосудистых осложнений — хрониче-
ской сердечной недостаточности и особенно инсульта и оказывает суще-
ственное неблагоприятное влияние на выживаемость. Многочисленными
16 7-242
481
исследованиями доказано, что при артериальной гипертензии летальность
одинаково тесно коррелирует с уровнем систолического и диастолического
АД. Это обосновывает целесообразность проведения антигипертензивной тера-
пии у таких больных, что длительное время считалось спорным. Ее целью
является снижение систолического АД (S 140 мм рт.ст.), за исключением
случаев плохой переносимости. Антигипертензивные препараты назначают
осторожно, начиная с малых доз, так как чрезмерное снижение УОС может
вызывать нарушение кровоснабжения жизненно важных органов (мозга,
сердца, почек) и ухудшать состояние больных. Лечение начинают обычно с
назначения салуретиков (гипотиазида). При неэффективности применяют
малые дозы p-адреноблокаторов, блокаторов кальциевых каналов (группа
нифедипина), а-метилдофа, клофелин. Закончившиеся недавно кооператив-
ные исследования, в частности, программа “Систолическая гипертензия у
пожилых” (Systolic Hypertension in the Elderly Program, SHEP, Cooperative
Research Group, 1991) с периодом наблюдения более 5 лет, подтвердили эф-
фективность антигипертензивной терапии таких больных по сравнению с
плацебо, особенно в отношении предотвращения фатальных и нефатальных
инсультов.
При гипертиреозе артериальная гипертензия обусловлена гиперкинетиче-
ским синдромом — повышением УОС и МОС. Для увеличения доставки
тканям организма кислорода, необходимого для удовлетворения возросшей
потребности в нем, периферические артериолы расширяются и ОПСС сни-
жается. Дилатация артериол особенно выражена в сосудах кожи, что обес-
печивает увеличение теплоотдачи в условиях повышенного теплообразова-
ния, а также в скелетных мышцах. Это обусловливает характерный систо-
лический характер артериальной гипертензии с увеличением пульсового дав-
ления, что отличает ее от многих других заболеваний. Частыми, но не обя-
зательными признаками являются возбудимость, плохой сон, похудание при
сохраненном аппетите, тремор рук, экзофтальм и другие глазные симп-
томы, диффузная или очаговая гиперплазия щитовидной железы, тахикар-
дия. В отличие от феохромоцитомы при этом заболевании кожа теплая и су-
хая на ощупь, а артериальная гипертензия является систолической. Под-
твердить диагноз позволяет повышение уровня тироксина (Т4) и трийод-
тиронина (ТЗ) в крови. Лечение хирургическое или медикаментозное (мер-
казолил).
Артериальная гипертензия при застойной сердечной недостаточности обус-
ловлена: 1) повышением ОПСС в ответ на снижение УОС и 2) увеличением
ОЦП вследствие задержки в организме Na+ и воды в результате активации
ренин-ангиотензг н-альдостероновой системы при уменьшении почечного
кровотока. Артериальная гипертензия носит систоло-диастолический харак-
тер и развивается в основном в период нарастания отеков, исчезая после их
ликвидации. Ретинопатия отсутствует или слабо выражена, кризы мало ха-
рактерны. Определяются признаки “застойной почки” в виде сочетания мо-
чевого синдрома с высокой относительной плотностью мочи.
482
ЛЕКАРСТВЕННАЯ (ЯТРОГЕННАЯ) АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Употребление пероральных эстроген- и прогестероисодержащих контрацеп-
тивов относится к частым причинам симптоматической артериальной гипер-
тензии. В большинстве случаев она мягкая, реже умеренная, но иногда мо-
жет быть злокачественной. Ее генез не ясен и предположительно связан с
увеличением образования субстрата ренина ангиотензиногена. При отмене
препарата АД нормализуется медленно — в течение 3 мес и более. Доказано
повышение летальности от сердечно-сосудистых заболеваний среди женщин,
принимающих пероральные контрацептивы, в связи с чем их назначение
больным со стойкой артериальной гипертензией нежелательно.
ГЛАВА 11.
СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Сердечная недостаточность представляет собой клинический синдром. В ее
основе лежит неспособность сердца как насоса обеспечить снабжение орга-
нов и тканей кровью в объеме, необходимом для их нормального метабо-
лизма. Иными словами, при сердечной недостаточности развивается несоот-
ветствие между производительностью сердца и потребностями тканей в кис-
лороде и питательных веществах.
Очевидно, что определение понятия “сердечная недостаточность” весьма
нечеткое. Так, не существует удовлетворительного определения “метаболи-
ческих потребностей” тканей. Если в качестве критерия считать накопление
в них молочной кислоты, то при физической нагрузке это происходит и у
здоровых лиц. Отсутствует и достаточно четкая разделительная грань между
“чистым” заболеванием сердца и начальными признаками сердечной недо-
статочности, которая при нем возникает. Поскольку сердечная недостаточ-
ность является конечным проявлением действия различных патологических
и биохимических процессов, более точного патофизиологического или кли-
нического определения этого понятия не существует.
В характеристике понятия сердечной недостаточности следует отметить
ряд моментов.
1. В ее основе лежит снижение насосной функции сердца, то есть МОС,
несмотря на достаточный венозный приток и давление наполнения. В этом
состоит важное отличие сердечной недостаточности от сосудистой, при ко-
торой уменьшение доставки крови к органам и тканям является результа-
том снижения венозного возврата, то есть наполнения сердца, вследствие
уменьшения объема внутрисосудистой жидкости или тонуса перифериче-
ских вен.
2. Сердечная и сосудистая недостаточность являются основными разно-
видностями недостаточности кровообращения.Этоболееширо-
кое понятие, характеризующееся неспособностью системы кровообращения
16*
483
(то есть либо сердца, либо сосудов) доставлять органам и тканям необходи-
мое для их нормального функционирования количество крови.
3. Критериями сердечной недостаточности являются: 1) снижение МОС;
2) циркуляторная гипоксия с увеличением артериовенозной разницы по кис-
лороду; 3) венозный застой, то есть повышение давления на путях притока
к одному или обоим желудочкам сердца. Важность этого критерия сердечной
недостаточности, в отличие от сосудистой, подчеркивается распространен-
ным термином “застойная сердечная недостаточность ”. Сле-
дует, однако, отметить, что этот термин может иметь разную трактовку и
используется иногда в узком смысле для обозначения бивентрикулярной
(лево-правожелудочковой) сердечной недостаточности.
4. Сердечная недостаточность означает не только неспособность сердца
поддерживать адекватный выброс, но и способность обеспечивать нормаль-
ный его уровень за счет напряжения компенсаторных механизмов, прежде
всего повышения КДО и КДД в желудочке в соответствии с механизмом
Франка—Старлинга. В первом случае имеет место явная, а во втором — скры-
тая, субклиническая, сердечная недостаточность.
5. Снижение насосной функции сердца, то есть МОС, как критерий сер-
дечной недостаточности, может быть как абсолютным, так и относитель-
ным. Относительное уменьшение МОС может быть обусловлено первичным
повышением метаболических запросов органов и тканей, например, при
тиреотоксикозе, или снижением кислородотранспортной функции крови при
анемии. При этом проявления сердечной недостаточности отмечаются при
нормальных и даже несколько повышенных величинах МОС. Такие случаи
относятся к варианту сердечной недостаточности с высоким
МОС. Следует отметить, что для ранних стадий сердечной недостаточности
характерен неизмененный уровень МОС в покое, который, однако, не спо-
собен в достаточной степени повышаться при возрастании метаболических
потребностей тканей в условиях физического или эмоционального напря-
жения.
6. Сердечную недостаточность следует отличать от миокардиальной.
Последняя обусловлена нарушением сократительной функции миокарда и
является, таким образом, более узким понятием. Ее причинами могут быть
как первичные заболевания миокарда (например, миокардит), так и экстра-
миокардиальные факторы — коронарный атеросклероз, вызывающий ише-
мию и некроз кардиомиоцитов, или длительная гемодинамическая пере-
грузка сократительного миокарда при пороках сердца. Миокардиальная не-
достаточность всегда вызывает развитие сердечной недостаточности, но при
сердечной недостаточности не обязательно имеется миокардиальная! При-
мерами сердечной недостаточности при неизмененной функции миокарда
могут служить острая гемодинамическая перегрузка сердца, например, при
разрыве хорды митрального клапана или межжелудочковой перегородки, или
такие хронические заболевания, характеризующиеся нарушением наполне-
ния желудочков, как митральный стеноз и констриктивный перикардит.
Эпидемиология. Клинический синдром сердечной недостаточности
484
([превнагрузки
J [постнагрузки
I [сократимости миокарда
Гемодинамическая
перегрузка
____________[тс
♦ симпатической части (УОС, ЧСС) _
вегетативной нервной системы [эффективного объема
крови в артериальной системе
Почечные юмпесаторные механизм
Гормональные
[ренина
[ангиотензина
[альдостерона
[АДГ
Синусовая
тахикардия
Артериолярная
вазоконстрикция
1 постнагрузки
поддерживает АД
| сократимости
миокарда
Гемодинамические
[почечного кровотока
♦ клубочковой фильтрации
[Фильтрационной фракции
[кортикального кровотока в почках
[реабсорбции Na*
[реабсорбции воды
/
♦ Эффективного объема крови ПН УФ
[растяжёния’ I
- стенки предсердий |
Нормализация
УОС
[венознко давления
[ давления наполнения
желудочков
[гидростатического давления
в капиллярах______________
Периферические отеки
Отек легких
Натрийурез,
диурез
Схема 22. Основные патофизиологические Застой в печени и
механизмы при сердечной недостаточности внутренних органах
отмечается более чем у 1 % населения. Его распространенность увеличивает-
ся с возрастом и достигает 10 % у лиц старше 75 лет (W.Parmley, 1987, и др.).
Сердечная недостаточность является одной из наиболее частых причин гос-
питализации и смерти.
Этиология. Различают причинные и способствующие факторы. Наиболее
частыми причинами сердечной недостаточности являются артериальная ги-
пертензия, затем различные формы ИБС, клапанные пороки сердца и неко-
ронарогенные заболевания миокарда. Выявление причинных и способствую-
щих факторов и по возможности их коррекция имеют важное значение для
повышения эффективности лечения.
Причины сердечной недостаточности
I. Первичное поражение миокарда
1. Диффузное: миокардиты и другие специфические заболевания миокарда; кардио-
миопатии.
2. Очаговое с уменьшением массы жизнеспособного миокарда: инфаркт миокарда
острый и старый (постинфарктный кардиосклероз), сердечная недостаточность как
форма ИБС (атеросклеротический кардиосклероз).
3. Ятрогенное поражение миокарда: лекарственное (доксорубицин, дизопирамид),
радиационное (рентгенотерапия средостения).
II. Нарушение наполнения желудочков сердца
1. Стеноз левого или правого атриовентрикулярного отверстия.
2. Констриктивный и экссудативный перикардит.
3. Заболевания с повышенной жесткостью камеры и (или) миокарда желудочков:
фиброэластоз, рестриктивная кардиомиопатия (эндомиокардиальный фиброз), гипер-
трофия миокарда различного генеза (в том числе гипертрофическая кардиомиопатия).
485
Преднагрузка ЛЖ или конечно-
диастолическая длина долокна
Рис. 67. Кривая функции левого
желудочка Франка-Старлинга: Л —
норма; Б, В — сердечная недостаточ-
ность (от легкой степени до тяже-
лой), Г — кардиогенный шок
III. Гемодинамическая перегрузка
желудочков: 1) повышение сопротив-
ления изгнанию крови (перегрузка
сопротивлением); системная и легоч-
ная артериальная гипертензия; сте-
ноз устья аорты и легочной артерии.
2. Увеличение УОС (перегрузка
объемом): недостаточность клапанов
сердца (митрального, аортального, трехстворчатого); врожденные пороки сердца со
сбросом крови слева направо.
3. Повышение метаболических потребностей тканей организма (сердечная недоста-
точность с высоким МОС): гипоксические состояния (анемия, хроническое легочное
сердце); повышение обмена веществ (тиреотоксикоз); беременность.
Факторы, способствующие развитию сердечной недостаточности
1) уменьшение активности или прекращение лечения сердечной недостаточности;
2) физическое и эмоциональное перенапряжение;
3) неблагоприятное воздействие внешней среды (жара, влажность);
4) алиментарные (злоупотребление солью и жидкостью);
5) нарушения сердечного ритма и проводимости;
6) интеркуррентные инфекции;
7) ТЭВЛА;
8) состояния, связанные с повышением метаболических потребностей органов и тка-
ней: артериальная гипертензия, анемия, лихорадка, тиреотоксикоз, беременность и др.;
9) ятрогенные (прием лекарств, обладающих отрицательным инотропным свойством
или способностью задерживать жидкость);
10) развитие сопутствующего заболевания сердца, которое может оставаться нерас-
познанным: инфаркта миокарда, инфекционного эндокардита, ревматического и не-
ревматического миокардита и др.
Патогенез. Патофизиологические механизмы сердечной недостаточности
представлены на схеме 22. Поскольку МОС является функцией преднагруз-
ки (при сердечной недостаточности возрастает), постнагрузки (возрастает)
и сократимости (снижается), у таких больных кривая Франка—Старлинга
смещается вправо и книзу и уплощается (рис. 67).
Основные факторы компенсации со стороны сердца и организма в целом,
направленные на поддержание насосной функции при гемодинамической
перегрузке или первичном повреждении миокарда, представлены на схеме 23.
При реализации действия большинства из них, наряду с полезными, от-
мечаются более или менее выраженные неблагоприятные эффекты, которые
при определенных условиях становятся превалирующими. Так, поддержание
адекватного ударного выброса с помощью механизма Франка-
Старлинга в условиях сниженной сократимости при характерном сме-
щении и уплощении кривой функции сердца обеспечивается значительным
повышением КДО и КД Д в желудочке (рис. 67) и давления на путях прито-
486
Срочная
изменения со
стороны
сердца
Дилатация
полостей
/механизм
Франка-Старлинза)
Увеличение ЧСС
Компенсация
Системные
изменения
Активация САС
Активация РААС и
АДГ
(задержка Na* и
веды, увеличение
ОЦП)
ПНУФ
Долговременная
Гипертрофия
миокарда
Замедление кровотока
Уменьшение сродства
нь к Ог
(увеличение отдачи
Ог тканям)
Схема 23. Факторы компенсации при сердечной недостаточности: САС — симпатико-
адреналовая система; РААС — ренин-ангиотензин-альдостероновая система; АДГ — анти-
диуретический гормон; ОЦП — объем циркулирующей плазмы; ПНУФ — предсердный
натрийуретический фактор; НЬ - гемоглобин
ка. При перерастяжении миокарда свыше определенного предела его функ-
ция, наоборот, ухудшается.
Снижение МОС непосредственно, путем уменьшения раздражения
барорецепторов аорты, а также в результате ухудшения перфузии почек,
приводит к активации симпатической части вегетативной
нервной системы и важнейших гуморальных регуляторных
систем. При этом стимуляция р,-адренорецепторов вызывает повышение
сократимости миокарда и ЧСС, а а,-адренорецепторов — сужение артериол
(поддержание АД) и вен (увеличение венозного притока крови к сердцу).
Активация ренин-ангиотензин-альдостероновой систе-
м ы (схема 24) вначале также играет компенсаторную роль, способствуя
увеличению КДО за счет роста венозного возврата и объема внутрисосудис-
той жидкости. Однако со временем это приводит к обратным результатам —
снижению УОС из-за резкого повышения постнагрузки и развитию отеков
вследствие увеличения гидростатического давления в капиллярах выше уровня
коллоидно-осмотического давления. При этом концентрация Na+ в крови
снижается из-за относительно большей выраженности задержки воды под
влиянием антидиуретического гормона.
При хронической сердечной недостаточности компенсаторная роль симпа-
тико-адреналовой системы резко ограничивается из-за уменьшения плотности
Р]-адренорецепторов в миокарде и истощения запасов норадреналина в нерв-
ных окончаниях.
487
Схема 24. Роль ренин-ангиотензин-альдостероновой системы в патогенезе сердечной
недостаточности: АПФ — ангиотензин П-превращающий фермент; АДГ — анти-
диуретический гормон
Выделяющийся при повышении давления в левом предсердии П Н У Ф
(гормон) способствует увеличению натрийуреза и диуреза, противодей-
ствует констрикторному влиянию на сосуды норадреналина и ангиотен-
зина II и уменьшает секрецию альдостерона.
Важное значение имеет замедление скорости кровотока, которое создает
благоприятные условия для увеличения отдачи кислорода и питательных ве-
ществ крови тканям, и проявляется увеличением артериовенозной разницы
по кислороду. Этому же способствует уменьшение сродства гемоглобина к
кислороду (сдвиг кривой диссоциации оксигемоглобина вправо) в результа-
те повышения уровня 2,3-дифосфоглицерата в условиях гипоксии и ацидоза.
Гипертрофия миокарда функционально отягощенных отделов
сердца является основным механизмом его долговременной адаптации. Од-
новременно с увеличением массы сократительных элементов происходит
снижение диасто; ической податливости камер сердца, что вызывает повы-
шение К ПД для обеспечения адекватного наполнения желудочка (его КДО)
и МОС. Этому способствует усиление сокращения предсердия, что обуслов-
ливает образование патологического S4.
В ранних стадиях сердечной недостаточности компенсаторные механизмы
обеспечивают поддержание нормального МОС и давления в полостях сердца
как в покое, так и при физической нагрузке. Впоследствии при сохранении
488
компенсации в покое наступает ее срыв при нагрузке. При этом характерен
меньший, чем у здоровых лиц, прирост МОС и отсутствие изменений или
даже снижение УОС и ФВ и повышение КДД в желудочке. В развернутой
стадии декомпенсации увеличение КДО и КДД пораженного желудочка от-
мечается и в покое. При преимущественном нарушении сократительной фун-
кции эти показатели возрастают параллельно друг другу, часто с большим
приростом КДО. В то же время для изолированной диастолической дисфунк-
ции характерны значительное увеличение КДД и застой крови на путях при-
тока при неизмененном КДО.
Нарушения метаболизма миокарда при сердечной недостаточности, ле-
жащие в основе снижения его насосной функции, включают:
1) нарушение утилизации энергии, то есть преобразования химической
энергии АТФ в механическую энергию сокращения миокарда (хемомехани-
ческое сопряжение 2-а, см. рис. 68) вследствие уменьшения активности Са2+-
зависимой АТФ-азы миозина (основная причина);
2) нарушение сопряжения возбуждения с сокращением (сопряжение 2-6,
см. рис. 68), что приводит к уменьшению количества Са2+, поступающего в
клетку при ее деполяризации, а следовательно, количества образующихся
актомиозиновых мостиков. Это особенно выражено в гипертрофированном
миокарде вследствие уменьшения площади клеточных мембран относитель-
но площади миофибрилл;
3) нарушение образования энергии, то есть окислительного фосфорили-
рования (сопряжение 1, см. рис. 68), с истощением запасов макроэргических
фосфатов — АТФ и КФ. Этот механизм играет ведущую роль только при
бери-бери, связанной с дефицитом тиамина, а в остальных случаях сердеч-
ной недостаточности отмечается в далеко зашедшей стадии.
При пороках сердца развитию сердечной недостаточности способствует
значительная доля бесполезной работы в общей работе сердца, особенно при
489
перегрузке сопротивлением, которая резко возрастает при физической на-
грузке (нарушение сопряжения 4, см. рис. 68).
Формы сердечной недостаточности включают: а) сердечную недоста-
точность с высоким и низким выбросом; б) острую и хроническую; в) ле-
во- и правостороннюю; г) “недостаточность выброса” и “ретроградную
недостаточность”; д) систолическую и диастолическую сердечную недо-
статочность. При далеко зашедшей недостаточности различия между эти-
ми формами в значительной мере стираются.
Сердечная недостаточность с высоким и низким выбросом. В большин-
стве случаев, например, при ИБС, артериальной гипертензии, пороках
сердца, мио- и перикардите, сердечная недостаточность сопровождается
снижением МОС. Тенденция к его повышению характерна для сердечной
недостаточности, которой свойственно увеличение потребности тканей
в кислороде. Это имеет место при гипертиреозе, анемии, хроническом
легочном сердце, беременности, значительных артериовенозных свищах
и болезни Педжета. Повышение МОС при этих заболеваниях обусловлено
снижением ОПСС и увеличением ОЦП вследствие задержки Na+ и воды
под влиянием альдостерона. К развитию сердечной недостаточности при-
водит хроническая перегрузка сердца объемом и в ряде случаев наруше-
ние метаболизма миокарда под действием этиологического фактора с
развитием миокардиодистрофии (тиреотоксикоз, бери-бери, анемия и др.).
В клинике различие между сердечной недостаточностью с низким и вы-
соким сердечным выбросом довольно относительно. В первом случае величи-
на МОС может не выходить за нижнюю границу нормы в покое, уменьша-
ясь лишь при физической нагрузке, а во втором обычно но превышает ее
верхнего предела, будучи сниженной, однако, по сравнению с уровнем до
развития сердечной недостаточности. Независимо от абсолютной величины
МОС о сердечной недостаточности свидетельствуют смещение вправо и книзу
кривой функции сердца (Франка-Старлинга) и характерные клинические
признаки.
Острая и хроническая сердечная недостаточность. Примером острой сер-
дечной недостаточности может служить недостаточность, развивающаяся при
обширном остром инфаркте миокарда или разрыве хорд митрального клапа-
на, а хронической — постепенно прогрессирующее нарушение насосной фун-
кции сердца при его пороках, хронической ИБС или кардиомиопатии. При
острой сердечной недостаточности внезапное снижение МОС часто приво-
дит к артериальной гипотензии без периферических отеков, в то время как
для хронической сердечной недостаточности более характерно сохранение
нормального АД в сочетании с периферическими отеками. Эти особенности
клинических проявлений весьма относительны и являются единственными
отличиями между двумя формами сердечной недостаточности, которые прин-
ципиально идентичны по своим патофизиологическим механизмам, а также
диагностическим признакам и методам лечения.
490
Термин “острая сердечная недостаточность” часто используют в более
узком смысле. При этом под острой левожелудочковой (или левосторонней)
недостаточностью понимают кардиогенный отек легких, а под правожелу-
дочковой — синдром острого легочного сердца.
Лево- и правосторонняя сердечная недостаточность. Для левосторон-
ней,тоесть левожелудочковой или левопредсердной сер-
дечной недостаточности, характерно снижение выброса левого же-
лудочка и (или) застой крови на путях притока к левым отделам сердца, то
есть в венах малого круга кровообращения. Это сопровождается повышением
К/1Д в левом желудочке (отсутствует при левопредсердной недостаточно-
сти), давления в левом предсердии и легочных венах. Если повышение давле-
ния в этих отделах развивается остро, может возникнуть интерстициальный
(сердечная астма) или альвеолярный отек легких. При медленном повыше-
нии давления происходит рефлекторное сужение легочных артериол, кото-
рое “защищает” больного от отека легких “ценой” усугубления легочной
гипертензии. Левожелудочковая недостаточность свойственна гемоди-
намической перегрузке желудочка (например, митральная недостаточность,
аортальные пороки) или первичному поражению миокарда (ИБС), а лево-
предсердная — митральному стенозу и (редко) миксоме левого предсердия.
Для правожелудочковой недостаточности характерно сни-
жение выброса правого желудочка при каждой данной величине давления в
правом предсердии и (или) застой крови и повышение давления на путях
притока к нему, то есть в венах большого круга кровообращения. Изолиро-
ванная правожелудочковая недостаточность встречается редко при перегруз-
ке давлением (легочное сердце, стеноз легочной артерии). Причиной право-
предсердной недостаточности может быть миксома правого предсердия.
Бивентрикулярная (тотальная) сердечная недостаточ-
ность развивается при одновременном поражении патологическим про-
цессом обоих желудочков (например, при миокардите) или при поражении
одних левых отделов сердца, которое приводит к стойкому повышению дав-
ления в левом предсердии, легочной гипертензии и перегрузке правого же-
лудочка сопротивлением и, в результате, к правожелудочковой недостаточ-
ности. В последнем случае определенную роль играет также хроническая за-
держка Na+ и воды. Независимо от того, какая камера сердца испытывает
гемодинамическую перегрузку, свойственные сердечной недостаточности
биохимические изменения в миокарде (истощение норадреналина, сниже-
ние активности АТФ-азы миозина и др.) развиваются одновременно в обо-
их желудочках. Левожелудочковая недостаточность является наиболее частой
причиной правожелудочковой недостаточности.
“Недостаточность выброса ”и “ретроградная недостаточность ”. Соглас-
но концепции “ретроградной недостаточности” Норе (1832), пер-
вичным механизмом развития сердечной недостаточности является скопле-
ние крови на путях притока к желудочку вследствие нарушения его систоли-
ческого опорожнения. Повышение давления в венозном и капиллярном рус-
ле в свою очередь вызывает задержку Na+ и воды и транссудацию жидкости
491
А б В
Рис. 69. Систолическая и диастолическая функции левого желудочка при различных
формах сердечной недостаточности. Зависимость КДД от КДО (верхний ряд кривых)
характеризует податливость левого желудочка, то есть его диастолические свойства, а
УОС от КДО (нижний ряд кривых) — его систолическую функцию. В норме (А) КДД
в левом желудочке повышается до 30 мм рт.ст., то есть уровня, при котором возникает
отек легких, при увеличении КДО до 200 мл. При гипертрофии левого желудочка,
например, у больного со стенозом устья аорты (Б), его систолическая функция, то
есть положение кривой Франка-Старлинга, не изменяется, тогда как кривая зависи-
мости КДД-КДО смещается влево и кверху. В результате каждый данный уровень
КДД, в том числе необходимый для развития отека легких, достигается при меньших
величинах КДО. Для дилатированного вследствие систолической сердечной недоста-
точности левого желудочка (В) характерно смещение кривой Франка—Старлинга вправо
и книзу, что приводит к уменьшению УОС при каждом данном уровне КДО. Диасто-
лическая податливость такого желудочка может быть умеренно повышенной, благода-
ря чему для достижения уровня КДД, при котором возникает отек легких, требуется
более выраженная дилатация левого желудочка, то есть большее увеличение КДО
в интерстициальную ткань. В то же время сторонники теории “недоста-
точности выброса” Mac Kenzie (1913) считают первичным сниже-
ние поступления крови в артериальное русло, что за счет активации ре-
нин-ангиотензин-альдостероновой системы вследствие уменьшения по-
чечного кровотока приводит к задержке Na+ и воды.
В настоящее время доказана искусственность разделения сердечной недо-
статочности на недостаточность “выброса” и “притока”, так как в ее патоге-
незе участвуют оба эти механизма. Степень их участия в каждом случае мо-
жет быть неодинаковой. Так, у одних больных в клинической картине пре-
обладают симптомы неадекватности МОС, а у других — венозного застоя.
492
Интерстициальный
Фиброз,
заместительный
склероз
пассивной жесткости
камеры —
Хаотичное Взаимное
расположение кмц
Гипертрофия
Диастолическая
дисфункция
г желудочка
Асинхрония
^активного расслабления
миокарда
Ишемия
Схема 25. Основные факторы, обусловливающие диастолическую дисфункцию
желудочка: КМЦ — кардиомиоциты
Систолическая и диастолическая сердечная недостаточность. Нарушение
насосной функции желудочка может быть обусловлено двумя причинами:
систолической и диастолической дисфункцией. Более распространенная,
“классическая”, систолическая недостаточность обусловлена сни-
жением сократимости миокарда, что приводит к уменьшению УОС при каж-
дой данной величине КДО, который обычно увеличен (рис. 69, В). Д и а с т о -
лическая дисфункция обусловлена снижением диастолической по-
датливости желудочка вследствие нарушения активного расслабления и (или)
повышения пассивной жесткости миокарда (схема 25). Это приводит к повы-
шению КДД в желудочке при нормальном КДО (рис. 69,5). Стойкая диасто-
лическая сердечная недостаточность характерна для гипертрофии и (или)
распространенного интерстициального фиброза миокарда как, например,
при его инфильтративном поражении (амилоидоз и др.), рестриктивной и
гипертрофической кардиомиопатии. Транзиторная диастолическая дисфунк-
ция отмечается во время преходящей ишемии миокарда. У многих больных с
гипертрофией и дилатацией желудочков наблюдается одновременно систо-
лическая и диастолическая дисфункция и, как следствие, - нарушение как
опорожнения, так и наполнения. Типичным примером может служить ИБС.
Основные клинические проявления систолической сердечной недостаточ-
ности связаны с низким МОС и включают симптомы и признаки гипопер-
фузии (“недостаточность выброса”), а диастолической недостаточности — с
повышенным давлением наполнения желудочка и застоем крови на путях
его притока (“ретроградная недостаточность”).
При диастолической недостаточности в отличие от систолической отмеча-
ются неизмененный КДО и отсутствие дилатации желудочка в сочетании с
повышением КДД и давления на путях притока; ФВ практически не изменя-
ется. Для систолической недостаточности характерно сочетание повышенно-
го КДО и дилатации желудочка с увеличением КДД и давления на путях
притока при снижении ФВ и, в меньшей степени, УОС.
Механизмы сердечной недостаточности в зависимости от ее этиологии
представлены в табл. 50.
493
Таблица 50. Механизмы сердечной недостаточности в зависимости от ее этиологии
Этиология сердечной недостаточности Дисфункция левого желудочка
систолическая диастолическая иного меха- низма
ИБС +++ От 0 до ++ —
Артериальная гипертензия + +++ —
Пороки сердца:
стеноз устья аорты От + до ++ +++ —
митральный стеноз (ПЖ +) — +
аортальная недостаточность ++ ++ —
митральная недостаточность ++ (ПЖ +) — —
Кардиомиопатия:
дилатационная +++ — —
гипертрофическая — +++ —
рестриктивная и специфические инфильтра- От 0 до ++ +++ —
тивные заболевания миокарда с синдромом
рестрикции
Примечание. ПЖ — правый желудочек.
Клиника. Диагноз сердечной недостаточности ставят главным образом на
основании данных клинического обследования. Они не специфичны и не
зависят от этиологии заболевания. Ниже описаны критерии диагностики сер-
дечной недостаточности (лево- и правосторонней) по Р.Мас Кее и соавто-
рам (1971).
Критерии диагноза сердечной недостаточности:
А. Большие критерии:
1. Пароксизмальная ночная одышка или ортопноэ.
2. Одышка и кашель при физической нагрузке.
3. Набухание шейных вен.
4. Застойные хрипы в легких.
5. Кардиомегалия.
6. Альвеолярный отек легких.
7. Протодиастолический (S.) ритм галопа.
8. Повышение ЦВД более 160 мм вод.ст.
9. Гидроторакс.
10. Похудание на 4,5 кг и более за 5 дней в результате лечения.
Б. Малые критерии:
1. Отечность голеней и стоп.
2. Кашель по ночам.
3. Гепатомегалия.
4. Выпот в плевральную полость.
5. Уменьшение жизненной емкости легких на 1/3 от верхней границы
нормы.
6. ЧСС более 120 в 1 мин.
494
Для постановки диагноза определенного вида сердечной недостаточности
необходимо наличие одновременно не менее 2 больших или 1 большого и 2
малых критериев.
Клинические проявления лево- и правосторонней сердечной недоста-
точности обусловлены 3 основными причинами: 1) венозным застоем
крови на путях притока; 2) неадекватным МОС с гипоперфузией тканей;
3) миокардиальной недостаточностью.
Недостаточность левых отделов сердца (левосторонняя недостаточность)
в большинстве случаев является левожелудочковой, связанной с первичным
поражением миокарда или хронической перегрузкой желудочка. Реже ее при-
чиной является нарушение наполнения левого желудочка (нарушения рит-
ма, митральный стеноз и др.). В таких случаях более корректными являются
термины “недостаточность левых отделов сердца”, “левосторонняя недоста-
точность” или “левопредсердная недостаточность” при патологии, связан-
ной с этим предсердием.
Основные этиологические факторы недостаточности левых отделов серд-
ца (левосторонней недостаточности):
1. Гемодинамическая перегрузка левого желудочка: ар-
териальная гипертензия; митральная недостаточность; аортальные пороки;
гиперкинетический синдром (анемия, тиреотоксикоз и др.); перевосполне-
ние ОЦП инфузионными средами.
И.Первичное поражение миокарда левого желудочка:
ИБС (все формы); миокардит; кардиомиопатия; медикаментозные препара-
ты с отрицательным инотропным действием.
III. Нарушение наполнения левого желудочка:митральный
стеноз; миксома или тромбоз левого предсердия; аритмия.
Патогенез. Повышение давления в левом предсердии вследствие наруше-
ния систолического опорожнения или диастолического наполнения левого
желудочка распространяется на пути притока — легочные вены и капилляры.
Увеличение гидростатического давления в легочных капиллярах выше онко-
тического, то есть в среднем более 25 мм рт.ст., приводит к нарушению
равновесия Старлинга и усиленной транссудации жидкой части плазмы крови
(воды и коллоидов) в интерстициальную ткань. При снижении содержания
белков в плазме крови пропотевание жидкости начинается при меньшем
уровне гидростатического давления, а при утолщении альвеолярно-капил-
лярной мембраь ы из-за периваскулярного склероза при хроническом тече-
нии заболевания — при его более высоком уровне. Вследствие раздражения
юкстакапиллярных рецепторов интерстициальной ткани при начальном на-
коплении транссудата происходит возбуждение дыхательного центра ствола
мозга с увеличением частоты дыхания, которое обеспечивает усиление лимфа-
тического оттока в вены большого круга кровообращения. Когда скорость
транссудации начинает превышать производительность лимфатического дре-
нажа, жидкость накапливается в наиболее податливых участках интерстици-
ального пространства, заполненных рыхлой соединительной тканью, окру-
жающей бронхиолы, артериолы и венулы. Развивается интерстициаль-
495
ный отек легких , который иначе называется сердечной астмой.
Скопление жидкости в интерстициальном пространстве приводит к умень-
шению податливости легких, то есть нарушению вентиляции по рестрик-
тивному типу и, одновременно вызывая сдавление просвета бронхиол, обус-
ловливает повышение сопротивления воздухоносных путей. Нарушение вен-
тиляции по обструктивному типу, которому способствуют также отек сли-
зистой оболочки бронхов в результате застоя в системе бронхиальных сосу-
дов, и нарушение оттока слизи, приводит к умеренному снижению РаО2,
которое корригируется ингаляцией 100 % кислорода. Насыщение гемоглоби-
на кислородом существенно не изменяется. Стойкое и выраженное повыше-
ние давления в легочных венах может распространяться также на плевраль-
ные вены, что иногда приводит к развитию гидроторакса, усугубляющего
дыхательную недостаточность.
Дальнейшее повышение гидростатического давления в легочных ка-
пиллярах, как правило, более 30—35 мм рт.ст., вызывает разрывы в мес-
тах соединения клеток альвеолярного эпителия друг с другом, в резуль-
тате чего транссудат из интерстициальной ткани попадает в альвеолы.
Вначале он накапливается в участках с наименьшим радиусом кривизны
(“углах”), вызывая их сглаживание. Когда изменение формы альвеол ста-
новится критическим, дальнейшее сохранение наполнения их воздухом
становится невозможным, они полностью заполняются транссудатом и воз-
никает альвеолярный отек легких.
Резкое нарушение газообмена вызывает выраженную артериальную ги-
поксемию, которая усугубляется нарушениями вентиляционно-перфузион-
ных соотношений из-за увеличения венозной примеси к артериальной кро-
ви в результате перфузии невентилируемых участков легких. Артериальная
гипоксемия, в свою очередь, приводит к значительному повышению актив-
ности симпатико-адреналовой системы и освобождению вазоактивных ве-
ществ — серотонина, гистамина, кининов, простагландинов и др. Это спо-
собствует спазму легочных артериол с еще большим ростом давления в ле-
гочных капиллярах и повышению проницаемости альвеолярно-капиллярной
мембраны. В результате в заполняющий альвеолы транссудат поступают клетки
крови, в частности эритроциты, которые обусловливают розовую окраску
пенистой мокроты. Гиперактивация симпатико-адреналовой системы, вызы-
вая значительное увеличение ЧСС, частоты дыхания и работы дыхательных
мышц, приводит к повышению потребности миокарда в кислороде, что мо-
жет усугублять снижение его сократимости и ударного выброса.
Таким образом, сердечная астма и отек легких представляют собой раз-
личные стадии одного и того же патологического процесса, имеют общий
патогенез и различаются лишь по степени повышения гидростатического
давления и состоянию альвеолярно-капиллярной мембраны. Наличие ее фиб-
розных изменений, которые развиваются при длительном повышении ле-
гочно-капиллярного давления, предотвращает переход интерстициального
отека в альвеолярный. Необходимо отметить, что острая левосторонняя сер-
дечная недостаточность — не единственная причина отека легких. Другими
496
Таблица 51. Симптомы и клинические признаки недостаточности левых отделов сердца
Причины Симптомы Признаки
Венозный застой в Одышка при физической Ортопноэ, тахипноэ, ослабление
легких нагрузке, в положении лежа (ортопноэ); сердечная астма (пароксизмальная одышка по ночам); альвеолярный отек легких Кашель, кровохарканье перкуторного тона, застойные хрипы в нижних отделах легких
Снижение МОС и перфузии тканей Миокардиальная недостаточность Слабость, утомляемость Никтурия, олигурия Нарушение функции центральной нервной системы (поздний симптом) Бледность, влажность, похолодание кожи, акроцианоз Дыхание типа Чейна—Стокса Артериальная гипотензия (пп. 2—3 — поздние признаки) Тахикардия Альтернирующий пульс
Дилатация левых отделов сердца
Ритм галопа
Акцент Р2
Систолический шум относительной
недостаточности митрального клапана
возможными причинами являются резкое снижение онкотического давле-
ния плазмы крови (при болезнях почек, печени, энтеропатиях) и повыше-
ние проницаемости альвеолярно-капиллярной мембраны (при ингаляции ток-
сических веществ, синдроме диссеминированного внутрисосудистого свер-
тывания, уремии, анафилактическом шоке и др.).
Симптомы и клинические признаки недостаточности левых отделов сер-
дца перечислены в табл. 51.
Жалобы. 1. Основным и наиболее ранним симптомом венозного застоя в
легких является о д ы ш к а . Ее точный механизм не ясен. Причинами одыш-
ки могут быть: 1) увеличение работы дыхательных мышц вследствие сниже-
ния податливости легких из-за отека интерстициальной ткани в относитель-
но острых случаях и развития периваскулярного склероза при длительном
повышении легочно-капиллярного давления; 2) возбуждение дыхательного
центра при раздражении рецепторов растяжения в интерстициальном про-
странстве в результате скопления транссудата; 3) вторичное нарушение брон-
хиальной проходимости вследствие отека интерстициальной ткани легких и
слизистой оболочки бронхов.
Самым ранним симптомом является одышка при повышенной
физической нагрузке. По мере нарастания тяжести левожелудочко-
вой недостаточности она возникает при нагрузке все меньшей и меньшей
интенсивности и наконец появляется в покое в положении лежа, затем в
виде приступов сердечной астмы и альвеолярного отека легких.
Одышку, возникающую в положении лежа с низким головным концом
497
и исчезающую в положении сидя или стоя, часто называют ортопноэ.
Она обусловлена увеличением внутригрудного объема крови и венозного
возврата за счет уменьшения депонирования крови в периферических венах.
При этом левый желудочек, насосная функция которого снижена, не в со-
стоянии обеспечить изгнание в аорту дополнительного объема крови, по-
ступающего к нему благодаря хорошей функции правого желудочка, что
приводит к еще большему повышению давления в легочных венах и капил-
лярах. Одышка часто сопровождается непродуктивным кашлем, который также
исчезает в положении сидя и может быть единственным признаком орто-
пноэ. Выраженность ортопноэ можно оценить по количеству подушек, на
которых вынужден спать больной.
Весьма характерна способность больных спокойно засыпать с вечера, но
спустя несколько часов просыпаться от ощущения удушья, которое вынуж-
дает их садиться в постели со спущенными ногами. Это состояние представ-
ляетсобой приступ сердечной (кардиальной) астмы , то есть ин-
терстициальный отек легких, и его часто обозначают термином “пароксиз-
мальная ночная одышка”. Она сопровождается кашлем и, в отличие
от ортопноэ, не исчезает в вертикальном положении и может переходить в
альвеолярный отек легких (см. ниже).
2. Кашель обычно сопровождает одышку и может быть сухим или с
выделением слизистой мокроты. Поскольку большинство бронхиальных ка-
пилляров впадает в легочные вены, застой крови в альвеолярной сосудистой
сети распространяется на бронхиальные сосуды, что приводит к увеличению
образования слизи. При разрыве переполненных кровью бронхиальных ка-
пилляров может наблюдаться кровохарканье.
3. Слабость и повышенная утомляемость при физичес-
кой нагрузке являются симптомами неадекватного МОС и обусловлены
уменьшением кровотока в скелетных мышцах. Определенную роль могут
играть также гипонатриемия и гиповолемия вследствие избыточного при-
ема мочегонных препаратов.
4. Никтурия относится к ранним и весьма характерным проявлениям
левожелудочковой недостаточности. В дневное время в вертикальном поло-
жении из-за перераспределения кровотока для первоочередного обеспечения
кровью жизненно важных органов в условиях снижения МОС почечный
кровоток уменьшен. Ночью в горизонтальном положении несоответствие
между МОС и потребностями тканей в кислороде уменьшается, и почечный
кровоток возрастает, что приводит к увеличению диуреза. Необходимо иметь
в виду возможность другого генеза никтурии.
5. Олигурия свидетелютвует о значительном уменьшении МОС в по-
кое и характерна для далеко зашедших стадий сердечной недостаточности.
6. Мозговые симптомы, обусловленные снижением мозгового кро-
вотока, — нарушение памяти, сна, головная боль, изредка бред и галлюци-
нации — наблюдаются редко и лишь у больных пожилого возраста с сопут-
ствующим церебральным атеросклерозом и выраженной сердечной недоста-
точностью.
498
При объективном исследовании определяют две группы признаков — ос-
новного заболевания и осложняющей его сердечной недостаточности. Для
недостаточности левых отделов сердца характерны следующие признаки.
1. Тахипноэ при движении, а в тяжелых случаях — в покое, усиливаю-
щееся при разговоре и в положении лежа, из-за чего больные принимают
вынужденное положение сидя (ортопноэ). В далеко зашедших стадиях при
сопутствующем церебральном атеросклерозе отмечается дыхание типа
Чейна — Стокса вследствие снижения чувствительности дыхательного
центра к повышению РаСО2.
2. Кожа бледная и холодная на ощупь вследствие перифери-
ческой вазоконстрикции, обусловленной повышением активности симпа-
тико-адреналовой системы. Это приводит также к усилению потоотделения и
повышенной потливости.
3. Характерен акроцианоз, связанный с увеличением содержания вос-
становленного гемоглобина в венозной части капилляров из-за увеличения
экстракции кислорода из венозной крови. Другой его причиной может быть
вторичная рестриктивная дыхательная недостаточность.
4. Тахикардия является постоянным признаком сердечной недоста-
точности и имеет компенсаторный характер, так как направлена на поддер-
жание адекватного МОС при сниженном УОС.
5. Притяжелой миокардиальной недостаточности можетот-
мечаться альтернирующий пульс, который более четко определяет-
ся при пальпации бедренной артерии. Он особенно характерен для сердечной
недостаточности, вызванной хронической перегрузкой сопротивлением, а
также ИБС и дилатационной кардиомиопатией. Альтернирующий пульс час-
то сопровождается альтернацией звучности тонов и шумов сердца и может
исчезать в положении сидя, то есть при уменьшении венозного возврата.
6. Артериальная гипотензия с уменьшением пульсового давле-
ния может отмечаться при тяжелой сердечной недостаточности с резким
снижением МОС в покое. Чаще, однако, наблюдается склонность к артери-
альной гипертензии вследствие компенсаторной системной вазоконстрик-
ции, которая обеспечивается барорецепторным рефлексом при снижении
МОС.
7. Гипертрофия и особенно дилатация левого желудочка
являются важными признаками сердечной недостаточности. Они определя-
ются при исследовании верхушечного толчка и подтверждаются данными
электрокардиографии, рентгенологического исследования и эхокардиогра-
фии. Дилатация левого желудочка отсутствует при диастолической форме сер-
дечной недостаточности, митральном стенозе и констриктивном перикар-
дите и слабо выражена при остром инфаркте миокарда.
8. Протодиастолический ритм галопа (S3) характерен для
преимущественно систолической сердечной недостаточности вследствие
резкого замедления притока крови в желудочек в конце быстрого наполне-
ния из-за увеличения его объема. В отличие от физиологического S3 он не
исчезает в положении стоя. О диастолической дисфункции левого желудочка
499
свидетельствует пресистолический галоп (S4), возникающий при
усиленном сокращении левого предсердия и сниженной податливости
желудочка.
9. Акцент II тона над легочной артерией (Р2) отражает ле-
гочную гипертензию.
10. Систолический шум относительной недостаточности митраль-
ного клапана обусловлен дилатацией левого желудочка и уменьшается при ее
обратном развитии в случае успешного лечения. Может представлять сложность
для дифференциальной диагностики с органическими пороками сердца.
11. Влажные хрипы в легких возникают при транссудации плаз-
мы крови в альвеолы при альвеолярном отеке легких (см. ниже) либо при
гиперпродукции бронхиального секрета при хроническом венозном застое в
легких. В последнем случае они носят характер мелкопузырчатых, выслуши-
ваются в нижних отделах легких с обеих сторон и сопровождаются ослабле-
нием перкуторного тона. Односторонняя локализация таких хрипов должна
настораживать в отношении возможной тромбоэмболии мелких ветвей ле-
гочной артерии с инфарктом легкого.
Изредка при изолированной недостаточности левых отделов сердца раз-
вивается гидроторакс, обычно односторонний слева. Его возникнове-
ние связано с высокой легочной гипертензией и объясняется тем, что плев-
ральные вены впадают не только в систему верхней полой вены, но и в
легочные вены. При уменьшении венозного застоя транссудат обычно само-
стоятельно всасывается.
Спазм артериол кожи может приводить к значительному снижению теп-
лоотдачи и возникновению субфебрилитета.
Диагностика. На ЭКГ определяются признаки гипертрофии левого желу-
дочка. У лиц пожилого возраста ее вольтажные критерии могут отсутствовать.
На возможную гипертрофию в таких случаях указывают нарушения реполя-
ризации с инверсией зубца Т в отведениях I, aVL и V56 и косвенный при-
знак RV5 > Rw
При рентгенологическом исследовании в передне-задней и боковой проек-
циях характерны увеличение левого желудочка и признаки венозного застоя
в легких.
1. Увеличение левого желудочка , а в ряде случаев и левого
предсердия за счет их дилатации является одним из наиболее ценных и по-
стоянных признаков недостаточности левых отделов сердца. Исключение со-
ставляют митральный стеноз, констриктивный перикардит и случаи диасто-
лической сердечной недостаточности. Форма тени сердца определяется ос-
новным заболеванием.
2. Признаки венозного застоя в л е г к и х. При левожелудоч-
ковой недостаточности, в отличие от правожелудочковой, при повышении
давления в левом предсердии до 20—25 мм рт.ст. вследствие увеличения со-
противления легочных артериол в нижних долях легких возрастает кровена-
полнение артерий верхних долей легких, сопротивление которых ниже. Весьма
характерны линии Керли, обусловленные накоплением жидкости в интер-
500
стициальной ткани междольковых перегородок. Отмечаются также увеличе-
ние теней корней легких за счет отека периваскулярной интерстициальной
ткани и усиление сосудистого рисунка. Может определяться небольшой вы-
пот в плевральную полость. Больший его объем обычно обусловлен правоже-
лудочковой недостаточностью. Рентгенологические признаки отека легких
см. ниже.
Эхокардиография имеет важное значение в диагностике сердечной недо-
статочности, особенно ее систолической формы. Для левожелудочковой не-
достаточности характерны дилатация и, как правило, гипертрофия левого
желудочка и признаки нарушения его систолического опорожнения. Дилата-
ция желудочка особенно выражена в период диастолы, вследствие чего КДО
увеличен в большей степени, чем КСО. В М-режиме характерно увеличение
расстояния между передней створкой митрального клапана при ее макси-
мальном движении кпереди в начале диастолы и межжелудочковой перего-
родкой (расстояние Е—S), которое в норме практически отсутствует. Отме-
чается диффузная или сегментарная гипокинезия стенок желудочка с умень-
шением показателей сократимости фазы изгнания (ФВ и др.) и в ряде случа-
ев УОС. О снижении УОС косвенно свидетельствуют уменьшение открытия
митрального и аортального клапанов. При допплеровском исследовании час-
то определяется митральная регургитация. При диастолической сердечной
недостаточности обычно выражена гипертрофия миркарда желудочка при
практически неизмененных величинах объема полости и амплитуды движе-
ния стенок. На снижение податливости камеры указывает увеличение скоро-
сти трансмитрального кровотока во время систолы предсердий по сравне-
нию с периодом раннего диастолического наполнения по данным доппле-
ровского исследования. Определяются также эхокардиографические призна-
ки основного заболевания, обусловившего развитие сердечной недостаточ-
ности, например, митрального стеноза, аневризмы левого желудочка и др.
Свойственные сердечной недостаточности изменения КДО, КСО, УОС
желудочка и движения его стенок отмечаются при радионуклидной и рентге-
ноконтрастной вентрикулографии. При катетеризации сердца определяются
повышение КДД левого желудочка, среднего давления в левом предсердии и
в малом круге кровообращения, в начальных стадиях - только при физичес-
кой нагрузке. Специальные исследования с измерением КДД и КДО в дина-
мике на протяжении диастолы позволяют получить кривую их зависимости
и количественно оценить скорость диастолического наполнения и другие
показатели податливости желудочка.
Сердечная астма и альвеолярный отек легких. Для сердечной астмы
характерно ощущение удушья, которое возникает чаще ночью, во время
сна, заставляя больных в страхе просыпаться и садиться в постели, спустив
ноги, что немного облегчает их состояние. Типично преимущественное
затруднение вдоха, однако достаточно часто вследствие сопутствующего
нарушения бронхиальной проходимости затруднен также выдох (отсюда и
название: “сердечная астма”). Одышка сопровождается сухим кашлем и мо-
жет сочетаться с приступом стенокардии.
501
Кардиальная астма возникает обычно у больных с признаками прогрес-
сирующей хронической недостаточности левых отделов сердца в анамнезе,
но может оказаться и ее первым проявлением, особенно в случаях тяжелой
артериальной гипертензии, острого инфаркта миокарда, выраженного аор-
тального или митрального стеноза. Причины ее излюбленного возникнове-
ния в ночное время не совсем ясны. Вероятно, определенную роль играют
физиологическое снижение адренергической стимуляции левого желудочка
и угнетение дыхательного центра в ночное время, а также увеличение внутри-
грудного объема крови в положении лежа. Приступы сердечной астмы в днев-
ное время обычно связаны с физическим и эмоциональным напряжением,
но иногда возникают без видимой причины.
При объективном исследовании больные беспокойны, занимают поло-
жение ортопноэ. Кожа бледная, покрыта холодным потом, отмечается акро-
цианоз, выражено тахипноэ. В связи с гиперкатехоламинемией может уме-
ренно повышаться АД. Отмечаются тахикардия и в большинстве случаев в
различной степени выраженное смещение верхушечного толчка влево и вниз.
В нижних отделах легких с обеих сторон перкуторный тон умеренно укоро-
чен, при аускультации дыхание жесткое, иногда с несколько удлиненным
выдохом и незвучными сухими хрипами, что может вызывать трудности
при дифференциальной диагностике с бронхиальной астмой. Поскольку
транссудат не выходит за пределы интерстициального пространства, влаж-
ные хрипы не определяются, а РаО2 лишь умеренно снижено. Вследствие
отека интерстициальной ткани в бронхах, бронхиолах, межальвеолярных и
междольковых перегородках на рентгенограмме появляются нечеткие, не-
видимые в норме, многочисленные мелкие линейные тени на всем протя-
жении легочных полей, которые, накладываясь на изображение легочных
сосудов, искажают его. Особенно типичны линии Керли.
При развитии альвеолярного отека легких удушье нарастает, а
при кашле начинает выделяться пенистая мокрота белого или розового цвета,
которая иногда отходит полным ртом. Дыхание становится шумным, на рас-
стоянии слышны клокочущие хрипы на вдохе и выдохе, вследствие чего,
образно говоря, диагноз ставят “с порога комнаты”. Больные значительно
возбуждены, появляется страх смерти от удушья. Нарастает холодный цианоз.
АД вначале может умеренно повышаться, но при затянувшемся отеке легких
снижается. Крепитация быстро сменяется мелкопузырчатыми хрипами, а за-
тем, при заполнении транссудатом бронхов все более крупного калибра, —
разнокалиберными средне- и крупнопузырчатыми хрипами над всей поверх-
ностью легких. Из-за звучных хрипов мелодия сердца практически неразли-
чима. Развивается выраженная артериальная гипоксемия, которая вначале со-
провождается гипокапнией вследствие гипервентиляции, а в далеко зашед-
ших случаях — гиперкапнией. При рентгенологическом исследовании запол-
нение жидкостью альвеол обусловливает появление негомогенного затемне-
ния, которое занимает средние 2/3 легочных полей в виде крыльев бабочки.
Поскольку при этом полного замещения воздуха не происходит, интенсив-
ность тени меньше, чем при пневмонии.
502
В ряде случаев приступ может спонтанно купироваться в течение 1—3 ч
благодаря уменьшению внутригрудного объема крови в вертикальном поло-
жении и постепенному увеличению МОС. Возможно также резкое снижение
насосной функции левого желудочка с развитием кардиогенного шока и
быстрым наступлением летального исхода.
Недостаточность правых отделов сердца в большинстве случаев обуслов-
лена легочной гипертензией и в связи с этим часто развивается при хрони-
ческой недостаточности левых отделов сердца любого генеза. Увеличение дав-
ления в левом предсердии приводит к пассивному повышению давления в
легочной артерии, необходимому для обеспечения тока крови через легкие,
а также, в части случаев, — к активной констрикции легочных артериол
(рефлекс Китаева). Этим самым достигается уменьшение венозного застоя в
легких, но увеличивается легочное сосудистое сопротивление, что вызывает
перегрузку правого желудочка давлением и способствует развитию его недо-
статочности. Распространенной причиной являются и хронические заболева-
ния легких, причем массивная ТЭВЛА может вызывать острую правожелу-
дочковую недостаточность. Другими этиологическими факторами изолиро-
ванной недостаточности правых отделов сердца являются поражение трех-
створчатого клапана или клапана легочной артерии как результат врожден-
ных пороков или инфекционного эндокардита, либо карциноматоза.
При миокардите и кардиомиопатии обычно поражаются оба желудочка.
Во всех случаях, кроме весьма редких, — стеноза трехстворчатого клапана
или миксомы правого предсердия — обусловливающих нарушение наполне-
ния правого желудочка и недостаточность правого предсердия, имеет место
правожелудочковая недостаточность.
Основными этиологическими факторами правосторонней сердечной не-
достаточности являются:
I. Легочная гипертензия вследствие: недостаточности левых от-
делов сердца; заболеваний легких; повышенного легочного кровотока при
шунтировании крови слева направо; ТЭВЛА.
II. Заболевания клапана легочной артерии и трехствор-
чатого клапана.
III. Поражение правого желудочка при миокардитах и кардио-
миопатиях.
IV. Инфаркт миокарда правого желудочка.
Патогенез. При выраженной гемодинамической перегрузке или сниже-
нии насосной функции вследствие первичного поражения миокарда систо-
лическое опорожнение правого желудочка нарушается. Это приводит к его
дилатации, повышению КДД и застою крови на путях притока с увеличени-
ем давления в правом предсердии, периферических венах и капиллярах, осо-
бенно в нижней части туловища. Возникающая при этом транссудация жид-
кости из капилляров в ткани обусловливает развитие отеков и уменьшение
эффективного объема крови в артериальном русле. Для восстановления его
нормальной величины включается ряд компенсаторных механизмов. Они
опосредуются снижением почечного крово- и плазмотока под влиянием
503
Сердечная недостаточность
Венозный застой,
щвд
|tA/Oc|
| 'К
^гидростатического X
давления в капиллярах
^транссудации
Нарушение
Функции
печени
ь Эффективного
объема крови
в артериальном
русле
| объема интерстициальной
жидкости
^почечного кровотока
|ренина
, I
/ \ ангиотензина Ц
t клубочковой
фильтрации
I реабсорбции На
и воды в
проксимальных
канальцах
Отеки
\ реабсорбции Na
в проксимальных
канальцах
-^альдостерона-
f
♦,реабсорбции На*
в дистальных
канальцах
^задержки Na* и воды
почками______________
\объемаплазмы крови
^транссудации
4 объема
интерстициальной
жидкости
—~\АДГ,жажда
\ реабсорбции
воды в
дистальных
канальцах
Схема 26. Патогенез отеков при сердечной недостаточности: ЦВД - центральное веноз-
ное давление; АДГ — антидиуретический гормон
активации симпатико-адреналовой системы и повышения образования ангио-
тензина II и обеспечивают задержку в организме Na+ и воды (схема 26). Это
достигается, в частности, уменьшением клубочковой фильтрации вследствие
снижения гидростатического давления в афферентных артериолах клубоч-
ков, что способствует также повышению онкотического давления в периту-
булярных капиллярах и увеличению реабсорбции Na+ и воды в проксималь-
ных канальцах. Усиление реабсорбции Na+ в дистальных канальцах обеспе-
504
Таблица 52. Симптомы и клинические признаки недостаточности правых отделов сердца
Причины Симптомы Признаки
Венозный застой в Периферические отеки Набухание шейных вен, повышение
большом круге Тяжесть или боль в ЦВД, гепатоюгулярный рефлюкс
кровообращения надчревной области и Увеличение печени (застойная гепатоме
Снижение МОС и перфузии тканей Миокардиальная недостаточность правом подреберье Диспепсия См. табл. 51 талия, кардиальный фиброз и цирроз) Периферические и полостные (гидро- торакс, гидроперикард, асцит) отеки Тахикардия Альтернирующий пульс
Дилатация правых отделов сердца
Правожелудочковый ритм галопа
Систолический шум относительной
недостаточности трехстворчагого клапана
чивается увеличением уровня альдостерона в крови вследствие повышения
его секреции надпочечниками под влиянием ангиотензина II, с одной сто-
роны, и снижения катаболизма в печени из-за ее дисфункции — с другой.
Хотя переполнение кровью предсердий вызывает увеличение образования
предсердного ПНУФ, обладающего способностью расширять почечные со-
суды и уменьшать секрецию ренина и реабсорбцию Na+ в дистальных ка-
нальцах, он не способен нормализовать выделение Na+ почками.
В ряде случаев относительно легкой сердечной недостаточности неболь-
шая задержка Na+ и воды и увеличение объема плазмы крови могут норма-
лизовать эффективный объем артериального русла. Это способно приводить
к установлению нового устойчивого равновесия за счет повышения УОС с
помопщю реализации механизма Франка—Старлинга. Однако при более глу-
боком нарушении кардиогемодинамики задержка жидкости не может вос-
полнить дефицит этого эффективного объема и, накапливаясь в венозной
системе, вызывает увеличение в ней гидростатического давления и образо-
вание отеков.
Симптомы и клинические признаки недостаточности правых отделов сердца
представлены в табл. 52.
Жалобы. У больных с левожелудочковой недостаточностью развитие не-
достаточности правых отделов сердца вследствие снижения выброса правого
желудочка приводит к уменьшению выраженности венозного застоя в лег-
ких с прекращением или значительным уменьшением приступов сердечной
астмы и отека легких. В клинической картине заболевания преобладают сим-
птомы венозного застоя в большом круге кровообращения.
1. Периферические отеки располагаются по силе тяжести,то есть
в местах максимального повышения гидростатического давления в венах. У
ходячих больных они появляются вначале в области лодыжек и стоп к вечеру
и исчезают к утру, затем становятся стойкими. Как правило, они одинаково
505
выражены на обеих конечностях, за исключением случаев сопутствующего
варикозного расширения вен или тромбофлебита, которые могут обуслов-
ливать их асимметрию. У лежащих больных отеки локализуются вначале в
области крестца, ягодиц и задней поверхности бедер. Постепенно отеки “под-
нимаются” до промежности и передней брюшной стенки и могут распрост-
раняться на всю поверхность тела. В настоящее время благодаря широкому
применению мочегонных препаратов такой генерализованный отек (ан а-
сарка) встречается редко.
2. Ощущение тяжести или боль в надчревной области и
правом подреберье обусловлены растяжением капсулы печени при ее
быстром увеличении в размерах вследствие венозного застоя. Часто усилива-
ются при физической нагрузке (“печеночная жаба”). При стабилизации пра-
вожелудочковой недостаточности эти симптомы могут отсутствовать.
3. Диспептический синдром — анорексия, тошнота, вздутие жи-
вота, запоры, реже рвота и понос связаны с венозным застоем в органах
брюшной полости.
4. Симптомы фиксированного МОС — слабость и утомляе-
мость при физической нагрузке и другие — проявляются так же, как при
недостаточности левых отделов сердца.
Хотя венозный застой в легких для “чистой” недостаточности правых от-
делов сердца не характерен, больных может беспокоить одышка, обуслов-
ленная гидротораксом, асцитом или, в терминальных стадиях, резким умень-
шением выброса правого желудочка.
При объективном исследовании определяются признаки основного за-
болевания, например, патологии легких при хроническом легочном сердце,
а также собственно правосторонней сердечной недостаточности. К ним
относятся:
1. Набухание шейных вен и повышение ЦВД, которые
обусловлены: а) нарушением систолического опорожнения или наполнения
правого желудочка; б) повышением тонуса вен, обеспечивающим увеличе-
ние венозного притока к правым отделам сердца (компенсаторная реакция);
в) увеличением ОЦП. При относительной недостаточности трехстворчатого
клапана появляется положительный венный пульс. Усиление пресистоличе-
ской пульсации яремных вен (волн “а”) свидетельствует об уменьшении
диастолической податливости правого желудочка (например, при стенозе устья
легочной артерии) и может наблюдаться также при стенозе трехстворчатого
клапана. Сдавление печени и увеличение в результате этого венозного при-
тока к правым отделам сердца при нарушении его опорожнения в период
систолы вызывает нарастание ЦВД, которое может достигать 5 мм рт.ст., и
усугубление набухания шейных вен (гепатоюгулярный рефлюкс).
2. Увеличение печени вследствие венозного застоя предшествует
появлению периферических отеков и более или менее длительно сохраня-
ется после их исчезновения. Размеры такой застойной печени варьируют,
она мягкая и умеренно болезненная при пальпации. Длительный венозный
506
застой и гипоксия способствуют некрозу гепатоцитов и развитию фиброза
печени, а в далеко зашедших стадиях — ее морфологической перестройке с
формированием кардиального цирроза. При пальпации печень плотная и без-
болезненная. Фиброз и цирроз печени являются одной из причин возникно-
вения асцита и иногда могут приводить к тяжелой печеночной недостаточ-
ности. Для недостаточности трехстворчатого клапана характерна систоличес-
кая пульсация печени, а при его стенозе и констриктивном перикардите
может наблюдаться пресистолическая пульсация. При стойкой и выраженной
гепатомегалии (например, при констриктивном перикардите) может разви-
ваться также умеренное увеличение селезенки.
3. Периферические отеки не являются ранним признаком право-
желудочковой недостаточности, так как появляются при увеличении объема
внеклеточной жидкости не менее чем на 5-7 л. В отличие от почечных оте-
ков локализация в области лица не характерна, а образование “ямки” при
надавливании отличает их от лимфостаза.
4. Гидроторакс встречается у 1/3 больных с тяжелой хронической
сердечной недостаточностью. Он связан с нарушением лимфатического дре-
нажа плевральной жидкости из-за повышения давления в системных венах,
а также с повышением проницаемости капилляров, что обусловливает отно-
сительно высокое содержание белка — до 30 г/л. Выпот обычно двусторон-
ний или локализуется справа. Левосторонний выпот более характерен для
инфаркта легкого, перикардита или поддиафрагмальной патологии, напри-
мер, панкреатита.
5. Гидроперикард обычно имеет относительно небольшой объем —
50—100 мл — и протекает бессимптомно. Его возникновение и разрешение
является более частой причиной соответствующей быстрой динамики разме-
ров сердца, чем миокардиальная недостаточность.
6. Асцит относится к поздним признакам правожелудочковой недоста-
точности. Он обусловлен стойким повышением давления в печеночных ве-
нах и венах брюшины и тесно связан с повышением ЦВД. Асцит особенно
характерен для заболеваний, сопровождающихся нарушением наполнения
правого желудочка, — констриктивного перикардита, хронической тампо-
нады сердца, а также пороков трехстворчатого клапана. Во всех случаях не-
достаточности правых отделов сердца, кроме заболеваний перикарда, появ-
лению асцита предшествуют увеличение печени и периферические отеки.
7. Клинические признаки миокардиальной недостаточ-
ности включают тахикардию, альтернирующий пульс, увеличение гра-
ниц сердца вправо, которое лучше определяется при рентгенологическом
исследовании, правожелудочковый ритм галопа (S3 или, при снижении диа-
столической податливости, S4). Достаточно часто выслушивается также сис-
толический шум относительной недостаточности трехстворчатого клапана,
усиливающийся на вдохе.
Диагностика. На ЭКГчасто отмечаются признаки гипертрофии правого
желудочка, особенно увеличение амплитуды зубца R в отведении V, более
3 мм и отклонение электрической оси сердца вправо. Они, однако, могут
507
Таблица 53. Клиническая оценка функционального состояния бальных с сердечно-сосудистыми
заболеваниями Нью-Йоркской ассоциации кардиологов — NY1IA (1973)
Класс Симптомы Ограничение по- вседневной физиче- ской активности Трудоспособность
I Отсутствуют Отсутствует Полностью сохранена
II Умеренно выражены Незначительное’ Обычно сохранена
III Выражены и появляются при меньшей, чем повседневная, физической активности Умеренное Ограничена"
IV Определяются в покое и усиливаются при малейшей физической активности Резко выраженное Утрачена
* Одышка при подъеме на 2 лестничных пролета;
** — работа с неполным рабочим днем.
быть слабо выражены или отсутствовать при хроническом легочном сердце,
а также маскироваться признаками гипертрофии левого желудочка в случаях
первичной левожелудочковой недостаточности. Часто регистрируются также
признаки гипертрофии правого предсердия.
При рентгенологическом исследовании определяется дилатация правых отде-
лов сердца и двусторонний либо правосторонний выпот в плевральную по-
лость, обычно умеренный, часто лишь в реберно-диафрагмальных синусах.
Двухмерная эхокардиография позволяет уточнить наличие и выраженность
дилатации правого желудочка (при миокардиальной недостаточности) и пред-
сердия, а также, в ряде случаев, характер основного заболевания. При доп-
плеровском исследовании подтверждается наличие трикуспидальной регур-
гитации. С помощью радионуклидной правосторонней вентрикулографии мож-
но количественно оценить нарушение насосной функции желудочка по сте-
пени увеличения его КДО и КСО, снижения УОС, ФВ и других индексов
сократимости. При катетеризации сердца в значительной части случаев опре-
деляется повышение КДД правого желудочка и среднего давления в правом
предсердии.
При лабораторном обследовании в крови могут определяться признаки
цитолиза и печеночноклеточной недостаточности, обусловленные некрозами
гепатоцитов в условиях гипоксии и нарушения кровообращения. Они вклю-
чают повышение активности ферментов (АЛТ, ACT, иногда щелочной фос-
фатазы), содержания билирубина за счет обеих фракций, снижение про-
тромбинового индекса и уровня альбуминов. Увеличение ОЦП, ограниче-
ние соли и прием мочегонных препаратов часто приводят к гипонатриемии
и гипокалиемии, а снижение почечного кровотока — к преренальной азоте-
мии. В моче отмечаются изменения, свойственные застойной почке, - про-
теинурия, иногда значительная, часто цилиндрурия, которые, в отличие от
первичной патологии почек, сочетаются с ее высокой относительной плот-
ностью.
508
Таблица 54. Классификация функционального состояния больных с сердечно-сосудистыми
заболеваниями Н.М.Амосова н Я.А.Бендета
Группа Трудоспособность Физическая работоспособность Vb2, мл/мин/кг
М Ж м Ж
I Полностью сохранена >150 >125 >30 >26
II Умеренно ограничена 101-150 84-125 21,6-30 18,6-26
III Значительно ограничена 51-100 51-83 14,1-21,5 14,1-18,5
IV Утрачена 17-50 17-50 8-14 8-14
V Требуется посторонний уход S16 S16 <8 <8
Примечание. М - мужчины, Ж - женщины; V02 - потребление кислорода на суб-
максимальном или пороговом уровне нагрузки.
Классификация сердечной недостаточности. Классификация острой лево-
желудочковой недостаточности по T.Killip-J.Kimball при остром инфаркте
миокарда - см. главу 9.
Общепринятая классификация хронической сердечной не-
достаточности Нью-Йоркской ассоциации кардиологов -
NYHA (1973) базируется на клинической оценке наличия и выраженности
ограничения функционального состояния больных, то есть их толерантности
к повседневной физической нагрузке (табл. 53). Основными симптомами, ко-
торые обусловливают ограничение физической активности, являются одыш-
ка, сердцебиение, утомляемость и слабость. Недостатками классификации
NYHA являются субъективность критериев и ограниченное количество гра-
даций, вследствие чего почти все больные с развернутой клинической карти-
ной сердечной недостаточности относятся либо к III, либо к IV классу.
Более точно оценить выраженность ограничения переносимости больны-
ми физической нагрузки позволяет определение их физической работоспо-
собности и потребления кислорода на последнем этапе нагрузки с помощью
субмаксимального спировелоэргометрического теста. На этих количествен-
ных показателях основывается классификация физического состояния и тру-
доспособности больных с сердечно-сосудистыми заболеваниями Н.М.Амо-
сова и Я.А.Бендета (1975), которая предусматривает выделение 5 групп фи-
зического состояния (табл. 54).
В нашей стране на практике продолжают пользоваться классифика-
цией недостаточности кровообращения Н.Д.Стражеско и
В.X.Василенко, принятой на XII съезде терапевтов бывшего СССР в
1935 г. Она предусматривает разделение недостаточности кровообращения на
острую и хроническую. Острая недостаточность включает синдромы
острой сердечной, сосудистой, сердечно-сосудистой, лево желудочковой и
правожелудочковой недостаточности. Выделяют несколько стадий хрониче-
ской недостаточности кровообращения , отражающих после-
довательность ее прогрессирования. В I стадии, или начальной, скрытой,
симптомы недостаточности кровообращения появляются только при
509
повышенной физической нагрузке, которая ранее их не вызывала (напри-
мер, подъем на 4-й этаж). В покое гемодинамика и функция сердца не наруше-
ны. Трудоспособность умеренно ограничена. Эта стадия включает синдромы
хронической сердечной и сосудистой недостаточности. Во II стадии, дли-
тельной, выделяют 2 периода. Период А, или начало длительной стадии,
характеризуется появлением симптомов недостаточности кровообращения
при обычной физической нагрузке (например, подъем на 2-й этаж) и слабо
выраженных нарушений функции сердца или какой-либо его части в покое.
Трудоспособность значительно снижена. В период Б (конец длительной
стадии) симптомы отмечаются при незначительной физической нагрузке и
в покое. Характерны выраженные нарушения функции всех отделов сердца и
расстройства гемодинамики в покое. Трудоспособность полностью утрачена.
Во II стадии предусматривается выделение синдромов хронической сердеч-
ной и сердечно-сосудистой недостаточности и хронической недостаточности
преимущественно левого и правого желудочка. В 111 стадии нарушения
гемодинамики в покое резко выражены. Отмечаются необратимые дистрофи-
ческие изменения всех органов и тканей и стойкие нарушения их функции.
Следует отметить, что классификация хронической недостаточности кро-
вообращения Н.Д.Стражеско и В.Х.Василенко более удобна для характерис-
тики стадийности недостаточности левых отделов сердца с вторичным раз-
витием недостаточности правых отделов. В то же время ее использование при
изолированной правожелудочковой недостаточности, например, при хро-
ническом легочном сердце, представляет затруднения. На практике прихо-
дится встречаться и со случаями левожелудочковой недостаточности, при
которой от начала развития и до конца жизни больного отмечаются призна-
ки недостаточности только одного отдела сердца, на что указывал Г. Ф.Ланг
еще в 1936 г.
На основе классификации НД.Стражеско и В.Х.Василенко Н.М.Мухар-
лямовым (1978) была разработана классификация хронической сердечной
недостаточности с учетом ее этиологии, патогенеза и клинических вариан-
тов (табл. 55). Трехстадийная система развития сердечной недостаточности в
ней сохранена, но I и II стадии разделены на два периода. Периоды Б этих
стадий соответствуют I и III стадиям недостаточности кровообращения по
НД.Стражеско и В.Х.Василенко. Период А I стадии — это доклиническая
сердечная недостаточность, для которой характерны полное отсутствие жа-
лоб и минимальные нарушения функции миокарда при физической нагруз-
ке в виде небольшого повышения КДД желудочка и снижения ФВ. Период А
III стадии проявляется тяжелой бивентрикулярной недостаточностью с пе-
риферическими отеками (до анасарки), асцитом, гидротораксом и другими
симптомами и признаками и возможностью достижения их нестойкой поло-
жительной динамики при активной терапии. Учитывая определенные осо-
бенности течения и лечения, автор выделяет особые клинические варианты
хронической сердечной недостаточности. К ним относятся гиперкинетиче-
ский вариант с относительно высоким МОС, коллаптоидный, характеризу-
ющийся сопутствующей сосудистой недостаточностью со снижением ОПСС
510
Таблица 55. Классификация хронической сердечной недостаточности по Н.М.Мухарлямову (1978)
По происхождению По сердечному циклу Клинические варианты По стадийности прогрессирования
Вследствие перегрузки Систолическая Преимущественно Стадия I:
давлением недостаточность левожелудочковая период А период Б
Вследствие перегрузки Диастолическая Преимущественно Стадия II:
объемом недостаточность правожелудочковая период А период Б
Первично-миокардиальная Смешанная Тотальная Стадия III:
(метаболическая) недостаточность недостаточность Гиперкинетическая Коллапгоидная Сохраненный синусовый ритм Брадикардия период А период Б
и АД, по-видимому, вследствие резкого уменьшения МОС, вариант с со-
храненным синусовым ритмом и брадикардией.
Дифференциальный диагноз при сердечной недостаточности предусматри-
вает: I этап — дифференциальная диагностика с другими заболеваниями,
которые проявляются одышкой или удушьем, артериальной гипотензией с
признаками гипоперфузии тканей, цианозом и периферическими отеками;
II этап - установление причины сердечной недостаточности в результате
дифференциальной диагностики различных заболеваний, которые могут ее
вызвать. Дифференциальному диагнозу при одышке, отеках и кардиомега-
лии посвящены отдельные главы (в т. 2).
Диагноз сердечной недостаточности как клинического синдрома ставят
главным образом на основании данных клинического обследования. Основ-
ными признаками левосторонней недостаточности являются одышка при
физической нагрузке, в положении лежа и ортопноэ, правосторонней — уве-
личение печени, отеки, набухание шейных вен и повышение ЦВД, а в
обоих случаях, кроме того, акроцианоз, олигурия, ритм галопа и увеличе-
ние размеров сердца при физическом и особенно рентгенологическом об-
следовании. Последний критерий является важным, но не строго обязатель-
ным. Подтвердить диагноз позволяет демонстрация нарушения насосной фун-
кции желудочка (или желудочков) сердца на основании изменений показа-
телей кардиогемодинамики (МОС, КДО, КДД, ФВ) в покое, а в случаях
начальной сердечной недостаточности — при физической нагрузке, по дан-
ным эхокардиографии, радионуклидной или рентгеноконтрастной вентри-
кулографии и катетеризации сердца.
Осложнения сердечной недостаточности неспецифичны и отмечаются чаще
в ее поздних стадиях.
1. Кровохарканье. Обусловлено диапедезом или разрывом расширенных ле-
гочных и бронхиальных капилляров вследствие значительного повышения в
них давления. Изредка при разрыве мелких бронхиальных вен может возни-
кать легочное кровотечение. Является относительно ранним осложнением
511
левосторонней сердечной недостаточности, прекращается при развитии скле-
роза сосудистой стенки. Отмечается при сердечной астме, отеке легких, а
также может быть обусловлено ТЭВЛА.
2. Частые респираторные инфекции и бронхопневмонии. Благоприятные ус-
ловия для инфекции создают застой и транссудация жидкой части плазмы
крови в альвеолы, а также гиповентиляция.
3. Нарушения сердечного ритма и внезапная смерть. Удельный вес внезап-
ной сердечной смерти среди причин летальных исходов у больных с застой-
ной сердечной недостаточностью колеблется от 40 до 60 % (CONSENSUS
Trial Study Group, 1987; W.Stevenson и соавт., 1993), и по данным мета-
анализа результатов 12 исследований составляет 44 % (G. Francis, 1986). Кри-
терием внезапной сердечной смерти при застойной сердечной недостаточно-
сти, включая выраженную, является внезапное наступление летального ис-
хода — в течение нескольких минут (до 1 ч) от момента появления новых
симптомов либо во сне, на фоне стабилизации или положительной динами-
ки симптомов и признаков застойной сердечной недостаточности в предше-
ствующие 2—4 нед (L.Hirkle, H.Thaler, 1982; H.Greene и соавт., 1989). При
этом исчезновение пульса и потеря сознания предшествуют критическому
падению МОС и нарушению периферического кровообращения, то есть шоку.
Более половины случаев внезапной сердечной смерти при сердечной недо-
статочности связаны с потенциально фатальными желудочковыми аритмия-
ми (P.Milner и соавт., 1985, и др.).
Основными и независимыми факторами риска внезапной сердечной смерти
при застойной сердечной недостаточности, как и у перенесших инфаркт
миокарда, являются выраженная дисфункция миокарда (ФВ левого желу-
дочка менее 40 %) и сложные желудочковые аритмии, в том числе бессимп-
томные. Роль других предикторов, хорошо зарекомендовавших себя у по-
стинфарктных бальных, — индуцируемой желудочковой тахикардии или фиб-
рилляции желудочков при электрофизиологическом исследовании, поздних
потенциалов и уменьшения вариабельности ЧСС как показателя вегетатив-
ного дисбаланса — у больных с застойной сердечной недостаточностью, осо-
бенно некоронарогенного генеза, пока не определена и, по-видимому, от-
носительно невелика.
Частота бессимптомных желудочковых аритмий при холтеровском мони-
торировании ЭКГ больных с застойной сердечной недостаточностью колеб-
лется в пределах 85—95 %, в том числе Ш—IV класса по В.Lown — 80—85 % и
“пробежек” желудочковой тахикардии — 44-60 %. По данным мета-анализа
P.Podrid и соавторов (1992) результатов 13 исследований, охватывавших 1322
таких больных, частота бессимптомных желудочковых аритмий составляет в
среднем 87 %, а нестойкой желудочковой тахикардии — 45 %. Подвержен-
ность, тяжесть по B.Lown и суточное количество преждевременных желу-
дочковых сокращений, по-видимому, не зависят от этиологии сердечной
недостаточности и не всегда коррелируют с ее выраженностью.
Морфологические изменения в миокарде с наличием более или менее
обширных очагов склероза являются структурным субстратом ри-энтри, спо-
512
Причины и механизмы подверженности больных с застойной сердечной
недостаточностью аритмиям и внезапной сердечной смерти
Патогенетические факторы Непосредственные причины
Структурные изменения в миокарде Дисфункция миокарда Аневризма сердца, очаговый (рубец) и диф- фузный кардиосклероз, гипертрофия миокарда Регионарная или тотальная дилатация желудочка
Ишемия миокарда Дефицит электролитов Нейроэндокринные нарушения Гипокалиемия, гипомагниемия Повышение активности симпатико-адреналовой и ренин-ангиотензин-альдостероновой систем
Медикаментозная терапия сердечной недостаточности Салуретики, симпатомиметические амины, ин- гибиторы фосфодиэстеразы, некоторые вазоди- лататоры и антиаритмические препараты
собствуя дисперсии эффективного рефрактерного периода и мембранной
проводимости в миокарде. К этому приводит и гипертрофия миокарда, кото-
рая, кроме того, сопровождается увеличением амплитуды последеполяриза-
ций и триггерной активности вследствие нарушения внутриклеточного об-
мена Са2+.
Важная роль в аритмогенезе принадлежит дисфункции желудочков. Про-
исходящее при этом регионарное или общее растяжение миокарда с увели-
чением стеночного напряжения приводит к укорочению потенциала дей-
ствия и эффективного рефрактерного периода, а также деполяризации мем-
браны в начале диастолы, которая может быть триггером и вызывать внеоче-
редной потенциал действия. Этот феномен, получивший название механо-
электрической обратной связи, может объясняться наличием в клеточной
мембране специальных Na+-каналов, активируемых при ее растяжении, от-
крытие которых, начиная с определенного числа, приводит к спонтанной
деполяризации (D.Hansenn соавт., 1990). Гетерогенностьстеночного напря-
жения в различных участках желудочка при его дисфункции усугубляет дис-
персию де- и реполяризации миокарда и его “аритмическую готовность”.
Изменению электрофизиологических свойств миокарда и их неоднородно-
сти способствует и ишемия миокарда.
В последние годы все большее внимание уделяется роли повышения ак-
тивности симпатико-адреналовой и ренин-ангиотензин-альдостероновой си-
стем, которое закономерно развивается при застойной сердечной недоста-
точности как важная компенсаторная реакция, направленная на поддержа-
ние МОС. Участие этих нейрогуморальных факторов в аритмогенезе реали-
зуется путем как прямого воздействия на электрофизиологические свойства
мембраны кардиомиоцитов, так и косвенного - за счет вторичной гипока-
лиемии, увеличения объема внутрисосудистой жидкости, пред- и постнаг-
рузки и потребности миокарда в кислороде.
Существенное влияние на возникновение аритмий оказывают препара-
ты, которые применяют для лечения сердечной недостаточности (см. выше),
вследствие выделения почками К+ и Mg2+ (салуретики) либо повышения
513
автоматизма и возбудимости миокарда желудочков (инотропные агенты
разного механизма действия). Имеющиеся данные об увеличении часто-
ты и тяжести желудочковых аритмий на фоне лечения р-агонистами и инги-
биторами фосфодиэстеразы позволяют предполагать их роль в повышении
риска внезапной сердечной смерти таких больных. Отмечена способность
некоторых прямых вазодилататоров, в частности миноксидила и производ-
ных дигидропиридина, увеличивать количество желудочковых экстрасистол
и “пробежек” желудочковой тахикардии, что объясняют рефлекторной ак-
тивацией симпатико-адреналовой и ренин-ангиотензин-альдостероновой
систем (М.Packer, 1992, и др.).
Для возникновения предсердных аритмий, среди которых особенно рас-
пространена мерцательная, важное значение имеют также дилатация полос-
тей сердца, гипоксия и ацидоз.
4. Печеночноклеточная недостаточность. Проявляется желтухой и изме-
нением лабораторных показателей функции печени. Основными причинами
являются венозный застой и ухудшение ее перфузии как результат центра-
лизации кровотока в условиях низкого МОС. Нарушение функции печени
выражено весьма умеренно и не требует специального лечения, однако по-
вышает опасность кровотечения при лечении антикоагулянтами. В отличие
от первичных заболеваний печени, несмотря на гепатомегалию и асцит, спле-
номегалия не характерна. Гипербилирубинемия и желтуха могут быть обус-
ловлены также внутрисосудистым гемолизом при инфаркте легкого, селе-
зенки, почки.
5. Осложнения вследствие стаза крови. Образующиеся в венах нижних ко-
нечностей и расширенных полостях сердца тромбы являются источниками
эмболий и инфарктов легкого и внутренних органов.
6. Осложнения, обусловленные низким МОС. К ним относятся: а) хроничес-
кая почечная недостаточность; б) кардиоцеребральная недостаточность; в) ин-
фаркты органов пищеварительного канала без окклюзии артерий с карти-
ной острого живота.
7. Сердечная кахексия. Потеря массы тела, иногда значительная, отмеча-
ется при далеко зашедшей сердечной недостаточности и обусловлена: а) ано-
рексией вследствие венозного застоя в печени и органах пищеварительного
канала; б) нарушением всасывания жиров; в) повышением обмена веществ
в результате значительного увеличения работы дыхательных мышц.
Лечение сердечной недостаточности. Традиционное лечение таких больных
направлено на достижение симптоматического улучшения и уменьшение
выраженности нарушений гемодинамики. Однако кооперативные плацебо-
контролируемые исследования последних лет убедительно доказали существо-
вание реальной возможности изменения клинического течения застойной
сердечной недостаточности и улучшения ее прогноза (J.Cohn и соавт., 1986;
CONSENSUS Trial Study Group, 1987, и др.). Это позволяет сместить акцен-
ты в подходе к таким больным от решения ближайших, тактических, задач
к проведению долговременной программы по улучшению их выживаемости.
Поскольку выраженность сердечной недостаточности колеблется в
514
Основные цели лечения сердечной недостаточности и средства их достижения
Симптоматическое улучшение
Положительные инотропные агенты
Периферические вазодилататоры
Мочегонные препараты
Ограничение соли
Ограничение физической активности
Отрицательные инотропные агенты и дру-
гие препараты, уменьшающие ЧСС
Препараты, улучшающие диастолическое
расслабление миокарда
Трансплантация сердца
Увеличение выживаемости
Некоторые периферические вазодилататоры
Специфические инотропные агенты и ан-
тиаритмические средства?
Имплантированные автоматические дефиб-
рилляторы
Трансплантация сердца
широких пределах, прежде всего следует оценить тяжесть состояния больно-
го и принять решение, насколько интенсивным должно быть лечение.
Общие принципы и средства лечения сердечной недостаточности. Ниже
будут рассматриваться вопросы терапии преимущественно ее хронической
формы, которые, однако, во многом применимы к острой. Неотложная те-
рапия кардиогенного отека легких и острого легочного сердца как острой
лево- и правожелудочковой недостаточности рассматривается ниже.
Лечение хронической лево-, правосторонней и тотальной сердечной не-
достаточности в принципе одинаково.
Ограничение физической активности основывается на спо-
собности физической, а также эмоциональной нагрузки повышать потреб-
ность миокарда в энергии и кислороде и вызывать задержку Na+ и воды
вследствие увеличения секреции альдостерона и уменьшения перфузии по-
чек. При срыве механизмов компенсации постельный режим дает существен-
ный эффект, способствуя уменьшению венозного застоя, дилатации сердца
и увеличению диуреза. Продолжительность соблюдения покоя зависит от тя-
жести и причины сердечной недостаточности, возраста больного. Слишком
быстрое возобновление повседневной активности сразу после исчезновения
отеков сводит на нет достигнутый эффект. Следует также учитывать увели-
чение венозного притока к сердцу в положении лежа и риска возникнове-
ния тромбоза глубоких вен и ТЭВЛА.
Для их предотвращения при необходимости длительной иммобилизации
назначают гепарин в малых дозах подкожно до активизации больного.
Важное значение имеет ободрение пациента, а при сохранении тревож-
ности и нарушениях сна — применение транквилизаторов, антидепрессан-
тов и снотворных препаратов.
Уменьшить расход энергии и кислорода миокардом позволяют также нор-
мализация избыточной массы тела иадекватная коррекция
артериальной гипертензии.
Оксигенотерапия показана в периоды ухудшения при снижении
насыщения кислородом артериальной крови менее 90 %. Кроме случаев тя-
желой гипоксемии, ее проводят через носовые катетеры увлажненным кис-
лородом, менее 100 % концентрации, 4-6 л/мин.
515
Общие принципы п средства лечении сердечной недостаточности
1. Установление и по возможности устранение причины сердечной недостаточности Диагностика основного заболевания и опреде- ление показаний к хирургическому лечению при пороках сердца, констриктивном перикардите, миксоме сердца, обструктивной гипертрофиче- ской кардиомиопатии, некоторых симптоматиче- ских артериальных гипертензиях, ИБС
2. Выявление и устранение способству- ющих и отягощающих факторов 3. Лечение собственно сердечной недостаточности: Терапия артериальной гипертензии, лечение на- рушений сердечного ритма и проводимости и пр.
ликвидация задержки Na* и воды Ограничение потребления соли и в ряде случаев жидкости Мочегонные препараты Удаление жидкости путем торакоцентеза, парацентеза, ультрафильтрации, диализа, кровопускания
повышение сократимости миокарда Сердечные гликозиды, симпатомиметические амины и другие положительные инотропные средства
уменьшение нагрузки иа сердце Ограничение физической активности, уменьшение пред- и постнагрузки с помощью периферических вазодилататоров Вспомогательное кровообращение Нормализация избыточной массы тела при ожирении
предотвращение венозного тромбоза и тромбоэмболий определение показаний к трансплантации сердца Физические упражнения для ног, антикоагулянты
Ограничение потребления соли с пищей . Поступление Na+
усугубляет периферические проявления сердечной недостаточности, что осо-
бенно важно из-за уменьшения выделения его почками пропорционально
снижению почечного кровотока и МОС.
Одно только прекращение досаливания готовой пищи и исключение
из рациона солений и продуктов с высоким содержанием соли (жареный
картофель, мясные и овощные консервы и др.) приводит к уменьшению
потребления соли на 50 %. Большего ограничения приема соли при лечении
адекватными дозами мочегонных препаратов обычно не требуется, кроме
случаев особенно тяжелой сердечной недостаточности или низкой эффек-
тивности сильнодействующих мочегонных средств.
Ограничение жидкости. Поскольку объем внеклеточной жидко-
сти прямо пропорционален содержанию соли, ограничение ее приема, обычно
до 1,5 л/сут, показано в первую очередь при гипонатриемии разведения. Не-
обходимость в ограничении жидкости возникает также при далеко зашед-
шей сердечной недостаточности, особенно осложненной нарушением фун-
кции почек при рефрактерности к мочегонным препаратам. В таких случаях
516
УОС
Норма
Недостаточность Сердечная недостаточность
Выброса к ^£Преднагрузка>или КДД В лебом желудочке
W/////M
Недостаточность переполнения
Рис. 70. Влияние лечения на кривые функции левого желудочка при сердеч-
ной недостаточности: А — мочегонные средства и венозные вазодилататоры;
Б — ингибиторы ангиотензин П-превращающего фермента и вазодилататоры
смешанного действия (венозные и артериальные); В - препараты
с положительным инотропным действием
для уменьшения объема внеклеточной жидкости рекомендуют также ее уда-
ление путем ультрафильтрации, гемодиализа или перитоне-
ального диализа.При значительном скоплении транссудата в грудной
и брюшной полостях показаны торако- и парацентез. Способствуя
расправлению поджатых легких, они улучшают вентиляцию и газообмен.
Одномоментно следует эвакуировать не более 1 — 1,5 л во избежание резкого
снижения УОС и артериальной гипотензии вследствие ускоренной транс-
судации внутрисосудистой жидкости в плевральную или брюшную полость.
При хорошем эффекте мочегонных препаратов механическое удаление жид-
кости обычно не требуется.
Для быстрого уменьшения объема внутрисосудистой жидкости, преднаг-
рузки и венозного застоя в легких применяют кровопускание или ве-
нозные жгуты на конечности.
Медикаментозная терапия. Как показано на рис. 70, улучшения насосной
функции сердца можно достичь путем повышения сократимости миокарда и
уменьшения пред- и постнагрузки. Средства, снижающие преднагрузку, дают
наибольший эффект у больных с высоким КД Д в желудочке и признаками
венозного застоя в малом или большом кругах кровообращения, то есть при
“недостаточности переполнения”. В то же время препараты, вызывающие
уменьшение постнагрузки или повышение сократимости миокарда, особен-
но показаны при наличии признаков низкого МОС.
Мочегонные препараты относятся к основным средствам лечения сердеч-
ной недостаточности, изолированное применение которых способно давать
хороший клинический и гемодинамический эффект у ряда больных с лег-
ким и умеренно тяжелым течением заболевания. Увеличивая выделение поч-
ками Na+ и воды, они приводят к ликвидаций их задержки в организме,
уменьшению ОЦП, а следовательно, к устранению отеков и снижению пред-
нагрузки. Кроме того, мочегонные препараты оказывают слабое непосред-
ственное дилатирующее действие на сосудистую стенку системных и легоч-
ных артерий и вен. Вследствие этого отмечается умеренное снижение КДД и
КДО желудочков и венозного застоя в малом и большом кругах крово-
обращения, а также небольшое уменьшение постнагрузки. Хотя снижение
517
Проксимальный
избитой каналец
Дистальный
извитой каналец
Саг*
Собира-
тельная
трубка
НаНальдо-
— стерон)
~К*Н*
©
©
Наружный слой
мозгового вещества
Внутренний слой
мозгового
вещества
НгОЫДП
К'
На
Нисходящая
часть петли
Генле
Восходящая
часть петли
Генле
Рис. 71. Точки приложения мочегонных средств и препаратов с мочегонным эффектом в
нефроне (по B.Katzung и соавт., 1992, с дополнениями): 1— допамин, дигиталис, ксан-
тины; 2— ацетазоламид: 3— осмотические диуретики; 4— петлевые диуретики; 5— тиа-
зидовые диуретики; 6— калийсберегаюшие диуретики. АДГ— антидиуретический гормон
давления наполнения желудочка может сопровождаться уменьшением его
выброса вследствие уплощения кривой Франка-Старлинга при “недоста-
точности переполнения” (рис. 70), значительное уменьшение КДД и симп-
томов венозного застоя на путях притока обычно сопровождается лишь ми-
нимальным изменением УОС.
В зависимости от точки приложения по ходу нефрона препараты, оказы-
вающие мочегонное действие, распределяются, как показано на рис. 71.
1. Клубочек. Повышение клубочковой фильтрации приводит к увели-
чению количества профильтровавшихся Na+ и их выведения с мочой. Этим
свойством обладают сердечные гликозиды, допамин и ксан-
тины (эуфиллин и др.).
2. В проксимальном извитом канальце осуществляется пассив-
ная реабсорбция около 2/3 Na+ и воды, связанная с активным транспортом
NaHCO3, глюкозы и аминокислот. Развивающееся при этом повышение осмо-
тического давления в интерстициальной ткани почки обеспечивает пассив-
ный транспорт воды. За счет выхода NaHCO3 в проксимальном канальце
возрастает концентрация СГ, что позволяет им реабсорбироваться по концен-
трационному градиенту. Вслед за СГ по электрохимическому градиенту
пассивно реабсорбируется Na+, а вслед за NaCl по осмотическому градиенту
всасывается вода.
Проксимальный извитой каналец служит местом приложения действия
518
ингибиторов карбоангидразы и осмотических диуретиков. Накапливаясь в
его клетках, ингибиторы карбангидразы (диакарб, илифонурит,
или ацетазоламид и др.) оказывают мочегонное действие за счет уменьше-
ния образования Н+, необходимых для реабсорбции NaHCO3. Чтобы нейтра-
лизовать НСО3“, большее количество Na+, а следовательно, воды остается в
просвете канальца. Мочегонный эффект связан с количеством профильтро-
вавшегося NaHCO3, которое возрастает при метаболическом алкалозе и сни-
жается при ацидозе. Поскольку обмен Н+ на Na+, уменьшается на всем
протяжении канальцев, pH крови сдвигается в кислую сторону. Из-за быст-
рого развития толерантности ингибиторы карбоангидразы рекомендуют при-
менять 1—2 раза в неделю. В связи с этим, а также, учитывая слабый мочегон-
ный эффект, в настоящее время для лечения сердечной недостаточности их
практически не используют, за исключением коррекции метаболического
алкалоза.
Действие осмотических диуретиков (маннитол, мочевина и др.)
основано на повышении осмолярности плазмы крови, что приводит к уси-
ленному переходу интерстициальной жидкости в сосудистое русло и ее пос-
ледующей экскреции почками. Развивающееся в первой фазе действия уве-
личение ОЦП сопряжено с опасностью возникновения отека легких, в свя-
зи с чем при сердечной недостаточности осмотические диуретики противо-
показаны.
3. Нисходящая часть петли Генле отличается низкой проницаемо-
стью для Na+ и высокой для воды и мочевины. Вода здесь усиленно всасыва-
ется пассивно благодаря высокой осмолярности интерстициальной ткани,
создаваемой мочевиной. Тонкая восходящая часть петли Генле, наоборот,
проницаема для Na+ и непроницаема для воды и мочевины. Вследствие ги-
перосмолярности поступающей в нее провизорной мочи происходит пассив-
ная реабсорбция NaCl по осмотическому градиенту. В толстой восходящей
части петли активно всасывается СГ, вслед за чем пассивно реабсорбирует-
ся Na+. Непроницаемость этого отдела нефрона для воды приводит к повы-
шению осмотического давления в интерстициальной ткани и гипоосмоляр-
ности канальцевого содержимого.
Петлевые диуретики фуросемид (лазикс),этакриновая
кислота (урегит) и буметанид оказывают сильное мочегонное
действие путем уменьшения активной реабсорбции СГ в толстой восходя-
щей части петли Генле. Это обусловливает снижение обратного всасывания
Na+ и в результате уменьшение гиперосмолярности интерстициальной тка-
ни, которая в существенной мере определяет относительную плотность вы-
деляющейся мочи. Возможно, что вторым местом действия препаратов явля-
ется нисходящая часть петли Генле. Петлевые диуретики являются наиболее
мощными из всех известных мочегонных средств, так как блокируют реаб-
сорбцию до 25—40 % профильтровавшегося Na+. Хлоруретический эффект вы-
ражен больше, чем натрийуретический. Действуя проксимальнее места сек-
реции К+, они увеличивают его потери с мочой. Препараты назначают при
необходимости значительного увеличения диуреза. Они эффективны при
519
выраженном снижении
клубочковой фильтрации.
При внутривенном введе-
нии вазодилатирующее
действие со снижением
давления в легочных венах
и, как результат, умень-
шение преднагрузки, воз-
растает и развивается че-
рез 2~10 мин, предше-
ствуя увеличению диуре-
за, которое наступает спу-
стя 15-30 мин. Этот эф-
фект препаратов объясня-
ет их успешное использо-
вание при лечении отека
легких и тяжелой сердеч-
ной недостаточности.
Благодаря мощности
мочегонного действия,
петлевые диуретики пред-
ставляют и наибольшую
опасность в отношении
развития тяжелых побоч-
ных эффектов (см. ниже).
Вследствие этого их сле-
дует назначать только в
случаях неэффективности
более слабодействующих
препаратов. При перораль-
но м приеме начинают
оказывать натрий- и диу-
ретическое действие через
30—60 мин (табл. 56).
Максимум действия на-
блюдается спустя 4 ч,
окончание — примерно
через 6 ч. Препараты дают
дозозависимый эффект в
дозировках: 20—500 мг
фуросемида, 50-200 мг
этакриновой кислоты и 1—
8 мг буметанида. При хо-
рошем эффекте для вос-
полнения потерь К+ и Na+
520
и предотвращения побочного действия рекомендуют прием через день или 2
раза в неделю, если этого достаточно для поддержания постоянства массы
тела (сухого веса). Лечение начинают с назначения 40 мг фуросемида и 25—
50 мг этакриновой кислоты утром натощак с постепенным увеличением дозы.
При резистентности в случаях тяжелой сердечной и почечной недостаточно-
сти мочегонный эффект можно усилить путем распределения суточной дозы
на 2 и даже 3 приема (рано утром, около 12 и 17—18 ч).
4. В ди стал ьн о м извитом канальце происходит активная ре-
абсорбция Na+, которая усиливается под влиянием альдостерона. При этом
Na+ обменивается на секретируемый в просвет канальца К+.
Дистальный извитой каналец и дистальный сегмент петли Генле являют-
ся местом действия тиазидовых диуретиков, механизм которого не
вполне ясен. По-видимому, он связан с уменьшением проницаемости ка-
нальца для Na+, вследствие чего снижается реабсорбция этого иона. Одно-
временно увеличивается секреция К+.
По силе мочегонного действия тиазидовые диуретики занимают проме-
жуточное положение, уступая место петлевым диуретикам. В наибольшей
эффективной дозе они уменьшают реабсорбцию Na+ лишь на 5 % от его
профильтровавшегося количества, чего, однако, оказывается достаточным
для получения эффекта у ряда больных с отеками. Тиазидовые диуретики
неэффективны при снижении клубочковой фильтрации менее 30 мл/мин,
что ограничивает их применение при тяжелой сердечной недостаточности.
Лечение начинают с назначения гидрохлортиазида (гипотиазида) 1 раз в
сутки утром с постепенным увеличением дозы до 50—100 мг. В связи с упло-
щением кривой зависимости “доза—эффект” повышение разовой дозировки
свыше 100 мг не вызывает дальнейшего увеличения диуреза и поэтому не-
целесообразно. При пероральном приеме действие начинается через 1—2 ч и
достигает максимума через 4 ч, а его продолжительность в большинстве слу-
чаев составляет до 12 ч (см. табл. 56). Предпочтительнее прием 2-3 раза в
неделю под контролем измерения массы тела, которое желательно прово-
дить ежедневно. Побочные эффекты и предосторожности описаны ниже.
5. В собирательных трубках происходит активная реабсорбция Na+
под влиянием альдостерона, который обменивается на К+ и Н+, секретиру-
емые в их просвет. При этом количество обмениваемого К+ зависит от содер-
жания Na+ в канальцевой жидкости. При его повышении в случаях увеличе-
ния поступления соли с пищей или уменьшения реабсорбции в более прок-
симальных отделах нефрона под действием петлевых диуретиков и тиазидов,
секреция К+ возрастает. В собирательных трубках происходит также активная
реабсорбция воды, которая целиком определяется действием антидиурети-
ческого гормона на канальцевую проницаемость.
Способностью ингибировать действие альдостерона и тем самым умень-
шать реабсорбцию Na+ и потери К+ обладают спиронолактон, амилорид и
триамтерен. Благодаря тому, что торможение секреции К+ выражено в зна-
чительно большей степени, чем увеличение выделения Na+, эти препараты
получили название калийсберегающих. Для увеличения диуреза в
521
качестве монотерапии их применяют только при циррозе печени. При сер-
дечных и почечных отеках эти препараты используют исключительно в соче-
тании с более сильными мочегонными средствами в целях уменьшения по-
терь К+ с мочой. При этом, чтобы избежать развития гиперкалиемии, необ-
ходим систематический контроль содержания К+ в плазме крови. Риск его
повышения возрастает при одновременном приеме ингибиторов АПФ и осо-
бенно при олигурии, вследствие чего такие препараты противопоказаны при
почечной недостаточности.
Спиронолактон (верошпирон) оказывает свое действие путем свя-
зывания с клеточными рецепторами альдостерона, являясь его истинным
конкурентным антагонистом. Эффективные дозы колеблются в пределах от
25 до 400 мг в сутки в зависимости от выраженности альдостеронизма. Ха-
рактерно отсроченное действие, которое достигает максимума через 24—72 ч.
Спиронолактон стимулирует образование ренина, ангиотензина II, а в ре-
зультате — альдостерона, вследствие чего в процессе лечения может требо-
ваться увеличение дозы.
Поскольку три амте ре н и амилорид не являются истинными ан-
тагонистами альдостерона, в отличие от спиронолактона, они эффективны
в начальных стадиях сердечной недостаточности при отсутствии гиперальдо-
стеронизма. В дозе от 5 до 20 мг в сутки амилорид оказывает более сильное
действие и лучше переносится, чем триамтерен, а также спиронолактон.
Специальные проблемы при лечении мочегонными препаратами сердечной
недостаточности. 1. Избыт очный диурез и абсолютная гипо-
натриемия (гипонатриемия истощения). Применение больших
доз мочегонных препаратов, особенно наиболее мощных петлевых диурети-
ков, может вызывать уменьшение ОЦП, венозного притока к сердцу, МОС
и следовательно, артериальную гипотензию и снижение клубочковой филь-
трации. Это особенно опасно в случаях преимущественно диастолической
сердечной недостаточности, при которой адекватный МОС обеспечивается
повышением КДД, как, например, при гипертрофической кардиомиопа-
тии, констриктивном перикардите и, в меньшей степени, в острый период
инфаркта миокарда. Пагубный эффект оказывает и рефлекторная стимуля-
ция ренин-ангиотензин-альдостероновой системы. Клинически у больных
появляются выраженная слабость, сонливость, мышечные судороги, отме-
чаются снижение тургора кожи, малый быстрый пульс, олигурия. Заподоз-
рить гиповолемию позволяют развитие при схождении отеков постуральной
гипотензии, исчезновение видимой пульсации шейных вен, азотемия, по-
вышение гематокритного числа. Содержание Na+ и СГ в крови - в пределах
нормы. Лечение заключается в приостановлении приема мочегонных препа-
ратов, увеличении поступления соли с пищей, а при необходимости — внут-
ривенной инфузии 3—5 % раствора натрия хлорида. При возобновлении мо-
чегонной терапии используют меньшие дозы более слабых средств.
2. Относительная гипонатриемия, или “гипонатриемия
разведения”. Возникает при преимущественной задержке воды вследствие
свойственной ряду больных с сердечной недостаточностью гиперсекреции
522
антидиуретического гормона и вазопрессина, а также при резком повыше-
нии содержания ангиотензина II. Больных беспокоят слабость, жажда и пло-
хое общее самочувствие. В отличие от абсолютной гипонатриемии в таких
случаях сохраняются отеки, снижается содержание Na+ в крови и уменьша-
ется относительная плотность мочи (при “гипонатриемии истощения” она
повышена). Лечение состоит в резком ограничении приема жидкости (до
500-800 мл в сутки), а также в сочетанном применении фуросемида с ин-
гибиторами АПФ.
3. Гипокалиемия. Причинами являются: 1) увеличение обмена Na+на
К+ в конечных отделах дистальных извитых канальцев и собирательных труб-
ках как результат блокады реабсорбции Na+ в проксимальной части нефро-
на; 2) повышение секреции альдостерона в ответ на снижение содержания
Na+ в крови. Настораживает в отношении возможности гипокалиемии появ-
ление выраженной мышечной слабости, тошноты, рвоты, иногда — артери-
альной гипотензии, а также эктопических аритмий. Особенно опасны желу-
дочковые нарушения ритма, которые могут способствовать фибрилляции же-
лудочков. В серьезных случаях единственно надежным методом восполнения
потерь калия является внутривенное введение 3—4 % раствора калия хлори-
да, так как его всасывание в пищеварительном канале очень вариабельно и
сопряжено с раздражающим действием на слизистую оболочку. Профилак-
тика гипокалиемии включает: 1) обогащенную калием диету; 2) по возмож-
ности назначение мочегонных препаратов, начиная с тиазидовых диурети-
ков в малых дозах, по интермиттирующей схеме; 3) сочетание тиазидовых и
петлевых диуретиков с калийсберегающими, что более эффективно, чем
дополнительное назначение препаратов калия внутрь. При повышении уровня
калия в плазме крови до 5—6 ммоль/л их прием следует временно прекратить.
4. Метаболический алкалоз. Обусловлен увеличением потери СГ
вследствие уменьшения его реабсорбции в проксимальных отделах нефрона и
Н+ из-за возрастания его секреции вместе с К+ в собирательных трубках при
лечении тиазидовыми и петлевыми диуретиками. Обычно не требует лечения.
При необходимости корригируется внутривенным введением калия хлорида.
5. Гипомагниемия. Может развиваться вследствие нарушения реаб-
сорбции Mg2+ в восходящем отделе петли Генле под влиянием тиазидовых и
петлевых диуретиков. Этому способствуют употребление мягкой питьевой
воды и нарушение всасывания. Клинические проявления в виде депрессии,
мышечной слабости и рефрактерных предсердных и желудочковых аритмий
отмечаются относительно редко и корригируются путем внутривенного вве-
дения магния сульфата.
6. Гиперурикемия. Этот эффект тиазидовых диуретиков, фуросемида
и этакриновой кислоты имеет клиническое значение только у больных с
подагрой, когда прием этих препаратов за счет конкуренции при секреции в
почках с мочевой кислотой может провоцировать приступ артрита.
7. Снижение толерантности к углеводам (тиазидовые
диуретики). Выражено преимущественно при сахарном диабете и может тре-
бовать повышения дозы инсулина.
523
8. Снижение почечного кровотока (тиазидовые диуретики).
9. Гиперкальциемия (тиазидовыедиуретики).
10. Гиперлипидемия (тиазидовые диуретики). Обычно незначитель-
ная и нестойкая. Клиническое значение ее неясно.
11. Реакции гиперчувствительности (тиазидовыедиуретики).
Встречаются редко и могут проявляться кожной сыпью, агранулоцитозом,
тромбоцитопенией, васкулитом, гломерулонефритом и интерстициальным
нефритом.
Общие принципы применения мочегонных препаратов при сердечной недо-
статочности. При задержке жидкости, не поддающейся умеренному огра-
ничению потребления соли, то есть исключению досаливания, и неизме-
ненной функции почек, когда достаточно относительно умеренного увели-
чения диуреза, лечение начинают с интермиттирующего приема тиазидово-
го производного. При недостаточном эффекте добавляют один из калийсбе-
регающих диуретиков, а при сохранении отеков переходит на ежедневный
прием обоих препаратов. Если, несмотря на это, желаемый эффект не дос-
тигнут, тиазидовый диуретик заменяют петлевым. При необходимости более
активной мочегонной терапии следует стремиться к тому, чтобы суточное
количество мочи преобладало над выпитой жидкостью в 1,5—2 раза, или на
1,5—2 л в сутки. В случаях далеко зашедшей сердечной недостаточности при-
бегают к сочетанию 3 препаратов: петлевого, тиазидового и калийсберегаю-
щего диуретиков, чем достигается последовательная блокада реабсорбции
Na+ на протяжении значительной части нефрона. При этом тиазидовый диу-
ретик, триамтерен и амилорид назначают 2 раза в сутки, петлевые диурети-
ки — чаще однократно с периодическими перерывами, спиронолактон — 3—
4 раза в сутки.
Некоторые больные с тяжелой сердечной недостаточностью резистентны
к мочегонным препаратам. Причинами этого могут быть:
1) неправильное назначение препаратов, например, тиазидовых диурети-
ков при сниженной клубочковой фильтрации, применение чрезмерно боль-
ших доз;
2) нарушение всасывания в пищеварительном канале;
3) нарушение электролитного баланса, вызываемое мочегонной терапией
(гипонатриемия, гипомагниемия, гипокалиемия);
4) гиповолемия как следствие чрезмерного диуреза, которая приводит к
снижению почечного кровотока и клубочковой фильтрации;
5) то же вследствие высокого уровня циркулирующих катехоламинов,
свойственного сердечной недостаточности (для коррекции необходимо уси-
лить инотропную поддержку);
6) вторичная активация ренин-ангиотензин-альдостероновой системы.
Корригируется дополнительным назначением ингибиторов АПФ;
7) плохая “податливость” больного.
С учетом этих факторов для преодоления резистентности по показаниям
проводят коррекцию водно-электролитного баланса, переходят на паренте-
ральное введение, усиливают инотропную поддержку и прибегают к допамину
524
в малых, так называемых диуретических, дозах (см. ниже). Часто хороший
эффект дает сочетание мочегонных препаратов с ингибиторами АПФ. Одна-
ко в отдельных случаях эти препараты могут вызывать, наоборот, падение
клубочковой фильтрации с азотемией, что обратимо при их отмене.
Терапию мочегонными препаратами следует проводить особенно осто-
рожно у больных, получающих сердечные гликозиды, так как гипокалие-
мия увеличивает риск развития их токсического действия.
Сердечные гликозиды. Занимают важное место в лечении сердечной недо-
статочности уже на протяжении 200 лет. Тем не менее, механизм их дей-
ствия остается не вполне ясным, а его сила и, в ряде случаев, направлен-
ность, могут варьировать в зависимости от многих факторов.
На молекулярном уровне в основе фармакологического действия глико-
зидов лежит ингибирование Na+, К+-АТФ-азы. Это непосредственно опре-
деляет их электрофизиологический эффект — уменьшение автоматизма и
проводимости синоатриального и атриовентрикулярного узлов и косвенно
- инотропный.
1. Влияние на сократимость миокарда. Повышение силы и
скорости сокращения рабочего миокарда обусловлено повышением содержа-
ния Na+ внутри кардиомиоцитов к началу кардиоцикла, что приводит к
увеличению притока в них Са2+ посредством Na+-Ca2+- обменного меха-
низма (Na+ выходит из клетки, обмениваясь на Са2+). В результате увеличе-
ния концентрации внутриклеточного Са2+ возрастает количество образую-
щихся актомиозиновых мостиков. Достигаемый инотропный эффект у боль-
ных с сердечной недостаточностью приводит к повышению УОС, что спо-
собствует снижению КД Д в желудочках и давления на путях их притока,
увеличению почечного кровотока и диуреза.
2. Влияние на автоматизм: а) синоатриальный узел. Уд-
линяя медленную диастолическую деполяризацию, гликозиды способны
уменьшать автоматизм клеток атриовентрикулярного узла, давая отрица-
тельный хронотропный эффект. Уменьшению ЧСС способствует также кар-
диотоническое действие препаратов, благодаря которому исчезает необходи-
мость в компенсаторной тахикардии для поддержания МОС, а также их
рефлекторное ваготоническое действие;
б) атриовентрикулярное соединение, волокна Пурки-
нье и сократительного миокарда предсердий и желудоч-
ков. Способность гликозидов повышать автоматизм водителей ритма П и
III порядков обусловлена: 1) частичной деполяризацией этих клеток в покое
вследствие повышения содержания внутриклеточного Na+ и снижения —
К+; 2) повышением амплитуды подпороговых импульсов деполяризации, ко-
торые могут достигать порогового уровня. Возникновение при этом эктопи-
ческих аритмий, особенно желудочковых, относится к характерным при-
знакам гликозидной интоксикации (см. ниже).
3. Влияние на проводимость: а) проводящая система
сердца. Путем непосредственного удлинения рефрактерного периода и кос-
венного ваготонического действия гликозиды замедляют проводимость. Этот
525
Таблица 57. Некоторые показатели фармакокинетики основных сердечных гликозидов
Показатель Дигоксин Дигитоксин Строфантин G (оубаин)
Всасывание в пищеварительном канале, % 66 > 90 < 5
Связывание с белками плазмы крови, % 25 96 5
Выделение почками, % 80 15 50
Метаболизация в печени, % 15 80 50
Выделение с желчью, % 8 20 30
Период полужизни' 40 ч 7 сут 20 ч
* При неизмененной функции почек.
эффект особенно выражен в атриовентрикулярном соединении и обеспечи-
вает уменьшение количества предсердных импульсов, достигающих желу-
дочков, при мерцании предсердий, а также может приводить к атриовентри-
кулярной блокаде;
б) сократительный миокард. Гликозиды увеличивают скорость
проведения по рабочим кардиомиоцитам. Этим объясняется, в частности, их
способность увеличивать ЧСС при мерцательной аритмии у больных с синд-
ромом Вольфа—Паркинсона-Уайта, так как добавочные проводящие пути
при этом заболевании образованы волокнами сократительного миокарда.
4. Влияние на периферические сосуды . Благодаря Са2+-опо-
средованному увеличению сократимости гладкой мускулатуры сосудистой
стенки, гликозиды могут несколько повышать ее тонус. При отсутствии сер-
дечной недостаточности повышение ОПСС и уменьшение венозного прито-
ка к сердцу нивелируют прирост УОС вследствие инотропного эффекта пре-
паратов и УОС не изменяется. У больных с сердечной недостаточностью
гликозиды оказывают косвенное дилатирующее действие на артериальные и
венозные сосуды, опосредуемое снижением повышенной активности сим-
патико-адреналовой системы в ответ на увеличение МОС.
Наиболее важные показатели фармакокинетики трех основных предста-
вителей сердечных гликозидов, имеющие клиническое значение, приведе-
ны в табл. 57. Благодаря хорошей всасываемости многих гликозидов даже при
свойственном сердечной недостаточности системном венозном застое, па-
рентеральное введение имеет преимущества перед приемом внутрь только
при неотложных ситуациях или невозможности приема таблетированных пре-
паратов. Включение в Фармакопею обязательного стандарта для растворимо-
сти каждого из препаратов в последние годы позволило унифицировать их
скорость всасывания в пищеварительном канале и тем самым биодоступ-
ность (то есть процент внутривенно введенной дозы), которые до этого ко-
лебались в широких пределах в различных выпускаемых партиях. Всасывание
повышается при уменьшении моторики кишечника и гипотиреозе. Оно умень-
шается при гипертиреозе, одновременном приеме антацидов, секвестрантов
и сорбентов. Большая часть содержащихся в организме гликозидов связана с
различными тканями, в том числе с миокардом. Содержание в сердце ди-
526
токсина, например, более чем в 30 раз выше, чем в плазме крови, где
находится лишь 1 % его количества в организме. Концентрация в сердце
дигитоксина в 7 раз превышает его уровень в плазме крови.
Основными показаниями к назначению сердечных глико-
зидов являются: 1) лечение сердечной недостаточности; 2) лечение
суправентрикулярных аритмий.
При сердечной недостаточности гликозиды наиболее эффек-
тивны в случаях сопутствующего мерцания и в меньшей степени - трепета-
ния предсердий, так как благодаря замедлению атриовентрикулярного прове-
дения оказывают брадикардитическое действие. Клинический эффект препа-
ратов при синусовом ритме весьма вариабелен и у части больных (по некото-
рым данным, до 50 %) отсутствует. В определенной мере он зависит от причи-
ны сердечной недостаточности. Гликозиды оказывают наибольшее кардиото-
ническое действие при нарушении систолической функции желудочков с их
дилатацией, ритмом галопа и низкой ФВ в случаях поражения миокарда в
результате непосредственного повреждающего действия этиологического фак-
тора и при хронической перегрузке сопротивлением или объемом. В силу этого
они наиболее эффективны у больных с хронической ИБС, артериальной ги-
пертензией и у ряда больных с приобретенными и врожденными пороками
сердца и дилатационной кардиомиопатией, даже при относительно слабо вы-
раженной сердечной недостаточности. Эффект незначителен и может отсут-
ствовать при острой сердечной недостаточности у больных острым инфарктом
миокарда, активном воспалительном процессе в миокарде, гиперкинетичес-
кой форме сердечной недостаточности при легочном сердце, тиреотоксикозе,
а также в случаях нарушения наполнения при митральном стенозе с синусо-
вым ритмом без правожелудочковой недостаточности, констриктивном и экс-
судативном перикардите. При легочном сердце, острой сердечной недостаточ-
ности, в том числе кардиогенном шоке, их применение лимитируется значи-
тельным сужением широты терапевтического действия из-за гипоксии и аци-
доза. Гликозиды неэффективны и даже способны ухудшить насосную функ-
цию сердца при диастолической недостаточности, наиболее ярко выраженной
у больных с гипертрофической кардиомиопатией.
При получении положительного эффекта лечения в период ухудшения
течения хронической сердечной недостаточности на фоне синусового ритма
последующий длительный прием гликозидов дает клинический эффект при-
мерно у 10 % больных. У 2/3 больных их отмена не вызывает ухудшения
состояния в течение нескольких месяцев и даже лет, а еще у 1/4 с этим
ухудшением можно справиться с помощью усиления мочегонной терапии.
Установить критерии отбора больных, нуждающихся в длительном лече-
нии, пока не удается. Доводом в пользу его продолжения при стабилизации
состояния больного может служить сохранение III тона, а противопоказани-
ем — повышенный риск развития токсичности, как, например, устойчивая
гипокалиемия и ухудшение функции почек.
При нарушениях ритма гликозиды наиболее эффективны и явля-
ются средством выбора при лечении тахисистолической формы мерцания
527
предсердий, за исключением случаев гипертиреоза, дли которого характерна
резистентность к ним. При купировании других суправентрикулярных арит-
мий, включая трепетание предсердий, препараты менее эффективны и от-
носятся к средствам II ряда, а в случаях синдрома предвозбуждения желу-
дочков противопоказаны. Еще слабее профилактический эффект гликозидов
при этих видах аритмии.
Противопоказания. Абсолютным противопоказанием является
только гликозидная интоксикация. Относительные противопоказания, при
которых назначение гликозидов нежелательно и требует особой осторож-
ности, включают:
1) острый инфаркт миокарда и нестабильную стенокардию вследствие
возможного повышения потребности миокарда в кислороде и повышенного
риска тяжелых эктопических аритмий и фибрилляции желудочков;
2) атриовентрикулярную блокаду II—III степени в связи с опасностью ее
усугубления и появления приступов Морганьи—Адамса—Стокса. По этой же
причине нежелательно назначать гликозиды при трепетании предсердий с
коэффициентом проведения 3:1 и более. При стойкой полной атриовентри-
кулярной блокаде возможно очень осторожное применение короткоживу-
щих гликозидов, от которых, по образному выражению Б.Е.Вотчала (1965),
блокада не станет полнее, однако лучше проводить лечение на фоне элект-
рокардиостимуляции;
3) обструктивную гипертрофическую кардиомиопатию из-за опасности
увеличения внутрижелудочкового градиента давления и падения УОС;
4) гипокалиемию и гипомагниемию, которые способствуют раннему раз-
витию гликозидной интоксикации и требуют коррекции перед назначением
этих препаратов.
Ни одно из нарушений ритма у больного с сердечной недостаточностью
не является противопоказанием к назначению гликозидов при условии, если
можно с уверенностью исключить его связь с приемом дигиталиса. В таких
случаях, особенно при желудочковых аритмиях высоких градаций, лечение
следует проводить с особой осторожностью во избежание передозировки.
Дигоксин (по 0,25 мг в таблетках и по 2 мл 0,025 % раствора в ампу-
лах) содержится в листьях шерстистой наперстянки. Он всасывается глав-
ным образом в тонкой кишке с биодоступностью, равной 65—75 %; 80 %
препарата выделяется почками в неизмененном виде путем клубочковой
фильтрации прямо пропорционально ее величине и 15—20 % с калом из желчи.
Небольшое количество дигоксина, которое секретируется в почечных ка-
нальцах, практически полностью реабсорбируется и не влияет на величину
его суточной экскреции. При неизмененной функции почек ежедневно из
организма удаляется в среднем 1/3 принятой дозы. При этом период полу-
жизни составляет 36—48 ч. При почечной недостаточности выделение дигок-
сина значительно нарушается и его действие удлиняется, что может приво-
дить к интоксикации. При внутривенном введении действие препарата на-
чинается через 15—30 мин и достигает максимума через 2—5 ч, а при приеме
внутрь — соответственно через 2—3 и 4—6 ч.
528
Дигитоксин (по 0,1 мг в таблетках), содержащийся в пурпуровой и
шерстистой наперстянке, практически полностью всасывается в пищевари-
тельном канале и 96 % его связывается с белками плазмы крови. Большая
часть препарата метаболизируется в печени, так что в неизмененном виде с
мочой выделяется лишь около 15 %. Благодаря выраженной способности свя-
зываться с белками и кишечно-печеночной циркуляции препарат имеет длин-
ный период полужизни — 7 дней. Этот период укорачивается при гипопроте-
инемии (например, у больных с нефротическим синдромом) и практически
не зависит от функции почек. Действие принятой дозы начинается через 4—
5 ч и достигает максимума через 7—10 ч.
Ланатозид С (целанид, изоланид по 0,25 мг в таблетках и по 1 мл
0,2 % раствора в ампулах), гликозид из листьев шерстистой наперстянки,
по своим фармакокинетическим свойствами (период полувыведения, путь
выведения, степень кумуляции) сходен с дигоксином, но хуже всасывается
и частично превращается в дигоксин в кишечнике. При внутривенном вве-
дении действие начинается раньше.
Препараты строфанта строфантин К (по 1 мл 0,05 % раствора в ампулах)
и строфантин G (оубаин), в отличие от дигоксина, хорошо растворя-
ются в воде и плохо — в липидах, поэтому практически не всасываются в
пищеварительном канале, обладают коротким действием и очень слабо ку-
мулируют. Поэтому их применяют исключительно парентерально, а именно
— внутривенно, так как при внутримышечном введении, как и у гликози-
дов наперстянки, биодоступность колеблется в широких пределах и неконт-
ролируема. Действие начинается через 5—10 мин и достигает максимума че-
рез 30 мин — 2 ч (в среднем через 60 мин). Вследствие относительно корот-
кого периода полужизни (20 ч) препарат лучше назначать 2 раза в сутки,
так как к концу суток строфантин практически перестает действовать. Пре-
парат значительно меньше, чем дигоксин, замедляет ЧСС и проводимость,
что позволяет использовать его при брадикардии. За рубежом строфантин
практически не применяется.
Коргликон (по 1 мл 0,06 % раствора в ампулах), содержащий сумму
гликозидов из листьев ландыша, по своей фармакокинетике близок к стро-
фантину. Практически не кумулирует. Продолжительность действия — 7—
10 ч, поэтому его назначают не менее 2 раз в сутки. По силе своего действия
значительно уступает строфантину (0,6 мг соответствуют 0,2 мг строфанти-
на), в связи с чем используется редко.
В целом по брадикардитическому эффекту и кумуляции препараты сер-
дечных гликозидов располагаются в следующей последовательности: диги-
токсин > дигоксин > ланатозид С > строфантин > коргликон, что следует
учитывать при их назначении.
Тактика назначения гликозидов. В зависимости оттемпов по-
лучения полного клинического эффекта различают три вида дигитализации.
При быстрой и умеренно быстрой дигитализации первоначально назначают
большие, так называемые нагрузочные, дозы, а потом переходят на поддержи-
вающие, которые принимают д лительно. Величина суммарной нагрузочной,
529
или насыщающей, дозы определяется достижением насыщения. Его крите-
риями являются получение клинического эффекта в виде снижения ЧСС до
60—70 в 1 мин в покое без учащения при физической нагрузке или после
введения атропина сульфата, уменьшения одышки и увеличения диуреза,
желательно в 1,5 раза. Дальнейшее насыщение прекращают также при воз-
никновении первых признаков интоксикации, обычно анорексии или арит-
мии. При этом появление на ЭКГ характерной корытообразной депрессии
сегмента ST, переходящей в асимметричный отрицательный зубец Т в отве-
дениях с высоким зубцом R расценивается как проявление действия глико-
зидов, а не их токсичности. Эти изменения могут сохраняться после исчез-
новения гликозидов из крови.
Величина насыщающей дозы для каждого препарата различна и варьиру-
ет в зависимости от индивидуальных особенностей больного. В среднем она
составляет для дигоксина: внутрь — 1,5 мг (до 3 мг), внутривенно — 0,75—
1 мг; для дигитоксина: внутрь - 1,2 мг (до 1,6 мг); для ланатозида С: внутри-
венно — 0,8 мг; для строфантина К: внутривенно - 1 мг. При быстрой диги-
тализации среднюю насыщающую дозу вводят в один прием или, что менее
рискованно, — дробно за 12—24 ч с интервалами 2—4 ч. При умеренно быст-
рой дигитализации насыщение проводят за 2—3 сут с интервалами 6—8 ч.
При этом некоторые авторы рекомендуют в 1-е сутки вводить 50 % средней
насыщающей дозы.
Если лечение начинают с назначения нагрузочных доз, величину под-
держивающей дозы (ПД) можно рассчитать по специальным формулам, ко-
торые приведены ниже для дигоксина:
ПД = НД • % элиминации,
где НД — нагрузочная доза, то есть суммарная принятая доза, позволившая
достигнуть насыщения. Процент элиминации (% ЭЛ) дигоксина за сутки
определяется величиной клубочковой фильтрации и может быть подсчитан
по формулам:
20
% ЭЛ = 11,6 + для мужчин
К
или
16
12,6 + для женщин,
К
где К — концентрация креатинина крови (в мг%). Дозировка дигитоксина
при почечной недостаточности не изменяется, но уменьшается при пече-
ночной. Индивидуальную поддерживающую дозу подбирают под контролем
динамики клинических проявлений и ЭКГ (см. ниже признаки интоксика-
ции) с учетом массы тела, возраста больного, функции почек и допустимо-
го уровня риска развития побочных эффектов в каждом случае. Для расчетов
НД и ПД с учетом этих факторов существуют специальные номограммы.
Медленная дигитализация предусматривает применение поддерживающих
доз с самого начала лечения без насыщения. Средняя величина суточной
поддерживающей дозы для приема внутрь для дигоксина составляет 0,125—
0,375 мг, для дигитоксина — 0,1 мг, а насыщение достигается соответствен-
но примерно через 1 и 3-4 нед.
530
При недостаточном эффекте лечения дигоксином и дигитоксином опре-
деляют их содержание в сыворотке или плазме крови. При использовании
радиоммунного метода терапевтическая концентрация этих препаратов со-
ставляет соответственно 0,8—2,0нг/мл (1,0—2,6 нмоль/л) и 20—30 нг/мл
(26—39 нмоль/л), а токсическая — больше этих величин. При низкой кон-
центрации и недостаточном клиническом эффекте дозу препарата можно
увеличить.
При выборе темпов дигитализации исходят из тяжести состояния боль-
ного и степени риска развития побочных эффектов. Для их предотвраще-
ния быструю и умеренно быструю дигитализацию следует проводить в
стационаре, а медленную можно выполнять при амбулаторном лечении.
Факторы, вызывающие уменьшение эффективной дозы сердечных гли-
козидов, то есть способствующие развитию гликозидной интоксикации:
I. Фармакокинетические факторы (повышают содержание пре-
парата в организме при введении одной и той же дозы):
1. Уменьшение объема распределения препарата: почечная недостаточ-
ность*; гипотиреоз.
2. Уменьшение клиренса в почках: почечная недостаточность’; пожилой
возраст; взаимодействие с другими лекарственными препаратами (хинидин,
верапамил, амиодарон, спиронолактон).
3. Нарушение метаболизма: печеночная недостаточность (особенно при
назначении дигитоксина).
II. Фармакодинамические факторы (повышаютчувствитель-
ность тканей без изменения содержания препарата в организме):
1. Нарушения электролитного и кислотно-основного баланса: гипокали-
емия’; гипомагниемия; гиперкальциемия или внутривенное введение Са2+;
ацидоз и гипоксия.
2. Заболевания сердца: хроническое легочное сердце; кардиогенный шок;
миокардит; инфаркт миокарда;
3. Прочие: пожилой возраст’; гипотиреоз.
Токсическое действие гликозидов отмечается примерно у 10-25 %
больных, а летальность при этом колеблется в пределах от 4 до 36 % (Т. Smith
и соавт., 1984). Проявления токсичности неспецифичны и могут быть вне-
сердечными и сердечными.
1. Внесердечные проявления: а) состороны пищеваритель-
ного канала наиболее частыми и ранними симптомами являются анорек-
сия и тошнота, реже - рвота. Они имеют центральное (мозжечковое) проис-
хождение и не связаны с раздражающим действием препаратов при всасыва-
нии. Может отмечаться также понос;
б) состороны центральной нервной системы отмечаются сон-
ливость или беспокойство, головокружение, ночные кошмары, спутанность
сознания, реже острый психоз, делирий, судороги. Характерны нарушения
цветоощущения (до 15 % больных), чаще в виде появления ореолов желтого
цвета (ксантоксия) реже - “вспышек”, диплопии.
* Наиболее важные факторы.
531
2. Сердечными проявлениями являются все возможные виды
аритмий и блокад, обусловленных повышением автоматизма и ухудшением
проводимости. Ниже они перечислены в порядке убывания встречаемости по
данным мета-анализа результатов 10 исследований, охватывающих в общей
сложности 631 наблюдение (C.Fisch, 1967);
а) желудочковые аритмии. Отмечаются у 71 % больных. Наиболее
распространенными из них являются желудочковая экстрасистолия, особен-
но по типу алгоритмии, или парная, политопная, которая может переходить
в пароксизмальную желудочковую тахикардию и фибрилляцию желудочков.
Несмотря на столь значительную частоту желудочковых аритмий, сердечные
гликозиды не повышают риск внезапной сердечной смерти. Это, возможно,
связано с их косвенным тормозящим влиянием на активность симпатико-
адреналовой системы (Captopril-Digoxin Multicenter Research Group, 1988;
R.Di Bianco и соавт., 1989);
б) суправентрикулярные тахикардии: пароксизмальная пред-
сердная, часто с неполной атриовентрикулярной блокадой, и пароксизмаль-
ная и непароксизмальная тахикардия из атриовентрикулярного соединения
(29 %);
в) атриовентрикулярная блокада I —111 степени (26 %), реже
атриовентрикулярная диссоциация (10 %);
г) синусовая брадикардия, синоатриальные блокады, остановка
синусового узла с заместительным ритмом из атриовентрикулярного соеди-
нения или идиовентрикулярным (13 %). Мало показательны. Изредка ток-
сичность гликозидов приводит к развитию мерцания или трепетания пред-
сердий (6 %).
Все эти аритмии лишены специфичных черт, которые позволили бы до-
казать их связь с передозировкой гликозидов. Наиболее характерно сочета-
ние одной из эктопических аритмий с каким-либо нарушением проводимо-
сти. Риск возникновения дигиталис-инициируемых аритмий повышается после
электроимпульсной терапии, поэтому гликозиды лучше предварительно от-
менять.
В отдельных случаях передозировка гликозидов проявляется нарастанием
сердечной недостаточности.
Подтвердить интоксикацию гликозидами позволяет повышение их содер-
жания в плазме крови. Однако признаки передозировки могут наблюдаться
и при терапевтической концентрации препарата вследствие повышения чув-
ствительности к нему (см. с. 531), самой частой причиной чего является ги-
покалиемия.
Лечение гликозидной интоксикации предусматривает: временную отме-
ну гликозидов и мочегонных препаратов, выявление и по возможности кор-
рекцию факторов, способствующих проявлению их токсичности, прежде всего
гипокалиемии, обеспечение уровня К+ в плазме крови на верхней границе
нормы путем назначения калия хлорида внутрь или внутривенно.
Активное антиаритмическое лечение проводят только при угрожающих
аритмиях и усугублении нарушений гемодинамики из-за частого или редкого
532
ритма. При тахисистолических аритмиях препаратом выбора является фени-
тоин (дифенин) в дозе 3—5 мг/кг внутривенно в сутки, который в отличие
от других антиаритмических препаратов улучшает проводимость через атрио-
вентрикулярный узел. При неэффективности фенитоина прибегают к про-
пранололу, который вводят по 0,5-2 мг внутривенно медленно, при необ-
ходимости повторно через 1—2 ч при отсутствии нарушений проводимости,
и лидокаину — по 1 мг/кг внутривенно каждые 1-5 мин, затем путем инфу-
зии. Иногда эффективен новокаинамид. При наличии атриовентрикулярной
блокады перед введением антиаритмических препаратов вводят эндокарди-
альный электрод для электрокардиостимуляции. Электроимпульсная тера-
пия не показана, так как существует опасность возникновения некупирую-
щейся фибрилляции желудочков. Предпочтительнее урежающая элекгрокар-
диостимуляция. Трансторакальную деполяризацию проводят по жизненным
показаниям при неэффективности других методов лечения разрядами низ-
кой мощности под прикрытием препаратов калия и антиаритмических средств.
При симптоматичной брадикардии и блокадах показаны атропина суль-
фат и временная элекгрокардиостимуляция. Симптоматические препараты
нежелательны, так как могут провоцировать желудочковые аритмии.
Весьма эффективны специфические антитела к фрагменту Fab белка, об-
разующего комплекс с дигоксином, которые получают путем иммунизации
животных. Они вводятся внутривенно через специальные фильтры в наибо-
лее тяжелых случаях и специфически связывают дигоксин. В 75—90 % случаев
эффект отмечается спустя 20 мин. Как показали результаты многоцентрово-
го исследования этих антител у 700 больных с тяжелой гликозидной инток-
сикацией, полное исчезновение всех ее симптомов и клинических призна-
ков было достигнуто у 50 % пациентов (A.Hickey и соавт., 1991).
В менее тяжелых случаях, особенно при лечении дигитоксином, для
уменьшения всасывания гликозида в кишечнике и его печеночно-кишеч-
ной рециркуляции можно использовать активированный уголь, холестира-
мин и холестипол. Достигаемый эффект довольно слабый.
Уменьшить риск развития гликозидной интоксикации позволяют: 1) пред-
варительная коррекция факторов, повышающих их токсичность; 2) по воз-
можности медленная дигитализация и применение наименьших эффектив-
ных поддерживающих доз; 3) во время насыщения осмотр больного перед
приемом каждой очередной дозы для выявления ранних признаков токсич-
ности; 4) назначение гликозидов внутрь, а не внутривенно.
Взаимодействие гликозидов с другими препаратами.
Всасывание уменьшают большие дозы антацидов. При приеме внутрь неко-
торых антибиотиков (тетрациклинов, эритромицина и др.) может тормо-
зиться метаболизация дигоксина бактериальной флорой кишечника и повы-
шаться его содержание в крови на 10—40 %. Фенобарбитал и рифампицин,
повышая активность микросомальных ферментов в печени, ускоряют инак-
тивацию дигитоксина, что требует увеличения его дозировки. Благодаря
уменьшению секреции дигоксина в почечных канальцах, хинидин, вера-
памил и в меньшей степени спиронолактон приводят к увеличению его
533
Влияние симпатомиметических аминов
на адренергические рецепторы
Препарат Адренорецепторы
Норадреналин Адреналин Изопротеренол Допамин: <Хр<х2,РрР2 “i’a2> ₽1>Р2 Р„Р2
малые дозы средние дозы большие дозы Добутамин Леводопа Преналтерол Пирбутерол Сальбутамол Допаминергические допаминергические ар р, (допаминергические ±) ₽,<«!*) Рр допаминергические Pi Р. Р2
концентрации в крови. Это требует уменьшения дозировки препарата (при
сочетании с хинидином — на 50 %, верапамилом - на 40 %). Подобный
эффект, механизм которого неясен, дает и амиодарон.
Симпатомиметические амины являются мощными инотропными агента-
ми, которые используют при плохо поддающейся лечению сердечной недо-
статочности, больше острой (инфаркт миокарда, затянувшийся отек лег-
ких, кардиогенный шок, ранний послеоперационный период после кардио-
хирургических операций). В зависимости от степени ее обратимости препара-
ты оказывают более или менее выраженное положительное действие на ге-
модинамику, однако далеко не всегда способны улучшать выживаемость
больных.
В основе их прямых (терапевтических) и побочных эффектов лежит сти-
муляция адренергических рецепторов: р,-рецепторов сердца, а- и Р2-рецеп-
торов периферических сосудов, а также особых допаминергических рецепто-
ров почечного и брыжеечного сосудистых бассейнов. При взаимодействии
агониста с р-рецепторами происходит активация аденилатциклазы клеточ-
ной мембраны, что приводит к увеличению синтеза цАМФ в эффекторной
клетке и посредством цАМФ-зависимой протеинкиназы вызывает физиоло-
гический ответ. Взаимодействие адреностимулятора с а-адренорецептором
приводит к повышению тока Са2+ внутрь клетки.
Действие симпатомиметических аминов на сердечно-сосудистую систему
зависит главным образом от того, с какими рецепторами они взаимодей-
ствуют. Это в значительной степени определяет характер вызываемых ими
изменений ЧСС, сократимости, ОПСС и кровотока во внутренних органах.
Некоторое влияние оказывают также состояние гемодинамики в это время,
а также количество рецепторов, с которыми происходит взаимодействие. Так,
при хронической сердечной недостаточности количество р-адренорецепто-
ров в сердце уменьшается, а при тиреотоксикозе увеличивается.
За исключением сальбутамола и малых доз допамина, которые применя-
ют в целях периферической вазодилатации или избирательного расширения
почечных сосудов, симпатомиметические амины используют главным обра-
534
Средние дозы симпатомиметических аминов
при внутривенном капельном введении
Препарат Доза, мкг/кг/мин
Норадреналин 0,01-0,07
Адреналин 0,06-0,18
Изопротеренол 0,02-0,18
Допамин:
допаминергический (мочегонный) 1-5
эффект
^-эффект 5-15
a+0-эффекты > 15
Добугамин 2-40
Преналтерол 10-20
Сальбутамол 0,2-0,5
зом для повышения инотропного состояния миокарда. В большинстве случа-
ев при этом достигается повышение АД в результате либо улучшения насос-
ной функции сердца, либо периферической вазоконстрикции, что менее
желательно. Благодаря этому симпатомиметические средства находят широ-
кое применение при лечении шока. Исключение составляет изопротеренол
(изадрин), оказывающий вазодилатирующее действие.
Повышение сократительной способности миокарда, вызываемое симпато-
миметическими аминами, в большинстве случаев сопровождается тахикар-
дией, обусловленной стимуляцией Pj -адренорецепторов. Она особенно выра-
жена при применении изопротеренола, так как усугубляется за счет бароре-
цепторного рефлекса вследствие периферической вазодилатации. Вызываемое
норадреналином повышение АД сопровождается менее выраженной тахикар-
дией, так как ей препятствует рефлекторное угнетение синоатриального узла.
К серьезным неблагоприятным эффектам относятся также аритмогенное дей-
ствие из-за увеличения возбудимости миокарда и увеличение его потребно-
сти в кислороде вследствие повышения инотропизма, ЧСС и постнагрузки. В
условиях ограниченного расширительного резерва коронарных артерий при
ИБС и уменьшения доставки кислорода из-за тахикардии это может приво-
дить к усугублению ишемии миокарда. Такой эффект нивелируется при сни-
жении КДД и КДО желудочка, а следовательно, его преднагрузки в резуль-
тате улучшения его систолического опорожнения.
Данные о характере влияния основных симпатомиметических аминов,
используемых для лечения сердечной недостаточности, на гемодинамику
представлены в табл. 58. Из-за очень короткой продолжительности действия
их назначают путем непрерывной внутривенной капельной инфузии.
Норадреналин вызывает преимущественно а -адреностимулирующий
эффект путем сужения артериол и вен. В сочетании с менее выраженным
положительным инотропным действием это приводит к значительному по-
вышению АД, в то время как МОС обычно уменьшается. Вследствие сни-
жения периферического кровотока, в том числе почечного и мышечного,
длительное введение норадреналина гидротартрата может вызывать
535
Таблица 58. Характер влияния основных симпатомиметических аминов на гемодинамику
Препарат ЧСС Сокра- тимость миокар- да ОПСС АД МОС Потреб- ность миокар- да в Oj Перфу- зионное давление в коро- нарных артериях
Норадреналин 0 ттт ттт ттт 1 ттт ттт
Изопротеренол ттт тт II 1 тт тт т
Допамин, средние дозы тт тт 1 т тт тт т
Допамин, большие дозы тт ттт тт ттт ттт ттт тт
Добугамин тт ттт 1 т ттт тт тт
Преналтерол, пирбугерол ТТ тт 0 тт тт тт тт
Сальбутамол тт 0 II II тт 1 II
Примечание. 1 — увеличение, 1 - уменьшение показателя.
необратимые нарушения микроциркуляции и некрозы в тканях. Одновре-
менно повышая постнагрузку, преднагрузку и сократимость миокарда, пре-
парат приводит к резкому увеличению потребности миокарда в кислороде.
При нарушении насосной функции желудочка он может усугублять повы-
шение его КДД и вызывать отек легких. Таким образом, при сердечной не-
достаточности норадреналин может оказывать неблагоприятное действие на
гемодинамику, и поэтому у таких больных его используют очень редко,
главным образом в сочетании с другими симпатомиметическими препарата-
ми при необходимости повысить ОПСС. Изолированно его можно приме-
нять в целях коррекции артериальной гипотензии, связанной с избыточной
вазодилатацией при неизмененном КДД в левом желудочке (12—15 мм рт.ст.)
и СИ не ниже 2,5 л/мин/м2, например, у ряда больных с септическим шо-
ком. При некорригированной гиповолемии норадреналин, как и другие ва-
зопрессорные препараты, вызывает ее усугубление вследствие преобладания
веноконстрикторного эффекта над сужением артериол, вследствие чего внут-
рисосудистая жидкость переходит в интерстициальное пространство.
Адреналин в отличие от норадреналина оказывает менее выраженное
вазоконстрикторное гипертензивное действие. В малых дозах оно практичес-
ки отсутствует и преобладает р]-эффект с повышением сократимости мио-
карда и ЧСС, что в ряде случаев сопровождается снижением ОПСС. В боль-
ших дозах a-эффект такой же, как у норадреналина, и происходит значи-
тельное уменьшение периферического, в том числе почечного, кровотока.
Неблагоприятным является также частое возникновение выраженной тахи-
кардии и аритмий. Вследствие этого адреналин, как и норадреналин, усту-
пает по своей эффективности другим симпатомиметическим аминам и для
лечения сердечной и сосудистой недостаточности в настоящее время прак-
тически не используется.
Изопротеренол (изадрин, новодрин). Непосредственным результа-
том его Pj-адреностимулирующего действия является повышение сократи-
мости, ЧСС и возбудимости миокарда и улучшение атриовентрикулярной
536
проводимости. Снижение диастолического АД и ОПСС за счет периферичес-
кого р2-адреностимулирующего эффекта приводит к еще большему увели-
чению МОС, снижению КД Д в левом желудочке и рефлекторным путем
усугубляет тахикардию. Одновременно снижается ЛСС. Среди всех симпато-
миметических аминов изопротеренол обладает наиболее выраженной спо-
собностью вызывать ишемию миокарда. Наряду со значительным повыше-
нием потребности в кислороде он вызывает уменьшение перфузии миокар-
да за счет снижения диастолического давления в аорте и тахикардии. В экспе-
рименте инфузия изопротеренола вызывает увеличение размеров инфаркта
миокарда. Учитывая эти обстоятельства, препарат не рекомендуют приме-
нять для лечения недостаточности кровообращения у больных с инфарктом
миокарда. Практически единственной его областью применения как кардио-
тонического средства является недостаточность кровообращения в сочета-
нии с брадикардией, особенно неотложная терапия блокад сердца с аритми-
ческим кардиогенным шоком.
Допамина гидрохлорид (допмин, дофамин, инотропин) — не-
посредственный предшественник норадреналина. Влияние на гемодинамику
зависит от дозы. Малые дозы (1-4 мкг/кг/мин) оказывают избирательное
действие на специфические допаминергические рецепторы почечных, а так-
же брыжеечных сосудов, что вызывает увеличение кровотока в этих бассей-
нах с повышением клубочковой фильтрации, натрийуреза и диуреза. Этот
эффект блокируется фенотиазидами и метоклопрамидом, но не р-адрено-
блокаторами!
В средних дозах (5—10 мкг/кг/мин) на первый план выступает сти-
муляция р, -адренорецепторов, что приводит к увеличению сократимости ми-
окарда и МОС и небольшому повышению АД- Последнее уменьшает выра-
женность хронотропной реакции. В результате улучшения опорожнения же-
лудочков уменьшаются КПД, преднагрузка и застой крови на путях притока.
В больших дозах (более 10 мкг/кг/мин) преобладает периферичес-
кий вазоконстрикторный эффект вследствие стимуляции «-адренорецепто-
ров, и характер изменений гемодинамики приобретает сходство с таковым
под действием норадреналина. Органный кровоток, в том числе почечный и
коронарный, снижается, а резкое увеличение ОПСС и АД, повышая пост-
нагрузку, оказывает неблагоприятное влияние на МОС и потребность мио-
карда в кислороде.
Преимуществами малых и средних доз допамина по сравнению с други-
ми симпатомиметическими препаратами являются способность улучшать
почечный и коронарный кровоток, меньший тахикардитический и аритмо-
генный эффекты, а также меньший риск усугубления ишемии миокарда.
Применяют при острой и хронической сердечной недостаточности и шоке,
особенно кардиогенном, для получения мочегонного эффекта и обеспече-
ния инотропной поддержки при синдроме низкого МОС. В последнем случае
его лучше назначать дополнительно к добутамину или амринону при
сохранении на фоне лечения этими препаратами артериальной гипотензии.
Такое сочетание обеспечивает аддитивный инотропный эффект. Допамин
537
противопоказан при гиповолемии и тахиаритмиях. Применяют его путем не-
прерывной инфузии, которую лучше проводить через центральную или дос-
таточно крупную вену и с помощью инфузионного насоса для большей
точности дозировки. Введение начинают с малых доз (2 мкг/кг/мин), по-
степенно увеличивая дозировку под тщательным контролем показателей ге-
модинамики, желательно с непосредственным изменением АД, КДД в ле-
вом желудочке или диастолического давления в легочной артерии и МОС.
Важно следить за цветом и температурой конечностей и наполнением ка-
пиллярного ложа для своевременного выявления периферического спазма.
Для его устранения можно вводить внутривенно а-адреноблокаторы (хлор-
промазин, фентоламин).
Добутамин (добутрекс) — производное изопротеренола. Является
одним из основных средств лечения рефрактерной сердечной недоста-
точности. Отличается избирательным р,-адреностимулирующим действи-
ем. Р2- и а-адренорецепторы активируются в минимальной степени. Сре-
ди вызываемых препаратом изменений гемодинамики наиболее выражено
повышение сократимости миокарда, которое приводит к увеличению МОС,
преимущественно за счет УОС, и уменьшению КДД и КДО левого желу-
дочка, давления в венах на путях притока, рефлекторной системной вазоди-
латации, снижению постнагрузки. АД обычно не изменяется, изредка, при
применении больших доз, за счет а-адреностимулирующего действия, не-
много повышается. К преимуществам препарата относятся и увеличение ко-
ронарного кровотока вследствие стимуляции р2-адренорецепторов коронар-
ных артерий, а также меньшее по сравнению с другими симпатомиметичес-
кими аминами повышение автоматизма синоатриального узла и ЧСС при
каждой данной величине прироста сократимости. Тахикардия может нарас-
тать рефлекторно при снижении КДД в левом желудочке до субнормальных
величин. Несмотря на уменьшение пред- и постнагрузки добутамин может
вызывать неблагоприятный сдвиг равновесия между потребностью миокар-
да в кислороде и его доставкой и ишемию миокарда, особенно у больных
ИБС при развитии тахикардии. Показан при сердечной недостаточности с
низким выбросом без артериальной гипотензии. Неблагоприятными эффек-
тами являются синусовая тахикардия, тахиаритмии и повышение АД. Про-
тивопоказан при гиповолемии и обструктивной гипертрофической кардио-
миопатии (идиопатическом гипертрофическом субаортальном стенозе). Пре-
парат не следует использовать при преимущественно диастолическом генезе
сердечной недостаточности или ее гиперкинетическом варианте. Назначают
путем непрерывной внутривенной капельной инфузии, начиная с 1—2 мкг/
кг/мин, постепенно увеличивая дозу до получения клинико-гемодинами-
ческого эффекта или появления выраженной тахикардии, эктопических арит-
мий. Доза более 15 мкг/кг/мин нежелательна. Инфузию следует проводить
под мониторным контролем показателей гемодинамики. Предварительно не-
обходимо убедиться в отсутствии дефицита ОЦП.
Показано, что при периодическом повторении инфузий добутамина в
течение 2—4 дней при рефрактерной хронической сердечной недостаточности
538
достигнутое клинико-гемодинамическое улучшение сохраняется в течение
нескольких недель и даже до 8—10 мес. Причина такого стойкого эффекта
остается неясной.
Преналтерол является сравнительно новым селективным р^аго-
нистом, который повышает сократимость миокарда без существенного
изменения ЧСС, что обусловлено увеличением систолического АД. По
сравнению с другими симпатомиметическими аминами обладает более
длительным действием и его можно применять внутрь. Способность пре-
парата повышать сниженный МОС показана как при остром инфаркте
миокарда, так и при хронической сердечной недостаточности, однако
его место в лечении таких больных пока не определено.
Пирбутерол оказывает на р, -адренорецепторы более выраженный сти-
мулирующий эффект, чем на Р2-адренорецепторы. Назначают в таблетках
внутрь. Сочетая положительное инотропное действие со свойствами артерио-
лярного вазодилататора, вызывает повышение УОС и МОС и снижение КДД
и “заклинивающего” давления в легочных капиллярах. Тахикардия обычно
не выражена.
Сальбутамол — селективный Р2-агонист. Широко используют при ле-
чении бронхиальной астмы. Вызывая периферическую вазодилатацию и сни-
жение ОПСС, облегчает изгнание крови из левого желудочка и уменьшает
КДО и КДД. Приводит к тахикардии вследствие стимуляции Р2-адреноре-
цепторов в миокарде и рефлекторно за счет систолической артериальной ги-
потензии. В итоге увеличение МОС сопровождается умеренным повышением
потребности миокарда в кислороде. Большая выраженность тахикардии, чем
при приеме периферических вазодилататоров, ограничивает применение саль-
бутамола при сердечной недостаточности.
Леводопа превращается в допамин путем декарбоксилирования после
приема внутрь и оказывает положительное клиническое и гемодинамиче-
ское действие в ряде случаев тяжелой сердечной недостаточности. Удобным
является возможность приема внутрь (по 1—2 г через 6 ч). Применение пре-
парата ограничено из-за развития тахикардии, которая может приводить к
усугублению ишемии миокарда, а также тошноты и рвоты.
Эффективность и безопасность длительного приема таблетированных
Р-агонистов при хронической сердечной недостаточности окончательно не
доказаны. Для всех симпатомиметических аминов характерно развитие толе-
рантности вследствие уменьшения количества их рецепторов в миокарде при
длительном применении. Существенным недостатком является также арит-
могенность и повышение риска внезапной смерти (S.Yusuf, К.Тео, 1990). Их
используют главным образом для кратковременной инотропной поддержки
в периоды ухудшения состояния больных.
Ингибиторы фосфодиэстеразы являются особой группой негликозидных
и несимпатомиметических препаратов с положительным инотропным дей-
ствием. В его основе лежит снижение активности фермента, расщепляющего
цАМФ, что приводит к увеличению ее содержания в клетках и в результате
— к возрастанию притока в них Са2+, торможению его захвата саркоплазма-
539
тическим ретикулумом и нивелировке отрицательного инотропного эффек-
та аденозина. Препараты оказывают также прямое действие на гладкую мус-
кулатуру сосудистой стенки, вызывая вазодилатацию. Влияние ингибиторов
фосфодиэстеразы на гемодинамику сходно с действием допамина. Они вы-
зывают увеличение МОС, ФВ, коронарного и почечного кровотока, сни-
жают КДД в желудочках и ОПСС.
Наибольшее распространение в клинике получил а м р и н о н, который
можно вводить внутривенно и принимать внутрь. Лечение начинают с введе-
ния 0,75 мкг/кг в виде болюса, после чего переходят к инфузии со скоростью
5—10 мкг/кг/мин. При одновременном назначении с вазодилататорами следует
соблюдать осторожность во избежание чрезмерной артериальной гипотензии.
Несмотря на дополнительное вазодилатирующее действие существенных пре-
имуществ амринона перед добугамином не обнаружено. Препарат применяют
главным образом в виде коротких курсов внутривенно при рефрактерной сер-
дечной недостаточности, не поддающейся лечению гликозидами, мочегон-
ными средствами и вазодилататорами, наблюдая хороший ближайший клинико-
гемодинамический эффект. При длительном приеме внутрь амринон не влияет
на выживаемость, а его более мощное по своему действию производное
милринон даже ухудшает ее (PROMISE-Prospective Randomized Milrinone
Survival Evaluation, M.Packer и соавт., 1991), по-видимому, вследствие увели-
чения подверженности фатальным аритмиям. Аритмогенность связана с раз-
витием следовых деполяризаций при повышении содержания внутриклеточного
Са2+.
Завершившиеся сравнительно недавно многоцентровые исследования об-
наружили ухудшение выживаемости больных с хронической сердечной не-
достаточностью различной степени выраженности при включении в амбула-
торное лечение, наряду с сердечными гликозидами и мочегонными сред-
ствами, нового ингибитора фосфодиэстеразы эноксимона (B.Uretsky и со-
авт., 1990). К побочным эффектам препаратов этой группы относятся также
ухудшение функции миокарда под влиянием накапливающегося при дли-
тельном приеме цАМФ, тромбоцитопения и диспептические явления (ам-
ринон). Учитывая эти обстоятельства, применение ингибиторов фосфодиэс-
теразы внутрь для длительного амбулаторного лечения сердечной недоста-
точности не рекомендуется.
[З-Адреноблокаторы. Рассматривая сердце при сердечной недостаточности
как “энергетически голодающий” орган, становится очевидным, что увели-
чение его инотропной функции влечет за собой повышение энергетических
запросов миокарда и прогрессирующую гибель клеток в условиях нарастаю-
щего энергодефицита. С этих позиций патогенетически обоснованным явля-
ется осторожное применение препаратов с отрицательным инотропным дей-
ствием в сочетании с периферическими вазодилататорами и мочегонными
средствами.
Нетрадиционный подход к лечению сердечной недостаточности с помо-
щью р-адреноблокаторов начал развиваться с середины 70-х годов, однако
до настоящего времени многие вопросы остаются неясными. До недавних
540
пор нарушение насосной функции сердца, особенно выраженное, принято
было относить к классическим противопоказаниям к назначению этих пре-
паратов. В настоящее время доказана способность р-адреноблокаторов в ин-
дивидуально подобранных дозировках уменьшать выраженность признаков
декомпенсации, приводить к положительным сдвигам показателей кардио-
гемодинамики и улучшать выживаемость больных даже при тяжелой застой-
ной сердечной недостаточности. Этот эффект обусловлен предупреждением
прогрессирования дисфункции миокарда вследствие уменьшения его энер-
гетических потребностей, повышения исходно сниженной плотности р-ад-
ренорецепторов и активности аденилатциклазного комплекса. Последнее про-
является восстановлением адекватного гемодинамического ответа на экзо-
и эндогенные симпатомиметические амины. Определенную роль играет так-
же антиишемическое и антиаритмическое действие препаратов и их способ-
ность предотвращать фибрилляцию желудочков, которая не всегда коррели-
рует с выраженностью противоаритмического эффекта.
Показания к назначению р-адреноблокаторов при сердечной недостаточ-
ности окончательно не разработаны. Основным из них является, по-види-
мому, стойкая синусовая тахикардия, как показатель выраженной дисрегу-
ляции симпатико-адреналовой системы. Предпочтительнее использовать кар-
диоселективные препараты, имеющие меньше побочных эффектов, напри-
мер, метопролол (спесикор). Начинать лечение следует с применения очень
малых доз, например, 5 мг метопролола 2 раза в сутки, медленно повышая
дозировку (так называемое титрование дозы). Хороший эффект р-адрено-
блокаторов отмечен при дилатационной кардиомиопатии, ИБС, “алкоголь-
ном сердце”. Возможно, он связан с их действием не столько на сердечную
недостаточность, сколько на основное заболевание. Этот вопрос пока оста-
ется открытым. Следует подчеркнуть, что несмотря на эти обнадеживающие
данные, применение p-адреноблокаторов как препаратов с отрицательным
инотропным эффектом при тяжелой сердечной недостаточности требует боль-
шой осторожности и целесообразно только у части больных.
Периферические вазодилататоры. Применение вазодилататоров при лече-
нии сердечной недостаточности основывается на свойственной ей чрезмер-
ной артериолярной и венозной вазоконстрикции вследствие “избыточно-
сти” компенсаторного повышения активности симпатико-адреналовой,
ренин-ангиотензин-алвдостероновой систем, антидиуретического гормона
и некоторых других гуморальных агентов в ответ на снижение МОС. Возра-
стание ОПСС в сочетании с увеличением объема желудочка вследствие на-
рушения его систолического опорожнения вызывает повышение постнаг-
рузки, что приводит к еще большему уменьшению выброса (рис. 72). Разом-
кнуть этот порочный круг и тем самым обеспечить повышение МОС помо-
гают вазодилататоры.
В зависимости от основного места действия (точки приложения) в сосудис-
той системе выделяют вазодилататоры венозные, артериолярные и смешанные
(венозные и артериолярные). Кроме того, различают также вазодилататоры по
механизму своего сосудорасширяющего эффекта (табл. 59, см. также главу 10).
541
Рис. 72. “Порочный круг” при сер-
дечной недостаточности: КТХА -
катехоламины
Инотропные
агенты
Венозные вазодила-
таторы (нитроглицерин,
нитраты, молсидомин), увели-
чивая емкость периферических
вен, приводят к перераспреде-
лению крови и ее перемеще-
нию из малого круга кровооб-
ращения в большой. В резуль-
тате уменьшения венозного
притока снижается КДД в же-
лудочках и давление в системных и легочных венах. Выраженность влияния
венозных вазодилататоров на показатели функции желудочка зависит от ее
исходного состояния, особенно уровня КДД. При исходно нормальном уров-
не КДД у здоровых лиц он уменьшается относительно мало, что сопровож-
дается резким снижением УОС и АД (рис. 73). Снижение УОС и АД до суб-
нормальных величин может иметь место и при начальной сердечной недо-
статочности с неизмененным давлением наполнения левого желудочка в
покое. Венозные вазодилататоры, как и мочегонные препараты, вызывают
наиболее выраженное снижение КДД, не приводя при этом к существенно-
му уменьшению УОС, только у больных, у которых основным проявлени-
ем сердечной недостаточности является венозный застой в легких при со-
храненном МОС и удовлетворительной перфузии тканей. Такой гемодина-
мический профиль служит показанием к изолированному назначению этих
препаратов. “Чистые” венозные вазодилататоры не показаны в случае норма-
лизации преднагрузки с помощью мочегонных препаратов или при гипово-
лемии (КДД менее 15 мм рт.ст.). При сердечной недостаточности, которая
проявляется одновременно венозным застоем в легких и снижением МОС,
венозные вазодилататоры лучше использовать в сочетании с артериолярными.
Артериолярные вазо-
дилататоры (гидралазин,
миноксидил), уменьшая ОПСС
и постнагрузку, приводят к
смещению кривой функции же-
лудочка кверху и влево и уве-
Рис. 73. Влияние венозных и арте-
риолярных периферических вазоди-
лататоров на функцию левого же-
лудочка у здоровых лиц (А) и у
больных с сердечной недостаточнос-
тью (Б). Г— гидралазин; Н~ нитро-
глицерин
Таблица 59. Основные точки приложения и механизмы действия вазодилататоров, используемых для
лечения сердечной недостаточности
Препараты Место действия Механизм действия
веиы артерии
Нитроглицерин, нитраты, молсидомин ++++ (+) Непосредственное расслабление гладкой мускулатуры сосудистой стенки
Натрия нитропруссид +++ ++++ То же
Гидралазин, миноксидил (+) ++++ «
Нифедипин, фелодипин, дилтиазем +++ Блокада медленных кальциевых каналов и уменьшение тока Са2+ в клетку
Фенголамин, празозин, тримазозин ++ ++ Блокада периферических а,- и (или) ^-адренорецепторов
Пенгамин, триметафан +++ ++ Блокада передачи импульсов в симпатических ганглиях
Каптоприл, эналаприл, лизиноприл ++ +++ Ингибиторы АПФ, уменьшают образование ангиотензина II из ангиотензина I
Сальбутамол, пирбутерол + + ++ Стимуляция периферических адренорецепторов
личению УОС. Выраженность этого эффекта, как и при использовании ве-
нозных вазодилататоров, зависит от исходной функции желудочка и опреде-
ляет характер изменения АД. Так, у здоровых лиц прирост УОС относитель-
но мал (см. рис. 73), вследствие чего происходит значительное снижение
АД, которое, как правило, сопровождается выраженной рефлекторной та-
хикардией. Такая же реакция наблюдается и у больных с начальной сердеч-
ной недостаточностью, характеризующейся снижением сократимости мио-
карда при неизмененной преднагрузке без венозного застоя в легких (см.
рис. 73). Наибольшее увеличение УОС достигается у больных с далеко за-
шедшей сердечной недостаточностью, протекающей с синдромом малого
выброса. Вследствие этого, несмотря на снижение ОПСС, АД не изменяет-
ся или лишь незначительно уменьшается.
Таким образом, выбор вазодилататора определяется характером измене-
ний гемодинамики — преимущественным увеличением КДД или снижени-
ем МОС при относительно малоизмененных других показателях. При тен-
денции к артериальной гипотензии препараты следует применять с осто-
рожностью. Хороший эффект может наблюдаться при их сочетании с поло-
жительными инотропными агентами.
Смешанные вазодилататоры (натрия нитропруссид, блокаторы
кальциевых каналов, периферические а-адреноблокаторы, ганглиоблокато-
ры, ингибиторы АПФ, р2-адреностимуляторы) действуют одновременно на
артериальные и венозные сосуды. При неизмененной функции левого желу-
дочка они вызывают снижение КД Д, УОС и АД (см. рис. 73). Такой же эффект
543
Таблица 60. Действие вазодилататоров на гемодинамику ври сердечной недостаточности
Вазодилататор ЦВД КДД, давление в легоч- ных венах ЛСС ОПСС АД МОС ЧСС
Венозный XXX XXX XX о, X 4. о, 4-.Т 0
Артериолярный о о, X X XXX 0,4. ??? ?
Смешанный XX XX XX XX о—XX ТГ о, Т
Примечание, f — увеличение, -L - уменьшение показателя.
отмечается при начальной сердечной недостаточности. Сочетая в себе луч-
шие свойства “чистых” венозных и артериолярных вазодилататоров, они
обеспечивают при выраженной дисфункции левого желудочка одновре-
менно существенное снижение КДД, давления в легочных венах и повы-
шение МОС при относительно небольшом уменьшении АД и рефлекторном
увеличении ЧСС (так называемые сбалансированные вазодилататоры). Вели-
чина результирующего изменения УОС определяется соотношением выра-
женности уменьшения КДО в результате расширения вен и снижения ОПСС
как следствие дилатации артериол.
Влияние различных вазодилататоров на гемодинамику у больных с сер-
дечной недостаточностью отражена в табл. 60.
Как известно, постнагрузка, то есть омс, является функцией не только
систолического давления, но и объема желудочка. В связи с этим “чистые”
венозные дилататоры, одновременно с уменьшением преднагрузки, вызы-
вают менее выраженное снижение постнагрузки за счет уменьшения объема
желудочка без изменения ОПСС. Подобным образом артериолярный вазо-
дилататор, вызывая увеличение УОС, приводит к более полному опорожне-
нию желудочка, а следовательно, к снижению его преднагрузки.
Важным достоинством вазодилататоров является их способность одно-
временно с увеличением МОС вызывать снижение потребности миокарда в
кислороде за счет уменьшения стеночного напряжения и оказывать тем са-
мым антиишемическое действие. Это выгодно отличает их от препаратов с
положительным инотропным действием, которые повышают МОС “ценой”
увеличения потребности миокарда в кислороде.
Вазодилататоры противопоказаны при преимущественно диастолической
сердечной недостаточности и нарушении наполнения желудочков (гипер-
трофическая кардиомиопатия, выраженный стеноз устья аорты, рестрик-
тивная кардиомиопатия, констриктивный перикардит и др.). В таких случаях
более или менее адекватный МОС обеспечивается значительным повыше-
нием давления наполнения желудочка и вследствие этого повышенной пред-
нагрузкой. Снижение постнагрузки также может приводить к выраженной
артериальной гипотензии, так как вазодилатация не сопровождается увели-
чением УОС.
При острой или тяжелой хронической сердечной недостаточности, требу-
ющей парентерального введения вазодилататоров и инотропных препаратов,
544
желательно проводить такое лечение в условиях инвазивного гемодинами-
ческого мониторинга с регистрацией давления в легочной артерии. В менее
тяжелых случаях следует тщательно контролировать АД и диурез, уменьше-
ние которых, а также увеличение ЧСС, могут указывать на неблагоприят-
ные эффекты вазодилататоров, прежде всего чрезмерное снижение пред-
нагрузки.
Нитраты наиболее эффективны при внутривенной инфузии у боль-
ных с острой левожелудочковой недостаточностью. Нитроглицерин для
внутривенного капельного введения является препаратом вы-
бора у больных ИБС благодаря своему дополнительному коронародилатиру-
ющему эффекту. Вследствие способности вызывать снижение УОС и артери-
альную гипотензию при нормальном уровне КД Д в левом желудочке за счет
уменьшения венозного притока к сердцу препарат долгое время считался
противопоказанным при остром инфаркте миокарда. В настоящее время эта
точка зрения пересмотрена, и при строгом соблюдении предосторожностей
внутривенная инфузия нитроглицерина находит широкое применение у та-
ких больных при развитии острой левожелудочковой недостаточности с по-
вышением КДД в левом желудочке или диастолического давления в легоч-
ной артерии более 20 мм рт.ст. Инфузию следует начинать с малых доз — 5-
10 мкг/мин — и постепенно увеличивать дозировку примерно на 3-5 мкг/
мин каждые 3—5 мин до получения желаемого гемодинамического эффекта
или снижения систолического АД ниже 90-100 мм рт.ст. Кроме измерения
АД и ЧСС, при инфузионной терапии нитратами рекомендуется проводить
мониторный контроль диастолического давления в легочной артерии или
“заклинивающего” давления в легочных капиллярах, которое стремятся сни-
зить до 18 мм рт.ст. Эффективная дозировка составляет в среднем 50 мкг/
мин, однако, поскольку чувствительность больных к нитроглицерину ко-
леблется в широких пределах, она иногда достигает 200—300 мкг/мин. В боль-
ших дозах препарат оказывает также артериолодилатирующее действие, ко-
торое при внутривенном введении выражено больше, чем при приеме под
язык или внутрь. При этом за счет снижения ОПСС и постнагрузки может
немного повышаться МОС. Благодаря короткому периоду полужизни (1-
3 мин) действие нитроглицерина заканчивается практически сразу же после
прекращения введения, что выгодно при развитии побочных эффектов. При
сердечной астме и отеке легких нитроглицерин назначают сублингвально по
1 таблетке каждые 15—20 мин.
Натрия нитропруссид применяют исключительно для внутривен-
ного капельного введения. Поскольку он является смешанным вазодилата-
тором, его используют преимущественно при сердечной недостаточности
вследствие артериальной гипертензии, митральной или аортальной регурги-
тации. При ИБС натрия нитропруссид может вызывать межкоронарное “об-
крадывание”, поэтому предпочтение отдают нитроглицерину, особенно при
остром инфаркте миокарда или нестабильной стенокардии. Инфузию начи-
нают с 10 мкг/мин, постепенно увеличивая дозу на 10 мкг/мин до дости-
жения желаемого снижения АД и КД Д в левом желудочке и повышения
545
МОС. Длительное введение натрия нитропруссида зачастую позволяет полу-
чить эффект в случаях сердечной недостаточности, рефрактерной к глико-
зидам и мочегонным препаратам. Максимальная доза обычно составляет 300—
400 мкг/мин. Следует остерегаться резкой артериальной гипотензии и не-
медленно уменьшить скорость или прекратить инфузию при снижении АД
ниже 90 мм рт.ст. или более чем на 30 мм рт.ст. от исходного уровня. При
умеренном снижении АД у больных с сердечной недостаточностью значи-
тельная тахикардия не развивается. Период полужизни препарата такой же,
как у нитроглицерина. При длительном, в течение нескольких дней, приме-
нении возможны проявления токсического действия метаболита натрия нит-
ропруссида тиоцианата, выведение которого осуществляется почками и на-
рушается при почечной недостаточности. Во избежание этого в таких случаях
лучше использовать нитроглицерин. Интоксикация этим производным циа-
нида проявляется нарушением сознания, судорогами, болью в животе, тош-
нотой, гиперрефлексией и сопровождается повышением содержания тиоци-
аната в сыворотке крови, что имеет диагностическое значение.
Непрерывное внутривенное капельное введение препаратов нитроглице-
рина продолжают обычно в течение 48—72 ч, изредка — до 7 сут. После дос-
тижения стойкого эффекта переходят на прием вазодилататоров внутрь. Дли-
тельная пероральная терапия этими препаратами показана также в случаях
хронической сердечной недостаточности, не поддающейся лечению глико-
зидами и мочегонными средствами.
Эффективность длительного непрерывного приема внутрь нит-
ратов относительно невелика. Доказано отсутствие существенной динамики
толерантности к физической нагрузке и улучшения выживаемости больных.
Это обусловлено невысокой гемодинамической эффективностью снижения
преднагрузки, отсутствием в большинстве случаев увеличения МОС, разви-
тием венозного стаза и задержки жидкости. Определенное значение имеет и
развитие толерантности к нитратам, которая возникает уже через 7—10 дней
регулярного лечения. В связи с этим применение венозных вазодилататоров
для лечения хронической сердечной недостаточности имеет смысл главным
образом при их сочетании с артериолярными или ингибиторами АПФ.
Среди препаратов нитроглицерина и нитратов в настоящее время наи-
большее распространение получили изосорбида динитрат (нитросорбид), пре-
параты депо-нитроглицеринаи накожный нитроглицерин. Изосорбида
динитрат назначают по 10-40 мгвнутрь или по 5—15 мгсублингвально
3 раза в сутки, а препараты депо-нитроглицерина - по 6,5—9 мг
внутрь 2—3 раза в сутки. Такое увеличение интервала между приемами при
продолжительности действия препаратов 4—6 ч позволяет в какой-то мере
предотвратить развитие толерантности и тахифалаксии.
Нитроглицерин накожно применяют в области груди или живо-
та. Он особенно удобен при применении на ночь для предотвращения парок-
сизмальной ночной одышки, так как продолжительность действия мази со-
ставляет 3-6 ч, а аппликации - 8-12 ч. Во избежание тахифилаксии и толе-
рантности в дневное время желательно делать перерыв.
546
Венозный вазодилататор молсидомин (корватон, сиднофарм), хотя
и не вызывает развития толерантности, по своим клиническим и гемодина-
мическим эффектам при коротком и длительном приеме не отличается от
нитратов.
Гидралазин (апрессин) вызывает выраженное снижение постнагруз-
ки и увеличение МОС, поэтому особенно эффективен у больных с мит-
ральной и аортальной регургитацией, так как, уменьшая сопротивление из-
гнанию крови в аорту, обеспечивает уменьшение обратного тока и увеличе-
ние эффективного МОС. Несмотря на это он, как и нитраты, не вызывает
существенного повышения толерантности к физической нагрузке, что, по-
видимому, связано с расширением сосудов неработающих мышц. Недостат-
ком гидралазина является способность вторично активировать симпатико-
адреналовую и ренин-ангиотензин-альдостероновую системы. Развивающи-
еся при этом тахикардия и повышение скорости нарастания внутрижелудоч-
кового давления могут приводить к повышению потребности миокарда в
кислороде. Это обусловливает необходимость соблюдения осторожности при
применении препарата у больных ИБС и нежелательность его назначения
при остром инфаркте миокарда и нестабильной стенокардии. Существует
точка зрения о том, что в таких случаях гидралазин противопоказан. К воз-
можным побочным эффектам относятся также электрическая нестабильность
миокарда, головная боль, задержка Na+ и воды, тошнота, рвота и развитие
толерантности. Лечение начинают с назначения 25 мг 3—4 раза в сутки с
постепенным увеличением дозы. Для достижения гемодинамического эф-
фекта в большинстве случаев требуется более 200 мг препарата в сутки (75 мг
4 раза в сутки и более). Однако длительный прием таких больших доз неже-
лателен ввиду опасности развития синдрома лекарственной системной крас-
ной волчанки. Он возникает у 10—15 % больных и обычно подвергается пол-
ному обратному развитию после отмены препарата.
Клинический и гемодинамический эффекты гидралазина значительно
усиливаются при сочетании его с нитратами. В таких случаях его действие
приближается к таковому натрия нитропруссида. Показано существенное (на
34 %) улучшение выживаемости больных с умеренной хронической сердеч-
ной недостаточностью (II-III класс NYHA) при длительном (до 3 лет) ле-
чении гидралазином и изосорбида динитратом на фоне одних и тех же доз
мочегонных препаратов и сердечных гликозидов по сравнению с примене-
нием плацебо и празозина (V-HeFT-I, Vasodilatator Heart Failure Trial-],
J.Cohn и соавт., 1986).
Следует отметить, что летальность при приеме празозина не отличалась
от таковой при использовании плацебо. Это кооперативное исследование ад-
министрации Госпиталя Ветеранов США впервые убедительно продемонст-
рировало возможность улучшения прогноза у больных с застойной сердеч-
ной недостаточностью с помощью медикаментозной терапии.
Значительный прогресс в лечении острой и хронической сердечной недо-
статочности связан с появлением ингибиторов АПФ. В основе дей-
ствия этих сбалансированных артериолярных и венозных вазодилататоров
18*
547
лежит уменьшение образования ангиотензина II, что вызывает снижение
ОПСС и уменьшение продукции альдостерона, приводящее к снижению
преднагрузки и препятствующие гипокалиемии. В результате происходит по-
вышение СИ, уменьшение КДД и КДО левого желудочка, улучшение по-
чечного кровотока и диуреза. Существенным преимуществом перед другими
вазодилататорами является отсутствие рефлекторной тахикардии. Изредка воз-
можно развитие гиперкалиемии, обратимого ухудшения азотовыделитель-
ной функции почек и в единичных случаях, при применении больших доз,
— нефропатии вследствие иммунного поражения клубочковой мембраны и
агранулоцитоза. Это обусловливает необходимость контроля лейкоцитоза,
уровня калия, мочевины и креатинина в крови, а также протеинурии в
процессе лечения.
Первый пероральный ингибитор АПФ каптоприл (капотен) назна-
чают, начиная с 6,25 мг 3 раза в сутки. Максимальный ингибирующий эф-
фект в отношении АПФ достигается в дозе 25 мг 4 раза в сутки. Это обуслов-
ливает нецелесообразность применения более высоких доз при лечении сер-
дечной недостаточности. Препараты второго поколения эналаприл и ли-
зиноприл обладают большей силой и продолжительностью действия (от
12 до 24 ч), а также меньшими побочными эффектами. Эналаприл назнача-
ют, начиная с 2,5—5 мг 1 раз в сутки, а максимальная доза составляет 12—
20 мг дважды. В ряде многоцентровых двойных слепых исследований пока-
зана способность этого препарата на фоне стандартного лечения гликозида-
ми и мочегонными средствами существенно уменьшать летальность среди
больных с хронической сердечной недостаточностью как II—III, так и IV
класса NYHA в течение периода наблюдения (6 мес — 4 года) по сравнению
с плацебо (CONSENSUS — The Cooperative North Scandinavian Enalapril
Survival Study, 1987; SOLVD - The Studies of Left Ventricular Dysfunction,
1991).
Выживаемость больных с хронической сердечной недостаточностью II—
III класса NYHA, получавших эналаприл, оказалась более высокой, чем
принимавших гидралазин в сочетании с изосорбида динитратом (V-HeFT—
II, 1991). К концу 2-летнего периода лечения летальность в этой группе
больных оказалась ниже на 25 %, что было связано главным образом с умень-
шением частоты внезапной смерти. Следует отметить, что последнее было
наибольшим у больных с наименее выраженными клиническими проявле-
ниями сердечной недостаточности (J.Cohn и соавт., 1991). Эти исследования
доказывают преимущества ингибиторов АПФ перед другими вазодилатато-
рами, а также сердечными гликозидами при лечении сердечной недостаточ-
ности, как тяжелой, так и начальных стадий. Способность этих препаратов
улучшать прогноз связана с их непосредственным благоприятным влияни-
ем на повышенную активность ренин-ангиотензин-альдостероновой систе-
мы и косвенным ингибирующим действием на симпатико-адреналовую си-
стему. Полагают также, что важное значение имеет и местное уменьшение
образования ангиотензина II в миокарде и гладкой мускулатуре стенки артери-
альных сосудов различных бассейнов. Следствием этого является увеличение
548
кровотока в работающих мышцах и почках, что обеспечивает повышение
толерантности больных к физической нагрузке.
Блокаторы кальциевых каналов нифедипин и близкие ему по
действию фелодипин, никардипин и низолдипин являются преимуществен-
но артериолярными вазодилататорами. За счет снижения ОПСС и постнаг-
рузки они вызывают повышение МОС, несмотря на определенный отрица-
тельный инотропный эффект. В связи с отсутствием существенного веноди-
латируюшего действия они не оказывают заметного влияния на КДД в ле-
вом желудочке, давление в легочных капиллярах и ЦВД. Недостатком этих
препаратов является вторичная активация симпатической части вегетатив-
ной нервной системы с повышением содержания катехоламинов в крови, а
также ренин-ангиотензин-альдостероновой системы, что часто требует уве-
личения дозы мочегонных средств. Как и гидралазин, они наиболее показа-
ны при сердечной недостаточности у больных с артериальной гипертензией
и недостаточностью митрального и аортального клапанов, но уступают ему
по выраженности клинического эффекта. Единственным преимуществом
нифедипина и близких ему блокаторов кальциевых каналов перед гидрала-
зином является антиишемическое действие. Вследствие этого основным по-
казанием к их применению у таких больных является сердечная недостаточ-
ность, обусловленная ИБС. Благоприятное действие блокаторов кальциевых
каналов в определенной мере может быть связано также с предотвращением
вторичного повреждения миокарда из-за перегрузки Са2+ и энергосберегаю-
щим эффектом. Несмотря на это препараты не оказывают никакого влияния
на показатели выживаемости больных. В связи с возможным снижением на-
сосной функции сердца существует мнение о целесообразности их примене-
ния только при мягкой хронической сердечной недостаточности вследствие
ИБС с относительно умеренными изменениями ФВ и других показателей
кардиогемодинамики. Начальная доза нифедипина составляет 10 мг внутрь
через 6-8 ч. При хорошей переносимости она может быть увеличена до 40 мг
4 раза в сутки. Что касается верапамила, то он является средством выбора в
относительно редких случаях диастолической сердечной недостаточности у
больных с неизмененным МОС, например, при гипертрофической кардио-
миопатии.
а,-Адреноблокаторы празозин и тримазозин, будучи сбалансиро-
ванными артериолярными и венозными вазодилататорами, у больных с сер-
дечной недостаточностью способны увеличивать МОС и одновременно умень-
шать КДД в левом желудочке, легочную гипертензию и давление в правом
предсердии. В связи с тем что по своим гемодинамическому и клиническому
эффектам они значительно уступают ингибиторам АПФ и комбинации гидра-
лазина с изосорбида динитратом, а также ранним развитием толерантности,
в настоящее время их используют мало. Начальная доза празозина — 1 мг
внутрь на ночь, затем его назначают по 2—5 мг 4 раза в сутки, максималь-
ная доза — 10 мг 4 раза в сутки. Побочные явления описаны в главе 10.
Ганглиоблокаторы триметафан (арфонад) и пентамин вводят
внутривенно капельно. Они вызывают одновременно уменьшение венозного
549
возврата, давления наполнения левого желудочка и АД, что требует тща-
тельного контроля.
Сальбутамол оказывает действие, сходное с гидралазином, то есть
уменьшает ОПСС и увеличивает МОС при малоизмененном давлении в легоч-
ных капиллярах. Недостатком является выраженный тахикардитический
эффект.
В целом периферические вазодилататоры относятся к вспомогательным
средствам лечения сердечной недостаточности, которые ни в коей мере не
способны заменить сердечные гликозиды и мочегонные препараты, а лишь
дополняют их действие. Их место в лечении таких больных в определенной
мере зависит от причины и механизма сердечной недостаточности. Так, ва-
зодилататоры наиболее эффективны при систолической дисфункции в слу-
чаях артериальной гипертензии, регургитации на митральном или аорталь-
ном клапанах, острого инфаркта миокарда и других форм ИБС. При ИБС их
следует применять осторожно, так как резкое снижение АД может вызвать
значительное уменьшение перфузионного давления в коронарных артериях
и коронарного кровотока. То же касается и значительной аортальной недо-
статочности. При стенозах клапанов и других заболеваниях с выраженной
гипертрофией левого желудочка при умеренном снижении МОС вазодилата-
торы могут приводить к его усугублению. В основе нарушения насосной фун-
кции сердца у таких больных лежит повышение жесткости желудочка, и они
нуждаются в более высоком КДД для обеспечения адекватного УОС.
Антиаритмическая терапия. Тахи- и брадисистолические аритмии явля-
ются частым осложнением сердечной недостаточности и подчас значитель-
но усугубляют нарушения гемодинамики, вызывая еще большее снижение
МОС и повышение давления на путях притока, а сложные желудочковые
аритмии считаются триггерами внезапной смерти.
Способностью провоцировать усугубление электрической нестабильно-
сти сердца обладают положительные инотропные агенты и мочегонные пре-
параты, которые широко используются при лечении сердечной недостаточ-
ности. Интересно, что улучшение состояния гемодинамики с помощью ва-
зодилататоров не оказывает существенного влияния на частоту желудочко-
вых аритмий.
Учитывая значительную распространенность высокостепенных желудоч-
ковых аритмий и отсутствие надежных предикторов внезапной смерти по
данным специальных исследований, ряд авторов высказывают мнение, что
все больные с застойной сердечной недостаточностью, особенно выражен-
ной, нуждаются в длительном превентивном антиаритмическом лечении.
Основная проблема при применении антиаритмических препаратов при
сердечной недостаточности связана с их кардиодепрессивным действием
(кроме гликозидов), что обусловливает необходимость гемодинамического
контроля.
В лечении аритмий у таких больных особенно эффективен амиода-
рон, что обусловлено его благоприятным гемодинамическим профилем и
модулирующим влиянием на метаболические триггеры аритмий. В отличие
550
от большинства других антиаритмических препаратов, несмотря на свои анти-
адренергические свойства, амиодарон практически не дает отрицательного
инотропного эффекта и не вызывает снижение УОС и ФВ, даже у больных с
выраженной застойной сердечной недостаточностью. Это объясняется его
способностью уменьшать ОПСС и постнагрузку левого желудочка, а также
оказывать антиишемическое действие благодаря увеличению коронарного
кровотока путем прямого расширения коронарных артерий и уменьшения
потребности миокарда в кислороде. Особенно ценным при застойной сердеч-
ной недостаточности является тормозящее влияние на ренин-ангиотензин-
альдостероновую и симпатико-адреналовую системы как результат анти-
адренергической и антитиреоидной активности препарата, так как именно с
этим связывают возможность улучшения прогноза у таких больных. Это по-
лучило подтверждение в результате завершившегося недавно проспектив-
ного многоцентрового плацебоконтролируемого Аргентинского исследова-
ния эффективности амиодарона при застойной сердечной недостаточности
GESICA (Grupo de Estudio de la Sobrevida en la Insuficiencia Cardiaca en Argentina).
Оно охватывало 516 больных с сердечной недостаточностью II—IV класса
NYHA различного генеза вне зависимости от наличия желудочковых арит-
мий. Прием малых доз амиодарона (200-400 мг в сутки) в течение 2 лет
способствовал существенному снижению как числа случаев внезапной смерти
(на 27 %), так и смерти от прогрессирующей сердечной недостаточности (на
23 %), а также частоты повторных госпитализаций по поводу нарастания
декомпенсации (на 31 %, H.Doval и соавт., 1994).
Окончательный ответ на вопрос об эффективности амиодарона в отно-
шении предотвращения внезапной смерти и улучшения выживаемости боль-
ных с застойной сердечной недостаточностью, сопровождающейся бессимп-
томными желудочковыми аритмиями и протекающей без нарушения ритма,
возможно, будет получен при завершении более репрезентативных между-
народных проектов — Европейского исследования EMIAT у перенесших ин-
фаркт миокарда с ФВ менее 40 % (A.Camm и соавт., 1993) и исследования
администрации Госпиталя Ветеранов США больных с хронической сердеч-
ной недостаточностью различного генеза (W.Stevenson и соавт., 1993).
Применение дизопирамида нежелательно из-за выраженных кардиодеп-
рессивных свойств, а хинидина, мексилетина, энкаинида и флекаинида — в
связи с усугублением их проаритмического эффекта при наличии дисфунк-
ции левого желудочка. Назначение этих препаратов целесообразно только
при симптоматической желудочковой тахикардии, резистентной к другим
лекарственным средствам. Доказано улучшение выживаемости больных II и
III классов NYHA с желудочковыми тахиаритмиями после имплантации ав-
томатического дефибриллятора - кардиовертера.
Антикоагулянты. Дилатация полостей сердца и замедление периферического
кровотока, особенно выраженное у больных с массивными отеками нижних
конечностей, а также длительное соблюдение постельного режима предрас-
полагают к образованию тромбов в периферических венах и полостях сердца
и тромбоэмболиям в сосуды малого и большого кругов кровообращения. Таким
551
больным показано профилактическое назначение малых доз гепарина с пос-
ледующим переходом на антикоагулянты непрямого действия. Их примене-
ние, однако, требует большой осторожности в случаях печеночной недоста-
точности вследствие развития фиброза печени.
В весьма распространенных случаях развития сердечной недостаточности
вследствие ИБС следует решать вопрос о показаниях к хирургической ревас-
куляризации миокарда. Так, у части больных миокард в бассейне значитель-
но суженной коронарной артерии может находиться в так называемом со-
стоянии гибернации, сохраняя свою жизнеспособность путем значительно-
го снижения уровня обменных процессов и сократимости соответственно
ограниченной доставке кислорода. После реваскуляризации такой миокард
способен в большей или меньшей степени восстанавливать свою сократи-
мость, приводя ее в соответствие возросшему уровню поступления кислоро-
да и питательных веществ. Эффект гибернации подтверждается многочис-
ленными наблюдениями улучшения сегментарной и общей фракции выб-
роса левого желудочка после аортокоронарного шунтирования и ангиоплас-
тики. Оценить обратимость ишемической дисфункции у таких больных по-
зволяет эхокардиографическая проба с введением добутамина.
Установлено, что хирургическая реваскуляризация миокарда дает наи-
больший эффект в отношении улучшения функции левого желудочка и про-
гноза сердечной недостаточности у пациентов с клинически значимой сте-
нокардией напряжения и покоя. У перенесших инфаркт миокарда без при-
ступов стенокардии ее эффект значительно меньше, и показания к опера-
ции определяются в каждом случае индивидуально с учетом наличия и вы-
раженности ишемии при нагрузочном тестировании и результатов корона-
рографии.
Этапность лечения хронической сердечной недостаточности. Течение хро-
нической сердечной недостаточности редко бывает неуклонно прогрессиру-
ющим. Обычно периоды ухудшения чередуются с восстановлением более
или менее полной компенсации после устранения провоцирующего фактора
и усиления лечения.
Лечение начинают с проведения общих мероприятий — ограниче-
ния физической активности и соли. Медикаментозное лечение включает не-
сколько этапов:
I этап — мочегонные препараты. В настоящее время мочегон-
ные препараты принято считать “средствами первой линии” медикаментоз-
ной терапии хронической сердечной недостаточности. Рекомендуется следую-
щая этапность в их назначении: а) тиазидовый диуретик в малой дозе; б) уве-
личение его дозы под контролем содержания К+ в плазме крови, при гипо-
калиемии — добавление калийсберегающего диуретика (обычно триамтерена
или амилорида); в) фуросемид или другой петлевой диуретик в сравнитель-
но малой дозе; г) увеличение дозы, при необходимости сочетание с калийсбе-
регающим диуретиком; д) комбинация петлевого диуретика с тиазидовым
и, по показаниям, с калийсберегающим; е) при выраженных отеках и (или)
олигурии — фуросемид парентерально до 500 и даже 1000 мг в сутки, в со-
552
четании с малыми (мочегонными) дозами допамина внутривенно капельно
непрерывно в течение 48 ч — 7 сут с последующим перерывом.
II этап — сердечные гл и коз ид ы. Единой установки относи-
тельно их места в этапности лечения хронической сердечной недостаточно-
сти не существует. Наиболее распространенными точками зрения являются
следующие:
1) гликозиды — препараты I ряда, с которых следует начинать медика-
ментозную терапию при появлении первых признаков сердечной недоста-
точности. Эта установка бесспорна при сопутствующей мерцательной арит-
мии, а также в ряде случаев синусового ритма (главным образом в США и
Германии);
2) у больных с синусовым ритмом гликозиды являются препаратами II
ряда, которые добавляют к мочегонным средствам при неэффективности
малых доз фуросемида. Эта точка зрения имеет много сторонников среди
ведущих специалистов США;
3) при сохранении синусового ритма гликозиды назначают только в слу-
чаях тяжелой сердечной недостаточности, не поддающейся лечению петле-
выми диуретиками и ингибиторами АПФ. Такой подход распространен в
частности, в Великобритании.
III этап — ингибиторы А П Ф. Этим препаратам в настоящее время
отдают предпочтение перед другими вазодилататорами благодаря большей
эффективности, отсутствию толерантности и менее выраженному побочно-
му действию. Их назначают дополнительно к мочегонным средствам в тех
случаях, когда необходимо прибегать к приему больших доз. В последние
годы изучается целесообразность их более раннего назначения, до примене-
ния мочегонных средств и сердечных гликозидов, как медикаментозной те-
рапии “первого ряда”. Окончательные доказательства эффективности такого
подхода пока не получены.
IV этап — нитраты. При выраженном застое в малом круге крово-
обращения ингибиторы АПФ сочетают с нитратами для приема внутрь или
внутривенного капельного введения, которые применяют короткими кур-
сами или с большими интервалами между приемами во избежание развития
толерантности. При подверженности приступам пароксизмальной ночной
одышки и сердечной астмы нитраты назначают на ночь, часто в виде аппли-
кации на кожу.
V этап — кратковременная инотропная поддержка. Вэтих
целях используют повторные короткие курсы непрерывной инфузии добута-
мина или амринона, которые позволяют подучить временное облегчение.
VI этап. При резистентности к мочегонным препаратам в качестве средств
симптоматического лечения используют также парацентез, торакоцентез,
ультрафильтрацию, диализ и другие немедикаментозные методы
уменьшения ОЦП. Торакоцентез позволяет также уменьшить выражен-
ность рестриктивной дыхательной недостаточности, свойственной сердечной
недостаточности. За один прием следует удалять не более 1500 мл жидкости,
553
Показания к дифференцированному применению различных средств лечения сердечной
недостаточности в зависимости от их влияния на ее основные патофизиологические
механизмы
Средство лечения
Ограничение физической активности
Ограничение соли в пище
Мочегонные препараты
Положительные инотропные агенты
Периферические вазодилататоры
(кроме ингибиторов АПФ)
Ингибиторы АПФ
Верапамил и дилтиазем
Р-Адреноблокаторы
Антиаритмические средства, имплан-
тация автоматического дефибриллято-
ра - кардиовертера
Антикоагулянты
Трансплантация сердца
Патофизиологический эффект
Неспецифический эффект
То же
И
Уменьшение систолической дисфункции
Преимущественно уменьшение систоличес-
кой дисфункции
Уменьшение как систолической, так и ди-
астолической дисфункции
Уменьшение диастолической дисфункции
Уменьшение диастолической дисфункции и,
возможно, в ряде случаев — и систолической
Неспецифический эффект
То же
и
иначе ее быстрый переход из сосудистого русла в плевральную и брюшную
полости может вызвать резкое снижение УОС.
Следует отметить, что традиционное лечение, эффективное при сис-
толической дисфункции миокарда, оказывается значительно менее дей-
ственным в случаях преимущественного нарушения диастолической фун-
кции. У таких больных положительные инотропные агенты неэффектив-
ны, а уменьшение преднагрузки может ухудшать наполнение желудочков
сердца. Определенные возможности в отношении коррекции диастолической
дисфункции открывают следующие подходы:
а) улучшение активного диастолического расслабления миокарда: непос-
редственное (верапамил, дилтиазем) или за счет уменьшения ишемии (бло-
каторы кальциевых каналов, р-адреноблокаторы);
б) уменьшение пассивной жесткости миокарда путем предотвращения
развития интерстициального фиброза или его регресса (ингибиторы АПФ);
в) уменьшение жесткости камеры желудочка за счет обратного развития
или предотвращения гипертрофии кардиомиоцитов (ингибиторы АПФ, бло-
каторы кальциевых каналов);
г) увеличение продолжительности диастолического наполнения и особенно
— времени систолы предсердий (p-адреноблокаторы, верапамил, диалтиазем).
Подход к больному с рефрактерной сердечной недостаточностью. Рефрак-
терной считается сердечная недостаточность, не поддающаяся общеприня-
тому лечению. Ее лечение предусматривает следующую последовательность
действий:
1) исключение возможности нераспознанной ранее и потенциально об-
ратимой при хирургическом или специфическом терапевтическом лечении
причины сердечной недостаточности (например, инфекционного эндокар-
дита, “немого” стеноза устья аорты и др.);
554
2) поиск и коррекция потенцирующих ее факторов (повышение АД, арит-
мии, рецидивирующая ТЭВЛА и др.);
3) оценка возможности осложнений проводившейся ранее слишком
активной медикаментозной терапии и их коррекция. Примерами могут
быть стойкое снижение МОС с преренальной азотемией при применении
мощных петлевых диуретиков, нарушения ритма и изредка — усугубление
сердечной недостаточности как проявление интоксикации гликозидами;
4) коррекция нарушений электролитного обмена и КОС;
5) по показаниям — удаление транссудата из плевральной и брюшной
полостей;
6) активная терапия миокардиальной недостаточности путем непрерыв-
ной, в течение 4—7 сут, а иногда и дольше, внутривенной инфузии комби-
нации из вазодилататора (нитроглицерина или натрия нитропруссида), до-
памина в мочегонной дозе и кардиотонического препарата (добутамина или
амринона). Параллельно обычно эффективно назначение ингибиторов АПФ
внутрь.
При неэффективности этих мер, свидетельствующей о глубоком угнете-
нии сократительной способности миокарда, необходимо решать вопрос о
трансплантации сердца (см. ниже). Механическая поддержка насосной функ-
ции сердца с помощью внутриаортальной баллончиковой контрпульсации,
как правило, эффективна только во время ее проведения. В связи с этим она
рекомендуется в качестве временной меры для поддержания гемодинамики
на период подготовки к трансплантации сердца или другому хирургическо-
му вмешательству, направленному на устранение причинного или способ-
ствующего сердечной недостаточности фактора.
Лечение отека легких. Кардиальная астма и альвеолярный отек легких пред-
ставляют угрозу для жизни больного и требуют неотложной терапии. При
затянувшемся отеке легких лечение целесообразно проводить под контролем
измерения диастолического давления в легочной артерии или “легочных ка-
пиллярах” в динамике с помощью катетера Свана—Ганза, газового состава
артериальной крови, КОС, а также МОС методом термодилюции.
Неотложное лечение острой левожелудочковой недостаточности (кардио-
генного отека легких) направлено на решение следующих основных задач:
1) уменьшение венозного возврата крови к сердцу, и тем самым снижение
давления в левом предсердии и гидростатического давления в легочных ка-
пиллярах; 2) коррекцию нарушенного газообмена в легких; 3) купирование
бронхоспазма; 4) повышение сократимости миокарда; 5) устранение способ-
ствующих факторов.
1. Придание больному положения сидя со спущенными ногами обес-
печивает уменьшение венозного притока к сердцу и центрального объема
крови.
2. Морфина гидрохлорид. Благодаря быстроте и выраженности сво-
его эффекта является средством I ряда при купировании острой левожелу-
дочковой недостаточности. Этот эффект обусловлен несколькими фактора-
ми, к которым относятся: а) уменьшение возбуждения больного, стресса и,
555
Лечение кардиогенного отека легких
Принципы
Средства
1. Угнетение перевозбужденного
дыхательного центра, уменьшение
активности симпатико-адреналовой
системы
2. Уменьшение венозного возврата к
сердцу и гидростатического давления в
легочных капиллярах
3. Коррекция нарушения газообмена
4. Купирование бронхоспазма
5. Уменьшение постнагрузки
(по показаниям)
6. Устранение способствующих факторов
7. Повышение сократимости миокарда
Морфина гидрохлорид внутривенно
Положение больного сидя со спущенными ногами
Петлевой диуретик внутривенно
Нитроглицерин сублингвально или внутривенно
капельно
Кровопускание
Венозные жгуты на конечности (+)
Дыхание под положительным давлением на выдохе
Ингаляция кислорода под положительным
давлением на выдохе, при необходимости с
пеногасителями, по показаниям ИВЛ
Эуфиллин внутривенно
Ганглиоблокаторы внутривенно
Кровопускание
Натрия нитропруссид внутривенно капельно
Лечение артериальной гипертензии, нарушений
ритма
Сердечные гликозиды внутривенно (+)
Симпатомиметические амины внутривенно
капельно
следовательно, активности симпатико-адреналовой системы, что способствует
ослаблению ее вазоконстрикторного действия на артериальные и венозные
сосуды; б) снижение пред- и постнагрузки (то есть давления в легочных
капиллярах и АД) также благодаря слабому а-адреноблокирующему дей-
ствию; в) угнетение перевозбужденного дыхательного центра, что приводит
к уменьшению одышки и тахипноэ. В результате увеличиваются глубина ды-
хания и поглощение кислорода; г) уменьшение работы дыхательных мышц
и, следовательно, их потребности в кислороде, которая в таких случаях рез-
ко возрастает. Препарат обладает небольшим бронхосуживающим эффектом
и противопоказан при сопутствующем бронхообструктивном синдроме. Вво-
дят по 5-10 мг внутривенно струйно, можно дробно. Пожилым рекоменду-
ются меньшие дозы. Чрезмерное угнетение дыхания устраняют введением
налорфина.
3. Петлевые диуретики. Увеличение диуреза приводит к уменьше-
нию ОЦП и тем самым венозного притока к сердцу и гидростатического
явления в легочных капиллярах. Мочегонное действие начинает проявляться
через 5 мин и достигает максимума спустя 30 мин после внутривенного
введения фуросемида. В то же время отчетливый клинический эффект и
заметное снижение давления в легочной артерии отмечаются в первые 5 мин,
то есть значительно раньше. Это обусловлено способностью препарата вызы-
вать расширение периферических сосудов, главным образам вен, путем
556
непосредственного действия на их стенку. Такой эффект напоминает вазоди-
латирующее действие нитроглицерина и выражен тем больше, чем выше дав-
ление в левом предсердии. Фуросемид вводят внутривенно струйно в дозе
40-80 мг, при необходимости повторно.
4. Нитроглицерин. Как венозный вазодилататор быстро и эффектив-
но снижает преднагрузку и повышенное давление в легочных капиллярах.
Применяют сублингвально по 0,5 мг каждые 15—20 мин или внутривенно
капельно. Следует остерегаться резкого снижения АД при артериальной ги-
потензии.
5. Кровопускание. Применяют для снижения легочной гипертензии
при недостаточной эффективности предыдущих мероприятий. Для получе-
ния эффекта его следует производить быстро и в объеме около 500 мл. Недо-
статком является усугубление нарушения кислородтранспортной функции
крови, свойственного больным хронической сердечной недостаточностью.
Противопоказано при анемии.
Венозные жгуты на конечности в настоящее время используют ред-
ко, так как по своей эффективности они значительно уступают другим ме-
тодам уменьшения преднагрузки. Накладывают на проксимальные отделы
одновременно 3 конечностей под давлением примерно на 10 мм р т.ст. ниже
диастолического АД во избежание нарушения артериального притока. Каж-
дые 15—20 мин один из жгутов перемещают на свободную конечность.
6. Оксигенотерапия. Чрезвычайно важное средство лечения отека
легких, так как отмечающееся при этом скопление в альвеолах транссудата
значительно нарушает диффузию и вызывает артериальную гипоксемию. Ин-
галяцию кислорода (40—100 %, 6-8 л/мин) лучше всего производить под
положительным давлением на выдохе, равным 10—20 см вод.ст., через мас-
ку. Сохранение при дыхании 100 % кислородом РаО2 меньше 60 мм рт.ст., а
также нарастание гиперкапнии являются показаниями для интубации тра-
хеи и ИВЛ. Выдох против сопротивления повышает давление газа в альвео-
лах и благодаря этому уменьшает транссудацию в них жидкости из капилля-
ров. Кроме того, он уменьшает венозный возврат к сердцу и давление в
легочных капиллярах, что, однако, может приводить к усугублению сниже-
ния МОС и АД в случаях отека легких в сочетании с кардиогенным шоком,
а также при некардиогенном отеке легких. Следует соблюдать осторожность
при длительном использовании 100 % кислорода у больных с сопутствую-
щей выраженной дыхательной недостаточностью, у которых сниженное РаО2
оказывает стимулирующее действие на дыхательный центр. Гипероксемия
может также давать отрицательный инотропный эффект. Кислород обяза-
тельно должен быть увлажнен. При обильном выделении пены ее отсасыва-
ют или гасят путем вдыхания через маску паров 20 % спирта или антифом-
силана.
7. Уменьшение ОПСС (постнагрузки).У значительной части
больных вызываемая удушьем активация симпатико-адреналовой системы
приводит к сужению артериол и повышению ОПСС и АД. Применение арте-
риолярных вазодилататоров в таких случаях позволяет увеличить МОС и тем
557
самым улучшить также опорожнение левого желудочка и уменьшить застой
на путях притока. В этих целях используют внутривенную инфузию натрия
нитропруссида или ганглиоблокаторов (пентамин, триметафан), а также
кровопускание. Дозы препаратов подбирают индивидуально таким образом,
чтобы систолическое АД снизилось до 90—100 мм рт.ст. у нормотоников.
8. Эуфиллин. Назначают главным образом для купирования бронхо-
спазма, в том числе как препарат I ряда в случаях затруднений при диффе-
ренциальной диагностике кардиальной и бронхиальной астмы. Выгодной яв-
ляется также его способность вызывать умеренное снижение давления в ле-
вом предсердии и легочных капиллярах за счет некоторого венодилатирую-
щего действия, положительного инотропного эффекта и увеличения диуре-
за в результате увеличения клубочковой фильтрации и уменьшения реаб-
сорбции Na+ в проксимальных почечных канальцах. Назначают внутривен-
но струйно медленно в дозе 240-480 мг. Неблагоприятным является тахи-
кардитический эффект эуфиллина, который подчас ограничивает возмож-
ность его применения и дозу.
9. Положительные инотропные агенты. Используют ограни-
ченно, так как по своей эффективности они значительно уступают другим
препаратам, а в ряде случаев могут оказывать неблагоприятное действие на
гемодинамику. Так, при отеке легких на высоте гипертонического криза они
могут усугублять артериальную гипертензию, а в случаях митрального сте-
ноза при синусовом ритме увеличивать выброс правого желудочка, что при
ограниченной пропускной способности левого атриовентрикулярного отвер-
стия может приводить к еще большему повышению давления в легочных
венах и капиллярах. Подобная ситуация может наблюдаться при стенозе ус-
тья аорты. Кардиотонические препараты противопоказаны при обструктив-
ной гипертрофической кардиомиопатии (или идиопатическом гипертрофи-
ческом субаортальном стенозе). Таким образом, сферой их применения при
острой левожелудочковой недостаточности являются случаи затянувшегося
отека легких на фоне артериальной гипо- или нормотензии, особенно при
кардиогенном шоке.
Сердечные гликозиды наиболее эффективны при сопутствующей
тахисистолической форме мерцательной аритмии, когда оказываемое ими
брадикардитическое действие способствует улучшению наполнения левого
желудочка и снижению давления в левом предсердии. Они не являются сред-
ством экстренной терапии отека легких, так как их действие при внутри-
венном введении начинается не ранее чем через 15-20 мин и достигает
максимума только после насыщения. При этом оно открывает возможности
для предотвращения повторения отека легких. В первые дни после острого
инфаркта миокарда из-за опасности возникновения аритмий и неблагопри-
ятного влияния на перинфарктную зону гликозиды противопоказаны. Если
больной ранее не получал эти препараты, первоначально можно ввести внут-
ривенно до 3/4 насыщающей дозы дигоксина, строфантина или ланатозида
и проводить дигитализацию быстрыми или умеренными темпами.
558
С им патом атические амины, преимущественно добутамин, при-
меняют путем длительной внутривенной инфузии при острой левожелудоч-
ковой недостаточности, плохо поддающейся общепринятой неотложной те-
рапии. В таких случаях их обычно сочетают с инфузией препаратов, снижаю-
щих пред- и постнагрузку (нитроглицерин, натрия нитропруссид и др.).
При длительно некупирующемся кардиогенном отеке легких на фоне
склонности к артериальной гипотензии и особенно при шоке для уменьше-
ния проницаемости альвеолокапиллярных мембран внутривенно назначают
глюкокортикостероиды (например, преднизолон по 60-120мг, при
необходимости повторной). Они оказывают также бронхолитическое действие.
10. Устранение способствующих фактор о в. Осуществляется
по показаниям и включает купирование гипертонического криза, тахи- или
брадисистолических аритмий, коррекцию перегрузки жидкостью или гипер-
термии при интрекуррентном инфекционном заболевании. Для предупреж-
дения повторения отека легких и усугубления хронической сердечной недо-
статочности важное значение имеет своевременная диагностика и активное
лечение обострения ИБС, в частности нестабильной стенокардии и инфарк-
та миокарда.
Трансплантация сердца. Является лечением выбора у отдельных больных с
терминальной сердечной недостаточностью. Первая успешная пересадка до-
норского сердца была выполнена Christiaan Barnard в ЮАР в 1967 г., вторая
- Norman Shumway в Стендфордском университете (США). Толчком к раз-
витию этого метода послужило внедрение в клиническую практику, начи-
ная с 1980 г., нового иммуносупрессанта циклоспорина, что позволило зна-
чительно уменьшить частоту реакций отторжения и увеличить выживаемость
оперированных. По данным регистра Международного общества трансплан-
тации сердца, к 1990 г. в 128 центрах стран мира было выполнено более
12 000 таких операций. В настоящее время ежегодно производят более 1500
трансплантаций, и дальнейший рост их количества лимитируется лишь не-
хваткой донорских сердец. Так, согласно оценке специалистов, в США еже-
годно на более чем 20 000 потенциальных реципиентов приходится лишь
около 2000 возможных доноров.
Основным показаниемк трансплантации сердца является резко вы-
раженная хроническая сердечная недостаточность IV класса NYHA, не под-
дающаяся активной медикаментозной терапии и не подлежащая хирурги-
ческому лечению, с вероятным летальным исходом в течение ближайших
6—12 мес. При этом обязательными условиями являются отсутствие тяжелых
внесердечных заболеваний, в том числе активных инфекций, необратимых
изменений в различных органах вследствие самой сердечной недостаточно-
сти и существенного повышения ЛСС (во избежание острой перегрузки пра-
вого желудочка донорского сердца), а также эмоциональная устойчивость
больных, добросовестное выполнение ими всех врачебных рекомендаций,
(compliance). Возраст реципиента обычно не превышает 65 лет. Соблюдение
этих условий обеспечивает отбор больных, у которых можно рассчитывать
на хороший функциональный результат операции, что имеет важное значение
559
ввиду ограниченного количества доноров и высокой стоимости. В США сто-
имость операции и последующего лечения в течение первого года составляет
в среднем 150 тыс. долларов. Среди причин сердечной недостаточности у та-
ких больных преобладают ИБС и дилатационная кардиомиопатия, реже она
вызывается иноперабельными пороками сердца и другими заболеваниями.
С учетом эпидемиологии коронарного атеросклероза забор сердца для пе-
ресадки производят у лиц не старше 35—40 лет, у которых двумя врачами
независимо друг от друга диагностирована гибель ствола мозга в результате
несчастного случая или спонтанного внутричерепного кровоизлияния. При
индивидуальном подборе должна быть обеспечена совместимость по антиге-
нам АВО, а при наличии в сыворотке крови реципиента цитотоксических
антител — отсутствие их перекрестной реакции с лимфоцитами донора.
В ожидании подходящего донора у части реципиентов с терминальной
сердечной недостаточностью приходится прибегать к внутриаортальной бал-
лончиковой контрпульсации или другим, более сложным, методам вспомо-
гательного кровообращения.
Методика ортотопической трансплантации предусматри-
вает иссечение обоих желудочков и части предсердий реципиента с сохра-
нением их участков в местах впадения вен, к которым в условиях искус-
ственного кровообращения фиксируют донорское сердце. Имплантацию за-
канчивают наложением анастомозов на аорту и легочную артерию.
Гетеротопическую трансплантацию, которая заключается в под-
шивании сердца донора параллельно сохраняемому сердцу реципиента, при-
меняют редко.
Особенности функционирования донорского сердца связаны с его де-
нервацией. В покое характерна стойкая синусовая тахикардия, возрастающая
при повышении содержания катехоламинов в крови, перфузирующей сину-
совый узел. Гемодинамическое обеспечение физической нагрузки реализует-
ся в большей мере за счет механизма Франка-Старлинга, вследствие чего
наивысший достигаемый уровень МОС примерно на 30 % ниже, чем у здо-
ровых.
Наиболее распространенными осложнениями раннего послеопера-
ционного периода являются острое отторжение и инфекция, а позднего —
стенозирование коронарных артерий трансплантата и злокачественные но-
вообразования, особенно лимфомы.
Отторжение вначале протекает бессимптомно и лишь в далеко зашедшей
стадии проявляется клинически ритмом галопа, резкой слабостью, задерж-
кой жидкости и предсердными аритмиями. Поэтому его ранняя диагностика
для своевременной коррекции иммуносупрессивной терапии возможна только
с помощью гистологического исследования эндомиокардиальных биоптатов,
забор которых производят трансвенозным путем из правого желудочка. В пер-
вые 6 мес биопсия выполняется каждые 1—2 нед, затем реже — через 1—2 и
6—12 мес в зависимости от клинического течения. Для предотвращения оттор-
жения больные непрерывно получают иммуносупрессивную терапию тремя
препаратами - циклоспорином, азатиоприном и глюкокортикостероидами.
560
Лечение острого отторжения проводят в зависимости от его выраженности с
помощью подавляющих доз глюкокортикостероидов с последующим их сни-
жением и антитимического глобулина.
Инфекционные осложнения чаще всего обусловлены вирусными и
грибковыми, реже — бактериальными возбудителями и тесно связаны с
дозами иммуносупрессивных препаратов.
К 3-му году после операции у большинства больных в донорском сердце
развивается распространенное стенозирующее поражение коронарных арте-
рий различного калибра, в том числе интрамуральных, обусловленное про-
лиферацией интимы. Предполагают, что оно в значительной мере связано с
хроническим течением реакций отторжения. При этом из-за денервации сер-
дца ангинозная боль отсутствует, и единственным проявлением заболева-
ния является прогрессирующая сердечная недостаточность, которая в зна-
чительной степени определяет отдаленный прогноз у таких больных.
Для своевременной диагностики ежегодно в плановом порядке выполня-
ют коронарографию. Лечение включает гиполипидемическую диету и анти-
агреганты, что в целом мало эффективно.
В настоящее время госпитальная летальность составляет около 10 %, а
выживаемость к концу первого года - 80-90 % и через 5 лет — 60—70 %.
Наибольшая зарегистрированная к настоящему времени продолжительность
жизни после трансплантации сердца достигает 19 лет. Следует отметить хоро-
шие функциональные результаты операции. Так, 90 % выживших относятся
к I функциональному классу NYHA, а 70 % возвращаются к труду или уче-
бе (L.Fragomeni и соавт., 1990). Таким образом, по своей эффективности при
тяжелой сердечной недостаточности трансплантация сердца значительно пре-
восходит медикаментозную терапию.
Трансплантацию комплекса сердце-легкие началипри-
менять в клинике относительно недавно в далеко зашедших случаях врож-
денных пороков сердца с комплексом Эйзенменгера и первичной легочной
гипертензии. Выживаемость составляет примерно 50 % к концу первого года
и 30 % - к концу второго и лимитируется развитием тяжелых инфекций и
облитерирующего бронхиолита как проявления нераспознанной хроничес-
кой реакции отторжения (L.Fragomeni и соавт., 1990). Предотвращение этого
осложнения затруднено в связи с отсутствием до настоящего времени дос-
таточно информативных методов ранней диагностики отторжения легких,
которое может происходить независимо от сердца.
Перспективным методом лечения далеко зашедшей сердечной недоста-
точности является имплантация искусственного сердца. Имею-
щийся первый опыт создания такой модели и ее клинического использова-
ния оказался не вполне удовлетворительным: все больные вскоре умерли от
инфекционных осложнений и тромбоэмболий.
Основным недостатком метода является необходимость во внешнем ис-
точнике питания, чрескожное соединение которого с сердцем связано с
рядом проблем.
Прогноз. Широкое применение эффективных медикаментозных методов
561
лечения сердечной недостаточности - мочегонных препаратов, ингибиторов
АПФ и других вазодилататоров, инотропных агентов, а также хирургичес-
кой коррекции ее причины в последние годы позволило улучшить прогноз у
таких больных. Тем не менее в целом он остается неблагоприятным. Выжи-
ваемость больных зависит от выраженности сердечной недостаточности и в
меньшей степени — от ее причины. Так, при умеренной малопрогрессирую-
щей сердечной недостаточности ежегодная летальность составляет около 10—
15 %, тогда как при тяжелой (IV класс NYHA) - 50 % и больше (CON-
SENSUS, 1987). При ИБС прогноз хуже, чем в случаях некоронарогенных
заболеваний миокарда, в частности дилатационной кардиомиопатии. Выжи-
ваемость таких больных к концу первого года составляет соответственно 35
и 65 %.
Прогноз тесно коррелирует с выраженностью изменений показателей
дисфункции миокарда (КДО, КДД, ФВ, СИ и др.). Так, ближайший (на
1 год) прогноз неблагоприятен при ФВ менее 20 %. Независимым фактором
риска является повышение уровня циркулирующих в крови катехоламинов.
При приобретенных пороках сердца важное прогностическое значение имеет
функциональное состояние правого желудочка и величина площади интер-
стициального фиброза (в %) в эндомиокардиальных биоптатах.
Кроме прогрессирующего ухудшения гемодинамики, частой причиной
смерти больных с сердечной недостаточность являются внезапные фаталь-
ные аритмии, главным образом фибрилляция желудочков. Их удельный вес
примерно одинаков. Наличие упорных желудочковых аритмий, особенно стой-
ких эпизодов желудочковой тахикардии, не поддающихся медикаментозно-
му подавлению при электрофизиологических исследованиях, является неза-
висимым от глубины нарушения кардиогемодинамики фактором риска. На-
копленные к настоящему времени данные свидетельствуют о том, что целе-
направленное антиаритмическое лечение таких больных практически не спо-
собно предотвратить внезапную смерть, отчасти, по-видимому, из-за аритмо-
генного и прочих побочных эффектов препаратов. В связи с этим вопрос о
целесообразности лечения бессимптомных эпизодов желудочковой тахикар-
дии остается нерешенным.
Профилактика. Учитывая неблагоприятный прогноз и не вполне удовлет-
ворительные результаты лечения сердечной недостаточности в стадии раз-
вернутых клинических проявлений, важное значение приобретает ее профи-
лактика. Характер наиболее распространенных этиологических факторов у
населения стран Запада свидетельствует о том, что она должна быть направ-
лена прежде всего на предотвращение возникновения и прогрессирования
различных форм ИБС и эссенциальной артериальной гипертензии, а также
раннюю диагностику и хирургическую коррекцию врожденных и приобре-
тенных пороков сердца. Данные об эффективности тех или иных методов
профилактики (при этих заболеваниях изложены в соответствующих главах.
Вторичная профилактика основывается на раннем выявлении и начале
лечения сердечно^недостаточности с использованием наиболее действен-
ных средств, обеспечивающих улучшение выживаемости больных (см. выше).
562
ГЛАВА 12. ШОК
Шок представляет собой клинический синдром, характеризующийся кри-
тическим и распространенным снижением перфузии тканей вследствие
уменьшения эффективно циркулирующего объема крови. Другими словами,
шок — это острое нарушение кровообращения, в основе которого лежит
несоответствие между метаболическими потребностями тканей и их снабже-
нием кислородом и питательными веществами вследствие резкого умень-
шения кровотока, обусловленного снижением МОС и его перераспределе-
нием. Центральное место в картине шока занимает нарушение перифериче-
ского кровообращения с развитием расстройств микроциркуляции и внача-
ле обратимого, а затем необратимого повреждения клеток. Независимо от
этиологического фактора шок как клинический синдром характеризуется
артериальной гипотензией, периферической вазоконстрикцией, олигурией
и часто нарушением сознания.
Наряду с термином “шок” в литературе можно встретить также термин
“коллапс”. Трактовка этих понятий, наличие и характер различий между ними
до настоящего времени остаются предметом дискуссий. Так, есть предложе-
ние рассматривать шок как острую сосудистую недостаточность в результате
воздействия экзогенных факторов (травмы, аллергены и др.), а коллапс —
как эндогенно обусловленную сосудистую недостаточность (например, при
остром инфаркте миокарда, декомпенсации сахарного диабета). Существует
и другая точка зрения, согласно которой шок отличает от коллапса наличие
начальной фазы психомоторного возбуждения и повышенного тонуса сосу-
дов. Такой критерий, однако, весьма нечеток, так как эта, так называемая
эректильная, фаза может быть слабо выраженной, стертой и, быстро сменя-
ясь состоянием угнетения, оставаться нераспознанной. В целом же очевид-
но, что принципиального различия между обоими понятиями не существует
и их следует признать одним и тем же состоянием. Синонимами термина
“шок” являются также “острая циркуляторная недостаточность” и “синдром
малого выброса”.
Этиология. В зависимости от этиологии выделяют 4 формы шока.
Причины шока можно объединить в две большие группы: связанные с
низким ЦВД (гиповолемический и большинство случаев перераспредели-
тельного шока) и характеризующиеся повышенным ЦВД (кардиогенный и
обструктивный шок).
Гиповолемический шок является наиболее распространенной его
формой. Основной причиной является кровотечение — наружное или внут-
реннее, то есть в пищеварительный канал и полости (гемоторакс, гемопе-
ритонеум). К более редким случаям гиповолемии относятся дегидратация из-
за потери плазмы крови при тяжелых ожогах, ее накопления в брюшной
полости при остром панкреатите, а также рвоты, поноса и полиурии при
сахарном и несахарном диабете. Уменьшение ОЦП приводит к нарушению
наполнения обоих желудочков и снижению их КДО и КДД.
563
Классификация шока в зависимости от этиологии
(по M.Weil, H.Shubiu, 1967)
Форма шока Заболевание
1. Кардиогенный: вследствие
миокардиальной
недостаточности механический Острый инфаркт миокарда Миокардит и дилатационная кардиомиопатия Митральная недостаточность Дефект межжелудочковой перегородки Аневризма желудочка Препятствие изгнанию из левого желудочка (стеноз устья аорты, идиопатический гипертрофический субаортальный стеноз)
аритмический 2. Экстракардиальный обструктивный Тахи- и брадисистолические нарушения ритма Тампонада сердца Констриктивный перикардит ТЭВЛА (массивная) Высокая легочная гипертензия (первичная или комплекс Эйзенменгера)
3. Гиповолемический Кровотечения Дегидратация
4. Перераспределительный Сепсис Анафилаксия Патология центральной нервной системы Экзо- и эндогенные интоксикации Эндокринные заболевания
Кардиогенный шок обусловлен резким нарушением систоличес-
кой функции сердца, при котором снижение МОС в большинстве случаев
сопровождается повышением давления наполнения желудочков и ЦВД. Наи-
более частой причиной является острый инфаркт миокарда с поражением
более 40 % массы левого желудочка, реже — значительное нарушение сокра-
тимости миокарда после кардиохирургических операций или остановки сердца,
а также при тяжелом миокардите. Необходимо иметь в виду и возможность
кардиодепрессивного действия лекарственных препаратов, особенно на фоне
тяжелого поражения миокарда или в сочетании друг с другом. Прямым ток-
сическим действием на миокард обладают некоторые иммуносупрессанты
(например, адриамицин) и этиловый спирт. Отрицательный инотропный эф-
фект оказывают большие дозы р-адреноблокаторов, блокаторов кальциевых
каналов, антиаритмические препараты I класса (особенно дизопирамид и
флекаинид), салицилаты, трициклические антидепрессанты.
Вторая группа причин кардиогенного шока связана с острой механиче-
ской перегрузкой левого желудочка, которая вызывает значительное умень-
шение эффективного МОС, то есть поступления крови в аорту и большой
круг кровообращения. К ее причинам относятся остро возникшие митраль-
ная и аортальная недостаточность (например, вследствие разрыва хорды или
створки клапана при инфекционном эндокардите иди другом заболевании,
хирургическом вмешательстве), дефект межжелудочковой перегородки и
острая аневризма левого желудочка при инфаркте миокарда. Кардиогенный
564
шок может развиться также вследствие резкой перегрузки левого желудочка
сопротивлением при клапанном и подклапанном стенозе устья аорты и на-
рушении его наполнения из-за препятствия на путях притока, например,
при миксоме или шаровидном тромбе в предсердии. Его причинными или
способствующими факторами могут быть также острые тахи- и брадисисто-
лические аритмии на фоне предсуществующей дисфункции левого желудоч-
ка, например, при ИБС или митральном стенозе.
Обструктивный шок обусловлен снижением МОС вследствие пре-
пятствия кровотоку, не связанного с миокардом или клапанами сердца. Ти-
пичным примером является тампонада сердца, в основе которой лежит зна-
чительное нарушение диастолического наполнения желудочков. Ко второй
группе причин относятся массивная ТЭВЛА и высокая легочная гипертен-
зия другого генеза (например, ее резкое усугубление при первичной легоч-
ной гипертензии).
Перераспределительный шок обусловлен генерализованной
вазодилатацией вследствие снижения сосудистого тонуса с развитием относи-
тельной гиповолемии (неврогенный и септический шок) либо абсолютной
гиповолемии в результате повышения проницаемости капилляров и перехо-
да жидкости из сосудистого русла в ткани (анафилактический и септический
шок). В обоих случаях происходит уменьшение венозного возврата к сердцу
и, как следствие, — его выброса. Возможными причинами неврогенного шока
являются наркоз, спинномозговая анестезия, травма спинного мозга, пере-
дозировка ганглиоблокаторов или других антигипертензивных препаратов,
отравление барбитуратами и фенотиазидами, нарушение функции сосудод-
вигательного центра продолговатого мозга при его органическом поражении
или резком снижении уровня глюкозы в крови (инсулиновый шок).
Патогенез. Вне зависимости от характера этиологического фактора в ос-
нове развития шока лежит несоответствие между емкостью сосудистого рус-
ла и ОЦП, которое во всех случаях гиповолемического, обструктивного и
кардиогенного шока и у части больных с перераспределительным шоком
обусловлено снижением МОС (схема 27). В результате нарушается перфузия
тканей и снижается АД. В ответ включаются механизмы компенсации, на-
правленные на восстановление нормального АД и МОС. К ним относится в
первую очередь барорецепторный рефлекс, обеспечивающий посредством ак-
тивации симпатической части вегетативной нервной системы и выделения
катехоламинов надпочечниками спазм артериол, вен и увеличение силы и
скорости сердечных сокращений. Аналогичный эффект дает и ишемия цент-
ральной нервной системы с повышением РСО2 крови, поступающей в сосудо-
двигательный центр. Сужение артериол приводит к повышению ОПСС и
наиболее выражено в органах брюшной полости, почках, мышцах и коже,
практически не распространяясь на мозг и сердце. Такая централизация крово-
тока обеспечивает приоритетное снабжение кровью жизненно важных органов.
Спазм почечных артериол как часть генерализованной вазоконстрикторной
реакции вызывает уменьшение клубочковой фильтрации и активацию ре-
нин-ангиотензин-альдостероновой оси. В результате сужение системных, в
565
Схема 27. Общие механизмы развития шока: САС — симпатико-адреналовая система;
ОПСС - общее периферическое сосудистое сопротивление; ДВС — диссеминированное
внутрисосудистое свертывание крови
том числе почечных, артериол и в меньшей степени вен усугубляется, воз-
растает реабсорбция Na+ в почечных канальцах, что способствует увеличению
объема внеклеточной жидкости. Снижение гидростатического давления в
системных капиллярах вследствие спазма артериол приводит к перемещению
в них жидкости из интерстициального и внутриклеточного пространства.
Сужение артериол, развивающееся как важнейшая компенсаторная реак-
ция, направленная на поддержание системного кровотока и перфузии жиз-
ненно важных органов, при значительной продолжительности приобретает
характер патологического. Ключевую роль в этом играют нарушения микро-
циркуляции, связанные с гипоперфузией тканей, прогрессирование кото-
566
рых неизбежно приводит к необратимой ишемии и распространенной гибе-
ли клеток. В результате шок переходит в необратимую стадию, когда устра-
нение его причины не способно предотвратить летальный исход. Снижение
перфузионного давления вызывает замедление кровотока в капиллярах, что
приводит к ухудшению реологических свойств крови, агрегации и агглюти-
нации форменных элементов. Заполнение капилляров “монетными столби-
ками” эритроцитов сопровождается открытием артериовенозных шунтов, что
усугубляет нарушение кровоснабжения тканей. Развиваются глубокая ги-
поксия и ацидоз, что способствует повреждению эндотелия микрососудов,
увеличению образования тканевого тромбопластина и возникновению син-
дрома диссеминированного внутрисосудистого свертывания. Артериальная
гипоксемия усугубляется вследствие нарушения оксигенации крови в лег-
ких при развитии “шокового легкого” (см. ниже). Прогрессирующая гипок-
сия и ацидоз на определенном этапе вызывают паралич прекапиллярных
сфинктеров, что при сохранении спазма более устойчивых к ним постка-
пиллярных сфинктеров приводит к увеличению притока крови в капилляры
и ее стазу. Повышение гидростатического давления в сочетании с увеличе-
нием проницаемости сосудистой стенки способствует усиленному переходу
жидкости в интерстициальное пространство, а следовательно, усугублению
нарушений реологических свойств. При дальнейшем накоплении недоокис-
ленных продуктов и углекислого газа, а также гистамина и простагландинов
с вазодилататорными свойствами, метаболизм которых в печени нарушен,
происходит паралич посткапиллярных сфинктеров. Развивается секвестрация
крови в капиллярах, что, наряду с экстравазацией жидкости, вызывает даль-
нейшее снижение ОЦП, венозного возврата и МОС. В поздних стадиях в
результате нарушения трофики сосудистой стенки и угнетения сосудодвига-
тельного центра вследствие ишемии мозга наступает атония артериальных и
венозных сосудов, происходят дальнейшее скопление крови в венозном рус-
ле, резкое падение кровотока в жизненно важных органах и, наконец, пре-
кращение кровообращения.
На клеточном уровне дефицит макроэргов, закономерно развивающийся
в условиях анаэробного метаболизма, приводит к мультиорганной недоста-
точности и, в итоге, к гибели клеток и некрозу тканей.
Патогенез нарушения функции отдельных органов при шоке. Основными
органами-мишенями, поражение которых при шоке происходит независимо
от его генеза и имеет важное клиническое значение, являются легкие, поч-
ки и сердце.
Патогенез “шокового легкого”, или респираторногодистресс-
синдрома взрослых, схематически представлен на схеме 28.
“Шоковое легкое” развивается через 24—72 ч и обусловлено двумя основ-
ными факторами: отеком интерстициальной ткани и ателектазированием
альвеол. В формировании интерстициального отека важную роль играет повы-
шение проницаемости альвеолярно-капиллярных мембран и их повреждение,
что приводит к выходу в интерстициальное пространство не только воды,
но и белков с повышением онкотического давления интерстициальной
567
Схема 28. Патогенез “шокового легкого”: ЛЖ - левый желудочек; КДД - конечно-
диастолическое давление
жидкости, что усугубляет отек. При кардиогенном шоке важное значение
имеет также венозный застой в легких вследствие нарушения систолическо-
го опорожнения левого желудочка. В итоге нарушение вентиляционно-
перфузионных соотношений приводит к увеличению альвеолярно-артери-
ального градиента по кислороду и выраженной артериальной гипоксемии,
не корригирующейся ингаляцией 100 % кислорода.
“Шоковая почка” характеризуется преренальной острой почечной
недостаточностью, обусловленной ишемией почки в результате снижения
ее кровотока как проявления системной компенсаторной реакции. В началь-
ных стадиях шока отмечается преренальная олигурия как следствие обрати-
мого нарушения клубочковой фильтрации. При длительной, свыше 1 ч, сис-
темной артериальной гипотензии развивается острый некроз канальцев с
обратной диффузией клубочкового фильтрата в интерстициальную ткань через
568
fMOC
\КТХА, ангиотензина II
Спазм афферентных артериол
почек
Схема 29. Патогенез “шоковой почки”: КТХА - катехоламины; ДВС - диссеминиро-
ванное внутрисосудистое свертывание крови
поврежденный эпителий и закупоркой канальцев цилиндрами и клеточным
детритом (схема 29).
Развивающиеся с течением времени в различных органах необратимые
изменения закономерно наступают ивмиокарде, вне зависимости от
этиологии шока. В их основе лежит ишемия миокарда,прежде всего ее субэндо-
кардиальных слоев, вплоть до некрозов, вследствие несоответствия между
потребностью миокарда в кислороде и его доставкой (схема 30). Нарушение
поступления кислорода в миокард при некардиогенном шоке обусловлено:
1) уменьшением коронарного кровотока вследствие увеличения сопротивления
артерий из-за повышения вязкости крови; 2) снижением давления в аорте;
3) артериальной гипоксемией из-за нарушения оксигенации крови в легких.
Ишемия миокарда, вызывая нарушение его систолической и диастоличе-
ской функций, усугубляет расстройства гемодинамики и тяжесть шока.
569
ypa02
Учсс
Спазм артериол,
Упостнагрузки
| сопротивления
коронарных *
артерий
f коронарного
кровотока
/ Удавления в
/ аорте
Необратимые
Обратимые
У доставки
02
Употребности
в Ог
Нарушение реологических
свойств крови------
ДВС
Асинергия лж
У жесткости лж
— Аритмии
Схема 30. Патогенез поражения миокарда при шоке: ДВС- диссеминированное внутри-
сосудистое свертывание крови
Дальнейшему снижению МОС способствуют и нарушения сердечного рит-
ма, подверженность которым связана с ишемией миокарда и гиперкатехол-
аминемией. Создаются условия для развития инфаркта миокарда как ослож-
нения шока.
Кроме ишемии, угнетение сократимости миокарда вызывают ацидоз и
ряд токсических гуморальных факторов, выделяющихся в поздних стадиях
шока любого генеза. Наиболее известен “фактор, угнетающий миокард”
(MDJ-Myocardial Depressant Factor). По-видимому, он представляет собой
кинин, который образуется из неактивного предшественника под влиянием
протеолитических ферментов, освобождающихся из лейкоцитов и повреж-
денных тканей, в частности, ишемизированных поджелудочной железы и
тонкой кишки. Отрицательное инотропное действие этого фактора связано с
нарушением Са2+-опосредованого сопряжения возбуждения с сокращением.
570
При инфекционном шоке кардиодепрессивный эффект дает также эндо-
токсин.
В целом следует подчеркнуть, что шок отличается от банальной артери-
альной гипотензии глубоким нарушением перфузии тканей, что вызывает
расстройство жизнедеятельности и, в итоге, гибель клеток.
Особенности патогенеза отдельных форм шока. При инфекционно-
токсическом шоке в результате взаимодействия микробных агентов
со специфическими и неспецифическими факторами антимикробной защи-
ты образуется большое количество различных медиаторов, которые действу-
ют местно либо циркулируют в крови. Часть из них, например, гистамин,
кинины, многие простагландины, входящий в состав энтотоксина липид А,
некоторые эндорфины, интерлейкин 1 и 2, оказывают сильное дилатирую-
щее действие на артериальные и венозные сосуды. Другие медиаторы — не-
которые простагландины и лейкотриены - обладают, наоборот, вазоконст-
рикторным эффектом. Это обусловливает патологическое перераспределение
и неравномерность кровотока в различных сосудистых бассейнах. Вследствие
преобладания сосудорасширяющих реакций отмечается снижение ОПСС,
которое может достигать 1/10 нормальной величины, что способствует со-
хранению и даже повышению МОС, несмотря на угнетение сократитель-
ной способности миокарда. Близкий механизм нарушений кардиогемодина-
мики может иметь место при анафилактическом шоке. У части больных пе-
реход большого количества жидкости, содержащей белок, из сосудистого
русла в брюшную полость или просвет кишечника может приводить к абсо-
лютной гиповолемии и гиповолемической острой почечной недостаточности.
Одновременно в периферической крови происходит накопление лактата с
развитием ацидоза. В генезе нарастающих нарушений микроциркуляции важ-
ное значение имеют повышение агрегации форменных элементов крови и
активация диссеминированного внутрисосудистого свертывания под действи-
ем гуморальных медиаторов — фактора, активирующего тромбоциты, и др.
Вызываемая компонентом 5а комплемента агрегация нейтрофилов приво-
дит к распространенной микроэмболизации.
При прогрессировании шока смерть наступает при явлениях нарастающе-
го снижения сосудистого тонуса и артериальной гипотензии, которая в ряде
случаев усугубляется вследствие падения МОС из-за выраженной дисфунк-
ции миокарда. Возможно возникновение отека легких в результате резкого
повышения давления в левом предсердии и (или) повреждения базальной
мембраны капилляров. Одновременно развивается полиорганная недостаточ-
ность, обусловленная необратимыми изменениями в почках, печени, лег-
ких, мозге и других органах.
Патогенез анафилактического шока отличается рядом ха-
рактерных признаков, которые имеют важное клиническое значение. Он пред-
ставляет собой общую аллергическую реакцию немедленного типа, возни-
кающую в сенсибилизированном организме в ответ на повторное введение
антигена. В основе патогенеза анафилактического шока лежит активация туч-
ных клеток и базофилов периферической крови вследствие взаимодействия
571
поступившего в организм аллергена с образовавшимися ранее специфиче-
скими антителами — реагинами, главным образом иммуноглобулинами
класса Е, фиксированными на этих клетках. В результате происходит их
дегрануляция, опосредованная нарушением баланса циклических нуклео-
тидов с уменьшением внутриклеточного содержания цАМФ и увеличением
цГМФ. Дегрануляция сопровождается выделением большого количества био-
логически активных веществ — медиаторов, которые играют ключевую роль
в генезе острой сосудистой недостаточности и гибели клеток. Так, гистамин,
серотонин и так называемое медленно действующее вещество анафилаксии
вызывают спазм гладких мышц бронхов, кишечника и посткапиллярных
сфинктеров, а также резко повышают проницаемость капилляров. Секвест-
рации крови в них с уменьшением эффективного ОЦК способствует и раз-
витие распространенного диссеминированного внутрисосудистого сверты-
вания под влиянием активирующего тромбоциты фактора и других медиато-
ров. В патологический процесс включаются кинины, активируемые проте-
азами, которые освобождаются при гибели клеток в результате нарушений
микроциркуляции. Они вызывают дилатацию артериол, усугубляют спазм
венул и повышение капиллярной проницаемости. В результате развивается
тяжелая сосудистая недостаточность, обусловленная снижением тонуса арте-
риальных сосудов, переходом жидкости из сосудистого русла во внесосудис-
тое пространство, уменьшением ОЦП, венозного возврата и МОС.
Кардиогенный шок, в отличие от других форм шока, обусловлен
остро возникшим нарушением насосной функции сердца, которое, как и
при шоке любого другого происхождения, вызывает тяжелое нарушение кро-
вообращения в тканях. При этом в основе снижения МОС лежит либо пер-
вичное нарушение изгнания (например, при остром инфаркте миокарда,
острой митральной регургитации), либо нарушение диастолического напол-
нения (тампонада сердца, тахиаритмии и др.). В последнем случае наруше-
ние сократимости миокарда вначале отсутствует или не выражено, но зако-
номерно присоединяется при длительной артериальной гипотензии вслед-
ствие развития ишемической дисфункции миокарда.
Наиболее частой причиной кардиогенного шока является острый инфаркт
миокарда. В большинстве случаев в его основе лежит выраженная миокарди-
альная недостаточность вследствие ишемии и некроза значительной части
миокарда левого желудочка. Дальнейшее его развитие связано с рядом “по-
рочных кругов”, обусловленных усугублением ишемии и распространением
зоны некроза вследствие прогрессирующего ухудшения коронарного крово-
тока из-за длительного снижения давления в аорте, стаза проксимальнее и
дистальнее окклюзии и нарушений коронарной микроциркуляции (рис. 74).
Увеличение зоны некроза приводит к дальнейшему нарушению изгнания и
еще большему уменьшению МОС и в результате к усугублению расстрой-
ства перфузии миокарда.
Хотя для кардиогенного шока при инфаркте миокарда характерны повы-
шение КДД в левом желудочке и легочная венозная гипертензия, он не
всегда сопровождается отеком легких. Отек легких закономерно возникает в
572
Окклюзия
крупной коронорной
артерии
I
Ишемия миокарда
Рис. 74. Патогенез кардиогенного шока при остром инфаркте миокарда (по R.Ross и
соавт., 1977, с изменениями): ЛЖ — левый желудочек
случаях относительно мало измененных сократимости и насосной функции
правого желудочка. При развитии же значительной правожелудочковой дис-
функции как следствия гипоксии, ацидоза, гипоперфузии, ишемии или
инфаркта миокарда в условиях повышения давления в легочной артерии, то
есть постнагрузки, кардиогенный шок протекает без отека легких.
Нарушения гемодинамики при шоке. Единого гемодинамического профиля
шока не существует. Характер и выраженность нарушений гемодинамики у
таких больных разнообразны. В определенной мере они зависят от этиологии
шока (табл. 61), однако этим не исчерпываются.
Так, например, у больного инфарктом миокарда ведущей причиной сни-
жения МОС и нарушения периферического кровообращения может быть не
только нарушение систолического опорожнения левого желудочка, но и
573
Таблица 61. Особенности изменений гемодинамики при шоке в зависимости от этиологии*
Этиология шока "Заклиниваю- щее" дав- ление в легочных капиллярах Сердечный выброс Прочее
Кардиогенный шок вследствие: миокардиальной тт XX
недостаточности гемодинамической перегрузки остро возникшего дефекта Т или N Левого желу- Насыщение гемоглобина кисло-
межжелудочковой дочка XX родом в правом желудочке
перегородки остро возникшей ТТ Эффектив- выше, чем в правом предсердии На кривой давления в легочных
митральной регургитации ный XX капиллярах выражены волны "V"
Экстракардиальный обструктивный шок вследствие: тампонады сердца ТТ X или XX Величины среднего давления в
массивной ТЭВЛА N или 1 XX правом предсердии, КДД в правом и левом желудочках, диастолического давления в легочной артерии и "заклини- вающего" давления в легочных капиллярах равны между собой ЦВД и давление в правом
Гиповолемический шок IX XX сердце резко увеличены
Перераспределительный шок септический X или N ТТ или N,
анафилактический X или N изредка X Т или N
* Указанный гемодинамический профиль является характерным, но не строго обяза-
тельным в каждом случае.
Примечание, Т — увеличение, I — уменьшение показателя; N - норма.
уменьшение диастолического наполнения сердца в результате гемотампона-
ды (шок от разрыва сердца), гиповолемии из-за рвоты, профузного пото-
отделения и бесконтрольного применения мочегонных препаратов, а также
рефлекторное снижение сосудистого тонуса по типу рефлекса Бецольда-Яри-
ша. В первых двух случаях характерно повышение ЦВД и давления в левом
предсердии, а в 3-м и 4-м - снижение этих показателей. Уменьшение ОЦП,
патогномоничное для гиповолемического шока, отмечается также в терми-
нальной стадии кардиогенного шока. При каждой из этиологических форм
шока ОПСС может быть как увеличенным, так и неизмененным и даже
низким. Его повышение отражает распространенный спазм артериол как про-
574
явление ранней неспецифической компенсаторной реакции, которая потен-
цируется введением а-адреностимулирующих агентов. Снижение ОПСС под
местным воздействием гуморальных факторов либо центрального рефлек-
торного происхождения характерно для начальной стадии перераспредели-
тельного шока, но может отмечаться и при далеко зашедшем шоке любого
генеза как результат срыва первоначальной компенсации. Таким образом,
очевидна необходимость гемодинамического мониторинга для выявления и
дифференцированной коррекции дисфункции сердца и нарушений перифе-
рического кровообращения при всех формах шока.
Клиника шока обусловлена одновременно нарушением периферической
и внутрисердечной гемодинамики и дисфункцией органов и тканей в ре-
зультате их обратимого, а затем необратимого повреждения.
Шок является чисто клиническим синдромом, который распознается на
основании совокупности клинических признаков, каждый из которых сам
по себе неспецифичен. При этом специальные инструментальные и лабора-
торные методы не имеют существенного диагностического значения, что,
однако, ни в коей мере не умаляет их ценности для оптимизации лечения
таких больных.
Шок может развиваться остро или исподволь. Жалобы больных связаны
преимущественно с основным заболеванием. Симптомы собственно шока
отсутствуют либо неспецифичны и проявляются слабостью, нехваткой воз-
духа, иногда жаждой вследствие уменьшения объема внеклеточной жидко-
сти. У больных ИБС может возникать ангинозная боль.
Основными клиническими признаками, общими для всех форм шока, яв-
ляются изменения сознания, кожи, ослабление пульсации периферических
артерий вплоть до отсутствия, снижение АД, уменьшение диуреза, наруше-
ния дыхания.
1. Нарушения поведения и сознания. Ранними признаками
являются психомоторное возбуждение и раздражительность, обусловленные
гиперкатехоламинемией и гипоксией. По мере нарастания гипоксии, ацидо-
за и снижения мозгового кровотока развиваются апатия, сонливость и угне-
тение сознания, вплоть до комы. Выраженность нарушения сознания у от-
дельных больных значительно колеблется.
2. Изменения кожи. В результате периферического спазма кожа блед-
ная и холодная на ощупь. При надавливании на ногтевую пластинку время
наполнения капилляров ногтевого ложа удлиняется. Увеличивается разность
между температурой в прямой кишке и температурой поверхности тела. Раз-
вивается гипотермия вследствие снижения уровня обменных процессов. Эти
периферические признаки очень характерны для всех форм шока, кроме
перераспределительного, особенно инфекционного. Кожа покрыта обильным
потом, что обусловлено стимуляцией потоотделения под влиянием гиперкате-
холаминемии. По этой причине может возникать мышечная дрожь. Выражен
цианоз.
3. Изменения пульса. В зависимости от выраженности сосудосужи-
вающей реакции пульс на периферических артериях конечностей ослаблен,
575
вплоть до отсутствия. Кроме далеко зашедших случаев, этот признак сочета-
ется с более или менее сохраненной пульсацией крупных сосудов — сонных
и бедренных артерий, что отражает централизацию кровотока. Характерна
тахикардия, часто отмечаются различные аритмии.
4. Артериальная гипотензия. Является важным и постоянным при-
знаком шока, за исключением его начальной фазы, когда в случаях адекват-
ной компенсаторной вазоконстрикции уровень АД некоторое время может
сохраняться практически в пределах нормы. Критерием шока обычно счита-
ют снижение среднего АД до уровня менее 60 мм рт. ст., или, что менее
надежно, систолического — менее 90—100 мм рт. ст. При оценке величины
АД в каждом случае необходимо учитывать его обычный уровень и динами-
ку. Так, у больных, страдающих выраженной стойкой артериальной гипер-
тензией, о развитии гипотензии свидетельствует снижение среднего АД на
40 мм рт. ст. и более от исходного, даже если его абсолютная величина сохра-
няется на уровне выше 60 мм рт. ст. При тяжелом шоке АД может не опреде-
ляться, в значительной степени из-за неточности его измерения по методу
Короткова при выраженном периферическом спазме. В таких случаях жела-
тельно пользоваться прямым методом. Характерно уменьшение пульсового
давления, что часто предшествует значительному снижению систолического.
5. Тахипноэ. Вначале может быть в значительной степени обусловлено
общим психомоторным возбуждением, затем — развитием “шокового лег-
кого”. Наряду с соответствующей аускультативной картиной может быть при-
знаком кардиогенного отека легких, который у части больных возникает в
ранних стадиях заболевания.
6. Олигурия. Уменьшение диуреза менее 30 мл/ч и 500 мл/сут вплоть
до полного отсутствия (анурия) является наиболее надежным критерием
шока.
Другие клинические признаки, включая изменения наполнения перифе-
рических вен и ЦВД, в значительной мере зависят от причины шока.
Данные дополнительных методов обследования включают общие признаки
и изменения, более или менее характерные для отдельных форм шока. Об-
щие признаки неспецифичны и коррелируют с тяжестью клинического тече-
ния шока.
1. Изменения газового состава к р о в и. Характерна артериаль-
ная гипоксемия, не корригирующаяся при дыхании 100 % кислородом. РСО2
вначале снижено вследствие компенсаторной гипервентиляции, затем по
мере прогрессирования шока нарастает.
2. Изменения КОС. Характерен метаболический ацидоз, который в
начальных стадиях шока компенсируется дыхательным алкалозом, затем ста-
новится декомпенсированным и может сменяться дыхательным ацидозом.
При этом отмечаются повышение содержания лактата и снижение уровня
бикарбоната в крови.
3. Признаки острой почечной недостаточности. Включают
снижение клиренса эндогенного креатинина и увеличение содержания кре-
атинина и мочевины в плазме крови.
576
4. Гиперкалиемия. Является поздним признаком и обусловлена как
почечной недостаточностью, так и ишемическим некрозом скелетных мышц.
5. Изменения показателей свертывающей системы крови.
При определении коагулограммы и тромбоэластограммы отмечаются призна-
ки прогрессирующего диссеминированного внутрисосудистого свертывания.
Особенности клиники и диагностики отдельных форм шока. У больных с
гиповолемическим шоком могут быть признаки желудочно-кишечного кро-
вотечения, в том числе при осмотре per rectum, или указания на потерю
большого количества жидкости вследствие профузной рвоты или поноса. При
отсутствии этих проявлений нужно подумать о возможности кровотечения в
брюшную полость вследствие разрыва аневризмы брюшной части аорты, се-
лезенки или эктопической беременности. Эти заболевания часто развивают-
ся исподволь и не имеют характерных клинических проявлений. На гипово-
лемический генез шока в таких случаях указывают спавшиеся шейные вены
и вены конечностей, отсутствие дилатации сердца и признаков венозного
застоя в легких, низкое ЦВД и “заклинивающее” давление в легочных ка-
пиллярах, а также повышение гематокритного числа (признак гемоконцен-
трации). В случаях кровопотери спустя некоторое время развивается анемия,
и гематокритное число снижается. Диагноз подтверждает установление при-
чины гиповолемии.
Для инфекционно-токсического шока характерны явления бактериемии —
лихорадка, озноб, которые у ряда больных сочетаются с тошнотой, рвотой,
поносом или признаками очаговой инфекции, например, пневмонии, пие-
лонефрита, абсцесса той или иной локализации. При выраженной нейтропе-
нии очаг инфекции обычно клинически не определяется, а входными воро-
тами при сепсисе являются микротравмы кожи, слизистых оболочек или
кишечник, где активизируется собственная микрофлора. Отличительным
клиническим признаком инфекционно-токсического шока является теплая,
сухая кожа вследствие снижения ОПСС и по этой же причине — сохранение
относительно адекватного МОС при значительной артериальной гипотен-
зии — порядка 50-60 мм рт.ст. При этом может практически не нарушаться
образование мочи. По мере прогрессирования шока сердечный выброс пада-
ет, и может развиваться периферический сосудистый спазм. Обычно выраже-
ны нарушения сознания в виде начального возбуждения, сопровождающе-
гося гипервентиляцией, которое сменяется угнетением.
Из данных дополнительных методов характерны лабораторные признаки
острой бактериальной инфекции: лейкоцитоз с нейтрофилезом и сдвигом
лейкоцитарной формулы влево или, наоборот, выраженная нейтропения, а
также тромбоцитопения и признаки коагулопатии потребления (снижение
тромбинового и протромбинового индексов и др.). Диагноз устанавливают
при возникновении артериальной гипотензии и картины шока при наличии
любого инфекционного процесса. Подтвердить его позволяет выделение воз-
будителя из крови, что, однако, не всегда удается. Основными причинами
отрицательной гемокультуры являются интермиттирующий характер бакте-
риемии и предшествовавшее лечение антибиотиками.
577
Для анафилактического шока характерно острое начало и его связь с по-
ступлением в организм лекарственного препарата или укусом насекомого.
Он может вызываться любыми медикаментозными средствами и в боль-
шинстве случаев возникает при их парентеральном введении, иногда — при
ректальном или пероральном. В анамнезе, как правило, имеются указания
на различные виды аллергии - лекарственную, пищевую и др.
Больные жалуются на удушье с затрудненным выдохом и схваткообраз-
ную боль в животе вследствие спазма гладких мышц, головную боль. При
объективном исследовании может отмечаться как бледность, так и, наобо-
рот, гиперемия кожи. Часто появляются сыпь по типу крапивницы или урти-
карной, отек Квинке. Возможно развитие острого отека гортани с характер-
ным стридорозным дыханием и бронхообструктивного синдрома, проявля-
ющегося сухим кашлем, удлинением выдоха и сухими хрипами, которые
часто слышны на расстоянии. Может наблюдаться ринорея. У ряда больных
боль в животе сопровождается рвотой и поносом. Ярко выражена мозговая
симптоматика — возбуждение, сменяющееся угнетением, спутанностью со-
знания, часто потеря сознания, судороги, что связано с отеком оболочек
мозга и его ишемией. При выходе из шока обычно отмечаются озноб, лихо-
радка, резкая слабость.
Тяжесть анафилактического шока определяется продолжительностью ин-
тервала времени от момента поступления аллергена в организм до развития
шока. При этом доза аллергена не имеет существенного значения. Для наи-
более тяжелой молниеносной формы характерны резкая бледность
или цианоз, потеря сознания и остановка кровообращения и дыхания через
1-2 мин после введения препарата. Она часто заканчивается летальным ис-
ходом, а диагноз ставят ретроспективно. При тяжелой форме шока его
симптоматика развивается также достаточно бурно - через 5-7 мин. Для шока
средней степени тяжести характерен “светлый промежуток” про-
должительностью обычно до 30 мин, иногда несколько часов. В этот период
могут отмечаться продромальные явления: беспокойство, или, наоборот,
подавленность, чувство жара, головная боль, звон в ушах, загрудинная
боль, першение в горле, ринорея.
Диагноз анафилактического шока в большинстве случаев не представляет
сложности и основывывается на непосредственной связи артериальной ги-
потензии, часто в сочетании с выраженной церебральной и абдоминальной
симптоматикой, бронхо- и ларингоспазмом, с инъекцией лекарственного
препарата или укусом насекомого.
Особенностью клинических проявлений неврогенного шока является час-
тое развитие вазодилатации вследствие снижения ОПСС подобно инфекци-
онно-токсическому шоку (“теплый шок”).
Для кардиогенного шока не характерны значительные изменения созна-
ния. Периферические признаки шока и централизация кровотока ярко выра-
жены. Нарушение систолического опорожнения левого желудочка с повы-
шением его КДО и КДД обычно приводит к некоторому увеличению разме-
ров сердца и физикальным признакам венозного застоя в легких, вплоть до
578
альвеолярного отека. Появляется ритм галопа. У большинства больных отме-
чается в различной степени выраженное повышение ЦВД вследствие дис-
функции правого желудочка, обусловленной его первичным поражением либо
недостаточностью левых отделов сердца. При этом шейные вены набухшие.
Характерны также симптомы и признаки, специфические для заболевания
сердца - причины шока, например, жгучая загрудинная боль при остром
инфаркте миокарда или расслаивающей аневризме грудной части аорты, шум
митральной регургитации или дефекта межжелудочковой перегородки с ак-
центом II тона (Р2) на легочной артерии и т.д. На ЭКГ регистрируются разно-
образные нарушения сердечного ритма и проводимости, признаки ишемии
или инфаркта миокарда. При рентгенологическом исследовании важное ди-
агностическое значение имеют увеличение сердца, особенности изменения
его формы, наличие и выраженность венозного застоя в легких. Ценную
информацию относительно наличия и характера патологии сердца и круп-
ных сосудов позволяют получить эхокардиография и в ряде случаев данные
катетеризации правых отделов сердца и легочной артерии.
При остром инфаркте миокарда, который является наиболее распростра-
ненной причиной кардиогенного шока, выделяют несколько его клиничес-
ких вариантов. Согласно классификации Е.И.Чазова и соавторов (1971), к
ним относятся:
Цистинный кардиогенный ш о к. В его основе лежит резкое сни-
жение сократимости миокарда при его обширном ишемическом поврежде-
нии. Отличается тяжелым течением и неблагоприятным прогнозом, особен-
но при поздно начатом лечении;
2) аритмический кардиогенный шок. Обусловлен резким
снижением МОС вследствие тахи- и брадисистолических нарушений ритма
- пароксизмальной тахикардии и тахиаритмий, полной атриовентрикуляр-
ной блокады. При достаточно быстром купировании аритмии нарушения ге-
модинамики в значительной степени ликвидируются;
3) рефлекторный кардиогенный ш о к. Обусловлен рефлектор-
ным снижением сосудистого тонуса и брадикардией как реакцией на резкую
боль или следствием ваго-вагальных рефлексов, в частности Бецольда—Яри-
ша, при заднем инфаркте миокарда. После своевременного и адекватного
обезболивания, однократного введения а-адреностимуляторов и атропина
сульфата гемодинамика полностью восстанавливается, даже отмечается склон-
ность к гипердинамии, то есть повышению МОС при неизмененном КДД в
левом желудочке, возможно, в результате лечения;
4) ареактивный кардиогенный ш о к. Представляет собой шок в
необратимой стадии как возможный исход трех предыдущих его форм, чаще
истинного. Проявляется быстрым падением гемодинамики, тяжелой поли-
органной недостаточностью, выраженным диссеминированным внутри-
сосудистым свертыванием крови и заканчивается летальным исходом.
В качестве одного из вариантов кардиогенного шока при остром инфарк-
те миокарда Е.И.Ганелина и соавторы (1966) выделили также шок от раз-
рыва миокарда. В большинстве случаев разрыв свободной стенки
579
Таблица 62. Классификация истинного кардиогенного шока при остром инфаркте миокарда по тяжести клинического течения
(по А.И.Грицюку и соавт., 1982)
желудочка приводит к внезапной смерти, но из-
редка, при первоначально небольшом надрыве,
и относительно медленно нарастающем гемопе-
рикардите МОС, хотя и резко снижен, но какое-
то время сохраняется. Отмечается картина обстук-
тивного шока вследствие тампонады сердца.
Классификация истинного кардиогенного
шока при остром инфаркте миокарда по тяжести
клинического течения, разработанная А.И.Гри-
цюком и соавторами (1982) и дополняющая клас-
сификацию Е.И.Чазова, представлена в табл. 62.
Диагноз ставят на основании общих призна-
ков шока при наличии соответствующего заболе-
вания сердца, которое может быть его причиной.
Дифференциальный диагноз. Подход к больно-
му с шоком неизвестной этиологии представлен
на схеме 31.
Дифференциальную диагностику целесообраз-
но начинать с исключения (или подтверждения)
напряженного пневмоторакс а. При ус-
ловии соответствующей настороженности врача
это обычно не представляет сложности ввиду ха-
рактерных данных физического исследования и
рентгенографии. При угрожающем жизни пнев-
мотораксе ЦВД всегда повышено.
Важное значение для дифференциальной ди-
агностики имеет определение ЦВД. В зави-
симости от его величины больных с шоком раз-
деляют на две большие группы — со сниженным
и повышенным ЦВД. Нормальная величина этого
показателя при наличии выраженной недостаточ-
ности кровообращения обычно обусловлена соче-
танной патологией, например, острым инфарк-
том миокарда и диабетическим кетоацидозом. Если
состояние больного крайне тяжелое или резко
ухудшается, эта информация позволяет начать
дифференцированную экстренную терапию. В
случаях высокого ЦВД это инотропная поддерж-
ка, а при низком ЦВД — инфузия плазмозаме-
нителя. Если после нормализации ЦВД с помо-
щью увеличения ОЦП признаки нарушения кро-
вообращения сохраняются, это свидетельствует о
наличии дисфункции сердца и является показа-
нием для дополнительного назначения инотроп-
ного агента.
580
Шок
Исключить напряженный пневмоторакс
Измерить ЦВД
ЦВД низкое
п I
Оценить
периферическое
кровообращение
ЦВД высокое
Вены спазмированы,
конечности холодные
Тонус Вен поВышен
Вены расширены,
конечности теплые
Тонус вен снижен
Плазмозаменители
рдиогенный шок,
ктруктивный шок
Определить*
НЬ и Hi'
ониN или}
Нормализация ЦВД
Инотропная
' поддержка
Инотропная
поддержка
Геморрагический^ Шок В
шок | результате
J- шлазмопотери
Уточнить
источник
Дифференцировать:
Уточнить
источник
Пищеварительный
канал
Почки
Инфекционно-
токсический шок
Токсический шок
(Барбитураты,
опиаты и др)
Неврогенный шок
Перфорация,
перитонит,
панкреатит,
стеноз привратника,
токсический мегаколон,
энтерит,
септицемия
Диабетический
кетоацидоз,
полиурическая
стадия
почечной
недостаточности
Уточнить причину;
острый инфаркт миокарда,
нарушения ритма сердца и
проводимости,
миокардит, ДКМП,
острая аортальная
недостаточность,
стеноз устья аорты,
расслаивающая аневризма
грудной части аорты,
острая митральная
недостаточность,
митральный стеноз,
миксома предсердия,
массивная ТЭВЛА,
острая тампонада сердца
Схема 31. Подход к больному с шоком: НЬ — гемоглобин; Ht — гематокритное число;
ДКМП - дилатационная кардиомиопатия; ТЭВЛА — тромбоэмболия ветвей легочной
артерии; W - норма; ЦВД — центральное венозное давление
Одновременно с оказанием неотложной помощи продолжают обследова-
ние больного для установления причины шока и проведения этиотропного
лечения, которое в ряде случаев, например, при острой тампонаде сердца,
является единственно эффективным.
При низком ЦВД клиническая оценка состояния периферического крово-
581
обращения позволяет выделить 2 подгруппы больных: с высоким и низким
тонусом периферических вен (см. схему 31). Похолодание конечностей и спав-
шиеся вены свидетельствуют о повышенном сосудистом тонусе, характер-
ном для абсолютной гиповолемии. Для установления ее причины необходи-
мо использовать данные простого лабораторного исследования крови — оп-
ределения гемоглобина, гематокритного числа, лейкоцитоза и лейкоцитар-
ной формулы, сахара, белка и электролитов. Если величина гемоглобина и
гематокритное число не изменены или снижены, вероятной причиной шока
является острая кровопотеря. Уточнить ее источник позволяют данные анам-
неза, пальцевого исследования прямой кишки, фиброгастродуоденоскопии,
ультразвукового исследования и других специальных методов.
При повышенном гематокритном числе следует думать о потере воды,
электролитов и белков плазмы крови (при соответствующих лабораторных
данных) в пищеварительном канале или с мочой. В первом случае жидкость
может поступать в просвет кишечника и (или) брюшную полость, что чаще
всего отмечается при перфорации желудка или кишечника, перитоните, ост-
ром панкреатите, дизентерии, токсическом мегаколоне и септицемии. Диффе-
ренциальная диагностика этих заболеваний основывается на их характерных
клинических признаках и данных дополнительных методов исследования.
Значительная потеря жидкости почечного генеза может отмечаться при ди-
абетическом кетоацидозе и в полиурической стадии почечной недостаточности.
Диагностировать эти причины не представляет сложности на основании кли-
нических и лабораторных данных. Необходимо иметь в виду, что нормальные
величины гематокритного числа могут маскировать его повышение у больных
с тяжелой хронической анемией после потери большого количества воды и
электролитов. Даже если причина гиповолемии в таких случаях первоначально
окажется нераспознанной, это не повлияет на тактику неотложной помощи.
Острая недостаточность кровообращения, сопровождающаяся повышен-
ным ЦВД, указывает на вероятный кардиогенный или обструктивный ге-
нез шока. Их причинами являются заболевания левых и правых отделов сер-
дца, аорты, сосудов легких и перикарда, среди которых наиболее часто встре-
чаются острый инфаркт миокарда и массивная ТЭВЛА. При возникновении
затруднений в постановке диагноза следует последовательно оценить воз-
можность каждой из более редких возможных причин: расслаивающей анев-
ризмы аорты, порока аортального и митрального клапанов, миокардита,
кардиомиопатии, миксомы левого предсердия, инфаркта правого желудоч-
ка, тампонады сердца, нарушения ритма.
Острый инфаркт миокарда левого желудочка диагности-
руют на основании характерной клиники и изменений ЭКГ. Необходимо
иметь в виду, однако, что электрокардиографические признаки ишемии и
даже некроза могут быть вторичными, то есть следствием шока, или обус-
ловленными другими тяжелыми заболеваниями, например, ТЭВЛА. Диаг-
ноз инфаркта миокарда подтверждается повышением активности кардио-
специфических ферментов, а в спорных случаях — данными сцинтиграфии
миокарда с "mTc. С учетом особенностей гемодинамического профиля следует
582
иметь в виду возможность одновременного инфарцирования правого желу-
дочка. В таких случаях не бывает отека легких, а активная мочегонная тера-
пия усугубляет нарушения гемодинамики.
Для массивной ТЭВЛА характерно острейшее развитие артери-
альной гипотензии, которая обычно сопровождается резкой одышкой, у
больного с признаками тромбоза глубоких вен нижних конечностей. По-
ставить предварительный диагноз помогают данные ЭКГ, ЭхоКГ и кате-
теризации правых отделов сердца и особенно — сканирования легких.
Несмотря на высокую информативность радионуклидного метода, для
верификации диагноза массивной ТЭВЛА как причины шока и решения
вопроса о целесообразности срочной эмболэктомии необходима рентге-
ноконтрастная ангиопульмонография.
Острое расслоение грудной части аорты можно заподоз-
рить при наличии резко выраженного болевого синдрома, который часто со-
провождается признаками сдавления некоторых ветвей аорты, склонностью
к брадикардии и протодиастолическим шумом. Подтвердить диагноз помога-
ют данные рентгено- и эхокардиографии. Для верификации диагноза и опре-
деления показаний к хирургическому лечению требуется аортография.
Острая аортальная и митральная регургитация вслед-
ствие инфекционного эндокардита (митральная также при инфаркте мио-
карда и пролапсе митрального клапана) и выраженный стеноз устья аорты у
больного с шоком могут представлять значительную трудность для диагно-
стики. Это обусловлено тем, что шумы и другие признаки этих пороков при
снижении МОС значительно уменьшаются, а дилатация сердца обычно от-
носительно слабо выражена. Распознать эти заболевания помогают эхокар-
диография и допплеровское исследование. Пусковым фактором в развитии
кардиогенного шока при стенозе устья аорты обычно является остро воз-
никшая тахисистолическая аритмия. Во всех этих случаях шок обычно проте-
кает с тяжелым отеком легких.
Развитие шока может вызывать также резкое усугубление нарушения из-
гнания крови из левого желудочка при обструктивной гипертро-
фической кардиомиопатии, связанное с гиповолемией, тахисисто-
лической аритмией или артериальной гипотензией.
Редкими причинами кардиогенного шока являются тяжелый неревмати-
ческий и ревматический миокардит и дилатационная кардио-
миопатия. Диагноз ставят с учетом особенностей клинической картины и
данных ЭхоКГ, но ввиду их неспецифичности только после исключения
других возможных причин недостаточности кровообращения.
Вызывая нарушение диастолического наполнения, острые тахиарит-
мии могут приводить к развитию кардиогенного шока при любых заболе-
ваниях, сопровождающихся дисфункцией левого желудочка, а также при
митральном стенозе. Диагноз устанавливают после клинического и электро-
кардиографического исследований.
Тампонада сердца является не частой, но важной причиной шока,
так как,будучи нераспознанной, связана с высокой летальностью, в то время
583
Таблица 63. Дифференциально-диагностические признаки преренальной олигурии и острого некроза
почечных канальцев при шоке
Показатель Физиологическая Пререиальная Острый иск-
олигурия олнгурня роз канальцев
Уровень Na* в моче, ммоль/л <10 <25 >25
Относительная плотность мочи >1024 >1015 <1015
Осмолярность мочи : >2,5:1 >1,8:1 -1:1
осмолярность плазмы крови Мочевина мочи : >100:1 >20:1 -3:1
мочевина плазмы крови Цилиндрурия Редко Редко Часто
как своевременный перикардиоцентез дает разительный эффект. Заподоз-
рить это заболевание позволяет резко повышенное ЦВД, как правило, более
300 мм вод.ст., увеличивающееся на вдохе. Часто, но не всегда, отмечаются
значительная кардиомегалия и парадоксальный пульс. Особенности измене-
ний кардиогемодинамики — см. табл. 61. Диагноз подверждают данные ЭхоКГ.
Изредка к развитию обструктивного шока могут приводить о п ухо л и
сердца, особенно миксомы предсердий, а также их шаровидные
тромбы при субтотальной обтурации атриовентрикулярных отверстий. Высо-
коинформативным методом диагностики является эхокардиография.
Осложнения. Тяжелые осложнения шока развиваются довольно рано, даже
при небольшом запоздании в лечении и недостаточно активном его прове-
дении. В их основе лежат распространенные прогрессирующие расстройства
микроциркуляции самых различных органов и тканей, которые и обуслов-
ливают необратимость шока.
Наиболее частыми общими осложнениями шока являются:
1) полиорганная недостаточность:
а) острая дыхательная недостаточность вследствие респираторного дист-
ресс-синдрома (“шокового легкого’’). Характерны одышка, физикальные и
рентгенологические признаки интерстициального отека легких и множе-
ственных ателектазов альвеол, выраженная артериальная гипоксемия, в да-
леко зашедших случаях - также гиперкапния;
б) острая почечная недостаточность. Отличительные признаки ее причин
— преренальной олигурии и острого некроза почечных канальцев - пред-
ставлены в табл. 63;
в) острая сердечная недостаточность (при не кардиогенном шоке). О ее
развитии свидетельствуют дилатация полостей левого и часто также правого
желудочков, повышение “заклинивающего” давления в легочных капилля-
рах, а также сохранение артериальной гипотензии и периферических при-
знаков шока, несмотря на восстановление нормального ЦВД с помощью
плазмозаменителей;
г) печеночная недостаточность. Обусловлена некрозом гепатоцитов вслед-
ствие гипоперфузии. Повреждение купферовских клеток приводит к нару-
шению детоксикационной функции печени, что способствует рециркуля-
584
ции инфекционных возбудителей при инфекционно-токсическом шоке, а
также попавшей в кровь микрофлоры из кишечника. Нарушается и синтез
факторов свертывания крови. При лабораторном исследовании отмечается
повышение активности печеночных ферментов АЛТ и ACT, иногда гипер-
билирубинемия;
2) синдром диссеминированного внутрисосудистого
свертывания крови способствует развитию тромбозов и инфарктов
органов и повышенной кровоточивости;
3) острые эрозии и язвы желудка и кишечника. Связа-
ны с гиперкатехоламинемией и ишемией слизистой оболочки, могут слу-
жить причиной тяжелых кровотечений, развитию которых способствует дис-
семинированное внутрисосудистое свертывание;
4) гангрена мягких тканей дистальных отделов конечностей как ре-
зультат их необратимой ишемии;
5) инфаркт миокарда и других органов;
6) нарушения ритма сердца вследствие нарушений электролит-
ного баланса и КОС.
Для анафилактического шока характерны также специфические поздние
осложнения аллергического генеза: миокардит, гепатит, гломерулонефрит,
невриты.
Лечение шока по возможности необходимо проводить в специализиро-
ванных отделениях (БРИТах). Его успех в значительной степени зависит от
быстроты оказания помощи. Лечение включает: 1) общие срочные мероприя-
тия, направленные на восстановление и поддержание МОС до уточнения
причины шока; 2) специфическое лечение в зависимости от этиологии. Пер-
вая задача подразумевает обеспечение адекватного кровотока жизненно важ-
ных органов — головного мозга, сердца и органов-мишеней — почек, лег-
ких, печени. Критериями ее решения могут служить: а) поддержание сред-
него АД выше 60 мм рт.ст. у нормотоников; б) восстановление более или
менее адекватного диуреза. Следует подчеркнуть, что желательный уровень
АД — это минимально необходимый для адекватного диуреза. Стремление
достичь как можно более высокой его величины у таких больных является
порочным, так как связанное с этим повышение постнагрузки закономер-
но влечет за собой снижение МОС, что при наличии левожелудочковой
недостаточности может приводить к развитию отека легких. В случаях исход-
но повышенного ОПСС усугубление вазоконстрикции вызывает еще боль-
шее ухудшение периферического кровотока и микроциркуляции.
Одновременно с началом лечения налаживают постоянный мониторный
контроль ЭКГ и ЧСС, желательно АД и ЦВД прямым способом, почасовое
измерение диуреза с помощью постоянного мочевого катетера. Определяют
также динамику ряда показателей, необходимых для контроля его эффек-
тивности. К ним относятся показатели газового состава артериальной крови,
КОС, свертывающей системы крови, состав электролитов. Весьма желатель-
но определение МОС методом термодилюции и давления в легочной арте-
рии или “легочных капиллярах”.
585
Установление диагноза шока
Общие срочные мероприятия:
1. Купирование боли и Возбуждения
2. Ингаляция кислорода, обеспечение адекватной
вентиляции с помощью мвл по показаниям
3. Коррекция КОС и гипокалиемии
Срочная коррекция нарушений гемодинамики
♦
Нормализация ЦВД
при сохранении_____
признаков шока
•инотропная
поддержка ftjcc+ji -
адреностимуляторами
'оптимизация ЧСС
при брадикардии
морщин
f ОЦП-диуретики
дыхание под
положительным
давлением на
Выдохе
•вазодилататоры
(♦ адреностимуляторы,
+плазмозаменители)
•Контрпульсация
• инотропная
поддержка
р - адреностимуляторами
— отек купирован
Схема 32. Тактика
дифференцирован-
ного лечения шока:
ИВЛ — искусственная
вентиляция легких;
КОС - кислотно-
основное состояние;
ОЦП - объем цир-
кулирующей плазмы;
ДВС - диссемини-
рованное внутрисосу-
дистое свертывание
крови; ЦВД - цент-
ральное венозное дав-
ление
5. Глюкокортикостероиды
б.Прощилактика и лечение поражений
других органов и систем:
ДВС, „шоковой почки", „шокового легкого" и др.
Уточнение причины шока
Специфическое этиотропное лечение
586
Тактика дифференцированного лечения шока в порядке его проведения
представлена на схеме 32. Его начинают с общих срочных мероприятий, ко-
торые проводят параллельно с дообследованием в целях установления при-
чины шока и оценки его тяжести.
1. Купирование боли и возбуждения. Уменьшает стресс и тем
самым активность симпатической части вегетативной нервной системы и
выброс катехоламинов надпочечниками, которые играют существенную роль
в патогенезе заболевания.
2. Коррекция гипоксемии путем ингаляции кислорода через но-
совые катетеры или маску. Содержание кислорода в дыхательной смеси дол-
жно быть в пределах 40-60 %, так как чистый кислород усугубляет повреж-
дение альвеоло-капиллярных мембран. При неадекватной вентиляции (РО2
меньше 60 мм рт.ст. на фоне дыхания кислородом и (или) РСО2 больше
60 мм рт.ст.) показан перевод на ИВЛ.
З.Коррекция КОС. Проводится обычными способами при метаболи-
ческом ацидозе с помощью инфузии натрия гидрокарбоната, при метаболи-
ческом алкалозе — аммония хлорида, дыхательном ацидозе— путем ИВЛ.
Ранняя коррекция гипоксии и ацидоза имеет важное значение, так как спо-
собствует уменьшению периферического сосудистого спазма, улучшению
сократимости миокарда, устранению аритмий. Антиаритмический эффект
дает и нормализация уровня калия в крови при гипокалиемии.
4. Срочная коррекция нарушений гемодинамики. Прово-
дится с учетом уровня ЦВД и патогенеза шока.
При низком ЦВД вследствие абсолютной или относительной гипово-
лемии лечение начинают с восполнения ОЦП, которое проводят под контро-
лем ЦВД до его нормализации - 120-140 мм вод.ст. Достигаемое этим восста-
новление адекватного венозного притока способствует повышению МОС и
АД и тем самым ликвидации рефлекторным путем шокового спазма сосудов.
При коррекции абсолютной гиповолемии стремятся обеспечить воспол-
нение дефицита той жидкой среды организма, потеря которой вызвала шок,
и в объеме, равном величине этой потери. При этом учитывают изменения
вязкости крови, функциональное состояние миокарда и тонус перифери-
ческих вен.
При уменьшении кровотока вязкость крови резко повышается и нахо-
дится в экспоненциальной зависимости от величины гематокритного числа.
Этому способствует свойственная шоку гиперфибриногенемия. Улучшение
реологических свойств крови достигается с помощью гемодилюции, которая
в условиях гипоперфузии обеспечивает и лучшую кислородтранспортную
функцию крови. С учетом этого фактора оптимальным является поддержа-
ние гематокритного числа на уровне около 30 %. Транспорт кислорода тка-
ням начинает страдать при его величинах менее 27—28 %, что в случаях
кровопотери свидетельствует о дефиците более 1,5 л крови и служит показа-
нием для гемотрансфузии. При более высоком гематокритном числе воспол-
нение проводят с помощью коллоидных растворов (плазмозаменителей),
обычно в сочетании с кристаллоидами.
587
Коллоидные растворы долго - до 1 сут и даже более - циркулируют в
крови и, будучи гиперосмолярными, способствуют перемещению воды из
тканей в сосудистое русло и ее длительному сохранению. К ним относятся
растворы декстрана — более высокомолекулярный полиглюкин (декстран 70)
и низкомолекулярный реополиглюкин (декстран 40), а также гемодез, плазма
крови, альбумин и желатиноль. Принято считать, что в отличие от полиглю-
кина, являющегося “чистым” плазмозаменителем, реополиглюкин обладает
не зависящей от гемодилюции способностью уменьшать агрегацию формен-
ных элементов и улучшать реологические свойства крови. Гемодез содержит
6 % низкомолекулярного поливинилпирролидона, Na+, К+, Са2+, Mg2+ и
СГ. Вступая в соединения с циркулирующими в крови токсинами, препарат
способствует их выведению почками, чем достигается дезинтоксикацион-
ный эффект. Выделяется за 4-5 ч. В связи с высокой осмолярностью колло-
идных растворов на каждые 500 мл рекомендуется вводить 1 л солевого ра-
створа. При инфузии в больших количествах - свыше 1—1,5 л, особенно при
олигурии, может возникать повреждение почечных канальцев вследствие
гиперосмолярности мочи.
Для восполнения ОЦП при шоке используют и кристаллоиды, к кото-
рым относятся изотонический раствор натрия хлорида и другие солевые ра-
створы, и 5 % раствор глюкозы. Большая часть этих растворов быстро пере-
ходит из сосудистого русла в интерстициальное пространство, а оставшаяся
разжижает кровь, уменьшая ее вязкость. В связи с коротким плазмозамеща-
ющим действием кристаллоидов их вводят в объеме, в 3-4 раза большем
величины дефицита ОЦП, что требует тщательного контроля ЦВД.
Скорость инфузии плазмозаменителя и общий объем восполнения опре-
деляются величиной потери ОЦП, клиническим состоянием больного и ди-
намикой ЦВД. При необходимости быстрого вливания все растворы следует
нагревать до температуры тела.
Оценка фактического ОЦК и его дефицита с помощью радионуклидных
методов у больных с шоком нецелесообразна, так как полное восполнение
этого дефицита привело бы к резкому повышению ЦВД и тяжелым наруше-
ниям гемодинамики. Это обусловлено: 1) значительным уменьшением ем-
кости венозной системы из-за выраженного периферического сосудистого
спазма вследствие гипоксии и ацидоза; 2) развивающейся при шоке миокар-
диальной недостаточностью, из-за чего увеличение преднагрузки свыше оп-
ределенного уровня может приводить к выраженной легочной венозной ги-
пертензии и даже снижению МОС. Возникновению “синдрома перевоспол-
нения” способствует также исходная дисфункция миокарда. Действие этих
факторов приводит к тому, что восстановления нормального ЦВД с помо-
щью плазмозаменителей часто оказывается недостаточно для полной ликви-
дации нарушений периферического кровообращения. Для решения этой за-
дачи, наряду с продолжением коррекции гипоксии и ацидоза, показана ино-
тропная поддержка, а при сохранении, несмотря на это, периферического
спазма — добавление вазодилататоров в сочетании с плазмозаменителями
(см. ниже).
588
При перераспределительном шоке, характеризующемся низким сосудис-
тым тонусом, коррекцию нарушений гемодинамики также начинают с уве-
личения венозного подпора сердца с помощью плазмозаменителей до нор-
мализации величины ЦВД. В результате АД повышается, но не нормализует-
ся, что связано с низким ОПСС. В таких случаях попытки полностью ликви-
дировать артериальную гипотензию путем продолжения инфузионной тера-
пии до значительного увеличения ЦВД являются частой ятрогенной причи-
ной отека легких. Как и при гиповолемическом шоке, следующим шагом
является назначение а-, 0-адреностимуляторов.
При высоком ЦВД, характерном для кардиогенного и обструктив-
ного шока, срочную, до уточнения причины шока, коррекцию нарушений
гемодинамики проводят с учетом наличия или отсутствия отека легких.
При отсутствии отека легких лечение направлено на повышение снижен-
ного МОС (см. схему 32).
1. Инотропная поддержка. Желательно использовать препараты,
не повышающие ОПСС, то есть р- или а-,р-адреностимуляторы. Лечение
обычно начинают с назначения допамина в дозе до 6—7 мкг/кг/мин, при
недостаточном эффекте добавляют добутамин (2—10 мкг/кг/мин). Если и
при этом сохраняется олигурия менее 0,5 мл/кг/ч и (или) артериальная ги-
потензия (систолическое АД ниже 80 мм рт.ст.), дополнительно назначают
адреналин в дозе от 0,01 до 0,4 мкг/кг/мин. Реже вместо адреналина исполь-
зуют норадреналин (до 5—7 мкг/кг/мин). При инфекционно-токсическом
шоке для стабилизации гемодинамики часто требуются большие дозы адре-
налина - до 2 мкг/кг/мин. При склонности к брадикардии инотропным пре-
паратом выбора является изопротеренол (от 0,007 до 0,07 мкг/кг/мин).
Перед назначением вазопрессорных аминов необходимо убедиться в от-
сутствии абсолютной или относительной гиповолемии. При малейших со-
мнениях рекомендуется дробное — по 50—100 мл — внутривенное капельное
введение плазмозаменителя (низкомолекулярного декстрана) под контро-
лем АД, ЧСС и ЦВД, которое прекращают при появлении первых призна-
ков венозного застоя в легких и заметного повышения ЦВД. Более надеж-
ным критерием является величина “заклинивающего” давления в легочных
капиллярах, примерно соответствующая КДД в левом желудочке. Инфузион-
ную терапию проводят до нормализации этого показателя. При остром инфарк-
те миокарда, которому свойственно нарушение диастолического расслабле-
ния миокарда левого желудочка вследствие ишемии, оптимальным является
поддержание более высокого уровня — 18—20 мм рт.ст. В ряде случаев кардио-
генного шока, когда гемодинамический профиль больного соответствует
точке на восходящей части кривой Франка-Старлинга, дозированное уве-
личение преднагрузки может обеспечить некоторое повышение МОС.
Неблагоприятным эффектом инотропных аминов является “цена”, ко-
торую приходится платить за увеличение МОС. Это повышение потребности
миокарда в кислороде, что способствует быстрейшему истощению в нем
запасов макроэргов, а при инфаркте миокарда - увеличению его зоны. При
применении больших доз симпатомиметических аминов, кроме того,
589
происходит усугубление периферического спазма, ишемии органов и роста
ОПСС вследствие преобладания а-адреностимулирующего действия над Р-
адреностимулирующим. По этой причине смешанные а-, р-адреностимуля-
торы стараются использовать в минимальных дозах для поддержания пре-
дельного АД, достаточного для обеспечения адекватной перфузии миокарда
и диуреза. Для повышения инотропного эффекта и нивелировки избыточной
вазоконстрикции эти препараты сочетают с периферическими вазодилатато-
рами. Применение “чистых” а-адреностимуляторов (мезатон) ограничива-
ется редкими случаями рефлекторного шока в результате первичного сни-
жения ОПСС при практически неизмененных МОС и ЦВД.
При острой сердечной недостаточности у больных с шоком, как и в слу-
чаях отека легких без шока, сердечные гликозиды по своей эффективности
значительно уступают симпатомиметическим аминам. Это отчасти обуслов-
лено тем, что в условиях выраженной активации симпатико-адреналовой
системы сила и скорость сокращений сохранивших свою жизнеспособность
мышечных волокон и так предельно повышена. Препараты могут оказывать
также заметное периферическое сосудосуживающее действие и вследствие
увеличения тонуса коронарных артерий уменьшать коронарный кровоток.
Из-за гипоксии, гипокалиемии и ацидоза широта их терапевтического дей-
ствия существенно суживается. Основным показанием к применению сердеч-
ных гликозидов у таких больных являются суправентрикулярные аритмии.
В целом чем хуже функция миокарда, тем менее выражена его реакция на
инотропные агенты, что обусловлено меньшей массой жизнеспособного
миокарда.
2.Оптимизация ЧСС. Показано, что при значительной дисфункции
сердца МОС линейно возрастает с увеличением ЧСС до 100 в 1 мин, умень-
шаясь при более выраженной тахикардии. Увеличение ЧСС до оптимального
уровня в случаях брадикардии достигается с помощью введения атропина
сульфата или, что более надежно, учащающей предсердной электрокардио-
стимуляции.
3. Периферические вазодилататоры при шоке применяют в
сочетании с симпатомиметическими средствами для обеспечения оптималь-
ного положительного инотропного эффекта одновременно с улучшением
кровообращения и микроциркуляции в тканях. Нивелируют избыточную ва-
зоконстрикцию при применении средних и более высоких доз адреностиму-
ляторов. Непременным условием назначения вазодилататоров является пол-
ное восполнение ОЦП. Используют нитропрепараты — натрия нитропруссид
и нитроглицерин, а также ганглиоблокаторы в виде длительной внутривен-
ной инфузии, а после достижения относительной стабилизации гемодина-
мики — ингибиторы АПФ внутрь, начиная с минимальных доз. Скорость
инфузии вазодилататоров регулируется одновременно с корректировкой дозы
симпатомиметических аминов так, чтобы поддерживать минимально адек-
ватный уровень АД и диуреза. Это достигается также сохранением достаточ-
ной преднагрузки, для чего ввиду вызываемого вазодилататорами увеличе-
ния емкости венозного русла дополнительно дробно вводят плазмозамени-
590
тели под контролем клинических показателей, ЦВД и желательно “закли-
нивающего” давления в легочных капиллярах.
4. Контрпульсация. Проводится с помощью специального баллончи-
ка, который вводят в грудную часть аорты через бедренную артерию. Синхро-
низируясь с ЭКГ, он раздувается газом во время диастолы, сразу после
закрытия аортального клапана, что обеспечивает повышение перфузионно-
го давления и кровотока в коронарной системе. К началу систолы баллончик
автоматически сдувается, способствуя уменьшению постнагрузки и увели-
чению УОС при снижении потребления миокардом кислорода. При этом МОС
возрастает на 10—20 %, а в случаях митральной регургитации и дефекта меж-
желудочковой перегородки - еще больше вследствие увеличения доли УОС,
поступающей в аорту. Недостатком метода является полное исчезновение
положительного эффекта после прекращения процедуры. В связи с этим в
настоящее время область применения контрпульсации ограничивается глав-
ным образом поддержанием гемодинамики на период подготовки к хирур-
гическому лечению отдельных больных с острой митральной регургитаци-
ей, дефектом межжелудочковой перегородки и острым инфарктом миокар-
да, а также при кардиогенном шоке в ранний послеоперационный период
после кардиохирургических вмешательств.
Лечение кардиогенного шока, протекающего с отеком легких, включает
следующие средства.
1. Морфина гидрохлорид.
2. Уменьшение ОЦП с помощью мощного мочегонного препарата
(фуросемид по 40—80 мг). При этом необходимо учитывать, что одновре-
менно происходит уменьшение преднагрузки, которые может вызывать сни-
жение МОС, иногда значительное. По этой причине мочегонные препараты
не показаны для коррекции повышенного ЦВД при отсутствии отека легких.
Неблагоприятным гемодинамическим последствием уменьшения ОЦП яв-
ляется также рефлекторное повышение ОПСС и ЛСС.
З. Нитропрепараты. Действие натрия нитропруссида и нитроглицери-
на на гемодинамику таких больных выгодно отличается от такового моче-
гонных препаратов благодаря их способности расширять венозные и артери-
альные сосуды и повышать МОС. Однако это достигается путем усугубления
артериальной гипотензии и в значительной части случаев еще большего сни-
жения перфузионного давления в коронарных артериях.
4. ИВЛ под положительным давлением на выдохе. Ее пре-
имуществом перед гемодинамическим эффектом нитратов является более
выраженное положительное влияние на МОС за счет резкого уменьшения
расхода кислорода на работу дыхательных мышц. Интубацию трахеи и прове-
дение ИВЛ под положительным давлением на выдохе у таких больных сле-
дует начинать незамедлительно при отсутствии заметного эффекта от введе-
ния мочегонных препаратов и ингаляции кислорода.
5. Инотропная поддержка р-или а-, р-адреностимуляторами. На-
правлена на предотвращение падения МОС, которое может быть связано с
перечисленными выше мероприятиями, и его дальнейшее повышение.
591
Среди общих методов неотложной терапии шока введение глюкокор-
тикостероидов имеет второстепенное значение. Защитное действие, ко-
торое приписывается большим дозам этих препаратов (до 1000 мг преднизо-
лона в сутки), связано со стабилизацией клеточных и лизосомальных мемб-
ран, ингибированием вазоконстрикторного действия катехоламинов и по-
ложительной динамикой фагоцитарной функции макрофагов. В настоящее
время их эффективность при шоке подвергается сомнению, за исключением
анафилактического шока и острой надпочечниковой недостаточности.
Профилактика и лечение связанных с шоком поражений органов и систем
предусматривает следующие методы.
1. Профилактику и лечение диссеминированного внут-
рисосудистого свертывания крови проводят с помощью дли-
тельной внутривенной инфузии гепарина.
2 . При “шоковой п о ч к е”, то есть острой почечной недостаточности в
стадии преренальной олигурии, нормализация диуреза часто достигается вос-
полнением ОЦП. Если, несмотря на ЦВД, равное 130-150 мм вод.ст., этого
не происходит, для снятия спазма почечных артериол с успехом используют
малые, диуретические, дозы допамина (2-4 мкг/кг/мин). Эффективны так-
же осмотические диуретики (маннитола 25—30 % раствора около 25 г) и фу-
росемид (до 200 и даже 1000 мг в сутки). Обеспечение достаточного диуреза
помогает предотвратить острый некроз почечных канальцев. Если же он раз-
вивается, во избежание отека легких ограничивают поступление в организм
жидкости, а для получения мочи приходится прибегать к перитонеальному
диализу или гемодиализу.
3. Для лечения “шокового легкого” проводят дыхание под положи-
тельным давлением на выдохе, в случаях резко выраженной артериальной
гипоксемии и отека легких — с помощью ИВЛ. Это позволяет “открыть”
ателектазированные альвеолы и, обеспечив их вентиляцию, уменьшить вели-
чину легочного венозного шунта. При этом следует учитывать возможность
снижения МОС. Для уменьшения проницаемости альвеоло-капиллярных мем-
бран эффективны большие дозы глюкокортикостероидов. При использова-
нии коллоидов, в частности, альбумина, для повышения онкотического дав-
ления плазмы крови необходимо иметь в виду возможность их “утечки” в
интерстициальную ткань легких и усугубления интерстициального отека.
Увеличение осмотического давления достигается с помощью фуросемида.
Установление этиологии шока позволяет, наряду с общими мероприяти-
ями, проводить также специфическое лечение. При инфекционно-ток-
сическом шоке оно заключается в возможно более раннем примене-
нии больших доз соответствующих антибиотиков. При олигурии и анурии
необходимо оценить возможность абсолютной гиповолемии, для коррекции
которой в случаях вероятных потерь белка используют инфузию плазмы крови.
Несмотря на отсутствие повышения ЦВД следует подумать о возможной
острой сердечной недостаточности и своевременно обеспечить инотропную
поддержку. Эффективность применения больших доз глюкокортикостерои-
дов в последнее время оспаривается.
592
Тактика лечения анафилактического шока имеет ряд особенно-
стей. Она предусматривает:
1) прекращение дальнейшего поступления аллергена в организм. В этих
целях проксимальнее места инъекции или укуса можно наложить жгут на
20—30 мин или обколоть его раствором адреналина гидрохлорида;
2) введение а-, р-адреностимулятора адреналина гидрохлорида . Путем
возбуждения соответствующих рецепторов он способствует сужению пери-
ферических сосудов, дает положительный ино-, хронотропный и бронходи-
латирующий эффект. Повышая внутриклеточное содержание цАМФ, адре-
налин предотвращает дальнейшее освобождение гистамина из тучных кле-
ток и базофилов и выделение лизосомальных ферментов из нейтрофилов во
время фагоцитоза. Назначают дробно по 0,3—0,5 мл 0,1 % раствора внутри-
венно струйно с переходом на инфузию до стабилизации гемодинамики;.
3) введение антигистаминных препаратов. Используют в основном для
ликвидации кожных проявлений аллергии;
4) купирование бронхоспазма. Применяют эуфиллин, который, будучи
ингибитором фосфодиэстеразы, обладает также другими полезными в дан-
ной ситуации свойствами;
5) введение глюкокортикостероидов. Направлено на уменьшение прони-
цаемости мембран и предотвращение экстравазации внутрисосудистой жид-
кости и белков, купирование бронхоспазма, а также предупреждение позд-
них аллергических осложнений шока. Дозы и кратность введения зависят от
тяжести состояния больного.
При кардиогенном шоке у больных острым инфарктом
миокарда тяжесть и исход которого в значительной степени определяют-
ся массой некротического очага, важное значение имеет восстановление ко-
ронарной перфузии для спасения миокарда, находящегося в состоянии глу-
бокой, но потенциально обратимой ишемии. В этих целях по показаниям
применяют тромболитическую терапию, раннюю коронарографию и, в за-
висимости от характера поражения артерий, “раннюю” ТЛАП или аортоко-
ронарное шунтирование. Такой активный подход способствует снижению
летальности, по некоторым данным, с 90 до 60 % (см. главу 9).
В случаях кардиогенного шока, развившегося вследствие остро
возникшей митральной или аортальной регургитации
либо дефекта межжелудочковой перегородки, показана хи-
рургическая коррекция порока. Ее производят также при расслаиваю-
щей аневризме грудной части а о р т ы, хотя при этом наблюда-
ется очень высокая летальность. Необходимо иметь в виду, что у ряда таких
больных причиной шока может быть тампонада сердца вследствие кровоте-
чения в полость перикарда, которая требует соответствующего лечения.
При аритмическом кардиогенном шоке залогом успеха яв-
ляется возможно более раннее купирование нарушения ритма. При парок-
сизмальных тахикардиях и тахиаритмиях методом выбора является электро-
импульсная терапия, а при брадисистолических аритмиях - элекгрокардио-
стимуляция.
593
Наиболее эффективным путем повышения МОС при обструктивном
шоке вследствие массивной ТЭВЛА является уменьшение ве-
личины препятствия кровотоку в легких. В этих целях используют терапевти-
ческие и хирургические методы (см. также главу 13). Медикаментозное лече-
ние включает:
1) увеличение объема внутрисосудистой жидкости с помощью введе-
ния плазмы крови. Это позволяет: а) максимально заполнить сохранив-
шую проходимость часть сосудистого русла легких и тем самым снизить
его сопротивление за счет функционального компонента; б) посредством
повышения давления в правом предсердии и желудочке (преднагрузки) уве-
личить МОС. Поскольку давление в левом предсердии значительно ниже,
чем в правом, угроза отека легких при этом, как правило, не возникает.
Отек легких может, однако, развиться позже, после восстановления крово-
тока, как результат повреждения базальной мембраны капилляров при ма-
лоизмененном гидростатическом давлении в них;
2) инотропную поддержку р- или а-адреностимуляторами. Обеспечивает
повышение выброса правого желудочка и тем самым увеличение кровотока
в легких;
3) ингаляцию кислорода.
У части больных эти меры позволяют добиться временной стабилизации
гемодинамики до завершения спонтанного тромболизиса. При отсутствии
эффекта для ускорения этого процесса проводят тромболитическую терапию
стрептокиназой или другими препаратами (подробнее см. главу 13), а при ее
безуспешности выполняют эмболэктомию. В случаях резко повышенного —
свыше 15 мм рт.ст. — давления в правом предсердии, что свидетельствует о
крайней неустойчивости гемодинамики, показано безотлагательное хирур-
гическое вмешательство.
При лечении обструктивного шока у больных с ТЭВЛА не менее важно
избегать мероприятий, которые приводят к снижению давления наполнения
правого желудочка и усугублению повышения ЛСС. Такой отрицательный
гемодинамический эффект дают мочегонные препараты, вазодилататоры,
кровопускание, перевязка полой вены, а также наркоз и введение контраст-
ного вещества при ангиопульмонографии.
Единственно эффективным средством лечения обструктивного
шока в результате острой тампонады сердца является сроч-
ная эвакуация жидкости из перикарда. Ее выполняют обычно с помощью
пункции через иглу или катетер, иногда, при возникновении затруднений
или подозрении на продолжающееся кровотечение, - путем дренирования
оперативным путем. Увеличение ОЦП с помощью плазмозаменителей и ино-
тропная поддержка позволяют добиться лишь небольшого и временного
улучшения гемодинамики на время подготовки к манипуляции (см. также
главу 14).
Прогноз определяется главным образом причиной шока. Так, например,
даже при самом активном лечении часто не удается компенсировать необрати-
мое повреждение значительной части миокарда при его обширном инфаркте.
594
Летальность при этом до сих пор составляет около 85-90 %. С другой сторо-
ны, при шоке, развившемся вследствие острой тампонады сердца, прогноз
значительно лучше. Важное значение для исхода имеет также состояние
периферического кровообращения, прежде всего, микроциркуляции, и ок-
сигенации тканей. Обратимость нарушений в значительной мере зависит от
фактора времени.
Профилактика шока предусматривает предотвращение, раннюю диагнос-
тику и активное лечение заболеваний, которые могут быть его причинами.
ГЛАВА 13.
ЗАБОЛЕВАНИЯ МАЛОГО КРУГА КРОВООБРАЩЕНИЯ
ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ
Критерием легочной гипертензии считается повышение систолического дав-
ления в легочной артерии более 30 мм рт.ст. или среднего более 20 мм рт.ст. В
отличие от системной артериальной гипертензии, причина которой в боль-
шинстве случаев остается неизвестной, повышение давления в легочной ар-
терии является распространенной реакцией сосудов легких на различные за-
болевания сердца и других органов. Идиопатическая, то есть неясной этио-
логии, легочная гипертензия встречается редко. При резко выраженной ле-
гочной гипертензии давление в легочной артерии может становиться выше
системного, однако обычно не превышает 150 мм рт.ст.
Этиология. В зависимости от того, в какой части сосудистого русла легких
происходит первичное повышение давления, различают венозную, или
посткапиллярную, и артериальную, или прекапиллярную,
легочную гипертензию. Основной причиной легочной гипертензии у
взрослых является повышение ЯСС. Оно наблюдается при широком круге брон-
холегочных заболеваний, первичных поражениях легочных артериальных сосу-
дов с уменьшением их просвета, а также торакодиафрагмальных заболевани-
ях, вызывающих нарушение легочной вентиляции. Значительно реже легочная
гипертензия бывает обусловлена увеличением легочного кровотока при неиз-
мененном ЛСС. Это отмечается при врожденных пороках у детей с большим
лево-правым сбросом крови, а также при гиперкинетическом кровообраще-
нии, то есть увеличении МОС различного генеза. При врожденных пороках
сердца длительное сохранение значительно повышенного кровотока в легких
постепенно приводит к сужению артериол и стойкому увеличению ЛСС.
Причины легочной гипертензии
I. Причины венозной (посткапиллярной) легочной гипертензии:
1) левожелудочковая недостаточность любой этиологии;
2) нарушение наполнения левого желудочка при:
митральном стенозе;
595
гипертрофической обструктивной кардиомиопатии;
констриктивном перикардите;
миксоме или шаровидном тромбе левого предсердия;
3) тромбоз легочных вен - идиопатический или связанный с опухолевыми
заболеваниями.
II. Причины артериальной (прекапиллярной) легочной гипертензии'.
1)хронические бронхолегочные заболевания:’
а) обструктивные:
хронический бронхит;
бронхиальная астма;
эмфизема легких;
б) рестриктивные:*
пневмосклероз;
пневмокониозы;
милиарный туберкулез;
поликистоз;
карциноматоз;
фиброзирующий альвеолит;
пульмонит и пневмосклероз при диффузных заболеваниях соединительной
ткани и гранулематозных заболеваниях (саркоидоз и др.);
в)нагноительНые: бронхоэктатическая болезнь;*
2) поражение артериальных сосудов легких:
тромбозы и эмболии легочной артерии;*
системные васкулиты (узелковый периартериит, синдром Гудпасчера и др.),
васкулиты при диффузных заболеваниях соединительной ткани и некоторых
тропических паразитарных заболеваниях (шистосомоз и др.);*
высокогорная легочная гипертензия;*
первичная (идиопатическая) легочная гипертензия;*
синдром Эйзенменгера при врожденных пороках сердца с шунтированием
крови слева направо;
полицитемия;
3)торакодиафрагмальные заболевания:
а) нервно-мышечные:*
полиомиелит;
миастения;
миопатия и мышечные дистрофии;
боковой амиотрофический склероз;
б)деформации скелета — кифосколиоз;*
4) угнетение дыхательного центра:*
синдром гиповентиляции при ожирении (синдром Пиквика) или идиопатический;
сосудистые заболевания мозга;
5)заболевания, сопровождающиеся гиперкинетическим синдромом:
врожденные пороки сердца с повышенным легочным кровотоком вследствие
шунтирования крови слева направо;
легочная артериовенозная фистула;
болезнь Педжета;
бери-бери;
тиреотоксикоз;
тяжелая анемия;
печеночная недостаточность.
Примечание. Звездочкой обозначены причины легочного сердца.
596
Патогенетические механизмы легочной гипертензии
Патогенетические механизмы и факторы
I. Пассивные ("механические”) механизмы:
1) повышение давления в легочных венах
2) уменьшение сосудистого русла легких в
результате:
а) внутрисосудистых факторов
(первичного поражения артериаль-
ных сосудов легких)
б) внесосудистых факторов (первичной
деструкции паренхимы легких)
3) увеличение легочного кровотока
Причины
Нарушение систолического опорожнения или
наполнения левого желудочка; тромботическая
окклюзия легочных вен
Тромбозы и эмболии; васкулит; первичная
(идиопатическая) легочная гипертензия;
синдром Эйзенменгера при врожденных пороках
сердца
Эмфизема; пневмопатии и пневмосклероз
различного генеза
Врожденные пороки сердца со значительным
шунтированием крови слева направо;’ легочная
артериовенозная фистула и гиперкинетический
синдром другого генеза
II. Активные механизмы — спазм легочных
артериол под действием:
1) альвеолярной гипоксемии вследствие:
а) альвеолярной гиповентиляции
б) уменьшения содержания кислорода
во вдыхаемом воздухе
2) вазоактивных гуморальных веществ
Хронические Обструктивные заболевания легких;
торакодиафрагмальные заболевания; угнетение
дыхательного центра
Высокогорная легочная гипертензия
ТЭВЛА; цирроз печени и портальная гипертен-
зия другого генеза; карциноидный синдром
В раннем детском возрасте.
Патогенез. Патогенетические механизмы легочной гипертензии, как и ее
этиология, разнообразны, причем в ее возникновении при некоторых забо-
леваниях могут принимать участие несколько патогенетических факторов.
Однако во всех случаях их точкой приложения служит гладкая мускулатура
легочных артериол с развитием начальной, функциональной, и обратимой
реакции — спазма. Вазоконстрикция стимулирует гипертрофию миоцитов ме-
дии, которая “закрепляет” сужение легочных артериол, и на определенном
этапе органические изменения становятся необратимыми.
Патогенетические механизмы легочной гипертензии можно разделить на
пассивные, или механические, и активные.
К пассивным механизмам относятся:
1)повышение давления в левом предсердии . Рефлектор-
ное сужение легочных артериол в ответ на повышение давления в левом
предсердии и легочных венах обеспечивает поддержание нормального
градиента давления между артериальным и венозным концами легочных
капилляров и является основной причиной легочной гипертензии и право-
желудочковой недостаточности при заболеваниях левых отделов сердца.
597
Механизм ретроградной передачи повышенного давления не вполне ясен.
Предполагают, что аккумуляция жидкости в интерстициальной ткани лег-
ких вызывает сдавление мелких сосудов и мелких воздухоносных путей, что
влечет за собой местную альвеолярную гипоксемию и вазоконстрикцию. К
такой реакции приводит повышение давления в левом предсердии любого
генеза — вследствие митрального стеноза, миксомы левого предсердия, аор-
тальных пороков, ИБС и др. Выраженность ее весьма вариабельна. В ряде
случаев, обычно при резком повышении давления в легочных венах (свыше
25 мм рт.ст.), давление в легочной артерии возрастает в значительно боль-
шей степени, чем это требуется для поддержания легочного кровотока. При-
соединение такой активной легочной гипертензии чаще всего отмечается
при выраженном митральном стенозе, но иногда бывает и при тяжелой лево-
желудочковой недостаточности различного генеза;
2) уменьшение сосудистого русла л е г к и х. Может вызываться
двумя группами факторов — внутри- и внесосудистыми. К первым относятся
первичное поражение легочных артерий разного калибра с развитием раз-
личной по своей выраженности окклюзии или облитерации их просвета. Его
причинами являются тромбозы и эмболии, а также васкулиты — системные,
при всех диффузных заболеваниях соединительной ткани, шистосомозе и
некоторых других тропических паразитарных заболеваниях. В ряде случаев
причина артериальной вазоконстрикции с последующим стойким повыше-
нием ЛСС остается неясной. Это заболевание получило название первич-
ной, или идиопатической, легочной гипертензии.
Существует предположение о связи ее возникновения с бессимптомной
рецидивирующей тромбоэмболией или тромбозом множественных мелких
веточек легочной артерии. Повышение ЛСС вызывает также увеличение вяз-
кости крови при полицитемии и ее секвестрацию в легких при серповидно-
клеточной анемии.
Уменьшение нормальной емкости сосудистого русла легких может быть
следствием и первичного разрушения паренхимы в результате воспаления,
фиброза и атрофии. Значительное повышение ЛСС и заметные клинические
проявления легочной гипертензии в таких случаях возникают при уменьше-
нии сосудистой сети примерно на 7/8;
3) увеличение легочного кровотока. Вызывает сужение ле-
гочных артериол путем местных рефлекторных механизмов, включающихся
в ответ на увеличение механического растяжения сосудистой стенки при
поступлении большего, чем в норме, объема крови. Развивается при значи-
тельных лево-правых внутрисердечных шунтах либо гиперкинетическом син-
дроме различного генеза.
Активные механизмы легочной гипертензии обусловливают спазм легоч-
ных артериол под действием альвеолярной гипоксемии и вазоактивных гу-
моральных веществ. В первом случае повышение ЛСС часто связано с альвео-
лярной гиповентиляцией, свойственной хроническим обструктивным забо-
леваниям легких, грудной клетки и угнетению дыхательного центра, и воз-
никает сначала лишь в периоды обострения этих заболеваний, исчезая после
598
нормализации вентиляции. В далеко зашедших случаях легочную гипертен-
зию усугубляет повышение вязкости крови вследствие компенсаторной по-
лицитемии. Патогенез и другие аспекты легочной гипертензии при этих за-
болеваниях, а также патологии сосудов легких подробно освещены ниже.
Хроническая альвеолярная гипоксемия вследствие сниженного содержания
кислорода во вдыхаемом воздухе лежит в основе формирования легочной
гипертензии у жителей высокогорья.
Преходящий спазм легочных артериол вызывает также ряд вазоактив-
ных гуморальных веществ — серотонин, гистамин, тромбоксан А2 и дру-
гие. Обладая одновременно бронхоконстрикторными свойствами, эти аген-
ты повышают ЛСС как непосредственно, так и за счет усугубления альвео-
лярной гипоксемии. Замедление метаболизации таких веществ при печеноч-
ной недостаточности может вызывать легочную гипертензию при циррозах
печени и усиленную секрецию серотонина — при карциноидном синдроме.
Патологическая анатомия. Морфологические изменения в легочных арте-
риях неспецифичны и заключаются в гипертрофии медии и фиброзе интимы.
При этом относительно небольшое уменьшение просвета артериол приво-
дит к резкому повышению ЛСС, обратно пропорциональному их радиусу в
четвертой степени (г4).
При рецидивирующих множественных микротромбоэмболиях постепенно
развивается окклюзия дистальных отделов артериальной системы. Последующая
организация тромбоэмболов сопровождается появлением клеток воспаления,
фиброзом и частично — реканализацией. В легочных артериолах проксимальнее
участков окклюзии развиваются гипертрофия медии и фибротизация интимы.
Для выраженной легочной гипертензии, наблюдающейся с рождения
вследствие внутрисердечного шунтирования крови, а также далеко зашед-
шей первичной легочной гипертензии характерно образование расширений
наиболее мелких артериол в виде тонкостенных мешочков с пролиферацией
эндотелия, которые часто тромбируются. Это приводит к еще большему по-
вышению ЛСС, снижению МОС и при наличии сброса крови - к измене-
нию его направления и цианозу.
В наиболее тяжелых случаях легочной гипертензии любого генеза разви-
вается некротизирующий артериит с фибриноидным некрозом медии, вос-
палительной инфильтрацией полиморфноядерными лейкоцитами и исходом
в фиброзную облитерацию просвета. Аналогичные изменения обнаружива-
ются в артериолах большого круга кровообращения при системной злокаче-
ственной артериальной гипертензии.
Клиника. Поскольку легочная гипертензия в большинстве случаев не яв-
ляется самостоятельной нозологической единицей, при ее умеренной выра-
женности в клинической картине преобладают симптомы и признаки ос-
новного заболевания сердца, легких или, реже, других органов. Нарастание
гипертензии может вызывать их изменения, что подчас затрудняет распоз-
навание ее причины. Например, при митральном стенозе значительное сни-
жение МОС и кровотока через митральный клапан может приводить к ис-
чезновению диастолического шума. В случаях врожденных пороков сердца -
599
дефектов перегородок и открытого артериального протока — уменьшение
объема шунта сопровождается исчезновением диастолического шума и
ослаблением систолического.
Жалобы. При выраженной легочной гипертензии больных беспокоят рез-
кая слабость, утомляемость, одышка даже в покое, головокружение, вплоть
до потери сознания, при физической нагрузке. Распространенным симпто-
мом является боль за грудиной или в области сердца ангинозного характера,
обусловленная несоответствием между увеличенной потребностью правого
желудочка в кислороде вследствие повышения его постнагрузки и ограни-
ченным из-за низкого МОС коронарным кровотоком. Периодически может
отмечаться кровохарканье, свойственное венозной и, реже, далеко зашед-
шей артериальной легочной гипертензии. В сочетании с болью в грудной
клетке плеврального характера такие эпизоды указывают на возможную ре-
цидивирующую тромбоэмболию мелких ветвей легочной артерии.
При объективном исследовании выявляют характерные признаки низкого
МОС — бледность кожи, периферический цианоз, холодные на ощупь
конечности и малый пульс. При центральном цианозе следует подумать о
ТЭВЛА или синдроме Эйзенменгера.
Гиперфункция правого предсердия, имеющая важное значение для обес-
печения наполнения жесткого правого желудочка, приводит к увеличению
амплитуды волны “а” пульсации яремных вен. При давней легочной гипер-
тензии и развитии гипертрофии активно сокращающегося правого желудоч-
ка иногда можно пальпировать его толчок у левого края грудины. При аус-
культации для выраженной венозной легочной гипертензии характерна зас-
тойная крепитация в базальных отделах легких, а для артериальной — ак-
цент Р2 и реже — добавочный систолический тон изгнания, которые изредка
определяются пальпаторно. Чем выше давление в легочной артерии, тем боль-
ше Р2 приближается к А2 на выдохе. В далеко зашедших случаях возникают
недостаточность клапана легочной артерии и мягкий протодиастолический
шум на основании сердца, который может усиливаться на вдохе. Изредка
при значительной дилатации ее ствола определяется мягкий короткий сред-
несистолический шум изгнания. Его необходимо дифференцировать от пан-
систолического шума относительной недостаточности трехстворчатого кла-
пана в точке Боткина, для которого характерно также увеличение амплиту-
ды волны “v” пульсации яремных вен (так называемый положительный вен-
ный пульс). Развитие недостаточности перегруженного сопротивлением пра-
вого желудочка проявляется также появлением правожелудочкового ритма
галопа (S3, S4 или суммационного).
Диагностика. При рентгенографии грудной клетки до осложнения легоч-
ной гипертензии правожелудочковой недостаточностью тень сердца практи-
чески не увеличена. Характерно расширение ствола легочной артерии и ее
левой и правой ветвей. При венозной гипертензии отмечаются усиление со-
судистого рисунка легких и линии Керли. В отличие от этого у больных с
выраженной артериальной гипертензией прозрачность периферических от-
делов легочных полей повышена вследствие сужения мелких артериальных
600
ветвей. Такое местное увеличение прозрачности характерно для ТЭВЛА. На-
личие и характер изменений легочных полей, а также конфигурации тени
сердца указывают на причину легочной гипертензии.
На ЭЛТобычно определяются признаки гипертрофии правых желудочка и
предсердия, которые, однако, при некоторых заболеваниях легких, напри-
мер, эмфиземе, могут отсутствовать. Часто регистрируется блокада правой
ножки пучка Гиса, связанная с гипертрофией правого желудочка.
О повышении давления в легочной артерии и его выраженности можно
косвенно судить на основании изменения характера движения клапана ле-
гочной артерии при эхокардиографии. В М-режиме наибольшее диагности-
ческое значение имеют следующие признаки:
1) уменьшение скорости движения передней створки клапана на отрезке
е—f (см. в главе 5). Зачастую она может становиться отрицательной, то есть
точка “е” смещается ниже точки “f“. Снижение этой скорости обусловлено
ограничением движения створки кпереди в связи с более высоким диасто-
лическим давлением в легочной артерии, чем в правом желудочке;
2) уменьшение амплитуды волны “а”, соответствующей систоле правого
предсердия, вплоть до ее полного исчезновения. Этому способствует сниже-
ние податливости стенки легочной артерии в результате легочной гипертензии;
3) возрастание амплитуды и скорости открытия передней створки клапа-
на легочной артерии в начале систолы правого желудочка (увеличение на-
клона “Ь—с”). Обусловлено расширением устья легочной артерии;
4) появление среднесистолической положительной волны прикрытия створ-
ки (волны “и”) во второй половине систолы, когда давление в легочной
артерии превышает давление в правом желудочке. Обычно сопровождается
ранним закрытием клапана и свидетельствует о высокой легочной гипер-
тензии.
Характерно также расширение ствола легочной артерии и ее правой ветви.
В связи с трудностями четкой визуализации клапана легочной артерии
эти признаки не относятся к числу надежных. То же касается и определения
толщины стенок правого желудочка и величины его полости, которая дила-
тируется при осложнении легочной гипертензии правожелудочковой недо-
статочностью.
Измерение скорости потока в устье легочной артерии с помощью доп-
плерэхокардиографии позволяет ориентировочно оценить величину ее диас-
толического давления.
Для определения систолического давления в легочной артерии (СДЛА)
расчетным путем предложена формула, выведенная из номограммы Бурстина:
СДЛА=ПИРпрж + ЧСС - 107,5, где ПИРпрж - период изометрического рас-
слабления правого желудочка, который рассчитывается от легочного компо-
нента II тона (Р2) на ФКГ до открытия трехстворчатого клапана на ЭхоКГ.
Поскольку величина этого интервала, кроме давления в легочной артерии,
зависит также от других факторов, точность такого непрямого метода весь-
ма ограничена.
601
Диагностическое значение эхокардиографии состоит в основном в уточ-
нении причины легочной гипертензии, особенно выявлении препятствия
на пути притока левого желудочка — “немого” митрального стеноза, миксо-
мы левого предсердия и пр.
Катетеризация сердца является единственно надежным методом вери-
фикации наличия легочной гипертензии, оценки ее характера и выраженно-
сти путем прямого измерения давления в легочной артерии, “капиллярах”,
легочных венах и левом предсердии и расчета ЛСС. В сочетании с ангиокар-
диографией она помогает установить причину заболевания в сложных случа-
ях. Следует иметь в виду, что выполнение ангиопульмонографии связано с
определенным риском возникновения острой правожелудочковой недоста-
точности и фибрилляции желудочков вследствие объемной перегрузки пра-
вых отделов сердца.
Неинвазивные расчетные методы оценки величины давления в легочной
артерии по данным поликардиографии, реографии и флебографии весьма
неточные.
Биопсия легкого показана для определения этиологии тяжелой легочной
гипертензии в редких случаях при подозрении на ее относительно курабель-
ную причину, например, при узелковом периартериите или рецидивирую-
щей ТЭВЛА. В связи с малой специфичностью морфологической картины и
необходимостью выполнения открытой биопсии из нескольких участков,
что у такой тяжелой категории больных сопряжено со значительным рис-
ком, этот метод используют очень ограниченно.
Определение газового состава артериальной крови имеет значение только
для выявления выраженного общего нарушения вентиляционно-перфузион-
ного соотношения, характерного для относительно массивной ТЭВЛА (низ-
кое РО2 в сочетании с низким РСО2), а также для диагностики внутрисер-
дечных шунтов крови.
В целом диагноз легочной гипертензии ставят на основании: 1) клиничес-
ких признаков: акцента Р2, в далеко зашедших случаях - протодиастоличе-
ского шума недостаточности клапана легочной артерии в сочетании с рез-
кой слабостью, одышкой и синкопе при физической нагрузке; 2) выбухания
ствола легочной артерии и изменений сосудистого рисунка легких по дан-
ным рентгенологического исследования: 3) гипертрофии правых желудочка
и предсердия, часто также блокады правой ножки пучка Гиса на ЭКГ; 4) ха-
рактерного для легочной гипертензии изменения движения клапана легоч-
ной артерии при эхокардиографии. Диагноз подтверждается путем катетери-
зации легочной артерии.
Дифференциальный диагноз при легочной гипертензии. Установление этиоло-
гии легочной гипертензии предусматривает дифференциальную диагностику
заболеваний, которые могут приводить к ее возникновению (см. с. 595—596).
Заболевания, вызывающие легочную венозную гипертензию. О левожелу-
дочковой недостаточности свидетельствуют клинические, рентге-
нологические, электрокардиологические и эхокардиографические признаки
дилатации и в большинстве случаев признаки гипертрофии левого желудочка.
602
При определении показателей кардиогемодинамики с помощью эхокардио-
графии и катетеризации сердца отмечаются изменения, характерные для его
систолической дисфункции и застоя крови на путях притока (снижение ФВ,
повышение КДД в левом желудочке, давления в левом предсердии и “легоч-
ных капиллярах”). Часто отмечается левожелудочковый ритм галопа. Диагноз
основного заболевания устанавливают на основании характерных в каждом
случае диагностических признаков (см. также разделы “Дифференциальный
диагноз при одышке” и “Дифференциальный диагноз при кардиомегалии и
сердечной недостаточности”, т. 2). Необходимо помнить также о возможнос-
ти экссудативного и констриктивного перикардита.
Заболеваниям, связанным с препятствием на пути от-
тока из левого предсердия, свойственна выраженная венозная ле-
гочная гипертензия с низким МОС при сравнительно мало измененных
размерах сердца. Наиболее распространенным из них является митраль-
ный стеноз, при котором легочная гипертензия часто имеет и артериаль-
ный компонент. Диагноз легко уточняют с помощью эхокардиографии, ко-
торая позволяет также выявлять другие причины нарушения наполнения
левого желудочка.
Тромботическая окклюзия легочных вен представляет зна-
чительную сложность для диагностики и обычно остается нераспознанной.
Она может быть самостоятельным заболеванием с неизвестной этиологией,
или отмечаться при злокачественных опухолях, или служить проявлением
узелкового периартериита. Клинические симптомы и признаки сходны с та-
ковыми при выраженной первичной легочной гипертензии, в отличие от
которой заболевание может осложняться приступами отека легких и появле-
нием выпота в плевральную полость. При катетеризации сердца отмечается
значительное повышение давления в легочной артерии при неизмененном
его уровне в левом предсердии, что позволяет исключить препятствие кро-
вотоку на этом уровне. Поставить диагноз позволяет выявление дефектов
перфузии при ангиопульмонографии.
Наиболее распространенной причиной легочной артериальной гипертензии,
не связанной с венозной, являются хронические заболевания лег-
ких, чаще обструктивные. Для них характерны периоды резкого усугубления
гипертензии в связи с интеркуррентными острыми респираторными инфекци-
ями и ухудшением течения основного заболевания. Второе месте по частоте
занимает рецидивирующая ТЭВЛА. Эти заболевания рассмотрены ниже.
При легочной гипертензии вследствие внутрисердечного шунти-
рования крови отмечаются характерные клинические и инструменталь-
ные признаки соответствующих врожденных пороков сердца (см. главу 6).
Полицитемия усугубляет легочную гипертензию в цианотической ста-
дии врожденных пороков сердца, а также при бронхолегочных заболевани-
ях, способствуя также развитию тромбообразования in situ.
Поражение легких при тропических паразитарных ин-
фекциях - шистосомозе, филяриозе и других имеет аллергиче-
ский генез и в начальных стадиях проявляется астматическими приступами
603
с отделением мокроты. При этом часто отмечается повышение температуры
тела, в ряде случаев — эозинофилия. Легочная гипертензия развивается по-
степенно и обусловлена как васкулитом, так и поражением паренхимы лег-
ких и мелких бронхов. Сходный генез имеет и легочная гипертензия при
системных васкулитах, прежде всего при узелковом периартериите,
и диффузных заболеваниях соединительной ткани, которые диагностируют
на основании характерных особенностей поражения различных органов и
систем.
Первичная легочная гипертензия. Этиология и патогенез неизвестны. Пред-
полагают, что она обусловлена вначале преходящим, а затем стойким повы-
шением тонуса легочных артериол, о чем может свидетельствовать частое
сочетание заболевания с синдромом Рейно. Закреплению повышенного ЛСС
способствуют эпизоды тромбоза мелких артериол in situ в периоды спазма, а
возможно, и рецидивирующие микротромбоэмболии. Морфологические из-
менения сосудов легких неспецифичны и аналогичны патогистологической
картине легочной артериальной гипертензии, обусловленной митральным
стенозом, врожденными пороками сердца и другими причинами.
Хотя заболевание может развиваться в любом возрасте, даже с рождения,
в большинстве случаев оно возникает у молодых людей, особенно у жен-
щин, которые болеют в 4 раза чаще, чем мужчины. В ряде случаев оно носит
семейный характер.
Болезнь начинается исподволь с необъяснимой одышки, утомляемости
при физическом напряжении и похудания. Эти симптомы появляются, од-
нако, только после снижения МОС, который становится фиксированным,
и свидетельствуют о высокой и устойчивой легочной гипертензии. Относи-
тельно ранними проявлениями заболевания могут быть также головокруже-
ние и обмороки при физической нагрузке. Реже и в поздних стадиях появля-
ются загрудинная боль и кровохаркание, нарастает похудание.
Объективное клиническое и инструментальное обследование также не
выявляет специфичных признаков и их данные аналогичны общим проявле-
ниям легочной гипертензии. При катетеризации правых отделов сердца опре-
деляется значительное повышение давления в легочной артерии и ЛСС при
неизмененном “заклинивающем” давлении в легочных капиллярах. За ис-
ключением далеко зашедших случаев показатели внешнего дыхания, а так-
же газовый состав крови находятся в пределах нормы.
Диагноз первичной легочной гипертензии ставят путем исключения из-
вестных причин повышения ЛСС. При этом наибольшие сложности могут
возникать при дифференциальной диагностике с аутоиммунным васкули-
том с преимущественным поражением сосудов легких и рецидивирующей
ТЭВЛА. На вероятный моносиндромный вариант системного васкулита, чаще
узелкового периартериита, или, в редких случаях, одного из диффузных
заболеваний соединительной ткани указывает наличие общих клинических
и лабораторных признаков воспаления в статусе или анамнезе. При тщатель-
ном расспросе больного и анализе медицинской документации обычно уда-
ется выявить скудные проявления иммуновоспалительного поражения дру-
604
гих органов и систем. Диагностическое значение имеют данные биопсии кожи
и эффект от лечения глюкокортикостероидами.
Для посттромбоэмболической легочной гипертензии в результате реци-
дивирующей ТЭВЛА, в отличие от первичной, характерны острое начало
заболевания и рецидивирующий характер его течения с резким нарастанием
одышки, которая часто сопровождается болевым синдромом и другими при-
знаками плеврита и пневмонии. При этом должно настораживать много-
кратное повторение пневмоний, особенно двусторонних. Следует иметь в
виду, что признаки тромбоза периферических вен могут отсутствовать, что
затрудняет распознавание заболевания. Поставить правильный диагноз по-
могает сцинтиграфия легких, особенно в сочетании с оценкой регионарной
вентиляции, а также изменения газового состава артериальной крови.
Лечение первичной легочной гипертензии симптоматическое и направле-
но на снижение давления в легочной артерии (см.ниже).
Течение и осложнения. Умеренная легочная гипертензия обычно протекает
бессимптомно, в связи с чем диагноз часто ставят в далеко зашедшей стадии
патологического процесса. В дальнейшем заболевание быстро прогрессирует.
Основными осложнениями легочной гипертензии являются нарастающая
правожелудочковая недостаточность и нарушения ритма, особенно мерца-
ние предсердий. Д ля выраженной артериальной гипертензии характерны также
тромбозы мелких артериальных сосудов легких, а для венозной - приступы
отека легких. Смерть наступает в результате прогрессирующей сердечной не-
достаточности или внезапно, вследствие электрической нестабильности сер-
дца либо ТЭВЛА.
Лечение. Основными задачами являются: 1) устранение причины легоч-
ной гипертензии (например, альвеолярной гиповентиляции при заболева-
ниях легких, стеноза митрального отверстия и др.); 2) снижение давления в
легочной артерии и ЛСС. В этих целях используют различные вазодилатато-
ры, а при высокой венозной гипертензии также мочегонные препараты и
кровопускание.
Вазодилататоры дают более или менее выраженный эффект лишь в
относительно ранних стадиях заболевания, до развития распространенных
органических изменений в артериолах с их окклюзией и облитерацией. В свя-
зи с этим важное значение имеет возможно более ранняя диагностика легоч-
ной гипертензии и установление ее этиологического фактора. Применяют дли-
тельную непрерывную инфузию а-адреноблокаторов (фентоламин), диазокси-
да, ганглиоблокаторов и простациклина, что у ряда больных приводит к вре-
менному снижению ЛСС. Внутрь назначают возможно более высокие дозы
гидралазина, празозина, нифедипина. Кроме необратимых морфологических
изменений в легочных артериолах эффективность этих препаратов лимитиру-
ется невозможностью достижения адекватных дозировок из-за критического
снижения системного АД. Для отбора больных, у которых можно рассчиты-
вать на успех такой терапии, целесообразно использовать острые фармаколо-
гические пробы во время диагностической катетеризации легочной артерии.
Снижение давления после внутривенного введения фентоламина или других
605
препаратов позволяет прогнозировать положительный эффект длительного
перорального приема вазодилататоров.
Для уменьшения вязкости крови используют дезагреганты (ацетил-
салициловую кислоту, дипиридамол), а при ее сгущении (гематокритное
число более 55) — кровопускания до нормализации гематокритного
числа. С учетом компенсаторной роли полицитемии у таких больных опти-
мальным считают поддержание гемоглобина на уровне около 170 г/л.
В целях профилактики тромбоза легочных артериол in situ и усугубления
повышения ЛСС показан длительный прием антикоагулянтов не-
прямого действия.
Кислород, хотя и обладает некоторым вазодилатирующим действием,
мало облегчает одышку ввиду ее рефлекторного генеза. В далеко зашедших
случаях при мучительной одышке в покое в качестве симптоматической те-
рапии назначают опиаты.
При осложнении легочной гипертензии правожелудочковой недостаточ-
ностью проводят лечение, направленное на улучшение насосной функции
желудочка, которое, кроме вазодилататоров, включает применение ино-
тропных агентов и мочегонных препаратов (подробнее см. Легочное сердце).
В терминальной стадии легочной гипертензии можно прибегнуть к транс-
плантации комплекса “сердце-легкие”. Хотя мировой опыт таких операций
пока относительно невелик, предварительные результаты свидетельствуют
об улучшении выживаемости тщательно отбираемых больных.
Прогноз зависит от причины легочной гипертензии. В случаях хорошо под-
дающейся лечению недостаточности левых отделов сердца и гипоксии он
более благоприятен, чем при далеко зашедших заболеваниях легких, ТЭВЛА
или системных васкулитах. При первичной легочной гипертензии прогноз
неблагоприятен. При среднем давлении в легочной артерии свыше 50 мм
рт.ст. большинство больных умирают в течение ближайших 5 лет.
Профилактика предусматривает раннюю диагностику и активное лечение
заболеваний, которые могут приводить к развитию легочной гипертензии.
ЛЕГОЧНОЕ СЕРДЦЕ
Легочное сердце — это увеличение правого желудочка, обусловленное ле-
гочной гипертензией в результате заболеваний паренхимы, воздухоносных
путей или сосудов легких, скелета и нервно-мышечного аппарата грудной
клетки либо нарушения регуляции дыхания. Хотя связь правожелудочковой
недостаточности с бронхолегочными заболеваниями была установлена еще
в середине XIX в., термин “легочное сердце” предложен и получил призна-
ние лишь в 1950 г. В соответствии с современными представлениями, регла-
ментированными ВОЗ (1961), в определении сущности этого понятия необ-
ходимо подчеркнуть ряд основополагающих моментов (схема 33).
Непосредственной причиной и обязательным критерием легочного сердца
606
Заболевания
паренхимы
легких и \
бронхов \
Заболевания Легочная
скелета и —артериальная
и нервно-мышечного к гипертензия
аппарата 1
грудной клетки
Заболевания •
сосудов легких
нарушение регуляции
дыхания
Варианты ЛС *
Схема 33. Сущность легочного сердца и его варианты: ЛС — легочное сердце; ПЖ —
правый желудочек
является артериальная (прекапиллярная) легочная гипертензия, которая
вызывает повышение постнагрузки правого желудочка. При этом о легочном
сердце можно говорить только в тех случаях легочной гипертензии, причинами
которой служат заболевания, вызывающие нарушения функции или струк-
туры легких, или и той, и другой одновременно. Сюда не относятся пораже-
ния легких, обусловленные первичной патологией левых отделов сердца.
Повышение постнагрузки правого желудочка вызывает его гипертрофию и
(или) недостаточность, которые и лежат в основе собственно “легочного сер-
дца”. Гипертрофия является важнейшим адаптационным механизмом, обес-
печивающим поддержание неизмененного МОС и давления наполнения пра-
вого желудочка как в покое, так и в условиях гипоксии и физической нагруз-
ки. Гипертрофия правого желудочка без его недостаточности характерна для
компенсированного легочного сердца, которое может отмечаться
при хроническом течении заболевания. При исчерпании компенса-
торных возможностей гипертрофии возникает правожелудочковая недоста-
точность, и легочное сердце становится декомпенсированным. У ряда
таких больных гипертрофии правого желудочка в ответ на повышение пост-
нагрузки препятствует гипоксическая миокардиодистрофия, что приводит к
раннему развитию правожелудочковой недостаточности. Дилатация и недо-
статочность правого желудочка при отсутствии его гипертрофии могут возни-
кать при остром повышении давления в легочной артерии. Это свойственно
острому и подострому легочному сердцу (см. схему 33).
607
ОСТРОЕ ЛЕГОЧНОЕ СЕРДЦЕ
Острое легочное сердце развивается в течение нескольких часов, реже
дней, и всегда является декомпенсированным. Его основной причиной яв-
ляется тромбоэмболия крупных ветвей легочной артерии или множествен-
ная тромбоэмболия мелких. В последнем случае возникновению легочного
сердца способствует исходное уменьшение сосудистого русла легких в ре-
зультате предшествующих заболеваний. Крайне редко острое легочное сердце
может осложнять тяжелые бронхолегочные заболевания и возникать при аст-
матическом статусе, клапанном пневмотораксе, массивной пневмонии и
тотальном экссудативном плеврите. Резкое нарушение насосной функции
правого желудочка сопровождается его дилатацией и снижением МОС, под-
час значительным, с развитием обструктивного шока. Для клинической кар-
тины заболевания характерно внезапное возникновение выраженной одышки
и артериальной гипотензии с признаками нарушения периферического кро-
вообращения и высоким ЦВД. Вопросы клиники, диагностики и лечения
острого легочного сердца подробно изложены ниже в разделе “Эмболия ле-
гочной артерии”.
ПОДОСТРОЕ ЛЕГОЧНОЕ СЕРДЦЕ
Развивается в течение нескольких дней — недель в связи с подостро воз-
никающей легочной гипертензией, чаще умеренной, вследствие окклюзии
мелких сосудов легких или, реже, распространенной альвеолярной гипоксе-
мии. Основными причинами являются сосудистые факторы - рецидивирую-
щая тромбоэмболия средних и мелких ветвей легочной артерии и васкулит.
Подобно острому легочному сердцу заболевание проявляется выраженной
одышкой, цианозом, признаками легочной гипертензии и быстро прогрес-
сирующей правожелудочковой недостаточности, которая развивается обыч-
но при повышении систолического давления в легочной артерии более 40-
45 мм рт.ст.
ХРОНИЧЕСКОЕ ЛЕГОЧНОЕ СЕРДЦЕ
При этом варианте течения легочного сердца свойственное ему пораже-
ние правого желудочка — гипертрофия и (или) недостаточность — развива-
ется постепенно, исподволь, в течение нескольких лет.
Распространенность в различных регионах колеблется, так как в значи-
тельной степени определяется частотой хронических обструктивных заболева-
ний легких, которые являются основной причиной хронического легочного
сердца. Заболеваемость наибольшая в промышленных центрах со значитель-
ным загрязнением воздуха и тесно коррелирует с распространенностью сре-
ди населения курения. На долю хронического легочного сердца приходится
608
Заболевания-,
бронхолегочные
легочных сосудов
тооако -диафрагмальные
Схема 34. Патогенез хронического легочного сердца: ЦИС — центральная нервная система;
ПЖ — правый желудочек
примерно 6—7 % всех сердечно-сосудистых заболеваний у взрослых, и эта
патология занимает 4-е место среди причин инвалидизации от них (Chronic
cor pulmonale: report of an expert committee, 1963).
Этиология. Основные этиологические факторы перечислены на с. 596.
Хроническое легочное сердце развивается почти у 50 % больных с хрониче-
скими обструктивными заболеваниями легких — хроническим бронхитом,
инфекционнозависимой бронхиальной астмой и эмфиземой. Более редкими
причинами являются хронические рестриктивные заболевания органов дыха-
ния вследствие поражения паренхимы легких (в том числе резекции) или
грудной клетки, а также центральной нервной системы с нарушением регуля-
ции вентиляции. Из окклюзивных заболеваний сосудов легких хроническое
609
легочное сердце могут вызывать первичная легочная гипертензия и васкули-
ты, реже рецидивирующая ТЭВЛА. Вследствие значительной протяженности
сосудистого русла легких и быстроты лизиса в нем тромбов даже многократ-
ные тромбоэмболические эпизоды часто не приводят к развитию хроничес-
кой легочной гипертензии.
Патогенез. В основе патогенеза хронического легочного сердца лежит
прогрессирующая легочная прекапиллярная гипертензия, обусловленная
несколькими механизмами (схема 34).
1. Рефлекторный спазм легочных артериол вответнааль-
веолярную гипоксемию является важнейшим патогенетическим фактором
формирования легочного сердца. По имени описавших его впервые исследо-
вателей он носит название рефлекса Эйлера —Лильестранда. По-
видимому, он реализуется местно без участия вегетативной нервной систе-
мы при возбуждении хеморецепторов в паренхиме легкого и опосредуется
каким-то неизвестным пока медиатором.
Гипоксический спазм легочных артериол может быть генерализованным
и локальным. В первом случае он имеет место при общей гиповентиляции,
которая обусловлена распространенным поражением легочной паренхимы и
бронхов с сокращением площади дыхательной поверхности и нарушением
диффузии, уменьшением подвижности грудной клетки и диафрагмы при
заболеваниях скелета и нервно-мышечного аппарата и снижением чувстви-
тельности дыхательного центра к гиперкапнии у больных с поражением
центральной нервной системы и резким ожирением (синдром Пиквика). Ге-
нерализованный спазм легочных артериальных сосудов возникает также при
уменьшении содержания кислорода во вдыхаемом воздухе, например, у
жителей высокогорья. Местная вазоконстрикция развивается при локальном
дисбалансе вентиляции и перфузии, что свойственно многим бронхолегоч-
ным заболеваниям, особенно в начальных стадиях. Она имеет важное физио-
логическое значение, так как обеспечивает оптимальное перераспределение
кровотока в целях предотвращения поступления значительного количества
ненасыщенной кислородом крови в левые отделы сердца. Гиперкапния усу-
губляет гипоксическую констрикцию легочных артериальных сосудов.
2. “Мускуляризация” легочных артерио л. При формировании
легочного сердца легочная гипертензия часто имеет преходящий характер
вследствие транзиторного характера гипоксии, связанной с обострениями
бронхолегочной инфекции. По мере установления стойкой гиповентиляции
она стабилизируется. Этому способствует разрастание мышечной ткани в со-
судистой стенке за счет гипертрофии клеток медии и появления продольно-
го слоя миоцитов в интиме. Такая “мускуляризация” легочных артериол при-
водит к стойкому сужению их просвета и обеспечивает большую выражен-
ность и длительность констрикторных реакций.
3. Анатомическое уменьшение сосудистого русла лег-
ких. Уменьшение общей площади поперечного сечения артериальной сети
легких вследствие органических изменений является ведущим патогенети-
ческим механизмом хронического легочного сердца только при первичной
610
легочной гипертензии и васкулитах. Разрушение и облитерация мелких сосу-
дов при эмфиземе и рестриктивных заболеваниях легких имеет второстепен-
ное значение по отношению к фактору гипоксии. Об этом свидетельствует
отсутствие существенной корреляции выраженности разрушения легочной
паренхимы с величиной легочной гипертензии и гипертрофии правого же-
лудочка. Развитию легочного сердца более подвержены страдающие хрони-
ческим бронхитом “синие одутловатики” (“blue bloaters”), чем больные эм-
физемой “розовые пыхтелыцики” (“pink puffers”), у которых альвеолярная и
артериальная гипоксемия выражена значительно меньше.
Среди анатомических факторов повышению ЛСС способствуют также уд-
линение легочных сосудов при увеличении объема легких у больных с об-
структивными заболеваниями и их сдавление и деформация при распростра-
ненном пневмофиброзе и склерозе.
4. Увеличение вязкости кров и. Обусловлено полицитемией, раз-
вивающейся в ответ на гипоксию, и способно усугублять повышение ЛСС.
5. Увеличение МОС. Артериальная гипоксемия и гиперкапния вы-
зывают увеличение МОС в покое вследствие системной вазодилатации, гипер-
волемии и повышения ЧСС. Это обусловливает объемную перегрузку право-
го желудочка и увеличение легочного кровотока, которое в условиях анато-
мической редукции сосудистого русла легких, когда резерв увеличения его
емкости исчерпан, приводит к возрастанию давления в легочной артерии.
Этот прирост особенно выражен при физической нагрузке. Увеличению кро-
вотока в легких способствует также возрастание шунтирования крови в сис-
тему легочной артерии из бронхиальных артерий через коллатерали, что осо-
бенно характерно для бронхоэктатической болезни. При легочном сердце
вследствие первичного поражения сосудов МОС не изменен или снижен.
Значительная перегрузка правого желудочка сопротивлением рано или
поздно приводит к развитию его недостаточности. Вначале она носит прехо-
дящий характер и возникает при нарастании гипоксии и гиперкапнии в пе-
риоды обострений бронхолегочных инфекций, чему способствуют гипокси-
ческая дистрофия миокарда правого желудочка и его перегрузка объемом
вследствие увеличения МОС. Развитие правожелудочковой недостаточности
приводит к снижению МОС и повышению КДД в желудочке.
У значительной части больных с хроническим легочным сердцем отмеча-
ются также умеренная гипертрофия и недостаточность левого желудочка,
патогенез которых не вполне ясен. Возможно, определенную роль играют
гипоксия, увеличение МОС, эритроцитоз и сопутствующий атеросклероз
коронарных артерий.
Патологическая анатомия. Патоморфологические изменения при хрони-
ческом легочном сердце включают: 1) признаки основного заболевания (лег-
ких, грудной клетки и др.); 2) неспецифическую “мускуляризацию” и фиб-
роз легочных артериол, свойственные прекапиллярной легочной гипертен-
зии любого генеза; 3) гипертрофию и дистрофию миокарда правого желу-
дочка. Гипертрофия правого желудочка при патоморфологическом исследо-
вании является обязательным критерием диагноза хронического легочного
611
сердца, но ее выраженность колеблется в широких пределах — от минималь-
ной до значительной.
Клиника. Клиническая картина компенсированного легочного сердца скла-
дывается из трех групп симптомов и признаков: симптомов основного забо-
левания (легких или грудной клетки), дыхательной недостаточности и ле-
гочной гипертензии. О наличии гипертрофии правого желудочка позволяют
судить данные инструментальных методов исследования.
Заболевание развивается исподволь у больных, длительное время страда-
ющих хронической бронхолегочной или торакодиафрагмальной патологией.
Наиболее распространенной жалобой является кашель различного характе-
ра, чаще продуктивный, реже — повышение температуры тела. Всех больных
беспокоит одышка при физической нагрузке и временами в покое, которая
является симптомом дыхательной недостаточности. Она обусловлена увели-
чением работы дыхательных мышц вследствие патологии легких. При пер-
вичном поражении сосудов легких (васкулит, первичная легочная гипертен-
зия) ее механизм не ясен. В отличие от ортопноэ при левожелудочковой
недостаточности, одышка не уменьшается в положении сидя. Для хроничес-
ких обструктивных заболеваний легких характерны приступы удушья с дис-
танционными свистящими хрипами. Может отмечаться частая головная боль
вследствие гиперкапнии. У всех больных имеется длительный анамнез с пе-
риодами стационарного лечения при ухудшениях, часто связанных с обо-
стрениями бронхолегочных инфекций.
При объективном исследовании обращают на себя внимание признаки хро-
нического заболевания легких: бочкообразная грудная клетка, уменьшение
дыхательной экскурсии легких и опущение диафрагмы, свойственные эм-
физеме, различного характера изменения дыхания и хрипы. В зависимос-
ти от основного заболевания могут выявляться те или иные изменения ске-
лета и мышц грудной клетки, выраженное ожирение. У больных с хроничес-
кими гнойными бронхолегочными заболеваниями часто обнаруживаются
“барабанные палочки”. О наличии дыхательной недостаточности свидетель-
ствуют тахипноэ, иногда с участием в дыхании вспомогательных мышц, и
центральный цианоз. При увеличении МОС кожа теплая на ощупь, пульс на
периферических артериях быстрый и скачущий, пульсовое АД увеличивает-
ся. В сочетании с упорной тахикардией эти проявления синдрома гипердина-
мии подчас заставляют заподозрить тиреотоксикоз. При гиперкапнии отме-
чаются заторможенность, сонливость, которые усугубляются при дыхании
100 % кислородом, гиперемия лица.
Данные клинического обследования сердца указывают на легочную артери-
альную гипертензию и гиперфункцию правого желудочка. К ним относятся
пульсация под мечевидным отростком или у левого края грудины в ее нижней
части, акцент Р2, реже - добавочный систолический тон изгнания во втором
межреберье слева. Размеры сердца не изменены. При этом при наличии эмфи-
земы легких пальпаторное определение верхушечного толчка затруднено.
При декомпенсации хронического легочного сердца присоединяются симп-
томы и признаки правожелудочковой недостаточности, которые вначале часто
612
связаны с респираторными инфекциями и обратимы, но постепенно стано-
вятся стойкими. Отмечается резкая слабость, нарастает цианоз, который при-
обретает характер периферического, холодного вследствие снижения МОС.
Появляются отчетливые отеки голеней и истинное увеличение печени. Она
мягкая и болезненная при пальпации. Отмечается гепатоюгулярный реф-
люкс. Шейные вены набухшие, при развитии относительной недостаточности
трехстворчатого клапана венный пульс положительный. ЦВД повышено. При
аускультации сердца в точке Боткина определяется правожелудочковый прото-
диастолический или пресистолический ритм галопа, в части случаев — систо-
лический шум трикуспидальной регургитации, которые усиливаются на вдо-
хе. При высокой легочной гипертензии может выслушиваться шум Грэма Стилла.
Нарушения ритма сердца в целом мало характерны и появляются обычно при
гликозидной интоксикации, респираторных инфекциях, вызывающих усу-
губление гипоксии, а также сопутствующих заболеваниях левого желудочка.
Изменения на ЭКГ при легочном сердце
1. Отклонение электрической оси сердца (среднего вектора комплекса QRS) вправо.
2. R/S > 1 в отведении Vp
3. R/S < 1 в отведении V6.
4. 5|-2п1 или Sj-Sh-Shp
5. P-pulmonale.
6. Изоэлектрический зубец Р в I отведении или отклонение вектора Р вправо.
Диагностика. На ЭКГ в большинстве случаев на фоне синусового ритма
отмечаются признаки гипертрофии правых желудочка и предсердия.
Наиболее ранними изменениями ЭКГ, которые вначале могут быть пре-
ходящими и связанными с усугублением альвеолярной гипоксемии, явля-
ются поворот электрической оси сердца вправо более чем на 30° от исходного,
отрицательные зубцы Т в отведениях V,_3, депрессия сегмента ST в отведе-
ниях II, III, aVF, различная степень блокады правой ножки пучка Гиса,
увеличение амплитуды зубца R в отведении V3R_5R по типу qR или rSR\ В
более поздних стадиях отмечаются истинный поворот электрической оси сердца
вправо от 90 до 180° и высокие зубцы R или R’ (R>S) в отведениях V] 2 с
отрицательными зубцами Гили без них. Эти изменения ЭКГ наиболее выраже-
ны при первично-сосудистом генезе легочного сердца. В то же время у больных
с хроническими обструктивными заболеваниями легких (бронхит, эмфизема)
они в значительной степени маскируются вследствие опущения диафрагмы,
увеличения передне-заднего размера грудной клетки, гиперинфляции лег-
ких, ткань которых обладает низкой электропроводностью, и поворота более
вертикально расположенного сердца таким образом, что правые предсердие и
желудочек перемещаются кпереди, а верхушка сердца - кзади. В таких случаях
единственным “классическим” электрокардиографическим признаком легоч-
ного сердца часто является P-pulmonale, которое при этом в большей степени
отражает изменение анатомического положения сердца, чем гипертрофию
правого предсердия. О развитии гипертрофии и перегрузки правого желудочка
613
косвенно судят на основании синдрома “S,-Sn—S)n” вследствие поворота
вектора QRS вправо и кверху. Это обусловливает и появление глубоких
зубцов Q вплоть до зубца QS, в отведениях III и V34, напоминающих
признаки рубцовых изменений в миокарде после перенесенного инфаркта.
Вольтаж ЭКГ часто снижен. Атипичные изменения отмечаются и при де-
формациях грудной клетки, которые приводят к различным изменениям
анатомического расположения сердца.
Рентгенография грудной клетки. На первый план часто выступают призна-
ки основного заболевания легких, причем эмфизема вследствие переполне-
ния легких воздухом существенно маскирует увеличение сердца. Наиболее
ранним и надежным признаком легочного сердца при рентгенологическом
исследовании является увеличение ствола легочной астерии вследствие ги-
пертензии, а также его обеих основных ветвей. При этом усиление сосудисто-
го рисунка на периферии легочных полей, обусловленное венозным застоем,
отсутствует за исключением случаев сопутствующего заболевания левых от-
делов сердца. В относительно поздней стадии - при декомпенсации легочного
сердца — отмечается дилатация правых желудочков и предсердия. При этом в
прямой проекции тень сердца увеличивается, обычно умеренно, не только
вправо, но и влево за счет оттеснения левого желудочка правым, а верхушка
приподнимается и закругляется. Дилатация обращенных к грудине артерий и
выносящего тракта правого желудочка определяется также в правой передней
косой и боковой проекциях.
Хотя эмфизема легких иногда значительно затрудняет ультразвуковую
визуализацию сердца, двухмерная эхокардиография позволяет качественно
определить дилатацию полостей правых желудочка и предсердия и увеличение
толщины стенки желудочка, а по характеру изменения движения клапана
легочной артерии судить о наличии легочной гипертензии (см. выше). При
регургитации крови на трехстворчатом клапане или клапане легочной арте-
рии величину систолического давления в правом желудочке и легочной арте-
рии можно оценить расчетным путем по данным допплеровского исследования.
Эхокардиография позволяет исключить поражение миокарда левого же-
лудочка и стеноз митрального клапапа, которые являются частыми причи-
нами легочной гипертензии.
Наиболее точным методом выявления свойственной легочному сердцу
гипертрофии правого желудочка в настоящее время является сцинтиграфия
миокарда с 201Т1. Вследствие увеличения поглощения нуклида происходит
визуализация миокарда правого желудочка, которая в норме практически
отсутствует, и увеличение соотношения величин счета правого и левого же-
лудочков.
В случаях недостаточной информативности эхокардиографии радионук-
лидная правосторонняя вентрикулография позволяет в ранних стадиях забо-
левания обнаружить отсутствие повышения ФВ правого желудочка при на-
грузочном тестировании, свойственного здоровым лицам. Впоследствии от-
мечаются дилатация полости правого желудочка и снижение его ФВ в покое
при неизмененной функции левого желудочка.
614
Исследование внешнего дыхания помогает отдифференцировать “легочную”
одышку от “сердечной” (см. главу “Дифференциальная диагностика при одыш-
ке”, т. 2) и уточнить причину легочного сердца. У больных с его первично-
сосудистым генезом существенные изменения легочных объемов и механи-
ки дыхания обычно отсутствуют. РаО2 мало изменено, реже умеренно сни-
жено из-за нарушения вентиляционно-перфузионных соотношений. При этом
часто определяется выраженная артериальная гипокапния, обусловленная
гипервентиляцией. В то же время для бронхолегочных и торакодиафрагмаль-
ных заболеваний характерны заметные нарушения внешнего дыхания, ко-
торые обусловлены дыхательной недостаточностью и отражают ее тип (об-
структивный, рестриктивный) и выраженность. РаО2 значительно снижено.
В отличие от сердечной недостаточности, оно не корригируется при дыхании
100 % кислородом и сопровождается уменьшением насыщения гемоглобина.
РаСО2 не изменено или в далеко зашедших случаях повышено.
При стойкой артериальной гипоксемии закономерно развивается поли-
цитемия с увеличением содержания гемоглобина и гематокритного числа
свыше 55.
Катетеризация правых отделов сердца является единственным надежным
методом измерения давления в легочной артерии и, будучи технически от-
носительно несложной, может быть выполнена с помощью катетера Сван-
Ганца непосредственно в палате. Диагностическое значение имеют легочная
гипертензия с повышением ЛС при нормальном “заклинивающем” давле-
нии в легочных капиллярах, которая возрастает при физической нагрузке,
что имеет важное значение для подтверждения диагноза легочного сердца в
ранних стадиях. При компенсированным легочном сердце МОС, измерен-
ный методом термодилюции, в большей части случаев повышен, но может
быть и не изменен или несколько снижен (последнее чаще наблюдается при
“чистой” эмфиземе легких и сосудистом генезе легочного сердца). При раз-
витии правожелудочковой недостаточности он снижается одновременно с
повышением КДД в правом желудочке, среднего давления в правом пред-
сердии и ЦВД. В отдельных случаях производят также катетеризацию левых
отделов сердца и рентгеноконтрастную ангиокардиографию для исключения
врожденных пороков и заболеваний левых отделов сердца как причины ле-
гочной гипертензии и сердечной недостаточности.
Дифференциальный диагноз при хроническом легочном сердце предусмат-
ривает:
1) дифференциальную диагностику хронического декомпенсированного
легочного сердца с “чистой” дыхательной недостаточностью;
2) дифференциальный диагноз с легочной гипертензией вследствие не-
достаточности левых отделов сердца, врожденных пороков с синдромом
Эйзенменгера и окклюзии легочных вен;
3) установление причины легочного сердца, то есть характера основного
заболевания.
1. Решение вопроса о наличии или отсутствии у больного с хроническим
бронхолегочным заболеванием, особенно обструктивным, с выраженной
615
дыхательной недостаточностью, правожелудочковой недостаточности иногда
представляет определенные трудности. Это обусловлено тем, что ухудшение
бронхиальной проходимости обусловливает образование механического пре-
пятствия для венозного возврата крови в фазу выдоха, что проявляется набу-
ханием шейных вен и небольшими периферическими отеками. В обоих случаях
отмечается также выраженный цианоз и пальпируется нижний край печени.
При тщательном клиническом обследовании в пользу развития декомпенси-
рованного хронического легочного сердца свидетельствует сохранение набу-
хания шейных вен независимо от фаз дыхания, тогда как при нарушении
бронхиальной проходимости оно отмечается только во время выдоха. Харак-
терными признаками являются также акроцианоз, холодные на ощупь конеч-
ности, в отличие от теплого центрального цианоза при изолированной дыха-
тельной недостаточности, и истинное увеличение печени, помимо смеще-
ния ее края книзу из-за опущения диафрагмы. Важное диагностическое зна-
чение имеют данные инструментального исследования сердца — рентгено- и
эхокардиографии, позволяющие обнаружить дилатацию правого желудочка,
предсердия, а также ствола легочной артерии с признаками ее гипертензии.
2. При исключении других причин легочной гипертензии отдифференци-
ровать первичную правожелудочковую недостаточность, то есть легочное
сердце, от вторичной, обусловленной недостаточностью левых отделов сер-
дца (недостаточностью левого желудочка, митральным стенозом и др.), обыч-
но не сложно на основании клинического обследования (см. ниже). Уточнить
диагноз позволяют данные рентгено-, эхокардиографии, а также результа-
ты определения газового состава артериальной крови при дыхании воздухом
и 100 % кислородом. В сложных случаях можно прибегнуть к измерению “зак-
линивающего” давления в “легочных капиллярах”, нормальный уровень
которого исключает как левожелудочковую недостаточность, так и тромбоз
легочных вен.
Катетеризация сердца и ангиокардиография являются практически един-
ственно надежными методами дифференциальной диагностики легочного
сердца сосудистого генеза, например при первичной легочной гипертензии,
и синдрома Эйзенменгера вследствие врожденных пороков сердца. Необхо-
димо, однако, иметь в виду, что значительное повышение давления в пра-
вом предсердии по сравнению елевым при хроническом декомпенсирован-
ном легочном сердце может вызвать открытие овального отверстия и появ-
ление право-левого сброса крови.
3. Причину хронического легочного сердца устанавливают на основании
данных клинического и инструментального обследования, которые обычно
без труда позволяют диагностировать хронические заболевания бронхов и
легочной паренхимы, скелета грудной клетки, нейромышечные заболевания
и центральные нарушения вентиляции. При отсутствии изменений в этих
органах более сложной задачей является определение причины первичного
поражения легочных артерий. Дифференциальный диагноз первичной легоч-
ной гипертензии с легочной гипертензией вследствие рецидивирующей
ТЭВЛА и легочного васкулита - см. выше.
616
Ранняя диагностика хронического легочного сердца до развития наруше-
ний газового состава крови и сердечной недостаточности представляет зна-
чительные трудности в связи со сложностью достаточно надежного выявле-
ния гипертрофии правого желудочка. Диагноз ставят на основании: 1) нали-
чия бронхолегочного, сосудистого или торакодиафрагмального заболевания
с достаточно тяжелым течением, чтобы вызывать выраженную дыхательную
недостаточность и гипоксию; 2) наличия легочной гипертензии по данным
клинического и инструментальных (рентгено-, эхокардиография) методов
при отсутствии других ее возможных причин; 3) гипертрофии правого желу-
дочка (электрокардио-, эхокардиография, радионуклидные методы) и (или)
его недостаточности (данные клинического обследования, рентгено-, эхо-
кардиографии, правосторонней радионуклидной вентрикулографии). В со-
мнительных случаях уточнить степень легочной гипертензии и функцию пра-
вого желудочка позволяет катетеризация правых отделов сердца.
Варианты течения. При бронхолегочном генезе хронического легочного сер-
дца его клинические проявления существенно не зависят от характера ос-
новного заболевания. В случаях хронических обструктивных за-
болеваний с преобладанием эмфиземы легких (“розовые пыхтелыци-
ки”) за счет гипервентиляции газовый состав крови долгое время не изме-
няется и, несмотря на выраженную одышку, тяжелая легочная гипертензия
и сердечная недостаточность возникают поздно — лишь в терминальных ста-
диях. При хроническом диффузном бронхите гиповентиляция, сопровожда-
ющаяся гипоксемией, легочной гипертензией и сердечной недостаточно-
стью, развивается относительно быстро и сначала протекает волнообразно с
периодами ухудшения и улучшения. У таких больных, которых называют
“синими одутловатиками”, рано проявляется выраженный цианоз, несмот-
ря на теплые конечности и “скачущий” пульс. Часто отмечаются также “ба-
рабанные палочки”и сонливость.
Длябольныхрестриктивными заболеваниями легких вслед-
ствие диффузного пневмосклероза характерны цианоз, одышка с тахипноэ
и гипервентиляцией, особенно при физической нагрузке. Сердечная недо-
статочность развивается относительно поздно при выраженном и стойком
нарушении газового состава крови и, как в случаях тяжелой эмфиземы,
носит неуклонно прогрессирующий характер.
Нервно-мышечные заболевания и заболевания цент-
ральной нервной системы (сосудистые, опухолевые, энцефалит и
др.), сопровождающиеся выраженной альвеолярной гиповентиляцией, при-
водят к формированию хронического легочного сердца даже при отсутствии
бронхолегочной патологии. В то же время при кифозе и кифосколиозе сер-
дечная недостаточность развивается относительно редко и обычно лишь при
сопутствующих хронических бронхолегочных инфекциях.
Для синдрома Пиквика характерно сочетание выраженного
ожирения и сонливости с цианозом, полицитемией и правожелудочковой
недостаточностью. Гиповентиляция и легочная гипертензия имеют сложный
патогенез и связаны главным образом с резким ожирением, вызывающим
617
слабость дыхательных мышц, снижение податливости грудной клетки и об-
струкцию дыхательных путей во время сна. Определенную роль играет также
уменьшение чувствительности дыхательного центра к углекислому газу.
Правожелудочковая недостаточность развивается даже при неизмененных
легких, и в ранних стадиях заболевания при своевременном похудании мо-
жет быть предотвращена.
Первичная легочная гипертензия описанавыше.
Осложнения. Кроме осложнений, связанных с выраженной ле-
гочной гипертензией (синкопе, тромбозы и ТЭВЛА и др.), и пра-
вожелудочковой недостаточности, встречаются:
1)предсердные аритмии, особенно трепетание предсердий. Боль-
шей частью связаны с усугублением легочной гипертензии в периоды обо-
стрения бронхолегочных заболеваний. Постоянная форма мерцания (трепе-
тания) предсердий встречается, однако, относительно редко;
2) внезапная сердечная с м е р т ь. Обусловлена главным образом
фатальными желудочковыми аритмиями, в генезе которых важная роль от-
водится ишемии и фиброзу миокарда правого желудочка.
Лечение при хроническом компенсированном легочном сердце состоит в
предотвращении стойкой легочной гипертензии и правожелудочковой недо-
статочности путем улучшения вентиляции и коррекции артериальной гипоксе-
мии. Эти же мероприятия являются первоочередными при декомпенсации
легочного сердца. Они предусматривают:
1) прекращение курения и контакта с другими раздражающими
веществами, прежде всего пылью. Рекомендуется также максимально избе-
гать вдыхания холодного воздуха;
2) активное л е ч е н и е основного заболевания в целях улучше-
ния альвеолярной вентиляции. При хронической бронхолегочной патологии
оно заключается прежде всего в улучшении проходимости бронхов. Обеспе-
чение хорошего удаления бронхиального секрета достигается путем разжи-
жения мокроты и широкого использования бронходилататоров. Не следует
допускать дегидратации организма, особенно при применении мочегонных
препаратов в условиях эритроцитоза, так как это приводит к увеличению
вязкости бронхиального секрета и усугублению нарушения его отхождения.
Для удаления слизи, накапливающейся во время сна, показаны постураль-
ный дренаж и при необходимости ингаляции бронходилататора. Эти препа-
раты широко применяют в виде аэрозолей (изопротеренол и др.), а также,
при ухудшении, парентерально (эуфиллин, глюкокортикостероиды). В тяже-
лых случаях при нарастающей дыхательной недостаточности производят раз-
жижение и отсасывание секрета из бронхов при бронхоскопии;
3) раннее и активное л е ч е н и е обострений хронической брон-
хо-легочной инфекции, которые усугубляют нарушение бронхиаль-
ной проходимости и гипоксию и могут вызывать дальнейшее разрушение
паренхимы легких. Их своевременное распознавание у больных с хроничес-
ким легочным сердцем основывается на изменении характера кашля, осо-
бенно появлении гнойной мокроты, а также дистанционных хрипов и боли
618
в грудной клетке при дыхании, повышения температуры тела. Характерны
также нарастание одышки, слабости, цианоза и, при наличии сердечной
недостаточности, ее выраженности. Изменения данных физикального об-
следования легких часто отсутствуют или весьма скудные, в виде увеличе-
ния количества сухих и влажных хрипов. Лечение состоит в раннем назначе-
нии антибиотиков - тетрациклинов, эритромицина или полусинтетических
пенициллинов. При отсутствии эффекта проводят коррекцию антибактери-
альной терапии в соответствии с чувствительностью возбудителя, выделен-
ного из мокроты при ее бактериальном посеве. При бронхообструктивном
синдроме, особенно в случаях недостаточной эффективности лечения, ис-
пользуют короткие курсы глюкокортикостероидов;
4)коррекцию альвеолярной и артериальной гипоксе-
мии и гиперкапнии с помощью повышения концентрации кислорода
во вдыхаемом воздухе. Роль оксигенотерапии в лечении легочного сердца
определяется патогенетическим значением гипоксии при этом заболевании.
Доказана ее способность снижать давление в легочной артерии и ЛСС, улуч-
шать функцию центральной нервной системы и вызывать уменьшение пери-
ферических отеков, особенно в периоды обострений бронхолегочной инфек-
ции. Во избежание уменьшения стимуляции дыхательного центра под влияни-
ем гипоксемии и гиповентиляции с задержкой углекислого газа рекомендуют-
ся относительно небольшие дозы кислорода (1—3 л/мин, 25—30 %), который
подают увлажненным через носовые катетеры. Длительные, не менее 12—
15 ч ежедневно на протяжении многих месяцев и даже лет, ингаляции кисло-
рода способствуют значительному улучшению выживаемости и уменьшению
количества случаев госпитализации больных с хроническими обструктивными
заболеваниями легких. Этот эффект проявляется, однако, лишь через несколь-
ко месяцев от начала оксигенотерапии и более выражен при ее непрерывном,
в течение 24 ч, применении и наличии гиперкапнии. При неэффективности
самостоятельного дыхания кислородом и нарастании РаСО2 более 60 мм
рт.ст. используют различные методы вспомогательной вентиляции легких.
При декомпенсации легочного сердца коррекция альвеолярной гипоксе-
мии дополняется терапией, направленной на улучшение насосной функции
правого желудочка. О ее второстепенном значении при этом заболевании
свидетельствует отсутствие существенного эффекта при изолированном при-
менении у большинства больных. Лечение правожелудочковой недостаточ-
ности включает следующие средства, которые перечислены ниже в порядке
убывающей значимости:
1) мочегонные препараты. Уменьшают отеки и улучшают пери-
ферическое кровообращение и газообмен через альвеолярно-капиллярную
мембрану. Обычно применяют сильнодействующие петлевые диуретики. Для
предотвращения метаболического алкалоза, который усугубляет снижение
чувствительности центров продолговатого мозга к углекислому газу, их со-
четают с антагонистами альдостерона;
2) периферические вазодилататоры . Применяют для лечения
легочной гипертензии и уменьшения постнагрузки правого желудочка. По
619
аналогии с левожелудочковой недостаточностью такой подход при хрони-
ческом декомпенсированном легочном сердце представляется теоретически
обоснованным, однако его клиническая эффективность не получила пока
убедительного подтверждения. Имеются сообщения о возможности сниже-
ния ЛСС у части больных с помощью диазоксида, начиная с дозы 200 мг 3
раза в сутки, больших доз блокаторов кальциевых каналов (нифедипин —
240 мг в сутки, дилтиазем - по 720 мг в сутки), которые способствуют так-
же регрессии гипертрофии правого желудочка (S.Rich, B.Brundage, 1987), а
также а-адреноблокаторов (празозин), ингибиторов АПФ, гидралазина и
эуфиллина. Для оптимизации назначения вазодилататора желателен подбор
наиболее эффективного препарата под контролем давления в правом желу-
дочке и легочной артерии во время катетеризации правых отделов сердца;
3) кровопускания. Показано при гематокритном числе более 55 для
уменьшения вязкости крови, снижения постнагрузки правого желудочка и
предупреждения тромбозов легочной артерии. Производят дробно по 200—
300 мл до снижения гематокритного числа около 45;
4) сердечные гликозиды. При хроническом легочном сердце с пра-
вожелудочковой недостаточностью и синусовым ритмом не способны улуч-
шить легочное кровообращение и функцию правого желудочка и практиче-
ски не эффективны. У части больных они могут даже усугублять легочную
гипертензию за счет повышения МОС и ЛСС. Показаны преимущественно
при мерцательной аритмии и сопутствующей левожелудочковой недостаточ-
ности. В связи с наличием у больных с легочным сердцем гипоксии, а часто
и гипокалиемии, требуют осторожного применения.
Учитывая подверженность больных с хроническими обструктивными забо-
леваниями легких с дыхательной недостаточностью острым язвам желудка,
при их лечении следует сохранять настороженность ввиду возможности воз-
никновения желудочно-кишечных кровотечений (контроль кала на скры-
тую кровь, фиброгастродуоденоскопия) и избегать назначения антикоагу-
лянтов.
При терминальной легочной гипертензии у больных молодого возраста
производят трансплантацию комплекса “сердце—легкие”. Опыт 1000 таких
операций, выполненных к концу 1991 г., свидетельствует о возможности
достижения значительного увеличения выживаемости - до 65 % к концу
1-го года и 55 % — 3-го (J.Kreitt, М.Кауе, 1991). Основной проблемой при
этом, кроме нехватки доноров, является невозможность длительной (более
6 ч) консервации легких. Отторжение проявляется облитерирующим брон-
хиолитом, который распознается при серийной биопсии.
Прогноз. Поскольку хроническое легочное сердце развивается при далеко
зашедших заболеваниях легких, сопровождающихся тяжелой дыхательной
недостаточностью, прогноз неблагоприятен. Продолжительность жизни та-
ких больных после развития правожелудочковой недостаточности обычно не
превышает 3—4 лет. При первичной легочной гипертензии она колеблется от
3 до 7 лет с момента появления первых симптомов. По данным G.D’Alonzo и
соавторов (1991), в группе из 194 таких больных 3-х летняя выживаемость
620
составила 48 %, а 5-летняя — 34 %. Выживаемость больных о хроническим
легочным сердцем вследствие многократно рецидивирующей тромбоэмбо-
лии мелких ветвей легочной артерии может быть большей благодаря лизису
и реканализации тромбов. Смерть наступает преимущественно от прогресси-
рующей правожелудочковой недостаточности, однако нередко бывает и вне-
запной.
Профилактика у больных с хроническими заболеваниями легких предус-
матривает:
^предотвращение интеркуррентных бронхолегочных
инфекций. В этих целях необходимо избегать контакта с инфицирован-
ными лицами, особенно в осенне-зимнее время. При отсутствии аллергии
желательно каждую осень проводить иммунизацию поливалентной вакци-
ной вирусов гриппа. Отдельным больным с тяжелым течением основного
бронхолегочного заболевания, подверженным особенно частым и длитель-
ным респираторным инфекциям, можно рекомендовать в зимнее время анти-
биотикопрофилактику тетрациклином (по 250 мг 4 раза в сутки), эритроми-
цином или ампициллином;
2)исключение контакта с раздражающими слизистую
оболочку бронхов веществами. Чрезвычайно важное значение имеет
прекращение курения. В связи с раздражающим действием вдыхаемого хо-
лодного воздуха в осенне-зимнее время на улице больным рекомендуют
прикрывать рот и нос шарфом или маской. Следует избегать использования
различных аэрозолей и нахождения в среде со значительной запыленностью
воздуха. Нельзя допускать длительного непродуктивного кашля, который
раздражает нижние дыхательные пути;
3) улучшение проходимости б р о н х о в. Для облегчения отхож-
дения бронхиального секрета рекомендуется его разжижение путем упот-
ребления большого количества жидкости (Зли более в сутки). Более эффек-
тивному удалению накапливающейся за ночь мокроты сразу после пробуж-
дения помогает постуральный дренаж с предварительной ингаляцией брон-
ходилататора. Традиционно назначаемые отхаркивающие препараты и муко-
литические средства, которых с каждым годом становится все больше, не
оказывают существенного и стойкого влияния на проходимость бронхов;
4) физические методы.К ним относятся обучение больных неко-
торым приемам, позволяющим уменьшить выраженность бронхиальной об-
струкции и облегчить выдох, тренировки с задержкой дыхания и дозиро-
ванные физические упражнения (ходьба и др.), способствующие улучше-
нию толерантности к физической нагрузке.
ЭМБОЛИЯ ЛЕГОЧНОЙ АРТЕРИИ
В подавляющем большинстве случаев эмболия ветвей легочной артерии
обусловлена их окклюзией фрагментами венозных тромбов, то есть является
тромбоэмболией. Значительно реже встречается эмболизация каплями жира
621
из костей при их переломе, клетками опухоли, паразитами, амниотической
жидкостью и воздухом.
Частота. ТЭВЛА — распространенная причина заболеваемости и смер-
тности. Ее истинную частоту трудно установить в связи с противоречиво-
стью клинических и патологоанатомических данных.
На аутопсии ТЭВЛА различной давности выявляется примерно в 10—20 %,
а у больных пожилого возраста с хроническими сердечно-сосудистыми забо-
леваниями — более чем в 30 % случаев. С учетом результатов микроскопии,
позволяющих обнаруживать следы эмболов, частота ТЭВЛА достигает 60 %.
Даже эти данные являются, возможно, заниженными, так как многие тром-
боэмболы лизируются, не оставляя после себя следа. Кроме того, отличить
прижизненные тромбы в сосудах легких от посмертных довольно трудно. В
ряде таких случаев имеет место также агональный тромбоз in situ, связан-
ный с резким замедлением кровотока.
Клиническое значение мелких тромбоэмболов в большинстве случаев
невелико, и многие такие эпизоды остаются нераспознанными. По некото-
рым данным ТЭВЛА диагностируют прижизненно лишь у 30 % больных.
Удельный вес ТЭВЛА среди причин летальных исходов зависит от контин-
гента больных и в среднем не достигает 10 %. Он выше у пожилых и лиц,
умерших в стационаре. В многопрофильной больнице возникновение фа-
тальной ТЭВЛА следует ожидать у 3—5 на 1000 больных, а с благоприятным
исходом - еще у 15-20 больных.
Этиология. Основная причина ТЭВЛА - тромбоз глубоких вен илеофемо-
ральной системы, главным образом крупных — подколенной и расположен-
ных проксимальнее. При этом флебит, как правило, отсутствует. При пато-
логоанатомическом исследовании тромбоз глубоких вен выявляют у 80-100 %
больных ТЭВЛА, однако его клинические признаки регистрируются в сред-
нем лишь в 50 % случаев.
Более редкими источниками легочной эмболии являются тромбы в ве-
нозном сплетении таза, образующиеся в основном как осложнение хирур-
гических и гинекологических операций, тромбы правого предсердия при мер-
цательной аритмии и правого желудочка при тяжелой сердечной недостаточ-
ности. В последние годы в связи с катетеризацией подключичных и яремных
вен для проведения интенсивной инфузионной терапии появились случаи
их тромбоза с последующей легочной эмболией. Тромбофлебит поверхност-
ных вен нижних конечностей, который часто отмечается при их варикозном
расширении, практически никогда не осложняется ТЭВЛА.
Факторы риска ТЭВЛА аналогичны факторам, предрасполагающим к ве-
нозному тромбозу. Среди них ведущая роль принадлежит сердечно-сосудис-
тым заболеваниям — ревматизму, острому инфаркту миокарда, кардиомио-
патиям и другим, протекающим с застойной сердечной недостаточностью.
Они обнаруживаются более чем в 80 % случаев смерти от ТЭВЛА.
Патогенез и течение. Возникновению легочной эмболии у больных с ве-
нозным тромбозом способствуют физическое усилие и ускорение кровото-
ка, например, резкое вставание, натуживание при дефекации (“смерть на
622
стуле”), надсадный кашель. При этом тромбоз не обязательно приводит к
массивной тромбоэмболии, так как при ударах о стенки легочного ствола и
его ветвей тромб фрагментируется, что влечет за собой множественную ок-
клюзию, в 70 % случаев двустороннюю. Учитывая склонность эмболизации
к непрерывному рецидивированию, а также местному увеличению тромба в
размерах в проксимальном направлении, то есть против тока крови (асцен-
дирующий тромбоз), достаточно часто массивная ТЭВЛА развивается из не-
массивной. Это отмечается в 1/2-2/3 случаев и обусловливает относитель-
ность такого подразделения заболевания. Лишь примерно у 10 % больных
имеет место первичная обтурация легочного ствола или его главных ветвей
свежими тромботическими массами, что сопровождается острым, без пред-
вестников, развитием грозной клинической картины. Даже в этом случае
могут наблюдаться частичная окклюзия и быстрый лизис тромба.
Непосредственным результатом ТЭВЛА является полное или частичное
прекращение снабжения кровью соответствующих участков паренхимы лег-
ких. Это приводит к нарушениям гемодинамики (легочной, внутрисердеч-
ной, системной), с одной стороны, и легочной вентиляции — с другой,
выраженность которых в значительной мере определяется размером зоны
гипоперфузии.
В подавляющем большинстве случаев к 10—14-м суткам отмечается пол-
ное или почти полное восстановление кровотока как в крупных, так и в
мелких легочных артериях. Как и при тромбозе глубоких вен, восстановле-
ние легочного кровотока происходит посредством спонтанного тромболизи-
са и (или) организации тромба. Циркулирующий в крови плазминоген ад-
сорбируется на поверхности сгустка и под действием киназ превращается в
плазмин — протеолитический фермент, способный вызывать распад фибри-
ногена с образованием более мелких растворимых фрагментов, которые мо-
гут смещаться током крови в более дистальные мелкие разветвления легоч-
ной артерии. Чем мягче и “свежее” тромб, тем он легче и быстрее подверга-
ется лизису и организации. Стойкое сохранение окклюзии у небольшой час-
ти больных связано, по-видимому, с эмболизацией старыми плотными тром-
бами и (или) несостоятельностью собственной фибринолитической систе-
мы организма. Однако спустя несколько недель развиваются коллатерали
бронхиальных артерий, что способствует частичному восстановлению пер-
фузии альвеол и продукции сурфактанта. Способность к спонтанному лизи-
су эмбола и его темпы весьма вариабельны и, наряду с объемом сгустка,
уровнем обтурации сосудистого русла и исходным состоянием легочного кро-
вотока, определяют характер клинического течения ТЭВЛА.
Клиника. Проявления ТЭВЛА неспецифичны и варьируют от скудных,
обнаруживаемых лишь при целенаправленном обследовании, симптомов и
признаков, до картины тяжелого шока и внезапной смерти.
По клиническому течению с определенной долей условности можно вы-
делить два основных варианта ТЭВЛА — массивную и немассивную. Первая
может быть обусловлена как тотальной или субтотальной окклюзией круп-
ных ветвей, так и (реже) распространенной эмболизацией мелких на фоне
623
Основные симптомы и клинические признаки ТЭВЛА и их частота
(по S.D.Shapiro, ЕЛ.СатрЬеП, 1989)
Симптом, % Клинический признак, %
Боль в грудной клетке, 88 Тахипноэ (г20 в 1 мин) 85
в том числе плевральная 74 Тахикардия (г100 в 1 мин) 58
другого характера 14 Акцент Р2 57
Одышка 84 Хрипы в легких 56
Чувство тревоги 63 Лихорадка (а38,5 "С) 50
Кашель 50 Флебит 32
Кровохарканье 28 Цианоз 19
Синкопе 13 Шум трения плевры 18
исходного нарушения легочного кровотока вследствие хронических заболе-
ваний сердца или легких. Массивная ТЗВЛА может протекать остро и под-
остро. Ее основные проявления - синдром острого легочного сердца, об-
структивный шок и внезапная смерть.
Немассивная (локальная) легочная эмболия обычно развивается при
поражении мелких ветвей легочной артерии и проявляется синдромом
малых признаков и (или) инфаркта легкого. В большинстве случаев она
имеет рецидивирующее течение, изредка с исходом в хроническую тром-
боэмболическую легочную гипертензию. У ряда больных протекает бессимп-
томно. Таким образом, отдельные клинические синдромы ТЭВЛА могут от-
мечаться изолированно либо в сочетании друг с другом.
Острая массивная ТЭВЛА. Развивается при глубоких нарушениях легоч-
ной гемодинамики в результате острого уменьшения суммарной площади
поперечного сечения артериального русла легких более чем на 60 %, что
обусловлено значительной резервной емкостью их артериальной сети. При
этом, наряду с механической (анатомической) окклюзией, значительную
роль в уменьшении легочного кровотока играет спазм мелких артерий и
артериол под влиянием вазоактивных веществ - серотонина, тромбоксана и
других, которые выделяются из тромбоцитов, оседающих на поверхности
свежего тромбоэмбола. У больных с хроническими заболеваниями сердца
или легких для возникновения тяжелых расстройств гемодинамики доста-
точно обструкции эмболом менее 30 % легочного артериального русла.
Патогенез острой массивной ТЭВЛА (схема 35) обусловлен: 1) наруше-
ниями гемодинамики, 2) нарушениями дыхания.
1. Нарушения гемодинамик и. Книмотносятся: 1) острая пра-
вожелудочковая не достаточност ь, или острое легочное
сердце; 2) синдром малого выброс а,включая обструктивный
ш о к. В их основе лежит повышение сопротивления легочному кровотоку в
ответ на значительное уменьшение емкости артериального русла. Резкая пе-
регрузка сопротивлением тонкостенного правого желудочка, приспособлен-
ного к работе в системе низкого давления, приводит к острому развитию
его недостаточности с дилатацией полости, повышением КДД и давления
на путях притока - в правом предсердии и центральных венах. При этом у
больных без тяжелых “фоновых” заболеваний сердца и легких легочная
624
^сосудистого русла легких тромБозыБалом
Схема 35. Патогенез острого легочного сердца и нарушения вентиляционно-перфузи-
онных соотношений при массивной ТЭВЛА: ЦВД — центральное венозное давление
гипертензия не достигает значительной выраженности. Так, по некоторым
данным, систолическое давление в легочной артерии составляет в среднем
около 40 мм рт.ст.
Препятствие изгнанию крови из правого желудочка вызывает более
или менее выраженное уменьшение минутного объема малого круга кро-
вообращения, и следовательно, венозного возврата к левым отделам сер-
дца и МОС. Именно с этим связан один из самых частых первых клиничес-
ких признаков массивной ТЭВЛА — так называемый “коллапс”, проявле-
ния которого варьируют от кратковременного синкопе вследствие преходя-
щего уменьшения мозгового кровотока до внезапной сердечной смерти. При
значительном и стойком сохранении малого сердечного выброса развивают-
ся признаки обструктивного шока (см. главу 12).
Снижение давления в аорте в сочетании с его повышением в правом
предсердии, вызывая уменьшение перфузионного давления в коронарных
артериях, может приводить к развитию ишемии миокарда и, как следствие,
к еще большему снижению МОС.
625
2. Нарушения дыхания (см. схему 35). Обусловлены дисбалансом
легочной вентиляции и перфузии, основными механизмами которого
являются: 1) вентиляция неперфузируемых альвеол, что приводит к увели-
чению внутрилегочного функционального “мертвого пространства” и ухуд-
шению газообмена; 2) перфузия невентилируемых или гиповентилируемых
альвеол вследствие бронхоспазма и ателектазов. Констрикция дыхательных
путей обусловлена: а) влиянием вазоактивных веществ (гистамина, серото-
нина, простагландинов и др.), которые освобождаются из тромбоцитарных
агрегатов и тучных клеток; б) бронхиальной гипокапнией, которая развива-
ется в участках гипоперфузии и носит компенсаторный характер. Ишемия
пневмоцитов вызывает нарушение выработки сурфактанта, которое дости-
гает значительной выраженности через 12—15 ч после прекращения кровото-
ка и спустя 24—48 ч может приводить к развитию ателектаза. Такая так назы-
ваемая облигатная перфузия гиповентилируемых альвеол обусловлена стой-
ким повышением давления в артериальных сосудах проксимальнее препят-
ствия, которое превосходит рефлекторные вазоконстрикторные влияния. Ее
следствием является увеличение легочного венозного шунта и альвеолярно-
артериального градиента РО2. В итоге возникает выраженная артериальная
гипоксемия (РО2 составляет в среднем 50 мм рт.ст.), которая относится к
наиболее характерным признакам массивной ТЭВЛА. Сердечная недоста-
точность приводит к снижению РО2 и в смешанной венозной крови.
Острая массивная ТЭВЛА обычно развивается у ранее относительно здо-
ровых лиц любого возраста, чаще у женщин, после операции или травмы в
области таза и нижних конечностей или периода иммобилизации по другой
причине. Образующиеся в глубоких венах этого бассейна рыхлые тромбы
часто своевременно не распознаются и легко отрываются от сосудистой стенки.
Если такой тромб застревает в области бифуркации легочной артерии или в
непосредственной близости от нее, наступает внезапная смерть, которой за
считанные минуты предшествуют падение АД и часто потеря сознания. При
смещении тромбов в более дистальные, но достаточно крупные, ветви раз-
вивается картина острого легочного сердца.
Заболевание начинается остро с выраженной одышки, резкой боли за
грудиной, у части больных наблюдается кратковременное синкопе. Как вы-
ясняется лишь при целенаправленном расспросе, примерно у 1/3 пациентов
этому предшествуют непродолжительная плевральная боль, кровохарканье
и другие “малые” симптомы “продромального” эпизода тромбоэмболии мел-
ких ветвей легочной артерии (см. ниже).
Основными жалобами при остром легочном сердце являются: 1) одыш-
к а. Ведущий и наиболее постоянный симптом. Носит преимущественно ин-
спираторный характер и, если нет исходного венозного застоя в легких, не
сопровождается ортопноэ;
2) интенсивная разлитая загрудинная боль. Напоминает ангиноз-
ную, что при наличии картины шока создает значительные трудности для
дифференциальной диагностики с острым инфарктом миокарда. Механизм
626
болевого синдрома не вполне ясен. Возможно, имеется связь с острой дила-
тацией правого желудочка и коронарной недостаточностью;
3) нарушение сознания. Отмечается примерно у 1/3 больных и
обусловлено снижением мозгового кровотока и артериальной гипоксемией
при резком падении МОС.
Поскольку эмболия развивается исключительно или преимущественно в
центральных крупных ветвях легочной артерии, плевральная боль в боку и
кровохарканье не характерны.
Общее состояние больных тяжелое или крайне тяжелое. Данные физичес-
кого обследования неспецифичны и позволяют лишь заподозрить ТЭВЛА.
Важное значение доя их правильной интерпретации имеет настороженность
врача. К ним относятся признаки правожелудочковой недостаточности в со-
четании с тахипноэ и в ряде случаев с картиной шока. При этом признаки
легочной гипертензии — пульсация во втором межреберье слева у края гру-
дины, акцент Р2 — слабо выражены или не определяются, особенно в 1-е
сутки, что отчасти связано с низким МОС.
Наиболее постоянными клиническими признаками являются:
1) “бледный цианоз” кожи из-за периферического сосудистого спазма
и снижения насыщения артериальной крови;
2)стойкая тахикардия;
3) набухшие шейные вены и повышение ЦВД;
4) тахипноэ. При этом больные предпочитают лежать с низким изго-
ловьем. При попытке сесть может возникнуть потеря сознания, так как в
соответствии с законом Франка-Старлинга поддержание выброса крови пра-
вым желудочком в такой критической ситуации в значительной степени обес-
печивается высоким давлением наполнения.
Менее постоянными клиническими признаками являются:
1) правожелудочковая пульсация вдоль левого края грудины и в надчрев-
ной области;
2) широкое расщепление S2 из-за запаздывания изгнания крови правым
желудочком (Р2) и более раннего захлопывания аортального клапана (А2)
вследствие малого МОС;
3) правожелудочковый ритм галопа слева у края грудины (S3 или сумма-
ционный “галоп”);
4) артериальная гипотензия и признаки периферической гипоперфузии
при развитии шока;
5) признаки тромбоза глубоких вен нижних конечностей. Их отсутствие
не исключает, однако, ТЭВЛА.
Для подострой массивной ТЭВЛА характерно постепенное - в течение
нескольких дней или недель - развитие клинической картины. В отличие от
острого течения первые проявления часто связаны с тромбозом глубоких
вен. Боль и отек нижней конечности сопровождается эпизодами боли в груд-
ной клетке плеврального характера и кровохарканья с постепенным нараста-
нием одышки. Синкопэ не характерно. При катетеризации давление в легочной
627
артерии обычно выше, чем при острой массивной ТЭВЛА. По-видимому,
это связано с его постепенным повышением, что дает возможность пра-
вому желудочку адаптироваться к перегрузке сопротивлением и в итоге
развивать более высокое давление при одной и той же величине редук-
ции сосудистого русла.
Острая немассивная ТЭВЛА возникает при эмболизации периферических
ветвей легочной артерии мелкими тромбами, обычно множественными, с
поражением обоих легких, чаще нижних отделов. Инфаркт легкого возника-
ет, однако, у меньшего числа таких больных. Сохранение жизнеспособно-
сти легочной паренхимы обусловлено поддержанием ее адекватной оксиге-
нации посредством системы бронхиальных артерий и благодаря прямой аэра-
ции. Такая двойная защита направлена на надежное предохранение легких
от ишемии. Поэтому инфаркт легкого развивается преимущественно при на-
личии “фоновых” заболеваний сердца с венозным застоем в малом круге
кровообращения и хронических обструктивных заболеваний легких, кото-
рые вызывают ухудшение венозного оттока из легочных и бронхиальных
артерий и газообмена. Его субстратом является экссудация жидкой части плаз-
мы крови и клеточных элементов, в том числе эритроцитов, в просвет аль-
веол, изредка с образованием некроза. Часто в процесс вовлекается плевра.
Может присоединяться вторичная инфекция с развитием перифокальной
пневмонии. Поскольку уменьшение площади легочного артериального рус-
ла не достигает значительной выраженности, легочная гипертензия и нару-
шения кардиогемодинамики не характерны.
У ряда больных заболевание протекает бессимптомно и без каких-либо
клинических признаков. В клинической картине можно выделить два основ-
ных синдрома — так называемых малых признаков ТЭВЛА и инфаркта
легкого.
Синдром малых признаков. Включает скудные неспецифические проявле-
ния, которые позволяют заподозрить это заболевание и провести целена-
правленное обследование для его подтверждения или исключения лишь при
наличии настороженности в отношении возможности ТЭВЛА у лиц с фак-
торами риска. К ним относятся:
1) необъяснимая одышка, тахикардия или другие признаки ухудшения
хронического заболевания сердца или легких;
2) необъяснимый субфебрилитет, не уступающий антибиотикотерапии;
3) рецидивирующая “пневмония” то в одном, то в другом легком;
4) сухой или экссудативный плеврит;
5) пароксизм мерцательной аритмии;
6) “малые” неврологические симптомы — головокружение, обморок, тош-
нота, рвота;
7) чувство тревоги и сдавления в груди.
Распознавание ТЭВЛА в таких случаях облегчается при наличии призна-
ков венозного тромбоза, которые, однако, даже при целенаправленном ос-
мотре примерно у половины больных отсутствуют.
При синдроме инфаркта легкого основными жалобами являются:
628
Таблица 64. Особенности течения различных клинических вариантов ТЭВЛА
Клинический вариант ТЭВЛА Симптомы Признаки Давление в легочной артерии Лечение
Острая Плеврит, крово- Шум трения плев- Нормальное Не требуется
немассивная харканье (могут отсутствовать) ры, крепитация (могут отсутствовать) (гепарин по поводу тромбо- за глубоких вен)
Острая Острая одышка и Правожелудочковая Незначи- Тромболитичес-
массивная боль в трудной клет- ке, головокруже- ние, обморок недостаточность, нарушения вентиляции и перфузии, шок тельно повышено кая терапия, эмболэктомия
Подострая массивная Одышка, развива- ющаяся постепен- но, кровохарканье, боль и отек нижней То же Умеренно повышено То же
конечности
1) боль в грудной клетке, усиливающаяся на вдохе, связанная с вовлече-
нием в процесс плевры;
2) кровохарканье, от незначительного до обильного, повторяющегося.
Следует подчеркнуть, что, вопреки укоренившимся представлениям, оно
не является обязательным для ТЭВЛА.
Могут отмечаться также сухой кашель и невыраженная одышка вслед-
ствие раздражения альвеолярных рецепторов и снижения активности поверх-
ностно-активного вещества.
При объективном исследовании определяются:
1) повышение температуры тела;
2) иктеричность кожи вследствие внутрисосудистого гемолиза (редкий
признак);
3) тахипноэ, обычно небольшое;
4) физикальные признаки легочного инфильтрата: очаг притупления пер-
куторного тона, бронхиального дыхания, крепитируюгцих или мелкопузыр-
чатых хрипов;
5) шум трения плевры или признаки экссудативного плеврита. Выпот обыч-
но скудный. Лишь у единичных больных требуются повторные пункции с
эвакуацией серозно-фиброзного или геморрагического экссудата. Как и симп-
томы, эти изменения в статусе могут отсутствовать, что не исключает воз-
можности инфаркта легкого.
Симптомы и клинические признаки основных вариантов ТЭВЛА приве-
дены в таблице 64.
Диагностика представляет иногда значительные трудности, которые обус-
ловлены неспецифичностью и скудностью не только клинических проявле-
ний, но и данных рутинных дополнительных методов обследования. Если
при постановке диагноза ТЭВЛА руководствоваться только классическими
629
признаками, то в большинстве случаев его не удается поставить. В то же
время раннее и точное распознавание этого заболевания очень важно в
связи с высокой вероятностью потенциально фатального рецидива при
отсутствии специфического лечения, с одной стороны, и возможными
осложнениями этого лечения - с другой.
Электрокардиография имеет ограниченное диагностическое значение, так
как изменения в целом неспецифичны и могут отсутствовать. “Классичес-
кие” электрокардиографические признаки ТЭВЛА регистрируются преиму-
щественно при массивной эмболии с развитием острого легочного сердца и
тяжелых нарушений кардиогемодинамики. Они отражают острую перегрузку
правого желудочка и предсердия и постепенно исчезают в течение 5—7 дней.
К ним относятся:
1) отклонение электрической оси сердца вправо с глубоким зубцом 5 в I
отведении;
2) глубокий зубец Q в III отведении при его отсутствии в отведении aVF
(так называемый синдром S|-QIU);
3) отрицательные зубцы Тв отведениях III, Унз;
4) блокада правой ножки пучка Гиса (полная или неполная);
5) P-pulmonale;
6) смещение переходной зоны в грудных отделениях влево (rS в отведе-
ниях V(_4) в результате поворота сердца по часовой стрелке вокруг продоль-
ной оси вследствие дилатации правого желудочка;
8) стойкая синусовая тахикардия, иногда - пароксизмы мерцания или
трепетания предсердий, обусловленные гипоксией и дилатацией правого пред-
сердия.
У значительной части больных, особенно страдающих хроническими сер-
дечно-сосудистыми заболеваниями, ТЭВЛА проявляется на ЭКГ лишь не-
специфическими изменениями зубца Т, изолированными либо в сочетании
с отклонением электрической оси сердца вправо (Sf). При сопутствующей
ИБС могут регистрироваться также неспецифические признаки ишемии мио-
карда в виде изменений сегмента ST и зубца Т в отведениях V4_6. Необходи-
мо иметь в виду, что даже при массивной ТЭВЛА в 15 % случаев изменения
на ЭКГ отсутствуют, за исключением, пожалуй, упорной синусовой тахи-
кардии. Не меньшая, а, возможно, даже большая ценность ЭКГ при ТЭВЛА
состоит в исключении обширного инфаркта миокарда и перикардита. Нали-
чие, однако, глубоких зубцов Q и отрицательных зубцов Тв III отведении,
иногда с небольшим подъемом сегмента ST, создает дополнительные труд-
ности для диагностики (см. ниже).
Изменения на ЭКГ при немассивной ТЭВЛА обычно представлены от-
рицательными зубцами Т. Изредка отмечаются отклонение электрической
оси сердца вправо и (или) глубокий зубец Q в III отведении, P-pulmonale.
Рентгенография. Возможные изменения неспецифичны и в 30—40 % слу-
чаев, в том числе при массивной эмболии, вообще отсутствуют. Косвенны-
ми признаками ТЭВЛА без инфаркта легкого могут быть:
630
1) локальное обеднение сосудистого рисунка соответственно зонам гипо-
перфузии;
2) увеличение высоты стояния диафрагмы на стороне поражения;
3) небольшое расширение тени легочной артерии в корне легкого, кото-
рое лучше видно справа, вследствие “обрыва” ее ветвей. Следует подчерк-
нуть, что выраженное выбухание ствола легочной артерии у больных без
серьезных “фоновых” заболеваний сердца и легких ввиду отсутствия высо-
кой легочной гипертензии не характерно. Размеры сердца обычно не изме-
нены. Редко, при наличии тяжелой правожелудочковой недостаточности,
может определяться дилатация правых отделов сердца и верхней полой вены.
Рентгенологические признаки инфаркта легкого фор-
мируются к концу 1-х суток (через 12-36 ч), реже в течение нескольких
дней от начала заболевания. Ими являются очаговая инфильтрация легочной
ткани, чаще двусторонняя, в базальных отделах и плевральный выпот. Класси-
ческая треугольная, или клиновидная, форма тени с основанием, достига-
ющим реберной плевры, встречается довольно редко. Одновременно с соот-
ветствующей стороны часто отмечается смещение кверху купола диафрагмы.
Сроки разрешения легочного инфильтрата различны и колеблются от 7—
10 дней в случаях кровоизлияния до 20 дней и более при истинном инфарк-
те с некрозом. Изредка инфильтрат подвергается распаду. Его обратное раз-
витие обычно полное. У части больных, в том числе при отсутствии инфарк-
та легкого, образуются небольшие дисковидные ателектазы в виде линей-
ных теней, обусловленные истощением сурфактанта и обтурацией мелких
бронхов. На месте поражения возможно утолщение плевры.
Выпот в плевральную полость, обычно небольшой, появляется и исчеза-
ет одновременно с инфильтратом, иногда предшествуя ему.
Следует подчеркнуть, что отсутствие изменений на рентгенограмме груд-
ной клетки не исключает ТЭВЛА.
Эхокардиография имеет ограниченное значение, в основном при разви-
тии острого легочного сердца. В таких случаях определяется дилатация правых
отделов сердца и нижней полой вены при неизмененных размерах и систо-
лическом опорожнении левых отделов сердца.
Специфическими инструментальными методами диагностики ТЭВЛА
являются радионуклидное сканирование легких на гамма-камере и ангио-
пульмонография.
Сканирование легких введенным в периферическую вену сывороточным
альбумином, меченным 1311 или "п1Тс, которое позволяет оценить распреде-
ление легочного кровотока, является ценным методом диагностики ТЭВЛА
у больных без предшествовавших заболеваний легких. Его достоинствами
являются неинвазивный характер, простота и безопасность, что дает воз-
можность использовать его даже у самых тяжелых больных. Подтвердить диаг-
ноз позволяет обнаружение одного или нескольких дефектов перфузии при
отсутствии изменений или повышенной прозрачности этих участков легочной
паренхимы на рентгенограмме. Дефекты перфузии часто множественные и
631
имеют треугольную форму с основанием, обращенным к поверхности
грудной клетки. Специфичность метода и его диагностическая ценность
повышаются при одновременном определении регионарной вентиляции
с помощью сканирования с ,33Хе или 127Хе, которым “метится” вдыхае-
мый газ. Это позволяет выявить характерное для ТЭВЛА нарушение вен-
тиляционно-перфузионных соотношений в виде сохранения вентиляции
в зонах гипоперфузии.
Отсутствие при сканировании очаговых нарушений перфузии исключает
ТЭВЛА с вероятностью 95 %. При наличии крупных, занимающих один сег-
мент и более, дефектов перфузии и неизмененных показателях их вентиля-
ции вероятность ложно-положительных результатов не превышает 10 %. У
значительной части больных с подозрением на ТЭВЛА, особенно страдаю-
щих хроническими заболеваниями сердца и легких, имеются сочетанные
дефекты перфузии и вентиляции либо дефекты перфузии, сочетающиеся с
очаговыми изменениями на рентгенограмме, обычно небольшие, субсег-
ментарные, и множественные. Вероятность ТЭВЛА в таких случаях состав-
ляет около 20 % и значительно повышается при выявлении признаков ве-
нозного тромбоза при инструментальном обследовании, что часто позволя-
ет склониться в пользу этого диагноза (М.Kelley и соавт., 1991). Поскольку
отсутствие данных за венозный тромбоз не позволяет исключить ТЭВЛА, а
риск ее потенциально фатального рецидива высок, при наличии убедитель-
ной клинической картины заболевания и во всех других сомнительных слу-
чаях показана рентгеноконтрастная ангиопульмонография. Определенное диа-
гностическое значение имеет также быстрое разрешение дефектов перфузии
в динамике.
Ангиопульмонография является самым надежным методом подтверждения
или исключения ТЭВЛА. Эмболы обусловливают резкий “обрыв” ветвей ле-
гочной артерии (симптом культи) или дефект наполнения сосуда. Ангиогра-
фия показана при противоречивых результатах клинического и неинвазив-
ных методов обследования, особенно при повышенном риске применения
тромболитических средств и антикоагулянтов, а также при нестабильности
гемодинамики для решения вопроса о местном введении тромболитических
средств и оперативном лечении. Несмотря на недостатки, связанные с инва-
зивным характером процедуры, опасность развития ее осложнений значи-
тельно меньше, чем риск, который представляет нелеченая ТЭВЛА или не-
оправданная антикоагулянтная терапия. Если исключить больных с отрица-
тельными или четко положительными результатами сканирования в сочета-
нии с ренгенографией легких, то потребность в ангиопульмонографии воз-
никает примерно в 20 % случаев (PIOPED Investigators, 1990). Следует отме-
тить, что при тромбоэмболии очень мелких — менее 1—2 мм в диаметре -
ветвей легочной артерии точность этого метода уступает перфузионному ска-
нированию, так как образующаяся зона ишемии в 20—30 раз превышает
размеры обтурированного сосуда.
Лабораторные методы имеют вспомогательное значение. Изменения газо-
вого состава артериальной крови отражают выраженность нарушений вентиля-
632
Схема 36: Алгоритм диагностики и принятия решения о проведении антикоагулянтной
терапии при ТЭВЛА: Ro — рентгенограмма органов грудной клетки; ИП — импенданс-
ная плетизмография
ции и перфузии, и, будучи неспецифичными, представляют диагностическую
ценность главным образом при отсутствии хронических сердечно-легочных
заболеваний. Характерно сочетание артериальной гипоксемии с низким РаСО2
вследствие гипервентиляции и дыхательным алкалозом. Более информатив-
633
ным, однако, считается увеличение альвеолярно-артериальной разницы по
кислороду и углекислому газу (последнее за счет увеличения альвеолярного
мертвого пространства). Уменьшение насыщения артериальной крови кис-
лородом относительно мало выражено. Нормальное РаО2 не исключает воз-
можности ТЭВЛА. Определение газового состава крови имеет важное значе-
ние для оценки прогноза и адекватного лечения заболевания.
При биохимическом исследовании крови в типичных случаях отмечается
характерная триада: 1) повышение активности ЛДГ, особенно ЛДГ 3 (в 50 %
случаев при ТЭВЛА и в 97 % — при инфаркте легкого); 2) неизмененные
показатели ACT и КФК; 3) небольшое увеличение содержания непрямого
билирубина, преимущественно связанное с венозным застоем в печени. Эти
показатели, а также одновременное и параллельное умеренное повышение
содержания лейкоцитов и СОЭ, сохраняющееся несколько недель, имеют
определенное значение для дифференциальной диагностики ТЭВЛА и ост-
рого инфаркта миокарда.
Чувствительным, но неспецифичным является увеличение содержания в
крови продуктов деградации фибриногена и фибрина, свойственное внутри-
сосудистому тромбообразованию любой локализации. Изменения других по-
казателей коагулограммы колеблются в широких пределах и их используют
только для контроля за действием тромболитических средств и антикоагу-
лянтов в процессе лечения.
Объем специального обследования в каждом случае, когда клинические
данные позволяют заподозрить ТЭВЛА, зависит от наличия или отсутствия
тромбоза глубоких вен, тяжести состояния больного и риска кровоточиво-
сти при антикоагулянтной тепапии. Алгоритм диагностики и принятия ре-
шения о назначении антикоагулянтов представлен на схеме 36.
Дифференциальная диагностика. Диагностика ТЭВЛА часто представляет
значительные трудности, особенно у больных с тяжелыми хроническими
сердечно-легочными заболеваниями и в ранний послеоперационный период.
В связи с неспецифичностью и часто скудостью ее проявлений важнейшее
значение имеет настороженность врача в отношении необъяснимого ухуд-
шения состояния больных с факторами риска.
1. Острую немассивную ТЭВЛА и инфаркт легкого необходимо диффе-
ренцировать с другими заболеваниями, сопровождающимися “плевральной”
болью в грудной клетке и кровохарканьем, - пневмонией и плевритом дру-
гой этиологии, бронхогенным раком и туберкулезом легких и др.
Наиболее часто ТЭВЛА ошибочно принимают за банальную пнев-
монию, особенно застойную, у больных с хронической левожелудочковой
недостаточностью. Дифференциальная диагностика этих заболеваний требу-
ет тщательного анализа клинических данных. Так, в пользу пневмонии сви-
детельствует начало заболевания: лихорадка, познабливание, у ряда боль-
ных - после недавно перенесенной респираторной вирусной инфекции. Мок-
рота имеет гнойный характер, поражение часто локализуется в одном лег-
ком, отмечается быстрый положительный эффект антибиотикотерапии. В от-
личие от этого, начало заболевания с внезапной одышки, нарушения со-
634
знания и беспричинной боли в грудной клетке и кровохарканья у лежачего
больного, слизистый характер мокроты, двустороннее поражение легких без
динамики после назначения антибиотиков позволяют предположить диаг-
ноз инфаркта легкого и предпринять поиск тромбоза глубоких вен. Настора-
живать в отношении ТЭВЛА должны также частые “рецидивы пневмонии”.
2. Свойственная ряду больных с ТЭВЛА, особенно массивной, резкая
загрудинная боль, нередко сочетающаяся с артериальной гипотензией, тре-
бует исключения острого инфаркта миокарда, перикардита, расслаивающей
аневризмы аорты, спонтанного пневмоторакса, реже перфоративной язвы
желудка и острого холецистита. С учетом изменений на ЭКГ чаще всего при-
ходится проводить дифференциальную диагностику ТЭВЛА с острым ин-
фарктом миокарда — крупноочаговым (инфарктом с зубцом Q) зад-
не-диафрагмальной стенки левого желудочка или мелкоочаговым, без зубца
Q, передне-перегородочной локализации. Отличительными признаками ост-
рого инфаркта миокарда являются характерная иррадиация боли, ее волно-
образный характер, при наличии одышки — ортопноэ, венозный застой в
легких, вплоть до отека легких, и дилатация левого желудочка по данным
физического и инструментального обследований. В то же время при массив-
ной ТЭВЛА с острым легочным сердцем загрудинная боль и одышка сопро-
вождаются картиной недостаточности не левого, а правого желудочка с по-
вышением ЦВД и резким снижением РаО2. При наличии на ЭКГ синдрома
Qni-Т„, против острого задне-диагфрагмального инфаркта свидетельству-
ют: 1) отсутствие глубоких зубцов Q в отведениях aVF и D по Небу; 2) отсут-
ствие дискордантной депрессии сегмента ST в отведениях V,_4; 3) уплощен-
ные или отрицательные зубцы Т в отведениях V,_4 вместо высоких заост-
ренных, свойственных реципрокным изменениям при заднем инфаркте ми-
окарда; 4) уменьшение глубины зубцов Q и Т, а также отклонения электри-
ческой оси сердца вправо в динамике. Важное дифференциально-диагности-
ческое значение имеют различия профиля и динамики ферментативной ак-
тивности, а также лейкоцитоза и СОЭ. В сомнительных случаях параллельно
с дообследованием при отсутствии противопоказаний начинают гепарино-
терапию.
3. В случаях осложнения массивной ТЭВЛА шоком проводят дифферен-
циальный диагноз сразличными видами шока другой этио-
логии, прежде всего кардиогенным при остром инфаркте миокарда (см.
главу 12), септическим и геморрагическим. Распознавание септического шока
особенно важно у оперированных больных. Хотя, как и при ТЭВЛА, у таких
больных могут отмечаться одышка и акроцианоз, у них не бывает повы-
шенного ЦВД, что в ургентной ситуации является надежным дифференци-
ально-диагностическим критерием. Определение ЦВД и лабораторных пока-
зателей красной крови позволяет исключить и возможность скрытого внут-
реннего кровотечения.
Диагноз массивной ТЭВЛА ставят на основании характерного сочетания
резкой одышки с признаками правожелудочковой недостаточности и в час-
ти случаев шока у больного с тромбозом глубоких вен нижних конечностей.
635
Дополнительное диагностическое значение имеют: 1) признаки перегрузки
правого желудочка на ЭКГ; 2) дилатация правых отделов сердца при неизме-
ненных левых на ЭхоКГ; 3) артериальная гипоксемия в сочетании с гипокап-
нией; 4) инструментальные признаки венозного тромбоза по данным импе-
дансной плетизмографии, сканирования, допплеровского исследования.
Заподозрить немассивную ТЭВЛА позволяют острое возникновение “плев-
ральной” боли в грудной клетке, кровохарканья (необязательный признак!),
а также необъяснимой одышки и тахикардии, клинических и рентгенологи-
ческих признаков ограниченного легочного инфильтрата и (или) плеврита у
больного с тромбозом глубоких вен нижних конечностей и (или) его фак-
торами риска. Как и при клинической картине массивной ТЭВЛА, уточнить
диагноз позволяет радионуклидное сканирование легких с определением ре-
гионарной перфузии в сопоставлении с регионарной вентиляцией и данны-
ми рентгенографии. При неопределенных результатах диагноз подтверждают
данные ангиопульмонографии.
Течение и осложнения. Для ТЭВЛА очень характерно рецидивирующее те-
чение, причем эмболизация мелких ветвей часто предшествует возникнове-
нию массивной ТЭВЛА. Основными осложнениями являются:
1) вторичный асцендирующий тромбоз с усугублением наруше-
ния легочного кровотока;
2) хроническая тромбоэмболическая легочная гипер-
тензия и хроническое легочное сердце васкулярного генеза.
Развиваются при неадекватной реканализации тромбов с сохранением пост-
тромботической окклюзии части легочного русла. Возможно, определенную
роль играют нарушения спонтанного фибринолиза. Значительная редукция
артериальной системы с развитием стойкой легочной гипертензии встреча-
ется, однако, редко - менее чем в 5 % случаев и формируется при частом
рецидивировании ТЭВЛА в течение нескольких месяцев или лет. Возможно,
что эта цифра занижена из-за трудности дифференциальной диагностики с
первичной легочной гипертензией. Остаточная общая площадь легочного русла
может быть не меньше, чем при острой массивной эмболии, но выраженное
повышение давления в легочной артерии свидетельствует о способности пра-
вого желудочка благодаря развитию компенсаторной гипертрофии обеспечи-
вать более высокий ударный выброс. Верификация тромбоэмболического ге-
неза легочной гипертензии, в отличие от первичной (идиопатической), час-
то представляет большие трудности, даже при аутопсии, вследствие неспе-
цифичности морфологических данных, а иногда отсутствия в анамнезе ука-
заний на тромбоз глубоких вен и эпизоды ТЭВЛА.
Больные обращаются к врачу по поводу нарастающей одышки и иногда
головокружения при нагрузке. При осмотре и дополнительном обследовании
определяются признаки высокой прекапиллярной легочной гипертензии и
часто хронической правожелудочковой недостаточности. Диагноз ставят на
основании выявления асимметричных участков окклюзии ветвей легочной
артерии при значительно повышенном давлении в ней при катетеризации и
ангиопульмонографии;
636
3) вторичное инфицирование инфаркта легкого — так называемая тромб-
инфарктная пневмония. Возможно образование абсцесса легкого.
Лечение. Так как большинство тромбоэмболов со временем подвергается
спонтанному фибринолизу, основными целями лечения ТЭВЛА являются:
1) коррекция развившихся нарушений гемодинамики и дыхания; 2) профи-
лактика рецидивов легочной эмболии.
Массивная ТЭВЛА, сопровождающаяся тяжелой сердечно-сосудистой и
дыхательной недостаточностью, подлежит интенсивному лечению в отделе-
нии реанимации, которое включает: 1) неотложные мероприятия по поддер-
жанию кровообращения и дыхания; 2) специфическое лечение; 3) параллельно
проводят профилактику рецидивирования ТЭВЛА с помощью антикоагу-
лянтов прямого действия.
1. Поддержание кровообращения и дыхания предусматривает: а) коррек-
цию артериальной гипоксемии путем ингаляции кислорода через
маску или, по показаниям, интубации трахеи иИВЛ; б) поддержание
функции правого желудочка и увеличение МОС.Посколь-
ку функция правого желудочка у таких больных критически зависит от вы-
сокого давления наполнения, необходимо обеспечение хорошего венозного
подпора. Следующим этапом лечения является уменьшение препятствия ле-
гочному кровотоку.
Ввиду необходимости поддержания высокого венозного давления, не-
смотря на резко повышенное ЦВД, противопоказаны вазодилататоры и мо-
чегонные препараты. Коррекцию артериальной гипотензии можно начать
с пробного внутривенного введения кристаллоидов или низкомолекулярно-
го декстрана (примерно со скоростью 1 мл/мин). При отсутствии быстрого
эффекта от плазмозамещения назначают инотропную поддержку — инфу-
зию симпатомиметических аминов - добутамина, норадреналина и др. Сер-
дечные гликозиды, как правило, в этом случае неэффективны.
Сохранение синдрома малого сердечного выброса с артериальной гипо-
тензией (систолическое АД ниже 100 мм рт.ст.), олигурией, признаками
нарушения периферического кровотока является показанием для специфи-
ческого лечения — тромболизиса или эмболэктомии. Иногда фрагментацию
тромбоэмбола и его смещение удается вызвать с помощью наружного мас-
сажа сердца в случаях невозможности определения АД и резких пассивных
поворотов туловища больного (M.Essop и соавт., 1992).
2. Специфическое лечение. Показано только после подтверждения диагноза
с помощью сканирования легких или ангиопульмонографии.
Тромболитическая терапия. Ее место в лечении ТЭВЛА окон-
чательно не установлено. Результаты проведенных к настоящему времени
многоцентровых испытаний — итальянского исследования активатора плаз-
миногена (алтеплазы) PAIMS-2 (S.Dalla-Volta и соавт., 1992), Европейского
сравнительного исследования урокиназы и алтеплазы (G.Meyer и соавт.,
1992) и других не смогли доказать способность тромболитических средств
уменьшать летальность и частоту рецидивов ТЭВЛА по сравнению с гепа-
ринотерапией. Это отчасти объясняют недостаточно большим количеством
637
наблюдений во всех сериях. Основным преимуществом тромболитической
терапии перед антикоагулянтной является более быстрое - в первые 24 ч -
и, возможно, более полное восстановление проходимости артерии с умень-
шением легочной гипертензии и более ранним достижением клинического
улучшения. Предполагают также возможность уменьшения остаточных яв-
лений окклюзии глубоких вен при их массивном тромбозе, в частности, при
локализации в бедренно-подколенном сегменте.
В большинстве случаев проводят системный тромболизис стрептокиназой
в нагрузочной дозе 250 000 ЕД за 30—60 мин, затем по 100 000 ЕД в 1 ч в
течение 24 ч. Для предотвращения возможных аллергических реакций препа-
рат вводят “под прикрытием” глюкокортикостероидов. Можно использовать
также урокиназу — сначала по 4400 ЕД/кг за 10 мин, затем по 4400 ЕД/кг/ч
в течение 12—24 ч, или рекомбинантный ТАП (алтеплаза) — 100 мг на курс
лечения: 60 мг в 1-й час (из них первые 6-10 мг в виде болюса за 1-2 мин),
20 мг за 2-й час и 20 мг за 3-й. Эти более дорогостоящие препараты не обла-
дают существенными преимуществами перед стрептокиназой по своей эф-
фективности (S.Goldhaber и соавт., 1992; G.Meyer и соавт., 1992). Им отда-
ют предпочтение в случаях отягощенного аллергологического анамнеза и
лечения стрептокиназой в течение предшествующего года в связи с сохране-
нием повышенных титров циркулирующих противострептококковых антител.
Повысить эффективность тромболитической терапии иногда позволяет мест-
ное введение препаратов непосредственно в легочную артерию, как можно
ближе к месту окклюзии, которое определяют при ангиопульмонографии.
Каждые 4—6 ч проводят лабораторный контроль. Критерием тромболити-
ческого эффекта считают удлинение тромбинового времени в 2—5 раз. Во
избежание коагулопатии потребления с высоким риском кровотечения не
следует допускать снижения уровня фибриногена ниже 1-2 г/л.
По сравнению с гепарином тромболитические средства вдвое повышают
риск возникновения кровотечений и противопоказаны в следующих случаях:
1) при перенесенных в течение 7-10 предыдущих дней операциях, ро-
дах, артериографии;
2) при наличии очагов с высокой вероятностью кровотечения в пищева-
рительном канале, мочеполовой системе, легких;
3) при высокой и плохо контролируемой артериальной гипертензии;
4) при тяжелом течении почечной или печеночной недостаточности, са-
харного диабета с ретинопатией;
5) при интракраниальных патологических процессах (перенесенный ин-
сульт, опухоль и др.).
Эмболэктомия. Имеет довольно ограниченное значение в лечении
ТЭВЛА. Это обусловлено тем, что большая часть больных, которым она
показана, умирают в первые 1—2 ч, то есть до операции, а также ее выпол-
нением в условиях искусственного кровообращения, которые имеются в
считанных хирургических центрах. Эмболэктомию выполняют:
1) в случаях сохранения шока и тяжелой правожелудочковой недостаточ-
638
ности (среднее давление в правом желудочке более 22 мм рт.ст.) несмотря
на тромболитическую и кардиотоническую терапию;
2) больным, которым показана тромболитическая терапия, но проведе-
ние ее невозможно из-за наличия противопоказаний. Обязательными усло-
виями являются ангиографическое подтверждение массивной тромбоэмбо-
лии крупных ветвей легочной артерии и доступность тромба для извлечения.
Операция не показана при тяжелых сопутствующих заболеваниях с выра-
женной хронической сердечной и дыхательной недостаточностью. Этим кри-
териям удовлетворяют не более 8-16 % больных с ТЭВЛА. Хирургическая
летальность составляет около 25—30 %, так как оперативное лечение прово-
дят у избранного контингента больных, которые, несмотря на массивную
эмболию и шок, смогли пережить первые часы заболевания, что дало воз-
можность провести тромболитическую терапию (H.Gray и соавт., 1988).
В плановом порядке эмболэктомию выполняют у некоторых больных с
хронической тромбоэмболической легочной гипертензией при нарушении
проходимости крупных ветвей легочной артерии. При этом удаляют фраг-
менты старых, эндотелизированных тромбоэмболов. Хотя эта операция но-
сит паллиативный характер, у ряда больных достигается значительное сни-
жение ЛСС и симптоматическое улучшение.
Профилактика рецидивов ТЭВЛА с помощью гепарина. Его назначают
с целью: 1) воспрепятствовать увеличению размеров тромбоэмбола в легоч-
ном сосудистом русле, что одновременно способствует ускорению его лизи-
са; 2) предотвратить образование новых тромбов в системных венах. Благода-
ря способности тормозить агрегацию тромбоцитов, а следовательно, местное
освобождение тромбоксана, серотонина и других вазоактивных веществ, ге-
парин может предупреждать спазм легочных артериол и мелких бронхов. Од-
нако влияние гепарина на функцию тромбоцитов относительно невелико,
и, как антитромбиновый препарат, он наиболее эффективно предотвращает
образование фибриновых тромбов в венозной системе и полостях сердца.
За исключением случаев повышенного риска геморрагических осложне-
ний, лечение гепарином следует начинать как можно раньше, при первом
подозрении на ТЭВЛА, и проводить параллельно с дообследованием больного.
Если в результате диагноз не подтвердится, введение гепарина прекращают.
Первую дозу 10 000-15 000 ЕД вводят внутривенно в виде болюса, после
чего лечение можно продолжать любым из трех способов — путем непрерыв-
ной внутривенной инфузии, прерывистого внутривенного или подкожного
введения полных терапевтических доз, обеспечивающих торможение обра-
зования фибрина в присутствии тромбина. Внутримышечное введение неже-
лательно из-за образования в местах инъекций болезненных гематом.
Непрерывную инфузию производят со скоростью 1000-1500 ЕД/ч. При-
мерная доза при внутривенном струйном введении составляет 5000 ЕД каж-
дые 4 ч или 7500 ЕД каждые 6 ч, а при подкожном введении — 5000 ЕД
каждые 4 ч, или 10 000 ЕД каждые 8 ч, или 20 000 ЕД каждые 12 ч. Неза-
висимо от пути и схемы введения суммарная суточная доза составляет в
639
среднем 30 000 ЕД. Эффективность и безопасность всех трех способов назна-
чения гепарина примерно одинаковы.
Для контроля за адекватностью гипокоагуляционного эффекта гепарина
и оптимизации его дозирования среди всех гемокоагуляционных показате-
лей достаточно следить за временем свертывания крови по Ли Уайту или,
лучше, за ЧАТВ. Оптимальным считается поддержание удлинения времени
свертывания крови в 2—3 раза, а ЧАТВ в 1,5—2 раза от их исходных величин
при определении непосредственно перед каждой очередной инъекцией при
прерывистом назначении препарата или 4 раза в сутки при непрерывном.
Следует отметить, однако, отсутствие тесной зависимости прекращения ро-
ста тромба in vitro от величины показателей гемокоагуляции. Это же касается
и риска кровотечений — основного осложнения гепаринотерапии, которое
связано главным образом с наличием с организме locus minoris resistentia
(язвы желудка, почечной недостаточности и др.) и повышается с возрастом.
Необходимо иметь в виду способность гепарина вызывать уменьшение ко-
личества тромбоцитов и проводить контроль их содержания в динамике.
Лечение гепарином рекомендуется продолжать 7—10 дней. Это время счи-
тается необходимым для полного лизиса или организации тромба. Начиная с
3—5-х суток, добавляют антикоагулянты непрямого действия для приема
внутрь, так, чтобы за 3-4 суг до отмены гепарина протромбиновый индекс
стабилизировался на уровне в 1,5—1,8 раза ниже исходного, или около 50 %.
Постепенная отмена гепарина без перехода на антикоагулянты непрямого
действия на 9—10-е сутки лечения после мобилизации больного допускается
только в редких случаях при быстром исчезновении причинного фактора,
симптомов ТЭВЛА и нормализации данных импендансной плетизмографии.
Вопрос о продолжительности т е р а п и и антикоагулянтами не-
прямого действия после выписки из стационара решается индивиду-
ально. При наличии таких обратимых факторов риска, как перенесенная опе-
рация, травма, роды, их прием рекомендуют продолжать от 6 нед до 3-6
мес, поскольку в этот период вероятность рецидива ТЭВЛА наиболее высо-
ка. Неопределенно длительное, иногда пожизненное лечение показано в слу-
чаях рецидивирования ТЭВЛА и стойкого сохранения предрасполагающего
заболевания, прежде всего венозного тромбоза, хронической венозной не-
достаточности, выраженной застойной сердечной недостаточности, дефи-
цита антитромбина III, обнаружения циркулирующих антифосфолипидных
антител, а также развития хронической тромбоэмболической легочной ги-
пертензии (NIH Consensus Development Statement, 1986).
Кроме специфического лечения и профилактики при ТЭВЛА проводят
симптоматическую терапию болевого синдрома анальге-
тиками и в большинстве случаев антибиотикопрофилактику вто-
ричной инфекции и пневмонии. Сроки двигательной активиза-
ции больных определяются динамикой обратного развития сердечно-легоч-
ной недостаточности и проявлений венозного тромбоза.
Лечение немассивной ТЭВЛА, которая не сопровождается нарушениями
гемодинамики, включает:
640
1) симптоматическую терапию болевого синдрома, связанного с плеври-
том и венозным тромбозом конечности;
2) профилактику рецидива с помощью антикоагулянтов прямого и не-
прямого действия аналогично ведению массивной легочной эмболии. В
редких случаях выраженного кровохарканья антикоагулянтную терапию
временно отменяют;
3) при развитии инфаркта легкого, а также у больных с хронической
сердечно-легочной недостаточностью - антибиотикопрофилактику пнев-
монии.
Прогноз. При наличии симптомов летальность колеблется от 20 до 40 % и
в значительной степени зависит от массивности ТЭВЛА, а также наличия и
выраженности хронической сердечной и дыхательной недостаточности. При
фатальном исходе у 2/3 больных смерть наступает внезапно, то есть в тече-
ние 1 ч от начала заболевания. По истечении этого времени прогноз улучша-
ется благодаря возможности проводить активное лечение и спонтанной фраг-
ментации тромба со смещением его частей в более мелкие сосудистые ветви.
У подавляющего большинства выживших, независимо от массивности
ТЭВЛА, наступает практически полное восстановление исходной функции
сердца, легких и трудоспособности. При отсутствии факторов риска и при-
знаков венозного тромбоза при импедансной плетизмографии вероятность
рецидива ТЭВЛА мала. В очень редких случаях развития хронической васку-
лярной легочной гипертензии прогноз неблагоприятен.
Профилактика. Ввиду того что большую часть летальных исходов ТЭВЛА
можно предотвратить только путем профилактики, ее значение при этом
заболевании чрезвычайно велико.
Первичная профилактика ТЭВЛА — это профилактика венозного тромбо-
за. Весьма перспективными в этом отношении представляются препараты
низкомолекулярного гепарина - кальципарин и фраксипарин, обладающие
высокой антикоагулянтной активностью и не требующие коагулологического
контроля. Однако дифференцированные показания к их применению пока
не установлены.
Вторичная профилактика направлена на предупреждение рецидивов ТЭВЛА
и включает:
1) длительный прием антикоагулянтов непрямого действия;
2) хирургические методы — установление различных фильтров в просвете
нижней полой вены или перевязку последней. Обязательным условием явля-
ется ангиографическое подтверждение ТЭВЛА и венозного тромбоза. По-
казаниями к имплантации кава-фильтра являются:
1) наличие противопоказаний к назначению антикоагулянтов: а) наличие
источника высокого риска кровотечения (активное течение язвенной болез-
ни, инфекционный эндокардит, геморрагические диатезы и др.), б) тяже-
лая артериальная гипертензия или ретинопатия; в) геморрагический инсульт;
г) недавно перенесенное хирургическое вмешательство; д) перикардит; е) бе-
ременность (противопоказаны преимущественно антикоагулянты непрямо-
го действия); ж) невозможность обеспечения адекватного лабораторного
641
контроля в процессе лечения; з) неспособность больного к адекватному со-
трудничеству (например, при хроническом алкоголизме);
2) осложнение антикоагулянтной терапии значительным кровотечением;
3) рецидивирование ТЭВЛА несмотря на адекватную антикоагулянтную
терапию (отмечается редко).
Иногда по жизненным показаниям кава-фильтр устанавливают во время
выполнения легочной эмболэктомии при массивной ТЭВЛА для максимально
надежного предотвращения ее потенциально фатального рецидива.
Перед плановой операцией производят контрастную флебографию для
исключения аномалии вен, определения уровня тромбоза и оптимального
расположения фильтра. Его устанавливают трансвенозно через яремную или
бедренную вену. При невозможности имплантации фильтра, в частности,
связанной с индивидуальными анатомическими особенностями строения
венозной системы, а также при септических эмболах из вен таза и брюшной
полости показана частичная или полная перевязка нижней полой вены. Су-
щественные ограничения этих хирургических методов профилактики связа-
ны с недостаточной надежностью предотвращения ТЭВЛА из-за образова-
ния коллатералей и создания условий для тромбообразования проксималь-
нее сужения просвета полой вены, а также с развитием отеков нижних ко-
нечностей.
ГЛАВА 14.
ПЕРИКАРДИТЫ
Как отмечал еще Лаэннек, лишь немногие заболевания представляют
большую трудность для распознавания, чем перикардит. Он имеет много
общих признаков с другими, более распространенными заболеваниями сердца
— стенокардией, инфарктом миокарда, миокардитом и другими, что часто
является причиной диагностических ошибок. Поскольку перикардит редко
бывает первичным патологическим процессом, его проявления в большей
или меньшей степени маскируются картиной поражения других органов и
систем, а также значительно варьируют в зависимости от этиологического
фактора. В ряде случаев признаки перикардита могут быть единственными
клиническими проявлениями системного заболевания.
Клиническое значение перикардита также весьма разнится — от “невин-
ного”, часто бессимптомного, заболевания с полным обратным развитием,
до тяжелого, потенциально фатального.
Перикардит часто протекает с распространением патологического про-
цесса на миокард и (или) плевру, либо, наоборот, с первичным поражени-
ем этих тканей.
Частота перикардита по данным аутопсии составляет около 5 %, причем
более чем в половине этих случаев он имеет острое течение. В то же время в
клинике перикардит диагностируют значительно реже — менее чем у 0,1 %
642
Классификация перикардитов
А Клинико-морфологическая
I. Острый перикардит (до 6 нед) 1. Сухой, или фибринозный 2. Выпотной, или экссудативный: а) без тампонады сердца б) с тампонадой сердца
II. Подострый перикардит (6 нед—6 мес) III. Хронический перикардит (более 6 мес) 1. Выпотной, или экссудативный 2. Экссудативно-адгезивный 3. Адгезивный: а) неконстрикгивный б) констриктивный
Б. По этиологии
I. Инфекционный перикардит 1. Бактериальный: а) "неспецифический" б) специфический, в том числе туберкулезный 2. Вирусный 3. Грибковый 4. При паразитарных и других инфекциях
II. Неинфекционный перикардит 1. Метаболический (при уремии, микседеме, аддисоническом кризе и др.) 2. Аллергический: а) при ревматизме, диффузных заболеваниях соединительной ткани, системных васкулитах б) при сывороточной болезни и лекарственный в) связанный с повреждением сердца (при постинфарктном, постперикардио- томическом синдромах) 3. При остром инфаркте миокарда 4. При воздействии физических факторов: а) травматический б) радиационный 5. При опухолях перикарда 6. При некоторых других заболеваниях (семей- ная средиземноморская лихорадка, болезнь Уиппла, талассемия, панкреатит и др.)
III. Идиопатический перикардит
госпитализированных больных. Мужчины болеют в 1,5 раза чаще, чем жен-
щины.
Классификация. Как и плевра, перикард может подвергаться воспалению,
инфильтрации опухолевыми клетками и кальцинозу. В ряде случаев отмеча-
ется накопление жидкости воспалительного или невоспалительного харак-
тера. Выпот невоспалительного происхождения носит характер гидро-, гемо-
или хилоперикарда.
Перикардиты разделяются по этиологии и клиническому течению.
643
Наиболее распространенными этиологическими факторами являются ви-
русная инфекция и острый инфаркт миокарда.
Вирусный перикардит, как и миокардит, обычно протекает ост-
ро, чаще всего вызывается кардиотропными возбудителями - энтеровируса-
ми Коксаки группы В, реже А, вирусами простого герпеса, гриппа, ЭКХО.
Неидентифицируемую вирусную инфекцию считают причиной не менее 50 %
случаев идиопатического миокардита.
Острый перикардит, проявляющийся шумом трения перикарда, отмеча-
ется у 15—20 % больных впервые 72 ч инфаркта миокарда. Его истин-
ная частота, по-видимому, еще выше. В поздние сроки инфаркта — от 2 нед
до нескольких месяцев — у 3—4 % больных возникает перикардит как прояв-
ление аутоиммунного постинфарктного синдрома Дресслера
(см. главу 9).
Среди бактериальных перикардитов преобладает туберку-
лезный. Такой перикардит может возникать не только на фоне “цветуще-
го” туберкулеза легких, но и быть единственным клиническим проявлени-
ем инфекции при отсутствии видимого первичного очага. Туберкулез - наи-
более частая причина констриктивного перикардита.
Острый бактериальный неспецифический перикардит,ко-
торый называют также гнойным, встречается значительно реже. Он развива-
ется при септицемии (в части случаев в результате инфицирования ранее
стерильного выпота) или при острых инфекционных процессах в органах
грудной клетки либо при ее проникающих ранениях. Важным способствую-
щим фактором является значительное угнетение иммунной системы боль-
ного вследствие основного заболевания или применения иммуносупрессив-
ной терапии.
Среди причин грибкового перикардита чаще всего встречаются
актиномикоз, кокцидиомикоз и гистоплазмоз.
Перикардит довольно часто встречается при тяжелой хронической
почечной недостаточности, исчезая после гемодиализа. Вероятность
его возникновения находится в прямой зависимости от уровня мочевины в
крови.
Весьма распространенной причиной перикардитов являются реакции
гиперчувствительности.К этой категории прежде всего относятся пе-
рикардитыпри ревматических заболеваниях. При специальном об-
следовании выпот в перикард, часто не дающий клинических симптомов,
обнаруживается у большинства больных с острой ревматической лихорадкой
(острым ревматизмом). Реже перикардит встречается при ревматоидном арт-
рите, системной красной волчанке, а также в отдельных случаях системной
склеродермии и узелкового периартериита.
Аналогичный генез перикардита при сывороточной болезни и
приеме лекарственных препаратов, в частности новокаинамида,
гидралазина, дифенингидантоина (дифенина) и адриамицина. К этой груп-
пе относится и аутоиммунный перикардит при постперикардиотоми-
ческом синдроме. Он сходен с поздним осложнением острого инфаркта
644
Схема 37. Варианты клинического течения перикардита и их взаимосвязь
миокарда и может возникать в течение 6-9 мес после кардиохирургических
операций.
Злокачественные опухоли перикарда преимущественно ме-
тастатические и обусловлены прямым распространением опухолевых клеток
при раке молочной железы, легких или средостения, их заносом кровью или
прорастанием путей лимфатического оттока перикарда. Значительно реже
встречаются первичные опухоли, главным образом, мезотелиома и саркома.
Радиационный перикардит развивается при наружном облуче-
нии средостения в дозе свыше 400 рад, что на практике обычно встречается
при проведении рентгенотерапии злокачественных опухолей.
При травмах, проникающих и непроникающих ранениях перикард мо-
жет повреждаться непосредственно либо в результате перелома ребер с воз-
никновением асептического перикардита или гемоперикарда. Кровоизлия-
ние в перикард может быть связано и с ятрогенными причинами: установ-
лением эндокардиального электрода при электрокардиостимуляции, кате-
теризацией сердца, эндомиокардиальной биопсией или операцией на откры-
том сердце. К частым причинам гемоперикарда относятся наружный раз-
рыв сердца при остром инфаркте миокарда и расслоение восхо-
дящей части аорты надклапаном.
Накопление невоспалительного выпота в полости перикарда чаще всего
обусловлено сердечной недостаточностью и является результа-
том транссудации. К более редким причинам относятся микседема и нару-
шение целости лимфатических сосудов, например, при травме и тромбозе
верхней полой вены, с развитием хилоперикарда.
За последние 25 лет удельный вес различных этиологических факторов
претерпел существенные изменения. При уменьшении доли туберкулеза и
неспецифической бактериальной инфекции возросла роль вирусов и ятро-
генных факторов, связанных с современными методами лечения злокаче-
ственных новообразований и операциями на сердце и легких. Чаще всего,
однако, приходится встречаться с идиопатическим перикардитом.
645
Основными клиническими вариантами перикардита являются:
1) острый сухой (фибринозный); 2) выпотной без тампонады и ослож-
ненный тампонадой сердца; 3) констриктивный. Все они могут быть связа-
ны с самыми различными этиологическими факторами,каждый из которых,
однако, обусловливает определенные особенности клинического течения за-
болевания.
Спектр вариантов клинического течения перикардита и их взаимосвязь
представлены на схеме 37.
ОСТРЫЙ ФИБРИНОЗНЫЙ (СУХОЙ) ПЕРИКАРДИТ
Является самым распространенным клиническим вариантом перикардита.
Патологическая анатомия. Строго говоря, фибринозный перикардит не
является “сухим”, так как сопровождается увеличением пропотевания в по-
лость перикарда жидкой части плазмы крови, богатой фибриногеном и дру-
гими белками. Жидкость активно всасывается, а фибриноген выпадает на
листках перикарда в виде фибрина. Поскольку при каждом сокращении сердца
площадь его эпикардиальной поверхности изменяется, отложения на ней
фибрина имеют вид складок, которые постепенно утолщаются. Нити фибрина
протягиваются между листками перикарда и, обрываясь при вскрытии, прида-
ют сердцу “лохматый” вид (’’волосатое сердце” - corvillosum). В воспалитель-
ный процесс вовлекаются прилежащие субэпикардиальные слои миокарда,
что служит анатомическим субстратом характерных изменений на ЭКГ.
Фибринозный перикардит может быть ограниченным, как, например, в
ряде случаев pericarditis epistenocardica при остром инфаркте миокарда, и рас-
пространенным. Его исходами являются полное обратное развитие или уве-
личение экссудации с переходом в острый экссудативный перикардит.
Патогенез зависит от причинного фактора. Эта форма перикардита не со-
провождается нарушениями гемодинамики.
Клиника. Для фибринозного перикардита характерна триада: боль в груд-
ной клетке, шум трения перикарда и изменения на ЭКГ. Начальные прояв-
ления заболевания и особенности его течения зависят от этиологии.
Жалобы. Основным симптомом является боль в грудной клетке.
Она связана с раздражением чувствительных рецепторов левого диафраг-
мального нерва, которые располагаются на ограниченном участке парие-
тального перикарда между пятым и шестым межреберьями. Часто боль обус-
ловлена воспалением окружающих тканей, особенно плевры. Локализуется
обычно за грудиной и может иррадиировать в шею, спину, левое плечо, но,
в отличие от стен жардии, не распространяется на кисть. Иногда она ощу-
щается в надчревной области, имитируя острый живот, или в области вер-
хушки сердца. Боль носит постоянный характер, а по своей интенсивности
варьирует от слабой до нестерпимой. Весьма характерно усиление боли на
вдохе, при глотании, резких движениях, иногда в положении лежа. Боль
облегчается в положении сидя с наклоном туловища кпереди или в коленно-
646
локтевом положении. Из-за болезненного вдоха больные часто дышат повер-
хностно, что может сопровождаться ощущением нехватки воздуха. Боль обыч-
но возникает внезапно. Иногда за несколько дней ей предшествует неопре-
деленное недомогание. У половины больных болевой синдром отсутствует
или слабо выражен и быстро исчезает.
У рада больных отмечаются также различные общие симптомы, свя-
занные с основным заболеванием, — повышение температуры тела, сла-
бость, иногда похудание.
При объективном исследовании ведущим и патогномоничным признаком
является шум трения перикард а. Он имеет характерный скребущий
тембр и состоит из одного, двух или, реже, трех компонентов, не связан-
ных с тонами, соответственно систоле предсердий, систоле желудочков и
фазе их быстрого наполнения. Он лучше выслушивается во втором, третьем
или четвертом межреберье слева от грудины до среднеключичной линии,
при наклоне туловища кпереди, запрокидывании головы, иногда на вдохе,
и не проводится. Шум отличается изменчивостью в зависимости от положе-
ния тела и нажатия стетоскопом и непостоянством, так как может выслу-
шиваться лишь считанные часы.
При распространении воспалительного процесса на прилежащую плевру
в зоне относительной сердечной тупости синхронно с сердечными сокраще-
ниями может определяться плевро-перикардиальный шум. Этот
термин неудачен, так как шум обусловлен трением париетального листка
плевры о висцеральный.
У ряда больных отмечается частое поверхностное дыхание.
Диагностика. Изменения на ЭКГ, как и шум трения перикарда, могут быть
единственным признаком заболевания. Лежащий в их основе поверхност-
ный миокардит обусловливает появление тока повреждения, который отра-
жается на ЭКГ в виде подъема сегмента ST, а запаздывание реполяризации
субэпикардиальных слоев вызывает инверсию зубца Т. При распространен-
ном, “плащевидном”, воспалении перикарда и субэпикардиального мио-
карда эти изменения регистрируются практически во всех отведениях ЭКГ.
Подъем сегмента ST является частым и ранним признаком, появ-
ляется у 90 % больных в первые часы после возникновения болевого синд-
рома. Его характерными особенностями являются: 1) конкордантность, то
есть регистрация в отведениях, отражающих потенциалы всех сегментов ле-
вого желудочка — I, II, aVL, aVF, V2_6; 2) форма дугой книзу; 3) небольшая
амплитуда — менее 5 мм. Эти изменения достаточно характерны, что позво-
ляет дифференцировать перикардит с острым нарушением коронарного кро-
вообращения.
Через несколько дней сегмент ST возвращается к изолинии, после чего
на его месте формируются симметричные отрицательные зубцы Т. Они со-
храняются несколько недель или месяцев, по-видимому, отражая относи-
тельно стойкое повреждение субэпикарда. В этой стадии изменений на ЭКГ
дифференциация перикардита и острого инфаркта миокарда без зубца Q свя-
зана с трудностями и основывается на других диагностических признаках.
647
Часто определяются изменения зубца Р и депрессия сегмента PQ (по от-
ношению к Т— Р) вследствие вовлечения в патологический процесс миокар-
да предсердий.
При рентгенологическом исследовании и эхокардиографии увеличение сердца
или его отделов не характерно. Если этот признак обнаруживается, его сле-
дует отнести за счет основного заболевания. Иногда как исход воспаления
на ЭхоКГ может определяться утолщение перикарда.
Лабораторные изменения определяются основным заболеванием. Возмож-
ны неспецифические воспалительные сдвиги, иногда небольшое повыше-
ние активности изофермента МВ КФК в крови как следствие поверхностно-
го миокардита.
Дифференциальная диагностика перикардитов предусматривает: 1) диффе-
ренциацию с другими заболеваниями, главным образом болезнями миокар-
да; 2) по возможности установление этиологии перикардита.
Острый фибринозный перикардит, особенно при отсутствии признаков
системного поражения (идиопатический или вирусный), необходимо диф-
ференцировать в первую очередь с острым инфарктом миокарда и острым
диффузным миокардитом.
Для острого инфаркта ми о кард а, как и для перикардита, ха-
рактерны загрудинная боль, часто - шум трения перикарда, небольшое по-
вышение температуры тела и изменения сегмента ST и зубца Т на ЭКГ.
Важность своевременного распознавания этих заболеваний обусловлена от-
части тем, что антикоагулянты, широко используемые у больных инфарк-
том, при остром перикардите противопоказаны. При перикардите эти симп-
томы и клинические признаки проявляются с самого начала заболевания,
тогда как при осложненном эпистенокардитическим перикардитом остром
инфаркте миокарда боль появляется на 1 сут и более раньше возникновения
шума трения и температурной реакции, не связана с дыханием, движением
и положением тела, шум трения менее стойкий, часто отмечаются различ-
ные нарушения сердечного ритма и проводимости. Уточнить диагноз позво-
ляет динамика ЭКГ и активности кардиоспецифичных ферментов в крови.
На ЭКГ при остром инфаркте, в отличие от перикардита, приподнятый сег-
мент ST имеет форму дугой кверху, большую амплитуду, регистрируется
только в отдельных отведениях и сопровождается реципрокными изменени-
ями в виде дискордантной депрессии сегмента ST (при перикардите депрес-
сия сегмента ST может отмечаться только в отведении aVR). Характерна так-
же более быстрая динамика его приближения к изолинии, до которого начи-
нают формироваться отрицательные зубцы Т. У больных инфарктом миокар-
да с эпистенокардитическим перикардитом некроз миокарда, как правило,
трансмуральный, и на ЭКГ определяются патологические зубцы Q (QS).
Отличительные признаки острого диффузного миокардита
связаны с проявлениями остро развившейся сердечной недостаточности. Важ-
ное значение имеют ритм галопа, данные ЭхоКГ, а также особенности ЭКГ:
отсутствие предшествующего инверсии зубца Т подъема сегмента ST, меньшее
648
количество отведений, в которых она регистрируется, частые нарушения
ритма и проводимости.
При выраженном болевом синдроме острый перикардит дифференциру-
ют со стенокардией, ТЭВЛА, в том числе с инфарктом легкого, плевритом,
пневмонией, расслаивающей аневризмой аорты, спонтанным пневмоторак-
сом, медиастинитом, ущемленной грыжей пищеводного отверстия диаф-
рагмы, острым панкреатитом, перфоративной язвой желудка, межреберной
невралгией, синдромом Титце. Анализ данных клинического, электрокар-
диографического и других инструментальных, а также лабораторных мето-
дов исследования обычно позволяет поставить правильный диагноз.
При выслушивании шума трения перикарда исключают пролапс митраль-
ного клапана и плеврит.
Регистрация в большинстве отведений ЭКГ и характерная форма подъема
сегмента ST при перикардите напоминают графику синдрома ранней
реполяризации желудочков, который является довольно распростра-
ненным вариантом нормы. Отличительными признаками этого синдрома
являются наибольшая выраженность подъема сегмента 5Тв грудных отведени-
ях и нередко его отсутствие в отведениях от конечностей, а также высокие
остроконечные зубцы Т. При этом отношение амплитуд ST/Т составляет менее
0,25, тогда как для острого перикардита характерны его большие величины.
Следует отметить, что, поскольку диагноз острого фибринозного пери-
кардита основывается на ограниченном количестве критериев - боль, шум
трения, изменения на ЭКГ, которые из-за нестойкости, неспецифичности
и подчас слабой выраженности могут оставаться невыявленными, часть слу-
чаев этого заболевания не распознается.
При установлении этиологии перикардита исходят из характера других
проявлений лежащего в его основе заболевания и особенностей клиническо-
го течения свойственного ему поражения перикарда (см. ниже). В неясных
случаях уточнить причину помогает лабораторный скриннинг, который вклю-
чает определение: 1) признаков воспаления в общем и биохимическом ана-
лизах крови; 2) возможной бактериемии при посеве крови; 3) нарушения
азотовыделительной функции почек; 4) серологическую диагностику недав-
но перенесенной кардиотропной вирусной (титр противовирусных антител
в динамике) и стрептококковой (антистрептолизин О, антигиалуронидаза)
инфекции; 5) туберкулиновой пробы; 6) ревматоидного фактора, антинук-
леарных антител и волчаночных клеток в крови при подозрении на диффуз-
ное заболевание соединительной ткани. У некоторых больных распознава-
ние общего заболевания возможно только после длительного наблюдения в
динамике. В значительной части случаев, несмотря на все усилия, причина
перикардита остается неясной и методом исключения ставят диагноз идио-
патического перикардита.
Течение и осложнения зависят от причины заболевания (см. ниже). Течение
острого идиопатического перикардита у большинства больных доброкаче-
ственное. Полное выздоровление наблюдается даже без лечения. Возможны,
649
однако, рецидивы, по-видимому, опосредованные аутоиммунными меха-
низмами, и прогрессирование заболевания с развитием экссудативного пе-
рикардита.
Лечение этиотропное — основного заболевания и симптоматическое - пе-
рикардита. Последнее заключается преимущественно в назначении нестеро-
идных противовоспалительных препаратов (ацетилсалициловая кислота по
3—4 г в сутки и др.), которые оказывают также определенное патогенетиче-
ское действие. У единичных больных при отсутствии противопоказаний, свя-
занных с активной инфекцией, в связи с выраженной болью и высокой
лихорадкой прибегают к глюкокортикостероидам. Преднизолон по 40-60 мг
в сутки внутрь или другие препараты этой группы назначают коротким кур-
сом с полной отменой в течение 1—2 нед в расчете преимущественно на
аналгезирующий эффект. Убедительные доказательства влияния противовос-
палительной терапии нестероидными препаратами и глюкокортикостерои-
дами на течение перикардита отсутствуют. Из-за опасности кровотечения в
полость перикарда и возникновения тампонады сердца не следует назначать
антикоагулянты.
Пропюз определяется основным заболеванием. У большинства больных с
острым идиопатическим перикардитом он благоприятен.
Профилактика. Определенное значение имеет раннее и активное этиопа-
тогенетическое лечение основного заболевания как возможной причины пе-
рикардита.
ОСТРЫЙ ЭКССУДАТИВНЫЙ ПЕРИКАРДИТ
БЕЗ ТАМПОНАДЫ СЕРДЦА
Характеризуется накоплением в перикарде большого количества жидко-
сти вследствие значительно более обширного, чем при сухом перикардите,
поражения перикарда. При этом эпикард становится “фильтрующим” на всем
своем протяжении, так что эффективное всасывание даже жидкой части вы-
пота становится невозможным.
Патологическая анатомия и классификация. В зависимости от характера
экссудата различают серозно-фибринозный, геморрагический (или точнее
серозно-геморрагический) и гнойный перикардит. С формальной точки зре-
ния к экссудативному перикардиту можно отнести и фибринозный. Чисто
серозным экссудат не бывает, так как при воспалении обязательно присут-
ствует фибрин, тогда как серозный выпот — это транссудат (гидроперикард).
По характеру невоспалительного выпота различают также гемоперикард, хи-
лезный и холестериновый перикардит.
При одной и той же причине заболевания характер выпота может быть
самым разным. Например, хотя бактериальный перикардит чаще бывает
гнойным, он может быть и серозно-фибринозным. В ряде случаев в зависимо-
сти от характера жидкости можно выделить излюбленные, наиболее частые
этиологические факторы.
650
Клинико-морфологические варианты экссудативного перикардита и их наиболее частые причины
Характер выпота Основные причины
Серозный (гидроперикард) Застойная сердечная недостаточность, гипоальбуминемия (нефротический синдром)
Серозно-фибринозный Вирусная, реже бактериальная инфекция; диффузные заболевания соединительной ткани и другие аутоиммунные заболевания; радиация
Гнойный Серозно-геморрагический Бактериальная инфекция Злокачественные опухоли, в том числе лейкоз; туберкулез; травма грудной клетки; уремия; любой характер перикардита на фоне лечения антикоагулянтами
Геморрагический (гемоперикард) Хилезный (хилоперикард) Холестериновый Наружный разрыв сердца (инфаркт миокарда, травма); расслаивающая аневризма восходящей части аорты Хирургические операции, травмы, опухали Микседема
С течением времени экссудат подвергается организации с замещением
грануляционной тканью в виде отдельных очагов (“солдатские пятна”) или
с распространенным утолщением перикарда. Если он покрывается регенери-
рующими мезотелиальными клетками, перикардиальное пространство со-
храняется. В противном случае в результате организации фибриновых “мос-
тиков” полость перикарда в большей или меньшей степени облитерируется,
и развивается адгезивный перикардит.
Нарушения гемодинамики. При медленном накоплении выпота они дли-
тельное время не развиваются благодаря постепенному растяжению пери-
карда. При этом объем его содержимого может достигать 1—2 л, а внутри-
перикардиальное давление — 300 мм вод.ст. без сдавления сердца. Адекватное
наполнение кровью правого желудочка и его ударный выброс обеспечива-
ются повышением КДД. Это сопровождается ростом ЦВД вследствие нару-
шения равновесия между венозным притоком и емкостью желудочка.
Увеличение ЦВД, как правило, невелико. Если объем выпота достигает
определенного критического уровня, вызывающего существенное сдавле-
ние сердца, возникают расстройства гемодинамики — тампонада сер-
дца (см. ниже). Ее развитие, однако, в значительно большей степени зави-
сит от скорости накопления жидкости. При ее быстрой аккумуляции для
возникновения тампонады бывает достаточно наличия 200 мл выпота и по-
вышения внутриперикардиального давления до 160 см вод.ст.
Клиника. Сам по себе выпот в перикард не вызывает каких-либо специфи-
ческих симптомов. Основными жалобами являются: 1) боль в грудной клетке;
2) одышка; 3) общие симптомы, связанные с причиной поражения перикарда.
Характерный для острого перикардита болевой синдром может исчезать
при накоплении выпота либо, наоборот, появляться при его большом коли-
честве, возможно, вследствие растяжения перикарда.
Одышка при физической нагрузке при отсутствии тампонады не выра-
жена и связана с болью, механическим сдавлением бронхов и паренхимы
легких.
651
Общие симптомы - повышение температуры тела, слабость, поху-
дание и другие — могут быть резко выражены и, выступая на первый план,
мешать распознаванию перикардита.
Реже при значительном объеме выпота отмечаются также симптомы
сдавления соседних органо в: 1) дисфагия из-за сдавления пище-
вода; 2) сухой кашель рефлекторного характера, связанный с увеличением
давления на трахею; 3) осиплость голоса вследствие раздражения возвратно-
го нерва.
При объективном исследовании определяются: 1) шум трения перикарда;
2) тахипноэ; 3) признаки наличия жидкости в полости перикарда.
Шум трения перикарда может сохраняться даже при значитель-
ном выпоте, поскольку жидкость собирается преимущественно книзу и кза-
ди от сердца, тогда как кпереди от него листки перикарда длительное время
находятся в соприкосновении друг с другом.
Клинические признаки наличия выпота в перикарде
без сдавления сердца и нарушения его диастолического наполнения (то есть
тампонады) включают:
1) набухание шейных вен и повышение ЦВД, обычно умеренное;
2) расширение тупости сердца во все стороны с изменением ее границ в
зависимости от положения тела. При переходе из горизонтального положе-
ния в положение стоя или сидя зона притупления во втором-третьем межре-
берье сокращается, расширяясь на 2—4 см и более в третьем-четвертом меж-
реберье. Угол между правой границей сердечной тупости и печеночной тупо-
стью (угол Эбштейна) становится тупым. Из-за наличия жидкости сердеч-
ная тупость приобретает особенно выраженный, “деревянный” характер;
3) ослабление верхушечного толчка и его смещение кверху до третьего-
четвертого межреберья и кнутри от границ сердечной тупости. Такое смеще-
ние верхушки сердца кпереди в значительной мере связано с упругостью
крупных сосудов — аорты и легочной артерии. В период систолы желудочков,
растягиваясь кровью, они напрягаются, с силой отбрасывая сердце к перед-
ней поверхности грудной клетки. Благодаря этому даже при значительном
объеме выпота верхушечный толчок часто не исчезает;
4) ослабление звучности сердечных тонов не является обязательным при-
знаком и больше характерно для миогенной дилатации сердца;
5) притупление перкуторного тона с усилением голосового дрожания и
бронхофонии и очагом бронхиального дыхания слева книзу от угла лопатки
(признак Эварта). Обусловлено сдавлением экссудатом нижней доли левого
легкого. При наклоне больного кпереди легкое расправляется.
Диагностика. Изменения на ЭКГ, связанные с наличием выпота, неспеци-
фичны и включай т:
1) низкий вольтаж зубцов;
2) сглаженность, уплощение, двухфазность или инверсию зубцов Г как
следствие давления жидкости на субэпикардиальный миокард и его воспа-
ление;
3) электрическую альтернацию. Изменение амплитуды и полярности
652
комплексов QRS в одном и том же отведении связано с увеличением ампли-
туды перемещения сердца в переполненной жидкостью полости перикарда;
4) синусовую тахикардию, не соответствующую выраженности повыше-
ния температуры тела и одышки, либо, реже, брадикардию в результате
раздражения блуждающего нерва.
При рентгенологическом исследовании характерно увеличение тени сердца
в обе стороны, которое в динамике развивается быстро и сердце может до-
стигать огромных размеров (corbovinutn), не сопровождаясь выраженными
клиническими признаками нарушения насосной функции. В передне-задней
проекции сердце имеет шаровидную форму, образуя острый угол с диаф-
рагмой, в отличие от треугольной формы при хроническом экссудативном
перикардите. Дуги сердечной тени сглажены, пульсация ослаблена. При вы-
раженном увеличении сердца характерно несоответствие его больших раз-
меров и прозрачности легочных полей вследствие отсутствия значительного
венозного застоя. Часто отмечается сопутствующий плевральный выпот, осо-
бенно слева. Установить этиологию заболевания помогает обнаружение оча-
говых изменений в легких, обусловленных туберкулезом, опухолью, пнев-
монией.
Методом выбора для диагностики выпота в перикард служит эхокардио-
графия, сочетающая в себе высокую точность и специфичность с простотой
и быстротой получения результата непосредственно у постели больного. Скоп-
ление жидкости между листками перикарда вызывает их разъединение с об-
разованием эхо-свободного пространства вокруг желудочков сердца. Оно не
распространяется кзади от левого предсердия и хорошо видно как в М-ре-
жиме, так и в двухмерном изображении. Метод настолько высокочувстви-
тельный, что позволяет обнаружить до 20—50 мл выпота. При минимальном
количестве жидкости разделение эхо-сигналов эпикарда и париетального
перикарда определяется только позади задней поверхности сердца и лишь во
время систолы. При умеренном количестве выпота оно прослеживается на
всем протяжении кардиоцикла, а при значительном количестве появляется
и над передней поверхностью сердца. При организации экссудата определя-
ется утолщение перикарда. Эхокардиография позволяет также диагностиро-
вать опухоли перикарда как возможную причину выпота.
Выпот в перикард и утолщение его листков хорошо визуализируются
при компьютерной томографии и ядерно-магнитном резонансе.
Катетеризация правых отделов сердца и правосторонняя контрастная ан-
гиокардиография. Необходимость в использовании этих инвазивных методов
для уточнения диагноза выпотного перикардита в настоящее время возни-
кает очень редко — лишь при невозможности проведения эхокардиографии
по техническим причинам. На наличие жидкости или утолшение перикарда
указывает увеличение расстояния между концом катетера, который упира-
ется в боковую стенку правого предсердия, или границей контрастного ве-
щества в желудочке, и краем тени сердца более 1 см.
Диагностический перикардиоцентез. При всей информативности эхо-
кардиографии методом верификации диагноза экссудативного перикардита
653
считают перикардиоцентез. Аспирацию жидкости из полости перикарда в диаг-
ностических целях производят главным образом для уточнения причины пе-
рикардита и выполняют при наличии достаточно большого выпота по дан-
ным эхокардиографии. Пункцию перикарда желательно выполнять под элект-
рокардио- и эхокардиографическим контролем. Желательно использовать
доступ либо с верхушки сердца, лишенной крупных коронарных сосудов,
либо из-под мечевидного отростка. Первый доступ более безопасен, так как
тонкостенный правый желудочек легче перфорировать иглой, чем толсто-
стенный левый. При прикосновении иглы к сердцу на ЭКГ регистрируются
экстрасистолы. Эвакуацию выпота лучше производить через канюлю после
измерения давления в полости перикарда, очень медленно. При кровянис-
том характере полученной жидкости необходимо удостовериться, что источ-
ником крови не является перфорированный при пункции желудочек. Про-
тив этого свидетельствует отсутствие сгустков, а также более низкие, чем в
венозной крови, уровень гемоглобина и гематокритное число.
Определенную информацию в отношении возможной этиологии дает уточ-
нение характера выпота (транссудат, невоспалительный выпот другого про-
исхождения, различные виды экссудата) при лабораторном исследовании,
включая количественное определение и состав клеток воспаления. Обяза-
тельно проводят также поиск бактериального возбудителя, в том числе ми-
кобактерии туберкулеза, путем бактериоскопии и бактериального посева, а
также проводят цитологическое исследование для выявления атипичных клеток.
При подозрении на диффузное заболевание соединительной ткани в жидко-
сти можно определять титр ревматоидного фактора и ЛЕ-клетки, характер-
ные для системной красной волчанки.
Другие методы лабораторной диагностики, к которым прибегают для уточ-
нения этиологии перикардита, перечислены выше (см. раздел “Острый фиб-
ринозный (сухой) перикардит”). Изредка выполняют гистологическое ис-
следование биоптата перикарда, полученного при перикардиотомии, кото-
рую производят в целях дренирования перикарда.
Дифференциальный диагноз проводят с увеличением сердца вследствие
миогенной дилатации полостей — прежде всего с острым миокардитом и
дилатационной кардиомиопатией. Отличительными признаками тяжелого
поражения миокарда являются ритм галопа, часто — систолический
шум относительной митральной и (или) трикуспидальной недостаточно-
сти, сравнительно медленное увеличение размеров сердца, которое при рент-
генологическом исследовании сочетается с расширением корней и другими
признаками венозного застоя в легких, а также одинаковая выраженность
ослабления пульсации сердца и аорты. Уточнить диагноз позволяет эхокар-
диография. Необходимо иметь в виду возможность сочетанной патологии —
миоперикардита и тяжелого поражения миокарда с гидроперикардом.
В целом установление диагноза острого экссудативного перикардита не
представляет сложности при наличии характерных признаков: 1) аналогич-
ных фибринозному перикардиту: а) типичная боль в грудной клетке; б) шум
трения перикарда; в) типичные изменения на ЭКГ, а также: 2) выпота в
654
перикард по данным эхокардиографии или инвазивного обследования. Даль-
нейшим подтверждением является аспирация жидкости, характер которой и
результаты лабораторного общеклинического, бактериологического и цито-
логического исследований дают важную информацию для установления при-
чины заболевания.
Особенности течения и диагностики перикардита в зависимости от этио-
логии описаны ниже.
Осложнения. Основным осложнением острого экссудативного перикарди-
та является тампонада сердца (см. ниже). Примерно в 1/3 случаев возникает
пароксизмальная мерцательная аритмия или суправентрикулярная тахикар-
дия, что связывают с распространением воспаления на миокард предсердий.
Лечение обязательно проводят в стационаре. Оно зависит от причины пе-
рикардита и выраженности нарушений гемодинамики и включает:
1) лечение основного заболевания с помощью антибиоти-
ков, туберкулостатических и химиопрепаратов, гемодиализа и др.;
2) симптоматическую и отчасти патогенетическую терапию нестеро-
идными противовоспалительными средствами и глюко-
кортикостероидами. Кроме выраженного болевого синдрома и лихо-
радки, показанием к назначению глюкокортикостероидов является также
наличие большого объема выпота. За исключением случаев иммунного гене-
за заболевания, способность этих препаратов ускорять рассасывание, по-
видимому, относительно невелика. Лечение обычно начинают с назначения
относительно больших доз — 60—80 мг преднизолона в сутки внутрь — и
проводят коротким курсом с быстрым снижением дозы до полной отмены в
течение 2—4 нед.
3) эвакуацию выпота из полости перикарда. Показанапри
первых признаках тампонады сердца, а также при большом объеме выпота,
который вызывает дискомфорт и не рассасывается в течение 2-3 нед. Обяза-
тельным показанием является также гнойный перикардит. Удаляют жидкость
при остром перикардите обычно путем пункции. Если конец иглы соединить
с грудным электродом, при соприкосновении с эпикардом на ЭКГ регист-
рируется подъем сегмента ST, что служит сигналом для оттягивания иглы
назад до исчезновения этого подъема. Аспирацию жидкости желательно про-
изводить через пластиковый катетер, введенный по проводнику. В конце про-
цедуры в полость перикарда по показаниям вводят антибиотики, глюкокор-
тикостероиды, химиопрепараты. Основными осложнениями являются нару-
шения ритма, пневмоторакс и гемотампонада вследствие повреждения ко-
ронарной артерии или желудочка сердца. При вязком экссудате, обычно гной-
ного характера, или ограниченном выпоте дренирование перикарда произ-
водят открытым путем. Если, несмотря на повторные пункции, жидкость
продолжает быстро накапливаться, прибегают кперикардэктомии.
Прогноз зависит от причины заболевания, и при отсутствии тампонады в
большинстве случаев благоприятный. Необходимость в повторении
перикардиоцентеза возникает относительно редко, главным образом при зло-
качественных опухолях и в отдельных случаях диффузных заболеваний
655
соединительной ткани. Возможен, однако, исход в хронический экссуда-
тивный и констриктивный перикардит. Доказано отсутствие существенного
эффекта открытого дренажа полости перикарда и глюкокортикостероидной
терапии в отношении предотвращения развития констрикции (J. Strang и со-
авт., 1988).
Профилактика состоит в раннем и активном этиопатогенетическом лече-
нии заболеваний, которые могут быть причиной перикардита.
ТАМПОНАДА СЕРДЦА
Тампонада сердца, или тампонада перикарда, — это осложнение экссуда-
тивного перикардита, при котором давление в перикарде повышается на-
столько, что создает значительное препятствие притоку крови в желудочки
и вызывает нарушение их диастолического наполнения. Объем жидкости,
который требуется для возникновения тампонады, варьирует в широких пре-
делах, будучи обратно пропорциональным скорости ее накопления и тол-
щине париетального перикарда и прямо пропорциональным толщине стен-
ки желудочка. Она может развиваться чрезвычайно быстро, так как из-за
нелинейного характера растяжимости перикарда аккумуляция в его полости
небольшого дополнительного количества жидкости при определенных усло-
виях может вызывать резкое повышение внутриперикардиального давления.
Этиология. Наиболее частой причиной тампонады сердца является крово-
течение в перикард (гемоперикард) после хирургических операций, травм,
включая ятрогенные (перфорация сердца катетером, сердечно-легочная реа-
нимация), при наружном разрыве сердца вследствие инфаркта миокарда,
расслоении аневризмы аорты, гемофилии, а также при лечении антикоагу-
лянтами больного с острым перикардитом любого генеза. Реже тампонада
осложняет инфекционный перикардит, особенно гнойный или туберкулез-
ный, и выпот неопластического или уремического генеза.
Патофизиология. Тампонада сердца развивается, когда давление в полости
перикарда достигает его уровня в полостях сердца в период диастолы. Внача-
ле сдавливаются правые отделы сердца и полые вены, в которых диастоли-
ческое давление наименьшее, а затем, по мере дальнейшего роста внутри-
перикардиального давления, прогрессирующе повышается диастолическое
давление и в левых отделах сердца. При этом происходит выравнивание КДД
в обоих желудочках и предсердиях, чего не бывает при миокардиальной не-
достаточности, даже резко выраженной. Выраженному застою в системных
венах способствует их сдавление внутри полости перикарда и перегиб в мес-
тах впадения в правое предсердие. Особенно затруднен кровоток по печеноч-
ным венам, которые испытывают дополнительное давление извне от пери-
карда, передающееся через диафрагму, что обусловливает более раннее по-
явление асцита, чем периферических отеков. В легких венозный застой, как
правило, не возникает, так как поступление крови в них ограничено малым
наполнением и выбросом правого желудочка.
656
При выравнивании диастолического давления в правых и левых отделах
сердца значительное влияние на гемодинамику оказывает дыхание, что ле-
жит в основе возникновения парадоксального пульса. Увеличение
отрицательной величины внутригрудного давления в фазу вдоха способствует
растяжению сдавленного правого желудочка, возрастанию его выброса и по-
ступлению крови в легкие. Одновременно расширяются легочные вены, дав-
ление в них снижается, и венозный возврат к левым отделам сердца падает.
Наполнение левого желудочка ухудшается также из-за выбухания в его по-
лость межжелудочковой перегородки. В результате на вдохе УОС и АД умень-
шаются, а при выдохе, наоборот, возрастают благодаря притоку к левым
отделам сердца дополнительного объема крови, который накопился в легких.
Повышение давления в системных и легочных венах и КДД в желудоч-
ках, характерное для нарушений гемодинамики при тампонаде сердца, од-
новременно является важным компенсаторным механизмом, направлен-
ным на обеспечение адекватного наполнения сердца и его выброса. Увеличе-
нию венозного притока способствует и опосредуемое нейрогуморальными
механизмами сужение системных вен, а поддержанию МОС — компенса-
торная тахикардия. Несмотря на повышение КДД наполнение желудочков
при тампонаде страдает. В далекозашедших случаях происходит снижение КДО
и УОС, что, несмотря на артериолярную вазоконстрикцию и рост ОПСС,
может приводить к критическому падению АД, гипоперфузии тканей и раз-
витию шока.
Клиника. Проявления тампонады сердца обусловлены малым МОС и зас-
тоем в системных венах.
Жалобы неспецифичны. Наблюдаются одышка, слабость, головокруже-
ние, а при медленном развитии тампонады — также чувство тяжести или
боль в надчревной области и в правом подреберье и увеличение живота.
Изменение данных клинического обследования варьируют от признаков от-
носительно умеренного нарушения гемодинамики до развернутой картины
шока. Вследствие малого МОС кожа бледная, влажная, пульс час-
тый, малый, диурез снижен. Характерно набухание шейных вен и
значительное увеличение Ц В Д. Поскольку повышенное внутри-
перикардиальное давление создает препятствие наполнению сердца на всем
протяжении сердечного цикла, резкое спадение шейных вен, соответствую-
щее зубцу “у” флебограммы, не выражено, но отмечается в течение корот-
кого периода систолы предсердий (спад “х”). АД имеет тенденцию к сниже-
нию, но в начальных стадиях может сохраняться в пределах свыше 100 мм
рт.ст. за счет артериолярной вазоконстрикции.
Важное диагностическое значение имеет парадоксальный пульс
вследствие снижения систолического АД на вдохе более чем на 10 мм рт.ст.,
или 10 %, от исходного, который свидетельствует о выраженных нарушени-
ях гемодинамики. Поскольку физиологическая реакция АД имеет ту же на-
правленность, отличаясь лишь меньшей выраженностью, этот термин нельзя
считать удачным. В тяжелых случаях парадоксальный пульс определяется
пальпаторно, лучше на сонной артерии, вплоть до полного исчезновения
657
артериальной пульсации на вдохе. Он не является, однако, патогномонич-
ным для тампонады сердца и встречается у ряда больных с констриктивным
перикардитом, рестриктивной кардиомиопатией, бронхообструктивным син-
дромом и гиповолемическим шоком.
При остром возникновении тампонады размеры сердца мало измене-
ны, но значительно увеличиваются при относительно медленном накоп-
лении перикардиального выпота. Верхушечный толчок ослаблен, иногда
не определяется. Тоны сердца глухие, может сохраняться шум трения
перикарда. Добавочные тоны, как и застойные хрипы в легких, не харак-
терны. При хронической тампонаде отмечаются увеличение печени и ас-
цит. Последний предшествует периферическим отекам, что имеет важное
дифференциально-диагностическое значение.
Диагностика. Изменения на ЭКГ, хотя и распространены, неспецифичны.
Отмечаются тахикардия, часто сниженный вольтаж комплекса QRS, упло-
щенные или отрицательные зубцы Т. При большом объеме выпота характер-
на электрическая альтернация, связанная с циклическими движениями серд-
ца в полости перикарда.
При рентгенологическом исследовании размеры тени сердца могут быть
самыми разными, хотя чаще увеличены. Пульсация ее ослаблена. Более важ-
ное диагностическое значение имеет отсутствие признаков венозного застоя
в легких.
Наибольшую диагностическую ценность имеет эхокардиография, которая
позволяет быстро и с высокой точностью выявить выпот в полости перикар-
да и провести дифференциальную диагностику с констриктивным перикар-
дитом и тяжелой миокардиальной недостаточностью. Хотя диагноз тампона-
ды основывается на патофизиологических критериях, ее косвенными эхо-
кардиографическими признаками могут быть увеличение амплитуды движе-
ния межжелудочковой перегородки при дыхании, значительное расширение
нижней полой вены, сохраняющееся на вдохе, и особенно диастолическое
сдавление правых предсердия и желудочка на выдохе, вплоть до полного
исчезновения (облитерации) их полостей, что свидетельствует о выравнива-
нии давления в полости перикарда и правых отделах сердца (G. Reeder, 1989).
Выполнение катетеризации сердца обычно не является необходимым для
диагностики тампонады сердца и может отсрочить оказание помощи. В неяс-
ных случаях уточнить диагноз позволяет обнаружение повышенных пример-
но до 20—25 мм рт.ст. и более и одинаковых величин диастолического давле-
ния в полости перикарда и всех четырех камерах сердца. Об этом можно
косвенно судить по выравниванию “заклинивающего” давления в легочных
капиллярах и среднего давления в правом предсердии при правосторонней
катетеризации сердца с помощью катетера Сван-Ганца непосредственно у
постели больного. На кривой давления в правом предсердии волны “а” и “v“
накладываются друг на друга.
Дифференциальную диагностику проводят с другими причинами остро воз-
никшего синдрома малого МОС - гиповолемией, инфарктом миокарда и
658
другими заболеваниями, протекающими с выраженной миокардиальной
недостаточностью, а также массивной ТЭВЛА. Исключить гиповолемию легко
позволяет высокое ЦВД. Против левожелудочковой недостаточности свиде-
тельствует отсутствие признаков венозного застоя в легких, ритма галопа и
систолического шума относительной недостаточности атриовентрикулярных
клапанов, а также выраженной дилатации полостей сердца и их гипокине-
зии. Массивная ТЭВЛА обычно сопровождается характерными изменения-
ми на ЭКГ, однако с уверенностью исключить ее можно лишь после опре-
деления регионарной перфузии и вентиляции легких с помощью радионук-
лидного сканирования.
Настораживать в отношении возможности тампонады сердца должно соче-
тание артериальной гипотензии и признаков периферической гипоперфузии
со значительно повышенным и прогрессирующе возрастающими ЦВД и та-
хикардией при отсутствии венозного застоя в легких. Подтвердить это пред-
положение позволяет выявление парадоксального пульса, электрической аль-
тернации на ЭКГ и значительного выпота в перикарде при эхокардиографии.
Критерием верификации диагноза может служить выравнивание повышенно-
го диастолического давления в правых и левых отделах сердца по данным
катетеризации.
Основным осложнением тампонады является шок.
Лечение. Как угрожающее жизни состояние тампонада сердца требует неот-
ложного лечения — перикардиоцентеза. Он показан во всех случаях
тампонады и снижения систолического АД более чем на 30 мм рт.ст. от его
обычного уровня. Чаще всего перикардиоцентез производят из субксифо-
идального доступа или при пункции в четвертом межреберье слева. Особен-
но выраженный клинический эффект дает аспирация первых 25-50 мл жид-
кости.
Средством первой помощи до перикардиоцентеза является обеспечение
гемодинамической под держки наполнения желудочков путем быстрого внут-
ривенного введения жидкости, желательно плазмы крови или коллоидных
растворов, со скоростью 100—500 мл/ч. Это особенно важно при невозмож-
ности выполнения пункции перикарда. Мочегонные и другие препараты,
снижающие преднагрузку, противопоказаны.
Дальнейшая тактика предусматривает активное лечение основного забо-
левания для пре;,отвращения рецидива тампонады. Если же это не удается, в
полость перикарда устанавливают катетер для постоянного дренирования и
введения лекарственных препаратов. В ряде случаев прибегают к хирургичес-
кому лечению — частичной или полной перикардэктомии.
Прогноз. Нераспознанная тампонада сердца является фатальной. Однако
при своевременном оказании помощи ближайший прогноз обычно благо-
приятен. Исключение составляют случаи разрыва сердца, его значительной
травмы и расслоения аневризмы аорты. Отдаленный прогноз зависит от ге-
неза поражения перикарда.
Профилактика такая же, как при других формах перикардита.
659
ХРОНИЧЕСКИЙ ЭКССУДАТИВНЫЙ ПЕРИКАРДИТ
Часто встречается у больных без предшествовавшего острого перикардита
в анамнезе. Экссудат может быть как воспалительного, так и невоспалитель-
ного характера. В большинстве случаев установить этиологию заболевания не
удается. Чаще всего причинами являются диффузные заболевания соедини-
тельной ткани, туберкулез, уремия, опухоль перикарда, а при наличии экс-
судата невоспалительного характера - застойная сердечная недостаточность,
нефротический синдром, микседема.
Клиника. Хронический экссудативный перикардит может протекать бес-
симптомно и в ряде случаев обнаруживаться случайно при выявлении уве-
личения тени сердца на рентгенограмме грудной клетки. Заболевание часто
начинается исподволь с постепенно нарастающей одышки, чувства тяжести
в грудной клетке и симптомов правожелудочковой недостаточности. Реже
отмечается острое начало с проявлений острого перикардита. У части боль-
ных в клинической картине доминируют симптомы основного заболевания.
Данные физического исследования схожи с таковыми при остром экссуда-
тивном перикардите. Характерны кардиомегалия, склонность к тахикардии,
ослабление или отсутствие верхушечного толчка, который иногда определя-
ется лишь в положении лежа на спине и исчезает в положении сидя и на
левом боку. Тоны сердца ослаблены, может выслушиваться шум трения пе-
рикарда. При невоспалительном экссудате болевой синдром и шум трения
отсутствуют. У ряда больных отмечаются признаки венозного застоя в боль-
шом круге кровообращения — увеличение печени, асцит, периферические
отеки, указывающие на хроническую тампонаду сердца. Установить, в ка-
кой мере эти клинические проявления обусловлены хроническим экссуда-
тивным перикардитом, а в какой - фоновым заболеванием сердца, бывает
очень сложно.
Диагностика. При рентгенологическом исследовании тень сердца всегда уве-
личена, иногда значительно, дуги сглажены, пульсация ослаблена, вплоть
до видимого отсутствия, что контрастирует с минимальной выраженностью
признаков венозного застоя в легких.
В отличие от острого перикардита изменения на ЭКГ неспецифичны и со-
стоят в уменьшении вольтажа комплекса QRS и уплощении, иногда инвер-
сии зубцов Т. Могут регистрироваться широкие зазубренные зубцы Р. Необ-
ходимо иметь в виду, что у части больных какие-либо изменения на ЭКГ
отсутствуют.
Наиболее чувствительным и надежным неинвазивным методом диагнос-
тики является эхокардиография.
При лабораторном исследовании крови в случаях хронической тампонады
может определяться повышение активности АЛТ и ACT вследствие некроза
гепатоцитов в условиях выраженного венозного застоя и гипоксии.
Данные лабораторного анализа экссудата определяются его причиной и
имеют важное значение для ее установления. При холестериновом перикар-
дите высокое содржание холестерина придает жидкости характерный вид
660
золотой краски, а при хилезном она становится опалесцирующей, наподо-
бие молока.
Дифференциальную диагностику проводят с другими причинами кар-
диомегалии и сердечной недостаточности. Она основывается на данных
ЭхоКГ. Следующим этапом является распознавание экссудативного пе-
рикардита и выпота в перикард невоспалительного генеза и по возмож-
ности установление этиологии заболевания с учетом особенностей кли-
нического течения и данных дополнительного обследования (см. ниже).
Течение и прогноз зависят от причины. В значительной части случаев, в
частности, при хроническом идиопатическом перикардите даже большое ко-
личество экссудата хорошо переносится годами. Возможными осложнения-
ми являются тампонада и развитие констриктивного перикардита. Они свой-
ственны преимущественно инфекционному перикардиту. Больные подвер-
жены также предсердным аритмиям, включая мерцание.
Лечение. Наиболее эффективно успешное лечение основного заболевания.
Перикардиоцентез и мочегонные препараты в большинстве случаев не пре-
дотвращают повторного накопления жидкости. Ее неоднократная аспирация
способствует образованию сращений и осумкованию экссудата. Мало эф-
фективны и глюкокортикостероиды. Единственно действенным является
хирургическое лечение - ранняя и широкая перикардэктомия, кото-
рая может приводить к полному выздоровлению. Создание плевроперикар-
диального “окна” менее эффективно и в настоящее время применяется редко.
Профилактика предусматривает раннее и адекватное лечение основного
заболевания, а также острого перикардита.
КОНСТРИКТИВНЫЙ ПЕРИКАРДИТ
Характеризуется склерозом и сокращением париетального перикарда и
(или) эпикарда, что приводит к сдавлению сердца и нарушению его диасто-
лического наполнения. В большинстве случаев заболевание является хрони-
ческим и сопровождается облитерацией полости перикарда. В последнее вре-
мя, однако, чаще встречается его подострое течение, при котором сдавле-
ние сердца вызывают одновременно фиброзное утолщение листков пери-
карда и выпот в его полость (так называемый подострый экссудативно-кон-
стриктивный перикардит).
Частота. Констриктивный перикардит является редким заболеванием. Его
распространенность точно не установлена, однако, по-видимому, не пре-
вышает 1 % всех случаев болезней системы кровообращения. Характерно пре-
имущественное поражение мужчин в возрасте 20-50 лет, которые составля-
ют 50-80 % таких больных.
Этиология. К развитию констриктивного перикардита в принципе может
приводить острый или хронический экссудативный перикардит любой этио-
логии. На практике, однако, в 50—80 % случаев его причина остается не-
известной, несмотря на применение современных методов исследования,
661
включая бактериологические и гистологические. Среди установленных этио-
логических факторов первое место занимает туберкулез, который выявляет-
ся примерно у 30 % таких больных. Возможно, его истинная частота еще
выше. На долю всех других известных причин приходится лишь около 10 %.
Среди них наибольшее значение имеют гнойная инфекция и гемоперикард
постперикардиотомического генеза или вызванный лечением антикоагулян-
тами. Следует отметить, что в настоящее время отмечается рост случаев кон-
стриктивного перикардита, связанного с операциями на открытом сердце,
с развитием этого заболевания спустя несколько недель или месяцев после
кардиохирургического вмешательства (D.Killian и соавт., 1989). Более редки-
ми этиологическими факторами являются диффузные заболевания соедини-
тельной ткани, хроническая почечная недостаточность при лечении хрони-
ческим гемодиализом и вирусная инфекция. Изредка сдавление сердца вы-
зывают злокачественные опухоли перикарда или крупные организованные
сгустки крови в его полости.
Патологическая анатомия. Утолщение перикарда обусловлено образо-
ванием грубой грануляционной ткани и может быть неодинаковым на
своем протяжении. Часто в нем встречаются отложения кальция, иногда об-
разующие сплошной панцирь вокруг сердца (панцирное сердце). Утол-
щенный кальцинированный перикард может легко отделяться от сердца или
прочно припаиваться к нему, а иногда также к диафрагме, плевре и тканям
средостения. Фиброз часто распространяется на миокард - от субэндокарди-
альных отделов в толщу мышцы желудочков. При длительном сдавлении
толщина их стенок постепенно уменьшается из-за фибротизации и атрофии
мышечных волокон. В редких случаях утолщение перикарда и сдавление сер-
дца могут быть ограниченными, например, в виде полосы в области атрио-
вентрикулярной борозды, вокруг полых или легочных вен.
Патофизиология, как и при тампонаде сердца, обусловлена нарушением
наполнения желудочков, вследствие того что окружающий утолщенный и
неподатливый перикард ограничивает их расширение в период диастолы. В
обоих случаях нарушение диастолического наполнения одинаково выражено
в обоих желудочках и приводит к выравниванию КДД во всех четырех каме-
рах сердца, центральных, системных и легочных венах, которое в тяжелых
случаях достигает 25 мм рт.ст. Ударный выброс снижен и фиксирован, то
есть неспособен увеличиваться при физической нагрузке. Поддержание МОС
обеспечивается тахикардией.
Однако, в отличие от тампонады сердца, при констриктивном перикар-
дите в фазу быстрого наполнения способность желудочков к дилатации со-
храняется и резко снижается лишь в середине диастолы спустя 100—150 мс
после открытия митрального клапана, когда исчерпывается лимит эластиче-
ского растяжения перикарда. Этим объясняется длительное хроническое тече-
ние констриктивного перикардита, что невозможно при тампонаде. Такой
характер наполнения желудочков обусловливает специфическую форму
квадратного корня кривой их диастолического давления и образование глубо-
кой направленной книзу волны “у“ на флебограмме, что не свойственно
662
тампонаде. За счет глубоких волн “у“ и “х” кривая давления в предсердиях и
центральных венах приобретает М-образный вид. Эти изменения
гемодинамики, хотя и характерны для констриктивного перикардита, не
являются патогномоничными. Они отражают так называемый гемодина-
мический синдром рестрикции наполнения желудочков, кото-
рый отмечается также при некоторых заболеваниях миокарда, в частности,
амилоидозе и рестриктивной кардиомиопатии, что необходимо учитывать
при дифференциальной диагностике.
В отличие от тампонады сердца, при констриктивном перикардите пара-
доксальный пульс отмечается редко из-за отсутствия колебаний давления в
перикарде, а следовательно, венозного притока к предсердиям в зависимо-
сти от дыхания из-за облитерации полости перикарда. Свойственное ему зна-
чительное повышение ЦВД носит отчасти активный характер как компен-
саторная реакция, направленная на поддержание наполнения правого желу-
дочка. Вследствие этого развивается выраженный застой крови в системных
венах. При длительном течении заболевания из-за вовлечения в патологи-
ческий процесс миокарда часто отмечается снижение его сократимости.
Хотя от ограничения диастолического наполнения, или гиподиастолии,
больше страдают правые отделы сердца, как более податливые, в большин-
стве случаев поражается и его левая половина. Поскольку ударный объем
правого желудочка снижается до достижения “заклинивающего” давления в
легочных капиллярах 25 мм рт.ст., венозная легочная гипертензия обычно
умеренная (менее 18 мм рт. ст.) и не вызывает интерстициального отека
легких. Поэтому ортопноэ и приступы острой левожелудочковой недостаточ-
ности не характерны.
Клиника. В основе клинических проявлений констриктивного перикарди-
та лежит препятствие венозного притока к сердцу, преимущественно его
правым отделам, и снижение МОС.
Заболевание в большинстве случаев развивается исподволь, без видимой
причины, реже — подостро. Больные жалуются на увеличение живота и чув-
ство тяжести в правом подреберье, которые, в отличие от застойной сердеч-
ной недостаточности, предшествуют отекам нижних конечностей. Большин-
ство больных беспокоят также слабость, утомляемость и одышка при физи-
ческой нагрузке вследствие умеренной легочной гипертензии и фиксиро-
ванного МОС, которая не достигает значительной выраженности. Отсут-
ствуют и приступы сердечной астмы и отека легких, что является важным
отличием от систолической левожелудочковой недостаточности.
В запущенных случаях отмечаются похудание и диспепсия,обусловленные
печеночной недостаточностью. Боль в грудной клетке отсутствует или не-
определенная.
Распознавание заболевания облегчается при наличии в анамнезе указа-
ний на перенесенный острый перикардит или туберкулез, что, однако, встре-
чается редко. Важное диагностическое значение имеют перенесенные не-
сколько месяцев назад острая вирусная или гнойная инфекция, травма груд-
ной клетки, операция на сердце, а также лечение по поводу диффузного
663
заболевания соединительной ткани, уремии. Ценным является и отсутствие
какого-либо “сердечного” анамнеза.
При физическом исследовании состояние больного обычно неудовлет-
ворительное, а его вид говорит о серьезном хроническом недуге. Для за-
болевания наиболее характерны следующие признаки.
1. Гепатомегалия, асцит и периферические отеки.Харак-
терно раннее появление увеличения печени и асцита (ascitis ргаесох). Послед-
ний, как правило, значительно превосходит по своей выраженности отеки
нижних конечностей. Часто отмечается гидроторакс. В далеко зашедших слу-
чаях определяются порто-кавальные анастомозы и увеличение селезенки (у
10-25 % больных), а также желтуха, кожный зуд, кахексия. Такая картина
напоминает цирроз печени (отсюда и название - “псевдоцирроз
Пик а”) и может быть причиной ошибочного диагноза этого заболевания,
чему способствует ее сочетание с “маленьким тихим сердцем”. Избежать
диагностической ошибки помогает тщательное исследование шейных вен.
2. Высокое венозное давление и изменения венного
пульса. Шейные вены резко набухшие вследствие значительного повыше-
ния ЦВД, которое составляет обычно 250—300 мм рт.ст. и является наиболее
постоянным признаком заболевания, не изменяясь даже при активном ле-
чении мочегонными препаратами. Столь высокий уровень ЦВД не свой-
ствен правожелудочковой недостаточности вследствие заболеваний мио- и
эндокарда. При осмотре в положении сидя и стоя отмечается также резкое
раннее диастолическое спадение шейных вен, соответствующее негативной
волне “у“ флебограммы (признак Фридрейха), более выраженное, чем
их спадение в начале систолы (см. рис. 17,/). Генез этой волны при конструк-
тивном перикардите связан с возможностью дополнительного растяжения
правого предсердия при сокращении желудочка. На вдохе набухание шейных
вен и ЦВД возрастают. Этот феномен носит название признака К у с -
с м а у л я и обусловлен невозможностью сжатого перикардом правого пред-
сердия вместить дополнительный объем крови при увеличении венозного
притока. Оба признака неспецифичны для констриктивного перикардита и
могут наблюдаться при тяжелой правожелудочковой недостаточности. На-
бухшие шейные вены и одутловатое лицо с цианотичным оттенком придают
характерный вид “консульской головы”.
Картина тяжелого системного венозного застоя контрастирует с относи-
тельно слабой выраженностью признаков левожелудочковой недостаточно-
сти. Тахипноэ в покое отсутствует или минимальное, застойных хрипов в
легких обычно нет, размеры сердца чаще не изменены или (реже), незначи-
тельно увеличены. Хотя ортопноэ принято считать не характерным для кон-
стриктивного перикардита, на практике оно встречается и в значительной
степени связано с гидротораксом, а также с высоким стоянием диафрагмы
вследствие асцита.
3. Частый малый пульс. Как правило, отмечается стойкая тахикар-
дия, а у 30 % больных — мерцательная аритмия. Вследствие тенденции к
664
артериальной гипотензии и снижению пульсового давления пульс малый,
мягкий. У части больных может определяться парадоксальный пульс.
4. Изменения верхушечного толчка. Верхушечный толчок
обычно отсутствует. Вместо него при пальпации часто можно определить
систолическое втяжение грудной клетки в области верхушки сердца и
левого края грудины и выбухание этой области в начале диастолы. Такой
диастолический верхушечный толчок образуется в момент
резкого прекращения дальнейшего наполнения сердца из-за противодей-
ствия со стороны неподатливого перикарда.
5. Перикард-тон. Этот добавочный тон в период протодиастолы спе-
цифичен для констриктивного перикардита, однако встречается лишь при-
мерно у 40 % больных. Механизм его образования такой же, как и диастоли-
ческого верхушечного толчка, который является пальпаторным эквивален-
том этого тона. Он образуется через 0,06—0,12 с после А2 и представляет
собой патологически измененный III тон. Перикард-тон лучше всего выслу-
шивается в третьем-четвертом межреберье у левого края грудины и по звуч-
ности может превышать I и II тоны, которые обычно заметно ослаблены. В
связи с этим, а также отсутствием шумов говорят о “тихом сердце” у таких
бальных.
Диагностика. Хотя изменения на ЗЯТ отмечаются во всех случаях конст-
риктивного перикардита, они не специфичны и не имеют диагностического
значения. К ним относятся низкий вольтаж комплекса QRS, уплощение или
инверсия зубцов Т во многих отведениях, отклонение электрической оси
сердца вправо, двухгорбый зазубренный зубец Р, напоминающий P-mitrale,
и изредка — признаки гипертрофии правого желудочка.
При рентгенологическом исследовании размеры сердца не изменены или
умеренно увеличены. При подостром экссудативно-констриктивном пери-
кардите возможно, однако, и его выраженное расширение за счет выпота.
Форма тени сердца обычно мало изменена. Часто отмечается дилатация вер-
хней полой вены, реже — небольшое увеличение предсердий. Пульсация сердца
резко ослаблена. Патогномоничным рентгенологическим признаком являет-
ся отложение в перикарде кальция в виде отдельных очагов или ободка в
области атриовентрикулярной борозды, диафрагмальной и стернальной по-
верхностей правого или левого желудочка за исключением верхушки. Оно
встречается у 30—50 % больных, однако позволяет подтвердить диагноз только
при наличии клинических признаков сдавления сердца, поскольку может
образовываться и при отсутствии перикардита.
В легких признаки застоя не определяются. У 60—90 % больных обнаружи-
вается выпот в плевральные полости (гидроторакс). У отдельных больных
изменения при рентгенологическом исследовании полностью отсутствуют.
Изменения данных ЭхоКГ в М-режиме и секторального сканирования
неспецифичны, иногда нечеткие, и непостоянные. К ним относятся: 1) утол-
щение перикарда, которое определяется, к сожалению, недостаточно
надежно; 2) отсутствие расширения левого желудочка во второй половине
665
диастолы; 3) парадоксальное движение межжелудочковой перегородки в пе-
риод систолы при отсутствии объемной перегрузки правого желудочка. Такой
характер изменения движения стенок левого желудочка отмечается и при
других причинах синдрома рестрикции. Будучи мало информативной в отно-
шении диагностики констриктивного перикардита, ЭхоКГ имеет важное
дифференциально-диагностическое значение, так как позволяет исключить
заболевания миокарда, сопровождающиеся его систолической дисфункцией.
Компьютерная томография и ядерно-магнитный резонанс служат надеж-
ными методами визуализации утолщения перикарда, которое является цен-
ным диагностическим признаком констриктивного перикардита. Однако
следует иметь в виду, что, как и кальциноз, оно не обязательно приводит к
нарушению наполнения желудочков.
Для подтверждения диагноза проводят инвазивное обследование - кате-
теризацию сердца. Диагностическое значение имеет выявление нарушения
позднего диастолического наполнения (синдрома рестрикции). Для
него характерно повышение КДД при неизмененном КСО, а также специ-
фическая форма кривой диастолического давления в желудочках в виде квад-
ратного корня.
Дифференциально-диагностическое значение, в отличие от заболеваний
миокарда, имеют одинаковая выраженность повышения КДД в правых и
левых отделах сердца (различие КДД в желудочках допускается не более 5 мм
рт.ст.) и умеренная легочная гипертензия — систолическое давление в ле-
гочной артерии менее 50 мм рт.ст., “заклинивающее” — менее 18 мм рт.ст.
Однако в сложных случаях после инвазивного обследования иногда при-
ходится прибегать к пробной торакотомии с непосредственным осмотром
перикарда.
При лабораторном обследовании у значительной части больных определя-
ются признаки печеночной недостаточности — гипоальбуминемия, повы-
шение уровня билирубина и мочевины, положительная бромсульфолеино-
вая проба.
Дифференциальный диагноз проводят с другими причинами выраженной
рефрактерной сердечной недостаточности и изолированной портальной ги-
пертензией.
1. Заболевания миокарда.Дифференциальнаядиагностикас по-
ражениями мышцы сердца с его систолической дисфун-
кцией (тяжелый миокардит, дилатационная кардиомиопатия, различные
формы ИБС, эссенциальная артериальная гипертензия и др.) обычно не
представляет сложности. Отличительными признаками этих заболеваний яв-
ляются: 1) болезнь сердца в анамнезе; 2) наличие ортопноэ и пароксизмаль-
ной ночной одышки, которые предшествуют развитию правожелудочковой
недостаточности; 3) появление вначале стойких периферических отеков и
лишь затем — асцита; 4) кардиомегалия с дилатацией полостей сердца и их
гипокинезией по данным рентгенологического исследования и ЭхоКГ, а
также выраженный венозный застой в легких; 5) гипертрофия левого желу-
дочка, нарушения внутрижелудочковой проводимости, часто патологиче-
666
ские зубцы Q на ЭКГ; 6) снижение ЦВД после увеличения диуреза при ак-
тивной терапии мочегонными препаратами.
Значительно более трудной задачей является разграничение констрик-
тивного перикардита и инфильтративных заболеваний миокар-
д а (амилоидоза, гемохроматоза, саркоидоза, поражения сердца при сис-
темной склеродермии и др.), а также рестриктивной кардиомиопатии, кото-
рые сопровождаются клинико-гемодинамическим синдромом рестрикции. В
их пользу могут свидетельствовать ортопноэ с приступами острой левожелу-
дочковой недостаточности в случаях относительно более выраженного пора-
жения мышцы левого желудочка, сохранение верхушечного толчка, ритм
галопа, блокада ножек пучка Гиса и иногда патологические зубцы Q на ЭКГ.
В ряде случаев патологический процесс распространяется на атриовентрику-
лярные клапаны с развитием их недостаточности при неизмененных разме-
рах полости желудочка. На ЭхоКГ часто обнаруживаются гипертрофия желу-
дочков и нарушения их сегментарной сократимости, перикард не утолщен,
что можно уточнить с помощью компьютерной томографии. Определенное
дифференциально-диагностическое значение имеют и данные катетериза-
ции сердца. Эти признаки, однако, весьма относительны, и иногда устано-
вить точный диагноз позволяют лишь пробная торакотомия и морфологи-
ческое исследование интраоперационных биолтатов мио- и перикарда.
2. Хроническое легочное сердце . Каки при констриктивном
перикардите, при этом заболевании часто отмечается выраженная право-
желудочковая недостаточность при отсутствии или минимальной выражен-
ности венозного застоя в легких, сердце не увеличено, может наблюдаться
парадоксальный пульс. Отличить хроническое легочное сердце позволяет на-
личие в большинстве случаев клинических и инструментальных признаков
хронического заболевания легких, тяжелого нарушения внешнего дыхания,
исчезновение цианоза и нормализация насыщения гемоглобина при дыха-
нии кислородом, снижение венозного давления на вдохе (отрицательный
признак Куссмауля).
3. Другие причины препятствия на путях притока к
правым отделам сердца. Для стеноза правого атриовент-
рикулярного отверстия характерны соответствующая мелодия серд-
ца, часто признаки сопутствующего порока митрального или аортального
клапана. Уточнить диагноз позволяют данные двухмерной эхокардиографии,
допплеровского исследования и катетеризации сердца.
Развитие недостаточности трехстворчатого клапана час-
то связано с высокой легочной гипертензией, которая не свойственна кон-
стриктивному перикардиту. Полости правого желудочка и предсердия дила-
тированы, определяются характерные изменения флебограммы и регургита-
ция крови при допплеровском исследовании.
Диагностировать миксому правого предсердия позволяет эхо-
кардиография.
Сдавление верхней полой вены и повышение ЦВД может вызывать опу-
холь средостения. При этом, однако, отсутствуют признаки застоя в
667
системе нижней полой вены — увеличение печени, периферические отеки,
асцит. Не изменена и пульсация сердца.
4. Митральный стеноз может напоминать констриктивный пе-
рикардит, поскольку в обоих случаях отмечаются одышка и слабость при
физической нагрузке, небольшие размеры сердца, добавочный тон в на-
чале диастолы, на ЭКГ - отклонение электрической оси вправо и Р-
mitrale, в ряде случаев - мерцательная аритмия. На митральный стеноз
указывают ортопноэ, пароксизмальная ночная одышка, приступы сер-
дечной астмы и отека легких, эпизоды кровохарканья, позднее развитие
асцита, характерная мелодия сердца, при рентгенологическом исследо-
вании — значительное увеличение левого предсердия и легочной артерии
и выраженный венозный застой в легких. Уточнить диагноз позволяет выяв-
ление фиброза и кальциноза митрального клапана при эхокардиографии.
5. Заболевания, протекающие с изолированной (первичной)
портальной гипертензией, — цирроз, реже рак печени, тромбоз во-
ротной или печеночной вены и другие — имеют значительное сходство с
тяжелым констриктивным перикардитом. Однако они не сопровождаются
изменениями давления и пульсации центральных вен, а также ослаблением
пульсации сердца при пальпации и рентгеноскопии, что облегчает уточне-
ние диагноза.
Заподозрить констриктивный перикардит позволяют жалобы на слабость,
снижение толерантности к физической нагрузке, выраженные признаки
правожелудочковой недостаточности с гепатомегалией, значительным ас-
цитом при небольших отеках нижних конечностей, резкое (более 250 мм
рт.ст.) и стойкое повышение ЦВД и набухание шейных вен, усиливающее-
ся на вдохе, которые диссонируют с небольшими размерами сердца и его
полостей. Вероятность этого заболевания возрастает при выявлении харак-
терного изменения пульсации шейных вен и верхушечного толчка, а также
перикард-тона в период ранней диастолы. Уточнить диагноз позволяет обна-
ружение участков кальциноза перикарда при рентгенографии и его утолще-
ния при эхокардиографии и особенно — компьютерной томографии в соче-
тании с гемодинамическим синдромом рестрикции по данным ЭхоКГ и
катетеризации сердца с одинаковыми уровнями КДД в правых и левых отде-
лах сердца.
Течение и осложнения. Заболевание имеет прогрессирующее течение, тем-
пы которого могут быть разными. Атипичные проявления имеют случаи ог-
раниченного утолщения перикарда. Например, при его локализации в облас-
ти атриовентрикулярной борозды развивается картина митрального и (или)
трикуспидального стеноза, а сдавление выносящего тракта правого желу-
дочка напоминает врожденный подклапанный стеноз легочной артерии. Ис-
ключить эти пороки позволяет эхокардиография.
Для подострого экссудативно-констриктивного перикар-
дита характерно сочетание признаков синдрома рестрикции и хрониче-
ской тампонады сердца различной выраженности с исходом, обычно в тече-
ние года, в “чистый” констриктивный перикардит.
668
К возможным осложнениям констриктивного перикардита относятся:
1) мерцательная а р и т м и я. Отмечается в 30—40 % случаев и обус-
ловлена, вероятно, вовлечением в патологический процесс миокарда пред-
сердий;
2) миокардиальная недостаточность. Развивается при длитель-
ном течении заболевания и наиболее ярко проявляется после перикардэкто-
мии, ухудшая ее результаты;
3) кардиальный цирроз п е ч е н и. Возникает при длительном и
выраженном венозном застое в печени;
4) энтеропатия вследствие нарушения лимфатического оттока от
тонкой кишки из-за выраженного повышения венозного давления. Может
приводить к значительной потере белка, что усугубляет асцит и перифери-
ческие отеки, вплоть до развития нефротического синдрома.
Лечение. Единственно эффективным является хирургическое лечение —
перикардэктомия. Активная мочегонная терапия и парацентез связаны
с риском резкого снижения давления наполнения желудочков и падения
МОС, вплоть до развития гиповолемического шока.
Операция показана во всех симптоматичных случаях, в частности, при
снижении переносимости физических нагрузок и признаках задержки жид-
кости, несмотря на умеренные дозы мочегонных препаратов. Она состоит в
возможно более полном удалении перикарда и освобождении от сдавления
полых вен и других сосудов. Выполняют операцию без искусственного крово-
обращения. Нередко, особенно в далеко зашедших случаях заболевания, утол-
щенный и обызвествленный перикард местами настолько тесно припаян к
миокарду и врастает в него, что иссечение связано с риском перфорации
стенок сердца, особенно тонкостенных предсердий, а также вен, и может
быть выполнено лишь частично. Имеется и опасность травматизации коро-
нарных артерий. Для того чтобы определить в ходе операции, достаточно ли
уменьшилось сдавление сердца, измеряют уровень давления в правом пред-
сердии и добиваются его заметного снижения.
Хирургическая летальность составляет около 5 % и зависит от тяжести
заболевания. Хороший клинический эффект, то есть исчезновение или зна-
чительное уменьшение проявлений и признаков заболевания отмечается в
85—90 % случаев. Он обычно наступает лишь через несколько недель и даже
месяцев после операции, что объясняют детренированностью и отчасти атро-
фией миокарда “от бездействия”. Недостаточная эффективность хирургиче-
ского лечения связана с неполной перикардэктомией и необратимыми из-
менениями в миокарде и печени, которые развились до операции.
При минимальной выраженности симптомов рекомендуют ограничить
прием соли и назначают мочегонные препараты. Такие больные подлежат
тщательному наблюдению для раннего выявления ухудшения гемодинамики.
Прогноз. Отдаленный прогноз в симптоматичных неоперированных слу-
чаях заболевания, а также при отсутствии эффекта от перикардэктомии в
целом неблагоприятен. Хирургическое лечение обеспечивает 10—15-летнюю
выживаемость с сохранением хорошего качества жизни.
669
Особенности течения, диагностики и лечения отдельных вариантов перикар-
дита в зависимости от этиологии. Острым вирусным перикардитом болеют чаще
лица молодого возраста. Характерно острое начало с высокой лихорадки и
боли в грудной клетке через 10—12 дней после вирусной инфекции. В связи с
возможным бессимптомным ее течением заболевание может возникать и
без видимой причины. В таких случаях обычно ставят диагноз идиопатиче-
ского перикардита. Перикардит сухой или экссудативный, часто серозно-
фибринозный, но может быть и геморрагическим. Характерны сопутствую-
щие миокардит, плеврит, иногда пульмонит. Течение, как правило, добро-
качественное и в течение 2 нед заканчивается выздоровлением. Тампонада и
исход в констриктивный перикардит не характерны. Примерно у 1/4 боль-
ных в первые несколько недель или месяцев развиваются рецидивы пери-
кардита, иногда неоднократно, которые имеют аллергический патогенез.
Отрицательные зубцы Т на ЭКГ могут сохраняться годами. Диагностика ос-
новывается на обнаружении повышенных в 4 раза и более титров противо-
вирусных антител в сыворотке крови в первые 3 нед заболевания с последу-
ющим их снижением через 2—4 нед. Выделение вирусов из перикардиальной
жидкости, крови и кала технически очень сложно и редко удается. Отмеча-
ются также неспецифические воспалительные сдвиги в крови. Специфиче-
ского лечения не существует. Обычно бывает достаточно покоя и примене-
ния нестероидных противовоспалительных средств. В более тяжелых случаях
прибегают к короткому курсу глюкокортикостероидной терапии.
Острый идиопатический перикардит. Этиология неизвестна. Предполага-
ют роль вирусной инфекции и аллергических факторов, о чем свидетель-
ствует частое сочетание с миокардитом, плевритом и пневмонитом. Выпот
серозно-фибринозный, иногда геморрагический. Диагноз ставят путем ис-
ключения известных причин перикардита, прежде всего инфекционных. Те-
чение и лечение такие же, как при вирусном перикардите.
Гнойный перикардит. Наиболее частой причиной является стафилококко-
вая инфекция (до 40 % случаев). Возрастает роль грамотрицательных микро-
организмов (кишечная палочка, протей, клебсиелла и pseudomonas), тогда
как удельный вес стрептококков и пневмококков уменьшается. Инфекция
может попадать в перикард несколькими путями: 1) контактным из плевры
или легкого при пневмонии, абсцессе легкого или гнойном плеврите, при
перфорации пищевода в полость перикарда, или распространяясь через диа-
фрагму при абсцессе печени; 2) гематогенным при септицемии, остеомие-
лите, инфекционном эндокардите; 3) при инфицировании грудной полости
во время операции или при открытой травме. Характерно острое течение за-
болевания с высокой лихорадкой, ознобом, потливостью и симптомами ин-
токсикации. Боль в грудной клетке обычно не выражена. Если шум трения
перикарда отсутствует, проявления перикардита могут маскироваться кар-
тиной общей или очаговой инфекции. В крови выражены изменения воспа-
лительного характера. Важное диагностическое значение имеет выявление
возбудителя в крови и перикардиальном выпоте. Характерно быстрое (в те-
чение считанных дней) накопление экссудата с частым возникновением
670
тампонады и исходом в констриктивный перикардит. Летальность превыша-
ет 20 %. Наряду с антибиотикотерапией, которая по возможности должна
основываться на определении чувствительности возбудителя, обязателен от-
крытый дренаж полости перикарда или ранняя перикардэктомия. Если гной-
ный экссудат не удалить, то даже его стерилизация с помощью антибиоти-
ков может оказаться недостаточной для предупреждения развития конст-
риктивного перикардита.
Туберкулезный перикардит. Обусловлен лимфогенным распространением
инфекции из лимфатических узлов средостения или, значительно реже, ее
гематогенной диссеминацией. При этом клинические и даже морфологиче-
ские признаки активного или неактивного туберкулезного поражения дру-
гих органов могут отсутствовать. Вначале перикардит имеет аллергический
генез и носит характер серозно-геморрагического. Постепенно в субсероз-
ных слоях перикарда развивается хроническое гранулематозное воспаление
и казеозный некроз с исходом в фиброз с очагами кальциноза. Заболевание
начинается исподволь с появления субфебрильной температуры и неопреде-
ленного недомогания, реже — остро, когда отмечаются высокая лихорадка,
потливость, кашель, одышка, которые более выражены, чем боль в грудной
клетке. Как правило, отмечается значительный выпот в перикард, серозно-
геморрагический или геморрагический, который при остром течении забо-
левания может осложниться тампонадой. Позже часто развивается констрик-
тивный перикардит. Летальность при туберкулезном перикардите значитель-
но выше, чем при туберкулезе без поражения перикарда. На туберкулезную
этиологию перикардита указывают клинико-рентгенологические признаки
активного или неактивного туберкулеза легких, внутригрудных лимфати-
ческих узлов, выделение микобактерий туберкулеза из перикардиального
выпота, в том числе при заражении морских свинок, и положительные ту-
беркулиновые пробы. Отрицательные результаты всех этих методов не ис-
ключают, однако, возможности туберкулеза. В таких случаях прибегают к
оценке эффективности терапии ex juvantibus и при возможности — к био-
псии перикарда. Лечение состоит в специфической химиотерапии тремя
препаратами, на фоне которой при упорном сохранении или рецидивирова-
нии экссудата назначают глюкокортикостероиды. Если несмотря на это экс-
судат продолжает накапливаться либо уменьшение размеров сердца сопро-
вождается ростом ЦВД, показана перикардэктомия.
Перикардит при остром инфаркте миокарда. По патологоанатомическим
данным ограниченный фибринозный перикардит отмечается в 1 -4-е сутки
у всех больных с трансмуральным инфарктом, а диффузный - не менее чем
у 20 % больных. Часто, однако, его не диагностируют, так как быстро пре-
ходящий шум трения перикарда не выявляется, болевой синдром расцени-
вается как ангинозный или радикулярный, тахипноэ относят за счет острой
левожелудочковой недостаточности, повышение температуры тела — за счет
резорбционно-некротического синдрома, а изменения на ЭКГ маскируются
признаками острого инфаркта. Возможность этого осложнения необходимо
иметь в виду при выраженной боли, плохо купирующейся наркотическими
671
анальгетиками, а также при интерпретации изменений ЭКГ, которые могут
ошибочно расцениваться как распространение инфаркта. Для его выявления
в первые 5—7 сут болезни рекомендуется часто и тщательно проводить аус-
культацию сердца при разных положениях тела. При эхокардиографии выпот
обычно не определяется. Течение благоприятное со спонтанным выздоровле-
нием. Лишь изредка на фоне лечения антикогулянтами может накапливать-
ся геморрагический экссудат, во избежание чего при выявлении перикарди-
та эти препараты рекомендуется отменять. Специальное лечение в большин-
стве случаев не требуется. При выраженном болевом синдроме эффективны
нестероидные противовоспалительные средства и глюкокортикостероиды,
которые достаточно применять в течение 2—3 сут.
Острый перикардит при постинфарктном синдроме Дресслера. Возникает
остро через 2 нед или несколько месяцев после инфаркта миокарда. При
этом появляется болевой синдром перикардиального или плеврального про-
исхождения, к которому быстро присоединяется лихорадка. Шум трения плев-
ры звучный и довольно стойкий. Характерен небольшой выпот в перикард
серозно-фибринозного или реже — серозно-геморрагического характера. Ди-
агноз основывается на наличии в анамнезе инфаркта миокарда и сочетании
перикардита с лихорадкой, экссудативным плевритом, реже — пульмони-
том. В крови отмечаются неспецифические воспалительные сдвиги. Заболева-
ние необходимо дифференцировать с ТЭВЛА, застойной сердечной недо-
статочностью и рецидивом инфаркта миокарда. Течение обычно доброкаче-
ственное. Тампонада и констриктивный перикардит не характерны. В легких
случаях специальное лечение не требуется, в более тяжелых назначают глю-
кокортикостероиды. Необходимость в перикардиоцентезе, как правило, не
возникает. Противопоказаны антикоагулянты.
Сходную картину имеет постперикардиотамический синдром. Он развива-
ется через 2—3 нед, а иногда через несколько месяцев после кардиохирурги-
ческой операции и связан с реакциями гиперчувствительности замедленно-
го типа в ответ на попадание в полость перикарда крови. Перикардит, кото-
рый является наиболее постоянным проявлением этого синдрома, носит ха-
рактер фибринозного или серозно-геморрагического и может осложняться
тампонадой. Заболевание обычно заканчивается полным выздоровлением через
2-4 нед, реже через несколько месяцев, но может рецидивировать в течение
2 лет. В отличие от этого острый перикардит при травматическом постпери-
кардиотомическом синдроме, связанном с гемиперикардом, часто перехо-
дит в констриктивный. Лечение не требуется или проводится с помощью
нестероидных противовоспалительных средств и глюкокортикостероидов.
При острой ревматической лихорадке (остром ревматизме) перикардит
возникает при высокой активности воспалительного процесса, чаще у де-
тей, и обычно служит одним из проявлений тяжелого панкардита с сердеч-
ной недостаточностью. Перикардит, как правило, фибринозный или сероз-
но-фибринозный с небольшим количеством экссудата, не требующим эва-
куации. Течение заболевания обычно доброкачественное и оно заканчивает-
ся полным клиническим выздоровлением. Тампонада и констриктивный
672
перикардит не развиваются. Диагноз основывается на наличии критериев
острой ревматической лихорадки. Лечение включает глюкокортикостероиды.
При ревматоидном артрите и системной красной волчанке по данным
аутопсии перикардит обнаруживается примерно в 50 % случаев, главным
образом в виде клинически незначимого адгезивного неконстриктивного. В
клинике он диагностируется значительно реже, преимущественно при эхо-
кардиографии, так как часто протекает бессимптомно и доброкачественно.
Перикардит обычно фибринозный или серозно-фибринозный, однако у не-
большой части больных возможно развитие констриктивного процесса. Пе-
рикардит не бывает изолированным проявлением этих заболеваний, что по-
зволяет легко установить его этиологию. У больных, получающих иммуно-
супрессивную терапию, в том числе большие дозы глюкокортикостероидов,
необходимо иметь в виду возможность его вирусного и инфекционного, в
частности, туберкулезного, происхождения. Лечение состоит в повышении
дозы глюкокортикостероидов.
Уремический перикардит встречается у 30—50 % больных с хронической
почечной недостаточностью и у 10 % больных - с острой, особенно часто у
находящихся на хроническом гемодиализе. Механизм его развития не ясен.
Обсуждается роль неизвестного токсического фактора, активации медлен-
ной вирусной инфекции, гепаринотерапии. При нелеченной диализом уре-
мии перикардит обычно фибринозный, тогда как на фоне диализа более чем
у половины больных он серозно-геморрагический или геморрагический. Осо-
бенностями его течения являются лихорадка, снижение повышенного уров-
ня АД. Возникновение перикардита слабо коррелирует с уровнем креатини-
на в сыворотке крови и часто наблюдается при его уменьшении после сеанса
диализа. Достаточно часто развивается тампонада.
В последние годы растет частота развития подострого экссудативно-
констриктивного и даже хронического констриктивного перикардита. Хотя
и не столь заметно, как раньше, возникновение острого перикардита ухуд-
шает прогноз у больных с хронической почечной недостаточностью. Лече-
ние заключается в назначении гемодиализа либо его интенсификации и при-
менении нестероидных противовоспалительных препаратов и глюкокорти-
костероидов. Если, несмотря на это, экссудат продолжает накапливаться, а
также при развитии констрикции необходима перикардэктомия. Антикоагу-
лянты противопоказаны.
При злокачественных опухолях настораживать в отношении перикардита
должно появление признаков поражения сердца — боли в грудной клетке,
одышки, предсердных аритмий, системного венозного застоя. Выпот внача-
ле серозный, но вскоре становится геморрагическим и быстро накапливает-
ся, что представляет опасность в отношении тампонады и требует неодно-
кратного перикардиоцентеза. Изредка развивается подострый экссудативно-
констриктивный перикардит. Диагноз ставят на основании наличия злока-
чественной опухоли (рака легкого, молочной железы, лейкоза, лимфомы и
др.) и выявления в экссудате атипичных клеток, и он подтверждается при
пробной торакотомии с биопсией. Продолжительность жизни больного обычно
673
не превышает 1 года. Вследствие инфильтративного роста опухоли иссечь ее
обычно не удается. Лечение паллиативное и включает химиотерапию (общую
и местно в полость перикарда), лучевую терапию и перикардэктомию.
При микседеме выпот в перикард, даже массивный, часто не дает симп-
томатики и не осложняется тампонадой. Он носит характер серозного и от-
личается высоким содержанием холестерина, что может вызывать вторич-
ный реактивный перикардит. Диагноз основывается на клинических прояв-
лениях гипотиреоза, которые, однако, могут быть стертыми. Поэтому в слу-
чаях значительного выпота неясного генеза следует иметь в виду эту воз-
можность и контролировать уровни ТЗ и Т4 в крови. Заместительная гормо-
нальная терапия, как правило, приводит к полной и стойкой резорбции
выпота. В случаях холестеринового перикардита при эутиреоидном состоянии
обычно требуется перикардэктомия.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Автоматизм 34
Автоматический дефибриллятор-кардиовер-
тер 398,551
Адалат (см. Нифедипин)
Аденозин, влияние на коронарное крово-
обращение 60
Адреналин 55,476,534,536,593
Адреноблокаторы (см. Альфа- и Бета-
адреноблокаторы)
Адренорецепторы 48
Адреностимуляторы (см. Симпатомимети-
ческие амины)
Актин 15-17
Алтеплаза (см. Тканевый активатор плаз-
миногена)
Альдактон (см. Спиронолактон)
Альдомет (см. Альфа-метилдофа)
Альдостерона антагонисты 438,453,521, 619
Альдостеронизм вторичный 466,475
— первичный 474—476
— артериальная гипертензия 474-476
Альфа-адреноблокаторы, клиническая фар-
макология 445
— при артериальной гипертензии 434,
445,452-455,480
— сердечной недостаточности 382,538,
543,549
Альфа-адреностимуляторы периферические
(см. Симпатомиметические амины)
- центральные 434,437,443-444,452
Альфа-метилдофа 437,443—444,450,453—
456,458,461,462,468,472,482
Амилорид 520,522,552
- при артериальной гипертензии 436,438
Амиодарон 379,534
— для профилактики внезапной смерти 398
-------после инфаркта миокарда 394
-------при хронической сердечной недо-
статочности 550—551
Амринон 540,553
Анамнез кардиологического больного 64,
65
Анаприлин (см. Пропранолол)
Анасарка 506
Ангинозная боль (см. Стенокардия)
Ангиография почечных артерий при их сте-
нозе 467
Ангиокардиография 162—163 (см. также
Вентрикулография, Катетеризация сердца)
- осложнения 165
Ангиопластика (см. Чрескожная транслю-
минальная ангиопластика)
- лазерная 169
Ангиопульмонография при легочной ги-
пертензии 602
— тромбоэмболии легочной артерии 632
Ангиотензин II 55,523
Ангиотензинпревращающий фермент 55
Аневризма грудной части аорты расслаи-
вающая 424
- левого желудочка 363-364,386
— синуса Вальсальвы, разрыв 164,187,253
Анистреплаза - см. АПСАК
Антагонисты кальция (см. Блокаторы каль-
циевых каналов)
Антиагреганты (см. Антитромбоцитарные
препараты)
Антиадренергические препараты перифери-
ческого действия 435,445,452 (см. также
Резерпин, Гуанетидин)
Антиангинальные препараты (см. Нитраты,
Бета-адреноблокаторы, Блокаторы каль-
циевых каналов)
Антидиуретический гормон, роль при сер-
дечной недостаточности 488,523
Антикоагулянты (см. Гепарин)
- непрямого действия 552,606,640,641
---у перенесших инфаркт миокарда 392
Антитромбоцитарные препараты (см. также
Ацетилсалициловая кислота) при легоч-
ной гипертензии и тромбоэмболии ле-
гочной артерии 606
---остром инфаркте миокарда 369
---стабильной стенокардии 326
Аортальная недостаточность (см. Недоста-
точность аортального клапана)
Аортальный клапан, анатомия в норме 11
— визуализация с помощью эхокардио-
графии 139
— протезирование при комбинированном
аортальном пороке 255
----- недостаточности аортального кла-
пана 254
-----стенозе устья аорты 242—243
675
Аортальный клапан, протезирование при
стенозе устья аорты 242—243
— порок (см. Комбинированный аорталь-
ный порок, Недостаточность аортального
клапана, Стеноз устья аорты)
— стеноз (см. Стеноз устья аорты)
Аортокоронарное шунтирование 328
— при остром инфаркте миокарда 375
-------после инфаркта миокарда 395
— при стенокардии 328-330
Аортография 164
- при недостаточности аортального кла-
пана 251-252
Апекскардиография 148
Апопротеины 267
Апрессин (см. Гидралазин)
АПСАК 372-373
Аритмии 583,618
— при интоксикации сердечными глико-
зидами 532
------- лечение 533
— остром инфаркте миокарда 355-357
-------лечение 378—379,393—394
— хронической сердечной недостаточно-
сти 512-514,550,562
-------лечение 550-551
Артериальная гипертензия системная 400-
405
-----гипертрофия левого желудочка 411 —
412
-----злокачественная 403,410,411,414,
415,423-424,479
-----лечение 456,457,460—462
-----изолированная систолическая 403,
405,477,481,482
-----классификация 402—404
----- критерии 402
-----пограничная 402,405,419,420
-----симптоматическая (вторичная) 403,
464,465
-----виды 403,404
-----лекарственная 483
-----при сердечной недостаточности 482
-----реноваскулярная 465—469
-----ренопаренхиматозная 469-472
-----эндокринные (см. Альдостеронизм,
Иценко-Кушинга болезнь и синдром,
Феохромоцитома, Гипертиреоз)
-----эпидемиология 404,405
-----эссенциальная 403,405-464
-----гемодинамические варианты 418
-----диагностика 413—415
-----диспансерное наблюдение
-----дифференциальная диагностика
(см. Симптоматическая артериальная ги-
пертензия)
-----доброкачественная 403,415
-----классификация 415—418
-----клиника 411-413
-----кризы (см. Гипертензивные кризы)
-----лечение 425—463
-----осложнения 420-425
-----патологическая анатомия 409—411
-----поражение почек 410,413—415
-----сердца 409-411,413-415
-----сосудов 409,410,421 (см. также
Ретинопатия гипертоническая)
-----центральной нервной системы 413
-----прогноз 463
-----профилактика 464
-----распространенность 405
-----течение 425,426
-----этиология и патогенез 405—409
Артериальная гипотензия 571 (см. также
Шок)
— при остром инфаркте миокарда
342,343,359,384,385
-----сердечной недостаточности 490,497,
499
Артериальное давление системное 57
-----в норме 402
-----измерение 91,412,413
----- пульсовое 57
-----регуляция 57
-----среднее гемодинамическое 57
Артериальный пульс альтернирующий 72,
497,499,505,507
— bisferiens 72
— большой 71
— дикротический 72
— differens 72
— малый 71
— методика исследования 69
— мягкий 71
— парадоксальный 72,657
— при недостаточности аортального кла-
пана 249
-----стенозе устья аорты 236
Артерии 19
Артериолосклероз, при артериальной ги-
пертензии 410
Артериолы 19
Артериолярные вазодилататоры 542,543
Артериосклероз 261
Арфонад (см. Триметафана кадсилат)
676
Аспартатаминотрансфераза, при остром
инфаркте миокарда 350
Аспирин (см. Ацетилсалициловая кислота)
Астма сердечная 496,498,501,502
— лечение (см. Отек легких)
Асцит 93,505,507,658,664
Атенолол 323,324,376,436,439
Атеросклероз 261—292
- клиника и диагностика 281 (см. также
Гиперлипопротеинемия)
- лечение 281-292 (см. также Гиперлипо-
протеинемия)
— патогенез 263—265
- патологическая анатомия 262,263
- профилактика 292
— регрессия 264—265
— роль нарушений липидного обмена 266—
280
— факторы риска 265,266,280
— эпидемиология 261
Атерэктомия, из коронарных артерий 169
Атриовентрикулярная блокада, при остром
инфаркте миокарда 357
— лечение 380
- коммуникация 175
— проводимость 35,110,111
Атриовентрикулярное соединение (узел)
11,12
Атриовентрикулярные клапаны 10,11 (см.
также Митральный клапан и Трикус-
пидальный клапан)
Аускультация сердца 71,72
— тоны (см. Сердечные тоны)
— шумы (см. Сердечные шумы)
Ацебутолол 323,324,436
Ацетазоламид 518,519
Ацетилсалициловая кислота при нестабиль-
ной стенокардии 337
---остром инфаркте миокарда 369
--- стабильной стенокардии 326
— у перенесших инфаркт миокарда 392
Баллончиковая ангиопластика (см. Чрескож-
ная транслюминальная ангиопластика)
— вальвулопластика (см. Вальвулопластика)
Барорецепторный рефлекс 50,54
Бахмана пучок межпредсердный 11
— тракт межузловой 11
Бейнбриджа рефлекс 50
Беременность, артериальная гипертензия
456
— сердечная недостаточность 490
Бета-адреноблокаторы, клиническая фар-
макология 322—324,439
— при артериальной гипертензии 432,433,
436,439,440,449-456,462,468,472,480,482
— нестабильной стенокардии 336
— остром инфаркте миокарда 375,376
-----для вторичной профилактики 392
— стабильной стенокардии 324
— хронической сердечной недостаточно-
сти 540,541,554
Бета-адреностимуляторы, при хронической
сердечной недостаточности 514
Бецольда—Яриша рефлекс 340,342,356,385,
579
Биопсия легкого, при легочной гипертен-
зии 602
- эндомиокардиальная 167,560
Блокады сердца при гликозидной инток-
сикации 532,533
-----остром инфаркте миокарда 357,380
Блокаторы кальциевых каналов, клиничес-
кая фармакология 324-326
----при артериальной гипертензии 433,
434,436,437,441-443,449-453,456,462,
472,482
-----нестабильной стенокардии 336,337
-----остром инфаркте миокарда 377
-----стабильной стенокардии 325,326
-----хронической сердечной недостаточ-
ности 543,549,554
-----хроническом легочном сердце 620
Боталло проток (см. Открытый артериаль-
ный проток)
Боудича лестница 43
Брадикардия и брадиаритмии, при остром
инфаркте миокарда 356,357
----лечение 379,380
Буметанид 519,520
Вальвулопластика 169
- при митральном стенозе 215
— стенозе устья аорты 243
-----легочной артерии 194
Вальсальвы проба, влияние на данные аус-
культации сердца 86,227
- синус 11,22
Вариантная стенокардия (см. Стенокардия
Принцметала)
Векторкардиография 125
Велоэргометрия 308-310 (см. также Нагру-
зочные тесты)
Венкебаха тракт 11
Венный пульс, в норме 68
— положительный 69,506,600
— при патологии 68,69
677
Венозное давление центральное 92
---- в норме 92
---- измерение 92
----при шоке 563,580,581
Венозные вазодилататоры, при сердечной
недостаточности 542,543,545-547
Вентрикулография 163,164 (см. также Ан-
гиокардиография)
— при ишемической болезни сердца 314,
353
Вены 20
Верапамил 325,326,533
— после инфаркта миокарда 394,436,442,
549,554
Вернера синдром 65
Верошпирон (см. Спиронолактон)
Верхушечнвй толчок 73
Вильсона однополюсные грудные отведе-
ния 104,105
Внезапная смерть 395
— коронарная 395-398
— сердечная 396,618
----при хронической сердечной недоста-
точности 512,550
Возбудимость 33
Волна возбуждения 30
Вольфа—Паркинсона-Уайта синдром 111
Врожденные пороки сердца 170
----“белые” 173
----классификация 173
----патогенез и механизмы компенсации
171,172
----“синие” 173,198
----эпидемиология 170
---- этиология 170,171
Галопа ритм 81,82
— правожелудочковый 82,505,507,600
— при сердечной недостаточности 497,499,
500
Ганглиоблокаторы 605
— при артериальной гипертензии 444,445,
462
— сердечной недостаточности 549,550,558
Гемодинамика, инвазивный мониторинг у
больных острым инфарктом миокарда
359
— при физической нагрузке 60—62
Гемфиброзил 286,290,515
Гепарин, клиническая фармакология 367,
368
- при нестабильной стенокардии 337
— остром инфаркте миокарда 367—369
— тромболитической терапии 374
— тромбоэмболии легочной артерии 639-
641
— хронической сердечной недостаточно-
сти 552
— шоке 592
Гепатоюгулярный рефлюкс 68,258,505,506
Гидралазин 382,383,437,447,448,450,453-
456,458,461,462,472,542,547,605,620,644
Гидроксибутиратдегидрогеназа, при остром
инфаркте миокарда 350—352
Гидроперикард 505,507,650,651
Гидроторакс 93,500,505,507
Гидрохлортиазид 520,521
Гиперкалиемия, ЭКГ-признаки 120
Гиперкальциемия 524
— ЭКГ-признаки 120
Гиперлипидемия 524
— семейная комбинированная 278,279
--- лечение 291
Гиперлипопротеинемия 271-291
— вторичная 274—276,280
- выявление 277
— диагностика 277
— классификация 271,272
- лечение 282-291
- первичная 273,276 (см. также Гиперхо-
лестеринемия полигонная, Гиперхолес-
теринемия семейная, Гиперлипидемия
семейная комбинированная, Дисбетали-
попротеинемия семейная)
— профилактика 291
— типы 271,272
Гипертензивная (гипертоническая) энце-
фалопатия 421,422,424
Гипертензивное (гипертоническое) серд-
це 412
Гипертензивный (гипертонический) криз
421
— виды 422,423
— клиника и диагностика 421—422
— лечение 444—445,457—463
— осложнения 422
— при феохромоцитоме 462,476—477,479
Гипертиреоз, артериальная гипертензия 482
- сердечная недостаточность 490
Гипертоническая болезнь (см. Артериальная
гипертензия системная эссенциальная)
Гипертрофическая кардиомиопатия, об-
структивная 232-234,239,240,583
Гипертрофия миокарда желудочков и сер-
дечная недостаточность 172,488
678
----при артериальной гипертензии 411—
412
----врожденных пороках сердца 171—172
----ЭКГ-диагностика (см. Левый желу-
дочек, Правый желудочек)
Гиперхолестеринемия поли генная (“обыч-
ная”) 278
— лечение 291
- семейная 278
— лечение 291
Гипокалиемия 466,475
— при лечении салуретиками 431,438,523
— ЭКГ-признаки 120
Гипокальциемия, ЭКГ-признаки 120
Гиполипидемические препараты 286,289-
290
Гипомагниемия 523
Гипонатриемия
— при лечении мочегонными препаратами
431,498
— сердечной недостаточности 522—523
Гипотензивные препараты (см. Мочегонные
препараты, Бета-адреноблокаторы, Ин-
гибиторы АПФ, Блокаторы кальциевых
каналов, Альфа-адреностимуляторы цен-
тральные, Альфа-адреноблокаторы, Ан-
тиадренергические препараты перифери-
ческого действия, Периферические ва-
зодилататоры, Миотропные препараты)
Гипотиазид 520,521
— при артериальной гипертензии 436,438
Гиса пучок 12
— электрограмма 124
Гликозиды сердечные 518,525-534
— клиническая фармакология 525-531,
533,534
— при острой сердечной недостаточности
527,556,558,590
----хронической сердечной недостаточ-
ности 527-531,533,620
— токсичность 528,531—533
ГМГ-Ко А-редуктаза 270
Грэма Стилла шум 88,177,208,613
Грудная жаба (см. Стенокардия)
Гуанетидин 437,446,447,451,454,456
Да Коста синдром 71
Двойное произведение 58
Дельта-волна 111
Деполяризация 29,30
— спонтанная диастолическая 34
Дефект межжелудочковой перегородки
врожденный 181-184
-----диагностика 182—183
-----дифференциальная диагностика 183
-----клиника 181,182
-----лечение 183-184,
-----хирургическое 183,184
-----механизмы нарушения гемодина-
мики 181
-----течение и осложнения 183
-----приобретенный, при остром инфаркте
миокарда (см. Разрыв миокарда)
- межпредсердной перегородки 174-180
-----диагностика 177-178,179
-----дифференциальная диагностика 178—
179
-----классификация 174-175
----- клиника 176—177
-----лечение 179-180
-----хирургическое 179—180
-----механизмы нарушения гемодинами-
ки 175—176
----- прогноз 180
-----течение и осложнения 179
Джеймса пучок 12
Диакарб 519
Диазоксид 448,458,460,462,620
Диастазис 38
Диастолическая податливость желудочка
42,501
-----при диастолической сердечной недо-
статочности 493
Дибазол 461
Дигитализация 529—531
— изменения ЭКГ 112,114,530
- методы и критерии 530
Дигитоксин 529-531
Дигоксин 528-531
Дизопирамид 551
Дилтиазем 325,326,377,436,442,554,620
— после инфаркта миокарда 394
Дипиридамол 316,606
- проба 312
Дисбеталипопротеинемия семейная 279
Диуретики (см. Мочегонные препараты)
Дифенин (см. Фенитоин)
Диэнцефальный синдром, артериальная
гипертензия 479
Добавочные проводящие пути сердца 12
Добутамин 534-536,538
— при острой сердечной недостаточности
383,559
— хронической сердечной недостаточно-
сти 538,539,553
679
Добутамин, проба 314
Добутрекс (см. Добутамин)
Допамин 518,534-538
— при острой сердечной недостаточности
383,537
— хронической сердечной недостаточно-
сти 524,525,537,553
— шоке 537,592
Допегит (см. Альфа-метилдофа)
Допплерэхокардиография 138
— определение показателей гемодинамики
143
— показания 133
Допплера эффект 138
Дофамин (см. Допамин)
Дресслера синдром 364,365,386,644,672
Дрожание в прекардиальной области 74
Дыхательная аритмия 51,71
Дюрозье шум 250,251
Желудочки (см. также Левый желудочек.
Правый желудочек)
- анатомия 8-9
- диастола 35
- жесткость (см. Диастолическая податли-
вость)
- наполнение 38
— систола 35
Изадрин (см. Изопротеренол)
Изгнание 37
Изобарин (см. Гуанетидин)
Изоволюмическое (изометрическое) рас-
слабление 38
— сокращение 36
Изометрическая нагрузка, влияние на ге-
модинамику 62
-----сердечные шумы и тоны 86,227
Изопротеренол 534—536
— при сердечной недостаточности 537
- проба 312
Изоптин (см. Верапамил)
Изосорбида динитрат 322,546
- мононитрат 322
Импульс возбуждения 29,34
Инвазивное обследование сердца (см. Ангио-
кардиография, Катетеризация сердца)
Ингибиторы ангиотензинпреврашающего
фермента 441
---после инфаркта миокарда 395
---при артериальной гипертензии 433,
436,440,441,450-456,463,467,468,472
-----остром инфаркте миокарда 377,378
----------осложненном острой левоже-
лудочковой недостаточностью 382,383
---хронической сердечной недостаточ-
ности 524,525,543,547-549,553,554,620
- ГМГ-КоА-редуктазы 289
— карбангидразы 519
— фосфодиэстеразы 514,539,540
Инотропные агенты при сердечной недо-
статочности (см. также Бета-адрености-
муляторы, Ингибиторы фосфодиэстера-
зы, Гликозиды сердечные)
Интерстициальный отек легких (см. Астма
сердечная)
Инфаркт легкого 628,635
— миокарда 338
— варианты 354,355
— диагностика 343-353,582
--- лабораторная 350-352
---радионуклидная 352,353
---электрокардиографическая 343-350
---дифференциальная 353,635,648
— изменения гемодинамики 342,359,360
— интрамуральный 344,346
— клиника 341-343
— крупноочаговый (с зубцом Q) 338
---особенности патогенеза 338
— лечение 365
---осложнений 378—386
---хирургическое 374-375,386
— мелкоочаговый (без зубца Q) 338,339,
345,346,355
— организация медицинской помощи
365,366
— осложнения 355—365,644 (см. также от-
дельные осложнения)
— патологическая анатомия 339—341
— правого желудочка 348,355
— прогноз 390—391
— профилактика вторичная 391—395
— распространение 361,362,385
— реабилитация 386—390
— рецидив 361,362,385
— субэндокардиальный 344
— трансмуральный 344
— эпидемиология 338
Ионные каналы мембраны 31,32
ИсмелиН (см. Гуанетидин)
Исрадипин 437
Иценко—Кушинга болезнь и синдром 472,
474
------артериальная гипертензия 64,472—
474
680
Ишемическая болезнь сердца 293 (см. также
Ишемия миокарда и отдельные формы
ИБС)
---классификация 301
---патогенез 294,300
---факторы риска 265
---эпидемиология 293,294
--- этиология 293
Ишемия миокарда 296 (см. также Стено-
кардия)
— безболевая (немая) 302,307
— диагностика 298,305-308
— патофизиология 296-300
— субэндокардиальная 306
Калиевые каналы 31
Калиево-натриевый насос 28,29
Кальциевые каналы 31
Кальциевый насос 28
Кальций, роль в патогенезе эссенциаль-
ной артериальной гипертензии 409
---сокращении и расслаблении 27,28
Кальциноз митрального кольца 219,230
- устья аорты 234
Капилляры 20
Капотен (см. Каптоприл)
Каптоприл при артериальной гипертензии
436,441,459
— остром инфаркте миокарда 378,383
— хронической сердечной недостаточно-
сти 548
Кардиогенный шок, при остром инфаркте
миокарда 360
— лечение 384,385,589—592,593
Кардиосклероз атеросклеротический 342,
399
- постинфарктный 342,399
Кардиоторакальный индекс 126
Карциноидный синдром 255,257-258,479,
599
Катапрессан (см. Клонидин)
Катетеризация сердца 157-160,165-166
— левых отделов 158
- осложнения 161,165
— правых отделов 158,160
Квинке пульс 249
Кента пучок 12
Керли линии 131,500,502,600
Киллипа—Кимбалла классификация 358
Кислород, артериовенозная разница 39,489
- насыщение гемоглобина, значение 161,
162
- поглощение в покое 39
— при физической нагрузке 62,509
Китаева рефлекс 205,503
Клапаны сердца (см. отдельные клапаны)
Клонидин 437,443-444,451,453,454,456,
458,459,461-463,482
— проба 478
Клофелин (см. Клонидин)
Коарктация аорты 188—190.
— артериальная гипертензия 480-481
— диагностика 189—190
— клиника 188-189
— лечение, хирургическое 190
— механизмы нарушения гемодинамики
188
— прогноз 190
— течение и осложнения 190
Коллапс (см. Шок)
Комбинированный аортальный порок 255—
256
- митральный порок 230-234
Комиссуротомия, митральная 214—215
Компьютерная томография в диагностике
болезней сердечно-сосудистой системы
154-155
Конна синдром (см. Альдостеронизм пер-
вичный)
Контрацептивы пероральные, влияние на
сердечно-сосудистые заболевания 483
Контрпульсация, внутриаортальная баллон-
чиковая 384,385,555,560,591
Коргликон 529
Корданум (см. Талинолол)
Кордарон (см. Амиодарон)
Коринфар (см. Нифедипин)
Коронарная болезнь сердца 293 (см. Ише-
мическая болезнь сердца)
— недостаточность 293
— при стенозе устья аорты 235
Коронарное кровообращение 22—24 (см.
также Коронарные артерии)
— в норме 58
— распределение 22—23
— регуляция 58-60
Коронарные артерии (см. также Коронар-
ное кровообращение)
— анастомозы 23-24
— анатомия 22-23
— вены 23
Коронарный резерв 294
— синус 23
Коронарография 164 (см. также Ангиокар-
диография, Катетеризация сердца)
681
Коронарография при ишемической болез-
ни сердца 314—315
Коронароспазм 295 (см. также Стенокар-
дия Принцметала)
— механизмы 295
— диагностика 166
Корригана пульс 249
Креатинфосфокиназа, в диагностике ост-
рого инфаркта миокарда 350
— изоферменты 350—351
Кровохарканье, при левосторонней сердеч-
ной недостаточности 497,498,511,512
— митральном стенозе 206
— тромбоэмболии легочной артерии 624,
627
Ксангелазмы 67
Ксантомы 67,276,279
Кумбса шум 89
Курантил (см. Дипиридамол)
Куссмауля признак 69,664
Лебаталол 434,460,462,480
Лазикс (см. Фуросемид)
Лактатдегидрогеназа при остром инфаркте
миокарда 350,351—352
— тромбоэмболии ветвей легочной арте-
рии 634
Ландольфи признак 249
Ланатозид 529,530
Лапласа уравнение 8,41
Левая коронарная артерия 22
Леводопа 534,539
Левое предсердие, гипертрофия, ЭГК-при-
знаки НО
— давление 39
Левожелудочковая недостаточность 491 (см.
также Недостаточность левых отделов
сердца)
— при недостаточности аортального кла-
пана 247,248,253
----остром инфаркте миокарда 357—359
--------классификация 358
--------лечение 381—384
----стенозе устья аорты 235,236,241
— рентгенологическое исследование 500—
501
— эхокардиография 501
Левопредсердная нед >статочность 491,495
Левый желудочек, гипертрофия и дилата-
ция при левожелудочковой недостаточ-
ности 499
--------артериальной гипертензии 411 —
512
-------обратное развитие под влиянием
лечения 440,442
-------ЭКГ-признаки 118
— движение стенок 163
— методы оценки и показатели функции
141-143,164
Легочная артерия, “заклинивающее” дав-
ление 160,161
— мониторинг давления у постели боль-
ного 160-161
— гипертензия 595—606,607—608
— артериальная (прекапиллярная) 597-
599
— венозная (посткапиллярная) 597-598
— виды 595,597,636
— диагностика 600—602
----дифференциальная 602—604
— клиника 599-600
— лечение 605—606
— патогенез 597-599
— патологическая анатомия 599
— первичная 598,604-606,610,616,636
— прогноз 606
— профилактика 606
— течение и осложнения 605
— этиология 595-596
Легочное кровообращение 20,21
- сердце 606
— варианты течения 607
— острое и подострое 608,624,626
— хроническое 608—621,636
----варианты течения 617-618
----диагностика 613-615,617
----дифференциальная 615—616
----клиника 612—613
----лечение 618—620
----осложнения 620,718
----патогенез 609-611
----патологическая анатомия 611-612
---- прогноз 620—621
----профилактика 621
----распространенность 608-609
----сердечная недостаточность 490, 611
---- этиология 609-610
Легочной артерии клапан, анатомия в
норме 11
----визуализация с помощью эхокардио-
графии 140
Лецитинхолестеринацилтрансфераза 271
Лидокаин 369,378,379,533
Лизиноприл 378,436,441,548
Липидная дуга роговицы 277
682
Липопротеинлипаза 266,268
Липопротеины 267
- высокой плотности 268,270-271
- низкой плотности 268,269
- очень низкой плотности 268,269
— промежуточной плотности 268,269
Ловастатин 286
Льюиса отведение ЭКГ 108
Лютембаше синдром 175,232
Магния сульфат 379,456,461
Маннитол 519,592
Марфана синдром 66,245
Махейма пучок 13
Межкоронарного обкрадывания синдром
294
Мезаортит 245
Мезатон 560
Мексилетин 551
Мекситил 379
Мерцательная аритмия, гликозиды 527-
528
— изменения пульса 71
— лечение при остром инфаркте миокар-
да 379
— при митральном стенозе 211
Метопролол, при артериальной гипертен-
зии 436,456
— остром инфаркте миокарда 376
-------у перенесших инфаркт миокарда
392
— стенокардии 324
— хронической сердечной недостаточно-
сти 541
Механокардиография 94,146
Миксома сердца 210-211,491,565,584
Милринон 540
Миноксидил 437,448,542
Минутный объем сердца 39
---как критерий сердечной недостаточ-
ности 484
---при физической нагрузке 61,62
---факторы, его определяющие 40,41
Миоглобин, при остром инфаркте миокарда
350
Миозин 15-16
— при сердечном сокращении 16—17
Миокард, анатомия функциональная 13—
18
- метаболизм 24-26
— механизм сокращения и расслабления
16,26-28
- потребление кислорода 58
— потребность в кислороде 57—58,536
- электрофизиологические свойства 33
----при сердечной недостаточности 513
Миокардиальная недостаточность 484,499,
507
Миокардит 648-649
Митрализация аортального протока 250
Митральная недостаточность (см. Недоста-
точность митрального клапана)
Митрально-аортальный порок с преобла-
данием недостаточности 260—261
Митральный клапан, анатомия в норме 10
— визуализация с помощью эхокардио-
графии 139
— миксоматозная дегенерация 219,226
— протезирование, при комбинирован-
ном митральном пороке 233
----митральном стенозе 215—216
----недостаточности митрального кла-
пана 255
— порок (см. Комбинированный митраль-
ный порок. Митральный стеноз. Недо-
статочность митрального клапана)
— стеноз 204—217
— в сочетании с аортальным стенозом
259-260
------- недостаточностью аортального
клапана 260
— диагностика 208—210,211
----дифференциальная 210-211
— классификация 212-213
— клиника 206-208
---- мелодия сердца 207-208
— лечение 213
---- хирургическое 214
----отдаленные результаты 216-217
— механизмы нарушения гемодинамики
204-205
— осложнения 211-212
— патологическая анатомия 204
— прогноз 213,216
— течение 212—213
— эпидемиология 204
— этиология 204
Молуретик (см. Амилорид)
Молсидомин 542,543,547
Морфин 366,555,591
Мочегонные препараты (см.также Тиази-
довые диуретики)
— калийсберегающие 438-439
----при артериальной гипертензии 438—
439,450,456,472
683
Мочегонные препараты при сердечной не-
достаточности 520,524,552
— клиническая фармакология 517-522
— неблагоприятные эффекты и их преду-
преждение 513,522-524
— осмотические 519
— петлевые 438,518,519-520 (см. также
Фуросемид)
----при артериальной гипертензии 438
----отеке легких 556-557
----хронической сердечной недостаточ-
ности 520,524,552
Мышца сердца (см. Миокард)
Мюллера признак 249
Мюссе признак 248
Нагрузочные тесты, в диагностике ИБС
308-313
— клиническое значение 310—312
— критерии оценки 310
— показания и противопоказания 309
— с физической нагрузкой 308,309-310
(см. также Велоэргометрия)
-------после инфаркта миокарда 388
— фармакологические 309,312 (см. также
Дипиридамоловая проба, Эргометрино-
вая проба)
Надолол 323,324,426,439
Наполнение желудочков, быстрое 38
— медленное 38
Натриевые каналы клеток миокарда 30,31
Натрий, задержка при сердечной недоста-
точности 485,487,488,490,491
— роль в этиологии и патогенезе эссенци-
альной артериальной гипертензии 407,409
Натриево-кальциевый обменный механизм
28
Натрия нитропруссид 377,382,448,456,457,
458,460,462,480,543,545-546,558,570,571
Неба отведения ЭКГ 107
Недостаточность аортального клапана 244—
254
----диагностика 251—252
----дифференциальная 252-253
----клиника 247-251
---- мелодия сердца 249—250
----лечение 253-254
---- хирургическое 254
----механизмы нарушения гемодинамики
246-247
----осложнения 253
----прогноз 254
----течение острой недостаточности, осо-
бенности 253,283
---- эпидемиология 244
----этиология 244,245
Недостаточность клапана легочной артерии
252,259,600
— кровообращения 483
— классификация 509—510
- левых отделов сердца 491,495-503 (см.
также Левожелудочковая недостаточ-
ность, Астма сердечная, Отек легких)
----диагностика 500—501
----клиника 497—500
----патогенез 495—496
---- этиология 495
- митрального клапана 217-225
---- диагностика 222
----дифференциальная 222-223
----клиника 220-222
----лечение 224-225
---- хирургическое 225
----механизмы нарушения гемодинамики
219-220
----осложнения 224,564
---- острая 583
----относительная 217,223
----при сердечной недостаточности 497,
500
----патологическая анатомия 218-219
----прогноз 225
---- течение 224
----эпидемиология 217
---- этиология 217—218
— правых отделов сердца 491,503-508 (см.
также Правожелудочковая недостаточ-
ность)
----диагностика 507-508
----клиника 505—507
----патогенез 503-505
---- этиология 503
— трехстворчатого клапана 257—258
----относительная 258,505,507,600
Незаращсние артериального протока (см.
Открытый артериальный проток)
Нейролептаналгезия 366
Низолдипин 549
Никардипин 325,437,442,549
Никотиновая кислота 286,289
Никтурия, при сердечной недостаточнос-
ти 497,498
Нитраты (см. также Нитроглицерин)
- внутрь 322,546
684
- механизм действия 319,320
- накожно 321
- побочные эффекты 320
- при нестабильной стенокардии 336
— остром инфаркте миокарда 376
— стабильной стенокардии 320,321,322
— хронической сердечной недостаточно-
сти 542,543,546,553
- толерантность 322,546
Нитроглицерин, внутривенно 376,545,556-
557
- для купирования приступа стенокардии
320-321
— накожно 321,546
— под язык 321,556-557
- при нестабильной стенокардии 336
— остром инфаркте миокарда 367,376,
381,545
— сердечной недостаточности и шоке 542,
543,545-546,556-557,590,591
— стабильной стенокардии 320-321
— толерантность 322
Нитросорбид (см. Изосорбида динитрат)
Нифедипин 605
- действие 325-326
— при артериальной гипертензии 437,442,
459,463
— стабильной стенокардии 325-326
— хронической сердечной недостаточно-
сти и легочном сердце 549,620
Ножки пучка Гиса 12
Норадреналин 55,476,534,535,536
Неба отведения ЭКГ 107
Обзидан (см. Пропранолол)
Овальное окно 10,616
Оксигенотерапия 515,556-557,587,591,606,
619
Окспренолол 323,436
Ортопноэ 206,497,498,499
Осмотр кардиологического больного 65-
69
Отек легких, альвеолярный 496,498,502-
503
— интерстициальный 496,498
— лечение 555-559
— причины 496—497
Открытый артериальный проток 21,184-
188
---диагностика 186—187
-----дифференциальная 187
---клиника 185-186
--- лечение, хирургическое 187—188
----механизмы нарушения гемодинамики
185
----течение и осложнения 187
Пальпация прекардиальной области 73—74
Пенистые клетки 264,270
Пентада Фалло 198
Пентамин 382,444,459,460-461,549
Перикард 18
Перикард-тон 665
Перикардиоцентез 653-654,655,659
Перикардит 507,642-674
- классификация 643,646
— констриктивный 661-669
— диагностика 665-666,668
----дифференциальная 666-668
— клиника 663—665
— лечение 669
— механизмы нарушения гемодинамики
662-663
— патологическая анатомия 662
— прогноз 669
— течение и осложнения 564,565,668-669
— частота 661
— этиология 661-662
----острый фибринозный (сухой) 646-
650
----диагностика и дифференциальная
диагностика 647-649
---- клиника 646-647
---- лечение 650
----патологическая анатомия 646
---- прогноз 650
----течение 649-650
- отдельные варианты, вирусный 670
----гнойный 670-671
----острый идиопатический 670
----постперикардиотомический 672
----при микседеме 674
---- опухолях 673-674
----остром инфаркте миокарда 671-672
---- ревматических заболеваниях 672-
673
----туберкулезный 671
---- уремический 673
- частота 642-643
- экссудативный острый 650-656
----диагностика и дифференциальная
диагностика 652-655
----клиника 651-652
---- лечение 655
----нарушения гемодинамики 651
----патологическая анатомия и класси-
фикация 650-651
685
Перикардит экссудативный острый, про-
гноз 655-656
— хронический 660-661
— этиология 644—645
Периферические вазодилататоры (см. так-
же Артериолярные и Венозные)
— миотропные 435,447,513,514
— при легочной гипертензии и легочном
сердце 605,619-620
----стенокардии 321
----сердечной недостаточности 541,543,
550
----шоке 590-591
Периферическое кровообращение, регуля-
ция 52-56
Перкуссия области сердца 74-75
Персантин (см. Дипиридамол)
Пика псевдоцирроз 664
Пиквика синдром 65,595,610,617-618
Пиндолол 323,324,436,439,456
Пирбутерол 534,536,539
Поздние потенциалы желудочков 123,396-
397
----после инфаркта миокарда 391
----при хронической сердечной недоста-
точности 512
Позитронная эмиссионная томография 156
Показатели внутрисердечной гемодинами-
ки, в норме 39-40
Полулунные клапаны 11 (см. также Аор-
тальный, Легочной артерии клапаны)
Порог возбуждения (пороговый потенциал)
29-30
Постинфарктный синдром (см. Дресслера
синдром)
Постнагрузка 41,44
Потенциал действия миокарда 29—31
----изменение при ишемии 300
- покоя миокарда 28-29
----изменение при ишемии 300
Почки и почечный кровоток, при арте-
риальной гипертензии 406-407,410,412,
414,415,424
----------злокачественной 423,424
-------стенозе почечной артерии 465,
466-467
-------шоке 568-569,584
Правая коронарная артерия 22
Правое предсердие, гипертрофия, ЭКГ-
признаки НО
— давление 39
Правожелудочковая недостаточность 49 (см.
также Недостаточность правых отделов
сердца)
— дифференциальная диагностика 616
— при легочной гипертензии и легочном
сердце 600,605,608,611,612
----стенозе устья легочной артерии 191,
193
Правый желудочек, гипертрофия, ЭКГ-
признаки 119
— давление 39
Празозин 437,445,451,454,455,472,480,547,
549,605,610
Преднагрузка 40,41
Предсердия (см. также Левое предсердие,
Правое предсердие)
- анатомия 9-10
— систола 38
Предсердный натрийуретический фактор
51-52,474,489,505
----роль в патогенезе эссенциальной ар-
териальной гипертензии 409
Преждевременного возбуждения желудоч-
ков синдром (см. Вольфа—Паркинсона-
Уайта синдром)
Преналтерол 534,535,536,539
Приобретенные пороки сердца, сложные
259 (см. также Митрально-аортальный
порок, Митральный стеноз в сочетании)
---- хирургическое лечение 261
---- частота 203
Пробукол 287,290
Проведение возбуждения, скорость 35
Проводимость 34-35
Пролапс митрального клапана 219,226-228
Пропранолол при аритмиях 533
— артериальной гипертензии 436, 456,480
— остром инфаркте миокарда 376
— стенокардии 324
- проба 227
- у перенесших инфаркт миокарда 392
Простагландин 56 (см. также Простацик-
лин, Тромбоксан)
Простациклин 19,56,60 -
— роль в коронароспазме 295
Пульсация, в прекардиальной области 69
----нормальная (см. Верхушечный
толчок)
----патологическая 73—74
— сосудов шеи 67-69
Пуркинье волокна 12,13
Радионуклидная вентрикулография 151
Разрыв сердца при остром инфаркте мио-
686
карда, внутренний, межжелудочковой
перегородки 360,385,564
-------наружный (гемотампонада) 360-
361,579-580,645
— сухожильной хорды митрального кла-
пана 229-230
Рамиприл 436,441
Ранней реполяризации желудочков синд-
ром 114,649
Расслабление мышцы сердца 27—28
-----изоволюмическое 38
Расслоение аорты 583,645
Раувольфии алкалоиды 446
Рауседил (см. Резерпин)
Регитин (см. Фентоламин)
Резерпин 437,446,453,454,456,459,461,462
Ремоделирование левого желудочка при
инфаркте миокарда 362—363
-------предупреждение с помощью ме-
дикаментозной терапии 377
Ренин 55
- при реноваскулярной артериальной ги-
пертензии 419
— эссенциальной артериальной гипертен-
зии 419
Ренин-ангиотензиновая система 55
— при артериальной гипертензии 481
-----почечной 465,470
-----эссенциальной 408-409,412
-----сердечной недостаточности 488,504,
513
-----шоке 565
Ренитек (см. Эналаприл)
Рентгенологическое исследование грудной
клетки обзорное, при сердечно-сосуди-
стых заюолеваниях 126
----- изменения в легких 131-132
-----изменения формы сердца 130-131
-----при левосторонней сердечной не-
достаточности 500—502
-----признаки легочной гипертензии
131-132,600-601
-------увеличения отдельных отделов
сердца и сосудов 129-130
-----размеры сердца 126,127
География 150-152
Реполяризация 30-31
Респираторный дистресс-синдром взрослых
567-568,584
Рестрикции гемодинамический синдром
663,666,667
Ретинопатия гипертоническая 410,413—414
Рефрактерность клеток миокарда 33
Рефрактерный период 33—34,513
— при ишемии 300
Ри-энтри 300
Риверо Корвальо симптом 208
Салбутамол 534,535,536,539,550
Салюса-Гуна симптом 413
Сван-Ганза катетер 160,555,615
Сердечная недостаточность 485-563 (см.
также Недостаточность левых и правых
отделов сердца, Недостаточность крово-
обращения, Миокардиальная недостаточ-
ность)
— бивентрикулярная (тотальная) 491
— диастолическая 493,501
— дифференциальный диагноз 511
— клиника 494
— критерии диагностики 494-495,511
— лечение 514, 552-555 (см. также лече-
ние астмы сердечной, отека легких,
Трансплантация сердца)
---- диастолической сердечной недоста-
точности 554
----медикаментозное 517 (см. Мочегон-
ные препараты, Гликозиды сердечные,
Симпатомиметические амины, Ингиби-
торы фосфодиэстеразы, Ингибиторы
ангиотензинпревращающего фермента,
Периферические вазодилататоры, Бета-
адреноблокаторы)
---- немедикаментозное 515-517
----рефракторной сердечной недостаточ-
ности 554-555
----увеличение выживаемости 547,548
— минутный объем сердца 490
— осложнения 511-514
— острая 490,491,569—570,584
— патогенез 485,488-489,493
----в зависимости от этиологии 494
--------нарушения метаболизма мио-
карда 489-490
— при артериальной гипертензии 412,424—
425
— прогноз 562-563
— профилактика 563
— систолическая 493
— формы 490
— хроническая 490
----как форма ИБС 399—400
----классификация 508—511
— эпидемиология 484-485
— этиология 485
687
Сердечные тоны 78
— изгнания 82-83
— 1-й (S,) 78-79
— 2-й (S2) 79-81
— 3-й и 4-й (S3> S4) 81 (см. также Галопа
ритм)
- шумы 83—84
— диастолические 85,88-90
— невинные (физиологические) 87,223
---- волчка 90
— систолические 85-88
— систоло-диастолические 90
— специальные приемы при выслушива-
нии 85-86
— трения перикарда 90,647,652,660
— функциональные 87
Сердечный выброс 40
— при физической нагрузке 61,62
— регуляция 40-41
— индекс 39
- цикл, фазовый анализ 35-38
Сердце, анатомия функциональная 8-18
— иннервация 45
- искусственное 561
- камеры 8-10
- клапаны 10—11
- “крест” 23
- кровоснабжение 22-24
- насосная функция 39-40
- панцирное 662
- проводящая система 11-13
- регуляция нервная 45-47
— рефлекторная 50-51
— электрофизиология 28-35
Серотонин, действие на сосуды 56,295
Симпатико-адреналовая система, роль в
патогенезе артериальной гипертензии
эссенциальной 407,408
--------ишемии миокарда 296,298
--------сердечной недостаточности 488,
496,513
--------шока 565,566
Симпатомиметические амины, при сердеч-
ной недостаточности 534-539,556,559
----шоке 589-590,591,637
Синоатриальный (с шусовый) узел 11
Синусовый ритм содца 109
Систола предсердий 38
— электрическая 115
— электромеханическая 150
Систолический тон (щелчок) 83,227
Сифилитический аортит 245
Сканирование легких, при тромбоэмболии
легочной артерии 154,631-632
Слапака отведения ЭКГ 108,348
Сократимость 41,43
— нервная регуляция 48-49
- показатели 43-44,148,150
- факторы 43
Сокращение сердца, изоволюмическое (изо-
метрическое) 36
----механизм 16-17,26-27
---- сила 41
Сосочковые мышцы 10
— дисфункция 229,537,400
— разрыв 360,385
Сосудистая недостаточность 483
Сосудистое сопротивление, коронарных ар-
терий 39
— легочное 39-40
— периферическое 39-40
Сосуды 18 (см. также Артерии. Вены)
— коронарные (см. Коронарное кровообра-
щение)
- легких 20—21
- системные 18-19
— иннервация 53
Спиронолактон 436,438,476,520,522,533
Старлинга равновесие 495
Старра—Эдварса протез клапана сердца
216,242
Статины (см. Ингибиторы ГМГ-Ко А-ре-
дуктазы)
Стеноз правого атриовентрикулярного от-
верстия 255—257
— устья аорты 234-243
----диагностика 237-238,239
----дифференциальная 238-240
----клиника 235-237
----лечение 241—243
----хирургическое 242-243
----механизмы нарушения гемодинамики
234-235
----осложнения и течение 241,564,583
----патологическая анатомия 234
---- прогноз 243
----эпидемиология 234
---- этиология 234
- устья легочной артерии 191-194
----диагностика и дифференциальная
диагностика 192-193
----клиника 191-192
---- лечение, хирургическое 193-194
----механизмы нарушения гемодина-
мики 191
688
---- прогноз 193
----течение и осложнения 193
Стенокардия 302 (см. также Ишемия мио-
карда)
- нестабильная 333-338
— диагностика 335—336
— классификация 333
— клиника 334-335
— лечение 336-337
---- хирургическое 337
— осложнения и исходы 336
— патогенез 333—334
— патологическая анатомия 333
— пост- (пери-) инфарктная 363
— прогноз 337-338
— при недостаточности аортального кла-
пана 248
— стенозе устья аорты 236
- Принцметала 166,317-318
— лечение 332
— прогноз 332
- профилактика 332-333
- стабильная 302-333
— атипичные варианты 316
— диагностика 305—315,316
— классификация 315
— клиника 302-305
— лечение 318-331 (см. также Антианги-
нальные препараты)
----купирование 319-321
----предотвращение 326-327
----хирургическое 328-331
— осложнения 318
— прогноз 332
- этиология 302
Стеночное напряжение желудочка 8,9,40,41
Стент 331
Стилла шум (см. Грэма Стилла шум)
Стрептокиназа 371-372
- при остром инфаркте миокарда 372
— тромбоэмболии ветвей легочной арте-
рии 638
Строфантин 529,530
Сульфинлиразол 326
Сфигмография 148—149
— при недостаточности аортального кла-
пана 251
— стенозе устья аорты 149,238
Сцинтиграфия миокарда, с таллием (М1Т1)
152-153
---- нагрузочная 153,313
----при остром инфаркте миокарда 353
----технецием (WmTc) 153
----при остром инфаркте миокарда 352-
353
Такаясу болезнь, артериальная гипертен-
зия 245,465,469
Талинолол 376
Тампонада сердца 651,656-659
— диагностика и дифференциальная диаг-
ностика 583-584,658,659
— клиника 564,565,583,657-658
— лечение 594,659
— патофизиология 656—657
— причины 656
— прогноз 659
— хроническая 507,660
Тебезия вены 23
Теразозин 437,445
Термодилюции метод 162
Тетрада Фалло 198-203
— варианты 199,201
— диагностика 200-202
----дифференциальная 193
— клиника 199-200
— лечение 202-203
---- хирургическое 202-203
— механизмы нарушения гемодинамики
198-199
— одышечно-цианотические приступы
199-200
— патологическая анатомия 198
— прогноз 202
— течение и осложнения 202
Тиазидовые диуретики 430-431,520,521
— побочные эффекты 522—524
— при артериальной гипертензии 430—
431,436,438,449,450,451,456,472,482
----сердечной недостаточности 520,524,
552
Тимолол 323,392,436
Тиреотоксическое поражение сердца 93,210
Тканевый активатор плазминогена 372
----при остром инфаркте миокарда 272
----тромбоэмболии легочной аретрии
637,638
Толочинова-Роже болезнь 181
Тоны сердца (см. Сердечные тоны)
Тореля тракт 11
Тразикор (см. Окспренолол)
Трансплантация сердца 555,559-561
— и легких 561,606,620
Трехстворчатый клапан, визуализация с
помощью эхокардиографии 140
689
Трехстворчатый клапан, миксоматозная де-
генерация 257
Триамтерен 520,522,552
- при артериальной гипертензии 436,438
Триглицериды 267
Тримазозин 549
Триметафана камсилат 382,444,459,460-
461,549
Тромбоз глубоких вен 622
-----при остром инфаркте миокарда 363
----- сердечной недостаточности 514,551
Тромбоксан А2 56,295
Тромболитическая терапия, клиническая
фармакология препаратов 371-373
— последующее лечение 374
— при остром инфаркте миокарда 370-
374
-----тромбоэмболии легочной артерии 594,
637-638
— противопоказания 370—371
Тромбоэмболия ветвей легочной артерии
500,600,621-642
----- варианты 624-629
-----диагностика 583,629-636
-----дифференциальная 634-635
-----клиника 632-634
-----лечение 594,637-641
----- хирургическое 638-639
-----патогенез 622—626,628
----- прогноз 641
-----профилактика 641-642
-----рецидивирующая 605,610
-----течение и осложнения 564,565,597,
608,636-637
----- этиология 622
----- частота 622
- системных артерий после протезирова-
ния клапанов сердца 217
-----при митральном стенозе и комбини-
рованном митральном пороке 212,233
-----остром инфаркте миокарда 363
Тропомиозин 16,27
Тропонин 16,27
Угол а 116
Ударная работа желудочка 40
Ударный объем сердца 41
Узелковый периартериит, артериальная
гипертензия 469
Ультразвуковое исследование сердца (см.
Допплерэхокардиография. Эхокардио-
графия)
Ультрафильтрация, при сердечной недо-
статочности 516,517,553
Урегит (см. Этакриновая кислота)
Урокиназа 372
- при остром инфаркте миокарда 372
— тромбоэмболии легочной артерии
637,638
Фазовый анализ систолы левого желудоч-
ка 149-150
Фактор роста тромбоцитов 264
— угнетающий миокард 570
Факторы риска ИБС 265
Фелодипин 436,549
Фенигидин (см. Нифедипин)
Фенитоин 533,644
Феноксибензамин 480
Фентоламин 382,383,445,462,480,605
Феохромоцитома, артериальная гипертен-
зия 476—480
- лечение 480
Фибраты 289-290
Фиброзная бляшка 262
Фиброэластоз 486
Физические тренировки, влияние на гемо-
динамику 62
— после инфаркта миокарда 389
— при гиперлипопротеинемии 288
---стенокардии 318-319
Физическое обследование больного 65 (см.
также Осмотр, Аускультация, Пальпа-
ция, Перкуссия)
Фика метод 162
Флебография 68,147
Флекаинид 551
Флинта шум 89,211,250
Фонокардиография 77-78,94,144-146
Фосфодиэстераза 49
Фосфолипиды 267
Фраксипарин 641
Фракция выброса 142
Франка—Старлинга закон (зависимость) 41
— при сердечной недостаточности 485,
486,490
Фремингемское исследование 265,404,416
Фридволда формула 272
Фридрейха признак 664
Фуросемид 519,521
— при артериальной гипертензии 436,438,
455,456,458,461,462,472
— остром инфаркте миокарда, осложнен-
ном острой левожелудочковой недоста-
точностью 381,556-557
690
— сердечной недостаточности и шоке 552,
591,592
Х-синдром 294
Хеморецепторный рефлекс 50,54
Хилла признак 249
Хиломикроны 267,268
Хинидин 533
Хлорталидон 520
Холестерин 267
Холестрипол 286
Холестирамин 286
Холтеровское мониторирование ЭКГ 122
---при ИБС 308
Целанид (см. Ланатозид)
Чейна-Стокса дыхание, при левожелудоч-
ковой недостаточности 66,497,499
Чрескожная транслюминальная ангиопла-
стика, методика 167,168,330
---осложнения 168,330
---показания и противопоказания 167
---последующее лечение 331
---при нестабильной стенокардии 337
---инфаркте миокарда 374-375,395
---хронической ИБС 330-331
---рестеноз 168,330
Шарко-Бушара микроаневризмы 424
Шок 563-595 (см. также Кардиогенный
шок при остром инфаркте миокарда)
- данные дополнительных методов иссле-
дования 576—577
— диагностика 580
— дифференциальная 580-584,635
- классификация 564
- клиника 575-576
- лечение 585-592
— отдельных форм 592-594
- нарушения гемодинамики 573-575
— осложнения 584-585
— особенности отдельных форм, анафи-
лактический шок 571-572,578
---гиповолемический шок 577
---инфекционно-токсический шок
571,577
---кардиогенный шок 572-573,578-
580
— патогенез 594—595
- прогноз 594-595
- профилактика 595
- этиология 563-565
Шумы сердца (см. Сердечные шумы)
Щелчок открытия 83
— аортального клапана 237
— митрального клапана 207
Эбштейна угол 652
- аномалия 194-198
Эварта признак 652
Эйзенменгера синдром 171,182,193,596,
600,616
Эйлера-Лильестранда рефлекс 610
Эктопические желудочные аритмии при
остром инфаркте миокарда, лечение
378-379
Электрическая ось сердца 116
Электрокардиография 94,96
- внутрисердечная 123-124
— диагностическое значение 96
- зубцы и интервалы 106-107
— Р- зубец 108-110
— 70-интервал 110-111
— 0Л5-комплекс 111-113
---патологический зубец Q 343-344
- 57-сегмент 113-114
- 7-зубец 114-115
- 07-интервал 115
- (/-зубец 116
- картирование (см. Электрокардиотопо-
грамма)
— отведения дополнительные (специаль-
ные) 105,107
— при артериальной гипертензии 414
— гипертрофии желудочков сердца 117-
118 (см. также Левый желудочек. Пра-
вый желудочек)
— гипертрофии предсердий (см. Левое
предсердие. Правое предсердие)
— ишемии миокарда 305-308
— легочном сердце 613-614
— нарушениях обмена электролитов 120
— остром инфаркте миокарда 343-349
— остром перикардите 647
— синдроме диффузных изменений в
миокарде 119
— тромбоэмболии легочной артерии 630
— регистрация 98
— стандартные отведения (12) 100-105
— усредненная и усиленная 123
— электрофизиологические основы 98-
100
Элекгрокардиостимуляция, диагностиче-
ская, программируемая эндокардиаль-
ная 166,379,397,512
— чреспищеводная 308-309,312
- лечебная 533,590
— при остром инфаркте миокарда 379,380
Электрокардиотопограмма 121,348
Электромеханическая диссоциация 361
691
Эналаприл, при артериальной гипертензии
436,441
— остром инфаркте миокарда 378
— хронической сердечной недостаточно-
сти 548
Эндокард 18
Эндотелиальный фактор расслабления 60,
295
Эндотелий 18,19
Энкаинид 551
Эноксимон 540
Эпикард 18
Эргометриновая проба 166,313
Эссенциальная артериальная гипертензия
(см. Артериальная гипертензия системная)
Этакриновая кислота 436,438,461,519,521
Эуфиллин, при отеке легких 556,558
Эхокардиография 94,132 (см. также Доп-
плерэхокардиография)
- в М-режиме (одномерная) 134,139
- двухмерная 135—136
- диагностическое значение и показания
133-134
- клапанов сердца (см. отдельные клапаны)
- левого желудочка 140-141
- нагрузочная 144
- определение показателей гемодинамики
и морфологии левого желудочка 141—
143
- при выпоте в перикард 653
— легочной гипертензии 601
— митральном стенозе 209
— недостаточности аортального клапана
251
— остром инфаркте миокарда 353
— пролапсе митрального клапана 277-
228
— сердечной недостаточности, левосто-
ронней 501
— хронической ИБС 314
-----с добутамином 314
— чреспищеводная 143—144
Ядерно-магнитная спектроскопия миокарда
156
Ядерно-магнитный резонанс при заболе-
ваниях сердца и сосудов 155—156
СПИСОК ЛИТЕРАТУРЫ
Амосов НМ., Бендет Я.А. О количественной оценке и градациях физического состояния
больных с сердечно-сосудистыми заболеваниями //Кардиология. — 1975. — № 9- —
С. 19-26.
Амосов Н.М., Бендет Я.А. Терапевтические аспекты кардиохирургии. - К.: Здоров’я,
1983. - 296 с.
Амосов Н.М., Бендет Я.А. Физическая активность и сердце. — К.: Здоров’я, 1984. —
231 с.
Атьков О.В., Сергакова Л.М., Митина И.Н. Ультразвуковые методы исследования сердца
И В кн.: Болезни сердца и сосудов /Под ред. Е.И.Чазова. — Т. I. - М.: Медицина,
1992.-С. 318-381.
Белоконь НА., Подзолков В.П. Врожденные пороки сердца. — М.: Медицина, 1991. —
351с.
Бобров В.А., Каминский А.Г. Кардиология. — К.: Здоров’я, 1994. — 103 с.
Василенко В.Х., Фельдман С.Б., Могилевский Э.Б. Пороки сердца. — Ташкент: Медицина
УзССР, 1983.- 366 с.
Васюк Ю.А., Тимоничев Н.В., Абакумов Ю.А., Захарова Т.Ю. О сроках стационарного
лечения больных инфарктом миокарда // Кардиология. — 1991. — № 5. — С. 91-95.
Внутрикоронарное введение фибринолизина при остром инфаркте миокарда /Чазов Е.И.,
Матера Л.С., Мазаев А.В. и др. //Терапевт, арх. - 1976. — № 4. — С. 8—19.
Вотчал Б.Е. Очерки клинической фармакологии. — М.: Медицина, 1965. - 492 с.
Ганелина И.Е., Бриккер В.Н., Вольперт Е.И. О типах кардиогенного коллапса при
инфаркте миокарда // Клин, медицина. - 1966. - № 8. — С. 37—45.
Гватуа НА., Кравцов ВЛ., Толстопятов С.М., Яновский АД. Гемодинамические варианты
острого инфаркта миокарда // Кардиология. — 1979. — №1.-С. 24—31.
Гогин Е.Е. Болезни перикарда. — М.: Медицина, 1979. - 190 с.
Голиков А.П., Борисенко А.П., Бабков В.К. Гипертонические кризы (вопросы
классификации и экстренной помощи) //Терапевт, арх. — 1976. — № 10. - С. 8—14.
Грицюк А.И. Пособие по кардиологии. - К.: Здоров’я. - 1984. — 558 с.
Грицюк А.И., Гватуа НА., Следзевская И.К. Инфаркт миокарда. —К.: Здоров’я, 1977. —
269 с.
Грицюк А.И., Нетяженко В.З., Сиренко Ю.Н Дифференциально-диагностические
критерии истинного кардиогенного шока у больных острым инфарктом миокарда //
Материалы I съезда кардиологов Грузии. - Тбилиси: Б.и., 1982. - С. 190-191.
Зарецкий В.В., Бобков В.В., Ольбинская Л.И. Клиническая эхокардиография. - М.:
Медицина, 1979. — 247 с.
Инфаркт миокарда /Чазов Е.И., Виноградов А.В., Вихерт А.М. и др. — М.: Медицина,
1971.-312с.
Исаков И.И., Кушаковский М.С., Журавлева Н.Б. Клиническая электрокардиография. —
М.: Медицина, 1984. - 272 с.
Йонаш В. Частная кардиология. — Прага: Госмедиздат, 1963. — 1078 с.
693
Кассирский ИЛ., Кассирский Г.И. Звуковая симптоматика приобретенных пороков сердца.
— 2-е изд. — М.: Медицина, 1964. —320 с.
Мазур Н.А. Внезапная смерть больных ишемической болезнью сердца. — М.: Медицина,
1985.- 192 с.
Мазур Н.А. Основы клинической фармакологии и фармакотерапии в кардиологии. —
М.: Медицина, 1988. — 304 с.
Маколкин В.И. Приобретенные пороки сердца. — М.: Медицина, 1986. — 254 с.
МалаяЛ.Т., Власенко М.А., Микляев Ю.И. Инфаркт миокарда. — М.: Медицина, 1981.
- 487 с.
Малая Л. Т., Яблучанский Н.И., Власенко М.А. Клиническая характеристика больных с
неосложненным и осложненным течением крупноочагового инфаркта миокарда //
Клин, медицина. — 1989. — № 1. - С. 67-70.
Малая Л. Т, Горб Ю.Г., Рачинский ИД. Хроническая недостаточность кровообращения.
— К.: Здоровья, 1994. — 624 с.
Меерсон Ф.З. Адаптация, деадаптация и недостаточность сердца. - М.: Медицина, 1978.
- 344 с.
Меерсон Ф.З. Патогенез и предупреждение стрессорных и ишемических повреждений
сердца. — М.: Медицина, 1984. — 272 с.
Мухарлямов Н.М. Ранние стадии недостаточности кровообращения и механизмы ее
компенсации. — М.: Медицина, 1978. — 215 с.
Мясников А.Л. Гипертоническая болезнь. — М.: Медгиз, 1954. —391 с.
Николаева Л.Ф., Аронов Д.М. Реабилитация больных ишемической болезнью сердца. —
М.: Медицина, 1988. - 288 с.
Оганов Р.Г. Первичная профилактика ишемической болезни сердца. — М.: Медицина,
1990.- 159 с.
ОльбинскаяЛ.И, Литвицкий П.Ф. Коронарная и миокардиальная недостаточность. —
М.: Медицина, 1986. — 270 с.
Орлов В.И. Руководство по электрокардиографии. — М.: Медицина, 1983. — 528 с.
Практическая эхокардиография / Мухарлямов Н.М., Хайне X., Андриан Б. и др. - М.:
Медицина, 1982. — 303 с.
Ратнер Н.А. Артериальные гипертонии. — М.: Медицина, 1974. — 415 с.
Соколов Б.П. Клинико-анатомические сопоставления при стенозе устья аорты // Клин,
медицина. - 1963. - № 1. — С. 38—43.
Сыркин А.Л. Инфаркт миокарда. — М.: Медицина, 1991. — 302 с.
Тареев Е.М. Гипертоническая болезнь. — М.: Медгиз, 1948. — 153 с.
Удельное М.Г. Физиология сердца. - М.: Изд-во Моск, уни-та, 1975. — 303 с.
Физиология и патофизиология сердца / Под ред. Н.Сперелакиса: В 2 т. — Пер. с англ. —
М.: Медицина, 1990. — 1244 с.
Фуркало Н.К, Яновский Г.В., Следзевская И.К. Клинико-инструментальная диагностика
поражений сердца и венечных сосудов. — К.: Здоров’я, 1990. - 189 с.
Чазов Е.И Инфаркт миокарда. — В кн.: Болезни сердца и сосудов. - Т. 2. — М.: Медицина,
1994.-С. 5-119.
Чазова Л.В., Шишова А.М., Щепкин В.В. Факторы риска и их динамика в исследовании
по многофакторной профилактике ишемической болезни сердца // Вести. АМН СССР.
- 1987. - № 2. - С. 35-40.
Шхвацабая И.К. Гипертоническая болезнь: В кн.: Болезни сердца и сосудов: Рук-во для
врачей /Под ред. Е.И.Чазова. — Т. 3. — М.: Медицина, 1992. — С. 147—196.
Aiderman E.L., Bourassa M.G., Cohen L.S. et al. Ten-year follow-up of survival and
myocardial infarction in the randomized coronary artery surgery group, study // Circulation.
- 1990. - Vol. 82. - P. 1629-1646.
694
Amery A. et al. The European Working Party on High Blood Pressure in the Elderly I I Amer.
J. Med. - 1991. - Vol. 90. - Suppl ЗА. - P. 82-89.
Anti platelet Trialists’ Collaboration: Secondary prevention of vascular disease by prolonged
antiplatelet treatment // Brit.Med.J.— 1988.— Vol.296.— P.320—328.
Australian Therapeutic Trial in Mild Hypertension: Report by the Management Committee
I I Lancet. - 1980. - Vol. 1. - P. 1261-1272.
Bailey C.P. Surgery of the heart. — Philadelphia: Lea and Fehiger, 1955. — 1062 p.
Банкл Г. (BanclH.) Врожденные пороки сердца и крупных сосудов. Пер. с англ. — М.:
Медицина, 1980. - 312 с.
Beta-Blocker Heart Attack Study Group. A randomized trial of propranolol in patients with
acute myocardial infarction. I. Mortality results//JAMA. — Vol. 247. — P. 1707—1714.
Bilheimer D. IK Therapeutic control of hyperli pidaemia in the prevention of coronary athero-
sclerosis: a review of results from recent clinical trials // Amer. J. Cardiol. — 1988. — Vol. 62.
- P. 1J-9J.
Braunwald E. (ed.). Heart Diseases. — 3rd ed. — Philadelphia: Saundrs, 1988.
Brown G., Albers J J., Fisher L.D. et al. Regression of coronary artery disease as a result of
intensive lipid-lowering therapy in men with high of levels of apoprotein B// N.Engl.J.
Med. - 1990. - Vol. 323. - P. 1289-1298.
Buchwald H, Vdrco Rl.L., Matts J.P. et al. Effect of partial ileal bypass surgery on mortality
and morbidity from coronary heart disease in patients with hypercholesterolemia. Report of
the program on the Surgical Control of the Hyperli pidemias (POSCH) // N.EnglJ.Med.
- 1990. - Vol. 323. - P. 946-955.
Bugiardini R. Angiographic morphology in unstable angina and its relation to transient myo-
cardial ischemia and hospital outcome // Amer. J. Cardiol. — 1991. — Vol. 67. — P. 460—468.
Burkart F., Pfisterer M., Kiavski L. et. al. Effect of antiarrhythmic therapy on mortality of
survivors of myocardial infarction with asymptomatic complex ventricular arrhythmias:
Basel Antiarrhythmic Study of Infarct Survival (BASIS) //J. Amer. Coll. Cardiol. — 1990. —
Vol. 16.-P. 1711-1718.
Cairns J.A., Connoly S.J., Gent M. et al. Post-myocardial infarction mortality in patients
with ventricular premature depolarizations: Canadian Amiodarone Myocardial Infarction
Arrhythmia Trial pilot study (CAMIAT) // Circulation. — 1991. — Vol. 84. — P. 550—557.
Captopril-Digoxin Multicenter Research Group. Comperative effects of therapy with captopril
and digoxin in patients with mild to moderate heart failure // JAMA — 1988. — Vol. 259. —
P. 539-548.
Cardiac Arrhythmia Suppression Trial (CAST) Investigators. Effect of encainide and flecainide
on mortality in a randomized trial of arrhythmia suppression after myocardial infarction //
Circulation. - 1990. - Vol. 81. - P. 1123-1127.
The CASCADE Investigators. The CASCADE study-randomized antiarrhythmic drug therapy
in survivors of ca; diac arrest in Seatie // Amer. J. Cardiol. — 1993. — Vol. 72. — P. 280—287.
CASS Principal Investigators and their Associates.Coronary Artery Surgery Study (CASS).A
randomized trial of coronary artery bypass surgery: Survival data // Circulation. — 1983. -
Vol. 68. - P. 939-950.
Ceremuzynski L., Kleczar E., Krzeminska-Pacula M. et al. Effect of amiodarone on mortality
after myocardial infarction: a double-blind placebo-controlled pilot study // J. Amer. Coll.
Cardiol. - 1992. - Vol. 20. - P. 1056-1062.
Chesebro J.H., Knatterud G., Roberts R. et al. Thrombolysis in Myocardial Infarction (TIMI)
Trial, Phase I: A comparison between intravenous tissue plasminogen activator and intra-
venous atreptokinase: Clinical finical findings throups hospital discharge // Circulation. —
1987.-Vol. 76.-P. 142-154.
695
Chronic cor pulmonale: Report of an expert committee 11 Idem. — 1963. — Vol. 27. — P.
564-569.
Cohn J.N., Archibald D.G., Ziesche S. et al. A comparison of enalapril with hydralazine-
isosorbide dinitrate in the treatment of chronic congestive heart failure I IN. Engl. J. Med. —
1991. - Vol. 325. - P. 303-310.
Come P.C. Echocardiography in diagnosis and management of cardiovascular disease. //
Compr. Ther. - 1980. - Vol. 6. - P. 58-72.
The CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive
heart failure//N. Engl. J. Med. - 1987. - Vol. 316. - P. 1429-1435.
Conti C.R. Unstable angina pectoris: Morbidity and mortality in 57 consecutive patients
evaluated angiographically//Amer. J. Cardiol. — 1973. — Vol. 32. — P. 745—752.
Counsil on Scientific Affairs. Physician-supervised exercise programs in rehabilitation of
patients with coronary heart disease//JAMA. — 1981,—Vol. 245. — P. 1462—1470.
Criteria Committee of the New York Heart Association. Nomenclature and criteria for diagnosis
of diseases of the heart and great vessels. — 8th ed. — Boston: Little, Brown, 1979. — 290 p.
D'Alonzo G.E. Survival in patients with primary pulmonary hypertension I I Ann. Intern. Med.
- 1991. - Vol. 115. - P. 343-349.
The Danish Study Group on Verapamil in Myocardial Infarction. Effects of verapamil on
mortality and major events after acute myocardial infarction. (The Danish Verapamil
Infarction Trial-ll-DAVIT-II) // Amer. J. Cardiol. — 1990. — Vol. 66. — P. 770—785.
De Feyter P.J. Coronary angioplasty for unstable angina: Immediate and late results in 200
consecutive patients with identification of risk factors for unfavourable early and late outcome
I I J. Amer. Coll. Caixliol. - 1988. - Vol. 12. - P. 324-331.
De Maria A., Wisenbaugh T., Smith M. et al. Doppler echocardiographic evaluation of
diastolic dysfunction I I Circulation. - 1991. - Vol. 84. — Suppl. III. — P. 288—291.
De Wood M.A., Spores J., Notske R. et al. Prevalence of total coronary occlusion during the
early hours of transmural myocardial infarction I IN. Engl. Med. — 1980. — Vol. 303. — P.
897-902.
Devereux B.B., Kramer-Fox R., Kligfteld P. Mitral valve prolapse: Causes, clinical manifesta-
tions and management I I Annals Intern. Med. — 1989. — Vol. 111. — P. 305—317.
DiBianco R., Shabetai R., Kostuk W. et al. A comparison of oral milrinone, digoxin and
their combination in the treatment of patients with chronic heart failure //N. Engl. J. Med.
- 1989. - Vol. 320. - P. 677-683.
Dhingra R.C. Electrophysiologic studies during acute myocardial infarction: Do they prog-
nosticate? (ed.) // J. Amer. Coll. Cardiol. — 1991. — Vol. 18. — P. 789—796.
Dodge H., Baxley W. Left ventricular volume and mass and their significance in heart
disease // Amer. J. Cardiol. — 1969. — Vol. 23. — P. 528—536.
Doval H.C., Nul D.R., Grancelli H.O. etal for the Grupo de Estudio de les Sobrevuda on la
Insuficiencia Cardiaca en Argentine (GESICA). Randomized trial of low-dose amiodarone in
severe congestive heart failure // Lancet. — 1994. — Vol. 1. — P. 493—498.
Ertl G. Cardiac dysfunction and development of heart failure I I Eur. Heart. J. — 1993. — Vol. 14.
— Suppl. A. — P. 33—37.
European Coronary Surgery Study Group. Coronary artery bypass surgery in stable angina
pectoris: survival at two years // Lancet. — 1979. — Vol. 2. — P. 889-893.
Feigenbaum H. Echocardiography. 4th ed. Lea and Febiger. — Philadelphia, 1989. — 668 p.
Fitzhibbon E.M. Coronary bypass graft fate: Long term angiographic study//J. Amer. Coll.
Cardiol. - 1991. - Vol. 17. - P. 1075-1081.
Fleckenstein A., Fleckenstein-Grun G., Frey M., Zorn J. Calcium antagonism and ACE inhi-
bition: two outstandingly effective means of interference with cardiovascular calcium over-
696
load, high blood pressure and arteriosclerosis in spontaneously hypertensive rats // Amer. J.
Hypertens. — 1989. — Vol. 2. — P. 194—204.
Forrester J.S., Waters D.D. Hospital treatment of congestive heart failure: management according
to hemodynamic profile I I Amer. J. Med. — 1978. — Vol. 65. — P. 173—180.
Fragomeni L.S., Bonser R.S., Kaye M.P. Clinical results of heart and heart—lung transplanta-
tion // Prog. Cardiovasc. Dis. — 1990. — Vol. 33 - P. 97—104.
Frishman W.H. Secondary prevention with p-adrenoblockers and aspirin in ischaemic heart
disease I I Curr. Opin. Cardiol. — 1991. — Vol. 6. — P. 367—372.
Faster V., Badimon L., Badimon J.J., Chesebro J.N. The pathogenesis of coronary artery
disease and the acute coronary syndromes // N. Engl. J. Med. — 1992. — Vol. 326. P. 242—250,
310-318.
Gibson R.S., Boden W.E., Theroux P. etal. Reinfarction Study Group. Diltiazem and reinf-
arction in patients with non-Q-wave myocardial infarction. Results of a double-blind rand-
omized multicenter trial I IN. Engl. J. Med. — 1986. — Vol. 315. — P. 423—429.
Goldhaber C.Z. Thrombolysis for pulmonary embolism // Prog. Cardiovasc. Dis. — 1991. —
Vol. 34.-P. 113-119.
Greene H.L., Richardson D. W., Barker A.H. etal., the CAPS Investigators. Classification of
deaths after myocardial infarction as arrhythmic or non-arhythmic (the Cardiac Arrhyth-
mic Pilot Study) I I Amer. J. Cardiol. — 1989. — Vol. 63. — P. 1—6.
Grover S.A. The benefits of treating hyperlipidemia to prevent coronary artery disease 11
JAMA. - 1992. - Vol. 267. - P. 816-822.
Gruntzig A., Kumpe D.A. Technique of percutaneous transluminal angioplasty with the Gruntzig
balloon catheter//AJR. - 1979. - Vol. 132. - P. 547-552.
Gruppo Italiano per lo Studio della Soprawivenza nell’lnfarcto Miocardio (GISSI—2): A facto-
rial randomized trial of alteplase versus streptokinase and heparin versus no heparin among
12490 patients with acute myocardial infarction//Lancet. — 1990. — Vol. 336. - P. 65—71.
Gruppo Italiano per lo Studio della Streptochinasi nell’lnfarcto Miocardio (GISSI): Long-
term effects of intravenous thrombolysis in acute myocardial infarction. Final report of the
GISSI study// Lancet. - 1987. - Vol. 2. - P. 871-879.
Gunnar R.M. Guidelines for early management of patients with acute myocardial infarction:
A report of the ACC/AH A task force on assessement of diagnostic and therapeutic cardio-
vascular procedures // J. Amer. Coll. Cardiol. — 1990. — Vol. 16. — P. 249—256.
The GUSTO Investigators (Global utilization of Streptokinase and Tissue Plasminogen Acti-
vator for occluded coronary arteries). An international randomised trial comparing four
thrombolytic strategies for acute myocardial infarction // N. Engl. J. Med. — 1993. — Vol. 329-
- P. 673-682.
Guyton A.C. Textbook of Medical Physiology, 6th ed., W.B.Saunders Co., Philadelphia,
1981.
Henry W.L., DeMaris A., Gramiak R. et al. Report of he American Society of Echocardiog-
raphy committee on nomenclature and standarts in two-dimensional echocardiography //
Circulation. - 1980. - Vol. 62. - P. 212-218.
Hinkle L.E., Thaler H. T. Clinical classification of cardiac deaths I I Circulation. — 1982. -
Vol. 65. P. 457-462.
Нотта Y., Mikami Y, Tamachi H. et al. Comparison of selectivity of LDL removal by
double filtration and dextran-sulfate cellulose column plasmapheresis in heterozygous fa-
milial hypercholesterolaemia I I Metabolism. — 1987. — Vol. 36. — P. 419—425.
Hsia J., Hamilton W.P., Kleiman H. et al. A comparison between heparin and low-dose
aspirin as adjunctive therapy with tissue plasminogen activator for acute myocardial infarc-
tion: Heparin-Aspirin Reperfusion Trial (HART) Investigators // N. Engl. J. Med. — 1990. —
Vol. 323. - P. 1433-1437.
697
Hurst J. W. (ed.)The Heart. 7th ed. New York, McGraw-Hill, 1990.
Hurst J. Ж, Schlant R.D. Inspection and palpation of the anterior chest. In: Examination of
the Heart, Pt 3, 1972.
Hypertension Detection and Follow-up Program Cooperative Group: Persistense of reduction
in blood pressure and mortality of participants in the Hypertension Detection and Follow-
up Program 11 JAMA. - 1988. - Vol. 259. - P. 2113-2119.
IMPACT Research Group. International Mexiletine and Placebo Antiarrhythmic Coronary Trial. I.
Report on arrhythmia and other findings//J. Amer. Coll. Cardiol.— 1984. — Vol. 4, — P. 1148-1163.
International Study Group: In-hospital mortality and clinical course of 20891 patients with
suspected acute myocardial infarction randomised between alteplase and streptokinase with
or without heparin// Lancet. — 1990. — Vol. 1. P. 336—371.
INTERSALT Cooperative Research Group: INTERSALT: An international study of electro-
lyte excretion and blood pressure // Brit. Med. J. — 1988. — Vol. 297. — P. 319—326.
ISIS—2 (Second International Study of Infarct Survival) Collaborative Groupe: Randomised
trial of intravenous streptokinase, oral aspirin, both or neither among 17187 cases of
suspected acute myocardial infarction I I Lancet. - 1988. — Vol. 2. - P. 349—360.
ISIS—3 (Third international Study of Infarct Survival collaborative group) ISIS-3: a randomised
comparison of streptokinase versus tissue plasminogen activator versus antistreptase and of
aspirin plus heparin versus aspirin alone among 41299 cases of suspected acute myocardial
infarction I I Lancet. — 1992. — Vol. 1. — P. 753—770.
Johns J.A. Quantification of acute miocardial infarct size by nuclear magnetic resonance
imaging I I J. Amer. Coll. Cardiol. — 1990. - Vol. 15. — P. 143-149.
Joint National Committee : The 1988 report of the Joint National Committee on Detection,
Evaluation and Treathment of High Blood Pressure// Arch. Intern. Med. — 1988. — Vol. 148.
-P. 1023-1029.
Jugdutt B.I. Effect of nitrate therapy on ventricular remodelling and function I I Amer. J.
Cardiol. - 1993. - Bol. 72. - P. 161G-168G.
Katzung B.F. (ed.) /Basic and Clinical Pharmacology. 5th ed. Appleton and Lange, 1992.
Keith N.M., Wagener HP. Some different types of essential hypertension: their course and
prognosis//Amer. J. Med. Sci. — 1939. —Vol. 197, —P. 332—341.
Kelley M.A. Diagnosing pulmonary embolism: New tests and strategies // Ann. Intern. Med. —
1991.-Vol. 114.-P. 300-310.
Killip T., Kimball J. T. Treatment of myocardial infarction in a coronary care unit. A two-year
experience with 250 patients // Amer. J. Cardiol. — 1967. — Vol. 20. — P. 457—464.
Kirklin J. W. ACC/AHA Task Force on Assessement of diagnostic and therapeutic cardiovascular
procedures (Subcommittee on Coronary Artery Bypass Graft Surgery): Guidelines and
indications for coronary artery bypass graft surgery I I J. Amer. Coll. Cardiol. — 1991.- Vol.
17. - P. 543-548.
KreittJ.M., Kay M.P. The registry of the International Society for Heart and Lung Transplan-
tation: Eighth official report//J. Heart Lung Transplant. — 1991. — Vol. 10. — P. 491—498.
Krone R.J. The role of risk stratification in the early management of a myocardial infarction
I I Ann. Intern. Med. — 1992. — Vol. 116. — P. 223—228.
Чамбич И.С., Стожинич С.П. (Lambic I.S., Stozinic S.P.) Стенокардия. — Пер. с сербо-
хорватского. — М.: Медицина, 1990. — 430 с.
Lee L., Erbel R., Brown Т. et al. Multicenter registry of angioplasty therapy of cardiogenic shock:
Initial and long-term survival (abstr.) I I Circulation. — 1989. — Vol. 76. Suppl. IV. - P.IV — 261.
darcovitz P.A., Armstrong W.F. Accuracy of dobutamine stress echocardiography in detecting
coronary artery disease //Amer. J. Cardiol. — 1992. — Vol. 69. — P. 1269—1275.
daroko P.R., Libby P., Cowell J.W. et al. Precordial ST-segment elevation mapping: an
atraumatic method for assessing alterations in the extent of myocardic ischemic injury. The
698
effects of pharmacologic and hemodynamic interventions // Amer. J. Cardiol. — 1972. — Vol.
29. - P. 223-230.
Маршалл P., Шеферд Дж.Т. (Marshall R., Shepherd L.T.) Функция сердца у здоровых и
больных. — Пер. с англ. — М.: Медицина, 1972. — 392 с.
Mason J.K. Asymptomatic disease of coronary arteries in young men // Brit. Med. J. — 1963. —
Vol. 2.-P. 1234-1239.
McKee P.A., Castelli W.P., McNamara P.M., Kannel W.B. The natural history of congestive
heart failure: the Framingham Study//N. Engl. J. Med. — 1971. — Vol. 285. — P. 1441—1446.
Medical Research Counsil Working Party: MRC trial of triatment of mild hypertension:
Principal results // Brit.Med.J.— 1985.— Vol.291.- P.97—106.
Milner P.G., Platia E. V., Reid P.R. et al. Ambulatory electrocardiographic recording at the
time of fatal cardiac arrest // Amer. J. Cardiol. - 1985. — Vol. 56. — P. 588—592.
Moosvi A.R. Early revascularization improves survival in cardiogenic shock complicating acute
myocardial infarction //J. Amer. Coll. Cardiol. — 1992. — Vol. 19. — P. 907—911.
Morganroth J., Goin J.E. Quinidine-mortality in the short to medium term treatment of
ventricular arrhythmias I I Circulation. — 1991. — Vol. 84. — P. 1911—1983.
Moss A J., Bigger J.T., Odoroff C.L. Postinfarct risk stratification // Progr. Cardiovasc. Dis. —
1987. - Vol. 29. - P. 389-396.
The Multicenter Diltiazem Postinfarction Trial Research Group. The effect of diltiazem on
mortality and reinfarction after myocardial infarction I IN. Engl. J.Med. — 1988. — Vol. 319.
- P. 385-392.
Multiple RiskFactor Intervention Trial Research Group: Mortality rates after 10.5years for
participants in the Multiple RiskFactor Intervention Trial (MRFIT) // JAMA — 1990 —
Vol. 263.-P. 1795-1809.
National Center for Health Statistics — National Heart, Lung and Blood Institute Collabo-
rative Li pid Group.Trends in serum cholesterol levels among US adults aged 20 to 74 years
I I Idem. - 1987. - Vol. 257. - P. 937-942.
NIH Consensus Development Statement: Prevention of venous thrombosis and pulmonary
embolism // Idem. — 1986. — Vol. 256. — P. 744—752.
Norwegian Multicenter Study Group: Timolol-induced reduction in mortality and reinfarc-
tion in patients surviving acute myocardial infarction // N. Engl. J. Med. — 1981. — Vol. 304.
P. 801-810.
Packer M. Long-term strategies in the management of heart failure: looking beyond ventricu-
lar function and symptoms//Amer. J. Cardiol. — 1992. — Vol. 69. — P. 150G—156G.
Packer M., Carver J.R., Rodenheffer R. etal. for the PROMISE study research group. Effect
of oral milrinone on mortality in severe chronic heart failure I I N.Engl. J. Med. — 1991. -
Vol. 325.-P. 1468-1475.
Paffenbarger R.S., Hyde R. T., Wing A. L. et al. The association of changes in physical activity
level and other life style characteristics with mortality among men I I Idem. - 1993. — Vol.
328. - P. 538-545.
Parisi A.F., Folland E.D., Hartigan P. et al. A comparison of angioplasty with medical
therapy in the treatment of singlevessel coronary artery disease: Veterans Affairs ACME
Investigators//Idem. — 1992. — Vol. 326. — P. 10—21.
Parmley Ж. Ж. Factors causing arrhythmuas in congestive heart failure // Amer. Heart J. —
1987. - Vol. 114. - P. 1267-1272.
PedoeD.S., Walker J. M. Cardiovascular disease. In: Textbook of Medicine. Ed. R.L.Souhami,
J.Moxham. Chuchill Livingstone, Edinburgh—London—Melbourne and New York, 1990. —
P. 329-450.
Pellikka P.A. The natural history of adults with asymptomatic, hemodynamically significant
aortic stenosis//J. Amer. Coll. Cardiol. — 1990. — Vol. 15. — P. 1012—1018.
699
Pfeffer M.A., Braunwald E., Moye L.A. et al. on behalf of the SAVE Investigators. Effect of
captopril on mortality and morbidity in patients with left ventricular dysfunction after
myocardial infarction. Results of the Survival and Ventricular Enlargement Trial // N. Engl.
J. Med. - 1992. - Vol. 327. - P. 669-677.
PIOPED Investigatois: Value of the ventilation /perfusion scan in acute pulmonary embolism
I I JAMA. - 1990. - Vol. 263. - P. 2753-2759-
Podrtd P.J., Fogel K.I., Fuchs T. Ventricular arrhythmia in congestive heart failure // Amer. J.
Cardiol. - 1992. - Vol. 60. - P. 82G-87G.
Prinzmetal M., Kennamer R., Merliss R. et al. Angina pectoris. l.A variant form of angina
pectoris. Preliminary report//Amer. J. Med. — 1959- — Vol. 32. — P. 375—378.
Reeder G.S. Pericardial disease: Echocardiographic and hemodynamic aspects //Curr. Opin.
Cardiol. - 1989. - Vol. 4. - P. 417-423.
Report from the Committee of Principal Investigators. A cooperative trial in the primary
prevention of ischemic heart disease using clofibrate // Brit. Heart. J. — 1978. — Vol. 40. — P.
1069-1118.
Rogers W.J., Coggins C.J., Gersch В J. et al. Ten-year follow-up of quality of life in patients
randomized to receive medical therapy or coronary artery bypass graft surgery (CASS) I I
Circulation. - 1990. - Vol. 82. - P. 1647-1658.
Ross R.S., Lesch M., Braunvald E. In: Harrison’s Principles of Internal Medicine.Thorn
G.W. et al (ed.). — New York, Me Graw Book Co., 1977. — P. 568—606.
Ryan T.J. Rewascularization foor acute myocardial infarction. Strategies in need of revision
// Circulation. 1990. - Vol. 82. - Suppl. II. - P. 110-118.
Sagawa K. The end-systolic pressure-volume relation of the ventricle: definition, modification
and clinical use (ed.) // Idem. - 1981. — Vol. 63. — P. 1223—1227.
SHEP Cooperative Research Groupe. Prevention of stroke by antihypertensive drag treatment
in older persons with isolated systolic hypertension. Final results of the Sistolic Hyperten-
sion in the Elderly Program (SHEP) // JAMA. -1991.- Vol. 265. - P. 3255-3263.
Siebels J., Cappato R., Ruppel R. et al. Preliminary results of the Cardiac Arrest Study
Hamburg (CASH)//Amer. J. Cardiol. - 1993. - Vol. 72. - P. 109F-113F.
Smith P., Arnrsen H., Holme I. et al. The effect of warfarin on mortality and reinfarction
after myocardial infarction // N. Engl. J. Med. — 1990. — Vol. 323. — P. 147—152.
The SOLVD Investigators. Effect of enalapril on mortality and the development of heart
failure in asymptomatic patients with reduced left ventricular ejection fraction // N. Engl. J.
Med. - 1992. - Vol. 327. - P. 685-691.
Steering Committee of the Physisians’ Health Study Research Group: Final report on the
aspirin component of the ongoing Physicians’ Health Study I IN. Engl. J. Med. — 1989. —
Vol. 321- P. 129-135.
Steinberg D., IVitztum J.L. Lipoproteins and atherogenesis: Current concepts // JAMA.—
1990. - Vol. 264. - P. 3047-3052.
Steinberg J.S. Predicting arrhythmic events after acute myocardial infarction using the signal-
averaged electrocardiogram//Amer. J. Cardiol. — 1992. — Vol. 69. — P. 13—20.
Stevenson W.G., Stevenson L. Ж, MiddlekauffH.R. etal. Sudden death prevention on patients
with advanced ventricular dysfunction I I Circulation. - 1993. - Vol. 88. — P. 2953—2959.
Swan H.J., Ganz Ж, Forrester J. et al. Catheterization of the heart in man with the use of a
flow—directed balloon-tipped catheter // N.Engl.J.Med.— 1970.— Vol.283.— P.3—7.
Swedberg K., Held P., Kjekshus J. et al. on behalf of the CONSENSUS II Study Group.
Effects of the early administration of enalapril on mortality in patients with acute myocar-
dial infarction. Results of the Cooperative New Scandinavian Enalapril Survival Study II
(CONSENSUS II) // Idem. - 1992. - Vol. 327. - P. 678-684.
700
Talley J.D., Hurst J. Ж, King S.B. et al. Clinical outcome 5 years after attempted percutaneous
transluminal coronary angioplasty in 427 patients I I Circulation. — 1988. - Vol. 77. — P. 820—827.
Teichholz L.E., Kreulen T.N., Herman M. V., Bozlin R. Problems in echocardiographic vol-
ume determination: echocardiografic correlation I I Idem. — 1972. — Vol. 46. — Suppl. II. — P.
120-220.
Teo K., YusufS., Furberg C. Effect of prophylactic antiarrhythmic drug therapy on postmyo-
cardial infarction mortality//Eur. Heart J. — 1992. — Vol. 13. — Suppl. — P. 224—230.
TIMI Study Group. Comparison of invasive and conservative strategies after treatment with
intravenous tissue plasminogen activator in acute myocardial infarction: Results of the
thrombolysis in Myocardial Infarction (TIMI) phase II trial // N. Engl. J. Med. — 1989. —
Vol. 320. - P. 618-627.
Trials of Hypertension Prevention Collaborative Research Group. The effects of non-pharma-
cologic interventions on blood pressure in persons with high normal levels // JAMA. -
1992. - Vol. 267. - P. 1213-1220.
Vaughan- Williams E.M. A classification of antiarrhythmic actions reassessed after a decade of
new drugs//J. Clin. Pharmacol. — 1984. — Vol. 17. — P. 129—147.
Veterans Administration Coperative Study Group on Antihypertensive agents. Effects of treat-
ment on morbidity in hypertention // JAMA. — 1970. — Vol. 213. — P. 1143-1149.
Veterans Administration Coronary Artery Bypass Surgery Cooperative Study Group. Eighteen
year folow-up in artery bypass surgery for stable angina // Circulation. - 1992. - Vol. 86. —
P. 121-128.
Ватанабе A.M., Линдеманн Дж.П. (Watanabe А.М., Lindemann J.P.) Механизмы
адренергической и холинергической регуляции сократимости миокарда. В кн.:
Физиология и патофизиология сердца: Под ред. Н.Сперелакиса. — М.: Медицина,
1990. - Т. 2. - С. 124-168.
Weil М.Н., Shubin Н. Diagnosis and treatment of shock. Williams and Wilkins, Baltimore,
1967.
Weisman H.F., Healy B. Myocardial infarction expansion, infarct extension and re-infarc-
tion: pathophysiological concepts // Progr. Cardiovasc. Dis. — 1987. — Vol. 30. — P. 73—110.
Wilcox R. G., von der Lippe G., Olsson C. G. et al for the ASSET Study Group. Trial of tissue
plasminogen activator for mortality reduction in acute myocardial infarction: Anglo-Scan-
dinavian Study of Early Thrombolysis (ASSET) // Lancet. — 1988. — Vol. 2. — P. 525—530.
Williams D.O., Knatterud G., Chesebro J.H. et al. One-years results of the thrombolysis in
myocardial infarction investigation (TIMI) Phase II Trial I I Circulation. — 1992. — Vol. 85.
-P. 533-541.
Yusuf S., Furberg C.D. Effects of calcium channel blockers on survival after myocardial
infarction // Cardiovasc. Drug. Ther. - 1987. - Vol. 1. — P. 343—349.
Yusuf S., Teo K. Inotropic agents increase mortality patients with congestive heart failure
(abstr.) // Circulation. — 1990. - Vol. 82. — Suppl. - P. 673.
Yusuf S., Peto R., Lewis J. et al. Beta-blockade during and after miocardid infarction: an
overview of the randomized trials // Prog. Cardiovasc. Dis. — 1985. — Vol. 27. — P. 335—371.
Yusuf S., Wittes J., Friedman L. et al. Overview of results of randomized clinical trials in
heart disease. II. Unstable angina, heart failure, primary prevention with aspirin and risk
factor modification I I JAMA. — 1988. — Vol. 260. — P. 2259—2265.
Zardini P. Ventricular remodelling and infarct expansion // Amer. J. Cardiol. — 1993. — Vol. 72.
- P. 98G-106G.
ОГЛАВЛЕНИЕ
СПИСОК СОКРАЩЕНИЙ...................................3
ОТ АВТОРА...........................................5
ГЛАВА 1. КЛИНИЧЕСКАЯ АНАТОМИЯ СЕРДЦА И СОСУДОВ......8
ГЛАВА 2. БИОХИМИЯ И КЛЕТОЧНАЯ ФИЗИОЛОГИЯ
МИОКАРДА И МЕМБРАН............................... 24
ГЛАВА 3. КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ СЕРДЦА, ПЕРИФЕРИЧЕСКОГО
И КОРОНАРНОГО КРОВООБРАЩЕНИЯ ........;............35
ГЛАВА 4. КЛИНИЧЕСКОЕ ОБСЛЕДОВАНИЕ..................63
ГЛАВА 5. ИНСТРУМЕНТАЛЬНЫЕ МЕТОДЫ ДИАГНОСТИКИ.......93
ГЛАВА 6. ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА У ВЗРОСЛЫХ......170
ГЛАВА 7. ПРИОБРЕТЕННЫЕ ПОРОКИ СЕРДЦА..............203
ГЛАВА 8. АТЕРОСКЛЕРОЗ.............................261
ГЛАВА 9. ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА...............293
ГЛАВА 10. АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ................400
ГЛАВА 11. СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ...............483
ГЛАВА 12. ШОК.....................................563
ГЛАВА 13. ЗАБОЛЕВАНИЯ МАЛОГО КРУГА КРОВООБРАЩЕНИЯ.595
ГЛАВА 14. ПЕРИКАРДИТЫ ............................642
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ...............................675
СПИСОК ЛИТЕРАТУРЫ..................................693
ВИРОБНИЧЕ ВИДАННЯ
Амосова Катерина Миколашна
КЛ1ШЧНА КАРДЮЛОГ1Я
УДВОХ ТОМАХ
ТОМ I
Ки!в, “Здоров’я”, “Книга-Плюс”
(РосШською мовою)
Редактор 1.М.Грубрша
ХудожнШ редактор М.П.Черненко
Техтчний редактор Ж.М.Головко
Коректори О.П.Ломачинська,
1.Л.Златоус.
Пщп. до друку 10.11.97. Формат 60х84/)6.
Пап!р друк. Гарн. Таймс. Друк, офсет.
Ум.-друк. арк. 40,92. Обл.-вид. арк. 53,83.
Тираж 5000 прим. Зам. 7-242
Видавництво “Здоров’я”, 252601, МСП, м. Ки!в-1,
вул. Олеся Гончара, 65.
Свщоцтво видавництва “Здоров’я” № 02473139 вщ 02.11.95.
Видавництво “Книга-Плюс”,
252001, м.Ки!в-1, а/с 222.
Свщоцтво видавництва “Книга-Плюс” № 23164170 вщ 17.03.95.
Кишське акщонерне товариство «Книга».
254655, МСП, Киш-53, вул. Артема, 25.
Амосова К.М.
Кл1тчна кардюлопя. - T.I. - К.: Здоров’я, 1997. - 704 с., и.
А62 ISBN 5-311-00891-1
У книз! викладено сучасн! дан! про етюлопю, патогенез, клЫку, д!агности-
ку, л!кування та профилактику ряду захворювань серцево-судинно! системи —
вад серця, атеросклерозу, !шем!чно! хвороби серия, артер!ально! ппертензи,
серцево! недостатносп, хвороб малого кола кровооб!гу, перикардиев. Висв!т-
лення питань юишчно! кардюлоп! грунтуеться на короткому викладен! ос-
новних положень фундаментальних дисциплш — анатомп, 6ioxiMii, нормаль-
но! та патолопчно! ф1з!ологп, що стосуються серцево-судинно! системи. В ок-
ремих роздщах подано основн! вщомосп про клшчн! та сучасн! шструмен-
тальн! методи дослщження та !х д!агностичне значения, а також про юйшчну
фармаколопю л!карських засоб!в, що застосовуються в кард!ологп.
А4108Д0-°^1нфоРм. лист ББК 54.101