Author: Меньшиков В.В. Лукичева Т.И. Михайлов Ю.Е. Берсенева Е.А.
Tags: формы лекарственных средств медицинские материалы оборудование здравоохранение медицинские науки диагностика технология учебное пособие
ISBN: 978-5-7695-3394-5
Year: 2007
СРЕДНЕЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАНИЕ
КЛИНИКО-ЛАБОРАТОРНЫЕ
АНАЛИТИЧЕСКИЕ
ТЕХНОЛОГИИ
И ОБОРУДОВАНИЕ
Под редакцией профессора В. В. МЕНЬШИКОВА
Допущено
Министерством образования Российской Федерации
в качестве учебного пособия для студентов
образовательных учреждений среднего
профессионального образования
ACADEMA
Москва
Издательский центр «Академия»
2007
УДК 615.478(075.32)
ББК 5я723
К49
Авторы:
Т. И.Лукичева (разд. I и II), В. В. Меньшиков (разд. I и II);
Ю. Е. Михайлов (разд. Ill), Е. А. Берсенева (разд. III)
Рецензенты:
зав. лабораторией иммунологии и регуляторных механизмов в хирургии
Российского научного центра хирургии РАМН, профессор, д-р мед. наук
Л. И. Винницкий',
преподаватель биохимии высшей категории медицинского училища
при городской клинической больнице им. С. П. Боткина Г. П. Сасс
Клинико-лабораторные аналитические технологии и
К49 оборудование : учеб, пособ. для студ. средн, проф. учеб, заведе-
ний / [Т. И. Лукичева и др.]; под ред. проф. В. В. Меньшикова. —
М. : Издательский центр «Академия», 2007. — 240 с.
ISBN 978-5-7695-3394-5
Рассмотрены аналитические технологии и оборудование, применяе-
мые в клинико-диагностических лабораториях учреждений здравоохране-
ния. Подробно изложены принципы методов исследования, описаны про-
цедуры подготовки проб биоматериалов для анализа, детально охаракте-
ризованы особенности и последовательность аналитических процедур при
различных видах лабораторных исследований. Представлены конструктив-
ные характеристики соответствующих видов современного лабораторного
оборудования, правила работы на приборах, рекомендации по их теку-
щему обслуживанию.
Для студентов средних профессиональных учебных заведений. Может
быть использовано как справочное пособие в работе медицинских техно-
логов, техников и лаборантов в клинико-диагностических лабораториях.
УДК 615.478(075.32)
ББК 5я723
Оригинал-макет данного издания является собственностью
Издательского центра «Академия», и его воспроизведение любым способом
без согласия правообладателя запрещается
ISBN 978-5-7695-3394-5
© Коллектив авторов, 2007
© Образовательно-издательский центр «Академия», 2007
© Оформление. Издательский центр «Академия», 200 7
ПРЕДИСЛОВИЕ
Клинические лабораторные исследования выполняются в це-
лях получения наиболее точного объективного представления о
состоянии внутренней среды организма пациента для рациональ-
ного решения диагностических и лечебных задач медицинской
помощи. Лабораторные результаты стали важным инструментом
лечащего врача.
С развитием лабораторных технологий клиническая медицина
получает все более разностороннюю и полную информацию о
состоянии пациентов, что приводит к повышению эффективно-
сти диагностики и лечения больных.
Признание лабораторной информации неотъемлемой частью
клинической аргументации накладывает на работников клинико-
диагностических лабораторий высокую ответственность за каче-
ство своей работы, поскольку лабораторная ошибка может по-
влечь за собой неправильные действия лечащего врача и нанести
серьезный ущерб здоровью пациента. Залогом аналитической
надежности лабораторных результатов служат знания и умения
специалистов, их хорошая лабораторная работа.
Современные клинические лабораторные технологии посто-
янно совершенствуются на основе достижений фундаменталь-
ных наук — биологии, физики, химии и аналитического прибо-
ростроения. Применение этих технологий на практике требует от
лабораторных специалистов глубокого понимания принципиаль-
ных основ технологического процесса и точного соблюдения ус-
ловий, обеспечивающих получение надежных результатов иссле-
дований.
В современных условиях в связи с реформой здравоохранения
наибольшее значение приобретает серьезная теоретическая и прак-
тическая подготовка специалистов со средним образованием, ко-
торые выполняют основную аналитическую работу в лаборатории.
Авторы учебного пособия стремились применительно к каж-
дой аналитической технологии представить синтез необходимых
теоретических сведений и практических рекомендаций, основан-
ных на обобщении данных специальной литературы и опыта спе-
циалистов. Авторы надеются, что материал этой книги будет по-
лезен будущим медицинским лабораторным техникам и медицин-
ским технологам как в процессе обучения, так и при последу-
ющей работе в клинико-диагностических лабораториях.
ВВЕДЕНИЕ
Основное назначение клинических лабораторных исследований
биологических материалов пациентов состоит в изучении их со-
става в целях обнаружения возможных отклонений от состояния,
присущего здоровому человеку. При этом необходимо уточнить
наличие или количественно оценить содержание определенного
компонента (или группы компонентов) биоматериала, имеюще-
го наиболее тесную причинно-следственную связь с предполагае-
мым заболеванием.
Биологические материалы, исследуемые в клинико-диагно-
стических лабораториях, представляют собой.сложные системы,
состоящие из жидких сред, в которых находится смесь веществ и
клеточных элементов. С позиций аналитики в них выделяют иско-
мый компонент — аналит, прочие компоненты — конкомитанты
и основную среду — матрикс. Одни компоненты биоматериалов
человека имеют эндогенное происхождение, т. е. образуются внут-
ри самого организма, другие — экзогенное, т. е. проникают из
внешней среды.
Эндогенные компоненты отражают структуру и функциональ-
ную характеристику органов и тканей организма человека.
Экзогенные компоненты поступают в организм из внешней сре-
ды и носят характер неорганических или органических веществ,
не свойственных организму человека, микроорганизмов (бакте-
рий, вирусов, грибов) и паразитарных организмов (на опреде-
ленных стадиях развития). Отдельные группы компонентов соот-
ветственно их природе служат объектами изучения определенных
дисциплин лабораторной медицины (табл. В.1).
Поскольку в биоматериалах человека содержится сложная смесь
различных веществ и клеток, в процессе клинического лабора-
торного исследования приходится решать несколько аналитиче-
ских задач. Среди них разделение биологической смеси веществ и
клеток, выделение из нее нужного компонента, детекция (иден-
тификация) искомого компонента, количественная оценка со-
держания определенного компонента. Решение этих задач дости-
гается путем применения аналитических технологий.
Клинико-лабораторная аналитическая технология — это сово-
купность процедур, проводимых с образцами биоматериала па-
4
Таблица B.l
Объекты исследования дисциплин лабораторной медицины
Вид компонентов биоматериалов человека Компоненты биоматериалов (аналиты) Раздел лабораторной медицины
Собственные клеточные элементы организма Эндогенные химические компоненты Биологические факторы распознавания и защиты Носители генетической информации Экзогенные химические компоненты Экзогенные патогенные организмы Клетки крови Клетки тканей Субстраты, метаболиты, ферменты, коферменты Гуморальные регуляторные компоненты: гормоны, медиаторы Факторы гемостаза и тромболизиса: ферменты, тромбоциты Антигены, антитела, компоненты комплемента, цитокины, ростовые факторы, лимфоциты, макрофаги Гены, нуклеиновые кислоты, нуклеотиды и их последовательности Токсины, металлы, спирты, Лекарственные препараты Наркотические вещества Бактерии Вирусы Грибы Паразиты Гемоцитология Цитология Клиническая биохимия Лабораторная эндокринология, нейрохимия Гемостазиология (коагулология) Клиническая лабораторная иммунология Молекулярная биология Лабораторная токсикология Фармакохимия, фармакокинетика, терапевтический лекарственный мониторинг Лабораторная наркология Бактериология Вирусология Микология Паразитология
циента и представляющих собой воздействия физического, хими-
ческого и биологического характера, направленные на разделение
биологической смеси веществ и клеток, обнаружение, идентифи-
кацию и/или количественную оценку искомого компонента — ана-
лита.
5
Аналитическая технология имеет в своей основе определен-
ный аналитический принцип, т. е. закономерное взаимодействие
используемых для анализа физических, химических или биологи-
ческих факторов с искомым аналитом, обусловленное известны-
ми свойствами этого аналита. Во многих современных аналити-
ческих технологиях сочетаются несколько видов воздействий на
компоненты биоматериала, что расширяет возможности лабора-
торного анализа, позволяя многосторонне учитывать различные
свойства исследуемых аналитов, а иногда и одновременно опре-
делять несколько аналитов.
Клиническая лабораторная аналитика — это совокупность ана-
литических технологий, применяемых для анализа биоматериалов
пациентов в клинико-диагностических лабораториях учреждений
здравоохранения. Современная клиническая лабораторная анали-
тика является результатом длительного исторического процесса,
в ходе которого происходило постепенное восприятие достижений
фундаментальных наук — физики, химии, биологии — и творче-
ское их преобразование в форму лабораторных технологий и при-
годных для широкого практического использования средств анали-
за. В итоге этого развития анализ биоматериалов пациентов, имев-
ший в далеком прошлом характер примерной, субъективной оцен-
ки, превратился в строго регламентированный процесс, опира-
ющийся на научные представления и на объективную регистрацию
качественной характеристики или количественной оценки состава
биопробы или содержания в ней отдельного компонента.
Сфера клинической лабораторной аналитики постоянно раз-
вивается. В совершенствовании клинических лабораторных техно-
логий прослеживается сочетание нескольких тенденций:
применение новых технологических принципов и приемов,
основанных на достижениях фундаментальных медико-биологи-
ческих наук, что позволяет постоянно расширять диапазон ана-
литов, используемых в целях диагностики патологии человека;
совершенствование практических качеств технологий в направ-
лении повышения их аналитической надежности, ускорения по-
лучения результатов, упрощения условий их применения на
практике, в том числе и вне лаборатории, а также за счет приме-
нения роботизированных и автоматизированных систем для вы-
полнения аналитических технологий с минимальной затратой руч-
ного труда, лабораторных информационных систем для управле-
ния всем процессом лабораторного обеспечения потребностей
диагностики болезней и лечения пациентов;
повышение чувствительности аналитических методов, что по-
зволяет улавливать малейшие отклонения в составе биоматери-
ала, содержании или соотношении отдельных компонентов, ис-
пользуя минимальные количества биоматериалов.
РАЗДЕЛ I. ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ
В ЛАБОРАТОРНОЙ АНАЛИТИКЕ
Гл а в а 1
ОПТИЧЕСКИЕ МЕТОДЫ ДЕТЕКЦИИ И КОЛИЧЕСТВЕННОГО
ОПРЕДЕЛЕНИЯ АНАЛИТОВ В БИОМАТЕРИАЛАХ
1.1. Методы фотометрии
Физические свойства света. Основные понятия. Многие опреде-
ления в клинической лабораторной диагностике основаны на из-
мерении лучистой энергии, испускаемой, поглощаемой, рассеи-
ваемой и отражаемой в определенных условиях. Методы исследо-
вания веществ, основанные на их (веществ) способности порож-
дать оптическое излучение или взаимодействовать с ним, называ-
ются оптическими.
Оптическое излучение представляет собой электромагнитные
колебания определенного диапазона частот, распространяющих-
ся в пространстве со скоростью с, которая в вакууме составляет
3 • 108 м/с.
Понятие «электромагнитное излучение» относится ко всем ви-
дам лучистой энергии: у- и рентгеновскому излучению, ультра-
фиолетовому, видимому и инфракрасному свету, а также к ра-
диоволнам. Самая короткая длина волны и, соответственно, са-
мые большие кванты — у у-лучей, испускаемых радиоактивными
веществами; самые длинные волны, и, соответственно, самые
малые кванты — у радиоволн.
Светом обычно называют ту область лучистой энергии, кото-
рая видна человеческим глазом, распространяя это понятие на
близлежащие области ультрафиолетового и инфракрасного спек-
тра света. Свет — одна из форм электромагнитного излучения,
которое распространяется в виде волн и характеризуется часто-
той, т. е. числом колебаний в единицу времени (v), длиной вол-
ны (Л.) и постоянной скоростью распространения в вакууме с. Эти
величины связаны между собой соотношением: v = с/Л..
Лабораторные специалисты обычно выражают длину волны
света в метрических единицах — нанометрах: 1 нм = 1 ммк = 10 А=
= 10“9 м = 10~7 см. Человеческий глаз различает (видит) лучистую
энергию в диапазоне примерно от 380 до 750 нм. При помощи
приборов можно измерить свет и в более коротковолновой (ульт-
7
рафиолетовой) и более длинноволновой (инфракрасной) облас-
ти спектра.
Солнечный свет — это смесь различных длин волн, которые
человеческий глаз воспринимает как белый. Различные цвета пред-
ставляют собой компоненты солнечного света, соответствующие
отдельным участкам его спектра (табл. 1.1).
Физические свойства света сложны. В одних случаях он ведет
себя как электромагнитная волна, в других — это поток матери-
альных частиц — фотонов. Энергия светового потока — энергия
фотонов, или энергия излучения, прямо пропорциональна его
частоте и обратно пропорциональна длине волны. Спектр излуче-
ния — функция распределения электромагнитной энергии в за-
висимости от частоты и длины волны. Излучение энергии на од-
ной частоте и соответствующей ей длине волны называется моно-
хроматическим излучением.
При взаимодействии света с веществом могут наблюдаться два
случая:
1) вещество достаточно прозрачно, поэтому свет, проходя че-
рез него, поглощается очень слабо. Отношение скорости света в
вакууме к его скорости в данном веществе представляет показа-
тель преломления этого вещества. Поскольку он во многом зави-
сит от длины волны, свет при прохождении через прозрачную
стеклянную призму разлагается в спектр по длинам волн. По обе
стороны от видимого спектра располагаются невидимые лучи —
ультрафиолетовые и инфракрасные;
2) вещество поглощает значительную часть световой энергии.
Энергия света согласно квантовой теории поглощается квантами.
При этом отдельные молекулы, обладающие совокупностью близко
Таблица 1.1
Спектр солнечного света
Длина волны, нм Название диапазона Воспринимаемый глазом цвет
Менее 380 Ультрафиолетовый Невидимый
380-440 Видимый Фиолетовый
440-500 » Голубой
500-580 » Зеленый
580-600 » Желтый
600-620 » Оранжевый
620-750 » Красный
750-4 000 Ближний инфракрасный Невидимый
4 000-20 000 Дальний инфракрасный »
8
Оптические методы
Рис. 1.1. Классификация оптических методов исследований
расположенных один от другого энергетических уровней, могут,
поглощая кванты света, переходить с относительно низкого энер-
гетического уровня на более высокий. В таком «возбужденном»
состоянии они способны флюоресцировать или подвергаться фо-
тохимическим превращениям. В результате «возбуждения» они ис-
пускают электромагнитные волны разнообразных частот, образу-
ющих спектр испускания. При прохождении света через слой ве-
щества оно поглощает те длины волн, которые само способно
излучать в определенных условиях. Так образуется спектр поглоще-
ния. Таким образом, оптические методы количественного анализа
веществ основаны на регистрации изменений, происходящих с
лучом света при прохождении его через исследуемый раствор.
Классификация оптических методов количественного анализа
в зависимости от принципа измерения представлена на схеме
(рис. 1.1).
Рефрактометрия. Это метод измерения показателя преломле-
ния света при прохождении его через оптически неоднородные
среды. Ранее рефрактометрию применяли для определения содер-
жания общего белка в плазме или сыворотке крови. Вследствие
измерения при этом преломления света не только белками, но и
небелковыми компонентами биожидкости рефрактометрический
анализ дает ложнозавышенные результаты и не рекомендуется к
применению в клинико-диагностических лабораториях.
Поляриметрия. Метод основан на свойстве прозрачных веществ
вращать плоскость поляризованного луча света. В настоящее вре-
мя этот метод применяют в миниатюризованном лазерном поля-
9
риметре МП 1010 (EKSMA; Латвия) для определения глюкозы в
моче.
Принципы и виды фотометрии. Фотометрия — это измерение
интенсивности света, прошедшего через раствор. Фотометри-
ческие методы — это методы количественного анализа, осно-
ванные на переведении аналитов в поглощающие свет соедине-
ния с последующим определением их количества путем изме-
рения светопропускания или светопоглощения растворов. При
фотометрии измерение энергии светового потока происходит с
помощью фотоэлектрических приемников оптического излуче-
ния, или фотодетекторов, преобразующих световую энергию в
электрический сигнал. С помощью этих приборов можно опре-
делять концентрацию аналитов по окраске растворов окрашен-
ных веществ.
Колориметрия. Если при измерении не выделяется узкий диа-
пазон длин волн, а измеряются характеристики всего светового
потока, то такой метод называют колориметрическим. Метод пред-
ставляет собой измерение интенсивности цвета раствора неизвест-
ной концентрации путем сравнения его с интенсивностью цвета
стандартного раствора. Предполагается, что толщину слоя одного
из этих растворов изменяют, пока не будет достигнуто визуальное
(видимое на глаз) равенство окрасок.
Спектрофотометрия. При выделении характерного для погло-
щения данным веществом оптического диапазона и проведении
измерения на определенной длине волны речь идет о собственно
фотометрическом методе. Фотометрию можно выполнять в раз-
ных вариантах: если есть возможность выделения только одного
или нескольких спектральных интервалов с помощью светофильт-
ров, то говорят о фильтровом фотометре', если существует моно-
хроматор — устройство, позволяющее выделять пучок света с
любой длиной волны, то говорят о спектрофотометрии.
Поток световой энергии, переносимый через единицу площа-
ди, называется интенсивностью потока световой энергии. Часть
света, которая падает на оптическую среду (например, раствор
исследуемого вещества) отражается, другая поглощается или рас-
сеивается, а остальная проходит насквозь. Если интенсивность
падающего потока световой энергии обозначить как 10, интенсив-
ность отраженного света — 1Г, поглощенного — 1а, рассеянного —
Id, а прошедшего — то Io= Ir+ Ia + Id + I,.
При измерении концентрации исследуемого вещества фотомет-
рическим методом подбирают такие условия, при которых отра-
женным и рассеянным светом можно пренебречь. Поэтому количе-
ство прошедшего света равно количеству падающего за вычетом
поглощенного. Отношение интенсивности потока световой энер-
гии, прошедшего через слой исследуемого раствора /„ к интенсив-
ности падающего (на кювету) потока световой энергии Zo называ-
10
ется коэффициентом пропускания Т = It/I0, или Т - 100 % (/,//0)-
Величина D = lgl/Тназывается оптической плотностью. Величина
оптической плотности безразмерна, но может исчисляться в бел-
лах (Б). Для обозначения оптической плотности в инструкциях к
реагентам и в зарубежной литературе по биохимическим исследо-
ваниям используют символ А. В отечественной литературе для обо-
значения оптической плотности стандартизован символ D.
Оптическая плотность — мера непрозрачности раствора — за-
висит только от толщины поглощающего слоя (/), или внутрен-
него размера кюветы (внутренняя длина кюветы, см); концентра-
ции поглощающего вещества (С, г/л) и поглощающей способно-
сти исследуемого вещества в растворе (k): D = klC. Эта зависимость
известна под названием закона Бугера—Ламберта — Бера. Коэф-
фициент к — показатель поглощения, постоянная величина, за-
висящая от длины волны и природы вещества.
Если длину кюветы выражают в сантиметрах, концентрацию
вещества в растворе в моль/л, то к называют молярным показате-
лем поглощения и обозначают е;_. Молярный показатель поглоще-
ния является константой и характеризует свойство вещества по-
глощать свет на данной длине волны оптического излучения при
определенных условиях: температуре, pH, растворителе и т.д. Его
выражают в л/(моль-см)-1, а численное значение, таким обра-
зом, равно оптической плотности D раствора с концентрацией
вещества 1 моль/л при длине кюветы 1 см. В системе СИ моляр-
ный показатель поглощения выражается в м2/моль, т. е. в величи-
не оптической плотности, которой обладал бы раствор, на 1 м2
поверхности которого приходится 1 моль вещества. Численное зна-
чение е;_в 10 раз меньше, чем при размерности лДмоль-см)"1.
Светопропускание имеет обратную и логарифмическую связь с
концентрацией поглощающего вещества. Оптическая плотность,
характеризующая поглощение, в соответствии с законом Буге-
ра—Ламберта—Бера прямо пропорциональна концентрации рас-
творенного вещества. При фиксированной длине кюветы / (в кли-
нической химии принята стандартная кювета 1 см) оптическая
плотность D и концентрация растворенного вещества С связаны
через молярный показатель поглощения г;_. Будучи специфичным
для каждого вещества, он зависит от структуры вещества, харак-
теризует собой способность молекул вещества поглощать свет с
длиной волны А. и не зависит от концентрации вещества. Показа-
тель является функцией длины волны света, и поэтому зависи-
мость е(А) может служить количественной характеристикой спек-
тра вещества.
Каждое вещество имеет свой спектр поглощения. Для разных
форм вещества он разный, например для окисленных и восста-
новленных форм никотинамидаденинпиридиндинуклеотидов и их
фосфатов. Так, при длине волны 334 нм, е334 для НАДН составля-
11
ет 6,18- 103 л/(моль-см)-1, а при длине волны 340 нм, е340 равен
6,22-103 лДмоль-см)4.
Величину 8;, используют для характеристики веществ, оценки
их чистоты и для сравнения чувствительности измерений различ-
ных производных веществ.
Часто линейная зависимость между концентрацией вещества и
соответствующей ей величине оптической плотности в данных
условиях, т. е. соответствие закону Бугера—Ламберта —Бера, имеет
место лишь на определенном участке калибровочного графика,
например в его начале, до определенной концентрации. В случае
использования коэффициента поглощения к = D/С, концентра-
ция вещества для данного диапазона С = D/(kl). Так как к и / в
данном случае постоянны, то их можно заменить параметром F=
= \/(kl), который называют фактором расчета. В этом случае фор-
мула упрощается: С - FD.
Для того чтобы вычислить величину F, проводят калибровку —
измеряют в соответствии с методикой оптические плотности (Д)
нескольких калибровочных растворов с известными концентра-
циями (С) и сопоставляют графически полученные значения D
и С. Для этого строят градуировочный, или калибровочный гра-
фик: на миллиметровой бумаге изображают систему координат,
на которой по оси абсцисс (ось «х») откладывают значение кон-
центраций вещества (С), по оси ординат (ось «у») — соответству-
ющие им величины оптической плотности с поправкой на холо-
стую пробу (АД). Если они пропорциональны друг другу, говорят,
что калибровочный график — линейный и приведенной выше фор-
мулой можно пользоваться. Если пропорциональности нет, гово-
рят, что зависимость — нелинейная и закон Бугера—Ламберта —
Бера к данным условиям не применим.
Найти фактор расчета F можно несколькими способами.
1. Используют линейную часть калибровочного графика. Для
этого на калибровочном графике в линейной части выбирают точ-
ку «л» и от нее проводят перпендикуляры к осям х и у. В точке
пересечения перпендикуляра с осью х находят концентрацию оп-
ределяемого вещества Сп, а с осью у — соответствующую этой
концентрации величину оптической плотности АД„. Фактор Fn =
= Cn/\Dn.
2. Исключительно для линейной части калибровочного графи-
ка по сходной с указанной ранее формуле для Fn рассчитывают
значение фактора расчета F1; F2, ..., Д„для каждого калибровоч-
ного раствора с концентрацией С1; С2, Сп. Далее рассчитывают
среднюю арифметическую для фактора расчета:
п
F =2=1--.
п
12
Закон Бугера—Ламберта—Бера лежит в основе всех методов
колориметрии и фотометрии, независимо от того, в какой обла-
сти спектра — видимой, ультрафиолетовой или инфракрасной —
выполняют измерение, а также от того, каким способом измеря-
ют интенсивность светового потока и как проводят расчет: по дан-
ным измерений на одной или нескольких длинах волн. Современ-
ные фотоэлектроколориметры, фотометры и спектрофотометры
представляют собой настоящие анализаторы со встроенными мик-
ропроцессорами и компьютерами, имеющими программное обес-
печение для проведения расчетов результатов и в тех случаях, когда
калибровочный график не имеет линейного характера в соответ-
ствии с алгоритмами, характерными для поведения аналита и
конкретного продукта реакции в данном методе.
Остановимся еще на некоторых видах фотометрии, используе-
мых при выполнении различных исследований. Ранее всего были
созданы фотометры и спектрофотометры, в которых луч света от
источника излучения идет горизонтально — горизонтальная фо-
тометрия.
В 1968 г. финский врач О.Суованиеми разработал метод верти-
кальной фотометрии и основанный на нем полуавтоматический
анализатор для биохимических исследований (FP 9, последующие
варианты прибора — FP 900, FP 900М). При вертикальной фото-
метрии луч света идет снизу вверх или сверху вниз, а у измери-
тельной кюветы только одна грань — нижняя, функцию верхней
грани выполняет мениск жидкости. Было показано что поскольку
общая масса абсорбирующего свет вещества в растворе всегда
размещена между нулевым и верхним уровнями, то независимо
от вертикального распределения молекул вещества и количества
растворителя в кювете величина абсорбции света А равна специ-
фической абсорбции исследуемого вещества (а), умноженной на
его массу (т) и деленной на площадь поперечного сечения кюве-
ты (5):
Поэтому случайное или предусмотренное методикой разбавле-
ние пробы не сказывается на результатах, так как уменьшение кон-
центрации компенсируется увеличением столба жидкости (рис. 1.2).
Выделенный интерференционным светофильтром монохромати-
ческий свет передается с помощью стекловолоконной оптики и
проходит через коллимационные линзы (линзы, превращающие
расходящиеся пучки света в параллельные) и через раствор в
кювете. Реакцию выполняют в планшетах, состоящих в зависимо-
сти от конструкции и назначения прибора из 6, 8, 9 или 96 и
более кювет, которые являются одновременно емкостями для
проведения реакции и фотометрии. В одноканальных фотометрах
13
Общий объем раствора в кювете, мкл
б
Рис. 1.2. Схематическое представление зависимости результатов измере-
ния в вертикальном фотометре от общего количества вещества, абсор-
бирующего свет (а), и отсутствие зависимости от длины пробега луча в
исследуемом растворе и концентрации вещества в растворе (б)
для вертикальной фотометрии измерение оптической плотности
происходит в каждой из кювет последовательно. В многоканальных
фотометрах для иммуноферментных исследований (ридерах, счи-
тывателях) детекция прошедшего света происходит несколькими
детекторами одновременно в нескольких кюветах.
Хотя в клинико-диагностических лабораториях достаточно ши-
роко используют простые спектрофотометры, в том числе для
ручной работы, основная тенденция развития технической мыс-
ли идет в направлении создания специализированных лаборатор-
14
ных приборов для клинико-диагностических лабораторий и уни-
версальных спектрофотометров для научных исследований, воз-
можности которых по некоторым пунктам выходят за пределы
потребностей клинической лаборатории.
Современный спектрофотометр — это полностью компьюте-
ризированный полуавтоматический или автоматический прибор,
который может проводить измерения с точным выделением тре-
буемой длины волны монохроматического света в очень широком
диапазоне длин волн — ультрафиолетовом, видимом и инфра-
красном. Прибор основан на двухлучевой схеме (см. с. 20, «Устрой-
ство фотометров и спектрофотометров»). Компьютер обрабатыва-
ет результаты измерений, сохраняет их в электронной форме и
выдает на дисплее. Для получения сопоставимых спектров для раз-
личных диапазонов длин волн прибор снабжен программой, ко-
торая обеспечивает получение равномерных по ширине пучков
монохроматического света по всему рабочему диапазону.
Турбидиметрия. Это метод фотометрического измерения по-
глощения света взвешенными в растворе частицами определяемо-
го вещества, т. е. измерение света, прошедшего через мутный рас-
твор, подобно измерению абсорбции при фотометрии в направ-
лении прохождения света. Поэтому в качестве турбидиметров можно
использовать большинство фотометров для ручных и полуавтома-
тических измерений и биохимических автоанализаторов, основан-
ных на фотометрической детекции. Чаще всего такие измерения
используют в методах гомогенного иммунохимического анализа,
например, при определении индивидуальных белков на основе
реакции «антиген —антитело». Особенностью таких определений
является нелинейный характер калибровочного графика и расчет
результатов в соответствии с алгоритмами и программным обес-
печением для нелинейных графиков, если таковые встроены в
фотометр.
Отражательные фотометры, или рефлектометры. Это особый
вид фотометрических устройств для количественного измерения
света, отраженного поверхностью (рис. 1.3). В клинической лабо-
раторной диагностике они находят применение в «сухой химии»,
когда цветную биохимическую реакцию проводят на полоске,
в результате чего определенная ее зона окрашивается (см. раздел
«Технологии и средства анализа по месту лечения»), В качестве
источников света в таких системах использованы светодиоды, из-
лучающие свет той длины волны, которая специально подобрана
для определенной цветной реакции на исследуемой зоне диагно-
стической полоски. Для детекции света, отраженного от окрашен-
ных зон полоски, можно применять измерительные головки, вос-
принимающие свет спустя отрезок времени, соответствующий ско-
рости развития окрашивания зоны, предназначенной для детек-
ции определенного аналита. Особенность отражательной фотомет-
15
Аналого-цифровой
Рис. 1.3. Схематическое представление процесса измерения и обработки
результата в отражательном фотометре:
ф — красный; — оранжевый; Q — зеленый
рии заключается в том, что нужно измерить сумму световых пото-
ков, которые отразились от исследуемой поверхности в разных
направлениях.
Предварительно свет надо собрать в одно место. Для этого ис-
следуемый объект помещают в сферу (шар), внутренние стенки
которого равномерно отражают все цвета спектра. Лучи света, от-
раженные и рассеянные в разных направлениях, многократно от-
ражаются от внутренней поверхности шара, внутри которого со-
здается равномерная освещенность, интенсивность которой оп-
ределяется суммой всего отраженного исследуемой поверхностью
света. Сфера усредняет свет по всем направлениям. Фотоприемник
вмонтирован в сферу и фиксирует освещенность внутри нее.
Методы фотометрических измерений. Как правило, для фото-
метрии выбирают ту область спектра, где поглощение максималь-
но, обычно это увеличивает точность количественного измерения
и повышает его чувствительность. Однако, с другой стороны, оп-
тическая плотность не должна быть слишком большой, иначе ко-
личество прошедшего света мало', соответственно падает и стано-
вится ненадежным сигнал фотоприемника. Кроме того, длину
волны выбирают так, чтобы по возможности уменьшить интер-
ференцию (мешающее влияние) посторонних веществ. Так, ще-
лочной пикрат при определении креатинина имеет пик в види-
мой области при длине волны 480 нм, но реактив сравнения (холо-
стой опыт) сильно абсорбирует свет с длиной волны менее 500 нм,
поэтому для измерения выбирают светофильтр 520 нм, что умень-
16
шает влияние холостой пробы, улучшает точность и правильность
результата.
Желательно, чтобы в выбранном для измерения спектральном
участке кривая была по возможности горизонтальной, тогда не-
которая немонохроматичность измерительного пучка мало сказы-
вается на результатах. Если же она приходится на «склон» пика,
то оказывается, что внутри данного пучка одни участки сильно
поглощают свет, другие — мало, это приводит к тому, что закон
Бугера—Ламберта —Бера не выполняется. Основной способ уст-
ранения мешающего влияния посторонних веществ и факторов
(интерференции) — это вычитание оптической плотности холо-
стой пробы из опытной.
Обычно холостую пробу готовят так же, как и исследуемую
(опытную), с той разницей, что в нее не добавляют анализируе-
мый материал, либо ставят реакцию таким образом, что в содер-
жащей биоматериал и реактивы холостой пробе специфическая
реакция, как в опытной пробе, не развивается.
Можно независимо измерить оптическую плотность опытной
(А«,) и холостой (Dbiank) проб, а затем вычесть одну из другой
либо установить начальную точку отсчета фотометра (100 % про-
пускание) по холостой пробе. Первый способ более трудоемок,
но имеет преимущество в том, что необычное отклонение «фона»,
которое может быть признаком неправильного выполнения мето-
дики, сразу становится очевидным.
Интерференцию вследствие попадания загрязнений, неболь-
шой мутности и царапин на стенках кюветы можно исключить
или уменьшить, измеряя оптическую плотность на двух или трех
длинах волн. По существу, это шаг в сторону хемометрии — высо-
котехнологического метода, который предполагает измерение на
многих длинах волн и компьютерную обработку результатов, с тем
чтобы вычленить небольшой полезный сигнал на фоне многочис-
ленных помех.
В двухволновом м е т о д е измерения делают на максиму-
ме пика (опорная, или основная, длина волны) и на уровне его
основания (поддерживающая длина волны), полагая, что любые
помехи в равной степени сказываются и на поглощении света,
и на той и на другой длине волны, а исследуемое вещество специ-
фически поглощает только на одной из них. Это так называемый
бихроматический анализ, который широко применяется во мно-
гих приборах.
В трехволновом методе делают следующие измерения:
одно до начала пика, а другое после него, затем на соединяющей
их прямой находят то место, которое соответствует пику, и эту
величину вычитают из значения для опытной пробы. При опреде-
лении гормонов используют так Hawwwiwiiyw’^^'^^TTCT’TrKop-
рекцию Аллена: делают три измерф^щй^^|йМ«йШбвги:®®й^'Ж)! и
1т
$
320 нм, «коррегированную» оптическую плотность Dcor вычисля-
ют по формуле:
Dcor= Дзоо _ (^280 + Аго)/2-
Различают измерения в конечной точке реакции, т.е.
когда реакция уже завершилась, и изменение оптической плотно-
сти более не происходит в течение некоторого периода времени
(реакция вышла на плато). Период выхода оптической плотности
на плато и его продолжительность могут быть иногда довольно дли-
тельными, что имеет различное значение, в зависимости от того,
каким образом выполняются измерения — ручным или автомати-
ческим. При работе ручными методами выбирают такие методы,
когда оптическая плотность в конечной точке реакции не изменя-
ется в течение длительного времени (10, 30 мин и более), для того
чтобы можно было точно выполнить достаточно большую серию
измерений. Примерами могут служить определение общего белка
по биуретовой реакции, когда при комнатной температуре обра-
зование биуретового комплекса происходит в течение 30 мин. Оп-
тическая плотность при этом нарастает и через 30 мин выходит на
плато, а далее стабильна по меньшей мере еще в течение 30 мин.
При определении мочевины уреазным методом с реакцией
Бертло на аммиак оптическая плотность синего, или «изумрудно-
го», комплекса стабильна в течение нескольких часов. Автомати-
зация таких методов требует сокращения времени реакции для
получения рентабельной производительности анализаторов за счет
изменения некоторых условий, например повышения температу-
ры или использования другого принципа измерения — не в ко-
нечной точке реакции, а по «начальной скорости», т.е.
наибольшей скорости реакции после ее запуска, поскольку в даль-
нейшем скорость реакции уменьшается. Этот метод используют
как для определения активности ферментов, так и для установле-
ния концентрации некоторых субстратов, например в случае опре-
деления общего белка по биуретовой реакции на центрифужных
анализаторах, которые позволяют проводить быстрые, с очень ко-
роткими интервалами времени (миллисекунды), и высокоточные
фотометрические измерения.
Другой принцип фотометрического измерения основан на спо-
собе измерения оптической плотности в двух временных точках
реакции: в начале и спустя 1 — 2 мин или более — принцип
фиксированного времени. Условием использования этого
способа измерения является сохранение линейной зависимости
между концентрацией аналита и оптической плотностью комп-
лекса, образующегося в ходе реакции. Если измерять оптическую
плотность через короткие равные промежутки времени после до-
бавления рабочего реактива к пробе (или пробы к рабочему реак-
тиву) и перемешивания, начинается изменение оптической плот-
18
ности, в котором можно выделить несколько периодов. Вначале,
когда происходят неспецифические реакции, линейной зависи-
мости изменения оптической плотности в равные интервалы вре-
мени не наблюдается. Это так называемая фаза «задержки» (lag
phase, delay), по окончании которой изменение оптической плот-
ности носит линейный характер в зависимости от времени в тече-
ние некоторого периода, специфичного для данного метода,
а затем по мере окончания реакции — вновь нелинейный. Изме-
рения оптической плотности для расчета результата могут про-
водиться в двух точках линейной части этого графика. Такие ме-
тоды проведения реакции и фотометрии называются еще двух-
точечными, или псевдокинетическими. Этот принцип известен в
одноэтапных, простых, быстрых методах определения креати-
нина по реакции Яффе без осаждения белка, гексокиназном
методе определения глюкозы, полностью ферментативном
УФ-тесте определения мочевины, турбидиметрическом методе
определения фибриногена, иногда в УФ-тестах определения ак-
тивности аланиновой и аспарагиновой аминотрансфераз.
Принцип кинетического измерения, т.е. многократ-
ного (многоточечного) измерения оптической плотности после
окончания фазы «задержки» через равные интервалы времени и
расчета изменения ее в линейной части графика, отражающего
зависимость изменения оптической плотности от времени после
запуска реакции, широко применяют при определении каталити-
ческой активности ферментов (а-амилазы, аспартатаминотранс-
феразы — АсАТ, аланинаминотрансферазы — АлАТ, у-глутамил-
трансферазы у-ГТ, лактатдегидрогеназы — ЛДГ, кислой и щелоч-
ной фосфатаз, холинэстеразы и др.) или для ферментативного
определения субстратов (глюкозы, креатинина, мочевины, моче-
вой кислоты и др.). Он получает все более широкое распростране-
ние в связи с внедрением в практику клинико-диагностических
лабораторий полуавтоматических и автоматических анализаторов,
основанных на фотометрии.
Осуществление таких измерений предъявляет особые требова-
ния к конструкции фотометров:
выделение строго монохроматического светового потока, осо-
бенно для длин волн 340 и 405 нм за счет применения хороших
интерференционных светофильтров в фотометрах или использо-
вания спектрофотометров;
высокая точность измерения оптической плотности не только
в диапазоне до 1,0 Б, но и в более высоком диапазоне — около
2,0 Б, что необходимо для реализации УФ-теста Варбурга;
точное соблюдение температуры термостатирования не только
при инкубации реактивов и развитии реакции, но и при фото-
метрическом измерении (общепринятым считается поддержание
температуры в измерительной ячейке в пределах ±0,2 °C);
19
оснащение компьютеризированных фотометров специальным
программным обеспечением для расчета конечного результата на
основе многократных измерений оптической плотности.
При фотометрической детекции результата в коагулологиче-
ских методах используют принцип измерения фиксированной аб-
сорбции-. определяют время, в течение которого оптическая плот-
ность продукта реакции, образующегося в растворе в кювете, до-
стигает определенного значения, например 0,1 Б. Особенность
технологии выполнения реакции и измерения светопоглощения в
этих случаях заключается в том, что запуск реакции в кювете осу-
ществляется с помощью специальных пипеток, соединенных с
фотометром и встроенным в фотометр секундомером. Подобным
образом определяют протромбиновое время, активированное ча-
стичное тромбопластиновое время (АЧТВ) в плазме методами с
хромогенными субстратами.
Устройство фотометров и спектрофотометров. Оптические при-
боры, измеряющие полихроматический световой поток (в спект-
ральной полосе 7 — 12 нм) только в видимом диапазоне света,
называют фотоэлектроколориметрами. Приборы, измеряющие
полихроматический световой поток в ультрафиолетовом, види-
мом и инфракрасном диапазонах называют фотометрами (рис. 1.4).
Спектрофотометры — оптические приборы, разделяющие свето-
вой поток на непрерывный спектр и позволяющие измерять его на
любой длине волны в пределах оптического диапазона. Фотометрия
может выполняться по однолучевой или двухлучевой схеме.
1 000 нм 540 нм
Спектр
до светофильтра
Спектр после
светофильтра
Рис. 1.4. Схема фотометра:
1 — источник света; 2 — линза; 3 — светофильтр; 4 — оптическая кювета; 5 —
фотоприемник; 6 — усилитель; 7 — микропроцессор; 8 — дисплей
20
При однолучевом методе (рис. 1.5) с помощью фотоприемни-
ка (фотодетектора, сенсора) измеряют интенсивность светового
потока в отсутствие кюветы с исследуемой пробой или когда она
заменена кюветой с растворителем (холостой опыт, «Ыапс»). За-
тем ставят кювету с исследуемым раствором, снова измеряют ко-
личество прошедшего света и вычисляют величину оптической
плотности по приведенной ранее формуле. В зависимости от кон-
кретной конструкции прибора расчет выполняют с помощью
встроенной микросхемы или по специальной шкале. Таким обра-
зом, фоновое (холостой опыт) и опытное измерения разнесены
во времени, что может быть причиной ошибок, если источник
света нестабилен.
При двухлучевом методе (рис. 1.6) оба измерения выполняют
одновременно. Это достигается за счет того, что источник света
генерирует два луча одинаковой интенсивности: один из них про-
ходит через опытную пробу (исследуемый раствор), другой через
пробу сравнения (холостую), обычно один растворитель, затем
их интенсивности сравнивают. Сравнение можно выполнять меха-
нически, в этом случае пучок света после пробы сравнения про-
ходит через отверстие диафрагмы, сужая которое, добиваются
равенства интенсивностей обоих пучков. Диафрагму приводят в
движение барабаном, который обычно градуирован непосредствен-
но в величинах оптической плотности.
Равенство обоих пучков света можно оценить разными спосо-
бами: визуально оценивая различие освещенности двух половин
поля зрения, либо электрически, добиваясь равенства фотото-
ков, о чем судят по положению стрелки гальванометра. Механи-
ческий способ, несмотря на надежность и малую зависимость
результатов от колебаний в электрической сети, практически не
употребляют вследствие высоких требований к механической
отладке, юстировке и равномерности потоков света. В фотомет-
рах устанавливают встроенные электронные микросхемы, кото-
рые позволяют считывать результаты непосредственно в едини-
цах оптической плотности, если надо, сразу же пересчитывать
их в единицы концентрации и передавать в компьютер или рас-
печатывать на бумаге.
й)1- | | | | |
Рис. 1.5. Схема однолучевого спектрофотометра:
1 — источник света; 2 — входная щель; 3 — монохроматор; 4 — выходная щель;
5 — кювета; 6 — детектор; 7 — измерительное устройство
21
Рис. 1.6. Схема двухлучевого спектрофотометра:
а — спектрофотометр с пространственным разделением лучей света; б — спект-
рофотометр с разделением лучей света во времени; 1 — источник света; 2 —
входная щель; 3 — монохроматор; 4 — выходная щель; 5 — кювета с пробой; 6 —
детектор; 7 — измерительный прибор; 8 — кювета с раствором сравнения (холо-
стая проба); 9 — зеркало; 10 — прерыватель; 11 — разделитель луча света
Принципиальное различие между одно- и двухлучевой схема-
ми остается, каждая из них имеет свои преимущества и недостат-
ки. В двухлучевой схеме значение фона вычитается автоматически,
в ней легче добиться стабильности результатов измерения на про-
тяжении определенного периода времени (устранить дрейф нуля),
но все ошибки и помехи, возникшие в канале сравнения (напри-
мер, опалесценция раствора или появление в нем пузырьков)
сказываются и на результатах опыта.
Любой фотометрический прибор — самый простой гемоглоби-
нометр или совершенный спектрофотометр — имеет одинаковые
элементы: источник света, устройство выделения нужной обла-
сти спектра (монохроматическое устройство), кюветное отделе-
ние, фотоприемник (фотоэлектрический преобразователь), изме-
рительно-регистрирующее устройство.
22
Источник света зависит от рабочего диапазона длин волн из-
мерения. В качестве источников света в фотометрах используют
несколько типов ламп, каждая из которых характеризуется раз-
личным сплошным излучением.
Вольфрамово-галогеновая лампа известна всем как
используемый в домашних условиях источник света. Для продле-
ния жизни колбы в нее в малых количествах добавляют галоген.
Серьезным недостатком этих ламп является их слабая способность
возбуждать УФ-излучение требуемой интенсивности.
Дейтериевую дуговую лампу обычно располагают ря-
дом с вольфрамово-галогеновой. Вместе они покрывают весь спектр
длин волн, необходимый для фотометров видимого и ультрафио-
летового диапазона (200—1 100 нм). Дейтериевая дуговая лампа
излучает слабый свет в видимой части спектра.
Основное преимущество ксеноновой лампы — это воз-
можность получения с ее помощью хорошего излучения во всей
требуемой области спектра. Дополнительных источников излуче-
ния при использовании этой лампы не требуется. Она более доро-
гая, содержит газ ксенон и возбуждает свет, сходный с солнеч-
ным светом.
Дуговые ртутные лампы (ртутно-кварцевые) относят-
ся к смешанным (люминесцентно-тепловым) источникам. Основ-
ную часть их излучения составляет излучение плазмы дугового
разряда паров ртути. Спектры излучения этих ламп охватывают
ультрафиолетовую, видимую и инфракрасную области спектра.
Сильное тепловое излучение, вызываемое лампами, нужно тем
или иным способом отводить, чтобы не вызывать порчу свето-
фильтров и не воздействовать на исследуемую пробу.
Широкое применение, особенно в приборах, созданных для ре-
шения конкретных аналитических задач (гемоглобинометры, нефе-
лометры), находят светоизлучающие диоды — светодиоды —
полупроводниковые устройства, излучающие монохроматический
свет. Это — важное преимущество, поскольку отпадает необходи-
мость в светофильтре, а кроме того, светодиод не нагревается во
время работы.
Лазеры (аббревиатура от Light Amplification by Stimulated
Emission of Radiation) — оптические квантовые генераторы — со-
временные источники излучения, отличающиеся узким направ-
ленным пучком и когерентностью. Важнейшим свойством лазер-
ного пучка является его монохроматичность и минимальное рас-
сеивание в однородной среде. Полупроводниковые лазеры в отли-
чие от других типов лазеров обладают рядом преимуществ: малы-
ми размерами и компактностью; простотой конструкции; высо-
кой эффективностью преобразования электрической энергии в
энергию когерентного излучения; возможностью перестройки дли-
ны волны излучения и наличием большого числа полупроводни-
23
ков, непрерывно перекрывающих интервал длин волн от 320 до
32 000 нм.
Выделение области спектра. Поскольку для разных веществ ха-
рактерно поглощение света на разных длинах волн, в приборах
для фотометрии используют оптические средства (зеркала, лин-
зы, светофильтры, монохроматоры) для выделения определен-
ных интервалов и длин волн света. Нужные спектральные участки
(полосы) выделяют с помощью светофильтров или монохрома-
торов. Наиболее простой и дешевый, поэтому наиболее распрост-
раненный, способ — использование светофильтров. С помощью
монохроматора можно определить полный спектр, полученный
от пробы. В фильтровых фотометрах монохроматор заменен свето-
фильтрами.
Принцип действия светофильтров заключается в следу-
ющем. Свет от лампы концентрируется в узкий луч зеркалами и
линзами перед тем, как направляется на фильтр. В приборах ста-
рой конструкции в качестве светофильтров использованы цвет-
ные стекла, в настоящее время их вытеснили интерференцион-
ные светофильтры, которые позволяют выделять полосы по 5 —
10 нм, в то время как для стеклянного фильтра полоса 50 нм —
уже очень большое достижение. Характеристика фильтра — это
ширина полосы пропускания в нанометрах, через которую про-
ходит половина света.
Интерференционные светофильтры имеют удовлетворительную
спектральную ширину полосы света и длину волны. С их помощью
«паразитный» (побочный, а не с нужной длиной волны, свет)
может быть исключен более эффективно, чем с помощью других
фильтров. Интерференционные светофильтры состоят из двух по-
лупрозрачных серебряных пленок и диэлектрического слоя между
ними. Толщина диэлектрического слоя определяет длины волн
света, который пропускает фильтр. Так же, как и решетка моно-
хроматора подвергает дифракции более чем один спектр, интер-
ференционные светофильтры пропускают свет с различными дли-
нами волн, поэтому необходим дополнительный фильтр, кото-
рый пресекает свет ненужных длин волн. Каждый фильтр пропус-
кает довольно широкую полосу света, например 336 — 344 нм. Од-
нако наивысшая интенсивность в середине этого диапазона —
при 340 нм.
Кроме свойства обеспечения высокой монохроматизации света
с относительно высоким его пропусканием интерференционные
светофильтры обладают большой термоустойчивостью. Это связано
с тем, что они не поглощают, а отражают прошедший сквозь них
свет, что позволяет использовать светофильтры с высокоинтенсив-
ными источниками светового (и теплового) излучения.
В настоящее время большинство фотометров и биохимических
автоанализаторов оснащены интерференционными светофильтра-
24
ми. Работая с ними, нельзя забывать два обстоятельства: во-пер-
вых, со временем они стареют, теряя свои оптические характери-
стики, во-вторых, они выделяют очень узкие пучки света, поэто-
му важно убедиться, что длина волны соответствует пику погло-
щения окрашенного продукта. Может случиться так, что два внешне
одинаковых интерференционных светофильтра на самом деле про-
пускают свет с разными длинами волн.
Монохроматор действует следующим образом. Свет лам-
пы с помощью линз и зеркал концентрируется в узкий световой
пучок, направляемый на монохроматор, в котором он подверга-
ется дисперсии, образуя спектр. Пройдя через монохроматор, по-
лихроматический свет становится более или менее монохромати-
ческим (в зависимости от щели на выходе устройства). Щель на
выходе разделяет спектр таким образом, что выходящий свет имеет
некоторый диапазон длин волн, например в пределах 539 — 541 нм.
Щель на входе представляет собой отверстие, через которое
свет входит в монохроматор узким лучом во избежание избытка
света на дифракционной решетке. Обычно щели на входе и выхо-
де имеют одинаковую ширину.
Устройство дисперсии света. Узкий луч света фокусируется на
дисперсионном устройстве — обычно дифракционной решетке.
Последняя является сердцем монохроматора так же, как моно-
хроматор является сердцем спектрофотометра. До использования
решеток применяли призмы из стекла (для видимой области) или
кварца (для ультрафиолетового излучателя). Они позволяют ис-
следовать непрерывный спектр, особенность их заключается в
большой неравномерности по длинам волн: в области коротких
волн они позволяют выделять значительно более узкие пучки, чем
в области длинных.
Дифракционная решетка представляет собой тщательно отпо-
лированную поверхность или зеркало, на которые нанесены па-
раллельные штрихи (несколько сотен штрихов на 1 мм) или сде-
ланы прорези на строго одинаковом расстоянии друг от друга,
что обеспечивает дифракцию, поэтому под определенным углом
отражается только свет соответствующей длины волны. При этом
может быть более одной дифракционной серии, которые пере-
крывают друг друга. Они не будут интерферировать, если поме-
щен дополнительный светофильтр, удаляющий побочные длины
волн.
Преимущество дифракционной решетки по сравнению с приз-
мой — более равномерное разрешение по длинам волн, линейная
дисперсия на всем диапазоне видимого и ультрафиолетового спек-
тра. От решетки спектр распространяется по направлению к щели
на выходе и свет с единственной длиной волны проходит через
нее и далее через кювету, достигая детектора. Обычно решетка
вращается для контроля длины волны проходящего света.
25
Спектральная ширина полосы света равна ширине щели на выхо-
де, если входная и выходная щели одинаковых размеров. Спект-
ральную ширину не следует смешивать с естественной шириной
полосы, которая представляет собой полуширину пика абсорб-
ции (светопоглощения).
Спектральная ширина полосы света определяет разрешение
спектрофотометра, т.е. его способность дифференцировать два
очень близких друг к другу пика. Чем меньше ширина полосы, тем
выше разрешение и тем более подробный спектр может быть по-
лучен. Щель на выходе оказывает наибольшее влияние на форму
определяемого спектра: чем шире щель, тем шире пучок света и
тем больше лучистой энергии попадает на приемник.
Сделав щель слишком широкой, можно выйти за пределы,
в которых действует закон Бугера—Ламберта —Бера. Если щель
слишком узкая, в приемник попадает мало лучистой энергии,
что сказывается на точности измерения. В связи с тем что спект-
ральное разрешение спектрофотметра зависит от длины волны,
в разных спектральных участках оптимальны разные ширины ще-
лей. В больших спектрофотометрах существуют встроенные про-
граммы, которые обеспечивают для каждой длины волны автома-
тический выбор рекомендованной ширины щели.
Кюветы и кюветные отделения. Кювета — это оптический ком-
понент большинства фотометров и спектрофотометров. Луч света,
прошедший через светофильтр или монохроматор, отражается
зеркалом, проходит через кювету, содержащую реакционную
смесь, и подвергается измерению. Кювета представляет собой ем-
кость из прозрачного материала, которая устанавливается в кюве-
тодержателе кюветного отделения. Обычно используют сменные,
или, как их еще называют, сливные, кюветы квадратного сече-
ния с длиной оптического пути 1 см, реже 0,5 или 0,3 см.
Кюветы имеют точную внутреннюю ширину (длина пути све-
та), что обеспечивает возможность сравнения кювет по этому при-
знаку. Различают три типа кювет, отличающихся качеством, при
аттестованной длине пути света 10 мм: тип А — кюветы, имеющие
длину пути, установленную с точностью до ±0,01 мм, тип В —
до ±0,04 мм, и тип С — до ±0,3 мм. Различные кюветы обладают
различными свойствами и светопропусканием, особенно в отно-
шении УФ-света. Для измерений в УФ-свете обычно используют
только кварцевые или кремниевые кюветы.
Разовые пластмассовые кюветы могут быть использованы не
только для фотометрии, но и в качестве пробирок для выполне-
ния подготовительных операций и анализа. В некоторых фотомет-
рах используют кюветы, представляющие собой круглые пробир-
ки для микроанализа, но, как правило, в таких приборах приме-
няется измерение реакционной смеси на двух длинах волн (би-
хроматическое измерение) для исключения погрешностей, свя-
26
занных со светорассеянием, вызванным непосредственно кюве-
той.
Широко распространены проточные кюветы, которые обычно
снабжены устройством, позволяющим автоматически или полу-
автоматически заполнять их до определенного уровня. Это облег-
чает и ускоряет работу, особенно, если фотометр соединен с
печатающим устройством или напрямую связан ,с компьютером.
Скорость заполнения проточной кюветы — несколько секунд.
Объемы этих кювет исчисляются десятками микролитров (от 18
до 80 мкл) в зависимости от конструкции кюветы и прибора. Но
для получения правильных результатов, как правило, требуется
300 — 500 мкл реакционной смеси, в том числе необходимых для
промывания кюветы от предыдущей реакционной смеси и ис-
ключения влияния концентрации компонента в предыдущей
пробе на последующую, т.е. ошибки от так называемого «пере-
носа».
Некоторые современные фотометры имеют одновременно две
встроенные кюветы, что позволяет не тратить время на смену
кюветодержателей для различных кювет. Большинство современ-
ных фотометров и спектрофотометров имеют термостатирован-
ные кюветные отделения или блоки для поддержания постоянной
температуры до 37 °C, которую контролируют специальные уст-
ройства. Это позволяет проводить измерения при фиксированной
температуре, что особенно важно для кинетического определе-
ния активности ферментов.
Для исключения различий между кюветами, особенно при ра-
боте на спектрофотометрах, для измерения в кюветодержатель
кроме кюветы, содержащей опытную пробу, помещают кювету
с жидкостью для сравнения (холостая проба). Свет одного и того
же луча направляется через обе кюветы полупроницаемым зер-
калом или через отражающий прерыватель света. Это важно для
анализа, при котором нулевая (базовая) линия измеряется од-
новременно.
Детектор. В конце своего пути луч света достигает детектора,
который преобразует поток света (фотонов) в поток электронов
(электрический ток). Существует несколько типов устройств для
этих целей, имеющих разную способность в выполнении этого
преобразования — это фотоэлементы, фотосопротивления, фо-
тодиоды и фотоумножители.
Принцип действия фотоэлементов основан на явлении
фотоэффекта, которое заключается в том, что при действии света
вещество (как правило, одновалентный металл — цезий и др.)
испускает электроны, которые в безвоздушном пространстве лампы
устремляются от фотокатода к аноду. На практике выделяют два
типа фотоэлементов — с внутренним и внешним фотоэффектом.
Фотоэлементы с внешним фотоэффектом могут быть вакуумны-
27
ми и газонаполненными. Вакуумные фотоэлементы обладают мень-
шей фоточувствительностью, чем газонаполненные.
Освобождение электронов происходит и в полупроводниках,
что увеличивает их электропроводность при освещении. Такие
фотоэлементы с внутренним фотоэффектом называются фото-
сопротивлениями. Самым большим преимуществом фото-
диодов является их малый размер. Они могут быть расположены
в ряд, образуя диодный массив. Когда диодный массив располо-
жен прямо за решеткой поперек спектра, требуется меньше оп-
тических компонентов. Кювета должна быть расположена перед
монохроматором, и это является недостатком для нестабильных
веществ. Диоды могут регистрировать интенсивность поступа-
ющего света, так что весь спектр может быть определен с помо-
щью массива диодов. В настоящее время лучшие фотодиоды раз-
работаны для улучшения детекции УФ-света. Детекция ими в
области длин волн от 250 до 1 000 нм используется уже на прак-
тике. Фотоумножители обнаруживают длины волн в широ-
ких пределах. Когда фотон входит в детектор, он ударяется о
металлическую поверхность и освобождает один или более элек-
тронов из этой поверхности. Электроны ударяются о вторую ме-
таллическую поверхность, при этом освобождается еще большее
количество электронов. После приблизительно десяти таких эта-
пов электронный поток измеряют для расчета количества фото-
нов, которые вошли в детектор.
В качестве фотоприемников для видимой и ультрафиолетовой
областей используют в основном вакуумные фотоэлементы, реже
фотоумножители, для инфракрасной области — фотосопротивле-
ния. На приборах прежней конструкции используется компенса-
ционная схема измерения — оптическая либо электрическая. При
оптической схеме, вращая барабан, связанный с диафрагмой,
добиваются равенства световых потоков. При электрической схе-
ме, вращая ручки потенциометра, добиваются электрической ком-
пенсации фототока. И в первом, и во втором вариантах о наступ-
лении момента компенсации судят по показаниям индикатора на
панели прибора. Отсчет делают по положению барабана или ручек
потенциометра. В выпускаемых в настоящее время приборах прак-
тически всегда световой поток вызывает пропорциональный его
интенсивности фототок, который измеряется цифровым вольт-
метром, вся дальнейшая обработка информации выполняется в
цифровой форме.
Измерительно-регистрирующие устройства. Такие устройства
подразделяют на показывающие, регистрирующие и печатающие,
аналоговые и цифровые. В показывающих приборах наблюдаемая
величина определяется по шкале механического или электриче-
ского отсчетного устройства. Регистрирующие приборы выполня-
ют автоматическую графическую регистрацию результата. В при-
28
Поре с цифропечатью показания распечатываются в цифровом виде.
Аналого-цифровые преобразователи, встроенные в большинство
современных фотометров, наряду с печатающими устройствами
(принтерами) позволяют получать результат в распечатанном виде
непосредственно в единицах концентрации или активности ана-
лита.
Стандартизация фотометрических приборов. Правильность фо-
тометрических измерений оценивают по результатам исследова-
ния стандартных образцов (эталонов), свойства которых счита-
ются известными. Поскольку фотометрическое измерение дает
два вида результатов, одни из которых выражены в единицах
длин волн (частоты), а другие — оптической плотности (пропус-
кания), в фотометрии используют стандарты для поверки шка-
лы длин волн и шкалы оптической плотности, или пропускания.
Как средства измерения, к которым фотометры, спектрофото-
метры и анализаторы на их основе, используемые в лаборатори-
ях медицинских организаций, относятся в соответствии с зако-
нодательством Российской Федерации, они подлежат обязатель-
ной сертификации и периодической (не реже 1 раза в год) по-
верке в эксплуатации.
Стандартизацию можно выполнять по эталонным светофильт-
рам с редкоземельными элементами, обладающими весьма узки-
ми полосами поглощения. Для приборов с узкой шириной полосы
пропускания используют хлорное оксидное олово, имеющее очень
узкие полосы пропускания: 279,3; 278,6; 333,8; 360,8; 418,5; 536,4;
637,5 нм, ддя широкополосных приборов — дидимиевый фильтр,
имеющий максимум пропускания при 530 нм (зеленая область).
Стеклянные фильтры умеренного нейтрального стекла в серти-
фикатах позволяют проверять калибровку фотометров на четырех
длинах волн от 440 до 635 нм. Стеклянные оптические меры для
поверки фотометрических приборов непосредственно являются
средствами измерения, они занесены в Государственный реестр
средств измерения и могут быть использованы для этого и в по-
вседневной практике.
В связи с тем что поверочными средствами практические ра-
ботники клинико-диагностических лабораторий часто не распо-
лагают, некоторые характеристики фотометров (правильность,
линейность показаний, их вариация) могут быть проверены так-
же с помощью специально приготовленных растворов — жидких
индикаторов. Эти растворы в определенной области спектра име-
ют постоянные спектральные характеристики. Характеристики
некоторых растворов приведены в табл. 1.2. Методика приготовле-
ния растворов приведена далее.
1. Бихромат калия К2Сг2О7 высушить при температуре 100 —
110 °C в течение двух часов, охладить в эксикаторе при комнатной
температуре. Растворить 200 мг вещества в 3 000 мл дистиллиро-
29
оо Таблица 1.2
Характеристика растворов для проверки фотометров
Наименование раствора Пик абсорбции, нм Спектральный диапазон, нм Значение оптической плотности, отн. ед. опт. пл.* Влияние температуры, ед. опт. пл./ °C Диапазон температуры, °C Стабильность хранения, лет
Бихромат калия 350 290-410 0,536 Понижение на 0,0003 20-30 10
Сульфат никеля 394 334-454 0,588 Повышение на 0,0008 24-26 10
Сульфат кобальта аммония 512 453 -573 0,478 Повышение на 0,0009 24-26 —
Сульфат кобальта аммония — 400 450 500 550 0,012 0,077 0,163 0,077 — — —
Сульфат меди — 400 600 650 700 0,002 0,068 0,224 0,527 — — —
Хромат калия — 340 375 400 450 0,316 0,991 0,396 0,033 — — —
*Для спектрофотометров с полушириной пропускания длины волны ±2 нм, измерения в прямоугольной кювете с длиной пути
1 см.
ванной воды, добавить 0,34 мл концентрированной 70 % хлорной
кислоты НС1О4. Количественно перенести в мерную колбу на
4 000 мл. Довести объем до метки дистиллированной водой. Пере-
мешать. Хранить раствор плотно закрытым в темной посуде. Кро-
ме того, для проверки точности измерения оптической плотно-
сти используют и другой раствор бихромата калия. Для его приго-
товления реактив высушивают при температуре НО °C в течение
1 ч, навеску 0,0500 г растворяют в 1 л серной кислоты концент-
рацией 0,005 моль/л. Оптическая плотность надлине волны 350 нм
в кювете 10 мм при температуре 15 — 25 °C против серной кислоты
концентрацией 0,005 моль/л должна составлять 0,536 ±0,005. При-
родная ширина полосы растворов бихромата при длине волны
350 нм — 63 нм; для спектрофотометров с шириной щели менее
6 нм этот раствор должен выявлять пик абсорбции при 350 нм.
2. Сульфат никеля NiSO4- 6Н2О высушить в эксикаторе при ком-
натной температуре в течение 48 ч. В мерной колбе на 1 000 мл
растворить 30,4523 г NiSO4 - 6Н2О в 800 мл дистиллированной воды,
добавить 9 мл концентрированной 70 % хлорной кислоты. Дове-
сти объем до метки дистиллированной водой. Перемешать. Хра-
нить раствор плотно закрытым в темной посуде.
3. Сульфат кобальта аммония CoSO4[NH4]2SO4- 6Н2О высушить
в эксикаторе при комнатной температуре в течение 48 ч. В мерной
колбе на 1 000 мл растворить 39,5250 г вещества в 800 мл дистил-
лированной воды. Добавить 9 мл концентрированной 70 % хлор-
ной кислоты. Довести объем до метки дистиллированной водой.
Перемешать. Хранить раствор плотно закрытым в темной посуде.
4. Сульфат кобальта аммония CoSO4[NH4]2SO4- 6Н2О в количе-
стве 14,481 г растворить в 10 мл концентрированной серной кис-
лоты. Количественно перенести в мерную колбу на 1 000 мл, со-
держащую 400 мл дистиллированной воды. После достижения рас-
твором комнатной температуры довести объем до метки дистил-
лированной водой. Перемешать. Хранить раствор плотно закры-
тым в темной посуде.
5. Сульфат меди CuSO4-5H2O в количестве 20 г растворить в
10 мл концентрированной серной кислоты, количественно пере-
нести в мерную колбу на 1 000 мл и довести объем при комнатной
температуре до метки дистиллированной водой. Хранить раствор
плотно закрытым в темной посуде.
6. Хромат калия К2СгО4 в количестве 40 мг растворить в 600 мл
раствора едкого кали концентрацией 0,05 моль/л в мерной колбе
на 1 000 мл, затем довести объем до метки раствором едкого кали
концентрацией 0,05 моль/л.
Растворы 1, 2, 3 приготавливают путем разведения основного
раствора жидкого индикатора: 1 — основной раствор жидкого
индикатора; 2— основной раствор жидкого индикатора в дву-
кратном разведении; 3 — в четырехкратном разведении; растворы
31
1 — 5 разводят дистиллированной водой; раствор 6 — раствором
едкого кали концентрацией 0,05 моль/л.
Области применения фотометрии в клинической лабораторной
аналитике. Современная фотометрическая лабораторная техника
представлена приборами различной степени сложности, что по-
зволяет выбрать тот вариант фотометра, который наиболее соот-
ветствует конкретным условиям и задачам данной лаборатории.
Наиболее распространены фотометры и фотоэлектроколоримет-
ры, которые обеспечивают потребности основной массы клини-
ко-диагностических лабораторий при выполнении большей части
биохимических (более 80 %), коагулологических, иммунохимиче-
ских исследований как в ручном, так и в полуавтоматическом ре-
жиме.
Фотометры для ручных методов и программируемые полуавто-
матические фотометры небольшой производительности применяют
в основном как базовые приборы в клинико-диагностических ла-
бораториях небольшой мощности и экспресс-лабораториях. Полу-
автоматические фотометры с встроенными термостатами для ин- ;
кубации реакционной смеси и термостатируемыми проточными1
кюветами для микроанализа можно использовать не только как
базовые приборы в небольших или средних по мощности лабора-;
ториях, но и как вспомогательные приборы к автоматическим
анализаторам. '
Фотометры, оснащенные встроенными микропроцессорами,^
управляющими процессами фотометрического измерения, термо-j
статирования, расчета и автоматической выдачи результатов, кон-\
тролирующими этапы работы прибора, могут быть одноканаль-i
ными (для последовательного измерения реакционных смесей в:
одной кювете) или многоканальными (для одновременного из-
мерения их в нескольких кюветах). Такие приборы называют по-
луавтоматическими фотометрическими анализаторами. Их произ-;
водительность подчас сравнима с автоанализаторами, хотя рабо-
та на них всегда требует участия оператора в процессе анализа.
Некоторые из них при дооснащении дилютором и самплером могут
быть преобразованы в так называемые серийные (batch) автоана-
лизаторы.
Широкое применение находят также многоканальные фото-
метры, в которых применена оптическая схема, позволяющая
установить одновременно большое количество (до 96) проб и
фотометрировать их либо одновременно, либо последовательно
за короткий промежуток времени. Такие приборы работают по од-
нолучевой схеме. Многоканальный фотометр — это шаг к биохи-
мическому анализатору, от которого он отличается тем, что авто-
матизирует только фотометрию, т. е. один из многих этапов ана-
лиза. В многоканальных фотометрах использована вертикальная
схема измерения.
32
1.2. Нефелометрические методы
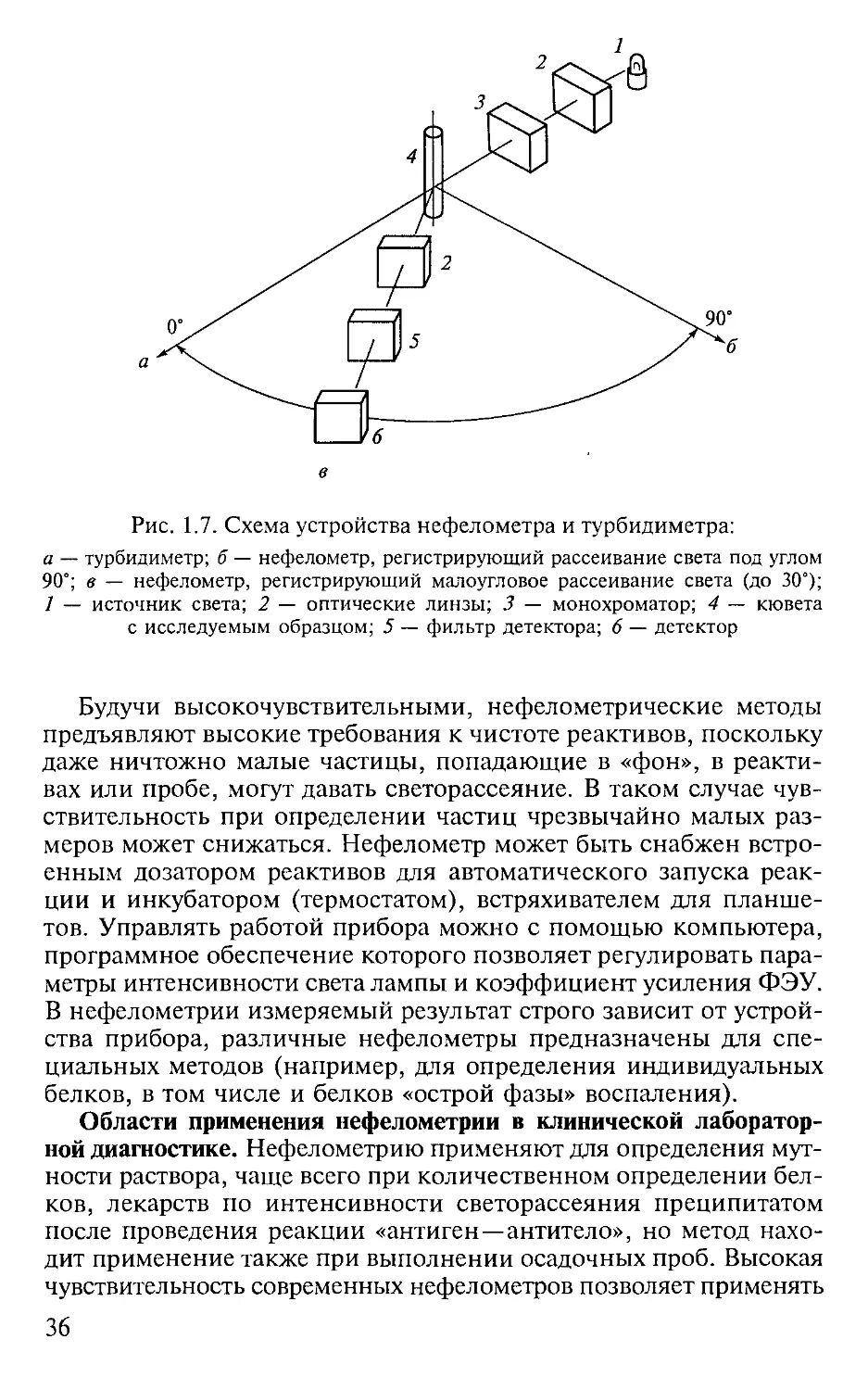
Принцип и виды нефелометрического анализа. Нефелометрия —
метод определения концентрации, размеров и (или) формы час-
тиц веществ, находящихся в состоянии тонких взвесей, эмульсий
или коллоидных растворов, путем измерения интенсивности их
светорассеяния. Когда мутный раствор помещают в кювету фото-
метрического прибора, то световой поток, проходя через кювету,
будет наталкиваться на частицы в растворе и изменять свое на-
правление, отклоняясь под разными углами. Это явление и носит
название светорассеяния. Оно зависит от длины волны, частоты,
интенсивности светового потока, а также свойств рассеивающей
среды: размеров частиц, их формы, количества, способности к
поляризации и др.
Нефелометрия изучает свечение, которое возникает при осве-
щении исследуемого объекта внешним источником, но в этом
случае речь идет не о новом излучении, а о рассеянии света. По-
этому длины волн света возбуждения и излучения при нефело-
метрии практически совпадают.
Характер (тип) рассеивания зависит от соотношения длины
волны света (Z.) и размера частицы, на которой оно происходит.
Если размер частиц рассеивающей реакционной смеси значительно
меньше длины'волны светового потока, проходящего через кюве-
ту (диаметр частиц меньше либо равен Х/10), то такой вид свето-
рассеяния называют упругим, или релеевским. В основе его лежит
явление дифракции. Каждая частица рассеивает свет независимо
от других частиц, и он распространяется во всех направлениях,
но максимальное количество света рассеивается под углом 0° и
180° по отношению к лучу, падающему на частицу. Такое свето-
рассеяние дают некоторые белки плазмы, в том числе иммуно-
глобулины, альбумин, липиды, малые агрегаты в случае ранних
иммунологических реакций. Светорассеяние в этом случае сим-
метрично, т.е. рассеиваются равные количества света, как в на-
правлении источника света, так и от него. Для фиолетового света
с длиной волны 400 нм это составляет 40 нм, а в красном спектре
с длиной волны 700 нм рассеяние света происходит в соответ-
ствии с открытыми Релеем закономерностями, если размер час-
тицы меньше 70 нм. Наибольший диаметр молекулы альбумина
8 нм, IgG — 20 нм, а длина нити фибриногена 50 нм. Таким обра-
зом, частица агрегата «антиген—антитело», состоящая из несколь-
ких молекул исследуемого белка и антител, в ряде случаев уклады-
вается в размеры релеевской частицы и проявляет ее свойства.
При увеличении размеров частиц (для плазменных белков раз-
мер в диапазоне приблизительно от 40 нм до 400 нм) рассеяние
становится несимметричным и максимальное количество света
рассеивается в направлении падающего луча — преимущественно
2 Меньшиков 33
вперед. Такое светорассеяние называют рассеянием Редея—Дебие.
При А = 400 нм этот тип светорассеяния будет характерен для
IgM, хиломикронов, формирующихся комплексов антигенов с
иммуноглобулинами. В некоторых случаях выгоднее измерять свет,
рассеянный не в бок (т. е. под углом 90° к падающему лучу), а под
меньшими углами, что повышает чувствительность. В этом случае
возбуждающий луч должен быть узконаправленным, что лучше
всего обеспечивается лазером. Это послужило причиной появле-
ния семейства лазерных нефелометров. Однако в последнее время
их успешно вытесняют приборы с ксеноновыми лампами и свето-
диодами.
В случае если размер частиц превышает длину волны света
(в нашем примере, если диаметр частицы более 400 нм), несим-
метричность светорассеяния еще более увеличивается. При этом
по направлению к источнику света рассеивается большее количе-
ство света, чем от него. Этот вид рассеяния света, известный как
рассеяние Ми, характерен для взвеси бактерий, клеток крови —
тромбоцитов и эритроцитов, латексных частиц, белков поздних
иммунологических реакций и других крупных частиц. Пропорцио-
нально четвертой степени длины волны большая часть энергии
рассеивается вперед и назад по отношению к ходу луча.
Интенсивность светорассеяния можно оценивать двояко: либо
по количеству рассеянного света, либо по ослаблению прошед-
шего. В первом случае говорят о нефелометрии, во втором —
о турбидиметрии.
Преимущество нефелометрии заключается в том, что можно
уловить как очень маленькие, так и очень большие величины рас-
сеянного света. Если раствор прозрачен, постороннего светорас-
сеяния практически нет, чувствительность нефелометрического
датчика можно сделать очень высокой, соответственно, будет улов-
лено появление очень небольшого сигнала. С другой стороны, если
светорассеяние велико,. чувствительность можно понизить так,
чтобы все величины укладывались в шкалу прибора.
При турбидиметрии, где измеряется процент прошедшего све-
та, чувствительность должна быть постоянной, она определяется
силой света при измерении фона, поэтому малые или, наоборот,
большие степени светорассеяния точно измерить нельзя. Преиму-
щество турбидиметрии состоит в том, что для нее не требуется
специальный прибор, измерения могут быть выполнены на том
же фотометре или анализаторе, на котором выполняют обычные
биохимические исследования.
Нефелометрические измерения можно выполнять по оконча-
нии исследуемой реакции — в «конечной точке», т.е. через впол-
не определенный промежуток времени (20 — 30 мин), это так на-
зываемая статическая нефелометрия. Другой подход — измерение
на уровне максимальной скорости реакции — кинетическая, или
34
скоростная нефелометрия. Она позволяет значительно сократить
время анализа.
Устройство приборов для нефелометрии. Прибор для измерения
светорассеяния называется нефелометром. В конструктивном отно-
шении флюорометр и нефелометр очень похожи и в определен-
ных случаях может использоваться один и тот же прибор.
В скоростной (кинетической) нефелометрии в качестве источ-
ников света используют вольфрамово-галогеновую и кварцево-
йодную лампы накаливания. Свет от них, пройдя через фильтр
(фильтры) и приобретя определенную длину волны, достигает
кюветы с измеряемой пробой. В течение некоторого времени изби-
раются различные длины волн, при этом измеряют, например,
скорость взаимодействия антител и антигена (гаптена) путем опре-
деления максимального светорассеяния на число образующихся
комплексов. Высокопроизводительный светодиод (LED) возбуж-
дает свет одной, специфической, длины волны, диапазон длин
волн не может быть избран. В качестве источника света в нефело-
метрах используют также лазеры. Требования к качеству спектров
в нефелометрии не очень высоки.
Достаточно дешевые гелиево-неоновые лазеры (Z. = 633 нм)
применяют не из-за спектральной чистоты света, который они
излучают, а из-за таких важных для измерения светорассеяния
характеристик лазера, как способность излучать свет высокой
интенсивности, выходящий узким и строго направленным пуч-
ком.
Светорассеяние в нефелометрах регистрирует фотоумножитель
(ФЭУ) или силиконовый твердофазный фотодетектор. Оба вида
детекторов преобразуют свет в электрические сигналы, но ФЭУ
имеет внутренний сигнал амплификации, который обеспечивает
его очень высокую чувствительность. Сигнал от ФЭУ проходит
через синхронный демодулятор, который производит сигнал и
посылает его в усилитель светорассеяния, сигнал сохраняется и в
конечном итоге поступает в компьютер для преобразования в ре-
зультат. Адекватная стабильность ФЭУ обеспечивается высоковольт-
ным стабилизатором постоянного тока.
На ранних этапах развития нефелометрии детекторы в нефело-
метрах располагали под углом 90° к исходящему лучу. Однако ком-
плексы «антиген — антитело» относятся к частицам, которые рас-
сеивают свет преимущественно в направлении вперед, поэтому
фотодетектор может быть помещен под меньшим углом к исходя-
щему лучу для увеличения чувствительности. При использовании
ФЭУ или силиконовые фотодетекторы помещают под углом 70° к
проходящему лучу света, в то время как в LED-системах угол
расположения фотодиода по отношению к исходящему свету мо-
жет широко варьировать: от 13 —24 до 90° (рис. 1.7). Можно при-
менять вертикальную схему измерения светорассеяния.
35
Рис. 1.7. Схема устройства нефелометра и турбидиметра:
а — турбидиметр; о — нефелометр, регистрирующий рассеивание света под углом
90°; в — нефелометр, регистрирующий малоугловое рассеивание света (до 30°);
1 — источник света; 2 — оптические линзы; 3 — монохроматор; 4 — кювета
с исследуемым образцом; 5 — фильтр детектора; 6 — детектор
Будучи высокочувствительными, нефелометрические методы
предъявляют высокие требования к чистоте реактивов, поскольку
даже ничтожно малые частицы, попадающие в «фон», в реакти-
вах или пробе, могут давать светорассеяние. В таком случае чув-
ствительность при определении частиц чрезвычайно малых раз-
меров может снижаться. Нефелометр может быть снабжен встро-
енным дозатором реактивов для автоматического запуска реак-
ции и инкубатором (термостатом), встряхивателем для планше-
тов. Управлять работой прибора можно с помощью компьютера,
программное обеспечение которого позволяет регулировать пара-
метры интенсивности света лампы и коэффициент усиления ФЭУ.
В нефелометрии измеряемый результат строго зависит от устрой-
ства прибора, различные нефелометры предназначены для спе-
циальных методов (например, для определения индивидуальных
белков, в том числе и белков «острой фазы» воспаления).
Области применения нефелометрии в клинической лаборатор-
ной диагностике. Нефелометрию применяют для определения мут-
ности раствора, чаще всего при количественном определении бел-
ков, лекарств по интенсивности светорассеяния преципитатом
после проведения реакции «антиген—антитело», но метод нахо-
дит применение также при выполнении осадочных проб. Высокая
чувствительность современных нефелометров позволяет применять
36
эти методы для определения концентрации белков не только в
сыворотке или плазме, но и в моче, спинномозговой, суставной
и амниотической жидкостях, в элюатах при ионообменной хро-
матографии.
1.3. Люминесцентный анализ
Основные понятия. Среди оптических методов измерения кон-
центраций аналитов в клинической лабораторной практике боль-
шое место занимает измерение света, излучаемого молекулами
исследуемых веществ. Испускание света молекулой после ее воз-
буждения в результате поглощения энергии в любой форме, в том
числе вслед за избирательным поглощением света, называется
люминесценцией.
Испускаемый молекулами свет несет энергию, высвобождае-
мую при переходе электронов из возбужденного (метастабильно-
го) состояния в невозбужденное.
Среди процессов испускания света при комнатной температу-
ре различают:
флюоресценцию как частный случай люминесценции, при этом
молекула находится в возбужденном состоянии очень недолго,
излучение следует непосредственно за поглощением возбужда-
ющего света;
фосфоресценцию, когда молекула долго находится в метаста-
бильном состоянии, время между поглощением возбуждающего
света и эмиссией может длиться в течение многих часов;
хемилюминесценцию, когда источником энергии служит хими-
ческая реакция;
электрохемилюминесценцию — испускание света молекулами
веществ, перешедших в возбужденное состояние в результате элек-
трохимических процессов;
биолюминесценцию — частный случай хемилюминесценции,
имеющей биологическое происхождение свечения. Этот вид лю-
минесценции присущ живым организмам, в которых выделение
световой энергии излучения происходит в окислительных про-
цессах, катализируемых люциферазами.
Флюоресценция. Фотоны испускаются в результате биологически
обоснованных реакций, которые характеризуются образованием
очень высокого кванта световой энергии. Возвращение в исходное
(невозбужденное) состояние может происходить различными спо-
собами, один из которых флюоресценция, т.е. испускание моле-
кулой света.
Флюоресцирующая молекула может непосредственно погло-
щать квант возбуждающего света, но ее «накачка» энергией мо-
жет быть и опосредованной, когда свет поглощается соседней,
37
иногда многокомпонентной, молекулярной структурой, а только
затем передается флюорофору.
Большинство традиционно используемых в лабораторной ана-
литике флюоресцирующих веществ — это карбоциклические орга-
нические красители.
Другой класс очень перспективных с точки зрения примене-
ния в клинической лабораторной диагностике флюоресцирующих
веществ — это редкоземельные элементы, относящиеся к группе
лантанидов (европий, самарий, тербий и другие — № 58 — 71 Таб-
лицы Д.И.Менделеева). Квантовый механизм, лежащий в основе
их свечения, несколько отличается от механизма флюоресценции
органических молекул. Само испускание света флюоресценции
определяется квантовыми переходами в атоме металла, но воз-
буждающий флюоресценцию свет поглощается более крупной
частицей, в состав которой входит также органическая молекула,
образующая комплексное соединение с ионом лантанида, и ра-
створитель, поэтому состав среды очень влияет на интенсивность
свечения. Доля излученного света по отношению к поглощенному
может колебаться от 0 до 1. Обычно испускаемый свет имеет боль-
шую длину волны (т.е. энергия кванта меньше), чем возбужда-
ющий.
Меру потери энергии называют «сдвигом Стокса», он опреде-
ляет разницу между максимальными длинами волн возбуждающего
и испускаемого света, которая для органических веществ обычно
измеряется десятками нанометров. Время между возбуждением
флюресцирующей органической молекулы и испусканием ею света
занимает около одной стомиллионной доли секунды (10 нс). Дру-
гое дело — флюоресценция лантанидов, здесь оно на пять поряд-
ков дольше — около 1 мс, сдвиг Стокса также сильнее выражен,
достигая сотен нанометров.
Фосфоресценция. Она характеризуется большей по сравнению с
флюоресценцией величиной сдвига Стокса и временем запазды-
вания испускания света — от 1 с-3 до нескольких часов.
Вещества, способные флюоресцировать, называются флюоро-
форами, их используют в клинической химии и лабораторной
диагностике для количественного определения концентрации
флюоресцирующего продукта по интенсивности его свечения и
для того, чтобы метить различные компоненты биоматериала (как
вещества, так и клетки), делая их доступными для исследова-
ния.
Интенсивность флюоресценции прямо пропорциональна кон-
центрации флюорофора и интенсивности возбуждающего света.
Ее величину обычно выражают в относительных единицах. Фак-
тически прибор (флюорометр) улавливает лишь малую часть об-
щей эмиссии флюоресценции, которая зависит от светосилы при-
бора (ширины щели), чувствительности детектора, эффективно-
38
сти монохроматора. Результаты измерения флюоресценции выра-
жают в единицах концентрации, при использовании калибровки
прибора по исследуемому веществу либо по специальному этало-
ну, который в химическом отношении может не иметь ничего
общего с исследуемым аналитом, но обладать такой же флюорес-
ценцией.
Преимущества флюоресценции заключаются в простоте изме-
рения, высокой специфичности и чувствительности. К недостат-
кам относятся зависимость результата от многих факторов, что
сказывается на линейности калибровочных графиков. Сюда отно-
сится насыщение флюоресценции (эффект внутреннего тушения),
побочные эффекты, вызванные рассеиванием, неспецифической
флюоресценцией растворителя, матриксом пробы. Эффект внут-
реннего тушения состоит в потере интенсивности возбуждения
при прохождении света через раствор из-за его абсорбции.
Некоторые кварцевые стекла и пластинки содержат материа-
лы, поглощающие ультрафиолетовый свет или флюоресцирующие.
Помехой также является тушение флюоресценции из-за взаимо-
действия флюорофора с раствором, что приводит к потере энер-
гии.
Пробы сыворотки и мочи содержат много веществ, способных
флюоресцировать, поэтому матрикс (основа) пробы может быть
источником неспецифической флюоресценции, например, обус-
ловленной присутствием белка или билирубина. Свет рассеивает-
ся также большими молекулами белка и липопротеидными комп-
лексами. Неспецифическое свечение фона — основная причина,
лимитирующая чувствительность флюорометрических методов
исследования.
Эффект флюоресценции используют в основном для опреде-
ления флюоресцентных меток — веществ, специально добавляе-
мых в аналитическую систему, которые химически ничего общего
с аналитом не имеют, например акридин оранжевый, метилум-
беллиферон, пропидиум йодид, этидиум бромид, родамин, флюо-
ресцеин — 5-изотиоцианат (FITS) и др. Для каждого из этих со-
единений характерны собственные длины волн света возбужде-
ния и света излучения. Метки могут быть молекулярные, когда
метят определенные молекулы, и клеточные, когда метят иссле-
дуемые клетки или определенные участки на их поверхности. Ме-
нее распространен подход, когда в результате химических пре-
вращений молекула аналита превращается во флюоресцирующее
соединение.
Поляризация флюоресценции. При прохождении через кристал-
лическую решетку (поляризатор) волны света ориентируются в
одной плоскости, такой свет называется поляризованным. В силу
броуновского движения молекулы в растворе не только непре-
рывно перемешиваются, перемещаясь в пространстве, но и хао-
39
тически вращаются. Время, за которое молекулы успевают равно-
мерно распределиться в пространстве, называется временем ре-
лаксации. Соответственно говорят и о времени вращательной ре-
лаксации, как о том промежутке времени, который необходим
для того, чтобы первоначально одинаково ориентированные мо-
лекулы оказались равномерно повернутыми в разные стороны. Для
больших молекул этот промежуток времени длиннее, чем для
маленьких.
Если время вращательной релаксации велико по сравнению со
временем между поглощением кванта света и его эмиссией (зату-
хания флюоресценции), то молекула флюорофора не успевает
повернуться и свет эмиссии будет поляризован в той же плоско-
сти, что и возбуждающий свет. Если молекула небольшого разме-
ра, то она вращается быстро и за время между поглощением света
и его эмиссией успевает повернуться. Соответственно свет флюо-
ресценции не будет поляризован в той же плоскости, что свет
возбуждения, а будет деполяризованным. Таким способом можно
оценить размеры молекулы. Этот эффект используют при выпол-
нении гомогенных иммуноисследований (см. главу 4 «Методы,
основанные на специфическом связывании веществ лигандами»).
Затухание {гашение) энергии излучения. Принцип метода осно-
ван на прямо пропорциональной зависимости между измеряемой
интенсивностью флюоресценции раствора, содержащего флюо-
рофор, и абсорбции света этим раствором. Если абсорбция рас-
твора более нуля, интенсивность флюоресценции будет затухать.
Если в ходе реакции аналита с реактивом образуется хромоген,
то он будет увеличивать светопоглощение и тем самым гасить ин-
тенсивность флюоресценции флюорофора. Чем больше аналита в
биожидкости, тем больше образуется хромогена, и, следователь-
но, выше светопоглощение и больше затухание флюоресценции.
Флюоресценция с разрешением во времени. Чувствительность флюо-
ресцентных методов в значительной степени зависит от помех,
вызванных тем, что свет возбуждения примешивается к свету эмис-
сии, а также неспецифической флюоресценции исследуемого био-
логического объекта. Если сдвиг Стокса (т.е. различие в длинах
волн света возбуждения и эмиссии) велик, помехи меньше, по-
тому, что удается «уйти» от света возбуждения флюоресценции и
потому что у неспецифической флюоресценции сдвиг Стокса мал.
Помехи можно уменьшить и, используя временную задержку (раз-
решение во времени), возбуждать флюоресценцию короткими
импульсами света, а измерять ее через некоторое время, когда
возбуждающий импульс уже угас. Технически это осуществимо
только при условии, что время флюоресценции флюорофора ве-
лико. На этом основана флюоресценция с разрешением во време-
ни (ФРВ). Флюоресцентные метки для ФРВ — лантаниды — обла-
дают чувствительностью и избирательностью намного более вы-
40
сокими, чем у органических красителей, например флюоресцеи-
на. По чувствительности они приближаются к радиоактивным мет-
кам.
Измеряя флюоресценцию на разных длинах волн и через раз-
ные промежутки времени после освещения импульсом возбужда-
ющего света, можно одновременно количественно определять
несколько флюорофоров этой группы. Это позволяет использо-
вать двойные метки, например одновременно пометить и изме-
рять концентрации и антигена, и антитела, что значительно по-
вышает точность определения.
Принцип ФРВ используют в некоторых анализаторах (напри-
мер, Delfia фирмы «Wallac», Финляндия, или Kryptor фирмы «CIS
Diagnostics»). Принцип связывания флюорофора с биологически-
ми макромолекулами используется в иммунофлюоресцентном ана-
лизе (метка флюорофором антитела), в проточной иммуноцито-
флюорометрии (метка флюорофором лимфоцитов и определение
их подклассов с помощью меченых моноклональных антител),
в флюоресцентном иммуноферментном анализе, в флюоресцент-
ном иммуноанализе с использованием микрочастиц (см. гл. 4).
Хемилюминесценция. Свечение молекул, перешедших в возбуж-
денное состояние в результате химической реакции, называется
хемилюминесценцией. Чаще всего ее вызывают, окисляя опреде-
ленные органические вещества перекисью водорода, гипохлори-
том, молекулярным кислородом. Специальная форма хемилюми-
несценции биологического материала, когда каталитический бе-
лок, например люцифераза, повышает эффективность люминес-
центной реакции, называется биолюминесценцией. Чувствитель-
ность определения с помощью биолюминесценции выше, чем при
прямом флюоресцентном исследовании.
Принцип хемилюминесцентной детекции реализуется в вари-
антах хемилюминесцентных методик и хемилюминесцентной де-
текции ферментных меток в иммунохимических исследованиях.
Основными хемилюминесцентными метками служат сульфонами-
ды и эфиры акридина, инициаторами их свечения выступает смесь
пероксида водорода и гидроксида натрия. Регистрируются вспыш-
ки длительностью до 5 с, предел детекции эфира акридина
0,5 аттомоль (5 • 10-18). Хемилюминесцентная детекция фермент-
ных методик чувствительнее и удобнее колориметрической или
флюоресцентной детекции.
При хемилюминесцентном исследовании активности перокси-
дазы хрена используют комбинацию «люминол + окислитель +
+ усилитель». В качестве последнего применяют ароматические ами-
ны, арилбороновые кислоты, гидроксиацетанимиды, гидрокси-
бензотиазолы, нафтолы, фенолы, тиофенолы.
Активность щелочной фосфатазы также может быть исследова-
на хемилюминесцентным методом. В качестве субстрата использу-
41
ют адаматил-1,2-диоксиэтанарилфосфатные соединения. Порог
определения щелочной фосфатазы при этом 1 цептимоль (602
молекулы фермента). Свечение длительное — более 30 — 60 мин.
В хемилюминесцентном варианте методики определения глю-
козоксидазы используют смесь изолюминола и пероксидазы для
определения пероксида водорода, образующегося под действием
фермента на глюкозу.
Еще одним вариантом является электрохемилюминесценция,
представляющая собой процесс возникновения свечения, при
котором высокореактивные соединения, способные испускать свет,
образуются из стабильных предшественников на поверхности элек-
трода, к которому приложен положительный потенциал. Для это-
го можно использовать соединения рутения, осмия, рения и дру-
гих элементов. В электрохемилюминесцентном методе, который
реализуется на приборах Elecsys («Roche Diagnostics», Швейца-
рия), в качестве метки применяется комплекс рутений (П)-трис
(бипиридил)2зМН8 эфир, который способен сопрягаться с ами-
ногруппами белков, гаптенов и нуклеиновых кислот.
Бипиридиловые лиганды могут легко преобразовываться в фор-
му активных хемилюминесцентных соединений. Моноклональные
антитела, меченные рутением, сопрягаются с исследуемым ан-
тигеном, который захвачен другими моноклональными антите-
лами, связанными с биотином и за счет стрептавидина прочно
связанными с магнитными шариками диаметром 2,8 мкм. Под вли-
янием магнита магнитные частицы с иммунным комплексом,
меченным рутением, привлекаются в зону контакта с рабочим
электродом, в результате чего развивается электрохемилюминес-
центная реакция, интенсивность которой регистрируется фото-
умножителем.
Последовательность происходящих на поверхности положитель-
ного электрода процессов такова: окисляющийся под влиянием
заряда электрода трипропиламин (ТПА) высвобождает протон и
становится нестабильным радикалом, который в свою очередь,
отдавая электрон образовавшемуся при контакте с электродом
трехвалентному рутениевому бипиридилу, переводит его в воз-
бужденную форму, способную, испустив фотон света с длиной
волны 620 нм, возвратиться в исходное стабильное состояние.
Таким образом, происходит хемилюминесцентная реакция, ини-
циируемая электрическим зарядом электрода, что и дало назва-
ние этому методу.
Приборы и оборудование для люминесцентного анализа. Прибо-
ры для измерения концентрации веществ по интенсивности флюо-
ресценции называются флюорометрами. Приборы, в которых вы-
деление спектрального интервала происходит с помощью щелей,
линз или зеркал, а диспергирующими элементами служат призмы
и дифракционные решетки, монохроматоры различного типа,
42
называются спектрофлюорометрами. Для измерения люминесцен-
ции используют люминометры.
Любой прибор для измерения флюоресценции состоит из че-
тырех компонентов: источника возбуждающего света; кюветы для
измерения флюоресценции пробы; устройства, регистрирующе-
го флюоресценцию — детектора; светофильтров или монохрома-
тора для выделения длин волн возбуждающего и эмиттирован-
ного света.
Спектры абсорбции и, следовательно, возбуждения флюорес-
ценции большинства флюоресцирующих веществ лежат в области
300 — 550 нм. Это позволяет использовать в качестве источников
света в флюорометрах яркие лампы с широким спектром. Вольф-
рамово-галогеновые лампы применяют для измерений в видимой
и ультрафиолетовой областях спектра. Они служат в течение дли-
тельного времени (2 000 — 3 000 ч до замены). Ртутные вакуумные
лампы имеют прозрачные кварцевые колбы и возбуждают свет с
длиной волны 254 нм или могут быть покрыты белым фосфором,
который излучает свет с постоянным спектром от 300 до 405 нм.
Дуговая ксеноновая лампа излучает постоянный свет в пределах
200 — 700 нм и может использоваться для получения как спектров
возбуждения, так и флюоресценции.
Как и для фотометров, кюветы для флюорометров могут быть
изготовлены из стекла, кварца оптической чистоты и пластмасс.
Поскольку свет флюоресценции рассеивается во все сторо-
ны, возможны различные варианты конструкций приборов. Чаще
всего фотодатчик флюорометра (рис. 1.8) расположен под пря-
мым углом к направлению возбуждающего света, что уменьшает
засветки, снижающие чувствительность определения. Устройство
прибора для анализа поляризации флюоресценции представле-
но на рис. 1.9.
В люминометрах отсутствует необходимость возбуждения свето-
излучения. Поэтому свет, излученный исследуемой средой, как пра-
вило, проходит через светофильтр, пропус-
кающий поток излученной световой энер-
гии в определенной полосе длин волн, и по-
падает в фотоприемник. Возможна как го-
Рис. 1.8. Схема устройства флюорометра:
1 — источник света возбуждения; 2 — монохрома-
тор (светофильтр) света возбуждения; 3 — кювета с
исследуемым раствором; 4 — монохроматор (свето-
фильтр) света флюоресценции; 5 — детектор; б —
измерительный прибор
43
Рис. 1.9. Схема устройства анализатора
поляризации флуоресценции:
1 — источник света возбуждения; 2 — моно-
хроматор света возбуждения; 3 — поляриза-
тор света возбуждения; 4 — кювета с иссле-
дуемым раствором; 5 — монохроматор света
флюоресценции; б— поляризатор света флюо-
ресценции; 7 — детектор; 8 — измеритель-
ный прибор
ризонтальная, так и вертикальная
флюорометрия и люминометрия, двух-
лучевое измерение.
Современные флюорометры, спек-
трофлюорометры и люминометры
представляют собой анализаторы, которые в зависимости от уст-
ройства предназначены для ручного, полуавтоматического и ав-
томатического выполнения различных методов люминесцентного
анализа. Практически все они оснащены микропроцессорами,
встроенными компьютерами, принтерами или имеют возможность
подсоединения к персональному компьютеру и принтеру. Они часто
оснащены также дозаторами реактивов, устройствами для термо-
статирования (инкубаторами) при проведении реакции и термо-
статированными кюветными отделениями, в том числе и при из-
мерениях в планшетах.
Среди флюорометров выделяют приборы специального назна-
чения для определения концентрации отдельных компонентов,
например отечественный флюорометр АКЛ 01 ЗОНД для опреде-
ления концентрации альбумина в сыворотке крови с одним флюо-
рохромом и суммарной концентрации холестерина и триглицери-
дов — с другим, а также универсальные приборы для определения
различных компонентов. Отечественный анализатор ФЛУОРАТ 02
АБЛФ сочетает в себе, в сущности, три прибора — фотометр,
флюорометр и люминометр, а при оснащении проточной кюве-
той может быть использован в качестве флюорометрического де-
тектора при высокоэффективной жидкостной хроматографии.
Комбинация различных принципов измерений в одном приборе
(одно- и двухлучевое измерение флюоресценции, выбор диамет-
ра луча, вертикальная флюорометрия с направлением луча в кю-
вету снизу или сверху, флюорометрия с разрешением во времени
и пр.) применяется во многих моделях планшетных полуавтома-
тических анализаторов для различных видов люминесцентного
анализа в иммунохимических и других исследованиях.
Области применения в клинической лабораторной диагностике.
Методы люминесцентного анализа широко применяют в различ-
ных областях клинической лабораторной диагностики вследствие
44
высокой чувствительности и специфичности. Основанные на флюо-
ресцентном анализе, они применяются для определения различ-
ных аналитов в скрининге и диагностике различных заболеваний,
а также наблюдении за их течением и эффективностью лечения.
Различные виды флюорометрии и люминометрии и разрабо-
танные для них наборы биохимических и иммунохимических ре-
активов применяют для определения концентрации альбумина,
триглицеридов и холестерина в сыворотке крови, катехоламинов,
продуктов их биосинтеза и обмена, гистамина, гистидина, серо-
тонина и его метаболита — 5-оксииндолилуксусной кислоты, сте-
роидов и их метаболитов, порфиринов, витаминов, аминокис-
лот, меди и других микроэлементов, различных токсических ве-
ществ и продуктов их распада в организме, лекарств, наркоти-
ков, исследовании цитотоксичности, для определения ДНК, РНК,
экспрессии ДНК, захвата кальция, фагоцитоза, генной инжене-
рии, подсчета бактерий в микробиологических исследованиях,
обнаружения и дифференциации вирусов, факторов роста, ком-
понентов комплемента, для количественного определения про-
дуктов ПЦР, в исследованиях, основанных на анализе АТФ.
Спектр патологических состояний, для выявления, диагно-
стики, выбора лечения которых могут быть применены флюоро-
метрические и другие люминесцентные методы, чрезвычайно
велик. Это — дифференциальная диагностика гипертоний, выяв-
ление опухолей, происходящих из клеток хромафинной ткани и
симпатической нервной системы — феохромоцитом, симпато-
бластом, ганглионевром, диагностика карциноида, детского це-
ребрального паралича, порфирий, различных генетических забо-
леваний, включая их неонатальный скрининг. Флюорометриче-
ские детекторы используют в различных системах для хроматогра-
фического анализа и, в частности, для высокопроизводительной
жидкостной хроматографии, на анализаторах для определения
гормонов, опухолевых маркеров, лекарств, антибиотиков, нар-
котиков и других препаратов, в диагностике токсикоманий.
1.4. Эмиссионные спектральные методы
Принципы методов. Атомы химических элементов — металлов,
присутствующие в растворе в виде солей, попадая в раскаленный
газ горячего пламени, теряют часть внешних электронов, превра-
щаясь в положительно заряженные ионы. Электроны остаются в
той же среде, суммарный заряд которой, таким образом, нейтра-
лен. Этот газ физики называют плазмой (прим. авт. — совпадение
терминов: эта плазма не имеет отношения к плазме крови). В вы-
сокотемпературной плазме кинетическая энергия движения ионов
находится в равновесии с их внутренней энергией, т. е. все время
45
находятся такие ионы, скорость движения которых замедляется.
При этом один или несколько электронов внутри атома перехо-
дит на более высокий энергетический уровень — в возбужденное,
т. е. более богатое энергией квантовое состояние. Спустя некото-
рый, очень небольшой промежуток времени электроны возвра-
щаются в прежнее состояние, и излучается квант света.
Если пламя освещается светом с соответствующей длиной вол-
ны, события могут идти в обратном направлении — ион погло-
щает квант света, переходя в возбужденное состояние. Практиче-
ски в раскаленной плазме оба процесса находятся в равновесии,
т. е. число ионов металлов, которые переходят в возбужденное со-
стояние, равно числу тех, которые возвращаются в обычное.
Возможные энергетические уровни атомов, их так называемые
квантовые состояния, строго детерминированы, различия между
ними в точности равны энергии кванта поглощенного или излу-
чаемого света, которая однозначно связана с длиной волны. По-
этому переход из одного энергетического состояния в другое со-
пряжен с испусканием или поглощением света совершенно опре-
деленной, строго фиксированной длины волны. Поскольку в
составе большинства атомов много электронов, теоретически воз-
можно большое число разных энергетических уровней (т. е. разных
степеней возбуждения атома), соответственно, атом может излу-
чать свет с разными длинами волн. Однако при реальных темпера-
турах пламени в аналитических приборах речь идет только об од-
ном, самом низком, уровне возбуждения, а следовательно, и об
одной длине волны излучаемого или поглощаемого света.
Способность находящихся в плазме ионов испускать и погло-
щать кванты света используется в двух аналитических методах —
пламенной фотометрии и атомной абсорбциометрии. В первом слу-
чае речь идет об эмиссии (излучении) света, во втором — о его
поглощении. Спектральные методы — и фотометрия пламени,
и атомная абсорбция — позволяют определить общее содержание
элемента в исследуемой пробе независимо от того, в какой форме
он находится: свободной, связанной с белком или низкомолеку-
лярным веществом и т. д. В этом заключается принципиальное раз-
личие результатов спектроскопического и потенциометрического
(ионоселективного) методов исследования. Одновременно это
большое преимущество спектроскопического метода, поскольку
полученные результаты в большей степени являются абсолютны-
ми, так как спектральная линия элемента — его физическая кон-
станта, которая может быть определена очень точно, в то время
как измеренная потенциометрическим методом активность иона,
во-первых, всегда меньше общей концентрации и, во-вторых,
зависит от большего числа привходящих обстоятельств.
В связи с ранее сказанным на международном уровне суще-
ствует договоренность считать эталонным (референтным, спра-
46
ночным) методом спектроскопический и калибровать ионоселек-
тивные электроды по его данным. Иными словами, при измере-
нии натрия и калия потенциометрическим методом прибор дол-
жен выдавать такие же результаты, какие получились бы, если бы
исследование выполнялось методом фотометрии пламени или атом-
ной абсорбции. В случае сомнения в работе ионоселективного элек-
трода или калибровочного раствора, по которому этот электрод
калибруется, ориентиром должен быть результат спектрального
метода.
Пламенная фотометрия. Находящиеся в раскаленной плазме
ионы атомов, переходя из возбужденного состояния в невозбуж-
денное, излучают свет, состоящий из одной или нескольких уз-
ких спектральных линий разной интенсивности (это зависит в
основном от температуры), что визуально воспринимается как
окрашивание пламени. Длина волны испускаемого света зависит
от структуры электронной оболочки атома и отражает химиче-
скую природу элемента. Так, линия натрия имеет длину волны
589 нм, и он окрашивает пламя в желтый цвет, магний — в крас-
ный, калий в — фиолетовый, рубидий — в красный, марганец —
в голубой. Если в пламени присутствует несколько элементов, бо-
лее интенсивная линия делает менее интенсивные практически
невидимыми, что, конечно, создает помехи при анализе. Помехи
возникают и вследствие диффузного, или фонового свечения,
которое наблюдается на месте линии и в отсутствие излучающего
ее иона. Количество ионов в пламени невелико, а среди них воз-
бужденные составляют лишь несколько процентов, однако этого
достаточно, чтобы выполнить измерения. Прибор, который по-
зволяет использовать эмиссию (свечение) плазмы для определе-
ния концентраций в ней излучающих химических элементов, на-
зывается пламенным фотометром.
Устройство пламенного фотометра. Пламенный фотометр состоит
из следующих элементов: системы подачи газов — горючего газа и
поддерживающего горение окислителя воздуха или воздушно-кис-
лородной смеси, распылителя — эжектора (смесителя), горелки,
монохроматора (светофильтра), фотоприемника, измерительно-
го устройства (рис. 1.10).
Система подачи газа состоит из линии горючего газа и линии
воздуха. В качестве горючего газа можно использовать бытовой
газ — метан, но он не дает высокотемпературного пламени, что
очень ограничивает перечень определяемых элементов. Бутан или
пропан обеспечивает более высокую температуру, но самое горя-
чее пламя получается при сгорании ацетилена. Горючий газ по-
ступает в прибор из баллона через систему редукторов давления
и, если это необходимо, очистки.
Воздух обычно поступает из компрессора, но его источником
могут быть и баллоны с соответствующей системой редукторов.
47
3
Рис. 1.10. Схема устройства пламенного фотометра:
1 — аспиратор; 2 — распылитель; 3 — пламя горелки; 4 — щель на входе; 5 —
монохроматор (светофильтр); б — щель на выходе; 7 — детектор; 8 — измери-
тельный прибор
Для обеспечения равномерного свечения пламени надо поддер-
живать давление и горючего газа, и воздуха с высокой точностью,
чтобы не повторять регулировку прибора и не переделывать ка-
либровку.
Работая с пламенным фотометром, нельзя забывать, что это
источник повышенной опасности, неправильное обращение с
которым может привести к пожару или даже взрыву. Включая при-
бор, надо сначала включить воздушную магистраль, а затем уже
газовую, иначе газ может проникнуть в воздушную систему и,
смешиваясь с воздухом, образовать взрывоопасную смесь.
Раствор, содержащий исследуемое вещество, всасывается в
поток воздуха или воздушно-кислородной смеси с помощью эжек-
тора. По принципу работы эжектор напоминает пульверизатор: он
всасывает исследуемый раствор и распыляет его с образованием
множества мелких капелек. Большая часть их тут же оседает на
стенках, накапливается на дне сосуда и удаляется через водяной
запор. Последний обеспечивает небольшое превышение давления
воздуха в распылителе над давлением газа, благодаря чему воздух
и поступает в горелку. Если этой разности давлений нет, газ из
горелки может проникнуть в распылитель, где накопится взрыво-
опасная смесь. Поэтому, работая с прибором, надо все время сле-
дить, чтобы водяной запор был заполнен. Небольшая часть (5 —
10 %) исследуемого материала в виде очень мелкой взвеси посту-
пает в горелку, где смешивается с горючим газом. Этого вполне
достаточно, чтобы создать интенсивное свечение.
В спектре излучаемого горелкой света на общем фоне видны
узкие спектральные линии исследуемых элементов, ширина каж-
дой из которых зависит от условий возбуждения и составляет не-
сколько нанометров. Свет нужных линий выделяется монохрома-
тором или с помощью светофильтров и попадает на фотоприем-
ник, регистрирующий его интенсивность. Необходимость в этом
возникает потому, что, во-первых, в исследуемом материале обыч-
но присутствует несколько химических элементов, спектральные
48
линии которых могут оказаться достаточно близко друг от друга,
а во-вторых, это фоновое свечение, т. е. то, которое наблюдается
в отсутствие исследуемого элемента на месте его линии. Чем уже
спектральный участок, который выделяет монохроматор, тем мень-
ше суммарная интенсивность фонового свечения и, соответствен-
но, меньше помех в работе. В идеальном случае монохроматор дол-
жен выделять только участок, который соответствует ширине из-
меряемой спектральной линии, т. е. несколько нанометров.
Очень часто пламенные фотометры представляют собой двух-
канальные приборы, поскольку они предназначены для одновре-
менного определения концентрации ионов натрия и калия в био-
жидкостях.
Существует несколько возможных схем работы пламенного
фотометра: прямой способ определения концентрации электро-
литов, компенсационный и с внутренним стандартом.
В самом простом, прямом способе, который обычно используют
при определении натрия или калия в сыворотке крови или моче,
исследуемый материал разводят водой в 50 или 100 раз и сжигают
в пламенном фотометре. Эмитируемый свет, проходя через свето-
фильтр, попадает на фотоприемник, сигнал которого пропорцио-
нален количеству исследуемого элемента. Такое прямое измере-
ние оказывается эффективным только при таком условии, когда
исследуемого элемента много и у него яркие линии, как в случае
натрия. Если же концентрация исследуемого вещества невелика
по сравнению с содержанием других элементов, спектральные
линии которых более интенсивны и создают помехи при анализе,
необходимо использовать более сложные приемы. Эффективнее
всего, конечно, иметь монохроматор, выделяющий узкую спект-
ральную полосу, в точности соответствующую ширине линии, но
такие монохроматоры дороги, светосила у них обычно невелика,
поэтому необходимы более чувствительные и, соответственно,
более дорогие светоприемники.
Используя компенсационный метод, одновременно выделяют два
пучка света — один, который соответствует линии исследуемого
элемента, второй — того элемента, который мешает определе-
нию, поскольку излучаемый им интенсивный свет создает поме-
хи (для биологических жидкостей в таком положении оказывает-
ся натрий). Оба сигнала включаются навстречу друг другу, прибор
фиксирует разность между ними, тем самым вводя поправку на
концентрацию присутствующего в растворе натрия.
Метод внутреннего стандарта состоит в разведении исследуе-
мой биологической жидкости не водой, а раствором элемента,
которого нет в биологическом материале, чаще всего солями ли-
тия. В процессе анализа делают два измерения: на длине волны,
характерной для линии определяемого элемента, и на длине вол-
ны линии внутреннего стандарта. Если показания стандарта отли-
49
чаются от того, которое было при калибровке, вносят соответ-
ствующую поправку и в измеряемую величину. Такой порядок ра-
боты позволяет избежать ошибок, связанных с нестандартными
условиями распыления; нестабильностью режима сгорания аэро-
золя, различием состава анализируемого и стандартного раство-
ров. Особенно важно это при исследовании жидкостей, вязкость
которых может значительно колебаться.
Точность пламенно-фотометрических методов исследования во
многом зависит от условий распыления исследуемой жидкости и
возбуждения пламени. Чтобы их стандартизировать, надо не толь-
ко хорошо отрегулировать распылитель, но и проследить, чтобы
вязкость калибровочных и исследуемых растворов была одинако-
вой. Для этого в разводящие растворы рекомендуется добавлять
соответствующие вещества. Натрий и калий возбуждаются значи-
тельно легче остальных, и характерные для них линии спектра
излучения четко отделены друг от друга. В случае применения пла-
мени с более высокими температурами и более чувствительных
регистрирующих устройств возможно провести анализ до 50 эле-
ментов.
Помимо указанных выше основных частей прибор может быть
снабжен различными сервисными устройствами: электрическим
зажиганием газа, системой автоматической подачи и разведения
проб, печатающим устройством и др.
Область применения пламенной фотометрии в клинической ла-
бораторной диагностике. Этим методом чаще всего определяют ионы
калия и натрия в сыворотке крови, моче, эритроцитах, спинно-
мозговой жидкости, экссудатах, транссудатах, в желудочном соке;
иногда измеряют содержание кальция и лития. Для одновремен-
ного определения натрия и калия нет необходимости исполь-
зовать ни методы внутреннего стандарта, ни компенсации, до-
статочно правильно приготовить комплексный калибровочный
раствор, который одновременно содержит и калий, и натрий в
концентрациях, близких тем, которые бывают в исследуемом ма-
териале. Нельзя только забывать, что в плазме крови соотноше-
ние концентраций этих элементов другое, чем в моче, поэтому
калибровочный раствор для мочи не подходит для анализа крови,
и наоборот.
Определение электролитов методом пламенной фотометрии
характеризуется высокой надежностью, чувствительностью, про-
стотой и быстротой выполнения (в течение нескольких минут)
и считается референтным методом для определения натрия и ка-
лия. Однако опасность работы с горючими и взрывоопасными га-
зами и системами все чаще приводит к замене этих приборов мик-
роанализаторами ионов с ионоселективными электродами.
Атомная абсорбционная спектроскопия (ААС). Атомная абсорб-
ционная спектроскопия, или атомная абсорбциометрия, — ме-
50
тод, в известном смысле, обратный пламенной фотометрии, по-
скольку здесь измеряют не излучение пламени (раскаленной плаз-
мы), а, наоборот, поглощение им света. Однако физические ос-
новы и того, и другого — одни: очень избирательное взаимодей-
ствие иона в газовой фазе с квантом света. Оно заключается в
том, что атомы каждого химического элемента поглощают и ис-
пускают только кванты света с определенной длиной волны. По-
этому, если через пламя проходит белый свет (например, солнеч-
ный или от лампы накаливания), на спектрограмме будут замет-
ны узкие темные полосы — линии, соответствующие спектраль-
ным линиям присутствующих в пламени элементов. Именно этим
объясняются узкие, темные полосы в солнечном спектре — так
называемые фраунгоферовы линии. Преимущество ААС перед фо-
тометрией пламени заключается в том, что это — фотометриче-
ский процесс, подчиняющийся закону Ламберта—Бера, он луч-
ше воспроизводим, меньше подвержен действию помех и поэто-
му точнее.
Устойчивость к помехам объясняется еще и тем, что измеряет-
ся именно количество прошедшего света, поэтому, если его ис-
точник — монохроматический, излучающий только свет опреде-
ленной длины волны, посторонние ионы не мешают определе-
нию: они могут поглотить только тот свет, которого в данном
источнике нет. Это позволяет определять методом ААС самые не-
значительные примеси элементов в присутствии значительных
концентраций веществ, которые сделали бы измерение методом
пламенной фотометрии невозможным.
Устройство атомно-абсорбционных спектрофотометров. Схема
таких спектрофотометров представлена на рис. 1.11. В методе атом-
ной абсорбциометрии источником света служит лампа с полым
катодом, который выполнен из элемента, подлежащего исследо-
ванию. Таким образом, катоды должны быть разными в зависимо-
сти от анализируемого элемента. В некоторых случаях в мультиэле-
ментных лампах катоды изготавливают из сплавов различных ме-
таллов. Лампы заполняют аргоном, неоном под низким давлением.
Аргоновые лампы дают накал от голубого цвета до красного,
неоновые — от красного до оранжевого. Во время работы в лампе
идет электрический разряд, который возбуждает эти атомы. Когда
Рис. 1.11. Схема устройства атомно-абсорбционного спектрофотометра:
1 — катод; 2 — прерыватель; 3 — пламя горелки; 4 — щель на входе; 5 — моно-
хроматор; 6 — щель на выходе; 7 — детектор; 8 — измерительное устройство
51
атомы металла сталкиваются с газом — неоном или аргоном, они
теряют энергию, и при этом возбуждается их собственное свече-
ние. В результате излучается свет точно той длины волны, которая
нужна для данного исследования. Например, для определения
натрия, ионы которого, попадая в плазму, излучают и поглоща-
ют свет с длиной волны 589 нм, используют натриевую лампу,
излучающую свет именно с такой длиной волны; для кальция —
422,8 нм. Это известное неудобство метода — необходимость сво-
ей лампы для каждого химического элемента — компенсируется
другими его преимуществами.
Практически оказывается, что метод ААС почти в 100 раз чув-
ствительнее пламенной фотометрии и более избирателен. Суще-
ствует два способа перевести исследуемый элемент в газовую фазу
для исследования. В первом случае, так же, как и в пламенной
фотометрии, используют горелку, в которой газы — водород и
воздух — смешиваются с пробой в пламени. Исследуемое веще-
ство распыляется в воздушный поток, с которым и поступает в
горелку. Преимущество этого метода — более высокая температу-
ра и концентрация исследуемого вещества, недостатки — относи-
тельно большие капли воды, попадая в пламя, увеличивают ко-
личество рассеянного света, так называемый, «шум сжигания».
Меньшие помехи от фона получаются в случае использования
горелки с предварительным смешиванием газов и распылением
пробы перед сжиганием. В результате происходит сброс больших
капель, а в пламя поступает проба, очень мелко распыленная. Путь
пробы в пламени этой горелки больший, чем в предыдущем ва-
рианте, результатом чего являются большие величины светопо-
глощения и чувствительность измерения.
Недостатком горелок с предварительным смешиванием явля-
ется меньшая температура пламени, некоторые металлокомплек-
сы неадекватно диссоциируют, например комплексы кальция с
фосфатом. Существует еще один вариант пламенных горелок —
горелки с окисью азота и предварительным смешиванием. Они
дают очень высокую температуру плазмы, многие комплексы каль-
ция диссоциируют при этой более высокой температуре и каль-
ций возбуждает очень сильное свечение, что тоже может созда-
вать проблемы.
В технологии, так называемой «беспламенной атомной абсорб-
ции», использован углеродный стержень или «графитовая горел-
ка». Исследуемое вещество вносится в нагретую электричеством
до высокой температуры графитовую трубку под вакуумом, кото-
рая в этом случае играет роль газовой кюветы (графитовая кюве-
та), могут быть использованы также полоски тантала. При повы-
шении температуры графитового стержня или танталовых Стри-
пов проба высушивается, сжигается и распыляется в камеру,
в которой распыленный исследуемый элемент абсорбирует энер-
52
гию соответствующей катодной лампы. Этот метод более чувстви-
телен, чем обычные пламенные методы, и позволяет определять
следы металлов в микропробах крови и тканей.
Область применения атомно-абсорбционной спектроскопии в
клинической лабораторной аналитике. Данный метод используют
для определения концентрации микроэлементов и редких элемен-
тов в различных биологических жидкостях и тканях, при токси-
кологических исследованиях. Его применяют в централизованных
и специализированных лабораториях, лабораторных отделениях
диагностических центров, токсикологических лабораториях для оп-
ределения общего кальция, железа, меди, хрома, кобальта, селе-
на, свинца (для хрома, селена, свинца и кобальта рекомендуется
беспламенная техника), молибдена, лития, ртути, цинка, мышь-
яка и др. Атомно-абсорбционный метод определения кальция в
сыворотке крови утвержден в качестве референтного Междуна-
родной федерацией клинической химии и лабораторной медици-
ны.
Гл а в a 2
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ ДЕТЕКЦИИ
И КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АНАЛИТОВ
В БИОМАТЕРИАЛАХ
2.1. Потенциометрия
Принцип метода. Электрохимические методы исследования ос-
нованы на электрохимических процессах, которые происходят на
границе раздела фаз на электродах, погруженных в водный рас-
твор, и связаны с изменениями структуры, химического состава
или концентрации анализируемого вещества.
Потенциометрия объединяет методы, основанные на измере-
нии электродвижущих сил (потенциалов) обратимых электрохи-
мических реакций, протекающих на границе погруженных в ра-
створ электродов.
Известно много различных электрохимических устройств, ос-
нованных на принципах потенциометрии, объединяемых общим
названием «электроды». В клинической лабораторной диагностике
наиболее часто применяют приборы для исследования кислотно-
щелочного состояния, pH-метрические и ионоселективные элек-
троды.
Электрод для измерения pH, по существу, является ионосе-
лективным электродом, который обладает специфической чув-
ствительностью к водородным ионам (рис. 2.1.). Электрический
Рис. 2.1. Схема электрохимической ячей-
ки для измерения pH:
а — каломельный электрод (референтный);
б — электрод для индикации pH; 1 — ртуть;
2 — хлорид ртути Hg2CI2; 3 — насыщенный
раствор хлорида калия КС1; 4 — жидкое со-
членение; 5 — Ag/AgCl (внутренний электрод);
6 — референтный раствор; 7 — стеклянная
ионоселективная мембрана; 8 — исследуемый
раствор
54
потенциал, измеряемый в этих методах, возникает на границе
двух сред в том случае, когда ионы одного заряда проникают че-
рез эту границу легче, чем противоположно заряженные. Это раз-
личие может быть обусловлено свойствами специальной мембра-
ны (перегородки), разделяющей растворы (фазы), или тем, что
ионы одного заряда диффундируют из раствора с большей кон-
центрацией в раствор с меньшей концентрацией быстрее, чем
ионы противоположного заряда. В первом случае говорят о мемб-
ранном, или фазовом, потенциале, во втором — о диффузионном.
В аналитических целях измеряют мембранный потенциал, а диф-
фузионные потенциалы обычно являются только помехой, поэтому
измерительные электроды или, как их иногда называют, ячейки,
конструируют так, чтобы диффузионный потенциал как можно
меньше сказывался на результатах измерения.
Мембрана может быть пористой (например, изготовленной из
эфиров целлюлозы) или непористой — стеклянной или из нейт-
рального носителя — поливинилхлорида.
Стеклянные электроды — это ионоселективные электроды,
в которых чувствительным элементом является перегородка, из-
готовленная из специального сорта стекла, состав которого опре-
деляет свойства электрода.
К таким электродам относятся электроды для определения pH
(чувствительные к концентрации ионов водорода) и некоторых
одновалентных катионов, например для определения иона натрия.
Электрическая цепь ионоселективного электрода имеет следу-
ющую схему: по одну сторону ионоселективной (т. е. избиратель-
но пропускающей определенные виды ионов) мембраны нахо-
дится эталонный раствор, по другую — исследуемый. Оба раство-
ра посредством солевых мостиков, т.е. трубочек, заполненных
раствором соли (обычно хлоридом калия), контактируют с ме-
таллическими электродами, на границе которых с раствором все-
гда одна и та же разность электрических потенциалов. Иногда та-
кой металлический электрод называют полуэлементом. Его мате-
риал и состав раствора, в который он погружен, подбирают та-
ким образом, чтобы величина этого потенциала была максималь-
но устойчивой.
В ионоселективных электродах, как правило, используют в ка-
честве полуэлементов серебряные (хлорсеребряные электроды) —
кусочки серебряной проволоки, покрытые слоем хлорида серебра.
Исправный полуэлемент обычно темного цвета. Когда он портит-
ся, хлорид серебра осыпается и видна светлая металлическая по-
верхность. Реже, в основном в научных исследованиях, использу-
ют каломельные полуэлементы, в которых устойчивый потенци-
ал образуется на границе ртути и ее соли — каломели.
Конструктивно ионоселективные электроды изготавливают так,
что эталонный раствор (или заменяющая его масса) вместе с мем-
55
браной объединены в один блок с металлическим электродом (по-
луэлементом), к которому подведен электрический провод. Вто-
рая половина электрической цепи также изготовлена в виде от-
дельного блока, который называется электродом сравнения, или
референтным. Пример такого электрода для определения СО2 при-
веден на рис. 2.2.
Часто несколько ионоселективных электродов, например для
определения натрия, калия и хлора, объединяют в один агрегат.
В этом случае достаточно одного, общего для них электрода срав-
нения. На границе растворов электролитов разных концентраций,
разделенных перегородкой с избирательной проницаемостью,
ионы из более концентрированного раствора диффундируют в
менее концентрированный. Но через полупроницаемую перего-
родку могут проходить ионы только одного заряда, в данном слу-
чае — положительного. Поэтому на границу раздела возникает
Рис. 2.2. Схема устройства электрода рСО2:
1 — ввод пробы; 2 — бикарбонат натрия; 3 — референтный электрод (Ag/AgCl);
4 — стеклянная капсула электрода; 5 — пластик; 6 — оболочка электрода; 7 —
внутренний электрод (Ag/AgCl); 8 — фосфатный буфер; 9 — кислородное коль-
цо; 10 — выход пробы; 11 — pH-чувствительная стеклянная мембрана; 12 —
пористая оболочка; 13 — проницаемая для СО2 мембрана (силиконовая резина);
14 — кювета; 15 — стеклянное окно
56
разность потенциалов — положительные ионы прошли через нее,
отрицательные остались в более концентрированном растворе, раз-
бавленный раствор приобретает положительный заряд, концент-
рированный — отрицательный. Эта разность потенциалов препят-
ствует диффузии новых порций ионов, таким образом разность
концентраций способствует перемещению ионов, а разность элек-
трических потенциалов препятствует этому.
Изменение концентрации ионов в одинаковое количество раз
вызывает одинаковое изменение электрического потенциала, не-
зависимо от того, какой ион и в каком диапазоне концентраций
исследуют, имеет значение только заряд иона. Так, изменение
концентрации натрия со 150 до 165 ммоль/л, т. е. на 10 %, вызыва-
ет такое же изменение электрического потенциала, как измене-
ние калия от 5,0 до 5,5 ммоль/л, хотя в первом случае концентра-
ция возрастает на 15 ммоль/л, а во втором всего на 0,5 ммоль/л.
В этом заключается принципиальное преимущество потенцио-
метрических методов по сравнению, например, с фотометри-
ческими — точность определения всегда пропорциональна кон-
центрации, она не зависит от диапазона — идет ли речь о нор-
мальных или патологических величинах.
Ионоселективный электрод измеряет не общую концентрацию
вещества, а так называемую активность иона, которая, хотя обычно
пропорциональна общему содержанию, но зависит от многих фак-
торов: связи ионов с каким-либо компонентом биологической
среды, другими ионами или белком, влияния ионной силы рас-
твора, а также от того, что измеряют не общее содержание иона в
единице объема, а концентрацию его в свободной воде. Простран-
ство физически занятое другими молекулами, в первую очередь
большими молекулами белка, а также липопротеинами, исклю-
чают из расчета. В условиях патологии, при гиперпротеинемии или,
особенно, при гиперлипидемии, их влиянием нельзя пренебре-
гать. Так, массовая концентрация воды сыворотки крови у здоро-
вых людей обычно около 0,93 кг/л, но в некоторых случаях может
падать и до 0,80 кг/л. Поэтому активность иона в биологической
среде никогда не равна его концентрации, причем коэффициент
активности — отношение активности к концентрации — несколько
варьирует.
Ионометры (приборы, которые считывают данные ионоселек-
тивных электродов) калибруют так, чтобы измерялась активность
иона, а на шкале выдавались значения концентраций. Такая ка-
либровка возможна только при совершенно определенных усло-
виях: величине pH, концентрации других ионов, содержании бел-
ка, температуре. Изменение любого из этих параметров приводит
к ошибке вследствие нарушения калибровки.
Согласно рекомендациям Международной федерации кли-
нической химии и лабораторной медицины по применению
57
ионоселективных электродов для анализа электролитов в крови в
калибровочном растворе содержание воды должно составлять
0,93±0,005 кг/л, pH 7,40±0,05, концентрация альбумина, обще-
го белка, холестерина и триглицеридов — в пределах референт-
ных величин. Результаты выдаются в единицах концентрации ве-
щества, моль/л, в расчете на один литр «стандартной плазмы»
или на воду, содержащуюся в плазме.
Калибровку электрода необходимо проводить ежедневно по двум
точкам по промышленно изготовляемым калибровочным раство-
рам с указанием в паспорте концентрации в плазме или в воде
плазмы. В постоянной и систематической калибровке нуждаются
все электроды, срок работы каждого из них ограничен. Они очень
чувствительны к попаданию посторонних веществ — щелочей,
кислот, дезинфицирующих агентов, а также к нагреванию. Осо-
бую опасность представляют поверхностно-активные вещества,
которые могут попасть в пробы, если используется недостаточно
чистая посуда.
Промывка растворами, не предусмотренными инструкцией,
чревата разрушением устройства. Белковые молекулы, адсорбиру-
ясь на поверхности электродов, могут быть причиной неверных
показаний, их удаляют многократным промыванием или разру-
шая протеолитическими ферментами (пепсином).
Области применения в клинической лабораторной диагностике.
Потенциометрический метод анализа электролитов обладает ря-
дом преимуществ перед колориметрическими и пламенно-фото-
метрическими методами. В отличие от последнего это — полно-
стью безопасный микрометод. Ионоселективные анализаторы —
настольные малогабаритные приборы, позволяющие устанавли-
вать уровень функционально активных ионов. Электроды с ис-
пользованием потенциометрии применяют в полуавтоматических
и автоматических анализаторах — ионометрах для определения
pH растворов, а также для определения электролитов — ионов
натрия, калия, кальция, лития, хлоридов, общего СО2 в сыво-
ротке, плазме, цельной крови, моче, почечных диализатах, поте.
Метод определения ионов без разведения биожидкости назы-
вается прямой потенциометрией, в случае разведения биожидко-
сти перед определением метод называется непрямой потенциомет-
рией. Без этих анализаторов не может работать экспресс-лаборато-
рия, обслуживающая операционные блоки, реанимационные от-
деления, отделения неотложной терапии и «искусственной» поч-
ки; дежурные лаборатории.
В лабораториях нашей страны работают отечественные микро-
анализаторы ионоселективные ЭЦ-59 (ООО «Квертимед») для
быстрого и прямого определения ионов натрия и калия, известен
анализатор «АнИон» (Беларусь) для одновременного определе-
ния ионов натрия, калия, хлоридов, лития, кальция и pH, ана-
58
лизаторы зарубежного производства. Ионоселективные электроды
на основе потенциометрии в виде модулей (блоков) включают в
общее устройство различных биохимических автоанализаторов,
в том числе и в линии срочного анализа. Разработан метод прямой
потенциометрии с использованием «сухой» химии — потенцио-
метрические слайды для определения натрия, калия, хлоридов.
2.2. Полярография
Принцип метода. Полярография, или вольтамперометрия, —
метод анализа, в котором изучается зависимость между силой тока
и напряжением на границе «электрод—-раствор». В отличие от по-
тенциометрии при вольтамперометрии разность электрических по-
тенциалов на границе двух фаз (между электродом и исследуемым
раствором) поддерживается постоянной, а измеряется сила про-
ходящего тока. В классическом варианте полярографии исследует-
ся зависимость тока, протекающего через погруженный в раствор
электрод, от величины приложенного электрического напряже-
ния (потенциала). Величина потенциала обычно изменяется в диа-
пазоне от положительного значения в несколько десятых вольта
до отрицательного, примерно до двух вольт, записанную кривую
называют полярограммой и регистрируют прибором — поляро-
графом.
Большие отрицательные или положительные разности напря-
жений прилагать нельзя, так как начинается электролиз воды.
В специальных датчиках или приборах может измеряться сила тока
только при одном, фиксированном значении потенциала. В поля-
рографической ячейке всегда, по крайней мере, два электрода —
рабочий, на котором, собственно, и происходят исследуемые
процессы, и электрод сравнения, который выбирают так, чтобы
его характеристики по возможности не влияли на процессы, про-
исходящие на рабочем электроде.
В выпускаемых промышленностью для клинико-диагностиче-
ских лабораторий полярографических датчиках в качестве элект-
рода сравнения обычно используется хлорсеребряный, реже ка-
ломельный полуэлемент. Иногда используют более сложную элек-
трическую схему, в которой есть еще третий — компенсацион-
ный — электрод, разгружающий рабочий электрод от фонового
(неспецифического) тока.
Электрохимическая сущность метода заключается в том, что
на рабочем электроде молекула исследуемого вещества восстанав-
ливается (получает электрон), реже окисляется (теряет электрон),
что обеспечивает прохождение электрического тока в цепи. Усло-
вия измерения подбирают так, чтобы величина тока определялась
скоростью диффузии молекул к электроду, т. е., в конечном счете,
59
их концентрацией. Для молекулы каждого вещества характерна
пороговая величина электродного потенциала, при которой она
может отдать или получить электрон. При достижении этой вели-
чины ток в цепи усиливается, так как в процесс включается но-
вый вид молекул или ионов. При постепенном увеличении элект-
рического потенциала происходит характерный рост силы тока в
цепи, называемый полярографической волной. Ее форма позво-
ляет судить о качественном и количественном составе раствора.
Потенциал, соответствующий половине высоты волны, так на-
зываемый потенциал полуволны, является величиной, характер-
ной для данного вещества. Он зависит также от состава раствора
(фона).
Если в растворе находятся несколько электрохимически ак-
тивных веществ, т. е. способных обмениваться электронами с элек-
тродом, полярограмма представляет собой полярографическую
кривую с отдельными подъемами (волнами), каждая из которых
соответствует какому-то определенному сорту молекул или ионов.
Высоты полярографических волн пропорциональны концентра-
циям веществ, участвующих в реакциях на электроде. Для успеш-
ного воспроизведения полярографических эффектов большое зна-
чение имеет материал электрода, качество его поверхности и ус-
ловия перемешивания раствора.
Эти параметры хорошо стандартизуются в классическом вари-
анте полярографии, использующем так называемый ртутный ка-
пельный электрод. В нем вытекающая из капилляра ртуть выпол-
няет функцию рабочего отрицательного электрода (катода), по-
верхность которого непрерывно обновляется, одновременно рас-
тущая капля перемешивает раствор. Функцию второго электрода
выполняет ртуть, разлитая на дне сосуда. По понятным причинам
ртутный капельный электрод неудобен в работе, его используют
в основном в научных исследованиях, а для клинико-диагности-
ческих лабораторий разработаны и широко применяются специ-
альные аналитические устройства с твердыми электродами, в ко-
торых исследуется не вся полярографическая кривая, а измеряет-
ся сила тока лишь при том значении потенциала, при котором
аналит наиболее специфично участвует в электродных реакциях.
Оптимальная величина потенциала зависит не только от свойств
исследуемого вещества, но и от того, какой используется элект-
род сравнения, поскольку он сам генерирует определенную раз-
ность потенциалов по отношению к раствору. В некоторых случаях
складывается такая ситуация, что никакой внешний источник
электрического напряжения не нужен, его функцию выполняет
электродвижущая сила электрода сравнения. На характер поля-
рографической кривой, и, соответственно, силу тока при фикси-
рованном напряжении, влияют не только свойства электрода и
состав раствора, но и присутствие катализатора.
60
Анализируемые вещества далеко не всегда способны непосред-
ственно передавать электроны на электрод (окисляться) или за-
бирать их от него (восстанавливаться), часто это реализуется че-
рез посредство промежуточного вещества — переносчика элект-
ронов, например соединений железа.
В качестве материала для твердых электродов используют бла-
городные металлы или графит.
Применяют три варианта полярографического определения
метаболитов, имеющих клиническое значение. Первый основан
на учете потребления кислорода, второй — на образовании пер-
оксида водорода, третий — на использовании в качестве катали-
заторов ферроценов.
Кислородный электрод — это отрицательно заряженный метал-
лический электрод, на поверхности которого происходит восста-
новление кислорода воздуха с образованием иона гидроксила ОН-.
Выбирают такие условия, при которых сила тока в цепи пропорцио-
нальна количеству кислорода воздуха в растворе, т. е. величине его
парциального давления. Если нет никаких химических реакций с
участием кислорода, его концентрация постоянна, она зависит от
высоты местности над уровнем моря и температуры. Однако если в
растворе идет химическая реакция, в которой потребляется кисло-
род, его парциальное давление падает, что и улавливает прибор.
В компактном кислородном электроде предусмотрена защита
от некоторых компонентов пробы, которые могут мешать Опреде-
лению, например от белков. Мембрана из некоторых полимеров,
проницаемая для кислорода, отделяет платиновый катод и сереб-
ряный анод от исследуемой пробы. В качестве электролита чаще
всего используют хлорид калия, который дает стабильный (се-
ребро/хлористое серебро) референтный потенциал.
Поскольку известно много биохимических ферментативных
реакций, в процессе которых потребляется кислород, этот прин-
цип реализован в некоторых приборах для определения глюкозы,
холестерина, мочевой кислоты в сыворотке крови. Возможность
исследовать целый спектр аналитов зависит от состава буферной
смеси и используемых ферментов. Ферментная система не обяза-
тельно должна быть иммобилизованной, она может функциони-
ровать и в растворенном виде.
Кислородный электрод также широко используют для опреде-
ления парциального давления кислорода РОг в биологических жид-
костях и тканях (рис. 2.3). Чаще всего он входит в состав анализа-
тора для оценки кислотно-щелочного состояния крови. Так как в
крови много веществ, способных участвовать в электродных реак-
циях, для повышения селективности электрод покрывают тонкой
гидрофобной пластмассовой мембраной, через поры которой мо-
гут диффундировать только небольшие нейтральные молекулы
кислорода, а более крупные органические молекулы не проходят.
61
Рис. 2.3. Схема устройства РО2 электрода:
1 — катод — платиновая проволока (-0,65 В); 2 — стеклянный резервуар; 3 —
пластиковый контейнер; 4 — оболочка электрода; 5 — кислородное кольцо; 6 —
выход пробы; 7 — пластиковый катод (открытый конец проволоки); 8 — прони-
цаемая для кислорода мембрана; 9 — кювета; 10 — стеклянное окно; 11 — ввод
пробы; 12 — фосфатный буфер; 13 — анод — Ag/AgCl (0 В)
Пероксид водорода, который образуется во многих оксидазных
реакциях, можно уловить полярографически. Кислородный дат-
чик можно преобразовать для определения пероксида водорода,
если изменить полярность электрода. При положительном потен-
циале, прилагаемом к рабочему электроду, пероксид водорода
окисляется. Такой анодный электрод тоже должен быть изготов-
лен из платины.
Методы, основанные на полярографическом измерении пер-
оксида водорода, применяют в анализаторах для определения глю-
козы, свободного и общего холестерина.
В анализаторе «Эксан-Г» для быстрого определения глюкозы и
его модификации «ЭКСАН-Г-И» (экспресс-анализатор глюкозы
индивидуального пользования) фермент глюкозооксидаза иммо-
билизован на пористой полупроницаемой мембране, которая зак-
рывает материал платинового Н2О2 электрода, имеющего форму
62
диска (диаметром 1,5 —2,0 мм), — анода, и электрода сравнения —
хлорсеребряного электрода, имеющего форму кольца, окружаю-
щего платиновый электрод. Непосредственно к электроду приле-
гает трехслойная ферментная мембрана (для удобства пользова-
ния она приклеена к резиновому кольцу, с помощью которого
надевается на торец электрода).
Первый — ацетилцеллюлозный — слой затрудняет диффузию
органических веществ (аминокислот, аскорбиновой кислоты и др.),
которые могут подвергаться превращениям при потенциале окис-
ления перекиси водорода. Таким образом, повышается специфич-
ность электрода, его избирательность, поскольку к его поверхно-
сти пропускаются преимущественно газы и нейтральные молеку-
лы небольшой молекулярной массы. Второй слой мембраны со-
держит глюкозооксидазу, иммобилизованную в геле с помощью
глутарового альдегида. В этом слое происходит ферментативное
окисление глюкозы и образование глюконолактона. Третий слой
представляет собой лавсановую пленку, защищающую фермента-
тивный слой от загрязнения белками, клетками крови. Он также
придает мембране механическую прочность. Ферментный элект-
род с мембраной закреплен в стенке, заполненной буфером ячейки
объемом 1 мл.
При введении полуавтоматической пипеткой 50 мкл пробы она
разбавляется буферным раствором в 20 раз. Перемешивание про-
бы в ячейке происходит с помощью магнитной мешалки, а уда-
ление отработанного раствора, промывка ячейки и заполнение ее
буфером — с помощью перистальтического насоса. При введении
в измерительную ячейку пробы, содержащей глюкозу, образу-
ющийся в ферментной мембране пероксид водорода окисляется
на рабочем электроде, вызывая увеличение анодного тока. Сигнал
об этом увеличении поступает последовательно в электронный
блок, и цифровой индикатор регистрирует показатели глюкозы
(ммоль/л) в крови.
Преимущество этого метода — дешевизна реактивов, посколь-
ку мембрана с иммобилизованной на электроде глюкозооксида-
зой служит несколько месяцев, фактически расходуется только
недорогой фосфатный буферный раствор.
Полярографический метод определения глюкозы с использо-
ванием в качестве катализатора ферроцена — соединения железа,
аналога бензола, в кольце которого пять атомов углерода, реали-
зован в портативных анализаторах гликемии — глюкометрах. Вхо-
дящее в состав ферроцена железо окисляется глюкозой в присут-
ствии глюкозооксидазы, а затем восстанавливается на электроде.
Все необходимые ингредиенты заранее нанесены на полоску
(стрип) разового использования, что очень упрощает работу. Стрип
(биосенсор) вставляется в прибор концевой частью, напомина-
ющей вилку.
63
Количественная оценка результатов в этих системах может эко-
номично осуществляться с помощью потенциометрических, по-
лярографических или микрокалориметрических устройств. Неред-
ко ферменты наносят на поверхность ионоселективного электро-
да, с помощью которого измеряется количество иона, участву-
ющего в катализируемой ферментом реакции (например, чувстви-
тельный к кислороду электрод, покрытый слоем, содержащим
глюкозооксидазу, измеряет содержание глюкозы в растворе по
количеству кислорода, использованного в реакции окисления глю-
козы; аммонийчувствительный электрод может быть совмещен с
мембраной, содержащей уреазу). Эта схема применения иммоби-
лизованных ферментов является одним из вариантов их включе-
ния в состав биосенсоров, т. е. устройств, преобразующих эффект
специфического взаимодействия с аналитом, основанного на био-
логических закономерностях, в сигнал, поддающийся обработке
электронным компонентом этого устройства (более подробно
см. гл. 3. «Технологии с использованием специфической активнос-
ти ферментов»).
Области применения в клинической лабораторной диагностике.
Чувствительные к кислороду и пероксиду водорода полярогра-
фические электроды применяют для определения концентрации
субстратов в клинической химии в специальных анализаторах для
определения одного или многих компонентов: глюкозы (гидролиз
ее глюкозооксидазой), мочевой кислоты (с уриказой), холесте-
рина (используют два фермента: холестеролэстеразу и холесте-
ролоксидазу), в двухканальных анализаторах для определения глю-
козы с другим компонентом (мочевой кислотой, мочевиной, лак-
татом).
В случае сочетания определения глюкозы с мочевиной для мо-
чевины используют электрод с уреазой, а определение аммиака
выполняют кондуктометрическим методом. Эти приборы приме-
няют в лабораториях для выполнения как плановых, так и сроч-
ных анализов, в том числе в экспресс-лабораториях, отделениях
реанимации, блоках интенсивной терапии и т.д. Устройства, ис-
пользующие биосенсоры и позволяющие выполнить анализ не-
посредственно по месту лечения пациента, применяют для быст-
рого и специфичного определения содержания искомого аналита
при неотложных состояниях, в практике семейного врача, непо-
средственно пациентом в домашних условиях.
В отечественном анализаторе глюкозы «Сателлит» (АО «ЭЛТА»)
использован биосенсор, содержащий в рабочей зоне глюкозоок-
сидазу и акцептор электронов ферроцен. Этот карманный прибор
имеет 4 элемента питания, хранит в памяти 10 последних резуль-
татов и применяется для индивидуального самоконтроля уровня
глюкозы больными сахарным диабетом, для срочного определе-
ния глюкозы у постели больного, например бригадой скорой по-
64
мощи, в экспресс-лаборатории, дежурным персоналом клиниче-
ских отделений. Газовые полярографические электроды использу-
ют для определения нейтральных молекул: в первую очередь кис-
лорода, закиси азота, перекиси водорода, окиси серы, а также
некоторых металлов.
2.3. Кулонометрия
Принцип метода. Кулонометрия — метод анализа, основанный
на измерении количества вещества, выделяющегося на электроде
в результате электрохимической реакции, или на измерении ко-
личества электричества, проходящего между двумя электродами в
электрохимической ячейке. В соответствии с законом Фарадея ко-
личество вещества оценивают по количеству израсходованного
электричества.
Области применения в клинической лабораторной диагностике.
Метод кулонометрического титрования наиболее часто использу-
ют для определения концентрации ионов хлора, например в тит-
раторе Котлова, в котором ионы серебра образуются при элект-
ролизе из серебряной проволоки, используемой в качестве ано-
да, погруженного в исследуемый раствор. Ионы хлора взаимодей-
ствуют с ионами серебра с образованием преципитата из AgCl.
После использования всех ионов хлора имеющиеся свободные
ионы серебра увеличивают электропроводность раствора, что вы-
зывает выключение реле и прекращение прохождения тока в си-
стеме. Количество образующихся ионов серебра, которое пропор-
ционально времени прохождения постоянного электрического
тока, эквивалентно количеству ионов хлора, присутствующих в
растворе.
Известно несколько вариантов кулонометрии, в любом из
них необходимы два вида электродов: один электрод, генери-
рующий ионы, а другой — электрод сравнения. Последний мо-
жет быть использован для потенциометрического или амперо-
метрического определения в конечной точке. Методы кулоно-
метрического титрования относятся к наиболее точным анали-
тическим методам.
2.4. Кондуктометрия
Кондуктометрия — метод анализа, в котором о химическом
составе раствора судят по электропроводности в межэлектродном
пространстве. Электрохимический потенциал рабочего электрода
не имеет значения, обычно измерения выполняют на перемен-
ном токе.
3 Меньшиков
65
При кондуктометрии измеряют электрический ток между дву-
мя неполяризованными электродами, между которыми установ-
лен определенный электрический потенциал. Помимо оценки ка-
чества деионизированной, или дистиллированной, воды, кондук-
тометрию используют для измерения концентрации некоторых
аналитов, например, в анализаторах для определения концентра-
ции мочевины в сыворотке крови на основе гидролиза мочевины
уреазой с образованием аммиака, а также в гематологических ана-
лизаторах для подсчета клеток крови.
2.5. Субстратно-селективные электроды
Субстратно-селективные электроды представляют собой осно-
ванные на различных принципах датчики концентрации, элект-
рические характеристики которых меняются, когда поверхность
соприкасается с раствором, содержащим исследуемый аналит.
В эту группу входят и ферментные электроды, имеющие участок
(слой), содержащий фермент, способный ускорять химическую
реакцию, в которой аналит выступает в роли субстрата, а продукт
реакции улавливается электрохимическим методом.
Субстратно-специфические электроды могут быть как потенцио-
метрическими, в том числе ионоселективными, так и полярогра-
фическими. Четкой границы между субстратно-селективными и
ионоселективными электродами нет, речь идет скорее о степени
сложности конструкции. К той же категории относятся и газоселек-
тивные электроды, предназначенные для электрохимического
определения растворенных в воде газообразных продуктов.
Контрольные вопросы
1. Какие оптические методы и приборы для измерения концентрации
или активности аналитов в клинико-диагностических лабораториях вы
знаете?
2. В чем отличие устройства фотометра от спектрофотометра, флюо-
рометра от спектрофлюорометра?
3. Объясните различие принципов выполнения измерений при гори-
зонтальной и вертикальной фотометрии. Где их применяют? В чем пре-
имущества и недостатки каждого из этих видов фотометрии?
4. Назовите виды люминесценции. Объясните их основные принципы.
5. В чем отличие турбидиметрии от нефелометрии при измерениях в
мутных растворах? Как устроены турбидиметры и нефелометры?
б. Назовите эмиссионные спектральные методы, применяемые в кли-
нической лабораторной диагностике. Какие из них являются референт-
ными и почему?
7. Охарактеризуйте основной принцип электрохимических методов
исследования.
66
8. Какие электрохимические методы, применяемые в клинико-диаг-
ностических лабораториях, вы знаете?
9. Объясните устройство электродов для потенциометрии. В каких це-
лях их применяют в клинико-лабораторной диагностике?
10. Объясните принципы работы полярографических электродов. Ка-
кие виды полярографических электродов для определения аналитов вам
известны? Назовите эти аналиты.
11. В чем заключается принцип кулонометрии? Для определения како-
го аналита в клинической лабораторной диагностике чаще всего приме-
няют данный метод?
12. Объясните принцип кондуктометрических измерений. В каких при-
борах клинико-диагностических лабораторий используется кондуктомет-
рия?
13. Опишите строение и принцип действия субстратно-селективных
электродов. Почему к ним относят ферментные электроды?
РАЗДЕЛ II. ФИЗИКО-БИОЛОГИЧЕСКИЕ
ТЕХНОЛОГИИ
Гл а в а 3
ТЕХНОЛОГИИ С ИСПОЛЬЗОВАНИЕМ СПЕЦИФИЧЕСКОЙ
АКТИВНОСТИ ФЕРМЕНТОВ
3.1. Ферменты как объекты клинико-лабораторных
исследований
Свойства ферментов. Ферменты (энзимы) — это белки, спо-
собные ускорять течение биохимических реакций. Они вырабаты-
ваются клетками организма, из которых попадают в его жидкие
среды — плазму, мочу, пищеварительные соки — либо в резуль-
тате физиологических процессов, либо как следствие заболевания.
Каждый орган вырабатывает определенный набор ферментов,
увеличение, снижение их содержания или исчезновение в био-
жидкостях служит характерным признаком повреждения органа.
На этом основано использование определения ферментов в кли-
нической лабораторной диагностике.
Как катализаторы ферменты обладают следующими свойства-
ми: они действуют в мельчайших количествах; выходят из реакции
неизмененными; при увеличении активности не влияют на состо-
яние равновесия реакции, а лишь ускоряют его установление.
Ферменты обладают всеми свойствами, характерными для бел-
ков. Большое значение имеет лабильность структуры фермента
(белка). Ее изменение или денатурация ведет к потере фермента-
тивной активности. Кроме того, стабильность ферментов зависит
от температуры, концентрации водородных ионов (pH) и кон-
центрации буфера. Белки являются поливалентными электроли-
тами и содержат способные к ионизации группы. Ионизационное
состояние влияет на активность фермента и зависит от pH. Будучи
электролитами, белки перемещаются в электрическом поле: по-
ложительно заряженные молекулы движутся к катоду, отрица-
тельно заряженные — к аноду. Чем выше заряд, тем быстрее дви-
жение молекулы. Вследствие этого смесь белков с различными
зарядами можно разделить электрофоретически, что и применя-
ется при разделении изоферментов.
Изоферменты — ферменты, катализирующие одну и ту же ре-
акцию, различающиеся величиной молекулярной массы, соста-
вом аминокислот, электрофоретической подвижностью, термо-
68
стабильностью, оптимумом pH, субстратной специфичностью,
действием на них активаторов и ингибиторов и иммунологиче-
скими характеристиками.
Различные формы ферментов могут различаться по органу,
в котором преимущественно синтезируются (печень, сердце, мозг
и др.), по частям клетки (митохондрии, цитоплазма и т.п.),
а также по генной структуре индивидуума.
К ферментам, существующим в виде различных форм, отно-
сятся креатинкиназа, аспартатаминотрансфераза, лактатдегидро-
геназа, малатдегидрогеназа, щелочная фосфатаза и др.
Под количеством фермента следует понимать концентрацию
специфического белка, а под активностью — его способность
ускорять течение биохимической реакции. Для большинства фер-
ментов по определяемой активности можно судить и об их коли-
честве. Но есть и такие ферменты, специфические изменения ко-
торых отражает только массовая концентрация, например креа-
тинкиназа и ее изофермент МВ.
Комиссия по ферментам Международного биохимического со-
юза установила, что единицу каталитической активности фер-
мента можно определить как количество фермента, которое ката-
лизирует превращение 1 мкмоль субстрата в 1 мин. Эта единица
называется международной единицей, ME, или Ш (International
Unit). В системе СИ единицей каталитической активности фер-
мента является катал (кат), который соответствует количеству
фермента, превращающему 1 моль субстрата за 1 с. При этом объем-
ная активность фермента выражается как МЕ/л или кат/л, или
кат/м3 и носит название концентрации каталитической активно-
сти, или каталитической концентрации, в отличие от удельной
активности, которая выражается в МЕ/мг белка. В случае опреде-
ления массовой концентрации фермента, например креатинки-
назы МВ, ее выражают в мкг/л, используя иммунохимические
методы (радиоиммунологический анализ или иммуноэнзимомет-
рические тесты).
Вещество (вещества), которое подвергается воздействию фер-
ментов (ферментации) называется субстратом (субстратами),
образующееся вещество — продуктом. Скорость ферментативной
реакции зависит не только от количества фермента, но и от мно-
гих других условий, в которых протекает эта реакция (pH среды;
температуры; присутствующих солей; модификаторов — ускори-
телей реакции (активаторов); веществ, тормозящих реакцию —
ингибиторов; концентрации субстратов; продуктов реакции). Для
точного выполнения анализа ферментов необходима стандарти-
зация и оптимизация всех условий выполнения исследования, при
которых исследуемый фермент проявляет максимальную актив-
ность. Тогда неизбежные небольшие отклонения в повседневной
работе будут сказываться на результатах в минимальной степени.
69
Активность фермента определяют путем измерения превраще-
ния субстрата в единицу времени при строго определенных и кон-
тролируемых условиях опыта. Эти условия выбирают, основыва-
ясь на данных кинетики ферментативных реакций — науки об их
скоростях.
Основное положение кинетики ферментативных реакций за-
ключается в том, что эти реакции протекают в два этапа (рис. 3.1).
Первоначально фермент взаимодействует с субстратом (субстра-
тами), который присоединяется к определенному месту молеку-
лы фермента — активному центру:
Е+ ESЕ+ Р.
При этом образуется фермент-субстратный комплекс, который
затем распадается с образованием продукта (продуктов) реакции.
Освободившийся фермент может затем снова участвовать в реак-
ции.
Высокую каталитическую активность ферментов, благодаря
которой реакции в живой клетке ускоряются во много раз, мож-
но объяснить высокой субстратной специфичностью ферментов.
Различают абсолютную субстратную специфичность ферментов, т. е.
их способность катализировать расщепление лишь одного вида
соединений (например, мочевина — единственный природный
субстрат для уреазы; пируваткиназа способствует переносу фос-
фатной группы только между фосфоенолпируватом и АДФ). Не-
которые ферменты проявляют групповую субстратную специфич-
ность, т.е. эти ферменты способны катализировать аналогичное
превращение близких по строению соединений. Например, гексо-
киназа способна переносить фосфатную группу от АТФ не только
на D-глюкозу, но с той же скоростью и на D-фруктозу, D-ман-
нозу, 2-дезокси-0-глюкозу, но не проявляет аналогичной ката-
литической активности в отношении D-галактозы и других гексоз
и пентоз; липаза гидролизует липиды различного состава.
ES
Рис. 3.1. Механизм действия фермента:
Е — фермент; 5 — субстрат; ES — фермент-субстратный активный комплекс;
(£ + Р) — продукт реакции
70
Некоторые ферменты не проявляют специфичности в отноше-
нии субстрата. Например, щелочная фосфатаза катализирует ре-
акцию гидролиза эфиров ортофосфорной кислоты, причем спе-
цифична в отношении однозамещенных производных ортофос-
фата (4-нитрофенилфосфат, фенолфталеинмонофосфат, тимол-
фталеинмонофосфат и др.). Двух- и трехзамещенные производные
гидролизу не подвергаются.
Многие ферменты проявляют стереоспецифичность, т. е. спо-
собны катализировать превращения лишь определенных стерео-
изомеров (например, аминокислот L-ряда, но не D-ряда, D-изо-
форм моносахаридов, но не L-изоформ). Использование катали-
тических свойств ферментов в отношении определенных специ-
фических субстратов лежит в основе применяемых в клинической
лабораторной диагностике методов исследования их активности в
биоматериалах человека. Субстраты бывают природного происхож-
дения и синтетические. Чаще всего используют синтетические суб-
страты. Выбор субстрата очень важен, так как субстраты гидроли-
зуются с различной скоростью.
Оптимальная концентрация субстрата зависит от pH и темпе-
ратуры, при которой проводят реакцию. Природные субстраты для
некоторых ферментов остаются неизвестными до настоящего
времени. Так, нативный субстрат для у-глутамилтрансферазы неиз-
вестен. В наборах реактивов для определения активности этого фер-
мента используют синтетические субстраты — Ь-у-глутамил-4-нит-
роанилид и Ь-у-глутамил-3-карбокси-4-нитроанилид.
Особую группу составляют хромогенные субстраты. Будучи со-
единены с некоторыми ионами, аминокислотами, полипепти-
дами, сахаридами, эти соединения имеют низкую величину оп-
тической плотности, иногда практически бесцветны. Под дей-
ствием ферментов они гидролизуются с образованием окрашен-
ных соединений, таких, как 4-нитроанилин, 4-нитрофенол,
5-амино-2-нитробензойная кислота. Когда окрашенное соеди-
нение высвобождается из хромогенного субстрата в реакцион-
ную смесь, светопоглощение этой смеси увеличивается и мо-
жет быть оценено фотометрически. Таким образом, можно по-
лучить количественный результат, характеризующий активность
фермента. Хромогенные субстраты используют для определения
концентрации некоторых ферментов, компонентов системы
гемостаза, ионов, которые активируют фермент, входящий в
состав рабочего реактива (например, для определения натрия,
калия, хлоридов).
Показатель pH и вид буфера оказывают большое влияние на
определение активности фермента. Для каждого фермента суще-
ствует оптимальное значение pH, при котором его активность самая
большая, именно в этих условиях она и должна быть измерена.
Определение активности фермента проводят в буферных раство-
71
pax — смесях слабых кислот и солей, которые способны обеспе-
чивать стабильное значение pH. Буферный раствор, в котором
проводят определение ферментативной активности, должен быть
выбран так, чтобы его максимальная буферная емкость по воз-
можности точно совпадала с оптимумом действия ферментов.
Оптимум pH зависит от многих факторов: вида буфера, вида и
концентрации субстрата, присутствия активаторов, ингибиторов
реакции, т. е. в известной степени, от среды, в которой протекает
реакция.
Влияние вида буфера для некоторых ферментов очень велико.
Так, для щелочной фосфатазы можно выделить три группы бу-
феров: инертные (карбонатный, барбиталовый); буферы, инги-
бирующие активность фермента (глициновый, пропиламино-
вый); активирующие буферы (2-метил-2-амино-пропанол-1, или
АМП-буфер, диэтаноламиновый — ДЭА, N-мртилглюкаминовый
буфер). Активность щелочной фосфатазы в этих буферах с суб-
стратом 4-нитрофенилфосфатом при одной и той же температуре
будет возрастать в такой последовательности: глициновый буфер <
< АМП < ДЭА < N-метилглюкаминовый буфер.
Активирующие буферы относятся к так называемым трансфор-
мирующим, или трансфосфорилирующим, буферам, которые в
отличие от других обладают свойством акцептировать ион фосфа-
та и таким образом удалять один из продуктов реакции из реакци-
онной смеси, освобождать активный центр фермента и ускорять
ферментативную реакцию. Понятно, что в зависимости от вида
буфера конечные результаты активности щелочной фосфатазы
будут различны, а следовательно, и значения активности фер-
мента у здоровых людей также будут зависеть от состава буфера.
Так, при определении у здоровых взрослых людей с субстратом
4-нитрофенилфосфатом при температуре 37 °C активность щелоч-
ной фосфатазы с буфером АМП у женщин составляла 27 — 93 МЕ/л,
у мужчин 34—88 МЕ/л, с буфером ДЭА — соответственно 80 —
306 МЕ/л и 60-306 МЕ/л.
Кроме того, известно, что вещества — активаторы фермента-
тивной реакции проявляют свои активирующие свойства в буфе-
рах определенного состава, а в других буферах — не проявляют.
Это уже в течение многих лет используют для повышения чув-
ствительности методов определения активности аминотрансфе-
раз (АсАТ и АлАТ). Так, при использовании фосфатного и трис-
буфера в кинетических определениях активности аминотрансфе-
раз на основе оптического теста Варбурга без активаторов резуль-
таты практически совпадают (при соблюдении одинаковых про-
чих условий: субстрат, кофакторы, температура и т.д.). Но такой
активатор реакции, как витамин В6 (пиридоксальфосфат), про-
являет свои активирующие свойства лишь в трис-буфере и не про-
являет их в фосфатном буфере.
72
При проведении внутрилабораторного контроля качества с
контрольным материалом следует сопоставлять свои результаты,
полученные в нем, с величинами, указанными в паспорте к кон-
трольному материалу (контрольной сыворотке) именно для того
метода определения активности фермента, который совпадает с
используемым. При этом важное значение имеет и применяемый
буфер.
Активность фермента в большой степени зависит от темпера-
туры. Температура должна быть точно фиксирована. Существует
представление о «температурном оптимуме» при определении ак-
тивности ферментов. В здоровом организме человека фермент функ-
ционирует при температуре 36 — 37 °C. При любой избранной тем-
пературе должен быть обеспечен строгий контроль за ее постоян-
ством в пределах ±0,1 °C. Каждый температурный режим имеет
свои преимущества и неудобства. Определение при температуре
37 °C имеет то преимущество, что такие условия ближе всего к
физиологическим. Однако некоторые ферменты при этой темпе-
ратуре, хотя и медленно, но все же инактивируются. Чем выше
температура, тем быстрее идет реакция, иногда ее скорость на-
столько велика, что трудноизмерима.
Соблюдение и знание температуры, при которой выполнено
измерение ферментативной активности, важно как для лабора-
торных работников, так и для клиницистов. Активность фермен-
тов с повышением температуры увеличивается, следовательно,
увеличиваются референтные величины активности их в сыворот-
ке у здоровых людей и результаты в контрольных материалах, что
необходимо принимать во внимание при повседневной работе. Так,
например, при определении АсАТ в сыворотке крови УФ-тестом
с фосфатным буфером активность ее у здоровых женщин при тем-
пературе 30 °C менее 21,0 МЕ/л, при 37 °C менее 32,0 МЕ/л,
у мужчин соответственно менее 25,0 МЕ/л и менее 38,0 МЕ/л.
Для сопоставления результатов, полученных при различных тем-
пературных условиях, существуют коэффициенты перевода. В не-
которых моделях высокопроизводительных автоанализаторов, бы-
стро и точно выполняющих кинетические методы микроанализа
ферментов, обеспечено термостатирование при температурах 25,
30, 37 °C.
Обеспечение термостатирования при температуре 25 °C в ана-
лизаторах представляет большую сложность, особенно для рабо-
ты в жарком климате. Для поддержания температуры на различ-
ных этапах анализа необходимо исследуемый материал, реактивы,
измерительную кювету прогреть до заданной температуры. В боль-
шинстве лабораторий определение активности ферментов прово-
дится при температуре 37 °C. В настоящее время условия выполне-
ния референтных методов определения активности ферментов тоже
оптимизированы для измерения при температуре 37 °C.
73
К модификаторам действия ферментов относятся активаторы
и ингибиторы их активности. Активаторы — это, во-первых, ко-
факторы и коферменты, а во-вторых, собственно активаторы.
Кофакторы — соединения небелковой природы, в присутствии
которых проявляется активность ферментов благодаря их участию
в конформации активного центра. В роли кофакторов могут высту-
пать ионы металлов, например ионы Mg2+(фосфогидролазы, фос-
фотрансферазы); Fe2+, Fe3+ (цитохромы, пероксидаза, каталаза),
Мп2+ (аргиназа, фосфотрансферазы), Cu2+, Сп+(цитохромоксида-
за), К+(пируватфосфокиназа), Иа+(АТФаза) или сложные орга-
нические соединения.
Коферменты — органические соединения небелковой приро-
ды с относительно низким молекулярным весом по сравнению с
белком фермента. Они выполняют специфические функции, как,
например, перенос водорода (НАД или НАДФ в реакциях с уча-
стием гидрогеназ), перенос ацильных групп (кофермент А(КоА)
в реакциях синтеза и разложения жирных кислот), изомеризацию
(уридиндифосфат в реакции превращения глюкозы в галактозу).
В группу коферментов различного химического строения вхо-
дят глутатион, производные витаминов В6, BH фолиевой кисло-
ты, биотин, нуклеотиды и нуклеозиды (НАД, НАДН, АТФ, КоА)
и др. При выполнении определения коферменты добавляют в до-
статочном количестве, чтобы их недостаток не явился лимитиру-
ющим фактором реакции.
Собственно активаторы — вещества, препятствующие разру-
шению фермента или переводящие его из неактивной формы в
активную. Это органические вещества — желчные кислоты, акти-
вирующие панкреатическую липазу, тиоловые соединения, на-
пример N-ацетилцистеин (NAC), препятствующие окислитель-
ной инактивации креатинкиназы, минеральные соли и кислоты,
специальные ферменты — энтерокиназа в реакции превращения
трипсиногена в трипсин.
Иногда активацию фермента обеспечивает не один, а несколь-
ко ионов. Одни и те же ионы в различной концентрации могут
быть активаторами и ингибиторами для одних и тех же ферментов
или для различных ферментов (например, Zn активирует глицил-
лейцинпептидазу, алкогольдегидрогеназу, карбоксипептидазу, но
тормозит активность креатинкиназы).
Вещества, подавляющие активность ферментов, называются
ингибиторами. Так, йодуксусная кислота тормозит ферментатив-
ные реакции углеводного обмена. По механизму реакции с фер-
ментами ингибиторы подразделяют на две группы: ингибиторы,
вступающие с ферментами в обратимую реакцию (конкурентное
и неконкурентное торможение), и ингибиторы, реагирующие с
ферментом необратимо. К первой группе относятся ионы тяжелых
металлов, азид натрия, фторид натрия, дикарбоновые кислоты,
74
ко второй — фосфорорганические соединения (в частности, ин-
сектициды).
Концентрация природных ингибиторов в тканях и плазме не-
значительна и заметно не влияет на определение активности фер-
ментов. Лишь в моче найдены ингибиторы, мешающие определе-
нию, поэтому перед определением ферментов ее подвергают диа-
лизу. Известными ингибиторами являются фосфат для фосфатаз,
мочевая и аскорбиновая кислоты для пероксидаз. Конкурентные
ингибиторы являются аналогами субстрата. Увеличение концент-
рации субстрата в этом случае ведет к возрастанию скорости ре-
акции.
Неконкурентные ингибиторы образуют комплексы не с са-
мим ферментом, а с соединением фермента с субстратом. При
накоплении продукта реакции, являющегося для фермента суб-
стратом в обратной реакции, при достаточной концентрации
продукта часть фермента будет связана им, в результате скорость
прямой реакции замедлится. Это так называемое ретроингибиро-
вание. Поэтому удаление продукта после распада фермент-суб-
стратного комплекса ускоряет и увеличивает ферментативную
активность. Этим фактом и объясняется более высокая величина
активности щелочной фосфатазы при использовании трансфос-
форилирующих буферов (АМП, ДЭА), чем нетрансфосфорили-
рующих (глициновый буфер). При разведении сыворотки дей-
ствие обратимых ингибиторов уменьшается, поэтому измеряе-
мая активность фермента становится выше, чем у неразведен-
ной сыворотки. Тормозят ферментативные реакции и некоторые
антикоагулянты.
Необратимое ингибирование связано с образованием вещества,
которое не может отделиться от фермента. Большинство необра-
тимых ингибиторов разрушают структуру ферментов. Возможно
внесение ингибиторов — остатков поверхностно-активных ве-
ществ — детергентов, входящих в состав моющих средств, ис-
пользуемых для мытья лабораторной посуды. Кроме того, извест-
ны ингибиторы, образующиеся спонтанно в растворах НАДН и
НАДНФ. Поэтому вопросы стабильности растворов этих кофер-
ментов имеют чрезвычайно важное значение. Необходимо не только
соблюдать сроки хранения реактивов, содержащих эти вещества,
но и постоянно следить за их пригодностью, которая характери-
зуется определенным значением оптической плотности этого ре-
актива, измеренной против воды при длине волны 340 нм и дли-
не оптического пути равной 1 см. Если оптическая плотность ре-
актива меньше значения, нормируемого изготовителем при изме-
рении в указанных им условиях, такой реактив применять нельзя.
Для того чтобы правильно оценить полученные результаты, при
ручной работе такими методами необходимо предварительно из-
мерять оптическую плотность реактива, а при работе на автоана-
75
лизаторах нормированное значение оптической плотности реак-
тива (так называемое Ло) должно быть заложено в программу для
метода.
Методы определения активности ферментов. Методы, исполь-
зуемые в клинико-диагностических лабораториях, можно подраз-
делить на несколько групп.
Методы, основанные на измерении продукта реакции в ее конеч-
ной точке. В качестве примеров можно привести методы определе-
ния активности АсАТ, АлАТ и ЛДГ по реакции с 2,4-динитрофе-
нилгидразином (метод Райтмана — Френкеля). В них кетокисло-
ты, образующиеся в ходе реакции переаминирования под дей-
ствием АсАТ (щавелевоуксусная кислота) или АлАТ (пировино-
градная кислота) или окисления под действием ЛДГ (пировино-
градная кислота), при взаимодействии с 2,4-динитрофенилгид-
разином в щелочной среде образуют 2,4-динитрофенилгидразоны.
В случае щелочной фосфатазы специфическая реакция с 4-нитро-
фенилфосфатом останавливается после длительной инкубации
раствором щелочи, а в случае у-глутамилтрансферазы — раство-
ром уксусной кислоты. Измеряют оптическую плотность стабиль-
ных в течение достаточно длительного времени окрашенных про-
дуктов реакции (2,4-динитрофенилгидразонов, 4-нитрофенола,
4-нитроанилина).
Технология методов обеспечивает такие условия, что реакция
инкубации пробы с субстратом развивается в течение достаточно
длительного времени (30 мин). В конце ее объем полученной сме-
си для измерения велик, чтобы провести измерение на обычных
фотоколориметрах, более простых и дешевых, чем фотометры для
измерений в ультрафиолетовой области. Эти методы более просты
и доступны лабораториям. Но (это особенно касается АсАТ и АлАТ)
отмечается их меньшая специфичность (другие кетокислоты, боль-
шой спектр лекарств завышают результаты), низкая чувствитель-
ность, меньшая точность, небольшой диапазон измерения актив-
ности, необходимость постановки холостой пробы на каждую
сыворотку по сравнению с не имеющими этих недостатков кине-
тическими методами.
Кинетические методы. Эти методы характеризуются тем, что в
ходе ферментативной реакции непрерывно или периодически че-
рез равные промежутки времени определяют потребление субстра-
та, кофермента или образование продукта.
Регистрируя изменение сигнала детектора (чаще всего исполь-
зуют фотометрические кинетические методы) в зависимости от
времени, чрезвычайно важно установить линейную область этого
графика (линейный участок I кривой кинетики на рис. 3.2, и
участок II на рис. 3.3). Здесь изменение оптической плотности (Л2 -
-Ai, А3 - А2, ..., А9 - As или А„ - A„.j) через равные интервалы
времени (t2 - Zjj 6 - h-, ~ h или - 6»-1) одинаково и макси-
76
А, ед. опт. пл. (340 нм)
Рис. 3.2. Изменение оптической плотности (А) в зависимости от времени
с момента запуска (старта) реакции (?) при определении активности
ферментов в методах, основанных на измерении уменьшения оптиче-
ской плотности (УФ-тест) на фотометре FP-901 (Labsystems, Фин-
ляндия)
мально. Важно установить также начало линейной части кривой
кинетики реакции после добавления стартового реактива — (см.
рис. 3.2, Ао — оптическая плотность реакционной смеси до добав-
ления стартового реактива, /0 — момент добавления стартового ре-
актива, (?! - tQ) — период задержки выхода изменения оптичес-
кой плотности на линейный участок — lag phase, delay). В течение
этой фазы в реакционной смеси проходят неспецифические реак-
ции, и все компоненты реакционной смеси приходят в состояние
равновесия.
Рис. 3.3. Изменение оптической плотно-
сти (Л) в зависимости от времени с мо-
мента запуска (старта реакции, f) при
определении активности ферментов в ме-
тодах, основанных на измерении увели-
чения оптической плотности:
I — период задержки (lag phase); II — линей-
ный участок графика, скорость увеличения
оптической плотности в равные интервалы
времени постоянна и максимальна; III —
период истощения субстрата
На рис. 3.3 периоду lag phase, соответствует участок I, когда так
же, как и на отрезке кривой III — при истощении субстрата,
изменение оптической плотности в равные интервалы времени
происходит нелинейно.
В современных кинетических методах определения активности
ферментов для измерений избирают ту продолжительность линей-
ной части кривой кинетики реакции, которая обеспечивает до-
статочную чувствительность, точность результатов и хорошую про-
изводительность метода.
В 1933 г. немецкий химик О.Варбург обнаружил эффект высо-
кого светопоглощения восстановленного никотинамидаденинпи-
ридиндинуклеотида (НАДН) в ультрафиолетовой области спект-
ра (при длине волны 340 нм) и отсутствие этого эффекта у окис-
ленной формы — НАД. Аналогичными свойствами обладают и
соли этих соединений — фосфаты. Как в фотометрических, так и
флюорометрических методах определения активности ферментов
и других аналитов метод известен как оптический тест Варбурга,
или УФ-тест.
В зависимости от характера изменения оптической плотности в
ходе реакции различают кинетические методы, в которых проис-
ходит снижение оптической плотности, например окисление
НАДН сопровождается уменьшением оптической плотности в
кинетических методах определения активности АсАТ, АлАТ, ЛДГ,
основанных на оптическом тесте Варбурга (см. рис. 3.2), и мето-
ды, в которых происходит увеличение оптической плотности (оп-
ределение активности креатинкиназы на основе оптического те-
ста Варбурга, определение активности щелочной фосфатазы с
4-нитрофенилфосфатом, у-глутамилтрансферазы с указанными
выше субстратами, а-амилазы с хромогенными субстратами) (см.
рис. 3.3). Это обстоятельство имеет значение при программирова-
нии методов на фотометрических анализаторах и автоанализато-
рах, учитывающем направление изменения оптической плотно-
сти и все фазы ферментативной реакции.
Фаза задержки в различных методах различна и ее продолжи-
тельность относится к обязательно программируемому парамет-
ру. При ручном выполнении кинетического метода измерения
оптической плотности следует начинать после фазы задержки.
Надо знать продолжительность линейной части кинетического
графика, в течение которой проводят измерения. Она также обя-
зательно программируется в автоматических и полуавтоматичес-
ких анализаторах, как и количество измерений оптической плот-
ности за этот период. При этом возможно два варианта програм-
мирования:
1) в программу вводят общее время реакции и интервал
(в секундах), через который должно осуществляться периодичес-
кое измерение оптической плотности;
78
2) количество измерений через равные интервалы времени на
протяжении общего времени реакции.
Методы измерения начальной скорости реакции. Данные методы
используют для измерения активности ферментов в тех случаях,
когда скорость реакции изменяется нелинейно. Измерения долж-
ны быть проведены лишь в самом начале реакции, при использо-
вании современных быстрых фотометров начальная скорость мо-
жет быть зарегистрирована в течение нескольких сотен или тысяч
миллисекунд. Для правильного определения начальной скорости
проводят касательную к кривой реакции в точке tQ.
Методы, основанные на измерении оптической плотности в двух
точках в линейной части кинетического графика. Первая точка из-
мерения находится в начале линейной части, вторая — через
определенное время после измерения первой точки. Это так назы-
ваемое псевдокинетическое измерение, или метод фиксирован-
ного времени.
В зависимости от принципа методы исследования ферментов
подразделяют на каталитические методы, без использования
НАД(Ф) или с использованием НАДН(Ф). К первым относятся
колориметрические методы с применением хромогенных субстра-
тов, флюориметрические методы, титриметрические, газометри-
ческие, электрохимические, с использованием субстратных элек-
тродов; изотопные методы, позволяющие проводить исследова-
ния на уровне клетки. Во вторую группу входят методы, основан-
ные на оптическом тесте Варбурга (используют для определения
активности более 100 ферментов); колориметрические методы,
сопряженные с применением индикаторов, образующих окрашен-
ные соединения; флюорометрические методы и др. Выделяют так-
же некаталитические методы (иммунологические, с применени-
ем аффинной хроматографии или титрования активного центра
фермента мечеными ингибиторами).
В клинико-диагностических лабораториях каталитическую ак-
тивность ферментов (каталитическую концентрацию) наиболее
часто определяют кинетическими (реже двухточечными) и коло-
риметрическими методами, массовую концентрацию — иммуно-
логическими методами.
Для расчета активности ферментов при работе методами ко-
нечной точки вместе с опытными пробами инкубируют калибро-
вочные пробы, содержащие калибровочные растворы с опреде-
ленной концентрацией образующегося в ходе реакции вещества
(например, пирувата при определении АсАТ и АлАТ). Измерив
оптическую плотность калибровочных растворов, строят калиб-
ровочный график и по нему находят активность фермента в опыт-
ной пробе. В случае кинетического определения вычисляют изме-
нение оптической плотности за 1 мин и рассчитывают активность
по формуле:
79
А(МЕ/л) = И-1 000 (ДЛ /1 мин),
tlv
где V — объем реакционной смеси, мл; 1 000 — коэффициент
перерасчета на 1 л сыворотки; ДВ/1 мин — изменение оптиче-
ской плотности в 1 мин; е — коэффициент миллимолярной опти-
ческой плотности хромогенного вещества в реакции, л/(ммоль см);
/ — длина оптического пути, см; v — объем пробы, мл.
Результат арифметических вычислений для первой дроби фор-
мулы V-1 ООО/eZf является постоянной величиной для конкрет-
ных условий определения активности фермента и используется в
расчетах как фактор (Т7). Значение фактора со знаком «+» или «-» в
зависимости от характера изменения оптической плотности в ходе
реакции — увеличения или уменьшения — вводят в программу
фотометра или биохимического анализатора, активность фермента
рассчитывается автоматически по формуле: А(МЕ/л) = F&D/X мин.
В случае применения единиц СИ, поскольку определяемая ка-
талитическая активность фермента намного ниже, используют
единицу нанокатал (нкат), либо микрокатал (мккат). Активность
фермента в таком случае выражают числом нанокатал (микрока-
тал), рассчитанных на 1 л сыворотки крови или 1 мг белка для
ткани, размерность в этом случае — нкат/л или нкат/мг белка.
Величина объемной активности фермента выражается следующим
образом:
1 МЕ/л = 16,67 нкат/л, 1 нкат = 0,06 МЕ/л.
В настоящее время для некоторых ферментов (изоферментов
креатинкиназы ВВ, МВ, у-глутамилтрансферазы, АсАТ, АлАТ,
щелочной фосфатазы, простатической кислой фосфатазы, пан-
креатической а-амилазы, изофермента ЛДГ) разработаны рефе-
рентные материалы (стандарты), которые можно использовать в
повседневной работе и в кинетических методах определения ката-
литической концентрации ферментов. В этих случаях расчет ре-
зультатов проводят по формуле:
(Д/)/1 мин)
А(МЕ/л) = Аст(МЕ/л),
(Д/)/1 мин)ст ’
где индексы «пр» и «ст» означают соответственно значения пробы
и стандарта.
3.2. Ферменты как аналитические реагенты
Специфичность действия, высокая активность в минимальных
количествах вещества, способность многократного участия в ре-
акции, отсутствие токсичности делает ферменты весьма привле-
80
кательным видом реагентов для клинических лабораторий. Их при-
менение позволяет значительно упростить многие аналитические
процедуры и сделать их экологически более чистыми, поскольку
ферментативные методы не нуждаются в едких или летучих реа-
гентах и высокой температуре реакции. Особенно удобно приме-
нять их в автоматических анализаторах, использующих фотомет-
рию в качестве завершающего этапа, так как при этом можно
обойтись легко автоматизируемыми операциями: отмериванием,
инкубацией и фотометрией.
Ферменты как реагенты используют в качестве вспомогатель-
ных и индикаторных ферментов в энзиматических тестах, а как
специфические катализаторы — при количественном определе-
нии различных аналитов, включая ионы.
Ферментные реагенты в клинической лаборатории применяют
практически только в форме готовых наборов реактивов промыш-
ленного изготовления. Можно выделить несколько видов этих ре-
активов: используемые для проведения ферментативной реакции
в жидкой среде; иммобилизованные на носителях ферменты для
проведения реакций в растворах электрохимическими методами —
биосенсоры; ферменты — реактивы в лигандных технологиях,
например в иммуноферментных методах; «сухая» химия.
В случаях использования ферментов в составе смеси реактивов
это могут быть сухие порошки, полученные путем лиофилизации.
Перед употреблением их необходимо растворить в предписанном
инструкцией объеме воды, обычно в том же флаконе, в котором
упакован порошок. Срок годности растворенного реактива значи-
тельно меньше, чем сухого порошка. Наличие в воде солей метал-
лов, органических примесей, которые могут тормозить или, на-
оборот, катализировать некоторые нежелательные ферментные
реакции, обусловливает требования к качеству воды, используе-
мой в лаборатории, для выполнения которых необходимо приоб-
ретение аппаратуры для эффективной очистки воды от возмож-
ных примесей.
Более надежны жидкие реактивы, поскольку их качество га-
рантировано изготовителем и реактивы готовы к применению,
так что исключена ошибка разведения. Задача лаборанта или ме-
дицинского технолога заключается в том, чтобы слить, как пра-
вило, два жидких реактива в соответствующей пропорции. Такие
высокоспецифичные ферменты, как уриказа, уреаза и глюкозо-
оксидаза широко используют в наборах реагентов для соответ-
ствующих рутинных исследований содержания мочевой кислоты,
мочевины и глюкозы.
Применение менее специфичных ферментов становится также
возможным за счет использования ферментных аналитических
систем, основанных на сопряженных реакциях, причем первый
из ферментов может обладать лишь относительной специфично-
81
стью (например, гексокиназа в системе для определения глюкозы
способна превращать в 6-фосфорные эфиры наряду с глюкозой и
другие сахара), а второй фермент обеспечивает специфичность
общего результата исследования (в данном примере эту специ-
фичность обеспечивает глюкозо-6-фосфатдегидрогеназа). Исполь-
зование нескольких ферментов в качестве последовательных эта-
пов исследования основано на их хорошей совместимости в реак-
ционной среде.
Многие химические методы определения метаболитов дают
завышенные результаты, так как присутствующие в сыворотке
соединения со сходной структурой реагируют аналогично опреде-
ляемому метаболиту. Например, в методе определения пирувата,
основанном на образовании гидразона с 2,4-динитрофенилгидра-
зином, другие кетокислоты, встречающиеся в сыворотке, реаги-
руют так же, как пируват, что приводит к завышению результа-
тов определения пирувата.
Специфичность действия ферментов как реагентов позволяет
при их применении не подвергать исследуемую биологическую
жидкость предварительной очистке, которую обычно проводят во
избежание интерференции. Так, определение пирувата по реак-
ции с НАДН с использованием в качестве катализатора фермента
лактатдегидрогеназы является специфичным только для пирувата.
К другим метаболитам, которые определяют с применением фер-
ментов как катализаторов, относятся АТФ, АДФ, АМФ, этанол,
глюкоза, сс-кетоглютарат, мочевина, мочевая кислота, холесте-
рин, креатинин, триглицериды, известны ферментативные мето-
ды для билирубина, ионов — натрия, калия, хлоридов, магния и
железа. Фотометрические принципы измерения в этих методах
исследования аналитов те же, что и перечисленные выше прин-
ципы фотометрических измерений активности ферментов.
Наиболее широко применяют методы исследования, в кото-
рых определяют количество продуктов катализируемой фермен-
том реакции по достижении равновесия — методы «конечной точ-
ки». Оптимальными вариантами таких реакций являются те, при
которых происходит практически полное превращение субстрата
в метаболит. Если такое полное превращение на первом этапе ре-
акции не достигается, можно дополнительно с помощью подхо-
дящего фермента выполнить преобразование первоначального
продукта во вторичный, что позволяет уже полностью обеспечить
измерение всего количества исследуемого субстрата.
Классическими примерами ферментативных методов опреде-
ления аналитов в конечной точке реакции являются методы опре-
деления глюкозы после ее гидролиза глюкозооксидазой на основе
колориметрической реакции Триндера с 4-аминофеназоном —
ГОД-ПОД-ПАП. Это реакция, основные компоненты реактивов
для которой — глюкозооксидаза (ГОД), пероксидаза (ПОД),
82
4-аминофеназон и фенольное соединение: p-D-глюкоза + Н2О2 +
+ О2 —ГОД -> D-глюконовая кислота + Н2О2; Н2О2 + 4-аминофе-
назон + оксибензолсульфонат —ПОД -> хинониминовый краси-
тель + Н2О. Образующийся краситель имеет розово-красное окра-
шивание, оптическая плотность которого измеряется при длине
волны 540 нм.
«Двуточечные» кинетические методы теоретически точнее ме-
тодов «конечной точки», однако они более требовательны к со-
блюдению постоянства условий реакции — pH, температуре и
количеству фермента. Сохранение такого постоянства условий ре-
акции облегчается выполнением исследований на автоматических
анализаторах.
При определении метаболитов ферментативными методами
количественную оценку результата можно проводить фотометри-
ческим или электрохимическим способом, причем в качестве не-
посредственного объекта количественной оценки целесообразно
использовать содержание относительно простого продукта, об-
разующегося в процессе различных аналитических процедур. Зна-
чительная часть ферментативных методов заканчивается либо оп-
ределением пероксида водорода, либо измерением концентрации
НАДН или НАДН(Ф), т. е. наиболее универсальных продуктов био-
логического окисления. О количестве образовавшегося пероксида
водорода можно судить либо по потреблению кислорода, служа-
щего источником ее образования, либо непосредственно опреде-
ляя само вещество. Такую возможность предоставляют электрохи-
мические методы, которые будут рассмотрены далее.
Фотометрические методы, основанные на способности перок-
сида водорода в присутствии ПОД окислять бесцветные органи-
ческие соединения с образованием ярко окрашенных продуктов,
применяют значительно чаще. Известно много вариантов этого
метода, используемого для различных аналитов.
Так как молярные показатели поглощения НАДН и НАДН(Ф)
хорошо известны, некоторые производители наборов реактивов
предлагают использовать в кинетических методах способ расчета
результатов, не нуждающийся в калибровочном графике, при
котором изменение величины оптической плотности в минуту
умножают на заранее известный коэффициент (фактор). Этот под-
ход связан с необходимостью строгого соблюдения условий вы-
полнения реакции, состава среды и длины волны, поскольку толь-
ко для таких условий действителен предлагаемый в инструкции к
набору реактивов фактор. Для уверенного его применения реко-
мендуется тщательно проверять результаты, используя контрольные
сыворотки.
Хотя для выполнения исследований требуется относительно
небольшое количество ферментного белка, высокая стоимость
хорошо очищенных препаратов ферментов несколько ограничи-
83
вает сферу их рутинного применения в тех случаях, когда нет воз-
можности использовать микроанализ. Сократить расход фермент-
ных реактивов можно за счет уменьшения объема пробы и разме-
ра фотометрической кюветы, что возможно в автоматических ана-
лизаторах, но довольно затруднительно при ручной работе из-за
сложностей операций с микрообъемами биологического матери-
ала.
Более экономным способом применения ферментов в клини-
ческом лабораторном анализе представляется их иммобилизация
на том или ином носителе, что позволяет полностью использо-
вать их способность многократно, не разрушаясь, катализировать
необходимый для анализа процесс превращения субстрата. Для
иммобилизации чаще всего применяют такие ферменты, как гек-
сокиназа, уреаза, глюкозооксидаза, трипсин, лейцинаминопеп-
тидаза, сс-амилаза.
Иммобилизованные ферменты стабильнее, чем ферменты в
растворе, по отношению к нагреванию и другим способам инак-
тивации, однако некоторые их свойства, например оптимум pH,
могут изменяться. Такие ферменты рациональнее всего использо-
вать в аналитических системах, которые предназначены для пря-
мого определения искомого аналита без дополнительного вклю-
чения сопряженных ферментов и коферментов. Количественная
оценка результатов катализируемых в этих системах реакций мо-
жет экономично осуществляться с помощью потенциометриче-
ских, полярографических или микрокалориметрических устройств.
Нередко ферменты наносят на поверхность ионоселективного элек-
трода, с помощью которого измеряют количество иона, участву-
ющего в катализируемой ферментом реакции (например, чувстви-
тельный к кислороду электрод, покрытый слоем, содержащим
глюкозооксидазу, измеряет содержание глюкозы в растворе по
количеству кислорода, использованного в реакции окисления глю-
козы; аммонийчувствительный электрод может быть совмещен с
мембраной, содержащей уреазу). Эта схема применения иммоби-
лизованных ферментов является одним из вариантов их включе-
ния в состав биосенсоров. Иммобилизованные ферменты служат
одним из важных компонентов аналитических систем одноразо-
вого использования: диагностических полосок, многослойных
аналитических элементов, некоторых иммунохроматографических
тест-кассет. Ферменты используют в качестве меток при проведе-
нии иммуноферментных исследований.
Гл а в a 4
МЕТОДЫ, ОСНОВАННЫЕ НА СПЕЦИФИЧЕСКОМ
СВЯЗЫВАНИИ ВЕЩЕСТВ ЛИГАНДАМИ (ЛИГАНДНЫЕ
ТЕХНОЛОГИИ)
4.1. Основные положения и принципы методов
Основой данной группы методов исследования служит свой-
ство специфического связывания исследуемого вещества лиган-
дами — природными или синтетическими соединениями, име-
ющими к этому веществу (аналиту) высокое сродство. В подавля-
ющем большинстве случаев речь идет об иммунохимической реак-
ции связывания исследуемого белка (аналита), который согласно им-
мунохимической терминологии является антигеном со специфи-
ческим белком антителом.
Иммунохимические методы — совокупность методов определе-
ния химического строения и свойств антигенов и антител, а так-
же химических закономерностей их взаимодействия. Принципы
иммунохимических методов основаны на специфичности имму-
нологической реакции и белковой природе антител.
Однако в иммунохимической реакции антигеном может быть и
низкомолекулярное вещество, в этом случае оно называется гап-
теном. В настоящее время в лабораторной аналитике чаще всего в
качестве лигандов используют антитела, значительно реже другие
белки, например транспортные или клеточные белки — мишени
гормонов. В последнее время появились сообщения о разработке
нового класса лигандов — аптамеров (от лат. aptus — соответство-
вать, точно подходить). Это — семейство синтетических одноце-
почечных олигонуклеотидов РНК и ДНК, среди которых, как
выяснилось, можно найти представителя, обладающего очень
высоким сродством почти к любому соединению.
Антитела — белки, содержащие углеводную часть, образуются
и секретируются плазматическими клетками. Они принадлежат к
белкам плазмы и называются иммуноглобулинами, или гамма-
глобулинами.
В качестве антител в лабораторной диагностике используют
белки класса IgG. Их молекулы состоят из тяжелых и легких це-
пей, сложенных таким образом, что молекула имеет форму ла-
тинской буквы «Y», на обеих ножках находятся одинаковые ги-
первариабельные участки (т.е. такие участки, аминокислотный
состав которых у разных антител очень различен), это — связыва-
ющие рецепторы (рис. 4.1). Тем самым каждая молекула антитела
может соединяться с двумя молекулами антигена.
85
Рис. 4.1. Схема молекулы антитела IgG:
Cbh — углеводы; —S —S— — дисульфидные мостики; F(ab+)2, Fc, Fab, Fd —
основные фрагменты, образующиеся при протеолитической ферментативной
обработке
На поверхности антигена в свою очередь находится много раз-
личных детерминант, или эпитопов, — участков, с которыми
может специфически. связываться рецептор антитела. Поэтому
против молекул антигена одного сорта может быть выработано
много различных антител, но каждое антитело содержит два оди-
наковых рецептора и может связываться только с одним опреде-
ленным участком (детерминантой) антигена. Если молекула IgG
встречает две молекулы белка, содержащие детерминанты, кото-
рыми она может связаться, образуется мостик, соединяющий
молекулы антигена. За счет подобных мостиков могут образовы-
ваться и более крупные конгломераты.
Различают моноклональные и поликлональные антитела. В первом
случае речь идет об антителах, все молекулы которых одинаковы,
их рецепторы имеют сродство (направлены) против одних и тех
же детерминант (участков поверхности) антигена, а поликлональ-
ные антитела представляют собой смесь антител против разных
участков поверхности одного и того же антигена. Поэтому моно-
86
клональные антитела очень специфичны, но не очень чувстви-
тельны в том смысле, что для проведения иммунохимической
реакции нужна их высокая концентрация.
Поликлональные антитела могут в буквальном смысле слова
облепить молекулу антигена, поэтому реакция — более выражен-
ная, но менее специфичная. Поликлональные антитела получают
традиционным способом — путем иммунизации животного, а мо-
ноклональные — размножением в тканевой культуре потомков од-
ной и той же клетки — клеточного клона, все клетки которого
вырабатывают одинаковые молекулы антител против одной и той
же детерминанты антигена. Если данный набор антител — поли-
клональных или реже моноклональных — реагирует не только со
«своим» антигеном, но и с другими, то говорят о перекрестных
реакциях.
Аптамеры оказались серьезными конкурентами моноклональ-
ных антител, потому что это — синтетические соединения, хими-
ческая структура которых известна, их всегда можно получить в
нужном количестве и необходимого качества. Моноклональные
антитела — это природные соединения, никто не знает, какая
именно последовательность аминокислот обеспечивает формиро-
вание нужного рецептора. Моноклональные антитела подбирают
методом проб и ошибок, выделяя тот клеточный клон, который
вырабатывает наиболее специфические белки, однако никогда
нельзя гарантировать, что это самые специфичные. Может быть,
самого специфичного клона в данной популяции и нет. Если ли-
ния клеток-производителей погибла, восстановить производство
точно таких же антител уже невозможно. Аптамеры лишены этих
недостатков, поэтому среди них удается найти вещества, облада-
ющие на порядок большим сродством к аналиту. Недостаток апта-
меров — их чувствительность к действию содержащихся в биоло-
гическом материале ферментов нуклеаз, способных быстро раз-
рушить любую цепочку ДНК или РНК. Для того чтобы преодолеть
это отрицательное свойство, используют олигонуклеотиды, в ко-
торых некоторые гидроксильные группы рибозы или дезоксири-
бозы заменены на метильную или аминогруппу, или на фтор.
Методами избирательного связывания определяют много раз-
нообразных веществ, хотя в большинстве своем это — белки,
а также полипептиды, гормоны небелковой природы и лекарствен-
ные препараты. В любом случае задача заключается в том, чтобы
сделать видимым образовавшийся комплекс, который отличается
от исходных аналита и лиганда в первую очередь большим разме-
ром. Все иммунохимические методы, как и другие методы, осно-
ванные на связывании лигандами, в той или иной форме исполь-
зуют это обстоятельство.
Закономерности образования крупных комплексов «антиген —
антитело» несколько отличаются от других вариантов связывания
87
с лигандами тем, что антитела имеют по две связывающие нож-
ки; на антигене много детерминант. Если антител мало (меньше
чем молекул антигена), то самые большие комплексы могут со-
стоять только из двух молекул аналита, соединенных мостиком из
антитела. При увеличении количества антител могут образовы-
ваться и более крупные комплексы, в которых несколько моле-
кул антигена соединены аналогичным способом. Такие крупные
комплексы плохо растворимы и выпадают в осадок (преципитат),
что лежит в основе реакции преципитации. Если наблюдается из-
быток молекул антител (их больше, чем детерминант, с которы-
ми они связываются), комплекс растворяется, потому что анти-
тела только одной ножкой присоединяются к антигенам, для вто-
рой нет свободной детерминанты. Реакция «антиген — антитело»
проявляется в растворе в виде образования агрегатов. Если при
определении антигена ввести в тест-систему постоянное количе-
ство антител, то при невысокой концентрации белка-антигена все
антигены связаны с антителами. Если образующиеся иммунные
комплексы осадить центрифугированием, то в надосадочной жид-
кости можно определить несвязанные антитела. Такое явление на-
зывают избытком антител (зона А, рис. 4.2).
В том случае, если концентрация антигенов и антител пропор-
циональна, происходит связывание всех антигенов и антител, та-
кой комплекс выпадает в осадок в виде преципитата, и в над-
осадке не определяются ни антитела, ни антигены. Это состояние
называют эквивалентным (зона В, пик кривой, см. рис. 4.2). Под-
бирая соответствующие условия, область эквивалентности можно
расширить, но устранить этот эффект нельзя.
Рис. 4.2. Схема кривой
преципитации Гейдель-
бергер— Кендалла (пояс-
нение в тексте)
При дальнейшем увеличении концен-
трации антигена количество антител бы-
вает недостаточным для полного связы-
вания белка. Частицы иммунных комп-
лексов становятся мелкими, преципитат
не образуется. В надосадочной жидкости
определяются свободные антигены. Дан-
ное состояние называется избытком ан-
тигена (зона С, см. рис. 4.2).
В 1929 г. М.Гейдельбергер и Ф. Кен-
далл описали эти взаимоотношения
между концентрацией антигена и ан-
тител в растворе в виде графика — клас-
сической преципитационной кривой
Гейдельбергера—Кевделла (см. рис. 4.2).
Во всех методах иммунопреципитации —
радиальной иммунодиффузии, иммуно-
электрофореза — системы «антиген —
антитело» доведены таким образом, что
88
реакция протекает в зоне эквивалентности. В случае избытка анти-
гена образуются растворимые иммунные комплексы малого раз-
мера, снижается измерительный сигнал. Для получения сигнала,
пропорционального количеству антигена, биожидкость разводят
таким образом, чтобы концентрация антигена пришлась на пре-
делы восходящей части кривой Гейдельбергера — Кендалла.
В классическом варианте на выполнение реакции «антиген —
антитело» уходили часы или даже сутки, однако оказалось, что
это время можно значительно сократить, проводя реакцию в рас-
творе, содержащем 30 — 50 г/л полиэтиленгликоля-6 000 (ПЭГ).
Это высокомолекулярное соединение, связывающее значитель-
ный объем воды, снижает растворимость белка, ускоряет процес-
сы в оставшемся свободном пространстве, приводит к повыше-
нию преципитации иммунного комплекса и расширяет зону эк-
вивалентности. Присутствие в реакционной смеси ПЭГ создает
определенную вязкость раствора, молекулы ПЭГ заполняют часть
объема реакционной смеси. Относительная концентрация белка в
таком растворе становится выше и реакция взаимодействия белка
(антигена) и антител в таком растворе проходит значительно
быстрее. Результаты исследования в таких методах можно полу-
чить уже спустя несколько минут.
4.2. Характеристика методов
Определение антигена или антитела возможно только тогда,
когда реакция «антиген —антитело» может быть визуализирована
или измерена. Выбор метода определения зависит от характери-
стик антигена (размеры, количество, структуры антигенных де-
терминант) и характеристик соответствующих антител (авидность,
специфичность). Антигены и антитела могут быть измерены мето-
дами прямой и непрямой детекции, детекции на основе меченого
антигена или антитела.
Признаком того, что наступило специфическое связывание,
является образование комплекса аналита и лиганда, который от-
личается прежде всего более крупными размерами молекулы.
В некоторых случаях эти комплексы настолько велики, что выпа-
дают в осадок — образуется видимый на глаз преципитат. Иногда,
чтобы определить количество комплекса, его отделяют от непро-
реагировавшего продукта — гетерогенный анализ, если об образо-
вании комплекса судят по появлению каких-либо новых свойств
молекул — это гомогенный анализ.
Прямые методы детекции антигена или антитела включают
технику агглютинации корпускулярных антигенов, опосредован-
ную антителами, и исследования, в которых наблюдается реак-
ция преципитации. К таким методам относятся: прямая агглю-
89
тинация, например тест прямой гемагглютинации для определе-
ния группы крови; агглютинация бактерий (определение антител —
реакция Видаля); реакции классификации и типирования бакте-
рий (определение антигена — реакция Грубера); преципитино-
вые реакции — реакции с образованием преципитата. Многие из
этих реакций проводят в полутвердой матрице (агароза, агар) —
радиальная иммунодиффузия, иммуноэлектрофорез, электрофо-
рез с иммунофиксацией, электроиммунодиффузия, двунаправ-
ленный иммуноэлектрофорез. Анализ антигенов или антител как
растворимых иммунных комплексов (иммунонефелометрия и им-
мунотурбидиметрия) также относится к группе методов прямой
детекции.
Непрямые методы детекции антигена или антитела применяют
в тех случаях, когда иммунопреципитат имеет очень низкий пре-
дел детекции, прямая визуализация преципитиновой реакции
невозможна. Но если лиганд связан с твердой фазой, такой, как
частицы латекса, то реакция «антиген —антитело» становится ви-
димой, например в форме агглютината. К этой группе относятся
методы латексной агглютинации, непрямой (пассивной) гема-
гглютинации, тесты ингибирования гемагглютинации, тесты фик-
сации комплемента.
Иммуноанализ с использованием антигенов или антител, ме-
ченных различными способами, применяют для обнаружения и
определения антител (или антигенов) в низких концентрациях.
Методические принципы включают конкурентное и неконкурен-
тное связывание. Далее приведена краткая характеристика наибо-
лее распространенных методов, основанных на специфическом
связывании аналита.
Иммунодиффузия. Это — один из методов иммунологического
анализа антигенов и антител, основанный на реакции преципи-
тации в геле. В результате реакции между антигенами и антитела-
ми, поступающими в гель путем диффузии, в зоне оптимального
их соотношения образуются полосы преципитации, легко выяв-
ляемые визуально или окрашиванием на белки.
Особенность метода заключается в том, что каждая пара «ан-
тиген-антитело» формирует свою полоску, и реакция не зависит
от наличия в системе других антигенов и антител. Местоположе-
ние полос преципитации определяется скоростью диффузии ан-
тигенов и антител и их концентрацией в исходных растворах.
Пассивная диффузия в геле может быть одиночной, когда ус-
танавливается градиент концентрации для одного реактанта (на-
пример, антигена), а среда импрегнирована антителом. Вариан-
том этого метода является радиальная иммунодиффузия (РИД),
метод Манчини с соавт.
РИД служит методом количественного определения белков.
Исследование выполняют на специальных пластинках, на поверх-
90
ности которых закреплен слой геля, содержащий моноспецифи-
ческие антитела. Подобные пластинки выпускают отечественные
предприятия.
В геле есть лунки для внесения 5 мкл исследуемой пробы, обычно
без предварительного разведения и обработки трех различных ка-
либраторов, в качестве которых могут быть использованы только
специальные, приготовленные в промышленных условиях и отка-
либрованные по калибраторам более высокого уровня, растворы
исследуемого белка.
Исследуемое вещество (аналит) и антитело (реактив) диффун-
дируют в геле навстречу друг другу. В результате создаются проти-
воположные по направлению градиенты концентраций реактива
и аналита. Растворимая часть иммунных комплексов сначала обра-
зуется около места нанесения пробы. С увеличением радиуса диф-
фузии концентрация нанесенного антигена будет уменьшаться с
образованием нерастворимых комплексов. В определенном месте
соотношение антигена и антитела таково (эквивалентная зона
кривой Гейдельбергера — Кенделла), что выпадает осадок (преци-
питат) и образуется четкая линия преципитации в виде круга,
обычно видимая на глаз, но иногда возникает необходимость в
специальном красителе, который делает зону преципитации бо-
лее отчетливой.
Пластины инкубируются при комнатной температуре в тече-
ние 12 —24 ч, продолжительность зависит от определяемого анти-
гена и оговаривается инструкцией к набору, например для опре-
деления IgG достаточно 12 ч. За это время вокруг лунки форми-
руется зона преципитации, диаметр которой измеряют с помо-
щью специальной линейки с точностью до 0,1 мм.
Расчет выполняют по калибровочному графику, при построе-
нии которого исходят из того факта, что концентрация исследуе-
мого белка (антигена) пропорциональна квадрату диаметра пре-
ципитата или площади поверхности, очерченной окружностью
линии преципитации.
Известны возможности объективизировать определения, вы-
полняемые методом РИД, с помощью компьютеризированного
считывателя (ридера). Пластины после проведенной диффузии
помещают на площадку ридера над источником света и оценива-
ют по двум изображениям треугольных светодиодов, расположен-
ных на противоположных сторонах кольца преципитации. Резуль-
таты опытных и контрольных проб рассчитываются автоматиче-
ски в соответствии с выбранной программой калибровочной кри-
вой (по диаметру или по площади колец преципитации) и выво-
дятся на экран прибора в величинах диаметров колец преципита-
ции, их площади и концентрации исследуемых белков.
Преимущество этого метода состоит в его простоте, он не нуж-
дается в сложной аппаратуре, поэтому подходит для небольших
91
лабораторий, где исследуют малые серии. В то же время, метод
продолжителен, трудоемок, не может быть автоматизирован, имеет
достаточно низкую чувствительность (пределы измерения 10“3 —
10“7 моль/л), оценка результатов в значительной мере субъектив-
на. В целом метод достаточно надежен, однако присутствие в од-
ной из проб необычных белков (например, моноклональной при-
роды), которые быстро диффундируют и попадают в места распо-
ложения других преципитатов, может повлиять на результаты в
соседних лунках.
Чрезвычайно большая концентрация исследуемого белка мо-
жет привести к образованию зоны преципитации, в которой на-
рушены обычные соотношения между радиусом и количеством
антигена. Надо иметь в виду также, что маленькие молекулы ан-
тигена диффундируют быстрее больших, поэтому при том же ко-
личестве белка радиус зоны преципитации больше.
Двумерная иммунодиффузия, или метод двойной диффузии Оух-
терлони характеризуется установлением градиента концентраций
и для антигена, и для антитела. Этот метод позволяет сравнивать
два исследуемых материала и устанавливать идентичность или не-
идентичность антигенов в них. Наиболее простой вариант этого
метода проводят в чашках Петри, наполненных агаром. В одну из
лунок наносят антитело, в две других — антигены: известный и
неизвестный. При их идентичности образуется одна сплошная ду-
гообразная полоска преципитации, в противном случае — две
пересекающиеся полоски. При близости, но не идентичности ан-
тигенов образуется одна сплошная полоска преципитации и дру-
гая, не пересекающая ее (частичная идентичность). Четвертый
вариант позволяет в третью лунку поместить два антитела.
Иммуноэлектрофорез. Метод представляет собой комбинацию
двух методов — иммунодиффузии и электрофореза. Первоначально
выполняют процедуру электрофореза белков в геле агара или ага-
розы, помещенном на тонкую стеклянную или пластмассовую
пластинку (на рис. 4.3 — это лунки х, у, z для внесения сыворот-
ки). После ее завершения в узкий желобок полосы, сформиро-
ванной вблизи его края (параллельно направлению движения
разделяемых белков), вносят антисыворотку к определенному виду
белка, каждую в отдельную бороздку (на рис. 4.3, а — антисыво-
ротка, содержащая антитела к пяти белкам; на рис. 4.3, б — к двум
белкам; на рис. 4.3, в — к одному белку) и дают ей возможность
диффундировать в геле агара. Гель инкубируют во влажной каме-
ре при температуре 4 °C в течение 24 — 72 ч. В месте контакта ан-
тисыворотки с электрофоретически разделенными белками об-
разуются преципитационные дуги вследствие образования ком-
плексов «антиген —антитело», характерные для отдельных бел-
ков. При сравнении с известной контрольной сывороткой белки
могут быть идентифицированы.
92
©
а б в
0
Рис. 4.3. Схема проведения
иммуноэлектрофореза на геле
агара/агарозы (пояснение
в тексте)
При необходимости положение
специфических полосок преципита-
ции может быть зафиксировано с
помощью их окрашивания и фото-
графирования.
Метод позволяет разделить более
25 белков сыворотки. Для детально-
го анализа состава белков с более
высоким разрешением можно про-
водить поперечный иммуноэлектро-
форез с разделением компонентов
в двух направлениях.
Иммуноэлектрофорез противоточ-
ный (встречный). Это — метод элек-
трофореза, в котором антитела под
действием эндоосмоса перемещают-
ся в геле в направлении к катоду,
противоположном направлению пе-
ремещения в электрическом поле антигенов, обладающих элект-
рофоретической подвижностью. Имея более низкую изоэлектри-
ческую точку, антигены при электрофорезе перемещаются к ано-
ду быстрее, чем антитела к катоду. В области реакции антигенов с
соответствующими антителами образуются полосы преципитации
(их расположение перпендикулярно направлению электрическо-
го тока), по которым выявляют исследуемые вещества.
Иммуноэлектрофорез прерывистый встречный. Метод представ-
ляет собой разновидность иммуноэлектрофореза, характеризу-
ющуюся уменьшением ионной силы в геле по сравнению с тако-
вой буфера, заполняющего электродные камеры, а также сокра-
щением (прерыванием) времени электрофореза до 1,0—1,5 ч.
Электроиммунодиффузия, иммуноэлектрофорез «ракетный» (ме-
тод Лаурелла) — иммунохимический метод, при котором также
сочетаются иммунодиффузия и электрофорез. Он позволяет раз-
личить вещества по электрической подвижности с помощью спе-
цифической преципитации между антигеном, нанесенным на пла-
стинку с гелем (агар, агароза) или на ацетат целлюлозы, и соот-
ветствующими антителами, содержащимися в геле. Метод полу-
чил такое название за форму, которую приобретают преципитаты
в результате реакции «антиген—антитело», проходящей в геле.
Вдоль кромки геля делают ряд лунок, в которые помещают
исследуемый материал, например диск из фильтровальной бума-
ги размером 4 мм, обильно пропитанный кровью, после чего про-
водят электрофорез. При этом в слое геля создается электрическое
поле, благодаря которому антиген входит в гель. Поскольку анти-
гены обычно движутся быстрее, чем антитела, но в одном на-
правлении, реактанты продвигаются в геле вместе. Это позво-
93
ляет пренебречь различиями в относительной молекулярной мас-
се веществ и конфигурации неправильной формы. Высота «раке-
ты», образующейся в ходе такой реакции, прямо пропорциональ-
на концентрации антигена, ее измеряют от верхней границы лун-
ки до высоты пика.
«Ракетный» иммуноэлектрофорез — вариант метода, при ко-
тором градиент концентрации устанавливается лишь для одного
антигена, как и при радиальной иммунодифузии, однако прило-
жение напряжения побуждает нанесенный в лунки антиген дви-
гаться в сторону гомогенной суспензии антител в геле. При их
контакте и образуются заостренные «ракетообразные» линии пре-
ципитации. Сравнение со стандартом, нанесенным на ту же плас-
тинку, позволяет проводить количественную оценку исследуемо-
го белка.
Поскольку калибровочная кривая для этого метода линейна
лишь в узком диапазоне концентраций, исследуемую пробу при-
ходится соответственно разводить или концентрировать. Недостатки
метода заключаются в большой продолжительности процедуры (2—
18 ч) и малой производительности.
Метод иммунофиксации. В методе иммунофиксации после про-
ведения однонаправленного иммуноэлектрофореза на различные
зоны геля наносят специфичные антисыворотки. Иммунопреци-
питаты связывают с гелем, а остальные непреципитировавшие
белки удаляют промыванием геля. Окрашивание геля позволяет
наблюдать и идентифицировать исследуемые белки.
Комбинация электрофореза с иммунофиксацией и субтракцией
(иммунофиксация с вычитанием). Метод позволяет точно опреде-
лять специфичность белкового расстройства. Иммунофиксация
состоит в связывании фракций белков сыворотки со специфиче-
скими антителами, закрепленными в лунках сефарозы. Связавша-
яся с антителом фракция белка не выявляется при последующем
капиллярном электрофорезе сыворотки. В приведенном на рис. 4.4
примере проба разведенной сыворотки наносится на пять различ-
ных подложек, каждая из которых содержит специфическое анти-
тело — три из них специфичны для тяжелых цепей иммуногло-
булинов (IgG, IgA, IgM), а два (по одной) для легких цепей к и А.
После контакта с твердой подложкой проба подвергается элект-
рофорезу параллельно с необработанной пробой сыворотки. Спе-
цифический иммуноглобулин идентифицируется отсутствием со-
ответствующего пика при сравнении с электрофореграммой бел-
ков необработанной антителами сыворотки данного пациента: на
рис. 4.4 на электрофореграмме 2, полученной после обработки
исследуемой сыворотки антисывороткой против IgG, высокий пик
в области у-глобулинов, отмечаемый на электрофореграмме 7,
отсутствует; на электрофореграмме 5, полученной после обработ-
ки сыворотки пациента антисывороткой против легких к-цепей,
94
Рис. 4.4. Распечатка результатов при комбинации метода иммунофикса-
ции с вычитанием фракций белков, связавшихся с соответствующими
им антителами, с последующим капиллярным электрофорезом:
1 — электрофореграмма без обработки исследуемой сыворотки пациента анти-
сыворотками; обнаружен высокий пик в области у-глобулинов: 2—4— электро-
фореграммы после обработки сыворотки пациента антисыворотками соответ-
ственно против IgG, IgA и IgM; 5, 6 — электрофореграммы после обработки
сыворотки пациента антисыворотками соответственно против легких к и X-цепей
также отсутствует высокий пик, наблюдаемый на электрофоре-
грамме 1. В данном случае речь идет о у-глобулинопатии по типу
IgG и легких к-цепей.
Методы определения антигенов или антител как растворимых
иммунных комплексов. Принцип этих методов заключается в том,
что растворимые комплексы «антиген —антитело» способны по-
95
глощать или рассеивать падающий на них свет. Светопоглощение
может быть измерено фотометрически (иммунотурбидиметриче-
ские методы), светорассеяние — нефелометрически (иммуноне-
фелометрические методы).
Эти микрометоды нашли применение для определения широ-
кого спектра индивидуальных белков в биологических жидкостях
в клинико-диагностических лабораториях. Включение в состав
реактивов ПЭГ или других полимеров позволяет выполнять реак-
цию в течение нескольких минут.
Распространению методов способствовало появление готовых
наборов реактивов, анализаторов (фотометрических анализаторов,
турбидиметров и нефелометров), а также достижения в стандар-
тизации этих методов: разработка вторичных калибровочных рас-
творов для наборов реактивов на основе референтного материала
CRM 470. Как правило, калибровочные графики в этих методах
носят нелинейный характер.
Пределы измерения концентрации белков регламентируются
изготовителями наборов реактивов. При этом следует учесть, что,
исходя из кривой Гейдельбергера—Кендалла, одинаковые резуль-
таты могут быть получены, когда измерение проводят в избытке
антител (на восходящей части кривой, до зоны эквивалентно-
сти), и в избытке антигена (нисходящая часть кривой после зоны
эквивалентности). Существует ряд приемов (с разведением проб
или с добавлением белка), которые позволяют преодолеть этот
эффект и правильно определить концентрацию антигена в пробе.
Наиболее точные результаты получают при применении этой
группы методов на автоматических анализаторах, адаптирован-
ных для исследования индивидуальных белков, в том числе и с
использованием многоточечных, кинетических измерений.
Методы этой группы применяют не только для определения
концентрации индивидуальных белков, содержащихся в больших
количествах в биожидкостях, но и для тех антигенов, концентра-
ция которых невелика. В этих случаях (например, при определении
ревматоидного фактора) антитела иммобилизуются на синтетиче-
ских полимерных (чаще из полистирола) латексных частицах. Они
входят в состав реактивов. При этом молекулы антигена образуют
мостики между частицами латекса, потому что на поверхности каж-
дой такой частицы много детерминант. Повышается чувствитель-
ность метода, избыток антигена не мешает реакции. Этот принцип,
используемый для количественного определения в растворах инди-
видуальных белков, которые содержатся в биожидкостях в следо-
вых количествах (10 — 8 моль/л) с помощью нефелометрии или
турбидиметрии, получил название латексной, или усиленной час-
тицами, турбидиметрии. В литературе обозначается английской аб-
бревиатурой PETIA (Particle Enhanced Turbidimetric Immunoassay)
или LPIA (Latex Particle Enhanced Immunoassay).
96
Латексные тесты. Методы основаны на использовании латекс-
ных частиц размерами 80—1000 нм, на которых адсорбированы
чаще всего антитела к искомому антигену, для проведения реак-
ции «антиген —антитело».
Поскольку на антигене много детерминант, к ним подсоеди-
няются адсорбированные на латексе антитела. Добавление доста-
точного количества антигена приводит к склеиванию (агглютина-
ции) латексных частиц, чему избыток антигена не мешает. Рас-
творения комплекса «антиген —антитело» в избытке антигена не
происходит, а образовавшийся агглютинат становится видимым.
Реакция существенно усиливается, когда участвующие в ней «парт-
неры» образуют крупные частицы.
Как правило, латексные тесты выпускают в виде наборов ре-
активов, к которым приложены контрольные сыворотки, дающие
положительную и отрицательную реакцию. Иногда взвеси латекс-
ных частиц в буферном растворе подкрашивают красителями раз-
ных цветов.
Постановка реакции латексагглютинации очень проста. На стек-
лянную или пластмассовую пластинку или пленку на темном фоне
наносят сыворотку и реактив и перемешивают. Спустя 2 — 3 мин
считывают результат, покачивая пластину, регистрируя агглюти-
нацию частиц (качественный метод). Метод не калибруется. Для
количественной оценки результатов ставят серию разведений ис-
следуемой сыворотки физиологическим раствором и учитывают
то максимальное разведение, при котором еще наблюдается аг-
глютинация. Реакция может быть выполнена и в пробирках.
Иммуноанализ с использованием меченых антигенов или анти-
тел (immunoassay). Иммуноанализ включает большую группу ме-
тодов, имеющую разнообразные варианты. Основная суть методов
заключается в том, что образовавшиеся в ходе иммунохимиче-
ской реакции или изолированные комплексы «антиген—антите-
ло» соединяются с другими партнерами по реакции, которые на-
зываются «маркерами», или «метками», способствующими обна-
ружению или количественному определению исследуемого веще-
ства. Метка может быть соединена с антителом или антигеном.
Этот комплекс называется конъюгатом.
Таким образом, в этих видах исследований аналит (антиген или
антитело) оказываются связанными с мечеными антителом или
антигеном, в результате образуется сигнал, который может быть
обнаружен или измерен.
Маркеры в иммуноанализе указывают на присутствие лиганда
и дифференцируются на связанные и несвязанные. Избыток не-
связанной метки называется свободной фракцией. В качестве мет-
ки могут быть использованы различные вещества: радиоактивные
изотопы — такие методы называются радиоиммунными (РИА или
ИРМА); ферментиммуноферментные методы (ИФА); (хеми)лю-
4 Меньшиков
97
минесцентные-иммунолюминесцентные методы; флюоресциру-
ющие вещества-иммунофлюоресцентные методы.
Как уже указывалось, методы иммуноанализа можно подраз-
делить на две категории: гомогенный и гетерогенный иммуноана-
лиз. В гомогенном иммуноанализе метка, присутствующая в не-
связанном, свободном, состоянии дает сигнал, отличающийся от
сигнала связанного, меченого комплекса «антиген —антитело».
Поэтому нет необходимости в этапе их физического разделения.
В гетерогенном иммуноанализе одна из фракций (обычно связан-
ный комплекс) прикрепляется к твердой фазе, покрытой антиге-
ном или антителом, поэтому другие фракции должны быть удале-
ны (отмыты, отцентрифугированы).
Конкурентный иммуноанализ {конкурентное связывание, сатура-
ционный анализ'). Все реактивы согласно данному методу смешива-
ют одновременно или последовательно. В первом случае в реакци-
онную систему добавляют пробу, содержащую исследуемый ана-
лит, и известное количество аналогичного аналита, меченного
каким-либо образом (например, радиоактивным изотопом йода).
В результате происходит конкуренция меченого и немеченого ан-
тигенов за связывание с ограниченным количеством антител, вхо-
дящих в состав реакционной смеси: чем больше в пробе аналита,
тем меньше меченого аналога свяжется с антителами; чем ниже
концентрация аналита, тем больше меченого аналога свяжется с
антителами. После завершения реакции в зависимости от техно-
логии связанную фракцию можно отделить центрифугированием
или отмыванием и определить количество метки (рис. 4.5).
При последовательной постановке реакции анализируемый
антиген в пробе помещают в реакционной смеси сначала в усло-
вия, при которых он приходит в равновесие с избытком антител,
а затем добавляют меченый антиген. После отделения несвязан-
ного с меткой комплекса от связанной метки измеренный сигнал
t
♦
Разделение
Измерение
незанятых
мест
а
Рис. 4.5. Принцип лигандной аналитической технологии:
а — конкурентная иммунологическая технология; б — неконкурентная иммуно-
логическая технология; ф* — меченый антиген; * — меченое антитело; 4* —
меченое антиидиотипическое антитело; — аналит
98
используют для расчета концентрации анализируемого антигена в
пробе.
Неконкурентный иммуноанализ. Классическим примером некон-
курентного иммуноанализа является метод «сэндвича». Он осно-
ван на том, что каждый белок имеет много детерминант — участ-
ков, к которым могут подсоединяться антитела, причем антитела
также являются белками, которые могут связываться с соответ-
ствующими антителами. В этом случае на какой-либо твердой фазе
(подложке, например, полистирольной ячейке, пробирке, буси-
нах, шариках и т.д.) адсорбированы специфичные антитела про-
тив исследуемого белка-антигена, способные связать все его ко-
личество, имеющееся в пробе.
При одностадийном «сэндвиче» одновременно пипетируют
исследуемый образец и меченые антитела (рис. 4.6, а), при двух-
стадийном — после связывания исследуемого аналита адсорбиро-
ванными на твердой фазе антителами, другие белки отмывают и
удаляют. На второй стадии в систему добавляют меченые антитела
(конъюгат), которые связываются с уже связанным с антителами
на твердой фазе исследуемым антигеном, но на месте другого
эпитопа (рис. 4.6, б), образуя «сэндвич». Избыток меченых анти-
Рис. 4.6. Схема ИФА «сэндвич»:
а — одностадийный; б— двухстадийный; 1 — иммобилизованные моноклональ-
ные антитела; 2 — анализируемый образец и конъюгат моноклональных антител
с пероксидазой; 3 — иммобилизованные иммунокомплексы с мечеными антите-
лами; 4 — субстратная реакция; 5 — иммобилизованные антитела; 6 — анализи-
руемый образец; 7 — иммобилизованные иммунокомплексы; 8 — конъюгат ан-
тител с пероксидазой; 9 — иммобилизованные комплексы с мечеными анти-
телами
99
тел отмывают и определяют количество связавшейся метки, ко-
торое прямо пропорционально содержанию исследуемого белка в
пробе. Метод является типичным примером гетерогенного имму-
ноанализа. Один из наиболее часто используемых вариантов — это
когда в качестве метки антитела используют фермент (enzyme-
linked immunosorbent assay — ELISA).
В неконкурентных методах исследования антител на твердофаз-
ной поверхности иммобилизуется специфический к искомому ан-
тителу антиген. Анализируемое антитело, реагируя с этим антиге-
ном, образует комплекс «антиген—антитело». Остальные белки
удаляют методом промывки, далее добавляют меченые антитела к
другому эпитопу исследуемого антитела, уже связавшегося с анти-
геном на твердой фазе. Избыток конъюгата удаляют промыванием.
Разделение всех методов иммуноанализа на две группы — кон-
курентных и неконкурентных («сэндвича»), в которых непосред-
ственно определяют либо количество связанного аналита, либо
количество незанятых им мест связывания, условное, поскольку
можно определять сразу оба параметра, нужно только метить их
разными метками. Это усложняет и изготовление набора реакти-
вов, и непосредственно аналитическую процедуру, однако по-
зволяет увеличить точность исследования. По этому направлению
ведут разработку иммуноанализа с повышенной точностью.
Радиоиммунологический анализ (РИА). Это — метод исследова-
ния взаимодействия антитела с антигеном, при котором в один
из компонентов вводят радиоактивную метку. Он требует наличия
специфических антител в качестве связывающего агента. Метод
основан на законе действия масс, в соответствии с которым
определяемое вещество конкурирует со своим аналогом (антиге-
ном), меченным радиоактивным изотопом, за ограниченное чис-
ло мест связывания антитела до достижения химического равно-
весия компонентов реакционной смеси.
Разновидность РИА — метод двойной системы антител, в ко-
тором комплекс «антиген—антитело» обрабатывают антиглобу-
линовой преципитирующей сывороткой (вторые антитела) с по-
следующим отделением преципитата центрифугированием.
Иммунорадиометрический метод (ИРМА). Определение антиге-
на с помощью меченых антител получило название иммунорадио-
метрического метода. Биожидкость смешивают с избытком мече-
ных антител к исследуемому веществу и после инкубации удаля-
ют непрореагировавшие антитела путем фиксации на твердофаз-
ном сорбенте. Количество меченых антител в надосадочной жид-
кости прямо пропорционально содержанию исследуемого веще-
ства.
Вариантом метода ИРМА является метод двойного связыва-
ния, в котором определяемый антиген образует комплекс с анти-
телами, иммобилизованными на твердофазном сорбенте; после
100
удаления свободного антигена добавляют меченые антитела, вы-
являющие комплекс. Радиоактивность вновь образующегося ком-
плекса «антитела — антиген — меченое антитело» служит мерой кон-
центрации вещества.
Методы РИА обладают очень высокой чувствительностью, по-
зволяют определять очень малые количества веществ, радиоизо-
топы обладают высокой «специфической» активностью. Однако
они характеризуются и недостатками. Для их выполнения необхо-
димо применение радиоактивных веществ, их производство, хра-
нение, уничтожение и т.д. Кроме того, как правило, наборы ре-
активов для РИА имеют короткий срок хранения (несколько ме-
сяцев), что создает трудности для обеспечения бесперебойной
работы этими методами. Обычно используют 1251, изотопы воз-
буждающие у-радиацию, имеющие период полужизни 60 дней.
Радиоаллергосорбентный метод. Этот метод является вариантом
метода РИА, его используют для определения в крови человека
антител к разным видам аллергенов, например IgE или компонен-
тов классического пути активации комплемента. Аллерген иммоби-
лизуют на твердой основе — диске из фильтровальной или хрома-
тографической бумаги (отсюда другое название теста — бумажный
радиоиммуносорбентный тест — БРИСТ), на которую наносят ис-
следуемую биожидкость. В присутствии соответствующих антител
образуется прочно связанный с диском комплекс «антиген — анти-
тело». После удаления несвязавшихся антител к этому комплексу
добавляют антитела сыворотки животных, например кроликов,
меченные изотопом 1251 против определяемых антител. После уда-
ления несвязавшихся меченых антител подсчитывают радиоактив-
ность дисков с фиксированным на них комплексом «аллерген—
антитело — антиген — антитело 1251».
Основные группы методов разде-
ления свободных и связанных с ан-
тителами антигенов — это адсорбция
свободных меченых антигенов на дек-
стране, ионообменных смолах, Се-
фадексе; преципитация ПЭГ, этано-
лом, сульфатом аммония комплекса
лиганда с антителом; иммунопреци-
питация комплекса «антиген —анти-
тело» с помощью вторых антител,
использование твердой фазы (стен-
ки пробирки, в которой проводят ре-
акцию, сферические поверхности,
фильтры из нитроцеллюлозы, ячей-
ки микротитровальных планшетов).
Один из современных методов —
стрептавидинбиотиновый.
Рис. 4.7. Схема связывания
биотинилированного антите-
ла со стрептавидином на твер-
дой фазе
101
Стрептавидин — это тетрамерный белок с молекулярной мас-
сой 60 кДа, способный захватывать и связывать четыре биоти-
нилированных антигена или антитела (рис. 4.7).
Стрептавидинбиотиновый метод представляет собой систему
для фиксирования антигенов или антител на твердой фазе. Такой
твердой фазой могут служить покрытые стрептавидином пробир-
ки и др.
Иммуноферментный анализ (ИФА). Это вид иммуноанализа,
в котором для выявления комплекса «антиген — антитело» в каче-
стве метки антигена, антитела или обоих компонентов этой реак-
ции используют их конъюгаты с ферментами. Наиболее часто ис-
пользуемые ферменты — щелочная фосфатаза, пероксидаза из
конского хрена, глюкозо-6-фосфатдегидрогеназа, р-галактозида-
за. После добавления специфического субстрата фермент превра-
щает его в продукт, образование которого может быть измерено
кинетически или методом конечной точки.
Различают гомогенный ИФА (EIA), в котором активность мет-
ки измеряют без разделения фракций реакционной смеси. Исполь-
зуемые метки включают ферменты, субстраты или ингибиторы,
которые связываются с антигеном, либо антиген, связанный с
ферментом и соответствующим антителом, связывается со вто-
рым ферментом. Этот метод позволяет определять гаптены, име-
ющие малую молекулярную массу, выше 10~9 моль/л.
Вариант гомогенного ИФА — enzyme multiplied immuno test
(EMIT) — технология, при которой антитела к антигену ингиби-
руют активность фермента в конъюгате. Добавление антигена с
пробой биожидкости исследуемого аналита-антигена нейтрализу-
ет антитело и реактивирует фермент. Активность фермента прямо
пропорциональна концентрации анализируемого антигена в био-
жидкости.
Существуют различные варианты гетерогенного ИФА, класси-
ческими примерами которого являются методы ELISA. Они в свою
очередь основаны на конкурентном и неконкурентном связыва-
нии. В первом случае специфические антитела к исследуемому ан-
тигену иммобилизуются на твердой фазе (например, стенках про-
бирки). Анализируемый антиген и антиген, меченный фермен-
том, конкурируют за ограниченное число мест связывания на ан-
тителах, иммобилизованных на твердой фазе: чем выше концент-
рация исследуемого антигена, тем меньшее количество меченого
антигена связано с антителами на твердой фазе. После связыва-
ния антигена с иммобилизованными антителами на твердой фазе
другие белки отмывают и выбрасывают. Далее добавляют субстрат
для измерения активности фермента, которая обратно пропорцио-
нальна концентрации аналита в биожидкости.
Примером неконкурентного ИФА — ELISA — служит уже опи-
санный метод «сэндвича». Реакцию проводят в два этапа.
102
На первом этапе практически весь анализируемый антиген свя-
зывается со специфическими антителами против него, иммоби-
лизованными на твердой фазе. После первой инкубации выполня-
ют промывку буфером и удаление других белков. На втором этапе
добавляют другие антитела к иному эпитопу анализируемого ан-
тигена, меченные ферментом (конъюгат).
В результате меченые антитела присоединяются к уже образо-
вавшемуся на первом этапе комплексу «антиген — антитело». Та-
ким образом, антиген окружен антителами с обеих сторон, а фер-
мент, будучи неактивным в конъюгате с антителами, становится
активным. Далее добавляют субстрат, специфичный в отношении
данного фермента. Связанная ферментативная активность пропор-
циональна концентрации антигена в пробе. Известны методы
ELISA, которые могут быть выполнены в один этап.
В иммуноэнзимометрическом анализе (IEMA) используют ме-
ченные ферментом антитела и связанный с твердой фазой анти-
ген. На первом этапе реакции весь исследуемый антиген связыва-
ется меченными ферментом антителами. Реакция развивается в
растворе. На втором этапе реакции избыток меченных ферментом
антител связывается с антигеном, иммобилизованным на твер-
дой фазе. Измеряют ферментативную активность растворимой
фракции комплекса «антиген —антитело», которая пропорциональ-
на концентрации исследуемого в биожидкости антигена.
Иммунофлюоресцентный метод (immunofluorescence test, IFT).
Это иммунохимический метод, основанный на использовании яв-
ления люминесценции (флюоресценции) для исследования ре-
акции «антиген — антитело», происходящей на поверхности кле-
ток микроорганизмов или антител в сыворотке против таких кле-
ток, в срезах тканей.
Локализацию изучаемых антигенов (антитела) обнаруживают
в результате образования ими иммунных комплексов со специфи-
ческими антителами (антигенами), меченными флюоресцирую-
щими красителями — флюорохромами (например, флюоресцеин,
родамин). Таким образом, иммунофлюоресцентный тест представ-
ляет собой комбинацию гистологической и иммунологической тех-
нологий.
Различают прямые иммунофлюоресцентные тесты, в которых
антигены, связанные с клетками, выявляют с помощью специ-
фических к исследуемому антигену антител, конъюгированных с
флюорофором. В непрямых иммунофлюоресцентных методах оп-
ределяемый антиген тканевых клеток или микроорганизмов обра-
батывают немеченой специфической антисывороткой против этого
антигена. Несвязавшиеся белки отмывают, а связавшиеся с клет-
ками антитела выявляют путем обработки препарата меченной
флюорофором поливалентной антисывороткой против этих анти-
тел (глобулина немеченой антисыворотки).
103
Флюоресцентную микроскопию проводят, используя различ-
ные источники света и наборы светофильтров. Наличие флюорес-
ценции и ее интенсивность являются критериями присутствия
исследуемого компонента и его концентрации.
Флюоресцентный иммуноанализ (FIA). Метод объединяет вари-
анты иммуноанализа, в которых в качестве маркера используют
флюорохром. Как и в случае ИФА, известны методы гомогенного
и гетерогенного FIA. Известно несколько вариантов методов го-
могенного FIA.
Иммуноанализ с измерением поляризации флюоресценции (рис. 4.8).
Наиболее часто используемая метка — флюоресцеин. Меченое
соединение очень мало и вращается быстро (низкая поляризация).
После его связывания с большой молекулой антитела к аналиту в
его отсутствие вращение значительно замедляется (поляризация
изменяется от низкой к высокой). В присутствии аналита он свя-
зывается с антителом, меченое соединение вращается быстро (низ-
кая поляризация).
Иммуноанализ с усилением флюоресценции. В том случае, если
меченный флюорохромом антиген связывается с антителом, флюо-
ресценция реакционной смеси усиливается. При добавлении ис-
следуемого антигена происходит его связывание с антителами.
Таким образом ингибируется усиление флюоресценции.
Иммуноанализ с гашением флюоресценции. Флюоресценция ме-
ченного флюорохромом антигена снижается, если он связывается
с антителом. Добавление исследуемого антигена ведет к связыва-
нию антител и увеличению флюоресценции.
Известны варианты методов гетерогенного FIA. Как и в гетеро-
генном ИФА, свободный меченный флюорохромом антиген от-
деляется от связанного с антителом антигена перед измерением
флюоресценции.
Иммуноанализ с разрешающей во времени флюресценцией (см. под-
разд. 1.3. «Люминесцентный анализ»).
Рис. 4.8. Схема иммуноисследования, основанного на поляризации
флюоресценции:
а — без аналита; б — в присутствии аналита; ФТ — метка флюоресцентной
молекулой; А — аналит в образце биоматериала; АЬ — антитело против аналита;
— скорость ротации молекул
104
Флюоресцентный иммуноферментный анализ на микрошариках. На
микрошариках иммобилизуются антитела к исследуемому антиге-
ну. На первом этапе анализируемый антиген инкубируется с мик-
рошариками. Затем добавляют вторичные антитела к этому анти-
гену, меченные щелочной фосфатазой. Это ведет к образованию
«сэндвича» на микрошариках. На этапе разделения реакционную
смесь пипетируют на матрицу из стекловолокна, на которой удер-
живаются микрошарики. На последнем этапе матрицу промывают
буфером, содержащим субстрат метилумбеллиферилфосфат. На
этом этапе удаляют несвязанные, меченные щелочной фосфата-
зой антитела, а связанная в «сэндвиче» на микрошариках щелоч-
ная фосфатаза становится активной в отношении субстрата и гид-
ролизует его в месте присоединения фосфатной группы. Образу-
ется метилумбеллиферон, флюоресценцию которого измеряют.
Многослойный флюоресцентный иммуноанализ («сухая» иммуно-
химия на полосках и слайдах). Нанесенная на аналитический эле-
мент (например, многослойную пленку) исследуемая проба, про-
никает в специальный слой. Определяемый антиген диффундиру-
ет в более глубокий слой, содержащий буфер и детергенты. Под
слоем, содержащим буфер, находится слой пленки с молекулами
окислов железа. Антиген первоначально мигрирует через этот слой.
Он достигает расположенного под ним сигнального слоя, кото-
рый содержит иммунные комплексы, состоящие из аналога ис-
следуемого меченного флюорофором антигена и гомологичного
антитела. Антиген пробы вытесняет меченный флюорофором ан-
тиген из этого иммунного комплекса. Меченый антиген мигриру-
ет в слой, содержащий окислы железа, и не флюоресцирует при
воздействии света, возбуждающего флюоресценцию. Чем выше
концентрация определяемого антигена, тем меньше флюорес-
ценция. Эта технология предназначена для измерения очень ма-
лых молекул, например тиреоидных гормонов. Полоски, пред-
назначенные для гетерогенной «сухой иммунохимии» или мно-
гослойные пленки могут быть основаны на технологии «сэнд-
вич», конкурентного связывания и обратимого образования ком-
плекса. В последнем случае определяемый антиген наносят на
полоску, содержащую конъюгат антител против этого антигена
с флюоресцентной меткой, соединенной с аналогом исследуе-
мого вещества. Если в ходе реакции конъюгат подвергается фер-
ментативному гидролизу, его флюоресценцию можно измерить.
Когда комплекс антигена и конъюгата диссоциирует, определя-
емое вещество и его конъюгат конкурируют за ограниченное число
мест связывания на антителах.
Количество замещенного конъюгата антигена измеряют флюо-
рометрически после ферментативного гидролиза (конъюгат, свя-
занный с антителом, невосприимчив к гидролизу) и пропорцио-
нально концентрации определяемого аналита в пробе.
105
Люминесцентный иммуноанализ. В зависимости от конкретного
исследования носителем люминесцентной метки также могут быть
антигены или антитела. В иммуноанализе используют хемилюминес-
ценцию. Метками высокой активности для этих целей являются эфиры
акридина и изолюминол. Окисление изолюминола перекисью водо-
рода вызывает образование аминофталатов и люминесценцию света
при 425 нм. Реакцию катализирует пероксидаза хрена.
В случае биолюминесценции образованию света в люминесцент-
ной системе предшествует ферментативная реакция:
а) реакция хемилюминесценции:
Люминол + 2Н2О2 + ОН” —катализатор—> аминофталат + N2 + ЗН2О + свет;
б) реакция биолюминесценции:
Люциферин + АТФ——>люцифериладенилат;
Люцифериладенилат _—возбужденный ферментативный;
комплекс
Возбужденный ферментативный оксилюциферин + АМф + Со2
+ свет.
комплекс 1
В системе «люциферин—люцифераза» фермент катализирует
окисление люциферина в «возбужденный» продукт, который раз-
рушается, когда люминесцирует. Предшествующие образованию
энергии реакции могут включать, например, АТФ-пируваткиназ-
ную реакцию, в случае использования системы «люциферин —
люцифераза», полученной из светлячков, или окислительные ре-
акции, если используется НАДФ- Независимая система «люци-
ферин—люцифераза», полученная из грибов, морских водорос-
лей или бактерий.
В люминесцентном иммуноанализе малых молекул (тироксин,
дигоксин и т.п.) используют технологию конкурентного связы-
вания, когда эндогенный антиген-аналит конкурирует с антиге-
ном, меченным люминолом или эфиром акридина, за ограни-
ченное число мест связывания моноклональными моноспецифи-
ческими антителами. Измеряемый сигнал люминесценции обратно
пропорционален концентрации определяемого антигена. Принцип
этого анализа сходен с принципом конкурентного РИА. «Сэнд-
вич»-технологию используют для иммуноанализа молекул боль-
ших размеров, таких, как тиротропин (ТТГ), паратиреоидный
гормон, ферритин, хорионический гонадотропин человека, про-
лактин, изофермент креатинкиназы МВ.
Иммунолюминометрический анализ (ILMA). В варианте метода,
который носит название «иммунолюминометрический анализ»,
106
захватывающие антиген антитела в избытке закреплены на твер-
дой фазе и на первом этапе инкубации связывают определяемый
антиген. После отмывки всех остальных белков, во время второй
инкубации комплексы «антиген —антитело», закрепленные на
твердой фазе, взаимодействуют со вторыми антителами, мечен-
ными люминесцентной меткой. Измеряемый люминесцентный
сигнал пропорционален концентрации анализируемого антигена
в биожидкости.
Иммунолюминометрический метод с мечеными вторыми анти-
телами. Технология метода аналогична иммунолюминометриче-
скому анализу (ILMA). Суть заключается в том, что после обра-
зования иммунного комплекса исследуемого антигена с иммобили-
зованными на твердой фазе специфическими антителами добавляют
вторые специфические антитела к исследуемому антигену. В резуль-
тате образуется «сэндвич». Затем этот «сэндвич» метят специфич-
ными, меченными люминесцентной меткой, антителами и изме-
ряют люминесценцию.
Иммуноанализ с использованием электрохемилюминесценции. Тех-
нология метода аналогична описанной ранее в подразд. 1.3. Это
«закрытая» технология, на основе которой работают различные
варианты автоанализаторов «Elecsys» для хемилюминесцентного
иммуноанализа.
С появлением люминесцентного иммуноанализа стало возмож-
ным определение веществ, имеющих различную молекулярную
массу, с аналитической чувствительностью, сравнимой с чувстви-
тельностью радиоиммунологического анализа.
Вследствие высокой специфической активности флюоресцент-
ные и люминесцентные метки позволяют определять вещества с
более высокой чувствительностью, т.е. имеют более низкий пре-
дел определения или обнаружения (до Ю-20 моль), чем это позво-
ляет, например, радиоактивная метка 1251 — 10~18 моль.
Иммуноблоттинг. Данный вид анализа включает методы, осно-
ванные на образовании окрашенного пятна в том месте, где про-
изошло связывание аналита. В сущности, блоттинг — это перенос
электрофоретически разделенных белков на иммобилизованные
матрицы. Основные преимущества этих технологий заключаются
в следующем: возможность получить на матрице идеальную ко-
пию электрофоретического разделения образцов белков, присут-
ствующих в геле; после переноса образца на матрицу существует
возможность проведения с ним большого количества аналитиче-
ских процедур, которые впоследствии могут быть приложены к
иммобилизованным белкам, в то время как в гелях после элект-
рофореза проводить такие реакции невозможно; через техноло-
гию блоттинга можно комбинировать различные типы высокораз-
решающего электрофореза в геле, включая изоэлектрическое фо-
кусирование и двунаправленный электрофорез с разнообразны-
107
ми исследованиями связывания белков в матрице; для идентифи-
кации белков могут быть использованы антитела; лиганды могут
быть элюированы с иммобилизованного антигена, различные ли-
ганды могут быть использованы для связывания на одном и том
же блоте (пятне). Существуют различные методы блоттинга.
Саутерн блоттинг. Это — технология, в которой разделенные
электрофоретически фракции ДНК переносятся с агарозы на нит-
роцеллюлозу под действием капиллярных сил. Фрагменты ДНК на
нитроцеллюлозных фильтрах далее гибридизируются с радиоактив-
ной РНК для проверки комплементарных последовательностей.
Нортерн блоттинг. Метод представляет собой модификацию,
при которой РНК и малые фрагменты ДНК, которые недостаточ-
но прочно связаны с нитроцеллюлозой, могут быть ковалентно
связаны с диазобензилоксиметиловой бумагой. Метод используют
для идентификации РНК.
Вестерн блоттинг. Этот метод представляет собой процедуру
электрофоретического переноса белков с додецилсульфатполиак-
риламидных гелей на полосу чистой немодифицированной нит-
роцеллюлозы. Данный метод лежит в основе иммуноблоттинга (им-
муноблот), использующего иммунохимическую реакцию для иден-
тификации белков.
Иммуноблот — очень чувствительный метод визуализации спе-
цифических белков. В целом эта реакция может быть разделена на
фазы (рис. 4.9). Первоначально проводят разделение белков мето-
дами высокоразрешающего электрофореза в геле (двунаправлен-
ный электрофорез или изоэлектрическое фокусирование). В каче-
стве гелей чаще всего используют полиакриламидный гель или
агарозу. Буферные растворы, как правило, содержат додецилсуль-
фат натрия или мочевину. Далее белок переносят из среды, в ко-
торой проводили электрофоретическое разделение, на твердую
фазу. В качестве твердой фазы исполь-
зуют полоски (стрипы) нитроцеллю-
лозы или мембраны на нейлоновой
основе. Твердая фаза должна иммоби-
лизовать белки так, чтобы не наблю-
далось их диффузии. Для этого приме-
няют ковалентное связывание с нит-
Рис. 4.9. Принцип иммуноблота:
а — гель с разделенными белками (Р) или гли-
копротеинами (GP); б — твердая фаза с пере-
несенным белком; в — инкубация с антитела-
ми, образование иммунных комплексов; г — ин-
кубация с антителами, меченными ферментом
(конъюгат)
108
робензилоксиметил- или цианогенбромидактивированной бума-
гой. Перенос белков с электрофоретической среды на твердую фазу
выполняют либо методом простой диффузии (под вакуумом, по-
вышенным давлением) при капиллярном давлении, либо элект-
рофоретически (электроблоттинг).
Наиболее эффективен и чаще всего применяется метод элект-
роблоттинга. После переноса белков на твердую фазу неспецифи-
ческие места связывания на ней блокируются. Белки (в виде по-
лос) определяют путем использования антител, меченных фермен-
тами или радиоактивными изотопами. После добавления субстра-
та связанный конъюгат выявляется в виде окрашенной полосы.
Микроточечный анализ. Биочипы. Суть микроточечного анализа
заключается в том, что на твердой подложке в точке диаметром
приблизительно 10 — 50 мкм иммобилизованы антитела, специ-
фичные для определенного аналита. После экспозиции исследуе-
мой биожидкости с этими антителами (их называют «сенсорны-
ми», т. е. антителами, распознающими антиген), образования ком-
плекса «антиген — антитело», удаления остатка исследуемой про-
бы добавляют так называемые «развивающие, или выявляющие»,
антитела, специфичные к другому эпитопу определяемого анти-
гена (в случае, если исследуют аналиты с большой молекулярной
массой) или «выявляющие» антитела к незанятым местам связы-
вания антигена на «сенсорных» антителах (в случае определения
аналитов с малой молекулярной массой).
Можно использовать технологию неконкурентного и конкурент-
ного связывания. Оценку фракционной занятости «сенсорных»
антител можно провести по измерению отношения между «сен-
сорными» (а-фотоны, образующиеся под действием возбужда-
ющего луча лазера в случае использования флюоресцентных ме-
ток) и «выявляющими» (р-фотоны) антителами, образующими
димеры двойных антител. Измеряют это отношение путем исполь-
зования различных меток для данных антител, например пары
радиоактивных меток, ферментов, хемилюминесцентных марке-
ров либо меток другого происхождения. Большое значение имеет
использование флюоресцентных меток. Соотношение а- и р-фо-
тонов является мерой для расчета концентрации аналита. Каждая
микроточка, как указано ранее, предназначена для отдельного
аналита.
Если поместить на твердую подложку мономолекулярный слой
антител в микроточках ко многим аналитам, то в случае примене-
ния флюоресцентных меток и оптического сканирования оказыва-
ется возможным в одной пробе провести анализ многих компонен-
тов, т. е. выполнить многопараметровый анализ десятков, сотен и
даже тысяч различных веществ в пробе объемом 0,1 — 1,0 мл.
Многопараметровые чипы имеют до 100 дискретных (отдель-
ных) мест для разных аналитов на одном чипе. Чувствительность
109
этих методов намного выше, чем обычного иммуноанализа. Изве-
стные технологии иммуноанализа на биочипах применяют в авто-
анализаторе «EVIDENCE» (фирма «Randox Laboratories Ltd.», Ве-
ликобритания). Они предназначены для исследования многих ана-
литов (гормонов, аполипопротеинов, онкомаркеров, маркеров
повреждения сердечной мышцы, бесплодия, анемий), для опре-
деления лекарств, средств, вызывающих токсикомании, и т.д.
Количество дискретных мест на биочипе будет зависеть от из-
бранной панели аналитов для исследования. Каждую из техноло-
гий иммуноанализа применяют на любом биочипе, представля-
ющем собой квадрат из плотного материала площадью 9 мм2.
Добавление проб пациентов в точки для каждого аналита (тес-
та) и реактивов, инкубация, калибровки и другие операции дан-
ный анализатор выполняет автоматически. Биочип (каждую точку
для аналитов на нем формируют в заводских условиях) содержит
различные антитела и другие компоненты в зависимости от каж-
дого вида исследований. Метод конкурентного связывания исполь-
зуют для определения аналитов с низкой молекулярной массой,
метод «сэндвич» — для анализа веществ с большой молекулярной
массой, технологии с захватом антител — для выявления аллер-
генов в пробе пациента.
По завершении анализа биочип сбрасывается в емкость, нахо-
дящуюся в автоанализаторе. Количественное определение и каче-
ственное обнаружение аналитов основано на принципе измере-
ния хемилюминесценции высокочувствительного субстрата для
пероксидазы.
4.3. Приборы и оборудование для лигандных технологий
Исходя из назначения, задач, перечня исследований, мощно-
сти, финансовых возможностей лаборатории, могут быть выбра-
ны методы, а соответственно, и различные наборы реактивов,
приборы и оборудование. Понятно, что выполнить любую мето-
дику, основанную на перечисленных выше технологиях, без го-
товых наборов реактивов для нее практически невозможно. Реак-
тивы, необходимые для реакции, в составе того или иного набора
поставляются в готовой к употреблению и концентрированной
жидкой формах или в сухом виде во флаконах. Наборы содержат
калибровочные и контрольные материалы, инструкцию для пользо-
вателя. Если контрольные материалы отсутствуют, то пользова-
тель обязательно должен быть информирован о том, какие из них
должны быть приобретены отдельно, а также о том, какие допол-
нительные реактивы необходимы для выполнения анализа.
В клинико-диагностических лабораториях наиболее распрост-
ранен метод иммуноферментного анализа в планшетах с фото-
110
метрическим измерением конечного результата, который чаще
всего выполняется на полуавтоматических анализаторах. При этом
используют готовые наборы реактивов, в состав которых входят
96-луночные планшеты с плоским дном, на дне и стенках кото-
рых уже адсорбированы в заводских условиях нужные антитела.
Рационально использовать планшеты, собранные из отдельных
полосок, стрипов, на 8 или 12 проб, которые могут быть отделе-
ны от целого планшета в зависимости от количества проб для
анализа.
Распределение проб (холостая проба на весь планшет или каж-
дую пробу, калибровочные, контрольные, пробы пациентов)
может быть не произвольным, а зависеть от последовательности
измерения на конкретном анализаторе.
Все варианты гетерогенного иммуноанализа требуют выполне-
ния многих последовательных операций связывания и отмывания.
Трудно добиться, чтобы каждая из них проходила до конца. Кро-
ме того, результат зависит от качества антител и способа их полу-
чения. По этим причинам в каждой аналитической серии (на каж-
дом планшете) ставят несколько калибровочных проб, по кото-
рым проводят расчет в количественном анализе.
Калибровочный график, как правило, нелинейный; вычисле-
ния выполняют встроенным в ридер микропроцессором. Это точ-
нее, чем вручную, что тоже возможно, но очень трудоемко. В лю-
бом случае приходится выбирать форму калибровочного графика.
Способ расчета результатов, вид калибровочного графика иногда
указаны в инструкциях к наборам реактивов.
Поскольку многочисленные аналитические операции — дози-
рование проб и реактивов, инкубация, встряхивание, фермента-
тивная реакция, отмывание — проводят в тех же лунках, на кото-
рых были адсорбированы антитела, для выполнения на многолу-
ночных планшетах всех предусмотренных методом процедур при-
меняют различные устройства, позволяющие стандартизовать вы-
полнение процедур в каждой лунке и рационализирующие работу
персонала.
Планшеты на 384, 864, 1 536 лунок в клинико-диагностиче-
ских лабораториях обычно не применяют. Их используют для на-
учных исследований. Если лаборатория использует наборы реак-
тивов, в состав которых входят планшеты, составленные из оди-
ночных или сдвоенных микрострипов (соответственно, на 8 и 16
(2x8) проб, 12 проб), необходимо приобрести рамки по формату
планшета, подходящие для данных стрипов и считывающего уст-
ройства.
Для проведения анализа в 96-луночных микропланшетах с плос-
ким дном лаборатория должна быть обеспечена: первичными про-
бирками для взятия крови; центрифугой для получения сыворотки
или плазмы; вторичными пробирками, в которые помещают ис-
111
следуемую биожидкость после центрифугирования; дозирующими
устройствами — одноканальными полуавтоматическими пипетка-
ми с фиксированными или переменными объемами доз с соответ-
ствующими насадками, многоканальными полуавтоматическими
пипетками (8-, 12-канальными пипетками с переменными объе-
мами доз с соответствующими насадками); автоклавом (при ис-
пользовании автоклавируемых пипеток и насадок к ним); штатива-
ми для закрепления наконечников на многоканальных пипетках;
гид-планшетом; встряхивателем (шейкером) для планшетов; тер-
мостатом (инкубатором) для планшетов; промывочным устройством
(вошером); ридером, или фотометром с вертикальным ходом луча,
для микропланшетов с набором светофильтров, позволяющим про-
водить измерения в соответствии с длинами волн, рекомендуемы-
ми в инструкциях к используемым наборам реактивов.
Существуют основные устройства и оборудование, которое
применяют для различных видов лабораторных исследований,
и оборудование, включающее специфические для данного вида
иммуноанализа (например, планшетного) приборы и устройства,
которые не могут быть применены при пробирочном иммуноана-
лизе.
Гид-планшет представляет собой устройство для рационализа-
ции работы персонала на этапе пипетирования проб и реактивов.
Это планшет, на который помещают планшеты или стрипы для
проведения анализа. После пипетирования пробы (или реактива)
в лунку планшета для анализа лаборант нажимает специальную
клавишу на гид-планшете. При этом загорается свет под этой лун-
кой. Таким образом, уменьшается вероятность возникновения гру-
бой погрешности в результате перепутывания проб или реактивов.
Гид-планшет может быть соединен с пипеткой, которой выпол-
няют пипетирование. В таком случае после помещения пробы или
реактива в лунку свет под ней загорается автоматически.
В лабораториях с большой нагрузкой для пипетирования при-
меняют высокопроизводительные дозаторы-сэмплеры (от англ.
sample — проба), управляемые компьютерами. Их можно исполь-
зовать как отдельные устройства или они могут быть встроены в
автоматические анализаторы для иммунохимического анализа и
выполнять различные операции, связанные с пипетированием,
включая разведение проб на всем планшете.
Промывочные устройства — вошеры для планшетов — автома-
тизируют процесс добавления и удаления жидкости из лунок план-
шета. В некоторых методах иммуноферментного анализа рекомен-
дуется от трех до пяти стадий отмывания планшета буфером для
удаления непрореагировавших с антигеном антител или конъю-
гатов антител с ферментом. Это — программируемые 8- или
12-канальные устройства, в которых процесс отмывания должен
быть возможен в планшетах любой конфигурации, с плоскодон-
112
ними, круглыми или коническими лунками, с переменной вы-
сотой головок для внесения и аспирации жидкости (вертикальное
или горизонтальное положение головки).
Конструкции вошеров для планшетов учитывают наличие план-
шетов с различным числом лунок, возможность работы в ручном
и автоматическом режиме, различие параметров отмывки: число
циклов, необходимость применения нескольких буферных раство-
ров, объем, скорость подачи и удаления раствора из лунок, про-
должительность задержки в лунках, замачивание планшета с про-
мывочным раствором, положение каналов моющего узла относи-
тельно стенок и дна лунок, встряхивание планшета между цикла-
ми отмывки.
В зависимости от потребностей лаборатории и применяемой
методики можно использовать различные модификации промы-
вателей: ручные — 8-, 12-канальные для планшетов и стрипов
представляют собой компактные устройства, в которых переме-
щение планшетов и стрипов выполняют вручную, промывающий
раствор подается в лунки при нажатии клавиши на моющем узле,
удаление жидкости из лунок происходит за счет непрерывно ра-
ботающего вакуумного насоса при опускании промывающих ка-
налов в лунки.
Возможна регулировка высоты каналов, что и позволяет ис-
пользовать планшеты с различной конфигурацией дна лунок; ав-
томатические 8-, 12-канальные промыватели, которые могут быть
использованы не только при иммуноферментном, флюоресцент-
ном или люминесцентном планшетном анализах, но и при работе
с клеточным монослоем в лунках, а также с методиками, в кото-
рых в качестве носителей используют бумажные диски. Скорость
подачи промывающего раствора и аспирации жидкости такова,
что клеточный монослой не повреждается.
Промыватели имеют встроенный шейкер (встряхиватель), обес-
печивающий линейное встряхивание с регулировкой скорости,
встроенный микропроцессор для программирования большого
количества протоколов по всем параметрам отмывки. Скорость
отмывки 96-луночного планшета (три цикла по 300 мкл раствора
на одну лунку) около 2 мин. Известны еще более автоматизиро-
ванные промыватели, имеющие 96-канальный моющий узел,
встроенный микропроцессор для программирования параметров
отмывки, скорость отмывки 96-луночного планшета (три цикла
по 300 мкл раствора на одну лунку) около 0,5 мин.
Отечественный автоматический промыватель «ПРОПЛАН»
имеет 8-канальный промывочный узел; автоматизированные мо-
дели для решения различных задач, например проведения про-
мывки в 96-луночных планшетах в исследованиях с применением
магнитных бусин. Магнитная подставка под планшет удерживает
магнитные бусины на дне лунок во время промывки.
113
Иммуноферментный анализ в планшетах является разновид-
ностью микроанализа. Для эффективного встряхивания реакци-
онной смеси в таких маленьких ячейках, какими являются лунки
планшета или стрипов, необходим встряхиватель. Как правило,
в лабораториях стараются приобрести инкубатор-шейкер, с по-
мощью которого возможно термостатирование и встряхивание по-
следовательно и/или одновременно. При выборе такого устрой-
ства важно учитывать параметры его загрузки (количество одно-
временно термостатируемых и встряхиваемых планшетов); возмож-
ность термостатирования пробирок, диапазон температур и точ-
ность термостатирования; продолжительность термостатирования
и встряхивания (установку времени); виды встряхивания — ли-
нейное, орбитальное, двойное орбитальное (в отличие от линей-
ного орбитальное встряхивание обеспечивает более эффективное
перемешивание содержимого лунок или пробирок) и диапазон
скоростей встряхивания.
Для объективной оценки результатов иммунохимических ис-
следований в качестве ридеров используют различные оптические
приборы, при планшетном анализе — с вертикальным ходом луча:
фотометры, спектрофотометры, флюорометры, люминометры. В
фотометрическом иммуноферментном анализе — это фотометры
и спектрофотометры. Обычно при разработке и производстве ри-
деров учитывают потребности и производительность лабораторий
различной мощности. В том случае, если поток анализов невелик,
можно применять фотометр для стрипов, на котором измеряют
одинарные, двойные, тройные стрипы длиной в 8 —
12 лунок либо отдельные лунки. В целом эти фотометры представ-
ляют собой анализаторы, на которых возможно программирова-
ние методик, сохранение их в памяти прибора, автоматическая
установка светофильтров, расчет и вывод результатов на дисплей
и распечатка их с помощью встроенного принтера, построение
калибровочных графиков, сохранение калибровки в памяти при-
бора, возможность двухволновых измерений. Известны ридеры для
1-, 8-канального фотометрирования 96-луночных планшетов, ко-
торые помимо перечисленных выше характеристик, имеют еще
встроенный шейкер с программируемым временем встряхивания
и применяются в лабораториях с небольшим потоком анализов.
Компьютеризированные комплексы для иммуноферментного
анализа включают в себя планшетный фотометр, персональный
компьютер и программное обеспечение (например, «ИФАН»),
Особенностями этого комплекса является возможность програм-
мирования и сохранения в памяти неограниченного числа мето-
дик; автоматическое управление процессом измерения; контроль
результатов измерения; представление и распечатка всей основ-
ной и дополнительной информации по результатам исследова-
ний; возможность распечатки результатов в виде лабораторного
114
журнала; автоматическое ведение данных по контролю качества,
представление отчетов по проделанным исследованиям за год, по
месяцам и для каждого пользователя в отдельности. Скорость из-
мерения 96 лунок — несколько секунд.
Многие флюорометры для планшетов имеют режимы измере-
ния флюоресценции, люминесценции и абсорбции, предназна-
чены для планшетов различного формата. Измерения проводят с
поверхности и дна лунок планшетов, по конечной точке и кине-
тические, возможны измерения кинетики в отдельных лунках,
есть встроенный инкубационный модуль, программное обеспече-
ние для управления прибором и обработки результатов; скорость
измерения — высокая.
При выборе ридера очень важно учитывать его комплектацию
светофильтрами и способ смены светофильтра (ручной или авто-
матический). Если в лаборатории необходимо помимо выполне-
ния методов, основанных на иммуноферментном анализе, вы-
полнять и иммунохимический анализ белков, следует выбрать
ридер, в котором предусмотрено турбидиметрическое измерение и
на длине волны 340 нм. При работе с наборами реактивов, в кото-
рых в качестве метки используется щелочная фосфатаза, конъю-
гированная с антителами против исследуемого антигена, и в каче-
стве субстрата — 4-нитрофенилфосфат, фотометрические измере-
ния выполняют на длинах волн 405 или 410 нм. В случае примене-
ния в качестве метки в конъюгате с антителами пероксидазы,
а в качестве субстрата — ортофенилендиамина, измерение опти-
ческой плотности проводят при длине волны 492 нм, когда суб-
стратом является тетраметилбензидин (ТМБ), измерения прово-
дят при длине волны 450 нм.
Если фотометр позволяет проводить измерения не только на
одной, но и на двух длинах волн, то в качестве второй длины вол-
ны при бихроматных измерениях используют длину волны 620 —
630 нм. Отечественный ридер «УНИПЛАН» (производства ЗАО
«ПИКОН») представляет собой малогабаритный вертикальный
фотометр для измерения оптической плотности в 96-луночных план-
шетах. Результаты распечатываются на обычной бумаге формата А4
с указанием даты анализа, фамилии лаборанта, названия учрежде-
ния в виде таблицы в форме планшета. Прибор работает и програм-
мируется в диалоговом режиме. Он оснащен дисплеем, а программ-
ное обеспечение позволяет использовать большой спектр наборов
реактивов, так как можно ввести в память прибора и сохранить в
ней большое количество формул для расчета результатов. Имеется
также звуковая сигнализация для всех режимов. Как и все совре-
менные приборы, этот ридер может быть подключен к персональ-
ному компьютеру. Установку светофильтров проводят вручную. При-
бор позволяет получать качественные результаты по принципу
(«+», «-»), «оптическая плотность критическая» — «cut-off» и осу-
115
Рис. 4.10. Пример графического представления «оптической плотности
критической» на анализаторе «УНИПЛАН»
ществляет расчет «серой зоны» для того, чтобы дифференцировать
группу положительных реакций (оптическая плотность результата
выше значения «cut-off») от группы «неопределенных» — сомни-
тельных результатов, четко обозначить область положительных и
отрицательных результатов (рис. 4.10).
В России выпускается семейство автоматизированных иммуно-
ферментных анализаторов АИФ и комплект для систематического
оперативного контроля качества иммуноферментных анализато-
ров — КПА-01 (ЗАО «ИЛИП»), Этот комплект позволяет прове-
рить стабильность и воспроизводимость результатов во всем диа-
пазоне, идентичность измерений в измерительных каналах, длин
волн измерительного светового потока, правильность положения
планшета, функционирования ридера в специальных режимах. Он
имеет режим градуировки ридера с помощью набора нейтральных
светофильтров.
Дозаторы, промыватели, инкубаторы используют и в других
лигандных методах (радиоиммунных, люминесцентных, флюорес-
центных). Имеются и отличия в оборудовании, особенно в риде-
рах, предназначенных именно для этих методов. Микропланшеты
на 96 ячеек, используемые для измерения поляризации флюорес-
ценции, должны быть черного цвета для исключения интерфе-
ренции смешанного света отражения (как в белых плашках) и
поляризованного света.
4.4. Области применения методов, основанных
на специфическом связывании в клинической
лабораторной диагностике
Методы, основанные на специфическом связывании, исполь-
зуют в различных областях клинической лабораторной диагности-
ки. В распоряжении лабораторий находятся разнообразные сред-
116
ства для обнаружения индивидуальных белков в сыворотке, плаз-
ме, моче, спинномозговой жидкости. Так, иммуноглобулины в
сыворотке или плазме можно определить и методом радиоимму-
нологического анализа, и с помощью иммунотурбидиметрических,
иммунонефелометрических методов, и другими методами имму-
ноанализа.
Методы иммуноанализа с различными маркерами применяют
для определения белков острой фазы, гормонов и других биоло-
гически активных веществ в диагностике эндокринных расстройств,
бесплодия, в пренатальной диагностике и плацентарной недоста-
точности, определения андрогенных гормонов, а также гормонов
и факторов роста, характеризующих соматотропную функцию ги-
пофиза, сахарного диабета и маркеров жировой ткани, онкомар-
керов, для определения маркеров повреждения сердечной мыш-
цы, сердечной недостаточности, маркеров метаболизма костной
ткани, цитокинов и родственных молекул в диагностике аутоим-
мунных заболеваний, маркеров заболеваний печени и почек, по-
вреждения мозговой ткани, в аллергологии и иммунологии, им-
муногематологии, в инфектологии (диагностика сифилиса, хла-
мидиозов, микоплазмозов, вирусных заболеваний — гепатитов,
ВИЧ, герпеса, краснухи, ветряной оспы, цитомегаловируса и др.),
в диагностике особо опасных инфекций, для определения лекарств
и их контроля в биожидкостях человека, для обнаружения и опре-
деления лекарственных средств, наркотиков в целях диагностики
наркоманий и токсикоманий.
Эти методы используют как в плановом порядке в клинико-
диагностических лабораториях, так и в форме технологий и средств
диагностики для применения непосредственно рядом с пациен-
том на основе «сухих» иммунохроматографических тестов.
Лигандные технологии одновременного многопараметрового
анализа применяют для идентификации специфических аллергий,
вирусных антигенов в крови, предназначенной для переливания.
Даже в том случае, когда диагностика требует определения толь-
ко ограниченной панели аналитов (например, диагностика забо-
леваний щитовидной железы), миниатюризованные технологии,
требующие очень малого количества крови, экономят время пер-
сонала и расходы на определение клинически важных параметров.
Многопараметровые миниатюризованные системы чрезвычайно
важны в анализе ДНК, основанном на олигонуклеотидных ре-
шетках для определения специфических полинуклеотидных по-
следовательностей, в диагностике для типирования тканей при
пересадке, в идентификации вирусов в крови и тканях, в фарма-
кодиагностике и производстве лекарств.
Гл а в a 5
МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИЕ
ТЕХНОЛОГИИ
5.1. Основные положения и принципы методов
Молекулярно-биологические диагностические технологии за-
ключаются в гибридизации и амплификации нуклеиновых кислот.
Общим для этих процессов является воспроизведение механизма
дублирования наследственной информации в геноме. Последова-
тельность нуклеотидов в одиночной цепи ДНК или РНК законе-:
мерно воспроизводится в последовательности нуклеотидов комп-
лементарной цепи благодаря способности гуанина соединяться по
принципу «ключ —замок» только с цитозином, тогда как адениц
соединяется только с тимином. Считывание информации и вос-
произведение цепи ДНК, РНК или определенных их фрагментов!
происходит с помощью специфических ферментных систем.
При нагревании ДНК и ее быстром охлаждении, обработке ще-
лочью и другими денатурирующими агентами сначала происходит
разрыв наиболее слабых водородных связей, в результате из двуни-
тевых образуются однонитевые последовательности нуклеиновой
кислоты. Образовавшиеся комплементарные одиночные цепи мож-
но использовать в качестве матрицы для синтеза новых цепей ДНК.
Гибридизация нуклеиновых кислот представляет собой процесс
образования стабильных двунитевых молекул нуклеиновых кис-
лот из комплементарных однонитевых молекул. Спаривание осно-
ваний комплементарных цепей нуклеиновых кислот происходит
путем образования водородных связей между основаниями, под-
соединения зонда к специфическим последовательностям нукле-
иновых кислот, которые могут быть или могут не быть продукта-
ми амплификации. В результате образуются гибриды «ДНК—ДНК»,
или «ДНК—РНК», или «РНК—РНК».
В различных модификациях метода гибридизации нуклеиновых
кислот используется подсоединение специфичных зондов, конъ-
югированных с субстратом или ферментом. Зонд — это небольшая
часть ДНК, которую применяют для детекции комплементарной
последовательности в реакционной цепи. В результате происходит
усиление образующегося сигнала, регистрируемого тем или иным
способом в ходе определения. Избираемые ДНК-зонды компле-
ментарны изучаемому фрагменту, например зонд, состоящий из
нуклеотидов GATA (гуанин —аденин —тимин —аденин), прили-
пает к фрагментам СТАТ (цитозин —тимин —аденин —тимин).
118
Основные принципы зондовых технологий сходны с принци-
пами дублирования наследственной информации в геноме орга-
низма. И те и другие основаны на следующих закономерностях:
последовательность однонитевой цепи ДНК определяет после-
довательность комплементарной цепи; в репликации ДНК дву-
нитевые молекулы ДНК образуются под действием ДНК-поли-
мераз — ферментов, которые считывают исходную матрицу и
связывают нуклеотиды в растущие дочерние цепи.
Необходимыми условиями для технологий с использованием
зондовых методов являются: денатурация исследуемой нуклеи-
новой кислоты для образования однонитевой последовательно-
сти нуклеиновой кислоты чаще всего путем обработки щелочью
или нагреванием; выбор зонда с подходящей известной после-
довательностью нуклеотидов (зондами могут быть синтезирован-
ные олигонуклеотиды, клонированные — рекомбинантные — или
геномные меченые однонитевые последовательности нуклеино-
вой кислоты); применение правильно избранного метода гибри-
дизации. Избираемые в качестве зондов олигонуклеотиды часто
состоят из 15 — 20 оснований с точно определенной последова-
тельностью. Зондом с наибольшим потенциалом индивидуаль-
ности у людей является олигонуклеотид (САС)5. Эти нуклеотиды
с отпечатков пальцев различны у всех людей, за исключением
монозиготных близнецов.
Амплификация — это процесс производства множества копий
ДНК из участка искомой ДНК или РНК. Выделяют технологии
амплификации матрицы и технологии амплификации сигнала. Сре-
ди различных технологий для амплификации фрагментов (матри-
цы) ДНК и РНК следует выделить: полимеразную цепную реак-
цию (ПЦР, PCR) и ее разновидности — модификации с исполь-
зованием обратной транскриптазы, ПЦР — мультипраймерную,
гнездовую, in situ, количественную; лигазную цепную реакцию
(LCR), амплификацию с вытеснением цепи (SDA); амплифика-
цию с использованием транскрипции (NASBA, NFS, 3 SR). К тех-
нологиям, применяемым для амплификации сигнала, относятся
различные модификации метода гибридизации нуклеиновых кис-
лот, при которых используют специфичные зонды: гибридизация
с использованием разветвленных зондов (branched DNAtest); ДНК/
РНК-гибридный захват.
5.2. Полимеразная цепная реакция
Принцип метода. Полимеразная цепная реакция (ПЦР) была
разработана сотрудником американской компании «Cetus» К. Мюл-
лисом в 1983 г. Спустя 10 лет за это открытие ему была присужде-
на Нобелевская премия.
119 '
В основе метода ПЦР лежит комплементарное достраивание
ДНК-матрицы, осуществляемое in vitro с помощью фермента
ДНК-полимеразы. Эта реакция носит название репликации ДНК.
Естественная репликация протекает в несколько стадий: 1) де-
натурация ДНК (расплетение двойной спирали, расхождение
нитей ДНК); 2) образование коротких двунитевых участков ДНК
(«затравок», необходимых для начала синтеза ДНК); 3) синтез
новой цепи ДНК (комплементарно, для получения копий ко-
ротких участков ДНК, специфичных, например, для конкрет-
ных микроорганизмов, т.е. происходит целенаправленный поиск
таких специфических участков, что и служит целью генетиче-
ской диагностики для выявления возбудителей инфекционных
заболеваний).
Открытие термостабильной ДНК-зависимой ДНК-полимера-
зы (Taq-полимеразы) из термофильных бактерий Thermus aquaticus
с оптимумом реакции при температуре 70 —72 °C позволило сде-
лать процесс репликации ДНК циклическим.
Предпосылками для широкого внедрения метода ПЦР в прак-
тику клинико-диагностических лабораторий послужили разработка
и промышленный выпуск термостатов с циклической сменой тем-
пературы по заданной программе (амплификаторов) и автомати-
зация этого процесса. При многократном повторении циклов син-
теза происходит экспоненциальное (в геометрической прогрес-
сии) увеличение количества копий специфического фрагмента
ДНК. Часто искомая ДНК не присутствует в исследуемом матери-
але в достаточном количестве для генетических исследований или
определения микроорганизмов. Поэтому для увеличения аналити-
ческой чувствительности искомая ДНК должна быть размножена.
Полимеразная цепная реакция — наиболее подходящий метод для
этих целей.
Таким образом, по своему принципу, ПЦР — метод много-
кратно повторяющихся циклов ферментативного синтеза in vitro
специфических нуклеотидных последовательностей ДНК-матри-
цы, катализируемого ферментом ДНК-зависимой ДНК-полиме-
разой (амплификация).
Многократно копируемый участок ДНК заведомо выбран ис-
следователем из известной нуклеотидной последовательности опре-
деленного фрагмента ДНК-матрицы, который является маркер-
ным, т.е. специфическим, уникальным, например для данного
вида возбудителя. С внедрением этого метода отпала необходи-
мость выделять и очищать ДНК-мишень. Очень небольшой по объе-
му и необработанный материал может быть исследован и подверг-
нут детекции. Комплементарное достраивание цепи ДНК начина-
ется не в любой точке последовательности ДНК, а только в опре-
деленных стартовых блоках — коротких двунитевых участках. В случае
присоединения таких блоков к специфическим участкам ДНК
120
можно направить процесс синтеза новой цепи только в этом уча-
стке, а не по всей длине цепи ДНК.
Для создания стартовых блоков в заданных участках ДНК ис-
пользуют две олигонуклеотидные «затравки», содержащие 18 —
35 нуклеотидов, которые комплементарны последовательностям
ДНК на правой и левой границах специфического фрагмента и
ориентированы таким образом, что достраивание новой цепи ДНК
происходит только между ними.
Каждый цикл амплификации при полимеразной цепной реак-
ции протекает в присутствии следующих основных компонентов:
ДНК-матрица (ДНК или ее часть, содержащая искомый спе-
цифический фрагмент ДНК в образце любого происхождения,
в частности в любой биожидкости);
два синтетических олигонуклеотидных праймера, комплемен-
тарные участкам ДНК, находящимся на противоположных нитях
на границах определяемого специфического фрагмента и фланки-
рующим искомую мишенную последовательность ДНК;
четыре дезоксирибонуклеотида (дНТФ) — смесь дезоксирибо-
аденозинтрифосфата, дезоксирибоцитидинтрифосфата, дезоксири-
богуанозинтрифосфата, дезоксириботимидинтрифосфата, явля-
ющихся материалом для синтеза новых комплементарных цепей ДНК;
термостабильная ДНК-зависимая ДНК-полимераза, выдержи-
вающая нагревание до 95 °C, катализирующая удлинение цепей
праймеров путем последовательного присоединения нуклеотид-
ных оснований из смеси дезоксирибонуклеотидов к растущей цепи
синтезируемой ДНК;
соответствующий солевой буфер, реакционная среда с обяза-
тельным присутствием ионов магния, необходимых для поддер-
жания активности ДНК-зависимой ДНК-полимеразы.
Выбор специфического фрагмента и подбор праймеров играют
важнейшую роль в специфичности проведения амплификации,
что сказывается на качестве проведения анализа.
Конструирование праймеров проводят после определения нук-
леотидных последовательностей в исследуемой ДНК. Для подбора
оптимальных условий полимеразной цепной реакции с выбран-
ными праймерами используют специальные компьютерные про-
граммы. Для анализа сходства испытуемых ДНК с известными
нуклеотидными последовательностями используют международ-
ные банки данных и компьютерные программы.
Для определения специфических участков генома РНК-содер-
жащих вирусов сначала получают ДНК-копию с РНК-матрицы,
используя реакцию обратной транскрипции, катализируемую фер-
ментом ревертазой (обратной транскриптазой).
Для получения достаточного количества копий искомого спе-
цифического фрагмента амплификация ДНК должна включать
несколько (20 — 40) циклов. Каждый цикл ПЦР состоит из трех
121
этапов (фаз), протекающих при различных температурных режи-
мах (рис. 5.1). Продолжительность каждого этапа зависит от конк-
ретного определяемого аналита, используемого набора реактивов
и типа амплификатора.
1-й этап — денатурация ДНК (расплетение двойной цепи),
протекает при температуре 93 — 95 °C в течение 30 — 40 с.
2-й этап — присоединение праймеров (отжиг), происходит
комплементарно к соответствующим последовательностям на
противоположных однонитевых цепях ДНК на границах специфи-
ческого участка. Для каждой пары праймеров существует своя темпе-
ратура отжига в интервале 50 — 65 °C. Продолжительность отжига —
20-60 с.
3-й этап — элонгация — комплементарное достраивание це-
пей ДНК, происходит от 5'-конца к 3'-концу цепи в противопо-
ложных направлениях, начиная с участков присоединения прай-
меров. Материалом для синтеза новых цепей ДНК служат, как
указано ранее, дНТФ. Процесс синтеза происходит при темпера-
туре 70 — 72 °C. Продолжительность этапа — 20 — 40 с.
Образовавшиеся в первом цикле амплификации новые цепи
ДНК служат матрицами для второго цикла, в котором происхо-
дит образование искомого специфического фрагмента «ДНК-ам-
пликона» (рис. 5.2). В течение следующих циклов копии праймеров
Искомый фрагмент ДНК возбудителя
93-95 °C а
+Тад-полимераза
+дНТФ
Рис. 5.1. Схема полимеразной цепной реакции. Первый цикл процесса
амплификации искомого фрагмента ДНК возбудителя в ПЦР:
а — денатурация двунитевой молекулы ДНК; б — присоединение или отжиг
стартовых блоков (праймеров); для последующего комплементарного достраива-
ния нитей ДНК; в — комплементарное достраивание нитей ДНК с помощью
фермента Taq-полимеразы и дНТФ
122
Удвоенные
фрагменты ДНК,
полученные в первом
цикле амплификации
5'ШЕ
Рис. 5.2. Схема полимеразной цепной реакции:
а — денатурация; б — отжиг праймеров; в — достраивание цепи ДНК
специфически гибридизуются с новыми участками. В результате
образуются фрагменты одинаковой длины — ампликоны, концы
которых завершаются праймерами. Во время каждого цикла коли-
чество вновь синтезированных цепей ДНК удваивается.
Итак, ампликоны, т.е. специфические продукты амплифика-
ции, ограниченные двумя праймерами, образуются, начиная со
второго цикла.
Образованные во втором цикле ПЦР из одной материнской
ДНК два синтезированных участка также служат матрицами для
последующих циклов ПЦР. Начиная с третьего цикла, образуются
ампликоны со строго определенным количеством нуклеотидов,
и, следовательно, с определенной молекулярной массой, что по-
зволяет в классическом методе детекции — гель-электрофорезе
выявить эти ампликоны. Так, специфический фрагмент ДНК мо-
жет быть копирован миллиард раз за короткое время.
Если для выявления нуклеиновой кислоты-мишени методом гиб-
ридизации in situ с применением радиоактивного меченого зонда
необходимо, чтобы мишень присутствовала в препарате в несколь-
ких тысячах копий, то при ПЦР интересующая последовательность
может быть первоначально представлена лишь одной молекулой. По
окончании первого цикла ПЦР из одной молекулы ДНК образуют-
ся две новые, идентичные оригинальной. Поскольку праймеры гиб-
123
ридизуются с обеими цепями ДНК, то и нативная последователь-
ность, и синтезируемые ПЦР-продукты могут служить матрицами
в последующих циклах репликации. В результате число копий уни-
кальной последовательности увеличивается экспоненциально по
формуле 2". Благодаря этому последовательности, присутствующие
в изучаемом материале в минимальном количестве (одна или не-
сколько копий) и не поддающиеся обнаружению никакими други-
ми методами, легко выявляются с помощью ПЦР.
Таким образом, ПЦР позволяет найти «иголку в стоге сена»,
например при исследовании клеток — всего одну аномальную по-
следовательность на 100 000 — 1 000 000 клеток. Экспоненциальное
увеличение числа копий молекулы-мишени не только обеспечи-
вает высокую чувствительность, но и облегчает их выявление.
Увеличение числа копий ДНК носит экспоненциальный ха-
рактер только в первых 20 — 25 циклах, в дальнейшем в результате
истощения дНТФ, снижения активности Taq-ДНК-полимеразы
и по другим причинам увеличение количества образующихся ко-
пий прекращается.
Итак, схема ПЦР-диагностики выглядит следующим образом:
1) взятие биоматериала для исследования;
2) пробоподготовка (выделение нуклеиновых кислот);
3) постановка и проведение собственно ПЦР;
4) детекция ампликонов (электрофорез в геле, планшетная
гибридизация);
5) интерпретация результатов.
Модификации методов с использованием ПЦР. Полимеразная
цепная реакция с использованием обратной транскриптазы. Техно-
логия применяется для идентификации РНК вирусов. Простая ПЦР
не пригодна для идентификации рибонуклеиновых кислот, так
как ДНК-зависимая ДНК-полимераза не способна катализиро-
вать синтез ДНК на матрице РНК. Этих целей достигают несколь-
кими приемами:
1) применяют дополнительный фермент — РНК-зависимую
ДНК-полимеразу — обратную транскриптазу. В результате реак-
ции, катализируемой этим ферментом, образуются однонитевые
фрагменты ДНК, которые в дальнейшем используются в ампли-
фикации с помощью Taq-полимеразы;
2) применяют ДНК-зависимую ДНК-полимеразу, выделенную
из другого термофильного микроба Thermus thermophilus (Tth-поли-
меразы), с помощью которой в присутствии ионов марганца мож-
но катализировать синтез на РНК однонитевой комплементарной
ДНК. При последующем добавлении в среду ионов магния и хела-
торов ионов марганца этот же фермент катализирует обычную ДНК-
зависимую ДНК-полимеразную реакцию. Таким образом, он мо-
жет быть одновременно использован и для синтеза комплементар-
ных однонитевых фрагментов ДНК, и для амплификации ДНК.
124
Мулътипраймерная ПЦР. В ходе мультипраймерной ПЦР про-
цесс коамплификации нескольких матриц ДНК происходит в од-
ной реакционной среде с несколькими парами праймеров. Это
позволяет одновременно провести, например, скрининг по не-
скольким возбудителям инфекционных болезней, исследовать со-
стояние нескольких аллельных генов у эукариотических организ-
мов, в том числе и у человека.
Гнездовая ПЦР. Это модификация ПЦР, при которой исполь-
зуют две пары праймеров, одна из которых участвует в амплифи-
кации внутреннего участка ампликона, полученного после пред-
варительного цикла амплификации с внешней парой праймеров.
В ходе этой ПЦР необходимо перенести ампликон на определен-
ном этапе из одной пробирки в другую, что может привести к
появлению ложноположительных результатов. Вместе с тем этот
вариант ПЦР характеризуется высокой чувствительностью.
ПЦР in situ. Данный метод позволяет специфически амплифи-
цировать и локализовать какую-либо последовательность ДНК
внутри клетки. Внутриклеточное обнаружение продуктов ПЦР
можно выполнять через непрямую гибридизацию in situ или без
этого этапа, с прямой детекцией меченых нуклеотидов. При не-
прямой ПЦР in situ после проведения амплификации и гибриди-
зации ПЦР-продукт взаимодействует с пробой, меченной флюо-
рохромом. При прямой детекции меченые нуклеотиды (например,
дигоксигенин-11-дУТФ, флюоресцеин-дУТФ) включаются непо-
средственно в состав амплифицируемого продукта.
Метод неоценим в исследовании вирусных инфекций и эксп-
рессии генов в клетке, в оценке эффекта действия новых лекар-
ственных средств на клеточном и молекулярном уровнях.
Количественная ПЦР. При проведении количественной ПЦР
частым подходом является использование внутренних стандартов,
которые, как и определяемая ДНК, участвуют в ПЦР. Используя
добавленные внутренние стандарты с разным количеством копий
на один образец, можно определить количество копий матрицы,
участвующей в реакции. Такой внутренний контроль позволяет:
выявить возможное снижение активности реакции ингибитора-
ми, содержащимися в исследуемом образце; учесть эффект нерав-
номерности протекания реакции, так как условия амплификации
стандарта и определяемой ДНК или РНК идентичны; в значи-
тельной степени абстрагироваться от изучения закономерностей
протекания реакции, так как основным алгоритмом расчета ко-
нечного результата является совпадение сигнала от внутреннего
контроля — стандарта и сигнала от определяемого ампликона.
ПЦР в реальном времени. Наиболее технологичным подходом в
создании количественного метода является ПЦР в реальном вре-
мени. Характерной чертой этого метода является возможность пря-
мого определения продуктов реакции непосредственно в процес-
125
се амплификации без последующего электрофореза. Для поста-
новки ПЦР в реальном времени необходим специальный ампли-
фикатор, с помощью которого можно детектировать и регистри-
ровать флюоресценцию, отражающую накопление ампликонов,
на каждом цикле амплификации.
Регистрация накопления продуктов реакции и построение ка-
либровочных кривых происходит по реальным процессам в каж-
дой конкретной пробирке. Используемая для этих целей техноло-
гия «TaqMan» имеет в основе способность Taq-полимеразы гид-
ролизовать последовательность ДНК в направлении 5'—3'. Прин-
цип работы подобной системы представлен на рис. 5.3:
а) в ходе реакции к образцу добавляют специальный зонд,
модифицированный двумя флюоресцентными красителями (3) и
(Т), имеющими близкие максимумы поглощения и флюоресцен-
ции света; расстояние между молекулами красителей подобрано
таким образом, что происходит перенос энергии от одной моле-
ШЛ ТОТ3'
ПП1ТПМПИПИЛИ1ЛПП1ПВПИП..
б
в
Новый цикл ПЦР
Рис. 5.3. Количественная ПЦР. Схема TaqMan (пояснения в тексте):
а — денатурация ДНК; б — отжиг с праймерами и пробой; в — деградация
5’-конца, вызванная Taq-полимеразой; г — детекция сигнала
126
кулы, испускающей первичный квант флюоресценции (3), к дру-
гой, которая испускает квант света в более длинноволновой обла-
сти спектра (Т);
б) при наличии специфической матрицы в начале амплифика-
ции происходит смещение максимума флюоресценции из-за де-
градации олигонуклеотидного зонда;
в) измерение флюоресценции в каждой амплификационой
ячейке позволяет рассчитывать количество исходной матрицы,
используемой в реакции амплификации. Последняя происходит
в приборе, оснащенном устройством освещения возбуждающим
светом каждой амплификационной ячейки и многоканальным
флюоресцентным детектором. Информацию можно наблюдать
на дисплее амплификатора. Для выявления продуктов амплифи-
кации используют различные подходы: интеркалирующие мет-
ки, к которым относится флюоресцентная метка SYBR Green I,
флюоресценция которой значительно возрастает при внедрении
ее в двухцепочечные молекулы ДНК. Добавление в реакционную
смесь позволяет наблюдать за накоплением продуктов ампли-
фикации.
Другой метод основан на использовании ДНК-зондов, в со-
став которых входят флюоресцентная метка и гаситель флюорес-
ценции. Когда зонд находится в растворе, гаситель поглощает ис-
пускаемое меткой излучение и свечение отсутствует. Когда в ходе
ПЦР происходит присоединение ДНК-зонда к комплементарной
цепи ДНК, происходит разъединение метки и гасителя, что при-
водит к увеличению детектируемого свечения. Чем больше ампли-
конов наработано, тем интенсивнее флюоресценция.
Методы детекции продуктов амплификации. Для детекции и ре-
гистрации продуктов амплификации можно использовать различ-
ные методы: электрофоретическое разделение ампликонов с по-
следующей их визуализацией окрашиванием, например, броми-
дом этидия; использование систем для количественного анализа —
компьютеризированных УФ-трансиллюминаторов с встроенной
цифровой видеокамерой и программ, обеспечивающих анализ ви-
деоизображения с количественным представлением и распечат-
кой результатов. Широкое распространение получают гибридиза-
ционные методы детекции в планшетном формате с использова-
нием иммуноферментной стадии с флюорогенными субстратами
для выявления продуктов амплификации (рис. 5.4, а) или прямо-
го измерения флюоресценции олигонуклеотидного зонда после
его гибридизации с продуктами реакции в жидкой фазе, либо на
специальной подложке (рис. 5.4, б).
К другим методам анализа ампликонов относят высокоэффек-
тивную жидкостную хроматографию, капиллярный электрофорез,
масс-спектрометрию. Аналогичные методы используют в биологи-
ческих устройствах — микросистемах-биочипах. Большинство био-
127
Рис. 5.4. Плашечная схема детекции продуктов ПЦР:
а — ПЦР с биотинилированными праймерами; б — гибридизация продукта ПЦР
на плашку со стрептавидином; в — щелочная денатурация, отмывка комплемент,
тарной цепи ДНК; г — гибридизация со специальным зондом, меченным флюо-
ресцентным маркером; 1 — иммуноферментная детекция с использованием флюо-
рогенного субстрата; 2 — прямая детекция флюоресцеинмеченого зонда; В — био-
тин; S — стрептавидин; SF — меченный флюоресцентной меткой субстрат
для ИФА
чипов является устройствами для детекции продуктов амплифика-
ции и технические принципы их работы будут описаны далее.
Особенности и преимущества ПЦР. Они заключаются в высо-
кой специфичности и чувствительности метода, что и позволяет
использовать малое количество (0,01 — 0,1 мл) любого исследуе-
мого материала, в том числе и гистологические препараты. Ни
один из существующих в настоящее время методов не обладает
большей чувствительностью, чем методы с ПЦР.
128
Исследуемый материал может быть дезинфицирован термиче-
ской или химической обработкой в момент его взятия, и, следо-
вательно, исключается возможность инфицирования персонала в
ходе анализа; метод прямой, простой, возможна его полная авто-
матизация (например, автоанализаторы «Cobas Amplicor» фирмы
«Hoffmann La Roche», Швейцария; «Light Cycler System» фирм
«Roche Diagnostics GmbH», «Roche Molecular Biochemicals», Гер-
мания); результаты могут быть получены в течение нескольких
часов, т.е. в течение одного рабочего дня.
Специфичность методов с ПЦР определяется правильно из-
бранным участком ДНК для каждого аналита или возбудителя и
уникальной структурой искусственно синтезируемых праймеров,
используемых при амплификации.
Точность ПЦР обеспечивается применением в процедуре ана-
лиза положительных и отрицательных контролей, хотя вопросы
стандартизации и контроля качества остаются пока еще открыты-
ми. Но именно потому, что чувствительность ПЦР очень высока,
существует опасность получения ложноположительных результа-
тов в результате переноса на предметы, оборудование, реагенты
как самой матрицы ДНК, так и (что наблюдается гораздо чаще)
ампликонов.
Приборы, оборудование и другие средства для ПЦР. Особенно-
сти постановки ПЦР требуют соблюдения определенных правил,
поэтому организация лаборатории для ПЦР регламентируется
рядом нормативных документов, утвержденных Госсанэпиднад-
зором Министерства здравоохранения Российской Федерации. Для
ПЦР-лаборатории необходимо иметь 2 — 3 комнаты общей пло-
щадью не менее 60 м2, оснащенных водопроводом и приточно-
вытяжной вентиляцией. В случае использования электрофореза для
разделения ампликонов три процедуры (подготовка анализируе-
мых проб, амплификация и детекция результатов) должны быть
физически изолированы друг от друга для предотвращения кон-
таминации, и проводиться в разных помещениях, оснащенных
предбоксами. Если комнаты для подготовки проб и амплифика-
ции в крайнем случае могут быть совмещены и разграничены на
зоны за счет установки дополнительных ПЦР-боксов или лами-
нарных шкафов, то комната для электрофореза должна находить-
ся как можно дальше от первых двух и иметь не связанную с дру-
гими зону вентиляции. Должны быть предусмотрены помещения
для переодевания персонала, хранения верхней одежды, приема
пищи, складское помещение для лабораторных материалов. Каж-
дая рабочая комната должна иметь источник УФ-излучения с дли-
ной волны около 260 нм.
Облучение, инактивирующее ДНК-матрицы, необходимо про-
водить в течение 1 ч до начала работы и в течение 1 ч после ее
окончания. При работе с биоматериалом необходимо использо-
5 Меньшиков
129
вать резиновые перчатки, так как анализируемые пробы являются
потенциально инфицированным материалом, способным длитель-
ное время сохранять и передавать вирусы гепатитов, HIV и других
возбудителей вирусных инфекций. При работе с потенциально
инфицированным материалом необходим автоклав. При работе с
трансиллюминатором необходимо пользоваться защитным экра-
ном или специальной защитной маской, защитными очками, так
как ультрафиолетовое излучение вызывает ожоги лица и слизи-
стой глаз. Все лабораторное оборудование, пипетки, штативы, по-
суда, рабочие растворы должны быть строго стационарными. Запре-
щается их перемещение из одного помещения в другое. Использо-
ванные наконечники, пробирки, другие загрязненные предметы
инактивируют погружением в специальный раствор, вызывающий
деградацию ДНК и утилизируют. Рабочую поверхность стола об-
рабатывают дезинфицирующим средством.
Минимальный комплект при электрофоретической детекции
результатов включает следующие лабораторные приборы и обору-
дование: амплификатор; термостат для термоподготовки проб;
настольную центрифугу типа MiniSpin; центрифугу-вортекс; ка-
меру для электрофореза 9x13 см; источник питания для электро-
фореза; трансиллюминатор; комплект одноканальных полуавто-
матических дозаторов на объемы доз от 0,5 до 1 000 мкл; подстав-
ку для пробирок на 0,5 мл; охладитель для пробирок; штативы для
дозаторов; штативы с крышкой на 30 пробирок по 1,5 мл; лами-
нарный бокс для ПЦР; документирующую систему типа «DNA
Analyzer» — отечественный программный продукт для докумен-
тирования картины электрофореграмм с результатами ПЦР, их
учета, обработки и длительного сохранения изображения в памя-
ти компьютера.
Основным прибором для постановки ПЦР является амплифи-
катор, или термоциклер, в гнезда которого устанавливают специ-
альные амплификационные пробирки, изготовленные из тепло-
проводного пластика, или предметные стекла. В эти пробирки с
ПЦР-смесью вносят необходимое количество образца с выделен-
ной ДНК. После этого пробирки, закрытые крышками, помеща-
ют в амплификатор. Он представляет собой программируемый тер-
мостат.
Устройство амплификаторов разнообразно. Они отличаются друг
от друга количеством программируемых блоков, системами охлаж-
дения (водяное, воздушное, фреоном, с использованием полу-
проводниковых кристаллов), способами обогрева (передача тепла
через пробирки с жидкостью или воздушная передача тепла в
микрокалориметр для обогрева образцов срезов, тканей, мазков),
диапазоном поддерживаемой температуры, точностью поддержа-
ния температуры, скоростью нагревания и охлаждения блоков,
количеством платформ, на которых происходит амплификация
130
по одной и той же (для увеличения производительности) или по
разным (для одновременного анализа разных аналитов или возбу-
дителей инфекционных болезней в одних и тех же пробах) про-
граммам, режимами регулирования смены температуры в пробах,
объемом памяти при программировании работы амплификатора.
Современные амплификаторы оснащены нагревающимися
крышками и позволяют работать без добавления минерального
масла. Лаборатория-пользователь может выбрать амплификаторы
со сменными блоками для пробирок по 0,5 или 0,2 мл на различ-
ное количество образцов, для плашек на 96 или 384 лунки. Кроме
того, устройство некоторых амплификаторов зависит и от спосо-
ба детектирования продуктов амплификации.
При проведении ПЦР в реальном времени фирма «BioRad»
рекомендует амплификатор «ICycler IQ», в котором существует
возможность подключения оптического блока, позволяющего ре-
гистрировать образующиеся ампликоны в ходе реакции. При этом
на дисплее отражается концентрация продуктов амплификации в
виде графика изменения флюоресцентного сигнала. Если в ходе
анализа используют образцы с известной концентрацией ДНК
(калибраторы), то результат сопоставляют с динамикой сигнала
от калибраторов, и, таким образом, становится возможным ко-
личественный анализ нескольких вариантов обработки информа-
ции в режиме реального времени, включая автоматический рас-
чет кривых плавления ДНК.
Анализатор «Light Cycler System» представляет собой высоко-
скоростную систему для ПЦР. Требуемая температура в камере
достигается в течение нескольких секунд при скорости изменения
ее 20 °C в секунду. ПЦР происходит в специальных капиллярах из
боросиликатного стекла, которые вмещают 20 мкл пробы. Капил-
ляры имеют очень высокое соотношение «поверхность/объем» для
создания быстрого равновесия между воздухом и компонентами
реакции. Такая комбинация с использованием быстрого нагрева-
ния воздухом и высокого соотношения площади поверхности ка-
пилляра к объему позволяет завершить 1 цикл ПЦР менее чем за
30 с, а 30 — 40 циклов за 20 — 30 мин. Свойства боросиликатного
стекла капилляров позволяют использовать их в качестве кювет
для измерения флюоресценции.
Для выявления продуктов амплификации методом электрофо-
реза в агарозном геле используют электрофоретические камеры,
представляющие собой готовые к работе системы. Формат геля
определяет пропускную способность камеры, т.е. количество об-
разцов для разделения.
Трансиллюминаторы («столики с подсветкой») представляют
собой несложные приспособления, предназначенные для просмот-
ра гелей, а также для документации результатов, если составляют
часть документирующей системы. Их главной особенностью явля-
131
ются специальные лампы (4 — 6 шт.), излучающие ультрафиоле-
товый свет различной интенсивности.
Формат геля в электрофоретической камере должен соответ-
ствовать размеру окна для просмотра гелей в трансиллюминаторе.
В последние годы большое внимание уделяют модификации и
модернизации методов регистрации результатов ПЦР. Разработан
широкий спектр устройств, позволяющих перевести изображение
геля в цифровой формат и отказаться от фотодокументации ре-
зультатов.
Гибридизационные методы регистрации результатов позволя-
ют существенно повысить специфичность определения, а выпол-
нение в планшетах делает возможными стандартизацию и автома-
тизацию процесса. В зависимости от метки, входящей в олигонук-
леотидный зонд, используют различные способы детекции гиб-
ридизационного комплекса (прямое измерение флюоресценции,
иммуноферментный анализ). Гибридизационные системы детек-
ции на планшетах явились прообразом при создании современ-
ных ДНК-биочипов. Оптические биосенсоры не требуют каких-
либо модификаций ампликона или зонда, а позволяют опреде-
лять очень малые (в пикограммах) количества фрагментов нукле-
иновых кислот, иммобилизованных на поверхности оптической
кюветы, свойства которой дают возможность проводить в ней не-
сколько сотен определений после циклов регенерации по завер-
шении каждого определения.
5.3. Лигазная цепная реакция
Лигазная цепная реакция (ЛЦР) основана на способности фер-
мента ДНК-зависимой ДНК-лигазы сшивать (лигировать) цепь
ДНК в присутствии АТФ и ионов магния при наличии разорван-
ной фосфодиэфирной связи. Фермент высокоспецифичен при
лигировании одноцепочечных разрывов на матрице, которая пред-
ставляет собой вторую комплементарную цепь. Низкая специфи-
ческая активность наблюдается при сшивании одновременно двух
разрывов на обеих цепях или разрыва на однонитевой ДНК. Ли-
газная цепная реакция использует две пары праймеров компле-
ментарных друг другу и исходно выбранному фрагменту матрицы
(например, ДНК какого-либо инфекционного агента) по прин-
ципу «голова к хвосту» в направлении 5'—3'. Таким образом,
в ходе ЛЦР начинает накапливаться лигированный двунитевый
фрагмент ДНК — продукт, полностью идентичный по структуре
четырем используемым праймерам. Эту реакцию широко исполь-
зуют для выявления различных инфекционных агентов, содержа-
щих ДНК (например, возбудителей хламидиоза — Chlamydia
trachomatis и туберкулеза — Mycobacterium tuberculosis) с помощью
132
готовых наборов реактивов заводского производства. Метод удо-
бен для автоматизации, может быть объединен с ПЦР или други-
ми методами.
Основные особенности ЛЦР в сравнении с ПЦР заключаются
в том, что в методе ПЦР используют два праймера для получения
трех видов информации (присутствие искомой последовательно-
сти, длина последовательности, последовательность между прай-
мерами); в ЛЦР используют четыре праймера для получения двух
видов информации (присутствия примыкающих к искомым по-
следовательностей, точная комплементарность к праймерам в ме-
стах их связывания).
5.4. Другие молекулярно-биологические технологии
Реакции гранскрипциоппо опосредованной амплификации. Наи-
более распространенная технология — амплификация, основанная
на чередовании последовательности нуклеиновых кислот (англ. —
Nucleic Acid Sequence-Based Amplification NASBA). Это праймер-
опосредованная ферментативная реакция in vitro для поточной и
изотермальной амплификации специфических последовательно-
стей нуклеиновых кислот. Метод используют в основном для реп-
ликации РНК. При реверсивной транскрипции сДНК образуется
из искомой РНК. Важно, что праймер для этого этапа имеет до-
полнительный РНК-промотер — последовательность, прикреп-
ляющуюся к его 5' концу. Второй фермент РНКаза Н, присут-
ствует в реакционной смеси и немедленно расщепляет искомую
РНК внутри этой двойной цепи. Параллельно первый фермент
(реверсивная транскриптаза, обладающая также полимеразной
активностью) начинает полимеризовать комплементарную ДНК
с праймера 2. Эта двухцепочечная сДНК теперь имеет функцио-
нальную последовательность РНК-промотера, с которой третий
фермент в реакционной смеси (РНК-полимераза) может синте-
зировать несколько новых копий РНК. Эти копии немедленно
конвертируются в копии сДНК и, соответственно, в двойные цепи
ДНК, которые снова служат стартовым материалом для новых РНК
цепей. Таким образом, в течение 40 — 50 мин в растворе образует-
ся 108- 109 РНК.
ДНК/РНК-гибридный захват. Данная методика относится к тех-
нологиям амплификации сигнала (рис. 5.5). Принцип основан на
иммунохимической детекции продуктов гибридизации нуклеино-
вых кислот РНК/ДНК или ДНК/РНК с помощью моноклональ-
ных антител, распознающих образующиеся дуплексы (двойные
цепи) нуклеиновых кислот. Для обнаружения бактерий или
ДНК-содержащих вирусов применяют РНК-зонд. В случае выявле-
ния РНК-содержащих инфекционных агентов (вирус гепатита С)
133
используют ДНК-зонд. Обнаружение и определение в этих случа-
ях основано на хемилюминесцентной детекции результатов гиб-
ридизации. Здесь сведены к минимуму процессы подготовки био-
жидкости для исследования и очистки нуклеиновых кислот, что
позволяет использовать иммунохимическую детекцию PH К/ДНК-
гибрида для скрининга.
Метод гибридизации с использованием разветвленных зондов
(ЬДНК, branched DNA-test). Это — метод амплификации сигнала в
ходе определения, независимый от праймеров, основан на связыва-
нии синтетических, разветвленных молекул ДНК с искомой нукле-
иновой кислотой. В результате многоступенчатого процесса гибриди-
зации происходит присоединение многочисленных зондов, конъю-
гированных с молекулами фермента, окисляющего люминогенный
субстрат и запускающего таким образом хемилюминесценцию.
Эти методы очень надежны, чувствительны и хорошо подходят
для количественной оценки содержания нуклеиновых кислот в
биожидкостях. Однако на некоторых этапах они трудоемки и их
применение в клинико-диагностических лабораториях зависит от
доступности коммерческих тест-систем.
5.5. Технологии биочипов
Биочипы, микрочипы лабораторные аналитические (микрочип-
ные анализаторы, геносенсоры, микрототальные аналитические
системы) — это миниатюрные аналитические устройства, изго-
товленные из силикона, кварца, стекла, пластмасс с применени-
ем фотолитографии. Необходимые для проведения аналитических
процедур компоненты — каналы, камеры — формируют способом
фотолитографии или реактивной ионной гравировки, используют
134
сверление лучом лазера, а особенно малые компоненты (размером
0,1 мкм) получают методом гравировки рентгеновскими, элект-
ронными лучами или другими способами, заимствованными из тех-
нологий производства компонентов микроэлектроники.
Создание лабораторного микрочипа, являющегося средством
миниатюризации лабораторных технологий и лабораторного обо-
рудования, вызвало, в сущности, революционный переворот в ла-
бораторных и научных исследованиях. Микрочипные анализаторы
позволяют существенно сократить расход биоматериалов, калибра-
торов, реактивов, времени анализа, максимально стандартизовать
аналитический процесс, упростить работу, повысить производи-
тельность, снизить стоимость анализа. Устройства этого типа были
созданы впервые при проведении работ по расшифровке генома
человека и поиска эффективных лекарственных средств среди со-
тен вариантов химических соединений близкой структуры.
Ранее фирмой «Randox» (Великобритания) были описаны мик-
рочипы (размером 1 см2), использованные как устройства для
размещения групп биозондов, представляющих собой биосенсо-
ры для детекции искомых аналитов, в конструкции многоцелево-
го автоанализатора «EVIDENCE». Производимые в настоящее время
микрочипные анализаторы позволяют осуществлять как считаю-
щиеся рутинными процедуры, например дифференциацию кле-
ток крови, так и новейшие методы, в том числе исследования
нуклеиновых кислот: гибридизацию ДНК, определение последо-
вательности нуклеотидов, ПЦР и ее разновидности, лигазную
цепную реакцию, анализ полиморфизма длины рестрикционных
фрагментов, обнаружение мутаций генов.
Для микрочипных анализаторов уже существует большое се-
мейство конструктивных элементов, включая фильтры, линзы,
насосы, диафрагмы, ионоселективные электроды, фотодиоды,
светофильтры и т.п. Типовые размеры микрочипа — 1,5x1,5 см
при толщине в несколько миллиметров. В молекулярно-биологиче-
ских технологиях биочипы играют очень важную роль не только
на этапах детекции результатов.
Технология ДНК-чипов основана на гибридизации неизвест-
ной нуклеотидной последовательности с расположенными в
определенном порядке известными ДНК-последовательностями,
иммобилизованными на поверхности стекла или кремния. Резуль-
тат определяют по флюоресценции зонда, предварительно мечен-
ного флюорофором и гибридизованного с одной из иммобилизо-
ванных проб. Детекцию гибридизационного сигнала на ДНК-чи-
пах проводят специально разработанными сканерами флюорес-
ценции. В последние годы предприняты попытки внедрить новые
высокочувствительные методы детекции, такие как масс-спект-
рометрия, хемилюминесценция, оптоволоконная техника, диод-
ные детекторы, детекция электрических зарядов.
135
ДНК-чипы имеют несколько преимуществ перед другими тра-
диционными молекулярно-биологическими технологиями. В них
осуществлен принцип миниатюризациии дифференциальной по-
следовательности анализируемой пробы, а также полная автома-
тизация рабочего места. Они могут быть использованы неодно-
кратно (за исключением ДНК-чипов на гелевых подложках).
5.6. Области применения молекулярно-биологических
технологий
Молекулярно-биологические технологии широко внедряются
в практику лабораторий и, в первую очередь, для решения про-
блем микробиологии и эпидемиологии. Методы с использовани-
ем ПЦР дополняют спектр традиционных методов микробиоло-
гической диагностики. Применение ПЦР наиболее эффективно
для обнаружения микроорганизмов, трудно культивируемых в ла-
бораторных условиях, атипичных форм бактерий, а также внут-
риклеточных паразитов и микроорганизмов, способных длитель-
но находиться в организме хозяина без проявления клинических
симптомов (микобактерии туберкулеза, вирусные инфекционные
агенты). Так, с помощью набора реагентов для выявления мико-
бактерий туберкулеза возможна дифференциальная диагностика
вирусных и бактериальных пневмоний и туберкулеза.
Отечественная технология с применением гибридизации на
биочипе с последующим считыванием флюоресценции ДНК-зон-
да, комплементарного району гена гроВ (81-я пара олигонуклео-
тидов), который содержит наиболее часто встречающиеся мута-
ции штаммов микобактерии туберкулеза, устойчивые к рифам-
пицину и изониазиду, позволяет в значительно более короткие
сроки, чем определение лекарственной чувствительности стан-
дартными микробиологическими методами, установить диагноз
MDR-формы заболевания, устойчивой к лечению этими препа-
ратами. Молекулярно-биологические технологии позволяют вы-
являть многие клинически значимые вирусы, в том числе вирусы
герпеса различных типов, гепатитов А, В, С, D, G, мононуклео-
за, ротавирусов, энтеровирусов, кальцивирусов: вирусов Норфолка
1-го и 2-го типов, астровирусов, флавивирусов, вируса крымской
геморрагической лихорадки, краснухи, аденовирусов, коронави-
руса, вируса, вызывающего тяжелый респираторный синдром,
«ТОРС» («атипичная пневмония»).
Наиболее экономически обосновано использование этих тех-
нологий для выявления урогенитальных бактериальных инфекций,
хламидиоза, уреаплазмоза, микоплазмоза, гарднереллеза, трихо-
моноза, сифилиса.
В целях диагностики инфекционных заболеваний применяют
наборы реактивов для выявления сальмонелл, шигелл, микроор-
136
ганизмов рода кампиллобактер, клостридий, листерий, иерсиний,
возбудителей дифтерии (токсигенных штаммов), а также для ди-
агностики протозойных инфекций (например, токсоплазмоза).
Молекулярно-биологические технологии высокочувствительны
и специфичны при выявлении ДНК-фрагментов возбудителей
туляремии, мониторинге природных очагов туляремии, возбуди-
теля сибирской язвы.
Мультиплексная ПЦР используется для идентификации виру-
са натуральной оспы и других ортодоксвирусов (вирусов оспы
коров, обезьян), патогенных для человека.
С помощью тест-систем на основе ПЦР осуществляется диаг-
ностика арбовирусных инфекций (что особенно важно в первые
дни заболеваний), клещевого энцефалита и клещевого боррелио-
за, диагностика риккетсиозных лихорадок, возможно проведение
как первичного генотипирования возбудителя, так и эпидемио-
логическое расследование вспышек заболевания путем анализа
нуклеотидной последовательности генома.
В диагностике особо опасных инфекций методы с применени-
ем ПЦР используются в качестве экспресс-тестов для исследова-
ния материала от больного (подозрительного на заболевание) при
выполнении культурального и биологического методов и для иден-
тификации подозрительных колоний, для индикации биологи-
чески патогенных агентов в объектах окружающей среды. По ре-
зультатам анализа выдается предварительный ответ о наличии в
пробе ДНК микроорганизма. При наличии очага инфекции поло-
жительные результаты ПЦР в комплексе с данными других эксп-
ресс-методов (ИФА, люминесцентная микроскопия и др.) могут
быть основанием для окончательного положительного ответа и
проведения противоэпидемических мероприятий. Эпидемиоло-
гическая значимость изолятов может быть оценена на основании
выявления генетических маркеров вирулентности, например ге-
нов ctxA, tcpA у возбудителя холеры.
Огромный интерес ПЦР представляет для выявления онкови-
русов, например вирусов папилломы человека различных типов
и, прежде всего, высокого канцерогенного риска.
Амплификационная диагностика занимает свое место в арсе-
нале методов, направленных на выявление предрасположенности
пациентов к онкологическим заболеваниям, микродиссеминации
опухолей.
Микрочиповые микро- и нанотехнологии, как полагают раз-
работчики ДНК-чипов, станут средствами быстрого и недорогого
выявления генетически обоснованных заболеваний и состояний,
ВИЧ, болезни Альцгеймера, цистофиброза, некоторых форм рака.
С другой стороны, эти технологии позволят разработать стра-
тегии для недорогого скрининга лекарств.
Гл а в a 6
МИКРОСКОПИЯ
6.1. Принцип действия и устройство микроскопа
Потребность в визуальных наблюдениях работников лаборато-
рий за клетками, их структурами или другими корпускулярными
компонентами биоматериалов пациентов возникает в следующих
случаях: при исследовании мочи, спинномозговой и других био-
логических жидкостей; подсчете клеток крови в счетных камерах;
дифференциальном подсчете лейкоцитов в мазках перифериче-
ской крови; исследовании клеток в мазках, соскобах, срезах тка-
ней; исследовании микроорганизмов, грибов, паразитарных орга-
низмов.
Для этого используют оптические приборы — микроскопы.
Микроскоп (от греч. rnikros — малый, skopeo — смотрю) — это
прибор, позволяющий получать увеличенное изображение объек-
тов и структур, недоступных глазу человека. В медицинских и био-
логических исследованиях применяют методы световой и элект-
ронной микроскопии. Современные микроскопы — это новое по-
коление приборов со сложной оптико-механической и электрон-
ной конструкцией.
Принцип световой микроскопии основан на законах геометри-
ческой оптики и волновой теории образования изображения. Для
освещения используют естественный свет или искусственные ис-
точники света. Световые микроскопы могут увеличивать объект
размером от 0,5 мкм с разрешением элементов объекта до 0,1 мкм
более чем в 1 800 раз.
Электронная микроскопия обеспечивает получение электрон-
нооптического изображения с помощью потока электронов. Пост-
роение изображения тоже основано на законах геометрической и
волновой оптики, а также на законах электромагнитных полей.
Электронная микроскопия делает возможным исследование объек-
тов, размеры которых лежат за пределами разрешающей способно-
сти светового микроскопа (менее 0,2 мкм) и применяется для изу-
чения вирусов, бактериофагов, тонкого строения микроорганиз-
мов и других субмикроскопических объектов и макромолекуляр-
ных структур. Она обеспечивает увеличение объекта в 20 000 раз.
Современные микроскопические приборы подразделяют на сле-
дующие группы: биологические микроскопы (проходящего света);
инвертированные биологические микроскопы (инвертированные
138
микроскопы проходящего света), люминесцентные микроскопы;
поляризационные микроскопы проходящего света; стереоскопи-
ческие микроскопы; анализаторы изображения. По степени слож-
ности каждую группу микроскопов можно разделить: на учебные;
рутинные; рабочие; лабораторные; исследовательские.
Микроскоп состоит из нескольких функциональных частей:
механической, оптической и осветительной системы (рис. 6.1).
Механическая часть микроскопа представлена основным бло-
ком — штативом, в состав которого входят основание и тубусо-
держатель. Предметный столик микроскопа, на котором распола-
гают, крепят и фиксируют в определенном положении объект на-
блюдения, является чисто механическим узлом микроскопа. Он
закреплен на специальном кронштейне. Предметные столики мо-
гут быть подвижными и неподвижными. Неподвижные столики
обычно применяют в самых простейших моделях микроскопов,
передвижение объекта на них наблюдатель выполняет вручную.
В настоящее время такие микроскопы встречаются очень редко.
При оснащении микроскопов подвижными столиками возможно
механическое перемещение и вращение объекта под объективом
микроскопа. Управляемые от электродвигателя предметные сто-
лики называют сканирующими, в современных микроскопах уп-
равление может происходить с помощью специальной компью-
терной программы.
Механические компоненты микроскопа выполняют не только
функцию крепления и обеспечения необходимого взаимораспо-
ложения оптических и осветительных компонентов, но и их точ-
ного перемещения в процессе фокусирования и наводки на рез-
кость, создания оптимальных условий освещения, передвижения
и ориентации исследуемого объекта.
Оптическая часть микроскопа обеспечивает его основную функ-
цию, создает увеличенное изображение объекта с достаточной
степенью достоверности по форме, соотношению размеров и цвету.
Рис. 6.1. Схема устройства микро-
скопа:
1 — окуляр; 2 — штатив; 3 — грубая
настройка; 4 — тонкая настройка; 5 —
основание; 6 — зеркало; 7 — конден-
сор под предметным столиком с ири-
совой диафрагмой; 8 — предметный
столик; 9 — объектив; 10 — револь-
верная головка; 11 — призма; 12 —
основной тубус
139
Оптика микроскопа должна обеспечивать такое увеличение, кон-
траст и разрешение элементов, которые позволяют проводить на-
блюдение, анализ и измерение, соответствующие требованиям
методик в практике клинико-диагностических лабораторий.
Основными оптическими элементами микроскопа являются
объектив, окуляр, конденсор; вспомогательными — осветитель-
ная система, оптовар, визуальные и фотонасадки с оптическими
адаптерами и проективами.
Принципиальная схема оптической части микроскопа состоит
из двух систем линз. Одна из них расположена в окуляре, т. е. уст-
ройстве для глаз наблюдателя. Окуляр вставлен в тубус — трубку,
по которой свет от наблюдаемого объекта проходит к глазу на-
блюдателя. Вторая система линз находится в непосредственной
близости к изучаемому объекту, поэтому называется объективом.
Различными конструкциями микроскопов предусмотрено нали-
чие одного, двух или трех окуляров (монокулярные, бинокуляр-
ные, тринокулярные микроскопы), нескольких сменных объек-
тивов, позволяющих подбирать желательные степени увеличения
объекта. Бинокулярные микроскопы удобнее для наблюдателя,
поскольку в этом случае есть возможность наблюдать объект дву-
мя глазами одновременно.
Объектив микроскопа выполняет функцию воспроизведения
изображения наблюдаемого объекта с требуемым увеличением при
разрешении элементов изображения, необходимом для их деталь-
ного изучения, и при точном воспроизведении их по форме и
цвету. Объективы имеют сложную конструкцию, которая включа-
ет несколько одиночных и склеенных компонентов из двух, трех,
а иногда до 13—14 линз.
Маркировка объективов осуществляется в соответствии с систе-
мой надписей на их корпусе, принятой Международной организа-
цией по стандартизации (ISO). Большое значение имеет наличие
иммерсионной среды между объектом и объективом, толщина по-
кровного стекла. В некоторых технологиях микроскопирования суще-
ствует также необходимость выполнения работ непосредственно под
микроскопом. В них очень важна такая характеристика, как рабочее
(свободное) расстояние между объективом и объектом. Такие объек-
тивы называют объективами с большим рабочим расстоянием.
Основные формулы, используемые в микроскопии, позволя-
ющие рассчитать общее полезное увеличение, увеличение объек-
тива, окуляра, поле на предмете, числовую апертуру и разреша-
ющую способность микроскопа, а также детальные сведения об
оптических схемах и устройстве различных типов микроскопов при-
ведены в специальном справочнике*.
* Медицинские лабораторные технологии: справочник : в 2 т. / под ред.
А. И. Карпищенко. — СПб. : Интермедика, 1998.
140
При работе с иммерсией применяют три типа иммерсионных
жидкостей: масляную (МИ/Oil), водную (ВИ/W) и глицерино-
вую (ГИ/Glyc). Последнюю в основном применяют в ультрафио-
летовой микроскопии. Иммерсионная жидкость необходима для
повышения разрешающей способности микроскопа; в соответствии
с технологией микроскопирования; повышения видимости за счет
увеличения разности показателя преломления среды и объекта;
увеличения глубины просматриваемого слоя, который зависит от
показателя преломления среды. Иммерсионная жидкость может
уменьшать количество рассеянного света за счет устранения бли-
ков от объекта. При этом исключаются неизбежные потери света
при попадании его в объектив.
Окуляр — обращенная к глазу часть оптического прибора,
предназначенная для рассматривания с некоторым увеличени-
ем изображения, созданного объективом прибора. Окуляры слу-
жат для построения микроскопического изображения на сет-
чатке глаза наблюдателя. Они играют роль лупы, дополнитель-
но увеличивающей изображение, созданное объективом. Оку-
ляры в общем виде состоят из двух групп линз: глазной, бли-
жайшей к глазу наблюдателя, и полевой, ближайшей к плоско-
сти изображения, в которой объектив строит изображение рас-
сматриваемого объекта.
Одним из направлений в современном производстве микро-
скопов является использование в них оптики без хроматической
разности увеличения (ХРУ = 0 %). Этот принцип связан с развити-
ем систем анализа изображения, в которых от собственно изобра-
жения требуется четкость контура для его распознавания и затем
обработки с помощью компьютерных программ (измерение пло-
щади, периметра, оптической плотности и др.).
Окуляры обеспечивают работу оператора, имеющего нормаль-
ное зрение или пользующегося очками. Если микроскопические
исследования требуют проведения точных измерений, то конст-
рукция окуляров таких микроскопов предусматривает расположе-
ние внутри них шкал и сеток. Эти окуляры изготавливают с мини-
мальным искажением изображения на краях поля зрения.
Осветительная система — это система линз, диафрагм и зер-
кал (при необходимости), обеспечивающая равномерное освеще-
ние объекта и полное заполнение апертуры объектива. В нее вхо-
дят: источник света (естественный или искусственный); коллек-
тор — оптическая система, проецирующая нить лампы в плос-
кость апертурной диафрагмы конденсора, при этом нить лампы
увеличивается до размера диафрагмы. При встроенной осветитель-
ной системе проходящего света коллекторная часть расположена
вблизи источника света в основании микроскопа и предназначе-
на для увеличения размера светящегося тела. Для обеспечения
настройки коллектор может быть выполнен подвижным и пере-
141
мещаться вдоль оптической оси. Вблизи коллектора расположена
полевая диафрагма микроскопа.
Конденсор — оптическая система, которая проецирует полевую
диафрагму коллектора в плоскость предмета, обеспечивая требуе-
мую числовую апертуру осветительного пучка, она предназначе-
на для увеличения количества света, поступающего в микроскоп.
В микроскопах проходящего света конденсор расположен между
объектом (предметным столиком) и источником света (коллек-
тор, зеркало). В микроскопах отраженного света роль конденсора
выполняет объектив.
В качестве источника света в осветительной системе использу-
ется естественный свет, а также искусственное освещение, созда-
ваемое лампами накаливания, галогенной, ртутной лампами.
С формой и размером нити лампы связаны габаритные размеры и
увеличение осветительной системы. Мощность, габаритные раз-
меры источника света влияют на параметры и габаритные разме-
ры блока питания лампы, и все это влияет на размеры и дизайн
самого микроскопа.
Для получения достаточно яркого и* равномерно освещенного
поля зрения микроскопа осветительная система и источник света
должны обеспечивать следующие электрические параметры: све-
товой поток в плоскости предмета и световой поток, попадающий
на сетчатку глаза или фотопленку; освещенность; максимальную
силу света; яркость изображения; спектральную составляющую (те
линии спектра, которые выделяет данный источник света). В оте-
чественных световых микроскопах для обеспечения этих парамет-
ров использовали лампу накаливания РН8-20-1, а в современных
микроскопах отечественного и зарубежного производства приме-
няют в основном галогеновые лампы, чаще всего фирмы «OSRAM»
(Германия), с напряжением 6 В, мощностью 20 или 30 Вт. В ис-
следовательских микроскопах применяют более мощные лампы —
напряжением 12 В и мощностью 50 или 100 Вт.
6.2. Приборы и оборудование для микроскопии
Световые микроскопы подразделяют на микроскопы плоского
поля, которые обеспечивают воспроизведение объекта в двухмер-
ном пространстве — двухмерное плоское изображение, и стерео-
скопические (объемное или трехмерное изображение объекта).
С помощью таких микроскопов можно рассматривать прозрачные
и полупрозрачные объекты.
Микроскопы проходящего света плоского поля называют в
отечественной литературе биологическими микроскопами. Они
позволяют рассматривать тонкие объекты исследования толщи-
ной от 10 до 0,1 мм, просматриваемый слой от 1,0 до 0,001 мм.
142
В этих микроскопах возможно наблюдение объемного изображе-
ния в пределах 100 — 200 мкм по высоте за счет особых способов
освещения (эффекты косого освещения, фазового контраста и др.).
В стереоскопических микроскопах объекты исследования име-
ют большие размеры — в среднем толщиной от 100 до 1 мм, про-
сматриваемый слой по высоте (глубине) — от 50 до 0,5 мм.
В этих микроскопах можно наблюдать и плоские объекты.
Микроскопы конструктивно могут быть выполнены в двух ва-
риантах.
Прямые микроскопы имеют классическую схему построения: и в
микроскопах плоского поля, и в стереоскопических наблюдатель-
ная часть (бинокулярная насадка с окулярами) расположена сверху
объекта.
Инвертированные микроскопы (перевернутое строение схемы
микроскопа) сконструированы таким образом, что наблюдатель-
ная часть микроскопа (бинокулярная насадка с окулярами) рас-
положена снизу объекта. В инвертированных микроскопах опти-
ческая система расположена ниже предметного столика, а источ-
ник света — выше. Это обеспечивает возможность свободных мик-
романипуляций с объектом наблюдения, что важно для работы с
культурами клеток.
В зависимости от способа освещения все микроскопы подраз-
деляют на три группы: проходящего, отраженного и падающего света.
В микроскопах первого типа свет проходит через объект. Эти мик-
роскопы позволяют наблюдать прозрачные и полупрозрачные пред-
меты. В микроскопах отраженного света свет сначала проходит че-
рез оптическую систему микроскопа, в том числе и объектив,
отражается от объекта и вновь проходит через оптическую систе-
му (объектив). В микроскопах падающего света свет падает на
объект, минуя оптическую систему (объектив), отражается от
объекта и проходит через оптическую систему микроскопа (объек-
тив). В основном микроскопы падающего света — это стереоско-
пические микроскопы.
В зависимости от различных принципов построения изображе-
ния выделяют микроскопы светлого поля — на светлом фоне на-
блюдается более темное изображение объекта. Микроскопы с ме-
тодом косого освещения позволяют наблюдать контрастное изоб-
ражение объекта с неровным по толщине контуром. При этом
обычный прямо проходящий свет перекрывается до того, как по-
падает на объект. Для наблюдения объектов, имеющих размеры
меньше, чем разрешающая сила микроскопа, применяют осве-
щение под таким углом, чтобы световые лучи от осветителя не
попадали в объектив. Наблюдаемые объекты становятся при этом
видимыми как светящиеся точки на темном поле или контур объек-
та имеет ярко блестящий вид — микроскопия в темном поле, или
ультрамикроскопия {микроскопы с методом темного поля).
143
Микроскопы с методом фазового контраста (фазово-контраст-
ная микроскопия) позволяют с максимальной степенью визуа-
лизации и детальности наблюдать на сером фоне более темное
«объемное» изображение объекта, окруженное по контуру свет-
лой полосой; известен негативный (темнопольный) фазовый кон-
траст, при котором наблюдается обратная картина. В этом виде
микроскопии использована разная скорость распространения света
в средах с разной плотностью, при этом значительно повышается
контрастность структур изучаемых объектов.
Люминесцентные микроскопы обеспечивают возможность наблю-
дения на темном фоне свечения объектов под воздействием света.
Одним из вариантов люминесцентного анализа в микроскопии
является флюоресцентная микроскопия, которая основана на свой-
стве некоторых объектов при облучении светом с короткой дли-
ной волны флюоресцировать на большей длине волны для выяв-
ления первичной — собственной — флюоресценции объекта,
а также вторичной флюоресценции, вызванной окрашиванием спе-
цифическими красящими веществами — флюорохромами.
В зависимости от характера свечения, присущего тому или иному
флюорохрому, в микроскопах для исследования люминесценции
или флюоресценции объектов применяют различные комбинации
светофильтров для выделения необходимой длины волны света
возбуждения и света излучения. По сравнению с обычными мето-
дами микроскопии люминесцентная микроскопия обладает ря-
дом преимуществ, обеспечивая цветное свечение, высокую сте-
пень контрастности светящихся объектов, возможность исследо-
вания как прозрачных, так и непрозрачных живых объектов, раз-
личных жизненных процессов в динамике развития, обнаруже-
ния, установления локализации отдельных микробов и вирусов.
С помощью люминесцентных микроскопов проводят феноти-
пический анализ клеток периферической крови, костного мозга
и тканей по наличию поверхностных антигенов с применением
моноклональных антител в диагностике первичных и вторичных
иммунодефицитов, лейкозов, а также оценку функциональной
активности фагоцитирующих клеток крови. В новой технологии
флюоресцентной микроскопии — FISH — препараты маркируют
для «многократной» флюоресценции, чтобы выявить различные
структуры объекта, которые светятся с разной длиной волны. В ре-
зультате обеспечивается возможность наблюдения двух или трех
маркировок в одном изображении.
Фирма ЛОМО (Санкт-Петербург) выпускает малогабаритный
люминесцентный осветитель ОИ-28, который можно устанавли-
вать в микроскопы проходящего света серий «БИОЛАМ Р.С.Д.» и
«МИКМЕД 1».
Наиболее известны в России модели прямой конструкции
«AXIOLAB AXIOSCOP».
144
Для работы и исследований в области биотехнологии, генной
инженерии, репродукционной медицины, в эпидемиологических
и вирусологических лабораториях используют инвертированные
люминесцентные рабочие микроскопы. Все большее распростра-
нение получают стереоскопические люминесцентные микроско-
пы. В России в эксплуатации находятся несколько моделей отече-
ственных специализированных микроскопов — ЛЮМАМ Р-8,
МЛД-2, ЕС ЛЮМАМ РПО-11, а также биологический микро-
скоп МБИ-15-2.
Отечественный микроскоп ЕС ЛЮМАМ РПО-11 отличают ма-
лые габариты, встроенная в основание вместе с коллектором и
блоком питания малогабаритная галогеновая лампа, спектраль-
ный диапазон света возбуждения флюоресценции 400 — 550 нм,
света флюоресценции 500 — 700 нм, объективы с увеличенными
числовыми апертурами и уменьшенной собственной люминес-
ценцией, в которых отсутствует хроматическая разность увели-
чения, его можно применять с фазово-контрастным устройством
КФ-4М и микрофотонасадкой МФН-11.
Поляризационные микроскопы обеспечивают наблюдение на се-
ром или темном фоне разноцветного, четкого или контрастного
изображения. Обычный прямо проходящий свет с помощью по-
лярофильтров поляризатора в осветительной системе и в проме-
жутке между объективом и окуляром анализатора превращается в
имеющий одно преимущественное направление линейно-поляри-
зованный свет.
Поляризационная микроскопия характеризуется высокой сте-
пенью контрастности изображения в поляризованных лучах; чет-
костью цветного изображения без дополнительного рассеянного
света, ухудшающего качество изображения; визуализацией объек-
тов, невидимых в обычном свете и обладающих свойством ани-
зотропии (двойного лучепреломления).
Анизотропные структуры становятся видимыми как ярко све-
тящиеся на темном фоне. Свойство анизотропности присуще струк-
турам с упорядоченным расположением молекул (кристаллам,
фибриллярным белкам). В медицинской практике поляризацион-
ные микроскопы применяют при анализе состава почечных и жел-
чных камней, желчи, различных гистологических срезов (напри-
мер, мышечных тканей при инфаркте миокарда, в фармаколо-
гии — при анализе лекарственных смесей).
Световые микроскопы объемного изображения объекта, или сте-
реомикроскопы, позволяют видеть объект одновременно под сво-
им углом зрения, как это имеет место при наблюдении невоору-
женным глазом. Основная задача стереомикроскопа — не изме-
нять физиологического восприятия объекта. Обязательным усло-
вием в конструкции этих микроскопов является наличие или двух
микроскопов, или двух оптических каналов, расположенных (на-
145
клоненных) под определенным углом друг к другу, как глаза че-
ловека. Визуальная насадка при этом всегда должна быть биноку-
лярной.
Лазерные микроскопы позволяют сканировать объект в трех из-
мерениях и с помощью компьютера, сопоставляя до 20 срезов в
разных позициях, формировать трехмерное изображение объек-
та, не давая, однако, точной цветопередачи. Эти микроскопы
предназначены для исследования объектов в биологии, медици-
не, материаловедении, криминалистике в трехмерном изображе-
нии на уровне разрешения, приближенного к электронной мик-
роскопии с помощью лазерной системы, состоящей из 3 — 4 лазе-
ров и комплексной системы светофильтров.
В электронных микроскопах роль линз выполняют электрические
и магнитные поля, обладающие вращательной симметрией. Пу-
чок электронов, движущихся в вакууме с постоянной скоростью,
при ускорении их электрическим полем создает волновой про-
цесс с определенной длиной волны. Проходя через изучаемый
объект, электроны не поглощаются им, а рассеиваются, поэто-
му, чем больше объект рассеивает электроны, тем более темным
он представляется на флюоресцирующем экране микроскопа.
Применение специфических цитохимических красителей,
в частности солей металлов, позволяет значительно расширить
исследовательские возможности электронной микроскопии при-
менительно к выявлению на субмикроскопическом уровне лока-
лизации отдельных веществ — ферментов, нуклеиновых кислот и
др. Современные просвечивающие электронные микроскопы об-
ладают компьютерным управлением, обеспечивающим мощную
систему обработки изображения. Они могут быть использованы
практически в любой области биологии, патологической анато-
мии, гистологии, материаловедении.
6.3. Преаналитический этап при микроскопическом
исследовании клеток
При использовании того или иного метода микроскопии ре-
зультаты в значительной степени зависят от соответствующей под-
готовки объекта исследования: мазка крови, цитологического или
гистологического препарата и др.
В процессе приготовления мазка крови на предметном стекле
важно равномерно распределить клетки тонким слоем по всей
поверхности стекла, без излишнего их повреждения с формиро-
ванием «щеточной каемки», необходимой длины и толщины, т.е.
получить монослойный мазок практически на всем его протяже-
нии. Техника приготовления мазков на предметном стекле тща-
тельно описана во многих руководствах и пособиях. Важно отме-
146
тить, что не следует сильно нажимать на предметное стекло при
использовании шлифованного стекла, которым будет сделан ма-
зок, чтобы не повредить исследуемые клетки.
Значительную помощь оказывает пластиковый шпатель для
растяжки мазков. Даже при большом потоке анализов применение
этого шпателя позволяет стандартизовать процесс приготовления
мазков, сберечь руки лаборанта и максимально соблюсти сани-
тарно-эпидемиологические нормы. Легкий пластмассовый инст-
румент позволяет лаборанту равномерно распределить кровь по
поверхности стекла и получить мазок высокого качества. Правый
и левый края шпателя закруглены и могут быть его рабочей час-
тью. Они имеют микропористую структуру, благодаря которой
кровь хорошо смачивает поверхность шпателя и удерживается в
процессе растяжки мазка. Даже в хорошо приготовленном мазке в
его начале наблюдается небольшое перекрывание слоев эритро-
цитов, но большая площадь отделенных друг от друга клеток име-
ется в области «хвоста» мазка.
Существует два типа автоматических устройств для приготов-
ления равномерных мазков крови. В их основе используется меха-
ническое распределение клеток или центрифугирование (центри-
фуга «Cytospin» фирмы «Shandon», Великобритания). Цитоцент-
рифуга концентрирует клетки на небольшой площади, и такие
мазки используют для изучения клеток в низких концентрациях,
например в спинномозговой жидкости.
В современных гематологических анализаторах есть устройство
автоматического приготовления мазков с последующей их фикса-
цией и окрашиванием, что еще больше сокращает время приго-
товления препаратов и обеспечивает стандартизацию и постоян-
ство характеристик окраски. Такие анализаторы требуют приме-
нения стандартных стекол размером (26х76х 1 мм).
Для изучения морфологии клеток в препаратах — мазках, со-
скобах, пунктатах, срезах тканей — обычно первоначально про-
водят их химическую фиксацию с помощью коагулирующих белок
веществ: тетраоксида осмия, хромовой кислоты, сулемы, уксус-
ной или пикриновой кислот. Для более быстрой фиксации можно
применять лиофилизацию — быстрое замораживание при темпе-
ратуре жидкого азота с последующим высушиванием в вакууме.
В практике для фиксации мазков-Отпечатков, соскобов используют
метанол и этанол, для фиксации срезов тканей — 10 % формалин
и лиофилизацию, для препаратов, исследуемых под электронным
микроскопом, — глутаровый альдегид (0,5 % и 0,2 % растворы).
В целях повышения контрастности клеточных структур приме-
няют их избирательное окрашивание, основанное на противопо-
ложности зарядов красителя и вещества структуры (например,
положительно заряженные структуры оксифильны, т.е. окраши-
ваются кислыми красителями).
147
Для некоторых автоматизированных систем анализа изображе-
ния разрабатывают специальные механизированные устройства,
обеспечивающие стандартизацию процесса приготовления моно-
слойных препаратов. Так, отечественная система автоматической
микроскопии мазков крови «АСПЕК» выпускается в комплекте с
устройством механизации и автоматизации подготовки пробы
крови. Оно представляет собой градуированную стеклянную плас-
тину, зашлифованную под определенным углом и закрепленную
в специальном держателе. Плавное перемещение пластины по пред-
метному стеклу в пазах держателя под углом 16° со скоростью
5 см/с обеспечивает стандартный клеточный монослой. Стандар-
тизации фиксации и окрашивания мазков (по методу Паппенгей-
ма — Крюкова) достигают путем одновременной обработки партии
препаратов по 20—100 шт. также в специально разработанном для
данной системы устройстве. Такая подготовка проб крови приво-
дит к тому, что все клетки в препарате лежат отдельно друг от
друга, сохраняя при этом геометрию, структуру, текстуру, опти-
ческую плотность, цвет, яркость и т.д.
Для фиксации и окраски мазков крови можно использовать
различные устройства. Приспособление ФОМК-2 (Украина) пред-
назначено для фиксации и окраски мазков крови на предметных
стеклах с минимальным расходом красителей для максимального
количества предметных стекол. В состав приспособления входят
узлы (модули) фиксации, окраски, промывки и сушки предмет-
ных стекол, а также съемные кассеты для размещения предмет-
ных стекол. Приспособление имеет световую сигнализацию и
обеспечивает установку продолжительности окрашивания мазков
(от 2 до 30 мин.). Все процедуры выполняют вручную. Одновре-
менно окрашивают 50 предметных стекол.
Устройство «Минилаб-301» (фирма АО «ЮНИМЕД») пред-
назначено для окраски гематологических мазков и цитологиче-
ских препаратов. Оно позволяет оптимальным образом организо-
вать рабочее место лаборанта для окраски мазков. В состав прибора
входят четыре независимо работающих таймера и сушильный кон-
тейнер, через который продувается горячий воздух. Комплект при-
надлежностей к устройству «Минилаб-301» включает четыре шта-
тива для предметных стекол (на 25 стекол каждый) и четыре кю-
веты для красителей, фиксаторов, отмывочных растворов, ком-
пактно расположенных на металлическом поддоне. Применение
этого устройства позволяет проводить одновременное окрашива-
ние до 100 мазков; параллельно окрашивать мазки по нескольким
методикам (до четырех); в несколько раз ускорить процесс высу-
шивания окрашенных мазков.
Для приготовления препарата для исследования осадка мочи и
других биологических жидкостей используют пластиковый слайд-
планшет производства фирмы «PLIVA-Lachema a.s» (Чехия). Он
148
имеет размер предметного стекла и содержит 10 камер для микро-
скопии, 10 нативных или суправитально окрашенных образцов
осадка мочи и других биологических жидкостей. Каждая камера
покрыта тонкой, идеально прозрачной пластиковой пластинкой,
играющей роль покровного стекла. Расстояние между поверхно-
стью слайд-планшета и этим «покровным стеклом» позволяет эле-
ментам клетки располагаться однослойно.
В каждой камере (рис. 6.2) слева расположены две серии окруж-
ностей по девять в каждой серии. Они видны в проходящем свете
и при малом увеличении микроскопа. При большом увеличении
(объектив 40х) одна окружность занимает все поле зрения. Каж-
дая окружность диаметром 0,376 мм, объем пространства, очер-
ченного одной окружностью, — 0,011 мкл, девятью окружностя-
ми (т.е. каждой серии) — около 0,1 мкл. Количество клеточных
элементов, подсчитанных в одной серии, соответствует количе-
ству клеточных элементов в 1 мкл жидкости.
Особенности приготовления препарата с использованием слайд-
планшета определяют и особенности микроскопирования. Под-
счет общего количества клеточных элементов в биологических
жидкостях с использованием одной или двух серий из девяти кру-
гов можно проводить при малом увеличении микроскопа (окуляр
10х, объектив 8х или 10х). Дифференциацию клеточных элемен-
тов (подсчет лейкоцитарной формулы, количества эритроцитов,
лимфоцитов, других элементов клетки, цилиндров) ориентиро-
вочно можно проводить, используя объектив 20хз окуляр 10х,
а более точную дифференциацию клеток выполняют при боль-
шом увеличении микроскопа, при объективе 40х и окуляре 10х.
Таким образом можно провести микроскопическое исследование
мочи по методу А.З. Нечипоренко, исследование цитоза в спин-
номозговой жидкости при окраске препарата реактивом Самсона.
В камере при патологии обычно содержится достаточное количе-
ство клеток, позволяющее сосчитать лейкоцитарную формулу лик-
Рис. 6.2. Схема деталей слайд-планшета:
а — вид отдельной камеры (слева две серии окружностей при увеличении
в 100 раз); б — отдельная окружность в разрезе
149
вора. Дифференциацию клеточных элементов необходимо прово-
дить при увеличении 400 х. В тех случаях, когда клеток мало и ре-
шается вопрос о нормальном или патологическом количестве эле-
ментов клетки в ликворе, необходимо провести подсчет в камере
Фукса—Розенталя. Поиск патологических клеточных элементов,
тканевых комплексов клеток, злокачественных новообразований,
клеток арахноэндотелия, кристаллов всегда ведут при малом уве-
личении микроскопа.
Преимущество применения слайд-планшетов заключается в
простоте приготовления препарата, сокращении затрат труда,
комфортности, удобстве в работе и стандартизации исследова-
ния, в первую очередь на преаналитическом этапе. При работе с
ним не используют предметные и покровные стекла, а следова-
тельно, исключены процедуры пришлифовывания для каждого
анализа покровного стекла к камере, что вызывает затруднения в
работе и отнимает время. Исследование осадка мочи в слайд-план-
шете позволяет одновременно определить количество клеточных
элементов в 1 мл мочи (число Нечипоренко) и получить пред-
ставление о количестве элементов клетки в поле зрения или пре-
парате, провести быстрое и достаточно точное определение уве-
личенного количества клеток в ликворе, а также в экссудатах,
транссудатах, синовиальной жидкости. Достаточно трудоемкие
процессы на пробоподготовительном этапе исследования клеток
могут быть автоматизированы.
6.4. Цитохимические методы при микроскопии
В основе цитохимических исследований лежит окрашивание
специально подобранными красителями, избирательно реагиру-
ющими с отдельными химическими компонентами структур клетки.
Так, белки выявляют путем обработки препарата реактивами,
специфически реагирующими с аминогруппами, сульфгидриль-
ными или дисульфидными группами, либо с отдельными амино-
кислотами. Для выявления ДНК можно использовать реакцию
Фельгена (слабый кислотный гидролиз, отщепление пуриновых
оснований, реакция альдегидных групп с фуксиносернистой кис-
лотой с развитием красно-фиолетовой окраски). РНК окрашива-
ют основными красителями (азур II, тионин). Окисление полиса-
харидов йодной кислотой вызывает образование альдегидных
групп, реагирующих с фуксиносернистой кислотой (реактив
Шиффа или PAS-реакция). Кислые мукополисахариды выявляют
с помощью метахромазии, т.е. окрашивания некоторыми основ-
ными красителями (например, толуидиновым синим) в цвет,
отличный от цвета самого красителя (в данном примере — крас-
но-фиолетовый). Липиды окрашиваются жирорастворимыми кра-
150
сителями (судан красный и черный), отдельные их классы —
с помощью специфических красителей.
Неорганические вещества (железо, калий, фосфаты, кальций
и др.) можно окрасить известными специфическими для этих
ионов реагентами. Ферменты выявляют путем обработки препара-
тов субстратами этих ферментов с образованием продуктов реак-
ции, имеющих окраску или поддающихся окрашиванию.
Дальнейшим развитием цито- и гистохимического направле-
ния явилось использование меченных различными метками анти-
тел, направленных против определенных клеточных структур и их
отдельных компонентов (иммуноцито- и гистохимия). Для этого
направления используют различные варианты методов специфи-
ческого связывания и разнообразные хромогены. Иммуногистохи-
мические методы позволяют локализовать и идентифицировать
клеточные и тканевые антигены, основываясь на их связывании с
антителами. Использование антител лежит в основе изучения раз-
личных образований: структурных компонентов клетки; клеточ-
ных продуктов (гормонов, ферментов, иммуноглобулинов); ре-
цепторов клеточной поверхности. Для визуализации места связы-
вания антигена с антителом применяют разные метки: флюорес-
центные красители; ферментные метки; металлы; металлопроте-
ины; радиоизотопы.
Первоначально визуализацию тканевых антигенов иммунофер-
ментными способами окраски проводили прямым методом с ис-
пользованием ферментов, непосредственно конъюгированных с
антителами известной антигенной специфичности. Этот метод
позволяет применять световой микроскоп, но обладает низкой
чувствительностью. Чувствительность иммуногистохимического
окрашивания была значительно повышена с использованием не-
прямого метода, в котором меченые ферментом антитела связы-
ваются с первыми антителами, соединенными с антигеном. Впо-
следствии появились и трехэтапные методы, такие как перокси-
дазно-антипероксидазный метод, метод с использованием ави-
дин-биотинового комплекса. Новое поколение ферментопосредо-
ванных методов окрашивания препаратов позволяет проводить эти
исследования с высокой специфичностью и чувствительностью
при наличии только светового микроскопа. Это делает доступны-
ми современные методы исследования даже для лабораторий, не
оснащенных специальным оборудованием.
Несмотря на бурное развитие иммунологии и цитогенетики,
простые цитохимические методы, не требующие сложной и доро-
гой аппаратуры, основанные на использовании достаточно про-
стого светового микроскопа, хорошо воспроизводимые, инфор-
мативные, востребованы во многих лабораториях. Они не утрати-
ли своего значения в диагностике различных форм гемобластозов.
Особенно оно велико в подтверждении острых миелоидных лей-
151
козов. В настоящее время некоторые производители выпускают
готовые наборы реактивов, позволяющие получать хорошо вос-
производимые и правильные результаты.
Цитохимические методы позволяют изучить содержание раз-
личных веществ и активность ферментов в клетках крови, костно-
го мозга, лимфатических узлов и других тканей. Применяя их в
гематологии в комплексе с морфологической оценкой клеточных
элементов, можно выявить направленность дифференцировки
кроветворных клеток. Основой идентификации этих клеток слу-
жат особенности их метаболизма. В большинстве случаев цитохи-
мическую реакцию оценивают качественно (слабая, умеренная,
интенсивная) с указанием процента положительно реагирующих
клеток. Существует и полуколичественный метод оценки резуль-
татов в условных единицах или с вычислением среднего цитохими-
ческого коэффициента (СЦК).
Методы специального окрашивания для выявления активности
миелопероксидазы по окислению хромогенов о-дианизидина и бен-
зидина, реакции на липиды (окрашивание с Суданом черным Б),
PAS-реакция на присутствие в клетках гликозаминогликанов (му-
кополисахаридов), реакции на неспецифическую эстеразу с ис-
пользованием а-нафтил ацетата и других субстратов с постановкой
реакции ингибирования активности эстеразы фторидом натрия
представляют собой стандартную панель цитохимических методов,
которой в большинстве случаев в онкогематологии бывает доста-
точно для выявления линейной принадлежности опухолевых кле-
ток, и, следовательно, для выявления варианта острого лейкоза и
бластных кризов при хроническом миелолейкозе.
В некоторых случаях, например при использовании цитохими-
ческой реакции на тартратрезистентную фракцию кислой фосфа-
тазы при волосатоклеточном лейкозе, можно определить принад-
лежность клеток к опухолевому клону. Реакции на щелочную фос-
фатазу с применением а-нафтилфосфата или фосфорных эфиров
более сложных нафтолов применяют для дифференцирования хро-
нического миелолейкоза от других миелопролиферативных за-
болеваний и реактивных состояний.
Повышение активности щелочной фосфатазы наблюдается при
истинной полицитемии и миелофиброзе, хроническом метакарио-
цитарном лейкозе, резкое снижение активности наблюдается при
хроническом миелолейкозе. Реакция с берлинской лазурью на
содержание в цитоплазме эритробластов и эритроцитов (т. е. сиде-
робластов и сидероцитов) негемоглобинового железа позволяет
выявить истощение запасов железа при железодефицитной ане-
мии или избыточное накопление железа при различных вариантах
гемохроматоза, талассемии.
Для определения количества веществ в клетках используют ци-
тоспектрофотометрию. Она основана на измерении поглощения
152
ими лучей света определенной длины волны. Результаты измерения
автоматически пересчитываются в количество вещества, поглоща-
ющего монохроматический свет определенной длины волны.
6.5. Анализаторы изображения
Современное развитие науки и техники предусматривает при-
менение новых методов обработки изображения и документиро-
вания с элементами сбора, систематизации и анализа информа-
ции. При необходимости современные микроскопы оснащают уст-
ройствами для фиксации изображений исследуемых объектов с
помощью фотографии или цифровой видеозаписи. Управление этим
процессом через компьютер позволяет получать наилучшие вари-
анты изображений.
Свое развитие анализаторы изображения получили с конца
1980-х гг. Базовым микроскопом может служить любой микро-
скоп с дополнительным выводом изображения в плоскость, со-
пряженную с фотопленкой и видиконом передающей камеры.
Среди отечественных микроскопов такими являются «БИОЛАМ Р»,
«МИКМЕД-2», «ЕС ЛЮМАМ РПО» с микрофотонасадкой
МФН-11, приспособленной работать с цифровой камерой вмес-
то фотоаппарата.
Компьютерные, или цифровые, микроскопы состоят из микро-
скопа с тринокуляром, средств ввода изображений (камера циф-
ровая либо цифровой фотоаппарат, плата ввода — так называе-
мый фрейм-граббер), компьютера и программного обеспечения.
Принципы работы компьютерных микроскопов заключаются в
следующем: 1) изображение поля зрения микроскопа при помо-
щи камеры и фрейм-граббера отображается на экране монитора;
2) по указаниям врача изображение, выведенное на экран, запо-
минается в памяти компьютера вместе с сопровождающей его тек-
стовой информацией; 3) вся информация, ранее занесенная в
память компьютера, может быть вызвана, передана по электрон-
ным сетям, отредактирована, распечатана; 4) при выполнении
количественных анализов изображения подвергают компьютерной
обработке, цель которой — выделить границы клеток и внутри-
клеточных структур. Данная процедура называется сегментацией
и может происходить как в автоматическом (для контрастных объек-
тов), так и в полуавтоматическом режиме (для слабоконтрастных
объектов); выделенные объекты автоматически измеряются с оп-
ределением более чем 30 различных геометрических, цветовых,
структурных, плотностных (текстурных) и других признаков; 5)
результаты измерений клеток популяции используются для коли-
чественного анализа изображений, классификации и диагности-
ки.
153
Цифровой микроскоп позволяет облегчить формирование за-
ключений на основе системы подсказок, вызвать на экран изоб-
ражения сходных объектов из атласа, передать изображения для
консультаций, напечатать их, измерить интересующие объекты,
воспользоваться советами компьютерных систем диагностики,
сохранить в памяти и напечатать результаты анализа. С его помо-
щью эффективно выполняются и трудоемкие количественные
анализы.
Врач может активно пользоваться опытом, заложенным в про-
граммном обеспечении цифрового микроскопа. В последние годы
цифровые микроскопы получили широкое распространение в
практике врачей, занимающихся морфологическим исследовани-
ем клеток. Цифровой микроскоп «не принимает» решений, ответ-
ственность за подбор исследуемых клеток и условия их наблюде-
ния остается за врачом, от которого при применении цифрового
микроскопа требуется такая же высокая квалификация, как и при
ручной микроскопии.
Гл а в a 7
ТЕХНОЛОГИИ И СРЕДСТВА АНАЛИЗА
ПО МЕСТУ ЛЕЧЕНИЯ
7.1. Общие принципы методик
Анализ по месту лечения (АМЛ) — обнаружение или опреде-
ление аналита при проведении исследования непосредственно
около пациента внутри или вне медицинского учреждения или
лаборатории. Чаще всего это — экстренный, обязательно быстрый
экспресс-анализ, который выполняется непосредственно вблизи
пациента либо медицинским персоналом (для некоторых тестов
анализ может быть выполнен только медицинским персоналом, и
это указано в инструкции к таким тестам), либо самим обследуе-
мым, его родственниками и т.д.
Развитие метода стало возможным на основе разработки и про-
изводства: промышленно изготовляемых «сухих» готовых форм
реактивов для микроанализа; миниатюрных приборов для считы-
вания и количественной оценки результатов анализа, выполненно-
го с помощью этих реактивов.
Сочетание в одном аналитическом элементе необходимых ре-
активов для проведения реакции обнаружения или определения
исследуемого компонента с возможностью детекции результата
вплоть до создания аналитических систем служит особенностью
этих технологий.
Понятие «сухие тесты» — условно, поскольку эти реакции про-
текают в жидкой среде после нанесения на тестовую зону полос-
ки или на иммунохроматографическую тест-кассету образца био-
жидкости и растворения ею сухих реактивов, иммобилизованных
на носителе аналитического элемента.
Преимущества технологий и распространения «сухих» тестов
обусловлены следующими причинами:
максимальной приближенностью выполнения анализа к обсле-
дуемому пациенту;
возможностью квалифицированного выполнения анализа пер-
соналом, не имеющим профессиональной лабораторной подго-
товки и во многих случаях без использования специального лабо-
раторного оборудования;
малым объемом биожидкости, требуемой для анализа;
быстротой и простотой выполнения анализа (секунды, минуты);
сокращением преаналитических этапов до минимума, возмож-
ностью использования капиллярной крови для анализа;
155
достаточной аналитической надежностью тестов, высокой спе-
цифичностью;
возможностью обнаружения, полуколичественного и количе-
ственного определения компонентов;
длительной стабильностью реактивов, иммобилизованных на
носителях для «сухих тестов» (до нескольких лет при правильном
хранении и использовании);
стандартизацией этих методов, получившей развитие в после-
дние годы;
наличием систем внутри- и межлабораторного контроля каче-
ства, обеспечивающих надежное выполнение методов;
разработкой минитюризованных («карманных») приборов для
этих тестов;
экономией лабораторного оборудования, посуды, помещений;
экономией затрат труда персонала лабораторий.
Недостатки этих систем заключаются в довольно высокой сто-
имости анализов; «закрытости» систем, т.е. зависимости выбора
метода от производителя; в возможности влияния лекарств и дру-
гих веществ.
Варианты технологий анализа по месту лечения различают:
по виду и форме носителя, на котором закреплены реактивы
(бумага, гель, нитроцеллюлоза, различные пористые материалы);
способу компановки реагентов для аналитической процедуры
(диагностические полоски, многослойные слайды, иммунохро-
матографические тест-кассеты, специальные устройства — карт-
риджи в виде камер со структурой каналов, колонки);
по виду биоматериала, для исследования которого они пред-
назначены (цельная кровь, сыворотка, плазма, моча, кал, слю-
на, спинномозговая жидкость, пот и др.);
по способу оценки результата анализа (визуальный, с помо-
щью приборов — отражательных фотометров, флюорометров, ам-
перметров, приборов для распознавания образцов). В «сухих тес-
тах» объединено использование высоких химических, физических
и электронных технологий.
Наиболее ранними направлениями в развитии технологий ана-
лиза по месту лечения являются системы «сухой химии», появив-
шиеся в конце XIX в. в виде индикаторных лакмусовых бумажных
полосок для определения pH растворов и в виде сложных комп-
лексов реактивов, закрепленных на твердофазных носителях, го-
товых для специфической реакции с исследуемым аналитом био-
жидкости.
Первая реагентная полоска «Глюкотест» для обнаружения глю-
козы в моче была создана более 100 лет назад фирмой «Boehringer
Mannheim» в Германии.
Структура аналитического компонента системы «сухой химии»
состоит из трех основных частей: реактивной, отражательной и
156
подложки. В качестве носителя реактивов (подложки) на диагно-
стических полосках используют импрегнированные волокна чис-
той а-целлюлозы. Бумажные матрицы полоски имеют стандарт-
ную плотность волокон и определенную толщину. Реактивы аб-
сорбируют на носителе путем погружения в соответствующие рас-
творы с последующим высушиванием.
7.2. Применение диагностических полосок
для общеклинического анализа мочи
Техника анализа. Эти полоски используют для массового «си-
тевого» (от слова «просеивание», т. е. пропускание через скринин-
говое «сито») исследования большого числа образцов мочи. На
рис. 7.1 изображены схема диагностической полоски «СошЬиг 10
Test» и устройство одной из зон — для обнаружения крови (ге-
моглобина) в моче.
Если на полоске объединены несколько реакционных зон, со-
держащих реагенты для анализа различных аналитов, их наклеи-
вают на общую полимерную подложку. Бумажная подложка, со-
держащая абсорбент, предотвращает интерференцию и удаляет
избыток мочи. Чувствительная реакционная зона защищена от
контакта, загрязнений и царапин специальной нейлоновой сет-
кой, которая также обеспечивает быстрое и однородное проник-
новение мочи и равномерное развитие окраски реакционной зоны,
что существенно повышает аналитическую надежность полоски.
Рис. 7.1. Схема устройства диагностической тест-полоски для исследова-
ния мочи «Combur 10 Test» (а) и тестовое поле для обнаружения гемо-
глобина (б) в разрезе:
1 — нейлоновая сетка; 2 — сетчатый слой, содержащий йод; 3 — бумага с реаген-
том; 4 — абсорбирующая бумага; 5 — подложка
157
В целях предотвращения влияния интерференции содержащей-
ся в моче аскорбиновой кислоты в полоске, например «СотЬш
10 Test» верхний слой зоны для определения гемоглобина имп-
регнируется йодатом, который окисляет аскорбиновую кислоту.
Чтобы избежать воздействия влаги на реагенты тест-полосок, кон-
тейнеры для их хранения оснащают осушителем, который распо-
лагают в крышке контейнера или пенала.
Некоторые аналиты мочи при отсутствии патологии имеют
значения, близкие к нулю. Для них важной характеристикой явля-
ется порог обнаружения (чувствительность метода). В основе мето-
дов «сухой химии» для анализа мочи лежат цветные реакции, при-
водящие к изменению окраски тестовой зоны полоски. В зависи-
мости от химических свойств определяемого аналита используют
как обычные химические реакции, так и ферментативные (на-
пример, глюкозооксидазная реакция для анализа глюкозы в моче,
или количества лейкоцитов в моче на основе исследования актив-
ности их собственной эстеразы).
Результат с диагностической полоски может считываться ви-
зуально, изменение окраски тестовой зоны сопоставляется с цвет-
ной шкалой, обычно нанесенной на пенал, в котором хранятся
полоски. При этом важно, чтобы диагностически значимые изме-
нения показателя мочи вызывали визуально заметные изменения
окраски. Для объективизации измерения изменения окраски по-
лоски используют отражательные фотометры — анализаторы мочи.
Анализ может быть автоматизирован.
Полоски для исследования одного аналита называются мо-
нотестами, или монофункциональными (например, полоски
«УРИБЕЛ» отечественного предприятия «Биосенсор АН» или
«альбуФАН» фирмы «PLIVA-Lachema a.s.», Чехия) предназначе-
ны для исследования альбумина в моче, «глюкоФАН» — глюко-
зы. Полоски для одновременного анализа нескольких аналитов
называются политестами, или полифункциональными. Различа-
ют специальные полоски целевого назначения для выявления
определенного вида функциональных нарушений или заболева-
ний, например «КЕТОГЛКЖ-1», «диаФАН» — полоски с двумя
тестовыми зонами для исследования кетонов и глюкозы, для
выявления сахарного диабета, «иктоФАН» — с тестовыми зо-
нами на билирубин и уробилиноген для выявления гепатитов и
других заболеваний печени и желчных путей, заболеваний крови;
«нефроФАН» — для исследования мочи на эритроциты, белок,
нитритобразующие бактерии и pH для диагностики заболеваний
почек.
Концентрация реактивов в тестовых зонах подобрана таким
образом, чтобы как можно быстрее получить результат, в течение
40 — 60 с. Лишь при анализе лейкоцитов время реакции на некото-
рых тест-полосках удлиняется до 120 с. Отечественное предприя-
158
тие «Биосенсор АН» выпускает тест-полоски для обнаружения в
моче одного или двух аналитов. Политесты поставляют различные
зарубежные фирмы. Максимальное количество тестовых зон на
одной полоске —11.
Химические принципы, лежащие в основе реакций на полос-
ках различных изготовителей для одного и того же аналита близ-
ки, хотя существуют отличия в составе реактивов, что влияет и
на различие окраски тестовой зоны, чувствительность и подвер-
женность ее воздействию различных факторов, что, как правило,
подробно описано в инструкциях к тест-полоскам.
Определение глюкозы. Для обнаружения глюкозы используют
ферментативный, высокоспецифичный для D-глюкозы глюкозо-
оксидазный метод. Образующийся в ходе гидролиза глюкозы пер-
оксид водорода в реакции, катализируемой пероксидазой, уча-
ствует в окислении индикатора — хромогена. Им может быть в
зависимости от изготовителя о-толидин, йодат натрия, тетраме-
тилбензидин, 4-аминофеназон и др. Соответственно и окраска
тестовой зоны изменяется от зеленой до синей и коричневой или
может приобретать различные оттенки пурпурного цвета, что ука-
зано на шкале упаковки полосок. Чувствительность этих тестов
также различна, минимальная обнаруживаемая концентрация —
от 0,495 ммоль/л, как в полосках «Phan», до 4 — 7 ммоль/л —
в полосках «Multistix». Диапазон обнаружения глюкозы в моче очень
широк: до 55 — 111 ммоль/л.
Обнаружение белка. Все известные тесты обнаружения белка
основаны на принципе, получившем название «белковой ошиб-
ки», или «белковой обманки индикатора», когда в присутствии
кислотно-основного индикатора (как правило, тетрабромфено-
лового синего одного или в сочетании с тетрабромфенолфталеи-
ном) окраска индикатора в зависимости от содержания белка в
моче меняется от желтого до зеленого и синего цвета. Тест высо-
кочувствителен к альбумину и реагирует на его присутствие в моче
в концентрации 0,1—0,15 г/л. В большинстве тестов диапазон об-
наружения — до 10 г/л.
Определение билирубина. Метод обнаружения билирубина ос-
нован на реакции прямореагирующего конъюгированного били-
рубина с диазотированными фенольными соединениями (триа-
зеном, диазотированным 2,4-дихлоранилином, диазотированным
2-метил-5-нитроанилином и др.) с образованием продуктов, ок-
рашенных в различные оттенки розового цвета. Реакция высоко-
специфична для конъюгированного билирубина. В зависимости от
теста чувствительность — от 4,3 до 8,5 мкмоль/л, диапазон обна-
ружения до 50— 100 мкмоль/л.
Определение уробилиногена. Для определения уробилиногена су-
ществуют две группы тестов: тест-полоски, в основе действия
которых лежат реакции с солями диазония в кислой среде с обра-
159
зованием продуктов, окрашенных в различные оттенки от розо-
вого до красного цвета; другой тип — реакция Эрлиха с р-диме-
тиламинобензальдегидом с образованием окрашенных в красный
цвет соединений. Реакция с солями диазония более специфична в
отношении уробилиногена, чем реакция Эрлиха. Чувствительность
у разных тестов колеблется от 6,0 до 35,0 мкмоль/л, диапазон
обнаружения — до 200 мкмоль/л.
Определение эритроцитов. Благодаря пероксидазной активно-
сти гемоглобин и миоглобин катализируют окисление индикато-
ра (о-толидина, тетраметилбензидина) органической гидропере-
кисью — кумен гидроксипероксидом. Гомогенная (от зеленой до
синей) окраска характерна для гемоглобина (гемолизированные
эритроциты); негемолизированные эритроциты обнаруживаются
в виде сине-зеленых точек. Тест специфичен для гемоглобина и
миоглобина. Чувствительность — 5 — 20 эритроцитов на 1 мкл,
0,15 — 0,3 мг/л гемоглобина. Тестовые зоны, как правило, более
чувствительны к гемоглобину, чем к цельным эритроцитам. Диа-
пазон обнаружения — до 250 эритроцитов на 1 мкл или до 10 мг/л
гемоглобина.
Определение нитритов. Тесты на нитриты основаны на реакции
Гризза: нитриты, образующиеся в результате деятельности нит-
ратредуцирующих бактерий {Klebsiella, E.coli, Proteus, Aerobacter
и др.) под действием нитратредуктазы, взаимодействуют с суль-
фаниламидом (например, лара-арсаниловой кислотой), иммоби-
лизованным в тестовой зоне, с образованием соли диазония.
В последующей реакции азосочетания этого диазосоединения с
N-1-нафтилэтилендиаминдигидрохлоридом или тетрагидробензо-
хинолином образуется соединение — азокраситель, окрашивающее
желтую тестовую зону в различные оттенки от розового до крас-
ного цвета. Тест не является показателем бактериурии, вызванной
другими микроорганизмами.
Нижний предел обнаружения количества образующихся нит-
ритов соответствует 0,5— 1,0 мг/л нитратов, или количеству мик-
робов 100 000 на 1 мл мочи. Обычное количество — 10 000 бакте-
рий на 1 мл мочи — не вызывает изменения окраски тестовой
зоны. Появление гомогенной розовой окраски любой интенсив-
ности свидетельствует о бактериурии, вызванной нитратредуци-
рующими бактериями.
Выразить результаты полуколичественно не представляется
возможным, поскольку концентрация образующихся нитритов не
отражает степень инфицирования мочеполового тракта. Отрица-
тельный результат не свидетельствует об отсутствии бактериурии.
В некоторых тестах, например полосках «CYBOW», цветовая шка-
ла рассчитана до верхнего предела 30,0 мг/л нитратов.
Определение PH мочи. Для оценки pH мочи используют сме-
шанный кислотно-основной индикатор (метиловый красный,
160
иногда крезоловый красный или фенолфталеин в сочетании с
бромтимоловым синим). Он изменяет цвет в переходном диапазо-
не от желтого (pH 5,0) до бирюзового (pH 9,0). Нижний предел
оценки 0,5 —1,0 ед. pH.
Определение относительной плотности. Тестовая зона полоски
для оценки относительной плотности мочи содержит детергент и
индикатор бромтимоловый синий, реагирующий на присутствие
ионов и, следовательно, осмоляльность мочи. В присутствии катио-
нов протоны освобождаются агентом, образующим комплексы с
ними, и окраска индикатора бромтимолового синего меняется от
голубого через зелено-голубой до желтого. В некоторых полосках
индикаторная зона пропитывается еще и окрашенным в красный
цвет красителем, в конечном итоге в этих случаях тестовая зона
окрашивается в зависимости от концентрации электролитов в моче
в темно-синий, пурпурный и красно-коричневый цвет. Чувстви-
тельность — 0,005 ед., диапазон обнаружения — от 1,000 до 1,030.
Определение лейкоцитов. Принцип обнаружения лейкоцитов ос-
нован на способности эстеразы лейкоцитов, локализующейся в
цитоплазме, в основном в лизосомах сегментоядерных нейтрофи-
лов, расщеплять эфир индоксила, иммобилизованный в тестовой
зоне. Свободный индоксил взаимодействует с диазониевой солью
с образованием соединения, окрашенного в различные оттенки
фиолетового цвета. Метод специфичен для нейтрофилов и в зави-
симости от теста позволяет обнаруживать от 10 до 25 лейкоцитов
на 1 мкл мочи. Пределы обнаружения — от отрицательной реак-
ции приблизительно до 500 лейкоцитов на 1 мкл.
Определение аскорбиновой кислоты. Некоторые диагностические
полоски имеют тестовые зоны, позволяющие обнаруживать ас-
корбиновую кислоту (например, полоски «ФАН», «Урискан»),
Реакция основана на использовании аскорбиновой кислоты как
восстановителя, например, при обесцвечивании реактива Тилль-
манна: в присутствии аскорбиновой кислоты иммобилизованный
в тестовой зоне 2,6-дихлорфенолиндофенол восстанавливается,
и окраска зоны изменяется от серо-голубой до оранжевой (полос-
ки «Лабстрип У»). В полосках «ФАН» аскорбиновая кислота вос-
станавливает фосфорную кислоту и образуется молибденовый си-
ний. Чувствительность — 0,18 — 0,3 ммоль/л, диапазон обнаруже-
ния — до 3,4 ммоль/л.
Выполнение анализа и оценка результатов исследования. Визу-
альная оценка результатов по цветным шкалам, нанесенным на
контейнеры для хранения полосок, а также при полуколичествен-
ном определении на отражательных фотометрах может быть вы-
ражена как в единицах концентрации, так и в виде градации
результатов: отрицательные — «-», сомнительные — «±», поло-
жительные — «+», «++», «+++», а для некоторых компонентов
(белок, глюкоза, относительная плотность, уробилиноген) —
6 Меньшиков
161
«++++». Учитывая, что некоторые полоски могут быть использо-
ваны не только для визуальной оценки, но и для полуколиче-
ственного определения указанных компонентов на отражатель-
ных фотометрах для мочи, в них предусмотрены так называемые
компенсационные зоны. Последние не импрегнированы реакти-
вами и представляют собой своего рода «холостые пробы», по-
становка которых необходима для приборной компенсации на-
тивного окрашивания мочи при обнаружении некоторых компо-
нентов.
При практическом выполнении тестов на диагностических по-
лосках для мочи следует внимательно изучить инструкцию и про-
водить анализ в соответствии с правилами, изложенными в ней.
1. Для исследования используют свежесобранную мочу, хра-
нившуюся до анализа не более двух часов.
2. Мочу тщательно перемешивают, не центрифугируют.
3. Далее нужно изъять из пенала, не прикасаясь руками к тесто-
вым зонам, необходимое для анализа количество полосок. Пенал
следует быстро закрыть крышкой.
4. Держа полоску за конец, свободный от тестовых зон, плавно
погрузить полоску в пробирку или другой сосуд с мочой, не делая
резких и перемешивающих движений, что может приводить к
вымыванию реагентов из тестовых зон. Включить секундомер.
5. Спустя 1 —2 с (время указано в инструкции) полоску извле-
кают из мочи, ребром полоски касаясь сосуда, в котором она
находится, удаляют избыток мочи. Этой операции следует уделять
особое внимание. Лишнее количество мочи в виде капли на тесто-
вой зоне может привести к завышенным результатам. Присутствие
мочи в промежутках между зонами вызывает смешивание реаген-
тов соседних зон, что вызывает нарушение протекания реакций и
ошибочные результаты.
6. После удаления избытка мочи полоску следует держать гори-
зонтально для исключения перекрестного загрязнения реактива-
ми из прилегающих зон.
7. Спустя 30 —60 с (60— 120 с — для лейкоцитов) после погру-
жения полоски в мочу сравнить окраску тестовых зон с окраской
соответствующих зон цветной шкалы на пенале и зарегистриро-
вать результат.
При работе на отражательном фотометре (рис. 7.2) диагности-
ческую полоску после удаления избытка мочи помещают в специ-
альный держатель (например, в анализаторах мочи «Urilux»,
«Clinitek 20, 50», «Pocket Chem UA», «Aution Mini») или уклады-
вают на транспортер (в анализаторах «Miditron», «LabUReader»),
или на место считывания результата («Rapimat II»). В некоторых
анализаторах («Miditron») нет необходимости в удалении избытка
мочи, это происходит в процессе движения полоски на транспор-
тере к фотометру, в котором идет детекция результата. В анализа-
162
Рис. 7.2. Этапы исследования мочи с помощью диагностической полоски
на приборе «Pocket Chem UA»:
а — погружение диагностической полоски в образец мочи; б — помещение диаг-
ностической полоски, смоченной мочой, в прибор; в — отпечатанный на прин-
тере результат анализа
торе мочи «Aution Mini» существует специальная функция удале-
ния избытка мочи.
После помещения полоски в анализатор происходит измере-
ние (метод отражательной фотометрии) и распечатывание резуль-
тата. Патологические результаты отмечаются особыми пометка-
ми, «флагами» (звездочкой, латинской буквой «Н» — от англ, high
и др.). При обнаружении хотя бы одного патологического резуль-
тата повторяют исследование всех компонентов общеклиническо-
го анализа мочи химическими методами (например, обязательно
проводят количественное определение белка в моче с сульфоса-
лициловой кислотой или другим химическим методом, определе-
ние глюкозы гексокиназным или глюкозооксидазным методом на
анализаторе глюкозы), а также исследование осадка мочи.
В случае приема аскорбиновой кислоты при работе на анализа-
торах с полосками, на которых есть тестовая зона для ее обнару-
жения, появляются «флаги» у результатов обнаружения билиру-
бина, общего белка, глюкозы. Эти результаты не могут быть выда-
ны клиницисту, поскольку могут быть ошибочными вследствие
влияния аскорбиновой кислоты. Надо отменить лекарства, содер-
жащие аскорбиновую кислоту, по меньшей мере, на 3 дня, и
повторить анализ.
В некоторых анализаторах оператору не приходится извлекать
каждую полоску после измерения. В них после анализа диагности-
ческие полоски заворачиваются автоматически в рулон фильтро-
вальной бумаги, который затем выбрасывается.
Для обработки и документирования результатов анализа тестов
«сухой химии» и иммунохроматографических тестов российская
фирма «Синтеко-Комплекс» разработала анализатор рефлектомет-
рический компьютерный видеоцифровой «Видиком». С его помо-
163
Зона 1 Зона 2
Интенсивность
Пороговое значение
Концентрация
Оценка теста
Подпись врача
Рис. 7.3. Представление результатов исследования на видеоцифровом ком-
плексе «Видиком»:
а — диагностическая тест-кассета с выявившимися тестовой и контрольной зо-
нами; б — денситограмма; в — количественные результаты исследования и их
оценка
щью и с компьютерными программами «Видеотест», «Алкодиаг-
ностика» и «Уродиагностика» результаты анализов, проведенных
на этих тестах, подвергаются цифровой обработке, выдаются в
виде документа — бланка-ответа (рис. 7.3), полученные данные
могут быть сохранены на магнитном или бумажном носителях
информации. Анализатор адаптирован под широкий спектр «су-
хих» тестов и, кроме того, не нуждается в питании от электриче-
ской сети, к ответу прилагается изображение полоски (или тест-
кассеты) после проведения анализа, денситограмма, оценка кон-
трольных и тестовых зон и результата в целом.
Отражательные фотометры для анализа мочи на полосках за-
нимают очень мало места в помещении, а анализатор «Pocket Chem
UA», работающий на батареях, — массой всего 300 г, размером с
ладонь — может помещаться в кармане. Помимо анализаторов для
анализа мочи на диагностических полосках, работающих на осно-
ве отражательной фотометрии, известны анализаторы, в которых
считывание результатов происходит с помощью цифровой фото-
камеры («Laura») или видеокамеры и компьютерного анализа изоб-
ражений.
7.3. Технологии «сухих тестов» для исследований крови
и других биологических жидкостей
Особенности биохимического анализа крови. Ранее всего были
разработаны методы «сухой химии» для определения глюкозы в
крови. В настоящее время исследование как глюкозы, так и раз-
личных других аналитов в крови может быть выполнено на диаг-
ностических полосках, многослойных пластиковых элементах —
164
слайдах, биосенсорах, с помощью специальных картриджей, со-
держащих сухие реактивы.
Принцип метода исследования глюкозы с помощью диагно-
стических полосок и слайдов практически совпадает с методом,
используемым для определения глюкозы в моче — это специфи-
ческий глюкозооксидазный —пероксидазный метод с окислени-
ем хромогена — индикатора (о-толидина, тетраметилбензидина)
и образованием окрашенного соединения, изменяющего окраску
тестовой зоны.
Для оценки концентрации глюкозы в исследуемом образце
окраску тестовой зоны визуально сравнивают с окраской зон цвет-
ной шкалы, нанесенной на пенал для хранения полосок, либо
полоску или слайд помещают в отражательный фотометр для из-
мерения результата. Изменение окраски пропорционально кон-
центрации глюкозы. Структура и состав элементов диагностиче-
ской полоски для исследования глюкозы, как и других аналитов
в крови, отличается от таковых в диагностических полосках для
мочи, поскольку различаются состав и вязкость этих биожид-
костей.
Отличаются соответственно виды и состав контрольных и ка-
либровочных материалов. При использовании глюкометров после
нанесения капли капиллярной (или венозной) крови врач, лабо-
рант или сам пациент, строго соблюдая время, указанное в инст-
рукции, не удаляя каплю крови, помещает полоску в прибор.
Характеристика диагностических систем. Примеров диагности-
ческих полосок отечественного и зарубежного изготовления для
определения глюкозы в крови очень много: полоски «ДИАГЛЮК»
производства ООО «Биосенсор АН», «Глюкофотохром-БП-М» для
глюкометра, изготовленного ЗАО «Биоприбор», «Асси-Chek» для
анализатора «Асси-Chek», «Accutrend Glucose» для глюкометра
«Accutrend GCT», полоски «Betachek» для одноименного глюко-
метра,», «One-Touch» для глюкометра «One-Touch II» и др.
Следует обратить внимание на особую технологию полосок
«Betachek». Каждая полоска содержит две тестовые зоны на глю-
козу, расположенные на полоске параллельно. В связи с иммо-
билизацией в них различных редокс-индикаторов зоны окрашива-
ются в различные цвета: одна в разные оттенки розового, другая —
синего. Технология этих полосок позволяет лучше воспринимать
оттенки цвета людям со сниженным цветоощущением, что очень
важно для самоконтроля уровня гликемии больными диабетом,
у которых часто наступают нарушения зрения. На современных
диагностических полосках результат определения глюкозы в цель-
ной крови можно получить очень быстро: в зависимости от полос-
ки и прибора от 12 с до 1 мин.
Одной из первых аналитических систем для определения не-
скольких аналитов в цельной крови, сыворотке или плазме по-
165
явилась система «Reflotron» на основе диагностических полосок
«Reflotest». С помощью такой системы можно определять до 16
компонентов. Каждая из полосок «Reflotest» является монотестом:
она предназначена для анализа одного отдельного аналита. Визу-
альное считывание результатов при их применении невозможно.
Они служат лишь для измерения на приборе «Reflotron».
Схема устройства полоски представлена на рис. 7.4. Сверху каж-
дая из них плотно закрыта фольгой, удаляемой перед выполнени-
ем исследования. Все реактивы для проведения реакции иммоби-
лизованы на пластиковой подложке белого цвета, хорошо отра-
жающей свет. На нижней стороне подложки к полоске прикреп-
лена магнитная лента, несущая всю необходимую информацию о
тесте, для которого она предназначена: тип теста; продолжитель-
ность инкубации и фазы реакции; длина волны измерения; коли-
чество измерений, которые необходимо выполнить и временные
интервалы между ними; способ расчета результатов после измере-
ния отраженного света; факторы перерасчета результатов из еди-
ниц СИ в обычные единицы. Используя эти данные, микропро-
Рис. 7.4. Схема устройства диагностической тест-полоски для исследова-
ния крови «Reflotest»:
а — нанесение крови на тестовую зону полоски; б — эритроциты отделяются от
плазмы крови, плазма вытекает вниз в резервуар для плазмы; в — вид полоски в
камере отражательного фотометра, слои с реактивами погружены в резервуар
для плазмы; г — развитие окраски в индикаторной зоне полоски и измерение
отраженного света; 1 — проба крови; 2 — защитное покрытие; 3 — материал для
отделения плазмы от клеток крови; 4 — дополнительный реагент; 5 — магнит-
ный код; 6 — транспортный слой для плазмы крови; 7 — подложка; 8 — слой
с реагентом 1; 9 — слой с реагентом 2; 10 — прозрачная пленка
166
цессор, встроенный в отражательный фотометр «Reflotron», авто-
матически контролирует работу прибора в процессе анализа. С обоих
концов полоска имеет по одному отверстию, что позволяет поме-
щать ее на штифты в кюветной камере прибора в точно опреде-
ленное положение, что обеспечивает правильное положение тес-
товой зоны, с которой считывается результат, под детекторами
фотометра, а магнитной ленты — над сенсором, который считы-
вает ее код.
После снятия фольги можно заметить, что элементы полоски,
иммобилизованные на подложке, разделены на две части. В пра-
вой части находится выступ — зона для нанесения биожидкости,
покрытая сеткой из стекловолокна. Окраска этой зоны различна в
зависимости от биожидкости, которую можно использовать для
определения данного аналита на этой полоске, и сразу правильно
ориентирует оператора.
В том случае, когда полоска может быть использована только
для работы с сывороткой или только с плазмой, зона для нанесе-
ния биожидкости окрашена в желтый цвет. Из 16 аналитов таких
только две — для калия и холестерина липопротеидов высокой
плотности (ЛПВП). В полосках для остальных 14 аналитов эта зона
окрашена в красный цвет, и это означает, что кроме сыворотки и
плазмы первичной биожидкостью, которую наносят на эту зону,
может быть цельная капиллярная или венозная кровь. Однако ус-
тройство полоски таково, что определение компонента при ис-
пользовании цельной крови (за исключением гемоглобина) про-
исходит в плазме, и это не следует забывать при интерпретации
результатов. Зона для введения биожидкости многослойна. Нане-
сенная на нее сетка служит для удаления эритроцитов, других
форменных элементов и частиц крови.
Поступающая в нижние слои плазма либо просто перетекает в
находящийся между правой и левой частями полоски отдел —
резервуар для плазмы, либо до попадания в резервуар для плазмы
приходит в соприкосновение с иммобилизованными внутри сло-
ев зоны для нанесения биожидкости реактивами, способству-
ющими удалению веществ, которые могут помешать определе-
нию искомого аналита. Так, в полоске для определения холесте-
рина липопротеидов высокой плотности внутри зоны для нанесе-
ния биожидкости иммобилизованы декстран и сульфат магния,
которые осаждают хиломикроны — триглицериды и липопротеи-
ды низкой и очень низкой плотности. В резервуар для плазмы по-
ступает плазма только с липопротеидами высокой плотности.
В полоске для определения активности панкреатической амилазы
в этой зоне иммобилизованы два вида различных моноклональ-
ных антител для удаления из плазмы слюнного изофермента ами-
лазы. В результате плазма поступает в резервуар только с панкреа-
тическим изоферментом амилазы.
167
В полоске для определения гемоглобина внутри зоны для нане-
сения крови иммобилизованы реактивы для выполнения геми-
глобинцианидного метода, а для определения креатинина в эту
зону нанесена креатинамидогидролаза, избавляющая вытекающую
в резервуар плазму от присутствующего в ней креатина. Левая часть
полоски (индикаторная зона) для всех тестов кроме гемоглобина
представлена несколькими лепестками носителей реактивов, при-
крытыми прозрачной пленкой. После того, как полоска с нане-
сенной на нее биожидкостью — кровью, сывороткой или плаз-
мой — в объеме 32 мкл не позднее, чем спустя 15 с после нанесе-
ния, помещается в кюветную камеру рефлектометра, крышка
фотометра закрывается и придавливает эти лепестки с иммоби-
лизованными в них реактивами, погружая их в резервуар для плаз-
мы. Реактивы растворяются и запускается реакция.
В случае гемоглобина вытекающий после нанесения крови ци-
анметгемоглобин попадает в разделенные друг от друга фольгой
наподобие сот микрокюветы, отражающийся от них свет измеря-
ется при длине волны 567 нм. В других методах измеряется свет,
отражающийся от индикаторного лепестка, который в результате
реакции изменяет окраску. Этот индикаторный слой частично
поглощает свет, а отраженный от него свет измеряется фотоде-
текторами, позволяющими регистрировать его на длинах волн 565,
642 и 950 нм, у которых спектральная чистота поглощенного све-
та имеет такие же хорошие качества, как и у светофильтров. Из-
мерение отраженного света происходит с высокой точностью и
хорошей воспроизводимостью.
Фотометр позволяет проводить как кинетические измерения,
так и измерения в конечной точке реакции. Кюветная камера мо-
жет быть термостатирована при трех температурах: 25, 30 и 37 °C.
Расчет результатов после измерения отраженного света выполня-
ется автоматически микропроцессором.
При разработке этой технологии для многих аналитов (глюко-
зы, триглицеридов, холестерина, мочевины, билирубина, гемо-
глобина) использовались аналитические принципы, применяв-
шиеся в обычных биохимических исследованиях с жидкими реак-
тивами. Для определения иона калия, креатинина, у-глутамил-
трансферазы и аминотрансфераз — АсАТ и АлАТ — были разра-
ботаны методы, основанные на абсолютно новых аналитических
принципах. Можно выделить несколько групп методов.
1. Специфические ферментативные методы с сопряженными
реакциями, катализируемыми рядом ферментов, в конечном итоге
с образованием пероксида водорода. В катализируемой пероксида-
зой реакции образующийся атомарный кислород окисляет вос-
становленную форму бесцветного индикатора, иммобилизован-
ного в верхнем лепестке в левой части полоски, в голубой цвет.
Отражающийся от этой индикаторной части свет измеряется при
168
длине волны 642 нм. Такой принцип применяется в полосках
«Reflotest» для значительного количества аналитов — субстратов
(глюкозы, креатинина, триглицеридов, холестерина, холесте-
рина липопротеидов высокой плотности, мочевой кислоты), из-
меряемых в конечной точке реакции. Аналогичный принцип ис-
пользуется в кинетических методах определения активности трех фер-
ментов: АсАТ (субстрат — аланинсульфинат), АлАТ (субстрат — ала-
нин) и креатинкиназы (субстрат — креатинфосфат). Специфи-
ческая реакция в них запускается воздействием на субстрат опре-
деляемого фермента сыворотки или плазмы и в результате
серии сопряженных реакций приводит к образованию пероксида
водорода. В катализируемой пероксидазой реакции бесцветная вос-
становленная форма индикатора приобретает при окислении си-
ний цвет, измерения проводят отражательным фотометром при
длине волны 567 нм.
2. Образование окрашенных в красно-фиолетовый цвет диазо-
соединений при взаимодействии определяемых компонентов (глю-
куронида билирубина) или продуктов распада специфических
субстратов под действием измеряемых ферментов (например, ин-
доксила под действием а-амилазы или панкреатической амилазы
и а-глюкозидазы) с диазониевыми солями. Измерение отражен-
ного света проводят при длине волны 567 нм.
3. Методы, основанные на изменении окраски индикаторов pH:
под действием уреазы мочевина гидролизуется с образованием
углекислого газа и аммиака, который, проникая в забуференный
индикаторный слой, вызывает изменение его окраски от желтого
до зеленого или синего цвета в зависимости от концентрации
мочевины в крови (измерение при длине волны 642 нм); при
определении иона калия последний, переходя из водной фазы в
органическую, образует комплекс с валиномицином. Индикатор
pH, растворенный в органической фазе, освобождает при этом
протон и окрашенный в голубой цвет анион. Измерение отражен-
ного от индикаторного лепестка света проводят при длине волны
642 нм.
4. Гемиглобинцианидный метод для определения гемоглобина.
5. Метод с синтетическим хромогенным субстратом — у-глу-
тамил-3-карбокси-1,4-фенилендиамином для определения актив-
ности у-глутамилтрансферазы. Под действием у-глутамилтранс-
феразы хромогенный субстрат гидролизуется и у-глутамиловый
остаток переносится на глицилглицин с образованием у-глута-
милглицилглицина, а освобождающийся 3-карбокси-1,4-фени-
лендиамин в присутствии N-метилантраниловой кислоты окис-
ляется феррицианидом калия с образованием вещества, окра-
шенного в зеленовато-голубой цвет. Кинетическое измерение от-
раженного от индикаторного лепестка света проводят при длине
волны 642 нм.
169
Время измерения результатов варьирует для различных анали-
тов от 120 с (гемоглобин, у-глутамилтрансферазы) до 230 с (кре-
атинин). Перед внедрением этих тестов для каждого из них было
проведено тщательное изучение влияния таких факторов, как ге-
матокрит, гемолиз, липемия (для сыворотки), билирубин в пато-
логических концентрациях; восстанавливающих веществ, аскор-
биновой кислоты, различных антикоагулянтов и большого переч-
ня лекарств. Для данной системы выпускают специальные конт-
рольные материалы с аттестованными значениями аналитов в
нормальном и патологическом диапазонах. Система «Reflotron»
предназначена для количественного определения аналитов с вы-
соким уровнем качества и аналитической надежностью, что по-
зволяет использовать эту технологию не только для лабораторной
диагностики, но и для слежения — мониторинга — за результата-
ми в процессе лечения пациентов.
Система «Seralyzer» использует диагностические полоски для
биохимических компонентов (субстраты, ферменты, лекарства),
предназначенные для работы с 10 мкл сыворотки или плазмы для
кинетических измерений и измерений в конечной точке реакции
также на основе отражательной фотометрии (девять светофильт-
ров с длинами волн от 340 нм до 740 нм). Цельная кровь необхо-
дима только для определения гемоглобина. Палитра тестов вклю-
чает те же биохимические исследования, которые были развиты
для системы «Reflotron», (кроме у-глутамилтрансферазы, холе-
стерина липопротеидов высокой плотности, калия), а также ана-
лизы на альбумин, щелочную фосфатазу, общий белок, кальций,
лекарства.
Известны системы с использованием диагностических поло-
сок для небольшого количества исследований, например «Accutrend
GCT» фирмы «Roche Diagnostics» для определения глюкозы, три-
глицеридов и холестерина высокоспецифичными ферментатив-
ными методами.
Для определения глюкозы (глюкозооксидазный метод) и лак-
тата применяют диагностические полоски, основанные на элект-
рохимическом принципе измерения, являющиеся биосенсорами.
Измерение выполняют с помощью портативного амперометри-
ческого прибора. Глюкоза из нанесенной на тестовую зону капли
крови гидролизируется с образованием глюконовой кислоты и
пероксида водорода, специальные медиаторы (ферроцен) пере-
носят электроны на зонд электрода, с помощью которого изме-
ряется сила возникающего электрического тока, пропорциональ-
ная концентрации глюкозы в пробе.
Некоторые из таких приборов уменьшены до размеров кредит-
ной карточки, например глюкометр «Super Glucocard II» или при-
бор для определения лактата в крови «Lactate PRO». Биосенсоры
для этих приборов длиной около 2,0 см, а тестовая зона диамет-
170
ром около 3,0 мм. В отечественном электрохимическом глюкомет-
ре «Сателлит» длина биосенсора составляет около 4 см, а длина
тестовой зоны — около 5 мм. Расчет результатов по измеренной
силе тока проводят в соответствии с градуировочным кодом, ко-
торый обозначен на упаковках с биосенсором. Одноразовые био-
сенсоры герметично упакованы в фольгу по одному.
К таким приборам прилагаются контрольные биосенсоры или
биоматериалы в жидком виде, позволяющие гарантировать хоро-
шее качество выполнения измерений.
В качестве «сухих» тестов для биохимических исследований ис-
пользуют также многослойные пленки. Технология была разработа-
на как для полуавтоматических экспресс-анализаторов DT 60, так
и для больших биохимических автоанализаторов (в настоящее вре-
мя — анализаторы «Vitros»). Аналитический элемент размером с
почтовую марку представляет собой слайд, вмонтированный в рам-
ку, на обратной стороне которой указан биохимический тест, для
которого этот слайд предназначен, и штрих-код. В середине слай-
да расположен кружок — тестовая зона для нанесения сыворотки
или плазмы. В качестве подложки используется негнущийся плас-
тик или аналогичный материал. Для усиления отражения света,
что необходимо для процедуры измерения, поры пластика запол-
няют неорганическим пигментом, чаще всего двуокисью титана.
В этом случае подложка играет роль отражательного слоя. Реагент-
ная часть системы состоит из нескольких слоев пленок, в которых
иммобилизованы реактивы в сухой форме.
Иногда в систему включены дополнительные промежуточ-
ные слои, предназначенные для определения, разрушения и
маскировки интерферирующих веществ, содержащихся в ис-
следуемой пробе, а также верхний, распределительный, слой,
обеспечивающий равномерное распределение биожидкости по
поверхности слайда и более равномерное проникновение ее в ре-
активный слой. Он действует как микрофильтр, удаляющий мел-
кие частицы и крупные молекулы, такие, как белки. Этот слой
также содержит белое диффузно распределенное в нем отража-
ющее вещество, которое обеспечивает отражение света во время
колориметрии через прозрачную основу. Отдельные слои с помо-
щью самоклеящихся пленок или одновременно все слои с помо-
щью специальной рамки объединены в слайд. Различают три
типа слайдов: для биохимических тестов, иммунохимических
определений (отражательная фотометрия) и электролитов (по-
тенциометрия).
«Сухие иммунохимические тесты». Под понятием «сухая имму-
нохимия» объединяют аналитические устройства, в которых им-
мобилизованы в сухой форме реактивы для проведения гомоген-
ного и гетерогенного иммуноанализа в пористом матриксе с при-
менением моноклональных и поликлональных антител для спе-
171
цифического связывания с исследуемым аналитом. Это могут быть
диагностические полоски или тест-кассеты. Наиболее часто ис-
пользуют два вида этих устройств: «проточный тип» и тесты, ос-
нованные на латеральном, или поперечном, токе на диагно-
стических полосках и кассетах.
В первом случае пористый матрикс образует реакционную зону
и действует как твердая фаза в варианте гетерогенного иммуно-
анализа. Антитело ковалентно связано с поверхностью пористого
матрикса. При нанесении пробы на матрикс содержащийся в ней
аналит связывается с иммобилизованным антителом. Добавление
второго меченого антитела формирует «сэндвич» и привязывает
метку к месту иммобилизации первого антитела. Оценку результа-
та по окрашенной метке выполняют визуально. В качестве метки
при этом можно использовать окрашенные частицы латекса, кол-
лоидального золота.
При постановке иммуноферментных реакций окраска выявля-
ется после добавления к связанному с искомым аналитом антите-
ла, конъюгированного с ферментом, соответствующего субстрата.
На этом принципе основано обнаружение и полуколичественное
определение ряда компонентов (Д-димера, С-реактивного бел-
ка) на карточках «NycoCard». Карточка отмечена названием ком-
понента, для которого она предназначена, и имеет шесть лунок
(каждая для одного анализа), содержащих пористую мембрану с
иммобилизованными антителами к исследуемому аналиту.
В случае превышения концентрации аналита в крови или сыво-
ротке, нанесенной в лунку, порогового значения (например,
10 мг/л для С-реактивного белка) аналит связывается с иммоби-
лизованными на мембране моноклональными антителами, спе-
цифичными к одному его эпитопу. После добавления конъюгата
моноклональных антител с частицами коллоидального золота (раз-
мером 3 — 5 нм), специфично связывающихся с другим эпитопом
молекулы аналита, образуется «сэндвич», в котором реализуется
оптический эффект связанного в нем коллоидального золота. После
промывки ячейка приобретает различные оттенки красного цвета.
Окрашивание сравнивают с прилагаемой к данному тесту полу-
количественной шкалой. Возможно количественное определение
аналита с помощью отражательного фотометра, имеющего ори-
гинальную конструкцию: ячейку в карточке не помещают в кю-
ветную камеру ридера, а на нее накладывают соединенный с ним
детектор.
Концентрацию важного для диагностики нарушений в системе
гемостаза Д-димера можно определить аналогичным способом в
диапазоне от 0,5 мг/л до 8,0 г/л. На этом принципе основано не-
сколько «сухих» тест-систем для обнаружения антител к антиге-
нам вирусов HIV1/HIV2 или раздельного обнаружения антител к
этим вирусам.
172
Другой тип иммуноаналитических устройств — тесты, осно-
ванные на латеральном, или поперечном, токе на диагностиче-
ских полосках и кассетах. В них нанесенная на тестовую зону проба
с искомым аналитом выступает в роли растворителя и в связи с
хроматографическими свойствами носителя движется по участку
пористого матрикса, на котором в высушенной форме располо-
жены необходимые для соответствующей иммунохимической ре-
акции реактивы (антигены, меченые и другие антитела и т.д.).
Эти тесты, как правило, выполняют в один этап, анализ за-
вершается в течение несколько минут. Подобно другим вариантам
«сухих» технологий в данном имеются как монотесты, предназна-
ченные для обнаружения одного аналита, так и политесты для
выявления целой панели аналитов. Так, панель «М1» двухэтапно-
го иммунохроматографического теста для выявления инфаркта
миокарда насчитывает четыре маркера повреждения сердечной
мышцы: миоглобин, легкие цепи миозина, КК МВ и тропонин I,
для каждого из которых в случае положительной реакции обнару-
живается отдельная окрашенная полоса.
В серии тестов «Status DS» для скрининговых исследований при
наркоманиях и токсикоманиях имеются иммунохроматографиче-
ские кассеты для обнаружения лекарств и наркотиков на одно
вещество (или его метаболиты), на 2, 3, 4, ..., 10 аналитов (мета-
дон, опиаты, кокаин, марихуана, фениелидин, амфетамины, бар-
битураты, трициклические антидепрессанты, метамфетамины,
бензодиазеп ины).
Один из наиболее распространенных аналитических принци-
пов носит название «GLORIA» (Gold Labeled Optical Rapid
ImmunoAssay) — быстрое иммуноисследование с оптически счи-
тываемой меткой коллоидальным золотом. Впервые эта техноло-
гия была описана для диагностических «сухих» тест-систем «ТгорТ»
на кассетах для выявления миокардиального тропонина Т.
Принцип метода заключается в следующем (рис. 7.5). Тест-кас-
сета имеет три отделения:
1) аппликационная зона — место нанесения 150 мкл капил-
лярной или венозной крови. В этой зоне на ворсинчатых элементах
иммобилизованы два вида антител к двум различным эпитопам
молекулы тропонина Т: моноклональные биотинилированные
мышиные антитела и антитела к другому эпитопу молекулы, мечен-
ные коллоидальным золотом. В несвязанном состоянии метка —
коллоидальное золото — себя не проявляет. После нанесения кро-
ви на аппликационную зону растворенные ею антитела транспор-
тируются в следующую зону;
2) зона реакции, где происходит связывание тропонина Т с
двумя указанными антителами с образованием «сэндвича», если
он присутствует в концентрации выше порогового значения
0,1 нг/мл. «Сэндвич» в крови, непрореагировавшие антитела и кровь
173
Рис. 7.5. Механизм реакции «GLORIA» и схема устройства аналитиче-
ской тест-кассеты:
а — зона нанесения крови; б — реакционная зона; в — зона детекции
в реакционной зоне проходят через находящиеся в ней стеклово-
локна, отделяясь от эритроцитов. Далее плазма, «сэндвичи» и сво-
бодные антитела достигают третьей зоны;
3) зона детекции, в которой находятся две полосы. Одна из
них — контрольная. В этой области кассеты иммобилизован синте-
тический пептид — аналог тропонина Т. Поступившие в зону де-
текции непрореагировавшие, меченные золотом, антитела свя-
зываются с этим веществом.
В результате коллоидальное золото проявляет свою окраску в
виде контрольной полоски красного цвета. При хорошей стабиль-
ности реактивов и правильной постановке теста эта полоса долж-
174
на появляться всегда, независимо от результата (положительного
или отрицательного). Рядом с ней в зоне детекции на так называ-
емой сигнальной линии иммобилизован стрептавидин, который
связывает, с одной стороны, непрореагировавшие биотинилиро-
ванные антитела, а с другой — «сэндвичи» тропонина Т с такими
же антителами (биотинилированный конец) и антителами, ме-
ченными золотом. В результате коллоидальное золото в этом со-
стоянии может быть обнаружено визуально по окрашенной в крас-
ный цвет тестовой полосе, что свидетельствует о положительном
результате.
Время считывания результата после нанесения крови — от 3 до
15 мин, оно регистрируется обязательно секундомером и должно
быть внесено в специальную наклейку на кассету, на которой вы-
полнен анализ. Таким образом, в случае, если концентрация тро-
понина Т в крови выше порога чувствительности теста (0,1 нг/мл),
появляются две таких полосы — тестовая (сигнальная) и конт-
рольная. Скорость появления тестовой полосы зависит от концен-
трации тропонина Т: чем выше его концентрация, тем быстрее
она появляется.
В тестах, предназначенных для выявления антител, использу-
ют антигены, конъюгированные с коллоидальным золотом (на-
пример, на кассетах «Uni-Gold HIV») или с коллоидальным се-
леном (например, в тесте «Dainabot Determine HIV1/2»). В этом
случае антигены, иммобилизованные в тестовой зоне на нитро-
целлюлозе, представляют собой рекомбинантные или синтети-
ческие белки, соответствующие иммунодоминантным участкам
искомых антигенов (например, в случае HIV1 это могут быть им-
мунодоминантные участки оболочечных гликопротеинов gp41,
gp 120, при HIV2 — пептид gp36). Аналогичные белки сорбируют-
ся на полоске в области контрольной линии (внутренний конт-
роль), кроме того, на полоске абсорбированы и антитела к IgG
человека. В технологии «GLORIA» биожидкость при нанесении на
полоску растворяет меченные золотом антигены. Присутствующие
антитела к HIV1 и/или HIV2 связываются с меченными золотом
антигенами и образуют красную полосу в тестовой зоне.
Иммунохроматографические тесты могут быть основаны на
принципе иммуноферментного анализа. Так, диагностическая по-
лоска «Micral» содержит антитела к альбумину, меченные [3-га-
лактозидазой. После погружения полоски в мочу в связи с хромато-
графическими свойствами носителя альбумин достигает зоны, где
находятся ворсинки, на которых иммобилизованы конъюгирован-
ные с ферментом антитела к альбумину. Образуется растворимый
комплекс: «альбумин + конъюгированные антитела». Далее этот
комплекс и непрореагировавший конъюгат антител продвигают-
ся к зоне реакции через промежуточную зону («ловушку»), в ко-
торой иммобилизован альбумин человека. С ним связывается из-
175
быток конъюгата антител, а комплекс альбумина с антителами к
нему, меченными р-галактозидазой, достигает реакционной зоны.
Здесь конъюгированная с антителами, связавшимися с альбуми-
ном р-галактозидаза становится доступной для реакции с субстра-
том — хлорфенолом красным-р-галактозидом. В результате его гид-
ролиза образуется хлорфенол красный, окрашивающий тестовую
зону в красный цвет. Для полуколичественной оценки результата
интенсивность окраски сравнивают со шкалой, нанесенной на
пенал для полосок.
«Сухие тесты» для обнаружения «скрытой крови» в кале. В зави-
симости от принципа, можно выделить две основные группы ме-
тодов обнаружения «скрытой крови» — гемоглобина — в кале на
основе «сухих» тестов: тесты, использующие псевдопероксидаз-
ные свойства гемоглобина (реакция с гваяковой смолой или орто-
толидином) и иммунохимические тесты.
Все тесты на «скрытую кровь» в кале выполняют только специ-
алисты, имеюще медицинское образование. «Сухие» тесты с гвая-
ковой смолой основаны на модификации реакции Грегора. Гемо-
глобин, обладая пероксидазными свойствами, в присутствии пер-
оксида водорода катализирует превращение фенольных соедине-
ний в гваяковой смоле в хиноны, имеющие голубую окраску.
В состав набора реактивов для этих тестов входят: упакованная в
непроницаемую для бактерий извне бумажную или картонную кар-
точку (например, тест «Haemoccult» или «Hexagon OBScreen»)
хроматографическая бумага; картонные или другие шпатели; ре-
активы — активаторы реакции (раствор цитрата в этаноле); рас-
твор пероксида водорода в этаноле, развивающий реакцию.
Тест выполняется в картонных картах, которые могут быть от-
крыты с обеих сторон. Одна сторона предназначена для лаборанта
или врача, осуществляющего взятие материала для исследования.
При ее открытии можно видеть два круга или квадрата хромато-
графической бумаги (тестовые зоны), на каждый из которых шпа-
телем, вложенным в набор, равномерно наносят из подозритель-
ного участка кал в пределах, ограниченных кругом или квадра-
том, слева и из 4 — 5 участков справа. Упаковку закрывают и пере-
дают врачу, который открывает ее с обратной стороны и добавля-
ет раствор пероксида водорода. Результат считывают визуально спу-
стя 30 с и не позднее 10 мин с момента нанесения пробы. Присут-
ствие «скрытой крови» обнаруживают по голубому окрашиванию
тестовой зоны.
«Сухие» тесты с гваяковой смолой обладают некоторыми не-
достатками: невысокой чувствительностью и специфичностью (вли-
яние диеты — пероксидаз, содержащихся в пище, в необработан-
ных фруктах и овощах, ложноположительная реакция наблюдает-
ся при приеме аскорбиновой кислоты, препаратов железа). Ряд
лекарств — ацетилсалициловая кислота, индометацин, фенилбу-
176
тазон, кортикостероиды и резерпин могут вызвать кровотечение
из желудочно-кишечного тракта. Следовательно, за три дня до
исследования необходимо назначить особую диету и отменить ле-
карства.
Тест на диагностических полосках «ОК test» (ОК 8) основан на
реакции обладающих псевдопероксидазными свойствами гемо-
глобина и миоглобина с ортотолидином и куменпероксидом, ко-
торыми пропитана реагентная зона (положительная реакция на
пероксидазу эритроцитов). После нанесения кала на окошко тест-
карты полоску «okPHAN» помещают индикаторной зоной вниз и
оставляют для протекания реакции на 30 с. Далее цвет индикатор-
ной зоны сравнивают с цветной шкалой на этикетке пенала. Об-
ладает высокой чувствительностью к гемоглобину. Реакция может
быть положительной в присутствии пероксидаз бактерий, грибов
и некоторых лекарств.
Иммунохимические тесты для обнаружения «скрытой крови» в
кале основаны на иммунологической реакции гемоглобина чело-
века с моноклональными антителами, меченым лигандом, обес-
печивающим визуализацию положительной реакции. Чаще всего
используют иммунохроматографические тесты в кассетах с попе-
речным током реакционной смеси через пористый матрикс. Раз-
личают два основных вида технологий иммунохимических тестов
на гемоглобин в кале.
В технологии «GLORIA» используются двойные антитела к раз-
ным эпитопам молекулы гемоглобина. Вторая группа тестов осно-
вана на реакции гемоглобина с антителами, иммобилизованны-
ми на латексных частицах, окрашенных в голубой цвет (набор
реактивов «Hexagon OBTI»). Эти антитела иммобилизованы в тес-
товой зоне, и в случае присутствия в кале «скрытой крови» обра-
зующийся комплекс «антиген — антитело» окрашивает тестовую
зону в голубой цвет.
Избыток антител, иммобилизованных на латексных частицах,
движется к контрольной зоне, в которой иммобилизованы анти-
тела к мышиному IgG против гемоглобина человека, т.е. против
тех антител к гемоглобину человека, которые иммобилизованы
на латексных частицах, окрашенных в голубой цвет. В результате
связывания антител на латексных частицах с этими мышиными
антителами образуется контрольная полоса, окрашенная в голу-
бой цвет, которая должна образовываться всегда при правильной
постановке теста. Таким образом, в случае присутствия «скрытой
крови» в кале (при положительном результате) образуются две
окрашенные в голубой цвет полосы.
Как правило, в состав наборов реактивов для этих тестов вхо-
дят и пробирки для сбора кала, содержащие обычно трис-буфер
pH 7,5 и аппликационную палочку (аппликатор), закрепленную в
завинчивающейся крышке. После внесения кала аппликатором в
7 Меньшиков 177
буфер пробирку закрывают той же крышкой. Для нанесения не-
скольких капель экстракта кала на тестовую зону, предназначен-
ную для пробы, верхний конец крышки пробирки отламывают.
Ответ в таких тестах готов спустя 2 — 5 мин. Но отрицательный
результат обязательно должен быть подтвержден спустя 10 мин.
Эти тесты высокоспецифичны для всех подтипов гемоглобина
человека, нет интерференции с гемоглобинами крови различных
видов животных кроме приматов.
«Сухие тесты» для коагулологических исследований. Наряду с
иммуноаналитическими технологиями обнаружения отдельных ком-
понентов и показателей состояния системы гемостаза в «сухих» тех-
нологиях для коагулологических исследований преобладают клот-
тинговые (от англ, clot — сгусток, сверток) технологии, основан-
ные на образовании в каскаде свертывания сгустка фибрина.
Ранее всего для этих целей в конце 1990-х гг. разработаны при-
бор и полоска «CoaguChek РТ» для определения протромбинового
времени в 25 мкл капиллярной крови. По аналогии с принятым
самоконтролем концентрации глюкозы в крови этот прибор и
полоски РТ предназначены и для самостоятельного контроля про-
тромбинового времени пациентами, принимающими антикоагу-
лянты.
В полоску вмонтирован прозрачный капилляр, внутри которо-
го иммобилизован кроличий тромбопластин и находятся мель-
чайшие частицы окислов железа, которые придают капилляру
серую окраску. После того как полоску помещают в прибор —
отражательный фотометр, на ее тестовую зону наносят кровь.
Попадая в электромагнитное поле, которое создается под капил-
ляром, окислы железа вращаются по определенной траектории,
и, таким образом, при попадании света от источника можно за-
регистрировать определенный сигнал от отраженного света.
После взаимодействия крови с тромбопластином в капилляре
полоски протромбин превращается в тромбин, последний в при-
сутствии ионов кальция вызывает превращение фибриногена в
фибрин. Образующиеся сгустки фибрина наматываются на метал-
лические частицы окислов железа, приостанавливают их враще-
ние в магнитном поле, вызывая образование из них конгломера-
тов, отражение света от которых имеет другую характеристику,
чем при первоначальном измерении.
Далее разница в результатах измерения отражения света пре-
образуется в окончательный показатель протромбинового време-
ни, который может быть с помощью этого прибора выражен во
всех приемлемых для этого показателя единицах: секундах, про-
центах содержания факторов протромбинового комплекса у здо-
ровых людей (по Квику), в величине отношения протромбиново-
го времени у пациента к аналогичному показателю у здоровых
людей или в виде международного нормализованного отношения
178
(MHO). Результаты последних 60 измерений хранятся в памяти
прибора.
Другой вариант клоттингового метода определения протром-
бинового времени использован в так называемой картриджной
технологии «сухих» тестов на другом приборе «CoaguChek Pro
System». Картридж представляет собой похожее на миниатюрную
кассету устройство с несколькими полостями, в которых содер-
жатся лиофилизированные реактивы, иногда и растворитель, не-
обходимые для выполнения теста. При введении в картридж про-
бы биожидкости она растворяет все реагенты в последовательно-
сти, определяемой расположением каналов, соединяющих поло-
сти (камеры) картриджа, подвергается воздействию реагентов и
результат анализа может быть зарегистрирован оптически или элек-
трохимически. Чаще всего применяют миниатюрные картриджи
из прозрачного пластика, содержащие все необходимые для ана-
лиза реактивы, вызывающие образование окрашенного соедине-
ния. По измерению светопоглощения этого соединения в измери-
тельном приборе можно рассчитать концентрацию аналита. Опре-
деление протромбинового времени с помощью этого теста начи-
нается с помещения предназначенного для него прозрачного кар-
триджа в прибор.
Картридж состоит из ячейки для пробы, реакционной камеры
и реакционного «пути». После считывания кода и номера анализа
картридж прогревается в приборе, капля свежей капиллярной или
венозной крови помещается в ячейку для пробы. Под действием
капиллярных сил кровь движется в реакционную камеру, где сме-
шивается с реактивами и начинает свертываться. Кровь продол-
жает двигаться по реакционному пути до тех пор, пока не завер-
шится образование сгустка. Лазерная оптическая система осуще-
ствляет слежение за током крови, конечная точка реакции харак-
теризуется остановкой тока крови. Время с момента нанесения
крови до детекции образования сгустка — протромбиновое время.
Следует особо отметить для этой системы, что прослеживае-
мость результатов, получаемых для протромбинового времени на
ней с помощью картриджной технологии, была достигнута путем
сравнения результатов с данными механического клоттингового
теста в пробирках и сравнения с описанной выше технологией для
протромбинового времени на полосках с использованием серти-
фицированного в рамках Всемирной организации здравоохране-
ния (ВОЗ) референтного калибровочного материала «CRM 149 S».
Существуют электронные контрольные картриджи, позволя-
ющие ежедневно проводить контроль качества на двух уровнях зна-
чений протромбинового времени, а кроме того, есть и контрольные
материалы для этой системы.
Таким образом, описанная система основана на достаточно
высокоорганизованной технологии, которая иногда заявляется как
179
«золотой стандарт» применительно к коагулологическим иссле-
дованиям, которые характеризуются особыми требованиями к пре-
аналитической фазе — взятию, обработке и хранению материала
перед исследованием. В данном случае система для анализа по ме-
сту лечения не требует обработки крови, получения плазмы и
каких-либо манипуляций с ней, хранения, транспортировки и с
большей вероятностью и достоверностью может отражать истин-
ное состояние исследуемого показателя системы гемостаза в кро-
ви пациента.
7.4. Картриджные технологии
Достаточно широко применяются электрохимические биосен-
сорные технологии. Реактивы для одновременного определения
1—8 аналитов (ионов натрия, калия, хлоридов, глюкозы, моче-
вины, гемоглобина, pH, РО2, РС02) и расчета других параметров:
НСО3, общего содержания углекислого газа, избытка оснований,
насыщения крови кислородом) упакованы в картриджи для раз-
личных комбинаций тестов. В определенное гнездо картриджа не-
обходимо нанести 2 — 3 капли крови. Размер одноразового карт-
риджа составляет приблизительно 4,5x2,5 см. Его вставляют в элек-
трохимический ручной анализатор «i-STAT», по форме и разме-
рам напоминающий трубку телефона. После нанесения капли крови
результаты считывают с дисплея или распечатывают при подсое-
динении «i-STAT» в систему мониторинга состояния пациента с
помощью компьютера (рис. 7.6). Картриджи выбирает медицин-
Рис. 7.6. Этапы процедуры исследо-
вания газов крови и электролитов в
портативном анализаторе «i-STAT»:
а — внесение пробы крови в картридж;
б — введение картриджа в прибор; в —
чтение результата спустя 2 мин
180
Рис. 7.7. Процедура определения глюкозы в фотометрическом анализаторе
«НешоСие»:
а — взятие пробы крови из пальца в капиллярную систему кюветы; б — вставле-
ние кюветы в анализатор; в — считывание результата на дисплее анализатора
ский персонал соответственно клинической ситуации, требующей
срочной информации.
В приборах для быстрого определения аналитов, применяемых
в анализе по месту лечения, могут использоваться сухие реакти-
вы, предварительно упакованные в кюветы из прозрачного пла-
стика, и работа их основана на обычной абсорбционной фото-
метрии. Такой принцип реализован в миниатюрных анализаторах
«HemoCue В — Glucose Analyzer» и «HemoCue В — Hemoglobin
Analyzer» (рис. 7.7).
Результат может быть считан на дисплее прибора, распечатан
на подключенном принтере или введен через соответствующий
интерфейс в персональный компьютер. Результаты не зависят от
величины гематокрита в отличие от тестов на полосках.
Устройства анализа по месту лечения, основанные на приме-
нении картриджей, могут содержать реактивы и для иммуноана-
лиза с детекцией рассеянного света. Такие системы известны для
гликированного гемоглобина, лекарственных препаратов в кро-
ви, альбумина в моче. Строение картриджа позволяет пробе и ре-
агентам перетечь в реакционную камеру, а результаты иммуноаг-
регации оцениваются турбидиметрически.
Для устройств, рассчитанных на определение компонентов в
плазме, существуют специальные приспособления, отделяющие
плазму из капиллярной или венозной крови. «Сухие тесты», пред-
варительно упакованные в секторах ротора одноразового пользо-
вания, применяют для проведения биохимических реакций у по-
стели больного в уменьшенном центрифужном анализаторе
«Piccolo». В определенное место ротора, разделенного на 10 секто-
ров для одновременного определения 10 аналитов у одного боль-
ного или одного аналита у 10 больных (роторы имеют идентифи-
181
кацию), вносят пробы крови. В процессе центрифугирования плазма
перетекает по каналам ротора в сектора, в которых в сухой форме
находятся реактивы, и растворяет их. Продукты реакции измеря-
ют методом абсорбционной фотометрии. Известны технологии на
основе картриджей и для иммунохимических флюоресцентных
исследований.
7.5. Приборы и оборудование для анализа по месту
лечения
Отражательные фотометры используют в наиболее массовых
исследованиях, основанных на применении диагностических по-
лосок (глюкометры, отражательные фотометры для анализа мочи).
Простота, быстрота выполнения исследования, автоматическая
калибровка приборов, специфичная для каждой партии полосок,
возможность проверки качества исследований с помощью специ-
альных контрольных полосок, которые измеряются через опреде-
ленное количество измерений проб пациентов, способствуют
широкому их распространению.
Наряду с моноцелевыми отражательными фотометрами разра-
ботаны полуавтоматические и автоматические измерительные при-
боры для регистрации результатов различных биохимических ис-
следований с помощью средств «сухой химии». Это многопрофиль-
ные настольные анализаторы «Reflotron II, IV»; «Seralyzer III»;
«DT 60 II», настольный автоматический отражательный фотометр
«Spotchem EZ», предназначенный для количественной оценки
результатов исследований в сыворотке или плазме крови 23 био-
химических компонентов с помощью диагностических полосок
как для одиночных исследований (одновременно могут быть оце-
нены три полоски), так и для панельных исследований (одна по-
лоска на девять параметров). Для девяти тестов требуется около
100 мкл сыворотки, продолжительность анализа — 10 мин. При-
бор калибруется магнитной картой для каждой партии полосок,
имеет встроенную центрифугу и автоматическое устройство для
дозирования проб после центрифугирования, термопринтер. Фо-
тометр ориентирован на внешнюю программу обработки данных,
с которой может иметь дистанционную связь.
На принципе отражательной фотометрии основано действие
транскожных билирубинометров (например, «Билитест-М») для
неинвазивного определения транскожного билирубинового индекса
при скрининге гипербилирубинемии у новорожденных и фототе-
рапии при ней.
Приборы для быстрого определения одного аналита (напри-
мер, глюкозы, гемоглобина, протромбинового времени) могут
быть основаны на фотометрическом или электрохимическом его
182
определении в одноразовом картридже. Принцип работы таких
приборов рассмотрен ранее при описании основных методик.
Портативная аналитическая система «RapiScan» предназначе-
на для быстрого иммунохимического определения наличия нар-
котических препаратов в жидкости полости рта. Прилагаемые кар-
триджи рассчитаны на определение панели из пяти или двух нар-
котиков.
На измерении непосредственно в гематокритной пробирке
флюоресценции флюорохрома и светопоглощении слоев клеток
крови, расположенных компактно в соответствии с их градиен-
том плотности после высокоскоростного центрифугирования,
основано устройство гематологического анализатора («сухая тех-
нология») «QBC-Autoread Plus». Его используют для экспресс-опре-
деления гематокрита, гемоглобина, средней концентрации гемо-
глобина в эритроците, количества тромбоцитов, лейкоцитов, гра-
нулоцитов (количество и процентное содержание), лимфоци-
тов, моноцитов (количество и процентное содержание).
Оптическая регистрация в приборах анализа по месту лечения
все чаще заменяется биосенсорной, поскольку для приборов это-
го типа достаточен значительно меньший объем пробы (менее
10 мкл). Помимо большой группы портативных глюкометров, ос-
нованных на амперометрическом измерении с помощью биосен-
соров, многопрофильного анализатора «i-STAT», известны раз-
личные анализаторы, использующие биосенсоры и электрохими-
ческие принципы измерения: анализатор «AVL OMNI», позволя-
ющий исследовать несколько аналитов, например мочевину, глю-
козу, лактат. Проба цельной крови или плазмы объемом 44 мкл
наполняет 12 сенсорных пятен кассеты, содержащих соответствен-
но уреазу, глюкозооксидазу и лактатоксидазу. Кассету помещают
в термостат при температуре 25 °C, и спустя 90 с с помощью ам-
перометрических детекторов могут быть получены результаты.
Работа прибора «GEM Premier» основана на измерении кон-
центрации газов крови и электролитов с помощью потенциомет-
рии и других электрохимических методов, но его картриджи рас-
считаны на многоразовое использование (до 300 тестов).
Биосенсорная технология применяется и в устройствах для
определения гемоглобина. Ведутся разработки по созданию био-
сенсорных устройств для определения ДНК, онкомаркеров, гор-
монов, вирусов, микроорганизмов.
Портативность и миниатюрность средств анализа по месту ле-
чения диктуется условиями их применения вне стен лаборатории:
в клиническом отделении, приемной семейного врача, машине
скорой помощи, на дому у пациента. Портативные приборы —
небольшие и легкие, имеют автономное электрическое питание
от батареек, помещаются в удобных чемоданчиках. В то же время
для некоторых вариантов внебольничной помощи (приемная се-
183
мейного врача, машина скорой помощи, сельская амбулатория)
могут быть приемлемы и компактные настольные приборы, осно-
ванные на'средствах «сухой химии» и «сухой иммунохимии».
Потребность в одновременном получении разносторонней ин-
формации о больном, находящемся в критическом состоянии,
побудила к созданию комплексных систем быстрого анализа,
объединяющих несколько разнородных устройств. Так, портатив-
ный прибор для измерения газов крови может быть совмещен в
одном переносном компьютеризованном комплексе с глюкомет-
ром и коагулометром, а также может быть соединен с прибором
«CardioReader» для определения маркеров повреждения сердеч-
ной мышцы и D-димера. Этот комплект приборов «ОРТ1 Plus»
представляет собой переносную лабораторию для быстрого ис-
следования 14 параметров, компьютерной обработки и беспро-
водной передачи результатов исследований в лабораторию или
больничную информационную систему.
7.6. Области применения технологий и средств
для анализа по месту лечения в клинической медицине
Результат исследования с помощью средств анализа по месту
лечения может быть получен в течение нескольких минут, в лю-
бое время суток и в любом месте контакта с пациентом. Эти тех-
нологии и средства находят применение в условиях как стацио-
нарной, так и внебольничной медицинской помощи. Их исполь-
зуют как в экспресс-лабораториях, так и в клинических отделе-
ниях больниц, в том числе и в тех учреждениях, которые не рас-
полагают лабораторией.
Для исследований достаточен минимальный объем пробы кро-
ви, что немаловажно при их неоднократном выполнении у тяже-
лых больных, особенно у детей. В условиях стационара средства
анализа по месту лечения можно применять для срочного получе-
ния лабораторной диагностической информации о пациенте, на-
ходящемся в критическом состоянии, когда необходимо приня-
тие неотложных лечебных мер. Такая потребность возникает у хи-
рургов и анестезиологов в ходе операции, у травматологов, реа-
ниматологов, в отделениях интенсивной терапии, приемных, кар-
диологических и эндокринологических отделениях.
К числу аналитов, исследуемых в таких ситуациях, относятся
₽о2, Рсо2> гематокрит, гемоглобин, лактат, катионы — калий,
кальций, натрий, pH крови как показатели жизненно важных
функций организма; глюкоза при лечении инсулинзависимого
сахарного диабета для быстрого купирования гипогликемии или
гипергликемии; лекарства, исследование которых необходимо в
палатах интенсивной терапии новорожденных, отделениях химио-
184
терапии и отделениях скорой помощи; креатинин в сыворотке
крови и моче для слежения за проявлениями нефротоксичности
при медикаментозной терапии.
В сфере внебольничной помощи может требоваться быстрая
диагностика состояния больного в случае предположения о пато-
логии, способной привести к критической ситуации. Обнаруже-
ние и количественное определение концентрации сердечных мар-
керов — тропонинов I или Т, миоглобина, креатинкиназы МВ
используют для немедленной диагностики инфаркта миокарда при
остром приступе загрудинных болей. Тесты с количественной оцен-
кой малых концентраций тропонинов I и Т позволяют устанавли-
вать наличие минорных повреждений миокарда при нестабиль-
ной стенокардии и могут быть применены в машине скорой по-
мощи для обоснования решения о внутривенном введении стреп-
токиназы.
При возникновении инфекционного заболевания быстрое ис-
следование С-реактивного белка или прокальцитонина позволяет
дифференцировать бактериальную инфекцию от вирусной и при-
нять решение о назначении антибиотиков.
Более широкая сфера применения средств анализа по месту
лечения при внебольничной помощи — скрининг пациентов для
обнаружения подозреваемой патологии, мониторинг хронических
заболеваний и слежение за результатами лекарственной терапии.
К этим средствам относятся диагностические полоски для анали-
за мочи, позволяющие выявить поражения почек, оценить состо-
яние печени и желчных путей, сахарный диабет; скрининговые
тесты на содержание холестерина в крови, наличие простатиче-
ского специфического антигена при подозрении на опухоль пред-
стательной железы; тест на скрытую кровь в кале, содержание
глюкозы и гликированного гемоглобина в крови при сахарном
диабете; определение протромбинового времени и АЧТВ в случае
применения антикоагулянтной терапии. При мониторинге хрони-
ческих заболеваний и влияния постоянного приема лекарствен-
ных препаратов некоторые средства анализа по месту лечения
пациенты могут применять самостоятельно при условии их под-
робного инструктирования (контроль за уровнем гликемии у боль-
ных сахарным диабетом, контроль за уровнем теофиллина в кро-
ви при лечении бронхиальной астмы, контроль за показателями
гемостаза при амбулаторном приеме антикоагулянтов и т.д.).
Устройства, основанные на иммунохроматографическом прин-
ципе, могут использоваться в различных вариантах для обнаруже-
ния, а в некоторых случаях и полуколичественного определения
очень большой группы аналитов (гормонов, опухолевых марке-
ров, лекарств, аллергенов). Для обнаружения хламидий (в выде-
лениях из шейки матки, в моче, в вагинальных мазках), стрепто-
кокков группы А в мазках из шейки матки и стрептококков груп-
185
пы В в вагинальных мазках, вируса гепатита В в цельной крови,
сыворотке и плазме, аденовирусов, ротавирусов в кале, для вы-
явления малярии и аллергенов используют методы выявления
антигенов.
Информативность исследований с помощью средств анализа
по месту лечения может быть повышена путем применения для
обработки результатов исследований объединенных с ними ком-
пьютеров, в том числе и портативных, или путем дистанцион-
ной передачи результатов в лабораторную информационную си-
стему.
Контрольные вопросы
1. Какие условия влияют на активность ферментов при определении
их каталитической концентрации?
2. Какие методы фотометрических измерений при определении ак-
тивности ферментов вы знаете?
3. Объясните способы расчета результатов при определении активно-
сти ферментов.
4. В каких формах применяют ферменты в технологиях с использова-
нием их как реактивов?
5. Дайте характеристику лигандной технологии.
6. Перечислите принципы иммуноанализа.
7. Охарактеризуйте понятие метки в иммуноанализе. Какие виды ме-
ток вы знаете?
8. Какие виды иммуноанализа вам известны?
9. В чем заключаются сходство и отличие иммуноферментного, имму-
нофлюоресцентного, иммунолюминесцентного видов анализа?
10. Каковы преимущества и недостатки радиоиммунологического ана-
лиза по сравнению с другими видами иммуноанализа?
11. Какие приборы и оборудование необходимы для выполнения им-
муноферментного анализа?
12. Какой вид фотометрии используют в ридерах для планшетного
иммуноферментного анализа? Перечислите преимущества и недостат-
ки данного метода.
13. Что лежит в основе молекулярно-биологических технологий?
14. Объясните понятие «гибридизация нуклеиновых кислот».
15. Какие виды амплификации вам известны?
16. Какой принцип лежит в основе метода полимеразной цепной ре-
акции? Перечислите этапы ПЦР.
17. Какие основные компоненты необходимы для каждого цикла ам-
плификации при ПЦР?
18. В чем заключается отличие метода лигазной цепной реакции от
полимеразной?
19. Приведите примеры использования в клинико-лабораторной ди-
агностике молекулярно-биологических технологий.
20. В каких целях применяют микрочипы в молекулярно-биологичес-
ких методах?
186
21. Из каких функциональных частей состоит микроскоп и какое на-
значение они имеют?
22. Какие типы микроскопов в зависимости от конструкции, способа
освещения, принципов построения изображения вам известны?
23. В чем заключаются особенности люминесцентной микроскопии?
24. Какими особенностями характеризуется преаналитический этап
при микроскопических исследованиях в клинико-лабораторной диагно-
стике?
25. Расскажите о технике приготовления объектов для микроскопии
(монослойного мазка крови, препарата осадка мочи и др.).
26. В чем заключаются особенности микроскопии препарата осадка
мочи в слайд-планшете? Какие преимущества имеет данный метод по
сравнению с микроскопией препарата на предметном стекле?
27. Какие методы называют цитохимическими, в чем их особенность,
в каких случаях их применяют?
28. Перечислите основные компоненты систем компьютерного изоб-
ражения. Какое назначение они имеют?
29. Охарактеризуйте принципы работы компьютеризованных микро-
скопов.
30. Что входит в понятие «анализ по месту лечения»?
31. Какие принципы лежат в основе обнаружения и определения раз-
личных аналитов с помощью устройств для анализа по месту лечения?
32. Какие вам известны диагностические тест-полоски для биохими-
ческих исследований в сыворотке крови и моче?
33. На каких принципах основаны иммунохроматографические техно-
логии для анализа по месту лечения?
34. В чем заключается технология «GLORIA» в иммунохроматографи-
ческих тестах?
35. Какие принципы положены в основу методики обнаружения ле-
карств и веществ, вызывающих наркоманию и токсикоманию, в сред-
ствах для анализа по месту лечения?
36. Расскажите об устройстве тест-полоски «Reflotest» и аналитиче-
ской системы «Reflotron».
РАЗДЕЛ III. АВТОМАТИЗАЦИЯ
КЛИНИКО-ДИАГНОСТИЧЕСКИХ
ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
Гл а ва 8
АВТОМАТИЗАЦИЯ БИОХИМИЧЕСКИХ ИССЛЕДОВАНИЙ
По степени участия в аналитическом процессе человека сред-
ства лабораторного анализа подразделяют на несколько групп:
для ручных методов, в которых все аналитические процедуры
выполняют вручную; механизированных методов, в которых от-
дельные этапы аналитических процедур (например, этап дози-
рования проб и реагентов, этап измерения оптической плотно-
сти и др.) могут оснащаться узкоцелевыми автоматизированны-
ми устройствами, и, перенося пробы последовательно от одного
устройства к другому, лабораторный работник объединяет эти
устройства в полуавтоматическую аналитическую систему, пол-
ностью автоматизированных методов.
В полностью автоматизированной системе — автоанализа-
торе — исследуемая проба перемещается по непрерывному пути,
подобному производственному конвейеру, вдоль ряда автомати-
зированных устройств, выполняющих свой этап анализа и пред-
ставляющих собой блоки единого аналитического прибора. При
работе с такими приборами человек выполняет функцию управ-
ления.
Первые автоанализаторы были созданы в 1950-е гг., когда прак-
тически параллельно были выдвинуты идеи автоматизации лабо-
раторных тестов путем измерения аналитов в потоке исследуемой
биожидкости: для гематологических исследований на основе про-
точного кондуктометрического метода цитометрии, т.е. подсчета
числа клеток крови и измерения их объема, а для биохимических
исследований — путем последовательного анализа проб биомате-
риала в постоянном потоке жидкости, представляющей смесь
пробы с реагентами в системе капиллярных трубок.
Если в дальнейшем развитии производства гематологических
автоматических анализаторов кондуктометрический принцип (хотя
и дополненный некоторыми другими способами измерения свойств
клеточных элементов) сохранился как основной до настоящего
188
времени, конструирование биохимических анализаторов развива-
лось и по другим направлениям.
Концепция проточного биохимического анализатора была реа-
лизована не только в одноканальном варианте, где пробы анали-
зировались лишь в отношении одного компонента, но и в виде
многоканальных (2-, 6-, 12-канальных) последовательных, про-
точных автоматических анализаторов, позволявших исследовать
одну и ту же пробу параллельно по нескольким параметрам.
В дискретных анализаторах, в которых каждую пробу помеща-
ют в отдельную емкость, куда затем поступают необходимые для
реакции реагенты (рис. 8.1), указанная концепция была реализо-
вана во многих вариантах, и стала основной в действующем парке
лабораторных автоматических анализаторов.
9
Рис. 8.1. Принципиальная схема устройства автоматического биохими-
ческого анализатора дискретного типа:
7 — пробоподготовка; 2 — перенос пробы в реакционные сосуды и добавление
реагента 1; 3 — добавление реагента 2; 4— смешивание; 5 — инкубирование; 6 —
добавление реактива 3; 7 — перенос пробы для измерения в кювету фотометра;
8 — фотометрия; 9 — расчет и распечатка результатов
189
Концепция центрифужного анализатора совместила в себе по-
следовательность, дискретность и параллельность анализа одно-
временно, поскольку в отдельные радиальные бороздки диска ро-
тора одновременно вносились пробы, реагенты для выполнения
одного и того же анализа, проводившегося параллельно в процес-
се вращения ротора.
Важным свойством многих современных автоматических ана-
лизаторов является селективность, т. е. способность выполнять для
каждой исследуемой пробы те анализы, которые введены соот-
ветствующей командой, а также возможность выполнения вне
очереди экстренно необходимых исследований (свободный дос-
туп).
Отдельные блоки автоматизированных аналитических систем
для клинико-биохимических исследований выполняют следующие
операции:
1) идентификация образца биоматериала;
2) обработка образца;
3) перенос образца и его распределение;
4) удаление белка и других интерферентов;
5) отмеривание пробы, ее перенос и распределение;
6) хранение реагентов;
7) отмеривание реагентов, их распределение;
8) фаза химической реакции;
9) измерение результата реакции;
10) обработка сигнала и хранение данных.
Идентификация образца биоматериала необходима для безус-
ловного опознания его на всех этапах аналитического процесса и
отнесения полученного результата анализа к обследуемому паци-
енту. Каждому образцу присваивается порядковый номер, кото-
рый кодируется тем или иным образом, принятым в данной лабо-
ратории. Этот код должен быть нанесен на пробирку с образцом.
Наиболее распространен штриховой код. Определенные соче-
тания штриховых линий соответствуют порядковым номерам об-
разцов. Метки со штрих-кодами можно заготавливать заранее и
присваивать образцам по мере поступления их в лабораторию.
Наряду с этим существует возможность изготовления меток с по-
мощью ручных печатающих устройств непосредственно в месте
взятия материала у пациента.
Штрих-кодами могут маркироваться упаковки реагентов, ис-
пользуемых в аналитическом процессе. Заложенная в них инфор-
мация считывается предназначенными для этого устройствами
(«световыми карандашами», лазерными штрих-ридерами).
В настоящее время существует несколько систем штрих-кодов,
и поэтому необходимо удостовериться в соответствии возможно-
стей ридера по отношению к штрих-коду, используемому произ-
водителем маркированных пробирок и упаковок реагентов. Среди
190
вариантов способов идентификации — пробирки с колпачками
разного цвета для дифференциации различных видов образцов
(с гепарином, теми или иными консервантами), код образца мо-
жет быть нанесен на колпачок; контейнеры с кодами, нанесен-
ными непосредственно на стенку пробирки; недавно предложен-
ный «матричный код», который позволяет уплотнить закодиро-
ванную информацию и может быть нанесен на различные части
контейнера с образцом; специальные держатели для пробирок с
вмонтированными в них электронными запоминающими устрой-
ствами, куда при взятии образца у пациента заносят всю необхо-
димую информацию, включая паспортные данные, локализацию
пациента в лечебном учреждении и назначенную врачом программу
лабораторных исследований. Считывающие устройства для «мат-
ричного кода», электронных чипов отличаются своим устройством
от лазерных штрих-ридеров.
Необходимость предварительной обработки образца до начала
анализа существует для аналитов, которые обычно исследуют в
плазме или сыворотке крови. Автоматизация центрифугирования
образцов крови непосредственно в моноблочном анализаторе за-
труднительна, хотя и реализована в некоторых вариантах анали-
заторов. Чаще применяют способы быстрой обработки образцов
крови до их введения в анализатор. При исследованиях в цельной
крови этап обработки образцов не нужен.
Детали устройств для тех или иных операций с образцами (как
и на последующих этапах — с пробами биоматериалов) представ-
ляют собой роботизированные аналоги приспособлений, исполь-
зуемых при ручном выполнении анализов.
Поступившие в анализатор образцы в приборах некоторых кон-
струкций затем подвергаются сортировке, т. е. группировке по виду
исследований, которые должны быть выполнены с содержащим-
ся в них материалом. Это необходимо в многопараметровых
анализаторах. Для такой сортировки в конструкцию анализатора
включают соответствующее устройство, обладающее способностью
распознавать информацию, содержащуюся в кодах пробирок с
образцами, и распределять пробирки по видам исследований. Та-
кие сортирующие устройства (сортеры) могут быть как самосто-
ятельным лабораторным прибором, так и одним из компонентов
аналитической системы. Сортеры могут быть различной пропуск-
ной способности — от нескольких десятков до тысяч пробирок
в час.
Поступившие в автоматический анализатор образцы биомате-
риалов перемещаются внутри прибора, чтобы оказаться в зоне
действия тех или иных устройств, выполняющих процедуры, не-
обходимые для обработки, дозирования и распределения проб
образца. Это перемещение осуществляется за счет продвижения
конвейерной цепи, кассет с пробирками или вращения диска,
191
в отдельных ячейках или секциях которых находятся пробирки,
содержащие образцы (рис. 8.2). При различных конструктивных
решениях в анализаторах можно размещать от нескольких десят-
ков до сотен образцов. Поскольку процесс передвижения образ-
цов занимает некоторое время, для предотвращения испарения
жидкости из сосудов, содержащих образцы, их закрывают кол-
пачками. При достижении пробиркой с образцом зоны распреде-
ления образца на отдельные порции колпачок снимается соответ-
ствующим роботизированным устройством.
Из пробирки, в которой образец был доставлен в лаборато-
рию, должны быть взяты порции сыворотки или плазмы для вы-
полнения отдельных анализов. При этом используют пробирки
небольшого объема, рассчитанные на размещение в них необхо-
димого для анализа количества исследуемой жидкости и реаген-
тов. Их конструкция должна способствовать минимизации так на-
зываемого «мертвого» объема, т. е. избыточного количества жид-
кости, нужного лишь для того, чтобы взятое для измерения
результата анализа количество жидкости было не меньше требуе-
мого. Эти «вторичные» пробирки могут быть многоразового пользо-
вания, что требует их мытья; одноразовыми, что требует их ути-
лизации после употребления; они могут формироваться непо-
средственно в приборе по мере необходимости. Материал, из ко-
торого изготовлены эти сосуды, не должен содержать компонен-
тов, способных влиять на ход реакции.
Операции сортировки образцов, откупоривания пробирок и
дозирования отдельных порций образца (аликвот) могут быть объе-
динены в одном комплексе, представляющем собой самостоятель-
ный прибор, готовящий пробы для нескольких анализаторов.
В этом приборе поступивший в лабораторию образец биоматериа-
Взятие пробы
Рис. 8.2. Схемы вариантов устройств для размещения и перемещения про-
бирок с образцами биоматериалов в автоматических биохимических ана-
лизаторах дискретного типа:
а — вращающийся диск с пробирками; б — перемещение кассет с пробирками;
в — цепь с пробирками
192
ла идентифицируется с пациентом в соответствии со штриховым
кодом, нанесенным на контейнер с образцом, с вакуумных про-
бирок снимаются крышки, из образца отбирается материал для
предварительной обработки.
Пробы автоматически загружаются во встроенную в прибор
центрифугу с охлаждением, подвергаются центрифугированию.
Проверяется объем пробы и качество биоматериала на наличие
желтушной окраски, гемолиза и липемии. Автоматически кодиру-
ются штриховым кодом и размещаются в пробонакопителе вто-
ричные пробирки, в которые дозируется автоматическими пи-
петками необходимое количество обработанной пробы из первич-
ных пробирок. Пробы сортируют, т. е. собирают в кассеты по ви-
дам исследований, готовят для переноса на автоанализаторы.
В зависимости от рабочей нагрузки лаборатории можно приме-
нять автоматические устройства для подготовки проб различной
производительности. Такие рабочие ячейки способны обработать
от 300 до 1 700 первичных пробирок с пробами за один час; на
борт устройства можно одновременно загрузить до 1 000 проби-
рок или 32 микропланшета. Считывающее приспособление может
распознавать до 256 штрих-кодов в течение 90 с.
В тех случаях, когда зона первичной обработки образцов в поме-
щении лаборатории отдалена от анализаторов, перемещение рас-
сортированных и распределенных по видам исследований проб био-
материалов можно проводить не только вручную, но и по стацио-
нарной конвейерной линии, и с помощью специальных роботов.
Следует учитывать, что для получения надежного результата проба
должна находиться в контакте с электродом примерно 20 — 30 с.
Этот интервал времени определяет скорость работы аналитическо-
го канала, оснащенного ионоселективными электродами.
Реже в автоматических анализаторах используется кулономет-
рия (система с серебряным электродом для измерения хлоридов)
и кондуктометрия (система с золотым электродом для измерения
азота мочевины).
Для предотвращения неблагоприятного воздействия на лабиль-
ные аналиты повышенной температуры и ультрафиолетового из-
лучения в приборах может быть обеспечено охлаждение образцов,
размещение их в пробирках из затемненного материала и т.д.
В тех случаях, когда белки и другие интерферирующие веще-
ства могут отрицательно повлиять на результаты анализов, в ана-
лизаторах могут быть предусмотрены устройства для диализа био-
материала через полупроницаемую мембрану или хроматографи-
ческие колонки с использованием гель-фильтрации или ионооб-
менников. В приборах, использующих средства «сухой химии»,
освобождение от интерферентов достигается за счет соответству-
ющих компонентов многослойных аналитических элементов или
с помощью фильтрующих мембран на диагностических полосках.
193
Точное дозирование порций образца, взятых для проведения
определенного анализа (проб), достигается с помощью дозиру-
ющих устройств типа шприцев или автоматических пипеток в при-
борах дискретного типа, а в проточных анализаторах — за счет
трубок со строго определенным внутренним диаметром, в кото-
рые биоматериал и реагенты подаются перистальтическим насо-
сом, причем пробы отделяются в этом потоке одна от другой пу-
зырьками воздуха.
Скорость продвижения анализируемой жидкости должна соот-
ветствовать скорости осуществления реакции, составляющей суть
аналитического процесса. Пузырьки воздуха обеспечивают также
уменьшение опасности взаимного загрязнения проб (переноса),
очищая внутренность стенок трубки от остатков предыдущей пробы.
Такую же роль играет добавление в поток жидкости поверхност-
но-активного вещества — детергента.
В дискретных анализаторах дозирующие устройства должны быть
не только отъюстированы в отношении дозируемых объемов про-
бы и реагентов, но и точно запрограммированы на промежутки
времени, необходимые для осуществления аналитических процедур
в рабочем цикле прибора. Обычно в приборах, рассчитанных на
один вид исследований, дозаторы имеют фиксированные объемы
дозирования, тогда как в многопараметровых селективных анали-
заторах дозаторы должны перенастраиваться на различные объе-
мы дозирования по вводимым командам или по заданным про-
граммам.
Для обеспечения непрерывности работы автоанализаторов со-
ответствующими объемами реактивов, предотвращения их порчи
хранение реагентов во многих из них осуществляется в холодиль-
никах, встроенных в анализаторы. Наряду с соображениями со-
хранности реактивов, не меньшее значение имеет и их рацио-
нальное использование. Хранимая партия реактивов должна соот-
ветствовать расчетной потребности в них с учетом ожидаемого
количества анализов. В наибольшей степени это относится к реак-
тивам короткого срока хранения. Естественно, что предпочтение
оказывают системам, рассчитанным на минимальные объемы проб
и, соответственно, потребляемых для их исследования реактивов.
Применение средств «сухой химии» в полностью автоматизи-
рованных системах, например для биохимического исследования
мочи, существенно влияет на конструкцию автоматического ана-
лизатора, поскольку при этом отпадает необходимость в уст-
ройствах для дозирования реактивов, их охлаждения и т. п.
Фаза химической реакции в автоматических анализаторах конст-
руктивно обеспечена по-разному. Необходимое для протекания
реакции перемешивание материала пробы с реактивами в про-
точных анализаторах осуществляется при прохождении жидкости
через спиралевидный участок трубок. При необходимости для ре-
194
акции с более высокой температурой этот участок размещают в
водяной бане с требуемым уровнем температуры, а протяжен-
ность этого участка определяется скоростью протекания жидко-
сти в сопоставлении с временем, необходимым для полного за-
вершения реакции.
В дискретных анализаторах реакция может проходить в сосуде,
в который была дозирована проба и введены растворы реактивов,
либо в специальной реакционной камере.
Перемешивание пробы с реактивами осуществляется различны-
ми способами: за счет быстрого впрыскивания реактивов в сосуд
с пробой, путем вибрации, использования механических меша-
лок, магнитного перемешивания и т. п.
Нагрев и термостатирование смеси пробы с реагентами осуще-
ствляется с помощью суховоздушной или водяной бани, специ-
ального нагревателя.
Оригинальное решение проблемы подачи реагентов было при-
менено в автоматическом анализаторе «АСА» фирмы «DuPont»,
где использовались готовые наборы реагентов в таблетированной
форме для отдельных видов анализов, упакованные в специаль-
ные пластиковые контейнеры, выполняющие последовательно
также роль реакционных сосудов, в которые вводили раствори-
тель для реактивов и пробу биоматериала, и роль кювет при фото-
метрическом измерении результатов реакции.
В центрифужном анализаторе смешивание пробы с реактивами
и перемещение смеси от центра ротора к измерительной ячейке,
расположенной на периферии, происходит в радиальных углуб-
лениях ротора под действием центробежной силы при его враще-
нии с переменной скоростью, а нагрев обеспечивается с помо-
щью воздушной бани или электрического нагревателя, размещен-
ного непосредственно на роторе.
Измерение результатов анализов можно выполнять в том же
сосуде, где проходила реакция или в специальной измерительной
кювете, в которую прореагировавшая смесь переносится током
жидкости (проточный анализатор), при вращении (центрифуж-
ный анализатор) или отбирается специальным устройством. Чаще
всего используют фотометры или спектрофотометры для измере-
ния светопоглощения прореагировавшей смеси, которое может
сопоставляться с результатами измерения холостой пробы, с ка-
либровочным материалом. В других видах исследований можно из-
мерять флюоресценцию, хемилюминесценцию, поляризацию
флюоресценции, светорассеяние, электрохимические характери-
стики и т.д.
Для исключения интерференции различных эндогенных и эк-
зогенных компонентов можно использовать бихроматическое (на
двух длинах волн) и полихроматическое (на 3—16 длинах волн
света) измерение поглощения света продуктами реакции. В случае
195
применения в анализаторе средств «сухой химии» для детекции и
измерения результатов используют отражательный фотометр.
При электрохимической детекции применяют чаще всего ион-
селективные электроды, в некоторых случаях, сопряженные с
закрепленным ферментом (определение электролитов, глюкозы,
мочевины). Измерительное устройство может быть основано на
применении биосенсора или микрочипа.
Обработка сигнала, поступающего от детектора, происходит в
микропроцессоре или компьютере, встроенном в анализатор или
сопряженном с ним. При этом в программу закладывается не только
преобразование сигнала в цифровую форму, но и сложный расчет
результатов с учетом данных калибровки прибора, показаний хо-
лостой пробы и т.д. В современных аналитических приборах мик-
ропроцессоры выполняют обширный перечень функций: текущий
контроль за функционированием отдельных блоков прибора; ста-
тистическую обработку результатов исследований; расчет средней
арифметической, среднего квадратического отклонения, коэффи-
циента вариации; распечатку контрольных карт с одновременной
интерпретацией результатов; накопление данных, полученных при
исследовании проб пациентов; объединение результатов различ-
ных исследований, выполненных для одного пациента, и пр.
Гл а в a 9
АВТОМАТИЗАЦИЯ ИММУНОХИМИЧЕСКИХ
ИССЛЕДОВАНИЙ
Автоматизация иммунохимических исследований осуществля-
ется как в форме полуавтоматических систем, перенос проб меж-
ду которыми проводят вручную, так и в полностью автоматиче-
ском варианте. В зависимости от варианта технологии — конку-
рентное или неконкурентное связывание, метод одинарных или
двойных антител, микроточечное иммуноисследование или мик-
роточечный зонд — в состав блоков автоматического анализатора
должны входить следующие устройства: распределения проб био-
материала; дозирования связывающего агента (если он заранеее
не закреплен в реакционной емкости — пробирке, лунках план-
шета); процессов отмывания.
Для детекции радиоактивной метки в радиоиммунологических
и иммунорадиометрических методах используют сцинтилляцион-
ные счетчики, в иммуноферментных методах — фотометры,
в иммунофлюоресцентных методах — флюорометры, в иммунохе-
милюминесцентных — люминометры. При использовании план-
шетов детекцию и измерение результата можно выполнять с по-
мощью вертикальной фотометрии.
Программы компьютерной обработки данных в этих приборах
особенно сложны, так как должны учитывать большое число фак-
торов и использовать калибровочную кривую Гейдельбергера—
Кендалла.
Для выполнения иммунохимических исследований в лаборато-
риях различной мощности можно использовать семейство анали-
заторов ES 33, ES 300, ES 700, позволяющих определять до
40 различных параметров, относящихся к сферам интересов ин-
фектологии, эндокринологии, кардиологии, онкологии, аллер-
гологии, акушерства. Специализированной системой для автома-
тизированного аллергологического иммуноанализа является
«UniCAP 100» (Швеция).
В случае автоматизированного иммуноферментного анализа
используют предназначенные для этих исследований автоанали-
заторы, например автоматизированную систему «OMNI» (США)
для такого анализа в планшетах, представляющую собой полно-
стью «открытый» (можно использовать наборы реактивов различ-
ных изготовителей) автоанализатор производительностью 5 план-
197
шетов в час. Одновременно можно загрузить 17 планшетов и вы-
полнить анализы по 12 методикам.
Автоматизированная система «Alpha» для планшетного анали-
за этой же фирмы тоже является полностью «открытой» систе-
мой, в которой анализ можно выполнить по 18 методикам, одно-
временно до 8 аналитов в одной пробе. На борту автоанализатора
есть холодильник для хранения конъюгатов, субстратов, конт-
рольных материалов и калибраторов, а наличие двух отсеков для
инкубации позволяет одновременно выполнять методики, требу-
ющие различной температуры инкубации. Приготовление разве-
дений проб, реагентов, смешивание субстратов выполняются ав-
томатически без вмешательства лаборанта.
Роботизированная рабочая станция «GENESIS RMP» (Швей-
цария) представляет собой полностью автоматизированную плат-
форму для подготовки проб и проведения иммуноферментного
анализа в планшетах. Она рассчитана на работу в клинико-диаг-
ностических лабораториях больниц, где требуется широкий спектр
тестов в условиях относительно невысокой загруженности; в бан-
ках крови, где в условиях короткого времени необходимо выпол-
нить ограниченный и постоянный спектр тестов; референсных
лабораториях, где нужны большие объемы анализов и высокая
производительность. Система является открытой. Все стадии им-
муноферментного анализа с ее помощью выполняются без учас-
тия человека, а внутреннее пространство аппарата изолировано
от окружающей среды. Обслуживание прибора сводится к загрузке
оператором расходных материалов и исследуемых образцов.
Автоматическим иммуноферментным анализатором для рабо-
ты с микро планшетами является система «WAAMC-2» (Франция).
В основе ее конструкции использована «механическая рука» —
высокоточный трехкоординатный робот. Система состоит из
1 — 4 технологических модулей, каждый из которых включает ав-
тосамплер, дилютор-диспенсер, шейкер-инкубатор, промыватель,
считыватель, робот-манипулятор, систему питания. Поскольку си-
стема «WAAMC-2» предназначена для выявления ВИЧ-инфекции,
в ее конструкции особое внимание уделено безопасности для пер-
сонала. Каждый модуль выполнен в виде стойки с защитным про-
зрачным кожухом, исключающим контакт оператора с биологи-
ческим материалом. Все технологические операции выполняются
в закрытом изолированном пространстве, использование однора-
зовых наконечников исключает возможность «переноса».
В иммунохемилюминесцентном автоанализаторе «Access» ис-
пользуется метод непрямой хемилюминесценции с парамагнит-
ными частицами в качестве твердой фазы (при производительно-
сти 100 тестов в час). Одномоментная загрузка прибора — 6 шта-
тивов (по 10 образцов каждый) любого перечня тестов из 24 име-
ющихся в приборе наборов реагентов, а всего с помощью прибо-
198
pa «Access» можно выполнить 49 лабораторных тестов, применяе-
мых при эндокринной, сердечно-сосудистой, онкологической,
гематологической, аллергологической, инфекционной патологии
и лекарственном мониторинге.
Автоматизированная система иммуноферментного анализа
«А1А-21» (США, Япония и Бельгия) представляет собой анали-
затор нового поколения для лигандной технологии («сэндвич» ана-
лиз одно- и двустадийный, конкурентный одностадийный имму-
ноанализ) и с использованием сухих реактивов, фиксированных
на магнитных носителях, помещенных в изолированные пласти-
ковые капсулы с конъюгатом. Пробу, разбавитель и в некоторых
случаях конъюгат добавляют в капсулу после ее прокалывания
зондом и перемешивания. Детекцию результатов реакции прово-
дят в этой же капсуле по кинетике образования флюоресцентной
метки методом двухволновой флюорометрии. Имеется режим для
срочных анализов — STAT-режим, производительность автоана-
лизатора — 120 анализов в час.
Высокие аналитические возможности иммунохемилюминесцен-
ции реализованы также в автоматическом анализаторе свободно-
го доступа «IMMULITE» (США), использующем не микроплан-
шеты, а пробирки (тест-ячейки) в качестве реакционных емко-
стей. Он широко распространен в клинико-диагностических лабо-
раториях нашей страны, хотя и относится к «закрытым» системам
(реактивы только изготовителя анализатора).
На рис. 9.1 представлена схема процесса определения в этом
приборе. Проба и реагент автоматически дозируются в тест-ячей-
ку для анализа, которая содержит покрытый специфическими
антителами шарик (рис. 9.1, а). Далее ячейку инкубируют при тем-
пературе 37 °C и постоянном встряхивании. После инкубации тест-
ячейку подвергают высокоскоростному центрифугированию в ана-
лизаторе вокруг вертикальной оси (рис. 9.1, б). Реакционная жид-
кость отсасывается в специальную камеру. В процессе нескольких
промываний с поверхности шарика и внутренней поверхности
а б в г
Рис. 9.1. Схема процесса иммунолюминесцентного определения в авто-
матическом анализаторе «IMMULITE» (пояснения в тексте)
199
пробирки удаляется весь несвязавшийся материал (рис. 9.1, в). За-
тем в ячейку добавляется хемилюминесцентный субстрат. Свет
люминесценции измеряется высокочувствительным счетчиком
фотонов (рис. 9.1, г).
Хотя производство микрочипных аналитических систем нахо-
дится еще на ранней стадии развития, тем не менее уже имеются
комбинации камеры для иммуноанализа с устройством для ка-
пиллярного электрофореза. Осуществляется стыковка нескольких
индивидуальных микрочипов, предназначенных для отдельных
аналитических процедур, в единый комплекс, представляющий
собой многоканальную аналитическую систему, способную од-
номоментно выполнять несколько видов исследований из одной
пробы биоматериала. Примером может служить многоцелевой ана-
лизатор «EVIDENCE», позволяющий одномоментно из одной
капли крови определять до 25 аналитов на одном биочипе. При
этом упрощается работа, повышается производительность, сокра-
щается общая стоимость теста.
Гл а в a 10
АВТОМАТИЗАЦИЯ МЕТОДОВ ИССЛЕДОВАНИЯ
СВЕРТЫВАЮЩЕЙ И ПРОТИВОСВЕРТЫВАЮЩЕЙ
СИСТЕМ КРОВИ
В этих приборах используются все виды аналитических техно-
логий, известных в коагулологии: клоттинговые, хромогенные и
иммунохимические.
Клоттинговые технологии основаны на образовании в ходе ис-
следования аналита сгустка фибрина и регистрации механически-
ми, оптическими или оптико-механическими методами начала
или окончания времени его образования. Так определяется актив-
ность исследуемого фактора свертывающей или противосверты-
вающей систем в каскаде процесса образования сгустка или его
лизиса.
Методы с использованием хромогенных субстратов основаны на
способности факторов свертывания проявлять ферментативные
свойства сериновых протеаз. Такими свойствами обладает тром-
бин, образующийся в ходе реакций определения протромбиново-
го времени, протеин С и др. В ходе анализа образующийся тром-
бин (или другая сериновая протеаза) вызывает гидролиз хромо-
генного субстрата в месте присоединения к полипептидной цепи
окрашенного соединения, например, 4-нитроанилина. В результа-
те не имеющий окраски субстрат (тосилглицилпролиларгинил-
4-нитроанилид) отдает в реакционную смесь отсоединившийся
от него 4-нитроанилин и раствор приобретает зеленовато-желтый
цвет, светопоглощение которого измеряется фотометрически —
кинетически или путем измерения фиксированной абсорбции.
Учитывая, что при этом параллельно вследствие образования тром-
бина (например, при определении протромбинового времени с
хромогенными субстратами) фибриноген превращается в фибрин,
вызывающий помутнение раствора, при специальном програм-
мировании коагулологических анализаторов в рамках определе-
ния одного показателя, в данном случае протромбинового време-
ни, можно определять и концентрацию фибриногена.
Иммунохимические методы на основе реакции преципитации
комплекса «антиген —антитело» с использованием антител (на-
пример, в случае Д-димера), иммобилизованных на латексных
частицах или путем иммуноферментного анализа позволяют
определять факторы свертывающей и противосвертывающей сис-
тем так, как определяют различные белки, антигены. В первом
201
случае для детекции используют лазерную нефелометрию, во вто-
ром — фотометры и фотометрические ридеры для иммунофер-
ментного анализа.
Соответственно в конструкции автоматических коагулологиче-
ских анализаторов должны быть представлены устройства или блоки
для реализации этих технологий: устройства для вращения шари-
ков в тестовых пробирках и детекторы, регистрирующие время
прекращения этого вращения в результате образования сгустка
крови; дозаторы для добавления хромогенных реагентов и фото-
метрические детекторы; комплекс устройств для иммунохимиче-
ского исследования. Примером такого прибора может служить «STA
Compact» (Швейцария), способный реализовать до 80 програм-
мируемых тестов системы свертывания, включая протромбиновое
время, факторы внешнего пути активации (II, V, VII, X), факто-
ры внутреннего пути активации (VIII, IX, XI, XII), фибриноген
и др. Производительность прибора — до 150 тестов в час, может
быть выполнено до 12 методов на одну пробу. До 1 000 анализов
выполняются в режиме walk away, т. е. без присутствия оператора
после запуска прибора в работу.
Механический способ детекции образования сгустка путем ре-
гистрации изменения (снижения вследствие повышения вязкости
пробы) амплитуды колебаний стального шарика, находящегося в
магнитном поле, в кювете на полукруглом ее дне обеспечивает
независимость результатов от окраски и оптических свойств про-
бы плазмы, в частности до концентрации гемоглобина в ней
20 г/л.
Сосуды с реактивами охлаждаются в штативе для них и про-
греваются в специальных позициях до требуемой температуры 37 °C.
Кюветы для выполнения и измерения продукта реакции загружа-
ют в рулонах по 1 000 шт. по аналогии заправки фотопленки в
фотоаппарат, а по окончании использования их сбрасывают в опе-
чатанный контейнер для обеспечения максимума безопасности и
исключения контакта с оператором. Свыше 14000 результатов мо-
жет храниться в памяти прибора. Имеются встроенные програм-
мы контроля качества с представлением статистических данных
за любой период времени (день, месяц, год).
В семействе коагулологических анализаторов «Thrombolyser
Compact», «Thrombolyser Rack Rotor», «Thrombolyser Combi» (Гер-
мания) применяется единая технология с использованием общей
кюветы, куда дозируются проба и реагенты и где они одновре-
менно инкубируются, не смешиваясь, после чего при помеще-
нии в измерительный блок и перевороте кюветы на 90° происхо-
дит их смешивание до гомогенной смеси с помощью стального
шарика (рис. 10.1). Связывание шарика с нитями фибрина позво-
ляет точно документировать время образования сгустка. Описан-
ные анализаторы относятся к автоматам дискретного типа.
202
Рис. 10.1. Схема исследования в автома-
тическом коагулологическом анализаторе
«Trombolyzer Combi»:
а — пипетирование; б — перевертывание
кюветы; в — измерение
С помощью центрифужных анализаторов семейства «ACL 100 —
7000» (США) автоматизированные коагулологические исследова-
ния выполняют в секторах роторов. Каждый из секторов заканчи-
вается измерительной кюветой. В случае измерения мутности ис-
пользуется нефелометрический способ измерения рассеяния света
луча лазера частицами под углом 90° к направлению падающего
света. Другой принцип измерения в этих анализаторах — фотомет-
рический — для методов с хромогенными субстратами. Автоана-
лизаторы для наиболее трудно автоматизируемых коагулологиче-
ских исследований — агрегации тромбоцитов (анализаторы
«Trombostat 4000» и их последующие варианты — «PFA-100»,
США) позволяют не только выявлять дефекты функции тромбо-
цитов, но и отслеживать эффекты лечения, например, ацетилса-
лициловой кислотой. Кроме того, на них в течение 10 мин опре-
деляется и время кровотечения.
Эти приборы контролируются микропроцессорами. Реакция для
каждого теста проходит в специальном картридже, компонента-
ми которого являются чашка с так называемой капиллярной ас-
самблеей, которая вставляется в специальный кожух — резервуар
для пробы. Цельная кровь с антикоагулянтом (цитрат) пипетиру-
ется в отверстие для ввода пробы.
203
После инкубации чашка, соединенная с капилляром, пере-
двигается вниз внутрь кожуха, капилляр из нержавеющей стали
пробивает мембрану, покрывающую пробу. Кровь движется вверх
по капилляру и приходит в контакт с мембраной, покрытой кол-
лагеном, адреналином, барбитуратами или АДФ. Эти вещества
стимулируют тромбоциты к прилипанию и агрегации на мем-
бране.
Таким образом, путем автоматизации коагулологических ис-
следований, появляется возможность не только упростить техно-
логию (как, например, в случае определения фибриногена в плаз-
ме) по сравнению с ручным методом, не только ускорить выпол-
нение анализа и увеличить производительность труда, но и стан-
дартизовать методы, значительно улучшить качество, повысить
надежность результатов.
Гл а в a 11
АВТОМАТИЗАЦИЯ ИССЛЕДОВАНИЯ КЛЕТОК
11.1. Автоматизированные устройства для фиксации
и окраски мазков крови
Используются два принципа: погружение мазков в краситель и
извлечение из него; опрыскивание или заливка мазков красите-
лем. Окрашенные мазки автоматически промываются дистилли-
рованной водой или фосфатным буфером и высушиваются. Дей-
ствия оператора сводятся к подготовке устройства к работе и рас-
пределению стекол с мазками в носителе. После завершения цик-
ла окрашивания мазки остаются в этом носителе или попадают в
емкость для них, а затем в камеру для высушивания в принуди-
тельном потоке воздуха. Варианты конструкции предусматривают:
линейный транспорт мазков; поточно двигающиеся платформы;
центрифужные распылители, в которых реактивы распыляются
на мазки, расположенные во вращающейся карусели.
Классическим примером полностью автоматизированной си-
стемы окрашивания мазков крови является аппарат «Нета-Тек 2000»
(США). Он обеспечивает автоматическую окраску гематологиче-
ских препаратов на стандартизованных по размеру предметных
стеклах до одинаковой глубины и отчетливости, полностью авто-
матизированное прохождение мазка через три дополняющих друг
друга этапа окрашивания с производительностью 60 мазков в час.
Вновь поступившие мазки загружаются без прерывания работы
устройства. В конце процесса окрашенные и высушенные мазки,
готовые к немедленному исследованию под микроскопом скла-
дываются в специальном ящике для хранения.
Устройство имеет ряд преимуществ: обеспечивает автоматизи-
рованное равномерное окрашивание мазков, а значит, и получе-
ние воспроизводимых результатов; автоматически регулирует все
параметры процесса окрашивания гематологических препаратов,
за исключением получения мазка крови; автоматически дозируе-
мые растворы обеспечивают точный химический баланс и опти-
мальную степень окрашивания каждого мазка крови; значительно
повышает производительность труда в лаборатории, специалисты,
занятые на данном участке работы, освобождаются для других
работ; устраняется необходимость в трудоемком приготовлении
окрашивающих и буферных растворов, так как устройство обес-
печивается специальными наборами реактивов, каждый из
которых содержит точно стандартизованные растворы уникаль-
205
ного состава; устраняется необходимость в трудоемком процессе
чистки и уборки рабочего места, попадание красителя на руки и
одежду, рабочий стол; предлагается широкий выбор режимов ок-
рашивания. Однако, приобретая это устройство, пользователю не-
обходимо учитывать некоторые особенности его применения —
стандартизованные по размерам предметные стекла, которые бы
не мешали процессу продвижения препаратов в технологической
цепочке, и реактивы от изготовителя — «закрытые», обеспечива-
ющие высокое качество окрашивания и бесперебойную работу пе-
ристальтических насосов.
Современные устройства для фиксации и окраски мазков кро-
ви имеют встроенные микропроцессоры, позволяющие програм-
мировать объемы реактивов, процедуру их розлива, временные
параметры, вносить необходимые изменения в эти параметры в
случае необходимости, наблюдать за ходом всех процессов на дис-
плее. Так, прибор «CELL-DYN SMS» (США) способен автомати-
чески выполнить все процедуры приготовления мазков крови: от-
бор крови из пробирки с образцом, нанесение мазка на пленку,
печатание там же идентификационных данных о пациенте, про-
ведение процедуры окраски по одному из 10 запрограммирован-
ных протоколов со скоростью до 120 проб в час. Некоторые вари-
анты таких приборов используются только с реактивами фирм-
изготовителей, т.е. являются «закрытыми» системами.
11.2. Автоматизация микроскопии
Автоматизация исследований клеток может быть осуществлена
несколькими способами. Принципиально новый класс микроско-
пов — автоматические микроскопы-анализаторы — самостоятельно
выполняют основные этапы исследования. В состав такого микро-
скопа-анализатора кроме цифрового микроскопа входят автома-
тические средства перемещения и фокусировки препарата (мото-
ризованные предметный стол и узел фокусировки, блок управле-
ния) (рис. 11.1). Автоматически избирается маршрут просмотра
препарата, фокусируются и обнаруживаются клетки заданных ти-
пов, контролируется качество приготовления препарата и усло-
вий наблюдения. В сравнении с ручной микроскопией есть воз-
можность значительно увеличить выборку просматриваемых кле-
ток, следовательно, повысить объективность и точность анализа,
автоматически классифицировать клетки по субпопуляциям, пред-
ставлять их на экране монитора для просмотра врачу в виде гале-
рей изображений.
При классификации лейкоцитов и эритроцитов используют
статистические параметры формы, размеров, окраски, текстуры,
полученные на основе архива из 300 000 изображений. Врач избав-
206
Рис. 11.1. Схема микроскопа-анализатора
ляется от рутинных операций по сбору выборки клеток и выпол-
няет роль эксперта. В нашей стране функции автоматизированного
микроскопа удалось реализовать для анализа мазков крови (МЕ-
КОС-Ц1, вариант 1, производительность 20 мазков в час, преду-
смотрена возможность подключения гематологического анализа-
тора), подсчета клеток крови в камере Горяева, анализа препара-
та фекалий при исследованиях в паразитологии с производитель-
ностью 15 препаратов в час (МЕКОС-Ц1, вариант 3), осадка мочи,
подсчета популяции лимфоцитов, меченных FITC, с использова-
нием компьютерных программ «Денситоморфометрия» и «Фоно-
тека».
Отечественная программа «Денситоморфометрия» предназна-
чена для того, чтобы после полуавтоматического определения
контуров объектов определять более 20 их характеристик, вклю-
чая оптическую плотность, форму, размеры, текстурные и другие
характеристики. С помощью программы «Фонотека» можно созда-
вать базы высококачественных видеоизображений, структуриро-
вать и вести документацию, а также импортировать, экспортиро-
вать, редактировать и формировать галереи изображений.
Анализ мазка крови с использованием МЕКОС-Ц1 происхо-
дит следующим образом: лаборант устанавливает мазок на пред-
метный столик автоматизированного микроскопа и нажимает
кнопку клавиатуры. Далее система начинает сканировать препа-
рат, отображая на экране монитора траекторию движения и вы-
деляя клетки заданных типов. Через 2 мин после начала сканиро-
вания препарата на экран монитора выводятся все обнаруженные
лейкоциты в виде отдельных галерей (сегментоядерных, палочко-
ядерных лейкоцитов, лимфоцитов, моноцитов, эозинофилов
и Т.Д.).
207
Если в анализируемом мазке присутствуют бластные клетки,
то после завершения просмотра они представляются в виде от-
дельной галереи под названием «прочие». В этой же галерее пред-
ставляются все случаи, связанные с нарушением технологии при-
готовления мазка и его окраски. Врач-гематолог просматривает
представленные галереи клеток и при необходимости нажатием
1 — 2 клавиш корректирует результаты автоматического анализа.
На основе автоматизированных микроскопов МЕКОС-Ц1 со-
здается автоматизированное рабочее место (АРМ) врача-гемато-
лога, в котором сочетаются исследования на гематологическом
анализаторе с микроскопическим анализом морфологии клеток
крови. Точность дифференцировки лейкоцитов с применением
АРМ врача-гематолога составляет не менее 90 %.
На просмотр лейкоцитарной формулы и при необходимости ее
коррекцию у врача уходит 30 — 40 с. Аналогичным образом про-
грамма автоматического анализа создает «эритроцитарную фор-
мулу» крови, когда в отдельные галереи выделяются микроциты,
нормоциты, макроциты и все патологические формы эритроци-
тов (каплевидные, дакриоциты, эхиноциты, сфероциты и т.д.),
морфологический анализ при этом дополняется автоматическим
построением кривой Прайс-Джонса и уникальной гистограммы
распределения эритроцитов по содержанию гемоглобина.
При исследовании эритроцитов в препарате анализируется не
менее 1 000 клеток. Точность автоматизированного анализа пара-
метров красной крови составляет не менее 99 %. Для анализа маз-
ков крови при лейкозах и подсчета миелограмм в мазках костного
мозга существует специальная программа.
Полностью автоматизированные системы для микроскопии
наряду с автоматизацией самого процесса микроскопии включа-
ют и компьютерный анализ, т. е. распознавание и классификацию
изображений. Такая система состоит из автоматизированного мик-
роскопа, в который ручным способом вносят фиксированные и
окрашенные мазки биоматериала, она сканирует препарат, фик-
сирует изображения клеток, «просеивает» изображения с помо-
щью сложной аналитической системы, основанной на принципе
«нервной сети» (neural network). Системы автоматического анали-
за изображений разработаны и для флюоресцентной микроско-
пии.
На аналогичном принципе основана работа отечественной си-
стемы автоматической микроскопии мазков периферической крови
«АСПЕК» (автоматический скрининг периферической крови).
Система может использоваться как автоматический счетчик для
выполнения гематологических анализов в клинико-диагностиче-
ских лабораториях, как исследовательская система для проведе-
ния морфометрии клеток и демонстрационная установка в учеб-
ном или экспертном процессе.
208
Другим примером автоматизированных систем анализа изобра-
жения клеток являются системы фирмы «ВидеоТесТ» (Санкт-Пе-
тербург). Система «ВидеоТесТ-Мастер (Морфология)» обеспечива-
ет преобразование и анализ изображений, полученных с помощью
цветной камеры высокого разрешения, установленной на микро-
скопе. Результаты обрабатываются статистически. Изображения и
данные могут быть сохранены в базе данных «ВидеоТесТ-Альбом».
Программа «ВидеоТесТ-Сперм» обеспечивает анализ видеоизоб-
ражений нативных эякулятов спермы и используется для изуче-
ния морфологии сперматозоидов в окрашенных мазках.
Система «ВидеоТесТ-Карио» позволяет выполнять хромосом-
ный анализ, обеспечивает ввод метафазных пластинок с микро-
скопа с помощью цифровой камеры, автоматическое кариотипи-
рование, построение кариограмм и идиограмм. «ВидеоТесТ-Под-
счет колоний» — система, предназначенная для выделения, под-
счета, измерений, идентификации колоний бактерий одного, двух,
трех, четырех типов.
Дальнейшим шагом является подключение микроскопа в си-
стему телемикроскопии для осуществления консультации у спе-
циалистов, находящихся в другом учреждении или городе.
11.3. Автоматизация проточной цитометрии
В современных технологиях гематологического анализа все шире
используются проточные анализаторы разного уровня сложности.
Но, несмотря на все достоинства, даже самые совершенные со-
временные анализаторы не могут полностью заменить микроско-
пический анализ клеток крови. Этот метод должен сохраняться на
вооружении в любой лаборатории, выполняющей гематологиче-
ские исследования, поскольку является «золотым стандартом».
Преимущества современных проточных анализаторов для под-
счета и оценки форменных элементов крови состоят в следующем:
высокая производительность (до 100—120 проб крови в час); мик-
роанализ (объем пробы — 12—150 мкл крови); анализ большого
массива (десятки тысяч) клеток; высокая точность (правильность
и воспроизводимость); большое количество одновременно опре-
деляемых и рассчитываемых параметров (более 20); графическое
представление результатов исследований (гистограммы, скето-
граммы).
Технология автоматического подсчета клеток была разработа-
на в 1947 г. братьями Култер. Метод получил название апертуро-
импедансного (или метод электрического импеданса, кондукто-
метрический метод, метод Култер).
Принцип метода. Метод основан на подсчете числа и определе-
нии характера импульсов, возникающих при прохождении кле-
8 Меньшиков 209
ток через отверстие малого диаметра (апертуру) в узкой капил-
лярной трубке диаметром порядка 100 мкм, по обе стороны от
которой расположены изолированные друг от друга электроды сети
постоянного тока. Если через этот узкий канал, заполненный элек-
тропроводящим раствором, проходит клетка крови, то в этот мо-
мент сопротивление электрическому току в канале слегка возра-
стает (рис. 11.2), это изменение улавливают современные элект-
ронные приборы. Таким образом, каждый случай прохождения
клетки через канал сопровождается появлением электрического
импульса, и для того чтобы подсчитать концентрацию клеток,
необходимо пропустить через него определенный объем суспен-
зии клеток в электропроводящем растворе и сосчитать число элек-
трических импульсов, которые при этом образуются.
Если в канале одномоментно находятся две клетки, то образу-
ется один импульс, и это приведет к ошибке подсчета клеток. Для
исключения этих ошибок пробу крови разводят до такой концен-
трации клеток, при которой в канале датчика всегда будет не бо-
лее одной клетки. При характерном диаметре канала 80 мкм и его
длине 100 мкм, объем измерительного канала получается 0,5 мм3.
В этом случае, чтобы уменьшить концентрацию клеток крови до
нужной величины, необходимо выполнить разведение крови в
25 000 раз.
Задача разделения эритроцитов и тромбоцитов в проточных
анализаторах решается путем измерения амплитуды (высоты) элек-
трического сигнала. Тромбоциты — клетки, меньшие по разме-
рам, чем эритроциты, они образуют импульсы низкой амплиту-
ды, а сравнительно большие по размерам эритроциты дают им-
пульсы высокой амплитуды. Устройство, разделяющее импульсы
Рис. 11.2. Схема работы кондуктометрического счетчика клеток: справа
вверху показаны линии прохождения электрического тока через микро-
отверстие в отсутствие клетки крови, внизу — в том случае, когда через
микроотверстие проходит клетка крови
210
К насосу
Рис. 11.3. Схема датчика объема клетки
по величине амплитуды, называется дискриминатором. В совре-
менных гематологических анализаторах встроены многоканальные
дискриминаторы. Поскольку каждый канал соответствует опреде-
ленному объему клеток (рис. 11.3), они дают детальную информа-
цию о размерах клеток в виде гистограмм (рис. 11.4).
После выделения на гистограмме зоны объемов клеток, соот-
ветствующих эритроцитам, и после суммирования данных, заре-
гистрированных по всем каналам дискриминатора, получают об-
щее количество эритроцитов (они в современных анализаторах
обозначаются аббревиатурой RBC (от англ, red blood cells)), про-
шедших через датчик. При суммировании результатов подсчета
эритроцитов, полученное в каждом канале значение умножают
Рис. 11.4. Гистограмма распределения эритроцитов по объему, получен-
ная в автоматическом цитометре: по оси абсцисс — объем клеток в фем-
толитрах; по оси ординат — число клеток; медиана — средний объем
клеток (MCV); коэффициент вариации или среднее квадратичное откло-
нение — ширина распределения (RDW)
211
на объем соответствующего канала, в результате автоматически
вычисляют объем, который занимают эритроциты в крови, т.е.
значение гематокрита НСТ. При делении величины гематокрита
на концентрацию эритроцитов получают характеристику эритроци-
тов — средний корпускулярный объем (mean corpuscular volume —
MCV). Этот показатель используют также для расчета коэффици-
ента вариации объема эритроцитов и обозначают как RDW (red
cell distribution width). Он является показателем гетерогенности
эритроцитов по объему, характеризует степень анизоцитоза. Ана-
логичным образом измеряют концентрацию тромбоцитов —
PLT(platelet), тромбокрит — PCT (platelet crit), средний объем
тромбоцитов (mean platelet volume — MPV), ширину распределе-
ния тромбоцитов по объему (platelet distribution width — PDW),
рассчитывают как коэффициент вариации тромбоцитометрической
кривой. Этот показатель количественно отражает гетерогенность
популяции тромбоцитов по объему, т. е. степень анизоцитоза тром-
боцитов.
В отличие от ручного подсчета тромбоцитов, при котором про-
водят предварительный лизис эритроцитов, в проточных гемоци-
тометрах подсчет эритроцитов и тромбоцитов выполняют в одной
камере без предварительной обработки крови. При этом возника-
ют проблемы дифференцировки больших форм тромбоцитов
(макротромбоцитов) и сравнимых с ними по объему эритроцитов
(микроцитов), их фрагментов (шизоцитов), а также отшнуровав-
шихся фрагментов цитоплазмы лейкоцитов (клеточный дебрис).
Для предупреждения подсчета одних элементов вместо других
в кондуктометрических счетчиках анализируется не только амп-
литуда электрического импульса, но и его форма. Встроенные
дискриминаторы определяют высоту электрического сигнала,
пропорциональную размеру частицы, и ширину (длительность)
импульсов. Таким образом, все импульсы, соответствующие раз-
мерам частиц от 1,8 до 30,0 фл, подсчитываются как тромбоциты.
Если амплитуда импульса превышает соответствующую размерам
30 фл, появляется сообщение «Micro RBC», либо «Macro PLT»,
при этом происходит автоматическая коррекция количества тром-
боцитов и выдается истинный результат.
Поскольку размеры эритроцитов и лейкоцитов близки, разде-
лить их по величине амплитуды электрического импульса невоз-
можно. Поэтому лейкоциты вносят некоторый вклад в подсчет
эритроцитов. Но вклад этот, за исключением явных лейкоцито-
зов, ничтожно мал, им можно пренебречь, так как в норме кон-
центрация эритроцитов в крови на три порядка выше концентра-
ции лейкоцитов. Для раздельного определения концентрации лей-
коцитов (white blood cells — WBC) и эритроцитов в крови ис-
пользуют различие свойств мембран этих клеток к действию ге-
молитиков.
212
Эритроциты легко лизируются под действием поверхностно-
активных веществ. Претерпевающие при этом некоторые измене-
ния лейкоциты остаются целыми и могут быть подсчитаны. По-
этому перед подсчетом лейкоцитов в кондуктометрических счет-
чиках, прежде, чем пропустить кровь через апертуру датчика,
к ней добавляют раствор, лизирующий эритроциты. Мелкие фраг-
менты, до которых разрушаются эритроциты, дают электриче-
ские импульсы очень низкой амплитуды и не мешают определе-
нию лейкоцитов.
Во всех современных проточных цитометрах есть возможность
для определения концентрации гемоглобина с помощью встро-
енных в них гемоглобинометров. Поэтому кроме определения кон-
центрации гемоглобина НЬ, имеется возможность рассчитать сред-
нее содержание гемоглобина в эритроците (mean corpuscular
hemoglobin — МСН) в пикограммах, которое очень важно знать
при разделении анемий на нормохромные, гипо- и гиперхром-
ные. Среднее содержание гемоглобина является более объектив-
ным показателем, чем цветной показатель, не отражающий синтез
гемоглобина в эритроците и его содержание в нем. Метод позво-
ляет рассчитать также среднюю концентрацию гемоглобина в
эритроците (mean corpuscular hemoglobin concentration — MCHC),
которая отражает истинное насыщение эритроцита гемоглоби-
ном.
Получаемую в результате проточной цитометрии информацию
можно разделить на две основные группы — параметры непосред-
ственно измеряемые на этих анализаторах, например RBC, PLT,
WBC, НЬ, и расчетные параметры, такие, как MCV, МСН,
MCHC, PCT, PCV, PCD и др.
Гистограммы распределения отдельных типов клеток крови по
размерам, которые также выдаются при этом автоматическом ана-
лизе, как и возможность получения новых параметров, по срав-
нению с ручными визуальными измерениями избавили специа-
листов лабораторий от необходимости использовать трудоемкие
методы.
С помощью автоматических счетчиков клеток крови можно не
только оценить размеры клеток, но и получить цитохимические и
другие характеристики клеток крови. Они анализируют около
10 000 клеток в одном образце и имеют несколько различных ка-
налов для подсчета клеток и определения гемоглобина.
Современные цитометры наряду с кондуктометрическим ме-
тодом могут быть оснащены устройствами для оценки рассеяния
света лазера, что дает возможность строить скетограммы, т. е. ди-
аграммы распределения клеток по их способности рассеивать свет
лазера. Это позволяет более четко выделять различные группы кле-
точных элементов, отличающиеся не только по размеру, но и по
зернистости.
213
На гистограмме клеток крови, полученной с помощью анали-
затора «Coulter STKS» (рис. 11.5), видны пики лимфоцитов, мо-
ноцитов, эозинофилов, гранулоцитов, а также «флаги» — сигна-
лы о наличии нетипичных клеток: R} — наличие ядерных эритро-
цитов, сгустков тромбоцитов, больших тромбоцитов, криоглобу-
лина, малых лимфоцитов, нелизированных эритроцитов; R2 —
реактивные лимфоциты, лимфобласты, базофилы, свертки кро-
ви; 7?з — эозинофилия, моноцитоз, бласты, сгустки крови; R4 —
гранулоцитоз.
Отечественный гематологический анализатор «МИКРОН-2000»
позволяет анализировать 21 гематологический параметр с произ-
водительностью 60 анализов в час. Для анализа требуется 20 мкл
капиллярной или 150 мкл венозной крови. Однако возможно диф-
ференцированное определение лишь трех категорий лейкоцитов —
а
Рис. 11.5. Гистограмма распределения клеток крови по объему на анали-
заторе Coulter STKS:
а — пример графического распределения лейкоцитов; б — скетограмма нормаль-
ного соотношения лейкоцитов; в — скетограмма при эозинофилии; Rt, R2, R3,
Ri — пояснения в тексте
214
гранулоцитов, лимфоцитов и клеток, промежуточных между лим-
фоцитами и гранулоцитами (средние клетки, моноциты).
Сочетание кондуктометрического принципа с применением
радиочастотного анализа, рассеивания света лазера, дифферен-
цирующих лизатов, специфического окрашивания клеток позво-
лило расширить использование автоматических анализаторов для
исследования различных клеточных элементов крови, в первую
очередь для дифференциального подсчета лейкоцитов.
На высокотехнологичных гематологических анализаторах вы-
полняется дифференцированный счет лейкоцитов по пяти основ-
ным категориям. Кроме того, эти анализаторы обладают система-
ми «сигналов тревоги». Это — сигналы, предупреждающие и кон-
центрирующие внимание оператора на наличие в образцах пато-
логических клеток.
Технологии автоматизированной цитометрии. Можно выделить
несколько типов технологий для дифференциального подсчета
клеток, лейкоцитов и лейкоцитарной формулы, реализованных в
высокотехнологичных гематологических анализаторах.
Радиочастотный анализ. При прохождении клеткой апертурно-
го отверстия в токе высокой частоты возникают сигналы, кото-
рые отражают характер внутренней структуры клетки.
Технология пероксидазного канала. Это проточная цитохимичес-
кая технология, позволяющая дифференцировать лейкоциты на
основе различной активности пероксидазы в них. Активность это-
го фермента наиболее выражена в эозинофилах и нейтрофилах,
слабую реакцию дают моноциты, в лимфоцитах она не выявляет-
ся. При этом измеряется рассеяние клетками света от луча лазера
(так определяется размер клеток) и поглощение клеткой света
(оценка активности пероксидазы в клетке).
Технология VCS — трехмерный анализ дифференциации лейкоци-
тов. Технология основана на одновременном компьютерном ана-
лизе клеток по трем направлениям: объем (volume), электропро-
водность (conductivity), дисперсия лазерного света (laser scatter).
Полученные по трем каналам данные комбинируются и анализи-
руются с помощью компьютера, в результате происходит распре-
деление клеток по дифференцировочным кластерам, и, таким
образом, лейкоциты разделяются на пять основных популяций:
лимфоциты, моноциты, нейтрофилы, эозинофилы, базофилы.
Технология MAPSS— изменение дисперсии лазерного света клет-
ками. Это многоугловая система лазерного светорассеяния, или
поляризация многоуглового светорассеяния, т. е. регистрация ин-
тенсивности светорассеяния клетками поляризованного лазерно-
го луча под разными углами. Технология компьютерного анализа
дисперсии лазерного света клетками крови применена в гемато-
логических автоанализаторах фирмы «Abbott» для дифференциа-
ции эозинофилов и базофилов. С помощью этой технологии могут
215
быть получены сведения о различных свойствах клеток и в резуль-
тате на гематологических анализаторах строятся скетограммы лей-
коцитов крови.
Технология с использованием специфического химического лизиса
лейкоцитов. Технология основана на предварительной обработке
лейкоцитов реактивами, вызывающими дифференцированный
лизис всех клеток, за исключением лейкоцитов определенной
популяции (эозинофилов или базофилов). Затем проводят диск-
риминантный анализ всех клеток по размеру и сложности струк-
туры.
Измерение флюоресценции красителей, связанных с избиратель-
ными клеточными структурами. Технология лежит в основе про-
точной цитофлюориметрии. Наибольшее применение в цитофлюо-
риметрии нашли методики распределения клеток по содержанию
ДНК и флюоресцентные метки клеток антителами (иммунофено-
типирование), которые можно применить одновременно на од-
ном образце.
В проточных цитометрах флюоресценция имеет несколько пре-
имуществ: флюоресцентное излучение прямо пропорционально
специфическим клеточным компонентам, концентрация флюо-
рохромов, используемых для исследования клетки, очень низкая,
нефлюоресцирующие соединения могут становиться флюоресци-
рующими при взаимодействии с внутриклеточными структурами
или ферментами.
Дальнейшее развитие проточная цитометрия получила за счет
сочетания трех аналитических принципов: одновременного при-
менения оптических эффектов флюоресценции, переднего (FSC)
Рис. 11.6. Схема устройства проточного цитофлюорометра:
1 — проточная камера; 2 — зона гидродинамического фокусирования; 3 — ис-
точник света; 4 — линзы; 5 — светофильтры; 6 — зеркала; 7 — фотодетектор
света флюоресценции; 8 — фотодетектор бокового светорассеяния; 9 — фото-
детектор прямого светорассеяния; 10 — электронная система обработки дан-
ных; 11 — дисплей; 12 — сортер; 13 — резервуары для разделенных клеток; 14 —
пьезоэлектрический детектор
216
и бокового (SSC) светорассеяния; метода специфического связы-
вания с использованием разнообразных моноклональных антител
при возможном одновременном связывании нескольких монокло-
нальных антител с различными антигенами одной и той же клет-
ки для более точной ее антигенной характеристики (двойное, трой-
ное, четырехточечное связывание; нанесение меток на монокло-
нальные антитела разнообразными флюорохромами, отличающи-
мися своими флюоресцентными характеристиками (многоцветная
флюорометрия) использования разных источников света, в том
числе одновременного (например, двух лазеров).
Вследствие перечисленных свойств современные проточные
цитофлюорометры значительно превосходят по своим аналити-
ческим возможностям гематологические анализаторы, предназ-
наченные для подсчета количества клеток, позволяя одновремен-
но исследовать множество клеточных популяций в одной пробе с
помощью нескольких методов и маркеров.
Принципиальная схема цитофлюорометра приведена на рис. 11.6.
Гл а в a 12
АВТОМАТИЗАЦИЯ ИССЛЕДОВАНИЙ МОЧИ
Автоматизация клинического анализа мочи основана на при-
менении приборов двух типов: автоанализаторов для исследова-
ния аналитов мочи методом «сухой химии» на полосках и авто-
анализаторов для исследования корпускулярных элементов мочи
(для анализа «осадка» мочи).
В автоанализаторах для анализа мочи с использованием «сухой
химии» на полосках для количественного измерения аналитов
используют в основном отражательную фотометрию. Примерами
таких анализаторов являются «Supertron» (Германия), «Clinitek
Atlas» (США), «Super Aution S-4220 А» (Италия), «AUTION МАХ»
(Япония). Целесообразно использовать эти анализаторы в лабора-
ториях с большим объемом исследований, при интенсивном по-
токе образцов мочи и широком спектре исследований.
Эти автоанализаторы обладают большой производительностью
(200 — 250 и более полосок в час), представляют собой «закры-
тые» системы, проводить исследования возможно на полосках для
мочи только определенного изготовителя, например в анализато-
ре «Supertron» это — полоски «Combur 10».
Задача оператора заключается в том, чтобы разместить мочу в
первичных пробирках (объем 2—10 мл) в пробонакопитель ана-
лизатора (круглый стол или штативы и др.) в зависимости от
конструкции прибора, загрузить полоски или рулоны в специаль-
ный бункер и включить прибор в работу. Анализаторы позволяют
проводить анализ 10 аналитов мочи на полосках (белок, билиру-
бин, глюкоза, кетоновые тела, кровь, лейкоциты, нитриты, от-
носительная плотность, pH, уробилиноген).
Относительную плотность определяют на основе измерения
индекса преломления света встроенным рефрактометром, как
правило, с высокой точностью и интервалом до 0,001. В автоана-
лизаторе «AUTION МАХ» нанесение мочи на полоску в отличие
от полуавтоматических анализаторов мочи выполняется путем
пипетирования точного объема мочи на каждую тестовую зону на
полоске для перечисленных аналитов. В этом случае исключается
опасность перетекания мочи с одной тестовой зоны на другую.
После необходимой инкубации мочи с реактивами тестовой зоны
анализатор считывает результат отражательным фотометром на двух
218
длинах волн. В указанных анализаторах предусмотрено определе-
ние других показателей — мутности и цветности мочи, а также
поправка на окраску так называемой «холостой» зоны (не содер-
жащей реактивов), после нанесения на нее мочи, для того чтобы
учесть цвет самой мочи и снизить влияние на результат лекар-
ственных средств или их метаболитов. Все полученные результаты
выводятся на принтер, могут быть переданы во внешний компь-
ютер или внешнюю сеть.
Некоторые анализаторы для анализа мочи на полосках могут
быть стыкованы с автоанализаторами для исследования элемен-
тов «осадка» мочи с образованием комплексной автоматической
станции для совокупности этих исследований. (Слово «осадок» в
данном случае неслучайно взято в кавычки, поскольку для рабо-
ты на этих анализаторах не требуется получение осадка мочи, ана-
лиз проводится в нецентрифугированной моче). Так, автоанали-
затор «осадка» мочи «IQ 200» (США), может быть подключен к
анализатору «AUTION МАХ» через специальное соединение. Под-
ключение дополнительного компьютера позволяет автоматически
координировать их работу. При этом к результатам по 10 аналитам
мочи, полученным при исследовании полосок, добавляются
12 показателей по исследованию корпускулярных элементов мочи.
При работе на автоматическом проточном цитофлюориметре
UF-100 имеется возможность в дополнение к результатам иссле-
дования «осадка» мочи результатов, полученных на анализаторах
«Clinitek» для анализа мочи на полосках. Память компьютеров,
которыми оснащены эти приборы, позволяет хранить данные по-
чти 1 000 пациентов, а также результаты исследования калибро-
вочных и контрольных материалов. Калибровку анализаторов вы-
полняют либо с использованием калибровочных полосок, либо
жидких калибровочных материалов. Для контроля качества исполь-
зуют контрольные полоски либо специальные контрольные мате-
риалы.
Автоматизация анализа «осадка» мочи предлагается в различ-
ных конструктивных решениях. Одно из них основано на совме-
щении процесса приготовления пробы — центрифугирования —
непосредственно с процессом микроскопического анализа осадка
в оригинальной центрифуге с центрифужными пробирками. Пос-
ледние имеют в своих стенках зоны, позволяющие осуществлять
микроскопию «осадка» без переноса пробы. Центрифуга управля-
ется микропроцессором, что обеспечивает полную воспроизводи-
мость условий подготовки проб, необходимую степень концентра-
ции «осадка» и распределение его по зоне микроскопирования.
Другой подход к автоматизации анализа корпускулярного со-
става мочи основан на проточном принципе анализа, как, на-
пример, в приборе UF-100 (рис. 12.1). При прохождении через
апертуру анализатора в потоке мочи корпускулярных элементов
219
Рис. 12.1. Принципиальная схема устройства автоматического проточного
анализатора для исследования «осадка» мочи UF 100:
1 — источник света — аргоновый лазер с длиной волны света 488 нм; 2 —
зеркала; 3 — конденсорная линза; 4 — электроды; 5 — проточная камера; 6 —
коллекторная линза; 7 — разделитель потока света; 8 — датчик проводимости; 9 —
усилитель импедансного сигнала; 10 — щель; 11 — дихроичный фильтр; 12 —
линза; 13 — фотодиод; 14 — усилитель сигнала света флюоресценции; 75—фильтр;
16 — фотоумножитель; 17 — усилитель сигнала рассеянного света
парные электроды отмечают изменение проводимости и регист-
рируется импедансный сигнал, что позволяет осуществлять под-
счет форменных элементов. Окрашенные форменные элемен-
ты, гидродинамически сфокусированные (по принципу «струя
в струе»), проходя через апертуру анализатора, пересекают луч
аргонового лазера. При этом происходит рассеяние света, что
детектируется фотодиодом (прямое светорассеяние), и возника-
ет флюоресцентное свечение, детектируемое фотоумножителем
(рис. 12.1).
Измерение трех видов сигналов дает необходимый объем све-
дений о каждом форменном элементе, а система кластерного ана-
лиза позволяет на этой основе определить тип форменного эле-
мента: эритроцит, лейкоцит, эпителиальная клетка, цилиндр или
бактерия. Система «флагов» помогает оператору быстро выделить
те образцы, которые требуют дополнительного исследования. Эти
«флаги» указывают на наличие в моче патологических цилинд-
ров, мелких округлых, дрожжеподобных клеток, кристаллов, спер-
матозоидов.
220
Результат анализа может быть представлен на экране монитора
в графической форме в виде гистограмм и скетограмм и в цифро-
вой форме с отметкой данных, выходящих за пределы нормы. Та
же информация может быть распечатана. Производительность ана-
лизатора — до 100 проб в час. Имеется встроенная программа кон-
троля качества, результаты анализа 1 000 проб мочи пациентов
хранятся в памяти анализатора.
Автоматизированная система для комплексного исследования
мочи «900UDx Urine Pathology System» состоит из трех модулей,
выполняющих химическое исследование с помощью диагности-
ческих полосок, определение относительной плотности мочи и
микроскопию ее осадка. При протекании мочи в непрерывном
потоке через проточную ячейку микроскопа проводится запись
видеоизображений корпускулярных компонентов осадка, которые
обрабатываются компьютером, классифицируются и выводятся на
экран монитора для окончательного подтверждения оператором.
С этими данными автоматически сопрягаются результаты хими-
ческого анализа и определения относительной плотности, что в
совокупности дает полную картину исследования мочи. Приборы
этого типа рассчитаны на выполнение от 50 до 1 000 анализов
мочи в день.
Одна из последних версий аналогичной системы для автомати-
ческого анализа «осадка» мочи основана на подключении к авто-
анализатору «AUTION МАХ» автоматического анализатора «осад-
ка» мочи «IQ 200». Производительность «IQ 200» — 60 анализов в
час, измеряемые аналиты (пока их 12) — эритроциты, лейкоци-
ты, лейкоцитарные сгустки, гиалиновые цилиндры, другие пато-
логические цилиндры, клетки плоского эпителия, клетки несква-
мозного эпителия, слизь, сперматозоиды, бактерии, грибы, кри-
сталлы. Существует возможность выполнять срочные анализы. При
исследовании для каждого образца автоматически создается сор-
тированный архив всех найденных элементов мочи вместе с их
микрофотографиями.
Гл а в a 13
АВТОМАТИЗИРОВАННЫЕ СИСТЕМЫ УПРАВЛЕНИЯ
В КЛИНИКО-ДИАГНОСТИЧЕСКОЙ ЛАБОРАТОРИИ
В различных отраслях медицины создаются и используются
информационные системы. Области их применения широки и
многогранны — от форм государственной отчетности, автомати-
зированных рабочих мест до экспертных систем, баз данных и
принятия управленческих решений.
Медицинские информационные системы (МИС). В широком
смысле это форма организации в медицине, объединяющая в про-
цессе деятельности медицинских работников, математиков, тех-
ников с комплексом технических средств и обеспечивающая сбор,
хранение, обработку, анализ и выдачу медицинской информации
различного профиля в процессе решения задач, а в узком смысле —
это комплекс математических и технических средств, обеспечи-
вающих сбор, хранение, переработку и выдачу медицинской ин-
формации в процессе решения задач клинической медицины
или здравоохранения в целом.
Целью создания любой медицинской информационной систе-
мы является облегчение и упорядочение работы с потоками ме-
дицинской информации, интенсификация использования ресур-
сов здравоохранения при одновременном улучшении качества
медицинской помощи и в конечном счете — снижение предотв-
ратимых потерь активной и потенциальной жизни населения.
Основными качествами, которыми должна обладать любая ме-
дицинская информационная система, являются следующие:
надежность — защищенность данных как от аппаратных сбоев,
так и от неправильных действий пользователей;
удобство применения при эксплуатации — полнота, наглядность,
дружественность интерфейса по отношению к пользователю;
универсальность — гибкость, модифицируемость, наращивае-
мость;
целостность — способность системы выполнять определенный
организационно и функционально логичный круг вопросов;
открытость — способность системы к обмену информацией с
другими системами;
эффективность — характеризует степень удовлетворения по-
требностей пользователя в обработке данных с учетом затрат эконо-
мических, человеческих и вычислительных ресурсов;
222
корректность — полнота реализации заданных функций, доста-
точность их описания в программной документации, однознач-
ность и непротиворечивость описаний;
оперативность — способность системы обрабатывать данные в
приемлемые для пользователя сроки.
Выделяют четыре класса медицинских информационных сис-
тем (С. А. Гаспарян, 1986).
I. Технологические медицинские информационные системы
(ТИМС).
II. Банки медицинских информационных медицинских служб
(БИМС).
III. Статистические медицинские информационные системы
(СИМС).
IV. Научно-исследовательские медицинские системы (НИМС).
В основу этой классификации положен функционально-целе-
вой принцип формирования массивов. Классы выделены по сле-
дующим признакам: объект описания, пользователь, степень аг-
регации информации, решаемая социальная задача.
Технологические МИС. Для данных медицинских информацион-
ных систем объектом описания является человек (пациент), пользо-
вателем — медицинский работник, информация интегрируется
на уровне одного пациента, решаемой социальной задачей — обес-
печение автоматизации процесса сбора и обработки информации
для диагностики.
В свою очередь технологические медицинские информацион-
ные системы подразделяются: на автоматизированные системы
клинико-лабораторных исследований — АСКЛИ; автоматизиро-
ванные системы консультативно-вычислительной диагностики —
АСКВД; автоматизированные системы постоянного интенсивно-
го наблюдения — АСПИН; автоматизированные системы профи-
лактических осмотров населения — АСПОН.
Банки информации медицинских служб. Социальной задачей ме-
дицинских информационных служб является информационное
обеспечение управления лечебно-диагностическим процессом на
уровне лечебных учреждений и медицинских служб. Различают банки
медицинской информации лечебного учреждения (БМИЛУ)
и банки медицинской информации специализированных служб
(БМИСС).
Банки медицинской информации лечебного учреждения обес-
печивают:
сбор, накопление, хранение информации по медицинскому
обслуживанию пациентов на уровне лечебного учреждения (по-
ликлиники, больницы и т.д.), что создает уникальные возможно-
сти формирования, использования и постоянного пополнения ста-
тистической базы для медико-демографического и экономичес-
кого анализа (данные заболеваемости по законченному случаю,
223
временная утрата трудоспособности, динамика инвалидности и
инвалидизация, оценка стоимости по любым группам);
автоматизацию всех управленческих функций, связанных с
обслуживанием данного пациента.
Банки медицинской информации специализированных служб
обеспечивают формирование специализированных автоматизиро-
ванных регистров (как персонифицированных, так и деперсони-
фицированных), например пострадавших при аварии в г. Черно-
быле, страдающих сахарным диабетом, онкологических больных,
больных туберкулезом и т.д.
Статистические МИС. Для данных систем объект описания —
различный (популяция, социальные институты, экологические
объекты), пользователь — руководители органов управления здра-
воохранением, социальная задача — информационное обеспече-
ние процесса управления здравоохранением на административ-
но-территориальном и государственном уровне, степень агрега-
ции информации — по совокупности и территориям.
Научно-исследовательские МИС. К этой группе относятся авто-
матизированные системы научной медицинской информации
(АСНМИ), организационные научно-исследовательские медицин-
ские системы (НИСОТ), системы автоматизации медико-биоло-
гических исследований (САМБИ).
Выделяют следующие основные стадии жизненного цикла ме-
дицинских автоматизированных систем: разработка или приобре-
тение готовой системы; внедрение системы; сопровождение про-
граммного обеспечения; эксплуатация; демонтаж системы.
Применяют специальные термины. Под сетью понимают сово-
купность компьютеров, которые могут быть связаны между собой
и разделять общие периферийные устройства (такие, как жесткие
диски и принтеры).
Локальная сеть — это сеть, размещенная на ограниченной тер-
ритории. Компьютер, подключенный к локальной сети, называ-
ют рабочей станцией или сервером в зависимости от задач, решае-
мых на нем. Под сервером понимают комбинацию аппаратных и
программных средств, которая служит для управления сетевыми
ресурсами общего доступа. Он обслуживает другие станции, пре-
доставляя общие ресурсы и услуги для совместного использова-
ния. В сетях с выделенным сервером в основном именно ресурсы
сервера, чаще всего дисковая память, доступны всем пользовате-
лям. Серверы, разделяемым ресурсом которых является дисковая
память, называют файл-серверами.
Каждый компьютер в локальной вычислительной сети (ЛВС)
должен иметь сетевой адаптер, который позволяет ему взаимо-
действовать с другими устройствами в сети. Среди локальных вы-
числительных сетей на базе персональных компьютеров различа-
ют сети с выделенным сервером (централизованным управлени-
224
ем) и одноранговые сети. В последнем типе сетей при совместном
использовании информации каждая станция может выступать и
как клиент, и как сервер. Одноранговые локальные вычислитель-
ные сети достаточно дешевы и просты в обслуживании, но не
могут обеспечить должной защиты информации при большом раз-
мере сети. Локальные сети с выделенным сервером имеют хоро-
шие средства обеспечения безопасности данных и возможности
для расширения, однако требуют постоянного квалифицирован-
ного обслуживания.
Эффективно использовать возможности локальных сетей мож-
но при использовании приложений, реализованных в модели «кли-
ент-сервер». В них работа по обработке данных распределена между
клиентской и серверной частью. В этом случае один (реже несколь-
ко) наиболее мощных компьютеров сети конфигурируют как сер-
веры приложений, на которых устанавливают серверную часть. Раз-
деляемым ресурсом сервера приложений является процессор. Кли-
ентская часть приложения на рабочей станции формирует запро-
сы, которые выполняются на сервере приложений. После этого
результаты передаются обратно на рабочую станцию, где и обра-
батываются в дальнейшем.
Автоматизированные системы в клинико-диагностических ла-
бораториях. Лабораторные данные являются одной из основных
составляющих диагностической информации как по объему объек-
тивных данных, так и по значимости в распознавании патологи-
ческого процесса, мониторинге и оценке эффективности лечеб-
ных мероприятий. По официальным документам Министерства
здравоохранения и социального развития РФ около 80 % инфор-
мации, используемой в диагностическом процессе, являются дан-
ными лабораторных исследований.
В мире ежегодно расходуется около 20 млрд долл, на лаборатор-
ную диагностику, поскольку она несет около 70 % диагностической
информации.
Клинические лабораторные исследования выполняются с по-
мощью аналитических технологий, основанных на различных прин-
ципах детекции и измерения содержания аналитов во многих видах
биологических жидкостей. Наряду с анализами, проводимыми руч-
ными методами, в современных клинико-диагностических лабора-
ториях используются полуавтоматические аналитические системы,
полностью автоматизированные анализаторы, микроскопы с си-
стемами анализа изображений, проточные автоматические ци-
тофлюорометры, автоматические многоцелевые анализаторы.
Рациональным средством обеспечения четкого функциониро-
вания всего лабораторного механизма, особенно при необходи-
мости выполнения значительного числа исследований, являются
автоматизированные системы управления лабораториями — ла-
бораторные информационные системы (ЛИС).
225
По мнению ведущих европейских специалистов (31 страна)
среди новых разработок, которые будут внедрены в лаборатории
больниц в ближайшие годы, ведущее место занимает проблема
применения информационных сетей в больницах. Лишь примене-
ние полимеразной цепной реакции при генетических заболевани-
ях и в микробиологии по своей актуальности для практической
клинической диагностики сопоставимо с данной проблемой.
Основными задачами, решение которых должно обеспечить
создание и внедрение автоматизированных систем в лаборатории,
являются:
обеспечение единой схемы работы с образцами биоматериалов
при их поступлении в лабораторию и проведении анализов (чет-
кая идентификация с пациентом, исключение ошибок неверной
адресации результатов исследования, обеспечение точного выпол-
нения врачебных запросов на анализы);
обеспечение сбора всех видов лабораторных результатов, полу-
ченных как ручными, так и автоматизированными методами, при-
менительно к одному пациенту;
обеспечение контроля качества исследований в соответствии с
нормативными требованиями.
Выделяют следующие направления в создании автоматизиро-
ванных систем клинических лабораторий:
1) создание базового программно-аппаратного комплекса, обес-
печивающего автоматизацию следующих функций — сбора зая-
вок на исследования и необходимого информационного сопро-
вождения; сбора результатов и производных расчетных значений;
оценки полноты и качества выполненных исследований (опыт
авторов); выдачи информации клиницисту в кратчайшие сроки и
в оптимальном для восприятия виде; создание программ, обеспе-
чивающих ведение баз данных результатов исследований и орга-
низацию анализа полученных данных; создание баз данных для
принятия административно-хозяйственных решений;
2) создание компьютерных систем, обеспечивающих интегра-
цию в единую сеть автоматизированных систем различных струк-
турных подразделений лабораторной службы и их интеграцию в
системах более высокого уровня;
3) разработка средств генерирования качественно новой диаг-
ностической информации — создание компьютерных систем ин-
терпретации лабораторных данных (лабораторного диагноза); со-
здание систем, автоматизирующих сканирование изображения и
распознавание образа.
В лечебных учреждениях можно использовать различные авто-
матизированные рабочие места (АРМ врачей-специалистов, АРМ
врача-медицинского статистика, АРМ главного врача, АРМ ла-
боранта и т.д.). АРМ — это рабочее место специалиста, осна-
щенное средствами вычислительной техники и программными
226
комплексами для сбора, хранения, медицинской информации,
используемой им в качестве интеллектуального инструмента в при-
нятии диагностических и тактических решений. Автоматизирован-
ные рабочие места позволяют оперативно использовать необхо-
димую информацию для подготовки справок, отчетов, и разра-
ботки проектов решений.
При создании автоматизированных систем клинических лабо-
раторий блок выполняемых в лаборатории задач дробится на со-
ставные части с соотнесением с конкретным автоматизирован-
ным рабочим местом (АРМ). В результате создается совокупность
таких рабочих мест с различным функциональным содержанием.
Кроме того, возможно существование нескольких однотипных АРМ
по числу соответствующих рабочих мест. Например, в лаборато-
рии клинической диагностики Российского научного центра хи-
рургии Российской академии медицинских наук (РНЦХ РАМН)
в рамках автоматизированной рабочей группы (АРГ) «Гематоло-
гия» функционируют следующие АРМ: «Регистратор» (1 рабочее
место), «Лаборант» (1 рабочее место), «Врач» (3 рабочих места)
(рис. 13.1).
В лаборатории клинической диагностики РНЦХ РАМН при
создании АРГ «Гематология» за тремя разнотипными рабочими
местами закреплены перечисленные далее функции.
Рис. 13.1. Автоматизированные рабочие места в клинико-диагностиче-
ской лаборатории
227
1. «АРМ регистратора»:
прием и маркировка биологических проб;
идентификация проб по базе данных и присвоение рабочего
номера;
ввод дополнительной информации;
формирование заданий на рабочие места: спектр, приоритеты;
плановая и экстренная печать результатов и журналов.
2. «АРМ лаборанта»:
прием заданий на исследования с АРМ регистратора;
автоматический ввод результатов с двух восьмипараметровых
счетчиков крови;
ручной ввод СОЭ;
контроль качества исследований.
3. «АРМ врача»:
прием и распределение заявок с АРМ регистратора;
прием аналитической информации с АРМ лаборанта (данные
автоанализаторов, СОЭ и контроля качества);
подсчет формулы крови;
оценка аналитических данных по карте динамики; минималь-
ной или расширенной клинической информации; корреляции с
другими лабораторными данными;
управление технологическим процессом — повторные измере-
ния или забор крови; контроль полноты исследований; утвержде-
ние результатов; управление информационными потоками;
формирование и анализ научно-исследовательской базы;
создание административных и статистических отчетов.
Следует отметить, что медицинский технолог и медицинский
лабораторный техник могут осуществлять деятельность на рабо-
чем месте регистратора и лаборанта.
Внедрение автоматизированных систем в практику лаборато-
рий позволяет исключить ошибки при регистрации материала (не-
верное прочтение фамилии, номера истории болезни или амбу-
латорной карты и т.п.), при неверном написании результатов до-
врачебного этапа лаборантом; расширить возможность контроля
врачом результатов исследований по корреляции данных с ре-
зультатами, полученными во всех структурных подразделениях
лаборатории.
Развитие лабораторной медицины сопряжено с формирова-
нием субдисциплин, а в лабораторной службе — с выделением
соответствующих специализированных лабораторных структур.
В настоящее время существуют специализированные биохими-
ческие, цитологические, микробиологические и другие лабора-
тории.
В клинико-диагностических лабораториях крупных учреждений
могут выделяться специализированные группы или отделы. Это
диктуется необходимостью углубленной разработки специальных
228
дифференциально-диагностических задач, что сопряжено с ис-
пользованием специфического оборудования и профильной ори-
ентацией знаний персонала. Такая специализация является есте-
ственным следствием и необходимым условием поступательного
развития лабораторно-диагностической службы. Однако обратной
стороной подобной специализации является раздробленность ла-
бораторной службы, и фрагментация информационных потоков,
что неизбежно ведет к снижению качества диагностической ин-
формации.
Лабораторная информация в конечном счете должна интегри-
роваться по каждому пациенту, так как для оценки его состояния
важно знать не только гематологические или биохимические па-
раметры, а всю совокупность лабораторных данных; кроме того,
важно сопоставлять результаты различных тестов.
Одним из средств интеграции лабораторной информации яв-
ляется создание автоматизированных систем и ведение единой базы
результатов лабораторных исследований с выдачей их по каждому
пациенту, с возможностью доступа в любой момент времени к
результатам исследований других подразделений (для сопоставле-
ния и анализа). Технически данная задача может решаться различ-
ными путями: созданием локальных сетей в каждом подразделе-
нии и интеграцией их в единую сеть лабораторной службы, созда-
нием сети лабораторной службы с автоматизированными рабочи-
ми группами, соответствующими каждому подразделению, без
локальных сетей в каждом подразделении и т.д.
Автоматизированная система лаборатории должна представлять
собой законченную подсистему по отношению к сети лечебного
учреждения, в состав которого входит данная лаборатория. В та-
ком случае существует возможность автономного функциониро-
вания лаборатории при неполадках в сети лечебного учреждения
или прекращении функционирования сети по другим причинам,
а также модификации и расширения системы независимо от ос-
тальной сети.
В формате одной из подсистем единой компьютерной сети ле-
чебного учреждения лабораторная информационная система обес-
печивает взаимодействие лаборатории с клиническими подразде-
лениями, лечащими врачами, позволяет проводить учет клини-
ческой информации на рабочем месте специалистов лаборатории,
а также просматривать в электронном виде информацию различ-
ных диагностических подразделений для сопоставления с лабора-
торными результатами по данному пациенту.
Недостаточно лишь выдавать полученные значения тех или
иных параметров в отделения. Оптимальна следующая организа-
ция связи (в условиях наличия сети лечебного учреждения и ав-
томатизированной системы лаборатории или локальной сети ла-
боратории):
229
1) клиницист ставит задачу в терминах тех состояний, кото-
рые необходимо дифференцировать у пациента, или того диагно-
стического заключения, которое надо подтвердить или отвергнуть;
2) данная заявка автоматически поступает в лабораторию, где
врач клинической лабораторной диагностики определяет спектр
исследований, которые необходимо выполнить. На данном этапе
возможно существование экспертной системы, предлагающей уже
готовые решения, которые врач клинической лабораторной диаг-
ностики или выбирает, или дополняет, или отвергает и назначает
свои (в условиях грамотно разработанной системы число таких
случаев должно стремиться к нулю);
3) в лаборатории выполняют соответствующие исследования,
причем результаты с приборов автоматически передаются в свя-
занный с анализатором компьютер;
4) на основании полученных результатов лабораторных пока-
зателей врач клинической лабораторной диагностики формули-
рует заключение о наличии того или иного состояния в терминах
лабораторных синдромов у пациента. На данном этапе также воз-
можно использование экспертной системы или автоматизирован-
ной диагностической системы, использующей другой метод по-
строения алгоритма диагностики. Возможно также наличие не-
скольких диагностических систем с различными методами пост-
роения алгоритма диагностики и их использование в зависимости
от решаемой диагностической проблемы;
5) на основе полученной из лаборатории информации, кото-
рую врач в случае готовности результатов просматривает на своем
рабочем месте (средствами АРМ данного специалиста), а также
учитывая клиническую картину и результаты инструментальных
методов исследования, врач-клиницист формирует диагно-
стическое заключение и назначает лечение.
Таким образом для организации эффективной связи «клини-
ка—лаборатория—клиника» невозможно обойтись без использо-
вания в повседневной практике автоматизированных систем.
Контроль качества лабораторных исследований в рамках авто-
матизированной системы лаборатории. Контроль качества лабора-
торных исследований представляет собой многостадийный про-
цесс, требующий на каждом этапе значительного количества вы-
числений и выполняемый по каждой из методик, применяемых в
лаборатории.
Внутрилабораторный контроль качества для каждой из мето-
дик включает три последовательные стадии: оценку внутрисерий-
ной воспроизводимости (прецизионности) методики; оценку си-
стематической погрешности и общей воспроизводимости (преци-
зионности) методики, построение контрольных карт; проведе-
ние оперативного (текущего) контроля качества результатов ла-
бораторных исследований в каждой аналитической серии.
230
Компьютерные программы позволяют более рационально вы-
полнять контроль качества.
Во-первых, при проведении контроля качества в расчетах фи-
гурирует большое количество измеренных лабораторных показа-
телей. В случае использования компьютерных программ можно
применять два способа введения данных показателей: вручную,
т.е. с клавиатуры, и автоматически — с приборов. Оптимальным
является второй способ, так как при первом происходит неэф-
фективная трата времени сотрудников лаборатории.
Во-вторых, на основной стадии (стадия 3) внутрилаборатор-
ного контроля качества с использованием построенных конт-
рольных карт проводят оперативный (текущий) контроль каче-
ства. Наиболее рационально получение врачом сообщений в ре-
жиме on-line, а не ретроспективно; более наглядна графическая
иллюстрация.
В-третьих, необходима возможность проведения контроля ка-
чества с использованием разных подходов: по контрольным мате-
риалам (как аттестованным, так и неаттестованным); слитой сы-
воротке; контроль воспроизводимости по дубликатам контрольного
материала или проб пациента; контроль правильности по ежед-
невным средним данным (с использованием только результатов
измерения проб пациента) и выбор пользователем требуемого ему
в каждой конкретной ситуации подхода. Решение этих задач вы-
полняют, используя компьютерную программу.
I
Печать | Д Закрыть, <-| ->| Серия: 11 Дата- 30.11.03 I0 Г
Рис. 13.2. Диалоговое окно пользователя программы КК-ЛАБ с постро-
енной контрольной картой, сформированным заключением по параметру
«общий белок»
231
На рис. 13.2 приведен пример контрольной карты, созданной с
помощью программы для выполнения внутрилабораторного кон-
троля качества (КК-ЛАБ), созданной в лаборатории клинической
диагностики РНЦХ РАМН.
Развитие автоматизированных лабораторных технологий тре-
бует соответствующей подготовки и компьютерной грамотности
от всего персонала лаборатории — врачей, медицинских техноло-
гов, медицинских лабораторных техников.
Контрольные вопросы
1. Какая существует классификация средств лабораторного анализа в
зависимости от участия лабораторного специалиста в аналитическом
процессе?
2. Как классифицируют автоанализаторы в зависимости от конструк-
ции?
3. Каким образом реализуются этапы выполнения автоматизирован-
ных биохимических исследований? Приведите примеры для различных
автоанализаторов?
4. Какие «закрытые» и «открытые» иммунохимические автоанализа-
торы вам известны?
5. В каких исследованиях целесообразно применять иммунохимиче-
ские автоанализаторы?
6. Какие принципы детекции используются в иммунохимических ав-
тоанализаторах?
7. Перечислите основные технологии, выполняемые на автоматиче-
ских и полуавтоматических коагулологических анализаторах. В чем их суть?
8. Какие дискретные и центрифужные анализаторы используют для
определения факторов свертывающей и противосвертывающей систем
крови?
9. Какой автоматический анализатор исследования агрегации тромбо-
цитов вам известен?
10. Какие принципы лежат в основе автоматизации устройств для
приготовления мазков крови?
11. Расскажите об автоматизированной микроскопии. Как устроены
анализаторы изображений?
12. Объясните принцип метода Култер. Какое значение он имеет для
развития проточной цитометрии?
13. Какие вам известны технологии дифференцированного подсчета
клеток и лейкоцитарной формулы на гематологических автоанализато-
рах?
14. Какие автоанализаторы мочи в зависимости от их назначения вам
известны? Расскажите об их устройстве и принципах работы.
15. Какие особенности имеет конструкция анализаторов компонентов
«осадка» мочи?
16. Что входит в понятие «автоматизированное рабочее место»?
17. Как взаимосвязаны автоматизированные рабочие места в лабора-
тории?
232
18. Что представляет собой лабораторная/информационная система
(ЛИС)?
19. Какие функции выполняет лабораторная информационная систе-
ма на этапах лабораторной работы? Какие преимущества имеет ЛИС?
20. Каким образом лабораторная информационная система связана с
общей компьютерной сетью всего лечебного учреждения?
СПИСОК ЛИТЕРАТУРЫ
Балаховский И. С. Белковые фракции / И. С. Балаховский, Э. Г.Лар-
ский; под ред. В. В. Меньшикова // Руководство по клинической лабора-
торной диагностике. — М.: Медицина, 1982. — С. 150— 163.
Долгов В. В. Фотометрия в лабораторной практике / В. В. Долгов,
Е.Н. Ованесов, К.А. Щетникович. — СПб. : Витал Диагностике, 2004. —
192 с.
Егорова О. В. С микроскопом на «ты» / О. В. Егорова. — СПб.: Интер-
медика, 2000. — 324 с.
Исследование системы крови в клинической практике / под ред.
Г.И. Козинца, В. А. Макарова. — М.: Триада-Х, 1997. — 537 с.
Камышников В. С. Справочник по клинико-биохимической диагно-
стике : в 2-х т. / В. С. Камышников. — Минск : Беларусь, 2000.
Клиническая лабораторная аналитика :5т.: руководство / под ред.
В. В. Меньшикова. — М.: Лабпресс, 2002. — 856 с.
Лабораторные методы исследования в клинике : справочник / под
ред. проф. В. В. Меньшикова. — М.: Медицина, 1987. — 368 с.
Лабораторная гематология / [С. А. Луговская и др.]. — М.: ЮНИМЕД-
Пресс, 2002. — 115 с.
Медицинские лабораторные технологии: справочник: в 2 т. / А. И. Кар-
пищенко. — СПб.: Интермедика, 1998.
Меньшиков В. В. Анализ по месту лечения / В. В. Меньшиков. — М. :
ЮНИМЕД-Пресс, 2003. - 159 с.
Общая санитария и санитарная микробиология с техникой микробио-
логических исследований / А. С.Лабинская, Л. П. Блинкова, А. С.Ещи-
на; под ред. А.С. Ещиной. — М.: Медицина, 2004. — 576 с.
Потемкина Е. Е. Пособие по клинической лабораторной иммуноло-
гии / Е. Е. Потемкина, Р.З. Позднякова, Л. М. Манукян. — М. : Изд-во
Российского университета дружбы народов, 2003. — 311 с.
Почтарь М. Е. Цитохимическая диагностика в лабораторной гемато-
логии : методическое руководство / М.Е. Почтарь, С.А. Луговская,
В.Т. Морозова. — СПб.: Атлас, 2003. — 91 с.
ОГЛАВЛЕНИЕ
Предисловие................................................3
Введение...................................................4
РАЗДЕЛ I
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ В ЛАБОРАТОРНОЙ
АНАЛИТИКЕ
Глава 1. Оптические методы детекции и количественного
определения аналитов в биоматериалах...................... 7
1.1. Методы фотометрии.................................. 7
1.2. Нефелометрические методы...........................33
1.3. Люминесцентный анализ..............................37
1.4. Эмиссионные спектральные методы....................45
Глава 2. Электрохимические методы детекции и количественного
определения аналитов в биоматериалах......................54
2.1. Потенциометрия.....................................54
2.2. Полярография.......................................59
2.3. Кулонометрия.......................................65
2.4. Кондуктометрия.....................................65
2.5. Субстратно-селективные электроды...................66
РАЗДЕЛ II
ФИЗИКО-БИОЛОГИЧЕСКИЕ ТЕХНОЛОГИИ
Глава 3. Технологии с использованием специфической активности
ферментов.................................................68
3.1. Ферменты как объекты клинико-лабораторных
исследований.........................................68
3.2. Ферменты как аналитические реагенты................80
Глава 4. Методы, основанные на специфическом связывании
веществ лигандами (лигандные технологии)..................85
4.1. Основные положения и принципы
методов.................................................85
4.2. Характеристика методов.............................89
4.3. Приборы и оборудование для лигандных технологий....ПО
235
4.4. Области применения методов, основанных
на специфическом связывании в клинической
лабораторной диагностике.................................116
Глава 5. Молекулярно-биологические технологии.............118
5.1. Основные положения и принципы
методов..................................................118
5.2. Полимеразная цепная реакция........................119
5.3. Лигазная цепная реакция............................132
5.4. Другие молекулярно-биологические
технологии...............................................133
5.5. Технологии биочипов................................134
5.6. Области применения молекулярно-биологических
технологий...............................................136
Глава 6. Микроскопия......................................138
6.1. Принцип действия и устройство
микроскопа...............................................138
6.2. Приборы и оборудование для микроскопии....;........142
6.3. Преаналитический этап при микроскопическом
исследовании клеток......................................146
6.4. Цитохимические методы при микроскопии..............150
6.5. Анализаторы изображения............................153
Глава 7. Технологии и средства анализа
по месту лечения..........................................155
7.1. Общие принципы методик.............................155
7.2. Применение диагностических полосок
для общеклинического анализа мочи........................157
7.3. Технологии «сухих тестов» для исследований крови
и других биологических жидкостей ........................164
7.4. Картриджные технологии.............................180
7.5. Приборы и оборудование для анализа
по месту лечения.........................................182
7.6. Области применения технологий и средств
для анализа по месту лечения в клинической
медицине.................................................184
РАЗДЕЛ III
АВТОМАТИЗАЦИЯ
КЛИНИКО-ДИАГНОСТИЧЕСКИХ
ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
Глава 8. Автоматизация биохимических исследований.........188
Глава 9. Автоматизация иммунохимических
исследований..............................................197
Глава 10. Автоматизация методов исследования свертывающей
и противосвертывающей систем крови........................201
Глава 11. Автоматизация исследования клеток...............205
236
11.1. Автоматизированные устройства для фиксации
и окраски мазков крови.................................205
11.2. Автоматизация микроскопии............................206
11.3. Автоматизация проточной цитометрии...................209
Глава 12. Автоматизация исследований мочи....................218
Глава 13. Автоматизированные системы управления
в клинико-диагностической лаборатории........................222
Список литературы............................................234
Учебное издание
Лукичева Татьяна Ивановна,
Меньшиков Вадим Владимирович,
Михайлов Юрий Евгеньевич,
Берсенева Евгения Александровна
Клинико-лабораторные аналитические
технологии и оборудование
Учебное пособие
Редактор Н. В. Шувалова .
Технический редактор О. Н. Крайнова
Компьютерная верстка: В.А.Крыжко
Корректоры В. М. Малек, Л. В. Гаврилина
Изд. № 101112627. Подписано в печать 19.10.2006. Формат 60x90/16.
Гарнитура «Таймс». Печать офсетная. Бумага тип. № 2. Усл. печ. л. 15,0.
Тираж 3 000 экз. Заказ № 18213.
Издательский центр «Академия», www.academia-moscow.ru
Санитарно-эпидемиологическое заключение № 77.99.02.953.Д.004796.07.04 от 20.07.2004.
117342, Москва, ул. Бутлерова, 17-Б, к. 360. Тел./факс: (495)330-1092, 334-8337.
Отпечатано в ОАО «Саратовский полиграфический комбинат».
410004, г. Саратов, ул. Чернышевского, 59. www.sarpk.ru