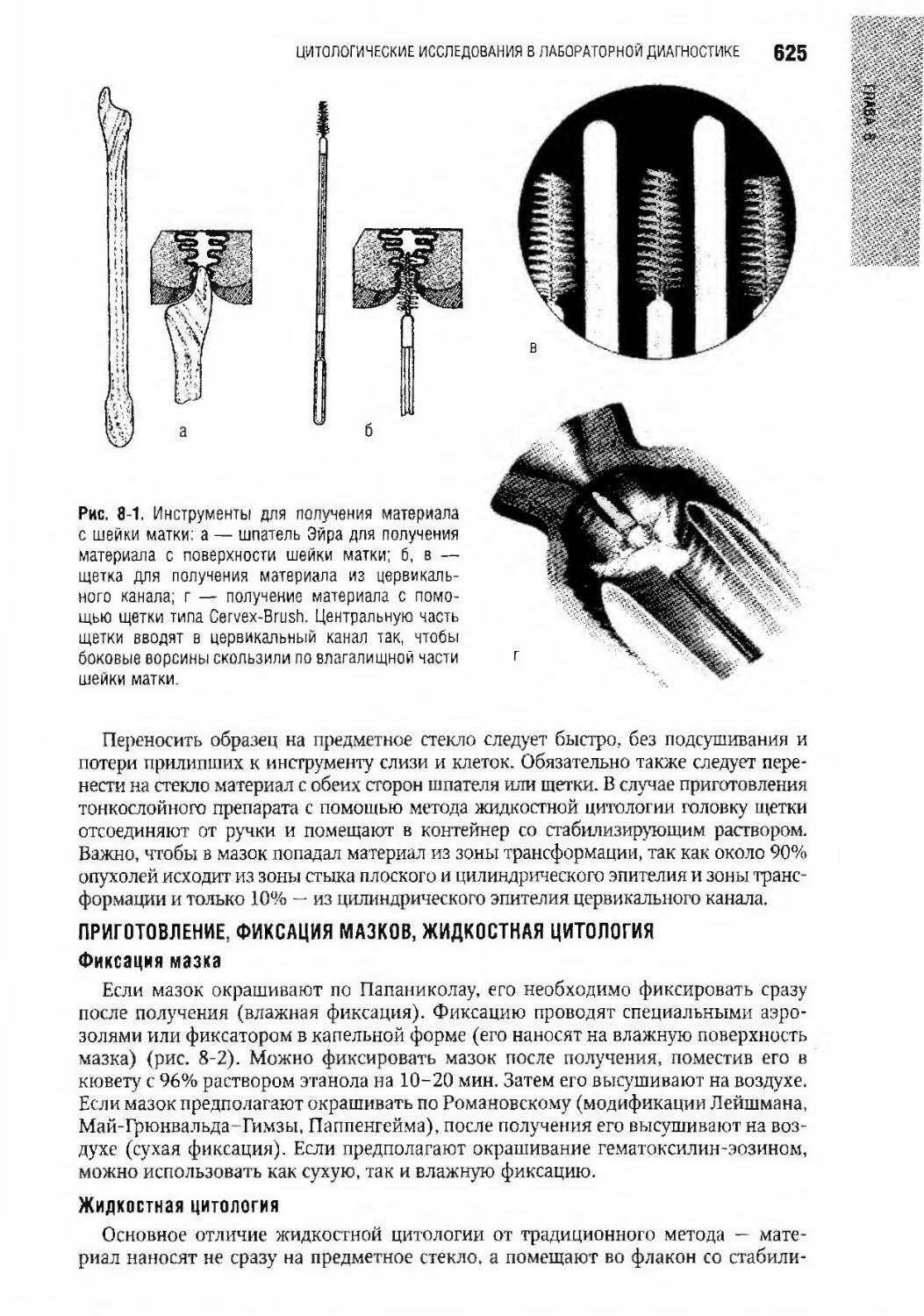
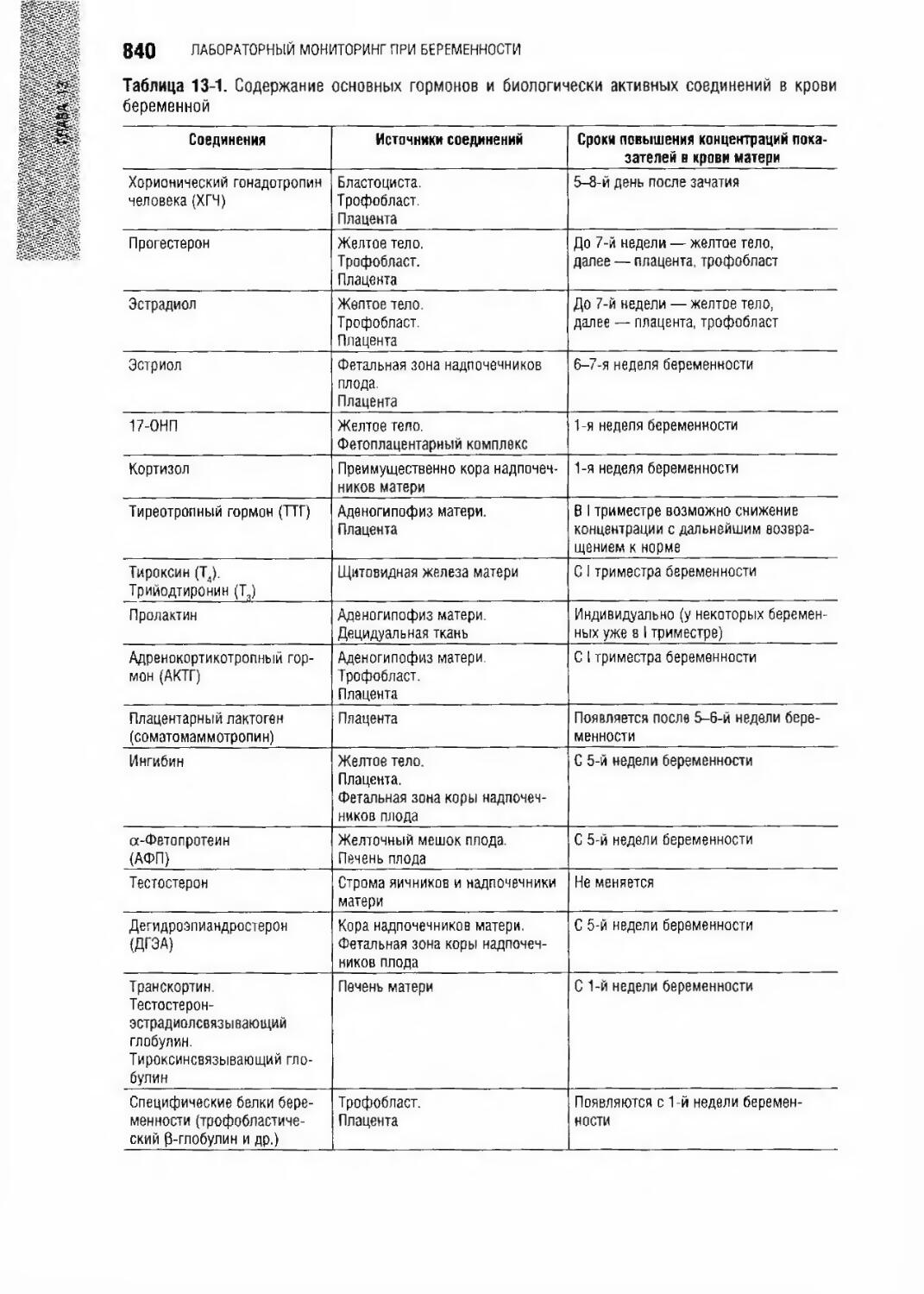
Author: Долгов В.В.
Tags: семиология симптоматология признаки и симптомы заболеваний исследование диагностика пропедевтика общая диагностика клиническая диагностика
ISBN: 978-5-9704-2129-1
Year: 2012
Научное общество специалистов
лабораторной медициныКЛИНИЧЕСКАЯ ЛАБОРАТОРНАЯ
ДИАГНОСТИКАНАиИОНАЛЬНОЕ РУКОВОДСТВОUCMOKiАССОЦИАЦИЯ
МЕДИЦИНСКИХ
ОБЩЕСТВ
ПО КАЧЕСТВУИЗДАТЕЛЬСКАЯ ГРУППА«ГЭОТАР-Медиа»
АССОЦИАЦИЯ
МЕДИЦИНСКИХ
ОБЩЕСТВ
ПО КАЧЕСТВУКЛИНИЧЕСКАЯ
ЛАБОРАТОРНАЯ ДИАГНОСТИКАНАЦИОНАЛЬНОЕ РУКОВОДСТВОВ двух томах
Том Iглавные редакторы
д-р мед. наук В.В. Долгов,
чл.-корр. РАЕН, д-р мед. наук В.В. МеньшиковПодготовлено под эгидой Научно-практического
общества специалистов лабораторной медицины
и Ассоциации медицинских обществ по качеству•шМоскваИЗДАТЕЛЬСКАЯ ГРУППА«ГЭОТАР-Медиа»
2012
УДК 616-07(035)ББК 53.4Я81К49Национальное руководство рекомендовано
Наугно-практигеским обществом специалистое лабораторной медицины
и Российской медицинской академией последипломного образовать в кагестве
угебного пособия для последипломной подготовки врагейК49 Клиническая лабораторная диагностика: национальное руководство: в 2 т. - Т. I. /
под ред. В.В. Долгова, В.В. Меньшикова. — М.: ГЭОТАР-Медиа, 2032. — 928 с.ISBN 978-5-9704-2129-1 (т. Т)ISBN 978-5-9704-2127-7 (общ.)Национальное руководство по клинической лабораторной диагностике разработано и
рекомендовано Научно-практическим обществом специалистов клинической лаборатор¬
ной медицины. В издании отражены все разделы клинических лабораторных исследо¬
ваний, представленные ведущими специалистами научных, образовательных и лечебно-
профилактических учреждений, расположенных в Центральном, Северо-Западном,
Сибирском, Уральском, Северо-Кавказском федеральных административных округах.В том I включены материалы о научных основах и обшей организации лабораторного
обеспечения медицинской помощи в нашей стране, об аналитических технологиях и диа¬
гностическом применении наиболее часто используемых в клинической лабораторной
диагностике биохимических, гематологических, коагулологических, цитологических
исследований. Наряду с этим представлены современные данные о передовых высокотех¬
нологичных методах лабораторной диагностики и их применении при ряде состояний —
при беременности, онкологических заболеваниях, эндокринных нарушениях и наслед¬
ственных боле.чнях обмена веществ, отравлениях.Представленные сведения основаны на данных современной научной литературы,
рекомендациях профессиональных обществ специалистов, стандартах медицинской
помощи, многолетнем научно-практическом опыте авторов.Руководство предназначено для сотрудников клинико-диагностических лабораторий,
врачей различных клинических дисциплин, студентов медицинских образовательных
учреждений. Материалы руководства могут быть использованы как для базового меди¬
цинского образования, так и для последипломной подготовки.УДК 616-07(035)
ББК 53.4Я81Авторы, редакторы и издатели руководства предприняли максимум усилий, чтобы
обеспечить точность представленной информации, в том числе дозировок лекарствен¬
ных средств. Учитывая постоянные изменения, происходящие в медицинской науке, мы
рекомендуем уточнять дозы лекарственных средств по соответствующим ИНСТр\Т{ЦИЯМ.
Пациенты не моїуг использовать эту информацию для диагностики и самолечения.Права на данное издание принадлежат ООО Издательская группа <^ТЭОТАР-Медиа^,
Воспроизведение и распространение в каком бы то ни было виде гасти или целого издания не
могут быть осуществлены без письменного разрешения ООО Издательская группа ^ГЭОТАР-
Медиа».© Коллектив авторов, 2012® ООО Издательская группа «ГЭОТАР-Медиа?>^. 2012
ISBN 978-5-9704-2129-1 (т. I) © ООО Издательская группа «ГЭОТАР-Медиа»,ISBN 978-5-9704-2127-7 (общ,) оформление, 2012
ОГЛАВЛЕНИЕПредисловие 6Участники издания 9Методология создания и программа обеспечения качества 13Список сокращений и условных обозначений 16Глава 1. Лабораторное обеспечение медицинской помощиВ,В. Меньшиков, С.В. Цвиренко 23Предмет клинической лабораторной медицины 23Объекты клинических лабораторных исследований 25Лабораторная аналитика 28Формы организации лабораторного обеспечения медицинской помощи 31Оперативность получения лабораторной информации 33Стандартизация организации лабораторного обеспечения 37Критерии эффективности работы лабораторий 40Глава 2. Обеспечение и контроль качества клинических лабораторных
исследований В,В. Меньшиков, Ю.В. Первушин 42Общие положения 42Оценка аналитической надежности методов исследования 47Основы внутрилабораторного контроля качества 51Аналитические характеристики методов 55Правила установления референтных интервалов и пределов 58Выбор отсечных точек и их влияние на характеристику информативностилабораторных исследований 66Внешняя оценка качества клинических лабораторных исследованийВ.Н. Малахов 68Обеспечение сопоставимости результатов лабораторных исследованийМ.И. Прищепа 81Глава 3. Высокотехнологичные лабораторные исследования 84Лабораторные информационные системы А.А. Кишкун 84Методы видеоцифровой регистрации Ю.Ю. Венгеров, ТА. Старовойтова,НЛг Стериополо, В.В. Зайко 89Проточная цитометрия СВ. Хайдуков, А.В. Зурогка,Арег А. Тотолян, ES. Наумова 103Иммунохимические методы анализа Н.Г. Ракова, КС. Рытикова 135Мультиплексный иммунный анализ А. С. Симбирцев, Арег А. Тотолян 143Молекулярная клиническая диагностика А.Б. Чухловин, Л.В. Тумбинская,В,Е. Колупаев, Я.Г. Ракова 147Глава 4. Биохимические исследования 175Ферменты С.А. Ельганинова, АЛ. Ройтман 177Субстраты и продукты биохимических реакций С.А. Ельганинова, А.Я. Ройтпман 192Индивидуальные белки О.П. Шевченко 215Минералы и электролиты С.А. Ельганинова 240Витамины, биоактивные медиаторы С.А. Ельганинова, А.П. Ройтман 253Маркеры обмена костной ткани В.В. Долгов 259
4 ОГЛАВЛЕНИЕГлава 5. Диагностика эндокринных нарушений А.В. Селиванова 268Шпоталамус-гипофиз 268Диагностика заболеваний щитовидной железы 269Гормональная регуляция репродуктивной функции мужчин 281Гормональная регуляция репродуктивной функции женщин 289Другие гормоны 299Глава 6. Химико-микроскопические исследования биологических
материалов 312Исследование мочи И.И. Миронова, ЛЛ. Романова 312Исследование кала И.И. Миронова 352Исследование спинномозговой жидкости В.В. Долгов, И.И. Миронова 372Исследование синовиальной жидкости ВЗ. Базарный 398Исследование выпотных жидкостей ИЛ. Шабалова, Т.В. Джангирова 403Исследование спермы И.И. Миронова, СЛ. Луговская, Н.Г. Ракова 432Исследование мокроты И.И. Миронова, Л.А. Романова 457Исследование желчи И.И. Миронова 467Глава 7. Лабораторная гематология 475Гемопоэз С.А. Луговская 475Основные исследования в лабораторной гематологии С.А. Луговская,М.Е. Погтаръ, В.М. Погорелое 492Реактивные изменения крови (лейкемоидные реакции) Т.Н. Соболева 519Анемии С.А. Луговская, М.Е. Погтарь, С.К Суплотов 530Миелодиспласгические синдромы Т.Н. Соболева, СЛ. Луговская 567Лейкозы С.А. Луговская, М.Е. Погтарь 570Глава 8. Цитологические исследования в лабораторной диагностикеИ.П. Шабалова, Т.В. Джангирова, К.Т, Касоян, В.И. Новик, Н.А. Шапиро 607Цитологическое исследование в клинической практике 607Особенности цитологического исследования заболеваний органов 623Глава 9. Биологические маркеры опухолей Н.Е. Кушлинский, Е.С. Герштейн,B.C. Сергеева, Н.В. Любимова 657Рецепторы стероидных гормонов — критерий чувствительности к эндокриннойтерапии 659Серологические опухольассоциированные маркеры 665Молекулярно-генетические онкомаркеры 684Использование молекулярно-генетических маркеров при некоторых солидныхопухолях 689Иммунохимические и биохимические онкомаркеры 693Маркеры костного ремоделирования при обследовании онкологических
больных с поражением скелета 701Глава 10. Лабораторная генетика 705Цитогенетическая диагностика хромосомных болезней М.А. Ермакова 705Наследственные болезни обмена веществ Е.Ю. Захарова, Е.Ю. Воскобоева,LB. Байдакова, О.В. Шехтер, Т.М. Букина, А.М. Букина 719Массовый скрининг новорожденных на наследственные болезни обмена
веществ С.И. Козлова, Н.А. Кузьмигева, С.Г. Калиненкова, AM. Прыткое 736Глава 11. Коагулологические исследованияА.Ж. Гильманов, Т.В. Вавилова, А.Н. Мамаев 749Основы функционирования системы гемостаза 749Преаналитический этап исследований гемостаза 751Тромбоцитарный компонент гемостаза 756
ОГЛАВЛЕНИЕ $Плазменное звено гемостаза 772Методы исследования коагуляционного гемостаза 775Глава 12. Лабораторная диагностика неотложных состоянийИ.И. Дементьева 816Причины нарушения гомеостаза во время операции, диагностикаи методы их коррекции 817Причины нарушений гомеостаза у больных в отделении интенсивной терапии 819Влияние гипоксии на метаболические показатели и водно-электролипгныйбаланс 823Лабораторная диагностика нарушений гомеостаза при острых состояниях,
полиорганной недостаточности, шоке. ДВС 826Глава 13. Лабораторный мониторинг при беременности Н.Д. Фангенко,Т.Ю. Иванец, М.Л. Алексеева 839Механизм взаиморегуляции в системе «мать-плацента-плод» 839Мониторинг беременности 841Алгоритм пренатального мониторинга 844Регуляции метаболизма организмов матери и плода 849Глава 14. Химико-токсикологический анализ СЖ. Еремин, БЛ. Изотов 854Общие вопросы химико-токсикологического анализа 854Физико-химические методы исследования 858Химико-токсикологический анализ в клинической токсикологии 862Анализ наркотических средств 864Частные методики обнаружения токсичных веществ 870Глава 15. Терапевтический лекарственный мониторинг CJI. Арсенин 883Предметный указатель 918
ПРЕДИСЛОВИЕФормирование диагноза и определение лечебных мер для конкретного паци¬
ента в сознании врача происходит в результате анализа информации о пациенте и
его состоянии: сбора анамнеза заболевания, данных врачебного осмотра, включая
аускультацию, перкуссию и другие субъективные методы, динамическое наблюде¬
ние. Если заболевание имеет типичные проявления, совпадающие с классическими
описаниями соответствующей формы патологии, этой информации оказывается
достаточно для установления диагноза и назначения лечения. Однако в большин¬
стве случаев врач нуждается в более полных сведениях о состоянии функций и
структур организма пациента. Выдающийся канадский клиницист XIX в. Вильям
Ослер писал: «Медицина — это наука неопределенности и искусство вероятности.
Одной из главных причин этой неопределенности является возрастающая вариа¬
бельность проявлений любой болезни». Эту неопределенность призваны были
уменьшить объективные методы исследования организма пациента.Еще врачеватели древности обратили внимание на исследование таких био¬
материалов, как выделения больных. Органолептически — на цвет, прозрачность,
запах и даже на вкус — оценивали мочу пациентов (болезнь «сладкой мочи», впо¬
следствии названную сахарным диабетом, описал в VI веке до нашей эры индий¬
ский врач Сашрута). Широко применяли уроскопию: рассматривание лечащим
врачом сосуда с пробой мочи пациента одновременно с подсчетом пульса. Степень
прозрачности и цвет этого биоматериала сравнивали с так называемым колесом
уроскопий — эмпирической шкалой, на которой цвет и характер мочи сопостав¬
лялся с перечнем болезней.Предпосылки научного периода изучения жидкостей человеческого организма
химическими методами зародились в XV-XVI вв. в лабораториях алхимиков, а
затем в трудах Кузанциса и Парацельса, которые пытались использовать химиче¬
ские представления в медицинской практике.Середина XVII в. стала переломным периодом в отношении способов исследо¬
вания биологических жидкостей больных — временем перехода от органолепти¬
ческого их исследования врачом при осмотре больного к объективным методам.
Создание голландским естествоиспытателем Левенгуком первого оптического
прибора — микроскопа — позволило разглядеть клетки крови, корпускулярные
компоненты мочи, некоторые микроорганизмы и тем самым расширить способ¬
ность человека визуально изучать эти объекты, неразличимые простым глазом. В
конце XVII в. английский ученый Роберт Бойль опубликовал исследования крови
человека с помощью доступных в ту пору химических методов дистилляции,
став, тем самым, одним из основоположников клинической химии. Вслед за тем
Лангриш описал изменения крови больных с лихорадкой. Очевидно, подобные
работы дали М.В. Ломоносову основание заявить: «Врач без довольного знания
химии совершенен быть не может».Понадобился еще примерно двухвековой путь, чтобы на основе общего раз¬
вития естественных наук возникла система объективных методов исследования.
Знаковыми событиями на этом пути стали создание Ю. фон Либихом в 1840 г.
первой аналитической лаборатории, издание им фундаментального труда «Химия
животных», а в 1842 г. создание его учеником И. Шерером в больнице г. Вюрцбурга
(Германия) «клинической химической лаборатории». В 1838 г. были опубликова¬
ны таблицы по микроскопии осадка мочи, а в 1844 г. — курс микроскопии для
медицинских исследований (А. Донне). В 1843 г. вышла в свет основанная на кли¬
ническом материале монография И. Шерера «Химические и микроскопические
исследования при патологии», явившаяся практически первым р)ководством по
клинической лабораторной диагностике. С 1843 г. под редакцией И. Симона стал
издаваться один из первых журналов по лабораторной диагностике «Beitragenjur
ПРЕДИСЛОВИЕphysiologiscke undpathologische Ckemie undMikroscopie^, a с 1847 г. — «Archivjurphysi-
ologische und pathologische Chemie und Mikroscopie^, В 1848 г. Г, фон Фелинг разрабо¬
тал тест для определения глюкозы. В 1870 г. Ж. Дюбоск предложил колориметр,
ставший на долгие годы одним из основных инструментов клинической химии.
Эти события ознаменовали собой начало существования клинической лаборатор¬
ной диагностики как самостоятельной отрасли медицины.Лабораторные исследования стали первыми объективными диагностическими
технологиями в истории развития медицины, а лабораторная специальность —
первой по объему информации среди профессий специалистов по объективным
методам диагностики — рентгенологов, электрокардиографистов, эндоскопистов,
специалистов по ультразвуковой диагностике. Уже в первые годы существования
клинических лабораторий Вильям Ослер сравнил их роль со значением скальпеля
для врача. За полтора века клинико-лабораторная специальность постоянно нахо¬
дилась в процессе развития аналитических возможностей на основе восприятия
все новых и новых открытий и изобретений в области биологии, химии, физики, а
также их прикладных медико-биологических дисциплин — биохимии, цитологии,
микробиологии, иммунологии, молекулярной биологии и др. (табл. 1).Существенно расширился диапазон технологий, составляющих содержание прак¬
тической деятельности в лабораториях. Микроскопия биологических жидкостей и
простые химические методы, с которых начиналась лабораторная деятельность в
середине XIX в., составляют в настоящее время едва лишь десятую часть диапазона
аналитических приемов клинической лабораторной аналитики. Б распоряжение
специалиста современной лаборатории предоставлена широкая гамма разнообраз¬
ных фото-, флюоро-, люминометрических, электрохимических, лигандных, хро¬
матографических, масс-спектрометрических, молекулярно-биологических методов
исследования. К концу XX в. доступными для качественной и количественной
оценки стали практически все клеточные и химические компоненты биологических
материалов, которые позволяют с той или иной степенью точности характеризовать
состояние органов и физиологических систем организма человека и, следовательно,
представляют определенный клинический интерес.Таблица 1. Вехи развития лабораторной диагностики в ХІХ-ХХ вв. (по Дати, Метцманн, 2007)ГодыИмена исследователей: описание исследования1830-1840Юстус Либих; разработка методов количественного химического анализа1838Йёнс Берцелиус: применил термин «белок» (от греч. proteios — «из первого разряда»)1877-1908Пауль Эрлих: признание тучных клеток, основные принципы иммунитета, теории формиро¬
вания боковой цепи/антитела, специфичность антител1883-1908Илья Мечников; теория фагоцитоза, теория клеточного иммунитета1885Луи Пастер: микробиологическая теория инфекции1891-1905Роберт Кох: реакция на туберкулин, гиперчувствительность отсроченного типа1895-1919Жюль Бордет: комплемент и активность антител при бактериолизе1897Рудольф Крауз: токсин и реакция антитоксина, формирование преципитата1901-1930Карл Ландштейнер: открытие А, В и 0 групп крови, унитарная концепция антигена и анти¬
тела, клеточный иммунитет1907Сванте Аррениус: ввел термин «иммунохимия»1926Лойд Фельтон и Байли: химическая природа антитела как белка и его выделение1935Михаэль Гейдельберг и Форрест Кендалл: описание иммунопрецилитиновой реакции1948Астрид Фаграуз; демонстрация образования антитела в плазме В-клетки1950Альберт Кунс и Каплан; разработка техники иммунофлюоресценции1950Ричард Гершон и Кондо: открытие супрессорной Т-клетки1950-еБруце Глик; лимфоцит как тип клетки, ответственной за клеточный и гуморальный иммунитет1953Мортон Симонсен и Демпстер: отторжение почки у собак (реакция «имплантат против хозяина»)
ПРЕДИСЛОВИЕОкончание табл. 1Годы1953-19621958-19621959-19771960-19751961-19691961-1962196519711975-19841977-19801985-19932001НастоящеевремяИмена исследователей; описание исследованияДжеймс Уотсон и Фрэнсис Крик: описание двойной спиральной структуры ДНКЖан Доссе; идентификация антигенов лейкоцитов человекаРозалин Ялоу: разработка радиоиммунологического исследованияРенато Дульбекко: разработка современных методов культуры тканиРодни Портер и Джеральд Эдельман; описание структуры антитела (IgG)Ноел Вернер с соавторами; различие клеточных и гуморальных иммунных ответовДжулиана Манчини. Ангела Карбонара и Иозеф Гереманс: иммунохимическое количествен¬
ное определение антигенов однонаправленной радиальной иммунодиффузией Ева Ингволл и Пельман: разработка фермент-связанного иммуносорбентного исследования
(ELISA) Георг Кёлер и Сезар Мильштейн; разработка техники гибридомы для производства моно¬
клональных антител (Mabs) Фредерик Сенгер и Уолтер Гилберт: методы секвенирования нуклеиновых кислотКэри Маллис; разработка цепной полимеразной реакции (PCR) для массового копирования
ДНКПроект «Геном человека»: публикация последовательности человеческого геномаГенно-инженерные моноклональные антителаШироко распространены и быстро развиваются исследования гормонов, гемо¬
стаза, иммунной системы, молекулярной генетики. Полностью преобразился при¬
борный парк современной клинической лаборатории, как по видам инструментов,
так и по степени автоматизации. На службу лабораторной диагностике постоянно
поступают все более мощные технические средства, обладающие высокой чув¬
ствительностью, стабильностью, оснащенные роботизированными устройствами,
автоматикой, компьютерами. Расширение рамок лабораторно-аналитической
деятельности, благодаря разнообразию как самих технологий, так и применяемой
аппаратуры, привело к значительному увеличению объема специальных знаний и
умений, которыми должен в настоящее время обладать лабораторный специалист.
В свою очередь, существенно расширился объем и повысилась информативность
тех объективных сведений о состоянии организма обследуемого пациента, которые
лабораторная медицина готова предоставить лечащему врачу. В настоящее время
лабораторные исследования для удовлетворения клинических потребностей полу¬
чили прочный научный фундамент лабораторной медицины, а их практическое
выполнение приобрело характер системы лабораторного обеспечения медицин¬
ской помощи, осуществляемого в различных формах и объеме, соответствующих
нуждам и возможностям системы здравоохранения.Настоящее издание, направленное в первую очередь на клиническую аудито¬
рию, призвано дать представление о современном состоянии лабораторной меди¬
цины, помочь лечащим врачам в подборе наиболее информативных и клинически
значимых лабораторных анализов и обеспечить их диагностическую интерпрета¬
цию. В то же время в руководстве приводятся и методические материалы, которые
предназначены для специалистов практических клинико-диагностических лабора¬
торий. Такой комплексный подход позволяет рассмотреть представляемый мате¬
риал с разных сторон и представить материал как справочно-аналитический.Главные редакторыДокт. мед. наук В.В. Долгов
Ч л.-корр. РАЕН, докт. мед. наук В Л Меньшиков
УЧАСТНИКИ ИЗДАНИЯГЛАВНЫЕ РЕДАКТОРЫДолгов Владимир Владимирович — д-р мед. наук, профессор, зав. кафедрой
клинической лабораторной диагаостики ГБОУ ДПО «Российская медицинская
академия последипломного образования», МоскваМеньшиков Вадим Владимирович — д-р мед. наук, профессор, заслужен¬
ный деятель науки РФ, член-корреспондент РАЕН, зав. лабораторией проблем
клинико-лабораторной диагностики НИЦ ГБОУ ВПО «Первый Московский госу¬
дарственный медицинский университет им. И.М. Сеченова»АВТОРЫ И СОСТАВИТЕЛИАлексеева Марина Леонидовна — канд. биол, наук, ст. научн. сотр. научно¬
диагностической лаборатории ФГУ «Научный центр акушерства, гинекологии и
перинатологии им. В.И. Кулакова Минздравсоцразвития России», МоскваАрсенин Сергей Леонидович — канд. мед. наук, руководитель лабораторного
направления ООО «МК», МоскваБазарный Владимир Викторович — д-р мед. наук, профессор кафедры клини¬
ческой лабораторной и микробиологической диагностики ГБОУ ВПО «Уральская
государственная медицинская академия», ЕкатеринбургБайдакова Галина Викторовна — ст. научн. сотр. лаборатории наследствен¬
ных болезней обмена веществ Медико-генетического научного центра РАМН,
МоскваБелохвостов Александр Сергеевич — д-р мед. наук, профессор, руководитель
генетической службы НПЦ медицинской помощи детям, заведующий лаборатори¬
ей молекулярной онкологии и генетики ФГУ «ФНКЦ ДГОИ» Минздравсоцразви¬
тия России, МоскваБукина Анна Михайловна — научн. сотр. лаборатории наследственных болез¬
ней обмена веществ Медико-генетического научного центра РАМН, Москва
Букина Татьяна Михайловна — канд. биол. наук, ст. научн. сотр. лаборатории
наследственных болезней обмена веществ Медико-генетического научного центра
РАМН, МоскваВавилова Татьяна Владимировна — д-р мед. наук, профессор кафедры клини¬
ческой лабораторной диагностики ГБОУ ВПО «Северо-Западный Государственный
медицинский университет», Санкт-ПетербургВенгеров Юрий Юзефович — д-р биол. наук, профессор, вед. научн. сотр.
лаборатории иммунобиохимии Института биохимии им, А.Н. Баха РАН, Москва
Воскобоева Елена Юрьевна — канд. мед наук, вед. научн. сотр. лаборатории
наследственных болезней обмена веществ Медико-генетического научного центра
РАМН, МоскваГерштейн Елена Сергеевна — д-р биол. наук, ведущий научный сотрудник
лаборатории клинической биохимии РОНЦ им. Н.Н. Блохина РАМН, Москва
Гильманов Александр Жанович — д-р мед. наук, профессор, зав. кафедрой
лабораторной диагностики ГБОУ ВПО «Башкирский государственный медицин¬
ский университет Минздравсоцразвития РФ», УфаДементьева Инна Иосифовна — д-р биол. наук, профессор, зав. лабораторией
экспресс-диагностики ГУ «Российский научный центр хирургии РАМН», Москва
Джангирова Татьяна Владимировна — канд. мед. наук, доцент кафедры
клинической лабораторной диагностики ГБОУ ДПО «Российская медицинская
академия последипломного образования», МоскваЕльчанинова Светлана Александровна — д-р биол. наук, профессор, зав.
кафедрой биохимии и лабораторной диагностики ГБОУ ВПО «Алтайский государ¬
ственный медицинский университет», Барнаул
10УЧАСТНИКИ ИЗДАНИЯвЕремин Серафим Кузьмич — ст. научн. сотр., ст. преподаватель кафе¬
дры аналитической и судебно-медицинской токсикологии ГБОУ ВПО «Первый
Московский государственный медицинский университет им. И.М. Сеченова»
Ермакова Марина Александровна — канд. мед. наук, ассистент кафедры
медицинской генетики ГБОУ ДПО «Российская медицинская академия последи¬
пломного образования», МоскваЗайко Виктория Витальевна — канд. биол. наук, мл. научн. сотр. лаборато¬
рии иммунобиохимии Института биохимии им. А.Н. Баха РАН, МоскваЗахарова Екатерина Юрьевна — канд. мед. наук, зав. лабораторией наслед¬
ственных болезней обмена веществ Медико-генетического научного центра РАМН,
МоскваЗурочка Александр Владимирович — д-р мед. наук, профессор, зав. курсом
клинической лабораторной диагностики ГБОУ ВПО «Челябинская государствен¬
ная медицинская академия»Иваиец Татьяна Юрьевна — канд. мед. наук, заведующая научно-диаг¬
ностической лабораторией ФГУ «Научный центр акушерства, гинекологии и пери-
натологии им. В.И. Кулакова Минздравсоцразвития России», МоскваИзотов Борис Николаевич -д-р хим. наук, профессор, зав. кафедрой анали¬
тической и судебно-медицинской токсикологии ГБОУ ВПО «Первый Московский
государственный медицинский университет им. И.М. Сеченова»ІСалиненкова Светлана Георгиевна — канд. биол. наук, зав. лабораторией
генетики МОНИКИ им. Владимирского, МоскваКасоян Карине Тимуровна — канд. мед. наук, ассистент кафедры клиниче¬
ской лабораторной диагностики ГБОУ ДПО «Российская медицинская академия
последипломного образования», МоскваКишкун Алексей Алексеевич — д-р мед. наук, профессор кафедры медицин¬
ской биохимии ГБОУ ДПО «Российская медицинская академия последипломного
образования», МоскваКозлова Светлана Ивановна — д-р мед. наук, профессор кафедры медицин¬
ской генетики ГБОУ ДПО «Российская медицинская академия последипломного
образования», МоскваКолупаев Всеволод Евгеньевич — канд. мед. наук, менеджер по продукции
ООО «БИО-РАД лаборатория», МоскваКузмичева Нелли Алексеевна — канд. биол. наук, доцент кафедры медицин¬
ской генетики ГБОУ ДПО «Российская медицинская академия последипломного
образования», МоскваКушлинский Николай Евгеньевич — д-р мед. наук, профессор, член-
корреспондент РАМН, зав. лабораторией клинической биохимии РОНЦ им.Н.Н. Блохина РАМН; зав. кафедрой биохимии ГБОУ ВПО «Московский государ¬
ственный медико-стоматологический университет»Луговская Светлана Алексеевна — д-р мед. наук, профессор кафедры клини¬
ческой лабораторной диагностики ГБОУ ДПО «Российская медицинская академия
последипломного образования», МоскваЛюбимова Нина Васильевна — д-р биол. наук, ведущий научный сотрудник
лаборатории клинической биохимии РОНЦ им.Н.Н. Блохина РАМН, Москва
Малахов Владимир Николаевич — д-р биол. наук, профессор, руководитель
отдела стандартизации и контроля качества клинртческой лабораторной диа¬
гностики ФГУ ГНИЦ профилактической медицины, генеральный директор НО
«Центр внешнего контроля качества», МоскваМамаев Андрей Николаевич — д-р мед. наук, зав. лабораторией гемостаза
МУЗ «Городская больница № 11», г. Барнаул, ст. научн. сотр. Алтайского филиала
ГУ «Гематологический научный центр РАМН»
УЧАСТНИКИ ИЗДАНИЯ Ц ІЙШІМиронова Ирина Ивановна — канд. мед. наук, доцент кафедры клинической
лабораторной диагностики ГБОУ ДПО «Российская медицинская академия после¬
дипломного образования», МоскваНаумова Елена Владимировна — канд. мед. наук, ассистент кафедры клини¬
ческой лабораторной диагностики ГБОУ ДПО «Российская медицинская академия
последипломного образования», МоскваНовик Виктор Иванович — д-р мед. наук, профессор, руководитель группы Щ
онкоцитологии ФГУ НИИ онкологии, Санкт-Петербург |f||Первушин Юрий Владиславович — канд. мед. наук, профессор, зав. кафедрой ^
клинической лабораторной диагностики Института последипломного и дополни¬
тельного образования ГБОУ ВПО «Ставропольская государственная медицинская
академия»Погорелов Валерий Михайлович — д-р мед. наук, профессор, зав. лаборато¬
рией гемоцитологии Гематологического научного центра РАМН, МоскваПочтарь Маргарита Евгеньевна — канд. мед. наук, доцент кафедры клини¬
ческой лабораторной диагностики ГБОУ ДПО «Российская медицинская академия
последипломного образования», МоскваПрищена Михаил Иванович — канд. техн. наук, президент ЗАО «Аналитика»Ракова Наталья Геннадьевна — канд. мед. наук, доцент кафедры клинической
лабораторной диагностики ГБОУ ДПО «Российская медицинская академия после¬
дипломного образования», МоскваРойтман Александр Польевич — канд, мед наук, доцент кафедры клиниче¬
ской лабораторной диагностики ГБОУ ДПО «Российская медицинская академия
последипломного образования», МоскваРоманова Людмила Андреевна — канд. мед. наук, доцент кафедры клиниче¬
ской лабораторной диагностики ГБОУ ДПО «Российская медицинская академия
последипломного образования», МоскваРытикова Наталья Станиславовна — канд. биол. наук, руководетель направ¬
ления иммуноферментного анализа ЗАО «БиоХимМак», МоскваСеливанова Анна Владимировна - канд. мед. наук, врач-эндокринолог ГКБ
им. С.П. Боткина, МоскваСергеева Наталья Сергеевна — д-р биол. наук, профессор, зав. лабораторией
прогноза эффективности консервативного лечения опухолей ФГУ «Московский
научно-исследовательский онкологический институт им. П.А.Герцена»Симбирцев Андрей Семенович — д-р мед. наук, профессор, зав. лаборатори¬
ей фармиммунологии Государственного НИИ особо чистых биопрепаратов ФМБА
России, Санкт-ПетербургСкуинь Людмила Михайловна — канд. мед. наук, доцент кафедры иммуно¬
логии ГБОУ ДПО «Российская медицинская академия последипломного образо¬
вания», МоскваСоболева Татьяна Николаевна — канд. мед. наук, доцент кафедры клиниче¬
ской лабораторной диагностики ГБОУ ВПО «Российский национальный исследо¬
вательский медицинский университет», МоскваСтаровойтова Татьяна Авенировна — д-р мед. наук, врач высшей категории,
зав. клинико-диагностической лабораторией НУЗ Центральная клиническая боль¬
ница № 1 ОАО «Российские железные дороги», МоскваСтериополо Ника Александровна — канд. биол. наук, врач высшей кате¬
гории, заведующая клинико-диагностической лабораторией ФГУ «Клиническая
больница» Управления делами Президента РФ, МоскваСуплотов Сергей Николаевич — д-р мед. наук, профессор, зав. кафедрой
клинической лабораторной диагностики ГБОУ ВПО «Тюменская государственная
медицинская академия»Тарасенко Ольга Анатольевна — канд. мед. наук, зам. главного врача ФГУЗ
♦Головной центр гигиены и эпидемиологии» ФМБА России, Москва
12 УЧАСТНИКИ ИЗДАНИЯТотолян Арег Артемович — д-р мед. наук, профессор, зам. директора ФБУН
«Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера?^
Тумбинская Лидия Викторовна — канд. биол. наук, зам. директора по раз¬
витию ЗАО НПФ «ДНК-технология», МоскваФанченко Николай Дмитриевич — д-р биол. наук, профессор, консультант
научно-диагностической лаборатории ФГУ «Научный центр акушерства, гине¬
кологии и перинатологии им. В.И. Кулакова Минздравсоцразвития России»,
МоскваХайду ков Сергей Валерьевич — д-р биол. наук, зав. лаб. физиологии и пато¬
логии иммунной системы ФГУ ФНКЦ детской гематологии, онкологии и имму¬
нологии Росздрава; специалист по проточной цитофлуорометрии ООО «Бекмен
Культер», МоскваЦвиренко Сергей Васильевич — д-р мед. наук, профессор, зав. кафедрой
лабораторной и микробиологической диагностики ГБОУ ВПО «Уральская госу¬
дарственная медицинская академия», ЕкатеринбургЧухловии Алексей Борисович - д-р мед. наук, профессор кафедры клини¬
ческой лабораторной диагностики с курсом молекулярной медицины ГБОУ ВПО
«Санкт-Петербургский государственный медицинский университет им. академика
И.П.Павлова Росздрава»Шабалова Ирина Петровна — д-р мед. наук, профессор кафедры клинической
лабораторной диагностики ГБОУ ДПО «Российская медицинская академия после¬
дипломного образования», МоскваШапиро Наум Абрамович — д-р мед. наук, профессор, заслуженный врач
РФ, лаборатория цитологии Центральной клинической больницы №1 ОАО «Рос¬
сийские железные дороги», МоскваШевченко Ольга Павловна — д-р мед. наук, профессор, зам директора ФГУ
«Научный центр трансплантологии и искусственных органов», МоскваШехтер Ольга Владимировна — канд. хим. наук, ст. научн. сотр. лаборатории
наследственных болезней обмена веществ Медико-генетического научного центра
РАМН, Москва
МЕТОДОЛОГИЯ СОЗДАНИЯ И ПРОГРАММА
ОБЕСПЕЧЕНИЯ КАЧЕСТВАНациональные руководства — первая в России серия практических руководств
по медицинским специальностям, включающих в себя всю основную информацию,
необходимую врачу для практической деятельности и непрерывного медицинско¬
го образования. В отличие от большинства других руководств в национальных
руководствах равное внимание уделено профилактике, диагностике, фармакотера¬
пии и немедикаментозным методам лечения заболеваний.Почему необходимы национальные руководства? Динамичное развитие меди¬
цинской науки, быстрое внедрение в клиническую практику новых высокотех¬
нологичных методов диагностики и лечения требуют от врача непрерывного
повышения профессионализма и обновления знаний на протяжении всей его про¬
фессиональной жизни. Данная задача решается системой последипломного обра¬
зования и периодической сертификацией специалистов лишь частично. Быстро
возрастающий объем научной медицинской информации предъявляет особые
требования к качеству используемых учебных и справочных руководств, особенно
с учетом внедрения в широкую клиническую практику достижений медицины,
основанной на доказательствах. Имеющиеся на сегодня руководства для врачей
и фармакологические справочники не в полной мере отвечают современным
потребностям врачебной аудитории.Ниже приведено описание требований, которые были разработаны при подго¬
товке Национального руководства по клинической лабораторной диагностике, и
мероприятий по лабораторному обеспечению медицинской помощи,КОНЦЕПЦИЯ И УПРАВЛЕНИЕ ПРОЕКТОМДля работы над проектом была создана группа управления в составе руководи¬
теля и менеджеров проекта.Для разработки концепции и системы управления проектом его руководители про¬
вели множество консультаций с отечественными и зарубежными специалистами —
руководителями профессиональных обществ, ведущими разработчиками аналити¬
ческих и диагностических методов, клинических рекомендаций, организаторами
здравоохранения, представителями компаний, производящих лабораторное меди¬
цинское оборудование и другие средства клинического лабораторного анализа.В результате разработана концепция проекта, сформулированы этапы, опреде¬
лены их последовательность и сроки исполнения, выработаны требования к эта¬
пам и исполнителям; утверждены инструкции и методы контроля.ЦЕЛЬОбеспечить врача всей современной информацией в области клинической
лабораторной диагностики, необходимой для непрерывного медицинского обра¬
зования, что позволит значительно повысить качество специализированной меди¬
цинской помощи в Российской Федерации.ЗАДАЧИ• Проанализировать все современные источники достоверной высококаче¬
ственной информации.• На основе полученных данных составить обобщающие материалы с учетом
особенностей отечественного здравоохранения по следующим направлениям:❖ аналитические лабораторные технологии;клинические рекомендации по применению лабораторных исследований;
алгоритмы лабораторной диагностики:
терапевтический мониторинг лекарственных средств.
шшШ14МЕТОДОЛОГИЯ СОЗДАНИЯ И ПРОГРАММА ОБЕСПЕЧЕНИЯ КАЧЕСТВА• Подготовить издание, соответствующее всем современным требованиям
к национальному руководству по отдельной специальности.АУДИТОРИЯНациональное руководство по клинической лабораторной диагностике предна¬
значено врачам клинической лабораторной диагностики, врачам различных кли¬
нических специальностей, интернам, ординаторам, студентам медицинских образо¬
вательных учреждений. Составители и редакторы привели авторские материалы в
соответствие с условиями специализированной клинической практики в России.ЭТАПЫ РАЗРАБОТКИСоздание команды управления и команды разработчиков, составление концеп¬
ции, выбор тем, поиск литературы, разработка авторских материалов, экспертиза,
редактирование, независимое рецензирование с получением обратной связи от
рецензентов (специалисты, практикующие врачи, организаторы здравоохранения,
производители средств лабораторного анализа, медицинского оборудования и
др.), публикация, внедрение, получение обратной связи и дальнейшее улучшение.СОДЕРЖАНИЕКак и все книги серии. Национальное руководство по клинической лаборатор¬
ной диагностике включает в себя описание клинико-анатомических форм различ¬
ных заболеваний, методов их диагностики и лечения.РАЗРАБОТЧИКИ• Авторы-составители — практикующие врачи, сотрудники научно-
исследовательских и образовательных учреждений России, руководители
кафедр;• главные редакторы — д-р мед. наук, проф. В.В, Долгов, зав. кафедрой кли¬
нической лабораторной диагностики Российской медицинской академии
последипломного образования: д-р мед. наук, проф., член-корреспондент
Российской академии естественных наук. В.В. Меньшиков, зав. лабораторией
проблем клинико-лабораторной диагностики Первого Московского меди¬
цинского университета им. И.М. Сеченова;• научные редакторы и рецензенты — ведущие специалисты различных раз¬
делов лабораторной медицины;• редакторы издательства — практикующие врачи с опытом работы в издатель¬
стве не менее 5 лет;• руководители проекта — с опытом руководства проектами с большим числом
участников при ограниченных сроках создания, владеющие методологией
создания специализированных медицинских руководств.Всем специалистам были предоставлены описание проекта, формат статьи,
инструкция по составлению каждого элемента содержания, источники информа¬
ции и инструкции по их использованию, пример каждого элемента содержания.
В инструкциях для составителей указывалась необходимость подтверждать эффек¬
тивность (польза/вред) вмешательств в независимых источниках информации,
недопустимость упоминания каких-либо коммерческих наименований. Приведены
международные (некоммерческие) названия лекарственных препаратов, которые
проверялись редакторами издательства по Государственном}'^ реестру лекарственных
средств (по состоянию на 1 июля 2010 г.). В требованиях к авторам-составителям
было подчеркнуто, что материалы должны кратко и конкретно отве^шть на клини¬
ческие вопросы. После редактирования текст согласовывали с авторами.Со всеми разработчиками руководитель проекта и ответственные редакторы
поддерживали непрерывную связь по телефону и электронной почте с целью
решения оперативных вопросов.
МЕТОДОЛОГИЯ СОЗДАНИЯ И ПРОГРАММА ОБЕСПЕЧЕНИЯ КАЧЕСТВА 15РЕЗУЛЬТАТНациональное руководство по клинической лабораторной диагностике в удоб-
ной и доступной форме содержит всю необходимую информацию для практиче¬
ской деятельности и непрерывного медицинского образования.РЕКЛАМАВ инструкциях для авторов, научных редакторов и рецензентов подчеркивалась
необходимость использовать при работе над национальным руководством только
достоверные источники информации, не зависящие от мнения производителей
средств лабораторного анализа и медицинской техники, что в конечном счете обе¬
спечило отсутствие информации рекламного характера в авторских материалах
руководства.КОМПАКТ-ДИСК «КОНСУЛЬТАНТ ВРАЧА. КЛИНИЧЕСКАЯ ЛАБОРАТОРНАЯ
ДИАГНОСТИКА»В рамках проекта «Клиническая лабораторная диагностика. Национальное
руководство» также подготовлена электронная информационно-образовательная
система «Консультант врача. Клиническая лабораторная диагностика» (на
компакт-диске). Система содержит текст национального руководства, стандарты,
утвержденные Минздравсоцразвития России, и другие дополнительные материа¬
лы. Программа снабжена уникальной системой поиска. Информацию об электрон¬
ной информационной системе «Консультант врача. Клиническая лабораторная
диагностика» можно получить по тел.; (495) 921-39-07; по электронной почте:
bookpost@geotar.ru, а также на интернет-сайте: www.geotar.ru.ОБРАТНАЯ СВЯЗЬЗамечания и пожелания по подготовке книги «Клиническая лабораторная диа¬
гностика. Национальное руководство» можно направлять по адресу: г. Москва,
ул. Садовническая, д. 9, стр. 4; электронный адрес: info@asmok.ru. Таким образом.
Национальное руководство по клинической лабораторной диагностике в удобной
и доступной форме содержит всю необходимую информацию для практической
деятельности и непрерывного медицинского образования по клинической лабора¬
торной диагностике. Все приведенные материалы рекомендованы Научным обще¬
ством специалистов клинической лабораторной диагностики и ведущими научно-
исследовательскими институтами. Национальное руководство по клинической
лабораторной диагностике будет регулярно пересматриваться и обновляться не реже
одного раза в 3-4 года. Дополнительную информацию о проекте «Национальные
руководства» можно получить на интернет-сайте: http://nr.asmok.ru.
СПИСОК СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ* — знак лекарственного средства, не имеющего международного непатентованно¬
го названия^ — лекарственное средство не зарегистрировано в Российской Федерации
® — лекарственное средство в Российской Федерации аннулировано, т.е. исключе¬
но из Государственного реестра лекарственных средств
11-ДГТ — 11-дегидротромбоксанАСТ/ВСКа — activated clotting time, время свертывания цельной крови при актива¬
ции контактной фазыaPCR — activated protein С resistance, резистентность фактора V к активированному
протеину СаРТТ/АЧТВ — activated partial thromboplastin time, активированное частичное тром-
бопластиновое времяBNP — мозговой натрийуретический пептид
BE — bases excess, избыток буферных оснований
CD - кластер дифференцировкиCDKI — cyclin-dependent kinase inhibitor, ингибитор циклин-зависимых киназ
СІЄГ — внепочечный клиренс
СІГ — почечный клиренс
Clt— общий клиренсCssmax — максимальная равновесная концентрация
Cssmin — минимальная равновесная концентрация
С„ — кажущаяся начальная концентрация
CTAD — цитрат натрия, аденозин, теофилин и дипиридамол
СТАР-Ш — connective tissue-activating peptide III, пептид, активирующий соедини¬
тельную тканьDDU — D-dimers unit, единицы D-димераdRVVT - diluted Ru^el Viper Venom Test, тест с разведенным ядом гадюки Рассела
Е2 — эстрадиол
ЕЗ — эстриолF — биодоступная молярная доляFEU — fibrinogen equivalent units, фибриногеновые эквивалентные единицыGP — гликопротеинGRP — гастрин-рилизинг-пептидHbOj, НЬСО, МетНЬ — фракции гемоглобина: окси-, карбокси-, метгемоглобин
НЬА,^ — гликированный гемоглобинhs-CPB —уровень С-реактивного белка, определенный высокочувствительным
методомIg — иммуноглобулинISTH — Исследовательская группа по ВА и фосфолипидзависимым антителамКа — константа скорости абсорбцииКСТ — kaolin clotting time, каолиновое времяKel — константа скорости элиминацииМАРК — система митоген-активируемых протеинкиназРАІ-1/ИАП-1 — plasminogen activator inhibitor 1, ингибитор активатора плазмино-
гена 1РВ — белковосвязывающая молярная доляРВР — platelet basic protein, основной пептид тромбоцитовPC — protein С, протеин СРСТ ~ прокальцитонинРСТ —platelet erit, тромбокритPDGF — platelet-derived Growth Factor, фактор роста тромбоцитарный
список СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ ПPDW -platelet distribution width, ширина гистограммы по объему тромбоцитов,степень тромбоцитарного анизоцитозаproBNP — прогормон мозгового натрийуретического пептидаРТ/ПВ — prothrombin time, протромбиновое времярОз рСО^ — напряжение кислорода, углекислого газаRIA — radioimmunoassay, радиоиммунный анализRVV — Russel Viper Venom, яд гадюки РасселаSCC — антиген плоскоклеточного ракаSHBG — секс-стероидсвязывающий глобулинSSCP — single strand conformation polymorphism, конформационный полиморфизм
одноцепочечных фрагментов ДНК
SB — стандартный избыток основанийSO2, sp2’ S3O2 — насыщение крови (венозной, артериальной) кислородом
TF — tissue factor, тканевой факторtPA — tissue plasminogen activator, тканевой активатор плазминогенаиве - Urinary Bladder Cancer, опухоль мочевого пузыряVd — объем распределенияа-ГБДГ — а-гидроксибутиратдегидрогеназаАпоА-1 — аполипротеин A-IАпоА-П — аполипротеин А-ПАА — апластическая анемияABC — активированное время свертыванияАДГ - антидиуретический гормонАДФ — аденозиндифосфатАИГА — аутоиммунная гемолитическая анемияАИТ — аутоиммунный тиреоидитАКТГ - адренокортикотропный гормонАЛТ — аланйнаминотрансферазаАнти-ред.ТТГ, a-KTSH — антитела к рецептору ТТГАПГ — анализатор показателей гемостазаАПТИ - аспирационная пункция тонкой иглойАПФ — ангиотензин-превращающий ферментАСА — аргинин-янтарная ацидурияАСК — анализатор свертывания кровиАСЛ-0 — антистрептолизин-ОACT — аспартатаминотрансферазаАТ — антитромбинАТФ — аденозинтрифосфатАТППК1 — аминотерминальные пропептиды проколлагена I типа
АТ-ТГ — антитела к тиреоглобулинуАТТК 1 — аминотерминальные телопептиды коллагена I типаАФА — антифосфолипидные антителаАФП ~ а-фетопротеинАФС — антифосфолипидный синдромАХЗ — анемия хронических заболеванийАЧТВ — активированное частичное тромбопластиновое времяБАЛ — бронхоальвеолярный лаважБГЛ — большие гранулярные лимфоциты і ’ БОЕ-Э — бурстобразующие единицы эритропоэзаБТП - бедная тромбоцитами плазма — БТЦ - болезнь тяжелых цепей
ВА — волчаночный антикоагулянт
ВКЛ — волосатоклеточный лейкоз
18 список СОКРАЩЕНИЙ и УСЛОВНЫХ ОБОЗНАЧЕНИЙВОК — внешняя оценка качестваВПР — врожденные пороки развитияВПЧ — вирус папилломы человекаВС — водные стандартывек — время свертывания цельной кровиВФ — внутренний фактор КаслаВЦР — видеоцифровая регистрацияВЭЖХ — высокоэффективная газовая хроматографияГ-6-ФД - глюкозо-6-фосфатдегидрогеназаГАГ — гликозаминогликаныГАЛК — галактокиназаГАЛТ — галактозо-1-фосфатуридилтрансферазаГАЛЭ — уридилдифосфогалактозо-4-эпимеразаГГА — гипоталамо-гипофизарно-адреналоваяГГТ — -^глутамилтранспептидазаГЖХ ~ газово-жидкостная хроматографияГ-КСФ — гранулоцитарный колониесгимулирующий факторГМ-КСФ — гранулоцитарно-макрофагальный колониестимулирующий факторГнРГ — гонадолиберинГОЛ — галактозилоксилизинГСПГ — глобулин, связывающий половые гормоныГТТ — глюкозотолерантный тестГФА — гиперфенилаланинемияГХ — газовая хроматографияГХ/МС — газовая хроматография/масс-спектрометрияГХ/ПИ — газовая хроматография/плазменная ионизацияГЦР — гепатоцеллюлярный ракГЭБ — гемато-энцефалический барьердве — диссеминированное внутрисосудистое свертываниеДГПЖ — доброкачественная гиперплазия предстательной железыДГЭА-С — дегидроэпиандростерон-сульфатДО2 — доставка кислородаДПИД — дезоксипиридинолинДТ — детектор термоионныйДТЗ - диффузно-токсический зобДТП — детектор теплопроводностиДУ — дискриминационный уровеньДЭА — дегидроэпиандростеронДЭЗ — детектор по захвату электроновЖДА — железодефицитная анемияЖЖЭ — жидкость-жидкостная экстракцияЖКТ — желудочно-кишечный трактЖХ-МС — жидкостная хроматография-масс-спектрометрия
ЖХВР — жидкостная хроматография высокого разрешения
ИАП — ингибитор активности плазминогена
ИБС — ишемическая болезнь сердца.ИВЛ — искусственная вентиляция легких
ИГХ — иммуногистохимический
ИЛ — интерлейкинИМА — индекс множественных аномалий
ИМЛ — исследования по месту лечения
ИОХ — ионно-обменная хроматография
ИРТ — иммунореактивный трипсиноген
список СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ 19иен — индекс созревания нейтрофиловИСЭ — индекс созревания эритрокариоцитовИТЗ — индекс тератозооспермииИФ — иммунофлюоресценцияИФА - иммуноферментный анализИФР-1 - инсулиноподобный фактор роста 1ИХА — иммунохимический анализИХЛ - иммунохемилюминесцентный анализКДЛ — клинико-диагностическая лабораторияКК — креатинкиназаКЛ - кардиолипинКОД — коллоидно-осмотическое давление плазмыКОЕ — колониеобразующие единицыКОЕ-Г - колониеобразующая единица гранулоцитопоэзаКОЕ-ГМ - колониеобразующая единица грануломоноцитопоэзаКОЕ-ГЭММ — колониеобразующая единица гранулоцитарно-эритроцитарно-макрофагально-мегакариоцитарнаяКОЕ-Э - колониеобразующие единицы эритроидного рядаКОС — кислотно-основное состояниеКРР — колоректальный ракКСФ — колониестимулирующий факторКТ — компьютерная томографияКТА — клинико-токсикологический анализКТППК1 — карбокситерминальные пропептиды проколлагена I типа
КТР — копчико-теменной размерКТТК 1 — карбокситерминальные телопептиды коллагена I типа
КФ — кислая фосфатазаКЩФ - костный изофермент щелочной фосфатазыДА — латекс-агглютинацияЛБН — лизосомные болезни накопленияЛГ — лютеинизирующий гормонЛДГ - лактатдегидрогеназаЛИС — лабораторная информационная системаЛП - липопрогеинЛПВП - липопротеиды высокой плотностиЛПНП - липопротеиды низкой плотностиЛПОНП - липопротеиды очень низкой плотностиЛУ — лимфатические узлыМА — моноклональные антителаМАО — моноаминооксидазаМДС - миелодиспластический синдромМИЧ — международный индекс чувствительностиМКРЛ — мелкоклеточный рак легкихММП — матриксные металлопротеиназыМНС - международное нормализованное соотношениеМОД - минутный объем дыханияМПО - миелопероксидазаМС — детектор масс-селективныйНАД - никотйнамидадениндинуклеотидНБО — наследственные болезни обмена веществНМРЛ — немелкоклеточный рак легкогоНО - нормализованное отношениеНСЕ — нейроспецифическая енолаза
20 список СОКРАЩЕНИЙ и УСЛОВНЫХ ОБОЗНАЧЕНИЙНТЖ — насыщение трансферрина железом
НФХ - нормально-фазовая хроматография
НХЛ - неходжкинская лимфома
ОДН — острая дыхательная недостаточность
ОЖСС — общая железосвязывающая способность
ОИМ — острый инфаркт миокарда
ОК — остеокальцин
ОЛ — острый лейкозОЛЖН — острая левожелудочковая недостаточность
ОЛЛ — острый лимфобластный лейкоз
ОМ - опухолевые маркеры
ОМЛ — острый миелолейкозОНМК — острое нарушение мозгового кровообращенияОП - оптическая плотностьОПр — оксипролинОтП - отношение правдоподобияОПеН — острая печеночная недостаточностьОПЖН - острая правожелудочковая недостаточностьОПН — острая почечная недостаточностьОРВИ — острая респираторная вирусная инфекцияОСН — острая сердечная недостаточностьОФК - обращенно-фазовая хроматографияОЦК - объем циркулирующей кровиПАБК — парааминобензойная кислотаПАСК - парааминосалициловая кислотаПВ — протромбиновое времяГТДТ — первичный документ тестаПДФ — продукты деградации фибринаПДФ/ПДф - продукты деградации фибрина и фибриногенаПИД - пиридинолинПНГ — пароксизмальная ночная гемоглобинурияПО — протромбиновое отношениеnOj — потребление кислородаПОЛ — перекисное окисление липидовПОН - полиорганная недостаточностьnpS — протеин SПРЛ — пролактинПСА — простатоспецифический антигенПСМА - простатоспецифический мембранный антигенПТГ — паратиреоидный гормонПФИА — поляризационный флюороиммунологический анализПЦР — полимеразная цепная реакцияРА - рецептор андрогеновРА — рефрактерная анемияРАИБ — рефрактерная анемия с избытком бластовРАКС - рефрактерная анемия с кольцевидными сидеробластамиРГ ~ рецептор глюкокортикоидовРДС — респираторный дистресс синдромРИА — радиоизотопный анализРМЖ — рак молочной железыРМП — рак мочевого пузыряРИГА — реакция непрямой гемагглютинацииРНК — рибонуклеиновая кислота
список СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ 21РНП-плазма — референтная нормальная пулированная плазмаРП — рецептор прогестеронаРПГА — реакция прямой гемагглютинацииРПЖ — рак предстательной железыРСК — реакция связывания комплементаРТК — рак толстой кишкиРФМК — растворимые фибрин-мономерные комплексыРЦМД - рефрактерная цитопения с многоростковой дисплазиейРШМ — рак шейки маткиРЭ — рецептор эстрогеновРЭА — раково-эмбриональный антигенРЭС — ретикулоэндотелиальная системаРЭФР — рецептар эпидермального фактора ростаРЯ — рак яичниковСД — сахарный диабетСЖ — синовиальная жидкостьСЖК — свободные жирные кислотыСИ — сердечный индексСКВ — системная красная волчанкаСКК — стволовые кроветворные клеткиСКФ — скорость клубочковой фильтрацииСМФ — система мононуклеарных фагоцитовСОЭ — скорость оседания эритроцитовСПИД — синдром приобретенного иммунодефицитаСРБ — С'реактивный белокСТГ — соматотропный гормонСЦК — средний цитохимический коэффициентТЗ - трийодтиронинТ4 - тироксинТБГ — трофобластический глобулинТВ - тромбиновое времяТВП — толщина воротникового пространстваТГ — тиреоглобулинТГ — триглицеридыТКПБ — тонкоигольная капиллярная биопсия
ТЛМ — терапевтический лекарственный мониторинг
ТМБ — тетраметилбензидин
ТПО — тиреопероксидаза
Тр — тропонинТРГ — тиреотропин-рилизинг-гормонТС At — тиреоид-стимулирующие антителатег ~ тироксинсБязывающий глобулинТСИ — тиреоид-стимулирующий иммуноглобулинТСПА — тироксинсвязывающий преальбуминтех — тонкослойная хроматографияТТГ — тиреотропный гормонТТП — тромботическая тромбоцитопеническая пурпураТФР — трансформирующий фактор ростаТЭСГ — тестостерон-эстрад иол связывающий белокУЗИ — ультразвуковое исследованиеyOj — утилизация кислородаФАБ-классификация — Франко-Американо-Британская классификация
ФВ — фактор фон Виллебранда
22 список СОКРАЩЕНИЙ и УСЛОВНЫХ ОБОЗНАЧЕНИЙФДК — фолликулярные дендритные клетки
ФИ — фосфатидилинозитол
■ фолиевая кислота
ФКУ — фенилкетонурия
ФМ — фибрин-мономеры
ФНО — фактор некроза опухолиФПИА — флюоресцентно-поляризационный иммуноанализ
ФС — фосфатидилсеринФСВОК — Федеральная система внешней оценки качества
ФСГ — фолликулостимулирующий гормон
ФСК — фактор стволовых клеток
ФЭА — фосфатидилэтаноламин
ФЭУ — фотоэлектронные умножители
ХГАБ ~ холодовая гемагглютининовая болезнь
ХГЧ — хорионический гонадотропин человека
ХЛЛ ~ хронический лимфолейкоз
ХМ — хиломикроны
ХМЛ — хронический миелолейкоз
ХММЛ — хронический миеломоноцитарный лейкоз
ХМПЗ — хронические миелопролиферативные заболевания
ХМС — хроматомасс-спектрометрия
ХПН — хроническая почечная недостаточность
ХС-ЛПВП — холестерин липопротеидов высокой плотности
ХЭ — холинэстераза
ЦБ — центробласты
ЦВД — центральное венозное давление
ЦИМ — цитологическое исследование мокроты
ЦМВ — цитомегаловирус
ЦНС — центральная нервная система
ЧСС — частота сердечных сокращений
ЩФ — щелочная фосфатаза
ЭДТА — этилендиаминтетраацетат
ЭКО — экстракорпоральное оплодотворение
ЭПО — эритропоэтин
эЭПО — эндогенный эритропоэтин
р-ТГ — р-тромбоглобулин
Глава 1
Лабораторное обеспечение
медицинской помощиПРЕДМЕТ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ
МЕДИЦИНЫПрактическая деятельность врача любой специальности связана
с потребностью в сведениях о состоянии процессов жизнедеятель¬
ности отдельных органов и тканей, а также организма пациен¬
та в целом. Уменьшить имеющуюся неопределенность призваны
объективные методы исследования, которые активно внедряются
в клиническую практику. Выполнение таких исследований, как
правило, требует специального оборудования, профессиональной
подготовки персонала, особой организации работы в учрежде¬
нии здравоохранения. В настоящее время многочисленные виды
объективных исследований консолидированы в три направления:
лучевую (интраскопическую), функциональную и клиническую
лабораторную диагностику. Последнюю все чаще определяют как
лабораторную медицину, что, с одной стороны, подчеркивает мас¬
штаб и значимость этого направления в современной практике, с
другой — очерчивает область исследований in vitro, включая микро¬
биологические, токсикологические, генетические и другие виды
исследований, выполняемые вне человека с материалами от него.Предмет лабораторной медицины — получение и предоставление
для клинического использования информации о составе (химиче¬
ском и клеточном) биоматериалов и изменениях, доказательно свя¬
занных причинно-следственными взаимоотношениями с опреде¬
ленными патологическими процессами и состояниями в организме
человека. Эта информация необходима для решения важнейших
медицинских задач:• оценки состояния здоровья человека при профилактическом
обследовании:• обнаружения признаков болезней (диагностика и дифферен¬
циальная диагностика);• определения характера (активности) патологического процесса;• оценки функциональных систем и их компенсаторных воз¬
можностей;• определения эффективности проводимого лечения;• слежения за концентрацией лекарств (лекарственный монито¬
ринг);• определения прогноза заболевания;• определения достижения результата лечения.
ШШ24ЛАБОРАТОРНОЕ ОБЕСПЕЧЕНИЕ МЕДИЦИНСКОЙ ПОМОЩИЛабораторная медицина открывает широкие возможности для точного и ран¬
него обнаружения признаков патологических процессов и заболеваний, в ней
используются качественные и количественные показатели, поддающиеся кон¬
тролю. Ее методы доступны для большинства учреждений здравоохранения по
финансовым и иным критериям. Лабораторные данные приобретают все большую
значимость как доказательства при решении социальных и юридических вопро¬
сов. Общепризнан вклад лабораторной диагностики в развитие доказательности
в медицине. Неотъемлема роль современной лаборатории в обеспечении высо¬
ких медицинских технологий, внедрение которых принято как часть программы
модернизации здравоохранения России.В настоящее время лабораторная информация используется при принятии
до 70% медицинских решений практически во всех клинических дисциплинах.
Лабораторные исследования включены в программу диспансеризации, в стандар¬
ты медицинской помощи при большинстве форм патологии. Высокая востребо¬
ванность лабораторных исследований демонстрируется ежегодным приростом их
количества по стране. Согласно статистическим данным Минздравсоцразвития
Российской Федерации, только лаборатории учреждений здравоохранения мини¬
стерского подчинения (без ведомственных, частных) в течение года выполняют
свыше 3 млрд анализов. На одного больного в стационаре в 2008 г. приходи¬
лось в среднем 38,9 анализа, на 100 амбулаторных посещений - 122 анализа.
Лабораторные исследования составляют 89,3% общего количества объективных
диагностических исследований. Анализ отчетов по регионам однозначно свиде¬
тельствует о росте количества исследований и увеличении технологичных иссле¬
дований. В ведомственных учреждениях здравоохранения обеспечение анализами
пациентов заметно выше, чем в среднем по стране. Это, а также быстрый рост
объема исследований, выполняемых в коммерческих лабораториях, позволяет
говорить о неполном удовлетворении реальной потребности в данном виде меди¬
цинских услуг, причем как специализированных, так и массовых рутинных.Лабораторная информация основана на обнаружении и/или измерении в образ¬
цах биоматериалов определенных компонентов (аналитов), которые функцио¬
нально или структурно связаны с нарушенной функцией или с пораженным орга¬
ном, отражают наличие патологического процесса и характеризуют его причину,
механизмы развития, выраженность и индивидуальную картину заболевания. Для
обеспечения ценности получаемой информации лабораторная медицина решает
следующие задачи;• определение круга компонентов биологических материалов человека, изме¬
нения которых имеют доказанную причинно-следственную связь с возмож¬
ными патологическими состояниями;• разработку методов исследования биоматериалов, применение которых
позволяет обнаружить искомый компонент биоматериала и при необходи¬
мости измерить его содержание;• разработку условий для выполнения исследований биоматериалов и интер¬
претации их результатов, обеспечивающих получение достоверной лабора¬
торной информации.При решении этих задач лабораторная медицина:• опирается на фундаментальные медико-биологические науки — биологию,
физиологию, биохимию, цитологию, микробиологию, иммунологию, моле¬
кулярную биологию, общую патологию;• использует современные возможности химического анализа, биофизики,
электроники, приборостроения, метрологии;• применяет методы доказательной медицины, математической статистики,
информатики для установления связи между элементами лабораторной и
клинической информации.
ЛАБОРАТОРНОЕ ОБЕСПЕЧЕНИЕ МЕДИЦИНСКОЙ ПОМОЩИ 25Соответственно в рамках лабораторной медицины можно выделить патобиоло¬
гию как ее теоретическую основу, лабораторную (клиническую) аналитику — как
совокупность средств и способов выполнения исследований и собственно клинико¬
лабораторную диагностику — как совокупность доказательств информативности
лабораторных показателей для конкретных медицинских задач. Эти три раздела
гармонично связаны между собой, причем не только в масштабах отрасли знаний,
но и в рамках практической деятельности конкретных лабораторий и учреждений,
что реализуетсяся через соответствующую профессиональную подготовку кадров
(знания и компетенции), техническое и материальное оснащение, а также анализ
клинического материала.Лабораторная медицина — медицинская специальность, в которой как никакой
другой активно используют достижения фундаментальных наук для клинической
медицины, способствуя применению фундаментальных разработок в практиче¬
ском здравоохранении.ОБЪЕКТЫ КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙБиоматериалы человека (биологические жидкости, ткани и экскреты) представ¬
ляют собой сложные системы — смеси различных веществ и клеток. Эндогенные
компоненты биоматериалов, ифая определенную функциональною роль, изменя¬
ются при нарушениях физиологических процессов под воздействием на организм
патогенных факторов, а также в ходе формирования защитных и компенсаторных
реакций. Именно поэтому исследование эндогенных компонентов может способ¬
ствовать выявлению или подтверждению наличия патологических процессов,
установлению их характера. Что касается экзогенных компонентов биоматериалов
(бактерий, вирусов, грибов, паразитарных организмов и продуктов их жизнедея¬
тельности), то они обычно играют причинную роль в развитии патологических
процессов.В аналитике компоненты системы подразделяют на аналиты, конкомитан-
ты и растворители; последние два вида компонентов обозначают как матрицу.
Аналит — компонент пробы, указанный в названии исследуемого свойства или
измеряемой величины.В клинической лабораторной диагностике аналитами могут быть (табл. 1-1):• физические свойства;• химические элементы, ионы, неорганические молекулы;• органические структуры с малой молекулярной массой;• макромолекулы с известной или приблизительно установленной структурой
и специфическими биологическими свойствами;• клетки, их структурные элементы или клеточные системы;• микроорганизмы, их структуры и свойства;• паразитарные организмы, их структуры и свойства.Соответственно характеру и свойствам исследуемых аналитов и особенностям
применяемых аналитических процедур клинические лабораторные исследования
подразделяются на химико-микроскопические, биохимические, гематологиче¬
ские, коагулологические, иммунологические, изосерологические, цитологические,
генетические, молекулярно-биологические, бактериологические, вирусологиче¬
ские, паразитологические, микологические, токсикологические, лекарственный
мониторинг. Номенклатура клинических лабораторных исследований постоянно
пополняется соответственно развитию медицинской науки.
Таблица 1-1. Виды аналитов — объектов клинических лабораторных исследованийIV»о>ВидыбноматериаяовВиды компонентов
биоматериалов
человекаВиды аналитовОтдельные аналитыприменяемые технологииВиды исследованийКровьЭндогенные химиче¬
ские компонентыХимические элементы, ионы,
неорганические молекулы.Электролиты, микроэлементы.
Ионы водородаЭлектрохимические методы.
Свето-эмиссиониые технологииКлинико-биохимическиеорганические соединения с
малой молекулярной массойСубстраты.МетаболитыХимические технологииКлинико-биохимическиеЭндогенные гумо¬
ральные факторы
распознавания и
защитыМакромолекулы с известной
или приблизительно установ¬
ленной структурой и специфи¬
ческими биологическими
свойствамиФерменты.Транспортные белки.Антигены гистосовместимости.
Факторы гемостаза.АнтителаАгглютинационные и преципита-
ционные технологии.Лигандные технологии.
Химические технологииКлинико-биохимические.ИммунологическиеСобственные кле¬
точные элементы
организмаКлетки крови, их структурные
элементы или клеточные
системыМембраны клеток, митохон¬
дрии. ядра; структурные белки,
рецепторы, ферментыСветовая микроскопия.
Цитохимические технологии.
Проточная цитометрия.
ИммуноцитофлюорометрияГематоцитологическиеСобственные кле¬
точные факторы
распознавания и
защитыМакрофаги.Т- и В-пимфоцитыМембраны клеток, митохон¬
дрии, ядра; структурные белки,
рецепторы, ферментыЛигандные технологии.
Световая микроскопия.
Цитохимические технологииИммунологическиеЭндогенные гумо¬
ральные и кле¬
точные факторы
гемостаза и фибри-
нолизаМакромолекулы с известной
или приблизительно установ¬
ленной структурой и специфи¬
ческими биологическими
свойствами.Клетки кровиКаскад ферментов и их инги¬
биторов.ТромбоцитыКлоттинговые, хромогенные,
иммунологические технологии.
Световая микроскопияКоагулологическиеБиологические
жидкости (помимо
крови) и экскретыСобственные
клеточные эле¬
менты организма.
Эндогенные химиче¬
ские компонентыКлеточные элементы.
Химические элементы, ионы,
неорганические молекулы.
Органические соединения с
малой молекулярной массойКлетки.Метаболиты.Корпускулярные образования
(остатки клеток, соли)Световая микроскопия.
Химические технологииХимико-микроскопическиеТканиСобственные кле¬
точные элементы
организмаКлетки, формирующие струк¬
туры тканей и органов; реали¬
зующие функции органовМембраны клеток, митохон¬
дрии, ядра: структурные белки,
рецепторы, ферментыСветовая микроскопия.
Цитохимические технологии.
Проточная цитометрияЦитологическиеізSSZ
Окончание табл. 1-1ВидыбиоматериаловВиды компонентов
биоматериалов
человекаВиды аналитовОтдельные аналитыПрименяемые технологииВиды исследованийТкани, кровьНосители генетиче¬
ской информацииМакромолекулы с известной
или приблизительно установ¬
ленной структурой и специфи¬
ческими биологическими
свойствамиНуклеиновые кислотыГибридизационные и амплифика-
ционные технологииМолекулярно-биологическиеБиологическив жид¬
кости, экскретыЭкзогенные патоген¬
ные организмыМикроорганизмы, их структура
и свойстваБактерии, вирусы, грибы.
Рост колоний.АнтигеныКультуральные технологии.
Световая микроскопия.
Лигандныв технологии.
Технологии гибридизации и
амплификации избранных после¬
довательностей нуклеотидовБактериологически.еВирусологические.МикологическиеПаразитарные организмы, их
структура и свойстваПростейшие, гельминтыСветовая микроскопия.
Лигандные технологииПаразитологическиеБиологические жид¬
костиЭкзогенные химиче¬
ские компонентыТоксины, металлы, спиртыНеорганические и органические
веществаХимические технологииТоксикологическиеНаркотические препаратыХимические соединения раз¬
личной степени сложностиХимические технологииНаркологическиеЛекарственные препаратыХимические соединения раз¬
личной степени сложностиХимические технологииТерапевтический лекар¬
ственный мониторингоВго
28 ЛАБОРАТОРНОЕ ОБЕСПЕЧЕНИЕ МЕДИЦИНСКОЙ ПОМОЩИЛАБОРАТОРНАЯ АНАЛИТИКАКлинические лабораторные исследования выполняются с применением анали¬
тических технологий (методов исследования), Клинико-лабораторная аналитиче¬
ская технология основана на взаимодействии используемых для анализа физиче¬
ских, химических или биологических факторов с искомым аналитом (табл. 1-2),
что приводит к генерации сигнала, который регистрируется измерительным
прибором. Методика лабораторного анализа проб биоматериалов включает сле¬
дующие процедуры:• сбор, обработку, хранение, транспортировку пробы биоматериала;• разделение компонентов биоматериалов перед их анализом;• специфическое взаимодействие химического, биологического или физиче¬
ского фактора с искомым аналитом, в результате чего происходят его моди¬
фикация, распознавание и генерация сигнала об этом;• детекцию и/или измерение сигнала, вызванного взаимодействием реагента
с аналитом, с помощью специального устройства или измерительного при¬
бора;• калибровку измерительного прибора для обеспечения правильности измере¬
ния сигнала в единицах измеряемой величины;• оценку рабочих характеристик методики исследования и ее выполнения
(контроль качества проведенного исследования);• обработку результатов анализов и их сообщение заказчику.Таблица 1-2. Основные принципы аналитических технологий, применяемых в клинической лабо¬
раторной аналитикеПринцип распознавания аналитаГенерация сигнала
0 характеристиках аналитаДетекция/измерение сигналаХимическое сродство молекул
реактива к аналиту, химическая
реакцияПреобразование структуры молекул
аналита.Изменение светолролускания раство¬
ра. содержащего аналитФотоколориметрия.
Абсорбционная фотометрия.
СпектрофотометрияСродство структуры аналита к
структуре фермента, расщелле-
ние соединенияТо жеАбсорбционная фотометрия.
СпектрофотометрияТо жеРасщелление хромогенного субстрата.
Изменение светолролускания раство¬
ра, содержащего аналитТо жеХимическое сродство молекул
реактива к аналиту, химическая
реакцияПереход молекул аналита в возбуж¬
денное состояние. Ислускание света.
ХемилюминесценмияХемилюминометрияСродство структуры фибриногена
к структуре ферментов — факто¬
ров свертывания крови, образо¬
вание фибринаОбразование сгустка крови, измене¬
ние вязкости пробыКлоттинговые методы коагуло-
метрии — оптическая, механи¬
ческая, оптико-механическая
регистрация времени образо¬
вания сгусткаВоздействие возбуждающего
света олределенной длины волны
на аналитПереход молекул аналита в возбуж¬
денное состояние.Испускание света большей длины
волныФлюорометрияВоздействие химической иони¬
зации, электронной лушки, тока
высокого напряжения, нагрева¬
ния на молекулы аналитаОбразование ионов с различными
молекулярной массой и зарядом,
разделение их с помощью электри¬
ческих и магнитных полей. Величина
сигнала зависит от количества ионов
в определенной зонеМасс-спектрометрия
ЛАБОРАТОРНОЕ ОБЕСПЕЧЕНИЕ МЕДИЦИНСКОЙ ПОМОЩИ 29Продолжение табл. 1-2принцип распознавания аналитаГенерация сигнаяа
0 характеристиках аналитаДетекция/измерение сигналаВоздействие высокотемпера¬
турного пламени на молекулы
аналитаИонизация молекул. Испускание света
специфической длины волны, окра¬
шивание пламениПламенная фотометрияВоздействие высокой температу¬
ры на молекулы аналитаИонизация молекул. Поглощение
света специфической длины волны,
излучаемого лампой с полым като¬
дом, изготовленным из исследуемого
элементаАтомно-абсорбционная спек-
трофотометрияЭлектрохимический процесс на
границе раздела фаз на электро¬
де, погруженном в раствор,
содержащий аналитИзменение структуры или концентра¬
ции аналита.Изменение электрического потен¬
циалаПотенциометрияТожеИзменение силы проходящего токаПолярография, вольт-
амперометрияТожеИзменение количества вещества,
выделяющегося на электроде.
Изменение количества электричества,
проходящего между двумя электрода¬
ми в электрохимической ячейкеКулон ометрияТо жеИзменение электропроводности
между двумя электродамиКондуктометрияСпецифическое связывание
аналита лигандами, имеющи¬
ми к нему высокое сродство.
Иммунохимическая реакция свя¬
зывания белка (антигена) специ¬
фическим белком (антителом)Образование агглютината.
Образование преципитатаРадиальная иммунодиффузия.
Иммуноэлектрофорез.
Электрофорез с иммунофик¬
сацией.Злектроиммунодиффузия.Иммунонефелометрия.Имму нотурбиди метр ИЯТожеЭффект связанной с лигандом
метки — фермента, флюорофора,
радиоактивного изотопаИммуноферментный анализ.Иммунофлюоресцентныйанализ.Радиоиммуноанализ.ИммуноблопингСпаривание комплементарных
последовательностей нуклеоти¬
дов зонда с однонитевой молеку¬
лой исследуемой ДНК или РНКЭффект связанной с зондом меткиГибридизация нуклеиновых
кислот.Выявление генетических
дефектовМногократная репликация фраг¬
мента исследуемой ДНК, ограни¬
ченного комплементарными оли-
гонуклеотидными праймерамиОбразование множества ампликонов
(амплификация).Эффект меткиЭлектрофорез в геле.
Регистрация флюоресценции.
Выявление генетических
дефектовИзбирательная реакция красителя
с отдельными химическими ком¬
понентами структур клеткиИзбирательная окраска компонентов
клетки (цитохимия)Визуальная детекция, световая
микроскопияИммунохимическая реакция
связывания белка (антигена)
структур клетки специфическим
белком (антителом), меченным
хромофором или флюорофоромИзбирательная окраска или свечение
компонентов клетки (иммуноцито¬
химия)Визуальная детекция, световая
микроскопия, флюоресцентная
микроскопияТожеТожеСветовая или флюоресцентная
микроскопия, цифровая реги¬
страция изображений клеток,
компьютерный анализ изо¬
бражений
MiІШІ!30ЛАБОРАТОРНОЕ ОБЕСПЕЧЕНИЕ МЕДИЦИНСКОЙ ПОМОЩИПродолжение табл. 1-2Принцип распознавания аналитаПрохождение клеток нерез
апертуру капиллярной трубки,
заполненной электропроводящим
раствором, между электродами
сети постоянного токаПрохождение клеток через апер¬
туру капиллярной трубки, осве¬
щаемую поляризованным лучом
лазера, между электродами сети
постоянного токаПрохождение клеток, обработан¬
ных антителами, связанными с
флюоресцентными красителями,
через апертуру капиллярной
трубки, освещаемую поляризо¬
ванным лучом лазера, между
электродами сети постоянного
токаСпособность микроорганизмов
размножаться на питательной
среде определенного состава,
соответствующей особенностям
метаболизма данного вида
микроорганизмовСпособность микроорганизмов
с помощью присущих им фер¬
ментов вызывать расщепление
определенных субстратовСпособность микроорганизмов
вызывать образование в орга¬
низме пациента специфических
антителТо жеСпособность антител тест-
системы специфически связы¬
ваться с антигенами, свойствен¬
ными микроорганизму, в образце
культуры микроорганизмаСпаривание комплементарных
последовательностей нуклео¬
тидов зонда с однонитевой
молекулой исследуемой ДНК или
РНК образца культуры микро¬
организмаГенерация сигнала
о характеристиках аналитаИзменение электропроводностиИзменение электропроводности, рас¬
сеяние света лазераИзменение электропроводности, рас¬
сеяние света лазера.Специфическое свечение окрашенных
структур клетокОбразование растущими микроорга¬
низмами колоний определенного видаИзменение цвета набора субстратов-
хромогенов при контакте с образцом
из культуры микроорганизмаСпецифическое связывание антител,
образовавшихся в организме пациен¬
та под действием патогена, с антиге¬
ном или антителом тест-системы.
Образование агглюгината или пре¬
ципитатаСпецифическое связывание анти¬
тел, образовавшихся в организме
пациента под действием патогена, с
меченым антигеном или антителом
тест-системы.Эффект меткиТо жеЭффект связанной с зондом меткиДетекция/измерение сигналаКондуктометрия.
Проточная цитометрияРадиочастотный анализ.
Трехмерный анализ лейко¬
цитов.Многоугловая система лазер¬
ного светорассеянияПроточная иммуноцитофлюо-
рометрия.ИммунофенотипированиеклетокВизуальная оценка, световая
микроскопия, счетчики коло¬
ний.Культуральный методВизуальная оценка цветовой
реакции.ФотометрияИммуносерологические мето¬
ды.Радиальная иммунодиффузия.
Иммуноэлектрофорез.
Электрофорез с иммунофик¬
сацией.Электроиммунодиффузия.Иммунонефелометрия.Иммунот^бидиметрияИммуноферментный анализ.Иммунофлюоресцентныйанализ.Радиоиммуноанализ.ИммуноблоттингТо жеГибридизация нуклеиновых
кислот.Генотипирование микроорга¬
низма
ЛАБОРАТОРНОЕ ОБЕСПЕЧЕНИЕ МЕДИЦИНСКОЙ ПОМОЩИ 31Окончание табл. 1-2Прннцип распознавания аналитаГенерация сигнала
о характеристиках аналитаДетекцмя/измерение сигналаМногократная репликация спе¬
цифического фрагмента иссле¬
дуемой ДНК, ограниченного оли-
гонуклеотидными праймерами,
комплементарными концевым
участкам фрагмента-мишени,
образца культуры микроорга¬
низмаОбразование множества ампликонов
(амплификация).Эффект меткиЭлектрофорез в геле.
Регистрация флюоресценции.
Идентификация микроорга¬
низмаВ процессе лабораторного исследования применяют изделия для диагностики in
vitro, предназначенные для выполнения определенных процедур:• препаративные устройства, используемые для сбора, транспортировки, хра¬
нения и подготовки проб биожидкостей человека и создания необходимых
условий для их анализа;• реагенты и аналитические тест-системы — химические или биологические
вещества и их функционально связанные комплексы, способные участво¬
вать в реакциях распознавания искомых аналитов и генерировать сигналы,
используемые для обнаружения или измерения содержания аналитов;• детекторы и измерительные приборы, предназначенные для измерения
сигналов, возникающих при исследовании аналитов, включая устройства,
совмещающие функции разделения компонентов с их измерением;• калибраторы и контрольные материалы — изделия, применяемые для кали¬
бровки средств измерения (калибраторы) и контроля рабочих характеристик
методик исследования (контрольные материалы);• средства информатики, программное обеспечение и федства коммуникации,
предназначенные для обработки и передачи лабораторной информации,
получаемой в результате исследования.В настоящее время разработаны и широко применяют полуавтоматические
и автоматические устройства, называемые автоанализаторами. Различные кон¬
структивные варианты этих устройств предусматривают выполнение в одном при¬
боре препаративных, дозировочных и измерительных процедур, сопоставления
результатов с референтными пределами, встроенного контроля качества, выдачи
результатов исследований в обработанном виде.Другое направление развития средств лабораторного анализа представляют
медицинские изделия для самотестирования и исследований in vitro вне лаборато¬
рии — портативные аналитические устройства, предназначенные для выполнения
определенных исследований образцов биологических материалов человека вне
лаборатории, в том числе самим пациентом,ФОРМЫ ОРГАНИЗАЦИИ ЛАБОРАТОРНОГО ОБЕСПЕЧЕНИЯ
МЕДИЦИНСКОЙ ПОМОЩИЛабораторные исследования проводятся специально организованны¬
ми и оснащенными подразделениями медицинских организаций — клинико-
диагностическими лабораториями. Заказчиком исследований является лечащий
врач или врач, организующий диспансерное обследование. Именно врач определя¬
ет круг исследований и организует сбор и взятие биоматериала. Ответственность
за соблюдение правил подготовки больного к исследованию, правил взятия, хра¬
нения и доставки материала в лабораторию несет персонал клинических подраз¬
делений, за исключением случаев взятия крови из пальца. На основе применения
32ЛАБОРАТОРНОЕ ОБЕСПЕЧЕНИЕ МЕДИЦИНСКОЙ ПОМОЩИразнообразных средств лабораторного анализа сложились три формы организа¬
ции лабораторного обеспечения медицинской помощи.Традиционная форма, которую можно назвать локальной, возникла с
началом существования лабораторной медицины как самостоятельной сферы
медицинской деятельности. Многое из достигнутого лабораторной медициной
было получено в лабораториях больниц и поликлиник. Лаборатории изначально
создавались как одно из диагностических подразделений медицинского учрежде¬
ния, что дало право рассматривать лабораторную диагностику как клиническую
дисциплину. Такое положение лаборатории в составе учреждения позволяет ее
работникам не только выполнять лабораторные исследования, но и участвовать
во всем лечебно-диагностическом процессе, дает им возможность как реализо¬
вывать и совершенствовать свои медицинские знания, так и влиять на оказание
медицинской помощи пациентам. Такая связь способствует организации лабора¬
торного обследования в интересах решения клинических задач и более глубокой
интерпретации лабораторных результатов применительно к каждому случаю забо¬
левания. Лаборатории функционируют в составе примерно 80% государственных
и муниципальных учреждений здравоохранения страны (табл. 1-3) в соответствии
с положением, утвержденным Министерством здравоохранения и социального
развития РФ.Таблица 1-3. Количество лабораторий учреждений здравоохранения России в 2008 г.ЛабораторияКоличествоКлинико-диагностическая7942Радиоизотопной диагностики181Микробиологическая (бактериологическая),970в том числе централизованная272Иммунологическая (серологическая),541в том числе централизованная221Биохимическая,448в том числе централизованная87Цитологическая,279в том числе централизованная105Коагулологическая,66в том числе централизованная20В лабораториях трудятся специалисты с высшим и средним специальным обра¬
зованием (табл. 1-4), профессиональная подготовка которых осуществляется в
установленном порядке в соответствии с образовательными стандартами, а долж¬
ностные обязанности определены положениями, утвержденными Министерством
здравоохранения и социального развития РФ.Таблица 1-4. Персонал государственных клинико-диагностических лабораторий (по данным за
2002 г.)ПерсоналДолжностиКоличество
физических лиц
медицинских
работников на
занятых дояжностйхВсего физических
лиц мецицинских
работниковштатныезанятыеВрачи клинической лабора¬
торной диагностики39 9103711614 08016 531Специалисты со средним
медицинским образованием47 89444 86326 64339 454
ЛАБОРАТОРНОЕ ОБЕСПЕЧЕНИЕ МЕДИЦИНСКОЙ ПОМОЩИ33Клинико-диагностические лаборатории выполняют широкий круг лабора¬
торных тестов (табл. 1-5) в соответствии с номенклатурой, утвержденной феде¬
ральным органом исполнительной власти в сфере здравоохранения. Перечень
исследований, выполняемых в конкретной лаборатории, должен соответствовать
лицензионному уровню учреждения, утверждается главным врачом и обеспечива¬
ется материально-техническими ресзфсами.Таблица 1-5. Количество анализов, выполняемых в государственных клинико-диагностических
лабораториях (по данным за 2008 г.)АнализыВсегоВ том числе амбулаторным бальным
(включая бальных на дому)Всего, в том числе:3 260 965 4081 828 639 134гематологические1 009 780 847571 493 338цитологические45 811 07135 543 689биохимические594 365 031265 776 040коагулологические89 763 83932109 353иммунологические264 784 375166 576 549микробиологические140 202 ООО70 091 778Удаленная форма лабораторного обеспечения развивается на основе центра¬
лизованного выполнения наиболее сложных видов лабораторных исследований и
внедрения автоматизированных аналитических систем. Положительные стороны
работы крупных автоматизированных лабораторий: значительное повышение
производительности, повышение качества результатов, сокращение удельной
стоимости анализов за счет их выполнения в больших сериях. Однако при этом
нельзя не видеть ослабления связи лабораторного персонала с процессом оказания
медицинской помощи конкретному больному, тенденцию к превращению центра¬
лизованных лабораторий в «фабрики лабораторных анализов», к углублению раз¬
рыва между достижениями аналитики и их освоением в клинической практике.Мобильная форма лабораторного обеспечения медицинской помощи полу¬
чила распространение за счет разработки, производства и использования порта¬
тивных аналитических устройств, свойства которых позволяют их применение
по месту лечения пациента или оказания неотложной помощи нелабораторным
персоналом, а также самими пациентами на дому (табл. 1-6).Несомненный выигрыш при таком способе выполнения лабораторных иссле¬
дований — резкое сокращение сроков получения лабораторной информации
клиницистами. Лабораторное исследование становится частью непосредственного
оказания помощи пациенту. Однако при проведении таких исследований необ¬
ходимо сохранять контроль со стороны традиционных стационарных лабора¬
торий для обеспечения качества и надежности результатов (ГОСТ Р ИСО 22870
«Исследования по месту лечения. Требования к качеству и компетентности»).ОПЕРАТИВНОСТЬ ПОЛУЧЕНИЯ ЛАБОРАТОРНОЙ ИНФОРМАЦИИИнформация о состоянии внутренней среды пациента, получаемая в результате
клинических лабораторных исследований, имеет реальную клиническую ценность
только при условии ее предоставления в сроки, позволяющие принять необхо¬
димые лечебные меры. Б зависимости от характера и темпа патологического
процесса, от цели назначения лабораторного теста потребность в лабораторной
ішформации может быть:• неотложной, т.е. требоваться в течение нескольких минут для принятия сроч¬
ных клинических решений в критических ситуациях;
Таблица 1-6. Основные принципы аналитических технологий, используемые в средствах анализа вне лабораторииыСредства анализа внеДетекция сигналаЖидкостный методлабораториираспознаваниегенерация сигналаформатматрицадвижущая сила для
жидкостиДиагностическая тест-
полоскаИндикаторы (конъюгация, образование
ионов, гидрофобное связывание)Оптическая детекция (индикато¬
ры, катализ)АбсорбентБумагаАдсорбцияГлюкометрКаталитические реакции (субстрат фер¬
мента, продукт реакции катализа)Оптическая детекция.
Электрохимическая реакцияАбсорбент, капилляр¬
ный эффектБумага, пластик,
пленкиАдсорбция, капиллярный
эффектИммунохроматографияАссоциация совокупности (антитела,
селективные мембраны, макромолеку¬
лы)Оптическая детекция (катализ,
частицы)Латеральный поток,
кассетаБумага, мембраныХроматографияМикрокюветаИндикаторы (конъюгация).
Каталитические реакции (продукт реак¬
ции катализа)Оптическая детекция (прямая,
индикаторы, каталитическая
реакция)Капилляр, кассетаПластикКапиллярный эффектИммуножидкостнаякассетаАссоциация совокупности (антитела,
селективные мембраны, макромолеку¬
лы)Оптическая детекция (катализ,
частицы)КассетаПластикКапиллярный эффект, дей¬
ствие центрифуги, насоса,
вакуумаКассета для газов крови
и электролитовАссоциация совокупности (селективные
мембраны, макромолекулы)Электрохимическая (ампероме-
трия, потенциометрия)Кассета, капилляр,
трубкаПластик, мембра¬
ны, пленкиДействие насоса, вакуума,
нагревания, механикаКассета для коагуломе-
трииКаталитические реакции (субстрат
фермента, детекция фермента, продукт
реакции катализа)Смещение света (нано-, пара¬
магнитные частицы, интерфе¬
ренция света)Латеральный поток,
кассетаБумага, пластикХроматография.
Капиллярный эффектИммуноволновое измене¬
ние поверхностиАссоциация совокупности (антитела,
макромолекулы)Индукция поверхности (усиле¬
ние поверхности, распознавание
образов)Кассета, волокно,
поверхностьПластик, неорга¬
ническая основаНасос, пипетирование
ЛАБОРАТОРНОЕ ОБЕСПЕЧЕНИЕ МЕДИЦИНСКОЙ ПОМОЩИ35• систематической, т.е. требоваться периодически, через строго определенные
промежутки времени (при проведении функциональных тестов, лекарствен¬
ном мониторинге);• плановой, т.е. требоваться в соответствии с общим планом обследования
пациента для осуществления диагностического алгоритма и мониторинга
эффективности лечебных мер.требования к своевременности получения лабораторной информации должны
определяться протоколом диагностики и лечения соответствующей болезни с
учетом аналитических возможностей и организации лабораторного обеспечения в
данной медицинской организации. Форма обеспечения лабораторных исследова¬
ний (табл. 1-7) в медицинской организации (выполнение анализов в лаборатории
учреждения, централизованной лаборатории, экспресс-лаборатории, лаборатории
приемного отделения или «по месту лечения») должна удовлетворять клиниче¬
ским потребностям диагностики и лечения больных в данном учреждении в соот¬
ветствии с его медицинским профилем.Таблича 1-7. Формы лабораторного обеспечения в медицинских организациях различной мощ¬
ностиОрганизационно-кадроваяформаСпособы лабораторного обеспеченияПримерные сроки предоставления
лабораторной информацииОтсутствие лабораторииНаправление проб в централизован¬
ную лабораториюОбщий оборот теста от 1 до несколь¬
ких суток в зависимости от рас¬
стояния, способа доставки проб и
передачи результатовИспользование средств «исследова¬
ний по месту лечения» (ИМЛ) клини¬
ческим персоналом5-15 минЛаборатория, располагаю¬
щая лишь персоналом со
средним образованием, без
врача клинической лабора¬
торной диагностикиПредписанный для данного типа
учреждений набор лабораторных
тестов.В течение дня или на следующий
день. Возможно внеочередное
выполнение экстренных анализовТрадиционные ручные методыИспользование средств ИМЛ для
некоторых тестов клиническим пер¬
соналом5-15 минНаправление проб для анализов в
лабораторию, аккредитованную для
их выполненияОт одних до нескольких суток в
зависимости от расстояния, способа
транспортировки проб и передачи
результатовВрач + персонал со средним
образованиемПредписанный для данного типа
учреждений набор лабораторных
тестов.В течение рабочего дня. Возможно
внеочередное выполнение экстрен¬
ных анализовТрадиционные ручные методыМалая автоматизацияТожеИспользование средств ИМЛ для
некоторых тестов клиническим пер¬
соналом5-15 минНаправление проб для сложных ана¬
лизов в более крупную лабораториюОт 1 до нескольких суток в зави¬
симости от расстояния и способа
транспортировки проб и передачи
результатовНесколько врачей + био¬
логи + технологи и другой
персонал со средним обра-
зованиемВозможность выделения отдельных
рабочих мест или групп сотрудников
по видам исследований.
Автоматизация (зависит от общей
рабочей нагрузки)В течение рабочего дня. Возможно
внеочередное выполнение экстрен¬
ных анализов
36ЛАБОРАТОРНОЕ ОБЕСПЕЧЕНИЕ МЕДИЦИНСКОЙ ПОМОЩИОкончание табл. 1-7Организационно-кадроваяформаСпособы лабораторного обеспеченияПримерные сроки предоставления
лабораторной информацииСпециализированная центра¬
лизованная лабораторияАссортимент тестов близок к макси¬
мальному по данной специализации.
АвтоматизацияСобственное время анализа зависит
от типа автоанализзтора.Общий оборот теста зависит от рас¬
стояния, способа доставки проб и
передачи результатовЛаборатория клинического
диагностического центраНаиболее широкий ассортимент
тестов.Несколько специализированных
отделов.АвтоматизацияСобственное время анализа зависит
от типа автоанализатора.Общий оборот теста зависит от рас¬
стояния, способа транспортировки
проб и передачи результатовСроки получения результатов лабораторных анализов клиницистом, заказав¬
шим исследования, обозначаются периодом оборота лабораторного теста и зави¬
сят от следующих факторов:• времени анализа, необходимого для выполнения пробоподготовительных
и аналитических процедур в лаборатории; примерный расход времени на
выполнение основных лабораторных тестов в клинико-диагностических
лабораториях приведен в ГОСТ Р 53022.4-2008 «Технологии медицинские
лабораторные. Требования к качеству клинических лабораторных исследо¬
ваний. Правила разработки требований к своевременности предоставления
лабораторной информации»;• пре- и постаналитического времени, определяемых организацией лабора¬
торного обеспечения лечебно-диагностической деятельности в медицинской
организации, в том числе:❖ порядком и сроками выполнения процедур подготовки пациента;❖ длительностью взятия биоматериала и его первичной обработки;❖ порядком и способом доставки образца биоматериала в лабораторию;❖ порядком и способом доставки результата исследования из лаборатории
врачу, назначившему исследование.В зависимости от мощности учреждения здравоохранения предусмотрена
различная организация его лабораторного обеспечения: численность и уровень
подготовки лабораторного персонала, оснащение лабораторным оборудовани¬
ем, объем исследований, выполняемых непосредственно в учреждении, и т.д.
Поскольку аналитические возможности части учреждений не охватывают всего
спектра анализов, которые могут оказаться необходимыми пациенту, предусмо¬
трена возможность выполнения таких анализов в более крупных лабораториях.На основе учета факторов, влияющих на сроки получения результата лабора¬
торного исследования, в медицинском учреждении разрабатываются требования
к срокам выполнения лабораторных исследований, результаты которых имеют
жизненно важное значение для пациентов, находящихся в критических состояни¬
ях. Такие требования должны содержать:• перечень исследований, которые должны выполняться неотложно, с указа¬
нием предельного срока, отводимого на собственно аналитическую процеду¬
ру (табл. 1-8);• форму заявки на выполнение таких исследований;• форму учета соблюдения этих требований.Соблюдение сроков выполнения неотложных исследований подлежит строгому
контролю со стороны руководства медицинской организации. Порядок и сроки
выполнения исследований, потребность в результатах которых является система¬
тической и плановой, определяются руководством медицинской организации и
закрепляются соответствующим внутренним распорядительным документом.
ЛАБОРАТОРНОЕ ОБЕСПЕЧЕНИЕ МЕДИЦИНСКОЙ ПОМОЩИ37Таблица 1-8. Перечень исследований, результаты которых имеют жизненно важное значение для
пациентов в критических ситуациях, с указанием срока выполнения тестаВиды исследованийРекомендуемые
сроки, МИНПоказатели газообмена и кислотно-основного ранновесия крови
{pH, рСО,, BE. SO,. рО,)5Показатели электролитного баланса {калий, натрий, кальций, хлор)5Гемоглобин,гематокрит5Основные метаболиты (лактат, глюкоза)5-10Показатели функционального состояния почек (креатинин, мочевина)10Основные ферменты (ACT, АЛТ, КФК, ЛДГ)10Тропонин10-15Основные показатели гемостаза (время свертывания, протромбиновое и тромби-
новое время, АЧТВ, фибриноген, антитромбин, тромбоциты и их функции, ПДФ,
0-димеры)10-15Показатели гемореологии {вязкость крови и плазмы, функциональные свойства
эритроцитов)5-7Осмоляльность крови и мочи5СТАНДАРТИЗАЦИЯ ОРГАНИЗАЦИИ ЛАБОРАТОРНОГО
ОБЕСПЕЧЕНИЯСодержание деятельности клинико-диагностических лабораторий определя¬
ется рядом распорядительных и нормативных документов. Общий перечень
лабораторных тестов содержится в периодически обновляемой «Номенклатуре
лабораторных исследований» (табл. 1-9).Таблица 1-9. Количество тестов в «Номенклатуре клинических лабораторных исследований»Виды исследованийКоличество тестов1970-е гг.2000-е гг.Химико-микроскопические5275Гематологические3235Биохимические81170кос, газы крови1811Коагулологические20130Гормоны и медиаторы25258Иммунологические57287Токсикология и лекарства6195Примечание. Не приведено количество микробиологических тестов, поскольку для идентифика¬
ции одного и того же микроорганизма необходимо выполнить несколько исследований (культу¬
ральных, биохимических, микроскопических).в 2004 г. Минздравсоцразвития РФ утвердил реестр медицинских услуг, в
котором приведено значительное количество лабораторных тестов. Этот реестр
использован при разработке в 2005-2007 гг. и в новой редакции 2010 г. стандартов
медицинской помощи при различных формах патологии.Стандарты медицинской помощи представляют собой перечни диагностиче¬
ских и лечебных услуг (включая лабораторные услуги), признанньгх ведущими
специалистами соответствующей отрасли медицины минимально необходимыми
и достаточными для оказания медицинской помощи пациенту при определенной
форме патологии в ее типичных вариантах. Стандартам медицинской помощи
38 ЛАБОРАТОРНОЕ ОБЕСПЕЧЕНИЕ МЕДИЦИНСКОЙ ПОМОЩИПридано значение официальных документов. Каждый из них утверждается прика¬
зом Минздравсоцразвития Российской Федерации. Они имеют единую структуру,
включающую характеристику модели пациента, формы оказания медицинской
помощи и таблицы медицинских услуг в периоды диагностики и лечения болезни.
Стандарт медицинской помощи является государственным документом, в котором
федеральный орган исполнительной власти в сфере здравоохранения формулиру¬
ет перечень медицинских услуг, необходимых для оказания медицинской помощи
при определенной форме патологии. Другими словами, стандарт представляет
собой форму конкретизации прав гражданина на оказание помощи при опреде¬
ленном заболевании, что гарантировано Конституцией Российской Федерации и
Основами законодательства Российской Федерации по охране здоровья граждан.
Наряду с этим стандарты медицинской помощи являются для Фонда обязательно¬
го медицинского страхования обоснованием минимально необходимого объема
медицинских услуг, оплачиваемых из средств Фонда.Введение коэффициентов частоты предоставления отдельных услуг дает учреж¬
дениям здравоохранения свободу для маневра, необходимость которого может
быть продиктована медицинскими, организационными и экономическими услови¬
ями оказания медицинской помощи. Например, известно явление биологической
вариации: в зависимости от влияния многих факторов — генетических, экологиче¬
ских, образа жизни — разные люди по-разному реагируют на один и тот же болез¬
нетворный агент. Некоторые случаи заболевания моїут требовать более широкого,
чем указано в стандарте, перечня медицинских услуг как для точного установления
диагноза болезни и состояния пациента, так и для успешного лечения. Такие слу¬
чаи требуют согласованных мер со стороны лечебно-диагностических подразделе¬
ний и организационно-финансового руководства учреждения. С другой стороны,
не оправданные клиническими потребностями услуги не должны оказываться,
потому что они не могут принести ни необходимой информации, ни реальной
пользы больному.обеспечение медицинской помощи в полном объеме, предусмотренном феде¬
ральным стандартом, является целью, к которой обязаны стремиться служба здра¬
воохранения каждого региона и каждое медицинское учреждение. Существенным
шагом в этом направлении стало выполнение Национального проекта «Здоровье»,
в рамках которого учреждения здравоохранения были оснащены большим коли¬
чеством разнообразного медицинского оборудования.При всем разнообразии практических форм лабораторного обеспечения меди¬
цинской помощи, определяемых конкретными условиями в данном медицинском
учреждении, существуют общие принципы организации деятельности лабора¬
торных структур, поставляющих клинически важную информацию о состоянии
внутренней среды пациентов. Эти принципы сформулированы в международных и
национальных стандартах. Стандарт ГОСТ Р ИСО 15189 «Лаборатории медицин¬
ские. Частные требования к качеству и компетентности» устанавливает основные
требования к системе менеджмента качества и технические требования ко всем
сторонам деятельности клинико-диагностических лабораторий.Стандарт ГОСТ Р ИСО 15189 включает следующие разделы.• Требования к менеджменту.• Организация и менеджмент,• Система менеджмента качества.• Управление документацией.• Рассмотрение контрактов.• Исследование во вспомогательных лабораториях.• Приобретение услуг и запасов.• Консультативные услуги.• Претензии.
ЛАБОРАТОРНОЕ ОБЕСПЕЧЕНИЕ МЕДИЦИНСКОЙ ПОМОЩИ 39• Управление при несоответствии требованиям,• Корректирующие действия.• Предупреждающие действия.• Улучшение.• Управление записями.• Внутренние проверки.• Анализ со стороны руководства.• Технические требования:персонал:❖ помещения и условия окружающей среды;❖ лабораторное оборудование;
преаналитические процедуры.• Аналитические процедуры (методики).• Обеспечение качества аналитических процедур.• Постаналитические процедуры.• Отчетность о результатах,• Приложения:❖ сопоставление со стандартами ИСО 9001 и ИСО 17025;
рекомендации по защите лабораторных информационных систем;❖ этика в лабораторной медицине.Из приведенного перечня разделов стандарта следует, что он затрагивает все
ключевые стороны организации работы клинико-диагностических лабораторий
(КДЛ). Федеральная служба по надзору в сфере здравоохранения и социального
развития рассматривает положения ГОСТ Р ИСО 15189 как основу тех требова¬
ний, которые должны предъявляться при добровольной сертификации процессов
выполнения лабораторных исследований. Способствовать внедрению положений
этого основополагающего нормативного документа в отечественную лаборатор¬
ную практику призваны материалы стандарта ГОСТ Р ИСО 22869.Стандарт ГОСТ Р 52905-2007 (ИСО 15190-2003) «Лаборатории медицинские.
Требования безопасности» содержит комплекс требований к обеспечению в дея¬
тельности лабораторий мер безопасности по отношению ко всем видам опасности,
начиная с биологической.Федеральным агентством по техническому регулированию и метрологии
утверждены национальные стандарты РФ по медицинским лабораторным тех¬
нологиям. Положения этих стандартов коррелируют с основными положениями
ГОСТ Р ИСО 15189 и конкретизируют применение его требований к различным
сторонам процесса клинического лабораторного исследования.• ГОСТ Р 53022.1-2008 «Технологии лабораторные медицинские. Требования
к качеству клинических лабораторных исследований». Часть 1. Правила
менеджмента качества клинических лабораторных исследований.• ГОСТ Р 53022.2-2008 «Технологии лабораторные медицинские. Требования
к качеству клинических лабораторных исследований». Часть 2. Оценка ана¬
литической надежности методов исследования.• ГОСТ Р 53022.3-2008 «Технологии лабораторные медицинские. Требования
к качеству клинических лабораторных исследований». Часть 3. Правила
оценки клинической информативности лабораторных тестов.• ГОСТ Р 53022.4-2008 «Технологии лабораторные медицинские. Требования
к качеству клинических лабораторных исследований». Часть 4. Правила
разработки требований к своевременности предоставления лабораторной
информации.• ГОСТ Р 53079.1-2008 «Технологии лабораторные медицинские. Обеспечение
качества клинических лабораторных исследований». Часть 1. Описание
методов исследования.
40ЛАБОРАТОРНОЕ ОБЕСПЕЧЕНИЕ МЕДИЦИНСКОЙ ПОМОЩИ• ГОСТ Р 53079.2-2008 «Технологии лабораторные медицинские. Обеспечение
качества клинических лабораторных исследований». Часть 2. Руководство по
качеству исследований в клинико-диагностической лаборатории. Типовая
модель.• гост Р 53079.3-2008 «Технологии лабораторные медицинские. Обеспечение
качества клинических лабораторных исследований». Часть 3. Правила взаимо¬
действия персонала клинических подразделений и клинико-диагностических
лабораторий медицинских организаций при выполнении клинических лабо¬
раторных исследований.• ГОСТ Р 53079.4-2008 «Технологии лабораторные медицинские. Обеспечение
качества клинических лабораторных исследований». Часть 4. Правила веде¬
ния преаналитического этапа.• ГОСТ Р 53133.1-2008 «Технологии лабораторные медицинские. Контроль
качества клинических лабораторных исследований». Часть 1. Пределы
допускаемых погрешностей результатов измерения аналитов в клинико-
диагностических лабораториях.• ГОСТ Р 53133.2-2008 «Технологии лабораторные медицинские. Контроль
качества клинических лабораторных исследований». Часть 2. Правила про¬
ведения внутрилабораторного контроля качества количественных методов
клинических лабораторных исследований с использованием контрольных
материалов.• ГОСТ Р 53133.3-2008 «Технологии лабораторные медицинские. Контроль
качества клинических лабораторных исследований». Часть 3. Описание
материалов для контроля качества клинических лабораторных исследова¬
ний.• ГОСТ Р 53133.4-2008 «Технологии лабораторные медицинские. Контроль
качества клинических лабораторных исследований». Часть 4. Правила про¬
ведения клинического аудита эффективности лабораторного обеспечения
деятельности медицинских организаций.Ряд положений этих стандартов рассмотрен в главе «Обеспечение и контроль
качества клинических лабораторных исследований».КРИТЕРИИ ЭФФЕКТИВНОСТИ РАБОТЫ ЛАБОРАТОРИЙДля управления лабораторным процессом и разработки мероприятий по разви¬
тию лабораторий могут быть применены критерии эффективности, основанные на
положениях вышеупомянутых стандартов. Несмотря на существенные различия в
масштабах, оснащенности, обеспеченности кадрами и в других параметрах отдель¬
ных лабораторий, критерии для них универсальны.1. Аналитическая надежность (качество) результатов исследований явля¬
ется результирующей влияния множества факторов, внешних и внутренних, дей¬
ствующих продолжительно и быстро меняющихся. Система обеспечения качества
исследований в лаборатории включает максимально возможные действия персо¬
нала, предотвращающие получение ошибочных результатов. Важное место при¬
надлежит ежедневному внутрилабораторному и регулярному внешнему контролю
качества исследований (ГОСТ Р 53022.2, ГОСТ Р 53133.1, ГОСТ Р 53133.2).2. Клиническая информативность выполняемых исследований зависит от
использования современных тестов с установленными клинико-диагностическими
чувствительностью и специфичностью, от применения диагностических алгорит¬
мов и исключения дублирующих по содержанию и малоинформативных тестов.
Перечень используемых в лаборатории тестов зависит не только от технического
оснащения и материального снабжения лаборатории, но и от профессионализма
ЛАБОРАТОРНОЕ ОБЕСПЕЧЕНИЕ МЕДИЦИНСКОЙ ПОМОЩИ 41специалистов и степени их взаимодействия с клиницистами (ГОСТ Р 53022.3,ГОСТ Р 53079.3).3. Своевременность получения результатов врачами, заказавшими лабора¬
торные исследования, обеспечивается рациональной организацией работы лабо¬
ратории, рациональным распределением обязанностей персонала, определением
оптимального объема внеочередных (экспресс-) исследований (ГОСТ Р 53022.4).Ускорение получения результатов обеспечивается техническим оснащением л або- И
ратории, использованием автоматизированных систем анализа, а также средств
исследований по месту лечения.4. Экономическая эффективность — получение ценной клинической инфор¬
мации с наименьшими финансовыми и прочими затратами.Соответствие каждому из критериев зависит от успешности решения задач по
контролю влияющих факторов, главным образом от профессионального уровня
кадров, особенно специалистов клинической лабораторной диагностики,СПИСОК ЛИТЕРАТУРЫМеньшиков В.В. Исследования вне лаборатории. Средства, технологии, условия приме¬
нения. — М.: Агат-Мед, 2008.Кишкун А.А., Гузовский А.Л. Лабораторные информационные системы и экономические
аспекты деятельности лаборатории. — М.; Лабора, 2007,
Глава 2
Обеспечение и контроль
качества клинических
лабораторных исследованийОБЩИЕ ПОЛОЖЕНИЯСущность лабораторного исследования — анализ пробы био¬
материала, взятой у пациента, с целью обнаружить или измерить
содержание в ней компонентов, имеющих доказанную причинно-
следственную связь с предполагаемым патологическим процессом.
Информация о данных компонентах, представленная в описатель¬
ной или количественной форме, составляет результат проведенного
исследования. Потребителю (назначившему данное исследование
врачу или заказавшему анализ пациенту) важно, чтобы представ¬
ленная информация обладала следующими свойствами:• аналитической надежностью, т.е. точно отражала содержание
искомого компонента в пробе;• клинической информативностью, т.е. точно отражала процес¬
сы, происходящие в организме пациента, и отвечала на воп¬
росы о наличии и характере предполагаемой патологии;• оперативностью, т.е. была доступна в сроки, опережающие
темп развития патологического процесса и позволяющие свое¬
временно предпринять необходимые лечебные меры.Лабораторное исследование можно рассматривать как процесс,
имеющий вход и выход. Продукт на выходе данного процесса -
информация об исследованных аналитах. Характер входа зависит
от точки отсчета. Ранее за вход в процесс исследования принимали
поступление образца биоматериал в лабораторию и начало собствен¬
но аналитических процедур. Однако со временем стало ясно, что для
качества лабораторной информации крайне важны этапы, которые
предшествуют поступлению исследуемого образца в лабораторию,
начиная с момента назначения исследования врачом.Согласно современной концепции, в процессе клинического
лабораторного исследования выделяют три этапа:• преаналитический (доаналитический);• аналитический;• постаналитический (послеаналитический).Преаналитический этап включает:• внелабораторную фазу:❖ выбор и назначение исследования врачом;^ подготовку пациента к проведению анализа, взятие образца
биоматериала, чаще всего клиническим медперсоналом;
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ 43❖ маркировку образца для идентификации его с пациентом;❖ необходимую в ряде случаев первичную обработку, краткосрочное хране¬
ние и транспортировку образца биоматериала в лабораторию;• внутрилабораторную фазу:❖ регистрацию образца биоматериала;❖ идентификацию образца с пациентом;❖ распределение биопроб или их порций по назначенным видам исследова¬
ний;❖ необходимую дальнейшую обработку проб для подготовки к анализу.На результаты лабораторных исследований могут влиять следующие факторы
преаналитического этапа:• ошибки идентификации пациента и образца биоматериала;• биологические факторы — пол, возраст, этнос, физиологическое состояние
(физическая тренированность, беременность), биологические ритмы, влия¬
ния среды обитания;• устранимые факторы — прием пищи, голодание, положение тела, физическая
активность, курение, употребление алкоголя;• ятрогенные факторы:❖ диагностические процедуры (пальпация, пункции, биопсии, функцио¬
нальные тесты, физический стресс при нагрузках, эндоскопия, введение
контрастных сред, иммуносцинтиграфия);❖ оперативные вмешательства;❖ лечебные процедуры (инъекции и трансфузии, диализ, лучевая терапия);
прием лекарственных препаратов (в том числе без назначения врача);• условия взятия, временного хранения и транспортировки биоматериала:<> время взятия, срок сбора;❖ подготовка участка тела для взятия материала;❖ процедуры взятия крови, мочи, других биоматериалов;<0^ посуда (чистота, материал);❖ воздействие факторов среды (температуры, состава атмосферы);❖ консерванты, антикоагулянты;❖ процедуры первичной обработки (смешивание, центрифугирование,
охлаждение, замораживание);• свойства аналита:❖ биологический полупериод жизни аналита;❖ стабильность в биологическом материале при различных температурах;❖ метаболизм in vitro, включая чувствительность к свету.Аналитический этап включает комплекс необходимых для выполнения иссле¬
дования аналитических процедур, объединяемых методикой исследования и
завершающихся получением результата в числовой или описательной форме в
зависимости от вида и метода исследования. Основные процедуры методик клини¬
ческих лабораторных исследований заключаются в создании условий для выделе¬
ния аналита из многообразия других компонентов биоматериала, идентификации
аналита на основе детекции его специфических свойств и (в некоторых случаях)
в количественной оценке его содержания. В процессе лабораторного исследова¬
ния используют химические или биологические реагенты, которые избирательно
взаимодействуют с аналитом, преобразуя его в ту форму, которая генерирует соот¬
ветствующий сигнал и позволяет осуществить его идентификацию, детекцию или
измерение. Принцип исследования и детали аналитических процедур зависят от
особенностей состава, структуры и свойств определяемого аналита. Регистрация
результата анализа осуществляется на основе субъективной (визуальной) или объ¬
ективной (приборной) оценки.
.^•A№44 ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙВ рамках аналитического этапа клинического лабораторного исследования на
его результат оказывают влияние условия выполнения анализа и компоненты
аналитической системы:• состав и свойства исследуемого образца биоматериала;• точностные характеристики методик исследования;• свойства различных видов оборудования и расходных материалов, при¬
меняемых для взятия образца биоматериала и его первичной обработки и
оказывающих на него влияние;• метрологические характеристики средств измерения;• свойства добавок, обеспечивающих временную стабильность образца био¬
материала или исследуемого аналита;• состав и свойства реагентов (преобразователей аналита), специфически
реагирующих с аналитом благодаря своим химическим или биологическим
свойствам, генерирующих соответствующий сигнал и создающих возмож¬
ность его обнаружения или измерения;• состав и метрологические характеристики калибровочных материалов (рабо¬
чих стандартных образцов состава или свойств исследуемых аналитов),
используемых для количественной оценки содержания аналита в биопробе;• точность соблюдения послєдовзтєльности отдельных аналитических про¬
цедур, их длительности, температурного режима и других условий анализа,
предусмотренных установленной методикой;• состав и свойства контрольных материалов, представляющих собой раз¬
новидности рабочего стандартного образца аналита или образца сравнения,
предназначенных для проведения процедур внутрилабораторного контроля
или внешней оценки качества исследований;• образовательная подготовка, уровень профессиональной квалификации и
дисциплина выполнения методик лабораторными специалистами.Выполнение исследований клиническим персоналом вне лаборатории с приме¬
нением портативных аналитических устройств требует систематического контроля
со стороны компетентного лабораторного персонала за качеством выполнения
внелабораторных процедур с помощью обучения клинического персонала пра¬
вилам выполнения исследований средствами анализа по месту лечения, способам
контроля качества и сопоставления результатов исследований, выполненных вне
лаборатории, с лабораторными результатами.Постаналитический этап включает:• внутрилабораторную фазу, в рамках которой результат исследования оце¬
нивается лабораторным специалистом на предмет его аналитической досто¬
верности (по данным внутрилабораторного контроля качества), биологи¬
ческой вероятности (правдоподобия), а также путем сопоставления с ранее
проведенными аналогичными исследованиями или другими, параллельно
проведенными исследованиями у того же больного (при цитологических
исследованиях лабораторное заключение может содержать формулировку
вероятного диагноза);• внелабораторную фазу, в рамках которой врач оценивает клиническую зна¬
чимость информации о состоянии определенной сферы внутренней среды
организма пациента, полз^енной в результате лабораторного исследования,
и сопоставляет ее с данными собственного наблюдения за больным и резуль¬
татами других исследований.Обязательное условие правильного использования лабораторной информации
в клинической диагностике — обоснованная интерпретация результатов исследо¬
ваний с учетом влияния биохимических и физиологических механизмов.При интерпретации результатов лабораторного исследования должны быть
приняты во внимание следующие физиологические и метаболические аспекты:
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ 45• дляаналита:<>■ структура или природа аналита;<>■ распределение в организме;❖ способ выведения или экскреции;
биологический полупериод жизни;❖ физиологическая вариация;• для лекарственных препаратов:❖ структура;❖ объем распределения и фармакокинетика;❖ связывание с белком;❖ активные метаболиты;•0^ клиренс;❖ взаимодействие с другими лекарственными средствами, которые могут
влиять на биодоступность.При оценке возможных механизмов отклонения результатов лабораторных
исследований от параметров, свойственных состоянию здоровья, следует учиты¬
вать влияние патологических факторов:• повышение или понижение поступления аналита в данную биологическую
жидкость, которые могут бьггь обусловлены:❖ количеством ткани, в которой синтезируется аналит, скоростью синтеза;❖ изменением доступности субстрата, нарушением пути метаболизма;❖ вторичностью изменений в зависимости от стимулирующих или тормозя¬
щих регуляторных механизмов;❖ проницаемостью капилляров или клеток (при повреждении мембран);❖ прямым вливанием (внутривенным введением):❖ абсорбцией из кишечника или места введения;❖ сосудистым или лимфатическим дренажем ткани;• повышение или понижение удаления аналита из биологической жидкости,
в которой проводится измерение, из-за изменений скорости катаболизма
и/или скорости экскреции;• изменение объема распределения аналита (изменение гидратации тканей);• изменение структуры или активности аналита, которое сказывается на детек¬
ции аналитической системой этого метаболита (например, изменение связы¬
вания с белком).На постаналитическом этапе отрицательное влияние на использование лабора¬
торных результатов в клинических целях могут оказать:• непринятие во внимание других исследований у одного и того же больного;• недоучет результатов внутрилабораторного контроля качества и вьздача
результатов с неприемлемыми погрешностями;• использование для оценки результатов общих популяционных референтных
интервалов без учета возраста или индивидуальных особенностей пациента;• неучтенные интерференции;• несвоевременная доставка результатов исследований лечащему врачу;• игнорирование лечащим врачом результатов лабораторных исследований.
Сравнительная частота ошибок, вызванных факторами различных этапов лабо¬
раторного исследования, приведена в табл. 2-1.При неточности лабораторных данных риск клинических затруднений достига¬
ет 26-30%, а риск неоправданных действий врача составляет 7-12%.Следовательно, важное условие обеспечения качества клинических лаборатор¬
ных исследований — учет всех факторов, способных оказать влияние на содер¬
жание изучаемых аналитов в организме пациента, содержание аналита в образце
биоматериала, организацию собственно аналитического процесса и на интерпре¬
тацию полз^ченного результата. С этой целью разработаны индикаторы качества
46ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙТаблица 2-1. Сравнительная частота лабораторных ошибок, вызванных факторами различных
этапов клинического лабораторного исследования (Р. Bonini et al.. 2002)Авторы наблюденийСрокнаблюдвиияПреаналитическийэтапАналитическийэтапПостаналитическийзтапчастота ошибок, %Goldschmidt, Lent6 лет532324Nutting etal.6 мес55,613,3Plebani, CarraroЗ мес68,213,318Stahl et al.3 года7516Hof partner, Tait1 год601915для всех этапов исследования, систематическое использование которых позволяет
отслеживать и предотвращать влияние факторов, способных извратить результа¬
ты и вызвать неправильные действия врача.Современные представления о способах обеспечения качества любого процесса
выражены в понятиях системы менеджмента качества.Менеджмент — скоординированная деятельность по руководству и управлению
процессом.Менеджмент качества - скоординированная деятельность по руководству и
управлению процессом применительно к качеству, которая обычно включает раз¬
работку политики в области качества, планирование качества, управление каче¬
ством, обеспечение качества и улучшение качества.Система менеджмента — система для разработки политики и целей и достиже¬
ния данных целей.Система менеджмента качества — система менеджмента для руководства и
управления организацией применительно к качеству.На рис. 2-1 представлена схема системы менеджмента качества.Потре¬
бители
(и другие
заинтере¬
сованные
стороны)Постоянное улучшение
системы менеджмента качестваВыход—[продукция] Потре¬
бители
(и другие
заинтере¬
сованные
стороны)Удов¬летво¬ренностьУсловные обозначения: )► Деятельность, добавляющая ценность ► Поток информацииРис. 2-1. Схема системы менеджмента качества.
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ 47Система менеджмента качества применительно к деятельности клинико-
диагностических лабораторий установлена в стандарте ГОСТ Р ИСО 15189
«Лаборатории медицинсюїе. Требования к качеству и компетентности».ОЦЕНКА АНАЛИТИЧЕСКОЙ НАДЕЖНОСТИ МЕТОДОВ
ИССЛЕДОВАНИЯАналитическая надежность клинических лабораторных исследований характе¬
ризуется свойствами методов, с помощью которых их выполняют:• для количественных методов;❖ точностью (правильностью и прецизионностью) измерений;❖ аналитической чувствительностью;❖ аналитической специфичностью;• для неколичественных (качественных) методов:частотой совпадения обнаружения патологических отклонений изучае¬
мого компонента биоматериала с объективно подтвержденным наличием
соответствующего заболевания.Целевой параметр аналитической надежности клинических лабораторных
исследований — их способность достоверно разграничивать свойственные состоя¬
ниям здоровья и патологии значения содержания определенных аналитов в соста¬
ве биоматериалов. При дифференциации результатов лабораторных исследований,
характерных для состояния здоровья или патологии, следует учитывать, что дан¬
ные исследований проб биоматериалов отражают содержание искомых веществ
или клеток в организме обследуемого с некоторой степенью неопределенности,
т.е, с дисперсией численных значений. Именно поэтому для выявления патологи¬
ческих отклонений (патологической вариации) они должны быть дифференциро¬
ваны от колебаний результатов, вызванных другими причинами (табл. 2-2).Таблица 2-2. Вариации лабораторных результатов, вызванные непатологическими факторамиВариацияПричины и механизм возникновения колебанийБиологическая внутриинди-
видуальная (персональная)Колебания проявлений физиологических функций вокруг гомеостатиче¬
ских точек V обследуемогоБиологическая межиндиви¬
дуальная (гоупповая)Интервалы колебаний гомеостатических точек у разных людей, состав¬
ляющих ПОПУЛЯЦИЮПреаналитическаяВлияние условий взятия, хранения и транспортировки в лабораторию
образцов биологических материалов, взятых у пациентовЯтрогеннаяВлияния диагностических и лечебных воздействий на пациента перед про¬
ведением лабораторного тестаАналитическаяКолебания результатов измерений содержания аналитов в пробах био¬
логических материалов, вызванные факторами случайных и систематиче¬
ских погрешностей аналитических процедурДля уверенного выявления отклонений, обусловленных патологией и называе¬
мых патологической вариацией, они должны быть дифференцированы от анали¬
тической вариации.Биологическая вариация — основной фактор неопределенности лаборатор¬
ных результатов, который по своему характеру принципиально отличается от
аналитической вариации. Другими словами, изменения состава биоматериалов
человека, отражающие протекание в организме процессов жизнедеятельности,
характеризуются сочетанием устойчивости в определенных рамках постоян¬
ства внутренней среды (гомеостаза) и динамических колебаний вокруг точки
гомеостаза. Персональная биологическая вариация отражает колебания прояв¬
лений физиологических функций вокруг гомеостатических точек у обследуемого.
Межиндивидуальная, или групповая, биологическая вариация, подчиняющаяся
статистическим закономерностям, представляет собой интервалы колебаний
48 ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙгомеостатических точек групп людей, объединенных по определенному признаку
(полу, возрасту, этнической или профессиональной принадлежности).Преаналитическая вариация — проявления биологической вариации, отра¬
жающие реакцию организма на различные факторы внешней среды, условия под¬
готовки обследуемого к лабораторному тесту и на взятие образца биоматериала.
Ятрогенная вариация отражает различного рода диагностические и лечебные воз¬
действия на пациента перед проведением лабораторного теста.Влияние преаналитических и ятрогенных факторов вариации может быть
минимизировано или точно охарактеризовано с помощью стандартизованных
правил ведения преаналитического этапа клинических лабораторных исследо¬
ваний (ГОСТ Р 53079.4 «Технологии лабораторные клинические. Обеспечение
качества клинических лабораторных исследованийs>. Часть 4. Ведение преанали¬
тического этапа). Степень влияния аналитической вариации может быть охарак¬
теризована и сведена до допустимого уровня при выборе методов исследования
компонентов с проверенной аналитической надежностью (точностью, чувстви¬
тельностью, специфичностью) [ГОСТ Р 53022.2 «Технологии лабораторные
клинические. Требования к качеству клинических лабораторных исследований».
Часть 2. Правила оценки аналитической надежности методов исследования (точ¬
ности, чувствительности, специфичности)], соблюдении правил внутрилаборатор-
ного контроля качества методов клинических лабораторных исследований (ГОСТ
Р 53133,2 «Технологии лабораторные клинические. Контроль качества клиниче¬
ских лабораторных исследований». Часть 2. Правила проведения внутрилабора-
торного контроля качества количественных методов клинических лабораторных
исследований с использованием контрольных материалов) и применении преде¬
лов погрешностей измерений в клинико-диагностических лабораториях (ГОСТ
Р 53133.1 «Технологии лабораторные клинические. Контроль качества клиниче¬
ских лабораторных исследований». Часть 1. Пределы допустимых погрешностей
результатов измерения аналитов в клинико-диагностических лабораториях),В качестве основы для оценки точности различения патологической и аналити¬
ческой вариаций и для установления единых требований применительно к каж¬
дому аналиту принято имеющее естественную фундаментальную основу свойство
состава биоматериалов человека — биологическая вариация в различных комби¬
нациях ее компонентов, внутрииндивидуальной и межиндивидуальной.Точность (правильность и прецизионность) количественных клинических лабо¬
раторных исследований (измерений), как и любых измерений, характеризуется
размерами случайной и систематической погрешности результатов. Разработка
объективно обоснованных требований к точности клинических лабораторных
исследований заключается в установлении предельно допустимых значений ана¬
литических погрешностей количественных методов исследований (измерений)
физических величин (состава и свойств компонентов биологических материалов)
в образцах биологических материалов, взятых у пациентов. В соответствии с ГОСТ
Р ИСО 5725-1 при оценке точности измерений каждый результат измерений рас¬
сматривают как сумму трех составляющих:у = m ± В ± е, (1)где у — результат измерения; ш — общее среднее значение (математическое ожида¬
ние); В — лабораторная составляющая систематической погрешности в условиях
повторяемости; е — случайная составляющая погрешности каждого результата
измерения в условиях повторяемости.Общее среднее значение совокупности результатов измерений или принятое
опорное значение используются в условиях, когда истинное значение измеряемой
физической величины (эталонное значение измеряемой величины в узаконенных
единицах) не может быть установлено из-за отсутствия необходимого эталона.
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ 49Оно может быть получено как теоретическое или установленное значение, осно¬
ванное на научных принципах, или как приписанное (согласованное) или атте¬
стованное значение, основанное на экспериментальных работах, согласно ГОСТ
8.315-91, а также как среднее значение заданной совокупности результатов изме¬
рений. Систематическая погрешность (разность между математическим ожидани¬
ем результатов измерений и истинным или принятым опорным значением) харак¬
теризует правильность измерений, т.е. степень близости результата к истинному
значению измеряемой величины, а на практике — к принятому опорному значе¬
нию. Лабораторная составляющая систематической погрешности (смещение) при
использовании конкретного метода измерений в реальных условиях измерений в
клинико-диагностической лаборатории относится к общему среднему результату
или к установленному, атгестованному значению.Случайная составляющая погрешности результата измерения характеризуется
прецизионностью — степенью близости друг к другу независимых результатов
измерений, полученных в конкретных регламентированных условиях. Она не
имеет отношения к истинному или установленному, аттестованному значению
измеряемой величины.Для количественных методов исследований разрабатываются требования к
характеристикам повторяемости и прецизионности, отражающим размер случай¬
ной погрешности, проявляющейся в дисперсии результатов однородных изме¬
рений и выражаемой среднеквадратичным отклонением, или коэффициентом,
вариации. ГОСТ Р ИСО 5725-1-2002 устанавливает значения неопределенностей
оценок стандартных отклонений прецизионности (сходимости и воспроизводимо¬
сти) и систематической погрешности метода измерений и его реализации в данной
лаборатории, которые приводятся в таблицах указанного стандарта.При расчете базового (желательного) уровня математически ожидаемого значе¬
ния случайной аналитической погрешности (при бесконечно большом количестве
измерений) исходят из того, что предельно допустимая аналитическая погреш¬
ность, характеризуемая коэффициентом вариации, должна составлять:CV^<0,5xCVj. (2)где СУд — коэффициент аналитической вариации; CVj — коэффициент биологиче¬
ской внутрииндивидуальной вариации.Коэффициент вариации результатов исследований не должен превышать 50%
показателя внутрииндивидуальной вариации.Требования к правильности, т.е. степени отклонения определяемого значения
величины от его истинного значения, основаны на расчете математически ожидае¬
мого (при бесконечно большом количестве исследований) значения систематиче¬
ской аналитической погрешности {Bias - В). При расчете базового (желательного)
уровня требований к правильности исследований исходят из того, что предельная
допустимая систематическая аналитическая погрешность, характеризуемая отно¬
сительным аналитическим смещением, должна составлять:В (%) <0,25 X [(CV,)^ + (CVq)2]V2, (3)где в (%) — относительное аналитическое смещение; CVj — коэффициент биоло¬
гической внутрииндивидуальной вариации; CV^^ — коэффициент биологической
межиндивидуальной (групповой) вариации.Рассчитанные на основании данных зависимостей значения предельных допу¬
стимых погрешностей представляют базовый (желательный) уровень требований
к точности лабораторных исследований. Реальные аналитические возможности
методов исследований ряда аналитов и характеристики точности доступных изме¬
рительных приборов в одних случаях не позволяют обеспечить базовый уровень
точности результатов клинических лабораторных исследований, В иных случаях в
50 ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙотношении других аналитов базовый уровень точности легко превышается. Исходя
из этого во многих случаях в действующих нормативных документах допускается
использование дифференцированных, биологически обоснованных критериев
прецизионности и правильности исследований с применением коэффициентов,
повышающих или понижающих уровень требований аналитической точности.При повышенном (оптимальном) уровне точности применяют коэффициент
0,25 (вместо 0,5) для расчета общей аналитической вариации и коэффициент 0,125
(вместо 0,25) — для относительного аналитического смещения [см. уравнения (1)
и (2)J. При пониженном (минимальном) уровне точности используют коэффици¬
ент 0,75 (вместо 0,5) для расчета общей аналитической вариации и коэффициент
0,375 (вместо 0,25) — для относительного аналитического смещения.Требования к аналитической точности следует устанавливать с учетом клини¬
ческих потребностей. Принимая во внимание особенности требований к правиль¬
ности результатов исследований, предназначенных для целей диагностики, и их
прецизионности при мониторинге течения заболеваний, рекомендуют варианты
расчетов предельных допустимых значений погрешностей.Для диагностических целей предельные значения систематической погрешно¬
сти клинико-лабораторных измерений должны соответствовать неравенству:В <0,25 X [(CV,)2+ (4)а предельные значения случайной погрешности — неравенству:CV^<0,58x[(CV^)4(CV,)^]V^ (5)При исследованиях, предназначенных для целей мониторинга заболеваний,
предельное значение систематической погрешности (Д8Е) должно соответствовать
неравенству:ASE<0,33xCV,, (6)а предельное значение случайной погрешности (CV J — неравенству:CV^ <0,5 X CV,. (7)Допустимая разница результатов между двумя методами, используемыми для
исследования одной и той же величины в одной лаборатории (например, в отде¬
лении реанимации и интенсивной терапии и в центральной КДЛ), не должна пре¬
вышать 7з размера внутрииндивидуальной вариации для данного аналита (допу¬
скаемая разница <^/^ CV^).Требования по качеству при исследовании лекарственных препаратов в про¬
цессе лекарственного терапевтического мониторинга с использованием простой
теории фармакокинетики должны соответствовать неравенству:CV^ (%) <0,25 X [(2^/' - 1)/(2'г^' + 1)] X 100, (8)где Т — интервал между введением доз препарата; t — период полураспада пре¬
парата.Контроль качества аналитического этапа клинических лабораторных исследо¬
ваний осуществляется в двух взаимодополняющих формах — внутрилаборатор-
ном контроле и внешней оценке качества.Комплексная система контроля качества клинических лабораторных исследова¬
ний осуществляется с помощью:• установления единых требований к аналитическому качеству количествен¬
ных методов;• ежесерийного выполнения процедур внутрилабораторного контроля каче¬
ства с использованием контрольных материалов (оперативный контроль
качества);• регулярного участия в программах внешней оценки качества.
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ 51ОСНОВЫ ВНУТРИЛАБОРАТОРНОГО КОНТРОЛЯ КАЧЕСТВАНаличие системы внутрилабораторного контроля качества — условие полу¬
чения достоверной аналитической информации. Организация и обеспечение
внутрилабораторного контроля качества количественных методов клинических
лабораторных исследований — обязанность заведующего лабораторией или
сотрудника, ответственного за обеспечение качества лабораторных исследова¬
ний, Внутрилабораторный контроль качества клинических лабораторных иссле¬
дований выполняют сотрудники каждой КДЛ в целях поддержания стабильности
аналитической системы. Внутрилабораторный контроль качества обязателен
в отношении всех видов количественных исследований, выполняемых в лабо¬
ратории, для которых разработаны контрольные материалы. Если для коли¬
чественного метода контрольные материалы недоступны, рекомендуют другие
способы контроля качества с использованием проб пациентов — метод оценки
воспроизводимости измерений аналита по дубликатам и ежедневным средним
значениям.Статистическая основа оценки погрешностей при внутрилабораторном контро¬
ле качества количественных методов лабораторных исследований — допущение,
что частотные распределения результатов многократного измерения одного и того
же контрольного материала одним и тем же аналитическим методом имеют вид
нормального распределения. Для оценки случайных и систематических погреш¬
ностей измерения используют статистические характеристики нормального рас¬
пределения.Среднеарифметическое значение (X):(9)пгде X. — результат і-го измерения из п выполненных; п — количество измерений;п— сумма результатов измерений х^, х^... х^.Среднеквадратичное отклонение (S):где X(xi-x)^ — сумма квадратов отклонений результатов измерений х^, х^...1=1х^ от X.Коэффициент вариации (CV):CV =Ах100%. (11)Среднеквадратичное отклонение (S) и коэффициент вариации (CV) характери¬
зуются случайными погрешностями и используются для оценки повторяемости и
прецизионности измерений.Среднеарифметическое значение (X) используется при расчете смещения (В)
в установочной серии измерений. Смещение (В) определяется близостью средне¬
арифметического значения результатов установочной серии измерений контроль-S =
52ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙНОГО материала (X) к аттестованному значению (АЗ) измеряемой величины и
может быть выражено в абсолютных или относительных величинах.Относительная систематическая погрешность или смещение (В) рассчитывается
по формуле:В=^ — х100%-
АЗ(12)В полученном результате обязательно указывается знак числа (+/")•Выявление недопустимых случайных погрешностей выполняют с помощью
оценки повторяемости и прецизионности результатов измерения аналитов в
контрольном материале (по результатам установочной серии измерений), а
систематических погрешностей — с помощью оценки относительного смеще¬
ния.Систематическое выполнение процедур оперативного контроля качества позво¬
ляет на основании контрольных правил и установленных контрольных пределов
для каждого аналита выявить недопустимые погрешности и провести работу по их
устранению.Порядок проведения внутрилабораторного контроля качества для каждой
выполняемой в лаборатории количественной методики исследования состоит из
трех последовательных стадий:• I — оценка повторяемости результатов измерения;• II ~ оценка прецизионности и относительного смещения по результатам
установочной серии измерений, построение контрольных карт;• III — ведение оперативного контроля качества.После выполнения 10 аналитических серий из 10 полученных результатов изме¬
рения для каждого контрольного материала следует рассчитать значения иВ,у и сравнить с предельно допустимыми пределами. Если полученные значения
и B^Q превышают допустимые, выявляют источники погрешностей и проводят
работу по их устранению, затем измерения повторяют. Если полученные значения
не превышают установленных норм, выполняют следующие 10 аналитических
серий.Указанный расчет по 10 измерениям аналита в контрольных материалах сле¬
дует проводить для предварительной оценки погрешностей в установочной серии
измерений (табл. 2-3).Таблица 2-3. Последовательность процедур при ведении внутрилабораторного контроля качества
{установочная серия измерений)ПроцедураИсследуемый материалКоличествосерийКоличество
измерений
в серииРассчиты¬ваемыепоказателиСтадия 1Оценка повторяемости изме¬
ренийКонтрольный материал или
проба пациента110CV.Стадия IIПредварительная оценка отно¬
сительного смещенияАпестованные контрольные
материалы101Предварительная оценка пре¬
цизионности измеренийКонтрольные материальг
для текущего ежесерийного
контроля101Построение контрольной картыКонтрольные материалы
для текущего ежесерийного
контроля201x,s
ишОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ 53Окончание табл. 2-3ПроцедураОкончательная оценка относи¬
тельного смещенияОкончательная оценка преци*
зионности измеренийИсследуемый материалАттестованные контрольные
материалыКонтрольные материалы
для текущего ежесерийного
контроляКоличествосерий2020Количество
измерений
в серии1Рассчиты¬ваемыепоказателиВ.ПОСТРОЕНИЕ КОНТРОЛЬНЫХ КАРТ• Из полученных в установочной серии 20 результатов измерений опреде¬
ляемого показателя рассчитывают среднеарифметическое (X) (формула 9),
среднеквадратичное (S) отклонение (формула 10) и контрольные пределы
(X±1S, X±2S и X±3S).• Если в ряду результатов оказалось значение, выходящее за пределы X±3S, его
отбрасывают, выполняют еще одну аналитическую серию, после чего снова
подсчитывают значения X и S.• Контрольная карта, построенная по установочной серии измерений, пред¬
ставляет собой график, на оси абсцисс которого откладывается номер ана¬
литической серии (или дата ее выполнения), а на оси ординат — значения
определяемого показателя в контрольном материале (рис. 2-2),• Через середину оси ординат проводят линию, соответствующую среднеариф¬
метическому (X) значению, и параллельно ей отмечают линии, соответству¬
ющие контрольным пределам:❖ X±1S — контрольный предел «1 среднеквадратичное отклонение*^;❖ X±2S — контрольный предел «2 среднеквадратичных отклонения»;❖ X±3S — контрольный предел «3 среднеквадратичных отклонения».• Контрольные карты строят для каждого лабораторного показателя и для
каждого контрольного материала, предназначенного для оперативного кон¬
троля качества.Глюкоза,ммоль/лСреднее значение (Хф) = 6,5 ммоль/лВремя последовательных измерений
Рис. 2-2. Пример контрольной карты.
54ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИИ• В каждой аналитической серии проводят однократное (как минимум) изме¬
рение показателя в каждом контрольном материале. Количество образцов в
аналитической серии не ограничивается.• Образцы контрольных материалов равномерно распределяют среди анали¬
зируемых проб пациентов при отсутствии иных указаний производителей
приборов и реагентов.• Наносят точки, соответствующие результатам контрольных измерений, на
соответствующие контрольные карты.• При отклонении результатов контрольных измерений за контрольные преде¬
лы оценивают приемлемость результатов проб пациентов в данной аналити¬
ческой серии с помощью контрольных правил.КОНТРОЛЬНЫЕ ПРАВИЛАКонтрольное правило включает контрольный предел (X±1S, X±2S, X±3S) и
количество контрольных измерений в аналитической серии. Контрольные прави¬
ла обозначаются символами типа где А — количество контрольных результа¬
тов; L — контрольный предел.• — одно из контрольных измерений выходит за пределы X±3S;• 2^5 — два последних контрольных измерения превышают предел X+2S или
лежат ниже предела X-2S;• — два контрольных измерения в рассматриваемой аналитической серии
расположены по разные стороны от коридора X±2S;• 4jj. — четыре последних контрольных измерения превышают X+1S или лежат
ниже предела X-1S;• lOjj — десять последних контрольных измерений расположены по одну сто¬
рону от линии, соответствующей X.ПОРЯДОК ОЦЕНКИ КОНТРОЛЬНЫХ КАРТ• Проверяют присутствие на контрольных картах предупредительного кон¬
трольного правила 135.• Если один из результатов анализа контрольных материалов выходит за пре¬
делы X±2S, последовательно проверяют наличие контрольных правил I35,225,
R^, 4jg и 10^ — аналитическая серия признается неудовлетворительной при
наличии одного из них.• Если в дополнение к нарушению признака обнаруживается хотя бы один
из указанных признаков (l,^, 225, R^, 4^^ или lO^), все результаты, полученные
в данной аналитической серии, следует считать неприемлемыми (рис. 2-3).’3SD+3S+2SX-2s-3s' жИщите случайную или систематическую ошибкуРис. 2-3. Пример неудовлетворительного результата измерения. Одно значение находится вне
области доверительного интервала результата лаборатории.
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ 55• Контрольные признаки 2^^, 4^^, 10^ следует проверять на одной или обеих -а
контрольных картах. J• Проведение анализа приостанавливают, выявляют и устраняют причины «
возникновения погрешностей. Все пробы, проанализированные в данной
серии (и пациентов, и контрольные), исследуют повторно.• Результаты измерения контрольных материалов в серии, признанной непри¬
емлемой, не используют при оценке по контрольным правилам повторной и
последующих серий.• Если ни один из перечисленных выше признаков не обнаруживается ни на
одной контрольной карте, исследования продолжают.• Решение о приемлемости результатов измерения аналита в биологическом
материале пациентов принимает сотрудник, отвечающий за качество иссле¬
дований.• Если результаты аналитической серии признаются неприемлемыми, делают
соответствующую запись в журнале регистрации отбракованных результатов
внутрилабораторного контроля качества.АНАЛИТИЧЕСКИЕ ХАРАКТЕРИСТИКИ МЕТОДОВАналитическая чувствительность исследования — способность метода выяв¬
лять наименьшее различие между двумя концентрациями анализируемого ком¬
понента. Она характеризуется степенью зависимости изменения значения резуль¬
тата от сигнала, который должен быть измерен, и измеряется отношением
разницы измеренных значений к единице концентрации анализируемого ком¬
понента. Аналитическая чувствительность также может быть количественно
выражена наклоном точного калибровочного графика и отношением прироста
значений измерения на единицу анализируемого компонента в диапазоне линей¬
ности калибровочного графика. Линейность метода представлена интервалом зна¬
чений, в котором ожидаемое и действительное значение различаются случайным
образом.Нижний предел чувствительности метода характеризуется концентрацией веще¬
ства или активностью аналита в отдельной индивидуальной пробе, при которой
исследуемая проба может быть дифференцирована с высокой степенью вероят¬
ности от холостой пробы.Количественным выражением нижнего предела чувствительности может бьггь
значение измерения холостой пробы по формуле:X„p = X+3S, (13)где — предельная величина нижнего порога концентрации вещества или актив¬
ности аналита: X — значение измерения холостой пробы; S — среднеквадратичное
отклонение для серии из 20 измерений.Диапазон измерения метода — интервал значений измерений от нижнего преде¬
ла чувствительности на протяжении всего линейного участка калибровочного
графика.При клинических лабораторных исследованиях анализ исследуемого (искомо¬
го) компонента осуществляется в образце биологического материала, представ¬
ляющем собой сложную смесь веществ и клеток.Аналитигеская специфигность метода — способность метода обнаруживать
только искомый компонент. Аналитическая специфичность по отношению к
анализируемой величине (компоненту биоматериала) оценивается по степени
влияния различных примесей или матрицы биоматериала на результат анали¬
за. Для проверки специфичности метода используют примеси, которые моїут
служить источником аналитической погрешности. В области верхней и нижней
56ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙкалибровочных точек для исследуемого компонента проводят сравнение между
должным и действительным значением исследуемого компонента при различных
концентрациях примесей. В качестве сравнительного интервала в верхней и ниж¬
ней трети диапазона используют соответствующее значение среднеквадратичного
отклонения в серии, умноженное на коэффициент 2Д для 95% доверительного
интервала или 2,88 - для 99% доверительного интервала. Превышение абсолют¬
ного значения разницы между должным и действительным значением анализируе¬
мого компонента характеризуется воздействием данной концентрации примеси на
аналитическую специфичность метода исследования.Для полуколичественных методов оценка прецизионности может быть выраже¬
на как пропорция ожидаемых результатов по принятой их классификации — «отри¬
цательные», «1+», «2+», «3+». Данные пропорции имеют 95% доверительный
интервал, рассчитываемый на основе статистических таблиц. При сопоставлении
групп с низкой («1+») или среднеповышенной («2+«») концентрацией аналитов
могут быть получены более точные результаты, чем при сопоставлении с группой
с высокой концентрацией аналитов («3+»), которая не имеет четко ограниченного
верхнего предела.Правильность исследований оценивается на основе градации отрицательных и
положительных результатов с установлением порога обнаружения и порога под¬
тверждения (на основе сравнения с результатами, полученными при параллельных
исследованиях количественным методом). Приемлемая правильность определе¬
ний с помощью полуколичественных тест-полосок характеризуется долей лож¬
ноположительных результатов на уровне менее 10% при пороге обнаружения и
долей ложноотрицательных результатов также на уровне менее 10% при пороге
подтверждения, в серой зоне (между порогами обнаружения и подтверждения)
доля ложноотрицательных результатов должна сохраняться на уровне менее
30%.Требования к аналитической надежности неколичественных методов должны
разрабатываться с учетом специфики их аналитических принципов, биологиче¬
ских и морфологических характеристик (особенностей) изучаемых компонентов
биологических материалов. В отношении визуальных неколичественных методов
применяется оценка по частоте обнаружения с их помощью искомых компонен¬
тов биоматериалов, включая компоненты, характерные для специфических форм
патологии, для диагностики которых предназначен соответствующий вид иссле¬
дования.При разработке требований к аналитической надежности визуального метода
в качестве ориентира должны использоваться результаты исследования образцов
биоматериалов, проведенного исследователем, имеющим большой опыт визуаль¬
ного изучения изображений (не менее 5000 исследований), правильного обнару¬
жения и классификации исследуемых компонентов биоматериалов.Информативность клинигеских лабораторных тестов определяется степе¬
нью уменьш:ения неопределенности представления о физиологическом процессе,
состоянии органа или организма в целом на основе результатов данных тестов.
Для клинической диагностики лабораторная информация представляет ценность
в следующих отношениях:• как средство выявления патологии, т.е. отклонения от состояния здоровья;• как способ выявления отличий неодинаковых форм патологии, т.е. как сред¬
ство дифференциальной диагностики;• как средство наблюдения за изменением функций организма в ходе развития
патологического процесса и проведения лечебных мероприятий;• как средство определения целей лечения и оценки их достижения;• как средство определения показаний для профилактических мер и оценки их
эффективности.
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ57Информационная ценность результатов лабораторных тестов определяется харак¬
тером исследуемых компонентов биоматериалов и возможным информационным
содержанием получаемых с их помощью результатов исследований {табл. 2-4).Клинигеская информативность — способность лабораторного теста на основе
информации, полученной в результате исследования определенного аналита в
биологическом материале, характеризовать состояние внутренней среды организ¬
ма у обследуемого пациента и выявлять патологические отклонения.Порог клинигеского решения — числовое значение определенного аналита, при¬
нятое на основании экспериментальных данных в качестве критерия наличия или
отсутствия существенных сдвигов в состоянии внутренней среды и соответствую¬
щих клинических проявлений у обследуемого человека, и объективного основания
для принятия решения об оценке состояния пациента и применении лечебных
мер. Для более точной диагностики клинических состояний могут быть выделены
несколько порогов решения.Основная задача при оценке клинической информативности клинических лабо¬
раторных исследований — установление достигаемой с их помощью степени точ¬
ности разграничения исследуемых и сопоставляемых состояний организма паци¬
ента или исследуемых групп пациентов (здоровье или болезнь, реакция на лечение
или отсутствие такой реакции, благоприятный или неблагоприятный прогноз).Таблица 2-4. Примеры информационного содержания результатов лабораторных тестовХарактеринформацииТестыХарактер изменений относительно
референтного интервалаКоличество эритроцитов
Количество лейкоцитовв кровиПовышение или снижениеОбщая ори¬
ентация вСОЭв кровиПовышениесостояниипациентаБелокГлюкозаЛейкоцитыБактериив мочеПовышениеОценка остро¬
ты состоянияБелки острой фазыПовышениеПоказатели кислотно-щелочного состоянияГлюкозаГемоглобинПовышение или снижениеСистемные маркеры (рилизинг-факторы гипо¬
таламуса, гормоны гипофиза и периферических
эндокринных желез)Повышение или снижениеОценка лока¬
лизации пора¬
женияорганные маркеры (сердечные маркеры, функ¬
циональные печеночные и почечные тесты,
панкреатические ферменты, простатический
специфический антиген)ПовышениеКлеточные маркеры (компоненты клеток,
специфически окрашиваемые красителями и
флюорохромами; антитела к кластерам диффе-
ренцировки — антигенам клеток)Выявление отклоненийОценка воз¬
можной этио¬
логииТесты на экзогенные патогенные организмы (бак¬
терии, вирусы, грибы, паразиты)Тесты на аутоантителаТесты на дефицит экзогенных и эндогенныхкомпонентовПоложительный результат —
выявление
58 ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙОкончание табл. 2-4ХарактеринформацииТестыХарактер изменений относительно
референтного интервалаМолекулярно-биологические методы (ДНК- и
РНК-зондирование, ПЦР)Обнаружение характерных
генетических отклоненийОценкадиагнозаопределеннойболезниГликированный гемоглобинПоеышение — наличие и степень
тяжести сахарного диабетаГлюкокортикоиды и АКТГПовышение — наличие болезни или
синдрома КушингаКатехоламины и их метаболитыПовышение — наличие
феохромоцйтомыСоставляющими решения этой задачи являются:• вариация лабораторных результатов и ее виды:• референтные интервалы аналитов и правила их установления;• индексы индивидуальности аналитов и их влияние на характер применения
соответствующих тестов;• применение статистических и эпидемиологических методов в лабораторной
информатике;• отсечные точки и их влияние на характеристику информативности лабора¬
торных исследований.Значения, свойственные состоянию здоровья, могут быть охарактеризованы
референтными интервалами. Они определяются дисперсией значений аналитов,
определенных в группе здоровых референтных индивидуумов. Референтные интер¬
валы, установленные в здоровой популяции, отражают групповую биологическую
вариацию и обычно применяются для разграничения патологии от состояния здо¬
ровья.Референтные интервалы ограничены референтными пределами, за которые
при 96% вероятности обычно принимают 2.5 и 97,5 процентили. Возможно при¬
менение других процентилей в качестве референтных пределов, но это должно
быть оговорено в условиях определения соответствующего референтного интер¬
вала.Наряду с унивариантными и не зависящими от времени популяционными рефе¬
рентными интервалами предусмотрена возможность установления:• мультивариантных областей, получаемых комбинированной обработкой
нескольких лабораторных показателей в одной и той же группе референтных
индивидуумов;• референтных интервалов, зависящих от времени взятия материала для иссле¬
дования с учетом биоритмов (оценку ритмической вариабельности и расчет
узких повременных референтных интервалов следует проводить адекватны¬
ми математическими или статистическими методами);• индивидуальных референтных интервалов, присущих вариации аналитов у
данного индивидуума.Правила установления референтных интервалов и пределов• Референтный интервал — ограниченный референтными пределами и стати¬
стически охарактеризованный диапазон значений результатов лаборатор¬
ных исследований определенного аналита, полученных при обследовании
одного индивидуума или группы пациентов, отобранных по специальным
критериям.
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ 59Референтный предел — верхний или нижний предел референтного интервала
(не идентичный с порогом клинического решения). Референтные пределы
в здоровой популяции определяются факторами межиндивидуальной био¬
логической вариации при соотношении аналитической и биологической
вариации менее 0,4.Исходный пункт установления референтного интервала — решение о той
доле ряда референтных значений (действительных значений результатов
лабораторных исследований, полученных при обследовании референтных
индивидуумов), которая должна составить референтный интервал. Обычно
референтный интервал охватывает 95% референтных значений результатов,
полученных в референтной популяции, при этом он ограничивается двумя
значениями (референтными пределами), между которыми расположено 95%
всех референтных значений, а по 2,5% их с каждой стороны отбрасываются.
Следовательно, значения референтного интервала расположены между 2,5 и
97,5% уровнями (процентилями), или 0,025 и 0,975 фрактилями.
Референтные индивидуумы — пациенты, отобранные из здоровой популя¬
ции на основании критериев включения и исключения для формирования
референтной популяции. Референтные значения, полученные в данной попу¬
ляции, используют для сравнения с индивидуумом, страдающим специфиче¬
ским заболеванием,Референтная популяция — контингент референтных индивидуумов, значения
аналитов в котором используют для сравнения со значениями, получаемыми
у больного, страдающего определенным заболеванием. Референтная популя¬
ция должна быть подобна по этническим, возрастным, половым признакам,
насколько это возможно. Она должна включать всех возможных пациентов,
которые могут дать полный комплекс возможных референтных значений,
относящихся к соответствующему аналиту. Для получения референтного рас¬
пределения могут быть использованы следующие референтные группы:❖ сам испытуемый индивид (свойственная ему патология, несколько данных);
идентичные близнецы (свойственная им патология, несколько данных);
амбулаторно отобранные индивиды без признаков патологии (практиче¬
ски здоровые люди);❖ госпитализированные отобранные больные без определенных признаков
патологии;❖ отобранные больные с определенными признаками одной болезни;❖ отобранные индивиды из іруппьі лежачих больных без определенных
признаков патологии.Для наиболее эффективного клинического использования референтные
интервалы и референтные пределы должны быть отнесены к различным
субпопуляциям по этническим, возрастным (у пожилых пациентов многие
лабораторные показатели могут отражать процесс старения или наличие
хронического заболевания) или иным признакам. Референтные пределы для
беременных должны быть отнесены к различным триместрам беременности.
У пациентов, постоянно принимающих препараты, регулирующие нарушен¬
ные функции, должны быть специально установленные референтные преде¬
лы содержания соответствующих аналитов с учетом присутствия постоянно
принимаемых лекарственных препаратов.Популяционные референтные интервалы могут быть:^ унивариантными — относящимися к определению одного аналита и неза¬
висящими от времени;^ мультивариантными — получаемыми комбинированной обработкой
нескольких лабораторных показателей в одной и той же группе референт¬
ных индивидов;
ш60ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ❖ повременными — зависящими от времени взятия материала для исследо¬
вания с учетом биоритмов (оценка ритмической вариабельности и расчет
узких повременных референтных интервалов с использованием адекват¬
ных математических методов).• Всех входящих в референтную группу пациентов следует обследовать с приме¬
нением одного и того же аналитического метода, обладающего необходимыми
чувствительностью, специфичностью, стабильностью, хорошо откалиброван¬
ного и точно выполняемого лабораторным персоналом с соблюдением всех
методических требований, при условии применения сертифицированных
реагентов, с учетом критериев отбора референтных групп, стандартизованных
условий подготовки обследуемых пациентов к проведению лабораторных
тестов, с помощью единого надежного аналитического метода. Это обеспечи¬
вает получение однородного пула результатов — референтных значений, кото¬
рые могут служить надежной основой для расчета референтных интервалов.• Статистический метод расчета референтного интервала обусловлен харак¬
тером распределения в ряду референтных значений: при предварительном
предположении о характере распределения данных применяют параметри¬
ческие методы, при отсутствии предварительных допущений относительно
распределения данных используют и непараметрические методы.При нормальном распределении референтные значения характеризуются
среднеарифметическим значением (X) и среднеквадратичным отклонением (S);
последнее позволяет оценить разброс данных, т.е. дисперсию. При нормальном
распределении часть площади между -1S и +1S охватывает 683% всех вариантов,
от -2S до +2S — 95,5% всех вариантов, от -3S до +3S — 99,7% всех вариантов.
Центральные 95% находятся в пределах X±1,96S. Именно поэтому для получения
95% референтного интервала необходимо найти среднее значение и две точки,
соответствующие X-1,96S и X+1,96S. При этом одно значение из 20 будет выхо¬
дить за пределы референтного интервала.Для расчета точности определения границ референтного интервала могут быть
определены их доверительные интервалы — интервалы значений, в которых с
определенной вероятностью находится значение данного параметра. Так, при при¬
менении параметрического метода Гаусса доверительный интервал с 90% вероят¬
ностью рассчитывают по формуле:A±2,81S/Vn,(14)где А — значение границы референтного интервала (нижней или верхней).Проверка совпадения полученного распределения с нормальным может быть
проведена графически с помощью построения гистограммы. При этом оценивают
наличие асимметрии, т.е. увеличение частоты значений в левой (положительная
асимметрия) или правой (отрицательная асимметрия) половине ряда.Один из способов оценки распределения — выявление эксцессов по характеру
пиков. Слишком острый пик называют положительным эксцессом, слишком пло¬
ский — отрицательным. Наличие двух пиков свидетельствует о бимодальности
распределения, отражающей, скорее всего, недостаточно однородный состав рефе¬
рентной группы (по полу, возрасту, физиологическому состоянию).в качестве математических методов оценки характера распределения использу¬
ют статистический тест Lilliefors — адаптированный тест Колмогорова-Смирнова,
тест хи-квадрат. Возможно также математическое преобразование распределения
путем замены полученных значений их логарифмами.При расчете референтных интервалов для аналитов, которым свойственны рас¬
пределения значений в референтных группах здоровых людей, отличающиеся от
нормального распределения, применяют непараметрические методы, в частности
ранговый метод. При использовании рангового метода все результаты исследова¬
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ 61ний располагают по порядку увеличения их численных значений, каждой величи¬
не присваивают номер от единицы до п, соответствующего числу вошедших в ряд
значений.Значение нижней границы 95% референтного интервала (2,5 процентиля, или
0,025 фрактиля) соответствует значению, порядковый номер которого определяют
по формуле:г = 0.025х(п+1), (15)где г — порядковое место (ранг) величины; п — численность группы.Соответственно значение верхней границы 95% референтного интервала (97,5
процентиля, или 0,975 фрактиля) равно значению, порядковый номер которого
0,975х(п+1). Доверительные интервалы для верхней и нижней границ референт¬
ного интервала определяют по специальным таблицам. Пользуясь такой таблицей,
можно определить минимальную численность обследуемой группы с 90% довери¬
тельным интервалом не менее 120 человек. Поскольку биологическая вариация
аналитов может быть довольно велика, численность референтных групп должна
быть большей.При обследовании референтной группы значения отдельных результатов могут
оказаться в стороне от основной массы численных значений. Такие результаты
называют выпадающими из ряда {outliers). Для проверки, действительно ли данное
значение выпадает из ряда, применяют следующий критерий: самое большое или
самое маленькое значение может бьггь отброшено, если расстояние между ним и
ближайшим в ряду значением превышает V3 всего ряда значений.• Значительная часть лабораторий не имеет возможности самостоятельно
установить референтные пределы для исследуемых в ней аналрггов и обра¬
щается к сведениям, публикуемым в рзтсоводствах и справочниках. При
использовании в исследованиях готовых наборов реагентов применяют
референтные пределы, установленные производителем данных наборов.
Однако, прежде чем ориентироваться на литературные или сообщаемые про¬
изводителем набора реагентов референтные пределы, необходимо провести
сравнительную оценку характеристик правильности и воспроизводимости
метода, использованного для установления референтных пределов, и метода,
используемого в лаборатории. На основе такого сравнения значения рефе¬
рентных пределов могут быть откорректированы,• Возможны следующие способы оценки референтных пределов перед их
использованием в лаборатории.-о Документированное сравнение всех факторов, которые могут оказывать
влияние на референтный интервал (эндогенных, экзогенных, этнических,
генетических, лабораторных, аналитических, статистических), между соб¬
ственной лабораторией и источником референтного интервала.❖ Тщательный отбор и обследование небольшой референтной группы
(порядка 20 человек), исключение выходящих из ряда значений на осно¬
ве критерия Reed's (Уз ряда) и пополнение группы вновь до 20 человек.
Если при этом не больше 2 значений окажется за пределами референтного
интервала, он может бьггь принят лабораторией. Если за пределами интер¬
вала окажется 3 и больше значений, процедура может быть повторно про¬
ведена с другой группой из 20 человек.❖ Обследование сокращенной референтной группы из 60 человек и сравне¬
ние среднеарифметических и среднеквадратичных отклонений опыгного
интервала и интервала, предлагаемого для использования.❖ При уверенности в высокой аналитической надежности используемого
метода, переходя к новой технологии или новому прибору, можно приме¬
нить уравнение линейной регрессии:
62 ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
НОВЫЙ результат = старый результат х коэффициент + интерсепт.• Перенос референтных пределов в данную лабораторию из другой может быть
облегчен использованием идентичных калибраторов.• Референтные интервалы и их пределы, сочетающиеся с подтвержденным
нормальным состоянием здоровья данного индивидуума или группы заведо¬
мо здоровых людей одного пола и возрастной группы, используют для отне¬
сения определенного у данного больного результата лабораторного иссле¬
дования к нормальному или патологическому диапазону значений. Обычно
наблюдаемые значения сопоставляют с верхним или нижним референтным
пределом.При этом следует учитывать степень взаимного перекрывания распределе¬
ний значений данного аналита у здоровых людей и у страдающих определенной
болезнью, а также используемую в данном случае отсечную точку. Наблюдаемое
значение может характеризоваться низким, средним или высоким положением в
референтном распределении.Также возможен расчет наблюдаемой величины по отношению к среднеариф¬
метическому значению и среднеквадратичному отклонению по формуле:Z=(x.-X)/s, (16)где Z — положение наблюдаемой величины в распределении; X — среднеарифме¬
тическая величина; х^ — наблюдаемая величина, s — среднеквадратическое откло¬
нение.Для более точной характеристики определяемого значения можно использо¬
вать не только процентили 2,5 и 97,5, но и 5 и 95, 10 и 90, 15 и 85, 20 и 80, 25
и 75 и т.д. Расчет процентильной оценки определенного значения результата
исследования возможен с использованием уравнения регрессии, что может обе¬
спечить более стабильные результаты и возможность получения всех желаемых
процентилей.• Референтные пределы, установленные в группе пациентов, страдающих под¬
твержденным другими способами видом патологии, можно применять для
выявления соответствующей формы болезни.ИНДЕКСЫ ИНДИВИДУАЛЬНОСТИ АНАЛИТОВ И ИХ ВЛИЯНИЕ НА ХАРАКТЕР
ПРИМЕНЕНИЯ СООТВЕТСТВУЮЩИХ ТЕСТОВВыход значений содержания аналита у обследуемого пациента за референтные
пределы обычно принято считать признаком патологии. Универсальность такого
подхода может быть ограничена особенностями индивидуальных свойств ана-
литов — размахом вариации результатов их определений. Для аналитов с малым
размахом вариации в состоянии здоровья вероятность выхода патологической
вариации за популяционные референтные пределы меньше, чем для аналитов с
большим размахом вариации. Эти особенности аналитов можно охарактеризовать
количественно с помощью расчета их индекса индивидуальности, представляюще¬
го собой соотношение коэффициентов внутри- и межиндивидуальной вариации
аналитов;II = CVyCV„ (17)где II — индекс индивидуальности; CV — коэффициент внутрииндивидуальной
биологической вариации; CV^ — коэффициент межиндивидуальной биологиче¬
ской вариации.Диагностическая чувствительность теста тем выше, чем больше значение
индекса индивидуальности.В простейшем сл5^ае (использование одного лабораторного теста и возможное
наличие одной формы патологии) присущие группе здоровых и группе больных с
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ63Рис. 2-4. Гипотетическое распределение результатов теста среди здоровых и больных.определенной формой патологии результаты лабораторного теста формируют две
кривые, частично накладываемые друг на друга (рис. 2-4). Соотношение площади,
описанной каждой кривой, с их накладываемыми частями даст количественную
характеристику дискриминирующей (различающей) способности теста по отно¬
шению к изучаемой патологии.При интерпретации результатов лабораторных исследований полученные зна¬
чения классифицируют как положительные (подтверждающие патологию) и
отрицательные (не подтверждающие патологию). Под влиянием факторов био¬
логической и аналитической вариации может наблюдаться взаимное перекрытие
значений результатов исследований между интервалами, свойственными группам
больных и здоровых людей, что приводит к классификации части полученных
значений как ложноположительных или ложноотрицательных. Истинно положи¬
тельный результат подтверждает действительно имеющуюся патологию, истинно
отрицательный результат исключает патологию при действительном ее отсут¬
ствии.Ложноотрицательный результат исключает болезнь при ее действительном
присутствии. Ложноположительный результат подтверждает патологию, несмо¬
тря на ее отсутствие в действительности. Соотношения данных групп полученных
значений используют для количественной оценки клинической информативности
лабораторных тестов на основе расчетов вероятности определенной категории
значений при состоянии здоровья или болезни, а также при дифференциации
нескольких заболеваний.При дифференциации нескольких болезней сопоставляют кривые, образован¬
ные значениями лабораторных результатов, полученными соответственно при
обследовании пациентов, страдающих данными формами патологии. Сочетание
этих кривых образует многомерное пространство, в котором математически
могут быть определены области, соответствующие определенным видам пато¬
логии. Критерий дискриминирующей способности теста может быть определен
расстоянием координат наибольшей частоты показателей теста при данной пато¬
логии от центра области пространства, присущего другой патологии. Поскольку
в этой системе важную роль играет реальная вероятность патологии, для обосно¬
вания численных значений вероятности привлекают данные клинической эпи¬
демиологии, полученные с помощью принципов доказательной медицины. Они
64ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙДОЛЖНЫ быть основаны на результатах рандомизированных контролируемых
клинических исследований, проведенных на опытной и контрольной группах
обследуемых, отобранных случайным образом, но при строгом соблюдении кри¬
териев включения» исключения и равенства по факторам, влияющим на исход
заболевания.Практически данные характеристики лабораторных тестов определяются на
основании статистического анализа массивов результатов исследований и матема¬
тически характеризуются патогмоничностью лабораторного показателя для диа¬
гностики заболевания. В результате накопления данных о реальном применении
лабораторных тестов в группах здоровых людей и пациентов, заведомо страдаю¬
щих определенным видом патологии, формируются 4 класса значений результатов
исследований данного аналита:• истинно положительные;• истинно отрицательные;• ложноположительные;• ложноотрицательные.Математические соотнощения этих групп лабораторных результатов служат
основанием для характеристики параметров клинической информативности лабо¬
раторного теста:• клинической чувствительности;• клинической специфичности;• диагностической эффективности;• предсказательной ценности;• пре- и посттестовой вероятности;• отношения правдоподобия.Клиническая (диагностическая) специфичность лабораторного тестахарактеризуется количеством людей, правильно классифицированных по резуль¬
татам исследования, как не находящихся в определенном состоянии, деленное на
число всех людей, не находящихся в данном состоянии (табл. 2-5).Таблица 2-5. Критерии оценки диагностической ценности лабораторного тестаКритерииБолезнь присутствуетБолезнь отсутствуетРезультат положительныйа — истинно положительныйЬ — ложноположительныйРезультат отрицательныйс — ложноотрицательныйd — истинно отрицательныйАприорная вероятность болезни(a+c)/(a+b+c+d) = доля больных в обследуемой группеКлиническая чувствительностьа/(а+с) ^ доля истинно положительных результатов в группе больныхКлиническая специфичностьd/(b+d) = доля истинно отрицательньіх результатов в группе здоровыхПредсказательная ценность
положительного результатаа/(а+Ь) = доля истинно положительных результатов среди всех положи¬
тельных результатовПредсказательная ценность
отрицательного результатаd/(c+d) = доля истинно отрицательных результатов среди всех отрица¬
тельных результатовДиагностическая эффектив¬
ность теста(a+d)/(a+b+c+d) = доля истинных результатов среди всех результатов
тестаОтношение правдоподобия поло¬
жительного результата тестаа /(a+c)/b/(b+d)Отношение правдоподобия
отрицательного результата тестаc/(a+c)/d/{b+d}Оценка чувствительности и специфичности важна при выборе лабораторного
теста для его применения в определенных клинических целях. Чувствительность
теста отражает вероятность его положительного результата при наличии патоло¬
гии. Высокая чувствительность теста позволяет выявлять с его помощью больных
в общей популяции. Специфичность теста отражает вероятность отрицательного
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ65результата при отсутствии патологии, что при высокой специфичности позволяет
отсеивать здоровых из популяции с предполагаемой патологией.Комбинация клинической чувствительности и клинической специфичности
теста характеризует диагностическую эффективность теста. При интерпретации
лабораторных тестов вероятность действительного наличия патологии при поло¬
жительном результате или надежность исключения патологии при отрицательном
результате оценивается на основе определения предсказательной ценности поло¬
жительных или отрицательных результатов.Предсказательная ценность (посттестовая вероятность болезни у пациента)
результата лабораторного теста зависит от распространенности болезни в популя¬
ции (табл. 2-6), которую иначе можно рассматривать как претестовую вероятность
наличия болезни у пациента.Таблица 2-6. Взаимосвязь распространенности болезни в популяции и предсказательной цен¬
ности положительного результата лабораторного тестаРаспространенность болезни в популяции. %Предсказательная ценность положительного
результата теста, %116,127,950,01067,92586,45095,0Взаимозависимость пре- и посттестовой вероятности болезни при определен¬
ной чувствительности и специфичности теста представлена в табл. 2-7.Таблица 2-7. Взаимозависимость пре- и посттестовой вероятности патологии у пациента при
использовании лабораторного теста с чувствительностью 90% и специфичностью 90%Претестовая вероятностьПосттестовая вероятность0,010,080,50,90,990,999Для вычисления вероятности болезни (посттестовой вероятности) на основа¬
нии положительного или отрицательного результата теста используют отношение
правдоподобия (ОтП), которое обобщает ту же информацию, что и показатели
чувствительности и специфичности. ОтП для конкретного результата диагностиче¬
ского теста — отношение вероятности получения данного результата у пациентов
с заболеванием к вероятности получения такого же результата у людей без забо¬
левания. ОтП показывает, во сколько раз выше или ниже вероятность получения
данного результата теста у больных по сравнению со здоровыми людьми.ОтП позволяет выйти за рамки грубой оценки результатов лабораторного теста
(норма или патология) в случае характеристики точности диагностического теста
на основе только понятий чз^вствительносги и специфичности при единственной
точке разделения. В подобных ситуациях положение точки разделения (cut-off) на
непрерывном переходе между нормой и патологией устанавливается произвольно.
ОтП можно определять для любого количества результатов теста по всему диа¬
пазону допустимых значений. Наличие заболевания более вероятно при крайнем
отклонении результата теста от нормы, чем в случае результата, близкого к грани¬
це нормы. При данном подходе формируется информация о степени отклонения от
нормы, а не только о факте наличия или отсутствия болезни.
68 ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙПри вычислении ОтП внутри некоторого диапазона значений результатов теста
под чувствительностью понимают уверенность врача при использовании конкрет¬
ного результата теста для идентификации пациентов с заболеванием, а не с той
или иной степенью отклонения от нормы. Аналогичный подход применяют при
определении специфичности.^^111 Интерпретация результатов вычисления ОтП:* ОтП(+) более 10 или ОтП(-) менее ОД — основа для окончательного диагно-
^^1 стического решения;• ОтП(+) от 5 до 10 и ОтП(-) от ОД до 0,2 — умеренные основания для диа¬
гностического решения;* ОтП(+) от 2 до 5 и ОтП(-) от 0,5 до 0,2 — малые основания для изменения
оценки вероятности болезни;• ОтП(+) и ОтП(-) от 0,5 до 2 — почти не изменяет вероятность заболевания у
пациента.С использованием приведенных показателей может быть осуществлен количе¬
ственный расчет информативности лабораторного тесга (J):J ^ log^ (посттестовая вероятность/претестовая вероятность), (18)где претестовая вероятность — вероятность болезни в популяции; посттестовая
вероятность — предсказательная ценность результата лабораторного теста.J = log^ [R / (1 + р X (R - 1))] X бит информации, (19)где R — ОтП; р “ претестовая вероятность.Для точной оценки значимости различия между значениями двух последова¬
тельных измерений аналитов у одного и того же пациента применяют коэффици¬
ент критической разницы (референтное различие значений).Расчет данного критерия основан на зависимости:RCV = К X [(CV,)2+ (CVJ2)1V2, (20)где RCV — коэффициент критической разницы или референтное различие значе¬
ний; К — константа, зависящая от размера риска (при размере риска 0,5 константа
составляет 2,77); CV, - коэффициент внутрииндивидуальной биологической
вариации; CV^ — коэффициент аналитической межсерийной вариации.ВЫБОР ОТСЕЧНЫХ ТОЧЕК И ИХ ВЛИЯНИЕ НА ХАРАКТЕРИСТИКУ
ИНФОРМАТИВНОСТИ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙКлассификация значений результатов как истинных или ложных зависит от
выбора отсечной точки — границы раздела между значениями, характерными для
здоровых и больных индивидуумов.Поскольку от количественных соотношений различных классов значений
результатов зависит оценка клинической чувствительности и специфичности,
выбор отсечной точки должен определяться характером патологического процесса
и вытекающими из установленного диагноза медицинскими последствиями.На примере рис. 2-4 при выборе в качестве отсечной точки А тест имеет 100%
чувствительность в отношении наличия патологии и низкую специфичность.
Наиболее информативны отрицательные результаты теста с такой чувствительно¬
стью, поскольку при этом исключаются здоровые индивидуумы из общей популя¬
ции. Рекомендуют на ранних стадиях диагностики для сужения рамок исследуемой
популяции.Выбор в качестве отсечной точки С придает тесту 100% специфичность и снижа¬
ет чувствительность. Наиболее информативны положительные результаты такого
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ 07теста, поскольку они позволяют выявить в обследуемой популяции больных и
подтвердить предположительный диагноз. Свойства теста позволяют предотвра¬
тить вред ложноположительного результата.Для большинства клинических ситуаций в качестве отсечной выбирают точку
В как предел референтного интервала, т.е. диапазона значений результатов теста
у здоровых людей, характеризуемого среднеарифметическим значением и интер¬
валом, ограниченным среднеквадратичными отклонениями в каждую сторону.
Выход результата за референтные пределы, свойственные здоровым людям, может
свидетельствовать о патологии.При оценке точности разграничения обследуемых групп по результатам лабо¬
раторного теста используют его диагностическую эффективность (дискримини¬
рующую способность), которая зависит от соотношения диагностической (кли¬
нической) чувствительности и специфичности. Лабораторный тест может иметь
множество пар чувствительности и специфичности и должен быть описан полным
спектром их соотношений для установления точек разделения (уровней решений,
диагностических порогов). Соотношение между чувствительностью и специфич¬
ностью теста, разбросы результатов которого в двух альтернативных группах
обследуемых (здоровые и больные) взаимно перекрываются, зависит от критерия
разделения этих групп. Смещение точки разделения в ту или иную сторону приво¬
дит к изменению соотношения чувствительности и специфичности в противопо¬
ложном направлении.Для установления точки разделения с учетом последствий ложных решений
используют характеристическую кривую (Receiver Operating Characteristic, Relative
Operating Characteristic — ROC-curve) — кривую взаимной зависимости вероятно¬
стей ложноположительных и истинно положительных результатов (чувствитель¬
ности и специфичности).ROC-кривая — графическое представление полного спектра чувствительно¬
сти и специфичности, поскольку на ней могут быть отображены все во.^можные
пары «чувствительность-специфичность» для конкретного лабораторного теста.
Поскольку частота истинно положительных и ложноположительных тестов может
быть вычислена исходя из результатов в двух группах (здоровые и больные)
отдельно, ROC-кривая не зависит от распространенности заболевания.В зависимости от точек разделения и степени их наложения ROC-кривая имеет
разные форму и положение. Желательное соотношение между чувствительностью
и специфичностью теста достигается выбором точки разделения. Наиболее четкое
разграничение между больными и здоровыми обследуемыми достигается при
использовании тестов, которые имеют характеристическую кривую результатов,
сдвинутую в сторону левого верхнего угла графика (рис. 2-5).Для идеального теста график проходит через верхний левый угол, где доля
истинно положительных тестов составляет 100%, или 1 (идеальная чувствитель¬
ность), а доля ложноположительных равна О (идеальная специфичность). Именно
поэтому чем ближе кривая к верхнему левому углу, тем выше диагностическая
эффективность (точность) теста, и наоборот, чем меньше изгиб кривой и чем
ближе она расположена к прямой, проходящей под углом 45°, тем менее эффек¬
тивно диагностическое исследование. Точки на такой диагонали соответствуют
отсутствию диагностической эффективности.Метод оценки ROC-кривых — оценка площади под кривыми. Теоретически
площадь изменяется от О до 1, однако, поскольку диагностически полезные тесты
характеризуются кривой, расположенной выше положительной диагонали (на
рис. 2-5 она обозначена пунктирной линией), обычно говорят об изменениях от 0,5
(отсутствие диагностической эффективности теста) до 1 (максимальная эффектив¬
ность теста). Данная оценка может быть получена непосредственно вычислением
площади под многогранником, ограниченным справа и снизу осями координат иШШ
68 ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙРис. 2-5. ROC-кривая.слева вверху — экспериментально полученными точками. При визуальной оценке
ROC-кривых расположение относительно друг друга указывает на их сравнитель¬
ную эффективность. Кривая, расположенная выше и левее, свидетельствует о
большей диагностической эффективности лабораторного теста.ВНЕШНЯЯ ОЦЕНКА КАЧЕСТВА КЛИНИЧЕСКИХ
ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙВнешняя оценка качества (ВОК) исследований, выполняемых в КДЛ. — важ¬
нейший элемент системы обеспечения качества клинической лабораторной диа¬
гностики, ВОК направлена прежде всего на обеспечение правильности результатов
исследований биологических материалов в КДЛ и соответственно сопоставимости
результатов, получаемых в разных лабораториях. Кроме того, внешняя оценка
служит объективным инструментом оценки соответствия лабораторных результа¬
тов установленным нормативам качества.ЗАРУБЕЖНЫЙ ОПЫТЗарубежный опыт построения систем ВОК показал серьезные преимупдества
крупных общенациональных систем по сравнению с небольшими региональными
системами. Именно на общенациональном уровне организованы системы ВОК во
многих развитых странах (Австралии, Великобритании, США, Финляндии, ФРГ,
Франции). Некоторые из этих систем стали приобретать черты транснациональ¬
ных, привлекая к участию клинические лаборатории других стран.Основные преимущества общенациональных системСоздание крупной общенациональной системы ВОК позволяет привлечь к ее
осуществлению ведущих специалистов страны, что необходимо для достижения
высокого научного и методического уровня системы, соответствующего той ответ¬
ственной роли, которую вок играет в медицине. Контроль качества лабораторных
исследований составляет специальную область знаний, включающую, помимо
методических аспектов лабораторной медицины, современную методологию кон¬
троля качества аналитических систем, основы теории ошибок, метрологию и мате¬
матическую статистику. Ввиду специфики этой области количество работающих в
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ ggней специалистов ограничено, что делает возможность объединения их усилий в
таких системах довольно уникальной, недостижимой в других условиях.Корректная аттестация контрольных образцов (основы любой системы ВОК),
прежде всего получение достоверных референтных значений, специфичных для
каждого отдельного метода лабораторного анализа и каждой отдельной серии
контрольного образца, возможна только при наличии в системе большого коли¬
чества клинических лабораторий. Для получения достоверных референтных
результатов необходимо минимум 30, желательно более 70 участников в метод-
специфичных группах. Реализация других подходов к аттестации контрольных
образцов в сети аккредитованных экспертных и/или референтных лабораторий,
созданной на базе лучших клинико-диагностических и аналитических лаборато¬
рий страны, также доступна только для общенациональных систем ВОК. Ввиду
возможности выделения больших по численности групп лабораторий, исполь¬
зующих идентичные средства лабораторной диагностики, крупные системы ВОК
позволяют получать статистически достоверные данные по сравнительной харак¬
теристике качества разных наборов реактивов, стандартных образцов, измери¬
тельных устройств и т.п.Привлекая к участию большое количество клинических лабораторий, такие
системы позволяют получать информацию, которая может бьггь эффективно
использована на разных уровнях принятия управленческих решений. Участвующие
в подобных системах клинические лаборатории получают объективные данные о
качестве выполняемых исследований, на основе которых они принимают реше¬
ния о необходимости пересмотра используемых методов, наборов реагентов и
средств измерения, внедрения внугрилабораторных систем обеспечения качества
и их совершенствования. Большой объем данных по используемым в лаборато¬
риях методам, наборам реагентов и средствам измерения позволяет оценивать
состояние материально-технической и методической базы лабораторной службы,
определять наиболее актуальные проблемы ее улучшения. Сравнение показате¬
лей качества исследований, выполняемых в группах лабораторий, использующих
одни и те же методы, наборы реагентов и средства измерения, позволяет выделять
методы, требующие целенаправленной проверки качества. Получаемые при этом
данные могут быть использованы соответствующими надзорными органами.Важное обстоятельство — возможность снижения себестоимости вок в рас¬
чете на одну участвующую лабораторию: при большом количестве участников
стоимость контрольных материалов существенно ниже при их изготовлении или
закупке большими партиями. Это же обстоятельство определяет наличие в круп¬
ной системе возможности закупать контрольные образцы, специально приготов¬
ленные для системы «на заказ» и отвечающие целям конкретного цикла ВОК.Серьезное преимущество общенациональных систем ВОК заключается в воз¬
можности организации регулярной проверки силами компетентных (экспертных)
лабораторий качества коммерческих контрольных материалов, предполагаемых
для использования в ВОК, без чего невозможно обеспечить правильность оценки
качества исследований в клинических лабораториях.ФЕДЕРАЛЬНАЯ СИСТЕМА ВНЕШНЕЙ ОЦЕНКИ КАЧЕСТВА КЛИНИЧЕСКИХ
ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙФедеральная система внешней оценки качества клинических лабораторных
исследований (ФСВОК) была создана в нашей стране в 1994-1995 гг. Основные
цели ФСВОК:• помощь клиническим лабораториям в объективной оценке качества выпол¬
няемых исследований и выработке рекомендаций по его повышению;• информирование лабораторий, главных специалистов по клинической лабо¬
раторной диагностике и органов управления здравоохранения о сравни-
'ШШ ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙтельном качестве наборов реактивов, калибраторов и оборудования, при-
меняемых в отечественной практике, а также о новых средствах и методах
исследования.fMJ- с самого начала своей деятельности ФСВОК работает не как административно-
разрешительная система, а как часть лабораторной службы страны, позволяющая
выявлять ошибки, возникающие в КДЛ, и оказывать помощь в устранении их
источников. Для обеспечения объективности получаемых из КДЛ результатов
анализа направляемых им контрольных образцов, имитирующих реальные кли¬
нические пробы, и в целях исключения подмены административными санкция¬
ми помощи, необходимой лабораториям в обеспечении качества выполняемых
исследований, в ФСВОК соблюдается конфиденциальность результатов оценки
качества исследований конкретной лаборатории. Результаты направляют только
ее заведующему под кодом данной лаборатории. Ответственность за использова¬
ние результатов внешней оценки качества и принятие по ним решения несет непо¬
средственно только заведующий КДЛ.Работа ФСВОК направлена на выявление реальных погрешностей, присут¬
ствующих в р>”гинной работе лабораторий при анализе реальных проб. С этой
целью в ФСВОК принимаются меры для обеспечения условий, в которых уча¬
ствующие лаборатории не видели бы необходимости в создании «особых условий»
при исследовании получаемых контрольных образцов, а также по недопущению
каких-либо прямых административных санкций по результатам оценки качества
анализов. Это обеспечивается, в частности, анонимностью конкретной лаборато¬
рии: все лаборатории кодируются, информация о качестве исследований в лабора¬
тории сообщается только ее заведующему. В тех случаях, когда такая информация
сообщается главному лаборанту региона или ведомства, строго выполняется тре¬
бование использовать указанную информацию только конфиденциально и только
для определения лабораторий, наиболее остро нуждающихся в оказании им мето¬
дической помощи. Такой подход стимулирует лаборатории представлять честные
результаты исследований контрольных образцов, выполненные в тех же условиях,
что и анализы проб пациентов, чтобы самим оценить реальную ценность выдавае¬
мой врачу диагностической информации.В то же время нормативные документы Минздравсоцразвития РФ обязывают
каждую клиническую лабораторию к ежегодному участию в ФСВОК. Предъяв¬
ление свидетельств об участии в ФСВОК в прошлые годы и письма, подтверждаю¬
щего участие в текущем году, необходимо при лицензировании и инспекционных
проверках лабораторий. Нормативные документы Минздравсоцразвития РФ
обязывают региональные и ведомственные органы управления здравоохранения
и главных врачей лечебных учреждений обеспечивать возможность ежегодного
участия подведомственных лабораторий в ФСВОК.Работу ФСВОК обеспечивает Центр внешнего контроля качества клинических
лабораторных исследований совместно с территориальными организационно-
методическими и контрольными центрами по клинической лабораторной диагно¬
стике, Научно-методическим центром по клинической лабораторной диагностике и
экспертными группами ФСВОК.За годы работы ФСВОК количество ее участников выросло более чем в 4 раза и
к 2010 г. превысило 7000 лабораторий, представляющих все субъекты РФ. ФСВОК
охватывает все виды рутинных клинико-лабораторных исследований и состоит из
более 77 разделов.Контрольные образцы ФСВОКСвойства контрольных образцов должны максимально соответствовать свой¬
ствам реальных проб, исследуемых в клинических лабораториях, и при этом оста¬
ваться однородными и стабильными в процессе транспортировки и хранения. В
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ 71ряде случаев одновременное выполнение всех требований нереально, и это накла¬
дывает известные ограничения на методологию внешней оценки качества, делая
невозможным охват всех стадий подготовки пробы и аналитического процесса.
В ФСВОК применяют следующие виды контрольных образцов:• контрольные образцы биологических жидкостей человека (крови, сыворот¬
ки, плазмы, мочи) и контрольные штаммы микроорганизмов (в виде культур,
лиофилизированных культур и бактериальных суспензий) — внешней оцен¬
кой качества охвачены все стадии аналитического процесса, кроме процеду¬
ры взятия биологической жидкости у пациента;• искусственные образцы и смеси (контрольный водный раствор глюкозы,
искусственную мочу, суспензию эритроцитов, штаммы из государственной
коллекции микроорганизмов, образцы бактериальной ДНК) — образец
может не содержать посторонних компонентов, влияющих на результат
исследования реальной пробы;• окрашенные и неокрашенные микроскопические мазки (см. разделы
«Лейкоцитарная формула», «Микроскопическое выявление микобактерий
с окраской по Цилю-Нильсену»-, «Цитология») — контролируется только
стадия окраски препаратов и работы с микроскопом, ошибки на стадии при¬
готовления мазка не выявляются;• микрофотографии и видеоизображения — контролируется только оконча¬
тельный этап диагностического исследования (распознавание образов).■ Во многих разделах применяют контрольные образцы промышленного изго¬
товления. Б этих слз^чаях конкретный производитель (поставщик) контрольных
образцов определяется на конкурсной основе, к конкурсу приглашаются ведущие
отечественные и зарубежные производители. Один из критериев отбора — степень
соответствия свойств контрольного образца свойствам реальных проб, исследуе¬
мых в клинических лабораториях. В разных разделах ФСВОК в наборы входят от
1 до 20 контрольных образцов, отражающих разнообразие исследуемых в клини¬
ческих лабораториях реальных проб, в том числе нормальные и патологические
пробы.Алгоритмы работы ФСВОКНаборы закодированных контрольных образцов с сопроводительной докумен¬
тацией, в которой изложен порядок исследования образцов, бланками для записи
полученных результатов и другой необходимой для оценки качества информацией
доставляют из Центра внешнего контроля качества в лаборатории почтой или
курьерской службой. Исследования контрольных образцов должны быть выпол¬
нены в рутинной серии исследований обычных проб, пост>'пающих в лабораторию
на анализ, в тех же условиях, с теми же реагентами и на том же оборудовании.
Результаты выполненных по заданной схеме исследований контрольных образ¬
цов, внесенные в соответствующие бланки (формы), направляют в ФСВОК для
последующей оценки.Полученные из лабораторий данные изучают сотрудники Центра внешнего
контроля качества, при этом проверяют их соответствие установленной схеме
анализа контрольных проб, правильность использованных единиц измерения и
т.п., на основе чего делают заключение о возможности их ввода в компьютер и
последующей обработки.Схемы и алгоритмы внешней оценки качества зависят от формы представления
результата исследования. Результаты количественного анализа, выраженные в
виде числа из непрерывной шкалы измерений (в таких разделах, как «Биохимия
крови», «Віюкоза», «Гемоглобин», «Гемоцитометрия», «Анализ мочи», «Коагуло-
логия», «Гормоны и витамины», «Газы крови», «Липиды и аполипопротеины»
и др.), оценивают с использованием статистики, основанной на распределении
72 ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙГаусса. Для каждого контрольного образца устанавливают целевые значения по
каждому из определяемых в нем показателей. В качестве целевого значения может
быть выбрано Среднее значение результатов участников, использующих один и
тот же аналитический метод, среднее значение всех участников, определяющих
один и тот же показатель любым методом, за вычетом 5% крайних результатов,
или же референтное значение, установленное методом высшего порядка точности
(например, в разделе «Глюкоза» — концентрация глюкозы, определенная в водном
стандартном растворе по навеске чистого вещества). Индивидуальные целевые
значения по каждому методу устанавливают только в тех случаях, когда имеются
достоверные различия между средними значениями, заложенные в природе самих
методов. При этом лаборатория, корректно использующая свой метод, не может
нести ответственность за его систематическую погрешность относительно других
методов.Для оценки приемлемости систематической погрешности результата измерения
вокруг целевого значения откладывают диапазон допустимых значений, который
в большинстве случаев составляет ±l,64s (s — мелелабораторное стандартное
отклонение), что соответствует 90% доверительному интервалу вокруг среднего
значения. В разделах «Биохимия крови» и «Глюкоза», «Электрофорез белков
сыворотки крови» и «Коагулология» эксперты ФСВОК установили фиксирован¬
ные нормы точности на основе достигнутых в лабораториях аналитических харак¬
теристик и с учетом требований, вытекающих из биологической вариации данных
показателей в популяции. Помимо систематической погрешности для результатов
количественного анализа, проводят оценку допустимости случайной погрешности
по величине относительного размаха между двумя параллельными измерениями
одного образца. В качестве нормы точности для воспроизводимости установлены
либо фиксированные критерии, либо величина 2,46R (R — средний относительный
размах в оцениваемой совокупности лабораторий), соответствующая верхней 95%
отрезной точке распределения размахов. Данная схема оценки имеет преимуще¬
ства перед рядом зарубежных схем внешней оценки качества, в которых оценку
проводят по единственному результату анализа контрольного образца, поскольку
позволяет выявить источник аналитической погрешности — слз^айной или систе¬
матической. По результатам одного измерения это сделать невозможно. Вместе с
тем эксперты ФСВОК в разделах «Биохимия крови» и «Глюкоза», «Электрофорез
белков сыворотки крови» и «Коагулология» установили нормы точности также и
для ошибки единичного измерения — для случаев, когда лаборатория представля¬
ет только один результат анализа.Помимо методов количественного анализа, для оценки которых применяют
известные статистические методы, в рамках ФСВОК разработаны оригинальные
схемы внешней оценки качества методов лабораторной диагностики, в которых
результат исследования не может считаться измерением. Для оценки результатов
полуколичественного анализа мочи с помощью диагностических полосок, у кото¬
рых каждое последующее деление шкалы в несколько раз превышает предыдущее,
используют критерии, основанные на степени точности применяемой дискретной
шкалы: медиана результатов участников, использующих один и тот же тип диа¬
гностических полосок, должна укладываться в пределах ±1 деление шкалы изме¬
рения.Подходы к оценке качества методов обнаружения веществ, антигенов, антител,
микроорганизмов и т.п. основаны чаще всего на заранее известных свойствах кон¬
трольного образца (дефинитивная оценка). В ряде случаев используют контроль¬
ные панели с контрольными образцами различной степени нагруженности (см.
разделы «ИФА-выявление HB^Ag», «Микроскопическое выявление микобактерий
с окраской по Цилю-Нильсену», «Культуральное выявление микобактерий тубер¬
кулеза», «ПЦР-выявление микобактерий туберкулеза»), что позволяет оценить
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ 73диагностические чувствительность и специфичность методики, в тех слз^чаях,
когда используют контрольные образцы с заранее неизвестным содержанием
компонента, подлежащего обнаружению (качественный анализ мочи), для оценки
качества используют методы непараметрической статистики: не более 20% край¬
них результатов признают неудовлетворительными, остальные — правильными.В ряде разделов ФСВОК лаборатории заранее не сообщают, какое задание
ей предстоит выполнить. Например, в разделе «Микробиология» требуется
определить до рода и вида бактериальный штамм из государственной коллекции
микроорганизмов, а также его спектр лекарственной чувствительности, а в раз¬
деле «Цитология«> — дать диагностическое описание цитологического препарата.
Оценкой качества такого заключения служит сравнительное заключение комиссии
экспертов, изз^ивших данный препарат.РАЗДЕЛЫ ФСВОК
Биохимия кровиТри цикла оценки качества определения в сыворотке/плазме крови на двух
уровнях концентрации АЛТ, альбумина, а-амилазы общей, а-амилазы панкреа¬
тической, ACT, белка общего; билирубина, билирубина прямого, глюкозы, гамма-
ГТ, железа, ОЖСС, калия, кальция общего, кальция ионизированного, кислой
фосфатазы, креатинина, креатинкиназы, ЛДГ, липазы, магния, мочевой кислоты,
мочевины, натрия, триглицеридов, фосфора, хлоридов, холестерина, холинэстера-
зы, щелочной фосфатазы. (Цикл — рассылка контрольных образцов з^частвующим
лабораториям, сбор и обработка результатов их исследования, сообщение лабора¬
ториям заключений о качестве выполненных исследований. Указано количество
ежегодно выполняемых циклов активности и массы МВ-креатинюшазы, миогло-
бина, тропонинов I и Т.)Глюкозатри цикла оценки качества определения глюкозы в сыворотке/цельной крови
на двух )ровнях концентрации. Для лабораторий, определяющих только этот био¬
химический показатель крови.Анализ мочитри цикла оценки качества исследований в моче на двух уровнях концентраций.
Количественное определение а-амилазы, белка, глюкозы, креатинина, альбумина,
мочевой кислоты, мочевины, калия, кальция, натрия, pH, фосфора, хлоридов.Полуколичественное определение: диагностическими тест-полосками ~ белка,
билирубина, гемоглобина, глюкозы, pH; химическими методами — белка, глюко¬
зы, pH.Качественное определение белка, билирубина, гемоглобина, глюкозы, pH, нитри¬
тов.Анализ мочи «мини»Три цикла оценки качества исследований на двух уровнях концентраций: белка,
pH, глюкозы — любыми методами, кроме определения на приборе «Эксан»; нитри¬
тов, гемоглобина, удельного веса — диагностическими тест-полосками; кетоновых
тел — качественными и полуколичественными (например, тест-полосками) мето¬
дами.Гормоны и витаминыТри цикла оценки качества определения в сыворотке/плазме крови на двух уров¬
нях концентраций АКТГ, витамина ДГЭА-сульфата, инсулина, кальцитонина,
кортизола, лютеинизирующего гормона, паратиреоидного гормона, С-пептида,
74 ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙПрогестерона, 17 а-ОН-прогестерона, пролактина, тестостерона, свободного тесто¬
стерона, тиреотропного гормона, Т.^, свободного Т3, свободного Т^, соматотропи-
на, а-фетопротеина, фолиевой кислоты, фоллитропина, общего [І-ХГЧ, эстрадиола,
свободного эстриола.Газы кровиТри цикла оценки качества определения РСО2, рО^ и pH крови на двух уровнях
концентраций.Гликозилированный гемоглобинДва цикла оценки качества определения концентрации гликозилированного
гемоглобина крови на двух уровнях концентраций.КардиомаркерыДва цикла оценки качества определения в сыворотке/плазме крови активности
креатинкиназы, активности и массы МВ-креатинкиназы, миоглобулина, тропонина
]иТ.ОнкомаркерыТри цикла оценки качества определения в сыворотке/плазме крови на двух уров¬
нях концентраций СА 15-3, СА 19-9, СА 125, пролактина, ПСА общего, ПСА свобод¬
ного, РЭА, тиреоглобулина, а-фетопротеина, ферритина, общего р-ХГЧ.Специфические белкиДва цикла оценки качества количественного иммунохимического опреде¬
ления в сыворотке/плазме крови концентраций а^-кислого гликопротеина,
«j-антитрипсина, аз-макроглобулина, антистрептолизина-0, (^2"^^икроглобулина.
С-реактивного белка, церулоплазмина, СЗ- и С4-компонентов комплемента, гап-
тоглобина, IgA, IgE, IgG, IgM, легких цепей каппа и лямбда, преальбумина, рети-
нолсвязывающего белка, ревматоидного фактора, трансферрина, ферритина.Электрофорез белков сыворотки кровиТри цикла оценки качества определения в сыворотке крови двух концентраций
альбумина, -глобулинов, аз-глобулинов, |3-глобулинов суммарных, -глобу¬
линов, [32-глобулииов, у-глобулинов.Липиды и аполипопротеиныДва цикла оценки качества определения аполипопротеинов A-I и В, ЛП(а), три¬
глицеридов, общего, ЛВП- и ЛНП-холестерина в сыворотке/плазме крови на двух
уровнях концентраций.Неонатальный скринингТри цикла оценки качества определения двух концентраций галактозы, имму-
нореактивного трипсина, 17-оксипрогестерона, тиреотропного гормона и фенила¬
ланина в крови новорожденных.Пренатальный скринингТри цикла оценки качества определения двух концентраций биохимических
маркеров наследственных заболеваний плода; а-фетопротеина, хорионического
гонадотропина и свободного эсградиола в крови беременных.Гемоцитометрия-8Два цикла оценки качества определения на гемоцитометрах гематокрита, гемо¬
глобина, эритроцитов, лейкоцитов, тромбоцитов, среднего значения содержания
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ 75гемоглобина в эритроците, концентрации гемоглобина в эритроците, среднего
объема эритроцита (8 показателей, два уровня).Гемоцитометрия-1бТо же, что в разделе «Гемоцитометрия-8», с добавлением среднего объема тром¬
боцита, показателя гетерогенности эритроцитов, абсолютного и относительного
количества лимфоцитов, средних клеток и гранулоцитов, определяемых на «3-diff»
гематологических анализаторах Abacus Junior, Aduia 60, Вс 3000-series, Coulter A с
Tdiff, Erma PCE-210, MEK 6400/6410, Medonic CA 620/530, Medonic M-series. Micros
60, Mythic 18, Swelab AC 920/970EO+, Sysmex KX-21 (16 показателей, 2 уровня).
Лейкоцитарная формулаДва цикла оценки качества подсчета лейкоцитарной формулы в препаратах
крови.ГемоглобинТри цикла оценки качества определения гемоглобина на двух уровнях концен¬
траций.КоагулологияТри цикла оценки качества определения протромбинового и тромбинового
времени, процента протромбина по Квику, МНО, АЧТВ и фибриногена на двух
уровнях концентраций.Коагулология-плюстри цикла оценки качества определения протромбинового и тромбинового
времени, процента протромбина по Квику, МНО, АЧТВ, фибриногена, активно¬
сти факторов VIII, IX, XIII, фактора фон Виллебранда (ристоцетин-кофакторной
активности), антитромбина III, протеина С, плазминогена, ингибитора плазмина
(а2-антиплазмина) и общей системы фибринолиза (ХІІа-зависимого фибриноли-
за) на двух уровнях.Волчаночный антикоагулянтДва цикла оценки качества выявления волчаночного антикоагулянта.Контроль гепаринотерапииДва цикла оценки качества определения АЧТВ и тромбинового времени в гепа-
ринизированной плазме.ИммуногематологияДва цикла оценки качества определения группы крови, резус-принадлежности,
выявления ауто- и аллосенсибилизации, основанных на типировании антигенов
эритроцитов и антиэритроцитарных антител.Иммуноглобулин еДва цикла оценки качества определения общего IgE крови.Ревматоидный факторДва цикла оценки качества определения ревматоидного фактора количествен¬
ными, полуколичественными (в том числе агглютинация частиц латекса) и каче¬
ственными методами.Антинуклеарные антителаДва цикла оценки качества определения антинуклеарного фактора методом
непрямой иммунофлюоресценции с определением титра и типа свечения ядра, а
также антител к экстрагируемому ядерному антигену методом ИФА.
76 ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙАнтитела к двуспиральной ДНКДва цикла оценки качества определения антител к двуспиральной ДНК количе¬
ственными и качественными методами ИФА.Антитела к фосфолипидамДва цикла оценки качества определения антител к фосфолипидам, антител IgG
и IgM к кардолипину, антител IgG к Р^'гликопротеину методом ИФА.Антитела к тиреоидпероксидазе и тиреоглобулннуДва цикла оценки качества иммунохимических тестов определения антител к
тиреоидпероксидазе и тиреоглобулину.Антитела IgG к HeUcobacter pyloriДва цикла оценки качества иммуноферментных тестов определения антител IgG
к Helicobacter pylori в сыворотке крови.Клиническая микробиологияДва цикла оценки качества идентификации возбудителей гнойно-септических
заболеваний, внутри- и внебольничных инфекций и определения их чувствитель¬
ности к антибиотикам.Микроскопическое выявление микобактерий с окраской по Цилю-НильсенуДва цикла оценки качества микроскопического выявления кислотоустойчивых
микобактерий в препаратах мокроты.Выявление микобактерий методом люминесцентной микроскопииДва цикла оценки качества микроскопического выявления кислотоустойчивых
микобактерий в препаратах мокроты с окраской флюорохромами.Культуральное выявление микобактерий туберкулезаОдин цикл оценки качества выявления микобактерий культуральными метода¬
ми. Десять контрольных образцов. Доставка курьерской почтой.Определение лекарственной чувствительности микобактерий туберкулеза к
препаратам первого рядаОдин цикл оценки качества определения лекарственной чувствительности мико¬
бактерий туберкулеза к изониазиду, рифампицину, стрептомицину и этамбутолу.Выявление микобактерий туберкулеза и исследование их лекарственной
чувствительности на жидких средахОдин цикл оценки качества выявления микобактерий туберкулеза и определе¬
ние их лекарственной чувствительности к изониазиду, рифампицину, стрептоми¬
цину, этамбутолу и пиразинамиду на жидких средах.ПЦР-выявление микобактерий туберкулезаДва цикла оценки качества выявления ДНК микобактерий туберкулезного ком¬
плекса методом ПЦР.Молекулярно-генетическое выявление лекарственной устойчивости микобактерий
туберкулезаОдин цикл оценки качества выявления мутационных изменений ДНК микобак¬
терий туберкулеза, приводящих к их устойчивости к изониазиду и рифампицину.Микроскопия осадка мочи (микрофотографии)три цикла оценки качества микроскопического исследования препаратов осад¬
ка мочи.
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ ТіМикроскопия трихомонад (микрофотографии)Три цикла оценки качества микроскопического выявления возбудителей три-
хомониаза.Микроскопия гонококков (микрофотографии)Три цикла оценки качества микроскопического исследования возбудителей
гонореи.Микроскопия кала (микрофотографии)Три цикла оценки качества микроскопического исследования препаратов кала.
Микроскопия вагинальных препаратов (микрофотографии)Три цикла оценки качества микроскопического исследования микрофлоры ваги¬
ны при вагинозах и вагинитах.Микроскопия клеток периферической крови (микрофотографии)Т^и цикла оценки качества микроскопического исследования препаратов пери¬
ферической крови при анемиях, гемобластозах и реактивных состояниях.Микроскопия мокроты (микрофотографий)три цикла оценки качества микроскопического исследования препаратов
мокроты.Микроскопия спинномозговой жидкости (микрофотографии)три цикла оценки качества микроскопического исследования препаратов лик-
вора.Микроскопия эякулята (микрофотографии)Три цикла оценки качества микроскопического исследования препаратов эяку¬
лята.Люминесцентная микроскопия С. trachomatis (микрофотографии)три цикла оценки качества микроскопического выявления С, trachomatis в пре¬
паратах соскобов слизистой урогенитального тракта методом РИФ.Люминесцентная микроскопия С. trachomatis (препараты)Два цикла оценки качества микроскопического выявления С. trachomatis в
препаратах, имитирующих соскобы слизистой урогенитального тракта методом
РИФ,Серодиагностика сифилисаДва цикла оценки качества выявления специфических антител к Treponema
pallidum с использованием фазных серологических методов и тест-систем.ИФА-выявление KBsAgДва цикла оценки качества первичного и подтверждающего выявления HBsAg
методом ИФА.ИФА-выявление и определение концентрации анти-HBsДва цикла оценки качества выявления антител IgG к вирусу гепатита В и опреде¬
ление концентрации методом ИФА.ИФА-выявление анти-ВГСДва цикла оценки качества выявления антител IgG к вирусу гепатита С методом
ИФА в скрининговом исследовании и антител к структурным и неструктурным бел¬
кам вируса гепатита С методами ИФА или иммуноблота (подтверждающие тесты).
78 ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИИИФА-выявление и определение концентрации анти-ВГАДва цикла оценки качества выявления антител IgG к вирусу гепатита А.ИФА-выявление ВИЧДва цикла оценки качества серологической диагностики ВИЧ методом ИФА при
скрининговом исследовании.Серологическая диагностика ВИЧ-инфекцииДва цикла оценки качества выявления серологических маркеров ВИЧ методами
ИФА в скрининговом и подтверждающем исследованиях с постановкой иммуно-
блота.ИФА-выявление IgG к С. trachomatisДва цикла оценки качества выявления антител IgG к С. trachomatis методом
ИФА.ИФА-выявление IgA к С. trachomatisДва цикла оценки качества выявления антител IgA к С. trachomatis методом
ИФА.ИФА-выявление антител к роду ChlamydiaДва цикла оценки качества выявления антител IgG к роду Chlamydia методом
ИФА.ИФА-выявление вируса герпесаДва цикла оценки качества выявления антител IgG к вирусу простого герпеса I
типа методом ИФА.ИФА-выявление цитомегаловирусаДва цикла оценки качества выявления антител IgG к цитомегаловирусу (ЦМВ)
методом ИФА.ИФА-выявление Candida albicansДва цикла оценки качества выявления антител IgG к Candida albicans методом
ИФА.ИФА-выявление Mycoplasma hominisДва цикла оценки качества выявления IgG к Mycoplasma hominis методом ИФА.ИФА-выявление И определение концентрации zm\k-Toxop\asma gondiiДва цикла оценки качества выявления антител IgG к Toxoplasma gondii и опреде¬
ление их концентрации методом ИФА.ИФА-выявление Ureaplasma urealyticumДва цикла оценки качества выявления антител IgG к Ureaplasma urealyticum
методом ИФА.Проточная цитофлюориметрияДва цикла оценки качества определения субпопуляционного состава лимфоцитов
периферической крови методом проточной цитофлюориметрии с использованием
моноклональных антител, меченных флюорохромами.ПЦР-выявление ВГВДва цикла оценки качества выявления ДНК вируса гепатита В методом ПЦР.
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ 79Количественное определение ДНК ВГВ методом ПЦРДва цикла оценки качества количественного определения концентрации ДНК
вируса гепатита В методом ПЦР,ПЦР-выявление ВГСДва цикла оценки качества выявления РНК вируса гепатита С методом ПЦР.Количественное определение РНК ВГС методом ПЦРДва цикла оценки качества количественного определения концентрации РНК
вируса гепатита С методом ПЦР.ПЦР-выявление ВИЧДва цикла оценки качества выявления РНК вируса иммунодефицита человека
методом ПЦР,ПЦР-выявление С. trachomatis, М. hominis, U. urealyticumДва цикла оценки качества выявления ДНК Chlamydia trachomatis, Mycoplasma
hominis, Ureaplasma urealyticum методом ПЦР.ПЦР-выявление Neisseria gonorrhoeaeДва цикла оценки качества выявления ДНК Neisseria gonorrhoeae методом ПЦР.ПЦР’Выявление ВПЧДва цикла оценки качества выявления ДНК вируса папилломы человека высо¬
кого канцерогенного риска методом ПЦР.Оценка качества микроскопических исследований с использованием виртуальных
препаратовДва цикла оценки качества микроскопических исследований, имитируемых на
экране компьютера:- осадка мочи,- кала,- возбудителей паразитарных заболеваний в кале,- трихомонад,- гонококков,- эякулята,- лейкоцитарной формулы,- мазков шейки матки,- выпотных жидкостей,- материалов из молочной железы.Обеспечивается возможность просмотра множественных полей зрения препара¬
та, а для препаратов мочи и кала, помимо этого, изменение фокусировки, а также
просмотр виртуальных препаратов с увеличением 100, 200,400,1000, управление
«виртуальным» препаратово дител ем, что позволяет выбирать зону для детального
исследования и переключать на большие увеличения.Исследование подвижности сперматозоидов (виртуальная кинезиограмма)Два цикла оценки качества определения сперматозоидов разных категорий под¬
вижности. Лаборатория получает компакт-диск с четырьмя видеофрагментами
нативных препаратов спермы.Клиническая цитологияОдин цикл оценки качества цитологической диагностики доброкачественных
и злокачественных патологических процессов. Используются окрашенные препа¬
раты, подобранные в соответствии с характером цитологических исследований и
80ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙметодами окрашивания препаратов в лаборатории, а также цифровые микрофото¬
графии с окрашенных препаратов, приготовленных из биоматериала определен¬
ной локализации.Клиническая цитология (цифровые микрофотографии)Один цикл оценки качества цитологической диагностики с использованием
цифровых фотографий пяти микроскопических полей зрения каждого из двух пре¬
паратов, приготовленных из следующего биоматериала:- шейка матки,- выпотные жидкости,- мокрота или биоптат, взятый при бронхоскопии,- молочная железа,- желудок,- щитовидная железа.Клиническая цитогенетика-1Один цикл оценки качества идентификации хромосом человека в целях опре¬
деления кариотипа. Три контрольных препарата лимфоцитов периферической
крови.Клиническая цитогенетика-2Один цикл оценки качества идентификации хромосом человека в целях опреде¬
ления кариотипа. Три контрольных препарата костного мозга.ГистологияОдин цикл оценки качества патогистологических исследований. Используются
контрольные окрашенные препараты срезов тканей биопсийного и операционного
материала.Экспертная оценка качества приготовления и микроскопического исследования
препаратовЛаборатория пересылает в ФСВОК определенные количества приготовленных и
исследованных ею рутинных препаратов, где их исследуют эксперты. Результаты,
полученные экспертами, заключение о качестве препаратов и рекомендации по
повышению качества исследований направляют в лабораторию (по указанию лабо¬
ратории препараты ей возвращают).Выявление трихомонад в отделяемом слизистой урогенитального тракта с окра¬
ской метиленовым синим или по Романовскому-Гимзе.Выявление гонококков в отделяемом слизистой урогенитального тракта с окра¬
ской по Граму.Выявление кислотоустойчивых микобактерий с окраской по Цилю-Нильсену,
Цитогенетическое исследование лимфоцитов периферической крови и костного
мозга, G-окрашивание.Особенности обработки результатов лабораторий для оценки их качества при¬
ведены в табл. 2.8.Таблица 2-8. Особенности обработки результатов количественных исследований в разных раз¬
делах ФСВОК (ЦЗ — целевое значение, s — стандартное отклонение)Раздел ФСВОКВид распределения
результатовСпособ установления
целевого значения (ЦЗ)Способ расчета диапазона
допустимых значенийБиохимия кровиНормальное или
логнормальноеМетод-зависимое
среднее участниковПо установленным груллой экс¬
пертов фиксированным значениямЭлектрофорез белков
сыворотки кровиНормальное или
логнормальноеМетод-зависимое
среднее участниковПо установленным груллой экс¬
пертов фиксированным значениям
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ $1Окончание табл. 2-8Раздел ФСВОКВид распределения
результатовСпособ установления
целевого значения (ЦЗ)Способ расчета диапазона
допустимых значенийЛипиды и аполипо-
протеиныНормальное или
логнормальноеМетод-зависимое
среднее участниковI43±1,64sАнализ мочиНормальное или
логнормальноеМетод-зависимое
среднее участниковЦЗ±1.648ГемоглобинНормальноеМетод-зависимое
среднее участниковЦЗ±1,648ГликолизированньїйгемоглобинЛогнормальноеМетод-зависимое
среднее участниковЦ3±1,64зГазы кровиНормальноеМетод-зааисимое
среднее участниковЦЗ±1,648ГемоцитометрияНормальное или
логнормальноеМетод-зависимое
среднее участниковЦЗ±1,648ГлюкозаНормальноеЗначение, рассчитанное
по навеске чистого
веществаПо установленным группой экс¬
пертов фиксированным значе¬
ниямКоагулологияЛогнормальноеМетод-зависимое
среднее участниковПо установленным группой экс¬
пертов фиксированным значе¬
ниямГормоны и витаминыНормальное или
логнормальноеМетод-зависимое
среднее участниковЦ3±1,64sОнкомаркерыНормальное или
логнормальноеМетод-зависимое
среднее участниковЦЗ±1,Є4зНеонатальный скри¬
нингНормальное или
логнормальноеСреднее всех участ¬
никовU3±1.64sПренатальныйНормальное или
логнормальноеМетод-зависимое
среднее участниковЦ3±1,64зКардиомаркерыНормальноеПаспортное значение
или среднее участниковПаспортный диапазон или
ЦЗ±1,648Специфические белкиНормальноеПаспортное значение
или среднее участниковПаспортный диапазон или
ЦЗ±1,648Лейкоцитарная фор¬
мулаПолинормальноеЗначения, полученные
экспертамиЦЗ±1,Э6Экспертная оценка качества определения лекарственной чувствительности
микобактерий туберкулеза методом абсолютных концентрацийЛаборатория представляет 20 выделенных ею культур микобактерий туберку¬
леза на среде Левенштейна-Иенсена и результаты определения их чувствитель¬
ности к изониазиду, рифампицину, стрептомицину и этамбутолу методом абсо¬
лютных концентраций. Культуры повторно исследуют в экспертных лабораториях
ФСВОК, на основании полученных результатов делают заключение о качестве
исследования лекарственной чувствительности в испытуемой лаборатории.ОБЕСПЕЧЕНИЕ СОПОСТАВИМОСТИ РЕЗУЛЬТАТОВ
ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙНепременным условием обеспечения единства результатов измерений в кли¬
нической диагностике является доступность полноценной эталонной базы для
всех клинико-диагностических лабораторий страны. В России, как и в других
странах, для лабораторных исследований такой базы пока не создано, поэтому
обеспечить единство измерений для всех лабораторных показателей на практике
82 ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙне представляется возможным. Тем не менее, даже в отсутствие необходимого
метрологического обеспечения лабораторных измерений, в КДЛ имеется возмож¬
ность получения объективных и сопоставимых результатов за счет внедрения в
практику стандартизованных методик, а также внутрилабораторного контроля
качества (БКК) и внешней оценки качества (ВОК) клинических лабораторных
исследований.Программы ВКК и ВОК имеют существенные различия в методологии и целях.
При оценке и контроле аналитического качества они друг дрз^а не заменяют, а
дополняют.В методологии любой программы ВКК предполагается, что лабораторная мето-
дика изначально имеет коэффициент вариации CV и смещение В в пределах допу¬
ска, что, таким образом, является гарантией получения правильных результатов.
Пределы допустимых значений CV и В декларируются на основе опыта исследова¬
ний биологических вариаций лабораторных показателей, вариаций аналитическо¬
го процесса лабораторных исследований и характеристик изделий медицинского
назначения (включая приборы, реактивы, вспомогательные технологии и др.).
Пока CV и смещение В сохраняют свои изначальные значения в течение контроли¬
руемого периода, нет оснований считать получаемые результаты неправильными.
Поэтому основной целью любого ВКК является именно контроль во времени над
стабильностью этих двух аналитических характеристик для каждого количествен¬
ного лабораторного теста.Целью любой программы БОК является предоставление возможности КДЛ
проверить то, что лабораторная методика действительно имеет значение смеще¬
ния Б в пределах допуска. Именно поэтому необходимо регулярное участие КДЛ
в программах ВОК, Если результаты исследования лабораторией образцов кон¬
трольного материала находятся в пределах контрольных границ, установленных в
данной программе ВОК на базе среднегруппового значения аналогичных результа¬
тов всех лабораторий-участников, то считается, что смещение В данной методики
находится в пределах допуска. Чем стабильней будут располагаться результаты
исследований лабораторией контрольных материалов относительно среднего
показателя группы участников, тем более сопоставимыми будут результаты иссле¬
дований этой же КДЛ проб пациентов в динамике. Чем уже будет распределение
контрольных результатов в группе лабораторий — участников данной программы
ВОК, тем выше будет степень сопоставимости результатов исследования проб
пациентов между лабораториями.Методология контроля аналитического качества в КДЛ России регламенти¬
руется ГОСТ Р 53133.2-2008. ГОСТ разработан для нормативного обеспечения
повседневных процедур ВКК, направленных на выявление недопустимых случай¬
ных и систематических погрешностей на аналитическом этапе клинических лабо¬
раторных исследований, выполняемых количественными методами с помощью
контрольных материалов. Стандарт исходит из того, что КДЛ без использования
контрольных материалов не может обеспечить аналитическое качество результа¬
тов и, соответственно, их достоверность.Из гост следует, что ВКК обязателен в отношении всех видов количественных
исследований, для которых доступны контрольные материалы с аттестованными
значениями. Положения стандарта требуют, чтобы уровни исследуемых компо¬
нентов в контрольном материале соответствовали значениям показателей в нор¬
мальном и патологическом диапазонах и для повышенных, и для пониженных
значений. Следовательно, при ведении ВКК для количественного лабораторного
показателя должны обязательно использоваться контрольные материалы и с
нормальными, и с патологическими значениями. Для каждого такого контроль¬
ного материала лаборатория должна проводить установочную серию измерений с
целью определения собственных среднеарифметических значений и значений CV.
ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВА КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ 83В соответствии с общемировой практикой, ВКК должен обеспечивать контроль
аналитического качества результатов лабораторных исследований и в нормаль¬
ном, и в патологическом диапазонах. Кроме того, стандарт устанавливает, что
контрольные материалы с нормальными и патологическими значениями должны
исследоваться так же, как и пробы пациентов, в одних и тех же аналитических
сериях.Особо следует отметить, что гост запрещает использовать контрольный
материал одновременно и в качестве калибровочного, и в качестве контроль¬
ного для одной и той же методики. Стандарт допускает, что для одного и того
же лабораторного показателя в паспорте на контрольный материал может быть
указано несколько значений, соответствующих разным методам измерения или
разным аналитическим системам. ГОСТ также устанавливает, что аттестован¬
ное значение контрольного материала не предназначено для использования в
качестве среднеарифметического значения при построении контрольной карты.
Среднеарифметическое значение и CV для построения контрольных карт измери¬
тельной методики получают в результате проведения установочной серии измере¬
ний контрольного материала.Оперативный контроль качества с использованием контрольного материала
должен выполняться в течение достаточно длительного времени с использова¬
нием одного и того же контрольного материала, т.е. с использованием образцов
из одного и того же лота. Для биохимических исследований ГОСТ рекомендует
использовать один тот же контрольный материал на протяжении не менее 200
серий, а для гематологических исследований ~ на протяжении не менее 40 серий.
В таких условиях существенно возрастает актуальность внедрения в КДЛ средств
автоматизации ведения ВКК - компьютерных программ.€3ііе в 199Х тщ іазрабо-шш йервыЙ б Росси»^ KOl)|j€biOTepHbit йролукт для ВКК ~ Ш нію^'шении 20 летдрограммй мойфвизїфсфзлась в cecmtrtfsm с зременй (нор-«атйййш Сег&днй поавояй^^ проводить автощшчшсіїйаяалйїйчейсого качества лабї^торшйх ишгедований в^ ёоотвектвии е требетвайшшй ГОСТ Р 5320 лет «Лнаштїка»
ярсУйвіЧйком внсококачешешшх коїггрольаьїх м^герйвяов ддй ВКК
коагулол^гйя и й дредетавляе'Г в Росшй такие
да^стые кйк Ншааа, JXBakei:. Ti^oag ш щ. Сотрудааки колша-нш готовы OK86atb безв'озмезді^'ш пошщь специалистам КДЛ е ааяажішшй
аі^одессов ВКК в соответетвїш ? дейс-тушщими сгандарташї/^ Для іернтаїт>»:ЗАр 12934Э, Москва, пр, д. 2» к, і, а/й ^5' І4Щ П7 ЬШ. фак£ 737 ЬШ е-таЙ: ^^ОШтная телефбйная линая для конс5ШШДий ~ (#00) 200
Глава З
Высокотехнологичные
лабораторные исследованияЛАБОРАТОРНЫЕ ИНФОРМАЦИОННЫЕ СИСТЕМЫСовременная клинико-диагностическая лаборатория (КДЛ) —
сложная производственная система, в которой реализуются
сотни технологических процессов. Использование лабораторных
информационных систем (ЛИС) в целях создания современной
технологии управления КДЛ, гарантирующей высокое качество
результатов лабораторных исследований при минимальных затра¬
тах, — единственный конструктивный путь и один из ключевых
инструментов, позволяющих достичь поставленной цели, лис
предназначены для комплексной автоматизации деятельности
КДЛ, поэтому их называют системами управления лабораторной
информацией. Управление современной КДЛ предусматривает
деятельность по организации непосредственно технологического
процесса производства лабораторных анализов и целого ком¬
плекса других процессов, таких как материальное обеспечение,
экономическая и клиническая эффективность. ЛИС позволяют
не только решать многочисленные задачи ввода и хранения
лабораторных данных, но и на базе новейших информационных
технологий интегрироваться с другими системами автоматизации
для участия в решении задач всего лечебно-профилактического
учреждения.лис состоит из технических средств (центрального процессора,
устройств ввода-вывода, запоминающих устройств, интерфейсов,
автоанализаторов) и программного обеспечения (компьютерных
программных средств, обеспечивающих работу технических средств
и обработку информации).В функции ЛИС входят;• регистрация доставленного в лабораторию биоматериала и
заявок на его исследования, их распределение по частным тех¬
нологическим процессам выполнения анализов, регистрация и
оформление результатов исследований, оперативный и ретро¬
спективный анализ деятельности лаборатории;• автоматизация выполнения исследований, включая ввод и
обработку данных с автоанализаторов, составление отчетов о
загрузке оборудования;• контроль качества лабораторных исследований, оперативное
выявление и исправление ошибок, оценка точности и вослро-
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 85изводимости аналитических результатов, их статистическая обработка и при¬
нятие решения по этим данным;• анализ и выдача результатов исследований;• составление различных статистических отчетов;• предоставление информации для принятия управленческих решений по
повышению качества результатов анализов;• учет поступления и использования реактивов, расходного имущества.Одной из основных функций лис является обеспечение специалистов лабо¬
ратории информацией об исследуемой пробе (данные о пациенте, время взятия
материала, перечень исследований, которые нужно выполнить, диагноз, лечащий
врач, специалист, проводивший взятие биоматериала) на всех этапах единого
технологического процесса производства анализов. Потоки лабораторной инфор¬
мации при традиционном лабораторном исследовании должны идти практически
параллельно с движением пробы по различным технологическим процессам и
операциям производства анализов.Второе направление информатизации деятельности лаборатории — решение
проблемы взаимодействия лабораторий с клиническими отделениями стационара
(поликлиники) на базе единой компьютерной информационной системы учрежде¬
ния — включает автоматизацию процессов оформления заявок на лабораторные
исследования, составления списков пациентов для взятия биоматериала, а также
передачу результатов анализов в отделения. Кроме того, единая информационная
система учреждения должна иметь не только базу справочных данных (инструк¬
ции для взятия биоматериала, информацию по оценке результатов анализов,
перечень исследований, выполняемых лабораторией, и т.д.), но и доступ к другим
информационным системам справочного или обучающего характера (например,
Интернет), В рамках этого направления решаются следующие задачи;• составление заявок на лабораторные исследования с терминалов в клини¬
ческих отделениях (рабочее место врача-клинициста) и выдача результатов
анализов из ЛИС на эти терминалы;• составление списка пациентов, заявок на анализы и их распечатка на терми¬
налах рабочих станций процедурной медицинской сестры или лаборанта;• маркировка взятого биоматериала;• предоставление информации о пациенте, заявке на анализы, о способе мар¬
кировки биоматериала в ЛИС;• создание банка данных с результатами лабораторных исследований, доступ¬
ного лечащим врачам для оперативного пользования;• автоматизированная поддержка врачебных решений: предоставление диа¬
гностических карт обследования пациентов, схем назначений анализов,
данных о диагностической чувствительности и специфичности тестов, алго¬
ритмов оценки результатов и т.д.Главной целью информатизации этого направления является уменьшение коли¬
чества необоснованных назначений исследований, сокращение времени получе¬
ния результатов анализов, более аргументированная интерпретация результатов
и контроль их использования для оказания качественной медицинской помощи
пациенту. В целом лабораторные информационные системы, которые предна¬
значены для комплексной автоматизации деятельности КДЛ, позволяют достичь
следующих преимуществ:• оптимизации и упрощения рабочих процессов лаборатории;• оптимизации документооборота лаборатории;• максимально эффективного использования рабочего времени сотрудников
лаборатории;• максимально эффективного использования технической базы лаборатории
(анализаторов);
86 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ• гарантирования конфиденциальности информации о результатах анализов
пациентов;• возможности эффективного и легкого масштабирования лаборатории как по
спектру выполняемых исследований, так и по потоку проб без потери каче¬
ства;• улучшения и постоянного контроля качества выполняемых исследований:• упрощения ведения коммерческой деятельности лаборатории (приема и
учета частных пациентов, введения индивидуальных скидок пациентам,
работы с корпоративными заказчиками);• простоты интеграции удаленных процедурных кабинетов в единую информа¬
ционную систему;• возможности удаленного доступа лечащих врачей к информации о лабора¬
торных анализах пациентов;• возможности интеграции с внешними системами для получения заявок
(электронной историей болезни, общебольничной системой):• возможности интеграции с внешними системами для автоматической выгруз¬
ки отчетности (системами ОМС, ДМС);• получения оперативной и ретроспективной информации о деятельности
лаборатории (большом количестве аналитических отчетов и федств для их
визуального представления);• ведения и контроля использования ресурсов (расходных материалов, реакти¬
вов и т.п.), потребляемых лабораторией;• подсчета себестоимости услуг, выполняемых лабораторией;• предоставления данных для анализа экономической эффективности деятель¬
ности лаборатории.Ориентированная на технологию ЛИС оказывает благоприятное воздействие
практически на все аспекты технологического процесса производства лаборатор¬
ных анализов: устраняется множество рутинных операций, возрастает эффектив¬
ность использования современных лабораторных анализаторов, упрощается доку¬
ментооборот, обеспечивается принципиально новый уровень информационного
взаимодействия с заказчиками лабораторных исследований, позволяет управлять
качеством результатов лабораторных анализов. Потоки информации на раз¬
личных этапах технологического процесса производства лабораторных анализов
представлены на рис. 3-1.В настоящее время КДЛ (особенно централизованные) все больше превра¬
щаются в самостоятельные предприятия. Соответственно КДЛ должны демон¬
стрировать свою экономическую эффективность. В связи с этим ЛИС становятся
мощным инструментом КДЛ, обеспечивая конкурентоспособное преимущество
перед другими лабораториями, экономя время и деньги. ЛИС коренным образом
улучшают взаимодействие КДЛ и клиентов, как физических, так и юридических
лиц. В отношении физических лиц первая и главная задача КДЛ — качественное
обслуживание пациентов. Пациентами процесс обслуживания оценивается по
наличию очереди в процедурный кабинет, качеству взятия проб крови, по тому,
насколько быстро и четко организован прием и насколько удобно для него полу¬
чение результата. Эти запросы пациентов должна помочь решить современная
ЛИС. Главной целью информационной поддержки взаимодействия с медицин¬
скими учреждениями является обеспечение максимально быстрого и комфорт¬
ного для клиента процесса приема заявок на исследования и выдачи результатов.
Ускорение приема заявок достигается за счет тесной интеграции составляющих
процесса приема заказа: регистрации заявок на исследования, забора проб био¬
материала.Изменения условий деятельности КДЛ требуют создания четко отлаженной
системы учета оказанных лабораторией медицинских услуг с выдачей результатов
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯЛИС87ТехнологическаяоперацияподготовкипациентаПациент~ГТехнологическая
операция взятия
и сбора биоматериалаТехнологическая
операция доставки
биоматериалаПроцедурная
медицинская сестра
или лаборантМеханизм получения
заявки на исследованиеЇКлиницист(составление заявки)РезультатыисследованийКомпьютерная историяболезниЕдиная
компьютерная
система ЛПУ,обеспечи¬
вающая
связь между
отделениямии лис,где заявки,
взятые пробы
и результаты
собирают,
регистрируют,
сортируют,
разделяют,
проверяют,
группируют,
приводят
в порядок,
доставляют,
сортируют
вновь,
комбинируют,
сообщают
и т.д.<->Технологический процесс
приема и подготовки
материала к исследованиямТТехнологические операции
подготовки анализаторов,
реактивов к проведению
исследований, калибровка,
внутрилабораторный
контроль качестваЇЧастные
технологические
процессы проведения
исследованийЇТехнологическая
операция обработки
результатов
и написание заключенийЇТехнологическая операция
передачи результатовtТехнологическая
операция составления
статистических отчетов
о проведенных
исследоваваниях,
расходе реактивов,
хранение информации и тд.Технологическая
операция обслуживания
анализаторовРис. 3-1. Потоки информации на различных этапах технологического процесса производства
лабораторных анализов (схема).в виде журналов или с периодической передачей сведений в страховую систему
медучреждения либо непосредственно в страховую компанию в электронном виде.
Внутри самой лаборатории возникла необходимость учитывать услуги в денеж¬
ном выражении с периодическим выставлением счетов страховым компаниям и
корпоративным клиентам. Медицинские учреждения (особенно коммерческие)
предъявляют достаточно жесткие требования к исполнителю лабораторных иссле¬
дований. Наиболее важные из них следующие.
88ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ• Гибкость механизма ценообразования и условий оплаты услуг. Вследствие
большого разнообразия организационных форм заказчиков лабораторных
исследований возникает соответствующее разнообразие вариантов цено¬
образования и условий платежа. Ведение счетов корпоративных клиентов с
учетом индивидуальных вариантов взаимодействия по мере роста количе¬
ства клиентов оборачивается серьезной задачей финансового учета.• Четкое регламентирование обслуживания: соблюдение сроков выполнения
исследований, эффективность технологии приема заказов и передачи резуль¬
татов. Пиковые нагрузки при обработке заказов могут в десятки раз превы¬
шать среднестатистические. Во избежание нарушений регламента и решения
спорных вопросов необходимо обеспечить учет и контроль длительности
каждого этапа прохождения заказа от забора материала и транспортировки
пробы до получения результата заказчиком.• «Прозрачность» деятельности лаборатории для корпоративного клиента
(медицинских учреждений). Клиент должен иметь возможность оперативно
получить сведения по широкому кругу вопросов: текущим ценам, детализа¬
ции счетов, стадии прохождения конкретного заказа и т.д. В информацион¬
ном взаимодействии с медицинскими учреждениями намечается переход от
реагирования на запросы клиентов по телефону к предоставлению им досту¬
па непосредственно к информационным ресурсам лаборатории.С учетом различного уровня информационного обеспечения медицинских
учреждений современная ЛИС должна поддерживать два способа взаимодействия
с ними: традиционный прием пакета заказов и выдачу результатов в бумажном
виде, обмен информацией в электронном виде.Для регистрации заказов, поступающих в виде бланков-заявок, ЛИС должна
иметь механизмы пакетной и многостадийной регистрации, которые позволяют
очень быстро провести первичную регистрацию заказов, достаточную для переда¬
чи большого количества проб на исследования. Дальнейшую регистрацию заказов
можно выполнять параллельно с исследованиями. Данный механизм позволяет
одному регистратору передавать на исследования несколько тысяч проб в час.Обмен данными с медицинскими учреждениями в электронном виде может
осуществляться способом, наиболее подходящим конкретному клиенту: на маг¬
нитных носителях, по электронной почте и через Интернет. Для первых двух
случаев клиенту необходимо установить специальное программное обеспечение,
позволяющее самостоятельно регистрировать заказы и передавать их в виде фай¬
лов вместе с пробами на магнитных носителях или по электронной почте, затем
таким же образом получать файлы с результатами и выводить их на печать. При
взаимодействии через Интернет клиент регистрирует заказы и просматривает
результаты непосредственно на сайте лаборатории с помощью веб-интерфейса.
ЛИС должна обеспечивать учет оказанных лабораторией медицинских услуг с
выдачей результатов в виде журналов или с периодической передачей сведений в
страховую систему медучреждения либо непосредственно в страховую компанию
в электронном виде. По результатам работы с медицинскими учреждениями за
отчетный период лис должна выдавать полный комплект документов, необходи¬
мых для расчета по договорам.На современном этапе КДЛ из технологического подразделения в составе пред¬
приятия становится самостоятельной структурой или отдельным предприятием в
составе ЛПУ. В связи с этим экономическая эффективность становится важнейшей
составляющей функционирования лаборатории. Сам факт существования КДЛ
определяется экономическим расчетом. Новая функция КДЛ — экономически
целесообразное существование на рынке лабораторных услуг. С этой точки зрения
ЛИС обеспечивает получение всех необходимых данных для эффективного управ¬
ления деятельностью адл, включая:
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ $9• определение норм расходования реактивов, калибраторов, контрольных
материалов и другого расходного материала для каждого вида анализов, а
также себестоимость анализов;• ежедневный з^чет количества выполненных исследований по тестам;• формирование помесячных заявок на реактивы и расходные материалы;• получение, учет и контроль расходования реактивов и расходных материа¬
лов;• планирование и контроль бюджетов;• оптимизацию расходов в целях повышения рентабельности деятельности
лаборатории;• формирование данных для принятия управленческих решений.Реальное решение перечисленных задач возможно только при использованииЛИС. По своей экономической сущности лис обеспечивает создание прозрачной
модели производства лабораторных исследований в КДЛ для осуществления опе¬
ративного контроля над формированием переменных затрат, к которым в лабо¬
ратории относятся наборы реактивов, калибраторы, контрольные и расходные
материалы (кюветы, моющий раствор, чистящий раствор, разводящий раствор
и т.д.). Именно уровнем развития информационных технологий в КДЛ опреде¬
ляются в настоящее время эффективность обеспечения реактивами, расходными
материалами, бесперебойность снабжения, учета расходования материалов, необ¬
ходимых для производства анализов, и соответственно себестоимость анализов и
экономический успех лаборатории.Современная ЛИС в состоянии обеспечить как безопасность баз данных и поль¬
зовательских функций, так и конфиденциальность данных клиента и результатов
исследований. Каждый пользователь ЛИС должен иметь строго определенные
полномочия по работе только с определенными группами данных в ЛИС — это
важнейшее требования по безопасности. В итоге пользователь имеет возможность
выполнять разрешенные ему функции только с теми данными, к которым он допу¬
щен.Информационные компьютерные технологии находят наибольшее примене¬
ние в первую очередь там, где имеется большой объем выполняемой рутинной
работы. КДЛ ежедневно выполняют огромное количество различных видов
исследований. Объем обрабатываемой при этом информации достаточно велик.
Типичная средняя КДЛ насчитывает 15 пользователей (специалистов лаборато¬
рии), исследующих примерно 10 ООО проб в год и выполняющих по каждой пробе в
среднем 5 тестов с определением 4 параметров в каждом. В крупных лабораториях
одновременно может быть задействовано до 100 пользователей и более, поэтому
информатизация деятельности КДЛ приносит более ощутимую практическую
выгоду. Для КДЛ современная ЛИС является таким же незаменимым производ¬
ственным инструментом для выполнения лабораторных анализов, как и автома¬
тические анализаторы,МЕТОДЫ ВИДЕОЦИФРОВОЙ РЕГИСТРАЦИИв регистрации результатов биохимических, иммунохимических и других лабо¬
раторных исследований доминируют фото- и рефлектометрические системы, что
обусловлено значительным парком фотометрических приборов, отработанными
методическими схемами их применения и производственными мощностями для
производства этого оборудования.Однако одной из очевидных тенденций модернизации лабораторной диагно¬
стики является все более широкое внедрение компьютерных и информационных
технологий, в частности замена традиционных систем регистрации на комплексы,
базирующиеся на подходах видеоцифровой регистрации (ВЦР). Масштабному
90ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯвнедрению видеоцифровых систем способствуют многие факторы, среди которых
постоянно улучшающиеся технические характеристики приборов получения изо¬
бражений — видеокамер и сканеров, их экономическая доступность, развитие и
массовое использование информационных и коммуникационных технологий.Помимо факторов, связанных с общими достижениями научно-технического
прогресса, с)'^ществуют и конкретные аналитические преимущества ВЦР перед тра¬
диционной фотометрией, которые позволяют получать дополнительн)то инфор¬
мацию об изучаемых объектах, совершенствовать имеющиеся и создавать новые
лабораторные методики.Эти преимущества в общем виде проиллюстрированы на рис. 3-2, где представ¬
лена схема, сопоставляющая в общем виде возможности технологии видеоцифро-
вой регистрации и обычных фотометрических методов.Системы ВЦР дают возможность получать изображение образца, представляю¬
щее собой совокупность количественно измеряемых сигналов, отвечающих боль¬
шому количеству точек — пикселей аналитического объекта (например, лунки
микропланшета или иммунохроматографической тест-полоски). При ВЦР на один
объект приходится большое количество (от сотен до нескольких тысяч) регистри¬
руемых цифровых характеристик, которое определяется пространственным раз¬
решением соответствующего устройства, в случае однородных объектов при ВЦР
эти характеристики усредняются (обычно берется не менее тысячи значений) и
вычисляется оптическая плотность или коэффициент светоотражения, как и при
обычной фотометрии.Однородный объектНеоднородный объектФотометрияВЦРИсточниксветаДетекторОдно
числовое
значение
на объект0D1ПЗС-линейка,ПЗС-матрицаКоличество
численных значений
на объект равно
количеству пикселей
(-22000/лунка)ИзображениеФотометрияВЦРИсточниксветаДетектор???ПЗС-линейка,ПЗС-матрицаКоличество
численных значений
на объект равно
количеству пикселей
(-22 ООО/лунка)ИзображениеРис. 3-2. Видеоцифровая регистрация и фотометрия применительно к однородным и неодно¬
родным объектам.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 9tДля неоднородных объектов ВЦР позволяет численно охарактеризовать полу¬
чаемую картину по степени дисперсии (неоднородности) или другим параметрам,
отражающим интенсивность прохождения аналитической реакции с последующим
представлением результатов в зависимости от поставленных задач. Таким образом,
возможность анализа изображения объекта позволяет либо установить наличие и
исключить влияние артефактов — неоднородностей в однородном образце, либо,
если неоднородность несет диагностически значимую информацию, получить ее
аналитические характеристики, выраженные в численном виде.Помимо этого, ВЦР обеспечивает сохранение первичного изображения, фик¬
сирующего полную информацию об объекте в конкретный, определяемый лабо¬
раторной методикой момент времени, которое может быть названо первичным
документом теста (ПДТ), что имеет самостоятельную ценность. Такое докумен¬
тирование и архивирование результатов обеспечивают возможность ретроспек¬
тивного контроля выполненного исследования, что повышает ответственность
персонала, может придать юридический статус исследованию и ставит барьер на
пути ошибок и фальсификаций. Возможность возвращаться к ПДТ через некото¬
рое время позволяет отслеживать динамику изменения лабораторных параметров,
консультироваться при неоднозначных результатах, оценивать эффективность
лечения, сравнивая непосредственно результаты. Немаловажное значение имеет
и возможность передачи первичной информации (ПДТ) через Интернет, в том
числе и при проведении анализов у постели больного и в полевых условиях, когда
в неясных случаях соответствующими специалистами выносится компетентное
заключение.Системы получения изображений аналитических объектовВ качестве аппаратной части систем ВЦР могут использоваться два типа
устройств — цифровые видеокамеры и сканеры. Каждое из этих устройств имеет
свои достоинства и недостатки.Видеоцифровые камеры компактны, позволяют получать качественные изобра¬
жения, обеспечивают высокою скорость съемки, дают возможность конструировать
малогабаритные мобильные с автономным питанием и более универсальные, чем
сканеры, приборы. К недостаткам систем с видеокамерами относятся небольшое
поле зрения и сложность создания равномерного освещения исследуемого объекта.Сканеры являются готовым промышленным изделием, AOCT)TIHbI по ценам,
дают изображения высокого разрешения, обладают хорошей цветопередачей.
Вследствие больших размеров и требований к электропитанию их используют в
основном только как стационарное оборудование. Существенным достоинством
сканерных систем является возможность работы с широко распространенными
лабораторными тестами, проводимыми в 96-луночных планшетах.На рис. 3-3 показаны варианты адаптированных к различным аналитическим
объектам видеоцифровых систем получения изображения. Система на основе
видеоцифровых камер «Рефлеком» (а) позволяет регистрировать результаты
иммунохроматографических тестов (ИХ-тестов) в режиме отражения. Система
«Рефлеком-Микро» (в) предназначена для работы с ИХ-тестами в полевых усло¬
виях. Система «Эксперт-Лаб» (б) создана на основе промышленного сканера.ПРИНЦИПЫ ПОСТРОЕНИЯ ПРОГРАММНОГО ОБЕСПЕЧЕНИЯ ДЛЯ ЛАБОРАТОРНЫХ
СИСТЕМ ВЦРПрограммное обеспечение (ПрО) для систем ВЦР разрабатывается на основе
универсальной схемы построения интерфейсов вне зависимости от типа устрой¬
ства получения изображения. Алгоритмы обработки информации создаются в
соответствии с характеристиками конечных результатов (изображений аналити-
92ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯРис. 3-3. Модификации регистрирующих видеоцифровых устройств на основе видеоцифровой
камеры: а — «Рефлеком»; б — многофункциональная лабораторная система «Эксперт-Лаб»;
в — анализатор «Рефлеком-Микро».ческих объектов) для конкретных типов реакций с вьщачей результатов с уче¬
том специфических требований практических лабораторий. На основе единых
принципов построения про удается создать многофункциональные устройства —
программно-аппаратные комплексы, способные обеспечивать достоверную и объ¬
ективную регистрацию результатов различных лабораторных исследований.В практике лабораторной диагностики можно выделить два типа аналитических
объектов и исследований, требующих различных подходов при регистрации про¬
хождения реакции. Это исследования, проводимые на тест-полосках (ИХ-тесты,
тесты «сухой химии»), и исследования, проводимые Б матричном формате (имму-
нохимические тесты в 96“Луночных микропланшетах и планшетах других форма¬
тов, исследования на основе микроматриц — микрочипов).При использовании ИХ-тест-полосок результатом исследования является появ¬
ление нескольких линий: контрольной, обозначающей пригодность теста, и тесто¬
вых, обозначающих наличие или отсутствие определяемого аналита. При при¬
менении полосок «сухой химии» в ходе исследования регистрируется изменение
цвета расположенных на тест-полоске реагентных зон.Для ИХ-тестов и полосок «сухой химии» аналитическими зонами (зонами
интереса), в которых необходима оценка интенсивности реакций с помощью ПрО,
являются линии и окрашенные зоны, которые несут значимую информацию.На рис. З-За показано выделение аналитически значимой зоны ИХ-полоски и
представление в рабочем окне этой программы гистограмм интенсивности линий
на полоске после проведения теста. Интегральная интенсивность линий исполь¬
зуется для автоматического определения положительных или отрицательных
результатов теста. Про для ИХ-тестов предусматривает сохранение всей анали¬
тической информации в цифровом виде в памяти компьютера, включая исходное
изображение аналитической зоны тест-полосок, которое в данном случае является
ПДТ. ПрО является универсальным и может быть адаптировано к любым иммуно-
хроматографическим полоскам.Тесты «сухой химии»^ для биохимического анализа крови и мочи широко
используются в клинической лабораторной диагностике и являются традицион¬
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 93ным объектом регистрирующих приборов на основе обычной рефлектометрии.
Для этих объектов ВЦР обладает рядом преимуществ. Каждая зона интереса и
изображение каждой полоски могут обрабатываться одновременно. Это дает систе¬
мам ВЦР преимущества перед традиционными рефлектометрическими методами,
такие как сохранение первичного изображения тест-полоски (ПДТ); возможность
работать с произвольным количеством независимых каналов регистрации, т.е.
анализировать несколько полосок одновременно; применимость этого подхода к
различным типам тестов в режиме конечной точки и кинетическом режиме. Таким
образом, гибкое ПрО для полосок «сухой химии» обеспечивает объективную
интерпретацию результатов и получение информации в виде концентраций соот¬
ветствующих аналитов.Для исследований в матричном формате (аналитические объекты — микро-
планщеты или матрицы точек на мембране, стекле и других планарных носителях)
зонами интереса являются отдельные лунки, или элементы, матрицы. Получение
изображений 96-луночных планщетов из-за их значительных размеров и трех¬
мерной (неплоскостной) геометрии возможно с помощью сканерной системы
«Эксперт-лаб». После получения изображения для каждой из лунок микро¬
планшета или точек матрицы с помощью разработанных алгоритмов можно в
численной форме определить или оптическую плотность содержимого лунки, или
интенсивность окрашивания индивидуального пятна. По этим численным значе¬
ниям можно определить концентрации соответствующих аналитов и представить
их в любом необходимом виде.Более сложные математические процедуры необходимы в тех слздіаях, когда в
результате иммунологических реакций возникают неоднородные объекты. Такие
реакции, как пассивная гемагглютинация, латекс-агглютинация, агглютинация
эритроцитов, приводят к формированию в лунках осадков, характерных для
каждого типа исследования, по наличию или отсутствию которых и определяется
положительный или отрицательный результат реакции. Для каждого варианта
таких исследований используется свой алгоритм обработки изображения.СКАНЕРНАЯ ВИДЕОЦИФРОВАЯ СИСТЕМА ДЛЯ 96-ЛУНОЧНОГО ПЛАНШЕТАДля оценки иммунохимических реакций (реакции «антиген-антитело» или
более широко “ реакции специфического связывания) разработаны и использу¬
ются специализированные аналитические технологии, которые условно можно
разделить на три группы.1. Прямые (непосредственные) методы определения реакции «антиген-
антрггело». Образующийся при этом комплекс «антиген-антитело» иден¬
тифицируется визуально либо с помощью простых оптических устройств,
к таким методам относятся преципитация в растворе (в том числе реакции
турбидиметрии и нефелометрии), в геле, на полимерной пленке, агглюти¬
нация бактериальных клеток, простейших, прямая реакция агглютинации
эритроцитов антителами, вирусами.2. Реакции агглютинации частиц, с поверхностью которых связаны антигены
или антитела. К этим методам относятся реакции прямой гемагглютинации
(РИГА) и непрямой гемагглютинации (РИГА), латекс-агглютинации (ЛА),
коагглютинации, агглютинации частиц бентонита, желатиновых капсул,
частиц сефарозы и др. Метод регистрации чаще всего визуальный.3. Индикаторные методы, основанные на использовании различного рода меток
для выявления реакции «антиген-антитело». Наиболее распространены имму-
ноферментный, иммунофлюоресцентный, радиоиммунологический анализы.
TYin регистрирующего устройства определяется используемой меткой.Из этих методов наиболее востребованы в медицинской лабораторной практике
иммуноферментный анализ, латекс- и гемагглютинация, турбидиметрия и нефело-
94 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯметрия. Во всех этих технологиях используются планшеты для микротитрования.
ВЦР позволяет регистрировать результаты этих исследований с использованием
одной многофункциональной лабораторной сканерной системы. Система пози¬
ционирования обеспечивает строгое пространственное расположение планшета и
жестко фиксирует положение зон интереса после настройки. Все настройки скане¬
ра, соответствующие геометрическим характеристикам объекта и другим параме¬
трам анализа, устанавливаются однократно и сохраняются в памяти компьютера
для данного вида анализа.Сканерная система «Эксперт-Лаб» является универсальным устройством
и может обеспечивать документирование, объективизацию и интерпретацию
результатов латекс-агглютинационных, гемагглютинационных, изосерологиче-
ских исследований, а также применяться в качестве иммуноферментного ридера.
ПО для всех этих методов построено по единому принципу и обеспечивает:• получение и архивирование первичного изображения (ПДТ);• различные алгоритмы визуализации полученных данных программными
методами — увеличение исследуемого изображения (инструмент «лупа«>),
контрастирование, инвертирование (обращение цветов для лучшей иденти¬
фикации агглютинации), сопоставление увеличенных изображений положи¬
тельных и отрицательных образцов;• объективизацию результатов за счет использования программных методов
математической обработки изображения и возможность автоматической
интерпретации результатов;• унифицированный интерфейс модульных программ, что облегчает освоение
и рутинное использование всех разнообразных возможностей системы;• возможность подключения комплекса к ЛИС с автоматической передачей
данных согласно коду пробы пациента, что значительно снижает количество
ошибок, связанных с неправильной идентификацией образца при выдаче
результата.Единый принцип построения рабочего интерфейса программных модулей про¬
иллюстрирован на рис. 3-4 (см. цв, вклейку). Показаны варианты сохраняемых
изображений всего планшета после проведения различных типов реакций.ПРИМЕНЕНИЕ СИСТЕМЫ ВЦР ДЛЯ ОБЪЕКТИВИЗАЦИИ РЕЗУЛЬТАТОВ ЛАТЕКС-
АГГЛЮТИНАЦИОННЫХ ТЕСТОВДиагностические системы на основе латекс-агглютинации широко распростра¬
нены в лабораторной диагностике благодаря простоте и быстроте проведения ана¬
лиза. Разработаны методы получения латексных частиц различного состава, раз¬
меров, цвета и свойств, а также способы сенсибилизации латексов разнообразными
антигенами и антителами, что позволяет сконструировать практически любой
диагностикум. Биологическая инертность латекса позволяет снизить возмож¬
ность перекрестных неспецифических реакций, а также обеспечивает длительную
сохранность готовых реагентов. Однако латексные тесты имеют ряд существенных
недостатков, обусловленных быстрым протеканием и нестабильностью резуль¬
татов реакции во времени. Необходимость визуальной регистрации результатов
через строго определенное время, часто составляющее не более 2-3 мин, приво¬
дит к субъективности оценки результатов. Эти факторы ограничивают ценность и
сужают область применения латексных тестов.Задачи документирования результатов тестов ЛА через определенное время и
объективизации интерпретации результатов могут бьггь решены с привлечением
методов ВЦР. Удобным объектом постановки реакции с применением сканерной
регистрации являются крышки планшетов для титрования с нанесенными на
них конденсационными кольцами, которые представляют собой упорядоченную
матрицу из 96 микролунок. Максимальный объем такой лунки составляет 30 мкл.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ95Соотношение реагент/образец определяется производителем и соответствует мак¬
симальной линейности системы. Именно поэтому необходимо подобрать объем
реагента, не меняя данное соотношение. Оптимальным является общий объем
20 мкл (при эквивалентном соотношении 10 мкл образца/10 мкл реагента), так как
при меньших объемах возникают трудности при пипетировании, а при больших
объемах возможна кросс-контаминация соседних лунок.Реакцию ЛА в крышках проводят следующим образом. В лунки помещают по
10 мкл латексного реагента и образца (контрольных сывороток, цельных и раз¬
веденных сывороток пациентов). Для полуколичественного определения концен¬
трации аналита готовят серию двукратных разведений тестируемой сыворотки
физиологическим раствором. Концентрация определяется как самое большое
разведение тестируемой сыворотки с положительной реакцией (титр сыворотки),
умноженное на чувствительность реагента (например, 6 мг/л — для СРБ).Тщательно перемешивают и наблюдают отсутствие или наличие агглютинации
при круговом покачивании крышки. Через заданный промежуток времени крышку
помещают в позиционер сканирующего устройства. Полученное первичное изо¬
бражение всей крышки сохраняется в памяти компьютера и слз^жит основой для
последующих цифровых операций с конкретными зонами интереса (контрастиро¬
вания, з^величения, математической обработки).Результаты расчета количества агглютинатов в образцах могут быть выражены
с помощью числа, которое тем выше, чем больше обнаруженное количество кон¬
гломератов. Математический расчет и численное представление интенсивности
агглютинации дают возможность количественной оценки результата реакции
агглютинации и определения порогового значения для автоматической дискрими¬
нации положительных и отрицательных образцов.Компьютерная программа позволяет также ввести и сохранить протокол анали¬
за (расположение контрольных, тестируемых образцов, их разведения и дублиро¬
вания). На рис. 3-5 показан вариант заполнения протокола анализа.At: м' М«Aiіod :т1.f ы.‘Г ж" А9' ^ АрМІМІ|: Ш:- --1 - щ■ щИзмерениеКонтроль отрицательныйКонтроль положительныйКалибровкаДубльРазведениеПусто[ Jі Ш\ :ш: Hid 'Viгшт<St2lгтРис. 3-5. Заполнение протокола анализа контрольных и калибровочных образцов, цельных проб,
дублбй, разведений исследуемых сывороток пациентов.
96ВЫСОКОТЕХНОЛОГИ4НЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯНа рис. 3-6 (см. цв. вклейку) представлены результаты цифровой обработки
изображения нескольких лунок с положительными и отрицательными образцами
сывороток при определении СРВ: контрастирование и последующее визуальное
отображение количества конгломератов (агглютинатов) в тестируемых образцах,
рассчитанное с помощью математических методов.Информация о наличии или отсутствии агглютинации для конкретного образца
с помощью системы ВЦР фиксируется в строго определенное, соответствующее
инструкции время и представляется и сопоставляется многократно в различных
видах:• сопоставление контрастированных и увеличенных изображений образцов и
контролен;• оценка визуального представления расчетного количества конгломератов;• численные расчетные значения интенсивности агглютинации;• дискриминация положительных и отрицательных образцов на основе рас¬
чета порогового значения.Получение объективных цифровых характеристик интенсивности реакции
латексной агглютинации позволяет вести внутрилабораторный контроль этого
типа исследований, что принципиально невозможно при традиционной визуаль¬
ной регистрации. Применяются рассчитанное целевое значение интенсивностей
в контрольных материалах и стандартный набор контрольных правил; предупре¬
дительный критерий — далее - 2^^, R^, 4^^, 10^. Пример контрольной карты
для СРБ показан на рис. 3-7.Контрольная карта для определения СРБ методом ЛА с ВЦРИнтенсивность агглютинации
Целевое значениеXCP+2SD —— Xcp+SD
XCP-2SD —— Xcp-SDРис. 3-7. Контрольная карта определения СРБ методом латекс-агглютинации с ВЦР.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ97РЕАКЦИЯ ПАССИВНОЙ ГЕМАГГЛЮТИНАЦИИ С ВИДЕОЦИФРОВОЙ РЕГИСТРАЦИЕЙ
РЕЗУЛЬТАТОВРеакция пассивной гемагглютинации широко используется в серодиагностике,
по чувствительности этот метод сопоставим с иммуноферментным анализом. Хотя
существуют наборы РПГА различной специфичности (для определения антител к
возбудителю кори, иерсиниоза, бруцеллеза и некоторых других инфекций), одна¬
ко наибольшее распространение имеют системы определения антител к Treponema
pallidum для серодиагностики сифилиса, используемые многими лабораториями
как основной тест. Эти системы, как и другие наборы РПГА, предполагают визу¬
альный учет результатов, что является их существенным недостатком.Автоматизированный учет результатов диагностики сифилитической инфек¬
ции методом РПГА обеспечивает повышение диагностической специфичности и
чувствительности, позволяет исключить субъективный подход к интерпретации
результатов.Реакция РПГА основана на регистрации формирования агрегатов сенсибилизи¬
рованных эритроцитов («зонтика») в лунках круглодонного планшета при нали¬
чии в сыворотке пациента специфических антител.Программа «Эксперт-Лаб-РПГА» лабораторного комплекса позволяет осу¬
ществить дискриминацию результатов по стандартной 4-крестовой шкале. На
рис. 3-8 показано соответствие внешнего вида агглютинации образца и заданного
значения шкалы (составленные по данным экспертной оценки врачей КДЛ, дан¬
ным литературы и инструкции производителя тест-систем).Исследование проводят согласно инструкции производителя эритроцитарного
диагностикума. Для получения воспроизводимых результатов необходимо учиты¬
вать результаты реакции через строго заданное время инкубации (для РПГА при
определении антител к Гг. pallidum оптимально -1ч).Так же как и для латексных тестов, наличие численной характеристики выра¬
женности агглютинации позволяет определить воспроизводимость тестирования
и на основании рассчитанных целевых значений проводить внутрилабораторный
контроль качества.Существуют разновидности реакции пассивной агглютинации, где вместо эри¬
троцитов используются искусственно созданные желатиновые частицы с сорбиро¬
ванным на них соответствующим антигеном/антителом.ПО «Эксперт-Лаб-РПГА» адаптировано к серии тест-систем на основе этого
принципа с разработкой варианта программного обеспечения «Эксперт-Лаб
Serodia». На рис. 3-9 (см, цв. вклейку) представлены положрггельные, сомнитель¬
ные и отрицательные результаты реакции агглютинации желатиновых частиц.47-СОМНИТЕЛЬНАЯ РСАІСМИЯ’.~гЗ)рмірв«ига ойршлит.'..',
' V:'; к«0«париоа миько
; с твмыммлмсмпм.:• ЦВНІ)».«рмірпмпм|iqroBKa)*M*npeРис. 3-8. Окно соответствия вариантов исходов реакции РПГА 4-крестовой шкале (по экспертной
оценке врачей КДЛ).
98 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯПредложенный алгоритм оценки интенсивности гемагглютйнации (образова¬
ние «зонтика») может быть использован и для регистрации результатов других
лабораторных методов, где в качестве индикаторных частиц используют эритро¬
циты, например реакции торможения агглютинации (иначе — реакции нейтрали¬
зации вирусов).МЕТОДИКИ ИЗОСЕРОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ В ФОРМАТЕ 96-ЛУНОЧНОГО
ПЛАНШЕТАВ случае изосерологических анализов (определения группы крови) регистри¬
руется агглютинация эритроцитов крови пациента в присутствии специфических
антител, причем для каждого образца ставится несколько реакций с антителами к
групповым антигенам А и В, резус-фактору.Изосерологические исследования остаются одной из самых консервативных
технологий в клинической лабораторной аналитике, что обусловлено их высокой
значимостью. До сих пор нет однозначного решения вопросов визуализации и
документирования этих тестов. По-прежнему самыми распространенными спо¬
собами проведения этих исследований в нашей стране остаются ручные методы.
Их известно три: 1 — на плоскости, 2 — в пробирках, 3 — в планшетах для микро¬
титрования.К недостаткам агглютинации на плоскости следует отнести невозможность
определения слабых антигенов эритроцитов и низких титров гемагглютининов
в сыворотке пациента; для некоторых исследований используют пробирочный
метод и практически никогда — микропланшетную технологию. Во многом это
связано со сложностью визуальной интерпретации агглютинации в этом формате,
отсутствием специальных сканируюш;их устройств, более длительным временем
проведения исследования, необходимостью предварительной обработки эритро¬
цитов для приготовления суспензии.в то же время микропланшетная технология имеет следующие преимущества:• использование малых количеств антисывороток и эритроцитов;• проведение серийных исследований;• сокращение времени проведения исследования за счет предварительного
внесения реагентов в плашку;• уменьшение ошибок благодаря внедрению регистрирующих устройств.Для регистрации результатов изосерологических исследований в круглодонныхпланшетах разработана программа «Эксперт-Лаб-Изосерология». Программа
позволяет автоматически фиксировать наличие/отсутствие агглютинации при
взаимодействии тестируемых эритроцитов с цоликлонами в каждой лунке и соот¬
ветственно определять группу крови для каждого пациента. Видеоцифровая реги¬
страция позволяет избежать стадии центрифугирования.По результатам исследований оптимальным следует признать алгоритм про¬
ведения изосерологических исследований по системе АВО и Rh в микропланшете с
видеоцифровой регистрацией. Описан вариант постановки, включающий типиро-
вание перекрестным методом (со стандартными эритроцитами).• Вносят в соответствующие лунки стандартные эритроциты О, А1 и В при¬
близительно по 5-10 мкл и цоликлоны анти-А, анти-В, анти-D-cynep, физ¬
раствор по 150 мкл.• Вносят соответственно по 150 мкл исследуемой сыворотки и по 5-10 мкл
исследуемой цельной крови.• Инкубируют при комнатной температуре на шейкере в течение 5-10 мин.
Агглютинация эритроцитов с цоликлонами обычно наступает в первые
несколько минут. Но считывание следует повторить через 15-20 мин ввиду
более позднего появления агглютинации с эритроцитами, содержащими
слабые разновидности антигенов А или Б. Агглютинация сыворотки со стан¬
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 99дартными эритроцитами может наступить поздно в связи с возможностью
низкого титра содержащихся в исследуемой сыворотке агглютининов.• Сканируют планшет.• В случае несовпадения определения групп крови с помощью цоликлонов и
стандартных эритроцитов повторяют процедуру сканирования через 20 мин
для выявления слабых антител и антигенов.В случае унифицированного расположения цоликлонов в планшете возмож¬
на автоматическая интерпретация группы крови для конкретной пробы крови.
Используют алгоритм, приведенный на рис. 3-10 (см. цв. вклейку). Показаны
увеличенные изображения с выбором зоны интереса в лунках при определении
различных групп крови с использованием цоликлонов в круглодонном планшете.ПРИМЕНЕНИЕ СКАНЕРНОЙ СИСТЕМЫ ВЦР ДЛЯ РЕГИСТРАЦИИ РЕЗУЛЬТАТОВ
ИММУНОФЕРМЕНТНОГО АНАЛИЗАКоммерчески доступный сканер может быть использован в качестве вертикаль¬
ного фотометра 96-луночных микропланшетов для ИФА. Большинство используе¬
мых в настоящее время тест-систем в качестве ферментной метки имеют перок-
сидазу хрена, субстрат — раствор 3,3’, 5,5'-тетраметилбензидина гидрохлорида
(ТМБ), содержащий перекись водорода. Образующиеся окрашенные продукты в
кислой среде имеют максимальное поглощение при 450 нм,Иммуноферментные исследования проводят согласно инструкциям произ¬
водителя. ПО универсально и позволяет настраивать систему регистрации и
дискриминации результатов в соответствии с любыми требованиями методик.
Обеспечиваются варианты в режимах измерений оптической плотности, дискри¬
минации по уровню «cut-qff», рассчитываемому по различным формулам, количе¬
ственных измерений по калибровочной кривой.На рис. 3-11 (см. цв. вклейку) показано окно регистрации результатов в режиме
измерений по калибровочной кривой. Программа «Эксперт-Лаб-ИФА» позво¬
ляет вводить значения калибраторов, строить калибровочную кривую (могут
быть использованы различные алгоритмы: линейно-кусочный, сплайн, линей¬
ная регрессия и др.) и выводить на экран значения концентраций исследуемых
веществ.Помимо оптической плотности, сканерное изображение несет значительное
количество дополнительной информации, недоступной при фотометрировании.
При постановке ИФА возможны ошибки, связанные с неправильным заполне¬
нием лунок, наличием пузырьков, случайных загрязнений, выпадением в осадок
субстрата в отдельных лунках. Для их исключения рекомендуют перед измере¬
нием просмотреть ИФА-планшет. Анализ сканерного изображения позволяет по
наличию негомогенности окрашивания автоматически выявлять и маркировать
такие лунки, что дает возможность идентифицировать образцы, требующие
повторной постановки. Эта опция принципиально нереализуема для обычных
анализаторов.Сохранение и возможность повторного анализа изображения планшета дают
возможность ретроспективного анализа неясных случаев и исправления ошибок
интерпретации результатов, что выгодно отличает систему ВЦР от традиционных
ридеров, которые после измерений сохраняют только по одной цифре — значению
оптической плотности для каждого образца.ВЦР И МИНИАТЮРИЗАЦИЯ ДЛЯ СЕРИЙНЫХ И МУЛЬТИПЛЕКСНЫХ ИССЛЕДОВАНИЙ
В МАТРИЧНОМ ФОРМАТЕПрименение ВЦР открывает возможности миниатюризации тест-систем и
проведения мультианалитических исследований. Достаточно большое разре¬
шение сканерной системы позволяет без труда зафиксировать наличие и оце-
100 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЬІЕ ИССЛЕДОВАНИЯЙЛіі-Та’/О'Ь-ЇА*нить интенсивность агглютинации или прохождения других реакций в малых
объемах. Разработаны специальные 12-луночные носители с объемом лунки не
более 15 мкл, форматом матрицы аналитических зон 3x4, шагом, совпадающим с
таковым стандартных микропланшетов. Для реакции Л А в этих микропланшетах
используется всего по 3 мкл образца и реактива. Исследования, проводимые в
микропланшетах такого формата, с одной стороны, не требуют дополнительных
приспособлений, с другой — значительно экономят дорогостоящие реактивы.На рис. 3-12 показан такой 12-луночный микропланшет после проведения реак¬
ций ЛА. Программную обработку результатов проводят по тем же принципам, что
и для 96-луночного микропланшета. При сохранении всех преимуш;еств и анали¬
тических характеристик тестов удается снизить потребление реагентов более чем
на порядок.Дальнейшие перспективы миниатюризации тест-систем предполагают умень¬
шение количества реагентов и образцов до десятых долей микролитров. С умень¬
шением объема образцов и реагентов встает проблема нанесения микроколичеств
вещества, тем более что с переходом к количественным тестам требуется более
высокая степень точности дозировки жидких объектов и позиционирования
нанесенных линий или точек на носителе, а также высокая воспроизводимость
этих параметров. Для таких целей обычные пипетки неприменимы, требуются
специальные приспособления. В этом плане перспективной является технология
пинового нанесения, т.е. перенос микрокапли, сформировавшейся на пине (микро¬
стержне) после погружения в образец, на носитель, где и протекает реакция.
Подбором пинов удается добиться малого разброса объема микрокапель (CV —
0,8-7,8% для различных пинов). Рационально объединять одиночные пины в
многопиновые системы — мультиаппликаторы.Для различных лабораторных исследований в объемах реакционной смеси
менее 1 мкл разработан полный аналитический комплекс, включающий систему
позиционирования-смешивания и видеоцифровые регистрирующие устройства
с программным обеспечением (сЭксперт-Лаб» или «Рефлеком»), так как учет
результатов реакции может бьггь выполнен только с помощью ВЦР. В данном слу¬
чае визуальная регистрация неприменима.Рис. 3-12. Внешний вид 12-луночного микропланшета формата 3x4 с проведенной реакцией
латексной агглютинации.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 1Q1Система позиционирования-смешивания состоит из аппликаторов для реаген¬
тов и образцов, соответствующих им микропланшетов и позиционера, обеспе¬
чивающего фиксированное положение микропланшетов, и носителя, на котором
проводится реакция. При использовании системы после соответствующих анали¬
тических реакций на носителе формируются матрицы точек формата 5x6, каждая
из которых соответствует отдельной пробе. Далее проводят компьютерную обра¬
ботку результатов по заданным алгоритмам. В подобном миниатюризированном
формате могут быть проведены различные биохимические и иммунохимические
тесты.Возможны два варианта использования системы позиционирования-смешива¬
ния для различных лабораторных исследований.Первый вариант — предполагается только нанесение образца на носитель.
Носитель может содержать реагенты, которые вступают в реакцию с исследуемым
веществом («сухая химия»), либо происходит иммобилизация образца на мем¬
брану для дальнейших, например иммунохимических, исследований (иммунодот-
анализ). В этом варианте 30 капель одного объема (менее 0,5 мкл) одномоментно
наносят на мембрану, формируя матрицу аналитических точек образца, имеющих
фиксированное геометрическое положение на носителе.Например, серийное измерение глюкозы в сыворотке крови с матричным
дот-нанесением образцов проводят следующим образом. В микропланшет вно¬
сят образцы сывороток и калибраторы по 10 мкл в каждую лунку. Планшет и
носитель с мембраной помещают в соответствующие отделения системы пози¬
ционирования. С помощью аппликатора капли образца переносят на мембрану,
содержащую иммобилизованные реагенты для проведения глюкозооксидазной
ферментативной реакции с формированием цветного пятна, время проявления
которого составляет около 60 с. После этого носитель сразу же помещают в сканер
для регистрации результатов. Вся процедура (после заполнения планшета) зани¬
мает не более 3 мин, причем результаты, представленные в электронной форме,
сохраняются в базе данных или их можно распечатать.Для регистрации результатов дот-анализа в микроматричном формате исполь¬
зуют пакет ПО «Эксперт-Лаб-Видеодот» с автоматической геометрической фик¬
сацией зон интереса, соответствующих матрице точек, формируемой с помо¬
щью системы позиционирования. Применяется система расчета интенсивности
отраженного света от точек объекта для каждой зоны. Принцип «многозонного
анализа» позволяет одновременно регистрировать результаты определений в
каждой отдельной зоне независимо. Принцип организации основного окна ПО
«Эксперт-Лаб-Видеодот» показан на рис. 3-13 (см. цв. вклейку) на примере опре¬
деления глюкозы. Калибровочная кривая отражает обратно пропорциональную
зависимость средней интенсивности отраженного света для анализируемой зоны
интереса и концентрации аналита. Концентрации глюкозы, рассчитанные по
калибровочной кривой, представлены в таблице результатов.Интерфейс предполагает заполнение протокола для каждой серии исследова¬
ний и каждого отдельного теста: задается расположение исследуемых образцов,
контролей и калибраторов. На экране отображаются данные автоматической
интерпретации результатов по заданному референсному интервалу.Другой вариант применения системы позиционирования-смешивания — про¬
ведение реакций со смешиванием нескольких реагентов в геометрически фикси¬
рованных точках на поверхности носителя. Этот вариант позволяет разработать
новые модификации методов для обнаружения аналитов с помощью реакции
латексной агглютинации или для изосерологических исследований.В ходе реакции из микропланшета аппликатором переносят капли реагента на
носитель, с помощью позиционера фиксируя их положение. Такую же операцию
проводят и с каплями образца. В результате каждая капля образца смешивается
102 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯС каплей реагента, уже находящейся на носителе. Реакция проводится во всех 30
аналитических зонах одновременно, причем объем реакционной смеси не превы¬
шает 1 мкл.Система позиционирования-смешивания позволяет варьировать объемы нано¬
симых капель за счет использования аппликаторов с разными размерами пинов и
изменять соотношения и количество реагентов, что открывает новые перспективы
применения этого варианта микроматричного анализа в мультиплексном режиме
для различных методов биохимии и иммунологии.Примером варианта применения системы позиционирования-смешивания со
смешиванием реагентов является проведение реакции латексной агглютинации
для серийного определения С-реактивного белка в сыворотке крови. В соответ¬
ствующие микропланшеты вносят по 10 мкл сыворотки и латексной суспензии.
Затем аппликаторами последовательно переносят капли образцов и реагента на
носитель, перемешивают и фиксируют результаты реакции с помощью анализато¬
ра. Результаты реакции учитывают с помощью ПО «Эксперт-Лаб-Агглютинация-
Микро». Принципы построения пользовательского интерфейса и основного окна
аналогичны описанным выше для программы «Эксперт-Лаб-Агглютинация».Изучение аналитических характеристик миниатюризированных систем, осно¬
ванных на применении мультиаппликаторов в различных исследованиях методом
ЛА, показало, что они полностью соответствуют параметрам макрометодов, сохра¬
няя все преимущества, которые дает ВЦР.ПЕРСПЕКТИВЫ РАЗВИТИЯ СИСТЕМ ВЦР ДЛЯ КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ
ИССЛЕДОВАНИЙВидеоцифровая регистрация благодаря гибкости подходов при разработке
регистрирующих систем, единым принципам построения программного обеспе¬
чения для объектов различных форматов позволяет решать практически любые
задачи лабораторной диагностики. Для сканерных систем дальнейшее развитие
состоит в увеличении разнообразия проводимых исследований в 96-луночных
планшетах. Это иммунотурбидиметрические и биохимические исследования с
вертикальной фотометрией, микробиологические тесты. Также будут развиваться
уже используемые варианты цифровой регистрации разнообразных исследований
на тест-полосках в формате иммуноблота: например, Вестерн-блот или Лайн-блот
(с нанесением реагентов в виде полос).Системы с видеокамерами развиваются в направлении миниатюризации реги¬
стрирующих устройств с разработкой мобильных и даже так называемых карман¬
ных форматов с использованием иммунохроматографических тестов для прове¬
дения анализов «в месте оказания врачебной помощи» или домашних условиях.
В этой сфере развивается тенденция к использованию встроенных в мобильные
телефоны видеокамер. Для таких внелабораторных систем особую важность при¬
обретают сохранение первичной информации (ПДТ) — изображения аналитиче¬
ского объекта и возможность дистанционного консультирования, так как иссле¬
дования будут проводить люди, не обладающие профессиональными навыками
лабораторных работников.Развитие подходов ВЦР гармонично вписывается в концепцию бурно разви¬
вающейся телемедицины. Это связано с тем, что аналитическая информация при
использовании ВЦР уже имеется в компьютерном виде и легко может передаваться
по современным коммуникационным системам - через Интернет или с помощью
мобильной телефонии. С использованием подобного алгоритма могут быть органи¬
зованы профильные лабораторные сети с вертикально интефированной системой
контроля качества. И в этом случае очевидна важность передачи и сохранения ПДТ.Кроме того, возможность передачи первичного изображения аналитического
объекта позволяет перейти на следующую ступень, обеспечиваемую развитием
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 1Q3информационных технологий, — дистанционную обработку изображений. При
этом подходе на месте проведения исследования (в полевых условиях, возле посте¬
ли больного) получается только изображение аналитического объекта, которое
передается на сервер, где происходит его обработка и получается результат, кото¬
рый, в свою очередь, передается обратно, к месту проведения исследования. В этом
случае может быть обеспечена передача информации и консультативной помощи
из единого центра. Применение современной аналитической технологии — видео-
цифровой регистрации — предоставляет специалистам новые возможности совер¬
шенствования качества лабораторного обследования,ПРОТОЧНАЯ ЦИТОМЕТРИЯ
Возможности проточной цитометрииПроточная цитометрия — высокотехнологичный метод быстрого измерения
характеристик клеток. Проточная цитометрия основывается на арсенале флюо¬
ресцентных методов анализа структурных компонентов клеток, их антигенов и
внутриклеточных процессов. Этим методом исследуются выборки от нескольких
тысяч до нескольких миллионов клеток, что гарантирует статистическую досто¬
верность результатов. В свою очередь, от классической биохимии и молекулярной
биологии цитометрию отличает возможность анализировать не усредненные
молекулярные характеристики по всей популяции, а индивидуальные параметры
для каждой клетки. Созданная для ускорения анализа в клинической цитологии
и цитодиагностике, эта технология постепенно развилась в эффективный под¬
ход к решению многих важных задач биологии клетки, иммзшологии, клеточной
инженерии и т.д. в клинической практике наиболее часто проточную цитометрию
используют для исследования клеток крови и костного мозга, их антигенного
состава, функциональной активности, количества ДНК и РНК, определения уров¬
ня продукции цитокинов.Существуют два направления: проточная цитометрия и проточная цитометрия-
сортировка. Первое представляет аналитический подход, второе позволяет ото¬
брать интересующие исследователя субпопуляции клеток, основываясь на анали¬
тических возможностях первого, и в дальнейшем проводить работу с отобранными
субпопуляциями. Б последнее время позиции проточных цитометров как сорти¬
ровщиков поколебались за счет появления магнитной сепарации, но целый ряд
научных исследований невозможен без их использования. К таким исследованиям
можно отнести сортировку индивидуальных хромосом, получение тетраном и др.Две существенные особенности проточной цитометрии делают этот метод осо¬
бенно ценным для клинической практики. Во-первых, этот метод позволяет охарак¬
теризовать гетерогенные клеточные популяции по фенотипу, а при использовании
ДНК-цитометрии — и по генотипу входящих в них клеток. Анализы такого рода слу¬
жат для выявления отклонений, происходящих в процессе онкогенеза. Большинство
современных применений цитометрии связано с анализами именно такого рода.
Во-вторых, это возможность обнаружить и охарактеризовать редкие события, т.е.
встречающиеся с частотой 10 что стало возможным благодаря огромнойпроизводительности. Современные цитометры могут регистрировать несколько
параметров для каждой отдельной клетки со скоростью до 10 тыс. клеток в секунду.области применения проточной цитометрии сегодня весьма разнообразны.
Первоначально интенсивно развивались способы количественного анализа вну¬
триклеточных компонентов, таких как ДНК и РНК. Работа в данном направлении
привела к созданию методов анализа параметров клеточного цикла. В свою оче¬
редь, это послужило фундаментом для разработки методик анализа делящихся
клеток и клеток с аномальным содержанием ДНК. Информация, извлекаемая из
104ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯсигналов светорассеяния и измерения времени пролета клеток через зону ана¬
лиза, позволила судить о морфологических характеристиках клеток (размере,
соотношении размеров ядра и цитоплазмы, гранулярности цитоплазмы, степени
асимметрии клеток).Развитие гибридомной технологии привело к тому, что появился такой инстру¬
мент, как моноклональные антитела (МА). МА предоставили возможность типи-
ровать клетки не только по морфологическим различиям, но и за счет набора
поверхностных антигенов и рецепторов, характерных для строго определенных
клеток и их функционального состояния, в различных лабораториях мира были
получены МА к одним и тем же антигенам, авторы присвоили им свои собственные
названия. Это привело к тому, что возникла путаница, исследователи говорили об
одних и тех же антигенах клеточной поверхности, но называли их по-разному.
Во избежание этого в начале 1980-х гг. было созвано Междзгнародное рабочее
совещание по антигенам лейкоцитов человека и предложено объединить МА в
группы, или кластеры, исходя из того, какую антигенную структуру на клеточной
поверхности они распознают. Таким образом, первоначальный смысл понятия
«кластер дифференцировкиї^ {Cluster of Differentiation — CD) — это набор моно¬
клональных антител, которые распознают одну и ту же структуру на клеточной
поверхности независимо от эпитопной специфичности. Со временем это понятие
видоизменилось, и многие исследователи понимают под CD саму структуру на
клеточной поверхности. Исходя из изложенного выше становится понятно, что
для эффективного использования МА должны быть кластеризованы, т.е. внесены
в реестр известных МА и отнесены к определенному кластеру дифференцировки.
Для этого каждые МА должны пройти проверку в нескольких независимых лабо¬
раториях, где должно быть показано, что они взаимодействуют с определенными
клетками и распознают определенную структуру на их поверхности. В настоящее
время известно более 350 основных кластеров дифференцировки клеток челове¬
ка. Использование МА изменило подходы к иммунофенотипированию клеток.
Меченные флюорохромами МА позволяют проводить как качественный, так и
количественный анализ поверхностных и внутриклеточных антигенов.Как отдельное направление развивается исследование активности внутрикле¬
точных ферментов. Это направление получило название «проточная цитоэнзимо-
логия». Разработан ряд реагентов, представляющих собой синтетические субстра¬
ты для измерения активности внутриклеточных ферментов. Новые флюорогенные
субстраты позволяют оценить активность большего количества ферментов по
сравнению с доступными ранее субстратами. Преимушество данного подхода в
том, что при сопоставлении уровня активности ферментов нормальных клеток с
уровнем активности клеток, вовлеченных в патологический процесс, могут быть
обнаружены различия, позволяющие идентифицировать поврежденные клетки и
исследовать процессы, протекающие в них.Сочетание различных флюорохромов сделало возможным количественное и
качественное исследование таких физиологических внутриклеточных параметров,
как pH (флюоресцеин и 7-гидроксикумарин), концентрация свободных ионов
кальция (Fura-2, Indo-1, Fluo-3), уровень окислительных процессов, активация
митохондрий, потенциал наружной мембраны клеток, процессы, связанные с
апоптозом, и т.д. Достижения в различных областях молекулярной биологии, био¬
химии и медицины позволяют изучать с помощью проточной цитометрии содер¬
жание секретируемых цитокинов в сыворотке крови с помощью мультиплексного
анализа, локализацию антигенспецифичных клонов клеток с помощью тетрамер.
Существуют методы, позволяющие с помощью проточной цитометрии измерять
функциональные показатели, такие как фагоцитарная активность, апоптоз, экс¬
прессия цитокинов и др. Все это создает предпосылки для современных исследова¬
ний всего комплекса внутриклеточных процессов на уровне отдельных клеток.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 1Q5Современные проточные цитометры обладают высокой чувствительностью и
высоким уровнем автоматизации, простотой эксплуатации и имеют небольшие
размеры — все это позволяет рассматривать их не только как исследовательские,
но и как клинико-диагностические инструменты.Основы проточной цитофлюориметриив основе проточной цитофлюориметрии лежат фотометрические и флюорес¬
центные измерения отдельных клеток, пересекающих одна за другой вместе с
потоком жидкости лазерный луч монохроматического света (рис. 3-14).Методом проточной цитометрии можно измерять следующие параметры.• Рассеяние света под малыми углами (1-19°). Этот параметр используют для
определения размеров клеток.• Рассеяние света под углом 90°. Использование этого параметра позволяет
судить о соотношении размеров ядра и цитоплазмы, а также о неоднород¬
ности или гранулярности цитоплазмы.• С помощью флюоресцентных каналов изучают клеточные маркеры, для чего
используют моноклональные антитела (МА) к мембранным и внутриклеточ¬
ным компонентам клеток, меченные различными флюорохромными краси¬
телями.• Интенсивность флюоресценции изучаемого объекта может служить количе¬
ственным критерием, характеризующим экспрессию антигенов (плотность
рецепторов) на клетках.• Проточные цитофлюориметры оборудованы несколькими фотоэлектрон¬
ными умножителями (ФЭУ), что позволяет одновременно регистрировать
несколько типов флюоресценции.• Существует возможность измерять поляризацию флюоресценции и время
прохождения частицы через зону анализа. Первое позволяет исследователюшСуспензия клетокОбжимающая жидкостьДетекторСфокусированные
«струя в струе» клеткиРис. 3-14. При пересечении лазера потоком клеток регистрируются прямое, боковое светорассея¬
ние и спектр эмиссии, испускаемый флюоресцентным красителем.
lAVC-' ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯсудить о степени вязкости мембран клеток, которая меняется в зависимости
/УУ W от их функционального состояния, а второе — о степени асимметричностиклеток или исследуемых органелл.Фотометрические каналы используются для оценки размеров клетки и внутри¬
клеточных структур. Частицы, отличающиеся по размеру, по-разному рассеивают
свет, при этом характер рассеивания зависит от соотношения длины волны света
и диаметра частиц. В том случае, когда длина волны облучения сопоставима с раз¬
мерами частиц, характер рассеивания меняется, световая волна огибает частицу,
взаимодействует с ней и отклоняется от прямолинейного распространения на
небольшой угол — малоугловое (1-19°) или прямое (FS или FSC) светорассея¬
ние (рис. 3-15, см. цв. вклейку). Такой тип рассеяния при взаимодействии света с
поверхностью клеток позволяет оценить их размер.Если размер частиц меньше длины волны облучающего монохроматического
света лазера (например, внутриклеточные структуры), существенное количество
света рассеивается под углом 90" (боковое светорассеяние, SS или SSC) (рис. 3-16,
см. цв. вклейку).При одновременной регистрации бокового и прямого светорассеяния можно
выделить все клеточные популяции лейкоцитов, в этом случае удается определить
физические свойства каждой неокрашенной клетки (размер и сложность структу¬
ры), таким образом разделить анализируемую клеточную популяцию на отдель¬
ные субпопуляцииОсновной формой отображения результатов в процессе накопления данных
являются двухпараметрические гистограммы распределения. Чаще всего именно
на гистограммах отмечается гейт (от англ. gate — ворота). Гейт — это логическое
ограничение, используемое для селекции событий при анализе по нескольким
скоррелированным параметрам. Параметры клеток, попавших внутрь отмеченно¬
го гейта, будут отображаться на других гистограммах и цитограммах, а данные о
клетках, не попавших в гейт, будут проигнорированы.Флюоресцентные каналы применяют для изучения клеточных маркеров, для
чего используют моноклональные антитела (МА), меченные различными флю-
орохромными красителями к мембранным и внутриклеточным компонентам
клеток. После окрашивания клеток МА происходят специфическое связывание
последних с клеточными структурами и регистрация флюоресценции, индуци¬
рованной излучением лазера. Техника регистрации состоит в следующем. При
облучении меченых клеток лазером с длиной волны, возбуждающей флюоро¬
хром, происходит поглощение света. Затем флюорохром испускает свет, но уже
меньшей интенсивности (большей длины волны), чем поглощенный. Кроме того,
флюорохром испускает свет во все стороны, поэтому флюоресценцию можно
регистрировать под любым углом по отношению к облучаемому свету. Как пра¬
вило, регистрацию проводят под прямым углом, однако для монохроматического
лазерного облучения это не является обязательным условием, так как испускае¬
мый флюоресцентный сигнал всегда имеет большую длину волны, чем возбуж¬
дающий свет лазерного облучения. В проточной цитофлюориметрии применяют
множество флюоресцентных красителей. Моноклональные антитела, меченные
различными флюорохромами, различаются как по специфичности их молеку¬
лярного связывания, так и по оптическим характеристикам: по спектрам погло¬
щения и соответственно возбуждения флюоресценции, величинам молекулярных
коэффициентов экстинкции, спектрам и квантовым выходам флюоресценции,
в зависимости от того, какими лазерами укомплектован прибор, подбирают флю¬
оресцентные красители (табл. 3-1).Количественный анализ интенсивности иммунофлюоресценции служит для
точного подсчета количества определенньЕх молекул внутри клетки или на ее
поверхности. Разработана группа методов, основанных на детекции исследуемых
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 1Q7Таблица 3-1. Флюорохромы, наиболее часто используемые для прямой конъюгации с монокло¬
нальными антителамиФлюорохромДлина волны возбуждения, нмЭмиссия, нмФлюоресцеинизотиоцианат (RTC)488525Алекса Флюор 488 (Alexa Fluor 488)488525Фикоэритрин (РЕ, R-PE, RD1)488575ECD (PE-Texas Red)488610РС5 (PE/CY5)488675РС5.5 (PE/CY5.5)488700РЕ Alexa Fluor 700488725РС7 {PE/CY7)488790Алофикоцианин (АРС)633/635680Alexa Fluor 647633/635680Alexa Fluor 700633/635725APC Alexa Fluor 700633/635725APC7 (APC/CY7)633/635790молекул с помощью меченых моноклональных антител. Количественный анализ
некоторых маркеров раскрывает полезную клиническую информацию. Например,
опухолевые клетки, относящиеся к предшественникам В-лимфоцитов, можно
дифференцировать от нормальных предшественников и зрелых В-лимфоцитов по
высокой плотности экспрессии CD 10 или CD38 соответственно и низкой экспрес¬
сии CD24 и CD45; высокая экспрессия CD10 клетками острого В-клеточного лим¬
фобластного лейкоза является полезным признаком для выявления минимальной
остаточной болезни. Количественный анализ флюоресценции — косвенная мера
определения количества антигенных структур, способных связаться с определен¬
ным меченым антителом. Калибровка интенсивности флюоресценции связывает
интенсивность сигнала флюоресценции с количеством меченых моноклональных
антител, присоединившихся к клетке.Учитывая, что интенсивность флюоресценции от каждой конкретной клетки
зависит от количества меченых моноклональных антител, связавшихся со специ¬
фическими антигенами на поверхности лимфоцитов, средняя интенсивность флю¬
оресценции популяции клеток (MFI — Mean Fluorescence Intensity) может служить
количественным критерием, характеризующим экспрессию антигенов (плотность
рецепторов) на клетках.С помощью современных проточных цитофлюориметров можно одновременно
измерить спектр эмиссии до десяти различных флюорохромов. Результаты изме¬
рений по каналам флюоресценции, как правило, отображаются в виде двухпара¬
метрических гистограмм. При анализе двухпараметрического графика по каналам
флюоресценции оценивают процент клеток, несущих тот или иной маркер, одно¬
временную экспрессию на клетках двух и более различных антигенов, а также по
федней интенсивности флюоресценции меченых антител, соединенных с клеткой,
можно судить о плотности экспрессии клеточных антигенов (рис, 3-17).Аналитические характеристики проточной цитофлюориметрииМатериалом для анализа методом проточной цитофлюориметрии могут слу¬
жить любые микрочастицы, находящиеся в суспензии. Наиболее часто объектом
исследования являются клетки крови и костного мозга. Также могут быть изучены
клетки выпотных жидкостей, бронхоальвеолярного смыва, ликвора, гомогенизи¬
рованные образцы тканей, клеточная суспензия, полученная при аспирационной
108 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯШ10^
CD43FHCTqiQ2■:*-гт1тпго10’FITC10^Рис. 3-17. Периферическая кровь больного хроническим лимфолейкозом. Слева точечный гра¬
фик, отражающий события в лимфоцитарном гейте, характеризующий экспрессию В-клеточного
антигена CD20, меченного фикоэритрином (РЕ), и CD43, меченного флюоресцеинизотиоциона-
том (FITC). В верхнем левом квадранте отображены клетки, которые несут только РЕ, меченные
CD20, — это нормальные В-лимфоциты, их 4,84%. В правом нижнем квадранте — клетки,
экспрессирующие только CD43, — это Т-лимфоциты, их 12,46%. В правом верхнем квадранте
находятся события, позитивные по РЕ и FITC, — это клетки, ко-экспрессирующие CD20 и CD43
(опухолевые клетки В-клеточного хронического лимфолейкоза), их 82,36%. Следует Обратить
внимание, что средняя интенсивность флюоресценции CD20 РЕ опухолевой популяции значи¬
тельно ниже, чем популяции нормальных В-лимфоцитов, что также характерно для В-клеточного
хронического лимфолейкоза.тонкоигольной пункции лимфатических узлов и селезенки, а также хромосомы и
бактерии. Возможно исследование цитокинов в сыворотке крови и тканях.Предпочтительнее для исследования клеток крови и костного мозга использо¬
вать пробирки с калиевыми солями ЭДТА либо, при необходимости исследования
функциональной активности клеток, гепарин. Существенным этапом подготовки
проб для анализа является выделение из образца только тех клеток, которые
интересуют исследователя. Первое, что может помешать анализу чистой лейкоци¬
тарной популяции, — это эритроциты. С помощью лизирующих растворов либо
выделения лейкоцитарной фракции на градиенте плотности происходит удаление
эритроцитов из образца, и для анализа становятся доступны только ядросодер¬
жащие клетки крови или костного мозга. При исследовании костного мозга и
гомогенизатов тканей важно, чтобы анализу не мешали конгломераты клеток
соединительной ткани, — для этого используют специальные фильтры. При имму-
нофенотипировании клеток костного мозга и периферической крови у больных с
парапротеинемиями важно снизить неспецифическое связывание меченых анти¬
тел белками плазмы крови, — для этого используют дополнительное отмывание
клеток фосфатно-солевым буфером.Метод проточной цитофлюориметрии позволяет одновременно оценивать до
миллиона клеток. Позитивной считается область, насчитывающая не менее 50
событий. Таким образом, чувствительность метода проточной цитофлюориме¬
трии — 1 на 20 ООО клеток. Метод многоцветовой проточной цитометрии позволя¬
ет детектировать до 18 параметров клетки одновременно со скоростью до 10 ООО
тысяч клеток в секунду. Современные цитометры, как правило, оборудованы
тремя и более ФЭУ (от 3 до 10), что позволяет в одном образце периферической
крови проанализировать экспрессию основных маркеров практически всех клеток
крови и костного мозга. Чем большее количество меченых моноклональных анти¬
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ ‘ЮЭтел, связавшихся с клеткой, можно проанализировать в одном образце, тем выше
специфичность метода. Все это привело к формированию многопараметрического
анализа в цитометрии.Преимущества проточной цитофлюориметрииОсновным преимуществом проточной цитометрии перед морфологическими
методами исследования является возможность оценки большого количества кле¬
ток за короткий промежуток времени. Кроме того, проточная цитофлюориметрии
дает возможность выявлять иммунофенотип различных субпопуляций, лимфоци¬
тов, линейную принадлежность бластов, прогностические маркеры, определять
аберрантный фенотип опухолевых клеток, чего невозможно добиться при класси¬
ческом морфологическом исследовании клеток.По сравнению с иммуноцитохимическими и иммуногистохимическими иссле¬
дованиями проточная цитофлюориметрия является менее трудоемким, более
информативным методом, также преимуществом является быстрота исполнения
(1-3 ч). Кроме того, проточная цитометрия существенно экономичнее иммуноги¬
стохимии и иммуноцитохимии.в сравнении с молекулярными методами диагностики преимущества проточной
цитометрии — скорость исследования и экономичность. Также при определении
минимальной остаточной болезни проточная цитометрия дает возможность
детектировать только жизнеспособные клетки и исключать из зоны анализа мерт¬
вые клетки, в то время как методы молекулярной диагностики применительно к
диагностике минимальной остаточной болезни основаны на выявлении ДНК неза¬
висимо от того, принадлежит она погибшим или еще жизнеспособным клеткам.Ограничения проточной цитометрииИммунофенотипирование методом проточной цитометрии позволяет охаракте¬
ризовать клетки с помощью МА или каких-либо других флюоресцентных зондов
и дает возможность судить об их типе и функциональном состоянии по наличию
набора клеточных маркеров и происходящих в них процессах. Однако многие
маркеры могут экспрессироваться на различных типах клеток, и определять их
наличие следует в режиме не менее чем двухцветного анализа.Важной проблемой является отсутствие стандартных диагностических пане¬
лей, поэтому не всегда при постановке первичного диагноза в одной лаборатории
оценку минимальной остаточной болезни при гемобластозах можно провести в
другой.проточная цитометрия уступает в чувствительности и специфичности
молекулярно-генетическим методам исследования в дифференциальной диагно¬
стике Т-клеточных опухолевых заболеваний и при оценке минимальной остаточ¬
ной болезни при острых лейкозах миелоидной направленности и Т-клеточной
линейности.Для оценки плотности рецепторов существуют коммерческие наборы для кали¬
бровки приборов, однако они дают возможность оценить только один флюоро¬
хром и очень дорого стоят. При этом оценка плотности экспрессии отдельных
антигенов повышает информативность метода проточной цитофлюориметрии
в диагностике и дифференциальной диагностике гемобластозов. Интенсивность
флюоресценции от каждой конкретной клетки зависит от количества меченых
моноклональных антител, связавшихся со специфическими клеточными антиге¬
нами, следовательно, средняя интенсивность флюоресценции популяции клеток
(MFI) может служить количественным критерием, характеризующим плотность
клеточных рецепторов. Однако средняя интенсивность флюоресценции, детек-
110 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯV. тируемая прибором, зависит не только от количества меченых моноклональныхантител, присоединившихся к клетке, но и от собственной интенсивности све-
чения флюорохромов, интенсивности лазеров и чувствительности детекторов.
Следовательно, оценку плотности рецепторов по MFI можно использовать лишь
как сравнительный метод, применяемый только на одном приборе в условиях
конкретной лаборатории.в клинической практике проточную цитофлюориметрию применяют:; • для оценки параметров клеточного иммунитета;■ • исследования функциональных особенностей клеток иммунной системы;• оценки абсолютного количества CD4^ Т-лимфоцитов в стадировании течения
ВИЧ-инфекции;• диагностики острых лейкозов и лимфопролиферативных заболеваний,
пароксизмальной ночной гемоглобинурии;• оценки минимальной остаточной болезни;• подсчета гемопоэтических и мезенхимальных стволовых клеток;• определения клеточного состава выпотных жидкостей и ликвора;• мониторинга септического состояния;• диагностики таких генетических патологий, как синдром Вискотта-Ол-
дрича;• подсчета ретикулоцитов и тромбоцитов (референтный метод);• оценки функциональной активности тромбоцитов.Оценка клеточного звена иммунитетаУспехи фундаментальной иммунологии, основанные на достижениях моле¬
кулярной биологии и генной инженерии, позволили уточнить иммунопатогенез
аллергических, аутоиммунных, онкологических и инфекционных заболеваний.
В то же время возросшие возможности проточной цитометрии расширили пред¬
ставления о необходимом перечне популяций лимфоцитов, исследование которых
целесообразно при оценке клеточного звена иммунитета.Процесс развития иммунного ответа организма на проникновение инфекции
или какие-либо другие воздействия сопровождается значительными изменениями
субпопуляционного состава иммунокомпетентных клеток. Это относится как к
изменению абсолютного количества иммунокомпетентных клеток, их субпопуля¬
ций, так и к появлению на клеточной поверхности определенных функциональных
молекул. Под воздействием различных агентов клетки приспосабливаются и отве¬
чают на это изменением экспрессии тех или иных мембранных и внутриклеточных
маркеров. Таким образом, одним из эффективных механизмов иммунорегуляции
является модуляция экспрессии функционально значимых молекул. Не менее важ¬
ным является и изменение абсолютного количества иммунокомпетентных клеток
в периферической крови.Определение субпопуляционного состава, или фенотипа, лимфоцитов как одной
из основных популяций иммунокомпетентных клеток в настоящее время является
важным диагностическим признаком, позволяющим судить о течении процессов,
происходящих в организме. Под фенотипом следует понимать совокупность функ¬
ционально значимых маркеров, характерных для определенных стадий диффе-
ренцировки, пролиферации, активации или программируемой клеточной гибели
(апоптоза). Абсолютное и относительное количество клеток, имеющих тот или
иной фенотип, является конечным результатом иммунофенотипирования.Разработка современных цитометров, успехи в химии флюоресцентных кра¬
сителей, открытие новых CD-маркеров, усовершенствование программного обе¬
спечения позволили проводить анализ фенотипа иммунокомпетентных клеток как
рутинную процедуру и получать наиболее полную и достоверную информацию.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 111Это позволяет локализовать и отследить процессы, протекающие в организме,
изучить их, а значит, адекватно на них реагировать. Как следствие, разрабатыва¬
ются новые подходы к коррекции активности патологически измененных клеток
и процессов, которые они определяют.в течение последних 20 лет в практике КДЛ определение показателей, отра¬
жающих количественное содержание пяти основных популяций лимфоцитов Б
периферической крови (Т-клеток, Т-хелперов, цитотоксических Т-лимфоцитов,
В-клеток и NK-клеток), проявило недостаточную их информативность. С другой
стороны, интенсивное изучение патогенеза различных заболеваний выявило клю¬
чевую роль активированных лимфоцитов, регуляторных Т-клеток, субпопуляций
В- и NK-клеток. Б связи с этим для оценки иммунного статуса при иммунофеноти-
пировании лимфоцитов наряду с основными пятью популяциями целесообразно
расширить анализ за счет малых субпопуляций лимфоцитов и пулов активиро¬
ванных клеток. Технические и методические возможности для этого у практиче¬
ских лабораторий появились. Так, если ранее для определения цитотоксических
Т-лимфоцитов считалось достаточным использовать только один маркер — CD8,
согласно современным представлениям необходимо одновременное исследование
четырех маркеров — CD8, CD4, CD3 и CD45. Реализация такого подхода возможна
только при использовании многоцветового цитометрического анализа. Однако
появление новых лабораторных показателей, их внедрение в рутинную практику
требует стандартизации протокола определения показателей и значений нормы.В-ЛИМФОЦИТЫ и их СУБПОПУЛЯЦИИПопуляцией лимфоцитов, отвечающей за продукцию антител, являются
В-клетки. Каждый лимфоцит, относящийся к В-клеткам, запрограммирован на
продукцию антител одной-единственной специфичности, и эти антитела присут¬
ствуют на его поверхности в качестве рецептора для соответствующего антигена.
Один В-лимфоцит несет на своей поверхности примерно 10^ идентичных молекул
антител. Данные антитела называют поверхностными, или мембранными, имму¬
ноглобулинами.Основной формой мембранных иммуноглобулинов являются иммуноглобули¬
ны класса М (IgM). Они экспрессируются на мембране всех зрелых В-лимфоцитов,
которые не имели контакта с антигеном. Однако на поверхности Б-клеток, диффе-
ренцировка которых уже завершилась, присутствуют и иммуноглобулины класса
D (IgD). В процессе формирования иммунного ответа происходит переключение
изотипов мембранных иммуноглобулинов на IgG, IgA, IgE.Кроме мембранных иммуноглобулинов, В-лимфоциты экспрессируют целый
ряд мембранных маркеров, которые, во-первых, необходимы для формирования
В-клеточного рецептора и играют важную роль в передаче сигнала в процессе рас¬
познавания антигена, во-вторых, являются маркерами линейной принадлежности
В-клеток, что особенно полезно при идентификации данной популяции лимфоци¬
тов. К таким маркерам прежде всего относятся CD 19 и CD21. Данные молекулы
формируют ко-рецепторный комплекс, в который вовлечен также и CD81.СВ19-антиген, так же известный как В4, представляет собой мембранный
гликопротеин с молекулярной массой 95 кДа. GDI9 участвует в регулировании
развития В-лимфоцитов, активации и их дифференцировке. Эта молекула экспрес¬
сируется на всех нормальных В-клетках, включая про-В-лимфоциты, но исчезает у
плазматических клеток. Молекула CD19 отсутствует на мембране нормальных Т-,
NK-клеток, моноцитов и гранулоцитов. В связи с этим данный антиген рекоменду¬
ют для количественной оценки общей популяции В-клеток.CD21-антиген представляет собой трансмембранный гликопротеин с моле¬
кулярной массой 145 кДа. Он принадлежит к семейству белков, регулирующих
активность комплемента. CD21 (CR2) является рецептором для СЗсі-компонента
112 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯкомплемента и вируса Эпштейна-Барр. Данный антиген присутствует на зре¬
лых В-лимфоцитах и отсутствует на Т-лимфоцитах, гранулоцитах и моноцитах.
Молекула CD21 вовлечена в активацию и пролиферацию В-лимфоцита.Кроме перечисленных выше структур, к пан-В-клеточным антигенам относят
такие молекулы, как CD20 и CD22.СВ20-антиген (Вр35) является интегральным негликозилированным мембран¬
ным белком с четырьмя трансмембранными доменами. Существуют три изоформы
CD20 в зависимости от молекулярной массы (33, 35 и 37 к Да), которые являются
результатом дифференцированного фосфорилирования внутри цитоплазматиче¬
ских доменов. Данная молекула является Са'^'-каналом и участвует в активации и
пролиферации В-клеток за счет регуляции трансмембранной проводимости ионов
Са^^. Молекула CD20 присутствует на всех нормальных В-лимфоцитах перифери¬
ческой крови, лимфатических узлов, селезенки, миндалин и костного мозга, но
отсутствует на плазматических клетках. Хотя CD20 первоначально был описан как
В-клеточный линейный маркер, оказалось, что небольшая субпопуляция Т-клеток
человека экспрессирует CD20 в низкой плотности, причем В-клетки экспрессиро¬
вали CD20 в высокой плотности (CD20^’“sht), g т-клетки — в низкой (CD20'^™) и
составляли 2,4±1,5% лимфоцитов периферической крови. Хотя оценка экспрессии
CD20 полезна при характеристике В-клеток, необходимо достаточно осторожно
подходить к интерпретации получаемых результатов. Особенно это относится
к случаям иммунофенотипирования клеток костного мозга. Сходная проблема
может возникнуть при изучении клеток периферической крови у пациентов с
ревматоидным артритом. Молекула CD20 является мишенью для терапии неход-
жкинских В-клеточных лимфом.С022-антиген (BL-CAM) — трансмембранный гликопротеин, принадлежащий
к суперсемейству иммуноглобулинов. Данная молекула экспрессируется в виде
двух изоформ: а-формы (130 кДа) и р-формы (140 кДа). С022-антиген экспрес¬
сируется в цитоплазме В-клеточных предшественников и на поверхности зрелых
В-лимфоцитов. Экспрессия CD22 исчезает после активации В-клеток предше¬
ствующей стадии созревания плазматической клетки. Молекула CD22 отсутствует
на Т-лимфоцитах, гранулоцитах и моноцитах периферической крови.В настоящее время среди В-лимфоцитов выделяют три основные субпопуляции:
В-1, В-2 и В-клетки памяти. Достаточно важная роль при данном делении отво¬
дится молекуле CD5.Кроме роли, связанной с передачей сигналов при активации, молекула CD5
расценивается как возможный маркер В-лимфоцитов, позволяющий различать
их субпопуляции: CD5* В-клетки (В-1-клетки) и обычные CD5” В-клетки (В-2-
клетки). В-1-клетки вызывают значительный интерес вследствие ассоциации с
продукцией аутоантител, а также с аутоиммунной патологией. Значительная роль
В-1-клеток была отмечена при ревматоидном артрите, системной красной вол¬
чанке (СКВ) и синдроме Шегрена. Увеличение количества CD5"^ В-лимфоцитов
наблюдали у пациентов, страдающих миастенией, инсулинозависимым диабетом
и тиреоидитом Хашимото. В табл. 3-2 приведен список заболеваний, при которых
определение относетельного уровня В-1-лимфоцитов является диагностически
значимым (рис. 3-18).Следующей субпопуляцией В-лимфоцитов являются так называемые В-клетки
памяти. Идентификация CD27 как маркера В-клеток памяти позволила надежно
и эффективно идентифицировать в периферической крови нативные В-клетки
(IgM^CD27“) и В-клетки памяти (CD27"^).СВ27-антиген представляет собой трансмембранный гликопротеин в виде
гомодимера из двух мономеров с молекулярной массой 55 кДа, связанных дисуль-
фидными мостиками. CD27 принадлежит к семейству генов-рецепторов фактора
некроза опухоли. CD27 антиген найден на медуллярньге тимоцитах, перифериче-
10®^102^EUО.|A iO^-a10®-=ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ Ц ЗF271.9%3.5%16.8%7.8%A' • ‘ -•;тгігі*~"г» і.*іМі ""і“ T'l'iuiH—I I і ill
1flO ibi lb2 10='CD19-FITCaCDie^^lTC6Рис, 3-18. Гистограмма распределения CD5 и CD19 на лимфоцитах периферической крови.
Субпопуляции В-1-лимфоцитов у пациента с аутоиммунным тиреоидитом: а — до лечения; б — в
процессе лечения.Таблица 3-2. Заболевания, при которых определение относительного уровня В-1-лимфоцитов
является диагностически значимымЗаболеваниеПовышение относительного уровня
В-1-лимфоціт>в1. Системная красная волчанка2. Синдром Шегрена3. Ревматоидный артрит4. Инсулинозависимый диабет5. Аутоиммунный тиреоидит6. Миастения7. Неспецифический язвенный колит8. Аутоиммунные поражения при инфекционных заболеваниях (хла-
мидиозе, синдроме Рейтера, бруцеллезе и др.)9. Другие заболевания, имеющие в своей основе аутоиммунные
механизмыских Т-лимфоцитах, активированных В-лимфоцитах и NK-клетках. Его лигандом
является молекула CD70. Взаимодействие CD27 с его лигандом CD70 на Т-клетках
является одним из условий дифференцировки В-клеток в плазматические клетки.
Отсутствие IgD‘CD27^ В-клеток памяти в значительной степени объясняет нару¬
шение продукции иммуноглобулинов, несмотря на функциональную передачу
сигналов молекулой CD40 у пациентов с Х-связанным rnnep-IgM-cnHflpoMOM.Гуморальный иммунный ответ играет важную, а порой и критическую роль
в устранении внутри- и внеклеточных патогенов. Этот процесс осуществляется
за счет дифференцировки зрелых В-клеток в плазматические клетки, которые
секретируют большие количества иммуноглобулинов. Однако большинство анти¬
генов вызывают иммунную реакцию лишь при наличии и участии Т-лимфоцитов.
Это относится к белковым и клеточным антигенам, а также к вирусам, которые
объединяют в понятие «Т-зависимые антигены». Лишь небольшое количество
антигенов способно вызывать иммунный ответ без участия Т-клеток. Некоторые
бактериальные липополисахариды при достаточно высокой концентрации способ¬
ны к поликлональной активации значительной части популяции В-лимфоцитов,
т.е. для такой стимуляции антигенная специфичность роли не играет. Линейные
114 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ- антигены, медленно распадающиеся в организме и имеющие организованнуюопределенным образом и часто повторяющуюся детерминанту (полисахарид пнев-мококков, полимеры D-аминокислот, поливинилпироллидон), также способны
непосредственно стимулировать В-лимфоциты. Индуцируемый Т-независимыми
антигенами иммунный ответ практически не сопровождается формированием кле¬
ток памяти. При иммунном ответе на Т-независимые антигены вырабатываются
IgM и эффективность Т-независимого ответа во много раз ниже. В свою очередь,
Т-зависимые антигены при отсутствии Т-клеток лишены иммуногенности. При
ответе на эти антигены требуется подключение Т-лимфоцитов. Т-зависимые анти¬
гены обеспечивают и определяют кооперативное взаимодействие В- и Т-клеток, в
результате чего происходит переключение синтеза с IgM на IgG.Выделяют два пути образования различных фракций антител; Т-зависимый
путь в герминальных центрах и Т-независимый путь вне герминальных центров.
Точная функция второго пути и генерирование IgM'CD27^ В-клеток в настоящее
время окончательно не выяснены. Однако IgM"CD27' В-клеток играют важную
роль в гуморальном ответе против Т-независимых патогенов, например инкапсу¬
лированные бактерии.Активация зрелых В-клеток с Т-зависимым антигеном приводит к образо¬
ванию плазматических клеток двумя независимыми путями дифференцировки.
Активированные В-клетки могут войти в экстрафолликулярные пролиферативные
центры, где они быстро дифференцируются в короткоживущие плазматические
клетки, секретирующие IgM. с другой стороны, активированные В-клетки могут
попасть в герминальный центр, где происходят различные молекулярные пере¬
стройки: соматические гипермутации, переключение изотипов иммуноглобулинов
и отбор высокоаффинных вариантов. Антигенселективные В-клетки герминаль¬
ного центра являются предшественниками двух типов клеток: высокоаффинных
В-клеток памяти и долгоживущих плазматических клеток, которые отвечают за
долгосрочную гуморальную устойчивость.Помимо перечисленных молекул рецепторного и ко-рецепторного комплекса,
на поверхности В-клеток экспрессируются антигены главного комплекса тканевой
совместимости класса II (HLA-DR). Эти молекулы принимают участие в представ¬
лении антигенов, а В-клетки являются антигенпредставляющими клетками. Однако
HLA-DR-антигены также представлены на активированных Т- и NK-клетках, что
объясняется несовпадением относительного количества CD3“CD19+ В-клетки и
СОЗ'НЬА-ОК'^-клетки при некоторых патологиях.Оценка относительного количества В-клеток является одним из важных диа¬
гностических признаков. При воспалительных заболеваниях наблюдается значи¬
тельное снижение количества В-клеток. Особенно ярко это выражено при остром
панкреатите, хроническом пародонтите и тонзиллите, гнойном осложнении травм.
Противоположный эффект наблюдается при острых и хронических формах гепа¬
титов В и С.Развитие и протекание иммунологических процессов в популяции В-клеток
сопровождается количественными и качественньїми процессами. Активация
В-клеток сопровождается изменением экспрессии антигенов CD80 и CD86.CDSO-антиген (В7, ВВІ) является высокогликозилированным одноцепочечным
белком, его внеклеточная область состоит из двух иммуноглобулиноподобных
доменов. Эта молекула имеет молекулярную массу 60 кДа, и лигандами для нее
служат две стрзт(турно-подобные молекулы, экспрессируемые на Т-лимфоцитах,
а именно CD28 и CD 152 (CTLA-4). При активации В-лимфоцитов in vitro антиген
CD80 экспрессируется после 24-часовой стимуляции и достигает максимального
уровня к 48-72 ч. Данный антиген не экспрессируется на большинстве покоящих¬
ся В-клеток периферической крови, но определяется на отдельных субпопуляци¬
ях активированных В-клеток. Антиген CD80 также экспрессируется на HTLV-1
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 115трансформированных Т-клетках и активированных моноцитах. Контакт CD80 с
лигандами обеспечивает проведение ко-стимуляторных сигналов при активации
Т-клеток.С086-антиген (В7-2, В70) — также трансмембранный одноцепочечный глико¬
протеин, по своей структуре подобный CD80. Его молекулярная масса составляет
80 кДа. Внеклеточная область состоит из иммуноглобулиноподобных доменов:
одного V-типа и одного С-типа, на которых находятся 8 потенциальных сайтов
для N-гликозилирования. Цитоплазматический конец CD86 имеет 3 участка для
фосфорилирования протеинкиназой С. CD86 взаимодействует с теми же самыми
ко-рецепторами на Т-клетках, что и молекулы CD80, CD28 и CD152 (CTLA-4).
Однако взаимодействие CD86 с CD152 в 20-100 раз более высокоаффинно,
чем с CD28. Молекула CD86 экспрессируется в низкой плотности дендритными
клетками периферической крови и очень высокой плотности на моноцитах. На
лимфоцитах CD86 появляется как антиген активации В-клеток, экспрессируется в
основном В-клетками памяти и В-клетками герминального центра, но полностью
отсутствует на плазматических клетках. Его экспрессия может быть повышена
путем активации через поверхностные иммуноглобулины, CD40, молекулы МНС
(главного комплекса гистосовместимости) класса II или действием РМА (ацетата
фарболмиристата) в присутствии иономицина.При СКВ продукция аутоантител находится в зависимости от Т-клеток. Для
надлежащего взаимодействия Т- и В-клеток необходима передача сигналов
ко-стимуляторными молекулами на этих клетках. Было показано, что экспрессия
CD80 на CD 19^ В-клетках низкая и не коррелирует с тяжестью болезни, тогда как
количество CD19^ В-клеток, экспрессирующих CD86, увеличено и коррелирует с
тяжестью заболевания. С другой стороны, продукция аутоантител В-клетками при
СКВ в присутствии активированных Т-клеток может быть подавлена антителами
против CD86, но не против CDSO, Таким образом, наиболее полную характеристи¬
ку относительного количества В-клеток и их субпопуляционного состава можно
получить при следующей комбинации моноклональных антител: CD5/CD19/
CD27/CD45 (рис. 3-19). Использование морфологических параметров (малоугло¬
вого светорассеяния — FS, рассеяния света под углом 90"— SS) для локализации
пула лимфоцитов достаточно часто приводит к получению некорректных резуль¬
татов. Это связано, как правило, с неполным лизисом эритроцитов, попаданием"licp ’ ' "їо^CD27-PC6бРис. 3-19. Гистограммы распределения CD19, CD5 v\ CD27 на лимфоцитах периферической
крови: а — выбор зоны анализа по С019-позитивным клеткам; 6 — распределение CD19-
позитивных клеток. Квадрант Е1 — В-1-лимфоциты (CDID-^CDS'}; квадрант Е4 — В-клетки памяти
(CD19*CD27^).
116 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯбазофилов в зону лимфоцитов и т.д. Для определения состояния иммунной систе¬
мы и ее аномалий более корректной представляется локализация лимфоцитов
на основе экспрессии панлейкоцитарного антигена CD45. При многоцветовом
цитофлюориметрическом анализе (более трех цветов) и многостадийном выборе
зоны лимфоцитов с использованием CD45 исключается попадание клеток другой
этиологии (не лимфоцитов) в конечный результат исследования. Таким образом,
при иммунофенотипировании В-лимфоцитов предпочтительнее использование
именно CD45 для выбора зоны анализа лимфоцитов.В связи с тем что молекула CD 19 представляет собой специфический маркер
В-клеток и не встречается на другах популяциях клеток периферической крови,
данный антиген рекомендуют для количественной оценки общей популяции
В-клеток. Дополнительное логическое ограничение по CD 19-позитивным клеткам
позволяет четко локализовать как В-1-клетки (CD19"CD5^), так и В-клетки памя¬
ти (CD19‘CD27^).Таким образом, оценка и характеристика В-клеточной популяции лимфоци¬
тов является не только важной задачей с точки зрения научных интересов, но и
позволяет практикующему врачу подтвердить или снять диагноз аутоиммунного
процесса. В свою очередь, качественная оценка изменения количества В-клеток
позволяет не только выявить степень активности процесса воспаления и его адек¬
ватности, но и оценить активность самих В-клеток в ходе иммунной реакции.
В то же время современные подходьЕ позволяют оценить эффективность уже сфор¬
мировавшегося ответа по наличию В-клеток памяти. Расширение потенциальных
возможностей современной проточной цитометрии значительно увеличивает
вероятность и точность оценки всех этих диагностически значимых моментов.
Многоцветовое окрашивание и многоэтапное гейтирование позволяют провести
многопараметрический анапиз клеток периферической крови с высокой точно¬
стью и достоверностью в одной пробе крови пациента. Данный подход значитель¬
но облегчает интерпретацию полученных результатов анализа и позволяет судить
о функционировании В-клеточного звена иммунной сисгемы пациентов при раз¬
нообразных патологических состояниях.Т’ЛИМФОЦИТЫ и их СУБПОПУЛЯЦИИМногие микроорганизмы, обитая внутри клеток организма-хозяина, недо¬
ступны для гуморального иммунитета, т.е. антител. В частности, вирусы способны
размножаться только внутри клеток, используя репликационную систему клеток
хозяина. Факультативно внутриклеточные микроорганизмы, такие как микобак¬
терии и лейшмании, могут размножаться как в клетках, главным образом в макро¬
фагах, так и вне клеток, но внутриклеточный способ существования для них более
предпочтителен, поскольку обеспечивает защиту от иммунной системы. Против
внутриклеточных микроорганизмов в организме действует особый механизм
приобретенного иммунитета, а именно клеточный иммунитет. Он обеспечивается
отдельной субпопуляцией лимфоцитов — Т-клетками. в отличие от В-клеток они
дифференцируются в тимусе, откуда и их название. Т-лимфоциты специализиру¬
ются на уничтожении клеток организма-хозяина, которые инфицированы вну-
триклеточно размножающимися возбудителями инфекции. Т-лимфоциты играют
важную роль в элиминации опухолевых клеток, в реакциях «трансплантат против
хозяина» и «хозяин против трансплантата», гиперчувствительности замедленного
типа и других реакциях организма, направленных на поддержание гомеостаза.Оценка как относительного, так и абсолютного количества Т-клеток и их
основных субпопуляций широко распространена в лабораторной практике. При
иммунофенотипировании лимфоцитов эти данные являются диагностически
значимыми при различных патологических состояниях, включая первичные и
вторичные иммунодефициты. Динамика изменения субпопуляционного состава
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 117Т-лимфоцитов при некоторых патологиях представляет значительную ценность
для контроля эффективности терапии, прогноза течения заболевания.К маркерам, характеризующим линию Т-лимфоцитов, в первую очередь отно¬
сится T'клеточный рецептор (T-cell Receptor - TcR). TcR — поверхностный
специфический рецептор для распознавания антигена, является гетеродимером,
состоящим из двух цепей с молекулярной массой 40-50 кДа, которые не явля¬
ются продуктами генов иммуноглобулинов. Существует два вида TcR, каждый из
которых ассоциируется с разными типами Т-лимфоцитов. TcRl, состоящий из у- и
5-цепей, появляется на ранних стадиях онтогенеза. TcR2 состоит из а- и р-цепей.
Каждая цепь образует два домена; один из них имеет относительно неизменную
структуру, гомологичную характерной укладке цепи иммуноглобулинов, а другой
обладает большей структурной изменчивостью, поскольку по своему строению
напоминает вариабельные домены иммуноглобулинов (Fai-фрагмент).Примерно 81,4-98,4% Т-лимфоцитов представляют собой вариант a|3-TcR и
обозначаются как ар-Т-клетки. Остальные 1,6-8,9% Т-лимфоцитов несут на своей
поверхности yS-TcR и обозначаются как 78-Т-клетки.ар-Т-клетки подразделяются на две различные неперекрывающиеся субпопу¬
ляции. Клетки одной из них несут маркер CD4 и в основном способствуют осу¬
ществлению иммунного ответа или индуцируют его. Эта субпопуляция получила
название Т-хелперов. Т-клетки другой субпопуляции несут маркер CD8 и облада¬
ют преимущественно цитотоксической активностью.Небольшая часть ар-Т-клеток и большинство у5-Т-клеток, циркулирующих в
периферической крови, не экспрессируют CD4 и CD8. Однако некоторые из них
все же экспрессируют молекулы CD8. Напротив, большая часть уб-Т-клеток в тка¬
нях экспрессируют CD8. Кроме молекулы CD8, у§-Т-клетки на своей поверхности
могут экспрессировать CD56, CD94, CD161. В свою очередь, цитотоксическую
активность у8-Т-клеток возможно стимулировать через CD122 (р-цепь рецептора
интерлейкина-2).Одной из особенностей уб-Т-клеток в отличие от ар-Т-клеток является то, что
они распознают непептидные антигены, полученные из микробных патогенов, неза¬
висимо от главного комплекса гистосовместимости (МНС — major histocompatability
complex). Эта субпопуляция выполняет ряд важных функций, так как они могут
усиливать иммунный ответ, производя большие количества интерферона у (IFN-y),
фактора некроза опухоли-а (TNF-a) и хемокинов. Кроме этого, у6-Т-клетки имеют
эффекторную (цитотоксическую) активность. С эволюционной точки зрения у5-Т-
клетки занимают уникальное место между высокоспецифичными ар-Т-клетками и
врожденной иммунной системой для выполнения защиты организма от патогенов.
Доказана существенная роль у6-Т-клеток в устойчивости организма против целого
ряда микроорганизмов, так, функциональную значимость уб-Т-клеток отмечали
в устойчивости к Mycobacterium, ВогеШа, Francisella tularensis. Salmonella и вирусам,
включая ВИЧ. Кроме того, у5-Т-клетки играют важную роль и в противоопухолевом
ответе, описано значительное увеличение этих клеток у пациентов с некоторыми
видами лимфом. уб-Т-клетки также участвуют в восстановлении эпителия и поддер¬
жании гомеостаза. С другой стороны, у5-Т-клетки могут быть вовлечены в патогенез
некоторых иммунопатологических состояний, таких как сахарный диабет, аутоим¬
мунные расстройства, болезнь Бехчета, бронхиальная астма.Содержание у5-Т-клеток в периферической крови может варьировать, суще¬
ствуют половые и возрастные различия. Их количество увеличивается с момента
рождения до половозрелости и в дальнейшем постепенно снижается. У женщин
количество у6-Т-клеток несколько выше и высокий уровень сохраняется значи¬
тельно дольше, чем у мужчин,в ответ на действие специфического антигена у5-Т-клетки обладают быстро-
начинающейся (после 4-6 дней), высокой (в 200 раз) и длительной (более 7 мес)
118 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯпролиферативной способностью. Кроме того, в течение иммунного ответа анти-
генспецифические у5-Т-клетки могут составлять до 48-98% общего количества
циркулирующих у8-Т-клеток. Таким образом, обнаружение увеличенной циркули¬
рующей субпопуляции уб-Т-клеток позволяет предположить недавнюю или теку¬
щую хроническую антигенную стимуляцию, особенно на слизистых оболочках или
участках кожи, что, в свою очередь, позволяет практикующим врачам заподозрить
медленно прогрессирующее заболевание инфекционной природы (табл. 3-3).Таблица 3-3. Изменения относительного количества у5-Т-клеток при различных заболеванияхИзменение относительного
количества у5-Т-1слето1сЗаболеваниеПовышение относительного уровня у5-Т-клетокВирусные инфекцт
ВИЧЦитомегаловирусВирус Эпштейна-БаррБактериальные инфекцииMycobacterium tuberculosis {туберкулез легких)Legionella рпеитопіе (легионеллез)Francisella tularensis (туляремия)Salmonella enteritidis (сальмонеллез)Borellia burgdorferi (болезнь Лайма)
Атопический дерматит (у детей)Болезнь Крона
Болезнь Бехчета
Первичные иммунодефицитыПонижение относительного уровня уб-Т-клетокАтопический дерматит (у взрослых)Возрастное снижение относитепьного уровня у5-Т-клетокНа клеточной поверхности и ар-, и у5-антигенраспознающие рецепторы
Т-клеток расположены непосредственно рядом с полипептидным комплексом,
имеющим групповое название CD3. Это соседство и ассоциация с CD3 являются
необходимым условием для экспрессии всего рецепторного комплекса на поверх¬
ности клеток.Антиген CD3 представляет собой комплекс 5 инвариантных полипептидных
цепей: у, 5, Є, ^ и т\, молекулярные массы которых составляют соответственно
25-28, 21, 20,16 и 22 кДа. Полипептидная цепь ^ находится в СВЗ-комплексе как
гомодимер, связанный дисульфидным мостиком, или как гетеродимер с т^-цепью.
Комплекс CD3, в свою очередь, является частью значительно большего комплекса,
который включает TcR. Этот комплекс экспрессируется зрелыми Т-лимфоцитами
и тимоцитами. Активация Т-клеток может быть вызвана за счет взаимодействия
TcR с антигенпредставляющими клетками, несущими процессированный чужерод¬
ный антиген в комплексе с антигенами МНС I и II класса.СВЗ^-цепь экспрессируется также NK-клеткам и и большинством (более 90%)
клонов клеток, являющихся производными децидуальных гранулярных лимфоци¬
тов, которые CD3-отрицательны.Приведенные факты свидетельствуют в пользу более полной характеристики
Т-клеток пациента, анализ следует проводить не только по такому линейно¬
специфическому маркеру, как CD3, но и по наличию субпопуляций а|3-Т-клеток
и у5-Т-клеток. Определение последних важно для целого ряда заболеваний, в
первую очередь к ним относятся ВИЧ-инфекция, вторичные и первичные иммуно-
дефицитные состояния, сопровождающиеся длительной персистенцией микроор¬
ганизмов в организме человека на фоне депрессии Т-клеточного звена иммунной
системы. Особенно важным определение у6-Т-клеток становится при оценке обще¬
го количества Т-клеток в тех случаях, когда от их количества зависит доза препа¬
ратов, например назначение антиретровирусной терапии ВИЧ-инфицированным
пациентам. Количественный анализ Т-клеток является наиболее востребованным
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ119исследованием для иммунологического контроля состояний приобретенного
иммунодефицита, мониторинга за пациентами после трансплантации костного
мозга и эффективности иммунодепрессивной терапии. Стандартные протоколы
иммунофенотипирования, использующие 4 цвета, позволяют проводить иденти¬
фикацию субпопуляций Т-лимфоцитов в одном образце. Этот анализ представляет
исследователю намного больше информации, но до последнего времени она нахо¬
дилась вне зоны внимания врачей-клиницистов.При использовании комбинации моноклональных антител CD3/CD4/CD8/
CD45 при обычном анализе периферических Т-клеток достаточно часто наблю¬
дается бимодальное распределение экспрессии CD3, которое предполагает нали¬
чие двух субпопуляций Т-клеток. Помимо молекул CD3, антигенспецифический
Т-клеточный рецептор является другим пан-Т-клеточным маркером, который
необходимо использовать при анализе данных пациентов с иммунологическими
расстройствами. Как было описано выше, существует два различных типа TcR:
ap-TcR и 76*TcR, различающихся по онтогенезу и функциональным свойствам.
В медицинской практике, как правило, внимание врачей-клиницистов сосредото¬
чено прежде всего на а^-Т-клетках, составляющих большую часть Т-лимфоцитов.
Оставшиеся около 5% у§-Т-клеток, как правило, выпадают из зоны внимания
врачей-клиницистов, их рассматривают исключительно при исследовании имму¬
нитета слизистых оболочек и в тимусе.Однако уб-Т-клетки играют значительную роль в защите организма от различ¬
ных типов инфекций, знание об их количественном составе должно быть неотъем¬
лемой частью анализа иммунного статуса пациентов.Комбинация моноклональных антител CD3/CD4/CD8/CD45 дает не только
основную информацию о наличии Т-клеток и их основных субпопуляций, но и
позволяет обратить внимание на неоднородность распределения СВЗ-молекулы,
если она есть. В этом случае необходимо проверить контрольную сумму CD3-
позитивных клеток (CD4"^+CD8* должно равняться общему количеству CD3^). В слу¬
чае если контрольная сумма не совпадает с общим количеством CD3^-лимфоцитов,
следует проверить субпопуляционный состав Т-клеток на наличие a^-TcR и уб-TcR.
Данный этап необходим, так как большинство уб-Т-клеток, циркулирующих в пери¬
ферической крови, дважды отрицательны. Другая их особенность заключается в
том, что они имеют более высокую плотность экспрессии молекулы CD3 на своей
поверхности CD3*’"®'’' (рис. 3-20). Все эти признаки характерны для у5-Т-клеток.Для выявления у8- и ар-Т-лимфоцитов, как правило, используют комбинацию
моноклональных антител ap-TcR/y5-TcR/CD3/CD45 (рис. 3-21).Рис. 3-20. Однопараметрические гистограммы распределения Т-лимфоцитов по плотности CD3
на их поверхности: а — распределение СОЗ-позитивных Т-клеток у здорового донора; б — рас¬
пределение СОЗ-позитивных Т-клеток у пациента с вирусом Эпштейна-Барр.
120ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ103-0.2%ш€О)10*-=10S1F3’,3F211.1%CD3-FITCаРис. 3-21. Примеры деухпараметрических гистограмм распределения Т-лимфоцитов, полученные
в результате многоцветового анализа лимфоцитов периферической крови пациента с хрониче¬
ским носительством вируса Эпштейна-Барр.Таким образом, для наиболее полной фенотипической характеристики Т-лим¬
фоцитов и правильного назначения химиотерапевтических препаратов, направ¬
ленных на восстановление нормального функционирования защитных систем
организма, необходимо проводить анализ не только линейно-специфического
маркера Т-клеток CD3, но и определять субпопуляционный состав Т-клеток по
экспрессии Т-клеточного рецептора, а именно у6- и a[5-TcR. Для этих целей следует
использовать многоцветовой анализ и следующие комбинации моноклональных
антител: CD3/CD4/CD8/CD45 и a|3-TcR/75-TcR/CD3/CD45.Помимо описанных выше популяций Т-клеток, в крови человека можно лока¬
лизовать как наивные Т-клетки, так и Т-клетки памяти, различающиеся между
собой по функциональным и фенотипическим признакам. Жизненный цикл
Т-клеток в организме делится на две фазы: независимую от чужеродного антигена
стадию дифференцировки Т-клеток и стадию, связанную с присутствием чуже¬
родного антигена. Первая завершается появлением в кровотоке зрелых наивных
Т-лимфоцитов, каждый из которых способен отвечать только на «свой» антиген.
Стимулированные антигеном в ходе первичного ответа Т-клетки проходят даль¬
нейшую дифференцировку.Все Т-клетки памяти появляются в результате дифференцировки активиро¬
ванных антигеном наивных предшественников в ходе нормального развития
первичного иммунного ответа in vivo. Экспрессия на клеточной поверхности
различных изоформ молекулы CD45 позволяет разделить CD4" Т-лимфоциты
человека на наивные Т-клетки и Т-клетки памяти. Принято относить субпопуля¬
цию CD4‘^CD45RA‘CD45R0"^ Т-лимфоцитов к Т-клеткам памяти и соответственно
CD4^CD45RA‘CD45R0' — к наивным Т-клеткам. Подобное разделение основано
исключительно на способности CD4'CD45RA'CD45R0'' Т-клеток, а не наивных
Т-лимфоцитов, интенсивно отвечать на повторный контакт с антигеном in vitro.
В свою очередь, быстрый и усиленный ответ Т-клеток памяти на специфический
антиген является их важнейшим функциональным отличием от наивных пред¬
шественников.Покоящиеся CD4^ Т-лимфоциты памяти также отличаются от наивных пред¬
шественников системой внутриклеточной сигнализации, приводящей к резистент¬
ности к действию Са-^' ионофоров. Чувствительная к действию Са^^ ионофоров
популяция CD4 Т-клеток человека составляет основную часть покоящихся
наивных CD4"^CD45RA"CD45R0“ Т-лимфоцитов. В свою очередь, большинство
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 121резистентных К действию ионофоров CD4" Т-клетки являются покоящимися
CD4*CD45RA CD45R0^ Т-лимфоцитами памяти.Основная методическая сложность в исследованиях процесса дифференцировки
CD4^ Т-лимфоцитов в периферической крови связана с тем, что активированные
клетки составляют лишь незначительную часть. Как правило, в крови здоровых
доноров доля активированных CD4^ Т-клеток составляет менее 10% общего коли¬
чества CD4' Т-лимфоцитов.Однозначным фенотипическим признаком дифференцировки покоящихся наи¬
вных CD4*CD45RA*^CD45R0‘ Т-лимфоцитов человека в покоящиеся Т-клетки памя¬
ти принято считать появление на поверхности клеток молекул CD45R0 взамен изо¬
формы CD45RA. Данная особенность позволяет выявить три субпопуляции CD4"^
Т-лимфоцитов человека: покоящиеся наивные CD45RA'CD45R0 Т-клетки. покоя¬
щиеся CD45RA CD45R0‘ Т-клетки памяти и активированные CD45RA*CD45R0'^
Т-клетки. Зрелых CD4+CD45RA CD45R0‘ Т-лимфоцитов в периферической крови
человека не существует. Все активированные CD4^CD45RA'CD45R0^ Т-лимфоциты
появляются в процессе стимуляции наивных клеток антигеном in vivo.Определение относительного количества CD4*CD45RA*CD45R0‘ и CD4'CD45RA‘
CD45R0 '-лимфоцитов полезно для диагностических целей. При развитии инфекции
или при хирургическом вмешательстве происходит накопление доли CD4’CD45RA‘
CD45R0^ клеток и снижение CD4*CD45RA*CD45R0‘. Для более точной идентифика¬
ции этих субпопуляций Т-клеток, как правило, используют многоцветовой анализ и
комбинацию моноклональных антител CD4/CD45RA/CD45R0/CD45 (рис. 3-22).Появление молекул CD69 считают основным фенотипическим признаком наи¬
более ранней (первые часы) стадии активации наивных CD4^ Т-лимфоцитов. Как
правило, в крови здоровых доноров не удается обнаружить присутствие более чем
1-4% CD4"CD69" Т-клеток.Экспрессия молекул CD25 на поверхности CD4* Т-лимфоцитов обычно рассма¬
тривается как специфический признак стадии, зависимой от антигена интенсивной
пролиферации активированных Т-клеток. Отсутствие в крови здоровых доноров
зрелых CD4^CD69"CD25* Т-клеток позволяет корректно разграничить данную
стадию активации Т-клеток от предыдущей.Популяция CD4"CD25" Т-лимфоцитов человека гетерогенна по функциональ¬
ным свойствам и фенотипическим признакам. Она включает популяции проли¬
ферирующих CD4XD45RA*CD45R0’CD25‘'=‘" Т-клеток и регуляторных (T-reg)
CD4^CD45R0*CD25*’‘^ Т-лимфоцитов. Являясь супрессорами, они играют ведущую
роль во многих иммунологических процессах (таких как аутоиммунные заболевания,
трансплантационный иммуні-ггет, противоопухолевый ответ и иммуногомеостаз):
регулируют Т-клеточный гомеоааз, предотвращают аутоиммунные заболевания,
аллергии, гиперчувствительность, реакции «трансплантант против хозяина». Однако
регуляторные Т-клетки снижают противоопухолевый иммунитет и иммунитет к
инфекциям.T-reg-клетки имеют фенотип CD3XD4^CD25^*^CD45R0^CD95% но наиболее
важным их маркером является F0XP3, который кодирует фактор транскрипции
и является главным регулирующим геном для развития и функционирования
CD4^CD25'‘‘sb регуляторных Т-клеток. В настоящее время самым точным маркером
для идентификации T-reg-клеток является фактор транскрипции F0XP3. Однако
идентификация этого маркера требует пермеабилизации клеток, что затрудняет
работу по идентификации T-reg-клеток.Экспрессия CD 127 на T-reg-клетках снижена или отсутствует. В экспериментах
in vitro показано, что экспрессия CD127 после активации Т-клеток резко снижает¬
ся. CD127 представляет собой а-цепь гетеродимерного рецептора IL-7, который
состоит из CD127 и общей уцепи, которая представлена и у других рецепторов
цитокинов (IL-2R, IL-4R, IL-9R, IL-15R и IL-21R). CD127 экспрессируется наГ
Ші122ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ1*0» "іЬ*' ’ ‘ 10»C04Nt9-£CDРис. 3-22. Распределение лимфоцитов условно здорового человека (а и в) и пациента в послео¬
перационный период (6 и г). На гистограммах в и г анализ лимфоцитов проводили только с
гейтированием по CD45. На гистограммах а и б анализировали клетки при помощи многоэтапного
гейтирования по CD45 и CD4.тймоцитах, Т- и В-предшественниках, зрелых Т-клетках, моноцитах и некоторых
других лимфоидных и миелоидных клетках. Доказано, что IL-7R играет важную
роль в пролиферации и дифференцировке зрелых Т-клеток.Таким образом, окончательный фенотип T-reg-клеток будет выглядеть сле¬
дующим образом: CD3‘^CD4*CD25‘’“fi'''CD127‘^'"’ '® '’'^^РОХРЗ^, но для их определения
можно использовать фенотип T-reg без выявления F0XP3. Для более точной
локализации T-reg-клеток предпочтительнее использовать многоцветовой анализ
и многоэтапное гейтирование с использованием набора моноклональных антител
CD45/CD4/CD25/CD127.nk-клетки и их субпопуляциик одной из наиболее важных популяций иммунокомпетентных клеток относятся
NK-клетки. Среди больших гранулярных лимфоцитов {Large Granular Lymphocytes —
LGL) выделяют отдельную популяцию клеток, получившую название естествен¬
ных киллеров, или NK-клеток {Natural Killer). За счет цитолитической активности
против клеток-мишеней и способности продуцировать цитокины NK-клетки явля¬
ются важным компонентом врожденной иммунной системы. Первоначально они
были описаны на основании их функциональной способности уничтожать клетки
некоторых опухолей гемопоэтического происхождения без предшествующей
стимуляции. Таким образом, одной из основных функций данной субпопуляции
иммунокомпетентных клеток является защита организма от видоизмененного
своего.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 123NK-клетки являются носителями двух основных функций: первая — лизис
опухолей и клеток, инфицированных вирусами, вторая — регуляция врожденного
и адаптивного иммунных ответов с помощью секреции хемокинов (CCL3, CCL4,
CCL5 и XCL1) и цитокинов (GM-CSF, TNF-a и IFN-y).Способность NK-клеток взаимодействовать и ликвидировать опухолевые клет¬
ки возможна за счет нескольких специализированных рецепторов, распознающих
молекулы МНС класса I. Эти рецепторы формируются на NK-клетках при ассоциа¬
ции молекул CD94 с молекулами семейства NKG2 (CD 159).В свою очередь, NK-клетки являются субпопуляцией лимфоцитов, наиболее
чувствительной к физиологическим и психологическим стрессам. Доказано выра¬
женное воздействие высоких физических нагрузок на NK-клетки. Их цитолити-
ческая активность увеличивается при нарастании физической наі^)узки и умень¬
шается после ее окончания в течение нескольких часов. Это отражается главным
образом на распределении NK-клеток с небольшими изменениями их цитотокси-
ческой активности.В периферической крови NK-клетки составляют 5-20% циркулирующих лим¬
фоцитов. Б табл. 3-4 приведены примеры взаимосвязи изменения активности и
количества NK-клеток с клиническими признаками или увеличением риска забо¬
леваний у людей. Относительное количество NK-клеток и их активность суще¬
ственно изменяются не только при оп)^холевых процессах и вирусной инфекции,
но и при гнойном воспалении, нарушении функций ЦНС, аутоиммунных заболева¬
ниях и т.д. Вероятно, что в результате применения более тонких и точных методов,
таких как проточная цитометрия и многопараметрический анализ, будут выявле¬
ны и другие изменения в субпопуляциях этих клеток при различных патологиях.Таблица 3-4, Примеры отклонений в активности и количестве NK-клеток, связанные с проявлени¬
ем клинических признаков или увеличенным риском заболеваний у людейИзменение количе¬
ства и активности
NK-клетокПостоянно низкие
активность и количе¬
ство NK-клетокПатологические состоянияПриобретенный или врожденный
иммунодефицит, включая СПИД.Синдром Чедиака-Хигаси.Дефицит CD11/CD18 молекул семей¬
ства клеточной адгезии.
Онкологические заболевания:
онкологические заболевания, связан¬
ные с наследственностью;
лейкемия;Х-связанный лимфопролиферативный
синдром;рак молочной железы;рак шеи и головы (до терапии);терапия цитостатиками.Вирусная инфекция {цитомегаловирус,
вирус Эпштейна-Барр, вирус герпеса).
Другие вирусные и бактериальные
инфекции.Аутоиммунные заболевания.
Психические расстройства:
синдром дефицита NK-клеток;
синдром хронической усталости;
депрессия;
хронический стрессАссоциированные симптомы и рискиВысокий риск возникновения онкологи¬
ческих заболеваний и достаточно частые
инфекционные заболевания.
Повышенный риск образования лимфом.
Увеличенная восприимчивость к вирус¬
ным инфекциям.Распространение метастазов.Вероятность появления злокачественно¬
го образования выше нормального.
Предшествует рецидиву.Повышенная чувствительность к вирусу
Эпштейна-Барр.Неблагоприятный прогноз.
Неблагоприятный прогноз.Более вьюокая вероятность рецидива.
Более высокие частота, серьезность и
продолжительность заболевания.Более высокие частота, серьезность и
продолжительность заболевания.
Возможны более активное течение
болезни, увеличенная частота инфекций.Усталость, сниженная восприимчивость,
лихорадка.Повышенная утомляемость, апатичность,
частые вирусные заболевания.Более серьезные признаки.
Неспособность справляться с ежеднев¬
ными проблемами, усталостьИР
124 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯОкончание табл. 3-4Изменение количе¬
ства и аістивности
NK-клегокПостоянно высокие
активность и количе¬
ство NK-клетокПатологические состоянияпролиферация NK-клеток;хроническая пролиферация большихгранулярных лимфоцитов (LGL-пролиферация);острая пролиферация большихгранулярных лимфоцитов (LGL-пролиферамия);гепатитАссо1|иированные симптомы и рискиLGL-лимфоцитоз, цитопения, спленоме-
галия.Встречается одновременно с активной
лейкемией/лимфомой.Нет данныхДля локализации NK-клеток среди других лимфоцитов используют монокло¬
нальные антитела, распознающие различные маркеры, экспрессируемые на их
поверхности. Однако многие поверхностные молекулы NK-клеток представлены и
на других субпопуляциях лимфоцитов, что накладывает свои особенности на иден¬
тификацию этих клеток. Для их выявления среди других лейкоцитов используют
уникальную комбинацию из нескольких маркеров, таких как CD56 и CD 16. Б то
же время NK-клетки не экспрессируют такие линейные маркеры, как CD3, CD14 и
поверхностные Ig, и это также используется при их локализации.Одним из основных маркеров, используемых для выявления NK-клеток, явля¬
ется молекула CD 16. Антиген CD 16 представляет собой низкоаффинный рецеп¬
тор для IgG (FcyRlII), Данный антиген существует в двух различных формах,
кодируемых двумя различными генами: FcyRIIIA (или III-2) и FcyRIIIB (или
III-1). Генетическая разнородность CD16 приводит к альтернативным путям ассо¬
циации молекул с мембраной клеток. Первая, трансмембранная форма (FcyRIIIA,
50-65 кДа) экспрессируется на NK-клетках, моноцитах и макрофагах. Другая
форма (FcyRIIIB, 48 кДа), ассоциированная с мембраной за счет гликозилфосфа-
тидилинозитола (GPI), экспрессируется только на нейтрофилах. Антиген CD16 на
мембране NK-клеток может быть нековалентно связан с гомо- или гетеродимера¬
ми, состоящими из СБЗС-цепи и БсєКІу-цепи, которые, в свою очередь, связаны
между собой дисульфидными мостиками.Другим антигеном является молекула CD56. Данный антиген представляет
собой изоформу N-CAM (Neural Cell Adhesion Molecule) с молекулярной массой
140 кДа. Посттрансляционные модификации полипептида N-CAM включают
N' и 0-гликозилирование, ацилирование, сульфатирование и фосфорилиро-
вание. Различные изоформы N-CAM имеют молекулярную массу в пределах
135-220 кДа. С056-антиген умеренно экспрессируется на субпопуляциях клеток
периферической крови, таких как большие гранулярные лимфоциты, и всех клет¬
ках с NK-активностью. Молекула CD56 также экспрессируется отдельными субпо¬
пуляциями Т-лимфоцитов.Циркулирующие зрелые NK-клетки имеют фенотип CD3 CD56^CD16^CD2''™
и отличаются от Т-клеток отсутствием Т-клеточного рецептора и CD3. Отличие
от Б-клеток заключается в том, что NK-клетки никогда не экспрессируют мем¬
бранные Ig, но за счет экспрессии FcyRIII они могут быть позитивными при
окрашивании антителами. Поверхностные маркеры, экспрессируемые активи¬
рованными NK-клетками, включают ряд молекул, таких как CD25, другие типы
Fc-рецепторов, (CD29)- и ]32 (CD18)-HHTerpHHbi, различные активационные
антигены, включая HLA-DR, CD71 и CD69. В зависимости от степени активации
NK-клеток поверхностные рецепторы могут менять свою экспрессию за счет повы¬
шения или понижения.Популяция NK-клеток обладает достаточной гетерогенностью по составу.
Вьщеляют несколько подтипов этих клеток, а именно npe-NK-клетки, зрелые
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 125N К-клетки и активированные NK-клетки, у которых различна экспрессия мар¬
керов клеточной поверхности. Среди популяции циркулирующих NK-клеток
выделяют две основные субпопуляции: первая экспрессирует CD16 и низкий
уровень CD56 вторая экспрессирует CD56, но CD16 на нихпредставлен в низкой плотности или полностью отсутствует
Последняя субпопуляция составляет приблизительно 10-20% общего количества
NK-клеток. Они секретируют интерферон Y и другае цитокины, имеют мень-
шую цитолитическую активность, в свою очередь, субпопуляция CD16'’‘«'‘CD56'““
составляет приблизительно 80-90% NK-клеток периферической крови, они слабо
секретируют цитокины, но обладают высокой цитолитической активностью.NK-клетки экспрессируют на своей поверхности многочисленные маркеры:
CD2, CD5, CD7, СіЗв, CD94, CD96, CD 158, CD159 и др. Однако для локализации
и характеристики NK-клеток наиболее широко используют двухпараметрический
анализ экспрессии CD 16 и/или CD56 на CD3-негативных клетках. Данная ком¬
бинация моноклональных антител позволяет локализовать общую популяцию
NK-клеток и количественно охарактеризовать ее, но не подтипы клеток.Достаточно часто NK-клетки экспрессируют на поверхности а-цепи CD8, но
в более низкой плотности, чем цитотоксические Т-клетки. Показано, что субпо¬
пуляции NK-клеток человека, экспрессирующие а/а гомодимер CD8, обладают
большей цитотоксичностью, чем CD8' NK-клетки. Соединение CD8 а-цепей
в гомодимер индуцирует быстрое повышение внутриклеточных ионов Са^’^ и
инициированное этим увеличение экспрессии CD69. Хотя секреция цитолитиче-
ских ферментов инициирует апоптоз NK-клеток, приток экзогенных ионов Са^*
защищает CD8oc" NK-клетки от этого. Эта защита от апоптоза может быть снята
преинкубацией NK-клеток с антителами против МНС класса L Таким образом,
данный механизм позволяет CD8a ^ NK-клеткам сохранять жизнеспособность и
участвовать в лизисе клеток-мишеней.Большое внимание уделяют экспрессии CD38 на поверхности NK-клеток.
Молекула CD3S — мембранный гликопротеин, представляющий собой фер'
мент, регулирующий концентрацию цитоплазматического кальция. Кроме того,
данный фермент обладает рядом других активностей: аденозиндифосфат-рибо-
зил-циклазной, циклической аденозиндифосфат-рибозил-гидролазной и NAD-
гликогидролазной. Данная молекула также выполняет роль рецептора, модулируя
межклеточные взаимодействия, и является переносчиком трансмембранных сиг¬
налов. Молекула CD38 экспрессируется на активированных Т-, В-, NK-клетках и
других типах клеток.Вызванный NK-клетками цитотоксический эффект на клетки-мишени сопро¬
вождается тесным контактом между ними, причем этот контакт предшествует
выбросу цитотоксических гранул. Таким образом, ведущую роль в установлении
этого контакта выполняют молекулы клеточной адгезии. Данные молекулы также
вовлечены в сигнальную систему, приводящую к выбросу цитотоксических гранул.
Молекулы LFA-1 на лимфоцитах и ICAM-1 на клетках-мишенях представляют
собой основу для межклеточных взаимодействий цитотоксических лимфоцитов
и реализации их функции. LFA-1 — гетеродимерный рецептор, формирующийся
в результате ассоциации цепи а^-интегрина (CDlla) с цепью Рз'Интегрина CD18.
Антитела, взаимодействующие с молекулами LFA-1, блокируют цитотоксичность,
вызываемую NK-клетками. У пациентов с заболеванием, связанным с дефици¬
том адгезии лейкоцитов, отмечается недостаток как в LFA-1, так и в активности
NK-клеток. Данная аномалия является генетически обусловленным дефектом
CD18. Для выявления NK-клеток, обладающих цитотоксической активностью и
способных ее реализовать, необходима локализация NK-клеток, экспрессирую¬
щих молекулы CDlla, причем необходимо оценивать не только наличие CDlla на
NK-клетках, но и плотность экспрессии данных молекул.'Ш
126 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯТаким образом, для наиболее полной характеристики NK-клеток необходимо
определить на СПЗ-негативных клетках следующие поверхностные маркеры:
CD16, CD56, CD38, CD8 и LFA-1. При этом CD38, CDS и LFA-1 позволяют оце¬
нить цитотоксическую активность NK-клеток пациента и, как следствие этого,
более корректно представлять картину, происходящую на данном этапе развития
иммунного ответа. Для этих целей рекомендуют использовать следующие комби¬
нации моноклональных антител: CD3/CD16/CD56/CD45, CD3/CD8/CD38/CD45
и CD3/CDlla/CD56/CD45.Применение двухцветового окрашивания лимфоцитов с использованием ком¬
бинации антител CD3, CD56+CD16 позволяет локализовать NK-клетки и оценить
их абсолютное и относительное количество. Однако в этом сл)^ае отсутствует воз¬
можность определить их подтипы.Другим вариантом окрашивания лимфоцитов для выявления NK-клеток явля¬
ется использование комбинации антител CD16 и CD56. Но в этом случае результат
получается несколько завышенным, поскольку дополнительный вклад вносят
Т-клетки, так как они могут экспрессировать на своей поверхности CD56 и CD 16.
Это особенно ярко проявляется при различных заболеваниях, когда резко возрас¬
тает количество Т-клеток, экспрессирующих данные структуры. Задачу разделе¬
ния этих типов клеток позволяет решить применение многоцветового анализа и
комбинации моноклональных антител CD3/CD16/CD56/CD45. CD45 используют
для локализации всей популяции лимфоцитов, что является более корректным
по сравнению с гейтированием по морфологическим параметрам FS и SS. В свою
очередь, CD3 позволяет исключить из анализа Т-клетки.CDSS^^CDS' NK-клетки обладают высокой цитолитической активностью, поэ¬
тому знание о наличии данной субпопуляции, относительном и абсолютном ее
количестве имеет важное диагностическое значение. Для локализации CD38"^CD8^
NK-клеток возможно использование двухпараметрического анализа, но более
корректно применять трех- и четырехцветовой анализ (CD3/CD8/CD38 и CD3/
CD8/CD38/CD45).Б случае использования комбинации CD3/CD8/CD38 для вьщеления лимфо¬
цитов используют морфологические параметры, однако существует вероятность
исключения из анализа части больших гранулярных лимфоцитов, которые могут
просто не попасть в выделенную зону при гейтировании. Использование CD45 для
локализации всей популяции лимфоцитов является более корректным.Комбинация моноклональных антител CD3/CD8/CD38/CD45 и многоэтапное
позитивное и негативное гейтирование позволяют четко выделить активирован¬
ные NK-клетки.Дальнейший анализ проводят на отдельных гистограммах с использованием
логических ограничений по зонам позитивных и негативных по CD3 клеток. На
гистограмме, полученной с использованием гейтирования по CD3"^, находят акти¬
вированные цитотоксические Т-клетки с фенотипом CD8‘^‘«***CD38' .Аналогичная процедура, но с гейтированием по зоне CD3-негативных клеток,
позволяет выявить активированные NK-клетки с фенотипом CD8‘^'‘“CD38^. Данное
утверждение правомерно, поскольку CD8 экспрессируется не только на Т-клетках,
но и на части популяции CD3-негативных клеток, а именно NK-клетках.Таким образом, используя комбинации моноклональных антител, можно в
одном образце выявить активированные цитотоксические Т-клетки и активиро¬
ванные NK-клетки.В последние годы становится весьма очевидной необходимость при типировании
NK-клеток выявлять общее количество и содержание отдельных их субпопуляций.NK-клетки и их цитотоксическая функция имеют ведущее значение при опухо¬
левых и вирусиндуцированных процессах.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 127Регуляторная функция у отдельных субпопуляций NK-клеток ставит вопрос об
их клиническом и патогенетическом значении.Данные о наличии активационных рецепторов NK-клеток позволяют по-новому
оценить их функциональную активность, не осуществляя трудоемких и весьма
затратных экспериментов по киллингу клеток-мишеней.Появилась возможность оценить степень воздействия медикаментозной тера¬
пии на собственно NK-клетки как в норме, так и при патологии, как in vivo, так и
in vitro. Это позволяет значительно расширить возможности клинической фарма¬
кологии по поиску средств, влияющих непосредственно на данную группу клеток
(химиотерапия опухолей, противовирусная терапия и др.).Изучение субпопуляций NK-клеток и их функциональной активности может
повлиять на представления о природе патологических процессов. Это весьма
важно как для известных патологий, где значение NK-клеток уже определено, так
и для других процессов, при которых значимость врожденных механизмов имму¬
нитета недостаточно изучена. Как следствие, новые данные могут способствовать
более корректной иммунотерапии различных патологических состояний с учетом
ее влияния на данные клетки.Использование возможностей современной проточной цитометрии позво¬
ляет получить более точные данные о протекающих в организме изменениях в
короткие сроки, в свою очередь, применение 3, 4 и более флюоресцентных меток
позволяет более корректно интерпретировать клинико-лабораторные результаты
обследования пациентов с различными патологиями, в основе которых лежат
механизмы нарушений количества и активности NK-клеток.Фенотипирование лимфоцитов периферической кровиДля оценки показателей иммунограммы разработана многоцветовая панель
моноклональных антител (табл. 3-5).Таблица 3-5. Панель моноклональных антител для анализа основных и малых популяций лимфо¬
цитов периферической кровиФлюорохромыFITCРЕECDРС5Моноклональные антителаCD19CD5CD45CD27CD8CD4CD3CD45CD16CD56GD3CD45CD8CD38CD3CD45CD45RACD4CD45R0CD45CD4CD127CD25CD45Y5-TcRa(i-TcRCD3CD45CD3CD25HLA-DRCD45Анализ В-1-, В-2-лимфоцитов и В-клеток памяти в периферической крови
человека с использованием этой комбинации моноклональных антител позволил
определить интервалы распределения относительного и абсолютного количества
этих субпопуляций у практически здоровых доноров, результаты представлены в
табл. 3-6. Использование дополнительного логического ограничения по CD19^-
клеткам позволило получить дополнительную информацию по интервалам рас¬
пределения В-1-, В-2-клеток и Б-клеток памяти внутри популяции В-лимфоцитов
практически здоровых доноров (табл. 3-7).Для наиболее полной фенотипической характеристики Т-лимфоцитов про¬
водили анализ не только линейно-специфического маркера Т-клеток CD3, но
и определяли субпопуляционный состав Т-клеток по экспрессии Т-клеточного
128ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯрецептора, а именно у5- и ap-TcR (см. табл. 3-5). В слз^ае анализа а[5-Т-клеток и
у6-Т-лимфоцитов использование дополнительного логического ограничения по
СВЗ*-клеткам позволило получить дополнительную информацию по интервалам
распределения этих клеток в основной популяции Т-клеток (см. табл. 3-7).Количество наивных Т-лимфоцитов было проанализировано с помощью ком¬
бинации моноклональных антител CD4/CD45RA/CD45R0/CD45. Применение
многоцветового анализа и комбинации моноклональных антител CD3/CD16/
CD56/CD45 позволило локализовать не только популяции NK- и T-NK-клеток,
но и отдельные малые субпопуляции NK-клеток, имеющие фенотип
CD56'^''" и Результаты анализа общих NK-клеток, малых суб¬популяций NK-клеток и T-NK-клеток взрослых, практически здоровых доноров
представлены в табл. 3-6 и 3-7.Таблица 3-В. Интервалы распределения популяций лимфоцитов в зависимости от их фенотипов
практически здоровых доноровСубпопуляцииСодержаниеотносительное, %абсолютное количество,х10*/лВ-клетки (CD3-CD19’HLA-DR-CD45‘)7-170,111-0,376В-1-КЛЄТКИ (CD19'CD5^CD27-CD45*)0,5-2,10,022-0,115В-2-КЛЄТКИ (CD19^CD5-CD27-CD45")6.5-14.90,081-0,323В-клетки памяти (CD19*C05-CD27’CD45+)1,8-6,80,012-0,040NK-клетки (CD3-CD16^CD56*CD45")8-180,123-0,3691\1К-клетки цитолитические (CD3-CD16*(”'''e''}CD56'''"’GD45*)0.2-1,00,00a-fl,022NK-клетки цитокинпродуцирующие (CD3-CD16
CD56'>''='''CD45")7,8-17,00,120-0,347Т-клетки (CD3"C019-CD45*)61-^50,946-2,079Т-хелперы (CD3‘CD4*CD8-CD45*)35-550,576-1,336Т-цитотоксические (CD3*CD8^CD4-CD45*)19-350,372-0,974Т-хелперы активированные/памяти
{CD4*CD45R0’CD45RA*CD45*}5-250.068-0.702Т-хелперы наивные (CD4*CD45RA*CD45R0-CO45^)20^00,272-1.123ар-Т-клетки (CD3*ap-TcR*75-TcR-CD45")60.8-80,20,924-1,9647&-Т-КЛЄТКИ (CD3*76"TcR*0Cp TcR’CD45*)1,8-7,40,022-0,115T-NK-клетки (CD16 CD56‘CD3*CD45*)0.5-6,00,007-0.165Т-клетки актив. {CD3*HLA‘DR*CD25"CD45")0,5-6,00,007-0,165Регуляторные Т-кпетки {CD4*CD25‘"''f'"CD127'"‘*'CD45*)0,6-1.10,009-0,078Индекс соотношения(Т-хел п е рыЯ-цитотоксическив)1,5-2.6Таблица 3-7. Интервалы распределения содержания малых субпопуляций лимфоцитов в пери¬
ферической крови взрослых, практически здоровых доноров относительно основных популяций
лимфоцитовСубпопуляцииСодержание клеток, %В-1-клеткиОтносительно общих4.1-17,5В-2-клеткиВ-клеток82,1-96,3В-клетки памяти22.8-39,7у5-Т-клеткиОтносительно общих1,7-12,6а|3-Т клеткиТ-клеток87,2-98,4
Р>Ол<Л<»^®Х ,.О)«■> ■•>■•>'*)0'
0)О>ед«0>ФЫ»><т>0>o>e>'•»'•<•>(Ы<»п.-ім»Латексагглютинаціїя 1©0груППы крови
X 4 т -т w.’wh^ • тЗависншсть интенсивности
латексной агглютинации от
концентрации аналита(!.} -. '#)
•» <г; Л-. »>:■<№Увеличенное нгображение лунокс
выявленной агглютинацией или
неодюродностью (HHCTpyNenT «лупа-’)Рис. 3-4. Схема ОСНОВНОГО рабочего окна программ сканерной системы «Эксперт-Лаб».А8 (8) ІЕ] А9 (9) ША8 (8) иА9 (9) Ш)(Рис. 3-6. Лунки с тестируемыми положительными (А8) и отрицательными (А9) сыворотками:
а — до программной обработки; б — после контрастирования: в — визуальное представление
результатов математической обработки, отражающее количество конгломератов.
Определяемый аналитРезультат реакции агглютинации
желатиновых частиц++/--Антитела к Тг. pallidumПШВЯШЖ5Антитела к HCV5їГ ^Антитела к HTLVРис. 3-9. Изображения положительных (+), отрицательных (-) и сомнительных (+/-) результатов
определения антител к 7л. pallidum, HCV и HTLV в тесте агглютинации желатиновых частиц фирмы
Serodia.г руппаЦоликлоныГ руппаЦоликлоныанти-Аанти-Ванти-А анти-В0(1)В (III)ШЗЯЙР: ЛСЯЬЖЕГ' jaА (II)шжи^ ~ лШЖВИ. лАВ (IV)шшRh(-)ПК : ■ аRh (+)Цоликлон анти-DЦоликлон анти-DРис. 3-10. Гемагглютинация в лунках круглодонного планшета при определении групп крови с
помощью цоликлонов.
ш\ 'f8 9 102«ro 2.44 7.60 4.09 ^t4 3^ 1.7Э 4.ЄЗІГооЩ:z£06.Ю;som9.01 г?4 гм гіо tea гм г.041.14 2.05 R.60 26.8$ 4.01 1.33 1.7616.93 гао 3.12 9.13 High 3.22 2.S3>rnJK2.69 2.31 3.54 4.09 1.87 гб6 28.036.26 2.15 гб8 3^1 3.1S гі9 1.843.31 3.54 3.33 6.14 324 4.03 6.96329 227 13.06 42S 1Л iS2 rtgh <113.41 5.117.14 1J3
0.525j01 3.372.64 гобH»gh 6.49
>mtK4.14 3.539.56 гі911 126.64 2.8917.18 7.484.03 4.680.95 3.063.38 3.143.10 1.622.56 5.454.63 7.45 ; ; :—г*г-;—^КалибровочнаякриваяКонцентрацииопределяемогоаналитаРис. 3-11. Калибровочная кривая и значения концентрации общего ПСА, рассчитанные при
использовании линейно-кусочной аппроксимации.ІІІ чИ X!1 *-'1 ІІ-Ut201 110-г 6КомпьютернаяинтерпретациярезультатовПервичноеизображениеРис. 3-13. Окно программы «Эксперт-Лаб-Видеодот» после построения калибровочной кривой и
введения пороговой величины.
Рис. 3-15. Схема канала прямого светорассеяния.©Бомово»Рис. 3-16. Схема канала бокового светорассеяния.Рис. 3-30. Стадии реакции ПЦР с детекцией результатов в режиме реального времени.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 129Окончание табл. 3-7СубпопуляцииСодержание клеток, %Регуляторные Т-клеткиОтносительно1,65-5,75Т-хелперовQ[)1g*(orhigh)QQ56difn мк-кпетки цитолитическиеОтносительно общих2,5-6,25Cdi6-<"'hcD56'’"”''' NK-кяетки цтокинпродуцирующиеNK-клеток93,75-97,5Таблица 3-8. Сравнение полученных авторами интервалов распределения основных субпо-
пуляций лимфоцитов в периферической крови взрослых здоровых людей с литературными
даннымиСубпопуляцииZiltovec Lepej
s. et al.(2003)
n=50Pope V. ei al.
(1994)
n=246Comans-Bitter
WJVI. et aL
(1997) n=51ТотолянААидр.(1999)Хайдуков С.В^
Звонка А.В^
Тоталян АЛ
(№356)Т-лимфоуиты {CD3")73,3 (59,0-88,2)72,1 (54-85)72 (55-83)70 (60-80)73 (61-85)Т-хелперы
(CD3*. CD4*)43,8 (34,9-64,3)44,1 (32-58)44 (28-57)41,5(33-50)45 (35-55)Т-цитотоксические
(CD3*, CD8")23,9 (11,0-37,1)31,2 (19-44)24 (10-39)27,5(16^9)27 (19-35)Т-активированные
(CDЗ^ HLA-DR*)В-лимфоцу|ты (GDI9*)1.9 (0,5-25,9)Нет данных5(2-12)Нет данных3 (0,5-6)9,7 (4,4-26,4)13,3 (6-23)12 (6-19)13,5 (5-22)12(7-17)NK-клбтки
(CD3-, СР16%СР56^3,9 (0,4-19,3)12,2 (5-23)13(7-31)11,5 (3-20)15 (12-18)Литературные источники свидетельствуют о близости референтных интервалов рас¬
пределения основных субпопуляций клеток иммунной системы практически здоровых
людей в разных местах проживания (табл. 3-8). Однако остается открытым вопрос о
нормах, связанных с региональными особенностями отдельных областей и этни¬
ческими группами населения Российской Федерации. Развитие проточной цито¬
метрии в России привело к широкомасштабному применению оценки основных
субпопуляций лейкоцитов и их активационных маркеров в клинической практике,
причем не только в целях выявления количественных дефектов этих клеток, но и
для диагностических целей (диагностики аутоиммунных процессов, септических
состояний и др.). Учитывая насущную необходимость в формировании референт¬
ных интервалов нормативных показателей различных клеточных субпопуляций,
была предпринята попытка регламентации нормативных показателей популяций
и субпопуляций лимфоцитов по их фенотипу. Подобранная оптимальная комбина¬
ция моноклональных антител и использование многоцветового цитометрического
анализа с многоэтапным гейтированием могут служить основой для исследовате¬
лей и врачей-иммунологов при трактовке результатов у пациентов с той или иной
иммунопатологией.Проточная цитометрия для исследования функциональных
особенностей клеток иммунной системыКлеткам иммунной системы присущи определенные функции, которые они
выполняют в ответ на внешние раздражители. Наличие или отсутствие такого
ответа может о многом сказать специалисту, например нейтрофилы как эффек¬
торы играют важную роль в неспецифическом иммунном ответе для обеспечения
резистентности организма, индуцируют и регулируют деятельность различных
130 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯЩ клеток иммунной системы. Нарушение фагоцитарной активности как одной из
^ основных функциональных характеристик нейтрофилов является индикатором
снижения устойчивости организма к инфекционным заболеваниям.5Г Наиболее часто используемые приложения метода проточной цитометрии для^ ^ данного рода исследований — измерение фагоцитарной и бактерицидной актив¬
ности нейтрофилов, мониторинг септического состояния пациентов, измерение
количества клеток, находящихся на различных стадиях программируемой клеточ-
ной гибели, а также определение пролиферативной активности клеток.Определение фагоцитарной активности нейтрофилов и моноцитов.
Изменение фагоцитарной активности нейтрофилов может стать результатом
разнообразных клинических расстройств. Известны врожденные дефекты, такие
как дисфункция актина и дефицит рецептора комплемента СЗЬі. В результате
сниженного фагоцитоза нейтрофилов эти дефекты могут привести к повы¬
шенной восприимчивости к инфекциям, приобретенные дефекты, связанные с
изменением фагоцитарной активности, обнаруживают при травмах, сахарном
диабете, почечной недостаточности и инфекциях. Так, снижение фагоцитарной
активности было обнаружено у пациентов с текущими бактериальными инфек¬
циями кожи и легочного синуса, при инфицировании ран от ожогов, у пациентов
со СПИДом.Процесс фагоцитоза разделяют на несколько стадий: хемотаксис (пере¬
мещение фагоцитов к воспаленным участкам), адгезию (прилипание частиц к
поверхности фагоцитов), собственно фагоцитоз и внутриклеточное уничтожение
фагоцитированных объектов. Использование метода проточной цитометрии и
флюоресцентно меченных частиц (бактерий, дрожжей, латексных частиц) для
измерения стадии собственно фагоцитоза значительно облегчило анализ этой
важной функции нейтрофилов. Однако данный метод не обеспечивал регистра¬
цию различий между частицами, находящимися внутри клеток, и теми части¬
цами, которые могли прикрепиться к их поверхности. Эту проблему удалось
преодолеть путем подавления флюоресценции прикрепившихся снаружи частиц
за счет использования витальных красителей, таких как трипановый синий и
кристаллический фиолетовый.Для регистрации фагоцитарной активности нейтрофилов рядом компаний были
разработаны коммерческие наборы, которые с успехом применяются в настоящее
время. В частности, к ним относится PHAGOTEST® компании ORPEGEN Pharma
(Германия), который позволяет количественно определить фагоцитарную актив¬
ность нейтрофилов. Измеряется процент фагоцитов, поглотивших бактерии, и их
активность (количество бактерий в клетке).Анализ кислородного взрыва, Нейтрофилы играют важную роль в неспеци¬
фическом иммунном ответе и резистентности организма, нейтрализуя чужеродные
объекты. Поглощенные микроорганизмы уничтожаются за счет как зависимых,
так и не зависимых от кислорода механизмов. Свободные радикалы кислоро¬
да убивают поглощенные бактерии в фагосомах и частично высвобождаются в
окружающую среду, с одной стороны, усиливая уничтожение микроорганизмов,
а с другой — повреждая окружающие ткани. Этот эффект получил название
окислительного, или кислородного, взрыва. Данный процесс усиленно протекает
при остром воспалении и в меньшей степени при хроническом течении болезни.
Уничтожение микроорганизмов также возможно за счет белков в азурофильных
гранулах, таких как катепсин G, лизоцим, интерфероны и др.Снижение или отсутствие кислородного взрыва наблюдается при врожденных
дефектах, например хроническом гранулематозе. Данное заболевание обычно
проявляется в течение первых двух лет жизни и характеризуется клинически
повторяющимися и опасными для жизни инфекциями, вызванными бактериаль¬
ными и грибковыми микроорганизмами. Эти инфекции клинически проявляются
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 131как пневмонии, лимфадениты или абсцессы, которые затрагивают лимфатические
узлы, легкие и печень. Одну из ведущих ролей при этом играет НАДФН^-оксидаза,
которая представляет собой систему ферментов, ответственных за продукцию
супероксид-анионов, которые быстро преобразуются в перекись водорода и
гидроксильные радикалы. Нарушения структуры основных пептидов НАДФН"^-
оксидазы являются главной причиной дисфункций при хроническом гранулемато-
зе, так как нейтрофилы у данных пациентов не могут осуществить значительный
окислительный взрыв после активации. Данные нарушения наблюдаются также
при трансплантациях и у пациентов со СПИДом,Коммерческие наборы для измерения кислородного взрыва, так же как и для
измерения фагоцитарной активности, присутствуют на рынке. Процедура изме¬
рения фагоцитоза представляет собой многоэтапный и многофакторный процесс,
специалист должен контролировать его на всех этапах. Высокая производитель¬
ность современных цитометров и большие выборки анализируемых клеток делают
этот метод более достоверным по сравнению с микроскопией.Мониторинг септического состояния. Достаточно часто нарушения фаго¬
цитарной активности и окислительного взрыва наблюдаются при септическом
шоке. Исследование его патогенеза все более сосредоточивается на роли иммун¬
ной системы, поскольку изменения ее функций являются главным фактором
риска для развития серьезных инфекций у пациентов, которые подвергались
хирургическому вмешательству. Так, многочисленные отклонения механизмов
иммунной защиты возникают у тяжелобольньЕх пациентов в послеоперационном
периоде. К ним относятся понижение экспрессии макрофагами антигенов глав¬
ного комплекса гистосовместимости класса II (HLA-DR), измененная активация
Т-клеток, пониженный хемотаксис и фагоцитоз нейтрофилов. Данные нару¬
шения были описаны также при раневой инфекции и травмах. Снижение экс¬
прессии HLA-DR связывают с усилением продукции IL-10, поскольку сыворотка
пациентов с сепсисом снижает экспрессию HLA-DR, а моноклональные антитела
к IL-10 блокируют этот эффект. Активно влияют на снижение экспрессии HLA-
DR'антигенов и глюкокортикоиды. Таким образом, снижение экспрессии моно¬
цитами HLA-DR-антигенов, которые играют критическую роль в представлении
антигена Т-хелперам, является признаком развивающейся инфекции в послео¬
перационном периоде, а анализ экспрессии HLA-DR в течение первых двух дней
после операции может служить основанием для применения более раннего тера¬
певтического вмешательства.Клинические и экспериментальные данные свидетельствуют о том, что паци¬
енты с низкой экспрессией HLA-DR на моноцитах должны получать терапию с
использованием иммуномодуляторов, таких как интерферон у, растворы, обо¬
гащенные глутамином, гликопептиды, содержащие мурамил, и другие препараты
для стимуляции иммунной системы.Все перечисленные выше данные привели к тому, что была предложена мето¬
дика мониторинга септического состояния пациентов с открытыми травмами в
послеоперационном периоде.Принцип оценки септического состояния заключается в измерении экспрессии
HLA-DR-антигенов на поверхности моноцитов, для этого используют цельную
периферическую кровь (рис. 3-23). Анализ проводят на двух окрашенных образ¬
цах, один из которых является контрольным. Для локализации моноцитов при¬
меняют CD 14, рецептор эндотоксина липополисахарид (LPS), являющийся одним
из основных маркеров для моноцитов. Экспрессию HLA-DR измеряют с помощью
многопараметрического анализа и сравнивают с контрольным образцом, где вме¬
сто моноклональных антител к HLA-DR применяют неспецифические антитела
того же изотипа.
ш132 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯРис. 3-23. Гистограмма распределения моноцитов в зависимости от экспрессии HLA-DR-антигенов;
а — гистограмма пациента с нормальной экспрессией молекул HLA-DR на моноцитах перифери¬
ческой крови; б — гистограмма больного с сепсисом на 10-е сутки от начала заболевания.Критерием оценки состояния пациента при сепсисе служит относительное
количество моноцитов, экспрессирующих HLA-DR; прогноз благоприятен, если
количество позитивных клеток превышает 40% на 5-й день после госпитализации
и проведения соответствующей терапии. Данный критерий был получен на госпи¬
тализированных пациентах с септическим шоком. В первые 48 ч госпитализации
экспрессия HLA-DR на моноцитах значительно снижена у пациентов с сепсисом
(25±4%) по фавнению со здоровыми донорами (89±1%). Экспрессия HLA-DR на
моноцитах выживших пациентов в первые 48 ч после госпитализации не отлича¬
ется от этого показателя у больных, впоследствии погибших. Однако экспрессия
HLA-DR на моноцитах у оставшихся в живых пациентов на 5-й день госпита¬
лизации более выраженная (выше 40%), что свидетельствует о восстановлении
иммунного статуса.Таким образом, в период разгара септического состояния более 50% популяции
моноцитов не экспрессируют HLA-DR-молекулы на своей поверхности. В период
клинической ремиссии заболевания экспрессия данных молекул восстанавлива¬
ется практически до нормальных значений. Данный показатель может служить
дополнительным критерием диагностики сепсиса и оценки эффективности прово¬
димых лечебных мероприятий. Процедура оценки дефекта презентации антигена
доступна для использования практически в любой клинической лаборатории, обо¬
рудованной проточным цитометром.Таким образом, использование метода проточной цитометрии для оценки функ¬
ционального состояния фагоцитов, включая их отдельные субпопуляции, не имеет
технических препятствий в клинической практике. Метод применим для оценки
функций клеток при различных патологиях, в основе которых лежат механизмы
нарушения фагоцитоза.Оценка апоптоза методом проточной цитометрии. Апоптоз является про¬
явлением физиологического процесса — генетически запрограммированной кле¬
точной смерти, естественной, закономерной. Апоптоз включает несколько этапов:
во-первых, получение клеткой экзогенного (внешнего, рецепторного) или эндо¬
генного (нерецепторного) сигнала, запускающего процесс апоптоза; во-вторых,
характерную для многих биологических процессов каскадную активацию внутри¬
клеточных белков, реализующих программу апоптоза (инициирующих и эффек-
торных каспаз), которая регулируется множеством про- и антиапоптогенных
белков; в-третьих, деструктуризацию жизненно важных для функционирования
ШІШВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 133клетки белковых субстратов, «запуск» ядерных эндонуклеаз, деградацию ДНК до
олигонуклеосомных фрагментов и формирование «апоптозных телец» с после¬
дующим их удалением путем фагоцитоза.В базовых руководствах по иммунологическим методам выделяют следующие
цитометрические методы документации апоптозаг идентификацию характерных
для апоптотирующих клеток изменений мембраны; идентификацию изменений
структуры и содержания ДНК. К сожалению, большинство этих методов не позво¬
ляют использовать цельную кровь, что важно при клинических исследованиях.Развитие апоптоза уже на ранних этапах сопровождается снижением активности
-зависимой аминофосфолипидтранслоказы, что приводит к нарушению фос-
фолипидной асимметрии мембраны и появлению фосфатидилсерина на наружном
слое мембраны. Использование меченного флюорохромами (как правило, FITC)
антикоагулянта аннексина V (Ап V), который специфически связывается с фосфа-
тидилсерином в присутствии ионов Са^", и последующая цитометрия обеспечива¬
ют четкую идентификацию клеток, уходящих в апоптоз. Использование многопа¬
раметрического анализа и одновременное докрашивание клеток красителями для
нуклеиновых кислот, которые не проникают в живые клетки, например йодидом
пропидия (PI), позволяют дифференцировать клетки, находящиеся в ранней фазе
апоптоза (Ап У'РГ), позднем апоптозе (Ап У"РГ), и мертвые клетки (Ап V'PI*)
(рис. 3-24). Весьма ценной является возможность одновременной оценки экспрес¬
сии мембранных маркеров и окрашивания Ап V, что позволяет охарактеризовать
популяцию апоптотирующих клеток.Довольно распространенными являются методы, основанные на окрашивании
клеток ДНК-флюорохромами, что связано с простотой выполнения, невысокими
затратами и возможностью длительного хранения клеток. Чаще всего используют
йодид пропидия и 7-аминоактиномицин D (7-AAD). В этом случае клетки фикси¬
руют этанолом, что обеспечивает, с одной стороны, вымывание низкомолекуляр¬
ных фрагментов ДНК, с другой — фиксацию клеток. Затем клетки окрашивают
флюорохромом в присутствии РНКазы и в процессе цитометрии выявляют так
называемый гиподиплоидный (суб-Gl) пик на гистограммах. Существенным
недостатком данного подхода является довольно низкая точность идентифика¬
ции апоптоза, однако он оптимален для скрининговых исследований, требующих
анализа большого количества проб и характеризуется хорошей воспроизводимо¬
стью.103Рис. 3-24 Гистограмма распределения
клеток при одновременном окрашива¬
нии Р1 и Ап V; квадрант Е1 — некроти¬
ческие клетки; квадрант Е2 — некро¬
тические клетки и поздние стадии
апоптоза; квадрант ЕЗ — живые клет¬
ки: квадрант Б4 — ранние стадии апоп¬
тоза.1025: 10ІЕ2
21.1%. -л л .■ “'""liob ' ‘ ’’’’"liOfZ ' Vo3AnnexinVFITC
134 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯТест на аллергическую реакцию. Продолжительное время работы по лока-
лизации и анализу базофилов находились вне области применения проточной
цитометрии, что было связано с незначительным содержанием этих клеток в пери-
, ферической крови (до 0,5%). Однако существует целый ряд специфических пара-
метров, которые можно измерить на базофилах. Это прежде всего мембранный IgE
^ экспрессия CD63-молекулы. Анализ мембранного IgE представляет достаточно
' сложную задачу вследствие значительных различий его экспрессии у отдельных
pz'/ индивидуумов, в связи с этим недавно описанные маркеры базофилов заняливажное положение среди используемых параметров для анализа аллергической
реакции in vitro — это CD203c и CD294 (CRTH2).Существенное место в процессе активации базофилов занимают такие антиге¬
ны, как CD63 и CD203C. Они отличаются своей экспрессией и местоположением
в клетке. CD63 находится внутри клеток на мембране гранул, которые содержат
гистамин, лейкотриены и цитокины. После стимуляции аллергеном происходит
дегрануляция клеток и CD63 оказывается на поверхности базофилов. Напротив,
CD203C является мембранным антигеном. При активации базофилов аллерге¬
ном экспрессия СВбЗ-молекул увеличивается на 100%, тогда как экспрессия
С0203с-рецепторов возрастает на 350%. Таким образом, определение CD203c-
рецептора является наиболее информативным маркером для анализа активации
базофилов.CD294 может экспрессироваться на базофилах и одновременно на ТЬ2-клетках,
поэтому, если локализовать путем гейтирования зону мононуклеаров, фенотип
базофилов можно описать как CD294'CD3‘, тогда как активированные базофилы
будут иметь фенотип CD3‘CD294^CD203c'.При активировании базофилов in vitro в многопараметрическом анализе можно
увидеть значительное повышение экспрессии молекулы GD203C на их мембране
относительно контрольных образцов.Для активации базофилов ш vitro, как правило, используют агенты, активирую¬
щие максимальное количество базофилов, — это анти-IgE, анти-FceRI или синте¬
тический пептид FMLP {Formyl Methionyl-Leucyl Phenylalanine). В ходе анализа в
дальнейшем используют различные аллергены. В настоящее время разработаны
наборы, предназначенные для идентификации покоящихся и активированных
базофилов. Они содержат все компоненты, необходимые для проведения анализа,
за исключением аллергенов (исследователи, как правило, сами подбирают необхо¬
димый набор аллергенов в зависимости от аллерг№іеского анамнеза пациента).Использование данного подхода предоставило недоступную ранее возможность
определять сенсибилизацию к аллергенам, например лекарственным препаратам,
выявлять не связанные со специфическим IgE-ответом аллергические состояния,
диагностировать и дифференцировать псевдоаллергические реакции.Таким образом, появление методов, позволяющих объективно оценивать
функциональные параметры клеток в процессе их активации и пролиферации,
выделяя среди совокупности всех лейкоцитов отдельные субпопуляции, значи¬
тельно расширяет возможности лабораторного анализа в клинической практике.
Эти возможности способствуют появлению надежного инструмента для диагно¬
стики заболеваний, в основе которых лежат механизмы повреждения иммунного
гомеостаза организма. Формирование же нового подхода к диагностике дефектов
иммунной системы влечет за собой и изменение обоснований для этиотропной и
патогенетической иммунокорригирующей терапии.СПИСОК ЛИТЕРАТУРЫВопросы современной проточной цитометрии. Клиническое применение / Под ред.
С.В. Хайдукова, А.В. Зурочки. - Челябинск: Челябинская государственная медицинская
академия, 2008. — 196 с.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 135Клиническая аллергология и иммунология: Руководство для практикующих врачей / Под
ред, л.А. Горячкиной, К.П. Кашкина. — М.: Миклош, 2009. -432 с,Клиническое руководство по лабораторным тестам: Пер. с англ. / Под ред. Н. Тица. — М.:
ЮНИМЕД-пресс, 2003. - 960 с. JЛуговская С.А., Почтарь М.Е., Тупицыи Н.Н. Иммунофенотипирование в диагностике
гемобластозов. — М.; Тверь; Триада, 2005. — 168 с.Хайдуков С.В., Зурочка А.В. Расширение возможностей метода проточной цитометрии
для клинико-иммуиологической практики // Мед. иммунология. - 2008. - № 10 (1). -
С. 5-13.Хайдуков С.В., Зурочка А.В., Тотолян А.А., Чсрешнев В.А. Основные и малые популя¬
ции лимфоцитов периферической крови человека и их нормативные значения (методом
многоцветного цитометрического анализа) // Мед. иммунология. — 2009. - № 11 (2-3). —С. 227-238.Clinical Immunology: Principis and Practice. 3rd ed. / Ed. R.R. Rich et al. - MOSEY, 2008. --
157S p.Janevays, Immunobiolog}^ 7th ed, / K. Murphy, P. Travers, M. Valport. — Garland Science,2008. - 887 p.Practical Immunology. 4th ed. / RC. Hay. O.M.R. Westwood. - Blackwell, 2003. — 400 p.WHO Scientific Group: Primary immunodeficiency diseases // Immunodeficiency Rev. —1992. - Vol. 3. - P. 195-236.ИММУНОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗАИммунохимические методы анализа, основанные на специфическом связыва¬
нии определяемого соединения соответствующими антителами, широко вошли
в аналитическую практику и используются в различных областях медицины.
Индикация образующегося комплекса «антиген-антитело» может быть осущест¬
влена, если в один из исходных компонентов реакционной системы ввести метку,
которая легко детектируется соответствующим высокочувствительным физико¬
химическим методом. Удобными для этой цели оказались изотопные, фермент¬
ные, флюоресцентные, парамагнитные и другие метки, использование которых
дало возможность увеличить чувствительность классических иммунохимических
методов анализа в миллионы раз. Иммунохимические методы анализа можно
использовать в диагностике заболеваний сердечно-сосудистой, эндокринной и
других систем, для установления причин бесплодия, нарушения развития плода, в
онкологии — для определения маркеров опухолей и контроля за эффективностью
лечения, для определения концентрации в крови иммуноглобулинов, ферментов и
лекарственных веществ. В ряде случаев исследования выполняют на фоне нагру¬
зочных функциональных проб (например, определение содержания инсулина в
сыворотке крови на фоне пробы на толерантность к глюкозе) либо в динамике
(например, определение в крови половых гормонов на протяжении менструаль¬
ного цикла).Иммуноферментный методИммуноферментный анализ (ИФА) — вид иммунохимического анализа,
основанный на высокоспецифической иммунологической реакции антигена с
соответствующим антителом с образованием иммунного комплекса, для выяв¬
ления которого используют в качестве метки фермент или ферментзависимое
вещество.ПРИНЦИП МЕТОДАВ основе метода ИФА лежит оценка результатов иммунной реакции антигена с
антителом. Полученный комплекс определяется следующим образом: в реакцион-
136 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯную смесь вводят конъюгат, который включает ферментную метку, а также добав¬
ляют специальный хромогенный субстрат. Фермент, взаимодействуя с субстратом,
изменяет его окраску. Учет результатов проводят фотометрически.ХАРАКТЕРИСТИКИ И НАЗНАЧЕНИЕ ТЕСТ-СИСТЕМВ современной лаборатории исследования методом ИФА проводят с использо¬
ванием коммерческих тест-систем. Основными характеристиками тестов являются
чувствительность и специфичность.Под гувствительностью понимается процент выявленных тест-системой пози¬
тивных образцов из массива положительных образцов, где все результаты были
подтверждены, например сероконверсионные панели позитивных контрольных
сывороток. Таким образом, чувствительность тест-системы является показателем
вероятности появления ложноотрицательного результата. Ложноотрицательный
результат — отрицательный результат, полученный в данной тест-системе для
образца, являющегося на самом деле положительным.Под специфигностъю понимается процент выявленных негативных образцов
из панели негативных контрольных сывороток. Таким образом, специфичностью
тест-системы является показатель вероятности появления ложноположительного
результата, т.е. положительный в данной тест-системе результат, полученный для
образца, являющегося на самом деле отрицательным.Кроме подразделения тест-систем по исследуемому показателю (инфекционной
диагностике, исследованию эндокринной системы, определению онкомаркеров
и др.), тесты делятся на группы по своему целевому назначению. Так, например,
применительно к диагностике инфекционных заболеваний тест-системы подраз¬
деляются:• на скрининговые, призванные при первичном обследовании выявлять инфи¬
цированных;• диагностигеские, используемые при обследовании больных, у которых подо¬
зревается или имеется определенная инфекция;• подтверждающие, используемые как дополнительные после получения поло¬
жительных результатов скринингового или диагностического теста;• тесты для мониторинга (оценка эффективности проводимой терапии).ПРЕАНАЛИТИЧЕСКИЙ ЭТАП
Подготовка пациентаНеправильное выполнение этих процедур является одним из основных источ¬
ников (до 20%) ошибок на преаналитическом этапе, поэтому процедура взятия
крови и других образцов в инструкции для персонала должна быть описана всесто¬
ронне, включая идентификацию образца, детальное описание технологии и био¬
логическую безопасность. Условия подготовки пациента удобно отражать в виде
памятки в направлении на анализ, где следует указать ошибки и рекомендации при
взятии венозной крови — основного материала для ИФА-исследований.В инструкции по качеству проведения преаналитического этапа необходимо
четко прописать условия взятия биологического материала для исследования.
Следует учитывать, что на результаты исследования влияет набор биологических
факторов, которые описывают состояние организма.БеременностьТрактуя результаты лабораторных исследований у беременных, необходимо
учитывать срок беременности в момент взятия пробы. При физиологической бере¬
менности средний объем плазмы возрастает примерно от 2600 до 3900 мл, причем
в первые 10 нед прирост может быть незначительным, а затем происходит нарас¬
тающее увеличение объема к 35-й неделе, когда достигается указанный уровень.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 137Объем мочи также может физиологически увеличиваться до 25% в III триместре.
В последнем триместре наблюдается 50% физиологическое повышение скорости
клубочковой фильтрации. Хорошо известные свойственные беременности изме¬
нения выработки и концентрации в плазме половых гормонов сопровождаются
изменениями различных аналитов, например тиреоидных гормонов.Влияние суточных колебанийНекоторые компоненты подвержены влиянию суточных колебаний. Так, содер¬
жание кортизола возрастает в течение дня и снижается ночью (табл. 3-9).Таблица 3-9. Суточные колебания содержания некоторых аналитов в сыворотке кровиАналитМаксимальная
концентрация, чМинимальная
хонцентраімія, чАмплитуда, % средней
за суткиАКТГ6-100^150-200Кортизол5-821-3180-200Тестостерон2-420-2430-50тег20-27-135-15т.8-1223-310-20ПГ21-231-21300^00Пролактин5-710-1280-100Альдостерон2-412-1460-80Ренин0-610-12120-140Адреналин9-122-530-50Циркадный ритм может изменяться под влиянием индивидуальных ритмов —
еды, сна, физической активности. Эти влияния не следует путать с действительно
циркадными колебаниями.Влияние фазы менструального циклаСтатистически значимые изменения концентрации могут быть вызваны колеба¬
ниями гормонального фона при менструации. Так, концентрация альдостерона в
плазме определяется в два раза выше перед овуляцией, чем в фолликулярной фазе.
Подобным образом ренин может проявить предовуляторное повышение.Употребление лекарств. Диагностические и лечебные мероприятияПри подготовке обследуемых к биохимическим исследованиям приняты сле¬
дующие подходы:• лекарства, мешающие определению компонентов, исключают до взятия био¬
материала, если их дают не по жизненным показаниям;• утренний прием лекарств проводят только после взятия биоматериала:• взятие крови с диагностической целью проводят перед инфузией лекарств и
растворов.Таблица 3-10. Препараты, оказывающие существенное влияние на результаты лабораторных
исследованийПрепаратыИсследованияВлияниеТироксинПГСнижениеТ.ПовышениеФенотиазиныTj, щелочная фосфатазаПовышениеЭстрогеныТироксин, щелочная фосфатазаПовышениеАлкогольЩелочная фосфатаза, кортизолПовышение
138 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯЗагрязнение лабораторных проб инфузионными растворами является самой
обычной и часто встречаемой формой преаналитической интерференции в боль¬
ницах. Рекомендуют информировать лабораторию, когда и какое вливание было
проведено пациенту и когда бьЕла взята проба крови.Пробу крови никогда не следует брать из сосуда, расположенного проксимально
месту инфузии. Пробы следует брать из вены другой руки, в которую не проводили
вливание.ДиетаПосле приема пищи содержание отдельных продуктов обмена в крови может
повышаться или подвергаться изменениям в результате постабсорбционных гор¬
мональных эффектов. Определение других аналитов может затрудняться вслед¬
ствие мутности, вызванной хиломикронемией в послеобеденных пробах крови.
Для того чтобы исключить влияние данных факторов, рекомендуют соблюдать
8-12-часовой период голодания перед взятием проб для лабораторного исследо¬
вания.Психический стресс и физическая активностьСтепень влияния психического стресса (страха перед взятием крови, предо¬
перационного стресса и т.д.) на лабораторные результаты часто недооценивается.
Между тем под его влиянием может наблюдаться увеличение секреции гормонов
(альдостерона, ангиотензина, катехоламинов, кортизола, пролактина, ренина,
соматотропина, ТСГ, вазопрессина), а также повышение других показателей (аль¬
бумина, фибриногена, глюкозы, инсулина, лактата и холестерина).Состояние физической активности обследуемого оказывает большое влия¬
ние на результаты. При длительном строгом постельном режиме и ограничении
физической активности повышается экскреция с мочой норадреналина, кальция,
хлора, фосфатов, аммиака, повышается активность щелочной фосфатазы в сыво¬
ротке крови.Таким образом, для объективного лабораторного анализа необходимо доби¬
ваться стандартизации подготовки пациента перед взятием клинического мате¬
риала.ВЗЯТИЕ ПРОБ У ПАЦИЕНТАРекомендации по условиям взятия крови и других биожидкостей для лабора¬
торного исследования методом ИФА следующие.1. По возможности пробы следует брать между 7 и 9 ч утра.2. Взятие проб следует выполнять через 8-12 ч после последнего приема пищи.3. Взятие проб следует выполнять до диагностических и лечебных процедур,
способных оказать влияние на результаты теста.4. В случае проведения лекарственного мониторинга следует учитывать пик
концентрации после введения лекарственного препарата и фазу устойчивого
состояния перед введением следующей дозы препарата.5. Период воздержания от приема алкоголя должен быть не менее 24 ч до взятия
биожидкости.6. кровь для исследования на вещества, концентрация которых в крови изме¬
няется циклически, следует забирать в строгом соответствии с физиологиче¬
скими циклами. Например, оценка уровня ФСГ и ЛГ привязывается ко дню
менструального цикла.7. Для исключения влияния изменения положения тела обследуемый должен
находиться в покое, сидеть или лежать не менее 5 мин.8. При динамическом наблюдении за пациентом взятие материала нужно про¬
водить в идентичном положении тела.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 1399. Сдавление сосудов (вен) при наложении жгута (манжеты) при взятии крови
должно быть минимальным и не превышать 1 мин.10. Всегда следует отмечать точное время взятия пробы в соответствующих
документах.ТРАНСПОРТИРОВКА ОБРАЗЦОВ. ВЛИЯНИЕ ВРЕМЕНИ И ТЕМПЕРАТУРЫПолученная кровь должна быть своевременно доставлена в лабораторию.
Согласно рекомендациям практически всех компаний — производителей иммуно-
ферментных тест-систем, необходимо не позже 1 ч после взятия крови отобрать из
нее сыворотку. Б табл. 3-11 приведены временные интервалы, рекомендованные
при проведении процедуры пробоподготовки.Таблица 3-11. Требования ко времєни выполнения некоторых преаналитических этапов для имму¬
нологических исследований'ШШФШ'ПроцедураВремя выполненияЦентрифугирование для получения сывороткиНе позднее чем через 1ч после взятия кровиЦентрифугирование охлажденной крови30-90 мин после взятия из холодильникаЦентрифугирование в пробирках с ускорителями
свертывания крови5-15 минЦентрифугирование в пробирках с антикоагулянта¬
ми для получения плазмы Возможно немедленно после взятия кроеиОтделение сыворотки от сгустка во вторичную
(транспортную) пробирку после центрифугированияТотчас после центрифугированияВзятие сыворотки из пробирки с гелевым барьеромНе позднее 48 ч после центрифугированияВ пробирках с негелевым барьеромНе позднее чем через 1 чСыворотка, плазма, если нельзя выполнить анализ
8 течение 5 чПоместить биожидкость в холодильник на 24 чРекомендации по условиям хранения и транспортировке биологического мате¬
риала для иммунологических исследований следующие.1. Быстрая транспортировка и короткий срок хранения улучшают достовер¬
ность результатов лабораторных исследований. Следует избегать хранения
цельной крови. Пробы крови должны быть доставлены в лабораторию в
течение 45 мин после взятия крови, чтобы центрифугирование и разделение
пробы было выполнено в течение 1 ч.2. образцы и пробы сохраняются тем лучше, чем ниже температура их хранения.3. Образцы и пробы всегда следует хранить в закрытых сосудах (испарение!).
Испарение/сублимация приводят к заметному повышению концентрации/
активности всех нелетучих компонентов. Это особенно выражено, когда
объем пробы относительно небольшой, а площадь поверхности относитель¬
но велика. Опасность испарения существует и в холодильниках (конденсация
влаги на охлаждающих элементах).4. Проблемы хранения уменьшаются при использовании одноразовых систем
для сбора проб.5. Разделительные элементы (например, разделительные гели) улучшают выход
сыворотки/плазмы и позволяют оставлять сыворотку в первичных пробир¬
ках над сгустком.6. Избегают встряхивания сосудов с пробами (системы пневматической достав¬
ки пробирок!): риск гемолиза увеличивается,7. Всегда хранят сосуды с кровью в вертикальном положении. Избегают воз¬
действия света.8. Маркируют инфицированный материал и обращаются с ним с особой осто¬
рожностью.
140 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯСТАНДАРТНАЯ КОМПЛЕКТАЦИЯ ИФА-НАБОРАИФА-набор, как правило, включает все необходимые для анализа реагенты,
обычно на 96 определений.В набор, как правило, входот следующие реагенты.• Стандарты (если это набор для количественного ИФА), 5-7 растворов с раз¬
личными концентрациями определяемого аналита.• Конъюгат (готовый раствор или концентрат), содержащий антитела или
антиген с ферментной меткой.• 96-луночный микропланшет с иммуносорбентом, упакованный в алюминие¬
вую фольгу с осушителем.• Концентрат промывочного буфера.• Субстратно-хромогенный реактив — монореагент или состоящий из двух
компонентов: раствора А, обычно содержащего тетраметилбензидин (ТМБ)
в буфере, и раствора В — перекиси водорода в буфере.• Стоп-раствор, чаще всего это раствор соляной кислоты.• Контрольная сыворотка (одна или несколько). В некоторые наборы реаген¬
тов контрольные сыворотки не входят, их заказывают отдельно.В набор могут дополнительно входить реагенты для разведения образцов,
конъюгата, субстрата, стандарта.ТВЕРДОФАЗНЫЙ ИФА В МИКРОПЛАНШЕТНОМ ФОРМАТЕОбъектом исследования в формате ИФА могут быть как антигены, так и анти¬
тела. В схемах ИФА для определения антигенов в качестве последнего могут
выступать антиген возбудителя инфекции, регуляторный белок или гормон,
онкомаркер или другое соединение, обладающее иммуногенной активностью,
которое должно быть определено в образце. Существует множество модификаций
метода ИФА, но наибольшее распространение получил гетерогенный (твердофаз¬
ный) ИФА в микропланшетном формате. Б качестве твердой фазы используется
поверхность лунок полистиролового микропланшета, на которую адсорбированы
входящие в состав тест-системы известные антигены или антитела. Антиген или
антитело, иммобилизованное на поверхности твердого носителя, принято назы¬
вать иммуносорбентом. В ходе высокоспецифической реакции иммуносорбента с
определяемыми в исследуемом образце антителами или антигенами образуются
иммунные комплексы, которые также оказываются фиксированными на твердой
фазе. Субстанции, не участвующие в реакции, и избыточное количество реагентов
удаляются при многократной промывке. Такая схема позволяет упростить процесс
разделения компонентов реакции.В настоящее время получили распространение тест-системы с использованием
стрептавидина и биотинилированных моноклональных антител. В этом случае
стандарты, контроли и пробы пациентов сначала добавляют в микроячейки,
покрытые стрептавидином. Стрептавидин отдаляет реакцию от поверхности
плашки, создавая эффект взаимодействия «антиген-антитело» в объеме, а не на
поверхности, тем самым увеличивая чувствительность диагностической систе¬
мы. Затем добавляют биотинилированные антитела (смесь высокоочищенных
специфических моноклональных антител к различным эпитопам), меченные
ферментом антитела (конъюгат), реагенты перемешивают. Результатом реакции
между различными антителами и определяемым антигеном становится образо¬
вание «сэндвич»'к0мплекса, который связывается со стрептавидином в ячейках.
Несвязавшиеся компоненты удаляются промывкой. После инкубации с субстрат¬
ным раствором и остановки реакции фотометрически определяют оптическую
плотность растворов в лунках. Тест-системы с использованием стрептавидина и
биотинилированных моноклональных антител являются тестами II поколения,
обладают повышенной чувствительностью.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 141ОСОБЕННОСТИ КАЧЕСТВЕННОГО АНАЛИЗАКачественный анализ часто используют при скрининговых исследованиях и
диагностике инфекционных заболеваний. Как правило, для диагностики инфек¬
ций используют два вида серологических реакций:• обнаружение патогенспецифических антител в сьшоротке крови обследуемого;• установление родовой и видовой принадлежности микроорганизма или вируса.В этом случае неизвестным компонентом реакции является антиген. Такоеисследование требует постановки реакции с заведомо известными иммунными
сыворотками.В тест-системах для качественного анализа результат исследования определяет¬
ся при сравнении его оптической плотности с расчетной величиной критической
оптической плотности (ОП^ ^). Для обозначения могут быть использованы
другие термины — или «пороговое значение оптической плотности».Формулу для расчета указывают в инструкции к тест-системе. В расчетеCut-offbiojyr участвовать как усредненные значения оптических плотностей поло¬
жительных и отрицательных контролей, так и оптическая плотность специального
контрольного образца — контроля уровня среза.Если оптическая плотность образца выше, чем Cut-off, образец считается поло¬
жительным на специфические антитела.Очень часто в расчетах необходимо учитывать серую зону. Серая зона — это
диапазон концентраций специфических антител, в который с равной вероятно¬
стью могут попадать как положительные, так и отрицательные пробы (рис. 3-25).
Границу серой зоны указывают в инструкции к тест-системе, как правило, это 10%
пороговой величины. Результаты анализа, попавшие в серую зону, не могут быть
однозначно интерпретированы, для уточнения результата необходимо повторить
исследование с новой сывороткой, полученной через 1-2 нед.Для контроля эффективности лечения важно использовать тест-системы, кото¬
рые позволяют получать результаты в полуколичественном или количественном
вариантах. Для полуколичественного варианта проведения методики рассчиты¬
вают отношение между средней оптической плотностью образца и оптической
плотностью Cut-off. образцы рассматриваются как:• положительные, если отношение более 1,1;• сомнительные, если ±10% Cut-off,• отрицательные, если отношение менее 0,9.Рис. 3-25. Серая зона (качественный анализ).
142 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯРадиоиммунный анализРадиоиммунный анализ (РИА) — метод количественного определения биологи¬
чески активных веществ (гормонов, ферментов, лекарственных препаратов и др.)
в биологических жидкостях, основанный на конкурентном связывании искомых
стабильных и аналогичных им меченных радионуклидом веществ со специфиче¬
скими связывающими системами. Последними чаще всего являются специфические
антитела. В связи с тем что меченый антиген добавляют в определенном количестве,
можно определить часть вещества, которая связалась с антителами, и часть, остав¬
шуюся несвязанной в результате конкуренции с выявляемым немеченым антигеном.
Для метки антител или антигенов чаще всего используют изотоп йода который
имеет период полураспада 60 дней и высокую удельную радиоактивность. Для РИА
выпускают стандартные наборы реагентов, каждый из которых предназначен для
определения концентрации какого-либо одного вещества. Исследование проводят
в несколько этапов: смешивают биологический материал с реагентами, инкуби¬
руют смесь в течение нескольких часов, разделяют свободное и связанное радио¬
активное вещество, осуществляют радиометрию проб, рассчитывают результаты.
Радиоиммунный анализ обладает высокими ч)^вствительностью и специфичностью.
Недостатком метода являются ограничения, определяемые режимом работы с
радиоактивным материалом, и относительно короткий срок годности диагностиче¬
ского набора, что связано с распадом радиоактивной метки.Реакция иммунофлюоресценцииИммунофлюоресценция — комплекс методов флюоресцентного анализа, при¬
меняемых в иммунологии, главным образом в гистохимии, а также в вирусологии,
бактериологии, микологии, паразитологии и т.п. Сочетание иммунохимических
реакций и флюоресцентной микроскопии позволяет выявлять тканевые и клеточ¬
ные антигены, в том числе при аутоиммунных заболеваниях и злокачественном
перерождении клеток, изучать закономерности синтеза антител и идентифициро¬
вать возбудителей многих вирусных и микробных заболеваний.Популярность РИФ объясняется экономичностью, наличием широкого спек¬
тра диагностических наборов, быстротой получения ответа. В настоящее время в
этой реакции используют как поликлональные сыворотки, так и моноклональные
антитела, меченные флюоресцеина изотиоцианатом (ФИТЦ). Для уменьшения
неспецифического свечения фона применяют обработку мазка бычьим сыворо¬
точным альбумином, меченным родамином или голубым Эванса.Чаще всего РИФ используют для быстрого обнаружения возбудителя в патоло¬
гическом материале. В этом случае из исследуемого материала готовят мазок на
предметном стекле, как для обычной микроскопии. Препарат фиксируют метило¬
вым спиртом, ацетоном или другим химическим фиксатором, иногда входящим в
состав диагностического набора. На поверхность фиксированного мазка наносят
меченные ФИТЦ сыворотки или моноклональные антитела (в случае непрямой
РИФ сначала препарат обрабатывают сывороткой против искомого антигена, а
затем мечеными антителами к иммуноглобулинам, использованным на первом
этапе). Поскольку РИФ является разновидностью гетерогенного анализа, один
этап отделяется от другого промывкой.Учет результатов реакции осуществляют с помощью люминесцентного микро¬
скопа, в оптическую систему которого устанавливают набор светофильтров, обе¬
спечивающих освещение препарата ультрафиолетовым или сине-фиолетовым све¬
том с заданной длиной волны. Это заставляет флюорохром светиться в заданном
диапазоне спектра. Исследователь оценивает характер свечения, форму, размер
объектов и их взаимное расположение.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 143Наибольшее распространение полз^или наборы, основанные на прямой реак-
ции иммунофлюоресценции, однако имеются тест-системы, где используется
реакция непрямой иммунофлюоресценции.Если прямую РИФ можно использовать только для обнаружения антигена, то
непрямой вариант этой реакции может быть использован как для обнаружения
антигена, так и для серодиагностики (например, при болезни Лайма, сифилисе).
В этом случае готовят мазки из эталонного штамма возбудителя. Исследуемую
сыворотку наносят на мазок. Если в ней присутствуют искомые антитела, то они
связываются с антигенами микробных клеток. Промывка препарата буферным
раствором позволяет удалить несвязавшиеся антитела. Затем препарат обрабаты¬
вают меченой сывороткой против иммуноглобулинов человека. В случае положи¬
тельного результата реакции при микроскопии мазка в люминесцентном микро¬
скопе наблюдают специфическое свечение эталонной культуры.Основным недостатком РИФ является ее субъективность. Классическими кри¬
териями специфичности этой реакции являются:• характерная морфология, размеры и расположение возбудителя в мазке;• периферический характер свечения объекта;• цвет флюоресценции;• интенсивность флюоресценции.при исследовании крупных объектов (трихомонад, гарднерелл, клеток, пора¬
женных вирусами) эти критерии позволяют получить высокодостоверный резуль¬
тат, в то же время элементарные тельца хламидий и микоплазмы имеют размеры,
лежащие на пределе разрешающей способности люминесцентного микроскопа.
При этом оценка морфологии микроорганизмов затруднена, а свечение теряет
периферический характер. Оставшихся критериев явно недостаточно для уверен¬
ной идентификации наблюдаемого микроорганизма, В связи с вышесказанным
субъективный характер учета реакции предъявляет особые требования к квалифи¬
кации персонала, проводящего исследования.МУЛЬТИПЛЕКСНЫЙ ИММУННЫЙ АНАЛИЗМетодологическое развитие ИФА позволило создать системы, в которых раз¬
ные виды захваченных молекул-мишеней проецируются в разных точках твер¬
дой фазы, что и привело к созданию мультиплексных технологий, позволяющих
одновременно определять большое количество (около 100) параметров в одном
биологическом образце. В качестве твердой фазы стали использовать не поверх¬
ность лунок полистироловых планшетов, а разнообразные дискретные шарики —
микрочастицы.Впервые флориметрическая технология на шариках была разработана еще в
1977 г. для определения различных антигенов в одном биологическом образце.
В настоящее время такую оценку часто используют для определения а-фетопроте-
ина, р^-микроглобулина, иммуноглобулинов и иммунных комплексов.Технология мультиплексного анализа на шариках постоянно совершенствуется.
Изначально мультиплексный анализ выполняли в разных сочетаниях.• В ряде тест-систем один шарик покрывали разными антителами, меченными
флюоресцеином.• В других тест-системах использовали шарики разного размера.• Шарики могли состоять из различных материалов, таких как латекс, поли¬
стирол, полиакриламид, стекло, и соответственно имели разную способность
к адсорбции.В настоящее время распространенными методами мультиплексного анализа
являются мультиплексные, в основе которых лежит «сэндвич»-метод - ИФА в
разных комбинациях: FAST Quant, Search Light и xMAP, Каждый из этих методов
144ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯщшшшимеет некоторые различия по ряду параметров; определению доступных анали¬
зируемых веществ, возможности использования новых аналитов, динамическому
ряду оценки, чувствительности метода, стоимости оборудования, цене расходных
материалов.Поскольку результаты определения биологически активных веществ в каждом
методе могут существенно различаться, считают, что проводить статистический
анализ данных, полученных с помощью разных методов, нецелесообразно. Для
каждого отдельного исследования следует выбирать только одну технологию, для
того чтобы полученные данные и выводы были репрезентативными и соответство¬
вали требованиям доказательной медицины. Так, в анализе, основанном на микро¬
шариках, в качестве твердой фазы используют микрочастицы (рис. 3-26).Их кодируют одинаковыми или разными (красными и оранжевыми) флюорес¬
центными метками. В хМАР'СИстеме, например, используют шарики одного раз¬
мера, внутри меченные в разных сочетаниях красными и близкими к инфракрас¬
ным флюорофорами: 658 и 712 нм. На шариках адсорбированы антитела разной
специфичности, созданные к разным молекулам-мишеням, присутствующим в
биологическом образце, причем возможны варианты: на разных типах шариков
могут быть адсорбированы антитела к разным молекулам-мишеням либо к одной
молекуле-мишени, при этом образуются ковалентные связи. Таким образом, приt!AMОамнг* Аіаік<вwksts SA'KP'•АйЦ^ш:!•m ^,&0•Aotlg«n:2•AnUgvniJ•m .Ф•Ant]e«D:4ФOrmge lnt»n»ltrЯР«с. 3-26. хШР-технология: а —100 различных типов микрочастиц с точным количеством крас¬
ного и инфракрасного красителя составляют основу хЛМР-технологии мультиплексного анализа;
б — каждый тип микрочастиц покрывают антителами против конкретного антигена, после этого
проводят классический «сэндвич»-ИФА; в — с помощью проточного цитофлюориметра (Luminex
или ВІ0-РІЄХ) проводят регистрацию результатов: красным лазером (630 нм) идентифицируют тип
микрочастицы (1), а зеленым (532 нм) измеряют количество связавшегося антигена (2).
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 145ЭТОМ типе оценки сами шарики (их поверхность) представляют собой твердую
фазу, на которой и происходят реакции «антиген-антитело» (в ИФА такие реак¬
ции осуществляются на поверхности пластика). После захвата соответствующих
молекул-мишеней из биологической пробы различные окрашенные места на
шариках заполняются, при этом оценка разных мишеней осуществляется одно¬
моментно в одной биопробе. Детекция интенсивности захвата осуществляется с
помощью считывающей системы, принцип действия которой основан на оценке
интенсивности флюоресценции. Сигнал усиливается и измеряется на флюоци-
тометре, при этом каждая отдельная молекула-мишень определяется с помощью
цветового кода, измеряемого с помощью вторичного флюоресцентного сигнала.
В результате обеспечивается подсчет количества захваченных молекул-мишеней в
каждом отдельном локусе шариков.Метод позволяет проводить комплексный учет множества различных молекул-
мишеней в одном биологическом образце. Чувствительность, специфичность и
точность анализа при таком мультиплексном определении на шариках превыша¬
ют соответствующие характеристики ИФА. Б отличие от ИФА, мультиплексный
анализ на микрочастицах позволяет одновременно учитывать до 100 параметров в
одном образце, при этом не требуется проводить этапы отмывок. Согласно мето¬
дике проведения мультиплексного анализа, биологический образец инкубируется
вместе с меченными флюоресцеином антителами, а после образования иммунного
комплекса по типу «сэндвича» проводится детекция только тех флюорофоров,
которые связаны с поверхностью шариков.Как в ИФА, так и в мультиплексном иммунном анализе (МИА) в тест-системах
используется принцип «сэндвича». Если биологические образцы содержат гетеро¬
фильные антитела (такие как у больных с аутоиммунными заболеваниями), неспе¬
цифическое связывание может приводить к ложноположительным результатам.В условиях патологии уровни таких аналитов, как, например, цитокины при
воспалении, могут быть существенно повышены в разных биологических жид¬
костях и существенно превышать динамические возможности тест-системы.
Анализ стандартных кривых в мультиплексных данных является критичным для
правильной интерпретации полученных данных. Классический иммунофермент-
ный анализ очень удобен для измерения уровней одного какого-либо цитокина в
биологических образцах. Однако измерение уровня одного цитокина для харак¬
теристики различных процессов, протекающих в организме, является абсолютно
недостаточным, так как не позволяет получить более или менее объективную
информацию о комплексных биологических взаимодействиях на клеточном
уровне как в норме, так и при патологии. В последнее время возрастает интерес
к интегральному изучению биологических процессов. Вследствие этого все более
широкое распространение приобретают методы мультиплексного анализа. Роль
повышения или понижения уровня одного какого-либо цитокина в межклеточных
взаимодействиях необходимо рассматривать с учетом изменения уровней других
цитокинов, присутствующих в этом же исследуемом биологическом образце.Ниже приведен ряд сравнительных характеристик хМАР- и ИФА-методов
определения цитокинов (табл. 3-12).Срок храненияВ большинстве так называемых home-made ИФА-тест-системах планшеты,
покрытые антителами, используют в тот же день либо их хранят в течение непро¬
должительного времени (несколько дней) при температуре +4 “С или заморажива¬
ют и хранят при температуре -20 “С (до 2-3 мес). В хМАР-технологии покрытые
антителами микрочастицы остаются стабильными в течение 2 лет. При этом срок
хранения тест-систем скорее ограничивается не этапом напыления антител, а
интенсивностью свечения люминофоров.
14В ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯттФТаблица 3-12. Сравнительные характеристики ИФА- и МИА-методов определения цитокиновПараметрыЧувствительностьОпределениеСпецифичностьВыявлениеВремя проведения ана¬
лизаКозффициенг вариацииИнтерференцияПротокол исследованияОбъем образцаСтимуляция детекцииСрок хранения тест-
системыРазрешающая способ¬
ностьИФАВысокая —<10 пг/мпКоличественноеВысокаяБиологически активных и неактив¬
ных молекул Относительно небольшое (день)5-10%ОтсутствуетОтносительно простойОтносительно большой (100-
200 мкл на 1 определение)ОтсутствуетНебольшойОпределение 1 цитокина в одной
биопробеМИАВысокая — несколько пг/млКоличественноеВысокаяБиологически активных и неактивных
молекулБолее быстрый анализ (часы)10-15%ОтсутствуетпростойНебольшой (50 мкл на все определе¬
ния —до 100 параметров)ПрисутствуетБолее продолжительныйОдновременное определение до 100
цитокинов в 1 биопробепроизводительностьС помощью хМАР-тест-системы можно одновременно определять до 100 раз¬
личных протеинов с широким спектром молекулярной массы — от 6 до 150 к Да
всего лишь в 50 мкл биологической жидкости. ИФА-тест-система позволяет опре¬
делить только один белок, причем объем биологической пробы варьирует от 100
до 200 мкл, а в дублях — от 200 до 400 мкл. Нетрудно рассчитать, какое количество
биологического материала необходимо для определения уровней, например, 10
или 20 цитокинов.Сопоставимость полученных данныхв ИФА для определения нескольких цитокинов каждый раз следует обращаться
к изначальному образцу биологической жидкости. Обычно аликвоты заморажи¬
вают и хранят при температуре -20 °С в течение ограниченного срока (до 3 мес).
Недопустимо повторное размораживание и замораживание образцов. Сроки хра¬
нения биообразцов до момента постановки ИФА-тест-систем для определения
цитокинов могут существенно различаться и, поскольку определение цитокинов с
помощью этого метода проводят с временным интервалом, невозможно с уверен¬
ностью считать, что все условия проводимого анализа и соответственно получен¬
ные результаты адекватны и сопоставимы.жМАР-технология, в отличие от ИФА, позволяет определять целый ряд молекул
одновременно, что снижает вероятность ошибок, связанных с условиями хранения
биологических проб, и, наконец, все антитела, используемые в лЛГЛР-технологии,
в отличие от ИФА, сопоставимы друг с другом.Стоимость исследования одного параметраЕсли использовать МИА-технологии для определения многих цитокинов, стои¬
мость одного определения в мультиплексной технологии становится в целом ниже,
чем в ИФА.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЬІЕ ИССЛЕДОВАНИЯ 147МОЛЕКУЛЯРНАЯ КЛИНИЧЕСКАЯ ДИАГНОСТИКАУспехи молекулярной и клеточной биологии привели к возникновению новой
клинической дисциплины — молекулярной клинической диагностики, область
интересов которой включает лабораторную диагностику инфекций и многих пато¬
логических состояний человека путем детекции генных вариантов, присущих тому
или иному виду организмов.Молекулярную клиническую диагностику определяют в настоящее время как
науку, занимающуюся выявлением патологий, изучением их причин и механизмов
развития на молекулярном уровне. Преимущество такого подхода заключается в
том, что он дает возможность выявить склонность к тому или иному заболеванию
задолго до его клинических проявлений, вовремя принять профилактические
меры, предотвратив его развитие или облегчив течение, и с учетом индивиду¬
альных особенностей применять терапию. При этом молекулярный уровень
исследований включает не только гены и мРНК, но и соответствующие белки,
поэтому исследования в области молекулярной диагностики принято разделять на
геномику и протеомику (рис. 3-27). Используемые в исследованиях современные
молекулярные технологии представлены в табл. 3-13.Таблица 3-13. Основные методы современных молекулярно-диагностических исследованийТип технологииМетодыМолекулярно¬
генетические методы
для поиска новых генов
или аллелей. Выявление
мутацийСеквенированив.Анализ конформационного полиморфизма одноцепочечной ДНК (SSCP).
Гетеродуплексный анализ.Денатурирующий гель-электрофорез.Химическое/ферментативное расщепление некомплементарных оснований.
Масс-спектрометрия.ДНК-чипыМолекулярно¬
генетические методы
для выявления извест¬
ных генов или аллелейАллельспецифическая гибридизация/амплификация (ПЦР, LCR, NASBA).
Капиллярный денатурирующий гель-электрофорез.
Мини-секвенироеание в твердой фазе,Олигонуклеотидлигазный анализ (OLA)Геномные функциональ¬
ные методы для опреде¬
ления генной активности
{экспрессия генов)Экспрессионные РНК-чипы.
Количественный РТ-ПЦРПротеомные технологииДвухмерный электрофорез.Многомерная хроматография.Масс-спектрометрия.Белковые чипы (SELDI).Мультиплексный анализ по технологии «Люминекс» («Биоплекс»)На основе успехов в исследовании молекулярных основ патологии, в част¬
ности достижений программы «Геном человека», и с помощью рекомбинантных
ДНК, ПЦР, новейших методов анализа ДНК удается многое узнать о генотипе при
минимальных затратах. Возможности молекулярно-биологических исследований
определяются универсальностью принципов анализа ДНК и РНК любого происхо¬
ждения, высокими чувствительностью и специфичностью применяемых методов.
Объектом молекулярно-генетического исследования могут служить практически
любые биологические образцы. Проводимое исследование включает подготовку
проб, состоящую из стандартизированного выделения нуклеиновых кислот, детек¬
ции искомой генной последовательности, учета результатов исследования и фор¬
мулирования заключения с установлением (или подтверждением) нозологической
формы в соответствии с принятыми клиническими классификациями. Комплексы
молекулярно-биологических методов позволяют:
•Р148ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯтРепликация
удвоение ДНК(ШІТранскрипция
синтез РНК^[П[1І(1ІІПІШШІ1ЇЇІ!1Ш:ЦитоплазмаjlljlllBimiJIffrfnfflflllffllillilp^^л ч РибосомаПротекиТрансляция
Синтез белкаРис. 3-27. Структура молекулярного уровня исследований; процессы репликации, транскрипции
и трансляции.• проводить диагностику инфекционных заболеваний по наличию или отно¬
сительному содержанию специфических последовательностей ДНК/РНК
патогенных микроорганизмов в биологических образцах;• осуществлять дифференциальную генную диагностику злокачественных
новообразований с неопухолевыми (предопухолевыми) поражениями,
определять прогностически неблагоприятные генотипы лейкозов, выявлять
минимальную остаточную болезнь и рецидивы злокачественных заболева¬
ний;• осуществлять своевременную диагностику генных мутаций и генных вариан¬
тов у больных и их родственников в целях медико-генетического консульти¬
рования, а также для вдентификации личности и установления родства.Генную диагностику используют при решении задач скрининга (профилактиче¬
ском обследовании), для установления (^очнения) диагноза, ранней диагностики
заболеваний. На основе генной диагностики проводят;• установление ориентировочного диагноза для выработки дальнейшей такти¬
ки обследования;• обоснование и планирование специфической терапии;• установление диагноза, включая исследование интраоперационного мате¬
риала (например, генотипирование Н. pylori в образцах слизистой оболочки
желудка);
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 149• раннюю диагностику заболеваний (в некоторых ситуациях — единственный
возможный метод диагностики на начальном этапе болезни, в частности при
ранней диагностике гепатита С).Это эффективный метод уточняющей диагностики, а во многих случаях —
основной диагностический метод (например, в выявлении наследственных забо¬
леваний и прогнозе развития лейкозов).Значение результатов генной диагностики отражено в федеральном законе от
05.07.1996 № 86-ФЗ (ред. от 30.12.2008) «О государственном регулировании в
области генно-инженерной деятельности».Методы молекулярной диагностикиСреди молекулярно-генетических технологий наиболее широко применяются в
рутинной диагностической практике методы для выявления уже известных эндо¬
генных и экзогенных ДНК-последовательностей, которые можно разделить на
два класса: гибридизационный анализ нуклеиновых кислот и амплификационные
методы.в последние годы в практику клинико-лабораторных исследований активно
внедряется метод секвенирования генов, т.е. определения последовательности
нуклеотидов в целевом участке гена.В основе всех молекулярно-биологических методов лежит представление о том,
что универсальным носителем генетической информации, исключая РНК-вирусы,
является ДНК. ДНК представляет собой двойную цепь, скрученную в спираль.
Каждая цепочка состоит из соединенных последовательно нуклеотидов (рис. 3-28).
Нити ДНК имеют противоположную направленность: 5’-коицу одной нити соот-АлеминГуанинЦнтозйкТимішI6. p.Л "Рис. 3-28. Структура цепи ДНК. Последовательное соединение нуклеотидов.
150 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯУ лї ветствует З’-конец второй нити. Уникальным свойством ДНК является ее способ-
} ность удваиваться. В живой клетке этот процесс развивается следующим образом:с помощью специальных ферментов — гираз происходит расплетание спирали в
том ее з^іастке, где должна наблюдаться репликация. При этом водородные связи
^ ^ " между азотистыми основаниями разрываются и нити расходятся. Одна из цепей
^ ^ (смысловая) используется в качестве основной матрицы. Построение новой нити
ДНК идет только в одном направлении — от 5’-конца к З’-концу. Данный процесс
осуществляется по принципу комплементарности. Это строгое соответствие соеди¬
нения азотистых оснований, занимающих положение в двух цепях ДНК напротив
друг друга и соединенных водородными связями, в котором: аденин соединяется с
ТИМИНОМ (А-Т) и гуанин соединяется с цитозином (Г-Ц).Гибридизационный анализИсторически метод ДНК- или РНК-гибридизации был внедрен раньше, чем
метод ПЦР. В основе метода лежит способность нуклеиновых кислот к гибри¬
дизации — образованию двух цепочечных структур за счет взаимодействия ком¬
плементарных последовательностей нуклеотидов. В 1970-е гг, для выявления
инфекционного возбудителя или мутации использовали ДНК-зондовую детекцию,
основанную на габридизации специфических олигонуклеотидных зондов, мечен¬
ных радиоактивным изотопом (или флюорохромом) с образцом выделенной ДНК.
Олигонуклеотидные зонды были синтезированы таким образом, что содержали
последовательности нуклеотидов, коплементарные участку цепи ДНК-мишени с
известной структурой.Различают два типа гибридизационного анализа;• методы гибридизационного анализа, проводимые в растворе (гомологич¬
ные);• методы гибридизационного анализа, проводимые на твердом носителе (гете¬
рогенные).Последние получили более широкое распространение в связи с тем, что имеют
большие аналитическую чувствительность и специфичность, являются более тех¬
нологичными, их проще стандартизировать и автоматизировать.Принцип метода основан на гибридизации зонда на твердой поверхности.
В качестве твердой поверхности чаще всего используют полимерную нейлоновую
мембрану.Протокол анализа состоит из следующих стадий:• пробоподготовки (выделения ДНК из образца);• фиксации ДНК-образца на мембране;• гибридизации с ДНК-зондом, меченным флюорофором или ферментом;• детекции результата.Для освобождения нуклеиновых кислот из состава клеточных структур при про-
боподготовке проводят лизис клеток, а в некоторых случаях очищают препарат
ДНК с помощью фенола.Фиксацию ДНК-образца на твердом субстрате осуществляют в два этапа: вначале
ДНК денатурируют с помощью щелочи, затем образец нуклеиновой кислоты фик¬
сируют на носителе — нитроцеллюлозной или нейлоновой мембране, обычно путем
инкубации от 10 мин до 4 ч при 80 “С в вакууме. Для того чтобы олигонуклеотидный
зонд не взаимодействовал с мембраной, свободные точки связывания на мембране
инактивируются. На стадии гибридизации искомые фрагменты ДНК (РНК) компле¬
ментарно связываются со специфическим зондом, меченным флюорофором, радио¬
активной меткой или ферментом. Избыток зонда удаляется в процессе промывки.
Далее осуществляют детекцию одним из возможных методов (авторадиографиче¬
ским, ферментативно-гибридизационным или флюориметрическим).
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 15*|Критическим этапом в данном протоколе является неспецифическая фикса¬
ция ДНК-мишени на мембране с последующей нейтрализацией свободных точек
связывания. Эффективность этой стадии в большой степени зависит от длины
и структуры нуклеотидной последовательности мишени, поэтому в настоящее
время, преимущественно в научных исследованиях, используют разновидности
данного протокола (саузерн-блот, нозерн-блот).В лабораторно-клинической практике метод прямого связывания мишени с
твердой фазой уступил место так называемой «сэндвич»-технологии. Протокол,
основанный на принципе «сэндвича», отличается от описанного тем, что уча¬
ствуют два зонда, гомологичных различным участкам нуклеотидной цепи ДНК-
или РНК-мишени. Один зонд фиксируют на мембране для того, чтобы связать
искомую мишень, присутствующую в исследуемом образце. После гибридизации
мембран}? отмывают от исследуемого материала и добавляют раствор, содержащий
второй зонд, который представляет собой конъюгат олигонуклеотида и какой-
либо метки. Процесс гибридизации проводят повторно, при этом зонд с меткой
взаимодействует с искомым участком ДНК (РНК). Дальнейший процесс детекции
проводят стандартным методом в зависимости от природы метки (ферментно-
гибридизационным, радиографическим, авторадиографическим, флюоресцент¬
ным, хемилюминесцентным).в настоящее время ведутся интенсивные разработки по совершенствованию
методов гибридизации в следующих направлениях:• упрощение процедуры генного зондирования до одной-двр стадий процесса;• отказ от сорбции мишени на мембране;• повышение чувствительности гибридизационных методов за счет использо¬
вания процедуры амплификаций сигнала с зонда.Преимущество этого подхода заключается в том, что практически сведены
к минимуму подготовка клинического материала и очистка нуклеиновых кис¬
лот. Описанная схема реализована в нескольких коммерческих тест-системах,
В современных наборах реагентов применяется хемилюминесценция в качестве
процесса, обеспечивающего чувствительную детекцию результатов гибридизации.
Технология автоматизирована, время выполнения анализа составляет 2,5-3 ч.По мере миниатюризации соответствующих носителей-подложек для гибри¬
дизации в практику вошли микрочипы (microarrays) с сотнями и тысячами ДНК-
зондов для выявления практически любых известных генов, их вариантов и
мутаций. Часто для гибридизации применяют не исходные нуклеиновые кислоты,
а продукты амплификации целевых генов. Учет результатов гибридизации на био¬
чипах осуществляется посредством оптических устройств, обычно предлагаемых
фирмой-разработчиком.Метод полимеразной цепной реакцииПолимеразная цепная реакция (ПЦР) — молекулярно-биологический метод
исследования, получивший широкое распространение в современных лаборато¬
риях и используемый для диагностики инфекционных, наследственных и онко¬
логических заболеваний, а также для исследования состава условно патогенной
флоры.Метод ПЦР основан на принципе естественной репликации ДНК, включающем
денатурацию двойной спирали ДНК, расхождение нитей ДНК и комплементар¬
ное удвоение обеих. Ценность метода заключается в многократном копирова¬
нии (амплификации) определенных, специфических только для данной мишени
участков ДНК в процессе повторяющихся температурных циклов. На каждом
цикле амплификации синтезированные ранее фрагменты вновь копируются ДНК-
полимераэой. Благодаря этому происходит многократное увеличение концен¬
152 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯтрации специфических для данной мишени фрагментов ДНК в миллионы раз, что
значительно упрощает дальнейший анализ.Для проведения полимеразной цепной реакции необходимо наличие в реакци¬
онной смеси ряда основных компонентов.праймеры — искусственно синтезированные олигонуклеотиды, имеющие, как
правило, размер от 15 до 30 нуклеотидов, идентичные соответствующим участ¬
кам ДНК-мишени. Они играют ключевую роль в образовании продуктов реакции
амплификации. Правильно подобранные праймеры обеспечивают специфичность
и чувствительность тест-системы.полимераза — термостабильный фермент [максимальная активность фер¬
мента проявляется при температуре 70-74 (хотя фермент может работать
и при более низких температурах)] массой приблизительно 94 кДа. Источник
происхождения этого фермента — микроорганизм Thermus aquaticus, время полу-
жизни которого при 94 °С составляет около 45 мин. Гя^-полимераза обеспечивает
достраивание З’-конца второй цепи ДНК согласно принципу комплементарности,
осуществляя синтез ДНК в направлении 5'->3’ в присутствии ионов Mg^‘ и при
соответствующем значении pH, а также обладает 5’->3'-экзонуклеазной активно¬
стью. Наличие 5’->3’-экзонуклеазной активности делает фермент пригодным для
использования его в ПЦР в реальном времени (ПЦР-РВ).Смесь дезоксинуклеотидтрифосфатов (дНТФ): дезоксиаденозинтрифосфата
(дАТФ), дезоксигуанозинтрифосфата (дГТФ), дезоксицитозинтрифосфата (дЦТФ)
и дезокситимидинтрифосфата (дТТФ) — «строительный материал», используе¬
мый Тй^-полимеразой для синтеза второй цепи ДНК.Буфер — смесь катионов и анионов в определенной концентрации, обеспечи¬
вающей оптимальные условия для реакции, а также стабильное значение pH.Анализируемый образец — подготовленный к внесению в реакционную смесь
препарат, который может содержать искомую ДНК, например ДНК микроорга¬
низмов, служащую мишенью для последующего многократного копирования. При
отсутствии ДНК-мишени специфический продукт амплификации не образуется.Для удобства детекции или контроля эффективности амплификации в состав
реакционной смеси могут быть включены следующие дополнительные компо¬
ненты.• Внутренние контроли — гетерологичный специфическому фрагмент ДНК,
как правило, большего размера, ограниченный специфическими праймера¬
ми. Фактически представляет собой альтернативную матрицу ПЦР и позво¬
ляет контролировать эффективность амплификации в каждой конкретной
пробирке.• ДНК-зонды — искусственно синтезированные олигонуклеотиды небольшого
размера (приблизительно 30 нуклеотидов), комплементарные специфиче¬
ским ампликонам. Благодаря прикрепленным к ним изотопным или флюо¬
ресцентным меткам ДНК-зонды могут быть маркерами ПЦР-продуктов.Каждый цикл амплификации состоит из трех этапов (рис. 3-29). Переход от
одной стадии реакции к другой достигается изменением температуры инкубаци¬
онной смеси.• Денатурация. На первом этапе необходимо расплести двойную цепь ДНК,
находящуюся в образце. Для этого реакционную смесь нагревают до 92-95 °С,
в результате чего двухцепочечные молекулы ДНК расплетаются с образова¬
нием двух одноцепочечных молекул.• Отжиг. На втором этапе праймеры присоединяются к одноцепочечной ДНК-
мишени. Праймеры подбирают так, что они ограничивают искомый фраг¬
мент и комплементарны противоположным цепям ДНК. Отжиг происходит в
соответствии с правилом комплементарности Чаргаффа, означающим, что в
двухцепочечной молекуле ДНК напротив аденина всегда находится тимин, а
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 153ПЦР : Полимеразная цепная реакция^Пїпшпштпїїшішіші^^lUarUj
94 *С■ ■ -jv?ОТЖИГ-54 Xу Шаг 2-Vi I'" ї зі-мишиїшашішшу'.-V 72‘CРис. 3-29. Схема реакции и принцип амплификации ДНК-мишени в ПЦР.напротив гуанина — цитозин. Если это условие не соблюдено, отжига прай¬
меров не происходит.После отжига праймеров Га^-полимераза начинает достраивание второй цепи
ДНК с З’-конца праймера.• Элонгация (синтез). На третьем этапе температуру в реакционной смеси
доводят до оптимума работы Га^-полимеразы и синтез второй цепи продол¬
жается с максимальной эффективностью.Таким образом, в идеальных условиях проведения реакции за 35 циклов ПЦР
синтезируется несколько миллиардов копий ампликона определенной длины.Этого количества достаточно для достоверной визуальной детекции фраг¬
мента, например, с помощью флюориметрии или методом электрофореза в
геле.
154 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯЭФФЕКТ ПЛАТОпроцесс накопления специфических продуктов амплификации по геометриче¬
ской прогрессии идет лишь ограниченное время, а затем его эффективность кри¬
тически падает. Это связано с так называемым эффектом плато.Термин «эффект плато» используют для описания процесса накопления про¬
дуктов ПЦР на последних циклах амплификации, когда количество ампликонов
достигает 0,3-1>0 пмоль (ДНК в количестве, необходимом для их дальнейшей
детекции).в зависимости от условий и количества циклов реакции амплификации на
момент достижения эффекта плато влияют: утилизация субстратов (дНТФ и
праймеров); стабильность реагентов (дНТФ и фермента); количество ингибито¬
ров, включая пирофосфаты и ДНК-дуплексы; неспецифические продукты или
праймер-димеры, конкурир)тощие за праймеры, дНТФ и полимеразу; концентра¬
ция специфического продукта и неполная денатурация при высокой концентрации
продуктов амплификации. Чем меньше начальная концентрация ДНК-мишени,
тем раньше происходит выход реакции на плато. Этот момент может наступить
до того, как количество специфических продуктов амплификации будет достаточ¬
ным, чтобы их можно было проанализировать.ПРОТОКОЛ ИССЛЕДОВАНИЯПЦР в диагностической лаборатории является достаточно сложной, многосту¬
пенчатой методикой, требующей правильного выполнения всех процедур. Ниже
изложены основные специфические требования к процессам взятия образцов,
выделения наследственного материала, выполнения амплификации и регистрации
результатов, т.е. преаналитической, аналитической и постаналитической стадии
исследования.ВЗЯТИЕ ОБРАЗЦОВКлиническим материалом для исследования методом ПЦР могут служить
соскобы эпителиальных клеток, кровь, плазма, сыворотка, плевральная и спин¬
номозговая жидкости, моча, мокрота, слизь и другие биологические выделения,
биоптаты. Однако в большинстве анализов в качестве образца используют соскоб
эпителиальных клеток и сыворотку крови пациента. К особенностям метода сле¬
дует отнести то, что материал, необходимый для исследования, должен потенци¬
ально содержать искомую ДНК (например, в абсолютном большинстве случаев
невозможно детектировать в крови микроорганизм Chlamydia trachomatis, так как
это внутриклеточный паразит эпителиальных клеток урогенитального тракта).ВЫДЕЛЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ ИЗ БИОЛОГИЧЕСКОГО МАТЕРИАЛАВ зависимости от поставленных задач используют различные методики для
выделения нуклеиновых кислот из биологического материала. Суть методик
заключается в экстракции из исследуемого образца нуклеиновых кислот и нейтра¬
лизации ингибиторов ПЦР.В настоящее время существуют экспресс-методики выделения ДНК, позво¬
ляющие за сравнительно небольшое время обрабатывать много образцов с мини¬
мальными трудозатратами. Если перед лабораторией стоит задача получить более
чистый препарат ДНК или детектировать низкокопийный образец, существуют
методики, позволяющие провести очистку с высокой чистотой, но требующие
больших трудозатрат.АМПЛИФИКАЦИЯ (УМНОЖЕНИЕ СПЕЦИФИЧЕСКИХ ФРАГМЕНТОВ ДНК)На данной стадии происходит накопление коротких специфических фрагментов
ДНК в количестве, необходимом для их дальнейшей детекции.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 155ДЕТЕКЦИЯ РЕЗУЛЬТАТОВ РЕАКЦИИРегистрировать результат ПЦР можно либо по завершении реакции («по конеч¬
ной точке» ), либо на протяжении всей реакции (в реальном времени). Классическая
ПЦР предполагает анализ результатов реакции по «конечной точке». Для этого
используют методы электрофореза в геле, гибридизационно-ферментный анализ
(ГИФА), флюоресцентную детекцию после ПЦР (FLASH) и др. Различные методы
детекции результатов ПЦР имеют свои преимущества и недостатки (табл. 3-14), и,
как правило, их выбирают в зависимости от задач, решаемых лабораторией. Для
выявления количества ДНК в исходной пробе и наблюдения за кинетикой процес¬
са в современных лабораториях используют метод ПЦР с детекцией результатов в
режиме реального времени.Таблица 3-14^ Сравнение методов детекции результатов ПЦР {Ребриков Д.В., Саматов Г.А.,
Трофимов Д.Ю. и др„ 2009)ХарактеристикаметодаЭлектрофорезГИФАСистема Flash
и флюорииетр
«Джин»Система детекции
результатов ПЦР в
режиме реального
времениПриблизительное
время детекции для
30 образцов40 мин60 мин3 мино минКонтаминация продук¬
тами ПЦРВысокаяВысокаяНизкаяНизкаяФиксирование данныхВручнуюАвтоматическоеАвтоматическоеАвтоматическоеВозможность исполь¬
зования метода в
роботизированных
системах (совмеще¬
ние с пипетирующими
станциями)ОтсутствуетОтсутствуетОтсутствуетПрисутствуетОсобенностиВозможность
увидеть резуль¬
тат ПЦР в виде
полоски на геле,
оценить количе¬
ство и качество
амплификата по
нескольким пара¬
метрамПовышение досто¬
верности иссле¬
дования за счет
специфичности
пробы к целевому
амплификатуПовышение досто¬
верности иссле¬
дования за счет
специфичности
пробы к целевому
амплификатуВозможность оцен¬
ки исходного коли¬
чества копий ДНК в
образцеПЦР с ДЕТЕКЦИЕЙ РЕЗУЛЬТАТОВ ПО ОКОНЧАНИИ РЕАКЦИИВ процессе ПЦР (при наличии в биопробе искомой ДНК) в геометрической
прогрессии происходит увеличение копий ее специфического фрагмента. По
окончании реакции (30-50 циклов) количество таких копий достигает значений,
при которых становится возможной надежная регистрация результатов реакции.
Регистрацию результатов ПЦР «по конечной точке» проводят несколькими спо¬
собами:• методом электрофореза в агарозном геле;• гибридизацией фрагментов ДНК с меченым зондом, в планшете, на мембране
или микропластинке (биочипы):• флюоресцентными методами детекции (при использовании технологии раз¬
рушающихся ДНК-зондов).В последние годы ПЦР широко используется в лабораторной практике для
идентификации таких инфекций, как трихомониаз, гонорея, ВИЧ и т.д.Преимуществом метода является то, что он универсален для диагностики
любых микроорганизмов и поэтому лишен недостатков культивационных мето-
т156 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯдов, связанных с высокими требованиями ряда микроорганизмов к условиям
культивирования.К достоинствам также следует отнести возможность тестирования большого
количества любых клинических образцов.Диагностическая ценность метода ПЦР признана во всем мире. В соответствии с
данными Европейских стандартов диагностики и лечения заболеваний, передавае¬
мых половым путем (2004), чувствительность ПЦР в диагностике хламидийной
инфекции составляет 70-95%, специфичность — 97-99% (Рэдклиф К.. 2004).ПЦР С ДЕТЕКЦИЕЙ РЕЗУЛЬТАТОВ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИМетод ПЦР с детекцией результатов в режиме реального времени предусма¬
тривает автоматическую регистрацию увеличения флюоресцентного сигнала,
пропорционального количеству синтезированных в ходе реакции специфических
фрагментов ДНК (микроорганизмов, человека, животных и т.д.).Реакция выполняется и автоматически регистрируется специализированными
приборами для осуществления ПЦР в режиме реального времени. Программное
обеспечение оборудования может автоматически переводить полученные данные
в удобный для чтения врача-лаборанта формат.В зависимости от исходной концентрации специфических нуклеиновых кислот
(микроорганизмов, человека и т.д.) в исследуемом образце переход из стадии
инициации в экспоненциальную стадию происходит на разных циклах (рис. 3-30,
см. цв. вклейку). Чем больше в образце искомой ДНК, тем на более раннем цикле
прибор начнет регистрировать флюоресценцию; чем меньше искомой ДНК, тем на
более позднем цикле начнется автоматическая регистрация флюоресценции.Метод ПЦР с детекцией результатов в процессе амплификации предоставля¬
ет возможность количественно оценивать ДНК микроорганизмов в исходном
материале, а также использовать мультиплексный анализ (анализ результатов по
нескольким каналам детекции), что дает возможность выявлять большее количе¬
ство микроорганизмов в каждой пробирке.АНАЛИТИЧЕСКИЕ ХАРАКТЕРИСТИКИ ПЦР
ЧувствительностьТеоретическая чувствительность метода ПЦР — 1 копия искомого гена в иссле¬
дуемом образце (5-10 мкл раствора ДНК). Такой результат в идеале можно полу¬
чить при минимальных потерях ДНК в процессе выделения, отсутствии факторов,
разрушающих ДНК, и оптимальном режиме амплификации. Однако на практике
максимальная чувствительность метода ПЦР составляет от 5 до 50 генокопий в
образце, что является пороговым значением для обычной (качественной) реакции
с электрофоретическим учетом результатов. На чувствительность метода могут
влиять следующие факторы.• Качество выделенной ДНК (РНК).• Примеси и добавки (фенол, муцины и др.).• Параметры реакции.❖ Состав реакционного буфера.❖ Температура и время денатурации.❖ Температура отжига.^ Правильный состав и длина праймеров.❖ Количество циклов ПЦР.• Варианты постановки ПЦР («гнездовая», мультиплексная и др.).Несмотря на то что методики real-time PCR в целом являются намного болеечувствительными, нежели обычные (электрофоретические) способы детекции (в
силу суммирования сигналов на протяжении всей реакции), на их чувствитель¬
ность влияют те же факторы, связанные с подготовкой проб, сохранностью ДНК
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 157И принятым режимом ПЦР. Считается, что минимальное количество генокопий,
выявляемое при real-time PCR, составляет от 2 до 10 в исследуемом образце в
зависимости от оптимальности реакционной смеси и режима ПЦР. В такой ситуа¬
ции основной проблемой становится возникновение сигнала в отрицательных
контрольных пробах, который может быть сравним с минимальными значениями
сигнала в испытуемых образцах.СПЕЦИФИЧНОСТЬСпецифичность диагностического ПЦР-набора — способность выявлять ДНК
исключительно искомого микроорганизма (микроорганизмов). При разработке
специфической тест-системы на какой-либо микроорганизм выбирают специфи¬
ческий участок генома данного вида, имеющий как можно более существенные
отличия среди всех близкородственных видов.другой задачей при создании ПЦР-тест-системы является правильный подбор
праймеров, которые должны отвечать ряду критериев.• Праймеры должны бьггь специфичными. Особое внимание уделяют З’-концам
праймеров, так как именно с них Га^-полимераза начинает достраивать компле¬
ментарную цепь ДНК. Если их специфичность недостаточна, вероятен синтез
неспецифической ДНК (дополнительные полосы, сплошной мазок на электро¬
форезе — «шмер»). Оценка результатов реакции становится затруднительной,
легко перепутать специфический продукт амплификации с синтезированной
посторонней ДНК. Часть праймеров и дНТФ расходуются на синтез неспецифи¬
ческой ДНК, что приводит к значительной потере чувствительности.• Праймеры не должны образовывать димеры и петли, т.е. не должно образо¬
вываться устойчивых двойных цепей в результате отжига праймеров самих
на себя или друг с другом.• Область отжига праймеров должна находиться вне зон мутаций, делеций или
инсерций (вставок) в пределах видовой или иной специфичности, взятой
в качестве критерия при выборе праймеров. При попадании на такую зону
отжига праймеров происходить не будет, и, как следствие, — ложноотрица¬
тельный результат.Секвенирование геновПрямое секвенирование ДНК основано на синтезе in vitro исследуемого участка
гена с применением ДНК-полимеразы, меченых дНТФ и праймеров, после чего
устанавливается позиция меченого нуклеинового основания. Метод определения
последовательностей (сиквенсов) РНК, считываемых с матрицы ДНК, основан на
использовании радиоактивных фрагментов ДНК. Короткие полинуклеотидные
участки подвергаются полимеразной реакции в присутствии или отсутствии каж¬
дого из 4 дНТФ (так называемый плюс-минус метод). При отсутствии того или
иного нуклеотида рост цепочки прерывается перед соответствующей позицией его
в цепочке исходной ДНК, а при их наличии идет далее. Продукты реакции фрак¬
ционируют путем электрофореза, сравнивают по длине и делают выводы о пози¬
циях каждого из 4 нуклеотидов в коротких фрагментах. Этот подход применим для
секвенирования ДНК в небольших участках генов фагов и вирусов.Современный, более эффективный и быстрый способ секвенирования ДНК
основан на копировании изучаемого участка ДНК посредством ДНК-полимеразы.
Главное отличие от прямого секвенирования состоит в том, что в реакционную
смесь добавляют один из нуклеотидов в форме дидезоксиНТФ (ддНТФ). При
включении его в ДНК рост цепочки прекращается, т.е. тот или иной ддНТФ слу¬
жит в качестве «терминатора» синтеза. С изучаемым образцом ДНК ставятся
одновременно четыре реакции с каждым из 4 ддНТФ. Затем продукты реакций
158 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯнаносят на полиакриламидный гель, оценивают их относительную длину (т.е.
место прерывания синтеза) и позицию данного нуклеотида в последовательности
участка гена. Именно этот метод в 1980-х гг. получил применение в клинических
исследованиях, в частности при анализе тонких генетических различий (генных
вариантов), что оказалось крайне важным для идентификации индивидуальных
молекулярно-генетических признаков. Данный способ лег в основу углубленного
{high-resolution) типирования генов гистосовместимости (генов системы HLA) у
доноров и реципиентов по мере широкого внедрения в клинику аллогенной транс¬
плантации костного мозга.Преимущества методов молекулярной
клинической диагностикиОсновным Преимуществом метода ПЦР при диагностике инфекционных аген¬
тов по сравнению с классическими микробиологическими методами (культивиро¬
ванием и идентификацией клинических изолятов) является быстрота исполнения
(5-6 ч). В сравнении с иммунологическими определениями (например, иммуно-
ферментными или иммунофлюоресцентными методами выявления антигенов)
ПЦР ДНК во многих случаях является более чувствительным и экономичным
методом (по крайней мере, на отечественном рынке соответствующих реагентов),
В частности, при диагностике вирусных инфекций, особенно гепатита С, вирусную
РНК в плазме больных обнаруживают с первых дней заболевания, тогда как спе¬
цифические антитела (основной объект иммунологического скрининга при гепа¬
тите С) — только спустя 2-7 нед после заражения. При диагностике папилломы
молекулярно-биологические методы позволяют дифференцировать онкогенные и
менее патогенные типы вируса, а также идентифицировать вирус, интегрирован¬
ный в хромосомы человека, т.е. предраковые состояния.При идентификации генетических заболеваний (инактивации белка из-за
генной мутации) ДНК-диагностика стала более практичным методом выявления
больных и членов семей — носителей мутантного гена по сравнению с биохими¬
ческими методами определения соответствующих метаболитов. Молекулярно¬
биологические методы особенно важны для диагностики наследственных заболева¬
ний, для которых неизвестен четкий биохимический субстрат или соответствующая
биохимическая диагностика весьма дорога. Прогресс генной диагностики связан
с успешным завершением проекта «Геном человека», в результате которого стала
известна нормальная последовательность нуклеотидов в 99,9% генов человека.
При подозрении на наличие редких мутаций гена проводят амплификацию и
последующее секвенирование выделенного сегмента, Медико-генетические иссле¬
дования касаются в первую очередь наиболее распространенных генетических
заболеваний — муковисцидоза, фенилкетонурии, миодистрофий.При выявлении онкогенов, специфичных для различных злокачественных
заболеваний, особенно лейкозов и лимфом, ПЦР-диагностика (при необходи¬
мости с последующим секвенированием продукта ПЦР) становится методом
диагностики, превосходящим иммунохимические способы диагностики (иммуно-
гистологические, проточно-флюориметрические) по чувствительности и часто по
экономичности исследования.Приборное оснащениетипы АМПЛИФИКАТОРОВДля проведения ПЦР используют амплификаторы, или термоциклеры.
В основе устройства прибора для проведения ПЦР лежит принцип циклического
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 159нагревания-охлаждения. Эти термальные процессы обычно проходят в диапазоне
температур от 95 '‘С (верхняя граница) до 4 “С (температура хранения проб после
завершения ПЦР). В настоящее время используют приборы для амплификации,
которые имеют матрицу с лунками для стандартных ПЦР-пробирок (на 200 или
600 мкл) и электрический термоэлемент типа Пельтье для последовательного
нагревания-охлаждения этой матрицы. Приборы для ПЦР разных моделей раз¬
личаются главным образом емкостью (количеством загружаемых проб), конструк¬
тивными материалами (сталь, алюминий, пластик и др.), элементами дизайна и
интерфейса.С помощью термоциклеров можно осуществлять размножение нужных участков
молекул ДНК (или кДНК, полученных из РНК) в тысячах копий. Амплификаторы
ДНК можно отнести к специализированным термостатам с температурой, изме¬
няющейся во времени согласно заданной программе. В зависимости от количества
ПЦР-программ, проводимых одновременно, амплификаторы можно разделить:• на моноблочные модели (одна программа в одном термоблоке);• модели с двумя и более автономно функционирующих блоков;• модели с возможностью градиента температуры в пределах одного блока
(«Т-градиент»),В зависимости от задач и методов учета амплификации современные термоци¬
клеры можно классифицировать;• на приборы для качественной ПЦР (только термоинкубация без системы
учета результатов);• приборы для ПЦР и учета количества ПЦР-продукта в конечной точке реак¬
ции;• приборы для оценки динамики и учета результатов ПЦР в реальном режиме
времени {real-time ПЦР).Для многих моделей амплификаторов предусмотрена возможность программи¬
рования и управления посредством компьютера.СИСТЕМЫ ДЕТЕКЦИИ РЕЗУЛЬТАТОВ ПЦР
ЭлектрофорезКлассический метод детекции результатов ПЦР — разделение ее продуктов
(ампликонов) методом электрофореза в полиакриламидном геле (ПААГ). Этот
способ незаменим при детекции продуктов ПЦР с малыми различиями по моле¬
кулярной массе. Однако приготовление ПААГ достаточно трудоемко, что ограни¬
чивает его использование при массовых исследованиях, В настоящее время сепа¬
рацию продуктов амплификации чаще всего проводят в 1,5-2% агарозном геле.
Учет результатов проводят в гелях, содержащих бромистый этидий, образующий
химические комплексы с ДНК, которые интенсивно флюоресцируют при под¬
светке ультрафиолетовым излучением. Для учета результатов реакции применяют
трансиллюминатор. В настоящее время используют системы видеодокументации
изображений, которые включают трансиллюминатор, видеокамеру с высоким
разрешением, персональный компьютер с соответствующим программным про¬
дуктом для записи и хранения изображений.Практическими недостатками такого способа детекции являются:• высокий риск контаминации продуктами амплификации;• получение только качественных результатов реакции амплификации (коли¬
чественный з^чет невозможен).Бесфорезный качественный анализ ПЦРв настоящее время разработаны приборы, созданные на базе флюориметров, в
которые вместо обычных кювет загружаются пробирки после проведенной ПЦР (в
которой используются специфические флюоресцентные ДНК-зонды), с помощью
160 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯтаких приборов можно определеть сигнал ПЦР по наличию специфического све¬
чения, сила которого пропорциональна количеству ПЦР-продукта. Метод хорош
тем, что пробирки после ПЦР не надо открывать и анализ целого блока пробирок
(12 шт.) проводится в течение минут. При этом снижается вероятность загрязне¬
ния помещений лаборатории продуктами амплификации, как это происходит при
использовании электрофореза.ПРИБОРЫ ДЛЯ КОЛИЧЕСТВЕННОГО УЧЕТА ПЦР В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ
PCRIПриборы для оценки ПЦР в режиме реального времени представляют собой
своеобразный гибрид амплификатора и флюориметра и позволяют оценивать
динамику ПЦР прямо в закрытых пробирках по мере накопления продукта ампли¬
фикации и проводить количественный ПЦР-анализ. Специфичность сигнала при
ПЦР в реальном времени обусловлена применением специальных ДНК-зондов с
флюоресцентной меткой, в процессе ПЦР по мере синтеза новых и новых копий
искомого участка гена происходят специфическое связывание этой меченой
цепочки нуклеотидов и ее разрушение с выходом красителя в окружающую среду.
По мере протекания ПЦР светочувствительные элементы снимают показатели с
каждой из пробирок и вводят эти данные в память компьютера. При этом строится
динамическая кривая накопления ПЦР-продукта по отдельным пробам.Объемы анализируемых проб, время анализа и температура измерений соот¬
ветствуют таковым для обычной ПЦР. Тем не менее в этом режиме не требуется
дополнительное время на процедуры, связанные с электрофорезом, так как кри¬
вые накопления продуктов реакции доступны сразу по окончании real-time PCR.
Калибровка зависит от типа имеющегося прибора. Она требуется для оптимизации
параметров оптического блока и выравнивания показателей по отдельным лун¬
кам, осуществляется с теми флюорохромами, которыми помечены применяемые
ДНК-зонды.Количественная оценка ДНК или РНК патогенного микроорганизма в кли¬
нических образцах бывает исключительно важна для прогноза заболевания и
контроля терапии. Эта технология активно внедряется в российские клинико-
диагностические лаборатории.Кроме возможности количественного учета результатов реакции, к несо¬
мненным достоинствам real-time PCR следует отнести высокую технологичность
исследования и снижение вероятности загрязнения помещений лаборатории про¬
дуктами амплификации.ОБОРУДОВАНИЕ ДЛЯ АВТОМАТИЧЕСКОГО СЕКВЕНИРОВАНИЯ ДНКАвтоматическое секвенирование в большинстве приборов для клинических
исследований сводится к использованию метода терминирующих ddNTP. На
первом этапе проводятся терминирующие полимеразные реакции, затем — раз¬
деление продуктов реакций методом капиллярного микроэлектрофореза.
Современное приборное обеспечение позволяет автоматизировать процесс раз¬
деления флюоресцентно-меченых фрагментов ДНК в полиакриламидном геле,
получение типа и распределения эмиссии флюорофоров, последующий анализ
собранных данных и выдачу готового результата.Помимо оптимизации полимеразной реации, важнейшим моментом является
мечение определенных нуклеотидов для реакции. Это делают, включая метку в
состав праймера или в нуклеотид, который терминирует реакцию. Например, каж¬
дый из четырех терминирующих НТФ метят «своим» флюорофором, что позво¬
ляет проводить все четыре реакции в одной пробирке и анализировать продукты
реакции в пределах одной зоны электрофореза. В автоматическом секвенировании
используют флюорофоры, абсорбция и излучение у которых происходят в диапа¬
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 161зоне длин волн 450-650 нм (видимая область спектра) или 650-825 нм (ближняя
инфракрасная область спектра). Оптические системы и аппаратура для обработки
данных должны минимизировать возможное наложение спектров лучевой эмис¬
сии для отдельных флюорофоров. При анализе данных следует учитывать, что
некоторые флюорофорные молекулы могут изменять заряд (и соответственно
подвижность) продуктов реакции в электрофорезе, что может быть причиной
артефактов.Ферменты, применяемые для секвенирующих процедур, относятся к реком¬
бинантным ДНК-полимеразам, не обладающим экзонуклеазной активностью и
толерантностью к включению меченых дезоксинуклеотидов. Выбор термочув¬
ствительных или термостабильных полимераз определяется режимами реакции
(обычной или циклической, т.е. типа ПЦР) в зависимости от задач секвенирования
в конкретном случае.Аппаратура для секвенирующего гель-электрофореза должна обладать доста¬
точно высоким разрешением, чтобы разделять фрагменты, различающиеся по
длине лишь на один нуклеотид. Разделяют фрагменты в денатурирующем режиме
(5-8% ПААГ с 7М мочевиной). Обычно электрофорез проводится в трис-боратном
буфере. Важным условием при проведении электрофореза является однородность
температуры геля и заключающих стекол. Прекрасным решением для автоматиче¬
ского секвенирования является капиллярный электрофорез в стеклянной трубке
длиной 30-100 см при небольшом диаметре капилляра (50-100 мкм), что значи¬
тельно ускоряет процедуру разделения.Основные модели автоматических секвенаторовСовременные секвенаторы можно разделить по типу проводимого электрофо¬
реза на капиллярные и с гелевыми пластинами. Последние могут различаться по
количеству детектируемых красителей — один, два или четыре. Капиллярные сек¬
венаторы выпускаются только в варианте, использующем детекцию четырех флю¬
оресцентных красок, возбуждаемых излучением аргонового лазера. Разделение
фрагментов проводится в геле толщиной 0,4 мм. Возбуждение флюорофора и сле¬
дующая за этим эмиссия флюоресценции происходят при прохождении меченым
фрагментом ДНК зоны сканирования. Для уменьшения эффекта перекрывания
спектров эмиссии получаемый сигнал пропускается через колесо с 4 последова¬
тельно заменяемыми фильтрами. В результате первичные данные представляют
собой наборы из четырех чисел (в соответствии с сигналом, прошедшим через
каждый из фильтров) для каждой точки сканирования (по ширине геля), собран¬
ные через равные интервалы времени в течение всего электрофореза.Секвенаторы на гелевых пластинках обнаруживают флюоресценцию от одного
до нескольких красителей. Имеется несколько модификаций в зависимости от
типа лазера, направления луча возбуждающего света. В частности, у секвенатора
MicroGene разделение происходит в одноразовых МгстСе/-кассетах, заполняемых
фотополимеризуемым акриламидом. Высота кассет варьирует от 140 до 280 мм,
что позволяет секвенировать от 300 {MicroCel 300 Cassette) до 700 (МісгоСеї 700
Cassette) нуклеотидов. В качестве источника излучения используют гелиево¬
неоновый лазер с длиной волны 632,8 нм. Луч лазера направляют поперек геля.
Это позволило отказаться от любых движущихся частей и, следовательно, значи¬
тельно повысить надежность прибора и уменьшить его размеры.Высоким качеством отличаются секвенаторы, работающие на красителях
инфракрасной области спектра. Как известно, естественное инфракрасное излу¬
чение несвойственно биологическим макромолекулам и компонентам акрила-
мидных гелей, поэтому регистрируется исключительно сигнал от красителя.
Двухканальная система позволяет избежать перекрывания спектров эмиссии (они
разнесены) и проводить одновременное двунаправленное секвенирование (сразу
162 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯС двух праймеров, каждый из которых мечен своим красителем). За один про¬
гон секвенатор IR2 DNA Sequencer способен определять более 1000 нуклеотидов.
В секвенаторе ABI Prism 377 основное новшество заключается в замене оптиче¬
ской фильтрации .флюоресценции на «виртуальную» фильтрацию. В процессе
сканирования эмиссия флюоресценции отделяется от отраженного света лазера
посредством дифракционной решетки и фиксируется CCD-камерой. В итоге кван¬
ты света преобразуются в пиксели на всем промежутке спектра от 514 до 680 нм,
анализ выполняется. Максимально возможный размер определяемых фрагмен¬
тов — 800-900 нуклеотидов.Схожая технология записи и обработки данных применяется в некоторых
капиллярных секвенаторах.Клиническое применение результатов исследованияМЕТОДЫ МОЛЕКУЛЯРНОЙ КЛИНИЧЕСКОЙ ДИАГНОСТИКИ ПРИ СКРИНИНГЕ
(МАССОВЫХ ОБСЛЕДОВАНИЯХ)Уникальным преимуществом молекулярно-биологических методов является
возможность динамического наблюдения за присутствием и содержанием опре¬
деленных генов, что позволило ввести их в соответствующие диагностические
панели. Основным требованием на скрининговом этапе исследований является
высокая чувствительность при достаточной специфичности диагностики. В част¬
ности, сочетанное применение иммунологических методов и ДНК-диагностики
позволяет проводить серийные обследования на наличие гепатитов В, С и ВИЧ-1
в особых группах риска. На следующем этапе возможно повторное проведение
диагностики уточняющего характера в отобранных во время скрининга группах с
сомнительными или положительными результатами.Методы молекулярной клинической диагностики при
установлении или уточнении диагноза заболеванияУточняющая диагностика требует не только достаточной чувствительности, но
и высокой степени специфичности определений. Задачей цитологического анализа
в этих ситуациях является не только подтверждение диагноза, но и при возмож¬
ности определение специфического генотипа в целях прогнозирования течения
заболевания и планирования оптимальных схем лечения.КОНТРОЛЬ в ХОДЕ И ПОСЛЕ ЛЕЧЕНИЯЦенность молекулярно-биологических методов наиболее высока при проведе¬
нии специфической терапии из-за их высокой чувствительности и возможности
отслеживать минимальные уровни патологических генных мишеней, будь то гены
инфекционных патогенных микроорганизмов или онкогены при злокачественных
заболеваниях. Разработка методов полуколичественной и количественной оценки
количества генокопий в образце (ПЦР в реальном времени) дает уникальную воз¬
можность отслеживать динамику концентраций патологических генов (вирусов,
микробов при лечении инфекций или онкогенов при терапии лейкозов) в био¬
логических пробах. Особое значение имеет количественная ПЦР-диагностика при
гепатитах и ВИЧ-инфекции, так как сроки назначения и интенсивность специфи¬
ческого лечения в этих случаях во многом зависят не только от клинического
статуса, но и от содержания вируса в периферической крови, а также от генотипа
вируса. Ответ на терапию определяется наряду с улучшением клинической карти¬
ны по снижению содержания количества копий вируса в плазме крови.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 163Другая важная область применения генной диагностики в динамике заболе¬
ваний — определение остаточных специфических онкогенов при интенсивном
лечении лейкозов и лимфом. Особую роль имеет количественная диагностика
минимальной остаточной болезни после трансплантации костного мозга боль-
ным с лейкозами, когда критерием излечения считается молекулярная ремиссия
(содержание клеток с патогенным онкогеном менее 1 на 1 ООО ООО лейкоцитов
костного мозга или периферической крови). Такой же важной частью динамиче¬
ского наблюдения является регулярное качественное или количественное опреде¬
ление целевых патологических генов для оценки качества, продолжительности
достигнутой клинической ремиссии и раннего выявления рецидивов болезни.КОНТРОЛЬ КАЧЕСТВА И СТАНДАРТИЗАЦИЯУчитывая многообразие генетических маркеров, определяемых методами моле¬
кулярной диагностики, и большое количество тест-систем, доступных на рынке
лабораторных реагентов, правильность получаемых результатов зависит от стан¬
дартности выполнения основных этапов диагностики, а именно от заготовки и
хранения биологических образцов, процесса подготовки проб, выделения нуклеи¬
новых кислот, составления ПЦР-смесей, режима амплификации ДНК и учета
результатов. В связи с этим следует обращать внимание на следующие факторы;• наличие регистрационного удостоверения, относящего оборудование к издели¬
ям медицинского назначения (особенно микродозаторов, термоблоков, прибо¬
ров для амплификации, средств учета и документирования результатов);• правильное получение, хранение и доставку материала (выдача ясных и под¬
робных инструкций врачам и медсестрам);• стандартное выполнение процедур подготовки проб, ПЦР, гибридизации и
секвенирования ДНК персоналом лаборатории. Под этим подразумевается
как работа строго по протоколам, изложенным в инструкциях от производи¬
теля, так и соблюдение общих правил работы в молекулярно-биологических
лабораториях и санитарно-эпидемиологических норм при взаимном контро¬
ле и преемственности отдельных этапов исследования;• наличие сертификатов по клинической лабораторной диагностике и
молекулярно-биологическим методам исследования у врачей и среднего
лабораторного персонала КДЛ и соответствующей квалификации у биологов-
исследователей;• обязательное привлечение данных клинической картины и лабораторно¬
инструментальных методов исследования при комплексном обследовании
больного и оценке результатов молекулярно-биологического исследования.
Врачу КДЛ важно понимать суть и значение имеющихся симптомов забо¬
левания, чтобы провести своевременно повторное исследование или анализ
дополнительных молекулярно-генетических маркеров. Специалистам по
генной диагностике необходимы рабочие контакты со специалистами по
иммунодиагностике, клинической биохимии, вопросам дополнительной диа¬
гностики обследованных больных.ВНУТРИЛАБОРАТОРНЫЙ КОНТРОЛЬГенную диагностику в большинстве лабораторий проводят с помощью коммер¬
ческих тест-систем для ПЦР и/или гибридизации ДНК. Во многих из этих систем
предусмотрен так называемый ген внутреннего контроля (ВК), т.е. данный ген
должен выявляться в любом клиническом биологическом образце, содержащем
нуклеиновые кислоты. Присутствие четкого сигнала ВК свидетельствует о том,
что подготовка проб и выделение нуклеиновых кислот из данного клинического
образца проведены успешно. К каждому диагностическому набору прилагается
образец положительного контроля с образцом целевого гена (в форме ДНК, к ДНК,
164ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯплазмиды или специфического ампликона), а также отрицательный контроль
(им может служить буферный раствор, применяемый для растворения ДНК).
Эти контрольные образцы подвергают той же обработке и амплификации, что и
исследуемые клинические пробы ДНК. Правильность проводимого исследования
подтверждается специфическим сигналом в положительном контроле и отсут¬
ствием сигнала в отрицательном. Это свидетельствует о достаточной активности
компонентов тест-системы и об отсутствии существенных загрязнений реактивов,
использованных на этапе подготовки проб и выделения ДНК.Пробы ДНК и РНК, выделенные для рутинной клинической генной диагностики,
должны храниться, по крайней мере, до 1-2 мес в глубоком холоде на случай необ¬
ходимости повторных или дополнительных исследований. Внутрилабораторный
контроль качества проводят регулярно путем повторных анализов положитель¬
ных проб и сравнения с результатами текущих серий. Такие сравнения особенно
важны при переходе с реагентов одного производителя к тест-системам другой
фирмы, В мероприятиях по внутрилабораторному контролю качества особое зна¬
чение имеет видеоаппаратура для фиксации и хранения результатов исследований.
Помимо обычного оснащения, для учета результатов ПЦР (трансиллюминатора,
видеокамеры) необходимо иметь компьютер для сохранения полученных изо¬
бражений, возможности их сопоставления и контроля в разные сроки и с разными
тест-системами,МЕЖЛАБОРАТОРНЫЙ КОНТРОЛЬВ качестве средств межлабораторного контроля в молекулярной диагностике
периодически или при необходимости проводят следующие мероприятия:• обмен образцами ДНК и сравнение результатов, полученных разными лабо¬
раториями и разными диагностическими системами;• подтверждающую ДНК-диагностику первично-положительных результатов,
проводимую в лабораториях с большим опытом работы по диагностике кон¬
кретных патогенных микроорганизмов (например, ВИЧ-1, гепатита С).СИСТЕМЫ ВНЕШНЕГО КОНТРОЛЯ КАЧЕСТВА (ОЦЕНКА ЭФФЕКТИВНОСТИ
ВНУТРИЛАБОРАТОРНОГО КОНТРОЛЯ)По мере расширения сети лабораторий, использующих методы молекулярной
диагностики, возникли проблемы стандартизации соответствующих исследова¬
ний. В последние годы в различных странах создаются системы внешнего контро¬
ля качества молекулярно-биологических исследований. Учитывая многообразие
генов, определяемых методами ПЦР, и большое количество диагностических про¬
дуктов, предлагаемых на рынке лабораторных тестов, задачи системы внешнего
контроля качества представляются вполне рациональными и обоснованными.Контроль качества молекулярно-биологических исследований является одним
из новых направлений работы Федеральной системы внешней оценки качества
(ФСВОК) РФ. Основной задачей этой контрольной системы является оценка
традиционных лабораторных показателей. Так, на 2007 г. ФСВОК включала
121 раздел с участием более чем 7000 лабораторий по России. В программах по
оценке качества ПЦР в 2007 г, участвовали более 200 лабораторий, от которых
было сделано более 400 заказов на контрольные образцы. Большая часть лабо¬
раторий проявила интерес к диагностике урогенитальных инфекций [Chlamydia
trachomatis. Mycoplasma hominis, Ureaplasma urealyticum, Neisseria gonorrhoeae (около
70% контрольных образцов)], около 25% — к контролю ПЦР-диагностики гепати¬
та С и лишь около 5% — к диагностике туберкулеза. Это свидетельствует, с одной
стороны, о достаточно ограниченном круге ПЦР-диагностикумов, предлагаемых
ФСВОК, а с другой ~ об узкой специализации молекулярно-диагностических
исследований в большинстве клинических лабораторий.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 165Аналогичные системы контроля качества генной диагностики созданы в ряде
европейских стран (Великобритании, Финляндии, Франции), они пока ограничи¬
ваются небольшим ассортиментом контрольных образцов. Так, система Labquality
(Университет Хельсинки) в основном занимается оценкой качества диагностики
Chlamydia trachomatis и Neisseria gonorrhoeae. Контроль качества количественной ПЦР
пока не приобрел распространения на зфовне национальных систем, хотя соответ¬
ствующие тест-системы, особенно наборы для диагностики ВИЧ-І, гепатитов В и
С и контрольные образцы к ним, выпускаются рядом фирм в России и за рубежом.
Проблема состоит в том, что в количественной ПЦР-диагностике пока не вырабо¬
таны общепризнанные стандарты для количественного контроля, которые могли
бы служить в качестве референтных. Количественные тест-системы от крупных
фирм-производителей {Roche, Chiron и др.) после получения разрешений от своих
надзорных органов (FDA в США и др.) могут использоваться для неофициальных
референтных оценок результатов другими лабораториями с иными тест-системами.Применение ПЦР-диагностики
в различных областях медициныМетоды клинической молекулярной диагностики получили широкое распростра¬
нение в нашей стране и применяются в различных областях медицины, таких как:• акушерство и гинекология;• онкогинекология;• дерматология и микология;• иммунология (диагностика ВИЧ);• фтизиатрия и пульмонология;• гастроэнтерология и гепатология;• гематология и онкология;• неврология;• урология;• стоматология;• изучение наследственных болезней и предрасположенностей к различным
заболеваниям и т.д.Ниже рассмотрены некоторые клинические аспекты применения молекулярных
методов.ГИНЕКОЛОГИЯ И АКУШЕРСТВОВыявление и идентификация возбудителей инфекционных заболеваний явля¬
ются одними из основных задач современной медицинской микробиологии. При
микробиологических исследованиях возникают ситуации, когда использование
традиционных культуральных, а также современных иммунохимических методов
диагностики оказывается недостаточным для идентификации возбудителя, что
заставляет создавать и внедрять принципиально новые методы выявления и иден¬
тификации патогенов.В последнее десятилетие происходит стремительное развитие генетических
методов диагностики инфекционных заболеваний, основанных на детекции спе¬
цифических нуклеотидных последовательностей инфекционных агентов, среди
которых лидирует метод ПЦР и его модификации (ПЦР и ее применение для диа¬
гностики в дерматовенерологии, 2004).В диагностике инфекций, передающихся половым путем, ПЦР нашла свое место
для решения следующих задач:• скрининга условно-патогенной флоры;• оценки эффективности проведенной терапии;• количественной оценки вирусной нагрузки.
шШ: 16S ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ"ШБлагодаря своей высокой чувствительности ПЦР позволяет выявлять инфекци¬
онный агент при минимальном содержании в исследуемом материале. Это необхо¬
димо при бессимптомном течении инфекционного процесса, вызванного условно
fMi патогенными микроорганизмами.Метод ПЦР с детекцией в режиме реального времени позволяет проводить
многофакторные исследования качественного и количественного состава условно-
патогенной флоры. Этот анализ дает врачу-клиницисту представление о состоянии
биоценоза урогенитального тракта, этиологической причине дисбиоза и предо¬
ставляет возможность назначить необходимый объем терапии.ПЦР как чувствительный и специфичный инструменг исследования биоценоза
урогенитального тракта у женщин — это:• количественная оценка условно-патогенной и нормальной флоры уроге¬
нитального тракта, выявление соотношений между различными группами
микроорганизмов и общей бактериальной массой;• выявление труднокультивируемых облигатно-анаэробных грамположитель-
ных бактерий (Atopobium vaginae), облигатно-анаэробных грамотрицатель-
ных бактерий (Prevotella, VetlloneUa spp., Porphyromonas spp., Fusobacterium spp.,
Eubacterium spp., Sneathia, Leptotrichia, Megaspkaera, Dialister, Lachnobacterium);• возможность проведения динамических наблюдений.Такая технология позволяет врачу-клиницисту быстрее поставить диагноз иначать этиологически направленное лечение исходя из состояния конкретного
пациента.При выявлении пре- и перинатальных инфекций в дородовых отделениях часто
возникает вопрос о наличии активных инфекций, особенно при экспозиции плода на
ранних стадиях развития. Эту группу инфекционных агентов, опасных для развиваю¬
щегося плода, часто обозначают сокращением TORCH по их начальным буквам.• Toxoplasma gondii.• Вирус краснухи (Rubeola).• Цитомегаловирус (Cytomegalovirus).• Герпес-вирус (Herpesvirus).Кроме того, в расширенный список входит еще ряд инфекционных агентов.• Парвовирус (в особенности подвид В19).• Вирус Коксаки В.• Вирусы гриппа и парагриппа.• Патогенные штаммы лептоспиры.• Л истерия (Listeria monocytogenes).• Бледная трепонема.В настоящее время существуют диагностические ПЦР-наборы с высокими чув¬
ствительностью и специфичностью для выявления перечисленных возбудителей.ОНКОГИНЕКОЛОГИЯОсобое место в онкогинекологий занимает диагностика вируса папилломы
человека (ВПЧ). Диагностика папилломатоза стала достоверной лишь с появле¬
нием методов, основанных на детекции нуклеиновых кислот, ~ гибридизации
ДНК ВПЧ и полимеразной цепной реакции, В зависимости от целей и возмож¬
ностей лабораторий широко применяются различные техники ПЦР и/или ДНК-
гибридизации. Среди подобных методик вьщеляется НС П (Hybrid Capture И),
отличающаяся простотой выполнения и специфичностью. В целом следует отме¬
тить, что методы, основанные на реакции гибридизации, менее чувствительны к
случайным загрязнениям образцов в сравнении с ПЦР-диагностикой, что снижает
частоту ложноположительных результатов.Из десятков штаммов ВПЧ около ’Д считаются онкогенньши. Их присутствие в
организме ассоциируется с высоким риском развития рака шейки матки, гортани
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 107И других эпителиальных опухолей. Именно поэтому генная диагностика ВПЧ в
клетках, взятых с шейки матки, входит в число исследований при оценке степени
онкологического риска у женщин. На протяжении нескольких лет широко при¬
меняют диагностические наборы, выявляющие ДНК ВПЧ 16, 18, 6, 11-го и ряда
других онкогенных типов, которые вполне пригодны для рутинных исследований.
Более точная и чувствительная диагностика возможна с применением методов
молекулярной гибридизации ДНК со специфическими ДНК-зондами, соответ¬
ствующими онкогенам ВПЧ.Практическое значение имеет генетическое типирование ВПЧ. Этот ДНК-
содержащий вирус принадлежит к семейству PAPOVA-вирусов (РАрШота,
POlyoma and simian VAcuolating viruses). Известны более 80 типов ВПЧ, обладаю¬
щих различной тропностью к эпителию верхних дыхательных путей и аногени¬
тальной системы, а также различным уровнем онкогенности. Среди них выделя¬
ют субтипы низкого и высокого онкогенного риска. ВПЧ низкого риска типов в,11, 40, 42, 43, 44 обычно ассоциированы с доброкачественными экзофитными
папилломами, тогда как ВПЧ высокого риска (типы 16,18, 31, 33, 39, 45, 52, 56,
58) обнаруживают в 90-95% случаев преинвазивных и инвазивных форм рака
шейки матки (РШМ). Частота возникновения РШМ у женщин, инфицированных
ВПЧ высокого риска, возрастает в среднем в 30 раз по сравнению с незараженны-
ми, поэтому данный контингент обследуемых требует пристального мониторин¬
га, особенно в группах среднего возраста.Значительную актуальность приобретает обнаружение онкогенных ВПЧ, инте¬
грированных в геном инфицированных клеток. Если вирус существует в эписом-
ной (внехромосомной) форме, инфекция может с годами прекратиться. При инте¬
грации же вирусного генома в хромосомы эпителиальных клеток и персистенции
инфекции в возрасте после 40 лет резко возрастает опасность злокачественного
перерождения и развития ракового заболевания. В патогенетическом аспекте
наиболее важна диагностика ранних генов Е6 и Е7 в геноме вирусов высокого
риска (типы 16, 18, 31 и др.), которые связаны с персистенцией ВПЧ-инфекции
и ее осложнениями и выявляются во всех случаях рака шейки матки, так как, по
современным данным, подавляют действие гена р53 — ключевого антионкогена.
Описан ряд ПЦР-методик генотипирования ВПЧ и экспрессии генов-интеграции
в геном. Используемые отечественными авторами аналитические подходы не
менее чувствительны и специфичны, чем стандартная методика (НСА-1) для
выявления субтипов ВПЧ при различных клинических формах дисплазии шейки
матки. Они в основном основаны на методах гибридизации РНК или ДНК ВПЧ с
£7-специфичными зондами.Кроме вариабельности генов Е6 и Е7 ВПЧ, изучается и изменчивость гена Е2 —
ингибитора транскрипции Е6, Е7. При этом сравнительная оценка интенсивности
геноспецифических сигналов Е2 и Е6 позволяет ориентировочно оценить статус
интегрированности ВПЧ в геном инфицированных клеток.ДЕРМАТОЛОГИЯСовершенствование способов диагностики и контроля лечения грибковых
инфекций (микозов) имеет большое значение в связи с высокой частотой заболе¬
ваемости среди населения всех возрастных групп. Дифференциальная диагностика
грибковых поражений кожи и ногтей имеет особое значение в связи с различиями
схем лечения при микозах различного генеза. Классическая симптоматика мико¬
зов обычно дает возможность диагностировать заболевание по клиническим при¬
знакам. Однако во многих случаях симптомы болезни бывают слабовыражены,
особенно в начальной стадии заболевания или после курса лечения. Микроскопия
исследуемых образцов кожи и ее придатков не всегда точна при малой интенсив¬
ности инфекции или глубоком поражении тканей.
168 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ«Золотым стандартом» в медицинской микологии является точный и надежный
способ культивирования грибов в специальных микробиологических средах. Его
недостаток — большая длительность культивирования (до 4 нед) и в ряде случаев
отсутствие роста гриба на фоне проводимого лечения.ПЦР ДНК позволяет проводить точную и быструю диагностику трихофитии
{Trichophyton rubrum. Trichophyton mentagrophytes, Tr.floccosum и др.), a также канди-
доза и аспергиллеза. По некоторым данным, ДНК-диагностика патогенных грибов
в образцах кожи или ногтевых пластинок возможна в течение 1-2 сут после полу¬
чения клинического материала.ГЕМАТОЛОГИЯ И ОНКОЛОГИЯОбщеизвестно, что интенсивная цитостатическая терапия наряду с противоопу¬
холевым эффектом оказывает выраженное иммунодепрессивное действие, В связи
с этим у больных необходимо регулярно контролировать наличие системных или
локальных инфекций, прежде всего вирусной природы. Так, инфекция цитомега-
ловирусом или парвовирусом В19 может вызвать выраженное подавление гемопо-
эза. Вирус Эпштейна-Барр иногда сопутствует возникновению лимфом. Это осо¬
бенно важно при использовании препаратов, подавляющих иммунитет (например,
циклоспорина) после пересадки костного мозга. Кроме того, после многократных
трансфузий эритроцитов или тромбоцитов больных нужно периодически прове¬
рять на наличие вирусов гепатитов В и С в плазме крови.НЕВРОЛОГИЯВ неврологической практике часто возникают вопросы дифференциальной
диагностики энцефалитов и менингитов, а также задачи исключения нейроинфек¬
ций у больных с неврологическими заболеваниями. В этом случае стоит задача
выявления вирусных инфекций (или их активации). Известно, что многие вирусы
группы герпеса являются нейротропными. Так, цитомегаловирус, вирусы про¬
стого герпеса, опоясывающего лишая и др. могут десятилетиями персистировать
в организме без особых клинических симптомов. Нарастание титров специфиче¬
ских антител класса IgM в сочетании с соответствующей клинической картиной
и положительной ПЦР-реакцией на данный вирус ставит вопрос о проведении
антивирусной терапии. Именно поэтому наиболее востребованными в неврологи¬
ческой клинике являются ПЦР ДНК цитомегаловируса, простого герпеса, вируса
Эпштейна-Барр, а также Herpes zoster (опоясывающего лишая). В ряде случаев
требуется определение ДНК вируса герпеса VI типа, который является вероятной
причиной синдрома хронической усталости и может вызывать пневмонии. Кроме
того, в сомнительных случаях необходимо исключение хламидийной инфекции
и токсоплазмоза у больных. Особое значение (при соответствующем анамнезе)
имеет детекция ДНК боррелий — трепонем, переносимых клещами и вызывающих
эндемичный клещевой боррелиоз с кожной и неврологической симптоматикой.
Оптимальный вариант — проведение серологических исследований (выявление
специфических антител, особенно нарастания титра антител класса IgM) с при¬
менением ПЦР-диагностики в качестве уточняющего метода.При ряде демиелинизирующих заболеваний (например, рассеянном склерозе)
клиническая картина может быть сходной с таковой при подострых и хрониче¬
ских нейроинфекциях, в этих ситуациях в целях дифференциальной диагностики
проводят ПЦР-исследование на наличие вирусов группы герпеса и боррелий в
спинномозговой жидкости.ФТИЗИАТРИЯ И ПУЛЬМОНОЛОГИЯВопросы своевременной диагностики т>'беркулеза стали очень актуальны в
последние годы в связи с ростом заболеваемости. Безусловно, «золотым стандар¬
том» во фтизиатрии является серологическая и бактериологическая диагностика.
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 169ПЦР-диагностику туберкулеза применяют в качестве подтверждающего метода
выявления туберкулеза, особенно при внелегочной локализации очагов пораже¬
ния. Имеется значительный выбор коммерческих тест-систем для выявления ДНК
Mycobacterium tuberculosis, Mycobacterium bovis и комплексной диагностики этих
видов. Использование ПЦР с детекцией результатов в реальном времени позво¬
ляет проводить высокочувствительное исследование как в специализированном,
так и в общелечебном учреждении уже на первичном этапе (Смирнов С.Н., 2007).
Возможность количественной оценки позволяет своевременно делать заключениео степени эпидемической опасности пациента. Кроме того, исследование парных
образцов или сравнение материала до и после начала курса лечения дает возмож¬
ность контролировать эффективность противотуберкулезной терапии.В последние годы появились методы генной диагностики штаммов микобакте¬
рий, резистентных к противотуберкулезным препаратам. В частности, устойчивость
палочки Коха к изониазиду или рифампицину связана с мутациями микробных
генов. Для выявления «генов резистентности?» необходимо вырастить чистую куль¬
туру туберкулезных бактерий от данного больного. Из бактерий выделяют ДНК и
подвергают амплификации (в варианте мультиплексной ПЦР) с целью получить
сегменты генов, которые могут содержать эти мутации. Затем эти продукты ПЦР
дополнительно подвергают гибридизации на носителях (биочипах) с набором ДНК-
зондов, специфичных к искомым мутациям. Положительный результат гибридиза¬
ции свидетельствует о наличии мутации, вызывающей устойчивость к определенно¬
му препарату, в связи с чем больному следует назначить другой препарат.Выявление патогенных бактерий в мокроте, бронхоальвеолярном лаваже и
других биологических материалах при неспецифических бронхолегочных забо¬
леваниях (бронхитах, пневмониях) обычно проводят стандартными бактериоло¬
гическими и иммунологическими методами. Однако при подозрении на вирусные
инфекции можно и нужно проводить ПЦР-диагностику (например, на вирусы
гриппа, парагриппа, респираторно-синцитиального вируса и др.). Особое значение
имеет своевременная диагностика патогенных грибов, в частности рода Aspergillus,
Candida, Mucor и др., у маленьких детей, пациентов пожилого возраста и больных
с подавленным иммунитетом (например, после интенсивной цитостатической
терапии при онкологических заболеваниях). Здесь методы ПЦР ДНК по скорости
выполнения, точности и специфичности диагностики существенно превосходят
обычные способы исследования, применяемые в микологии (микроскопию, куль¬
тивирование, определение специфических галактоманнанов в плазме крови и
т.д.).ГАСТРОЭНТЕРОЛОГИЯ И ГЕПАТОЛОГИЯПри выявлении наиболее частых патогенных микроорганюмов желудочно-
кишечного тракта доминируют классические бактериологические методы. Это
касается стандартных способов диагностики колибактериоза, сальмонеллеза, кам-
пилобактериоза, основанных на культивировании микроорганизмов, выявлении
микробных антигенов и оценке титров специфических антител. ПЦР-диагностику
инфекционных заболеваний кишечника применяют нечасто, например для диа¬
гностики патогенных грибов, анаэробных бактерий или вирусных заболеваний
(в частности, энтеровирусной инфекции). Определение генных вариантов микро¬
организмов можно проводить в целях выявления особо патогенных генотипов
(например, стрептококка, Escherichia coli и др.). Б последние годы разрабатываются
методы выявления мутаций, ведущих к лекарственной резистентности микробов к
специфической химиотерапии. Сейчас доступны отечественные тест-системы для
ПЦР-диагностики генов устойчивости к тетрациклину и эритромицину в популя¬
циях уреаплазмы. Выявление генов резистентности следует проводить в чистых
170 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯкультурах микроорганизмов, что значительно увеличивает продолжительность и
повышает стоимость исследования.Существенное значение генная диагностика имеет при выявлении Н. pylori.
Прямое обнаружение бактериальной ДНК в локальных пробах и слюне является
фактором повышенного риска язвенной болезни желудка и ее осложнений. При
этом необходимо определять патогенные штаммы этого микроорганизма (пози¬
тивные по cag, иге, vac и ряду других генов). Повышенная патогенность микро¬
организмов связана с наличием у них специфических факторов, которыми могут
быть клеточные токсины, ферменты, разрушающие окружающие ткани, белки,
подавляющие иммунный ответ, и др. Выработка этих факторов контролируется
соответствующими генами, которые часто образуют в геноме так называемые
островки патогенности.Наиболее важным приложением генной диагностики в гепатологии является
детекция вирусных гепатитов. Вирусы гепатитов, способных вызывать поражение
печени, относятся к различным семействам, имеют разные биологические свой¬
ства. Тактика лечения заболевания будет значительно отличаться в зависимости
от этиологии. Таким образом, адекватная этиологическая диагностика вирусных
гепатитов является наиболее значимой задачей, решение которой невозможно
без использования современных молекулярно-биологических методов, одним из
которых является ПЦР.ПЦР используют для обследования контактных людей и более раннего выявле¬
ния заболевших гепатитом А в очагах инфекции, так как РНК вируса гепатита А
появляется в крови больного с гепатитом А гораздо раньше, чем антитела.ПЦР в диагностике гепатита В применяется:• для качественного обнаружения ДНК;• ранней диагностики острого гепатита В — ДНК вируса гепатита В обнару¬
живают в крови больного с гепатитом В в среднем на 20 дней раньше, чем
HBAg;• количественной оценки вирусной нагрузки:• выявления мутантных штаммов вируса гепатита В;• выявления скрытых форм вирусного гепатита В;• диагностики хронического гепатита В;• контроля эффективности противовирусной терапии.ПЦР в диагностике гепатита С позволяет:• установить факт инфицированности гепатитом С;• установить показания к противовирусному лечению;• выбрать оптимальную схему лечения;• оценить эффективность проводимого лечения.Первичная диагностика гепатита С традиционно основана на выявлении специ¬
фических антигенов и антител. Однако от момента инфекции до выработки анти¬
тел проходит значительное время (серонегативное окно). Обнаружение вирусной
РНК в плазме больных на ранних этапах инфекции — важный критерий диагноза.
Особую роль играет эпидемиологическая опасность гепатита С, что диктует необ¬
ходимость ПЦР-скрининга в группах высокого риска (в частности, у больных при
многократных гемотрансфузиях, а также среди «шприцевых» наркоманов).Вирус гепатита С (ВГС) обладает значительной генетической вариабельностью.
В ходе генных мутаций возникают варианты с измененным антигенным составом,
что затрудняет серологическую диагностику. Именно поэтому детекция вирусной
РНК методом ПЦР является единственным методом ранней диагностики этого
заболевания.Когда решается вопрос о терапии ВГС и ее длительности, прогностически благо¬
приятными факторами считаются молодой возраст больного, низкий уровень РНК
ВГС в плазме крови (менее 10“ генокопий в 1 мл плазмы), а также определенные
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 171генотипы вируса (2 или 3). Генотипирование ВГС у ПЦР-положительных боль¬
ных проводят с образцами комплементарной ДНК, полученной из вирусной РНК
методом обратной транскрипции, посредством амплификации типоспецифиче¬
ских участков генома. Наиболее часто в Европе встречаются 6 типов вируса, из
которых в России тип 1Ь является прогностически менее благоприятным в связи
с более частым развитием цирроза печени и худшим ответом на антивирусную
терапию.УРОЛОГИЯМочевые инфекции являются нередкой причиной развития почечной недоста¬
точности, некоторые патогенные микроорганизмы представляют собой важный
фактор возникновения мочекаменной болезни. Наиболее часто в мочевыводящих
путях выявляют следующие микроорганизмы,• Escherichia coli.• Другие энтеробактерии {Proteus, Klebsiella, Enterobacter, Citrobacter).• Pseudomonas aeruginosa.• Enterococcus.• Staphylococcus saprophyticus.• Staphylococcus aureus,• Streptococcus agalactiae (группа Б) — в основном у женщин.• Candida.Реже встречаются такие патогенные и условно-патогенные микроорганизмы,
как Haemophilus influenzae, Haemophilus parainfluenzae, Blastomyces dermatitidis.Наиболее часто в клинике исследуют наличие Neisseria gonorrhoeae. Гонококк
легко выявляется с помощью микроскопии и другими бактериологическими мето¬
дами, ПЦР-диагностику ДНК гонококков проводят довольно часто, но ее эффек¬
тивность значительно ниже ожидаемой. Причиной этого может быть ранняя анти-
биотикотерапия больных в высоких дозах, что резко снижает выявляемость любых
патогенных микроорганизмов, чувствительных к данному антибактериальному
препарату. Другим микроорганизмом, поиск которого весьма актуален, является
Mycobacterium tuberculosis, в диагностике которого молекулярно-биологическая
диагностика играет уточняющую роль после классических способов бактериоло¬
гического исследования.Микробные факторы уропатогенности могут лежать в основе существенных
механизмов, способствующих образованию кристаллов на слизистой оболочке
мочевыводящих путей и возникновению мочекаменной болезни. Так, Proteus
mirabilis и Corynebacterium urealyticum вырабатывают значительные количества
уреазы — фермента, расщепляющего мочевину с образованием ионов аммония,
повышением щелочности мочи, что ведет к облегченному росту бактерий и обра¬
зованию камней в мочевом пузыре. Доказано, что уреазопозитивные штаммы
бактерий способствуют повышению pH мочи, это ведет к повышенному риску
формирования оксалатных и струвитных камней, К таковым относится Proteus
mirabilis, который может образовывать биопленки, особенно на поверхности моче¬
вых катетеров. Интенсивный рост протея приводит к быстрому осаждению каль¬
циевых конкрементов в просвете катетера и появлению потенциального источ¬
ника восходящей мочевой инфекции, уреазопозитивные штаммы Proteus mirabilis
способствуют .защелачиванию мочи, что создает условия для камнеобразования.Непосредственную роль конкретных инфекционных возбудителей в процессах
камнеобразования довольно сложно проследить, поскольку патогенные микроор¬
ганизмы в ходе формирования конкрементов могут находиться как на их поверх¬
ности, так и в глубине этих структур. По этой причине до сих пор не установлена
роль так называемых нанобактерий (содержащих кальций частиц размерами
менее 0,5 мкм), обнаруженных в составе почечных камней. Предполагалось, что
172 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯнанобактерии могут играть определенную роль в камнеобразовании, так как они
были связаны с формированием карбонатных отложений. Однако последующие
изыскания не подтвердили эту теорию, поскольку выделенные микроорганизмы
уже были известны ранее как сапрофитная флора.Таким образом, в урологической практике имеет смысл поиск микробных мар¬
керов, связанных с повышением щелочности мочи и риском развития камней.
Поскольку многие из этих бактерий культивируются недостаточно эффективно,
применение ДНК-диагностики для выявления и количественной оценки этих
бактерий в моче и на слизистой оболочке является перспективным способом
оценки факторов риска мочекаменной болезни и других урологических заболе¬
ваний.СТОМАТОЛОГИЯНекоторые из 600 видов микроорганизмов, населяющих полость рта, играют
важную роль в развитии воспалительных заболеваний зубов и десен. Так, в стар¬
ших возрастных группах наличие анаэробных бактерий в поддесневой области
является признаком развития пародонтита. ПЦР-диагностику этих микробов
начинают применять главным образом для обоснования антимикробной тера¬
пии. Изучалась частота выявления микроорганизмов — маркеров заболеваний
эмали и пародонта в различных возрастных группах российской популяции.
Выявление ДНК AcUnobaciUus actinimycetemcomitans (АА), Porphyromonas gingivalis
(PG), Bacteroidesforsythus (BF) осуществляли в стандартных образцах биоматериа¬
ла из ротовой полости. Всего обследованы 1985 человек в четырех городах России
(Санкт-Петербурге, Екатеринбурге, Нижнем Новгороде и Новосибирске) в пяти
возрастных группах (6,12,15, 35, 65 лет и старше) по 100 человек в каждой. Оба
пола были одинаково представлены в подгруппах. Пробы забирали с поверхности
языка, наддесневого и поддесневого зубного налета. Геноспецифическую ПЦР ДНК
пародонтогенных бактерий проводили по мультиплексной методике. Как в общей
выборке, так и в пределах отдельных регионов выяснилось, что частота выявления
микрофлоры оказалась наиболее высокой в пробах наддесневого зубного налета и
составила для А А — 46,7%, для PG — 53,75%, для BF — 40,5%. Отмечена четкая
возрастная динамика выявления микроорганизмов в полости рта, начиная с груп¬
пы 6-7 лет. Максимум выявления АА, BF и PG отмечался в старших возрастных
группах. Полученные данные показывают достаточно высокую чувствительность
ПЦР-диагностики, что дает возможность оценивать тяжесть пародонтитов и
эффективность проводимого лечения.ИММУНОЛОГИЯПрисутствие антител к ВИЧ в крови пациента может служить только косвен¬
ным маркером ВИЧ-инфекции, поэтому применяется прямой метод диагностики
(ПЦР).Первичную диагностику ВИЧ-1 проводят в образцах плазмы и сыворотки крови
с помошрью наборов для серологической диагностики, основанных на детекции
специфических ВИЧ-антигенов и противовирусных антител. Важной пробле¬
мой является определение динамики патологического процесса у ВИЧ-инфици¬
рованных. в частности количества вирусных частиц в крови (так называемой
вирусной нагрузки). Этот показатель определяется методами количественной
ПЦР. Проводят выделение вирусной РНК, ее обратную транскрипцию с получе¬
нием комплементарной ДНК (кДНК). Количество вируса в образце вычисляют по
содержанию этой кДНК в реакционном объеме.Таким образом, использование ПЦР позволяет решить ряд актуальных задач
диагностики, таких как:• раннее выявление ВИЧ-инфекции;• определение вирусной нагрузки;
ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ 173• обследование детей, родившихся от ВИЧ-инфицированных матерей;• в качестве подтверждающего теста при сомнительных результатах иммуно-
блота;• мониторинг заболевания.Большое значение имеет анализ генов лекарственной устойчивости вируса
иммунодефицита человека (ВИЧ-1). Известны десятки мутаций генов протеа-
зы и ревертазы ВИЧ'1, приводящих к развитию его резистентности к терапии
препаратами-ингибиторами. Это поколение лекарств составляет основу совре¬
менной антиретровирусной терапии, существенно отодвигая сроки развития
СПИДа и облегчая его течение. Методы диагностики этого класса мутаций
ВИЧ'1, в том числе гибридизационные тесты, методы прямого секвенирования,
существенно дороже обычной ПЦР, но данное исследование целесообразно
проводить до начала дорогостоящего лечения соответствующими препаратами-
ингибиторами.ИЗУЧЕНИЕ НАСЛЕДСТВЕННЫХ БОЛЕЗНЕЙ И ПРЕДРАСПОЛОЖЕННОСТЕЙ
К РАЗЛИЧНЫМ ЗАБОЛЕВАНИЯМНаиболее актуальным направлением использования ПЦР в настоящее время
является изучение генетики человека, а именно предрасположенностей к различ¬
ным заболеваниям. По различным оценкам, в геноме человека от 3 до 10 млн SNP.
Точечные нуклеотидные полиморфизмы, так же как и более крупные генетические
повреждения (делеции, хромосомные аберрации), являются фактором риска раз¬
вития многих заболеваний и обусловливают эффективность метаболизма различ¬
ных веществ. Особенностью данных генетических перестроек является то, что они
могут долгое время никак себя не проявлять, а спусковым механизмом могут стать
особенности питания, беременность, прием некоторых лекарств, образ жизни и
другие факторы. Таким образом, генетическая паспортизация имеет колоссальное
значение не только для генетики человека, но и для практической медицины.ПЕРСПЕКТИВЫ РАЗВИТИЯСреди перспектив развития метода следует отметить:• повышение точности и достоверности анализа, которые зависят от реагентов,
используемых в лаборатории (системы выделения и амплификации нуклеи¬
новых кислот);• расширение спектра исследований, что повысит востребованность ПЦР-
метода;• увеличение скорости проведения анализа, что позволит повысить произво¬
дительность ПЦР-лаборатории;• возможность интеграции ПЦР-оборудования в автоматизированные линии,
что значительно снизит ошибки, связанные с работой персонала.Наряду с внедрением современных технологий в клинико-диагностическую
практику остро встает вопрос об обеспечении этих технологий современной
нормативно-правовой базой (методическими рекомендациями, указаниями, сани¬
тарными правилами, техническим контролем, программами подготовки персонала
и Т.Д.).СПИСОК ЛИТЕРАТУРЫДмитриев А.в., Кантикова М., Микула И., Тотолян А.А. Факторы и генетика патогенности
стрептококков группы В // Микробиология, эпидемиология и иммунология. — 2000. —
№ 5. - С. 92-97.Полимеразная цепная реакция и ее применение для диагностики в дерматовенерологии /
Под ред. А.А. Воробьева. — М., 2004. — 272 с,Радченко В.Г., Стельмах В.В., Козлов В.К. Оптимизация этиопатогенетической терапии
хронического гепатита С. — СПб.: МАПО, 2004. — 168 с.
174 ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯРсбриков Д.В., Саматов Г.А., Трофимов Д.Ю. и др. ПЦР «в реальном времени». - М.:
Бином, 2009.- 215 с.Рэдклиф К. Европейские стандарты диагностиюі и лечения ЗППП. — М.. 2004. — 272 с.I Сафронникова Н.Р., Зарайский М.И., Чухловин А.Б. Факторы онкологического риска припапилломатозной инфекции // Вопр. онкол. — 2003. - Т. 49, № 4, — С. 450-454.Сенчук А.Я., Дубоссарская З.М. Перинатальные инфекции. — М.: Медицинское информа-
ционное агентство, 2005. — 318 с.Смирнов С,Н. Перспективы использования ПЦР-методологии в диагностике туберку-
ШШШ леза // Тезисы доклада на конференции Российского общества фтизиатров. - М., 21 мая
2007 г.Федеральный закон от 05.07.1996 № 86-ФЗ (ред. от 30.12.2008) «О государственном
регулировании в области генно-инженерной деятельности».
Глава 4
Биохимические исследованияВ этой главе содержится информация о биохимических иссле¬
дованиях, наиболее часто используемых в клинической практике.
Применение биохимических исследований в клинической диагно¬
стике опирается на фундаментальные представления о химическом
составе клеток и биологических жидкостей организма человека,
закономерно происходящих в них процессах метаболизма, специ¬
фической связи определенных соединений и веществ с функциями
органов и физиологических систем, первичных биохимических рас¬
стройствах, вызывающих определенные болезни, вызванных болез¬
нями вторичных нарушениях биохимического равновесия.Из всего обилия соединений, когда-либо обнаруженных в тка¬
нях и биологических жидкостях организма человека, в клинико-
биохимических исследованиях внимание привлечено к той части
соединений, обнаружение или измерение содержания которых
позволяет достоверно охарактеризовать определенную функцию
организма или состояние определенного органа, т.е. несет диагно¬
стическую информацию. Поэтому из примерно 5 млн белков чело¬
веческого организма в повседневной лабораторной практике иссле¬
дуют около 200 (хотя в ходе поиска новых, диагностически важных
белковых соединений, например для онкодиагностики, в рамках
исследований протеома изучают тысячи белковых молекул).Результаты клинико-биохимических исследований позволя¬
ют не только яснее представлять механизмы патогенеза опреде¬
ленных болезней, но и создавать диагностические алгоритмы с
использованием достаточно специфичных и чувствительных био¬
маркеров искомых патологических процессов, сфера клинико-
биохимических исследований охватывает широкий круг аналитов,
имеющих различные характеристики их структуры и свойств, — от
простых ионов и малых органических молекул до сложных высо¬
комолекулярных соединений, выполняющих функции катализа и
регуляции процессов метаболизма. В связи с этим в современной
клинической химии принято подразделять изучаемые аналиты на
отдельные классы соответственно их особенностям, в руководствах
применяют различные подходы для классификации и рассмотрения
клинико-химических аналитов:• по особенностям структуры (например, белки, липиды, угле¬
воды);
176 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ• СВЯЗИ с функцией определенных органов (например, показатели функции
печени, почек);• собственной функциональной роли (например, гормоны и медиаторы, фак¬
торы кислотно-основного равновесия);• связи с поражениями определенных органов и систем (например, биохимия
диабета, биохимические изменения при неврологических и психических рас¬
стройствах).В данном руководстве применена классификация аналитов по их основным
функциям в обмене веществ: ферменты, субстраты и продукты химических реак¬
ций, индивидуальные белки, газы и электролиты, витамины и биоактивные медиа¬
торы. В рамках каждого класса биохимические тесты расположены в алфавитном
порядке. Приведены сведения о каждом аналите, изучаемом в практической лабо¬
ратории: основная биохимическая характеристика, данные о структуре, иссле¬
дуемом материале (пробе), референтных пределах, клиническом использовании,
влияющих факторах.Лабораторные тесты можно выполнять различными методами, имеющими
особенности референтных пределов, подготовки пациентов, взятия и хране¬
ния материала, лекарственной интерференции. Именно поэтому при описании
некоторых тестов значения референтных пределов соотнесены с определенным
методом исследования, а также возрастом и полом. При биохимических иссле¬
дованиях оценивают клиническую значимость комплекса показателей, каждый
из которых имеет специфическое значение. При использовании данных лабо¬
раторных исследований в клинической диагностике врач обычно сопоставляет
результат исследования с должными значениями, свойственными состоянию
здоровья (референтными пределами). При этом следует иметь в виду те преде¬
лы, которые использует данная лаборатория. Это необходимо потому, что в
условиях отсутствия стандартизированных технологий и при применении лабо¬
раториями аналитических тест-систем, не имеющих калибровки едиными кали¬
браторами, референтные пределы могут существенно отличаться от значений,
приводимых в литературе. Стандартизация методов достигается применением
международных рекомендаций: DGKC — рекомендации Немецкого общества
клинической химии, IFCC — рекомендации Международной федерации клини¬
ческой химии. К сожалению, на практике в лабораториях могут применяться
методы, отличающиеся от рекомендованных профессиональными организация¬
ми специалистов.Приводимые применительно к каждому аналиту сведения о возможных
ситуациях, связанных с повышением или понижением его концентрации или
активности, обусловлены тем, что многие компоненты клеток и биожидкостей
полифункциональны, они могут испытывать влияние многих одновременно
происходящих в организме процессов. Следует применять способы оценки диа¬
гностической специфичности и чувствительности теста, его предсказательного
значения по отношению к искомой патологии. Не менее важно при интерпрета¬
ции результатов исследований учитывать наличие возможных влияющих факто¬
ров; применяемых лекарственных средств и других лечебных процедур, условий
перед взятием пробы биоматериала (время суток, прием пищи, физическую
активность) и др. Если нет специального указания, для плановых биохимиче¬
ских исследований кровь забирают из вены утром натощак (через 8-10 ч после
последнего приема пищи). Необходимо учитывать, что влияние на результат
исследования перечисленных при описании тестов лекарственных препаратов
и других факторов зависит от индивидуальных особенностей пациента, схем
лечения и др.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 1ФЕРМЕНТЫАктивность ферментов определяется с диагностическими целями в сыворотке,
секретах, тканевой жидкости. Ферменты обладают субстратной специфичностью,
т.е. только определенные реакдии могут катализироваться конкретным фермен¬
том. Большая часть ферментов в сыворотке крови — это тканевые ферменты,
попадающие в кровь в результате разрушения клеток или секреции. Несмотря
на то что концентрация ферментов в клетках в 1000-10 ООО выше, чем в плазме,
в норме только очень незначительная их активность регистрируется в плазме.
Причинами повышения активности ферментов при патологии являются: прямое
поражение клеточных мембран, в частности вирусами и химическими соединения¬
ми; гипоксия, аноксия и ишемия тканей; иногда активность ферментов увеличи¬
вается в результате повышенного синтеза в тканях. Имеются ферменты, которые
присутствуют только в определенной ткани или одной из тканей в высокой кон¬
центрации. При поражении этой ткани в крови появляются органоспецифические
ферменты (табл. 4-1).Таблица 4-1. Специфичность ферментов для диагностики патологииФерментОрганДиагмостическае значениеа-АмилазаПоджелудочная железа, слюнные
железыОстрый панкреатит, отитАЛТПеченьЗаболевания паренхимы печенилетМиокард, печеньИнфаркт миокарда, заболевания паренхимы печени,
поражения скелетных мышцГГТПеченьПатология желчевыводйщих путей, алкоголизмккСкелетные мышцы, сердце, глад¬
кие мышцыИнфаркт миокарда, поражения мышечной тканиКФПростата, костная тканьАденома, рак простаты, метаболические заболева¬
ния костной тканилдгПечень, сердце, скелетные
мышцы, эритроциты, тромбоциты,
лимфатические узлыЗаболевания паренхимы печени, инфаркт миокарда,
гемопиз, неэффективный эригропоэз, лимфомыЛипазаПоджелудочная железаОстрый панкреатитХолинэстеразаПеченьОтравления фосфорорганическими соединениями,
заболевания паренхимы печениЩФПечень, костная ткань, кишечник,
почкиМетаболические заболевания костной ткани, гепато-
билиарная патологияЕДИНИЦЫ АКТИВНОСТИ ФЕРМЕНТОВВ системе СИ единицей активности ферментов является катал (кат), который
соответствует количеству фермента, которое превращает 1 моль субстрата за
1 с. Наряду с изменением активности ферментов в каталах единицу количе¬
ства фермента можно характеризовать и другой величиной — международ¬
ной единицей (ME): количество фермента, которое катализирует превращение1 микромоля (мкмоль) субстрата в 1 мин. При этом объемная активность фермен¬
та выражается как МЕ/л, удельная активность — как МЕ/мг белка. При необходи¬
мости выразить результаты в каталах следует пересчитать конечные результаты по
представленному ниже алгоритму.ЕдиницаКоэффициент переводаЕдиницамккат/л60ЕД/лнкат/л0,06ЕД/лЕД/д0,9167мккат/лЕД/л16,67нкат/п
178 БИОХИМ ИЧ ЕС КИЕ ИССЛЕДОВАНИЯПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИПреаналитические требования при исследовании ферментов однотипные. Если
нет специального указания, для плановых биохимических исследований кровь
забирают из вены утром натощак (через 8-10 ч после последнего приема пищи).
Следует избегать гемолиза; до исследования сыворотку можно хранить в течение
дня при комнатной температуре, неделю - при +4 °С.АланинаминотрансферазаАланинаминотрансфераза (АЛТ) относится к группе аминотрансфераз, содер¬
жащих в качестве кофермента производное витамина пиридоксальфосфат;
АЛТ катализирует обратимую реакцию дезаминирования аминокислоты аланина.
Продукт дезаминирования (пируват) метаболизируется во многих направлениях,
включая распад с выделением энергии, синтез глюкозы и др. Наиболее высокую
активность фермента обнаруживают в печени (цитоплазме гепатоцитов), подже¬
лудочной железе, сердце, скелетных мышцах, эритроцитах, почках.Референтные пределы (ориентировочные): 5-40 ЕД/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕВыявление и оценка выраженности цитолитического синдрома при диагностике
и мониторинге заболеваний печени. Тест используют вместе с определением ACT,
При типичном течении острых вирусных гепатитов гипераминотрансфераземия
развивается у 97% больных за неделю до появления клинических симптомов (при¬
мерно у 50% больных — за 5 сут до гепатомегалии или желтухи, у 90% — за 2 сут
до желтухи). Гипераминотрансфераземия достигает максимума (повышение в5-10 раз и более) на 1-2-й неделе заболевания, что в основном совпадает с появле¬
нием желтухи или максимальной клинической тяжестью болезни. У 90% больных
активность АЛТ выше активности ACT, но при тяжелом поражении паренхимы
может быть обратное соотношение, что связано с «утеканием» в кровь не только
цитоплазматической, но и митохондриальной изоформы ACT (АЛТ локализована
в цитоплазме гепатоцитов). Нормализация показателей происходит обычно через6-7 нед заболевания (у некоторых пациентов — в течение 90 сут). Удлинение
периода гипераминотрансфераземии может свидетельствовать о переходе острого
процесса в хронический, но судить об окончании патологического процесса в пече¬
ни по этому тесту не всегда возможно. Отсутствие гипераминотрансфераземии не
исключает хронизации процесса. При остром алкогольном гепатите происходит
повышение активности аминотрансфераз, в большинстве случаев 2-3-кратное (не
более чем в 5 раз); как правило, активность ACT увеличивается в большей степе¬
ни, чем АЛТ, что объясняется токсическим поражением не только гепатоцитов,
но и миоцитов, кардиомиоцитов. При хронических персистирующих гепатитах
вне обострения активность аминотрансфераз в сыворотке крови, как правило,
находится в референтных пределах; в период обострения повышена у 70-80%
больных, но относительно немного — в 2-5 раз. При легких формах хронического
активного гепатита активность ферментов может быть такой же, как при хрони¬
ческом персистирующем гепатите, при более тяжелых формах увеличение актив¬
ности аминотранфераз у 85-90% больных обычно в пределах от 2,5 до 10 выше
референтных пределов (нормы).Увеличением активности фермента сопровождаются:• острые и хронические заболевания печени с поражением паренхимы любой
этиологии (гепатиты, цирроз, внутри- и внепеченочный холестаз, инфекци¬
онный мононуклеоз);• шок, сердечная недостаточность с застойными явлениями в печени;• метастазы рака в печень, первичный рак печени;
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 179• острый инфаркт миокарда, острый миокардит, миопатии;• травма или операционное повреждение скелетных мышц, печени, миокарда;• гангрена;• миозит, дерматомиозит;• гемолитическая анемия, мегалобластная анемия;• инфаркт почки, инфаркт легких, острый панкреатит.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение активности: гемолиз in vivo или in vitro, терапия гепарином, перо-
ральные контрацептивы, изониазид, кодеин, кортизон, гепатотоксичные препа¬
раты.Альфа-амилаза общаяФермент, катализирующий гидролитическое расщепление полисахаридов
пищи — крахмала и гликогена до мальтозы. Секретируется в полость рта слюн¬
ными железами (изоферменты амилазы S-типа) и в ЖКТ поджелудочной железой
(изоферменты амилазы Р-типа). Ткани, наиболее богатые ферментом, — околоуш¬
ные слюнные железы, поджелудочная железа. Значительно меньшую активность
амилазы обнаруживают в слизистой оболочке кишечника, печени, легких, ске¬
летных мышцах, почках, фаллопиевых трубах. Основным источником фермента
в сыворотке крови в норме являются слюнные железы (60%) и поджелудочная
железа (40%). Оба изофермента а-амилазы имеют молекулярную массу около
45 кДа, поэтому фильтруются в почках и экскретируются с мочой. Тем не менее в
составе мочи больший удельный вес приходится на панкреатический изофермент.Референтные пределы представлены в табл. 4-2.Таблица 4-2. Референтные пределы альфа-амилазы общей в сыворотке кровиВозрастЕД/лмккат/лДогода5-650,08-1,081-70 лет25-1250,42-2,08>70 лет20-1600,33-2,67КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕПри остром панкреатите активность амилазы в крови начинает увеличиваться
через 3-12 ч после приступа боли, достигает максимума через 20-30 ч, превышая
верхнюю границу референтных пределов в 5-10 раз в зависимости от степени
проходимости протоков и размера поражения паренхимы поджелудочной желе¬
зы. При некротическом панкреатите гиперамилаземия выше, чем при отечном.
В случае острого геморрагического некротизирующего панкреатита с обширной
деструкцией поджелудочной железы амилаза крови может не увеличиваться или
даже снижаться, что является плохим прогностическим признаком. В стациона¬
рах частота выявления гиперамилаземии у больных с острым панкреатитом —
82-97%. При хроническом панкреатите исследование амилазы позволяет выявить
обострение (для диагностики хронического панкреатита более информативны
инструментальные исследования и некоторые тесты со стимуляцией ферментов),
при этом уровень гиперамилаземии, так же как гиперамилазурии и гиперлипа-
земии, меньше, чем при остром панкреатите. Ценность тестов для выявления
обострений снижается по мере разврггия в поджелудочной железе атрофически-
склерозируюїдего процесса, проявляющегося гипосекрецией ферментов. Наиболее
чувствительный ферментный индикатор обострений хронического панкреатита и
более специфичный, чем альфа-амилаза, маркер острого панкреатита — повыше¬
ние Р-изоферментов (панкреатической) амилазы в сыворотке крови.
180 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯУвеличением активности фермента в крови в 5-10 раз сопровождаются:• острый панкреатит;• почечная недостаточность;^ • тяжелый диабетический кетоацидоз;^ до 5 раз:• киста или псевдокиста поджелудочной железы;Щ • острый холецистит;• прободение язвы желудка;• кишечная непроходимость;• абдоминальная травма;• прободение при внематочной беременности (выход в кровоток амилазы фал¬
лопиевых труб);• заболевания слюнных желез — эпидемический паротит, камни в слюнной
железе или ее протоке;• инфаркт миокарда (в некоторых случаях);• острая алкогольная интоксикация;• макроамилаземия (образование комплексов амилазы с белками плазмы,
имеющими большую молекулярную массу), в связи с чем снижено выведение
амилазы почками (может быть у здоровых людей);• некоторые опухоли легких и яичников.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение активности: средства, вызывающие сокращение сфинктера Одди
(наркотические анальгетики, бетанехол^, секретин и др.), некоторые антибио¬
тики, сульфаниламиды, рентгенологическое исследование слюнных желез и их
протоков.Амилаза мочиМатериал: случайная порция или суточная моча. Сбор суточной мочи: после
утреннего мочеиспускания отметить время и 24 ч собирать мочу в сухую чистую
емкость, хранящуюся в прохладном месте; после сбора мочу перемешать, измерить
объем, указать его в направлении на анализ; около 50 мл отлить в контейнер для
исследования и отправить в лабораторию. До исследования мочу можно хранить2 сут при комнатной температуре, 10 сут - при +4 “С, 3 нед — при -20 “С.Референтные пределы: 1-17 ЕД/л, или 0,02-0,28 мккат/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика и мониторинг цитолитического синдрома при остром и хрониче¬
ском панкреатите, реже — выявление паротита.Увеличение экскреции амилазы почками происходит вслед за развитием гипер-
амилаземии, запаздывая на 6-10 ч. Степень повышения амилазы в моче всегда
более выражена, чем в крови. Причиной амилазурии является не только гиперами-
лаземия, но и повышенный клиренс фермента вследствие подавления канальцевой
реабсорбции при панкреатите, Амилазурия может сохраняться в течение несколь¬
ких дней после нормализации уровня сывороточной амилазы. Следует зачитывать
зависимость этого показателя от скорости клубочковой фильтрации, она может
быть изменена при панкреатите и особенно при панкреатите у больных с почечной
недостаточностью.Увеличением активности фермента в моче сопровождаются:• острый панкреатит, обострение хронического панкреатита;• тяжелый диабетический кетоацидоз:• почечная недостаточность;• киста или псевдокиста поджелудочной железы;
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 181острый холецистит;
прободение язвы желудка;
кишечная непроходимость;
абдоминальная травма;
острая алкогольная интоксикация;прободение при внематочной беременности (выход в кровоток амилазы фал¬
лопиевых труб);• заболевания слюнных желез - эпидемический паротит, камни в слюнной
железе или ее протоке;• некоторые опухоли легких и яичников.Альфа-амилаза панкреатическаяГруппа изоферментов а-амилазы, присутствующих в наибольшем количестве
в ацинарных клетках поджелудочной железы. В норме в сыворотке крови у 73%
здоровых людей присутствуют Р2-изофермент, у 10% может также выявляться
Р^-амилаза.Референтные пределы представлены в табл. 4-3.Таблица 4-3. Референтные пределы а-амилазы панкреатической в сыворотке кровиВозрастЕД/лмккат/л5 сут-6 мес<8<0,136-12 мес<23<0,38>12 мес<50<0,83КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика и мониторинг цитолитического синдрома при остром и хрони¬
ческом панкреатите. Более чувствительный и специфичный индикатор цитолиза
ацинарных клеток поджелудочной железы, чем общая альфа-амилаза.
Увеличением активности фермента сопровождаются:• острый панкреатит, обострение хронического панкреатита;• тяжелый диабетический кетоацидоз;почечная недостаточность;киста или псевдокиста поджелудочной железы;острый холецистит;прободение язвы желудка;кишечная непроходимость;абдоминальная травма;острая алкогольная интоксикация.АспартатаминотрансферазаАспартатаминотрансфераза (ACT) относится к группе ферментов аминотранс-
фераз, содержащих в качестве кофермента производное витамина пиридоксаль-
фосфат; ACT катализирует обратимую реакцию дезаминирования аминокислоты
аспартата. Продукт дезаминирования — щавелевоуксусная кислота метаболизи-
руется во многих направлениях, включая распад с выделением энергии, синтез
глюкозы и др. ACT широко распространена в органах и тканях организма чело¬
века, присутствует в митохондриях и цитоплазме клеток. Наибольшая активность
фермента обнаружена в сердечной мышце, затем, по убыванию, — в печени (в
цитоплазме и митохондриях гепатоцитов), скелетных мышцах, головном мозге,
семенниках и почках. Высокая активность ACT обнаружена в эритроцитах.Референтные пределы (ориентировочные): 5-40 ЕД/л.
182БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯКЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕВыявление и оценка выраженности цитолитического синдрома при диагностике
и мониторинге заболеваний печени, сердца. Тест используют вместе с определени¬
ем активности АЛТ.При остром инфаркте миокарда (ОИМ) активность ACT начинает повышаться
через 6-12 ч, достигая максимума через 24-48 ч (активность ACT может уве¬
личиваться в 10-15 раз, что коррелирует с площадью некроза миокарда). При
неосложненном течении острого инфаркта миокарда нормализация активности
происходит через 4-6 сут. Если через 3-4 сут активность ACT не снижается, это
является прогностически неблагоприятным признаком.Увеличением активности фермента сопровождаются:• острый инфаркт миокарда;• острый миокардит:• острые и хронические заболевания печени с поражением паренхимы любой
этиологии (гепатиты, цирроз);• инфекционный мононуклеоз с поражением паренхимы печени;• шок, сердечная недостаточность с застойными явлениями в печени;• метастазы рака в печень;• первичный рак печени;• внутри- и внепеченочный холестаз с поражением паренхимы печени;• миопатии;• травма или операционное повреждение скелетных мышц, печени, миокарда;• гангрена;• миозит, дерматомиозит;• гемолитическая анемия, мегалобластная анемия;• инфаркт почки;• инфаркт легких;• острый панкреатит;• судороги.г амма-глутамилтрансферазаГамма-глутамилтрансфераза (ГГТ) — фермент, катализирующий одну из реак¬
ций переноса аминокислот из плазмы крови в клетки, а также реакции в процессах
реабсорбции аминокислот из желчи и мочи в кровь. В значительных количествах
фермент обнаруживают в эпителии извитых канальцев нефрона, желчных каналь¬
цах и ближайших к просвету частях эпителиальных клеток, выстилающих желч¬
ный проток. Наибольшую активность фермента отмечают в цитоплазме и гладком
эндоплазматическом ретикулуме (микросомах) гепатоцитов, расположенных в
области воротной вены. Основным источником сывороточной активности фер¬
мента являются гепатоциты.ГГТ не фильтруется в почках, но активность фермента в моче в 2-6 раз выше,
чем в крови. В моче повышение активности фермента свидетельствует о пораже¬
нии проксимальных канальцев нефрона.Материал (проба): сыворотка крови; избегать гемолиза. Можно хранить 7 сут
при +4 °С, годы — при -20 “С.Референтные пределы (ориентировочные): женщины — менее 30 ЕД/л, муж¬
чины — менее 50 ЕД/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика и мониторинг лечения заболеваний печени и билиарного тракта.
Повышение фермента при этом является многозначным: отражает внутри- и вне¬
печеночный холестаз (вследствие деструкции желчевыводящих путей), в некото¬
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 183рой степени — цитолиз паренхиматозных клеток (фермент менее чувствителен к
поражениям паренхимы, чем аминотрансферазы), является показателем индукции
микросомальной гамма-глутамилтрансферазы алкоголем и гепатотоксичными
лекарственными препаратами, может отражать поражение печени злокачествен¬
ным процессом (при этом причины гиперферментемии разнородны). При острых
вирусных гепатитах происходит увеличение активности ГГТ до 10 раз (чаще в5 раз), что обусловлено в основном развитием холестаза, поэтому при холеста-
тической форме гиперферментемии более выражена; сроки максимума сходны с
таковыми для аминотрансфераз, нормализация происходит позже. При алкоголь¬
ном гепатите активность ГГТ увеличивается в 20 раз, при лекарственном — варьи¬
рует в зависимости от природы и дозы лекарственного препарата. Увеличение
активности ГГТ может выявляться при отсутствии повышения активности ами¬
нотрансфераз. При хронических гепатитах выраженность гиперферментемии
зависит от активности процесса. При декомпенсированном циррозе увеличение
активности ГГТ может быть не связано со снижением биосинтеза фермента. При
первичном билиарном циррозе возможно повышение до 10 норм еще в бессим¬
птомной стадии. При гепатоцеллюлярной карциноме у 90% больных без желтз^хи
активность ГГТ увеличивается в 10-20 раз, с желтухой — до 30 раз. Увеличение
активности возможно задолго до появления клинических симптомов и изменения
других биохимических показателей. При метастазах в печень, сопровождающихся
клиническими симптомами, активность ГГТ меняется так же, как при первичном
раке печени. Наиболее высокая активность фермента наблюдается при метастазах
в области воротной вены или по ходу желчных путей, чувствительность как пока¬
затель поражения печени метастатическим процессом составляет около 96%.Особую ценность тест представляет для выявления патологий гепатобилиар-
ной системы у детей (после 2 лет) и беременных, когда сывороточная активность
других ферментов, используемых в гепатологии, повышена физиологически.
Сывороточная активность фермента не изменяется при патологии костной ткани,
поэтому тест используется для установления источника повышенной активности
щелочной фосфатазы.Увеличением активности фермента сопровождаются:• обтурация внутри- и внепеченочных желчных путей;• острые и хронические гепатиты;• инфекционный мононуклеоз с поражением печени;• токсические поражения печени;• панкреатит острый и хронический;• сахарный диабет;• травма;• нефротический синдром:• хроническая почечная недостаточность (редко);• неврологические заболевания.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение активности: терапия барбитуратами, фенитоином, стрептокиназой,
гепатотоксичными лекарственными препаратами.Кислая фосфатазаКислая фосфатаза (КФ) — группа ферментов, катализирующих гидролитиче¬
ское отщепление фосфатной группы от различных органических соединений с
максимальной активностью в кислой среде (pH <7,0). Ферменты присутствуют в
лизосомах печени, селезенки, эритроцитах, тромбоцитах, костном мозге, макро¬
фагах и остеокластах. Самая высокая активность кислой фосфатазы отмечается в
184 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯпредстательной железе (простатическая кислая фосфатаза). У мужчин половину
содержащейся в сыворотке крови кислой фосфатазы вырабатывает предстатель¬
ная железа, остальное дают печень и разрушающиеся тромбоциты, эритроциты.
У женщин источниками фермента в сыворотке крови являются печень, эритроци¬
ты и тромбоциты. Большинство тканей содержат несколько изоферментов кислой
фосфатазы.Референтные пределы представлены в табл. 4-4.Таблица 4-4. Референтные пределы кислой фосфатазы в сыворотке кровиВозраст, полЕД/Л<14 лег<5,5>14 лет, женский<5,5>14 лет, мужской<6,5КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика и мониторинг рака простаты (более информативна кислая фосфа¬
таза простатическая).Увеличением активности фермента сопровождаются:• рак простаты (у 20-25% пациентов без метастазов, у 60% пациентов с мета¬
стазами, при костных метастазах аі<тивность повышается в 40-50 раз);• аденома простаты;• опухоли с метастазами в костную ткань;• болезнь Гоше, болезнь Ниманна-Пика;• гемолитическая анемия;• патология гепатобилиарной системы;• остеопороз;• тромбоэмболии и другие состояния с повышенным разрушением тромбоци¬
тов;• гиперпаратиреоидизм;• болезнь Педжета.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение активности: гемолиз, цистоскопия, катетеризация мочевого
пузыря, пальпация простаты (активность возрастает на 25-30%, нормализует¬
ся через 24 ч), биопсия, операция на простате (нормализация через несколько
суток), дефекация с напряжением, повышенная температура, сексуальная
активность.Кислая фосфатаза простатическаяМетод исследования: расчетный — определяют общую и непростатическую
КФ в пробе с добавлением тартрата, ингибирующего простатическую КФ; по раз¬
нице рассчитывают активность простатической КФ.Референтные пределы: мужчины старше 14 лет — менее 2,6 ЕД/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика и мониторинг рака простаты.Увеличением активности фермента сопровождаются:• рак простаты (увеличение в 10-20% случаев у пациентов без метастазов, в
20-40% случаев — при метастазах без поражения костей, в 40-90% случа¬
ев — при метастазах в костную ткань; увеличение в 10-40 раз в зависимости
от количества продуцирующих фермент клеток);
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 185• орхиэктомия (эстрогенотерапия приводит к снижению активности фермента;
сохранение высокой активности фермента, как правило, свидетельствует о
резистентности больного к проводимому лечению);• аденома простаты (у 10-30% больных).КреатинкиназаКреатинкиназа (КК) — фермент, участвующий в энергопродукции, катализиру¬
ет фосфорилирование креатина и его дефосфорилирование с образованием АТФ.
Наибольшая активность фермента выявлена в скелетных мышцах и миокарде,
меньшая — в головном мозге, плаценте, гладких мышцах, прямой кишке, пред¬
стательной железе и других тканях. Изоферменты КК состоят из двух субъединиц,
обозначаемых как М {Muscle — мышца) и В {Brain — мозг). Известны три цито¬
плазматических изофермента, различающихся комбинацией субъединиц: ММ-КК,
МВ-КК, ВВ-КК. Общей КК называют их суммарную активность в сыворотке крови.
В веществе головного мозга КК представлена почти на 100% ВВ-КК. В скелетных
мышцах присутствует в основном ММ-КК. В наибольших количествах МВ-КК
присутствует в миокардиоцитах. Піадкие мышцы интестинального тракта (желуд¬
ка, кишечника) и матки содержат в основном ВВ-КК и менее 10% МВ-КК. Именно
поэтому увеличение в сыворотке крови МВ-КК — один из наиболее специфичных
показателей цитолиза и некроза кардиомиоцитов.ВВ-КК — изофермент, который не проходит гематоэнцефалический барьер и в
норме в сыворотке или плазме крови не обнаруживается. Общая КК крови в норме
состоит на 95% из ММ-КК и на 5% — из МВ-КК. Появление большого количества
В-субъединицы, как правило, свидетельствует о нарушении гематоэнцефалическо-
го барьера при черепно-мозговых травмах, инсультах.Референтные пределы (ориентировочные): женщины — менее 170 ЕД/л,
мужчины — менее 190 ЕД/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕВыявление и мониторинг цитолитического синдрома при заболеваниях мио¬
карда и скелетной мускулатуры. При диагностике острого инфаркта миокарда,
миокардитов более специфичным показателем поражения миокарда является
увеличение МВ-КК, чем возрастание активности общей КК.Для дифференциальной диагностики нейрогенных мышечных заболеваний
и миопатий, а также для наблюдения за течением последних определение сыво¬
роточной активности КК является наиболее информативным ферментативным
тестом. Несмотря на то что обычные клинические проявления заболеваний
мышц — мышечная слабость, истощение и боль — могут наблюдаться как при мио-
патиях, так и при нарушении иннервации, многие формы миопатий сопровожда¬
ются специфическим увеличением активности КК в сыворотке крови, в отличие
от нейрогенных заболеваний мышц, при которых подобные изменения обычно
отсутствуют. Однако при детских нейрогенных заболеваниях мышц на ранних ста¬
диях мышечной атрофии (например, в восстановительной стадии полиомиелита),
если они протекают тяжело, может наблюдаться повышение уровня КК, обычно
превышающее верхнюю границу нормы не более чем в 2 раза. Изменения КК в
сыворотке могут иметь место в доклинический период наследуемых миопатий, а
также при носительстве (доказано для дистрофии Дюшенна). При интерпретации
лабораторных данных необходимо учитывать, что наиболее высокие величины
гиперферментемии удается обнаружить на ранних стадиях миопатий. Позже, когда
значительная часть мышечной ткани уже претерпела патологические изменения и
биосинтез КК в мышцах снижен, уровень КК в сыворотке может быть понижен.Увеличением активности фермента сопровождаются:WШ
186 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ• острый инфаркт миокарда (повышение активности, часто коррелирующее с
обширностью инфаркта, может быть обнаружено через 4-6 ч после инфаркта,
максимум достигается через 12-24 ч, снижение — через 2-4 сут; в первые 12 ч
после болевого приступа активность повышена в 80-89% случаев крупнооча¬
гового инфаркта и в 60-64% — мелкоочагового; достижение пика активности
и нормализация могут наблюдаться раньше указанных временных диапазонов
при тромболизисе и реперфузии коронарных сосудов; рационально проводить
повторное определение активности фермента каждые 12 ч в первые 2-3 сут,
при подозрении на рецидив, повторный инфаркт миокарда);• острые миокардиты (инфекционные и токсические);• заболевания скелетных мышц — полимиозиты, дерматомиозиты, мышечные
дистрофии:• злокачественная гипертермия;• инсульт;• судороги;• операционное или травматическое повреждение миокарда, скелетных мышц
(как правило, ниже троекратного превышения верхней границы нормы, нор¬
мализуется через 5-10 сут после повреждения);• синдром Рейно;• гипотиреоидизм (вероятно, из-за генерализованного увеличения мембран¬
ной проницаемости);• отравление, сопровождающееся комой;• некоторые инфекционные заболевания;• аритмии, застойная сердечная недостаточность, эмболия легочной артерии
(редко);• алкоголизм;• гипоксические поражения миокарда и скелетных мышц при шоке, гипертермии,
ВЛИЯЮЩИЕ ФАКТОРЫУвеличение активности: гемолиз, внутримышечные инъекции (превышение
верхней границы нормы в 5-8 раз после однократной инъекции сохраняется 48 ч,
в отдельных случаях — до недели после прекращения инъекций), интенсивная
физическая нагрузка, умеренная физическая нагрузка после малоподвижного
образа жизни, амфотерицин В, карбеноксолон<^, карбромал'^, клофибрат^\ этанол
(у больных с алкоголизмом), сочетанные введения галогана^ и сукцинилхолина^
во время наркоза, отравление барбитуратами,Креатинкиназа-МВРеферентные пределы: представлены в табл. 4-5.Таблица 4-5. Референтные пределы креатинкиназы-МВ в сыворотке кровиПолЕД/Лмккат/лМужской<15<0,25Женский<20<0,33Определение массовой концентрации КК-МВ
Материалы (проба): сыворотка, плазма, цельная кровь.Метод: иммунохимический («сэндвич», моноклональные антитела к субъеди¬
ницам КК-МВ).Референтные пределы: для мужчин — менее 5,0 мкг/л, для женщин — менее
2,5 мкг/л; относительный индекс (отношение массовой концентрации КК-МВ к
активности общей КК) — менее 2%.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 187КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕУвеличением активности фермента сопровождаются:• острый инфаркт миокарда (динамика, как правило, соответствует таковой
для КК общей; характерно возрастание соотношения МВ-КК/КК более 25%;
повторное определение МВ-КК более информативно, чем единичное);• миокардиты;• полимиозиты (в 15-20% случаев при поражении миокарда);• миопатии (источником МБ-КК в этих случаях, по крайней мере частич¬
но, служит сердечная мышца, повреждение которой часто сопровождается
дистрофией, а кроме того — скелетные мышцы; диагностическая ценность
изменения МВ-КК не превышает таковую для КК общей; при дистрофии
Дюшенна активность МВ-КК увеличена в несколько раз у 90% больных, при
других миопатиях изменение менее выраженно);• синдром Рейно;• гипо- и гипертермия;• затяжные аритмии, шок;• отравления;• некоторые инфекции;• карциномы прямой кишки, легких, яичников, простаты, эндометрия;• почечная недостаточность.ЛактатдегидрогеназаЛактатдегидрогеназа (ЛДГ) — фермент, катализирующий обратимую реак¬
цию превращения пирувата в лактат в процессе распада и синтеза глюкозы.
Содержится в цитоплазме клеток практически всех органов и тканей организма.
Наибольшая активность — в миокарде, почках, скелетной мускулатуре, парен¬
химе печени, эритроцитах; меньшая — в лимфоцитах, легких, поджелудочной
железе.Референтные пределы: менее 250 ЕД/л, менее 4,2 мккат/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика и мониторинг заболеваний печени и миокарда. Увеличение актив¬
ности ЛДГ в сыворотке крови отражает цитолиз, некроз кардиомиоцитов и
гепатоцитов. Тест можно использовать для диагностики и мониторинга лечения
заболеваний скелетных мышц (миопатии), некоторых злокачественных новооб¬
разований. Чувствительность и специфичность возрастают при сочетании с иссле¬
дованием 5 изоферментов ЛДГ. ЛДГ-1 — наиболее специфичный изофермент для
патологии сердечной мышцы. Для определения активности ЛДГ-1 используют
гидроксибутиратдегидрогеназную реакцию (а-ГБДГ).Увеличением активности фермента сопровождаются:• застойная сердечная недостаточность (при развитии гипоксии печени и дру¬
гих органов);• острые гепатиты (при вирусных гепатитах — увеличение в течение первой
недели желтушного периода в 2-3 раза и более, при типичном течении нор¬
мализация активности на 5-8-й неделе);• хронические гепатиты различной этиологии (как правило, лишь в период
обострения);• токсические поражения паренхимы печени;• первичный рак печени, метастазы рака в печень;• миопатии различной этиологии, исключая дистрофию нейрогенного характе¬
ра (более информативным ферментативным тестом является креатинкиназа);
188 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯіРЛсгСїо>Л>(>\‘• острый инфаркт миокарда (начало увеличения — через 10-24 ч, максималь¬
ная активность — через 36-72 ч, нормализация - через 10-15 сут и более);• миокардиты любой этиологии;• острый панкреатит;• инфаркт почек;• инфаркт легких;• крупозная пневмония;• инфекционный мононуклеоз;• гемолитическая анемия;• мегалобластная анемия;• дерматомиозит;• полимиозит;• феохромоцитома (в 60% случаев при развитии гипертензии);• травма почек, скелетных мышц, печени, миокарда, легких, селезенки;• шок, гипоксия;• опухоли яичников (герминомы).ВЛИЯЮЩИЕ ФАКТОРЫУвеличение активности; беременность, гемолиз in vitro, даже минимальный
вследствие высокой активности ЛДГ в эритроцитах, гемотрансфузия, терапия
гепарином (у 30% больных), анальгетики ненаркотические и наркотические, эта¬
нол, клофибрат*^, дикумарин имипрамин, метотрексат, нитрофураны, хинидин,
сульфаниламиды.ЛипазаЛипаза — фермент, катализирующий гидролиз триглицеридов (нейтрального
жира) с высвобождением жирных кислот в клетках жировой ткани, а также в
тонкой кишке, куда фермент секретируется поджелудочной железой. Увеличение
активности в сыворотке крови, как правило, является следствием цитолиза и
некроза ацинарных клеток поджелудочной железы.Референтные пределы представлены в табл. 4-6.Таблица 4-6. Референтные пределы липазы в сыворотке кровиВозрастЕД/лмккат/л5 сут-18 лет<130<2,2>18 лет<190<3,2КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика и мониторинг острого и хронического панкреатита. В отличие от
альфа-амилазы, активность липазы не повышается при паротите, внематочной
беременности, аппендиците.Увеличением активности фермента сопровождаются:• острый панкреатит любой этиологии (начало увеличения — через 4-8 ч,
максимальная активность — через 24 ч, снижение до референтного уровня —
через 8-14 сут);• рак поджелудочной железы;• киста или псевдокиста поджелудочной железы;• обострение хронического панкреатита (не всегда);• перфорации кишечника;• перитонит;• заболевания желчного пузыря.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 189ВЛИЯЮЩИЕ ФАКТОРЫУвеличение активности: лекарственные препараты, провоцирующие спазм
сфинктера Одди (наркотические анальгетики, секретин и др.) или развитие пан¬
креатита (тетрациклины, сульфаниламиды, цитостатики и др.), терапия гепари¬
ном.ТрипсинТрипсин — фермент (гидролаза), участвующий в переваривании белков в
кишечнике. Продуцируется экзокринными клетками поджелудочной железы в
виде неактивного предшественника (трипсиногена), превращающегося в трип¬
син в кишечнике под действием энтерокиназы энтероцитов и следов трипсина.
Некоторое количество этого фермента в норме проникает из клеток поджелу¬
дочной железы в кровь в виде трипсина, трипсиногена и трипсина, связанного с
панкреатическим ингибитором. В крови трипсин ингибируется в результате связы¬
вания со специфическими белками плазмы — а^-антитрипсином и др. Повышение
активности трипсина в сыворотке крови отражает цитолиз клеток поджелудочной
железы, у новорожденных ассоциируется с врожденным муковисцидозом.Методы исследования: иммунохимические (иммуноферментный, иммунохе-
милюминесцентный, радиоиммунный).Референтные пределы зависят от особенностей антител в составе реагента,
определяющих выявление разных форм (свободного трипсина, связанного с бел¬
ковыми ингибиторами плазмы крови, трипсиногена), поэтому при интерпретации
результатов исследования рекомендуют использовать сведения лаборатории о
референтных пределах.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика панкреатита. Оценка функционального состояния поджелудочной
железы. Ранняя постнатальная диагностика муковисцидоза (в первые несколько
недель жизни). При положительном результате исследования иммунореактивного
трипсина проводят исследование пота.Увеличением активности фермента сопровождаются:• острый панкреатит;• хроническая почечная недостаточность;• болезни печени;• пептические язвы и камни желчного пузыря (редко);• недавно развившаяся мальабсорбция;• р-талассемия (в некоторых случаях);• вирусные инфекции с вовлечением поджелудочной железы;• врожденный муковисцидоз (кистозный фиброз).Уменьшением активности фермента сопровождаются:• хронический панкреатит, особенно при наличии стеатореи (возможно повы¬
шение при обострении);• рак поджелудочной железы (в части случаев концентрация может бьггь нор¬
мальной или повышенной);• хроническая мальабсорбция;• сахарный диабет;• р-талассемия (в некоторых случаях).ВЛИЯЮЩИЕ ФАКТОРЫСуточный биоритм, максимальный уровень вечером.Увеличение активности: панкреатография, стимуляторы поджелудочной желе¬
зы (холецисгокинин, бомбезин, секретин, церулеин), прием пищи.
190 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯХолинэстеразаРазличают два типа холинэстераз, катализирующих реакции гидролиза раз¬
личных эфиров: первый — истинная ХЭ (холинэстераза I, ацетилхолинэстераза)
содержится преимущественно в эритроцитах, нервно-мышечных синапсах скелет¬
ной мускулатуры, центральной нервной системе; второй — S-псевдохолинэстераза
или холинэстераза II, находится в сыворотке (плазме) крови, печени, гладкой
мускулатуре.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕРаннее выявление и оценка степени снижения белоксинтезирующей функции
печени.Диагностика острых и хронических отравлений фосфорорганическими соеди¬
нениями (карбофосом, хлорофосом и т.п.), которые необратимо связываются с
холинэстеразамй и ингибируют их (ингибируется также и истинная ХЭ, однако
псевдохолинэстераза снижается раньше). Накопление в нервных синапсах ацетил-
холина приводит к нарушениям проводимости в симпатической нервной системе.Оценка чувствительности к мышечным релаксантам (дитилину*, местинону^), в
норме подверженным быстрому распаду под действием ХЭ. У некоторых больных
после их введения наступает длительный период апноэ и/или миорелаксации. Это
ассоциируется с низкой активностью или отсутствием ХЭ в сыворотке крови, что
может быть связано либо с врожденной наследуемой недостаточностью ХЭ, либо с
хроническим отравлением фосфорорганическими соединениями. Если есть подо¬
зрения на патологию первого рода, рекомендуют обследование родственников й
при выявлении пониженного уровня ХЭ — выдачу медицинского заключения об
опасности введения дитилина* и его аналогов.Референтные пределы представлены в табл. 4-7.Таблица 4-7. Референтные пределы холинэстеразы в сыворотке кровиВозраст, полЕД/лмккат/л<40 лег5300-1290088-215Женщины 16-39 лет, не принимающие пероральные контрацептивы,5300-1120088-187небеременкыеСнижением активности фермента сопровождаются:• генетически обусловленный вариант;• отравления фосфорорганическими инсектицидами (острое отравление —
полное отсутствие активности, хроническое — снижение на 25-50% в срав¬
нении с нормой, нормализация — после исключения контакта с ядом через6 кед);• заболевания печени (хронические гепатиты, цирроз);• метастазирующий рак различной локализации;• дерматомиозиты;• мышечные дистрофии;• анемии;• острые инфекции;• недостаточность или нарушение питания;• инфаркт миокарда.Увеличением активности фермента сопровождаются:• нефроз;• дислипопротеинемия IV типа.ВЛИЯЮЩИЕ ФАКТОРЫСнижение активности: карбамат, циклофосфамид, эстрогены, тестостерон,
пероральные контрацептивы, фенотиазины, рентгеноконтрастные средства.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 191Щелочная фосфатазаЩелочной фосфатазой (ЩФ), или общей щелочной фосфатазой, называют
группу ферментов, катализирующих гидролитическое отщепление фосфатной
группы от различных органических соединений с максимальной активностью в
щелочной среде. Щелочная фосфатаза широко распространена в тканях человека,
особенно много этого фермента в слизистой оболочке кишечника, остеобластах
(остеокласты не содержат фермента, остеоциты содержат немного), эпителиоци-
тах желчных протоков, образующих просвет желчных канальцев в гепатоцитах,
проксимальных отделах извитых канальцев почек, плаценте, легких.Референтные пределы представлены в табл. 4-8,Таблица 4-8. Референтные пределы щелочной фосфатазы в сыворотке кровиВозрастЕД/лмккат/лНоворожденные<420<7Дети<480<8Взрослые<150<2,5КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕВыявление и мониторинг поражений костей, сопровождающихся повышением
активности остеобластов (остеодистрофий, остеомаляции, метастазов и неко¬
торых первичных опухолей костной ткани), а также внутри- и внепеченочного
холестаза.Увеличением активности фермента сопровождаются:• обусловленные поражением гепатобилиарной системы:холестаз при гепатитах, метастазах в печени, циррозах, первичном раке
печени, инфекционном мононуклеозе с поражением печени;❖ холангит;❖ холангиолит;• обусловленные увеличением функциональной активности остеобластов:❖ болезнь Педжета:❖ метастазы рака (остеобластные) в кости;❖ остеогенная саркома;<> остеомаляция;<> первичный и вторичный гиперпаратиреоз при вовлечении скелета;• клиничесю! малоинформативным увеличением активности сопровождаются:❖ миеломная болезнь;❖ лимфогранулематоз с поражением костей;❖ болезнь Гоше с поражением костей;-0- повышенный метаболизм в костной ткани при заживлении переломов;
о- саркоидоз, амилоидоз, инфаркт легких, инфаркт миокарда при поражении
печени;❖ неспецифический язвенный колит;❖ прободение кишечника;❖ сепсис.Снижением активности фермента сопровождаются (возможно);• гипотиреоз;• цинга;• анемия;• квашиоркор;• ахондроплазия;• кретинизм;• гипофосфатаземия.
ШМ192 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯЩелочная фосфатаза костнаяПредставляет собой глипопротеид, находящийся на поверхности остеобла-
стов. Количественное определение костной щелочной фосфатазы дает полезную
информацию о костном ремоделировании, эффективности антирезорбтивной
терапии.Метод исследования: иммуноферментный анализ (ИФА).КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕЗначительное увеличение костной щелочной фосфатазы наблюдается при
повышенной активности остеобластов: рост костей, болезнь Педжета, возобнов¬
ление движений после длительного постельного режима, переломы, деформирую¬
щий остит, рахит, гиперпаратиреоидизм, остеогенная саркома, миелома, костный
туберкулез, лейкозы.Снижение костной щелочной фосфатазы отмечается при гипофосфатаземии,
кретинизме.СУБСТРАТЫ и ПРОДУКТЫ БИОХИМИЧЕСКИХ РЕАКЦИЙ
АльбуминАльбумин — белок, синтезируемый печенью. На долю альбумина приходится
55-60% белка в сыворотке крови. Основные функции альбумина: транспорт, под¬
держание постоянства коллоидно-осмотического давления и обеспечение клеток
аминокислотами. При гипоальбуминемии снижается онкотическое давление плаз¬
мы, жидкость не возвращается в кровеносное русло, по такому принципу развива¬
ются белковые («голодные») отеки.Время полужизни альбумина в плазме — 15-20 сут, поэтому даже полное пре¬
кращение синтеза альбумина печенью не должно сопровождаться значительным
его снижением в сыворотке крови на протяжении 3-4 сут. в острых ситуациях
гипоальбуминемия наблюдается при потере альбумина с мочой или при пропо-
тевании вместе с жидкостью в ткани и полости.Референтные пределы: 30-50 г/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕНеблагоприятна пониженная концентрация альбумина, особенно тяжелый про¬
гноз у больных с хроническими заболеваниями печени. Для них повышение кон¬
центрации альбумина после гипоальбуминемии указывает на успешное лечение.
Увеличением концентрации (гиперальбуминемией) сопровождаются:• обезвоживание;• прием анаболических стероидов;• чрезмерное внутривенное введение альбумина при инфузиях.Уменьшением концентрации (гипоальбуминемией) сопровождаются:• сниженный синтез альбумина (недоедание, синдром мальабсорбции, болезни
печени);• повыщенная потеря альбумина (нефротический синдром, энтероколиты,
ожоги, кровотечения, выпот, экссудат):• повышенный распад альбумина (сепсис, лихорадка, травмы, новообразова¬
ния, синдром Кушинга, гипертиреоз, гиперкортицизм);• гипергидратация.Интерференция.• Физиологическая гипоальбуминемия проявляется у детей до третьего месяца
жизни, у женщин — в III триместре беременности.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 193• Положение тела и физическая активность могут влиять на уровень альбуми¬
на. У госпитализированных пациентов (постельный режим) концентрация
альбумина на 5-10 г/л ниже нормы.• Пережатие сосудов во время взятия крови может несколько повысить кон¬
центрацию белка в крови.Белок общийобщий белок — сумма всех белков в сыворотке крови (всего около 100), по осо¬
бенностям структуры молекул их делят на альбумины и глобулины. Белки в сыво¬
ротке крови поддерживают онкотическое давление и, следовательно, объем крови,
участвуют в процессах гемостаза, поддержании постоянства pH крови, связывают и
транспортируют жирные кислоты, билирубин, стероидные и тиреоидные гормоны,
железо, медь, кальций; некоторые плохо растворимые в воде витамины и другие низ¬
комолекулярные компоненты плазмы крови участвуют в иммунных реакциях (имму¬
ноглобулины, опсонины, белки острой фазы). Большая часть белков в сыворотке
крови синтезируется в печени, иммуноглобулины — плазматическими клетками.Референтные пределы представлены в табл. 4-9.Таблица 4-9. Референтные пределы общего белка в сыворотке кровиВозрастг/л<1 года44-731-2 года56-752-14 лет60-80>14 лет65-85КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕВыявление нарушений белкового обмена при различных патологических состо¬
яниях (острых и хронических инфекциях, заболеваниях печени и почек, онкологи¬
ческих заболеваниях, мальабсорбции при хронических заболеваниях желудочно-
кишечного тракта, голодании, ожогах, критических состояниях и др.). В сочетании
с альбумином и белковыми фракциями — для оценки диспротеинемии.Увеличением концентрации (гиперпротеинемией) сопровождаются:• гипергаммаглобулинемия (следствием, как правило, является абсолютная
гиперпротеинемия);• хронические инфекционные заболевания;• хронические неинфекционные гепатиты;• аутоиммунная патология (системная красная волчанка, ревматоидный
артрит, ревматизм и т.д.);• моноклональные гаммапатии, связанные с миеломой, макроглобулинемией,
амилоидозом, лимфомой;• дегидратация (относительная гиперпротеинемия);• обширные ожоги;• диарея, рвота;• полиурия при синдроме неадекватной секреции вазопрессина и др.Уменьшением концентрации (гипопротеинемией) сопровождаются:• гипоальбуминемия;• снижение синтеза белков при недостаточном поступлении и/или усвоении
белков пищи (голодание, панкреатиты, энтероколиты, неадекватное парен¬
теральное или зондовое питание);• заболевания печени с синдромом гепатодепрессии (циррозы, гепатиты, ток¬
сическое поражение печени);
194 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ• потери белков (шіазмопотеря при обширных ожогах, протеинурия при забо-
леваниях почек, экcqщaтивнaя энтеропатия при энтеритах);• усиленный распад белков (послеоперационное состояние, тяжелые сома¬
тические заболевания, продолжительная гипертермия, ожоговая болезнь,
онкопатология);• выход белков из сосудистого русла, образование экссудатов и транссудатов;• врожденная агаммаглобулинемия.ВЛИЯЮЩИЕ ФАКТОРЫУменьшение концентрации: гипергидратация при массивной инфузионной
терапии, физиологически — во время беременности (особенно в III триместре).Ложное повышение может быть вызвано длительным наложением жгута при
венепункции, изменением положения тела из горизонтального в вертикальное (в
течение 30 мин).Белковые фракции в сыворотке кровиБелки в сыворотке крови имеют разные размеры и заряд молекул. Этим обу¬
словлена разная подвижность белков в разделяющей среде под действием электри¬
ческого поля, что позволяет разделять их на фракции (группы) методом электро¬
фореза. Вариантами электрофореза, используемыми в клинических лабораториях,
выделяют пять фракций: альбумины, а^-, Р- и у-глобулины. Фракция альбумина
однородна. Глобулиновые фракции содержат множество функционально различных
белков, но на изменение показателей электрофореграммы влияет лишь часть бел¬
ков, концентрация которых в норме или при патологии составляет не менее 1 г/л:
-глобулины, белки острой фазы ^ а^-антитрипсин, а^-кислый гликопротеин
или орозомукоид, aj-липопротеины;а2-глобулины: а2-макроглобулин, гаптоглобин;|5-глобулины: трансферрин, СЗ-компонент системы комплемента, (і-липо-
протеины;фракция у-глобулинов: иммуноглобулины IgA, IgM, IgG.Изменение соотношения белковых фракций в сыворотке крови (диспро-
теинемия) наблюдается при многих патологических состояниях, но исследование
белковых фракций клинически информативно лишь при парапротеинемических
гемобластозах, системных аутоиммунных патологиях, нефротическом синдроме,
хронических гепатитах и циррозе печени разной этиологии, в ряде случаев острого
и хронического воспаления. За исключением диагностики парапротеинемических
гемобластозов, более точную информацию позволяют получить исследования
отдельных белков в сыворотке крови (специфических белков), их изменения
специфичны для соответствующего патологического состояния.Материал (проба): сыворотка крови; избегать гемолиза и примеси фибри¬
ногена из-за преждевременного отделения сыворотки. До исследования можно
хранить 3 сут при +4 °С, 3 нед — при -20 ‘'С.Метод исследования: электрофорез на пластинках с агарозным гелем.
Референтные пределы представлены в табл. 4-10.Таблица 4-10. Референтные пределы белковьіх фракций в сыворотке крови для взрослыхБелковые фракцииРеферентные пределы, %Альбумин60,5-74,2ot,-r лобулины1.М.За,-Г лобулины4,2-10.9р-Глобулины8,4-12,8у-Глобулйны6,4-17.0
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 19$Варианты электрофореза в разных лабораториях значительно отличаются,
поэтому референтные пределы должны быть уточнены лабораторией.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕВыявление и мониторинг диспротеинемии при острых и хронических воспа¬
лительных заболеваниях, диффузных заболеваниях соединительной ткани, хро¬
нических гепатитах и циррозе печени разной этиологии. Диагностика миеломной
болезни и других моноклональных гаммапатий.Основные типы протеинограмм• Острофазный ответ — повышение а^- и аз-глобулинов в связи с усилением
биосинтеза в печени белков острой фазы при воспалении любой этиологии
(травма, хирургическое вмешательство, острый инфаркт миокарда, инфек¬
ция и др.).• Хроническое воспаление — увеличение у-глобулинов (хронические гепа¬
титы разной этиологии, ревматоидный артрит, некоторые хронические
инфекции).• Цирроз печени — увеличение у-глобулинов, слияние |5- и у-глобулинов
вследствие мезенхимально-воспалительного синдрома, при развитии гепато-
депрессивного синдрома возможно снижение альбумина.• Нефротический синдром “ повышение а2-ГЛ0буЛИН0В в связи с усилением
синтеза и повышением сывороточного уровня а2-макроглобулйна, возможно
снижение альбумина из-за его массивной потери с мочой.• Моноклональная гаммапатия — появление на электрофореграмме отдель¬
ной дискретной полосы в области глобулярных фракций (моноклональный
белок, М-градиент, М-белок), состоящей из иммуноглобулинов или их фраг¬
ментов, синтезирующихся злокачественно трансформированными клонами
В-лимфоцитов. Концентрации М-белка более 15 г/л с высокой вероятностью
свидетельствует о миеломной болезни, при болезни легких цепей м-белок
при электрофорезе сыворотки может не определяться, поскольку легкие
цепи иммуноглобулинов (белок Бенс-Джонса) проходят через почечный
фильтр и выводятся с мочой. Появление м-белка может наблюдаться при
хронических гепатитах, циррозе печени, а также у некоторых пациентов
престарелого возраста без клинических патологий, ассоциированных с моно¬
клональной гаммапатией. Имитировать М-белок могут высокие концентра¬
ции С-реактивного белка и некоторых других острофазных белков, а также
фибриноген. При выявлении М-белка необходима его последующая иммуно-
химическая идентификация методом электрофореза с иммунофиксацией.ВЛИЯЮЩИЕ ФАКТОРЫБеременность (III триместр), прием андрогенов, эстрогенов, глюкокортикоидов.Белок мочив норме выведение белка с мочой не превышает 0,08 г/сут, что обусловле¬
но ограничением поступления в первичную мочу белков плазмы почечным
фильтром, а также реабсорбцией в канальцах фильтрующихся в небольшом
количестве низкомолекулярных белков. Некоторое количество белка в норме
поступает в мочу в результате его секреции эпителием канальцев почек (белок
Тамма-Хорсфалля).Материал (проба): суточная моча — после утреннего мочеиспускания отме¬
тить время и 24 ч собирать мочу в сухую чистую емкость, хранящуюся в прохлад¬
ном месте; по окончании сбора мочу перемешать, измерить объем, указать его в
направлении; около 50 мл отлить в контейнер для исследования в лаборатории.
Избегать интенсивных физических нагрузок, по согласованию с врачом исклю-
Ш196 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯчить прием диуретиков; до исследования мочу можно хранить 7 сут при +4 "С,
месяц — при -20 “С.Методы определения: турбидиметрия с сульфосалициловой кислотой, коло-
щ риметрия с пирогаллоловым красным.Референтные пределы; менее 80 мг/сут; менее 250 мг/сут после интенсивной
физической нагрузки.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика и мониторинг заболеваний почек. Выявление и мониторинг
нефропатии при сахарном диабете, артериальной гипертензии (см. «Альбумин»).
Выявление и мониторинг поражений почек при интоксикации, инфекционных и
аутоиммунных заболеваниях.Увеличение концентрации (протеинурия).• Функциональная протеинурия обусловлена транзиторным увеличением про¬
ницаемости капилляров клубочков вследствие:интенсивных физических нагрузок;^ длительной ходьбы (маршевая протеинурия);❖ эмоционального стресса;❖ переохлаждения;❖ ортостатической реактивности.• Патологическая протеинурия.❖ Преренальная протеинурия обусловлена парапротеинемией (миеломной
болезнью, лимфопролиферативными заболеваниями).❖ Ренальная протеинурия обусловлена замедлением почечного кровотока с
увеличением проницаемости капилляров клубочков или увеличением про¬
ницаемости клубочковой мембраны, снижением канальцевой реабсорб¬
ции вследствие их повреждения (застойной сердечной недостаточностью,
лихорадкой, гломерулонефритом, пиелонефритом, амилоидозом почек,
липоидным нефрозом, туберкулезом почки, геморрагическими лихорад¬
ками, геморрагическим васкулитом, нефропатией беременных, диабетиче¬
ской нефропатией, нефропатией при артериальной гипертензии),❖ При минимальных повреждениях клубочков почек, снижении канальцевой
реабсорбции наблюдается потеря низкомолекулярных белков, преимуще¬
ственно альбумина (селективная протеинурия). При более выраженных
патологических изменениях в клубочках нефрона в мочу попадают и более
крупные белковые молекулы (неселективная протеинурия). Массивная
потеря белка с мочой при нефротическом синдроме (>3 г/сут) всегда
связана с клубочковой протеинурией и может приводить к гипопротеи-
немии.❖ Постренальная протеинурия связана с поступлением белков воспалитель¬
ного экссудата в мочу при патологиях мочевыводящих путей (воспалении,
инфекциях, опухолях мочеточников, мочевого пузыря, уретры),ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания: аминогликозиды, глюкокортикоиды, эналаприл,
интерферон, изониазид, сульфониламиды, нестероидные противовоспалительные
препараты, некоторые антибиотики и противогрибковые средства.БилирубинПродукт распада порфиринового кольца гемоглобина и других гемсодержа-
щих бежов в клетках ретикулоэндотелиальной системы, селезенке и печени.
Билирубин содержится в сыворотке крови в виде двух фракций: прямого (свя-
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 197занного, конъюгированного) и непрямого (свободного, несвязанного) билиру¬
бина, составляющих общий билирубин. При распаде гемоглобина первоначально
образуется билирубин, который из-за плохой растворимости в воде является
токсичным: при повышении его содержания он растворяется в липидах мембран
и вызывает нарушения их функционирования. В норме в плазме крови билирубин
связывается с альбумином (непрямой билирубин), что предотвращает его про¬
никновение в липидные слои мембран. В печени при участии фермента уридинди-
фосфатглюкуронилтрансферазы гепатоцитов свободный билирубин связывается
с глюкуроновой кислотой с образованием водорастворимого конъюгированного
(прямого) билирубина, секретируемого в желчные протоки, в кишечнике происхо¬
дят химические превращения билирубина под действием ферментов микрофлоры
с образованием пигмента стеркобилиногена (стеркобилина), который выводится
из организма в основном с калом и частично с мочой. В клинических лабораториях
измеряют концентрацию общего и прямого билирубина, по разнице рассчитыва¬
ют концентрацию непрямого билирубина. Если общий билирубин не превышает
референтных пределов, допустимо не проводить измерение прямого билирубина.
При гипербилирубинемии более 27-34 мкмоль/л развивается синдром желтухи
(легкая форма — до 85 мкмоль/л, среднетяжелая — 86-169 мкмоль/л, тяжелая
форма — свыше 170 мкмоль/л), обусловленный накоплением билирубина в тка¬
нях организма с появлением желтой окраски кожи и конъюнктивы. По патобио¬
химическим особенностям развития выделяют механическую (обтурационную),
паренхиматозную и гемолитическую желтуху, а также физиологическую желтуху
новорожденных, гемолитическую болезнь новорожденных, при гипербилиру-
бинемии с повышением прямого билирубина он может быть обнаружен в моче,
поскольку почечный фильтр в норме проницаем для этого низкомолекулярного
пигмента. Поступления в мочу непрямого билирубина при повышении его плаз¬
менной концентрации не происходит (задерживается почечным фильтром из-за
комплексированного с ним альбумина), за исключением слз^аев патологий почек
с поражением почечного фильтра.Материал (проба): сыворотка крови; избегать гемолиза и воздействия света.
До исследования можно хранить в темноте 48 ч при комнатной температуре,7 сут - при +4 °С, 6 мес - при -20 °С.Референтные пределы: новорожденные 1 сут — до 68 мкмоль/л; взрослые и
дети (кроме периода новорожденности) — до 19 мкмоль/л (билирубин прямой;
конъюгированный до 6,8 мкмоль/л).КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕВыявление и мониторинг желтухи при гемолитических анемиях, заболеваниях
печени, холестазе. Дифференциальная диагностика желтух.Увеличение концентрации (гипербилирубинемия).• Состояния, связанные с повышенным гемолизом эритроцитов и усилением
продукции билирубина; гипербилирубинемия развивается в основном за
счет непрямого билирубина (острые и хрон^гческие гемолитические анемии,
талассемия, массивные переливания крови, несовместимость при гемотранс¬
фузии, физиологическая желтуха новорожденных, гемолитическая болезнь
новорожденных), у новорожденных физиологическая желтуха наблюдается
в первую неделю жизни, когда происходит ускоренное разрушение эри¬
троцитов в связи со сменой типов гемоглобина на фоне еще не совершен¬
ной билирубин-конъюгирующей системы гепатоцитов. При гемолитической
болезни новорожденных, вызванной чаще всего несовместимостью крови
матери и ребенка по резус-принадлежности, может наблюдаться гораздо
более значительное повышение уровня билирубина крови (до токсических
величин 200 мкмоль/л и выше).
вж198БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ• Заболевания печени с поражением гепатоцитов и связанным с этим ослабле¬
нием образования прямого билирубина и его транспорта в желчь, а также
«утеканием» прямого билирубина в кровь; гипербилирубинемия развивается
за счет прямого и непрямого билирубина (острые и хронические заболева¬
ния печени, первичный и метастатический рак печени, правожелудочковая
сердечная недостаточность, холестатический гепатит, первичный билиарный
цирроз печени, токсическое поражение печени четыреххлористым водоро¬
дом, хлороформом, трихлорэтиленом, фторотаном, алкоголем, некоторыми
лекарственными препаратами).• Обтурация внутри- и внепеченочных желчных протоков; гипербилирубине¬
мия развивается в основном за счет прямого билирубина (желчнокаменная
болезнь, опухоли поджелудочной железы, гельминтозы).• врожденные гипербилирубинемические синдромы, развивающиеся вслед¬
ствие генетически детерминированных дефектов метаболизма в гепатоцитах:
синдром Жильбера (идиопатическая неконъюгированная гипербилирубине¬
мия); синдром Криглера-Найяра (отсутствие или дефицит уридиндифосфат-
глюкуронилтрансферазы); синдром Дабина-Джонсона (нарушение транс¬
порта билирубина из гепатоцитов в желчь); синдром Ротора (идиопатическая
семейная доброкачественная гипербилирубинемия с адекватным повышени¬
ем конъюгированного и неконъюгированного билирубина).ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания; гемолиз in vivo или in vitro (аналитическая интерфе¬
ренция), гепатотоксичные и холестатические лекарственные препараты, а также
препараты, вызывающие гемолиз.Гликированный гемоглобинОбразование гликированного гемоглобина (НЬА^^) в крови определяется уров¬
нем гликемии и длительностью контакта гемоглобина с глюкозой.Методы исследования: высокоэффективная жидкостная хроматография,
жидкостная ионообменная хроматография, аффинная хроматография, иммуно-
турбидиметрия, электрофорез.Материал (проба): цельная кровь (с ЭДТА) стабильна 4-7 сут при +4 '’С,
30 сут - при -20 “С.Референтные пределы; в сыворотке крови — менее 6,1% общего гемогло¬
бина.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕУровень гликированного гемоглобина в эритроцитах является интегральным
показателем углеводного обмена за предшествующие 6-8 нед и отражает риск раз¬
вития осложнений сахарного диабета. Интерпретация представлена в табл. 4-11.Таблица 4-11. Контрольные параметры (цель лечения) сахарного диабетаТипы диабетаНормаАдекватный контрольНеадекватный контрольСахарный диабет
1-го типа
НЬА,^.%<6,16,1-7,5>7,5Сахарный диабет
2-го типаНизкий риск ангио¬
патииРиск макроангиопатииРиск микроангиопагииНЬА,„%<6,56,5-7,5>7,5Измерение концентрации НЬА^^ показано для выявления нарушенной толерант¬
ности к глюкозе, в том числе сахарного диабета, «скрытых» или доманифестных
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 199форм И диабета беременных. Используется для оценки компенсации сахарного
диабета, эффективности лечения и степени риска осложнений.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания;• уремия (образование карбамилированного гемоглобина);• прием лекарственных препаратов — пропрано л о ла, гидрохлоротиазида, мор¬
фина, индапамида.Снижение содержания;• гемолитическая анемия;• нарушение синтетической способности печени;• недостаточное белковое питание;• нефротический синдром.Глюкоза в кровиГлюкоза — моносахарид, являющийся основным энергетическим субстратом
для большинства тканей организма. Концентрация глюкозы в плазме (сыворотке)
крови — интегральный показатель обмена углеводов в организме. К повышению
концентрации глюкозы в крови ведут поступление углеводов (крахмала, гликоге¬
на, сахарозы и др.) с пищей, распад гликогена в печени, синтез глюкозы в печени
из продуктов распада белков, жиров и углеводов (глюконеогенез). Отток глюкозы
из крови в ткани происходит вследствие ее использования для синтеза запасной
формы глюкозы — гликогена в основном в печени и скелетных мышцах, синтеза
гетерополисахаридов, высших жирных кислот (при избыточном поступлении в
организм углеводов). Соотношение скорости процессов образования и утилизации
глюкозы, следовательно, и концентрация глюкозы в крови регулируются гормона¬
ми. Пїпергликемический эффект в норме оказывают несколько гормонов — глюка¬
гон, кортизол, адреналин, глюкокортикоиды, усиливающие различные процессы
образования глюкозы в тканях. Инсулин — единственный гипогликемический
гормон. Стимуляция транспорта глюкозы из крови в клетки и активация фермента
глюкокиназы (гексокиназы) инсулином ведут к усилению всех процессов утили¬
зации глюкозы в тканях-мишенях для этого гормона (печени, скелетных мышцах,
жировой ткани). Инсулиновая недостаточность, развивающаяся вследствие осла¬
бления продукции инсулина поджелудочной железой и/или снижения количества
рецепторов к инсулину на клетках-мищенях, ведет к гипергликемии после приема
углеводов с пищей (в течение 1-2 ч — при нарушении толерантности к глюкозе,
в течение 8 ч и более — при сахарном диабете). У здоровых беременных из-за
потребления глюкозы растущим плодом ее уровень натощак может быть немно¬
го снижен по сравнению с небеременными. Адаптивные гормональные сдвиги
при беременности вызывают некоторое повышение толерантности к инсулину
в организме женщины, что направлено на увеличение доступности глюкозы для
плода. У некоторых женщин относительная недостаточность инсулина может
вызвать развитие диабета беременных (гестационного диабета), проходящего
после родов.Материал (проба): сыворотка (быстро отделять от форменных элементов
крови до исследования; можно хранить 8 ч при комнатной температуре, 72 ч — при
+4 °С), цельная кровь, плазма крови, забранная с гепарином и фторидом натрия в
качестве ингибитора гликолиза (до исследования можно хранить сутки при ком¬
натной температуре, 7 сут - при +4 Т).Референтные пределы представлены в табл. 4-12,Концентрация глюкозы в сыворотке крови примерно на 11-14% выше, чем в
цельной крови, из-за разведения растворенной в плазме глюкозы форменными
200 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯТаблица 4-12. Референтные пределы глюкозыВозрастГлюкоза в сываротке крови,
ммоль/лГлюкоза цельной (капиллярной) крови, имоль/лНоворожденные2,8-4,42,5-4,1Взрослые4.0-6,13,3-5,5элементами крови. Концентрация глюкозы в гепаринизированной плазме на 5%
ниже содержания глюкозы в сыворотке. Вследствие утилизации глюкозы в тка¬
нях цельная венозная кровь содержит меньше глюкозы, чем капиллярная кровь
из пальца (натощак примерно на ОД ммоль/л, после приема пищи — на 15-20%,
большая разница может быть у пациентов с нарушениями микроциркуляции,
например при шоке).Лабораторные критерии диагноза сахарного диабета (ВОЗ, 1999): сочетание
клинических симптомов диабета (полиурия, полидипсия, необъяснимая потеря
массы тела) и случайных (независимого от времени предыдущего приема пищи).
Критерии нарушения толерантности глюкозы и сахарного диабета на основе уров¬
ня глюкозы в крови представлены в табл. 4-13.Таблица 4-13, Диагностический уровень концентрации глюкозы, ммоль/лДиагнозМомент взятия пробыЦельная кровьвенознаякапиллярнаяПлазма венозной
кровиНормаНатощак3,3-5,53,3-5,54,0-6,1Через 2 ч после нагрузки
глюкозой<6,7<7,8<7,8Нарушение толе¬
рантности к глю¬
козеНатощак<6,1<6.1<7,0Через 2 ч после нагрузки
глюкозой^,7и<10,0>7,8 и <11,1>7,8 и <11,1Сахарный диабетНатощак>6,1^.1>7,0Через 2 ч после нагрузки
глюкозойS10,0>11,1>11.1КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика и мониторинг сахарного диабета, диабета беременных, нарушения
толерантности к глюкозе. Выявление и мониторинг нарушений углеводного обме¬
на при недостаточности надпочечников, гипофиза, заболеваниях печени, сепсисе,
шоке и других критических состояниях. Скрининг нарушений углеводного обмена
в группах риска развития сахарного диабета (ожирение, возраст старше 45 лет,
сахарный диабет 1-го типа в семейном анамнезе). Дифференциальная диагностика
комы (гипо- и гипергликемической комы).Увеличение концентрации глюкозы (гипергликемию) вызывают:• умеренная физическая нагрузка;• эмоциональный стресс;• боль;• сахарный диабет;• увеличение продукции гипергликемических гормонов (феохромоцитома,
тиреотоксикоз, акромегалия, гигантизм, синдром Кушинга);• снижение продукции инсулина при заболеваниях поджелудочной железы
(острый и хронический панкреатит, опухоли поджелудочной железы);• травма, опухоли, операционные повреждения головного мозга, кровоизлия¬
ние в мозг.Уменьшение концентрации (гипогликемию) вызывают:• передозировка гипогликемических препаратов, инсулина;
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 201• повышение продукции инсулина (аденома или карцинома р-клеток остров¬
ков Лангерганса — инсулинома);• снижение продукции гипергликемических гормонов (недостаточность
а-клеток островков Лангерганса, болезнь Аддисона, адреногенитальный
синдром, гипопитуитаризм, гипотиреоз);• ослабление гликогенной функции печени при циррозе, тяжелых гепатитах
разной этиологии, первичном раке печени, гемохроматозе, алкогольной |
интоксикации;• ферментопатии (болезнь Гйрке, галактоземия, нарушенная толерантность к
фруктозе);• длительное голодание;• синдром мальабсорбции;• интенсивная физическая нагрузка;• лихорадочные состояния.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания: глюкокортикоиды, никотиновая кислота, адреналин,
некоторые диуретики, нестероидные противовоспалительные препараты, морфин,
кофеин, курение.Уменьшение содержания: без добавления ингибитора гликолиза длительное
хранение плазмы, сыворотки до отделения от форменных элементов крови, сгуст¬
ка; анаболические стероиды, пропранолол, амфетамин, леводопа.Глюкоза в мочеМатериал (проба): суточная моча; исключить применение диуретиков. До
исследования можно хранить 48 ч при -20 "'С.Референтные пределы: менее 0,08 ммоль/сут (большинство тест-систем
нечувствительны к такой концентрации и дают отрицательный результат).КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕМониторинг сахарного диабета беременных, нарушения толерантности к глю¬
козе. Диагностика и мониторинг почечного диабета, патологий почек с нарушени¬
ем канальцевой реабсорбции.С мочой глюкоза в норме не выводится, поскольку после фильтрации в почеч¬
ных клубочках полностью реабсорбируется в проксимальных канальцах. При
гипергликемии выше 9-10 ммоль/л (почечный порог для глюкозы) развивается
глюкозурия. Глюкозурия не является диагностическим критерием сахарного диа¬
бета, поскольку экскреция глюкозы с мочой зависит не только от уровня глике¬
мии, отражающей инсулярную функцию, но и от функционирования почек — спо¬
собности почечных канальцев реабсорбировать глюкозу, скорости клубочковой
фильтрации. Глюкозурия на фоне нормогликемии может развиваться при неко¬
торых заболеваниях почек из-за снижения почечного порога, а также во время
нормальной беременности из-за того, что физиологическое повышение клубоч¬
ковой фильтрации неадекватно абсорбционной способности канальцев. Одним
из критериев компенсации сахарного диабета 2-го типа является аглюкозурия,
при сахарном диабете 1-го типа допускается потеря глюкозы с мочой 20-30 г/сут.При диабетическом гломерулосклерозе почечный порог для глюкозы возрастает,
поэтому глюкозурия не развивается даже при выраженной гипергликемии.Увеличение экскреции (глюкозурия) связано;• с гипергликемией при сахарном диабете, гипертиреозе, стероидном диабете,
синдроме Кушинга, феохромоцитоме, заболеваниях іюджелудочной железы
и других состояниях;
202 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ• снижением почечного порога для глюкозы при тубулоинтерстициальных
поражениях почек любой этиологии, врожденных тубулопатиях.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания: глюкокортикоиды, адреналин, некоторые диуретики,
нестероидные противовоспалительные препараты, никотиновая кислота, морфин.Креатинин в сыворотке кровиКреатинин — конечный продукт неферментативного распада креатинфосфата и
креатина, участвующих в энергообеспечении мышечного сокращения. Креатинин
выводится из крови почками, относится к беспороговым веществам, которые
поступают в мочу путем фильтрации, не реабсорбируются и не секретируются в
канальцах. Увеличение концентрации креатинина в сыворотке крови отражает
снижение скорости клубочковой фильтрации. Креатинин не является чувстви¬
тельным показателем нарушений фильтрационной способности почек на ранних
стадиях, может оставаться в референтных пределах при поражении значительной
части нефронов, с другой стороны, медленнее, чем мочевина, изменяется при
гемодиализе у больных с почечной недостаточностью. Именно поэтому этот тест
обычно используют одновременно с определением мочевины: ее сывороточная
концентрация более чувствительна к функциональным изменениям состояния
почек. Дополнительно для оценки полезен расчет скорости клубочковой фильтра¬
ции по клиренсу эндогенного креатинина (см. «Проба Реберга»). На уровень креа¬
тинина в сыворотке влияет скорость его продукции в мышцах (мышечная масса),
в меньшей степени, чем на уровень мочевины, влияет характер пищи,КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика и мониторинг заболеваний почек, выявление и мониторинг нару¬
шений функций почек любой этиологии. Заболевания скелетных мышц.Референтные пределы представлены в табл. 4-14.Таблица 4-14, Референтные пределы креатинина в кровиВозраст, полмкмоль/л<1 года18-351-14 лет27-62>14 лет, женский53-97>14 лет. мужской62-115Увеличение концентрации наблюдается:• при снижении клубочковой фильтрации при дисфункции почек любой этио¬
логии (снижении почечной перфузии, заболеваниях почек, обтурации моче¬
выводящих путей);• эндокринных нарушениях, сопровождающихся изменением метаболизма
скелетных мышц (акромегалии и гигантизме, гипертиреозе);• некрозе скелетных мышц, воспалительных и метаболических заболеваниях с
вовлечением мышц;• голодании со снижением мышечной массы.Уменьшение концентрации наблюдается при снижении мышечной массы тела.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания: мясная диета, беременность (физиологически), нефро-
токсичные препараты.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 203Креатинин в мочеМатериал (проба): суточная моча; избегать интенсивных физических нагру¬
зок, по согласованию с врачом исключить прием диуретиков. До исследования
можно хранить 4 сут при +4 "С, месяц — при -20 “С.Референтные пределы представлены в табл. 4-15.Таблица 4-15. Референтные пределы креатинина в мочеВозраст, ЛОЛмкмоль/кг в сутки<1 года71-177Дети71-194Подростки71-265>14 лет, мужской124-230>14 лет, женский97-177КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика и мониторинг заболеваний почек, выявление и мониторинг нару¬
шений функций почек любой этиологии.Увеличение суточной экскреции креатинина с мочой указывает на увеличение
почечной фильтрации и/или повышенное образование креатина и креатинина в
скелетных мышцах. Увеличением концентрации сопровождаются:• увеличенный сердечный выброс;• начальные стадии диабетической нефропатии;• инфекции, ожоги, отравление окисью углерода;• гипотиреоз:• физическая нагрузка;• акромегалия, гигантизм.Уменьшение суточной экскреции креатинина с мочой указывает на снижение
уровня почечной фильтрации (более точно можно оценить по клиренсу эндоген¬
ного креатинина; см. «Проба Реберга») и/или сниженное образование креатина и
креатинина в мышцах. Уменьшением концентрации сопровождаются:• дисфункции почек любой этиологии (снижение почечной перфузии, заболе¬
вания почек, обтурация мочевыводящих путей);• паралич, мышечная дистрофия, заболевания с уменьшением мышечной
массы, голодание со снижением мышечной массы.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания: мясная пища, белковая диета, беременность.Уменьшение содержания: вегетарианская пища.Клиренс креатинина - проба РебергаПроба Реберга — оценка скорости клубочковой фильтрации (СКФ) по кли¬
ренсу эндогенного креатинина. Креатинин относится к беспороговым веществам,
которые поступают в мочу путем фильтрации, не реабсорбируются и не секре-
тируются в канальцах. Именно поэтому количество креатинина. выводимого за
определенное время с мочой, равно количеству креатинина, поступившего в пер¬
вичную мочу. Измерив концентрацию креатинина в сыворотке крови (она равна
уровню креатинина в первичной моче) и моче, а также объем мочи, выделяемой
за определенное время (обычно за сутки), можно рассчитать клиренс креатинина,
характеризующий СКФ по формуле:клиренс креатинина, мл/мирт = (концентрация креатинина в моче х диурез, мл) /
(концентрация креатинина в сыворотке крови х время сбора мочи, мин).
204 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯФильтрация в почках зависит от роста и массы тела, поэтому клиренс креатини-
на рассчитывают на стандартную среднюю поверхность тела, равную 1,73 м^. Для
этого в направлении на исследование, кроме объема мочи, собранной за сутки,
указывают рост и массу тела.Материал (проба); сыворотка крови, суточная моча при обьином водном
режиме. До исследования можно хранить при +4 "С до 6 сут, при -20 “С — 6 мес.
Референтные пределы представлены в табл. 4-16.Таблица 4-16. Референтные пределы клиренса креатининаВозраст, годымл/мин на 1,73мужской полженский пол65-10065-1001-3088-14681-13430-4082-14075-12840-5075-13369-12250-6068-12664-11660-7061-12058-110>7055-11352-105КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕВыявление и мониторинг нарушений гломерулярной функции почек.Увеличение концентрации:• начальный период сахарного диабета;• гипертоническая болезнь;• нефротический синдром.Уменьшение концентрации:• до 30 мл/мин на 1,73 м^ — умеренное снижение функций почек (самостоя¬
тельного значения не имеет);• от 30 до 15 мл/мин на 1,73 м^ — почечная недостаточность компенсирован¬
ная, субкомпенсированная;• менее 15 мл/мин на 1,73 м^ — декомпенсированная почечная недостаточ¬
ность.При выраженной почечной недостаточности СКФ, оцененная пробой Реберга,
может быть завышена (при значительно повышенном уровне креатинина в плазме
крови он может поступать в мочу путем секреции в почечных канальцах). В этой
ситуации сывороточный уровень креатинина может быть более чувствительным
индикатором изменения функции клубочков.ВЛИЯЮЩИЕ ФАКТОРЫФизические нагрузки, крепкий чай, кофе, алкоголь, прием кортикотропи-
на, кортизола, тироксина, метилпреднизолона, фуросемида (следует исключить
прием этих препаратов при проведении пробы).ЛактатЛактат — продукт анаэробного метаболизма глюкозы, активирующегося при
снижении обеспечения тканей кислородом. Источником лактата в крови в норме
являются скелетные мышцы (при физической работе), а также эритроциты,
неспособные расщеплять глюкозу аэробным путем из-за отсутствия митохондрий.
Отток лактата из крови обусловлен его использованием для синтеза глюкозы
(глюконеогенеза) в печени, в меньшей степени — в почках. Накопление лактата в
тканях, крови может быть следствием:
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 205• усиления его продукции при гипоперфузии тканей;• снижения парциального давления кислорода в крови;• повышения сродства гемоглобина к кислороду;• продукции опухолевыми клетками (из-за характерной для них высокой
активности гликолиза);• интенсивной физической нагрузки и/или ослабления его утилизации печенью.
Накопление лактата может привести к метаболическому ацидозу (при концен¬
трации в плазме артериальной крови >7 ммоль/л) с характерным увеличением
анионного интервала.Материал (проба): плазма крови, забранная с оксалатом (ЭДТА) и ингибито¬
ром гликолиза — фторидом натрия. При необходимости до исследования можно
хранить 3 сут при +4 °С.Референтные пределы представлены в табл. 4-17.Таблица 4-17. Референтные пределы лактата в плазме кровиМатериалимоль/лПлазма венозной крови<2,2Плазма артериальной крови<1,6КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕОценка адекватности доставки кислорода в ткани при всех критических состоя¬
ниях, сопровождающихся нарушениями кровообращения, внешнего дыхания,
кислородтранспортной функции крови. Исследования в спортивной физиологии
и медицине.Увеличение концентрации:• острое кровотечение, тяжелая анемия, экстракорпоральное кровообращение;• тяжелая сердечная недостаточность;• ацидоз при алкоголизме;• гипервентиляция, физическая нагрузка;• сахарный диабет (около 50% случаев);• почечная/печеночная недостаточность;• лейкозы;• гликогенозы.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение концентрации: наложение жгута при взятии венозной крови;
интоксикация аспирином*, адреналин* (особенно в избыточных дозах), этанол,
фруктоза, глюкоза, изониазид (передозировка), метформин, метилпреднизолон,
налидиксовая кислота, фенформин^, сахароза, тербуталин^, тетракозактрин^'.Снижение концентрации: метиленовый синий, морфин,Мочевая кислотаНизкомолекулярное азотсодержащее вещество, конечный продукт распада
пуриновых азотистых оснований — аденина и гуанина, входящих в состав сво¬
бодных нуклеотидов и нуклеиновых кислот. Выводится из организма с мочой.
При повышенном образовании мочевой кислоты в тканях и связанным с этим
увеличением ее концентрации в плазме крови могут образовываться кристаллы
натриевых солей мочевой кислоты — уратов, что лежит в основе патогенеза пода¬
гры. Клинические проявления подагры (артриты, мочекаменная болезнь, уратная
нефропатия) обусловлены отложением кристаллов уратов в суставной жидкости,
окружающих суставы тканях, паренхиме или канальцах почек. Повышенному
образованию мочевой кислоты способствуют врожденная недостаточность уча¬
206 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯствующих в обмене пуринов ферментов, усиленный катаболизм нуклеиновых
кислот при массивном разрушении тканей, повышенном потреблении животной
пищи, богатой пуринами. Риск подагры нарастает по мере увеличения гипер-
урикемии, но клинические проявления подагры не всегда тесно коррелируют с ее
уровнем. Гиперурикемия ассоциируется с метаболическим синдромом.
Референтные пределы представлены в табл. 4-18.Таблица 4-18. Референтные пределы мочевой кислоты в сыворотке кровиВозраст, пол<14 пет>14 лет, мужской>14 лет, женскиймкмоль/л12(W20210-420150-350КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика и мониторинг подагры, в том числе у больных, имеющих метабо¬
лический синдром. Исключение подагры как причины мочекаменной болезни.Увеличение концентрации:• подагра;• первичная подагра, синдром Леша-Нихана (генетически обусловленная
недостаточность фермента гипоксантин-гуанин-фосфорибозилтрансферазы,
участвующего в процессе повторного использования продукта распада пури¬
нов — гипоксантина);• токсикозы беременных;• псориаз;• синдром Дауна;• поликистоз почек, свинцовая нефропатия, почечная недостаточность.Уменьшение концентрации:• болезнь Вильсона-Коновалова (гeпaтo]^epeбpaльнaя дистрофия);• синдром Фанкони;• ксантинзфия;• болезнь Ходжкина;• бронхогенный рак;• дефекты проксимальных канальцев почек.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение концентрации: длительное голодание, физическая нагруз¬
ка, диета, богатая пуриновыми основаниями, употребление алкоголя, прием
|3-адреноблокаторов, глюкокортикоидов, цитостатиков (при лейкозах, лимфомах,
миеломной болезни, полицитемии), тиазидных диуретиков, салицилатов, теофил-
лина, метформина.Уменьшение концентрации: низкопуриновая диета, прием аллопуринола, глю¬
кокортикоидов, азатиоприна.Мочевина в сыворотке кровиМочевина — синтезируемый в печени конечный продукт детоксикации эндо¬
генного аммиака, образующегося при распаде белков и других азотсодержащих
соединений. Около 90% мочевины выводится с мочой; мочевина фильтруется
в клубочках, частично пассивно реабсорбируется и секретируется в канальцах.
Концентрация мочевины в плазме (сыворотке) крови отражает соотношение ско¬
рости ее образования и выведения с мочой. Скорость синтеза мочевины возрастает
при потреблении чрезмерно обогащенной белком пищи, усиленном эндогенном
катаболизме в условиях голодания или повреждения тканей, при всасывании ами¬
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 207нокислот и пептидов после кровоизлияния в желудочно-кишечный тракт. Однако
существенное увеличение содержания мочевины в плазме (сыворотке) крови, как
правило, указывает на нарушение функций почек. Это заключение почти одно¬
значно при содержании мочевины в плазме крови, превышаюшем 15 ммоль/л.
Вероятность нарушения функций почек возрастает, если при соответствующих
данных анамнеза выявлены отклонения в общем анализе мочи (обнаружение
белка, цилиндров, клеток крови), диурезе и/или повышенный уровень креатини-
на. Существенное возрастание концентрации мочевины ведет к увеличению осмо-
лярности плазмы крови, что может влиять на гидратацию клеток.Выделение мочевины с мочой зависит от скорости распада эндогенных бел¬
ков и поступления пищевых белков, необходимых для обеспечения организма
субстратами (аминокислотами) для синтеза белков и других азотсодержа¬
щих соединений, включая азотистые основания нуклеотидов. Именно поэтому
исследование экскреции мочевины с мочой используется для оценки баланса
между процессами синтеза и распада белков в организме — азотистого баланса.
Отрицательный азотистый баланс проявляется задержкой роста у детей, сниже¬
нием массы тела, снижением скорости заживления ран, а также нарушениями,
обусловленными снижением скорости пролиферации клеток быстрообновляе¬
мых тканей и синтеза короткоживущих белков (гипоальбуминемией, анемией,
мальабсорбцией, интеркуррентными инфекциями в связи с недостаточностью
иммунной системы и др.).Референтные пределы представлены в табл. 4-19.Таблица 4-19. Референтные пределы мочевины в сыворотке кровиВозрастммоль/л<14 лет1,8-6,414-60 лет2,5-6,4>60 лет2,9-7,5КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕОценка и мониторинг выделительной функции почек. Оценка мочевинообра¬
зующей функции печени при печеночной недостаточности различной этиологии.Увеличение концентрации:• острые или хронические заболевания почек, обтурация мочевыводящих
путей• снижение почечной перфузии (застойная сердечная недостаточность, шок);• изоосмотическая дегидратация при рвоте, диарее, повышенном диурезе или
потоотделении;• увеличение синтеза мочевины при повышенном катаболизме белка
(желудочно-кишечном кровотечении, ожогах, инфекциях, послеоперацион¬
ном состоянии и др.).Уменьшение концентрации:• повышенная скорость клубочковой фильтрации, обусловленная беременно¬
стью, чрезмерным объемом внутривенных инфузий, неадекватной секрецией
антидиуретического гормона;• снижение синтеза мочевины при функциональной недостаточности печени
(печеночной коме, гепатите, циррозе, острой гепатодистрофии, отравлении
фосфором, мышьяком);• мальабсорбция и/или недостаточность белка в рационе (в связи со снижени¬
ем продукции аммиака и соответственно синтеза мочевины);• врожденная недостаточность ферментов гепатоцитов, участвующих в про¬
цессе синтеза мочевины (орнитиновом цикле).
208 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯВЛИЯЮЩИЕ ФАКТОРЫУвеличение концентрации: диета с высоким содержанием белка, прием нефро-
токсичных лекарственных препаратов, )шеличенный катаболизм эндогенных бел¬
ков при гипертиреозе, приеме глюкокортикоидов.Уменьшение концентрации: вегетарианская низкобелковая диета.Мочевина в мочеМатериал (проба): суточная моча.Референтные пределы представлены в табл. 4-20.Таблица 4-20. Референтные пределы мочевины в суточной мочеВозрастммоль/сут<1 года10-100М года50-2004-8 лет130-2808-14 лет200^50>14 лет428-714КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕКонтроль азотистого баланса у больных в тяжелом состоянии, получающих
зондовое энтеральное и парентеральное питание. Корректно оценить азотистый
баланс с использованием этого теста можно лишь при отсутствии тяжелой пече¬
ночной и почечной недостаточности, сопровождающейся соответственно сниже¬
нием биосинтеза мочевины, уменьшением ее экскреции с мочой.Увеличением, указывающим на отрицательный азотистый баланс, сопровожда¬
ются:• послеоперационный период, лихорадка;• гипертиреоз;• тяжелые острые или хронические соматические заболевания.Уменьшением, указывающим на положительный азотистый баланс, сопрово¬
ждаются:• беременность;• период роста у детей;• восстановление после состояний с отрицательным азотистым балансом.Азотистый баланс может быть рассчитан по формуле:АБ (г) = суточное поступление белка - 6,25 х (суточный азот мочевины + 4 г),где 6,25 — коэффициент пересчета содержания азота в белок, 1 г азота = 6,25 г
белка; 4 г — поправка на выведение организмом азота не в составе мочевины.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение концентрации: диета с высоким содержанием белка, лечение анабо¬
лическими стероидами, соматотропным гормоном, инсулином.Уменьшение концентрации: диета с низким содержанием белка, лечение глюко-
кортикоидами.ПорфобилиногенПорфобилиноген — промежуточный метаболит синтеза порфиринового кольца
гема. Синтез гема происходит главным образом в печени и костном мозге, начинает¬
ся с образования 5-5-аминолевулиновой ю1Слоты, из которой образуются порфоби-
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 209линоген и другие метаболиты. Наследственные и приобретенные нарушения синтеза
гема, сопровождающиеся повышением содержания предшественников гема — пор-
фириногенов, а также продуктов их окисления в тканях и крови, появлением их в
моче, называют порфириями. Наследственные порфирии обусловлены генетиче-
скими дефектами какого-либо из восьми ферментов, участвующих в синтезе гема.
Поскольку гем является ингибитором аминолевулинатсинтазы, активность этого
фермента повышается, что приводит к накоплению аминолевулішовой кислоты и
порфириногенов. при тяжелых формах порфирий наблюдают нейропсихические
расстройства, нарушения функций ретикулоэндотелиальной системы, повреждения
кожи. При легких формах наследственных порфирий заболевание может протекать
бессимптомно, обострение вызывается приемом некоторых лекарственных препа¬
ратов, являющихся индукторами аминолевулинатсинтазы. Порфирии наблюдают
при отравлениях свинцом, галогенсодержащими гербицидами и инсектицидами,
являющимися ингибиторами отдельных ферментов процесса синтеза гема.Материал (проба): моча свежая, случайная порция для качественного теста;
суточная, собранная в темную емкость с 5 г углекислого натрия; собирают во время
или немедленно после приступа болей в животе. До исследования можно хранить
при +4 “С до 14 сут, при -20 “С — несколько недель.Методы исследования: качественный тест с реактивом Эрлиха, флюориме-
трия, колориметрия после выделения методом анионообменной хроматографии и
реакции с реактивом Эрлиха.Референтные пределы: отрицательные (<8,8 мкмоль/л, или <15 мкмоль/сут).КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика врожденных и приобретенных порфирий. При подозрении на пор-
фирию количественный тест следует проводить даже при отрицательном качествен¬
ном тесте. На первом этапе диагностики порфирии наиболее информативно одно¬
временное определение в моче порфобилиногена, 5-5-аминолевулиновой кислоты
и общих порфиринов. Установление формы врожденной порфирии проводят в спе¬
циализированных лабораториях с применением комплекса методов, включающих
высокоэффективную жидкостную хроматографию, а также генетический анализ.
Для постановки диагнозов отравления свинцом и профессиональной передозировки
свинца предпочтительнее проводить определение свинца в крови.Увеличение концентрации:• острая перемежающаяся порфирия (во время приступа);• наследственная копропорфирия;• смешанные порфирии.Свободные жирные кислотыСвободные жирные кислоты (СЖК), или неэтерифицированные жирные кис¬
лоты, в организме служат источником метаболической энергии, субстратом для
структур клеточной мембраны, а также предшественниками для многих внутри¬
клеточных сигнальных молекул, таких как простагландины. СЖК выделяются из
жировой ткани при липолизе. На процесс вьщеления оказывают влияние диета и
колебания уровня инсулина. Патологические состояния, такие как инсулинорези-
стентность при патогенезе сахарного диабета 2-го типа, ожирение, злокачествен¬
ные болезни и метаболический синдром, ассоциируются с повышенным содержа¬
нием СЖК в крови и содействуют развитию сердечно-сосудистых заболеваний.Материал (проба): сыворотка крови, забранной утром через 12-14 ч после
последнего приема пищи. Определение СЖК следует проводить в течение не более2 ч после забора крови. В противном случае из-за возможного наличия в образце
липазной активности может происходить гидролиз содержащихся в нем тригли-
210 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯцеридов с образованием дополнительных количеств СЖК, что может привести к
завышению их истинной концентрации.Референтные пределы: женщины — ОД-0,45 ммоль/л, мужчины — ОД-
0,6 ммоль/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика первичных нарушений липидного обмена (в комплексе с электро¬
форетическим анализом липопротеидов и другими исследованиями, выполняе¬
мыми в специализированных лабораториях). Диагностика вторичных нарушений
липидного обмена. Оценка риска атеросклероза и его осложнений. Мониторинг
коррекции атерогенных нарушений липидного обмена.Увеличение концентрации;• нарушение толерантности к глюкозе, гиперинсулинемия;• инсулинорезистентность, метаболический синдром;• ишемии, сердечно-сосудистые заболевания.Уменьшение концентрации:• гиполипопротеидемия, недостаточность питания, синдром мальабсорбции;• гипертиреоз, гиперпаратиреоз.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение концентрации: прием пищи менее чем за 12 ч до исследования,
высококалорийная пища, диета с высоким содержанием углеводов, беременность,
пероральные контрацептивы, прием р-адреноблокаторов, глюкокортикоидов,
эстрогенов, диуретиков.Уменьшение концентрации: прием холестирамина^’, витамина С, прогестинов,
лечение гепарином.ТриглицеридыТриглицериды (ТГ) — эфиры спирта глицерола и высших жирных кислот.
Основная функция — энергетический субстрат. Синтез эндогенных ТГ осуществля¬
ется в печени и жировой ткани; в эпителии тонкой кишки происходит ресинтез ТГ из
продз^ктов переваривавания пищи — моноглицеридов и жирных кислот. Из тонкой
кишки ТГ транспортируются лимфой в виде мелкодисперсных капель — хиломикро-
нов (транспортная форма липидов), расщепляющихся в крови липопротеидлипазой
эндотелия; образованные при этом жирные кислоты поступают в клетки жировой
ткани, где депонируются в составе триглицеридов, а также в мышцы и другие ткани,
где используются как энергетический субстрат. В жировой ткани ТГ могут гидроли¬
зоваться активируемой глюкагоном липазой, поступающие в кровь жирные кислоты
используются различными тканями как энергетический субстрат. Синтезированные
в печени ТГ и ТГ поступающих сюда ремнантов (остатков) хиломикронов переносят¬
ся кровью в составе липопротеидов очень низкой плотности (ЛПОНП). Содержание
ТГ в плазме (сыворотке) крови изменяется в течение дня в связи с приемом пищи:
увеличивается через 30-60 мин после приема пищи, что из-за присутствия хило¬
микронов придает плазме мутность (хилез), и возвращается к исходному уровню
в течение 12 ч. Повышенный уровень ТГ может быть обусловлен увеличением
содержания в плазме крови хиломикронов и/или ЛПОНП. Нахождение плазмы при
+4...+S "С в течение 12-18 ч сопровождается появлением сливкообразного слоя с
просветлением плазмы, что характерно для гиперлипидемии, обусловленной хило-
микронами, сохранение мутности плазмы — для повышенного содержания ЛПОНП.
Повышенная концентрация триглицеридов в крови ассоциируется с повышенным
риском развития атеросклероза и ишемической болезни сердца.Референтные пределы: триглицериды — 0,5-1,7 ммоль/л.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 211КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика первичных нарушений липидного обмена (в комплексе с электро¬
форетическим анализом липопротеидов и другими исследованиями, выполняе¬
мыми в специализированных лабораториях). Диагностика вторичных нарушений
липидного обмена. Оценка риска атеросклероза и его осложнений. Мониторинг
коррекции атерогенных нарушений липидного обмена.Увеличение концентрации.• Первичные дислипопротеидемии:❖ дислипопротеидемии I, ПЬ , ІП, IV и V типа (семейная или спорадическая
эндогенная гипертриглицеридемия, наследственный дефицит липопроте-
инлипазы, дефицит кофактора липопротеидлипазы, семейная дисбетали-
попротеидемия, семейная комбинированная гиперлипидемия).• Вторичные дислипопротеинемии:^ нарушение толерантности к глюкозе, сахарный диабет, атеросклероз;^ вирусные гепатиты, цирроз печени, обтурация желчевыводящих путей;❖ острый и хронический панкреатит, ожирение, алкоголизм;❖ нефротический синдром, хроническая почечная недостаточность;❖ гипотиреоз, подагра, гликогенозы I, III и VI типа;❖ талассемия, острая перемежающаяся порфирия;❖ респираторный дистресс-синдром; идиопатическая гиперкальциемия;❖ невротическая анорексия, синдром Дауна.Уменьшение концентрации:• гиполипопротеидемия, недостаточность питания, синдром мальабсорбции;• гипертиреоз, гиперпаратиреоз, лимфангиэктазии кишечника;• хронические обструктивные заболевания легких.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение концентрации: прием пищи менее чем за 12 ч до исследования,
высококалорийная пища, диета с высоким содержанием углеводов, беременность,
пероральные контрацептивы, прием р-адреноблокаторов, глюкокортикоидов,
эстрогенов, диуретиков.Уменьшение концентрации: прием холестирамина*®, витамина С, прогестинов,
лечение гепарином.Холестерин общийХолестерин (холестерол) — многоатомный циклический спирт, структурный
компонент мембран клеток, исходный субстрат при синтезе половых гормонов,
глюкокортикоидов, желчных кислот, витамина D. Синтезируется в печени (до
80%) и поступает в организм с продуктами животного происхождения (мясом, сли¬
вочным маслом, яйцами и др.). Транспортируется в крови в составе липопротеидов
низкой плотности (ЛПНП), высокой плотности (ЛПВП), очень низкой плотности
(ЛПОНП). Общий холестерин включает как этерифицированный (связанный
эфирной связью с жирной кислотой), так и свободный холестерин липопротеидов
всех видов. Повышенное содержание общего холестерина в крови ассоциируется с
высоким риском атеросклероза и ишемической болезни сердца.Материал (проба): сыворотка крови, забранная утром не ранее чем через
12-14 ч после последнего приема пищи. Для оценки атерогенных нарушений не
рекомендуют проводить исследование в течение 3 мес после острых заболеваний,
включая острый инфаркт миокарда.Референтные пределы: 3,1-5,2 ммоль/л.Риск развития ишемической болезни сердца и ее осложнений:• низкий — менее 5,0 ммоль/л;
212 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ• умеренный — 5,0-6,3 ммоль/л;• высокий — более 6,3 ммоль/л.У больных с ишемической болезнью сердца, атеросклерозом периферических и
сонных артерий, аневризмой брюшного отдела аорты, а также сахарным диабетом
2-го типа оптимальным является уровень менее 4,5 ммоль/л.При концентрации 5,0 ммоль/л и выше для оценки атеросклеротических
изменений необходимо исследовать холестерол в комплексе с триглицеридами,
ХС-ЛПВП и ХС-ЛПНП с расчетом индекса атерогенности.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ• Диагностика первичных нарушений липидного обмена (в комплексе с элек¬
трофоретическим анализом липопротеидов и другими исследованиями,
выполняемыми в специализированных лабораториях).• Диагностика вторичных нарушений липидного обмена.• Оценка риска атеросклероза и его осложнений.• Мониторинг коррекции атерогенных нарушений липидного обмена.• Оценка эффективности гиполипидемической терапии (статинами).
Увеличение концентрации.• Первичные дислипопротеидемии:семейная и полигенная гиперхолесгеролемия (типы Па, ПЬ);❖ дислипопротеидемия III типа;❖ семейная комбинированная дислипопротеидемия III типа;❖ дислипопротеидемии типов I (наследственная недостаточность липопро-
теинлипазы), IV, V (семейная гипертриглицеридемия);❖ повышение ЛПВП.• Вторичные дислипопротеидемии:❖ атеросклероз, ишемическая болезнь сердца;печеночная недостаточность, внутри- и внепеченочный холестаз;❖ нефротический синдром, хроническая почечная недостаточность;❖ гипотиреоз, сахарный диабет;<>- изолированный дефицит соматотропного гормона;❖ подагра, гликогенозы I типа (болезнь Гирке);❖ алкоголизм;❖ злокачественные опухоли поджелудочной железы;❖ рак простаты;❖ беременность (физиологически).Уменьшение концентрации:• снижение ЛПВП, ЛПНП;• кахексия, голодание, мальабсорбция;• тяжелые острые заболевания, включая острый инфаркт миокарда, сепсис,
обширные ожоги (обусловлено острым повреждением тканей; снижение до
40% исходного уровня в течение первого дня болезни, возвращение к состоя¬
нию до болезни на протяжении 3 мес);• печеночная недостаточность, связанная с некрозом гепатоцитов, циррозом
печени, гепатокарциномой;• гипертиреоз, мегалобластная анемия, талассемия;• хронические обструктивные заболевания легких;• ревматоидный артрит, лимфоангиоэктазия кишечника.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение концентрации: пища, богатая холестерином и ненасыщенными
жирными кислотами, терапия андрогенами, циклоспоринами, тиазидными диу¬
ретиками, эргокальциферолом (высокие дозы), глюкокортикоидами, леводопой,
амиодароном.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 213Уменьшение концентрации: пища с низким содержанием холестерина и высо¬
ким содержанием полиненасыщенных кислот (может снизить на 10-15%), прием
препаратов, снижающих уровень холестерола, а также терапия эстрогенами,
интерфероном, неомицином, тироксином, кетоконазолом, ингибиторами моно-
аминооксидазы.Холестерин липопротеидов высокой плотности (ХС-ЛПВП)Липопротеиды высокой плотности— сложные мицеллы, состоящие из фосфо¬
липидов, специфических белков, синтезируемых в гепатоцитах, — аполипопротеи-
нов (апо-белков) и гидрофобных липидов, преимущественно холестерина. ЛПВП
осуществляют в крови транспорт липидов, включая ХС, от клеток периферических
тканей, в том числе кровеносных сосудов сердца, в печень, где он может выво¬
диться из организма в виде желчных кислот. Сниженный уровень ХС-ЛПВП рас¬
сматривают как фактор риска развития атеросклероза.Референтные пределы: 0,9-1,9 ммоль/л.Рекомендации Всероссийского научного общества кардиологов, 2004Снижение концентрации ХС-ЛПВП менее 0,9 ммоль/л для мужчин и менее
1,2 ммоль/л для женщин связывают с повышенным риском развития ишемической
болезни сердца и ее осложнений, уровень выше 1,56 ммоль/л играет защитную
роль. Для корректной оценки атерогенных нарушений липидного обмена необ¬
ходимо исследовать комплекс показателей: триглицериды, ХС общий, ХС-ЛПНП,
ХС-ЛПВП с расчетом индекса атерогенности.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ• Диагностика первичных нарушений липидного обмена (в комплексе с элек¬
трофоретическим анализом липопротеидов и другими исследованиями,
выполняемыми в специализированных лабораториях).• Диагностика вторичных нарушений липидного обмена.• Оценка риска атеросклероза и его осложнений.• Мониторинг коррекции атерогенных нарушений липидного обмена.Увеличение концентрации:• наследственное увеличение ЛПВП;• заболевания, сопровождающиеся изменением метаболизма ЛПВП в печени, —
первичный билиарный цирроз печени, хронический гепатит, алкоголизм.Уменьшение концентрации:• атеросклероз;• первичные гипо-а-липопротеидемии;• различные формы первичной гипертриглицеридемии;• заболевания, сопровождающиеся изменением метаболизма ЛПВП, — деком-
пенсированный сахарный диабет, хронические заболевания печени, холестаз,
нефротический синдром, хроническая почечная недостаточность, острые
вирусные и бактериальные инфекции.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение концентрации: циметидин^, циклофенил^, эстрогены, производные
фибриновой кислоты, статины, никотиновая кислота, фенобарбитал, снижение
массы тела у пациентов с ожирением.Уменьшение концентрации: богатая углеводами или полиненасыщенными
жирными кислотами диета, прием ^-адреноблокаторов, даназола, интерферона,
диуретиков, прогестинов, андрогенов.
214БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯИНДЕКС АТЕРОГЕННОСТИИндекс атерогенности — показатель атерогенных нарушений липидного обме¬
на, а также адекватности проводимой гиполипидемической терапии. Оценивают в
комплексе с результатами других тестов липидного профиля.Метод исследования: расчет с использованием результатов исследования
холестерина общего, ХС-ЛПВП по формуле (Климов А.Н., 1995):, ОХС{ммоль! л) -индекс атерогенности- — -ХС-ЛПВП{ммоль1л).ХС - ЛПВП{лтоль1 л)Рекомендуемые пределы: не более 4 ЕД (Европейские рекомендации III пере¬
смотра, 2003; рекомендации Всероссийского научного общества кардиологов,
2004).Холестерин липопротеидов низкой плотности (ХС-ЛПНП)Липопротеиды низкой плотности — сложные мицеллы, состоящие из фосфо¬
липидов, специфических белков, синтезируемых в гепатоцитах (апо-белков),
ХС и триглицеридов; образуются из ЛПОНП в результате метаболизма в крови,
переносят ХС из печени к клеткам периферических тканей. Уровень ХС-ЛПНП в
крови положительно коррелирует с риском развития ИБС более тесно, чем уро¬
вень общего холестерина. Патогенез атеросклероза включает перекисное пораже¬
ние компонентов ЛПНП под действием местных факторов воспаления, их захват
макрофагами сосудистых стенок и включение ХС-ЛПНП в состав образующихся
атеросклеротических бляшек.Референтные пределы; 2,1-3,5 ммоль/л.Увеличение концентрации ХС-ЛПНП более 3,5 ммоль/л ассоциируется с повы¬
шенным риском развития ИБС и ее осложнений; 3,5-4,1 ммоль/л — пограничный
риск, более 4,1 ммоль/л — высокий. У больных с ИБС, атеросклерозом перифе¬
рических и сонных артерий, аневризмой брюшного отдела аорты, а также СД 2-го
типа оптимальным признан уровень ХС-ЛПНП менее 2,6 ммоль/л. Для коррект¬
ной оценки атерогенных нарз^шений липидного обмена необходимо исследовать
комплекс показателей: триглицериды, холестерин общий, ХС-ЛПНП, ХС-ЛПВП -
с расчетом индекса атерогенности,КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ• Диагностика первичных нарушений липидного обмена• Диагностика вторичных нарушений липидного обмена.• Оценка риска атеросклероза и его осложнений.• Мониторинг коррекции атерогенных нарушений липидного обмена.Увеличение концентрации:• атеросклероз;• первичная гиперлипопротеидемия типов Па и ПЬ (семейная гиперхолестери-
немия, комбинированная семейная гиперхолестеринемия);• синдромы и заболевания, сопровождающиеся изменением метаболизма
ЛПНП, - гипотиреоз, нефротический синдром, хроническая почечная недо¬
статочность, холестаз, хронические заболевания печени, порфирия, сахар¬
ный диабет, синдром Кушинга, неврогенная анорексия.Уменьшение концентрации:• возможно при первичной гиперлипопротеидемии I типа (дефицит липопро-
теинлипазы, дефицит апоС-П), III типа;• заболевания, сопровождающиеся снижением ХС-ЛПНП, — хронические
анемии, синдром Рейно, некоторые заболевания печени, артрит, миелома,
системная красная волчанка (редко), гипотиреоз (редко).
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 215ВЛИЯЮЩИЕ ФАКТОРЫУвеличение концентрации: [5-адреноблокаторы, андрогены, прогестины, цикло¬
спорин, диуретики, глюкокортикоиды, богатая холестерином диета.Уменьшение концентрации: салицилаты, холестирамин^^ эстрогены, фибраты,
статинь[, интерферон, кетоконазол, никотиновая кислота, тироксин, богатая поли-
ненасыщенными жирными кислотами диета.Холестерин липопротеидов очень низкой плотностиЛипопротеиды очень низкой плотности (ЛПОНП) — сложные мицеллы, состоя¬
щие из фосфолипидов, специфических белков (апо-бежов), а также холестерина и
триглицеридов, преимущественно экзогенных. Основное место синтеза ЛПОНП —
печень, небольшое количество их поступает в плазму крови из кишечника. Основная
роль этих частиц — транспорт триглицеридов из печени в периферические ткани.
В крови ЛПОНП превращаются в ЛПНП в результате гидролиза триглицеридов под
действием липопротеинлипазы. Поскольку ЛПОНП участвуют в механизме образо¬
вания атеросклеротических бляшек, их относят к высокоатерогенным липопротеи-
дам. Гиперлипемия, обусловленная ЛПОНП, как и хиломикронами, придает плазме
мутность (хилез), но, в отличие от мутности, обусловленной хиломикронами, она не
отделяется в виде слоя при хранении плазмы в течение 12-18 ч при 4 "С.Метод исследования: в большинстве лабораторий не определяется. Расчетный
метод по формуле Фридвальда в настоящее время использовать не рекомендуют.Для количественного определения ЛПОНП используют электрофорез липопро¬
теидов.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ• Диагностика первичных нарушений липидного обмена (в комплексе с элек¬
трофоретическим анализом липопротеинов и другими исследованиями,
выполняемыми в специализированных лабораториях).• Оценка риска атеросклероза и его осложнений.• Мониторинг коррекции атерогенных нарушений липидного обмена.Увеличение концентрации:• первичные дислипопротеидемии ПІ, IV, V типа;• вторичные дислипопротеидемии, сопровождающиеся патологическими
состояниями, — ожирением, хронической почечной недостаточностью,
нефротическим синдромом, сахарным диабетом с кетоацидозом, гипоти¬
реозом, хроническим алкоголизмом, острым и хроническим панкреати¬
том, гипофизарной недостаточностью, болезнью Ниманна-Пика, системной
красной волчанкой, гликогенозами;• беременность (ПІ триместр, физиологически).ИНДИВИДУАЛЬНЫЕ БЕЛКИ
Альфа^-антитрипсинГлобулин, относящийся к группе ингибиторов сериновых протеиназ, на его
долю приходится более 80% антипротеазной активности сыворотки. Способен
инактивировать трипсин, химотрипсин, коллагеназу, плазмин, тромбин и лейко¬
цитарную эластазу. Относится к острофазным белкам.Материал (проба): сыворотка крови. Можно хранить при 4 °С 72 ч, при -20 °С —
до 3 мес, дольше — при -70 °С.Методы исследования: иммунотурбидиметрия, нефелометрия.Референтные пределы: 0,9-2,0 г/л (у детей до 3 лет — 0,8-2,0 г/л).
216 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯКЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕВыработка а^-антитрипсина при реакциях острой фазы повышается примерно
в 5 раз в течение 48 ч. Дефицит -антитрипсина обусловлен генетически и сопро¬
вождается гепатитом новорожденных, циррозом печени в раннем возрасте, забо-леваниями легких с развитием эмфиземы у молодых людей 20-30 лет.Увеличение содержания:• реакции острой фазы воспаления (острые инфекции и воспаления, травмы, в
том числе хирургические);• острый гепатит и цирроз печени;• активно прогрессирующие злокачественные опухоли, особенно с метастаза¬
ми в печень.Снижение содержания:• врожденный дефицит (продолжительная желтуха новорожденных, гепатит
неясной этиологии у новорожденных и детей дошкольного возраста, эмфи¬
зема легких у взрослых, хронический обструктивный бронхит);• нефротический синдром;• тяжелое поражение печени или поджелудочной железы;• гастроэнтеропатии с потерей белка.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания: последний триместр беременности, высокие концен¬
трации эстрогенов (прием эстрогенсодержащих контрацептивов), анаболические
стероиды.Альфа,-кислый гликопротеин (орозомукоид)Подавляет иммунореактивность, изменяет адгезивность тромбоцитов, связы¬
вает гормоны и лекарственные препараты, обладающие основными свойствами.
Белок острой фазы воспаления.Референтные пределы: 0,5-1,2 г/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика острых воспалительных состояний. Исследование в динамике
позволяет оценить течение воспалительного процесса, при оперативном лечении
опухолей — диагностировать рецидив. Вместе с гаптоглобином используют для
выявления гемолиза (повышение уровня орозомукоида при нормальном уровне
гаптоглобина указывает на реакцию острой фазы с умеренным гемолизом).
Увеличение содержания;• реакции острой фазы воспаления (бактериальные инфекции и воспаления,
травма, в том числе хирургическая, опухоли);• ревматоидный артрит;• системная красная волчанка;• болезнь Крона;• инфаркт миокарда.Снижение содержания:• тяжелые поражения печени;• гастроэнтеропатии с потерей белка;• нефротический синдром.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• возраст, мужской пол, физическая нагрузка;• менопауза;
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 217• ожирение, курение;• прием лекарственных препаратов — карбамазепина, противосудорожных
средств, андрогенов, глюкокортикоидов.Снижение содержания:• голодание;• беременность на ранних сроках;• ранний детский возраст;• прием леарственных препаратов — антимикробных средств, циклоспоринов,
пеницилламина, тамоксифена, оральных контрацептивов.Альфа^-макроглобулинИнгибитор, инактивирующий большинство протеаз, включая ферменты систе¬
мы свертывания крови, фибринолиза, калликреин плазмы и компоненты ком¬
племента. Является транспортным белком для некоторых ферментов, гормонов,
цинка. Ингибирует бласттрансформацию лимфоцитов.Референтные пределы: в сыворотке (плазме) крови — 1,3~3,0 г/л; у новорож¬
денных содержание почти в 2 раза выше, чем у взрослых, у женщин примерно на
20% выше, чем у мужчин.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕСнижение содержания в плазме крови обычно связано с повышенной протео-
литической активностью при панкреатитах, недостаточном питании и нарушении
синтетической способности печени. При гипоальбуминемии синтез а^-макро-
глобулина в печени компенсаторно повышается.Увеличение содержания:• в сыворотке крови:❖ нефротический шндром (повышение в сыворотке пропорционально поте¬
ре белка с мочой);острые и хронические гепатиты, цирроз печени;❖ сахарный диабет, наследственные сердечно-сосудистые заболевания;❖ ишемический инсульт, дефекты нервной трубки;❖ воспалительные заболевания, тяжелый острый панкреатит;• в моче:❖ постренальная протеинурия.Снижение содержания:• активный фибринолиз, ДВС-синдром;• острый панкреатит, камни в почках или желчевыводящих путях;• опухоли печени, инфаркт миокарда, болезни легких;• язва желудка или двенадцатиперстной кишки;• гастроэнтеропатии с потерей белка;• множественная миелома, ювенильный ревматоидный артрит.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• беременность, значительная физическая нагрузка;• прием лекарственных препаратов — эсгрогенов, пероральных контрацептивов.
Снижение содержания:• питание с низким содержанием белка.Антистрептолизин-ОАнтистрептолизиН“0 (АСЛ-0) представляет собой антитела к стрептолизину
(антигену р-гемолитического стрептококка группы А).
218 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯРеферентные пределы: младше 14 лет — менее 150 ЕД/мл; старше 14 лет ~
менее 200 ЕД/мл.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕЯвляется маркером стрептококковой инфекции в организме: его уровень повы¬
шается через 1 нед после инфекции, достигает пика через 3-5 нед и снижается
через 6-12 мес. Стойкое повышение уровня связано с развитием ревматизма.
Б период реконвалесценции показатель ниже, чем в острый период, поэтому
может использоваться для наблюдения за динамикой течения, оценки степени
активности ревматического процесса. Максимальную диагностическую и про¬
гностическую ценность имеет серийное исследование (с интервалом около 1 нед).
Используют при дифференциальной диагностике ревматизма с ревматоидным
артритом, при котором степень повышения АСЛ-0 значительно меньше. Титр
АСЛ-0 может быть повышен и у здоровых носителей стрептококка.Увеличение содержания:• ревматизм (уровень повышен у 85% пациентов с острой ревматической лихо¬
радкой);• заболевания стрептококковой этиологии (рожа, отиты, скарлатина, анги¬
на, хронический тонзиллит, пиодермия, остеомиелит) и связанные с ними
осложнения (ревматизм, гломерулонефрит, миокардит).АнтитромбинАнтитромбин (АТ) — гликопротеид, формирующий стабильное соединение с
сериновыми протеазами плазменного гемостаза. АТ — наиболее значимый ингиби¬
тор системы свертывания крови. Ингибирует тромбин и другие сериновые протеазы
плазменного звена гемокоагуляции: факторы 1Ха, Ха, Х1а, ХІІа и калликреин.Материал (проба): цитратная плазма. Стабильна при -25 “С до 2 нед.Методы исследования: иммунотурбидиметрия, нефелометрия, метод с хро¬
могенным субстратом.Референтные пределы: в плазме крови — 0,2-0,4 г/л (80-120%), у новорож¬
денных — наполовину меньше и достигает уровня взрослых к 6 мес.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕКонцентрация снижена при повышенном риске тромбообразования. Длительная
гепаринотерапия может приводить к снижению активности АТ в плазме крови, а
лечение высокими дозами гепарина, особенно нефракционированным (высо¬
комолекулярным) гепарином, — к транзиторному снижению АТ по механизму
потребления, особенно у больных с тяжелой патологией, в критических случаях,
при ДВС-синдроме, сепсисе, злокачественных опухолях. Снижение АТ до 50%
нормальных значений — фактор риска развития венозных тромбозов.Увеличение содержания:• реакция острой фазы воспаления (острые инфекции, воспаления, травмы,
опухоли);• острый гепатит, холестаз;• дефицит витамина К.Снижение содержания:• врожденный (наследственный) дефицит или аномалии АТ (повышение
свертываемости крови) при ДВС-синдроме, сепсисе, тромбозе глубоких вен,
легочной эмболии;• заболевания печени (опухоли, цирроз, алкогольный гепатит, хроническая
печеночная недостаточность);• нефротический синдром (протеинурия свыше 5 г/л).
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 219ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• прием лекарственных препаратов — анаболических стероидов, пероральных
(непрямых) антикоагулянтов;• менструация.Снижение содержания:• середина менструального цикла;• пред- и послеродовой период, токсикозы второй половины беременности;• послеоперационный период, множественные травмы;• пожилой возраст;• прием лекарственных препаратов — гепарина, аспарагиназы, эстрогенов,
пероральных контрацептивов, глюкокортикоидов,Аполипротеины А-1 и А-ИАполипротеины А-1 и А-П (апоА-1 и апоА-П) синтезируются в стенке кишеч¬
ника, откуда транспортируются в составе хиломикронов и накапливаются в
ЛПВП. Являются основными белковыми компонентами липопротеидов высокой
плотности. Активируют липазу и ингибируют лецитилхолинацетилтрансферазу.
Физиологическая роль апоА-1 — обратный транспорт холестерина из клеток в
печень.Референтные пределы в сыворотке крови: апоА-1 — 1,1-1,8 г/л; апоА-П —
0,1-0,5 г/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДля диагностики наследственных форм нарушений обмена липидов.
Увеличение содержания:• семейная гиперальфалипопротеинемия;• болезни печени.Снижение содержания:• гипоальфалипопротеинемия (различные формы);• триглицеридемия, повышенный риск развития атеросклероза;• холестаз;• нефротический синдром, хроническая почечная недостаточность;• декомпенсированный сахарный диабет;• сепсис.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания;• снижение массы тела, физическая нагрузка;• умеренное потребление алкоголя;• беременность;• прием лекарственных препаратов — карбамазепина, производных фиброе-
вой кислоты, статинов, эстрогенов, пероральных контрацептивов.Снижение содержания:• прием лекарственных препаратов — диуретиков, андрогенов, прогестинов,
Р - адреноблокаторов.Аполипопротеин вАполипопротеин в (апоВ) имеет две формы: апоВ-48, синтезирующийся в ЖКТ
и являющийся наиболее важным структурным белком ХМ, и апоВ-100, синтези¬
рующийся в печени, АпоВ-100 присутствует во всех атерогенных фракциях липо-
220БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯПротеинов: ЛПНП, ЛПОНП, ЛППП и липопротеине(а) — ЯП (а). Уровень апоВ,
измеренный иммунотурбидиметрическим методом, большей частью отражает
содержание апоВ-100 в частицах ЛПНП, лучше соответствует количеству частиц
ЛПНП в сыворотке, чем ХС-ЛПНП. Измерение апоВ ЛПНП имеет преимущества
перед измерением ХС-ЛПНП, что обусловлено постоянным содержанием белка
в частице ЛПНП, в то время как количество ХС может варьировать в широких
пределах.Референтные пределы: апоВ-100 — 0,8-1,5 г/л; апоВ-48 — менее 0,5 г/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДля выявления и характеристики различных типов гипер- и гиполипопротеи-
демии при ишемической болезни сердца, сахарном диабете, нарушениях функций
щитовидной железы, заболеваниях печени и др.Увеличение содержания:• семейная гиперхолестеринемия, гиперапобеталипопротеинемия;• гиперлипопротеидемия II, IV и V типа;• ишемическая болезнь сердца, нефротический синдром;• сахарный диабет, гипотиреоз;• заболевания печени, обтурация желчного протока;• синдром Иценко-Кушинга, порфирия;• хроническая почечная недостаточность.Снижение содержания:• абеталипопротеинемия, семейная гипобеталипопротеинемия;• гипертиреоз;• болезни печени;• синдром мальабсорбции;• хроническая анемия;• тяжелая гепатоцеллюлярная дисфункция;• воспалительные заболевания суставов;• миеломная болезнь.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• диета с повышенным содержанием насыщенных жиров;• беременность;• прием лекарственных препаратов — диуретиков, катехоламинов, андрогенов,
глюкокортикоидов, прогестинов, р-адреноблокаторов, циклоспоринов.Снижение содержания:• диета с повышенным содержанием полиненасыщенных жирных кислот и
низким содержанием холестерина;• менопауза;• потеря массы тела;• прием лекарственных препаратов — холестирамина**^, эстрогенов, произво¬
дных фиброевой кислоты, статинов, тироксина,ОТНОШЕНИЕ апоА-1/апоВАбсолютные значения уровней апоА-1 и апоВ в сыворотке (плазме) крови могут
варьировать в широких пределах, тогда как отношение апоА-1/апоВ является
величиной значительно более стабильной и может быть использовано как ранний
индикатор нарушений липидного обмена и риска атеросклероза.Рекомендуемое значение апоА-1/апоВ — более 1,1. Превышение коэффициента
связано со снижением риска развития сердечно-сосудистой патологии, сниже¬
ние — с увеличением риска.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 221Липопротеин(а)ЛП(а) — сложная молекула, имеющая структурное сходство с ЛПНП. Блокирует
связывание плазминогена со сгустком фибрина, подавляет фибринолиз, способ¬
ствует тромбообразованию.Референтные пределы; в сыворотке крови — менее 0,3 г/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕНезависимый фактор риска сердечно-сосудистых заболеваний. Используется
для выявления наследственных нарушений, повышенного риска заболеваний
сердечно-сосудистой системы, атеросклероза, решения вопроса о назначении
гиполипидемической терапии.Увеличение содержания:• наследственное повышение;• нефротический синдром, уремия (у больных, находящихся на гемодиализе);• нелеченый и плохо контролируемый сахарный диабет;• тяжелый гипотиреоз;• реакция острой фазы, острая фаза инфаркта миокарда;• повышенный риск сердечно-сосудистых заболеваний;• ранняя патология коронарных и мозговых сосудов.Снижение содержания:• наследственное снижение, первичный билиарный цирроз;• гипертиреоз, гипертриглицеридемия.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• дефицит инсулина, свободного тироксина.Снижение содержания:
прием лека
эстрогенов.Гаптоглобиншжение содержания:прием лекарственных препаратов — неомицина, анаболических стероидов,
эстрогенов.Основная функция гаптоглобина — связывание свободного гемоглобина при
внутрисосудистом гемолизе, что предохраняет организм от потери железа. Он
выполняет защитную функцию, образуя комплексы с белками, освобождающими¬
ся при распаде клеток, является ингибитором катепсинов, транспортирует вита¬
мин Комплекс «гемоглобин-гаптоглобин» обладает высокой пероксидазной
активностью, тормозит перекисное окисление липидов, в острой фазе воспаления
концентрация гаптоглобина в сыворотке повышается до 3 раз в течение 48 ч.Референтные пределы: в сыворотке — 0,3-2,0 г/л. У новорожденных может
быть значительно ниже, увеличивается в течение первых пяти дней жизни в 3 раза
по сравнению с моментом рождения.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕОпределение гаптоглобина используют при диагностике анемий, для диффе¬
ренциальной диагностики повышенного гемолиза (уровень гаптоглобина снижен)
с неэффективным эритропоэзом (уровень гаптоглобина нормальный). При интер¬
претации следует учитывать результаты измерения концентрации реактантов
острой фазы. Уровень гаптоглобина повышается при воспалительных и некробио-
тических процессах, отражая степень деструкции соединительной ткани (коллаге-
нозах, ревматизме, сепсисе, остром инфаркте миокарда, пневмониях, опухолях).Увеличение содержания:• реакции острой фазы (воспаление, инфекции, злокачественные опухоли);
222 биохимические исследования• коллагенозы, холестаз, аутоиммунные заболевания;• болезнь Ходжкина (лимфогранулематоз).Снижение содержания (<0,25 г/л):• все виды внутрисосудистого гемолиза;• врожденный дефицит антитромбина;• хронические заболевания печени, цирроз;• инфекционный мононуклеоз, токсоплазмоз;• синдром мальабсорбции;• злокачественные новообразования (рак молочной железы, ЖКТ, легкого,
гениталий).ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• менопауза;• прием лекарственных препаратов — глюкокортикоидов, противосудорожных
средств, анаболических стероидов.Снижение содержания:• беременность;• прием лекарственных препаратов — декстранов, индометацина, аминопи-
рина^, аминосалициловой кислоты, метилдопы, тамоксифена, эстрогенов,
пероральных контрацептивов, сульфаниламидов.Глобулин, связывающий половые гормоныГлобулин, связывающий половые гормоны (ГСПГ), участвует в связывании и
транспорте половых гормонов (например, тестостерон и 5-дигидротестостерон с
высоким сродством, эстрадиол несколько слабее). Защищает тестостерон и эстра-
диол от метаболической инактивации во время их транспорта от места секреции к
органу-мишени.Референтные пределы в сыворотке крови (старше 14 лет): женщины (до
50 лет) — 20-120 нмоль/л, мужчины — 13-71 нмоль/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕУровень синтеза ГСПГ в печени зависит от половых гормонов: эстрогены уве¬
личивают, а андрогены снижают его продукцию. Сниженние уровня ГСПГ быва¬
ет при гирсутизме, угрях обыкновенных и синдроме поликистозных яичников,
уровень ГСПГ на поздних стадиях беременности или после введения эстрогенов
увеличен. После 60 лет содержание ГСПГ возрастает примерно на 1,2% в год.
Увеличение содержания:• гиперэстрогенемия, гипертиреоидное состояние;• цирроз печени;• хронический простатит, нарушение потенции.Снижение содержания:• гиперандрогенизм, гипотиреоз, гирс}тизм, гиперпролактинемия;• ожирение;• синдром поликистозных яичников, аменорея, ановуляция;• акромегалия, синдром Кушинга.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• беременность;• пожилой возраст;• прием лекарственных препаратов — фенитоина, эстрогенсодержащих ораль¬
ных контрацептивов.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 223Снижение содержания:• прием лекарственных препаратов — даназола, соматотропного гормона,
тироксина, андрогенов, глюкокортикоидов, антиэпилептических средств.Иммуноглобулин АИммуноглобулин А (IgA) составляет 10-15% общего количества иммуноглобу¬
линов сыворотки крови. Представлен двумя формами — сывороточной и секретор¬
ной. Сывороточные IgA вызывают активацию комплемента по альтернативному
пути, а также обеспечивают специфическое связывание некоторых антигенов.
Секреторные IgA содержатся в продуктах внешней секреции (слезной жидкости,
слюне, поте, желчи, слизи бронхиального и кишечного эпителия, влагалище,
сперме), обеспечивая антибактериальную и антивирусную защиту поверхностей.
Секреторные IgA, продуцируемые В-клетками, внутри слизистого слоя селективно
связываются с бактериями и предупреждают их адгезию к стенке, что обеспечи¬
вает защиту организма от проникновения BHjnrpb бактерий. Присутствие IgA в
грудном молоке защищает новорожденных от кишечной инфекции.
Референтные пределы представлены в табл. 4-21.Таблица 4-21. Референтные пределы иммуноглобулина А в сыворотке (плазме) кровиВозрастг/л1-3 мес0,054),54-6 мес0,08-0,87-12 мес0,3-1,42 года0,3-1,23-5 лет0,4-1,86-13 лет0,6-2,3Взрослые0,7-4.0КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕМаркер активации гуморального иммунитета. У пожилых пациентов более
информативен, чем IgM, при первичной инфекции. Используют в диагностике
возвратных инфекций, особенно желудочно-кишечного тракта и органов дыхания.
В секретах определяют для оценки местного иммунитета.Увеличение содержания:• хронические заболевания печени (поздняя стадия гепатита, цирроз);• хронические инфекции, саркоидоз;• аутоиммунные заболевания (ревматоидный артрит, СКВ);• IgA-миелома;• синдром Вискотта-Олдрич а;• муковисцидоз;• болезни органов дыхания.Снижение содержания:• врожденные и приобретенные иммунодефициты (агаммаглобулинемия, атак¬
сия);• телеангиоэктазия;• не-IgA-миелома;• гастроэнтеропатии с потерей белка;• потеря белка через кожу при ожогах.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• возраст, мужской пол;
224БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ• уровень билирубина;• прием лекарственных препаратов ~ метилдопы, оксифеназитина^.Снижение содержания:• курение:• прием лекарственных препаратов — каптоприла, пеницилламина, декстрана,
карбамазепина, циклоспорина, глюкокортикоидов, левотироксина, ловаста-
тина, оральных контрацептивов, эстрогенов.Иммуноглобулин DИммуноглобулин D (IgD) присутствует в сыворотке (плазме) крови в низких кон¬
центрациях (около 1% всех иммуноглобулинов). IgD образуются в В-лимфоцитах
и остаются прикрепленными к их поверхности. Преобладающий иммуноглобулин
на поверхности развивающихся В-клеток. Возможно, действует как рецептор,
запускающий процесс роста и развития В-лимфоцитов. Считается, что к классу
IgD принадлежат аутоиммунные противоядерные антитела, а также антитела к
инсулину и пенициллину.Референтные пределы: в сыворотке (плазме) крови — менее 0,15 г/л.Увеличение содержания:• аутоиммунные заболевания;• хронические инфекции;• некоторые заболевания печени;• IgD-миелома.Снижение содержания:• наследственные и приобретенные иммунодефицитные состояния;• не-IgD-миелома;• злокачественная меланома кожи.Иммуноглобулин ЕИммуноглобулин Е (IgE) — минорный класс иммуноглобулинов (около 0,2%
всех сывороточных иммуноглобулинов). Накапливается преимущественно в коже
и слизистых оболочках, где сорбируется за счет Fc-рецепторов на поверхности
тучных клеток, базофилов и эозинофилов. в результате присоединения специфи¬
ческого антигена происходят дегрануляция этих клеток и выброс биологически
активных веществ (медиаторов воспаления), что приводит к клиническим про¬
явлениям аллергии.Референтные пределы в сыворотке (плазме) крови; менее 03 мг/л (<100 МЕ/мл).КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕОпределение общего и специфических IgE используют в диагностике аллергии.Увеличение содержания:• атопические аллергические заболевания (бронхиальная астма, ринит, кра¬
пивница, экзематозный дерматит, атопический дерматит);• паразитарные инвазии (аскариды, токсоплазма, нематоды, шистосомы, анки¬
лостомы, эхинококки, трихинеллы);• болезнь Ходжкина (лимфогранулематоз);• системные лейкозы;• IgE-миелома (очень редкое заболевание).Снижение содержания:• наследственные и приобретенные дефициты;• первичный билиарный цирроз;
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 225 яязвенный колит;
атаксия, телеангиоэктазия;
He-IgE-миблома.Иммуноглобулин GИммуноглобулин G (IgG) составляет около 75% всех иммуноглобулинов в сыво¬
ротке крови человека. Главный опсонизирующий Ig для нейтрофилов и моноцитов.
Fc-рецепторы этих клеток присоединяют в первую очередь IgGj, в меньшей степе¬
ни — IgGj. Иммуноглобулины IgG^ IgG^ и IgG^ осуществляют активацию компле¬
мента по классическому пути, что обусловливает их важнейшую роль в образовании
иммунных комплексов и нейтрализации токсинов. IgG — единственные иммуногло¬
булины, проникающие через плацентарный барьер из крови матери в кровь плода
(активный транспорт), обеспечивая защиту новорожденных от инфекции.
Референтные пределы представлены в табл. 4-22.Таблица 4-22. Референтные пределы иммуноглобулина G в сыворотке (плазме) кровиВозрастг/дНоворожденные7.0-16,01-3 мес2,5-7,54-6 мес1,8-8,07-12 мес3-102 года3,5-10,03-5 лет5-136-13 лет6-14Взрослые7-16КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕЧаще всего используют в диагностике и мониторинге острых и хронических
инфекционных заболеваний, оценке эффективности вакцинации.Увеличение содержания:• хронические инфекции (туберкулез, инфекционный мононуклеоз, бактери¬
альный эндокардит, лепра и др.);• аутоиммунные заболевания (системная красная волчанка, ревматоидный
артрит, синдром Шегрена), саркоидоз;• IgG миелома (самая частая форма множественной миеломы);• коллагенозы, хронические заболевания печени, в том числе цирроз;• паразитарные болезни.Снижение содержания:• наследственный и приобретенный дефицит;• синдромы с потерей белка;• He-IgG-миелома;• макроглобулинемия Вальденстрема.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• возраст, физическая нагрузка (мышечная работа);• гипербилирубинемия;• прием лекарственных препаратов — метилдопы, оксифеназитина^, наркоти¬
ческих препаратов.Снижение содержания:• беременность, хирургические операции;
226 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ• курение;• прием лекарственных препаратов — циклоспорина, декстрана, ловастатина,
глюкокортикоидов.Иммуноглобулин МИммуноглобулин М (IgM) составляет 5-10% общего количества иммуноглобу¬
линов сыворотки крови. Синтезируется при первичном иммунном ответе: в начале
ответа появляются антитела класса IgM. Способен к активации комплемента, в
связи с чем служит посредником в цитотоксических реакциях. К IgM принадле¬
жат антимикробные антитела, антитела к системе гр)тіп крови АВО, холодовые
аутоиммунные противоэритроцитарные антитела, ревматоидные факторы и др.
IgM имеет большое значение в возникновении и поддержании аутоиммунных
заболеваний.Референтные пределы представлены в табл. 4-23.Таблица 4-23. Референтные пределы иммуноглобулина М в сыворотке (плазме) кровивозрастг/яНоворожденные0,1-0,31-3 мвс0,1-0,74-6 мес0,2-1,07-12 мес0,3-1,02 года0,4-1.43-5 лет0.4-1.86-13 лет0.4-1,6Взрослые0,4-2,3КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕIgM чаще всего используют в диагностике острых инфекционных заболеваний
(в том числе и в скрининговых исследованиях) и обострения хронических.
Увеличение содержания:• острые и хронические инфекции (особенно вирусные);• паразитарные инвазии (трипаносомия, токсоплазмоз);• болезни печени, нефротический синдром;• аутоиммунные заболевания, макроглобулинемия Вальденстрема;• гипep-IgM-диcгaммaглoбyлинeмия.Снижение содержания:• наследственный и приобретенный дефицит;• синдромы с потерей белка у детей;• He-IgM-миелома.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• физическая нагрузка (мышечная работа), беременность, эстрогены;• гипербилирубинемия.Снижение содержания;• менопауза;• курение;• прием лекарственных препаратов — декстрана, глюкокортикоидов, ловастати-
на, оральных контрацептивов, метилдопы, наркотических препаратов.
БИОХИМИЧЕСКИЕ ИССЛЕДОвАНИЯ 227Комплемент СЗЦентральный компонент системы комплемента. Синтезируется в печени,
макрофагах-моноцитах, фибробластах. Синтез ускоряется в острой фазе воспа¬
ления (активатор — интерлейкин-6), распад — при болезнях с формированием
иммунных комплексов по альтернативному пути активации комплемента. Уровень
в сыворотке может быстро падать при ожогах или потере белка (энтеропатия).
Основная функция — активация системы комплемента через классический и аль¬
тернативный пути, а также опсонизация и хемотаксис.Материал (проба): сыворотка крови. Определение при использовании имму-
нохимических методов лучше проводить не ранее чем через 1 ч инкубаций при
37 “С, когда все молекулы СЗ будут трансформированы в СЗс.Методы исследования: иммунотурбидиметрия, иммуноферментный.
Референтные пределы: в сыворотке крови — 0,9-1,8 г/л, у детей не старше
3 мес — 0,6-1,5 г/л,КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕБелок острой фазы, содержание которого в крови повышается при инфекциях,
хронических неинфекционных заболеваниях. Применяют при подозрении на
врожденный дефект комплемента (рецидивирующие инфекции, ангионевротиче-
ский отек или болезнь Квинке, аутоиммунные заболевания), для диагностики и
мониторинга болезней иммунных комплексов.Увеличение содержания:• реакции острой фазы (острое воспаление, травмы, инфекции, опухоли);• холестаз;• амилоидоз;• нефротический синдром.Снижение содержания:• врожденный дефицит;• снижение синтеза (мембранопролиферативный гломерулонефрит, тяжелый
белковый дефицит);• повышенный катаболизм (мембранопролиферативный гломерулонефрит,
системная красная волчанка, синдром Шегрена, ревматоидный артрит,
серповидноклеточная анемия, аутоиммунная гемолитическая анемия, гра-
мотрицательная бактериемия, респираторный дистресс-синдром новорож¬
денных);• потеря при гастроэнтеропатиях, ожогах и др.;• воспалительные и инфекционные заболевания, в том числе бактериальный
эндокардит, паразитарные инвазии, инфицирование грибами;• болезнь иммунных комплексов;• тяжелые хронические заболевания печени.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• беременность;• менопауза;• прием лекарственных препаратов — циклофосфамида, циметидина^, перо-
ральных контрацептивов, глюкокортикоидов.Снижение содержания:• роды;• недостаточное питание;• прием лекарственных препаратов — даназола, гидралазина, фенитоина,
метилдопы.
228 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯКомплемент С4Компонент классического пути активации комплемента. Основное место синте¬
за — печень.Референтные пределы: в плазме крови взрослых — 1-0,4 г/л, детей не более3 мес — 0,07-0,3 г/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕОпределение С4 важно для диагностики иммунокомплексных заболеваний,
сопровождающихся адсорбированием С4 на иммунных комплексах и снижением
его концентрации в крови.Увеличение содержания:• реакции острой фазы (острое воспаление, травмы, инфекции, опухоли).Снижение содержания:• врожденный дефицит;• болезнь иммунных комплексов;• тяжелые хронические заболевания печени;• гломерулонефрит;• злокачественные новообразования;• бактериальный эндокардит;• системная красная волчанка;• смешанная криоглобулинемия.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• беременность;• прием эстрогенов.Снижение содержания:• менопауза;• хирургические операции;• роды;• прием лекарственных препаратов — декстрана, пеницилламина, метилдопы,
цитостатиков, иммунодепрессантов.ЛептинЛептин — белок, вырабатываемый адипоцитами жировой ткани, играет ключе¬
вую роль в регулировании массы тела, влияя на активность энергетического мета¬
болизма и чувство сытости, в гипоталамусе взаимодействие лептина с рецептором
приводит к чувству насыщения и отказа от пищи. Снижение запасов жировой
ткани приводит к уменьшению секреции лептина, что дает сигнал мозгу противо¬
действовать потере жиров и способствует возникновению чувства голода. Уровень
лептина повышается с увеличением жировой ткани. Ожирение связано со сниже¬
нием чувствительности тканей к лептину.Лептин регулирует нейроэндокринную функцию гипоталамуса, повышая расход
энергии за счет увеличения метаболизма глюкозы, липидов и снижения потре¬
бления пищи. Уровень лептина в крови коррелирует с количеством и размерами
адипоцитов жировой ткани.Материал (проба): сыворотка (плазма) крови. До исследования можно хра¬
нить при 2-8 °С 24 ч, при -16 °С - 3 мес, при -40 °С - год. Нельзя использовать
гемолизированные образцы.Метод исследования: иммунохимический.Референтные пределы: для иммуноферментного метода — до 5-10 нг/мл.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 229КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕЛептин способствует уменьшению аппетита» снижению потребления пищи.
В печени тормозит действие инсулина на глюконеогенез и гликогенолиз.
В мышечной ткани увеличивает захват глюкозы и синтез гликогена. Повышает
скорость липолиза, усиливает окисление СЖК в жировой ткани. Усиливает тер¬
могенез.Увеличение содержания:• ожирение;• сахарный диабет;• лептинорезистентность;• аномалии гена-рецептора, нарушение передачи пострецепторного сигнала
лептина;• метаболический синдром;• инсулинорезистентность.Снижение содержания;• голодание.МиоглобинБелок, содержащийся в клетках скелетных мышц и миокарда. Обеспечивает
депонирование кислорода и облегчает его транспорт к митохондриям, где проис¬
ходит окислительное фосфорилирование.Референтные пределы: в сыворотке крови у женщин старше 14 лет —
12-76 мкг/л, у мужчин старше 14 лет — 19-92 мкг/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕПри диагностике заболеваний сердца и скелетных мышц (некроза, травмы,
ишемии). Поступает в кровь при любом повреждении, некрозе, лизисе ткани
скелетной мускулатуры или миокарда. Степень гипермиоглобинемии зависит
от размеров очага некроза. Один из самых ранних маркеров инфаркта миокарда
(обнаруживают уже через 2 ч после приступа; увеличение концентрации может
быть 10-кратным). Применяют для ранней диагностики, мониторинга и про¬
гнозирования течения заболевания. Поскольку не является специфическим мар¬
кером инфаркта миокарда, диагноз следует подтверждать более специфичными
для поражения сердечной мышцы маркерами. Поскольку миоглобин выводится
в неизмененном виде с мочой, его концентрация в крови зависит от функций
почек.Увеличение содержания:• инфаркт миокарда;• заболевания скелетных мышц (миозиты, миодистрофия, рабдомиолиз), а
также некроз, ишемия, травма, судороги;• почечная недостаточность, уремия:• ожоги.Снижение содержания:• наличие циркулир>тощих антител к миоглобину (при полиомиелите);• ревматоидный артрит.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• физическая нагрузка;• применение лекарственных препаратов — ацетилхолина, сукцинилхолина*’
(при внутривенном введении, особенно у детей).
230 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯМозговой натрийуретический пептидМозговой натрийуретический пептид (BNP) — гормон пептидной природы,
синтезируемый миоцитами желудочков сердца и нейронами головного мозга. BNP
ингибирует ренин-ангиотензин-альдостероновую систему, способствует усилен¬
ной экскреции натрия и дилатации периферических сосудов. В плазме крови BNP
находится в виде нескольких форм прогормонов (proBNP), имеющих различные
свойства и биологическую активность, при их расщеплении образуются пептиды,
в том числе собственно BNP и терминальная часть (Nt-proBNP).Материал (проба): сыворотка (плазма) крови. Кровь сразу после взятия необхо¬
димо поместить на лед и центрифугировать не позднее чем через час. Хранить сыво¬
ротку (плазму) можно при -20 °С. Не следует использовать липемичные образцы.Метод исследования: иммунохимический.Референтные пределы зависят от метода определения. Для иммунофермент-
ного метода — менее 350 фмоль/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕСекреция BNP увеличивается при повышении напряжения миокарда, увеличе¬
нии давления в левом желудочке сердца и механическом растяжении предсердий.
Именно поэтому его уровень в плазме крови коррелирует с функциональным клас¬
сом сердечной недостаточности, показателями систолической и диастолической
функции миокарда. Измерение содержания BNP в плазме крови эффективно для
оценки лечения пациентов с сердечно-сосудистыми заболеваниями и прогноза у
пациентов с острым коронарным синдромом, сердечной недостаточностью (его
уровень увеличивается пропорционально угрозе остановке сердца) и пороками
клапанов сердца.У больных с сердечно-сосудистыми заболеваниями повышение уровня BNP
является независимым фактором риска развития тяжелых осложнений (острого
инфаркта миокарда, инсульта) и смертности.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• почечная недостаточность;• заболевания печени;• различные формы вторичной гипертонии.ОстеокальцинОстеокальцин (ОК) — чувствительный и неинвазивный маркер обмена в кости.
Неколлагеновый белок матрикса кости, синтезируется остеобластами и одонто-
бластами. Концентрация остеокальцина в крови отражает метаболическую актив¬
ность остеобластов костной ткани, поскольку изменяется в результате нового
синтеза, а не освобождения при резорбции кости. Предполагается участие остео¬
кальцина и в регуляции процесса резорбции.Методы исследования: иммунохемилюминесценция, иммуноферментный.Материал (проба); гепаринизированная плазма, заморозить немедленно.
Стабильна при -20 °С до 14 мес.Референтные пределы; женщины до менопаузы — 4,4-17 мкг/л, после мено¬
паузы — 3,6-28 мкг/л; мужчины — 2,7-25,0 мкг/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДля диагностики нарушений метаболизма костной ткани (целесообразно опре¬
делять в комплексе с деоксипиридинолином мочи — продуктом распада коллагена
кости и показателем костной резорбции), гиперкальциемического синдрома, а
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 231также при мониторинге заболеваний костной ткани и оценке эффективности
лечения, при выраженном снижении клубочковой фильтрации уровень остео¬
кальцина в крови может быть завышенным. При наличии в кровотоке фрагментов
остеокальцина, образующихся при частичном его разрушении в сосудистом русле
под воздействием циркулирующих протеаз либо из-за его разрушения в процессе
резорбции кости, также могут быть получены завышенные значения.Увеличение содержания:• болезнь Педжета:• почечная недостаточность, остеодистрофия;• первичный и вторичный гиперпаратиреоидизм, гипертиреоз, акромегалия;• несовершенный остеогенез, переломы костей, метастазы в кости;• остеопороз.Снижение содержания:• гипотиреоз, гипопаратиреоз;• гиперкортицизм (болезнь и синдром Иценко-Кушинга);• болезни печени (первичный билиарный цирроз);• дефицит соматотропина;• рахит.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• быстрый рост у подростков:• гипертиреоз;• прием лекарственных препаратов - 25-дигидроксивитамина D*’, гормона
роста, соматомедина С^, дилантина*'.Снижение содержания:• беременность;• прием лекарственных препаратов — глюкокортикоидов, кальцитонина.Преальбумин (транстиретин)Транспортный белок тироксина, В комплексе с ретинолсвязывающим белком
транспортирует витамин А (ретинол). Синтез происходит в гепатоцитах и стиму¬
лируется глюкокортикоидами.Референтные пределы: в сыворотке крови у детей не старше 4 лет — 0,1-
0,2 г/л, старше 4 лет — 0,2-0,4 г/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕПоказатель нарушения синтетической функции печени, очень чувствительный
негативный острофазовый реактант (снижается до 20% средних величин).
Увеличение содержания:• в сыворотке крови:❖ болезнь Ходжкина;❖ гиперфункция надпочечников (избыток эндогенных стероидов);❖ хроническая почечная недостаточность;❖ алкоголизм (без поражения клеток печени);• в моче:❖ клубочковая и канальцевая протеинурия.Снижение содержания:• в сыворотке крови;❖ недостаток питания, в частности дефицит аминокислот;❖ реакция острой фазы, нефротический синдром, болезни печени;• вликворе:❖ спинальная обструкция.
232 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания в сыворотке крови:• прием лекарственных препаратов — анаболических стероидов, андрогенов,
глюкокортикоидов, нестероидных противовоспалительных препаратов.Снижение содержания в сыворотке крови:• повышенный уровень эстрогенов.ПрокальцитонинПрокальцитонин (РСТ) является предшественником гормона кальцитонина,
поддерживающего nocTOHHHjro концентрацию кальция в крови. У здоровых людей
за счет протеолиза из прокальцитонина в клетках щитовидной железы образуется
гормон кальцитонин.Материал (проба): сыворотка крови. До исследования можно хранить при
+4 "С 72 ч, при -20 ''С — до 3 мес, дольше — при -70 “С.Метод исследования: иммунохимический.Референтные пределы: для иммуноферментного метода - менее 0,5 нг/мл.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕПри тяжелых инфекционных заболеваниях уровень прокальцитонина в плазме
резко возрастает. Системный воспалительный ответ приводит к синтезу прокаль¬
цитонина в макрофагах и моноцитарных клетках различных органов. Уровень
прокальцитонина в плазме крови при системном воспалительном ответе повыша¬
ется раньше, чем других белков острой фазы.Увеличение содержания:• тяжелые инфекции, вызванные бактериями, грибами, паразитами (РСТ —
2-10 нг/мл);• синдром полиорганной недостаточности (РСТ — 2-10 нг/мл);• сепсис, шок (РСТ >10 нг/м);• обширные хирзфгические вмешательства, тяжелые множественные травмы;• хроническая сердечная недостаточность.Ревматоидный факторРевматоидный фактор (РФ) — аутоантитела, относящиеся ко всем классам
иммуноглобулинов (до 90% — IgM), направленные против Fc-фрагмента соб¬
ственных иммуноглобулинов G. Опасны способностью поражать синовиальные
оболочки суставов и стенки сосудов.Материал (проба): сыворотка крови, взятая натощак. Может храниться при
+4 “С 72 ч, при -20 “С - до 6 мес, дольше - при -70 ‘’С.Методы исследования: иммунотурбидиметрия, иммуноферментный.Референтные пределы: менее 15 МЕ/мл.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДля определения активности процесса, мониторинга, прогноза и контроля
эффективности лечения ревматических, других аутоиммунных и хронических вос¬
палительных заболеваний. В зависимости от наличия РФ выделяют серопозитив¬
ную и серонегативную формы ревматоидного артрита. Высокие концентрации РФ
связаны с развитием системных (внесуставных) поражений соединительной ткани
и высокой активностью деструктивных процессов, у детей с ювенильным ревма¬
тоидным артритом ревматоидный фактор часто отрицателен. Считается важным
прогностическим признаком исхода ревматоидного артрита.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 233Увеличение содержания:• ревматоидный артрит, синдром Шегрена, системная красная волчанка;• склеродермия, криоглобулинемия, дерматомиозит, саркоидоз;• бактериальные и вирусные инфекции;• первичный билиарный цирроз; ^• хронические воспалительные заболевания — подострый бактериальный
эндокардит, сифилис, туберкулез, малярия, хронический активный гепатит,
инфекционный мононуклеоз (обычно уровень РФ ниже, чем при ревматоид¬
ном артрите);• злокачественные опухоли.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания; пожилой возраст.С-реактивный белокС-реактивный белок (СРБ) - компонент иммунного ответа. Может связывать не
только полисахариды, присутствующие на поверхности бактерий, грибов и пара¬
зитов, но и полианионы, поликатионы, нуклеиновые кислоты. Присоединенный
к мембранам микроорганизмов и поврежденным клеткам, СРБ активирует каскад
комплемента, способствует фагоцитозу. Способен активировать тромбоциты.
Важными функциями являются распознавание потенциально токсичных веществ,
образующихся при распаде собственных клеток организма, связывание их, деток¬
сикация и удалении из крови.Материал (проба): сыворотка крови. Может храниться при +4 °С 72 ч,
при -20 ®С — до 6 мес, дольше - при -70 °С,Методы исследования; радиальная иммунодиффузия, иммунотурбидиметрия,
нефелометрия, латексная агглютинация, иммуноферментный.Референтные пределы: в сыворотке крови — 0,06-5,0 мг/л. В первые пять
дней жизни СРБ — менее 10 мг/л. После 5-го дня — менее 5 мг/л, как у взрослых.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕГлавный белок острой фазы (уровень СРБ повышается в течение 6-10 ч после
заболевания, травмы, хирургического вмешательства). Применяют для оценки
активности воспалительных процессов, наблюдения за их динамикой, дифферен¬
циальной диагностики бактериальных и вирусных инфекций, выбора адекватного
лечения и контроля за его эффективностью. После травмы или операции при
отсутствии осложнений концентрация СРБ возвращается к норме в следующие
5-7 сут. Плохой прогноз, если СРБ более 200 мг/л более 10 сут или через 7-10 сут
происходит только незначительное его снижение. Заметное увеличение СРБ
типично за 1-2 сут до летального исхода.Увеличение содержания:• 10-40 мг/л — вирусные и умеренные бактериальные инфекции;• 40-200 мг/л — острое воспаление и бактериальные инфекции федней тяже¬
сти, после травмы или хирургического вмешательства;• 300-700 мг/л — тяжелые травмы, ожоги, сепсис;• персистенция СРБ указывает на сохраняющийся в организме воспалитель¬
ный процесс, неадекватное лечение, плохой прогноз незначительное,
в пределах нормальных значений (до 5 мг/л) увеличение концентрации
(табл, 4-24).
234 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯТаблица 4-24. Оценка активности воспалительных процессов по уровню С-реактивного белкаСРВ -10-50 МГ/ЛСРБ >50 мгУлМестные бактериальные инфекции.Инфаркт миокарда (максимум пош 2 сут).Вирусные инфекции.Хронические инфекции (туберкулез, сифилис).
Саркоидоз.Ревматоидный артрит.Псориатический артрит, подагра.Заболевания соединительной ткани, такие как СКВ. дер¬
матомиозит.Язвенный колит.Внутриутробная инфекц^іяТяжелые бактериальные, в том числе после¬
операционные, инфекции (сепсис, пневмония,
пиелонефрит).Активный ревматоидный артрит.Крайне активный серонегативный спондило¬
артрит.Системные васкулиты.Активная болезнь Крона.Тромбоз ГЛубОК!4Х ВЄН.Острый панкреатит.Метастазирующие некротизирующие опухолиВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• возраст, физическая нагрузка, подъем по лестнице;• курение (может достигать 25 мг/л);• беременность;• повышенный уровень эстрогенов.БАЗОВЫЙ УРОВЕНЬ С-РЕАКТИВНОГО БЕЛКАБазовый уровень С-реактивного белка (hs-СРБ) — концентрация СРБ, которая
стабильно выявляется у практически здоровых людей или у пациентов при отсут¬
ствии острого воспалительного процесса либо вне обострения заболевания.Материал (проба); сыворотка крови. Может храниться при 4 '"С 72 ч, при
-20 °С — до 6 мес, дольше — при -70 "*С.Методы исследования: иммунотурбидиметрия с усилением латексом, нефело¬
метрия, иммуноферментный.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕУровень hs-CPB 3-10 мг/л ^ признак вялотекущего воспалительного про¬
цесса, связан с высоким риском сердечно-сосудистых заболеваний и их ослож¬
нений (инфаркта миокарда, мозгового инсульта), а также риском внезапной
сердечной смерти у людей, не страдающих сердечно-сосудистыми заболеваниями.
Применяют для вьщеления пациентов, нуждающихся в профилактическом лече¬
нии, для оценки эффективности профилактики сердечно-сосудистых заболеваний
и их осложнений: при отказе от курения, регулярной физической нагрузке, лече¬
нии ожирения базовый уровень СРБ снижается. Определение hs-СРБ может сти¬
мулировать пациента к изменению образа жизни, отказу от вредных привычек.
Увеличение содержания:• повышенный риск развития сердечно-сосудистых заболеваний у практически
здоровых взрослых людей;• у больных с ИБС повышенный риск ранних и отсроченных осложнений
после коронарного шунтирования, высокий риск последующего рестеноза;• у больных с нестабильной стенокардией и острым инфарктом миокарда риск
летальности:❖ hs-CPB менее 1 мг/л — низкий;
hs-СРБ 1-3 мг/л — средний;❖ hs-CPB >3 мг/л — высокий;<>■ более информативно сочетанное определение hs-СРБ и уровня тролони-
на Т:- hs-CPB более 1,.55 мг/л, тропонин Т более 0,1 мкг/л — максимальный риск;- hs-СРБ менее 1,55 мг/л, тропонин Т менее ОД мкг/л — минимальный риск;
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 235• артериальная гипертензия;• хроническая инфекция;• хронические воспалительные заболевания {системные ревматические);• метаболический синдром;• сахарный диабет.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• ожирение, понижение уровня ЛПВП, повышение уровня триглицеридов;• курение.Снижение содержания:• снижение массы тела;• прием лекарственных препаратов — аспирина*, производных никотиновой
кислоты, статинов, фибратов.ТрансферринМеталл связывающий транспортный белок плазмы крови, основной перенос¬
чик железа к клеткам. Связывание с трансферрином предупреждает токсический
эффект железа. Каждая молекула трансферрина может связать максимум два иона
Fe^*, что эквивалентно 1,4 мг железа на 1 г трансферрина. В качестве сопутствую¬
щего аниона обычно связывается бикарбонат.Референтные пределы; концентрация в сыворотке крови. Менее 7 дней —
1,3-3,6 г/л; более 1 года — 2,0-3,6 г/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕВыявление функционального (скрытого) дефицита железа и перегрузки орга¬
низма железом. Дифференциальная диагностика, мониторинг лечения железоде¬
фицитной анемии. У пациентов с уремией и находящихся на гемодиализе транс¬
феррин непригоден для определения недостатка железа.Увеличение содержания:• железодефицитная анемия.Снижение содержания:• реакции острой фазы (снижается в первые 17-48 ч);• расстройства синтеза гемоглобина;• неэффективный эритропоэз (талассемия, мегалобластные анемии, анемии
при хронических инфекциях);• гемохроматоз;• болезни печени;• недоедание;• потеря белка при гастроэнтеропатиях, нефротическом синдроме;• нарушения синтеза белка;• анемия при хронических инфекциях;• опухоли.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• физическая нагрузка;• беременность;• высокие концентрации эстрогенов;• прием лекарственных препаратов — карбамазепина, даназола, месгранола, перо-
ральных контрацептивов.Снижение содержания:• возраст до 9 мес и после 60 лет;
236 БИОХИМИЧЕСКИЕ ИССЛЕД08АНИЯ• подъем ПО лестнице;• прием лекарственных препаратов — аспарагиназы, кортизона, кортикотро-
пина, декстрана, тестостерона;• при взятии крови с антикоагулянтами (ЭДТА, цитрат).Тропонины I и IТропонины IИ Т (Тр1, ТрТ) — фрагменты сократительного белкового комплекса
поперечнополосатых мышц и мышцы сердца, участвующие в процессе регуляции
мышечного сокращения. Отношение концентрации тропонинов внутри мышеч¬
ных клеток и в плазме крови намного выше, чем для ферментов и миоглобина, что
делает эти белки высокочувствительными маркерами поражения миокарда.Материал (проба): сыворотка (плазма) крови. Стабильна при -20 °С до 3 мес.Методы исследования: иммуноферментный, иммунохемилюминесценция,
радиоиммунологический.Референтные пределы: в сыворотке (плазме) крови. Тр1 — менее ОД мкг/л;
ТрТ - менее 0,01 мкг/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕРанние и высокоспецифичные маркеры поражения миокарда: уровень в плазме
крови повышается через 4-8 ч после начала болей в груди; увеличенная концен¬
трация в крови сохраняется до 4-10 сут после инфаркта миокарда. Уровень тропо¬
нинов в плазме крови коррелирует с летальностью. Используют для диагностики
инфаркта миокарда, выбора тактики лечения больных с острым коронарным
синдромом, в том числе пациентов с нестабильной стенокардией, обследования
пациентов с инфарктом миокарда и нестабильной стенокардией в прогностиче¬
ских целях, контроля за эффективностью лечения.Увеличение содержания:• инфаркт миокарда, травма сердца, операции на сердце;• повреждения миокарда при манипуляциях на сердце (перкутанной транслю-
минальной коронарной ангиографии, дефибрилляции и др.);• нестабильная стенокардия (легкий подъем концентрации);• дилатационная кардиомиопатия;• лекарственная интоксикация (цитостатиками);• миокардиты, отторжение сердечного трансплантата;• сепсис и другие критические (шоковые) состояния;• терминальная стадия почечной недостаточности;• миодистрофии Дюшенна-Беккера;• ДВС-синдром.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания: гемолиз.Фактор некроза опухоли-аФактор некроза опухоли-а (ФНО-а) - полипептидный цитокин, продуциру¬
ется главным образом активированными макрофагами и обладает иммуномоду¬
лирующими и провоспалительными свойствами. ФНО-а регулирует выработку
В-клетками антител, стимулирует цитотоксичносгь Т-клеток. Участвует в регу¬
ляции апоптоза и межклеточного взаимодействия иммунокомпетентных клеток.
ФНО-а может вырабатываться клетками миокарда при таких патологических
состояниях, как инфаркт миокарда, повышение давления и объема левого желу¬
дочка.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 237Материал (проба): сыворотка (плазма) крови, которую необходимо исполь¬
зовать сразу или хранить в замороженном виде. Образцы нельзя повторно замо¬
раживать и оттаивать. Нельзя использовать гемолизированные и липемичные
образцы.Референтные пределы: для иммуноферментного метода — 0-50 пг/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕУчаствует в патогенезе некоторых аутоиммунных заболеваний и атеросклероза,
развитии кахексии при хронических инфекциях, реакции «транплантат против
хозяина». Негативно влияет на опухолевые и инфицированные вирусами клетки.
Уровень ФНО-а у пациентов с сепсисом и тяжелыми инфекциями коррелирует с
тяжестью и исходом заболевания.Увеличение содержания:• тяжелые инфекционные заболевания (бактериальный менингит, лепра):• сепсис;• бактериальный эндокардит;• сердечная недостаточность, особенно при декомпенсациях.ФерритинРастворимый в воде комплекс железа с белком апоферритином. Белок, обе¬
спечивающий депонирование железа в организме. Ферритин содержит примерно
15-20% общего количества железа в организме взрослого человека. Каждая клетка
тела и все жидкости организма содержат ферритин. Циркулирующий в кровотоке
ферритин практически не содержит железа, но его количество находится в равно¬
весии с резервным депо железа. Хотя в крови ферритин присутствует в небольших
количествах, его концентрация в плазме отражает запасы железа в организме.
Снижение уровня ферритина — первый показатель уменьшения запасов железа.Референтные пределы: в сыворотке (плазме) крови. 6 мес-15 лет —
15-120 мкг/л; мужчины — 30-300 мкг/л; женщины до 50 лет — 10-160 мкг/л,
старше 50 лет — как у мужчин.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕКонцентрация ферритина в сыворотке крови прямо коррелирует с количеством
депонированного железа в организме, ее измерение используют для диагностики
и мониторинга дефицита или избытка железа, дифференциальной диагностики
анемий, слежения за развитием опухолей. Б отличие от железа, уровень ферритина
не имеет суточного ритма, его концентрация не зависит от эстрогенов и синтеза в
печени, однако концентрация ферритина повышается в острой фазе воспаления.
Особое значение имеет контроль лечения железом, так как перегрузка клеток
железом приводит к их поражению.Увеличение содержания:• гипохромная анемия с нормальным или увеличенным депо железа;• повышение запасов железа в тканях, анемия вследствие инфекции или злока¬
чественного новообразования (лимфогранулематоза, острого лейкоза);• талассемия, сидеробластная анемия;• избыток железа при гемохроматозе, неэффективный эритропоэз;• гемотрансфузии, пероральное и парентеральное лечение препаратами железа;• реакции острой фазы (воспаление, инфекции, злокачественные опухоли);• заболевания печени с поражением гепатоцитов.Снижение содержания (при дефиците железа):• острая кровопотеря (концентрация ферритина падает спустя 1-2 нед);• хроническая кровопотеря (в частности, меноррагии);
238 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ• железодефицитная и гемолитическая анемия;• воспалительные заболевания кишечника с нарушением всасывания железа;• гемодиализ.Для диагностики латентного недостатка железа, помимо ферритина, следует
определить уровни трансферрина, железа и сделать гемограмму.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания;• повышение уровня эстрогенов.Снижение концентрации:• вегетарианство;• беременность;• прием лекарственных препаратов — глюкокортикоидов, аспарагиназы, дек-
страна, тестостерона.ФибриногенБелок, молекулы которого обладают свойством быстро полимеризоваться в
токе крови с образованием фибрина, способного закрывать повреждение сосуда и
предотвращать потерю крови. Синтезируется в печени и мегакариоцитах и содер¬
жится в тромбоцитах, а также в некоторых тканях: головном мозге, легких, кост¬
ном мозге, где 7-цепи фибриногена, видимо, выступают в роли молекул адгезии.
Материал (проба): плазма крови. Стабильна при -20 “С несколько месяцев.
Методы исследования: иммунотурбидиметрия, клоттинговый.Референтные пределы: в плазме крови ~ 1,8-3,5 г/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика врожденных или приобретенных дефицитов либо дефектов
фибриногена (афибриногенемии, гипофибриногенемии, дисфибриногенемии);
мониторинг тромболитической терапии. Повышенные концентрации фибриноге¬
на являются фактором риска заболеваний сердечно-сосудистой системы. Является
показателем коагулограммы первичного скрининга. Относится к белкам острой
фазы воспаления.Увеличение содержания:• реакции острой фазы (воспаление, опухоль, травма);• хроническое активное воспаление при ревматизме, коллагенозах;• компенсаторное повышение синтеза при потерях альбумина при нефротиче¬
ском синдроме;• врожденный феномен повышенного синтеза фибриногена;• независимый фактор риска инфаркта миокарда и инсульта.Снижение содержания:• ДВС-синдром;• патологии печени (цирроз, интоксикации, острая недостаточность);• увеличение потребления фибриногена (обширные метастазы опухолей,
острый промиелоцитарный лейкоз, отслойка плаценты, эмболия околоплод¬
ными водами и другие акушерские патологии);• врожденный дефицит.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• беременность;• высокие концентрации эстрогенов (пероральные контрацептивы).Снижение содержания:• младенческий возраст.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 239ФибронектинПрисутствует на поверхности многих клеток, во всех жидкостях организма.
Участвует в формировании межклеточных контактов, клеточной дифференци-
ровке, злокачественной трансформации. Является основной молекулой адгезии
в венозной и капиллярной сети. В плазме ограничивает протеолиз. Стимулирует
ретракцию сгустка фибрина.Референтные пределы: в сыворотке — 0,25-0,4 г/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕСодержание фибронектина в плазме повышено примерно у трети больных
со злокачественными новообразованиями и более чем у половины больных со
злокачественными опухолями печени, поджелудочной железы или желчевыво¬
дящих протоков. При первичном раке печени диагностическая чувствительность
определения фибронектина выше, чем а-фетопротеина, при одновременном их
определении — выше 80%. Диагностическое значение фибронектина ограничено
его неспецифичностью и частым увеличением при доброкачественных опухолях.В асцитической жидкости фибронектин измеряют при дифференциальной диа¬
гностике асцита различного происхождения; при асците неопухолевой природы
(циррозе печени) содержание фибронектина значительно ниже, чем у больных с
асцитом опухолевой природы.Увеличение содержания:• хронический активный гепатит.Снижение содержания:• две-синдром;• сепсис;• шок;• множественные травмы;• острая лейкемия;• острый панкреатит.ВЛИЯЮЩИЕ ФАКТОРЫСнижение содержания: недоедание.ЦерулоплазминБелок плазмы крови, молекула которого содержит 6 или 7 ионов меди,
Церулоплазмин транспортирует медь, связывая 90-95% меди в плазме крови.
Участвует в обмене (окисляя Fe^^ до Fe^O» транспорте и утилизации железа. Играет
важную роль в регулировании окислительно-восстановительного потенциала.
Обладает антиоксидантной активностью: предупреждает окисление липидов в
мембране клеток, способствует увеличению синтеза оксида азота эндотелием сосу¬
дов, тем самым контролирует NO-зависимую вазодилатацию. Церулоплазмин спо¬
собен инактивировать свободные радикалы кислорода, предотвращая окисление
полиненасыщенных жирных кислот, усиливает окисление аскорбиновой кислоты,
катехоламинов, серотонина и соединений, содержащих сульфгидрильные группы,
в частности гомоцистеина и цистеина.Влияет на процессы тромбообразования, являясь прокоагулянтом.Референтные пределы: в плазме (сыворотке) крови менее 5 сут — 0,05-
0,4 г/л; более 1 года — 0,2-0,6 г/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика наследственных заболеваний, связанных с нарушением мета¬
болизма меди. Снижение уровня церулоплазмина в сочетании с повышенными
240 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯконцентрациями СРБ имеет место при стенокардии и является неблагоприятным
прогностическим признаком s отношении возникновения рестеноза у больных с
ИБС после ангиопластики и стентирования коронарных артерий.Увеличение содержания!• острая фаза воспаления (инфекционно-воспалительные заболевания, опухо¬
ли, травмы);• холестаз;• первичный билиарный цирроз;• ревматоидный артрит;• системная красная волчанка;• лейкемия;• меланома;• шизофрения;• хронический алкоголизм.Снижение содержания:• болезнь Вильсона-Коновалова (гепатоцеребральная дистрофия);• синдром Менкеса;• болезнь Альцгеймера;• дефицит белка при нефротическом синдроме, гастроэнтеропатии с потерей
белка, синдроме мальабсорбции;• нарушение синтеза в печени;• стенокардия (уровень церулоплазмина обратно пропорционально связан с
функциональным классом стенокардии);• предшествует рестенозу у больных с ИБС после ангиопластики и стентирова¬
ния коронарных артерий.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• беременность;• хронический алкоголизм;• психоэмоциональное напряжение;• прием лекарственных препаратов — фенобарбитала, пероральных контра¬
цептивов, карбамазепина, метадона**’, фенитоина, тамоксифена.Снижение содержания:• прием аспарагиназы.МИНЕРАЛЫ и ЭЛЕКТРОЛИТЫ
ЖелезоМикроэлемент, входящий в состав гемоглобина, ряда ферментов (цитохромов
тканевого дыхания, оксидазы, супероксиддисмутазы и др.) и иных белков, уча¬
ствующих в обеспечении тканей кислородом и его использовании клетками глав¬
ным образом для энергопродукции. В организм железо поступает с растительной
и животной пищей, его всасывание в кишечнике усиливается при дефиците и огра¬
ничивается при избытке в организме. В плазме крови ионы железа нековалентно и
обратимо связаны с транспортным белком трансферрином. Уровень трансферрина
и его насыщение железом изменяются в зависимости от концентрации железа в
плазме крови. Поступление железа в клетки опосредуется мембранными рецеп¬
торами к трансферрину. Б мононуклеарных фагоцитах костного мозга, селезенки,
печени железо временно депонируется в форме комплекса с белком ферритином,
содержание которого в сыворотке крови отражает запасы железа в организме
(см. «Ферритин»). Дефицит железа в организме вследствие хронической кро-
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 241вопотери, мальабсорбцйй и других патологических процессов ведет к развитию
анемии.Материал (проба); сыворотка крови; избегают гемолиза и длительного хра¬
нения над сгустком крови. Можно хранить 3 нед при +4 “С, годы — при -20 °С.
Исследование проводят не ранее чем через 5-7 сут после прекращения приема
железосодержащих пищевых добавок или лекарственных препаратов, перелива¬
ния крови или эритроцитов.Референтные пределы представлены в табл. 4-25,Таблица 4-25. Референтные пределы железа в сыворотке кровиПол, возрастмкмоль/л<1 года7,2-17,91-14 лет9,0-21,5Женский. >14 лет7,2-25,2Мужской, >14 лет10,2-28,6КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДифференциальная диагностика анемий, контроль терапии железодефицитной
анемии. Выявление железодефицита при хронических инфекционных заболевани¬
ях, системных воспалительных заболеваниях, нарушенном питании, мальабсорб-
ции, гипо- и авитаминозах. Диагностика гемохроматоза, отравлений препаратами
железа. При решении диагностических задач рекомендуют назначать исследова¬
ние сывороточного железа в комплексе с другими биохимическими показателями
обмена железа (трансферрином, общей железосвязывающей способностью или
ферритином) и гематологическими исследованиями.Увеличение концентрации (часто сочетается с повышенным отложением железа
в паренхиматозных тканях и эпителии):• идиопатический гемохроматоз;• вторичный гемохроматоз при гемолитической анемии, свинцовой интокси¬
кации, талассемии, избыточном парентеральном введении препаратов желе¬
за, повторных гемотрансфузиях, остром отравлении железосодержащими
соединениями, алкогольном гепатите.Уменьшение концентрации:• железодефицитные анемии вследствие повышенных потерь железа орга¬
низмом (острых и хронических кровопотерь), недостаточного поступления
железа в организм при молочно-растительной диете, синдроме мальабсорб-
ции, хронических заболеваниях желудка и кишечника, повышенного потре¬
бления железа (во время беременности, в период лактации, в подростковом
возрасте, после интенсивных физических нагрузок);• анемия при хронических заболеваниях (диффузных заболеваниях соедини¬
тельной ткани, туберкулезе, грибковых инфекциях), онкопатологии, в том
числе при острых и хронических лейкозах, лимфомах, миеломе;• гемодиализ при хронической почечной недостаточности;• хронические заболевания печени (гепатит, цирроз) в связи со снижением
биосинтеза трансферрина.ВЛИЯЮЩИЕ ФАКТОРЫСуточный, менструальный ритмы.Увеличение содержания: лечение хлорамфениколом, метотрексатом, цисплати-
ном, эстрогенами, прием эстрогенсодержащих оральных контрацептивов.Уменьшение содержания: лечение аллопуринолом, метформином, глюкокорти-
коидами, прием больших доз ацетилсалициловой кислоты, анаболических стерои¬
242 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯдов; повышенное потребление железа (во время беременности, в период лактации,
в подростковом возрасте, после интенсивных физических нагрузок).Железосвязывающая способность сыворотки общаяПоказатель способности сыворотки связывать ионы железа; отражает концен¬
трацию главным образом трансферрина, а также небольшого количества других
железосвязывающих белков плазмы крови, зависит от скорости биосинтеза транс¬
феррина гепатоцитами, повышающ;ейся при дефиците железа в организме. Тест
менее информативен, чем определение трансферрина.Референтные пределы представлены в табл. 4-26.Таблица 4-26. Референтные пределы общей железосвязывающей способности сывороткиВозраст<2 лет2 лет, взрослыемкмоль/л17,3-71,644,8-76,1КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕУвеличение:• железодефицитные состояния:• острый гепатит.Уменьшение:• обусловленное снижением биосинтеза трансферрина в печени:❖ хронические гепатиты, циррозы, голодание;❖ первичный и вторичный гемохроматоз, неопластические процессы;• обусловленное потерями белков плазмы крови:❖ протеинурия;❖ экссудативная энтеропатия.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение: поздние сроки беременности.Калий в сывороткеКалий — основной внутриклеточный катион, участвующий в поддержании мем¬
бранного заряда клеток, механизмах возбуждения нервных и мышечных волокон.
Его концентрация внутри клеток существенно выше, чем во внеклеточной жидко¬
сти, включая плазму крови. Концентрация калия в плазме зависит от его поступле¬
ния в организм, распределения между клетками и внеклеточной жидкостью, выве¬
дения из организма почками, а также потовыми железами и кишечником. В почках
калий фильтруется, практически полностью реабсорбируется в проксимальных
канальцах и секретируется в дистальных отделах сопряженно с реабсорбцией
натрия (секреция усиливается альдостероном). Снижение клубочковой фильтра¬
ции ведет к уменьшению экскреции калия с мочой и повышению его концентрации
в крови. Многие диуретики, усиливающие экскрецию натрия и воды, увеличивают
потери калия с мочой. Изменение pH крови при ацидозе увеличивает выход калия
из клеток в плазму, при алкалозе — его поступление в клетки. Введение инсулина
вызывает увеличение перехода калия в клетки параллельно транспорту глюкозы.
Гиперкалиемия связана с риском остановки сердца. Гипокалиемия может вызы¬
вать нарушения сердечного ритма, мышечную слабость, атонию кишечника, осла¬
бление рефлексов, гипотонию.Референтные пределы представлены в табл. 4-27.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 243
Таблица 4-27. Референтные пределы калия в сыворотке кровиВозрастммоль/л<1 года4,1-5,31-14 лет3,447>14 лет3,5-5,5КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕКонтроль калиемии при острой и хронической почечной недостаточности,
сердечной недостаточности, ацидозе и алкалозе, при гемодиализе, приеме диуре¬
тиков, сердечных гликозидов. Исключение патологической концентрации калия
как причины нарушений сердечного ритма. Диагностика и мониторинг надпочеч¬
никовой недостаточности.Увеличение концентрации (гиперкалиемия):• избыточное поступление калия в организм (быстрое вливание растворов
калия);• выход калия из клеток во внеклеточную жидкость при массивном гемолизе,
рабдомиолизе, распаде опухолей, тяжелых повреждениях тканей, глубоких
ожогах, злокачественной гиперпирексии, ацидозе;• сниженное выделение калия почками (острая почечная недостаточ¬
ность с олиго- и анурией, ацидозом, терминальная стадия ХПН, болезнь
Аддисона, псевдогипоальдостеронизм, гипофункция ренин-ангиотензин-
альдостероновой системы, шоковые состояния, ишемия тканей);• уменьшение объема внеклеточной жидкости (дегидратация).Уменьшение концентрации (гипокалиемия):• недостаточное поступление калия в организм при хроническом голодании;• потеря калия с мочой при почечном канальцевом ацидозе, почечной недоста¬
точности, синдроме Фанкони, синдроме Конна (первичном альдостерониз-
ме), вторичном альдостеронизме, синдроме Кушинга, осмотическом диурезе
(при сахарном диабете), алкалозе;• потеря калия организмом с кишечными секретами при частой рвоте, профуз-
ной диарее, аденоме ворсинок кишечника, кишечных свищах, отсасывании
содержимого желудка через назогастральный зонд;• усиленное поступление калия внутрь клеток при лечении глюкозой и инсули¬
ном, семейном периодическом параличе, алкалозе;• потеря с потом при муковисцидозе;• дефицит магния.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение концентрации: гемолиз, длительное хранение плазмы, сыворотки до
отделения от форменных элементов крови, сгустка, амилорид^, спиронолактон, три-
амтерен, аминокапроновая кислота, противоопухолевые средства, дигоксин, нестеро¬
идные противовоспалительные препараты, триметоприм-сульфаметоксазол, гипотер¬
мия, введение большого количества жидкости с высоким содержанием калия.Уменьшение концентрации: прием глюкокортикоидов, диуретиков (кроме
калийсберегающих), (5-адреноблокаторов, аминогликозидных антибиотиков, вве¬
дение АКТГ, альдостерона; лечение мегалобластной анемии витамином
фолиевой кислотой.Калий в мочеМатериал (проба): суточная моча (после утреннего мочеиспускания отметить
время и 24 ч собирать мочу в сухую чистую емкость, хранящуюся в прохлад-
244 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯном месте; по окончании сбора мочу перемешать, измерить объем, указать его в
направлении; около 50 мл отлить в контейнер для исследования в лаборатории).
До исследования можно хранить 2 мес при +4 °С, год - при -20 “С.Метод исследования: ионселективные электроды.Референтные пределы представлены в табл. 4-28.Таблица 4-28. Референтные пределы экскреции калия с мочойВозрастммоль/ср<1 года1-201-4 года10-304-14 лет10-60>14 лет30-100КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕМониторинг баланса поступления и потерь. Контроль терапии гормональных
нарушений, особенно надпочечников. Почечная недостаточность. Метаболический
алкалоз.Увеличение (гиперкалиурия):• поступление ионов калия из клеток (травма, сепсис, переливание эритроци¬
тов со сроком хранения более 7 сут);• голодание (увеличение может быть до 10 ммоль/сут);• синдром Кушинга, первичный и вторичный альдостеронизм;• почечно-канальцевые синдромы (во время полиурической фазы острой
почечной недостаточности, почечный метаболический ацидоз);• синдром Фанкони.Уменьшение (гипокалиурия):• хронический дефицит калия в пище;• потери калия (рвота, диарея);• болезнь Аддисона;• почечные заболевания со снижением скорости фильтрации (гломерулонеф¬
рит, пиелонефрит, нефросклероз).при внепочечных потерях гипокалиурия, как правило, до 10 ммоль/л, при
почечных потерях, часто связанных с приемом диуретиков, — более 10 ммоль/л.ВЛИЯЮЩИЕ ФАКТОРЫЭкскреция калия с мочой зависит от диеты. Гиперкалиурия: введение АКТГ,
кортизола и гидрокортизона, прием диуретиков. Петлевые диуретики угнетают
механизм транспорта калия; осмотические диуретики и ингибиторы карбангидра-
зы угнетают проксимальную реабсорбцию калия; все формы диуретиков увеличи¬
вают доставку жидкости к собирательным трубочкам, что усиливает секрецию и
выведение калия; все диуретики, истощая запасы натрия и повышая концентра¬
цию альдостерона в крови, вторично стимулируют секрецию калия.КальцийКальций — один из минеральных веществ организма человека, выполняющий
множество функций. Концентрация кальция в цитоплазме примерно в 1000 раз
выше его уровня во внеклеточной жидкости, включая плазму крови. Такое
распределение кальция поддерживается Са-АТФазой клеточной мембраны и
мембраны саркоплазматического ретикулума в миоцитах, что необходимо для
выполнения этим ионом ряда регуляторных функций: процессов секреции гор¬
монов, внутриклеточной реализации эффектов множества биологически актив¬
ных соединений, инициации мышечного сокращения. Ионы кальция, связываясь
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 245с натриевыми каналами нервной и мышечной ткани, определяют порог их воз¬
буждения. В связи с этим уровень кальция в сыворотке крови - один из наиболее
жестко контролируемых параметров гомеостаза, который зависит от метаболиз¬
ма костной ткани, поступления кальция с пищей и выведения с мочой. Около 99%
кальция организма вместе с фосфатами образует гидроксиапатиты минеральной
фазы костной ткани костей скелета и зубов. Основными регуляторами обмена
кальция являются гиперкальциемические гормоны — кальцитриол (активная
форма витамина В.^) и паратиреоидный гормон (повышают уровень кальция в
плазме крови, усиливая его всасывание в тонкой кишке, реабсорбцию в почках,
резорбцию костной ткани), а также гипокальциемический гормон кальцитонин
(снижает уровень кальция в плазме крови в основном через усиление минерали¬
зации костной ткани). В норме эффекты паратгормона и кальцитриола на почки
и кишечник имеют определяющее значение для обеспечения содержания каль¬
ция в организме, необходимого для формирования и обновления костной ткани.
На обмен гидроксиапатитов костной ткани влияют также половые гормоны,
при повышенном уровне — глюкокортикоиды и тиреоидные гормоны, в плазме
крови кальций содержится в трех формах, находящихся в динамическом равно¬
весии: ионы кальция (свободный кальций) — около 50%; кальций, связанный
с белками (преимущественно с альбумином), — около 40%; комплексирован-
ный с низкомолекулярными анионами кальций (бикарбонатами, фосфатами,
лактатом, цитратом) — около 10%. Общим кальцием в плазме крови называют
суммарную концентрацию всех этих форм кальция. Соответствующие регуля¬
торные функции, так же как модуляция продукции гормонов, поддерживающих
кальциевый гомеостаз, осуществляются ионизированным кальцием. Отклонения
от референтных пределов плазменного уровня ионизированного кальция прояв¬
ляются нарушением нервной и мышечной возбудимости, а также сократительной
способности миокарда и гладких мышц, включая гладкие мышцы кровеносных
сосудов. Эти нарушения более выражены при быстром развитии гипо- или
гиперкальциемии. Возникновение тетании и судорог возможно при ионизиро¬
ванном кальции менее 0,8 ммоль/л; его угрожающий жизни уровень — менее
0,7 ммоль/л. Дефицит Са^^ в организме ведет к нарушению минерализации кост¬
ной ткани.Материал (проба): сыворотка или кровь, забранная с гепарином при мини¬
мальном пережатии вены. Для определения общего кальция сыворотку можно
хранить 3 нед при +4 X, 6 мес — при -20 X. Для определения ионизированного
кальция рекомендуют использовать плазму крови или цельную кровь с гепарином,
которую следует хранить плотно закупоренной не более 2 ч при +4 "С.Методы определения: кальций общий измеряют колориметрическим мето¬
дом, ионизированный — ионселективной потенциометрией.Референтные пределы представлены в табл. 4-29.Таблица 4-29. Референтные пределы общего кальцияПоп, возрастммоль/л<10 сут1,9-2,610 сут-2 года2,25-2,752-12 лет2,2-2,7Женский, >12 лет2,2-2,5Мужской, 12-60 лег2,1-2.55Мужской, >60 лет2,2-2,5Кальций ионизированный в плазме крови (гепарин) у новорожденных изменя¬
ется по дням жизни, у взрослых старше 18 лет — 1,03-1,23 ммоль/л.
246 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯКЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕВыявление нарушений обмена кальция при остеопении и остеопорозе, остеома¬
ляции, гипотонии мышц, судорожном синдроме, парестезиях, хронических забо¬
леваниях кишечника с мальабсорбцией, аритмиях, метастазах злокачественных
опухолей в костную ткань, гипертиреозе, гиперпаратиреозе, дефиците кальци-
триола, лечении глюкокортикоидами, панкреатите, у пациентов отделений интен¬
сивной терапии и реанимации. Интерпретация результатов определения общего
кальция крови в ряде ситуаций осложняется зависимостью этого показателя от
концентрации в плазме крови белков и органических анионов, с которыми связан
кальций. Для оценки вовлеченности нарушений кальциевого гомеостаза в раз¬
витие неврологических и сердечно-сосудистых расстройств необходимо исследо¬
вание ионизированного кальция. Предлагаемые формулы для расчета ионизиро¬
ванного кальция по общему кальцию, общему белку и альбумину в ряде ситуаций
неприменимы, так как их использование может приводить к ошибкам.Увеличение концентрации (гиперкальциемия) (связано чаще всего с усилением
мобилизации кальция из костной ткани):• гипервитаминоз D;• первичный гиперпаратиреоз (аденома или карцинома паращитовидных
желез);• эктопический синтез паратгормона при раке легких, почек, яичников, моче¬
вого пузыря, пищевода, опухолях головы и шеи;• вторичный гиперпаратиреоз при хронической почечной недостаточности, гипо¬
витаминозе D (зфовень общего, так же как и ионизированного, кальция перио¬
дически может быть в референтных пределах или снижен в сочетании с измене¬
нием уровня фосфатов и повышенной активностью щелочной фосфатазы);• тиреотоксикоз;• иммобилизация;• распад костной ткани в очагах гиперплазии при гемобластозах;• остеолизис при злокачественных опухолях костной ткани, метастазах в кост¬
ную ткань (чаще всего при раке молочной железы, легких, почек);• саркоидоз, туберкулез, гисгоплазмоз (в связи с повышенной абсорбцией
кальция в кишечнике);• идиопатическая гиперкальциемия новорожденных (синдром Вильямса);• наследственная гипокальциурическая гиперкальциемия;• увеличение ионизированного кальция в результате изменений связывания
кальция с белками и органическими анионами плазмы крови:❖ ацидоз (снижение pH на 0,1 вызывает увеличение концентрации ионизи¬
рованного кальция на 0,05 ммоль/л).Уменьшение концентрации (гипокальциемия):• острый панкреатит с панкреонекрозом;• недостаточное всасывание кальция из кишечника и/или снижение его реаб¬
сорбции в почках:❖ гиповитаминоз D при рахите у детей и остеомаляции у взрослых (в резуль¬
тате сниженной инсоляции, мальабсорбции и нарушений питания);❖ гипопаратиреоз (послеоперационный, аутоиммунный, синдром Ди
Георге);❖ гипопаратиреоз новорожденных при гиперпаратиреозе у матери;❖ псевдогипопаратиреоз (наследственный дефицит рецепторов к паратгор-
мону);❖ тяжелая гипомагниемия, гипермагниемия (вызывает нарушение продук¬
ции и механизмов действия паратгормона);❖ печеночная недостаточность, хроническая почечная недостаточность, свя¬
занная с уменьшением образования кальцитриола из витамина D;
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 247нефроз;❖ гипоальбуминемия (снижается общий кальций, тогда как ионизирован¬
ный может находиться в референтных пределах);• снижение ионизированного кальция в результате изменений связывания
кальция с белками и органическими анионами плазмы крови:❖ алкалоз (повышение pH на ОД вызывает снижение концентрации ионизи¬
рованного кальция на 0,05 ммоль/л);^ гемотрансфузии цитратсодержащих препаратов крови.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение: стаз при взятии крови, изменение горизонтального положения
тела Б положение сидя, диэтилстилбэстрод, тамоксифен, лечение витамином D,
кальцитриолом, тиазидными диуретиками.Уменьшение: кальцитонины, аминогликозиды, фуросемид, барбитураты (у
пожилых), противосудорожные средства, чрезмерное употребление слабитель¬
ных, индапамид, гемодиализ при низкой концентрации кальция в диализате.МагнийОколо 50% магния организма находится в составе минеральной фазы костной
ткани. Магний является антагонистом кальция по ряду эффектов в мягких тка¬
нях (изменению сосудистого тонуса, возбудимости нервных и мышечных клеток,
свертыванию крови и др.), где он содержится преимущественно в клетках (49%
всего магния). Магний входит в состав почти 300 ферментов, участвует в синтезе
белка, секреции паратгормона, образует комплексы с нуклеиновыми кислотами,
фосфолипидами клеточных мембран, уменьшая их текучесть и проницаемость.
Всасывание поступающего с пищей магния происходит в тонкой кишке, зависит от
содержания жира в пище и тормозится кальцием и фосфатами. Главным органом
регуляции содержания магния в организме являются почки. При дефиците магния
его реабсорбция из первичной мочи составляет 100%, при поступлении в организм
в повышенном количестве выделение магния почками усиливается. Факторы,
регулирующие гомеостаз магния, мало изучены. В плазме крови около 65% магния
находится в ионизированной форме, 35% — в виде комплексов с цитратом и аль¬
бумином. Концентрация магния в клетках поддерживается на постоянном уровне
даже при значительных изменениях его содержания в плазме крови. При гипомаг-
ниемии создаются условия для возникновения желудочковых экстрасистол, повы¬
шения активности сухожильных рефлексов, атаксии, дезориентации, судорожных
состояний, развития гипокальциемии. При гипермагниемии (выше 1,5 ммоль/л)
могут наблюдаться тошнота, рвота, сонливость, мышечная слабость, брадикардия,
атриовентрикулярная блокада.Референтные пределы; 0,70-1,05 ммоль/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕКлинические ситуации, создающие риск нарушений гомеостаза магния и/или
сопровождающиеся сенсорными и нейромьшіечньїми симптомами таких нарушений.Увеличение концентрации (гипермагниемия):• почечная недостаточность;• болезнь Аддисона;• гипотермия.Уменьшение концентрации (гипомагниемия):• наиболее часто — хронический алкоголизм (из-за сниженного содержания
магния в рационе, нарушения его абсорбции в кишечнике и повышенной экс¬
креции почками);
248 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ• мальабсорбция при раке, колите, сниженной функции поджелудочной желе¬
зы, резекции желудка, кишечника;• повышенные потери при длительной рвоте, диарее, свищах;• диабетический кетоацидоз или некомпенсированный сахарный диабет (переме¬
щение магния из клеток и усиление экскреции почками вследствие глюкозурии);• препараты, увеличивающие почечную экскрецию;• сердечно-легочный шунт.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение: чрезмерное использование магнийсодержащих препаратов (анта-
цидов, слабительных, растворов для клизм).Уменьшение: препараты, увеличивающие почечную экскрецию (петлевые диу¬
ретики, амфотерицин, гентамицин, дигоксин, циклоспорин), белково-калорийное
питание, передозировка диуретиков, длительный прием слабительных, бикарбо¬
наты, теофиллин.МедьМедь - микроэлемент организма человека, компонент многих ферментов,
катализирующих окисление веществ молекулярным кислородом в процессах
энергопродукции, синтеза нейромедиаторов, пигмента меланина и др. Свободные
ионы меди, так же как ионы других металлов с переменной валентностью, могут
инициировать перекисное повреждение белков и липидов. Именно поэтому в
плазме крови медь связана с синтезируемым печенью гликопротеидом — церуло-
плазмином. Этот белок одновременно с медьтранспортной функцией проявляет
антиоксидантную активность: функционируя как ферроксидаза в плазме крови,
он восстанавливает свободные ферри-ионы в ферро-ионы, связываемые белком
трансферрином. В норме с пищей поступает 2-5 мг меди в сутки, из них всасы¬
вается около 30%. Из организма медь выводится с желчью (около 89%) и со слу-
щенным эпителием слизистой оболочки кишечника (16%). с мочой выделяется
лишь около 4% всосавшейся меди. Проявления дефицита меди включают анемию,
нейтропению, различные костно-суставные нарушения, снижение пигментации
кожи, патологию со стороны ЦНС и сердечно-сосудистой системы. Для болезни
Вильсона-Коновалова (генетически обусловленного дефицита церулоплазмина и/
или его рецепторов) характерным является прогрессирующее поражение нервной
системы и печени, обусловленное токсическими эффектами меди, откладываю¬
щейся в этих органах. Избыток меди может вызывать признаки отравления (тош¬
ноту, рвоту, диарею, боли в животе), сопровождающиеся снижением активности и
биосинтеза некоторых ферментов.Референтные пределы представлены в табл. 4-30.Таблица 4-30. Референтные пределы общей меди в сыворотке кровиВозраст, ЛОЛмкмоль/л<4 мес1.4-7,24-6 мес4-177-12 мес8-21Мужской12-24Женский11-22КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика и мониторинг лечения врожденных нарушений обмена меди.
Увеличение концентрации (чаще всего обусловлено поступлением меди в кровь
из разрушенных клеток):
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 249• инфекции, острое и хроническое воспаление;• лейкоз, лимфогранулематоз;• анемии;• злокачественные опухоли, билиарный цирроз, ревматизм;• аутоиммунные заболевания соединительной ткани, тиреотоксикоз;• острый инфаркт миокарда, инсульт;• травма;• введение медьсодержащих растворов.Уменьшение концентрации:• первичные нарушения обмена меди;• болезнь Вильсона-Коновалова;• синдром Менкеса (болезнь «курчавых волос»);• диффузные поражения тонкой кишки в связи с нарушением всасывания меди
(целиакия, спру и др.);• муковисцидоз;• нефротический синдром;• ишемическая болезнь сердца;• некоторые железодефицитные анемии;• недостаточность белкового питания;• ожоги.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение концентрации: беременность (в связи с физиологическим усиле¬
нием биосинтеза церулоплазмина под действием эстрогенов), прием эстрогенов,
пероральных контрацептивов, фенобарбитала.Натрий в сывороткеНатрий — основной катион внеклеточной жидкости (около 96% содержится
вне клеток), определяющий величину ее осмотического давления, содержание
в ней воды и, таким образом, поддерживающий объем внеклеточной жидкости.
Участвует в механизме возбуждения нервных и мышечных клеток. Снижение уров¬
ня в плазме крови может приводить к различным неврологическим нарушениям.
Поступает с пищей при обычной диете в избыточных количествах и практически
полностью всасывается в кишечнике; избыток экскретируется почками, являющи¬
мися основным звеном регуляции гомеостаза натрия. Ионы натрия фильтруются
в почечных клубочках, а затем подвергаются регулируемой реабсорбции в разных
отделах почечных канальцев. Главными регуляторами обмена натрия являются
ренин-ангиотензин-альдостероновая система, вазопрессин (антидиуретический
гормон), предсердный натриуретический гормон. Изменения баланса натрия
сопровождаются многими патологическими состояниями.Референтные пределы: 136-145 ммоль/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика и мониторинг надпочечниковой недостаточности. Выявление
нарушений электролитного гомеостаза при заболеваниях почек, обезвоживании
(рвоте, диарее). Мониторинг терапии диуретиками.Увеличение концентрации (гипернатриемия):• гипертоническая дегидратация [усиленное потоотделение (лихорадка и др.),
гипервентиляция, рвота, диарея];• недостаточное поступление воды в организм;• снижение выведения с мочой (первичный и вторичный гиперальдостеро-
низм, синдром Кушинга).
250 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯУменьшение концентрации (гипонатриемия):• недостаточное поступление натрия в организм;• потеря натрия при рвоте, диарее, сильной потливости при адекватном водном
и неадекватном солевом замещении;• недостаточность надпочечников;• острая почечная недостаточность (полиурическая стадия);• осмотический диурез;• гипотоническая гипергидратация (избыточное парентеральное введение
жидкости, сниженное выведение воды при почечной недостаточности, повы¬
шенной секреции вазопрессина, дефиците глюкокортикоидов);• гипонатриемия разведения с отеками и асцитом при хронической сердечной
недостаточности, циррозе печени, печеночной недостаточности, нефротиче¬
ском синдроме;• гипотиреоз;• синдром неадекватной секреции АДГ.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение концентрации: избыточное введение солей натрия, например гипер¬
тонического раствора натрия хлорида, введение АКТГ, бикарбоната натрия, прием
анаболических стероидов, андрогенов, глюкокортикоидов, эстрогенов, оральных
контрацептивов, метилдопы.Уменьшение концентрации: передозировка диуретиков, прием аминогликози-
дов, нестероидных противовоспалительных препаратов, амитриптилина, галопе-
ридола, введение гипертонического раствора глюкозы.Натрий в мочеМатериал (проба): суточная моча
Референтные пределы представлены в табл. 4-31.Таблица 4-31. Референтные пределы экскреции натрия с мочойВозрастммоль/сут<1 года1-101-7 лет10-607-14 лет40-170>14 лет130-260КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕМониторинг водно-электролитного гомеостаза при патологии почек, надпо¬
чечников. черепно-мозговой травме, сахарном диабете. Контроль применения
диуретиков.Изменения выделения натрия с мочой связаны с изменениями осмолярности
плазмы крови, объема циркулирующей крови и зависят от поступления с пищей,
перераспределения между секторами внеклеточной жидкости, экскреции почками.
Усиление потери натрия с мочой — одна из важнейших причин гиповолемии. При
внепочечных потерях содержание натрия в суточной моче — менее 10 ммоль/л;
при потерях через почки, обусловленных недостаточностью альдостерона, —
более 30 ммоль/л; при острой преренальной олигурии — менее 10 ммоль/л; при
остром некрозе почечных канальцев — более 30 ммоль/л.Увеличение (гипернатриурия):• повышенное потребление натрия;• постменструальный диурез (физиологические состояния);
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 251• первичная или вторичная надпочечниковая недостаточность;• нефрит;• почечный канальцевый ацидоз;• терапия диуретиками;• сахарный диабет;• синдром Бартера;• неадекватная секреция АДГ различной этиологии;• любая форма алкалоза, сопровождающаяся выделением щелочной мочи.Снижение (гипонатриурия):• недостаточное потребление натрия;• предменструальная задержка натрия и воды;• внепочечная потеря натрия при адекватном потреблении воды и солевом
замещении (рвота, диарея, избыточное потоотделение);• первые 24-48 ч после операций (диуретический синдром стресса):• адренокортикальная гиперфункция;• состояния со снижением клубочковой фильтрации вследствие снижения
почечного кровотока;• ацидоз;• диарея;• повышенная потливость.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение: кофеин, терапия кальцитонином, ингибиторами карбоангидразы,
цисплатином, диуретиками, допамином, гепарином, прогестероном, тетрацикли¬
ном.Уменьшение: лечение глюкокортикоидами, адреналином.Фосфор неорганическийФосфатные анионы относятся к числу основных анионов организма. Около
85% фосфора присутствует в костной ткани в виде солей кальция — гидрок-
сиапатитов. В мягких тканях фосфаты содержатся преимущественно внутри
клеток, где выполняют роль структурного компонента органических соеди¬
нений (нуклеиновых кислот, фосфолипидов, коферментов и др.), участву¬
ют в энергетическом обмене (обмене креатинфосфата, АТФ), поддержании
кислотно-основного равновесия (в форме свободных фосфатных анионов).
Фосфаты выводятся с мочой, часть гидрофосфатных анионов первичной мочи
превращается в дигидрофосфаты в результате связывания секретируемых в мочу
протонов. Экскреция фосфатов с мочой зависит от поступления их с пищей,
возраста, мышечной массы, почечной функции, времени суток. Концентрация
фосфатов в плазме крови важна для процесса минерализации костной ткани и
зависит главным образом от их реабсорбции в канальцах почек, соотношения
скорости образования и резорбции костной ткани, выхода из мягких тканей.
Обмен фосфатов и тесно связанный с ним обмен кальция регулируют биоло¬
гически активная форма витамина D — кальцитриол (гиперфосфатемический
эффект), паратгормон (эффект зависит от уровня кальцитриола), кальцитонин
(гипофосфатемический эффект). Гипофосфатемия менее 0,3 ммоль/л может
сопровождаться нарушением энергетического обмена в клетках, проявляю¬
щегося рабдомиолизом, неврологической симптоматикой и др. Клинические
симптомы, ассоциированные с гиперфосфатемией, обусловлены, как правило,
одновременно развивающейся гипокальциемией.Референтные пределы представлены в табл. 4-32.
252 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯТаблица 4-32. Референтные пределы фосфора неорганическогоВозраст, полммоль/л<2 лет1,45-2,162-12 лет1.45-1,7812-60 лет0,87-1,45>60 лет, женский0,90-1,32>60 лет, мужской0,74-1,20КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ В КОМПЛЕКСЕ С ИССЛЕДОВАНИЕМ КАЛЬЦИЯ
В СЫВОРОТКЕ КРОВИМетаболические заболевания костной ткани. Оценка гомеостаза фосфатов и
кальция при почечной недостаточности. Оценка гомеостаза фосфатов и кальция
при дисфункции паращитовидных желез.Увеличение концентрации:• гипопаратиреоз, псевдогипопаратиреоз;• острая и хроническая почечная недостаточность;• остеолиз при злокачественных опухолях (особенно при метастазировании),
лейкозах;метаболический и дыхательный ацидоз;
гйпервитаминоз D;
акромегалия;цирроз печени с портальной гипертензией;
заживление переломов костей;
саркоидоз.Уменьшение концентрации:• дефицит витамина D (остеомаляция, рахит, семейный гипофосфатемический
рахит, при синдроме мальабсорбции);• первичный гиперпаратиреоз;• выраженная гиперкальциемия различной этиологии;• вторичный гиперпаратиреоз при дефиците витамина D;• эктопический синтез паратгормона злокачественными опухолями;• семейная гипокальциурическая гиперкальциемия;• тяжелые диарея, рвота;• гиперинсулинемия при лечении сахарного диабета;• дефицит соматотропного гормона;• пеллагра;• респираторный алкалоз;• грамотрицательная бактериальная септицемия;• почечный канальцевый ацидоз, синдром Фанкони.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение концентрации: гемолиз, цитостатики (вследствие цитолиза),
андрогены, ^-адреноблокаторы, фуросемид, физические нагрузки, прием алкого¬
ля, фосфорсодержащих препаратов и пищевых добавок, постельный режим.Уменьшение концентрации; салицилаты (отравление), кальцитонин, эстро¬
гены, пероральные контрацептивы, изониазид, глюкокортикоиды, внутривенные
инфузии растворов глюкозы, инсулина, менструация.ХлоридыХлорид — основной анион внеклеточной жидкости, содержание хлорида в кото¬
рой в 40-50 раз выше, чем в цитоплазме клеток. В организм поступает с пищей
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 253и почти полностью всасывается в желудочно-кишечном тракте. В почках ионы
хлора фильтруются в клубочках, затем реабсорбируются в канальцах. Его выде¬
ление с мочой изменяется при воздействии эндогенных факторов и лекарствен¬
ных препаратов, влияющих на почечную реабсорбцию натрия и воды, а также
при состояниях, связанных с изменениями кислотно-щелочного равновесия. Это II
основной анион секретов желудка. При потере хлорида развивается алкалоз, при
избытке — ацидоз. Содержание хлоридов в крови, как правило, изменяется парал¬
лельно изменению содержания натрия. Изолированное изменение концентрации
хлорида наблюдается при нарушениях кислотно-щелочного баланса. Определение
хлоридов в крови используют чаще всего при оценке кислотно-щелочного баланса.
Референтные пределы; 98-107 ммоль/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕМониторинг и динамическое наблюдение расстройств кислотно-основного
состояния при различных заболеваниях. Заболевания почек. Несахарный диабет.
Патология надпочечников.Увеличение концентрации (гиперхлоремия):• обезвоживание;• почечный канальцевый ацидоз:• острая почечная недостаточность;• метаболический ацидоз при длительной диарее с потерей бикарбонатов;• интоксикация салицилатами;• респираторный алкалоз;• травма головы, сочетающаяся со стимуляцией или повреждением гипотала¬
муса;• гиперфункция коры надпочечников;• несахарный диабет.Уменьшение концентрации (гипохлоремия):• усиленное потоотделение, в том числе при секреторных дисфункциях и гор¬
мональном дисбалансе;• длительная, повторная рвота в связи с дуоденальной язвой, высокой кишеч¬
ной непроходимостью, стенозом привратника;• метаболический гипокалиемический ацидоз;• альдостеронизм;• полиурическая стадия почечной недостаточности;• травмы головы;• водная интоксикация и другие состояния с увеличением объема внеклеточ¬
ной жидкости;• синдром неадекватной секреции АДГ;• острая перемежающаяся порфирия.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение концентрации: метилдопа, терапия андрогенами, эстрогенами.
Уменьшение концентрации: передозировка диуретиков, длительный прием сла¬
бительных, бикарбонаты, хроническое применение слабительных, теофиллин.ВИТАМИНЫ, БИОАКТИВНЫЕ МЕДИАТОРЫ
5-§-аминолевулиновая кислота5-5-аминолевулиновая кислота — промежуточный метаболит, образующийся при
синтезе порфиринового кольца гема. Синтез гема происходит главным образом в
печени и костном мозге и начинается с образования 5-5-аминолевулиновой кислоты.
254 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯиз нее затем образуются порфобилиноген и другие метаболиты. Наследственные
и приобретенные нарушения синтеза гема называют порфириями. Порфирии
сопровождаются повышением содержания предшественников гема — порфирино-
генов, а также продуктов их окисления в тканях и крови, появлением их в моче.
Наследственные порфирии обусловлены генетическими дефектами какого-либо из
восьми ферментов, участвующих в синтезе гема. При этих заболеваниях отмечают
снижение образования гема. Поскольку гем служит ингибитором аминолевули-
натсинтазы, активность этого фермента повышается, что приводит к накоплению
5-6-аминолевулиновой кислоты и порфириногенов.Приобретенные порфирии моїут развиваться при отравлениях веществами,
являющимися ингибиторами отдельных ферментов синтеза гема (свинцом, галоген-
содержащими гербицидами и инсектицидами).Материал (проба): моча суточная, собранная в темную емкость с 10 мл
бМ-соляной кислоты (после утреннего мочеиспускания отметить время и 24 ч
собирать мочу в сухую чистую емкость, хранящуюся в прохладном месте; по окон¬
чании сбора мочу перемешать, измерить объем, указать его в направлении; около
50 мл отлить в контейнер для исследования в лаборатории).Референтные пределы: менее 34 мкмоль/л, или менее 40 мкмоль/сут.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика врожденных и приобретенных порфирий, свинцового отравления.
Увеличение:• острая перемежающаяся порфирия, смешанные порфирии;• наследственная копропорфирия;• отравление свинцом (при зфовне свинца в крови 400 мг/л и выше увеличение
сочетается с нормальным уровнем порфобилиногена в моче);• наследственная тирозинемия;• дефицит аминолевулинатдегидратазы (гомозиготы);• диабетический кетоацидоз,ВЛИЯЮЩИЕ ФАКТОРЫУвеличение: аминоацетон, аммиак, глюкозамин, пенициллины.Витамин 8^2 (кобаламин)Витамин В, 2 — незаменимый компонент пищи. Это единственный витамин,
синтезируемый почти исключительно микроорганизмами. Основным источником
витамина для человека является животная пища, наиболее богата витамином
печень. В печени из витамина В^^ образуются его биологически активные формы —
коферменты метилкобаламин и дезоксиаденозилкобаламин, катализирующие в
составе соответствующих ферментов реакции переноса одноуглеродных групп. Эти
реакции необходимы для синтеза в организме нуклеиновых кислот, образования и
депонирования активных форм фолиевой кислоты, превращения гомоцистеина в
аминокислоту метионин, распада жирных кислот с нечетным числом углеродных
атомов и других метаболических процессов.При недостатке витамина так же как при дефиците фолиевой кислоты,
снижается скорость пролиферации клеток, что проявляется нарушением крове¬
творения (развивается мегалобластная анемия), а также нарушением регенерации
эпителия и связанным с этим глосситом, стоматитом и мальабсорбцией. Дефицит
витамина может сопровождаться неврологическими расстройствами (полиневри¬
тами, фуникулярным миелозом), объясняемыми токсичностью продуктов непол¬
ного распада жирных кислот с нечетным числом углеродных атомов и некоторых
аминокислот. Пшовитаминоз В^^ может развиваться при некоторых патологиях
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 255ЖКТ (атрофическом гастрите, тотальном удалении желудка и др.). Это обуслов¬
лено нарушением всасывания витамина ^ тонкой кишке, происходящим после
связывания витамина с внутренним фактором Касла — гликопротеидом, синтези¬
руемым обкладочными клетками слизистой оболочки желудка. В связи с депони¬
рованием витамина в печени симптомы гиповитаминоза могут появиться лишь
через 5-6 лет сниженного поступления в организм этого витамина.Известны генетически обусловленные формы гиповитаминоза при которых
вследствие недостаточности ферментов превращения витамина в кофермент или
плазменного белка-переносчика витамина — транскобаламина развивается мега-
лобластная анемия, проявляющаяся в первые месяцы после рождения.Материал (проба): плазма крови, забранная с ЭДТА; избегать гемолиза, защи¬
щать от света. До исследования можно хранить при комнатной температуре не
более 15 мин, 4ч — при +4 “С, 2 мес — при -20 '"С.Референтные пределы: представлены в табл. 4-33.Таблица 4-33. Референтные пределы витаминаВозрастпг/млНоворожденные160-1300Взрослые180-900КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДифференциальная диагностика макроцитарных анемий. Контроль обеспечен¬
ности витамином при хронических воспалительных заболеваниях и анатомических
пороках тонкой кишки, атрофическом гастрите, строгой вегетарианской диете.
Увеличение концентрации:• хроническая почечная недостаточность;• тяжелая сердечная недостаточность;• сахарный диабет;• острый и хронический гепатит, цирроз печени;• метастазы рака в печень;• острый и хронический миелолейкоз, моноцитарный лейкоз, лимфолейкоз,
истинная полицитемия.Уменьшение концентрации:• недостаточное поступление витамина в организм:❖ строгая вегетарианская диета;❖ алкоголизм;• нарушение всасывания кобаламинов:синдром мальабсорбции (целиакия, спру);<> состояния после резекции желудка, тонкой кишки;❖ состояния после лучевой терапии в области тонкой кишки;❖ хронические воспалительные заболевания и анатомические пороки тон¬
кой кишки, атрофический гастрит;❖ глистные инвазии, особенно дифиллоботриоз;❖ болезнь Аддисона-Бирмера;• врожденные нарушения метаболизма кобаламина:дефицит транскобаламина;❖ оротовая и метилмалоновая ацидурия;
синдром Иммерслунда-Гресбека.ВЛИЯЮЩИЕ ФАКТОРЫУменьшение концентрации: беременность, прием цитостатиков, аминогликози-
дов, противосудорожных средств (фенобарбитала), холестирамина, пероральных
контрацептивов, ранитидина, метформина.
256 БИОХИМИЧЕСКИЕ исследованияГомоцистеинГомоцистеин — непротеиногенная аминокислота, образующаяся во многих тка¬
нях в процессе деметилирования аминокислоты метионин. Некоторое количество
гомоцистеина необратимо превращается в цистеин, но большая его часть вновь пре¬
вращается в метионин при участии ферментов, коферментами которых являются
производные витаминов В^, В, (фолиевая кислота), В^^. Нарушения превращений
гомоцистеина вследствие генетически обусловленных или приобретенных дефек¬
тов ферментов его обмена, а также при дефиците указанных витаминов ведут к его
накоплению в клетках и, как следствие этого, в плазме крови. Гипергомоцистеине-
мия ассоциируется с развитием дисфункции и поражения эндотелия, что обуслов¬
лено цитотоксическим эффектом гомоцистеина. Гипергомоцистеинемия является
независимым фактором риска сердечно-сосудистых заболеваний: повышение
уровня гомоцистеина в плазме крови на 5 мкмоль/л увеличивает риск атероскле¬
ротического поражения сосудов на 80% у женщин и на 60% у мужчин, общий риск
смерти — в 1,3-1,7 раза. Иіпергомоцистеинемия более 15 мкмоль/л ассоциируется
с повышенным риском развития болезни Альцгеймера. Снижение повышенно¬
го уровня гомоцистеина в плазме крови может предотвращать возникновение
сердечно-сосудистых осложнений.Материал (проба): гепаринизированная плазма, отделенная от форменных
элементов центрифугированием крови сразу после ее получения. Можно хранить
7 сут при -20 “С.Референтные пределы: мужчины — 6,3-15,0 мкмоль/л; женщины — 4,6-
12,5 мкмоль/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕОпределение риска развития атеросклероза и его осложнений. Диагностика
генетически обусловленной гомоцисгеин^трии. Выявление гипергомоцистеине-
мии как одной из возможных причин акушерских патологий (фетоплацентарной
недостаточности, гипоксии плода, преэклампсии и эклампсии), артериальных и
венозных тромбозов.Увеличение концентрации:• дефицит фолиевой кислоты, витаминов Bg, Bj2»• гомоцистеинурия и другие состояния, обусловленные генетическими дефек¬
тами ферментов, участвующих в метаболизме гомоцистеина;• почечная недостаточность;• гипотиреоз;• псориаз;• пролиферативные заболевания.Уменьшение концентрации:• рассеянный склероз (иногда).ВЛИЯЮЩИЕ ФАКТОРЫУвеличение: курение, прием алкоголя, кофе (кофеина), лечение циклоспорином,
сульфасалазином, метотрексатом, карбамазепином, фенитоином; закись азота.Интерлейкин-2Интерлейкин-2 (ИЛ-2) — цитокин, вырабатываемой Т-лимфоцитами, играет
важную роль в иммунном ответе; активирует факторы, участвующие в противови¬
русной, противобактериальной и противоопухолевой защите. ИЛ-2 стимулирует
пролиферацию и секрецию лимфоцитами интерферона у, активирует моноциты и
макрофаги, участвует в дифференцировке и пролиферации Т-лимфоцитов.
wШБИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 257Материал (проба): сыворотка крови. До исследования можно хранить
при -16 °С до 3 мес, до года — при -40 °С. Нельзя использовать гемолизирован-
ные образцы.Метод исследования: иммуноферментный.Референтные пределы: 0-1 пг/л.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДля оценки тяжести инфекционно-воспалительных заболеваний, эффективно- ■
сти проводимого лечения, а также прогнозирования течения.Увеличение содержания:• инфекционно-воспалительные заболевания, в том числе вирусные;• аутоиммунные заболевания;• обострение язвенной и желчнокаменной болезни;• глютеновая энтеропатия;• плохой прогноз у потенциальных реципиентов органов;• криз отторжения пересаженного органа,Интерлейкин-6Цитокин, регулирующий иммунный ответ (способствует созреванию В-лимфо-
цитов в антителпродуцирующие клетки, пролиферации и дифференцировке
Т-клеток), реакции острой фазы, воспаление, онкогенез и гемопоэз. Стимулирует
синтез острофазных белков (СРБ, фибриногена, гаптоглобина и др.), тормозит
синтез провоспалительных цитокинов (ИЛ-ір, ФНО-а). Вырабатывается раз¬
личными активированными клетками, в том числе Т-лимфоцитами, моноцитами,
фибробластами, клетками эндотелия и др.Материал (проба): сыворотка (плазма) крови. До исследования можно хра¬
нить при ”С 24 ч, при -16 “С — 3 мес, при -40 “С — год. Нельзя использовать
сильно гемолизированные образцы.Метод исследования: иммунохимический.Референтные пределы: для иммуноферментного метода — 0-10 пг/мл,КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕПринимает участие в патогенезе многих заболеваний, в том числе инфекционно'
воспалительных. Уровень ИЛ-6 измеряют для оценки иммунного статуса.Увеличение содержания:• острые бактериальные и вирусные инфекции;• аутоиммунные, аллергические заболевания;• псориаз;• гломерулонефрит;• алкогольный и первичный билиарный цирроз печени;• злокачественная лимфома, миелома, плазмоцитома, карцинома почек, сарко¬
ма Капоши;• обострение язвенной болезни, неспецифический язвенный колит;• глютеновая энтеропатия;• вирусный гепатит;• инфицирование ВИЧ;• сердечная недостаточность, особенно при декомпенсации.ВЛИЯЮЩИЕ ФАКТОРЫУвеличение содержания:• ожирение;• атеросклероз.
258 БИОХИМИЧЕСКИЕ ИССЛЕД06АНИЯФенилаланинФенилаланин — незаменимая аминокислота. Генетически обусловленное нару¬
шение обмена фенилаланина — фенилкетонурия (пировиноградная олигофрения),
которая является одной из наиболее распространенных ферментопатий (1:10 ООО).
При этой патологии недостаточность фенилаланингидроксилазы, катализирующей
превращение фенилаланина в тирозин, ведет к накоплению фенилаланина в крови
и усилению экскреции с мочой продуктов дезаминирования аланина — фенилпи-
ровиноградной кислоты (фенилкетона). Наиболее тяжелые проявления фенил-
кетонурии — нарушения умственного и физического развития. При скрининге
новорожденных на фенилкетонурию положительные результаты скрининговых
тестов (экспресс-теста с хлоридом железа на фенилкетонурию и др.) должны быть
подтверждены количественным определением фенилаланина.Материал (проба): плазма (сыворотка) крови; немедленно после взятия крови
охладить, отцентрифугировать и заморозить в течение часа после взятия. До
исследования можно хранить при -20 °С 7 сут.Метод исследования: флюориметрия.Референтные пределы представлены в табл. 4-34.Таблица 4-34. Референтные пределы фенилаланинаВозрастмкмоль/лНоворожденные, доношенные с нормальной массой тела73-206Новорожденные с низкой массой тела или недоношенные121-454Новорожденные с фенилкетонурией, 2-3 сут после рождения>272Новорожденные с фенилкетонурией, 10 сут после рождения907-1815Взрослые48-109КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДиагностика фенилкетонурии.Увеличение концентрации:• фенилкетонурия;• транзиторная гиперфенилаланинемия новорожденных (обусловлена задерж¬
кой постнатального становления биосинтеза фенилаланингидроксилазы);• сепсис;• тяжелые ожоги;• вирусный гепатит;• печеночная энцефалопатия.ВЛИЯЮЩИЕ ФАКТОРЫУ новорожденных наблюдаются суточные колебания уровня фенилаланина
(наивысшие значения — в 7 ч вечера, наиболее низкие — в 7 ч утра).Увеличение концентрации: аспартам, котримоксазол*’.Уменьшение концентрации: аскорбиновая кислота (у недоношенных), глюкоза,
прогестерон (высокие дозы).Фолиевая кислота (фолацин)Водорастворимый витамин, активные формы (тетрагидрофолиевые кислоты)
образуются в печени, в качестве коферментов участвуют в синтезе нуклеотидов,
что обеспечивает нормальное протекание синтеза РНК и ДНК, процессов про¬
лиферации клеток. В конечном итоге этот витамин стимулирует эррггро-, лейко- и
тромбоцитопоэз, пластические и регенераторные процессы во всех органах и тка¬
нях. Недостаток фолиевой кислоты, так же как и дефицит витамина (активные
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 259формы фолиевой кислоты образуются в печени при участии витамина ведет
к развитию мегалобластной анемии. Дефицит ФК у беременных, как правило,
обусловленный повышенной потребностью в этом витамине, может приводить к
невынашиванию беременности, мертворождению, частичной или полной отслой¬
ке плаценты: у плода повышает риск развития врожденных пороков. Фолиевая
кислота участвует в обмене аминокислоты метионина (синтезе метионина из
гомоцистеина), а также образовании кофермента синтазы оксида азота. С этими
эффектами фолиевой кислоты связывают ее антиатерогенное действие.
Референтные пределы: 3-17 нг/мл.КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕДифференциальная диагаостика анемий. Диагностика вызванных химиотера¬
пией или лучевой терапией нарушений со стороны крови (анемии, лейкопении).
Увеличение концентрации;• вегетарианская диета;• пернициозная анемия, дефицит витамина• заболевания дистального отдела тонкой кишки;• синдром приводящей петли.Уменьшение концентрации:• недостаточное поступление с пищей или нарушение всасывания:❖ недостаток фолиевой кислоты в рационе питания;❖ анорексия;❖ алкоголизм;❖ нарушение всасывания при синдроме мальабсорбции, целиакии, спру,
энтерите, резекции желудка и кишечника;• повышенное потребление или потеря при нормальном поступлении с
пищей:❖ беременность, лактация;❖ периоды интенсивного роста;❖ пожилой возраст;❖ лихорадка, септические состояния;❖ гемолитические анемии;
злокачественные опухоли;❖ гипертиреоз у детей;❖ миелопролиферативные заболевания;❖ сидеробластическая анемия;❖ заболевания печени;
хронический гемодиализ.ВЛИЯЮЩИЕ ФАКТОРЫУменьшение концентрации: прием препаратов, нарушающих всасывание фолие¬
вой кислоты (аспирина*, противосудорожных препаратов, эстрогенов, нитрофура-
нов, пероральных контрацептивов, антацидов, сульфасалазина) и ее антагонистов
(триметоприма, метотрексата, азатиоприна, зидовудина).МАРКЕРЫ ОБМЕНА КОСТНОЙ ТКАНИКость — специализированная соединительная ткань, образующая вместе с хря¬
щом скелет. Кость, как и все соединительные ткани, состоит из клеток и внекле¬
точного матрикса, образованного коллагеновыми волокнами и неколлагеновыми
белками. Костный матрикс способен кальцифицироваться. Кальцифицированный
костный матрикс неинертен, в нем происходят обменные процессы при участии
260 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯшКОСТНЫХ клеток - остеоцитов. На протяжении жизни в различных участках кости
происходит замена минерализованного матрикса на вновь образованную кость.
Этот процесс получил название ремоделирования, или костного оборота. Он
включает удаление старой кости — резорбцию и синтез нового костного матрикса
с последующей его минерализацией — формирование кости. Цикл ремоделиро¬
вания сопровождается выходом в кровоток кальция, компонентов матрикса и
ферментов, секретированных костными клетками. Процесс резорбции кости осу¬
ществляется остеокластами и мононуклеарными клетками, процесс формирования
кости — остеобластами.Остеокласт образуется из предшественников моноцитарного ряда, это большая
клетка с несколькими ядрами, содержащими ядрышки. В месте контакта с костью
остеокласт образует рифленую кайму. В ее выступах локализуется протонная
помпа, создающая кислую среду около клетки. Эндоплазматическая ретикулярная
сеть в цитоплазме синтезирует тартратрезистентную кислую фосфатазу, протеазы
и другие лизосомальные ферменты, транспортирующиеся к зоне контакта с костью
лизосомальными пузырьками. Костный минерал растворяется кислой средой, а
матрикс — ферментами. Процесс образования остеокластов из предшественников
и активация остеокластов тонко регулируются гуморальными [паратиреоидным
гормоном (ПТГ) и ПТГ-подобным пептидом] и местными тканевыми факторами
(фактором некроза опухоли, трансформирующим ростовым фактором, интерлей¬
кином-1, интерлейкином-6 и др.).Остеобласт происходит из клеток соединительной ткани костного мозга, явля¬
ясь клеткой, формирующей кость. Он секретирует основные компоненты матрикса
(коллаген I типа, гликопротеины, другие специфические белки), специальные
ферменты (щелочную фосфатазу, коллагенозу и др.), способствует формирова¬
нию минерализованного матрикса. Дифференцировка остеобластов и их функция
тонко регулируются большим количеством гуморальных и местных тканевых фак¬
торов. Костный матрикс содержит в основном коллаген I типа (более 90%), много
неколлагеновых белков матрикса, играющих важную роль в минерализации кости,
другие тканевые составляющие, такие как протеогликаны. Минерализация кости
происходит при высокой местной концентрации кальция и фосфора для форми¬
рования гидроксиапатита. В создании условий для отложения гидроксиапатита
большая роль принадлежит щелочной фосфатазе.Для изучения обмена кости применяют следующие методы; измерение плот¬
ности кости, сцинтиграфию скелета с радиоактивным изотопом технеция,
гистоморфометрию костных биоптатов, кинетические исследования после вве¬
дения изотопа кальция, определение биохимических маркеров костного ремо¬
делирования. В клинико-диагностических лабораториях активно внедряются
биохимические методы оценки метаболизма костной ткани. Биохимические
маркеры дают информацию о патогенезе заболеваний скелета и скорости ремо¬
делирования. Их можно использовать для контроля эффективности лечения в
короткие сроки и идентификации больных с быстрой потерей костной массы.
Биохимические маркеры показывают усредненную скорость ремоделирования
всего скелета, а не отдельных его областей. Различают биохимические маркеры
формирования и резорбции кости, характеризующие функции остеобластов и
остеокластов.Маркеры формирования костной тканик биохимическим маркерам формирования кости (табл. 4-35) относятся
костный изофермент щелочной фосфатазы (КЩФ), остеокальцин (ОК), кар-
бокси- и аминотерминальные пропептиды проколлагена 1-го типа (КТПП 1 и
АТППК 1),
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 261Таблица 4-35. Биохимические маркеры формирования костиМаркерКостная щелоч¬
ная фосфатаза
(КЩФ)Остеокальцин(ОК)Карбоксй- и ами¬
нотерминальные
пропептиды про¬
коллагена 1 -го
типа (КТППК 1 и
АТППК1)Тканевая специфичностьСинтезируется остеобластами; синтез возрастает в
процессе дифференциации остеобластов. Уровень
в крови коррелирует с данными гистоморфометрии
кости и состоянием формирования кости, измерен¬
ным с помощью Са'*'Синтезируется остеобластами и одонтобластами.
Уровень в крови коррелирует с данными гисто-
морфометрии кости и состоянием формирования
кости, измеренным с помощьюНаходятся в тканях, содержащих коллаген
1-го типа (преимущественно в костях и коже).
Образуются в результате отщепления от молекулы
проколлагена 1-го типа под воздействием пепти¬
даз. Отражают синтез остеобластами коллагена
1-го типа. Уровень КТППК 1 в крови коррелирует с
данными гистоморфометрии кости и включением
в кость Са^'МетаболизмВыводится почками; время полу-
жизни в крови (t ) 1-2 сутВыводится почками; в крови при¬
сутствуют интактные молекулы
ОК и их фрагменты; несколько
минКТППК 1 метаболизируется в
печени; в крови — 6-8 мин.
Соответствующие данные в отно¬
шении АТППК 1 отсутствуютШтв■Костная щелочная фосфатазав кости щелочная фосфатаза (КЩФ) секретируется остеобластами. Она уча¬
ствует в созревании матрикса и его минерализации. Синтез КЩФ возрастает в
процессе дифференциации остеобластов при ускоренном формировании кости.
Костный изофермент ЩФ наиболее термолабильный — инактивируется при 55 °С,
Специфичность КЩФ, а так же такие характеристики ее метаболизма, как время
полужизни в крови, составляющее 1-2 сут, отсутствие метаболизма в печени,
выведение из крови почками, приближают КЩФ к идеальным маркерам актив¬
ности остеобластов. Значительное увеличение ее активности в сыворотке крови
наблюдается при повышенной деятельности остеобластов: росте костей (у детей
активность выше, чем у взрослых; она увеличивается в последний триместр бере¬
менности), при возобновлении движений после длительного постельного режима,
переломах, деформирующем остите, болезни Педжета, рахите, гиперпаратиреозе.
Это характерно и для процессов остеомаляции (злокачественных опухолей костей,
миеломы), а также костного туберкулеза и лейкозов. Повышение активности
костной ЩФ при рахите отмечается чаще, чем увеличение содержания неоргани¬
ческого фосфора; при выздоровлении активность ЩФ нормализуется позднее, чем
уровень Са и Р, примерно в те же сроки, что и рентгенологические показатели.Интерпретация данных исследования КЩФ бывает затруднена, что связано с
половыми и возрастными особенностями ее активности и недостаточной специ¬
фичностью методов, используемых для ее определения (тартратрезистентная
фракция ЩФ). Наиболее адекватными методами исследования КЩФ считаются
РИА и ИФА с моноклональными антителами.ОстеокальцинОстеокальцин (ОК) — неколлагеновый кальцийсвязывающий белок с молеку¬
лярной массой 5,7 кДа, синтезируемый остеобластами и одонтобластами и опреде¬
ляемый в сыворотке крови. ОК обогащен гаммакарбоксиглутаминовой кислотой,
для его синтеза требуется витамин К. Более 90% синтезируемого остеобластами
ОК у молодых и около 70% у взрослых людей включается в костный матрикс, а
остальная часть попадает в кровоток. Точно установить долю синтезированного
остеобластами ОК, попадающую в кровоток, не представляется возможным. Она
262БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯтшможет меняться в зависимости от характера метаболических нарушений в кости.
Выводится ОК из кровотока почками (посредством клубочковой фильтрации и
деградации в почечных канальцах). При выраженном снижении клубочковой
фильтрации, в частности при хронической почечной недостаточности, уровень
ОК в крови может быть завышенным. Наличие в кровотоке фрагментов ОК из-за
частичного его разрушения в сосудистом русле под воздействием циркулируюш;их
протеаз или его разрушения в процессе резорбции кости также может приводить
к завышенным значениям. Кроме того, зфовень ОК в крови подвержен большим
суточным колебаниям. Вместе с тем получена хорошая корреляция между уровнем
ОК в крови и данными инвазивных методов оценки процесса формирования кости
при различных метаболических поражениях скелета. Именно поэтому, несмотря
на все вышеописанные ограничения, ОК в крови рассматривается как один из
самых информативных биохимических маркеров формирования кости и скорости
ремоделирования. Наиболее адекватными методами исследования ОК считаются
радиоиммунный и иммуноферментный анализы с использованием антител.Карбокси- и аминотерминальные пропептиды
проколлагена 1-го типаКарбокси- И аминотерминальные пропептидьт проколлагена 1-го типа (КТППК
1 И АТППК 1; РІСН и PINP — в английской аббревиатуре). Коллаген 1-го типа —
основной белок, составляющий 90% органического матрикса кости. Он синте¬
зируется остеобластами в виде предшественника проколлагена 1-го типа, пред¬
ставляющего собой большую молекулу, содержащую с С- и N-концов частично
глобулярные фрагменты (КТППК 1 и АТППК 1), которые отделяются от основной
молекулы с помонїью специфических пептидаз после выброса проколлагена из
клетки.Помимо кости, они присутствуют во всех тканях, содержащих коллаген 1-го
типа. В сосудистое русло из костей телопептиды выходят исключительно в про¬
цессе резорбции. Для определения КТТК 1 и АТТК 1 применяют РИА и ИФА с
использованием моноклональных антител.Маркеры резорбции костной тканиБиохимические маркеры резорбции кости представлены в табл. 4-36.
Пиридинолин и дезоксипиридинолин (ПИД и ДПИД), карбокси- и аминотерми¬
нальные телопептиды коллагена 1-го типа (КТТК 1 и АТТК 1), оксипролин (ОПр),
фрагмент коллагена 1-го типа галактозилоксилизин (ГОЛ) попадают в кровоток
из зоны резорбции. Тартратрезистентная кислая фосфатаза — фермент, секрети-
руемый остеокластами, попадает в повышенном количестве в кровоток при увели¬
чении количества и возрастании активности остеокластов.Таблица 4-36. Биохимические маркеры резорбции костиМаркерТканевая специфичностьМетаболизмПиридиновые поперечные
связи пиридинолин (ПИД)
и дезоксипиридинолин
(ДПИД)Формируются между концевой областью одной моле¬
кулы коллагена и спиралевидной областью другой.
Способствуют стабилизации коллагена, ДПИД при¬
сутствует преимущественно в кости, освобождается
только в процессе ее резорбцииЭкскретируются с
мочой; не метаболи-
зируются в печениКарбокси- иаминотерминальные тело¬
пептиды коллагена 1-го
типа (КТГК1,АТГК1)Присутствуют во всех тканях, содержащих коллаген
1-го типа. В соединении с поперечными связями
выбрасываются из костей только в процессе их
резорбции
БИОХИМИНЕСКИЕ ИССЛЕДОВАНИЯ 263Окончание табл. 4-36МаркерТканевая специфичностьМетаболизмОксипролин (ОПр)присутствует во всех молекулах коллагена и эласти¬
на. Появляется 8 экстрацеллюлярной жидкости при
формировании {из-за частичной деградации вновь
синтезированного коллагена вне костного матрикса) и
резорбции костиМетаболизм руется
в печени; 10-15%
выводится почкамиГалактозилоксилизин(ГОЛ)Присутствует только в коллагене; содержится в 5-7
раз больше в коллагене костей, чем в коллагене кожи.
Освобождается только в процессе резорбции костиНе метаболизи-
руется в печени.
Экскретируется в
неизмененном виде
с мочойКостнаятартратрезистентная кис¬
лая фосфатаза (ТРКФ)Присутствует в остеокластах и других макрофагахПиридинолин и дезоксипиридинолинв костном коллагене присутствуют поперечные связи между отдельными
молекулами коллагена, играющие большую роль в его стабилизации. Они пред¬
ставлены в виде пиридинолина (оксилизилпиридинолина) и дезоксипириди-
нолина (лизилпиридинолина). Поперечные связи формируются экстрацеллю-
лярно после отложения молекул коллагена в матрикс. В результате резорбции,
осуществляемой остеокластами, при разрушении коллагена возможен их выход
из кости в сосудистое русло. Наиболее специфичным для костей является ДПИД,
поскольку он содержится преимущественно в костях и в небольшом количестве
в дентине, аорте и связках. ПИД, помимо костей, присутствует в достаточном
количестве в хрящах. ПИД и ДПИД не метаболизируются в организме, а экс-
кретируются с мочой. Для оценки резорбции используется отношение их кон¬
центрации к уровню креатинина в моче. Для анализа используют суточную или
утреннюю мочу.Определяют свободные ПИД и ДПИД в моче, применяя ИФА с использованием
моноклональных антител к ПИД или ДПИД. Уровень маркеров в моче у женщин
несколько выше, чем у мужчин, и повышается с возрастом.Оксипролин в мочеОксипролин (ОПр) составляет около 14% аминокислотного состава коллагена,
продуцируемого остеобластами. ОПр образуется в результате гидроксилирования
пролина в процессе модификации проколлагеновых цепей, которая частично
имеет тканевую специфичность. Около 85-90% ОПр, освобождающегося из костей
в результате разрушения коллагена, метаболизируется в печени и только 10-15%
появляется в моче. При этом около 10% ОПр, появляющегося в моче, образуется
не в результате резорбции, а в результате деградации вновь синтезированных про¬
коллагеновых пептидов или новых коллагеновых молекул, не использованных
при построении костного матрикса. Именно поэтому появляющийся в моче ОПр
отражает суммарно и функцию остеобластов (процесс формирования), и функ¬
цию остеокластов (процесс резорбции), но доля ОПр, образуемого в результате
резорбции, превалирует. Используя исследование ОПр в моче для оценки скорости
ремоделирования, следует иметь в виду, что он не является специфичным только
для костей, поскольку содержится, хотя и в меньшем количестве, во всех типах
коллагеновых молекул. Кроме того, он может появляться в моче в результате
приема пищи, содержащей коллаген.
264 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯГалактозилоксилизин в мочеГалактозилоксилизин (ГОЛ) образуется, как и ОП, в остеобластах в результате
гидроксилирования лизина с последующим гликозилированием (присоедине¬
нием галактозы). Содержится исключительно в коллагене, преимущественно в
коллагене 1-го типа, находящегося в костях. Его нет в коллагеновых пептидах
и поэтому он не выбрасывается из костей в процессе формирования, а появляется в
сосудистом русле исключительно в процессе резорбции, гол не метаболизируется
в печени, экскретируется с мочой.Тартратрезистентная кислая фосфатазаТартратрезистентная кислая фосфатаза (ТРКФ) — один из 6 изоферментов кис¬
лой фосфатазы, находится в большом количестве в остеокластах и секретируется
ими во внеклеточную среду во время резорбции. Она присутствует и в других клет¬
ках, особенно макрофагах. Поскольку активность ТРКФ в сыворотке крови воз¬
растает при состояниях, характеризуемых усилением процесса резорбции кости, а
также имеется корреляция между ее активностью и данными гистоморфометрии,
ТРКФ используют для определения выраженности резорбтивных процессов в
скелете.Биохимические маркеры ремоделирования кости
при заболеваниях скелетаДля всех заболеваний скелета характерны те или иные нарушения процессов
ремоделирования кости, что сопровождается возникновением отклонений в уров¬
не биохимических маркеров. Для всех заболеваний, кроме остеомаляции и сениль¬
ного остеопороза, характерно ускорение ремоделирования с усилением процессов
резорбции кости. Формирование кости при этом может быть снижено, нормально
или даже повышено, но степень усиления формирования всегда меньше, чем сте¬
пень усиления резорбции. Иными словами, происходит нарушение нормального
соотношения между процессами резорбции и формирования кости. Такое же нару¬
шение характерно для сенильного остеопороза (остеопороза I типа), при котором
наблюдается снижение формирования на фоне нормальной резорбции вследствие
нарушения функций остеобластов. У здоровых людей в результате деятельности
остеобластов резорбированная полость полностью заполняется вновь образован¬
ной костью. При остеопорозе область резорбции заполняется лишь частично, что
ведет к прогрессирующему истончению трабекул и даже их исчезновению из-за
перфоративной резорбции.Первичный остеопороз сопровождается отчетливым повьшіением ПИД и КТТК 1.
При остеопорозе вследствие дефицита эстрогенов у женщин показана линейная
зависимость между ДПИД и степенью снижения плотности предплечья, а также
среднегодовой потерей плотности кости шейки бедра. Выявлено, что значение
ДПИД в моче более 7,4 нМ/мМ креатинина указывает на риск потери костной
массы. Кроме того, риск переломов шейки бедра наибольший при сочетании высо¬
кой экскреции ДПИД с низкой плотностью кости. Экскреция ДПИД и ПИД у боль¬
ных на фоне перелома бедра больше, чем у больных, имевших переломы в анам¬
незе, Из других заболеваний скелета наибольшая экскреция ДПИД наблюдается
при раке грудной железы с метастазами в кость из-за большого, хотя и локального,
разрушения скелета. Из метаболических заболеваний скелета самая высокая экс¬
креция ДПИД и ПИД — при первичном гиперпаратиреозе, болезни Педжета и
гипертиреозе, что связано с самой большой скоростью ремоделирования кости.
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 265Биохимические маркеры формирования кости при различных заболеваниях
скелета изменяются по-разному, при этом важен уровень каждого маркера в
отдельности, поскольку они характеризуют разные функции остеобластов.При первичном гиперпаратиреозе, остеопорозе у женщин после менопаузы
выявлено повышение как костного изофермента щелочной фосфатазы, так и ОК,
но если при гиперпаратиреозе степень повышения обоих маркеров аналогична,
при остеопорозе повышение ОК незначительное, а КЩФ отчетливое, но меньше,
чем при первичном гиперпаратиреозе. При болезни Педжета диссоциация между
двумя маркерами такого же типа, как и при первичном остеопорозе. При гипер-
тиреозе и акромегалии оба маркера в пределах нормы или незначительно повы¬
шены, а при гипопаратиреозе — понижены. Дискордантные отклонения в уровне
КЩФ и ОК установлены при хронической почечной недостаточности, метастазах
злокачественных опухолей в кости, остеомаляции, а также при эндогенном и экзо¬
генном гиперкортицизме. Для хронической почечной недостаточности характерно
повышение ОК при нормальной величине КЩФ, а для гиперкортицизма, остео¬
маляции и метастазов в кости — повышение КЩФ и понижение ОК. Тем не менее
при хронической почечной недостаточности выявлена высокая и достоверная
прямая корреляция между ОК и КЩФ. Нормальные величины КЩФ ассоцииру¬
ются с умеренным повышением ОК, а повышение КЩФ, выявленное у трети боль¬
ных, — с наиболее высокими значениями ОК. Выявлена также прямая корреляция
между ОК и уровнем ПТГ в крови. Наиболее высокий ОК наблюдался у больных с
гиперпаратиреоидной субпериостальной резорбцией на рентгенограммах костей.
В исследованиях КЩФ в травматологии показано, что после перелома происходит
постепенное повышение уровня фермента, свидетельствующее об активации осте¬
областов, нарастающее до 13-й недели после травмы с последующим постепенным
снижением.Болезнь Педжета и гипертиреоз характеризуются повышением КТППК 1, в
то время как у женщин с дефицитом эстрогенов он остается в пределах нормы.
У онкологических больных повышение КТППК 1 наблюдается только при мета¬
стазах в кости и печень. Вместе с тем глюкокортикоидная терапия вызывает сни¬
жение КТППК 1, степень которого при лечении преднизолоном прямо зависит от
суточной дозы препарата.Для интерпретации результатов определения биохимических маркеров
формирования кости необходимо знать состояние резорбции кости. Особенно
трудна оценка повышения уровня биохимических маркеров формирования кости,
которая при сочетании с усилением резорбции свидетельствует, как правило, об
ускорении ремоделирования с потерей костной массы. Например, при гипертирео-
зе наблюдается увеличение ПИД более чем в 3 раза, указывающее на увеличение
резорбции и значительное ускорение ремоделирования. Вместе с тем ОК и КЩФ
повышаются незначительно, что свидетельствует об отставании процессов форми¬
рования кости от процессов резорбции.в основе возникновения постменопаузального остеопороза лежит дефицит
эстрогенов, который первично влечет активизацию процесса резорбции кости с
вторичным усилением процесса формирования вследствие спаренности обоих
процессов. Потери костной массы возникают в результате преобладания резорби-
рующих кость процессов и могут быть как быстрыми, так и медленными, в зави¬
симости от степени усиления резорбции и степени нарушения соотношения между
процессами ремоделирования кости. Именно поэтому для постменопаузального
остеопороза характерно увеличение таких маркеров резорбции, как ПИД, ДПИД,
КТТК 1 и ОПр, а также различной степени выраженности увеличение маркеров
формирования кости — ОК, КЩФ и КТПП. По соотношению изменения марке¬
ров резорбции и формирования можно судить о скорости костных потерь, пред¬
сказать риск развивающегося перелома кости, при котором находят снижение
266 БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯс^'-. OK и увеличение ДПИД и ТРКФ, а также выбрать оптимальную терапию (при
высокой скорости костного оборота предпочтительны препараты, подавляющие
резорбцию, а при низкой — стимулирующие формирование кости) и оценить ее
эффективность.Остеопороз при первичном гиперпаратиреозе развивается в результате первич¬
ного усиления процесса резорбции кости остеокластами под действием парати-
реоидного гормона и процесса формирования кости вследствие вторичной акти¬
визации остеобластов. Таким образом, при первичном гиперпаратиреозе имеет
место высокая скорость ремоделирования, которая неизбежно сопровождается
потерями костной массы и характеризуется значительным повышением уровня
как маркеров резорбции (ПИД, ДПИД), так и маркеров формирования кости (ОК
и КЩФ).Остеопороз при гипертиреозе, как и при первичном гиперпаратиреозе, развива¬
ется вследствие активизации остеокластов, т.е. первичного усиления резорбтивных
процессов в скелете. Изменения со стороны костного оборота и биохимических
маркеров резорбции и формирования аналогичны изменениям при первичном
гиперпаратиреозе.ОСТЕОПОРОЗ ПРИ ЭНДОГЕННОМ (БОЛЕЗНИ КУШИНГА) И ЭКЗОГЕННОМ
ГИПЕРКОРТИЦИЗМЕ, РАЗВИВАЮЩЕМСЯ ВСЛЕДСТВИЕ ДЛИТЕЛЬНОГО ПЕЧЕНИЯ
ГЛЮКОКОРТИКОИДАМИПатогенез возникновения костных потерь при избытке глюкокортикоидов
связывают с прямым подавлением глюкокортикоидами формирования кости
остеобластами, а также с увеличением резорбции кости вследствие активизации
остеокластов, вызываемой ПТГ. Его уровень повышается в ответ на гипокаль-
циемию (вторичный гиперпаратиреоз), возникающую в результате вызываемого
глюкокортикоидами нарушения всасывания кальция в кишечнике и снижения
реабсорбции кальция в почках. Таким образом, на тканевом уровне происходит
подавление формирования кости. При этом резорбция кости может быть либо
нормальной, либо усиленной, что и приводит к нарушению баланса между этими
двумя процессами в местах ремоделирования кости и соответственно к потере
костной массы.При остеопорозе, вызванном экзогенным и эндогенным гиперкортицизмом,
наблюдают снижение ОК и нормальный уровень КЩФ. Поскольку, по данным
гистоморфометрии, избыток глюкокортикоидов вызывает уменьшение количества
остеобластов, снижение ОК может бьггь обусловлено как подавлением синтеза ОК
активными остеобластами, так и уменьшением их количества. Гпюкокортикоиды
стимулируют продукцию остеобластами КЩФ, поэтому ее нормальные значения у
больных с остеопорозом можно объяснить комбинацией двух противоположных
влияний глюкокортикоидов на остеобласты (усилением продукции КЩФ каждой
клеткой и уменьшением количества продуцирующих клеток). Показано, что при
систематическом лечении глюкокортикоидами наблюдается выраженное сниже¬
ние не только ОК, но и КТППК 1, составляющее 48 и 38% соответственно, при этом
степень снижения КТППК 1-го зависит от дозы преднизолона. Глюкокортикоиды
подавляют синтез коллагена 1-го типа остеобластами. Значительных изменений
со стороны показателей резорбции кости при глюкокортикоидном остеопорозе не
выявлено.ИСПОЛЬЗОВАНИЕ БИОХИМИЧЕСКИХ МАРКЕРОВ ДЛЯ ОЦЕНКИ ЭФФЕКТИВНОСТИ
ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ СКЕЛЕТАДля большинства заболеваний скелета характерно ускорение ремоделирования
с усилением резорбции, поэтому для контроля лечения используют главным обра¬
зом маркеры резорбции кости. В исследовании ПИД и ДПИД после 3 мес лечения
БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ 267эстрогенами женщин с постменопаузальным остеопорозом выявлено снижение
резорбции кости. Более длительное лечение ведет к дальнейшему уменьшению
ДПИД, сопровождаемому нарастанием плотности кости. Лечение бисфосфонатами
женщин, страдающих остеопорозом, также ведет к прогрессирующему снижению
ДПИД с достижением нормальных величин к шестому месяцу лечения. Лечение
бисфосфонатами при болезни Педжета сопровождается закономерным снижением
ПИД, ДПИД^ ОПр и КЩФ, ДПИД нормализуется к 4-му, ПИД — к 5-му, ОПр — к
7-му, а КЩФ — только к 24-му месяцу терапии. Такое же отсроченное снижение
КЩФ характерно для гипертиреоидного остеопороза. На фоне лечения карбимазо-
лом, радиоактивным йодом, а также после тиреоидэктомии ПИД и ОК снижались
уже через месяц, в то время как КЩФ через месяц повышалась и снижалась лишь
через 4 мес. Возможно, такая динамика КЩФ обусловлена активацией репаратив-
ных процессов в скелете. Определение ПИД и ДПИД до и после удаления аденомы
паращитовидных желез демонстрирует хорошую эффективность операции.
Глава 5
Диагностика эндокринных
нарушенийГИПОТАЛАМУС-ГИПОФИЗЭндокринная система построена по иерархической схеме. В ней¬
ронах гипоталамуса вырабатываются рилизинг-гормоны, которые
под влиянием стимулов из ЦНС, механизмов обратной связи или
за счет циркадных ритмов периодически секретируют в сосудистые
сплетения рилизинг-гормоны. Рилизинг-гормоны, в СБОЮ очередь,
поступают в переднюю долю гипофиза и стимулируют там образова¬
ние тройных гормонов: соматотропного гормона (СТГ), пролактина
(ПРЛ), адренокортикотропного гормона (АКТГ), тиреотропного
гормона (ТТГ), фолликулостимулирующего гормона (ФСГ), лютеи-
низирующего гормона (ЛГ). В задней доле гипофиза синтезируются
вазопрессин (синоним — антидиуретический гормон) и окситоцин.
Каскадная схема организации гормональной активности учитывается
при лабораторной диагностике нарушений эндокринной функции.ГИЛОПИТУИТАРИЗМГипопитуитаризм — снижение функции передней доли гипофи¬
за — может проявляться как недостаточным синтезом одного, так и
отсутствием синтеза всех тройных гормонов. Это может быть след¬
ствием или недостаточности самих клеток гипофиза, или отсутстви¬
ем стимуляции со стороны гипоталамуса. Гипопитуитаризм может
быть врожденным или развиться в результате гипофизэктомии,
облучения, опухоли гипофиза, кровоизлияния или инфильтратив-
ного гранулематозного процесса.Лабораторный мониторинг при гипопитуитаризме:• Т_^, ТТГ, пролактин, тестостерон;• электролиты (гиперволемическаягипонатриемия):• анализ крови (нормохромная нормоцитарная анемия);• провокационные тесты.ОПУХОЛИ ГИЛОФИЗАОпухоли гипофиза составляют примерно 10% всех внутриче¬
репных опухолей. Симптомы связаны с локальным сдавлением,
нарушением секреции гомонов, гипопитуитаризмом. Аденома гипо¬
физа может быть нефункционирующей или функционирующей по
одному гормону с гипосекрецией других гормонов, как правило,
это болезнь Кушинга или акромегалия. Существует классификация
опухолей гипофиза по секретируемому гормону (табл. 5-1).
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 269
Таблица 5-1. Классификация опухолей гипофиза по секретируемому гормонуГормоныРаспространенность, %Пролактин35%СТГ20%Пролактин + СТГ7%АКТГ7%ЛГ/ФСГЛТГ1%Несекретирующие опухоли30%Лабораторный мониторинг при опухоли гипофиза следующий.• Определение ПРЛ, ТТГ, ФСГ, ЛГ.• Мониторинг кортизола.• Тесты стимуляции гормонов гипофиза.• Тест с сухоедением, если подозревается несахарный диабет (поражение зад¬
ней доли гипофиза).АКРОМЕГАЛИЯОсновная причина акромегалии — гиперсекреция СТГ (гормона роста) опухо¬
лью гипофиза, реже — эктопическая секреция СТГ или гиперпродукция соматоли-
берина (СТГ-рилизинг-фактор). Отличительные признаки заболевания — быстрое
старение, удлинение конечностей, сахарный диабет.Лабораторные исследованияИзолированное измерение СТГ может указать на повышенную секрецию
(норма — <8 нг/мл), однако СТГ секретируется непостоянно, имеет короткое
время полувыведения и многие факторы вызывают его повышение: физическая
нагрузка, гипогликемия и голодание, заболевания печени, почечная недостаточ¬
ность, стресс, неконтролируемый сахарный диабет.Скрининговый тест — определение содержания в сыворотке IGF-1 (ИФР-1, он
же соматомедин С или инсулиноподобный ростовой фактор'1). Его уровень отра¬
жает секрецию СТГ за 24 ч и может указать на гиперсекрецию СТГ.Подтверждающий тест — глюкозотолерантный (ГТТ) с определением СТГ:• необходимо брать кровь, не тревожа больного (устанавливают в вену каню¬
лю за 1 ч до теста);• кровь исследуют на О, 30,60, 90,120 и 150-й минуте после нагрузки 75 г глю¬
козы;• исследуют СТГ, инсулин и глюкозу.Интерпретация;• норма — СТГ составляет менее 2 нг/мл;• акромегалия (гипотиреоз, болезнь Кушинга, плохоконтролируемый сахар¬
ный диабет) — СТГ составляет более 2 нг/мл.ДИАГНОСТИКА ЗАБОЛЕВАНИЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Тиреоидная системаВысшие отделы регуляции тиреоидных гормонов включают систему
«гипоталамус-передняя доля гипофиза». Тиреотропин-рилизинг-гормон (ТРГ),
или тиреолиберин, синтезируется в ядрах гипоталамуса, секретируется в импульс¬
ном режиме, стимулирует синтез и секрецию тиреотропного гормона (ТТГ). ТТГ
стимулирует синтез тиреоидных гормонов — тироксина (Т^) и трийодтирони-
на (Т^), увеличивает размеры и количество фолликулов в щитовидной железе.
270 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙПродолжительная ТТГ-стимуляция сопровождается усилением васкуляризации
и гипертрофией щитовидной железы. Контроль над взаимодействием гипофиза и
гипоталамуса происходит за счет механизма обратной связи с участием тиреоид-
ных гормонов. Отрицательная обратная связь на уровне гипофиза проявляется в
том, что и Tj подавляют биосинтез и секрецию ТТГ. Гипофизарная секреция ТТГ
очень чувствительна к изменениям концентрации и Т, в сыворотке. Снижение
или повышение этой концентрации на 15-20% приводит к обратным сдвигам в
секреции ТТГ. Максимальное торможение секреции ТТГ возникает спустя дли¬
тельное время после достижения максимальной концентрации Т, и Т^ в сыворотке,
так же как резкое падение уровня тиреоидных гормонов после удаления щитовид¬
ной железы приводит к восстановлению базальной секреции ТТГ и его реакции
на ТРГ через несколько недель или даже позднее. Это необходимо помнить при
оценке состояния гипофизарно-тиреоидной системы у больных, подвергаемых
оперативному вмешательству по поводу заболеваний щитовидной железы.Многие факторы влияют на секрецию ТТГ и тиреоидных гормонов. Голодание
и хронические нетиреоидные заболевания уменьшают активность перифериче¬
ских тканей по преобразованию Т^ в активный гормон Т.,. Стресс, соматостатин,
эстрогены, глюкокортикоиды, охлаждение также влияют на образование ТТГ.
В кровотоке гормоны щитовидной железы связаны с циркулирующими белками
плазмы, период полувыведения гормонов составляет около 7 дней. Основным
белком, связывающим тироксин, является тироксиисвязывающий глобулин
(ТСГ) (табл. 5-2).Таблица 5-2. Характеристика и Tj в системе циркуляцииХарактеристикаТироксинТрийодтиронинМолекулярная масса777651Процент образования в щитовидной железе10020Время полувыведения из крови, дни70,75Общее содержание в плазме, нмоль/л (мкг/л)51-142(40-110)1,2-3,4 (0,75-2,2)Процент свободного0,030,3Процент связанного с белками плазмы99,9799,7Процент связанного с ТСГ70-7570-75Процент связанного с альбумином5-1020-25Процент связанного с транстиретином15-20О-бТСГ захватывает около 75% циркулирующих Т^ и Т,. Транстиретин, или
тироксиисвязывающий преальбумин (ТСПА), связывает около 15% Т^ и 5% Т,,
альбумин - около 10% Т^ и 20% Т,. Различия в связывании Т^ и Т3 объясняются
тем, что при физиологических pH Т^ ионизирован, а Т3 нет. Примерно 99,97%
циркулирующего Т^ и 99,7% Т3 связано с белками. Принято считать, что в таком
состоянии они не обладают метаболической активностью, но находятся в равно¬
весии со свободными фракциями гормонов. Тяжелые нетиреоидные заболевания,
а также голодание сопровождаются быстрым и значительным падением уровня
ТСПА в сыворотке.Нет сомнений, что свободный Т^ (свТ^ и свободный Tj (свТз) у'іаствуют в
метаболизме, так как доступны для клеточных рецепторов. Хотя тироксин —
основной продукт щитовидной железы, он не является наиболее активной фор¬
мой, Т3 — более сильный гормон, при нормальной функции щитовидной железы
около 15-20% циркулирующего Т, поступает из щитовидной железы, большая же
часть Т, образуется в результате периферического дейодирования Т^. При взаи¬
модействии с клетками-мишенями из связанного состояния гормоны лучше всего
освобождаются из альбумина. Альбумин-гормональный комплекс быстрее диссо¬
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 271циирует, чем комплексы с тег и ТСПА. Поскольку с альбумином связан больший
процент Т.^ (20-25%), чем (5-10%), то клиренс Т3 примерно в 25 раз выше, чем
клиренсГИПЕРТИРЕОЗФормы гипертиреоза (тиреотоксикоза) представлены в табл. 5-3.Таблица 5-3. Формы гипертиреоза (тиреотоксикоза)ФормыраспространенныеДиффузный токсический зоб* (базедова болезнь). ТТГ-продуцирующая опухоль гипофиза.
Токсический многоузловой зоб. Хориокарцинома или пузырный занос.редкиеТоксическая аденома
Искусственный тиреотоксикоз
Подострый тиреоидит.
Бессимптомный тиреоидитСтрума яичника (или яичка) или средостения.
Метастазирующий рак щитовидной железы из
А-клеток*Зоб (струма) — диффузное узловое или мноі’оузловое увеличение щитовидной железы.Диффузный токсический зоб (ДТЗ, базедова болезнь) — наиболее рас¬
пространенное заболевание щитовидной железы, возникающее из-за повышенной
продукции тиреоидных гормонов. ДТЗ характеризуется одним или несколькими
признаками: зобом, экзофтальмом, тахикардией и инфильтративной дермопатией
(претибиальной микседемой). Гипертиреоз имеет иммунологическую природу: в
сыворотке присутствуют стимуляторы щитовидной железы, объединенные под
общим названием — тиреоидстимулиругощие иммуноглобулины (ТСИ).ТСИ, как правило, представляют собой 7S-IgG и являются антителами к ТТГ-
рецегггору, расположенному на тиреоцитах. Наряду с ТСИ-антителами у больных
с ДТЗ часто обнаруживают антитела к другим тиреоидным антигенам: тиреопе-
роксидазе, тиреоглобулину, коллоидному компоненту, микросомальной фракции,
нуклеарному компоненту. Причиной ДТЗ не является гиперпродукция ТТГ, наобо¬
рот, при этом заболевании продукция ТТГ снижена.Диагноз ДТЗ при выраженной клинической картине не вызывает затруднений.
Для ДТЗ характерно повышение Т, и Т^ и снижение ТТГ. Обычно базальный уро¬
вень Т^ повышен в большей степени, чем уровень Т^ (иногда общий Т^ и свТ^ быва¬
ют в пределах нормы). Отсутствие снижения ТТГ исключает диагноз ДТЗ. При
диагностике ДТЗ большое значение имеет определение титра тиреостимулирую-
щих антител. ТСИ обнаруживают у 80-90% больных с нелеченым ДТЗ. Величина
их процентного содержания не определяет тяжести тиреотоксикоза, не коррели¬
рует с уровнем тиреоидных гормонов, но может служить критерием успешности
медикаментозной терапии. Прекращение лечения при повышенном уровне ТСИ
ведет к рецидиву заболевания. Больным, получающим тиреостатическую терапию,
по-видимому, следует определять ТСИ в начале терапии и перед предполагаемой
отменой лечения. При длительно повышенном уровне ТСИ больных целесообраз¬
но направлять на оперативное лечение, так как длительный тиреотоксикоз может
вызвать необратимые нарушения сердечной деятельности.Токсическая аденома и токсический многоузловой зоб (один или несколь¬
ко узлов в щитовидной железе) начинают функционировать автономно. Избыток
Т^ и Т3 ингибирует систему «гипоталамус-гипофиз», блокирует образование ТТГ и
уменьшает секрецию тиреоидных гормонов остальной частью железы. Поскольку
функционирование узлов часто сопровождается избирательным повышением
уровня Т,, при лабораторной оценке следует включать определение общего уровня
Т^ в сыворотке в скрининговые программы.Искусственный тиреотоксикоз. Этот синдром гипертиреоза развивается
в результате намеренного приема больших доз тиреоидных гормонов людьми
272 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ(часто из медицинского персонала), желающими похудеть или иметь симптомы
системной патологаи. Причиной может быть случайная передозировка тиреоид-
ных гормонов при лечении. Лабораторные данные варьируют. Если тиреотоксикоз
связан с приемом Т^, то уровень его в сыворотке будет повышен, если же с приемом
Т3, то будет снижен. Концентрация будет повышена в любом случае, особенно
при приеме Т3. Зоб отсутствует.Различные формы тиреоидитов обычно проходят в своем развитии гиперти-
реоидную стадию. Этот вопрос обсуждается ниже.Опухоль гипофиза индуцирует избыточную продукцию тиреоидных гормонов
и может приводить к вторичному гипертиреозу. Гипертиреоз, возникающий
при метастатической эмбриональной карциноме или хориокарциноме, связан с
тем, что по своим свойствам хорионический гонадотропин человека (ХГЧ) напо¬
минает ТТГ. Струма яичника, как правило, представляет собой доброкачественную
тератому яичников, состоящую преимущественно из тиреоидной ткани. Примерно
у 5% пациентов со струмой яичника развивается гипертиреоз. Отдаленные мета¬
стазы высокодифференцированного рака щитовидной железы из А-клеток могут
содержать достаточное количество гиперфункционирующей тиреоидной ткани,
чтобы вызвать Т^- или T^-tokchkos.ГИПОТИРЕОЗПіпотиреоз — характерная реакция на недостаточность тиреоидных гормонов
у взрослых.Врожденный первичный гипотиреоз — синдром функциональной недо¬
статочности щитовидной железы, формирующийся в силу разнообразных причин
внутриутробного развития и проявляющийся после рождения ребенка.Основные принципы неонатальной скрининг-диагностики врожденного
гипотиреозаБазируется неонатальный скрининг на лабораторной оценке ТТГ. После рож¬
дения концентрация ТТГ резко возрастает, что является компенсаторным меха¬
низмом адаптации организма новорожденного к новым условиям окружающей
среды. У здоровых новорожденных к 4-м. а у недоношенных — к 7-м суткам жизни
содержание ТТГ становится ниже 20 мЕД/л, тогда как при гипотиреозе его уровень
остается патологически высоким. На этом принципиальном отличии основана
скрининговая диагностика, охватывающая всех новорожденных и осуществляе¬
мая с применением специального лабораторного обеспечения. Для исследования
необходима капиллярная кровь, получаемая из пятки ребенка (на 4-5-е сутки у
доношенных, на 7-14-е сутки — у недоношенных), которой пропитывают марки¬
рованный бумажный носитель. После подсушивания на воздухе бланк отправляют
почтой в лабораторию на анализ ТТГ. Все случаи повышения ТТГ выше порогово¬
го (20 мЕД/л) являются подозрительными на врожденный гипотиреоз и требуют
повторной проверки (ретестинга) на бланке. В случае повторного обнаружения
надпороговой концентрации гормона лаборатория уведомляет поликлинику,
осуществляющую патронаж новорожденного, о необходимости дообследования
путем оценки уровня ТТГ уже не в капиллярной (на бумаге), а в венозной крови
одновременно с определением в сыворотке содержания Т3 и Т^.Если в ходе повторного анализа на бумаге получены значения выше порого¬
вого, но менее 50 мЕД/л, ожидают результата в сыворотке крови без назначения
терапии. Однако если в первом тесте выявлено значение более 50 мЕД/л, одно¬
временно с забором венозной крови следует сразу же, т.е. до получения сыворо¬
точных результатов, назначить лечение левотироксином натрия (тироксином),
поскольку вероятность врожденного гипотиреоза весьма реальна. При получении
уже в сыворотке крови низких показателей тиреоидных гормонов наряду с уров¬
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 273нем ТТГ более 50 мЕД/л устанавливают диагноз «врожденный гипотиреоз» и
ранее назначенное лечение продолжают. На основании многолетнего массового
обследования накоплен достаточный опыт, обнаружена немалая частота так назы¬
ваемых ошибок скрининга. Оказалось, что по разным причинам в 3-9% случаев
имеют место ложноотрицательные результаты, когда после рождения определяют
нормальные показатели ТТГ, но позднее выявляют заболевание. Поздняя диагно¬
стика, безусловно, отражается на сроках начала терапии, что ведет к неизбежному
развитию необратимых последствий со стороны интеллекта ребенка и снижает
эффективность лечения.Первичный гипотиреоз — это, как правило, аутоиммунное заболевание, раз¬
вивающееся вследствие тиреоидита Хашимото. Последний приводит к фиброзному
перерождению щитовидной железы, утрачивающей свою функцию. Симптомами
первичного гипотиреоза являются одутловатость и отеки вокруг глаз, опущение
век из-за сниженного адренергического тонуса, грубая, шелушащаяся толстая
кожа, избыточная масса тела, связанная с накоплением в мягких тканях мукополи-
сахаридов и жидкости, В результате недостатка тиреоидных гормонов угнетаются
все виды обменов, подавляется высшая нервная деятельность, что особенно ощу¬
тимо в детском возрасте.Диагноз гипотиреоза, как правило, не вызывает затруднений. Прямое определе¬
ние в крови ТТГ, Тз и Т^ дает дополнительную информацию к клинической карти¬
не. Наибольшую диагностическую ценность при гипотиреозе имеет определение
ТТГ, уровень которого значительно, иногда в десятки раз, возрастает.Ятрогенный гипотиреоз развивается после радиойодотерапии или операции
по поводу гипертиреоза. Гипотиреоз, развивающийся в ходе лечения пропилтио-
урацилом, метимазолом и йодидами, обычно проходит после отмены лечения.Гипотиреоидный зоб связан с эндемическим недостатком йода, встречается
в регионах, где нет йодированной соли. Недостаточность йода приводит к тормо¬
жению синтеза гормонов в щитовидной железе и соответственно к выбросу ТТГ,
под влиянием которого щитовидная железа увеличивается и жадно поглощает йод.
При тяжелой йодной недостаточности возникает гипотиреоз.Вторичный гипотиреоз развивается в результате нарушения функции гипо-
таламо-гипофизарной системы: либо из-за недостаточной секреции ТРГ гипотала¬
мусом, либо из-за прекращения секреции ТТГ гипофизом. Вторичный гипотиреоз
встречается значительно реже первичного, сопровождается, как правило, патоло¬
гией других эндокринных органов, контролируемых гипоталамо-гипофизарной
системой. Уровень ТТГ при вторичном гипотиреозе низкий, тогда как при пер¬
вичном — очень высокий. При вторичном гипотиреозе содержание холестерина в
сыворотке, как правило, снижено, а при первичном — повышено.ЗУТИРЕОИДНЫЙ ЗОБЭндемический нетоксический зоб — увеличение щитовидной железы, обу¬
словленное сниженной продукцией тиреоидных гормонов и не сопровождающееся
клиническими признаками нарушения ее функции. Если это состояние вызвано
недостаточным потреблением йода с пищей, его называют эндемическим (йодо¬
дефицитным) зобом. Эутиреоидный зоб — наиболее распространенная форма
увеличения щитовидной железы, часто развивается в начале пубертатного перио¬
да, во время беременности (обусловлено увеличенной потребностью организма в
гормонах щитовидной железы), при выраженных физических нагрузках, в период
менопаузы.Увеличение размера щитовидной железы происходит за счет повышения коли¬
чества и размеров клеток фолликулярного эпителия (паренхиматозный зоб).
Такой механизм рассматривают как физиологическую реакцию на недостаточ¬
ность йода. В качестве ответной реакции организма на длительную йодную недо¬
274 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙстаточность включается ряд механизмов адаптации, главные из которых — повы¬
шение тиреоидного клиренса неорганического йода, гиперплазия щитовидной
железы, усиление продукции тиреоглобулина, модификация йод со держащих
аминокислот в железе, увеличение синтеза в железе Т^, повышение превращенияв Т3 в периферических тканях.В районах с тяжелым дефицитом йода в окружающей среде важное профилак¬
тическое значение имеют скрининговые исследования первичного гипотиреоза.
Скрининг осуществляют путем определения уровня ТТГ, позволяя выявить
заболевание у людей без каких-либо других его проявлений. Повышенный уро¬
вень ТТГ является первым признаком дефицита гормонов щитовидной железы
в организме.ТИРЕОИДИТТермин «тиреоидит» объединяет заболевания щитовидной железы, различаю¬
щиеся по этиологии, патогенезу, обязательным компонентом которых является
воспаление.Аутоиммунный тиреоидит (АИТ, хронический лимфоцитарный тиреои-
дит, тиреоидит Хашимото) - хроническое воспаление щитовидной железы
с лимфоцитарной инфильтрацией, относимое на счет аутоиммунных факторов.
В основе патогенеза АИТ лежит изменение иммунокомпетентных клеток, а именно
регуляторных Т-клеток. в ответ на повреждающее действие аутоагрессии наблю¬
дается гиперплазия щитовидной железы, поддерживающая состояние эутиреоза,
а иногда сопровождающаяся признаками гиперфункции. Длительный процесс
аутоагрессии приводит к постепенному снижению функциональной активности
щитовидной железы — гипотиреозу.На ранних этапах заболевания у больных определяют нормальный уровень Т^
и высокий титр тиреоидных антимикросомальных антител. На последующих ста¬
диях болезни у больного развивается гипотиреоз со снижением уровня Т^. На этих
стадиях антитела обычно уже не выявляются.Диагностика. До недавнего времени обнаружение антител к тиреопероксидазе
(или микросомальному антигену), особенно при большом титре, служило диа¬
гностическим критерием АИТ. Сейчас установлено, что аналогичные изменения
наблюдаются при ДТЗ и некоторых формах рака. Именно поэтому эти иссле¬
дования помогают провести дифференциальную диагностику с нетиреоидными
нарушениями и играют роль вспомогательных, но не абсолютных. Пункционная
биопсия, как правило, позволяет на основании цитологических особенностей
уточнить диагноз АИТ.Подострый тиреоидит (гранулематозный или гигантоклеточный) —
острое воспалительное заболевание щитовидной железы, имеющее, как правило,
вирусную этиологию. При морфологическом исследовании щитовидной железы
не обнаруживается лимфоидная инфильтрация, характерная для тиреоидита
Хашимото, но постоянно отмечается инфильтрация гигантскими клетками. На
ранних стадиях обычно развивается гипертиреоз из-за разрушения фолликулов
и элиминации из них гормонов при воспалении железы. Подострый тиреоидит
проходит спонтанно, обычно через несколько месяцев, иногда рецидивирует, к
гипотиреозу приводит редко.в начале заболевания отмечаются повышенный уровень Т^, снижение погло¬
щения радиоактивного йода (часто до нуля), высокая СОЭ. Высокий лейкоцитоз
для под острого тиреоидита нехарактерен, так как заболевание имеет вирусную
этиологию. Через несколько недель уровень Т^ уменьшается, но поглощение йода
остается низким.Бессимптомный тиреоидит — подострое заболевание, чаще встречающееся у
женщин, нередко в послеродовом периоде (до 10% родильниц), характеризуется
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 275небольшим увеличением щитовидной железы, отсутствием ее болезненности и
наличием спонтанно проходящей фазы гипертиреоза длительностью до нескольких
месяцев, сменяющейся транзиторным гипотиреозом с восстановлением в конце
концов эутиреоидного состояния. Этиология неясна, но на долю этого заболевания
приходится подавляющее большинство случаев послеродового гипотиреоза.в биоптатах железы, как при тиреоидите Хашимото, обнаруживают лимфоид¬
ную инфильтрацию. Иногда в сыворотке присутствуют антитела к тиреоглобулину,
персистирующие до 9 мес, поэтому это заболевание относят к вариантам АИТ.
Повышение тиреоидных гормонов при этом сочетается с очень низким поглоще¬
нием йода щитовидной железой. Уровень лейкоцитов при этой патологии нахо¬
дится в пределах нормы, СОЭ нормальная, глазные симптомы отсутствуют.Тиреотропный гормонОпределение ТТГ в плазме крови является основным методом диагностики заболе¬
ваний тиреоидного профиля. Нормальный базальный уровень ТТГ у негоспитализи-
рованных пациентов исключает гипертиреоз и первичный гипотиреоз. У беременных
и женщин, принимающих контрацептивы, нормальный уровень ТТГ и повышенные
уровни Т3 и Т^ имеют место при эутиреозе. Нормальный уровень ТТГ в утренние часы
в случае неизмененных значений Т3 и Т^ однозначно позволяет подтвердить эутирео-
идное состояние человека. Отсутствие первичного заболевания щитовидной железы
можно констатировать у любого пациента, имеющего нормальные ТТГ и Т^ в сочета¬
нии с изолированным отклонением (в любую сторону) уровня Т3.При первичном гипотиреозе наблюдается снижение концентрации Т3 и Т^ и
патологическое увеличение секреции ТТГ. При вторичном гипотиреозе снижается
секреция ТТГ гипофизом. Щитовидная железа получает малое количество сти¬
мулов для секреции Т3 и Т^. При первичной гиперфункции щитовидной железы
частично или полностью подавляется секреция ТТГ. Высокочувствительные мето¬
ды способны дифференцировать подавленную и нормальную секрецию ТТГ. При
частичном подавлении секреции ТТГ для уточнения диагноза можно рекомендо¬
вать проведение ТРГ-стимулирующего теста.Если концентрация ТТГ находится в диапазоне от 0,1 до 0,4 или от 5 до 10 мЕД/л
(серая зона), необходимо провести анализ свободных фракций тиреоидных гор¬
монов. Патологический уровень ТТГ (ниже 0,1 или выше 10 мЕД/л) параллельно с
повышенными уровнями Т4 (свТ^) и/или Т3 (свТз) имеют место при гипертиреозе,
пониженный уровень Т^ (свТ^) подтверждает наличие гипотиреоза.У тяжелых больных при нормальной концентрации Т^ (свТ^ и Т, (cbTj) продук¬
ция ТТГ может нарушаться. Секреция ТТГ подавляется при лечении левотирокси-
ном натрия (L-тироксином*) и в ходе постоперационной заместительной терапии.
Нормальные или повышенные уровни ТТГ в этих случаях свидетельствуют о
малой дозе препарата, периферической резистентности к тиреоидным гормонам
или наличии антител к гормонам щитовидной железы.В ходе заместительной терапии при гипотиреозе оптимальный уровень ТТГ
должен находиться в пределах нижних значений референтных величин.При лечении тиреостатическими препаратами концентрация ТТГ должна соот¬
ветствовать референтным значениям (табл. 5-4, 5-5).Таблица 5-4. Референтные пределы ГГГОбследуемая группа, материалРеферентные пределыСкрининг по капле цельной крови у новорожденныхНиже 20 мЕД/лДети и взрослые (сыворотка, плазма крови)0,4-5,0 мЕД/л* (зависит от метода и набора)* Нижняя граница для ТТГ четко не определена. У некоторых людей могут наблюдаться низкие
значения ТТГ без клинически выраженных симптомов гипертиреоза.
276ДИАГНОСТИКА ЭНДОКРИННЫХ HAPVmEHHCiтТаблица 5-5. Базальные значения ТТГ и интерпретацияКонцентрация ТТГ,
мЕД/л<0,10.1-0,40.4-5,05-10>10КомментарийПри повышенных концентрациях свТ^ или cbTj — гипертиреоз с подавленной
регупяцией гипофизарно-тиреоидной системыНиже нормы. Необходимо определить свТ^ и Т,Эутиреоидный диапазон. Могут проявляться функциональные нарушения щито¬
видной железыВыше нормы. Рекомендуют проведение ТРГ-теста для подтверждения или исклю¬
чения латентной формы гипотиреоза.Дефекты усвояемости йода, ярко выраженная недостаточность йода, состояние
после лечения радиоактивным йодом или операции на щитовидной железе.
Опухоли гипофиза, продуцирующие ТТГ Первичный гипотиреоз, опухоли гипофиза, продуцирующие ТТГСниженный уровень ТТГ может сопровождать общие заболевания в пожилом
возрасте, акромегалию, синдром Кушинга, психогенную анорексию, вторичную
аменорею, задержку полового развития, эндогенные депрессии, хроническую
почечную недостаточность, цирроз печени, тяжелые общие заболевания, прием
глюкокортикоидов, апоморфина, допамина (дофамина), верапамила, фенитоина
(дифенина).Повышенный уровень ТТГ может наблюдаться после тяжелых физических
нагрузок, диагностических тестов с использованием приема амиодарона, хлор-
промазина, галоперидола, метоклопрамида, препаратов, содержащих йод.Тироксин, свободный тироксинУровень в сыворотке — основной аналитический параметр, дающий четкое
представление о функции щитовидной железы (табл. 5-6). Только 0,02-0,05%
циркулирует в крови в несвязанном с белками состоянии. Концентрация в сыво¬
ротке зависит не только от скорости секреции, но и от изменения связывающей
способности белков, при изменении связывания в сторону альбумина клиренс
увеличивается, и наоборот.Изолированное повышение общего на фоне нормальных значений ТТГ и
может быть редкой находкой у пациента с нормальной тиреоидной функцией, но
врожденной особенностью ~ избыточной печеночной продукцией белков — пере¬
носчиков тиреоидных гормонов.Уровень свТ^ более надежно, чем общий Т^, свидетельствует о тиреоидном ста¬
тусе пациента.При гипертиреозе уровни Т^ и/или Тз повышены, а уровень ТТГ понижен.При изолированном Т3 гипертиреозе уровень свТ^ и общего Т^ в пределах
нормы.На начальной стадии гипотиреоза уровень свТ^ понижается раньше, чем общий
Т^. Диагноз подтверждается повышением уровня ТТГ.Повышенный уровень свТ^ не всегда свидетельствует о нарушении функции
щитовидной железы. Это может быть следствием приема некоторых лекарствен¬
ных препаратов или тяжелых общих заболеваний. В этих случаях рекомендуют
проведение дополнительных тестов (общего Т^, ТТГ, тег, ТРГ-тест).Нормальный уровень Т^ не является гарантией нормальной тиреоидной функ¬
ции. Т^ в пределах нормы может быть при эндемическом зобе, супрессивной или
заместительной терапии, при скрытой форме гипертиреоза или гипотиреоза.При гипотиреозе левотироксин натрия (L-тироксин*) способствует нормализа¬
ции ТТГ и Т^. Повышенные концентрации общего Т^ и свТ^ и концентрация ТТГ
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 277в районе нижнего предела нормы наблюдаются при подборе адекватной замести¬
тельной терапии.Во время тиреостатической терапии зфовень в районе верхнего предела
нормы свидетельствует об адекватном выборе поддерживающей дозы.Таблица 5-6. Факторы, влияющие на уровень и свТ^ПричинаОбщий ТсвТ^КомментарийУвеличение связывающей способности ТСГПрием оральных контрацептивовТ-/ІМожет вызвать значительное повышение
общего Т^, но не свТ^Генетически повышенная связы¬
вающая емкостьт-Встречается у 1 из 40 000-75 ООО паци¬
ентовБеременностьтіПри беременности снижение свТ^ связано
с повышением ТСГНоворожденныет(Т)Незначительное повышение свТ^ связано
с повышением ТТГАктивная форма гепатитат(Т)Снижение скорости распада ТСГСнижение связывающей способности ТСГГенетически обусловленная низкая
связывающая способностьі-РедкоЦирроз печени(і)t. (і)Снижение ТСГ пропорционально степени
декомпенсацииИзменение концентрации альбуминаЭутиреоидный избыток Т^Т-Редкое семейное нарушение с увеличени¬
ем до 50 раз связывания Т^ альбуминомСелективная протеинурия с поте¬
рей альбумина{І}-Уровень ТСГ в норме, альбумин сниженИнгибиторы связыванияЭутиреоидный избытокTЛечение гепарином через активацию
липопротеинлипазы увеличивает сво¬
бодные жирные кислоты (СЖК). которые
блокируют связывание альбумином
гормоновДиабетический кетоацидозіTСЖК Т при кетоацидозе и голоданииГолодание-TАцетилсалициловая кислота-/{і)TУменьшает связывание с ТОПАФенитоин, фенобарбитал, карба-
мазепиніiУменьшают связывание Т^ с ТСПА и спо¬
собствуют распаду Т^ в печениАмиодаронViT/iЭффекты разнонаправленные в зависи¬
мости от исходного обеспечения йодом и
состояния ЩЖСниженный уровень — гипотиреоз.• Первичный гипотиреоз при аутоиммунном тиреоидите, после операции по
поводу удаления зоба, после приема йодсодержащих лекарственных препа¬
ратов.• Тиреостатическая терапия.• Генетические формы дисгормоногенеза.• Ярко выраженный дефицит йода.• Вторичный (гипофизарный) гипотиреоз.Повышенный уровень — гипертиреоз.• Локализованная аденома или рассеянные автономные клетки.• Диффузный токсический зоб (базедова болезнь).
РЩіШ?,-г 278 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИИ• Ранняя стадия подострого тиреоидита или тиреоидита Хашимото,- • Острый гипертиреоз.жштшПрием препаратов, содержащих йод (рентгеноконтрастных препаратов).• Опухоли гипофиза.• Трийодтиронин (Т3), свободный Т.^ (свТз).• Т.^ — основной биологически активный тиреоидный гормон.Только 0,1-0,3% Т, циркулирует в крови в свободном состоянии, около 99,7%
Т, связано с белками сыворотки. Аффинность Т3 к сывороточным белкам в 10 раз
ниже, чем Т^, поэтому уровень свТз имеет не такое большое диагностическое зна¬
чение, как уровень свТ^. Функцию щитовидной железы можно оценить с помощью
определения как общего Т3, так и cbTj.превращается в в периферических тканях. Если этот процесс замедляется,
то практически параллельно уменьшаются уровни общего Т3 и cbTj. Причинами
снижения могут быть тяжелые общие заболевания, прием лекарственных препара¬
тов (глюкокортикоидов, пропранолола, амиодарона), преклонный возраст.У мужчин старше 60 лет и женщин старше 70 лет уровень Т3 на 10-50% ниже,
чем у молодых. Это происходит в результате снижения скорости периферического
превращения в Т3.Во время беременности (особенно в III триместре) концентрация Т3 повышается
в 1,5 раза. После родов уровень Т3 снижается в течение недели.При дефиците йода наблюдается компенсаторное повышение общего Т3 и свТд.
Обеспечение достаточным количеством йода влечет нормализацию Т.^. Никакого
лечения этим людям не требуется. Неверная трактовка повышенного уровня Т^,
невзирая на нормальный ТТГ и иногда даже сниженный Т^, как тиреотоксикоз
(Т3-Т0КСИК03) может привести к необоснованному назначению тиреостатиков, что
является грз^бой ошибкой.При начальных стадиях развития гипотиреоза уровни общего Т3 и свТд могут
длительное время находиться в районе нижнего предела нормы за счет повышен¬
ного периферического превращения в Т3.Определение уровней Т3 и свТз проводят при дифференциальной диагностике
Тз-гипертиреоза, начальной стадии токсической аденомы и многоузлового зоба,
рецидивов гипертиреоза на фоне супрессивной терапии левотироксином.Нормальный уровень Т3 может быть при скрытых функциональных дефектах
тиреоидной функции, при гипотиреозе, компенсированном повышенным превра¬
щением в Т3.Во время лечения зоба или послеоперационной заместительной терапии левоти¬
роксином натрия уровни ТТГ и Т3 измеряют для предупреждения передозировки.
При лечении гипотиреоза левотироксином натрия (L-тироксином*) повышение Т3
значительно меньше по сравнению с Т^. При введении больших доз левотирокси-
на натрия (L-тироксина*) ТТГ подавляется до нерегистрируемых значений. Для
исключения передозировки лекарственных препаратов проводят анализ уровня
Т3, который должен находиться в пределах нормы. В начале курса тиреостатиче-
ской терапии уровень Т3 может возрастать в результате процессов компенсации.Сниженный уровень Т3.• Гипотиреоз, компенсирующего повышения уровня Т3 недостаточно для нор¬
мализации тиреоидного статуса.• Длительная тиреостатическая терапия,• Возрастное снижение превращения Т^ в Т3.• Хронические тяжелые заболевания.Синдром низкого Tj характеризуется сниженной концентрацией общего Т.^ и
CBT3. Наблюдается при нейрогенной анорексии, ХПН, декомпенсированном цир¬
розе печени, поздних стадиях опухолевых заболеваний, острой сердечной и легоч¬
ной недостаточности. За синдромом низкого Т3 следует снижение Т^.
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 279Повышенный уровень Т3.• Гипертиреоз, непропорциональное повышение Т.^ относительно встречает¬
ся у пожилых при функциональной автономии щитовидной железы.• Тз-гипертиреоз, в 5-10% случаев повышен только уровень Т.^ (наблюдается
при йодном дефиците).• Нарушения связывающей емкости белков (свТ., в норме).• Прием лекарств, содержащих Т^,Большое значение придается сопоставлению результатов лабораторных иссле¬
дований со сканированием железы, цитологическим исследованием биоптатов и
клиническим состоянием больных, в некоторых случаях биохимическая ситуация
может быть более сложной, что потребует более развернутой оценки гормональ¬
ного статуса, в некоторых случаях еще сохраняется оценка функции щитовидной
железы с использованием стимулирующих тестов.Антитела при заболеваниях щитовидной железыИзвестно несколько органоспецифических антигенов щитовидной железы, про¬
тив которых вырабатываются антитела. Наиболее изученными являются тирео-
глобулин (ТГ), тиреоидная пероксидаза (ТПО), являющаяся основным компонен¬
том микросомальной фракции тиреоцитов, и рецепторы к тиреотропному гормону
(рТТГ). Сравнительные данные о частоте и выраженности этих видов антител при
заболеваниях с нарушением тиреоидной функции представлены в табл. 5-7.Таблица 5-7. Тиреоидспецифические антитела при заболеваниях щитовидной железыЗаболеваниеАнтителаa-RTSHанти-ТПОанти-ТГ%МЕ/л%МЕ/л%МЕ/лТиреоидит ХашимотоДо 2515-2590-95>100050<5000Гипотиреоз (не аутоиммунный)<1015-40010^0<1000Базедова болезнь {начальная
стадия)80-85<5070-75300-
10 00030<1000Базедова болезнь (прогресси¬
рующая стадия)40-6015-7060-70150-100020<1000Диффузный или узловой зоб
(эутиреоз)<1015-2510-20<10005<1000Узловой токсический зоб<1015-25Аденома<1015-2515-25<100010400Карцинома щитовидной железы1015-5010-25<1000Здоровые люди<215-251-5<50001-5<200АУТОАНТИТЕЛА К РЕЦЕПТОРУ ТТГЧасть анти-рец.ТТГ антител могут имитировать ТТГ и связываться с рецепто¬
ром ТТГ, а другая часть связывает свободный ТТГ в сыворотке крови. Показано,
что продукция антител может повышаться при вирусной инфекции или связыва¬
нии вируса с рецептором. Антитела к рецептору ТТГ, в свою очередь, можно раз¬
делить на четыре группы,• Антитела, связывающиеся с рецептором и имитирующие функцию ТТГ. —
тиреоидстимулирующий иммуноглобулин (ТСИ, тиреоидстимулирующие
антитела — TCAt).• Если антитела связываются с рецептором с большей аффинностью, чем природ¬
ный лиганд (ТТГ), тиреоидные клетки постоянно стимулируются и уровни Т_, и
Т, возрастают — длительно действующий тиреоидный стимулятор (LATS).
280 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ• ТТГ стимулирует рост клеток, этот эффект может быть вызван аутоантите¬
лами — антителами, стимулирующими рост щитовидной железы (TGAt или
иммуноглобулин, стимулирующий рост щитовидной железы).• Антитела, связываемые с ТТГ-рецептором и блокирующие биологическую
активность ТТГ по стимуляции щитовидной железы, — связывающиеся с
рецептором ингибирующие антитела (TBAt или тиреоидсвязывающиеся
ингибирующие антитела — TBI). В результате клетки щитовидной железы
становятся нечувствительными к ТТГ,Клинико-диагностическое значениеОпределение a-RTSH используют при диагностике диффузного токсического
зоба (Базедовой болезни). В начальной стадии гипертиреоза a-RTSH обнаружи¬
ваются в 80-85% слз^аев, на более поздних стадиях заболевания уровень антител
снижается на 40-60%, при выздоровлении они исчезают.У пациентов с эутиреоидным зобом, острым, подострим и хроническим тиреои-
дитом a-RTSH наблюдаются не более чем в 10% случаев.Показания к определению аутоантител к рецептору ТТГ (a-RTSH).• Гипертиреоз типа ДТЗ.• Эутиреоидный зоб (все стадии гиперплазии щитовидной железы, кроме
функционально активной аденомы), дифференциальная диагностика с ауто¬
иммунным тиреоидитом.• Гипертиреоз у новорожденных.• Врожденный гипотиреоз.Аутоантитела к тиреоидной пероксидазе (анти-ТПО),• Высокая концентрация антител к ТПО наблюдается при тиреоидите Хаши-
мото (чувствительность — 90-100%).• Уровень антител к ТПО повышается на 40-60% при ДТЗ, но в меньшем титре,
чем при активной стадии тиреоидита Хашимото.• Антитела к ТПО присутствуют в крови 5% здоровых мужчин и 10% здоровых
женщин в возрасте до 50 лет.Показания к определению антител к тиреопероксидазе (анти-ТПО).• Аутоиммунный тиреоидит.• Гипертиреоз у новорожденных.• Врожденный гипотиреоз.• Эутиреоидный зоб (компенсированная стадия Базедовой болезни, одновре¬
менно рекомендуют определение a-RTSH).АУТОАНТИТЕЛА К ТИРЕОГЛОБУЛИНУАутоантитела к тиреоглобулину в основном относятся к иммуноглобулинам
класса G и реже — к IgA и IgM. В сыворотке здоровых людей анти-ТГ могут
содержаться в концентрации до 1,5 мкг/л (50 ЕД/л). Превышение этого порога
свидетельствует об активном поступлении ТГ в кровь, что может быть связано с
деструкцией тиреоцитов в результате как органоспецифического, так и неспецифи¬
ческого процесса в щитовидной железе, в том числе и аутоиммунного. Именно
поэтому в настоящее время многие авторы рассматривают повышение анти-ТГ как
неспецифический показатель патологического процесса в щитовидной железе.Клинико-диагностическое значениеВысокие концентрации анти-ТГ (а также анти-ТПО) характерны для хрониче¬
ского течения тиреоидита Хашимото.Антитиреоидные антитела и беременностьРаспространенность носительства антитиреоидных антител (анти-ТПО и анти-
ТГ) у беременных сопоставима с таковой у небеременных того же возраста и
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 281составляет 6-10%. Наличие высоких концентраций антител к антигенам щитовид¬
ной железы во время беременности может иметь, как минимум, три неблагопри¬
ятных последствия:• повышенный риск нарушения функции щитовидной железы во время бере¬
менности, которое потенциально опасно для развития плода;• повышенный риск развития послеродового тиреоидита;• повышенный риск выкидыша на ранних сроках.Поскольку во время беременности щитовидная железа оказывается под воз¬
действием комплекса стимулирующих физиологических факторов, в случае ее
поражения аутоиммунным процессом можно ожидать, что она не сможет ответить
адекватным усилением синтеза тиреоидных гормонов. В ряде исследований пока¬
зано, что в группе женщин с антитиреоидными антителами имеется риск развития
спонтанного аборта в I триместре беременности. Трудно предположить, что сами
по себе антитела к антигенам щитовидной железы могут играть какую-либо пато¬
генетическую роль в развитии невынашивания беременности. Данных об этом не
получено. Наиболее вероятно, что эти антитела являются маркером генерализо¬
ванной иммунной дисфункции, которая и приводит к аборту.Диагностическая ценность определения анти-ТГ значительно уступает таковой
в случае определения анти-ТПО. По мнению авторов, одновременное использо¬
вание этих двух тестов не дает дополнительной диагностической информации, в
большинстве случаев достаточно определения анти-ТПО.ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ РЕПРОДУКТИВНОЙ
ФУНКЦИИ МУЖЧИНРепродуктивную функцию мужчин регулируют три гонадотропных гормона:
фолликулостимулирующий (ФСГ), лютеинизирующий (ЛГ) и пролактин (ПРЛ).
Секреция этих гормонов гипофизом регулируется по принципу обратной связи:
при снижении концентрации определенного гормона в крови соответствующие
клетки гипоталамуса вырабатывают гонадолиберин, или гонадотропин-рилизинг-
гормон (ГїіРГ), который поступает по разветвлениям аксонов в переднюю долю
гипофиза. В ответ на это клетки передней доли гипофиза выделяют гонадотропные
гормоны, стимулирующие образование тестостерона клетками Лейдига. И наобо¬
рот, повышение содержания тестостерона в крови является сигналом для клеток
гипоталамуса прекратить выработку ГнРГ. Среди нейромедиаторов стимулируют
секрецию ГнРГ норадреналин и дофамин, ингибируют — серотонин и эндорфины.Нарушения, возникающие на разных уровнях нейрогормональной системы,
играют существенную роль в патогенезе бесплодия у мужчин. Эндокринные
нарушения составляют от 15 до 30% случаев мужского бесплодия. Они могут воз¬
никать внутриутробно в результате аномалии половых хромосом, при эндогенных
и экзогенных интоксикациях в процессе развития мужских половых органов.
Эндокринные нарушения могут носить приобретенный характер в результате
постнатального нарушения развития или повреждения яичек.Фолликулостимулирующий гормон
и лютеинизирующий гормонФолликулостимулирующий гормон (ФСГ), или фоллитропин, и лютеинизи¬
рующий гормон (ЛГ), или лютропин, — гликопротеины, синтез которых зависит
от частоты и амплитуды пульсирующих выбросов ГнРГ в гипоталамусе. В норме
пики ГнРГ наблюдаются с интервалом 90-120 мин, увеличение или уменьшение
частоты таких импульсов приводит к преобладанию секреции гипофизом ЛГ или
282 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙФСГ. при увеличении частоты импульсов синтезируется преимущественно ЛГ, при
уменьшении — ФСГ. Период полувыведения ЛГ из сыворотки крови составляет
20 мин, а ФСГ — 180-200 мин. Секреция ФСГ, помимо ГнРГ, контролируется и
другими гормонами, включая тестостерон и ингибин, которые угнетают его про¬
дукцию; активин увеличивает ее.ЛГ и ФСГ имеют общий принцип строения с другими гликопротеиновыми гор¬
монами, такими как тиреотропный гормон (ТТГ) и хорионический гонадотропин
человека (ХГЧ). Они состоят из двух полипептидных цепей: а-цепи (субъедини¬
цы), которая одинакова для всех гормонов, и р-цепи, которая хотя структурно
схожа, придает каждому гормону определенную специфичность. ЛГ и ФСГ имеют
разные терминальные гликозиды, что определяется разным периодом их полу-
выведения из системы циркуляции. ЛГ богат N-ацетилглюкозаминсульфатом и
быстро удаляется из системы циркуляции, так как взаимодействует со специфиче¬
скими рецепторами на гепатоцитах, которые распознают сульфатные группировки,
ФСГ имеет сиалированные окончания, которые защищают его от метаболического
поглощения в печени, поэтому он длительно циркулирует в крови.Синтез гормонов активируется в период полового созревания импульсами из
ЦНС, а также такими факторами, как масса тела и лептин (гормон, вырабатывае¬
мый клетками жировой ткани). Продукция ЛГ и ФСГ продолжается в течение всего
репродуктивного возраста. Основным ингибитором высвобождения ЛГ является
тестостерон, для ФСГ — ингибин В (гормон, вырабатываемый клетками Сертоли).Органами-мишенями гонадотропных гормонов у мужчин являются яички, где
под действием ЛГ происходит синтез половых гормонов (тестостерона, эстро¬
генов), которые оказывают воздействие на специфические рецепторы клеток-
мишеней в гонадах и других органах. ФСГ через клетки Сертоли стимулирует
сперматогенез и развитие семявыносящих канальцев.ТестостеронТестостерон — основной и наиболее активный андроген, вырабатываемый
клетками Лейдига семенников у мужчин, а у женщин — корой надпочечников
и яичниками. Является продуктом периферического метаболизма. Тестостерон
находится в крови в свободном (1-2%) и связанном (с SHBG и альбумином) виде.
В тканях, на которые направлено его действие, он превращается в более активный
дигидротестостерон. Конверсия тестостерона завершается в печени превращением
в 17-кетостероиды. Тестостерон на стадии внзтриутробного развития участвует в
дифференциации половых органов у мальчиков, а в период полового созревания
отвечает за развитие вторичных половых признаков, он необходим для поддержа¬
ния нормальной функции половых органов.Тестостерон свободныйПримерно 60% тестостерона крови в норме связано с высокоаффинным секс-
стероидсвязывающим |3-глобулином (SHBG). Другая часть, кроме 1-2%, неко¬
валентно связана с альбумином. Процент связывания гормона с SHBG у мужчин
несколько ниже, чем у женщин. Свободный и связанный с альбумином тестосте¬
рон обладает биологической активностью, в то время как SHBG эффективно инги¬
бирует активность гормона. Примерно половина тестостерона крови превращается
в печени в андростерон, этиохоланолон и эпиандростерон, являющиеся относи¬
тельно слабыми андрогенами. В некоторых тканях тестостерон превращается в
относительно сильный андроген — дигидротестостерон.Дигидротестостерон5а-дигидротестостерон (ДГТ) представляет собой андрогенный стероидный
гормон, родственный тестостерону и андростендиону. ДГТ образуется из тестосте¬
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 283рона с участием фермента 5«-редуктазы в клетках-мишенях. Небольшое количе¬
ство этого стероидного гормона находится в крови в не связанной с белком форме
и относится к свободной фракции. Дигидротестостерон имеет меньшее фодство к
SHBG по сравнению с тестостероном, ДГТ непосредственно контролирует деление
клеток предстательной железы и способствует пролиферации эпителия предста¬
тельной железы, т.е. железистой гиперплазии.ПролактинПролактин — пептидный гормон передней доли гипофиза, который отличается
от других гормонов гипофиза тем, что его секреция не регулируется по принципу
обратной связи, вовлекающей органы-мишени. Секрецию пролактина контроли¬
руют локальные факторы, нейромедиаторы и стероидные гормоны. Основными
стимуляторами секреции пролактина являются эстрадиол, тиреоидный рилизинг-
гормон, серотонин, гистамин и другие стимуляторы, функция пролактина в регу¬
ляции сперматогенеза неясна, возможно, он потенцирует эффекты двух других
гонадотропных гормонов — ФСГ и ЛГ. Повышенная концентрация пролактина
сопровождается дисфункцией гонад.Ингибин ВИнгибин — пептид, состоящий из а- и р-субъединиц, связанных дисульфид-
ными мостиками. Ингибин А состоит из а- и рА-субъединиц, ингибин В — из
а- и рВ-субъединиц. Только димерные формы ингибина являются биологически
активными. Главной формой циркулирующего в крови ингибина у мужчин явля¬
ется ингибин В, который синтезируется у них в семенных канальцах яичек (клетки
Сертоли).МУЖСКОЙ ГИПОГОНАДИЗМ, или ТЕСТИКУЛЯРНАЯ НЕДОСТАТОЧНОСТЬЭто патологическое состояние, клиническая картина которого обусловлена
снижением уровня андрогенов в организме с одновременным нарушением фер¬
тильности различной степени выраженности или бесплодием. Уровень андроге¬
нов определяется функционированием гипоталамо-гипофизарно-тестикулярной
системы. На основании нарушений этой системы выделяют первичный и вто¬
ричный мужской гипогонадизм. Как первичный, так и вторичный гипогонадизм
может быть врожденным или приобретенным.Первичная врожденная гонадная недостаточность при синдроме Клайнфельтера,
орхите, крипторхизме, синдроме резистентности к андрогенам характеризует¬
ся увеличением ЛГ и ФСГ в сыворотке крови в два раза и более по фавнению с
нормой. Для Сертоли-клеточного синдрома (синдрома Дель Кастильо) свойствен
высокий уровень ФСГ в крови на фоне нормального содержания ЛГ и тестостерона.
В качестве альтернативного неинвазивного метода оценки гонадной недостаточности
в последнее время используется определение концентрации ингибина В в сыворотке
крови, который является маркером функциональной активности клеток Сертоли.Первичный приобретенный гипогонадизм может быть обусловлен воспалитель¬
ным процессом непосредственно в яичке (орхит), который является осложнением
вирусного паротита или вызван непосредственно вирусами Коксаки или герпеса.
К орхиту может привести скрытая хламидийная или микоплазменная инфекция.
Повреждение яичка может быть вызвано токсическим действием некоторых
химических веществ (пестицидов, тяжелых металлов, избыточного приема глю-
кокортикоидов, анаболических стероидов, ингибиторов андрогенов) или рядом
физических факторов (ионизирующим, рентгеновским излучением, длительной
гипертермией или переохлаждением).
284 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙПричиной нарушения половой функции зачастую является неопущение одного
или обоих яичек в мошонку (крипторхизм), что наблюдается у 3-5% младенцев
мужского пола. Из них у трети младенцев без соответствующего лечения к момен¬
ту полового созревания яички остаются в брюшной полости или паховом канале,
а гормональные исследования обычно демонстрируют низкие значения тестосте¬
рона и повышенные ЛГ и ФСГ.В целом определение ФСГ является наиболее важным параметром для прогно¬
за; чем выше уровень этого гормона в крови, тем тяжелее поражение сперматоген-
ного эпителия и тем более пессимистичен прогноз, касающийся восстановления
фертильности. Механизм подобной реакции известен; первичное поражение
сперматогенного эпителия сопровождается снижением выработки ингибина В
клетками Сертоли, Ингибин В совместно с эстрадиолом регулирует секрецию ФСГ
гипофизом по принципу обратной связи. Снятие отрицательной обратной связи
приводит к повышению уровня ФСГ в крови, что сопровождается нарушением
сперматогенеза в извитых семенных канальцах и снижением концентрации спер¬
матозоидов. Поскольку синтез ФСГ и Л Г сопряжен, это часто приводит к повы¬
шению продукции ЛГ и тестостерона; последний метаболизируется до эстрадиола,
который подавляет выработку ГнРГ. Это в конечном итоге обусловливает отно¬
сительную, а затем абсолютную гипоандрогенемию. что усугубляет патологию
сперматогенеза, снижает выраженность вторичных половых признаков, ведет к
ослаблению либидо.Вторичный врожденный гипогонадизм развивается вследствие нарушения
секреции гонадотропных гормонов в результате дисфункции гипоталамуса или
гипофиза. Гипогонадизм гипоталамического происхождения может быть обуслов¬
лен рядом факторов.• Недостаточной выработкой ПнРГ (синдромом Каллмана) в результате нару¬
шения функции гипоталамуса.• Нарушением периодичности импульсов ГнРГ, что приводит к снижению
секреции Л Г и ФСГ (синдромы Руда и Лауренса-Муна-Бидля). При непуль¬
совом выбросе ГнРГ гипоталамусом не может осуществляться нормальная
секреция гипофизом ЛГ и ФСГ, что приводит к низкому их уровню в крови,
недостаточной продукции тестостерона. Клиническая картина — раннее про¬
явление евнухоидизма.• Изолированным дефицитом ЛГ (синдромом «фертильного евнуха»), что
проявляется низким уровнем в крови ЛГ и тестостерона; уровень ФСГ оста¬
ется в пределах нормы. В клинической картине преобладают импотенция,
гинекомастия, но сперматогенез сохранен на субнормальном уровне.• Изолированным дефицитом ФСГ, что характеризуется нормальным содержа¬
нием тестостерона и сохранением потенции, однако показатели спермограм-
мы варьируют от полного отсутствия до нормального количества малопод¬
вижных, неполноценных сперматозоидов.• Гиперпролактинемией — обособленной патологией функции гипофиза. При
этом происходит увеличение секреции пролактина, приводящее к дезоргани¬
зации сперматогенеза в результате конкуренции с ЛГ и ФСГ за рецепторы.
Чаще всего избыточная продукция пролактина является следствием развития
опухоли гипофиза, при этом снижается продукция ЛГ, ФСГ, тиреотропина,
кортикотропина. Именно поэтому при относительно низких уровнях в крови
ЛГ, ФСГ и тестостерона целесообразно определить уровень пролактина в
крови. При высоком его содержании следует исключить медикаментозную
гиперпролактинемию и провести компьютерную или магнитно-резонансную
томографию головного мозга. При выявлении аденомы гипофиза (пролакти-
номы) решают вопрос об оперативном вмешательстве.
№ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИИ 285 #1• Гіпотиреозом, при сниженном уровне гормонов щитовидной железы Т.^ и
происходит активация выработки тиреолиберина. Тиреолиберин стимулиру¬
ет одновременно выработку гипофизом тиреотропного гормона (ТТГ) и про-
лактина, который вызывает нарушения сперматогенеза. Именно поэтому при
обнаружении одновременного повышения уровня пролактина и ТТГ следует
исключить гипогонадизм, вызванный гипотиреозом.Вторичный приобретенный гипогонадизм• Ожирение, в случаях значительного ожирения повышается ароматизация
андрогенов до эстрогенов в жировой ткани. Увеличенное образование эстро¬
генов вызывает блокаду секреции гонадотропного рилизинг-гормона (ГнРГ)
гипоталамусом, нарушается периодичность секреции ГнРГ, что может быть
причиной временного бесплодия. Снижение массы тела восстанавливает нор¬
мальную секрецию ГнРГ и эякуляцию у мужчин, так же как менструальные
циклы у женщин.• Уремия постепенно приводит к атрофии гонад с прекращением сперматоге¬
неза, дисфункции эрекции и снижению либидо. Обычно при уремии имеет
место сниженный уровень тестостерона и повышение ЛГ и ФСГ. Часто выяв¬
ляют гиперпролактинемию, которая дополнительно ухудшает сексуальные
возможности мужчины.• Алкоголизм приводит к гипогонадизму через несколько механизмов.
Этиловый спирт оказывает прямой токсический эффект на тестикулы,• Наркотики, включая героин, морфин, метадон, вызывают центральную
активацию опиоидных механизмов, которые существенно подавляют гипо-
таламическую секрецию рилизинг-гормонов и соответственно ингибируют
образование ЛГ и тестостерона.Диагностика мужского гипогонадизмаБазовую гормональную диагностику используют для оценки функции гонадной
системы, по ней проводят дифференциальную диагностику между первичным и
вторичным гипогонадизмом. Она включает определение в крови содержания ЛГ,
ФСГ, пролактина и тестостерона. При необходимости диагностическую панель
расширяют, включая в нее определение эстрадиола, ТТГ и других гормонов.
В настоящее время получает все большее подтверждение тот факт, что концентра¬
ции некоторых белковых субстанций (антиспермальных антител, ингибина В) в
сыворотке крови и/или сперме могут служить маркерами фертильности.ЛГ стимулирует выработку и секрецию тестостерона, поэтому его определение
особенно важно при обследовании по поводу гипогонадизма. При одновременном
измерении ЛГ и тестостерона удается дифференцировать гипофункцию яичек от
гипофизарной и гипоталамической недостаточности.Особенностью измерения ЛГ является то, что для выявления патологии наи¬
более чувствительным является измерение в сыворотке, взятой в ночное время.
В ночной сыворотке выявляются изменения ЛГ в случаях дефицита гонадотро¬
пина, тогда как в утренней и дневной сыворотке за счет циркадных ритмов пато¬
логия часто не проявляется. В то же время выявление изменений концентрации
ЛГ никогда сразу не используют для клинической интерпретации гормональных
нар5ппений, необходимы измерение тестостерона при повышении ЛГ и проведение
функциональных тестов со стимуляцией ГнРГ освобождения ЛГ из гипофиза.ФСГ у мужчин стимулирует рост и функционирование клеток Сертоли и опо¬
средованно сперматогенез.• Уровень ФСГ в норме — наиболее частый результат исследований. В этом
случае, поскольку гормональных отклонений не выявлено, можно прове¬
сти тест с кломифеном. Кломифен — структурный аналог синтетического
эстрагена дизтилстилбэстрола, который снимает отрицательное обратное
286 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙдействие тестостерона на освобождение ГнРГ из гипоталамуса, тем самым
должна повышаться выработка ЛГ и ФСГ гипофизом (положительный кло-
мифеновый тест). Если такого не происходит, это свидетельствует о гипого-
надотропном евнухоидизме.• уровень ФСГ повышен из-за того, что в яичках недостаточно образуется
ингибин в, в результате по принципу обратной связи уровень сывороточного
ФСГ значительно превышает норму. Это является отрицательным прогно¬
стическим признаком. Вместе с результатами клинического обследования
(субнормально развитыми гонадами, крипторхизмом) и патологией спермы
(олигоастенозооспермией, азооспермией) эти данные могут свидетельство¬
вать о безуспешности какого-либо лечения.• Уровень ФСГ ниже нормы встречается в 1% случаев мужского бесплодия,
У таких больных возможно проведение эффективной терапии.В целях проведения дифференциальной диагностики гипофизарной недоста¬
точности с гипоталамической проводят пробу с ГнРГ. Для этого сначала измеряют
базальный уровень ФСГ и ЛГ, затем стимулируют гипоталамус введением ГнРГ.
Если в ответ на стимуляцию происходит повышение ФСГ в крови в 1,5 раза или
более, проба считается положительной и причиной снижения базального уровня
ФСГ является уменьшение синтеза ГкРГ. Таким пациентам показано длительное
введение ГнРГ. В случае отсутствия изменения концентрации ФСГ при его стиму¬
ляции причиной может являться гипофизарная недостаточность, лечение будет
заключаться в заместительной терапии гонадотропинами.В процессе базового обследования могут быть получены следующие резуль¬
таты.• При первичном гипогонадизме, когда поражены яички, в крови выявляется
высокий уровень гонадотропинов и низкий — тестостерона.• При вторичном гипогонадизме, когда имеется дефицит гонадотропинов,
уровни в крови ЛГ, ФСГ и тестостерона низкие.• Реже встречается нормогонадотропный гипогонадизм, когда имеет место
сочетанное поражение яичек и гипоталамо-гипофизарной области. При этой
патологии в крови выявляется низкий уровень тестостерона при нормальных
уровнях ЛГ и ФСГ.ПролактинРеферентные пределы: у мужчин — 35-330 мЕД/л (1,0-9,2 мкг/л).Пролактин — пептидный гормон передней доли гипофиза. Установлено, что
гиперпролактинемия может вызвать нарушение репродуктивной функции у муж¬
чин посредством нескольких механизмов. На уровне гипоталамуса гиперпролак¬
тинемия нарушает пульсирующий режим выброса ГнРГ, Соответственно гиперпро¬
лактинемия приводит к снижению ЛГ и ФСГ и вторичной недостаточности гонад
с низким уровнем тестостерона. Прямого действия пролактина на гаметогенез
не зарегистрировано, но повышенные концентрации пролактина вызывают дис¬
функцию гонадной системы. Именно поэтому связь гиперпролактинемии с пони¬
женной фертильностью объясняют скорее падением уровня гонадотропинов, чем
прямым эффектом пролактина на функцию гонад. Определяют пролактин в случа¬
ях бесплодия и импотенции. Гормональное обследование мужчин часто начинают
с определения уровня пролактина в крови.Небольшое повышение пролактина может быть результатом физического или
психологического стресса. Однако наиболее частой причиной гиперпролактине¬
мии являются опухоли гипофиза, которые могут быть как микропролактиномами
(<10 мм в диаметре), так и макропролактиномами (>10 мм). Секреция пролактина
гипофизом находится под влиянием ингибирующего эффекта дофамина, проду¬
цируемого гипоталамусом. Именно поэтому поражение гипоталамуса или воздей¬
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 287ствие лекарственных препаратов группы антагонистов дофамина (фенотиазинов,
бутирофенонов) могут вызвать гиперпролактинемию.ТестостеронРеферентные пределы: нмоль/л; мкг/л.• Дети до половой зрелости — 0,2-0,7; 0,06-0,2.• Женщины - 0,4-3,9; 0Д-1Д.• Мужчины:^ 20-39 лет - 9-38; 2,6-11;❖ 40-55 лет - 7-21; 2,0-6,0;❖ старше 55 лет — 6-18; 1,7-5,2.Коэффициенты пересчета: нмоль/л х 0,288 = мкг/л, мкг/л х 3,467 = нмоль/л.
Тестостерон — основной андроген организма мужчины, вырабатываемый
клетками Лейдига яичек. Уровень тестостерона имеет диагностическое значение
при следующих патологиях: синдроме Клайнфельтера и других хромосомных
заболеваниях, гипопитуитаризме, ферментативных нарушениях синтеза андро-
генов, гирсутизме и вирилизации у женщин, андрогенсекретирующих опухолях
яичников и надпочечников. У женщин параллельно нужно определять и уровень
ДГЭА-С, который обладает таким же, как и тестостерон, действием. У мужчин
анализ ДГЭА-С имеет вспомогательное значение при исследовании тестостерона.
Поскольку уровни тестостерона меняются в течение дня, необходимо брать пробы
крови три раза в течение часа в 8-10 ч утра и анализировать смешанную пробу.Свободный тестостерон — активная фракция гормона. Определение свобод¬
ного тестостерона предложено как способ определения биологически активного
тестостерона (табл. 5-8).Таблица 5-8. Клинико-диагностическое значение определения содержания тестостерона в сыво¬
ротке кровиПовышение концентрацииСнижение концентрацииМужчины с кариогипом XYY,Поликистозное пврерождениб яичников {синдром
Штейна-Левенталя),Синдром феминизирующих яичек (нечувствитель¬
ность периферических тканей на действие андро¬
генов, повышенная концентрация гонадотропинов
в крови).Преждевременное половое созревание мальчиков.
Вирипизирующая лютеома.Опухоли коры надпочечников.Экстрагонадные опухоли у мужчин.Лекарственные препараты (бромкриптин)Неподвижность,Синдром Иценко-Кушинга с высокой концентрацией
глюкокортикоидов.Первичный гипогонадизм;а) синдром Клайнфельтера;б) ложный мужской гермафродитизм;в) гонодальный дисгенез;г) врожденное отсутствие яичек;д) синдром Шерешевского-Тернера.Вторичный гипогонадизм;а) травма и анемические изменения яичек;6} двустороннее воспаление яичек;в) облучение;г) воздействие токсичных веществ;д) гипофункция гипофиза;е) запоздалое половое созревание.Лекарственные препараты (глюкокортикоиды) Дигидротестостерон — продукт метаболического превращения тестостерона.
Только одновременное определение уровня тестостерона и дигидротестостерона
(который в этом случае будет сниженным) позволяет сделать вывод о патогенезе
гормонально обусловленной сексуальной импотенции у мужчин. Любое отклоне¬
ние уровня тестостерона от физиологической нормы как в сторону уменьшения
(характерно для возрастного андрогенного дефицита), так и в сторону увеличения
(сильная половая конституция у мужчин, злоупотребление андрогенными препа¬
ратами) приводит к повышению продукции ДГТ и может увеличивать риск гипер¬
плазии предстательной железы.
«да288 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙДегидроэпиакдростерои^ , Референтные пределы:• дета до полового созревания — менее 2 мкмоль/л (<740 нг/мл);• женщины — 2-11 мкмоль/л (740-4050 нг/мл);• мужчины — 2-9 мкмоль/л (740-3320 нг/мл).Коэффициенты пересчета: мкмоль/л х 368,46 = нг/мл; нг/мл х 0,002714 =
мкмоль/л.Дегидроэпиандростерон (ДЭА) — предшественник андрогенов, в значительных
количествах вырабатывается в пучковой и сетчатой зонах надпочечников, секре¬
ция его контролируется АКТГ Семенники мужчин привносят около 10-15% ДЭА
сыворотки. Увеличение выделения гормона происходит за несколько лет перед
началом полового созревания. При лечении состояний, связанных с избыточным
образованием андрогенов, важно установить источник повышенной секреции гор¬
монов. Повышенная концентрация ДЭА указывает на надпочечник как источник
избыточного синтеза андрогенов. Увеличение образования андрогенов в семенни¬
ках связано с ростом концентрации в крови тестостерона. В свою очередь, увели¬
чение в крови глюкуронида 3-а-андростандиола имеет место при чрезмерном син¬
тезе андрогенов в периферических тканях. ДЭА выводится с мочой как 17-ОКС.
Повышение концентрации.• Синдром и болезнь Иценко-Кушинга (с симптомами вирилизма).• Врожденная гиперплазия надпочечника.• Дефицит 3-р-гидроксистероиддегидрогеназы, 21-гидроксилазы или
11-р-гидроксилазы в надпочечниках.• Гирсутизм у женщин. При нормальной концентрации ДЭА гирсутизм не свя¬
зан с нарушением функции надпочечников.Ингибин ВИнгибин в является маркером функции клеток Сертоли и экзокринной тестику¬
лярной функции (состояния сперматогенеза). Его концентрация у здоровых муж¬
чин обычно меньше 380 пг/мл, и, в отличие от женщин, она постоянна (не носит
циклических колебаний). Однако в патологических ситуациях (бесплодие) уро¬
вень ингибина В может быть снижен. Было показано, что у 100% обследованных
с содержанием сперматозоидов в сперме менее 20 млн/мл концентрация ингибина
В в сыворотке была ниже 80 пг/мл, а ФСГ — выше 10 ЕД/л, У мужчин, прошед¬
ших лечение по поводу варикоцеле, существенно увеличивался уровень ингибина
В в сыворотке крови, тогда как содержание ФСГ, ЛГ и тестостерона за все время
наблюдения не менялось. Это доказывает, что ингибин В можно использовать для
мониторинга лечения пациентов с варикоцеле. Ингибин В точно предсказывает
успех процедзфы TESE при азооспермии. Его низкая концентрация указывает на
неадекватное производство спермы и может исключать хирургическую процедуру
(TESE) для получения жизнеспособной спермы.Секс-стероидсвязывающий |3-глобулинРеферентные пределы• Метод ИФА:❖ мужчины — 43 (15-100) нмоль/л;<> женщины — 62 (15-120) нмоль/л.SHBG дает полезную информацию при оценке уровня андрогенов. Он является
сывороточным гликопротеином, который с относительно высокой специфично¬
стью связывает половые стероиды, включая тестостерон и дигидротестостерон и
в меньшей степени эстрадиол. SHBG образуется в печени. Его синтез и секреция
регулируются рядом факторов. Некоторые из них: тиреоиды, эстрогены, стресс.
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 289возраст (для мужчин), фенитоин, высокие концентрации углеводов — увеличива¬
ют, а другие: ожирение, тестостерон, пролактин, гормон роста, менопауза у женщин,
прогестерон, глюкокортикоиды — снижают сывороточные уровни. Измерение
уровня SHBG можно использовать в диагностических целях для интерпретации
результатов измерения концентраций тестостерона и эстрадиола, исследования
баланса андрогенов и эстрогенов при половых дисфункциях, оценки перифериче¬
ского действия гормонов, регулирующих выработку SHBG, Абнормально высокие
уровни SHBG обнаруживают у пациентов с ожирением, женщин с гиперсекрецией
андрогенов, включая синдром поликистозных яичников. При гирсутизме уровень
SHBG обычно низкий. SHBG также является главным фактором, регулирующим
соотношение свободной и связанной фракций этих гормонов. Для характеристи¬
ки биологически активного тестостерона иногда используют индекс свободного
тестостерона, равный отношению концентраций общего тестостерона и SHBG.ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ РЕПРОДУКТИВНОЙ
ФУНКЦИИ ЖЕНЩИН
Гормональная регуляция менструального циклаПериод С первого ДНЯ менструации до первого дня следующей менструации
называется менструальным циклом. Появление первой менструации называют
менархе, а прекращение менструаций — менопаузой. Средняя продолжительность
менструального цикла — 28 дней, возможны колебания продолжительности цикла
в диапазоне от 18 до 40 дней. Наибольшие изменения продолжительности цикла с
максимальными интервалами между менструациями обычно наблюдаются в пер¬
вые годы после менархе и в период перед менопаузой, когда повышается частота
ановуляторных (без овуляции) циклов. Во время менструального цикла репро¬
дуктивные органы претерпевают серию изменений, которые делают возможным
развитие яйцеклетки, ее оплодотворение и прикрепление оплодотворенной яйце¬
клетки в матке, в менструальном цикле различают четыре фазы: менструальную,
фолликулиновую (эстрогенную, пролиферативную), овуляторную и лютеиновую
(прогестиновую, секреторную). Эти фазы связаны с созреванием яйцеклетки,
которое регулируется гонадотропными гормонами гипоталамо-гипофизарной
системы.ЛГ и ФСГ являются определяющими факторами в регуляции женских половых
гормонов яичников — эстрогенов и прогестерона. Повышение ФСГ стимулирует
развитие нескольких (10-15) фолликулов, но наступает созревание лишь одного
из них, др)тие фолликулы подвергаются в этот период атрезии. ФСГ способствует
синтезу в фолликуле эстрогенов. Концентрация эстрадиола в крови достигает мак¬
симума в предовуляционный период, что приводит к высвобождению большого
количества гонадолиберина в гипоталамусе и последующему пику высвобождения
ЛГ и ФСГ, Предовуляторное повышение ЛГ и ФСГ стимулирует разрыв фоллику¬
ла и овуляцию, в общем виде считается, что ФСГ определяет рост фолликулов в
яичнике, а ЛГ — их стероидную активность. В течение менструального цикла про¬
исходит переключение секреторной активности яичников с эстрогенов в фоллику¬
лярной фазе цикла на прогестерон в фазе желтого тела.Идентифицировано около 30 эстрогенов, но только 3 из них имеют клиническое
значение и могут быть определены в клинико-диагностических лабораториях. Это
эстрадиол (Е2), эстрон и эстриол. Основным из них является эстрад иол, именно
его, как правило, определяют для оценки эндокринной активности фолликулов.
Прогестерон — гормон, вырабатываемый желтым телом, его активность наблю¬
дается в период после овуляции до следующей менструации. Эстрогены из яич-ш
290 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙников, в свою очередь, стимулирзлют органы-мишени репродуктивной системы
(молочные железы, матку и влагалище) и участвуют в регуляции гормональных
функций гипоталамо-гипофизарного комплекса центральной нервной системы по
принципу обратной связи.Менструальная фаза (фаза десквамации, отторжения эндометрия) насту¬
пает в случае, если оплодотворения яйцеклетки не происходит. В эту фазу
поверхностный (функциональный) слой слизистой оболочки матки отторгается.
Менструальная фаза длится до 3-5 дней. Ее первый день соответствует времени
гибели (обратному развитию) желтого тела в яичнике и началу созревания ново¬
го фолликула под влиянием ФСГ, уровень которого в крови возрастает в течение
первых дней менструального цикла. Описанные события связаны с уменьшением
содержания в крови прогестерона.В фазу пролиферации происходят регенерация слизистой оболочки матки и
созревание фолликула с яйцеклеткой. ФСГ гипофиза стимулирует рост и развитие
группы из 3-30 фолликулов, каждый из которых состоит из ооцита и окружающих
клеток. Один из этих фолликулов в последующем созревает, а остальные подверга¬
ются дегенерации. Под влиянием эстрогена, продуцирз^емого клетками созреваю¬
щего фолликула, строма функционального слоя эндометрия восстанавливаются.
Эта фаза длится с 5-го дня от начала менструации по 14-15-й день.Овуляция. Примерно в середине менструального цикла (14-15-й день) под
действием высокой концентрации эстрогена резко увеличивается выработка гипо¬
физом лютеинизирующего гормона (ЛГ). Под влиянием ЛГ и ФСГ происходит
овуляция — разрыв фолликула и выход яйцеклетки из яичника.Секреторная фаза является наиболее стабильной частью цикла. При отсут¬
ствии беременности она продолжается 14 дней и завершается с началом менстру¬
ации. После овуляции ЛГ вызывает развитие желтого тела в пустом (лопнувшем)
фоллику.ае. Желтое тело вырабатывает свой собственный гормон — прогестерон.
Значение желтого тела состоит в том, чтобы помочь сохраниться беременности.
Под влиянием прогестерона и эстрогена, секретируемых желтым телом, про¬
текает секреторная фаза преобразования эндометрия — внутренняя оболочка
матки утолщается, готовясь принять оплодотворенную яйцеклетку. Если яйце¬
клетка оплодотворена и имплантируется в эндометрий, желтое тело продолжает
функционировать и секреция прогестерона увеличивается. Если в течение 2 нед
оплодотворения яйцеклетки не произошло, желтое тело претерпевает обратное
развитие, превращается в «белое тело», прогестерон перестает вырабатываться,
слизистая оболочка матки отслаивается во время менструации и цикл повторя¬
ется.Женский гипогонадизмГлавным симптомом гипогонадизма у женщин является аменорея — отсутствие
менструаций более 6 мес. Аменорея может быть первичной (менструаций никог¬
да не было) или вторичной (менструации были, затем произошло их наруше¬
ние, вплоть до полного прекращения). Первичная аменорея может быть частью
нейроэндокринного или обменно-эндокринного синдрома (синдрома Иценко-
Кушинга, ожирения, врожденной гипоплазии коры надпочечников, надпочечни¬
ковой недостаточности, диффузного токсического зоба, гипотиреоза). Вторичная
аменорея может быть яичниковой или гнпоталамо-гипофизарной природы.
Недостаточность яичников может быть обусловлена аутоиммунным процессом,
облучением, синдромом резистентных или истощенных яичников, а также при
опухолях яичников, секретирующих андрогены, или поликистозе яичников.Гипергонадотропная аменорея проявляется синдромом истощенных яични¬
ков или синдромом резистентных яичников. Гипергонадотропная аменорея, или
ранний климакс, развивается у женщин моложе 40 лет, имевших до этого нормаль¬
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 291ную менструацию. Считается, что это состояние наследственно обусловлено и свя¬
зано с уменьшением количества ооцитов в яичниках ниже 10-15 тыс., что недоста¬
точно для поддержания их нормальной функции до 48-50 лет. Содержание ФСГ и
ЛГ в сыворотке резко повышено, концентрация эстрогенов снижена, что обычно
наблюдают при климактерическом периоде. Синдром резистентных яичников
также характеризуется гипергонадотропной аменореей, при которой вторичная
аменорея сочетается с повышенным уровнем гонадотропинов в сыворотке и нор¬
мальной секрецией эстрогенов. Это может быть обусловлено м}тацией рецептора
ФСГ или инактивирующими мутациями гена-рецептора ЛГ.Нормогонаїдотропная аменорея может быть причиной бесплодия при врож¬
денных или приобретенных нарушениях матки и ее придатков, К таким состояни¬
ям приводит внутриматочный спаечный процесс как следствие воспалительных
процессов (эндометрита, криминального аборта и др.).Гипогонадотропная аменорея может быть обусловлена нарушением
секреции гипоталамических или гипофизарных гормонов при первичных или
метастазирующих опухолях, травмах черепа, нарушениях кровоснабжения,
инфекционных болезнях (менингите и других заболеваниях), гиперпролакти-
немии, гранулематозных заболеваниях, нервной анорексии, состояниях после
приема пероральных контрацептивов. Нарушение гипоталамо-гипофизарно¬
яичниковой системы бывает при острой и хронической психической травме,
большой физической нагрузке (у спортсменов). В 30-50% случаев вторичная
аменорея и бесплодие являются следствием гиперпролактинемии даже при
отсутствии лактореи.Гормональная диагностика аменореиПри дифференциальной диагностике гипер- и гипогонадотропного гипогона-
дизма следует определять содержание ФСГ в сыворотке крови. Повышение ФСГ,
как правило, указывает на первичную недостаточность яичников. Вторичная аме¬
норея, наблюдаемая после приема пероральных контрацептивов, у большинства
больных связана с повышением секреции пролактина.Для выяснения причин бесплодия следует провести тщательное обследование
женщины, в том числе гормональное. Оценивают функцию щитовидной железы,
определяют уровень пролактина, ФСГ. В зависимости от изменения этих гормонов
определяют уровень ЛГ, прогестерона, эстрадиола в сыворотке крови в различные
фазы цикла, экскрецию с мочой 17-КС, 17-ОКС, кортизола, дегидроэпиандросте-
рона, тестостерона, эстрагенов.Лютеинизирующий гормонРеферентные пределы• В сыворотке.❖ Дети младше 11 лет — 1-14 ЕД/л.❖ Женщины:- фолликулиновая фаза — 1-20 ЕД/л;- фаза овуляции — 26-94 ЕД/л;- период менопаузы — 13-80 ЕД/л.• В моче.❖ Дети;- младше 8 лет — менее 7 ЕД/сут;- 9-15 лет — менее 40 ЕД/сут.о- Взрослые — менее 45 Ед/сут.ЛГ стимулирует овуляцию и активизирует в клетках яичников синтез эстрогенов
и прогестерона.шш
292 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙш
''"Шу женщин концентрация ЛГ в крови максимальна за 12-24 ч перед овуляцией
и удерживается в течение всего дня, достигая в 10 раз большего уровня по сравне¬
нию с неовуляционным периодом, в случае нерегулярных овуляционных циклов
для определения овулярности цикла кровь в целях установления ЛГ следует брать
каждый день в период между 8-18-м днем перед предполагаемой менструацией.В период менопаузы происходит повышение концентрации ЛГ и ФСГ.Вследствие пульсирующего характера вьвделения Л Г и ФСГ следует при состоя¬
ниях, сопровождающихся пониженной секрецией этих гормонов, сделать, по
крайней мере, три забора крови каждый раз не менее чем через 30 мин.Повышение концентрации в сыворотке:• дисфункция гипофиза;• первичная гипофункция гонад.Понижение концентрации в сыворотке:• нарушение функции гипофиза или гипоталамуса (гипопитуитаризм).Определение содержания ЛГ в моче применяют главным образом при диа¬
гностике эндокринных нарушений у детей с проявлениями слишком раннего
созревания. Явление пульсирующего выделения гормона не оказывает существен¬
ного воздействия на величину выделения ЛГ с мочой в течение суток.Фолликулостимулирующий гормон (ФСГ)Референтные пределы• в сыворотке.Дети младше 11 лет — менее 2 ЕД/л.Женщины:- фолликулиновая фаза — 4-10 ЕД/л;- фаза овуляции — 10-25 ЕД/л;- лютеиновая фаза — 2-8 ЕД/л;- период менопаузы — 18-150 ЕД/л.• В моче.❖ Дети:" младше 8 лет — менее 5 ЕД/сут;- 9-15 лет— менее 22 ЕД/сут.^ Женщины:- детородного периода — менее 30 ЕД/сут;- период менопаузы — в 2-3 раза выше, чем в детородный период.ФСГ стимулирует созревание фолликулов яичников и усиливает выделение
эстрогенов. Определение ФСГ проводят в целях диагностики нарушений генера¬
тивных органов (аменорея, олигоменорея, гипогонадизм, бесплодие у мужчин и
женщин, нарушение полового развития детей).Во время менопаузы происходит повышение ФСГ и ЛГ.Вследствие пульсирующего характера выделения ФСГ и Л Г при состояниях,
приводящих к понижению вьщеления этих гормонов, следует взять, по крайней
мере, три пробы крови не менее чем через 30 мин каждую.Повышение концентрации в сыворотке,• Менопауза, вызванная нарушением функции яичников• Первичная гипофункция гонад.• Синдром Клайнфельтера.• Синдром Шерешевского-Тернера.• Эктопическое выделение агентов, действующих аналогично гонадотропину
(особенно при новообразованиях легких).• Ранняя фаза гиперфункции гипофиза.Понижение концентрации в сыворотке.• Первичная гипофункция гипофиза.• Лекарственные препараты (эстрогены, прогестерон).
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 293Определение ФСГ в моче применяют в основном при диагаостике эндокрин¬
ных нарушений у детей с признаками слишком раннего полового созревания.
Явление пульсирующего выделения гормона не оказывает существенного воздей¬
ствия на выделение ФСГ с суточной мочой.Показания к определению ФСГ и ЛГ.• Нарушения менструального цикла — олигоменорея и аменорея,• Бесплодие.• Дисфункциональные маточные кровотечения.• Невынашивание беременности.• Преждевременное половое развитие или его задержка.• Задержка роста,• Синдром поликистозных яичников.• Эндометриоз.• Контроль эффективности гормонотерапии,• Дифференциальная диагностика гипер- и гипогонадотропного гипогона-дизма.ПролактинРеферентные пределы• Дети;❖ 3 мес - 540-13000 мЕД/л (15-361 мкг/л);❖ 3 мес-12 лет - 85-300 мЕД/л (2,8-8,3 мкг/л).• Женщины — 40-470 мЕД/л (1,1-13,0 мкг/л).• У беременных концентрация гормона постепенно нарастает с ранних сроковбеременности, вплоть до родов:❖ 12 нед — 290-1750 мЕД/л (8-49 мкг/л);❖ 12-28 нед - 330-4800 мЕД/л (9-133 мкг/л);о 29-40 нед - 770-5700 мЕД/л (21-158 мкг/л).Коэффициенты пересчета: мЕД/л х 0,02778 = мкг/л, мкг/л х 36,0 = мЕД/л.Пролактин у женщин регулирует развитие грудных желез и лактацию. Эстро¬
гены обычно увеличивают секрецию пролактина. Концентрация пролактина в
крови увеличивается во время физических упражнений, раздражения сосков,
гипогликемии, беременности, лактации, стресса (особенно вызванного операци¬
онным вмешательством). Опухоли из пролактинсекретирующих клеток вызывают
у женщин аменорею и галакторею. Г^перпролактинемия бывает причиной беспло¬
дия и нарушений функции яичников, пролактин сдерживает секрецию стероидов
в яичниках, дозревание желтого тела и секрецию ФСГ и ЛГ. После менопаузы
концентрация пролактина в крови снижается.Чрезмерное образование ТТГ может привести к гиперпролактинемии. Именно
поэтому следует критически относиться к заключению «пролактинома» при гипо¬
функции щитовидной железы. Следует предварительно проверить функцию щито¬
видной железы и предпринять соответствующее лечение.ЭстрадиолЭстрадиол — 17-бета (Е2).Референтные пределы: пмоль/л; пг/мл,• Дети до 11 лет — менее 35; менее 9,5.• Женщины:фолликулиновая фаза — 180-1000; 50-270;
фаза овуляции — 500-1500; 135-410;❖ лютеиновая фаза - 440-800; 120-220;❖ период менопаузы — 40-140; 11-40.Коэффициенты пересчета: пмоль/л х 0,272 = пг/мл, пг/мл х 3,671 = пмоль/л.
294 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙЕ2 — наиболее активный эстроген, У женщин детородного возраста Е2 практи¬
чески полностью образуется в фолликуле яичника и эндометрии. В системе цирку¬
ляции Е2 связывается с глобулином, связывающим половые гормоны (SHBG — Sex
Hormone Binding Globulin). Клетки-мишени для Е2 расположены в плаценте, матке,
грудных железах, влагалище, зфетре, гипоталамусе. У небеременных эстрадиол
меняется в течение менструального цикла. По мере созревания фолликул экс-
кретирует эстрадиол, экскреция достигает максимума перед овуляцией. За 14
дней до менструации уровень эстрадиола достаточен для стимуляции выброса ЛГ
гипофизом. Происходит болюсное освобождение ЛГ, стимулируется ОВЗ'ЛЯЦИЯ, и
концентрация эстрадиола значительно уменьшается. В последующие дни перед
менструацией эстрадиол поддерживается на стабильном уровне за счет синтеза
В эндометрии. Если происходит оплодотворение, уровень эстрадиола сохраняет¬
ся повышенным за счет синтеза плацентой. Концентрация эстрадиола в плазме
крови во время беременности примерно в 100 раз выше, чем у небеременных, на
36-й неделе беременности достигает значения 20-140 нмоль/л и постепенно рас¬
тет, вплоть до дня родов. Если же нет оплодотворения, эстрадиол снижается при
деградации эндометрия в период менструации. Определение концентрации эстра¬
диола в крови служит для оценки функции яичников при констатации нарушений
менструации (табл. 5-9). Анализ эстрадиола является основным параметром при
контроле индукции овуляции и гиперстимуляции яичников. Скорость синтеза
эстрадиола отражает количество и качество созревающих фолликулов. Прием
эстрогенов (оральных контрацептивов) повышает концентрацию эстрадиола в
сыворотке крови. Подобно другим эстрогенам, эстрадиол метаболизируется в
печени. Эстрадиол стимулирует анаболизм, предотвращает потерю кальция из
костей, вызывает половое созревание девочек, существенно влияет на процессы,
связанные с оплодотворением и рождением.Таблица 5-9. Диагностическое значение определения эстрадиолаПовышение концентрацииСнижение концентрацииГинекомастия.Синдром Тернера.Маточные кровотечения в период менопаузы {в ряде слу¬Первичный и вторичный гипогонадизм.чаев).Лекарственные препараты (17-а-эстрогены,Эстрогенпродуцирующие опухоли (гонад и коры надпо¬стильбен)чечников).Цирроз печени.Лекарстеенныв препараты (гонадотропины, кломифен,тамоксифен)ПрогестеронРеферентные пределы: нмоль/л; мкг/л.• Женщины.Фолликулиновая фаза — 0,9-2,3; 0,3-0,7.❖ Овуляционная фаза — 2,1-5,2; 0,7-1,6.❖ Лютеиновая фаза — 15,0-57,0; 4,7-18,0.❖ Период менопаузы — 0,2-4,0; 0,06-1,3.• Беременные.❖ 9-16 нед - 50-130; 15-40.❖ 16-18 нед - 65-250; 20-80.❖ 28-30 нед - 180-490; 55-155.❖ Предродовой период - 350-790; 110-250.Коэффициенты пересчета: нмоль/л х 0,314 = мкг/л, мкг/л х 3,18 = нмоль/л.
Прогестерон — женский половой гормон, его основным органом-мишенью
является матка. Б фолликулярную фазу его количество в крови минимальное,
после овуляции этот гормон повышается, стимулируя утолщение эндометрия и
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 295готовность к имплантации оплодотворенной яйцеклетки. При беременности гор¬
мон снижает чувствительность матки к веществам, вызывающим ее сокращение,
его концентрация постепенно повышается с 5-й по 40-ю неделю беременности,
увеличиваясь в 10-40 раз. У небеременных этот гормон выделяется желтым телом,
у беременных — плацентой. Небольшое количество гормона вырабатывается в
надпочечниках. Увеличение концентрации гормона наблюдается при врожденной
гиперплазии надпочечников и опухолях яичников. Снижение концентрации гор¬
мона при беременности позволяет заподозрить угрозу выкидыша.Повышение концентрации.• Беременность.• Опухоли надпочечника и яичников (в некоторых случаях).• Лекарственные препараты (прогестерон и синтетические аналоги).ИнгибинУ женщин гормон синтезируется в гранулезных клетках фолликулов. Во время
беременности основным продуцирующим органом ингибина А служит плацента.
Если ингибин А обнаруживают, как правило, у женщин (функция его у мужчин
неизвестна), то главной формой циркулирующего в крови ингибина у мужчин
является ингибин в.Ингибин селективно ингибирует освобождение ФСГ из передней доли гипофиза
и обладает паракринным действием в гонадах. Уровень ингибина А остается низ¬
ким в начале фолликулярной фазы, затем начинает повышаться к концу фоллику-
линовой фазы и достигает максимума в середине лютеиновой фазы. Уровни эстра-
диола и ингибина А сильно коррелируют друг с другом в течение фолликулярной
фазы (с 14-го по 2-й день менструального цикла).Приблизительно через неделю с момента образования желтого тела начинается
его обратное развитие, при этом секретируется меньше эстрад иол а, прогестерона
и ингибина А. Падение уровня ингибина А устраняет его блокирующий эффект
на гипофиз и секрецию ФСГ. В ответ на повышение уровня ФСГ окончательно
формируется пул антральных фолликулов, из которых в дальнейшем разовьется
доминантный фолликул.У женщин по мере старения отмечается снижение концентрации ингибинов
А и В. Когда количество созревающих фолликулов в яичниках становится ниже
определенного порога, наблюдается снижение концентрации ингибина, что ведет
к повышению уровня ФСГ. За последние два года в процедурах экстракорпораль¬
ного оплодотворения (ЭКО) для оценки овариального резерва стали использовать
ингибин В. Овариальный резерв — способность яичников отвечать на стимуляцию
гонадотропинами достаточным количеством зрелых яйцеклеток, пригодных для
оплодотворения в процедуре ЭКО. Измерение ингибина В позволяет напрямую
более точно оценить овариальную функцию, чем ФСГ.Антимюллеров гормон (АМГ, ингибирующее вещество Мюллера ~ MIS)Гормон принадлежит к семейству трансформирующего фактора роста-р вместе
с ингибином В. У женщин синтезируется непосредственно развивающимися пре-
антральными и антральными фолликулами, у мужчин — клетками Сертоли. Все
члены этого семейства являются димерными гликопротеинами, вовлеченными в
регуляцию роста и дифференцировки тканей. АМГ вместе с тестостероном необхо¬
дим для нормального развития внутренних половых органов эмбрионов мужского
пола, оказывает ингибирующий эффект на рекрутирование примордиальных
фолликулов в яичниках, а также может ингибировать ФСГ-зависимую селекцию
доминантного фолликула на ранней антральной стадии. Снижение синтеза АМГ
в фолликулах более 9 мм в нормальных яичниках — принципиально необходи¬
мое условие селекции доминантного фолликула. Концентрация АМГ лучше всего
отражает снижение репродуктивной функции у здоровых женщин с доказанной
296 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙфертильностью: она коррелирует с количеством антральных фолликулов и воз¬
растом женщины.Используют AM г в следующих направлениях.• Для диагаостики и мониторинга пациенток с нормогонадотропным беспло¬
дием.• Для прогноза успешного получения ооцитов и клинической беременности в
протоколах ЭКО.• Для выявления преждевременного или замедленного полового созрева¬
ния у обоих полов: АМГ подтверждает приближающееся половое созре¬
вание надежнее, чем более вариабельные тестостерон, ЛГ и эстрадиол.
Концентрация АМГ отражает количество и качество клеток Сертоли у маль¬
чиков до начала полового созревания, его определение возможно в оценке
мужской фертильности в любом возрасте, начиная с периода новорожден-
ности.• Для подтверждения наличия тестикулярной ткани (предсказательная цен¬
ность выще, чем у теста стимуляции тестостерона введением ХГЧ у пациентов
с анорхизмом и крипторхизмом).• Для дифференциальной диагностики интерсексуальных состояний/опреде¬
ления гонадного пола/амбивалентных гениталий [синдром нечувствитель¬
ности к андрогенам, аплазия клеток Лейдига, мутации рецепторов ЛГ, дефек¬
ты ферментов стероидогенеза, дисгенезия гонад, врожденная гиперплазия
надпочечников, синдром Суайра (врожденный дисгенез яичников), дефицит
5-а-редуктазы]. У XY-пациентов с амбивалентными гениталиями рекоменду¬
ют обязательное исследование АМГ перед дорогостоящими и инвазивными
рентгенологическими и хирургическими исследованиями,• АМГ отражает эффективность антиандрогенной терапии (тестостерон может
изменяться недостоверно, так как многие препараты действуют на его рецеп¬
торы, а не на его синтез), например, у мальчиков с преждевременным поло¬
вым развитием.• Как высокочувствительный и специфичный маркер гранулезоклеточного
рака яичников.• Высокая воспроизводимость: для определения АМГ достаточно единствен¬
ного определения.• АМГ - циклонезависимый маркер овариального резерва: уровень АМГ,
измеренный в течение менструального цикла, не имеет значительных коле¬
баний, в отличие от ФСГ, ЛГ и эстрадиола.АндрогеныАндрогены в организме женщины представлены в основном тестостероном,
андростендионом и дегидроэпиандростерон-сульфатом (ДГЭА-С). При этом
общий андрогенный уровень у них в большей мере определяется функцией надпо¬
чечников. у женщин уровень свободного тестостерона повышается при гирсутизме
с наличием или отсутствием поликистоза яичника. При тех ситуациях, когда SHBG
часто повышен (например, при гипертиреоидизме, состоянии гиперэстрогении, в
том числе беременности, приеме пероральных контрацептивов, а также при введе¬
нии противоэпилепт1«еских средств) или снижен (например, при гипотиреоидиз-
ме, избытке андрогенов, ожирении), измерение свободного тестостерона может
быть более целесообразным, чем измерение общего тестостерона.Дегидроэпиандростерон-сульфатДГЭА-С — стероид (С^д), секретируемый корой надпочечников (95%) и яични¬
ками (5%). Выделяется с мочой и составляет основную фракцию 17-кетостерои-
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 297дов, в процессе его метаболизма в периферических тканях образуются тестосте¬
рон и дигидротестостерон. ДГЭА-С обладает относительно слабой андрогенной
активностью, составляющей для несульфированного гормона примерно 10%
уровня тестостерона. Однако его биологическая активность усиливается благодаря
относительно высоким концентрациям в сыворотке ~ в 100 или 1000 раз превос¬
ходящим тестостерон, а также из-за слабой аффинности к стероидсвязывающему
р-глобулину. Содержание ДГЭА-С в сыворотке является маркером синтеза андро¬
генов надпочечниками. Низкие уровни гормона характерны для гипофункции над¬
почечников, высокие — для вирилизирующей аденомы или карциномы, дефицита
21-гидроксилазы и 3-|3-гидроксистероиддегидрогеназы, некоторых случаев гирсу-
тизма у женщин и др. Поскольку лишь незначительная часть гормона образуется
половыми железами, измерение ДГЭА-С может помочь в определении локали-
зации источника андрогенов. Если у женщин наблюдается повышенный уровень
тестостерона, с помощью определения концентрации ДГЭА-С можно установить,
связано ли это с болезнью надпочечников или с заболеванием яичников. Секреция
ДГЭА-С не связана с циркадными ритмами,Эстриол свободный (неконъюгированный)Определение неконъюгированного эстриола (Е3) в лабораторной практике
используют для характеристики течения второй половины беременности (табл.
5-10).Эстриол (Е^) — основной эстроген, образующийся в фетоплацентарном комплек¬
се при беременности, особенно в III триместре (28-40 нед). Неконъюгированный
Е3 проходит через плаценту и попадает в кровоток матери, где быстро преобра¬
зуется в глюкуронидные и сульфатные производные, которые могут экскретиро-
ваться с мочой. Время полужизни Е, в кровотоке матери составляет всего 20-30
мин. Уровень Е3 в крови матери отражает состояние плода. Внезапное уменьшение
фетоплацентарного образования Е3 сопровождается быстрым снижением Е^ в
крови матери.Преимущества определения Е3.• Определение неконъюгированного Е3, в отличие от определения общего Е3 в
сыворотке или моче, позволяет характеризовать состояние плода независимо
от функций печени или почек матери и от применения антибиотиков.• При сахарном диабете свободный Е более точно отражает состояние плода,
так как при его определении не требуется гидролиза конъюгированного Е^.Референтные пределы. Нормальные значения устанавливаются в КДЛ в
зависимости от использованного метода определения. Ориентировочные уровни
представлены в табл. 5-10.Таблица 5-10. Ориентировочные значения эстриола при беременностиНеделя беремен¬
ностиОжидаемые значе¬
ния, нг/млНеделя беремен¬
ностиОжидаемые значения,
нг/млДвойня, нг/мл12-я0.3-1,022-23-я2,7-163-1813-я0,3-1,124-25-я2,9-173-2014-я0,4-1,626-27-я3,0-184-2115-я1,0-4.428-29-я3,2-204-2216-я1.4-6,530-^1-я3,8-225-2517^я1,5-6,632-33-я4.6-236-3918-я1,6-8.534-35-я5,1-257-3919-я1.9-1136-37-я7,2-299-3820-я2.1-1338-39-я7,8-3713-4021-я2,6-1440^2-я8,0-39Ж
298 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙДиагностическое значение• Ез быстро повышается во второй половине беременности, особенно в III три¬
местре, концентрация его в плазме широко варьирует от пациента к пациенту,
поэтому однократное определение Ej малозначимо, необходимо серийное его
определение.• при высокой вероятности патологии беременности постоянно низкий уро¬
вень Ез или его внезапное снижение в III триместре свидетельствуют о нару¬
шении развития плода или возможной внутриутробной его гибели.• Заключение о патологии беременности можно делать только при сочетании
с результатами альтернативных диагностических методов, таких как амнио-
центез или УЗИ.• Измененный уровень Ез может быть при введении антибиотиков, глюкокор-
тикоидов или при выраженной патологии печени у матери.ХОРИОНИЧЕСКИЙ ГОНАДОТРОПИН ЧЕЛОВЕКА
р-СубъединицаРеферентные пределы• Женщины и мужчины — менее 3 ЕД/л,• Женщины в периоде менопаузы — менее 9 ЕД/л.Хорионический гонадотропин человека (ХГЧ) является гликопротеином с
молекулярной массой около 37 тыс. Да, в его состав входят неспецифическая
а*субъединица (молекулярная масса 14,5 тыс. Да) и специфическая р-субъединица
(молекулярная масса 22 тыс. Да). ХГЧ выделяется синцитиальным слоем трофо-
бласта во время беременности. ХГЧ поддерживает активность и существование
желтого тела, принимая эту роль от ЛГ примерно через 8 дней после овуляции,
является основным гормоном ранней беременности, стимулирующим развитие
эмбриобласта. ХГЧ выделяется с мочой. Обнаружение гормона в моче является
простым тестом на наличие либо отсутствие беременности. Определение ХГЧ в
сыворотке используют для ранней диагностики и наблюдения за развитием бере¬
менности, выявления угрожающего выкидыша и другой патологии беременности
(в первую очередь в группе риска). Определение концентрации ХГЧ в онкологии
используют для выявления и контроля эффективности хирургического лечения
и химиотерапии трофобластических опухолей (хорионэпителиомы, пузырного
заноса), а также для дифференциальной диагностики опухолей яичек.Следует обратить внимание на следующее.• Тесты на беременность проводят не ранее 3-5 дней первой (отсутствующей)
менструации после оплодотворения. Самая высокая концентрация ХГЧ во
время беременности достигается в конце I триместра, затем она постепенно
понижается, вплоть до дня родов. За 9 дней перед родами концентрация ХГЧ
падает ниже чувствительности обнаружения. Более высокая концентрация
[5-ХГЧ имеет место при многоплодной беременности.• Причины отсутствия ХГЧ при беременности; тест проведен слишком рано,
внематочная беременность, измерение выполнено в правильно проходящем
III триместре беременности.• Причины обнаружения ХГЧ, не вызванные беременностью: менопауза
(редко), эндокринные нарушения.Повышение концентрации.• Трофобластическая опухоль в матке.• Тератома яичка. Результат исследования концентрации в крови ХГЧ позволя¬
ет оценить действие химиотерапии на опухолевые клетки.• Хориокарцинома.• Многоплодная беременность.
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 299Понижение концентрации.• Внематочная беременность. Низкие значения концентрации относительно
фазы беременности.• Повреждение плаценты во время беременности. Об этом свидетельствуют
низкие концентрации в I триместре беременности.• Угрожающий выкидыш,ДРУГИЕ ГОРМОНЫ
Адренокортикотропный гормонРеферентные пределы:• на 8:00 менее 22 пмоль/л (<100 пг/мл) — максимальная концентрация гор¬
мона;• на 22:00 менее 6 пмоль/л (<30 пг/мл) — минимальная концентрация гормона.
Коэффициенты пересчета: пмоль/л х 4,54 = пг/мл, пг/мл х 0,22 = пмоль/л.
Во время взятия крови нельзя подвергать пациента стрессу; кровь лучше всегобрать через предварительно установленный катетер.Не следует пользоваться стеклянными пробирками (АКТГ сорбируется сте¬
клом).АКТГ является гормоном, выделяемым передней долей гипофиза по опреде¬
ленному суточному ритму под влиянием тропных факторов гипоталамуса.
Суточный ритм выделения зависит от времени экспозиции на свет (у слепых
не наблюдается суточного ритма выделения АКТГ). Сильным стимулятором
выделения АКТГ является стресс. Время полужизни гормона в крови состав¬
ляет 3-8 мин. АКТГ вызывает моментальное увеличение надпочечных корти-
коидов. У беременных концентрация АКТГ в плазме крови может быть слегка
повышена.Повышение концентрации.• Болезнь Иценко-Кушинга,• Эктопическое выделение АКТГ при паранеопластическом синдроме.• Первичная недостаточность корьі надпочечника (болезнь Аддисона).• Постгравматические и послеоперационные состояния.• Двусторонняя адреналэктомия при лечении синдрома Нельсона.• Надпочечный вирилизм.• Влияние препаратов (инъекции АКТГ, метопирон, постинсулиновая гипогли¬
кемия).Понижение концентрации.• Пїпофункция коры надпочечника из-за ослабления функции гипофиза (поте¬
ря на 90%).• Синдром Иценко-Кушинга, вызванный опухолью коры надпочечника.• Опухоль, выделяющая кортизол.• Сдерживание выделения АКТГ опухолью вследствие применения криптогеп-
тадина.• Введение глюкокортикоидов.АльдостеронРеферентные пределы• Новорожденные — 1000-5500 пмоль/л (38-200 нг/дл).• Младенцы — до 6-го месяца 500-4500 пмоль/л (18-160 нг/дл).• Взрослые - 100-400 пмоль/л (4-15 нг/дл),• После 40 лет происходит постепенное снижение концентрации.ш
■300 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙСуществует зависимость секреции альдостерона от количества потребленного
натрия и калия и положения тела.Альдостерон — стероидный гормон, синтезируется из холестерина в клетках
клубочкового слоя коры надпочечника. Это самый сильнодействующий минера-
локортикоид. Гпавным фактором, регулирующим секрецию альдостерона, явля¬
ется объем циркулирующей крови. Гиповолемия ведет к активизации системы
«ренин-ангиотензин?»' и к повышению секреции альдостерона.Кроме того, секреция альдостерона увеличивается вследствие:• повышения концентрации калия в плазме;• повышения концентрации АКТГ в плазме (при физиологических условиях):• возбуждения р-адренергической системы.Около 65% общего количества гормона в крови находится в связанном с бел¬
ками состоянии. Распад альдостерона происходит главным образом в печени. Тот
альдостерон, который не связан с белками плазмы, выводится с мочой. Органом-
мишенью для альдостерона являются почки. Он воздействует главным образом на
дистальные канальцы, стимулируя реабсорбцию ионов натрия и секрецию ионов
калия и водорода.Выделение альдостерона подчинено суточному ритму, подобному ритму выде¬
ления кортизола. Пик концентрации гормона отмечается по утрам, самая низкая
концентрация — около полуночи.Концентрация альдостерона увеличивается в лютеиновую фазу овуляционного
цикла и во время беременности.Повышение концентрации.• Первичный гиперальдостеронизм (синдром Конна):❖ снижение активности ренина в плазме крови;❖ альдостерома;гиперплазия коры надпочечников.• Вторичный гиперальдостеронизм (повышение активности ренина в плазмекрови):❖ сердечно-сосудистая, легочная, печеночная, почечная патологии, сопрово¬
ждающиеся гипертонией и отеками.• Дезоксикортикостеронацетат.• Кортизонацетат.Понижение концентрации.• Первичный гипоальдостеронизм:❖ поражение надпочечников;❖ врожденное или приобретенное нарушение биосинтеза альдостерона,• Вторичный гипоальдостеронизм:гепарин.• Препараты, блокирующие адренергическую систему.Ангиотензин I и IIРеферентные пределы• Ангиотензин I — 11-88 пг/мл.• Ангиотензин II:артериальная кровь — 12-36 пг/мл;❖ венозная кровь — 50-75% концентрации в артериальной крови.Ренин вызывает гидролиз ангиотензиногена до декапептида ангиотензина I,
который затем под влиянием ангиотензинпревращающего фермента трансформи¬
руется в ангиотензин II. Ангиотензин II стимулирует секрецию альдостерона в коре
надпочечников, сокращает гладкую мускулатуру кровеносных сосудов, вызывая
повышение артериального давления.
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 301Увеличение концентрации.• Повышение артериального давления (почечная гипертония).• Опухоли юкстагломерулярного аппарата почек, секретирующие ренин.Понижение концентрации.• Синдром Конна (первичный гиперальдостеронизм).• Обезвоживание (дегидратация). Щ
АНГИОТЕНЗИНЛРЕВРАЩАЮЩИЙ ФЕРМЕНТРеферентные пределы• Дети:❖ моложе 12 лет “ 9,4-37,0 ЕД/л;❖ 13-16 лет - 9,0-33,4 ЕД/л.• Взрослые — 6,1-26,6 ЕД/л.Ангиотензинпревращающий фермент (АПФ) представляет собой гликопротеид, при¬
сутствует в основном в легких и в небольших количествах в щеточной каемке эпителия
проксимальных канальцев почек, эндотелии кровеносных сосудов и плазме крови. АПФ
является ключевым ферментом сосудистого тонуса, с одной стороны, катализирует пре¬
вращение ангиотензина I в один из наиболее мощных вазоконстрикторов — ангиотен-
зин II. С другой стороны, АПФ гидролиз}^ет вазодилататор брадикинин до неактивного
пептида. Синтезированные ингибиторы АПФ оказались эффективными для понижения
давления у больньЕх с реноваскулярной формой гипертонии, в терапии сердечной недо¬
статочности, показан антиатеросклеротический эффект этих препаратов.Повышение активности,• Повышенная активность щитовидной железы.• Алкогольное поражение печени.• Сахарный диабет (в некоторых случаях).• Саркоидоз (особое значение имеет в мониторинге лечения).Понижение активности.• Болезни легких.• Лечение каптоприлом.• Пониженная активность щитовидной железы.25-гидроксихолекальциферолРеферентные пределы:• зима — 35-105 нмоль/л (14-42 нг/мл);• лето - 37-200 нмоль/л (15-80 нг/мл).Коэффициенты пересчета: нмоль/л х 0,4 = нг/мл, нг/мл х 2,496 = нмоль/л.Витамин D из кишечника или кожи переносится в печень, где подвергается
гидроксилированию до 25-гидроксихолекальциферола [25(ОН)Оз]. Последний
поступает в плазму и транспортируется в почки, где превращается в кальцитри-
ол [1,25(0H)2DJ. в плазме 25(ОН)Вз — доминирующий метаболит витамина D,
но он обладает небольшой биологической активностью, кальцитриол примерно
в 100 раз активнее. Підроксилирование 25(ОН)Оз до 1,25(ОН)2Вз в почке акти¬
вируется паратиреоидным гормоном, а сдерживается гиперфосфатемией. Время
полужизни в плазме крови составляет для 25(ОН)Оз приблизительно 21 день, для
1,25(0Н)20з — 3-6 ч. Основной функцией активных метаболитов витамина D
является активация абсорбции кальция из желудочно-кишечного тракта.Повышение концентрации.• Отравление витамином D.Понижение концентрации.• Дефицит витамина D (приводит к рахиту у детей и остеомаляции у взрос¬
лых). Нехватка витамина D пищевого происхождения касается тех, у кого
понижен уровень эндогенного отнтеза витамина.
302 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРШЕНИЙ• Синдром мальабсорбции.• Болезни печени (хронические и тяжелые).• Нефротический синдром.• Гиперфункция паращитовидных желез [повышенное потребление 25(OH)D J.• Саркоидоз.• Длительное лечение противоэпилептическими препаратами (индукция
лекарственными препаратами неспецифической гидроксилазы в печени).КАЛЬЦИТРИОЛРеферентные пределы: 36-144 пмоль/л (15-60 пг/мл).Кальцитриол [1,25(0Н)20з] — метаболит витамина D, синтезируется в почках
из 25(OH)D.,. Это стероидный гормон, основная биологическая роль которого —
стимуляция всасывания кальция и фосфора в кишечнике. При недостатке кальци¬
ферола замедляется формирование новых костей и нарушается обновление кост¬
ной ткани. Кальциферол способен усиливать действие паратиреоидного гормона
на реабсорбцию кальция в почках.Повышение концентрации.• Гиперфункция паращитовидных желез.• Врожденный рахит, зависимый от витамина D, тип II [возможная нечув¬
ствительность рецепторов тканей на физиологические концентрации
1,25(ОН),Вз].• Саркоидоз.• туберкулез.Понижение концентрации.• Остеолиз кости при новообразованиях:❖ первичная опухоль или метастазы в кость;выделение факторов, аналогичных тиреотропному гормону.• Дефицит витамина D (приводит к рахиту у детей и остеомаляции у взрос¬
лых). Нехватка витамина D пищевого происхождения касается тех, у кого
понижен уровень эндогенного синтеза витамина.• Прогрессирующая почечная недостаточность.• Гипофункция паращитовидных желез (в некоторых случаях концентрация
может быть нормальной).• Псевдогипофункция паращитовидных желез.• Врожденный рахит, зависимый от витамина D, тип I (вероятен метаболиче¬
ский блок образования кальцитриола в почке). Нормальная концентрация
25(ОН)Пз• Отравление витамином D (активность гидроксилазы в почке ингибируется
избытком субстрата).ГлюкагонРеферентные пределы: 50-100 нг/л.Глюкагон — пептидный гормон, выделяемый а-клетками островков Лангенгарса
поджелудочной железы. Вьщеление глюкагона увеличивается при понижении кон¬
центрации глюкозы в крови. Епюкагон активирует в печени процесс глюкогенеза и
гликогено л иза, а также процесс липолиза в жировой ткани, стимулирует секрецию
инсулина (это явление используют в тестах с нагрузкой глюкагоном). Секреция
глюкагона поджелудочной железой не подвержена существенным колебаниям в
течение суток. Около 50% общего количества глюкагона в крови составляет био¬
логически активная фракция гормона. Небольшое количество энтероглюкагона
(около 3% общего количества глюкагона) образуется в а-клетках, локализован¬
ных в желудке и тонкой кишке. Лабораторными методами с применением антител
определяют общий глюкагон.
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 303Выделение гормона увеличивается при:• гипогликемии, голодании;• насыщенном белками рационе питания, инфузии аминокислот;• интенсивной и длительной физической работе;• повышении активности адренергической системы.Повышение концентрации.• Гпюкагонома (опухоль, выделяющая глюкагон).• Кетоацидоз, гиперосмолярная кома при сахарном диабете,• Сепсис.• Тяжелый панкреатит.• Синдром Иценко-Кушинга.• Лечение глюкокортикоидами.• Акромегалия.• Уремия (снижен распад в почках).• Цирроз печени.• Феохромоцитома.ИнсулинРеферентные пределы: 15-180 пмоль/л (2-25 мкЕД/мл).Инсулин является пептидным гормоном, выделяемым |3-клетками островков
Лангерганса поджелудочной железы. Перед выделением из р-клеток полипептид
проинсулин подвергается протеолизу до инсулина и С-пептида. Инсулин активирует
доставку глюкозы в мышечную и жировую ткани, повьшіает поступление ионов калия
и фосфата в клетки. Метаболическое действие инсулина ведет к увеличению исполь¬
зования и накопления энергетических соединений в клетках. Гормон активирует
гликолиз и синтез гликогена, увеличивает синтез длинноцепочечных жирных кислот
(липогенез), сдерживает противоположные метаболические процессы: липолиз и
кетогенез. в организме происходят постоянные колебания концентрации инсулина во
внеклеточной жидкости: повышение после приема пищи и снижение при голодании.
Отражением изменения концентрации инсулина являются колебания концентрации
глюкозы в крови. Измерение концентрации инсулина в крови излишне для диагности¬
ки сахарного диабета, но информативно для диагностики инсулиномы. Диагностика
аденомы островковой ткани поджелудочной железы (инсулиномы) основывается на
констатации повышенной концентрации инсулина (I) по отношению к уровню глюко¬
зы в крови (G), определяемой утром натощак, в соответствии с формулой:иисулт{мкЕД! л)/ / G = ■глюкоза {ммоль / л) -1,7I/O более 30 подтверждает наличие аденомы островковой ткани поджелудоч¬
ной железы.Повышение концентрации.• При нормальной беременности.• Сахарный диабет 2-го типа (как правило, в начале заболевания).• После подкожного введения быстродействующего инсулина.• Ожирение (метаболический синдром).• Болезни печени.• Акромегалия.• Синдром Иценко-Кушинга.• Мышечная дистрофия.• Инсулинома (диагностика основывается на повышении соотношения I/G и
гипогликемии натощак).• Семейная непереносимость фруктозы и галактозы.
304 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙПонижение концентрации.• Длительная физическая нагрузка.• Сахарный диабет 1-го типа.• Сахарный диабет 2-го типа.Абсолютные показатели концентрации инсулина часто имеют минимальное
диагностическое значение, большее значение имеет тест со стимуляцией глюкозой.
В случае сахарного диабета максимальная концентрация инсулина после введения
глюкозы появляется позднее и может быть выше, чем у здоровых людей.С-ПЕПТИДРеферентные пределы: 0,5-2,0 мкг/л.С-пептид (соединительный пептид) является фрагментом пептидной цепи проин¬
сулина. Инсулин и С-пептид являются конечными продуктами преобразования про¬
инсулина в |3-клетках островков поджелудочной железы в результате воздействия
эндопептидазы. Вьщеление инсулина и С-пептида в кровь р-клетками равномоляр¬
но. Время полужизни в плазме крови С-пептида дольше, чем у инсулина; из системы
циркуляции инсулин удаляется печенью, С-пептид — почками. Именно поэтому
соотношение С-пептид/инсулин равно 5:1. Определение концентрации С-пептида
в крови позволяет охарактеризовать остаточную синтетическую функцию р-клеток
(после стимуляции глюкагоном или толбутамидом), особенно у больных, леченных
гетерогенным инсулином, в клинической практике определение С-пептида исполь¬
зуют для определения причины возникающей гипогликемии.Повышение концентрации.• Инсулинома. Проведение анализа особенно показано у пациентов, требую¬
щих лечения инсулином после резекции гормонально функционирующей
опухоли, производящей инсулин; обнаружение повышенной концентрации
С-пептида указывает на метастазы или рецидив опухоли.• Хроническая почечная недостаточность.Понижение концентрации.• Введение экзогенного инсулина. Оценка синтетической функции р-клеток
определением инсулина у пациентов, лечившихся инсулином или имеющих
противоинсулиновые антитела, невозможна по методическим соображениям
из-за присутствия экзогенного инсулина и антител к инсулину.• Сахарный диабет 1-го типа.• Сахарный диабет 2-го типа (за исключением ранней стадии).КальцитонинРеферентные пределы: менее 50 нг/л.Кальцитонин — пептидный гормон, выделяемый С-клетками щитовидной
железы. Основной эффект кальцитонина — снижение уровня кальция в крови
и отложение его в кости. Кальцитонин оказывает слабовыраженный эффект по
снижению фосфата в крови. В физиологических условиях кальцитонин играет
существенную роль в процессе кальцификации кости в период роста. Гормон
предотвращает высвобождение кальция из кости, по этой причине его вводят при
остеопорозе. в клинической практике измерение кальцитонина в плазме крови
нашло применение в диагностике С-клеточного рака щитовидной железы.Повышение концентрации.• Медуллярный рак щитовидной железы. У некоторой части больных медул¬
лярным раком щитовидной железы отмечается нормальная концентрация
кальцитонина в плазме. В этих случаях следует провести тест со стимуляцией
с пентагасгрином, чтобы выявить возможную секрецию кальцитонина ново¬
образованными С-клетками.
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 305Отдельные случаи рака молочной железы, легкого, простаты.
Синдром Золлингера-Эллисона.Первичная гиперфункция паращитовидной железы.Почечная недостаточность (уменьшение выделения гормона).
Патология парафолликулярных клеток щитовидной железы.
Передозировка витамина D.Злокачественная анемия с повышением гастрина.КатехоламиныРеферентные пределы в плазме:• совокупные катехоламины — менее 1 мкг/л;• отдельные катехоламины (табл. 5-11).Таблица 5-11. Отдельные катехоламиныКатехоламиныКонцентрация, мкг/лАдреналин<88Норадреналин104-548Дофамин<136Референтные пределы в моче:• Совокупные катехоламины:❖ 110 мкг/сут (метод хроматографии высокого давления);❖ 280 мкг/сут (флюорометрические методы).• Отдельные катехоламины (табл. 5-12).Таблица 5-12. Отдельные катехоламины (мкг/сут)КатехоламиныВозраст1-4 лет4-10 летвзрослыеАдреналин<30<65<100Норадреналин<6<10<20Дофамин40-26065^0065-400Внимание! За 3 дня перед взятием материала для анализа пациенты не должны
есть бананы, шоколад, цитрусовые, пить кофе и принимать ацетилсалициловую
кислоту (аспирин) — салицилаты.Катехоламины являются гормонами симпатоадреналовой системы, образуют¬
ся хромаффинными клетками мозгового слоя надпочечников и адренергически¬
ми постганглионарными нервами. Адреналин синтезируется главным образом
в мозговом слое надпочечников из норадреналина. Дофамин и норадреналин
являются важными нейромедиаторами. Катехоламины обеспечивают адапта¬
цию к острым и хроническим стрессам. Адреналин и норадреналин оказывают
сильный хронотропный и инотропный эффекты на сердце. Норадреналин при¬
водит к сужению сосудов в мышцах и повышению артериального давления. При
стрессе или значительной гипогликемии отмечается десятикратное увеличение
адреналина в плазме. Метаболический эффект адреналина аналогичен действию
глюкагона и противоположен действию инсулина. Адреналин стимулирует рас¬
пад гликогена до глюкозы, снижает поглощение глюкозы мышцами и жировой
тканью. В связи с быстрой элиминацией катехоламинов из кровотока основ¬
ную информацию о деятельности симпатоадреналовой системы у больных при
разных видах патологии получают измерением выделения катехоламинов с
мочой.
306 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙПовышение концентрации.• Инфаркт миокарда.• Черепно-мозговая травма.• Кетоацидоз у больных сахарным диабетом.• Феохромоцитома. При феохромоцитоме часто увеличено соотношение нор-
адреналин/адреналин. Вероятно, этим объясняется различие в клинических
проявлениях, поскольку норадреналику приписывают основную роль в пато¬
генезе гипертонии, а адреналин считают ответственным за гиперметаболизм.• Симпатиконейробластома.• Параганглиомы, апудома (синдром Сиппла).• Хронический алкоголизм, особенно алкогольный делирий.• Маниакальная фаза маниакально-депрессивного психоза.КортизолРеферентные Пределы:• на 8:00 - 200-700 нмоль/л (70-250 нг/мл);• на 20:00 — 55-250 нмоль/л (20-90 нг/мл).Разница между утром и вечером более 100 нмоль/л.Кортизол является стероидным гормоном, выделяемым в кровь корой над¬
почечника. Суточный ритм выделения кортизола формируется до третьего года
жизни и зависит от времени сна и темноты. Кортизол составляет 75-90% кор-
тикоидоБ, циркулирующих в крови. Концентрация его в крови обычно отражает
совокупную концентрацию кортикоидов. Кортизол в крови главным образом
связан с глобулином ~ транскортином и альбумином. Менее 5% циркулирующего
в крови кортизола биологически активно. Кортизол метаболизируется в печени,
период полураспада гормона составляет 80-110 мин, он фильтруется в почечных
клубочках и удаляется с мочой.Следует обратить внимание на следующее.• При беременности может повышаться концентрация кортизола и нарушаться
суточный ритм выделения.• в случае частичного или полного блока в синтезе кортизола происходит пони¬
жение концентрации кортизола, повышение концентрации АКТТ и совокупной
концентрации кортикоидов.• Во время взятия крови нельзя подвергать пациента стрессу; кровь лучше всего
брать через предварительно установленный катетер.Повышение концентрации.• Синдром Иценко-Кушинга.• Гипотиреоз (снижение катаболизма кортизола).• Цирроз печени (снижение катаболизма кортизола).• Некомпенсированный сахарный диабет.• Астматические состояния.• Состояние алкогольного опьянения у неалкоголиков.С сохранением суточного ритма выделения.• Стресс, болевой синдром.• Лихорадка.• Синдром Иценко-Кушинга (в некоторых случаях).С нарушением суточного ритма выделения (отсутствие вечернего понижения
концентрации кортизола).• Острые инфекционные заболевания.• Менингиты.• Опухоли ЦНС, сопровождающиеся повышением внутримозгового давления.• Акромегалия.
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 3Q7• Правожелудочковая недостаточность.• Печеночная недостаточность.• Почечная гипертония.• Гиперфункция гипофиза.• Психическая депрессия (в некоторых случаях).Влияние лекарственных препаратов.• Синтетические аналоги глюкокортикоидов (особенно преднизолон и пред-
низон). Это не касается дексаметазона.• Эстрогены (из-за повышения концентрации транскортина).• Амфетамин.Понижение концентрации.Оценку гипофункции коры надпочечников следует проводить по утреннему
определению концентрации кортизола в крови (8:00), когда секреция гормона
самая высокая.• Первичная гипофункция коры надпочечника (болезнь Аддисона).• Гипофункция коры надпочечника при нарушении функции гипофиза.• Торможение функции коры надпочечника в результате длительного приема
АКТГ или глюкокортикоидов.СВОБОДНЫЙ КОРТИЗОЛ в МОЧЕРеферентные пределы:• 30-300 нмоль/сут, 10-100 мкг/сут;• 15-30 нмоль/нмоль креатинина.Материал для исследования; суточная моча. Рекомендуют провести два
сбора суточной мочи в течение двз^^х дней, так как это ограничивает влияние фак¬
тора стресса на результаты анализа.Не связанный с белками кортизол фильтруется в почечных клубочках и
выводится с мочой. Кортизол в моче непосредственно отражает биологически
активнзтю форму циркулирующего в крови гормона. Определение кортизола в
моче является основным тестом при диагностике состояний гиперфункции коры
надпочечника. При нарушении метаболизма кортизола и почечной недостаточ¬
ности количество выводимого с мочой кортизола может не отражать размеров его
секреции. Тучность и физическая нагрузка могут повышать количество кортизола,
выводимого с мочой.Увеличение выделения.• Синдром Иценко-Кушинга.• Состояния гипогликемии.• Ночная гипогликемия при сахарном диабете.• Психическая депрессия.• Тучность.• Гирсутизм.• Алкоголизм.• Острый панкреатит.• Посттравматические и послеоперационные состояния.17а-0КСИПР0ГЕСТЕР0НРеферентные пределы: нмоль/л; мкг/л.• Новорожденные — менее 19,0; менее 6,3.• Недоношенные новорожденные — менее 40,0; менее 13,3.• Девочки до половой зрелости — менее 3,0; менее 1,0.• Мальчики до половой зрелости — менее 3,3; менее 1,1.• Женщины:❖ фолликулиновая фаза — менее 2,4; менее 0,8;ШЩ;
308 ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ<0- лютеиновая фаза — менее 8,6; менее 2,8;’О' период менопаузы — менее 1,5; менее 0,5.• Мужчины — менее 6,7; менее 2,2.17а-оксипрогестерон вырабатывается в надпочечниках, яичниках, яичках и
плаценте, является стероидом, наиболее специфическим показателем для диа¬
гностики адреногенитального синдрома. 17-оксипрогестерон — предшественник
кортизола, обладает натрийуретическими свойствами, в результате гидроксилиро-
вания превращается в кортизол. Недостаток гидроксилазы приводит к снижению
синтеза кортизола и увеличению секреции АКТГ, что сопровождается гиперплази¬
ей коры надпочечников и увеличением в плазме 17-оксипрогестерона, 21-дезок-
сикортизола и 11-дезоксикортизола. 17-оксипрогестерон метаболизируется до
прегнандиола, который удаляется с мочой. Имеют место колебания концентрации
17-гидроксипрогестерона в крови в течение суток.Внимание! Пробы крови для теста на 17-оксипрогестерон следует собирать
утром в 8:00-10:00 — время самых высоких концентраций. Гпюкокортикоиды
понижают концентрацию 17-оксипрогестерона в крови.Повышение концентрации,• Врожденная гиперплазия надпочечника (адреногенитальный синдром).
Значение концентрации 17-оксипрогестерона в крови выше 50 нмоль/л у
новорожденных (5-10-й день с момента рождения) указывает на врожден¬
ную гиперплазию надпочечника,Паратиреоидный гормонРеферентные пределы: радиоиммунологический метод — 10-65 пг/мл.Паратиреоидный гормон (ПТГ) контролирует метаболизм кальция и неор¬
ганического фосфора, действуя главным образом на кости, почки и желудочно-
кишечный тракт. ПТГ оказывает гиперкальциемический и гипофосфатемический
эффекты, вызывая выход кальция из кости, усиленную реабсорбцию его в прок¬
симальных канальцах почек и всасывание кальция в кишечнике. Кроме того,
ПТГ в почках активирует образование кальцитриола [1,25(ОН)2Вз]. Секреция
ПТГ находится в обратной зависимости от концентрации ионов кальция в крови.
Концентрация ионов кальция в плазме является главным фактором, регулирую¬
щим выделение ПТГ паращитовидными железами. Для гиперпаратиреоза патог-
номонично одновременное повышение содержания кальция и понижение неорга¬
нического фосфора в сыворотке, а для гипопаратиреоза — понижение кальция и
повышение неорганического фосфора. ПТГ — пептид, построенный из 84 амино¬
кислот, время его полужизни в крови — около 20 МИН- Гормон подвергается посте¬
пенному катаболизму в печени и почках, поэтому в системе циркуляции наряду с
интактным ПТГ присутствуют многочисленные пептидные фрагменты» заслужи¬
вающие внимания в плане диагностики. Преобладающим фрагментом является
биологически неактивный С-концевой пептид ПТГ. Его концентрация в сыворотке
коррелирует с секреторной функцией паращитовидных желез при том условии, что
процессы катаболизма интактного ПТГ не нарушены. В противном случае реко¬
мендуют определение концентрации другого фрагмента ПТГ — N-концевого 1-34
ПТГ, который является биологически активной частью гормона.Внимание! Концентрация ПТГ в крови пожилых людей почти в два раза выше,
чем у молодых.Повышение концентрации.При одновременной гиперкальциемии.• Первичная гиперфункция паращитовидных желез:гиперплазия паращитовидных желез:❖ рак паращитовидных желез.
'ШШіДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 3Q9 ШШ• Вторичная гиперфункция паращитовидных желез:❖ тип I — связанная с опухолью гипофиза или островковой ткани поджелу¬
дочной железы;❖ тип II — связанная с раком щитовидной железы или феохромоцитомой.• Эктопическое выделение ПТГ. Выделение субстанций, подобных ПТГ, ново¬
образованиями, но не паращитовидными железами (например, при раке
легких, молочных желез, надпочечника).Внимание! Непосредственное определение субстанций, подобных ПТГ, в сыво¬
ротке крови часто оказывается невозможным по аналитическим соображениям.При этом типе нарушений в диагностике помогает определение нефротического
цАМФ.При одновременной гипокальциемии.• Вторичная гиперфункция паращитовидных желез (чаще всего вызванная
почечной недостаточностью).• Псевдогипофункция паращитовидных желез;❖ тип I — отсутствие гиперфосфат)фии и изменения выведения цАМФ с
мочой после инъекции ПТГ;тип И — повышенное выведение цАМФ с мочой без гиперфосфатурии
после инъекции ПТГ.Понижение концентрации.При одновременной гиперкальциемии.• Саркоидоз.• Чрезмерное потребление молока {milk alkali syndrome).• Отравление витамином D.• Лечение тиазидами.• Гиперфункция щитовидной железы.• Атрофия костей в результате длительной неподвижности.• Злокачественные опухоли, продуцирующие простагландины или элементы,
активирующие остеолиз.• Острый панкреатит.При одновременной гипокальциемии.• Гипофункция паращитовидных желез.Ренин (рениновая активность плазмы)Референтные пределы:❖ горизонтальное положение (лежа) — 2,1-4,3 нг/мл в час;
вертикальное положение (стоя) — 5,0-13,6 нг/мл в час.Ренин является протеолитическим ферментом, выделяемым юкстагломеруляр-
ным аппаратом почек. Секреция ренина в почках стимулируется снижением кровя¬
ного давления в привносящих к клубочкам артериях, понижением концентрации
натрия в области плотного пятна и дистальных канальцев, а также в результате
возбуждения симпатической системы. В качестве субстрата для ренина выступа¬
ет ангиотензиноген — белок плазмы, принадлежащий к группе а^-глобулинов.При реакции, катализированной ренином, возникает биологически неактивный
ангиотензин 1, который подвергается дальнейшему превращению в ангиотензин
II. Ангиотензин II обладает выраженной способностью сокращать кровеносные
сосуды, тем самым вызывая почечную гипертензию. Ангиотензин II активирует
выделение альдостерона корой надпочечника.Внимание! Активность ренина в плазме крови существенно изменяется в зави¬
симости от положения тела и содержания натрия в пищевом рационе. Активность
ренина может быть повышенной у тех, кто придерживается низконатриевой
диеты, а также у беременных.
31 о ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ
Повышение активности.• Уменьшение внеклеточной жидкости (кровотечения, бедный натрием рацион
питания, ограничение питья).• Правожелудочковая недостаточность кровообращения.• Нефротический синдром.• Цирроз печени.• Первичная недостаточность коры надпочечников (болезнь Аддисона).• Активизация симпатической нервной системы.• Гипертония (в некоторых случаях).• Сужение почечной артерии.• Нейробластома, выделяющая рениноподобный белок.• Рак почки, выделяющий ренин.• Гемангиоперицитома.• Лекарственные препараты (диуретики, глюкокортикоиды, диазоксид, гидра-
лазин, простагландины, эстрогены).Понижение активности.• Чрезмерное потребление соли.• Ограниченное потребление калия.• Увеличенное выделение вазопрессина.• Острая почечная недостаточность.• Первичный гиперальдостеронизм.• Лекарственные препараты (антагонисты р-адренергических рецепторов,
«-метилдофа, резерпин, клонидин, ингибиторы синтеза простагландинов).Соматотропный гормон (гормон роста)Референтные Пределы: 0-10 ЕД/л (0-5 мкг/л).Соматотропный гормон (СТГ) является пептидом, выделяемым передней долей
гипофиза, анаболическим гормоном, стимулирующим синтез белков, процессы
митоза клеток и усиливающим липолиз, повышая освобождение свободных жир¬
ных кислот из жировой ткани. Выделение гормона повышено при физической
работе, во время глубокого сна, при гипогликемии, богатом белками питании.
Повышенное выделение СТГ гипофизом в период роста приводит к гигантизму, а у
взрослых — к акромегалии. Пониженное выделение СТГ в период роста приводит
к карликовости.Следует обратить внимание на следующее.• Концентрация СТГ в крови увеличивается во время голодания (примерно в
15 раз на 2-й день голодания) и во время сна.• Снижение концентрации гормона роста отмечается при тучном телосложе¬
нии.• У детей имеет место задержка роста. У взрослых значимые симптомы болез¬
ни отсутствуют. Нарушение выделения гормона роста является наиболее
ранним симптомом дисфункции гипофиза.Повышение концентрации.• Акромегалия и гигантизм.• Голодание.• Хроническая почечная недостаточность.• Стресс, посттравматические и послеоперационные состояния.• Алкоголизм.• Порфирия.• Гипергликемия при неправильно контролируемом диабете.• Эктопическая продукция опухолями желудка, легких.
ДИАГНОСТИКА ЭНДОКРИННЫХ НАРУШЕНИЙ 311• Лекарственные препараты; глюкагон, АКТГ (синактен), вазопрессин, эстроге¬
ны (пероральные контрацептивы), норадреналин, дофамин, серотонин, сти¬
муляторы а-адренорецепторов (клони дин), антагонисты р-адренорецепторов
(пропранолол), агонисты дофамина (L-дофа), бромокриптин, аргинин, инс>’- "'
ЛИН, витамин РР (внутривенно).Понижение концентрации.• Гипофизарная карликовость. ,• Гиперкортицизм.• тучность (в некоторых случаях).• Ятрогенные воздействия: радиотерапия, химиотерапия, оперативные вмеша¬
тельства.• Синдром Иценко-Кушинга.• Лекарственные препараты: прогестерон, глюкокортикоиды, антагонисты
«-адренергических рецепторов (фентоламин), стимуляторы р-адренорецеп-
торов, антагонисты серотониновых рецепторов, антагонисты дофаминовых
рецепторов (производные фенотиазина), соматостатин, факторы, вызываю¬
щие гипергликемию.
Глава 6
Химико-микроскопические
исследования биологических
материаловИССЛЕДОВАНИЕ МОЧИ
Правила сбора мочи для общего анализаДля получения качественных результатов исследований сбор и
консервирование мочи должны быть стандартизированы. Л)?чше
всего, если инструкции будут напечатаны и утверждены админи¬
страцией лечебно-профилактического учреждения (ЛПУ). Должны
быть четко определены порядок и последовательность процедуры,
а также сроки доставки мочи в лабораторию. Контейнер для мочи
должен быть или одноразовым, или перед использованием надеж¬
но очищен от детергентов. По возможности надо сразу собирать
мочу в посуду, в которой она будет доставлена в лабораторию. Если
назначено микробиологическое исследование, контейнер должен
быть стерильным. При исследовании белков и гормонов следует
предотвратить абсорбцию аналитов на стенках сосуда. Мочу из
судна, утки, горшка брать не рекомендуют, поскольку даже после
обработки этих сосудов в них может оставаться осадок фосфатов,
способствующих разложению свежей мочи. Во избежание попа¬
дания посторонних примесей мочу нельзя исследовать во время
менструации. После цистоскопии анализ можно назначать не ранее
чем через 5-7 сут.В клинической практике проводят химическое, микроскопиче¬
ское и бактериологическое исследование мочи. Пациент сам соби¬
рает мочу почти для всех типов исследований, за исключением тех
случаев, когда анализ требуется провести у детей, тяжелобольных
пациентов или методом катетеризации. Применяют три вида сбора
мочи: утреннюю порцию, случайные пробы (разовая моча), за
определенный промежуток времени (или суточную мочу).Первую утреннюю порцию мочи, которая в течение ночи
собирается в мочевом пузыре, предпочтительно использовать для
общего анализа. Это исключает естественные суточные колебания
показателей, и характеристика исследуемых параметров получается
более объективной.Моча должна быть собрана после тщательного туалета наружных
половых органов в сухую, чистую, хорошо отмытую от чистящих
и дезинфицирующих средств посуду или в посуду разового поль¬
зования, выпускаемую специально для этих целей. Мужчины при
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 313мочеиспускании должны полностью освободить наружное отверстие мочеиспуска¬
тельного канала, оттянув кожную складку. Женщинам следует раздвинуть половые
губы и перед мочеиспусканием тщательно протереть влажным тампоном область
мочеиспускательного канала.Для анализа можно собирать всю мочу, однако в нее могут попасть клеточные
элементы, не относящиеся к мочевьщелительной системе, такие как клетки орого¬
вевшего плоского эпителия с наружных частей половых органов. Именно поэтому,
как правило, первую порцию мочи не используют. Вторую порцию мочи собирают
в чистую и сухую посуду. Однако необходимо помнить, что в первой порции мочи
могут быть обнаружены диагностически ценные клеточные элементы, свиде¬
тельствующие о воспалении мочеиспускательного канала (двухсгаканная проба).
Посуду с мочой плотно закрывают крышкой и доставляют в КДЛ.Инструкцию о порядке сбора мочи необходимо довести до сведения каждого
пациента, подчеркнув важность этого для диагностики патологических процессов.
Анализ мочи следует провести в течение 2 ч после получения материала. При дли¬
тельном нахождении доставленной мочи в помещении разрушаются клеточные
элементы, уробилиногены восстанавливаются в уробилины, и результаты могут
оказаться ложноотрицательными. Кроме того, возможно загрязнение бактериями
и грибами, жизнедеятельность которых приводит к образованию аммиака, още¬
лачиванию мочи и увеличению значения pH, а при глюкозурии — к снижению
содержания глюкозы.Случайные пробы мочи можно собирать в любое время. Их используют для
общего клинического обследования и пробы Нечипоренко. Перед сбором мочи
проводят тщательный туалет наружных половых органов. Лежачих больных
предварительно подмывают слабым раствором марганцово-кислого калия, затем
промежность вытирают сухим стерильным ватным тампоном в направлении от
половых органов к заднему проходу. У лежачих больных, собирая мочу, важно сле¬
дить, чтобы сосуд был расположен выше промежности во избежание загрязнения
из области заднепроходного отверстия.Собранную мочу следует как можно скорее доставить в КДЛ. В идеале анализ
мочи должен проводиться в течение одного часа после взятия пробы. Время, про¬
шедшее с момента сбора материала, имеет существенное значение для морфологи¬
ческой оценки нестабильных компонентов мочевого осадка.Для сбора проб мочи у новорожденных применяют мешки с гипоаллергенным
покрытием, приклеивающимся к коже. Область лобка и промежности должны
быть вымыты с мылом.Пробы за определенный промежуток времени собирают после первого
утреннего мочеиспускания. При проведении пробы Зимницкого и исследовании
глюкозурического профиля используют сбор мочи за определенный промежуток
времени. Если для анализа требуется собрать мочу за 10-12 ч, перед сном пациент
должен опорожнить мочевой пузырь и отметить время этого действия. Эта порция
мочи не нужна для анализа. Затем больной собирает мочу через 10-12 ч в при¬
готовленную посуду, в которой проба доставляется в КДЛ. В дневное время сбор
мочи проводится аналогично — через 2-3 ч.Катетер или пункция мочевого пузыря могут быть использованы только в край¬
них случаях — у новорожденных, грудных детей, пациентов с заболеваниями про¬
статы, иногда — для микробиологических исследований. Из длительно стоящего
катетера мочу для исследований брать нельзя. Если используется не вся собранная
моча, перед сливанием ее части необходимо тщательное взбалтывание, чтобы оса¬
док, содержащий форменные элементы и кристаллы, не был утрачен.Для исследования суточной мочи пациент собирает мочу в течение 24 ч на
обычном питьевом режиме. Для сбора предпочтительнее использовать пласти¬
ковую емкость объемом не менее 2 л. Следует напомнить пациенту, что первую
314 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВутреннюю порцию не берут (нулевое время), ее выливают, а собирают все после¬
дующие порции, причем последняя порция берется в то же время, когда накануне
был начат сбор. Время начала и конца сбора отмечают. Если не всю мочу отправ¬
ляют в лабораторию, количество суточной мочи измеряют, тщательно перемеши¬
вают, отливают около 50 мл в чистый сухой контейнер, который снабжают соот¬
ветствующей этикеткой с указанием точного суточного диуреза, и направляют на
анализ.Физические свойства мочиСостав мочи значительно варьирует даже у здоровых людей, что осложняет
анализ мочи и заставляет быть осторожным при интерпретации полученных
результатов. Суточный объем мочи и концентрация в ней тех или иных компонен¬
тов зависят от интенсивности гломерулярной фильтрации, степени канальцевой
реабсорбции и экскреции.КОЛИЧЕСТВО МОЧИНормальное количество мочи, выделяемое в течение суток, зависит от возрас¬
та (табл. 6-1). Заподозрить олигурию или анурию у новорожденных можно при
сухих пеленках в течение 12-18 ч. Количество мочи, выделяемое за сутки у здоро¬
вых детей в возрасте от 1 года до 10 лет, можно вычислить по формуле:600 -ь 100 (А - 1) = мл мочи за 24 ч,где А — возраст ребенка.Таблица 6-1. Нормальное количество мочи, выделяемое за сутки людьми разных возрастовВозрастКоличество мочи за 24 ч млНедоношенные и искусственно вскармливаемыеБольше, чем у новорожденных доношенных того же
возрастаНоворожденный0-60До Зсут0-100До Юсут5-^20До 1 года100-8001-5 лет600-9005-10 лет700-120010-14 лет1000-1500Мужчины1000-2000Женщины1000-1600Изменение количества мочи у взрослых и детей при патологии представлено в
табл. 6-2.Таблица 6-2. Количество мочи у взрослых и детей при патологииКоличество мочиПатологияПолиурия — увеличе¬
ние суточного коли¬
чества мочи до 3 л и
болееПри полидипсии (повышенной жажде); разрешении отеков, транссудатов, экс¬
судатов; после приема мочегонных препаратов; при снижении или отсутствии
секреции антидиуретического гормона (АДГ) нейрогипофизом (несахарном диа¬
бете); при нечувствительности почечных канальцев к АДГ (наследственном неса¬
харном диабете, остром канальцевом некрозе, гипокалиемии, гиперкальциемии,
состоянии после трасплантации почки); при системных заболеваниях (миеломе,
амилоидозе, серповидноклеточной анемии, синдроме Шегрена); при осмотиче¬
ском диурезе (сахарном диабете); при хронической почечной недостаточности
(ХПН)
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 315Окончание табл. 6-2Количество мочиПатологияОлигурия — уменьше¬
ние суточного количв-
ства мочиПри гидролабильности у детей, лихорадочных состояниях, заболеваниях сердца,
острой почечной недостаточности (ОПН), нефросклерозеАнурия — отсутствие
мочиПри ОПН, тяжелых нефритах, закупорке мочевыводящих путей опухолью или
камнем, при менингитах (рефлекторно), отравлениях, перитоните, тетанииОлакизурня — редкое
мочеиспусканиеПри нервнорефпекторных нарушенияхСтрангурия — задерж¬
ка или затрудненное
мочеиспусканиеПри аденоме и раке предстательной железы, камне и обструкции нижних
отделов мочевыводящих путей (уролитиазе, склерозе шейки мочевого пузыря,
стриктуре мочеиспускательного канала от воздействия наркотиков, ганглиобло-
каторов, атропина), задержка мочи после операции, при парапроктите, остром
цистите, при заболеваниях или поражениях центральной нервной системы (ЦНС)Поллакиурия — уча¬
щенное мочеиспусканиеПри воспалении мочевыводяцих путей и мочевого пузыря, пиелонефрите
(типичный симптом), мочекаменной болезни, простатите, простуде, у детей
невротического склада (частые позывы, мочеиспускание малыми порциями,
иногда болезненное)Анишурия — недержа¬
ние мочи, связанное с
нарушением сфинкте¬
ров мочевого пузыря,
проявляется непроиз¬
вольным мочеиспуска¬
нием без позывовЧастое следствие послеродовой травмы, органических поражений ЦНС (нейро¬
генная дисфункция мочевого пузыря), пороков развития мочевыводящих пугей,
также возникает при воспалении мочевыводящих путей, судорогах, тяжелых
лихорадочных состояниях, функциональных (рефлекторных) нарушениях у
детей невротического склада (проявляется как ночное недержание мочи)Недержание мочи —неспособность удер¬
жать мочу при импера¬
тивном позывеПри остром цистите, аденоме, раке простаты, опухоли шейки мочевого пузыряНиктурия — ночное
мочеиспускание при
позывах на него и пере¬
полненном мочевом
пузыреПри начальной стадии сердечной декомпенсации, циститах, цистопиепитах и др.ЦВЕТ МОЧИНормальный цвет мочи у взрослых и детей старшего возраста зависит от
ее концентрации и колеблется от янтарно-желтого до соломенно-желтого.
Концентрированная и кислая моча обычно окрашена интенсивнее, выделяется в
меньшем количестве и обладает высокой относительной плотностью — явление
гиперхромурии. Бледноокрашенная моча имеет низкую относительную плотность,
слабокислую или нейтральную реакцию и выделяется в большом количестве
(физиологическая полиурия) — гипохромурия. Причины, от которых зависит цвет
мочи в норме и при патологии, представлены в табл. 6-3.Таблица б'З. Причины, определяющие цвет мочи в норме и при патологииЦвет мочиПричиныКомментарииМоча в физиологических условияхЯнтарно- или
соломенно-желтыйУрохромАиВ, уроэритрин.стер- 1
кобилин, гематопорфиринНа цвет мочи могут влиять хромогены
пищевых продуктов и витаминыГиперхромурия физио¬
логическаяОграниченное питье, усиленное
потоотделениеМоча темно-желтого цвета, с высоким
удельным весомУпотребление в пищу моркови,
ревеня, витаминов группы ВМоча часто окрашена в цвет съеденных
продуктовКрасныйУпотребление свеклыРеакция на кровь в моче («сухая химия»)
отрицательная
316 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВПродолжение табл. 6-3Цвет мочнПричиныКомментарииГипохромурия физио¬
логическаяПолиурия на фоне усиленного
питьяМоча почти бесцветная, с низкой относи¬
тельной плотностьюМоча при патологииГиперхромурияДегидратация: диарея, токсикозы,
рвота, лихорадкаПри взбалтывании пена бесцветная.
Реакция на уробилин и билирубин {«сухая
химия») отрицательнаяУробилинурия. гепатиты, цирроз
печени, гемолитические состоя¬
ния, разрешение больших кро¬
воизлияний, обширный инфаркт
миокарда, малярия, тяжелая скар¬
латина. отравления, запорыПри взбалтывании мочи пена бесцветная.
Положительная реакция с тестовой зоной
на уробилиноген («сухая химия»), положи¬
тельная реакция НейбауэраВилирубинурия: обтурационная
желтуха, паренхиматозное пора¬
жение печени (гепатиты острые и
хронические, цирроз печени)При взбалтывании мочи пена желтая.
Положительная реакция с тестовой зоной
на билирубин («сухая химия»), положитель¬
ная проба ФушеГипохромурияПолиурия на фоне сахарного и
несахарного диабетаПри сахарном диабете — высокая относи¬
тельная плотность мочи и положительная
реакция на глюкозуНефросклерозИзостренурия, плотность мочи постоянна и
близка плотности безбелковой плазмы —
1,010 г/млКрасный, бурый,
красновато-желтыйГемоглобинурия: холодоеая,
маршевая, при переливании несо¬
вместимой крови,отравлении
сульфаниламидами, анилиновыми
красителямиПоложительная реакция тестовой зоной
диагностических полосок на кровь {«сухая
химия»)Гематурия: кровотечение из почек,
мочевыводящих путейМиоглобинурия: инфаркт мио¬
карда, краш-синдром, удар
электрическим током, отравление
барбитуратами, окисью углерода,
пищевые токсикоинфекцииКачественная проба с кристаллическим
сульфатом аммония (получается ярко-
красная окраска)Розово-красныйПорфиринурия: заболевание
печени, интоксикации, инфекции,
железодефицитная и гемолитиче¬
ская анемия, лимфогранулематоз,
лейкозы, цитостатическая терапияОтрицательная реакция тестовых зон диа¬
гностических полосок на кровь («сухая
химия»), положительная реакция с реакти¬
вом ЭрлихаПорфобилиногенурия и атиоле-
вулинурия характерны для острой
перемежающейся порфирии с
поражением мышц, центральной и
периферической нервных системПорфобилиноген вступает в реакцию с
реактивом Эрлихаприем феназона, сульфатиазолаКристаллы сульфазола похожи на кристал¬
лы мочевой кислотыЗеленовато-желтыйОкисление билирубина в били-
вердинИнфекционная или обтурационная желту¬
ха — положительная реакция на
билирубин («сухая химия»)СинийПрием метиленовой сини* при
инфекции мочевыводящих путейМетиленовая синь* окрашивает в синий цвет
кристаллы оксалатов и клеточные элементыЖелто-коричневый или
коричневыйБилирубинурияЖелтая пена при встряхивании и положитель¬
ная реакция на билирубин («сухая химия»)Метгемоглобинурия, гемоглоби-
нурияПоложительная реакция на кровь («сухая
химия»)
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 317Окончание табл. 6-3Цвет мочиПричиныКомментарииМолочно-белыйМного нейтрофилов {пиурия) —
цистит, обострение пиелонефрита,
вскрытие абсцесса почкиПоложительная реакция тестовых полосок
на лейкоциты. При микроскопии осадка
мочи отмечаются нейтрофилы.Липурж нефрозы липоидные,
амилоидно-пипойдныеПри микроскопии осадка — клетки почеч¬
ного эпителия в состоянии жировой дис¬
трофии, гиалиновые цилиндры с каплями
жира, жировые цилиндры, иногда кристал¬
лы холестеринаХилурия возможна при тяжелых
травмах (разрыв крупного лимфа¬
тического протока)Исчезает при встряхивании мочи с эфиромЧерно-бурыйАлкаптонурия, меланинурияОтрицательная реакция тестовых полосок
на кровь. Черный цвет образуется при стоя¬
нии мочи на воздухеГ омогентизиновая кислотаФормируется при стоянии на воздухе в
щелочной среде, алкаптонурияПРОЗРАЧНОСТЬ МОЧИНормальная моча прозрачна. Помутнение мочи может вызываться солями, кле¬
точными элементами, бактериями, слизью, жирами (хилурия, липурия). Причину
помутнения определяют при микроскопии мочи или с помощью химического ана¬
лиза. Некоторые наиболее простые процедуры, позволяющие установить причину
помутнения, представлены в табл. 6-4. Для каждого исследования берут не более
2-3 мл материала.Таблица 6-4. Процедуры, позволяющие установить причину помутнения мочиИсследуемыйматериалРеактив, процедураРезультатПричина помут¬
ненияМутная мочаНагреваниеПросветлениеУратыНагреваниеЕще большее помутнениеФосфаты2-3 капли 30% уксусной кислотыПросветлениеФосфаты2-3 капли 30% уксусной кислотыШипение и просветлениеКарбонаты1-2 мл эфира, встряхнутьпросветлениеЖирЗАПАХ МОЧИСвежевыпущенная моча запаха практически не имеет. Аммиачный запах харак¬
терен для мочи больных с циститами, пиелитами, пиелонефритами. У больных
диабетом при кетонурии появляется яблочный или плодовый запах.Свойства мочи, определяемые тестовыми полоскамиДиагностические тестовые полоски предназначены для «первой линии контакта
врача с пациентом»; в клинических лабораториях ЛПУ, непосредственно у посте¬
ли больного в стационаре, в службе скорой помощи, для массовых обследований
(диспансеризации) населения, а также для использования пациентами или их род¬
ственниками в домашних условиях.Реагентные полоски изготавливаются из специальных волокнистых материалов.
Исследования биологических жидкостей могут быть выполнены с помощью как
монофункциональных, предназначенных для определения отдельных показате¬
лей, так и полифункциональных полосок с различными комбинациями диагности¬
ческих зон, что позволяет проводить комплексные исследования, целенаправленно
выявлять и контролировать широкий спектр заболеваний. Полифункциональные
318 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВПОЛОСКИ имеют несколько зон индикации (от 2 до 11). Комбинации реагентных
зон составлены так, чтобы полифункциональные полоски как можно полнее
отвечали требованиям диагностики заболеваний. Они позволяют систематически
контролировать и своевременно обнаруживать заболевания мочевыделительной
системы, такие как гломерулонефрит, пиелонефрит, нефропатии различной этио¬
логии, пиелоцистит, цистит, уретрит, а также сахарный диабет, обтурационная и
инфекционная желтуха и другие заболевания.ЗНАЧЕНИЕ pH МОЧИУ фильтруемой плазмы крови и первичной мочи в норме pH составляет 7,35. Все
значения pH плазмы крови ниже этой величины расцениваются как ацидоз, а все
значения pH более 7,35 — как алкалоз. Активность ионов водорода в моче зависит
от многих факторов, в том числе от характера пищи и отдельных метаболических
процессов. При употреблении «тяжелой» пищи (мяса), содержащей серу и фосфор,
обычно образуется кислая моча (pH = 4,5-5,5), а при употреблении молочной
и растительной пищи — нейтральная или слабощелочная (pH = 7,0-7,5). При
катаболических процессах в организме образуются выделяемые почками сильные
неорганические и органические кислоты. С окончательной мочой выделяется зна¬
чительное количество неорганических сульфатов и фосфатов, содержание кото¬
рых составляет около 60 ммоль/сут.Почечные канальцы участв)тот в поддержании кислотно-основного состояния
(КОС) внутренней среды организма. К одной из основных функций почек относится
поставка в кровоток дополнительного количества ионов бикарбоната, уравновеши¬
вающих образование ионов водорода в организме. Функция почек, направленная
на поддержание КОС, состоит из реабсорбции профильтрованных через почечный
фильтр ионов бикарбоната и выведения ионов водорода с мочой. Реабсорбция
бикарбоната происходит главным образом в проксимальном отделе нефрона.Существует взаимосвязь количества реабсорбированного бикарбоната с ионами
хлора. Так, рост реабсорбции бикарбоната при дыхательном ацидозе или мета¬
болическом алкалозе сопровождается снижением реабсорбции ионов хлора и
ведет к гипохлоремии. Определение концентрации ионов хлора в плазме и ионов
бикарбоната в моче может предоставить дополнительную информацию о типе
нарушения КОС.Референтные пределы. У здорового новорожденного pH окончательной мочи
составляет 5,5-6,0. Низкое значение pH является следствием кратковременного
эксикоза в первые дни жизни или следствием неокрепших функций почек.у недоношенных новорожденных pH мочи колеблется от 4,8 до 5,5.После периода новорожденности у детей, находящихся на грудном вскармли¬
вании, pH мочи составляет 7,0-7,8 (нейтральная или щелочная реакция), после
отнятия от груди становится таким же, как у взрослых — 6-7.У детей на искусственном вскармливании pH мочи колеблется от 5,5 до 7,0.У здорового взрослого человека и ребенка старшего возраста pH мочи в преде¬
лах 5,5-7,0 (чаще 6,0-6,5), а при патологии — в пределах 5-9.Ацидурия — состояние, когда pH окончательной мочи постоянно составляет
4,6-5,0. При передозировке или преобладании в рационе мясной пищи возникает
алиментарная ацидурия. Необходимо отметить, что при этом повышается экскре¬
ция с мочой мочевой кислоты.Резко кислая моча образуется при всех состояниях, приводящих к метаболиче¬
скому или дыхательному ацидозу, так как почки корригирзтот или компенсируют
сдвиги КОС (мочекислый диатез, подагра, лейкозы, цитостатическая и лучевая
терапия). Сопутствующие друг другу ацидоз и кетонурия встречаются, как пра¬
вило, при голодании и относительном дефиците углеводов. Сочетание ацидурии,
кетонурии и глюкозурии свидетельствует о декомпенсированном сахарном диабе¬
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 319те. Это состояние выделяют как диабетический кетоацидоз. Піпергликемический
синдром (включая подагру), сопровождающийся ацидурией, может привести к
кристаллизации в канальцах почек мочевой кислоты с образованием конкремен¬
тов в мочевыводящих путях (лоханках и мочевом пузыре). Кристаллизация моче¬
вой кислоты в канальцах почек при лейкозах может вызвать анурию. При таких
состояниях необходимо не только увеличивать объем выделяемой мочи, но и
способствовать ее ощелачиванию, вводя цитраты в количествах, поддерживающих
pH мочи в диапазоне 6,5-7,0. Резко кислая реакция мочи характерна для лимфати¬
ческого диатеза у детей, а также для туберкулеза почек, ОПН и }ШН.Если pH мочи остается постоянной в пределах 6,8 даже при изменении состава
пищи, это указывает на нарушение механизма регуляции КОС в канальцах (тубу¬
лярный ацидоз). Тубулярный ацидоз можно подтвердить с помощью регулярного
определения pH мочи пациента в течение нескольких суток.Алкалурия — состояние, при котором pH мочи постоянно выше 7,0. Если исклю¬
чается алиментарная алкалурия (бывает при молочно-овощной диете или введе¬
нии щелочных растворов), следует предположить, что стойкая щелочная реакция
мочи (pH = 7,0-9,0) связана с инфекцией мочевыводящих путей (микроорганиз¬
мы способны гидролизировать мочевину), «Аммониевое расщепление» может
наблюдаться также при бактериальной контаминации мочи in vitro, при этом pH
достигает 8,5-10,0, Дыхательный и метаболический ацидоз в первое время при¬
водит к алкалурии, но постепенно при истощении запасов калия или развитии
гиперальдостеронизма моча становится кислой.Интерпретация результатов pH мочи приобретает клиническое значение только
в том случае, если можно провести корреляцию с другой информацией, получен¬
ной при обследовании пациента, или же при поставленном диагнозе. Тогда по pH
мочи можно судить о течении заболевания. Самостоятельное определение pH
мочи не имеет большого клинического значения, но в сочетании с клиническими
симптомами и другими лабораторными показателями может дать важную инфор¬
мацию. В табл. 6-5 представлено соотношение pH мочи и крови при некоторых
патологических состояниях.Таблица 6-5. Значения pH мочи и крови при некоторых патологияхРеакция, pH j
мочи1 pH кровиПатологияКислая, pH =
5,0-6,0Ацидоз,
pH <7,35Сахарный диабет (предкома, кетоацидотическая кома), лихорадочные состо¬
яния, голодание, почечная недостаточность, туберкулез почек, лейкозыЩелочная,
pH = 8,0-9,0Алкалоз,
pH >7,35Циститы, пиепиты, гематурия, состояние после рвоты и диареи, при расса¬
сывании экссудатов и транссудатов, при приеме соды и минеральных водЩелочная,
pH = 8,0-9,0Ацидоз,
pH <7,35Гиперхлоремический ацидоз, почечный тубулярный ацидоз, хронические
инфекции мочевьшодящих путей — происходит бактериальное разложение
азотсодержащих веществ до аммиакаКислая, pH =
5,0-6,0Алкалоз,
pH >7,35Гйпокалиемия, лечение алкалоза внутривенной инфузией больших коли¬
честв раствора натрия хлорида (парадоксальная ацидурия)Определение pH мочи рекомендуют проводить при инфекции мочевыводящих
путей, почечном тубулярном ацидозе, дыхательном ацидозе, дыхательном алка¬
лозе, метаболическом ацидозе, метаболическом алкалозе, синдроме Фанкони,
лечении почечного калькулеза. Значение pH мочи учитывают при обосновании
диагноза и наблюдении за состоянием пациента.СОДЕРЖАНИЕ БЕЛКА В МОЧЕПовышение экскреции белка с мочой — протеинурия — сопровождает почти
любую патологию почек, однако белок в моче может иметь также пре- и постре-
нальное происхождение.
320 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИЛЛОВВ норме в результате фильтрации плазмы крови через гломерулярный фильтр
происходит практически полнее разделение макромолекулярных веществ (бел¬
ков) от электролитов и низкомолекулярных полипептидов, попадающих в плаз¬
менный фильтрат. Размеры пор базальной мембраны гломерулярного фильтра,
по-видимому, соответствуют размерам молекулы альбумина (по аналогии шара,
попадающего в лузу). Однако слой гликокаликса с анионными окончаниями
формирует электростатический заряд на поверхности фенестрированного эндоте¬
лия, базальной мембраны и подоцитов. В результате белки как полиэлектролиты
отталкиваются этим зарядом обратно в кровоток. Тем не менее небольшое количе¬
ство белков плазмы крови поступает в капсулу Боумена даже в норме. Проникшие
через гломерулярный фильтр белки подвергаются реабсорбции в извитом прокси¬
мальном отделе нефронов. Реабсорбция осуществляется на уровне микроворсинок
почечного эпителия в результате эндоцитоза. Реабсорбированные молекулы белка
расщепляются в клетках почечного эпителия, часть метаболитов реутилизируется,
а конечные продукты вновь секретируются в мочу. Количество белков, которые
оказываются в окончательной моче, в норме не превышает 100-150 мг/сут.Функциональные (транзиторные) протеинурииФизиологическая протеинурия наблюдается у большинства новорожденных
в первые 4-10 сут и объясняется неокрепшим почечным фильтром. Количество
белка не превышает 0,5 г/л. Неонатальная протеинурия, продолжающаяся дли¬
тельное время, может быть симптомом врожденного сифилиса.Транзиторные протеинурии возникают после продолжительных физических
нагрузок (маршевая), после перегревания или переохлаждения организма, гру¬
бой пальпации почек (пальпаторные протеинурии), при эмоциональном стрессе,
приеме обильной, богатой белками пищи (алиментарная протеинурия), потере
жидкости у грудных детей (дегидратационная протеинурия) или введении сосудо¬
суживающих препаратов. Такие варианты протеинурий легко возникают у детей
раннего возраста, так как почки маленького ребенка легче и быстрее реагируют на
раздражение. Для грудного возраста характерна дегидратационная протеинурия,
связанная с нарушением кормления, токсикозами, диареей и рвотой. Такие про¬
теинурии считаются транзиторными и быстро исчезают, когда вызывающий их
фактор устранен. Количество белка в моче может достигать 3-5 г/л.Увеличение проницаемости капилляров клубочков, приводящее к протеинурии,
наблюдается во время лихорадки, интоксикации, вызванной некоторыми лекар¬
ственными препаратами, а также при длительных запорах, тяжелой диарее и т.д.
При этом варианте транзиторной протеинурии в осадке мочи также отмечается
увеличенное содержание лейкоцитов, эритроцитов, цилиндров, а также клетки
переходного и почечного эпителия.Ортостатическая протеинурия характерна для детей дошкольного и школь¬
ного возраста. Обнаруживается случайно, при медицинских осмотрах у детей в
возрасте до 10 лет или между 10 и 20 годами. У детей этой группы отмечаются
быстрый рост за короткое время, слабая конституция, мышечная гипотония,
дорсальный кифоз или люмбальный лордоз, низкое артериальное давление и нор¬
мальные показатели при исследовании функций почек. Протеинурия появляется
только когда ребенок стоит, когда позвоночник занимает лордотическое поло¬
жение, при котором передняя поверхность печени опускается вниз и прижимает
нижнюю полую вену к позвоночнику. Это вызывает пассивный застой в почеч¬
ных венах и застойную протеинурию, представленную в основном альбумином,
В положении лежа протеинурия исчезает или ее степень резко снижается.Половина детей с ортостатической протеинурией после пубертатного периода
«выздоравливают», но иногда протеинурия исчезает позже, к возрасту 18-20 лет.
В то же время некоторые нефрологи считают ортостатическую протеинурию
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИЛПОВ 321Предвестником заболевания почек. При пункции почек у значительного количе¬
ства обследуемых молодых людей с диагнозом «ортостатическая протеинурия»
был обнаружен хронический очаговый или диффузный гломерулонефрит. При
гиперлордозе позвоночник остается искривленным независимо от положения
тела. Концентрация белка в моче стабильна и в горизонтальном, и в вертикальном
положении пациента. Такая протеинурия носит название гиперлордотической.К сожалению, любая персистирующая протеинурия в 40-70% случаев высту¬
пает признаком почечной патологии. Напротив, выявленная ортостатическая или
гиперлордотическая протеинурия только Б 10% случаев сочетается с патологией
почек. Гиперлордотическая протеинурия — одна из наиболее частых причин
положительных результатов теста на наличие белка в моче, ортостатическая про¬
теинурия встречается значительно реже.Протеинурии при различных патологияхПротеинурии при патологических состояниях делятся на преренальные, реналь-
ные и постренальные. Основные их характеристики представлены в табл. 6-6.Таблица 6-6. Основные характеристики протеинурии при различных патологических состоянияхТип протеинурииПричинаМасса белков,
кДаЭкскреция,г/сутМаркерПреренальнаяУвеличенный синтез низ¬
комолекулярных белков,
распад тканейНЬ, миоглобин,
моноклональ¬
ные 1д (белок
Бенс-Джонса0,1-50Увеличенное количество
общего белка: содержание
альбумина в пределах
нормыСелективная гло¬
мерулярнаяУвеличенная прони¬
цаемость клубочков для
анионных белков средней
молекулярной массы50-70, в основ¬
ном альбумин и
трансферрин0,03-0,3Альбумин, трансферринНеселективнаягломерулярнаяУвеличенная прони¬
цаемость клубочков для
высокомолекулярных
белков50-150 и более1,5-20Альбумин, IgA, IgGТубулярнаяСнижение реабсорбции
низкомолекулярных бел¬
ков клетками почечного
эпителия проксимального
отдела нефрона10-700,15-15а,-Микрогл обули н,
р^-микроглобулин, p-NAG,
цистатин С, ретинолсвязы-
вающий белокУвеличенная секреция
белка клетками почечно¬
го эпителия дистального
отдела нефрона80-1000,02-0.2Белок Тамма-Хорсфалля
(БТХ)СмешаннаяУвеличенная гломеруляр¬
ная проходимость высо¬
комолекулярных белков
с вторичным нарушением
или насыщением тубу¬
лярной реабсорбции10-150 и более0,15-20Альбумин,
а,-микроглобулйн,
общий бепокПостренальнаяКровотечение или вос¬
паление мочевыводящих
путейПлазменные
белки, IgAРазличноеа^-Макроглобупин, аполи-
попротеин А-1Преренальная протеинурия связана с появлением в плазме патологических
белков, которые в норме отсутствуют. Такие белки имеют низкую молекулярную
массу и проходят через неповрежденный почечный фильтр в мочу. Появление
их в плазме связано или с увеличенным синтезом, или с распадом тканей либо
клеток, примерно у 20% больных с миеломной болезнью опухоль продуцирует
только легкие цепи иммуноглобулинов (кг или А-), которые из-за низкой молеку-
322 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВлярной массы легко фильтруются через нормальный почечный фильтр, диагно¬
стируются в моче в виде белка Бенс-Джонса и не обнаруживаются в плазме крови.
Парапротеины обычно структурно однородны, т,е, молекула состоит из тяжелых
или легких цепей одного типа. Класс и тип парапротеина не меняются в течение
болезни. Парапротеины встречаются часто при множественной миеломе, а также
при макроглобулинемии Бальденстрема, остром плазмобластном лейкозе, болезни
тяжелых цепей, лимфоме с парапротеинемией и др. Для подтверждения диагноза
методом электрофореза в моче определяют белок Бенс-Джонса.При гемолитической анемии через неповрежденный почечный фильтр прохо¬
дит гемоглобин. Концентрация этого белка в плазме крови настолько велика, что
превышает его почечный порог, в результате чего развивается гемоглобинурия.
Появление этого белка в моче не свидетельствует о поражении почечного фильтра
почек.Миоглобинурия выявляется в моче как протеинурия. При миодистрофии, краш-
синдроме, ударе электротоком происходит поражение мышечной ткани и в кровь,
а затем в мочу выделяется мышечный белок — миоглобин. Его молекулярная масса
составляет всего 17 кДа. Он свободно проходит через неповрежденный почечный
фильтр и появляется в моче при превышении почечного порога концентрации.Застойная протеинурия характерна для пациентов с заболеванием сердца в ста¬
дии декомпенсации, при асцитах, вызванных метастазами и опухолями брюшной
полости. Количество белка обычно составляет 1-2 г/л, но иногда достигает 10 г/л.
Характерна положительная реакция мочи на уробилин. В осадке мочи обна¬
руживают единичные эритроциты, гиалиновые цилиндры. Продолжительный
застой крови в почках обычно приводит к органическому поражению нефрона.
Подобный вариант протеинурии в этой стадии основного заболевания уже можно
отнести к органическим почечным протеинуриям.Нейрогенная протеинурия наблюдается при черепно-мозговой травме, крово¬
излияниях, эпилептических припадках, маниакальных состояниях, вегетативных
кризах, при тяжелом инфаркте миокарда, приступе желчнокаменной болезни и т.д.
Степень протеинурии обычно умеренная, но может быть значительной.Ренальная протеинурия — частый, но неспецифический симптом патологии
почек. Почечная (ренальная) протеинурия, как правило, имеет персистирующий
характер, белок прис^ггствует в моче больного в любое время суток. Обнаружения
протеинурии недостаточно для диагностики патологии почек, необходимо про¬
вести дифференциальную диагностику. Различают клубочковую, тубулярную и
смешанную ренальную протеинурию.Клубогковая (гломерулярная) протеинурия характерна для всех заболеваний
почек, протекающих с поражением коркового вещества, в котором расположены
клубочки. Это острый и хронический гломерулонефрит, нефропатия при сахарном
диабете, нефропатия беременных, нефрозы, опухоль почки, поражение почек при
гипертонической болезни, подагра и др. Протеинурия при этой патологии связана
с нарушением принципа относительной селективности в почечных кл}^бочках.
Здесь необходимо различать селективную и неселективную формы гломерулярной
протеинурии.Селективная гломерулярная протеинурия развивается при нарушении фильтра¬
ции вследствие изменения поверхностного заряда сиалогликопротеинов на гло¬
мерулярной мембране или изменения поверхностного заряда белков. Типичным
примером такого эффекта считается гликирование альбумина (фруктозамина) и
поверхностных белков гломерулярного фильтра при сахарном диабете. В результа¬
те на ранних стадиях диабетической нефропатии развивается микроальбуминурия,
а затем, по мере прогрессирования заболевания, протеинурия. При селективной
гломерулярной протеинурии электрофореграмма белков мочи не соответствует
электрофореграмме белков сыворотки крови. Пюмерулярный фильтр не пропу¬
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 323скает высокомолекулярные белки, такие как глобулины. Это характерно для ком¬
пенсированной стадии хронического гломерулонефрита. Такие больные хорошо
поддаются лечению глюкокортикоидами и иммуносупрессорами.Неселективная (низкоселектиеная) гломерулярная про?пеинурия. При неселектив¬
ной гломерулярной протеинурии почечный фильтр практически отсутствует и про¬
пускает плазменные белки разной молекулярной массы. При неселективной про¬
теинурии в моче обнаруживают белки с молекулярной массой более 100 кДа (IgA,
IgG), за исключением белков с очень большой массой (IgM, а^-макроглобулина).
Электрофореграмма мочевого белка идентична электрофореграмме плазменного
белка. Эта форма протеинурии характерна для нефротического синдрома, при
котором больные нечувствительны к лечению глюкокортикоидами.Тубулярная протеинурия проявляется нарушением реабсорбции белков в прок¬
симальном отделе нефрона или усиленной продукцией белка (белка Тамма-Хорс-
фалля) клетками почечного эпителия дистального отдела нефрона. Характерно
выведение с мочой белков низкомолекулярной массы (менее 40 кДа), таких как
Р^-микроглобулин, ретинолсвязывающий белок или лизоцим. Эта форма протеи¬
нурии встречается при тубулярной нефропатии, развивающейся при отравлениях
солями тяжелых металлов (ртутью, свинцом, кадмием), токсичными веществами
(этиленгликолем, четыреххлористым углеродом), нефротоксичными препаратами
(аминогликозидами). Тубулярная протеинурия встречается при гипоксии, ОПН,
сопровождающейся тубулярным некрозом, бывает осложнением трансплантации
почек, отмечается при интерстициальном нефрите, тяжелых ожогах, синдро¬
ме Фанкони, врожденном почечном ацидозе, врожденном дефекте почечных
канальцев.Смешанная {гломерулярно-тубулярная) протеинурия является признаком
нескольких типов почечной недостаточности: нарушения фильтрации в клубочках
и реабсорбции в канальцах. Обычно это манифестная стадия всех нефропатий,
при которой в моче могут быть обнаружены практически все белки плазмы крови
(низкоселективная протеинурия). За сутки с мочой может теряться до 1 г белка.
Причинами смешанной протеинурии бывают острая почечная недостаточность,
пиелонефрит, тромбоз почечных вен.Постренальная протеинурия встречается при кровотечениях из мочевыводя¬
щих путей, локальном выделении иммуноглобулинов в случае инфекции мочевы¬
водящих путей, а также наблюдается при полипозе, раке мочевого пузыря. Часто
при постренальной протеинурии моча бывает мутной из-за примеси лейкоцитов и
большого количества воспалительных белков. Белковый состав мочи при постре¬
нальной протеинурии может быть сходным с таковым при почечной протеинурии
гломерулярного типа, что может привести к ошибкам в диагностике.Количественное определение белка в мочеДля количественного определения фотометрическим методом белка в моче
и других биологических жидкостях (ликворе, выпотных жидкостях и др.)
фирма НПП «Техномедика» разработала и выпустила анализатор «Белур 600».
Определение концентрации белка на анализаторе проводится по оптической плот¬
ности жидкой биопробы относительно оптической плотности холостой пробы с
ручным пересчетом по фактору или калибровочному графику. Также используется
автоматический пересчет по фактору. Численное значение фактора может быть
взято из инструкции на реагент и введено в прибор, а может быть определено
автоматически по измерению стандартного образца. При автоматическом опреде¬
лении фактора пользователю дана возможность измерения от 1 до 15 образцов,
что увеличивает точность определения до 4 раз. Значение концентрации белка
представляется на дисплее с минимальным шагом 0,01 г/л в диапазоне от 0,01 до
9,99 г/л (1 мг/дл в диапазоне от О до 999 мг/дл).
324 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВМикроальбуминурия — экскреция с мочой альбумина в количестве, превы¬
шающем физиологическую норму> но ниже пределов чувствительности обычно
используемых методов. Экскреция альбумина с мочой в норме — менее 20 мкг/мин,
микроальбуминемия определяется как экскреция альбумина с мочой до 200 мкг/мл,
что соответствует содержанию белка от 20 до 200 мг/л в утренней моче или от
30 до 300 мг/сут (табл. 6-7). Этот зфовень не определяется с помощью тестовых
полосок «сухая химия» на белок.Микроальбуминурия — достаточно ранний признак нарушения функции клу¬
бочков, в этот период, согласно оценкам многих клиницистов, болезнь поддается
медикаментозному лечению.Таблица 6-7. Классификация альбуминурииУровень альбуминурииЭкскреция альбумина с мочойКонцентрация альбумина вв утренней порции, мкг/
минза сутки, мгмоче, мг/лНормоальбуминурия<20<30<20Микроальбуминурия20-20030-^0020-200Макроальбуминурия>200>300>200Если в суточной моче концентрация альбумина выше 30 мг и эти значения
повторяются несколько раз, необходимо проводить лечение, так как данные изме¬
нения характерны для начинающейся диабетической нефропатии.По мере прогрессирования поражения почек при сахарном диабете развива¬
ется выраженная протеинурия. Тщательный контроль уровня глюкозы в крови
и лечение любых форм гипертонии может приостановить микроальбуминемию
и предупредить развитие манифестной почечной недостаточности. Согласно
рекомендациям Американской диабетической ассоциации (1997) и Европейской
группы по изучению сахарного диабета (1999), исследование микроальбумину¬
рии входит в перечень обязательных рутинных методов обследования больных с
сахарным диабетом 1-го и 2-го типа (табл. 6-8).Таблица 6-8. Рекомендации для скрининга на микроальбуминуриюКатегория больныхРекомендацииБольные сахарным диабетом 1-го типа, заболевшие 8
раннем детском еоэрастеЕжегодно с возраста 10-12 летБольные сахарным диабетом 1-го типа, заболебшие в
ny6epT8Tt10M возрастеПри постановке диагноза и далее раз в годБольные сахарным диабетом 1-го типа, заболевшие в
постпубертатном возрастеСпустя 5 лет с дебюта болезниБольные сахарным диабетом 2-го типаПри постановке диагноза и далее раз в годТрадиционными методами определения микроальбуминемии являются имму-
нохимические методы: радиоиммунный, иммуноферментный анализ, радиаль¬
ная иммунодиффузия, иммунотурбидиметрия или нефелометрия. Все указанные
методы обладают высокими чувствительностью и специфичностью, поэтому
выбор конкретного метода определяется аналитическими и финансовыми воз¬
можностями лаборатории. В последнее время тест на микроальбуминемию
вошел в состав многофункциональных полосок некоторых производителей.
Судя по результатам, основа этого теста та же, что и на протеинурию, но чув¬
ствительность к альбумину зпаеличена. Клиническая оценка микроальбуминурии
этим способом у больных с нефропатией пока остается в стадии накопления
данных.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 325СОДЕРЖАНИЕ ГЛЮКОЗЫ В МОЧЕУровень глюкозы в крови и клетках организма считается важнейшим фактором
гомеостаза. Он поддерживается на определенном зфовне функциями кишечника,
печени, почек, поджелудочной железы, надпочечников, жировой ткани и других
органов. В норме глюкоза как беспороговое вещество фильтруется в клубочках
почек, но затем почти полностью реабсорбируется в проксимальных канальцах.
Величина канальцевой реабсорбции относительно постоянна, но с возрастом ЩГ
отмечается тенденция к ее снижению. Максимальное количество молекул глюко¬
зы, реабсорбируемых из первичной мочи в кровь, зависит от количества энерго¬
зависимых переносчиков глюкозы и скорости их оборота в мембране. Количество
глюкозы, реабсорбируемой при максимальной загрузке ее переносчиков, служит
важным показателем функционального состояния проксимального отдела нефро-
на. Если содержание глюкозы в крови превышает количество, которое может быть
реабсорбировано в канальцах, глюкоза появляется в моче. При превышении в
крови уровня 8,8-9,9 ммоль/л глюкоза выделяется с мочой. Показатель гликемии,
при котором появляется глюкозурия, называется почечным порогом. С возрастом
почечный порог для глюкозы снижается, а также уменьшается при хронических
заболеваниях почек, гипертонической болезни, диабетической нефропатии. На
вьщеление глюкозы с мочой влияет скорость клубочковой фильтрации, которая в
норме составляет примерно 130 мл/мин. У больных с почечной недостаточностью
или страдающих снижением кровоснабжения почек глюкозурии не будет даже
при очень высокой концентрации глюкозы в крови. Вследствие низкой скорости
кровотока в клубочках фильтруется меньше глюкозы и вся она успевает реабсор-
бироваться в проксимальном отделе нефрона, поэтому по уровню глюкозы в моче
нельзя исключить сахарный диабет. В специальных исследованиях показано, что
выявление глюкозурии имеет 99% клиническую специфичность для диагностики
сахарного диабета (если выявляется глюкозурия — у больного сахарный диабет)
и только 55% диагностическую чувствительность (примерно у половины больных
сахарным диабетом нет глюкозурии).У пациентов с сахарным диабетом исследование глюкозы в моче служит
эффективным способом наблюдения за состоянием больного и контроля лечения.
Уменьшение суточной глюкозурии свидетельствует об эффективности лечебных
мероприятий, критерием компенсации сахарного диабета 2-го типа считается
достижение аглюкозурии, а при 1-м типе допускается потеря с мочой 2-3 г глю¬
козы в сутки.Определение глюкозы в моче можно проводить в домашних условиях. Для
этого применяют реагентные тестовые полоски. Глюкоза в моче появляется, когда
глюкоза крови превышает почечный порог, тем не менее глюкоза в моче плохо
отражает степень гипергликемии, что связано с ее разведением в мочевом пузыре,
индивидуальными колебаниями величины почечного порога и возможным нару¬
шением функций почек. Принципиальный недостаток мониторирования глюко-
зурии — невозможность определить гипогликемию. Именно поэтому в последнее
время больным сахарным диабетом рекомендуют иметь дома для индивидуально¬
го использования глюкометры (отражательные фотометры с тестовыми полоска¬
ми для определения глюкозы в крови), позволяющие определять уровень глюкозы
в капле капиллярной крови из пальца.Определение глюкозы в моче следует выполнить не позднее 2 ч после мочеиспу¬
скания. в течение 8-12 ч (в суточной моче) потеря глюкозы составляет примерно
40%, если не добавлять стабилизатор. При истинной бактериурии или при загряз¬
нении (контаминации) мочи бактериями и грибами из грязной посуды основной
причиной снижения уровня глюкозы в моче у больных сахарным диабетом (а у
здоровых людей — причиной полного отсутствия глюкозы в моче) является жиз¬
недеятельность бактерий и грибов. Если проводят исследование глюкозы в суточ-
= 326 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ^ НОЙ моче, в посуду для сбора мочи необходимо добавить в качестве стабилизатора0,5 г азида натрия.' ^" Патологическая глюкозурия — выделение с мочой повышенного количества^ / глюкозы от 1-5 т/л, а иногда до 500 г/л в сутки, Глюкозурия в сочетании с диагно-
стированной натощак гипергликемией считается основным и самым характерным
признаком сахарного диабета.‘''w'’ Почечный порог глюкозы у маленьких детей выше, чем у взрослых, и составля-V ет 10,5-13,0 ммоль/л сыворотки (0,2-0,23 г/л)." - Почечный порог повышается при введении паратгормона и адреналина, снижа¬ется при введении препаратов, содержащих желчные кислоты.Глюкозурии делятся на панкреатические и внепанкреатические.Панкреатическая глюкозурияПакреатическая, или инсулярная, глюкозурия появляется при снижении обра¬
зования инсулина поджелудочной железой. Наиболее частая причина глюко¬
зурии — сахарный диабет. Количество глюкозы в моче у больных сахарным
диабетом может достигать 100-120 г/л. Общая потеря глюкозы с мочой зависит
от степени полиурии. Обычно существует взаимосвязь количества выделенной
глюкозы со степенью полиурии. Для диабетической глюкозурии характерны
выделение глюкозы с мочой натощак и повышенная концентрация этого вещества
в крови натощак.При остром панкреатите глюкозурия — явление временное, исчезает при сти¬
хании воспалительного процесса.При остром некрозе поджелудогной железы гибнут островки Лангерганса и раз¬
вивается панкреатическая глюкозурия.К панкреатическим глюкозуриям относят также глюкозурию, которая наблю¬
дается при длительном голодании. Эта глюкозурия исчезает через несколько суток
после прекращения голодания.Внепанкреатические глюкозурииЦентральные глюкозурии. При травматическом, механическом, токсическом
раздражении ЦНС происходит усиление распада гликогена в печени, что приводит
к гипергликемии и глюкозурии. Глюкозурии центрального происхождения непро¬
должительны, возникают при травмах и опухолях мозга, менингитах, токсикозах,
энцефалитах, кровоизлияниях. Причинами временной глюкозурии могут быть
наркоз, отравление (токсическая глюкозурия), лихорадка. В отдельную группу
выделяют эмоциональные глюкозурии (экзамен, психоз, страх, плач).Гормональные глюкозурии. При гипертиреозе, феохромоцитоме, синдроме
Иценко-Кушинга, акромегалии, опухоли коры надпочечников увеличивается
секреция контринсулярных гормонов — адреналина, тироксина, глюкокортикои-
дов, что приводит к глюкозурии. По аналогичному механизму глюкозурия возни¬
кает при передозировке глюкокортикоидных препаратов и адренокортикотропно-
го гормона или при их длительном употреблении.Почечные (ренальные) глюкозурии. Ренальные глюкозурии развиваются
вследствие нарушения реабсорбции глюкозы почечным эпителием в проксималь¬
ном отделе нефрона. Почечную глюкозурию от диабетической можно отличить по
следующим признакам: глюкозурии при нормогликемии; нормальному глюкозо¬
толерантному тесту; нормальному значению гликированного гемоглобина (НЬГ^^ J
в сыворотке крови.Различают первичную и вторичную ренальную глюкозурию.Первигная реналъная глюкозурия, или реналъный несахарный диабет, рассма¬
тривается как невинная аномалия. У этой группы практически здоровых людей
отмечается низкий почечный порог глюкозы — до 6,3 ммоль/л (25-120 мг/дл).
Промежуточный обмен углеводов не нарушен, но утром при исследовании мочи
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 327шшвсегда диагностируется глюкозурия, а содержание глюкозы в крови натощак нахо- з
дится в пределах нормы или снижено. Двойная нагрузка глюкозой не приводит к g
появлению патологических результатов. Длительное, в течение 3-4 лет, наблюде- »
ние за этими пациентами не выявляет симптомов сахарного диабета. Первичный
почечный диабет имеет хороший прогноз и не нуждается в лечении.Глюкозурия при беременности связана со снижением почечного порога глюко¬
зы, что происходит, как правило, через 3 мес беременности. Экскреция глюкозы
с мочой максимальна в последнем триместре и не ассоциируется с экскрецией
кетонов. Каждый случай глюкозурии у беременных следует тщательно анализиро¬
вать, так как беременность может быть провоцирующим фактором для развития
сахарного диабета.Вторигные ренальные глюкозурии развиваются при органическом поражении
почек и снижении реабсорбционной функции почек (хроническом гломерулонеф¬
рите, липоидном нефрозе, острой почечной недостаточности, токсических пора¬
жениях почечной ткани и др.). Вследствие поражения клеток почечного эпителия
или их полной либо частичной десквамации нарушается реабсорбция глюкозы в
канальцах. В крови этих больных содержание глюкозы остается в пределах нормы,
а в моче появляется глюкоза. Снижение почечной функции на 30% нормального
значения может привести к симптоматической глюкозурии.Алиментарная глюкозурия — явление временное, развивается у практически
здоровых людей через 30-60 мин после приема богатой углеводами пищи или
при проведении глюкозотолерантного теста (200 г сахара) и исчезает через 2-5 ч.У детей младшего возраста отмечается высокий почечный порог глюкозы (200-
230 мг/100 мл, или 10,5-12,0 ммоль/л) и при проведении глюкозотолерантного
теста глюкозурия может не наступить.Лекарственная глюкозурия может развиваться при введении больным мор¬
фина, анестетиков, седативных средств, а также препаратов, обладающих гипер-
гликемическим и нефротоксическим эффектами.Глюкозурия при сахарном диабетеМассовые обследования населения в целях ранней диагностики сахарного диа¬
бета показали, что начальная стадия этого заболевания характеризуется отсут¬
ствием каких-либо явных симптомов. По разным оценкам, от 30 до 50% случаев
сахарного диабета остаются не выявленными. У пожилых людей вследствие сни¬
жения активности ферментов в почечном эпителии может отмечаться незначи¬
тельная глюкозурия. у этой группы обычно наблюдаются полиурия и ухудшение
самочувствия, что обычно связано с их возрастом, но не свидетельствует о мета¬
болических нарушениях. Незначительная глюкозурия компенсируется обычно
с помощью диеты. Тщательному обследованию должны подвергаться пациенты,
у которых появились симптомы, характерные для метаболического синдрома и
сахарного диабета:• ожирение, особенно абдоминального типа;• гиперлипопротеинемия;• полиурия;• гипертония;• гепатобилиарная патология;• хроническая инфекция мочевыводящих и дыхательных путей;• заболевания сердечно-сосудистой системы.Другие группы риска:• люди старше 40 лет;• люди с отягощенной наследственностью по сахарному диабету;• матери, родившие детей с массой тела более 4500 г и дефектами развития;• женщины после абортов или преждевременных родов.
т328 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВУстановлено, что примерно треть пациентов, у которых была обнаружена глю-
козурия после алиментарной нагрузки глюкозой, страдают сахарным диабетом.
Глюкозурия другой этиологии также имеет определенное диагностическое значе¬
ние. Именно поэтому обнаружение глюкозы в моче считается одним из важных
диагностических тестов во всех странах с развитой системой здравоохранения.
Этот анализ обязателен при исследовании мочи в КДЛ.Полуколичественный метод определения глюкозы в моче с помощью
тестовых полосок рассматривается как лучший при массовом обследовании насе¬
ления для выявления нарушений обмена глюкозы.Количественные методы определения глюкозы в моче - рекомендуют
использовать глюкозоксидазный и гексокиназный. Оба метода высокоспецифичны
для глюкозы и дают надежные количественные результаты по содержанию ее в
моче. Единственным существенным фактором, занижающим концентрацию глю¬
козы, считается использование глюкозоксидазного метода в моче с pH, равным
5,0-5,5. Такая резкокислая моча ингибирует активность фермента, чего можно
избежать с помощью добавления буферных растворов в пробу.СОДЕРЖАНИЕ КЕТОНОВЫХ ТЕЛ В МОЧЕ
Образование кетоновых телв организме человека диагностическое значение имеют три кетоно¬
вых тела: ацетоуксусная кислота (ацетоацетат), р-гидроксимасляная кислота
{(3-гидроксибутират) и ацетон. У здоровых людей в жировой ткани при липолизе
образуются жирные кислоты и глицерин, жирные кислоты затем через ацетил-
коэнзим-А превращаются в печени в ацетоацетат. Основная часть ацетоацетата
при участии ферментов превращается в р-гидроксиб)тират, небольшая часть
спонтанно декарбоксилируется в ацетон. Кетоны активно потребляются как энер¬
гетические субстраты сердцем, ЦНС и другими органами.Кетоновые тела могут быть определены в крови и моче. Пропорции в крови
между ними индивидуальны и зависят от выраженности кетогенеза. При незначи¬
тельном кетозе основным компонентом кетонов является ацетоуксусная кислота.
При ее превращении в р-гидроксимасляную кислоту происходит замена относи¬
тельно сильной ацетоуксусной кислоты (рК = 3,8) на более слабую р-гидрокси-
масляную (рК = 4,4). Ацетон в значительном количестве может быть удален из
крови дыхательной системой, потому его уровень среди трех компонентов кето¬
нов является наименьшим. Кетоны выделяются с мочой примерно в следующем
соотношении: р-гидроксимасляная кислота — 60-70%, ацетоуксусная кислота —
27-36%, ацетон — 3-4%.Клинические аспектыУ здорового человека с мочой вьщеляется 20-50 мг/сут кетонов. При обычных
качественных пробах такое количество кетонов не обнаруживают. Вьщеление с мочой
большего количества кетонов называется кетонурией. Кетонурия появляется при
нарушении углеводного, жирового или белкового обмена и имеет важное клиниче¬
ское значение. Так, ацетемическая рвота у детей раннего возраста наблюдается при
комбинации углеводного голодания и приема кетогенной пищи. Вследствие неустой¬
чивого углеводного обмена и склонности к кетозу после двухлетнего возраста даже
небольшие погрешности в диете, особенно если они совпадают с острым инфекцион¬
ным заболеванием, возбуждением или переутомлением, могут привести к кетозу.Кетоз в результате приема богатой кетогенными веществами пищи (жиров, бел¬
ков, содержащих большое количество кетогенных аминокислот) связан с усилен¬
ным кетогенезом, вследствие чего возникает транзиториая кетонурия.Кетонурия наблюдается у детей раннего возраста при голодании на фоне исто¬
щения (токсикозах, гастроэнтероколитах, дизентерии и т.д.), а также при лихо-
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 329радке, алкогольной интоксикации, отравлениях, тяжело протекающих инфекци¬
онных заболеваниях. При всех этих заболеваниях кетонурия является вторичным
непостоянным признаком {вториъная кетонурия) и не имеет диагностического и
прогностического значения. Кетонурия после операции, при обширных механиче¬
ских мышечных травмах (краш-синдром) объясняется распадом белка вследствие
активации протеолиза, вызванного гормонами стресса (катехоламинами, глюко-
кортикоидами, глюкагоном). Одновременно возникающее ограничение процессов
в цикле Кребса приводит к накоплению в тканях двууглеродистых соединений, в
том числе ацетил-коэнзима-А. Центральная кетонурия развивается после опера¬
ций на мозговых оболочках, при черепно-мозговых травмах, субарахноидальных
кровоизлияниях, энцефалографии, сильном раздражении и возбуждении ЦНС.
При ацетонемической рвоте центрального происхождения прием углеводов не
помогает. Резкое улз^шение состояния больного наступает при приеме седатив¬
ных препаратов.Кетоз может развиться при гликогеновой болезни (первый тип — недостаток
глюкозо-6-фосфатазы, третий тип — недостаток амино-1,6-глюкозидазы и шестой
тип — недостаток печеночной фосфорилазы) за счет нарушения образования гли¬
когена в печени, накопления ацетил-коэнзима-А и усиления его превращения в
ацетоуксусную кислоту.При тиреотоксикозе кетоз наступает вследствие повышенного расхода угле¬
водов, при резко выраженных ренальных глюкозуриях — за счет потери с мочой
углеводов и компенсаторном стимулировании липогенеза, при акромегалии — за
счет повышенной продукции гормона роста, при болезни Иценко-Кушинга — за
счет глюкокортикоидов. При этих заболеваниях отмечается уменьшение исполь¬
зования углеводов и увеличение мобилизации жиров. Это примеры вторичных
кетонурий. При таких патологиях кетонурия — признак непостоянный и не имеет
диагностического значения,Кетоацидоз при сахарном диабете. Обнаружение кетонов в моче позволяет
диагностировать метаболическую декомпенсацию у больных сахарным диабетом.
Кома и прекоматозные состояния почти всегда сопровождаются кетозом и кето-
нурией. Однако гиперосмолярная кома является исключением: она не сопрово¬
ждается образованием кетонов. Кетоацидотическая кома — наиболее серьезное
осложнение диабета. Больной сахарным диабетом в течение суток может выде¬
лить с мочой от 10 до 50 г кетонов. Комбинация кетонурии с глюкозурией служит
доказательством сахарного диабета, однако отсутствие глюкозурии при кетону¬
рии позволяет с уверенностью исключить такой диагноз. Кетонурия у больного
сахарным диабетом 1-го типа (инсулинозависимым) должна быть ликвидирована
быстро, в течение 1-2 сут, при этом рекомендуют исследовать мочу на кетоны
каждые 4 ч и в зависимости от полученных результатов изменять дозировку инсу¬
лина.Алкогольный кетоацидоз. При запое и отказе от пищи в течение 2-3 сут
возможно развитие состояния с дефицитом инсулина и стимуляцией липолиза.
В результате активации алкогольдегидрогеназы происходит увеличение соотно¬
шения НАДН^/НАД (НАД — никотинамидадениндинуклеотид). Дефицит НАД
приводит к подавлению липогенеза и увеличению синтеза кетоновых тел. При
алкогольном кетоацидозе кетоновые тела в моче обнаруживают в 90% случаев.
Если реакция мочи на кетоны отрицательная, это объясняется быстрым переходом
ацетоацетата в р-гидроксибутират из-за избыточного количества кофактора реак¬
ции НАДН^, который практически не определяется тестовыми полосками.Кетонурия при панкреатите. При остром панкреатите в сыворотке крови
накапливается липаза, которая приводит к мобилизации жирных кислот из жиро¬
вой ткани. В результате увеличивается кетогенез в печени и возникают кетонемия
и кетонурия.
330 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВСОДЕРЖАНИЕ БИЛИРУБИНА В МОЧЕ
Клинические аспектыБилирубин образуется при распаде гемоглобина в клетках ретикулоэндоте-
лиальной системы (РЭС), особенно в селезенке и купферовых клетках печени.
У взрослого человека в сутки образуется примерно 250-350 мг билирубина.В клетках печени свободный билирубин подвергается энзиматической конъю¬
гации с глюкуроновой кислотой и превращается в билирубинмоно- и били-
рубиндиглюкоронид (конъюгированный, прямой или связанный билирубин).
Конъюгированный билирубин водорастворим, он поступает с желчью в желч¬
ный пузырь, где под воздействием дегидрогеназ частично восстанавливается в
мезобилирубин и 1-уробилиноген. Последний вместе с остальным билирубином
поступает через общий желчный проток в двенадцатиперстную кишку, где теряет
глюкуроновую кислоту, всасывается слизистой оболочкой двенадцатиперстной
кишки и проксимального отдела тонкой кишки. По системе воротной вены вновь
возвращается в печень и в печеночных клетках окисляется до дипирролов.Мезобилирубин и билирубин поступают в толстую кишку, где под воздей¬
ствием нормальной кишечной микрофлоры восстанавливаются до бесцветного
стеркобилиногена. В дистальном отделе толстой кишки основное количество
стеркобилиногена окисляется в стеркобилин, который окрашивает каловые массы
в различные оттенки коричневого цвета. Незначительная часть стеркобилиногена
всасывается слизистой оболочкой толстой кишки и через геморроидальные вены
попадает в кровь, по нижней полой вене поступает в почки и фильтруется через
почечный фильтр в мочу. Минимальное количество конъюгированного билиру¬
бина (7-20 мкг/кг в сутки), вьщеляемое с мочой, не определяется качественными
методами (табл. 6-9).Таблица 6-9. Реакции на билирубин и уробилиногены в моче в норме и при патологииПоказательРеакция вЖелтуха, реакциянормегемолитиче¬паренхиматознаяобтурационнаяскаяначалоразгарвыздоров¬лениеразгарвыздоров¬лениеБилирубинНетОтрица¬тельнаяСлабо-положи¬тельнаяРезкоположи¬тельнаяОтрица¬тельнаяРезкоположи¬тельнаяОтрица¬тельнаяСтерко-билиногенСлабополо-
жительнан
или отрица¬
тельнаяРезко поло¬
жительнаяСлабо-положи¬тельнаяОтрица¬тельнаяПоложи¬тельнаяОтрица¬тельнаяПоложи¬тельная1-уроби¬линогенНетНетПоложи¬тельнаяНетНетНетНетОбтурационная (обструкционная, подпеченочная) желтуха обусловлена
вне- или внутрипеченочной обструкцией желчных путей, что сопровождается
частичным или полным прекращением оттока желчи. При обтурации общего
желчного протока (камнем, воспалением, опухолью и т.д.) из-за скопления в
печеночных капиллярах желчь (с прямым, конъюгированным билирубином)
проходит в кровеносные капилляры между оболочками печеночных клеток
(гепатоцитов). Уровень конъюгированного билирубина в плазме крови нарас¬
тает, а затем превышает почечный порог. Почечный фильтр свободно пропускает
прямой билирубин. Билирубинурия при обтурационных желтухах — явление
постоянное. Снижение содержания билирубина в моче или его полное исчез¬
новение указывает на частичное либо полное восстановление проходимости
желчных путей.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 331При гепатоцеллюлярной (паренхиматозной) желтухе, когда в резуль¬
тате интоксикации поражается паренхима печени (печеночные клетки — гепа-
тоциты), одновременно в крови повышается уровень конъюгированного и
неконъюгированного билирубина. Первопричинами этого состояния могут быть
нарушения клиренса неконъюгированного билирубина из крови, выделения
конъюгириванного билирубина из печеночных клеток в желчные капилляры
и последующее проникновение конъюгированного билирубина из печеночных
капилляров, переполненных желчью, в кровеносные капилляры через разрушен¬
ные гепатоциты.Гепатоцеллюлярная желтуха характерна для острого вирусного гепатита в
токсической фазе, а также для тяжелой бронхопневмонии, гриппа, токсикозов
и других инфекционных заболеваний. Уровень конъюгированного и общего
билирубина первично повышается при синдромах Дубина-Джонсона и Ротора.
Повышенная концентрация конъюгированного билирубина в сыворотке крови
больных инфекционным гепатитом сопровождается увеличенной экскрецией
билирубина с мочой. При этой патологии интенсивность билирубинурии усили¬
вается параллельно с тяжестью заболевания, достигая максимальных значений
в разгар болезни, после чего начинает уменьшаться. Б начале заболевания били¬
рубин в моче практически не обнаруживают, а его высокая концентрация (моча
цвета темного пива) на фоне выраженной желтухи и бесцветных каловых масс
служит признаком разгара заболевания (внутрипеченочного застоя желчи).Гемолитическая желтуха характеризуется чрезмерным образованием неконъ¬
югированного билирубина либо его задержкой в организме при нарушении
выведения. В плазме крови больных повышается уровень общего билирубина за
счет неконъюгированного. В моче же реакция на билирубин отрицательная, так
как неконъюгированный, связанный с альбумином билирубин не проходит через
неповрежденный почечный фильтр. Такое состояние характерно для гемолитиче¬
ских анемий с внутриклеточным и внутрисосудистым или смешанным гемолизом,
а также для гемолитического криза при малярии, В,2-мегалобластической анемии,
действии токсинов (отравлении грибами, змеиными ядами и т.д.) либо при транс¬
фузии несовместимой крови.Повышенный уровень неконъюгированного билирубина в плазме крови наблю¬
дается при нарушении его метаболизма, в частности при наследственном нару¬
шении транспорта желчных пигментов — синдроме Жильбера. У людей с этим
синдромом почти постоянно отмечается незначительная желтушность кожных
покровов, конъюнктивы и видимых слизистых оболочек, причиной этого являет¬
ся неспособность гепатоцитов захватывать, конъюгировать и выделять билирубин
в желчные капилляры.Другая форма наследственной врожденной гипербилирубине мии — болезнь
Криглера-Найяра, при которой также значительно увеличен уровень неконъю¬
гированного билирубина и может развиваться поражение ЦНС (билирубиновая
энцефалопатия). При так называемой физиологической желтухе новорожденных
{Icterus Neonatorum Gravis) также наблюдается транзиторная недостаточность
механизмов конъюгации вследствие недостаточности функции печени новорож¬
денных. При этом из-за повышенной проницаемости почечного фильтра неконъ¬
югированный билирубин выделяется с мочой в виде мелких желто-коричневых
зернышек, у новорожденного моча не окрашена, реакция на билирубин отрица¬
тельная, пеленки бесцветные, покрытые мелкими желто-коричневыми крупин¬
ками неконъюгированного билирубина — «песочком» (билирубин Клубера). Но
если приготовить хлороформную или эфирную вытяжку из этой мочи и провести
с ней пробу на билирубин — результат будет положительным.в норме билирубин в моче есть, но его концентрация настолько мала, что не
обнаруживается с помощью общепринятых в КДЛ качественных проб (реакций).
332 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВНижний предел чувствительности используемых методов позволяет опреде¬
лить конъюгированный билирубин в моче при его концентрации выше 0,25-
0,3 мг/100 мл.Непрямой (неконъюгированный) билирубин может попасть в мочу, только если
увеличение его концентрации в сыворотке крови сочетается с нарушением прони¬
цаемости гломерулярного фильтра.Патологическая билирубинурия отмечается при таких болезнях, как вирусный
(инфекционный) гепатит, цирроз печени, заболевания желчного пузыря и желч¬
ных протоков, рак печени и метастатическая карцинома печени, токсический
гепатит.С диагностической точки зрения билирубинурию можно расценивать следую¬
щим образом.• Положительная реакция на билирубин в моче свидетельствует об увеличении
концентрации конъюгированного билирубина в плазме крови и превышении
почечного порога билирубина, что характерно для нарушения поступления
желчи в двенадцатиперстную кишку (вне- или вн)трипеченочная желтуха).
Почечный порог билирубина составляет 30-34 мкмоль/л.• Одновременное повышение уровня билирубина и уробилиногена в моче счи¬
тается признаком паренхиматозной желтухи на 7-12-е сутки заболевания и в
период выздоровления.Билирубинурия — явление постоянное при обтурационных желтухах. При
паренхиматозных желтухах билирубинурия свидетельствует о разгаре заболе¬
вания, тяжести процесса, поражении гепатоцитов. В начале болезни и в период
выздоровления концентрация билирубина обычно незначительная или умерен¬
ная, постепенно снижается в период выздоровления. При гемолитических желту¬
хах билирубин в моче не обнаруживают.Определение билирубина (и одновременно уробилиногена) в моче считается
важным диагностическим тестом. Диагностические полоски на билирубин наи¬
более целесообразно использовать в следующих случаях:• при проведении химического анализа мочи;• диагностике обтурационной желтухи;• дифференциальной диагностике паренхиматозной, гемолитической и обту¬
рационной желтухи;• необходимости контроля в период лечения обтурационной желтухи и парен¬
химатозного гепатита;• обследовании рабочих, контактирующих с гепатотоксичными препаратами;• проведении скрининг-теста у пациентов, принимающих потенциально гепа-
тотоксичные препараты.Тест на билирубин на диагностических полосках качественный и позволяет
определять присутствие билирубина в моче в относительных величинах (-1-, +-I-,
+++) в зависимости от степени окраски диагностического поля.СОДЕРЖАНИЕ УРОБИЛИНОГЕНА В МОЧЕ
Клинические аспектыУробилиногеновые тела являются производными билирубина. Известно 4 уро-
билиногеновых тела (1-уробилиноген, D-уробилиноген, третий уробилиноген
и стеркобилиноген) и 4 уробилиновых тела (1-уробилин, D-уробилин, третий
уробилин и стеркобилин). Уробилиногены — бесцветные вещества, а уробили¬
ны окрашены, имеют желтовато-коричневый цвет. Превращение билирубина
в 1-уробилиноген частично происходит в желчном пузыре под действием деги¬
дрогеназ. Количество уробилиногенов, образующихся в организме, пропорцио¬
нально концентрации билирубина, экскретируемого печенью вместе с желчью
в кишечник. 1-уробилиноген реабсорбируется в двенадцатиперстной и частично
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 333В тонкой кишке и через систему воротной вены возвращается в печень, где часть
его окисляется до дипирролов, а часть вновь экскретируется в желчь (внепече-
ночная циркуляция 1-уробилиногена). Часть стеркобилиногена всасывается в
дистальном отделе толстой кишки, попадает в геморроидальные вены, нижнюю
полую вену, сосуды почки, фильтруется через почечный фильтр и выделяется с
мочой, окрашивая ее одновременно с другими нормальными урохромами в разные
оттенки желтого цвета.Уробилиногеновые тела являются нормальными продуктами катаболизма,
которые в физиологических условиях образуются с определенной скоростью,
постоянно экскретируются с калом и в небольших количествах с мочой. При раз¬
личных заболеваниях их образование может увеличиваться, что приводит к повы¬
шению экскреции (например, гемолитическому процессу); либо их образование
резко снижается или прекращается (ахилия), и тогда уробилиноген обнаруживают
в моче в следовых концентрациях или вообще не обнаруживают.Физиологическая концентрация уробилиногена в моче, составляющая
17 мкмоль/л (1 мг/дл), принимается за его верхний предел. Выделение уробили-
ногеновых тел в количестве, превышающем норму, называется уробилиногенури-
ей, она характерна для гемолитических состояний, поражений паренхимы печени
и для кишечной патологии.При гемолитигеских состояниях с мочой выделяется главным образом стер-
кобилиноген: гемолитическая анемия, пернициозная анемия, пароксизмальная
ночная гемоглобинурия, эритремия, внутрисосудистый гемолиз (гемотранс-
фузионная реакция, инфекция, укус ядовитых змей), рассасывание массивных
гематом.При поражении паренхимы пегени с мочой экскретируется главным образомI-уробилиноген: вирусный гепатит, хронический гепатит, токсическое поражение
печени, рак печени и метастазы.При заболеваниях китегника происходит усиленная реабсорбция стеркобили¬
ногена слизистой оболочкой дистального отдела толстой кишки, что приводит к
повышению концентрации в моче этого вещества. Такой тип стеркобилиногенурии
чаще наблюдается у детей; энтероколиты, запоры, кишечная непроходимость, уси¬
ленные гнилостные процессы в толстой кишке.Уровень уробилиногена в моче также увеличивается при шунтировании пегени,
циррозе печени с портальной гипертензией, тромбозе портальной вены. Если у
больного нет гемолиза и заболеваний кишечника, уробилиногенурия служит при¬
знаком поражения паренхимы печени. Она считается одним из наиболее характер¬
ных показателей функционального состояния печени. При вирусном поражении
паренхимы печени уробилиногенурия достигает максимальных значений в первые
дни заболевания, еще до наступления желтухи, а затем постепенно снижается.
В разгар болезни уробилиноген в моче практически не определяется. Это период
внутрипеченочноТо застоя. Содержание билирубина интенсивно увеличивается в
плазме крови, и билирубйнурия достигает максимальных значений. Затем, по мере
выздоровления пациента и очищения тканей организма от билирубина, уробили¬
ноген вновь появляется в'моче. Это второй пик уробилиногенурии. Постепенно
содержание уробилиногена в моче снижается до нормы. Длительная уробилиноге¬
нурия в период выздоровления указывает на развитие хронического гепатита или
цирроза печени.При опухоли печени, абсцессе, эхинококкозе уробилиногенурия диагностирует¬
ся только при генерализации процесса, когда патологический процесс распростра¬
няется на большую часть органа, нарушая его функцию.Уробилиноген в моче может снижаться или полностью исчезать после про¬
должительной окклюзии желчного протока опухолью, камнем или в результате
полного прекращения образования желчи (тяжелого вирусного гепатита, тяжелого
334 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВтоксического поражения печени и т.д.). При обтурационной желтухе кал бесцвет¬
ный, стеркобилин в кале и его следы в моче появляются только в период восста¬
новления поступления желчи по желчным путям в двенадцатиперстную кишку.Уробилиноген (стеркобилиноген) не определяется в моче в первые три месяца
жизни здорового новорожденного, находящегося на грудном вскармливании, так
как в кишечнике не происходит восстановления билирубина в стеркобилиноген
из-за отсутствия кишечной микрофлоры, с каловыми массами выделяется толь¬
ко билирубин, а моча окрашена только урозеином и уроэритрином. Это можно
считать нормой примерно до трехмесячного возраста детей. Но если нормальная
бактериальная микрофлора кишечника подавлена при лечении антибиотиками и
билирубин желчи не восстанавливается до стеркобилиногена, в моче такого боль¬
ного он также не будет определяться. Это тяжелый дисбактериоз. Каловые массы
будут окрашены в золотисто-коричневый цвет только билирубином.При гемолитических анемиях уробилиногенурия (стеркобилиногенурия) —
важный и резковыраженный симптом. Желчь в этот период носит название
плейохромной за счет высокой концентрации билирубина. В толстой кишке из
большого количества билирубина образуется много стеркобилиногена и каловые
массы приобретают темно-коричневую окраску.Возможности использования диагностических полосок для определения уроби-
линогенов в моче приведены в табл. 6-10.Таблица 6-10. Использование диагностических полосок для определения уробилиногеновОбщий анализ мачиДифференциальная диагностикаМонторингПроводят в приемном покое —
«линия первого контакта» врача с
пациентом.Это обязательное исследование
при массовых обследованиях
населенияГепатитГепатитМеханическая желтухаГемолитическая желтухаГемолитические заболеванияНарушения функции печениХимические интоксикацииЦирроз печениСОДЕРЖАНИЕ КРОВИ (ЭРИТРОЦИТОВ, ГЕМОГЛОБИНА), МИОГЛОБИНА В МОЧЕКровь в моче может быть представлена эритроцитами (синдром гематурии) или
продуктами их распада (гемоглобинурия, гемосидеринурия). Кроме того, в моче
могут присутствовать такие дериваты гемоглобина, как гематоидин, метгемогло-
бин и сульфгемоглобин.Мочу исследуют на наличие эритроцитов и гемоглобина при макро- и микро¬
скопическом (цитологическом) анализе.В моче здоровых людей обнаруживают единичные эритроциты. При приме¬
нении камерных методов для исследования осадков мочи было установлено, что
у практически здоровых людей в сутки выделяется до 1 млн эритроцитов (метод
Каковского-Аддиса). При исследовании мочи по методу Нечипоренко в 1 мл осад¬
ка мочи обнаруживают до 1000 эритроцитов, что соответствует 10 эритроцитам
в камере Горяева (или 1 эритроциту в 1 мкл нецентрифугированной мочи). Это
норма для детей и взрослых. Но обычно при использовании нецентрифугирован¬
ной мочи в 1 мкл обнаружить эритроциты не удается, и реакция нормальной мочи
на кровь на тестовых полосках отрицательная.Синдром гематурииМикрогематурия. Цвет мочи не изменен, эритроциты обнаруживают при
микроскопии осадка ориентировочным методом (1 эритроцит и более в поле зре¬
ния). При исследовании камерными методами обнаруживают более 1000 эритро¬
цитов в 1 мл мочи или более 1 ООО ООО эритроцитов в сутки.Макрогематурия проявляется специфической окраской мочи. Цвет ее в зави¬
симости от количества эритроцитов может быть розовым, красноватым, красным,
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 335моча может иметь цвет «мясных помоев». Границей между микро- и макрогема-
турией считается присутствие в 1 л мочи примерно 0,5 мл крови (около 2500 эри- Ж
троцитов в 1 мкл нецентрифугированной мочи). Цвет мочи становится красным,
когда в 1 л поступает 1 мл крови (более 5000 эритроцитов в 1 мкл нецентрифуги-
рованной мочи).Гематурии делятся на почечные и внепочечные.Почечные (ренальные) гематурии. Почечные гематурии разделяют на функ-
циональные и органические.Функциональные гематурии. В раннем детском возрасте эритроциты в "
осадке мочи встречаются часто и в большом количестве, что объясняется несо¬
стоятельностью почечного фильтра, его увеличенной проницаемостью. Это функ¬
циональные микрогематурии. Почки грудного ребенка реагируют на малейшее
раздражение: удар, неосторожную пальпацию поясничной или брюш[ной области.При переохлаждении и перегревании микрогемат>'рию обнаруживают и у взрос¬
лых. Функциональную микрогематурию отмечают при ортостатизме и гиперлор-
дотизме в пубертатном периоде жизни ребенка (10 лет и старше). Микрогематурия
отмечается после спортивных нагрузок, при длительных пеших переходах (марше¬
вая гематурия) и сочетается с альбуминурией.Органические гематурии. При остром диффузном гломерулонефрите гемату¬
рия — основной симптом. Моча цвета «мясных помоев» (макрогематурия) появ¬
ляется в начале заболевания. Эритроциты проникают в первичную мочу через
стенку гломерулярных капилляров, пораженную воспалительным процессом,
через базальную мембрану и подоциты.При очаговом гломерулонефрите цвет мочи не изменен, а единичные эритро¬
циты обнаруживают в поле зрения только при микроскопическом исследовании
осадка. При прогрессировании заболевания у больных развиваются протеинурия
и гипертония диастолического типа. В осадке мочи появляются цилиндры и клет¬
ки почечного эпителия, в период выздоровления эритроциты обычно исчезают
из осадка мочи быстрее, чем нормализуются остальные симптомы заболевания,
такие как протеинурия. Исчезновение гематурии считается первым признаком
наступающего выздоровления. Если в период выздоровления при микроскопиче¬
ском исследовании осадка мочи обнаруживают эритроциты, это прямой признак
нестихающего гломерулита, симптом обозначается как остато^шая гематурия.Хронические гломерулонефриты и нефрозы сопровождаются умеренной гема¬
турией (микрогематурией). Появление при нефрозе более выраженной гематурии
свидетельствует о присоединении воспаления клубочков — гломерулонефрита.При наблюдении за этими больными особое внимание надо обращать на измене¬
ние артериального давления и периодически определять количество мочевины и
креатинина в крови и моче.Острая погегная недостатогность, коллагенозы, тромбоз почечных вен сопро¬
вождаются тяжелой гематурией (макрогематурией).Застойная гематурия развивается при заболеваниях сердца, инфаркте почек
(веностазе), обусловлена циркуляторными нарушениями, приводящими к вторич¬
ной почечной недостаточности. Застойные микрогематурии быстро стихают при
улучшении состояния сердца.Гематурия при туберкулезе потек относится к микрогематурии, которая очень упор¬
на и продолжается долгие годы, сочетаясь с кислой реакцией мочи (pH = 5,0-6,0).Гематурия при токсикоинфекциях (сепсисе, гриппе, скарлатине, инфекционном
мононуклеозе, свинке, краснухе, бронхопневмонии, ангине, дизентерии и др.)
свидетельствует о вовлечении в процесс почек и служит ранним признаком ослож¬
нения, особенно у детей. Это первый признак нефрозонефрита.Гематурия на фоне применения лекарственных препаратов, вызывающих инди¬
видуальную интоксикацию, может носить функциональный, временный характер.
336 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВесли после прекращения приема этих лекарств симптоматика исчезает. Некоторые
лекарственные препараты обладают потенциальным нефротоксическим эффектом
(аминогликозиды, антибиотики, анальгетики, циклоспорин, цитостатические пре¬
параты, метенамин, сульфаниламиды). Применение этих препаратов может при¬
вести к развитию острого интерстициального нефрита (неинфекционного), а про¬
должительное их использование — к развитию хронического интерстициального
нефрита. Показателем поражения проксимальных канальцев в этом случае служат
микрогематурия и тубулярная протеинурия (примерно 1,5 г белка в сутки).При пиелонефрите у трети больных наблюдается гематурия. Пиелонефрит по
клиническим признакам диагностируют у 5-8% женщин и пожилых мужчин.
Диагностически ценно обнаружение у больного лейкоцитурии и бактериурии.Опухоли погки проявляются гематурией, чаще микрогематурией. При опухоли
почки болезненная гематурия может возникать задолго до того, как будет постав¬
лен окончательный диагноз. Именно поэтому при обнаружении гематурии неяс¬
ной этиологии необходимо в первую очередь исключить опухолевый процесс.при врожденных апатомигеских дефектах потек, поликистозе почек и геморра¬
гических диатезах гематурия имеет почечный и внепочечный характер.Постренальные (внепочечные) гематурии. Возникают при воспалении,
полипозе, новообразовании или травме могевыводящих путей, обычно сопровожда¬
ются пиурией, лейкоцитурией и бактериурией. Основные заболевания в этой груп¬
пе гематурий — пиелиты и пиелоциститы. Именно при них гематурия сочетается с
лейкоцитурией или пиурией и бактериурией.Постренальная гематурия отмечается при мочекислом инфаркте почек у ново¬
рожденного, опухоли Вильсона, гидронефрозе.Камни в погках и могевом пузыре, по разным оценкам, обнаруживают у 1-3%
взрослого населения. Чаще всего встречаются оксалатные камни (55%), уратные
(25%) и фосфатные (20%). Наличие мочевых камней обычно сочетается с повы¬
шенным содержанием в моче мочевой кислоты в кристаллическом или раство¬
ренном состоянии, а также кислого мочекислого аммония, уратов, оксалатов или
фосфатов. При длительно протекающей мочекаменной болезни гематурия наблю¬
дается примерно у 20% больных и часто сочетается с лейкоцитурией, что считается
признаком присоединившейся инфекции. Микрогематурия — первый симптом
мочекаменной болезни, диагностируется на фоне болей в области поясницы, слу¬
жит основным признаком мочекаменной болезни.Опухоль могевого пузыря всегда сопровождается гематурией.Преренальные (внепочечные) гематурии. Они не связаны с органическим
поражением паренхимы почек, осложняют врожденные и приобретенные коагу-
лопатии (тромбоцитопению или тромбоцитопатию, болезнь Верльгофа, Ослера-
Рандю, болезнь Шенлейна-Геноха, болезнь Буля, тяжелые анемии, гемофилии,
тяжелые поражения печени). Геморрагический диатез, сопровождающийся гема-
тзфией, может быть проявлением побочного эффекта антикоагулянтной терапии.Важное диагностическое значение имеет гематурия при болезни Барлоу (дет¬
ский скорбут — авитаминоз С). При выраженной кровоточивости десен (ведущем
симптоме этого заболевания) гематурия становится постоянным признаком.
Иногда гематурия возникает на 8-15 сут раньше появления других признаков
болезни. При легких форма авитаминоза С гематурия считается первым и един¬
ственным симптомом заболевания.Для дифференциальной диагностики ренальной гематурии с постренальной (из
мочевыводящих путей) можно применить трехстаканную пробу; преобладание
крови в первой порции свидетельствует о поражении мочеиспускательного канала,
во второй — о поражении мочевого пузыря, в третьей — о почечной гематурии.При односторонней изолированной гематурии (инструментальное исследо¬
вание — цистоскопия) можно предполагать рак почки, туберкулез почки, тромбоз
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 337почечных вен. при двусторонней почечной гематурии (цистоскопия) можно запо¬
дозрить коагулопатию. Рекомендуют провести расширенное исследование свертыва¬
ющей системы крови. При сочетании гематурии с лихорадкой и другими системными
проявлениями заболеваний необходимо провести бактериологическое исследование
мочи и крови, исследование крови на LE-клетки и антинуклеолярный фактор.Кровь может попасть в мочу из кровоизлияний в половых органах (метрор-
рагии у грудных детей, кровотечение из вульвы, влагалища). В неонатальном
периоде гематурии вызываются травмой, полученной во время родов, сепсисом,
мочекислым инфарктом почек, гемолитической болезнью новорожденных и
геморрагическими заболеваниями.ГемоглобинурииГемоглобинурии возникают в результате внутрисосудистого гемолиза и гемо-
глобинемии. при внутрисосудистом гемолизе гемоглобин появляется в моче, когда
концентрация свободного гемоглобина в плазме крови превышает 60 мкмоль/л
(10 г/л), что составляет почечный порог гемоглобина. Гемоглобин появляется в
моче после того, как насыщаются гаптоглобинсвязывающая способность плазмы
крови и тубулярная реабсорбция в почках.Для подтверждения диагноза гемоглобинурии необходимо химическим путем
доказать присутствие гемоглобина в моче, а при микроскопическом исследовании
осадка — подтвердить отсутствие в нем эритроцитов.Гемоглобинурии делят на две большие группы: первичные (идиопатические) и
вторичные (симптоматические).К первичным гемоглобинуриям относятся:• холодовая, приступы которой вызываются переохлаждением;• маршевая, или спортивная;• при болезни Маркиафавы-Микели или ночной пароксизмальной гемоглоби¬
нурии;• латиризме;• болезни Винкеля,к вторичным гемоглобинуриям относятся:• при переливании несовместимой крови;• отравлении;❖ сульфаниламидами;❖ анилиновыми красками;
арсином;❖ сероводородом;■O' соляной кислотой;❖ грибами;❖ хлороформом;
стрихнином;
хлористым калием;'J' парааминосалициловой кислотой и т.д.;• инфекционных заболеваниях (сепсисе, тифе, скарлатине, малярии, ангине).При лечении хинидином возникает резко выраженная гемоглобинурия. Этосостояние больного получило название счерноводная лихорадка», оно наступает:• при тяжелых травмах;• ангионевротических и аллергических состояниях;• острой и желтой атрофии печени;• врожденных и приобретенных гемолитических анемиях;• нефрите (встречается редко).Эритроциты, попавшие в мочу при гематурии, подвергаются гемолизу in vivo
и in vitro, присутствие свободного гемоглобина в моче при гематурии — явление
338 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВобычное, так как моча не является физиологаческой средой для эритроцитов, в
ней они достаточно быстро разрушаются. Как быстро это произойдет — зависит от
нескольких факторов, главными из которых считаются осмотическая резистент¬
ность, морфология проникших в мочу эритроцитов (нормальные эритроциты,
микросфероциты, гипсхромные эритроциты, мегалоциты) и длительность их
пребывания в моче. Однако не отмечается прямой зависимости между скоростью
и степенью разрушения эритроцитов от относительной плотности мочи, pH, кон¬
центрации хлористого натрия, аскорбиновой кислоты или белка.Гематурия, гемоглобинурия, миоглобинурия могут быть важными клинически¬
ми симптомами заболеваний и требуют дальнейших клинических исследований,
направленных на выявление их причины, В табл. 6-11 представлены показания
для исследования с помощью диагностических тестовых полосок.Таблица 6-11. Показания к исследованию мочи на кровь (эритроциты и гемоглобин) с использо¬
ванием тестовых полосок «сухая химия»Массовое обследо¬
ваниеДиагностикаМониторингБеременные.Острый гломерулонефрит.Беременность.Спортсмены.Хронический гломерулонефрит.Болезни почек.Дети школьногоНефросклероз.Мочекаменная болезнь.возраста.Нефрозы.Трансплантация почки.Госпитализи¬Пиелонефрит.Сахарный диабет.рованные больные.Цистит.Г ипертония.Пациенты, отно'Пиелоцистит.Системная красная вол¬сящиеся к «линииТуберкулез почек.чанка.первого контакта».Мочекаменная болезнь.Травмы почек и мочевы¬Пожилые людиСиндром Фанкони.водящих путей.Эклампсия.Поликистоз почек.Опухоли почек и мочевого пузыря.Гемолитические анемии.Сахарный диабет.Гипертония,Трансфузионные реакции при переливании несовмести¬
мой крови.Повреждение мышщ (краш-синдром).Токсические, гипоксические поражения или дегенератив¬
ные изменения в гломерулярных капиллярах и канальцах.
Тубулярная атрофия почек.Застойная почка при правожелудочковой недостаточности
сердцаЭклампсияМиоглобинурииПоложительную реакцию диагностических полосок на гемоглобин обуслов¬
ливает также продукт распада мышечной ткани — миоглобин. Почечный порог
миоглобина составляет 9-12 мкмоль/л (150-200 мг/л).Дифференциальную диагностику между гемоглобинурией и миоглобинурией
проводят с помощью качественной пробы: в 5 мл мочи растворяют 2,8 г кристал¬
лического сульфата аммония, затем раствор пропускают через бумажный фильтр.
Если в моче присутствует миоглобин, окраска фильтрата — красно-коричневая, а
если в моче был гемоглобин — окраска соответствует цвету обычной мочи, так как
сульфат аммония осаждает 80% гемоглобина.Миоглобинурии делят на травматические и нетравматические (табл. 6-12).Таблица 6-12. Виды миоглобинурииТравматическиеНетравматическиеОбширные травмы мышечной ткани (синдром
сдавления, краш-синдром), удар электрическим
токомТромбоз сосудов мышц, конвульсии, миозит, атрофия
МЫШЦ: отравление угарным газом, пароксизмальная
миоглобинурия, инфаркт миокарда
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 339Состояния, мимикрирующие гемоглобинуриюОкраска мочи, схожая с окраской мочи при гемоглобинурии и миоглобинурии,
характерна для алкаптснурии, меланинурии, порфиринурии* для приема пира-
золона, феназопиридина, слабительных фенолового ряда, употребления с пищей
продуктов, способных окрасить мочу в разные оттенки красного цвета (свекла).Алкаптонурия — наследственное заболевание, проявляется в детском возрас¬
те. С мочой выделяется гомогентизиновая кислота, вызывающая ее потемнение
при стоянии на воздухе, подщелачивании или подогревании. Гомогентизиновая
кислота выделяется с мочой при гипо- и авитаминозе С.Для обнаружения гомогентизиновой кислоты необходимо к 0,5 мл мочи доба¬
вить 3-4 капли 10% натрия гидроксида. Если через 1-2 мин появляется сине¬
фиолетовое окрашивание — реакция положительная. При отсутствии в моче
гомогентизиновой кислоты моча остается бесцветной,Меланинурия наблюдается у больных с меланомой. При метастазах в печень
выделяется большое количество бесцветного меланогена, который выделяется с
мочой и окисляется до меланина.Прибавление к такой моче хлорного железа, бромной воды, бихромата калия,
разбавленной серной кислоты вызывает черно-коричневое окрашивание.При алкаптонурии и меланинурии реакция на кровь реактивной зоны диагно¬
стических тест-полосок отрицательная.СОДЕРЖАНИЕ ЛЕЙКОЦИТОВ В МОЧЕЛейкоциты всегда присутствуют в моче здоровых людей. При ориентировочном
микроскопическом исследовании осадка мочи их количество определяется как0-3 в поле зрения. Норма количества лейкоцитов по методу Каковского-Аддиса
составляет 2 ООО ООО в сутки, а по Нечипоренко — 2000 в 1 мл мочи. У грудного
ребенка эти показатели значительно ниже и постепенно увеличиваются, достигая
величин взрослого к возрасту 10 лет. Лейкоцитурия у женщин наблюдается значи¬
тельно чаще, чем у мужчин. Отчасти это связано с большей распространенностью
заболеваний мочевыводящих путей у женщин. Кроме того, существует высокая
вероятность контаминации мочи лейкоцитами из влагалищных выделений. При
исследовании образцов мочи женщин без тщательного туалета наружных половых
органов лейкоцитурию обнаруживают в 40-50% случаев.Если моча прозрачная, а количество лейкоцитов в осадке после центрифугиро¬
вания превышает норму — это лейкоцитурия. Если моча мутнеет от количества
лейкоцитов, а в осадке после центрифугирования лейкоциты густо покрывают все
поля зрения - это пиурия. Лейкоцитурия и пиурия считаются важнейшими пато¬
логическими признаками воспаления почек и мочевыводящих путей.Особенно велико значение пиурии (лейкоцитурии) в раннем детском возрасте.
Большинство заболеваний в этот период осложняются пиурией. В таком же возрас¬
те часто встречаются первичные бактериальные пиурии (цистопиелиты). У детей
70-80% пиурий возникают в первые 2 года жизни, из них большая часть относится
к первым 3 мес жизни ребенка. После 6 мес в основном болеют девочки.В детском возрасте выделяют три группы пиурий.• Первичные (септические, острые) — первичные пиелоциститы. Инфекция
попадает в мочевыводящие пути восходящим путем, у ребенка появляется
лихорадка и нарастают симптомы, характерные для интоксикации.• Сопутствующие — вторичные пиелоциститы, возникшие как осложнения
после первичного заболевания (гриппа, ангины, пневмонии, отита, хрониче¬
ской дистрофии).• Хронические рецидивирующие — встречаются в более позднем детстве.
Развиваются обычно вследствие врожденных анатомических дефектов (ано¬
малия мочеиспускательного канала, пионефрозы, гидронефрозы и т.д.).
340 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВОбычно при лейкоцитуриях и пиуриях в моче обнаруживают нейтрофилы.
В осадке мочи нейтрофилов много, часто они густо покрывают все поле зрения
микроскопа, склеиваются в комочки. В нецентрифугированной моче при пиурии в
1 мкл содержится более 10 ООО клеток. Цистопиелиты, особенно у грудных детей,
могут протекать без пиурии. Обычно это связано с задержкой лейкоцитов в мочеи¬
спускательном канале при его спазме. Недостаточно однократного исследования
мочи, чтобы исключить пиурию у маленьких детей. Диагностировать скрытую
лейкоцитурию (пиурию) помогает подсчет количества лейкоцитов в камере (метод
Нечипоренко) или провокационная преднизолоновая проба (доза — 0,35 мг/м^
поверхности тела). Иногда в раннем детстве пиурии протекают даже без подъема
температуры тела, поэтому исследовать мочу необходимо у каждого больного
ребенка.Моча, содержащая большое количество лейкоцитов и бактерий, имеет щелоч¬
ную реакцию (pH = 8,0-9,0). Стойкая лейкоцитурия при pH = 5,0-6,0 в сочетании
с микрогематурией подозрительна на туберкулез почек.Лейкоцитурия может быть инфекционной (бактериальной) и асептической.
Пиурия, сочетающаяся с бактериурией, является признаком инфекционно¬
воспалительного процесса в мочевыделительной системе. При гломерулонеф¬
рите с нефротическим синдромом в период обострения можно обнаружить до
30-40 лейкоцитов в каждом поле зрения микроскопа, при этом бактериурии нет,
что подтверждается микробиологическими исследованиями мочи и тестом на
нитриты («сухая химия»).Инфекционная лейкоцитурия (пиурия) при пиелонефрите и других локализациях
воспалительного процесса в мочевыводящих путях представлена нейтрофилами. Для
абактериальной лейкоцитурии при волчаночном нефрите, хроническом гломеруло¬
нефрите в лейкоцитарной формуле мочи определяется до 20% и более лимфоцитов.
Эозинофилы появляются в осадке мочи при атопических формах нефрита и лекар¬
ственном интерстициальном нефрите, при аллергической реакции на лекарственные
препараты. Проведение топической диагностики (установление уровня возникнове¬
ния лейкоцитурии) помогает решить вопрос о происхождении лейкоцитов.о происхождении лейкоцитов из почек свидетельствует обнаружение в осадке
мочи на фоне лейкоцитов клеток почечного эпителия, лейкоцитарных, зернистых,
эпителиальных цилиндров. Помогают также трехстаканная проба и цистоскопия
мочевого пузыря.Лимфоцитурию устанавливают при изучении приготовленных в виде мазка
из осадка мочи препаратов, зафиксированных и окрашенных азур-эозином (по
Нохту, Романовскому, Паппенгейму или на приборах для окраски мазков типа
«ГемаТек»). В окрашенном мазке лейкоциты дифференцируют, так же как и в
мазке крови, на нейтрофилы, лимфоциты, эозинофилы, плазматические клетки.
Это подсчет мочевой лейкоцитарной формулы. Иногда в окрашенном препарате
обнаруживают макрофаги, клетки почечного и переходного эпителия.Лейкоциты в осадке мочи здорового человека представлены в основном нейтро¬
филами, в лейкоцитарной формуле мочи здорового человека лимфоцитьі состав¬
ляют всего 1-2%.Увеличение содержания лимфоцитов в лейкоцитарной формуле мочи (более
20%) на фоне лейкоцитурии отмечается при подостром, хроническом и особенно
волчаночном гломерулонефрите в период обострения, а также при отторжении
почечного аллотрасплантата.Лимфоцитурия при гломерулонефритах указывает на активность воспалитель¬
ного процесса. Присоединение вторичной инфекции приводит к увеличению сте¬
пени лейкоцитурии за счет нейтрофилов.При остром пиелонефрите, цистите и цистопиелите в мочевой лейкоцитарной
формуле нейтрофилы составляют основную массу, при переходе в хроническую
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 341форму появляются моноциты, макрофаги и плазматические клетки — клеточные
элементы, типичные для хронического вялотекущего воспалительного процесса.
При присоединении аллергического компонента добавляются эозинофилы.Определение лейкоцитов с использованием тестовых полосок основано на фер¬
ментативной реакции, катализируемой лейкоцитарной эстеразой. Метод специфи¬
чен только для нейтрофилов, позволяет выявлять в моче продукты их распада,
содержащие эстеразы. Чувствительность метода составляет 10 нейтрофилов в1 мкл нецентрифугированной мочи.СОДЕРЖАНИЕ НИТРИТОВ В МОЧЕ (БАКТЕРИУРИЯ)У здоровых людей мочевыделительная система стерильна, минимальное коли¬
чество непатогенных бактерий, которое смывается мочой из дистального отдела
мочеиспускательного канала, не превышает 1x10^ в 1 мл. Это количество бактерий
не успевает превратить нитраты, присутствующие в любой моче, в нитриты, поэто¬
му реакция мочи на нитриты в норме отрицательная.Появление бактерий в моче в количестве, превышающем 1x10^' в 1 мл (бакте-
риурия), свидетельствует об инфицировании почек и/или мочевыводящих путей.
Бактерии (в основном грамотрицательная микрофлора) попадают в мочевыводя¬
щие пути гематогенным путем или в результате восходящей инфекции при сни¬
женном иммунитете, Б мочевом пузыре бактерии быстро размножаются, так как
моча является хорошей питательной средой. При бактериурии нитраты восстанав¬
ливаются в нитриты в результате жизнедеятельности таких грамотрицательных
микроорганизмов, как Esherihia coli, Proteus, Klebsiella, Citrobacter, Salmonella и,
вероятно, энтерококков, стафилококков и Pseudomonas. Для диагностики бакте¬
риурии исследуют среднюю порцию мочи, собранную после тщательного туалета
наружных половых органов в стерильную посуду. Обнаружение нитритов при
исследовании мочи с помощью реакции Грисса или «сухой химии» позволяет диа¬
гностировать бактериурию. У детей грудного возраста моча не содержит нитриты,
поэтому применять для диагностики бактериурии реакцию Грисса или «сухую
химию» нельзя. Не рекомендуют применять реакцию Грисса при резко щелочной
моче (pH = 10,0). Положительная химическая реакция Грисса в 65-88% случаев
подтверждается культуральными исследованиями.Хронический пиелонефрит — часто встречаемое заболевание. Течение его
обычно бессимптомное, без субъективных клинических проявлений (20-30%
случаев). Хронический пиелонефрит обычно обнаруживают случайно или диа¬
гностируют на поздних стадиях, когда имеются выраженные нарушения функций
почек, либо при патологоанатомическом вскрытии. Заболевание проявляется
неспецифическими симптомами, такими как быстрая утомляемость, постоянные
головные боли, снижение аппетита, похудание, тошнота, персистирующая суб-
фебрильная температура, отеки. Реже отмечаются болезненное мочеиспускание,
преобладание ночного диуреза над дневным, анурез, протеинурия и т.д. Появление
этих признаков требует дополнительного обследования для выявления инфекции
мочевыводящих путей и почек. Пиелонефрит встречается чаще у молодых женщин
и детей, больных сахарным диабетом, и мужчин старше 45 лет. У беременных бак¬
териурию выявляют в 5 раз чаще, чем у небеременных.Развитию восходящей инфекции мочевыводящих путей способствует глюкозу-
рия. в группу риска развития пиелонефрита входят больные с уретритом, цисти¬
том, пиелоциститом, мочекаменной болезнью, гипертензией, а также пациенты,
подвергавшиеся инструментальному исследованию мочевыводящих путей или
хирургическому вмешательству.Бессимптомная бактериурия может сопровождаться латентной почечной пато¬
логией (врожденными анатомическими дефектами развотия почек и мочевыводя¬
щих путей), которая рано или поздно проявляется острым либо уже хроническим
342 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВпиелонефритом. Именно поэтому важно провести диагностику инфекционного
процесса мочевыделительной системы на стадии, когда можно предотвратить
Vp возможные осложнения своевременным назначением специфического лечения.
' ^ ; Для ранней диагностики инфицирования мочевыделительной системы показано
Vv' регулярное массовое обследование школьников, женщин детородного возраста и
^ людей, входящих в группы риска.,'.' Обследованию на бактериурию с помощью тестовых полосок подлежат:• дети начиная с 4 лет (диспансеризация);• женщины после преждевременных родов;• пациенты старше 70 лет;• больные с циститом, пиелоциститом, уретритом;• мужчины, страдающие аденомой простаты и простатитом;• больные сахарным диабетом;• больные с мочекаменной болезнью;• пациенты, постоянно выделяющие с мочой кристаллы мочевой кислоты;• больные, страдающие гиперкальциемией;• больные с гипертонической болезнью;• пациенты, которым проводили инструментальное исследование, хируршче-
ские вмешательства на мочевыделительной системе:• женщины после аборта или выкидыша.Чувствительность тестовых полосок на нитриты составляет 70% во всех случа¬
ях бактериурий. Для пробы на нитриты берут среднюю порцию утренней мочи,
анализ проводят не позднее чем через 4 ч после ее получения. Пациент за 3 сут
до исследования мочи на нитриты должен отказаться от антибактериальных пре¬
паратов и приема витамина С (аскорбиновой кислоты) и за день до исследования
съесть достаточное количество овощей. Причиной ложноотрицательного резуль¬
тата может быть высокий диурез, поэтому накануне исследования на нитриты
рекомендуют ограничить прием жидкости и отказаться от приема диуретиков.
Ложноотрицательная реакция на нитриты характерна для мочи, в которой при¬
сутствуют гонококки, стрептококки и микобактерии туберкулеза. Эти бактерии не
образуют нитритов.При работе со «старой», долго находившейся при комнатной температуре
мочой можно также получить ложноположительный результат за счет загрязне¬
ния ее бактериальной микрофлорой. При исследовании мочи на нитриты необхо¬
димо соблюдать следующие правила.• Исследуют среднюю порцию первой утренней мочи. Эта порция поступает
из мочевого пузыря, а для того чтобы бактерии восстановили NOj’ в NOj,
необходимо продолжительное время нахождения мочи в мочевом пузыре.• Пациент должен съесть накануне достаточное количество овощей (шпината,
капусты, моркови).• По крайней мере, за 3 сут до проведения теста следует отменить или прервать
антибактериальную терапию.ОТНОСИТЕЛЬНАЯ ПЛОТНОСТЬ (УДЕЛЬНЫЙ ВЕС)Относительная плотность мочи зависит от количества растворенных частиц и
их молекулярной массы. Величина относительной плотности мочи в норме опре¬
деляется количеством экскретируемых электролитов и мочевины. Относительная
плотность мочи повышается, если почка экскретирует глюкозу, плазменный белок
или экзогенные вещества (например, контрастные).Относительная плотность первичной мочи равна относительной плотности
безбелновой плазмы крови и составляет 1,010 г/мл. В зависимости от потреб¬
ностей организма почки могут концентрировать или разводить первичную мочу.
Относительная плотность мочи взрослого человека в течение суток колеблется в
ХИМИКО-МИКРОСКОПИ^ІЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 343пределах от 1,003 до 1,040 г/мл. Моча у детей раннего возраста менее концентри- 3
рованная, ее относительная плотность колеблется от 1,002 до 1,030 г/мл. Самая Щ
низкая относительная плотность мочи отмечается у новорожденных в первые дни о»
внеутробной жизни — от 1,002 до 1,020 г/мл.При паренхиматозных заболеваниях погек (хроническом гломерулонефрите,
пиелонефрите, нефросклерозе) способность почек к разведению и концентрации
мочи снижается, а в терминальный период заболевания полностью утрачивается.Почки перестают концентрировать и разводить первичную мочу и выделяют окон¬
чательную мочу с постоянной относительной плотностью, равной относительной
плотности первичной мочи, — 1,010 г/мл. продолжительное выделение мочи с
такой относительной плотностью называют изостенурией.Высокая относительная плотность мочи может наблюдаться при дегидратации,
надпочечниковой (адреналовой) недостаточности, заболеваниях печени и при
сердечной недостаточности, сопровождающейся отеками.При частичной утрате почками функции концентрации и разведения относи¬
тельная плотность мочи длительное время колеблется около точки изостенурии
(1,007-1,015 г/мл). Это состояние получило название «гипостенурия^ и считается
признаком тяжелого заболевания почек, при котором концентрационная и разво¬
дящая способность почек сохранена лишь частично.При незначительном поражении почек относительная плотность мочи в тече¬
ние суток может колебаться от 1,004 до 1,023 г/мл. Относительная плотность
1,023 г/мл рассматривается как минимальная верхняя граница концентрационной
способности здоровых почек. Если относительная плотность мочи у обследуемого
пациента доходит до 1,023 г/мл, концентрационная способность почек оценивает¬
ся как нормальная. Если относительная плотность мочи не достигает 1,023 г/мл,
это считается признаком снижения концентрационной способности почек. Чем
ближе относительная плотность мочи к 1,010 г/мл, тем более значительным счи¬
тается нарушение концентрационной функции почек.После стандартной водной нагрузки относительная плотность мочи при здоро¬
вых почках достигает значения 1,003 г/мл, поэтому считают, что относительная
плотность 1,003-1,004 г/мл — признак вполне достаточной способности почек к
разведению.В первые дни почки новорожденного не могут концентрировать и разводить
мочу. Относительная плотность их мочи низкая. Это состояние называют физио¬
логической гипо- и изостенурией.Сахарный диабет может сопровождаться массивной глюкозурией, относитель¬
ная плотность мочи увеличивается до 1,040-1,050 г/мл. Каждые 4 г/л белка уве¬
личивают относительную плотность мочи на 0,001 г/мл.При нелеченом диабете почечного или нейрогипофизарного происхождения
{diabetes insipidus) с нарушением обратной реабсорбции воды в канальцах почек
выделяется моча с относительной плотностью 1,001-1,004 г/мл.При тубулоинтерстициальных нефропатиях и ХПН относительная плотность
мочи колеблется в пределах 1,005-1,008 г/мл, что соответствует гипостенурии.Определение относительной плотности с использованием тестовых полосок
основано на методе ионного обмена, который происходит между полиэлектроли¬
том и ионами, присутствующими в моче. Этот метод отражает ионную концентра¬
цию мочи, но не дает количественной оценки недиссоциирующих составляющих,
таких как глюкоза, мочевина, креатинин.Диагностическая значимость тестовых полосокВо многих КДЛ исследование мочи с использованием тестовых полосок рассма¬
тривается как основная процедура. При профилактических осмотрах и массовых
344 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВисследованиях в ЛПУ, непрофильных по заболеваниям почек и мочевыводящих
путей, часто при анализе мочи используют только полифункциональные тестовые
полоски» дальнейшего исследования мочи не проводят. По опыту исследования
мочи тестовыми полосками самыми значимыми считаются тесты, позволяющие
качественно и полуколичественно определять присутствие в моче белка, эритро¬
цитов (гемоглобина), лейкоцитов, нитритов. Именно поэтому еще раз следует
подчеркнуть диагностическое значение тестов «сухая химия», разработанных для
анализов мочи (табл, 6-13).Таблица Б-13. Диагностическая информация, получаемая с помощью тестовых полосок «сухая
химия»ПоказательДиагностическое значениеЭритроциты,
гемоглобин, мио-
глобинТестовые полоски не могут различать гематурию, гемоглобинурию и миогпобину-
рию. Предел чувствительности тестовых полосок — 5 эритроцитов в 1 мкл нецен-
трифугироеанной мочи, что не позволяет диагностировать микрогематурию. По
методу Нечипоренко микрогематурия — это количество эритроцитов, превышающее
1000 эритроцитов в 1 мл центрифугированной мочи. 5 эритроцитов в 1 мкл нецентри-
фугированной мочи соответствуют 50 ООО эритроцитов в 1 мл мочи после центрифу¬
гирования.При микроскопическом исследовании по морфологии эритроцитов можно различить,
каково их происхождение — ренальное (дисморфные эритроциты) или постреналь-
ное. Наличие белка е моче не всегда подтверждает ренальную гематурию. Различить
ренальную или постренальнуга гематурию возможно также на основе исследования
морфологии эритроцитов в осадке мочиЛейкоцитыПоложительная реакция на эстеразы характерна для нейтрофилов. Тестовые полоски
не выявляют лимфоциты. Чувствительность тестовой зоны позволяет обнаружить
10 лейкоцитов в 1 мкл нецентрифугированной мочи. Это количество соответствует
100 ООО лейкоцитов в 1 мл мочи при исследовании по Нечипоренко. При микроско¬
пическом исследовании осадка мочи скрытая лейкоцитурия — это 1-5 лейкоцитов в
поле зрения. Отказаться от исследования осадка мочи и дифференциации лейкоцитов
в окрашенном азур-эозином препарате (лейкоцитарная формула мочи), ограничива¬
ясь только результатами «сухой химии», нельзя, так как присутствие лейкоцитарной
эстеразы в моче не всегда связано с инфекцией мочевыводящих путей, а может быть
результатом воспаления других органов и тканей. Для подтверждения инфекции почек
и мочевыеодящих путей необходимо бактериологическое исследование {посев) мочиНитриты (бакте-
риурия)Многие бактерии, которые колонизируют мочевыводящую систему, трансформируют
нитраты в нитриты. В норме нитритов в моче нет. Положительная реакция на нитриты
подтверждает инфекцию мочевыделительной системы.Тест на нитриты может давать ложноотрицательный результат, хотя культуральными
методами бактерии в моче выявляются. Так происходит в следующих ситуациях:V новорожденные и дети первых месяцев жизни, находящиеся только на грудном
вскармливании (нет нитратов — нет нитритов):V скудное количество бактерий в моче —10^ клеток/мл и менее;V количество бактерий в моче очень высокое, при этом нитриты восстанавливаются в
элементарный азот;V мочевыделительная система инфицирована бактериями, которые не переводят
нитраты в нитриты, в частности стафилококками и энтерококками, микобактериями
туберкулезаБелокДиагностическая зона тестовой полоски определяет практически альбумин, а не
общий белок в моче. Однако предел чувствительности подобран таким образом, чтобы
с помощью тестовых полосок не выявлялись низкие значения альбумина (микроаль¬
буминурия). Если белок определяется с помощью диагностических полосок, зто, как
правило, свидетельстеует о нефропатии. Для диагностики ранних стадий поражений
клубочков (диабетической, гипертонической нефропатии) существуют специальные
тестовые системы, в которых альбумин определяется иммунохимическими методамиФункциональные исследования почекСпособность почек экскретировать разведенную или концентрированную мочу
часто оценивается нагрузочными пробами. Пробу с водной нагрузкой проводят
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 345ДЛЯ определения способности почек реагировать на состояние, при котором необ¬
ходимо выделять увеличенное количество мочи, проба с сухоедением показывает,
насколько почки способны реагировать на ограничение воды и какова их способ¬
ность концентрировать мочу.ПРОБА НА КОНЦЕНТРИРОВАНИЕПри исследовании пациент в течение 18-24 ч не принимает жидкости и упо¬
требляет пищу с высоким содержанием белка. Богатая белком пища способствует
образованию в организме достаточного количества мочевины, которая прини¬
мает участие в механизме концентрирования мочи. Мочу собирают каждые 4 ч.
Измеряют ее количество и относительную плотность.Через 18-24 ч от начала исследования относительная плотность мочи достигает
максимальных значений, а моча — оптимального концентрирования. У здоровых
людей при 18-часовом лишении жидкости относительная плотность мочи дости¬
гает 1,028-1,030 г/мл. Более длительная дегидратация не оказывает заметного
влияния на максимальн)то концентрацию мочи. Концентрационная способность
почек считается нарушенной при снижении максимальной относительной плот¬
ности мочи до 1,017 г/мл при 18- или 24-часовом лишении жидкости. Если эти
показатели составляют 1,015-1,016 г/мл, регистрируют значительное нарушение
концентрирования мочи.Если относительная плотность мочи после 18 ч лишения жидкости составляет
1,010-1,012 г/мл, это свидетельствует о полном прекращении функции концен¬
трирования мочи (изостенурии), она становится равной относительной плотности
плазмы крови.Противопоказано проведение пробы на концентрирование при обильных вне-
почечных потерях жидкости (рвоте, диарее), после массивного диуреза, вызван¬
ного мочегонными препаратами, при ОПН и обострении ХПН на фоне высокого
уровня креатинина в крови (132 мкмоль/л).Ложноотрицательные результаты пробы на концентрирование могут быть
получены в период схождения отеков, при применении мочегонных препаратов.ПРОБА НА РАЗВЕДЕНИЕУтром натощак после опорожнения мочевого пузыря пациент выпивает слабо-
заваренный чай без сахара или воду в количестве, составляющем 20-22 мл/кг его
массы, через 30 мин опорожняет мочевой пузырь. До приема воды, после ее при¬
нятия и через 4 ч после окончания исследования измеряют массу тела. Во время
исследования пациент соблюдает постельный режим. Пробы мочи собирают
каждый час в течение 4 ч. Определяют ее количество и относительную плотность,
каждый раз больной выпивает дополнительно такой же объем жидкости. Затем в
течение всего дня определяют относительную плотность мочи при каждом моче¬
испускании.У здоровых пациентов при проведении пробы на разведение относительная
плотность мочи снижается до 1,001-1,002 г/мл. В дальнейшем в течение дня этот
показатель составляет 1,008-1,030 г/мл. Если относительная плотность не снижа¬
ется до 1,003-1,004 г/мл, это указывает на нарушение функции разведения. При
полном выпадении этой функции относительная плотность мочи будет составлять
или превышать 1,010 г/мл.Противопоказания к проведению такой пробы: сердечная недостаточность,
гипертоническая болезнь и олигурическая недостаточность почек (острая и хро¬
ническая). При отеках любого происхождения эта проба неинформативна.Для ребенка количество воды, которое надлежит выпить, вычисляют по массе
тела (3% массы тела) или по росту (количество миллилитров жидкости, равное
росту ребенка в миллиметрах, например рост 620 мм соответствует 620 мл).
Здоровый ребенок за 4 ч выделяет все принятое количество воды и даже больше
Щ346 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ(в отличие от взрослого). Моча при этом имеет относительную плотность 1,001-
1,003 г/мл. При нарушении функций почек мочи выделяется меньше, чем выпито
жидкости, а ее относительная плотность снижается нерезко.у грудного ребенка выделившееся количество мочи в норме составляет 40%
принятой жидкости.Проба с разведением менее чувствительна, чем проба на концентрирование.ПРОБА ЗИМНИЦКОГОЭто ориентировочный метод для определения функций концентрирования и
разведения мочи. При пробе Зимницкого не проводят нагрузку на почки, а остав¬
ляют эти органы работать при обычном режиме питьевом и питания (в физио¬
логических условиях), в течение суток 8 раз через каждые 3 ч собирают мочу,
определяют ее количество и относительную плотность. Суммируя общее количе¬
ство выделенной мочи, определяют общий, дневной и ночной диурез,у здорового человека суточное выделение мочи составляет 67-75% количества
выпитой жидкости. Дневной диурез составляет 2/3-3/4 количества суточной
мочи, относительная плотность колеблется в пределах 1,005-1,025 г/мл.Признаки нарушения функционального состояния почек:• уменьшение количества суточной мочи (олигурия, анурия);• превышение количества выделенной мочи такового выпитой жидкости
(полиурия);• увеличение диуреза в ночное время (никтурия);• снижение амплитуды колебаний относительной плотности мочи, которое
может проявляться:❖ снижением максимальной относительной плотности мочи до 1,012 г/мл и
менее (гипостенурией);❖ увеличением минимальной относительной плотности мочи до 1,010 г/мл
и более (гиперстенурией);фиксацией относительной плотности мочи на уровне 1,010-1,011 г/мл
(изостенурией).Для подтверждения полученных результатов следует провести нагрузочные
пробы на концентрирование и разведение мочи.Тест на относительную плотность мочи в сочетании с пробами на концентриро¬
вание и разведение выявляет снижение функций почек. Снижение концентрирую¬
щей способности наблюдается при тяжелом дефиците калия, гиперкальцием ии,
болезнях почечной паренхимы, ОПН и наследственной патологии почечных
канальцев. Моча, наиболее разведенная в результате снижения концентрирующей
способности почек, характерна для сахарного, несахарного диабета (при недостат¬
ке антидиуретического гормона), гиперальдостеронизма.Высокая относительная плотность отдельной порции мочи сама по себе не
может быть использована для дифференцировки нормы от патологии. Кроме
степени концентрации мочи, необходимо знать еще и состояние водного баланса
и/или концентрацию натрия в плазме. Хорошие результаты исследования отно¬
сительной плотности мочи могут быть достигнуты при тщательном сборе соот¬
ветствующей информации.Измерение относительной плотности мочи предоставляет важную информа¬
цию, которая необходима при интерпретации результатов других исследований.
В моче с высокой относительной плотностью происходит ингибирование реакции
с участием глюкозоксидазы, что используется для обнаружения глюкозы. Моча с
низкой относительной плотностью вызывает гемолиз эритроцитов, набухание и
лизис лейкоцитов и других клеточных элементов организованного осадка.Относительную плотность мочи определяют с помощью комбинированных
урометров, которые откалиброваны при температуре 15, 20 или 22,5 °С. При ком¬
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 347натной температуре, превышающей указанную на урометре, объем мочи увели¬
чивается, показатели относительной плотности понижаются. При снижении тем¬
пературы на 3 “С относительная плотность изменяется и должна быть уменьшена
на 0,001 г/мл, а при повышении на каждые 3 ‘’С относительную плотность нужно
увеличить на 0,001 г/мл.Исследование осадка мочиМикроскопическое исследование осадка мочи обязательно у больных уроло¬
гического, нефрологического профиля, при подозрении на заболевание мочевы¬
делительной системы и у пациентов группы риска. В комплекс общего анализа
мочи входит морфологическое исследование форменных и кристаллических
элементов осадка, которое обязательно проводят у пациентов при положительном
результате любого из показателей тестовых полосок, а также у больных с заболе¬
ваниями почек, мочевыводящих путей и другими соматическими заболеваниями.
Исследование осадка мочи проводят ориентировочным и количественным мето¬
дами.ОРИЕНТИРОВОЧНЫЙ МЕТОД ИССЛЕДОВАНИЯ МОЧЕВОГО ОСАДКАОриентировочный метод позволяет идентифицировать признаки заболевания в
моче. Количественные методы направлены на оценку выраженности патологиче¬
ских изменений, их проводят в утренней (наиболее концентрированной) порции
мочи.Получение осадка мочи и приготовление нативного препаратаВ центрифужную пробирку после перемешивания наливают 10-12 мл мочи, цен¬
трифугируют со скоростью 1500-2000 об,/мин в течение 10-15 мин. Надосадочную
мочу сливают быстрым движением (опрокидывают пробирку), а осадок размеши¬
вают с оставшейся мочой пастеровской пипеткой. Каплю осадка с помощью этой
же пипетки помещают на предметное стекло и накрывают покровным стеклом.
Это нативный препарат. Содержание форменных элементов (эритроцитов, лей¬
коцитов) подсчитывают в нескольких полях зрения при большом увеличении
микроскопа. Ответ дают по количеству клеток в поле зрения (например, 10-15, а
если клеток мало — 0-2 в поле зрения или единичные не в каждом поле зрения).Если клеточных элементов много и подсчитать их в поле зрения не удается,
отмечают в бланке, что лейкоциты (эритроциты) густо покрывают все поле зре¬
ния.При скудном содержании таких форменных элементов, как цилиндры, исследо¬
вание проводят при малом увеличении микроскопа и указывают их количество в
препарате (например, 2 цилиндра в препарате).Если цилиндров много, их количество отмечают в поле зрения, т.е, при большом
увеличении микроскопа. Для количества таких элементов, как эпителиальные
клетки (многослойный плоский, переходный, почечный эпителий) и кристаллы,
принято давать оценку «большое», «умеренное», «небольшое» или «незначитель¬
ное», при этом используют малое увеличение микроскопа.КОЛИЧЕСТВЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ МОЧЕВОГО ОСАДКАЭто методы Каковского-Аддиса и Нечипоренко. Принцип методов — подсчет
количества форменных элементов мочи (эритроцитов, лейкоцитов и цилиндров)
в счетных камерах. Количественные методы используют для диагностики скрытых
воспалительных процессов и контроля эффективности проведенного курса лече¬
ния больных с заболеваниями почек и/или мочевыводящих путей.Метод Каковского-Аддиса заключается в определении количества эритроци¬
тов, лейкоцитов и цилиндров, выделяемых с мочой в течение суток.
т348 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВПациент в течение дня ограничивает прием жидкости, отмечает время послед¬
него вечернего мочеиспускания (t^), а следующим утром, желательно спустя 8-2 ч,
после тщательного туалета собирает всю утреннюю порцию мочи в чистую сухую
посуду и отмечает время этого мочеиспускания (t^).В лабораторию доставляется вся утренняя порция мочи.Количество форменных элементов по Каковскому-Аддису для нормальной
мочи:• эритроцитов — до 1 ООО ООО в сутки;• лейкоцитов — до 2 ООО ООО в сутки;• цилиндров — до 20 ООО в сутки.Норма одинакова для взрослых и детей.Этот количественный метод целесообразно назначать для исследования мочи
пациентов, находящихся на лечении в стационаре.Метод Нечипоренко — определение количества форменных элементов (эри¬
троцитов, лейкоцитов и цилиндров) в 1 мл мочи. Исследуют одноразовую, жела¬
тельно среднюю, порцию мочи. Считают отдельно лейкоциты, эритроциты и
цилиндры. Полз^ают количество форменных элементов в 1 мкл материала.Нормальное количество форменных элементов по методу Нечипоренко:• эритроцитов — 1000 в 1 мл осадка с мочой;• лейкоцитов — 2000 в 1 мл осадка с мочой;• цилиндров — 20 в 1 мл осадка с мочой.Норма одинакова для взрослых и детей.ЭЛЕМЕНТЫ МОЧЕВОГО ОСАДКА
Эритроциты и продукты их распадаЭритроциты в осадке мочи бывают неизмененные^ измененные. Иногда обнару¬
живают продукты их распада, в частности гемосидерин и гематоидин.Неизмененные эритроциты — безъядерные клетки в виде дисков с централь¬
ным углублением. Их обнаруживают в слабокислой (pH = 6,5), нейтральной (pH =
7,0) или слабощелочной (pH = 7,5) моче. Неизмененные эритроциты характерны
для внепочечной гемат>'рии, чаще всего их появление бывает результатом мочека¬
менной болезни.Измененные эритроциты не содержат гемоглобин, бесцветны, представлены
в виде одно- или двухконтурных колец, их обнаруживают при длительном пребы¬
вании в резко кислой моче при pH = 4,5-5,0. Эритроциты, прошедшие почечный
фильтр, пораженный воспалительным процессом (дисморфные эритроциты),
обычно свидетельствуют о почечной гематурии,к измененным эритроцитам относятся сморщенные эритроциты с неровными,
зазубренными краями. Они встречаются в концентрированной моче с высокой
относительной плотностью (1,030-1,040 г/мл). Эритроциты, резко увеличенные
в размерах, наблюдаются в моче с pH 9-10 и низкой относительной плотностью
(1,002-1,005 г/мл). Эритроциты, лишенные гемоглобина, формируются при дли¬
тельном пребывании в резко кислой моче при pH = 5,0-5,5. Эти эритроциты отме¬
чаются в той же графе мочевого бланка, но диагностического значения не имеют.Гемосидерин образуется из гемоглобина эритроцитов в клетках, обладающих
макрофагальной функцией. При микроскопическом исследовании осадка мочи в
клетках почечного эпителия обнаруживают аморфные желто-коричневые кри¬
сталлы. Для подтверждения гемосидеринурии проводят реакцию с берлинской
лазурью, в ходе которой желто-коричневые клетки почечного эпителия, содержа¬
щие кристаллы гемосидерина, окрашиваются в голубой и синий цвет, т.е. желтые
оксиды железа превращаются в голубые.Гемосидерин в моче встречается при болезни Маркиафавы-Микели (ноч¬
ной пароксизмальной гемоглобинурии), хронических гемолитических анемиях.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 349гемохроматозе, анемии Кули, фетальных эритробластозах. При этих заболеваниях
гемосидеринурия сочетается с гемоглобинурией.Гематоидин образуется при распаде гемоглобина без доступа кислорода в гема¬
томах, расположенных глубоко в тканях. Кристаллы гематоидина — золотисто-
желтые или желто-оранжевые, слегка вытянутые в длину ромбы и/или довольно
длинные иглы. Гематоидин не содержит железа, растворяется в щелочах и обес-
цвечивается перекисью водорода. Обнаруживают в осадке мочи при вскрытии
старых почечных гематом, застое крови у больных с калькулезным пиелитом, при
абсцессе почки, раке мочевого пузыря и почек.ЛейкоцитыЛейкоциты — бесцветные клетки круглой формы, в 1,5-2 раза больше неиз¬
мененного эритроцита. Обычно в моче содержатся нейтрофилы. При pH = 5,0-7,0
и относительной плотности 1,015-1,030 г/мл это сероватые мелкозернистые кру¬
глые клетки, в 1,5 раза больше эритроцита по диаметру. При низкой относитель¬
ной плотности (1,002-1,008 г/мл) и щелочной или резко щелочной реакции мочи
(pH = 8,0-9,0) нейтрофилы увеличиваются в размерах, разбухают, в цитоплазме
хорошо видны при большом увеличении микроскопа сегментированные ядра и
иногда броуновское движение нейтрофильных гранул. При длительном нахожде¬
нии в моче, содержащей бактерии, нейтрофилы разрушаются.Эозинофилы такого же размера, как нейтрофилы, но отличаются от них содер¬
жанием в цитоплазме характерной зернистости одинаковых размера, сферической
формы, желтовато-зеленоватого цвета, резко преломляющей свет.Лимфоциты обнаруживают в моче только в препаратах, окрашенных азур-
эозином.Макрофаги могут быть обнаружены в осадке мочи и даже в нативном препара¬
те у больных, страдающих длительным воспалением мочевыводящих путей. Это
окрашенные мочевыми пигментами клетки с грубыми включениями, резко пре¬
ломляющими свет.в осадке мочи больных с хроническим миелопролиферативным процессом, ослож¬
ненным воспалением мочевыводящих путей (лейкоцитурией), обнаруживают все
формы созревания гранулоцитов — от бластной клетки до зрелого сегментоядерного
нейтрофила. В осадке мочи больных с хроническими лимфопролиферативными забо¬
леваниями лейкоциты представлены только лимфоцитами разной степени зрелости.
Осадок мочи больньпс с острыми лейкозами представлен бластными клетками.В норме в 1 мкл осадка мочи содержится не более 20 лейкоцитов (нейтрофи-
лов), что по методу Нечипоренко составляет 2000 лейкоцитов в 1 мл мочи. При
ориентировочном изучении осадка утренней порции мочи это количество лей¬
коцитов соответствует у мужчин 0-2, у женщин — 0-3 лейкоцита в полях зрения
микроскопа при увеличении в 400 раз.ЦилиндрыЦилиндры — образования белкового или клеточного происхождения цилин¬
дрической формы, разной величины, их обнаруживают в осадке мочи при пато¬
логиях мочевыделительной системы, в кислой моче они сохраняются довольно
долго, в щелочной быстро разрушаются. Цилиндры растворяются при большой
концентрации уропепсина в моче.Различают гиалиновые, зернистые, восковидные, пигментные, эпителиаль¬
ные, эритроцитарные, лейкоцитарные и жировые цилиндры, а также гиалиновые
цилиндры с наложением эритроцитов, лейкоцитов, клеток почечного эпителия
или аморфных зернистых масс (аморфные кристаллы — ураты или фосфаты,
аморфные белковые массы при выраженной протеинурии или зернистые массы,
образующиеся при распаде клеточных элементов).
350 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВБелковые цилиндры образуются в просвете извитой, наиболее узкой части дис¬
тального канальца в кислой среде (pH = 4,5-5,3) при наличии в моче альбумина,
белка Тамма-Хорсфалля, иммуноглобулинов. Белок Тамма-Хорсфалля — глико¬
протеин (уромукоид, мукопротеин), секретируется клетками почечного эпителия
широкого восходящего колена петли Генле и начального сегмента дистального
извитого канальца нефрона. Считают, что этот белок участвует во всасывании
воды и солей. При увеличении его концентрации в сочетании с возрастанием
уровня электролитов и ионов водорода в первичной моче происходит агрегация
белка и образуется гель, который служит основой для формирования гиалиновых
цилиндров. Клеточные элементы (эритроциты, лейкоциты и почечный эпителий)
захватываются (погружаются в гель), и формируются белковые цилиндры. Этот
процесс происходит обычно в самой узкой части нефрона — в просвете извитой
части дистального канальца. Содержание белка Тамма-Хорсфалля в нормальных
гиалиновых цилиндрах в 50 раз больше, чем альбумина. Альбумин в нормальных
гиалиновых цилиндрах составляет не более 2% всей его массы.Образованию патологических цилиндров способствуют уменьшение почеч¬
ного кровотока, увеличение содержания в первичной моче плазменных белков,
электролитов, Н^, интоксикация, присутствие желчных кислот, поражение клеток
почечного эпителия, спазм или расширение канальцев.Гиалиновые цилиндры — полупрозрачные, нежные, гомогенной структуры,
с закругленными концами, разной формы (короткие или длинные, широкие или
узкие, извитые), плохо видны при ярком освещении препарата. В моче здорового
человека и ребенка гиалиновые цилиндры можно обнаружить только при иссле¬
довании в камере. При исследовании мочи по методу Нечипоренко в норме в 1 мл
мочи содержится до 20 гиалиновых цилиндров, а по методу Каковского-Аддиса —
до 20 ООО цилиндров выделяется в сутки.Гиалиновые цилиндры постоянно встречаются в моче при всех органических
заболеваниях почек, количество их не взаимосвязано с тяжестью процесса. На их
поверхности могут откладываться кристаллы, лейкоциты, эритроциты, почечный
эпителий, зернистые белковые массы, бактерии. При геморрагическом гломеруло¬
нефрите цилиндры окрашиваются в буроватый цвет, при инфекционном гепатите
билирубин окрашивает их в ярко-желтый, зеленовато-желтый или зеленый цвет
(результат окисления желтого билирубина в зеленый биливер дин).Зернистые цилиндры — непрозрачные, мелкой или грубозернистой структу¬
ры, желтоватого, желтого цвета или почти бесцветные. Грубозернистые цилиндры
образуются при распаде клеток почечного эпителия, а мелкозернистые - при рас¬
паде нейтрофилов или коагуляции белка в случае изменения физико-химических
условий в канальцах. Их обнаруживают при гломерулонефрите, пиелонефрите,
туберкулезе, раке почек, диабетической нефропатии, скарлатине, системной крас¬
ной волчанке, остеомиелите и др. При инфекционном гепатите цилиндры окраши¬
ваются билирубином в желтый цвет или биливердином — в зеленый.Восковидные цилиндры имеют резко очерченные контуры, бухтообразные
вдавления, обломанные концы, трещины по ходу цилиндра, почти всегда окра¬
шены более или менее интенсивно в желтый цвет, но в бесцветной моче остаются
бесцветными. Они образуются преимущественно из гиалиновых и зернистых,
а также, вероятно, из клеточных цилиндров при длительном их пребывании в
канальцах. Такие цилиндры называются также застойными. Широкие застойные
цилиндры, образовавшиеся в собирательных трубочках нефронов, называются
терминальными. Появление застойных цилиндров в моче свидетельствует о тяже¬
лом поражении почек.Пигментные цилиндры имеют зернистую или гомогенную структуру и окра¬
шены в желто-коричневый или бурый цвет, образуются при коагуляции гемогло¬
бина или миоглобина, расположены на фоне зернистых масс пигмента.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 351Эпителиальные цилиндры состоят из клеток почечного эпителия, всегда
более или менее интенсивно окрашень! мочевыми пигментами и расположены
на фоне этих же клеток. Их обнаруживают в моче при ОПН, тубулярном некрозе,
остром и хроническом гломерулонефрите.Жировые цилиндры образуются из капель жира (липоидов) в почечных
канальцах при жировой дистрофии клеток почечного эпителия, расположены на
фоне жироперерожденного почечного эпителия. Иногда в этих препаратах можно
обнаружить кристаллы холестерина и иглы жирных кислот. Жировые цилиндры
встречаются при хроническом гломерулонефрите, пиелонефрите, осложненных
нефротическим синдромом, при липоидном и липоидно-амилоидном нефрозе и
диабетической нефропатии.Лейкоцитарные цилиндры серого цвета, состоят из лейкоцитов и располо¬
жены на их фоне. Образуются в просвете канальцев при остром пиелонефрите,
обострении хронического пиелонефрита, абсцессе почки.Эритроцитарные цилиндры — розовато-желтого и красновато-коричневого
цвета, образуются в канальцах при почечной гематурии (кровоизлиянии в парен¬
химу почек при инфаркте почки, эмболии, остром диффузном гломерулонефрите),
состоят из массы эритроцитов и расположены на их фоне.Цилиндрические образования из аморфных солей {ложные или солевые
цилиндры) растворяются при нагревании нативного препарата, а также при добав¬
лении к препарату капли 10% щелочи (уратные цилиндры) или 30% уксусной
кислоты (цилиндры из аморфных фосфатов). Солевые цилиндры образуются из
кристаллов оксалата кальция, мочевой кислоты, кислого мочекислого аммония
и других в результате их кристаллизации на какой-либо (обычно органической)
основе, например на тяже слизи.Слизь вырабатывается эпителием мочевыводящих путей, всегда присутствует
в незначительном количестве в осадке мочи. Иногда встречаются образования из
слизи в виде цилиндроидов, которые отличаются от цилиндров лентовидной фор¬
мой и продольной тяжистостью.Эпителийв осадке мочи встречается четыре основных вида эпителия: многослойный пло¬
ский ороговевающий, многослойный плоский неороговевающий, переходный, а в
мужской моче еще и цилиндрический.Многослойный плоский ороговевающий эпителий — поверхностно распо¬
ложенные клетки наружных половых органов, в осадке мочи обычно бесцветные,
полигональные или округлые, в 3-6 раз больше лейкоцитов по диаметру, с цен¬
трально расположенными маленькими ядрами, плотной гомогенной цитоплазмой.
Юіетки многослойного плоского эпителия смываются мочой с мочевыводящих
путей, обнаружение в препаратах мочи клеток многослойного плоского эпителия
диагностического значения не имеет.Многослойный плоский неороговевающий эпителий выстилает дистальный
отдел мужского и женского мочеиспускательного канала и влагалище. Этот эпителий
характерен для влажных поверхностей, где не нужна функция всасывания. Клетки
имеют округлую форму, их диаметр в 6-8 раз превышает диаметр эритроцита, бес¬
цветны, с гомогенной или нежно-зернистой цитоплазмой. На фоне цитоплазмы про¬
сматривается небольшое, занимающее меньшую часть клетки ядро.В моче, полученной во время цистоскопии, возможно наличие эпителия, похо¬
жего на клетки поверхностного слоя многослойного плоского ороговевающего
эпителия. Это клетки переходного эпителия в состоянии плоскоклеточной мета¬
плазии, что подтверждается обнаружением клеток, содержащих 2-3 и более ядер.Переходный эпителий выстилает лоханки почек, мочеточники, мочевой
пузырь, крупные протоки предстательной железы и верхний отдел мочеиспуска¬
®ЇІі 352 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВтельного канала. Это многослойный эпителий. Он объединяет морфологические
признаки многослойного плоского и цилиндрического эпителия. Базальный слой
этой ткани представлен клетками цилиндрической формы. Отторгнутые клетки
переходного эпителия полиморфны по величине (в 3-8 раз больше лейкоцитов)
и по форме (полигональные, округлые, цилиндрические), их цитоплазма обычно
находится в состоянии дистрофии — чаще грубозернистой белковой, вакуольной,
реже жировой, в клетках поверхностного слоя можно обнаружить 1-4 адра.Единичные клетки переходного эпителия могут встречаться в осадке мочи
здоровых людей. Б большом количестве переходный эпителий обнаруживают
при интоксикации, в моче лихорадящих больных, после операций, при непере¬
носимости наркоза, лекарственных препаратов, желтухе различной этиологии, а
также при почечнокаменной болезни в момент прохождения камня, хроническом
цистите, полипозе и раке мочевого пузыря в сочетании с клетками и комплексами
клеток злокачественного новообразования.Почечный (тубулярный) эпителий — клетки неправильной округлой, угло¬
ватой, четырехугольной формы, в 1,5-2 раза больше лейкоцитов, окрашены моче¬
выми пигментами в бледно-желтый, а билирубином — в желтый цвет. Цитоплазма
клеток в состоянии мелкозернистой белковой или жировой дистрофии, возможна
вакуольная дистрофия цитоплазмы.В моче здоровых людей (детей и взрослых) клетки почечного эпителия не встре¬
чаются. При дегенеративных поражениях канальцев клетки почечного эпителия
могут располагаться в нативных и окрашенных азур-эозином препаратах разроз¬
ненно, пластами или группами, иногда накладываются на гиалиновые цилиндры, а
при усиленном отторжении образовывают эпителиальные цилиндры.В период олигурической стадии ОПН клетки почечного эпителия находятся в
состоянии резко выраженной пролиферации, увеличиваются в размерах (в 3-5 раз
больше лейкоцитов), накладываются на гиалиновые цилиндры и образуют ажур¬
ный контур вокруг них, расположены в препаратах в виде железистых структур.
Клетки почечного эпителия в состоянии жировой дистрофии принимают круглую
или овальную форму, могут резко увеличиваться в размере — в 2-4 раза по срав¬
нению с диаметром нормальной клетки почечного эпителия. Почечный эпителий
обнаруживают в моче больных с нефротической формой хронического гломеруло-
нефрита, а также липоидным, липоидно-амилоидным нефрозом.ИССЛЕДОВАНИЕ КАЛА
Правила сбора материалаПодготовка пациента к копрологическому анализу (макроскопическому,
химическому и микроскопическому исследованию) заключается в приеме пищи
с ограниченным содержанием белков, жиров и углеводов в течение времени,
за которое у него проходит 3-4 дефекации. Этим требованиям отвечает диета
Певзнера.Диета Певзнера основана на принципе максимальной пищевой нагрузки для
здорового человека. Это обычный рацион здоровых людей, который включает еже¬
дневно гречневую и рисовую каши, 400 г белого и черного хлеба, 250 г жаренного
куском мяса, 100 г масла, 40 г сахара, жареный картофель, салат, квашеную капу¬
сту, компот из сухофруктов и свежие яблоки. Калорийность достигает 3250 ккал.
После ее применения у здоровых людей при микроскопическом исследовании
кала обнаруживают лишь единичные, редкие измененные мышечные волокна. Эта
диета позволяет выявить даже небольшую степень патологии ферментативной и
эвакуаторной способности пищеварительного тракта и нарушения всасывания в
тонкой кишке.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 353Диета Шмидта — щадящая, лечебная. Включает ежедневно 1-1,5 л молока,2-3 яйца всмятку, 125 г слабопрожаренного рубленого мяса, 200-250 г картофель¬
ного пюре, слизистый отвар (40 г овсяной крупы), 100 г белого хлеба или сухарей,
50 г масла. Общая калорийность — до 2250 ккал. После ее употребления при
нормальном пищеварении в кале не обнаруживают остатки пищи. Диета Шмидта
при патологии со стороны пищеварительного тракта в течение 3-5 сут оказывает
лечебное действие, и проведенный на фоне этой диеты копрологический анализ
может не выявить ожидаемой патологии.При подготовке пациента к исследованию кала на скрытое кровотечение из
рациона исключаются рыба, мясо, все виды зеленых овощей, помидоры и яйца
весенней кладки (с зародышем). Следует отменить лекарственные препараты-
катализаторы (гемоглобин, хлорофилл, железо), поскольку в реззшьтате их дей¬
ствия анализ может оказаться ложноположительным.Кал собирают после самопроизвольной дефекации пациента в специально пред¬
назначенную посуду. Нельзя направлять материал для исследования после клиз¬
мы, приема медикаментов, влияющих на перистальтику (препаратов белладонны,
пилокарпина и др.), после приема масла семян клещевины обыкновенной (касто¬
рового масла*) или парафина жидкого (вазелинового масла*), введения свечей,
препаратов, влияющих на окраску кала (содержащих железо, висмут, сернокислый
барий), йельзя брать на анализ фекалии из подгузников. Кал не должен содержать
мочу. Емкость с фекалиями следует доставлять в КДЛ сразу после дефекации или
не позднее 10-12 ч после дефекации при условии хранения в холодильнике при
температуре 3-5 °С.В лаборатории кал подвергается макроскопическому, химическому и микро¬
скопическому исследованиям.Химическое исследование кала с помощью
диагностических тестовых полосокХимическое исследование кала складывается из определения pH и ряда других
показателей, что помогает выявить скрытое кровотечение или воспалительный
процесс, обтурацию желчевыводящих путей. Для этих целей применяют диагно¬
стические полоски, по которым устанавливают уровень pH фекалий, а также белка,
крови, стеркобилина, билирубина и лейкоцитов.Для проведения химического анализа с помощью реагентных полосок и для
последующего микроскопического исследования следует приготовить каловую
эмульсию.Приготовление каловой эмульсииНебольшое количество фекалий (размером с лесной орех) помещают в центри¬
фужную пробирку. Постепенно добавляя дистиллированную воду или физиологи¬
ческий раствор, растирают субстрат стеклянной палочкой до консистенции густого
сиропа (разведение 1/2-1/8 в зависимости от характера фекалий).Правила работы с реагентными полоскамиТщательно размешивают каловую эмульсию.Стеклянной палочкой наносят эмульсию на уголок реагентного поля полоски.
Нельзя замазывать материалом все реагентное поле.Сразу включают секундомер.Наблюдают изменение или появление окраски реагентного поля около капли
каловой эмульсии.По истечении времени, указанного в инструкции к тесту, фавнивают окраску
реагентной зоны со шкалой на этикетке контейнера.
шт354 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВОПРЕДЕЛЕНИЕ рК КАЛАВ норме у здоровых людей, находящихся на смешанной пище, реакция кала
нейтральная или слабощелочная (pH = 7,0-7,5), обусловлена продуктами жизне¬
деятельности нормальной бактериальной микрофлоры толстой кишки.Кислая реакция (pH = 6,0-6,5) может быть связана с присутствием жирных
кислот (при ускоренной эвакуации расщепленного химуса, а также в случае нару¬
шения всасывания при воспалительном процессе в тонкой кишке).Резко кислая реакция (pH = 5,0-5,5) характерна для усиленных бродильных
процессов в толстой кишке (бродильной диспепсии: бродильного дисбиоза, дис¬
бактериоза, колита). При поступлении в толстую кишку большого количества
нерасщепленных углеводов усиливается пролиферация нормальной, а затем и
патологической бродильной микрофлоры. Усиленные процессы брожения приво¬
дят к образованию углекислого газа и органических кислот, вызывающих маце¬
рацию и экссудацию слизистой оболочки толстой кишки, в результате чего может
развиться бродильный колит.Щелочная реакция (pH = 8,0-8,5) наблюдается при усиленном гниении остат¬
ков белковой пищи, непереваренной в желудке и/или в тонкой кишке, а также при
энтерите, когда в толстую кишку поступает воспалительный экссудат. Сдвиг pH в
щелочную сторону приводит к активации гнилостной микрофлоры и образованию
в толстой кишке аммиака и других компонентов гниения, которые раздражают сли¬
зистую оболочку, вызывая мацерацию, а затем экссудацию и гнилостный колит, при
котором pH каловых масс обычно резко щелочной и колеблется от 8,5 до 9,5.ОПРЕДЕЛЕНИЕ БЕЛКА В КАЛЕВ каловых массах здорового человека белка нет. Положительная реакция на
белок свидетельствует о наличии воспалительного экссудата, слизи, непереварен¬
ного пищевого белка или о кровотечении.Белок в каловых массах обнаруживают при поражениях:• желудка (гастрит, язва, рак);• двенадцатиперстной кишки (дуоденит, язва, рак большого сосочка двенадца¬
типерстной кишки);• тонкой кишки (энтерит, целиакия и пр.);• толстой кишки (колит бродильный, гнилостный, язвенный, аллергиче¬
ский, полипоз, рак, дисбактериоз, повышенная секреторная функция толстой
кишки);• прямой кишки (геморрой, трещина, проктит, рак).ВЫЯВЛЕНИЕ КРОВИ В КАЛЕПоложительная реакция на кровь (гемоглобин) указывает на кровотечение
из любого отдела пищеварительного тракта (десен, варикозно расширенных вен
пищевода, желудка, кишечника), что бывает при поражении слизистой оболочки
язвенным, воспалительным процессом или злокачественным новообразованием.
Кровь в кале часто обнаруживают при геморрагическом диатезе, язвах, полипозе,
геморрое. С помощью диагностических тестовых полосок также выявляют так
называемую скрытую кровь, которая не определяется при макроскопическом
исследовании.Диагностическая зона на кровь очень чувствительна, часто дает положительные
результаты, поэтому необходимо соблюдать следующую инструкцию.• Наносят каловую эмульсию на уголок соответствующей диагностической
зоны.• Если окраска диагностической зоны развивается постепенно в течение 2 с и
более или остается бледно-фисташкового цвета, кровотечения в пищевари¬
тельной системе нет.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 355• Если диагностическая зона у капли каловой эмульсии сразу окрасилась в
темно-зеленый цвет, это позволяет заподозрить скрытое кровотечение и тре¬
бует проведения иммунохроматографического анализа кала.Иммунохроматографические тесты позволяют выявить в кале только чело¬
веческий гемоглобин и не реагируют на редуцирующие вещества, такие как хлоро¬
филл, продукты распада крови животных (мясные, рыбные и другие продукты) и
на лекарственные препараты, содержащие железо. Обладая высокими специфич¬
ностью и чувствительностью к человеческому гемоглобину, такие экспресс-тесты
позволяют проводить исследования без предварительной подготовки пациента
(она невозможна в экстренных случаях) при подозрении на кровотечение из
пищеварительного тракта.При использовании тестовых полосок необходимо обращать особое внимание
на скорость появления их окраски. Быстро возникающая (сразу или в течение1-3 с) темно-зеленая окраска свидетельствует о присутствии эритроцитов или
гемоглобина. Появление окраски через 5-10 с и более наблюдается при большом
количестве восстанавливающих веществ или мышечных волокон (непереваренной
белковой пищи), что обычно подтверждается микроскопическим исследованием
кала. Сочетание положительной реакции на белок и лейкоциты с быстрой поло¬
жительной реакцией на кровь (гемоглобин) подтверждает заболевание слизистой
оболочки пищеварительного тракта.Если у пациента нет кровотечений и он тщательно подготовился, а при микро¬
скопическом исследовании не обнаружены мышечные волокна, диагностическая
зона на кровь или не окрашивается, или приобретает бледную, слегка зеленоватую
окраску.ОПРЕДЕЛЕНИЕ УРОБИЛИНОГЕНА (СТЕРКОБИЛИНОГЕНА) В КАЛЕСтеркобилиноген и уробилиноген — конечные продукты катаболизма били¬
рубина в кишечнике. Аналитически различить уробилиноген и стеркобилиноген
весьма трудно. Уробилиноген (і-уробилиноген) всасывается в двенадцатиперстной
и тонкой кишке и окисляется до дипирролов в клетках печени. Стеркобилиноген
образуется из билирубина желчи в толстой кишке как результат жизнедеятель¬
ности нормальной бактериальной микрофлоры. В дистальном отделе толстой
кишки он окисляется до стеркобилина. Стеркобилиноген бесцветен, а продукт
его окисления — стеркобилин окрашивает каловые массы здорового человека в
разные оттенки коричневого цвета. В сутки с калом выделяется от 40 до 280 мг
стеркобилиногена и стеркобилина.При полной обтурации желчевыводящих путей стеркобилин и стеркобилиноген
в кале отсутствуют. Кал становится бесцветным.При остром панкреатите с калом выделяется лишь стеркобилиноген, каловые
массы имеют светло-серую окраску. Поверхностный слой каловых масс ш vitro
приобретает темно-коричневую окраску в результате окисления кислородом воз¬
духа стеркобилиногена в стеркобилин.При скрытом дисбактериозе содержание стеркобилиногена снижено и обнару¬
живают билирубин, так как патологическая бактериальная микрофлора толстой
кишки неспособна восстановить весь билирубин до стеркобилиногена.При гемолитических анемиях в кале увеличивается содержание стеркобилина,
но диагностировать это повышение можно только количественным методом.ОПРЕДЕЛЕНИЕ БИЛИРУБИНА В КАЛЕБ норме билирубин содержится в меконии и фекалиях ребенка, находящегося
на грудном вскармливании, примерно до трехмесячного возраста, К этому времени
в пищеварительном тракте появляется нормальная бактериальная микрофлора,
которая частично восстанавливает билирубин до стеркобилиногена. К 6-7-му
ШШШ- 356 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВмесяцу жизни билирубин почти полностью окисляется кишечной микрофлорой
до стеркобилиногена и стеркобилина. У здорового ребенка в 7-8 мес количество
билирубина в фекалиях настолько мало, что не определяется тестовой зоной, а в
Л 9 мес в кале ребенка присутствуют только стеркобилиноген и стеркобилин.Обнаружение в кале билирубина указывает на патологию: быструю эвакуацию
пищи из кишечника, тяжелый дисбактериоз (отсутствие нормальной бактериаль¬
ной микрофлоры в толстой кишке, подавление нормальной микрофлоры кишечника
при длительном приеме антибиотиков и сульфаниламидов).Сочетание стеркобилина с билирубином может указывать на появление в тол¬
стой кишке патологической микрофлоры и вытеснение ею нормальной микрофло¬
ры (скрытый, вялотекущий дисбактериоз), а также на быструю эвакуацию химуса
из кишечника.ОПРЕДЕЛЕНИЕ ЛЕЙКОЦИТОВ В КАЛЕКаловые массы здорового взрослого человека и ребенка не содержат лейко¬
цитов (нейтрофилов). Скудное количество нейтрофилов присутствует в слизи,
выделяемой кишечником грудных детей (слабоположительная реакция на белок в
сочетании со слабоположительной реакцией на лейкоциты).При воспалительном поражении слизистой оболочки прямой кишки и дис¬
тальных отделов толстой кишки на фоне слизи, а при диарее — с оптическим уве¬
личением в 400 раз в экссудате хорошо видны клеточные элементы, характерные
для воспаления. При использовании иммерсионной системы (увеличения в 900
или 1000 раз) можно четко диагностировать нейтрофилы, эозинофилы и клетки
цилиндрического эпителия. Для этого на покровное стекло с нативным препаратом
наносят иммерсионное масло и микроскоп переводят на иммерсионный объектив.
Однако при воспалении слизистой оболочки верхних отделов толстой кишки, а
также тонкой и двенадцатиперстной кишки при микроскопическом исследовании
не обнаруживают в каловой эмульсии ни слизи, ни клеточных элементов.С помощью тестовой полоски для определения лейкоцитов и теста на белок
удается диагностировать воспаление тонкой, толстой и прямой кишки, даже если
при микроскопии в слизи не были обнаружены лейкоциты.Макроскопическое исследование калаКОЛИЧЕСТВОЗдоровый человек за 24 ч выделяет 100-200 г каловых масс. Преобладание в
рационе белковой пищи сопровождается уменьшением, растительной — увели¬
чением их количества. Количество каловых масс резко уменьшается при запо¬
рах, спастических колитах. Напротив, увеличение их количества характерно для
поражений поджелудочной железы (до 1 кг/сут и более), а также встречается при
недостаточном переваривании в толстой кишке (бродильной и гнилостной дис¬
пепсии, воспалительных процессах), при колите, сопровождающемся диареей,
изъязвлениями, ускоренной эвакуацией химуса из кишечника.КОНСИСТЕНЦИЯ, ФОРМАКонсистенция кала зависит от содержания в нем воды, растительной клетчатки,
слизи и жира. Содержание воды в норме составляет 80-85% и зависит от времени
пребывания каловых масс в дистальном отделе толстой кишки, где происходит
всасывание жидкости. При запорах содержание воды снижается до 70-75%, а диа¬
рее увеличивается до 90-95%. При поражении эпителия толстой кишки, гиперсе¬
креции слизи клетками толстой и прямой кишки, воспалительном экссудате невсо-
савшаяся вода придает калу жидкую, водянистую консистенцию. В присутствии
большого количества неизмененного или расщепленного жира кал становится
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 357 Щмазевидным или тестообразным, а при большом содержании перевариваемой
клетчатки — кашицеобразным, слизистым.Плотный, оформленный кал выделяется в норме у здоровых людей, а также при
недостаточности желудочного пищеварения по типу ахилии, ахлоргидрии, гипер-
и гипохлоргидрии и при ускоренной эвакуации пищи из желудка.Мазевидный характер фекалии приобретают при нарушении секреции подже¬
лудочной железы (остром панкреатите, некрозе поджелудочной железы, муковис-
цидозе).Жидкий, водянистый кал характерен для недостаточного переваривания в тон¬
кой кишке при энтерите, ускоренной эвакуации, ахолии (синдроме нарушения
всасывания в тонкой кишке). Такой же характер фекалий можно наблюдать при
поражении толстой кишки (колите с изъязвлениями, гнилостном колите) — в
основном в результате нарушения всасывания воды в дистальном отделе толстой
кишки. Повышенная секреторная функция слизистой оболочки толстой кишки
приводит к ложной диарее.Кашицеобразный характер кал приобретает при бродильной диспепсии, колите,
хроническом энтероколите и ускоренной эвакуации содержимого толстой кишки.Пенистый кал бывает при бродильном колите, дисбиозе и дисбактериозе.Крошковатый оформленный и бесцветный кал характерен для ахолии.Крупными комками, плотный кал вьщеляется один раз в несколько дней при запоре.Ювегий» кал в виде мелких округлых фрагментов образуется при спастическом
колите.Лентовидную, карандашеобразную форму фекалии приобретают при наличии у
больного геморроидальных узлов, спазма ректального сфинктера, трещины задне¬
го прохода, опухоли прямой кишки.ЦВЕТЦвет нормальных каловых масс коригневый, обусловлен стеркобилином. При
молочной пище окраска кала менее интенсивная, желтая, в случае преобладания
мясного рациона — темно-коричневая. На окраску кала влияют пигменты расти¬
тельной пищи, лекарственные препараты. Цвет фекалий меняется при патологиче¬
ских процессах в пищеварительной системе.Черный или дегтеобразный цвет фекалии приобретают при кровотечении из
желудка, двенадцатиперстной и тонкой кишки.Темно-коригневый цвет отмечается при недостаточности желудочного пищева¬
рения, гнилостной диспепсии, колите с запором, изъязвлением, при повышенной
секреторной функции толстой кишки, запорах. Такая окраска обусловлена стерко¬
билином и скудным содержанием бесцветного стеркобилиногена.Светло-коригневый цвет фекалии приобретают при ускоренной эвакуации
содержимого толстой кишки из-за большого содержания в нем бесцветного стер¬
кобилиногена.Красноватый кал выделяется при колите с изъязвлениями и обусловлен при¬
соединением свежей крови.Желтый цвет фекалии приобретают за счет преимущественного содержания
стеркобилиногена при недостаточности переваривания в тонкой кишке, бродиль¬
ной диспепсии и ускоренной эвакуации химуса по кишечнику.Серый, бледно-желтый цвет фекалий типичен для недостаточности поджелудоч¬
ной железы и обусловлен частыми дефекациями, при которых фекалии содержат
только стеркобилиноген. при окислении кислородом воздуха бесцветные фекалии
покрываются темно-коричневой коркой — стеркобилиноген окисляется до корич¬
невого серкобилина.Белый кал выделяется при внутрипеченочном застое или полной обтурации
общего желчного протока.
358 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВЗАПАХЗапах каловых масс в норме обусловлен продуктами распада белков (индолом,
скатолом, фенолом, орто- и паракрезо лами). При обилии белков в пище запах
усиливается.Запах почти полностью исчезает при запорах, так как часть ароматических
веществ всасывается.Гнилостный запах наблюдается при недостаточности желудочного пищеваре¬
ния, гнилостной диспепсии, язвенном колите — при этих патологиях образуются
сероводород и метилмеркаптаны.Зловонный запах (прогорклого масла) отмечается при нарушении секреции
липазы поджелудочной железой, а также при ахолии (отсутствии поступления
желчи). Этот запах обусловлен бактериальным разложением жира и жирных кис¬
лот.Кислый запах встречается при бродильном процессе в толстой кишке и возни¬
кает за счет образования лету^шх органических кислот (масляной, уксусной, вале¬
риановой) при нарушении всасывания жирных кислот в тонкой кишке (остром
энтерите, ускоренной эвакуации расщепленной пищи из тонкой кишки).ОСТАТКИ НЕПЕРЕВАРЕННОЙ ПИЩИОстатки непереваренной белковой и растительной пищи выявляют в каловой
эмульсии, помещенной в чашку Петри, на темном и светлом фоне. Непереваренное
мясо в виде белесоватых клочков волокнистого строения (мышечные волокна,
связки, хрящи, фасции, сосуды) можно обнаружить уже при приготовлении кало¬
вой эмульсии.Различают переваримую и непереваримую растительную клетчатку. Перевари-
мая клетчатка состоит из клеток, имеющих тонкую, легкоразрушающуюся обо¬
лочку. Через эту оболочку легко проникают пищеварительные ферменты, которые
расщепляют содержимое клетки. Мякоть растительной пищи (переваримая клет¬
чатка) видна в неоформленном кале и каловой эмульсии в виде прозрачных, бес¬
цветных, напоминающих слизь округлых комочков, иногда окрашенных в тот или
иной цвет в зависимости от съеденной растительной пищи (морковь — оранжевая
окраска, свекла — вишневая и т.д.). Обнаружение переваримой клетчатки указы¬
вает на быструю эвакуацию пищи или на отсутствие в желудочном соке соляной
кислоты.Растительную непереваримую клетчатку обнаруживают при микроскопиче¬
ском исследовании как в нормальном, так и в патологическом кале. Это связано
с употреблением растительной пищи в том или ином количестве. Такая клетчатка
не подвергается действию ферментов пищеварительной системы человека. Она
отличается толстыми оболочками клеток и толстыми межклеточными перего¬
родками, обилием растительных сосудов. Пищеварительные органы человека не
вырабатывают ферментов, способных ее расщепить. Некоторые микроорганизмы
толстой кишки обладают этими ферментами и расщепляют неперевариваемую
растительную клетчатку. Такая микрофлора находится в илеоцекальной области:
клостридии, Bacillus cellulose dissolvens. Bacillus mesentericus vulgaris. Однако даже
при нормальном темпе передвижения пищи по толстой кишке микроорганизмы не
успевают расщепить всю неперевариваемую растительную клетчатку. Количество
выделяемой с калом растительной клетчатки по сравнению с вводимой с пищей
уменьшается до 50-60%, при запорах ее расщепление достигает 80%. Именно
поэтому непереваренную растительную клетчатку при микроскопическом иссле¬
довании кала обнаруживают легко, но этот показатель не имеет диагностического
значения.
ХИМИКО-МИКРОСКОГИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 359Микроскопическое исследование калаПриготовление препаратов для микроскопииI препаратКаплю каловой эмульсии наносят на предметное стекло и прижимают покров¬
ным. В этом препарате при микроскопическом исследовании на фоне калового
детрита обнаруживают:• остатки непереваренной белковой пищи (соединительную ткань, поперечно¬
полосатые и гладкие мышечные волокна);• остатки непереваренной углеводной пищи (переваримую клетчатку);• остатки нерасщепленного и расщепленного жира (капли, иглы, глыбки);• кристаллы оксалата кальция, трипельфосфата, Шарко-Лейдена, гематои-
дина.В этом же препарате можно обнаружить слизь, если она попала в препарат, и
заключенные в ней лейкоциты (нейтрофилы, эозинофилы), цилиндр№іеский эпи¬
телий, эритроциты, а также обнаружить яйца гельминтов, цисты простейших и их
вегетативные особи.II препаратНа предметное стекло наносят каплю каловой эмульсии и такую же каплю
раствора Люголя*, смешивают и прижимают покровным стеклом. Этот препарат
предназначен для выявления нерасщепленного (черного, темно-синего цвета) или
частично расщепленного внеклеточного и внутриклеточного крахмала (синего
или голубого цвета — амилодекстрин; розового, красноватого или фиолетового —
эритродекстрин) и йодофильной микрофлоры — нормальной и патологической
(черного и коричневого цвета).Раствор Люголя* готовят ежемесячно (1 г йода, 2 г йодистого калия и 50 мл
воды), так как йод в растворе при длительном хранении разлагается.III препаратНа предметное стекло наносят каплю каловой эмульсии и каплю 30% уксус¬
ной кислоты, смешивают, прижимают покровным стеклом. Препарат пред¬
назначен для диагностики игл и глыбок солей жирных кислот (мыл). Если в
нативном препарате иглы и глыбки при подогревании не превратились в капли
(жирные кислоты), приготовленный препарат доводят до кипения над пламе¬
нем спиртовки и микроскопируют под большим увеличением. Образование
капель после кипячения указывает на наличие в кале солей жирных кислот
(мыл),IV препаратЭтот препарат предназначен для дифференцирования капель нейтрального
жира от капель жирных кислот. Его делают, когда в нативном препарате обнару¬
живают капли жира. На предметное стекло наносят каплю каловой эмульсии и
каплю 0,5% водного раствора тетраметилтионина хлорида тригидрата (метилено¬
вой сини*), смешивают и прижимают покровным стеклом. Капли жирных кислот
окрашиваются метиленовой синью* в темно-синий, синий, голубой цвет, а капли
нейтрального жира остаются бесцветными.V препаратЭтот препарат готовят при наличии слизи, слизисто-кровянистых, гнойных
масс и тканевых клочков. Отобранные тканевые клочки и слизь наносят на пред¬
метное стекло и прижимают покровным. Этот препарат предназначен для обнару¬
жения лейкоцитов (нейтрофилов, эозинофилов), эритроцитов, цилиндрического
эпителия, элементов злокачественных новообразований, вегетативных форм про¬
стейших и т.д.
360 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВИммунохимические методы исследования калаОпределение концентрации специфических белков непосредственно в кале
достоверно отражает патологические процессы в ЖКТ. Кроме того, преимущества
сбора кала в том, что это неинвазивная нестрессовая процедура, легкая в исполне¬
нии, можно при необходимости ее повторить.ХИМОТРИПСИНХимотрипсин — фермент сериновая протеаза, которая секретируется поджелу¬
дочной железой после приема пищи. Белки пищи гидролитически расщепляются
химотрипсином преимущественно по ароматическим остаткам. Незначительная
часть активного фермента экскретируется с калом. В случае недостаточности под¬
желудочной железы секреция фермента значительно снижена. Анализ химотрип-
сина в кале — информативный неинвазивный параметр для оценки нарушений
панкреатической функции. Преимущество данного метода в том, что с его помо¬
щью измеряют именно концентрацию, а не активность фермента. Химотрипсин
характеризуется высокой стабильностью (12 дней при комнатной температуре),
что сравнимо с устойчивостью панкреатической эластазы, поэтому определение
химотрипсина в кале является альтернативным для теста панкреатической эла¬
стазы.Показания:• хронический панкреатит;• экзокринная недостаточность поджелудочной железы.Активность химотрипсинаАктивность химотрипсина может быть измерена в образце фекалий спектро¬
фотометрически. Пациентам с нарушениями пищеварения часто назначают пре¬
параты с панкреатическими ферментами. В этом случае необходимо отказаться от
приема подобных лекарств за 5 дней до сбора образца для анализа. Слабительные
препараты также необходимо исключить в ближайшее время перед сбором образ¬
ца. Ложнозаниженный результат активности химотрипсина может быть в случае
диареи, низкобелковой диеты или обструктивной желтухи, тогда как ложнонор¬
мальный результат может быть по причине заместительной ферментной терапии.
Очень высокие значения - показатель ферментации (брожения) или повышенной
кишечной секреции (например, энтероколит).Показание: экзокринная недостаточность поджелудочной железы.ПАНКРЕАТИЧЕСКАЯ АМИЛАЗАПанкреатическая амилаза, подобно липазе и эластазе, синтезируется в поджелу¬
дочной железе. При хронических панкреатитах, включая панкреатиты, вызванные
алкоголизмом и травмой, амилаза снижается. В рутинной лабораторной практике
панкреатическая амилаза — единственный альтернативный эластазе-1 диагности¬
ческий тест в образце кала.Показания:• хронический панкреатит;• эзокринная недостаточность поджелудочной железы,ПАНКРЕАТИЧЕСКАЯ ЗЛАСТАЗА-1Эластаза-1 — протеолитический фермент, синтезируемый исключительно под¬
желудочной железой. Для нее характерны стабильность в кишечном пассаже и
даже аккумуляция: концентрация эластазы в 6 раз выше в кале по сравнению
с дуоденальным соком. В этом анализе используют поликлональные антитела,
специфически взаимодействующие с эластазой-1. Стабильность фермента чрезвы¬
чайно высока, индивидуальная вариация довольно низкая, несмотря на ее протео-
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 301 Жлитическую активность. Таким образом, определение концентрации энзима отра¬
жает секреторную способность экзокринной ткани поджелудочной железы. Этот
метод видоспецифичен и не имеет перекрестных реакций со свиным ферментом,
поэтому пациентам не нужно прерывать лечение ферментными препаратами для
исследования.Показание — диагностика экзокринной недостаточности поджелудочной железы:• при хронических панкреатитах;• муковисцидозе;• карциноме поджелудочной железы;• инсулинзависимом сахарном диабете;• синдроме Швахмана-Даймонда;• панкреатической недостаточности другого происхождения.АЛЬБУМИНАльбумин является основным белком человеческой плазмы (40-60%), синте¬
зируется печенью в зависимости от поступления белка. Наличие альбумина в кале
отражает воспалительную реакцию и кишечное кровотечение. Повышенное содер¬
жание альбумина и гемоглобина в кале находят не только при колоректальных
карциномах, но также у пациентов с полипами и хроническими воспалительными
заболеваниями (болезнью Крона или язвенным колитом).Показания:• установление источника кровотечения в нижних отделах ЖКТ;• диагностика колоректальной карциномы;• обследование пациентов группы риска;• болезнь Крона;• язвенный колит.СЕКРЕТОРНЫЙ IgAСекреторный IgA (sIgA) состоит из двух мономеров IgA, соединенных J-цепью,
а также секреторным компонентом. Он секретируется плазматическими клетками
в lamina propria слизистых мембран. Синтез sIgA не зависит от синтеза плазматиче¬
ского IgA, это означает, что снижение IgA в сыворотке необязательно будет сопро¬
вождаться снижением sIgA. Секреторный IgA — основной иммуноглобулин слюны,
слезной жидкости, молозива и грудного молока, трахеобронхиального и гастроин¬
тестинального секретов. Ему принадлежит главная роль в предотвращении связыва¬
ния микроорганизмов со слизистой, активации альтернативного пути комплемента
и воспалительных реакций. Новорожденные получают sIgA из материнского молока
и, таким образом, пассивно иммунизируются против кишечных инфекций.Показания:• оценка активности иммунной системы слизистых оболочек;• диагностика нарушений иммунологического барьера слизистой кишечника;• аутоиммунные заболевания.ІдА/зІдА-АНТИТЕЛА К ТКАНЕВОЙ ТРАНСГЛУТАМИНАЗЕ, ГЛИАДИНУДля пациентов с целиакией характерны следующие нарушения: мальабсорб-
ция, бесплодие, осгеопороз, герпетиформный дерматит, задержка роста у детей.С целиакией ассоциированы следующие аутоиммунные заболевания: сахарный
диабет, ревматоидный артрит, нефриты, неврологические нарушения, тиреоидит
Хашимото/базедова болезнь и повышенный риск развития Т-клеточной лимфо-
мы. В случае отрицательных результатов исследования сыворотки пациента на эти
антитела предлагают дополнительно исследовать образцы кала.Показания:• аутоиммунные заболевания;• пищевая непереносимость.
362 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВЭОЗИНОФИЛЬНЫЙ НЕЙРОТОКСИН (EOSiNOPHIL-DERiVED NEUROTOXIN, EDN)Для диагностики пищевой аллергии немедленного типа, дифференциации
между пищевой аллергией и пищевой непереносимостью и оценки эффективности
элиминационной диеты рекомендуют измерять содержание эозинофильного ней¬
ротоксина рибонуклеаза ЕРХ в кале. EDN также помогает определить целостность
слизистой кишечника при воспалительных заболеваниях, карциноме кишечника,
кишечных паразитозах. Классические методы диагностики аллергии (определение
специфических IgE-антител и прик-тесты) имеют ограниченную ценность в случае
определения пищевой аллергии. Например, нормальный уровень IgE-антител и
отрицательный результат при к-теста не исключают интестинальной формы пище¬
вой аллергии. В этом случае рекомендуют тест EDN в кале. EDN — катионный
гликопротеин, который секретируется активированными эозинофилами, обладает
сильной цитотоксичностью и имеет большое значение в противовирусной защите.
Он высвобождается из эозинофильных гранул в местах скопления эозинофи-
лов: коже, легких, слизистых оболочках урогенитальной системы и желудочно-
кишечного тракта, т.е. в месте встречи организма с патогеном. Аккумуляция EDN
в кишечнике связана с повреждением тканей.Тест EDN в кале может служить объективным параметром текущего клиниче¬
ского или субклинического хронического воспаления в ЖКТ. У больных с язвен¬
ным колитом и болезнью Крона уровень EDN позволяет судить об активности и
прогнозе заболевания.Преимущества:• подтверждение пищевой аллергической реакции немедленного типа;• неинвазивная оценка активности эозинофилов гастроинтестинального тракта:• более специфичный тест по сравнению с измерением sIgA;• можно использовать для различных образцов — кала, сыворотки, мочи, плазмы;• белок остается стабильным в кале в течение нескольких дней.Ограничения: лечение глюкокортикоидами снижает количество эозинофилови может быть причиной ложноотрицательных результатов. Лечение ингибитора¬
ми ангиотензинпревращающего фермента может привести к ложнозавышенным
результатам.Показания:• диагностика пищевой аллергической реакции немедленного типа;• оценка эффективности элиминационной диеты;• оценка повреждения целостности слизистой оболочки кишечника, вызван¬
ной инвазивными заболеваниями;• кишечные паразитозы.лизоцимЛизоцим (мурамидаза) — белок с молекулярной массой около 15 кДа, принад¬
лежащий к группе щелочных гликозидаз. Лизоцим продуцируется гранулоцитами,
моноцитами и макрофагами. Основной источник лизоцима в кале — интести¬
нальные гранулоциты. Он может определяться в воспалительном инфильтрате в
острый период болезни Крона. Также он активно секретируется мононуклеарами
в просвет кишки.Показания:• диагностика и мониторинг болезни Крона;• бактериальные, вирусные, аллергические и аутоиммунные воспалительные
.заболевания кишечника.КАЛЬПРОТЕКТИНКальпротектин высвобождается из нейтрофилов и макрофагов во время их
активации или гибели и вовлекается в активный воспалительный процесс. Во
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 363время воспаления стенки кишечника гранулоциты мигрируют сквозь нее, поэто-
му кальпротектин также можно обнаружить в кале. Фекальный кальпротек- Щ
тин является маркером интестинального воспаления и позволяет неинвазивно
дифференцировать синдром раздраженного кишечника (СРК) и воспалитель-
ные заболевания кишечника (ВЗК), дает возможность мониторировать течение
болезни/терапию болезни Крона и язвенного колита, является потенциальным
скрининговым маркером колоректальной неоплазии. Клинические аспекты СРК:
очень распространенное заболевание (в урбанистических областях страдают
6-20% общей популяции), точный диагноз ставится на исключении других диа¬
гнозов, пациента необходимо подвергнуть более или менее агрессивным иссле¬
дованиям. Определение фекального кальпротектина дает возможность получить
первые результаты без радиологического и/или эндоскопического исследования,
поскольку его уровень коррелирует с гистологической и эндоскопической оцен¬
кой активности болезни Крона и язвенного колита так же, как и с определением
экскреции меченных изотопом индия нейтрофилов, которое считают«золотым стандартом» в оценке активности ВЗК. Но изотопный метод очень
дорог, требует госпитализации пациента, к тому же из-за экспозиции радиоактив¬
ного вещества непригоден для детей и беременных. Уровень ФК повышается при
рецидиве.Преимущества:• метод имеет высокую диагностическую ценность: низкая концентрация в
кале означает отсутствие органического заболевания кишечника (специфич¬
ность для СРК — 100%). Чувствительность для болезни Крона — до 100%,
специфичность — 97%. Для СРК чувствительность — 85% и специфич¬
ность — 71% (римские критерии СРК положительны);• высокая стабильность фекального кальпротектина в кале в течение несколь¬
ких дней;• неинвазивность (метод снижает количество болезненных исследований),
быстрота.Показания:• дифференциальная диагностика болезни Крона и синдрома раздраженного
кишечника;• оценка стадии/степени ВЗК;• параметр мониторинга болезни Крона, язвенного колита, пациентов после
удаления полипов кишечника;• маркер бактериальной диареи.а^-АНТИТРИПСИНа^-Антитрипсин действует как первичный ингибитор эластазы полиморфно¬
ядерных нейтрофильных гранулоцитов (PMN-эластазы) и секретируется во время
воспаления, снижая протеолитическую активность PMN-эластазы в месте вос¬
паления. Кроме того, через образование комплекса ингибирует группу сериновых
протеаз, участвующих в образовании сгустка, трипсина, химотрипсина и т.п. Таким
образом, а^-антитрипсин играет важную регуляторную роль в антивоспалитель-
ном ответе. а^-Антитрипсин — линейный гликопротеин с молекулярной массой
52 кДа (394 аминокислотных остатка), со свободным цистеиновым остатком и
тремя боковыми углеводными цепями. Синтезируется преимущественно в печени,
а также макрофагами, моноцитами и эпителиальными клетками слизистой обо¬
лочки кишечника, -Антитрипсин является основным ингибитором сериновых
протеаз в плазме человека. Также доказано, что фекальный -антитрипсин —
важный маркер интестинальной потери белка и повышенной проницаемости
кишечника, так как он устойчив к деградации в кишечнике за счет своей акти-
протеолитической активности. Кроме того, измерение концентрации фекального
ЩШ-364ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВа^-антитрипсина исполъззтот для оценки и мониторинга хронических воспа¬
лительных заболеваний кишечника. В клинической практике оценка клиренса-антитрипсина (соотношение уровней а^-антитрипсина в кале и крови) предпо¬
чтительнее по сравнению с единственным определением в кале: ложнонегативные
и ложноположительные результаты снижаются на 21%. Метод более чувствителен
по сравнению с рутинными методами и способствует определению концентрации
белка в супернатантах клеточных культур, а также успешному распознаванию как
печеночной, так и кишечной формы a_j-антитрипсина. Данный метод — перспек¬
тивная альтернатива методу радиальной иммунодиффузии, особенно при большой
потере белка. Комбинация двух типов специфических антител снижает количество
ложнонегативных результатов, гарантируя надежную диагностику. Таким обра¬
зом, это новый, простой в использовании и неинвазивный тест для определения
интестинальной потери белка.Показания:• синдром потери белка через кишечник и нарушение интестинальной прони¬
цаемости;• болезнь Крона;• некротический энтероколит;• воспаление вирусного, бактериального или аллергического происхождения.
ІЗ-ДЕФЕНЗИН-2р-Дефензины являются частью врожденного иммунитета и антимикробного
иммунного барьера слизистой кишечника. Дефензины обладают антимикробной
активностью в разной степени против бактерий, грибков и некоторых обол очеч¬
ных вирусов, у позвоночных различают а- и р-дефензины по различиям в структу¬
ре белков. У человека известны 9 видов дефензинов эпителиального происхожде¬
ния, 3 из них являются Р'Дефензинами {HBD-1, HBD-2 и HBD-3). Экспрессия
р-дефензинов индуцируется провоспалительными цитокинами и микроорганиз¬
мами (например, Е. СОІІ, Н. pylori или Р. aeruginosa).Дефицит р-дефензина-2 может наблюдаться в слизистой кишечника у паци¬
ентов с болезнью Крона, Система дефензинов у таких больных неполноценна и
не ограничивает инвазивный бактериальный рост, приводящий к типичным для
болезни Крона инфекциям.Роль недостаточности р-дефензина-2 в патогенезе болезни Крона в настоящее
время изучается. Также возможно, что некоторые пробиотические бактерии про¬
дуцируют р-дефензин.Показание — дифференциальная диагностика болезни Крона (снижение уровня
р-дефензина*2) и язвенного колита (повышение уровня р-дефензина).ОПРЕДЕЛЕНИЕ АНТИГЕНА//. РПОШHelicobacter pylori считается причиной хронического гастрита В, нелекарствен¬
ного язвенного дуоденита и этиологическим стимулом MALT-лимфомы желудка.
Кроме того, предполагают его участие в патогенезе карциномы желудка. В запад¬
ных индустриально развитых странах эпидемиология геликобактерной инфекции
характеризуется линейным ростом с возрастом, а в развивающихся странах вовле¬
чено также большое количество детей и подростков.Существующие методы инфекции Helicobacter pylori чувствительны и высоко¬
специфичны, но требуют либо инвазивных образцов, либо специального обо¬
рудования. Данный метод разработан для неинвазивной диагностики инфекции
Я. pylori в образцах кала и обеспечивает надежные результаты без потери чувстви¬
тельности и специфичности. Тест имеет эквивалентные с уреазным дыхательным
тестом чувствительность и специфичность.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 365Показания:• диагностика инфекции Helicobacter pylori;• контроль эффективности антигеликобактерной терапии.КОМПЛЕКС «ГЕМОГЛОБИН-ГАПТОГЛОБИН» (НЬ-Нр) В КАЛЕСвободный НЬ немедленно комплексируется с сывороточным белком гапто-
глобином (Нр). Комплекс НЬ-Нр более стабилен в кишечнике по сравнению с НЬ.
С помощью комбинации двух методов можно определить даже кровотечение из
аденоматозных узлов/карциномы верхнего отдела гастроинтестинального тракта.
Сочетание двух методов высокочувствительно для раннего обнаружения коло¬
ректальной карциномы, В отличие от других тестов определения крови в кале,
этот метод не требует диетических или лекарственных ограничений, способствует
определению FHb с чувствительностью, превосходящей экспресс-тесты в 100 раз,
что позволяет исключить ложноотрицательные результаты. Подобранные анти¬
тела обеспечивают высокую специфичность. На результаты не влияют гемоглобин
животных, миоглобин, пероксидазы животных и растений или антиоксиданты,
подобные витамину С. Метод доступен в иммуноферментном и экспресс-формате.
Показания:• анализ на скрытую кровь в кале;• болезнь Крона, язвенный колит;• подозрение на карциному толстого кищечника;• полипы прямой кишки.МИЕЛОПЕРОКСИДАЗАГранулы нейтрофилов содержат большое количество разных ферментов.
Миелопероксидаза катализирует окисление с образованием токсичных для микро¬
организмов перекисных продуктов. Эффективность разрушающего бактерии
действия усиливается под действием эластазы полиморфно ядерных лейкоцитов.
Определение миелопероксидазы в кале отражает активность болезни Крона и
язвенного колита.Показания:• маркер воспаления ЖКТ;• окислительный стресс.ЭЛАСТАЗА ПОЛИМОРФНОНУКЛЕАРНЫХ ЛЕЙКОЦИТОВ (ЗЛАСТАЗА ПМН)Эластаза азурофильных гранул нейтрофилов. гликопротеин из группы сери-
новых протеаз. Маркер воспалительных заболеваний, может вызвать серьезные
поражения ткани в месте секреции. Особенно это важно для болезни Крона,
характеризующейся ростом фагоцитарной активности и повышенной секрецией
эластазы ПМН и других лизосомальных ферментов.Показания:• маркер активации болезни Крона;• бактериальная инфекция;• дифференциальная диагностика болезни Крона и синдрома раздраженного
кишечника.Копрологические синдромыНОРМАЛЬНЫЙ КАЛпри микроскопическом исследовании нативного препарата на фоне большого
количества мелкозернистой массы калового детрита, состоящей из живых и мерт¬
вых бактерий и недифференцируемых остатков съеденной пищи, в редких полях
зрения встречаются единичные мышечные волокна с сарколеммами, лишенными
366 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВисчерченности, скудное количество солей жирных кислот (мыл) и остатки рас¬
тительной пищи в виде непереваренной клетчатки. Непереваренная растительная
клетчатка в кале отличается огромным разнообразием и может напоминать раз¬
личные элементы кала. Обнаружение капель растительного жира, содержащегося
внутри клеток грубой непереваренной клетчатки (семечек, орехов), может быть
неверно истолковано как признак нарушения липолиза при недостаточности под¬
желудочной железы. При микроскопическом исследовании кала можно обнару-
> ^ ' жить совершенно необычные элементы — артефакты.НЕДОСТАТОЧНОСТЬ ПИЩЕВАРЕНИЯ В ЖЕЛУДКЕАхилия (ахлоргидрия) — при микроскопическом исследовании обнаружи¬
вают большое количество мышечных волокон с резко обрубленными краями,
покрытых сарколеммой (с продольной или поперечной исчерченностьго) и рас¬
положенных преимущественно пластами (креаторея). В препаратах присутствуют
соединительная ткань, пласты и клетки непереваренной клетчатки, кристаллы
оксалата кальция.Гиперхлоргидрию диагностируют при обнаружении большого количества
покрытых сарколеммой (с продольной исчерченностью), разрозненно лежащих
мышечных волокон (креаторея) и соединительной ткани.Быструю эвакуацию пищи из желудка или гипохлоргидрию диагностиру¬
ют при малом и большом увеличении микроскопа по большому количеству раз¬
розненно лежащих мышечных волокон с поперечной или продольной исчерченно¬
стью и без нее, а также по умеренному количеству переваримой клетчатки в редких
полях зрения и единичным кристаллам оксалата кальция. При малом увлечении
микроскопа в препарате с раствором Люголя* можно обнаружить незначительное
количество вне- и/или внутриклеточного крахмала на разных стадиях перевари¬
вания.НЕДОСТАТОЧНОСТЬ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫПри поражении поджелудочной железы (остром панкреатите, некрозе, муко-
висцидозе) каловые массы, если они оформленные, покрыты блестящим жирным
налетом. В жидких фекалиях жир виден на поверхности. Это нерасщепленный
нейтральный жир (триглицериды), наличие его в кале служит показателем
нарушения панкреатического пищеварения. Большое количество нейтрального
жира (стеаторея), обнаруженное при микроскопическом исследовании каловой
эмульсии, свидетельствует об отсутствии липазы. Сочетание в препарате капель
нейтрального жира и жирных кислот (расщепленный жир) — признак неполного
отключения поджелудочной железы (острый панкреатит, муковисцидоз) или вос¬
становления ее функции при остром панкреатите. Нейтральный жир, обнаружен¬
ный при микроскопическом исследовании в кале больного с желтухой, считается
признаком рака поджелудочной железы.НАРУШЕНИЕ ЖЕЛЧЕОТДЕЛЕНИЯ (АХОЛИЯ)Ахолия характерна для печеночной и подпеченочной желтухи. Кал бесцвет¬
ный. При быстрой эвакуации химуса по кишечнику каловые массы больного с ахо¬
лией имеют кашицеобразную или жидкую консистенцию. При микроскопическом
исследовании выявляют большое количество жирных кислот (стеаторею) в виде
капель или игл. Кристаллы (иглы) жирных кислот — легкоплавкие соединения.
При подогревании нативного препарата на пламени спиртовки иглы превращают¬
ся в капли.При запорах, типичных для ахолии, жирные кислоты, которые не всосались в
тонкой кишке из-за отсутствия желчных кислот, в огромном количестве поступа¬
ют в толстую кишку, где реагируют с ионами К\ Са’, Mg^, Na^, Рнеорг.* образуя
соли жирных кислот — мыла. Стеаторею, представленн5^ю солями жирных кислот
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 307(мылами), обнаруживают при микроскопии нативного препарата при большом
увеличении. Это иглы и/или глыбки, содержащиеся в огромном количестве в
каловом детрите. Соли жирных кислот — тугоплавкие соединения. Они превраща¬
ются в капли жирных кислот при проведении термической реакции с 30% уксус¬
ной кислотой*. Глыбки и/или иглы в таком препарате, доведенном до кипения на
пламени спиртовки, вступают в реакцию с уксусной кислотой. В результате обра¬
зуются капли жирных кислот и соли уксусной кислоты. Эта термическая реакция,
заканчивающаяся образованием капель, доказывает наличие в кале солей жирных
кислот.Стеаторея при ахолии, представленная жирными кислотами или их солями,
возникает из-за отсутствия желчных кислот. Желчные кислоты в норме реагируют
с жирными кислотами, образуя мицеллы — водорастворимые комплексы, которые
легко всасываются в тонкой кишке.НАРУШЕНИЕ ВСАСЫВАНИЯ В ТОНКОЙ КИШКЕ - СИНДРОМ МАЛЬАБСОРБЦИИМногие заболевания и их осложнения могут вызывать нарушение всасывания
в тонкой кишке — мальабсорбцию (табл. 6-14). Нарушение всасывания в тонкой
кишке любой этиологии характеризуется стеатореей, выраженной в большей
или меньшей степени. Кал, как правило, бледноокрашен, неоформленный, каши¬
цеобразный или жидкий. При микроскопии обнаруживают большое количество
капель нейтрального жира или жирных кислот, а также аморфных глыбок и игл.Таблица 6-14. Патологические состояния, сопровождаемые мальабсорбциейВид нарушения
функцииМеханизм расстрой¬
ства функцииФорма патологииНарушение пище¬
варенияПри недостаточном
перемешивании химусаГастроэнтеростомияГастроэю-омияЖелудочно-ободочный свищПри недостаточности
факторов пищеваренияОстрый и хронический панкреатитХроническая дисфункция печениНепроходимость желчных путейДисахаридазная недостаточностьМукоеисцидозПри аномальных средахСиндром Золлингера-Эллисона (низкий pH в двенадцати¬
перстной кишке)Усиленный бактериальный рост (деконъюгация желчных
солей)Дивертикулы кишечникаАмилоидоз кишечникаНарушение всасы¬
ванияПри остром воспалении
эпителияОстрые кишечные инфекцииОстрые отравления (щелочами, кислотами, спиртами и др.)При хроническом вос¬
палении слизистой
оболочки кишечникаЦелиакия (глютеновая энтеропатия)Ишемическая энтеропатияБолезнь Крона (гранулематоз кишечника)Болезнь Уиппла (кишечная липодистрофия)а- и р-липопротеинемия (акантоцитоз)Экссудативная энтеропатияПри укорочении кишеч¬
никаРезекция кишечника (заворот, инфаркт кишки и др.)Нарушение транс¬
порта-Блокированные лимфатические сосуды при лимфомеЛимфангиэктазия
368 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВПАТОЛОГИЧЕСКИЕ ПРОЦЕССЫ В ТОЛСТОЙ КИШКЕБродильные процессы. Причиной усиленного бродильного процесса в толстой
кишке бывает обычно передозировка углеводов в рационе. Микроскопическое
исследование позволяет обнаружить в нативном препарате большое количество
переваримой клетчатки, внутри- и внеклеточного крахмала. В препарате с рас-
твором Люголя* выявляется внутри- и внеклеточный крахмал на разных стади-
ях переваривания, а также большое, иногда огромное количество нормальной
Ш йодофильной микрофлоры — клостридий. Реакция кала сдвигается в кислую
сторону (pH = 6,0-6,5). Каловые массы теряют форму, становятся кашицеобраз¬
ными, пенистыми — бродильный дисбиоз. Брожение сопровождается образованием
органических кислот и углекислого газа, которые в течение длительного времени
раздражают слизистую оболочку толстой кишки, вызывая ее гиперемию, а затем
мацерацию и экссудацию, что приводит к развитию бродильного колита. В кале
появляется слизь с лейкоцитами и эпителием толстой кишки. Нормальная йодо-
фильная микрофлора (клостридии) вытесняется патологической — мелкими и
крупными кокками, мелкой и крупной палочковой микрофлорой. Бродильный
дисбиоз переходит в бродильный дисбактериоз, на фоне которого развивается бро¬
дильный колит.Гнилостные процессы развиваются при поступлении в толстую кишку боль¬
шого количества непереваренного или недостаточно переваренного мяса или вос¬
палительного экссудата. Кристаллы трипельфосфата указывают на резко щелоч¬
ную реакцию (pH 8,0-9,0), обусловленную усиленными процессами гниения в
толстой кишке. Это сопровождается образованием аммиака, меркаптана, индола,
скатола и других веществ. При этом цилиндрическая форма каловых масс под¬
тверждает усиленную пролиферацию нормальной гнилостной микрофлоры тол¬
стой кишки и развитие гнилостного дисбиоза.Нарушение формы каловых масс (жидкий, водянистый кал), резко щелочная
реакция, непереваренные или частично переваренные мышечные волокна, появ¬
ление экссудата и слизи с клеточными элементами воспаления указывают на
развитие гнилостного колита и гнилостного дисбактериоза. Водянистый характер
кала служит прямым признаком нарушения всасывания воды в толстой кишке, что
происходит в результате глубокого поражения эпителия.Передозировка антибиотиков приводит к развитию колита с тяжелым дис¬
бактериозом и кандидамикозом слизистой оболочки. При микроскопии калового
детрита можно обнаружить нити псевдомицелия и споры гриба Candida albicans.
Часто обнаруживают нити мицелия и споры других грибов, слизь с лейкоцитами и
клетками цилиндрического эпителия.ЯЗВЕННЫЙ КОЛИТВ свежевыделенных теплых слизисто-гнойно-кровянистых массах среди слизи,
содержащей нейтрофилы, эритроциты и цилиндрический эпителий, можно обна¬
ружить вегетативные формы патогенных простейших Entamoeba histolytica или
Balantidium coli. Иногда в кале много эозинофилов и/или кристаллов Шарко-
Лейдена. Это характерно для аллергического неспецифического колита или аллер¬
гической реакции на простейшие. При тяжелых формах язвенного колита в кале
обнаруживают даже обрывки слизистой оболочки кишки.КРОВОТЕЧЕНИЕ ИЗ СТЕНКИ КИШКИКровотечение из верхнего отдела толстой, из тощей и тонкой кишки можно под¬
твердить при обнаружении кристаллов гематоидина. Это возможно при микро¬
скопии нативных и окрашенных азур-эозином препаратов из патологического
кишечного отделяемого. Гематоидин образуется при распаде гемоглобина без
доступа кислорода. Это золотистого цвета иглы и вытянутые в длину ромбики.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 369Гематоидин не содержит атомов железа, и реакция кала на скрытое кровотечение
отрицательная, но наличие кристаллов подтверждает поражение слизистой, диа-
педез эритроцитов через несостоятельную слизистую оболочку тонкой кишки при
энтеритах, особенно у грудных детей.ЗАМЕДЛЕННАЯ ЭВАКУАЦИЯ ИЗ ТОЛСТОЙ КИШКИ (ЗАПОР, СПАСТИЧЕСКИЙ КОЛИТ)Запор и спастический колит характеризуются при микроскопии большим
количеством детрита и неперевариваемой клетчатки. Наличие на поверхности
оформленного кала слизи, содержащей дистрофически измененные клеточные
элементы (лейкоциты и цилиндрический эпителий), указывает на воспали¬
тельный процесс слизистой оболочки толстой и/или прямой кишки. Слизь на
поверхности фрагментированного кала может быть гомогенной, не содержаш;ей
клеточных элементов.Особенности пищеварения и копрограммы у детей грудного
возраста в норме и при патологииПищеварительный тракт плода начинает функционировать на 16-20-й неделе
внутриутробного развития. В этот период хорошо выражен глотательный рефлекс,
слюнные железы вырабатывают амилазу, желудок — пепсиноген. Развивающийся
плод заглатывает амниотическую жидкость, близкую по химическому составу к
интерстициальной (тканевой и спинномозговой), содержащую белок и глюкозу.pH желудочного содержимого новорожденного составляет 6,0, снижается до 2,0
в первые 6-12 ч жизни, к концу первой недели повышается до 4,0, затем постепен¬
но снижается до 3,0. Пепсин не играет существенной роли в переваривании белка
у новорожденного. Ферментативная обработка белка грудного молока происходит
в двенадцатиперстной и тонкой кишке.Кишечник грудного ребенка в 8 раз превышает длину тела, В результате после¬
довательного подключения ферментов поджелудочной железы (трипсина, химо-
трипсина) и протеолитических ферментов тонкой кишки происходит почти пол¬
ная утилизация молочного белка. Ребенок при грудном вскармливании усваивает
до 98% аминокислот.Липолиз при грудном вскармливании в первую неделю жизни осуществля¬
ется в полости желудка преимущественно за счет липазы материнского молока.
Молочная липаза максимально эффективна при pH, равной 6,0-7,0. Дальнейший
липолиз происходит в двенадцатиперстной кишке под действием липазы подже¬
лудочной железы. Уже в первые недели и месяцы жизни ребенка в тонкой кишке
всасывается 90-95% расщепленного жира.Гидролиз углеводов в полости рта и желз^дка новорожденного незначительный
и в основном сосредоточен в тонкой кишке, где на поверхности микроворсинок
щеточной каемки энтероцитов расщепляются лактоза, сахароза и мальтоза.ПЕРВОРОДНЫЙ КАЛ (МЕКОНИЙ)Вьщеление мекония наступает через 8-10 ч после рождения и продолжается
в течение 2-3 сут в общем количестве 70-100 г. Консистенция мекония клейкая,
вязкая, густая, цвет темно-зеленый, запаха нет, pH равен 5,0-6,0, реакция на били¬
рубин положительная.Первая порция мекония играет роль пробки, состоит из слизи, на фоне которой
видны пласты ороговевшего плоского эпителия, единичные клетки цилиндриче¬
ского эпителия прямой кишки, капли нейтрального жира, представляющие перво¬
родную смазку, кристаллы холестерина и билирубина.Бактериальная микрофлора появляется в фекалиях новорожденного только
при последующих дефекациях.
370 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВW КАЛ ЗДОРОВОГО РЕБЕНКА ПРИ ГРУДНОМ ВСКАРМЛИВАНИИg Количество кала в первый месяц жизни — 15 г, а затем постепенно увеличивает-ся до 40-50 г за 1-3 дефекации в сутки. Это гомогенная, неоформленная, полувяз-
° кая или полужидкая масса, золотисто-желтого, желтого или желто-зеленого цветасо слегка кисловатым запахом, pH равен 4,8-5,8.Кислая среда фекалий объясняется жизнедеятельностью обильной сахароли-
тической микрофлоры, выраженными ферментативными процессами и большим
содержанием лактозы.Реакция на билирубин остается положительной до пятимесячного возраста,
затем параллельно с билирубином начинает определяться стеркобилин, появ¬
ляющийся в результате восстанавливающего действия нормальной бактериальной
микрофлоры толстой кишки. К 6-8 мес в кале определяется только стеркобилин.При микроскопическом исследовании кала обнаруживают единичные капли
нейтрального жира и скудное количество солей жирных кислот. Слизь в незначи¬
тельном количестве присутствует в кале грудного ребенка, перемешана с детритом.
В поле зрения в норме содержится не более 8-10 лейкоцитов.КАЛ РЕБЕНКА ПРИ ИСКУССТВЕННОМ ВСКАРМЛИВАНИИКоличество кала составляет 30-40 г в сутки. Цвет светло- или бледно-желтый,
при стоянии на воздухе становится серым или бесцветным, но может принимать
коричневые или желтовато-коричневые оттенки в зависимости от характера пищи,
pH равен 6,8-7,5 (нейтральная или слабощелочная реакция). Запах неприятный,
слегка гнилостный за счет гниения казеина коровьего молока.При микроскопическом исследовании выявляют несколько увеличенное коли¬
чество солей жирных кислот, в скудном количестве слизи, смешанной с фекалия¬
ми, встречаются единичные лейкоциты.ОСТРОЕ ВОСПАЛЕНИЕ В ПИЩЕВАРИТЕЛЬНОМ ТРАКТЕ У ДЕТЕЙОстрый энтерит (энтероколит) у ребенка грудного возраста сопровождается сдви¬
гом pH в щелочную или резко щелочную сторону и положительной реакцией на
воспалительный белок, лейкоциты, при поражении слизистой оболочки тонкой и
толстой кишки возможна положительная реакция на кровь, в результате диапедеза
эритроциты появляются в кале. Кал становится жидким или полужидким с большим
количеством слизи. Комки слизи в жидких фекалиях указывают на возникновение
фолликулярного энтероколита. При микроскопическом исследовании в детрите обна¬
руживают тяжи слизи, содержащие нейтрофилы, эозинофилы, моноциты, макрофаги,
плазматические клетки, цилиндрический эпителий, а иногда жирные кислоты как
признак нарушения всасывания в тонкой кишке. Появление капель нейтрального
жира свидетельствует о недостаточном воздействии липазы на содержимое кишечни¬
ка, что может быть связано с отеком слизистой оболочки двенадцатиперстной кишки
или с ускоренной эвакуацией пищи из кишечника (из двенадцатиперстной, тонкой
и толстой кишки). Если явления острого энтерита (энтероколита) ликвидированы и
характер каловых масс фудного ребенка нормализовался, а при микроскопическом
исследовании выявляется большое количество солей жирных кислот (мьш), это сви¬
детельствует о продолжающемся нарушении кишечного всасывания (хроническом
энтерите). Из организма ребенка выводятся соли кальция, фосфора, натрия, калия,
магния и другие вещества, что может привести к рахиту.НАРУШЕНИЕ КИШЕЧНОГО ВСАСЫВАНИЯ, ВЫЗВАННОЕ ВРОЖДЕННОЙ
НЕСОСТОЯТЕЛЬНОСТЬЮ ЭНТЕРОЦИТОВ
Глютеновая антеропатия (целиакия)Глютеновая энтеропатия развивается при врожденной недостаточности
L-глутамилпептидазы, характеризуется нарушением расщепления глютена. В про-
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 371цессе расщепления глютена образуется глутамин, который вызывает аллергиче¬
скую реакцию и тормозит регенерацию эпителия тонкой кишки,Целиакия проявляется у детей с момента прикорма мучнистыми веществами,
содержащими глютен (пшеничной и ржаной мукой, рисом, овсом). Жидкие кало¬
вые массы стеаторейного характера выделяются до 5-10 раз в сутки, имеют цвет
мастики с отвратительным затхлым запахом> Реакция кала слабокислая или ней¬
тральная (pH = 6,5-7,0). При микроскопии жирные кислоты или их соли (мыла)
свидетельствуют о нарушении всасывания в тонкой клшке. Присутствие на фоне
слизи эозинофилов и/или кристаллов Шарко-Лейдена подтверждает аллергиче¬
скую реакцию на слизистой кишечника.Синдром дисахаридазной недостаточностиСиндром обусловлен отсутствием в тонкой кишке новорожденного лактазы,
реже сахаразы. При недостатке одного или нескольких ферментов гидролиза
дисахаридов развивается дисахаридазная недостаточность. Дисахариды блокиру¬
ют места всасывания моносахаридов, поэтому всасывание последних нарушается.
У детей при лактазной недостаточности развивается гипотрофия. Непереваренная
лактоза поступает в толстую кишку, где расщепляется бактериями до органи¬
ческих кислот, в результате чего образуется огромное количество молочной и
уксусной кислот, что раздражает слизистую оболочку толстой кишки, вызывая
ее гиперемию, мацерацию и экссудацию. Повышение уровня лактозы и органи¬
ческих кислот нарушает осмолярность в просвете кишки. Нарастают секреция
жидкости, объем химуса, моторика кишечника, развивается диарея. Диагностика
дисахаридазной недостаточности основана на клинических проявлениях, а также
на определении активности ферментов дисахарид аз в биоптатах слизистой обо¬
лочки тонкой кишки, на определении лактозы, сахарозы в кале и на снижении
pH кала. Лактазная недостаточность (непереносимость лактозы грудного молока)
определяется в первые дни жизни новорожденного, у грудного ребенка 8-10 раз в
сутки выделяется водянистый или жидкий кал желтого цвета с резко кислым запа¬
хом, pH равен 5,0-6,0, реакция на билирубин, а также на воспалительный белок
и лейкоциты положительная. Обнаруженньїе при микроскопии жирные кислоты
подтверждают резко выраженный синдром нарушения всасывания.А-|3-липопротеинемия (акантоцитоз)Наследственная неспособность синтезировать р-липоггротеины выявляется в
раннем детском возрасте. В периферической крови больных обнаруживают акан-
тоциты, а в сыворотке крови отсутствуют р-липопротеины. Кал жидкий, светло-
желтого или золотисто-желтого цвета, с резко кислой или кислой реакцией (pH =5,0-6,0), с билирубином, положительной реакцией на воспалительный белок и
лейкоциты. При макроскопическом исследовании выявляют в жидких каловых
массах капли жира, который образует на поверхности жидких фекалий хорошо
различимый налет. При микроскопии обнаруживают капли жира, подтверждаю¬
щие нарушение всасывания в тонкой кишке, характерное для этой патологии,Муковисцндоз, или кистозный фиброз (кишечная форма)МукоБисцидоз — наследсгвенное заболевание, характеризуемое нарушением
секреторной функции поджелудочной железы, желез желудка и кишечника.Дети грудного возраста с этим заболеванием страдают полифекалией: частым,
обильным, кашицеобразным стулом с резким зловонным запахом, желтоватого
цвета, блестящим, жирным, с нейтральной или слабокислой реакцией (pH = 6,5-
7,0). На пеленках остаются жирные пятна, которые практически не отстирывают-
ся. У детей 6-7-месячного возраста возможна склонность к запорам: кал плотный,
оформленный или крупными комками, иногда «овечий», но всегда бледноокра-
шенный, жирный, со зловонным запахом прогорклого масла. Жир смешан скалом
372 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВи выделяется в конце дефекации, покрывая кал с поверхности. В этот период воз¬
можно осложнение заболевания в виде кишечной непроходимости.При микроскопическом исследовании в нативном препарате обнаруживают
капли жира, которые остаются бесцветными в препарате с 0,5% водным раствором
метиленовой сини*. Это характерно для нейтрального жира и указывает на кистоз-
|Щ| мое перерождение поджелудочной железы, которое приводит к отсутствию липазы
в 80-88% случаев заболевания. При неполном поражении поджелудочной железы
в препарате кала с метиленовой синью* можно видеть неокрашенные капли ней¬
трального жира в сочетании с синими каплями жирных кислот.Кистозное перерождение пищеварительных желез желудка и тонкой кишки
проявляется в период перехода с грудного на смешанное кормление. При микро¬
скопии обнаруживают большое количество непереваренной белковой пищи,
представленной соединительной тканью, микроскопическими кусочками непере¬
варенного мяса и мышечными волокнами с поперечной или продольной исчер-
ченностью. Можно также обнаружить переваренную растительную клетчатку,
вне- и внутриклеточный крахмал и единичные капли нейтрального жира. Все это
свидетельствует о нарушении гидролиза, протеолиза и липолиза, обусловленных
кистозным перерождением желез желудка, двенадцатиперстной, тонкой кишки
и поджелудочной железы в сочетании с ускоренной или замедленной эвакуацией
пищи из желудка и кишечника.Экссудативная энтеропатияЗаболевание характеризуется потерей белков плазмы крови через слизистую
оболочку пищеварительной системы и сопровождается нарушением всасывания в
тонкой кишке. У больных развивается гипопротеинемия.При химическом исследовании кала обнаруживают щелочную или резко щелочную
реакцию фекалий (pH = 8,5-9,0), резко положительную реакцию на белок, лейкоци¬
ты, что характерно для поражения слизистой оболочки кишечника (энтероколита).При микроскопическом исследовании обнаруживают большое количество жир¬
ных кислот, что характерно для ускоренной эвакуации пищи из кишечника, напри¬
мер при диарее, или солей жирных кислот (мыл), что характерно для нормальной
или замедленной дефекации.ИССЛЕДОВАНИЕ СПИННОМОЗГОВОЙ ЖИДКОСТИСпинномозговая жидкость (СМЖ) — своеобразная биологическая жидкость,
необходимая для правильного функционирования мозговой ткани и выполняю¬
щая защитную функцию. Образование, циркуляция и абсорбция СМЖ свидетель¬
ствуют о том, что она является питательной и экскреторной жидкостью головного
мозга. СМЖ — среда для обмена веществ между головным мозгом и кровью и
доставки питательных веществ от сосудистых сплетений желудочков мозга к
нервным клеткам. Головной мозг не имеет лимфатической системы, продукты его
метаболизма удаляются двумя путями — через капиллярный кровоток и СМЖ, а
затем через сосудистые сплетения и арахноидальные ворсинки. СМЖ образуется
преимущественно путем ультрафильтрации плазмы крови и секреции некоторых
компонентов в сосудистых сплетениях головного мозга.Правила исследования спинномозговой жидкостиДля получения СМЖ чаще всего применяют люмбальную, реже субокципиталь-
ную пункцию. Вентрикулярную СМЖ получают в ходе операции.• При проведении люмбальной пункции необходимо удалить первые 3-5 капель
СМЖ, что позволяет освободиться от примеси «путевой» крови, попадающей
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 373В первую порцию из поврежденных иглой кровеносных сосудов, расположен¬
ных в области эпидурального пространства.• Затем следует собрать 3 порции (в исключительных случаях — 2) СМЖ в сте¬
рильные пробирки, плотно закрыть, на каждой пробирке указать ее порядко¬
вый номер, ФИО больного, время пункции, клинический диагноз и перечень
необходимых исследований.• Собранную в пробирки СМЖ доставляют в клинико-диагностическую лабо¬
раторию немедленно.С помощью люмбальной пункции у взрослого человека можно без осложнений
получить 8-10 мл СМЖ, у детей, включая детей младшего возраста, — 5-7 мл, у
грудных детей - 2-3 мл.СМЖ должнь[ исследовать врачи клинической лабораторной диагностики, а
результаты интерпретировать совместно с лечащими врачами, сопоставляя полу¬
ченные данные с состоянием больного и результатами других инструментальных
исследований.На надежность информации, полученной при исследовании СМЖ, влияют
внутренние и внешние факторы. Внутренние факторы — пол, возраст, способ
питания, физическая активность и другие индивидуальные различия пациентов.
Внешние факторы — использование различных химикатов, аппаратуры, посуды,
условия получения и хранения СМЖ, солнечный свет. Особенно важно влияние
лекарственных препаратов. Необходимо знать, как и в какой дозе назначалось
лекарственное средство, в какой форме и каком количестве оно проникает в СМЖ,
каков его уровень. Лекарственные препараты влияют на показатели СМЖ in vivo, а
также могут изменять результаты определения некоторых параметров in vitro.При изучении СМЖ необходим систематический качественный контроль с
использованием контрольных и калибровочных материалов, так как повторное взя¬
тие образца не всегда желательно и может быть связано с определенными техниче¬
скими трудностями. Внутрилабораторный контроль должен охватывать все иссле-
дЗ^емые параметры и сочетаться с межлабораторным внешним контролем качества.ПРАВИЛА ПРОВЕДЕНИЯ ИССЛЕДОВАНИЯ СПИННОМОЗГОВОЙ ЖИДКОСТИ
С ПОМОЩЬЮ ДИАГНОСТИЧЕСКИХ ПОЛОСОККаплю аккуратно размешанной СМЖ наносят на соответствующую реактивную
зону с помощью пипетки. СМЖ сразу пропитывает пористую подушечку, окраска
которой изменяется в зависимости от концентрации определяемого вещества.
Результат исследования вносят в бланк. Для исследования СМЖ можно использо¬
вать диагностические зоны полифункциональных полосок, позволяющих опреде¬
лять относительную плотность, кровь (гемоглобин), лейкоциты (нейтрофилы),
билирубин, глюкозу, кетоны и нитриты.Физико-химические свойства спинномозговой жидкостишОТНОСИТЕЛЬНАЯ ПЛОТНОСТЬОтносительная плотность (удельный вес) люмбальной СМЖ составляет 1,005-
1,009, субокципитальной — 1,003-1,007, вентрикулярной — 1,002-1,004 г/мл.Повышение относительной плотности СМЖ наблюдается при менингитах, уре¬
мии, сахарном диабете, понижение — при гидроцефалии.ПРОЗРАЧНОСТЬНормальная СМЖ бесцветна, прозрачна, как дистиллированная вода, состоит
на 98,9-99,0% из воды и 1,0-1,1% сухого остатка.Помутнение СМЖ зависит от существенного увеличения количества клеточных
элементов (эритроцитов, лейкоцитов, тканевых клеточных элементов), бакте-
374 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВрий, грибов и повышения содержания белка. Помутнение, вызванное клетками иШ грибами, уменьшается или исчезает после центрифугирования. Помутнение, обу¬
словленное бактериями, после центрифугирования не исчезает. При повышении
- содержания фибриногена в СМЖ также отмечается изменение прозрачности в
/ виде легкой опалесценции.Легкое помутнение СМЖ наблюдается при количестве эритроцитов более
" /'• 400х10ул, лейкоцитов — более 200х10ул, а общего белка — более 3 г/л. Степень
пом>тнения СМЖ определяют, сравнивая в проходящем дневном свете на черном
фоне доставленную в пробирке пробу СМЖ с тем же количеством дистиллиро¬
ванной воды в такой же пробирке. Существуют следующие степени прозрачности
СМЖ: полностью прозрачная, опалесцирующая, слегка мутноватая, мутная или
резко мутная.ФИБРИНОВАЯ (ФИБРИНОЗНАЯ) ПЛЕНКАВ норме СМЖ практически не содержит фибриноген. Появление фибриноге¬
на в СМЖ обусловлено заболеваниями ЦНС. Образование фибринозной пленки
вызвано in vitro переходом фибриногена в фибрин. Фибринозная пленка имеет
вид нежной, почти невидимой сеточки или пленки на стенках пробирки, мешочка,
содержащего клеточные элементы, или желеобразного сгустка на дне пробирки.Если в лабораторию доставлена только одна пробирка СМЖ, а в направлении
указано, что необходим общий анализ СМЖ и определение фибринозной пленки,
следует выяснить у лечащего врача, что имеет для него большее диагностическое
значение. Процесс образования фибринозной пленки начинается сразу после
получения СМЖ, его нельзя нарушать, встряхивая или переливая часть достав¬
ленной СМЖ в другую пробирку. Фибринозная пленка может образоваться сразу
после получения СМЖ или через некоторое время (в течение 30 мин, 1 ч, 10-15 ч
и более).При обнаружении в пробирке с СМЖ фибринозной пленки в виде мешочка
важно помнить, что в нем клеточные элементы сохраняются при комнатной
температуре в течение 10-15 ч после получения СМЖ. Из фибринового мешочка
пастеровской пипеткой можно извлечь каплю СМЖ с клетками, нанести на пред¬
метное стекло, накрыть покровным стеклом и изучить клетки.Фибринозную пленку (мешочек) исследуют на туберкулез: извлекают, выливая
всю СМЖ из пробирки на предметное стекло, расправляют на предметном стекле
с помощью пинцета или бактериологической иглы или петли, высушивают на воз¬
духе, фиксируют в пламени спиртовки и окрашивают по Цилю-Нильсену. Если
при извлечении пленка сморщилась и превратилась в комочек или на дне пробир¬
ке образовался желеобразный сгусток фибрина, их растирают на обезжиренном
предметном стекле в капле 0,9% раствора натрия хлорида с помощью слегка подо¬
греваемой на пламени спиртовки бактериологической петли или раздавливанием
комочков между двумя предметными стеклами. Размер препарата на предметном
стекле не должен превышать 1x2 см.Если фибринозная пленка не образовалась в течение рабочего дня, пробирку с
СМЖ, не встряхивая, оставляют при комнатной температуре или в холодильнике
до следующего дня. Образовавшуюся фибринозную пленку и препараты из свер¬
нувшейся пленки окрашивают по Цилю-Нильсену и микроскопируют для выявле¬
ния микобактерий туберкулеза.Образование фибринозной пленки наблюдается также при гнойных и серозных
менингитах, опухолях ЦНС, мозговом кровоизлиянии, компрессии головного
мозга. Если СМЖ содержит эритроциты, фибринозная пленка обычно не обра¬
зуется, за исключением тех случаев, когда их количество превышает IxlO^V^-
При высоком содержании общего белка, фибриногена и выраженном плеоцитозе
(большом количестве клеточных элементов) в пробирке с СМЖ в течение 24 ч при
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 375комнатной температуре или в холодильнике образуется осадок, из которого также
готовят препарат и исследуют на туберкулез после окраски по Цилю-Нильсену.При синдроме Нонне-Фройна (полной блокаде ликворного пространства
при опухолях спинного мозга, абсцессах, туберкулах, арахноидитах и костных
компрессиях) фибринозная пленка образуется сразу же при извлечении СМЖ и
свидетельствует о полной блокаде ликворного пространства. Содержание в СМЖ
общего белка при данном синдроме составляет более 15 г/л.ЦВЕТНормальная СМЖ бесцветна. Появление окраски обычно свидетельствует о
патологическом процессе в ЦНС. Для обнаружения слабой окраски сравнивают
доставленную СМЖ с дистиллированной водой, налитой в такую же пробирку.
Сероватый или серовато-розоватый цвет СМЖ может наблюдаться при неудачной
пункции («путевая» кровь) или субарахноидальном кровоизлиянии.ЗРИТРОЦИТАРХИЯ (ЭРИТРОАРХИЯ)Присутствие крови в СМЖ (кровавая, или кровянистая, СМЖ) можно
обнаружить макро- и микроскопичесюї. Различают «путевую» (артефактную) и
истинную эритроцитархию. «Путевая» эритроцитархия вызывается попаданием
крови в СМЖ при ранении во время пункции кровеносных сосудов, располо¬
женных в области эпидурального пространства или конского хвоста. Истинная
эритроцитархия возникает при кровоизлияниях в ликворные пространства, раз¬
рыве кровеносных сосудов, геморрагическом инсульте, опухолях головного мозга,
черепно-мозговых травмах. При сборе СМЖ в три пробирки о присутствии «путе¬
вой» крови свидетельствует наличие крови только в первой пробирке.при субарахноидальном кровоизлиянии все три пробирки СМЖ будут окра¬
шены кровью с одинаковой интенсивностью, а при подсчете в камере большее
количество эритроцитов может оказаться во второй пробирке. При субарахнои¬
дальном кровоизлиянии примесь крови в СМЖ — ведущий симптом. Количество
крови, попавшее в ликворные пространства, может колебаться от 0,01 до 90 мл.
При содержании эритроцитов менее 0,1-0,15х10ул СМЖ остается бесцветной.
Положительная реакция диагностической зоны политеста на кровь и обнару¬
жение эритроцитов при микроскопическом исследовании нативного препарата
СМЖ позволяет диагностировать скрытую эритроцитархию. При содержании
0,6-1,0х10ул эритроцитов СМЖ приобретает серовато-розоватую окраску, при2-50х10ул — розовато-красную, при 51-150х10ул — цвет свежего мяса, при
содержании более 150х10^ул эритроцитов — кровавый цвет.Существующие критерии, позволяющие в 95% случаев отличить истинную эри¬
троцитархию от «путевой», представлены в табл. 6-15.Таблица 6-15. Критерии отличия истинной эритроцитархии от «путевой»Эритроцитархияистинная«путевая»Все 3 порции ШЖ при сборе в 3 пробирки
одинаково окрашеныПервая порция СМЖ окрашена кровью, остальные посте¬
пенно теряют окраскуКоличество эритроцитов в 3 пробирках одина¬
ковоеКоличество эритроцитов в 3 пробирках различноеПри повторной пункции получают СМЖ, окра¬
шенную кровьюПри повторной пункции получают бесцветную СМЖЭритроциты в СМЖ, окрашенной кровью, осе¬
дают медленно (в течение 2 ч)Эритроциты в СМЖ, окрашенной кровью, оседают очень
бьютро (в течение 15-20 мин)В кровянистой СМЖ содержатся фибриноген
и фибринВ кровянистой СМЖ фибриноген и фибрин отсутствуют
376 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВОкончание табл. 6-15 Эритроцитархия истинная«путевая»Кровь в кровянистой СМЖ не свертываетсяПри попадании в СМЖ более 1 мл крови она свертывает¬
ся в течение 30-40 минПосле центрифугирования кровянистой СМЖ
’ надосадочная СМЖ розовая, оранжевая или
желтаяПосле центрифугирования надосадочная СМЖ бесцвет¬
наяПри прямой спектрофотомвтрии кровавой
СМЖ обнаруживают метгемоглобин и оксиге-
моглобинПри прямой спектрофотометрии кровавой СМЖ метге¬
моглобин и оксигвмоглобин не выявляютсяЛикворная формула соответствует патологии
ЦНС;• при субарахноидальном кровоизлиянии —
нейтрофильный плеоцитоз и активация моно-
нуклеолярной фагоцитарной системы (моно¬
циты, эритро- и гемосидеринофаги);• при нейролейкемии — бластыЛикворная формула при подсчете с реактивом Самсона
и при окраске азур-эозином соответствует лейкоцитар¬
ной формуле периферической кровив препарате, окрашенном азур-эозином, эри¬
троциты представлены компактной массой с
размазанными контурамиВ препарате, окрашенном азур-эозином, эритроциты
расположены раздельно с хорошо видимым просветле¬
нием в центре клетокРеакции центрифугата кровавой СМЖ с поло¬
сками ФАН на кровь (гемоглобин) и билирубин
положительныеРеакция центрифугата кровавой СМЖ с полосками ФАН
на кровь (гемоглобин) положительная, а на билиру¬
бин — отрицательнаяЭритроцитархия свидетельствует о внутричерепном кровотечении в результате
разрыва аневризмы сосуда головного мозга, геморрагическом инсульте, кровоиз¬
лиянии в ткань головного мозга, геморрагическом энцефалите, черепно-мозговой
травме. Субарахноидальное кровоизлияние может произойти без повреждения
кровеносных сосудов в результате паралича вазомоторных нервов и сопровожда¬
ется расширением сосудов, стазом крови в капиллярах и диапедезом эритроци¬
тов.В динамике независимо от этиологии и степени кровоизлияния на 2-е сутки из
СМЖ удаляется 25-50%, а на 3-4-е сутки — 52-97% эритроцитов по отношению
к количеству, обнаруженному в 1-е сутки заболевания. Оставшаяся кровь удаля¬
ется из ликворных пространств в различные сроки. При массивном кровоизлия¬
нии на 2-е сутки удаляется больше эритроцитов, чем при менее обильном кро¬
вотечении. Эритроциты исчезают из СМЖ при легкой черепно-мозговой травме
и исключении кровотечения на 5-10-е сутки, при геморрагическом инсульте и
тяжелой черепно-мозговой травме — на 10-20-е сутки. При разрыве аневризмы
сосуда головного мозга эритроциты исчезают из СМЖ на 40-80-е сутки, что свя¬
зано с длительным выпотеванием эритроцитов через стенку измененных сосудов
головного мозга.Существует два механизма удаления эритроцитов из ликворных пространств;• миграция эритроцитов в неизмененном виде из субарахноидального про¬
странства в субдуральное через межклеточные щели паутинной оболочки, а
затем непосредственно в кровеносные сосуды твердой мозговой оболочки;• фагоцитоз эритроцитов клетками арахноэндотелия, выстилающего менинге-
альные оболочки.Эритроциты, захваченные клетками арахноэндотелия, разрушаются.
Гемоглобин под влиянием гемоксидазы арахноэндотелиальных клеток превра¬
щается в билирубин. Билирубин поступает в субарахноидальное пространство и
обусловливает окрашивание СМЖ в желтый цвет (ксантохромию, или билиру-
бинархию).
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 377БИЛИРУБИНАРХИЯ (КСАНТОХРОМИЯ)Розовая, оранжевая, желтоватая, желтая, кофейно-желтая или бурая окраска
обусловлена продуктами ра слада крови — гемоглобином и билирубином — и носит
название «ксантохромия» (от греч. ksantos — «желтый»). Различают геморраги¬
ческую и застойную ксантохромию, которую можно разделить в зависимости от
продуктов распада крови на гемоглобинархию (розовая окраска) и билирубинар-
хию (желтая окраска).Геморрагическая билирубинархия (ксантохромия) вызвана попаданием в
ликворные пространства крови, распад которой приводит к окрашиванию СМЖ
последовательно в розовый, оранжевый, желтоватый, желтый и насыщенно¬
желтый цвет. СМЖ может иметь кофейно-желтый, бурый и коричневый цвет. Эти
варианты окраски СМЖ обусловлены продуктами распада гемоглобина эритроци¬
тов — оксигемоглобина, метгемоглобина, билирубина и метальбумина.Оксигемоглобин, высвободившийся из лизированных эритроцитов, имеет
красную окраску, его присутствие обусловливает розовую окраску СМЖ, при этом
реакция на кровь резко положительная, а на билирубин — отрицательная.Появление билирубина, образовавшегося из оксигемоглобина под действием
гемоксидазы, находящейся в клетках сосудистого сплетения, коры и паутинной
оболочки головного мозга, проявляется оранжевой окраской СМЖ. Активность
этого фермента при патологии в ЦНС увеличивается до 4 раз. Переход гемогло¬
бина в билирубин продолжается до 12 ч, поэтому билирубин появляется вслед за
оксигемоглобином. Билирубин в сочетании с гемоглобином определяется в СМЖ
через 2 ч с момента кровоизлияния у 70%, через 6 ч — у 90% и через 12 ч — у 100%
больных, при этом через 12 ч в СМЖ преобладает билирубин, а реакция на гемо¬
глобин слабоположительная. Оранжевая окраска СМЖ исчезает через 4-8 сут.Метгемоглобин и метальбумин имеют коричневую окраску и обусловливают
темно-коричневую или желто-коричневую окраску СМЖ. Такой цвет СМЖ часто
наблюдается при инкапсулированных гематомах и геморрагиях.Желтая окраска СМЖ (ксантохромия) появляется через 2-4 сут, что подтверж¬
дается положительной реакцией СМЖ на билирубин, а исчезает (отрицательная
реакция на билирубин) через 12-40 сут. В среднем продолжительность ксанто¬
хромии составляет 22 сут.Билирубинархия при содержании белка в СМЖ менее 1,5 г/л и при отсутствии
желтухи и гиперкаротинемии — следствие предшествующей черепно-мозговой
травмы, кровоизлияния в головной или спинной мозг, при геморрагическом
инсульте, разрыве аневризмы сосуда головного мозга или черепно-мозговой трав¬
ме с массивным кровоизлиянием билирубинархия (ксантохромия) появляется
в 1-е сутки, при субарахноидальном кровоизлиянии ее интенсивность нарастает
обычно на 2-4-е сутки. Снижение степени билирубинархии п ее исчезновение
находятся в прямой зависимости от причины кровоизлияния. При разрыве
аневризмы билирубинархия сохраняется в течение 1-1,5 мес, а при инсультах и
черепно-мозговых травмах, не сопровождающихся кровотечением, — в течение
10-14 сут.Применение диагностических полосок для определения оксигемоглобина и
билирубина позволяет определять время возникновения кровотечения, его пре¬
кращение и постепенное освобождение СМЖ от продуктов распада крови. С помо¬
щью диагностических полосок «сухая химия» возможно динамическое наблюде¬
ние за течением патологического процесса в ЦНС.Застойная билирубинархия (ксантохромия) — результат замедленного
тока крови в сосудах головного мозга. Нарушение гемодинамики приводит к
увеличению проницаемости стенок сосудов и поступлению окрашенной в жел¬
тый цвет (билирубин) плазмы крови в СМЖ. Эта билирубинархия постоянна и
сопровождается гиперпротеинархией. Застойная билирубинархия встречается при
378 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВваскулизированных опухолях ЦНС, непосредственно сообщающихся с ликворны-
ми пространствами, при блокаде субарахноидального пространства, компрессии,
менингитах (главным образом при туберкулезном) и арахноидитах.Физиологическая билирубинархия (ксантохромия) встречается у ново¬
рожденных и почти у всех недоношенных детей. Это патологическое состояние
объясняется повышенной проницаемостью гематоэнцефалического барьера (ГЭБ)
для билирубина плазмы крови. Билирубин как жирорастворимое соединение
имеет высокую тропность к миелиновым оболочкам, так как в них содержится
большое количество фосфолипидов.Ложная билирубинархия вызывается проникновением в СМЖ липохромов
или лекарственных средств, например бензилпенициллина. При этом СМЖ при¬
обретает желтый цвет, а реакция диагностической зоны полоски на билирубин
отрицательная. Зеленая окраска СМЖ наблюдается при выраженной билируби-
нархии в результате окисления билирубина в биливердин.Зеленый цвет СМЖ придается примесью гноя, в этом случае СМЖ мутная, что
наблюдается при гнойных менингитах, прорыве абсцесса головного мозга в суба-
рахноидальное пространство или полость желудочков мозга,pHpH — один из относительно стабильных биохимических показателей СМЖ.
У здоровых людей pH люмбальной СМЖ составляет 7,28-7,32, цистернальной —
7,32-7,34, что несколько ниже pH плазмы крови. Изменение pH СМЖ отражает¬
ся на альвеолярной вентиляции и мозговом кровообращении и, следовательно,
состоянии сознания. При неповрежденном ГЭБ pH СМЖ остается постоянным
даже при изменении pH плазмы крови.Метаболический ацидоз чаще всего встречается при уремии, диабетическом
кетоацидозе или алкогольной интоксикации, а также при отравлении метиловым
спиртом. Несмотря на возможное снижение pH плазмы крови до 7,05-7,15, pH
СМЖ остается в пределах нормы или снижается очень незначительно. Это объ¬
ясняется существенным уменьшением рСОз в СМЖ по сравнению с плазмой крови
из-за увеличения мозгового кровообращения.Метаболический алкалоз наблюдается при заболеваниях печени, продолжи¬
тельной рвоте, приеме щелочных веществ, при этом pH плазмы крови обычно
нормальное или незначительно повышается, а pH СМЖ может парадоксально
снижаться до 7,27.Респираторный ацидоз, обусловленный легочной недостаточностью, харак¬
теризуется незначительным снижением pH СМЖ по сравнению с pH плазмы
крови.Респираторный алкалоз, вызванный мозговыми травмами, отравлениями
(особенно салицилатами) и заболеваниями печени, характеризуется увеличе¬
нием pH плазмы крови до 7,65, в то время как pH СМЖ остается в пределах
нормы.Первичные ацидозы СМЖ наблюдаются при заболеваниях ЦНС (тяжелых
субарахноидальных и мозговых кровоизлияниях, черепно-мозговых травмах,
инфаркте головного мозга, гнойном менингите, эпилептическом статусе, метаста¬
тическом поражении головного мозга).В группе больных с кровоизлиянием в головной мозг и снижением pH СМЖ
регистрируется более высокая смертность по сравнению с группой пациентов
с нормальным значением pH. Определение pH СМЖ показательно для выбора
лечебной тактики и прогноза заболевания.Определение pH СМЖ с помощью диагностической зоны, входящей в состав
любого политеста, практически невозможно из-за низкой чувствительности тест-
полосок.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 370ПРОТЕИНАРХИЯВ норме в СМЖ npHqiTCTByeT белок (протеинархия). Содержание белка в
люмбальной СМЖ составляет 0,22-0,33, желудочковой — 0,12-0,20, цистерналь-
ной — 0,10-0,22 г/л. При этом концентрация белка 0,33 г/л рассматривается как
величина, граничащая с патологией, а концентрация белка 0,22 г/л — как признак
гидроцефальной люмбальной СМЖ. Нормальные показатели содержания белка в
СМЖ зависят от применяемого лабораторного метода и могут варьировать в более
широких пределах.Гипопротеинархия. Снижение содержания белка в люмбальной СМЖ менее
0,20 г/л — признак гидроцефальной СМЖ. Гипопротеинархия встречается редко,
может возникать в результате уменьшения поступления сывороточного белка в
СМЖ или увеличения скорости ее обмена. Увеличение скорости обмена СМЖ в
результате усиленной реабсорбции наблюдается при повышении внутричерепного
давления. Однако чаще гипопротеинархия отмечается после удаления большого
количества СМЖ при проведении пневмоэнцефалографии и лечении гидроце¬
фалии. Описано снижение уровня общего белка у больных с доброкачественной
внутричерепной гапертензией, гипертиреозом и при некоторых лейкозах.Гиперпротеинархия — увеличение содержания белка в СМЖ — показатель
патологического процесса. Повышение белка в СМЖ при различных патологиче¬
ских процессах (воспалении, травме, опухоли) зависит от нарушения гемодинами¬
ки в сосудах головного мозга, приводящей к увеличению проницаемости их стенок
и поступлению белков плазмы крови в СМЖ. Поступление крови в ликворные
пространства при разрыве сосудов головного мозга или продуктов распада опухо¬
ли головного мозга увеличивает степень гиперпротеинархии. Субарахноидальные
кровоизлияния различной этиологии всегда сопровождаются гиперпротеинархией
как в результате непосредственного поступления крови в ликворные пространства,
так и нарушения проницаемости сосудистой стенки. При ишемических инсультах
гиперпротеинархия наблюдается редко, содержание белка в СМЖ колеблется от
0,33 до 1,0 г/л. При геморрагических инсультах отмечается значительная гипер¬
протеинархия — до 8,4 г/л.Опухоли головного мозга сопровождаются гиперпротеинархией, которая зави¬
сит от структуры опухоли, при глиомах больших полушарий вне зависимости от
их расположения примерно в 70% случаев отмечается повышение содержания
белка в СМЖ. При незрелых формах глиом гиперпротеинархия отмечается в 88%
случаев. Практически все сосудистые опухоли сопровождаются гиперпротеинар¬
хией.У больных с опухолями головного мозга альбумин-глобулиновый коэффициент
СМЖ может оставаться в пределах нормы, однако соотношение фракций глобули¬
нов меняется. При доброкачественных опухолях головного мозга незначительно
увеличиваются а-глобулины. При злокачественных опухолях головного мозга
степень изменения соотношения белковых фракций нарастает соответственно
степени злокачественности опухоли. Наблюдается уменьшение количества а^- и
ttj-глобулинов и увеличение содержания р- и у-глобулинов.Хронические воспалительные процессы различной этиологии (арахноидиты,
арахноэнцефалиты, перивентральные энцефалиты) сопровождаются повышением
содержания белка в СМЖ примерно у 35% больных. При этом чаще концентрация
белка составляет 0,39-0,50, реже - 0,50-1,0 г/л. Увеличение белка до 1,5-2,0 г/л
предполагает обострение воспалительного процесса. При воспалительных про¬
цессах в ЦНС в СМЖ отмечается увеличение содержания а^-, «2" и у-глобулинов,
а доля альбумина снижается.При абсцессе головного мозга в начальной стадии белок в СМЖ увеличивается
незначительно. При вовлечении в процесс мозговых оболочек или стенок боковых
желудочков количество белка в 90% случаев достигает 1,0 г/л.
380 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВПри цистицеркозе головного мозга, который практически всегда сопровождает¬
ся хроническим арахноидитом, примерно у 80% пациентов уровень белка в СМЖ
повышен до 0,5-2,0 г/л независимо от локализации цистицеркозных пузырей.
Только при их локализации в задней черепной ямке и в полости IV желудочка
содержание белка в пределах нормы.У больных с черепно-мозговой травмой альбумин-глобулиновый коэффициент
повышается за счет альбумина. Поскольку осмотическое давление альбумина
выше, чем глобулинов, перераспределение белковых фракций — один из защит¬
ных механизмов, предотвращаюш;их отек головного мозга. В плазме крови боль¬
ных в этот период содержание альбумина снижено.ИНДИВИДУАЛЬНЫЕ БЕЛКИ СПИННОМОЗГОВОЙ ЖИДКОСТИУ здоровых взрослых людей примерно 83% белков СМЖ поступает из плазмы
крови, а 17% белков имеет интратекальное происхождение. Количество белка в
СМЖ существенно меньше, и распределение его фракций и отдельных белков зна¬
чительно отличается от тех же показателей плазмы крови вследствие наличия ГЭБ.
В табл. 6-16 представлено содержание и состав белков СМЖ.Таблица 6-16. Белковый состав СМЖ взрослого человека (по: Clinical Diagnosis and Management
by Laboratory Methods. 20th ed. / Ed. J.B. Henry)БепокСодержание белков в СМЖСодержание белков
в плазме іфовиСоотношение плазма/
СМЖОбщий белок0,15-0,45 г/л68 г/лПрвальбумин6-22 мг/л (2-11%)238 мг/л14Альбумин70-350 мг/л (40-70%)59-69%236а,-Глобулины7-40 мг/л (4-10%)6-7%аг-Глобуяины9-42 мг/л (5-12%)7-12%Р,-Глобулины13-54 мг/л (7-13%)3-^%у-Глобулины6-26 мг/л (3-7%)4-8%Трансферрин9,61±2,57 мг/л2040 мг/л130-160Церулоплазмин1.15±0,53 мг/л366 мг/л305-375|дб30,62±12,6 мг/л9870 мг/л802IgA1,03+2,41 мг/л1750 мг/л1346а^-Макроглобулин2,4610,73 мг/л2200 мг/л1111Фибриноген0,6 мг/л2964 мг/л4940|дм0,6 мг/л700 мг/л1167(5-Липо протеин0,6 мг/л3728 мг/л6213Если при диагностическом исследовании установлено, что фракция сывороточ¬
ных белков в СМЖ составляет менее 1%, можно с уверенностью утверждать, что
ГЭБ не нарушен.Основную массу общего белка СМЖ составляет альбумин. Возраст почти не
влияет на его содержание. Как правило, существует прямая зависимость между
количеством общего белка и альбумина, что свидетельствует о большей лабиль¬
ности альбумина по сравнению с глобулинами. Альбумин СМЖ происходит
исключительно из альбумина плазмы крови. Альбумин — важнейший показатель,
который позволяет доказать нарушение функции ГЭБ и рассматривается как
неспецифический признак патологии. Его нормальная концентрация увеличи¬
вается от вентрикулярного к люмбальному пространству, что объясняется про¬
ницаемостью границ спинального субарахноидального ликворного пространства.
Концентрация альбумина от желудочковой СМЖ к люмбальной увеличивается
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 381ПОЧТИ в 2 раза. В нормальной СМЖ содержание альбумина варьирует от 0,07 до
0,36 г/л и выше. Почти всякое нарушение ГЭБ ведет к увеличению абсолютной
концентрации альбумина в СМЖ и повышению соотношения концентрации аль¬
бумина СМЖ и альбумина плазмы (табл. 6-17).Таблица 6-17. Степень дисфункции гематоэнцефалического барьера при патологии головного
мозгаСостояние функ¬
ции/степень
дисфункцииСооткошение альбумин
СМЖ/альбумин плазмы кровиВозможная причинаНормаМенее 7x10"^Примерно половина ткани головного мозга, осо¬
бенно кора, не контактируют с СМЖ. поэтому
патология этих областей не будет отражаться на
составе СМЖСлабаяДо 10ХІСНРассеянный склероз.Хронический ВИЧ-ассоциированный энцефалит.
Алкогольная полинейропатия.
Амиотрофический латеральный склерозУмереннаяДо 20x10-2Вирусный менингит.Оппортунистический менингознцефалит.
Диабетическая полинейропатия.Инфаркт головного мозга.Кортикальная атрофияТяжелаяБолее 20x10^Туберкулезный менингит.
Полиневрит Жиллиана-Барра.
МенингополиневритСоотношение альбумин/глобулин в СМЖ регулирует осмотическое давление
в ЦНС. Нормальное содержание общего белка в СМЖ еще не свидетельствует об
отсутствии патологии ЦНС, на ее органическое поражение указывает изменение
соотношений белковых фракций, которое определяется с помощью электрофо¬
реза. Белки СМЖ, синтезируемые тканями головного мозга и мозговых оболочек
(интратекально), представлены в табл. 6-18.Таблица 6-18. Белки СМЖ, синтезируемые интратекально тканями головного мозга и мозговых
оболочек (по; Clinical Laboratory Diagnostics / Ed. L. Thomas, 1998)БелокМолекулярная
масса, кДаСодержание
в СМЖСодержание
в ллазмЕ
кровиСоотношениеСМЖ/плазмакровиИнтратекальный
синтез, %Транстиретин (преаль-
бумин)5517 мг/л250 мг/л0,06893Простагландин-D-синтетаза2710 мг/л0,3 мг/л33>99Цистатин С136 мг/л1,0 мг/л>5>99Аполротеин Е346 мг/л93,5 мг/л0,06390Р,-Микроглобулин121 мг/л5,8 мг/л0,5999Нейронспецифическаяенолаза785 мкг/л5,8 мкг/л0,8733>99Ферритин4736 мкг/л120 мкг/л0,0597SIOO-белок212 мкг/л>0,3 мкг/л--Основной миелиновый
белок190,5 мкг/л>0,5 мкг/л--ил-62610,5 нг/л12 нг/л0,8899ФНО-а175,5 нг/л20 нг/л0,2894Нейрональная ацетилхо-
линэстераза29013ЕД/ЛЗЕД/л4.3>99
382 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВБЕЛКИ СОСУДИСТЫХ ОБОЛОЧЕК ГОЛОВНОГО МОЗГАТранстеритин (преальбумин), простагландин-В-синтетаза и цистатин С син¬
тезируются в сосудистых оболочках и оттуда поступают в лимфу. Относительное
содержание преальбумина в СМЖ в 10 раз превышает концентрацию его в плазме
крови: плазма крови — 0,5%, СМЖ — 5,0% общего белка.Поскольку преальбумин синтезируется эндотелием сосудистого сплетения
головного мозга, его низкая концентрация в люмбальной СМЖ свидетельствует о
спинальной обструкции.Простагландин-В-синтетаза — белок, синтезируемый эндотелием оболочек
сосудов мозга. Предлагают определять этот белок в плазме крови и использовать
его как маркер возникновения фистулы ликворных пространств.БЕЛКИ ПАРЕНХИМЫ ГОЛОВНОГО МОЗГАОпределение белков паренхимы головного мозга имеет небольшое диагности¬
ческое значение. Даже при разрушении клеток головного мозга концентрация
нейроспецифической енолазы, ЗІОО-белка, основного миелинового белка, кислого
глиафибриллярного белка, нейрональной ацетилхолинэстеразы составляет менее
1 мг/л.Содержание в СМЖ нейроспецифической енолазы (НСЕ, NSE) при инсульте
повышается до 10 мкг/л и более, максимальная концентрация наблюдается на3-5-е сутки. При болезни Клайнфельтера количество нейроспецифической енолазы
повышается до 30 мкг/л и более, ’что является важным диагностическим критерием
данной патологии, которую трудно отличить от других заболеваний коры головного
мозга, особенно на ранних стадиях. При болезни Альцгеймера содержание нейро¬
специфической енолазы в СМЖ, как правило, остается в пределах нормы.При опухолях головного мозга маркерные белки опухолей, в частности раково¬
эмбриональный антиген, редко достигают концентрации более 100 мкг/л.БЕЛКИ МИКРОГЛИИ И МАКРОФАГАЛЬНОЙ СИСТЕМЫДля определения активности белков микроглии и макрофагальной системы
используют определение в СМЖ Рз'микроглобулина и неоптерина. 132-Микро¬
глобулин отражает активность Т-клеток, а неоптерин — макрофагов. В норме
менее 1% р2'Микроглобулина СМЖ поступает из плазмы крови, неоптерин СМЖ
также только на 2,5% имеет плазменное происхождение и на 97,5% — интра-
текальное. Концентрация р2‘Микроглобулина в СМЖ составляет менее 2 мг/л,
неоптерина — менее 5 мкмоль/л.При хронических воспалительных процессах в ЦНС концентрация р2-микро-
глобулина и неоптерина отражает степень активации микроглии и интрапарен-
химальных макрофагов. Данная реакция особенно выражена при ВИЧ-индуци-
рованной энцефалопатии. Повышение в СМЖ концентрации р2"Микроглобулина
более 2 мг/л и неоптерина более 5 мкмоль/л указывает на вовлечение в воспали¬
тельный процесс белков микроглии и макрофагальной системы. Концентрация
неоптерина от 5 до 20 мкмоль/л свидетельствует о прогрессировании заболевания,
а его концентрация более 20 мкмоль/л — об агрессивном течении патологического
процесса.ГЛИКОАРХЙЯВ СМЖ содержание глюкозы примерно на 40% меньше, чем в плазме крови.
В субокципитальной и вентрикулярной СМЖ концентрация глюкозы на 12-15%
выше, чем в люмбальной СМЖ. Содержание глюкозы в СМЖ новорожденных и
недоношенных детей несколько выше, чем у взрослых.Определение концентрации глюкозы в СМЖ желательно проводить одновре¬
менно с определением ее уровня в плазме крови через 4-6 ч после приема пиш;и.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 383При нормальном уровне глюкозы в плазме крови в люмбальной СМЖ концентра¬
ция глюкозы составляет примерно 60% ее плазменного уровня. При гиперглике¬
мии разница между СМЖ и кровью значительно возрастает: концентрация глюко¬
зы в люмбальной СМЖ составляет только 30-35% ее плазменного уровня.Уровень глюкозы в СМЖ — результат ее активного транспорта через ГЭБ,
утилизации клетками пазтинной оболочки, эпендимы, глии, нейронами и выхода
в венозную систему, уровень глюкозы в СМЖ — один из важных индикаторов
функции ГЭБ, который широко используется для его оценки. Глюкоза — основной
субстрат энергетического обмена для нейронов.Гипогликоархия — уменьшение уровня глюкозы в СМЖ ниже 2,2 ммоль/л
или снижение соотношения глюкоза плазмы крови/глюкоза СМЖ менее 0,3.
Гипогликоархия наблюдается при бактериальном туберкулезном или грибковом
менингите. Причины гипогликоархии при данных заболеваниях — усиленный
гликолиз, нарушение транспорта через ГЭБ, повышенное использование глюкозы
клетками, особенно лейкоцитами.Менингиты, вызванные грибами, у 40-50% пациентов протекают с гипоглико-
архией. Сходные изменения наблюдаются при амебных менингитах. При сифи¬
литических менингитах снижения глюкозы в СМЖ не наблюдается. При цисти-
церкозе и трихинеллезе у 50% больных отмечается гипогликоархия. Вирусные
менингиты также сопровождаются гиногликоархией, однако снижение уровня
глюкозы невыраженное и часто не достигает критических значений.При первичных и метастатических опухолях мозговых оболочек отмечается
выраженная гипогликоархия, достигающая практически полного исчезновения
глюкозы из СМЖ (глиомы, саркомы, лимфомы, нейролейкемии, меланомы, мета¬
статические карциномы из легких, желудка). Основная причина гипогликоархии в
данном случае — интенсивная утилизация глюкозы клетками опухолей при нару¬
шенной проницаемости ГЭБ.При субарахноидальных кровоизлияниях в 1-е сутки отмечается незначитель¬
ная гипогликоархия.Гипергликоархия встречается относительно редко. При обнаружении высоко¬
го уровня глюкозы в СМЖ следует искать первичную или вторичную гиперглике¬
мию, хотя гипергликоархия нехарактерна для сахарного диабета.Пшергликоархия выражена во время сна, что объясняется замедленным кро¬
вообращением и уменьшением общего метаболизма мозговой ткани.Комбинированное легкое или умеренное повышение глюкозы в плазме крови и
СМЖ наблюдается при травме головного мозга и некоторых видах менингоэнце-
фалита.Гипергликоархия также отмечается у больных с ишемическими нарушениями
мозгового кровообращения: самое высокое увеличение концентрации глюкозы
наблюдается при геморрагическом инсульте, менее выраженное - при ишеми¬
ческом инсульте и незначительное — при преходящих нарушениях мозгового
кровообращения.При арахноидитах, гиперкинетическом прогрессирующем панэнцефалите,
грыже межпозвонкового диска, кровоизлияниях в головной мозг, полиневрите и
других заболеваниях ЦНС содержание глюкозы в СМЖ, как правило, остается в
пределах нормы (табл. 6-19).КЕТОНАРХИЯКетонархия развивается после операции на мозговых оболочках, при черепно¬
мозговых травмах, субарахноидальных кровоизлияниях, энцефалографии, силь¬
ном раздражении и возбуждении ЦНС. Кетонархия после операции объясняется
распадом белка вследствие операционной травмы, а также нарушением утилиза¬
ции кетоновых тел, которые в норме являются субстратом для клеток ЦНС.
384 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВТаблица 6-19. Содержание глюкозы в спинномозговой жидкости при заболеванияхцнсЗаболеваниеГлюкоза,ммоль/лЗаболеваниеГлюкоза,ммоль/лКонтроль3,33±0,42Ишемический инсульт4,47±1,12Серозные менингиты2,94±0,44Геморрагический инсульт4,66+1,62Гнойные менингиты1,38±0,58Интрацеребральная гематома3,33±0,42Туберкулезные менингиты2,51+0,36Мозговое кровоиалияние с проры¬
вом в ликворное пространство3,71±1,20Рассеянный склероз3,43+0,39Субарахноидальнее кровоизлияние3,11±0,66Гиперкинетический прогрессирую¬
щий панэнцефалит3,23±0,42грыжи межпозвонковых дисков3,38±0,41АрахноидитыЗ.Ш0,48Спинная сухотка3,18±0,42Доброкачественные новообразо¬
вания3,08+0,46Прогрессивный паралич3,36±0,34Злокачественные новообразования1,91 ±0,66Цереброспинальный сифилис3,58±0,61Преходящие нарушения мозгового
кровообращения4,05±0,81Эпилепсия3,16±0,47НИТРИТЫДанный тест в целях обнаружения продуктов жизнедеятельности бактерий —
нитритов — можно использовать для исследования СМЖ. Б норме СМЖ сте¬
рильная, поэтому положительная реакция Г^исса, заложенная в диагностических
полосках, позволяет своевременно, с последующим микробиологическим исследо¬
ванием установить этиологию менингита.При гнойных менингитах высеваются N. meningitidis, St. pneumoniae^ 5. aureus,
стрептококки групп А, Б, D, Н, £. сой, клебсиеллы, протей, псевдомонады. Эти
микроорганизмы способны восстанавливать нитраты в нитриты, т.е. при достаточ¬
ном количестве бактерий в СМЖ реакция Грисса положительна. Однако результа¬
ты данного теста отрицательны при асептических менингитах, туберкулезном и
стафилококковом менингите, так как микобактерии туберкулеза и стафилококки
не восстанавливают нитраты в нитриты.Для выявления менингококка, возбудителя эпидемического менингита, СМЖ,
собранную в стерильную пробирку, немедленно отправляют в бактериологиче¬
скую лабораторию для посева. При охлаждении СМЖ менингококк быстро поги¬
бает. Для бактериоскопического исследования прозрачную СМЖ центрифугируют
и из осадка готовят мазок. Мутную СМЖ не центрифугируют. Мазки окрашивают
по Граму. Обнаружение других возбудителей гнойного менингита возможно при
бактериоскопическом исследовании препаратов СМЖ, окрашенных по Граму.
Достоверную идентификацию микроорганизмов проводят с помощью посева на
соответствующие питательные среды и последующего бактериологического иссле¬
дования.Мазки для окраски по Цилю-Нильсену готовят из осадка СМЖ после центри¬
фугирования и из фибринозной пленки.Микроскопическое исследование спинномозговой жидкостиЦитологическое исследование СМЖ проводят в целях определения цитоза —
общего количества клеточных элементов в 1 мкл или в 1 л СМЖ — с последующей
дифференциацией клеточных элементов (ликворная формула), а в некоторых слу¬
чаях — подсчетом количества эритроцитов.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 385ОПРЕДЕЛЕНИЕ ЦИТОЗАДля получения точного результата необходимо подсчитать общее количество
клеток в СМЖ не позднее чем через 30 мин после ее получения. Установлено, что
разрушение эритроцитов, лейкоцитов и тканевых клеточных элементов происхо¬
дит из-за низкого содержания белка в СМЖ, который оказывает стабилизирующее
действие на клеточные мембраны. Во избежание примеси «путевой»^ крови для
цитологического исследования рекомендуют брать вторую или третью пробирку
полученной СМЖ,Для подсчета количества клеток в СМЖ применяют камеру Фукса-Розенталя
объемом 3 мкл. Согласно рекомендациям ликворологической лаборатории НИИ
нейрохирургии им. Бурденко, при подсчете количества клеток в камере Фукса-
Розенталя необходимо придерживаться следующего алгоритма;• клеток очень много, сетка не видна — дается описательный ответ — клеточ¬
ные элементы густо покрывают камеру и количественному подсчету не под¬
лежат;• клеток много, сетка видна — клетки подсчитывают в одном малом квадрате
камеры, а полученный результат умножают на 256;• клеток немного, сетка видна — клетки считают в одном ряду малых квадратов
(16 малых квадратов) и полученный результат умножают на 16;• клеток мало — клетки считают в 2 рядах малых квадратов (32 малых квадра¬
та), а результат умножают на 8;• клеток очень мало — клетки подсчитывают во всех 256 малых квадратах.При подсчете клеточной формулы СМЖ не все камеры Фукса-Розенталяможно исследовать при большом увеличении микроскопа из-за их толщины.
Рекомендуют каплю хорошо размешанной СМЖ, окрашенной реактивом Самсона,
нанести на обычное предметное стекло, накрыть покровным стеклом и диффе¬
ренцировать клетки СМЖ при большом увеличении микроскопа. Если некоторые
клетки окажутся неидентифицированными, на покровное стекло можно нанести
каплю иммерсионного масла и исследовать клетки на иммерсии.Если в СМЖ клеток мало (нормоцитоз или слабовыраженный плеоцитоз), ее
нужно подвергнуть центрифугированию в течение 10 мин со скоростью 1500 об./мин,
слить или отсосать надосадочную жидкость и аккуратно размешать осадок.
Приготовить 2-3 мазка для окраски азур-эозином, а в осадок внести 1 каплю реак¬
тива Самсона и аккуратно смешать. Через 10 мин каплю окрашенного реактивом
Самсона осадка СМЖ нанести на предметное стекло и накрыть большим покров¬
ным стеклом. При этом количество клеток увеличивается и становится возможной
их дифференцировка при большом увеличении (в 400 раз) и на иммерсии (увели¬
чение в 900 или 1000 раз). Обычно дифференцируют 100 или 200 клеток и выдают
ответ в виде ликворной формулы. Тканевые клетки можно ввести в формулу или
указать их количество на 100 лейкоцитов. Для получения однослойных препара¬
тов СМЖ рекомендуют использовать цитоцентрифугу. Для окраски мазков СМЖ
необходимы использование установленных соотношений азура и эозина, предва¬
рительная фиксация и соблюдение времени окраски.В нормальной СМЖ взрослого человека практически отсутствуют клеточные
элементы, в вентрикулярной СМЖ регистрируется 0-1 клетка в 1 мкл, в субокци-
питальной — 2-3 клетки в 1 мкл, в люмбальной — 3-5 клеток в 1 мкл. Содержание
клеток в нормальной СМЖ уменьшается от люмбальной к субокципитальной, а в
вентрикулярной СМЖ клетки практически отсутствуют.Общее количество клеток в люмбальной СМЖ (нормоцитоз) в зависимости от
возраста представлено в табл. 6-20.У доношенных и недоношенных новорожденных количество лейкоцитов прак¬
тически одинаково и составляет 0-32х10ул.'сімшШЩк
ЩщШ
в?386 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВТаблица 6-20. Нормоцитоз в зависимости от возраста (Ammon J., Richterich R., 1970)ВозрастКоличество клеток в 1 л люмбальной СМЖОт 0 до 3 мес20-25x10%От 3 мес и одного дня до 1 года14-15x10%От 1 года и 1 мес до 2 лет11-14x10«/лОт 2 лет и 1 мес до 5 лет10-12x10%От 5 лет и 1 мес до 7 лет8-10x10%От 7 лет и 1 мес до 10 лет6-8x10%Старше 10 лет4-6x10«/лВзрослые3-5x10%Увеличение количества клеток в СМЖ (плеоцитоз) рассматривают как признак
органического поражения ЦНС (табл. 6-21, 6-22), хотя некоторые заболевания
ЦНС сопровождаются нормальным количеством клеток (нормоцитозом).
Критерий плеоцитоза — количество клеток в люмбальной СМЖ:• слабый или легкий - 6-70х10Ул (0,006-0,07х10Ул);• умеренный — 70-250х10Ул (0,07-0,25х10ул);• выраженный — 250-1000x1 оул (0,25-1,0х10ул);• резко выраженный — более ІОООхІОул (>1х10ул);• массивный - более ЮхЮул.Таблица 6-21. Плеоцитоз при различных заболеваниях ЦНСЗаболеванияКоличество клеток в 1 л СМЖОстрый бактериальный менингитБолее 3x10%Актиномикоз ЦНСОколо 3x10%Вирусный менингоэнцефалит {вирус Коксаки*, ЕСНО-вирусы", аде¬
новирус)1-3x10%Туберкулезный менингит (острая стадия)0,3-3,0х10®/лГерпетическое поражение ЦНСМенее 1x10%МиелитМенее 0,15x10%Серозный менингит0,1-0,3x107л и болееАбсцесс головного мозга1-2x10%Энцефалиты0,03-0,3x10%Рассеянный склероз3-50x10%Нейросифилис (различные формы)0,05-0,5x10%НейролейкемииОт 0,1-0,3x10% до 2-5x10%Опухоли до операции10-^60x10%Опухоли после операцииВыраженный плеоцитоЗ; быстро
снижаетсяЭпилепсия, гидроцефалия, арахноидиты, спондилез, гиперкинетиче-
ский прогрессирующий панэнцефалит, дистрофические процессыЧаще всего нормоцитозМедиальная грыжа дискаНезначительный плеоцитоз* Вирус Коксаки относится к роду энтеровирусов семейства пикорнавирусов (вирус Коксаки типа А включает 24 серотипа,
типа В — 6 серотипов).** ЕСНО-вирусы относятся к роду энтеровирусов семейства пикорнавирусов, возбудители асептического менингита.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 387Таблица 6-22. Изменение количества клеточных элементов в люмбальной СМЖ при острых нару¬
шениях мозгового кровообращенияЗаболеванияКоличество клеточных элементовПреходящие расстройства мозгового
кровообращенияНормоцитозИшемический инсультв первые 24 ч развивается выраженный плеоцитоз, достигая мак¬
симума на 2-7-0 сутки, затем снижается.Количество лейкоцитов варьирует от О до 1,4х10УлГеморрагический инсультВыраженный плеоцитоз, в среднем 30,1-127,3x10%, максимум
наблюдается на 8-21-е сугкиИнтрацеребральная гематомаВ начале отмечается значительный плеоцитоз — 21,4-40,6x10%,
затем количество клеток снижаетсяКровоизлияние в головной мозг с про¬
рывом в ЛИКБОрНОе пространствов первые 24 ч регистрируется выраженный плеоцитоз, в среднем
196,1-281,1x10%, затем количество клеток быстро снижается до
умеренных значенийСубарахноидальное кровоизлияниеВ первые 24 ч плеоцитоз умеренный, на 2-7-е сутки — выра¬
женный (133,2-292,3x10%), через 3-4 нед количество клеток
снижается до нормальных значенийКлеточные элементы спинномозговой жидкостиПРОИСХОЖДЕНИЕ И ДИФФЕРЕНЦИАЦИЯ КЛЕТОК СПИННОМОЗГОВОЙ ЖИДКОСТИСовременные методы цитологического исследования (световая, электронная
И фазово-контрастная микроскопия, цитохимические, иммуноцитологические
исследования, исследования с использованием моноклональных антител) доказы¬
вают, что все клетки СМЖ (кроме арахноэндотелиальных клеток и клеток эпенди¬
мы) имеют гематогенное происхождение.Нормальные и патологические клетки сохраняются в СМЖ от 1-2 ч до несколь¬
ких дней. Находящиеся в СМЖ клетки удаляются интратекальным лизисом (эри¬
троциты и большая часть лейкоцитов), мигрируют обратно в кровь и лимфу или
подвергаются фагоцитозу. Макрофаги утилизируют часть эритроцитов и неболь¬
шую часть лейкоцитов. Лизис клеток непосредственно в СМЖ (интратекальный
лизис) активируется в результате снижения содержания белков и возникающего
при этом различного онкотического давления, которое обусловливает лабиль¬
ность оболочек клеток. Особенно легко происходит лизис базофильных, эозино¬
фильных и нейтрофильных гранулодитов.Клеточный состав СМЖ, полученный с использованием технологии цитоцен¬
трифуги, представлен в табл. 6-23.Таблица 6-23. Лейкограмма СМЖ, полученная по препаратам, приготовленным на цитоцентри¬
фугеТип клетокВзрослые, %Новорожденные, %Лимфоциты62±4320±18Моноциты36±2072±22Нейтрофилы2+53±5ЭозинофилыРедкоРедкоГистиоциты (макрофаги)Редко5+4Эпендимальные клеткиРедкоРедкоЛикворная формула здоровых людей представлена в основном лимфоцитами
(70%) и моноцитами (30%). В СМЖ здоровых доношенных и недоношенных ново¬
рожденных присутствуют еще нейтрофильные гранулоциты, содержание которых
колеблется от 6 до 50%. В нормальной СМЖ содержится 60% Т-лимфоцитов и
шЙ388 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ40% В-лимфоцитов. Нормальный цитоз и нормальная ликворная формула не
исключают наличия патологического процесса в ЦНС.Изменения в ликворной формуле — признаки патологического процесса в ЦНС,
а при воспательных процессах в ЦНС имеют большое клиническое значение.
Изменение соотношения клеточных элементов в СМЖ в процессе воспаления
соответствует правилу Schilling, согласно которому при инфекционных процессах
наблюдаются три фазы клеточной защиты:• нейтрофильная, или защитная, — может быть непродолжительной (несколь¬
ко часов) или продолжительной (несколько дней);• фагоцитарная — с участием мононуклеарных клеток фагоцитарной системы,
продолжительность данной фазы больше защитной;• лимфоцитарная — количество клеточных элементов (плеоцитоз) снижается,
и в СМЖ появляются спокойные, малые лимфоциты; данная фаза самая про¬
должительная, может длиться несколько месяцев.Закономерная смена одной клеточной реакции другой прослеживается при
воспалительных заболеваниях ЦНС, таких как бактериальный и туберкулезный
менингит и вирусные энцефалиты. При воспалении в СМЖ появляются сегмен¬
тоядерные гранулоциты, макрофаги и лимфоциты. Первыми в СМЖ проникают
гранулоциты. Интенсивность воспалительного процесса зависит от количества
лейкоцитов в СМЖ. Большая часть лейкоцитов не достигает СМЖ, оставаясь в
периваскулярном пространстве. Зрелые нейтрофилы проникают в СМЖ чаще, чем
молодые, и выполняют функцию микрофагоцитов (бактериофагов), а иногда и
макрофагов (эритрофагов). Нейтрофилы увеличивают проницаемость ГЭБ, раз¬
рыхляя с помощью лизосомальных ферментов и перекиси водорода эндотелиаль¬
ный монослой сосудистого сплетения. Через некоторое время нейтрофилы посте¬
пенно сменяются мононуклеолярными фагоцитами (макрофагами). Нейтрофилы
проникают в очаг воспаления быстро, а макрофаги — медленно. Фагоцитоз закан¬
чивается разрушением клеточных элементов и бактерий.При воспалении и других заболеваниях ЦНС происходят количественные и
качественные изменения лимфоцитов, характеризующиеся появлением активи¬
рованных лимфоцитов. Они отличаются большими размерами, более рыхлым
строением ядерного хроматина, выраженной базофилией цитоплазмы. Особенно
ярко данные изменения проявляются в СМЖ при вирусных менингоэнцефалитах,
туберкулезном менингите, рассеянном склерозе, нейросифилисе, полиневритах
и некоторых опухолях головного мозга. Изменяется соотношение между Т- и
В-лимфоцитами, Характерно увеличение содержания макрофагов при субарах-
ноидальных кровоизлияниях и других заболеваниях сосудов головного мозга.Наличие эритрофагов и гематоидинофагов в кровянистой, кровавой или бес¬
цветной СМЖ свидетельствует о кровоизлиянии в головной мозг.Считается, что наличие даже одной злокачественной клетки в СМЖ под¬
тверждает диагноз опухоли головного мозга. Присутствие в ликворной формуле
нескольких бластов — признак нейролейкемии.При многих заболеваниях ЦНС отмечается полиморфноклеточная реакция.
Преобладание определенного вида клеток зависит от фазы заболевания. При
туберкулезном менингите в начале заболевания наблюдается нейтрофильный
плеоцитоз, в разгар болезни — нейтрофильно-моноцитарно-лимфоцитарный, в
исходе заболевания — лимфоплазмоцитарный или фагоцитарный.При остром воспалительном процессе отмечается нейтрофильный, при хрони¬
ческом — лимфоидный плеоцитоз.ЛИМФОЦИТЫЛимфоциты входят в состав нормальной СМЖ (2-4 клетки в 1 мкл). При окра¬
ске азур-эозином лимфоциты выглядят так же, как и в мазках периферической
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 389Шкрови. Ядра имеют грубоглыбчатую структуру с просветлениями оксихромати-
на между глыбками базихроматина. Цитоплазма, обычно базофильная, узким
ободком окружает ядро. Диаметр малых лимфоцитов соответствует диаметру
эритроцита (7-8 мкм). В норме в СМЖ присутствуют, как правило, только малые
лимфоциты. Иногда в СМЖ обнаруживают единичные лимфоциты несколько
больших размеров (10-12 мкм), ядра которых окружены более широким ободком
цитоплазмы, светло- или темно-синих тонов, у новорожденных в СМЖ наблюда- Щ|
ется сочетание пролимфоцитов, средних и малых лимфоцитов.При патологических процессах в ЦНС лимфоциты отличаются полиморфиз¬
мом. Их называют активированными, реактивными или трансформированными, а
также лимфоплазмоцитами и иммуноб ласта ми. Лимфоциты диаметром 9-15 мкм
называют средними лимфоцитами, а более 16 мкм — большими. Большие лимфо¬
циты имеют округлое или бобовидное ядро, занимающее большую часть клетки,
достаточно широкий ободок цитоплазмы, бледно- или слабобазофильной окра¬
ски. В цитоплазме некоторых лимфоцитов обнаруживают азурофильные гранулы
с иммуноглобулинами (Т-лимфоциты). В таких клетках ядра имеют более рых¬
лую, тяжистую структуру. Активация лимфоцитов возникает на фоне бактериаль¬
ной, вирусной и паразитарной инфекции, а также при развитии злокачественных
новообразований и кровоизлияний.Резко выраженный лимфоидный плеоцитоз (более 85% всех лейкоцитов)
наблюдается при вирусных менингитах. При хронических воспалительных про¬
цессах мозговых оболочек (туберкулезном менингите, цистицеркозном арах¬
ноидите) количество гранулоцитов, лимфоцитов и моноцитов увеличивается
пропорционально. Нерезко повышается количество лимфоцитов при опухолях.В первые часы после операции на мозговых оболочках возникает нейтрофильный
плеоцитоз, затем он сменяется лимфоидным плеоцитозом.Состояния, сопровождающиеся увеличением количества лимфоцитов (лимфо¬
идным плеоцитозом) в СМЖ, следующие.• Инфекционные заболевания.Вирусные менингиты.❖ туберкулезные менингиты.Микотические менингиты.❖ Амебный энцефаломиелит.Сифилитический менингоэнцефалит.❖ Паразитарные заболевания ЦНС (цистицеркоз, токсоплазмоз).❖ Асептический менингит, вызванный септическим очагом, прилегающим к
оболочкам мозга.• Дегенеративные заболевания.❖ Подострый склерозирующий панэнцефалит.❖ Рассеянный склероз.❖ Энцефалопатии при неадекватном применении лекарственных препара¬
тов.Острый диссеминированный энцефаломиелит.• Другие патологии ЦНС.❖ Саркоидоз.❖ Полиневриты.❖ Периартериит с вовлечением сосудов головного мозга.МОНОЦИТЫМоноциты — вторая основная популяция клеток в нормальной СМЖ, допол¬
няющая нормальный цитоз. В норме их количество составляет 1-3 клетки в 1 мкл,В препаратах, окрашенных аз}^-эозином, моноциты СМЖ ничем не отличаются
от моноцитов периферической крови.
390 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВМоноциты — крупные клетки диаметром 10-15 мкм. Соотношение ядра и
цитоплазмы одинаковое. Ядра имеют вид почки или подковы овальной или
неправильной формы, иногда фрагмент ядра выступает в выемке в форме язычка.
Структура ядер рыхлая, состоящая из тонких нитей хроматина с небольшими и
мелкими уплотнениями, окрашиваемых азур-эозином в красновато-фиолетовый
цвет. Ядро более светлое по сравнению с лимфоцитами и нейтрофилами, иногда в
ядрах определяются остатки ядрышек. Цитоплазма окрашивается в дымчатый или
серовато-синий (редко в бледно-голубой) цвет и может содержать мелкие азуро-
фильные гранулы, расположенные вокруг ядра. Окраска цитоплазмы зависит от
возраста клетки (чем моложе клетка, тем базофильнее цитоплазма). Цитоплазма
может быть мелко вакуолизирована, но включений в вакуолях нет или у нее чет-
кий контур. Моноциты в СМЖ подвергаются дистрофии быстрее лимфоцитов.Крупные моноциты диаметром 16-30 мкм называют активированными моно¬
цитами или незрелыми макрофагами. От макрофагов они отличаются отсутствием
в вакуолях фагоцитированных частичек. Их обнаруживают в СМЖ при воспали¬
тельном процессе, после энцефалографии (как неспецифический показатель) или
интратекального введения лекарственных препаратов.Увеличение количества моноцитов в ликворной формуле наблюдается при хро¬
нических вялотекущих воспалительных процессах в ЦНС: туберкулезном менин¬
гите, цистицеркозе, нейросифилисе, вирусном менингите, рассеянном склерозе,
гиперкинетическом прогрессирующем панэнцефалите, ишемических заболевани¬
ях и опухолях головного мозга. Обнаружение моноцитов в сочетании с плазмати¬
ческими клетками и полным отсутствием макрофагов в СМЖ после оперативного
вмешательства на головном или спинном мозге свидетельствует о вялотекущем
заживлении послеоперационной раны.Моноцитарная реакция, как правило, неспецифична, обнаруживается как часть
смешанной клеточной реакции на воспаление, включающей увеличение количе¬
ства нейтрофилов, лимфоцитов и плазматических клеток.МАКРОФАГИМакрофаги принадлежат к мононуклеарной фагоцитарной системе. Ликворные
макрофаги относятся к группе нефиксированных макрофагов, в норме в СМЖ не
встречаются. Макрофаги — крупные клетки, обычно округлой или правильной
круглой формы, диаметром от 7 до 30 мкм. Ядро округлой формы занимает мень¬
шую часть клетки и сдвинуто к периферии, пикнотичное. Обычно в цитоплазме
макрофагов хорошо видны многочисленные вакуоли — пустые или содержащие
фагоцитированные органические и неорганические элементы либо их частички
(клетки, бактерии, вирусы, кристаллы, капли жира).Наличие 1-2 макрофагов в 1 мкл при нормоцитозе — признак кровотечения или
воспаления в ЦНС. Макрофаги всегда обнаруживают в СМЖ больных с опухолями
головного мозга, прорастающими в просвет желудочков мозга. Большое коли¬
чество макрофагов в послеоперационном периоде свидетельствует об активной
санации СМЖ. Скудное количество или полное отсутствие макрофагов — плохой
прогностический признак.Среди макрофагов выделяют бактериофаги, эритрофаги, лейкофаги, макрофа¬
ги с кристаллами гемосидерина, гематоидина, липофаги. Когда макрофагоциты
теряют способность к фагоцитозу, они могут быть фагоцитированы другими, более
молодыми макрофагами.Макрофаги с кристаллами гематоидина и гемосидерина хорошо различимы в
препаратах СМЖ, Макрофаги/моноциты появляются в геморрагической СМЖ
через 2-3 ч от начала кровотечения, а через 12-18 ч начинают активный фагоци¬
тоз эритроцитов. Кристаллы гемосидерина обнаруживают в макрофагах СМЖ на4-5-й день после субарахноидального кровоизлияния, черепно-мозговой травмы
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 391ИЛИ других причин, вызвавших кровотечение в СМЖ-пространства. Эритроциты
в цитоплазме макрофагов быстро разрушаются, появляются пустые вакуоли, в
которых из гемоглобина образуются кристаллы гемосидерина. Это разного раз¬
мера глыбки пигмента темно-желтого цвета в нативных препаратах и желтовато-
коричневого — в препаратах, окрашенных реактивом Самсона, содержащие в
своей молекуле атомы железа. Одновременное присутствие в СМЖ эритрофагов
и макрофагов с кристаллами гемосидерина указывает на продолжающееся или
повторное кровоизлияние.Кристаллы гематоидина образуются из гемоглобина без доступа кислорода в
гематомах, расположенных в тканях головного мозга или опухолях. Представляют
собой золотистого цвета иглы или вытянутые в длину ромбики. Кристаллы гема¬
тоидина появляются в СМЖ при распаде опухоли или гематомы в просвет желу¬
дочков мозга. Они расположены свободно на фоне клеточных элементов и детрита
или внутри макрофагов. Кристаллы гематоидина не содержат атомов железа. При
добавлении азотной кислоты они плавятся с образованием быстроисчезающего
синего окрашивания.Липофаги — макрофаги с каплями жира, или «зернистые шары», клетки в состо¬
янии жировой дистрофии. В препаратах, окрашенных азур-эозином, представляют
собой клетки с эксцентрично расположенным небольшим круглым гиперхромным
красновато-фиолетовым ядром и вакуолизированной серо-голубой цитоплазмой.
Размер вакуолей может быть различным в зависимости от размера капель жира.
Липофаги обнаруживают в патологической жидкости, полученной из мозговых
кист, в СМЖ при распаде ткани головного мозга и новообразований, прорас¬
тающих в просвет желудочков мозга. Липофаги свидетельствуют также о трав¬
матическом или ишемическом некрозе ткани головного мозга. Липофаги могут
сочетаться с кристаллами холестерина, которые образуются в очагах жировой дис¬
трофии, участках некроза ткани головного мозга и в кистах головного мозга. Это
бесцветные, прозрачные, тонкие, правильной прямоугольной формы пластинки,
накладывающиеся друг на друга и образующие ступени. Кристаллы холестерина
растворимы в эфире и спирте, расплавляются в концентрированной серной кисло¬
те с образованием конденсационных соединений красного цвета.НЕЙТРОФИЛЫНейтрофилы в СМЖ здорового человека практически не встречаются. Это
клетки гематогенного происхождения. Б препаратах, окрашенных азур-эозином,
нейтрофилы окрашиваются так же, как нейтрофилы в периферической крови.
Ядро зрелой хроматиновой структуры с четким делением на окси- и базихроматин
состоит из 2-4 сегментов, хотя иногда встречаются палочкоядерные нейтрофилы.
Ядра окрашиваются в темный красновато-фиолетовый цвет, цитоплазма окси-
фильная, хорошо различима пылевидная красновато-фиолетовая зернистость.
Нейтрофильная зернистость всегда окрашивается в цвет ядра. Вследствие низкого
содержания белка в СМЖ нейтрофилы быстро подвергаются разрушению (карио-
лизис, цитолиз, наличие голых ядер, жировая дистрофия, гиперсегментация).
Клетки вытягиваются, цитоплазма расслаивается, образует бесцветные выпячива¬
ния, напоминающие псевдоподии амеб, фрагменты ядер сливаются в одну гипер-
хромную массу с неровным когауром (опсосомия ядер нейтрофилов). Также встре¬
чаются нейтрофилы в состоянии апоптоза ядер. Цитоплазма нейтрофилов очень
быстро подвергается жировой дистрофии, в ней обнаруживают мелкие капли жира
уже через 3-4 ч при хранении образца СМЖ при комнатной температуре.При длительном, вялотекущем воспалительном процессе ядра нейтрофилов
подвергаются апоптозу, в результате чего в СМЖ на фоне нейтрофильного плео-
цитоза появляются одноядерные нейтрофилы с маленьким, правильной круглой
формы ядром, окруженным нейтрофильной цитоплазмой, или нейтрофилы с
392 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВдвумя правильной круглой формы гиперхромными ядрами. Мононуклеарные ней-
трофилы можно принять за оксифильные нормобласты.Преобладание в СМЖ неизмененных нейтрофилов указывает на острый вос¬
палительный процесс, появление измененных нейтрофилов — на его затухание.
Сочетание измененных и неизмененных нейтрофилов — признак продолжения
воспаления. При наличии «путевой» крови в СМЖ всегда присутствуют неизме¬
ненные нейтрофилы.Нейтрофильный плеоцитоз характерен для острой экссудативной фазы бакте¬
риального менингита. В данный период количество нейтрофилов в лейкограмме
может превышать 60%. Количество нейтрофилов более 2000 клеток в 1 мкл —
признак бактериального менингита.Гранулоциты привлекаются в очаг воспаления бактериальными токсинами,
В очаге воспаления они фагоцитируют бактерии и некротические ткани, а при
кровотечении — эритроциты. Фагоцитарная активность нейтрофильных грану-
лоцитов ограничена их старением. Признак старения нейтрофилов — появление
в цитоплазме капель жира, увеличение количества сегментов ядра (гиперсегмен¬
тация ядра — 5-6 сегментов и более). Цитоплазма заполняется вакуолями, клетка
теряет четко очерченные границы.Нейтрофильный плеоцитоз — первая выраженная клеточная реакция в острой
фазе туберкулезного менингита. При вирусных менингитах нейтрофильная фаза
кратковременна, выражена слабо и быстро сменяется лимфоцитарным плеоци-
тозом. Нейтрофильный плеоцитоз различной степени выраженности характерен
для абсцессов головного мозга, микозов, нейросифилиса, ранних этапов развития
субарахноидальной гематомы и субарахноидального кровоизлияния, а также для
ишемического и геморрагического инсульта. После операции на мозговых оболоч¬
ках количесгво нейтрофилов нарастает в первые часы и дни.Увеличением количества нейтрофилов в СМЖ (нейтрофильным плеоцитозом)
сопровождаются следующие состояния.• Менингиты:^ экссудативная фаза бактериального менингита;❖ ранняя кратковременная стадия вирусного менингита;❖ острая фаза туберкулезного менингита;❖ начальная стадия микозного менингита;
амебный менингоэнцефалит,• Другие заболевания ЦНС:❖ абсцесс головного мозга;❖ нейросифилис;^ субдуральная эмпиема;❖ ранний период после операции на мозговых оболочках:❖ геморрагический и ишемический инсульт;❖ субарахноидальные геморрагии (гематома или кровоизлияние), 1-3-и сутки;❖ внутримозговые геморрагии.• Реакция на первую и повторные пункции:❖ введение лекарственных препаратов в субарахноидальное пространство
(метотрексата, контрастных веществ).• Метастазы злокачественных новообразований в ЦНС.ЭОЗИКОФИЛЫв норме эозинофилы в СМЖ не встречаются. Их появление расценивается как
особая реакция сосудов соединительной ткани субарахноидального пространства
на чужеродные белки.Эозинофилы — клетки округлой формы с ядром, занимающим меньшую часть
клетки и состоящим обычно из 2, реже 3, а иногда 1 сегмента правильной круглой
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 393формы. Одноядерные эозинофилы — клетки в состоянии апоптоза. Цитоплазма
заполнена одинаковой по размеру, сферической, резко преломляющей свет, бле¬
стящей зернистостью. Эозинофилы в СМЖ in vitro разрушаются при комнатной
температуре в течение 2-3 ч. Б препаратах СМЖ, окрашенных азур-эозином,
эозинофилы идентичны эозинофилам периферической крови. Ядра клеток окра¬
шиваются в красновато-фиолетовый цвет, а на фоне голубой цитоплазмы четко
видна одинаковая по размеру, сферической формы зернистость, окрашенная в
кирпично-красный или оранжевый цвет.Эозинофилы в СМЖ фагоцитируют бактерии, споры грибов и комплексы
•«антиген-антитело:^’, особенно с иммуноглобулином и компонентами комплемен¬
та, При фагоцитозе эозинофилы дегранулируют. При разрушении эозинофильных
гранул образуется перекись водорода, которая подавляет освободившийся из гранул
гистамин. Эозинофилы при аллергических процессах играют роль супрессоров.Эозинофилия при паразитарной инфекции вызвана образованием специфи¬
ческих антител, направленных против паразитов. При мозговом цистицеркозе и
эхинококкозе наблюдается выраженная эозинофилия. Содержание эозинофилов
в ликворной формуле может достигать 40% и более.Эозинофилы в СМЖ обнаруживают после операции на мозговых оболочках,
при эозинофильном менингите, аскаридозе, туберкулезном и лимфоцетарном
менингите, некоторых опухолях ЦНС. Эозинофилы могут появиться в СМЖ после
введения в субарахноидальное пространство контрастных веществ, что расценива¬
ется как аллергическая реакция. Эозинофилы присутствуют в ликворной формуле
при субарахноидальных кровоизлияниях, токсических, реактивных, эпидемиче¬
ских и сифилитических менингитах, а также при кистах головного мозга,Эозинофилия различной степени отмечается при опухолях головного мозга
(нейробластоме, инфильтрирующей менингиоме, эозинофильной аденоме).Активное заживление послеоперационной мозговой раны также сопровождает¬
ся появлением в СМЖ эозинофилов, что свидетельствует о местной аллергической
реакции на продукты распада белковых продуктов, оставшихся после операции.Появление эозинофилов в СМЖ вызывают следующие состояния.• Состояния, протекающие с эозинофилией:❖ паразитарные инвазии (цистицеркоз, эхинококкоз):❖ эозинофильный менингит;❖ грибковые инфекции;
реакция на введение лекарственных препаратов или контрастных
веществ:❖ острые полиневриты;^ идиопатический гиперэозинофильный синдром;❖ киста головного мозга.• Состояния, при которых в ликворной формуле присутствуют эозинофилы:о бактериальные менингиты;■о туберкулезный менингоэнцефалит;лимфоцитарный менингит;❖ токсический менингит;
эпидемический менингит;^ сифилитический менингит;❖ вирусные менингиты;^ ишемический и геморрагический инсульт;❖ опухоли головного мозга (менингиома, нейробластома, эозинофильная
аденома);
лейкозы;
нейросаркоидоз;состояние после операции на мозговых оболочках.
394 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВЭозинофилия СМЖ не сопровождается эозинофилией периферической крови,
и наоборот. Эозинофилия СМЖ может наблюдаться как при нормоцитозе, так и
при плеоцитозе. Эозинофилы могут поступать в СМЖ из мезенхимы мягкой моз¬
говой оболочки или непосредственно из крови.БАЗОФИЛЫБазофилы в нормальной СМЖ не встречаются. Их морфология соответству¬
ет морфологии базофилов периферической крови. Базофильные гранулоциты
и тканевые базофилы (мастоциты) из-за большого морфологического сходства
считаются клетками единой функциональной клеточной системы. Их основные
функции — синтез и выделение биологически активных веществ (гистамина, гепа¬
рина, серотонина).Базофилы участвуют в воспалительных процессах аллергического происхожде¬
ния, их обнаруживают в СМЖ при тяжелопротекающих нейроинфекциях (осо¬
бенно у детей) и при примеси свежей крови.ПЛАЗМАТИЧЕСКИЕ КЛЕТКИПлазматические клетки встречаются в СМЖ только при патологических про¬
цессах. Образуются из В-лимфоцитов в фолликулах корковой зоны лимфатиче¬
ских узлов и краевой зоны белой пульпы селезенки, где при встрече с антигеном
они проходят этап антигензависимой дифференцировки. Основные функции
плазматических клеток — синтез и секреция антител. Во время этих процессов в
клетках повышается синтез белков, что сказывается на морфологии цитоплазмы,
которая становится схожей с цитоплазмой секретирующих клеток.Плазматические клетки имеют правильную круглую форму диаметром до 12 мкм.
Ядро также правильной круглой формы, расположено эксцентрично. Цитоплазма
обильная, окружает ядро больше с одной стороны. Б СМЖ иногда встречаются
двухъядерные плазматические клетки. При окраске азур-эозином плазматические
клетки в СМЖ идентичны плазматическим клеткам различной степени .зрелости в
периферической крови и костном мозге. Молодая плазматическая клетка (плазмо-
бласт, проплазмоцит) имеет диаметр 16-20 мкл, ядро занимает большую часть клет¬
ки, расположено центрально или несколько эксцентрично, хроматиновой струк¬
туры, темно-фиолетового цвета. Более молодые клетки (плазмобласты) содержат
1-2 ядрышка. Зрелая плазматическая клетка (плазмоцит) имеет диаметр 10-12 мкл,
круглую форму, ядро занимает меньшую часть клетки, расположено эксцентрично,
структура ядра зрелая, с четким делением на окси- и базихроматин, который рас¬
положен в ядре в виде мелких глыбок («булыжная мостовая») или колесовидно.Плазматические клетки встречаются в СМЖ при длительных вялотекуш;их
воспалительных процессах головного мозга и мозговых оболочек (хронических
энцефалитах, менингитах различной этиологии, арахноидитах), при этом их
количество в ликворной формуле может достигать 20-25%. Присутствие плазма¬
тических клеток в СМЖ характерно у больных с рассеянным склерозом и гипер-
кинетическим прогрессируюшіим панэнцефалитом. При хронических формах
нейросифилиса плазмоцитоз сочетается с нормоцитозом или незначительным
плеоцитозом. Плазмоциты можно обнаружить при острых воспалительных про¬
цессах ЦНС, а также при некоторых опухолях головного мозга, туберкулезном
менингите, саркоидозе, коллагенозах с вовлечением в процесс ЦНС, зоонозах,
после кровоизлияния в ткань головного мозга. Появление плазматических клеток
в СМЖ больных, перенесших операцию на головном мозге или мозговых обо¬
лочках, на фоне моноцитов и единичных макрофагов или полного их отсутствия
указывает на медленное заживление послеоперационного рубца. Наличие в СМЖ
плазматических клеток в сочетании с большими и малыми лимфоцитами — при¬
знак опухоли головного мозга.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 395БЛАСТЫУ больных лейкозами при вовлечении в патологический процесс мозговых
оболочек возникает лейкозный менингит. Это осложнение получило название
нейролейкемии. Нейролейкемия нередко развивается при острых лейкозах, у
детей чаще, чем у взрослых. При острых лейкозах у 5-42% больных бласты выяв¬
ляют при нормоцитозе. Обычно количество клеток в СМЖ варьирует от 100 до
ЗООхЮул, не исключается и более высокий плеоцитоз, составляющий 2-5х10ул
и более.Морфология бластов в мазках СМЖ при остром миелобластном лейкозе и
остром лимфобластном лейкозе при окраске азур-эозином соответствует их мор¬
фологии в мазках периферической крови и костного мозга. Ядра миелобластов
занимают большую часть клетки, полиморфны по величине и форме. На фоне
нежного ядерного хроматина просматриваются множественные голубые ядрыш¬
ки. В миелобластах на фоне базофильной цитоплазмы встречаются единичные
азурофильные гранулы. На фоне лейкозных клеток в препаратах присутствуют
лимфоциты, моноциты и другие клеточные элементы.Для лимфобластов характерны четкая, нежная хроматиновая структура и выра¬
женный полиморфизм ядер, наличие единичных, плохоразличимых ядрышек
и отсутствие зернистости цитоплазмы. При внимательном изучении препарата
можно обнаружить фигуры митоза.Лейкемизация злокачественной миеломы может сопровождаться развитием
специфического менингоэнцефалита с появлением в СМЖ большого количества
миеломных клеток. При злокачественных лимфомах у больных на фоне химио- и
иммуносупрессивной терапии мог}т развиться криптококкозный, кокцидиоидоз-
ный, кандидамикозный или бластомикозный менингит, энцефалит или менинго-
энцефалит.КЛЕТКИ АРАХНОЭНДОТЕЛИЯКлетки арахноэндотелия (арахноидальные или арахноэндотелиальные) —
однослойный эпителий эпендимального происхождения, морфологически сход¬
ный с мезотелием, выстилающий все пространства ЦНС, заполненные СМЖ, за
исключением желудочков мозга. Эти клетки тонким слоем покрывают мягкую
мозговую оболочку и паутинную оболочку, покрывающую ее сверху. Мягкую
мозговую и паутинную оболочки иногда рассматривают как единое целое (ріа-
arachnoidea, или leptomeninx). Мягкая мозговая оболочка, покрытая арахноэн-
дотелием, полностью покрывает головной и спинной мозг, выполняя функцию
гидравлического амортизатора. В СМЖ здоровых людей клетки арахноэндоте¬
лия не встречаются.Клетки арахноэндотелия обнаруживают в СМЖ больных с опухолью головного
мозга, при черепно-мозговых травмах и после операции на мозговых оболочках.Арахноэндотелиоциты — крупные клетки до 25-40 мкм в диаметре, округлой
или полигональной формы. Соотношение ядра и цитоплазмы зависит от зрелости
клетки. Ядро в молодых арахноэндотелиальных клетках занимает большую часть
клетки, в зрелых — меньшую. Форма ядер правильная, круглая или овальная,
структура ядра зернистая или петлистая, образована довольно толстыми нитями
хроматина. В молодых арахноэндотелиальных клетках могут быть ядрышки.
Реактив Самсона окрашивает ядра клеток в вишневый цвет, а цитоплазму — в
розовый. Структура цитоплазмы арахноэндотелия зернистая, при длительном
воспалительном процессе или длительном хранении СМЖ при комнатной темпе¬
ратуре (более 3 ч) может быть частично лизирована. В препаратах, окрашенных
азур-эозином, арахноидальные клетки по размерам и окраске ядра и цитоплазмы
соответствуют мезотелиальным клеткам, выстилающим плевральную, брюшную и
полость перикарда.
ФмшJill 396 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВКлетки опухолейКлетки опухолей ГОЛОВНОГО мозга и других органов и тканей обнаруживают
при исследовании СМЖ у больных с первичными и метастатическими опухолями
ЦНС. Опухолевые клетки попадают в СМЖ в результате отторжения от ткани
опухоли, прилегающей к ликворным пространствам, а также при прорастании
опухолью стенки желудочков мозга или мозговых оболочек и канцероматозе обо¬
лочек головного мозга.Выявить клетки злокачественных новообразований позволяют следующие
общепринятые цитологические признаки:• соотношение ядра и цитоплазмы (сдвинуто в сторону ядра);• неравномерная структура хроматина, гиперхромия или анизохромия;• полиморфизм ядер, полиморфизм ядрышек, полинуклеолярность;• повышенная митотическая активность, особенно при злокачественных опу¬
холях;• амитотическое деление (деление ядер без деления цитоплазмы);• клеточный полиморфизм;• многоядерность с выраженным анизоцитозом;• химическая анаплазия клеточных элементов (гипер- и полихромазия);• наличие атипичных клеточных комплексов.Обнаружение в СМЖ различных количеств злокачественных клеток зависит от
следующих факторов:• источника получения СМЖ;• периодичности исследования СМЖ;• количества препаратов, приготовленных из одной и той же порции СМЖ;• проведения исследования СМЖ до или после операции.Частота положительных результатов повышается при исследовании вентри¬
кулярной СМЖ в послеоперационном периоде. Выявляемость клеток злокаче¬
ственных новообразований колеблется от 3 до 51%, а иногда выявляют до 74%
опухолей головного мозга. Если в СМЖ обнаружены злокачественные клетки, в
99% случаев это указывает на опухоль ЦНС.Частота обнаружения злокачественных клеток в СМЖ зависит от характера
опухолевого процесса: при лейкозах она достигает 70%, при метастатических
поражениях ЦНС — 20-60%, а при первичных опухолях головного мозга — 30%.
При цитологическом исследовании СМЖ возможны следующие заключения:• клетки злокачественного новообразования не обнаружены;• атипичная цитограмма, признаков злокачественности не обнаружено;• наблюдается много митозов и голых ядер, клеток злокачественного новооб¬
разования не обнаружено;• обнаружены клетки злокачественного новообразования.Опухолевые клетки в СМЖ сравнительно быстро разрушаются, поэтому пре¬
параты для цитологического исследования необходимо готовить в первые 30 мин
после доставки СМЖ в лабораторию.ПЕРВИЧНЫЕ ОПУХОЛИ ЦНСПервичные опухоли ЦНС — опухоли нейроэпителиального, мезодермального и
эктодермального происхождения. В СМЖ с различной частотой могут встречать¬
ся клетки астроцитомы, олигодендроглиомы, мультиформной спонгиобластомы
(глиобластомы), эпендимомы, медуллобластомы и арахноэндотелиомы. При
невриномах и менингиомах опухолевые клетки в СМЖ практически отсутствуют,
потому что они не отторгают жизнеспособные клетки.при астроцитоме опухолевые клетки обнаруживают часто. При астроцитоме
больших полушарий в вентрикулярной СМЖ опухолевые клетки выявляют в 30%
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 397случаев. В мазке они имеют вид единичных клеток вытянутой формы, с полярно
отходящими отростками базофильной цитоплазмы. Ядра расположены цен¬
трально, имеют овальную или округлую форму, четко контурированы, структура
хроматина в ядрах мелкозернистая или тонкопетлисгая. Цитологическая карти¬
на различна в зависимости от степени развития астроцитомы (I или II степень),
В препаратах СМЖ опухолевые клетки могут располагаться одиночно или груп¬
пами на фоне голых ядер этих же клеток. В клетках астроцитомы обнаруживают
крупные ядра с неправильными контурами (дискариоз), цитоплазма окрашивает¬
ся базофильно (с различной интенсивностью) и может не иметь четкого контура.При олигодендроме опухолевые клетки округлой или неправильной формы и
обычно одинаковых размеров (15-20 мкм). Ядра гиперхромные, иногда крупно-
глыбчатые, хроматин распределен гомогенно. Цитоплазма серовато-голубоватого
цвета, широкой каймой окружает ядро.При мультиформной спонгиобластоме (глиобластоме) в СМЖ на фоне
эритроцитов, эритрофагов, моноцитов, лимфоцитов регистрируются единичные
опухолевые клетки или группы клеток, полиморфных по величине и форме. Ядра
с петлистой структурой хроматина, содержат одно или несколько ядрышек и
занимают, как правило, большую часть клеток. Цитоплазма голубого или серого
цвета, широким ободком окружает ядро. Ядра клеток окрашиваются азур-эозином
неравномерно, чаще встречаются гипохромные. Характерны дистрофические
изменения цитоплазмы.При эпендимомах обнаруживают опухолевые клетки примерно равной вели¬
чины (12-20 мкм), вытянутой формы, с полярно отходящими отростками цито¬
плазмы. Цитоплазма темно-базофильных тонов. Ядра клеток могут располагаться
центрально и эксцентрично, четко контурированы, с грубой хроматиновой струк¬
турой. Встречаются единичные митозы.Клетки медуллобластомы довольно часто выявляют в СМЖ при локализа¬
ции опухоли в заднечерепной ямке, поражающей, как правило, червь мозжечка
с последующим прорастанием в крышу IV желудочка. Опухолевые клетки харак¬
теризуются значительным полиморфизмом размеров и форм. Чаще наблюдаются
клетки округлой формы, с большими округлыми гипохромными ядрами с мелко¬
зернистой хроматинововй структурой, 1-2 мелкими ядрышками и узким ободком
базофильной цитоплазмы. В препаратах могут встречаться очень крупные мно¬
гоядерные клетки, фигуры митоза. Характерно расположение злокачественных
клеток в виде комплексов различной величины.При аденоме гипофиза в СМЖ могут присутствовать крупные клетки круглой
или овальной формы с базофильной или бледно-серой цитоплазмой. Ядра обычно
округлой формы, с четкой хроматиновой структурой и несколькими ядрышками.
Встречаются клетки гигантских размеров.При эозинофильной аденоме гипофиза опухолевые клетки обычно небольшие,
с эксцентрично расположенными ядрами. Митозы встречаются редко.Определить принадлежность злокачественных клеток к определенной опухоли
по цитограмме СМЖ довольно сложно.ВТОРИЧНЫЕ ОПУХОЛИ ЦНС (МЕТАСТАТИЧЕСКОЕ ПОРАЖЕНИЕ)В СМЖ клетки метастатических новообразований встречаются чаще и в боль¬
шем количестве по сравнению со злокачественными клетками при первичных опу¬
холях головного мозга. Метастазируют в головной мозг меланома, эпителиальные,
железистые и недифференцированные опухоли.Клетки меланомы в окрашенных препаратах СМЖ характеризуются различ¬
ной величиной и, как правило, округлой формой. Ядра округлые, гиперхромные.
хроматиновой структуры. У большинства клеток цитоплазма темно-базофильная,
содержит гранулы меланина черного цвета.
398 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВКлетки эпидермоидного, железистого и низкодифференцированного рака обна¬
руживают в СМЖ больных с карциноматозом мозговых оболочек. Обычно пред¬
ставлены в виде комплексов, групп и отдельно расположенных злокачественных
клеток.Морфологическая структура злокачественных клеток и комплексов зависит
от локализации первичной опухоли. В СМЖ могут быть обнаружены элементы
плоскоклеточного рака легких с признаками ороговения и без него, клеточные
элементы аденокарциномы и низкодифференцированного мелкоклеточного
рака.При плоскоклеточном раке без ороговения опухолевые клетки отмечает
резко выраженный полиморфизм размеров клеток, встречаются гигантские клетки
и клетки небольших размеров. Крупное гиперхромное ядро, содержащее единич¬
ные ядрышки, расположено центрально на фоне обильной цитоплазмы- Митозы
практически не встречаются.При высокодифференцированном плоскоклеточном раке (плоскокле¬
точном раке с ороговением) на фоне мелкозернистого детрита расположены
клетки различных размеров с цитоплазмой с признаками кератинизации. Ядра
небольшие, расположены центрально, пикнотичные, гиперхромные, не содержат
ядрышек. Отмечается резко выраженный полиморфизм размеров и форм клеток,
встречаются безъядерные кератогиалинизированные чешуйки.При аденокарциноме опухолевые клетки выявляются достаточно часто.
В зависимости от степени дифференцировки клеточные элементы могут сохра¬
нять признаки железистой ткани или резко от нее отличаться. Размеры клеток
иногда достигают 200 мкм в диаметре. Крупные ядра расположены эксцентрично,
содержат большое количество ядрышек. Цитоплазма может содержать секрет
(перстневидные злокачественные клетки). При сохранении железистых структур
комплексы состоят из клеток округлой формы, разных размеров, с выраженным
полиморфизмом ядер и ядрышек.Клетки и комплексы низкодифференцированного мелкоклеточного рака
часто метастазируют по оболочкам головного мозга и могут бьггь обнаружены
в СМЖ. Клетки, составляющие комплексы мелкоклеточного низкодифферен¬
цированного рака и расположенные разрозненно, имеют диаметр 12-15 мкм и
округлую форму. Ядра занимают практически всю клетку, они равномерно окра¬
шенные, гиперхромные, так как тонкие нити хроматина расположены в них очень
плотно, создавая впечатление монохромности. В комплексах округлой, вытянутой
формы или в виде папиллярных структур отмечается плотное прилегание клеток
друг к другу с образованием фасеток.ИССЛЕДОВАНИЕ СИНОВИАЛЬНОЙ ЖИДКОСТИСиновиальная жидкость (СЖ) — один из основных органоспецифических ком¬
понентов каждого сустава, в значительной степени определяющий его морфофунк¬
циональное состояние, СЖ выполняет метаболическую, локомоторную, трофиче¬
скую и барьерную функции, играющие важную роль в обеспечении нормальной
физиологии сустава и его связи с другими тканями,СЖ отражает процессы, происходящие в хряще и синовиальной оболочке, и
тонко реагирует на нарушения в суставе изменением физико-химических харак¬
теристик и клеточного состава. Именно поэтому лабораторное исследование СЖ
имеет принципиальное значение в диагностике заболеваний суставов. В ряде
случаев исследование СЖ — первый, а иногда и единственный необходимый диа¬
гностический тест.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 399Преаналитические предосторожностив норме количество СЖ в суставе невелико, однако при заболеваниях сусгавов
ее объем увеличивается — образуется суставной выпот. Его получают для ана¬
лиза пункцией сустава (артроцентеза). Во время процедуры применяют местные
анестетики, однако использование прокаина нежелательно, так как он вызывает
разрушение клеток. Поскольку СЖ нередко образует сгусток, для цитологического
исследования ее рекомендуют получать с антикоагулянтом, лучшим из которых
признается натриевая соль ЭДТА. СЖ распределяют в 3 пробирки:• в пробирку с антикоагулянтом для цитологического исследования;• в сухую пробирку для химико-микроскопического исследования и приготов¬
ления нативного препарата для микроскопии в поляризованном свете;• в стерильную пробирку для бактериологического исследования.На бланке направления на исследование СЖ в лабораторию врач должен ука¬
зать ФИО больного, а также клинический диагноз. Это может помочь при иденти¬
фикации необычных частиц в СЖ.Аналртз СЖ следует проводить в кратчайшие сроки с момента ее получения.
Ложные результаты могут быть получены при задержке исследования более чем
на 6 ч в результате следующих изменений;• снижения количества лейкоцитов;• уменьшения количества кристаллов (пирофосфатадигидрата кальция);• наличия артефактов в виде новообразований кристаллов.При необходимости допустимо хранение СЖ в шприце с минимальным коли¬
чеством воздуха в холодильнике в течение 1 с)Т без существенного изменения
ее параметров. Более длительное хранение возможно в морозильной камере при
температуре -70 °С.Лабораторная практикаСтандартное лабораторное исследование СЖ включает следующие этапы;• оценку физических свойств (объем, цвет, характер, вязкость, мутность, pH,
муциновый сгусток);• цитологическое исследование (подсчет количества клеток, микроскопию
нативного и окрашенного препарата);• поляризационную микроскопию нативного препарата;• химический анализ;• дополнительные исследования (по показаниям).ФИЗИЧЕСКИЕ СВОЙСТВАОбъем СЖ оценивают с помощью градуированной пробирки, цвет и характер —
визуально в проходящем свете по сравнению с дистиллированной водой.Вязкость определяют гемовискозиметром или по длине нити, тянущейся за
стеклянной палочкой, после ее погружения в пробирку и выражают в условных
единицах:• 1 — высокая вязкость;• 2 — умеренная вязкость;• 3 — крайне низкая вязкость (приближающаяся к воде).Для оценки мутности используют балльную оценку:• 1 балл — полная прозрачность;• 2 балла — легкая мутность;• 3 балла — мутность.Муциновый сгусток образуется при смешивании СЖ с уксусной кислотой,
В зависимости от состава СЖ сгусток может быть плотным или рыхлым.
400 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВДля определения pH используют диагностические полоски, обычно применяе¬
мые для исследования мочи. Этот показатель необходимо определять немедленно
после получения СЖ (при хранении pH изменяется).ЦИТОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕСущественное диагностическое значение имеет подсчет клеток в СЖ, который
проводят по общепринятым правилам (ручным или автоматическим способом).
В норме цитоз составляет не более 100 клеток в 1 мкл. Хранение СЖ в течение
нескольких часов при комнатной температуре ведет к разрушению лейкоцитов.Микроскопическому исследованию подвергают как нативный, так и окрашен¬
ный препарат. Техника его приготовления стандартная, рекомендуют исполь¬
зование цитоцентрифуги. Исследование нативного препарата позволяет ори¬
ентировочно оценить содержание клеточных элементов, выявить рагоциты и
неклеточные частицы. В окрашенном препарате подсчитывают цитограмму (сино-
виоцитограмму) на 100-200 клеток, предпочтительнее в 2-3 препаратах. Вопреки
известному мнению, что клетки тканевого происхождения в СЖ преобладают
над форменными элементами крови, часто клеточный состав выпота представлен
преимущественно нейтрофилами и лимфоцитами.При артритах в СЖ могут встречаться особые формы нейтрофилов — рагоциты,
В их цитоплазме содержатся включения иммунных комплексов, что придает клет¬
ке «ячеистый» вид (вакуолизация в виде грозди винограда),ПОЛЯРИЗАЦИОННАЯ МИКРОСКОПИЯДля выявления кристаллов используют поляризационную микроскопию.Для успешной идентификации кристаллов необходимо соблюдать ряд условий:• исключение контаминации образца СЖ;• исключение применения ЭДТА, растворяющего кристаллы;• использование абсолютно чистых пипеток, пробирок и предметных стекол.
Работу следует проводить в незапыленной рабочей зоне. Основное условие -наличие поляризационного микроскопа с хорошей оптикой. Для приготовления
препарата на стекло наносят небольшую каплю хорошо перемешанной СЖ, кото¬
рую накрывают покровным стеклом (следят, чтобы не образовались пузырьки
воздуха). Оптимально исследование двух препаратов. Проводят микроскопию при
малом увеличении, затем при увеличении в 1000 раз.Ураты натрия (MSUM) имеют вид длинных игл или пучков размером 1-20 мкм,
они хорошо видны на черном фоне как белые «искры» вследствие двулучепрелом-
ления. Часто выявляются в нейтрофилах, где их количество значительно увеличи¬
вается при острых приступах подагры.Кристаллы дегидропирофосфата кальция (CPPD) имеют разную форму (как
правило, прямоугольников или ромбов с тупыми концами) и очень мелкие разме¬
ры (менее 2 мкм в диаметре). Они видны несколько хуже из-за слабого свечения.Поскольку основная цель исследования СЖ — исключение инфекционного про¬
цесса, необходимо выполнять окраску мазков по Г^аму (что не исключает необхо¬
димости бактериологического исследования).ХИМИЧЕСКИЙ АНАЛИЗБелок и глюкозу определяют методами, которые используются в клинической
практике для определения белка и глюкозы в моче. Для полуколичесгвенной оцен¬
ки могут быть использованы диагностические полоски. При тяжелых гнойных
артритах рекомендуют определение лактата.ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАСуществует высокая вариабельность результатов анализа СЖ в различных
лабораториях. Специфических подходов к организации контроля качества при
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 4Q1исследовании СЖ не существует. Важное условие — стандартизация технологии
лабораторного анализа СЖ (табл. 6-24).Таблица 6-24. Референтные пределы лабораторных показателей СЖПоказательЗначенияХимический анализОбщий белок10-20 г/лГлюкоза3,5-5,5 ммоль/лКлеточный составЛейкоциты<0,1 млн/млСиновиоцитограммаСиновиоциты5-30%Гистиоциты5-10%Лимфоциты8-50%Моноциты1-5%Нейтрофилы1-2%При диагностике подагры в СЖ определяют концентрацию мочевой кислоты
(так же как и в плазме крови). Определение аутоантител (прежде всего, ревма¬
тоидного фактора и аутоантител к ДНК) удобно выполнять методом латекс-
агглютинации.Клинико-диагностическое значениеПри патологии цвет СЖ изменяется в зависимости от характера суставного
выпота (серозный, геморрагический, фибринозный, смешанный). При вторичных
синовитах СЖ пррюбретает янтарный цвет, а при ревматоидном и псориатическом
артрите цвет варьирует от желтого до зеленого. Желто-зеленый цвет СЖ может
быть при инфекционных и подагрических поражениях суставов. При септическом
или травматическом повреждении сустава СЖ приобретает кровянистый цвет
различной степени выраженности. При пигментированном ворсинчато-узловом
синовите суставной выпот имеет коричнево-красный цвет. Сливкообразный
характер СЖ могут придавать жиры при внзт'рисуставных переломах. Золотистый
оттенок СЖ обусловлен присутствием холестерина.Мутность характерна для ревматоидного, псориатического или септического
артрита.Вязкость СЖ снижается при ревматизме, ревматоидном, подагрическом и псо¬
риатическом артрите, болезни Рейтера, артрозах, анкилозирующем спондилоар¬
трите, в меньшей степени — при посттравматических артритах.Рыхлый муциновый сгусток всегда указывает на наличие воспалительного про¬
цесса в суставе (ревматоидный артрит и другие заболевания), однако существуют
более совершенные его индикаторы.Изменение pH СЖ не имеет принципиального диагностического значения, его
значение снижается при воспалении.При микроскопии нативного препарата моїуг бьггь обнаружены неклеточные
частицы — экзогенные (шипы растений, фрагменты искусственных кристаллов, ком¬
поненты эндопротезов, суспензии лекарственных препаратов) и эндогенные (фраг¬
менты хряща, менисков, связок, кристаллы) компоненты. Появление компонентов
эндопротезов Б СЖ — прогностический признак развития его нестабильности.Среди эндогенных компонентов СЖ важнейший элемент, имеющий принципи¬
альное клинико-диагностическое значение, — кристаллы урата натрия и пирофос¬
фата кальция. В СЖ могут выявляться амилоидные тельца, капли нейтрального
жира, кристаллы холестерина, кальция, гематоидина.
402 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВЦитоз — один из наиболее чувствительных диагностических критериев, позво¬
ляющий дифференцировать воспалительные и невоспалительные заболевания
и оценивать динамику патологического процесса. Повышение количества лей¬
коцитов в СЖ характерно для острого периода любого воспалительного артрита
(например, при приступе подагры количество лейкоцитов достигает 60x10^ клеток
в 1 мкл). Умеренный цитоз отмечен при псевдоподагре, синдроме Рейтера, псо-
риатическом артрите. При инфекционном (бактериальном) артрите цитоз обычно
выше (50x10^ клеток в 1 мкл), в таких образцах выявляется рост микрофлоры.
Малый цитоз (менее 1-2x10^ клеток в 1 мкл, преимущественно нейтрофилы)
характерен для «механического«> поражения сустава, в том числе для микрокри¬
сталлических артритов.При ревматоидном артрите содержание гранулоцитов достигает 90%, а коли¬
чество лимфоцитов снижается менее 10%. Эти изменения более выражены при
серопозитивном варианте ревматоидного артрита. При токсико-аллергических
синовитах, синовиальной форме туберкулеза или артритах паранеопластической
природы в СЖ преобладают мононуклеары.Наличие рагоцитов в значительном количестве характерно для ревматоидного
артрита. Единичные рагоциты могут встречаться и при других поражениях сустава
(септическом артрите и воспалительных артропатиях). LE-клетки встречаются в
СЖ при системной красной волчанке примерно у 50% больных. Атипичные клетки
в СЖ регистрируют сравнительно редко.Бактериоскопия имеет только вспомогательное и часто очень ограниченное
значение, так как при подозрении на микробный характер воспаления необходимо
стандартное бактериологическое исследование. Однако при микроскопии мазка СЖ
могут быть обнаружены гонококки при гонококковом артрите. Наличие в мазках
грамположительных кокков, объединенных в гроздья, позволяет предположить
стафилококковую этиологию инфекции, другими возбудителями инфекционных
артритов могут быть стрептококки, грамотрицательные палочки. При грибковых
артритах (кандидамикозе, аспергиллезе) в СЖ выявляется мицелий грибка.Уровень белка в СЖ несколько повышается при дегенеративных заболеваниях и
посттравматических артритах. Более выраженное увеличение содержания общего
белка наблюдается при воспалительных заболеваниях (например, при ревматоид¬
ном артрите — до 70 г/л), часто при этом изменяется и его качественный состав.Другой важный параметр, характеризующий состояние СЖ, — уровень глюко¬
зы. Это более специфичный, но менее чувствительный индикатор воспалитель¬
ных изменений в суставе, так как уровень глюкозы в СЖ заметно снижается при
воспалительных артропатиях. Именно поэтому в последние годы для экспресс-
диагностики гнойных (септических) артритов определяют уровень лактата в СЖ.Изменения состава СЖ позволяют установить воспалительную природу заболе¬
вания, приведшего к образованию суставного выпота. Нейтрофильный лейкоци¬
тоз, увеличение концентрации белка и лактата, а также снижение уровня глюко¬
зы — важные признаки воспалительного процесса в суставе (табл. 6-25).Таблица 6-25. Характеристика диагностической информативности лабораторных тестов в диа¬
гностике воспалительных заболеваний суставовПоказательЧувствительность, %Специфичность, %Лейкоциты8484Нейтрофилы7592Глюкоза2084Общий белок5256лдг8371Лактат8596
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 4Q3Иммунологические методы (определение иммуноглобулинов и СРБ) также
позволяют дифференцировать воспалительные и невоспалительные заболевания
суставов. Аутоантитела появляются в СЖ раньше, чем в плазме крови.ИССЛЕДОВАНИЕ ВЫПОТНЫХ ЖИДКОСТЕЙСерозная полость — узкий промежуток между двумя листками серозной обо¬
лочки. к серозным оболочкам относят;• плевру (оболочка, покрывающая каждое легкое — висцеральная и ребра —
париетальная):• брюшину (выстилает внутренние органы брюшной полости — висцеральная
и стенки таза — париетальная);• эпикард {epicardium — висцеральный листок серозной оболочки сердца);• перикард (pericardium — ее париетальный листок).В серозных полостях находится строго определенное количество серозной
жидкости, которая обеспечивает «смазку» серозной оболочки, необходимую для
выполнения ее основных функций, в перикардиальной полости присутствует
около 1-2 мл чистой серозной жидкости (перикардиальной), в плевральной —
около 10 мл жидкости (плевральной), в брюшной — около 50 мл жидкости (пери¬
тонеальной). Серозная жидкость — это ультрафильтрат плазмы крови, транссудат,
который постоянно продуцируется и реабсорбируется и служит своеобразной
смазкой, обеспечивающей скольжение органов при дыхании, сердечных и пери¬
стальтических сокращениях и т.д. В клинической практике жидкости серозных
полостей, образующиеся при патологических процессах, принято называть выпот¬
ными жидкостями.Условия получения качественного материалаЭвакуацию выпота проводят пункцией серозной полости. Пунктат высвобожда¬
ют в чистую сухую, а при необходимости в стерильную ПОС}Чу. Пункцию должен
проводить лечащий врач или процедурная медицинская сестра. В лабораторию
следует доставить максимальное количество жидкости (при возможности всю
полученную жидкость). Желательно получить достаточный объем жидкости для
биохимических, бактериологических и цитологических исследований.в случае получения слишком большого объема жидкости в лабораторию можно
доставить лишь ее часть (около 1 л) и обязательно последнюю порцию, так как она
наиболее богата клеточными элементами. Серозная жидкость при хранении может
свернуться. Для исследования рекомендуют разделить пробу; 10 мл нативной жид¬
кости будет использовано для биохимических и серологических исследований.
Для бактериологического исследования забор жидкости следует проводить в
стерильные пробирки. Если предполагается исследование аэробной и анаэробной
микрофлоры, жидкость для бактериологического анализа нужно забирать в две
разные пробирки. Для анаэробной микрофлоры необходимы соответствующие
(анаэробные) условия транспортировки. Если предполагается исследовать выпот
на выявление микобактерий туберкулеза, стерильности не требуется, на исследо¬
вание берут примерно 20 мл жидкости.К остальной жидкости рекомендуют добавить антикоагулянты или стабилиза¬
торы:• ЭДТА, этилендиаминтетрауксусную кислоту для подсчета клеточного состава
жидкости;• гепарин для цитологического исследования и измерения pH;• цитрат натрия для определения фибронектина;• фторид натрия для определения лактата.
404 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВЕсли проводят биохимическое исследование, одновременно следует отобрать
5 мл венозной крови для определения градиента «сыворотка — выпотная жид¬
кость» для альбумина, а-амилазы, билирубина, холестерина, общего белка, ЛДГ
и триглицеридов.в мировой литературе для предупреждения свертывания жидкости часто реко¬
мендуют использовать 5% раствор цитрата натрия. Однако, если есть возможность
исследовать жидкость сразу после ее эвакуации, добавления цитрата натрия лучше
избегать. Раствор может влиять на морфологию клеток, вызывая их деструкцию,
а также изменять реакцию среды, что, в свою очередь, может привести к плохому
прокрашиванию препаратов. К тому же, как показали практические наблюдения,
жидкость далеко не всегда подвергается свертыванию. Предпочтительнее раз¬
делить полученную жидкость на порции и поместить в отдельные сосуды.
Нативную жидкость, в которую ничего не добавляли, следует немедленно подвер¬
гнуть исследованию, в другие сосуды необходимо добавить антикоагулянты и
стабилизаторы.Исследование клеточного состава свернувшейся жидкости недопустимо,
поскольку клетки при свертывании поглощаются сгустком и в осадок центрифу-
гата не выпадают или обнаруживаются в незначительном количестве. В практиче¬
ской работе цитологам приходится сталкиваться с необходимостью анализировать
свернувшуюся жидкость, в этом случае ее следует исследовать гистологической
техникой срезов.Исследование серозной жидкости в лабораторииМАКРОСКОПИЧЕСКОЕ ИССЛЕДОВАНИЕПри лабораторном исследовании проводят дифференциальную диагностику
экссудата и транссудата, оценивают общие свойства (макроскопический вид) жид¬
кости: цвет, прозрачность, консистенцию.Транссудат и экссудатТранссудат — жидкость, скапливаемая в полостях тела, образуется в результа¬
те влияния системных факторов на образование жидкости и ее резорбцию. При
транссудативном выпоте листки серозных оболочек не вовлечены в первичный
патологический процесс. Транссудат возникает в случаях, когда гидростатическое
или коллоидно-осмотическое давление изменяется в такой мере, что жидкость,
фильтрующаяся в серозную полость, превышает объем реабсорбции. Это бывает
чаще всего в результате:• нарушения общего и местного кровообращения, например при хроническом
венозном полнокровии (сердечно-сосудистой, почечной недостаточности,
портальной гипертензии и т.д.);• снижения онкотического давления в сосудах при гипопротеинемии;• нарушения обмена электролитов.Транссудат, скапливаемый в плевральных полостях, называют гидротораксом, в
брюшной полости — асцитом, в полости перикарда — гидроперикардом.Транссудат обычно бывает прозрачным, почти бесцветным или с желтоватым
оттенком, реже — слегка мутноватым из-за примеси слущенного эпителия, лим¬
фоцитов, липоцитов; удельный вес не превышает 1,015 г/мл.Экссудат образуется в результате поражения серозных оболочек, чаще всего
из-за повышения проницаемости капилляров оболочек, но может возникнуть и
при нарушении лимфатического оттока из серозной полости. При инфекциях,
некоторых системных заболеваниях (ревматоидном артрите, системной красной
волчанке) экссудат формируется в результате нарушения проницаемости капил¬
ляров, при опухолевом росте причиной его формирования часто бывает блокада
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 4Q5лимфатической системы. Однако эта закономерность не является всеобщей: так,
при тяжелом воспалительном процессе, в частности при бактериальной эмпиеме,
может нарушаться лимфатический отток из-за набухания мезотелиальных клеток
или накопления клеточного детрита, фибрина и коллагена, блокирующих лимфа¬
тический дренаж.В течение многих лет дифференциацию серозного выпота на транссудат и
экссудат проводили на основании учета содержания белка в жидкости. Однако
использование только этого критерия в 10% случаев может давать ошибочные
результаты.Если выпот представляет собой транссудат, дальнейших диагностических иссле¬
дований не требуется, лечение может быть направлено на лежащую в основе выпо¬
та основную патологию (застойную сердечную недостаточность, цирроз печени
и т.д.). И наоборот, если выпот окажется экссудатом, для выявления причин его
образования необходимы дальнейшие диагностические исследования,ОБЩИЕ СВОЙСТВА (МАКРОСКОПИЧЕСКИЙ ВИД) ЖИДКОСТИПри описании макроскопического вида жидкости оценивают прозрачность,
цвет, консистенцию.в зависимости от характера жидкости, количественного содержания белка и
клеточного состава различают выпоты: серозный, серозно-гнойный, гнойный,
гнилостный, геморрагический, хилезный, хилусоподобный, холестериновый, сли¬
зистый, фибринозный.Серозный выпот (транссудат или экссудат) может быть прозрачным или мут¬
ным, обычно окрашенным в желтоватые тона различной интенсивности. Иногда
серозная жидкость оказывается резко мутной, при этом в ней просматриваются
крупные зернистые включения, быстро оседающие на дно сосуда. Такой характер
может иметь выпот при воспалительных процессах, туберкулезе, сифилисе, рев¬
матизме и др.Серозно-гнойный и гнойный экссудат — мутная, желтовато-зеленая жидкость с
обильным рыхлым осадком. Гнойный экссудат встречается при эмпиеме плевры,
перитоните и др.Гнтостный экссудат — мутная жидкость серо-зеленого цвета с резким гнилост¬
ным запахом; характерна для гангрены легкого и других процессов, сопровождае¬
мых распадом ткани.Теморрагигеский экссудат — прозрачная или мутная жидкость красновато- или
буровато-коричневого цвета. Количество эритроцитов может быть различным —
от небольшой примеси, когда жидкость имеет слабо-розовую окраску, до обиль¬
ного содержания, когда она сходна с цельной кровью. Наиболее частой причиной
данного выпота является новообразование, однако геморрагический характер
жидкости большого диагностического значения не имеет, поскольку наблюдается
также при ряде неопухолевых заболеваний (травме, инфаркте легкого, плеврите,
геморрагическом диатезе). В то же время при злокачественных процессах с обшир¬
ной диссеминацией опухоли по серозной оболочке может иметь место серозный
прозрачный выпот.Хилезный экссудат — мутная жидкость молочного цвета, содержащая во взве¬
шенном состоянии мельчайшие жировые капли. При добавлении эфира жидкость
просветляется. Такой выпот обусловлен попаданием лимфы из разрушенных круп¬
ных лимфатических сосудов или грудного лимфатического протока в серозную
полость, встречается при травмах лимфатических сосудов, абсцессах, инфильтра¬
ции сосудов опухолью, филяриозе, лимфоме и др.Хилусоподобный экссудат — молочно-мутная жидкость, появляющаяся в резуль¬
тате обильного распада клеток с жировым перерождением. Поскольку, кроме
жира, данный экссудат содержит большое количество жироперерожденных клеток.
408 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВдобавление эфира оставляет жидкость мутной или просветляет ее незначительно.
Хилусоподобный экссудат характерен для выпотных жидкостей, появление кото¬
рых связано с атрофическим циррозом печени, злокачественными новообразова¬
ниями, туберкулезом, саркоидозом и др.Холестериновый экссудат — густая желтоватая или буроватая с перламутровым
оттенком жидкость с блестящими хлопьями, состоящими из скоплений кристал¬
лов холестерина. Примесь разрушенных эритроцитов может придавать выпоту
шоколадный оттенок. На стенках пробирки, смоченной выпотом, видны слеп¬
ки кристаллов холестерина в виде мельчайших блесток. Такой характер имеет
осумковавшийся выпот, который длительно существует (иногда несколько лет) в
серозной полости, при определенных условиях — обратном всасывании из сероз¬
ной полости воды и некоторых минеральных компонентов экссудата, а также при
отсутствии притока жидкости в замкнутую полость экссудат любой этиологии
может приобрести характер холестеринового. Холестериновый экссудат встреча¬
ется при туберкулезе, злокачественных новообразованиях, разрыве кисты.Слизистый экссудат содержит значительное количество муцина и псевдомуци¬
на, может встречаться при мезотелиоме, муцинозной опухоли яичника, псевдо-
миксоме.Фибринозный экссудат содержит значительное количество фибрина.Встречаются также смешанные формы экссудата {серозно-геморрагигеский,
слизисто-геморрагигеский, серозно-фибринозный).Ни один из перечисленных видов экссудата не является патогномоничным для
злокачественной опухоли, так как может иметь место и при неопухолевых процес¬
сах. При злокачественных новообразованиях с вовлечением серозных оболочек
наиболее часто встречается геморрагический экссудат.МИКРОСКОПИЧЕСКОЕ ИССЛЕДОВАНИЕПодсчет количества клеточных элементов в выпотной жидкости проще и
надежнее проводить в камере Горяева. Клеточный состав выпота исследуют из
осадка, полученного центрифугированием 5-10 мин при 1500-3000 об./мин.
Лучшим способом обработки жидкости является центрифугирование в специаль¬
ной цитоцентрифуге типа Cytospin.Исследование осадкаКоличество осадка, его цвет и плотность зависят от клеточного состава жидко¬
сти, ее вязкости и различных включений. Осадок может быть сероватым, желто¬
ватым, кровянистым; рыхлым и плотным; однослойным и двухслойным, изред¬
ка трехслойным, в серозной прозрачной жидкости осадок обычно небольшой
(0,1-0,3 мл), мелкозернистый, серовато-белый. При мутном характере серозной
жидкости с большим количеством клеточных элементов осадок значительный (до1,0-1.5 мл), крупнозернистый. Геморрагическая жидкость с большой примесью
эритроцитов, как правило, дает двухслойный осадок: верхний слой в виде тонкой
белесоватой пленки и большой нижний слой эритроцитов.Если жидкость содержит значительную примесь лейкоцитов, в том числе
частично распавшихся, и большое количество разрушенных эритроцитов, осадок
может быть трехслойным. Верхний слой осадка состоит из продуктов распада
клеток, за ним идет слой сохранившихся клеток и нижний слой, состоящий из
эритроцитов.в зависимости от характера осадок извлекают из центрифужной пробирки
по-разному. Однослойный небольшой рыхлый осадок встряхивают, каплю осадка
наносят на стекло. Осадок, имеющий 2-3 слоя, желательно извлекать послойно.
Особенно это важно при большой примеси крови, поскольку в верхнем слое,
имеющем вид тонкой белесоватой пленки, сосредоточены почти все клеточные
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 4Q7элементы, при этом необходимо учитывать, что на дне большого кровянистого
осадка могут присутствовать плотные тканевые фрагменты опухоли, поэтому
после осторожного отсасывания и удаления основной массы осадка необходимо
также приготовить мазки из последней небольшой порции со дна пробирки.Очень плотный осадок берут небольшими порциями на отдельные предметные
стекла, распределяют по стеклу ребром пункционной иглы, стеклянной палочкой
или тонкой проволочной петлей. Петлю с осевшими на ней клеточными элемента¬
ми проводят по всей площади стекла в разных направлениях, что позволяет равно¬
мерно распределить клетки по стеклу. Мазки из студневидного осадка приготавли¬
вают препаровочными иглами. Если в осадке обнаружены мелкие крошковидные
массы или отдельные глыбки, их следует перенести на другое предметное стекло и
осторожно растянуть.Проводят исследование нативных и окрашенных препаратов. Микроскопическое
исследование нативных (влажных неокрашенных) препаратов целесообразно
применять как вспомогательный прием к основному методу исследования фик¬
сированных окрашенных мазков. Это дает возможность быстро составить пред¬
ставление о качественном и количественном содержании клеточных элементов в
исследуемой жидкости и правильно отобрать материал для окрашивания.Препараты для окрашивания из рыхлого осадка готовят, как мазки крови. Для
цитологического исследования обычно готовят 4-6 окрашенных мазков. При
большом количестве клеток в выпоте точный цитологический диагноз может быть
поставлен при микроскопии 1-3 препаратов.Плевральный выпотв норме в плевральной полости содержится около 10 мл прозрачной светло-
желтой жидкости. Плевральный выпот определяется как увеличение жидкости в
плевральном пространстве. Рентгенологическое исследование грудной клетки в
переднезадней проекции позволяет выявить плевральный выпот при объеме не
менее 300 мл, в боковой проекции — при объеме не менее 100 мл. Ультразвуковое
исследование (УЗИ) позволяет обнаружить плевральный выпот в количестве не
менее 50 мл. При объеме выпота более 100 мл чувствительность УЗИ по распозна¬
ванию жидкости практически равна 100%.Первичные поражения плевры, приводящие к накоплению выпота в грудной
полости, наблюдаются редко: первичный плеврит может развиваться при травме
грудной клетки, в том числе при проникновении в плевру инфекции. Также редко
встречаются доброкачественные (фиброма, липома, невринома и др.) и злокаче¬
ственные (мезотелиома) опухоли плевры.У подавляюшіего большинства пациентов изменения в плевре возникают как
проявление или осложнение заболеваний других органов и патогенетически явля¬
ются вторичными, несмотря на то что в клинической картине они выступают на
первый план. Наиболее частой причиной образования транссудата в плевральной
полости является декомпенсированная сердечная недостаточность. Более 80%
появления экссудата обусловлено болезнями органов дыхания (пневмонией,
туберкулезом, злокачественной опухолью) или тромбоэмболией легочной арте¬
рии. Плевра может вовлекаться в воспалительный процесс при проникновении в
нее инфекции при флегмоне шеи, остеомиелите ребер, перитоните, панкреатите,
холецистите, при острых и хронических инфекциях (брюшном тифе, дифтерии,
бруцеллезе и др.).Выпот в плевральной полости появляется при метастазах злокачественных
опухолей в плевру и лимфатические узлы средостения, у больных старше 60 лет
метастатические опухоли — самая частая причина плеврального экссудата. Из зло¬
качественных опухолей наиболее часто плевральный выпот встречается при раке
408ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВлегкого — до 50%, раке молочной железы — до 48%, лимфоме — до 26% и раке
яичника — до 8%. При других новообразованиях он выявляется у 1-6% пациентов
(раке желудка, толстой кишки, поджелудочной, предстательной желез, почки и
др.). Плевральный выпот — обычное осложнение как лимфомы Ходжкина (редко
появляется в начале болезни Ходжкина), так и неходжкинской лимфомы (может
возникать с самого начала заболевания). Причины образования плеврального экс¬
судата у больных со злокачественными опухолями представлены в табл. 6-26.Таблица 6-26. Причины и механизмы образования плеврального выпота у онкологических
больныхпрямое влияние опухолиОпосредованное влияние
опухалиВлияние сопутствующей патологииПоражение лимфатических узлов сре¬
достения (снижение лимфатического
оттока из плевры) ГипопротеинемияПатология дыхательной системы
(парапневмонический плеврит и др.)Метастазы в плевру:V обструкция лимфатических сосудов;
у увеличение проницаемости плеврыПневмония вследствие
обструкции бронховПатология сердечно-сосудистой
системы {сердечная недостаточ¬
ность и др.)Закупорка грудного протока {хилото-
ракс)Эмболия сосудов легоч¬
ной артерииПатология ЖКТ (цирроз печени,
панкреатит и др.)Обструкция бронха (снижение внутри-
плеерапьного давления)Состояние после лучевой
терапииПатология почек (нефротический
синдром)Вовлечение перикардаСостояние после химио¬
терапииПатология яичников (синдром
Мейгса и др.)У находящихся в стационаре больных накопление жидкости в плевральной
полости имеет место примерно в 10% случаев. Причины этого следующие:• сердечная недостаточность — 36%;• опухоли молочной железы, легкого, яичника, желудочно-кишечного тракта,
почки, а также лейкоз и мезотелиома — 27%;• воспалительные процессы, в том числе пневмония, состояние после тромбо¬
эмболии легочной артерии, посттравматические состояния, системная крас¬
ная волчанка, туберкулез — 26%;• цирроз печени, множественная миелома, макроглобулинемия Вальденстрема,
бактериальный перитонит и другие заболевания — 11%,Даже после обследования в стационаре до 20% случаев этиология плеврального
выпота остается сомнительной.ПОЛУЧЕНИЕ И ОБРАБОТКА МАТЕРИАЛА ДЛЯ ЛАБОРАТОРНОГО ИССЛЕДОВАНИЯКаждый выявленный случай плеврального выпота, даже при очевидном его
происхождении, предполагает диагностическую пункцию. Практика показывает,
что делать пункцию можно, когда на латерограмме толщина слоя жидкости не
менее 1 см. Если требуется провести пункцию при толщине слоя жидкости менее
1 см, следует использовать УЗИ-контроль.Жидкость из плевральной полости получают с помощью аспирационной пунк¬
ции или при эндоскопическом исследовании (торакоскопии). Обычно удается
получить от 20 до 100 мл плеврального выпота. Для цитологического исследова¬
ния всю полученную при пункции плевральную жидкость необходимо доставлять
в лабораторию, так как важно не упустить опухолевый процесс при малой клеточ-
ности. Рекомендуют определение градиентов между выпотом и сывороткой для
альбумина, общего белка, глюкозы, билирубина, холестерина, триглицеридов и
активности ЛДГ. Пробы крови и плеврального выпота следует брать с интервалом
друг от друга не более 0,5 ч.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 4Q9КЛИНИКО-ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ИЗМЕНЕНИЯ ПОКАЗАТЕЛЕЙ СЕРОЗНОЙ
ЖИДКОСТИ ПЛЕВРАЛЬНОЙ ПОЛОСТИ
Макроскопическое исследованиеДифференциальная диагностика транссудата и экссудата рассматривается в
рамках представления об экссудате/транссудате (табл. 6-27).Таблица 6-27. Характеристика плеврального выпотаЭтиологическая причина выпотаОценка по содержанию белка в выпотеСердечная недостаточностьТранссудат, возможно псевдоэкссудатЗлокачественная опухольЭкссудат, возможно транссудатВоспалениеЭкссудатЭмболия легочной артерииЭкссудат, транссудатБиохимическими критериями отличия транссудата от экссудата являются гра¬
диенты белка и активности ЛДГ между выпотом и сывороткой (табл. 6-28):• если один из этих градиентов превышает дискриминантное значение, то
утверждение, что выпот сформировался как экссудат, имеет диагностическую
чувствительность 99%, специфичность — 89%;• если оба градиента ниже декларированного для экссудата уровня, то диагно¬
стическая чувствительность, что это транссудат, составляет 81%, диагности¬
ческая специфичность — 100%.Особенно важно выяснить тип выпота при дифференциальной диагностике
злокачественной опухоли, при диссеминации которой обычно бывает экссудат, с
сердечной недостаточностью, при которой определяется транссудат.Таблица 6-28. Лабораторные критерии для дифференциации транссудата и экссудатаПоказательТранссудатЭкссудатВнешний видСерозная жидкость светло-желтая илиСерозная жидкость мутная, с нали¬зеленоватая, главным образом прозрачнаячием фибринозных сгустков, следови чистаякрови, гноя, хилезнаяОбщий белок, г/л<30>30Выпот/сыворотка<0,5>0,5ЛДГ. МЕ/л<2/3 верхней границы референтного диа¬>2/3 верхнего референтного значенияпазона для сывороткидля сывороткиВыпот/сыворотка<0,6>0,6Плевральный транссудатПлевральный транссудат при застойной сердечной недостаточности образуется
в результате увеличенного гидростатического давления в капиллярах, это состоя¬
ние особенно выражено при легочной гипертензии. Сердечная недостаточность с
присущим ей повышением системного и легочного давления— самая частая при¬
чина плевральных транссудатов. Выпот при этом двусторонний, но больше справа.
При тромбоэмболии легочной артерии (ТЭЛА) в 20% плевральные выпоты отно¬
сятся к транссудатам.Сниженное онкотическое давление, вызванное гипоальбуминемией, может
быть причиной развития транссудата в плевральной полости при циррозе пече¬
ни или нефротическом синдроме; это происходит при увеличении секвестрации
жидкости в полость, превышающей дренирующие возможности лимфатических
сосудов, в таких случаях выпот двусторонний и сочетается с генерализованными
отеками.Коллапс легкого в случаях ателектаза или рака легкого может привести к обра¬
зованию транссудата в плевральной полости из-за увеличения отрицательного
410ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВвнутриплеврального давления и соответственно повышения градиента гидроста¬
тического давления.У больных с портальной гипертензией асцитическая жидкость может проникать
в плевральное пространство. То же самое может произойти у пациентов на пери¬
тонеальном диализе. Кроме того, при обструкции мочевого пузыря моча также
может попадать в плевральное пространство, что вызывает уроторакс.Плевральный экссудатОсновным признаком экссудата является высокое содержание в нем белка,
который повышается в результате нарушения проницаемости плевральных капил¬
ляров при инфекции или опухолевом поражении. Экссудативный выпот развива¬
ется при некоторых системных заболеваниях, в частности при системной красной
волчанке, ревматоидном артрите, что может быть обусловлено локализованным
воспалением плевры.Окклюзия лимфатических сосудов внутри париетальной плевры или инвазия
медиастинальных лимфатических узлов злокачественной опухолью может при¬
вести к накоплению богатой белками жидкости в плевральном пространстве.
Тяжелый воспалительный процесс, в частности бактериальная эмпиема, может
привести к нарушению лимфатического оттока из-за набухания мезотелиальных
клеток или накопления фибрина, коллагена и элементов клеточного некроза, бло¬
кирующих лимфатический дренаж.Примерно 80% всех экссудатов появляется при пневмонии, злокачественной
опухоли или тромбоэмболии легочной артерии. Экссудативный выпот в плевраль¬
ное пространство имеет место у 30-50% больных с одним из этих трех патологи¬
ческих процессов. Примерно в 5% случаев экссудат связан с развитием какой-либо
относительно редкой патологии, например саркоидоза.При плеврите, вызванном грибами, плевральная жидкость экссудативная.
Примерно у 10% больных с бластомикозом появляется плевральный выпот, у
7% больных с первичным кокцидиоидомикозом возникает массивный выпот, что
может быть обусловлено прорывом кокцидиоидомикозной каверны в плевраль¬
ную полость, при пневмониях вовлечение в воспалительный процесс прилежащей
висцеральной плевры часто приводит к острому плевриту и пропотеванию сероз¬
ного плеврального экссудата, в котором содержится много нейтрофилов и иногда
обнаруживают микроорганизмы. Вирусный плевральный экссудат иногда наблю¬
дается у пациентов без клинических и инструментальных признаков пневмонии.Макроскопический вид плевральной жидкостиПлевральную жидкость следует внимательно рассмотреть до и после центрифу¬
гирования. В зависимости от вида жидкости следует решить, какие исследования
наиболее значимы в конкретном случае (табл. 6-29,6-30).Таблица 6-29. Рекомендуемые исследования плевральной жидкости до центрифугированияВидОписаниеРекомендуемые исследованияСерозный выпот
светло-желтого,
соломенного цвета,
прозраченТранссудат невоспалительный из-за сер¬
дечной недостаточности или опухоли, а
также возникший из-за диспротеинемии
при циррозе печени или почечной недо¬
статочностиАльбумин, общий белок, глюкоза,
креатинин, ЛДГ, лейкоцитыМутный серозный
выпотВоспалительный зкссудат при пневмонии,
туберкулезном, сифилитическом или дру¬
гих видах плевритаЛейкоциты, дифференцировка кле¬
точного состава, pH, лактат, иденти¬
фикация бактериальной микрофлоры
микобактерийПримесь кровиБолее 10 ООО зритроцитов/мкл в результа-
ге инфаркга легочной ткани, геморрагии
в плевральную полость или это «пяевая»
кровьПодсчет эритроцитов и лейкоцитов,
жидкость просветляется после центри¬
фугирования (если эритроциты еще
интактны)
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 411Окончание табл. 6-29ВидОписаниеРекомендуемые исследованияГеморрагическая
серозная жидкостьГематокрит >1% в результате опухоли,
тромбоэмболии легочной артерии или
травмы грудной клетки. Вследствие кро¬
вотечения при опухоли и гемотораксе
после травмы гематокрит плеврального
эффузата составляет более 50% гемато¬
крита кровиПодсчет эритроцитов и лейкоцитов,
гемоглобин, опухолевые маркерыМолочного вида
(хилезная)Жиросодержащий эффузат при травме
или спонтанном хилотораксе с триглице¬
ридами и хиломикронамиХолестерин, триглицериды, хиломи¬
кроныПримесь гнояПиоторакс, туберкулезная или неспеци¬
фичная бактериальная эмпиемаЛейкоциты, эритроциты, дифферен-
цировка клеточного состава, иденти¬
фикация бактериальной микрофлоры,
включая микобактерии туберкулезаТаблица 6-30. Рекомендуемые исследования плевральной жидкости после центрифугированияВидРекомендуемые исследованияПрозрачная или мутная жидкостьВозможна эмпиема: подсчет лейкоцитов, pH, глюкозы, ЛДГМутная, молочного вида (опалесцирует)Холестерин, триглицериды, хиломикроныГеморрагическаяГемоглобин, холестерин, триглицериды, хиломикроныЯрко-желтая, зеленоватаяБилирубинГнойнаяПодсчет эритроцитов, лейкоцитов, глюкозы, pHТягучий выпот указывает на вероятность мезотелиомы плевры с высоким
содержанием гиалурсновой кислоты.Гнилостный запах в сочетании со следами гноя почти всегда доказывает нали¬
чие анаэробной флоры в плевральном выпоте.Определение концентрации холестерина и содержания раково-эмбрионального
антигена (РЭА) в плевральном выпоте используют для дифференциальной диа¬
гностики опухолевого и неопухолевого происхождения выпота. Для этой же цели
определяют СА 15-3.Биохимические показателиШдростатическое давление в париетальной плевре выше, чем в висцеральной.
Основные лимфатические сосуды расположены в висцеральной плевре, из них
формируется плевральная жидкость, в нее попадают белок и клетки. В течение1 сут объем плеврального фильтрата превышает 1 л, при этом постоянно про¬
исходят фильтрация жидкости в плевральное пространство и реабсорбция ее
обратно в лимфатические сосуды. Низкомолекулярные соединения присутствуют
в плевральной жидкости в такой же концентрации, как в сыворотке крови, а кон¬
центрация высокомолекулярных соединений ниже, чем в сыворотке. Референтные
интервалы для наиболее часто исследуемых показателей в серозной жидкости
плевральной полости представлены в табл. 6-31.Общий белок, отношение белокКонцентрация общего
белка менее 30 г/л указывает на транссудат, тогда как более 30 г/л — на экссудат.
Отношение белок„,„^„^„.„„„убелок^ , более 0.5 указывает на экссудат с кли-
нической чувствительностью 92%, специфичностью 93%. Самое низкое содержа¬
ние белка в плевральном выпоте бывает у больных с нефротическим синдромом и
самое высокое — при туберкулезе.При выпоте, вызванном туберкулезом, концентрация общего белка в выпотной
жидкости находится обычно в диапазоне 35-65 г/л, при пневмонии и злокаче¬
ственных опухолях — 20-60 г/л.
412 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВТаблица 6-31. Референтные интервалы лабораторных показателей для плевральной жидкостиПоказательРеферентный интервалОбщий белок10-20 г/л, из которых 50-70% приходится на альбуминКлеточный состав, количество;• мезотелиальные клетки;• моноциты;• гранулоциты;• лимфоциты1000-5000/мкл3-70%30-75%До 10%2-30%ГлюкозаКонцентрация такая же, как в плазме кровиАктивность ЛДГМенее 50% сывороточной активностиpHБольше, чем плазмыОбъем0,1-0,2 мл/кг массы телаГлюкоза в концентрации более 5,3 ммоль/л присутствует в транссудате в 97%
слзг^іаев. Уровень глюкозы более 8,3 ммоль/л встречается примерно в 6% случаев
плевральных выпотов, особенно часто при лимфоме, циррозе печени, опухолях
почек, гипопротеинемии и сахарном диабете.Концентрация глюкозы в плевральной жидкости менее 2,8 ммоль/л считается
пониженной. Такая низкая концентрация наблюдается в 7% случаев плеврального
выпота и характерна для рака легкого и печени, системной красной волчанки, рев¬
матоидного артрита, туберкулеза. Концентрация глюкозы в плевральной жидко¬
сти менее 1,7 ммоль/л сочетается с хроническим полиартритом, злокачественны¬
ми опухолями и эритремией. При выпоте, вызванном злокачественной опухолью,
уровень снижения концентрации глюкозы отражает активность опухолевого про¬
цесса, очень низкие значения (<0,56 ммоль/л, или <10 мг/мл) свидетельствуют о
плохом прогнозе заболевания.Лактат. Нормальная концентрация лактата в плевральной жидкости и в
плевральном выпоте, не связанном с бактериальной инвазией (циррозом пече¬
ни, нефрозом, травмой или системной красной волчанкой), составляет 0,67-
5,20 ммоль/л (6-47 мг/дл). Концентрация лактата в интервале 5-22 ммоль/л
(45-200 мг/дл) указывает на бактериальную инфекцию. Очень высокие значения
лактата в плевральном выпоте выявлены при метастазах.Клеточные элементы пунктата из серозной полостиДля постановки верного цитологического заключения, помимо данных микро¬
скопического анализа, нужны сведения о предшествующем лечении (лучевом,
химиотерапевтическом и т.д.), вызывающем деструктивно-дистрофические изме¬
нения клеточных элементов, а также данные о различных вмешательствах, трав¬
мирующих мезотелиальный покров.Основными морфологическими элементами, которые можно обнаружить в
выпотах из серозных полостей, являются:• клетки крови и рыхлой соединительной ткани (эритроциты, лейкоциты, в
том числе нейтрофилы, эозинофилы, лимфоциты, плазматические клетки,
гистиоидные элементы);• мезотелий;• клетки злокачественных новообразований.Из неклеточных элементов можно выявить:• клеточный детрит (мелкозернистую массу из разрушенных клеток — гной¬
ные процессы, опухоли и т.д.):• капли жира (выпуклые, круглые, разного размера, хорошо преломляют
свет — экссудаты с клеточным распадом);• кристаллы холестерина (тонкие бесцветные таблички с обломанным углом —
туберкулез, опухоли, старые осумкованные выпоты);
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 413кристаллы гематоидина (золотисто-желтые иглы, иногда в виде ромба, звез¬
ды, метелочки — показатель наличия «старой» крови);аллергические процессы).Клеточный состав серозной жидкости отличается значительным разнообрази¬
ем. В ней присутствуют в разных количествах мезотелиальные клетки, гистиоид-
ные элементы, макрофаги, лимфоциты, реже эозинофилы, тучные клетки и ней-
трофильные лейкоциты, в патологических условиях при нарастании экссудации
количество слущенных мезотелиальных клеток увеличивается, а соотношение их с
другими видами клеточных элементов зависит от характера патологического про¬
цесса, стадии его развития и реактивности организма.При исследовании жидкости из серозных полостей важнейшим критерием
качественного анализа является дифференциальная диагностика клеточных эле¬
ментов злокачественного новообразования с мезотелиоцитами и гистиоидными
элементами. Это иногда проблематично, так как при слущивании и длительном
пребывании в жидкости клетки могут подвергаться деструктивно-дистрофическим
изменениям, увеличиваться в размерах и изменять форму. Часто возникают труд¬
ности в интерпретации обнаруженных клеток злокачественного новообразования.
Последнее связано с тем, что клетки, находящиеся в жидкости во взвешенном
состоянии, могут округляться, резко усиливается их полиморфизм, что приводит к
тому, что опухоль теряет морфологические особенности исходной ткани.Задачи цитологического исследования:• определить характер патологического процесса (неопухолевый или опухоле¬
вый);• при неопухолевом процессе идентифицировать клеточный состав (клетки
мезотелия, лимфоциты, эозинофильные, нейтрофильные лейкоциты, лим¬
фоциты, плазматические клетки);• в случае опухолевого поражения определить его первичный или метастатиче¬
ский характер;• по возможности определить первичный очаг и/или гистологическую форму
опухоли (плоскоклеточный, железистый, мелкоклеточный и другие формы
рака, неэпителиальные опухоли).Эритроциты выявляются в серозной полости в виде желтоватых (в нативных
препаратах) или розовых (в окрашенных препаратах) дисков в разном количестве
в зависимости от причины, вызвавшей их появление (травмы, злокачественного
новообразования, инфекции и т.д.). В серозном транссудате и экссудате их наличие
связано с травмой сосудов при пункции.Нейтрофилы входят в состав клеток плевральной жидкости в количестве до
10%. Преобладание нейтрофилов говорит о фоновой пневмонии и парапневмо-
ническом выпоте, который обычно бывает стерильным. Увеличение количества
нейтрофилов наблюдается при инфаркте легкого и панкреатите. Содержание ней¬
трофилов в плевральной жидкости может повышаться при заболеваниях, напря¬
мую не затрагивающих плевральную полость, в частности при травме пищевода,
субдиафрагмальном абсцессе, неспецифической эмпиеме. Если при пневмонии
с плевральным выпотом организм больного неспособен бороться с инфекцией,
количество нейтрофилов и микроорганизмов в экссудате возрастает, жидкость
макроскопически выглядит, как гной (эмпиема плевры).Нейтрофильные лейкоциты преобладают в гнойном экссудате любой этиологии.
Наличие нейтрофильных лейкоцитов в стадии дегенеративного распада на фоне
детрита и обильной микрофлоры свидетельствует о тяжести процесса. При выра¬
женных дегенеративных процессах вместо лейкоцитов могут оставаться лишь так
называемые клетки-тени. Дегенеративно измененные, сморщенные нейтрофилы
иногда ошибочно принимают за лимфоциты, В затруднительных случаях следуетш• кристаллы Шарко-Лейдена (в виде бесцветных игл, стрелок компаса — Щт
414 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВобращать внимание на структуру хроматина ядер: для лимфоцитов характерен
грубоглыбчатый хроматин.Эозинофильные лейкоциты — преимущественно бисегментированные клетки с
оранжевой гранулярной зернистостью. Дифференцировать их удается по харак¬
терным ядрам в виде пенсне, в отличие от эозинофилов (в мазках крови зерни¬
стость эозинофилов в выпоте может быть выражена нечетко). Эозинофильная
инвазия отмечается, если количество эозинофилов превышает 10% клеточного
состава плевральной жидкости. Эозинофилы могут появляться в серозном экс¬
судате при туберкулезном плеврите, опухолях, травмах, паразитарных, грибковых
заболеваниях, аллергических реакциях.Наиболее распространенной причиной эозинофилии плевральной жидкости
является попадание воздуха в плевральную полость. Если при первой пункции
количество эозинофилов не было увеличено, а при повторных процедурах отме¬
чается эозинофилия, скорее всего, это связано с небольшим пневмотораксом,
возникшим в результате торакоцентеза. Второй распространенной причиной эози¬
нофилии в плевральной жидкости может быть попадание крови в плевральную
полость. После травматического гемоторакса количество эозинофилов в плевраль¬
ной жидкости значительно увеличивается со второй недели. Плевральный выпот,
вызванный эмболией сосудов легких, также часто связан с попаданием крови в
плевральную полость, в результате количество эозинофилов в нем значительно
увеличивается. Возможен эозинофильный выпот на начальных стадиях диссеми-
нации злокачественной опухоли по серозной оболочке.Лимфоциты более стойкие, чем нейтрофилы, и в меньшей степени подвергают¬
ся дегенеративным изменениям в выпотной жидкости. Лимфоциты в плевральной
жидкости составляют в норме от 2 до 30% клеток, или до 10-15 в поле зрения в
транссудате. При выпоте, вызванном туберкулезом или злокачественной опухолью,
наблюдается лимфоцитоз с преобладанием молодых форм лимфоцитов. Наличие
множества мелких зрелых лимфоцитов, особенно в сочетании с мезотелиальными
клетками, свидетельствует о туберкулезе. Лимфоциты в плевральной жидкости
повышаются также при хроническом воспалении, вирусных и микоплазменных
инфекциях. Лимфоциты часто имеют неровные границы и содержат расщепленное
ядро. Существует мнение, что, если в экссудативном плевральном выпоте более
50% лейкоцитов представлены малыми лимфоцитами, это важный диагностиче¬
ский признак, означающий наличие у больного, вероятнее всего, туберкулеза или
злокачественного новообразования.Плазматигеские клетки выпотной жидкости морфологически не отличаются от
плазматических клеток крови. При затяжном характере воспалительного процесса
в серозной полости их можно выявить в значительном количестве.Мононуклеарпые фагоциты имеют диаметр в пределах 10-50 мкм. Клетки раз¬
нообразны по форме и окраске. Макрофагами называют гистиоциты с признаками
фагоцитоза, в зависимости от серозных полостей их обозначают как плевральные,
перитонеальные и т.д. Ядра у них округлой, овальной или неправильной, при¬
чудливой формьЕ. Распределение хроматина может быть либо нежно-сетчатым и
равномерным, либо более плотным и неравномерным. Ядрышки не всегда хорошо
видны. Нередко макрофаги содержат включения в виде остатков ядер лейкоцитов
и других клеток, эритроцитов, капель жира, гемосидерина и т.д.Мезотелий — однослойный плоский эпителий, выстилающий серозные оболоч¬
ки плевральной, перикардиальной и брюшной полости и попадающий в выпотную
жидкость в результате слущивания. Пласты из клеток неизмененного мезотелия
можно обнаружить в препаратах, полученных при эндоскопическом исследо¬
вании (торакоскопия — исследование плевральной полости, лапароскопия —
брюшной полости). Нередко такие пласты встречаются в материале, полученном
при пункции дугласова пространства. Слущенные клетки мезотелия принимают
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 415округлую или овальную форму и располагаются преимущественно разрозненно. 3.
При пролиферации мезотелия под действием различных факторов (инфекций, g
травм, лекарственных средств, диссеминации злокачественного процесса) увели- V
чивается общее количество и размеры клеток. Ядра увеличены, гиперхромные,
отмечается резкая базофилия цитоплазмы и ядрышек за счет увеличения содер¬
жания РНК в интенсивно пролиферирующих клетках, иногда увеличивается
ядерно-цитоплазматическое соотношение; можно обнаруживать клетки, в кото¬
рых ядерно-цитоплазматическое соотношение сдвинуто в сторону ядра.Различные патологические процессы могут сопровождаться дегенеративными
и дистрофическими изменениями мезотелия. Клетки округлой или неправильной
формы среднего размера. Ядра их в состоянии пикноза, лизиса или с разреженным
рисунком хроматина, расположены центрально или эксцентрически. Цитоплазма
вакуолизирована, пенистая, что может придавать клеткам мезотелия сходство с
гистиоидными элементами. Вакуоли в цитоплазме могут накладываться на ядра, и
их границы становятся зазубренными.При острых воспалительных процессах клетки мезотелия могут приобретать
выраженные признаки атипии, их становится трудно отличить от клеток рака.В начале острого воспалительного процесса появляется большое количество мезо¬
телия с выраженными признаками пролиферации в симпластах (многоядерных
структурах без клеточных границ), железистоподобных структурах и разрознен¬
но. Преобладают крупные клетки с резко выраженной базофилией цитоплазмы
и гиперхромией ядер, увеличением ядерно-цитоплазматического соотношения.В ядрах часто просматриваются увеличенные ядрышки. Многие клетки обладают
способностью к фагоцитозу. Встречаются гигантские многоядерные клетки. Резко
выраженная пролиферация клеток мезотелия с атипией наблюдается при механи¬
ческом и химическом повреждении серозного покрова (оперативном вмешатель¬
стве, травме, случайном попадании контрастной массы в серозную полость и т.д.).При хронигеской сердегной и погегной недостатогности в вьшотном материале пре¬
обладают округлые клетки небольшого и среднего размера, расположенные разроз¬
ненно, в виде небольших пластов и скоплений; могут встречаться единичные струк¬
туры, сходные с же.лезистоподобными. Ядра клеток обычно небольшие, цитоплазма
слабобазофильная. Большая часть клеток находится в состоянии дистрофии, дегене¬
рации. Резко выраженных признаков пролиферации с атипией не наблюдается.В жидкости из дугласова пространства, пункцию которого чаще всего выпол¬
няют при доброкачественных опухолях матки и яичника, клетки мезотелия рас¬
положены, как правило, в виде обширных однослойных пластов, имеют округлую,
полигональную, ромбовидную или вытянутую форму, реже — кубическую или
призматическую (в основном по краю пласта). В пластах сохраняется правильное
расположение (рядность) клеток. Ядра округлой или овальной формы, в клетке
чаще занимают центральное положение, имеют равномерный мелкозернистый
или смазанный рисунок хроматина. У части клеток ядра небольшие при относи¬
тельно широкой зоне цитоплазмы, у других могут быть укрупнены и окрашены
более интенсивно. Цитоплазма пылевидно-зернистая или мелкосетчатая, может
окрашиваться в различные тона (от светло-голубых и почти бесцветных до насы¬
щенно синих). Выраженная базофилия цитоплазмы сочетается обычно с укрупне¬
нием размеров и интенсивным окрашиванием ядер, эти признаки пролиферации
мезотелия свойственны всем клеткам одного пласта. В пределах пластов границы
между клетками могут быть четкими либо смазанными и улавливаться лишь по
более светлому ободку цитоплазмы. В некоторых пластах тесное взаимное рас¬
положение клеток может нарушаться, пласт как бы разрыхляется, клетки остаются
соединенными между собой лишь тонкими цитоплазматическими нитями.При системной красной волганке выпот может быть обнаружен в любой из сероз¬
ных полостей, чаще в плевральной или перикардиальной, реже в перитонеальной.
416 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВИногда выпот является первым проявлением заболевания. Цитологические при¬
знаки: LE-клетки (Lupus Erithematosus celb), клетки с дегенеративными измене¬
ниями, ядерный детрит. В мазках обнаруживают элементы воспаления, клетки
мезотелия. Патогномоничным признаком системной красной волчанки считают
LE-клетки — фагоциты (чащенейтрофильные), содержащие гомогенизированный
ядерный материал из других клеток («гематоксилиновое тельце»). Этот матери¬
ал обычно имеет округлую форму, окрашивается в различные тона малиново-
фиолетового цвета, заполняет почти всю цитоплазму нейтрофила, оттесняя ядро
к периферии клетки. Иногда ядро теряет сегментированность. Можно обнаружить
«розетки» — скопления фагоцитов вокруг гомогенизированного ядерного мате¬
риала. Обнаружение LE-клеток в выпотной жидкости иногда может быть про¬
явлением других заболеваний, поэтому для установления правильного диагноза
необходимо использовать и другие диагностические подходы.ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ОПУХОЛЕВЫХ ПОРАЖЕНИЙРяд лабораторных показателей выпотных жидкостей, в том числе обнаружение
опухолевых маркеров в концентрациях выше порогового значения, позволяет
предположить наличие опухолевого поражения плевры. Однако для уверен¬
ного суждения о характере процесса необходима морфологическая верифика¬
ция процесса с помощью цитологического или гистологического исследования.
Дополнительными методами для выявления опухолевого процесса служат цито¬
химические, иммуногистохимические и иммуноцитохимические исследования,
определение хромосомных аберраций, генетический анализ, проточная цито-
флюориметрия.Опухолевые маркерыИсследование опухолевых маркеров позволяет получить крайне важную
диагностическую информацию, позволяющую предположить наличие злока¬
чественной опухоли и выбрать правильный алгоритм обследования пациента.
Отрицательный результат при определении опухолевых маркеров нельзя считать
доказательством отсутствия злокачественного поражения, в то время как присут¬
ствие опухолевого маркера в значениях, превышающих пороговое, является при¬
знаком, указывающим на неопластический процесс, и требует крайне тщательного
обследования больного.Раково-эмбриональный антигенПороговое значение РЭА в плевральном вьіпоте, равное 3 мкг/л, имеет диагно¬
стическую чувствительность для выявления злокачественной опухоли 48-57%,
диагностическую специфичность — 78-99%, положительное предсказательное
значение — 87%, отрицательное предсказательное значение — только 32%,
Дополнительное исследование С А 19-9 с установленным пороговым значением
30 ЕД/мл увеличивает диагностическую чувствительность выявления опухоли
примерно на 10%, специфичность -- на 15%. Уровень РЭА обычно выше при мета¬
статическом поражении, чем при мезотелиоме плевры.При пороговом значении, равном 4,5 мкг/л, диагностическая чувствительность
дифференциальной диагностики между выпотом, вызванным диффузной злокаче¬
ственной мезотелиомой, и опухолью легкого составляет 68% при специфичности
94%, При уровне РЭА в плевральном выпоте более 4,5 мкг/л положительное пред¬
сказательное значение рака легкого составляет 90%, отрицательное — 81%.Повышенная концентрация РЭА в серозном выпоте определяется при ряде
доброкачественных заболеваний, в частности при аденоме бронха, послеопераци¬
онном фиброзе легкого, туберкулезном или вирусном плеврите, сепсисе, циррозе,
сердечной недостаточности, лечении радиоактивным облучением. В этих случаях
концентрация РЭА в плевральной жидкости в среднем составляет 1,5 мкг/л, коле¬
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 417бания — от 0,4 до 3,0 мкг/л. При выпоте, вызванном злокачественными опухоля¬
ми, концентрация РЭА в плевральной жидкости в среднем определена на уровне
113 мкг/л с колебаниями от 0,6 до более 3200 мкг/л.Раковый антиген 15-3 (СА15-3)Пороговое значение СА 15-3 в плевральном выпоте, равное 25 ЕД/мл, имеет
диагностическую чувствительность для выявления злокачественной опухоли 48%,
диагностическую специфичность — 97%.Фрагмент цитокератина 19 (CYFRA 21-1)Показания к определению — немелкоклеточная и плоскоклеточная карци¬
нома легких. Может быть использован для мониторинга течения мышечно¬
инвазивной карциномы мочевого пузыря. Средняя концентрация CYFRA 21-1 в
плевральном выпоте при реактивных заболеваниях составляет 41 мкг/л с коле¬
баниями от 1,4 до 225 мкг/л. Концентрация CYFRA 21-1 в выпоте, вызванном
злокачественной опухолью, составляет в среднем 533 мкг/л с колебаниями от2,3 до более 8500 мкг/л. При пороговом значении, равном 50 мкг/л, диагности¬
ческая чувствительность выявления злокачественной опухоли составляет 38%,
специфичность — 82%.Цитологическое исследованиеУ мужчин наиболее часто опухолевые клетки в плевральном выпоте обнару¬
живают при раке легкого, лимфоме и лейкозах, 0п)0£0лях желудочно-кишечного
тракта, У женщин опухолевые клетки в плевральном вьіпоте чаще обнаруживают
при опухолях молочной железы, примерно в 60% случаев опухоль относится к
аденокарциноме. Приблизительно в 14% случаев исследование клеточного соста¬
ва плеврального выпота является первым диагностическим признаком опухоли.
Иногда лабораторное обнаружение опухолевых клеток в асцитической жидкости
предшествует клинической манифестации опухоли на 3 года и более. Далеко не
во всех случаях плеврального выпота, вызванного злокачественной опухолью, в
выпотной жидкости обнаруживают опухолевые клетки, но цитологическое иссле¬
дование необходимо выполнять всегда, особенно при данных о злокачественном
процессе.Злокачественные опухоли серозных оболочек могут быть первичными (мезо-
телиома) и вторичными, т.е. метастатическими. В большинстве случаев при опу¬
холях серозных оболочек появляется экссудат, в котором обнаруживают атипич¬
ные клетки. Следует учитывать, что в жидкой среде все клетки, как опухолевые,
так и неопухолевые, имеют тенденцию округляться, их специфические черты
сглаживаются, они становятся похожими друг на друга. В то же время диффе¬
ренциальная диагностика реактивных изменений мезотелия и злокачественных
поражений является непременным условием цитологического исследования экс¬
судата, Несмотря на некоторое сходство клеток мезотелия с резко выраженными
реактивными изменениями и клеток злокачественных опухолей, у них имеются и
существенные различия (табл. 6-32),Перечисленные признаки опухолевых и мезотелиальных клеток не всегда
встречаются во всей совокупности. Это зависит, с одной стороны, от степени
реактивных изменений мезотелия, с другой — от степени дифференцировки
опухолевых клеток. Если нет полной уверенности в характере патологического
процесса, могут помочь повторные исследования, поскольку мезотелиальные
клетки с выраженными признаками атипии реактивно-воспалительной природы
в процессе лечения быстро исчезают, к тому же соотношение различных видов
сопутствующих клеток значительно меняется. Большую помощь в определении
характера поражения мезотелия способны оказать иммуноцитохимические
исследования.ш
418 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ^ Таблица 6-32. Морфологические особенности мезотелия при доброкачественных и злокачествен-
ных процессахЦитолагическме при¬
знакиКлетки мезотелияКлетки злокачественных опухолейХарактер расположе¬
ния клетокПреимущественно в однослойных
пластах, часто с разрыхлением, сим¬
пластах и разрозненно. Редко в виде
многослойных образованийПреимущественно в виде многоспойных
комплексов и железистоподобных струк¬
тур. Иногда преобладает однослойное
расположение клетокРазмер клетокНебольшая разница в размерах (диа¬
метр —12-30 мкм)Резкий полиморфизм размера: от мелких
(10-15 мкм) до гигантских (100-200 мкм)
клетокЯдраЯдра в клетках одного типа моно-
морфные, имеют одинаковые размер
и формуЯдра полиморфные, разных размера и
формы (иногда причудливой), с неров¬
ным контуром ядерной мембраны, нерав¬
номерным распределением хроматина.В скоплениях и комплексах ядра значи¬
тельно отличаются по размерамЯдрышкиОтсутствуют или одиночные правиль¬
ной формы, небольшого размераПрисутствуют во многих ядрах, отличают¬
ся по размеру и формеГиперхромия ядер и
цитоплазмыГиперхромия ядер сочетается с
гиперхромией цитоплазмы и наоборотГиперхромия ядер может сочетаться со
светлой цитоплазмой и наоборотСочетание выражен¬
ной гиперхромии ядер
с вакуолизированной,
пенистой цитоплаз¬
мойНе наблюдаетсяВстречается частоИзменения в клетках
одного типаВ клетках одного типа отмечаются
сходные измененияВ клетках одного типа отмечается клеточ¬
ный и ядерный полиморфизмМногоядерные клеткив многоядерных клетках ядра сходных
размера и формы В многоядерных клетках ядра разных раз¬
мера и формыЦитологическая картина экссудата при мезотелиомеМезотелиома — первичная опухоль серозных оболочек, субстратом которой
является мезотелий; встречается редко, может локализоваться в плевре, брюшине,
перикарде, а также в придатке яичка и области маточных труб (аденоматоидная
опухоль). Выделяют доброкачественный и злокачественный варианты мезотелио-
мы. К доброкачественным относят аденоматоидную опухоль половых органов, а
также фиброзную мезотелиому. Все остальные виды мезотелиом — злокачествен¬
ные.Фиброзная мезотелиома представляет собой медленно растущий, четко
ограниченный узел в висцеральной плевре, на разрезе — плотный, слоистый.
Микроскопически имеет строение богатой клетками фибромы. Только в культуре
ткани удается доказать происхождение клеток опухоли из мезотелия.Злокачественная мезотелиома встречается в плевре, брюшине и перикарде. Это
достаточно редкое заболевание (1 наблюдение мезотелиомы плевры» например,
приходится на 200 наблюдений рака легкого). Возраст людей, наиболее под¬
верженных заболеванию, — 40-60 лет. Макроскопически опухоль имеет форму
плотного инфильтрата, вызывающего резкое утолщение (до 2-3 см, иногда более)
серозной оболо^іки на ограниченном участке или же распространяющегося на весь
париетальный или висцеральный ее листок (в плевре, перикарде), окружающего
орган в виде панциря. Реже, главным образом в брюшной полости, где поражается
преимущественно сальник, опухоль может иметь форму нерезко ограниченного
узла или нескольких сливающихся узлов. В толще инфильтратов и узлов располо¬
жено много щелей и кист с серозным, кровянистым или слизистым содержимым,
в серозной полости, если она не облитерирована, экссудат скапливается уже на
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 419ранних стадиях заболевания, хотя у небольшой части пациентов он отсутствует
даже при распространенном процессе. Выпот геморрагический или серозный, ино¬
гда вязкой, тягучей (студенистой) консистенции. Для мезотелиомы плевры харак¬
терно одностороннее поражение. Заболеванию свойственно быстрое накопление
больших объемов жидкости (до 3 л), иногда в течение одного дня, несмотря на
систематическую эвакуацию.Клеточный состав экссудата при мезотелиоме в каждом отдельном случае
отличается значительным своеобразием, однако по совокупности наиболее общих
цитоморфологических признаков все цитограммы могут быть разделены на три
основные группы:• цитограмма напоминает картину регенераторно-пролиферативных процессов;• цитограмма напоминает картину железистого рака;• цитограмма смешанного типа.Железистый ракЖелезистый рак является наиболее частой причиной поражения серозных
оболочек. Морфологические особенности опухолевых клеток брюшной и плев¬
ральной полости идентичны. Однако при дифференциальной диагностике необхо¬
димо иметь в виду, что наиболее часто брюшина поражается при раке желудочно-
кишечного тракта и яичников, а плевра — при раке легкого и молочной железы.
Опухоли других локализаций метастазируют по серозному покрову значительно
реже. Наиболее часто встречающиеся метастазы злокачественных опухолей по
серозным оболочкам у женщин, мужчин и детей представлены в табл. 6-33.Таблица 6-33. Часто встречающиеся метастазы злокачественных опухолей по серозным обо¬
лочкамМетастазызлокачественныхновообразованийЖенщиныМужчиныДетиПлевральный выпотРак молочной железы,
яичника, ЖКТ, легкого;
лимфома и пр.Рак легкого, ЖКТ;
лимфома и пр.Лейкозы; лимфомаВыпот в брюшной
полостиРак яичника, молочной
железы, ЖКТ; лимфома
и пр.Рак ЖКТ; лимфома
и пр.Мелкие круглоклеточные опу¬
холи (нейробластома,
нефробластома,
рабдомиосаркома,
саркома Юинга)Экссудат при диссеминации рака легкогоПри цитологическом исследовании в экссудате могут быть определены три
основные формы рака легкого: аденокарцинома, мелкоклеточный и плоскокле¬
точный.Наиболее часто встречаются метастазы аденокарциномы, для которой харак¬
терно обилие элементов опухоли с выраженной атипией и полиморфизмом.
Оп>'холевые клетки в экссудате присутствуют обычно в большом количестве,
расположены в виде комплексов округлой или неправильной формы, железисто-
подобных структур, рядов различной протяженности, симпластов, а также в ско¬
плениях и разрозненно. Папиллярные структуры встречаются редко. Как правило,
преобладают клетки больших размеров, часто встречаются одно- и многоядерные
гигантские клетки. Реже в комплексах встречаются кубические и призмати¬
ческие клетки. Границы клеток могут быть ровными, четкими, но достаточно
часто встречаются клетки с округлыми и ворсинчатыми выростами цитоплазмы.
Характерен выраженный полиморфизм ядер. Они крупные, округлые, овальные
и причудливой формы. Наблюдаются значительные различия в интенсивности
420 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВокрашивания ядер и строении хроматина. Встречаются светлые ядра с равномер¬
ным рисунком хроматина, гиперхромные с грубым или разреженным рисунком
хроматина, пикнотичные и с выраженными признаками дегенеративных измене¬
ний. В ядрах выявляются гипертрофированные одиночные или множественные
ядрышки. Цитоплазма, как и ядра, разнообразна по интенсивности окрашивания,
может быть тяжистой. Наряду с клетками, имеющими интенсивно окрашенную
цитоплазму, встречаются клетки с серовато-голубоватой или почти бесцветной
цитоплазмой. В таких обесцвеченных клетках, как правило, просматривается
зернистая или хлопьевидная структура цитоплазмы. Наглядным отличием таких
клеток от пролиферирующих мезотелиальных является сочетание крупных,
хорошо сохранившихся ядер с неровными контурами и светло-зернистой, почти
бесцветной цитоплазмой. Выраженная гиперхромия ядер и их резко увеличенные
размеры в пролиферирующих клетках мезотелия сочетаются с насыщенно синей,
иногда мелкозернистой цитоплазмой. Секретирующие клетки встречаются часто
и в значительном количестве. Секрет расположен в апикальной части клеток или
в виде обильной оксифильной зернистости, или в виде гомогенных розоватых
масс шаровидной формы, или формирует клетки типа перстневидных. Б отличие
от метастаза рака из желудочно-кишечного тракта, ядра в этих клетках имеют
выпукло-овальную форму как со стороны, обращенной к краю клетки, так и с
противоположной стороны, граничащей с вакуолью.Клетки мелкоклеточного рака расположены в виде однослойных и многослой¬
ных скоплений, пластов, коротких рядов и цепочек, комплексов округлой или
неправильной формы. При тесном прилежании клетки образуют вдавлення, или
«фасетки», в близлежащих элементах. Имея в среднем размер 13-16 мкм в диа¬
метре, они нередко бывают меньше клеток мезотелия, поэтому их не всегда бывает
легко обнаружить и правильно интерпретировать, особенно в случаях располо¬
жения небольшими скоплениями или разрозненно. Ядра клеток округлые, окра¬
шиваются чаще в светлые тона и имеют мелкозернистый или мелкоглыбчатый
рисунок хроматина; занимают почти всю клетку, располагаясь центрально, реже
эксцентрически; иногда видны ядрышки. При исследовании материала из первич¬
ного очага ядрышки в клетках при мелкоклеточном раке практически не видны.
Для мелкоклеточного рака характерна легкая ранимость клеток, а из-за того, что
клетки находятся в жидкости, они еще более подвержены дегенеративным измене¬
ниям. В ядрах появляются мелкие округлые просветления (дырки). Цитоплазма у
большинства клеток определяется в виде узкого ободка, часто совсем не видна или
определяется на отдельных участках.Клеточные элементы плоскоклеточного рака в экссудате наблюдаются нечасто
из-за редкой диссеминации этой формы рака по серозному покрову. Первичным
очагом поражения наиболее часто является рак легкого, однако опухоль может
исходить также из пищевода, шейки матки и других органов. Морфология опухо¬
левых клеток в экссудате находится в прямой зависимости от степени дифферен-
цировки первичной опухоли. Атипичные клетки в экссудате наблюдаются иногда
в виде единичных элементов, в других случаях их обнаруживают в большом коли¬
честве, они расположены то разрозненно, то в виде пластов, тяжей, образований,
подобных луковице, одно- и многослойных скоплений, комплексов неправильной
формы.Наиболее легко по экссудату распознаются клетки плоскоклеточного рака с
ороговением, даже если они расположены разрозненно и имеются в небольшом
количестве. Ядра клеток пикнотичные или гиперхромные, с грубым рисунком хро¬
матина и неровными контурами. Цитоплазма различной степени базофилии, чаще
светло-голубая или почти бесцветная, по структуре гомогенная или стекловидная,
опалесцирующая (за счет накопления кератогиалина). В одних клетках цитоплаз¬
ма занимает небольшую часть, в других представляется широкой и обильной. Ядра
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 421клеток резко выделяются на фоне светлых тонов цитоплазмы. Подобные клетки
нередко имеют полигональную и вытянутую форму, что позволяет с уверенностью
отличить их от клеток железистого рака. Помогает установлению цитологического
диагноза постоянное присутствие в жидкости клеток с выраженными признаками
дистрофии и частичного распада, что обычно свойственно плоскоклеточному
ороговевающему раку. Кроме того, в экссудате встречаются «чешуйки» плоского
эпителия, клетки с почти лизированными ядрами, скопления клеточного детрита
и зернистых масс распада. Для плоскоклеточного рака с ороговением характерно
большое количество нейтрофильных лейкоцитов.При менее дифференцированных формах плоскоклеточного рака без ороговения
разрозненно лежащие клетки всегда округлые. Ядра их светлые, с мелкодисперсным
рисунком хроматина, цитоплазма базофильная, встречаются единичные клетки с
признаками ороговения цитоплазмы. Ядра в клетках расположены чаще всего цен¬
трально, но встречается и эксцентрическое расположение. Клетки с эксцентрически
расположенными ядрами и дегенеративно измененной вакуолизированной цито¬
плазмой могут иметь значительное сходство с элементами железистого рака. Если
дифференциальная диагностика между этими формами опухоли затруднительна, в
заключении уверенно указывают лишь то, что цитограмма соответствует метастазу
рака, а гистологическая форма может быть указана предположительно.Экссудат при диссеминации рака молочной железыНаиболее характерным признаком рака молочной железы является образование
из опухолевых клеток скоплений шаровидной или овальной формы, напоминаю¬
щих очертания концевых протоков и ацинусов молочной железы. Эти структуры
имеют разные размеры в зависимости от количества входящих в них клеток — от
сравнительно небольших до очень крупных. Клетки в таких образованиях отно¬
сительно мономорфны, среднего размера; в центре структуры расположены без
определенного порядка, а по периферии вытянуты и образуют как бы замыкающее
кольцо. Клетки плотно прилегают друг к другу, в них просматривается неболь¬
шая узкая зона цитоплазмы. Наряду с округлыми шаровидными образованиями
имеются папиллярные структуры, а также комплексы неправильной формы.
Выявление характерной группировки клеток в виде шарообразных структур
позволяет отнести их к опухолевым, особенно в тех случаях, когда клетки имеют
небольшие размеры и отличаются мономорфизмом, а именно подобные клетки в
экссудате встречаются при раке молочной железы наиболее часто.Резко выраженный клеточный и ядерный полиморфизм редко встречается
при диссеминации рака молочной железы. В подобных случаях клетки опухоли
обычно присутствуют в большом количестве, располагаясь как разрозненно, так
и в комплексах.Экссудат при миеломной болезниПри миеломной болезни в пунктатах из серозных полостей выявляется оби¬
лие плазматических клеток, разнообразных по степени дифференцировки.
Преобладают незрелые плазматические клетки с выраженной атипией ядер, часто
встречаются многоядерные клетки. Характерна грубоглыбчатая структура хро¬
матина, иногда в цитоплазме встречаются тельца Рассела. Миеломную болезнь
необходимо дифференцировать от реактивной плазмоклеточной реакции. В таком
случае в выпоте преобладают зрелые плазматические клетки.Перикардиальный выпотВ норме в перикардиальной полости содержится примерно 1-2 мл прозрачной
светло-желтой серозной жидкости. Перикардиальный выпот обусловлен в первую
422 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВочередь инфекциями (перикардиты), злокачественными опухолями или метабо¬
лическими нарушениями. Объем жидкости в перикарде может достигать 500 мл
и даже более 1 л. Массивный выпот не всегда вызывает тампонаду сердца, так как
перикард обладает большой растяжимостью.Наиболее частой причиной перикардиального выпота является инфекционный
перикардит, который вызывается бактериями, микобактериями, вирусами, осо¬
бенно вирусом Коксаки группы В, риккетсиями и грибами. Среди других причин
перикардиального выпота - сердечно-сосудистая патология, в том числе транс¬
муральный инфаркт миокарда, постинфарктное состояние, острое расслоение
аорты, тяжелая сердечная недостаточность, гипертрофическая и дилатационная
кардиомиопатия. Среди больных с трансмуральным инфарктом миокарда пре¬
ходящий выпот в полости перикарда удается обнаружить по данным УЗИ у 24%
пациентов. Накопление жидкости в перикарде может быть связано с ревматиз¬
мом, радиационным облучением, метаболическими заболеваниями (микседе-
мой, болезнями накопления), травмой, в том числе после операций на сердце,
контузией, нарушением свертывания крови при антикоаіулянтной терапии или
после трансфузий. Иногда перикардит развивается при уремии, авитаминозе,
геморрагическом диатезе. Патология лимфатической системы перикарда (лим-
фангиэктазии с нарушением целостности их стенок, реже — травмы грудного про¬
тока) может привести к скоплению лимфы (хилуса) с развитием хилоперикарда.
К опухолям, дающим метастазы в перикард, относятся рак, особенно легкого и
молочной железы, саркома и лимфома. Вторичные опухолевые поражения пери¬
карда отмечаются примерно у 5% онкобольных. Первичная мезотелиома пери¬
карда встречается редко.Морфологические изменения в перикарде зависят от остроты воспаления сероз¬
ных оболочек, интенсивности и выраженности экссудативных и пролиферативных
процессов. При умеренной интенсивности экссудации, сохранении всасыватель¬
ной способности основные изменения перикарда и эпикарда проявляются гипере¬
мией, набуханием и десквамацией мезотелия. Наложения фибрина умеренные, но
по мере прогрессирования процесса количество их может возрастать. Если интен¬
сивность экссудации значительна, в полости перикарда начинает накапливаться
выпот, который содержит пласты слущенного мезотелия, клетки крови, хлопья
фибрина. Иногда примесь эритроцитов настолько значетельна, что экссудат по
внешнему виду напоминает кровь. Однако он имеет более низкий гематокрит, чем
периферическая кровь больного, и неспособен свертываться, так как не содержит
фибриноген.при гнойном перикардите наряду с клетками, клеточным детритом, хлопьями
фибрина в выпоте можно обнаружить различные микроорганизмы и простейшие,
патогенные грибы, гистоплазмы. В таких случаях даже за короткий промежуток
времени на серозных оболочках выпадает значительный слой фибрина, так как
набухание, дегенерация и гибель мезотелия идут особенно быстро.Исчезновение клинических проявлений перикардита может свидетельствовать
не только о разрешении воспалительного процесса в перикарде, но и о накоплении
в нем выпота. Течение выпотного перикардита всегда длительное — недели, меся¬
цы. Продолжительность процесса определяется этиологией заболевания, выра¬
женностью и глубиной воспалительных изменений. Лишь в легких случаях может
наступить полное рассасывание выпота. Часто в результате организации выпота
происходит сращение листков перикарда (частичное или полное) либо разви¬
вается сдавление сердца. Иногда в процессе заболевания происходит изменение
характера выпота: при проникновении в перикардиальную полость гноеродной
микрофлоры серозно-фибринозный выпот превращается в гнойный. Чаше воз¬
никновение гнойного перикардита определяется поступлением инфекции извне
(раневой, послеоперационный перикардит), либо в связи с распространением
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 423ее из очагов, расположенных рядом с околосердечной сумкой (пневмония, пио-
пневмоторакс, гнойный медиастинит или перитонит, абсцессы печени и др.), либо
из отдаленных регионов (гематогенным или лимфогенным путем) с развитием
септического перикардита. У таких больных не только более выражены клиниче¬
ская картина поражения перикарда и темп развития критического состояния, но
и более значительно выраженны явления эндогенной интоксикации: лейкоцитоз,
повышение СОЭ, анемизация и др,ПОЛУЧЕНИЕ И ОБРАБОТКА МАТЕРИАЛА ДЛЯ ЛАБОРАТОРНОГО ИССЛЕДОВАНИЯВ случае тампонады проводят лечебный перикардиоцентез; диагностический
перикардиоцентез показано проводить при острых перикардитах с массивным
перикардиальным выпотом, при больших или рекуррентных перикардиаль¬
ных выпотах неясной этиологии и в случаях персистенции выпота более 1 нед.
Перикардиальный выпот большого объема слеізует тщательно исследовать в
лаборатории, так как он может быть вызван тяжелой патологией — опухолью,
туберкулезом, уремией. В большинстве случаев, включая метастатические новооб¬
разования, достаточным для постановки диагноза бывает исследование перикар¬
диального выпота без исследования биоптата. В случае большого объема выпота,
помимо жидкости, иногда берут биопсию ткани перикарда для культурального
исследования на бактериальную и вирусную инфекцию.Исследование перикардиального выпота следует проводить сразу после его
получения, так как от результатов лабораторного анализа часто зависит тактика
лечения, особенно в случаях инфекций или злокачественных опухолей.РЕЗУЛЬТАТЫ МАКРОСКОПИЧЕСКОГО ИССЛЕДОВАНИЯМакроскопическое исследование перикардиального выпота, так же как и плев¬
рального, выполняют в рамках представления об экссудате/транссудате.
Основные типы перикардиального выпота представлены в табл. 6-34.Таблица 6-34. Классификация перикардиального выпотаШІТип перикардиаль¬
ного выпотаХарактеристикаСерозныйНаиболее частый тип перикардиального выпота. Накопление серозного транссудата
в перикардиальной полости может быть вызвано застойной сердечной недостаточ¬
ностью, гипоальбуминемией при циррозе печени или нефротическом синдроме,
лечебном облучений дозами > 40 Гр при злокачественной пимфоме. Этот тип выпо¬
та характерен для опухолевого поражения перикардаГнойныйМутная желтоватая жидкость. В случаях инфекции Sf. pneumoniae аспирируется
янтарная, слегка мутная жидкость. Гнойный перикардиальный выпот появляется
после разрыва пищевода при эзофагальной карциноме, проникающей травме
в перикард, после операций на сердце, в результате иммуносупрессивной тера¬
пии, иногда при инфекционном эндокардите. Наиболее частым возбудителем
гнойного перикардита является стафилококк, затем стрептококк и пневмококк.Грамположительная микрофлора является причиной гнойного перикардита при¬
мерно в 42% случаев, 20% перикардитов вызвано грибами. Гнойный выпот часто
загустевает, в нем выпадает фибриновый сгусток, поэтому его трудно аспири-
ровать; в этих случаях возможно предварительное введение в перикардиальную
полость стрептокиназыГеморрагическийРедкий тип, геморрагии в перикард появляются после трансмурального инфаркта
миокарда передней стенки, разрыва аневризмы аорты внутрь перикарда, разрыва
миокарда, при злокачественном поражении перикарда, как осложнение антикоагу-
лянтной терапииХилезныйРедкий тип с накоплением хилезной жидкости в перикарде. Осноеной причиной
является обструкция грудного лимфатического протока при травмах, воспалении,
опухолях, Хилезный выпот необязательно связан с избытком липидов, примерно в
12% он бывает серозным или серозно-ангинозным
ШШ.424ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВБИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИХолестеринПри пороговом значении 1,6 ммоль/л в перикардиальном выпоте возможно
разделение транссудата от экссудата с 95% достоверностью. Концентрация менее1,6 ммоль/л указывает, что это транссудат, тогда как более 1,6 ммоль/л — экссудат.
В среднем концентрация холестерина в транссудате составляет 0,8 ммоль/л, тогда
как в экссздате при воспалении — 2,0 ммоль/л, при злокачественных опухолях —2,3 ммоль/л.ГлюкозаКонцентрация глюкозы в перикардиальной жидкости ниже, чем в сыворотке
при бактериальном перикардите, асептическом воспалении при ревматической
болезни и метастазах опухолей в перикард.
pHИзмерение pH плевральной жидкости проводят в пробах, взятых в гепарини-
зированные капилляры. pH более 7,4 бывает при гипотиреозе; 7,2-7,4 — при зло¬
качественных опухолях, туберкулезе, уремическом перикардите; менее 7,1 — при
бактериальных инфекциях, коллагенозах.БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕВ случае подозрения на инфекционную причину выпота необходимо взять
пробу выпотной жидкости для бактериологического посева до начала лечения
антибиотиками. Инфицирование перикардиального выпота может сочетаться с
инфекцией легких, плевры, средостения. Инфекционный перикардиальный выпот
составляет примерно 10% всех перикардиальных выпотов, чаще других он бывает
вызван бактериями (1-2%), микоплазмодиями (3%) и микобактериями (5%).Вирусы Коксаки — семейство энтеровирусов, которые могут вызвать генера¬
лизованную инфекционную патологию и перикардит. Примерно в 4% случаев
после энтеровирусной инфекции развиваются такие осложнения, как нарушения
ритма сердца, сердечная недостаточность и дилатация левого желудочка. В связи
с этим выдвигают предложения о постановке исследований на энтеровирусную
инфекцию при острых миокардитах и хронической дилатации сердца, при этом на
анализ берут биопсию эндокарда, перикардиальную жидкость и кровь,У новорожденных и младенцев инфекция вирусом Коксаки В вызывает миокар¬
дит, для которого характерна высокая детская смертность, У взрослых вирз'^сы под¬
групп А и В приводят к развитию острого инфаркта миокарда или миоперикарди-
та. До 5% всех случаев инфицирования вирусом Коксаки осложняется патологией
со стороны сердца.ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯПримерно 10% всех злокачественных опухолей в течение развития затрагивают
сердце, в 85% этих случаев опухоль выявляется в перикарде. Это чаще всего мета¬
стазы рака легкого (примерно 56%) и молочной железы (39%), однако и другие
опухоли могут быть причиной поражения перикарда. Б 80% случаев опухолевые
клетки имеют эпителиальное происхождение, в 20% — неэпителиальное. При
опухолевом перикардиальном экссудате количество лимфоцитов более 1000/мкл,
гранулоцитов — более 5000/мкл.Опухолевые маркерыРаковый антиген 125 (СА 125)Показанием к назначению исследования СА 125 является мониторинг течения
и эффективности терапии серозной карциномы яичника. СА 125 определяется в
перикардиальном выпоте, если есть подозрение на метастатическое поражение
перикарда из яичника. Специфичность С А 125 низкая.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 425Раково-эмбриональный антиген (РЭА)Концентрация РЭА в серозном выпоте определяется при ряде доброкачествен¬
ных заболеваний на уровне примерно 1,2 мкг/л. При выпоте, вызванном злокаче¬
ственными опухолями, концентрация РЭА в перикардиальной жидкости опреде¬
ляется в пределах от 9,4 до более 600 мкг/л.Асцитическая жидкостьНормальная серозная жидкость брюшной полости прозрачная и светло-желтая,
объем менее 50 мл. Если жидкость в брюшной полости накапливается в значитель¬
ном количестве, ее называют асцитической. Асцит — брюшная водянка, водянка
живота, значительное скопление свободной жидкости (чаще транссудата) в брюш¬
ной полости. Асцит может возникнуть внезапно (например, при тромбозе ворот¬
ной вены) или развиваться постепенно, в течение нескольких месяцев, сопро¬
вождаясь метеоризмом, который вначале может доминировать в клинической
картине. Иногда в полости брюшины накапливается от 8 до 30 л асцитической
жидкости. При физикальном обследовании больного асцит может быть распознан
при наличии в полости брюшины не менее 1 л жидкости.ПОЛУЧЕНИЕ И ОБРАБОТКА МАТЕРИАЛА ДЛЯ ЛАБОРАТОРНОГО ИССЛЕДОВАНИЯСерозную жидкость брюшной полости получают пункцией прямокишечно¬
маточного углубления (дугласова пространства, кармана) (кульдоцентез), с помо¬
щью чрескожной пункции (парацентез) или при лапароскопии. Одновременно
следует отобрать 5 мл венозной крови для определения градиента «сыворотка-
асцитическая жидкость» для альбумина и других биохимических показателей.Цитологическое исследование асцитической жидкости желательно провести
сразу после доставки пробы в лабораторию. При невозможности экстренного ана¬
лиза пробу необходимо хранить в холодильнике не более 12 ч с использованием
гепарина или цитрата натрия в качестве антикоагулянта.КЛИНИКО-ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ИЗМЕНЕНИЯ ПОКАЗАТЕЛЕЙ СЕРОЗНОЙ
ЖИДКОСТИ В БРЮШНОЙ ПОЛОСТИОсновными задачами лабораторного анализа асцитической жидкости являются:• установление доброкачественного или злокачественного характера выпота;• дифференцировка неинфицированности/инфицированности жидкости.Асцит при портальной гипертензии, гепатоцеллюлярном раке и метастазах впечень без распространения их по брюшине является транссудатом. Асцит при
заболеваниях печени, в случаях панкреатита, перитонеального туберкулеза и при
злокачественных опухолях с метастазами по брюшине является, как правило,
результатом экссудата.Разработаны соответствующие лабораторные критерии для дифференциальной
диагностики портального и злокачественного (метастазы по брюшине) типов
асцита (табл. 6-35).Основными лабораторными показателями разделения асцита на экссудат и
транссудат при отсутствии злокачественных клеток являются содержание альбу¬
мина, уровень холестерина и фибронектина. Для транссудата характерен высокий
градиент альбумина между сывороткой и асцитической жидкостью (>11 г/л), для
экссудата, наоборот, в асцитической жидкости содержится большое количество
альбумина и градиент для альбумина между асцитической жидкостью и сыворот¬
кой незначительный (<11 г/л). Содержание холестерина и фибронектина низкое в
транссудате и высокое в экссудате.Дальнейшие лабораторные исследования асцитической жидкости и сыворотки
определяются в каждом случае предположительным диагнозом и включают по
426ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВSiiТаблица 6-35. Принципы дифференциальной диагностики асцита, обусловленного портальной
гипертензией и опухолью с метастазами по брюшинеЛабораторные показателиХолестерин, ммоль/лРЭА, мкг/лАльбумин,^,^^,„^альбумин^^, г/лЛДГОбщий белок, г/лНейтрофилы (количество), мклОпухолевые клеткиБактериологический анализПортальный асцит<1,15<2,5>11>11 г/л верхней границы
нормы для сыворотки<30<250Отсутствуют (отрицат.)Отрицат./положит.Злокачественный асцит>1,15>2,5<11верхней границы нормы для
сыворотки>30>250Отрицат. при воспалении [бактери¬
альный перитонит, туберкулезный
перитонит (35% случаев с содер¬
жанием лейкоцитов/мкл <250),
панкреатит], положит, при пери¬
тонеальных метастазах, опухолях
ЖКТ, опухолях половых органов,
раке легкого, раке молочной
железыПоложит, или отрицат.
(см. предыдущую графу)необходимости определение АФП (а-фетопротеина), а-амилазы, билирубина, СА
125, СА 15-3, СА 19-9, СА 72-4, хиломикронов, глюкозы, липазы, pH, триглице¬
ридов.В случае хилезной асцитической жидкости показаны определение в ней тригли¬
церидов и постановка электрофореза липопротеидов.Уровень раково-эмбрионального антигена (РЭА) более 2,5 мкг/л асцитической
жидкости имеет высокую клиническую специфичность и прогностическое значе¬
ние, близкое к 100% для опухоли с метастазами по брюшине.При исследовании альбумина пробы сыворотки и асцитической жидкости долж¬
ны быть взяты в одно время. Концентрация альбумина в асцитической жидкости
должна быть определена иммунонефелометрическим или иммунотурбидиметри-
ческим методом. Фотометрическое определение альбумина с бромкрезоловым
зеленым дает завышенные результаты при концентрации альбумина более 7 г/л,
поэтому данный метод непригоден для определения альбуминового градиента.Уровень общего белка более 30 г/л для диагностики транссудата имеет диагно¬
стическую специфичность 86% и диагностическую специфичность 83%.Подсчет и дифференцировку клеток для определения нейтрофильных грануло-
цитов проводят в ЭДТА-асцитической жидкости. Если в пробе присутствует кровь,
то необходимо определить:• отношение эритроцитов к лейкоцитам, чтобы оценить возможность кровоте¬
чений из желудочно-кишечного тракта или примеси «путевой»^ крови;• содержание лейкоцитов (их высокое относительное количество указывает на
воспалительный процесс);• содержание нейтрофильных гранулоцитов (асцит с преобладанием и абсо¬
лютным содержанием нейтрофилов более 250/мкл классифицируется как
инфекционный).Если цитологическое исследование невозможно провести в течение 12 ч, пробу
можно хранить в холодильнике до 2 сут, однако следует фиксировать материал
добавлением 50% спирта в соотношении 1:1.Определение патогенной микрофлоры в асцитической жидкости проводят так
же, как в крови — культивированием в аэробных и анаэробных условиях.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 427ОБЩИЕ СВОЙСТВА (МАКРОСКОПИЧЕСКИЙ ВИД ЖИДКОСТИ)Асцитическая (перитонеальная) жидкость по своему характеру бывает чаще
серозной, реже геморрагической, хилезной, слизистой. Светлая, прозрачная
или с желтоватым оттенком асцитическая жидкость чаще бывает транссуда¬
том. Мутная серозная жидкость характерна для перитонита, возникающего как
осложнение аппендицита, панкреатита, кишечной непроходимости, первичной
бактериальной инфекции. Зеленоватый цвет, окраска желчью возникают при
перфорации желчного пузыря, луковицы двенадцатиперстной кишки, тонкой
кишки, а также при холецистите, остром панкреатите. Зеленоватый цвет асци¬
тическая жидкость приобретает при концентрации билирубина в ней свыше 100
мкмоль/л. Если концентрация билирубина в асцитической жидкости выше, чем
в сыворотке. — это свидетельство перфорации желчного протока или пузыря.
Молочный вид серозной жидкости (хилезный выпот) появляется при большом
количестве хиломикронов в асцитической жидкости. Это бывает чаще всего при
повреждении или обструкции грудного лимфатического протока, вызванного
туберкулезом, циррозом печени, может встречаться при лейкозе (лимфоме).
Возможна псевдохилезная инфузия при введении больным больших объемов
кровезаменителей.Геморрагическая серозная жидкость брюшной полости может появиться при
абдоминальной травме с разрывом внутренних органов, в частности при разрыве
маточной трубы при внематочной беременности, а также при диссеминации зло¬
качественной опухоли по серозной оболочке. Алый цвет жидкость имеет при при¬
меси «путевой«> крови во время проведения парацентеза. Бурый цвет асцитическая
жидкость приобретает вследствие кровотечения в брюшную полость при туберку¬
лезном перитоните, метастазах в брюшину и после травматических повреждений
органов брюшной полости.В интегральной оценке состояния больных с перитонитом применяют Ман-
геймский перитонеальный индекс (MPI), при расчете которого одним из наиболее
значимых показателей является характер экссудата (табл. 6-36).Таблица 6-36. Интегральная оценка состояния больных с перитонитомФактор рискаMPI, баллыВозраст старше 50 лет5Женский пол5Наличие органной недостаточности7Наличие злокачественной опухоли4Продолжительность перитонита более 24 ч4Толстая кишка как источник перитонита4Перитонит диффузный6Экссудат (указать один ответ):-• прозрачный;0• мутно-гнойный;6• калово-гнилостный12БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИНа концентрацию общего белка в асцитической жидкости в основном оказыва¬
ют влияние следующие факторы:• концентрация общего белка в сыворотке крови, с которым уровень белка в
асцитической жидкости имеет прямую зависимость;• уровень портальной гипертензии, с которой имеется обратная зависимость.
Кроме того, на концентрацию общего белка в асцитической жидкости влияетприем мочегонных препаратов.
428ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВПоказаниями к определению общего белка в асцитической жидкости являются:• профилактическое назначение антибиотиков для предупреждения бактери¬
ального перитонита;• дифференциальная диагностика первичного и вторичного (занесенного) бак¬
териального перитонита;• асцит при сердечной недостаточности.Общий белокпри пороговом значении содержания общего белка в асцитической жидкости
25 г/л классические представления о разделении транссудата и экссудата на осно¬
вании выпотевания белка подтверждаются только на 56%, т.е. практически не
имеют лабораторного подтверждения. Это связано с тем, что содержание общего
белка низкое при инфекционной этиологии асцита, хотя экссудативная природа
асцита бесспорна. С другой стороны, содержание общего белка в асцитической
жидкости высокое у больных с сердечной недостаточностью, у которых асцитиче¬
ская жидкость рассматривается как транссудат.Концентрация общего белка более 30 г/л указывает на экссудат с клиниче¬
ской чувствительностью 93% и специфичностью 85%. Значение соотношения
6елок„.„„„„,^„убелок„^„. более 0.5 указывает на экссудат с клинической чув-
ствительностью 93%, специфичностью 85%. При асците, вызванном злокачествен¬
ными опухолями, за исключением гепатоцеллюлярного рака, концентращія общего
белка составляет 49-65 г/л, тогда как при циррозе печени и гепатоцеллюлярном
раке — в диапазоне 17-21 г/л. Больные с циррозом печени и уровнем белка в асци¬
тической жидкости менее 15 г/л имеют плохой прогноз. Низкий уровень белка в
асцитической жидкости характерен для инфекционной природы асцита, в то же
время при вторичной бактериальной инфекции и при туберкулезном перитоните в
асцитической жидкости постоянно определяется уровень белка более 30 г/л.АльбуминАльбуминовый градиент между сывороткой и асцитической жидкостью опреде¬
ляется уровнем портальной гипертензии. Пациенты с альбуминовым градиентом
более 11 г/л имеют портальную гипертензию, а при градиенте менее 11 г/л — нет
(табл. 6-37). При циррозе печени с портальной гипертензией альбуминовый гра¬
диент более 11 г/л имеет клиническую специфичность 97%. Асциты при смешан¬
ных типах — вследствие цирроза печени и метастазов по брюшине или цирроза
печени и туберкулезного перитонита — также сопровождаются альбуминовым
градиентом более 11 г/л.Альбуминовый градиент менее 11 г/л указывает, что портальная гипертензия
маловероятна, скорее имеют место перитонеальные метастазы (клиническая
специфичность 96%) или перитонеальный туберкулез (100%).Таблица 6-37. Диагностическое значение альбуминового градиентаСыворотжа/асцит >11 г/лСыворотка/асцит <11 г/лХронические заболевания печени (цирроз).
Окклюзия портальной вены.Массивные метастазы в печени.Застойная сердечная недостаточность.
Спонтанный бактериальный перитонитПеритонеальные метастазы.Сниженное онкотическое давление при нефротиче¬
ском синдроме.Вторичный перитонит.Туберкулезный перитонитДля отличия транссудата от экссудата альбуминовый градиент имеет большее
значение, чем общий белок. Следует иметь в виду, что при использовании моче¬
гонных препаратов или парацентезе показатели альбумина и общего белка в асци¬
тической жидкости меняются.У больных с распространенным перитонитом степень снижения концентрации
сывороточного альбумина является высокоинформативным прогностическим
показателем, позволяющим оценить тяжесть заболевания и риск неблагоприятно-
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 429ГО исхода. Снижение уровня альбумина в крови происходит как за счет повышения
катаболизма белков, свойственного острой фазе любого воспалительного процес¬
са, так и за счет экссудации в брюшную полость. Перитонеальный экссудат содер¬
жит значительное количество белка. Считается, что в брюшную полость может
переместиться до 50% всей внеклеточной жидкости организма. С развитием отека
вначале процесс всасывания жидкости брюшиной даже ускоряется, однако затем
из-за нарушения микроциркуляции он резко замедляется - происходит накопле¬
ние экссудата. Какое-то количество белка, в том числе и альбумина, вышедшего из
кровеносного русла, теряется для организма; выпот с высоким содержанием белка
ведет к гипоальбуминемии. Кроме того, всегда возникает значительный отек пред-
и забрюшинной клетчатки и других тканей из-за действия биологически активных
веществ: ферментов, кининов, гистамина, благодаря чему альбумин депонируется
в тканях. Наряду с уменьшением синтеза (альбумин — отрицательный реактант
острой фазы воспаления) и увеличением распада (преобладание процессов катабо¬
лизма в организме) выход альбумина в брюшную полость и его депонирование в
отечных тканях являются основной причиной прогностически неблагоприятного
явления — снижения концентрации альбумина в сыворотке крови.Проникновение альбумина из крови в выпот характеризуется величиной ОКАв
(общей концентрацией альбумина в выпоте). В большинстве случаев ОКАв нахо¬
дится в тесной корреляционной связи с величиной ОКАс (концентрацией альбу¬
мина в сыворотке крови), в тех сл)г^іаях, когда ОКАс >34 г/ли ОКАв значительно
ниже ОКАс, пациенты имеют легкое течение послеоперационного периода; исход
заболевания благоприятный; отделяемое по дренажам незначительное.В случаях значительного отличия состояния альбумина в выпоте и сыворотке вели¬
чина ОКАв не связана с концентрацией альбумина в крови; очевидно, имеет место
протеолитическое воздействие на альбумин в экссудате, ведущее к его изменению и
разрушению. В остальных случаях абсолютная величина 01С\в зависит от величины
ОКАс, а не от активности воспалительного процесса в брюшной полости. Для характе¬
ристики выраженности воспалительного процесса в брюшной полости подходит соот¬
ношение ОКАв/ОКАс, характеризующее степень проницаемости сгенки сосудов для
альбумина. Параметр ОКАс отражает тяжесть состояния больного, а параметр ОКАв/
ОКАс — выраженность воспалительного процесса в брюшной полости.Эндотоксину больных с каловым перитонитом (перфорацией толстой кишки) концентра¬
ция эндотоксина в перитонеальной жидкости может достигать 1000 мкг/л. При
диффузном бактериальном перитоните концентрация эндотоксина, как правило,
относительно низкая. Если в послеоперационный период в брюшную полость
продолжает поступать микрофлора толстой кишки (повышается эндотоксин в
перитонеальной жидкости), это очень большая угроза разлитого перитонита и
гибели пациента.ГлюкозаПри небактериальном перитоните величина соотношения глюкоза^^ц^^,^^^,^^^^^^^У
глюкоза^,^^^^^ составляет более 1, при бактериальном перитоните эта величина
менее 1. концентрация глюкозы в асцитической жидкости менее 2,8 ммоль/л
характерна для бактериального перитонита. В большинстве случаев туберку¬
лезного перитонита концентрация глюкозы в асцитической жидкости менее1,7 ммоль/л. Она также снижена при злокачественных опухолях с метастазами,
являющихся причинами асцита.БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕПри инфицированности перитонеальной жидкости монокультурой культураль¬
ные исследования имеют клиническую чувствительность более 85-90%, в то же
время такой показатель, как содержание нейтрофильных гранулоцитов/мкл более
430 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ250 “ только 50%. Бактериологические исследования показывают, что в 70% слу¬
чаев имеет место грамотрицательная микрофлора, обычно Е. coli, в 20% случаев —
грамположительная.Этиологическая значимость анаэробных микроорганизмов доказана при всех
осложненных интраабдоминальных инфекциях, где они являются частью поли-
микробных ассоциаций. Clostridium petjringens и Clostridium septicum участвуют
в развитии вторичного перитонита, интраабдоминального абсцесса и сепсиса
при перфорации толстой и терминальных отделов подвздошной кишки. При
осложненной опухоли толстой кишки у 70-85% больных отмечена бактериемия,
обусловленная Clostridium septicum. При аппендиците из выпотной жидкости вьще-
ляется Bilophila wadsworthia. В смешанных инфекциях часто участвуют Peptococcus
spp., Peptostreptococcus spp. Встречаясь в 90-95% случаев, Actinomyces spp., Prevotella
spp., Lactobacillus spp., Fusobacterium spp. наиболее сложны в диагностике и терапии
актйномйкотических абсцессов печени. Ведущее значение при интраабдоминаль¬
ных инфекциях имеют бактероиды, прежде всего Bacteroides fragilis и Bacteroides
thetaiotaomicron. Частота выделения Bacteroides fragilis при вторичном перитоните
достигает 22,8-44,5%. Имеются данные об этиологической значимости анаэробов
при первичном перитоните, у всех пациентов с инфекциями желчевыводящих
путей с признаками желчной гипертензии или эндопротезами, обеспечивающи¬
ми проходимость общего желчного протока, выделяются Clostridium perfringens и
Bacteroides fragiis. При панкреатите бактероиды и клостридии среди возбудителей
выделяются в 5-14% случаев. При нозокомиальной интраабдоминальной инфек¬
ции значимой является ассоциация полирезистентных энтеробактерий, сине¬
гнойной палочки, энтерококков и анаэробов. Раневые инфекции у больных после
абдоминальных вмешательств в 3,9% вызваны Bacteroides spp., в 1,1% — Clostridium
perfringens. Развитие перитонита и летальность при интраабдоминальной инфек¬
ции обусловлены грамотрицательными аэробами, а формирование интраабдоми¬
нальных абсцессов у выживших — анаэробной микрофлорой.Прогрессирующий микробно-воспалительный процесс в брюшной полости (на
фоне операционной травмы, снижения резистентности организма и пр.) протекает
весьма бурно и в течение 4-5 сут может дойти до стадии, требующей хирурги¬
ческого вмешательства. Динамичность процесса, высокая вероятность реинфи¬
цирования, развития резистентности микрофлоры требуют как эмпирического
назначения антибактериальной терапии одновременно с проведением ориентиро¬
вочного микробиологического экспресс-анализа (микроскопия, газовая хромато¬
графия) и оценкой чувствительности микроорганизмов в клиническом материале
с помощью дисков с антибиотиками, так и постоянного мониторинга бактерио¬
логической ситуации в очаге воспаления. Рутинный бактериологический метод
культивирования позволяет получить результат через 24-72 ч после начала иссле¬
дования, выявить характер патогенной микрофлоры, подтвердить правильность
выбора антибактериальной терапии или подсказать необходимость ее коррекции.
Постоянный микробиологический мониторинг необходим, потому что микробио¬
логическая ситуация в очаге инфицирования может существенно меняться в ходе
патологического процесса и требовать изменения терапии.ИССЛЕДОВАНИЕ КЛЕТОК КРОВИЭритроциты в ЭДТА-асцитической жидкостиВ перитонеальной лаважной жидкости содержится менее 25 ООО эритрощтгов/мкл.
В асцитической жидкости эритроциты накапливаются после травм или явля¬
ются проявлением туберкулезного или злокачественного поражения брюшины.
Сходное соотношение количества эритроцитов и лейкоцитов в асцитической
жидкости и крови указывает на ятрогенное поражение («путевая» кровь) или на
кровотечение в брюшную полость.
ХИМИКО-МИКРОСКОПИМЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 431ЛейкоцитыОпределение лейкоцитов в перитонеальной жидкости можно проводить коли¬
чественно подсчетом в камере Горяева либо полуколичественно — с помощью
диагностических полосок с использованием тест-зоны для определения лейко¬
цитов. Чувствительность тест-зоны на лейкоциты составляет 3000 клеток/мкл.
Диагностическая чувствительность обнаружения лейкоцитов методом «сухой
химии» в перитонеальной жидкости составляет 88%, специфичность — 94%.Количество лейкоцитов в асцитической жидкости, pH и концентрация лактата
при инфицировании асцитической жидкости существенно отличаются от значения
этих показателей при стерильном асците, однако все эти значения меняются при¬
мерно однотипно и по ним не удается различить асцит при опухолевом и инфек¬
ционном перитоните.Относительное содержание нейтрофильных гранулоцитов более 25% популя¬
ции лейкоцитов асцитической жидкости рассматривается как патологическое и
характерное для бактериального перитонита. У больных с циррозом печени коли¬
чество лейкоцитов в асцитической жидкости обратно пропорционально объему
жидкости.Количество лейкоцитов в асцитической жвдкости повышается при уменьшении
объема асцита в результате лечения мочегонными препаратами, при этом относи¬
тельное содержание нейтрофилов в лейкоцитарной формуле не меняется.Если количество лейкоцитов более 500/мкл, особенно если гранулоцитов более
250/мкл, высока вероятность первичного бактериального перитонита, В данном
случае диагностическая специфичность подтверждения этого диагноза составляет
93%, чувствительность — 84%. При раке поджелудочной железы и гепатоцеллю-
лярном раке имеет место умеренный лейкоцитоз — 300-1000/мкл. При алкоголь¬
ном циррозе количество лейкоцитов в асцитической жидкости повышается до
1100-21 000/мкл.Относительное повышение эозинофилов более 10% указывает на наличие
аллергического или паразитологического заболевания, аутоиммунной патологии,
туберкулеза или злокачественной опухоли,Лимфоцитоз в асцитической жидкости — признак длительной застойной
экссудации, хронического воспаления, туберкулеза или опухолевого процесса.
У больных с циррозом печени и хилезной асцитической жидкостью относительное
содержание лимфоцетов в ней составляет от 12 до 96%, в среднем 70%.Опухолевые маркерыУглеводный антиген 19-9В асцитической жидкости при пороговом значении (дискриминантном уровне)
30 ЕД/мл диагностическая чувствительность злокачественной опухоли составляет
52%, диагностическая специфичность — 100%.Раково-эмбриональный антигенИсследование РЭА в асцитической жидкости позволяет дифференцировать
доброкачественные и злокачественные заболевания с диагностической специ¬
фичностью и чувствительностью 83%. При пороговом значении РЭА 2,5 мкг/мл
диагностическая чувствительность составляет 45%, диагностическая специфич¬
ность - 100%. Если определение РЭА в асцитической жидкости сочетается с
исследованием на наличие опухолевых клеток, диагностическая чувствитель¬
ность в случае злокачественной опухоли повышается до 80%. Следует отметить,
что исследование РЭА в асцитической жидкости малозначимо для диагностики
диффузной злокачесгвенной мезотелиомы: РЭА определяется только в 1-9%
случаев этой патологии. В то же время РЭА определяется в 80% наблюдений
асцита, связанного с опухолевым поражением при раке желудка, молочной желе¬
зы, легкого.
432 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВЦИТОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕСамая высокая аналитическая чувствительность достигается при цитологи¬
ческом исследовании препаратов, окрашенных по Паппенгейму и Лейшману,
и при необходимости при дополнительном цитохимическом исследовании.
Диагностическая чувствительность выявления опухолевых клеток под световым
микроскопом составляет 40-70%. Если же имеется возможность пол)^ить клетки
из 200 мл и более асцитической жидкости, диагностическая чувствительность
повышается до 70-90% при практически 100% диагностической специфичности.
Иногда лабораторное обнаружение опухолевых клеток в асцитической жидкости
предшествует клинической манифестации опухоли на 3 года и более.У женщин опухолевые клетки в асцитической жидкости в порядке убывания
чаще обнаруживают при опухолях генитального тракта, особенно яичников, затем
раке молочной железы и желудочно-кишечного тракта. У мужчин наиболее часто
определяется диссеминация по брюшине при опухолях желудочно-кишечного
тракта, лейкозах. Примерно в 80% случаев опухоль относится к аденокарциноме.Из патологических процессов, которые характерны для поражения брюшины и
практически не встречаются в плевре и перикарде, следует отметить псевдомиксо-
му брюшины.Поражение брюшины наблюдается при слизепродуцирующей опухоли, чаще
всего пограничной муцинозной опухоли яичника или мукоцеле аппендикса, а
также при высокодифференцированной муцинозной аденокарциноме яичника
или аппендикса. Считается, что поражение может развиться при разрыве кистоз¬
ной опухоли и генерализованной диссеминации опухолевых клеток по брюшной
полости. При этом в брюшной полости скапливается большое количество слизи,
которую трудно аспирировать из-за ее высокой плотности. Мазки из аспирата при
псевдомиксоме брюшины содержат большое количество ШИК-положительной
слизи, резистентной к гиалуронидазе. Опухолевых клеток, как правило, немного
или их не обнаруживают в нескольких препаратах, поэтому для установления диа¬
гноза нередко приходится просмотреть несколько мазков или выполнить повтор¬
ную пункцию.Для установления доброкачественного или злокачественного характера пора¬
жения следует быть очень внимательными. При доброкачественном поражении
клетки небольших размеров, с мелкими темными ядрами, умеренно обильной
цитоплазмой, в цитоплазме содержатся вакуоли. В слизи нередко содержатся
тяжи из фиброцитов. Нельзя делать вывод о злокачественном процессе только
на основании обнаружения большого количества слизи, так как она может быть
результатом разрыва мукоцеле аппендикса или доброкачественной муцинозной
цистаденомы яичника. Особенную осторожность следует проявлять в тех случаях,
когда слизь из доброкачественной опухоли сочетается с группами из мезотелиаль-
ных клеток с реактивными изменениями. Для установления характера поражения
следует внимательно изучить слизепродуцирующие клетки на предмет наличия
или отсутствия признаков злокачественности.ИССЛЕДОВАНИЕ СПЕРМЫОсновными целями исследования спермы в КДЛ являются определение способ¬
ности эякулята к оплодотворению и выявление симптомов поражения эякулята
вследствие различных заболеваний и/или патологических процессов (табл. 6-38).ПРИНЦИПЫ ИССЛЕДОВАНИЯ СПЕРМЫ• При трактовке результатов необходимо учитывать все негативные факторы,
способные оказать влияние на показатели спермограммы.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 433Таблица 6-38. Рекомендуемый бланк для исследования спермы и гормонов в клинико-
диагностической лаборатории андрологической клиникиФИО пациентаДаіїа рожденияДата исследованияВоздержание от семяизвержения (дни)Принимаемые препаратыВремя эякуляцииНачало анализаОбъем эякулята, млРазжижениеКонсистенция (вязкость)pHПодвижность спермато¬
зоидов, %а) быстрое поступательное движениеб) медленное поступательное движениев) непоступательное, манежное движениег) неподвижные сперматозоидыКоличество спермато¬
зоидовКонцентрация сперматозидов, млн/млОбщее количество в эякуляте, млнМорфология спермато¬
зоидовНормапьные, %Дефекты головки, %Дефекты шейки, %Дефекты хвоста, %Цитоплазматическая капля, %Специфические дефекты. %Жизнеспособность, % окрашенных эозином клетокГипоосмотическое набухание, % набухших клетокКруглые клетки, млн/млЛейкоциты, млн/млАгглютинация, %МАР-тестIgG, %IgA, %фруктоза (6,7-33,3 мкмоль/мл)Zn (>2,4 мкмоль на эякулят)а-Гликозидаза (>20 ME в эякуляте)Другие тесты 1Л Г (2-10 ЕД/л)ФСГ (1-7 ЕД/л)Прояактин (<500 МЕ/л)Тестостерон (угром ^12 нмоль/л)Эстрадиол (<250 пмоль/л)ТЭСБ (11-71 нмоль/л)ПСА (^ мкг/л)Качественные показатели эякулята гораздо больше, чем количественные,
подвержены воздействию негативных факторов, влияющих на эякулят.При трактовке полученных результатов необходимо основываться на нор¬
мах, рекомендуемых воз.Для получения достоверных и сравнимых между собой результатов необхо¬
дима стандартизация исследования по времени проведения и температуре
хранения эякулята.
V/ " 434 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ• Разведение эякулята в изотоническом растворе NaCl и многократное пипети-
, ^ рование — травмирующие факторы, приводящие к нарушению подвижности
, ^ у части сперматозоидов. Именно поэтому при просмотре сперматозоидов вкапле показатели подвижности будут намного выше, чем в камере Горяева.• Для того чтобы вызвать беременность, сперматозоиду необходимо пройти по
, половым путям женщины внутрь не менее 10 см, «прорваться» через лучи¬
стый венец {corona radiata) и проникнуть внутрь яйцеклетки через стенку.’ В «атаке» на яйцеклетку принимают участие сперматозоиды, сохраняющиевысокие скоростные параметры длительное время, поэтому для определения
динамики падения качественных параметров сперматозоидов при исследова¬
нии необходимо оценивать не только «стартовые» показатели, но и резуль¬
таты через несколько часов (например, 3, 6,24 ч) после получения эякулята.• Для зачатия необходимы регулярные коитусы без предохранения до 1 года
(только после этого стоить всерьез начинать обследовать пару по поводу
бесплодного брака). Задачи лаборатории — оценить (хотя бы условно) веро¬
ятность возникновения беременности от данного конкретного партнера и
определить способы ее повышения, с практической точки зрения для насту¬
пления беременности необходимо достаточно большое количество подвиж¬
ных, морфологически нормальных сперматозоидов, обладающих достаточно
высокими скоростными параметрами и временем сохранения подвижности.
В этом случае длительность регулярной половой жизни для наступления
беременности снижается до нескольких месяцев.• При исследовании эякулята следует помнить, что он представлен продуктами
деятельности двух систем: яичек, вырабатывающих «концентрат» спермато¬
зоидов, составляющий 2-5% объема эякулята, и группы желез, вырабаты¬
вающих семенную жидкость (сок простаты, составляющий 25-35%, секрет
семенных пузырьков - 50-60%, парауретральных и бульбоуретральных
желез — 5-10%). Выброс содержимого секреторных желез и сперматозоидов
из семявыносящих протоков в просвет мочеиспускательного канала проис¬
ходит за счет последовательных мышечных сокращений, причем возникает
несколько изгоняющих волн сокращений мочеиспускательного канала, что
приводит к перемешиванию и порционному выбросу эякулята. В первых пор¬
циях находится наибольшее количество сперматозоидов, а остальные порции
только «смывают» оставшиеся сперматозоиды со стенок мочеиспускатель¬
ного канала. Содержимое мочеиспускательного канала - слизь, выделения
желез, клетки, слущенные со стенок — также смываются и перемешиваются в
эякуляте.• Все манипуляции с эякулятом следует проводить с соблюдением техники
безопасности как с [ютенциально инфицированным биологическим материа¬
лом.Преаналитический этап исследования спермыЧасто этот этап не зависит от работы КДЛ, тем не менее за правильно прове¬
денную подготовку мужчины к сдаче анализа, процедуру получения эякулята и
даже за интерпретацию полученных результатов врач адл отвечает так же, как и
клиницист, назначивший анализ. Они должны совместно правильно ориентиро¬
вать пациента, знать и по возможности избегать погрешностей при исследовании
эякулята.ПОДГОТОВКА МУЖЧИНЫ к ИССЛЕДОВАНИЮПри направлении пациента на спермограмму врач обязан подробно объяснить,
какие условия подготовки должны быть выполнены для получения достоверно-
ХИМИКО^МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 435ГО результата этого исследования. Необходимо объяснить пациенту, что четкое 'й
соблюдение условий подготовки имеет очень большое значение для объективного
результата. лЭякулят должен быть получен после воздержания от семяизвержений в течение
2,5-4,5 сут (в крайнем случае от 1,5 до 6.5 сут), но не более 7 дней. Пациент должен
обеспечить регулярные семяизвержения в течение 1-2 мес перед исследованием
эякулята для предотвращения явлений застоя. За 2,5-4,5 сут нужно добиться семя¬
извержения любым доступным образом и больше до сдачи анализа семяизвержений
не иметь. Период воздержания при нескольких исследованиях рекомендуют сохра¬
нять одинаковым, чтобы можно было сопоставить результаты исследования.Длительные абстиненции в течение нескольких месяцев перед обследованием
могут привести к нарушению эффективного процесса сперматогенеза, появлению ста¬
рых, дегенеративных форм, снижению качественных параметров сперматозоидов.Воздержание от предыдущего семяизвержения менее 1 сут резко снижает общее
количество, концентрацию сперматозоидов в эякуляте и их качественные параме¬
тры (подвижность, жизнеспособность, скоростные параметры). При воздержании
более 6-7 сут часть сперматозоидов (наиболее старых) сбрасывается в семенные
пузырьки и разлагается. Точно оценить в этом случае сперматогенную функцию
паренхимы яичек оказывается невозможным.Следует запретить обследуемому употреблять алкоголь в любых количествах
в течение 6-7, а лучше 10 сут перед сдачей эякулята на анализ. Также следует
постараться исключить воздействие токсичных факторов в течение 2,5 мес перед
исследованием эякулята. Хронические интоксикации (алкогольная, табачная,
наркотическая, производственная, бытовая, лекарственная) закономерно приво¬
дят к снижению качественных, а иногда и количественных показателей эякулята.
Употребление алкоголя, наркотических препаратов, лекарственных средств и
других токсичных веществ в течение 5-10 сут перед сдачей анализа приводит
к накоплению токсинов в организме и может снизить качественные параметры
сперматозоидов.При воспалительных заболеваниях мочеиспускательного канала и/или
простато-везикулярного комплекса перед исследованием эякулята рекомендуют
провести санацию и выждать не менее 2 нед (для ликвидации медикаментозной
интоксикации). Интоксикации на фоне острых и хронических заболеваний могут
привести к снижению качественных и количественных показателей эякулята.Алиментарные факторы, такие как гипотрофия, авитаминоз, могут привести к
нарушению сперматогенеза и недостаточной выработке полноценных спермато¬
зоидов.Необходимо отказаться от исследования эякулята, если в течение 7-10 сут
перед анализом были отмечены простудные или другие острые заболевания, про¬
текавшие с лихорадкой. Гипертермия (бытовая, производственная, при лихорад¬
ке) нарушает сперматогенез, нормально протекающий при температуре на 2-3 °С
ниже температуры тела. При гипертермии могут снижаться как количественные,
так и качественные показатели спермограммы.Накануне сдачи эякулята на анализ исключают тяжелые физические нагрузки,
конфликтные ситуации. Ночью перед сдачей анализа рекомендуют обеспечить
полноценный отдых. Физическая усталость (работа в ночную смену, тяжелые
физические нагрузки, бессонная ночь накануне сдачи анализа эякулята) может
привести как к нарушениям процесса получения эякулята, так и снижению каче¬
ственных параметров сперматозоидов.Психоэмоциональный дискомфорт (подавленное, раздраженное состояние,
боязнь или нежелание мастурбировать, раздражающее, отвлекающее влияние
окружающих и обстановки сбора эякулята) может привести к нарушению процесса
получения эякулята.
436 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВОтсутствие опыта мастурбации иногда приводит к затруднениям (вплоть до
полной невозможности) в получении эякулята. Однако большинство мужчин,
даже не имеющих мастурбационного опыта, получают эякулят для исследования
без особых проблем. При отсутствии мастурбационного опыта можно порекомен¬
довать пациенту пробный мастурбационный тренинг в домашних условиях.Возможность умышленного нарушения условий подготовки для получения
негативных результатов сперматологического исследования (при судебных исках
об установлении отцовства и т.д.) обязательно должна учитываться при трактовке
полученных результатов.ПОЛУЧЕНИЕ ЭЯКУЛЯТА И ВОЗМОЖНЫЕ ПОГРЕШНОСТИ ПРИ ЭТОЙ ПРОЦЕДУРЕПеред получением эякулята следует помочиться (смыть мочой содержимое
мочеиспускательного канала). Перед мастурбацией необходимо обмыть половые
органы с мылом и после этого обязательно тщательно смыть мыльный раствор
проточной водой, вымыть руки с мылом (особенно тщательно, если планируется
бактериологическое исследование эякулята).Токсическое поражение эякулята возможно вследствие:• попадания в эякулят слюны, кремов, вазелина, используемых при мастурбации;• попадания влагалищного содержимого в эякулят при прерванном половом
акте;• умышленного введения пациентом слюны или химических веществ в собран¬
ный эякулят для искусственного создания некроспермии и астенозооспер-
мии.Получение на исследование только части эякулята может быть вызвано тем, что:• часть эякулята не попала в баночку (первые капли, реже средняя или конеч¬
ная порция);• умышленно взята только часть эякулята для получения негативного резуль¬
тата исследования;• эякуляция проведена с неполным опорожнением простаты, семенных пузырь¬
ков, придаточных половых желез, неполным выбросом сперматозоидов из
семявыбрасывающего протока;• при длительной мастурбации (затруднении в достижении эякуляции), неод¬
нократных неудачных попытках вызвать эякуляцию через короткий про¬
межуток времени (10-15 мин) происходит сброс части семенной жидкости
(сока простаты, содержимого семенных пузырьков) до начала эякуляции.Посуда для получения и хранения эякулята должна быть чистой, без капель
воды, следов дезинфицирующих и моющих веществ, поскольку примеси могут
повредить эякулят.Существует высокий риск использования «дефектных» показателей эякулята
при однократном его исследовании. Для первичной оценки следует провести
два исследования с интервалом не менее 7 сут и не более 3 нед. При выявлении
не обоснованных другими данными патологических изменений в спермограм-
ме необходимо убедиться в достоверности полученных результатов повторным
исследованием. Достоверными можно считать наиболее высокие количественные
и качественные показатели при отсутствии явных дефектов подготовки, получе¬
ния и проведения исследования (даже если часть показателей берется из одного
исследования эякулята, а остальные — из другого).Проведение лабораторного исследования спермыВследствие высокой специфичности исследование спермы должен проводить
специально обученный, прошедший подготовку врач КДЛ или специально под¬
готовленный медицинский лабораторный технолог.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 437Если эякулят в лабораторию доставляется самим обследуемым, у него уточняют
и фиксируют в журнале:• точное время эякуляции;• температуру посуды, в которую был получен эякулят, и температуру посуды
во время доставки эякулята в лабораторию;• полностью ли был собран эякулят;• длительность воздержания от предыдущего семяизвержения;• сколько времени понадобилось для получения эякулята (если более 10 мин —
следует отметить);• с первого ли раза был получен эякулят или из-за неспособности сразу настро¬
иться на семяизвержение удалось получить его только при второй (третьей)
попытке.Эякулят нужно поместить в термостат. Если материал доставлен в посуде с
большой площадью испарения, его перефасовывают. При этом рекомендуют сразу
определить объем полученного материала. Если планируется бактериологическое
исследование эякулята, то вся используемая посуда и весь инструментарий долж¬
ны быть соответствующим образом простерилизованы.ПОГРЕШНОСТИ ЛАБОРАТОРНОГО ИССЛЕДОВАНИЯ СПЕРМЫОшибки, часто возникающие иа лабораторном этапе исследования спермы• Нарушение температуры хранения эякулята. Чем выше температура хране¬
ния, тем более высокие скоростные параметры наблюдаются у сперматозои¬
дов и тем быстрее падают их подвижность и жизнеспособность при динами¬
ческом наблюдении. При снижении температуры хранения менее 18-20 °С
нарастает риск Холодовой травматизации сперматозоидов (прекращения их
подвижности), сначала временной, а затем и окончательной.• Загрязнение лабораторной посуды и инструментария приводит к токсическо¬
му поражению сперматозоидов.• Нелабораторная пластиковая посуда может быть токсичной и создавать
условия для обездвиживания и гибели сперматозоидов.• При исследовании эякулята из презерватива после полового акта оценивают
только количественные параметры и морфологию, так как резина самого
презерватива и спермицидная смазка почти моментально приводят к обез¬
движиванию и гибели сперматозоидов.• Отсутствие оценки скоростных параметров сперматозоидов — один из наи¬
более серьезных дефектов в исследовании эякулята.• Хранить эякулят лучше в одноразовых шприцах (апирогенная, химически
инертная пластмасса не изменяет его параметров в течение суток) с пласти¬
ковыми, а не резиновыми поршнями, так как при контакте с резиной сперма¬
тозоиды снижают свою подвижность и жизнеспособность.• Нарушение временных стандартов исследования (с момента получения эяку¬
лята) не дает возможности корректно сравнивать полученные качественные
параметры сперматозоидов. Согласно рекомендациям ВОЗ, установлено кон¬
кретное время исследования — через 1 ч после получения эякулята.• Испарение части семенной жидкости из посуды с широким горлышком (осо¬
бенно при малом объеме эякулята) приводит к сгущению эякулята, наруше¬
нию концентрации сперматозоидов и их качественных параметров.• Плохое перемешивание эякулята при взятии порции на исследование (осо¬
бенно при высокой вязкости) может привести к искажению полученных как
количественных, так и качественных показателей.• Плохое перемешивание при разведении эякулята изотоническим раство¬
ром натрия хлорида (особенно при высокой вязкости) может исказить
результаты.
438 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ• Задержка с подсчетом подвижных форм после внесения разведенного эяку¬
лята в камеру Горяева более чем на 1-2 мин может привести к снижению
процента подвижных форм,• Многократное пипетирование при высокой вязкости эякулята приводит к
механической травме сперматозоидов и падению качественных параметров,• После протирания камеры Горяева и покровного стекла спиртом необходимо
дать спирт)^ полностью испариться для предотвращения химической травмы
сперматозоидов. При некачественном спирте на поверхностях образуется
токсичный осадок, ухудшающий качественные параметры сперматозоидов,• Слишком быстрое начало просмотра (через 5-15 с) после многократного
пипетирования при разведении эякулята и внесении его в камеру Горяева
(механическая травма) приводит к временному прекращению движения у
части сперматозоидов и может снизить достоверность результатов.• Протирание спиртом камеры Горяева и покровного стекла перед исследова¬
нием.РЕФЕРЕНТНЫЕ ЗНАЧЕНИЯ ПОКАЗАТЕЛЕЙ ЭЯКУЛЯТАРеферентные значения эякулята указань[ в руководстве ВОЗ по лабораторному
исследованию эякулята человека и взаимодействия сперматозоидов с цервикаль¬
ной слизью (4-е издание). Эти данные, а также некоторые показатели, установлен¬
ные на основе многолетнего опыта и многократного обсуждения, представлены в
табл. 6-39. Данные показатели не являются минимально необходимыми для насту¬
пления зачатия. Следовательно, мужчины с более низкими показателями эякулята
также могут быть фертильны. Более того, стандартный параметр «количество
сперматозоидов в 1 мл эякулята» считается собирательным от функционирования
двух систем - выработки «концентрата» сперматозоидов (яички) и выработки
жидкой части эякулята (придаточные половые железы). Именно поэтому данный
параметр не может быть использован как критерий оценки сперматогенеза и его
нарушений (в расчет идут только выраженные отклонения от нормы).Таблица 6-39. Референтные значения эякулятаПоказательЗначениеОбъем2-6 млРазжижениеДолжно произойти в течение 60 минpH7,2-8,0Концентрация сперматозоидов20x1OVмл и болееОбщее количество сперматозоидов
в эякуляте40x10® и болееПодвижность50% и более подвижных (категория а + Ь) или 25% и более с
поступательным движением (категория а) в течение 60 мин после
эякуляцииМорфология>30% нормальных сперматозоидовЖизнеспособность>75% живых сперматозоидов, т.е. сперматозоидов, которые не
окрасились в тесте с суправитальной окраской;>30% сперматозоидов сохраняют жизнеспособность в течение 24 4АгглютинацияНе выявляетсяЛейкоциты<1х10»/млМакроскопическое исследование спермыЧасть параметров при макроскопической оценке эякулята (цвет, запах, мут¬
ность, консистенция) имеют суг5^бо ориентировочное значение и не используются
для клинического толкования результатов лабораторного исследования эякулята.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 439РАЗЖИЖЕНИЕСперма, полученная при эякуляции, густая и вязкая. Первоначальная коагуля¬
ция спермы в момент эякуляции, по-видимому, препятствует потере сперматозои¬
дов во влагалище, а последующее ее разжижение обеспечивает их продвижение
через шейку матки. Разжижение эякулята при комнатной температуре должно
наступить в течение 60 мин, обычно наступает через 10-30 мин. Однако в неко¬
торых случаях разжижения эякулята не происходит за 60 мин (этот факт следует
отметить в бланке). Если эякулят длительное время остается вязким, полу вязким
или вообще не разжижается, можно предположить воспаление простаты. При этом
отмечается нарушение образования слизи и выделения муколитических фермен¬
тов. Вязкая консистенция спермы препятствует движению сперматозоидов, кото¬
рые или не двигаются, или быстро теряют подвижность.Осторожное непрерывное перемешивание во время разжижения эякулята
уменьшает ошибки при оценке количества сперматозоидов. Образец следует пере¬
мешивать в том же контейнере, в котором он был получен (трясти нельзя). Для
равномерного осторожного перемешивания спермы можно использовать миксер
для перемешивания крови. Для этого сперму необходимо перелить в пробирку,
закрыть пробкой и поместить в миксер. Если разжижения эякулята не наст)тіило,
проводят дополнительн>то обработку образца перед анализом: добавляют фер¬
менты (например, трипсин до конечной концентрации 1%). Иногда разжижения
добиваются добавлением к сперме аналогичного объема питательной среды и
многократным перемешиванием, повторным пипетированием (взятие эякулята
в пипетку и сброс). Однако разбавление спермы может повлиять на показатели
семенной плазмы, подвижность и морфологию сперматозоидов.ВЯЗКОСТЬВязкость определяется через 1 ч после получения эякулята (после разжижения).
Для того чтобы определить вязкость разжиженного эякулята, нужно окунуть в
него стеклянную палочку, а затем поднять ее и измерить длину образующейся
нити, в норме ее длина не должна превышать 2 см. В эякуляте с повышенной вяз¬
костью образуется нить длиной более 2 см.Можно определить вязкость эякулята с помощью пипетки с широким отверстием.
Сперму следует набрать в пипетку и измерить длину нити при ее пассивном вьггека-
нии. в норме эякулят, вытекая из пипетки, образует маленькие отдельные капли.Вязкая консистенция разжиженного эякулята препятствует движению сперма¬
тозоидов, при этом сперматозоиды или вообще не двигаются, или быстро теряют
подвижность. Если в образце полученной спермы присутствуют тяжи слизи, вяз¬
кость оценивают в свободных от слизи участках. При повышенной вязкости для
дальнейших исследований применяют процедуры разжижения. Повышенная вяз¬
кость наблюдается достаточно часто (по некоторым данным, у 30-50% обследуе¬
мых) и может быть одним из факторов, снижающих подвижность сперматозоидов
и препятствующих оплодотворяющей способности спермы. Нормальная вязкость
разжиженного эякулята не исключает патологии.ОБЪЕМВ норме у здорового пациента после полового воздержания в течение 4-7 сут
объем эякулята колеблется от 2 до 6 мл (нормоспермия).Объем полученного эякулята измеряют сразу после разжижения в доставлен¬
ном контейнере, если он градуирован. Наиболее удобно засасывание полученного
эякулята в одноразовый 5-10 мл шприц с пластиковым поршнем. Можно взвесить
контейнер до и после получения эякулята (1 г соответствует 1 мл).Объем эякулята меньше 2 мл называют олигоспермией (гипоспермией), а пол¬
ное отсутствие эякулята — аспермией, Олигоспермия и аспермия наблюдаются
440 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВпри окклюзии семявыносящих протоков, ретроградной эякуляции, хроническом
воспалении предстательной железы и/или семявыносящих протоков, дефиците
гонадотропных гормонов, врожденном отсуствии предстательной железы или
семенных пузырьков, к уменьшению объема спермы приводит снижение секре¬
ции Б предстательной железе и семенных пузырьках. Снижение объема эякулята
характерно для азооспермии (отсутствие сперматозоидов в эякуляте, которое
наблюдается при атрофии яичек или облитерации обоих семявыносящих про¬
токов).Увеличение объема эякулята более 6 мл называется полиспермией (гиперспер-
мией). Причина и клиническое значение этого явления неизвестны. Полиспермия
не влияет на фертильность. Однако фертильность снижается, а иногда и отсутству¬
ет при сочетании полиспермии и олигозооспермии.ЗАПАХЭякулят имеет характерный запах, который сравнивают с запахом цветов каш¬
тана. Этот запах сперма приобретает при присоединении секрета предстательной
железы. При закупорке выводных протоков предстательной железы специфиче¬
ский запах спермы снижается. При атрофии простаты и после простатэктомии
сперма теряет этот запах.Гнилостный запах сперма приобретает при гнойно-воспалительных процессах в
простате, семенных пузырьках и зависит от продуктов жизнедеятельности микро¬
флоры, вызвавшей воспалительный процесс. Такой запах может появиться при
длительном хранении спермы за счет микрофлоры.ЦВЕТОписание цвета проводят сразу после разжижения или через 1 ч после эяку¬
ляции. Нормальный эякулят мутный, молочно-белый или серовато-желтый.
Степень мутности зависит от количества сперматозоидов: если количество их
снижено, эякулят более прозрачный. При длительном воздержании эякулят ста¬
новится более прозрачным. Если в эякуляте присутствуют эритроциты, образец
приобретает розовый, красный или красновато-коричневый оттенок (гемоспер-
мия). Желтоватый и желтый оттенок эякулят приобретает при желтухе, приеме
некоторых витаминов, рибофлавина и длительном половом воздержании. При
большом содержании лейкоцитов сперма окрашивается в желтовато-зеленый цвет
(пиоспермия).Микроскопическое исследование спермыМикроскопическое исследование эякулята проводят после полного разжижения
материала. Оно включает:• изучение в нативном препарате подвижности сперматозоидов (кинезиограм-
ма), наличия агглютинации или агрегации;• подсчет количества сперматозоидов, лейкоцитов и клеток сперматогенеза в
камере Горяева;• дифференциальную диагностику живых и мертвых сперматозоидов;• изучение морфологии сперматозоидов, клеток сперматогенеза, лейкоцитов и
эпителия в окрашенных препаратах;• обнаружение в этих препаратах простейших;• обнаружение в препаратах, окрашенных по Граму, грамотрицательных дипло¬
кокков (Gn).Согласно рекомендациям ВОЗ, микроскопическое исследование эякулята следу¬
ет проводить в два этапа. На первом этапе оценивают концентрацию, подвижность
и агглютинацию сперматозоидов, а также наличие других клеточных элементов.
ХИМИКО-ММКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 441Исследование проводят на неокрашенных мазках простой световой микроскопией
или с помощью фазово-контрастного микроскопа. На втором этапе исследование
проводят на окрашенных препаратах, оценивают жизнеспособность сперматозои¬
дов, определяют их концентрацию, проводят морфологическую классификацию
и выявляют наличие антиспермальных антител. Дополнительные исследования
сперматозоидов включают: определение индексов множественных дефектов спер¬
матозоидов, тест на гипоосмотическое набухание, посев эякулята и биохимиче¬
ский анализ функций придаточных половых желез.ПРИГОТОВЛЕНИЕ НАТИВНОГО ПРЕПАРАТАНа предметное стекло, предварительно согретое до температуры хранения
эякулята, полуавтоматической пипеткой с наконечником разового использования
наносят каплю тщательно размешанного эякулята. Для создания тонкого слоя
объем капли должен быть фиксированным (10 мкл), так же как и размер покров¬
ного стекла (22x22 мм).Под тяжестью покровного стекла эякулят равномерно и однослойно распреде¬
ляется по поверхности предметного стекла, стандартная толщина слоя — около
20 мкм, что обеспечивает оптимальный обзор препарата. Б приготовленном препа¬
рате между покровным и предметным стеклом не должно быть пузырьков воздуха.
Стабилизация препарата происходит в течение 1 мин. Не следует сильно прижимать
покровное стекло, так как при толщине препарата менее 20 мкм возможны наруше¬
ния вращательных движений сперматозоидов. Исследование следует проводить при
температуре не ниже 20 ‘’С, поддерживая температуру в помещении на постоянном
уровне, иначе будут искажаться результаты оценки подвижности сперматозоидов.Предварительная оценка сперматозоидовНативный препарат просматривается при малом увеличении с окуляром (уве¬
личение в 10 раз) или бинокуляром (в 7 раз) и объективами (в 8,10 или 20 раз) со
спущенным конденсором или же при поднятом конденсоре и закрытой диафрагме.
Определяют качество приготовления нативного препарата: отсутствие пузырьков
воздуха, равномерную толщину препарата. В бланке отмечают наличие агглю¬
тинации, агрегации сперматозоидов и слизи, а также присутствие эритроцитов,
«круглых клеток» (лейкоцитов, клеток сперматогенеза, эпителия и др.) и элемен¬
тов простаты [кристаллов спермина (Беттхера), лецитиновых зерен и амилоидных
телец], а также простейших (Trichomonas urogenitalis).Агглютинация сперматозоидов — склеивание подвижных сперматозоидов
между собой головками, хвостами или головок с хвостами. В норме у практически
здоровых пациентов агглютинации сперматозоидов нет. Агглютинация позволяет
предположить наличие иммунологического фактора бесплодия, однако ее нель¬
зя считать доказательством последнего. В бланке отмечают тип агглютинации
(головками, хвостами или смешанный вариант) и оценивают степень агглютина¬
ции полуколичественно:• «-» — отсутствие агглютинации;• «+» — слабовыраженная агглютинация (в нативном препарате до 10 кучек по
4-6 сперматозоидов в каждой);• «+-ь» — значительная агглютинация (в препарате более 20 кучек спермато¬
зоидов);• «+++» — резко выраженная агглютинация (в препарате более 20 кучек, при
этом в каждой более 20 сперматозоидов);• «++Н-+» — тяжелая степень агглютинации (при которой все подвижные спер¬
матозоиды агглютинированы).Агрегация (псевдоагглютинация) - хаотическое скопление неподвижных
сперматозоидов, нагромождение их на комочки или тяжи слизи, клеточные
442 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВэлементы и детрит. Агрегацию и агглютинацию оценивают как отдельные пока¬
затели.Слизь в нормальном эякуляте отсутствует, обнаруживают слизь при воспале¬
нии мочеиспускательного канала, бульбоуретральных желез, простаты, простати¬
ческих ходов и т.д.При определении вязкости разжиженного эякулята слизь вытягивается из
общей массы спермы в виде волокон и тяжей или густой липкой массы. При нане¬
сении капли спермы на предметное стекло может быть обнаружена слизь в виде
комочков. Происхождение слизи в нативных и окрашенных азур-эозином пре¬
паратах определяют по обнаруженным в них эпителиальным клеткам и другим
клеточным элементам. Слизь, в каком бы виде она ни присутствовала в сперме,
препятствует движению сперматозоидов и приводит к снижению фертильности
(оплодотворяющей способности спермы).Из предстательной железы с простатическим соком в сперму попадают липо-
идные, амилоидные тельца и кристаллы спермина.Trichomonas urogenitalis — простейшее из класса жгутиковых, имеет груше¬
видную форму, длину 10-20 и ширину 7-10 мкм. Форма тела поддерживается
скелетным образованием — аксостилем. В переднем конце тела клетки располо¬
жены ядро и пучок из четырех жгутиков. Пятый жгутик, возвратный, проходит
по краю ундулирзтощей мембраны (складки цитоплазмы). Движение простейшего
поступательно-колебательное, осуществляется в результате постоянного движе¬
ния жгутиков; ундулирующая мембрана совершает волнообразные движения,
препятствующие вращению клетки. Трихомонады достаточно легко распознаются
в нативном препарате спермы, несмотря на активное движение сперматозои¬
дов. Это достаточно крупные клетки, их диаметр в 1,5-3 раза больше диаметра
нейтрофила. Более четко строение трихомонад можно определить в препаратах,
окрашенных азур-эозином. Это клетки неправильной округлой формы. В перед¬
нем конце тела клетки расположено вытянутое, в виде косточки сливы, ядро с
четкой хроматиновой структурой, коричневато-вишневого цвета. Сложность
лабораторно-диагностических процедур при трихомонозе бывает связана с иден¬
тификацией нетипичных округлых и амебовидных форм простейших в клиниче¬
ском материале.ПОДСЧЕТ СПЕРМАТОЗОИДОВ (КИНЕЗИОГРАММА)Оценка подвижности сперматозоидов и разделение их по группам — субъек¬
тивный фактор. Существует несколько рекомендаций по способам определения
подвижности. Ниже приведено разделение подвижности сперматозоидов в соот¬
ветствии с рекомендациями ВОЗ.Подвижность каждого сперматозоида классифицируется по категориям а, Ь, с, d,
при .этом используются следующие критерии:• а — быстрое поступательное движение (т.е. >25 мкм/с при 37 “С и >20 мкм/с
при 20 "С; 25 мкм примерно соответствуют длине пяти головок или половине
длины хвоста нормального сперматозоида):• Ь — медленное, вялое поступательное движение:• с — непоступательное (колебательное или маятникообразное, манежное),
скорость движения менее 5 мкм/с;• d — неподвижные сперматозоиды.В окуляр с десятикратным увеличением вкладывают окошко Фонио и с объек¬
тивом, увеличивающим в 40 раз, подсчитывают 100 или 200 сперматозоидов.В первые 3-5 с регистрируются проходящие через поле зрения, ограниченное
окошком Фонио, активные, подвижные сперматозоиды (а), в следующие 3-5 с —
малоподвижные сперматозоиды с поступательным движением (Ь), после них
отмечаются сперматозоиды с непост}шательным движением (маятникообразным
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 443И манежным) (с) и, наконец, с помощью движения микровинта регистрируются
лежащие на предметном стекле (на нижнем уровне препарата) неподвижные спер¬
матозоиды (d).Препарат резко передвигают, после чего регистрируют сперматозоиды в новом
поле зрения в том же порядке. Не рекомендуют изучать подвижность спермато¬
зоидов по краю покровного стекла. Если сперматозоидов мало, подсчет проводят
без окошка Фонио.Подвижность сперматозоидов считается нормальной, если;• не менее 50% сперматоцитов относится к категории подвижности а + Ь;• не менее 25% сперматоцитов относится по подвижности к быстрым с посту¬
пательным движением (категория а).Дискинезия -- маятникообразное, или манежное, движение сперматозоидов, в
норме составляет 2%. При комнатной температуре сперматозоиды сохраняют под¬
вижность 12-24 ч, при этом в первые 2 ч подвижность их не снижается, к концу 5 ч
уменьшается примерно в 2 раза.ПРЕДВАРИТЕЛЬНАЯ ОЦЕНКА КОНЦЕНТРАЦИИ СПЕРМАТОЗОИДОВВ рекомендациях ВОЗ предлагается проводить предварительную оценку кон¬
центрации сперматозоидов в нативном препарате. При увеличении в 400 раз диа¬
метр поля зрения в различных микроскопах варьирует в пределах между 250 и
400 мкм, что соответствует 1-2,5 нл при толщине препарата 20 мкм. Подсчитать
диаметр поля зрения можно с помощью окуляр-микрометра или по решетке счет¬
ной камеры.Если количество сперматозоидов в поле зрения, соответствующем 1 нл, менее
15, сперму разводят теплым (37 ”С) изотоническим раствором натрия хлорида 1:5;
если 15-20, разводят 1:10; если 40-200 — 1:20; если более 200 — 1:50 или 1:100.Если в 1 нл присутствует очень мало сперматозоидов (всего 1-2), что соответ¬
ствует 1-2х10умл сперматозоидов, для клинических целей необходимо сделать
запись о малом количестве, а для повышения их концентрации и точного подсчета
провести центрифугирование (обогащение).Если количество сперматозовдов в каждом отдельном поле зрения значительно
колеблется, это свидетельствует о негомогенности образца. Причиной негомоген-
ности может быть плохое перемешивание — следует еще раз перемешать сперму.
Если негомогенность сохраняется, это следствие патологической консистенции и
разжижения образца, агрегации сперматозоидов в слизи или их агглютинации.
Эти находки следует обязательно зафиксировать в бланке.Нормозооспермия. У здорового мужчины в эякуляте в 1 мл содержится более
20 млн сперматозоидов. Общее количество сперматозоидов в эякуляте — более
40 млн.Полизооспермия. Количество сперматозоидов в 1 мл эякулята превышает
150 млн.Олигозооспермия. В 1 мл эякулята содержится менее 20 млн сперматозоидов.
Количество сперматозоидов между 10 и 20 млн/мл обозначается как олигозоо¬
спермия I степени, менее 10 млн/мл — как олигозооспермия II степени.Азооспермия — сперматозоиды при микроскопическом исследовании в натив¬
ном препарате и осадке эякулята после центрифугирования не обнаружены. Могут
присутствовать клетки сперматогенеза.Аспермия — нет эякулята.Для определения при олигозооспермии истинного количества сперматозоидов
необходимо провести 2-3 контрольных подсчета с интервалом 3-4 нед.Транзиторная и старческая олигозооспермия. У одного и того же мужчины
количество сперматозоидов подвержено большим физиологическим колебаниям,
у пожилых людей олигозооспермия связана с инволюцией половых желез.
444 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВИстинную олигозооспермию могут вызвать следующие патологические про¬
цессы.• обструкция семявыносящих путей — разделяется на врожденную и приобре¬
тенную. Предположить обструкцию можно, если после центрифугирования
спермы в осадке отсутствуют не только сперматозоиды, но и клетки спер¬
матогенеза. к приобретенной обструкции семявыносящих пугей приводят
хронические воспаления верхних отделов мочеполовых путей, вызванные
гонококками, хламидиями, микобактериями туберкулеза.• Муковисцидоз “ у таких больных сперма может не содержать спермато¬
зоидов и клеток сперматогенеза, а pH эякулята может быть ниже 7,0 (кислая
реакция). Патология связана с нарушением функций семявыносящих путей,
причем у этих пациентов также может быть обнаружена атрезия эпидидими-
са и семенных пузырьков.• Тестикулярная дисфункция — может привести к нарушению сперматогенеза.
При непосредственном поражении яичек (гонад) возникает первичный гипо-
гонадизм. При нарушении гипоталамо-гипофизарной регуляции сперматоге¬
неза развивается вторичный гипогонадизм.❖ Первичный гипогонадизм может быть врожденным и приобретенным.
Врожденный гипогонадизм обусловлен наследственными генетическими
аномалиями и дефектами развития.- Наследственные генетические аномалии: синдромы Клайнфельтера и
Шерешевского-Тернера, хромосомные аберрации, мутации AZF обла¬
сти Y (синдром «только клетки Сертоли»), наследственные синдромы с
нормальным кариотипом (синдром Нунан), низкая чувствительность к
андрогенам.- Врожденные дефекты развития: крипторхизм, врожденный анорхизм,
первичная недостаточность клеток Лейдига.- Приобретенный первичный гипогонадизм развивается при травмати¬
ческих или инфекционных орхитах, синдроме сдавления, варикоцеле,
новообразованиях половых органов, лейкемии, злокачественной лим-
фоме, повреждении спинного мозга, при печеночной и почечной не¬
достаточности, после облучения, при действии токсичных препаратов,
психологических стрессах и у людей пожилого возраста. Диагностика
приобретенного гипогонадизма складывается из изучения анамнестиче¬
ских данных, гормонального статуса и общеклинических исследований.❖ Вторичный гипогонадизм вызывается нарушением регуляторной функции
гипоталамо-гипофизарной системы. В крови у этих пациентов снижено
содержание гонадотропных гормонов (гипогонадотропный гипогона¬
дизм). Дефицит гонадотропинов может быть вызван как первичной пато¬
логией гипофиза, так и нарушением секреции гонадотропин-рилизинг-
факторов гипоталамуса (GnRH). У таких пациентов в крови снижен
уровень тестостерона (идиопатический гипогонадизм). К этой категории
патологии относятся синдром Кальмана (врожденный дефект гипотала¬
муса с дефицитом GnRH), синдром Прадера-Вилли, синдром фертильных
евнухов с характерным дефицитом ЛГ и тестостерона на фоне нормальной
концентрации фолликулостимулирующего гормона (ФСГ).Астенозооспермия — снижение подвижности сперматозоидов.Подвижность сперматозоидов считается нормальной, если:• в сумме не менее 50% сперматоцитов имеет быстрое или медленное поступа¬
тельное движение (категория подвижности а + Ь);• не менее 25% сперматоцитов относится по подвижности к быстрым с посту¬
пательным движением (категория а).
ХИМИКО^МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 445Физиологические колебания подвижностиПодвижность сперматозоидов зависит от времени года и суток. Имеются сооб¬
щения, что весной подвижность сперматозоидов снижается (сезонные колебания).
При наблюдении за количеством активных, подвижных сперматозоидов в течение
суток было отмечено увеличение их количества во второй половине дня (суточ¬
ные ритмы). Было также прослежено колебание подвижности сперматозоидов
от частоты эякуляции. У пациентов с олиго- и астенозооспермией при эякуляции
каждые 4-6 ч отмечалось относительное увеличение количества активных, под¬
вижных сперматозоидов.Астенозооспермия отмечается примерно у 50% пациентов с нарушением фер¬
тильности. Заключение о незначительной степени астенозооспермии можно сде¬
лать, если количество активных и малоподвижных сперматозоидов с поступатель¬
ным движением в сумме составляет менее 50, но более 30%, Астенозооспермию
вызывают эндогенные, генетические и экзогенные факторы.• Генетические нарушения строения жгутика.• Энергетические нарушения, связанные с генетически обусловленными или
функциональными дефектами митохондрий.• Хронические воспалительные заболевания.• Бактериоспермия.• Экзогенные токсические факторы.Хронигеские воспалительные заболевания. Подвижными сперматозоиды ста¬
новятся в процессе созревания в придатке яичка. Их подвижность меняется по
мере продвижения вдоль эпидидимиса. Созревание сперматозоидов обусловлено
андроген-зависимыми факторами, которые вырабатывает эпителий эпидидими¬
са. Эпидидимиты различной этиологии вызывают снижение подвижности спер¬
матозоидов. Астенозооспермия возникает в результате нарз^шения секреторной
функции эпителия эпидидимиса. В период между эякуляциями каудальный отдел
эпидидимиса является местом хранения зрелых сперматозоидов, при его воспа¬
лении интоксикация поражает сперматозоиды и приводит к астенозооспермии и
увеличению количества мертвых клеток.Бактериоспермия. Некоторые микроорганизмы приводят к снижению подвиж¬
ности сперматозоидов, вызывая их агглютинацию и/или адгезию. Этот процесс
зависит от концентрации бактерий в сперме. Так, in vitro Е. coli значительно снижа¬
ет подвижность сперматозоидов в концентрации юумл.Экзогенные и токсигеские факторы. Исследование следует проводить при
температуре не ниже 20 "“С, поддерживая ее в помеш;ении на постоянном уровне,
иначе будут искажаться результаты оценки подвижности сперматозоидов по
категориям. Подвижность сперматозоидов снижается при действии электро¬
магнитных полей, солей тяжелых металлов, свинца, наркотических препаратов,
накоплении в сперме кадмия. Экспериментально доказано, что у спермато¬
зоидов, помещенных в магнитное поле, снижается подвижность из-за изменения
формы жгутика. По-видимому, действие экзогенных факторов неспецифическое
и прямо или косвенно влияет на структуру компонентов жгутиков. Так, у нар¬
команов были обнаружены значительные изменения микротрубочек аксонемы
жгутиков, напоминающие подобные при синдроме Картагенера (сперматозоиды
живые, но неподвижные).СперматограммаСперматограмма ~ совокупность количественного и качественного исследова¬
ния морфологии сперматозоидов в окрашенных препаратах.Проводят последовательный подсчет 200 сперматозоидов (однократный под¬
счет 200 сперматозоидов предпочтительнее двукратного 100 сперматозоидов).ад
446 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВНесмотря на то что для снижения погрешности и вариабельности желательно про-
водить двукратный подсчет 200 сперматозоидов, в практическом плане нецелесо-
Ж' образно это делать длл каждого образца. Однако в ситз'^ациях, когда от результата
зависят постановка диагноза и выбор метода терапии, для повышения точности
следует проводить двукратный подсчет 200 сперматозоидов.НОРМАЛЬНЫЕ СПЕРМАТОЗОИДЫНормальные зрелые сперматозоиды человека имеют овальную головку, шейку
и хвост. Длина головки сперматозоида составляет 4,0-5,5, ширина — 2,5-3,5 мкм.
Большую часть головки занимает ядро, прикрытое акросомой. Акросома имеет
наружную и внутреннюю мембраны, между которыми находятся протеаза акрозин
и гиалуронидаза, которые способствуют проникновению сперматозоидов через
оболочку яйцеклетки. Разрыв внешней мембраны и высвобождение указанных
ферментов носит название акросомальной реакции. Шейка и тело сперматозоида
должны быть тонкими, менее 1 мкм в ширину, составлять 1,5 длины головки спер¬
матозоида и прикрепляться к головке вдоль ее оси. Размеры цитоплазматических
капель, если они есть, не должны превышать головки сперматозоида (цитоплаз¬
матическая капля — остаток цитоплазмы сперматиды). Хвост должен быть пря¬
мым, одинаковой толщины на всем протяжении и несколько уже в средней части,
не закрученным и иметь длину около 45 мкм. Отношение длины головки к длине
хвоста у нормальных сперматозоидов составляет в норме 1/9 или 1/10. Акросома,
или ядерная шапочка, в нативном и окрашенном (азур-эозином и другими кра¬
сителями) препарате — это просветление в верхней части головки, занимающее
40-70% ее площади.НОРМАЛЬНАЯ СПЕРМАТОГРАММАДля определения понятия морфологической нормы сперматозоидов приняты
строгие критерии, представленные выше. Любые отклонения, все пограничные
формы сперматозоидов должны быть отнесены к патологическим. Столь жест¬
кие требования связаны с тем, что имеются данные о прогностической ценности
морфологической классификации сперматозоидов для оценки результатов опло¬
дотворения. Только полноценные сперматозоиды способны проникать в верхний
отдел цервикального канала женщины. Эти сперматозоиды прошли селекцию в
цервикальном секрете и могут рассматриваться как сперматозоиды нормальной
морфологии. Строгие критерии, предъявленные для оценки морфологии нормаль¬
ных сперматозоидов, приняты большинством исследователей.Однако даже у здоровых мужчин сперматозоиды обладают выраженной гете¬
рогенностью и отличаются размерами и строением головки, шейки и хвоста (жгу¬
тика). Количество нормальных форм в эякуляте, принимаемое за референтное
значение, в разных источниках существенно разнится — от 30 до 87%, чаще всего
указывается, что нормальной считается сперматограмма, в которой не менее 30%
нормальных сперматозоидов. В руководстве ВОЗ указывается, что со снижением
частоты оплодотворения связано уменьшение количества морфологически нор¬
мальных сперматозоидов ниже 15% in vitro.ПАТОЛОГИЧЕСКИЕ ФОРМЫ СПЕРМАТОЗОИДОВДефекты головки: большие, маленькие, конические, грушевидные, круглые,
аморфные, с вакуолями в области хроматина. Головки с маленькой акросомаль¬
ной областью (менее 40% площади головки), вакуолизированной акросомой, с
несимметрично расположенной акросомой; двойные и множественные головки,
головки с компактным строением хроматина в виде ядра, многоядерные головки
и т.д.Дефекты шейки и средней части: «склоненная» шейка (шейка и хвост обра¬
зуют угол 90° к длинной оси головки), асимметричное прикрепление федней части
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 447К головке, утолщенная или неравномерная средняя часть, патологически тонкая ^
средняя часть (отсутствие митохондриальной оболочки) и их любая комбинация, Щ.Дефекты хвоста: короткие, множественные, в виде шпильки, сломанные, ег,
наклонные (угол больше 90°), неравномерная толщина хвоста, тонкая средняя
часть, закрученный конец (иногда полностью) и их любая комбинация.Цитоплазматическая капля занимает более 1/2 головки нормального сперма¬
тозоида.При дифференцированном морфологическом подсчете учитываются только
сперматозоиды с хвостами. Не следует учитывать клетки сперматогенеза, вплоть ’до стадии круглых сперматид. Сперматозоиды без хвоста или с неплотно приле¬
гающим хвостом при подсчете не учитываются. Однако их наличие следует отме¬
тить отдельно. Для сперматозоидов со скрученными хвостами характерна низкая
подвижность. Их наличие может быть показателем того, что сперматозоиды под¬
верглись гипоосмотическому стрессу. Иногда большое количество сперматозоидов
может иметь специфический структурный дефект — отсутствие акросомы. Для
этих сперматозоидов характерны маленькие круглые головки, такое состояние
носит название «глобозооспермия».Неспособность базальной пластинки прикрепляться к ядру на полюсе, противо¬
положном акросоме, приводит к отделению головки от хвоста. Головки фагоци¬
тируются клетками Сертоли, и в эякуляте можно обнаружить только отдельные
хвосты или так называемые булавочные головки. Булавочные головки (отделен¬
ные хвосты) не учитывают при подсчете как дефект головки, так как очень редко
в головках этих сперматозоидов, кпереди от базальной пластины, можно обнару¬
жить хроматин или другие структуры. Однако факт наличия большого количества
сперматозоидов с булавочными головками следует отметить.Тератозооспермия — увеличение количества патологических форм сперма¬
тозоидов выше определенных значений. Выраженная тератозооспермия резко
снижает шансы оплодотворения и увеличивает вероятность пороков развития у
плода, если оплодотворение произошло. Тератозооспермия обычно сочетается с
олигозооспермией и астенозооспермией.в нативном препарате при увеличении в 400 раз относительно хорошо видны
почти все патологические особенности сперматозоидов, касающиеся размера и
формы головки, ее расположения по отношению к шейке, количества головок;
длины, ширины, формы, расположения хвоста по отношению к головке, длины и
количества хвостов; размера и расположения цитоплазматической капли. Более
четкое представление о патологии сперматозоидов можно полу^ють на иммерсии
при увеличении в 900 или 1000 раз.Сперматозоиды, у которых головка заключена в цитоплазматическую каплю,
и те, у которых цитоплазматическая капля расположена на шейке в виде шарфа,
составляя более размера головки, считаются незрелыми, или юными. В нор¬
мальной спермограмме они составляют около 1%. Увеличение содержания незре¬
лых сперматозоидов указывает на частые половые акты, а также отмечается при
варикоцеле. Количество незрелых сперматозоидов при варикоцеле снижается
после операции,Хроматиновая структура головки, размер акросомы, наличие вакуолей в акро¬
соме и хроматине ядра головки диагностируются в препарате, окрашенном
азур-эозином. Увеличение относительного количества сперматозоидов с двумя
головками и двумя хвостами связывают с поражением сперматозоидов вирусом.
Глобулозооспермию (округление головки) объясняют полным или частичным
отсутствием акросомы. Удлиненные головки, макроголовки и множественные хво¬
сты обнаруживают у мужчин, у которых повышено количество полиплоидных и
анезшлоидных сперматозоидов. Микроделеции локуса азооспермии (AZF-локуса)
длинного плеча Y-хромосомы могут давать широкий спектр аномалий. Эта пато-
448 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВлогия может привести к полному отсутствию половых клеток (синдрому «только
клетки Сертоли») или к атипии их структуры. Искусственное оплодотворение
этими сперматозоидами может передать такую мутацию потомку мужского пола.Подсчет индексов множественных дефектов сперматозоидов. Сперма¬
тозоиды с патологической морфологией часто имеют множественные дефекты. Ранее
в протоколах фиксировали только один дефект, предпочтение отдавалось дефектам
головки, в настоящее время часто подсчитывают индекс тератозооспермии (ИТЗ)
или индекс множественных аномалий (ИМА), т.е. число дефектов, разделенное на
число патологических сперматозоидов. С помощью этих индексов прогнозируется
функция сперматозоидов как in vivo (экстракорпоральное оплодотворение — ЭКО),
так и ш vitro (фертильность эякулята). Отдельно вьщеляют дефекты головки, сред¬
ней части, хвоста. Значение ИТЗ лежит в пределах от 1,0 (каждый патологический
сперматозоид имеет только один дефект) до 3,0 (каждый патологический спермато¬
зоид имеет дефекты головки, федней части и хвоста). Имеются данные, что при ИТЗ
более 1,6 снижается частота беременностей.ЖИЗНЕСПОСОБНОСТЬ СПЕРМАТОЗОИДОВПод жизнеспособностью подразумевается доля (в процентах) живых сперма¬
тозоидов, которые определяются либо по исключению красителя, либо по гипо-
осмотическому набуханию. Жизнеспособность следует определять только в том
случае, если количество неподвижных сперматозоидов превышает 50%. Оценка
жизнеспособности может служить контролем оценки подвижности сперматозои¬
дов, поскольку процент мертвых клеток не должен превышать процента непод¬
вижных сперматозоидов. Наличие большого количества живых, но неподвижных
сперматозоидов указывает на структурные дефекты жгутиков. Если количество
неподвижных сперматозоидов в нативном препарате превышает 50% или все спер¬
матозоиды неподвижные, необходимо решить, что произошло со сперматозоида¬
ми — имеет ли место акинозооспермия или некрозооспермия.Некрозооспермия — неподвижность сперматозоидов. Она может быть связана
с патологией хвоста (генетически обусловленньпл дефектом строения акронемы -
синдромом Картегенера) или присутствием в эякуляте мертвых сперматозоидов.Дифференциальная диагностика живых и мертвых сперматозоидовСуправитальную окраску по Блюму проводят для решения вопроса о диф-
ференцировке живых и мертвых сперматозоидов. Живые сперматозоиды бес¬
цветные. мертвые окрашены в оранжево-красный цвет. Нормальным считается
эякулят, в котором не менее 75% живых сперматозоидов, т.е. сперматозоидов,
которые не окрасились.Тест на гипоосмотическое набухание проводят для решения вопроса о
дифференцировке живых и мертвых сперматозоидов. Набухание сперматозоидов
идентифицируют по изменению формы их хвостов. Результаты считаются нор¬
мальными, если хвосты набухли более чем у 60% сперматозоидов. Если набухание
хвоста произошло менее чем у 50% сперматозоидов, данный биологический мате¬
риал расценивается как патологический, в котором больше половины спермато¬
зоидов мертвы.Динамическое исследование эякулятаПовторные исследования проводят через 3, 6 и 24 ч после получения эякулята.
Исследования выполняют по стандартным методикам, определяющим следующие
параметры.• Через 3 и 6 ч:подвижность сперматозоидов;
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 449❖ жизнеспособность сперматозоидов;ВЯЗКОСТЬ эякулята;
агглютинацию сперматозоидов.Через 24 ч:❖ подвижность сперматозоидов;❖ жизнеспособность сперматозоидов;❖ вязкость эякулята;❖ агглютинацию сперматозоидов.Морфология других клеточных элементов спермыКлетки эякулята, кроме сперматозоидов, в совокупности обозначают как кру¬
глые клетки. Их количество не должно превышать 5х10Умл спермы.Лейкоциты. Эякулят здорового мужчины содержит лейкоциты. Это нейтрофи-
лы, количество которых не должно превышать ІхЮумл. Повышенное количество
лейкоцитов носит название <(лейкоспермия^. Если содержание лейкоцитов изме¬
няет белый цвет спермы на серовато-зеленоватый, можно говорить о пиоспермии.
Это круглые сероватые мелкозернистые клетки диаметром 14-16 мкм. Диаметр
нейтрофилов в сперме всегда несколько больше, чем в кислой моче, так как pH
спермы обычно равен 7,5-8,0. Если pH спермы на верхней границе нормы или пре¬
вышает ее, клетки разбухают еще больше, просматривается броуновское движение
нейтрофильных гранул и видны сегментированные ядра.Повышенная концентрация лейкоцитов коррелирует с бактериоспермией.
Обнаружение лейко- или пиоспермии служит сигналом к проведению бактерио¬
логического исследования эякулята.Лейкоспермия влияет на процессы, происходящие в репродуктивной системе.
Лейкоциты активируются при антигенной стимуляции и продуцируют большое
количество активных кислородных радикалов, которые способны поражать мем¬
браны сперматозоидов. Низкая концентрация кислородных радикалов не влияет
на жизнеспособность сперматозоидов, но уменьшает их подвижность, влияя на
сократительные белки жгутика. При высокой концентрации кислородные радика¬
лы спермы вступают в реакцию с фосфолипидами клеточных мембран, индуциру¬
ют перекисное окисление жирных кислот в мембранах и приводят к гибели клеток.
В эякуляте человека сперматозоиды также способны образовывать кислородные
радикалы, но нейтрофилы — более мощный их источник. Кислородные радикалы
необходимы для нормального процесса оплодотворения. В норме поражающий
эффект кислородных радикалов в сперме практически отсутствует, так как сперма¬
тозоиды и спермоплазма имеют защитную систему, регулирующую концентрацию
кислородных радикалов. Защитная система состоит из ферментов и ряда антиок¬
сидантов, таких как альбумин, глутатион, пируват и витамины Е и С. В семенной
плазме мужчин, страдающих бесплодием и астенозооспермией, содержание анти¬
оксидантов значительно ниже, чем у фертильных.Лейкоспермия и, вероятно, агрегация нейтрофилов при их нормальной концен¬
трации в сперме указывают на воспалительный процесс в органах репродуктивной
системы, особенно часто это происходит в придаточных железах. Лейкоспермия
снижает вероятность оплодотворения. На фоне лейко- и пиоспермии выявля¬
ются инфекционные и вирусные агенты, вызвавшие воспаление, следовательно,
лейко- и пиоспермия — маркеры возможной передачи инфекции между половыми
партнерами.Клетки сперматогенеза (незрелые половые клетки) — сперматогонии,
сперматоциты и сперматиды. В сперме чаще всего встречаются сперматоциты и
сперматиды на разных стадиях созревания. Клетки сперматогенеза хорошо раз¬
личимы в нативном препарате. Это клетки правильной круглой формы, разных
450 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВразмеров (размером с нейтрофилы или в 1,5-2 раза больше), характеризуются
плотной, гомогенной консистенцией цитоплазмы (увеличение в 400 раз)» на фоне
которой просматриваются одно или несколько ядер, также плотной структуры и
округлой формы.Дифференциальную диагностику круглых клеток и патологических сперма¬
тозоидов проводят Б фиксированных и окрашенных препаратах. В окрашенных
гематологическими красителями препаратах спермы выявляются клетки сперма¬
тогенеза, остаточные тельца, плоский, переходный и цилиндрический эпителии,
макрофаги, спермиофаги, лейкоциты, эритроциты, трихомонады. У сперматозои¬
дов прокрашиваются головка, распределенный в ней хроматин и акросомальная
зона, цитоплазматические капли на шейке и головке, хвост и шейка.Сперматогонии — неоднородная популяция, состоящая их клеток типа А и В.
Сперматогонии типа А подразделяются на темные и светлые клетки. Для ядер
обоих вариантов клеток типа А характерно преобладание деконденсированного
хроматина, имеющего вид мелких зерен. В светлых клетках типа А зерна так рас¬
пределены по ядру, что в световом микроскопе оно кажется бледноокрашенным.
Хроматин темных клеток типа А также относится к деконденсированному типу,
он недостаточно собран в глыбки, тем не менее его конденсация настолько выра-
женна, что в окрашенном препарате ядро окрашено более интенсивно (темное).
Вблизи ядерной оболочки ядер светлых и темных сперматогоний всегда есть
ядрышки. Б сперматогониях типа В ядра более крупные, хроматин в них часто
собирается в глыбки. Эти клетки делятся и образуют дочерние клетки — сперма-
тоциты I порядка.Сперматоциты 1 порядка, так же как и сперматогонии, в норме находятся в
яичках, но при тяжелом поражении сперматогенеза могут быть обнаружены в
эякуляте. Это крупные клетки, обычно овальной или круглой формы, в 3-3,5 раза
больше эритроцита по диаметру (21-24 мкм). Соотношение ядра и цитоплазмы
сдвинуто в сторону ядра. Ядро овальной или круглой формы. Нити хроматина
рыхло переплетаются между собой, напоминая структуру ядер мегалобластов. На
фоне хроматина можно видеть единичные ядрышки. Цитоплазма базофильная,
достаточно широким ободком окружает ядро. Вокруг ядра видна зона просветле¬
ния. В результате деления из этих клеток образуются сперматоциты II порядка.Сперматоциты П порядка в норме находятся в канальцах яичек и появляются
в сперме при нарушении сперматогенеза. Клетки круглой формы, их диаметр в2-2,5 раза превышает диаметр эритроцита, составляя 14-18 мкм. Ядро или два
ядра округлой формы, нити хроматина переплетаются между собой рыхло. Часто
встречаются сперматоциты II порядка в стадии деления (профазы). Ядрышки
не видны или видны нечетко. Цитоплазма базофильная, с сероватым оттенком,
достаточно широким ободком окружает ядро. Зона просветления вокруг ядра
(ядер) иногда не видна. Путем деления сперматоциты II порядка образуют дочер¬
ние клетки “ сперматиды.Сперматиды также находятся в семенных канальцах яичек. Они не делятся,
а постепенно созревают, образуя сперматозоиды. Вначале это небольшие, диа¬
метром 10-12 мкм, клетки круглой формы с круглым ядром хроматиновой, но
более плотной структуры. Затем они увеличиваются в размерах, постепенно вытя¬
гиваются, удлиняются, ядро уменьшается, теряет хроматиновую сруктуру и сдви¬
гается к проксимальному концу клетки (концу, обращенному к стенке семенного
канальца). Проксимальный конец ядра заостряется, и одна из двух центриолей,
расположенных вблизи закругленного конца ядра, формирует хвост (жгутик).
В окрашенных азур-эозиисм препаратах эякулята сперматиды по структуре ядра,
цвету и гомогенности цитоплазмы напоминают полихроматофильные мегало-
бласты. Форма сперматид круглая, неправильная, полигональная или вытянутая.
Эти изменения формы клетки происходят при созревании сперматид в семенном
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 451канальце. Соотношение ядра и цитоплазмы резко сдвинуто в сторону цитоплазмы.
Ядра круглой или неправильной округлой формы, могут занимать или
часть клетки и располагаться центрально (круглые сперматиды) или эксцентрич¬
но. Хроматиновая структура в более крупных ядрах частично сохранена, мелкие
ядра могут быть гиперхромными, бесструктурными или частично сохранять хро-
матиновую структуру. Более крупные ядра обычно расположены в цитоплазме
центрально, мелкие — эксцентрично, практически у края цитоплазмы. Окраска
цитоплазмы сперматид полихроматофильная — от серовато-синей до серой. При
нарушении сперматогенеза сперматиды в большом количестве обнаруживают в
эякуляте, иногда в сочетании со сперматоцитами II порядка и остаточными тель¬
цами (свободными цитоплазматическими каплями).Остатогные тельца (свободные цитоплазматические капли или фрагменты
цитоплазмы сперматид) образуются в процессе формирования сперматозоида или
разрушения сперматид (неэффективный спермиогенез). В норме процесс созрева¬
ния сперматозоида и освобождение его от цитоплазматической капли происходят
в семенном канальце, где клетки Сертоли, или эпителиальные клетки эпидиди-
миса, фагоцитируют эти остатки цитоплазмы. Остаточных телец в нормальном
эякуляте практически нет. Появление остаточных телец в эякуляте обычно соче¬
тается с появлением клеток сперматогенеза (сперматид, иногда в сочетании со
сперматоцитами).Макрофаги. Это большие клетки круглой формы, диаметром 20-36 мкм, с экс¬
центрично расположенным ядром. В окрашенных азур-эозином препаратах цито¬
плазма широким ободком окружает ядро больше с одной стороны, вакуолизирована,
в вакуолях можно видеть лейкоциты, фрагменты ядер или целые ядра разрушенных
клеточных элементов, бактерии. В сперме здорового мужчины макрофагов нет.
Макрофаги появляются в сперме больных, страдающих хроническими специфиче¬
скими и неспецифическими воспалениями простаты, эпидидимиса и др.Спермиофаги — макрофаги, фагоцитирующие сперматозоиды. Спермиофаги —
круглые клетки диаметром до 30-40 мкм, в цитоплазме которых в нативном и
окрашенном азур-эозином препаратах видны в основном головки сперматозоидов.
Иногда можно видеть спермиофаги, заполненные головками сперматозоидов, а
из их цитоплазмы по окружности, как лучи, торчат хвосты частично заглоченных
сперматозоидов. В норме в канальцах эпидидимиса роль макрофагов выполня¬
ют эпителиальные клетки (спермиофаги эпидидимиса), которые фагоцитируют
цитоплазматические капли, «сброшенные» с шейки созревших сперматозоидов.
Появление в сперме спермиофагов обусловлено длительным застоем спермы в
эпидидимисе, выходом в результате редких эякуляций из эпидидимиса неполно¬
ценных или старых сперматозоидов.Эритроциты, в нативном и окрашенном азур-эозином препаратах эритроци¬
ты выглядят так же, как и в любом другом биологическом материале. В нативном
препарате это правильной круглой формы бледно-желтые клетки с просветлением
в центре диаметром 7-9 мкм, лежащие разрозненно или скоплениями. В сперме
здоровых мужчин эритроцитов нет. Появление эритроцитов в эякуляте носит
название <^.гемоспермия^. Гемоспермия может быть истинной и ложной. Ложная
гемоспермия —появление эритроцитов в сперме в результате острой микротрав¬
мы (грубой мастурбации, исследования спермы, полученной на следующий день
после инструментального исследования мочевого пузыря или взятия материала из
мочеиспускательного канала для бактериологического исследования). Истинная
гемоспермия наблюдается при воспалении добавочных желез, новообразованиях.Эпителиальные клетки. Клетки многослойного плоского эпителия с орогове¬
нием смываются с головки полового члена и крайней плоти. Клетки переходного
эпителия выстилают простатическую часть мочеиспускательного канала в его
начальных участках. Самую короткую, перепончатую часть мочеиспускательно-
452ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ 5И0Л0ГИЧЕСКИХ МАТЕРИАЛОВИГО канала длиной 1 см и самую длинную, губчатую его часть выстилает высокий
многослойный цилиндрический эпителий. Ладьевидная ямка мочеиспускательно¬
го канала выстлана бокаловидными клетками, а ее дистальная часть — многослой¬
ным плоским неороговевающим эпителием.В нативном препарате клетки ороговевающего многослойного плоского эпи¬
телия “ это бесцветные крупные, полигональной или округлой формы клетки
с маленькими круглыми, в виде пузырька ядрами, В препаратах, окрашенных
азур-эозином, клетки поверхностного слоя крупные, диаметром 35-55 мкм, поли¬
гональной формы, с ядром диаметром 4-6 мкм, пикнотичным, гиперхромным.
Цитоплазма клеток слабоокрашена, серовато-голубая или серая. В сперме здоро¬
вого мужчины можно обнаружить единичные клетки ороговевшего поверхност¬
ного слоя многослойного эпителия, которые при эякуляции смываются с головки
полового члена и крайней плоти.Поверхностные клетки неороговевающего многослойного плоского эпителия,
выстилающие дистальный отдел ладьевидной ямки, также могут присоединиться
к эякуляту. В нативном препарате спермы это округлой формы крупные клетки
с маленькими пузырьковидными ядрами на фоне обильной бесструктурной
цитоплазмы. В препаратах, окрашенных азур-эозином, это крупные клетки диа¬
метром 30-35 мкм, овальной или круглой формы. Цитоплазма обильная, окра¬
шивается в светло-базофильные тона. Ядро диаметром 8-9 мкм расположено
центрально, круглой или овальной формы, с частично сохранившейся хромати-
новой структурой.Цилиндрический многослойный эпителий выстилает губчатую (перепончатую)
и дистальную (простатическую) части мочеиспускательного канала. Поверхностно
расположенные клетки могут отторгаться во время семяизвержения и выявляться
в сперме, в нативном препарате они имеют вытянутую форму, расширенный апи¬
кальный и заостренный дистальный конец, обладают хвостиком (хвостатые клет¬
ки). Это клетки обычно находятся в состоянии дистрофии ядра и цитоплазмы.Переходный (многослойный) эпителий выстилает начальные участки про¬
статической части мочеиспускательного канала, дистальные участки семяизвер-
гающих каналов и простатических ходов. Поверхностные клетки многослойного
переходного эпителия в нативном препарате округлой и неправильной округлой
формы («помятые»). При большом увеличении на фоне обильной цитоплаз¬
мы видны одно, два или три ядра. Цитоплазма этих клеток обычно находится
в состоянии дистрофии: грубозернистой белковой, вакуольной или жировой,
в препарате, окрашенном азур-эозином, это округлой или полигональной формы
клетки, содержащие 1-3 ядра и более, занимающих меньшую часть клеток.
Цитоплазма окрашена в насыщенно базофильные или светло-базофильные тона.
Ядра гиперхромные, грубоглыбчатые, могут быть в состоянии кариолизиса или
кариорексиса.Иммунологическое исследование спермыВЫЯВЛЕНИЕ АНТИТЕЛ К СПЕРМАТОЗОИДАМАнтитела к сперматозоидам относятся почти исключительно к двум классам
иммуноглобулинов — IgA и IgG. Исходя из того что IgA функционируют в боль¬
шей степени на поверхности, определяя барьерный иммунитет, а сперматоциты
в тестикулах отделены от остального организма гематотестикулярным барьером,
считается, что антитела класса IgA имеют большее клиническое значение, чем
антитела класса IgG. Антитела класса IgM в эякуляте выявляют очень редко из-за
большого размера их молекул.Скрининг на наличие антител проводят в нативном эякуляте. При этом исполь¬
зуют либо тест с иммунными шариками, либо тест на смешанную антиглобулино-
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 453вую реакцию (МАР-тест). Результаты теста с иммунными шариками и МАР-теста
не всегда согласуются. Если результаты этих тестов положительны, для подтверж¬
дения диагноза необходимо провести дополнительные исследования, в частности
тест на взаимодействие сперматозоидов с цервикальной слизью.Тест с иммунными шарикамиС помощью прямого теста с иммунными шариками можно выявить антитела на
поверхности сперматозоидов. Иммунные шарики представляют собой полиакрил¬
амидные сферы, ковалентно связанные с кроличьими античеловеческими имму¬
ноглобулинами. С помощью этого теста одновременно можно определять наличие
антител класса IgA и IgG.Сперматозоиды отделяют от семенной жидкости двукратным центрифуги¬
рованием, осадок смешивают с буфером для получения суспензии. Суспензию
сперматозоидов смешивают с суспензией иммунных шариков. Полученный пре¬
парат исследуют под фазово-контрастным микроскопом при увеличении в 400 раз.
Иммунные шарики склеиваются с подвижными сперматозоидами, на поверхности
которых имеются антитела. Проводят подсчет сперматозоидов (в процентах),
связанных с шариками, отмечают характер связывания. Класс антител можно
установить, применяя различные наборы иммунных шариков. Считается, что не
менее 50% подвижных сперматозоидов должны быть покрыты антителами, чтобы
существенно нарушилась пенетрация сперматозоидами цервикальной слизи и не
произошло оплодотворение in vivo. На основании этого, как минимум, 50% под¬
вижных сперматозоидов должны быть связаны с иммунными шариками, чтобы
тест можно было считать клинически значимым. Связывание иммунных шариков
с кончиками хвостов сперматозоидов необязательно ассоциируется с нарушением
фертильности и может встречаться у здоровых мужчин.Непрямой тест с иммунными шариками (антиспермальные антитела)Непрямой тест с иммунными шариками предназначен для обнаружения анти-
спермальных антител в инактивированной нагреванием сыворотке, семенной
плазме и цервикальной слизи, разведенной бромелайном.Тест па смешанную антиглобулиновую реакцию (МАР-тест)МАР-тест с антителами класса IgA и IgG проводят путем смешивания образ¬
ца нативного эякулята с частичками латекса или с эритроцитами, покрытыми
человеческими антителами класса IgA или IgG. К этой смеси добавляют моно-
специфическую античеловеческую IgG-антисыворотку, Образование смешанных
агглютинатов показывает, что сперматозоиды покрыты IgA или IgG. Диагноз
«иммунологическое бесплодие«>^ правомочен, если частички прикреплены не менее
чем к 50% подвижных сперматозоидов. Диагноз нужно подтвердить тестами с
цервикальной слизью.Исследование взаимодействия сперматозоидов
с цервикальной слизьюЭпителий слизистой оболочки шейки матки состоит из секреторных клеток
различного типа. Природа и количество секреторных клеток варьируют в раз¬
личных частях шейки матки. Продукты секреции этих клеток входят в состав
цервикальной слизи. Гормоны яичника регулируют секрецию цервикальной
слизи. Изменение объема секреции носит циклический характер. У здоровых жен¬
щин репродуктивного возраста суточная продукция слизи колеблется от 0,5 мл
в середине менструального цикла до менее 0,1 мл в другие фазы цикла, В состав
цервикальной слизи входит небольшое количество эндометриальной, трубной
454 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВИ, ВОЗМОЖНО, фолликулярной жидкости. Кроме того, в цервикальной слизи при¬
сутствуют лейкоциты и клеточный детрит из эпителия слизистой оболочки матки
и цервикального канала. Цервикальная слизь — гетерогенный секрет, состоящий
из компонентов высокой и низкой вязкости. Ее характеризуют по консистенции,
растяжимости и кристаллизации. Компонент высокой вязкости состоит из муци¬
на — волокнистой системы, построенной из пептидного ядра и олигосахаридных
боковых цепей, к компоненту низкой вязкости относятся электролиты, органиче¬
ские соединения и растворимые белки. Циклические изменения составных частей
цервикальной слизи могут влиять на проникающую способность и выживаемость
сперматозоидов. Сперматозоиды способны пенетрировать цервикальную слизь
приблизительно с 9-го дня нормального 28-дневного менструального цикла, и эта
способность постепенно усиливается, достигая своего пика непосредственно перед
овуляцией. После этого способность к пенетрации снижается, причем раньше, чем
наступают видимые изменения в характере цервикальной слизи. Часто отмечается
индивидуальная вариабельность во времени и степени проницаемости слизи для
сперматозоидов. Подвижные сперматозоиды, направляемые волокнами церви¬
кальной слизи, попадают в цервикальные крипты, где они могут собираться, а
затем постепенно проникать в матку и фаллопиевы трубы.Шейка матки и ее секрет восприимчивы к пенетрации сперматозоидами во
время или перед овуляцией и создают барьер для пенетрации в другие фазы цикла,
защищают сперматозоиды от агрессивной среды влагалища и фагоцитоза. В слизи
шейки матки происходит селекция сперматозоидов за счет разницы в подвижно¬
сти и морфологии, а также инициация капацитации сперматозоидов. В настоящее
время отсутствуют методы, с помощью которых можно было бы на практике
оценить влияние маточной и трубной жидкости на сперматозоиды. Цервикальная
же слизь легкодоступна для взятия образца и исследования. Оценка взаимодей¬
ствия сперматозоидов с цервикальной слизью очень важна, ее следует включать
в обследование по поводу бесплодия. Выявление нарушения взаимодействия
сперматозоидов с цервикальной слизью может служить показанием к проведению
искусственной внутриматочной инсеминации или к использованию других мето¬
дов вспомогательных репродуктивных технологий.ПОЛУЧЕНИЕ и КОНСЕРВАЦИЯ ОБРАЗЦОВ ЦЕРВИКАЛЬНОЙ СЛИЗИШейку матки обнажают в зеркалах и осторожно протирают тампоном для уда¬
ления вьщелений из влагалища. Слизь из наружного зева извлекают с помощью
тампона или пинцета. Слизь из цервикального канала можно получить методом
аспирации с помощью туберкулинового шприца (без иглы), шприца для слизи,
пипетки или полиэтиленовой трубочки. По возможности оценку качества слизи
следует проводить сразу же после взятия. Если это невозможно, слизь следует
законсервировать до проведения анализа.При получении слизи методом аспирации важно, чтобы сила давления на
поршень инструмента (шприца, катетера и т.д.) была стандартной. Аспирацию
начинают после того, как кончик инструмента введен приблизительно на 1 см в
цервикальный канал. Продолжая аспирацию, постепенно выводят инструмент.
Давление на поршень прекращают непосредственно перед выведением инструмен¬
та из наружного зева. Образцы слизи можно хранить в туберкулиновом шприце,
полиэтиленовых или маленьких закрытых аналитических пробирках. Следует сле¬
дить за тем, чтобы в контейнерах было минимальное количество воздуха. Образцы
следует хранить в холодильнике при температуре 4 °С не более 5 сут. При возмож¬
ности образцы слизи следует использовать в течение двух дней после получения,
а интервал между получением и использованием нужно всегда отмечать. Образцы
слизи нельзя замораживать.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 455ВЗАИМОДЕЙСТВИЕ СПЕРМАТОЗОИДОВ С ЦЕРВИКАЛЬНОЙ СЛИЗЬЮЦервикальная слизь в ограниченный период менструального цикла способ¬
ствует миграции сперматозоидов. Насыщенная эстрогенами цервикальная слизь
благоприятна для пенетрации сперматозоидами. Длительность благоприятного
периода у разных женщин различна. Более того, этот период варьирует у одной
и той же женщины от одного менструального цикла к другому. Следовательно,
только после повторения тестов в нескольких циклах можно сделать заключение о
нарушении взаимодействия сперматозоидов с цервикальной слизью.Тест ІП vivo (посткоитальный)Время проведения. Посткоитальный тест следует проводить как можно
ближе к моменту овуляции, определяемой на основании клинических критери¬
ев (это обычная продолжительность цикла, базальная температура, изменения
цервикальной слизи, цитологическое исследование влагалища, если возможно —
определение уровня эстрогенов в сыворотке или моче, УЗИ яичников). Важно,
чтобы каждая лаборатория проводила исследование цервикальной слизи через
стандартный промежуток времени после коитуса. Это время варьирует в пределах
от 9 до 24 ч.Рекомендации для пациентов по подготовке к посткоитальному тесту.Партнерам следует воздержаться от половых сношений до проведения теста в
течение, как минимум, 2 сут. Нужно назвать наиболее подходящий день для про¬
ведения теста (дату). Половое сношение должно произойти в ночь накануне этого
дня.Техника проведения посткоитального теста. Во влагалище вводят зеркало
(без смазки) и туберкулиновым шприцем (без иголки), пипеткой или полиэти¬
леновой трубкой берут образец выделений из заднего свода влагалища. Другим
шприцем или катетером берут образец слизи из цервикального канала. Далее
каждый образец наносят на отдельное предметное стекло, накрывают покровным
стеклом и исследуют при стандартной глубине с помощью фазово-контрастного
микроскопа.Образец выделений из влагалища. Обычно сперматозоиды во влагалище
погибают в течение 2 ч. Цель исследования образца выделений из влагалища —
установление факта попадания сперматозоидов во влагалище.Образец цервикальной слизи. Количество сперматозоидов в нижней части
цервикального канала варьирует к зависимости от времени, прошедшего после
полового сношения. Через 2-3 ч после коитуса в нижней части цервикального
канала скапливается большое количество сперматозоидов. Рекомендуют, чтобы
концентрация сперматозоидов в слизи выражалась в стандартных единицах
(количество сперматозоидов в мм^), что аналогично подсчеіу содержания клеточ¬
ных элементов в слизи.По подвижности сперматозоиды в цервикальной слизи классифицируют по
категориям:• быстрое поступательное движение:• медленное и вялое поступательное движение;• непоступательное движение;• неподвижность.Наличие любого количества сперматозоидов с быстрым поступательным движе¬
нием — наиболее важный индикатор нормальной функции цервикальной слизи.Интерпретация результатов. Целью посткоитального теста считается не толь¬
ко определение количества активных сперматозоидов в цервикальной слизи, но и
оценка выживаемости и поведения сперматозоидов спустя много часов после поло¬
вого сношения (роль резервуара). Следовательно, проведение теста через 9-24 ч
оптимально для оценки жизнеспособности и выживаемости сперматозоидов.'Ш
456 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВПо наличию в слизи цервикального канала любого количества сперматозоидов
с быстрым поступательным движением можно сделать вывод, что цервикальный
фактор у данной пары не является причиной бесплодия.При отрицательном или патологическом результате посткоитальноый тест
следует повторить. Если в цервикальном канале и влагалище не обнаружены спер¬
матозоиды, необходимо расспросить пару, действительно ли была эякуляция и
сперматозоиды попали во влагалище. Причиной отрицательного результата теста
может быть неправильное время его проведения. Тесты, проведенные слишком
рано или поздно, могут дать отрицательные результаты даже у фертильных пар.
У некоторых женщин тест может быть положительным только 1-2 сут из всего
менструального цикла. Если время овуляции установить точно невозможно, сле¬
дует повторить тест несколько раз в течение цикла либо провести тесты in vitro.
Только неоднократно полученный отрицательный результат посткоитального
теста в течение нескольких циклов при условии оптимального времени проведе¬
ния может свидетельствовать о роли цервикального фактора как возможной при¬
чины бесплодия.Тесты in vitroДетальное изучение взаимодействия сперматозоидов с цервикальной слизью
можно провести и с помощью тестов пенетрации in vitro. Обычно эти тесты про¬
водят в случае отрицательного результата посткоитального теста. Они наиболее
информативны при перекрестном тестировании с использованием сперматозои¬
дов и цервикальной слизи от доноров.Если целью проведения теста взаимодействия сперматозоидов с цервикальной
слизью является сравнение качества различных образцов цервикальной слизи,
следует использовать один образец эякулята с оптимальными характеристиками
концентрации, подвижности и морфологии сперматозоидов. При необходимости
оценить качество различных образцов эякулята используют один и тот же образец
цервикальной слизи, чтобы иметь представление о способности сперматозоидов
к пенетрации этой слизи. Если при использовании эякулята мужчины и слизи
женщины результат теста получился отрицательный, можно провести перекрест¬
ное тестирование со сперматозоидами и цервикальной слизью доноров, чтобы
выяснить, ответственны ли за патологический результат сперматозоиды и/или
цервикальная слизь. Донорскую цервикальную слизь можно получить от женщин,
которым проводят искусственную инсеминацию в середине менструального цикла.
Цервикальную слизь следует собирать перед инсеминацией в естественном цикле
или в цикле стимуляции овуляции гонадотропинами.Тесты in vitro проводят в течение часа после получения образца эякулята.
Следует использовать только цервикальную слизь, полученную от женщин в сере¬
дине менструального цикла. Использование суррогатных гелей, например церви¬
кальной слизи от коров или синтетических гелей, не может быть рекомендовано
в качестве эквивалента цервикальной слизи женщины для тестов взаимодействия
сперматозоидов с цервикальной слизью in vitro.Биохимическое исследование спермыПоддержание функциональной активности сперматозоидов осуществляется
спермоплазмой, в которой содержатся белки и ферменты, микроэлементы, фрук¬
тоза, лимонная кислота, карнитин и другие метаболиты. Спермоплазма представ¬
ляет собой смесь секретов добавочных половых желез. Нормальная деятельность
этих желез обеспечивается андрогенными гормонами. Тестостерон стимулирует
накопление фруктозы в семенных пузырьках, лимонной кислоты и микроэлемен¬
тов в предстательной железе, карнитина в придатках яичка, поэтому уровень этих
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 457метаболитов в спермоплазме может косвенно свидетельствовать об андрогенной
насыщенности организма и функциональном состоянии желез мужской половой
системы.Секреция фруктозы считается наиболее важной функцией семенных пузырь¬
ков, так как это вещество обеспечивает поддержание обмена веществ и подвиж¬
ности сперматозоидов. Нормальная концентрация фруктозы в спермоплазме —
10-60 ммоль/л. Снижение жизнеспособности сперматозоидов сопровождается
повышением уровня фруктозы в спермоплазме.Концентрация лимонной кислоты отражает функциональное состояние пред¬
стательной железы и эндокринной функции яичек, в норме ее более 20 ммоль/л.уровень карнитина в спермоплазме — около 0,47 моль/л. Он попадает в эякулят
из придатка яичка (94%) и семенных пузырьков. Карнитин участвует в переносе
жирных кислот через мембрану сперматозоида и увеличивает их подвижность.Существенное влияние на подвижность сперматозоидов и оплодотворяющие
свойства эякулята оказывают такие микроэлементы, как Fe, Mg, Mn, Zn. Их секре¬
ция осуществляется в основном предстательной железой.Спермоплазма содержит большое количество белков, которые секретируются
в основном предстательной железой и семенными пузырьками, в норме кон¬
центрация общего белка составляет 40-45 г/л. Ключевые ферменты процесса
оплодотворения — сериновая протеиназа (акрозин) и гиалуронидаза, участвую¬
щие в акросомальной реакции. Их активность находится в прямой зависимости
от концентрации сперматозоидов. Исследование активности акрозина служит
прекрасным тестом для оценки фертильности при подготовке к искусственному
оплодотворению. Содержание гиалуронидазы находится в прямой зависимости
от количества сперматозоидов: с их увеличением концентрация гиалуронидазы в
эякуляте возрастает.ИССЛЕДОВАНИЕ МОКРОТЫ
Порядок сбора мокротыПостановка диагноза при микроскопическом исследовании мокроты возможна
при соблюдении больным правил ее сбора. Забор мокроты проводят утром, после
туалета полости рта и полоскания 2% раствором соды, интенсивным кашлем.
Мокроту собирают в чистую широкогорлую хорошо закрываемую посуду после
нескольких кашлевых толчков и сразу доставляют в лабораторию.Микроскопия мокроты — трудоемкое исследование (табл. 6-40). Это обуслов¬
лено низкой концентрацией диагностически ценных клеток на единице площади
препарата, дегенерацией данных клеток под действием ферментов слюны, загряз¬
нением препарата клеточными и пищевыми элементами полости рта.Типичный признак при цитологическом исследовании мокроты — наличие
альвеолярных макрофагов. При подозрении на злокачественное новообразова¬
ние легких мокроту необходимо исследовать несколько раз. При микроскопиче¬
ском исследовании мокроты необходимо учить[вать, что повышение результатив¬
ности исследования мокроты больше зависит от увеличения количества порций,
из которых берут материал, чем от увеличения количества приготовленных
препаратов. Для диагностики рака легких достаточно провести 3-кратное цито¬
логическое исследование мокроты, для исключения этого диагноза — 5-кратное.
В особых случаях, когда другие способы получения диагностического материала
(бронхоскопия, пункция легкого) противопоказаны или не проводятся в данном
лечебном учреждении, количество анализов мокроты может значительно увели¬
чиваться.
458 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВТаблица 6-40. Достоинства и ограничения цитологического исследования мокроты (Шапиро Н.А.
2005}ДостоинстваОграниченияОтсутствие противопоказаний и специального обо¬
рудованияСпонтанное выделение мокроты
Возможность многократных исследований
Наличие в материале клеток из всех отделов легкого
{«зеркало» легкого)Высокая результативность при диагностике опухолей
центральной локализации
Высокая результативность при поражении легкого
плоскоклеточным ракомВысокая результативность при поражении легкого
мелкоклеточным ракомВозможность диагностики опухоли в бессимптомной
стадии заболевания
Лучший скрининг-тестПри отсутствии мокроты необходимость использо¬
вания специальных методик
Зависимость результативности от квалификации
лаборантаБольшая трудоемкость приготовления препарата
Длительность исследования одного препарата и
одной мокротыНизкая результативность диагностики при пери¬
ферической локализации поражения
Низкая результативность при диагностике добро¬
качественных новообразований
Отсутствие информации о локализации и распро¬
страненности пораженияНеобходимость исключения локализации опухоли
в соседнем органе (полости рта, глотке, гортани,
пищеводе) Свойства мокротыСуточное количество мокротыКоличество мокроты зависит от заболевания. При остром бронхите, бронхиаль¬
ной астме и начальной стадии пневмонии выделяется в течение суток до 1-2 мл
(2-3 плевка). При хроническом бронхите, аденоматозе, туберкулезе легких выде¬
ляется до 25-100 мл мокроты. При бронхоэктатической болезни, актиномикозе
и некоторых глистных заболеваниях ее количество достигает 2 л, а при вскрытии
абсцесса легкого — 4 л.В КДЛ для исследования доставляют обычно только утреннюю, свежевыделен¬
ную мокроту. Дети и резко ослабленные больные откашливают не всю мокроту,
поэтому выделяют ее очень немного.ЗапахСвежая мокрота не имеет запаха. Гнилостный или гангренозный запах све¬
жесобранной мокроты характерен для гнилостного бронхита, гангрены легкого,
абсцесса легкого и злокачественных новообразований легкого, сопровождаемых
некротическими процессами.Цвет и прозрачностьСлизистая мокрота обычно бесцветная и прозрачная или имеет белесоватый
цвет. Гнойная и гнойно-слизистая мокрота серого, желтоватого или зеленоватого
цвета, что обусловлено присутствием лейкоцитов, продуктов их распада и жиз¬
недеятельности бактерий (синегнойной палочкой). Кровянистая мокрота может
иметь цвет крови при значительном легочном кровотечении. Ржавый цвет типи¬
чен для крупозной пневмонии, буроватый — для парагонимоза, коричневый цвет
встречается при туберкулезе, гангрене, злокачественных новообразованиях лег¬
кого и обусловлен содержанием продукта распада гемоглобина — гемосидерина.
Мокрота малинового цвета отмечается при злокачественных новообразованиях
легкого, бывает прозрачной, как желе, из-за гемолиза эритроцитов, иногда мутной
за счет гемоглобина, эритроцитов и других клеточных элементов. При желтухе у
больных выделяется грязно-зеленая или зеленовато-желтая мокрота. При нанесе¬
нии такой мокроты на диагностическую зону полоски для определения билируби¬
на в моче отмечается характерное пурпурное окрашивание.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 459Характер мокротыОсновные составные части мокроты — слизь, гной, кровь, в редких случаях
серозная жидкость. В зависимости от преобладания той или иной составной
части различают чисто слизистую, слизисто-гнойную, гнойно-слизистую, чисто
гнойную, кровянистую мокроту, которая может быть также кровавой, слизисто¬
кровянистой, слизисто-гнойно-кровянистой или серозной. Преобладающая часть
полиморфной мокроты ставится в названии на последнее место.Слизистая мокрота — результат повышенного образования слизи мукоцитами
дыхательных путей под влиянием бактерий или других раздражителей. Эта мокро¬
та бесцветная, вязкой консистенции и содержит небольшое количество клеточных
элементов. Выделяется при хроническом воспалении верхних дыхательных путей,
у курильщиков, при астматических приступах, коклюше и остром бронхите. При
инфильтративной и очаговой форме туберкулеза легких мокрота может быть
только слизистой- Скудное количество слизистой, с мелкими серыми крупинками,
«рвущейсяз>, а не тянущейся мокроты выделяется при неспецифических воспали¬
тельных процессах легких.Слизисто-гнойная мокрота — довольно однородная мутная и вязкая масса.
Слизь и гной в ней равномерно смешаны. Такая мокрота характерна для заболева¬
ний бронхов и паренхимы легких.Гнойно-слизистая мокрота неоднородна. Она состоит из слизи, в которой рас¬
положены гнойные комочки округлой формы. Характерна для заболеваний верх¬
них дыхательных путей. На фоне слизи могут определяться беловато-серые или
кровянистые прожилки, что встречается при раке легкого.Гнойная мокрота — полужидкая или жидкая, в большом количестве характерна
для фиброзно-кавернозной формы туберкулеза. Большое количество гнойной
зеленоватой мокроты с гнилостным запахом выделяется при абсцессе легкого.
Выделение чисто гнойной мокроты наблюдается крайне редко, только при вскры¬
тии эмпиемы плевры в просвет бронха. При движении по бронхам к мокроте при¬
мешивается небольшое количество слизи.Кровавая мокрота наблюдается чаще при туберкулезе легких, но может встре¬
чаться и при актиномикозе, гангрене легкого, бронхоэктазах, новообразованиях,
сифилисе, ранениях легкого. Источник кровотечения может иметь и нелегочное
происхождение — полость носа, язва желудка (круглая язва), прорыв аневризма¬
тического узла аорты в просвет бронха или трахею.Слизисто-кровянистая мокрота встречается при инфаркте легкого в стадии
обратного развития, при воспалении верхних дыхательных путей или носо¬
глотки.Слизисто-гнойно-кровянистая мокрота часто выделяется при туберкулезе,
тяжелых застойных воспалительных процессах дыхательных путей, злокачествен¬
ных новообразованиях, актиномикозе, парагонимозе (дистоматозе), бронхоэкта¬
зах. Примесь крови в слизисто-гнойной мокроте может быть представлена в виде
мелких прожилок и тяжей.Пенистая мокрота обычно бесцветная, похожа на слюну, характерна для адено-
матоза легких.Серозная мокрота чаще бесцветная, пенистая, жидкая, невязкая и довольно
прозрачная. При примеси крови и продуктов ее распада цвет мокроты может
приобретать красноватый или желтоватый оттенок. Отличительный признак
серозной мокроты — большое содержание белка. Такая мокрота встречается при
отеке, туберкулезе легких. Следы белка характерны для мокроты при хроническом
бронхите.Ориентировочное представление о количестве белка в мокроте можно получить
с помощью диагностической зоны полоски для качественного и полуколичествен-
ного определения белка в моче.
460 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ. JМикроскопическое исследование мокротыМикроскопическое исследование нативного и окрашенного препаратов мокро¬
ты должен проводить врач. Клеточные и неклеточные элементы в мокроте всег¬
да распределяются неравномерно, поэтому необходимо исследовать несколько
нативных препаратов или два, составленных из всех частей мокроты. Если при¬
готовление комплексных нативных препаратов вызывает затруднения, следуетприготовить нативные препараты из каждой составной части мокроты, а изнативного препарата, в котором обнаружены клеточные элементы, вызвавшие
интерес микроскописта, приготовить препарат для окраски азур-эозином и по
Цилю-Нильсену.КЛЕТОЧНЫЕ ЭЛЕМЕНТЫ МОКРОТЫ
НейтрофилыБ препаратах мокроты лейкоциты могут быть хорошо сохранившимися и на
различных стадиях дегенерации, поэтому типы лейкоцитов, их морфология опре¬
деляются в препаратах, окрашенных азур-эозином.Нейтрофилы всегда содержатся в мокроте в большем или меньшем количе¬
стве. Чем больше гноя в мокроте, тем больше нейтрофилов. Нейтрофилы могут
сочетаться с другими типами лейкоцитов. При воспалительных неспецифи¬
ческих процессах нейтрофилы в густом по консистенции гное, выглядят как
бесцветные, мелкозернистые, четко контурированные объемные клетки с неко¬
торым блеском, в жидкой серозной мокроте нейтрофилы — крупные клетки (в2,5 раза больше эритроцита) с хорошо определяемыми фрагментированными
ядрами.ЗозинофилыЭозинофилы — клетки размером 10-12 мкм. Ядро обычно состоит из двух
сегментов. При большом увеличении в их цитоплазме видна желтоватая равно¬
мерная сферическая зернистость. Распознаются эозинофилы по способности
этой специфической зернистости преломлять проходящий свет, в препаратах,
окрашенных азур-эозином, у эозинофилов на фоне голубой цитоплазмы четко
визуализируется ядро с тяжистой хроматиновой структурой, состоящее обычно
из 2, реже 3-4 сегментов, окруженное равномерной сферической зернистостью.
Основные характеристики эозинофилов при заболеваниях бронхолегочной
системы:• в цитоплазме эозинофилов содержатся граьіульї с большим количеством
щелочного белка и перекисей, обладающих бактерицидной активностью;• в гранулах эозинофилов определяются кислая фосфатаза, акрилсульфатаза,
коллагеназа, эластаза, глюкуронидаза, катепсинмиелопероксидаза и другие
ферменты, обладающие литической активностью;• эозинофилы обладают слабой фагоцитарой активностью и обусловливают
внеклеточный цитолиз, участвуя в противогельминтном иммунитете, а также
принимая активное участие в аллергических реакциях;• появлению эозинофилов в мокроте способствуют заболевания аллергическо¬
го характера:<0^ бронхиальная астма;экзогенный аллергический альвеолит;❖ эозинофильная пневмония Лефлера;❖ гранулематоз из клеток Лангерганса;
лекарственный токсикоз;о- поражение легких простейшими;
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 461гельминтозы легких;❖ эозинофильный инфильтрат.Эозинофилы обнаруживают в мокроте при злокачественных новообразованиях
легких.Тучные клеткиЕдиничные тканевые базофилы можно обнаружить в гнойной мокроте феди
нейтрофилов, лимфоцитов и эозинофилов. Тканевые базофилы обладают гомео¬
статической функцией, оказывают влияние на проницаемость и тонус сосудистой
стенки, поддерживают баланс жидкостей в тканях. Защитная функция этих клеток
заключается в выделении медиаторов воспаления и хемотаксических факторов.
Базофилы участвуют в аллергических реакциях.Тканевые базофилы — клетки размером 10-15 мкм. Ядро занимает большую
часть клетки и практически неразличимо под полиморфной плоской зернистостью
черного, темно-коричневого или фиолетового цвета. Зернистость расположена в
цитоплазме и на ядре. Гранулы тучных клеток содержат гистамин, хондроитин-
сульфаты А и С, гепарин, серотонин, различные протеолитические ферменты
(трипсин, хемотрипсин, пероксидазу, РНКазу). На клеточной мембране тучных
клеток отмечается высокая плотность рецепторов IgE, обеспечивающих не только
связывание IgE, но и высвобождение гранул, содержимое которых участвует в
развитии аллергических реакций. Тканевые базофилы обладают способностью к
фагоцитозу.Количество тканевых базофилов резко увеличивается в мокроте и бронхолегоч¬
ном лаваже у больных с экзогенным аллергическим альвеолитом.МоноцитыДиаметр моноцита составляет 14-20 мкм, ядро бобовидной, подковообразной
формы или многолопастное. Иногда в углублении «подковы» визуализируется
выступающий округлый фрагмент ядра. Хроматин ядра нежной рыхлой структу¬
ры, ядрышек нет. Цитоплазма относительно широкая, серо-голубая, может содер¬
жать мелкую азурофильную зернистость и вакуоли вокруг ядра.Моноцит, попав в ткань легких, в зависимости от микроокружения трансфор¬
мируется в макрофаг с преобладанием той или иной функциональной активности.
В зависимости от выполняемой функции образовавшаяся клетка имеет отличи¬
тельные морфологические особенности, в процессе дифференцировки моноцита в
макрофаг исчезает азурофильная зернистость, содержащая пероксидазу, а актив¬
ность кислой фосфатазы возрастает.ЛимфоцитыЛимфоциты — основные эффекторные клетки иммунного ответа, участвуют во
всех иммунологических реакциях, высокочувствительны к воздействию различных
физических, химических факторов. Большое количество лимфоцитов появляется
при активации иммунологической реактивности организма. Появление плазмати¬
ческих клеток характерно для процесса образования антител. Лимфоциты в боль¬
шом количестве обнаруживают в мокроте при туберкулезе, саркоидозе, экзогенном
аллергическом альвеолите, парагонимозе, аскаридозе, амебной пневмонии.Эритроцитыэритроциты имеют вид желтоватых дисков диаметром 7-8 мкм. Единичные
эритроциты могут встречаться в любой мокроте. В большом количестве эритроци¬
ты обнаруживают в мокроте, окрашенной кровью. Такая мокрота характерна для
инфаркта легкого, застоя в малом круге кровообращения, туберкулеза, парагони-
моза, злокачественных новообразований легких.
462 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ Биологических МАТЕРИАЛОВЦилиндрический реснитчатый эпителийЦилиндрический реснитчатый эпителий выстилает слизистую оболочку НОСО¬
ВЫХ путей, гортани, трахеи, бронхов и бронхиол. В зависимости от того, из какого
участка бронхиального дерева слущиваются клетки цилиндрического эпителия,
изменяется их размер. Клетки цилиндрического реснитчатого эпителия обнару*
живают в препаратах мокроты, приготовленных из белесоватых тяжей, нитей и
пленок, лежащих на фоне слизи и представляющих собой отторгнутые при каш-
левых толчках участки воспаленной гипертрофированной слизистой оболочки
дыхательных путей. Клетки имеют удлиненную форму, расширенную в апикаль¬
ной части, направленной в просвет бронха, и суженную в основании клетки. На
расширенном конце расположена уплотненная оболочка («кутикула», или терми¬
нальная полоска), к которой прикрепляются реснички. Реснички сохраняются на
терминальной полоске при остром воспалении в свежевыделенной мокроте. Ядра
расположены в дистальной части прозрачной цитоплазмы. Клетки цилиндриче¬
ского реснитчатого эпителия расположень( в мокроте неравномерно, группами,
в виде скоплений разных размеров. Иногда пласты цилиндрического эпителия
образуют при движении по бронхам плотные клеточные комплексы округлой
или овальной формы с четкими контурами, по краям которых видны реснички,
довольно долго сохраняющие активную подвижность. Эти комплексы получили
название телец креола. Наблюдается движение ресничек на тканевых клочках
эпителиальной ткани более 8 ч от момента доставки мокроты в лабораторию. Эти
образования ошибочно можно принять за комплексы злокачественных клеток или
за вегетативные формы простейших.АЛЬВЕОЛЯРНЫЕ МАКРОФАГИАльвеолярные макрофаги образ}тотся из единой полипотентной клетки костного
мозга, проходят стадию моноцита, в легких превращаются в альвеолярные макро¬
фаги. Они выполняют фагоцитарную, секреторную и антигенпредставляющую
функции. В зависимости от функции альвеолярные макрофаги имеют отличитель¬
ные морфологические признаки, которые выявляют в нативных и окрашенных
азур-эозином препаратах. В слизи они представлены отдельно лежащими клет¬
ками, небольшими группами или большими скоплениями- Альвеолярные макро¬
фаги в препаратах, окрашенных азур-эозином, характеризуются полиморфизмом
величины и формы клеток, а также формы ядер и их количества. Диаметр клеток
колеблется от 18 до 40 мкм, количество ядер — от одного до 3-4 и более. Форма
ядер разнообразна: округлая, овальная, с выемкой. Ядерно-цитоплазматическое
соотношение резко смещено в сторону цитоплазмы, соблюдается в клетках всегда.
Форма альвеолярных макрофагов зависит от вязкости слизи, в которой они рас¬
положены. Б жидкой, серозной мокроте они имеют круглую форму.«Клетки курильщика» или «пылевые клетки» (кониофаги)Кониофаги фагоцитируют пыль, сажу, никотин, краску. Эти включения видны в
цитоплазме клеток в нативном препарате в виде желтовато-коричневых, коричне¬
вых, черных и цветных гранул различных размеров. Иногда они заполняют прак¬
тически всю цитоплазму клетки. Альвеолярные макрофаги в мокроте шахтеров
черного цвета, заполнены микрочастицами черного угля, у мукомолов — белого
цвета, у людей, работающих в красильном производстве, цвет альвеолярных
макрофагов зависит от цвета красителя.ЛипофагиЛипофаги — альвеолярные макрофаги с каплями жира или ксантомные клетки
из очага жировой дегенерации легочной ткани. Цитоплазма липофагов заполнена
каплями жира, поэтому их обозначают как жировые или зернистые шары. Эти
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 463клетки характерны для хронического воспалительного процесса или злокаче¬
ственных новообразований легких. сШАльвеолярные макрофаги с гемосидерином, сидерофаги, или клетки
«сердечных пороков» ,Сидерофаги содержат в цитоплазме кристаллы гемосидерина золотисто-жел¬
того или коричневатого цвета. Гемосидерин образуется из гемоглобина внутрикле-
точно в цитопла.чме альвеолярных макрофагов в результате распада эритроцитов
при застое в малом круге кровообращения, инфаркте легкого, легочном кровоте- ^
чении, идиопатическом гемосидерозе легких, в препаратах мокроты, окрашенных
азур-эозином, аморфные кристаллы гемосидерина в альвеолярных макрофагах
окрашиваются в черный или черно-синий цвет.Идиопатический гемосидероз легких, или «железное легкое», описали W. Ceelen
и N. Gellerstadt, поэтому он получил название синдрома Селена-Геллерстедта.
Встречается в юношеском и детском возрасте. Болезнь протекает волнообразно,
с двусторонними мелкоочаговыми изменениями в легких, кровохарканьем и
спленомегалией. При исследовании мокроты выявляют большое количество аль¬
веолярных макрофагов с желто-коричневыми включениями. Для подтверждения
природы патологического процесса и наличия в мокроте альвеолярных макрофа¬
гов с гемосидерином необходимо провести реакцию Перлса (реакцию образова¬
ния берлинской лаз>фи).АЛЬВЕОЛЯРНЫЙ ЭПИТЕЛИЙАльвеолярный эпителий представлен пневмоцитами II типа, его обнаружи¬
вают в препаратах из бронхоальвеолярного лаважа больных с идиопатическим
легочным фиброзом (синдромом Хаммена-Рича, прогрессирующим интерстици¬
альным фиброзом легких, склерозирующим альвеолитом). Заболевание характе¬
ризуется диффузным, острым очаговым или хроническим негнойным воспалени¬
ем легких с исходом в фиброз интерстициальной ткани легких. Десквамативная
пневмония, или болезнь Либова, — одна из форм данного заболевания, харак¬
теризуется обильным слущиванием альвеолярного эпителия. При этой форме в
бронхоальвеолярном лаваже общее количество клеток увеличивается до IxlOyмл
за счет лимфоцитов, большого количества альвеолярного эпителия, нейтро-
филов, эозинофилов и лимфоцитов. Б мазках, приготовленных из лаважа и
окрашенных азур-эозином, обычно присутствуют пневмоциты II типа — клет¬
ки размером с небольшой макрофаг, с ядром округлой или неправильной
формы, расположенным центрально и занимающим около трети цитоплазмы.
Цитоплазма серо-синего цвета, содержит однотипные вакуоли, придающие ей
дырчатый вид. Содержимое вакуолей при фиксации спиртсодержащими краси¬
телями разрушается.ЭЛАСТИЧЕСКИЕ ВОЛОКНАЭластические волокна — соединительная ткань легочной паренхимы, которая
появляется в мокроте в результате распада при туберкулезе, абсцессе легкого,
гангрене, абсцедирующей пневмонии, актиномикозе, злокачественных новооб¬
разованиях легких.Неизмененные эластические волокнаНеизмененные эластигеские волокна имеют вид извитых тонких блестящих
волокон равномерной толщины на всем протяжении, напоминают ветки дерева,
складываются в пучки, при выраженном распаде сохраняют строение альвеол.
Расположены на фоне полуразрушенных лейкоцитов или детрита. Эластические
волокна легко идентифицируются в нативных препаратах, приготовленных из
плотных гнойных частиц или белесоватых крупинок на фоне гноя, представляю-
464 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВщих собой некротические массы. Они хорошо различимы в препаратах, окрашен¬
ных азур-эозином.Коралловидные эластические волокнаКоралловидные волокна — резко преломляющие свет, грубоветвящиеся образо¬
вания, напоминающие кораллы. Объемные бугристые наслоения на эластических
волокнах состоят из кристаллов и солей жирных кислот, которые образуются
в очаге хронического воспаления, каверне при кавернозном туберкулезе. Если
мокроту с коралловидными волокнами обработать 10% раствором гидроксида
натрия или гидроксида калия, кристаллические образования растворяются, осво¬
бождая неизмененные эластические волокна.Обызвествленные эластические волокнаОбызвествленные эластические волокна грубые, хрупкие, пропитаны солями
извести, расположены на фоне грубозернистой массы обызвествленного детрита
в виде пунктирных линий, состоящих из сероватых, резко преломляющих свет
палочек. При приготовлении нативного препарата они ломаются под покровным
стеклом. Их обнаруживают в нативных препаратах мокроты при распаде первич¬
ного туберкулезного очага Гона, а также при абсцессе и гангрене легкого, злока¬
чественных новообразованиях легких. Элементы распада петрифицированного
очага называются тетрадой Эрлиха: .• обызвествленные эластические волокна;• обызвествленный детрит;• кристаллы холестерина;• микобактерии туберкулеза.СПИРАЛИ КУРШМАНАСпирали Кушмана — плотная слизь в виде осевого цилиндра, окруженная рых¬
лой слизью, называемой мантией. Центральная часть спирали Куршмана (осевой
цилиндр) резко преломляет свет и напоминает блестящую объемную нить или
спираль. Осевые цилиндры образуются в бронхах и бронхеолах при застое вяз¬
кой слизи во время спазма или обструкции. Спираль Куршмана формируется при
кашле, во время движения осевого цилиндра по бронхиальному дереву, когда он
окутывается рыхлой слизью (мантией). Спирали Куршмана, образовавшиеся в
крупных бронхах, могут иметь очень большие размеры, при малом увеличении
занимать несколько полей зрения. Они видны при макроскопическом просмо¬
тре мокроты, перенесенной в чашку Петри, Очень маленькие, короткие спирали
Куршмана, представленные только осевыми цилиндрами, образуются в мелких
бронхиолах. Спирали Куршмана встречаются в мокроте при бронхиальной астме,
туберкулезе, злокачественных новообразованиях легких, при воспалительных
процессах, сопровождаемых спазмом или обструкцией бронхов.КРИСТАЛЛЫ В ПРЕПАРАТАХ МОКРОТЫ
Кристаллы Шарко-ЛейденаКристаллы Шарко-Лейдена имеют вид вытянутых в длину ромбов различных
размеров. Они образуются из эозинофильной зернистости при ее распаде. Их
обнаруживают в препаратах мокроты, приготовленных из плотных желтоватых
или желтовато-коричневатых комочков, цилиндрических или ветвящихся, объ¬
емных образований из мелких бронхов, и они расположены на фоне эозинофи-
лов или эозинофильной зернистости, Б холодильнике в мокроте, содержащей
эозинофилы, происходит образование кристаллов Шарко-Лейдена. В нативных
препаратах они бесцветные, резко преломляют свет, в окрашенных препаратах
наблюдается сродство кристаллов к эозинофилам.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 465Кристаллы гематоидинаГематоидин продукт распада гемоглобина, образуется в глубине гематом и
обширных кровоизлияний, очагах распада злокачественных новообразований,
некротизированной ткани легкого. Кристаллы гематоидина золотисто-желтые,
имеют форму ромба, вытянутого в длину, разрозненно лежащих игл или склады¬
вающихся в пучки или звезды, в препаратах мокроты кристаллы гематоидина рас¬
положены на фоне детрита, эластических волокон, злокачественных клеток или в
очагах некроза легочной ткани либо распада гематомы.Кристаллы холестеринакристаллы холестерина — бесцветные тонкие пластинки четырехугольной
формы с обломанным в виде ступени углом. Они образуются при застое мокроты
в полостях, в очагах жировой дегенерации легочной ткани, при злокачественных
новообразованиях, абсцессе легкого. Расположены на фоне макрофагов с каплями
жира, обызвествленных эластических волокон и обызвествленного детрита.ПРОБКИ ДИТРИХАПри макроскопическом исследовании жидкости, полученной из полости абсцес¬
са легкого, в гное на дне сосуда видны мелкие желтовато-серые зернышки. При
микроскопическом исследовании зернышки представляют собой детрит, нафар¬
шированный макрофагами, содержащими жирные кислоты в виде игл или капель.
Кристаллы жирных кислот превращаются в капли при подогревании нативного
препарата на пламени спиртовки (препарат не должен закипеть!). Капли жирных
кислот окрашиваются в синий цвет при добавлении к препарату мокроты капли0,5% раствора метиленового синего. Пробки Дитриха расположены в нижнем
гнойном слое трехслойной мокроты, образовавшейся в полостях при абсцессе лег¬
кого и бронхоэктатической болезни.МиелинМиелин — конечный продукт аутолиза клеток и слизи, представляет собой
некротический детрит, состоящий из фосфолипидов. Миелин, как и альвеолярные
макрофаги, — неотъемлемая часть слизистой мокроты. Миелиновые образования
встречаются в слизистой мокроте или слизистой части гнойно-слизистой мокроты,
лежат свободно или являются фоном для альвеолярных макрофагов, которые их
фагоцитируют, превращаясь в белые, бесцветные клетки. Миелиновые образова¬
ния имеют нежный контур, иногда концентрическую исчерченность, овальную,
круглую, каплевидную или почкообразную форму и различные размеры.ПневмонииПневмонии делят на внебольничные, внутрибольничные (госпитальные), аспи-
рационные и пневмонии у больных с синдромом иммунодефицита. Внебольничные
пневмонии обычно вызываются пневмококками, реже гемофильной палоч¬
кой {Haemophilus influenzae), микоплазмой {Mycoplasma pneumoniae), хлами-
диями. Внутрибольничные (госпитальные) пневмонии вызываются палочкой
Фридлендера {Klebsiella pneumoniae), пневмококками (диплококком Френкеля),
золотистым стафилококком {Staphylococcus aureus), синегнойной палочкой
{Pseudomonas aeruginosa).ХЛАМИДИЙНАЯ ПНЕВМОНИЯВозбудитель хламидийной пневмонии — Chlamidia pneumoniae — облигатный
внутриклеточный паразит, размножающийся в цитоплазме клеток эпителия и
цитоплазме макрофагов. Жизненный цикл хламидии двуфазный. Первая фаза —
инфекционная: хламидии в стадии элементарных телец (спороподобных клеток
486 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВразмером 0,2-0,4 мкм) проникают в цитоплазматические вакуоли клеток дыха¬
тельных путей человека. В цитоплазматических вакуолях они увеличиваются,
достигая размера 0,6-1,5 мкл, и называются ретикулярными тельцами. Это спо¬
собная к размножению неинфекционная форма жизненного цикла хламидии —
вторая фаза. Ретикулярные тельца заполняют цитоплазматические вакуоли, обра¬
зуя микроколонии, или тельца Провачека. Через 20-48 ч ретикулярные тельца
вновь трансформируются в элементарные тельца и покидают цитоплазматические
вакуоли клеток.Хламидийная пневмония чаще поражает подростков, сопровождается сухим
кашлем, фарингитом, бронхитом, рентгенологически не выявляется. Возможны
проявление обструктивного синдрома и тенденция к переходу в хроническую
обструктивную болезнь легких, при цитологическом исследовании мокроты
или инструментально полученного материала из бронхов в цитоплазме клеток
цилиндрического эпителия либо макрофагов в вакуолях обнаруживают мелкие
полиморфные включения темно-вишневого цвета. В цитоплазме этих клеток
определяются пустые вакуоли.ПНЕВМОКОККОВАЯ ПНЕВМОНИЯКлинически различают две основные формы заболевания: крупозную и очаго¬
вую пневмонию. При крупозной пневмонии в ранней стадии заболевания мокрота
вязкая, очень скудная, ржавого цвета. При микроскопии определяются эритроци¬
ты, макрофаги с гемосидерином, лейкоциты, мелкие фибриновые свертки и пнев¬
мококки. В период разрешения воспалительного процесса мокрота приобретает
слизисто-гнойный характер, исчезает ее ржавая окраска. При очаговой пневмонии
характер мокроты сразу слизисто-гнойный, может не иметь ржавого цвета. При
молниеносном начале крупозной пневмонии у больного возникает кровохарка¬
нье.Грамположительный пневмококк {Streptoccocus pneumoniae, или диплококк
Френкеля), — ланцетовидный диплококк, состоящий из двух кокков, обращенных
друг к другу тупыми концами. Их свободные концы заострены или вытянуты в виде
язычка пламени. Могут встречаться диплококки, состоящие из двух овальных или
даже круглых кокков. Каждый диплококк окружен бесцветной капсулой ^ одним
из способов защиты от фагоцитоза. Размер диплококков — около 1 мкм.ГОСПИТАЛЬНЫЕ ПНЕВМОНИИК больничным, или госпитальным, относят пневмонии, которые развиваются
через 48 ч от момента госпитализации или в более поздние сроки. Возбудители
большинства госпрггальных пневмоний — палочка Фридлендера, синегнойная
палочка или золотистый стафиллококк. При возникновении госпитальной пнев¬
монии важна ранняя идентификация возбудителя для начала своевременного и
адекватного лечения. Пневмонию, сходную по клинической картине с крупозной,
может вызывать грамотрицательная палочка Фридлендера {Klebsiellapneumoniae).
Возникает такая пневмония у ослабленных больных, протекает тяжело, с образо¬
ванием абсцесса или гнойного плеврита и плохо поддается традиционной анти¬
бактериальной терапии. Мокрота при этой пневмонии не имеет специфического
характера, обычно слизисто-гнойная, иногда с примесью крови. Внутри плотных
темно- или светло-розовых червеобразных образований в бесцветных полисаха¬
ридных капсулах видны короткие, прямые толстые палочки с округлыми и слегка
утолщенными концами, расположенными поодиночке или парами.Тяжело протекает госпитальная пневмония, вызванная синегнойной палочкой
(Pseudomonas aeruginosa). Синегнойная палочка — грубая, полиморфная, слегка
изогнутая палочка размером от 0,5-1,0 до 1,5-5,0 мкм. Необходимо бактериоло¬
гическое исследование.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 467Гемофильная палочка {Haemophilus influenzae) усиливает патогенность вирусов
гриппа, при этом сама непосредственно грипп не вызывает. Это один из самых
мелких микроорганизмов, при окраске по Граму обесцвечивается. Обнаруживают
при окраске азур-эозином только в свежевыделенной мокроте. Необходимо бак¬
териологическое исследование.ВИРУСНЫЕ ПНЕВМОНИИВирусные пневмонии вызываются вирусом гриппа, парагриппа, простого герпе¬
са, аденовирусом и многими другими. При поражении дыхательных путей виру¬
сами в большей степени поражаются клетки реснитчатого эпителия. Появляются
гигантоклеточные и гигантоядерные клеточные элементы. Клетки цилиндриче¬
ского эпителия резко увеличиваются в размерах, нарастает количество ядер, они
нагромождаются друг на друга, изменяют цвет, становятся гипохромными, мато¬
выми.При пневмонии и трахеобронхите, вызванных вирусом простого герпеса {Herpes
simplex), в препаратах мокроты можно обнаружить гигантские многоядерные
клетки цилиндрического эпителия с достаточно крупными ядрами одинаковых
размера и формы. Ядер много, они частично накладываются друг на друга, лежат
плотно, образуя фасетки. Такая микроскопическая картина может напоминать
злокачественные клетки.ИССЛЕДОВАНИЕ ЖЕЛЧИЖелчь — сложная коллоидная система, секреторный продукт печени, который
содержит желчные пигменты, желчные кислоты и их соли, холестерин, белок
и другие компоненты, в течение суток в двенадцатиперстную кишку поступает
от 0,5 до 1 л желчи. Желчь синтезируется в печени с постоянной скоростью, но
попадает в двенадцатиперстную кишку не равномерно, а в зависимости от потреб¬
ности. Между приемами пищи желчь накапливается и концентрируется в желчном
пузыре. Получение желчи с помощью тонкого дуоденального зонда ввели в кли¬
ническую практику Мельцер и Лойон. Они наблюдали выделение пузырной желчи
после введения в двенадцатиперстную кишку 33% раствора сульфата магния. Этот
прием получил название способа Мельцера и Лойона. Лойон отметил диагности¬
ческое значение отсутствия выделения пузырной желчи и ввел обозначение пор¬
ций желчи «А», «В» и «С«> (трехфазное дуоденальное зондирование).Фракционное доуденальное зондированиеФракционное дуоденальное зондирование — процесс получения дуоденального
содержимого, разделенный на пять фаз с отбором фракций желчи в пробирки
каждые 10 мин. Этот вариант зондирования позволяет оценить проходимость
желчевыводящих путей и эвакуационную способность желчного пузыря, дает воз¬
можность получить материал для микроскопического исследования. Определение
количества дуоденального содержимого в различные фазы зондирования, динами¬
ки и скорости его выделения, результатов микроскопического исследования слизи
и осадка помогает в диагностике дуоденита, холангита, холедохита, ангиохолита,
холецистита, дискринии, нарушений функций желчевыводящих путей и двенадца¬
типерстной кишки.1 фаза фракционного дуоденального зондирования соответствует порции желчи
«А» и называется фазой общего желгного протока, Б норме:• желчь вьщеляется в ответ на раздражение зондом;• количество — 15-20 мл, время выделения — 10-20 мин;• характер выделения равномерный, непрерывный;
468ХИММКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ• скорость выделения 1 мл/мин;• цвет — золотисто-желтый или янтарно-желтый;• прозрачность — полная;• относительная плотность — 1,010-1,015 г/л;• pH-7,2-7,4;• концентрация (билирубиновый индекс Мейленграхта) — 90-100 ед.Патологические изменения• Гиперсекреция — выделение более 25 мл желчи в течение 10-20 мин. Большое
количество порции желчи «А» наблюдается при увеличении объема общего
желчного протока (врожденная или приобретенная холедохоэктазия), при
отключении или удалении желчного пузыря.• Гипосекреция ~ выделение менее 15 мл желчи за 10-20 мин — наблюдается
при поражении паренхимы печени. При уменьшении объема общего желчно¬
го протока количество порции желчи «А» может снизиться до 5 мл, что отме¬
чается при холедохите, гепатите или гепатозе, циррозе печени, дискринии и
наличии большого количества камней в общем желчном протоке.• Порция желчи «А» отсутствует в период внутрипеченочного застоя у боль¬
ных с инфекционным гепатитом и при обтурации сфинктера Одди.• Прерывистое выделение порции желчи «А» характерно для гипертонуса сфин¬
ктера Одди вследствие дуоденита, холедохита, ангиохолита, наличия камней
в общем желчном протоке и желчном пузыре.• Бледная окраска порции желчи «А» характерна для гепатита, цирроза
печени и обусловлена нарушением секреции билирубина печеночными
клетками. При этом pH желчи остается в пределах нормы, а относительная
плотность и концентрация (билирубиновый индекс) снижаются. pH порции
желчи «А» снижается при холедохите. Бледная окраска, сдвиг pH влево
(менее 7,0) и равномерное помутнение порции желчи «А» вызываются при¬
месью кислого желудочного содержимого. Этот материал исследованию не
подлежит.• Интенсивная окраска порции желчи «А» характерна для гемолитических
анемий, при этом отмечают увеличение относительной плотности и концен¬
трации желчи (билирубинового индекса).• Выделение порции желчи «А» с примесью хлопьев слизи указывает на дуоде¬
нит или холедохит. Слизь с примесью крови наблюдается при язве, раке две¬
надцатиперстной кишки, раке фатерова сосочка. Хлопья слизи немедленно
подвергаются микроскопическому исследованию.II фаза — фаза закрытого сфинктера Одди - время от введения энтерального
или параэнтерального раздражителя до появления новой порции желчи.Норма: время отсутствия желчи у здоровых людей не превышает 5 мин.Патология: увелигение времени отсутствия желги до 10 мин указывает на
спазм сфинктера Одди и/или сфинктера Люткинса-Мартынова, папиллит или
холелитиаз.III фаза — фаза порции желчи «А^».Норма: после открытия сфинктеров Одди и Люткинса-Мартынова у практи¬
чески здоровых людей в течение 3-4 мин выделяется 3-5 мл золотисто-желтой
прозрачной желчи.Патология• Увелигение колигества порции желчи «А^» свидетельствует о наличии удли¬
ненного или расширенного общего желчного протока.• Уменьшение колигества порции желчи «А^г» менее 3 мл указывает на резкое
уменьшение объема общего желчного протока, наблюдается при спазме
сфинктера Одди. При этом появившаяся во время зондирования боль в
правом подреберье постепенно исчезает.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 4$9IV фаза — порция желчи «В» — пузырная, везикулярная желчь или пузырный
рефлекс. В норме:• наступает сразу после III фазы;• количество — 30-50 мл;• время выделения — 20-30 мин;• скорость выделения — в начале пузырного рефлекса скорость выделения2-3 мл/мин, затем минутный объем замедляется;• характер выделения — равномерный, непрерывный;• прозрачность - полная:• вязкая;• цвет — темно-коричневый или темно-оливковый;• pH-6,5-7,2;• относительная плотность — 1,015-1,035 г/л;• концентрация (билирубиновый индекс Мейленграхта) — 300-500 ед.
Патология• Гипермоторная дискинезия — быстрое, в течение 10-15 мин, неполное опо¬
рожнение желчного пузыря.• Гипомоторная дискинезия — замедленное, иногда прерывистое выделение
пузырной желчи в количестве, превышающем норму.• Уменьшение колигества пузырной желчи до 10 мл и менее характерно для
желчнокаменной болезни, атрофических изменений желчного пузыря, холе¬
цистита, перехолецистита, а также отмечается при спазме сфинктера Одди,
спазме двенадцатиперстной кишки, гепатите, циррозе, гепатозе (за счет нару¬
шения холереза).• Увелигение колигества порции желчи «В» более 60 мл, сочетающееся с высо¬
кой степенью ее концентрации, наблюдается:❖ при длительном застое в расширенном и атоничном желчном пузыре;
препятствии к сокращению желчного пузыря (спайках с капсулой печени);
длительном спазме сфинктера Одди;❖ длительном спазме двенадцатиперстной кишки;❖ раке фатерова сосочка;раке головки поджелудочной железы.• Отсутствие пузырной желчи характерно для следующих состояний:❖ поражения желчного пузыря (такие как камни в желчном пузыре, атрофи¬
ческие изменения желчного пузыря, холецистит, атония желчного пузыря,
опущение желчного пузыря, перегиб шейки желчного пузыря);❖ поражения общего желчного протока (холедохит, холедохолитиаз); при
спазме сфинктера Одди;❖ инфекционного гепатита в период внутрипеченочного застоя.• Полное отклюъение желчного пузыря свидетельствует об отсутствии желчи
после двукратного введения энтерального раздражителя.• Светло-коритевая окраска порции желчи наблюдается при циррозе
печени, гепатите, инфекционном гепатите. При этом снижаются относитель¬
ная плотность и концентрация (билирубиновый индекс) желчи.• Зеленая или зеленоватая окраска порции желчи «В» характерна для холеци¬
стита и длительного застоя желчи в желчном пузыре. Данная окраска возни¬
кает за счет окисления желтого билирубина до зеленого биливердина.• Пузырная желчь белого цвета выделяется при длительном калькулезном
холецистите и водянке желчного пузыря, обусловленной закупоркой пузыр¬
ного протока. При этом в желчном пузыре происходит разрушение желчных
пигментов и образование бесцветных лейкосоединений.• Огенъ темная плеохромная порция желчи «В» наблюдается при гемолитиче¬
ских анемиях, что объясняется усиленным распадом гемоглобина. Выделение
470 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВтемной пузырной желчи возникает при длительном ее застое в желчном
пузыре. Для застойной желчи характерны высокие относительная плотность
и концентрация (билирубиновый индекс).V фаза — печеночная желчь, или порция желчи «С». Порция желчи «С» выде¬
ляется из зонда столько времени, сколько зонд находится в двенадцатиперстной
кишке. Именно поэтому нахождение зонда в двенадцатиперстной кишке ограни¬
чивают 20 мин, т.е. сбором желчи в 2 пробирки (2 десятиминутные фракции),Б норме:• выделяется по внутри- и внепеченочным желчным протокам сразу по окон¬
чании выделения порции желчи «в»;• скорость выделения — 1 мл/мин;• оттекает равномерно, непрерывно, пока зонд находится в двенадцатиперст¬
ной кишке;• цвет — светло- или лимонно-желтый;• вязкость — незначительная;• прозрачность — полная:• pH-7,5-8,5;• относительная плотность — 1,005-1,010 г/л;• концентрация (билирубиновый индекс Мейленграхта) — 60-70 ед.
Патология• Медленное (8-10 капель в минуту), прерывистое, с паузами выделение пор¬
ции желчи «С» наблюдается при инфекционном гепатите или циррозе, или
гепатозе печени. При этом окраска порции желчи «С» бледная, концентрация
резко снижена, относительная плотность — на нижней границе нормы или
ниже.• Более темная окраска печеночной желчи отмечается при гемолитических
анемиях и при запоздалом сокращении желчного пузыря в результате при¬
меси остатков пузырной желчи. Эту порцию желчи можно выделить как
порцию «ВС». При подозрении на холелитиаз и/или дискринию порцию
«ВС» необходимо собрать в отдельную пробирку, а образовавшийся осадок
подвергнуть микроскопическому исследованию.• прерывистое выделение порции желчи «С» указывает на гипертонус сфинкте¬
ра Одди.• Отсутствие порции желчи «С» свидетельствует о закупорке общего желчно¬
го протока камнем, спазме сфинктера Одди или наличии новообразования,
препятствующего оттоку желчи.Микроскопическое исследование желчиМикроскопическому исследованию должны быть подвергнуты все порции
желчи, содержащие взвещенные хлопья слизи и/или осадок на дне пробирок.
При этом необходимо учитывать, что протеолитический фермент поджелудочной
железы трипсин находится в активном состоянии и быстро расщепляет клеточ¬
ные элементы. Микроскопическое исследование желчи необходимо проводить
немедленно, по мере получения очередной пробирки (фракции), так как уже
через несколько минут клеточные элементы двенадцатиперстной кишки и жел¬
чевыводящей системы, заключенные в рыхлую слизь, будут частично или полно¬
стью лизированы. Долго сохраняются в дуоденальном содержимом клеточные
элементы дыхательных путей (носовая слизь, мокрота), заключенные в густую и
плотную слизь. При длительном стоянии in vitro нарушается коллоидная стабиль¬
ность полученной желчи, из раствора выпадают кристаллы желчных кислот или
холестерина, а билирубин окисляется до биливердина, что сопровождается позе¬
ленением желчи.
шшХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 471Методика приготовления препаратовСодержимое пробирки выливают в чашку Петри, поставленную на черный лист
бумаги. Пипеткой последовательно извлекают взвешенные хлопья слизи, состав¬
ляют из них нативный препарат и накрывают покровным стеклом. Из осадка,
образовавшегося на дне пробирки, нужно приготовить отдельный препарат.Слизь, обнаруженная в той или иной фракции дуоденального содержимого,
может относиться не только к пораженной воспалительным процессом желчевы¬
водящей системе (внутри- и внепеченочным желчным протокам, желчному пузы¬
рю, общему желчному проходу). Во время дуоденального зондирования однока¬
нальным тонким зондом в двенадцатиперстную кишку попадают слюна, носовая
слизь, мокрота, желудочная слизь. Следовательно, лейкоциты, обнаруженные в
слизи дуоденального содержимого, могут не свидетельствовать о воспалении две¬
надцатиперстной кишки и желчевыводящей системы, происхождение лейкоцитов
помогают установить обнаруженные клетки эпителия и другие элементы.Слизь из дыхательных путей пропитана пузырьками воздуха, поэтому она всег¬
да находится на поверхности пробирки с дуоденальнь[м содержимым. Эту слизь
перед микроскопией необходимо удалить с помощью пипетки. Если элементы
слизи попали в приготовленные для микроскопии препараты, следует учитывать
следующие признаки:• лейкоциты слюны и носовой слизи расположены на фоне плоского эпителия
и большого количества бактерий;• лейкоциты мокроты расположены на фоне реснитчатого эпителия, альвео¬
лярных макрофагов и миелина;• лейкоциты желудочной слизи представлены голыми сегментированными
ядрами на фоне эпителия в виде одинаковых по размеру мелких овальных
голых ядер (не относящиеся к желчевыводящей системе и двенадцатиперст¬
ной кишке лейкоциты в бланк-ответ не вносить!);• окрашенные желчью свободно лежащие лейкоциты диагностического значе¬
ния не имеют;• мертвые лейкоциты из любого очага воспаления, попавшие в желчь, сразу
окрашиваются желчью в желтый или темно-желтый цвет;• лейкоциты, находящиеся в состоянии парабиоза, не окрашиваются.ПатологияПри воспалении внутрипеченочных ходов (холангите, холангиогепатите) лей¬
коциты сочетаются с низким призматигеским эпителием, выстилающим внутри-
печеночные ходы. Этот эпителий имеет высоту 15-18 мкм, ядра расположены
близко к основанию клеток. Однако если в слизи данной порции обнаруживают в
большом количестве только низкий цилиндрический эпителий, диагноз холангита
или холангиогепатита не исключается, так как лейкоциты обычно разрушаются
непосредственно во внутрипеченочных желчных ходах.Низкий призматигеский эпителий обнаруживают при холангите или холангио-
гепатите в хлопьях слизи пегеногной желги (порции желчь «С»).При холедохите (воспалении обшего желчного протока) лейкоциты сочетаются
со <іспигегньш» эпителием, выстилающим общий желчный проток (длинным и
узким цилиндрическим эпителием высотой до 40-50 и шириной 5-6 мкм). При
холедохите лейкоциты со «спигегным» эпителием обнаруживают в хлопьях слизи
во всех фракциях порций желчи «А», «В» и «С» или представлены мелкозернистой
массой в результате их распада. Большое количество этого эпителия, покрываю¬
щее все поле зрения, даже без сочетания с лейкоцитами позволяет поставить или
подтвердить диагноз холедохита.При холецистите цилипдригеский эпителий, выстилающий желчный пузырь, в
порции желчи «В» обнаружить практически не удается, так как отторгнутый при
472 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВвоспалении цилиндрический эпителий желчного пузыря и лейкоциты разрушают¬
ся in vivo непосредственно в желчном пузыре и в порции желчи «в».при холецистите во время операции лейкоциты обнаруживают не в просвете, а
непосредственно в воспаленной стенке желчного пузыря, что подтверждается при
микроскопии желчи, полученной при пункции желчного пузыря перед его удалени¬
ем. о холецистите при дуоденальном зондировании можно судить по темно-зеленой
или зеленоватой окраске только что полученной пузырной порции желчи.Лейкоциты при воспалении двенадцатиперстной кишки, дуодените располо¬
жены на фоне цилиндригеского кутикулярпого эпителия. На свободной, обращен¬
ной в полость двенадцатиперстной кишки поверхности этого эпителия имеется
довольно толстая кутикула, образующая исчерченную кайму, хорошо различимую
в нативных препаратах. Кутикула состоит из сети тонких перекладин, между кото¬
рыми находятся узкие канальцы. Через эти канальцы происходит всасывание.
Цилиндрический кутикулярный эпителий имеет высоту 45-52 мкм, ширину в
апикальной части 12-16 мкм, крупные ядра овальной формы, веретенообразно
выдавливающие нижнюю часть клеток.При дуодените в слизи всех фракций дуоденального содержимого обнаруживают
скопления и большие пласты кутикулярпого эпителия в виде палисада или пчели¬
ных сот. Эпителий двенадцатиперстной кишки постоянно травмируется кислым
содержимым желудка, поэтом}'^ в норме он полностью обновляется в течение 2 сут.Главные критерии принадлежности лейкоцитов желчи — условия и фон их
обнаружения. Лейкоциты из желчных протоков и двенадцатиперстной кишки
обнаруживают в слизи на фоне цилиндрического эпителия соответствующего
участка. Они обычно бесцветные или слегка желтоватые, зернистые, быстро под¬
вергаются протеолизу. У больных с явной патологией желчевыводящей системы
приходится долго и упорно искать лейкоциты на фоне эпителия общего желчного
протока и эпителия мелких внутрипеченочных желчных протоков. Чаще обнару¬
живают только слизь, содержащую мелкозернистую массу, расположенную в виде
мелких зернистых пятен, отдаленно напоминающих контуры цилиндрического
эпителия и лейкоцитов. Такие препараты получают из фракций, несвоевременно
подготовленных для микроскопии.При холангите и холецистите септического характера и застое желчи лейкоци¬
ты и эпителий общего желчного протока и желчного пузыря могут покрывать в
нативных препаратах все поля зрения.В слизи дуоденального содержимого (порции желчи «А» и/или «С») обнаружи¬
вают круглые, достаточно крупные (до 18-22 мкм) клетки, получившие название
лейкоцитоидов, представляющие собой округлившийся цилиндрический эпителий
двенадцатиперстной кишки. В препаратах, окрашенных азур П-эозином, в этих
клетках хорошо определяются 3-4 фрагмента ядра, потерявшего специфическую
структуру хроматина (кариорексис). Среди лейкоцитоидов можно обнаружить
эозинофилы и лимфоциты. Если микроскопист принимает лейкоцитоиды за лей¬
коциты, это приводит к гипердиагностике воспалительных процессов в желчевы¬
водящей системе и двенадцатиперстной кишке.Часть лейкоцитоидов в быстрооттекающих порциях желчи «В» и «С» может
быть пузырного происхождения. Выделение хлопьев слизи с лейкоцитоидами
наблюдается как в норме, так и при патологии. Особенно большое количество
лейкоцитоидов в дуоденальном содержимом наблюдается у молодых людей с
повышенной нейрогуморальной раздражимостью.Осадочные образования желчиСодержание в желчи кристаллических и аморфных осадочных образований
указывает на потерю ее коллоидной стабильности и позволяет заподозрить дис-
кринию или наличие камней в желчных протоках.
ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ 473Диагностическое значение имеют следующие осадочные образования:• микролиты;• билирубинаткальция;• кристаллы холестерина;• кристаллы жирных кислот;• кристаллы желчных кислот.При большом количестве осадочных образований на дне пробирки образуется
осадок, из которого необходимо приготовить нативный препарат. Для этого каплю
осадка наносят на предметное стекло и накрывают покровным стеклом.Микролиты — темноватые, преломляющие свет округлые или многогранные
образования, их обнаруживают чаще в порции желчи «ВС», т.е. в желчи, посту¬
пающей в двенадцатиперстную кишку в конце пузырного рефлекса, но иногда и
в порции желчи «А» у больных с клинически выраженной патологией желчевы¬
водящих путей, в микролитах округлой формы (сферомикролитах) определяется
концентрическая структура, В состав сферомикролитов входят слизь, известь и
небольшое количество холестерина.кристаллы холестерина — бесцветные, прозрачные, прямоугольной формы
пластинки, обычно с выемками в виде ступенек. Кристаллы холестерина раство¬
ряются в концентрированной серной кислоте с образованием соединений красного
цвета. Кристаллы холестерина иногда встречаются в норме у практически здоро¬
вых людей, женщин — за 3-4 дня до начала менструального цикла, лихорадящих
больных. Иногда холестерин выпадает в осадок в чистых порциях желчи при их
длительном хранении.При патологии желчевыводящих путей кристаллы холестерина в порции желчи
«А» встречаются часто в большом количестве в виде осадка на дне пробирок или
в хлопьях слизи, что объясняется временной потерей коллоидной стабильности
желчи. Именно поэтому содержание большого количества кристаллов холесте¬
рина в желчи не является прямым доказательством наличия желчных камней и
свидетельствует только о высоком риске их образования. При этом целесообразно
проведение профилактических мероприятий, направленных на предупреждение
образования камней в желчевыводящих путях.Билирубинат кальция — бурые, желтые или черные комочки, глыбки пигмента,
встречаются в большом количестве в порции желчи «А» у пожилых людей, стра¬
дающих заболеваниями печени, продолжительным неполным застоем желчи и ее
инфицированием (бактериохолией). Билирубинат кальция в отдельных хлопьях
слизи, часто в сочетании с кристаллами холестерина и крупинками желчных кис¬
лот, служит основой для образования камней. Билирубинат кальция в норме не
встречается.Кристаллы желгных кислот — мелкие, блестящие, коричневатые, ярко-желтые
или серые зернышки, часто покрывающие все поля зрения в слизи нативного пре¬
парата. Большое количество аморфных кристаллов свободных желчных кислот
наблюдается в дуоденальной желчи (порции желчи «А») при примеси кислого
желудочного сока. При этом дуоденальная желчь становится равномерно мут¬
ной, а на дне пробирки скапливается обильный осадок. Результаты исследования
загрязненной желудочным соком желчи в бланк-ответ не вносятся.Соли желгных кислот входят в состав желчных камней, поэтому обнаружение
в незагрязненных фракциях порции желчи «А» при pH 7,0-7,5 и относительной
плотности 1,010 г/л обильного осадка, состоящего из желчных кислот, свидетель¬
ствует о дискринии.Кристаллы жирных кислот — длинные нежные иглы, часто сгруппированные в
пучки. Если кристаллы жирных кислот обнаружены только в порции желчи «В»,
то, вероятно, это связано со снижением pH пузырной желчи за счет воспалитель¬
ного процесса, а также уменьшением их растворимости в желчи. Жирные кислоты
474 ХИМИКО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВв больших количествах отщепляются от лецигтина желчи под влиянием фермен¬
та — лецитиназы, активность которой увеличивается в присутствии солей дезок-
сихолевой кислоты, глутаминовой кислоты и бактерий. В анацидном желудочном
соке содержится много жирных кислот, их в процессе дуоденального зондирова¬
ния одноканальным зондом обнаруживают в порциях желчи «А», «В» и «С».Исследование слизи играет важную роль при микроскопии дуоденального
содержимого, в нативном препарате она может быть обнаружена в виде белой
или желтой массы, комков, пленок или обрывков пленок, о происхождении слизи
можно судить по обнаруженным в ней эпителиальным клеткам, относящимся к
тому или иному отделу желчевыводящей системы или двенадцатиперстной кишки,
а также кристаллам, микролитам и другим клеточным и неклеточным элементам,
не относящимся к желчевыводящей системе.При микроскопическом исследовании только что полученных фракций желчи
можно обнаружить подвижные трофозоиды лямблий, личинки Strongyloid.es
stercoralis, яйца печеночного сосальщика.СПИСОК ЛИТЕРАТУРЫБазарный В.В. Синовиальная жидкость; клинико-диагностическое значение лаборатор¬
ного анализа. ~ Екатеринбург: УГМА, 1999. — 62 с.Долгов В.В., Луговская С.А., Фанченко Н,Д. и др. Лабораторная диагностика мужского
бесплодия. - М.: Тверь: Триада, 2006.Клиническая лабораторная аналитика. Т. 3. Частные аналитические технологии в клини¬
ческой практике / Под ред. В.В. Меньшикова. — М.; Лабпресс, 2000. — 384 с.Миронова И.И., Романова Л.А., Долгов В.В. Общеклинические исследования; моча, кал,
ликвор, мокрота. — М.: Тверь: Триада, 2009.Руководство ВОЗ по лабораторному исследованию эякулята человека и взаимодействия
сперматозоидов с цервикальной слизью. 4-е изд. — М,: МедПресс, 2001.Nieschlag Е., Behre Н.М. (eds). Andrology. Male Reproductive Health and Dysfunction.
2nd ed. — Berlin: Springer, 2000.
Глава 7
Лабораторная гематологияГЕМОПОЭЗ
Общие представления о гемопоэзеЗакладка кроветворной системы происходит посредством взаи¬
модействия трех клеточных пулов (производных мезодермы) —
гемопоэтического, стромального и сосудистого. Выделяют 4 крити¬
ческих периода становления эмбрионального гемопоэза:I — возникновение кроветворных клеток-предшественников в
желточном мешке эмбриона (внеэмбриональное кроветворе¬
ние, 4-5-я неделя развития плода);II — заселение печени плода кроветворными клетками-пред-
шественниками и начало печеночного кроветворения (5-я
неделя внутриутробного развития);III — проникновение ранних Т-лимфоцитов в тимус и формиро¬
вание Т-клеточной иммунной системы (9-10-я неделя);V — смена печеночного кроветворения на костномозговое (15-
18-я неделя).По-видимому, период изменения территории и типа кроветворе¬
ния наиболее уязвим для возникновения врожденных заболеваний
крови. Интерес к эмбриональному гемопоэзу в последние годы
возрос в связи с возможностью трансплантации гемопоэтических
предшественников, полученных из эмбриональных стволовых кле¬
ток in vitro. После рождения в костном мозге образуются клеточные
элементы эритро-, гранулоцито-, моноцито-, тромбоцитопоэза,
предшественники Т-лимфоцитов, НК-клеток и В-лимфоциты,Необходимое условие нормального роста и созревания клеток
крови — тесное взаимодействие стволовых кроветворных кле¬
ток, стромального микроокружения и гемопоэтических ростовых
факторов, функциональные и структурные изменения элементов
микроокружения могут быть причиной нарушений кроветворной
функции костного мозга.СТРУКТУРНАЯ ОРГАНИЗАЦИЯ КРОВЕТВОРЕНИЯСовременные представления о кроветворении основаны на уни¬
тарной теории А.А. Максимова, согласно которой все клетки крови
происходят из единой родоначальной клетки, морфологически
напоминающей лимфоцит. Подтверждение этой гипотезы было
получено в 60-е гг. прошлого века в эксперименте со смертельно
476ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯоблученными мышами, которым вводили донорский костный мозг. Клетки, спо¬
собные восстанавливать гемопоэз после облучения или токсических воздействий,
носят название стволовых клеток. Иерархическая модель гемопоэза предполагает,
что все гемопоэтические клетки происходят из относительно небольшого числа
гемопоэтических стволовых клеток через последовательные этапы образования
промежуточных клеток-предшественников, характеризующихся способностью
развиваться сначала во многие кроветворные линии (полипотентные клетки-
предшественники), а затем во все более ограниченное количество линий (олиго-,
уни- или монопотентные клетки-предшественники). Гемопоэз условно подраз¬
делен на ряд классов, границы между которыми весьма размыты, а между ними
содержится много переходных, промежуточных форм, в процессе дифференци-
ровки происходит постепенное снижение пролиферативной активности клеток и
способности развиваться сначала во все кроветворные линии, а затем во все более
ограниченное количество линий.Нормальное кроветворение поликлональное, т.е. осуществляется одновремен¬
но многими клонами. Размер индивидуального клона обычно меньше 0,5-1 млн
зрелых клеток, а продолжительность жизни клона не превышает 1 мес, около 10%
клонов существуют до полугода. Как правило, клональный состав кроветворной
ткани полностью меняется в течение 1-4 мес. Постоянную замену клонов объяс¬
няют исгошением пролиферативного потенциала стволовой кроветворной клетки.
Исчезнувшие клоны никогда не появляются вновь.Пул полипотентных, или мультипотентных, стволовых кроветворных клеток
(И отдел) образуется из тотипотентной эмбриональной стволовой клетки, нахо¬
дящейся на самом верху иерархической лестницы (I отдел). Стволовые кровет¬
ворные клетки (СКК) обладают уникальным свойством — полипотентностью,
т.е. способностью к дифференцировке во все без исключения линии гемопоэза.
в клеточной культуре можно создать условия, при которых возникающая из одной
клетки колония содержит до 6 различных клеточных линий дифференцировки.
в целом СКК обладают высоким, но ограниченным пролиферативным потенциа¬
лом и способны к ограниченному самоподдержанию, они могут проделать прибли¬
зительно 50 клеточных делений.Основная масса СКК находится в фазе покоя (О^) клеточного цикла, обладая
при этом огромным пролиферативным потенциалом. При выходе из состояния
покоя клетка вступает на путь дифференцировки, постепенно снижая пролифера-
тивный потенциал и ограничивая набор возможных дифференцировочных про¬
грамм, После нескольких циклов деления (от 1 до 5) СКК могут вернуться вновь
в состояние покоя, при этом вернувшиеся в резервный пул СКК неравноценны
исходным, их состояние покоя менее глубоко и при запросе они отвечают быстрее,
приобретая маркеры определенных линий дифференцировок за 1-2 сут, тогда как
исходным СКК для этого требуется 10-14 сут. Таким образом, длительное под¬
держание кроветворения обеспечивают СКК, находящиеся в глубоком резерве, а
срочный ответ на запрос удовлетворяется за счет СКК, прошедших основную дис¬
танцию на пути от Сц- к G^-фазе клеточного цикла.Гетерогенность пула СКК и степень их дифференцировки могут быть установле¬
ны на основе экспрессии ряда дифференцировочных мембранных антигенов, Среди
СКК выделены примитивные мультипотентные предшественники (CD34*Thyl^) и
более дифференцированные предшественники, характеризующиеся экспрессией
антигена гистосовместимости II класса (HLA-DR), — CD3S. Истинные СКК не
экспрессируют линейно-специфические маркеры и дают рост всем линиям гемо¬
поэтических клеток. Количество СКК в костном мозге невелико — около 0,01%, а
вместе с клетками-предшественниками — 0,05%.Один из основных методов изучения СКК — метод колониеобразования
in vivo или in vitro, поэтому иначе СКК называют колониеобразующими едини-
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 477цами (КОЕ). Истинные СКК способны к формированию колоний из бластных
клеток (КОЕ-бластные). Сюда же относят клетки, формирующие селезеночные
колонии (КОЕс). Эти клетки способны полностью восстанавливать гемопоэз.По мере снижения пролиферативного потенциала СКК дифференцируются
в полиолигопотентные коммитированные клетки-предшественники (III отдел).
Клетки этого отдела имеют ограниченную потентность, так как коммитированы к
дифференцировке в направлении 2-5 клеточных линий. Полиолигопотентные ком¬
митированные предшественники КОЕ-ГЭММ (гранулоцитарно-эритроцитарно-
макрофагально-мегакариоцитарные) дают начало четырем росткам гемопоэза,
КОЕ-ГМ — двум росткам. КОЕ-ГЭММ — общие предшественники миелопоэза. Они
имеют маркер CD34, маркер миелоидной линии — CD33, детерминанты гистосов¬
местимости HLA-A, HLA-B, HLA-C, HLA-DR.Клетки IV отдела (монопотентные коммитированные предшественники) явля¬
ются родоначальными для одного ростка гемопоэза: например, КОЕ-Г — для
гранулоцитарного, КОЕ-М — для моноцитарно-макрофагального, КОЕ-Э и БОЕ-Э
(бурстобразующая единица) — предшественники эритроидных клеток. КОЕ-
Мгкц — предшественники мегакариоцитов и т.д. Все коммитированные клетки-
предшественники имеют ограниченный жизненный цикл и неспособны к воз¬
вращению в состояние клеточного покоя. Монопотентные коммитированные
предшественники экспрессируют маркеры соответствующей клеточной линии
дифференцировки.СКК и клетки-предшественники обладают способностью к миграции — выхо¬
ду в кровь и возвращению в костный мозг, что полз^ило название homing-effect
(«инстинкт дома»). Именно это их свойство обеспечивает обмен кроветворных
клеток между разобщенными кроветворными территориями, позволяет использо¬
вать их для трансплантации в клинической практике,V отдел морфологически распознаваемых клеток включает дифференцирую¬
щиеся, созревающие и зрелые клетки всех 8 клеточных линий, начинал с бластов,
большинство из которых имеют характерные морфоцитохимические особенно¬
сти.РЕГУЛЯЦИЯ ГЕМОПОЭЗАКроветворную ткань относят к динамичной, постоянно обновляющейся клеточ¬
ной системе организма. Б кроветворных органах образуется более 30 млн клеток
в минуту. Появляющиеся в костном мозге клетки по мере созревания равномерно
поступают в кровеносное русло, при этом время циркуляции их также постоянно:
эритроциты живут 100-120 сут, тромбоциты — около 10 сут, нейтрофилы - менее
10 ч. Каждый день теряется 1x10^^ клеток крови, но эти потери постоянно воспол¬
няются костным мозгом.После кровопотери, при остром гемолизе или воспалении производство соот¬
ветствующих клеток может быть увеличено в 10-12 раз в течение нескольких
часов. Увеличение клеточной продукции обеспечивается гемопоэтическими фак¬
торами роста, действие которых очень разнообразно. Гемопоэз инициируется
ростовыми факторами, цитокинами и непрерывно поддерживается благодаря
пулу СКК. Стволовые кроветворные клетки стромозависимы и воспринимают
короткодистантные стимулы при межклеточном контакте с клетками стромаль-
ного микроокружения. По мере дифференцировки клетка начинает реагировать
на дальнодействующие гуморальные факторы. Эндогенную регуляцию гемопоэза
осуществляют цитокины через рецепторы на клеточной мембране. Основные
продуценты цитокинов — моноциты, макрофаги, активированные Т-лимфоциты,
стромальные элементы (фибробласты, эндотелиальные клетки и др.).Выделяют позитивные и негативные регуляторы гемопоэза. Позитивные регу¬
ляторы необходимы для выживания СКК, их пролиферации, для дифференциров-
478 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ^ ки И созревания более поздних стадий гемопоэтических клеток, к ингабиторам
пролиферативной активности СКК и всех видов ранних гемопоэтических пред¬
шественников относят трансформирующий ростовой фактор-р (TGF-p), макрофа-
гальный воспалительный белок (МІР-1а), фактор некроза опухоли-а (ФНО-а),
а- и у-интерфероны, кислые изоферритины, лактоферрин и другие факторы.Факторы регуляции гемопоэза подразделяют на короткодистантные (для СКК)
и дальнодействующие — для коммитированных предшественников и созревающих
клеток, в зависимости от уровня дифференцировки клетки факторы регуляции
делят на III основных класса.I. Факторы, влияющие на ранние СКК, — фактор стволовых клеток (ФСК), гра-
нулоцитарный колониестимулирующий фактор (Г-КСФ), интерлейкины (ИЛ-6,
ИЛ-11, ИЛ-12), а также ингибиторы, которые тормозят выход СКК в клеточный
цикл из состояния покоя (М1Р-1а , TGF-(5, ФНО-а , кислые изоферритины и др.).
Эта фаза регуляции СКК не зависит от запросов организма.II. Линейно-неспецифические факторы — ИЛ-3, ИЛ-4, ГМ-КСФ (для грануло-
цитомонопоэза).IIL Позднедействующие линейно-специфические факторы, которые поддер¬
живают пролиферацию и созревание коммитированных предшественников и их
потомков, к ним относят эритропоэтин, тромбопоэтин, колониестимулирующие
факторы (Г-КСФ, М-КСФ, ГМ-КСФ), ИЛ-5. Один и тот же ростовой фактор может
иметь разнообразные клетки-мишени на различных этапах дифференцировки,
что обеспечивает взаимозаменяемость молекул, регулирующих гемопоэз. Клетка
начинает дифференцировку только после взаимодействия с факторами роста, но в
выборе направления дифференцировки ростовые факторы не участвуют. От содер¬
жания этих факторов зависит количество продуцируемых клеток и проделывае¬
мых клеткой митозов. Так, после кровопотери снижение парциального давления
кислорода в почках приводит к усилению продукции эритропоэтина, под действи¬
ем которого эритропоэтинчувствительные эритроидные клетки-предшественники
костного мозга (бурстообразующие единицы эритропоэза) увеличивают число
митозов на 3-5, что повышает образование эритроцитов в 10-30 раз.Одним из регуляторов гемопоэза служит апоптоз — запрограммированная кле¬
точная смерть.МЕХАНИЗМЫ ГИБЕЛИ КЛЕТОКПоддержание клеточного равновесия, элиминация дефектных клеток и клеток,
достигших стадии терминальной дифференцировки, происходят за счет способ¬
ности клеток к программируемой смерти — апоптозу. Основной закон клеточ¬
ной кинетики гласит, что в единицу времени рождается и умирает одно и то же
количество клеток. Различают два вида клеточной смерти: некроз и апоптоз.
Морфологические признаки апоптоза: конденсация хроматина, фрагментация
ядра, буллезное (пузырчатое) выпячивание цитоплазматической мембраны. Ядро
уменьшается в размере (пикноз), хроматин конденсируется, сжимаясь в глыбки
неправильной формы, уплотняется и подвергается фрагментации (кариорексису)
в результате расщепления эндонуклеазами двойной цепочки ДНК на фрагменты,
которые хорошо выявляются с помощью гель-электрофореза в виде дискрет¬
ных полос, что используют для идентификации апоптоза. Процесс конденсации
цитоплазмы и ее распад на апоптозные тельца происходят за несколько минут.
Апоптозные тельца быстро поглощаются расположенными вблизи макрофагами.
Фагоцитоз протекает также быстро, из-за чего процесс апоптоза часто остается
гистологически незаметным. При апоптозе удаление умирающих клеток проис¬
ходит безболезненно для окружающей ткани, которая не пропитывается внутри¬
клеточным содержимым, и, таким образом, не создаются условия для развития
воспаления.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 479Апоптоз участвует в элиминации тех клеток, необходимость в которых отпа¬
ла или выживание которых вредно для организма в целом, например, клеток-
мутантов или вирусинфицированных клеток. Апоптоз стимулируется при лечении
опухолей химиопрепаратами. Уничтожение пораженных вирусом клеток путем
апоптоза обеспечивает минимальное повреждение ткани. При этом фрагментация
ДНК имеет исключительно важный биологический смысл, так как она предупре¬
ждает перенос генетического материала при фагоцитировании апоптозных телец.Ключевой фактор в реализации апоптоза — белок р53, относящийся к группе
супрессоров опухоли, он участвует в управлении клеточным циклом, вызывая блок
в делении клеток при повреждении ДНК. Генетические дефекты, связанные с мута¬
цией гена р53, приводят к образованию злокачественных опухолей с пониженной
способностью к апоптозу. Одним из основных ингибиторов апоптоза считают про¬
дукт гена Ьс1-2. В то же время сверхпродукция белка гена Ъс1-2 тормозит апоптоз в
клетке, что наблюдают, в частности, при В-клеточной фолликулярной лимфоме.Пролиферация и дифференцировка стволовых и коммитированных клеток-
предшественников Б нормальном кроветворении могут происходить только в
условиях их выживания, для чего необходимо воздействие антиапоптотических
факторов, среди последних наиболее значимы ростовые факторы» большинство
из которых препятствует апоптозу (фактор стволовых клеток, тромбопоэтин, эри-
тропоэтин, колониестимулирующие факторы, ИЛ-2, ИЛ-3, ИЛ-6 и др.). Ростовые
факторы действуют не только на клетки-предшественники, но и на зрелые клет¬
ки, обеспечивая их выживание и нормальное функционирование. Воздействие
ростовых факторов происходит через специфические рецепторы — FAS-R {CD95/
АРО-1) - поверхностные рецепторы клетки, передающие сигнал апоптоза, под
действием которого активируются каспазы (семейство цистеиновых протеаз),
эндонуклеазы, другие ядерные белки, приводящие к апоптозу. Уровень экспрессии
FAS/AP0-1 наиболее выражен в зрелых гранулоцитах, моноцитах и минимален в
бластных клетках, что, по-видимому, имеет свой биологический смысл: для клетки
в конечной стадии дифференцировки облегчаются условия запуска апоптоза, в то
время как для бластов вероятность программированной гибели низка. Изучение
механизмов апоптоза и его регуляции имеет большое значение в изучении онкоге¬
неза, поиске новых путей ингибиции опухолевого роста.Гибель клеток при физической или химической травме, ишемии, гипертермии
и других повреждениях происходит путем некроза, в клетке возникают дезинте¬
грация. изменение функции органелл, повреждается большая часть цитоплазма¬
тической мембраны, что приводит к высвобождению лизосомных ферментов. На
поздней стадии ядерный хроматин исчезает, т.е. происходит кариолизис. Некроз
сопровождается экссудативным воспалением, и, если в процесс вовлечено большое
количество клеток, происходит образование рубца.ЭРИТРОПОЗЗЭритропоэз — процесс образования и созревания эритроидных клеток в костном
мозге. У взрослого человека с массой тела 70 кг костный мозг ежедневно проду¬
цирует 20-25x10^^ новых эритроцитов. Такое количество клеток необходимо для
поддержания нормального уровня гемоглобина. Родоначальные клетки эритро-
поэза — бипотентные клетки-предшественники мегакариоцитарно-эритроидного
ростка. Коммитированные монопотентные клетки-предшественники называют¬
ся бурстообразующими единицами эритропоэза (БОЕ-Э), они гетерогенны по
составу, их различия зависят от степени дифференцировки. Колониеобразующие
единицы эритроидного ряда (КОЕ-Э) дифференцируются в первую, морфологиче¬
ски распознаваемую клетку костного мозга — проэритробласт, который в течение3-5 сут подвергается дальнейшей дифференцировке, проходит стадии базофиль-
ного, полихроматофильного и оксифильного эритробласта. Дифференцировка
480 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯИ созревание эритроидных клеток, начиная с проэритробласта до эритроцита,
происходит в течение 9-14 сут. Синтез гемоглобина в клетках эритроидного ряда
начинается на стадии проэритробласта и продолжается вплоть до ретикулоцита.Образование эритробластов происходит только в присутствии достаточной
концентрации эндогенного эритропоэтина (ЭПО), в противном случае клетки
подвергаются апоптозу. ЭПО действует через эритропоэтинчувствительные кле¬
точные рецепторы, количество которых максимально на клетках КОЕ-Э, проэри-
тробластах и базофильных эритробластах. Связывание ЭПО с соответствующим
рецептором предотвращает апоптоз клеток. В регуляции эритропоэза принимают
участие также витамин фолиевая кислота, микроэлементы (железо, медь).В норме на долю эритрокариоцитов костного мозга приходится 20-30% всех
ядросодержащих клеток.Оксифильный эритробласт после потери ядра (энуклеации) называется рети-
кулоцитом. Образовавшиеся ретикулоциты созревают в костном мозге в течение
36-44 ч, после чего поступают в кровь, где дозревают в течение 24-30 ч. Незрелые
ретикулоциты имеют большое количество РНК-содержащих структур и, несмо¬
тря на отсутствие ДНК, способны синтезировать гемоглобин, липиды, пурины.
Ретикулоцит имеет на поверхности те же молекулы, что и зрелый эритроцит,
включая гликофорин А, антигены группы крови и системы резус, абсорбирует
молекулы железа благодаря рецепторам к трансферрину (CD71), плотность кото¬
рых выражена у менее зрелых ретикулоцитов.Количество эритроцитов у взрослого человека в физиологических условиях —
25-30x10^2 клеток (около 2 кг). При средней продолжительности жизни эритро¬
цита 100-120 сут костный мозг должен продуцировать в течение часа порядка
клеток. Количество эритроцитов в организме зависит от скорости их образования
и разрушения. Тканевая гипоксия приводит к избыточному синтезу ЭПО, который
стимулирует пролиферацию БОЕ-Э, увеличение общего содержания эритрокарио¬
цитов в костном мозге и ретикулоцитов в периферической крови.Диаметр эритроцитов — 7,2-7,5 мкм, площадь поверхности — 140 мкм^,
объем — 90 мкм^. Благодаря дискоидной двояковогнутой форме клетка имеет
избыточную поверхность, которая при высокой пластичности и деформируемости
мембраны позволяет эритроциту проходить через капилляры диаметром 2-4 мкм,
проникать через стенки синусоидов (диаметр отверстия синусоидов в селезенке
равен 0,5-0,7 мкм), возвращаясь после этого к исходным параметрам. Мембрана
эритроцитов имеет сложный двойной слой фосфолипидов, в который встроены
гликопротеины, углеводная часть их образует надмембранный слой — гликока-
ликс. Ечикопротеиновые комплексы мембраны организованы таким образом, что
отрицательно заряженные участки (чаще всего сиаловые группы полисахаридов)
обращены кнаружи, придавая поверхности эритроцитов отрицательный заряд.
Внутренняя сторона мембраны эритроцитов связана с сетью миофиламентных
белков, формирующих спектрин-актиновый цитоскелет, придающий эритроциту
специфическую двояковогнутую форму.Эритроцит не имеет митохондрий, поэтому энергетическое обеспечение зави¬
сит от гликолиза. Прекращение гликолиза приводит эритроцит к «метаболиче¬
ской смерти» — процессу, конечным результатом которого является гемолиз. До
30% глюкозы эритроцита используется в пентозофосфатном цикле, результатом
которого является синтез НАДФНз — основного метаболита, обеспечивающего
функционирование антиоксидантных систем в эритроците. Эта система в эритро¬
ците предупреждает чрезмерное накопление свободных радикалов двухвалентного
железа (Ее^О и кислорода (О^-), способных вызвать активацию перекисного окис¬
ления липидов эритроцитарной мембраны и гемолиз.Основная функция эритроцита — участие в газообмене за счет высокого содер¬
жания в нем гемоглобина. Кроме того, эритроциты участвуют в гемостазе, иммун¬
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 481ных процессах, взаимодействуя с циркулир)тощими иммунными комплексами,
поскольку на мембране эритроцитов имеются Fc-рецепторы к иммуноглобули¬
нам. На мембране эритроцита адсорбируются токсины, липиды, аминокислоты.
Клеточная мембрана эритроцита имеет более 250 поверхностных антигенов,ГРАНУЛОЦИТОПОЭЗДифференцировка и созревание клеток гранулоцитопоэза происходят в костном
мозге, где из морфологически неидентифицируемых клеток-предшественников —
КОЕ-ГМ (колониеобразующей единицы грануломоноцитопоэза) и КОЕ-Г (коло¬
ниеобразующей единицы гранулоцитопоэза) формируется пул пролиферирую¬
щих гранулоцитов, состоящий из миелобластов, промиелоцитов и миелоцитов,
пролиферация и созревание этих клеток приводят к образованию метамиелоцитов,
палочкоядерных и сегментоядерных гранулоцитов. Процесс формирования зрело¬
го гранулоцита из миелобласта происходит в костном мозге в течение 10-13 суг.
Регуляцию гранулоцитопоэза обеспечивают колониестимулирующие факторы:
ГМ-КСФ (гранулоцитарно-макрофагальный) и Г-КСФ (гранулоцитарный), дей¬
ствующие до конечной стадии созревания гранулоцитов. І^етки, коммитирован-
ные в сторону миелопоэза, характеризуются экспрессией ранних линейных мие-
лоидных маркеров CD33, CD117, CD13, миелопероксидазы. Основные маркеры
зрелых клеток крови гранулоцитарного ряда — CD45, CD10, CDllc, CD13, CD15,
CD16, CD18, CD32, CD33, CD50, CD65w, CD117, лактоферрин.На стадии поздних миелобластов и промиелоцитов происходит первичный гра-
нулогенез. Первичные гранулы окрашиваются азуром, их маркерный фермент —
миелопероксидаза, в связи с чем их называют азурофильными, пероксидазопо-
зитивными. Первичные гранулы содержат бактерицидные ферменты (лизоцим,
катепсин, эластазу, миелопероксидазу), антибактериальные катионные белки,
нейтральные сериновые протеиназы, кислые гидролазы, гранулофизин. Эти веще¬
ства обладают выраженной антимикробной активностью. В цитоплазме миелоци¬
тов начинается формирование специфической зернистости (вторичные гранулы).
Маркеры вторичных гранул — лактоферрин, катионный белок кателицидин, В^^-
связьшающий белок и другие факторы. В состав вторичных гранул также входят
лизоцим, коллагеназа, металлопротеиназы. Нейтрофилы имеют и третичную
зернистость, в состав гранул которых входит желатиназа. Биосинтез желатиназы
происходит главным образом в палочко- и сегментоядерных клетках независимо
от специфических гранул. Желатиназу рассматривают как маркер циркулирз^ощих
нейтрофилов, не свойственный костномозговым предшественникам. Четвертый
тип гранул — секреторные пузырьки — эндоплазматические органеллы, содер¬
жащие щелочную фосфатазу, белок тетранектин, рз'Микроглобулин, биосинтез
которых происходит на уровне миелоцита.Зрелые гранулоциты костного мозга составляют гранул оцитарный костномоз¬
говой резерв, насчитывающий около 8,8x10^ клеток и мобилизуемый в ответ на
специфический сигнал при бактериальных инфекциях. Процесс выхода лейкоци¬
тов из костного мозга высокоселективен. В норме в кровоток поступают только
зрелые клетки. Покидая костный мозг, гранулоциты являются полностью диф¬
ференцированными клетками, имеющими полный спектр поверхностных рецеп¬
торов и цитоплазматических гранул с набором многочисленных биологически
активных веществ.НейтрофилыНейтрофилы составляют 60-70% общего количества лейкоцитов крови. После
выхода нейтрофильных гранулоцитов из костного мозга в периферическую кровь
часть их свободно циркулирует в сосудистом русле (циркулирующий пул), другие
занимают пристеночное положение, образуя маргинальный, или пристеночный,
482 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯпул. у здоровых людей соотношение циркулирующего и маргинального пулов
составляет 1:3. Скорость обновления пулов равна 1,6х10Укг массы тела в сутки.
Зрелый нейтрофил пребывает в циркуляции 8-10 ч, затем поступает в ткани,
образуя по численности значительный пул клеток. Продолжительность жизни
нейтрофильного гранулоцита в тканях составляет в среднем 2-3 сут. При этом
клетка «стареет», приобретая пикнотичный вид, У человека за сутки вырабаты¬
вается около 10’^ нейтрофильных гранулоцитов, поэтому наряду с продукцией
крайне важным для организма является их удаление, что происходит по механиз¬
му апоптоза.Нейтрофилы рассматривают как первую линию защиты от внешних и вну¬
тренних агентов, направленную на поддержание постоянства внутренней среды
организма. Их быстрая трансмиграция через клетки эндотелия опосредована
действием многих цитокинов, в том числе хемокинов. Основная функция нейтро-
филов — участие в борьбе с микроорганизмами путем их фагоцитоза. Содержимое
гранул способно разрушить практически любые микробы. В азурофильных и
специфических гранулах нейтрофилов содержатся более 20 различных протеоли-
тических ферментов, миелопероксидаза, интегрины, бактерицидные белки (лак-
тоферрин, дефенсины, катионный антимикробный белок), лизоцим, лактоферрин,
щелочная фосфатаза, вызывающие бактериолиз и переваривание микроорганиз¬
мов. В азурофильных гранулах имеется большое количество эластазы, которая
может быть фактором, приводящим к деструкции тканей в очаге воспаления. Две
металлопротеиназы — коллагеназа и желатиназа — могут вызывать деградацию
внеклеточного матрикса. На поверхности нейтрофилов обнаружены интегрины,
селектины, которые обеспечивают взаимодействие нейтрофилов с эндотелиаль¬
ными клетками и последующую миграцию нейтрофилов из кровеносного русла
в ткани. Нейтрофилы способны синтезировать и секретировать ряд цитокинов
(ФНО-а, ИЛ-1 а, ИЛ-1р, ИЛ-6, ИЛ-8, ИЛ-12), некоторые колониестимулирующие
факторы (ГМ-КСФ, Г-КСФ, М-КСФ), трансформирующий фактор роста-р. Эти
биологически активные вещества позволяют нейтрофилам участвовать в реакции
воспаления, обеспечивают их созревание и функциональную активность, а также
определяют влияние нейтрофилов на эффекторные функции других клеток.Ведущая функция нейтрофилов — фагоцитоз, открытый И.И. Мечниковым в
конце XIX в. Нейтрофил мобилизуется в очаг воспаления через минуты или часы.
Существенно позже сюда поступают макрофаги. Нейтрофилы могут захватывать
только опсонизированные частицы, Опсонизацию осуществляют сывороточные
факторы — опсонины, которые обволакивают бактерии или другие антигены,
готовя их к фагоцитозу. Основные опсонины — система комплемента, иммуногло¬
булины, фибронектин. С недостаточной опсонизирующей активностью сыворотки
связана восприимчивость к бактериальным инфекциям при многих заболеваниях.
Взаимодействие мембраны нейтрофила с микроорганизмом инициирует образо¬
вание псевдоподий, которые, окружая микроорганизм, сливаются между собой
по принципу застежки «молнии», в результате чего частица (и вместе с ней часть
мембраны) погружаются внутрь клетки (эндоцитоз), формируя фагосому. Внутри
образованной фаголизосомы происходит киллинг микроорганизмов протеолити-
ческими ферментами, содержащимися в гранулах, а также за счет образующихся в
результате «респираторного взрыва» перекиси водорода и гидроксильных радика¬
лов при кислородзависимом механизме киллинга.Некоторые бактерии способны угнетать слияние гранул с фагосомой и, таким
образом, избегать киллинга. К ним относят микобактерии туберкулеза, лепры,
сальмонеллы, гонококки, токсоплазмы, грибы. Гонококки, прикрепляясь к ней¬
трофилам, стимулируют кислородзависимый метаболизм, при этом азурофиль-
ные гранулы не выбрасывают свое содержимое в фагосомы и внутриклеточные
гонококки сохраняют свою жизнеспособность, Хламидии активно поглощаются
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 483нейтрофилами, однако, подавляя процесс дегрануляции, хламидии успешно раз¬
множаются в фагосомах. Ряд бактерий резистентны к действию лизосомальных
ферментов, в частности лейшмании, которые размножаются в фаголизосомах.ЭозинофилыОбразование эозинофилов из клеток-предшественников продолжается около3-4 сут, затем в течение 2-5 сут они остаются в костном мозге. Ростовой фактор
эозинофилов — ИЛ-5. Эозинофилы составляют 0,5-5% всех лейкоцитов крови,
циркулируют в крови в течение 6-12 ч, затем поступают в ткани; срок их жизни —
около 12 сут. Тканевый пул эозинофилов значительно превышает их количество в
крови; распределены эозинофилы неравномерно. Наибольшее их количество выяв¬
ляют в тканях, соприкасающихся с внешней средой: в подслизистом слое дыхатель¬
ного, пищеварительного и частично мочеполового трактов. Эозинофилы повторно в
кровеносное русло не возвращаются, разрушаются в тканях путем апоптоза.На поверхности мембраны эозинофила имеются рецепторы к Fc-фрагменту
молекулы иммуноглобулина, рецепторы к компонентам комплемента, молекулам
адгезии, CD52, CD69, CD40 и др. В клетках содержится значительное количество
гранул, основной компонент которых — главный щелочной белок (катионный
белок), а также перекиси, обладающие бактерицидной активностью. Главный
щелочной белок обладает цитотоксичностью, повреждает некоторые личинки
гельминтов, нейтрализует гепарин. Гранулы эозинофилов содержат простаглан-
дины, кислую фосфатазу, арилсульфатазу, коллагеназу, эластазу, глюкуронидазу,
катепсин, эозинофильную пероксидазу и другие ферменты. Простагландины угне¬
тают дегрануляцию тучных клеток. Арилсульфатаза ингибирует анафилактоидные
вещества, тем самым уменьшает реакцию гиперчувствительности немедленного
типа. Эозинофилы способны к генерации токсичных кислородных радикалов и
кислороднезависимых катионных белков. Обладая слабой фагоцитарной актив¬
ностью (по сравнению с нейтрофилами), эозинофилы обусловливают внекле¬
точный цитолиз, участвуя в противогельминтном иммунитете. Соприкосновение
эозинофилов с личинками, покрытыми антителами к IgG и активированным
СЗ-компонентом комплемента, сопровождается дегрануляцией эозинофилов с
отложением главного щелочного белка и пероксидазы на личинке, что вызывает
ее гибель. Цитотоксичность эозинофилов могут повышать не только антитела к
IgG, но и к IgE.Объектом фагоцитоза эозинофилов могут быть бактерии, грибы, продукты
распада тканей, иммунные комплексы. Механизм фагоцитоза такой же, как у ней-
трофилов, однако переваривающая и бактерицидная способность эозинофилов
значительно ниже. Возможно, это связано с отсутствием в них лизоцима, фагоци-
тина и недостаточной активностью пероксидазы.Основная функция эозинофилов — участие в механизмах защиты при гельмин-
тозах, паразитозах, в реакциях гиперчувствительности немедленного типа, связан¬
ных с острой аллергией.В зависимости от соответствующего антигена эозинофилы могут вызывать
повреждение эпителия дыхательных путей, отек и деструкцию гранулематозной
ткани. Эозинофилы способны быстро проникать из сосудистого русла в ткани и
концентрироваться в большом количестве в очаге поражения. Это приводит сна¬
чала к эозинопении, ответное усиление продукции эозинофилов в костном мозге
сопровождается нормализацией их уровня в периферической крови, а затем эози-
нофилией. Секреторная функция эозинофилов состоит в продукции и секреции
ИЛ-2, ил-3, ИЛ-4, ИЛ-5, ФНО, у-интерферона.БазофилыБазофилы и тучные клетки имеют костномозговое происхождение и диф¬
ференцируются из КОЕ-ГМ — гранулоцитарной клетки-предшественника.
484 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯДифференцировка базофилов в костном мозге длится 1,5-5 сут. Ростовые фак-
торы базофилов и тучных клеток — ИЛ-3, ИЛ-4, ГМ-КСФ. Созревшие базофилы
поступают в кровоток, период их полужизни составляет около 6 ч. На долю базо-филов приходится всего 0,5% общего количества лейкоцитов крови. Базофилы
ЩШМ мигрируют в ткани, где через 1-2 сут после осуществления основной эффекторнойщфункции погибают. Гранулы этих клеток содержат гистамин, гистидин, хондрои-
Щ тинсульфаты А и С, гепарин, серотонин, ферменты (трипсин, химотрипсин, перок-сидазу, РНКазу, арилсульфатазу, р-глюкуронидазу), лейкотриены, тромбоксаны,
простагландины, фактор хемотаксиса эозинофилов, фактор активации тромбоци¬
тов, фактор хемотаксиса нейтрофилов, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ГМ-КСФ, ФНО-а
и др. Базофилы подвижны, обладают, как и тучные клетки, слабой способностью
к фагоцитозу.Предшественники тучных клеток покидают костный мозг и через перифери¬
ческую кровь попадают в ткани, тучные клетки локализуются в эпителии, под-
слизистом слое желудочно-кишечного, дыхательного и урогенитального трактов,
в коже, соединительной ткани, окружающей капилляры, серозных оболочках. От
микроокружения зависит окончательный фенотип ТЗ'ЧНЫХ клеток, среди которых
выделяют две субпопуляции: соединительнотканные и слизистые тучные клет¬
ки, которые фиксируются на специфических структурах соединительной ткани,
таких как фибронектин и ламинин. Белки внеклеточного матрикса влияют на
окончательную дифференцировку, состояние активности и выживаемость клеток,
В отличие от базофилов, тучные клетки способны к делению и имеют большой
срок жизни (месяцы и годы).На поверхности тучных клеток и базофилов имеются рецепторы к комплементу,
Fc-y-рецепторы, рецепторы высокой плотности к IgE, обеспечивающие не только
связывание IgE, но и высвобождение гранул, содержимое которых обусловливает
развитие аллергических реакций. IgE, секретируемый плазматическими клетками в
слизистых оболочках, фиксируется на рецепторах тучных клеток. Такая фиксация
может сохраняться очень долго (до года) и не сопровождаться активацией клеток.
Состояние организма, характеризующееся фиксацией на рецепторах тучных клеток
IgE к конкретному аллергену, называется сенсибилизацией к данному аллергену.
При фиксации аллергена на поверхности тучных клеток происходят активация
клетки, слияние мембран гранул с цитоплазматической мембраной и выброс содер¬
жимого гранул наружу. Дегрануляция осуществляется в течение нескольких секунд
и не приводит к гибели клетки, В тучных клетках (но не в базофилах) возможен
процесс восстановления гранул. Активированными тучными клетками и базофила-
ми в течение нескольких часов секретируются цитокины, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6,
ИЛ-13, ГМ-КСФ, хемотаксические агенты, в частности ИЛ-8. Следствие активации
и дегрануляции тучных клеток — местная дилатация и повышение проницаемости
сосудов, гиперемия и зуд, гиперпродукция слизи, раздражение нервных окончаний,
т.е. реакция гиперчувствительности немедленного типа.моноцитопоэзКлетки, объединенные в систему мононуклеарных фагоцитов (СМФ), вклю¬
чают костномозговые предшественники, пул циркулирующих в сосудистом русле
моноцитов и тканевые макрофаги. Процесс дифференцировки и созревания клеток
моноцитопоэза регулируется колониестимулирующими факторами — ГМ-КСФ,
М-КСФ, ИЛ-3. Дифференцировка моноцитов из монобласта происходит в костном
мозге в течение 5 сут, после чего они сразу выходят в кровоток, не создавая кост¬
номозгового резерва (в отличие от гранулоцитов). В костном мозге клетки моно-
цитарного ряда представлены в основном пролиферирующим пулом. Небольшая
часть моноцитов дифференцируется в макрофаги костного мозга, количество
которых составляет примерно 30±12 в 1 мкл костного мозга.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 485В крови моноциты распределяются на циркулирующий и пристеночный пулы,
количественное соотношение которых может меняться, у человека циркулирую¬
щий пул моноцитов насчитывает в норме 18x10^ клеток/кг массы тела, а марги¬
нальный (пристеночный) — в 3,5 раза больше (63x10^ клеток/кг).В периферической крови моноциты составляют от 1 до 10% всех лейкоцитов
(80-600х10Ул). Моноциты циркулируют в кровотоке от 36 до 104 ч, затем поки¬
дают сосудистое русло, взаимодействуя со специализированными адгезивными
молекулами на эндотелиальных клетках. За сутки из кровеносного русла в ткани
уходит 0,4x10'^ моноцитов. При воспалении увеличивается количество моноцитов,
поступающих в кровь и покидающих кровеносное русло, время их транзита через
кровь при этом сокращается.Цитохимические маркеры клеток СМФ — неспецифическая эстераза, подавляе¬
мая фторидом натрия, кислая фосфатаза. По мере созревания клеток моноцитар-
ного ряда снижается активность миелопероксидазы, отмечается незначительное
содержание гликогена и липидов. В тканях моноциты дифференцируются в тка¬
невые макрофаги (гистиоциты), их незначительная часть (менее 5%) способна к
однократному делению. В основном обновление макрофагов происходит за счет
притока моноцитов из крови. Тканевый пул мононуклеарных фагоцитов в 25 раз
превышает их содержание в крови; наибольшее количество макрофагов содер¬
жится в печени (клетки Купфера) — 56,4%, легких — 14,9%, селезенке — 15%,
перитонеальной полости — 7,6%, несколько меньше — в центральной нервной
системе (клетки микроглии и астроциты), костной ткани (остеокласты) и других
тканях. Продолжительность жизни тканевых макрофагов (гистиоцитов) исчис¬
ляется месяцами и годами. Если не происходит их мобилизации в очаг инфекции
или воспаления, они погибают, мигрируя в селезенку или лимфатические пути.
Макрофаги в соответствии с их структурно-функциональными параметрами раз¬
делены на 2 класса; антигенперерабатывающие (профессиональные фагоциты) и
антигенпредставляющие (дендритные клетки).Функции моноцитов/макрофагов. Макрофаги принимают активное уча¬
стие в неспецифической защите от патогенных микроорганизмов, в процессах
репарации, инициации специфического иммунного ответа, в метаболизме липи¬
дов и железа. Мононуклеарными фагоцитами секретируются цитокины и другие
биологически активные вещества, способные запускать каскад воспалительных
реакций. Среди них провоспалительные (ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12, ИЛ-18,
ФНО-а, а-интерферон, моноцитарный хемотаксический протеин, фактор, инги¬
бирующий миграцию) и противовоспалительные (ИЛ-10, трансформирующий
ростовой фактор-(3) цитокины. С высоким уровнем ИЛ-1 связаны лихорадка, ано¬
рексия, нейтрофилез, активация эндотелиальных клеток с повышением экспрес¬
сии на них молекул адгезии, активация нейтрофилов, усиленный синтез остро¬
фазных белков, компонентов комплемента, глюкокортикоидов, синтез коллагена
и коллагеназ, активация остеокластов, усиление протеолиза в мышечной ткани.
Мононуклеарные фагоциты поддерживают постоянный уровень железа в орга¬
низме, обеспечивая регуляцию рециркуляции железа, катаболизм состарившихся
эритроцитов, высвобождение железа из гемоглобина и хранение основных фондов
запасного железа в виде ферритина. Кроме того, макрофагами продуцируются
железосвязывающие белки — трансферрин и ферритин. Многочисленные функ¬
ции мононуклеарных фагоцитов дают основание считать их ключевыми клетками
в инициации и регуляции иммунного ответа, гемопоэза, в реализации неспецифи¬
ческой резистентности организма.МЕГАКАРИОЦИТОПОЭЗДифференцировка и созревание клеток мегакариоцитарного ряда происходят
в костном мозге. При созревании клетки проходят три морфологически диффе¬
486 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯренцируемые стадии: мегакариобласт, содержание которого не превышает 10%
среди клеток всей популяции, промегакариоцит (около 15%) и мегакариоцит, на
долю которого приходится от 75 до 85% клеток. Время созревания мегакариоцита
составляет примерно 25 ч, его жизненный цикл длится около 10 сут. Отличительной
чертой клеточных элементов мегакариоцитопоэза является их способность к эндо¬
митозу (полиплоидизации) — делению ядра без разделения цитоплазмы, что при¬
водит к появлению клеток гигантского размера. В процессе мегакариоцитопоэза
клетки проделывают от 3 до 6 эндомитозов, что соответствует плоидности мегака¬
риоцита от 8п до 64п. Созревание мегакариоцитарных элементов сопровождается
накоплением в цитоплазме гранул, в которых содержится значительное количе¬
ство белков: фактора фон Виллебранда, тромбоцитарного фактора-4, тромбоспон-
дина, фибриногена, фибронектина, тромбоцитарного ростового фактора, транс¬
формирующего ростового фактора-13 (оба цитокина усиливают митотическую
активность фибробластов), тромбоцитарного ингибитора коллагеназы. Основная
масса их синтезируется в мегакариоцитах, некоторые белки, такие как альбумин,
фибриноген, IgG поступают в клетку путем эндоцитоза.Способность зрелых мегакариоцитов к эндоцитозу проявляется в эмпириопо-
лизисе, суть которого заключается в захвате гемопоэтических клеток. Частота его
возрастает при злокачественных новообразованиях.Основные функции мегакариоцитопоэза — репопуляция тромбоцитов, под¬
держание их количества в кровотоке на постоянном уровне. Мегакариоциты рас¬
положены в костном мозге вблизи костномозговых синусов, по мере созревания
внутрь клетки врастают разделительные мембраны, по которым в дальнейшем
происходит деление цитоплазмы на тромбоциты.Регуляция мегакариоцитопоэза происходит по принципу обратной связи:
избыток тромбоцитов в крови тормозит тромбоцитопоэз, а тромбоцитопения его
стимулирует. Основные регуляторы, стимулирующие мегакариоцитопоэз, — ИЛ-1,
ИЛ-3, ИЛ-4, ИЛ-6, ИЛ-11, фактор стволовых клеток, лейкозингибирующий фак¬
тор, ГМ-КСФ, Г-КСФ, эритропоэтин, тромбопоэтин. К факторам, ингибирующим
тромбоцитопоэз, относят тромбоцитарный фактор-4, трансформирующий фактор
роста-Pj, а- и у-интерфероны и др. Основные маркеры клеток мегакариоцитарного
ряда - CD41 и CD61.Тромбоцит — безъядерная клетка диаметром 2-4 мкм, ее средний объем —7,5 мкм^ (от 3 до 10 мкм-^). Популяция тромбоцитов неоднородна. Различают зрелые
тромбоциты (87%), юные (незрелые — 3,2%), старые (4,5%), формы раздражения
(2,5%). Микроформы тромбоцитов имеют диаметр менее 1,5 мкм, макроформы
могут быть диаметром 5 мкм, мегалоформы имеют диаметр 6-10 мкм. В центре
зрелого тромбоцита содержится обильная азурофильная зернистость. В кровотоке
в неактивном состоянии тромбоциты имеют дискоидную форму, при активации
клетки приобретают сферичность и образуют псевдоподии и нити. Период созре¬
вания тромбоцитов составляет в среднем 8 сут, продолжительность пребывания в
кровотоке варьирует от 9 до 11 сут. В циркуляции находится около 67% тромбо¬
цитов.Специфические функции тромбоцитов в гемостазе требуют активного взаимо¬
действия с другими тромбоцитами, плазменными белками и небелковыми веще¬
ствами. Роль посредника между тромбоцитом и различными факторами внешней
среды, в том числе другими участниками процесса гемостаза, играют рецепторы
тромбоцитов — гликопротеины, фиксированные на цитоплазматической мембра¬
не тромбоцита.Основные функции тромбоцитовАнгиотрофическая функция обеспечивает нормальную проницаемость и рези¬
стентность стенок микрососудов. Тромбоциты поддерживают или восстанавлива¬
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 487ют сосудистую стенку посредством процесса реэндотелизации места повреждения.
Дефицит тромбоцитов приводит к дистрофии эндотелия сосудов, и он становится
проницаем для плазмы и эритроцитов. Повышенная проницаемость (ломкость)
капилляров сопровождается мелкими кровоизлияниями (петехиями). При выра¬
женной тромбоцитопении развивается геморрагический синдром.Адгезивно-агрегационная функция обусловлена способностью тромбоцитов
адгезироваться к субэндотелиальным структурам поврежденной сосудистой стен¬
ки и образовывать сначала агрегаты, а затем тромбоцитарную пробку.В условиях патологии (парапротеинемии,криоглобулинемии) продукты фибри-
нолиза ингибируют агрегацию тромбоцитов. Также эта функция нарушается при
отсутствии фибриногена, дефиците или аномалии мембранных гликопротеинов.Сорбционно-транспортная функция тромбоцитов заключается в адсорбции
ими на своей поверхности и доставке к месту кровотечения плазменных факторов
свертывания, таких как фибриноген, фактор VHI, а также иммунных комплексов
и антикоагулянтов.Ретракция кровяного сгустка — функция тромбоцитов, обеспечивающая уплот¬
нение сгустка и выделение из него избытка сыворотки. Ретракция способству¬
ет улучшению механических характеристик сгустка и снижению активности
фибринолиза внутри него. При врожденной недостаточности фактора GPIIb-IlIa
(тромбастении Гланцмана) нарушается ретракция сгустка крови. Следствием этого
является не только фубый дефект тромбоцитарного гемостаза, но и качественный
дефект образовавшегося сгустка крови.ЛИМФОЦИТОПОЭЗЛимфоциты — клетки иммунной системы, гетерогенная популяция, отли¬
чающаяся по иммунофенотипическим и функциональным характеристикам. Для
типирования лейкоцитов предложена классификация мембранных антигенов
и распознающих их моноклональных антител (групп кластеров). Было введено
обозначение антигенов как CD (Cluster Designatior^ с указанием соответствующего
номера. При отсутствии контакта с антигеном лимфоциты представляют собой
покоящиеся клетки, они не делятся, не секретируют активные вещества, их мета¬
болическая активность минимальна. Морфологически такие клетки представлены
малыми лимфоцитами.Только после связывания антигенов происходит активация лимфоцитов, при¬
водящая к их дифференцировке в эффекторные и регуляторные клетки. На
каждом лимфоците имеется уникальный по специфичности рецептор, пере¬
дающийся дочерним клеткам. В результате возникают клоны, отличающиеся по
специфичности рецепторов. Каждый клон настроен на свой собственный антиген,
а в совокупности все клоны лимфоцитов узнают огромное множество антигенов,
существующих в природе, при попадании в организм антигена в иммунный ответ
вовлекается тот клон (группа клонов), клетки которого несут соответствующий
рецептор.Наиболее многочисленна Т-клеточная популяция лимфоцитов, нуждающаяся
в особых условиях развития, которые они находят, мигрируя из костного мозга в
тимус.Костномозговая дифференцировка Т-лимфоцитов. Наиболее ранним
Т-клеточным маркером является CD7, появление которого на стволовых CD34'-
гемопоэтических клетках указывает на Т-клеточную направленность дифференци-
ровки. Этап ко-экспрессии CD34 и CD7 в костном мозге протекает очень быстро.
Практически одновременно с CD7 начинается цитоплазматическая экспрессия
CD2 и CD3 и появляется мембранный антиген CD5, а затем CD2. На ранних этапах
дифференцировки Т-лимфоцитов может отмечаться экспрессия CD 10. Незрелые
протимоциты не имеют молекул HLA-DR, TdT (терминальной дезоксинуклеоти-Ш
488 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯдилтрансферазы), CD3, в них только начинается перестройка генов Т-клеточного
рецептора.Дифференцировка Т-лимфоцитов в тимусе. Миграция предшественников
Т-лимфоцитов из костного мозга в тимус сопровождается преодолением гемато-
тимического барьера. Под влиянием микроокружения тимуса клетки проходят
последовательные стадии преобразования сначала в кортикальном, затем в медул¬
лярном слое. В результате формируется Т-клеточный рецептор, служащий для
распознавания антигена.Для кортикальных тимоцитов характерны экспрессия молекулы CDla и одно¬
временное присзпгствие антигенов CD4 и CD8. Последний этап дифференцировки
тимоциты проходят в медуллярном слое (медуллярные тимоциты). Он харак¬
теризуется появлением мембранных маркеров CD3, CD2, TCR~ap, разделением
Т-лимфоцитов на две субпопуляции — Т-хелперы (CD4'^) и цитотоксические клет¬
ки (CD80.Из тимуса наивные Т-лимфоциты (CD4^ или CDS*) через сосуды кортикоме¬
дуллярной зоны и кровоток поступают в периферические лимфоидные органы.
Характерная иммунофенотипическая особенность этих клеток — мембранная экс¬
прессия молекулы CD45RA. Во вторичных лимфоидных органах (лимфатических
узлах, селезенке, лимфатических фолликулах) Т-лимфоциты занимают преиму¬
щественно тимусзависимые зоны: паракортикальные зоны лимфатических узлов,
параартериальные муфты селезенки. В медуллярной зоне обнаруживают Т-клетки
вместе с В-лимфоцитами и плазматическими клетками. В этих областях Т-клетки
CD4" преобладают над CD8^Т-лимфоциты недолго задерживаются в лимфоидных органах, быстро покида¬
ют их, поступая в лимфу, или мигрируют с током крови. Т-клетки вовлечены в про¬
цессы активации и иммунного ответа при контакте с антигеном в периферических
лимфоидных органах. После ряда последовательных делений дифференцировка
заканчивается образованием сенсибилизированных (эффекторных) Т-хелперов
(CD4) либо цитотоксических лимфоцитов (CD8) и формированием клеток памяти
(CD45R0^), доля которых составляет почти 50% лимфоцитов,Т-лимфоциты имеют разную продолжительность жизни. Небольшая часть
клеток живет несколько недель, месяцев, у большей части Т-лимфоцитов время
обновления составляет годы, что иногда сопоставимо со сроком жизни человека.
Именно поэтому с возрастом увеличивается количество CD3’^CD4'-клеток памяти
(CD45RO*) и уменьшается количество наивных клеток (CD45RO ).С возрастом количество Т-лимфоцитов в костном мозге повышается: в тре-
панобиоптате их насчитывают до 34,8%, в аспиратах костного мозга — до 46%.
Отмечен селективный хоминг-эффект зрелых С08"^-лимфоцитов в костный мозг,
где соотношение CD4/CD8 составляет менее 1,0. Зрелые Т-лимфоциты костного
мозга осуществляют контроль над процессами пролиферации и дифференцировки
гемопоэтических клеток как путем контактных взаимодействий, так и опосредо¬
ванно через продукцию цитокинов.Основной и наиболее специфический маркер Т-лимфоцитов — CD3. Менее
специфичны, но почти всегда присутствуют на Т-клетках CD7, CD2, CD5. Молекула
CD4 определяет субпопуляцию Т-хелперов, молекула CD8 — Т-киллеров (цито¬
токсических лимфоцитов).Среди клеток-хелперов выделяют Т-хелперы 1-го и 2-го типа (ТЫ и Th2), кото¬
рые помогают развитию соответственно клеточного и гуморального иммунных
ответов. Т-лимфоциты участвуют в реализации клеточного иммунного ответа,
который проявляется в двух формах: цитотоксическом ответе и реакции гиперчув¬
ствительности замедленного типа.В основе цитотоксического ответа лежит активация Т-киллеров, которые раз¬
рушают пораженные клетки-мишени (например, вирусинфицированные, опухо¬
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 489левые клетки). Реакция гиперчувствительности замедленного типа имеет в основе
реакцию макрофагов, направляемую клетками ТЫ. Клеточный иммунный ответ
развивается при отторжении аллогенного трансплантата — реакции «хозяин про¬
тив трансплантата» и «трансплантат против хозяина».Дифференцировка В-лимфоцитов. Костный мозг служит основным местом
дифференцировки в-лимфоцитов. Основная характеристика В-лимфоцитов —
присутствие на их мембране рецепторов для распознавания антигенов, основу
которых составляют молекулы иммуноглобулинов.В-лимфоциты в костном мозге проходят этап антигеннезависимой дифферен¬
цировки. Самый ранний распознаваемый этап дифференцировки В-лимфоцитов
носит название про-Б-лимфоцита. На этой стадии происходит начальный этап
перестройки генов тяжелых р-цепей иммуноглобулинов и на мембране появ¬
ляется CD 19, который является общим (пан-В-клеточным) маркером для всех
В-лимфоцитов, участвует в процессах активации клеток. Появление CD 19 про¬
исходит в клетках, экспрессирующих молекулы HLA-DR, часто в сочетании с
CD38, CD34 и TdT. Отличительная черта следующего этапа дифференцировки
В-лимфоцитов — экспрессия на мембране CD 10 (CALLA) и цитоплазматического
CD22 антигенов. Эта стадия носит название пре-пре-В-лимфоцита.На следующем этапе происходит появление цитоплазматических р-цепей имму¬
ноглобулинов и молекулы CD20 — клетка приобретает иммунофенотип пре-В-
лимфоцита. На этой стадии происходит перестройка генов легких цепей, которая
завершает процесс генетических преобразований в В-лимфоцитах. Легкие цепи
иммуноглобулинов еще не синтезируются в пре-в-клетках. Клетки с непродуктив¬
но перестроенными генами иммуноглобулинов гибнут в костном мозге, вероятно,
путем апоптоза. Следствие реаранжировки генов L-цепей — экспрессия полно¬
ценного мембранного IgM в сочетании с другими мембранными маркерами. Этот
этап соответствует стадии незрелой В-клетки. Процесс антигеннезависимой диф¬
ференцировки В-лимфоцитов завершается экспрессией IgD, который сосуществу¬
ет с IgM-рецептором. Присутствие на мембране комплекса «IgM + IgD», CD19-,
СВ20-антигенов позволяет считать В-лимфоцит зрелой (наивной) клеткой.
С момента завершения формирования рецепторного комплекса В-клетка приоб¬
ретает способность взаимодействовать с антигеном.Содержание В-лимфоцитов в трепанобиоптатах костного мозга у взрос¬
лых составляет 33,6% (16,5-40,3%), количество клеток с иммунофенотипом
CD20^CD19* —16,2% (12,3-22,7%), в аспиратах костного мозга — 8 и 6,6% соответ¬
ственно. С возрастом происходит уменьшение общего количества В-лимфоцитов
в костном мозге и снижение их пролиферативного потенциала. В основном это
происходит за счет примитивных В-клеток, а также клеток, экспрессирующих
CD45RA.Зрелые девственные (наивные) В-клетки покидают костный мозг, имея сфор¬
мированный иммуноглобулиновый рецептор, активационные антигены CD23 и
CD5 на мембране отсутствуют. Они попадают в циркуляцию и поступают в пери¬
ферические лимфоидные органы, где при встрече с антигеном проходят этап анти-
гензависимой дифференцировки. В этих органах они выполняют свои функции,
локализуясь в наружных слоях коры лимфатических узлов, краевой зоне и фол¬
ликулах белой пульпы селезенки, продолжительность жизни большинства зрелых
В-лимфоцитов при отсутствии антигенной стимуляции составляет несколько
месяцев. Зрелые В-лимфоциты располагают необходимыми мембранными моле¬
кулами, чтобы распознать антиген и эффективно контактировать с другими клет¬
ками иммунной системы, молекулами иммуноглобулинов, компонентами компле¬
мента, цитокинами.В лимфатических узлах (ЛУ) зрелые В-лимфоциты поступают в первичные
фолликулы, которые представлены в виде компактных округлых образований, не
490 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯЛ, имеющих светлого (зародышевого) центра. Вторичные фолликулы отличаются от
Лв первичных наличием зародышевого центра.Морфология клеток первичного фолликула соответствует малому лимфоциту,
большинство из них не имеет признаков активации. Лимфоциты экспрессируют на
мембране рецепторы CD19, CD20, CD21, CD22, CD24, CD37, т.е. имеют фенотип
периферических В-клеток. Чаще всего эти клетки содержат мембранный комплекс
«IgM + IgD» или IgM. Активационные антигены CD5, CD23, CD38, а также CD10,
как правило, отсутствуют. У плода и новорожденного фенотип клеток первичных
фолликулов Л У отличается от фенотипа клеток взрослых присутствием марке¬
ра CD5 на большинстве лимфоцитов. Содержание CD5*-клеток в ЛУ взрослых
составляет 2-3% общего количества В-лимфоцитов. При отсутствии антигенной
стимуляции клетки через несколько дней гибнут путем апоптоза. При взаимо¬
действии с антигеном происходит активация и пролиферация В-лимфоцитов,
отражением которой служат появление на мембране молекулы CD23, повышеннал
экспрессия HLA-DR, утрата мембранного IgD. Особая группа антигенов, вклю¬
чающая главным образом аутологичные и немногочисленные (преимущественно
тимуснезависимые) экзогенные антигены, ведет к появлению экспрессии CD5 в
процессе активации В-лимфоцитов. Активированные CD5"CD23^ В-лимфоциты
мигрируют в фолликул ЛУ, структура которого из-за быстрой пролиферации видо¬
изменяется — появляются зародышевый центр и мантийная зона.В условиях микроокружения зародышевого центра происходит многоступен¬
чатый процесс антигензависимого созревания и дифференцировки В-клеток.
В темной зоне зародышевого центра активированные В-клетки утрачивают CD23
и превращаются в центробласты (ЦБ), которые активно пролиферируют. Для цен-
тробластов характерны экспрессия CD77, CD10, CD19, CD20, CD38, практически
полное отсутствие IgM и IgD. Большинство этих клеток гибнет путем апоптоза,
поскольку ген антиапоптоза Ьс1-2 в центробластах не функционирует. Разрушенные
погибшие клетки поглощаются макрофагами зародышевых центров, называемых
макрофагами инородных тел (tingible-body macrophages). Здесь же, в зародышевом
центре, часть центробластов дифференцируется в центроциты — клетки с расще¬
пленными ядрами. На центроцитах появляются мембранные иммуноглобулины
(IgG, IgA или IgE). Синтез переключается с продукции IgM на IgG, IgA и IgE, но
преимущественно на синтез IgG, обнаружение которого свидетельствует о том, что
клетка подверглась антигенной стимуляции.Одновременно с пролиферацией и дифференцировкой центробластов в цен¬
троциты происходят соматические гипермутации в вариабельных участках генов
иммуноглобулинов. Процесс соматической мутации необходим для повышения
специфичности иммуноглобулиновых цепей и приобретения высокого аффинитета к
антигену. Из центроцитов формируются В-клетки памяти и плазматические клетки.
Это происходит в апикальной светлой зоне зародышевого центра фолликула, содер¬
жащей густую сеть фолликулярных дендритных клеток (ФДК) с CD23^. ФДК содер¬
жат значительное количество антигена, к которому формируется иммунный ответ в
данном зародьшіевом центре. Антиген на ФДК удерживается в виде иммунных ком¬
плексов с антителами и комплементом — за счет экспрессии на ФДК большого коли¬
чества Fc-рецепторов (CD23, CD16, CD32) и рецепторов комплемента (CD35, CD2],
CDllb). Антиген на ФДК представлен В-лимфоциту в свободном виде или в виде
маленьких мембранных телец, нагруженных антигеном. Направленность дифферен¬
цировки В-лимфоцитов в клетки памяти или в плазматические клетки регулируется
в апикальной светлой зоне зародышевых центров. Связывание молекулы CD40
на В-клетках с соответствующим лигандом Т-лимфоцитов ведет к формированию
В-клеток памяти. Плазмоцитарная дифференцировка В-лимфоцитов происходит
после их взаимодействия с растворимым фрагментом CD23 или с антигеном CD23,
присутствующим на ФДК. В этих взаимодействиях участвуют CD 21 и ИЛ-1.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 491Зрелые плазматические клетки выполняют основные функции — синтез и
секрецию иммуноглобулинов, обеспечивающих гуморальную защиту организма.
При этом плазматическая клетка теряет большинство В-клеточных мембранных
рецепторов, на их поверхности определяют только CD38. Субпопуляция CD5^
В-клеток присутствует на границе зародышевого центра и внутреннего слоя ман¬
тии. Эти клетки способны к дифференцировке в плазмоциты и переключению
синтеза иммуноглобулинов с IgM на IgG и IgA.Клетки маргинальной зоны фолликула ЛУ представлены в незначительном
количестве — это так называемые моноцитоидные В-клетки. Термин отражает
их внешнее сходство с моноцитоидными элементами (неправильная форма ядра,
широкая, обильная светлая цитоплазма). Выраженную пролиферацию этих кле¬
ток в ЛУ наблюдают при токсоплазмозе, инфекционном мононуклеозе, краснухе,
ВИЧ-инфекции. Иммунофенотип этих клеток соответствует активированным
В-клеткам, близким к терминальным стадиям дифференцировки (CD 19, CD20,
CD22, CD37, CD40, IgM), Экспрессия CD21, CD23, CD24 обычно отсутствует, что
отличает их от лимфоидных элементов светлых центров и зоны мантии фоллику¬
лов, Наибольшее сходство этот тип клеток имеет с лимфоцитами маргинальной
зоны селезенки, но отличается от них большим постоянством экспрессии CD20,
CD39, CD75, CD38.Общие маркеры В-лимфоцитов — CD19, CD20, CD22, CD79a.Основная функция В-лимфоцитов — реализация гуморального иммунного
ответа, в основе которого лежат активация В-клеток и их дифференцировка в
антителообразующие плазматические клетки, В процессе ответа происходит пере¬
ключение синтеза антител с IgM на IgG, а при иммунном ответе в слизистых обо¬
лочках — на IgA. Антитела нейтрализуют свободные антигены, образуя иммунньсе
комплексы, опсонизируют клетки и делают их мишенями для фагоцитов и есте¬
ственных киллеров, активируют комплемент,в результате иммунного ответа образуются Т- и В-клетки памяти, которые обе¬
спечивают ускоренное развитие реакции на повторное попадание в организм тех
же антигенов — вторичный иммунный ответ. Клетки памяти представляют собой
малые лимфоциты, обладающие способностью к рециркуляции и большой про¬
должительностью жизни, которая обусловливает длительное сохранение иммуни¬
тета к возбудителям инфекционных заболеваний и другим чужеродным агентам.
Естественные киллеры (NK-клетки) — фракция лимфоцитов, лишенных
маркеров Т- и В-клеток, Их фенотип — CD3 CD16"CD56\ Они не имеют пере¬
стройки генов Т-клеточного рецептора, экспрессируют на мембране рецептор к
комплементу (C3d), вирусу Эпштейна-Барр (CD21), Fc-рецептор. Наибольшее
содержание этих клеток отмечено в печени и селезенке, незначительное их коли¬
чество содержится в лимфатических узлах, костном мозге, легких, лимфоидных
фолликулах тонкой кишки. В периферической крови на долю NK-клеток при¬
ходится от 5 до 25% лимфоцитов, в трепанобиоптате костного мозга — 4,4%
(3,2-7,1%), Морфология этих клеток соответствует большим гранулярным лим¬
фоцитам — 12-15 мкм в диаметре, азурофильные гранулы в цитоплазме, количе¬
ство и плотность которых варьирует. Основная функция естественных киллеров —
контактный цитолиз клетки-мишени (инфицированные вирусом, опухолевые и
быстропролиферирующие клетки) с выбросом сигнальных молекул, включающих
в них апоптоз.Таким образом, благодаря своей полифункциональности клетки крови участву¬
ют во многих обменных процессах организма. Место пребывания клеток гемо-
поэза — кровь, лимфа, ткани, органы, где они выполняют транспортную функцию,
участвуют в защитных реакциях организма, репаративных, воспалительных и
других процессах. Имея ограниченную продолжительность жизни, клетки требуют
периодического обновления.
ж492 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯПостоянство клеточного состава крови обусловливает нормальные показатели
миело- и гемограммы. Несмотря на многочисленные изменения окружающей
среды, кроветворение остается стабильным, а ситуации, при которых имеются
отклонения от нормальных параметров гемограммы, служат показанием к более
глубокому гематологическому обследованию. Общий анализ крови рассматривают
как показатель состояния организма.ОСНОВНЫЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ГЕМАТОЛОГИИ
Общий анализ кровиАнализ результатов исследования крови составляет неотъемлемое звено в диа¬
гностическом процессе. При анализе гемограммы любые изменения трактуют
как патологические, что требует тщательного обследования пациента. Они могут
иметь неспецифический характер, и в этих случаях их используют для динами¬
ческого наблюдения за больным. При системных заболеваниях кроветворной
системы общий анализ крови приобретает первостепенное диагностическое зна¬
чение. Его результаты определяют дальнейшую стратегию обследования пациента
с последующим выбором схемы лечения. Анализ необходим для мониторинга
проводимой терапии.Следует учитывать влияние различных факторов на результаты гематологиче¬
ских исследований. Это такие физиологические факторы, как возраст, пол, особен¬
ности питания, физическая нагрузка, менструальный цикл, беременность, роды; к
факторам окружающей среды относят климатические условия, высоту над уровнем
моря, температуру окружающей среды, к токсическим факторам ~ курение, прием
алкоголя, наркотиков, лекарственных препаратов, профессиональные вредности.
На показатели крови оказывают влияние эмоциональное состояние пациента,
циркадные и сезонные ритмы, положение пациента в момент взятия крови.С увеличением высоты над уровнем моря повышается уровень гематокрита и
гемоглобина. Физические упражнения могут приводить к существенным измене¬
ниям количества лейкоцитов, что обусловлено гормональными сдвигами. Смена
пациентом положения тела (лежа, стоя) приводит к повыщению показателей
гемоглобина, гематокрита и количества эритроцитов и лейкоцитов. Этот эффект
обусловлен проникновением воды и фильтр)тощихся веществ из сосудистого русла
в ткани в результате повышения гидростатического давления. Выраженные диарея
и рвота могут приводить к значительной дегидратации и гемоконцентрации, и,
наоборот, после регидратации наблюдают снижение уровня гемоглобина и гема¬
токрита, что может быть ошибочно принято за кровопотерю.Для устранения или сведения к минимуму влияния этих факторов кровь для
повторных анализов необходимо брать в одних и тех же условиях.Кровь для клинического анализа берут у пациента из пальца, вены или мочки
уха, у новорожденных - из пятки.Кровь следует брать натощак (после примерно 12 ч голодания, воздержания от
приема алкоголя и курения), между 7 и 9 ч утра, при минимальной физической
активности непосредственно перед взятием (в течение 20-30 мин), в положении
пациента лежа или сидя.Взятие материала следует проводить в резиновых перчатках, соблюдая правила
асептики.Венозная кровьВенозную кровь считают лучшим материалом для клинического исследования.
Достоверность и точность гематологических исследований, проводимых из веноз¬
ной крови, во многом зависят от техники взятия крови.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 493Кровь для гематологических исследований должна поступать свободным током
непосредственно в пробирку, содержащую антикоагулянт К2ЭДТА (К3ЭДТА).
Взятие крови шприцем без антикоагулянта с последующим переливанием в про¬
бирку недопустимо из-за формирования микросгустков и гемолиза.Взятие крови вакуумными системами имеет ряд преимуществ, основными из
которых являются обеспечение высокого качества пробы и предотвращение любо¬
го контакта с кровью, а значит, обеспечение безопасности медицинского персона¬
ла и пациентов.ЭДТА (КрДТА или К3ЭДТА) - предпочтительный антикоагулянт при подсчете
форменных элементов крови с использованием автоматических гематологических
анализаторов. Использование Ка^ЭДТА не рекомендуют вследствие его плохой
растворимости. Концентрация ЭДТА во взятой крови должна бьггь постоянной и
составлять 1,5-2,2 мг/мл крови.Применение в качестве антикоагулянтов гепарина* или цитрата натрия сопро¬
вождается структурными изменениями клеток, поэтому эти антикоагулянты не
рекомендуют для использования как при автоматизированном, так и морфологи¬
ческом исследовании крови.Необходимо строго следить за количеством взятой крови, объем которой
должен соответствовать указанной отметке на пробирке. Несоблюдение этого
условия, а также недостаточно тщательное перемешивание крови приводит к
изменению конечной концентрации антикоагулянта, что может повлечь появле¬
ние микросгустков, неточное определение концентрации клеточных элементов,
искажение морфологической структуры клеток.Капиллярная кровьДля гематологических исследований капиллярную кровь рекомендуют брать
в следующих случаях: при ожогах, занимающих большую площадь поверхности
тела пациента; мелких или труднодоступных венах у пациента; выраженном ожи¬
рении; установленной склонности к венозному тромбозу; у новорожденных; при
необходимости ежедневного мониторинга за показателями крови, например, у
онкологических больных на фоне химиотерапии.Следует отметить, что при взятии капиллярной крови возможен ряд особен¬
ностей, которые бывает трудно стандартизировать: физиологические — холодные,
цианотичные пальцы, методические — малый объем исследуемой крови и в связи
с этим необходимость разведения образца для анализа на гематологическом ана¬
лизаторе и др.Нарушения методики взятия крови приводят к значительным разбросам в полу¬
чаемых результатах и, как следствие, к необходимости повторных исследований
для уточнения результата.Доставка, хранение и подготовка проб к исследованиюДля обеспечения качественного результата исследований необходимо четко кон¬
тролировать время и условия хранения проб до выполнения анализа. Оптимальное
время исследования крови — в интервале от 1 до 4 ч после взятия. В промежутке от
5 до 30 мин происходят временная адаптация тромбоцитов к антикоагулянту и их
агрегация, что может привести к ложному снижению их количества в пробе крови.
Нежелательно исследовать кровь позднее 8 ч после взятия вследствие изменения
некоторых характеристик клеток: снижается объем лейкоцитов, повышается
объем эритроцитов, что в конечном итоге приводит к ошибочным результатам
измерения и их неправильной интерпретации. Только концентрация гемоглобина
и количество тромбоцитов стабильны в течение CJTOK хранения крови.Кровь нельзя замораживать. Капиллярную кровь с ЭДТА следует хранить при
комнатной температуре и анализировать в течение 4 ч после взятия, более дли¬
494 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯтельное хранение капиллярной крови не рекомендуют из-за малого ее объема.
При необходимости проведения отсроченного анализа (транспортировка на даль¬
ние расстояния, технические неполадки прибора и т.д,) пробы венозной крови
хранят в холодильнике при температуре 4-8 X и исследуют в течение 24 ч. При
этом следует учитывать, что происходит набухание клеток и изменение параме¬
тров, связанных с их объемом. У практически здоровых людей эти изменения не
носят критического характера и не сказываются на количественных параметрах,
но при наличии патологических клеток последние могут изменяться или даже раз¬
рушаться в течение нескольких часов с момента взятия крови.Непосредственно перед исследованием кровь необходимо тщательно переме¬
шать в течение нескольких минут для разведения антикоагулянта и равномерного
распределения форменных элементов в плазме. Длительное постоянное переме¬
шивание образцов до момента их исследований не рекомендуют из-за возможного
травмирования и распада патологических клеток.Исследование крови на приборе проводят при комнатной температуре. Кровь,
хранившуюся в холодильнике, необходимо вначале согреть до комнатной темпе¬
ратуры, так как при низкой температуре увеличивается вязкость и форменные эле¬
менты имеют тенденцию к склеиванию, что, в свою очередь, приводит к нарушению
перемешивания и неполному лизису. Исследование холодной крови может быть
причиной появления «флагов*> из-за компрессии лейкоцитарной гистограммы.Мазки крови рекомендуют делать не позднее 1-2 ч после взятия крови.При выполнении гематологических исследований на значительном удалении от
места взятия крови неизбежно возникают проблемы, связанные с неблагоприят¬
ными условиями транспортировки. Воздействие механических факторов (тряски,
вибрации, перемешивания и т.д.), температурного режима, вероятность пролива
и загрязнения проб могут оказывать влияние на качество анализов. Для устране¬
ния этих причин при перевозках пробирок с кровью рекомендуют использовать
герметично закрытые пластиковые пробирки и специальные транспортные изо¬
термические контейнеры.Автоматизированное исследование клеток кровиАвтоматические счетчики крови позволяют оценить размеры, структурные,
цитохимические и другие характеристики клеток, анализировать большие попу¬
ляции клеток в одном образце, они имеют несколько различных каналов подсчета
клеточных популяций и концентрации гемоглобина. Гематологические анализаторы
позволяют не только автоматизировать процесс подсчета клеток крови, но и полу¬
чать дополнительные информативные характеристики клеток крови (табл. 7-1),В гематологических анализаторах разных производителей нормальные показа¬
тели крови, установленные на приборе, могут существенно варьировать в зависи¬
мости от норм, используемых в той или иной стране.Ниже приведены параметры, наиболее часто используемые в гематологических
анализаторах.Эритроцитарные параметрыRBC {RedBlood Cells) - количество эритроцитов в крови (хЮ^ул). Коэффициент
вариации для данного параметра при подсчете на приборе составляет 1-2%, а при
ручном подсчете в камере — до 5%.Возможные ошибки измерения при автоматическом счете RBCЛожное завышение:• гигантские тромбоциты (объемом более 30 фл);• криоглобулинемия;• высокий лейкоцитоз (более 50x1 оул).
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ495Таблица 7-1. Нормальные показатели периферической крови у взрослыхПоказательНормальные значенияГемоглобин, г/лМужчины — 130-160
Женщины —120-140Эритроциты (RBC), х10'7лМужчины — 4-5
Женщины — 3,9-4,7Гематокрит, %Мужчины — 40-48
Женщины — 36-42Средний объем эритроцита (MCV), фл. мкм^80-100Среднее содержание гемоглобина в эритроците (МСН), пг27-31Средняя концентрация гемоглобина в эритроците (МСНС), г/дл30-38Ширина распределения эритроцитов по объему (RDW-CV), %11,6-14.5Регикулоциты, %о {или %)2-12(0,2-1,2)Лейкоциты, х10®/л4-9Нейтрофилы, % (хЮУл):• палочкоядерные;• сегментоядерные1-6 (0.04-0.3)
47-72 (2-5,5)Эозинофилы {хЮ^л)0,5-5 (0.02-0,3)Базофилы (хЮ^/л)0-1 (0-0,065)Лимфоциты (хЮ^/л)19-37 (1,2-3)Моноциты3-11 (0,09-0,6)Плазматические клетки-Тромбоциты, х10®/л180-320Средний объем тромбоцита (MPV). фл7,4-10,4Ширина распределения тромбоцитов по объему (PDW), %10-20Тромбокрит (РСТ), %0,15-0,4СОЭ, мм/чМужчины -2-10.
Женщины —2-15Примечание. Нормы основаны на приказах М3 СССР № 960 от 1974 г. и № 1175 от 1979 г.Ложное занижение:• агглютинация эритроцитов;• выраженный микроцитоз эритроцитов;• гемолизированные образцы крови.Присутствие криоглобулинов может вызывать увеличение показателей WBQ
RBC или PLT и концентрации гемоглобина. В таких случаях следует подогреть
образец крови до температуры +37 ‘’С в течение 30 мин и немедленно провести
измерение. Криоглобулинемию можно наблюдать у больных с миеломой, макро-
глобулинемией Вальденстрема, злокачественными новообразованиями, лейкозом,
лимфопролиферативными и аутоиммунными заболеваниями, вирусным гепати¬
том, сахарным диабетом.Нормобласты (NRBC). В большинстве гематологических анализаторов под¬
считываются все ядросодержащие клетки, поэтому при наличии нормобластов в
периферической крови они определяются как лейкоциты и могут быть причиной
увеличения количества лейкоцитов и лимфоцитов, поскольку нормобласты имеют
размер малого лимфоцита. В этих случаях необходимы строгий визуальный кон¬
троль и коррекция истинного количества лейкоцитов.пример, общее количество лейкоцитов при подсчете в анализаторе — 45х10ул.
В лейкоцитарной формуле на 100 лейкоцитов приходится 50 нормобластов.
Формула расчета истинного количества лейкоцитов в крови:X = (100 X 45 X юул) /150 = 30 х Ю’/л,
496 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯгде X — истинный лейкоцитоз крови; 100 клеток — лейкоциты; 45х10Ул — коли-
чество клеток в 1 мкл, пслз^енное при подсчете в камере или на анализаторе; 150
клеток — общее количество лейкоцитов и нормобластов, полученное при подсчете
лейкоцитарной формулы.Таким образом, истинное число количество в крови составляет ЗОхЮ^/л.
Нормобласты появляются в периферической крови при онкогематологических
заболеваниях, анемиях (гемолитических, и фолиеводефицитных), тяжелых
^ септических состояниях и интоксикациях. Появление нормоб ластов в послеопера¬
ционном периоде — плохой прогностический признак, предсказывающий возмож¬
ный летальный исход. Обнаружение нормобластов в крови можно расценивать как
маркер гипоксии и воспаления.HGB {hemoglobin). Концентрацию гемоглобина (г/дл или г/л) в большинстве
гематологических анализаторов определяют фотометрически гемиглобинцианид-
ным или гемихромным методами. Коэффициент вариации на анализаторах не пре¬
вышает 2%, при ручном измерении допустим коэффициент вариации до 5%.
Возможные ошибки при измерении содержания гемоглобина
Ложное завышение:• высокий лейкоцитоз (более 50х10Ул);• присутствие нестабильных гемоглобинов (HbS, НЬС);• гиперлипидемия, гипербилирубинемия;• криоглобулинемия, парапротеинемия;• гемолиз {in vivo);• резистентные к лизису эритроциты.Ложное занижение;• образование микросгустков в пробе крови.Основные причины завышения концентрации гемоглобина обусловлены мутно¬
стью образца крови, которая может быть следствием гиперлипидемии и гиперби¬
лиру бинемии, приема жирной пищи, присутствия нелизированных эритроцитов,
гиперлейкоцитоза. Для снижения вероятности ошибки измерения рекомендуют
обработать кровь лизатом, отцентрифугировать образец и провести измерение
гемоглобина в надосадочной жидкости фотометрическим методом,В зависимости от концентрации гемоглобина вьщеляют три степени тяжести
анемии: легкую — концентрация гемоглобина более 90 г/л, среднюю — 70-90 г/л,
тяжелую — менее 70 г/л.Повышение концентрации гемоглобина наблюдают при реактивных и опухоле¬
вых эритроцитозах, обезвоживании.Снижение концентрации гемоглобина происходит при анемиях, гипергидрата¬
ции.нет {hematocrit) — гематокрит. При измерении на гематологических анализа¬
торах показатель отражает сумму прямо измеренных объемов эритроцитов в еди¬
нице объема крови. Именно поэтому проблемы «остаточной» плазмы в гематоло¬
гических анализаторах не существует, в отличие от исследования этого показателя
на гематокритной центрифуге, где после центрифугирования между эритроцитами
остается плазма. Коэффициент вариации для автоматического метода — менее 1%,
при определении показателя методом центрифугирования — 1-2%.Возможные ошибки измерения нет
Ложное завышение:• гигантские тромбоциты (объемом более 30 фл);• криоглобулинемия;• высокий лейкоцитоз (более 50х10‘Ул);• гипергликемия (более 600 мг/дл);• диабетический кетоацидоз.Ложное занижение:
• агглютинация эритроцитов;• выраженный микроцитоз эритроцитов (менее 36 фл).ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 407 ШШ&.шшПовышение гематокрита наблюдают при реактивных и опухолевых эритро-
цитозах, уменьшении объема циркулирующей плазмы (ожоговой болезни, деги- Щ|
дратации). Снижение гематокрита отмечают при анемиях, беременности (II три-
местр), гипергидратации.При гипергликемии и диабетическом кетоацидозе плазма крови гиперосмоляр-
на. При разведении крови in vitro изотоническим раствором натрия хлорида про¬
исходит быстрое набухание эритроцитов, что и вызывает завышение гематокрита.В этих случаях его определение на гематокритной центрифуге является более
точным.MCV (Mean Corpuscular Volume) — средний объем эритроцита, выражается в
кубических микрометрах (мкм^) или в фемтолитрах (1 фл = 1мкм^). В большинстве
гематологических анализаторов MCV определяется благодаря прямой зависимости
амплитуды электрического импульса от объема клетки. Вычисляется MCV делением
суммы клеточных объемов на количество эритроцитов. MCV — средний показатель
объема всей популяции эритроцитов, содержащихся в объеме 36-360 фл. Именно
поэтому MCV может иметь нормальное значение при наличии у пациента одно¬
временно выраженного макро- и микроцитоза, большом количестве аномальных
эритроцитов (например, при серповидно-клеточной анемии, выраженном пойки-
лоцитозе). в этом случае особую диагностическую важность приобретают анализ
эритроцитарной гистограммы и морфология клеток в мазках крови. При агглюти¬
нации эритроцитов прибор воспринимает их как одн)^ большзто клетку, если размер
их меньше верхнего порога эритроцитарного канала, что приводит к увеличению
показателя MCV. Сохранение крови in vitro и измерение таких проб при температуре
37 “С способствуют получению правильных результатов.Возможные ошибки измерения MCVЛожное завышение:• присутствие ХОЛОДОВЫХ агглютининов;• диабетический кетоацидоз, гиперосмолярность плазмы;• гипернатриемия;• высокий лейкоцитоз (более 50х10Ул);• длительное хранение крови (более 8 ч);• ретикулоцитоз;• макротромбоцитоз.Ложное занижение:• повышенное содержание фрагментов эритроцитов в крови вследствие меха¬
нического гемолиза;• коагулопатия потребления.MCV — важный показатель в дифференциальной диагностике анемий. На осно¬
вании измерения MCV анемии разделяют на нормоцитарные (MCV — 80-100 фл),
микроцитарные {MCV — менее 80 фл) и макроцитарные (MCV — более 100 фл).MCV меняется в течение жизни: у новорожденных он равен приблизительно
128 фл, в первую неделю жизни снижается до 100-112 фл, к году составляет
77-79 фл, в возрасте 3-4 лет стабилизируется, нижняя граница нормы — 80 фл.мен {Mean Corpuscular Hemoglobin) — среднее содержание гемоглобина в эри¬
троците, измеряется в пикограммах (пг). Его рассчитывают по формуле:мен = гемоглобин (г/л) / количество эритроцитов (х10^2^.мен характеризует среднее содержание гемоглобина в отдельном зрі-ггроците в
абсолютных единицах. В норме MCE равен 27-31 пг. МСН — более объективный
параметр, чем устаревший цветовой показатель, который не отражает синтез гемо¬
глобина и его содержание в эритроците.
498 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯПараметр МСНявляется расчетным, поэтому к ложноповышенным результатам
приводят все факторы, влияющие на увеличение значений гемоглобина и сниже¬
ние количества эритроцитов.Изменения МСН лежат в основе разделения анемий на нормохромные (МСН —
27-31 пг), гипохромные (МСН — менее 27 пг) и гиперхромные {МСН — более
31 пг). Снижение МСН наблюдают при анемиях, обусловленных нарушением
синтеза гемоглобина (железодефицитной анемии, порфирии), повышение — при
макроцитарных и особенно мегалобластных анемиях.мене {Mean Corpuscular Hemoglobin Concentration) — средняя концентрация
гемоглобина в эритроците (г/дл). Показатель вычисляют по формуле:мене = [гемоглобин (г/л) / гематокрит (%)j х 100.мене показывает концентрацию гемоглобина в одном эритроците, т.е. отража¬
ет насыщение эритроцита гемоглобином. МСНС не зависит от клеточного объема
и является чувствительным показателем нарушения процессов гемоглобинобра-
зования.В норме МСНС равен 30-38 г/дл.Возможные ошибки измерения. Поскольку параметр МСНС является рас¬
четным, то к ложнозавышенным результатам приводят все факторы, влияющие на
завышение значений гемоглобина и занижение гематокрита. Ложнозаниженные
результаты МСНС получаются вследствие завышенного определения MCVи зани¬
женного — концентрации гемоглобина.Снижение значения МСНС наблюдают при заболеваниях, сопровождающихся
нарушением синтеза гемоглобина.Повышение МСЯС более 38 г/дл в клинической практике встречается редко
(врожденный сфероцитоз, холодовые агглютинины). Чаще всего увеличение
МСНС свидетельствует об ошибках, допущенных при измерении пробы (погреш¬
ности определения уровня гемоглобина или MCV). Именно поэтому данный пара¬
метр часто используют в качестве индикатора ошибок, допущенных на аналитиче¬
ском или преаналитическом этапе исследования.RDW {Red cell Distribution Width) — показатель гетерогенности эритроцитов по
объему, характеризует степень анизоцитоза. В большинстве современных гемато¬
логических анализаторов этот показатель вычисляется на основании гистограммы
распределения эритроцрггов как коэффициент вариации объема эритроцитов:RDW (%) = (SD / MCV) X 100,где SD — стандартное среднеквадратичное отклонение объема эритроцита от
среднего значения.На этот показатель влияет MCV, поэтому как при микроцитозе, так и при
макроцитозе отмечается тенденция к увеличению RBW.Показатель RDW характеризует колебания объема клеток внутри популяции и не
связан с абсолютной величиной объема эритроцитов. Именно поэтому при наличии
в крови популяции эритроцитов с измененным, но достаточно однородным размером
(например, микроцитов), значения RDWмогут быть в пределах нормы (11,5-14,5%).
При выраженном анизоцитозе эритроцитов показатель MCV, характеризующий сред¬
ний объем всей клеточной популяции, нормален, а RDW будет повышенным. Таким
образом, сочетанное использование двух параметров — WW и MCV — позволяет
точнее характеризовать изменения в периферическом звене эритрона.Гистограмма — графическое отображение распределения определенного вида
клеток по количеству и объему. Для построения гистограмм в гематологических
анализаторах подсчитываются миллионы клеток в одном образце, сортируются
импульсы по амплитуде и распределяются частицы объемом от 24 до 360 фл по 256
каналам, каждый из которых соответствует объему частиц.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 499Эритроцитарная гистограммаВ норме регистрируемая кривая подчиняется закону гауссова распределения,
имеет симметричную (куполообразную) форму. По горизонтали откладывается
объем измеряемой клетки в фемтолитрах, вертикальная ось на графике фиксиру¬
ется как процентная шкала.При появлении патологических эритроцитов или их нескольких популяций
форма гистограммы меняется. Аномальное распределение эритроцитов может
сопровождаться следующими изменениями гистограммы.Кривая распределения RBC стартует не на базовой линии. В этом случае тромбо¬
циты и эритроциты не могут быть четко разделены. Возможные причины:• микроэритроциты — в этом случае значения MCV понижены, RDW — в
пределах нормы или повышены;• гигантские тромбоциты — в этом случае величины среднего объема тромбо¬
цитов (MPV) и ширина распределения тромбоцитов по объему (PDW) повы¬
шены;• агрегация тромбоцитов — в этом случае количество тромбоцитов понижено.
Ошибки, получаемые в подобных ситуациях, могут существенно исказитьрезультат исследования тромбоцитов и обычно незначительно влияют на значе¬
ния эритроцитов, так как тромбоцитов намного меньше, чем эритроцитов.Сдвиг эритроцитарной гистограммы вправо. Возможные причины:• холодовая агглютинация эритроцитов (в этом случае показатель МСНС ~ не
менее 40 г/дл);• эритробласты (в этом случае значения MCV повышеньг).Для исключения ХОЛОДОВОЙ агглютинации образец необходимо подогреть до
температуры 37 °С и снова измерить.Эритроцитарная гистограмма имеет несколько пиков. Возможные причины:• ответ на терапию препаратами железа у больных с железодефицитной ане¬
мией;• гемотрансфузии — эритроциты донора и пациента имеют разные размеры;• гиперлейкоцитоз более бООхЮУл.В последнем случае возможно получение неправильных результатов подсчета
количества эритроцитов, результат необходимо уточнить,Ретикулоцитарные параметрыРетикулоциты представляют собой незрелые эритроциты, содержащие остатки
РНК и образующиеся после потери нормобластами ядер. Исследование ретикуло-
цитов используют в целях:• оценки активности эритропоэза при состояниях, сопровождающихся гемоли¬
зом или кровопотерей;• детекции нарушения регенераторной способности костного мозга при дефи¬
ците железа, витаминов ®б’ Филатов, меди и мониторинга соответствую¬
щей терапии;• оценки состояния эритропоэза на фоне лечения эритропоэтином;• оценки способности костного мозга к регенерации после цитотоксической
терапии и трансплантации костного мозга;• оценки восстановления синтеза ЭПО после трансплантации почки;• допингового контроля у спортсменов (прием ЭПО).В связи с появлением высокотехнологичных гематологических анализато¬
ров стало возможным получать информативные ретикулоцитарные параметры.
Классические параметры ретикулоцитов:• RET% — относительное количество ретикулоцитов (%);• RET# — абсолютное количество ретикулоцитов (хЮУл).
ЩШ'іШ:500ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯВозможные ошибки измерения покателей ретикулоцитовЛожное завышение:• включения в эритроцитах (тельца Жолли, малярийные паразиты);• высокий лейкоцитоз;• аномальные формы гемоглобина;• гипертромбоцитоз;• гигантские тромбоциты.Ретикулоцитоз с резким увеличением фракции незрелых ретикулоцитов на
фоне активного эритропоэза отражает повышенную регенераторную способность
костного мозга. Сохраняющийся ретикулоцитоз может свидетельствовать о про¬
должающемся кровотечении. Ретикулоцитопения — индикатор угнетения эритро¬
поэза. Нормализация абсолютного количества ретикулоцитов {RET) — показатель
восстановления пролиферативной активности эритрокариоцитов.Объемные параметры ретикулоцитовMCVr (Mean Cell Volume reticuloqftes) — средний объем ретикулоцитов (фл).MVSR (Mean Volume Sphered Reticulocyte) — средний объем сферических клеток,
включающих эритроциты и ретикулоциты (фл).Малым объемом ретикулоцитов объясняется появление микроцитов в перифе¬
рической крови.Показатели объема ретикулоцитов используют в диагностике железодефицит¬
ной анемии, мониторинге ответа на терапию железосодержащими препаратами,
фолиевой кислотой, витаминомПовышение MVSR у спортсменов указывает на злоупотребление препаратами,
стимулирующими эритропоэз.Параметры, характеризующие степень зрелости ретикулоцитовLFR% — популяция малых зрелых RET (87-99%).MFR% — популяция средних RET (2-12%).HFR% — популяция больших незрелых RET (1-2%).Сочетание показателей MFR+HFR определяют как фракцию незрелых ретику¬
лоцитов — IRF (Immature Reticulocyte Fraction), составляющую 2-14%. Она может
служить индикатором активности эритропоэза. Увеличение свидетельствует об
ускоренном выбросе незрелых клеток из костного мозга, показатель повышается
значительно раньше (как правило, на 2 сут), чем процент ретикулоцитов, и может
служить наиболее чувствительным маркером в мониторинге состояния эритро-
поэтической активности костного мозга и эффективности лечения витамином
фолиевой кислотой, препаратами железа и ЭПО.Если у больного одновременно с низким гематокритом в периферической крови
присутствуют незрелые ретикулоциты {MFR и HFR), рассчитывают индекс продук¬
ции ретикулоцитов RP1 (Reticulocyte Production Index):RPI = [REI (%) X нет] / (0,45 х дни циркуляции RET в крови).Величина RPI широко варьирует в зависимости от степени тяжести анемии, про¬
дукции ЭПО и других факторов. Значение данного индекса менее 2 указывает на
низкую пролиферативную активность эритрокариоцитов.Тромбоцитарные параметрыPLT (platelet) — количество тромбоцитов (хЮУл). Для большинства современ¬
ных гематологических анализаторов коэффициент вариации этого показателя не
превышает 2-4%. В отличие от ручного подсчета тромбоцитов, где проводится
предварительный лизис эритроцитов, автоматические счетчики крови анализи¬
руют тромбоциты и эритроциты без предварительной обработки. Это создает
проблему дифференцирования больших форм тромбоцитов (макротромбоцитов)
и сравнимых с ними по объему эритроцитов (микроцитов), их фрагментов (шизо-
цитов), а также фрагментов цитоплазмы лейкоцитов (клеточный дебрис).
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 5Q1Возможные ошибки при подсчете количества тромбоцитовЛожное завышение;• микроцитоз;• криоглобулинемия;• гемолизированные образцы крови;• фрагменты эритроцитов и лейкоцитов.Ложное занижение:• агрегация или агглютинация тромбоцитов;• тромбоцитарный сателлизм (прилипание тромбоцитов к лейкоцитам);• гигантские тромбоциты;• агглютинация эритроцитов;• тромбообразование;• взятие крови с гепарином*;• гипертромбоцитоз (более ЮООхЮул).У некоторых пациентов может происходить небольшая спонтанная агрегация
тромбоцитов или, реже, так называемая ЭДТА-зависимая псевдотромбоцитопения
(иммунного характера), причем эти явления прогрессируют по мере увеличения
времени, прошедшего после взятия крови, у таких пациентов точный подсчет
клеток может быть осуществлен при взятии крови с цитратом натрия в качестве
антикоагулянта.MPV {Mean Platelet Volume) — средний объем тромбоцитов, выражается в
фемтолитрах (фл) или мкм^ В норме этот показатель варьирует от 7,4 до 10,4 фл
и имеет тенденцию к увеличению с возрастом: с 8,6-8,9 фл у детей 1-5 лет до9,5-10,6 фл у людей старше 70 лет. «Молодые» кровяные пластинки имеют боль¬
ший объем, поэтому при ускорении тромбоцитопоэза средний объем тромбоцитов
возрастает. В течение первых двух часов после взятия крови с ЭДТА происходит
набухание тромбоцитов с изменением их объема и соответственно увеличением
MPV.Увеличение MPV наблюдают при идиопатической тромбоцитопенической пур¬
пуре, гипертиреозе, атеросклерозе, сахарном диабете, у курильщиков и страдаю¬
щих алкоголизмом. Транзиторная макротромбоцитемия описана у рабочих, кон¬
тактирующих с асфальтовыми испарениями, работающих с ракетным топливом.
Крупные тромбоциты с аномальной морфологией появляются при миелопроли-
феративных заболеваниях.Уменьшение этого показателя отмечено после спленэктомии и при синдроме
Вискотта-Олдрича.PDW {Platelet Distribution Width) — ширина распределения тромбоцитов по
объему, измеряется в процентах. Этот параметр определяют на основании гисто¬
граммы распределения тромбоцитов. PDW количественно отражает гетероген¬
ность популяций таких клеток по размерам (степень анизоцитоза тромбоцитов).
В норме этот показатель составляет 10-20%.PDW изменяется при миелопролиферативных заболеваниях. Увеличение пока¬
зателя может быть признаком присутствия агрегатов тромбоцитов, микроэритро¬
цитов, фрагментов эритроцитов.РСТ {Platelet Crit) — тромбокрит, измеряется в процентах, является параме¬
тром, отражающим долю объема цельной крови, занимаемую тромбоцитами.
В норме тромбокрит составляет 0,15-0,40%,Тромбоцитарная гистограммаБ норме для тромбоцитарной кривой характерны унимодальность и асимме¬
тричность. Гистограмма должна начинаться с базовой линии в области значений
менее 2 фл и заканчиваться в зоне 20-30 фл. Количество тромбоцитов с объемом
более 20 фл невелико. Присутствие в пробе патологических тромбоцитов (макро-
или микроцитов), шизоцитов, микроэритроцитов, фрагментов лейкоцитов меняет
502 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯформу тромбоцитарной гистограммы, что требует определенной корректировки
получаемых результатов. Если тромбоцитарная гистограмма имеет несколько
пиков, возможными причинами этого могут быть анизоцитоз тромбоцитов, вос¬
становление тромбоцитарного звена после химиотерапии, агрегация тромбоцитов
(часто наблюдается зигзагообразная кривая).Анизоцитоз тромбоцитов не влияет на результаты их подсчета. Множественные
пики на тромбоцитарной гистограмме можно наблюдать при агрегации тромбоци¬
тов, при этом результат их подсчета может быть ложнозаниженным. Для исклю¬
чения ошибочного результата рекомендуют повторить исследование с цитратом
натрия, который предотвращает агрегацию тромбоцитов в случае несовместимо¬
сти образца с ЭДТА.Лейкоцитарные параметрыWBC {White Blood Cells) — количество лейкоцитов в крови (хЮул). Измерение
количества лейкоцитов проводят после полного лизиса эритроцитов специ¬
альным реагентом. Все частицы объемом более 35 фл считают как лейкоциты.
Тромбоциты, объем которых меньше порогового значения 35 фл, исключаются из
подсчета. Коэффициент вариации при автоматическом определении этого показа¬
теля составляет 1-3%, в то время как при ручном подсчете — 6,5-15% в зависимо¬
сти от количества лейкоцитов.При наличии резистентных к лизису эритроцитов эти клетки определяются как
лейкоциты и вызывают повышение их количества. Следует обратить внимание на
изменение формы С-гистограммы.Возможные ошибки при подсчете лейкоцитовЛожное завышение;• нормобласты в периферической крови;• криоглобулинемия, агрегаты тромбоцитов;• резистентные к лизису эритроциты;• малярия (эритроциты с гаметоцитами распознаются как лейкоциты).Ложное занижение:• хранение крови более 24 ч, ее грубое перемешивание.Подсчет лейкоцитарной формулыВ гематологических анализаторах определяется от 6 до 10 показателей лейко¬
цитарной формулы с учетом относительного и абсолютного количества клеток.
В большинстве гематологических анализаторов («3 Diff») все лейкоциты разделя¬
ются на три популяции и определяется относительное и абсолютное содержание
лимфоцитов, нейтрофилов и так называемых средних клеток (моноцитов, базофи-
лов и эозинофилов). Анализаторы с неполным дифференцированным подсчетом
лейкоцитов рекомендуют использовать для динамического наблюдения за состоя¬
нием крови пациентов.Гематологические анализаторы «5 Diff» способны осуществлять дифференци¬
рованный подсчет лейкоцитов по пяти основным популяциям с использованием
различных принципов дифференцирования клеток: нейтрофилы, эозинофилы,
базофилы, моноциты и лимфоциты. Некоторые высокотехнологичные анали¬
заторы способны оценивать наличие незрелых гранулоцитов, анализировать
ретикулоциты и их субпопуляции, проводить оценку стволовых гемопоэтических
клеток и субпопуляций лимфоцитов. Использование таких приборов позволяет
повысить точность дифференциального подсчета лейкоцитов, провести скрининг
нормы и патологии, динамический контроль за лейкоцитарной формулой и резко
сократить ручной подсчет лейкоцитарной формулы, оставляя примерно 15-20%
образцов крови для световой микроскопии, что связано с неспособностью гемато¬
логических анализаторов идентифицировать незрелые гранулоциты и бластные
клетки.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 5Q3Исследование пунктата костного мозгаИсследование костномозговых элементов (миелограмма) отражает клеточность
костного мозга, процессы пролиферации и дифференцировки отдельных ростков
кроветворения, его клеточный состав и функциональное состояние. Изучение
пунктата костного мозга необходимо при диагностике различных гемобластозов,
анемий, лизосомных болезней накопления, метастазов рака и других заболеваний.
Для исследования костного мозга проводят пункцию грудины или подвздошной
кости. Для проведения цитологического и иммунофенотипического исследования
достаточно 1 мл пунктата. При аспирации большего объема происходит разведе¬
ние костного мозга периферической кровью, что снижает диагностическую цен¬
ность этого исследования.Подготовка пунктата костного мозга к исследованиюПриготовление препаратов костного мозга можно проводить в отделениях или
гематологической лаборатории двумя способами.Первый способ. Для подсчета клеточности костного мозга 20 мкл пунктата
помещают в одноразовую кювету или пробирку с гемолизирующим раствором
(0,4 мл 3,5% раствора уксусной кислоты). Полученную смесь тщательно переме¬
шивают. Пробирки маркируют.Из другой части полученного пунктата быстро готовят мазки, предваритель¬
но освобождаясь от сопутствующей крови. Для этого стекло с костномозговой
взвесью клеток наклоняют, кровь стекает. Технология приготовления мазков из
пунктата костного мозга аналогична приготовлению мазков из периферической
крови. Для того чтобы правильно оценить цитологическую картину костномоз¬
гового кроветворения, из пунктата костного мозга должно быть приготовлено
не менее 10 препаратов. Сразу после взятия высушенные мазки и пробирки (с
разведенным пунктатом костного мозга) направляют в гематологическую лабора¬
торию вместе с бланком-направлением, в котором должны быть указаны данные
обследуемого: ФИО, возраст, номер истории болезни или амбулаторной карты,
отделение, диагноз, проведенная терапия.Второй способ. Врач, выполняющий пункцию, помещает весь полученный
пунктат (не более 1 мл) в пробирку, содержащую 1-1,5 мг К^ЭДТА, тщательно
все перемешивает, маркирует и незамедлительно направляет материал в лабора¬
торию вместе с бланком-направлением. Последующую работу по приготовлению
препаратов из п)'^нктата костного мозга выполняют в лаборатории сразу же после
получения материала.Из полученных или приготовленных непосредственно в лаборатории 10 мазков
для цитологического исследования отбирают 5, остальные 5 мазков предназначены
для цитохимического исследования клеток костного мозга. Технология фиксации и
окрашивания мазков пунктата костного мозга аналогична таковой для окраски маз¬
ков периферической крови, ее выполняют по Нохту и по Паппенгейму.Микроскопическое исследование костного мозгаХарактеристика костномозгового кроветворения включает подсчет клеточности
костного мозга, процентного состава миелокариоцитов, индексов миелограммы,
описание миелограммы и морфологических особенностей клеточных элементов
гемопоэза.Миелограмма — процентное соотношение кроветворных клеток костного
мозга (миелокариоцитов). В миелограмме отмечают наличие качественных и
количественных особенностей отдельных ростков кроветворения и описывают
морфологические признаки патологически измененных клеток (размер клеток,
форму клеток и ядер, соотношение ядра и цитоплазмы, характер хроматина, цвет
и зернистость цитоплазмы и т.п.).
504ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯПо результатам подсчета клеточного состава и соотношения клеток костного
мозга и их морфологических особенностей формулируют заключение, которое
носит описательный, предположительный или окончательный характер (послед¬
нее возможно при обнаружении в пунктате характерной картины, а также при
наличии необходимой клинической информации о пациенте). Заключение реги¬
стрируют на бумажных и электронных носителях, которые хранят в лаборатории в
течение 20 лет. Бланки с результатами цитологического исследования вклеивают в
историю болезни, при использовании компьютерной техники заключения вводят
в электронную историю болезни. Окрашенные мазки костного мозга архивируют
и хранят в течение 20 лет. Выдают препараты из архива только по письменно¬
му запросу лечащего врача или другого ответственного сотрудника лечебно¬
профилактического учреждения.Дополнительную информацию для оценки костномозгового кроветворения
полз^чают при расчете индексов лейкоэритробластического соотношения (Л/9),
созревания нейтрофилов (ИСН), созревания эритрокариоцитов (ИСЭ), парциаль¬
ной эритронормобластограммы.Лейкоэритробластическое соотношениеИндекс Л/Э определяет соотношение клеток белого ростка (гранулоцитарного,
моноцитарного и лимфоидного) и ядросодержащих клеток эритроидного ряда.
В норме соотношение составляет 2.1-4,5. Повышение индекса при нормальной
или повышенной клеточности костного мозга расценивают как гиперплазию кле¬
ток белого ростка (лейкопоэза), при пониженной — как сужение эритроидного
ростка или признак значительной примеси крови.Снижение индекса при высокой клеточности костного мозга — признак гипер¬
плазии клеток красного ряда; при пониженной клеточности костного мозга — при¬
знак угнетения пролиферации клеток белого ростка. Изменения индекса Л/Э при
различных заболеваниях представлены в табл. 7-2.Таблица 7-2. Изменения лейкоэритробластического индексаИзменение
индекса Л/ЭКлеточностъ
костного мозгаХарактер изменения
гемопоэзаЗаболеванияПовышенНормальная или
высокаяГиперплазия белого
росткаСепсис, хронический миелопейкоз, хрониче¬
ский лимфолейкозНизкаяРедукция красного
росткаАпластическая анемия, парциальная красно-
клеточная аплазияПониженНормальная или
высокаяГиперплазия красного
росткаГемолитические анемии, железодефицитная
анемия, мегалобластные анемииНизкаяРедукция белого росткаАгранулоцитозПримесь кровиРазведение костного мозга перифериче¬
ской кровьюИндекс созревания нейтрофиловИндекс отражает соотношение незрелых и зрелых нейтрофилов костного мозга,
в норме равен 0,5-0,9. Рассчитывают по формуле:ИСН = (ПроМц + Мц + МетаМц) / (п/я + с/я),где ПроМц — промиелоциты; Мц — миелоциггы; МетаМц — метамиелоциты; п/я —
палочкоядерные нейтрофилы; с/я — сегментоядерные нейтрофилы.При нормальной или высокой клеточности костного мозга повышение ИСН
свидетельствует о задержке созревания нейтрофилов, при сниженной — о повы¬
шенной элиминации зрелых нейтрофилов из костного мозга.Снижение ИСН при повышенной клеточности костного мозга указывает на
задержку выхода зрелых нейтрофилов; при бедном костном мозге — на разведение
его периферической кровью.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 5Q5Для разведения костного мозга периферической кровью в совокупности харак¬
терны следующие признаки:• низкая клеточность костного мозга;• резкое увеличение лейкоэритробластического соотношения;• снижение индекса созревания нейтрофилов;• отсутствие мегакариоцитов (при нормальном количестве тромбоцитов в
периферической крови);• близость процентного содержания сегментоядерных нейтрофилов и лимфо¬
цитов к их количеству в крови пациента.При высокой степени разведения пунктата периферической кровью невозмож¬
но адекватно оценить костномозговое кроветворение больного.Индекс созревания эритрокариоцитовИСЭ показывает соотношение гемоглобинизированных эритрокариоцитов ко
всем клеткам эритроидного ряда. Вычисляют по формуле:ИСЭ = (полихроматофильные нормобласты + оксифильные нормобласты) /
общее количество эритрокариоцитов.Нормальные значения — 0,8-0,9,Снижение ИСЭ отражает задержку гемоглобинизации (гипохромные, гемоли¬
тические и мегалсбластные анемии).Повышение ИСЭ свидетельствует об ускорении гемоглобинизации. ИСЭ не
всегда в полной мере отражает изменения, происходящие в красном ростке.
Именно поэтому при усиленной пролиферации эритроидных элементов необхо¬
димо оценивать парциальную эритронормобластограмму, которая выявляет соот¬
ношение базофильных (эритроб ласты + базофильные эритробласты), полихрома-
тофильных и оксифильных форм эритрокариоцитов.Нормальное соотношение «базофильные формы: полихроматофильные нормо¬
бласты: оксифильные нормобласты» равно 1:(2-4):(1,5-2).Уменьшение относительного содержания полихроматофильных и оксифиль¬
ных форм расценивают как задержку гемоглобинизации на стадии базофиль-
ных эритробластов. Уменьшение относительного содержания оксифильных при
нормальных или высоких показателях полихроматофильных форм указывает
на задержку гемоглобинизации на стадии полихроматофильных нормобластов.
Увеличение относительного содержания оксифильных и полихроматофильных
форм свидетельствует об ускоренной гемоглобинизации.После дифференцированного подсчета оценивают морфологические особен¬
ности клеток, кинетику созревания и составляют заключение по миелограмме в
целом при обязательном сопоставлении с показателями гемограммы.Результаты исследования пунктата костного мозгаРезультаты подсчета количества миелокариоцитов, мегакариоцитов и миело-
граммы сравнивают с референтными значениями состава клеток пунктата костно¬
го мозга, полученными при обследовании здоровых взрослых пациентов и детей
(табл. 7-3),Клинико-диагностическое значение миелограммыПравильная оценка состояния костномозгового кроветворения возможна толь¬
ко при сопоставлении данных миелограммы и гемограммы, поскольку зачастую
активная пролиферация кроветворных клеток в костном мозге может сопро¬
вождаться цитопенией из-за повышенной деструкции клеток или задержки их
созревания и элиминации из костного мозга. Лейкоэритробластический индекс
отражает активность лейко- и эритропоэза.
506ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯТаблица 7-3. Пределы референтных значений клеток в пунктате костного мозга (X — среднее,
S — стандартное отклонение)ПоказательВзрослые,X±1SНоворожденные,X±1SДети 3 лет,
X±1SДети 5-6 лет,
X±1SМиелокариоциты, хЮ^л41,6-195,0146,5-222,5170,8-296,8100.4-300,0Мегакариоциты, х10¥л50-15051,8-108,253,8-113,852,8-157,2Бласгы,%0,1-1,10,7-2.11,3-2.70-1,2Миелобласты, %0,2-1,70,8-1,80,8-3,31.5-3,6Иейтрофильные промиелоциты, %1,0^,14,2-6.22,8-5,81.2-3,8Нейтрофильные миелоциты, %7,0-12,28,1-12,38,5-11,94.2-8,7Иейтрофильные метамиелоциты, %8-156,8-8,87,1-9,06,5-10.3Л ал очкоядерные нейтрофилы, %12,8-23,720,0-25,214,0-25,413,2-24,0Сегментоядерные нейтрофилы, %13,1-24,118,0-23,613,3-22,58,3-13,98се иейтрофильные элементы, %52,7-68,9--43.0-54,7Эозинофилы всех генераций, %0,5-5,82,7-5.32.8-6,82,4-7,4Базофилы, %0-0,50-0,30-0,10.2-0,8Лимфоциты, %4,3-13,72,0-3,86,7-14,618,7-29,5Моноциты, %0,7-3,10-0,10-0,21.8-5,5Плазматические клетки, %0,1-1,80,1-0.10-0,30-0,5Эритробласты.%0,2-1.11,0-1.80,8-2,00,3-1,0Пронормобласты, %0,1-0,2---Нормобласты базофильные, %1,4-4,62,5-5,11,4-3,41,2-2,4Нормобласты полихром атоф иль¬
ные. %8,9-16,96,9-10,67,5-11,27,&-16,0Нормобласты оксифильные, %0,8-5,65,9-10,05,5-7,30,1-1,9Все эритрокариоциты, %14,5-26,5--11,3-19,4Ретикулярные клетки, %0,1-1,60,6-1.90.1-1,40,2-1,2Изменения гемопоэза могут носить опухолевый и реактивный (функциональ¬
ный) характер. Опухоли кроветворных органов сопровождаются пролиферацией
лейкозных клеток в костном мозге при одновременной редукции других ростков
кроветворения.При острых лейкозах в миелограмме отмечают сдвиг до бластных клеток, про¬
центом которых определяется наличие острого лейкоза (более 20%) или одного
из вариантов миелодиспластического синдрома (менее 20%). В процессе лечения
анализ миелограммы является необходимым исследованием, которое позволяет
судить о достижении полной ремиссии (менее 5% бластных клеток) или о разви¬
тии костномозгового рецидива (более 5% бластов).Особенности морфологии бластных клеток позволяют в некоторых случаях
предположить вариант острого лейкоза (острый миелобластный, острый про-
миелоцитарный, острый плазмобластный лейкоз). Для подтверждения варианта
острого лейкоза необходимы дополнительные цитохимические, иммунологиче¬
ские и цитогенетические исследования.Гиперплазия клеток гранулоцитарного ростка с высоким лейкоэритробласти-
ческим соотношением может быть опухолевой (миелопролиферативные забо¬
левания) или реактивной (воспалительные и инфекционные заболевания). При
опухолевых заболеваниях системы крови клетки гранулоцитарного ростка могут
иметь морфологические особенности: пельгеризацию или гиперсегментацию
ядер, кольцевидность ядер, снижение или отсутствие гранул, гипергранулярность
и базофилию цитоплазмы. Одновременное сопоставление данных миелограммы и
гемограммы позволяет судить о характере патологического процесса. Активный
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 5Q7гранулоцитарный росток и лейкопения в костном мозге свидетельствуют о
быстрой элиминации гранулоцитов из сосудистого русла в ткани, что может проис¬
ходить при абсцессах, тяжелых воспалительных заболеваниях. Расширенный гра¬
нулоцитарный росток на фоне лейкоцитоза с нейтрофилезом или сдвигом влево
до метамиелоцитов или миелоцитов — свидетельство сохранного костномозгового
гранулоцитарного резерва, за счет которого и происходят изменения в гемограмме.
В то же время такую картину крови можно наблюдать и при миелопролифератив-
ных заболеваниях (хроническом миелолейкозе, сублейкемическом миелозе), для
подтверждения которых необходимы цитохимические исследования (исследова¬
ние активности щелочной фосфатазы, миелопероксидазы). Возможно уменьшение
гранулоцитарных клеточных элеметов в костном мозге с задержкой их созревания
на стадии промиелоцита, миелоцита или метамиелоцита при агранулоцитозе.Увеличение клеток лимфоцитарного ростка можно наблюдать при лимфопроли-
феративных заболеваниях, вирусных и аутоиммунных процессах. Морфологические
особенности клеток при лимфопролиферативных заболеваниях: анизоцитоз клеток
и их ядер, расщепленные ядра, неправильный контур ядерной мембраны, высокое
ядерно-цитоплазматическое соотношение, извилистость, мозговидность ядер.Гиперплазия клеток эритроидного ростка со сниженным лейкоэритробла-
стическим соотношением может быть парциальной или тотальной и сопрово¬
ждаться различными изменениями в гемограмме. Мегалобластический тип кро¬
ветворения характерен для и фолиеводефицитной анемии, но может быть в
период криза гемолитической анемии, а в сочетании с увеличением количества
лимфоцитов, плазмоцитов и мегакариоцитозом возможен при циррозе печени.
Замедление синтеза ДНК ведет к остановке митозов на более ранних фазах кле¬
точного цикла, нарушению синхронности созревания ядра и цитоплазмы клетки
и гемоглобинобразования. В результате эритрокариоциты приобретают харак¬
терные морфологические признаки. При мегалобластическом кроветворении
в костном мозге отмечают высокий неэффективный гемопоэз. Основная масса
мегалобластов разрушается в костном мозге, лишь небольшая их часть дозревает
до мегалоцитов, поступающих в кровь. Степень неэффективного костномозгового
эритропоэза можно оценить при цитохимическом исследовании по накоплению
PAS-положительного вещества в эритрокариоцитах или повышению количества
сидеробластов.Резкое увеличение количества эритрокариоцитов может происходить при гемо¬
литических анемиях, особенно в период криза, железодефицитной анемии, остром
эритромиелозе, некоторых вариантах миелодиспластического синдрома (МДС).
Морфологические особенности эритрокариоцитов (многоядерные эритробласты,
кариорексис, асинхронное созревание ядра и цитоплазмы, межъядерные мостики,
уродливость ядер и др.) позволяют судить о степени выраженности дисэритрогюэ-
за, что имеет значение в дифференциальной диагностике МДС с другими заболе¬
ваниями.Обнаружение макрофагов с гранулами гемосидерина позволяет судить о запа¬
сах железа в костном мозге. Исследование сидеробластов в костном мозге дает
полезную информацию для оценки адекватности накопления железа в организме.
Истощение запасов железа происходит при железодефицитной анемии и сопро¬
вождается снижением количества сидеробластов. Избыточное накопление проис¬
ходит при идиопатическом и приобретенном гемохроматозе, хронической гемо¬
литической анемии, талассемии и МДС, что приводит к увеличению количества
сидеробластов. При диагностике МДС отличительным признаком рефрактерной
анемии с кольцевидными сидеробластами является присутствие в костном мозге
более 15% кольцевидных сидеробластов.Снижение количества эритрокариоцитов происходит при острых и хрониче¬
ских лейкозах, гипопролиферативной стадии железодефицитной анемии, апласти-
508 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯческой и парциальной красноклеточной апластической анемии. Гиперплазия мега-
кариоцитов возможна при миелопролиферативных процессах, в том числе при
идиопатической тромбоцитемии, МДС или трансформации его в острый лейкоз,
метастазах злокачественных новообразований в костный мозг, идиопатической
или иммунной и аутоиммунной тромбоцитопении. Морфологическая особенность
мегакариоцитов — появление одно- или двухъядерных форм, микроформ или
мегакариоцитов с большим количеством мелких ядер.Важен факт наличия или отсутствия отшнуровки тромбоцитов. Уменьшение
количества мегакариоцитарных элементов часто сопутствует ап ласти ческим,
иммунным и аутоиммунным процессам, лучевой болезни, острым лейкозам, мие-
ломной болезни, В^2-дефицитной анемии, а также может наблюдаться при мета¬
стазах рака в костный мозг с остеосклерозом костной ткани. Изменение тромбо-
цитопоэза проявляется тромбоцитопенией, тромбоцитопатией и тромбоцитозом.Картину гипо- или апластического костного мозга с низким лейкоэритробла-
стическим индексом можно наблюдать при воздействии лекарственных препара¬
тов, химических веществ, ионизирующего излучения, цитостатической терапии,
при эндокринных заболеваниях (акромегалии, дисфункции щитовидной железы),
тяжелых авитаминозах, общем истощении.При лизосомных болезнях накопления (Гоше, Ниманна-Пика и др.) обнаружи¬
вают макрофаги с характерными морфологическими признаками, которые хорошо
видны при исследовании препаратов костного мозга при малом увеличении. При
заболеваниях, сопровождающихся остеодеструкцией, в костном мозге выявляют
остеокласты и остеобласты, а при злокачественных новообразованиях — метаста¬
зы рака в костный мозг.Метастазы рака в костный мозг ~ результат гематогенной диссеминации
солидных опухолей. Для метастатического поражения костного мозга характерно
появление комплексов клеток, обладающих признаками атипии (полиморфизм
размеров и форм клеток, их ядер, высокое ядерно-цитоплазматическое соотно¬
шение, многоядерные клетки и т.д.). Определить первичную локализацию опу¬
холи по метастазам в костный мозг, как правило, не представляется возможным.
Нередко удается охарактеризовать гистологическую принадлежность опухолевых
клеток (аденокарцинома, плоскоклеточный рак, недифференцированный рак).
Б тех случаях, когда опухолевые клетки не образуют четких комплексов и имеют
низкую степень дифференцировки, выдают заключение об обнаружении «клеток
злокачественного новообразования» без установления их гистологической при¬
надлежности.Цитохимические исследования гемопоэтических клетокЦитохимические исследования позволяют изучить ферментативную актив¬
ность, содержание различных веществ в клетках крови, костного мозга, лимфати¬
ческих узлов и других тканей.Современные цитохимические методы исследования, применяемые в гемато¬
логии в комплексе с морфологической оценкой клеточных элементов, используют
для изучения направленности дифференцировки кроветворных клеток. Основой
их идентификации служат особенности метаболизма, специфичные для каждого
типа клеток. Цитохимические методы исследования обладают рядом достоинств:
просты в исполнении, воспроизводимы, не требуют сложной, дорогостоящей
аппаратуры, информативны.Цитохимические реакции проводят в мазках периферической крови, пунктатах
костного мозга, лейкоконцентрате венозной крови, спинномозговой жидкости,
аспиратах лимфатических узлов, селезенки, лейкозных инфильтратов различной
локализации.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 5Q9При цитохимических исследованиях следует учитывать, что качество препара¬
тов и хорошая техника приготовления мазков имеют решающее значение.Приготовление мазковМазки крови и костного мозга лучше делать непосредственно из материала,
полученного без добавления антикоагулянтов. Если это невозможно, готовят
мазки из стабилизированной антикоагулянтами клеточной взвеси или лейкокон-
центрата, полученного путем щадящего центрифугирования. При выраженной
лейкопении цитохимические исследования целесообразно проводить в препара¬
тах, полученных из лейкоконцентрата венозной крови.После приготовления мазки следует быстро высушить на воздухе до исчезно¬
вения влажного блеска, что позволит избежать сморщивания и смывания их со
стекла во время фиксации. Приготовленные мазки периферической крови и кост¬
ного мозга рекомендуют хранить не более суток, так как активность большинства
внутриклеточных ферментов снижается. Препараты фиксируют сразу после высу¬
шивания на воздухе.Оценка результатов цитохимических реакцийВ большинстве случаев достаточно определить характер цитохимической реак¬
ции (слабая, умеренная, интенсивная) с указанием процента положительно реаги¬
рующих клеток. При оценке PAS-реакции характер распределения положительно¬
го материала (диффузный, диффузно-гранулярный, гранулярный) имеет большую
диагностическую ценность, чем измерение его общего количества (например, при
острых лейкозах).В ряде случаев применяют полуколичественный метод с подсчетом услов¬
ных единиц или вычислением среднего цитохимического коэффициента (СЦК).
Принцип его заключен в оценке интенсивности окраски и количества положитель¬
ных гранул при анализе 100 клеток:О — отсутствие окраски цитоплазмы расценивается как отрицательная реакция (0);+ — слабодиффузное окрашивание или единичные гранулы в цитоплазме;++ — диффузная окраска цитоплазмы, умеренное количество гранул;+++ — интенсивное окрашивание цитоплазмы, многочисленные гранулы,
заполняющие всю клетку.После оценки интенсивности окраски считают количество условных единиц или
СЦК.Подсчет условных единиц (уе) по методике Kaplow:уе = ЗхС + 2хВ + А.Вычисление среднего цитохимического коэффициента:СЦК= (ЗхС + 2хВ + А)/100,где А — количество клеток со слабоположительной реакцией; В — количество
клеток с умеренно положительной реакцией; С — количество клеток с резко выра¬
женной реакцией.При этом показатель активности реакции в условных единицах может колебать¬
ся от О до 300, а СЦК - от О до 3.МиелопероксидазаМиелопероксидаза (МПО) преимущественно локализована в специфических
азурофильных гранулах в цитоплазме гранулоцитов и служит маркером клеток
миелоидного ряда. В клетках МПО участвует в реакции разрушения токсичной
перекиси водорода. В цитохимических реакциях активность фермента определя¬
ют по окислению хромогенов (бензидина, о-дианизидина и др.). МПО выявляют
в клетках гранулоцитарного ряда, начиная с миелобласта. Активность фермента
нарастает по мере созревания клеток. В сегментоядерных нейтрофилах здоровых
г/" 510 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ- людей выявляют высокую активность МПО, содержащуюся в клетках в виде гра-которые заполняют цитоплазму.Самую высокую активность фермента наблюдают в зрелых эозинофилах.
,г В базофильных промиелоцитах и миелоцитах активность МПО, как правило,
-v'" высокая, однако по мере дифференцировки их в зрелые клетки активность фер-Тмента снижается. Зрелые базофилы могут быть почти отрицательными по данному
признаку. Слабоположительна реакция на МПО в различном проценте моноцитов
." в виде немногочисленных рассеянных гранул. В эритрокариоцитах, лимфоцитах,базофилах и мегакариоцитах активность МПО не определяется.Б крови здоровых людей 3-16% нейтрофилов окрашены резко положительно,
60-90% — положительно, остальные — слабоположительно. СЦК нейтрофилов
здоровых людей — 2,56±0,33.Реакцию используют главным образом в целях диагностики острых лейкозов.
При острых миелобластных лейкозах активность фермента в опухолевых клетках
варьирует от умеренной до выраженной в зависимости от степени дифферен¬
цировки бластов. Так, при острых миелобластных лейкозах с низкой степенью
дифференцировки (Mj^ по ФАБ-классификации) количество МПО-положительных
бластов невелико (не превышает 10%), активность фермента в них невысокая.
В то же время при остром промиелоцитарном лейкозе (М^ по ФАБ-классификации)
МПО выявляют практически в 100% бластных клеток и активность ее равноценна
таковой в зрелых нейтрофилах.При острых монобластных лейкозах реакция на МПО в опухолевых клетках
слабая, при острых лимфобластных — отрицательная. Отсутствие точных коли¬
чественных способов оценки цитохимических реакций не позволяет использовать
их для верификации степени дифференцировки бластных клеток и, следовательно,
для более тонкой дифференциальной диагностики острых лейкозов. Таким обра¬
зом, та или иная цитохимическая реакция определяет линейную направленность,
а не степень дифференцировки бластных клеток.ЛипидыВ гемопоэтических клетках липиды рассеяны в виде тонкодисперсных образо¬
ваний, которые неразличимы в световом микроскопе без специальной окраски.
Стабильные и хорошо воспроизводимые результаты для исследования гемопоэти¬
ческих клеток получаются при применении метода с Суданом черным Б.Липиды обнаруживают практически во всех лейкоцитах, за исключением лим¬
фоцитов. Однако основная масса липидов связана с клетками гранулоцитарного
ряда. Они входят в состав специфической зернистости нейтрофильных гран}шо-
цитов, эозинофилов и накапливаются по мере созревания клеток. В миелобластах
обычно присутствует скудное количество гранул, локализованных в перинуклеар-
ной зоне, в промиелоцитах их становится несколько больше, в миелоцитах и мета-
миелоцитах содержание суданофильных гранул высокое. В зрелых нейтрофилах
липиды заполняют всю цитоплазму.На всех стадиях созревания эозинофилов обнаруживают липиды по периферии
специфических гранул с неокрашенной или слабоокрашенной центральной зоной.
Большинство незрелых базофилов дают положительную реакцию, по хмере созре¬
вания клеток содержание липидов в них снижается. Реакция в зрелых базофилах
вариабельна — от слабоположительной до отрицательной.Нормальные величины: большинство нейтрофилов (69-80%) у здоровых людей
окрашиваются интенсивно, 18-36% — среднеинтенсивно и 10% окрашены слабо.PAS-реакцияМеханизм PAS-реакции основан на окислении йодной кислотой гликолевых
групп или их амино- или алкиламинопроизводных до альдегидов. Альдегидные
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 511ШШйГруппировки при взаимодействии с реактивом Шиффа образуют продукт красного g
цвета. ЩМукополисахариды (гликозаминогликаны) определяют во всех морфологи-
чески идентифицируемых клетках гранулоцитарного ряда. Концентрация PAS-
положительного материала в клетках гранулоцитопоэза нарастает по мере созре¬
вания клеток. Диффузное окрашивание цитоплазмы обычно свойственно наиболее
молодым клеткам гранулоцитарного ряда (миелобластам, промиелоцитам, миело¬
цитам). В зрелых нейтрофилах содержится много PAS-положительного вещества в
виде мелких гранул, упакованных так плотно, что цитоплазматический фон плохо
различим. В зрелых эозинофилах и базофилах PAS-положительный материал рас¬
положен следующим образом: специфические гранулы остаются неокрашенными
и резко выделяются на фоне диффузного окрашивания цитоплазмы.В моноцитах PAS-положительный материал чаще выявляют в виде мелкой
пылевидной зернистости на фоне слабо-розового диффузного окрашивания.В лимфоцитах концентрация мукополисахаридов меньше, чем в гранулоцитах,В норме 10-40% лимфоцитов периферической крови содержат PAS-положитель¬
ный материал, расположенный в виде гранул вокруг ядра, в 1-2% клеток гранулы
могут быть интенсивно окрашены и образуют крупные блоки.Нормальные величины: в 95-100% нейтрофилов PAS-реакция выявляется в
диффузной форме, СЦК — 2,09-2,99, от 2 до 33% лимфоцитов содержат PAS-
положительное вещество в гранулярной форме, СЦК — 0,02-0,52.Вместе с реакцией на миелопероксидазу и неспецифическую эстеразу PAS-
реакция — один из основных цитохимических методов для дифференциальной
диагностики острых лейкозов.При диагностике острых миелобластных лейкозов бластные клетки могут быть
либо PAS-отрицательными, либо обнаруживается слабодиффузное окрашивание
цитоплазмы. Яркое диффузное окрашивание цитоплазмы наблюдают только при
остром промиелоцитарном лейкозе.В монобластах реакция может быть отрицательной, слабоположительной в
диффузной или диффузно-гранулярной форме (когда продзтст реакции выявляют
в виде рассеянных мелких или средних гранул, расположенных по краю цитоплаз¬
мы, на диффузном фоне).В то же время при остром лимфобластном лейкозе (ОЛЛ) бласты содержат гли¬
коген в цитоплазме в виде средних и крупных гранул, расположенных венчиком
вокруг ядра, иногда сливающихся в блоки. Количество клеток с таким характером
PAS-реакции сильно варьирует при различных случаях ОЛЛ.Неспецифические эстеразыНеспецифические эстеразы — неоднородная группа лизосомальных ферментов,
отличающихся по субстратной специфичности и действию активаторов и инги¬
биторов. На основании этого были разработаны различные методики выявления
эстераз в качестве потенциальных маркеров основных популяций лимфоцитов.В гематологии наиболее часто определяют а-нафтилацетатэстеразу, хлорацетат-
эстеразу, кислую а-нафтилацетатэстеразу.а-Нафтилацетатэстеразу обнаруживают во всех клетках миелоидного ряда,
начиная с миелобласта. Она активна в эозинофилах вне всякой связи с их специ¬
фической зернистостью, в небольшом количестве лимфоцитов, эррггрокариоцитах,
мегакариоцитах и тромбоцитах. Самую интенсивную реакцию дают моноциты
и макрофаги. Активность неспецифической эстеразы в клетках моноцитарного
ряда легко ингибируется фторидом натрия, но не подавляется в гранулоцитах.Этот феномен позволяет отличить клетки системы мононуклеарных фагоцитов от
клеток других ростков кроветворения, обладающих активностью неспецифиче¬
ской эстеразы. Активность нафтил-А5-В-хлорацетатэстеразы выражена в клетках
512 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯгранулоцитарного и отсутствует в клеточных элементах моноцитарного и лим¬
фоцитарного рядов. Кислую а-нафтилацетатэстеразу рано выявляют в процессе
дифференцировки Т-лимфоцитоБ, где она локализована в виде фокального пятна
в цитоплазме.Определение активности неспецифической эстеразы используют для идентифи¬
кации лейкозных моноцитарных предшественников. Эти клетки проявляют высо¬
кую активность неспецифической эстеразы с субстратами бутират, ацетат и AS-D-
ацетат, эта активность в значительной степени ингибируется фторидом натрия.Реакции на нафтил-А5-В-хлорацетатэстеразу по надежности выявления гра-
нулоцитарной направленности дифференцировки сравнимы с пероксидазной
реакцией. Реакция на а-нафтилацетатэсгеразу наиболее достоверна для иденти¬
фикации монобластного и моноцитарного типов лейкозов.При остром миеломонобластном лейкозе рекомендуют использовать двой¬
ное окрашивание с различными красителями на наличие хлорацетатэстеразы и
а-нафтилацетатэстеразы.ФосфатазыКислая и щелочная фосфатазы — ферменты, обладающие общим свойством —
способностью освобождать фосфат из спиртовых и фенольных фосфомоноэфиров
при соответственно кислом или щелочном pH среды.Цитохимическое выявление фосфатаз в световом микроскопе основано на обра¬
зовании нерастворимого окрашенного осадка в местах, где происходит гидролиз
субстрата. Наиболее распространенный метод определения активности фосфа¬
таз — метод азосочетания, который включает использование субстратов, содер¬
жащих фосфат нафтола или производное нафтола. Различные методы отличаются
деталями фиксации, выбором производных нафтола, но все они дают, по существу,
одинаковые результаты с минимальными вариациями чувствительности и распре¬
деления гранулярной окраски в положительно реагирующих клетках.Щелочная фосфатазаАктивность ЩФ присуща только зрелым клеткам гранулоцитарного ряда, преиму¬
щественно нейтрофилам. Изредка в эозинофилах встречается фоновая окраска цито¬
плазмы, но не специфических гранул. Базофилы, лимфоциты, моноциты, эритроциты
и тромбоциты не содержат ЩФ как в норме, так и при патологических состояниях.Показатели активности ЩФ широко варьируют при различных состояниях.
Определение активности щелочной фосфатазы применяют для дифференцировки
хронического миелолейкоза от других миелопролиферативных заболеваний и
реактивных изменений. Активность ЩФ увеличивается при истинной полиците-
мии, идиопатическом миелофиброзе, бактериальных инфекциях и резко снижает¬
ся при хроническом миелолейкозе (ХМЛ).Низкие показатели ЩФ почти всегда обнаруживают при Ph-положительном
ХМЛ, а также при Ph-отрицательном ювенильном ХМЛ. Лишь гемолитическая
и железодефицитная анемии или некоторые вирусные заболевания показывают
сравнительно низкий СЦК для ЩФ. У больных с ХМЛ в период ремиссии актив¬
ность ЩФ может быть в норме или даже повышенной.Кислая фосфатазаКислая фосфатаза (КФ) — лизосомальный фермент, обнаруживаемый в цито¬
плазме большинства ядросодержащих клеток крови. Наиболее высока активность
КФ в плазматических клетках, мегакариоцитах, тромбоцитах, моноцитах и макро¬
фагах, гранулоцитарных предшественниках. По мере созревания клеток нейтро-
фильного и эозинофильного ряда активность фермента снижается. Локализована
КФ в основном в первичных гранулах и отсутствует во вторичных. Зрелые нейтро-
филы и эозинофилы обладают либо низкой ферментативной активностью, либо
лишены ее. в лимфоцитах активность КФ весьма вариабельна.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 513При Т-клеточном остром лимфобластном лейкозе, плазмоцитоме, волосато¬
клеточном лейкозе (ВКЛ) проявляется положительная окраска в плазматических
клетках, Т-лимфоцитах и особенно властных клетках. Снижение активности КФ
в лимфоцитах отмечают при ХЛЛ и неходжкинских злокачественных лимфомах,
увеличение — при инфекционном мононуклеозе, продукт реакции выявляют в
виде мелкой пылевидной зернистости либо фокального пятна в цитоплазме лим¬
фоцитов.Определение активности КФ имеет значение в диагностике волосатоклеточного
лейкоза, при котором в клетках выявляют тартратрезистентную КФ (изофермент 5).Окраска на сидеробластыСидеробласты и сидероциты — это нормобласты (эритробласты) и эритроциты,
содержащие в цитоплазме негемоглобиновое железо в виде гранул, окрашиваемых
в реакции с берлинской лазурью. Если гранулы свободного железа многочислен¬
ные, грубые и располагаются вокруг ядра, образуя кольцо, такие клетки называют
кольцевидными сидеробластами.Содержание сидероцитов в периферической крови не превышает 1,1% (0,60-
0,04%), в костном мозге — 0,2-2,1% (0,09-0,90%). Содержание сидеробластов в
костном мозге — 23,7±2,4%.Соединений железа обычно не обнаруживают в лейкоцитах, тогда как выявле¬
ние их в эритрокариоцитах информативно для подтверждения неэффективного
эритропоэза и диагностики некоторых вариантов МДС. При МДС железо, посту¬
пающее в эритробласты, не используется для синтеза гемоглобина и откладыва¬
ется в эритрокариоцитах (сидеробластах), костномозговых макрофагах в виде
гемосидерина или ферритина.Исследование сидеробластов в костном мозге дает полезную информацию для
оценки адекватности накопления железа в организме. Истощение запасов железа
происходит при железодефицитной анемии и сопровождается снижением количе¬
ства сидеробластов. Избыточное накопление наблюдают при идиопатическом и
приобретенном гемохроматозе, хронической гемолитической анемии, талассемии
и МДС, что приводит к увеличению количества сидеробластов. При диагностике
такого варианта МДС, как рефрактерная анемия с кольцевидными сидеробласта¬
ми, отличительным признаком является присутствие в костном мозге более 15%
кольцевидных сидеробластов.Значение цитохимических реакций в онкогематологииОсновное применение цитохимические методы находят в диагностике гемо-
бластозов. Стандартной панели цитохимических методов (МПО, липиды, PAS-
реакция, а-нафтилацетатэстераза) в большинстве случаев бывает достаточно
для выявления линейной принадлежности опухолевых клеток. Цитохимические
реакции используют в целях:• установления варианта острого лейкоза и бластного криза ХМЛ;• дифференциальной диагностики идиопатического миелофиброза (сублейке-
мического миелоза) и ХМЛ;• диагностики волосатоклеточного лейкоза и лимфомы селезенки с отростча-
тыми лимфоцитами;• выявления особенностей метаболизма лейкозных клеток.Цитохимическими маркерами бластов гранулоцитарного ряда служат МПО,липиды и AS-D-хлорацетатэстераза. Содержание этих ферментов в миелобластах
сильно варьирует. В некоторых случаях можно выявить один или два из пере¬
численных маркеров (чаще липиды). Именно поэтому во избежание ошибочного
заключения при получении сомнительного результата необходимо проведение
двух реакций. Активность AS-D-хлорацетатэстеразы существенно ниже, чем
активность МПО, поэтому определение этого фермента представляет меньшую
514 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ‘ диагностическую ценность. Активность МПО у детей до 15 лет и пациентов старше
"М 60 лет ниже, чем у людей среднего возраста.щ Для определения монобластов важно измерение неспецифической эстеразы,подавляемой фторидом натрия. Для лимфобластов характерны отрицательная
реакция на МПО и положительная PAS-реакция в гранулярной форме.Проточная цитофлюориметрияЛазерная проточная цитофлюориметрия — современная технология быстрой
оценки частиц или клеток по определенным параметрам в процессе их продвиже¬
ния в потоке жидкости, в основе проточной цитофлюориметрии лежат фотоме¬
трические и флюоресцентные измерения отдельных клеток, пересекающих одна за
другой в потоке жидкости лазерный луч монохроматического света.Проточная цитофлюориметрия играет ключевую роль в онкогематологии. Ее
используют в целях диагностики и мониторирования опухолевой популяции при
острых лейкозах и лимфопролиферативных заболеваниях (ЛПЗ), прогноза, под¬
счета абсолютного количества стволовых гемопоэтических клеток, используемых
для последующей аутотрансплантации, диагностики пароксизмальной ночной
гемоглобинурии.Основные диагностические возможности иммунофенотипирования в онкогема¬
тологии представлены в табл. 7-4.Таблица 7-4. Возможности проточной цитофлюориметрииКлиническое значениеПотенциальные возможмостиДиагностика ОЛЛ и ОМЛ (М„, М^, М.); острых лейко¬
зов со смешанным фенотипомИдентификация вариантов острых лейкозов с
неблагоприятным прогнозомДиагностика и дифференциальная диагностика
В-клеточных лимфопролиферативных заболеваний
(ЛПЗ)Выявление минимальной остаточной болезни при
острых лейкозах и ЛПЗДиагностика Т-клеточных ЛПЗПодсчет гемопоэтических стволовых клеток пупо¬
винной и периферической крови, костного мозгаОценка экспрессии клеточных мишеней для таргетной
терапииCD20. CD33, CD52, CD23 и др.Широкое внедрение моноклональных антител в лабораторную практику позво¬
лило детально изучить антигенный состав поверхности нормальных лимфоцитов
и миелоидных клеток человека на различных стадиях дифференцировки. На осно¬
ве концепции соответствия фенотипа злокачественной клетки фенотипу нормаль¬
ного клеточного аналога на каждом уровне дифференцировки представилось воз¬
можным выделить ряд иммунологических вариантов (фенотипов), определяющих
клеточную природу лейкозов, уровень блока дифференцировки клетки в лейкеми-
ческой популяции, в большинстве случаев острых лейкозов бласты имеют имму¬
нофенотип, сравнимый с нормальными гемопоэтическими клетками аналогичных
стадий дифференцировки. При ОЛЛ и ОМЛ бластные клетки рассматриваются
как злокачественные аналоги нормальных клеток на ранних стадиях лимфо- и
миелопоэза. Таким образом, по набору мембранных и цитоплазматических анти¬
генов можно установить линейную принадлежность, стадию дифференцировки и
функциональное состояние клетки. Выделяют:• линейно-неограниченные (нерестриктированные) антигены — их экспрессия
не ограничена одной клеточной линией (CD34, CD38, HLA-DR, TdT);• линейно-ассоциированные (линейно-специфические) антигены — специфи¬
чески экспрессируются на некоторых линиях миелоидной (CD 13, CD33,
CD117, CD65, МПО, CD14, CD15, CD41, CD42, CD61 и т.д.) или лимфоидной
(CD 19, CD22, cig, sig, CD5, CD3 и т.д.) дифференцировки;
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ gig• дифференцировочные антигены — отражают стадии дифференцировки кле¬
ток (цитоплазматический IgM, к-, X,-легкие цепи Ig, CD34, CD 10, CDla);• активационные антигены — отражают активацию клеток (CD25, CD38, HLA-
DR и т.д.).Дифференцировочные антигены можно обнаружить на злокачественных клет¬
ках в комбинациях, которые очень редко встречаются или не выявляются в
нормальном костном мозге. В определении таких комбинаций может помочь
иммунофенотипирование с использованием трех-, четырех-, шестицветного флю¬
оресцентного анализа. Таким образом, лейкемические клетки можно отличить от
их нормальных аналогов по ряду критериев. К основным типам аберрантности
фенотипа лейкозных клеток относятся:• ко-экспрессия антигенов нескольких линий, т.е. лимфоидных маркеров при
ОМЛ или миелоидных маркеров при ОЛЛ;• асинхронная экспрессия антигена — одновременная экспрессия «раннего» и
«позднего» антигенов, которые в норме находятся на разных этапах диффе¬
ренцировки клеток, например CD34 и CD 15, CD 15 и CD117;• сверхэкспрессия антигена ~ плотность распределения антигенов на лейкоз-
ной клетке больше, чем на нормальной клетке костного мозга (например,
гиперэкспрессия CD 10 при BII ОЛЛ);• отсутствие или низкий уровень экспрессии антигена, характерного для дан¬
ной стадии дифференцировки, — потеря клеткой ряда поверхностных анти¬
генов, например утрата CD33 наблюдается в 21% сл)^^іаев ОМЛ;• фенотипический профиль, практически не встречаемый в норме.Аберрантность экспрессии антигенов отражает генетические изменения, лежа¬
щие в основе опухолевого перерождения клетки, позволяя выявлять атипичные
клетки даже при относительно небольшом их содержании в образце. Подобный
иммунофенотип лейкозной клетки позволяет проводить мониторинг остаточной
опухолевой популяции в процессе химиотерапии.в области исследования лимфопролиферативных заболеваний (ЛПЗ) про¬
точную цитометрию используют для классификации на Т-, В- и НК-клеточные
заболевания, а также для их дифференциальной диагностики. Проточная цито-
флюориметрия позволяет исследовать антигены, имеющие прогностическое зна¬
чение, например CD3S, ZAP-70, CD31 при В-клеточном хроническом лимфолей-
козе, и, таким образом, определять прогноз заболевания. Широкое использование
в клинической практике моноклональных антител (мабтеры, кэмпаса и др.) зна¬
чительно улучшило результаты лечения больных с индолентными лимфомами.
Для успешного их применения необходимо до начала терапии исследовать степень
экспрессии антигенов на соответствующих клетках-мишенях (например, CD20
или CD52 при использовании соответственно мабтеры и кэмпаса). В динамике
лечения, используя метод проточной цитофлюориметрии, можно проводить
мониторинг остаточной популяции опухолевых клеток. На сегодняшний день раз¬
работаны стандартные протоколы оценки минимальной остаточной болезни при
хроническом лимфолейкозе, ОЛЛ у детей, которые позволяют клиницистам при¬
нять решение о продлении или прекращении соответствующего лечения.Подсчет гемопоэтических стволовых клеток на основании идентификации анти¬
гена CD34 широко используется в клинической гематологии. В многочисленных
исследованиях продемонстрировано, что они обеспечивают постепенное восстанов¬
ление костного мозга после интенсивной химиотерапии. Проточная цитофлюори-
метрия позволяет не только подсчитать абсолютное количество гемопоэтических
стволовых клеток, но и после мобилизации их из костного мозга ростовыми факто¬
рами определить срок сбора в периферической крови. В клинических исследованиях
показано, что для успешного восстановления костного мозга после химиотерапии
требуется не менее 2х10укг CD34'-клеток периферической крови.
516 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯТаким образом, широкое использование проточной цитофлюориметрии в
онкогематологии привело к качественно новой диагностике лейкозов и лимфом,
а также к разработке новых подходов в оценке эффективности лечения и мони¬
торинга минимальной остаточной болезни, определяющей дальнейшую тактику
ведения больных.Цитогенетический анализМатериалом для исследования обычно служат метафазные или прометафаз-
ные клетки, накопленные in vitro. Цитогенетики, изучая кариотипы этих клеток,
стремятся определить связь их изменений с фенотипическими проявлениями
заболевания и установить вклад перестроек хромосом в обоснование диагноза
заболевания и прогноза его течения. При любом кариотипировании клеток необ¬
ходимо провести изучение достаточного количества контрольных проб и тест-
наборов как нормальных, так и с анеуплоидией, структурными перестройками,
хрупкими областями, сестринскими хроматидными обменами и т.д. При изучении
хромосомных аберраций необходимо правильно отбирать клетки для исследова¬
ния. Пригодными считают метафазные пластинки, удовлетворяющие следующим
требованиям:• все хромосомы должны быть хорошо прокрашены и равномерно разбросаны;• в поле зрения не должно бьггь случайных хромосом;• уровень конденсации хромосом должен находиться в следующих пределах:
максимум — малые акроцентрики видны в виде четких структур, а не в виде
точек (чтобы ошибочно их не принять за точечные фрагменты); минимум —
хромосомы разделены на две хроматиды и лежат отдельно друг от друга;• не допускается наличия в метафазной пластинке хромосом, вошедших в ана¬
фазу, так как их трудно отличить от парных фрагментов;• не допускается анализа метафазных пластинок с большим количеством нало¬
жений хромосом;• обычные потери хромосом из-за методических манипуляций регламентиру¬
ют проведение анализа только на клетках с числом хромосом от 44 до 47;• при выяснении количественных параметров действия мутагенного фактора
основным критерием является количество поврежденных хромосом; этот
критерий принято выражать по отношению к количеству неповрежденных
хромосом.Препараты метафазных хромосомСубстрат исследования — способные к митозу пролиферирующие клетки кост¬
ного мозга, лимфатических узлов, селезенки, ткани опухоли или ворсинчатого
хориона в прямых препаратах. В гематологии прямой метод кариотипирования
клеток костного мозга является методом выбора. В целях установления консти¬
туциональных изменений генома исследуют наборы хромосом клеток перифе¬
рической крови (лимфоцитов), культивируемых in vitro в питательной среде с
митогенами (фитогемагглютинином, конканавалином А, ионофором кальция
А 23187 и др.). В культурах исследуют и фибробласты кожи, клетки амниотиче¬
ской жидкости, костного мозга или лимфоидной ткани.Методы молекулярно-цитогенетического исследованияСтандартное цитогенетическое исследование дифференциально окрашенных
метафазных хромосом имеет ряд объективных ограничений: неоднородность
клеточной популяции в отношении митотической активности, индекса спирали-
зации и плохого расхождения хромосом; недоступность для анализа клеток, нахо¬
дящихся в интерфазе, В процессе предварительного культивирования возможен
избирательный выход в митоз клеточных клонов, имеющих селективные преиму¬
щества роста, что также искажает получаемые результаты. Кроме того, репрезен-
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ517тативность классической цитогенетики из-за трудоемкости ее методов невысока:
обычно исследзпот не более 15-20 метафазных пластинок. Для современного этапа
в развитии цитогенетики характерна активная разработка интерфазной методоло¬
гии, что существенно дополняет методы классического хромосомного анализа.Цитогенетики все шире используют молекулярные методы кариотипирования,
к которым относят:• гибридизацию in situ с использованием специфических проб к центромерам;• метод флюоресцентной гибридизации ш situ (FISH) с помощью специфиче¬
ских ДНК-зондов;• метод мягкой гипотонической обработки, оставляющей сохранными клеточ¬
ную мембрану и цитоплазму клетки, и фиксацию кислотой или формальдеги¬
дом перед иммунохимией (МАС-морфология, антитела, хромосомы);• FICTION {Fluorescence Immunophenotyping and interphase Cytogenetics as a Tool for
Investigation Of Neoplasm’s);• метод многоцветного спектрального кариотипирования (SKY).Метод MAC может комбинироваться с гибридизацией in situ (MACISH), и тогда
интерфазные клетки становятся легкообрабатываемым материалом, особенно при
заболеваниях, где получить метафазные пластинки трудно. FISH-метод позволяет
относительно быстро исследовать сотни интерфазных ядер или метафазных пла¬
стинок низкого морфологического качества для выявления перестроек того или
иного гена. Метод FICTION нашел применение при исследовании хромосомных
аберраций при лимфосаркомах. С помощью SKY-метода проводят анализ всего
хромосомного набора в одном эксперименте.В гематологии применение FISH-метода особенно перспективно при лим-
фопролиферативных заболеваниях с низким митотическим индексом или при
Ph-негативных вариантах хронического миелолейкоза, когда этот метод стано¬
вится единственно возможным для выявления химерного гена Ъсг/аЫ, а также при
дифференциальной диагностике с другими миелопролиферативными заболева¬
ниями или оценке эффективности терапии. Детальная цитогенетическая характе¬
ристика для прогнозирования течения заболевания часто невозможна из-за слож¬
ности и множественности хромосомных перестроек. Тогда полезно использовать
многоцветное спектральное кариотипирование (SKY) с ДНК-зондами на весь
хромосомный набор клетки.Использование молекулярных подходов в клинической практике началось в
1986 г., когда был предложен FISH-метод, разработанный для выявления спе¬
цифических нуклеотидных последовательностей ДНК в клетках, фиксированных
на предметных стеклах (цитогенетические, цитологические и гистологические
препараты). Принцип метода заключен в возможности гибридизации между ДНК
клетки-мишени и ДНК-зондом, меченным флюорохромом и имеющим последова¬
тельность нуклеотидов, комплементарную исследуемому участку макромолекулы.
Метод включает три обязательных этапа;• предварительную денатурациию двухцепочечной ДНК-клетки и ДНК-зонда;• гибридизацию в условиях избыточного содержания зонда;• выявление флюоресцентного сигнала.Локализацию связывания определяют при флюоресцентной микроскопии. Для
изучения хромосомных аномалий обычно используют три типа ДНК-зондов,
количество которых в связи с бурным прогрессом в изучении молекулярных меха¬
низмов патогенеза опухолей будет расти.Концепция многоцветного спектрального кариотипирования (многоцветная
SKY) предложена в конце 1990-х гг. На ее основе были разработаны методы мече-
ния хромосом комбинацией флюорохромов и регистрации флюоресценции путем
оцифровки сигнала и анализа изображения, SKY-метод позволяет одновременно
проанализировать все 46 хромосом, окрашенных в специфические для каждой
518 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ■^о пары аутосом цвета. На конечном этапе обработки изображения каждой хромосо-
Ж ме присваивается классификационный номер. Для этого параметры полученных
Ш' спектров автоматически сравниваются с базой данных компьютера, где хранятся
спектры каждой хромосомы. Единицы изображения с одинаковым цветом получа-
ют одинаковую окраску. Метод позволяет идентифицировать вставки, маркерные
хромосомы, транслокации и субмикроскопические хромосомные перестройки.Современное кариотипированиеМетоды анализа хромосом используют в целях изучения клеточного цикла,
исследования генной амплификации, определения кластерности синдромов
повреждения хромосом, оценки хрупких хромосомных областей и полиморфизма
хромосом при мониторинге трансплантаций органов или тканей.С помощью ДНК-зондов и гибридизации in situ не только определяют хромо¬
сомные перестройки, но и проводят генное картирование. Получили распростра¬
нение пренатальная диагностика и мониторинг беременности. В настоящее время
цитогенетическую «прописку» на хромосомах человека получили около 1500
клинических состояний, среди которых менделирующие расстройства (предрас¬
положенность к заболеваниям), болезни с конституциональными хромосомными
перестройками (идентифицированными или предполагаемыми), злокачественные
новообразования (солидные опухоли и гемобластозы), заболевания, ассоцииро¬
ванные с мутациями митохондриальной ДНК. Нет сомнения, что хромосомные
аберрации маркируют аномалии полового созревания и некоторые наследуемые
патологические состояния. Предприняты попытки создания регистра генных ком¬
понентов и полигенной специфики таких заболеваний, как диабет и психозы.Цитогенетика острых и хронических лейкозовЗа последние десятилетия с помощью цитогенетики была накоплена обширная
информация о значительном количесгве хромосомных нарушений, специфичных
для ряда гемобластозов. Выявлен клоновый характер изменений кариотипа гемопоэ-
тических клеток, лежащий в основе развития лейкозов и лимфатических опухолей.
Цитогенетический анализ в гематологии стал играть важную роль в диагностике,
прогнозировании течения заболеваний и оценке эффективности применяемой тера¬
пии, Изменения хромосом при заболеваниях системы крови сложны и затрагивают
как количественный состав наборов — численные аберрации, так и структуру отдель¬
ных хромосом — структурные аберрации. При типичных для острых и хронических
гемобластозов хромосомных аберрациях смена локализации или повреждение
структуры генов может приводить к нарушению их экспрессии или к структурно¬
функциональным изменениям кодируемых ими белков. По-видимому, эти измене¬
ния играют интегральную роль в патогенезе, а возможно, и в прогрессии лейкоза.При хроническом миелолейкозе, хроническом лимфолейкозе, хроническом мие-
ломоноцитарном лейкозе, В-лимфосаркоме хромосомные аберрации типа t(9;22),
t(5;12), t(14;19), t(14;18) приводят к перестройкам генов Ьсг, аЫ, tel или Ъс1, химер¬
ные белковые продукты которых, меняя характер клеточной пролиферации (при
этом не являясь трансформирующим сигналом), делают клетки бессмертными.При острых лейкозах повреждения хромосом с локализацией llq23 (острые
лимфоидные и миелоидные лейкозы), 15q22 и 17ql2 (острый промиелоцитарный
лейкоз и реже бластный криз хронического миелолейкоза), а также 21q22 (острый
миелобластный лейкоз, бластный криз ХМЛ), как правило, видоизменяют гене¬
тические факторы транскрипции (MILL, PML, RAPA, AML) и тем самым нарушают
клеточную и тканевую дифференцировку, создавая базу для злокачественной
трансформации клеток.Кроме перечисленных хромосомных аберраций, при лейкозах часто регистри¬
руют мутации генов. Так, мутации семейства протоонкогенов RAS бывают в 4%
случаев ХМЛ на стадии развернутых проявлений заболевания и в 26% — ОМЛ
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 519(чаще при остром миеломонобластном лейкозе), сочетаясь с большей продолжи¬
тельностью жизни больных.примерно у 20% больных острыми нелимфоцитарными лейкозами отмечены
мутации протоонкогенов FMS (локализованы на хромосоме 5q33) и повышение
тирозинкиназной активности. При ХМЛ частые мутации протоонкогена TPS3
(хромосома 17р13), т.е, утрата аллеля гена р53, как правило, сочетаются с бласт-
ной трансформацией хронической стадии лейкоза.Аберрации некоторых хромосом, например —7, — Y, del(5q), del(7q) и del(llq),
также приводят к значительному изменению фенотипа клеток. Однако пока мало
сведений о содержании супрессоров в утрачиваемых при этом областях хромосом,
в частности генов, вовлекаемых в миелоидный лейкогенез. Показано, что при
делеции 5q- из маркированных ею клеток исчезают факторы дифференцировки
миелобластов: гранулоцитарно-макрофагальный колониестимулирующий фактор,
протоонкоген FMS, интерлейкины -3, -4 и -5, FER-ген тирозинкиназы, ген интер-
феронрегуляторного фактора (IRF1). Возможно, что упомянутые здесь хромосом¬
ные перестройки играют определенную роль в генезе вторичных лейкозов.Менее изучены повреждения генома гемопоэтических клеток при остром мие¬
ломонобластном лейкозе, где инверсия inv(16)(pl3q22) приводит к образованию
химерного гена CBF (PEPB2B)/MYH11, а транслокация t(6;9)(p23;q34) и генный
маркер DEC/CAN ассоциируются с плохим прогнозом течения заболевания у моло¬
дых больных. Аналогично острый монобластный лейкоз с транслокацией t(9;ll)
(p22;q23) и химерным геном AF9/MLL протекает с высоким бластозом и плохим
ответом на терапию. У некоторых больных ОМЛ методом FISH обнаружена делеция
гена MRP (ген кодирует белок множественной лекарственной устойчивости).В лейкогенезе острого мегакариобластного лейкоза пока неясную роль играют
транслокация t(16;21)(pl;q2) и ее сливной ген ERG/FUS (протоонкоген erg гомо¬
логичен онкогену v-ets).Таким образом, несомненна перспективность цитогенетического метода для
обнаружения причинно-следственных связей при заболеваниях человека. В бли¬
жайшее время цитогенетический метод будет все более востребован при диа¬
гностике многих заболеваний человека с хромосомными аберрациями и генами,
локализованными в них.РЕАКТИВНЫЕ ИЗМЕНЕНИЯ КРОВИ
(ЛЕЙКЕМОИДНЫЕ РЕАКЦИИ)Лейкемоидные (подобные лейкозу) реакции являются изменениями, напо¬
минающими лейкозы, но всегда имеющими реактивный характер и никогда не
переходящими в ту опухоль, которую они напоминают, В широком смысле этот
термин включает неопухолевое увеличение количества клеток в крови, необычную
морфологию клеток, а также изменения в кроветворных органах. Тем не менее
в большинстве случаев подразумевается увеличение содержания клеток в крови
(лейкоцитоз, эритроцитоз, тромбоцитоз). При лейкемоидной реакции обычно
имеется существенная причина с яркой клинической картиной (например, вос¬
паление); изменения крови непостоянны, с исчезновением причины показатели
крови нормализуются, нет признаков угнетения нормального кроветворения.ЛейкоцитозЛейкоцитоз — увеличение количества лейкоцитов в крови более 9х10Ул.
Лейкоцитарный состав крови рассматривается как общий показатель состояния
организма при патологических процессах. Увеличение общего количества лей¬
коцитов редко характери.зуется пропорциональным изменением клеток разных
520 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯВИДОВ, поэтому применяют конкретные термины: «нейтрофилез», «лимфоцитоз»,
«моноцитоз», «эозинофилия», «базофилия». Для того чтобы правильно верифи¬
цировать имеющуюся патологию, нужно проанализировать абсолютные показате¬
ли содержания тех или иных клеток.Физиологический лейкоцитоз (перераспределительный, без увеличения про¬
дукции лейкоцитов) наблюдается при мышечной работе, эмоциональном напря¬
жении, боли, приеме белковой пищи, резкой смене температуры окружающей
среды, действии ультрафиолетовых лучей, ионизирующего излучения, приеме
глюкокортикоидов и др. Указанные причины следует исключать или учитывать
при интерпретации результатов исследования.Реактивный лейкоцитоз (как результат усиления лейкопоэза в ответ на выброс
провоспалительных факторов; цитокинов, токсинов, продуктов активации ком¬
племента и др.) наблюдается при инфекциях, воспалениях, обширных поврежде¬
ниях тканей, опухолях, интоксикациях, острых анемиях, постспленэктомическом
состоянии.Опухолевый лейкоцитоз обусловлен неконтролируемой опухолевой пролифе¬
рацией лейкозных клеток.НейтрофилезНейтрофилез — увеличение количества нейтрофилов в крови более бхЮУл,
Увеличение количества нейтрофилов обусловливает физиологический лейкоцитоз
и большую часть случаев реактивного лейкоцитоза. Степень выраженности нейтро-
фильного лейкоцитоза зависит от объема костномозгового и сосудистого резервов,
активности костномозговой продукции клеток, интенсивности потребления гра-
нулоцитов в тканях, вирулентности микроорганизмов, характера патологического
процесса, состояния защитных систем организма. Время развития нейтрофилеза
может исчисляться минутами (демаргинация), часами (выброс нейтрофилов из
костного мозга) и сутками (повышение продукции клеток в костном мозге).Перераспределительный лейкоцитоз (вследствие приема пищи, лекарственных
препаратов, физических и эмоциональных нагрузок, воздействия холода, тепла,
наркоза и др.) характеризуется переходом лейкоцитов из пристеночного пула в
циркулирующий. Этому способствуют такие факторы, как повышенное давление
крови в капиллярах, нарушение кровотока в мелких сосудах различных органов,
подъем уровня адреналина и кортизола (табл. 7-5). Перераспределительный лей¬
коцитоз бывает, как правило, незначительным и кратковременным.Таблица 7-5. Клинико-диагностическое значение нейтрофилезаВид лейкоцитозаПатогенетические механизмыКлинические формыРеактивный(перераспредели¬тельный)Перераспределение пристеноч¬
ного и циркулирующего пулов
нейтрофилов, мобилизация кост¬
номозгового пула нейтрофиловФизическая нагрузка, физиотерапевтические про¬
цедуры, горячие и холодные ванны, боль, стресс,
послеоперационные состояния, прием глюкокор¬
тикоидов.ГипоксияОстрые и хронические анемии (постгеморрагиче-
ская, гемолитическая, аутоиммунная и др.)Стимуляция лей¬
копоэзаИнфекционные агенты, токсиныАбсцесс, остеомиелит, ангина, скарлатина, дифте¬
рия, отит, пневмония, аппендицит, пиелонефрит,
менингит, сепсис, перитонитВоспаление и некроз тканей
(факторы воспаления и тканевого
распада)Эмпиема плевры, инфаркт органов, атака ревматиз¬
ма, обширные ожоги и травмы, оперативное вмеша¬
тельство, злокачественные новообразования и др.Эндогенные интоксикацииАцидоз, эклампсия, уремия, синдром Иценко-
Кушинга, подаграОпухолевыйЛейкозная пролиферация клетокЛейкозы
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ521Реактивный нейтрофильный лейкоцитоз наблюдается вследствие перераспре¬
деления клеток в органах и крови или при повышенном выбросе нейтрофилов
из костного мозга. Реактивным нейтрофилезом могут сопровождаться любое
воспаление, бактериальные, грибковые и паразитарные инфекции (местные и
генерализованные), некротические изменения тканей, интоксикации, гипоксемия
и опухоли различной локализации.Лейкоцитоз новорожденных и беременных носит в основном смешанный
характер: он может быть как перераспределительный, так и в результате актива¬
ции костномозгового кроветворения. Повышенное количество лейкоцитов сопро¬
вождается увеличением в крови нейтрофилов, сдвигом лейкоцитарной формулы
влево до мета- и миелоцитов, что отражает максимальную активность процессов
пролиферации и элиминации гранулоцитов из костного мозга.Истинное увеличение количества циркулирующих нейтрофилов наблюдается
в том случае, если повышенная продукция и выход в циркуляцию нейтрофилов
стимулируются на уровне костного мозга. При длительном воздействии факто¬
ров, индуцирующих нейтрофилез, происходит истощение костномозгового гра-
нулоцитарного резерва, и в кровь выходят молодые клетки нейтрофильного ряда:
палочкоядерные, метамиелоциты, миелоциты и промиелоциты, так называемый
сдвиг лейкоцитарной формулы влево. Такое состояние крови носит название
лейкемоидной реакции нейтрофильного типа. Дифференциальная диагностика
между реактивным лейкоцитозом и ХМЛ обычно несложна, так как в первом
случае имеется яркая клиническая картина, а при выздоровлении картина крови
нормализуется. В клинически неотчетливых случаях исследуют активность
щелочной фосфатазы нейтрофилов крови (высокая при реактивных состояниях
и низкая при ХМЛ), при ХМЛ в костном мозге обнаруживают филадельфийскую
хромосому или химерный ген BCR-ABL, а в трепанобиоптате — гиперплазию
кроветворной ткани.Изменениям количественного состава нейтрофилов могут сопутствовать и их
морфологические аномалии: токсическая зернистость (гипертрофированные азу-
рофильные гранулы), вакуолизация цитоплазмы, тельца Князькова-Деле (голубо¬
ватая пятнистость цитоплазмы), пикноз ядер (уплотнение хроматина ядер), лизис
(хроматолиз) ядер.ЛейкопенияЛейкопения — уменьшение количества лейкоцитов в крови менее 4,5х10^/л.
Возникает обычно как следствие нейтропении, абсолютное содержание нейтро¬
филов в крови составляет менее 2,0х10Ул. Падение абсолютного количества ней¬
трофилов ниже 0,5x1 оул обозначают как агранулоцитоз. Лейкопения — показа¬
тель угнетения костномозгового нейтропоэза, тяжести патологического процесса
и низкой реактивности организма. Нейтропения при пониженном содержании
лейкоцитов, палочкоядерном сдвиге, токсигенной зернистости нейтрофилов сви¬
детельствует о резком истощении костномозгового гранулоцитарного резерва и
является крайне неблагоприятным прогностическим признаком, так как всегда
связана с повышенным риском развития инфекции.Снижение продукции нейтрофилов в костном мозге является причиной нейтро¬
пении при апластических состояниях, гетерогенных по своему происхождению и
механизмам развития, для которых ведущими в патогенезе являются поражение
стволовых клеток, повышение супрессорной активности Т-лимфоцитов в отно¬
шении гемопоэза и повышенная способность клеток к апоптозу. Характерными
изменениями в лейкоцитарной формуле при апластических состояниях являются
абсолютная нейтропения и относительный лимфоцитоз.
522 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯСнижение продукции нейтрофилов может быть обусловлено уменьшением
гранулоцитопоэза из-за вытеснения гемопоэтических клеток опухолевыми
клетками при остром лейкозе, фиброзной тканью при миелофиброзе или мета-
стазировании злокачественных новообразований в костный мозг. Угнетение
нейтрофильного гранулоцитопоэза наблюдается при циклической нейтропении
как следствие дефекта продукции КСФ, врожденных нейтропениях (синдро¬
мах Костманна, Чедиака-Хигаси и др.). Клинически нейтропении сочетается
с резкой утомляемостью, гипотоническими состояниями, нарушениями сна,
голоданием, алиментарной дистрофией. Это так называемые функциональные
лейкопении.В основе ряда нейтропений может лежать усиленная внутрикостномозговая
деструкция нейтрофилов — неэффективный гранулоцитопоэз. Классическим
примером его является нейтропения при В,.^- и фолиеводефицитной анемии,
миелодиспластическом синдроме.Нарушение выхода зрелых нейтрофилов из костного мозга в кровь является
причиной нейтропении при синдроме «ленивых лейкоцитов», в основе которого
лежит снижение хемотаксиса клеток, обусловленное дефектом мембраны нейтро¬
филов.Повышенная деструкция нейтрофилов может наблюдаться при различных
состояниях, не связанных с угнетением гранулоцитопоэза. Такие состояния могут
развиваться после переливания крови, содержащей антитела к нейтрофилам.
Трансплацентарный переход антинейтрофильных IgG от матери к плоду может
быть причиной аутоиммунной нейтропении новорожденных. Одной из причин
развития нейтропении и агранулоцитоза является реакция на введение лекар¬
ственных препаратов. Пенициллины, сульфаниламиды, цефалоспорины и другие
препараты могут оказывать прямое токсическое действие на процессы пролифе¬
рации гранулоцитов в костном мозге или индуцировать продукцию аутоиммун¬
ных антител против клеток-предшествен ников нейтрофилов. Фармакологические
препараты могут снижать не только количество нейтрофилов в периферической
крови, но и вызывать их дисфункцию — угнетение хемотаксиса, фагоцитоза,
внутриклеточного киллинга. Лейкопения с нейтропенией и наличием антиней¬
трофильных цитоплазматических антител часто встречается при гранулематозе
Вегенера, язвенном колите. Ускоренное разрушение нейтрофилов происходит
при спленомегалии. Лейкопенией с нейтропенией сопровождаются аутоиммун¬
ные заболевания — ревматоидный артрит, системная красная волчанка, синдром
Фелти.Различные вирусные инфекции могут сопровождаться развитием лейкопении
с нейтропенией. Иногда лейкопения наблюдается при инфекционном моно¬
нуклеозе. Лейкопения с нейтропенией без сдвига лейкоцитарной формулы
влево возможна при хронических заболеваниях желудочно-кишечного тракта
(холецистите, холангите, гастрите, язвенной болезни), тяжелых атипичных фор¬
мах гнойно-септических и воспалительных процессов (хроническом сепсисе),
инфекциях (брюшном тифе, висцеральном лейшманиозе). Нейтропения может
появляться в результате генерализации инфекции, например при милиарном
туберкулезе. Кратковременная перераспределительная нейтропения возможна
при шоковых состояниях, заболеваниях, сопровождающихся выбросом гистами¬
на, при которых наблюдается переход нейтрофилов из циркулирующего пула в
маргинальный.Количественные изменения лейкоцитов могут сопровождаться морфологи¬
ческими аномалиями нейтрофилов в виде асинхронности созревания ядра и
цитоплазмы, нарушения гранулогенеза, дефицита ферментативной активности и
снижения функциональной способности нейтрофилов.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 523
Причины и механизмы развития нейтропений представлены в табл. 7-6.Таблица 7-6. Клинико-диагностическое значение нейтропенииНейтропенииПатогенезЗаболевания и состоянияФункциональныеНедостаточное образование нейтро-
филов из-за угнетающего воздействия
бактериальных токсинов на нейтро-
поэз, в результате активации макро¬
фагов при вирусных и риккетсиозных
инфекцияхБрюшной тиф, паратифы, бруцеллез, туля¬
ремия, подострый септический миокардит,
хронический сепсис, милиарный туберкулез,
тяжелое течение инфекционных заболеваний,
ОРВИ, грипп, вирусный гепатит, цирроз пече¬
ни, сыпной тиф и др.Ареактивное состояниеГипотоническое состояние, голодание, дли¬
тельное недосыпание и стресс, алиментарная
дистрофияПерераспределение нейтрофилов в
органахАнафилактический шок, синдром ФелтиПовышенное разрушение нейтрофилов
иммунного генеза;
гетероиммунные (гаптеновые)Гиперчувствительность к лекарственным пре¬
паратамаутоиммунныеСистемная красная волчанка, ревматоидный
артрит, лимфопролиферативные заболеванияизоиммунныеУ новорожденныхОрганическиеНедостаточность костномозгового
кроветворения Апластическая анемияНедостаточность нейтропоэза при
лейкозахОстрые лейкозы и хронические лимфолейко-
зы, МДСДефицит витамина фолиевой
кислотыМегалобластные анемииНаследственные формыНаследственная доброкачественная нейтро-
пения, циклическая нейтропения, синдром
Чедиака-ХигасиМивлотоксические экзогенные фак¬
торы;цитостатики, ионизирующая радиация,
химические агентыЛучевая болезнь, агранулоцитоз, гипо- и
апластические состоянияЭозинофилияЭозинофилия — увеличение количества эозинофилов в крови более 0,4х10Ул —
характерный признак аллергизации организма (бронхиальная астма, атопические
экземы, сенная лихорадка, пищевая аллергия и др.). Стойкая значительная эозино¬
филия может быть вызвана глистными и паразитарными инвазиями, опухолями,
коллагенезами, иммунодефицитами (гипер-IgE-синдромом). Эозинофилию обна¬
руживают при инфекционных заболеваниях в период развернутой клинической
картины и в фазе выздоровления — скарлатине, инфекционном мононуклеозе,
гонорее. Эозинофилия наблюдается при воспалительных заболеваниях, аутоим¬
мунных процессах, хронических инфекциях (туберкулезе), кожных заболеваниях
(экземе, псориазе, пузырчатке, герпесе, микозах), при которых присоединяется
аллергический компонент (табл. 7-7).Большая эозинофилия (эозинофилов — более ],5х10Ул), продолжающаяся
более 6 мес, при отсутствии известного этиологического фактора расценивает¬
ся как гиперэозинофильный синдром, характеризуемый тяжелыми органными
нарушениями, обусловленными токсическим действием эозинофилов. в случае
обнаружения клонового характера кроветворения может быть диагностирован
хронический эозинофильный лейкоз.
524 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯТаблица 7-7. Клинико-дагностическое значение эозинофилииПатогенезЗаболеванияИнвазия паразитамиАскаридоз, трихинеллез, токсокароз, зхинококкоз, шистосоматоз, филяриа-
тоз, стронгилоидоз, описторхоз, анкилостомидоз, ЛЯМбЛЙОЗОпухолевая пролиферация
(повышенная продукция
ИЛ-5)Гиперэозинофильный синдром, лимфогранулематоз, острые и хронические
лейкозы, лимфомы, злокачественные новообразования других локализа¬
ций, сопровождаемые метастазами или некрозом Сенсибилизация организмаЛекарственная аллергия, бронхиальная астма, аллергические дерматиты,
ринит, инфекционный эозинофилез и др. ИммунодефицитыСиндром Вискотта-Олдрича и др.Патология соединительной
тканиУзелковый периартериит, ревматоидный артрит, системная склеродермия,
эозинофильный фасциитИнфекцииТуберкулез, хламидийная пневмонияИнтерстициальные и другие
заболевания легкихСаркоидоз, гистиоцитоз из клеток Лангерганса, эозинофильный плеврит,
легочный эозинофильный инфильтрат (болезнь Леффлера), хроническая
эозинофильная пневмонияЭозинопенияЭозинопения — уменьшение количества эозинофилов в крови менее 0,2х10Ул
(или анэозинофилия — отаггствие эозинофилов в крови). Эозинопения встречает¬
ся на первом этапе воспалительного процесса, при тяжелых гнойных инфекциях,
шоке, стрессе, эклампсии, родах, интоксикациях химическими соединениями,
тяжелыми металлами, в послеоперационном периоде.Оценка динамики изменения количества эозинофилов в течение воспалитель¬
ного процесса имеет прогностическое значение. Эозинопения соответствует началу
воспаления, восстановление количества эозинофилов, или эозинофилия, — началу
выздоровления. Однако ряд инфекционных и других заболеваний с высоким уров¬
нем IgE характеризуются эозинофилией после окончания воспалительного про¬
цесса, что указывает на незаконченность иммунной реакции с ее аллергическим
компонентом. В то же время снижение количества эозинофилов в активной фазе
заболевания часто свидетельствует о тяжести процесса и является неблагоприят¬
ным признаком. В целом изменение количества эозинофилов в периферической
крови является результатом дисбаланса процессов продукции клеток в костном
мозге, их миграции и распада в тканях.БазофилияБазофилия — увеличение количества базофилов в крови более 0,2х10ул.
Базофилы и тучные клетки участвуют в клеточных воспалительных реакциях замед¬
ленного типа в коже и других тканях, вызывая гиперемию, формирование экссудата,
повышенную проницаемость капилляров. Эти клетки служат основным источни¬
ком медиаторов, запускаюш;их анафилактическую реакцию гиперчувствительности
немедленного типа. Дегрануляция базофилов и выделение ими в кровь биологиче¬
ски активных веществ, в том числе фактора хемотаксиса эозинофилов, сопровожда¬
ется повышением эозинофилов, которое встречается везде, где имеется увеличение
количества тучных клеток или повышение их активности. Увеличение содержания
базофилов может происходить в секретах дыхательных путей при аллергии, в
почках при хроническом интерстициальном нефрите и отторжении транспланта¬
та, при контактном дерматите, хроническом язвенном колите. Базофилия может
наблюдаться при аллергических заболеваниях, в ранней фазе ревматизма, при хро¬
ническом миелоидном лейкозе, миелофиброзе, эритремии. Тучноклеточный лейкоз
сопровождается увеличением тучных клеток в костном мозге и крови.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 525Моноцитоз и моноцитопенияМоноцитоз — увеличение количества моноцитов в крови более 0,8х10Ул.
Реактивный моноцитоз может развиваться при состояниях, характеризуемых
персистенцией антигена в организме (табл. 7-8): при хронических длительных
инфекциях, аутоиммунных заболеваниях, реактивных гистиоцитозах, опухолях.
Дифференциальную диагностику проводят с острыми лейкозами, имеющими
характерные изменения в костном мозге, и хроническими моноцитарными и мие-
ломоноцйтарными лейкозами. Диагноз хронического лейкоза может быть постав¬
лен после тщательного обследования пациента и исключения всех возможных
причин, способных вызвать реактивный моноцитоз.Моноцитопения — снижение количества моноцитов в крови менее 0,09х10Ул,
встречается при гипоплазии кроветворения.Таблица 7-8. Клинико-диагностическое значение моноцитозаМоноцитозРеаіаивньїй {усиление
пролиферации в кост¬
ном мозге клеточных
элементов моноцито-
позза)ОпухолевыйЗаболеванияИнфекции {подострый септический эндокардит, вирусные, грибковые, риккетси-
озные, протозойные), период реконвалесценции после острых инфекций.
Хронические инфекции, сопровождаемые эпителиоидноклеточной пролифера¬
цией с образованием гранулем (туберкулез, сифилис, бруцеллез, саркоидоз).
Хронические заболевания кишечника (язвенный колит).Системная красная волчанка, ревматоидный артрит, узелковый периартериитштОстрые и хронические моноцитарный и миеломоноцитарный лейкозыЛимфоцитозЛимфоцитов — увеличение количества лимфоцитов в крови более 4х10ул.
Основными причинами реактивного лимфоцитоза являются вирусные инфекции,
хронические бактериальные инфекции, токсоплазмоз (табл. 7-9). При инфекци¬
ях большинство лимфоцитов представлено широкоцитоплазменными клетками,
встречаются иммунобласты, лимфоциты с базофильной цитоплазмой (активиро¬
ванные лимфоциты), плазмоциты. Относительный лимфоцитоз с нейтропенией
характерен для кори, при этом может сохраняться нормальное количество лей¬
коцитов. Заболевания соединительной ткани (ревматизм, ревматоидный артрит,
системная красная волчанка, склеродермия и др.) сопровождаются лимфоцито-
зом, среди лимфоцитов встречаются широкоцитоплазменные и плазматизиро-
ванные клетки, увеличено количество плазмоцитов. Характерная клиническая
картина и детский возраст пациентов исключают хронический лимфолейкоз.
В неясных случаях при иммунофенотипировании выявляют поликлональный
характер лимфоцитоза при реактивных состояниях и моноклональный — при ХЛЛ
(CD19^CD23"CD5“) или лейкемизации лимфом.Таблица 7-9. Клинико-диагностическое значение лимфоцитозаЛимфоцитозЭтиологический факторЗаболеванияРеактивный (поли¬
клональный)ВирусИнфекционный мононуклеоз, инфекционный лимфоцитоз,
ветряная оспа, коклюш, корь, краснуха, острый и хрониче¬
ский вирусный гепатит, цитомегаловирусная инфекция, ВИЧБактерииХронические бактериальные инфекции, сопровождаемые
образованием эпителиоидноклеточной гранулемы (тубер¬
кулез, сифилис, бруцеллез и др.)Паразитарный антигенТоксоплазмозИммунопатологическийпроцессАутоиммунные нейтропенииОпухолевый(монокпональный)Опухолевая пролифе¬
рацияЛимфопролиферативные заболевания
526 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯИНФЕКЦИОННЫЙ ЛИМФОЦИТОЗпрактически бессимптомная вирусная инфекция маленьких детей, протекающая
с кратковременным (5-7 дней) лимфоцитозом, однако уровень лейкоцитов при
этом может достигать 30-50х10ул, а доля лимфоцитов - составлять 70-80%.ИНФЕКЦИОННЫЙ МОНОНУКЛЕОЗОстрое вирусное заболевание (воздушно-капельная инфекция) с выраженной бласт-
т^эансформацией лимфоцитов, появлением этих клеток в крови, реактивным лимфа¬
денитом. Встречается обычно в возрасте 3-20 лет (пик — 15-20 лет). Инфекционный
мононуклеоз вызывается вирусом Эпштейна-Барр. Этот В-лимфотропный вирус
инфицирует В-лимфоциты через поверхностные антигены CD21, вызывая их проли¬
ферацию, пожизненно персистирует в В-лимфоцитах, обусловливая развитие прочно¬
го нестерильного иммунитета. К 25 годам 85% людей инфицированы вирусом. Дети
до 6 мес невосприимчивы из-за наличия пассивного иммунитета, в возрасте до 3 лет
первичное инфицирование протекает под маской ОРВИ,При заражении происходит репликация вируса в верхних отделах дыхательных
путей и в ассоциированной лимфоидной ткани с развитием местных воспалитель¬
ных реакций (ангина) и лихорадочного состояния. При заболевании происходит
пролиферация реактивных Т-лимфоцитов, а также пораженных и реактивных
В-лимфоцитов в лимфатической ткани, что приводит к развитию характерных
симптомов: затрудненному носовому дыханию, увеличению затылочных, задне¬
шейных, затем всех групп лимфатических узлов, селезенки, выходу активирован¬
ных клеток в кровь, появлению желтухи.Диагностика основывается на сочетании ведущих клинических симптомов (лихо¬
радки, ангины, увеличения лимфатических узлов и селезенки) с характерной гемато¬
логической картиной (лимфоцитозом, более 10% атипичных мононуклеаров в 2 ана¬
лизах с интервалом более 5 дней). При этом учитывают возраст пациента и динамику
количества атипичных мононуклеаров: они нарастают к 10-му дню болезни, сни¬
жаются медленно, на протяжении месяцев. Доля атипичных мононуклеаров может
варьировать и достигать 60-80% в разгар заболевания с постепенным снижением по
мере выздоровления. Для инфекционного мононуклеоза в период реконвалесценции
характерны эозинофилия и моноцитоз, увеличение СОЭ, Заболевание длится 3-4 нед
с длительным астеническим синдромом после выздоровления. Используют также
серологическую диагностику в качестве скрининга — выявление гетерофильных
антител к эритроцитам барана или лошади и специфическ}то диагностику — выявле¬
ние антител класса IgM к капсидным антигенам вируса, что указывает на первичную
инфекцию, к ядерным - на уже имеющееся инфекционное заболевание.Атипичные мононуклеары (реактивные или активированные лимфоциты) —
это бласттрансформированные лимфоциты, в большинстве своем реактивные
Т-лимфоциты, обеспечивающие противовирусную защиту, а также пролифери¬
рующие В-лимфоциты. Им присущи выраженные анизоцитоз и полиморфизм:
различное ядерно-цитоплазматическое соотношение; разнообразная форма ядра,
часто моноцитоидная: сглаженное, гомогенное строение хроматина; различная по
объему и окраске цитоплазма, обычно с выраженной краевой базофилией.Атипичные мононуклеары характерны не только для инфекционного монону¬
клеоза, количество их возрастает при любых вирусных инфекциях (ОРВИ, гриппе,
гепатите, цитомегаловирусной инфекции, герпесе, некоторых детских инфекциях),
других инфекциях невирусной природы (иерсиниозе, токсоплазмозе, хламидиозе),
вакцинациях, аутоиммунных заболеваниях, лекарственной непереносимости, опу¬
холях. Дифференциальную диагностику проводят с у^іетом клинической картины,
возраста, результатов серологических исследований. Во всех случаях инфекцион¬
ного мононуклеоза рекомендуют обязательное исследование на ВИЧ-инфекцию,
так как при ВИЧ-инфекции нередки случаи мононуклеозоподобного синдрома —
увеличения лимфатических узлов и количества мононуклеаров в крови.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 527ЛимфоцитопенияЛимфоцитопения — уменьшение количества лимфоцитов менее Іхіоул,
наблюдается при острых инфекционных заболеваниях, милиарном туберкулезе
(висцеральная форма), системной красной волчанке, почечной недостаточно¬
сти, в терминальной стадии злокачественных новообразований, лимфограну¬
лематозе, как ранний признак острой лучевой болезни, в терминальной стадии
СПИДа, вторичных иммунодефицитах. У детей и подростков лимфоцитопения
возможна в результате аллергизации организма и при наследственном иммуно¬
дефиците.ЭритроцитозЭритроцитоз — увеличение количества эритроцитов крови более бхЮ^Ул у
мужчин и более 5х10^Ул у женщин, эритроцитоз может быть реактивным (вто¬
ричным, или симптоматическим) и опухолевым (первичным). Различают абсо¬
лютные (первичные и вторичные, или симптоматические) эритроцитозы, вызван¬
ные усилением эритропоэза, и относительные, характеризуемые уменьшением
объема плазмы (табл. 7-10). Реактивный эритроцитоз развивается вследствие
гиперпродукции эритропоэтина (ЭПО) в ответ на тканевую гипоксию, опухо¬
ли. поликистоз почек, стеноз почечной артерии, гидронефроз и т.д. Повышение
выработки ЭПО является важным критерием дифференциации реактивного эри-
троцитоза от эритремии, при которой уровень ЭПО не увеличен, а усиленный эри-
тропоэз — результат неконтролируемого опухолевого роста. Эритремию можно
предполагать, когда исключены все возможные причины симптоматических, или
реактивных, эритроцитозов. В пользу эритремии свидетельствуют спленомегалия,
обнаружение клональных генетических аномалий, лейкоцитоз выше 12х10Ул при
отсутствии инфекций, тромбоцитоз выше 400х10Ул.Таблица 7-10. Клинико-диагностическое значение эритроцитозовОсновные патогенетические группыКлинические формы (ситуации)Абсолютные эритроцитозы (обусловленные
повышенной продукцией эритроцитов)
Первичный эритроцитоз
Симптоматические эритроцитозы:• вызванные общей гипоксией• вызванные локальной гипоксией почек• вызванные повышенной продукцией ЭПО
опухолями• связанные с избытком гормонов коры надпо¬
чечников или андрогеновЭритремияЗаболевания легких, врожденные «синие» пороки серд¬
ца, курение (карбоксигемоглобинемия), гемолитические
анемии, обусловленные носительством аномальных
гемоглобинов, пребывание на больших высотах, синдром
Пиквика (ожирение), ИБС. постинфарктные состоянияГидронефроз и поликистоз почек, стеноз почечной
артерииГипернефроидный рак, гепатома, рак яичников, ангио-
бластома мозжечкаСиндром Иценко-Кушинга, феохромоцитома, гипераль-
достеронизмОтносительные эритроцитозы (вследствие гемо¬
концентрации)Потеря жидкости организмом (потоотделение, рвота,
диарея, ожоги, прием диуретиков, алкоголизм), стрессСмешанный эритроцитоз (вследствие сгущения
крови и плацентарной трансфузии)Физиологический эритроцитоз новорожденныхКоличество ретикулоцитов отражает скорость продукции эритроцитов в кост¬
ном мозге, поэтому их подсчет имеет значение для оценки степени активности
эритропоэза.
ш528 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯРетикулоцитоз (увеличение количества ретикулоцитов в крови более 80-90х10ул,
или более 1,2%) наблюдается при постгеморрагической анемии, гемолизе, тера¬
пии ЭПО, витамином фолиевой кислотой и других состояниях. Для проведе¬
ния допингового контроля у спортсменов предлагают использовать показатели
гематокрита и ретикулоцитов. Подозрением на прием рекомбинантного ЭПО
(рЭПО) являются ретикулоцитоз более 2,4% и гематокрит более 47%. Наиболее
чувствительным индикатором успешной трансплантации костного мозга считается
увеличение фракции незрелых ретикулоцитов более чем на 20%, которое часто
предшествует повышению количества нейтрофилов.Ретикулоцитопения имеет место при апластической анемии, парциальной крас¬
ноклеточной аплазии, метастазах рака в костный мозг, лейкозах, снижении уровня
ЭПО, неэффективном эритропоэзе, миелодиспластическом синдроме.ЭритроцитопенияЭритроцитопения — снижение количества эритроцитов в крови менее 4,0х10^Ул.
Эритроцитопения может развиться вследствие различных причин: кровопотери,
нарушенного кровообразования (апластических анемий), повышенного гемолиза
эритроцитов (эритроцитопатии, ферментопатии, гемоглобинопатии); радиаци¬
онного облучения; заболеваний печени, почек; гиперспленического синдрома;
дефицита гемопоэтических факторов (железа, витамина В^2« фолиевой кислоты);
гипергидратации; инфекций, в первую очередь хронических, и, в частности, тубер¬
кулеза. Эритроцитопения часто сопровождается неэффективным эритропоэзом,
который проявляется повышенным содержанием и дисплазией эритрокариоцитов
в костном мозге, накоплением в них ШИК-положительного материала и гранул
железа, повышенным апоптозом, ретикулоцитопенией.ТромбоцитозТромбоцитоз — увеличение количества тромбоцитов в крови более 400х10Ул.
Тромбоцитоз может быть первичным — в результате опухолевой пролифера¬
ции мегакариоцитов при хронических миелопролиферативных заболеваниях
(ХМПЗ) (эссенциальной тромбоцитемии, идиопатическом миелофиброзе, ХМЛ,
эритремии) и вторичным, или реактивным (табл. 7-11). Реактивный тромбоцитоз
возможен при злокачественных новообразованиях, воспалительных заболевани¬
ях, после кровотечений, гемолитических кризов, оперативных вмешательств и
спленэктомии. Первичный тромбоцитоз вследствие ХМПЗ предполагают после
исключения возможных причин реактивного тромбоцитоза. При остром и хро¬
ническом мегакариоцитарных лейкозах увеличение количества тромбоцитов
может быть до нескольких миллионов (гипертромбоцитоз). Большая масса клеток
приводит к микроциркуляторным нарушениям в результате свертывания крови с
последующим развитием геморрагического синдрома. Шпертромбоцитоз, кото¬
рый сопровождается геморрагическим синдромом, называют геморрагической
тромбоцитемией.Таблица 7-11. Клинико-диагностическое значение тромбоцитозовТромбочитоэыЗаболевания и синдромыРеактивныеСпленэктомия, острая кровопотеря и острый гемолиз, после операции, злокаче¬
ственные новообразования, ревматоидный артрит, туберкулез, язвенный колит,
остеомиелит и др.ОпухолевыеМиелопролиферативные заболевания (хронический миеяолейкоз, миелофиброз,
эритремия, мегакариоцитарный лейкоз, идиопатическая геморрагическая тромбо-
цитемия)
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ529ТромбоцитопенияТромбоцитопения — уменьшение количества тромбоцитов в крови менее
150x1 ОУл, Тромбоцитопении представляют собой заболевания или синдромы,
которые являются результатом недостаточного образования, повышенного раз¬
рушения или потребления тромбоцитов (табл. 7-12). Различают наследственные и
приобретенные тромбоцитопении.Таблица 7-12. Клинико-диагностическое значение тромбоцитопенииПатогенезКлинические ситуации и патологические состоянияНедостаточное образование
тромбоцитовГипо- и аппастические состояния, лейкозы, метастазы рака в костный мозг,
ионизирующее облучение, химиотерапия, дефицит витамина Вірили фолие¬
вой кислоты, вирусные инфекции, сепсис, милиарный туберкулез и др.Повышенное потребление тром¬
боцитовКровопотеря, две, гигантская гемаигиома, тромбоз, геморрагическая
тромбоцитемияПовышенная деструкция тром¬
боцитовАутоиммунные и иммунные гемолитические анемии, изоиммунные, гете-
роиммунные (гаптеновые), лекарственные, вирусные, лимфопролифера-
тивные заболевания, системная красная волчанка, поспрансфузионные
реакции. ПНГ и др. Механические повреждения
тромбоцитовПротезирование клапанов сердца, экстракорпоральное кровообращениеЭкзогенная интоксикацияХимические вещества, лекарственные препараты, алкоголь, сепсисЭндогенная интоксикацияУремия, тяжелые заболевания печениПовышенная секвестрация в
селезенке (гиперспленизм)Спленомегалия при циррозе печени, синдроме портальной гипертензии,
гистиоцитозах, болезнях накопления, синдроме Фелти, туберкулезе
селезенки, миелопролиферативных заболеваниях, талассемии Приобретенные тромбоцитопении наблюдаются при гиперспленизме, инфек¬
ционных заболеваниях, хронической интоксикации любого генеза, гипер- и мета-
пластических поражениях костного мозга, лучевой и цитостатической терапии и
сопровождаются геморрагическим синдромом. Среди приобретенных тромбоци-
топений наиболее часто встречаются иммунные и аутоиммунные.Иммунные тромбоцитопении — это группа заболеваний, при которых снижение
в крови количества тромбоцитов обусловлено продукцией антитромбоцитарных
ауто- или аллоантител и ускоренным разрушением сенсибилизированных тромбо¬
цитов в ретикулоэндотелиальной системе. В зависимости от механизма выработки
антитромбоцитарных антител различают несколько форм иммунных тромбоцито-
пений (табл. 7-13).Таблица 7-13. Иммунные тромбоцитопенииЗаболеваниеХарактеристика антитромбоцитарных антителИдиопатическая (аутоиммунная) тромбо-
цитопеническая пурпураАутоантитеяа против неизмененных антигенов тромбоцитов
больного (обычно гликопротеинов lib и 1Па и гликопротеинов 1Ь)Гаптеновая (гетероиммунная) тромбо¬
цитопенияГаптеновые аутоантитела против измененных или чужеродных
антигенов на поверхности тромбоцитовЛекарственная тромбоцитопенияАнтитела против комплекса лекарств (хинина, гепарина) с тром-
боцитарным антигеномТромбоцитопения, ассоциированная с
вирусной инфекциейАнтитела против вирусных антигенов, фиксированных на
поверхности тромбоцитов, или против измененных тромбоци-
тарных антигеновАплоиммунная тромбоцитопенияАллоантитела против аллоантигенов тромбоцитов плода или
переливаемых тромбоцитовНеонатальная аллоиммунная тромбоци-
топеническая пурпураАллоантитела матери, проникшие в организм плода, направ¬
ленные против аллоантигенов тромбоцитов плода и отца, отсут¬
ствующих на тромбоцитах матери
530 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯЭтиологический фактор идиопатических тромбоцитопений неизвестен.
Характерны увеличение количества мегакариоцитов, нормальная скорость про¬
дукции тромбоцитов и резко укороченная продолжительность их жизни. Для
определения времени жизни тромбоцитов в кровотоке используют определение
времени циркуляции радиоактивно-меченых тромбоцитов (^^Сг-меченых тромбо¬
цитов). Это состояние часто проявляется как тромботическая тромбоцитопениче-
ская пурпура и гемолитико-уремический синдром.Изменения морфологии тромбоцитов и показателей гемостаза при тромбоцито-
пениях независимо от генеза довольно однотипны. Отмечаются анизоцитоз тром¬
боцитов, атипичные и гигантские формы, небольшая азурофильная зернистость
или полное отсутствие грануломера, базофилия цитоплазмы, так называемые
голубые пластинки.ТромбоцитопатииТромбоцитопатии — патологические состояния, которые сопровождаются кро¬
вотечениями из-за нарушения функции тромбоцитов даже при их нормальном
содержании в крови (тромбоцитарные дефекты). Тромбоцитопатия может быть
наследственной или возникать в результате действия повреждающих факторов
на сами тромбоциты, мегакариоцитарный росток костного мозга или на процес¬
сы секвестрации тромбоцитов. Тромбоцитарные нарушения могут сопутствовать
миелопролиферативным заболеваниям, уремии, патологии печени, парапро-
теинемии, быть проявлением ДВС-синдрома или передозировки нестероидных
противовоспалительных препаратов, аспирина. Среди приобретенных нарушений
гемостаза наиболее распространенным заболеванием является тромбоцитопения
изолированная или комбинированная с другими нарушениями. Заболевания
сопровождаются нарушением микроциркуляции и петехиально-пятнистым типом
кровоточивости.Реакция крови на опухолиЛейкемоидные реакции на опухоль могут быть весьма разнообразными: одно-
ростковыми (например, нейтрофилез, моноцитоз, эозинофилия, эритроцитоз или
тромбоцитоз) или двухростковыми (нейтрофилез и тромбоцитоз, эритроцитоз
и моноцитоз или другие сочетания). При милиарных метастазах в костный мозг
наблюдается картина миелемии («костного мозга в крови»): наряду с нейтро-
филезом и выраженным сдвигом лейкоцитарной формулы влево до миелоцитов,
промиелоцитов и реже бластных форм в крови обнаруживают много эритрока-
риоцитов (более 20:100 лейкоцитов). Количество лейкоцитов при этом сильно
варьирует от выраженной лейкопении до гиперлейкоцитоза. Обычно выражены
анемия с ретикулоцитопенией и тромбоцитопения. Подобная же картина может
наблюдаться при остром эритромиелозе и иммунном гемолизе. Диагноз становит¬
ся очевидным при обнаружении раковых клеток в пунктате или трепанобиоптате
костного мозга,АНЕМИИАнемия — состояние, характеризуемое снижением концентрации гемоглобина и
в большинстве слу^іаев количества эритроцитов и гематокрита в крови.Критериями ВОЗ для диагностики анемии считаются:• у мужчин количество эритроцитов — менее 4х10умкл, НЬ — менее 130 г/л,
нет менее 39%;
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 531• у женщин количество эритроцитов — менее 3,8х10умкл, НЬ — менее 120 г/л,нет — менее 36%;• у беременных НЬ — менее 110 г/л, Ht — менее 33%.Анемия может быть относительной, вызванной увеличением объема плазмы
(гемодилюцией, гиперволемией), и абсолютной, обусловленной изменением коли¬
чества циркулирующих эритроцитов. Относительная анемия наблюдается при
беременности, сердечной недостаточности, трансфузии кровезаменителей, острой
кровопотере. Гемодилюция сопровождается снижением количества эритроцитов и
содержания гемоглобина в единице объема при сохранении общей массы эритро¬
цитов. Анемия может маскироваться при состояниях, сопровождаемых сгущением
крови (обильной рвоте, профузной диарее и др.).Анемии разнообразны по происхождению и часто имеют смешанный патогенез.
В большинстве случаев анемия — не самостоятельная нозологическая форма, а
проявление основного заболевания. Она сопутствует диффузным болезням соеди¬
нительной ткани, заболеваниям желудочно-кишечного тракта, печени, почек,
злокачественным новообразованиям, хроническим инфекционным заболеваниям
и воспалительным процессам.Большое разнообразие факторов, лежащих в основе развития анемий, затрудня¬
ет их дифференциальную диагностику. На первом этапе диагностического поиска
основной целью является определение патогенетического варианта анемии, т.е.
основного механизма, обусловливающего уменьшение количества эритроцитов и
гемоглобина. На следующем этапе диагностика заболевания направлена на уста¬
новление патологического процесса, лежащего в основе анемического синдрома.
Эти этапы диагностики анемий базируются на данных лабораторного исследова¬
ния и зависят во многом как от уровня и качества проведенных исследований, так
и от гфавильной интерпретации полученных результатов.Наиболее признанной является классификация анемий по этиологии и патоге¬
незу, получившая название «патогенетическая».Патогенетическая классификация анемийАнемии, обусловленные кровопотерей (постгеморрагические анемии).• Острая постгеморрагическая анемия.• Хроническая постгеморрагическая анемия.Анемии, обусловленные недостаточностью эритропоэза.• Гипохромные анемии.❖ Железодефицитная анемия.❖ Анемии, связанные с нарушением синтеза порфиринов.• Нормохромные анемии.❖ Анемии хронических заболеваний.<0- Анемия при хронической почечной недостаточности.❖ Апластические анемии.Анемии при опухолевых и метастатических поражениях костного мозга.• Мегалобластные анемии,❖ Анемии, обусловленные дефицитом витамина<> Фолиеводефицитные анемии.Анемии, обусловленные усиленным разрушением эритроцитов (гемолитиче¬
ские анемии).• Анемии, обусловленные внеэритроцитарными факторами.о Иммунные гемолитические анемии.- Изоиммунные гемолитические анемии.- Аутоиммунные гемолитические анемии.
532ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ❖ Гемолитические анемии, обусловленные механическим повреждением
эритроцитов.• Анемии, обусловленные эритроцитарными факторами.❖ Гемолитические анемии, связанные с нарушением структуры мембраны
эритроцитов (эритроцитопатии — наследственные и приобретенные).- Микросфероцитарная гемолитическая анемия.- Овалоцитарная гемолитическая анемия.- Стоматоцитарная гемолитическая анемия.- Гемолитические анемии, обусловленные нарушением структуры липи¬
дов мембраны эритроцитов (акантоцитоз).❖ Гемолитические анемии, обусловленные дефицитом ферментов эритроци¬
тов (эритроцитарные ферментопатии).- Гемолитические анемии, связанные с недостаточностью активности
ферментов гликолиза.- Гемолитические анемии, связанные с недостаточностью активности
ферментов пентозофосфатного шунта.- Гемолитические анемии, связанные с недостаточностью активности
ферментов глутатионовой системы.-о- Гемолитические анемии, связанные с нарушенным синтезом глобина
(гемоглобинопатии).- Талассемии.- Гемолитические анемии, обусловленные носительством аномального
гемоглобина (HbS, HbC, HbD, НЬЕ и др.).- Гемолитические анемии, обусловленные носительством аномальных не¬
стабильных гемоглобинов.• Гемолитическая анемия, обусловленная соматической мутацией клеток-
предшественников миелопоэза.<0^ Пароксизмальная ночная гемоглобинурия.Несмотря на многообразие анемий, для большинства из них характерно нали¬
чие общих клинических и лабораторных симптомов. Общими клиническими
симптомами являются слабость, повышенная утомляемость, бледность кожи и
слизистых оболочек, одышка, головокружение, сердцебиение.Общим лабораторным показателем анемий является снижение количества эри¬
троцитов и содержания гемоглобина в единице объема крови ниже нормальных
величин. Наряду с общими клинико-лабораторными симптомами каждая из ане¬
мий имеет свои специфические признаки.Анемии, обусловленные кровопотерей
(постгеморрагические анемии)ОСТРАЯ ПОСТГЕМОРРАГИЧЕСКАЯ АНЕМИЯОстрая постгеморрагическая анемия — патологическое состояние, развиваю¬
щееся в организме после быстрой потери значительного объема крови.Возникающая гиповолемия определяет снижение объема циркулирующей
крови (ОЦК) и вызывает последовательную активацию механизмов, направлен¬
ных на восстановление кровопотери. Вследствие этого в развитии анемии выделя¬
ют определенные стадии (фазы).Рефлекторно-сосудистая компенсация кровопотери возникают сразу после
кровопотери (рефлекторно-сосудистая фаза), развиваются гиповолемия (сниже¬
ние ОЦК) и гипоксия. Это приводит к спазму периферических сосудов, открытию
артериоло-венулярных шунтов и перераспределению крови из сосудов кожи,
подкожно-жировой клетчатки и мышц в центральные кровеносные сосуды, кро¬
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ533воснабжающие сердце, мозг, почки, печень. Средняя продолжительность фазы
составляет до 8-12 ч.Оценка лабораторных показателей в начальном периоде острой кровопотери
может быть необъективной, в стадию рефлекторно-сосудистой компенсации
количество эритроцитов, содержание гемоглобина и уровень гематокрита фак¬
тически не меняются, однако ОЦК снижен. В первые часы после кровопотери
возможно развитие перераспределительного лейкоцитоза и тромбоцитоза (до
400-500х10Ул), Это обусловлено выходом в кровоток депонированного в кро¬
веносных сосудах пристеночного пула лейкоцитов и выходом тромбоцитов из
селезенки.Гидремическая компенсация кровопотери (гидремическая фаза) длится в тече¬
ние нескольких дней, в организме усиливается выработка ренина, ангиотензина II,
альдостерона, что приводит к задержке натрия, а в дальнейшем, через стимуля¬
цию секреции антидиуретического гормона, — к удержанию воды в организме.
Сохраняющаяся гипоксия определяет повышение проницаемости клеточных мем¬
бран, что способствует выходу компонентов тканевой жидкости в сосудистое русло
и воды с восстановлением ОЦК.происходящее «разжижение» крови определяет изменение показателей общего
анализа крови - снижаются количество эритроцитов, концентрация гемоглоби¬
на и уровень гематокрита. Значение МСН существенно не меняется, поскольку в
единице объема крови снижено содержание как эритроцитов, так и гемоглобина.
Общее количество лейкоцитов также уменьшается, что обусловлено кровопотерей
и гемодилюцией. Увеличение ОЦК приводит и к снижению количества тромбо¬
цитов, усугубляющееся повышенным их потреблением в процессах тромбообра-
зования.Костномозговая компенсация (костномозговая фаза) развивается через 3-4 сут
после кровопотери, сопровождается активацией костномозгового кроветворения,
в патогенезе активации которого ведущее значение имеет повышение выработки
эритропоэтина. Количество эритроцитов достигает нормальных величин преиму¬
щественно благодаря ретикулоцитам, уровень которых может достигать 2-10% и
более. При значительной кровопотере в крови могут появляться единичные нор-
мобласты, полихромазия, а также анизоцитоз, который обусловлен повышением
интенсивности терминального эритропоэза и продукцией эритроцитов с большим
диаметром. На 4-7-й день после кровотечения выявляется умеренный нейтро-
фильный лейкоцитоз (12-20х10ул) со сдвигом лейкоцитарной формулы влево.
Количество тромбоцитов может увеличиваться. Компенсация возможна в сл^^ае
кровопотери, равной 10-25% ОЦК. При объеме кровопотери свыше 25% ОЦК на
фоне выраженной гиповолемии снижается артериальное давление, нарушается
капиллярный кровоток, развиваются гипоксия, сердечно-сосудистая недостаточ¬
ность и шоковое состояние.При острой постгеморрагической анемии наблюдаются изменения и биохими¬
ческих показателей, в частности снижение содержания железа в сыворотке крови
вследствие повышенного его использования эритроидными клетками костного
мозга. Развивающаяся при кровопотере гипоксия ведет к накоплению в организ¬
ме недоокисленных продуктов обмена веществ и ацидозу. В крови увеличивается
содержание калия, магния, неорганического фосфора, хлора. В период гемодилю-
ции возможна гипопротеинемия, исчезающая на 3-4-й день.Внутреннее кровотечение часто сопровождается повышением содержания в
крови неконъюгированного билирубина, что обусловлено разрушением эритро¬
цитов, высвобождением гемоглобина и последующей его утилизацией клетками
РЭС. При низком артериальном давлении в крови увеличивается уровень азота
мочевины из-за уменьшения почечного кровотока.
^ . 534 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯХРОНИЧЕСКАЯ ПОСТГЕМОРРАГИЧЕСКАЯ АНЕМИЯХроническая постгеморрагическая анемия — патологическое состояние, воз-
‘г, никающее в результате постоянно повторяющейся потери малого количествакрови на протяжении длительного времени (язвенная болезнь желудка и двенад¬
цатиперстной кишки, геморрой и др.)- Анемия имеет продолжительный скрытый
период, при котором отсутствуют какие-либо выраженные изменения гематоло¬
гических и биохимических показателей. Тем не менее для полноценной продук¬
ции эритроцитов необходимо железо, поскольку увеличивается утилизация его
клетками эритропоэза. При отсутствии компенсации повышенного потребления
железа сначала развивается железодефицитное состояние, а затем железодефицит¬
ная анемия. Именно поэтому основные клинические и лабораторные симптомы
хронической постгеморрагической анемии соответствуют аналогичным показате¬
лям при железодефицитной анемии.Анемии, обусловленные недостаточностью эритропоэза
Гипохромные анемииЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯЖелезодефицитная анемия (ЖДА) — заболевание, обусловленное недостатком
железа в организме, что вызывает нарушение синтеза гемоглобина и других желе¬
зосодержащих белков. По данным ВОЗ (2006), около 30% населения Земли имеют
дефицит железа разной степени, который может быть вызван множеством причин.
Ведущими из них являются хроническая кровопотеря (меноррагия, метроррагии,
донорство, желудочно-кишечные кровотечения), повышенная потребность орга¬
низма в железе (беременность, лактация, быстрый рост и др.), недостаточность
поступления железа с пищей, нарушения всасывания железа в ЖКТ.Клинические проявленияВыделяют несколько стадий железодефицитного состояния: предлатентный,
латентный дефицит железа, собственно железодефицитная анемия.В первую очередь снижается содержание депонированного железа в органах и
тканях, затем транспортного железа, позже — железа гемсодержащих ферментов и
затем железа, необходимого для синтеза гемоглобина,Предлатентный дефицит железа — состояние, которое сопровождается увеличе¬
нием всасывания железа в желудочно-кишечном тракте. Клинические симптомы
отсутствуют. Лабораторные показатели (картина периферической крови, показа¬
телей обмена железа) остаются в пределах нормы. Единственный метод, позво¬
ляющий определить эту стадию, — радиоизотопный, позволяющий обнаружить
повышенную абсорбцию в кишечнике.Латентный (скрытый) дефицит железа сопровождается сидеропеническим син¬
дромом, обусловленным тканевым дефицитом железа. Он включает следующие
симптомы: сухость кожи, изменения ногтей (ломкость, слоистость, исчерченность,
«койлонихии» - ногти ложкообразной формы), сглаженность сосочков языка,
ангулярный стоматит («заеды» в углах рта), извращение вкуса и обоняния, кари¬
ес, мышечную слабость, отставание в физическом и психическом развитии детей.
Лабораторные показатели метаболизма железа на этой стадии характеризуются
гипоферритинемией, снижением концентрации сывороточного железа, увеличе¬
нием содержания трансферрина и растворимых рецепторов для трансферрина,
а также увел№іением общей железосвязывающей способности (ОЖСС). В кост¬
ном мозге развивается железодефицитный эритропоэз, который характеризуется
снижением количества сидеробластов, отсутствием в макрофагах гемосидерина
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 535(отрицательная реакция Перлса). Однако синтез гемоглобина на этой стадии не
нарушен, и эритроцитарные показатели (НЬ, RBC, MCV, МСН, МСНС) сохраня¬
ются в пределах нормы, В случае незначительного снижения MCV, МСН и повы¬
шения RDW при нормальной концентрации гемоглобина можно предположить
латентный дефицит железа и исследовать содержание ферритина в сыворотке
крови. При трансформации латентного дефицита железа в железодефицитную
анемию повышение RDW может предшествовать изменениям других эритроци-
тарных параметров.Железодефицитная анемия проявляется гипоксическим и сидеропеническим
синдромами. Дефицит железа в организме приводит к нарушению функции имму-
нокомпетентных клеток и клеточных механизмов иммунорезистентности, что
является причиной частых острых респираторных и вирусных заболеваний, осо¬
бенно у детей.в зависимости от состояния эритропоэтической активности костного мозга
различают регенераторную и гипорегенераторную стадии ЖДА, а в соответствии с
лабораторными показателями — три степени тяжести ЖДА:• легкую — содержание гемоглобина более 90 г/л;• среднюю — содержание гемоглобина 70-90 г/л;• тяжелую — содержание гемоглобина менее 70 г/л.Регенераторная стадия (гиперпролиферативная) ЖДА характеризуется нор¬
мальной клеточностью костного мозга, умеренной гиперплазией клеток красного
ряда (количество их достигает 40-60% общего количества миелокариоцитов),
преобладанием базофильных и полихроматофильных эритробластов. Гиперплазия
эритроидного ростка обусловлена компенсаторным усилением синтеза эритро-
поэтина в ответ на тканевую гипоксию. При недостатке железа клетки эритрона
синтезируют гемоглобин в меньшей концентрации, что приводит к уменьшению
гемоглобинизации цитоплазмы созревающих эритрокариоцитов. Поскольку деле¬
ние клеток зависит от концентрации гемоглобина, количество митозов во время
их созревания может быть повышенным, что приводит к образованию не только
гипохромных, но и уменьшенных в размере эритрокариоцитов и соответственно
ретикулоцитов и эритроцитов (микроцитов). в крови количество эритроцитов
остается в пределах нормы, отмечается снижение концентрации гемоглобина,
показателей гематокрита, МСН (менее 27 пг), МСНС (менее 30 г/дл), MCV (менее
80 фл). RDW может оставаться нормальным, что свидетельствует о преобладании
однородных клеток с малым объемом. В регенераторной стадии железодефицит¬
ной анемии эритроцитарная гистограмма имеет обычную форму, но смещается
влево. Морфологическим признаком ЖДА являются гипохромия эритроцитов и
анизоцитоз со склонностью к микроцитозу. в мазках крови можно обнаружить
единичные мишеневидные эритроциты, овалоциты. Снижено количество сидеро-
цитов.Относительное и абсолютное количество ретикулоцитов при ЖДА в пределах
нормы, что свидетельствует о сохраняющейся регенераторной способности кост¬
номозгового кроветворения на фоне дефицита железа, либо несколько повышено
при кровотечении. Количество лейкоцитов и тромбоцитов при ЖДА остается в
пределах нормы. При хронических кровотечениях может наблюдаться небольшой
тромбоцитоз либо тромбоцитопения. СОЭ чаще бывает нормальной.По мере дальнейшего нарушения процессов гемоглобинобразования происхо¬
дит еще большее снижение MCV, МСН и МСНС. У таких больных эритроцитарная
гистограмма имеет вид одиночного пика, значительно сдвинутого в левую сторону,
RDW увеличен, отмечается появление микроретикулоцитов.Піпорегенераторная стадия ЖДА характеризуется истощением пролифера-
тивной активности костного мозга, снижением количества сидеробластов, повы¬
шением неэффективного эритропоэза, что приводит к снижению количества
536ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯэритроцитов, появлению популяции красных клеток с увеличенным объемом.
Эритроцитарная гистограмма уплощается и значительно растягивается, указывая
на наличие микро- и макроцитов. MCV может увеличиваться, так как является
усредненным показателем объема эритроцитов. Присутствие микро- и макроцитов
приводит к повышению RDW, что коррелирует с наличием смешанного анизоци-
тоза в мазках периферической крови. Может наблюдаться анизохромия эритроци¬
тов, а также незначительный пойкилоцитоз. Количество ретикулоцитов уменьше¬
но, что отражает снижение пролиферативной активности эритроидных клеток.На фоне приема препаратов железа отмечается незначительное повыше¬
ние количества эритроцитов, концентрации гемоглобина, МСН, МСНС, MCV.
Показатель анизоцитоза (RDW) значительно повышается, что свидетельствует о
гетерогенности популяции эритроцитов. Эритроцитарная гистограмма становится
бимодальной, первый пик ее характеризует популяцию с низким объемом (микро-
циты), второй — появление эритроцитов с нормальным объемом (нормоциты).
Максимальный подъем ретикулоцитов приходится на 16-18-й день лечения.Ж ДА характеризуется снижением содержания железа, ферритина в сыворотке
крови, процента насыщения трансферрина железом, повышением концентра¬
ции растворимых рецепторов к трансферрину (sTfR), ОЖСС, трансферрина.
Информативным показателем оценки метаболизма железа является коэффициент
насыщения трансферрина железом (НТЖ), который рассчитывают по формуле;НТЖ(%)=-железо (мкг/дл)трансферрин (мг/дл) х 1,41-хЮО.При ЖДА содержание сывороточного железа становится менее 7 ммоль/л,
показатель НТЖ менее 15% (норма - 15-45%). Концентрация ферритина в сыво¬
ротке крови отражает величину запасов железа в организме. Снижение уровня
ферритина (менее 15 мкг/л) наблюдается как при латентном дефиците железа, так
и при ЖДА. Эти показатели следует использовать только в комплексе с гематоло¬
гическими параметрами, так как их изменения наблюдаются при разнообразных
заболеваниях. Содержание ферритина в сыворотке крови не всегда отражает
истинные запасы железа в организме и часто повышается независимо от количе¬
ства депонированного железа при воспалении, инфекциях, онкологических забо¬
леваниях, заболеваниях печени и других состояниях. В этих случаях концентрация
растворимых рецепторов к трансферрину (sTfR), которая отражает потребности
преимущественно эритроидных клеток в железе, позволяет диагностировать ЖДА.
При воспалительных процессах и беременности sTfR остается стабильным.АНЕМИИ, СВЯЗАННЫЕ С НАРУШЕНИЕМ СИНТЕЗА ЛОРФИРИНОВАнемии этой группы обусловлены недостаточной или аномальной утилизацией
внутриклеточного железа при синтезе гемоглобина, несмотря на нормальное или
даже повышенное содержание железа в митохондриях эритрокариоцитов. Такие
дефекты могут быть связаны с наследственными нарушениями, главным образом
при синтезе порфиринов, или с приобретенным характером поражения, например в
результате отравления свинцом или недостаточности витамина В^. Отличительным
признаком этого типа анемий является насыщение организма железом.В лабораторных исследованиях выявляют высокую концентрацию железа и
ферритина в сыворотке крови и повышенное насыщение трансферрина железом.
В костном мозге отмечается гиперплазия эритроидных клеток. Окраска на железо
позволяет выявить изменения, обусловленные накоплением неутилизированного
железа в митохондриях эритрокариоцитов — кольцевидные сидеробласты.Наследственные и приобретенные анемии, связанные с нарушением синтеза
порфиринов, характеризуются гипохромией, высоким содержанием железа сыво¬
ротки и гемосидерозом органов.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 537Наследственные анемии этого типа встречаются сравнительно редко, пре¬
имущественно у мужчин, так как наследование сцеплено с Х-хромосомой.
Относительно чаще наблюдается форма болезни, вызванная дефектами синтеза
5-аминолевулиноБОй кислоты. Нарушение образования протопорфирина обу¬
словливает невозможность связывания железа, вследствие этого происходит
накопление его в организме. Преимущественное поступление железа в печень
приводит к развитию цирроза, в поджелудочной железе — к сахарному диабету,
накопление железа в яичках — к евнухоидизму, в надпочечниках — к недостаточ¬
ности надпочечников. Клинические проявления болезни зависят от выраженно¬
сти анемии и признаков избыточного отложения железа в организме. У больных
в молодом возрасте анемия в большинстве случаев невыраженная (содержание
гемоглобина 80-90 г/л), однако гемоглобин постепенно падает до 50-60 г/л.
Содержание ретикулоцитов нормальное или несколько снижено. Эритроциты
гипохромные, отмечаются анизоцитоз, пойкилоцитоз, отдельные мишеневидные
эритроциты.в костном мозге ~ гиперплазия красного ростка, увеличен процент базофиль-
ных, полихроматофильных и снижено количество оксифильных эритрокариоци-
тов, много кольцевидных сидеробластов. Для этой анемии характерны признаки
неэффективного эритропоэза, который определяется как анемия с относительной
или абсолютной ретикулоцитопенией.Содержание железа в сыворотке значительно повышено (до 100 мкмоль/л),
трансферрин насыщен железом почти на 100%. При исследовании содержа¬
ния порфиринов в эритроцитах у некоторых больных обнаруживают снижение
протопорфирина до 3-9 мкмоль/л (норма — 18-90 мкмоль/л) и повышение
копропорфирина до 60-75 мкмоль/л (норма - до 12 мкмоль/л). В отдельных
случаях снижается как протопорфирин, так и копропорфирин. Содержание5-аминолевулиновой кислоты и копропорфирина в моче нормальное.Приобретенные анемии обусловлены нарушением синтеза порфиринов.Возникают чаще при отравлении свинцом или дефиците витамина В^. Свинец
блокирует активные центры ферментов, участвующих в синтезе гема, снижает
скорость синтеза а-цепи глобина. Нарушается включение железа в молекулу про¬
топорфирина, увеличивается содержание железа в сыворотке и отложение его в
тканях. Своеобразен вид больного: землистая бледность с сероватым оттенком,
связанная как с анемией, так и со спазмом сосудов и отложением в коже порфири¬
нов, может быть лиловая кайма на деснах.В костном мозге отмечается резкое увеличение кольцевидных сидеробластов.
В периферической крови постепенно снижается гемоглобин до 50-60 г/л, эри¬
троциты с выраженной гипохромией (низкие МСН, МСНС), выявляется анизо- и
пойкилоцитоз, появляется базофильная пунктация эритроцитов.Содержание железа в сыворотке крови повышается до 350-550 мкг/дл, насы¬
щение трансферрина железом достигает 100%. В сыворотке крови отмечает¬
ся высокая концентрация ферритина. Самым характерным биохимическим
признаком свинцового отравления является увеличение концентрации в моче6-аминолевулиновой кислоты и копропорфирина, в эритроцитах повышено содер¬
жание протопорфирина.Нормохромные анемииАНЕМИЯ ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЙВзаимосвязь анемии с хроническими инфекционными, ревматическими забо¬
леваниями, другими воспалительными процессами описана более 150 лет назад.
Для характеристики таких анемий используют термины: «хроническая анемия».
538 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ«анемия воспаления?» и «анемия хронических заболеваний» (АХЗ). АХЗ занимает
по распространенности второе место после железодефицитной анемии. Анемия
обычно носит нормохромный нормоцитарный характер, однако гипохромия
встречается также часто, иногда анемия становится микроцитарной гипохромной.
АХЗ постоянно сопровождается нарушением метаболизма железа: гипоферреми-
ей, некоторым снижением концентрации трансферрина в крови и повышением
ферритина как в крови, так и в органах и тканях,Активация иммунной системы при воспалительных, инфекционных и неко¬
торых онкологических заболеваниях антигенными факторами индуцирует син¬
тез провоспалительных цитокинов (ИЛ-1, ФНО-а, ИЛ-6), интерферонов. ИЛ-6
является основным индуктором синтеза гепсидина в печени. Гепсидин является
негативным регулятором как выведения железа из макрофагов, так и всасывания
железа в ЖКТ. Результатом его действия являются блокада железа в клетках систе¬
мы моноцит/фагоцит (СМФ), гепатоцитах и энтероцитах, нарушение передачи
железа трансферрину и быстрое развитие гипоферремии.В норме ежедневно около 20 мг железа поступает в плазму крови, связывается с
трансферрином и большая часть его доставляется эритроидным клеткам костного
мозга для синтеза гемоглобина. Поскольку всасывание железа и мобилизация его
из дело нарушены, а клетки в костном мозге продолжают расходовать железо на
свои нужды, плазменный пул железа быстро истощается, вызывая гипоферремию.
При продолжительной гипоферремии развивается железодефицитный эритро-
поэз, одной из характеристик которого является повышение концентрации про-
топорфирина в эритроцитах. Таким образом, развивается перераспределительный
или функциональный дефицит железа, нарушается эритропоэз и наблюдается
анемия.Ряд цитокинов (ИЛ-1, ФНО-а, ТФР-р) подавляют экспрессию гена эритропоэ-
тина (ЭПО) в клетках почек и печени, и у больных с АХЗ отмечается неадекватно
низкая продукция ЭПО. Кроме того, эритроидные предшественники при АХЗ
резистентны к пролиферативному действию ЭПО. Ингибиторный эффект провос¬
палительных цитокинов на эритропоэз связан также с прямым супрессирующим
воздействием ряда цитокинов на пролиферацию эритроидных клеток костного
мозга.Костный мозг у больных с АХЗ характеризуется повышенным содержанием
сидеробластов и макрофагов с гранулами гемосидерина. Возможно обнаружение
эритрофагоцитоза.Периферическая кровь при АХЗ нормохромная нормоцитарная, реже умеренно
гипохромная или гипохромно-микроцитарная. Количество ретикулоцитов нор¬
мальное или уменьшено, ретикулоцитарный индекс продукции ниже нормы, что
отражает сниженную пролиферативную активность костного мозга.Изменения метаболизма железа характеризуются перераспределительным
дефицитом железа (снижением сывороточного железа, ОЖСС, трансферрина,
НТЖ и повышением содержания сывороточного ферритина). Ферритин относится
к белкам острой фазы, поэтому повышенный уровень сывороточного ферритина
при АХЗ может отражать не только запас железа в организме, но и быть проявле¬
нием острофазного ответа, что ограничивает его использование в качестве показа¬
теля определения запасов железа.Дифференциальная диагностика АХЗ и ЖДА основана на комплексном иссле¬
довании обмена железа, белков острой фазы, растворимых рецепторов к транс¬
феррину и в последнее время — гепсидина в моче, концентрация которого повы¬
шена при АХЗ (табл. 7-14), Ошибочная диагностика ЖДА может повлечь за собой
назначение препаратов железа (парентерально) с развитием вторичного гемоси¬
дероза.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 539Таблица 7-14. Дифференциальная диагностика анємии хронических заболеваний и желбзодефи-
цитной анемииЖДА — регене¬
раторная стадияЖДА — гипо-регенераторнаястадияАХЗііi/Nt/NПримечание. N — норма.АНЕМИИ ПРИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЯХУ 30-50% онкологических больных имеется анемический синдром той или
иной степени выраженности. Патогенез хронической анемии при злокачественных
новообразованиях включает интенсивное взаимодействие популяции опухолевых
клеток с иммунной системой, что проявляется активацией макрофагов и повышен¬
ной секрецией цитокинов. к развитию анемии приводят также метастатическое
поражение костного мозга, побочные эффекты химиотерапии и лучевой терапии,
микроангиопатии, повреждения почек, нарушения питания. Патогенез анемии
при злокачественных новообразованиях во многом сходен с таковым при АХЗ,
при которых ведущую роль придают повышенному синтезу гепсидина и провос-
палительных цитокинов. Метастазы в костном мозге встречаются при опухолях
различных локализаций, но наиболее часто при раке молочной железы, предста¬
тельной железы, почек, легкого, щитовидной железы, при нейробластоме. Так, при
раке молочной железы их выявляют в 50% случаев, при нейробластоме у детей — в
50-67%, при мелкоклеточном раке легкого — в 17-45% наблюдений.Анемия при злокачественных новообразованиях относится к гипопролифера-
тивным анемиям, носит нормохромный нормоцитарный характер, количество
ретикулоцитов снижено, нередко развивается панцитопения. В мазках крови
выявляются анизоцитоз, пойкилоцитоз, полихроматофилия, встречаются эритро-
кариоциты. Б лейкоцитарной формуле может наблюдаться сдвиг влево до миело¬
цитов.АНЕМИЯ ПРИ ХРОНИЧЕСКОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТИАнемия — один из наиболее характерных синдромов, сопровождающих течение
хронической почечной недостаточности (ХПН). Степень выраженности анемии не
всегда коррелирует с уремией, тем не менее при снижении клиренса креатинина
менее 30 мл/мин величина гематокрита всегда ниже 30%.Основное значение в развитии анемического синдрома при ХПН принадлежит
абсолютному или относительному дефициту эндогенного эритропоэтина (эЭПО),
имеют значение также ингибиторы эритропоэза, гемолиз, токсическое влияние на
эритроциты продуктов азотистого обмена, кровопотери, дефицит фолиевой кис¬
лоты, железа. Важную роль в развитии нефрогенной анемии играют ингибиторы
эЭПО; ФНО-а, ИЛ-1, ТФР-Р, интерферону.Анемия может быть первым признаком интоксикации алюминием у больных
на гемодиализе. Алюминий вызывает микроцитарную гипопролиферативную
анемию. Предполагается, что алюминий может препятствовать синтезу гема и.
540ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯВОЗМОЖНО, транспорту железа, связанного с трансферрином. При уремии в плазме
крови обнаруживают усиление активности протеолитических ферментов, что при¬
водит к десиализации мембран эритроцитов, снижению поверхностного заряда,
предрасполагая эритроциты к разрушению макрофагами.Лечение больных с ХПН препаратами рекомбинантного эритропоэтина приво¬
дит к частичной коррекции анемии, однако вследствие стимуляции эритропоэза
может развиться ЖДА, что диктует необходимость исследовать метаболизм желе¬
за в динамике проведения терапии рЭПО.АПЛАСТИЧЕСКИЕ АНЕМИИАпластическая анемия (АА) — заболевание, характеризуемое резким угнете¬
нием костномозгового кроветворения, торможением процессов пролиферации
и дифференцировки клеточных элементов с развитием глубокой панцитопении
в периферической крови. Апластические анемии могут быть наследственными
и приобретенными. Наследственная форма АА (анемия Фанкони) сочетается с
другими наследственными аномалиями. Приобретенные формы АА связаны с
действием ионизирующего излучения, лекарственных препаратов (антибиотиков,
сульфаниламидных, антитиреоидных, противосудорожных, противотуберкулез¬
ных, противодиабетических препаратов, декариса*, анальгина*, левомицетина*,
тетрациклина, бутадиена*, препаратов золота), химических соединений (бензола
и его производных, этилированного бензина, пестицидов), вирусов (гепати¬
тов А, В, С, Эпштейна-Барр, цитомегаловируса, герпеса, ВИЧ, парвовируса В19).
Апластическая анемия, развиваюш[аяся в течение первых 6 мес у больного, пере¬
несшего острый вирусный гепатит, называется гепатитассоциированной АА.
Доказана способность вирусов гепатитов А, В, С ингибировать рост колоний и
дифференцировку в костном мозге клеток-предшественников. Считается, что
гепатитассоциированная АА, скорее всего, является следствием иммунной агрес¬
сии в отношении гемопоэза. Описаны апластические кризы у больных с различ¬
ными формами гемолитических анемий, вызванных парвовирусной инфекцией.
Мишенью для парвовируса Б19 служат эритроидные клетки-предшественники,
поражение которых может привести к развитию парциальной красноклеточной
аплазии. Из числа эндогенных факторов, угнетающих гемопоэз, отмечают нару¬
шение функций яичников, щитовидной и вилочковой желез. Изменение функции
тимуса нередко сопровождается возникновением парциальной красноклеточной
аплазии. В большинстве слз^чаев АА этиологический фактор остается неизвест¬
ным (идиопатические АА). Ведущую роль в развитии АА придают иммунной
деструкции гемопоэза. При АА обнаружено повышение активности цитоток-
сических Т-лимфоцитов и натуральных киллеров, оказывающих подавляющее
действие на костный мозг. Большое внимание уделяется изучению апоптоза как
одного из механизмов развития аплазии кроветворения; при АА имеет место
повышенная способность гемопоэтических клеток к апоптозу. На поверхности
гемопоэтических клеток экспрессируются рецепторы, являющиеся маркерами
апоптоза (CD95).Клиническая картина определяется анемическим, геморрагическим синдро¬
мами и инфекционными осложнениями. Основные проявления АА обусловлены
угнетением нормального кроветворения, гипоксией тканей и органов (одышкой,
тахикардией, слабостью, головокружением) и резкой тромбоцитопенией (кро¬
воподтеками, петехиями, носовыми кровотечениями, меноррагиями и другими
кровотечениями). В результате выраженной нейтропении развиваются воспали¬
тельные процессы.Критериями диагностики А А являются:• трехростковая цитопения — анемия (НЬ — <110 г/л), гранулоцитопения
(гранулоциты — <2х10ул), тромбоцитопения (тромбоциты — <100х10ул);
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ541• снижение клеточности костного мозга и отсутствие мегакариоцитов по дан¬
ным пунктата костного мозга. Количество миелокариоцитов в костном мозге
резко снижено (<40х10ул);• преобладание жирового костного мозга по данным исследования трепаноби-
оптата.В периферической крови характерны признаки выраженной нормохромной
анемии с резким снижением концентрации НЬ (25-80 г/л), количества эритро¬
цитов (0,7-2,5х10^Ул), умеренным анизоцитозом с тенденцией к макроцитозу,
пойкилсцитозу. Ретикулоцитопения варьирует в пределах 0,3-0,9%, при гемо¬
лизе достигает 4-5%. Характерной для АА является выраженная лейкопения (до2,5-0,55х10ул) с абсолютной нейтропенией и относительным лимфоцитозом.
В случае присоединения инфекции может наблюдаться сдвиг лейкоцитарной
формулы влево до миелоцитов. Резко выражена тромбоцитопения (2-25х10Ул),
иногда в мазках периферической крови тромбоциты могут отсутствовать. В боль¬
шинстве случаев увеличена СОЭ.Тяжелая АА определяется при наличии двух любых из перечисленных критери¬
ев (гранулоцитопения — <0,5х10Ул, тромбоциты — <20х10Ул, ретикулоциты —
<1% с коррекцией по гематокриту или <20х10ул) в сочетании с аплазией костного
мозга по данным трепанобиопсии. Сверхтяжелая АА ~ гранулоцитопения менее
0,2х10ул.При АА на фоне частых гемотрансфузий повышаются сывороточное железо
и НТЖ, что ведет к гемосидерозу. Увеличение концентрации эритропоэтина в
крови связывают с падением утилизации его клеточными элементами костного
мозга.Наследственные апластические анемииКонституциональная апластическая анемия Фанкони является аутосомно-
рецессивным заболеванием, характеризуется врожденными соматическими ано¬
малиями и прогрессирующей недостаточностью функции костного мозга. Данный
тип анемии возникает у детей в возрасте до 10 лет, мальчики обычно болеют в два
раза чаще, чем девочки. Врожденные аномалии развития проявляются аплазией
или гипоплазией большого пальца руки, отсутствием лучевой кости, аномалиями
развития ребер, микроцефалией, низкорослостью, иногда половым недоразвити¬
ем, хромосомными нарушениями. Кроме этого, определяют ряд неврологических
расстройств (косоглазие, микрофтальм, птоз, нистагм, глухоту, умственную отста¬
лость), врожденные пороки сердца, пороки развития почек (поликистоз или апла¬
зию почек, подковообразную почку, удвоение лоханки или мочеточника и др.).
Характерно появление темной пигментации кожи как следствие нарушения обме¬
на меланина и повышенной секреции адренокортикотропного гормона (АКТГ).
Печень и селезенка обычно не увеличены, лимфаденопатия наблюдается в случае
присоединения инфекции. На фоне клинических проявлений общеанемического
синдрома возможно развитие кровоточивости.Гематологическим проявлением заболевания является нарушение кроветворе¬
ния в виде прогрессирующей гипоплазии костного мозга и нарастающей панцито¬
пении. Анемия носит нормо- или гиперхромный характер. Снижение количества
эритроцитов может доходить до 0,66-0,94х10’Ул, концентрации гемоглобина —
до 30-65 г/л. Количество ретикулоцитов в периферической крови снижено или
полностью отсутствует, хотя в начале заболевания возможен ретикулоцитоз. СОЭ
у всех больных повышена до 30-80 мм/ч. Ранним симптомом заболевания явля¬
ется лейкопения, сопровождаемая гранулоцитопенией. Одновременно диагности¬
руют тромбоцитопению, степень выраженности которой может бь[ть различной.
В костном мозге снижено количество миелокариоцитов вследствие прогрессирую¬
щей гипоплазии кроветворения.
542 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯЗаболевание характеризуется хроническим течением с периодами обострения# и ремиссии, имеется высокий риск трансформации болезни в острый миелоидный
^ лейкоз, прогноз неблагоприятный, длительность жизни в среднем составляет
около 7 лет.Наследственная парциальная гипопластическая анемия Даймонда-Блекфана
представляет собой патологию, при которой резко снижается количество эритро-
идных клеток в костном мозге, вплоть до полного их исчезновения. Заболевание
обычно выявляют на первом году жизни. Клиническая картина характеризуется
вялостью, бледностью ребенка, у новорожденных возможно наличие затянувшей¬
ся физиологической желтухи. По мере прогрессирования заболевания кожные
покровы приобретают восковидно-сероватый оттенок, затем появляется выра¬
женная пигментация кожи, связанная с развитием гемосидероза. Развивается гепа-
то- и спленомегалия, периферические лимфатические узлы интактны. При данной
анемии, как правило, отсутствует выраженный геморрагический синдром.С помощью лабораторных гематологических исследований выявляют нор-
моцитарную, нормохромную или слегка гиперхромную анемию, анизоцитоз
и пойкилоцитоз эритроцитов. Эритроцитарные индексы (MCV, МСН, МСНС,
RDW) существенно не изменяются, отмечается вьграженная ретикулоцитопения.
Продолжительность жизни эритроцитов обычно несколько укорачивается, у неко¬
торых больных наблюдается увеличение в крови уровня фетального гемоглобина
до 15%. Количество лейкоцитов, как правило, нормальное, иногда в лейкоцитар¬
ной формуле крови может выявляться нейтропения или эозинофилия.Картина костного мозга характеризуется резким уменьшением, вплоть до
исчезновения, эритроидных клеток. При цитохимическом исследовании эритро-
кариоцитов отмечается повышение количества ШИК-положительных клеток, что
свидетельствует о выраженности неэффективного эритропоэза. Характерны каче¬
ственные изменения клеток эритроидного ростка в виде появления клеток мелкой
генерации, с пикнотичными ядрами и скудной цитоплазмой. Количество лимфо¬
цитов в костном мозге увеличено, обнаруживают фибробласты, количество плаз¬
матических клеток и мегакариоцитов не изменено. Гранулоцитопоэз обычно не
нарушается, хотя иногда могут наблюдаться увеличение количества эозинофиль¬
ных форм, задержка созревания клеток на стадии миелоцитов и метамиелоцитов.
Б период ремиссии возможно повышение уровня эритрокариоцитов в костном
мозге. На поздних стадиях заболевания возможна трехростковая костномозговая
недостаточность. В крови у большинства больных выявляют увеличение содер¬
жания сывороточного железа, насыщение трансферрина железом приближается к
100%.Прогноз заболевания неблагоприятный и зависит от степени поражения кост¬
ного мозга. Развитие гемосидероза с присоединением инфекционных осложнений
может быть причиной летального исхода.Мегалобластные анемииВИТАМИН в,,-ДЕФИЦИТНЫЕ АНЕМИИАнемии, связанные с нарушением синтеза ДНК, могут быть как наследствен¬
ными, так и приобретенными. Общим признаком этих анемий является наличие
в костном мозге мегалобластического кроветворения. Чаще наблюдается изо¬
лированный дефицот витамина реже — с дефицитом фолиевой кислоты.
Источником поступления витамина В,2 являются только продукты животного
происхождения: мясо, яйца, сыр, молоко, особенно много его в печени и почках.
При обычной диете человек получает в среднем 5-15 мкг витамина В^^^жВДневно.
Общее содержание витамина в организме составляет 2-5 мг, чем объясняется
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 543развитие анемии в течение нескольких лет после прекращения поступления вита- g
мина в организм человека. В период беременности, роста увеличиваются суточные Щ
потребности в витамине ^В продуктах животного происхождения витамин связан с белками и высво¬
бождается в желудке под влиянием соляной кислоты и пепсина. Это является
первым важным этапом, необходимым для нормального всасывания витамина.У многих пожилых людей дефицит развивается вследствие неспособности к выде¬
лению витамина из пищи, например при атрофическом гастрите, когда имеется
снижение секреции соляной кислоты и протеаз. После высвобождения в желудке
витамин В^2 связывается с R-белками, которые вырабатываются слюнными желе¬
зами, а затем с внутренним фактором Касла (ВФ). ВФ секретируется париеталь¬
ными клетками слизистой оболочки фундального отдела желудка. Секреция ВФ
повышается при наличии пищи в желудке и находится под контролем п. vagus.
Выработка его стимулируется гастрином, гистамином, ингибируется атропином,
соматостатином, блокаторами Н^-рецепторов и после ваготомии. Всасывание
витамина происходит в подвздошной кишке, где имеются специфические
рецепторы, в печени происходит метилирование витамина, после чего метилкоба-
ламин попадает в плазму крови и связывается транскобаламинами. Таким образом,
для нормального обмена витамина B^j необходимы следующие факторы; наличие
витамина в пище, достаточная желудочная секреция, панкреатическая секреция,
интактная подвздошная кишка, наличие транскобаламинов. Дефект одного из
этих факторов может привести к развитию витамин В ^2-дефицитной анемии.Витамин В^2 участвует в превращении метилтетрагидрофолата, поступающего
в клетку из крови, в тетрагидрофолат (коферментную форму фолиевой кислоты).
Образующиеся активные фолаты необходимы для синтеза пуриновых и пирими¬
диновых оснований — предшественников ДНК и РНК. Дефицит витамина В^, и
фолиевой кислоты нарушает метаболизм нуклеиновых кислот, вызывает ингиби¬
рование клеточного деления. Эти нарушения более выражены со стороны гемо-
поэтических клеток и клеток желудочно-кишечного тракта.Наиболее частой причиной развития дефицита витамина Bj^ является атрофи¬
ческий гастрит, частота и выраженность которого увеличиваются с возрастом. При
этом прекращаются или уменьшаются секреторная способность слизистой желуд¬
ка и синтез ВФ. Снижение секреции ВФ возникает примерно через 3-4 года после
гастрэктомии или резекции Vj желудка.Существенное значение в развитии дефицита витамина имеют генетические
факторы. Семейная предрасположенность выявляется у 20-30% больных. В этих
семьях заболевание возникает в 20 раз чаще, чем в популяции. В большинстве слу¬
чаев семейная предрасположенность связана с выработкой аутоантител к парие¬
тальным клеткам слизистой оболочки желудка и внутреннему фактору. Нередко
витамин В^2“Д^ФиЦ^'^ная анемия сочетается с другими аутоиммунными заболева¬
ниями (гипертиреозом, гипотиреозом, гипопаратиреозом, недостаточностью над¬
почечников, аутоиммунной гемолитической анемией).Причиной развития витамин В^^'Д^Ф^^Ц^тной анемии может быть конкурент¬
ное потребление витамина в кишечнике микрофлорой или паразитами (инвазия
широким лентецом, синдром слепой кишки, дивертикулез). Микрофлора потре¬
бляет витамин В^2 для синтеза ДНК-бактерий.Клиническая картина заболевания включает три основных синдрома; анеми¬
ческий, желудочно-кишечный и неврологический. Заболевание обычно реги¬
стрируют в 50-60 лет. Чаще всего витамин В^,-дефицитная анемия дебютирует
анемическим синдромом (утомляемостью, общей слабостью, сердцебиением,
одышкой при обычной нагрузке). Исключение составляют пациенты, у которых
нарастание неврологической симптоматики опережает развитие анемического
синдрома. Жалобы на нарушения функций желудочно-кишечного тракта предъяв-
544 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯляют 40-50% больных (снижение аппетита, вплоть до отвращения к пище, потеря
вкуса, боли в полости рта, жжение язьжа, расстройства стула), однако эти наруше¬
ния не являются патогномоничным признаком дефицита витамина У 10-20%
больных встречается увеличение печени и селезенки, желудочная секреция резко
снижена.Костный мозг гиперклеточный благодаря увеличению количества эритрока-
риоцитов. Соотношение лейкоциты/эритроциты — 1:2-1:3 (норма — 3:1-4:1).
Характерен мегалобластический тип кроветворения с высоким уровнем неэф¬
фективного эритропоэза. Клетки не способны синтезировать достаточное коли¬
чество ДНК для клеточного деления, костный мозг переполняется клетками, что
создает видимость повышенного эритропоэза. Во время продолжительной фазы
покоя хроматин диффузно рассеивается на всем протяжении ядра, придавая ему
мегалобластный вид. Способность мегалобластов к делению резко нарушена (они
совершают только 1-2 митоза). При дефиците витамина РНК исчезает более
медленно по сравнению с нормальными клетками и остается в клетках с выражен¬
ной гемоглобинизацией.Ядра мегалобластов всегда имеют характерное нежно-сетчатое распределение
хроматина, асинхронное созревание ядра и цитоплазмы. При выраженной гемо-
глобинизации ядро сохраняет незрелый вид. Конденсация хроматина в мегалобла-
стах начинается при почти законченной гемоглобинизации цитоплазмы; конден¬
сированный хроматин расположен не радиально, а в виде глыбок неправильной
формы. Количественные соотношения между мегалобластами различной степени
зрелости весьма изменчивы и зависят от активности костномозгового кроветво¬
рения. Преобладание промегалобластов и базофильных мегалобластов создает
картину «синего» костного мозга. Отмечаются значительные дегенеративные
изменения в ядрах клеток, уродливость, многоядерность, митозы.Несмотря на эритроидную гиперплазию костного мозга, продукция эритроци¬
тов при дефиците витамина В^^ снижена, что приводит к анемии. Это обусловлено
резким повышением неэффективного эритропоэза и разрушением эритроидных
предшественников в костном мозге. Кроме того, продолжительность жизни
мегалобластов в 2-4 раза меньше нормальной, большинство клеток, не созревая,
погибают в костном мозге. Внутрикостномозговой гемолиз эритрокариоцитов
(неэффективный гемопоэз) и короткая продолжительность жизни мегалоцитов
приводят к повышению уровня непрямого билирубина и ЛДГ.Недостаток витамина В^^ влечет за собой изменения со стороны лейкопоэза,
поскольку синтез ДНК нарушается во всех клетках. Замедление процессов проли¬
ферации приводит к увеличению размеров миелоцитов, метамиелоцитов, палоч¬
коядерных и сегментоядерных нейтрофилов, характерна гиперсегментация ядер
нейтрофилов, в тяжелых случаях — нейтропения. Количество мегакариоцитов
обычно нормальное, может нарушаться отшнуровка тромбоцитов.Результатом мегалобластического кроветворения является развитие макроци-
тарной гиперхромной анемии (концентрация НЬ может снижаться до 25-40 г/л).
Количество эритроцитов резко снижено (1,0-1,5x10’V^). Отмечается увеличение
среднего объема эритроцитов (MCV >100 фл) и среднего содержания гемоглобина
в эритроците (МСН >32 пг) при нормальных значениях средней концентрации
гемоглобина в одном эритроците (МСНС). Эритроцитарная гистограмма значи¬
тельно смещается вправо, уплощается.Эритроциты отличаются равномерной окраской — гиперхромные вследствие
увеличения толщины клеток, без центрального просветления, диаметром более
10 мкм (макроциты и мегалоциты). Им свойственны анизоцитоз, пойкилоцитоз,
шизоцитоз, встречаются эритроциты с остатками ядерной субстанции (кольца
Кебота, тельца Жолли), базофильной пунктацией (остатки РНК), полихромато-
фильные эритроциты. Нередко присутствуют мегалобласты.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 545У больных с витамин В^2“Д^Ф^Цитной анемией на фоне макроцитарной, гипер-
хромной анемии отмечается абсолютное уменьшение содержания ретикулоцитов.
В процессе лечения витамином отмечается положительная динамика эритро-
цитарных показателей. Ретикулоцитарный криз развивается на 6-й день терапии,
однако даже через месяц абсолютное количество ретикулоцитов может полностью
не нормализоваться, что свидетельствует о еще недостаточно восстановленной
регенераторной способности костного мозга и необходимости продолжения лече¬
ния витамином Bj2- Более ранним маркером, оценивающим эффективность лече¬
ния витамином Bj^2» является фракция незрелых ретикулоцитов, возрастающая на
2-3-й день после начала терапии.Дефицит витамина В^, влияет на все пролиферирующие гемопоэтические клет¬
ки, поэтому в крови наблюдается панцитонения. При этом гранулоцитопения и
тромбоцитопения выражены не столь резко, как анемия. Для В^2-дефицитной
анемии характерны лейкопения, нейтропения с относительным лимфоцитозом,
моноцитопения, может наблюдаться анэозинофилия или абазофилия. Отмечается
появление в крови гигантских гиперсегментированных нейтрофилов (количество
сегментов — >5), иногда сдвиг лейкоцитарной формулы влево до миелоцитов
и метамиелоцитов. Тромбоцитопения носит умеренный характер, тромбоцитов
редко бывает менее іоохіоул, встречаются гигантские формы, но функция их не
нарушена и геморрагический синдром наблюдается редко, В зависимости от степе¬
ни выраженности анемии СОЭ повышается до 50-70 мм/ч.Диагноз В^^2‘Д^фицитной анемии может быть установлен при морфологическом
исследовании костного мозга, которое следует проводить до введения витами¬
на В^^или при биохимическом определении его в крови. Инъекции витамина В,^
в течение 1-2 сут изменяют тип кроветворения в костном мозге. Мегалобласть!
уменьшаются в размерах, меняется структура ядра, клетки становятся макро-
нормобластами. Только по присутствию гигантских форм нейтрофилов можно
предположить, что имело место мегалобластическое кроветворение. Анемия
корригируется в пределах 6-12 нед. У больных, которым длительно проводят
витаминотерапию, может со временем развиться железодефицитная анемия в
результате активации синтеза гемоглобина и нарушения метаболизма железа.
В этих случаях отмечаются изменения эритроцитарных показателей, характерные
для ЖДА.Наследственные формы витамин В^^-дефицитной анемииНаследственные формы витамин В^^-дефицитной анемии развиваются при мута¬
циях генов, определяющих процессы обмена витамина в организме. Как правило,
это редкая патология, имеющая более выраженный характер при гомозиготном
носительстве. В большинстве случаев наблюдаются клинические и лабораторные
признаки витамин Вдефицитной анемии, однако некоторые формы имеют свои
специфические симптомы, патогенез которых подлежит дальнейшему изучению.Синдром Имерслунда-Гресбека. Патогенетической основой синдрома явля¬
ется селективная мальабсорбция витамина в тонкой кишке вследствие нару¬
шения функции или снижения количества рецепторов, связывающих комплекс
«витамин В^2-ВФ». Заболевание наследуется по аутосомно-рецессивному типу, ему
подвержены люди обоего пола. Первые признаки синдрома Имерслунда-Гресбека
появляются в возрасте 7-24 мес, хотя могут проявляться и позднее. Характерны
мегалобластная анемия и развитие протеинурии при отсутствии других изменений
в моче. Показатели функционального состояния почек нормальные, хотя возмож¬
но незначительное уменьшение почечной фильтрации без признаков почечной
недостаточности.Наследственный дефицит ВФ. Заболевание обусловлено неспособностью
клеток желудка секретировать полноценный ВФ либо его секрецией в недостаточ-
546 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯНОМ количестве. Болезнь наследуется по аутосомно-рецессивному типу. Первые
проявления при гомозиготном носительстве наблюдаются у детей в возрасте7-24 мес после истощения запасов витамина, полученных от матери внутриутроб¬
но. Клиническая и лабораторная симптоматика в большей степени соответствует
витамин В^2'Дєфицитной анемии.Врожденные нарушения внутриклеточного метаболизма витамина
В настоящее время данная патология изучена недостаточно. Ведущая роль в патогене¬
зе отводится нарушению кинетики метаболитов витамина вызванной снижением
синтеза или нарушением активности ферментов, з^аствующ;их во внутриклеточном
обмене витамина. У больных отсутствуют классические признаки мегалобластной
анемии и нейропатии. В крови увеличивается содержание метилмалоновой кислоты
и гомоцистеина, уровень витамина соответствует нормальному.Наследственный дефицит и функциональные аномалии транскобалами-
на. Врожденное отсутствие транскобаламина П (у гомозигот) вызывает глубокий
дефицит витамина В^2 ^ клетках, однако в крови его уровень остается нормаль¬
ным. Клиническая и лабораторная симптоматика соответствует витамин
дефицитной анемии и начинает проявляться у ребенка в грудном возрасте. При
гетерозиготном носительстве сниженное содержание транскобаламина П обычно
не вызывает клинических и лабораторных признаков заболевания.ФОЛИЕВОДЕФИЦИТНЫЕ АНЕМИИСуточная потребность в фолиевой кислоте составляет 50-100 мкг. Запасы ее
истощаются через 3-4 мес после прекращения поступления в организм. Фолаты
синтезируются растениями и микроорганизмами. Наибольшее количество фолие¬
вой кислоты содержится в зеленых овощах, фруктах, печени, почках, дрожжах.
Фолиевая кислота всасывается в двенадцатиперстной кишке и проксимальном
отделе тощей кишки. Способность кишечника всасывать фолиевую кислоту пре¬
вышает суточную потребность в витамине. Фолаты, так же как и витамин зани¬
мают ключевое положение во многих видах клеточного метаболизма, включая
синтез аминокислот и нуклеиновых кислот, особенно необходимых для пролифе¬
рирующих клеток. Коферменты фолиевой кислоты необходимы для образования
пуриновых соединений, биосинтеза метионина.Наиболее частыми причинами дефицита фолиевой кислоты в организме явля¬
ются;• недостаточное поступление фолатов с пищей;• повышение потребности в фолатах (вследствие беременности, гиперпарати-
реоза, интенсивного гемопоэза, злокачественных новообразований и др.);• нарушение всасывания (при хроническом энтероколите, патологии кишеч¬
ника — спру, целиакии, недостаточности поджелудочной железы и др.);• нарушение метаболизма фолиевой кислоты (при алкоголизме, приеме анта¬
гонистов фолиевой кислоты, пероральных контрацептивов и др.);• истощение запасов фолатов в печени (вследствие цирроза, гепатоцеллюляр-
ного рака, алкоголизма).Болеют чаще молодые люди, беременные. Преобладают признаки анемии; блед¬
ность кожи с легкой субиктеричностью, тахикардия, слабость. Неврологическая
симптоматика, как правило, отсутствует, нарушения со стороны желудочно-
кишечного тракта — диарея, синдром мальабсорбции.У страдающих эпилепсией и шизофренией дефицит фолиевой кислоты приво¬
дит к учащению приступов и ухудшению течения заболевания. Дефицит фолиевой
кислоты увеличивает риск осложнений беременности и родов.Изменения в крови и костном мозге аналогичны витамин В^^’Д^фицитной ане¬
мии. В сыворотке крови отмечается снижение уровня фолата (норма — 6-20 нг/мл),
концентрация его уменьшена и в эритроцитах (норма — 160-640 нг/мл).
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 547Наследственные формы фолиеводефицитной анемии gНаследственные формы фолиеводефицитной анемии являются крайне ред- Щ
кой патологией и изучены недостаточно. Патогенетическую основу заболевания '
чаще всего составляет врожденная мальабсорбция фолатов или внутриклеточный
дефицит ферментов, участвующих в метаболизме фолиевой кислоты. Клинические
признаки наследственной фолиеводефицитной анемии чаще всего проявляются у
детей грудного возраста или периода раннего детства и характеризуются в основ¬
ном анорексией, задержкой психомоторного развития, неврологическими сим¬
птомами, умственной отсталостью, повышенным риском возникновения инфек¬
ционных заболеваний. Гематологически определяются признаки мегалобластной
анемии. При мальабсорбции фолатов наблюдается снижение их содержания в
крови, эритроцитах, спинномозговой жидкости.МЕГАЛОБЛАСТНЫЕ АНЕМИИ, НЕ СВЯЗАННЫЕ С ДЕФИЦИТОМ ВИТАМИНА О.,
И ФОЛИЕВОЙ КИСЛОТЫ
Наследственная мегалобластная анемия при синдроме Леша-НайханаЗаболевание наследуется рецессивно, сцеплено с Х-хромосомой, проявляется в
грудном возрасте или периоде раннего детства. Патогенетической основой синдро¬
ма является нарушение метаболизма пуринов, связанное с полным или частичным
дефицитом фермента гипоксантингуанинфосфорибозилтрансферазы. Данный
фермент в большей степени содержится в клетках головного мозга и базальных
ганглиях. Заболевание вызывает тяжелые клинические проявления: нарушение
психического развития, признаки тяжелого поражения спинного мозга, мегало-
бластную анемию. Нарушение нормального метаболизма гипоксантина приводит
также к избыточному образованию мочевой кислоты и развитию подагры.Наследственная мегалобластная анемия вследствие дефицита ферментов,
участвующих в метаболизме оротовой кислотыБолезнь наследуется по аутосомно-рецессивному типу. У гетерозигот заболева¬
ние клинически не проявляется. Вследствие дефицита ферментов оротатфосфо-
рибозилтрансферазы и/или оротидин-5-монофосфатдекарбоксилазы происходит
нарушение синтеза уридин-5-монофосфата из оротовой кислоты. Этим опреде¬
ляется снижение количества пиримидина, необходимого для синтеза нуклеино¬
вых кислот, с последующим развитием мегалобластной анемии. Наблюдается
массивная экскреция с мочой оротовой кислоты. Содержание в сыворотке крови
витамина и фолиевой кислоты имеет тенденцию к повышению. Клинические
симптомы появляются у детей с первых месяцев жизни и характеризуются задерж¬
кой физического и психомоторного развития, учащением возникновения инфек¬
ционных заболеваний, возможны пороки развития сердца, частичная обструкция
мочевыводящих путей.Тиаминозависимая мегалобластная анемия (синдром Роджерса)Заболевание встречается крайне редко, наследуется по аутосомно-рецессивному
типу, первые симптомы возникают обычно у детей в возрасте до 10 лет.
Патогенетический механизм не изучен. У больных наблюдаются глухота, инсули¬
нозависимый сахарный диабет, возможны атрофия зрительного нерва, задержка
психомоторного развития, органические поражения сердечно-сосудистой систе¬
мы. Отмечаются проявления мегалобластной анемии. Содержание фолатов и
кобаламина в сыворотке крови нормальное. Признаков дефицита тиамина нет,
активность тиаминозависимых ферментов не нарушена. Назначение больным
тиамина (витамина В^) приводит к нормализации клинико-гематологических
показателей.
548ЛАБОРЛТОРНДЯ ГЕМАТОЛОГИЯАнемии, обусловленные усиленным разрушением
эритроцитов (гемолитические анемии)Это большая группа анемий, обусловленных повышенным разрушением эри¬
троцитов и уменьшением продолжительности их жизни.КЛАССИФИКАЦИЯ ГЕМОЛИТИЧЕСКИХ АНЕМИЙНаследственные гемолитические анемии, связанные с нарушением:• структуры мембраны эритроцита (микросфероцитоз, эллиптоцитоз, стомато-
цитоз и др.);• активности ферментов эритроцитов (дефицит глюкозо-6-фосфатдегидро-
геназы, пируваткиназы и др.);• структуры или синтеза гемоглобина (талассемии, серповидно-клеточная ане¬
мия).Приобретенные гемолитические анемии:• иммунные (аллоиммунные, аутоиммунные):• связанные с механическим повреждением эритроцитов (гемолитико-
уремический синдром, тромботическая тромбоцитопеническая пурпура
и др.);• обусловленные инфекцией (малярия, токсоплазмоз);• связанные с воздействием физических факторов (термические поврежде¬
ния), химических агентов, медикаментов, ядов;• пароксизмальная ночная гемоглобинурия.В зависимости от механизма развития и преимущественной локализа¬
ции выделяют внутриклеточный и внутрисосудистый гемолиз (табл. 7-15).
Внутриклеточный гемолиз обусловлен наследственным дефектом эритроцитов
(патологией ферментов, мембраны, структуры гемоглобина) или наличием на
мембране эритроцита иммуноглобулинов [аутоиммунные гемолитические ане¬
мии (ЛИГА)]. Разрушение эритроцитов в норме происходит в селезенке и пече¬
ни. При внутрисосудистом гемолизе деструкция эритроцитов осуществляется
в сосудистом русле. Основными причинами внутрисосудистого гемолиза явля¬
ются: переливание крови, несовместимой по системам АВО, Rh, при дефиците
глюкозо-6-фосфатдегидрогеназы, прием лекарственных препаратов с оксидатив-
ным эффектом, состояния и заболевания, сопровождаемые фрагментацией эри¬
троцитов (протезирование сосудов, клапанов сердца, микроангиопатии, сепсис,
маршевая гемоглобинурия и др.), некоторые АИГА, пароксизмальная ночная
гемоглобинурия, малярия и др.Таблица 7-15. Сравнительная характеристика внутриклеточного и внутрисосудистого гемолизаГемолизпризнакивиутрисосуцнстыйвнутриклеточныйЛокализация гемолизаСосудистая системаРЭСПатогенетический факторГемолизины, ферментопатия
эритроцитовАномалия формы эритроцитовГепатоспленомегалияНезначительнаяЗначительнаяМорфологические изменения
эритроцитовАнизоцитозМикросфероцитоз, овалоцитоз, мише¬
невидные, серповидно-клеточные и др.Локализация гемосидерозаКанальцы почекСелезенка, печень, костный мозгЛабораторные признаки гемо¬
лизаГемоглобинемия, гемоглобину¬
рия, гемосидеринурия, повыше¬
ние гапто глобинаГипербилирубинемия, повышение
активности ЛДГ, повышение стеркоби-
лина в кале и уробилина в моче
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 549Клинические проявления гемолиза:• анемический синдром;• гемолитический синдром (иктеричность кожи, видимых слизистых оболо¬
чек, темная моча, спленомегалия);• дефекты развития (башенный череп, укорочение мизинцев и др.) — при
наследственных гемолитических анемиях; холелитиаз, язвы на голенях.Наследственные гемолитические анемииНАСЛЕДСТВЕННЫЕ ГЕМОЛИТИЧЕСКИЕ АНЕМИИ, СВЯЗАННЫЕ С НАРУШЕНИЕМ
СТРУКТУРЫ МЕМБРАНЫ ЭРИТРОЦИТОВ
Мнкросфероцитарная гемолитическая анемия (болезнь Минковского-Шоффара)Наследуется по аутосомно-доминантному типу, чаще встречается гетерозигот¬
ная форма. Распространена практически повсеместно, во всех расовых группах.
Чаще всего болезнь проявляется в возрасте 3-15 лет, однако нередко клинические
признаки выявляются в неонатальном периоде. Могут наблюдаться спорадиче¬
ские формы микросфероцитарной анемии.Патогенез. При микросфероцитозе описаны разнообразные дефекты состава
или функции белков мембраны эритроцитов. Наследственный дефект мембра¬
ны эритроцита способствует повышению ее проницаемости для ионов натрия,
воды, что в конечном итоге изменяет объем клетки. Наиболее распространена
аутосомно-доминантная форма, связанная с нарушением взаимодействия спектри-
на с анкирином и белком 4.2, или дефицитом белка 4,2, или с комбинированным
дефицитом анкирина и спектрина. Слабое взаимодействие трансмембранных
белков может приводить к фрагментации мембраны, снижению площади поверх¬
ности мембраны, повышению ее проницаемости, увеличению содержания в клетке
осмотически активных веществ. Таким образом, наследственный сфероцитоз —
результат дефекта в каком-либо белке, участвующем в формировании вертикаль¬
ного взаимодействия внутреннего цитоскелета, сформированного на спектрине, с
трансмембранными белками.Нарушение цитоскелета приводит к частичной утрате мембраны, уменьшению
площади поверхности эритроцита, что сопровождается уменьшением размеров
эритроцита и трансформацией клетки в микросфероцит. Циркулирующие микро-
сфероциты имеют низкую продолжительность жизни (до 12-14 дней), сниженную
осмотическую и механическую резистентность. Через 2-3 пассажа через селезен¬
ку сфероцит подвергается фагоцитозу макрофагами (внутриклеточный гемолиз).
Развивается вторичная спленомегалия, которая усугубляет гемолитический процесс.
После спленэктомии срок пребывания сфероцитов в крови значительно возрастает.Клиническая картина. Основной признак заболевания — гемолитический
синдром, который проявляется желтухой, спленомегалией и анемией. В зависи¬
мости от формы наследования патологии (гомо- или гетерозиготной передачи)
болезнь может выявляться в раннем детском возрасте или в более поздние перио¬
ды жизни, при возникновении заболевания в детском возрасте нарушается нор¬
мальное развитие организма, в результате наблюдаются выраженные клинические
признаки: деформация скелета (особенно черепа), рано отмечается увеличение
селезенки, общая отсталость развития (спленогенный инфантилизм). При гете¬
розиготной форме заболевания клинические признаки слабовыражены, но имеют
место характерные морфологические изменения эритроцитов (микросфероцитоз).
Гемолитический криз возникает под влиянием провоцирующих факторов (инфек¬
ции, переохлаждения, переутомления, беременности и др.).Микросфероцитарная гемолитическая анемия имеет хроническое течение,
сопровождается периодическими гемолитическими кризами и ремиссиями.
550 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ"Г ї#' в период криза может повышаться температура, появляется желтуха, увеличи-
Баются размеры селезенки, усиливается анемия. В период ремиссии признаки
S' заболевания незначительные. Высокий гемолиз и частые гемолитические кризы
способствуют быстрому увеличению размеров селезенки, постоянному увели-
^ чениго концентрации неконъюгированного билирубина в крови, иктеричности
склер. Создаются условия для застоя желчи в печени, который иногда приводит
^ к осложнениям гемолитической болезни: образованию пигментных камней вжелчном пузыре (желчнокаменной болезни), ангиохолециститу и др. Иногда раз¬
виваются трофические язвы голеней, заживление которых возможно только после
спленэктомии.Изменения в костном мозге. Костный мозг гиперклеточный. Развиваются экс¬
тра медуллярные очаги кроветворения в селезенке и других органах. Преобладают
эритробласты, количество которых составляет 60-70% костномозговых клеток,
соотношение лейкоциты/эритроциты — 1:3 и более. Созревание эритробластов и
выход эритроцитов на периферию идут ускоренными темпами. При интенсивном
кроветворении после тяжелого гемолитического криза в костном мозге могут
наблюдаться мегалобласты, очевидно, как следствие недостаточности витами¬
на В^2 или усиленного расхода фолиевой кислоты. Очень редко в стернальном
пунктате обнаруживают эритробластопению — так называемый арегенераторный
криз, который имеет обратимый характер.Изменения в периферической крови. При выраженном некомпенсированном
гемолизе анемия нормохромная. Вместе с тем анемия долгое время может отс)^-
ствовать, однако в периферической крови обнаруживают полихроматофилию и
ретикулоцитоз — признаки активного костномозгового эритропоэза. Эритроциты
(микросфероциты) характеризуются небольшим диаметром (в среднем 5 мкм),
повышенной толщиной и нормальным объемом. Средняя толщина увеличена до2,5-3,0 мкм. Сферический индекс — отношение диаметра (d) эритроцита к его тол¬
щине (Т) — снижен в среднем до 2,7 (при норме 3,4-3,9). Содержание гемоглобина
в эритроцитах в пределах нормы или несколько выше. Количество микросферо-
цитов в период ремиссии и при латентной форме болезни не бывает высоким, в то
время как в период криза гемолиз может сопровождаться увеличением их до 30% и
выше. Микросфероциты в мазках крови имеют небольшой размер, гиперхромные,
без центрального просветления, Эритроцитарная гистограмма дает отклонение
влево, в сторону микроцитов, RDW в норме или немного повышен. Особенностью
микросфероцитарной гемолитической анемии является постоянно повышенный
гемолиз, который сопровождается ретикулоцитозом. В период гемолитического
криза количество ретикулоцитов достигает 50-80% и больше, в период ремис¬
сии — не превышает 2-4%. Ретикулоциты обладают большим диаметром при
нормальной толщине. Могут появляться эритрокариоциты. Гемолитический криз
сопровождается небольшим нейтрофильным лейкоцитозом. Тромбоцитарный
росток, как правило, не изменен. СОЭ в период криза увеличена.Одним из характерных признаков заболевания является снижение осмотиче¬
ской устойчивости эритроцитов. Среди больных с микросфероцитарной гемолити¬
ческой анемией встречаются пациенты, у которых, несмотря на явный сфероцитоз,
осмотическая резистентность эритроцитов нормальная. В этих случаях необхо¬
димо исследовать резистентность эритроцитов по отношению к гипотоническим
солевым растворам после предварительной их инкубации в течение двух суток.
Спленэктомия не устраняет сниженной осмотической и механической устойчиво¬
сти эритроцитов.Развитию спленомегалии с синдромом гиперспленизма сопутствуют лейко¬
пения, нейтропения и нередко слабовыраженная тромбоцитопения. Отмечается
снижение гаптоглобина. Последствия высокого гемолиза: билирубинемия с преоб¬
ладанием неконъюгированного билирубина, в моче увеличено содержание уроби-
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 551линогена, она имеет коричнево-красный оттенок, каловые массы резко окрашены
из-за большого количества стеркобилиногена.Овалоцитарная гемолитическая анемия (овалоклеточная,
наследственный овалоцитоз, эллиптоцитоз)Редкая форма болезни, распространена в Ззападной Африке (2%), наследуется
по аутосомно-доминантному типу. В зависимости от гетеро- или гомозиготной
передачи возможны различные клинические и гематологические проявления
болезни.Патогенез. В основе заболевания лежит патология мембраны эритроцитов.
Возникает, как правило, из-за молекулярного дефекта белков цитоскелета мем¬
браны. Механическая основа уменьшения стабильности мембраны — ослабление
латеральных связей между молекулами спектрина (димер-димерное взаимодей¬
ствие) или дефект комплекса «спектрин-актин-протеин 4.1». Наиболее частой
причиной (65% случаев) наследственного овалоцитоза является мутация, приво¬
дящая к замене аминокислот в аминотерминальной части а-спектрина. Мутации
генов, ответственных за синтез (3-спектрина, встречаются примерно в 30% случаев,
гетерозиготное носительсгво мутаций сопровождается разнообразием клиниче¬
ских проявлений. Продолжительность жизни овалоцитов в организме укорочена.
Заболевание характеризуется внутриклеточным гемолизом с преимущественным
разрушением эритроцитов в селезенке.Клиническая картина. Как аномалия овалоцитоз в большинстве случаев
представляет собой бессимптомное носительство без клинических проявлений,
однако примерно у 10% больных развивается анемия средней тяжести или даже
тяжелая. При гомозиготной форме клинические признаки овалоцитарной анемии
практически не отличаются от микросфероцитоза. Заболевание характеризуется
хроническим нетяжелым течением с гемолитическими кризами, сопровождаю¬
щимися компенсированным или декомпенсированным гемолизом, желтухой и
анемией, уровень которой зависит от компенсаторных возможностей эритропоэза.
Больным свойственны спленомегалия, конституциональные изменения скелета
(черепа), возможны трофические язвы голени и другие симптомы, которые могут
наблюдаться при микросфероцитарной гемолитической анемии.Изменения в костном мозге. Для костного мозга характерен регенераторный
или гиперрегенераторный тип кроветворения с преобладанием эритробластов.
Соотношение лейкоциты/эритроциты составляет 1:3 и более (благодаря эритро-
бластам) в зависимости от активности гемолиза и костномозгового кроветворе¬
ния.Изменения в периферической крови. Анемия носит нормохромный харак¬
тер с высоким ретикулоцитозом. Овалоциты имеют нормальные средние объем и
содержание гемоглобина. Наибольший диаметр эритроцитов достигает 12 мкм,
наименьший — 2 мкм, Овалоцитоз эритроцитов может составлять от 10 до 40-50%
клеток при гетерозиготном носительстве и до 96% эритроцитов — при гомозигот¬
ном носительстве аномальных генов. Осмотическая резистентность овалоцитов
понижена, аутогемолиз повышен, СОЭ увеличена.Овалоцитоз как симптоматическая форма (с небольшим количеством овало¬
цитов) может встречаться при различных патологических состояниях, главным
образом при гемолитических анемиях, заболеваниях печени, миелодиспласти-
ческом синдроме. Известно сочетание овалоцитоза с серповидно-клеточной ане¬
мией, талассемией, пернициозной анемией. В таких случаях овалоцитоз носит
временный характер и исчезает при эффективной терапии основного заболевания.
Именно поэтому к истинному овалоцитозу следует относить лишь те случаи, при
которых не менее 10% эритроцитов имеют овальную форму и патология носит
наследственный характер.
552 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯСтоматоцитарная гемолитическая анемия (стоматоцитоз)Редкая форма заболевания, наследуется по аутосомно-доминантному типу.Патогенез. В основе заболевания лежит нарушение структурных белков
мембраны эритроцитов, приводящих к нарушению регуляции объема клетки.
Деформируемость эритроцита зависит от соотношения площади поверхности и
объема клетки. Дискоидная клетка имеет возможность изменять форму и преодо¬
левать узкие пространства капилляров, что также облегчает обмен кислорода в
капиллярах легких и периферических тканей. Клетка шаровидной формы практи¬
чески не способна изменить форму, у нее снижена способность к обмену кислорода
с тканями. У нормального эритроцита площадь поверхности составляет около
140 мкм^, объем — около 90 фл, концентрация гемоглобина — около 330 г/л.
Большие мембранные белки играют определяющую роль в катионном транс-
мембранном обмене эритроцита и тем самым регулируют объем клетки. К таким
белкам относятся трансмембранные Na^ К% С1'-ко-переносчики, Na\ С1’-ко-
переносчики, ионообменный белок-3. Na', К^-ко-переносчики, Na"^, К^-АТФаза,
Са^'^-АТФаза и др. Нарушение функционирования этих белков с накоплением
катионов внутри эритроцита приводит к накоплению в нем воды и приобретению
сферичности клетки. Аномалия эритроцитов сопровождается повышенным их раз¬
рушением главным образом в селезенке вследствие внутриклеточного гемолиза.Клиническая картина. Может быть с различными проявлениями — от полной
компенсации у носителей патологического гена до тяжелой гемолитической ане¬
мии, напоминающей микросфероцитоз. Внутриклеточный гемолиз эритроцитов
сопровождается увеличением селезенки, желтухой, склонностью к образованию
камней в желчном пузыре и изменениям скелета.Изменения в костном мозге. Костный мозг гиперклеточный благодаря рас¬
ширенному красному ростку. Показатели костномозгового кроветворения зависят
от степени выраженности гемолиза и активности эритропоэза. Ремиссия может не
сопровождаться анемией, в период криза анемия носит, как правило, регенератор¬
ный или гиперрегенераторный характер.Изменения в периферической крови. Морфологическая особенность болез¬
ни — стоматоцитоз, который характеризуется наличием в центре клетки неокра¬
шенного участка в виде вытянутой светлой полосы, напоминающей форму рта
(лат. stoma - рот), или округлой формы. Объем эритроцитов и концентрация
гемоглобина не отличаются от нормы, резистентность эритроцитов может быть
понижена. В период тяжелых гемолитических кризов наблюдаются низкий уро¬
вень гемоглобина и уменьшение количества эритроцитов. Анемия сопровождается
повышенным содержанием ретикулоцитов и неконъюгированного билирубина.Наследственные гемолитические анемии, обусловленные нарушением структуры
липидов мембраны эритроцитов (акантоцитоз)Редкое заболевание, наследуется по аутосомно-рецессивному типу. Наслед¬
ственный акантоцитоз выявляется при абеталипопротеинемии. Снижение содер¬
жания холестерина, триглицеридов, фосфолипидов в крови отражается на липид¬
ном составе мембраны эритроцитов: в них понижена концентрация лецитина,
фосфатидилхолина, повышено содержание сфингомиелина, уровень холестерина
нормальный либо повышен, содержание фосфолипидов нормальное или уменьше¬
но. Все эти нарушения в мембране эритроцитов способствуют снижению текучести
мембраны и изменению их формы. Эритроциты приобретают зубчатый контур,
похожий на листья аканта, поэтому их называют акантоцитами. Аномальные эри¬
троциты разрушаются главным образом в селезенке внутриклеточным гемолизом.Клиническая картина. Существуют признаки анемии, гемолиза эритроцитов,
симптомы нарушения обмена липидов: пигментный ретинит, нистагм глаз, тремор
рук, атаксия.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ553Изменения в костном мозге. Гиперплазия клеточных элементов эритро-
поэза.Изменения в периферической крови. Наблюдается нормохромная нор-
моцитарная анемия. Основным морфологическим признаком этой формы гемо¬
литической анемии являются эритроциты с зубчатым контуром (акантоциты),
которые могут составлять до 40-80% эритроцитов. Отмечается ретикулоцитоз.
Осмотическая стойкость эритроцитов нормальная или сниженная. Количество
лейкоцитов и тромбоцитов в пределах нормы.НАСЛЕДСТВЕННЫЕ ГЕМОЛИТИЧЕСКИЕ АНЕМИИ, ОБУСЛОВЛЕННЫЕ ДЕФИЦИТОМ
ФЕРМЕНТОВ ЭРИТРОЦИТОВГемолитические анемии, обусловленные дефицитом ферментов эритроцитов
(несфероцитарные гемолитические анемии), имеют рецессивный тип наследо¬
вания. Клинические и гематологические проявления болезни зависят от лока¬
лизации наследственного ферментного дефекта в эритроцитах. Эритроцитарные
ферментопатии связаны с недостаточностью ферментов гликолиза (пируватки-
наза, гексокиназа, глюкозофосфатизомераза, триозофосфатизомераза), пентозо-
фосфатного пути или метаболизма глутатиона (глюкозо-6-фосфатдегидрогеназа,6-фосфоглюконатдегидрогеназа и глутатионредуктаза). Чаще всего ферментопа¬
тии связаны с дефектами глюкозо-6-фосфатдегидрогеназы, пируваткиназы или
глутатионредуктазы. Ферментопатии с дефектами других метаболических путей
редки и не имеют практического значения в возникновении гемолитических ане¬
мий. Лабораторное подтверждение эритроцитарных ферментопатий основано на
биохимическом определении активности ферментов в гемолизате. Референтные
значения активности эритроцитарных ферментов представлены в табл, 7-16.Таблица 7-16. Референтные значения активности ферментов гликолизаФерментыАктивностьмкмоль субстрата/г НЬ
в 1 минмкмоль субстрата/10^^
эритроцитов в 1 минГликолизПируваткиназа20,2+2,241 ±10Гексокиназа1,0±0,12.3+0,5Глюкозофосфатизомераза44.7±4.8124±13Т риозофосфатизомераза2180125460551705Пентозофосфатный путь и метаболизм глутатионаГ л юкозо-6-фосфатде гидрогеназа11,0+1,630,6+4,56-фосфогпюконатдегидрогеиаза9,5+1,526,2+4,1Глутатионредуктаза4,6±0,825,7±3,0Дефицит глюкозо-6-фосфатдегидрогеназыГлюкозо-6-фосфатдегидрогеназа (Г-6-ФД) — единственный фермент пенто-
зофосфатного пути, первичный дефицит которого ведет к гемолитической ане¬
мии. Это самая распространенная эритроцитарная ферментопатия: в мире около
200 млн человек имеет эту патологию. Она превалирует среди жителей бассейна
Средиземного моря, Юго-Восточной Азии, Индии. Ген синтеза Г-6-ФД сцеплен
с Х-хромосомой, поэтому заболевание проявляется значительно чаще у мужчин.
Гемолитическую анемию, связанную с дефицитом Г-6-ФД, чаще обнаруживают у
жителей Азербайджана, Дагестана, реже в Средней Азии, среди русских она состав¬
ляет около 2%.Провоцирующими факторами гемолитического криза могут быть инфекцион¬
ные заболевания (грипп, сальмонеллез, вирусный гепатит), употребление в пищу
554 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯКОНСКИХ бобов (фавизм), вдыхание цветочной пыльцы. Последнее сопровожда¬
ется обычно более легким гемолитическим кризом, но возникает через несколь¬
ко минут после контакта с пыльцой. Особенностями фавизма являются острый
гемолиз, настзшающий быстрее, чем вызванный приемом лекарств, и диспепти-
ческие расстройства. Гемолитический криз может быть спровоцирован приемом
некоторых лекарственных препаратов, чаще всего противомалярийных (при-
махина, хинина, акрихина*), сульфаниламидных (норсульфазола*, стрептоцида*,
сульфадиметоксина, бисептола*), нитрофурановых (фуразолидона, фурадонина*),
ПАСК*, противогельминтных и других препаратов. Клинические симптомы могут
возникать на 2-3-и сутки от начала приема препарата. Первыми симптомами
обычно бывают иктеричность склер и темная моча. Прекращение приема лекар¬
ства исключает развитие тяжелого гемолитического криза. В противном случае
на 4-5-и сутки возникает гемолитический криз с выделением мочи черного или
бурого цвета в результате внутрисосудистого гемолиза эритроцитов.При тяжелом течении болезни повышается температура, появляются голов¬
ная боль, рвота, иногда диарея. Возникают одышка, увеличение селезенки.
Внутрисосудистый гемолиз провоцирует активацию свертывания крови, что
может приводить к блокаде микроциркуляции в почках и острой почечной недо¬
статочности. В костном мозге наблюдается резкое раздражение эритропоэза.
В крови — анемия, в период криза количество гемоглобина снижается до 20-30 г/л,
увеличивается количество ретикулоцитов, лейкоцитов со сдвигом лейкоцитарной
формулы влево до миелоцитов. Количество тромбоцитов обычно не меняется.
При тяжелом гемолитическом кризе может выявляться большое количество телец
Гейнца-Эрлиха как результат преципитации цепей глобина и белков мембраны
эритроцитов. Отмечаются анизоцитоз, пойкилоцитоз, полихроматофилия, базо-
фильная пунктация. тельца Жолли. В сыворотке крови повышается содержание
свободного гемоглобина (внутрисосудистый гемолиз), часто увеличивается кон¬
центрация неконъюгированного билирубина, наблюдается гипогаптоглобинемия.
В моче - гемоглобинурия, гемосидеринурия. Диагностика основана на определе¬
нии уровня фермента Г-6-ФД.Дефицит лируваткиназыПируваткиназа на заключительном этапе гликолиза катализирует образова¬
ние АТФ. Дефицит пируваткиназы может привести к снижению в эритроцитах
АТФ и накоплению промежуточных продуктов гликолиза, которые образуют¬
ся на предшествующих этапах. Содержание конечных продуктов гликолиза
(пирувата и лактата) снижается. Недостаток АТФ сопровождается нарушением
функции АТФазного насоса эритроцита и потерей ионов калия. Снижение одно¬
валентных ионов в эритроците приводит к дегидратации и сморщиванию клетки,
что затрудняет оксигенацию и отдачу кислорода гемоглобином. Вместе с тем
накопление промежуточных продуктов гликолиза, в частности 2,3-дифосфо-
глицерата, понижающего сродство гемоглобина к кислороду, облегчает отдачу
кислорода тканям.Клинические симптомы болезни наблюдаются у гомозиготных носителей.
Заболевание характеризуется )т*!Єренной или тяжелой гемолитической анемией с
внутриклеточным гемолизом. Повышенный гемолиз обнаруживают с рождения,
сопровождается частыми и тяжелыми гемолитическими кризами. Появление при¬
знаков болезни в 17-30 лет отличается скудной клинической симптоматикой в
виде иктеричности склер и кожных покровов. Спленомегалия наблюдается почти
постоянно, иногда и у гетерозиготных носителей, хотя анемия у них, как правило,
отсутствует. Гемолитический криз провоцируется инфекцией, тяжелой физической
нагрузкой, беременностью, гемолиз усиливается во время менстрз^аций.в пунктате костного мозга — выраженный эритрокариоцитоз.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ555Самым главным критерием диагностики является дефицит активности пиру-
ваткиназы. Выраженные клинические эффекты наблюдаются в тех случаях, когда
остаточная активность фермента ниже 30% нормы.В крови в большинстве случаев имеет место нормохромная несфероцитар-
ная анемия с незначительным анизоцитозом и пойкилоцитозом. Количество
гемоглобина и эритроцитов может быть нормальным, пониженным, возможна
и выраженная анемия (НЬ — 40-60 г/л), эритроцитарные индексы приближа¬
ются к норме. Нередко Б мазках выявляют полихроматофилию и эритроциты с
базофильной пунктацией, иногда мишеневидные эритроциты, эритрокариоциты.
Ретикулоцитоз в период криза может достигать 70%. Количество лейкоцитов
и тромбоцитов обычно нормальное, хотя в редких случаях бывает сочетанный
ферментный дефект эритроцитов, лейкоцитов и тромбоцитов. СОЭ в период
отсутствия резкой анемии — в пределах нормы. Осмотическая резистентность эри¬
троцитов не коррелирует с формой дефицита фермента и даже при одном и том же
дефекте эритроцитов может быть разной. В сыворотке крови при гемолитическом
кризе повышен неконъюгированный (непрямой) билирубин.ГЕМОЛИТИЧЕСКИЕ АНЕМИИ, СВЯЗАННЫЕ С НАРУШЕНИЕМ СИНТЕЗА ГЛОБИНА
(ГЕМОГЛОБИНОПАТИИ)Различают количественные и качественные гемоглобинопатии. При коли¬
чественных гемоглобинопатиях происходит нарушение соотношения обычных
цепей глобина. Качественные гемоглобинопатии — заболевания, при которых
генетическая аномалия приводит к синтезу гемоглобина с измененной структурой
глобина. Основой лабораторной диагностики качественных и количественных
гемоглобинопатий является электрофорез гемоглобина на ацетате целлюлозы.ТалассемииГетерогенная группа наследственно обусловленных заболеваний, в основе
которых лежит нарушение синтеза одной из полипептидных цепей глобина,
что приводит к увеличению продукции других цепей и развитию дисбаланса
между ними. Талассемии относят к количественным гемоглобинопатиям, так
как структура цепей гемоглобина не изменена. Чаще встречаются (3-талассемии.
Цепи, синтезируемые в избыточном количестве, накапливаются и откладыва¬
ются в эритрокариоцитах костного мозга и эритроцитах периферической крови,
вызывая поражение клеточной мембраны и преждевременную гибель клеток.
Эритрокариоциты гибнут в селезенке, костном мозге. Анемия сопровождается
небольшим повышением ретикулоцитов. Дисбаланс синтеза глобиновых цепей
вызывает неэффективный эритропоэз, внутриклеточный гемолиз эритроцитов
периферической крови — спленомегалию и гипохромную анемию различной
степени тяжести.р-Талассемия — гетерогенное заболевание. В настоящее время известно более
100 мутаций, вызывающих р-талассемию. Обычно дефект состоит в образовании
неполноценной мРНК р-глобина. Разнообразие молекулярных дефектов приводит
к тому, что так называемая гомозиготная р-талассемия нередко представляет двой¬
ное гетерозиготное состояние по разным дефектам синтеза р-глобина. Различают
р°-талассемию, когда у гомозигот полностью отсутствует синтез р-цепей глобина, и
р*-талассемию — при частично сохраненном синтезе р-цепей. Среди р^-талассемий
выделяют две основные формы; тяжелую средиземноморскую форму, при которой
синтезируется около 10% нормальной цепи (большая талассемия, анемия Кули),
и более легкую, негритянскую форму, когда сохраняется около 50% синтеза нор¬
мальной р-цепи. В группу р-талассемий относят также 5р-талассемию и НЬ Lepore.
В результате этого имеются существенные расхождения в клинической картине
различных форм талассемии, однако для всех р-талассемий общими являются
: 556 лабораторная гематологиявнутриклеточный гемолиз эритроцитов, неэффективный эритропоэз в костном
- мозге и спленомегалия.Большая талассемия (анемия Кули, thalassemia major). Считается гомозигот-
, ной формой талассемии, хотя во многих случаях заболевание является двойным
_ гетерозиготным С0СТ0ЯНИЄМ ПО различным формам р-талассемии. Клинически
If] [ заболевание проявляется к концу 1-2 года жизни ребенка спленомегалией, жел-
тухой, бледностью кожных покровов, изменением костей (квадратный череп,
7:-;, уплощенная переносица, выступающие скулы, сужение глазных щелей). Дети
физически плохо развиты.В костном мозге наблюдается гиперплазия красного ростка, выявляется зна¬
чительное количество сидеробластов. В крови — гипохромная микроцитарная
анемия (снижены MCV, МСН, МСНС), резкий анизоцитоз, встречаются эритроци¬
ты с базофильной пунктацией, эритрокариоциты, пойкилоцитоз, мишеневидные
эритроциты, шизоциты. Даже при тяжелой анемии количество ретикулоцитов не
бывает высоким, так как в костном мозге выражен неэффективный эритропоэз.
Отмечается повышение осмотической резистентности эритроцитов. Характерна
лейкопения с относительным лимфоцитозом, в период гемолитического криза -
нейтрофильный лейкоцитоз со сдвигом лейкоцитарной формулы влево, в сыво¬
ротке крови имеет место гипербилирубинемия за счет неконъюгированного
билирубина, повышено содержание сывороточного железа. Избыточное отло¬
жение железа приводит к сидерозу органов. Характерным признаком большой
талассемии является выраженное увеличение концентрации фетального гемогло¬
бина. Количество НЬА варьирует в зависимости от типа талассемии. У гомозигот с
Р®-талассемией НЬА практически отсутствует. При р^^-талассемии (средиземномор¬
ском типе) НЬА варьирует от 10 до 25%, при р^-талассемии негритянского типа
содержание НЬА значительно выше. Однако тяжесть заболевания не всегда корре¬
лирует с количеством фетального гемоглобина. Содержание НЬА^ может быть раз¬
личным, чаще повышенным, но соотношение HbA^HbA всегда меньше чем 1:40.
Диагноз подтверждается электрофорезом гемоглобина (уровень HbF — до 70%).Малая талассемия {thalassemia minor) является гетерозиготной формой
р-талассемии. Клинически малая талассемия характеризуется менее выраженны¬
ми симптомами, чем большая, может протекать практически бессимптомно.В костном мозге — гиперплазия эритроидного ростка, количество сидеробла¬
стов повышено или нормальное. В крови наблюдается умеренная гипохромная
микроцитарная анемия: умеренное снижение гемоглобина при нормальном, а
иногда и повышенном количестве эритроцитов, снижение индексов MCV, МСН,
МСНС. В мазках крови отмечаются анизоцитоз, пойкилоцитоз, мишеневидносгь
эритроцитов, может быть базофильная пунктация эритроцитов, выявляется рети¬
кулоцитоз. В сыворотке крови умеренно повышен неконъюгированный билиру¬
бин, содержание железа обычно нормальное или повышенное.Диагноз устанавливают на основании результатов определения малых фракций
гемоглобина HbAj и HbF. Для больных с гетерозиготной формой р-талассемии
характерно повышение содержания фракции HbAj до 3,5-8% и примерно у поло¬
вины больных — HbF до 2,5-7%.а-Талассемия возникает при мутации генов, расположенных в 11-й паре
хромосом, кодирующих синтез а-цепей. При дефиците а-цепей в крови новорож¬
денных накапливаются тетрамеры НЬ Bart's (у^), а в постнатальном периоде (и у
взрослых) — НЬН (р^). Различают 4 формы а-талассемии.Гомозиготная а-талассемия развивается вследствие полной блокады синте¬
за а-цепей и характеризуется отсутствием нормальных гемоглобинов -(70-100%
составляет НЬ Bart's). НЬ Bart's не способен переносить кислород из-за аномально
повышенного сродства к нему, вследствие чего наступает аноксия тканей, приво¬
дящая к водянке и внутри)тробной гибели плода.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 557Н-гемоглобинопатия обусловлена значительным угнетением продукции
а-цепей вследствие отсутствия 3 из 4 генов. Избыточный синтез (5-цепей приводит
к их накоплению и образованию тетрамеров (НЬН). У новорожденных 20-40%
приходится на долю НЬ Bart's (Y4), который позднее меняется на НЬН. НЬН в функ¬
циональном отношении неполноценен, так как обладает очень высоким сродством
к кислороду, не связывается с гаптоглобином, является нестабильным, нестойким,
легко подвергается окислению и осаждается в клетке по мере ее старения. При
этом заболевании наблюдается повышенное образование MetHb. Агрегация НЬН
изменяет эластичность мембраны эритроцитов, нарушает метаболизм клеток, что
сопровождается гемолизом.Юіинически Н-гемоглобинопатия протекает в форме промежуточной талассе-
мии. Заболевание проявляется обычно к концу первого года жизни хронической
гемолитической анемией умеренной степени тяжести, изредка наблюдается бес¬
симптомное течение. Заболевание характеризуется сравнительно нетяжелым кли¬
ническим течением, гепатоспленомегалией, желтушностью, анемией. Изменения
скелета незначительные. В костном мозге — умеренная гиперплазия эритроидного
ростка, незначительный неэффективный эритропоэз, В крови — выраженная
гипохромия и мишеневидность эритроцитов, небольшой ретикулоцитоз. После
инкубации крови с крезиловым синим при 55 ‘’С выпадает нестабильный НЬН в
виде множества мелких фиолетово-синих включений в эритроцрггах, что отличает
ее от других форм а-талассемий. После спленэктомии включения НЬН по внешнему
виду начинают напоминать тельца Гейнца-Эрлиха. Однако по химической структу¬
ре они отличаются от телец Гейнца-Эрлиха тем, что состоят из преципитировавших
(5-цепей ((3J, в то время как тельца Гейнца-Эрлиха представляют собой осажденные
молекулы НЬА (а^р.,) и некоторые другие нестабильные гемоглобины. При электро¬
форезе сыворотки крови в щелочном буфере наблюдается дополнительная фракция,
движущаяся впереди НЬА (быстродвигающаяся фракция), У взрослых людей зна¬
чения НЬН составляют 5-30%, до 18% может приходиться на долю НЬ Bart’s, HbA^
снижен (1-2%), HbF в норме или слегка повышен (0,3-3%).Малая а-талассемия (а-й,) — гетерозиготное состояние по гену a-th^. Синтез
а-цепей снижен в умеренной степени. В периферической крови обнаруживают
легкую степень анемии с характерными для талассемии морфологическими изме¬
нениями эритроцитов. У новорожденных, носителей этого гена, в пуповинной
крови содержание НЬ Bart's не превышает 5-6%, Продолжительность жизни эри¬
троцитов — на нижней границе нормы.Серповидно-клеточная анемияСерповидно-клеточная анемия (гемоглобинопатия S) — качественная гемо¬
глобинопатия. Аномалия структуры гемоглобина при серповидно-клеточной
анемии заключается в замене в положении 6 р-цепи глутаминовой кислоты на
валин, что приводит к усилению связи одной молекулы гемоглобина с другой.
Гемоглобинопатия S чаще развивается у людей, проживающих в странах, где рас¬
пространена малярия (Средиземноморье, Африке, Индии, Средней Азии). Замена
одной аминокислоты на другую сопровождается тяжелыми физико-химическими
изменениями гемоглобина и ведет к деполимеризации HbS. Дезоксигенация
вызывает отложение молекул аномального гемоглобина в виде мононитей, кото¬
рые агрегируют, превращаясь в кристаллы продолговатой формы, изменяя тем
самым мембрану и форму эритроцитов в виде серпов. Средняя продолжительность
жизни эритроцитов при анемии, гомозиготной по гемоглобину S, составляет около
17 дней, в то же время такая аномалия делает эти эритроциты непригодными для
жизнедеятельности плазмодий, носители гемоглобина S не болеют малярией, что
путем естественного отбора привело к распространению этой гемоглобинопатии в
странах «малярийного пояса».
558ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯГомозиготная форма клинически проявляется спустя несколько месяцев после
рождения. Характерны резкая болезненность суставов, припухлость кистей рук,
стоп, голеней, связанные с тромбозом сосудов, костные изменения (высокий рост,
искривленный позвоночник, башенный череп, измененные зубы). Нередки асеп¬
тические некрозы головок бедренной и плечевой костей, инфаркт легких, окклю¬
зии церебральных сосудов. У детей развиваются гепатомегалия, спленомегалия.
Болезнь характеризуется гемолитическими кризами с внутрисосудистым гемоли¬
зом, поэтому частым осложнением бывают тромбозы мелких и крупных сосудов
различных органов. В крови — невыраженная нормохромная анемия. При гемо¬
литическом кризе — резкое падение гемоглобина и гематокрита, ретикулоцитоз,
нормобластоз, тельца Жолли, серповидные эритроциты, базофильная пунктация,
мишеневидные эритроциты, пойкилоцитоз, лейкоцитоз, тромбоцитоз, повышение
СОЭ, неконъюгированного билирубина. Моча черного цвета за счет гемоглобину-
рии, обнаруживают гемосидерин. Присоединение инфекций может сопровождать¬
ся апластическим кризом - эритроцитопенией, ретикулоцитопенией, тромбо- и
лейкоцитопенией, Серповидность может быть выявлена в пробе с метабисуль¬
фитом натрия или при наложении жгута на основание пальца (снижение доступа
кислорода). Окончательный диагноз устанавливают после электрофореза крови,
где наблюдается 90% HbS, 2-10% HbF, HbA отсутствует.Гетерозиготная форма (носительство признака серповидно-клеточной анемии)
характеризуется доброкачественным течением заболевания. У некоторых боль¬
ных единственным симптомом может бьггь спонтанная гематурия, связанная с
мелкими инфарктами сосудов почек.Тяжелая гипоксия развивается на больших высотах. В этих случаях мог)т быть
тромботические осложнения. Во время криза в крови отмечаются низкий уровень
гемоглобина, серповидные эритроциты, эритрокариоциты.Гемолитические анемии, обусловленные носительством аномальных стабильных
гемоглобинов с, D, ЕРаспространенными формами стабильных гемоглобинов являются С, D, Е. В
НЬС глутаминовая кислота в положении 6 заменена лизином, что ведет к его кри¬
сталлизации; в НЬЕ глутаминовая кислота в положении 26 заменена лизином; в
HbD глутаминовая кислота в положении 121 заменена глутамином. Гетерозиготные
формы протекают без клинических проявлений.У гомозигот клиническая симптоматика обусловлена анемией: характерны
легкая гемолитическая анемия, желтуха, спленомегалия. Анемия носит нормоци-
тарный характер, в крови много мишеневидных клеток, Характерна склонность к
кристаллизации молекул гемоглобина. Сочетание всех 3 видов гемоглобинопатий
с талассемией дает тяжелую клиническую картину.НЬС распространен среди афроамериканцев и африканцев ЮАР, НЬЕ чаще всего
встречается в Юго-Восточной Азии и среди африканцев.Гемолитические анемии, обусловленные носительством аномальных
нестабильных гемоглобиновЗамена аминокислот в НЬА в а- или р-цепях вызывает появление аномально¬
го нестабильного гемоглобина. Замещение в зоне прикрепления гама вызывает
молекулярную нестабильность, ведущую к денатурации и преципитации гемо¬
глобина внутри эритроцита. Преципитированный гемоглобин прикрепляется к
мембране эритроцита, что приводит к разрушению эритроцита, появлению телец
Гейнца-Эрлиха, нарушаются эластичность и проницаемость клеточной мембраны.
При прохождении через селезенку эритроциты теряют часть мембраны, а затем
разрушаются.І^иническая картина. Гемолитическая анемия наблюдается с детства. Кризы
могут быть вызваны лекарственными веществами или инфекцией. В крови отме¬
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 559чаются низкий гемоглобин, мишеневидные эритроциты, базофильная пунктация,
полихромазия, ретикулоцитоз, тельца Гейнца-Эрлиха, повышено содержание
эритрокариоцитов. Осмотическая резистентность эритроцитов нормальная или
немного увеличена. Исследование первичной структуры патологического гемогло¬
бина позволяет установить тип нестабильного гемоглобина.Аномальный гемоглобин составляет 30-40% общего количества гемоглобина.Приобретенные гемолитические анемииприобретенные гемолитические анемии могут быть иммунными и неиммунны¬
ми (вследствие механического повреждения эритроцитов, инфекций, воздействия
физических и химических факторов и др.).ИММУННЫЕ ГЕМОЛИТИЧЕСКИЕ АНЕМИИИммунные гемолитические анемии развиваются вследствие образования анти¬
тел к эритроцитарным антигенам. Выделяют две основные формы — аллоим-
мунные и аутоиммунные гемолитические анемии. Процесс иммунного гемолиза
эритроцитов связан с взаимодействием IgM или IgG с антигенами мембраны
эритроцитов, после чего эритроцит разрушается макрофагами преимущественно в
селезенке. Такой вид иммунного гемолиза характеризуется внутриклеточным раз¬
рушением эритроцитов и встречается чаще всего. В случае присоединения компле¬
мента к Fc-фрагменту иммуноглобулина и последующей активации системы ком¬
племента происходит преимущественно внутрисосудистый гемолиз, показателями
которого являются гемоглобинемия, гемоглобинурия и гемосидеринурия.Приобретенные гемолитические анемии возникают при появлении в сыворотке
крови агглютининов, представляющих по серологическим свойствам неполные и
полные холодовые и тепловые антитела. Их отличительной особенностью явля¬
ются внутриклеточный гемолиз и изменение показателей пигментного обмена.
Гемолитические анемии, обусловленные присутствием в крови гемолизинов,
вызывают разрушение эритроцитов в кровеносном русле при обязательном
взаимодействии с комплементом. Для них характерно наличие внутрисосудистого
гемолиза.Аллоиммунные гемолитические анемииОбусловлены поступлением извне антител к собственным антигенам эритроци¬
тов, например при гемолитической болезни плода и новорожденного, после алло-
генной трансплантации органов или эритроцитов, к которым у пациента имеются
антитела (гемотрансфузии, несовместимые по системам АБО и Rh).В клинической картине посттрансфузионных осложнений выделяют два перио¬
да — гемотрансфузионный щок и ОПН. Гемотрансфузионный шок развивается в
ближайшие минуты или часы. Реакция начинается с появления болей в пояснице,
грудине, по ходу вен. Появляются беспокойство, озноб, одышка, гиперемия кожных
покровов, в тяжелых случаях развивается шок. Обязательным признаком при пере¬
ливании несовместимой крови является острый гемолиз. Характер гемолиза опреде¬
ляется видом антител: при наличии агглютининов имеет место преимущественно
внутриклеточный гемолиз, гемолизины вызывают внутрисосудистый гемолиз. При
групповой несовместимости внутрисосудистый гемолиз определяется наличием
высокого титра иммунных или аутоиммунных анти-А- или анти-В-антител донора,
кровь которого переливают реципиенту. Первые признаки гемолиза выявляются
сразу после переливания несовместимой крови. Тяжесть клинической и гематологи¬
ческой симптоматики зависит от дозы перелитой крови.Костномозговое кроветворение характеризуется резкой гиперплазией с преиму¬
щественной активацией эритропоэза. При ОПН в костном мозге обнаруживают
угнетение эритропоэза по гипорегенераторному типу.
550 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯИзменения в периферической крови. Анемия, возникающая вследствие
повышенного распада эритроцитов, имеет гиперрегенераторный характер, о
котором можно судить по нарастанию в крови ретикулоцитов, наличию поли-
хроматофилии, эритрокариоцитов. Другие гематологические признаки гемолиза
(изменение осмотической резистентности эритроцитов, их объема, диаметра)
непостоянны и нетипичны. Изменения лейкопоэза также вариабельны, чаще
отмечается лейкоцитоз со сдвигом лейкоцитарной формулы влево, вплоть до мие¬
лоцитов,в сыворотке крови повышена концентрация неконъюгированного билирубина.
Лишь в первые часы после переливания несовместимой крови можно обнаружить
гемоглобинемию, поскольку свободный гемоглобин быстро поглощается клетка¬
ми РЭС и выводится почками (гемоглобинурия). Количество мочи уменьшается,
благодаря наличию в ней свободного гемоглобина (гемоглобинурия) она приоб¬
ретает бурый цвет. Отмечается гемосидеринурия.Гемолитическая болезнь плода и новорожденногоГемолитическая анемия плода и новорожденного чаще всего связана с несо¬
вместимостью родителей по резус-фактору (Rh): у Rh-отрицательной жен¬
щины в период беременности Rh-положительным плодом, унаследовавшим
Rh-положительный фактор от О'гца, образуются антирезус*антитела. Резус-
конфликт развивается приблизительно у одной из 15 резус-отрицательных
женщин, и, возможно, не последнюю роль в этом играет повышенная для эри¬
троцитов проницаемость плаценты. Антитела, возникающие в организме матери,
проникают в кровь плода, оседают на поверхности эритроцитов и вызывают
их агглютинацию с последующим гемолизом эритроцитов в организме плода.
В результате у новорожденного в первые часы жизни развиваются гемолити¬
ческая анемия с эритробластозом, желтуха. Развитие эритробластоза плода
объясняют активной реакцией костного мозга на распад эритроцитов в орга¬
низме плода. Вследствие гемолиза резервов костномозгового кроветворения не
хватает и возобновляется экстрамедуллярный эритропоэз в печени и селезенке.
Появляется гепатоспленомегалия, повышается концентрация непрямого били¬
рубина, высокотоксичного для плода или новорожденного, что вызывает раз¬
витие билирубиновой энцефалопатии.Анти-НЬ-антитела в крови резус-отрицательной женщины могут сохраняться в
течение многих лет. Дифференциация Rh-фактора в эритроцитах плода начинает¬
ся с 3-4-го месяца вн>'триутробной жизни, а образование Rh-антител в организме
матери - с 4-5-го месяца беременности. Именно поэтому при раннем прерыва¬
нии беременности иммунизации женщины не происходит. Ъир анти-Rh-антител
в организме матери повышается в основном в конце беременности, в период
родов антитела оседают на эритроцитах плода, вызывая их гемолиз. Титр анти¬
тел увеличивается с каждой последующей беременностью, поэтому и вероятность
Rh-конфликта увеличивается с каждой беременностью.Гемолитическая болезнь новорожденных может зависеть также от несовмести¬
мости крови матери и плода по групповой системе АБО, когда через плаценту в
кровь плода проходят анти-А- или анти-В-агглютинины матери. Обычно группо¬
вая несовместимость по системе АВО крови матери и плода наблюдается при пер¬
вой беременности. При гемолитической болезни имеет место внутриклеточный
гемолиз.Клиническая картина и лабораторные показатели. У новорожденных
отмечаются резкая желтуха, увеличение селезенки и печени, кожные геморрагии,
анемия со значительным количеством эритробластов (до 100-150 тыс. в 1 мкл) и
высоким ретикулоцитозом, нейтрофильный лейкоцитоз со сдвигом лейкоцитар¬
ной формулы влево до миелоцитов, неконъюгированная гипербилирубинемия,
повышенное содержание стеркобилина в кале и уробилина в моче.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 501Аутоиммунные гемолитические анемииАИГА обусловлены наличием антител к собственным антигенам эритроцитов.
По течению АИГА подразделяют на острые и хронические. На основании серо¬
логической характеристики антител и клинических проявлений выделяют 4 вида
АИГА:• аутоиммунные гемолитические анемии с неполными тепловыми агглютини¬
нами (47-80% всех АИГА);• аутоиммунные гемолитические анемии с тепловыми гемолизинами;• аутоиммунные гемолитические анемии с полными Холодовыми агглютини¬
нами (12%);• аутоиммунные гемолити^іеские анемии с двухфазными гемолизинами.АИГА развиваются преимущественно после 40 лет и у детей до 10 лет, соотно¬
шение заболевших женщин и мужчин — 2:1. В патогенезе гемолиза имеет значение
комплекс факторов: класс, подкласс и титр антиэритроцитарных антител, темпера¬
турный оптимум их действия, антигенные особенности эритроцитарной мембраны
и направленность иммуноглобулинов к тем или иным антигенам, система компле¬
мента и активность клеток системы мононуклеарных фагоцитов. Все агглютинины
разделяются на полные и неполные. Неполные агглютинины отличаются тем, что
не дают агглютинации, если эритроциты находятся в водно-солевой среде. Полные
агглютинины дают агглютинацию в любой среде. Неполные антитела обладают
меньшей по сравнению с полными антителами молекулярной массой. В связи с
этим клиническая картина этих форм гемолитической анемии отличается от дру¬
гих форм.АИГА диагностируют по наличию аутоантител, фиксированных на эритро¬
цитах, с помощью пробы Кумбса, при которой антиглобулиновые антитела
вступают во взаимодействие с иммуноглобулинами эритроцитов (прямая проба
Кумбса) и вызывают агглютинацию эритроцитов. Можно выявлять циркулирую¬
щие антитела в сыворотке крови непрямой пробой Кумбса, смешивая сыворотку
с эритроцитами донора. Как правило, выраженность прямой пробы Кумбса тесно
коррелирует с количеством IgG, фиксированных на эритроцитах. Отрицательная
проба Кумбса не исключает АИГА, она может быть отрицательна при интенсивном
гемолизе, массивной гормональной терапии, низком титре антител. Эритроциты,
на которых, помимо Ig, фиксирован комплемент, быстрее удаляются из кровотока.
В этом процессе принимают участие макрофаги печени и селезенки. При отсут¬
ствии комплемента на поверхности эритроцита решающую роль в гемолизе игра¬
ют молекулы Ig и основным местом деструкции эритроцитов является селезенка.
Этим объясняются высокая эффективность спленэктомии при АИГА с неполными
тепловыми агглютининами, когда имеет место опсонизация эритроцитов Ig, и
отсутствие эффекта от операции при АИГА с полными Холодовыми агглютинина¬
ми, при которой эритроциты сенсибилизированы комплементом и разрушаются в
макрофагах печени.Аутоиммунная гемолитическая анемия, обусловленная неполными
тепловыми агглютининамиЭто наиболее распространенная форма аутоиммунных анемий. Заболевание
может быть как идиопатическим, т.е. без явной причины, так и симптоматическим.
Симптоматические, или вторичные, АИГА развиваются на фоне лимфопролифера-
тивных заболеваний и других злокачественных опухолей, болезней соединитель¬
ной ткани, инфекций, аутоиммунных заболеваний (тиреоидита, неспецифическо¬
го язвенного колита, сахарного диабета 1-го типа, саркоидоза и др.). Тепловые
агглютинины могут появляться при лечении большими дозами пенициллина
или цефалоспоринов, при этом они направлены против комплекса антибиотика
с антигенами мембраны эритроцита. Отмена антибиотика ведет к прекращению
гемолиза эритроцитов.
562 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯЛИГА с тепловым типом антител характеризуется наличием на поверхности
эритроцитов антител, как правило, направленных против антигенов системы резус.
С помощью моноспецифических антисывороток на поверхности эритроцитов уда¬
ется обнаружить иммуноглобулины классов G, А, М и компоненты комплемента СЗ
и С4, Гибель эритроцитов связана в одних случаях только с наличием антител на
клеточной поверхности, в других -- с присутствием комплемента. Течение болез¬
ни может быть острым, подострым и хроническим. Обычно гемолиз развивается
постепенно, редко остро. Острое начало более характерно для детского возраста и
всегда в ассоциации с инфекционным процессом. Разрушение эритроцитов проис¬
ходит в селезенке (внутриклеточный гемолиз), поэтому свободный гемоглобин в
сыворотке и моче не выявляется, в клинической картине наблюдаются признаки,
характерные для анемии (бледность, сердцебиение, головокружение) и внутри¬
клеточного гемолиза (желтуха различной интенсивности, спленомегалия).В костном мозге отмечается гиперплазия эритроидного ростка, встречаются
клетки с мегалобластоидной структурой ядерного хроматина.Изменения в периферической крови. Анемия имеет нормо- или гиперхром-
ный характер и сопровождается, как правило, умеренным, реже высоким ретику-
лоцитозом. Снижение концентрации гемоглобина зависит от степени гемолитиче¬
ского криза и достигает 50 г/л. При автоматическом подсчете клеток отмечаются
высокие показатели RDW и МСН. Б мазках крови — анизоцитоз, полихроматофи-
лия, могут присутствовать микроциты, микросфероциты, макроциты, эритрока-
риоциты. Количество лейкоцитов зависит от активности костного мозга и заболе¬
вания, которое лежит в основе гемолиза; оно может быть нормальным, однако при
острой форме наблюдается лейкоцитоз со сдвигом лейкоцитарной формулы влево,
иногда лейкопения. Содержание тромбоцитов в большинстве случаев нормальное,
реже сниженное. Однако возможно одновременное вовлечение в процесс двух или
трех ростков. Осмотическая резистентность эритроцитов умеренно снижена.При биохимическом исследовании выявляется повышенное содержание обще¬
го и непрямого билирубина, возможно повышение концентрации сывороточного
железа.В моче отмечается уробилинурия.у 60-70% больных отмечается положительная прямая проба Кумбса.
Корреляции между выраженностью прямой пробы Кумбса и интенсивностью
гемолиза нет. Отрицательная реакция Кумбса не исключает диагноз АИГА.
Минимальная разрешающая способность ее составляет 100-500 молекул IgG на
эритроцит, при меньшей концентрации антител реакция будет отрицательной.
Во многих случаях АИГА в разрушении эритроцитов активно участвует система
комплемента, и именно поэтому прямая проба Кумбса нередко бывает отрицатель¬
ной. Иммуноферментный анализ позволяет количественно оценить содержание
иммуноглобулинов на поверхности одного эритроцита, а также определить их
класс и тип. Важное значение этих исследований обусловлено тем, что различные
классы и типы иммуноглобулинов обладают неодинаковой физиологической
активностью in vivo. Доказано усиление остроты гемолиза при участии в процессе
одновременно нескольких классов иммуноглобулинов. Кроме того, подклассом
иммуноглобулинов во многом определяются острота гемолиза и место преимуще¬
ственной деструкции эритроцитов, в настоящее время применяют гелевый тест,
аналогичный пробе Кумбса, но более чувствительный. Проба не требует отмы¬
вания эритроцитов, с которым теряется часть иммуноглобулинов, так как гель
отделяет эритроциты от плазмы.Аутоиммунная гемолитическая анемия, обусловленная полными Холо¬
довыми агглютининами (холодовая гемагглютининовая болезнь)Холодовые антитела относятся к IgM. Описаны идиопатические формы, одна¬
ко наиболее часто процесс является вторичным, В молодом возрасте холодовая
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 563гемагглютининовая болезнь (ХГАБ) обычно осложняет течение острой мико-
плазменной инфекции и разрешается по мере купирования последней, У пожи¬
лых больных холодовый гемолиз сопутствует хроническим лимфопролифера-
тивным заболеваниям, протекающим с секрецией парапротеина IgM. Наиболее
часто ХГАБ сопровождается макроглобулинемией Вальденстрема и хроническим
лимфолейкозом с секрецией IgM, а также системными заболеваниями соедини¬
тельной ткани. Для этого вида анемии характерен преимущественно внутрикле¬
точный гемолиз.Макроглобулин, обладающий свойствами холодовых агглютининов, благодаря
высокой молекулярной массе вызывает гипервискозный синдром. Заболевание
проявляется синдромом Рейно, развитием акроцианоза, тромбофлебита, тромбо¬
зов, трофических изменений, вплоть до акрогангрены. IgM функционирует при
низких температурах. Оптимальной для действия макроглобулина является тем¬
пература +4 °С. Именно поэтому весь симптомокомплекс заболевания развивается
на холоде, при переохлаждении открытых частей тела. При переходе в теплое
помещение гемолиз прекращается.Холодовая форма ЛИГА отличается аутоагглютинацией эритроцитов, которая
происходит после взятия крови и часто мешает определению количества эритро¬
цитов, группы крови и биохимическому анализу. Эта агглютинация обратима и
полностью исчезает при подогреве крови. Анемия нормохромная, отмечается
ретикулоцитоз. При исследовании крови на гематологических анализаторах
агглютинация часто приводит к увеличению среднего объема эритроцитов и лож¬
нонизким значениям гемоглобина. Количество лейкоцитов и тромбоцитов — в
пределах нормальных величин, СОЭ увеличена. В сыворотке крови — незначи¬
тельное увеличение неконъюгированного билирубина.Наличие ХОЛОДОВЫХ агглютининов затрудняет определение количества эри¬
троцитов, групповой принадлежности эритроцитов и СОЭ, поэтому определение
проводят либо с подогретым физиологическим раствором, либо в термостате при
температуре 37 °С (кровь берут в пробирку, предварительно опущенную в горячую
воду), в сьшоротке крови таких больных обнаруживают диагностически значи¬
мое повышение титра холодовых антител, на поверхности эритроцитов — IgM.
При использовании поливалентной антиглобулиновой сыворотки прямая проба
Кумбса оказывается в ряде случаев положительной. Полные холодовые агглюти¬
нины имеют специфичность к эритроцитарным антигенам системы Ті, Pp.Аутоиммунные гемолитические анемии^ обусловленные тепловыми
гемолизинамиЭтот вариант АИГА встречается гораздо реже. В патогенезе данной формы
анемии основную роль играют тепловые гемолизины, оптимум действия которых
проявляется при +37 °С. Заболевание имеет хроническое течение и характеризу¬
ется признаками внутрисосудистого гемолиза. Доминирующим диагностическим
критерием являются гемоглобинурия и гемосидеринурия. Моча, как правило, чер¬
ного или бурого цвета. Интенсивность окраски зависит от степени гемолиза. При
выраженном гемолизе имеют место небольшая спленомегалия и незначительное
повышение неконъюгированного билирубина.Б костном мозге отмечается активный эритропоэз. В периферической крови —
анемия нормо- или гипохромного типа, ретикулоцитоз как результат постепенной
потери организмом железа. Количество лейкоцитов может быть повышено, неред¬
ко со сдвигом лейкоцитарной формулы влево до миелоцитов. Иногда развивается
тромбоцитоз, осложняющийся тромбозами периферических вен; именно они обу¬
словливают тяжелую симптоматику. Положительной может быть непрямая проба
Кумбса, особенно в кислой среде, тогда как прямая проба Кумбса чаще бывает
отрицательной.
564 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯПароксизмальная холодовая гемоглобинурия с двухфазными гемолизи¬
нами (анемия Доната-Л андштейнера)В патогенезе заболевания важную роль играют переохлаждение тела, перенесен¬
ная вирусная инфекция (грипп, корь, паротит, возможно, сифилис). Двухфазные
гемолизины относятся к классу IgG3. Фиксация гемолизинов на эритроцитах
происходит при температуре 0-15 °С (первая фаза), а вн>трисосудистый гемо¬
лиз, который идет с участием комплемента, при температуре 37 “С (вторая фаза).
Гемолитический эффект наступает при переходе человека в теплое помещение.Заболевание проявляется приступами озноба, лихорадкой, болями в животе,
рвотой, тошнотой, вазомоторными нарушениями, появлением мочи черного цвета
через несколько часов после переохлаждения. Могут появиться иктеричность
склер, спленомегалия.В костном мозге отмечается гиперплазия красного ростка. В периферической
крови содержание гемоглобина вне криза бывает нормальным. В период криза
развиваются анемия, ретикулонитоз, лейкопения, реже тромбоцитопения. В сыво¬
ротке — повышение уровня свободного гемоглобина, снижение концентрации
гаптоглобина, В моче — гемоглобинурия, гемосидеринурия.НЕИММУННЫЕ ГЕМОЛИТИЧЕСКИЕ АНЕМИИОсновными причинами неиммунных гемолитических анемий являются инфек¬
ции, вызванные менингококками, пневмококками, грамотрицательными бакте¬
риями, малярия, химические (медикаменты, яды, промышленные вещества) и
физические (ожоги) факторы, механическое повреждение эритроцитов (протези¬
рование клапанов сердца), микроангиопатии, ДВС-синдром, маршевая гемоглоби¬
нурия, пароксизмальная ночная гемоглобинурия.Гемолитические анемии, обусловленные инфекциямиИнфекционные агенты способны вызывать гемолитическую анемию как в резуль¬
тате воздействия токсинов (например, Clostridiumpeifringem, а- и (і-гемолитических
стрептококков, менингококков), так и прямой инвазии и разрушения эритроцитов
(Plasmodium, Bartonella).Малярия. Причиной анемии является инвазия малярийными плазмодиями,
которые вызывают распад эритроцитов в процессе эритроцитарной шизогонии.
Гемолиз преимущественно внугрисосудистый. при хроническом течении инфек¬
ции в патогенезе гемолиза акцент с внеклеточного распада переносится на органы
РЭС, где ведущая роль принадлежит увеличенной селезенке.Гемолитико-уремический синдром. Установлена связь синдрома с энте-
рогеморрагической Е. coli, продуцирующей шигатоксин. Заболевание чаще раз¬
вивается у детей до 10 лет, реже у взрослых. Гемолитико-уремический синдром
может развиваться вслед за диареей, но встречается и атипичная бездиарейная
форма с плохим прогнозом. Для заболевания характерны острое начало, микро-
ангиопатическая гемолитическая анемия, тромбоцитопения и поражение почек.
Б моче — протеинурия, гематурия. Развиваются олигурия и анурия. Поражение
ЦНС развивается у 25% больных (включая инсульт, судороги и кому). В различ¬
ные сроки болезни у 50-70% больных развивается острая почечная недостаточ¬
ность. В лабораторных исследованиях выявляют нормальное или удлиненное
протромбиновое время и АПТВ. Содержание фибриногена в плазме нормальное
или повышенное, концентрация продуктов деградации фибриногена может быть
увеличена. Диагноз устанавливают на основании триады: микроангиопатической
гемолитической анемии, тромбоцитопении, поражения почек. Анемия сопрово¬
ждается выраженными морфологическими изменениями эритроцитов (шизо-
цитов, эхиноцитов), нейтрофильным лейкоцитозом со сдвигом лейкоцитарной
формулы влево.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 565Гемолитические анемии, обусловленные механическим повреждением
эритроцитовТравма (с микроангиопатическим гемолизом)При избыточном воздействии сил сдвига и турбулентности в периферической
крови появляются фрагменты эритроцитов необычной формы (треугольные,
шлемовидные и др,), которые служат основанием для установления диагноза.
Вследствие присутствия подобных фрагментов эритроцитов MCV снижается, а
RDW ^ъеличивается (проявление анизоцитоза). Источник травмирования может
быть разным: находиться вне сосудов (маршевая гемоглобинурия), внутри сердца
(обызвествление и стеноз аортального клапана или дефекты протезов клапанов
сердца), в артериолах (злокачественная артериальная гипертензия), в концевых
артериолах (ДВС-синдром). При микроангиопэтической гемолитической анемии,
возникающей из-за травматической фрагментации эритроцитов при прохождении
через искусственные клапаны сердца или поврежденные кровеносные сосуды,
анемия может быть резкой, с фрагментированными эритроцитами (шизоцитами,
шлемовидными эритроцитами).Повышенный гемолиз сопровождается лейкоцитозом с нейтрофильным сдви¬
гом и выраженной тромбоцитопенией. Выявляется низкий уровень фибриногена,
протромбина, VII и X факторов плазмы, которые свидетельствуют о коагулопатии
потребления.Маршевая гемоглобинурия. Гемолиз внутрисосудистый в результате меха¬
нического повреждения эритроцитов в капиллярах стоп. Часто единственным
симптомом болезни является преходящая гемоглобинурия с появлением мочи
черного цвета. Интенсивность гемоглобинурии и интервалы между приступами
зависят от тяжести поражения и нагрузки.Химические яды, Внутрисосудистый гемолиз эритроцитов могут вызывать
яды органического и неорганического происхождения (сапонин, фенилгидразин,
мышьяк, свинец, отравление грибами и др.).Ожоговая болезнь. Гемолиз эритроцитов при ожоговой болезни наблюдается
в случае поражения 20% поверхности тела и имеет сложный генез. Признаки гемо¬
лиза выявляются не сразу. Они маскируются сгущением крови вследствие шокового
состояния и потери плазмы непосредственно после ожога. В послешоковом периоде,
в фазе компенсированной гидремии, отмечается снижение эритроцитов и гемогло¬
бина. Гемолиз может сопровождаться желтухой, а в тяжелых сл^'^иях — гемоглоби-
немией и гемоглобинурией с развитием острой почечной недостаточности,Тромботическая тромбоцитопеническая пурпура (ТТП) (болезнь Мош-
ковица). Заболевание развивается внезапно, часто с гриппоподобной продромой.
Классическими признаками ТТП являются:• тромбоцитопения (количество тромбоцитов менее ЗОхЮУл) наблюдается у
большинства больных;• геморрагический синдром — петехии, носовые, десневые и реже желудочно-
кишечные кровотечения, меноррагии;• микроангиопатическая гемолитическая анемия — снижение гемоглобина до
40-80 г/л, ретикулоцитоз, шизоциты в мазках крови, гипербилирубинемия
(за счет непрямой фракции), проба Кумбса отрицательная, повышение ЛДГ,
снижение гаптоглобина в сыворотке крови;• поражение ЦНС — нарушение сознания, вплоть до комы, психические нару¬
шения, головная боль, судороги, гемиплегия, афазия;• поражение почек — микрогематурия, протеинурия, цилиндрурия, повыше¬
ние креатинина, ОПН;• лихорадка неправильного типа.В анализе крови нормальное или повышенное количество лейкоцитов.
Количество шизоцитов варьирует в пределах 1-18%, в среднем составляет 8,35%
ІШВ 566 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ(норма — 0-0,27%). В течение первых 2 дней шизоцитоз отсутствует. Считается,
что достаточным аргументом в пользу ТТП является наличие более 1% шизо-
цитов.Пароксизмальная ночная гемоглобинурня (болезнь Маркиафавы-Микели)ПНГ — относительно редкая форма приобретенной гемолитической анемии.
Возникает болезнь в любом возрасте, но встречается преимущественно у людей
среднего возраста.Причиной повышенного гемолиза эритроцитов является дефект мембраны
эритроцитов, лейкоцитов и тромбоцитов, обусловленный соматической мутацией
в стволовых кроветворных клетках гена pig-A, ответственного за синтез гликозил-
фосфатидилинозитолового якоря (GPI), через который большинство поверхност¬
ных молекул (CD55, CD59, CD 14, CD16, CD58 и др.) прикрепляются к клеточной
мембране. GPI-AP белки функционируют как ферменты, рецепторы, регуляторы
комплемента и адгезивные молекулы. Снижение экспрессии GPI-связанных бел¬
ков повышает чувствительность эритроцитов к гемолитическому эффекту ком¬
племента.Эритроцить! подвергаются внутрисосудистому гемолизу, носящему кризовый,
периодический характер. Признаки аномалии свойственны всем гемопоэтическим
клеткам, что приводит к редукции гемопоэза и панцитопении.Экспрессию CD14 и CD48 определяют на моноцитах, CD16 и CD66b — на
гранулоцитах, CD48 и CD52 — на лимфоцитах, CD55 и CD59 — на эритроцитах,
CD55, CD58 и CD59 — на тромбоцитах. Пониженная их экспрессия свидетель¬
ствует в пользу ПНГ. Клетки крови и костного мозга становятся гиперчувстви-
тельными к воздействию нормальных компонентов плазмы, в первз'’ю очередь
к СЗ-компоненту комплемента. Гемолизу могут способствовать ночной ацидоз,
беременность, инфекция и другие факторы, Признаки аномалии свойственны не
только эритроцитам, но и клеткам лейкопоэза и тромбоцитопоэза. Наблюдаются
редукция гемопоэза и панцитопения. В лимфатических узлах, селезенке обнару¬
живают экстрамедуллярное кроветворение в виде очагов эритробластной гипер¬
плазии. Заболевание протекает с внутрисосудистым гемолизом, поэтому гемоси¬
дероз обнаруживают в канальцах почек.Клиническая картина. Отличительные признаки заболевания — ночные
гемолитические кризы, сопровождаемые выделением мочи бурого цвета (гемо-
глобинурия, гемосидеринурия). кризы возникают спонтанно либо провоцируют¬
ся интеркуррентными инфекциями, в том числе вирусными, гемотрансфузиями,
стимуляторами эритропоэза (например, витамином лекарственными препа¬
ратами, переутомлением и др. Гемоглобинурийные кризы бывают часто во время
физиологического сна. Интервалы между кризами бывают различными: могут
повторяться ежедневно, еженедельно, раз в год в течение нескольких лет или
быстро приводят к гибели больного. Гепатомегалия и спленомегалия нехарактер¬
ны для болезни Маркиафавы-Микели, однако они могут наблюдаться в связи с
развитием посттрансфузионного гемосидероза органов, при тромбозах системы
селезеночных вен, застойном полнокровии, инфаркте селезенки. Склонность к
тромбозам сосудов наряду с тромбоцитопенией является частым осложнением
болезни.Изменения в костном мозге. На первом этапе болезни присутствует гипер-
пластический тип кроветворения с преобладанием эритробластов и нередко мега-
кариоцитов, другие клеточные элементы сохранены, но не принимают участия в
гиперплазии. При прогрессировании заболевания кроветворная активность кост¬
ного мозга снижается: уменьшается количество эритробластов, мегакариоцитов,
элементов лейкопоэза, отмечается задержка их созревания на стадии миелоцита.
Изредка возникает арегенераторный криз, В костном мозге в этих случаях имеет
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 567место либо изолированная (парциальная) эритробластопения, либо тотальный
миелопарез. Арегенераторный криз затем может сменяться ремиссией. Б конеч¬
ной стадии заболевания развивается выраженная диффузная гипоплазия костного
мозга. Истощение костномозгового кроветворения проявляется панцитопенией.Изменения в периферической крови. Анемия является постоянным сим¬
птомом заболевания и носит чаще нормохромный характер. По мере развития
болезни железо постепенно выводится из организма с мочой и анемия приоб¬
ретает гипохромный характер. Концентрация гемоглобина в период обострения
может составлять 30-50 г/л. Анемия сопровождается небольшим ретикулоци-
тозом (2-4%), не соответствующим степени малокровия. В период арегенера-
торных кризов отмечается ретикулоцитопения. Анемия носит макроцитарный,
реже нормоцитарный характер. Отмечаются анизоцитоз, пойкилоцитоз и поли-
хроматофилия. Могут встречаться нормобласты. Почти постоянны лейкопения
(до 3-1,5х10Ул и ниже) и нейтропения. При инфекционных осложнениях могут
иметь место небольшой лейкоцитоз (до lO-llxlOV^), палочкоядерный сдвиг.
Периодически наблюдаются моноцитоз, относительный лимфоцитоз, базофи-
лия и эозинофилия. Количество тромбоцитов несколько понижено, возможна
значительная тромбоцитопения (ниже ЗОхЮУл), Частым симптомом болезни
является панцитопения.В сыворотке крови в период криза повышаются неконъюгированный били¬
рубин, свободный гемоглобин, снижается гаптоглобин, регистрируется поло¬
жительный тест Хема (лизис исследуемых эритроцитов донорской сывороткой,
где имеются белки комплемента). В моче — гемоглобинурия, гемосидеринурия.
Диагноз подтверждается выявлением мутации гена pig-A и изучением экспрессии
GPI-связанных протеинов на клетках крови.МИЕЛОДИСПЛАСТИЧЕСКИЕ СИНДРОМЫТермин «миелодиспластические синдромы» (МДС) объединяет группу про¬
грессирующих, необратимых опухолевых заболеваний стволовой кроветворной
клетки, характеризующихся длительно существующими цитопениями крови при
гипер- или нормоклеточном костном мозге, качественными (диспластическими)
изменениями всех миелоидных ростков, предрасположенностью к трансформации
в острый нелимфобластный лейкоз.Заболеваемость МДС довольно высокая — в среднем 3,5-7,7 на 100 ООО насе¬
ления в год, в возрастной группе старше 70 лет — около 50 на 100 ООО. МДС —
болезнь пожилых людей: более 80% случаев в возрасте старше 60 лет, не более
10% - в возрасте до 50 лет, редко диагностируют и у детей.Классификация миелодиспластических синдромов (ВОЗ, 2008 г.)• Рефрактерная цитопения с однолинейной дисплазией.• Рефрактерная анемия с кольцевидными сидеробластами.• Рефрактерная цитопения с мультилинейной дисплазией.• Рефрактерная анемия с избытком бластов.• Миелодиспластический синдром с изолированной делецией del(5q).• Неклассифицируемый МДС.• МДС у детей.В соответствии с этой классификацией ХММЛ отнесен к группе миелодиспла-
стических/миелопролиферативных заболеваний. Все случаи с количеством бла¬
стов более 20% отнесены к острому миелоидному лейкозу (ОМЛ).Различают первичный и вторичный МДС. Ко вторичному относят возникно¬
вение заболевания после химио- и/или лучевой терапии, чаще всего по поводу
других злокачественных опухолей, а также после канцерогенных воздействий.
Прогноз вторичного МДС неблагоприятный.
568 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯМДС — заболевание полиэтиологичное, возникающее вследствие повреждения
генетического аппарата гемопоэтических клеток-предшественников. Экзогенными
причинами опухолевой трансформации могут служить химические канцерогены,
цитотоксические медикаменты, проникающая радиация; эндогенными — повы¬
шенная чувствительность генома к повреждающим воздействиям и отсутствие
(или снижение) существующих в норме генетических и иммунологических меха¬
низмов защиты от них.Своеобразие МДС (цитопения в крови при гиперклеточном костном мозге) и
его существенное отличие от острых лейкозов (ОЛ) обусловлено наличием одно¬
временно высокой пролиферативной активности и интенсивного апоптоза опухо¬
левых клеток, пребывание клеток одновременно в S-фазе клеточного цикла и в
апоптозе — специфический признак МДС. При прогрессировании МДС интенсив¬
ность экспрессии факторов апоптоза (CD95 и его лиганда Fas-L, белка р53, ФНО-а)
снижается, а экспрессии BCL-2 — увеличивается, что приводит к снижению уровня
апоптоза и созревания и является причиной трансформации в ОЛ.В результате подавления нормального кроветворения, ускоренной гибели и
функциональной неполноценности клеток патологического клона развиваются
основные клинические проявления заболеваний, объединенных в группу МДС:• анемия (в 85-90% случаев);• нейтропения (у 50% больных; является причиной возникновения инфекци¬
онных заболеваний у 10-40%);• тромбоцитопения (приводит к кровоточивости у 25-70% больных);• похудание и лихорадка (нередко наблюдают при РАИБ).ДиагностикаНеспецифичность клинической симптоматики приводит к тому, что решающее
значение в диагностике МДС имеют данные лабораторных исследований крови и
костного мозга.Диагностическая триада МДС:• хроническая рефрактерная цитопения;• повышенная клеточность костного мозга;• дисплазия одного или нескольких ростков гемопоэза.Хроническая рефрактерная цитопения и повыщенная клеточность костного
мозга свидетельствуют о неэффективности гемопоэза. Морфологические изме¬
нения всех клеточных элементов (проявления дисгемопоэза) хорошо прослежи¬
ваются в мазках крови и костного мозга (табл. 7-17). Диагностическая ценность
находок различна. Такие признаки, как приобретенная пельгеризация нейтро-
филов или микромегакариоциты, почти патогномоничны для МДС, встречаются
у большинства больных. Піпогранулярность нейтрофилов высокоспецифична,
однако встречается реже. Важно помнить, что диспластические изменения клеток
крови наблюдаются не только при МДС, но и при воздействии ряда лекарственных
веществ и токсичных препаратов, проникающего излучения, у инфицированных
ВИЧ, больных с вирусными гепатитами, туберкулезом, при лейкозах, дефиците
витамина В^^ и фолиевой кислоты.Обычно при МДС костный мозг бывает гипер- или нормоклеточным, однако
примерно в 10% случаев наблюдается его гипоплазия, что требует дифферен¬
циальной диагностики с апластической анемией. Гистологическое исследование
трепанобиоптата костного мозга обязательно при диагностике МДС, поскольку
позволяет достоверно оценить клеточность костного мозга, а также выявить
характерные особенности, в частности атипичную локализацию миелоидных
предшественников (АЛМП) в центральных отделах костномозговых полостей, а не
вблизи костных балок. АЛМП встречается у большинства больных с любым вари-
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ569Таблица 7-17. Морфологические изменения в периферической крови и костном мозге при МДСВариантИзменения в кровиИзменения в костном мозгеРефрактерная цитопения с
однолинейной дисплазией;
рефрактерная анемия (РА);
рефрактерная нейтропения;
рефрактерная тромбоцито¬
пеніяОдно- или двухростковая циго-
пения*.Власты отсутствуют
или <!%*'Однолинейная дисплазия: >10% клеток
в одной миелоидной линии.Бласты — <5%.<15% кольцевидных сидеробластовРА с кольцевидными
сидеробластами (РАКС)Анемия.Бласты отсутствуют>15% кольцевидных сидеробластов
(5 гранул и более). Наличие дисплазии
только в эритроидном ростке.<5% бластных клетокРефрактерная цитопения
с мультилинейной
дисплазиейЦитопении (би- или панцитопе¬
ния), бласты отсутствуют или
<1 %**. нет палочек АуэраДисплазия в >10% клеток двух и более
ростков миелоидного кроветворения
(нейтрофильный, зритройдный и/или
мегакарйоцитарный), бласты — <5%,
отсутствуют палочки Ауэра, кольцевид¬
ные сидеробласты +15%РА с избытком бластов-1
{РАИБ-1)Цитопении,бласты — <5%", нет палочек
Ауэра.<1x10% моноцитовДисплазия в одном или более ростках,
бласты — 5-9%, нет палочек АуэраРА с избытком бластов-2
(РАИБ-2)Цитопении, бласты — 5-19%,
палочки Ауэра ±“*Дисплазия в одном или более ростках,
бласты —10-19%, палочки Ауэра ±МДС, ассоциированный с изо¬
лированной делецией del(5q)Анемия, нормальное или повы¬
шенное количество тромбоци¬
тов, бласты — <1%.<1х10^/л моноцитовНормальное или повышенное коли¬
чество мегакариоцитов со снижением
дольчатости ядер, бласты — <5%, нет
палочек Ауэра, изолированная делеция
del(5q)МДС неклассифицируемыйЦитопении,бласты отсутствуют или <1%*“Однолинейная дисплазия в <10% клеток
одной или более миелоидной пинии,
которая сопровождается цитогенетиче¬
скими аномалиями, бласты — <5%* Случаи с панцитопенией должны относиться к неклассифицируемому МДС.** При наличии в костном мозге менее 5% миелобластов, в крови — от 2-4% бластов МДС клас¬
сифицируют как РАИБ-1. Случаи рефрактерной цитопении с однолинейной и м}'льтилинейной
дисплазией с 1% миелобластов в периферической крови должны быть отнесены к неклассифици¬
руемому МДС.*** Наблюдения с менее 5% миелобластов в крови и менее 10% бластов в костном мозге и палоч¬
ками Ауэра классифицируют как РАИБ-2.антом МДС и почти у всех больных с РАИБ. Особенно ценно данное исследование
при низкой клеточности костного мозга.Если морфологических данных недостаточно для подтверждения диагноза
МДС, показано проведение цитогенетических исследований. Примерно в 50%
случаев первичных и в 75% случаев вторичных МДС обнаруживают клональные
хромосомные аномалии. Среди них нет патогномоничных, но можно выделить
наиболее характерные: моносомию по хромосоме 7, делецию в 5q и трисомию по
хромосоме 8. Часто обнаруживают транслокации. Выявление более 2-3 хромо¬
сомных отклонений (комплексное изменение кариотипа) имеет, как и моносомия
7, неблагоприятное прогностическое значение. В этих случаях всегда происходит
довольно быстрая (у 50% больных в течение 6 мес, а через год — у 80%) транс¬
формация в развернутый острый лейкоз.В случае недоступности или неинформативности цитогенетического иссле¬
дования могут быть использованы другие прогностические системы или крайне
упрощенное деление больных на 2 группы по количеству бластов в костном мозге
570 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯи/или крови: с благоприятным (менее 10% бластов) и неблагоприятным {10%
бластов и более) прогнозом,Ш ЛЕЙКОЗЫЛейкозы — опухолевые клональные заболевания кроветворной системы с первич¬
ным поражением костного мозга. Все лейкозы, как острые, так и хронические, имеют
клоновый характер роста. Мишенью злокачественной трансформации являются
стволовые кроветворные клетки или коммитированные клетки-предшественницы.
Клоповая теория лейкемогенеза основывается на положении, что бластная попу¬
ляция представляет собой не гомогенную структуру, а имеет сложную иерархию, в
которой сосуществуют клетки разных генераций на различном уровне своего раз¬
вития. Патологический клон при лейкозах происходит из лейкемической стволовой
клетки, которая во многом повторяет свойства нормальной стволовой единицы,
т.е. имеет высокий пролиферативный потенциал и способность к самообновлению.
При острых лейкозах в бластной популяции имеются небольшой процент клеток,
способных к бесконечному самообновлению, и значительная доля клеток, меняю¬
щихся в динамике заболевания с высоким, но не бесконечным пролиферативным
потенциалом. Большинство бластов находятся в фазе клеточного покоя.Острые лейкозыОстрые лейкозы делят на две группы: миелоидные и лимфоидные. Частота
встречаемости острых лимфоидных и миелоидных лейкозов неодинакова в различ¬
ных возрастных группах. Острые лимфобластные лейкозы регистрируются в 80%
случаев у детей и только в 20% — у взрослых. На долю ОМЛ приходится 15-20%
всех ОЛ у детей в возрасте до 15 лет и свыше 80% — у взрослых. Клинические про¬
явления ОЛ разнообразны и определяются патофизиологическими механизмами
развития заболевания.Диагностика острых лейкозов включает исследование периферической крови,
костного мозга и при необходимости трепанобиопсию.Диагноз ОЛ — исключительно морфологический, устанавливаемый при обнару¬
жении в крови и/или костном мозге бластных клеток, в миелограмме отмечается
увеличение количества бластов (в соответствии с постановлением ВОЗ — более
20%), которое сопровождается угнетением пролиферации элементов эритропоэза
и тромбоцитопоэза.В зависимости от массы опухоли изменения в анализе периферической крови
значительно варьируют от одно- и двухростковой цитопении до панцитопении.
Обнаружение панцитопении является абсолютным показанием к выполнению
стернальной пункции в целях дифференциальной диагностики лейкозов с гипопла¬
зией кроветворения. Анемия, обусловленная угнетением пролиферации эритрока-
риоцитов, носит обычно нормохромный нормоцитарный характер. Количество
тромбоцитов в периферической крови может быть нормальным, пониженным или
повышенным.при манифестации ОЛ количество лейкоцитов в периферической крови варьи¬
рует: оно может быть нормальным, пониженным с относительным лимфоцитозом
в лейкоцитарной формуле либо повышенным. Властные клетки в гемограмме
могут отсутствовать (алейкемическая стадия), или их обнаруживают в небольшом
количестве (3-5%), или они составляют основную массу клеточной популяции.
Гиперлейкоцитоз (более 50х10ул клеток) с бластозом наблюдается у 10% боль¬
ных ОЛ, наиболее часто при М^- и М2-вариантах острого миелоидного лейкоза.
При остром промиелоцитарном лейкозе чаще встречается лейкопения, реже
гиперлейкоцитоз.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ571При подозрении на развитие нейролейкоза, а также с лечебной целью больным
проводят спинномозговую пункцию, обнаружение в спинномозговой жидкости
высокого уровня белка и цитоза более 5 клеток в 1 мкл заставляет предположить
нейролейкоз. Для подтверждения диагноза необходимо морфологическое иссле¬
дование окрашенных мазков ликвора на наличие в них бластных клеток. Роль
лабораторных методов в диагностике острых лейкозов, а также требования к
исследуемому в этом случае материалу представлены в табл. 7-18.Таблица 7-18. Роль лабораторных методов в диагностике острых лейкозовДиагностическиеметодыМатериал для
мсследованияСпособы исследо¬
ванияДиагностическаязначимостьКомментарииОбщий клини¬
ческий анализ
кроаиКровь с К^ЗДТААвтоматизированное
исследование крови
с дифференци¬
альным подсчетом
лейкоцитов в окра¬
шенном мазкеОценка вида и
степени анемии,
тромбоцитолении,
изменения лейкоци¬
тов, обнаружение и
анализ морфологии
бластных клеток,
наличие нормобла-
стов, качественные
аномалии клетокКровь с К^ЭДТА может
быть использована
для цитохимии, про¬
точной цитофлюорй-
метрии, молекулярно¬
го анализаАспират костного
мозгаКостный мозг с
К^ЭДТА. Мазки
костного мозгаПодсчет клеточ-
ности костного
мозга, миелограмма.
Цитохимические
исследованияОпределение про¬
цента и морфологии
бластных клеток,
признаков дисгемо-
поэза в трех росткахОкраску на железо
используют для
оценки его запасов и
наличия кольцеаидных
сидеробластовБиопсия костного
мозгаСтолбик костной
ткани в фикса¬
тореГистологическое,
иммуногистохимиче-
ское исследованиеОценка клеточности,
фиброза, дисплазии
костного мозгаИммуногистохими-
ческое исследование
позволяет уточнить
диагнозЦитохимическиеисследованияНефиксиро¬
ванные пре¬
параты костного
мозга или пери¬
ферической
кровиМПО, липиды, PAS-
реакция, неспецифи¬
ческая эстераза,
кислая фосфатаза,
хло рацетатэстераза,
железоМПО и липи¬
ды — маркеры
миелоидной диф-
ференцировки,
неспецифическая
эстераза — моноци-
тарной дифференци-
ровки. Эритробласты
имеют гранулярную
PAS-реакциюОтрицательные реак¬
ции на МПО и липиды
не исключают диагноз
ОМЛПроточнаяцитофлюориме-трияКостный мозг,
венозная кровь
с К^ЭДТА, гепа¬
риномИсследование смоноклональнымиантителамиОпределение линей¬
ности бластов.
стадии дифферен-
цировки, аберрат-
ного фенотипа для
оценки рецидива или
МРБПозволяет диагности¬
ровать варианты ОЛ,
особенно редкие вари¬
анты ОМЛ. дифферен¬
цировать ОЛЛЦитогенетическиеисследованияКостный мозг
с гепарином
натрияХромосомныйанализИнформация 0
кариотипе, наличии
хромосомных ано¬
малийПозволяют анализиро¬
вать не менее 20 мета-
фазных пластинокМолекулярный
анализ (FISH)Костный мозг,
венозная кровь с
К,ЭДТАИсследование BCR-
ABL,t(15;17), t{8;21}.
inv(16), MLL- и RAR-
реаранжировкиИнформация 0 нали¬
чии генетических
аномалийПомогает в диагно¬
стике заболеваний,
оценке МРБМолекулярный
анализ (ПЦР)Костный мозг,
венозная кровь с
КгЗДТАИсследование гене¬
тических аномалий,
реаранжировки, Т- и
В-клетокИнформация 0 гене¬
тических аномалиях,
использование в
оценке МРБНельзя использовать
гепарин в качестве
антикоагулянта
572 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯОСТРЫЕ МИЕЛОИДНЫЕ ЛЕЙКОЗЫОМЛ встречаются наиболее часто у пациентов старше 60 лет. Развитие ОМЛ
может быть связано с предшествующей миелодисплазией, химиотерапией, иони¬
зирующей радиацией, воздействием бензолпроизводных соединений, конститу¬
циональными хромосомными аномалиями. Клиническая картина ОМЛ разноо¬
бразна и представлена в табл. 7-19.Таблица 7-19. Клинические проявления острых миелоидных лейкозовКлинические проявленияСимптомыАнемияОдышка, слабость, бледность кожного покрова и слизистых оболочекЛейкопения с абсолютной ней-
тропениейЯзвы в полости рта, боль в горле, лихорадка, инфекции дыхательных,
мочевыводящих путей, мягких тканейТромбоцитопенияКожные геморрагии (петехии, пурпура), кровоточивость десен, менорра-
гии, гематурия, носовые кровотеченияГиперлейкоцитозЛейкостаз, респираторный дистресс-синдромЭкстрамедуллярная инфиль¬
трацияГипертрофия десен, поражение кожного покрова (лейкемиды). цен¬
тральной нервной системы, увеличение лимфатических узлов, печени,
селезенкиНа фоне химиотерапии у больных, особенно с гиперлейкоцитозом, развивается
синдром лизиса опухоли, который проявляется повышением содержания лак-
татдегидрогеназы (ЛДГ), гиперкалиемией, гиперурикемией, гипокальциемией, в
связи с чем необходим лабораторный мониторинг показателей электролитного
обмена, ЛДГ и мочевой кислоты.Морфологические и цитохимические исследования продолжают формировать
фундамент современной диагностики и классификации острых лейкозов. Согласно
Франко-америка но-британской классификации (ФАБ-классификации) выделено 8
вариантов ОМЛ (табл. 7-20).Дифференциацию острых миелоидных лейкозов (М^-Мз и большинства слу¬
чаев MJ проводят на основании морфологии и цитохимии, которые позволяют
охарактеризовать линейную направленность дифференцировки лейкозных клеток
(гранулоцитарная, моноцитарная, эритроидная) и определить степень этой диф¬
ференцировки. Выделение вариантов М^ и М^ возможно лишь при использовании
иммунологических методов, к обязательным цитохимическим реакциям, исполь¬
зуемым в дифференциальной диагностике острых лейкозов, относят:• выявление миелопероксидазы и/или липидов;• исследование активностинеспецифическихэстераз-а-нафтилацетатэстеразы
с оценкой чувствительности реакции к ингибиции фторидом натрия и/или
а-нафтилбутиратэстеразы;• проведение PAS-реакции,Активность МПО обычно выявляется в миелоидных бластных клетках парал¬
лельно с липидами, которые реже обнаруживают в менее зрелых миелобластах
при отсутствии фермента. Описаны случаи острого лимфобластного лейкоза с
положительной реакцией на липиды в лейкозных лимфобластах. Распределение
МПО и липидов отличается в клетках гранулоцитарного и моноцитарного ряда.
В миелобластах МПО и липиды расположены компактно, чаще на одном полюсе
клетки, а в моноцитарных клетках — в виде рассеянных гранул. Для подтвержде¬
ния миелоидной природы бластов необходимо выявить 3% и более положитель¬
ных на МПО и/или липиды бластных клеток. МПО и липиды обычно не обнару¬
живают при остром монобластном и мегакариобластном лейкозе,Моноцитарная природа опухолевых клеток подтверждается выявлением неспе¬
цифических эстераз, чувствительных к действию фторида натрия. Мегакариобласты
также могут давать положительную реакцию на а-нафтилацетатэстеразу, но в
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ573Таблица 7-20. ФАБ-классификация острых миелоидных лейкозов (1991)ВариантлейкозаМорфологическая характеристика бластовЦитохимическая характеристика
бластовформаядраазурофильная
зернистость в цито¬
плазмеособенности мие-
лограмиыМПО*и/илилипидыPAS-реакциянеспецифиче¬
ская эстераза
подавляется
NaFМоОкруглаяНетБласты — >30%
НЭК**-/+ <3%
бластовВ диффузной
формеНе подавляетсяМ,Округлая<10% бластовБласты — >90%
НЭК,гранулоциты и
моноциты <10%+ (>3%
бла¬
стов)в диффузной
формеНе подавляетсяМ.Округлая>10% бластов,
могут быть палочки
АуэраБласты —
30-89%,
гранулоциты
>10%, моноцито-
идные клетки —
<20%++в диффузной
формеНе подавляетсяМзВыраженполиморфизм(скрученная,бобовидная)Гипергранулярность,
могут быть пучки и
палочки АуэраПреобладают
атипичные про-
миелоциты+++в диффузной
формеНе подавляетсям.(гипо-грану-лярныйвариант)Выраженполиморфизм(скрученная.бобовидная)Скудное количество
гранулПреобладают
атипичные про¬
миелоциты+++в диффузной
формеНе подавляетсяМ.Округлая имоноцитоид-наяМожет быть пыле¬
видная азурофиль¬
ная зернистостьБласты — >30%
НЭК, гранул, ком¬
понент — >20%
НЭК, моноцитар-
ный компонент —
>20% НЭК,
в п/кр. — моно¬
циты — >5х10®/л+в диффуз¬
ной или
диффузно¬
гранулярной
формеЧастично пода¬
вляетсяКОкруглая и
бобовиднаяОтсутствуетБласты — >30%
НЭК, моноцитар-
ный компонент —
>80% НЭК, моно-
бласты — >80%
моноцитарного
компонента+/-в диффуз¬
ной или
диффузно¬
гранулярной
формеПодавляетсяКМоноци-тоиднаяМожет быть пыле¬
видная азурофиль¬
ная зернистостьБласты — >30%
НЭК, моноцитар-
ный компонент —
^80% НЭК, моно-
бпасты — <80%
моноцитарного
компонента+/-в диффуз¬
ной или
диффузно¬
гранулярной
формеПодавляетсяМаОкруглаяМожет бытьБласты — >30%
НЭК, зритрокари-
ОЦИТЫ — >50®/),
дизэритропоэз+/-Бласты ~
диффузная,
нормобла-
сты — грану¬
лярнаяНе подавляетсяОкруглаяРезкая базофилия
цитоплазмыБласты — >30%
НЭКВ диффузной
форме или в
виде сливных
блоковНе подавляется*МПО — миелопероксидаза.*’*'НЭК - неэритроидный компонент костного мозга.
574 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯотличие от монобластов они не содержат а-нафтилбутиратэстеразу. Эритробласты
при М^-варианте дают положительную реакцию на а-нафтилацетатэстеразу и
а-нафтилбутиратэстеразу.PAS-реакция в миелобластах представлена в диффузной, в моноцитарных
клетках — диффузно-гранулярной форме. Присутствие PAS-положительных гра¬
нул или блоков в эритрокариоцитах характерно для М^-варианта ОМЛ, однако
может наблюдаться при миелодиспластическом синдроме и некоторых анемиях.
При ОЛЛ продукт PAS-реакции выявляется в гранулярной форме в 50-70% слу¬
чаев заболевания. Описаны наблюдения ОМЛ со сходным распределением PAS-
положительного вещества в миелобластах.Цитохимические исследования, как и любые другие методы, имеют свои
ограничения, поскольку в ряде случаев острых лейкозов они неинформативны
либо затруднена интерпретация полученных результатов, что может привести к
установлению диагноза ошибочного варианта ОЛ. При отсутствии морфоцито¬
химических признаков миелоидной или лимфоидной дифференцировки необ¬
ходимо иммунофенотипирование, которое позволяет в трудных случаях диффе¬
ренцировать острые лимфобластные и миелоидные лейкозы, диагностировать
В- и Т-клеточные острые лимфобластные лейкозы, острый миелобластный лейкоз
с минимальной миелоидной дифференцировкой и мегакариобластный лейкоз
(FAB — Mg и Му), выявлять лейкозы, ко-экспрессирующие миелоидные и лимфо¬
идные антигены (так называемые бифенотипические лейкозы). Точное установле¬
ние варианта острого лейкоза важно для рационального выбора соответствующей
программы лечения и прогнозирования течения заболевания.В классификации опухолей гемопоэтической и лимфоидной тканей ВОЗ (2001)
и ее пересмотре в 2008 г. на основании совокупности данных морфологического и
цитогенетического исследований предложены новые подходы к оценке клиниче¬
ских особенностей ОМЛ с использованием биологических характеристик опухо¬
левых клеток, в соответствии с рекомендациями ВОЗ диагноз ОЛ устанавливают
при количестве бластных клеток в костном мозге более 20%. При обнаружении
в костном мозге менее 20% бластных клеток, а в периферической крови - более
20% также устанавливают диагноз острого лейкоза. Наличие 5-19% бластов в
костном мозге предполагает диагноз рефрактерной анемии с их избытком (острый
малопроцентный лейкоз). При наличии эритрокариоцитов менее 50% всех ядро-
содержащих клеток в пунктате костного мозга подсчет бластов осуществляют по
отношению ко всем его ядросодержащим элементам. Если процент эритрокарио¬
цитов составляет 50 и более, то в зависимости от процента бластов проводят их
перерасчет на неэритроидные ядросодержащие клетки. При количестве бластов
20% и более перерасчет не проводят. В обновленной версии классификации ОМЛ
выделено 7 основных подгрупп (табл. 7-21). Условно добавлены ОМЛ с мутацией
NPM1 и ОМЛ с мутацией CEBRA.ОМЛ с повторяющимися генетическими аномалиямиОМЛ с t(8;21) (q22;q22); RUNXl-RUNXlTl обнаруживают в 5% наблюдений
ОМЛ и в 10% М^-варианта ОМЛ, преимущественно у молодых людей. Возможна
первичная экстрамедуллярная локализация опухоли в виде миелоидной саркомы.
В таких случаях в костном мозге может быть низкий процент бластных клеток,
что не является поводом для исключения диагноза ОМЛ, Властные клетки имеют
морфологические характеристики, аналогичные бластам при Мз-варианте. В кост¬
ном мозге присутствуют незрелые и зрелые гранулоциты с признаками дисплазии
различной степени выраженности. Властные клетки имеют высокую экспрессию
CD34, HLA-DR, МРО, CD13, относительно сниженную — CD33. В некоторых
случаях отмечается слабая экспрессия TdT. Иногда имеет место ко-экспрессия
CD34/CD15, что свидетельствует об асинхронном созревании бластов. Характерна
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ575Таблица 7-21. Классификация острых миелоидных лейкозов (ВОЗ, 2008)QM/I с повторяющимися генетическими аномалиямиОМЛ с t(8;21) (q22; q22); RUNXI-RUNXITIОстрый промиелоцитарный лейкоз ct(15;17) (q22; q12)w вариантный; PML-RARAОМЛ с inv(16) (p13.1q22) или t(16;16) (p13.1; q11); CBFB-MYH11ОМЛ ct(9:11) (p22; q23); MLLT3-MLLОМЛ с t(6;9) (p23: q34); DEK^NUP214ОМЛ с inv(3) {q21; q26.2) или t(3;3) (q21: q26.2); RPN1-EV11ОМЛ ct(1:22) (p13; q13); RBM15-MKL1 ОМЛ с изменениями, связанными с миелодисплазиейОМЛ с предшествующей историей МДС или МДС/миелопролиферативных опухолей
ОМЛ с МДС-ассоциированными цитогенетическими аномалиямиОМЛ с диспластическими изменениями в более 50% клеток двух или более миелоидных ростках
Миелоидные новообразования, ассоциированные с предшествующей терапией (t-ОМЛ)ОМЛ, не охарактеризованные иным образомОМЛ с минимальной дифференцировкойОМЛ без созреванияОМЛ с созреваниемОстрый миеломонобластный лейкозОстрый монобластный и моноцитарный лейкозОстрый эритролейкоз: эритромиелоз (>50% эритрокариоцитов + >20% бластных клеток) и истинный эри¬
тролейкоз (>80% зритрокариоцитов)Острый мегакариобластный лейкоз
Острый базофильный лейкоз
Острый панмиелоз с миелофиброзом
Миелоидная саркомаМиелоидные пролиферативные заболевания, ассоциированные с синдромом Дауна
Властное новообразование из плазмоцитоидных дендритных клетокко-экспрессия CD19/CD56 на бластных клетках. ОМЛ с t(8;21) обычно характери¬
зуется хорошим ответом на химиотерапию, высоким процентом полных ремиссий
и длительной выживаемостью, свободной от болезни, к неблагоприятным про¬
гностическим факторам относятся экспрессия CD56 и К1Т-мутации.ОМЛ с inv(16) (pl3.1q22) или t(16;16) (рІЗ.1; qll); CBFB-MYHll характеризу¬
ется гранулоцитарной и моноцитарной дифференцировкой и повышенным количе¬
ством эозинофилов в костном мозге. Составляет 5-8% случаев ОМЛ, Встречается
в любой возрастной группе. Морфологические характеристики бластных клеток
соответствуют ОМЛ-М^. В костном мозге часто обнаруживают повышенное коли¬
чество эозинофилов на любых стадиях их дифференцировки. Характерно наличие
аномалий в виде незрелых гранул на стадии эозинофильного промиелоцита и мие¬
лоцита. Б аномальных эозинофилах отмечается слабая реакция на нафтил-ASD-
хлорацетатэстеразу, что отличает их от нормальных клеток, в которых реакция
отрицательная. В периферической крови эозинофилия встречается значительно
реже, чем в костном мозге, при иммунофенотипировании возможно выявление
нескольких популяций бластов в соответствии с экспрессией ряда маркеров.
Например, незрелые бластные клетки характеризуются экспрессией CD34^CD117%
имеющие гранулоцитарную дифференцировку — CD13, CD33, CD15, CD65, МРО,
моноцитарную дифференцировку — CD14, CD64, CD4,CDllb,CDllc, CD36. Часто
встречается асинхронная экспрессия антигенов. Возможна ко-экспрессия CD2 с
миелоидными маркерами, что не является специфичным для этого варианта ОМЛ.
ОМЛ с inv(16) (рІЗ.1: q22) или t(16;16) (рІЗ.1; qll) характеризуется хорошим
ответом на терапию и длительными полными ремиссиями. У пожилых пациентов
наблюдается более низкая выживаемость и при наличии К1Т-мутаций — высокий
риск рецидива.ОМЛ с t(9;ll) (р22; q23); MLLT3-MLL встречается наиболее часто у детей
(9-12% ОМЛ), у взрослых составляет 2% всех ОМЛ. Часто в клинической карти¬
не имеет место ДВС-синдром. Морфологические и фенотипические особенности
57g ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯбластных клеток соответствуют ОМЛ-Мд^ или ОМЛ-М^. Преобладают монобласты
и промоноциты, в 80-100% случаев характерна экспрессия бластными клетка-
ІИИ HLA-DR, CD4, CDllb, CD15, CD33, CD38, CD64, реже CD34, CD13, CD14.
Ко-экспрессия лимфоидных маркеров CD2, CD7 не является отличительной осо¬
бенностью этого лейкоза,ОМЛ с t(6;9) (р23; q34); DEK-NUP214 обнаруживают в 0,7-1,8% случаев как у
детей, так и у взрослых. Морфологические и иммунофенотипические особенности
бластных клеток соответствуют ОМЛ-М^, реже -М^ или -М^. В 44-60% случаев
отмечаются в костном мозге и периферической крови базофилия (>2%) и дис¬
плазия чаще гранулоцитарного и эритроидного ростков. В дебюте заболевания
бласты чаще позитивны по CD45, CD 13, CD33, CD38, HLA-DR, МРО и могут быть
негативны по CD34. В половине случаев наблюдается экспрессия TdT. Прогноз
неблагоприятный,ОМЛ с inv(3) (q21; q26.2) или t(3;3) (q21; q26,2); RPNl-EVIl составля¬
ет 1-2% всех ОМЛ. Морфологические и иммунофенотипические особенности
бластных клеток могут соответствовать любому варианту ФАБ-классификации,
за исключением ОМЛ-Мд. В периферической крови часто встречается тромбо¬
цитоз, а в костном мозге - повышенное количество атипичных мегакариоцитов.
Характерны признаки мультилинейной дисплазии. Фенотип бластных клеток —
СО 13, CD33, CD34, CD38, HLA-DR. Часто аберрантная экспрессия CD7, редко
CD41 или CD61. ОМЛ с inv(3) (q21; q26.2) или t(3;3) (q21; q26.2); RPNl-EVIl -
агрессивное заболевание, характеризуемое короткой выживаемостью больных.ОМЛ С изменениями, связанными с миелодисллазиейОМЛ этой группы встречаются преимущественно у пожилых пациентов и
составляют 24-35% всех наблюдений. Характерна выраженная панцитопения.
Критерии диагностики этого варианта ОМЛ представлены в табл. 7-22.Таблица 7-22. Критерии диагностики ОМЛ с изменениями, связанными с миелодисплазией Критерии >20% бластов в костном мозге или крови
и любой из следующих признаков• Предшествующая история МДС• МДС-ассоциированные цитогенетические аномалии• Мультилинейная дисплазия
иотсутствие обоих признаков• Предшествующая цитотоксическая терапия по поводу других заболеваний• Цитогенетические аномалии, описанные при ОМЛ с повторяющимися генетическими аномалиями Для установления диагноза ОМЛ с изменениями, связанными с миелодиспла¬
зией, необходимы доказательства наличия дисплазии не менее чем в 50% клеток,
по крайней мере, в двух клеточных ростках. Эта группа ОМЛ гетерогенна и может
включать различные морфологические варианты по ФАБ-классификации. Бласты
часто экспрессируют CD 14, CD4dim, CD34, CD13, CD33. Может наблюдаться абер¬
рантная экспрессия CD56 и CD7. Дифференциальную диагностику проводят с реф¬
рактерной анемией с избытком бластов и 0МЛ-М^М7. Например, при наличии
в костном мозге >20% бластов, >50% эритрокариоцитов, мультилинейной дис¬
плазии и моносомии 7 предпочтителен диагноз ОМЛ с изменениями, связанными
с миелодисплазией, чем острый эритромиелоз. Аналогично при наличии >20%
мегакариобластов и мультилинейной дисплазии устанавливают диагноз ОМЛ с
изменениями, связанными с миелодисплазией.Прогноз этого варианта ОМЛ неблагоприятный. В ряде случаев в костном
мозге бластные клетки составляют 20-29%, и ранее такой вариант относился к
РАИБТ (рефрактерной анемии с избытком бластов в трансформации по ФАБ-
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ577классификации). Он характеризуется медленной прогрессией и относительно
стабильными показателями периферической крови.Миелоидные новообразования, ассоциированные с предшествующей терапиейВ эту группу включены о мл, ассоциированные с предшествующей терапией
(t-OMJl), МДС (t-МДС) и t-МДС/миелопролиферативные опухоли (МПО), как
поздние осложнения цитотоксической или лучевой терапии, назначенной по пово¬
ду предшествующих опухолевых или неопухолевых заболеваний. Эти заболевания
составляют около 10-20% всех случаев ОМЛ, МДС и t-МДС/МПО. Риск развития
этих заболеваний особенно повышается при приеме алкилирующих препаратов и
ингибиторов топоизомеразы II. Развитие данных опухолей происходит в среднем
через 5-10 лет после применения алкилирующих препаратов и лучевой терапии.
Наиболее часто у таких больных отмечаются признаки t-МДС, костномозговой
недостаточности в виде одно- или трехростковой цитопении, реже наблюдается
t-МДС/МПО и t-ОМЛ. Примерно у 20-30% больных латентный период составля¬
ет 1-5 лет и, как правило, это связано с использованием ингибиторов топоизоме¬
разы II. Особенностью развития миелоидных новообразований в этой подгруппе
пациентов является отсутствие миелодиспластической фазы. В большинстве слу¬
чаев t-ОМЛ и t-МДС ассоциируются с признаками мультилинейной дисплазии.
В периферической крови отмечается анемия, чаще макроцитарная, характерны
пойкилоцитоз, базофилия. Клеточность костного мозга варьирует, в 15% случаев
наблюдается фиброз. Специфичных иммунофенотипических признаков нет.Подгруппа ОМЛ, называемая в классификации ВОЗ как «ОМЛ. не охарак¬
теризованные иным образом», состоит из вариантов ОМЛ, указанных в ФАБ-
классификации 1991 г.Острые миелобластные лейкозы с минимальной миелоидной
дифференцировкой бластов (М^)Частота встречаемости — 2-3% всех ОМЛ. Власты характеризуются средним
или большим размером, округлой или овальной формой ядер, тонкодисперсным
хроматином, наличием нуклеол (1-3), слабобазофильной цитоплазмой без зер¬
нистости. Цитохимические реакции на миелопероксидазу и липиды, как правило,
отрицательные, а-нафтилацетатэстераза слабоположительная, PAS-реакция в
диффузной форме, что в ряде случаев позволяет предположить миелоидную диф-
ференцировку этих бластов. Этот вариант не может быть диагностирован морфо¬
цитохимическими методами. Для подтверждения Мр-варианта ОМЛ необходимо
иммунофенотипирование бластов в целях выявления экспрессии миелоидных
антигенов CD33 и/или CD13, CD117 и внутрицитоплазматической миелоперок-
сидазы. Властные клетки при данном варианте ОЛ экспрессируют в большинстве
случаев HLA-DR, CD38, CD34. Наряду с экспрессией маркеров миелоидной диф-
ференцировки опухолевые клетки в 50-70% случаев ко-экспрессируют лимфоид¬
ные антигены CD2, CD4, CD7, CD10, TdT.Острый ииелобластный лейкоз без созревания (М^)Частота встречаемости — 10-20% всех ОМЛ, характеризуется резким снижени¬
ем количества созревающих гранулоцитов и увеличением количества миелобластов
(>90%), Для четкого разграничения М,- и М^-вариантов в ФАВ-классификации
предложен критерий — пороговое значение созревающих гранулоцитов в миело-
грамме, начиная со стадии промиелоцита. Определяющий показатель для М^ —
менее 10% клеток гранулоцитарного ростка, а для М^ — более 10%. Для бластных
клеток характерен выраженный полиморфизм размера клеток, формы ядер,
количества нуклеол. Ядра округлой или овальной формы, хроматин сетчатый,
распределен равномерно, в ядре 1-3 нуклеолы. Согласно ФАВ-классификации,
различают бласты I типа — с отсутствием в них зернистости при окраске по
578 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯРомановскому-Гимзе, II типа — с азурофильной зернистостью и/или палочками
Ауэра (их наличие в цитоплазме бластных клеток позволяет отнести клетки к
более дифференцированному типу, чем вариант М^). Цитоплазма бледно-голубого
цвета, иногда вакуолизированная. Более 3% бластов дают положительную реак¬
цию на миелопероксидазу и/или липиды, PAS-реакция представлена в диффузной
форме. Реакция на неспецифическую эстеразу слабая и не ингибируется фтори¬
стым натрием.ОМЛ без созревания является более иммунологически очерченной группой по
сравнению с М^-вариантом. Опухолевые клетки характеризуются высоким уров¬
нем экспрессии миелоидных (CD33, CD13, CD65, CD117, цитоплазматическая
МПО) и линейно-неограниченных антигенов (HLA-DR, CD38). Экспрессия CD34
менее выражена, чем при CD4, CDllb, CD15, CD66 выявляются нечасто.Острый миелобластный лейкоз с созреванием (М^)Частота встречаемости — 25-30%, Бласты I и II типа составляют 20-89%.
Характеризуются средними и крупными размерами, умеренным ядерно-
цитоплазматическим соотношением, округлой или неправильной формой ядер,
наличием нескольких нуклеол. Цитоплазма слабобазофильная, с многочисленной
азурофильной зернистостью и единичными палочками Ауэра более чем в 10%
клеток. Характерным для Мз-варианта ОМЛ является различное соотношение
созревающих клеток гранулоцитарного ряда, часто с признаками дисплазии.
Властные клетки характеризуются положительной реакцией на МПО и диффузной
PAS-реакцией.При иммунофенотипировании бластных клеток М^-варианта регистрируется
выраженная активность цитоплазматической МПО, возрастает экспрессия CDllb,
CD15, CD65, CD13 и CD33, что соответствует более выраженной зрелости миело-
бластов при М^-варианте по сравнению с М^.В 35-40% случаев встречается типичная транслокация t (8;21), которая является
прогностически благоприятным маркером как у взрослых, так и детей.Острый промиелоцитарный лейкоз (М^)Частота встречаемости — 5-10%, преобладает у молодых пациентов. Выделяют
гипер- и гипогранулярный варианты (М,^,). Острый промиелоцитарный лейкоз
имеет ряд клинических и биологических особенностей. Блок дифференцировки
бластных клеток происходит на стадии промиелоцитов, которые составляют мор¬
фологический субстрат опухоли. Клиническая картина заболевания характеризу¬
ется выраженным геморрагическим синдромом, осложняется развитием ДВС.Бласты (атипичные промиелоциты) характеризуются средними размерами
(диаметр — 15-20 мкм), высоким ядерно-цитоплазматическим соотношением,
анизоцитозом клеток и их полиморфных ядер бобовидной, скрученной, складча¬
той, дольчатой формы. Последние часто расположены эксцентрично; характерна
их гиперхромия. а также отсутствие нуклеол. Цитоплазма голубого цвета с гру¬
бой, обильной, полиморфной азурофильной зернистостью. І^анульї варьируют
по величине, форме; крупные могут сливаться, образуя палочки Ауэра, иногда в
виде пучков. В некоторых случаях наблюдаются разрушенные гипергранулярные
промиелоциты, при этом гранулы и палочки Ауэра определяются внеклеточно.
Количество бластов с зернистостью составляет не менее 40%.Властные клетки характеризуются выраженной активностью миелопероксида-
зы, липидов, PAS-положительного вещества в диффузной форме.Иммунофенотип бластных клеток М^-варианта ОМЛ ассоциируется с выражен¬
ной экспрессией миелоидных антигенов - МПО, CD13, CD33, CD65. Для гипер- и
гипогранулярного вариантов острого промиелоцитарного лейкоза характерны
низкий уровень экспрессии CD34 и отсутствие HLA-DR-антигена.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 579У подавляющего большинства больных острым промиелоцитарным лейкозом
выявляется специфическая хромосомная аномалия — транслокация t(15;17).Острый миеломонобластный лейкоз (М^)Частота встречаемости ^ 15-20% всех ОМЛ. Этот вариант ОМЛ устанавлива¬
ется при наличии 20% и более бластных клеток с цитоморфологическими при¬
знаками миелобластов I и II типа, монобластов и промоноцитов. Моноцитарный
компонент в костном мозге составляет не менее 20% всех НЭК, а в перифериче¬
ской крови — не менее 5x1 ОУл. Монобласты представляют собой более крупные
клетки по сравнению с миелобластами с высоким ядерно-цитоплазматическим
соотношением. Ядра округлой или овальной формы, с равномерно распределен¬
ным хроматином, содержат чаще одно ядрышко. Цитоплазма различной степени
базофилии, может присутствовать пылевидная азурофильная зернистость. Наряду
с этим в периферической крови обнаруживают более дифференцированные клет¬
ки — промоноциты. Как монобласты, так и промоноциты характеризуются поли¬
морфизмом. Миелобласты и незрелые клетки гранулоцитарного ряда по цито-
морфологическим признакам аналогичны таковым при ОМЛ-Мз- В миелобластах
достаточно часто встречаются палочки Ауэра.При цитохимическом исследовании одна часть бластов имеет признаки, свой¬
ственные клеткам гранулоцитарного ряда, остальная — моноцитарной линии
дифференцировки. Миелобласты проявляют умеренную и выраженную реакцию
на МПО, хлорацетатэстеразу, липиды. Для монобластов характерным является
выраженная реакция на неспецифическую эстеразу, ингибирующаяся фторидом
натрия; ответ на МПО отрицательный или слабый. PAS-реакция в миелобластах
диффузная, в монобластах — диффузно-гранулярная.Для М^-варианта ОМЛ характерна экспрессия антигенов гранулоцитарной и
моноцитарной дифференцировки (CDllb, CD13, CD33, CD64, CD14), HLA-DR-
антигена. Б 20% случаев отмечается экспрессия CD4, что является косвенным
признаком моноцитарной направленности. Наличие антигена CD2 коррелирует с
вариантом М^^^,Дифференциальную диагностику ОМЛ-М^ наиболее часто проводят с ОМЛ-
М2 и OMn-Mgj,- При ОМЛ-М2 количество клеток моноцитарного ряда в костном
мозге менее 20%, а в периферической крови — менее 5х10Ул, что подтверждается
результатами цитохимических исследований. При ОМЛ-М.^^ содержание клеток
моноцитарного ряда в костном мозге составляет не менее 80%.В 15-30% случаев при ОМЛ-М^ наблюдается эозинофилия в костном мозге
(более 5%), представленная как незрелыми, так и зрелыми эозинофилами. В пери¬
ферической крови их количество не увеличивается. Особенностью М^з^ является
наличие цитогенетического маркера — inv(16) (р13; q22) и t(16;16), более частые
очаги экстрамедуллярного кроветворения (шейные лимфатические узлы, мин¬
далины, яичник и кишечник). ОМЛ-М^з^ характеризуется более благоприятным
течением заболевания.Острый монобластный лейкоз без созревания (М^)Частота встречаемости — 5-10% всех случаев ОМЛ. Чаще наблюдается в
молодом возрасте. Властные клетки в костном мозге составляют более 80%. Они
характеризуются большим размером, умеренным ядерно-цитоплазматическим
соотношением, крупными, округлой или бобовидной формы ядрами, нежно¬
сетчатой структурой хроматина, 1-2 нуклеолами, цитоплазмой различной сте¬
пени базофилии, образующей псевдоподии. В вакуолизированной цитоплазме
клеток можно обнаружить нежные азурофильные гранулы. Могут присутствовать
промоноциты. В типичных монобластах палочки Ауэра обычно не выявляются.
Монобласты характеризуются выраженной реакцией на неспецифическую эсте-
580 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯразу, полностью ингибируемую фторидом натрия. В некоторых случаях может
быть слабая реакция на МПО. Характер PAS-реакции различный. В большинстве
случаев окрашивание слабое.Бласты М,-варианта ОМЛ характеризуются полиморфным иммунофенотипом.
Обычно они экспрессируют МПО, HLA-DR, CD4, CDllb, CDllc, CD33, CD65.
В 30% случаев бласты имеют поверхностный антиген GDI 17, очень редко обна¬
руживают CD34. В большинстве наблюдений клетки экспрессируют CD15, CD36,
редко CD56. Экспрессия CD14 в основном характеризует моноцитарную направ¬
ленность бластных клеток, однако при М^-варианте ОМЛ у детей этот антиген
может отсутствовать.Частым цитогенетическим маркером является llq23, который ассоциируется с
плохим прогнозом, встречаются очаги экстрамедуллярного кроветворения.Острый монобластный лейкоз с созреваниемОМЛ-М^^ является разновидностью острого монобластного лейкоза с более
высоким уровнем дифференцировки. Частота этого варианта ОМЛ составляет
3-6%, В лейкозной популяции преобладают промоноциты — крупные клетки с
обширной цитоплазмой бледно-голубого цвета, содержащей азурофильную зер¬
нистость. Ядра бобовидные, дольчатые, структура хроматина нежная, ядрышки
нечеткие. Монобласты в костном мозге составляют менее 80%. Основным цито¬
химическим маркером клеток моноцитарной природы является наличие в них
неспецифической эстеразы, ингибируемой фторидом натрия.Острый эритромиелоз (Mg)Частота встречаемости — 3-4% всех ОМЛ. Эритроидный компонент превышает
50% всех ядросодержащих клеток в костном мозге. Бласты обычно представлены
двумя типами клеток: эритробластами и миелобластами. Отмечается выраженная
пролиферация клеток красного ряда с морфологическими признаками дисэри-
тропоэза (такими как многоядерность эритронормобластов, межклеточные и
межъядерные мостики, мегалобластоидность ядер, кариорексис, неровные кон¬
туры ядерной мембраны, уродливость ядер, форма которых напоминает розетку,
трилистник, базофильная пунктация, тельца Жолли, вакуолизация цитоплазмы).
В некоторых случаях эритропоэз может быть мегалобластическим. При ОМЛ-М^
обнаруживают миелобласты I и II типа. Достаточно часто в их цитоплазме
обнаруживают палочки Ауэра. В периферической крови могут определяться
клетки эритроидного ряда и незрелые клетки гранулоцитарного ростка. В ФАБ-
классификации выделены два подварианта: ОМЛ-М^^, при котором в костном
мозге имеются две популяции бластных клеток (миелобласты и эритробласты),
и ОМЛ-М^^, представляющий опухолевую пролиферацию клеток, коммитиро-
ванных только в эритроидном направлении. При этом миелобласты отсутствуют.
Эритроидные клетки при ОМЛ-М^ характеризуются гранулярной PAS-реакцией
в виде крупных гранул или блоков. Реакция на МПО отрицательная, активность
неспецифической эстеразы возможна в области аппарата Гольджи.Особенностью иммунологического фенотипа эритробластов является высокая
экспрессия эритроидного антигена — гликофорина А (GPA). На поверхности эри¬
тробластов с высокой частотой обнаруживают линейно-неограниченные антигены
HLA-DR, CD3S, трансферриновый рецептор CD71, реже CD34, возможно обнару¬
жение Т-клеточного антигена CD7. Клетки миелоидного компонента экспрессируют
CD13, CD33 и МПО. Высокая частота обнаружения линейно-неограниченных анти¬
генов и CD34 свидетельствует о преобладании ранних эритроидных предшественни¬
ков (БОЕ-Э), для которых характерен иммунофенотип CD34'HLA‘DR*CD38’.Наиболее частым цитогенетическим маркером М^-варианта ОМЛ является
делеция (del) хромосом 5 и 7, которая ассоциируется с плохим прогнозом.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ581Острый мегакариобластный лейкоз (М^)Встречается очень редко (менее 1% всех случаев ОМЛ) во всех возрастных груп¬
пах. Отмечается связь ОМЛ-М^ с синдромом Дауна. Властные клетки могут быть
достаточно разнообразными — от недифференцированных бластов небольших
размеров до крупных клеток с обширным ободком цитоплазмы, содержащей азуро-
фильные гранулы. Бласты характеризуются высоким ядерно-цитоплазматическим
соотношением, округлой формой ядер, равномерным распределением хроматина,
гиперхромией, отростчатой, резко базофильной цитоплазмой. В редких случаях
выявляются признаки мегакариоцитарной дифференцировки и определяются
промегакариоциты. Зрелые мегакариоциты обычно меньше нормальных, ядра
их не имеют дольчатой структуры. Мегакариобласты и промегакариоциты могут
располагаться в виде небольших групп, имитируя метастазы злокачественных
новообразований в костном мозге, В периферической крови обнаруживают моно*
морфную популяцию недифференцированных бластных клеток или с признаками
мегакариоцитарной дифференцировки. Тромбоциты характеризуются анизоци-
тозом, встречаются крупные, вытянутой формы клетки, частично или полностью
лишенные гранул. В периферической крови могут быть единичные нормобласты
и незрелые гранулоциты.При цитохимическом исследовании бластные клетки дают отрицательную
реакцию на МПО, липиды, PAS-реакцию в диффузно-гранулярной форме. В бла-
стах выявляется неспецифическая эстераза с субстратом а-нафтилацетат.Морфологический диагноз М_-варианта ОМЛ весьма затруднителен. Только
иммунологическое фенотипирование позволяет установить мегакариоцитарную
дифференцировку бластов и провести дифференциальную диагностику с ОЛЛ,
Mg-, М^-вариантами ОМЛ, метастазами в костный мозг мелкоклеточных злока¬
чественных опухолей (табл. 7-23). Атипичные клетки экспрессируют антигены
CD41a, и/или CD42b, и/или CD61. В большинстве случаев на бластных клетках
обнаруживают экспрессию миелоидных антигенов CD13, CD33, встречаются
линейно-неограниченные антигены — HLA-DR, CD38, CD34.Таблица 7-23. Иммунологическая характеристика ОМЛПоказательмум.М,м,м,КМПО+/-+++-/+г-/+-CD117+/~+++/--~CD13+/-++++/--+/-CD14---+/-+/---CD64-+/-+/-+++/--CD15-+/--/++/-+--CD33+/-+/-++н-++CD34+/-+/---/+---CD41------+CD61------+Гликофорин А-----+-HLA-DR+/-+-++-+примечания; отрицательная реакции; -/+ - экспрессия антигена отмечается в менее50% случаев; -г/ экспрессия антигена отмечается в более 50% слз^чаев; + - положительнаяреакция.С мегакариобластным лейкозом могут быть связаны аномалии хромосомы 3 —
inv(3), t(3;3), t(9;22), трисомия хромосомы 21.В классификации ВОЗ выделен острый базофильный лейкоз, при котором
бласты имеют средний размер, умеренно базофильную цитоплазму с базофиль-
582 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯными гранулами. Цитохимические реакции на МПО, липиды и неспецифическую
эстеразу в бластных клетках отрицательные. При остром базофильном лейкозе
бласты имеют положительную реакцию с толуидиновым синим и диффузную
реакцию на кислую фосфатазу. Б;гастные клетки экспрессируют CD9, реже CD10,
CD7.ОСТРЫЕ ЛИМФОБЛАСТНЫЕ ЛЕЙКОЗЫОстрые лимфобластные лейкозы (ОЛЛ) — гетерогенная группа заболеваний,
каждое из которых имеет клинические, иммунологические и прогностические
особенности. ОЛЛ у детей составляет до 75% гемобластозов и до 25% всех опухо¬
лей. Сравнение ФАБ- и ВОЗ-классификаций ОЛЛ представлено в табл. 7-24. При
наличии в костном мозге менее 20% бластных клеток состояние расценивается как
лимфобластная лимфома.Таблица 7-24. Сравнение ФАБ- и ВОЗ-классификаций ОЛЛФАБ-классификацияВОЗ-класснфикация>30% бластов>20% бластовЦ-/Ц-1У1орфологияПре-В-ОЛЛ (цитогенетические подгруппы)Морфологический вариант раз¬
личныйt(9;22) (ц34\ци.2)ВСЯ/АВІ
t(V;11) (V; q23) MLL реаранжировки
t(1;19) {ц23\ pU.3) E2A/PBX1
t(12;21)(p13; q22)ETV6/RUNX1 (TEUAML1)Гиподиплоидия <46 хромосом
Гипердиплоидия >50 хромосом
Пре-Т-ОЛЛ (цитогенетические подгруппы
t(V;14) (V; q11-13) Беркиттоподобный лейкозКлиническая картина ОЛЛ весьма вариабельна и обусловлена опухолевой
инфильтрацией и нарушением функций пораженных органов. Дисфункция кост¬
ного мозга проявляется анемическим синдромом; результатом тромбоцитопении
и коагулопатий является геморрагический синдром (кровотечения, пурпура).
Гйперпластический синдром включает лимфаденопатию, гепатоспленомегалию,
боли в костях, увеличение яичек. Интоксикационный синдром проявляется лихо¬
радкой, астенией, потерей массы тела.Цитохимические признаки бластных клеток при ОЛЛ: лимфобласты характери¬
зуются положительной PAS-реакцией, выявляемой в более 3% клеток в виде мел¬
ких или крупных гранул, иногда сливающихся в блоки, и отрицательной реакцией
на МПО и хлорацетатэстеразу. Реакция на липиды чаще всего отрицательная, в
редких случаях — положительная.Наиболее информативным и рещающим методом диагностики ОЛЛ является
проточная цитофлюориметрия с использованием моноклональных антител, кото¬
рая позволяет установить линейную направленность бластных клеток, а также ста¬
дию дифференцировки внутри каждой линии, диагностировать бифенотипические
и билинейные ОЛ. Современная диагностика ОЛЛ должна включать цитогенети¬
ческое и молекулярно-генетическое исследование для идентификации клинически
значимых генетических хромосомных аберраций. На этапе диагностики обяза¬
тельно выполнение поясничной пункции в целях выявления клинически скрытого
поражения мозговых оболочек.Современная иммунофенотипическая классификация ОЛЛ основана на выявле¬
нии экспрессии ядерных, цитоплазматических и поверхностных антигенов бласт¬
ных клеток. Различные стадии дифференцировки лимфоидных клеток характе¬
ризуются экспрессией специфических антигенов, выявление которых позволяет
установить блок в дифференцировке лейкемических клеток.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 583Согласно предложению Европейской группы по из)^ению острых лейкозов
(EGIL, 1995), все ОЛЛ разделяют на две большие группы: В- и Т-линейной направ¬
ленности, которые, в свою очередь, подразделяются на подтипы в зависимости от
стадии нормальной дифференцировки лимфоцитов (табл. 7-25).Таблица 7-25. Иммунологическая классификация ОЛЛ (EGIL, 1995)ФенотипыАнтигеныВ-линБйные*;В'1 (про-В) ОЛЛCD19" и/или CD79a* и/ипіл CD22* цитоплазматическийВ-11 {common) ОЛЛCD10*В-111 (пре-В) ОЛЛЦитоплазматическая [J,-uenb-i-B-1V (зрепый-В) ОЛЛПоверхностный 1дМ, моноклональный по к- или ^-типуБольшинство случаев TclT^ HLA-DR*, кроме B-IV, который часто TdT"Т-линейные**;Цитоплазматический или мембранный СОЗ*Т-1 (про-Т) ОЛЛС07*Т-11 (пре-Т) ОЛЛCD2", и/или CD5*, и/или CD8"Т-111 (кортикальный Т) ОЛЛС01а'T-IV (зрелый Т) ОЛЛМембранный CD3*, CD1a"*Пояитивные с двумя из трех маркеров,^^Большинство случаев TdT'', HLA-DR', CD34', но эти маркеры не всегда учитываются в диагно¬
стике и классификации ОЛЛ.Наиболее благоприятным считается вариант В-П {common) ОЛЛ, чаще всего
встречаемый у детей. Неблагоприятными прогностическими факторами течения
ОЛЛ являются: возраст менее 1 года, наличие Ph-хромосомы, раннее пораже¬
ние центральной нервной системы, распространенность опухолевого процесса,
Т-клеточный вариант ОЛЛ.Острый лимфобластный лейкоз из ранних В-клеток-предшественниковЧаще встречается у взрослых, чем у детей. Властные клетки имеют иммунологи¬
ческий фенотип предшественников В-лимфоцитов костного мозга. Они экспресси¬
руют CD19, в большинстве случаев отмечаются экспрессия цитоплазматического
CD22 и CD79a, слабая экспрессия поверхностного CD22. Высокая экспрессия
антигена TdT определяется в 90% случаев, CD34 — в 75% наблюдений. CD20'
антиген определяется на небольшой популяции бластных клеток в 50% случаев.
Экспрессию CD15 обнаруживают на популяции бластов при про-В-ОЛЛ с реа¬
ранжировкой llq23, поэтому обнаружение этого антигена при ОЛЛ может быть
индикатором этой хромосомной аномалии.Пре-пре-В-клеточный вариант острого лимфобластного лейкоза (В-11)Пре-пре-В-тип {common) ОЛЛ является преобладающим вариантом ОЛЛ у детей
(58-65% случаев), у взрослых — около 40%. Основной диагностический маркер —
common или общий антиген {CD 10) на поверхности бластных клеток.Пре-В-клеточный вариант острого лимфобластного лейкоза (В-ill)Определяющим в иммунофенотипе бластных клеток этого варианта ОЛЛ явля¬
ется наличие цитоплазматической тяжелой р-цепи при отсутствии поверхностных
иммуноглобулинов. Подобно предыдущему варианту ОЛЛ, бласты экспрессируют
CD19, CD22, CD79a, CD10, TdT, несколько реже — CD34. Во многих случаях пре-
В-ОЛЛ экспрессия CD20 отсутствует или очень слабая.В-клеточный острый лимфобластный лейкоз (B-IV)Регистрируется в 2-4% случаев ОЛЛ у детей и рассматривается как эквивалент
лимфомы Беркитта в фазе лейкемизации. Цитохимические реакции чаще всего
584ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯшшотрицательные. Иммунологический фенотип соответствует зрелым В-клеткам, т.е.
бласты экспрессируют поверхностные иммуноглобулины. На ліембране бластов
определяются CD19, CD22, CD20, IgM с рестрикцией легких цепей к или X, otcjt-
ствие CD34, очень редко определяется TdT.Т-хлеточный острый лимфобластный лейкозу взрослых Т-клеточный ОЛЛ составляет около 25% среди ОЛЛ, у детей встре¬
чается значительно реже. Этот вариант ОЛЛ считается неблагоприятным. Для
Т-линейных ОЛЛ специфическим маркером является экспрессия c^CD3. По сте¬
пени дифференцировки Т'линейные ОЛЛ также подразделяются на 4 типа:• про-Т-тип (Т-1) — бластные клетки соответствуют ранним тимоцитам и
характеризуются экспрессией общего Т-антигена CD7;• пре-Т'Тип (T-II) (кортикотимоцитарный) — определяется по экспрессии
антигенов CD2, и/или CD5, и/или CD8, и/или CDla;• кортикальный Т-тип (Т-ІП) — отличается наличием на мембране CDla в
дополнение к cytCD3, CD5, CD7, с ко-экспрессией CD4 и CD8;• зрелый Т-ОЛЛ (T-IV) (в ряде случаев рассматривают как лейкемизацию
периферической Т-клеточной лимфомы) — характеризуется мембранной
экспрессией CD3 и отсутствием CDla. Этот подтип, в свою очередь, подраз¬
деляется на две группы в зависимости от экспрессии цепей а/(3 или у/б мем¬
бранного Т-клеточного рецептора.ОСТРЫЕ ЛЕЙКОЗЫ С АБЕРРАНТНОЙ ЛИМФОИДНОЙ ИЛИ МИЕЛОИДНОЙ
ЭКСПРЕССИЕЙ АНТИГЕНОВОстрые лейкозы, при которых опухолевые клетки имеют признаки более
одной линии дифференцировки, например лимфоидной и миелоидной, называ¬
ются смешанно-линейными, гибридными, бифенотипическими, что необходимо
отличать от терминов «биклональный/билинейный?>- или «олигоклональный
ОЛ», характеризующихся двумя или более независимых линий опухолевых
клеток. Ко-экспрессию маркеров различных линий объясняют тем, что лейке-
могенез — это не абсолютный блок клеточной дифференцировки, а объединение
беспорядка созревания и пролиферации, дающее возможность экспрессии анти¬
генов, которые в норме отсутствуют. Описаны две категории смешанных ОЛ: ОЛЛ
с миелоидно-ассоциированными антигенами (My+ALL) и ОМЛ с лимфоидно-
ассоциированными антигенами (L)/+AML), Ниже представлены критерии, реко¬
мендованные D. Сатрапа, Е Behm (2000) для кяассификации этих вариантов ОЛ:• при В-линейном My+ALL бластные клетки должны обязательно экспресси¬
ровать:CD79a или cigia или CD19 и CD22;<> CD3-;❖ МРО-;❖ CD 13, CD15, CD33 или CD65;• при Т-линейном Му+ALL бластные клетки должны обязательно экспресси¬
ровать:❖ CD7 и CD3 (поверхностный или цитоплазматический);❖ CD79a ;❖ МРО';CD13, CD15, CD33 или CD65;• при ly+AML бластные клетки должны обязательно экспрессировать:❖ МРО или экспрессия не менее двух других миелоидных маркеров;❖ CD3-;❖ CD79a-;❖ CD2, CD5, CD7 CD19 CD22 или CD56;
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 585• При истинном смешанно-линейном лейкозе бластные клетки ко-экспресси-
руют:❖ МРО и CD79a или clgfi;о или МРО и CD3;❖ или cCD3 и clgin.НЕДИФФЕРЕНЦИРОВАННЫЙ ЛЕЙКОЗВ редких случаях ОЛ бластные клетки не имеют признаков линейной диффе-
ренцировки (недифференцированные лейкозы). Опухолевые клетки истинного
острого недифференцированного лейкоза не экспрессируют поверхностные и
цитоплазматические антигены, ассоциированные с В- (CD19, CD22, CD79a), Т-
(CD2, CD3, CD5, TCR), миеломоноцитарными (МРО, CD13, CD14, CD33, CD15,
CD65), мегакариоцитарными или эритроидными (CD36, CD41a, CD42b, CD61,
GPA) клетками. Бласты могут экспрессировать CD9, CD34, CD38, CD45, CD71,
HLA-DR или TdT, однако эти антигены не являются ключевыми в определении их
линейной принадлежности.Полная ремиссия устанавливается при наличии в пунктате костного мозга менее
5% бластных клеток, при количестве лейкоцитов более 1,5х10ул, тромбоцитов
более 100х10^/л, отсутствии очагов экстрамедуллярного кроветворения. Несмотря
на современную адекватную химиотерапию, у больных острыми лейкозами в пол¬
ной клинико-гематологической ремиссии сохраняется определенное количество
резидуальных лейкемических клеток, которые обычными морфологическими
методами выявить невозможно. При наличии в пунктате костного мозга менее 5%
бластов остаточный опухолевый клон составляет 10”’-10^^ лейкемических клеток.
Факт персистенции минимальной остаточной популяции лейкозных клеток в
период ремиссии заболевания послужил основанием для его изучения с помощью
более чувствительных методов, к которым относят проточную цитофлюориме-
трию, полимеразную цепную реакцию (ПЦР) (чувствительность — 1 опухолевая
на Ю"* нормальных клеток) и флюоресцентную гибридизацию in situ {FISH) (чув¬
ствительность — 1:1000). Основой для выявления и мониторирования мини¬
мальной остаточной болезни при остром лейкозе является феномен аберрантной
экспрессии антигенов на мембране опухолевых клеток (например, лимфоидных
антигенов на миелобластах, отсутствии экспрессии антигенов, свойственных
определенным этапам дифференцировки клеток, асинхронной экспрессии антиге¬
нов и т.д.). В случае если количество клеток с аберрантным фенотипом превышает
0,12%, устанавливается персистенция минимального остаточного опухолевого
клона. Оценка наличия или отсутствия остаточной популяции опухолевых клеток
констатирует наличие молекулярной ремиссии или рецидива, что позволяет изме¬
нять тактику ведения больных и избегать развития гематологического разверну¬
того рецидива. Терапия молекулярного рецидива во многом существенно улучшает
долгосрочные результаты лечения.Миелопролиферативные заболеванияХронические миелопролиферативные заболевания — клональные опухоли, раз¬
вивающиеся из стволовой кроветворной клетки, характеризующиеся пролифера¬
цией в костном мозге одного или более ростков миелоидной линии (гранулоцитар-
ного, эритроидного, мегакариоцитарного). Пролиферация клеток сопровождается
относительно нормальным созреванием (эффективным гемопоэзом), что приво¬
дит к повышению количества гранулоцитов, эритроцитов и/или тромбоцитов в
периферической крови. Наиболее часто поражаются печень и селезенка, где отме¬
чаются экстрамедуллярные очаги кроветворения, лейкозная инфильтрация и раз¬
рушение опухолевых клеток, к миелопролиферативным заболеваниям относят:
58Q ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯхроническим миелолеикоз;
сублейкемический миелоз (остеомиелосклероз);
эритремию (истинную полицитемию);
хронический миеломоноцитарный лейкоз;• хронический мегакариоцитарный лейкоз (эссенциальную тромбоцитемию).ХРОНИЧЕСКИЙ МИЕЛОЛЕЙКОЗХронический миелолейкоз (ХМЛ) составляет 15-20% всех случаев миелопро-
лиферативных заболеваний. Встречается в любом возрасте, чаще у пациентов
среднего и пожилого возраста. Заболеваемость ХМЛ — 1,0-1,5 случая на 100 ООО
населения. Заболевание связано с опухолевой трансформацией полипотентной
гемопоэтической стволовой клетки. Маркером опухолевого клона при ХМЛ явля¬
ется филадельфийская хромосома (Ph-хромосома), которая образуется в результате
приобретенной транслокации t(9;22) (q34; qll). При образовании Ph-хромосомы
происходит перенос генетического материала хромосомы 9 на 22, что приво¬
дит к образованию химерного гена BCR/ABL Продукт этого гена - онкобелок
р210 — является тирозинкиназой с повышенной активностью. Он играет ведущую
роль в патогенезе ХМЛ, приводя к неконтролируемой пролиферации, угнетению
апоптоза, нарушению дифференцировки гемопоэтических клеток и развитию
лейкозного клона. Появление BCR/ABL тирозинкиназы в гемопоэтических пред¬
шественниках приводит к нарушению нормального функционирования клетки и
ее злокачественной трансформации. Со временем клетки, содержащие патологи¬
ческий белок р210, вытесняют нормальные стволовые и у больного развивается
клинико-гематологическая картина ХМЛ. Аномальную хромосому обнаруживают
во всех клетках миелопоэза, а также Т- и В-лимфоцитах, поэтому все потомство —
гранулоциты, моноциты, эритрокариоциты, мегакариоциты и лимфоциты — при¬
надлежит к опухолевому клону. До 95% случаев ХМЛ — Ph-позитивные, лишь
5-8% наблюдений регистрируются как Ph-негативные. Диагноз ХМЛ окончатель¬
но может быть верифицирован с помощью цитогенетического или молекулярно¬
генетического метода исследования и обнаружения Ph-хромосомы или BCR/ABL-
транскрипта. Определение Ph-хромосомы в настоящее время является не только
диагностическим методом, но и фактором, определяющим тактику дальнейшей
терапии больных ХМЛ, особенно при мониторинге минимальных проявлений
остаточной болезни.Выделяют стадии ХМЛ:• хроническую;• прогрессирующую, или фазу акселерации;• терминальную, или бластный криз.Заболевание может быть диагностировано на любой стадии. У 85% пациентов
болезнь выявляется на хронической стадии. Наиболее частые клинические про¬
явления - слабость, потеря массы тела, ночные поты, спленомегалия, анемия.
Очень редко заболевание начинается с бластного криза. Пролиферация опухоле¬
вых клеток чаще ограничивается гемопоэтическими органами (костным мозгом,
селезенкой, печенью, кровью).хроническая стадия ХМЛ. В периферической крови наблюдается ней-
трофильный лейкоцитоз (количество лейкоцитов варьирует) со сдвигом до
миелоцитов. Бласты составляют обычно 1-3, но не более 10%. Частым симпто¬
мом является увеличение количества базофилов и/или эозинофилов (общее их
количество — более 6,5%). Выраженного дисгранулоцитопоэза не регистрируют.
Количество тромбоцитов в крови нормальное или повышенное (может быть и
более 1,0х10ул). у большинства больных отмечается незначительная анемия.Костный мозг гиперклеточный (более 350х] О^л) за счет повышенного содержа¬
ния клеток гранулоцитарного ростка и повторяет картину периферической крови.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 587Количество бластных клеток не превышает 5%, мегакариоцитов — нормальное
или повышенное. Процент эритроидных клеток варьирует, но чаще снижен.У некоторых больных повышено содержание эозинофилов. в 30% наблюдений ХМ Л
в костном мозге могут быть обнаружены псевдо-Гоше-подобные клетки и голубые
гистиоциты, что рассматривается как ответ на повышенный клеточный распад.Активность щелочной фосфатазы в нейтрофилах низкая или отсутствует.
Длительность хронической стадии заболевания варьирует от 3 до 5 лет. \Прогрессирующая, или фаза акселерации. Прогрессирование заболевания
в процессе терапии чаще всего наблюдается спустя 3 года стабильного течения
хронической фазы, однако у 10-15% больных ХМЛ она может быть выявлена
в период установления диагноза. Нарастают гепатоспленомегалия, астенический
синдром, анемия, появляется лихорадка, может наблюдаться лимфаденопатия.
Диагноз фазы акселерации устанавливают при наличии одного или более из
критериев фазы акселерации ХМЛ. В крови наблюдаются лейкоцитоз, снижение
гемоглобина и тромбоцитов, резкое увеличение незрелых форм гранулоцитов
и бластов. Возможно повышение количества эозинофилов и базофилов, в том
числе незрелых клеток этого ряда. Костный мозг гиперклеточный. Отмечаются
выраженные морфологические признаки дисгранулоцитопоэза, дисмегакариоци-
топоэза.Диагностические критерии фазы акселерации ХМЛ (ВОЗ, 2008):• содержание миелобластов — 10-19% от количества всех ядерных клеток в
крови и/или костном мозге;• количество базофилов в крови — более 20%;• персистирующая тромбоцитопения (<100x107^), не связанная с терапией,
или тромбоцитоз (>1000x1 ОУл), не поддающийся лечению;• прогрессирующее увеличение размеров селезенки и количества лейкоцитов,
несмотря на проводимое лечение;• цитогенетическое доказательство клональной эволюции (дополнительные
хромосомные аномалии).Бластный криз характеризуется нарастанием количества бластных клеток в
костном мозге и крови (более 20%). Возникают очаги экстрамедуллярного крове¬
творения с пролиферацией бластных клеток в коже, лимфатических узлах, костях,
центральной нервной системе и других тканях. В 70% случаев ХМЛ бластный криз
развивается по миелоидному и в 20-30% - по лимфобластному типу. Для иденти¬
фикации природы бластных клеток используют цитохимические исследования и
иммунофенотипирование опухолевых клеток.Диагноз бластного криза ХМЛ устанавливают при наличии одного или более из
диагностических критериев бластного криза ХМЛ (ВОЗ, 2008):• количество бластов — более 20% количества всех ядерных клеток в перифе¬
рической крови или костном мозге;• экстрамедуллярные очаги кроветворения с пролиферацией бластных кле¬
ток;• в трепанобиоптате костного мозга — крупные очаги или скопления бластных
клеток.Благодаря успешному использованию ингибиторов тирозинкиназ в лечении
ХМЛ [иманитиба (гливека*), нилотиниба (тасигмы*), дазатиниба (спрайсела*)],
способных элиминировать клоны клеток, несущих Pli-хромосому, достигнуты
существенные успехи в увеличении продолжительности жизни больных. Однако
полностью уничтожить родоначальные Ph-позитивные клетки пока не удается.В настоящее время необходимым является использование современных методов
для оценки минимальной остаточной болезни. Одним из них является метод
флюоресцентной гибридизации in situ (FISH), который может быть применен как к
делящимся, так и неделящимся клеткам, характерным для минимальной остаточ-
588 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯной болезни. Цитогенетический ответ определяется по содержанию Ph*-клеток в
пунктате костного мозга: полный - О, частичный — 1-35, малый — 36-65, мини¬
мальный — 66-95, нет ответа — более 95%. Молекулярный ответ оценивается
на основании определения количества ВСі?/АВІ-транскрипта в периферической
крови с помощью метода количественной ПЦР в реальном времени (RQ-PCR)
(чувствительность — 1:1000-1:100 ООО). Полным молекулярным ответом считают
случаи, когда ВС]?/ЛВ1-транскрипт выявить не удается. Негативные результаты
подтверждаются с помощью качественной реакции ПЦР, Большой молекулярный
ответ — это снижение уровня ВСі?/АВІ-транскрипта в 1000 раз по сравнению с
исходным показателем его экспрессии до начала лечения. Для прогнозирования
рецидива при минимальной остаточной болезни важен не сам уровень транс¬
крипта, а динамика изменения этого уровня, установление темпов нарастания или
убывания пролиферативной активности опухолевого клона, что необходимо для
своевременного назначения эффективной неагрессивной терапии.СУБЛЕЙКЕМИЧЕОКИЙ МИЕЛОЗСублейкемический миелоз (идиопатический миелофиброз, остеомиелоскле-
роз, агногенная миелоидная метаплазия) — хроническое клональное миело-
пролиферативное заболевание, возникающее вследствие трансформации
клеток-предшественников миелопоэза. У 50% больных обнаруживают мутацию
JAK2V617F. Неспецифические хромосомные аномалии встречаются у 30-40%
пациентов, что наиболее часто свидетельствует о неблагоприятном прогнозе.
Заболевание характеризуется опухолевой пролиферацией преимущественно мега-
кариоцитов и гранулоцитов в костном мозге, развитием фиброза и экстрамедул-
лярного кроветворения. Доминирующим признаком сублейкемического миелоза
является развитие фиброза в костном мозге, который служит неспецифической
реакцией стромальных клеток костного мозга на цитокины, секретируемые опухо¬
левым клоном и клетками стромального микроокружения. Усиление пролифера¬
ции фибробластов и остеобластов вследствие воздействия факторов роста, секре-
тируемых мегакариоцитами и тромбоцитами (TGF-p, PDGF, b-FGF), приводит к
развитию миелофиброза и остеомиелосклероза.Заболевание встречается чаще в пожилом возрасте. Преобладает доброкаче¬
ственное многолетнее течение болезни с медленным увеличением размеров селе¬
зенки. Сублейкемический миелоз проходит те же стадии в своем развитии, что и
ХМЛ. Наиболее часто развивается спленомегалия, несколько реже гепатомегалия
(у 40% больных). Внекостномозговое (экстрамедуллярное) кроветворение может
быть обнаружено в лимфатических узлах, почках, легких, желудочно-кишечном
тракте, коже, мочеполовой системе, центральной нервной системе, плевре и дру¬
гих органах и тканях. Изменения крови и костного мозга варьируют в зависимости
от стадии заболевания, развития фиброза.Прогрессирование заболевания сопровождается увеличением количества лей¬
коцитов, размера селезенки, нарастанием анемии. Развитие анемии является след¬
ствием недостаточности костномозгового кроветворения. Тромбоцитопения приво¬
дит к геморрагическому синдрому, который проявляется кровотечениями, чаще в
желудочно-кишечном тракте. Заболевание осложняется развитием тромбозов, ДВС-
синдрома. Выделяют следующие стадии развития сублейкемического миелоза:• пролиферативную (префибротическую, раннюю);• фибротическую (фибротически-склеротическую);• трансформацию в острый лейкоз.Основным гематологическим проявлением заболевания в префибротической
стадии является умеренный лейкоцитоз. Возможен эритроцитоз, постепенно
переходящий в анемию, часто выявляются тромбоцитоз, умеренная гепато- и/или
спленомегалия.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 589В периферической крови чаще бывает небольшой лейкоцитоз (10-20х10Ул).
В лейкоцитарной формуле наблюдаются сдвиг до миелоцитов, анизоцитоз нейтро-
филов, асинхронное созревание ядра и цитоплазмы, нарушение гранулогенеза в
нейтрофилах, гипо- и гиперсегментированные нейтрофилы. У большинства боль¬
ных присутствует нормохромная анемия. В мазках крови имеют место анизоцитоз,
пойкилоцитоз с преобладанием каплевидных эритроцитов (дакриоцитов), нормо-
бласты, невысокий ретикулоцитоз, атипичные крупные тромбоциты. В отличие от
ХМЛ активность щелочной фосфатазы в нейтрофилах резко увеличена.Костный мозг гиперклеточный с повышенным содержанием незрелых клеток
гранулоцитарного ряда, атипичных мегакариоцитов. Содержание эритрокариоци-
тов может быть в пределах нормы или незначительно снижено.Сублейкемический миелофиброз чаще диагностируют на стадии развития
фиброза в костном мозге. Зачастую аспирация костного мозга при пункции затруд¬
нена, В клинической картине нередко доминируют анемический и геморрагиче¬
ский синдромы, спленомегалия, рецидивирующие инфекционные осложнения,
в периферической крови наблюдаются многочисленные каплевидные эритроци¬
ты. Количество лейкоцитов варьирует от умеренного до выраженного лейкоцито¬
за. Дисгранулоцитопоэз встречается редко. В лейкоцитарной формуле возможно
наличие единичных бластов. Отмечается анизоцитоз тромбоцитов, встречаются
фрагменты ядер мегакариоцитов.Костный мозг нормо- или гипоклеточный. Количество миелобластов — менее
10%, часто встречаются атипичные мегакариоциты. Фиброз в костном мозге зна¬
чительно выражен, в трепанобиоптатах костного мозга отмечается остеосклероз.Эволюция сублейкемического миелоза характеризуется постепенным нарас¬
танием лейкоцитоза, может развиться вторичный острый лейкоз, резистентный
к лечению. Развитие лейкоза наблюдается как в случаях с лейкоцитозом, так и
с лейкопенией. Обнаружение в крови и/или костном мозге от 10-19% бластов
свидетельствует о переходе заболевания в прогрессирующую фазу, более 20% — о
трансформации в бластный криз по типу ОМЛ, ОММЛ, острого мегакариобласт-
ного лейкоза.Клинические признаки сублейкемического миелоза в стадии минимального
развития фиброза или его отсутствия:• увеличение размеров селезенки и печени;• незначительная анемия.Морфологические признаки:• кровь — сдвиг лейкоцитарной формулы влево, незначительный пойкилоци¬
тоз эритроцитов;• костный мозг — гиперклеточный, пролиферация гранулоцитов, мегакариоцитов
с признаками дисмегакариоцитопоэза, фиброз отсутствует или минимальный.Клинические признаки сублейкемического миелоза в стадии выраженного раз¬
вития фиброза:• выраженные сплено- и гепатомегалия;• умеренная или выраженная анемия;• нормальное, сниженное или повышенное количество лейкоцитов и тромбо¬
цитов.Морфологические признаки;• кровь — сдвиг лейкоцитарной формулы влево, нормобласты, постоянный
пойкилоцитоз с каплевидными эритроцитами (дакриоцитами);• костный мозг - гипоклеточный, фиброз, пролиферация мегакариоцитов с
признаками дисмегакариоцитопоэза, остеосклероз.Иногда, как следствие фиброза и остеосклероза костного мозга, заболевание
завершается развитием аплазии костного мозга, которая сопровождается лейкопе¬
нией, эритроцитопенией и тромбоцитопенией.
590 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯЭРИТРЕМИЯ (ИСТИННАЯ ПОЛИЦИТЕМИЯ)Эритремия — клональное миелопролиферативное заболевание, характеризуе¬
мое повышенной продукцией клеток эритроидного ряда в сочетании с избыточ¬
ной пролиферацией клеток грануле- и мегакариоцитопоэза. Основой патогенеза
эритремии является опухолевая трансформация клетки-предшественника миело-
поэза, В 2005 г. была открыта мутация в тирозинкиназе JAK2 (JAK2V617F), ген
которой расположен на хромосоме 9. Мутация приводит к усилению функций
тирозинкиназы за счет связывания внутриклеточного и поверхностного домена
эритропоэтинового рецептора, что сопровождается пролиферацией эритроид-
ных предшественников независимо от внешней стимуляции ЭПО. Кроме того,
дополнительно активируются такие киназы, как STAT5, ERK/MAP, PI3K/AKT, что
способствует значительному усилению проведения сигнала от ЭПО, а также выра¬
женной экспрессии рецепторов к ЭПО. В итоге результатом избыточной пролифе¬
рации клеток-предшественников миелопоэза являются стимуляция эритроцитоза
и тромбоцитоза и развитие эритремии.Заболевание встречается преимущественно у пожилых людей, характеризуется
относительно доброкачественным течением и большей выживаемостью в отличие
от других миелопролиферативных заболеваний. В соответствии с классификацией
ВОЗ выделяют две стадии заболевания; пролиферативную (полицитемическую),
характеризующуюся нарастанием массы эритроцитов, и постполицитемическую,
при которой развивается цитопения, в том числе анемия, ассоциируемая с неэф¬
фективным гемопоэзом, фиброз в костном мозге, очаги экстрамедуллярного кро¬
ветворения, гиперспленомегалия. Клиническая симптоматика связана с развитием
эритроцитоза: артериальная гипертензия, сосудистые осложнения, эритроцианоз
кожного покрова и слизистых оболочек, нередко кровоточивость десен, у боль¬
шинства пациентов имеют место венозные или артериальные тромбозы различ¬
ной локализации, кожный зуд, парестезии, нарушение зрения, головные боли.
Нарушается обмен мочевой кислоты с развитием гиперурикемии и урикозурии.
Развивается сплено- и/или гепатомегалия.В полицитемической стадии костный мозг клеточный с нормобластическим
типом кроветворения, при развитии панмиелоза — гиперклеточный с повышенным
содержанием клеток эритро- и мегакариоцитопоэза. При гистологическом исследо¬
вании костного мозга обнаруживают увеличение количества мегакариоцитов, часто
гигантских, с расширенными дольчатыми ядрами. Мегакариоциты расположены
скоплениями. Наблюдается увеличение количества эозинофилов и базофилов.В периферической крови эритроциты имеют нормальную морфологию, в слу¬
чае развития дефицита железа вследствие кровопотерь появляются гипохромия и
микроцитоз.Наиболее часто в лейкоцитарной формуле встречаются нейтрофилез и базофи-
лия, реже незрелые гранулоциты. Отмечается высокая активность ЩФ в нейтро-
филах. Тромбоцитоз имеет место у 50% больных. Характерны также снижение
СОЭ (до 0-1 мм/ч) и увеличение вязкости крови.На поздних стадиях развития заболевания снижается продукция эритроцитов,
нарастает спленомегалия. Костный мозг имеет низкую клеточность, фиброз выра¬
жен, отмечаются скопления мегакариоцитов. Количество клеток гранулоцитарно-
го и эритроидного ряда снижается, может встречаться остеосклероз. В перифери¬
ческой крови прослеживается тенденция к уменьшению количества эритроцитов
и гемоглобина до нормальных показателей, развитию нормо- или гиперхромной
анемии с выраженным анизоцитозом. Эритремия может завершиться развити¬
ем бластного криза, постэритремическим миелофиброзом. Диагноз эритремии
устанавливают после исключения всех возможных причин развития вторичного
эритроцитоза и основывают на клинических и лабораторных данных, гистологи¬
ческом исследовании костного мозга (табл. 7-26).
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ591Таблица 7-26. Диагностические критерии эритремии (ВОЗ. 2008)Критерииосновныеминимальные1. НЬ >185 г/л для мужчин и >165 г/л для женщин
или увеличение массы циркулирующих эритроцитов
>25% нормы.2. Присутствие JAK2 V617F или другой функцио¬
нально сходной мутации1.В костном мозге — панмиелоз с пролиферацией
клеток всех трех ростков.2. уровень ЭПО в сыворотке крови ниже нормаль¬
ных значений.3. Эндогенное формирование эритроидных колоний
in vitroХРОНИЧЕСКИЙ МЕГАКАРИОЦИТАРНЫЙ ЛЕЙКОЗХронический мегакариоцитарный лейкоз (эссенциальная тромбоцитемия, иди-
опатическая тромбоцитемия) — клональное миелопролиферативное заболевание,
характеризуемое пролиферацией мегакариоцитов и персистирующим тромбоци¬
тозом. Около 50% больных имеют мутацию в тирозинкиназе JAK2 0AK2V617F).
Встречается чаще у пациентов пожилого возраста, реже — моложе 60 лет и детей.
Ведущими гематологическими симптомами являются гипертромбоцитоз и гипер¬
плазия мегакариоцитов в костном мозге. Клиническая картина характеризуется
небольшой спленомегалией, которая прогрессирует по мере развития болезни,
реже гепатомегалией, медленно нарастающей анемией. Характерны расстройства
микроциркуляции, тромбозы артериальных и венозных сосудов. Геморрагические
осложнения встречаются у больных со значительным тромбоцитозом — более
1500х10ул. Диагностические критерии хронического мегакариоцитарного лей¬
коза представлены ниже. В периферической крови наблюдаются гипертромбо-
цитоз (500-1500х10ул и более), фрагменты ядер мегакариоцитов, умеренно
выраженная анемия, умеренный лейкоцитоз с левым сдвигом в лейкоцитарной
формуле, могут наблюдаться базофилия и эозинофилия. Морфология тромбо¬
цитов характеризуется анизоцитозом, увеличением среднего объема тромбоцитов
(MPV) и показателя анизоцитоза тромбоцитов (PDW), появлением гигантских и
уродливых форм с псевдоподиями, гипогранулярных тромбоцитов, фрагментов
ядер мегакариоцитов.Диагностические критерии хронического мегакариоцитарного лейкоза
(ВОЗ, 2008)Персистирующий тромбоцитоз >450х10ул при отсутствии причин реактивного
тромбоцитоза.В биоптате костного мозга — пролиферация преимущественно клеток мега¬
кариоцитарного ростка с повышенным количеством крупных, зрелых мегака¬
риоцитов. Незначительное увеличение или левый сдвиг в гранулоцитопоэзе или
эритропоэзе.Отсутствие признаков, характерных для эритремии, первичного миелофиброза,
ХМЛ Всг-АЫ 1-позитивного, МДС или других миелоидных опухолей.Обнаружение JAK2 V617F или других клональных маркеров или при отсутствии
JAK2V617F-мyтaции не найденьЕ доказательства развития реактивного тромбо¬
цитоза.Костный мозг нормо- или гиперклеточный, с трехростковой гиперплази¬
ей, сокращением массы жировой ткани. Отмечается значительная гиперплазия
мегакариоцитарного ростка. Мегакариоциты расположены в мазках костного
мозга поодиночке или группами (скоплениями). Характерна морфологическая
гетерогенность клеток мегакариоцитарного ростка — гигантские мегакариоциты
с многолопастными множественными ядрами без признаков атипии, возможны
микроформы мегакариоцитов. При хроническом мегакариоцитарном лейкозе
часто наблюдается явление эмпириополизиса (феномен поглощения клеток). По
мере прогрессирования заболевания может развиваться фиброз костного мозга.
592 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯХРОНИЧЕСКИЙ МИЕЛОМОНОЦИТАРНЫЙ ЛЕЙКОЗХронический миеломоноцитарный лейкоз (ХММЛ) возникает в результате
опухолевой трансформации клеток-предшественников миелопоэза. В классифи¬
кации ВОЗ хронический миеломоноцитарный лейкоз выделен в отдельную группу.
Выделяют два его варианта:• ХММЛ с признаками миелодисплазии (ХММЛ-МДС), при котором наблюда¬
ется лейкоцитоз менее 12х10Ул при абсолютном моноцитозе в перифериче¬
ской крови (>1000х10ул);• ХММЛ при лейкоцитозе более 12х10^/л и абсолютном моноцитозе в пери¬
ферической крови (>1х10Ул). Б этом варианте диагностируют ХММЛ, про¬
текающий как миелопролиферативное заболевание (ХММЛ-МПЗ).Морфологическим субстратом заболевания являются клетки моноцитарно-
го и миелоидного ряда (монобласты, промоноциты, моноциты, миелобласты,
гранулоциты). Заболевание чаще встречается в возрасте 65-75 лет, сопрово¬
ждается поражением костного мозга, печени, селезенки, кожи, лимфатических
узлов.В периферической крови наблюдаются нормальное или повышенное количе¬
ство лейкоцитов, абсолютный моноцитоз, возможен нейтрофилез. Большинство
моноцитов не отличаются от нормальных, однако встречаются клетки с более
грубой зернистостью, резко выражен полиморфизм ядер. Количество незрелых
гранулоцитов (промиелоцитов, миелоцитов) не превышает 10%. Может иметь
место умеренная базофилия, иногда эозинофилия. Отмечаются признаки дисгра-
нулоцитопоэза. ХММЛ сопровождается развитием нормоцитарной, реже макро-
цитарной анемии. Количество тромбоцитов варьирует, возможна тромбоцитопе-
ния. Встречаются атипичные крупные тромбоциты.В большинстве наблюдений костный мозг гиперклеточный, реже нормо- и
гипоклеточный с пролиферацией гранулоцитарного ростка, в котором отмечаются
диспластические изменения. В некоторых случаях ХММЛ возможна эритроидная
гиперплазия с морфологическими признаками дисэритропоэза. Количество моно¬
цитов в костном мозге может быть нормальным или повышенным, в 80% наблю¬
дений ХММЛ в костном мозге обнаруживают изменения в мегакариоцитарном
ростке (микромегакариоциты, измененные ядра мегакариоцитов). Количество
бластов составляет от 5 до 19%, повышено содержание незрелых гранулоцитов,
преимущественно миелоцитов, в костном мозге наблюдаются признаки дисэри¬
тропоэза и дисгранулоцитопоэза.В зависимости от содержания бластных клеток выделяют ХММЛ-1 (бластов в
крови — <5%, в костном мозге — <10%, абсолютный моноцитоз — >1,0х10ул),
ХММЛ-2 (бластов в крови — от 5 до 19%, в костном мозге — от 10 до 19%, абсо¬
лютный моноцитоз — >1х10^/л).Лимфопролиферативные заболеванияЛимфопролиферативные заболевания по месту первичного возникновения
делятся на две большие группы: хронические лимфоидные лейкозы и злокаче¬
ственные неходжкинские лимфомы, которые первоначально имеют внекост-
номозговую локализацию (лимфатические узлы, селезенка, кожа, лимфоидная
ткань слизистой желудка и др.), что отличает их от лейкозов. Рост опухоли может
сопровождаться инфильтрацией костного мозга и лейкемизацией. В соответствии
с критериями, предложенными ВОЗ, при верификации диагноза обязательным
является установление линейной принадлежности опухолевых лимфоидных кле¬
ток (Т- или В-клеток) и степени их дифференцировки (предшественники или зре¬
лые клетки) (табл. 7-27).
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ593Таблица 7-27. Классификация лимфоидных опухолей (ВОЗ, 2008)В-клеточные опухоли
Из предшественников В-клетокВ-лимфобластная лимфома/лейкоз.В-лимфобластная лимфома с повторяющимися генети¬
ческими аномалиями/лейкоз.В-клеточные опухоли из зрелых (периферических)
кпетокХронический лимфолейкоз/лимфома из малых лимфо¬
цитов.Пролимфоцитарный лейкоз.Лимфоплазмоцитарная лимфома.Лимфома из клеток мантии.Фолликулярная лимфома.Первичная кожная лимфома фолликулярного центра.
Лимфома маргинальной зоны селезенки.
Волосатоклвточный лейкоз.Лимфома/лейкоз селезенки, неклассифицированная.
Болезнь тяжелых цепей.Плазмоклеточные опухоли.Экстранодальная лимфома маргинальной зоны MALT-
типа {MALT-лимфома).Нодальная лимфома маргинальной зоны.Диффузная крупноклеточная В-клеточная лимфома.
Первичная диффузная крупноклеточная В-клеточная
лимфома ЦНС.Первичная кожная ДКВКЛ.ВЭБ-позитивная ДКВКЛ пожилых.ДКВКЛ, ассоциированная с хроническим воспалением.
Т'Клеточная/богатая гистиоцитами крупно клеточная
В-лимфома.Медиастинальная крупноклеточная В-клеточная лим¬
фома.Внутри сосудистая крупноклеточная В-клеточная лим¬
фома.АЛК-позигивная крупно клеточная В-клеточная лимфома.
Плазмобластная лимфома.Крупноклеточная В-клеточная лимфома из болезни
Кастельмана, ассоциированная с HHV8.Первичная лимфома серозных полостей.Лимфома Беркитта.Лимфоматоидный гранулематоз Т- и НК-клеточные опухоли
Из предшественников Т-клетокТ-лимфобластная лимфома/лейкоз из клеток-
предшественников.Властная НК-клеточная лимфома.Т-клеточные лимфоиы М3 зрелых (перифериче¬
ских) клетокТ-клеточный пролимфоцитарный лейкоз.
Т-кпеточный лейкоз из БГЛ.Хроническое лимфопролиферативное заболева¬
ние (ЛПЗ) из НК-клеток.Агрессивный НК-клеточный лейкоз.Т-клеточная лимфома/лейкоз взрослых {HTLV1*).
Экстранодальная НК-Я-клеточная лимфома,
назальный тип.ВЭБ-Т-ЛПЗ у детей.Т-клеточная лимфома, ассоциированная с энте-
ролатией.Гепатолиенальная Т-клеточная лимфома.
Т-клеточная панникулитоподобная лимфома
подкожной клетчатки.Ангиоиммунобластная Т-клеточная лимфома.
Анапластическая крупноклеточная лимфома.
Грибовидный микоз/синдром Сезари.Первичные кожные СОЗО-позитивные Т-ЛПЗ.
Первичная Т-клеточная лимфома NOS.
Анапластическая крупноклеточная лимфома
АЛК-позитивная.Анапластическая крупноклеточная лимфома
АЛК-негативнаяДиагностика лимфопролиферативных заболеваний включает:• выявление морфологического субстрата опухоли;• определение иммунофенотипа опухолевых клеток (иммуногистохимией,
проточной цитофлюориметрией);• установление степени распространенности опухоли (стадии заболевания);• выявление молекулярно-генетических изменений.ЛИМФОИДНЫЕ ОПУХОЛИ ИЗ КЛЕТОК-ПРЕДШЕСТВЕННИКОВ
В-лимфо6ластный лейкоз из клеток-предшественников/лимфабластная лимфомав-лимфобластный лейкоз из клеток-предшественников/лимфобластная лимфо¬
ма (В-клеточный острый лимфобластный лейкоз из клеток-предшественников) -
опухоли, морфологическим субстратом которых являются лимфобласты.
Диагностику лимфом из клеток-предшественников следует осуществлять только
с учетом данных иммунофенотипирования. Неопухолевый аналог находится в
костном мозге на антигеннезависимой стадии дифференцировки.Заболевание встречается у взрослых относительно редко (около 10%), однако
у детей составляет до 40% всех случаев неходжкинских злокачественных лимфом
594 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ(НХЛ). Характерно агрессивное течение с вовлечением в процесс центральной
нервной системы, лимфатических узлов, печени, селезенки, яичек, кожи, мягких
тканей, у большинства пациентов имеется большая опухоль в средостении с
вовлечением тимуса. Частыми симптомами являются артралгии, боли в костях.
Костный мозг поражается у половины первичных больных и у большинства при
прогрессировании заболевания.В периферической крови отмечаются анемия, и/или тромбоцитопения, и/или
нейтропения. Количество лейкоцитов может быть нормальным, пониженным
или повышенным, в костном мозге или других тканях имеет место диффузный
характер опухолевого роста. Морфология лимфобластов варьирует от микроформ
со скудной цитоплазмой, конденсированным ядром и неотчетливой нуклеолой
до макроформ с дисперсным распределением хроматина, отчетливыми ядрышка¬
ми, цитоплазмой различных оттенков базофилии, нередко вакуолизированной.
В редких случаях она содержит азурофильные гранулы, что может сочетаться
с цитогенетической аномалией — транслокацией t(9;22). Описана морфология
лимфобластов в форме «ручного зеркала». Форма ядер варьирует от округлой до
неправильной, скрученной, складчатой. Число митозов может быть различным,
значимое их количество не является абсолютным признаком опухолевого про¬
цесса. Морфология В- и Т-лимфобластов часто сходна и не может использоваться
для их дифференциации.Цитохимия: лимфобласты не содержат МПО, липиды; PAS-положительное
вещество распределяется в виде мелких, пылевидных гранул по периферии
цитоплазмы или вокруг ядра, может локализоваться блоками или несколькими
крупными гранулами в небольшом проценте клеток. В лимфобластах отмечается
активность кислой фосфатазы (КФ) разной степени выраженности.Иммунофенотип: лимфобласты экспрессируют TdT (терминальная дезоксину-
клеотидилтрансфераза — маркер ранних клеток-предшественников), HLA-DR,
CD 19, цитоплазматический CD79a. Б большинстве случаев имеются CD 10, CD24,
экспрессия CD20, CD22 вариабельна, а CD45 может отсутствовать.Цитогенетика: зарегистрировано множество хромосомных аномалий, однако
патогномоничных для данного заболевания молекулярно-генетических измене¬
ний не выявлено.Т'лимфобластный лейкоз из клеток-предшественников/лимфобластная лимфомаТ-лимфобластный лейкоз из клеток-предшественников/лимфобластная лимфо¬
ма (Т-клеточный острый лимфобластный лейкоз из клеток-предшественников ~
Т-ОЛЛ) — опухоли, морфологическим субстратом которых являются лимфобла¬
сты. Неопухолевые аналоги находятся в тимусе на антигеннезависимой стадии
дифференцировки. Т-ОЛЛ составляет 15% всех детских острых лимфобластных
лейкозов. Особенностью клинической картины являются частое вовлечение в
опухолевый процесс средостения, серозных оболочек, появление выпота в пре-
вральной полости. Другие места локализации опухоли — кожа, лимфатические
узлы, печень, селезенка, лимфатическое кольцо Вальдейера, центральная нервная
система, яички. Т-ОЛЛ часто сопровождается гиперлейкоцитозом и большой опу¬
холевой массой.Цитохимия: Т-лимфобласты проявляют активность КФ в виде фокального
пятна.Иммунофенотип: лимфобласты экспрессируют TdT, СО la, CD2, CD3, CD4,
CD5, CD7, CD8. Может наблюдаться ко-экспрессия CD4 и CD8, экспрессия CD10.
В зависимости от того, на какой стадии дифференцировки в тимусе произошла
онкогенная трансформация, лимфобласты могут иметь те или иные антигены [на
ранней стадии — цитоплазматический CD3, CD2, CD7, несколько позже — CD 1а,
CD5 (кортикальные тимоциты), на последней стадии - мембранный CD3J.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 595Цитогенетика: отмечаются многочисленные транслокации, затрагивающие
гены Т-клеточного рецептора.В-КЛЕТОЧНЫЕ ОПУХОЛИ ИЗ ЗРЕЛЫХ (ПЕРИФЕРИЧЕСКИХ) В-КЛЕТОК
В-клеточный хронический лимфолейкоз/лимфома из малых лимфоцитовв-клеточный хронический лимфолейкоз/лимфома из малых лимфоцитов — опу¬
холь лимфоидной ткани, характеризуемая поражением костного мозга и лимфа¬
тических узлов (ЛУ). За последние 10 лет накопилось достаточно фактов, ука¬
зывающих на гетерогенность происхождения В-ХЛЛ. В большинстве случаев
опухолевая трансформация происходит на уровне наивных, или «девственных»
(CD19*CD5'CD23^IgM~IgD^) (прегерминальных), В-лимфоцитов с последующим
блоком в их дальнейшей дифференцировке и пролиферацией (размножением) клона
опухолевых клеток. Не менее часто встречается В-ХЛЛ с опухолевой трансформащіей
постгерминальных В-лимфощітов (клеток памяти), о чем свидетельсгвуют обнару¬
живаемые соматические гипермутации генов вариабельного региона иммуноглобу¬
линов. В соответствии с мутационным статусом вариабельного региона Ig выделены
два варианта В-ХЛЛ: с мутациями (IgVmut) и без мутаций вариабельного региона Ig
(IgVmut). Группа больных с IgVmut характеризуется неблагоприятным прогнозом по
сравнению с пациентами группы IgVmut. Мутационный статус генов вариабельного
региона Ig может служить ориентировочным прогностическим маркером.В-ХЛЛ — заболевание с нарушенным процессом апоптоза. Большинство опухо¬
левых В-лимфоцитов являются покоящимися. Более 99% циркулирующих лим¬
фоцитов находится в С^-фазе клеточного цикла. Цитокины, секретируемые опухо¬
левыми клетками (ИЛ-8, TNF-a), а также ИЛ-2, продуцируемый Т-лимфоцитами,
способствуют пролиферации и выживанию клеток ХЛЛ,ХЛЛ составляет около 30% всех лейкозов. Заболеваемость — 3 на 100 ООО насе¬
ления, возраст — старше 55 лет. Заболевание выявляется случайно. При прогресси¬
ровании опухоли наиболее частыми клиническими симптомами являются лимфа-
денопатия, гепатомегалия, спленомегалия, бактериальные и вирусные инфекции.
Течение ХЛЛ часто осложняется аутоиммунными заболеваниями (гемолитической
анемией, тромбоцитопенией), появлением вторичных опухолей.Диагностические критерии В-ХЛЛ:• абсолютный лимфоцитоз в периферической крови — более 5000 в 1 мкл;• пролимфоциты — менее 10%;• лимфоцитоз в костном мозге — более 30%;• иммунологический фенотип - CD19^CD23"CD54В-клеточная клональность устанавливается обнаружением рестрикции легких
цепей поверхностных иммуноглобулинов (к либо Л).Картина периферической крови при ХЛЛ обычно представлена нормальным или
незначительно повышенным количеством лейкоцитов. Анемия и тромбоцитопе-
ния, как правило, отсутствуют. Основным гематологическим показателем при ХЛЛ
является абсолютный лимфоцитоз. В лейкоцитарной формуле морфологически
зрелые лимфоциты составляют от 45 до 95%, встречаются единичные пролимфо¬
циты, имеет место относительная или абсолютная нейтропения. Лимфоциты пери¬
ферической крови при ХЛЛ характеризуются небольшими размерами (7-10 мкм),
округлым ядром, глыбчатым распределением хроматина, отсутствием нуклеол,
узкой цитоплазмой базофильного цвета. Встречаются клетки цитолиза. В некото¬
рых случаях ХЛЛ наблюдаются клетки с морфологией атипичных лимфоцитов, но
с характерным для этого заболевания иммунологическим фенотипом.По мере прогрессирования опухолевого процесса нарастают лейкоцитоз, отно¬
сительный и абсолютный лимфоцитоз, нейтропения, наблюдается нормохром-
ная анемия и/или тромбоцитопения. В лейкоцитарной формуле пролимфоциты
составляют менее 10%, при просмотре препарата встречаются единичные лимфо¬
596 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯбласты. Прогрессия опухоли сопровождается увеличением количества пролимфо¬
цитов. При ХЛЛ может наблюдаться аутоиммунная гемолитическая анемия, реже
тромбоцитопения за счет образования аутоантител к эритроцитам или эритрока-
риоцитам, тромбоцитам.В зависимости от стадии заболевания костный мозг может быть нормо- или
гиперклеточным. Количество лимфоцитов в стернальном П5^нктате превышает
30%, морфология клеток аналогична периферической крови. Опухолевая инфиль¬
трация может иметь очаговый, диффузный, интерстициальный или смешанный
характер, что имеет прогностическое значение.Иммунофенотип; опухолевые клетки экспрессируют В-клеточные антигены —
CD19, CD20 (слабая), CD22 (слабая), CD79a, CD23, CD43, CD5, отмечается слабая
экспрессия поверхностных иммуноглобулинов класса IgM или IgM+IgD (н ряде
случаев не обнаруживают) с рестрикцией легких цепей (к либо X), вариабельно
представлены активационные антигены CD38, CD25, CD71. В редких наблюдени¬
ях ХЛЛ опухолевые клетки имеют фенотип CD19*CD5'CD23*, либо на них отсут¬
ствует экспрессия легких цепей иммуноглобулинов.Экспрессия CD38 на более 20% CD19"CD5^ клетках ассоциируется с плохим
прогнозом.В последние годы интенсивно исследуется экспрессия суррогатноі’о маркера
мутационного статуса вариабельных участков генов иммуноглобулинов — белка
ZAP-70 (70-kD Zeta-Associated Protein). Показано, что экспрессия этого белка при
варианте ХЛЛ {IgVmut) ассоциируется с плохим прогнозом.Цитогенетика: приблизительно в у, случаев обнаруживают дополнительную
хромосому 12 (трисомию 12), что связывается с более агрессивным клиническим
течением заболевания. У 25% больных определяются структурные нарушения в
хромосоме 13. Средняя продолжительность жизни больных составляет 7 лет.Хронический лимфолейкоз может трансформироваться в пролимфоцитарный
лейкоз, синдром Рихтера (диффузную крупноклеточную лимфому), острый лейкоз
(чаще острый лимфобластный лейкоз). Высок риск развития вторичных опухолей,
в первую очередь рака кожи и кишечника.В клеточный пролимфоцитарный лейкозРедкое заболевание, составляющее около 1% лимфатических опухолей. Сред¬
ний возраст больных — 70 лет. Чаще всего имеют место выраженная спленомега-
лия, незначительное увеличение периферических лимфатических узлов и быстрое
нарастание лейкоцитоза.Анемию и тромбоцитопению регистрируют у большинства больных, лейкоцитоз
превышает ЮОхЮул, пролимфоциты составляют более 55%. Пролимфоциты —
клетки среднего размера, диаметром 10-15 мкм, с округлым, реже неправильной
формы ядром, умеренно конденсированным хроматином, чаще одной нуклеолой
и относительно небольшой цитоплазмой базофильного или слабобазофильного
цвета, В костном мозге отмечается диффузная лимфоидная инфильтрация теми
же клетками.Иммунофенотип: опухолевые клетки экспрессируют В-клеточные антигены —
CD19, CD20, CD22, CD79a и Ь, FMC7; CD5 выявляется в ’Д наблюдений, CD23
отсутствует, отмечается яркая экспрессия поверхностных иммуноглобулинов
класса M+/-D.Цитогенетика: у больных В-пролимфоцитарным лейкозом наиболее частая
хромосомная аномалия — 14q+, реже транслокация t(ll;14), трисомия 12.Волосатоклеточный лейкозЗаболевание составляет 2% всех лимфоидных лейкозов, встречается в возрасте
от 26 до 75 лет, в 4 раза чаще у мужчин, чем у женщин. Выделяют классическую и
-:;^VЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ597вариантную формы волосатоклеточного лейкоза (ВКЛ). При классической (индо-
лентной) форме ВКЛ начало заболевания незаметное, 20% больных не имеют
классических признаков в момент установления диагноза, однако чаще всего
встречаются спленомегалия и панцитопения, значительно реже — гепатомегалия,
лимфаденопатия.Костный мозг нормо- или гиперклеточный с диффузной лимфоидной инфиль¬
трацией, часто развивается фиброз, процент «волосатых» клеток значительно
варьирует (8-60%). В периферической крови — панцитопения или двухростковая
цитопения (лейкопения, анемия и/или тромбоцитопения) либо сублейкемический
лейкоцитоз, в лейкограмме — абсолютный лимфоцитов, нейтропения (агрануло¬
цитоз), моноцитопения. Среди лимфоцитов обнаруживают «волосатые» клетки,
доля которых составляет от 2 до 90% и более. Это клетки среднего размера, с
округлым, овальным, почковидным ядром, гомогенной, сглаженной структурой
хроматина; нуклеолы, как правило, отсутствуют или неотчетливые, цитоплазма
обильная, светло-голубая, с отростками. Иногда в цитоплазме можно обнаружить
вакуоли. «Волосатые» клетки характеризуются диффузно-гранулярной реакцией
на кислую фосфатазу, не подавляемую тартратом натрия.Иммунофенотип: опухолевые клетки экспрессируют В-клеточные антигены —
CD19, CD20, CD22, slg^ G или А), CD79a, CDllc, CD25, CD103. Клеткине имеют на мембране CD5, CD10, CD23.Вариантная форма ВКЛ характеризуется наличием в крови лейкоцитоза (более
50х10ул), отсутствием классических антигенов CD25 и CD103. По морфологии
«волосатые» клетки менее зрелые, содержат мелкие нуклеолы в ядре и напомина¬
ют пролимфоциты, а реакция на тартратрезистентную кислую фосфатазу (TRAP)
отрицательная. Больные плохо поддаются стандартной терапии и имеют неблаго¬
приятный прогноз.Миеломная болезнь (множественная миелома)Миеломная болезнь — В-клеточное лимфопролиферативное заболевание,
характеризующееся клональной пролиферацией в костном мозге, реже в экстра-
медуллярных очагах, плазматических клеток, синтезирующих моноклональный
иммуноглобулин (IgG, IgA, IgD, IgE) и/или легкие цепи (к, А.). Заболеваемость
миеломной болезнью (МБ) составляет 3,5 на 100 ООО населения в год. Заболевание
диагностируется в возрасте 40-70 лет. Среди этиологических факторов выделяют
вирус герпеса 8-го типа. В патогенезе заболевания большую роль придают акти¬
вирующему действию некоторых цитокинов, в частности ИЛ-6, который под¬
держивает пролиферацию плазматических клеток и предотвращает их апоптоз.
Выживаемость и рост опухолевых клеток во многом зависят от стромального
микроокружения костного мозга. Адгезия миеломных клеток к внеклеточному
матриксу костного мозга с помощью адгезивных молекул [CD44, VLA-4, VLA-5,
CDlla, CD56, CD54 (ICAM-1), CD138, MPC-1J локализует опухолевые клетки в
костномозговом микроокружении. Синдекан'1 (CD138) регулирует рост и выжи¬
ваемость опухолевых клеток, а его повышение в крови коррелирует с плохим
прогнозом. Адгезия миеломных клеток через синдекан-1 к коллагену активиру¬
ет матриксную металлопротеиназу-1, способствуя резорбции костей и инвазии
опухоли. Кроме того, находясь в тесном физическом контакте со стромальным
микроокружением костного мозга, миеломнь[е клетки секретируют цитокины
(TNF-a, TGF-p, VEGF), которые в дальнейшем стимулируют секрецию ИЛ-6 стро-
мальными клетками костного мозга, способствуя остеолизу.Для клинической картины характерны: остеодеструкция плоских костей, поли¬
нейропатии, миеломная нефропатия с развитием почечной недостаточности,
реже гепатоспленомегалия, поражение лимфатических узлов, бактериальные и
вирусные инфекции, геморрагический синдром, криоглобулинемия, амилоидоз.
598 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯВыделяют различные клинические варианты — несекретирующую, дремлющую,
индолентную миелому, плазмоклеточный лейкоз. Диагностические критерии мие-
ломной болезни представлены в табл, 7-28,Таблица 7-28. Диагностические критерии миеломной болезни (ВОЗ, 2008)Критерии миеломной болезни симптоматическойасимптотическойМ-протеин в сыворотке крови или моче*.
Пролиферация в костном мозге моноклональных
плазматических клеток (ПК) или наличие плазмо-
цитомы**.Поражение органов и тканей (анемия, гиперкапьцие-
мия, почечная недостаточность, поражение костей,
амилоидоз, инфекции) М-протеин в сыворотке крови >30 г/л и/или
10% либо более моноклональных ПК в костном
мозге.Отсутствуют поражения органов и тканей или кли¬
нические симптомы, характерные для миеломной
болезни^Точные значения М-протеина в крови отсутствуют. В большинстве случаев; IgG >30 г/л, IgA
>25 г/л, >1 г белка Бснс-Джонса в сутки. Белок Беис-Джонса обнаруживают в моче у 75% боль¬
ных.**Моноклональные плазматические клетки превышают 10% ядерных клеток костного мозга,
нижняя граница ПК отсутствует, так как около 5% больных с миеломой имеют менее 10% ПК.Иммунофенотип: опухолевые плазматические клетки экспрессируют моно¬
клональный цитоплазматический иммуноглобулин (чаще IgG, реже IgA, IgD, IgE,
IgM). Пан-В-клеточные антигены (CD19, CD20) отсутствуют, отмечается экспрес¬
сия CD38, CD138, CD56/58.Несекретирующая миелома составляет около 1% всех случаев МБ, при кото¬
рой плазматические клетки синтезируют, но не секретируют молекулы имму¬
ноглобулинов, что ведет к отсутствию М'компонента в сыворотке крови и
моче. Обнаружение цитоплазматического моноклонального иммуноглобулина
возможно при иммунопероксидазном, иммунофлюоресцентном исследовании.
Клиническая картина этого варианта аналогична таковой при МБ, за исключением
редко встречаемой почечной недостаточности.Дремлющая (тлеющая) и индолентная формы миеломы ~ два варианта
МБ, характеризуемые длительным стабильным асимптоматическим течением
(табл. 7-29).Таблица 7-29. Варианты миеломной болезниДремлющая (тлеющая) миеломаИндолентная миеломаКомпонент в сыворотке или моче в той же концен¬
трации, что при миеломной болезни.Плазмоцитоз — 10-30% плазматических клеток в
костном мозге.Очаги остеолиза отсутствуют.Нет клинических симптомов, характерных для мие¬
ломной болезниХарактерны те же признаки, что и для миеломы, за
исключением;М-компонент: IgG — <70 г/л, IgA — <50 г/л.Редко очаги остеолиза (<3 очагов) без компрессион¬
ных переломов.Содержание гемоглобина, кальция и креатинина —
в пределах нормы.Отсутствуют инфекционные осложненияВ костном мозге при МБ отмечается плазмоклеточная инфильтрация различной
степени выраженности, характеризуемая анизоцитозом как клеток, так и их ядер,
анаплазией и разной степенью зрелости (от плазмобластов, проплазмоцитов до
зрелых плазматических клеток). В 10% наблюдений МБ субстрат опухоли пред¬
ставлен плазмобластами, при этом отмечается плохой прогноз заболевания. При
МБ в костном мозге встречаются многоядерные, многодольчатые плазматиче¬
ские клетки. Преобладание незрелых плазматических клеток редко наблюдается
при реактивном плазмоцитозе, что может служить морфологическим критерием
опухолевого процесса. Цитоплазма клеток имеет хорошо развитую эндоплаз-
матическую сеть, в которой могут конденсироваться или кристаллизоваться
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 599иммуноглобулины в виде включений: виноградной грозди (клеток Мотта), телец
Рассела, кристаллов. Эти включения не являются патогномоничными только для
МБ и могут быть обнаружены при реактивном плазмацитозе. Редко встречаются
пламенеющие, Гоше-подобные клетки (тезауроциты). В цитоплазме могут наблю¬
даться вакуолизация, явление клазматоза (отшнуровка цитоплазмы), фагоцитоза.
Описаны наблюдения МБ с явлением гемофагоцитоза в плазматических клетках.
Другим важным диагностическим признаком МБ является обнаружение моно¬
клонального иммуноглобулина в сыворотке крови и/или моче, выявляемого у
99% больных, у большинства больных наблюдается снижение уровней нормаль¬
ных иммуноглобулинов более чем на 50%, редко — нормальные их значения.
Моноклональный IgG встречается у 50%, IgA — приблизительно у 20%, монокло¬
нальные легкие цепи (белок Бене-Джонса) — у 15%, IgD — у 2%, биклональная
гаммапатия — у 2% больных. Протеи ну рию Бене-Джонса обнаруживают у 75%
больных. Лабораторными проявлениями МБ являются также повышение СОЭ (в
70% случаев), агрегация эритроцитов в мазке крови в виде монетных столбиков,
криоглобулинемия, гиперкальциемия.в случае если концентрация моноклонального иммуноглобулина менее 35 г/л,
доля плазматических клеток составляет менее 10%, отсутствуют очаги остеолиза,
анемия, гиперкальциемия или почечная недостаточность, устанавливают диагноз
доброкачественной моноклональной гаммапатии неясного генеза. Встречается у
1% больных старше 50 и 3% — старше 70 лет. Наиболее часто регистрируют моно¬
клональный парапротеин класса IgG. Примерно у 25% больных в дальнейшем
развиваются миеломная болезнь, макроглобулинемия Вальденстрема, первичный
амилоидоз или другие лимфопролиферативные заболевания. В среднем этот
интервал составляет около 10 лет.ПпазмоцитомаПлазмоцитома характеризуется клональной пролиферацией плазматических
клеток, которые по морфологическим признакам идентичны клеткам при мие-
ломной болезни, но в отличие от последней опухоль локализована либо в костной
ткани (солитарная плазмоцитома кости), либо имеет внекостное расположение
(экстраоссальная, или внекостная, плазмоцитома). Плазмоцитома составляет
3-5% всех случаев плазмоклеточных опухолей. Внекостная солитарная плазмо¬
цитома встречается во всех внутренних органах и тканях, чаще всего в носоглот¬
ке, верхних дыхательных путях, коже, по ходу желудочно-кишечного тракта.
Критериями диагноза солитарной плазмоцитомы являются плазмоклеточная
природа опухоли, нормальные показатели крови, отсутствие парапротеина в крови
и моче, нормальное содержание иммуноглобулинов, отсутствие других костных
поражений. У 15% больных возможна трансформация в миеломную болезнь.Острый плазмобластный (плазмоклеточный) лейкозОстрый плазмобластный (плазмоклеточный) лейкоз может быть первичным,
как и любой острый лейкоз, или вторичным, как этап эволюции МБ. Примерно
около 2% случаев МБ в терминальной стадии трансформируются в острый
плазмобластный лейкоз. Наиболее часто встречается при IgD- и IgE-миеломе.
Экстрамедуллярные инфильтраты наблюдаются у 50% больных, преимуществен¬
но в печени, селезенке, лимфатических узлах, коже.Остеодеструктивный синдром встречается реже, а парапротеинемия и парапро-
теинурия с такой же частотой, что и при МБ. Вторичный иммунодефицит резко
выражен. Острый плазмобластный лейкоз характеризуется диффузным пораже¬
нием костного мозга опухолевыми плазмобластами. которые обнаруживают и в
периферической крови (>2,0х10ул, или более 20% всех лейкоцитов). В крови
отмечаются незначительный лейкоцитоз, анемия, возможна тромбоцитопения.
600 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯПродолжительность жизни больных острым плазмобластным лейкозом — менее
года, ремиссии наблюдаются редко.Макроглобулинемия ВальденстремаМакроглобулинемия Вальденстрема (MB) — В-клеточная опухоль, морфологи-
ШвШ чески представленная лимфоцитами, зрелыми плазматическими клетками и пере¬
ходными формами клеток, секретирующими моноклональный IgM. Опухолевая
трансформация происходит на уровне постгерминальных В-лимфоцитов,
Макроглобулинемия Вальденстрема составляет 1,5% всех случаев В-клеточных
лимфом. Болеют преимущественно мужчины старше 60 лет. Клинические про¬
явления MB обусловлены пролиферацией лимфоцитов в костном мозге, печени,
селезенке, лимфатических узлах и накоплением в сыворотке моноклонального
IgM (>30 г/л). Синдром повышенной вязкости крови, коагулопатии, криоглобу-
линемия, нейропатии — наиболее частые клинические проявления МБ. В костном
мозге отмечаются пролиферация лимфоцитов, иногда с плазматизированной
цитоплазмой, увеличение плазматических клеток (до 15-20%), тучньЕХ клеток.
При гистологическом исследовании костного мозга выявляют диффузную, интер¬
стициальную или паратрабекулярную пролиферацию лимфоцитов, плазмоцитов
и их переходных форм, фиброз Стромы. Картина периферической крови харак¬
теризуется анемией, нередко наблюдается лейкопения с нейтропенией, но чаще
количество лейкоцитов нормальное, может наблюдаться моноцитоз. По мере
прогрессирования заболевания развивается тромбоцитопения. СОЭ всегда резко
увеличена. В сыворотке крови отмечается гиперпротеинемия, а на электрофоре-
грамме — М-градиент класса IgM, в моче — белок Бенс-Джонса.Иммунофенотип; опухолевые клетки экспрессируют поверхностные и цито¬
плазматические иммуноглобулины, обычно IgM, В-клеточные антигены (CD19,
CD20, CD22, CD79a), CD38. Клетки не экспрессируют CD23, CD5, CD10, CD43(V-).Цитогенетика: в 50% случаев имеют место транслокация t(9;14), нарушение
сборки генов тяжелых или легких цепей Ig.Продолжительность жизни больных при медленно прогрессирующем процес¬
се составляет свыше 5 лет, при быстрой прогрессии — около 2,5 года. Возможна
трансформация в диффузную крупноклеточную лимфому.Болезни тяжелых цепейБолезни тяжелых цепей (БТЦ) представляют собой В-клеточные лимфа¬
тические опухоли с гетерогенной клинической и морфологической картиной
и секрецией тяжелых цепей (Н-цепи) различных классов иммуноглобулинов.
Диагностика БТЦ основывается на иммунохимическом анализе сывороточных
белков, позволяющем выявить тяжелые цепи иммуноглобулинов (Н-цепи).
В соответствии с классом тяжелых цепей, синтезируемых опухолевыми клетками,
выделяют несколько вариантов БТЦ.БТЦ-у (вариант лимфоплазмоцитарной лимфомы) чаще встречается у мужчин
моложе 40 лет. Наблюдаются поражение лимфатических узлов, костного мозга,
печени, селезенки, вальдейерова глоточного кольца, лихорадка. У большинства
больных имеются симптомы интоксикации, в крови отмечаются признаки прогрес¬
сирующей анемии и тромбоцитопении, чаще аутоиммунного генеза, эозинофилия,
нормальная СОЭ. Уровень патологического иммуноглобулина в сыворотке невы¬
сокий, снижена концентрация нормальных иммуноглобулинов. Морфологический
субстрат опухоли представлен лимфоцитами, плазмоцитоидными лимфоцитами,
плазматическими клетками, иммунобластами и эозинофилами. Иногда цитоло¬
гическая картина напоминает МБ или ХЛЛ. Заболевание быстро прогрессирует,
выживаемость — 12 мес.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 601БТЦ-[і (вариант хронического лимфолейкоза) наблюдают у пожилых пациен¬
тов; проявляется как медленно прогрессирующий лимфолейкоз, отличающийся от
классического ХЛЛ выраженной гепатоспленомегалией, отсутствием перифериче¬
ской лимфаденопатии. В костном мозге отмечаются лимфоидная пролиферация,
увеличение процента плазматических клеток с вакуолизированной цитоплазмой.БТЦ-6 с клиническими и морфологическими проявлениями МБ описана в
1978 г. в Финляндии,БТЦ-а (вариант экстранодальной В-клеточной лимфомы маргинальной зоны,
ассоциированной с лимфоидной тканью слизистых оболочек) чаще регистриру¬
ют у детей и людей моложе 30 лет обоих полов. Около 85% случаев выявлено в
бассейне Средиземного моря; выделяют 2 варианта болезни: абдоминальный и
легочный. Абдоминальная форма характеризуется диффузной инфильтрацией
слизистой оболочки тонкой кишки и мезентериальных лимфатических узлов
лимфоидными и плазматическими клетками, макрофагами, тучными клетками.
Поражение всего ЖКТ приводит к атрофии ворсинчатого аппарата и развитию
синдрома мальабсорбции. В клинической картине преобладают боли в животе,
хроническая диарея, стеаторея, кахексия, эпизодическая лихорадка. Легочная
форма протекает с бронхопульмональными поражениями и медиастинальной
лимфаденопатией.Фолликулярная лимфомаОпухоль из В-клеток фолликулярного центра (центроцитов/центробластов).
Составляет 30-40% всех лимфоидных опухолей, средний возраст больных —
60 лет. При фолликулярной лимфоме преимущественно вовлекаются в опухолевый
процесс лимфатические узлы, селезенка, глоточное кольцо Вальдейера, костный
мозг (в 70% наблюдений). Экстранодальные очаги опухоли могут наблюдаться
в желудочно-кишечном тракте, мягких тканях, коже. На ранних стадиях заболе¬
вание характеризуется фолликулярным ростом. В классификации ВОЗ выделено
3 варианта роста опухоли: преимущественно фолликулярный (фолликулярный
характер роста занимает более 75% поля зрения), фолликулярный и диффузный
(фолликулярный характер роста занимает 25-75% поля зрения) и преимуществен¬
но диффузный (фолликулярный характер роста занимает менее 25% поля зрения).
Неопухолевые фолликулы плохо определяются и часто лишены зоны мантии.Субстрат опухоли представлен клетками зародышевого центра — центроцита-
ми и центробластами. Центроциты — клетки размером с малый лимфоцит или
несколько больше, с неправильной, расщепленной, складчатой формой ядер. Ядро
содержит грубый хроматин, ядрышки отсутствуют, ободок цитоплазмы практиче¬
ски не определяется. Центробласты крупнее центроцитов, ядра округлой формы,1 -2 нуклеолы, отчетливый ободок цитоплазмы базофильного цвета. Соотношение
этих клеток варьирует.Опухоль имеет склонность к ранней генерализации, только у Yj больных она
выявляется в I-II стадии заболевания. В костном мозге при лейкемизации про¬
цесса отмечается лимфоидная инфильтрация с вытеснением нормальных ростков
кроветворения, в периферической крови имеют место лейкоцитоз, анемия и/или
тромбоцитопения, абсолютный лимфоцитоз. Среди лимфоцитов преобладают
клетки средних размеров с высоким ядерно-цитоплазматическим соотношением,
ядром неправильной формы, с глубокими расщелинами, зазубринами. Цитоплазма
окружает ядро узким ободком светло-голубого цвета.Иммунофенотип: опухолевые клетки экспрессируют пан-В-клеточные антиге¬
ны (CD 19, CD20, CD22, CD79a) в сочетании с поверхностными иммуноглобули¬
нами, чаще IgM, IgG; Вс12^. В большинстве случаев выявляется экспрессия CD 10
и отсутствие CD5. Редко выявляется CD43. Опухолевые клетки экспрессируют
ядерный белок Вс12.*
602ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯЦитогенетика: классической аномалией является t(14;lS) (q32; q21), которая
приводит к гиперактивации Ьс12 и гиперпродукции белка гена Ьс12 — онкопротеина
Вс12, мощного ингибитора апоптоза. Он препятствует повышению концентрации
Са^* в ядре, что необходимо для деградации ДНК и индукции апоптоза. Экспрессия
протеина Вс12 позволяет дифференцировать фолликулярную лимфому и фол¬
ликулярную реактивную гиперплазию лимфатических узлов. Прогрессирование
фолликулярной лимфомы сопровождается трансформацией в агрессивную диф¬
фузную В“Крупноклеточную лимфому у 25-35% больных.Лимфома маргинальной зоны селезенки с отростчатыми лимфомитамиСоставляет менее 1% всех лимфоидных опухолей. Средний возраст больных —
70-75 лет. Характеризуется опухолевой пролиферацией В-лимфоцитов, которые
расположены в зародышевых центрах белой пульпы селезенки. Ведущим симпто¬
мом является выраженная спленомегалия. Увеличение периферических лимфати¬
ческих узлов незначительное либо отсутствует. Поражение костного мозга носит
очаговый характер. При гистологическом исследовании селезенки обнаруживают
инфильтрацию белой пульпы опухолевыми клеточными элементами. В 60%
случаев в сыворотке крови выявляется моноклональный парапротеин IgM-типа,
Характерно быстрое развитие лейкемизации процесса. У 50% больных в перифе¬
рической крови отмечаются умеренная анемия, тромбоцитопения и лейкоцитоз,
редко превышающий 25х10ул. В лейкоцитарной формуле имеют место абсолют¬
ный лимфоцитоз и нейтропения. Большинство клеток представлено атипичными
лимфоцитами, которые имеют больший размер, чем при хроническом лимфолей-
козе, округлое ядро, часто с вдавленнями, расщеплениями, глыбчатым распределе¬
нием хроматина, возможны нуклеолы. Цитоплазма скудная, умеренно базофиль-
ная, имеет тонкие, короткие цитоплазматические выросты, часто локализованные
на одном из полюсов клетки. В цитоплазме может наблюдаться вакуолизация.Цитохимия: реакция на тартратрезистентную кислую фосфатазу в лимфоцитах
крови и костного мозга отрицательная либо слабоположительная.Иммунофенотип: характерна яркая экспрессия поверхностных иммуноглобули¬
нов класса IgM, IgD, иногда определяются внутрицитоплазматические иммуногло¬
булины, экспрессия маркеров В-лимфоцитов — CD 19, CD20, CD22, CD79a. Б отли¬
чие от ХЛЛ клетки не экспрессируют CD5, CD23, CD43. Цитогенетика: в отдельных
случаях опухолевые клетки содержат трисомию 3, t(ll;18) и другие хромосомныме
аномалии. Заболевание характеризуется доброкачественным течением.Лимфома из клеток мантийной зоныСоставляет 3-10% всех злокачественных лимфом. Опухолевый аналог — лим¬
фоцит зоны мантии лимфатического узла (CD5"CD23“). Средний возраст боль¬
ных — 60 лет. Наиболее характерные клинические признаки: генерализованная
лимфаденопатия, поражение печени, селезенки, костного мозга. Вовлечение в
процесс костного мозга встречается в 50-82% наблюдений. Наиболее частые
места экстранодальной локализации опухоли — желудочно-кишечный тракт и
глоточное кольцо Вальдейера. Большинство наблюдений множественного лим-
фоматоидного полипоза (поражения желудочно-кишечного тракта) относится к
лимфоме из клеток мантийной зоны. Нормальный рисунок лимфатического узла
стерт, значительно чаще встречается диффузный тип поражения, реже — ноду-
лярный. Выделяют три цитологических варианта: из мелких клеток с округлым
ядром, полиморфный (из крупных и среднего размера клеток с расщепленным
ядром) и бластный (бластоидный), напоминающий лимфобласты. Лейкемическая
фаза лимфомы из клеток мантийной зоны характеризуется средним размером опу¬
холевых клеток с ядром неправильной формы, расщепленным или вдавленным,
нечеткими ядрышками.
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ 603Иммунофенотип: характерна экспрессия пан-В-клеточных антигенов (CD 19,
CD20, CD79a) в сочетании с поверхностными IgM, нередко с ко-экспрессией IgD.
Часто встречается экспрессия CD43, CD5 при отсутствии CD10 и CD23.Цитогенетика: в 70-75% наблюдений имеет место транслокация t(ll;14) (ql3;
q32), сверхэкспрессия мРНК циклима D1. Структурные нарушения также выявля-
ются в хромосомах 7,12 и 18.Диффузная В-хрупноклеточная лимфомаСоставляет 30-40% всех лимфосарком у взрослых, средний возраст больных —
70 лет. Характеризуется агрессивным течением. Может развиваться как самостоя¬
тельное заболевание или как результат трансформации зрелоклеточных лимфом.
Иммунодефицитное состояние у больных повышает риск развития диффузной
В-крупноклеточной лимфомы. Часто выявляется носительство вируса Эпштейна-
Барр. Характерно поражение лимфоидной ткани, но в 40% случаев встречается
экстранодальная локализация (центральная нервная система, кожа, желудочно-
кишечный тракт, кости, яички, мягкие ткани и др.). В классификации ВОЗ выде¬
лено несколько клинических вариантов диффузной В-крупноклеточной лимфомы:
медиастинальная (тимическая), интраваскулярная, первичная лимфома серозных
полостей, АЛК-позитивная В-крупноклеточная лимфома. Неопухолевый ана¬
лог — В-клетки зародышевого центра (центробласты) и постгерминативной зоны
(иммунобласты). При этом заболевании выделено несколько морфологических
вариантов: центробластный, иммунобластный, анапластический (характеризуется
наличием крупных клеток, сходных с клетками Березовского-Штернберга). При
лейкемизации диффузной В-крупноклеточной лимфомы в костном мозге и пери¬
ферической крови наблюдается инфильтрация бластными клетками.Иммунофенотип: опухолевые клетки характеризуются экспрессией пан-В-
клеточных антигенов (CD19, CD20, CD22, CD79a). Поверхностные и/или цито¬
плазматические иммуноглобулины обнаруживают в 50-75% наблюдений. Их
выявляют в клетках с морфологическими признаками плазматической диффе¬
ренциации. Несмотря на то что в большинстве случаев анапластической круп¬
ноклеточной лимфомы выявляют экспрессию CD30, подобная картина может
иметь место и при неанапластическом варианте крупноклеточной лимфомы.
Диффузная крупноклеточная В-лимфома в 30-50% случаев позитивна на Вс16,
Вс12. Пролиферирующая фракция Кі-67^-клеток высокая и составляет 40-90%.Цитогенетика: наиболее частой является транслокация t(14;18), сочетающаяся
с экспрессией гена Вс12, транслокация t(3;14), реже другие.Лимфома БеркиттаЛимфома Беркитта является агрессивной опухолью, составляющей 3-5% всех
злокачественных лимфом. Наиболее часто лимфому Беркитта регистрируют в
первые две декады жизни, редко встречается у взрослых. Выделяют эндемичный
тип (Экваториальная Африка, Новая Гвинея), который ассоциируется с вирусом
Эпштейна-Барр, спорадический тип (беркиттоподобная лимфома), регистри¬
руемый по всему земному шару, и лимфому Беркитта, ассоциированную с ВИЧ.
В Европе, США и России спорадический тип лимфом встречается редко и состав¬
ляет у взрослых 1-2%. У детей лимфома Беркитта достигает 30-50% всех случаев
лимфом, Лимфома Беркитта и беркиттоподобные лимфомы составляют до 40%
всех ВИЧ-ассоциированных лимфом. У некоторых больных заболевание прояв¬
ляется в виде острого лимфобластного лейкоза (ЬЗ-вариант).Неопухолевый аналог — бласгные клетки ранних зародышевых центров (фолли¬
кулярный В-бласт). Наиболее часто опухоль имеет экстранодальную локализацию
(органы желудочно-кишечного тракта, кости лицевой части черепа, средостение,
почки, молочная железа, центральная нервная система) с диффузным характе¬
ром роста. Лейкемизация опухолевого процесса характеризуется инфильтрацией
604 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯКОСТНОГО мозга и периферической крови мономорфными лимфоидными элемен¬
тами среднего размера с интенсивной базофилией и вакуолизацией цитоплазмы,
содержащей значительное количество липидов. Ядра содержат 2-3 некрупные
нуклеолы, размер клеток варьирует. Имеется множество макрофагов, содержащих
клеточные фрагменты — апоптотические тельца, что создает картину «звездного
неба». Редко преобладают крупные клетки, которые могут быть ошибочно при¬
няты за клетки В-крупноклеточной лимфомы. Отмечается много фигур митоза.
Пролиферирующая фракция Кі-б?""-клеток высокая и составляет от 80 до 100%.Иммунофенотип: опухолевые клетки экспрессируют поверхностные иммуно¬
глобулины IgM и пан-В-клеточные антигены (CD19, CD20, CD22), CD10, Вс1б,
часто — CD21 (рецептор вируса Эпштейна-Барр).Цитогенетика: характерной является транслокация t(8;14) (q24; q32) с акти¬
вацией протоонкогена с-тус. Могут выявляться транслокации t(2;8) и t(8;22).
Сверхэкспрессия гена с-тус приводит к дисрегуляции клеточного роста и является
ключевым событием в патогенезе лимфомы Беркитта.Т-КЛЕТОЧНЫЕ ОПУХОЛИ ИЗ ЗРЕЛЫХ (ПЕРИФЕРИЧЕСКИХ) Т-КЛЕТОКЭто гетерогенная группа опухолей, представленных Т-лимфоцитами со зрелым
посттимическим иммунологическим фенотипом. Около 15% злокачественных
лимфом имеют Т-клеточное происхождение. Отмечена связь этих заболеваний с
некоторыми географическими зонами. Так, в Японии и других странах Азии пре¬
обладают Т-клеточные лимфомы, ассоциированные с вирусом HTLV-I (человече¬
ским Т-лимфотропным вирусом 1-го типа).Т-клеточный пролимфоцитарный лейкозРедко встречаемое заболевание, регистрируют в возрасте старше 70 лет, имеет
агрессивное течение. В клинической картине наблюдаются генерализованная
лимфаденопатия, кожные поражения в виде эритематозных, папулезных высыпа¬
ний, гепатоспленомегалия. В костном мозге отмечается диффузная лимфоидная
инфильтрация с преобладанием пролимфоцитов. В периферической крови —
анемия, гиперлейкоцитоз с повышенным количеством пролимфоцитов ~ клеток
среднего размера, округлым, овальным или неправильной формы ядром, 1-2
нуклеолами и различной степени базофилии цитоплазмой. Иногда клетки мел¬
кие и нуклеолы в ядре неразличимы (мелкоклеточный вариант). Б ряде случаев
Т-клеточного варианта пролимфоцитарного лейкоза имеет место полиморфизм
ядер пролимфоцитов (извитые, скрученные, расщепленные, мозговидные).Иммунофенотип: опухолевые клетки экспрессируют CD2*CD3‘CD5^CD7'
CD4^CD8-/-.Цитогенетика: при Т-пролимфоцитарном лейкозе наблюдаются аномалии хро¬
мосомы 14, транслокация t(14;14).Средняя продолжительность жизни больных составляет около 7 мес,Т-клеточный лейкоз из больших гранулярных лимфоцитовЗаболевание характеризуется длительным лимфоцитозом (>6 мес) без четко
установленной причины за счет больших гранулярных лимфоцитов (БГЛ).
Т-клеточный лейкоз из больших гранулярных лимфоцитов составляет 2-3%
всех наблюдений ХЛЛ. Характеризуется доброкачественным течением процесса.
Клинической картине заболевания свойственны рецидивирующие бактериальные
инфекции, симптомы ревматоидного артрита, увеличение размеров селезенки,
поликлональная гипергаммаглобулинемия, цитопения (нейтропения, анемия),
абсолютный лимфоцитоз, БГЛ имеют диаметр 12-15 мкм, ядро округлой или
слегка овальной формы, расположено несколько эксцентрично, хроматин кон¬
денсированный, ядрышки не визуализируются. Цитоплазма широкая, светлая или
слабобазофильная, с нежными или плотными азурофильными гранулами разных
ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯ605размера и количества. Иммунофенотип: в 80% случаев имеет место CD3^, CD4‘,
CD8\ TCRa(5^ Редкие варианты:• CD3% TCRaP", CD4^ CDS ; CD3\ TCRap% CD4-, CD8^;• экспрессия CD3'. TCRy8% CD4 и CDS неотчетливая;• экспрессия CD 11b, CD56, CD57 значительно варьирует.Агрессивный НК-клеточный лейкозЛейкоз из натуральных Т-киллеров характеризуется клональной пролифера¬
цией НК-клеток, агрессивным клиническим течением. Заболевание регистрируют
чаще в странах Азии у молодых людей. Развиваются лихорадка, гепатоспленоме-
галия, поражение желудочно-кишечного тракта, лимфаденопатия. Заболевание
может осложняться коагулопатиями, гемофагоцитарным синдромом, полиорган-
ной недостаточностью. В патогенезе лейкоза из натуральных Т-киллеров играет
роль вирус Эпштейна-Барр. В костном мозге наблюдается массивная инфильтра¬
ция опухолевыми НК-клетками, имеющими морфологию БГЛ, Могут встречаться
реактивные гистиоциты с явлением гемофагоцитоза. Б периферической крови —
анемия, лейкоцитоз с абсолютным лимфоцитозом за счет БГЛ. Иммунофенотип:
опухолевые клетки экспрессируют CD2XD16^CD56^, отсутствует CD3.Грибовидный микоз/синдром Сезари (первичная Т-клеточная кожная лимфома}Составляет 2-3% всех злокачественных лимфом. Неопухолевый аналог —
периферические эпидермотропные Т-лимфоциты. Заболевание развивается мед¬
ленно. Характерно поражение кожи в виде папул, эритемы, которые постепенно
изъязвляются и сопровождаются зудом. Развивается алопеция как следствие
вовлечения в процесс волосистой части головы. Другим проявлением заболева¬
ния является эритродермия с интенсивным зудом и непереносимостью холода,
прогрессирование грибовидного микоза сопровождается лимфаденопатией, пора¬
жением печени, легких, центральной нервной системы.Синдром Сезари рассматривается как лейкемический вариант заболевания,
который характеризуется лимфаденопатией, эритродермией и наличием в кост¬
ном мозге и периферической крови опухолевых Т-клеток. в костном мозге и
периферической крови обнаруживают атипичнь[е лимфоциты с мозговидными
ядрами, среди которых вьщеляют клетки большого размера (классические клетки
Сезари) и мелкие. Ядра занимают большую часть клетки, они обычно округлой
или овальной формы, с мозговидной, конволютивной структурой хроматина, чаще
без нуклеол. Цитоплазма базофильная, расположена вокруг ядра в виде ободка,
гранул не содержит. Мелкие клетки выявляются чаще больших, имеют размер
малых лимфоцитов, изрезанную структуру хроматина (что соответствует его моз¬
говидной структуре при электронной микроскопии) и узкий ободок цитоплазмы.
Степень инфильтрации костного мозга клетками Сезари значительно варьирует.Иммунофенотип; опухолевые клетки имеют фенотип зрелых Т-лимфоцитов
(CD2, CD3, CD5, CD4). Описаны наблюдения синдрома Сезари со сниженной экс¬
прессией CD2, CD3. Не экспрессируются CDS, CD7, CD30.СПИСОК ЛИТЕРАТУРЫВладимирская Е.Б. Механизмы кроветворения и лейкемогенеза. — М„ 2007. — 152 с.Гематология / Под ред. О.А. Рукавицына. — СПб.: ООО 2007. — 911 с.Долгов В.В., Луговская С.А., Морозова В.Т., Почтарь М.Е, Лабораторная диагностика
анемий. - М.: Триада, 2009. - 147 с.Иммунология и аллергология / Под ред. А.А. Воробьева, А.С. Быкова, А.В, Караулова. —
М.: Практическая медицина, 2006. - 287 с,Козинец Г.И., Погорелов Б.М., Дягилева О,А., Наумова И.Н. Кровь. Клинический анализ,
Диагностика анемий и лейкозов. Интерпретация результатов. — М.: Медицина XXI, 2006. --
251 с.
606 ЛАБОРАТОРНАЯ ГЕМАТОЛОГИЯЛуговская С.А., Козинец Г.И. Гематология пожилого возраста. - М.: Триада, 2010. —
193 с.Луговская С.А., Морозова В.Т., Почтарь М.Е., Долгов В.В. Лабораторная гематология. —
М.: Триада, 2006. - 222 с.Луговская С.А., Почтарь М.Е. Ретикулоциты. - М., 2006. - 58 с.Луговская С.А., Почтарь М.Е. Гематологический атлас. — М.: Триада, 2008. — 296 с.Луговская С.А., Почтарь М.Е., Долгов В.В. Гематологические анализаторы. Интерпрета¬
ция анализа крови. - М.: Триада, 2007. - 109 с.Луговская С.А., Почтарь М.Е., Тупицын Н.Н. Иммунофенотипирование в диагностике
гемобластозов, — М.: Триада, 2005. - 166 с.Методики клинических лабораторных исследований / Под ред. В.В. Меньшикова. — М.;
Лабора, 2008. - Т. 1. - 446 с.Морозова В.Т., Луговская С.А. Лимфатические узлы. — М.: Триада, 2008. - 78 с.Новик А.А., Богданов А.Н. Анемии. - СПб.: Нева, 2004. - 320 с.Погорелов В.М., Козинец Г.И., Ковалева Л.Г. Лабораторно-клиническая диагностика
анемий. - М.: МИА, 2004. - 172 с.Погорелов В.М., Козинец Г.И. Хромосомы человека. Методы исследования — М.: Триада-
Фарм, 2004. - 178 с.Почтарь М.Е,, Луговская С.А., Морозова В.Т. Цитохимическая диагностика в лаборатор¬
ной гематологии. — СПб., 2003, — 79 с.Руководство по гематологии / Под ред, А.И. Воробьева. — М., 2003. — Т. 1-2,Румянцев А.Г., Морщакова Е.Ф., Павлов А,Д. Эритропоэтин: биологические свойства,
возрастная регуляция эритропоэза, клиническое применение. — М.: ГЭОТАР-МЕД, 2002. —
168 с.Hoffbrand A.V., Moss P.A.N., Pettit J.E. Essential Haematology. 5th ed. — 2006. — 380 p.WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. International
Agency for Research on Cancer. — Lyon, 2008. - 439 p.
Глава 8
Цитологические исследования
в лабораторной диагностикеЦИТОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
В КЛИНИЧЕСКОЙ ПРАКТИКЕЦитология — наука о клетке. Успехи в изучении таких патологи¬
ческих состояний человека, как злокачественный рост, регенерация,
лучевые поражения, в большой степени зависят от уровня развития
цитологии. Клиническая цитология — специальность, позволяю¬
щая решать задачи практического здравоохранения. С помощью
цитологического исследования можно не только диагностировать
злокачественную опухоль, но в ряде случаев провести ее точную
морфологическую верификацию; его результаты помогают опреде¬
лить тактику лечения новообразования, осуществить динамическое
наблюдение за больным, выявить рецидивы опухоли. Не менее
важно определить наличие неопухолевых состояний (дисплазии,
пограничных поражений), своевременное лечение которых предот¬
вращает развитие злокачественного поражения. С применением
современных методов анализа количество ошибок цитологической
диагностики снижается, достоверность цитологического диагноза
возрастает. Клиническое цитологическое исследование — специ¬
альное лабораторное исследование с помощью светового микро¬
скопа, в основе которого лежит изучение особенностей клеток и
неклеточных компонентов в мазке из материала разных органов и
тканей больного в целях установления диагноза разных поражений.
Цитологический диагноз основан на особенностях изменения ядра,
цитоплазмы, ядерно-цитоплазматического соотношения, клеточ¬
ных структур и комплексов, в практической работе - простота,
быстрота, возможность легко повторить исследование.Традиционно рісследование клеточного состава входит в ком¬
плекс клинических лабораторных анализов (крови, костного мозга,
экссудатов, отделяемого различных органов). Однако во многих
аспектах по применяемым методологическим принципам цитоло¬
гическое исследование приближено к патогистологическому, в том
числе в связи с равной мерой ответственности врача за установлен¬
ный морфологический диагноз.
608 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ в ЛАБОРАТОРНОЙ ДИАГНОСТИКЕЗадачи и возможности цитологического исследованияОбъектом цитологического исследования могут служить практически все орга¬
ны и ткани. Цитологический анализ включает получение и обработку материала,
его микроскопию и морфологическую оценку, определение природы процесса,
формулирование заключения с установлением нозологической формы забо-
левания в соответствии с принятыми морфологическими классификациями.
Цитологический метод позволяет проводить дифференциальную диагностику
злокачественного новообразования с неопзтсолевыми (предопухолевыми) пора¬
жениями и доброкачественными опухолями различной локализации, уточнить
стадию процесса, выявить ранние и поздние рецидивы, персистенцию опухоли
после лечения.Цитологическую диагностику используют при решении различных задач про¬
филактики и диагностики, которые были сформ^шированы Кардозо.• Скрининг (профилактический осмотр).• Установление (уточнение) диагноза заболевания.• Ранняя диагностика рака:
ориентировочный диагноз для выработки дальнейшей тактики обследова¬
ния;помощь в определении тактики лечения или обоснование показаний к
предоперационной лучевой терапии;^ метод установления диагноза, позволяющий экономить время и избежать
госпитализации;❖ предотвращение неприятных, сложных или даже рискованных диагности¬
ческих процедур;установление (уточнение) диагноза во время операции;<> в некоторых ситуациях — единственно возможный метод диагностики.• Цитологическое исследование в сопоставлении с патогистологическими дан¬
ными:❖ более безопасный морфологический метод, имеющий психологическое
преимущество перед патогистологическим;❖ при получении материала не оставляет шрама, дает меньше осложнений.• Динамическое наблюдение (для раннего определения рецидива опухоли).• Контроль в ходе лечения и после него, в том числе после операций, лучевой
и химиотерапии, а также при воспалительном процессе.• Для научных исследований.• Для определения в мазке некоторых разновидностей бактерий, грибов, про¬
стейших.ЦИТОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ПРИ ПРОФИЛАКТИЧЕСКОМ ОСМОТРЕУспехи в обеспечении здоровья населения во многом зависят от проведения
массовых профилактических осмотров, в первую очередь в группе повышенного
риска определенного заболевания, особенно в случае злокачественных ново¬
образований. Уникальное преимущество цитологического метода — возмож¬
ность динамического наблюдения за изменениями клеток (определение фоновых
и предопухолевых состояний). Ранняя диагностика опухолей организационно
состоит из двух этапов:• массового обследования населения для выявления опухоли или признаков,
не позволяющих ее исключить, а также неопухолевых и предраковых состоя¬
ний;• уточняющей диагностики в отобранных во время скрининга группах.На первом этапе цитологическое исследование должно быть с высокой степе¬
нью чувствительности. Исследование мазков из шейки матки — высокоэффектив¬
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 609ный скрининг-тест, который примерно в 10 раз повышает диагностику опухолей
по сравнению с визуальным обследованием. При этом происходит значительное
увеличение частоты обнаружения рака в ранней и доклинической стадии процесса.
Цитологическое исследование мазков из шейки матки входит в перечень исследо¬
ваний при диспансеризации населения.На втором этапе диагностики опухолей наряду с высокой чувствительностью к
цитологическому методу предъявляют требование высокой специфичности,ЦИТОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ПРИ УСТАНОВЛЕНИИ (УТОЧНЕНИИ)
ДИАГНОЗА ЗАБОЛЕВАНИЯЗадача цитологического анализа — подтверждение или опровержение наличия
злокачественной опухоли (онкоцитология), а также определение ее типа. В процессе
дифференциальной диагностики при отсутствии данных, указывающих на злокаче¬
ственную опухоль, врач-цитолог старается определить природу патологического про¬
цесса, диагностируя воспалительные, реактивные, пролиферативные, предопухолевые
поражения или доброкачественные опухоли. Диагноз, содержащий только описание
цитологической картины или заключение о наличии атипических клеток, не содер¬
жит информации, необходимой для определения лечебной тактики. Отрицательный
результат цитологического исследования не исключает наличие рака.Детальная цитологическая характеристика новообразования позволяет спе¬
циалисту обоснованно выбрать метод лечения (хирургическое, лучевое, химиоте¬
рапевтическое, их комбинация), поскольку опухоли различного происхождения
и строения по-разному реагируют на терапию. Цитологический анализ позволяет
оценить характер и степень выраженности гиперплазии эпителия, диагностиро¬
вать предраковое состояние (дисплазию эпителия) и на этой основе формировать
группы повышенного риска. Нередко это исследование — единственный метод,
обосновывающий начало лечения.ЦИТОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ПРИ РАННЕЙ ДИАГНОСТИКЕ РАКАЦитологическое исследование имеет несравненные преимущества перед други¬
ми методами обнаружения начальных стадий развития опухоли. Свидетельство
тому — цитологическая диагностика рака желудка, легкого, мочевого пузыря и
других органов еще до появления клинических, рентгенологических, эндоскопиче¬
ских симптомов заболевания. Развитие эндоскопической техники, ультразвуковых
и лучевых исследований в большой степени способствовало широкому внедрению
цитологического исследования в диагностику опухолей практически всех органов
и тканей организма, в том числе внутренних органов и мозга, ранее недоступных
внеоперационному морфологическому анализу.ЦИТОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ В СОПОСТАВЛЕНИИ
С ПАТОГИСТОЛОГИЧЕСКИМИ ДАННЫМИЭталон достоверности цитЬлогического диагноза — патогистологическое иссле¬
дование, поэтому принципиально важно проводить их сопоставление. Однако
при установлении диагноза даже опытным патологоанатомом возможны ошибки,
достигающие 18% наблюдений. Пространственные взаимоотношения компонен¬
тов ткани в цитологическом препарате в значительной мере нарушены (в гистоло¬
гическом препарате, как правило, сохранены), что ограничивает диагностическую
информативность мазка структурных характеристик патологически измененной и
нормальной ткани.Особенности цитологического метода в сравнении с патогистологическим:• значительно меньшее количество исследуемого материала;• малая травматичность и даже атравматичность его получения:• быстрое приготовление и окрашивание мазка, не требующее сложной дли¬
тельной обработки и специальной аппаратуры.
610 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ» Цитологическому исследованию отдают предпочтение, когда операционная§ биопсия кусочка ткани нежелательна или противопоказана (например, исследо-
Б вание отпечатков опухоли кожи при предположительном диагнозе меланомы),
для экстренного уточнения природы поражения во время инструментального
исследования (эндоскопического, ультразвукового, компьютерной и магнитно-
резонансной томографии), в некоторых ситуациях, возникающих во время опе¬
рации. Цитологическое исследование пунктатов лимфатических узлов позволяет
определить стадию распространения злокачественного процесса без биопсии. При
несовпадении результатов цитологического и патогистологического исследований
целесообразно выполнить повторный анализ всех данных больного, затем про¬
вести консилиум цитопатологов лаборатории совместно с ее заведующим или
(при отсутствии такового) с внешним консультантом, наконец, обсудить результат
исследования с патологоанатомом и лечащим врачом. Убежденность цитопа¬
толога в диагнозе диктует необходимость обращения в консультативный центр
Ассоциации клинических цитологов России (по существу, экспертную комиссию
с привлечением высококвалифицированных специалистов). При неудачах пато¬
гистологической диагностики уверенный цитологический диагноз может служить
основанием для проведения лечения.Установление (уточнение) диагноза во время операцииДостижения в цитологической диагностике позволяют широко использовать
метод в качестве интраоперационного исследования в целях;• установления природы патологического процесса, если ее не удалось опреде¬
лить до операции, а также если операционные находки противоречат уста¬
новленному до операции диагнозу;• оценки степени распространения, в частности прорастания и метастазирова-
ния опухоли в соседние или отдаленные органы и ткани;• определения эффективности радикального хирургического удаления опухоли.Цитологическое исследование — метод выбора при изучении материала, непри¬
годного для срочного гистологического исследования (плотных и рыхлых кроша¬
щихся масс, кусочков ткани очень мелких размеров, непригодных для приготовле¬
ния замороженных срезов, обызвествленных тканей, жидкости и др.).Контроль в ходе лечения и после негоЦитологическое исследование - метод выбора динамического наблюдения
за результатами лучевого, химиотерапевтического и гормонального лечения.
Цитологические данные по существу незаменимы для объективной морфологи¬
ческой оценки ранних и поздних изменений, возникающих в опухоли в процессе
лучевого и химиотерапевтического лечения больного (лечебный патоморфоз).
Они позволяют судить о чувствительности клеток опухоли к этим воздействиям и
об эффективности проводимого лечения.Динамическое наблюдение, обнаружение рецидивовЦитологическое исследование позволяет наблюдать за клеточными изменения¬
ми в динамике у представителей группы повышенного риска и больных, которым
проведено лечение по поводу злокачественной опухоли, что фактически невоз¬
можно с помощью других морфологических методов.Цитологическое исследование в различных
областях клинической медициныКлиническая цитология традиционно развивалась на основе эксфолиативных
способов получения материала; исследования жидкостей (экссудата, промывных
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 611ВОД, мочи), выделений (мокроты), мазков из шейки матки, соскобов с поверхности
опухоли, в настоящее время важный раздел цитологии — исследование материала,
полученного пункционными методами. В основном материал для исследования ЯЙ®
получают с помощью пункции опухолевых образований тонкой иглой под кон-
тролем ультразвука, рентгена, компьютерной томографии. Значительная доля
исследований в современной клинической цитологии приходится на получение ‘ Л \'
материала соскобом щеткой при эндоскопии, мазков-отпечатков операционного :V:
и биопсийного материала, в том числе при трепанобиопсии. Цитологическая диа-
гностика позволяет ответить на некоторые специальные вопросы, касающиеся ■ ' 'особенностей заболеваний в разных областях клинической медицины.• В гинекологии большое значение имеет цитологическое исследование для
диагностики предопухолевых поражений и опухолей, некоторых инфекций,
передаваемых половым путем, а также для определения гормонального ста¬
туса в различные периоды жизни женщины и выработки тактики гормональ¬
ного лечения.• в акушерстве — для диагностики срока беременности (недоношенности,
перенашивания беременности, угрозы выкидыша), оценки прогноза и так¬
тики лечения у беременных с гормональными нарушениями и привычными
выкидышами, определения предполагаемого начала менструального цикла в
послеродовом периоде.• в эндокринологии — для диагностики и дифференциальной диагностики
поражений щитовидной, паращитовидной, поджелудочной железы, надпо¬
чечников, гипофиза, а также генетических заболеваний (определения поло¬
вого хроматина в целях идентификации синдромов Шерешевского-Тернера,Клайнфельтера, Х-трисомии и др.).• В хирургии — для характеристики раневого экссудата, сроков заживления раны
(репаративная регенерация), распознавания хирургических заболеваний, для
срочной интраоперационной диагностики, установления характера патологи¬
ческого процесса при дифференциальной диагностике поражений, требующих
cpo^шoгo хирургического вмешательства, онкологических заболеваний и др.• В гастроэнтерологии — для диагностики различных неопухолевых заболева¬
ний и опухолей ЖКТ, распознавания Helicobacter pylori и определения степе¬
ни обсемененности слизистой оболочки.• В гематологии — для определения характера поражений лимфатических
узлов и костного мозга, дифференциальной диагностики злокачественных
лимфом, метастатических поражений, определения степени злокачествен¬
ности опухоли, ее распространенности.• Инфекционные болезни. Во фтизиатрии, помимо идентификации туберкуле¬
за, цитологическое исследование позволяет уточнить фазу воспалительного
процесса (альтеративную, экссудативную, пролиферативную), его активность
(фиброзирование, заживление). При диагностике СПИДа (особенно в III ста¬
дии поражения) с помощью цитологического метода можно определить 12 из
15 достоверных признаков заболевания (поражение иммунной системы, воз¬
будителей оппортунистических инфекций, микобактерии, болезнь Уиппла,
саркому Капоши и др.).Основные принципы обеспечения качества
цитологической диагностикиКВАЛИФИКАЦИЯ ВРАЧА-ЦИТОЛОГАЦитопатолог ЛПУ любого профиля наряду с общими вопросами цитологиче¬
ской диагностики должен быть компетентен в вопросах клинической онкологии,
612 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕонкоморфологии, знать международные гистологические классификации опу¬
холей, учитывая, что критерий достоверности цитологического исследования —
патогистологический диагноз. Оценка цитологического материала достаточно
субъективна, ее проводят на основании сравнения эталона нормы с основными
отличительными особенностями цитограммы патологических признаков конкрет¬
ного заболевания.ПОЛУЧЕНИЕ МАТЕРИАЛАПолучение материала для цитологического исследования, как и для патоги¬
стологического, осуществляют специалист по эндоскопии, УЗИ, хирург, онколог,
гинеколог, рентгенолог, значительно реже — цитолог (цитопатолог). Детали
методики получения материала — сфера компетенции цитопатолога, способного
реально оценить эффективность проведенного цитологического исследования.
Именно поэтому участие цитопатолога в выборе рациональной тактики комплекс¬
ного обследования больного в целях получения адекватного материала не только
правомочно, но и необходимо.КОНТАКТ С ВРАЧОМ-КЛИНИЦИСТОМ (ОНКОЛОГОМ, ХИМИОТЕРАПЕВТОМ,
ХИРУРГОМ, СПЕЦИАЛИСТОМ ПО ЛУЧЕВОЙ ТЕРАПИИ И ВРАЧАМИ ДРУГИХ
СПЕЦИАЛЬНОСТЕЙ)При комплексном обследовании больного оценку цитологической карти¬
ны осуществляют с обязательным привлечением данных клинической картины
и лабораторно-инструментальных методов исследования (анамнеза, клиниче¬
ских проявлений, результатов рентгенологического, эндоскопического метода
и др.). Цитопатологу важно понимать суть имеющихся симптомов заболевания.
Клиническое мышление помогает при дифференциальной цитологической диа¬
гностике опухолей. Многие клиницисты считают, что клиническую информацию
надо скрыть от цитопатолога, так как знание клинических данных приводит к
«тенденциозности» цитологического диагноза. Однако клиническая информация,
включая анамнез и физикальное обследование, — основа диагностики, и вместе
с другими лабораторно-инструментальными данными значительно сокращает
большое количество диагнозов до небольшого количества возможных заболе¬
ваний. Отсутствие контакта с врачом, получающим материал для исследования,
недопустимо, поскольку результат цитологического исследования зависит не толь¬
ко от клинической информации и находок при микроскопии, но и от наблюдений,
сделанных врачом в момент получения материала.Для цитопатолога принципиально важно уметь использовать детальную кли¬
ническую информацию о конкретном больном. По существу, «через мазок»
цитопатолог «контактирует» непосредственно с больным. Наличие клинического
мышления и высокий уровень компетентности не только в вопросах клинической
цитологии, но и в области определенного клинического метода обеспечивают
цитопатологу профессиональное общение со специалистом.КОНТАКТ С ПАТОЛОГОАНАТОМОМ (ГИСТОЛОГОМ)Важный принцип цитологической практики — работа в тесном контакте с
патологоанатомом. Цитологический материал по сравнению с патогистологиче¬
ским несет информацию о территориально более ограниченном участке патоло¬
гического субстрата, что определено способом получения материала. Не менее
значимо профессиональное общение с патологоанатомом с целью правильной
интерполяции патогистологических данных для понимания цитологической
картины. При этом цитопатологу важно знать особенности патологического
процесса (например, опухоли) на тканевом уровне, поскольку они отражают
цитологическую картину.
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 613Общеизвестно, что лучшие результаты диагностики получают те цитопатологи,
которые постоянно сопоставляют результаты цитологической и патогистологиче¬
ской диагностики.ОБЕСПЕЧЕНИЕ КАЧЕСТВЕННОЙ РАБОТЫ ЛАБОРАТОРИИ, ВКЛЮЧАЮЩЕЕ
ВНУТРЕННЮЮ И ВНЕШНЮЮ ОЦЕНКУ КАЧЕСТВАМикроскопическому изучению подлежит только качественно приготовленный
и окрашенный мазок. Существенную роль для установления правильного диагноза
играют хорошие фиксация и окраска исследуемого материала, В последние годы
все чаще традиционные методы приготовления препаратов заменяют стандарт¬
ным приготовлением тонкослойного мазка (жидкостная цитология). Проведение
внешнего и внутрилабораторного контроля качества повышает эффективность
работы цитологической лаборатории.Формулирование цитологического диагнозаЦитологическое исследование препаратов должно состоять из описания мор¬
фологической картины и собственно формулирования диагноза, по возможности
с указанием природы процесса (добро- или злокачественного) при наличии опу¬
холи, определении тканевой принадлежности, по возможности гистологической
формы и степени ее дифференцировки. Иногда данные цитологического исследо¬
вания позволяют только констатировать наличие злокачественного новообразо¬
вания, но не дают возможности определить тип опухолевых клеток. Однако даже
такой диагноз оказывается ценным для правильного ведения больного.Критерии цитологической диагностикиОснову цитологической диагностики составляет изучение клеток, изменений в
их расположении и строении. На основании известных критериев цитологической
диагностики анализируют клеточный и неклеточный состав: количество клеток,
наличие клеток разного типа, их расположение в структурах или разрозненно,
вид структур, размер, форма, строение клеток и ядер, ядерно-цитоплазматическое
соотношение, наличие или отсутствие клеточного и ядерного полиморфизма и
других параметров. По степени выраженности отклонения от нормального клеточ¬
ного состава судят о природе патологического процесса. При этом учитывают фон
препарата — элементы крови, бесструктурное вещество, коллоид, жир и др.Количество клеток в мазке определено прочностью межклеточной связи, оби¬
лием Стромы. Богатый клеточный состав характерен для низкодифференцирован¬
ных опухолей и рака, гемато- и лимфосаркомы, опухоли Юинга. Скудный матери¬
ал и даже единичные клетки встречают при остеопластической (склеротической)
остеогенной саркоме, скиррозном и дольковом раке молочной железы.Расположение клеток. Клетки в мазке могут располагаться разрозненно или
в виде структур. Для доброкачественных поражений характерны правильное, упо¬
рядоченное расположение клеток, одинаковое расстояние между ними, сходные
размеры клеток и ядер, образующих структуру.Для злокачественных новообразований характерны структуры, которые назы¬
вают комплексами. Комплексы встречают при раке (опухоли из эпителиальной
ткани) или саркоме (опухоли из неэпителиальной ткани - соединительной,
мышечной, нервной), часто в виде пучков.Размеры клеток и ядер. Размеры клеток обычно оценивают в сравнении с
размерами нормальных клеток того же типа. Размеры ядер обычно сравнивают с
размером эритроцита (в норме достаточно стабильным — примерно 7 мкм). Если
размер ядра меньше эритроцита, его считают мелким, если в 1-2 раза больше эри¬
троцита — средним, в 3-6 — крупным, в 7 и более раз — гигантским. Соотношение
614 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕразмеров ядра и цитоплазмы (ядерно-цитоплазматическое соотношение) также
весьма различно в разных клетках, и при его оценке учитывают степень отклоне¬
ния этого параметра от нормальной клетки того же титш.Фон препарата часто имеет большое диагностическое значение. Фоном могут
быть элементы периферической крови или воспаления, сопровождаемого опухо¬
левым процессом, клеточный детрит, межуточное вещество. Фон препарата в виде
межуточного вещества может иметь диагностическое значение при определении
тканевой принадлежности опухоли (хрящеобразующие опухоли) или гистологи¬
ческой формы (аденокарцинома со слизеобразованием).НЕКОТОРЫЕ КРИТЕРИИ ДОБРОКАЧЕСТВЕННЫХ И ЗЛОКАЧЕСТВЕННЫХ ПОРАЖЕНИЙПри реактивном и фоновом поражениях чаще всего увеличены количество
клеток (гиперплазия, пролиферация), размер ядер и наблюдается их более интен¬
сивная окраска (гиперхромия). Хроматин распределен сравнительно равномерно.
В некоторых ядрах (особенно характерно для железистого эпителия) увеличен
размер ядрышек. При некоторых состояниях изменены размер клеток и особен¬
ности окрашивания цитоплазмы.При пограничном процессе (поражении, близком к злокачественной опухоли)
размер ядер увеличен значительно, ядро деформировано, контуры его неровные,
ядерная мембрана неравномерно утолщена. Хроматин распределен неравномерно,
мелкие и крупные участки уплотнения чередуются. Образуются множественные
мелкие ядрышки или они могут увеличиться в размере, встречаются многоядер¬
ные клетки. Однако в отличие от злокачественной опухоли в разных клетках изме¬
нения оценивают как мономорфные (однотипные).Изменения в клеточном составе мазка при злокачественіюй опухоли.• Клеточный и ядерный полиморфизм — различие характеристик разных
клеток.• Образование комплексов из клеток — структур, отличающихся от нормаль¬
ных.• Изменение фона препарата: для многих злокачественных опухолей харак¬
терен так называемый опухолевый диатез - реакция соединительной ткани
на инвазию (прорастание опухоли). При этом определяют зернистые массы,
лейкоциты, эритроциты, что создает вид «грязного» фона.Если имеется достаточное количество материала и клетки сохранены, хорошо
приготовлен и окрашен препарат, часто без характеристики микроскопической
картины формулируют цитологический диагноз с указанием гистологической
формы опухоли и степени дифференцировки (низкодифференцированная адено¬
карцинома, плоскоклеточный ороговевающий рак, остеогенная саркома).При недостаточно убедительном материале и неяркой цитологической картине
приводят описание мазка и отдельных клеточных элементов.ФОРМУЛИРОВАНИЕ ЦИТОЛОГИЧЕСКОГО ДИАГНОЗА И ЕГО ТРАКТОВКАПри формулировании цитологического диагноза рекомендуют использовать
принятые международные термины, хотя допустимо в качестве дополнительного
замечания применять привычные в данном учреждении названия опухолей и дру¬
гих поражений.Утвердительный и предположительный цитологические диагнозы должны
соответствовать МКБ-10, Международным гистологическим классификациям
опухолей воз (2000-2007).• Картина воспаления — элементы воспаления (нейтрофильньїе и эозино¬
фильные лейкоциты, лимфоидные и плазматические элементы, гистиоциты,
макрофаги, клетки инородных тел).• Пролиферация (гиперплазия) эпителия.
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 015Диагноз доброкачественного поражения или опухоли без указания гистоло¬
гической формы.Диагноз доброкачественного поражения или опухоли с указанием гистологи¬
ческой формы в соответствии с гистологической классификацией (цитологи¬
ческая картина саркоидоза, цитограмма хондромы и др,).Клетки с признаками атипии (неясного происхождения) — такое заключение
не несет определенной диагностической информации и требует дальнейше¬
го обследования и повторного получения материала для цитологического
исследования. Это могут быть доброкачественные элементы с признаками
атипии, обусловленные усиленной гиперплазией и воспалением. В этом
случае необходимо повторить исследование, лечить воспаление или добро¬
качественный процесс, повторно обследовать после лечения. Однако клетки
с признаками атипии могут относиться и к злокачественной опухоли.
Предположение о злокачественной опухоли — клетки с выраженными при¬
знаками атипии, дистрофическими изменениями; в этом случае необходимы
обязательное повторное исследование, наблюдение. Чаще всего при таком
диагнозе есть серьезные основания предположить злокачественную опухоль.
Цитологический диагноз в предположительной форме рассматривают как
информацию, которая диктует необходимость и направленность дополни¬
тельных исследований. Он также не имеет юридической значимости. Однако
опыт показывает, что предположительный диагноз, в свою очередь, дает
определенную диагностическую информацию. Например, предположитель¬
ный цитологический диагноз злокачественной опухоли легкого в последую¬
щем, при продолжении диагностического исследования, подтверждается у
60-75% пациентов. Выявленная тяжелая атипия эпителиальных клеток в
мазке и предположение об опухоли в материале аспирационной пункции тон¬
кой иглой (АПТИ) предстательной железы в последующем подтверждаются
примерно у 50% пациентов. Особое значение предположительный цитоло¬
гический диагноз опухоли имеет на первых этапах проведения скрининга.
Также предполагают наличие злокачественной опухоли при получении
небольшого количества клеток с атипией или дистрофических изменениях.
Диагноз злокачественной опухоли без указания гистологической формы —
заключение, когда цитологическая картина не позволяет установить гисто-
Л0[ ическую форму опухоли.Диагноз злокачественной опухоли с }Т(азанием гистологаческой формы в соот¬
ветствии с гистологическими классификациями (плоскоклеточный рак с оро¬
говением, лимфогранулематоз, остеогенная саркома и др.). Цитологическое
исследование — эффективный метод диагностики злокачественных опухолей
различных органов, а цитологический диагноз опухоли в утвердительной
форме все чаще рассматривают как эквивалент патогистологического иссле¬
дования, т.е, имеет юридическую значимость и может вносить изменения в
предположительный клинический, эндоскопический, рентгенологический
диагноз. Установленный квалифицированным специалистом утвердитель¬
ный цитологический диагноз, учитьіваюіций возможности и пределы метода,
при совпадении с данными клинико-лабораторно-инструментальных иссле¬
дований - юридически значимый, служит основанием для начала ради¬
кального лечения. Поскольку методы лечения онкологических заболеваний
мог>т быть весьма агрессивными, при отсутствии убедительных признаков
опухоли необходим контроль в целях предотвращения гипердиагностики.
Некоторые сложные спорные случаи требуют гистологического подтверж¬
дения диагноза.Описательный ответ может быть, если имеется недостаточное количество
материала или он представлен в основном элементами воспаления и пери-
616 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕферической крови, отдельными клеточными элементами с выраженными
дистрофическими изменениями, затрудняющими идентификацию клеток,
в тексте можно указать, что послужило причиной отсутствия диагноза
(недостаточное количество материала, трудность трактовки обнаруженных
клеточных элементов и всей цитологической картины). Б противополож¬
ность распространенному мнению, можно утверждать, что и «неудовлетвори¬
тельные», и «неинформативные» результаты цитологического исследования
иногда дают лечащему врачу косвенную диагностическую информацию. Так,
например, большинство «безрезультативных» АПТИ молочной и щитовид¬
ной желез наблюдают при их доброкачественном поражении.• Отрицательный ответ — клетки злокачественной опухоли (или другого забо¬
левания, предполагаемого лечащим врачом) не обнаружены.В таких случаях можно указать, какие элементы обнаружены (периферическая
кровь, элементы воспаления и др.). Отрицательный результат цитологического
исследования обычно не содержит информации о заболевании и формально не
опровергает клинического предположения о патологическом процессе, его рас¬
сматривают как указание на необходимость продолжения диагностических иссле¬
дований.ЗНАЧЕНИЕ ЦИТОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯОпределенные трудности диагностики возникают в ситуации, когда вместо
предполагаемой по клиническим данным патологии в утвердительном цитологи¬
ческом диагнозе установлено другое заболевание. Уровень информации, содер¬
жащейся в утвердительном цитологическом диагнозе, связанный с определением
природы поражения, может быть различным. Утвердительный диагноз злокаче¬
ственной опухоли представляет пример первого (базового) уровня диагностиче¬
ской точности, часто достаточного для лечебных целей. Фактически во многих
случаях при любой биопсии реально ожидают прежде всего вывод о добро- или
злокачественном поражении.Цитологическая верификация гистологической формы опухоли отражает вто¬
рой уровень информации. Например, выявленные в мазке клетки злокачественной
опухоли с признаками железистой дифференцировки позволяют диагностировать
аденокарциному, установив при этом степень ее дифференцировки (высокую, уме¬
ренную, низкую).Следующий уровень диагностической информации при цитологическом иссле¬
довании — определение первичной или метастатической природы опухоли, а при
исследовании метастаза — предположение о наиболее вероятной первичной лока¬
лизации опухоли.Цель исследования вносит определенные коррекции в цитологический диа¬
гноз. В частности, цель скрининга — профилактика и раннее выявление опухоли.
Устанавливая цитологической диагноз во время скрининга, соблюдают принцип,
позволяющий при сомнении в трактовке микроскопических данных или при диф¬
ференциальной диагностике пограничных случаев и опухоли, выказывая онколо¬
гическую настороженность, «завышать^^ цитологический диагноз. Это оправдано
тем, что при скрининге специфичность метода — менее критический параметр, так
как результаты всегда проверяют на последующих этапах уточняющей диагности¬
ки и комплексного обследования больного.На этапе уточняющей диагностики в специализированном отделении роль
высокой достоверности цитологического диагноза возрастает. Именно поэтому в
сомнительном случае пограничного поражения цитологический диагноз лучше не
«завышать». Например, при невозможности проведения достоверной дифферен¬
циальной диагностики между тяжелой дисплазией эпителия и злокачественной
опухолью шейки матки в условиях скрининга целесообразно высказать предпо-
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 617ложение о раке, а во время уточняющей диагностики по тому же мазку в условиях
онкологического диспансера необходимо установить диагноз тяжелой дисплазии
эпителия, тем самым избежать неправомерных лечебных воздействий. Тем не
менее следует провести дополнительные исследования для установления точного
диагноза.ОГРАНИЧЕНИЯ ЦИТОЛОГИЧЕСКОЙ ДИАГНОСТИКИЦитологическая диагностика имеет ограничения:• неполноценный материал и недостаточная клиническая информация;• субъективизм и малый практический опыт цитолога;• недостаточное использование в практической работе объективных современ¬
ных методов.Несмотря на достижения цитологической диагностики, ошибки неизбежны. По
некоторым данным, цитологические ошибки составляют 8,35% при раке и нера¬
ковых заболеваниях с локализацией в легких, средостении, пищеводе, желудке,
молочной железе, шейке и теле матки, 14,6% — при патологических процессах
в коже, мягких тканях, костях. Ошибки разделены на три группы: объективные,
субъективные и технические.причины объективных ошибок:• отсутствие патогномоничных цитологических признаков злокачественности;• недостаточная изученность некоторых цитограмм;• многообразие цитологических картин злокачественных и доброкачествен¬
ных процессов;• отсутствие гарантии того, что исследуемый материал из патологического
очага, а не из окружающей ткани.Причины субъективных ошибок:• недостаточная профессиональная подготовка врача, выполняющего цитоло¬
гическое исследование;• игнорирование сведений о клинических проявлениях болезни, клинических
данных и результатов исследования другими диагностическими методами;• недостаточная онкологическая подготовка врача-клинициста, получающего
материал для цитологического исследования:• неправильная трактовка врачом-клиницистом результатов цитологического
исследования.Даже при соблюдении стандартных условий получения, приготовления и
окрашивания мазков могут возникать трудности, связанные с различной интер¬
претацией клеточного состава разными специалистами. В клинической цитоло¬
гии, помимо широкого спектра стандартных методов окрашивания препарата,
используют дополнительные методики, позволяющие определять различные
компоненты клеток (ДНК, РНК, гемосидерин, меланин, слизь, гликоген, липиды,
пероксидазу, неспецифическую эстеразу, кислую и щелочную фосфатазу и др.).
Активно применяют молекулярные и молекулярно-генетические методы диа¬
гностики: иммуноцитохимические, молекулярно-генетические (гибридизация in
situ - FISH, CISH) и др.Сутцествуют различные возможности организации работы цитолога: в составе
клинико-диагностической лаборатории, отдела патологической анатомии, цитоло¬
гической лаборатории онкологического диспансера и научно-исследовательского
института, централизованной цитологической лаборатории. Поскольку цитопато¬
лог и патологоанатом в одном учреждении, как правило, — разные специалисты, а
результаты цитологической диагностики постоянно сопоставляются с патогисто¬
логическими данными, у врачей-цитологов есть мощный стимул к развитию про¬
фессионализма. Значительный вклад в развитие цитологической службы России
вносит Ассоциация клинических цитологов, которая прилагает значительные
818 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ в ЛАБОРАТОРНОЙ ДИАГНОСТИКЕV' усилия по улучшению результатов цитологического исследования. Повышению
качества цитологической диагностики способствуют:'Ш. • совершенствование профессионального обучения, тестирования, обеспече-ния и контроля качества цитологических исследований;• консультации по сложному диагностическому материалу. В большой лабо-
ратории консультирование обычно проходит в пределах коллектива, однако''.;ч при некоторых СЛОЖНЫХ случаях даже опытным специалистам необходимопосоветоваться с коллегами с опытом диагностики редких и сложных опухо¬
лей в других учреждениях, в связи с этим существует практика консультаций
лично или по почте, обсуждения на заседаниях «круглого стола». В последнее
время эту проблему помогает решить телемедицина;• объективизация цитологической диагностики с помощью автоматизиро¬
ванных систем, морфометрии, иммуноцитохимическиX и молекулярно¬
генетических реакций, методов определения различных компонентов ядра
и цитоплазмы (ДНК, РНК, гемосидерина, меланина, слизи, гликогена, липи¬
дов, кислой и щелочной фосфатазы и др.),Эти методы еще недостаточно используют в клинической практике.Способы получения и обработки материала
для цитологического исследованияДля цитологического исследования необходимы полз'чение адекватного мате¬
риала, его обработка, окрашивание, микроскопия препаратов с последующим
изучением и интерпретацией цитологической картины. Наиболее ценную инфор¬
мацию о патологическом процессе цитологический метод дает при тщательном
соблюдении всех этапов исследования. Неправильная обработка или неадекват¬
ность материала и окрашивания мазка не мог>т быть компенсированы тщательно¬
стью последующего микроскопического исследования.Принципиальные положения;• цитологическое исследование — неотъемлемая часть общего комплекса диа¬
гностических мероприятий;• тесное сотрудничество цитопатолога с врачами других специальностей при
комплексной оценке клинических данных:• способ получения материала значительно влияет на цитологическую картину
и, что особенно важно, на цитоморфологические особенности клеток;• строгое соблюдение правил маркировки и обработки материала;• категорически запрещено посылать части пол)^іенного материала для иссле¬
дования в разные лаборатории:• недопустимо изучать нестандартно приготовленный мазок.Традиционно способы получения материала для цитологического исследованияподразделяют на эксфолиативные и пункционные.Эксфолиативные способы получения материалаТермином «эксфолиативный» обозначают самопроизвольное слущивание или
принудительное инструментальное соскабливание клеток с поверхности исследуе¬
мой ткани.Эксфолиативный материал:• секрет и экскрет из различных органов (мокрота, бронхиоло-альвеолярный
лаваж, выделения из соска молочной железы, моча и др.);• соскобы и отпечатки с поверхности образований на коже и слизистой обо¬
лочке, ран, язв и эрозий, разреза хирургически удаленной, биопсированной и
аутопсированной ткани, включая интраоперационные соскобы и отпечатки;
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ В19• аспираты из эндоцервикального канала и полости матки;• жидкость серозной полости (транссудат, экссудат), содержимое кисты;• материал, полученный во время эндоскопического исследования (ларинго-,
трахеобронхо-, эзофагогастро-, дуодено-, колоно-, ректоромано-, лапаро-,
цисто-, гистероскопии и др.).в современных эндоскопах для получения морфологического материала име¬
ются специальные приспособления (щетки, петли, катетеры, биопсийные щипцы).
Эффективность использования каждого перечисленного способа получения мате¬
риала во время эндоскопии определена особенностями локализации и распростра¬
ненности процесса.При эндоскопии используют:• браш-биопсию (соскоб нейлоновой щеткой, подведенной к исследуемому
участку) — наиболее результативный способ получения материала, особенно
из глубоких участков в зоне предполагаемого поражения;• прямые отпечатки с поверхности патологического очага ватным тупфером,
смоченным теплым физиологическим раствором;• отпечатки кусочка ткани, полученного при биопсии для гистологического
исследования (для повышения результативности диагностики необходимо
делать отпечатки со всех поверхностей кусочка);• аспират (секрет), полученный шприцем или электроотсосом;• промывные воды (аспират после 3-минутной экспозиции физиологическим
раствором, подогретым до 400 °С).Результативность исследования промывных вод достаточно низкая, поэтому
способ используют лишь как метод выбора при отрицательном результате при¬
менения других способов получения материала.К эксфолиативным методам относят также интраоперационный соскоб, ино¬
гда отпечаток ткани из патологического очага, которые все чаще используют во
время операции как эквивалент срочного патогистологического исследования.
Обязательное условие проведения интраоперационного соскоба — четко сформу¬
лированная оперирующим хирургом задача определения или уточнения морфо¬
логической природы и распространенности заболевания. Разрез уплотнения, опу¬
холи или лимфатического узла необходимо проводить сухим скальпелем, чтобы
избежать разрушения клеток водой. Б большинстве случаев производят соскоб с
поверхности свежего разреза с помощью легкого соскабливания острым лезвием
и последующим приготовлением мазка; при мягкой консистенции анализируемого
объекта можно приготовить отпечатки, прикладывая предметное стекло к поверх¬
ности разреза ткани.Правомерность срочного интраоперационного цитологического исследования
обусловлена высокой точностью цитологической диагностики и вместе с тем про¬
стотой получения и обработки материала. Проводимое опытным врачом срочное
цитологическое исследование нередко опережает результаты гистологического, во
многих клинических ситуациях его рассматривают как эквивалент срочного гисто¬
логического исследования замороженных срезов.ІІПункционные способы получения материалаМатериал для цитологического исследования получают проколом (пункцией)
органа или полости организма тонкой или толстой иглой. Пункцию проводит
лечащий врач или врач клинической лабораторной диагностики в процедур¬
ном кабинете, иногда в больничной палате (в зависимости от степени тяжести
состояния больного). Перед пункцией участок поражения тщательно пальпируют,
определяют его подвижность, связь с окружающими тканями и возможность опти¬
мальной фиксации. Опухоль фиксируют пальцами руки. Пункцию выполняют с
8ШШ620 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ в ЛАБОРАТОРНОЙ ДИАГНОСТИКЕсоблюдением правил асептики и антисептики. Не следует проводить анестезию
пунктируемого образования, так как сама пункция обычно не более болезненна,
чем прокол иглой для анестезии. Применение новокаина может вызвать измене¬
ние клеточных элементов.Обычно необходимо проверять положение иглы, пункцию выполняют под
визуальным контролем в соответствующем кабинете. Целенаправленную пункцию
патологического очага проводят под контролем рентгенологического, ультразву¬
кового исследования, компьютерной томографии, в том числе спиральной, стан¬
дартной рентгенотомографии, электронно-оптического усилителя с телевизион¬
ной установкой, магнитно-резонансной томографии. Манипуляцию осуществляют
с помощью высокотехнологичных биопсийных инструментов, в настоящее время
различают аспирационную пункцию тонкой иглой № 22 (собственно АПТИ);
пункцию толстой иглой (№ 18-21) с получением кусочка ткани для патогистоло¬
гического исследования, а также пункцию с помощью высокоскоростной дрели с
иглой для трепанации.Термин «аспирационная пункция» соответствует только АПТИ № 22. АПТИ —
высокорезультативный метод диагностики, выгодно отличающийся от эксцизи-
онной биопсии меньшей травматичностью, возможностью проведения в амбула¬
торных условиях, пригодностью для использования новых технологий (анализа
изображения, проточной цитометрии, иммуноцитохимических и молекулярно¬
генетических исследований), большей экономичностью. Достоинства метода —
возможность диагностики различных поражений, даже небольшого размера
(<1 см), независимо от их локализации, в частности в участках, недоступных для
применения эксфолиативных методов. Использование АПТИ все же ограничено
небольшими размерами (<0,5 см) и глубиной (3-4 см) расположения очага в том
или ином органе. При АПТИ высока диагностическая «концентрация» клеток на
единицу площади предметного стекла, а также сохранность клеток в полученном
материале. Эффективен метод (результативность — 89%, достоверность — 96%)
при диагностике злокачественных опухолей. Бытующее мнение о высокой частоте
осложнений при АПТИ в определенной мере связано с неправильным обозначе¬
нием методики.Если есть возможность, предпочтительнее использовать тонкие (№ 22-23) и
сверхтонкие (№ 24-25) иглы с наружным диаметром менее 0,4 мм и мандреном.
Частота осложнений при АПТИ обычно не превышает 10%, использование сверх¬
тонких игл значительно снижает количество различного рода осложнений (<1%).Применение толстых игл, включая троакар, для пункции внутренних органов
ограничено возможностью серьезных осложнений (30-40%). Этот метод реко¬
мендуют для исследования в основном мышечной и костной ткани.Место и направление хода иглы при пункции определяют на основании данных
лучевых и физикальных методов. Под визуальным контролем изображения очага
и иглы на мониторе продвигают иглу с мандреном по выбранной траектории.
Мандрен используют не всегда, так как иглы, применяемые для диагностических
пункций, имеют очень маленький диаметр и косой срез; игла легко проходит через
ткани, расположенные над пораженным участком (кожу, подкожную клетчатку,
мышцы), расслаивая их, поэтому закупорка иглы происходит очень редко.После достижения концом иглы очага поражения мандрен извлекают и при¬
соединяют шприц для аспирации материала (игла и шприц должны быть сухими!).
Затем (для получения материала) иглу осторожно продвигают вперед-назад в
одном или нескольких направлениях.В целях предотвращения возможной имплантации клеток опухоли в пункцион-
ном канале в шприце поддерживают отрицательное давление (вплоть до извлече¬
ния иглы!). Для повышения результативности и информативности исследования
иногда (например, при размере очага <2-3 см) очаг пунктируют из двух точек.
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 021ШШштУже при первой АПТИ почти в 90% случаев получают информативный мате-
риал. Задача цитолога при изучении мазка из полученного материала — оценка ;|Ш|
его адекватности и установление хотя бы предварительного цитологического
диагноза непосредственно во время АПТИ. Показаниями к повторным АПТИ (до
трех исследований) служат получение неинформативного материала или необхо¬
димость использования специальных методик. ШЩ)Противопоказания к проведению АПТИ: в• отсутствие четких данных о локализации процесса; кШЩ• предположительный диагноз сосудистого образования, подозрение на мела-
ному;• геморрагический диатез или проводимая больному антикоагулянтная тера¬
пия.В последнее время все большее распространение получает модификация
АПТИ — метод тонкоигольной капиллярной биопсии (ТКПБ), так называемой
аспирации без всасывания. При ТКПБ пункцию проводят одной иглой без помо¬
щи шприца и последующей аспирации материала. Теоретически считают, что
материал можно получить только с помощью режущего действия кончика иглы
при продвижении в глубь очага поражения, а всасывание может только усилить
повреждение ткани и привести к кровотечению. По некоторым данным, в настоя¬
щее время ТКПБ используют чаще, чем ТАПБ, хотя нет явных преимуществ в
качестве полученного материала.После проведения ТАПБ (ТКПБ) содержимое иглы выдувают на предметное
стекло или в контейнер со специальным консервирующим раствором для жидкост¬
ной цитологии с помощью шприца, который наполняют воздухом и вновь соеди¬
няют с иглой. Материал распределяют по стеклу краем шлифовального стекла или
ребром иглы.Если при проколе опухоли выделяется жидкость, ее собирают в подставленную
под иглу пробирку. Если она не стекает, можно использовать шприц, осторожно
оттягивая поршень и набирая жидкость, после чего его снимают и содержимое
выливают в пробирку. После удаления всей жидкости и сбора ее в пробирку
(с добавлением нескольких кристаллов цитрата натрия) обязательно следует
тщательно пропальпировать участок, из которого она была удалена, для исклю¬
чения остаточных масс, которые могли быть скрыты кистозным содержимым.
Необходимо дополнительно пунктировать стенку кисты и приготовить мазки из
этого материала.Всю полученную при пункции жидкость необходимо доставить в лабо¬
раторию.Цитологический материал доставляют в лабораторию в ближайшие сроки после
его получения, особенно если это содержимое кисты.Для доставки необходимо иметь специальные контейнеры для предметных
стекол, пробирки. Не допускают контакта нативного материала, в том числе под¬
сушенного предметного стекла, с бланком направления.В направлении на исследование должны быть паспортные данные пациента,
диагноз, проведенное лечение, точно указаны локализация участка, откуда
получен материал, способ его получения. Лаборант, принимающий материал,
должен провести маркировку препаратов, пробирок и др., оформление направ¬
ления, отметить характер и количество биоматериала, количество присланных
мазков.Правила приготовления препаратов едины вне зависимости от того, дела¬
ет мазок специалист, получивший материал, или его готовят в лаборатории.
Жидкости, полученные при пункции, тут же центрифугируют, сливают верхний
слой центрифугата, из осадка делают мазки.
622 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ в ЛАБОРАТОРНОЙ ДИАтОСТИКЕПриготовление И окрашивание мазкаМазок — основной объект изучения цитологической картины, тип цитологиче¬
ской пробы, приготовленной с помощью размазывания образца, его фиксации и
окрашивания перед исследованием. Для приготовления цитологического препарата
необходимо использовать новые стандартные тонкие сухие обезжиренные стекла.Параметры стандартно приготовленного мазка• Начало мазка — на расстоянии 1-1,5 см от узкого края предметного стекла,
конец ~ на расстоянии 2-2,5 см от другого его края.При исследовании жидкого материала (жидкости серозной и кистозной поло¬
сти, смыва) мазок из осадка должен заканчиваться у узкого края предметного
стекла в виде зубчатого следа (щеточки).• Мазок должен быть максимально тонким (приближенным к однослойному),
равномерной толщины на всем протяжении.• Мазок не должен достигать длинного края предметного стекла на расстоянии0,2-0,3 см.При невыполнении условий приготовления получают толстый, неравномер¬
ный (волнообразный) мазок, содержащий недоступные детальному изучению
(непросматриваемые) грубые скопления или комплексы клеток. Он становится
неинформативным, и его исследование ведет к «пропуску» важной диагностиче¬
ской информации на предметном стекле, а при отсутствии корригирующей кли¬
нической информации — к ошибочной оценке цитологической картины, а значит,
к неполноценному или ошибочному диагнозу. Именно поэтому приготовлению
стандартного мазка важно уделять особое внимание и при необходимости посто¬
янно обучать этому сотрудников клинических отделений, участвующих в получе¬
нии материала для цитологического исследования.ФИКСАЦИЯ И ОКРАШИВАНИЕ МАЗКАВ практике отечественных лабораторий фиксацию мазка чаще осуществля¬
ют в два этапа: после высушивания на воздухе применяют спиртовой фиксатор.
В настоящее время в ряде лабораторий применяют окрашивание мазков по
Папаниколау. Это окрашивание требует влажной фиксации мазка, т.е. сразу после
получения материала еще влажный мазок фиксируют специальными аэрозолями,
капельными фиксаторами или погружают на 10-15 мин в 96° этанол.В большинстве лабораторий страны для окрашивания используют азур-эозин
(по Романовскому, Паппенгейму, Лейшману) на «сухом» (высушенном на воздухе)
мазке.Все большее применение в цитологической диагностике находит жидкостная
цитология, когда на цитоцентрифуге или в автоматическом приборе для обработ¬
ки материала жидкостной цитологии готовят стандартные тонкослойные мазки.
Методика имеет ряд преимуществ перед традиционным приготовлением мазков,
прежде всего потому, что весь полученный материал переносят в фиксирующую
жидкость и из него при необходимости готовят мазки повторно; можно сразу
или при трудностях установления цитологического диагноза сделать несколько
препаратов для иммуноцитохимического исследования. Кроме того, мазки, при¬
готовленные методом жидкостной цитологии, удобны для микроскопии (клетки
расположены на небольшой площади в один слой, чистый фон препарата), а фик¬
сирующую жидкость можно использовать для проведения ПЦР и других молеку¬
лярных исследований.Весь материал, полученный при пункции, выдувают в фиксирующий раствор,
иглу промывают этим раствором несколько раз.Выбранная методика окрашивания мазка предопределяет способ фиксации мате¬
риала. Нарушение методики фиксации ведет к некачественном)^ окрашиванию мазка.
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 623 "Цель этих действий — получить информативный (адекватный) материал мак- -д.
симально быстро при наименьшем количестве исследований без вреда для боль- ^
ного, в определенной последовательности применить наиболее эффективные и
наименее инвазивные способы с учетом преемственности информации (каждый
последующий способ назначают после получения результатов предыд>тцего), '-г'-.-
предпочтение отдают одномоментным комплексным исследованиям. ■" ';При цитологическом исследовании у больного исходной позицией служат Л хГ
клинико-инстрзшентальные данные: локализация поражения в органе (ткани),
информация о распространенности и других особенностях течения патологиче¬
ского процесса.ЖИДКОСТНАЯ ЦИТОЛОГИЯЛучший способ обработки материала для цитологического исследования —
метод жидкостной цитологии. Материал, полученный при пункции, помещают в
специальную жидкую среду и доставляют в лабораторию. Для приготовления пре¬
паратов определенное количество жидкости помещают в специальные пробирки,
соединенные со стеклами, и обрабатывают на цитоцентрифуге. Препараты, при¬
готовленные таким способом, однослойные. Материал распределен равномерно на
относительно небольшой поверхности, что обеспечивает удобство в его изучении.После приготовления препарата методом жидкостной цитологии мазки окрашива¬
ют по Папаниколау или гематоксилин-эозином.Преимущества метода жидкостной цитологии:• возможность приготовления без повторной пункции большого количества
одинаковых цитологических препаратов хорошего качества;• сокращение времени изучения цитологическог’о препарата за счет уменьше¬
ния площади помещенного на стекло материала (всем цитопатологам зна¬
комы не очень приятные ощущения при необходимости изучения большого
количества малоклеточных препаратов, приготовленных традиционным
способом);• получение дополнительного материала для последующих диагностических,
прогностических и научных исследований:• экономия дорогостоящих реактивов, необходимых для дополнительных
методов исследования.ОСОБЕННОСТИ ЦИТОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
ЗАБОЛЕВАНИЙ ОРГАНОВ
Цитологическая диагностика заболеваний шейки маткиБлагодаря цитологическому исследованию во многих странах мира существен¬
но снизились заболеваемость и смертность от рака шейки матки (РШМ). Для
того чтобы цитологическое исследование оказалось эффективным, необходимы
соблюдение всех условий, предшсствуюіцих получению материала, правильное
получение, фиксация, окрашивание мазков, тщательное изучение всего клеточно¬
го состава препарата, правильная его интерпретация и формулирование диагноза
для определения тактики дальнейшего ведения больной. Одна из наиболее важ¬
ных причин неудач цитологического исследования — ошибки в технике получения
материала, вследствие чего до 30% результатов исследований становятся ложно-
отрицательными.Женщину необходимо информировать о значении и необходимости регулярных
цитологических исследований, условиях получения полноценного материала.
624 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ в ЛАБОРАТОРНОЙ ДИАГНОСТИКЕУСЛОВИЯ ПОЛУЧЕНИЯ ПОЛНОЦЕННОГО МАТЕРИАЛАРШМ чаще всего развивается в зоне трансформации, ему предшествует внутри*
эпителиальное поражение (дисплазия эпителия). Дисплазия эпителия может рас¬
полагаться на небольших участках, поэтому важно, чтобы материал был получен
со всей поверхности шейки матки, особенно из зоны трансформации. Количество
патологически измененных клеток в мазке бывает различным, если их мало, уве¬
личивается вероятность, что патологические изменения могут быть пропущены
при скрининге. Необходимые условия для эффективного цитологического иссле¬
дования следующие.• Мазки следует получать при первом обследовании женщин, приходящих к
гинекологу с какими-либо жалобами или при постановке на учет по поводу
беременности, у остальных — не реже чем раз в 3 года.• Желательно получать мазки не ранее чем на 5-е сутки менструального цикла
и не позднее чем за 5 сут до предполагаемого начала менструации.• Нельзя получать мазки в течение 48 ч после полового контакта, использова¬
ния любрикантов, раствора уксуса или Люголя, тампонов или спермицидов,
спринцевания, введения во влагалище медикаментов, свечей, кремов, в том
числе для выполнения ультразвукового исследования.• Беременность — не лучшее время для скрининга, так как возможны непра¬
вильные результаты, но если нет уверенности, что женщина придет на обсле¬
дование после родов, лучше мазки получить.• При симптомах острой инфекции желательно получать мазки в целях обсле¬
дования и выявления этиологического агента: после лечения, но не ранее чем
через 2 мес, необходим цитологический контроль.в направлении в лабораторию необходимо указать:• фамилию, имя, отчество, возраст женщины;• данные о менструальном цикле — дату начала менструального цикла, постме¬
нопаузу (сколько лет), беременность (сколько недель):• гинекологические клинические данные (выделения или кровотечение из
половых путей, гормональная терапия и др.);• предполагаемый диагноз;• дату получения материала, тип мазка (из экто- или эндоцервикса, эндоме¬
трия), проводимое лечение.Материал из щейки матки должен брать врач-гинеколог или хорошо обученная
медицинская сестра (акушерка).ИНСТРУМЕНТЫ ДЛЯ ПОЛУЧЕНИЯ МАТЕРИАЛА ИЗ ШЕЙКИ МАТКИС диагностической целью материал получают раздельно из эктоцервикса
(влагалищной порции шейки матки) и эндоцервикса (цервикального канала) с
помощью шпателя и специальной щетки (типа Cytobrush). При профилактическом
осмотре используют различные модификации шпателя Эйра и другие приспосо¬
бления. Лучшие результаты дает цитологическое исследование при использовании
специальных щеток типа Cervex-Brush, CYTOPREP, Papette и др. для получения
материала одновременно из влагалищной части шейки матки, зонь[ стыка (транс¬
формации) и цервикального канала (рис. 8-1).Перед получением материала шейку матки обнажают в зеркалах, дополнитель¬
ных манипуляций не проводят (шейку не смазывают, слизь не удаляют). Щетку
вводят в наружный зев шейки матки, осторожно направляя центральную часть
щетки по оси цервикального канала. Далее ее наконечник поворачивают на 360'"
(желательно 3-4 раза по часовой стрелке), достигая тем самым получения доста¬
точного количества клеток из эктоцервикса и зоны трансформации. Введение
инструмента выполняют очень осторожно, стараясь не повредить шейку матки.
Затем щетку выводят и материал распределяют на стекле.
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 625Рис. 8-1. Инструменты для получения материала
с шейки матки; а — шпатель Эйра для получения
материала с поверхности шейки матки; б, в —
щетка для получения материала из цервикаль¬
ного канала; г — получение материала с помо¬
щью щетки типа Cervex-Brush. Центральную часть
щетки вводят в цервикальный канал так, чтобы
боковые ворсины скользили по влагалищной части
шейки матки.Переносить образец на предметное стекло следует быстро, без подсушивания и
потери прилипших к инструменту слизи и клеток. Обязательно также следует пере¬
нести на стекло материал с обеих сторон шпателя или щетки. В случае приготовления
тонкослойного препарата с помощью метода жидкостной цитологии головку щетки
отсоединяют от ручки и помещают в контейнер со стабилизирующим раствором.
Важно, чтобы в мазок попадал материал из зоны трансформации, так как около 90%
опухолей исходит из зоны стыка плоского и цилиндрического эпителия и зоны транс¬
формации и только 10% — из цилиндрического эпителия цервикального канала.ПРИГОТОВЛЕНИЕ, ФИКСАЦИЯ МАЗКОВ, ЖИДКОСТНАЯ ЦИТОЛОГИЯ
Фиксация мазкаЕсли мазок окрашивают по Папаниколау, его необходимо фиксировать сразу
после получения (влажная фиксация). Фиксацию проводят специальными аэро¬
золями или фиксатором в капельной форме (его наносят на влажную поверхность
мазка) (рис. 8-2). Можно фиксировать мазок после получения, поместив его в
кювету с 96% раствором этанола на 10-20 мин. Затем его высушивают на воздухе.
Если мазок предполагают окрашивать по Романовскому (модификации Лейшмана,
Май-Грюнвальда-Гимзы, Паппенгейма), после получения его высушивают на воз¬
духе (сухая фиксация). Если предполагают окрашивание гематоксилин-эозином,
можно использовать как сухую, так и влажную фиксацию.Жидкостная цитологияОсновное отличие жидкостной цитологии от традиционного метода — мате¬
риал наносят не сразу на предметное стекло, а помещают во флакон со стабили-
626 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕЭктоцервикальнаяпробахЗВО”Эндоцервикальная
^ пробаОбозначение,
номерЭктоцервикальнаяпробаЭндоцервикальнаяпробахЗбО'КапельнаяФиксацияспреемРис. 8-2. Приготовление мазка. Материал
необходимо распределить по мазку тон¬
ким слоем (важно, чтобы он весь оказался
на стекле).зирующим раствором. Такой раствор сохраняет морфологические, иммуноцито-
химические и генетические свойства клеток. Можно сначала приготовить мазки
стандартным способом, а оставшийся на щетке (шпателе) материал поместить в
стабилизирующий раствор.Цитологические особенности эпителиальных клеток шейки маткиКлеточный состав мазков представлен слущенными клетками, находящимися
на поверхности эпителиального пласта. При адекватном получении материала с
поверхности слизистой оболочки шейки матки и из цервикального канала в мазок
попадают клетки влагалищной порции шейки матки (многослойный плоский
неороговевающий эпителий), зоны сть[ка или трансформации (цилиндрический
и, при плоскоклеточной метаплазии, метаплазированный эпителий) и клетки цер¬
викального канала (цилиндрический эпителий). Условно клетки многослойного
плоского неороговевающего эпителия принято делить на четыре типа: поверх¬
ностные, промежуточные, парабазальные, базальные. Чем лучше выражена спо¬
собность эпителия к созреванию, тем более зрелые клетки попадают в мазок. При
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 627атрофических изменениях на поверхности эпителиального пласта расположены
менее зрелые клетки.МОРФОЛОГИЧЕСКИЕ КЛАССИФИКАЦИИ ЗАБОЛЕВАНИЙ ШЕЙКИ МАТКИЦитологические термины обычно основаны на гистологических классифика¬
циях. Однако во многих странах для формулировки результатов цитологического
исследования используют классификацию Папаниколау, отличающуюся от гисто¬
логической. Согласно этой классификации изменения в шейке матки разделяют на
пять классов: I — норма, II — доброкачественная атипия, III — дисплазия эпителия,IV — carcinoma in situ (предположение о раке), V — рак.Часто используют цитологическую классификацию, основанную на гистологи¬
ческой (WHO histological classification of tumours of the uterine cervix', Lyon, 2003), в
которой вместо термина «дисплазия эпителия» применяют понятие CIN {Cervical
Intraepithelial Neoplasia):• CIN I — соответствует слабовыраженной дисплазии эпителия (дисплазии I);• CIN II — соответствует умеренной дисплазии эпителия (дисплазии II);• CIN III — объединяет резко выраженную дисплазию эпителия (диспла¬
зию III) и внутриэпителиальный рак {carcinoma in situ).Наиболее распространенная в настоящее время — Вейе5(/я-классификация,
разработанная в США в 1988 г. {The Bethesda System — TBS), в которую вносили
несколько изменений (блок 8-1). TBS создана для более эффективной передачи
информации из лаборатории врачам клинических специальностей и обеспечения
стандартизации лечения диагностированных нарушений, а также последующего
наблюдения за больными. Основные разделы включают поражение плоского и
железистого эпителия. Оценивают качество мазка. Изменения делят на доброка¬
чественные, неясного генеза, предопухолевые и опухоли.Блок 8-1.8е№е5гіа-классификация заболеваний шейки маткиОценка качества мазка;материал полноценный;материал недостаточно полноценные;неудовлетворительный для оценки;удовлетворигельный для оценки, но ограниченный чем-то (определить причину).в пределах нормы.Метаплазия (норма).Доброкачественные изменения клеток;инфекции:Trichomonas vaginalis]грибы, морфологически сходные с родом Candida]кокки,гонококки;преобладание коккобациллярной флоры;бактерии, морфологически сходные с Actinomyces.Прочее.Клеточные изменения, связанные с вирусом Herpes simplex.Реактивные изменения;воспалительные (включая репаративные);атрофия с воспалением (атрофический вагинит);лучевые;связанные с использованием внутриматочных контрацептивов.
ш.ш628ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕОкончание блока 8~1Патологические изменения плоского эпителия:клетки плоского эпителия сатипией неясного значения (Atypical Squamous Cells of Undetermined
Significance — ASCUS)*;клетки плоского эпителия с тяжелой атипивй неясного значения, не исключающие H-SiL (Atypical
Squamous Cells of Undetermined Significance — ASC-H);изменения плоского эпителий (не опухолевые, но требующие динамического наблюдения);интраэпителиальное поражение плоского эпителия слабовыраженной степени (Low Grade Squamous
Intraepithelial Lesion — iS\i) — папипломавирусная инфекция (HPV), слабая дисплазия эпителия (GIN I)**;интраэпитблиальное поражение плоского эпителия выраженной степени (High grade Squamous
Intraepithelial Lesion — HSIL) — умеренная, тяжелая дисплазия эпителия и внутризпителиальный рак
(CIN II, CIN III и carcinoma in situ)***.Инвазивный рак;плоскоклеточный рак.Атипичные клетки железистого эпителия (возможные предположения):неясного значения (Atypical Glandular Cells of Undetermined Significance — AGUS);предположительно опухоль:аденокарцинома in situ (AIS) эндоцервикса;аденокарцинома;клетки эндометрия, цитологически доброкачественные (у женщины в менопаузе и др.);аденокарцинома эндометрия;аденокарцинома другой локализации;аденокарцинома без дополнительной характеристики.Другие злокачественные опухоли (по возможности определить нозологическую форму).Оценка гормонального статуса' * * **При возможности ASCUS долшгы быть определены как сходные с реактивными, репаративными
или предраковыми поражениями.**Изменеиия, связанные с папилломавирусом, ранее обозначаемые как койлоцитоз, койлоци-
тарная атипия, кондиломатозная атипия, включены в категорию слабовыраженных изменений
клеток плоского эиителия.***110 возможности след>'ет отметить, относятся ли изменения к CINII, CINIII или carcinoma in situ.****Гормональную оценку проводят только но влагалищным мазкам.Оценка качества мазка• Материал полноценный (адекватный) — мазок хорошего качества, содержа¬
щий клетки плоского эпителия, эндоцервикса и/или метаплазированные.• Материал недостаточно полноценный — такое заключение дают, когда в
материале клеточный состав скудный, отсутствуют клетки эндоцервикса
и/или метаплазированные.• Материал неполноценный, по которому нельзя судить о наличии или отсут¬
ствии патологических изменений шейки матки.Причины получения неполноценного материала различны, желательно пере¬
числить клетки мазка и по возможности указать причину, по которой материал
признан неполноценным.Возможные причины получения неполноценного материала:• женщина должным образом не подготовлена к исследованию;• мазки получены во время менструации и представлены большим количе¬
ством клеток эндометрия, крови;• в препарате видны сперматозоиды;• загрязнение мазка спермицидными и антибактериальными кремами, смаз¬
кой презервативов, гелем для ультразвукового исследования;
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ Б29• многочисленные зерна талька — до забора цитологического материала про¬
ведено мануальное исследование;• не соблюдены условия получения материала;• шейка плохо выведена в зеркалах и не получен материал из зоны трансфор¬
мации и цервикального канала;• получено скудное количество материала вследствие недостаточного усилия
при надавливании на слизистую оболочку при получении материала;• в препарате большое количество элементов крови вследствие чрезмерного
усилия при заборе материала;• мазки представлены преимущественно элементами крови и/или воспаления;• небрежность при выполнении различных этапов приготовления мазка —
слишком тонкий или слишком толстый мазок, материал неравномерно рас¬
пределен на стекле, высушивание на воздухе мазков, предназначенных для
влажной фиксации, плохое их окрашивание.ИНТЕРПРЕТАЦИЯ ИССЛЕДОВАНИЯНегативный результат в отношении интраэпителиального поражения или зло¬
качественности. Доброкачественные, реактивные изменения клеток эпителия.Несколько противоречивы сведения о возможностях дифференциальной цито¬
логической диагностики поражений эпителия реактивными состояниями с опу¬
холями. в связи с этими в классификации Bethesda введен термин «ASCUS» —
Atypical Squamous Cells of Undetermined Significance (клетки плоского эпителия с
атипией неясного значения). Термин обозначает клеточные изменения, трактовка
которых затруднена. Этот диагноз нацеливает лечащего врача на необходимость
обследования и/или динамического наблюдения больной. Практически во всех
современных руководствах по ведению больных с поражениями шейки матки эта
диагностическая категория имеется, определена тактика обследования и наблюде¬
ния за ними.ПАТОЛОГИЧЕСКИЕ (ПРЕДОПУХОЛЕВЫЕ) ИЗМЕНЕНИЯ ПЛОСКОГО ЭПИТЕЛИЯВ классификации Bethesda выделяют плоскоклеточные интраэпителиальные
поражения низкой и высокой степени выраженности {Squa7nous Intraepithelial
Lesions Low and High grade — LSIL и HSIL). Плоскоклеточные интраэпителиальные
поражения низкой степени включают изменения, связанные с папиллома вирусной
инфекцией и слабой дисплазией эпителия (CIN I), высокой степени — умеренную
дисплазию эпителия (CIN II), тяжелую дисплазию эпителия и внутриэпителиаль-
ный рак (carcinoma in situ) (CIN III).Инвазивный рак (плоскоклеточный рак)Группы экспертов воз предложили алгоритмы ведения больных с результатами
цитологического исследования, в которых определены патологические изменения.
Они базируются на трех диагностических методах; кольпоскопическом, цитологи¬
ческом и тестировании на ВПЧ.В настоящее время нет сомнения в роли ВПЧ как основного этиологического
фактора в возникновении и развитии РШМ. Прогрессирование опухолевого про¬
цесса в шейке связано с типом вируса. В зависимости от выраженности трансфор¬
мирующего потенциала ВПЧ подразделяют на две группы: низкого и высокого
онкогенного риска. Инфекция, вызванная ВПЧ низкого онкогенного риска, обыч¬
но протекает доброкачественно. Выздоровление наступает в течение 12-18 мес.
ВПЧ 16-го типа — наиболее распространенный тип вирусов высокого риска,
выявляется более чем в половине случаев РШМ, Четыре типа ВПЧ (18, 31, 33, 45)
обнаруживают более чем в 85% наблюдений этого заболевания.Максимальную распространенность ВПЧ-инфекции у женщин отмечают в
возрасте 15-30 лет, показатели достигают 20-30% и более. Достаточно высокий
630 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ в ЛАБОРАТОРНОЙ ДИАГНОСТИКЕудельный вес инфицированных пациентов наблюдают в подростковом возрасте,
тогда как наиболее низкий — среди пациентов старше 65 лет. Самопроизвольное
излечение от ВПЧ происходит часто, в молодом возрасте достигает 90%.Мишень для воздействия онкогенных ТИПОВ ВПЧ — зона трансформации, где
развиваются предраковые изменения шейки матки (репликация и развитие вируса
продолжаются по мере созревания эпителиальных клеток и продвижения их к
поверхности эпителиального пласта). Весь процесс обычно занимает 10-40 лет, но
в редїсих случаях может происходить за 1-2 года. Классическое клиническое про¬
явление HPV-инфекции — кондиломы, которые могут располагаться как на шейке
матки, так и на слизистой оболочке влагалища, вульвы. Инфекция может иметь
латентную (без клинических, цитологических и гистологических проявлений),
субклиническ>то форму (слабовыраженные гистологические и/или цитологические
признаки без клинических проявлений). При бессимптомной форме инфекции
происходит только репликация вируса в клетке. В большинстве наблюдений при
такой «транзиторной» форме инфекции вирус исчезает в течение нескольких меся¬
цев, возможно, вследствие хорошего иммунного ответа. Бессимптомные формы
папилломавирусной инфекции можно определить только с помощью молекуляр¬
ных методов, таких как ГТЦР, метод захвата гибридов (Hybrid Capture — НС II) и др.
Данные о целесообразности ВПЧ-тестирования весьма противоречивы.• Чувствительность ВПЧ-тестирования (88-100%) значительно превышает
чувствительность цитологического исследования (68-86%).• Специфичность ВПЧ-тестирования (68-97%) лишь немного уступает специ¬
фичности цитологического метода (78-99%).• ВПЧ-тест может бьггь отрицательным при тяжелой дисплазии эпителия и
раке.• Чувствительность и прогностическая значимость отрицательного теста на
ВПЧ в сочетании с отрицательным результатом цитологического теста при¬
ближаются к 100%.Тест на ВПЧ не включен в скрининговые программы, так как имеет низкую
прогностическую значимость, особенно у молодых женщин (до 30 лет), у боль¬
шинства пациенток этой возрастной группы ВПЧ-инфекция транзиторного харак¬
тера. На основании результатов многих крупных международных исследований
сформулированы рекомендации по применению теста на ВПЧ в скрининге рака
шейки матки:• в первичном скрининге у женщин старше 30 лет в сочетании с цитологиче¬
ским исследованием или в качестве самостоятельного теста (в странах, где
плохо организованы программы цервикального цитологического скринин¬
га);• при ведении пациенток с ASCUS;• для мониторинга лечения выраженных поражений шейки матки — CIN 11+
(т.е, CIN III, carcinoma in situ, инвазивный рак).Разработан алгоритм обследования женщин в зависимости от выявленных
патологических изменений (методические указания «Профилактика рака шейки
матки», 2007) (рис. 8-3-8-6).Цитологический диагноз рака — показание к углубленному обследованию с
обязательным гистологическим подтверждением диагноза для проведения адек¬
ватного лечения. Если при гистологическом исследовании получен отрицательный
результат, цитологический диагноз не может быть отвергнз'^т без изучения послой¬
ных срезов, глубокого анализа, повторного изучения цитологических препаратов.
При цитологическом диагнозе аденокарциномы следует помнить о возможности
попадания в мазок клеток рака эндометрия, маточной трубы, яичника. При отри¬
цательных данных гистологического исследования следует также исключить рак
этих локализаций.
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 631Негативная
' гПовторить цитологию
через 4-6 мес “*1 гНегативная>ASC>ASC-ВПЧ позитивный ВПЧ негативный(типы высокого риска) (типы высокого риска)7Нет CIN/РакаCIN/РакТактика при CIN
в биоптатеОбычный g|-|L| негативный ВПЧ позитивный
скрининг неизвестный (типы высокого риска)пПовторить
цитологию
через 12 мес> ASC ^ Повторить
или ВПЧ(+) цитологиюучНегативныеОбычный►скринингРис. 8-3. Тактика ведения пациенток с ASCUS (клетками плоского эпителия с атипией неясного
значения).CIN(любой степени)Тактика при CIN
в биоптатеПоражение
не обнаруженодиагнозаЦитологиячерез 6 и 12 мес
илиВПЧ ДНК*тестчерез 12 месРис. 8-4. Тактика ведения пациенток с ASC-H (клетками плоского эпителия с тяжелой атипией
неясного значения).
632 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ в ЛАБОРАТОРНОЙ ДИАГНОСТИКЕCIN/Рака
не обнаружены/2:ASC или ВПЧ(+) НегативныеУПовторнаякольпоскопияОбычныйскринингCIN/Рак\Тактика при CIN
в биолтате1 Зона трансформации и края
поражения не визуализируются
или визуализируются не полностью.Рис. 8-5. Тактика ведения пациенток с LSIL (слабовыраженным интраэпителиальным поражением
плоского эпителия).Удовлетворительнаякольпоскопия/ \CIN II, III C1N отсутствует
или только CIN IТактика при C№i tt, HI
вбиоптате>-«Если видишь — лечи»Неудовлетворительнаякольпоскопия^Ревизия материала
/ \■' Зона трансформации и края
поражения не визуализируются
или визуализируются не полностью.Без измененийДиагностическаяэксцизияИзменениедиагнозаРис. 8-6. Тактика ведения пациенток с HSIL (выраженным интраэпителиальным поражением
плоского эпителия).
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 633Цитологическая диагностика при заболеваниях тела маткиПОКАЗАНИЯ К ПРИМЕНЕНИЮПри поражениях эндометрия цитологический метод применяют в целях:• цитологического скрининга рака тела матки в группах риска;• дифференциальной цитологической диагностики;• наблюдения за больными после лечения в целях диагностики рецидивов иметастазов опухоли.Одним из наиболее значимых этиологических факторов развития рака эндоме¬
трия, наряду с генетическими факторами, служит длительная стимуляция эндо¬
метрия эстрогенами на протяжении жизни женщины (раннее менархе и поздняя
менопауза). Основные состояния, при которых пациенток относят к группе риска
по раку эндометрия, следующие.• Синдром Штейна-Левенталя (склерокистозные яичники).• Факторы риска и их сочетания у женщин 45 лет и старше:-0^ гиперпластические процессы эндометрия в прошлом;о- миома матки;
эндометриоз;❖ поздняя менопауза (после 50 лет);❖ эстрогенный тип кольпоцитологической реакции в постменопаузе;
сахарный диабет, ожирение, гипертоническая болезнь;
отягощенная наследственность по раку репродуктивных органов;❖ рак молочной железы.Цитологическое исследование материала, полученного из полости матки, у
женщин из групп риска (с периодичностью 1 раз в 5 лет) способствует диагно¬
стике ранних форм рака эндометрия, в некоторых случаях за 10 лет до появления
клинических симптомов заболевания. При обследовании больных с предположи¬
тельным диагнозом «рак эндометрия» цитологическое исследование способствует
дифференциальной диагностике и верификации опухолевого процесса, а после
лечения его используют для диагностики рецидивов и метастазов опухоли.МЕТОДЫ ПОЛУЧЕНИЯ МАТЕРИАЛАМатериал лучше получать или в пролиферативной фазе (на 6-9-е сутки мен¬
струального цикла), или секреторной — не позднее чем за 5 qt до предполагаемой
менструации. Не рекомендуют брать материал перед менструацией и во время
нее, так как дегенеративные изменения в клетках могут быгь причиной ошибоч¬
ного цитологического диагноза. Предложены различные инструменты и способы
получения материала из полости матки. Их можно разделить на три группы: аспи¬
рацию содержимого полости матки, смывы физиологическим раствором, соскобы
слизистой оболочки полости матки (браш-биопсию). Наиболее распространенный
и простой способ — получение аспирата из полости матки с помощью шприца
емкостью 20 мл и канюли от шприца Брауна. Введенную в полость матки канюлю
продвигают до маточного дна и трубных углов, где чаще всего возникают очаги
гиперплазии и рака. Постепенно, оттягивая поршень шприца и медленно пово¬
рачивая наконечник канюли, получают материал так, чтобы отверстие на конце
канюли соприкасалось со слизистой оболочкой различных отделов полости матки.
Перед извлечением канюли оттягавание поршня прекращают, чтобы предот¬
вратить попадание клеток из шейки матки и влагалища в содержимое шприца.
Аспирированный материал выдавливают поршнем шприца на 2-4 предметных
стекла и распределяют по их поверхности тонким слоем.Другой распространенный в некоторых странах способ — использование устрой¬
ства «Эндопап», представляющее собой пластмассовый стержень с тонким концом,
на котором расположены шесть углублений — по три с двух сторон. Тонкий конец
634 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ в ЛАБОРАТОРНОЙ ДИАГНОСТИКЕЭТОГО одноразового стерильного стержня вводят в полость матки и им собирают
материал со всех ее стенок. После извлечения стержня материал из его углублений
наносят тонким слоем на предметные стекла. Сразу после высыхания мазки фик¬
сируют 96% раствором этилового спирта в течение 15-20 мин. Предпочтительнее
окрашивание мазков эндометриальных аспиратов гематоксилином Майера и
эозином. При этой окраске хорошо дифференцировать ядро и цитоплазму изо¬
лированных клеток и в составе групп, плотных клеточных комплексов и тканевых
фрагментов. Можно использовать окрашивание по Папаниколау или различные
модификации метода Романовского.В направлении на цитологическое исследование должны бьіть полная инфор¬
мация о гинекологическом статусе женщины (репродуктивном или постменопау¬
зальном периоде, характеристике менструального цикла, дата начала и окончания
последней менструации), сведения о проводившихся процедурах (выскабливании,
гормональном лечении и др.).ЦИТОЛОГИЧЕСКИЕ ОСОБЕННОСТИ КЛЕТОК ЭНДОМЕТРИЯ
Цитологические особенности эндометрия 8 норме и при гиперпластических
процессахПри оценке цитологической картины прежде всего необходимо определить
информативность цитологического материала. Неинформативным считают мате¬
риал, если в мазках обнаруживают лишь элементы крови или преобладают клетки
многослойного плоского эпителия шейки матки и влагалища, эндоцервикального
эпителия, а клеток эндометрия мало или они отсутствуют.Строение эндометрия и его цитоморфологические особенности изменяются в
соответствии с фазами овариа/^ьно-менструального цикла, а также с периодами
жизни женщины, в пролиферативной фазе цикла клетки эпителия эндометрия рас¬
положены в мазках в виде групп, пластов, железистых трубочек и тканевых фраг¬
ментов, состоящих из участков эпителия и клеточной стромы. Расположенные в
виде пластов эпителиальные клетки имеют однородные округлые ядра, структура
хроматина мелкозернистая. Цитоплазма слабобазофильная, границы ее в пластах
плохоразличимы. Клетки стромы эндометрия расположены более рыхло, разроз¬
ненно или в виде скоплений, В богатых клетками участках стромы нередко видна
разветвленная сеть капилляров.В секреторной фазе цикла в мазках наряду с пластами клеток эндометрия проли-
феративного типа видны пласты и скопления эпителиальных клеток с признаками
секреции. В ранней секреторной фазе цикла (13-15-е сутки) в образующих пласты
клетках видны четкие крупные околоядерные вакуоли. В более поздних периодах
секреторной фазы эпителиальные клетки расположены в пластах более рыхло, чем
клетки эндометрия пролиферативного типа, имеют более крупные ядра. Структура
хроматина мелкозернистая или мелкоглыбчатая, цитоплазма обильная, слабоба¬
зофильная или слабоэозинофильная, мелкозернистая.При получении аспирата из эндометрия в фазе менструации в мазках видны
элементы крови, пласты и участки отторгающегося эндометриального эпителия
с дистрофическими и некробиотическими изменениями. Эпителиальные клетки
в пластах расположены компактно, кое-где инфильтрированы лейкоцитами. Ядра
клеток различной величины и формы, окрашиваются неоднородно, цитоплазма
скудная, базофильная. Часто отмечают наличие множественных мелких вакуолей
в ядре и цитоплазме. Наличие в мазках пластов и участков эндометрия с выражен¬
ными дистрофическими и некробиотическими изменениями, полиморфизмом и
неоднородной окраской клеток эпителия может быть причиной ошибочного цито¬
логического диагноза рака. Именно поэтому следует избегать получения материа¬
ла для цитологического исследования во время менструации.
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ $35Иногда аспират из полости матки получают при клинически нераспознан¬
ной беременности, чаще всего у женщин старше 40 лет с ошибочным диагнозом
фибромиомы матки. В мазках при этом видны элементы плодного яйца, главным
образом элементы хориона. Клетки цитотрофобласта крупные, округлой формы,
с большими светлыми ядрами и обильной цитоплазмой, элементы синцитиотро-
фобласта представлены сплошной протопла.^матической массой с большим коли¬
чеством ядер. Ворсинки хориона имеют округлую или удлиненную колбовидную
форму с ядрами, окаймляющими ворсинку в виде ободка.В постменопаузе, когда прекращается циклическая деятельность яичников,
цитологическая картина в мазках эндометрия может быть различной. Наряду с
пластами эпителиальных клеток эндометрия пролиферативного и секреторного
типа видны пласты клеток индифферентного маточного эпителия: клетки мелкие,
однородные, расположены компактно, имеют мелкие, округлые, иногда сморщен¬
ные интенсивно окрашенные ядра с однородной структурой хроматина и скудную,
нередко плохоразличимую цитоплазму. При значительном снижении гормональ¬
ной стимуляции у женщин, особенно находящихся в глубокой менопаузе, раз¬
вивается атрофия эндометрия, которая может сопровождаться кровоизлияниями
и кровотечениями из-за истончения эндометрия и ломкости капилляров, в этих
случаях мазки обычно скудные, содержат элементы крови, слизи, могут быть
видны скопления гистиоцитов и гигантские многоядерные клетки инородных тел.
На этом фоне в небольшом количестве видны группы и пласты клеток индиффе¬
рентного маточного эпителия.Эндометрий активно реагирует на различные травматические воздействия. Если
получению аспирата предшествовало диагностическое выскабливание полости
матки или длительное массивное ациклическое кровотечение, в мазках обнаружи¬
вают признаки восстановления (регенерации) эпителия. Видны пласты эндоме¬
триальных клеток округлой или удлиненной формы с крупными полиморфными
или гиперхромными ядрами. Цитоплазма светлая, кажется распластанной. Такие
клетки расположены в виде отдельных пластов, ориентированных в одном или
нескольких направлениях участков по краям пластов нормального эндометри¬
ального эпителия. Местами пласты таких атипических клеток трудно отличить от
комплексов клеток железистого рака.Железистая гиперплазия эндометрия — довольно распространенное заболева¬
ние, как правило, обусловленное состоянием ановуляции, сопровождаемое нару¬
шениями менструального цикла и ациклическими кровотечениями. Аспират из
полости матки при железистой гиперплазии обычно бывает обильным, в мазках
находят элементы пролиферирующей стромы, пласты клеток эндометрия про¬
лиферативного типа, видны тканевые фрагменты, состоящие из эпителиальных и
стромальных клеток, железистые трубочки значительной протяженности, кое-где
с расширенным просветом, железисто-альвеолярные и сосочковые структуры.
На основании приведенных цитоморфологических особенностей предполагают
железистую гиперплазию, если они видны у женщин в постменопаузе, а также во
второй половине цикла при отсутствии в эпителиальных клетках секреторных
изменений.Цитология эндометрия при предраке и начальном ракек предраку эндометрия относят атипическую гиперплазию, которую можно
разделить на преимущественно структурную (аденоматозную) гиперплазию и кле¬
точную, которую иногда называют дисплазией эндометрия. Цитологическая кар¬
тина при структурной атипической гиперплазии в большинстве случаев не имеет
характерных особенностей и мало отличается от таковой при простой железистой
гиперплазии. При клеточной атипической гиперплазии в мазках наряду с пласта¬
ми и участками неизмененного и гиперплазированного эндометрия видны группы
636 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕИ пласты эпителиальных клеток с признаками атипии. Ядра таких клеток сравни¬
тельно крупные, умеренно полиморфные, преимущественно бледноокрашенные, с
гомогенным тонкодисперсным хроматином. Цитоплазма относительно обильная,
светлая, контуры ее нечеткие, сливаются с фоном. Среди этих клеток встречаются
клетки с более компактными, интенсивно окрашенными ядрами.Атипия клеток более вьЕражена при начальном (внутриэндометриальном)
раке, чем при атипической гиперплазии эндометрия. В клетках опухоли отмеча¬
ют увеличение ядерно-цитоплазматического соотношения, более интенсивное
окрашивание ядерного хроматина и выраженный ядерный и клеточный поли¬
морфизм. Клетки опухоли расположены в виде групп и пластов, сосочко- или
железистоподобных структур, а также комплексов с наслоением клеток друг на
друга.Цитологический диагноз атипической гиперплазии и начального рака эндоме¬
трия может быть высказан лишь в предположительной форме. Задача цитологиче¬
ского исследования — обнаружение этих заболеваний, а окончательный диагноз в
большинстве случаев может быть установлен лишь при гистологическом исследо¬
вании операционного материала.Цитологическая диагностика злокачественных новообразований тела маткиНаиболее распространенная гистологическая форма рака тела матки — желези¬
стый рак, или аденокарцинома (около 60-65% всех наблюдений). В зависимости
от уровня дифференцировки выделяют высоко-, умеренно и низкодифференциро¬
ванную аденокарциному.Клетки высокодифференцированной аденокарциномы довольно однороднь[е,
ядра сравнительно небольших размеров, округлой или продолговатой формы, хро¬
матин мелкозернистый или мелкоглыбчатый. в мазках аспиратов из полости матки
клетки опухоли расположены в виде мелких и крупных железисто-альвеолярных
комплексов или сосочков, гроздевидных структур, признаки злокачественности в
них выражены нерезко. Иногда это создает значительные трудности при их диф-
ференцировке от клеток гиперплазированного или даже неизмененного эндоме¬
триального эпителия и может быть причиной ложноотрицательных результатов
в отношении рака.В случаях умеренно и низкодифференцированной аденокарциномы цитоло¬
гические признаки злокачественности выражены в полной мере, в этих случаях
обычно не возникает трудностей в правильной оценке цитологических картин.Аденоакантома составляет около 20-25% рака эндометрия. При этой форме
опухоли в мазке наряду с элементами железистого рака встречают группы и пла¬
сты клеток, имеющих сходство с клетками многослойного плоского эпителия, рас¬
положенными по периферии железистоподобных комплексов.при железисто-плоскоклеточном раке (10% рака эндометрия) в мазке видны
комплексы клеток как железистого, так и плоскоклеточного (чаще неороговеваю-
щего) рака. При цитологическом исследовании правильно распознать эту форму
рака трудно.Плоскоклеточный рак эндометрия встречают крайне редко. Он имеет такие же
гистологические и цитологические особенности, как плоскоклеточный РШМ.Редкая форма рака эндометрия (4%) - светлоклеточная (мезонефрогенная)
аденокарцинома. В мазках при этой форме встречают группы, пласты и сосочковые
образования из клеток опухоли со светлой, резко вакуолизированной, оптически
пустой цитоплазмой; во многих клетках видны эксцентрически расположенные,
оттесненные к периферии ядра. Другие гистологические формы рака эндометрия
(серозную, муцинозную аденокарциному) встречают крайне редко.Цитологический метод исследования редко используют для диагностики хори-
онкарциномы матки, так как у таких больных обычно обильные кровянистые
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ $37выделения из половых путей, затрудняющие получение адекватного цитологиче¬
ского материала. В этих случаях диагностика основана на тестировании хориони- Щ:
ческого гонадотропина человека.Неэпителиальные опухоли (саркомы) матки составляют около 3% злокаче-
ственных новообразований матки. Наиболее часто встречают лейомиосаркому
и смешанную мюллеровскую опухоль, значительно реже — эндометриальную
строма льну ю и ботриоидную саркому. Цитологическая диагностика сарком матки
возможна при прорастании опухоли в слизистую оболочку полости матки, клетки
опухоли обнаруживают в аспирате эндометрия.Цитологическая диагностика заболеваний молочной железыВ структуре онкологической заболеваемости и смертности женского населения
России рак молочной железы прочно занимает первое место, Улучшение каче¬
ства ранней диагностики — единственный реальный способ успешного снижения
смертности от рака (чем раньше диагностируют опухоль, тем дольше продолжи¬
тельность жизни женщины). Цитологический диагноз может оказаться решаю¬
щим при планировании объема операции и дооперационного лучевого и химио¬
терапевтического воздействия, поэтому цитологическое исследование широко
используют в диагностике заболеваний молочной железы.ВОЗМОЖНОСТИ и ОГРАНИЧЕНИЯ ЦИТОЛОГИЧЕСКОЙ ДИАГНОСТИКИ ПОРАЖЕНИЙ
МОЛОЧНОЙ ЖЕЛЕЗЫАПТИ позволяет:• быстро определять наличие опухоли, гиперпластического и воспалительного
процесса, диагностировать некоторые доброкачественные состояния с необ¬
ходимостью операции, а также поражения, не требующие хирургического
вмешательства;• дифференцировать опухоль, ее распространение;• при установлении уверенного цитологического диагноза рака до операции —
планировать объем хирургического вмешательства, выполнять его без затрат
времени на срочное гистологическое исследование, при необходимости
проводить дооперационное лечение, отказаться от эксцизионной биопсии у
пожилых пациенток при планировании нехирургических методов лечения
рака;• контролировать эффективность лечения, в том числе определять выражен¬
ность лечебного патоморфоза;• подтверждать (исключать) рецидив рака;• устанавливать необходимость использования других диагностических
тестов.Ограничения цитологической диагностики• Неминуемо определенное количество ложноотрицательных результатов, свя¬
занных с получением неполноценного или некачественного материала (попа¬
дание в иглу жира и фиброзной ткани, получение материала из участков без
опухоли, дефекты приготовления, фиксации и окрашивания мазков), низкой
квалификацией цитопатолога.• Риск ложноотрицательных и ложноположительных результатов, обуслов¬
ленных объективными сложностями дифференциальной диагностики;доброкачественных неопухолевых поражений и опухолей;❖ доброкачественных и злокачественных опухолей;❖ дисплазии эпителия, внутриэпителиального и инвазивного рака;
листовидной опухоли (доброкачественной, пограничной, злокачествен¬
ной).
638 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ в ЛАБОРАТОРНОЙ ДИАГНОСТИКЕПОЛУЧЕНИЕ И ОБРАБОТКА МАТЕРИАЛА ДЛЯ ЦИТОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯМатериалами для цитологического исследования могут быть:• пункционный (АПТИ);• отпечатки материала биопсии столбика ткани (core biopsy);• соскоб ткани молочной железы (или опухоли), удаленной во время опера¬
ции;• отделяемое из молочной железы — выделения из соска (метод малоэффекти¬
вен для диагностики злокачественных новообразований молочной железы,
за исключением внутрипротокового рака);• материал, полученный с эрозивных поверхностей.Для установления цитологического диагноза важно получение полноценного
материала не из окружающих тканей, а из очага поражения. Трудности возникают
при выраженном фиброзе, кистозных изменениях; в таких случаях необходимо
получить материал из разных участков опухоли, из стенок кисты, при некрозе — из
периферии опухоли.Пункционный материалОпухоль при пальпации кажется расположенной более поверхностно, чем на
самом деле, поэтому угол направления иглы при аспирационной пункции не дол¬
жен быть перпендикулярен к ребрам, что особенно важно при маленькой молочной
железе (опухоль находится близко к грудной стенке и игла может попасть в ребро).
Если игла попадает в ребро, в мазках обнаруживают элементы костномозгового
кроветворения (мегакариоциты, миелоциты, бластные клетки, эритробласты и
др.). При небольшом подкожном узле можно несколько наклонить иглу, при этом
опухоль на игле сместится, что ощущается пальцами и подтверждает правильное
ее положение.Биопсийный материалЦитологические препараты можно делать из материала, полученного при биоп¬
сии (столбика ткани). Отпечатки выполняют с помощью аккуратного перемеще¬
ния биоптата иглой по стеклу, при этом нельзя травмировать биопсированный
кусочек.Операционный материалРазрез уплотнения, опухоли или лимфатического узла делают сухим скальпе¬
лем во избежание разрушения клеток водой.Операционный материал получают с помощью соскоба острым лезвием с
поверхности разреза удаленной опухоли или другого участка ткани.Если консистенция ткани мягкая, делают отпечаток, прикладывая предметное
стекло к поверхности разреза пораженного участка.Отделяемое из молочной железыДля приготовления препарата каплю отделяемого из молочной железы наносят
на предметное стекло в виде мазка.Если отделяемого мало, для получения мазков необходимо сцеживающими
движениями, надавливая большим и указательным пальцами в области околосо-
сковой зоны, получить более обильные капли выделений из соска.Мазок-отпечаток эрозированной поверхностиК месту поражения прикладывают предметное стекло, на котором остается
некоторое количество клеточных элементов и отделяемого. Материал можно
брать также с помощью ватного тампона и наносить на предметное стекло в виде
отпечатков.
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 639ЦИТОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯЦитологическая классификация поражений молочной железы основана на гисто¬
логической. По цитологаческим препаратам ограничено точное определение многих
нозологических форм поражения: разновидностей гиперпластических процессов,
дифференциальной диагностики фиброаденомы и доброкачественных неопухоле¬
вых поражений, дисплазий, некоторых форм рака, сгепени дифференцировки.
Цитологическая классификация опухолей и неопухолевых заболеваний молоч¬
ной железы предложена Московским научно-исследовательским онкологическим
институтом им. П,А. Герцена (1997).I. Доброкачественные дисгормонально-гиперпластические процессы — масто¬
патии.• Пролиферативно-диспластические процессы в протоковом и железистом
эпителии молочной железы:❖ мастопатии с пролиферацией эпителия;<0- мастопатии с пролиферацией эпителия по типу умеренной дисплазии (Дз);
мастопатии с пролиферацией эпителия по типу тяжелой дисплазии (Д^).• Пролиферативные изменения в эпителии выстилки кист:❖ киста с простой пролиферацией эпителия выстилки;
о киста с апокринизацией эпителия;^ киста с образованием папиллярных структур (папиллярная киста).II. Эпителиальные опухоли.• Доброкачественные.Внутрипротоковая папиллома.Аденома соска:- с простой пролиферацией эпителия;- пролиферацией эпителия по типу умеренной дисплазии (Д^);' пролиферацией эпителия по типу тяжелой дисплазии (Д3),❖ Аденома железы.• Злокачественные.❖ Рак (с учетом степени дифференцировки клеток паренхимы);- с низкой дифференцировкой клеток паренхимы;- умеренной дифференцировкой клеток паренхимы;- высокой дифференцировкой клеток паренхимы.❖ Дольковый рак.Слизистый рак:- с внеклеточной слизью (коллоидный);' из слизепродуцирующих клеток (перстневидный).Медуллярный рак.«> Папиллярный рак.❖ Скиррозный рак из мелких клеток.Аденокистозный рак,Апокринный рак.❖ Плоскоклеточный рак.III. Смешанные эпителиально-соединительнотканные опухоли.• Фиброаденома;❖ с простой пролиферацией эпителия;<!- пролиферацией эпителия по типу умеренной дисплазии (Д^);❖ пролиферацией эпителия по типу тяжелой дисплазии (ДЗ);^ выраженным стромальным компонентом.• Листовидная опухоль;❖ с полиморфной клеточной стромой;❖ предсаркоматозной стромой;
саркоматозной стромой.
640ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕIV. Злокачественные опухоли неэпителиальных тканей — саркомы различного
гистогенеза.V. Метастазы злокачественных опухолей в молочной железе.VI. Воспалительные процессы.* Неспецифические:❖ острые;<)> продуктивные, в частности гранулематозные (липогранулема);
плазмоклеточный мастит.• Специфические;туберкулезный мастит;❖ актиномикоз.Уверенность в цитологическом диагнозе зависит в первую очередь от качества
и количества полученного материала, а также от степени выраженности при¬
знаков доброкачественности или злокачественности патологического процесса.
Описательный ответ или заключение о неполноценном материале — показания к
повторной пункции.ИММУНОЦИТОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯВ последнее время для уточнения характера патологического процесса и
определения тактики ведения больных широко применяют иммуноцитохими-
ческие методы исследования. В список маркеров, рекомендуемых для из)^ения
тканей рака молочной железы, входит более 30 наименований, практическое
значение имеет очень ограниченное их количество. В первую очередь, к ним
относят рецепторы стероидных гормонов - эстрогена (ER) и прогестерона (PR);
от результатов анализа во многом зависит дальнейшая тактика лечения боль¬
ных. Высокие уровни ER и PR в раковых клетках достоверно свидетельствуют
о реальной возможности положительного ответа на гормональную терапию, а
низкий уровень или отсутствие их при раке молочной железы — об отсутствии
ответа на гормональное воздействие. Еще один тест, необходимый в современной
маммологической клинике, — определение белка HER-2 (онкопротеина с-егЬВ-2)
в гистологическом материале. Гиперэкспрессия HER-2 в клетках рака молочной
железы ассоциирована с повышенным метастатическим потенциалом новообра¬
зования, что определяет необходимость химиотерапии даже в случае 1-Па стадии.
Одновременное определение ER, PR, HER-2 позволяет прогнозировать течение
онкологического заболевания. В случае ER-, PR-отрицательной опухоли молочной
железы при одновременной детекции гиперэкспрессии HER-2 неблагоприятный
прогноз с наступлением раннего рецидивирования более вероятен. В случае ER-,
PR-положительной опухоли и отсутствия гиперэкспрессии HER-2 - неблагопри¬
ятный прогноз менее вероятен.Цитологическое исследование
при заболеваниях органов дыханияПОЛУЧЕНИЕ И ОБРАБОТКА МАТЕРИАЛА ДЛЯ ЦИТОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯВ зависимости от особенностей поражения верхних дыхательных путей при¬
меняют соскобы щеткой с поверхности поражения полости носа, глотки, гортани,
трахеи, смывы физиологическим раствором, АПТИ.Основные методы цитологической диагностики при заболеваниях легких• Исследование материала бронхоскопии (отпечатков с биоптата удаленной
опухоли или кусочка ткани, соскобов щеткой, аспирата бронхиального секре¬
та, трансбронхиальной АПТИ, бронхоальвеолярного лаважа).• Материал, полученный при катетеризации бронха без бронхоскопии.
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 641• Исследование мокроты.• Трансторакальная АПТИ.• Материал, полученный при медиастиноскопии, торакоскопии.• Материал, полученный во время операции.• Материал из внелегочных очагов (лимфатических узлов, выпотной жидко¬
сти).В клинике основную группу составляют больные, у которых в легких рентге¬
нологически определены очаговые изменения центральной или периферической
локализации. Больным показана бронхоскопия, поэтому цитологическое исследо¬
вание целесообразно начать с изучения материала бронхоскопии, хотя в рутинной
практике нередко используют многократное цитологическое исследование мокро¬
ты (ЦИМ). В связи с тем что клетки в мокроте часто подвержены дегенеративным
изменениям, интерпретация клеточного состава при ЦИМ может быть затруднена,
поэтому метод применяют в основном как скрининг при отсутствии данных о
злокачественном поражении, а также при предположительном диагнозе опухоли у
тяжелых, ослабленных больных. Принципиально в специализированных отделе¬
ниях торакального профиля предпочтение отдают комплексному использованию
инструментальных методов получения материала для цитологического исследова¬
ния, в первую очередь во время бронхоскопии.Алгоритм получения материала для цитологического исследования во время
бронхоскопии в зависимости от локализации и особенностей поражения, отобра¬
женных в рентгенологической и эндоскопической картине, приведен в табл. 8-1.Таблица 8-1. Материал для цитологического исследования во время бронхоскопии в зависимости
от локализации и эндоскопической картины пораженияЛокализачияЭндоскопическая картина пораженияпораженияпрямые признаки
опухоли (преимуще¬
ственна эндобронхи-
альный рост)косвенные признаки
опухоли (преимуще-
1 ственно перибронхи-
альный рост)признаки опухоли
отсутствуют (мате¬
риал получают
в зоне изменений,
выявленных луче¬
выми методами)эндоскопические
признаки поражения
лимфатических
узлов средостенияГлавный, про¬
межуточный,
долевой бронхОтпечаток биопси¬
рованного кусочка
тканитрансбронхиальная
АПТИ (по показа¬
ниям); соскоб +
аспират; отпечаток
биопсированного
кусочка тканиМазок; соскоб +
аспиратСубкаринальнаяпункцияСегментарныйбронхСоскоб + аспират;
отпечаток биопси-
роаанного кусочка
тканиСоскоб + аспират;
отпечаток биопси¬
рованного кусочка
тканиСоскоб + аспиратСубкаринальнаяпункцияМелкие бронхиАспират при катете-
ризации бронха (три
пробы)Аспират при катете¬
ризации бронха (три
пробы)Аспират при катете¬
ризации бронха (три
пробы)Аспират при катете¬
ризации бронха (три
пробы)Таким образом, при бронхоскопии в случаях прямых признаков поражения
главного, промежзточного, долевого бронха проводят биопсию с приготовлением
отпечатков всех поверхностей биопсированного кусочка ткани; при поражении
сегментарного и более мелких бронхов дополнительно получают соскоб щеткой и
аспират бронхиального секрета; при периферическом поражении проводят катете¬
ризацию соответствующего бронха с получением аспирата (три пробы).При косвенных признаках перибронхиального поражения в пределах главного
и промежуточного бронхов проводят соскоб щеткой, аспирацию бронхиального
секрета и трансбронхиальную АПТИ (по показаниям), а затем биопсию кусочка
ткани с приготовлением отпечатков. Показание к субкаринальной АПТИ — при¬
S42 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ в ЛАБОРАТОРНОЙ ДИАГНОСТИКЕзнаки поражения паратрахеальных и бифуркационных лимфатических узлов,
выявленные лучевыми и/или эндоскопическими методами.Результативность исследования биопсированного кусочка ткани и его отпечат¬
ков по мере удаления пораженного участка бронха от бифуркации трахеи снижа¬
ется, тогда как эффективность цитологического исследования соскоба щеткой и
аспирата бронхиального секрета возрастает.При центральной локализации поражения в случае отрицательного результата
исследования бронхоскопического материала больному проводят пятикратное
ЦИМ (спонтанной или индуцированной). При необходимости его проведения
после бронхоскопии следует исключить возможность ошибочной трактовки реак¬
тивных изменений бронхиального эпителия, связанных с травматизацией слизи¬
стой оболочки бронха. Именно поэтому ЦИМ допустимо не ранее чем через сутки
после предшествующей манипуляции.При отрицательном результате изучения бронхоскопического материала, в
том числе аспирата, полученного при катетеризации периферического бронха,
через 1-2 сут повторно проводят катетеризацию бронха под местной анестезией
без бронхоскопии; если она оказалась безуспешной, показана трансторакальная
АПТИ, а при противопоказаниях больному назначают пятикратное ЦИМ.Если на этапе обследования у больного обнаружены признаки распространения
процесса (опухоли.?) за пределы легкого, цитологическое исследование начинают
с изучения материала из внелегочных очагов: пунктатов лимфатических узлов,
плевральной, асцитической жидкости, материала стернальной пункции (по пока¬
заниям) и др.Бронхоальвеолярный лаважв группе больных с диффузным и диссеминированным поражением легких
основной метод цитологической диагностики — изучение бронхоальвеолярного
лаважа (БАЛ). Он показан при альвеолите, протеинозе легкого и других неопухо¬
левых поражениях как диагностическая и лечебная манипуляция.Материал получают при фибробронхоскопии под общим наркозом. Подводя
трубку бронхоскопа вплотную к устью сегментарного или субсегментарного брон¬
ха, шприцем (объемом 20 мл) в бронх вводят подогретый до 38 “С изотонический
физиологический раствор с pH 7,2-7,4, который затем аспирируют (лаваж).
Процедуру повторяют 5-6 раз, собирая каждую порцию лаважа в отдельную
емкость из силиконированного стекла или пластмассы (для предотвращения при¬
липания макрофагальных элементов к стенкам). За исключением первой порции,
обычно содержащей обильную примесь слизи и клеток бронхиального эпителия,
остальные порции лаважа в ледяной бане направляют в лабораторию.Первый этап исследования — изучение нативного материала БАЛ. После изме¬
рения количества доставленного лаважа его отфильтровывают и используют для
определения количества клеток и жизнеспособности макрофагов. Остальную часть
материала центрифугируют в течение 10 мин при 1500 об./мин и из осадка центри-
фугата готовят мазки. Подсчет клеток проводят в камере Фукса-Розенталя.Для подкрашивания ядер используют стандартную методику, как при под¬
счете лейкоцитов крови в камере или неокрашенных клеток, подобно подсчету
клеток спинномозговой жидкости. Оценивают количество клеток в 1 мл лаважа
и общее количество клеток во всей полученной порции; кроме того, определяют
преобладающие клетки (макрофаги, лимфоциты, нейтрофилы). При преоблада¬
нии лимфоцитов проводят иммунологическое, макрофагов — цитохимическое и
электронно-микроскопическое исследования.Для оценки жизнеспособности макрофагов 5 капель отфильтрованного лава¬
жа помещают на часовое стекло и добавляют 1 каплю 1% раствора трипанового
синего, приготовленного на изотоническом растворе натрия хлорида. Подсчет
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 643жизнеспособных клеток также проводят в камере Фукса-Розенталя, учитывая, что
в погибших клетках ядро прокрашивается в сине-фиолетовый цвет, а в живых не
окрашивается. Анализируют 100 клеток. Обычно у практически здоровых людей
жизнеспособность макрофагов составляет 90-95%, снижаясь при некоторых забо¬
леваниях.Если БАЛ исследуют не сразу, для сохранения жизнеспособности клеток лаваж
необходимо хранить в ледяной бане с 50 мл раствора Ханкса (pH = 7,2-7,4).Мазки из осадка БАЛ высушивают на воздухе и окрашивают в течение 5-7 мин
по методу Романовского-Гимзы, Лейшмана, Паппенгейма.При цитологическом исследований мазков определяют процентное соотноше¬
ние различных клеток (цитограмма), подсчитывают в 200 клетках. При значитель¬
ных различиях показателей в первой и второй сотне клеток подсчет продолжают
(до 300-500 клеток). Большая примесь эритроцитов и клеток бронхиального
эпителия (при подсчете их не учитывают) определяет непригодность БАЛ для
исследования.У здоровых людей большинство клеток в БАЛ составляют альвеолярные макро¬
фаги (85-90%); обычно присутствуют единичные нейтрофилы (0-2%) и неболь¬
шое количество лимфоцитов (7-12%); у курильщиков количество нейтрофилов
может достигать 4-5%.При различных заболеваниях легких, помимо изменения соотношений между
основными клетками БАЛ. находят другие клеточные элементы: эозинофилы,
плазмоциты, тучные клетки (лаброциты).По составу клеток выделяют несколько вариантов БАЛ;• лимфоцитарно-макрофагальный (саркоидоз, туберкулез, экзогенный аллер¬
гический альвеолит, альвеолярный протеиноз, пневмокониоз, коллагеновые
болезни);• нейтрофильно-макрофагальный (идиопатический фиброзирующий альвео¬
лит, гранулематоз Вегенера, коллагенозы, пневмокониозы, инфекционные
болезни, в том числе туберкулез);• увеличение количества эозинофилов (экзогенный аллергический альвеолит,
бронхиальная астма, аспергиллез, эозинофильная пневмония, аллергия на
лекарственные препараты);• макрофагальный вариант (у здоровых людей, часто у курильщиков, а также
при различных заболеваниях легких).БАЛ помогает отличить поражение, в котором преобладают лимфоциты (сар¬
коидоз, гиперчувствительная пневмония, включая реакцию на лекарства, берил-
лиоз), от заболеваний с преобладанием нейтрофилов или макрофагов (идиопа¬
тический фиброзируюш;ий альвеолит, гистиоцитоз X). Наличие гемосидерофагов
делает возможной диагностику «немой» легочной геморрагии (за исключением
острой фазы).В зависимости от фазы и остроты процесса при одном и том же заболевании
БАЛ может быть лимфоцитарным или макрофагальным; наоборот, при разных
заболеваниях иногда определяют схожую картину цитограммы, В этих случаях
для установления диагноза необходимо использовать дополнительные методы
(культуральное исследование — посев, окрашивание на микобактерии туберку¬
леза, цитохимические реакции, в сложных наблюдениях — электронную микро¬
скопию).При БАЛ возможна идентификация грибов, пневмоцист, вирусов. С его помо¬
щью можно диагностировать оппортунистическую инфекцию у иммунокомпро-
метированных пациентов (при СПИДе и трансплантации органа), интерстици¬
альные поражения легких, гранулематозы, гиперчувствительную пневмонию,
лекарственно-индуцированную легочную токсичность, асбестоз, что делает этот
метод особенно важным в современных условиях. Изучение БАЛ используют для
09644 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ в ЛАБОРАТОРНОЙ ДИАГНОСТИКЕпризнаки
распространения
поражения
за пределы легкогоКлинико-рентгенологические данные"'Т"Локальные изменения в легкихЦентральнаялокализацияПериферическаялокализацияДиффузные
и диссеминированные
изменения в легких^2-3-й день ^ 3-й день ^ 3-й день 3-й деньдень5-9-й день ^6-й деньРентгенологические
признаки поражения
в легких не определяются2-3-й день' 1-5-й деньПункциялимфатическихБронхоскопияпротивопоказанаКатетеризацияво время
бронхоскопииузлов и очагив
в других органах,
иоследоеаниеБронхоскопия(тактикуполученияКатетеризация
под местной5-й деньБронхоальвео¬
лярный лаваж
при бронхоскопииМокрота(5-кратно)плевральной,асцитическойжидкостиматериала
см. втабп. 6)анестезией
без бронхоскопии
(3 гробы аспирата)Повторно(3 пробы аспирата)Трансторакальная
АПТИ
(ита Nfi22)IАПТИпротивопоказана7-11-й день6-й деньПри обнаружении клеток ракаБронхоскопияс раздельным получением
материала из сегментарных бронховМокрота(5-кратно)~т~Хирургическая биопсия
при медиастиноскопии,
торакоскопии, торакотомииРис. 8-7. Тактика цитологического исследования при диагностике заболеваний легких.оценки отторжения трансплантата. Показатели диагностики периферического
рака легких при его использовании близки к значениям при исследовании мате¬
риала бронхоскопии (68,6% случаев).При отсутствии морфологического диагноза проводят цитологическое и гисто¬
логическое исследования во время торакомедиастиноскопии, торакотомии.Схема тактики цитологического исследования у легочных больных, в том числе
при опухолях, в специализированном отделении торакального профиля приведена
на рис, 8-7,Цитологическое исследование выпотных
жидкостей серозных полостейЗадачи цитологического исследования выпотных жидкостей:• определить характер патологического процесса (неопухолевый, опухоль);• при неопухолевом процессе — идентифицировать клеточный состав (клетки
мезотелия и плазматические, лимфоциты, эозинофильные и нейтрофильные
лейкоциты);• при опухоли — определить ее первичную или метастатическую природу;• по возможности определить первичный очаг и/или гистологическую форму
опухоли (плоскоклеточный, железистый, мелкоклеточный рак и другие его
формы, неэпителиальная опухоль).ЦИТОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ПЛЕВРАЛЬНОЙ ЖИДКОСТИОбразование плеврального выпота у онкологических больных связано с разны¬
ми причинами и не всегда с распространением (диссеминацией) клеток опухоли по
серозной оболочке (метастазированием). Об этом следует помнить при обследо¬
вании больных со злокачественной опухолью и сопутствующими заболеваниями
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 545(сердечно-соо^дистой недостаточностью, поражением печени, почек), особенно
пожилых больных, так как ошибочный диагноз метастатической природы выпо¬
та может привести к тому, что сопутствующее заболевание не диагностируют и не
лечат. Причины образования плеврального экссудата у больных со злокачествен¬
ными опухолями представлены в табл. 8-2.Таблица 8-2. Причины и механизмы образования плеврального выпота у онкологических боль¬
ныхПрямое влияние опухолиОпосредованное
влияние опухолиВлийние сопутствующей патологииПоражение лимфатических узлов сре¬
достения (снижение лимфатического
оттока из плевры)ГипопротеииемияПатология дыхательной системы
(парапневмонический плвврит и др.}Метастазы в плееру:обструкция лимфатических сосудов;Пневмония вследствие
обструкции бронхаувеличение проницаемости плеврыПатология сердечно-сосудистой
системы {сердечная недостаточность
и др.)Закупорка грудного протока (хилото-
ракс) Эмболия сосудов
легкихПатология ЖКТ (цирроз печени, пан¬
креатит и др.}Обструкция бронха (снижение внутри-
плеврального давления)Состояние после луче¬
вой терапииПатология почек (нефротический
синдром)Вовлечение перикардаСостояние после хими¬
отерапии Патология яичников (например, син¬
дром Мейгса) и др.Наиболее частая причина транссудата — сердечно-сосудистая недостаточность.
Экссудативный выпот чаще всего возникает при пневмонии, злокачественной
опухоли или эмболии легочной артерии. Он может быть при плеврите, вызванном
грибами (бластомикозе, кокцидиомикозе). Вирусный плевральный экссудат иногда
наблюдают при недиагностируемой пневмонии. Примерно в 5% наблюдений экссу¬
дат связан с развитием какого-либо редкого заболевания (например, саркоидоза).ЦИТОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ АСЦИТИЧЕСКОЙ ЖИДКОСТИОсновная причина асцита (83%) — доброкачественные (неопз^холевые) забо¬
левания. Это цирроз печени (алкогольный и как осложнение вирусного гепатита),
сердечная и почечная недостаточность, туберкулез, панкреатит, системная красная
волчанка и др. Злокачественные новообразования - причина асцита в 17% случа¬
ев, в том числе опухоли ЖКТ и прямой кишки (34%), половых органов (27%), рак
легкого (14%), лейкоз (4%), мезотелиома (3%), саркома, рак почек и мочевого
пузыря (18%) и др. «Злокачественный» асцит в 20% случаев связан не с перитоне¬
альными метастазами, а с опухолевым поражением печени (печеночно-клеточный
рак или метастазы в печени). У женщин в асцитической жидкости в порядке убы¬
вания клетки рака чаще обнаруживают при опухолях половых органов (особенно
раке яичников и молочной железы), ЖКТ. У мужчин наиболее часто определяют
диссеминацию по брюшине при опухолях ЖКТ, лейкозе.Смешанные типы асцита (сочетание цирроза и т}^беркулезного перитонита или
цирроза и рака печени) составляют в среднем 9% сл}^чаев.Диагностическая чувствительность клеток опухоли под световым микроскопом
составляет 40-70%. Если возможно получение клеток из асцитической жидко¬
сти объемом 200 мл и более, диагностическая чувствительность повышается до
70-90% при ее специфичности почти 100%. Лабораторное обнаружение клеток
опухоли в асцитической жидкости может предшествовать клинической манифе¬
стации опухоли на 3 года и более.Из поражений, не встречаемых в плевре и перикарде, для брюшины характерна
псевдомиксома (при слизепродуцирующей опухоли — пограничной муцинозной
і646 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕопухоли и высокодифференцированной муцинозной аденокарциноме яичника
или мукоцеле и аденокарциноме аппендикса).Проблемы цитологической диагностики могут быть связаны с неполноценным
материалом (свернувшейся жидкостью, малым количеством «диагностических»
клеток, дистрофическими изменениями ядер), а также интерпретацией цито¬
логической картины. Сложности интерпретации возникают при выраженной
пролиферации и дистрофических изменениях клеток мезотелия, которые могут
напоминать элементы злокачественной опухоли (например, при диссеминации
рака молочной железы и желудка, в некоторых случаях, имеющих сходство с про¬
лиферирующим и дистрофически измененным мезотелием, при высокодифферен¬
цированной цистаденокарциноме яичника).С другой стороны, клетки мезотелиомы могут напоминать пролиферирую¬
щий мезотелий, их не всегда можно отличить от клеток рака молочной железы.
Известны сложности при определении гистологической формы злокачественного
процесса. Для дифференциальной диагностики доброкачественных и злокаче¬
ственных поражений, а также определения органной специфичности некоторых из
них (рака предстательной, щитовидной железы) большое значение имеют допол¬
нительные исследования: цитохимические и иммуноцитохимические методы, про¬
точная цитофлюориметрия, определение хромосомных аберраций, генетический
анализ.Если сложности интерпретации связаны с дистрофическими изменениями
клеток, то при накоплении жидкости, как правило, эффективна ее повторная эва¬
куация.Заболевания органов желудочно-кишечного трактаС помощью фиброскопа можно визуализировать большинство участков пище¬
варительного тракта и получать под визуальным контролем материал щеткой,
иглой или щипцами для биопсии. Рекомендуют одновременно изучать мазки-
отпечатки кусочков ткани и проводить патогистологическое исследование биоп-
сийного материала.В последнее время метод выбора для диагностики интраабдоминальных опухо¬
лей — проведение АПТИ при эндоскопическом исследовании под контролем уль¬
тразвука. При этом возможно расположение датчика в непосредственной близости
от анализируемого участка, что резко увеличивает точность получения материала
при заболеваниях пищевода, желудка и двенадцатиперстной кишки.Для иммуноцитохимических исследований материал помещают в жидкостную
среду (при использовании одноразовых щеток их кончики аккуратно срезают и
помещают в физиологический раствор или специальную жидкость). Это иссле¬
дование необходимо, например, для подтверждения диагноза злокачественной
лимфомы. Как правило, до биопсии цитологический материал получают с помо¬
щью щетки, так как в этом сл}'чае бывает меньше примеси крови. Цитологическое
исследование имеет преимущества перед биопсией в диагностике обычных эпите¬
лиальных опухолей пищевода и желудка, при малигнизации язвы; у патогистоло¬
гического перед цитологическим - преимущество при диагностике распространен¬
ного подслизистого перстневидно-клеточного рака желудка, редких подслизистых
железистых опухолей пищевода, первичных злокачественных лимфом, включая
MALT-лимфомы желудка, неэпителиальных строма л ьных опухолей.Цитологическое исследование поражений ЖКТ имеет некоторые особенности.
При анапластическом раке желудка в мазках, как правило, немного клеток (обыч¬
но вместе со значительным количеством продуктов некроза и воспаления). Клетки
рака относительно небольшие и могут быть пропущены неопытным цитопато¬
логом. Мазки от больных с злокачественной лимфомой часто имеют необычно
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 647светло-голубой фон. Хотя природа этого феномена неизвестна, данный признак
должен насторожить цитопатолога в плане более тщательного поиска относитель¬
но небольших злокачественных клеток, которые ошибочно могут быть приняты за
лимфоциты и проигнорированы.ПРИГОТОВЛЕНИЕ И ОКРАШИВАНИЕ ПРЕПАРАТОВИз материала, полученного с помощью щетки или пункции, приготавливают
стандартный мазок. Для того чтобы получить качественный материал биопсийно-
го кусочка и не травмировать его, каждый биоптат фазу после получения кладут
на стекло и осторожно его передвигают. При этом клетки перемещаются на стекло,
а материал остается полноценным для гистологического исследования. При окра¬
шивании препаратов могут быть использованы традиционные методы.ПИЩЕВОД, ЖЕЛУДОКЦитологическая диагностика способна играть важную роль в диагностике забо¬
леваний пищевода и желудка.Цитологическая классификация заболеваний пищевода• Дисплазия:легкая;❖ умеренная;❖ тяжелая.• Лейкоплакия:❖ простая;❖ с атипией клеток.• Плоскоклеточный рак:❖ высоко дифференцированный (с ороговением);о умеренно дифференцированный (со склонностью к ороговению);❖ низкодифференцированный (без ороговения),• Аденокарцинома.• Железисто-плоскоклеточный рак.• Недифференцированный рак (овсяно-клеточный).• Лейомиома, лейомиосаркома.• Меланома.Цитологическая классификация заболеваний желудка• Пролиферация покровно-ямочного эпителия и эпителия желез:0^ резко выраженная, с атипией отдельных клеток;❖ резко выраженная пролиферация эпителия, подозрительная по переходу в
рак,• Метапластические изменения покровно-ямочного эпителия и эпителия
желез (кишечная метаплазия).• Аденокарцинома:высокодифференцированная;^ умеренно дифференцированная;❖ низкодифференцированная.• Перстневидно-клеточный рак.• Недифференцированный рак.• Плоскоклеточный рак.• Слизистый (коллоидный, мукоидный) рак с внеклеточной слизью.• Карциноид.• Злокачественная лимфома (лимфосаркома, лимфогранулематоз и др.).Клиническое значениеПри несомненной важности определенных клинических и визуальных призна¬
ков изменений слизистой оболочки для точного определения природы поражения
648 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ в ЛАБОРАТОРНОЙ ДИАГНОСТИКЕобязательно морфологическое исследование. Дифференциальная диагностика
рака желудка и доброкачественных процессов только на основании рентгеносе-
миотики сложна, а в ряде случаев невозможна.Из предраковых заболеваний желудка традиционно значительное место отво¬
дят хронической язве желудка. При сопоставлении клинических и морфологиче¬
ских характеристик первично-язвенного рака (опухоль инфильтрирует стенку
желудка до подслизистого слоя) и хронической язвы желудка показано, что они
неотличимы клинически, поэтому никакие другие варианты, кроме морфологиче¬
ской дифференциальной диагностики, недопустимы.Обнаружение изменений в эпителии, например тяжелой дисплазии эпителия, сви¬
детельствует о повышенном риске возникновения рака желудка и должно служить
основой для формирования группы риска из больных, страдающих хроническими
заболеваниями желудка и нуждающихся в тщательном диспансерном наблюдении.Наиболее высокий риск развития рака у больных с тяжелой дисплазией эпителия,
поэтому их необходимо подвергать комплексному обследованию не менее одного
раза в год даже на фоне ремиссии хронического заболевания и обязательно — при
возникновении каждого обострения. Отсутствие предраковых изменений эпителия
или меньшая их выраженность позволяют отложить повторные обследования на
3-5 лет или до возникновения любых «желудочных» жалоб. В отдаленные сроки
(10 лет и более) после перенесенных заболеваний желудка больные, в том числе
перенесшие операцию на желудке, подлежат обследованию один раз в 1-2 года.
Основная задача такого наблюдения — своевременная диагностика рецидива забо¬
левания. Диспансерное наблюдение необходимо проводить с помощью рентгеноэн¬
доскопических, морфологических и общеклинических методов исследования.Необходимо отметить, что при раке в стадии цитологическое исследование
не имеет преимуществ перед патогистологическим при верификации диагноза,
но при раке в стадии Т^-Т^ (Т.^ - опухоль инфильтрирует стенку желудка до суб-
серозной оболочки, Т.^ — опухоль прорастает серозную оболочку без инвазии в
соседние структуры, — распространение опухоли на соседние структуры) отказ
от использования обоих методов следует считать ошибкой, так как иногда под¬
тверждение опухолевого процесса возможно только в мазке.ТОЛСТЫЙ КИШЕЧНИКРазвитие эндоскопической техники практически устранило эксфолиативную
цитологию (смывы прямой кишки и толстого кишечника) в диагностике заболе¬
ваний толстого кишечника.При опухолях анального и нижнеампулярного отдела прямой кишки проводят
соскоб шпателем с поверхности опухоли через ректальное зеркало. Мазки могут
быть приготовлены также с поверхности перчатки после пальцевого исследования
прямой кишки, при опухолях, доступных осмотру через ректоскоп И.ИИ фибро-
колоноскоп, материал получают с помощью туго накрученного ватного тампона
или щетки под визуальным контролем. При опухолях прямой кишки, инфильтри¬
рующих кишечную стенку без изъязвления слизистой оболочки, проводят транс¬
ректальную пункционную биопсию. Щеточную биопсию проводят при выражен¬
ном стенозе, когда невозможно получить материал биопсийными щипцами, при
обширных изъязвлениях и язвенных колитах, когда прицельная биопсия может
быть малоинформативной.Цитологическая классификация заболеваний толстого кишечника и
прямой кишки• Изменения кишечного эпителия при полипах, выявленных при эндоскопиче¬
ском исследовании:❖ пролиферация эпителия;❖ выраженная пролиферация эпителия с атипией клеток.
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 649• Рак:❖ аденокарцинома (высоко-, умеренно, низкодифференцированная, с выра¬
женным слизеобразованием);
перстневидно-клеточный рак;
недифференцированный рак;
плоскоклеточный рак;
базально-клеточный рак.• Меланома.• Карциноид.• Неэпителиальные опухоли.• Опухоли гемопоэтической и лимфоидной ткани,ПЕЧЕНЬПечень - орган с широким спектром метаболических, регуляторных и
других важных функций, выполняемых гепатоцитами. Сложность строения и
чувствительность клеток печени делает их уязвимыми к воздействию различ¬
ных патогенных агентов. Через печень, преимущественно через портальную
вену, проходит у, всей крови минутного сердечного выброса, поэтому гепато-
циты постоянно подвержены неблагоприятному воздействию разнообразных
лекарств, токсинов и инфекций. Вследствие обильного кровоснабжения в ней
могут быть определены метастазы злокачественных опухолей различных орга¬
нов и тканей.Клиническое значение цитологического исследованияЦитологическое исследование материала АПТИ выполняют, как правило, для
верификации очаговых поражений печени. Это ценный диагностический метод в
сочетании с клиническими данными, радиологическими исследованиями, други¬
ми лабораторными тестами. Возможно также интраоперационное исследование
отпечатков удаленной ткани, что особенно ценно, если по каким-либо причинам
(очень маленькие кусочки, крошащийся материал и др.) невозможно приготовить
замороженные срезы.Цитологическое исследование используют для подтверждения или опроверже¬
ния диагноза злокачественного поражения, как первичного, так и метастатиче¬
ского. Многие первичные и метастатические опухоли печени имеют характерные
структурные и морфологические особенности, достаточные для установления
диагноза в рутинном цитологическом препарате. Для диагностики некоторых
опухолей необходимы дополнительные диагностические методы: клеточные
блоки, цитохимическое, иммуноцитохимическое исследования, электронная
микроскопия.Цель АПТИ — обеспечение точности диагностики, чтобы по возможности
исключить более сложную и дорогостоящую диагностическую процедуру. АПТИ
вызывает у пациента лишь легкий дискомфорт, серьезные осложнения наблюда¬
ют редко. При наличии кисты диагностическая пункция имеет также и лечебный
эффект.АПТИ может иметь большое значение для диагностики доброкачественных
диффузных заболеваний (острого и хронического гепатита, цирроза, неспецифи¬
ческих дистрофических изменений гепатоцитов, жирового некроза, амилоидоза
и др.). Безусловно, цитологическое исследование неспособно заменить патоги¬
стологическое при диагностике диффузных поражений печени, однако АПТИ в
большинстве случаев может помочь установить или хотя бы предположить добро¬
качественные диффузные изменения.
650 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ в ЛАБОРАТОРНОЙ ДИАГНОСТИКЕПолучение материалаИспользуют различные методики визуализации патологического очага (ультра¬
звук, компьютерную томографию, ангиографию, радиоизотопное сканирование).
Аспирацию в большинстве случаев проводят под контролем ультразвука — более
дешевого нелучевого метода по сравнению с компьютерной томографией (КТ).
Томографию используют при опухоли небольшого размера или глубоко располо¬
женной, а также при невозможности получить диагностический материал спосо¬
бом АПТИ под контролем ультразвука.В некоторых случаях пальпируемые опухоли пунктируют без дополнительных
методов визуализации (больному натощак без предварительной подготовки на
высоте вдоха проводят чрескожную пункцию печени тонкой иглой и набирают
материал для исследования). В этих случаях необходимо предварительное иссле¬
дование свертывания крови.Если для диагностики одиночных или множественных очаговых поражений
печени вместе с АПТИ используют различные радиологические методы, тогда
пункция может стать безопасной в любом участке печени (даже в непосред¬
ственной близости к кровеносным сосудам, расширенным желчным протокам и
желчному пузырю). Множественные движения иглой могут быть вьшолнены на
различных участках. Цитологический диагноз устанавливают быстро, точно и
безопасно, причем есть возможность немедленной оценки адекватности получен¬
ного материала.Техника АПТИ печени сходна с пункцией других локализаций. Движения иглой
вперед-назад проводят без удаления кончика иглы за пределы поражения для
исключения контаминации в окружающие непораженные участки. Некоторые
исследователи предлагают перемещать иглу под различными углами или одно¬
временно вращать ее для получения большего количества материала. Аспирация
материала увеличивает его количество, но может также увеличить и количество
полученной крови, поэтому в некоторых учреждениях рекомендуют его получе¬
ние только иглой, без всасывания. Получать материал только с помощью иглы
проще, в этом случае можно предотвратить осложнения (например, кровотече¬
ние) и почувствовать проникновение пунктата в иглу. Такой способ дает хорошие
результаты при солидных опухолях без выраженного стромального компонента.
Аспирация необходима, если имеется большое количество жидкости или гноя,
выражен фиброзный компонент.Приготовление и окрашивание материалаАспирационный или интраоперационный материал используют для приготов¬
ления стандартных мазков, окрашиваемых азур-эозином или по Папаниколау.
После приготовления мазков оставшийся в иглах и шприцах материал помещают
в физиологический раствор для использования метода жидкостной цитологии.
Иммуноцитохимические методы позволяют более точно определить тип опухоли,
а при исследовании метастазов - установить первичный очаг. Если предполагают
злокачественную лимфому, материал следует направить для фенотипирования,
если инфекционное заболевание — необходимо микробиологическое исследо¬
вание, Для установления адекватного цитологического диагноза рационален
комплексный подход к диагностике с применением цитохимического, иммуно-
цитохимического исследований, проточной цитофлюориметрии, электронной
микроскопии.Различные дополнительные методики могут быть использованы для отличия
злокачественных поражений печени от доброкачественных, но обычно их не
используют в рутинных исследованиях. Они включают определение ядрышко¬
вого организатора, иммуноцитохимическое определение р53, CD34, определение
теломеразной активности, проточную цитофлюориметрию, определение ДНК-
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 651плоидности и др, а-Фетопротеин — маркер первичного рака печени (положитель¬
ная реакция наблюдается в 25-75% случаев) при исключенной герминогенной
опухоли, однако количество а-фетопротеина в крови и ткани не всегда коррели¬
рует. В последнее время обнаружены более специфические и чувствительные мар¬
керы клеток печени. Нер Pari — маркер печеночной дифференцировки, МОС-1 —
маркер аденокарциномы (отрицательный в случае печеночно-клеточного рака),
виментин — маркер клеток Купфера.Точность диагностики заболеваний печени при АПТИ зависит от точности
получения материала из места поражения, опыта цитопатолога и специалиста,
выполняющего пункцию. С появлением УЗИ и КТ практически не осталось пора¬
жений, которые нельзя пунктировать, а так как местоположение иглы всегда
видно на экране, ошибки в пол>^ении материала и осложнения минимальные.
Чувствительность цитологического метода в диагностике злокачественных пора¬
жений печени составляет 84-100, специфичность — 45-100%. Прогностическая
ценность положительного результата — 93-100%. Типирование опухолей менее
успешно и колеблется в пределах 50-90%. Однако, если получено достаточное
количество материала для традиционного цитологического исследования и допол¬
нительных методик, ценность цитологического исследования равна ценности
патогистологического исследования.Тем не менее определение очага первичного метастазирования до сих пор пред¬
ставляет значительные трудности, поэтому часто устанавливают цитологический
диагноз метастаза без диагностированного первичного очага. Ложноположитель¬
ные результаты встречаются достаточно редко.ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗАКоличество злокачественных новообразований поджелудочной железы с каж¬
дым годом увеличивается. На момент установления диагноза большинство паци¬
ентов имеют распространенный неоперабельный рак.Современные методы получения изображения (КТ, чрескожная ультрасоногра-
фия, магнитный резонанс, эндоскопия под контролем ультразвука) улучшают воз¬
можности распознавания первичных и метастатических поражений поджелудоч¬
ной железы. Морфологическое исследование необходимо в большинстве случаев
из-за вариабельности неопухолевых поражений и доброкачественных опухолей,
напоминающих злокачественные опухоли клинически и при визуализации с помо¬
щью современной аппаратуры.В настоящее время АПТИ — один из самых важных методов диагностики при
солидных и кистозных поражениях поджелудочной железы.Ценность и ограничения цитологического исследованиятрадиционная хирургическая биопсия с использованием клиновидной резек¬
ции имеет высокий процент осложнений (5-20%), смертность составляет 2-3%.
В число осложнений входят формирование свищей, кровотечения, панкреатиты.
Тем не менее широкую биопсию считают безопасным методом, когда анализируе¬
мый участок находится на поверхности органа. АПТИ рекомендуют для пункции
поражений в глубине поджелудочной железы. При этом методе исследования
практически не бывает серьезных осложнений. Диагностическая точность цитоло¬
гического метода составляет 71-100%, чувствительность выше, чем при гистоло¬
гическом исследовании. Прилегающие лимфатические узлы и сальник могут быть
пунктированы при лапаротомии.АПТИ — признанный метод исследования для диагностики неоперабельного
рака поджелудочной железы. Однако некоторые авторы против проведения АПТИ
для диагностики небольшой, потенциально резецируемой опухоли, пока предопе¬
рационная химиотерапия или интраоперационная радиотерапия — часть лечения.
652 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ в ЛАБОРАТОРНОЙ ДИАГНОСТИКЕПолагают, что таким образом можно предотвратить потенциальную диссемина-
цию опухоли, которую нельзя игнорировать, хотя и редко встречают.Чрескожная АПТИ — высокодостоверный метод диагностики рака поджелудоч¬
ной железы со специфичностью почти 100%. Метод более чувствителен, чем чрес¬
кожная биопсия толстой иглой {core biopsy). Известны только единичные слз'^чаи
ложно положительных результатов, ложноотрицательных значительно больше.
Чувствительность АПТИ составляет 45-97%. Все основные ошибки происходят
при дифференциальной диагностике регенераторных процессов хронического
панкреатита и высокодифференцированной аденокарциномы. Чувствительность
цитологической диагностики опухолей в кисте ниже, чем солидных опухолей,
В некоторых исследованиях отмечено, что чувствительность АПТИ значительно
снижается при уменьшении размера опухоли.АПТИ с помощью эндоскопа под контролем УЗИ (ЭУЗИ-АПТИ) — метод менее
дорогой, менее рискованный и инвазивный, изменивший подход к клиническому
ведению значительного количества больных. С его помощью можно установить
уверенный диагноз аденокарциномы до хирургической резекции, химиорадио¬
терапии. Однако, несмотря на то что ЭУЗИ-АПТИ достигла большой диагности¬
ческой точности при диагностике злокачественных поражений, метод не может
предоставить окончательных результатов при доброкачественных процессах
(негативный результат не исключает злокачественного поражения).Получение материалаОсновные трудности в диагностике заболеваний поджелудочной железы заклю¬
чены в определении точной локализации поражения. Выбор диагностической про¬
цедуры зависит от размера и локализации опухоли, вида образования (солидное
или кистозное). ЭУЗИ-АПТИ — технически более сложная процедура, но позво¬
ляет видеть в режиме реального времени кончик иглы. КТ технически проще и не
зависит от наличия кишечного газа, ожирения и т.д., но не позволяет видеть изо¬
бражение в режиме реального времени, поэтому занимает больше времени.С помощью эндоскопической ретроградной холангиографии можно визуализи¬
ровать панкреатический проток. Это позволяет получать панкреатический сок с
помощью катетеризации основного панкреатического протока через фатеров сосо¬
чек при стимуляции секретином или без нее. Получение материала щеткой также
практикуют при ЭУЗИ для диагностики опухолей небольшого размера.Получение материала при ЭУЗИ-АПТИ — сравнительно новый, быстропро¬
грессирующий метод. В настоящее время он играет важную роль в диагностике
заболеваний поджелудочной железы. Есть много преимуществ ЭУЗИ-АПТИ перед
чрескожной АПТИ. Наиболее значительное достижение - возможность пункции
небольших поражений, что затруднительно при традиционных методах полу¬
чения изображения. Еще одно преимущество — нахождение эндоскопа вблизи
цели исследования. Короткий путь иглы снижает возможность потенциальных
осложнений. Ткани вокруг пути прохождения иглы резецируют при операции, что
снижает возможность диссеминации опухоли. После эндоскопического и ультра¬
звукового исследований иглу продвигают через желудок или двенадцатиперстную
кишку в ткань поджелудочной железы под контролем изображения в реальном
времени. Как только она оказывается в зоне поражения, зонд извлекают и прово¬
дят аспирацию с помощью шприца. Иглу можно перемещать вперед-назад внутри
опухоли. Процедуру продолжают до тех пор, пока диагностический материал не
будет получен, ЭУЗИ-АПТИ позволяет более точно определить стадию процесса,
наличие инвазии в окружающих тканях, оценить размер опухоли.Клиническое значениеДля проведения терапевтических мероприятий важно определить доброкаче¬
ственность или злокачественность поражения. Очень важна дифференциальная
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 053диагностика кистозных поражений, прогноз и лечение которых различаются,
Муцинозные кисты, как правило, потенциально злокачественные, поэтому необ¬
ходима их хирургическая резекция, Немуцинозные кисты, включая серозную
цистаденому, имеют очень низкий потенциал злокачественности, а псевдокиста —
всегда доброкачественное поражение, поэтому немуцинозную кисту резецируют
лишь при осложнениях. Муцинозные и немуцинозные кисты можно различить
при сопоставлении результатов ЭУЗИ-АПТИ, исследования кистозной жидкости
и определения опухолевых маркеров. Например, уровень СЕА — высокий в .злока¬
чественной кисте, низкий — в псевдокисте и вариабельный — в муцинозной кисте
и серозной цистаденоме. Уровень амилазы и липазы в кистозной жидкости вариа¬
бельный, но, как правило, высокий в псевдокисте и низкий при злокачественной
кисте. Содержимое муцинозной кисты с высокой относительной плотностью, в
псевдокисте и серозной цистаденоме — с низкой.Заболевания периферических эндокринных железПри заболеваниях щитовидной, паращитовидной, вилочковой желез и над¬
почечников материал для цитологического исследования получают с помощью
АПТИ, а также исследуют интраоперационный соскоб и отпечатки. Пункцию чаще
проводят без анестезии, стерильным одноразовым шприцем объемом 5-10 мл с
иглами длиной 4 см и наружным диаметром 0,8 мм с мандреном. Хорошие резуль¬
таты получают при использовании специальньЕх игл. АПТИ проводят под контро¬
лем эхотомографа или КТ в реальном времени,ЩИТОВИДНАЯ ЖЕЛЕЗАВажнейшее условие правильной оценки природы поражения щитовидной
железы — целенаправленное получение информативного материала из очага пора¬
жения, визуализированного при ультразвуковом исследовании. Цитологическое
исследование материала АПТИ помогает отобрать больных с узлами в щитовид¬
ной железе, подлежащих хирургическому лечению.Биопсию щитовидной железы толстой иглой не применяют из-за неоправ¬
данной травматичности. Для получения адекватного цитологического мате¬
риала при комплексной диагностике заболеваний щитовидной железы необ¬
ходим учет данных клинико-инструментального исследования больного и, в
частности, данных ультразвукового исследования об особенностях поражения.
Например, при тиреотоксикозе пункцией без аспирации можно избежать полу¬
чения неинформативного кровянистого материала. При предположительном
диагнозе тиреоидита, как и при очень плотном узле опухоли, пункцию прово¬
дят с интенсивным вращением, веерообразным смещением иглы и движениями
вперед-назад.Для получения адекватного материала следует соблюдать правила: выбрать
место и определить количество пункций, точно попасть иглой в выбранный уча¬
сток, провести манипуляцию в соответствии с ультразвуковыми особенностями
поражения и получить достаточное количество материала.Необходимо учитывать, что абсолютная точность попадания иглы в очаг пора¬
жения проблематична при размерах узла менее 5 мм в диаметре. При одиночном
узле диаметром более 1 см пунктируют центр узла; при размерах узла более 1 см
пунктируют дважды (его центр и периферию). При наличии двух узлов и более
пунктируют только два узла, отдавая предпочтение гипоэхогенным узлам с нечет¬
кими, неровными контз'рами, наличием микрокальцинатов и выходом за контуры
железы (т.е. при ультразвуковых признаках, наиболее неблагоприятных с точки
зрения онкологического риска). С учетом последнего пункцию обязательно про¬
водят в зоне диффузных изменений щитовидной железы.
654 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ в ЛАБОРАТОРНОЙ ДИАГНОСТИКЕПри диффузном увеличении щитовидной железы без узловых изменений
АПТИ проводят в зависимости от степени ее увеличения; при увеличении железыI-II степени пункция не показана, при увеличении III-V степени (диаметром 7 см
и более) ее проводят в центральной части обеих долей.Оценку адекватности материала для цитологического исследования проводит
цитопатолог при микроскопии мазка непосредственно в момент его получения.ПАРАЩИТОВИДНАЯ ЖЕЛЕЗАНа практике паращитовидную железу чаще всего исследуют интраонерационно.
Однако при большом размере поражения исследуют материал АПТИ.ВИЛОЧКОВАЯ ЖЕЛЕЗАПри поражениях вилочковой железы используют те же принципы получения
материала для цитологического исследования, что и при заболеваниях щитовид¬
ной железы.НАДПОЧЕЧНИКЦитологическую диагностику заболеваний надпочечника осуществляют с помо¬
щью АПТИ на основании данных ультразвука и КТ. Поскольку патологическая
извитость сосудистых структур в злокачественной опухоли препятствует адекват¬
ному получению цитологического материала, для ее определения УЗИ сочетают с
цветовым допплеровским диагностическим картированием.Если по клиническим данным (высокое артериальное давление, предпо*
ложение о феохромоцитоме) проведение пункции в долечебном периоде про¬
тивопоказано, ее выполняют во время лапаротомии или видеолапароскопии.
Используют также интраоперационные соскобы. При кистах надпочечника
проводят диагностическую аспирацию содержимого, одновременно имеющую
лечебный характер.На тактику проведения АПТИ влияют размер опухоли надпочечника, клиниче¬
ские данные о ее гормональной активности и признаках злокачественности.При четкой визуализации на экране монитора ультратомографа образования
надпочечника диаметром более 2,5 см необходимо выполнить АПТИ. При неболь¬
шом размере опухоли (до 2 см) используют АПТИ под контролем КТ; в таких же
условиях проводят повторную пункцию при получении неинформативного мате¬
риала из опухоли большого размера под контролем УЗИ. При получении неинфор¬
мативного материала необходимы повторные АПТИ в других участках объемного
образования (из-за риска возникновения осложнений проводить пункцию не
следует более трех раз).При АПТИ под контролем УЗИ применяют специальные иглы (диаметр их — от
0,8 мм, длина — до 20 см).Выполняя цитологическую диагностику опухолей надпочечника, необходимо
учитывать общий принцип обследования больных: при гормонально-неактивных
опухолях максимально используют АПТИ, при гормонально-активных опухолях
количество АПТИ максимально снижают.Данные цитологического исследования при гормонально-неактивной опухоли
надпочечника размером более 1,5 см позволяют определить дальнейшую тактику
лечения больного.Тактика проведения цитологического исследования у больных с гормонально¬
активными опухолями надпочечника (кортикостеромой, андростеромой), особен¬
но диаметром более 5 см, имеет большее значение в связи с увеличением частоты
озлокачествления, выбором оптимального доступа и объема операции. Учитывая
клинические данные гормонально-активной опухоли, показания к пункции могут
быть изменены. При предположительном клиническом диагнозе альдосгеромы
пункцию не выполняют.
ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ 655У больных с феохромоцитомой во время АПТИ часто отмечают резкое повы¬
шение артериального давления, требующее гипотензивной терапии. Поскольку
получаемая при АПТИ информация не влияет на выбор лечебной тактики, в
последние годы у больных с хромаффинными опухолями от проведения пункции
отказывались. Применение методики видеолапароскопического удаления феохро-
моцитомы делает более актуальным предварительное проведение АПТИ во время
лапароскопии,ВОЗМОЖНОСТИ ЦИТОЛОГИЧЕСКОЙ ДИАГНОСТИКИ ПРИ ЗАБОЛЕВАНИЯХ
ЭНДОКРИННЫХ ОРГАНОВПри цитологическом исследовании могут быть диагностированы различные
заболевания.• Доброкачественные поражения — преимущественно коллоидный или кле¬
точный эутиреоидный зоб, аутоиммунные поражения (диффузный тиреоток-
сический зоб и аутоиммунный тиреоидит), острый и под острый тиреоидит,
хронический тиреоидит Риделя.• Рак щитовидной железы:❖ папиллярный рак — наиболее частая форма рака (70% наблюдений), в
мазке видны двух- и трехслойные папиллоподобные структуры, иногда
с элементами фиброваскулярного стержня. У клеток опухоли плотная
цитоплазма, с четкими контурами, ядра в виде матовых часовых стекол,
ядерная мембрана неровная, определяют борозды ядер и внутриядерные
цитоплазматические включения, многоядерные клетки доброкачественно¬
го вида и своеобразные, четко отграниченные участки коллоида;❖ медуллярный рак — известный семейный анамнез, в сыворотке крови
повышен уровень кальцитонина, в материале АПТИ обнаруживают ней¬
роэндокринные плазмоцитоидные и веретенообразные клетки опухоли,
содержащие в цитоплазме нейросекреторные метахроматические розовые
гранулы, видны внутриядерные цитоплазматические включения, амилоид
(может быть метах роматическим);❖ недифференцированный (анапластический) рак - в мазке видны гигантские
и веретенообразные разрозненные клетки опухоли с большим количеством
митозов; также встречаются клетки довольно мелких размеров, без выра¬
женного полиморфизма, расположенные преимущественно в небольших
пластах и разрозненно, нет явных признаков (в том числе иммуноцитохи-
мических) папиллярного, фолликулярного или медуллярного рака;❖ фолликулярные поражения; особенность их диагностики — отсутствие
достоверных цитологических признаков дифференциальной диагностики
фолликулярной аденомы и фолликулярного рака; в цитологическом диа¬
гнозе их обозначают термином «фолликулярная опухоль», а ее доброкаче¬
ственную или злокачественную природу определяют предположительно.• Опухоли надпочечника:аденома светло- и темноклеточная;■о адренокортикальный рак — характерны крупные и многоядерные клетки,
их резкий полиморфизм;❖ феохромоцитома — в мазке определяют много крупных полиморфных и
многоядерных клеток с резким полиморфизмом ядер и ядрышек, сосу¬
дистые структурь[; цитологическая верификация доброкачественной или
злокачественной опухоли крайне затруднена, ее природу определяют
только предположительно,• Опухоли вилочковой железы:❖ тимома — эпителиальная опухоль, нередко сопровождаемая тяжелой
миастенией [в зависимости от преобладания эпителиальных (эпителиопо-
656 ЦИТОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕдобных) клеток полигональной или веретенообразной формы и выражен¬
ности лимфоцитарной инфильтрации различают кортикальный, медул¬
лярный и смешанноклеточный вариант опухоли];❖ рак — цитологическая картина определяется особенностями дифференци-
ровки клеток опухоли (плоскоклеточный, железистый, светлоклеточный,
все виды нейроэндокринного рака и др.);^ злокачественная лимфома — болезнь Ходжкина и злокачественная неход-
жкинская лимфома.Заболевания центральной и периферической нервных системМатериал для цитологического исследования обычно получают в специали¬
зированном отделении при АПТИ головного или спинного мозга под контролем
КТ с использованием высокоточной стереотаксической наводки после предва¬
рительной трепанации черепа (трепанационное отверстие в своде черепа выпол¬
няют заранее). После подготовки больного бригада врачей в составе радиолога,
нейрохирурга и морфолога выполняет манипуляцию в операционной или лучевом
отделении (манипуляция на веществе мозга безболезненна, поэтому пункцию про¬
водят под местной анестезией для адекватного контакта с больным). Морфолог
заранее изучает особенности анамнеза, клинической картины, уточняет топогра¬
фию патологического очага по снимкам, сделанным при КТ и МРТ,После наведения иглы и получения материала на основании комплексной
оценки образца (макроскопического вида, консистенции) цитопатолог должен
определить метод исследования у конкретного больного: мазки-отпечатки, «раз¬
давленные» мазки, ограничиться цитологическим исследованием, передать мате¬
риал целиком или частично для срочного интраоперационного исследования
замороженных срезов. При этом учитывают, что ткань большинства глиальных
опухолей рыхлая и мягкая, поэтому приготовление мазка-отпечатка и «раздавлен¬
ного» препарата не представляет трудностей.Исследуют также жидкость из внзтричерепных кистозных образований (пара¬
зитарные и коллоидные кисты, эпидермоиды), в жидкости из арахноидальных
кист и полостей в глиальных опухолях, как правило, нет диагностически значимых
элементов. Иногда для цитологического исследования присылают жидкость, полу¬
ченную при лечебных пункциях.Цитологическое исследование СМЖ — специальный и наиболее сложный раз¬
дел эксфолиативной цитологии. Отчасти это связано с ограниченным количеством
слущенных клеток в СМЖ и их плохой сохранностью.В последнее время методы получения, фиксации материала СМЖ, приготовле¬
ния и окрашивания мазков значительно усовершенствованы. Осаждение, центри¬
фугирование, фильтрация, улавливание клеток и использование влажного мазка
повысили диагностическое качество материала. В мазках ликвора можно обнару¬
жить клетки медуллобластомы, эпендимомы и метастатического рака. Элементы
других опухолей в ликворе встречают редко.При ликворошунтирующих операциях по поводу окклюзионной гидроцефалии
и сбросе ликвора в полости серозных оболочек иногда можно обнаружить элемен¬
ты опухоли в пунктате плевральной и брюшной полости (при десмопластическом
варианте медуллобластомы изредка возникают имплантационные метастазы).При цитологическом исследовании материала стереотаксической пункции,
АПТИ или интраоперационного соскоба можно диагностировать различные опу¬
холи центральной и периферической нервных систем: астроцитому, олигодендро-
глиому, ГЛИО-, медулло-, гемангио- и нейробластому, эпендимому, менингиому,
краниофарингеому.
Глава 9
Биологические маркеры
опролейБиологическими (тканевыми, клеточными или молекулярными)
маркерами характеризуются индивидуальные особенности опу¬
холи, специфика ее «биологического поведения» и регуляции,
в качестве потенциальных биомаркеров рассматривают, как прави¬
ло, молекулы, участвующие в проявлении таких фундаментальных
свойств опухолевых клеток, как метастазирование и инвазия, нео¬
граниченная пролиферация, способность противостоять апоптозу,
чувствительность к экзогенным и эндогенным регуляторам, в их
число входят онкогены и протоонкогены, онкобелки, различные
факторы роста, их рецепторы и нижележащие сигнальные белки
(все они часто являются продуктами различных онкогенов), рецеп¬
торы стероидных и пептидных гормонов, супрессорные гены и про¬
дукты их экспрессии, гормонозависимые белки, ассоциированные
с опухолью протеазы, участвующие в процессах метастазирования,
инвазии и ангиогенеза, белки, отвечающие за межклеточные кон¬
такты и другие регуляторы. При этом в качестве биологического
маркера могут рассматриваться изменение количества копий соот¬
ветствующего гена или его мутация, изменение уровня экспрессии
гена (мРНК), количества синтезируемого белка, его функциональ¬
ная активность, измеренная в строго контролируемых условиях,
В связи с этим для определения биологических маркеров может
быть использован весь арсенал методов современной иммунохи¬
мии, биохимии и молекулярной биологии.Определение биологического маркера может иметь два практи¬
ческих результата:• выявление среди больных с ранними стадиями подгруппы с
повышенным риском рецидивирования и/или метастазиро¬
вания, требующей немедленного адъювантного лечения или
более тщательного наблюдения {прогностигеские маркеры)',• оценку чувствительности опухоли к определенным видам
терапии и индивидуализацию схем адъювантного лечения
больных с распространенным процессом (предсказательные
маркеры).Поскольку количество биологических маркеров, для которых в
клинико-лабораторных исследованиях продемонстрирована потен¬
циальная практическая значимость, очень велико, а стоимость и
трудоемкость их определения весьма значительны, используют
четкие критерии, позволяющие рекомендовать каждый конкрет-
658БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙный показатель для включения в схему обследования больного и использования
результатов его определения для выбора тактики лечения:• определение маркера должно приводить к более благоприятным результатам
лечения — увеличению безрецидивной или общей выживаемости, улучше¬
нию качества жизни, снижению стоимости лечения;• эти преимущества должны иметь I уровень доказательности — доказатель¬
ства получены либо в специальном масштабном рандомизированном про¬
спективном исследовании, либо в результате метаанализа значительного
количества относительно небольших исследований;• необходимы стандартизированные воспроизводимые методы с четко обо¬
значенными критериями, а также наличие внутренних и внешних программ
контроля качества.Этим условиям удовлетворяют очень немногие маркеры, поэтому количе¬
ство реально используемых и рекомендуемых международными организациями
для обследования онкологических больных ограничено. Существует перечень
показателей, являющихся действующими или потенциальными молекулярными
маркерами. В табл. 9-1 жирным шрифтом выделены те из них, которые рекомен¬
дованы или могут быть рекомендованы для практического применения при раке
молочной железы.Таблица 9-1. Основные группы биологически значимых показателей, которые используются или
могут быть использованы в качестве биологических маркеров рака молочной железыБиологическое значениеМаркерыПоказатели гормональной
чувствительностиРецепторы стероидных гормонов; эстрогенов — РЭ, прогестерона — РП,
андрогенов — РА, глюкокортикоидов — РГПоказатели активности ауто-/
паракринной регуляции и
пролиферацииФакторы роста и их рецепторы, рецепторы семейства с-егЬВ (HER); РЭФР
и его лиганды — ЭФР, а-ТФР, амфирегулин и другие показатели; HER2/
пен; рецепторы инсулиноподобных факторов роста; рецепторы соматоста-
тинаФерменты и белки, участвующие е передаче митогенных сигналов: рецеп¬
торные тирозинкиназы, МАП-киназы, PI3K, Akt, NFkB, STAT, 6rb2 и другие
показателиПоказатели метастатической
и инвазивной активностиКомпоненты системы активации плазминогена; иРА, РАИ, рецепторы иРА,
PAI-2, tPAМеталлепроте/назы и их тканевые ингибиторыДругие протеолитические ферменты (катепсины, нексин и остальные
ферменты)Интегрикы, кадгериныПоказатели активности неоан-
гиогенезаVEGF А и его рецепторы 1-го и 2-го типаVEGF С и его рецепторДругие ангиогенные факторы; ФРФ, тимидинфосфорипаза, ФНО, интер¬
лейкины и другие показателиРегуляторы апоптозаСупрессорные гены и их продукты; р53, ген ретинобластомыПро- и антиапоптические факторы; Fas-рецептор и Еаз-пиганд, Ьс12. Akt
NFkB и другие факторыКаспазыПоказатели, не играющие
выраженной роли при РМЖБелок pS2Онкогены с-тус, int-2 и др.
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 059РЕЦЕПТОРЫ СТЕРОИДНЫХ ГОРМОНОВ - КРИТЕРИЙ
ЧУВСТВИТЕЛЬНОСТИ К ЭНДОКРИННОЙ ТЕРАПИИПервыми молекулярными маркерами, прочно вошедшими в онкологическую
практику, стали рецепторы стероидных гормонов — ядерно-цитоплазматические
белки, специфически и избирательно связывающие определенный класс стероидов
после их проникновения в клетку и опосредующие их биологические эффекты.Рак молочной железы. Определение рецепторов стероидных гормонов около
40 лет используется для оценки гормональной чувствительности рака молочной
железы (РМЖ), что позволяет повысить эффективность эндокринной терапии
у рецептор-положительных больных и избавить больных с заведомо нечувстви¬
тельными рецептор-отрицательными опухолями от ненужных хирургических
или терапевтических воздействий. Первоначально определяли только рецепторы
эстрогенов (РЭ), поскольку гормонозависимость РМЖ проявляется в том, что его
рост стимулируется эстрогенами. Позднее в дополнение к РЭ стали определять
также рецепторы прогестерона (РП), которые представляют интерес потому, что
синтез РП в клетках РМЖ индуцируется эстрогенами. Таким образом, наличие РП
может свидетельствовать о функциональной активности РЭ.В разных клиниках используют три относительно равнозначных метода опре¬
деления рецепторного статуса РМЖ: радиолигандный — оценка связывающей
способности рецепторов в цитозолях опухолей: иммуноферментный — определе¬
ние концентрации иммунореактивного рецепторного белка в тех же цитозолях,
и иммуногистохимический — специфическое окрашивание срезов опухоли с
помощью антител к рецепторным белкам. Совпадение результатов определения
рецепторного статуса РМЖ всеми тремя методами составляет в среднем 80-85%
случаев. Преимуществом первых двух методов является их количественный стан¬
дартизированный характер, позволяющий объективизировать критерии оценки
рецепторного статуса, Радиолигандный метод позволяет также оценить функцио¬
нальную активность рецептора на одной из первых стадий его взаимодействия с
гормоном, что делает прогноз гормоночувствительности более надежным, чем
при определении иммунореактивных белков. Иммуногистохимический метод,
хотя и носит относительно субъективный полуколичественный характер, имеет
важное достоинство, заключающееся в том, что при окрашивании срезов можно
четко определить принадлежность рецепторов именно к опухолевым клеткам,
что практически невозможно при использовании биохимических методов. Кроме
того, в отличие от биохимических методик, для которых необходим свежий или
замороженный при 70 "С образец, этот метод позволяет работать с архивным
материалом — парафиновыми блоками и даже готовыми стеклами, что делает его
единственно возможным вариантом в тех случаях, когда необходимость исследо¬
вания рецепторов стероидных гормонов возникла или была осознана через дли¬
тельное время после операции. Эти особенности иммуногистохимического метода
сделали его в последнее время международно признанным подходом к определе¬
нию рецепторного статуса РМЖ.Эндокринная терапия наиболее эффективна у больных РМЖ с положительным
рецепторным статусом: ее эффективность составляет около 75% при опухолях,
содержащих одновременно РЭ и РП, примерно 50% — при РЭ-положительных
опухолях и всего лищь около 10% при РЭ/РП-отрицательных опухолях. Эти
данные подтверждены метаанализом, включившим 37 ООО больных операбель¬
ным раком молочной железы. На основании этих данных пришли к выводу, что
определение рецепторного статуса обязательно у всех первичных больных РМЖ
для решения вопроса о целесообразности назначения эндокринной терапии либо
сразу после операции, либо при последующем прогрессировании. Таким образом.
660 БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙстатус рецепторов стероидных гормонов является важнейшим предсказательным
маркером РМЖ.Опухоли молочной железы, содержащие оба или хотя бы один из рецепторов
стероидных гормонов, имеют более благоприятное течение; послеоперационный
прогноз у таких больных, независимо от проводимого адъювантного лечения,
лучше, чем у больных с рецептор-отрицательными опухолями. Это позволяет
использовать определение рецепторного статуса в качестве прогностического
маркера РМЖ. Однако различия выживаемости в зависимости от рецепторного
статуса не очень велики (порядка 10%), поэтому статус рецепторов стероидных
гормонов самостоятельным прогностическим фактором не является, но входит
в различные прогностические индексы, основанные на классических клинико¬
морфологических показателях.Рак эндометрия — также потенциально гормонозависимое онкологическое
заболевание, в лечении которого на протяжении многих лет использовали про-
гестины в качестве дифференцирующего цитостатического агента. Показана взаи¬
мосвязь экспрессии РЭ и РП с наиболее важными прогностическими факторами, а
также с прогнозом заболевания и чувствительностью больных раком эндометрия
к гормональной терапии. По данным разных авторов, РП встречаются в 49-88%
опухолей при раке эндометрия, РЭ — в 61-100%.Отсутствие РП в ткани рака эндометрия (рецептор-отрицательные опухоли)
обычно указывает на бесперспективность назначения прогестинов, в то время как
вероятность ответа на лечение при рецептор-положительных опухолях зависит
от выбора границы рецептор-положительности — уровня рецепторов, начиная с
которого опухоль считают гормоночувствительной. На основании определения РП
с вероятностью 70-80% можно предсказать положительную реакцию на лечение
прогестинами (при РП-положительных опухолях) и с вероятностью 80-90% — на
отсутствие эффекта от этого лечения (при РП-отрицательных опухолях).Тем не менее определение рецепторов стероидных гормонов не входит в число
обязательных Л'есюъ при обследовании больных раком эндометрия. Это относится
и к раку предстательной железы, при котором определение рецепторов андрогенов
не является определяющим при решении вопроса о необходимости хирургической
либо лекарственной кастрации или других видов гормонотерапии,Фашры роста и их рецепторы - показатель способности
опухоли к автономному ростуЧувствительность к эндокринным стимулам свойственна, как правило, опухо¬
лям с достаточно высокой степенью дифференцировки, сохраняющим зависимость
от регуляторных воздействий со стороны организма или от внешних стимулов.
Между тем одной из фундаментальных особенностей всех высокозлокачествен¬
ных опухолей является способность к неограниченному автономному росту,
в основе этого свойства лежат эффекты факторов роста — белков или полипеп¬
тидов, продуцируемых опухолевыми клетками или другими компонентами опу¬
холевой ткани (фибробластами, макрофагами, эндотелиоцитами) и взаимодей¬
ствующих со специфическими рецепторами на поверхности клеток-продуцентов
(аутокринный механизм) или соседних клеток (паракринный механизм), стиму¬
лируя клеточное деление. Процесс передачи сигнала большинства факторов роста
в упрощенном виде можно представить как последовательное фосфорилирование
или дефосфорилирование трансмембранных и внутриклеточных белков, многие
из которых сами обладают ферментативной активностью. Распространение сиг¬
нала происходит путем последовательных воздействий одного белка в цепочке на
другой. Важнейшие внутриклеточные системы, участвующие в реализации эффек¬
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 661тов факторов роста, — это сигнальный путь, включающий фосфатидилинозитол-3-киназу (PI3K), ее эффектор серин-треониновую протеинкиназу Akt (протеинки-
казу В), и ras-Raf-сигнальный каскад, включающий систему митогенактивируемых
протеинкиназ (МАРК).Наиболее изученным и клинически реализованным является механизм дей¬
ствия сигнальной системы рецептора эпидермального фактора роста (РЭФР) и
родственных ему рецепторов семейства с-егЬВ, или HER {Human Epidermal growth
factor Receptor). В это семейство входят четыре белка — собственно РЭФР (ЕгЬВ-1,
HER1), а также ЕгЬВ-2 (HER2/neu). ЕгЬВ-3 (HER3) и ЕгЬВ-4 (HER4) - сходные по
структуре трансмембранные рецепторы, внутриклеточная часть которых обладает
тирозинкиназной активностью, т.е. способностью фосфорилировать различные
белки по входящему в их состав тирозину. Активация тирозинкиназных рецепто¬
ров происходит после связывания соответствующего фактора роста, образования
димера и аутофосфорилирования внутриклеточного домена. Существует доволь¬
но много лигандов рецепторов семейства с-егЬВ, наиболее изученными из них
являются эпидермальный и а-трансформирующий факторы роста, амфирегулин
и cripto, взаимодействующие только с РЭФР, а также херегулины (неурегулины),
взаимодействующие с ЕгЬВ-3 и ЕгЬВ-4.Наличие в опухоли молочной железы классического РЭФР (HER1), в особен¬
ности при отсутствии рецепторов стероидных гормонов, свидетельствует о небла¬
гоприятном прогнозе заболевания даже на ранних стадиях и о резистентности к
эндокринной терапии. Однако определение РЭФР не вошло в рутинную клини¬
ческую практику в качестве маркера общего прогноза или гормоночувствитель-
ности ни при РМЖ, ни при каких-либо других опухолях. Помимо рака молочной
железы, РЭФР присутствуют в 32-75% злокачественных опухолей. Чаще всего их
обнаруживают при немелкоклеточном раке легкого (НМРЛ), для которого про¬
демонстрировано значительное снижение безрецидивной и общей выживаемости
больных при уровне РЭФР более 20 фмоль/мг белка. Эти данные приобрели новое
практическое значение, когда на стадию клинических испытаний и практического
использования вышли препараты, специфически блокирующие активность РЭФР:
моноклональные антитела к рецептору [цетуксимаб (эрбитукс*)] и ингибиторы
его внутренней тирозинкиназы [гефитиниб (iressa*), эрлотиниб (tarceva*)], реа¬
лизующей первый этап передачи митогенного сигнала. Эти препараты уже реко¬
мендованы для лечения НМРЛ, а также опухолей головы и шеи, колоректального
рака и рака поджелудочной железы, в связи с чем вопрос об определении статуса
РЭФР перед их назначением вновь встал на повестку дня. Б то же время чувстви¬
тельными к антиРЭФР-направленным препаратам (в частности, к ингибиторам
тирозинкиназы) являются не все рецептор-положительные опухоли, а только те
из них, в которых имеется делеционная мутация L858R в тирозинкиназном домене
гена РЭФР. В связи с этим признана необходимость тестирования данной мутации
у РЭФР-положительных больных НМРЛ в качестве необходимого дополнитель¬
ного критерия чувствительности к ингибиторам тирозинкиназы.В то же время эффективное использование цетуксимаба (эрбитукса*) и подоб¬
ных препаратов при колоректальном раке ограничено только теми опухолями, в
которых отсутствуют специфические мутации в гене KRAS, кодирующем один из
ключевых нижележащих эффекторов РЭФР, потому что только опухоли с «диким»
типом этого гена чувствительны к препарату.HER2/NEU (C-ERBB-2) - МИШЕНЬ ДЛЯ СПЕЦИФИЧЕСКОЙ ТЕРАПИИПрорыв в области практического использования маркеров, связанных с РЭФР-
зависимой регуляцией роста опухолей, произошел после появления трастузумаба
(герцептина*), представляющего собой моноклональные антитела к рецептору2-го типа (HER2/neu) — ключевому звену передачи митогенных сигналов всех
662 БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ' ^ ЭФР-подобных пептидов. Роль HER2/neu объясняется тем, что у всех трансмем-I бранных рецепторных тирозинкиназ происходит димеризация для реализации
киназной активности и последующих биологических эффектов. При этом, после
связывания активирующего лиганда, рецепторы семейства с-егЬВ могут образовы-
вать как гомо-, так и гетеродимеры, а наиболее активными являются гетерострук¬
туры с участием НЕК2/пеи-рецептора. HER2/neu не только реализует мито генные
эффекты этого сигнального пути, но и вовлечен в процессы межклеточной комму¬
никации и адгезии, регуляции подвижности клеток и метастазирования, участвует
в неоангиогенезе.Блокирование HER2/neu может существенно замедлить или остановить рост
опухолей, зависимых от ЭФР-подобных стимулов, однако эффективное исполь¬
зование биологически активных препаратов предусматривает предварительную
оценку индивидуальной чувствительности больных к данному виду лечения, тем
более что НЕК2/пеи-положительными являются не более 30% РМЖ.Общепринятым методом оценки чувствительности больных РМЖ к трасту-
зумбу (герцептину*) является использование иммуногистохимического (ИГХ)
окрашивания опухолевых тканей на белок HER2/neu с последующей оценкой
амплификации гена с-егЪВ-2 методом флюоресцентной гибридизации in situ
(FISH), В тех спорных случаях, когда ИГХ-метод не дает строго положительного
(3+) или строго отрицательного ответа, HER2/neu — классический предсказатель¬
ный маркер для РМЖ. Прогностическое значение гиперэкспрессии HER2/neu или
амплификации гена с-егЬВ-2 утверждено тем, что с 2005 г. рекомендуют исследо¬
вать экспрессию (лучше — амплификацию) HER2/neu в числе других факторов
для формирования групп риска среди больных с ранними стадиями. Опухоли с
амплифицированным геном HER2/neu слабо реагируют на эндокринную терапию,
но чувствительны к последующей химиотерапии. При этом считают, что больным
с HER2/neu-пoлoжитeльными опухолями следует рекомендовать более интенсив¬
ные режимы химиотерапии с включением антрациклинов. Наличие у HER-2/neu
как внутриклеточной, так и экстраклеточной части приводит к тому, что в процессе
димеризации могут происходить деградация молекулы рецептора и миграция его
внешнего домена в межклеточную среду. Эта особенность и легла в основу раз¬
работки иммуноферментных систем для определения растворимого HER-2/neu
в сыворотке или плазме крови. Уже опубликованы результаты, свидетельствую¬
щие о перспективности этого направления, в первую очередь, для мониторинга
эффективности лечения трастузумабом (герцептином*). Тем не менее пока еще
существует необходимость дальнейшего набора материала и выработки четких
количественных критериев для внедрения этого теста в практику.АССОЦИИРОВАННЫЕ С ОПУХОЛЬЮ ПРОТЕАЗЫ - ПОКАЗАТЕЛЬ МЕТАСТАТИЧЕСКОГО
И ИНВАЗИВНОГО ПОТЕНЦИАЛА ОПУХОЛИФундаментальным свойством злокачественных опухолей является способность
к инвазии и метастазированию, важнейший механизм которых — разрушение
окружающей базальной мембраны и внеклеточного матрикса ассоциированными
с опухолью протеазами. Ключевым в этих процессах является протеолитиче-
ский каскад активации плазминогена в опухолевой ткани, а в многоступен¬
чатой цепочке протеаз, обеспечивающих разрушение внеклеточного матрикса,
ведущую роль играет активатор плазминогена урокиназного типа (иРА).
Важную роль играет также находящийся на поверхности клеток рецептор иРА
(uPAR), поскольку при связывании с ним способность иРА активировать плазми-
ноген увеличивается: секретируемый ферментативно неактивный одноцепочеч¬
ный предшественник про-иРА связывается с uPAR и превращается под действием
плазмина и некоторых других протеолитических ферментов в активную двухце¬
почечную молекулу. Активный иРА, в свою очередь, катализирует превращение
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 663плазминогена в плазмин, разрушающий компоненты опухолевой стромы, а также
активирующий металлопротеиназы. расщепляющие коллаген и другие компонен¬
ты базальной мембраны, что способствует метастазированию и инвазии опухолей.
В целом процесс образования плазмина представляет циклическую амплифика¬
цию, регулируемую по механизму обратной связи. Помимо иРА, в нем участвует
также активатор тканевого типа (tPA), роль которого в опухолях двояка и сводит¬
ся к разрушению опухолевых клеток и защите окружающих тканей. Активность
иРА и tPA подавляется двумя белковыми ингибиторами, принадлежащими к
семейству серпинов, — PAI-1 и RAI-2. Считается, что при опухолевом росте они
играют разную роль: PAI-1 защищает опухолевые клетки от саморазрушения, а
PAI-2 тормозит протеолитические процессы во внеклеточном матриксе. Различные
компоненты системы активации плазминогена могут находиться как на самих опу¬
холевых клетках, так и на фибробластах стромы, инфильтрирующих опухоль лим¬
фоцитах и макрофагах, эндотелиальных клетках. Именно поэтому считается, что
процесс активации плазминогена носит преимущественно паракринный характер.
Уровень и соотношение экспрессии компонентов системы активации плазминоге¬
на в опухолевой ткани могут служить показателем метастатической и инвазивной
активности опухоли, являясь вследствие этого биологически значимым фактором
прогноза.В репрезентативных исследованиях продемонстрирована высокая прогно¬
стическая значимость иРА и PAI-1 при раннем РМЖ. Многофакторный анализ
свидетельствует, что они являются независимыми факторами прогноза. Высокие
уровни иРА и РАМ являются независимыми факторами неблагоприятного про¬
гноза РМЖ без метастазов в лимфатических узлах, более значимыми, чем размер,
степень злокачественности и рецепторный стат^'^с опухоли и возраст пациенток.
В связи с этим определение иРА и РАМ у больных в ранних стадиях РМЖ можно
рекомендовать для выявления подгрупп с повышенным риском рецидивирования
и метастазирования, требующих более интенсивного лечения и наблюдения.Протеазы, матриксные металлопротеиназы (ММП), активация которых
является конечным звеном в разрушении внеклеточного матрикса, иницииро¬
ванном плазминогеновым каскадом, стали мишенями препаратов, проходящих
различные фазы клинических испытаний. Однако определение ММП в качестве
биологических маркеров различных опухолей или критериев чувствительности к
ингибиторам протеаз находится еще на стадии предклинического лабораторного
изучения.ФАКТОР РОСТА ЭНДОТЕЛИЯ СОСУДОВ - ПОКАЗАТЕЛЬ АКТИВНОСТИ
НЕОАНГИОГЕИЕЗАВажную роль в регуляции опухолевой прогрессии играют факторы, стимули¬
рующие неоангиогенез, поскольку опухоль не может развиваться и расти без обра¬
зования в ней разветвленной сети капилляров, обеспечивающих снабжение клеток
кислородом и питательными веществами. Изучение молекулярных механизмов
ангиогенеза позволило перейти от микроскопической оценки плотности сосудов в
опухолевой ткани к исследованию конкретных молекул, участвующих в регуляции
образования и роста новых сосудов. Продемонстрировано наличие целого ряда
регуляторных ангиогенных и антиангиогенных факторов, динамический баланс
которых обеспечивает формирование и распространение новых сосудов внутри
опухоли. В регуляции ангиогенеза участвуют факторы роста и цитокины, такие как
основные и кислые факторы роста фибробластов, эпидермальный фактор роста,
а- и р- трансформирующие факторы роста, тромбоцитарный фактор роста эндоте¬
лиальных клеток, фактор некроза опухоли, многие интерлейкины и др. Ключевым
положительным регулятором неоангиогенеза является фактор роста эндотелия
сосудов (VEGF/VEGF-A/VPF) — белок, индуцирующий активный рост клеток
664 БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙэндотелия и формирование новых капилляров. Биологические эффекты VEGF-A
опосредуются его рецепторами VEGFR-1/Flt-l и VEGFR-2/Flk-l/KDR.В клинических исследованиях показано, что экспрессия VEGF имеет суще¬
ственное значение для прогноза заболевания при раке молочной железы, а также
влияет на чувствительность опухолей к гормональному и лекарственному лече¬
нию. Его высокий уровень свидетельствует о неблагоприятном прогнозе как при
раннем, так и при распространенном РМЖ. Кроме того, некоторые компоненты
сигнального пути VEGF рассматриваются как перспективные мишени противо¬
опухолевой терапии, особенно активно исследуются возможности подавления
роста опухоли с помощью антител к VEGF [бевацизумаб (авастин*)] и специфи¬
ческих ингибиторов тирозинкиназ VEGFR-1 и VEGFR-2 [например, сунитиниб
(сутент*)].ВЫСОКОТЕХНОЛОГИЧНЫЕ ПОДХОДЫ К ИССЛЕДОВАНИЮ КОМПЛЕКСА
БИОЛОГИЧЕСКИХ МАРКЕРОВИспользование технологии микрочипов позволяет одновременно исследовать
амплификацию, экспрессию или транскрипцию многих тысяч генов и создавать
«молекулярные портреты» или «генные подписи» опухолей. Появление таких
высокотехнологичных методик с огромной пропускной способностью и высокой
чувствительностью, позволяющей работать с очень небольшим количеством мате¬
риала, должно в ближайшие годы произвести революцию в области исследования
биологических маркеров. К их недостаткам следует отнести сложность стандарти¬
зации исследований, в частности получения качественного материала для иссле¬
дования, трудности интерпретации результатов одновременного определения
большого количества различных показателей, которое абсолютно невозможно без
использования специальных компьютерных программ.Разработано несколько систем классификации РМЖ на основе «генных под¬
писей» — ограниченного набора генов, позволяющих выделять подгруппы боль¬
ных с различными прогнозом и чувствительностью к отдельным видам терапии.
Однако пока ни одна из «генных подписей» не вошла в число международно при¬
знанных рекомендаций. Одна из наиболее известных систем, базируемая на ана¬
лизе экспрессии 70 генов, — так называемая Амстердамская «70-генная подпись»
(MammaPrinf^), проходит клинические испытания по международной программе
Microarray for Node Negative Disease may Avoid ChemoTherapy (MINDACT) (EORTC
10041/ BIG 3-04 — с начала сентября 2006 г.). Б этом проспективном рандоми¬
зированном исследовании эффективность классификации с помощью данной
«генной подписи» будет сопоставлена с эффективностью клинических критериев.
Предполагается, что для получения достоверного результата в программу необхо¬
димо включить не менее 6000 больных. Другая достаточно стандартизированная
система — «подпись», состоящая из 21 гена (OncotypeDX), хотя и используется уже
в некоторых зарубежных клиниках для формирования прогностических индексов
и корректировки схем лечения, но в число обязательных тестов, рекомендуемых
международными организациями, также не вошла. Она проходит масштаб¬
ные клинические испытания в рамках американской программы TAILORx {Trial
Assigning Individualized Options for treatment /Rx/). В этом исследовании участвуют
более 10 ООО женщин, проходящих лечение в 900 медицинских учреждениях США
и Канады.Таким образом, благодаря успехам биохимии, молекулярной биологии и био¬
технологии, в арсенале исследователей и клиницистов имеется большое количе¬
ство биологически значимых показателей, которые могут помочь в прогнозе и
выборе адекватной лечебной тактики и схем терапии больных РМЖ на разных
стадиях заболевания. Тем не менее большинство молекулярных маркеров пока
еще не вошли в рутинную практику, что определяется высокой стоимостью подоб-
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 865ных исследований, сложностью интерпретации данных одновременного анализа
многих факторов и недостаточным уровнем доказательности для большинства
тестов.Для рутинного клинического использования международные организа¬
ции рекомендуют лишь несколько биологических маркеров РМЖ, эффектив¬
ность и полезность которых имеет достаточно высокий уровень доказательности,
а именно:• определение рецепторного статуса (РЭ и РП) у всех первичных больных для
решения вопроса о целесообразности назначения эндокринной терапии и
включения в комплекс прогностических факторов;• оценку экспрессии (амплификаций гена) HER2/neu у больных распростра¬
ненным раком, если планируется лечение трастузумабом (герцептином*),
или у больных в ранних стадиях рака для включения в комплекс прогности¬
ческих факторов;• определение опухолевой концентрации PAI-1 и/или иРА, а также двух
«генных подписей» {MammaPrinf^'*^ и Oncotype DX) для выявления группы с
повышенным риском рецидивирования и метастазирования среди больных с
ранними стадиями и определения тактики лечения находятся в стадии окон¬
чательной оценки.в особых случаях, когда планируется лечение антиРЭФР-препаратами, актуаль¬
ным становится исследование мутаций генов с-егЬВ1 и KRAS.В целом спектр молекулярно-биологических исследований в каждом конкрет¬
ном случае зависит от стадии заболевания, возраста больного, планируемой тера¬
пии и материально-технической базы учреждения.СЕРОЛОГИЧЕСКИЕ ОПУХОЛЬАССОЦИИРОВАННЫЕ
МАРКЕРЫОпухольассоциированными или просто опухолевыми маркерами (ОМ) в лабо¬
раторной диагностике называют вещества, концентрация которых в биологиче¬
ских жидкостях (крови, моче, содержимом кист, асцитической жидкости и др.)
указывает на развитие опухолевого процесса, дает дополнительную информа¬
цию о степени его распространенности и эффективности проведенной терапии.
Периодическое исследование ОМ после окончания лечения позволяет заподо¬
зрить развитие рецидива опухоли раньше традиционно используемых в онкологии
методов функциональной диагностики.В большинстве случаев ОМ — это сложные белки или пептиды, синтезируемые
опухолевыми клетками или окружающими опухоль нормальными клетками в
повышенных концентрациях, обнаруживаемые в тканевых жидкостях органа,
пораженного опухолью. Описано большое количество ОМ, повышение уровня
которых в сыворотке крови ассоциировано с развитием опухолевого процесса
разного генеза, однако в онкологической клинике широко применяют не более 20
из них. Основные методы определения уровня ом в сыворотке крови — иммуно-
ферментный (ИФА), иммунохемилюминесцентный (их л А) и радиоиммуноло-
гический (РИА). Все они основаны на использовании специфических антител к
соответствующим белкам.До настоящего времени нет общепринятой единой классификации ОМ: их делят
в соответствии с тканевой или органной принадлежностью, химической приро¬
дой, происхождением и функциональной характеристикой. Некоторые маркеры,
используемые в мониторинге и дифференциальной диагностике опухолей основ¬
ных локализаций, представлены в табл. 9-2, наиболее информативные из них
выделены жирным шрифтом.
666БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙЖТаблица 9-2. Маркеры опухолей основных локализацийЛокализацияРак предстательной железыОпухоли яичников:• эпителиальные• герминогенные• гранулезоклеточныеОпухоли яичекРак легкого:• мелкоклеточный• плоскоклеточный• аденокарцинома• крупноклеточныйГбпатоцеллюлярный ракРак щитовидной железы:* фолликулярный, папиллярный• медуллярныйРак молочной железыРак шейки маткиРак желудкаРак толстой кишкиРак поджелудочном железыРак мочевого пузыряРак почкиМеланомаОпухолевые маркерыпса,,,.пса,/пса„,.СА125
3-ХГЧ, АФП
Ингибин Вр-ХГЧ, АФПНСЕ, proGRP. АКТГ
CYFRA 21-1, SCC
Cyfra21-1
CYFRA 21-1, SCCАФПТиреоглобулин, ТТГ
Кальцитонин, РЭАСА15-3. РЭАSCC, TPSСА72-4, РЭА, СА 19-9РЭА, СА 19-9. СА 72-4, Tu М2-РКСА 19-9, СА 242, Tu М2-РКиве. ВТА, SCCTu М2-РК. seeS-100При биологической классификации ОМ учитывают их химическую структуру,
функции в клетках, роль в эмбриогенезе:• онкоэмбриональные и онкоплацентарные антигены (РЭА, АФП, {З-ХГЧ,
ТБГ);• опухольассоциированные гликопротеины (СА 125, СА 19-9, СА 15-3,
СА 72-4, СА 242, SCC);• ферменты (ПСА, НСЕ, Tu М2-РК);• цитокератины (UBC, Cyfra 21-1, ТРА, TPS);• гормоны и их предшественники, биогенные амины, стероиды (ингибин В,
кальцитонин, хромогранин А, АКТГ, ТГ, ТТГ, proGRP, серотонин, 5-ОИУК,
катехоламины, кортизол и др.).Диагностическая значимость серологического ОМ определяется его чувстви¬
тельностью и специфичностью. Чувствительность ом — процентное выражение
частоты истинно положительных результатов теста в группе онкологических
больных. Специфичность ом представляет собой процентное выражение частоты
истинно отрицательных результатов теста в группе здоровых людей и пациентов с
доброкачественными заболеваниями. До настоящего времени ни одного маркера
с абсолютными специфичностью и чувствительностью не найдено. Концентрации
известных сейчас ОМ могут повышаться при доброкачественных процессах и
воспалительных заболеваниях, но, как правило, в меньшем проценте случаев и в
значительно меньших концентрациях, чем при онкологических заболеваниях.Дискриминационный уровень (ДУ) серологического ОМ - допустимая верхняя
граница концентрации маркера у здоровых людей. Маркер удовлетворяет требова¬
ниям опухолевого, если при заданном ДУ его специфичность составляет не менее
90-95%, а чувствительность превышает 50%. Переходная, или «серая», зона —
это диапазон концентраций ОМ, в который попадают значения, характерные для
пациентов с доброкачественными опухолями, воспалительными и иными неонко-
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 067логическими заболеваниями, а также небольшая доля больных со злокачествен¬
ными новообразованиями, т.е, дифференциальная лабораторная диагностика «по
маркеру» в этой зоне затруднена. В то же время это зона онкологического риска.
При значениях маркера ниже этой зоны вероятность иметь рак мала, а выше —
велика.Простатоспецифический антигенПростатоспецифический антиген (ПСА) — гликопротеин с молекулярной
массой 34 кДа, выделенный из экстракта предстательной железы человека. ПСА
вырабатывается главным образом эпителиальными клетками предстательной
железы и секретируется в семенную жидкость в незначительных количествах.
ПСА обнаруживают и в других органах (парауретральных железах, молочной
железе, эндометрии, слюнных железах) и тканевых жидкостях. Этот белок явля¬
ется сериновой протеазой семейства калликреинов. Экзокринная функция ПСА
заключается в разжижении эякулята и увеличении подвижности спермы. Период
полувыведения ПСА составляет 2-3 дня. В сыворотке крови ПСА находится в двух
формах: свободной и связанной с ингибиторами протеаз; большая часть его (65-
95%) связана с аз^-антихимотрипсином и незначительное количество (1-2%) — с
а^-макроглобулином. Диагностическое значение в онкологии имеет определение
как общего ПСА (ПСА^,^), включающего обе формы маркера, так и соотношение
свободного ПСА (nCA^J и ПСА^^^ Период полувыведения ПСА^^ составляет 7 ч.Дискриминационный уровеньДискриминационный уровень (ДУ) ПСА^^^ для разных возрастных групп
может различаться (табл. 9-3). Концентрация этого маркера может увеличиваться
с годами из-за доброкачественных гиперпластических процессов в предстательной
железе.Таблица 9-3. Дискриминационный уровень ПСА в разных возрастных группахЛабораторный показательВозраст, годы40-4950-5960-691 0-79ПСА,нг/мл0-2,50-3,50-4,50-6,5в исследованиях, направленных на выявление рака предстательной железы
(РПЖ), показано, что среди мужчин старше 60 лет с уровнем ПСА^^,,^ менее 4 нг/мл
достаточно велика доля пациентов, имеющих непальпируемый РПЖ. Именно поэто¬
му в рекомендациях Европейской ассоциации урологов (2007) предлагается исполь¬
зовать в клинической практике для ПСА^^ ДУ, равный 2,5 нг/мл. Для свободного
ПСА в соответствии с рекомендациями Европейской ассоциации урологов (2007)
используют следующие пороговые значения доли ПСА^^ для здоровых людей:• при nCA^gj^ менее 4 нг/мл ДУ доли ПСА^^ составляет более 10%:• при nCA^jj^ в диапазоне 4-10 нг/мл ДУ доли ПСА^ - более 20-25%.
Снижение доли ПСА^^ служит обоснованием для углубленного обследования, втом числе с мультифокальной пункцией предстательной железы.Причины повышения nCA^g• Рак предстательной железы (РПЖ).• Причины повышения nCA^g^^, не связанные с РПЖ:❖ доброкачественная гиперплазия предстательной железы (ДГПЖ);❖ простатит;<>■ инфаркт или травма предстательной железы;^ цистоскопия;❖ биопсия предстательной железы.
668 БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙПричины повышения ПСА^^, не связанные с РПЖ• Механическое раздражение предстательной железы (исследование per
rectum).• Эякуляция.Показания к исследованию• Ранняя (скрининг) и уточняющая диагностика РПЖ.• Дифференциальная диагностика РПЖ и ДГПЖ.• Контроль при радикальной простатэктомии у больных РПЖ.• Оценка эффективности консервативной терапии РПЖ.• Мониторинг больных РПЖ в целях доклинического выявления рецидивов
РПЖ.• Мониторинг пациентов с ДГПЖ в целях оценки эффективности проводимого
лечения и выявления возможного процесса малигнизации.Клинико-диагностическая значимость простатоспецифического антигенаПСА широко используют в диагностике РПЖ, при уточнении стадии про¬
цесса, оценке эффективности лечения и доклиническом выявлении рецидивов.
Диагностическая чувствительность ПСА ~ менее 100%, поэтому у части больных
(до 20%) с морфологически подтвержденным РПЖ уровень ПСА^Дщ может быть
менее 4 нг/мл. при уровне ПСА^Дц^ выше J0 нг/мл биопсию выполняют независи¬
мо от результатов пальцевого ректального обследования.Наибольшие трудности возникают при дифференциальной диагностике РПЖ с
ДГПЖ при уровнях маркера в диапазоне 4-10 нг/мл («серая» зона) и нормальных
данных пальцевого ректального обследования. Для повышения специфичности
лабораторной диагностики в выявлении РПЖ у пациентов с уровнями маркера
в «серой» зоне используют дополнительные параметры. Такими являются соот¬
ношение ПСА^ к ПСА^„, (не зависит от возраста), плотность ПСА, скорость
увеличения nCAy^j^ во времени. Введение соотношения ПСА^УПСА^Щ основа¬
но на том, что при развитии РПЖ снижается доля ПСА^^ и увеличивается доля
ПСА, связанного с а^-антихимотрипсином, и в итоге соотношение nCA^ynCA^g^
снижается. Кроме того, для улучшения дифференциальной диагностики РПЖ у
пациентов со значениями ПСА, находящимися в «серой» зоне, и нормальными
результатами пальцевого ректального обследования используют дополнительный
показатель — плотность ПСА. Ее рассчитывают как отношение уровня ПСА^^^ к
объему предстательной железы, определенному с помощью УЗИ. При отсутствии
в предстательной железе узловых образований и уровне ПСА^^^ в «серой» зоне
плотность ПСА не должна превышать 0,15 нг/'мл на 1 см^ железы.Кроме РПЖ, уровень ПСА^(5^ц может повышаться при простатитах и ДГПЖ,
поэтому в скрининговые программы, направленные на раннее выявление РПЖ,
включен дополнительный критерий — скорость увеличения ПСА^щ во време¬
ни. Этот параметр, согласно рекомендациям Европейской ассоциации урологов
(2007), не должен превышать в норме 0,6 нг/мл. В противном случае обследуемый
попадает в группу риска развития РПЖ. Для того чтобы дифференцировать повы¬
шение уровня ПСА, вызванное воспалительным процессом, от увеличения марке¬
ра, обусловленного РПЖ, рекомендуют повторное определение ПСА после курса
антибактериальной терапии.Использование общего простатоспецифического антигена для динамического
наблюдения больных раком предстательной железы после проведенного леченияnCA^g^ широко применяют для мониторинга РПЖ после радикального лече¬
ния. Поскольку ПСА является органоспецифическим белком, после радикальной
простатэктомии его уровень должен упасть до биологического предела опреде¬
ления и составлять менее 0,1 нг/мл. У таких больных рекомендуют измерять
уровень ПСА через 90 дней после операции, затем 1 раз в 3 мес в течение первого
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 6S9года, в последующие три года — 1 раз в 6 мес и далее — ежегодно. У пациентов
с положительным краем резекции или метастазами в регионарных лимфоузлах
для выработки тактики лечения первое определение уровня рекомендуютвыполнять раньше — спустя 1 мес после операции. При динамическом наблюде¬
нии за больными РПЖ первым показателем, указывающим на возможное развитие
рецидива болезни, является увеличение уровня ПСА^д^ в двух последовательных
его определениях, по крайней мере, в 2 раза по сравнению с послеоперационной
концентрацией. Б большинстве клиник в качестве ДУ nCA^g^ для выявления био¬
химического (маркерного) рецидива РПЖ у больных после простатэктомии при¬
нята величина, равная 0,2 нг/мл.Критерием эффективности лучевой терапии при РПЖ до недавнего времени
считали уменьшение уровня ПСА^д^^ через 1 мес после нее не менее чем на 50%
исходного, в рекомендациях Европейской ассоциации урологов (2007) отмечает¬
ся, что уровень nCA^g^ менее 0,5 нг/мл, достигнутый в результате лучевой тера¬
пии у больного РПЖ, является показателем ее эффективности. Однако интервал
времени до минимального снижения ПСАд(5щ может составить несколько лет.
В настоящее время предлагается принимать за критерий неэффективности луче¬
вой терапии повышение уровня nCA^g^ на 2 нг/мл относительно самого низкого
значения маркера, достигнутого в результате данного вида лечения.При гормонотерапии у больных РПЖ оценка уровня ПСА^^ должна осущест¬
вляться каждые 3 мес для выявления случаев первичной или приобретенной рези¬
стентности к лечению в целях коррекции его тактики.Методы исследования — ИФА, РИА, ХМЛА.Объект исследования — сыворотка крови.Требования к пробе. Сыворотку хранят при +4 ”С до 24 ч, при -20°С — до 6°мес.
Нельзя допускать повторных циклов замораживания-оттаивания. Для того чтобы
исключить возможность ложных результатов, взятие крови на анализ (ПСА^д^
и nCA^J следует осуществлять до или спустя 5-6 дней после исследования per
rectum, трансректального УЗИ, тепловых процедур и различных механических
воздействий. После биопсии предстательной железы и цистоскопии взятие крови
на анализ ПСА проводят не ранее чем через 3-4 нед.СА125СА 125 — гликопротеиновый эпитоп (молекулярная масса — 200 кДа) высоко¬
молекулярного муцина. СА 125 относят к классу онкоэмбриональных белков; его
выявляют в эпителии серозных оболочек плода и тканях — производных эпите¬
лия. У взрослых людей его экспрессия в следовых количествах сохраняется в мезо-
телии брюшной и плевральной полости и перикарда. Основной источник СА 125
у здоровых женщин — эндометрий, что обусловливает изменение величины этого
ом в процессе менструального цикла. Период полувыведения СА 125 составляет4-6 дней.Дискриминационный уровеньУ 95% здоровых людей уровень СА 125 в сыворотке крови не превышает 35 ЕД/мл.
Для женщин в постменопаузе ДУ СА 125 ниже 20 ЕД/мл, что обусловлено
инволютивно-атрофическими изменениями эндометрия. У больных раком яични¬
ков (РЯ) после комбинированного лечения уровень СА 125 не должен превышать
нормальных значений.Причины повышения СА 125 (кроме рака яичников)• Воспалительные процессы органов малого таза, острый панкреатит, гепатит,
пневмония, почечная недостаточность, цирроз. СА 125 (как и большинство
ОМ) проявляет некоторые свойства острофазного белка.
670БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ• Беременность, особенно I триместр.• Менструация: уровень СА 125 минимален в первую фазу менструально¬
овариального цикла и возрастает с увеличением толщины эндометрия во вто¬
рую фазу, становясь больше верхней границы нормы во время MeHCTp3»^a4HH.• Заболевания, сопровождаемые вовлечением в процесс серозных оболочек, —
экссудативный плеврит, перикардит, асцит разной этиологии, перитонит,• Доброкачественные опухоли и кисты яичников.• Некоторые первичные и метастатические злокачественные опухоли других
локализаций.Показания к исследованию• Прогноз течения опухолевого процесса, контроль эффективности проведен¬
ного лечения и мониторинг больных серозным РЯ с целью доклинического
выявления рецидива.• Дифференциальная диагностика РЯ у женщин при образованиях в яичниках,
выявленных с помощью УЗИ,• Скрининг, направленный на раннее выявление РЯ (в комбинации с трансва¬
гинальным УЗИ), прежде всего среди женщин с отягощенной наследственно¬
стью и в постменопаузе.• Оценка эффективности оперативного лечения больных с доброкачественны¬
ми опухолями и кистами яичников.Клинико-диагностическая значимость СА 125Диагностическая чувствительность СЛ125 для РЯ колеблется от 42 до 99% в зави¬
симости от стадии (при III-IV стадии близка к 100%). Ограничение использования
СА 125 для диагностики РЯ — низкая его чувствительность (<50%) для I стадии
болезни и низкая специфичность, особенно у молодых женщин. Однако результаты23 крупномасштабных рандомизированных скрининговых исследований, в которых
приняли участие 250 ООО женщин, позволяют предположить целесообразность скри¬
нинга, основанного на оценке СА 125, с целью раннего выявления РЯ среди женщин в
менопаузе, а также у пациентов с отягощенным семейным анамнезом по РЯ.Устойчивое повышение уровня СА 125 у леченых больных РЯ, находящихся
в стадии ремиссии, свидетельствует о развитии рецидива. Промежуток времени
между началом увеличения маркера и клиническим выявлением рецидива коле¬
блется от 1 до 8 мес (в среднем 4,7 мес). Чувствительность СА 125 при выявлении
рецидива серозного РЯ составляет около 97%. Уровень СА 125 целесообразно
использовать для контроля эффективности лечения РЯ. Чем ниже уровень СА 125,
достигнутый в процессе комбинированного лечения больных РЯ. тем длиннее без-
рецидивный период. Наилучшим считают прогноз, если после операции уровень
с А 125 не будет превышать 10 нг/мл.Мониторинг больных с доброкачественными образованиями и кистами яич¬
ников, эндометриозом, а также злокачественными новообразованиями других
локализаций (с исходно повышенным уровнем СА 125) оправдан в целях оценки
эффективности лечения и доклинического выявления развития рецидивов.Методы исследования — ИФА, РИА, ХМЛА.Объекты исследования — сыворотка крови, асцитическая жидкоаь.Требования к пробе. Сыворотку крови/асцитическую жидкость хранят при +4 °С до24 ч, при -20 °С - до 6 мес. Не следует допускать повторных циклов замораживания-
оттаивания. Для того чтобы исключить возможность ложноположительных резуль¬
татов у женщин детородного возраста, взятие крови на анализ следует осуществлять
в первую фазу менструально-овариального цикла (7-8-й день).При изучении маркера в динамике у больных РЯ в период ремиссии переход
с одной тест-системы на другую нежелателен. В случае вынужденного перехода
необходимо последнюю сыворотку исследовать с помощью двух тест-систем.
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 671НЕ4НЕ4 принадлежит к семейству ингибиторов протеиназ. Это кислый глико¬
протеин с четырьмя дисульфидными связями и молекулярной массой 25 кДа.
Биологические функции НЕ4 точно неизвестны. Предполагают, что он обладает
антипротеиназной активностью, но протеиназа-мишень неизвестна. Возможно, он
обладает антимикробной и противовоспалительной активностью.НЕ4 экспрессируется в нормальном эпителии репродуктивных органов, верх¬
них дыхательных путей и поджелудочной железы. Повышенная продукция белка
выявлена при раке яичника и эндометрия, редко — при распространенной форме
аденокарциномы легких. Важно, что в нормальной ткани яичника наблюдается
только минимальная экспрессия гена, кодирующего НЕ4. У пациенток с доброка¬
чественными гинекологическими заболеваниями, эндометриозом, кистозом яич¬
ников также не наблюдается повышения уровня НЕ4. Гиперэкспрессия маркера
выявляется уже на ранних стадиях развития опухоли. При изучении многочислен¬
ных известных маркеров НЕ4 продемонстрировал наибольшие чувствительность и
специфичность для рака яичников, особенно на ранней стадии заболевания.НЕ4 и СА 125 - независимые маркеры и хорошо дополняют друг друга.
Сочетанное определение двух (СА 125 и НЕ4) маркеров значительно повышает диа¬
гностическую значимость теста для ранней диагностики РЯ и дифференциальной
диагностики доброкачественных и злокачественных образований малого таза.Разработан алгоритм расчета риска злокачественной опухоли яичника (Risk
of Ovarian Malignancy Algorithm — ROMA) для оценки риска эпителиального рака
яичника у женщин в пре- и постменопаузе при выявлении образований малого
таза на УЗИ.В алгоритме учитываются результат УЗИ, значения концентраций НЕ4 и СА 125,
а также менопаузальный статус пациентки. Это позволяет разделить пациенток на
группы высокого (86% РЯ I+II стадии и 99% РЯ III+IV стадии или 94% РЯ I-IV ста¬
дии) и низкого (75% пациенток без рака яичника) риска рака яичника на основании
рассчитанного значения ROMA. Эффективность использования ROMA определяли
в проспективном двойном слепом клиническом многоцентровом исследовании.НЕ4 может быть использован для мониторинга эффективности терапии.
Положительное изменение уровня НЕ4 определено как повышение значения не
менее чем на 25% по сравнению с предыдущим результатом тестирования. При
таком изменении учитываются и воспроизводимость метода, и биологические
колебания. Корреляция с прогрессией заболевания наблюдается у более 80%
пациенток с положительными изменениями уровня НЕ4. В 75% случаев отсут¬
ствие значительных изменений уровня НЕ4 совпадает с отсутствием прогрессии.Раково-эмбриональный антигенРаково-эмбриональный антиген (РЭА) - гликопротеин с молекулярной массой
180 кДа, относится к классу онкоэмбриональных маркеров. У плода он синтезиру¬
ется в клетках слизистых оболочек желудка и кишечника. После рождения про¬
дукция данного антигена резко снижается. Период полу выведения составляет от2 до 8 дней.Дискриминационный уровеньВерхняя граница нормы составляет 3-5 нг/мл (в зависимости от тест-системы),
для курильщиков возможны повышенные уровни (до 10 нг/мл).Причины повышения РЭА• Злокачественные аденогенные опухоли.<> Колоректальный рак.
672БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ<> Рак поджелудочной железы.❖ Рак желудка.^ Рак молочной железы.❖ Рак легкого (аденокарцинома и крупноклеточный).Рак эндометрия.Рак яичников.• Другие заболевания.❖ Патология печени (гепатит, цирроз).Патология легких (пневмония, бронхит, туберкулез, эмфизема, муковис-цидоз).Панкреатит, язвенный колит.❖ Болезнь Крона,Аутоиммунные заболевания.Показания к исследованию• Прогноз опухолевого процесса и дополнительная информация для уточнения
стадии заболевания (так как уровень РЭА до лечения отражает объем опухо¬
левой массы).• Оценка эффективности лечения у больных аденогенным раком (прежде всего
колоректальным, молочной железы, желудка, легкого и др.) с исходно повы¬
шенным уровнем РЭА.• Мониторинг больных аденогенным раком с целью доклинического выявле¬
ния развития рецидивов.Клинико-диагностическая значимость раково-эмбрионального антигенаРЭА является прежде всего маркером колоректального рака, в зависимо¬
сти от стадии опухолевого процесса его уровень повышен у 20-90% больных.
Предоперационный уровень РЭА может отражать объем опухоли и служить фак¬
тором прогноза опухолевого процесса (длительности безрецидивного периода и5-летней выживаемости).Концентрацию РЭА, превышающую ДУ, выявляют в 22-50% случаев при аде-
ногенных новообразованиях желудка, молочной железы, женских половых орга¬
нов и легкого. Наибольшей чувствительности для опухолей органов желудочно-
кишечного тракта удается достичь при использовании трех ОМ: РЭА, СА19-9 и СА
72-4. РЭА — один из наиболее чз^ствительных маркеров гематогенных метастазов
аденогенных карцином. Особенно высок уровень при метастазах в кости, печень,
легкие. Вследствие наличия у РЭА свойств острофазного белка он малопригоден
для дифференциальной диагностики в онкологии. РЭА успешно используют в
мониторинге больных аденогенным раком для оценки эффективности лечения и
доклинического выявления рецидивов опухолей.Методы исследования — ИФА, РИА, ХМЛА.Объект исследования — сыворотка крови.Требования к пробе. Сыворотку крови следует хранить при +4 “С до 24 ч, при
-20 — до 6 мес. Нельзя допускать повторных циклов замораживания-оттаи-
вания. Необходима осторожность при взятии, а также работе с тестируемыми
образцами, так как контаминация слюной может приводить к повышению концен¬
трации РЭА в образце.а-ФетопротеинАФП — онкоэмбриональный антиген, а-глобулин с молекулярной массой
70 кДа, имеющий структурное сходство с альбумином. ВI триместре беременности
АФП является физиологическим продуктом желточного мешка, а с 13-й недели
вырабатывается печенью плода. Основная функция АФП в период эмбрионально-
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 673ГО развития — транспортная. АФП обнаруживают в сыворотке крови плода, начи¬
ная с 4-й недели беременности, концентрация достигает пика между 12-13-й неде¬
лями. Затем содержание его постепенно снижается, достигая нормального уровня
(менее 15 нг/мл) у годовалого ребенка. Период полувыведения - 4-5 дней.Дискриминационный уровеньУровень АФП в сыворотке крови взрослого человека (вне зависимости от воз¬
раста и пола) не превышает 15 нг/мл.Причины повышения АФП• Злокачественные новообразования.❖ Первичный гепатоцеллюлярный рак.❖ Герминогенные опухоли (эмбриональный рак, незрелая тератома, опу¬
холи эндодермального синуса) любых локализаций (яичников, яичка,
средостения).❖ Рак желудка, кишечника, желчного пузыря, поджелудочной железы, лег¬
кого (в небольшом проценте случаев).• Неопухолевые заболевания.<> Заболевания печени (вирусный гепатит, цирроз).❖ Болезнь Крона.<0- Хроническая почечная недостаточность.• Пороки развития ЦНС и хромосомные аномалии плода.Показания к исследованию• В онкологии.Диагностика первичного гепатоцеллюлярного рака (ГЦР).<{> Оценка эффективности лечения больных первичным ГЦР.❖ Диагностика герминогенных опухолей (в сочетании с р-ХГЧ).<0- Мониторинг больных с герминогенными опухолями с целью доклиниче¬
ского выявления развития рецидивов.• в других областях.❖ Наблюдение за больными с хроническим гепатитом В и циррозом печени
для выявления возможной малигнизации.❖ Пренатальный скрининг (в целях выявления аномалий развития плода).
Наличие у плода пороков развития ЦНС сопровождается значительным
повышением концентрации АФП в сыворотке крови беременной во II
триместре. Напротив, в сыворотке крови беременных плодом с синдромом
Дауна средний уровень АФП во II триместре понижен.Клинико-диагностическая значимость а-фетопротеина в онкологииВ онкологии АФП является надежным маркером ГЦР (уровень повышен у 90%
больных). Исследование АФП целесообразно использовать в комплексе диагно¬
стических методов при первичном ГЦР и для мониторинга больных, у пациентов
с циррозом печени, хроническим HBsAg-позитивным гепатитом необходимо
исследовать сыворотку крови на содержание АФП с целью раннего выявления
гепатоцеллюлярного рака.В 10-15% случаев уровень АФП повышается при метастазах в печени опухо¬
лей разных локализаций. У таких пациентов целесообразно использовать его для
оценки эффективности специфического лечения. Высокие сывороточные уровни
АФП характерны для пациентов с герминогенными опухолями яичников (эмбрио¬
нальным раком, незрелой тератомой, опухолями эндодермального синуса) и
яичка. Обнаружена прямая зависимость между концентрацией АФП и стадией
болезни у первичных больных. Исходные уровни АФП коррелируют с прогнозом
течения заболевания. АФП целесообразно использовать в комплексе диагности¬
ческих методов для мониторинга больных с герминогенными опухолями с целью
доклинического выявления рецидивов.
874 БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙМетоды исследования ~ ИФА, РИА, ХМЛА.Объекты исследования — сыворотка крови, плевральная жидкость, асцитиче¬
ская жидкость, кистозная жидкость (яичник), желчь, амниотическая жидкость.Требования к пробе. Сыворотку крови хранят при +4 °С до 24 ч, при -20 С — до
^ мес.Хорионический гонадотропин человекаХорионический гонадотропин человека (ХГЧ) — гонадотропный гормон пла¬
центы, по химическому строению является гликопротеином, состоящим из двух
субъединиц. сс-Субъединица ХГ полностью гомологична а-субъединицам лютеи-
низирующего (ЛГ), фолликулостимулирующего (ФСГ) и тиреотропного (ТТГ)
гормонов гипофиза. р-Субъединица ХГЧ уникальна именно для этого гормона,
отличает его от ЛГ, ФСГ и ТТГ, именно ее используют как в качестве опухолевого
маркера, так и в диагностике и мониторинге беременности.р-ХГЧ — гликопротеин с молекулярной массой 40 к Да, секретируется нормаль¬
ной тканью плаценты и хориона, пролиферирующими клетками трофобласта (при
пузырном заносе), а также клетками хориокарциномы. Период полувыведения3-ХГЧ - 1,5-2,5 дня.Дискриминационный уровеньСодержание |3-ХГЧ в сыворотке крови мужчин и небеременных не превышает5 МЕ/мл, пограничные значения — 5-10 МЕ/мл,Причины повышения р-ХГЧ• Беременность.• Пузырный занос.• Хориокарцинома матки, яичников.• Герминогенные опухоли яичников (дисгерминома, полиэмбриома, эмбрио¬
нальный рак).• Семинома яичка.Причины понижения р-ХГЧ• Недостаточность функции плаценты.• Эктопическая беременность.Показания к исследованию• Беременность (диагностика и мониторинг),• Подозрение на пузырный занос.• Подозрение на хориокарциному.• Оценка эффективности лечения пациентов с трофобластической болезнью.• Мониторинг пациентов с трофобластической болезнью в целях выявления
рецидива заболевания.• Оценка эффективности лечения и мониторинг больных с герминогенными
опухолями яичников и семиномами яичек.Клинико-диагностическая значимость р-ХГЧВ гинекологии р-ХГЧ используют для диагностики и мониторинга беременности;
низкое содержание гормона на ранних сроках беременности — косвенный при¬
знак недостаточности функции плаценты или наличия внематочной беременности.
Высокое содержание |3-ХГЧ может быть признаком многоплодной беременности.Повышение уровня ^-ХГЧ наблюдают при патологической пролиферации кле¬
ток из трофобласта (пузырном заносе, хориокарциноме). При пузырном заносе
уровень (3-ХГЧ может достигать огромных значений (в отдельных случаях —
>1 млн МЕ/мл). Для хориокарцином (40-50% которых возникают из пузырного
заноса) также характерно значительное повышение уровня р-ХГЧ.
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 675При трофобластических опухолях матки наличие корреляции между клиниче¬
ским течением и уровнем секреции р-ХГЧ позволяет оценивать с помощью этого
маркера эффективность терапии, проводить коррекцию схем лечения, выявлять
развитие рецидива до его клинического проявления. Диагноз хориокарциномы
подтверждается выявлением в сыворотке крови другого маркера — трофобласти-
ческого р-глобулина (ТБГ), который имеет особенно важное значение для боль¬
ных с низким зфовнем р-ХГЧ.р-ХГЧ целесообразно использовать в комплексе диагностических методов для
мониторинга больных с дисгерминомами, эмбриональным раком яичников, а
также у мужчин с семиномами (исходно положительными по данному маркеру
примерно в 10% случаев) и эмбриональным раком яичка с целью доклинического
выявления рецидивов.Методы исследования — ИФА, РИА, ХМЛА.Объекты исследования — сыворотка крови, моча, амниотическая жидкость,
спинномозговая жидкость.Требования к пробе. Образцы исследуемого материала хранят при температуре
+4 "С до 24 ч, при -20 °С — до 6 мес.Антиген плоскоклеточного ракаАнтиген плоскоклеточного рака (SCC — Squamous Cell Carcinoma antigen) —
маркер плоскоклеточного рака, гликопротеин с молекулярной массой 48°кДа, был
выделен из печеночных метастазов плоскоклеточного рака шейки матки (РШМ).
SCC принадлежит к семейству ингибиторов сывороточных протеаз. В норме SCC
экспрессируется в плоском эпителии, преимущественно в эпидермисе (в шипова¬
том и зернистом слоях). Основные источники SCC в организме — кожа, много¬
слойный плоский эпителий бронхов, пищевода, шейки матки, анального канала.
Период полувыведения SCC менее 1 сут.Дискриминационный уровеньВерхняя граница нормы SCC у здоровых людей составляет 1,5 нг/мл.Причины повышения SCC• Злокачественные новообразования (плоскоклеточный рак).❖ Рак шейки матки.❖ Плоскоклеточный рак в области головы и шеи.❖ Рак пищевода.^ Рак легкого.Рак вульвы, рак влагалища.• Другие заболевания.❖ Доброкачественные заболевания кожи (псориаз, экзема, красный плоский
лишай и др.).о туберкулез.Хроническая печеночная недостаточность.<0^ хроническая почечная недостаточность.Показания к исследованию• Оценка эффективности лечения больных плоскоклеточным раком (преждевсего шейки матки, пищевода и легкого) с исходно повышенным уровнем SCC.• Мониторинг больных плоскоклеточным раком с целью доклиническоговыявления развития рецидивов.Клинико-диагностическая значимость антигена плоскоклеточного ракаПри цервикальной интраэпителиальной неоплазии уровень SCC повышен у
7-14,3% больных, при карциноме in situ — у 14-18%, при инвазивном РШМ I ста¬
676 БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙдии — у 24-53,8%, II стадии — у 33-85,8%, III стадии — у 67-96,5%, IV стадии — у
71-96,5% больных. Исходно повышенная концентрация антигена ассоциируется
с более низкими показателями 5-летней выживаемости больных. Рецидив РШМ
сопровождается повышением уровня SCC в 66-90% случаев. Временной проме¬
жуток между повышением уровня антигена и клиническим проявлением рецидива
колеблется, по разным данным, от 3 до 16 мес, в среднем составляя 4-6 мес.При плоскоклеточном раке пищевода уровень SCC повышен примерно в 50%
случаев (в зависимости от стадии), высокий исходный уровень SCC коррелиру¬
ет с неблагоприятным прогнозом (в плане высокой вероятности возникновения
раннего рецидива) и соответственно низким показателем общей и безрецидивной
выживаемости.Чувствительность SCC у больных плоскоклеточным раком легких составляет
в среднем 60%, специфичность — около 80%. Концентрация SCC после операции
выше 2,5 нг/мл является фактором плохого прогноза 5-летней выживаемости
больных плоскоклеточным раком легких. Чувствительность SCC для плоскокле¬
точного рака головы и шеи составляет 40-63%, специфичность — около 80%.
В случае рецидива плоскоклеточного рака головы и шеи повышенный уровень SCC
наблюдают в 30-60% случаев.Метод исследования — ИФА.Объект исследования — сыворотка крови.Требования к пробе. Сыворотку хранят при +4 °С до 24 ч, при -20 X — до 6 мес.
Не следует допускать повторных циклов замораживания-оттаивания. Необходима
осторожность при взятии, а также работе с тестируемыми образцами, так как
их загрязнение элементами кожи и слюны (высокие концентрации SCC) может
давать ложноположительный результат.СА19-9СА 19-9 — аналог гаптена антигенной детерминанты группы крови Lewis (а).
В сыворотке крови он находится в составе высокомолекулярного муцина, У людей
с редко встречающейся группой крови Lewis (а-/Ь-) (7-10% в популяции) СА
19-9 в организме не вырабатывается. В эмбриогенезе СА 19-9 экспрессируется в
эпителии органов ЖКТ и относится к классу онкоэмбриональных ОМ. Во взрос¬
лом организме данный антиген обнаруживают в следовых количествах в желе¬
зистом эпителии большинства внутренних органов. Верхняя граница нормы СА
19-9 составляет 37 ЕД/мл. Маркер выводится исключительно с желчью, поэтому
неспецифической причиной повышения его сывороточного уровня может быть
холестаз.Дискриминационный уровеньВерхняя граница нормы СА 19-9 составляет 37 ЕД/мл,Причины повышения СА 19-9• Злокачественные новообразования (аденогенные опухоли).❖ Рак поджелудочной железы.❖ Рак желчного пузыря и желчных путей.-O’ Рак желудка, рак пищевода.^ Рак яичников.❖ Колоректальный рак.❖ Первичный рак печени,❖ Метастазы перечисленных карцином в печень.• Другие заболевания и состояния,❖ Холестаз.-о Панкреатит (острый и хронический).
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 677Холецистит (острый и хронический), желчнокаменная болезнь.❖ Цирроз печени.Показания к исследованию• Оценка эффективности лечения больных аденогенным раком поджелудоч¬
ной железы, желчного пузыря и желчных путей, желудка, пищевода, рака
яичников, колоректального рака.• Мониторинг больных с указанными злокачественными образованиями с
целью доклинического выявления развития рецидивов.Клинико-диагностичБская значимость СА 19-9Среди злокачественных новообразований наиболее часто уровень СА 19-9
повышается при раке поджелудочной железы (в 75-82% случаев) и является мар¬
кером выбора для данного новообразования. Также он повышен при гепатобили-
арном раке (50-75% случаев), раке желудка, колоректальном раке. Этот маркер
используют для мониторинга больных в целях оценки эффективности терапии и
доклинического выявления прогрессирования заболевания.Низкая специфичность СА 19-9 для онкологических заболеваний ограничивает
его диагностические возможности.Методы исследования — ИФА, РИА, ХМЛА.Объекты исследования - сыворотка крови, асцитическая жидкость, содержи¬
мое кист.Требования к пробе. Сыворотку крови хранят при температуре +4 °С до 24 ч,
при -20 “С - до 6 мес. Нельзя допускать повторных циклов замораживания-
оттаивания. Необходима осторожность при взятии крови, а также при работе
с тестируемыми образцами, так как контаминация слюной может приводить к
повышению концентрации СА 19-9 в образце.СА242СА 242 — муциновый антиген. Он является нефукозилированным предшественни¬
ком сиалил-Ье’іУІ8-антигена. Его продукция не зависит от экспрессии Lewis-антигенов.
В зависимости от природы опухоли — доброкачественной или злокачественной —
экспрессии эпитопов СА 242 и СА 19-9 различаются: при доброкачественных забо¬
леваниях экспрессия СА 242 ниже по сравнению с СА 19-9, поэтому и специфичность
СА 242 по фавнению с СА 19-9 выше. СА 242 используют для диагностики и монито¬
ринга рака поджелудочной железы, толстого кишечника и прямой кишки.Преимуществом СА 242 по сравнению с СА 19-9 является то, что уровень мар¬
кера в сыворотке не зависит от экспрессии Lewis-антигенов и на его концентрацию
практически не влияет холестаз.В зависимости от изучаемой популяции чувствительность СА 242 для диагно¬
стики РПЖ варьирует от 41 до 75% при специфичности 85-95%.Дискриминационный уровень для СА 242 составляет 20 ЕД/мл.При равной специфичности (90%) чувствительность определений СА 242 для
дифференциальной диагностики рака поджелудочной железы и хронического
панкреатита выше, чем у СА 19-9.При диагностике рака толстой кишки (РТК) и рака прямой кишки СА 242 также
является более чувствительным, при специфичности теста 90% чувствительность
составляет 40%, в то время как чувствительность теста СА 19-9 и СА 50 — только
23%. Серийные определения СА 242 могут быть использованы для доклини¬
ческого выявления рецидивов колоректального рака (КРР) (5-7 мес до клини¬
ческого выявления). РЭА и СА 242 экспрессируются независимо друг от друга.
Комбинация С А 242+РЭА повышает чувствительность исследования более чем на
20% по сравнению с использованием одного маркера.
678 БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙСА 72-4СА 72-4 — высокомолекулярный муциноподобный гликопротеин с моле¬
кулярной массой 440 кДа, представитель класса онкофетальных маркеров
(обнаруживают в эпителиальных клетках желудочно-кишечного тракта плода).
В следовых концентрациях он экспрессируется в этих же структурах взрослого
человека.Дискриминационный уровеньВерхняя граница нормы СА 72-4 составляет 5,3 ЕД/мл.Причины повышения с А 72-4• Злокачественные новообразования (аденогенные опухоли).о Рак желудка.<0- Рак поджелудочной железы,❖ Рак толстой кишки,❖ Рак легкого (аденокарцинома).❖ Некоторые другие аденогенные новообразования.• Другие заболевания.Антиген характеризуется высокой специфичностью (более 95%), так как редко
повышается при воспалительных процессах и доброкачественных опухолях. Лишь
в отдельных случаях отмечают незначительное увеличение концентрации СА 72-4
при следующих заболеваниях:• циррозе печени;• остром панкреатите;• хроническом бронхите;• пневмонии;• язвенной болезни желудка.Показания к исследованию• Контроль эффективности лечения больных раком желудка, КРР.• Мониторинг больных с указанными злокачественными образованиями сцелью доклинического выявления рецидивов.Клинико-диагностическая значимость СА 72-4Уровень этого маркера повышается прежде всего при РЖ, для которого он явля¬
ется маркером выбора. Чувствительность СА 72-4 для РЖ составляет 28-80% (в
зависимости от стадии). Чувствительность СА 72-4 для выявления рецидива РЖ
составляет 70%: повышение уровня маркера начинается за несколько месяцев до
клинического проявления рецидива, что позволяет использовать С 72-4 для мони¬
торинга больных РЖ,СА 72-4 используют для мониторинга больных с КРР и другими аденогенными
новообразованиями.Методы исследования — ИФА, хемилюминесцентный анализ.Объекты исследования — сыворотка крови, асцит.Требования к пробе. Сыворотку крови хранят при температуре +4 “С до 24 ч,
при -20 “С — до 6 мес. Нельзя допускать повторных циклов замораживания-
оттаивания.СА15-3СА 15-3 — опухольассоциированный антиген, маркер выбора для рака молоч¬
ной железы (РМЖ), гликопротеиновый эпитоп муцина, относящийся к классу
онкофетальных антигенов. У плода он встречается в эпителиальных клетках брон¬
хов и гепатоцитах. Период полувыведения — 7 дней.
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 079Дискриминационный уровеньВерхняя граница нормы у здоровых небеременных составляет 28 ЕД/мл.
Физиологическое возрастание уровня СА 15-3 (до 50 ЕД/мл) возможно в III три¬
местре беременности.Причины повышения с А 15-3• Злокачественные новообразования,❖ Рак молочной железы.Некоторые другие солидные раки,■о В отдельных случаях при злокачественных заболеваниях крови и сарко¬
мах,• Другие заболевания,СА 15-3 отличается высокой специфичностью: уровень антигена может повы¬
шаться до 40 ЕД/мл лишь в редких случаях мастопатии и доброкачественных
опухолей молочных желез. Описаны случаи повышения уровня СА 15-3 при сле¬
дующих заболеваниях:• хроническом гепатите;• циррозе печени;• саркоидозе;• туберкулезе;• хроническом бронхите;• пневмонии;• системной красной волчанке;• ВИЧ-инфекции.Показания к исследованию• Оценка эффективности лечения больных РМЖ.• Мониторинг больных РМЖ с целью доклинического выявления рецидивов.Клинико-диагностическая значимость СА 15-3Для РМЖ антиген СА 15-3 является зависимым от стадии ОМ выбора: его
повышенный уровень обнаруживают в 85% случаев при распространенном опу¬
холевом процессе в молочной железе и только в 20% — при I-II стадии РМЖ,
Концентрация маркера коррелирует со степенью дифференцировки и злокаче¬
ственности опухолей. Существует корреляция между низкими предоперационны¬
ми уровнями СА 15-3 и хорошим прогнозом у больных РМЖ.Достаточно низкая чувствительность СА 15-3 при ранних стадиях РМЖ не
дает возможности использовать его для ранней диагностики РМЖ. В то же время
данный ОМ имеет высокую чувствительность (>70%) при выявлении рецидивов
болезни (в среднем за 2,7 мес до их клинического проявления), В целом изменения
уровней СА 15-3 в процессе динамического наблюдения за больными РМЖ, как
правило, коррелируют с клиническим течением болезни, что позволяет успешно
использовать его в сочетании с РЭА для мониторинга пациенток с СМЖ.Методы исследования — ХМЛА, ИФА.Объекты исследования — сыворотка крови, содержимое кист.Требования к пробе. Сыворотку крови хранят при -н4 X до 24 ч, при -20 °С — до6 мес. Нельзя допускать повторньЕХ циклов замораживания-оттаивания,CYFRA 21-1CYFRA 21-1 — растворимый фрагмент цитокератина 19 — каркасного белка
клеток (молекулярная масса — 30 кДа). Как и другие цитокератины, он является
маркером эпителия и соответственно злокачественных новообразований эпители¬
ального генеза.
680 БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙДискриминационный уровеньВерхняя граница нормы CYFRA 21-1 составляет 2,3 нг/мл.Причины повышения CYFRA 21-1• Злокачественные новообразования.❖ Рак легкого (плоскоклеточный, крупноклеточный).•0^ Рак мочевого пузыря.> Плоскоклеточный рак шейки матки, пищевода и др.0^ другие злокачественные опухоли.• Другие заболевания.о Цирроз печени.<> Хроническая почечная недостаточность.4- Бронхиальная астма.Инфекции дыхательных путей.Показания к исследованию• Уточняющая диагностика рака легкого.• Мониторинг больных раком легкого.• Мониторинг больных плоскоклеточным раком другой локализации.Клинико-диагностическая значимость CYFRA 21-1CYFRA 21-1 наиболее информативен в уточняющей диагностике рака легкого
в аспекте дифференциальной диагностики между доброкачественными и злока¬
чественными опухолями, а также между плоскоклеточным и неплоскоклеточным
раком легкого. Диагностическая чувствительность CYFRA 21-1 для РШМ состав¬
ляет около 40%. Исходно повышенный уровень CYFRA 21-1 до начала лечения —
неблагоприятный прогностический фактор в плане быстрого прогрессирования
заболевания. CYFRA 21-1 у больных плоскоклеточным раком (легкого, шейки
матки) адекватно отражает эффективность проведенного лечения: повышенный
уровень ОМ после завершения лечения — аргумент в пользу остаточной опухоли,
а возрастание этого маркера во время мониторинга свидетельствует о прогресси¬
ровании заболевания.CYFRA 21-1 может повышаться и при злокачественных новообразованиях
другой локализации, однако в этих случаях маркер имеет сравнительно низкую
диагностическую чз'^вствительность (в сравнении с основными ОМ для этих опу¬
холей).Методы исследования ~ хемилюминесцентный, ИФА.Объекты исследования — сыворотка крови, плевральная жидкость, асцитиче¬
ская жидкость, кистозная жидкость.Требования к пробе. Сыворотку крови хранят при +4 “С до 24 ч, при -20 X — до
6 мес. Нельзя допускать повторных циклов замораживания-оттаивания.Нейроспецифическая енолазаНейроспецифическая енолаза (НСЕ) впервые была обнаружена в нейронах
мозга и периферической нервной системы. Она представляет собой изоэнзим
цитоплазматического гликолитического фермента енолазы, катализирующего
превращение 2-фосфоглицерата в фосфоенолпируват. У плода НСЕ обнаруживают
в нервной и легочной ткани, у взрослых — преимущественно в нейроэндокринных
структурах.Период полувыведения НСЕ — 2 дня.Дискриминационный уровеньВерхняя граница нормы фермента составляет 12,5 нг/мл.
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ В81Причины повышений нейроспецифической енолазы• Злокачественные новообразования.❖ Нейроэндокринные злокачественные опухоли различной локализации, в
первую очередь, мелкоклеточный рак легких. Щ• Другие заболевания.❖ Пневмония.❖ Травмы головного мозга.❖ Почечная недостаточность.❖ Септический шок.❖ Доброкачественные опухоли легких и печени,❖ Доброкачественные опухоли нейроэктодермального происхождения.Клинико-диагностическая значимость НСЕНСЕ, обладая высокими чувствительностью (44-87% в зависимости от стадии
процесса) и специфичностью для мелкоклеточного рака легких, можно использо¬
вать в дифференциальной диагностике опухолей легкого, а также для мониторинга
больных в целях оценки эффективности лечения,НСЕ — наиболее значимый прогностический фактор выживаемости больных
мелкоклеточным раком легких, У преобладающего большинства больных (84%) в
случае ремиссии уровень маркера нормализуется.Уровень НСЕ часто повышен у больных со злокачественными новообразовани¬
ями нейроэктодермального происхождения (нейробластомы, медуллобластомы,
ретинобластомы), с помощью этого маркера можно осуществлять динамическое
наблюдение за пациентами. НСЕ — дополнительный опухолевый маркер при диа¬
гностике семином.Методы исследования — ИФА, хемилюминесцентный анализ.Объекты исследования — сыворотка (плазма) крови, плевральная жидкость,
асцитическая жидкость, кистозная жидкость.Требования к пробе. Образцы хранят при температуре +4 °С до 24 ч, при -20 “С —
до 6 мес. Следует избегать гемолиза и отсроченного центрифугирования крови, так
как НСЕ присутствует в эритроцитах, тромбоцитах и плазматических клетках.Нельзя допускать повторных циклов замораживания-оттаивания.ProGRPГастрин-рилизинг-пептид (GRP) — гормон кишечника, пептид, состоящий из
27 аминокислот, структурно и функционально подобный С-концевому участку
бомбезина желудка свиньи. Первично был вьщелен из желудка свиньи. GRP при¬
сутствует в тканях мозга, волокнах нервов, нейроэндокринных клетках, клетках
желудочно-кишечного тракта и легких.Хорошо известно, что он секретируется клетками мелкоклеточного рака легких
(МКРЛ). Было показано, что proGRP обладает митогенной активностью по отноше¬
нию к МКРЛ и продуцируется клетками мелкоклеточного рака легкого по аутокрин-
ному п}™. Несмотря на это, использование данного белка в качестве маркера для
рутинных исследований затруднено из-за нестабильности в крови и сложности его
выделения, в настоящее время разработаны тест-системы для определения proGRP
(области 31-98, общей для трех типов proGRP человека) - более стабильного белка-
предшественника гормона, также являющегося специфичным маркером для МКРЛ.Дискриминационный уровеньВерхняя граница нормы proGRP составляет 50 пг/мл.Снижение скорости клубочковой фильтрации может привести к повышению
уровня proGRP. За исключением пациентов с почечной недостаточностью, уровень
циркзширующего proGRP не превышает 80 пг/мл при доброкачественных заболе-
682 БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙваниях или 120 пг/мл — при злокачественных образованиях других локализаций.
Уровень proGRP в сыворотке строго ассоциирован с гистологическим типом опу¬
холи, высокие значения наблюдаются именно при МКРЛ, Уровень proGRP выше
120 пг/мл выявляют менее чем в 4% случаев немелкоклеточного рака легких
(НМКРЛ). И наоборот, повышенный уровень proGRP обнаруживают в 60-70%
и в 75-90% случаев у пациентов с локализованной и распространенной формой
МКРЛ соответственно. Таким образом, proGRP является более чувствительным и
специфическим маркером для МКРЛ, чем НСЕ.Белок S-100S-100 — белок, относящийся к семейству Са^'-связывающих белков, участвую¬
щих в процессах деления и дифференцировки клеток. S-100 функционирует в виде
димеров, состоящих из мономеров двух типов — А1 и в.Дискриминационный уровеньВерхняя граница нормы S-100 — менее 90 нг/л.Причины повышения S-100• Злокачественные новообразования.Меланома.<> Опухоли нервной ткани некоторых типов.• Другие заболевания.❖ Цирроз печени.❖ Почечная недостаточность.Показания к исследованию• Оценка эффективности лечения больных с меланомой.• Мониторинг больных с меланомой с целью доклинического выявления про¬
грессирования болезни.• прогноз течения опухолевого процесса.Клинико-диагностическая значимость S’100Концентрация S-100 в сыворотке крови достоверно коррелирует с основными
клинико-морфологическими факторами прогноза течения меланомы: толщиной
опухоли по Бреслоу, уровнем инвазии по Кларку и гистологическим подтипом
опухоли, а также со стадией заболевания. Его чувствительность возрастает с 20%
при I стадии заболевания до 67% — при III и 79% — при IV стадии. Сывороточный
уровень S-100 является независимым прогностическим фактором: выживае¬
мость больных с высоким уровнем белка заметно ниже, чем пациентов с низким
содержанием S-100. Низкие значения S-100 у больных с меланомой в ремиссии
и сравнительно высокие уровни маркера при клинически доказанном рецидиве
заболевания свидетельствуют о целесообразности его включения в комплекс диа¬
гностических методов, используемых для динамического наблюдения пациентов.
В настоящее время по европейским нормам рекомендуют проводить динамическое
наблюдение больных с меланомой с обязательным включением в диагностический
комплекс определения сывороточного уровня S-100.Метод исследования — И ФА.Объект исследования — сыворотка крови.Требования к пробе. Образцы хранят от +2 до +8 ‘’С не более 24 ч, при -20 °С — до
12 мес. Не рекомендуют тестировать гемолизированные образцы.TUM2-PKTu М2-РК — опухолевая пируваткиназа типа М2 — один из ферментов гли¬
колиза, катализирующий перенос фосфатной группы от фосфоенолпирувата на
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 683аденозиндифосфат (АДФ) с образованием пирувата и аденозинтрифосфата (АТФ).
Таким способом она обеспечивает синтез АТФ в тканях с низким содержанием
О^. В клетках нормальных тканей человека пируваткиназа функционирует в виде
тетрамера из изоформ типов L-PK, R-PK, М1-РК. В опухолевых клетках в условиях
гипоксии функционирует особый тип фермента — опухолевая пируваткиназа —
димер типа М2 (Tu М2-РК). Его принципиальным отличием от других маркеров
является отражение особенностей метаболизма опухолевых клеток вне зависимо¬
сти от локализации опухоли.Дискриминационный уровеньДУ составляет 17 ЕД/мл, переходная зона — 17-20 ЕД/мл.Причины повышения Tu М2-РК• Злокачественные новообразования.Рак почки.❖ Колоректальный рак.Рак желудка.❖ Рак поджелудочной железы.• Другие заболевания.❖ Бактериальные инфекции.❖ Ревматизм,Диабетическая нефропатия.Показание к исследованиюМониторинг больных раком почки для оценки эффективности лечения и
доклинического выявления развития рецидива.Клинико-диагностическая значимость Tu М2-РКУ больных раком почки отмечено существенное увеличение уровня Tu М2-РК
при прогрессировании злокачественного процесса. Маркер можно использовать
прежде всего для доклинического выявления рецидивов болезни. Время полувы-
ведения Tu М2-РК велико (более месяца). Это является причиной его медлен¬
ного снижения при специфической противоопухолевой терапии и ограничивает
использование маркера в мониторинге эффективности лечения.Существует корреляционная связь между концентрациями Tu М2-РК у онколо¬
гических больных и стадией опухолевого процесса, что позволяет использовать
маркер для уточнения степени его распространенности.Метод исследовант — ИФА.Объекты исследования — ЭДТА-плазма крови, кал.Требования к пробе. Плазму крови хранят при +4 “С до 24 ч, при -20 °С — до
6 мес. Нельзя допускать повторных циклов замораживания-оттаивания.Антиген рака мочевого пузыряАнтиген рака мочевого пузыря (Urinary Bladder Cancer — UBC) представляет
собой растворимый фрагмент цитокератинов 8 и 18 — промежуточных микро-
филаментов эпителиальных клеток. При пролиферации и злокачественной транс¬
формации клеток экспрессия цитокератинов (в частности, 8 и 18) усиливается, что
делает перспективным определение их в моче как ОМ при раке мочевого пузыря
(РМП). Концентрации UBC в моче корректируют к уровню креатинина и выража¬
ют в микрограммах на 1 мкмоль креатинина.Дискриминационный уровеньДУ составляет 0,49 нг/мкмоль креатинина..Г-'
684 БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙПричины повышения ивеж • Злокачественные новообразования.^ Рак мочевого пузыря.• Другие заболевания и состояния.❖ Циститы.❖ Воспалительные неурологические заболевания в острой фазе.❖ Бактериальная инфекция мочевыводящих путей в период обострения.
Гематурия неясного генеза.• Инвазивные методы диагностики (цистоскопия).Показания к исследованию• Гематурия неясного генеза.• Урологические жалобы.• Уточняющая диагностика РМП.• Мониторинг больных РМП.Клинико-диагностическая значимость UBCЧувствительность иве у первичных больных РМП составляет 60-87% при
специфичности (относительно доноров) до 85%. Уровень иве при РМП отражает
стадию опухолевого процесса и пролиферативную активность опухолевых клеток.
Уровень иве существенно выше при инвазивном раке, чем при поверхностном
(11,9 и 2,6 нг/мкмоль CREA соответственно). У больных РМП, находящихся в
стадии ремиссии, средний уровень UBC существенно ниже ДУ (0,23 нг/мкмоль
CREA) в 83% слз^чаев и, напротив, в 78% уровень маркера повышен при рециди¬
вах болезни. Это позволяет использовать UBC в уточняющей диагностике РМП в
качестве прогностического фактора болезни, при оценке эффективности лечения
и доклинического выявления рецидивов заболевания.Метод исследования — ИФА.Объект исследования — средняя порция утренней мочи.Требования к пробе. Мочу хранят при +4 °С до 24 ч, при -20 °С — до 6 мес. Нельзя
допускать повторных циклов замораживания-оттаивания. Сбор мочи следует осу¬
ществлять до или спустя 10 дней после инвазивных диагностических процедур, а
также до начала специфического лечения.МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ ОНКОМАРКЕРЫНаибольшую практическую ценность в качестве молекулярно-генетических
маркеров имеют онкогены и антионкогены. Онкогены - дефектные гены фак¬
торов положительной регуляции клеточного деления (семейства RAS- и MYC-
генов, семейства генов ростовых рецепторов) и генов антиапоптозных факторов,
особенно BCL-2. Антионкогены, или гены-супрессоры опухолевого роста, —
гены факторов отрицательной регуляции клеточного деления, или гены факто¬
ров апоптоза. Дефект антионкогенов приводит к потере их противоопухолевой
функции. Наибольшее диагностическое значение имеют мутации ингибитора
клеточного деления и ключевого фактора апоптоза — гена белка р53. Эти мута¬
ции встречаются более чем в половине случаев онкологических заболеваний.
Почти так же распространены при опухолях дефекты гена белка р16. При поли-
позном раке толстой кишки и некоторых других опухолях характерны мутации
гена АРС. Молекулярно-генетический анализ онкогенов MYC, JRA5, BCL-2 и
антионкогенов белков р53 и р16, а также АРС позволяет выявить большинство
опухолей человека.Ранним и постоянным признаком малигнизации является развитие состояния
генетической нестабильности, что вызывает мутации в микросателлитных ДНК, —
второй вид молекулярно-генетических онкомаркеров.
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 685Третьим видом молекулярно-генетических маркеров является анализ сайтов
метилирования в опухолевой ДНК. Для опухолей характерно нарушение метили¬
рования ДНК, которое заключается в изменении карты метилирования. Наиболее
характерно гиперметилирование генов ШС, белков р16, 14-3-35, АРС, GSTP1,
E-cad, hMLHl, PTEN.Поскольку опухоли имеют обычно моноклональную природу, т.е. являются
потомками одной мутантной клетки, маркерные мутации присутствуют во всех
опухолевых клетках, что позволяет обнаружить достаточное количество моле¬
кул мутантной ДНК при анализе как самой опухоли, так и лимфатических узлов,
крови, костного мозга, содержащих опухолевые клетки. Более того, мутантные
молекз'лы ДНК опухолевого происхождения могут быть выявлены даже в плазме
крови онкологических больных, что обеспечивает раннюю диагностику.Таким образом, для диагностики опухолей могут быть использованы три вида
молекулярно-генетических маркеров. Если для анализа онкомаркеров в ткани
опухоли достаточно невысокой чувствительности, то обнаружение их в лимфа¬
тических узлах, костном мозге, крови и особенно плазме крови требует особо
высокой чувствительности, которую надежно обеспечивает только полимеразная
цепная реакция (ПЦР). Новейшим направлением в диагностике циркулирующих
молекулярно-генетических онкомаркеров, возможно, станет определение в плазме
крови тканеспецифических РНК опухолевого происхождения,МЕТОДОЛОГИЧЕСКАЯ ОСНОВА ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ
И ДРУГИХ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ ТЕСТОВИзменения в нуклеотидных последовательностях ДНК и РНК являются гене¬
тическими маркерами опухолевых клеток. Для распознавания нуклеотидных
последовательностей чаще всего используют молекулярную гибридизацию со
специфическими ДНК-зондами или ПЦР. Чувствительность ПЦР может достигать
теоретического предела в один фрагмент ДНК, или 10'^®, тогда как уровень чув¬
ствительности ДНК-гибридизации — толькоВ основе ПЦР, так же как и при ДНК-гибридизации, лежит способность ком¬
плементарных цепей распознавать друг друга. При этом тестируемая молекула
ДНК многократно умножается (амплифицируется) и становится доступной для
выявления малочувствительными, но достоверными методами, например электро¬
форезом.При практическом использовании ПЦР хромосомные транслокации можно
успешно выявлять в соотношении одна опухолевая клетка на 100 ООО нормальных
клеток, что невозможно при цитогенетическом или каком-либо еще исследовании.
Предельно высокая чувствительность ПЦР позволила принципиально по-новому
подойти к ранней диагностике рака в доклинической стадии, ДНК — идеальный
субстрат для молекулярной диагностики, потому что легко переносит неблаго¬
приятные условия хранения биоматериалов, остается пригодной для анализа в
различных клинических образцах, в том числе в парафиновых срезах, и может
быть быстро амплифицирована с помощью технологии ПЦР. Последнее позво¬
ляет обходиться очень малым количеством материала для анализа, РНК — менее
подходящий субстрат для такой диагностики, чем ДНК, потому что легко дегра¬
дирует, но она может быть сохранена в специально обработанных образцах.
Преимуществом РНК как онкомаркера является возможность большего выбора
тканеспецифических последовательностей. Различные типы онкомаркеров для
молекулярно-генетической диагностики представлены в табл. 9-4.ІМ5 — ген мембранного фактора сигнальной трансдукции; егЬВ-2 — эстро-
гензависимый рецептор ростового фактора; ER — эстрогенрецептор; DCC — ген
рака толстой кишки, вызывающий делеции в других генах; EGFR — рецептор
эпидермального ростового фактора; ШС — ген, гиперметилирующийся при
686БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙТаблица 9-4. Молекулярно-генетические маркерьі опухолейИзменения/маркерыГенвтические повреж¬денияМетилированиеВирусная трансформацияТканеспецифические
маркеры мРНКОпухольспецифическиемаркерыМеханизмХромосомные транслокации,
точковые мутации, делеции, аль¬
тернативный сплайсинг, амплифи¬
кация, нарушение соотношенияИзменение сайтов метилированияМолекулярные мишениt{11;22): t(14;18), р53; RAS.rafB] ER,
BRCA1: BRCA2-, DCC: p16, CDD44; muc-
1; integrin; VLA-4, erbB-2; EGFR; C-MYC:
N-MYC-, RAS Gelatinase АЯМР2p16; HIC-, GSTP1- APC\ E-cad\ LINE; C-MYC]
ген кальцитонина; 14-3-3oHPV; HHV-8; JCV; HCV; MMTVPSA; PSMA; muc-18; кератин; альбумин;
маспин; тироглобулин; NPGP95; парати-
реоидный гормон; тирозиназа; р97; muc-
18; Mage-3 AFP; тирозин гидроксилаза;
сурфактантСЕА; P-HCG; кератин-19; цитокины; тело-
мераза; микросателлит; эндотелиальный
рецепторраке; GSTP1 — ген глутатион-З-метилтрансферазы Р1; АРС ~ ген аденоматозно-
полипозного рака; E-cad — ген Е-кадгерина HPV — папилломный вирус человека;
HHV — герпес-вирус человека; JVC — вирус JC; HCV — вирус гепатита С; PSMA —
мембранный антиген предстательной железы; MMTV — вирус опухолей молочной
железы мышей; AFP — а-фетопротеин; СЕА — раково-эмбриональный антиген; raf
В — ген серин-треониновой киназы RAFB.Молекулярно-генетические методы перспективны для раннего обнаружения
опухоли, дифференциального диагноза с гиперплазиями, более точного опреде¬
ления типа опухоли, мониторинга опухолевого процесса при лечении, оценки
степени злокачественности, развития множественной лекарственной устойчиво¬
сти и прогноза заболевания. Применение их при солидных опухолях отличается
от такового при лейкозах, так как кровь не является надежным источником
опухолевых клеток. Материалом для анализа нуклеиновых кислот при солид¬
ных опухолях могут быть сама опухолевая масса, полученная при операции или
биопсии, а также лимфатические узлы, содержащие опухолевые клетки. Для
выделения ДНК подходят даже парафиновые срезы для гистологических препа¬
ратов или кусочки ткани, хранящиеся в формалине или этиловом спирте много
лет. Помимо самой опухолевой массы, материалом для выделения нуклеино¬
вых кислот в зависимости от типа опухоли могут быть слизь, мокрота, слюна,
моча, выделения из молочных желез, сок поджелудочной железы, асцитическая
жидкость и др. Например, при раке легкого в среднем 2% ДНК в мокроте имеет
опухолевое происхождение.обнаружение какого-либо маркера в опухолевом материале позволяет вести
последующий мониторинг опухолевого процесса — оценивать наличие остаточ¬
ных опухолевых клеток после операции или химиотерапии. Это также позволяет
за несколько месяцев предсказывать появление метастазов или рецидива опухоли,
определяя этот же генетический маркер в ДНК плазмы крови или биоптатах лим¬
фатических узлов.Генетические нарушения, наиболее часто встречаемые
при солидных опухоляхХотя набор дефектных генов при различных оп)тіолях может отличаться,
повреждения нескольких из них встречаются особенно часто (табл. 9-4, 9-5).
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 687Таблица 9-5. Чувствительность и специфичность анализа молекулярно-генетических маркеров
для диагностики солидных опухолейЛокализацияопухалиГолова и шеяЛегкиеТолстая кишкаПоджелудочнаяжелезаМочевой пузырьКлиническийобразецСлюнаМокротаКалКалЖелчьМочаГенетическиймаркерр53ТеломеразаRAS/P53RASМикросателлиты
(4 вида)RASТеломеразаRASRASр53Микросагеллиты
{13 видов)Микросателлиты
(20 видов)ТеломеразаВерхнийпределанализаклеток1/10 0001/10 0001/10 0001/10 0001/5001/10 0001/10 0001/10 0001/100 ООО1/10 0001/5001/5001/10 ОООЧувстви¬
тельность, %713280100606066100100959162Специфичность, %1009510010010010010010010010010010096Это гены ШС, E-cad, АРС, белков р53, р16, семейства генов RAS и MYC, ген
ретинобластомы Rb и ген рецептора эстрогенов ER. Важнейший среди них — ген
белка р53. Мутации в этом гене встречаются в половине случаев онкологических
заболеваний. Ген содержит восемь кодирующих участков (экзонов), В опухолях
чаще всего встречается ген с мутацией в 8-м экзоне, реже -- в 5-7-м. С помощью
ПЦР и последующего определения нуклеотидной последовательности (секвени-
рования) можно выявить как точечные мутации, так и делеции гена белка р53.
Выполняя параллельно ПЦР с парами праймеров для 5-8-го экзона, можно обна¬
ружить делеции при последующем электрофорезе амплификатов по изменению их
подвижности в геле. Оценка продуктов ПЦР анализом однонитевого конформа-
циоиного полиморфизма (SSCP — Single Strand Conformation Polymorphism) позво¬
ляет обнаружить дефекты гена без проведения дорогостоящего секвенирования.
Предел чувствительности — 1% мутантных молекул. Другим способом оценки
является капиллярный электрофорез в условиях регулируемой денатурации.
Предел чувствительности — 0,1% мутантных последовательностей.SSCP-анализ после ПЦР часто является достаточным для мониторинга опухо¬
левого гена при ведении онкологических больных после удаления опухоли или ее
терапии. Часто для мониторинга больных с солидными опухолями достаточно ПЦР
только одного экзона (обычно седьмого) гена белка р53. Мутации гена белка р53
обычно возникают в предопухолевых клонах, уже прошедших значительную часть
предклинического развития. Именно поэтому обнаружение клона клеток с дефек¬
том гена белка р53 — признак начинающегося онкологического заболевания.Таким образом, определение с помощью ПЦР точечных мз^таций и делеций в
гене белка р53 является одним из наиболее ценных молекулярно-генетических
маркеров для диагностики и мониторинга онкологических заболеваний.
688 БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙПо частоте повреждений с геном белка р53 сопоставим только ген pl6/lNK4A/
MST-1/CDKN2A белка р16, также являющийся антионкогеном. Этот ген кодирует
ингибитор циклинзависимой киназы CDKI {CycUn-Dependent Kinase Inhibitor), Ієн
расположен на хромосоме 9 в районе 9р21. Дефекты гена возникают обычно на
ранних стадиях развития опухоли. Это в первую очередь гиперметилирование про-
моторной зоны гена, во вторую — делеции и точечные MjTaqHH. При делениях в гене
белка р16 происходит потеря гетерозиготности по его микросателлитным последо¬
вательностям, которую можно определить с помощью ПЦР. Делеции встречаются в
большинстве видов опухолей, но частота варьирует от 5 до 60% в разных опухолях.Геном, нарушения которого встречаются примерно в трети случаев при солид¬
ных опухолях, является онкоген K-RAS семейства і?А5-генов. Так, при опухолях
толстой кишки и аденокарциноме поджелудочной железы более 90% мутаций
приходится на ген K-RAS. В подавляющем большинстве опухолей с дефектным
онкогеном K-RAS выявляются точечные мутации в 12-м кодоне. Мзггации гена
K-RAS обычно происходят на более ранних стадиях онкогенеза, чем мутации в
гене белка р53. Строгая локализация мутаций в 12-м кодоне делает этот ген удоб¬
ным маркером опухоли. Выявление мутации гена K-RAS может осуществляться
не только SSCP-анализом, но и простым электрофорезом ПЦР-амплификата при
условии, что один из праймеров комплементарен только мутантному аллелю гена.
Для анализа онкогена K-RAS предложена также трехпраймерная схема ПЦР с про¬
межуточной рестрикцией нормальной последовательности гена или обогащенная
ПЦР. Эта схема приемлема в случае, когда мутантный ген опухолевого проис¬
хождения нужно определить в материале, содержащем большое количество копий
норма.пьного гена неопухолевого происхождения. Разработанная схема ПЦР чрез¬
вычайно чувствительна и позволяет выявить одну опухолевую клетку среди 10 или
даже 100 млн неопухолевых клеток. В случае анализа ДНК плазмы крови несколь¬
ко молекул дефектного гена опухолевого происхождения обнаруживают на фоне
сотен миллионов молекул ДНК неопухолевого происхождения. Такие особенности
метода позволяют использовать его для диагностики онкологических заболеваний
на доклинической стадии. Показано, что мутантный ген K-RAS выявляют в плазме
крови за 5-14 мес до обнаружения клинически диагностируемой опухоли; разви¬
тие аденокарциномы легких предсказывают задолго до клинического выявления
(от 1 мес до 4 лет) по обнаружению мутантного гена K-RAS в мокроте больного.Другие члены семейства RAS-тетв — N-RAS и H-RAS мутируют значительно
реже. H-RAS повреждается иногда при опухолях молочной железы, а N-RAS — при
лимфопролиферативных расстройствах.Для основных видов солидных опухолей характерны дефекты в микросателлит-
ных последовательностях. В половине случаев солидных опухолей эпителиально¬
го происхождения это позволяет обнаружить не менее 2 поврежденных последо¬
вательностей. Набора из 4 микросателлитных последовательностей достаточно
для диагностики 60% сл^^аев мелкоклеточного рака легкого. Набора из 13 микро-
сателлитов достаточно для диагностики 90% опухолей мочевого пузыря.Существует еще несколько генов, дефекты которых часто встречаются при
опухолях различной локализации. Это антионкогены Rb и BRCA1, гены BRCA2 и
ER (эстрогенового рецептора). Различные модификации ПЦР применяют для их
анализа. Анализ большинства тканеспецифических маркеров (см. табл. 9-4) также
выполняют с помощью ПЦР.Целый ряд генов при онкологических заболеваниях гиперметилирован, что
может быть выявлено мети л специфической ПЦР. Это гены белков р16, р15 и
p21(WAF), гены НІС (ген, гиперметилированный при раке), АРС, E-cad, ген каль-
цитонина, ген 14-З-За. Целесообразность использования отдельных молекулярно¬
генетических маркеров в плазме крови для выявления опухолей различной лока¬
лизации представлена в табл. 9-6.
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ689Таблица 9-6. Распространенность дефектов генов белка р53, K-RAS и микросателлитных после¬
довательностей в различных типах опухолей, %Вид опухолир53K-RASМикросателлитыПолипозный рак толстой кишки857315-20Неполип03ный рак толстой кишки13880**Аденокарцинома желудка-1235-60Аденокарцинома поджелудочной железы4080-904Немелкоклеточный рак легких4030-56*-Мелкоклеточный рак легких70-8030-Опухоли молочной железы53-865-Опухоли шейки матки19-5018Опухоли щитовидной железы40-5050-Опухоли головы и шеи63-81Аденокарцинома простаты60-80-_* Б аденокарциномах чаще, чем в плоскоклеточных карциномах.** Для наследуемьах неполипозных раков.Таблица 9-7, Присутствие генов с гиперметилированными промоторами в разных типах опухолей, %Вид опухолир1бНІСсотGSTP1hMLHIDPC4Полипозный рак толстой кишки2238--22-27-Неполипозный рак толстой
кишки608046-47Аденокарцинома желудка402542-80-22-Аденокарцинома поджелудоч¬
ной железы90----55Не мелкоклеточный рак легких4285----Мелкоклеточный рак легких7----_Опухоли молочной железы446-67*4030_-Опухоли шейки матки263----Опухоли щитовидной железы10-66*-----Опухоли головы и шеи7----Аденокарцинома простаты6--75-91'--Гепатоцеллюлярная карцинома290-85--ш*В зависимости от типа опухоли.ИСПОЛЬЗОВАНИЕ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ МАРКЕРОВ
ПРИ НЕКОТОРЫХ СОЛИДНЫХ ОПУХОЛЯХОПУХОЛИ толстой и ПРЯМОЙ кишкиПо распространенности занимают 2-3-є место среди онкологических заболе¬
ваний в развитых странах. Наиболее информативные молекулярно-генетические
маркеры для этих опухолей — мутации в гене K-RAS (около 70% слзгчаев), гене
белка р53 (70-80%), нарушения гена АРС (85%), инактивация гиперметилиро¬
ванием гена белка р16 (50%), делеция или гиперметилирование гена DDC (85%).
Дополнительные показатели - потеря гетерозиготности по микросателлитным
последовательностям и мутации митохондриальной ДНК. Наследственная пред¬
расположенность к аденополипозному типу рака может быть связана с точечной
мутацией в одном из аллелей гена АРС, а к неполипозному ~ с мутацией в одном
из генов системы репарации ДНК. Неоангиогенез и изменение проницаемости
690 БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙсосудов в опухолевой ткани ведут к выбросу дефектных генов в кровоток и воз-
'ШШ- можности обнаружения их в плазме крови. Наблюдается два типа опухолей,
отличающихся по распределению молекулярно-генетических маркеров: первый
^0 тип — аденоматозно-полипозные опухоли, а второй — неполипозные.Аденоматозно-полипозныи ракЭти опухоли имеют высокий процент случаев мутаций гена белка р53, K-RAS
и АРС и часто гиперметилированные гены белка р16, НІС и другие гены (см,
табл. 9-6,9-7). Для диагностики в первую очередь могут быть определены мутации
в генах K-RAS, белка р53 и АРС в ДНК плазмы крови по сравнению с немутантны¬
ми формами в клетках крови. Вероятность положительного ответа при опухоли —
более 90%. Маркерами второго ряда, увеличивающими надежность диагностики
при отсутствии мутаций в перечисленных трех генах, могут быть гиперметили¬
рованные формы генов белка р16, ШС или потеря гетерозиготности по микро-
сателлитным последовательностям. Для мониторинга заболевания может быть
рекомендована следующая последовательность анализов: выявление какого-либо
гена в плазме крови до операции, и далее 1-2 маркера из тех, которые окажутся
положительными, анализируют через 2 мес и через полгода или год после опе¬
ративного удаления опухоли. После операции тот же молекулярно-генетический
маркер анализируют в ДНК ткани опухоли или в парафиновых срезах опухоли.
Исчезновение соответствующих молекулярно-генетических маркеров из крово¬
тока после операции может свидетельствовать о молекулярной ремиссии и, веро¬
ятно, полном излечении. Наоборот, нарастание какого-либо из анализированных
маркеров свидетельствует о вероятном появлении рецидива или метастазов.
В соответствии с выявленными генетическими или эпигеномными нарушениями
в опухолевом материале схема химиотерапии может быть дополнена средствами
коррекции функции мутантных генов, что увеличивает ее эффективность. К ним
относятся препараты из группы ингибиторов фарнизилтрансферазы при дефектах
гена K-RAS, производные метилксантина при некоторых дефектах гена белка р53,
деметилирующие агенты при обнаружении гиперметилированной формы гена
белка р16 и др. Это новое направление в химиотерапии, опирающееся на анализ
генетических дефектов индивидуального опухолевого материала.Неполипозные колоректальные опухолиСпектр генетических маркеров неполипозных раков имеет свою специфику,
в первую очередь, это касается наследственной предрасположенности. Если в раках
аденоматозно-полипозного происхождения имеются наследственные дефекты
гена АРС, участвующего в контактном угнетении клеточного деления, то для непо-
липозного рака это гены репарации ДНК, в первую очередь ген hMLHl (более 70%
мутаций). Генетические нарушения, возникающие в опухолях, также отличаются.
Для неполипозных раков наблюдается низкий уровень повреждений гена белка
р53 и K-RAS, но высокий (более 80%) — микросателлитных последовательностей
(см. табл. 9-6). Последнее явление связано с нарушением работы генов репарации.
Для неполипозных видов рака толстой кишки характерным маркером также явля¬
ются гиперметилированные формы генов hMLHl и hMSH2 (более 70%).Рекомендуемые действия при диагностике — анализ мутантных форм гена белка
р53, K-RAS и hMLH в плазме крови по сравнению с клетками крови, выявление
гиперметилированных форм гена белка р16, hMLHl и hMSH2. При мониторинге
дополнительно следует назначать анализ ДНК ткани опухоли.АДЕНОКАРЦИНОМА ЖЕЛУДКАОпухоль обычно легко выявляется с помощью инструментальных клинических
методов. Для рака желудка наиболее характерны нарушения микросателлитных
последовательностей и наличие гиперметилированных форм гена CDH1, кодирую-
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 691щего Е-кадхерин, а также мутации в этом гене (см. табл. 9-6, 9-7), Мутации гена
белка р53, широко встречаемые в опухолях другой локализации, нехарактерны
для аденокарциномы желудка. Мутации гена K-RAS также встречаются лишь в
12% случаев (см. табл. 9-6). Анализ молекулярно-генетических маркеров важен
для мониторинга заболевания и оценки эффективности лечения.АДЕНОКАРЦИНОМА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫКлиническая диагностика опухолей поджелудочной железы затруднена, опухо¬
ли, как правило, выявляют в поздние сроки. Именно поэтому пятилетняя выжи¬
ваемость составляет менее 5%. Используя молекулярно-генетические маркеры,
опухоль можно диагностировать на І-ІІ стадии или в доклиническом периоде.Для аденокарциномы поджелудочной железы характерны мутации гена K-RAS в
12-м кодоне и изредка в 13-м и 61-м кодонах. Более 90% случаев сопровождается
такими мутациями (см. табл. 9-6). Распространенность других нарушений: гипер¬
метилирование гена белка р16 — более 90%, мутации в гене белка р53 — 50-75%,
дефекты гена DPC4 — 55% (см. табл. 9-7). Наследуемые дефекты различных генов
при этом составляют менее 10% случаев. В остальных случаях мутации обнаружи¬
вают только в опухоли и плазме крови, но не в клетках крови или других тканей.При мониторинге и оценке эффективности лечения в первую очередь использу¬
ют анализ гена K-RAS.АДЕНОКАРЦИНОМА ПРОСТАТЫАденокарцинома простаты занимает второе место по распространенности среди
опухолей у мужчин в высокоразвитых странах. Трудность представляет дифферен¬
циальная диагностика с аденомой простаты. Использование биопсии имеет серьез¬
ные недостатки, так как процедура травматична и может стимулировать опухолевый
рост, может быть взята ткань аденомы без захвата опухолевого очага на ранних
стадиях и пропущено перерождение клеток аденомы в аденокарциному.Важнейший молекулярно-генетіріеский маркер аденокарциномы простаты —
появление гиперметилированной формы гена GSTP1 (глутатион-5-ірансферазьі
Р1), которая присзтствует в 91% случаев аденокарциномы, но не встречается в
клетках аденомы. Выявление в плазме крови гиперметилированной формы GSTP1
позволяет говорить с надежностью, близкой к 100%, о присутствии злокачествен¬
ной опухоли. Для выявления аденокарциномы простаты целесообразно также
анализировать ДНК из клеточного осадка, получаемого при центрифугировании
мочи. При этом ДНК из клеток мочи выделяется тем же методом с предвари¬
тельной протеиназной (протеиназа К) обработкой и последующей фенольной
депротеинизацией, что и ДНК из клеток крови. В качестве дополнительных мар¬
керов в плазме крови и клетках мочи можно анализировать мутации гена белка
р53 (распространенность — 50-80%), гиперметилирование гена белка р16 (около
50%), гиперметилирование гена ШС и другие мутации. Анализ мРНК генов ПСА
и ПСМА в плазме и клетках крови является вспомогательным, так как может быть
положительным и при аденоме, и при простатитах. Иммунохимический анализ
ПСА также имеет относительную специфичность,ОПУХОЛИ МОЛОЧНОЙ ЖЕЛЕЗЫОпухоли молочной железы — одни из наиболее распространенных онкологиче¬
ских заболеваний у женщин. Опухоли, развитие которых связано с наследственной
предрасположенностью, составляют 5-10% этой патологии, у пожилых людей этот
показатель достигает 10-20%. Наследственную предрасположенность определяют
мутации в генах BRCA1 и BRCA2, в меньшей степени — в генах белка р53, PTEN,
ATM. В российской популяции наследственные дефекты гена белка р53 при раке
молочной железы встречаются достаточно часто. Особый интерес для диагностики
опухолей молочной железы представляет анализ гиперметилирования гена 14-3-За.
692 БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙЭкспрессия этого гена происходит в ответ на повреждения клеточной ДНК. При
опухолях молочной железы в 91% случаев промотор гена гиперметилирован и не
происходит адекватного синтеза белка стратифина. Функции гена и кодируемого
им белка еще не полностью изучены, однако это не снижает диагностическую цен¬
ность его анализа.При спонтанных опухолях молочной железы в российской популяции почти
в половине случаев обнаруживают мутации в гене белка р53, тогда как наличие
мутаций в гене K-RAS нехарактерно, а ген N-RAS того же семейства RAS поврежден
не более чем в 5-10% случаев. Дефекты гена белка р16 выявляются в половине
случаев этого заболевания. Гиперметилирование ряда генов также характерно для
клеток опухолей молочной железы (см. табл. 9-7).Для диагностических целей наиболее удобными маркерами можно считать мута¬
ции в гене белка р53, появление гиперметилированных форм генов белка р16, ШС и
Е-кадхерина в плазме крови при отсутствии их в клетках крови. Помимо ДНК опу¬
холевого происхождения, в плазме крови при формировании опухоли может выяв¬
ляться РНК маммоглобина, которая является тканеспецифическим молекулярно¬
генетическим онкомаркером. РНК маммоглобина выявляют с помощью ПЦР.
При мониторинге можно оценивать как содержание гиперметилированных форм
генов, так и уровень мРНК маммоглобина, а также наличие или отсутствие мутант¬
ных генов, обнаруженньгх в опухолевом материале. Повышенная экспрессия гена
CCND1, кодирующего циклин D1, наблюдается у 31% больных, что связывают с
благоприятным прогнозом. Обнаружение усиленного образования мРНК циклина
является основанием для назначения терапии с помощью антисмысловой РНК.КАРЦИНОМА ЭНДОМЕТРИЯКарцинома эндометрия составляет 13% онкологических заболеваний женщин,
это одна из наиболее часто встречающихся опухолей, связанных с мутациями
генов системы репарации ДНК (hMSH2, hMLHl, hPMSl и hPMS2). Наиболее
частыми нарушениями являются мутации в PTEN-тене с фосфатазной активно¬
стью (более 50%). Мутации в 12-м, 13-м кодонах гена K-RAS имеют место только в
6% случаев, но не встречаются при гиперплазии. Как и для большинства опухолей,
целесообразны оценка мутаций в гене белка р53 (10-30% опухолей), нарушений
стабильности микросателлитов (20%) и выявление гиперметилированных форм
гена белка р16. Помимо плазмы крови, целесообразно исследование соскобов
слизистой, где в злокачественных образованиях, кроме указанных генов, может
быть обнаружена амплификация или повышенная экспрессия гена PTEN более
чем в 60% случаев. Недостатком последнего анализа является то, что почти в
половине случаев предопухолевых состояний этот ген также сверхэкспрессирован.
Сверхэкспрессия гена белка р53 сочетается с плохим прогнозом,РАК ШЕЙКИ МАТКИПрогноз заболевания при РШМ в огромной степени зависит от своевременного
исследования поражений слизистой шейки матки (рака ш situ) и удаления очага.
Диспансеризация и регулярное цитологическое исследование мазков являются
основой ранней диагностики. Тем не менее молекулярно-генетические методы
могут быть полезным Д0П0ЛНЄНИЄМ для научно обоснованного выбора последую¬
щего ведения больного. Свыше 90% случаев рака in situ сопровождаются обнару¬
жением вируса папилломы человека HPV16 или HPV18. Эти вирусы передаются
половым путем, особенно девушкам-подросткам в связи с незавершенным форми¬
рованием слизистой оболочки шейки матки. При формировании опухоли харак¬
терны развитие мутаций в гене белка р53 (до 50%) и K-RAS (до 30%), обнаружение
гиперметилированных форм гена белка р16 и ЛРС, что может быть использовано
для мониторинга заболевания.
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 693ИММУНОХИМИЧЕСКИЕ И БИОХИМИЧЕСКИЕ ОНКОМАРКЕРЫИммунохимические и биохимические онкомаркеры “ большая грзшпа факто¬
ров, обнаруживаемых в злокачественных и ассоциированных со злокачественным Щ
ростом клетках. В нее входят эмбриональные антигены, такие как а-фетопротеин,
раковый эмбриональный антиген, онкофета л ьные трансплантационные антигены,
дифференцировочные антигены, продукты онкогенов, ростовые и трансформирую¬
щие факторы, ферменты и изоферменты и многие другие. Эти опухолевые маркеры
представляют собой белки с углеводным или липидным компонентом. Они находят¬
ся внутри или на поверхности опухолевых клеток или же образуются в результате
индукции в других клетках. Меньшие чувствительность и специфичность иммунохи-
мических и биохимических маркеров по сравнению с молекулярно-генетическими
маркерами компенсируются большей пригодностью иммунохимических и био¬
химических маркеров для мониторинга онкологических заболеваний и оценки
эффективности химиотерапии, так как их концентрация в крови строже зависит от
размера опухоли. Кроме того, себестоимость иммунохимических анализов ниже.ОБЩИЕ ПРАВИЛА КЛИНИЧЕСКОЙ ОЦЕНКИ РЕЗУЛЬТАТОВ АНАЛИЗОВ
ИММУНОХИМИЧЕСКИХ ОНКОМАРКЕРОВМониторинг уровня иммунохимических онкомаркеров проводят на протяжении
всего заболевания, как до проведения всех видов лечения, так и после их оконча¬
ния, при диспансерном наблюдении. При проведении нескольких курсов химиоте¬
рапии определяют уровень онкомаркеров до начала и через 2 мес после окончания
каждого курса. Практически для всех иммунохимических онкомаркеров имеется
прямая зависимость между концентрацией маркера и клинической эффективно¬
стью лечения. Так, при полной регрессии опухоли его концентрация снижается
на 50%, а при прогрессии — повышается не менее чем на 25%. Концентрацию
онкомаркеров необходимо определять через определенные временные интервалы,
например СА 15-3 при раке молочной железы - 1 раз в 3 мес первый год, а затем
каждые 6 мес. Для быстрорастущих опухолей (рака легких, рака яичка) это дела¬
ется чаще, для медленно растущих — реже.Колоректальная карциномаДанная патология составляет около 90% общего числа раковых заболеваний
желудочно-кишечного тракта, Полипоз толстого кишечника и язвенный колит
рассматриваются как предраковые состояния. Маркером выбора при колоректаль¬
ных опухолях является РЭА. Его содержание коррелирует со стадией опухоли, а
предоперационный уровень РЭА — с продолжительностью безрецидивного пост-
операционного периода и степенью выживаемости. Падение уровня РЭА после
терапевтических процедур свидетельствует об уменьшении объема опухоли. После
успешной радикальной операции уровень маркера возвращается к нормальному
за 6-8 нед. Отсутствие снижения уровня свидетельствует о неполном удалении
опухоли или наличии множественных опухолей. Вторичный подъем уровня РЭА
предполагает наличие рецидива или метастазов. Медленное, пологое увеличение
содержания маркера, например от 2 до 4 нг/мл в течение 6 мес, свидетельствуето локальном рецидиве, а более быстрый подъем — о метастазировании. В очень
редких случаях РЭА-негативной карциномы толстого кишечника может оказаться
полезным определение СА 19-9.Рак поджелудочной железыЗаболеваемость раком поджелудочной железы — 10 на 100 тыс. человек в год.
Мужчины заболевают в 3 раза чаще, чем женщины. Опухолевым маркером выбора
694 БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙпри этой патологии является СА 19-9. Не обнаружено корреляции между массой
опухоли и уровнем маркера, но очень высокий его уровень (более 10 ООО ЕД/мл)
практически всегда предполагает плохой прогноз. Содержание маркера более
1000 ЕД/мл у больных с карциномой поджелудочной железы обычно свиде¬
тельствует о вовлечении в процесс лимфатических узлов. Уровень маркера выше10 ООО ЕД/мл свидетельствует о гематогенной диссеминации. Пациентам с эпига¬
стральной симптоматикой рекомендуют проходить обследование на СА 19-9 через2-3 нед после болевого приступа. Нормальный уровень СА 19-9 не исключает кар¬
циномы поджелудочной железы, равно как и повышенное значение этого маркера
может наблюдаться при ряде доброкачественных заболеваний, а также при раке
желудка, толстой кишки и других органов и тканей. Мог}^т быть добавлены другие
иммунохимические онкомаркеры. Это определение РЭА, АФП, СА 242. Наиболее
надежным маркером опухолей поджелудочной железы является определение
мутантного ЛА5-гена методом ПЦР.Рак желудкаРаспространенность рака желудка по отношению к общему числу раковых забо¬
леваний составляет 12%. Мужчины болеют в 3 раза чаще, чем женщины. Наиболее
приемлемым маркером для мониторинга течения и эффективности терапии кар¬
циномы желудка является СА 72-4. При специфичности 95% чувствительность
первичной диагностики для СА 72-4 составляет до 48%, для РЭА — до 43%, для
СА 19-9 — до 41%. Чувствительность маркера СА 72-4 возрастает у пациентов с
отдаленными метастазами. Сочетание СА 72-4 и РЭА позволяет достичь макси¬
мальных чувствительности и специфичности, в связи с чем в настоящее время для
мониторинга течения и эффективности терапии карциномы желудка рекомендуют
именно эту комбинацию.Карцинома пищевода и анального отдела кишечникаОпухолевым маркером выбора при данной патологии является антиген пло¬
скоклеточной карциномы (SCC), поскольку большинство этих опухолей являются
плоскоклеточными.Гепатоцеллюлярная карциномаЧастота заболеваемости у мужчин в 3 раза выше, чем у женщин. Пик заболевае¬
мости приходится на возраст 40-60 лет. Опухолевым маркером выбора для мони¬
торинга течения заболевания и эффективности терапии является АФП. При пер¬
вичной диагностике у 95% пациентов отмечается повышенное содержание АФП,
68% имеют уровень выше 100 нг/мл, а 40% — выше 10 ООО нг/мл. В отличие от
больных с первичной гепатоцеллюлярной карциномой, при метастатическом пора¬
жении печени существенно повышается уровень РЭА (у 72% — выше 10 нг/мл).
Именно поэтому сочетанное определение АФП и РЭА обеспечивает точную
дифференциальную диагностику первичной гепатоцеллюлярной карциномы и
метастатического процесса в печени. При гепатите и других доброкачественных
заболеваниях печени уровень АФП может быть повышен, но редко увеличивается
более 500 нг/мл. Таким образом, АФП пригоден для раннего выявления гепато¬
целлюлярной карциномы у больных с циррозом печени. При АФП-негативных
холангиоцеллюлярных карциномах онкомаркером выбора является СА 19-9, а
при вторичных процессах в печени - РЭА.Рациональное использование иммунохимических онкомаркеров при опухолях
желудочно-кишечного тракта представлено в табл. 9-8.
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 695Таблица 9-8. Рациональное использование опухолевых маркеров при опухолях желудочно-
кишечного трактаЛокализация опухолиРЭААПФСА19-9СА72-4SCCСА 242Толстый кишечник+ +Поджелудочная железа+ + +ЖелудокПищеводПечень (ГЦК)+ + +Желчные протокиПримечание. Количество {+) отражает степень важности маркера.Карцинома яичникаКарцинома яичника составляет около 20% всех гинекологических злокаче¬
ственных заболеваний. Наиболее важным опухолевым маркером для мониторинга
течения и эффективности терапии серозной карциномы яичника является СА 125.
Он также пригоден при слизеобразующей карциноме яичника и карциноме эндо¬
метрия. Его чувствительность зависит от стадии опухолевого процесса. Обычно
данный маркер не дает ложноположительных результатов, таким образом, диагно¬
стическая операция, выполняемая после обнаружения повышенного уровня или
вторичного подъема СА 125, всегда позволяет выявить опухолевую ткань.Карцинома шейки маткиОпухолевым маркером выбора при данной карциноме является SCC, позволяю¬
щий не только обнаруживать рецидив на ранней стадии, но и отражать реакцию
уже обнаруженной карциномы на проводимую терапию. Если изначально повы-
шенньїй уровень SCC не снижается в течение трех циклов лечения, химиотерапия
должна быть прекращена. Определение РЭА в дополнение к SCC увеличивает про¬
гностическую ценность, способствует обнаружению рецидивов, позволяет оценить
эффективность терапии.ГерминомыВ эту группу заболеваний входят опухоли яичка — наиболее частые онкологи¬
ческие заболевания молодых мужчин. Абдоминальное расположение яичек при
крипторхизме в 4 раза увеличивает риск онкологического заболевания. Маркером
выбора для диагностики этих опухолей, мониторинга течения заболевания и
эффективности терапии являются в равной степени АФП и ХГЧ. Более того, так
как гистологический тип опухоли может меняться в ходе терапии, при герминомах
рекомендуют сочетанное определение этих двух маркеров. Серийное тестирование
АФП и ХГЧ особенно показано в ходе лечения термином, причем профили марке¬
ров могут не совпадать. Концентрация АФП снижается до нормальных значений
в течение 5 дней после радикальной операции, это падение отражает уменьшение
общей массы опухоли. Сочетанное определение АФП и ХГЧ при определении
рецидивов несеминоматозных опухолей яичка позволяет повысить чувствитель¬
ность до 86%. Возрастающая концентрация АФП и/или ХГЧ указывает на про¬
должающийся рост опухоли. Изначально высокие значения АФП и/или ХГЧ
предполагают неблагоприятный прогноз. При оценке эффективности химиотера¬
пии после двух ее циклов снижение ХГЧ должно быть более чем троекратным, а
АФП — более чем семикратным в положительном случае.
ШШШішщш.696БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙКарцинома простатыКарцинома простаты — вторая по распространенности опухоль у мужчин.
Особенно важна дифференциальная диагностика карциномы простаты с аденомой
простаты. Идеальным средством для дифференциальной диагностики является
гиперметилированная форма гена глутатион-5-трансферазы (GSTP1), появление
которой является различием между аденомой, где ген не гиперметилирован, и аде¬
нокарциномой, где ген гиперметилирован в 91% случаев. Тем не менее в случае диф¬
ференциальной диагностики с опухолями другого генеза этот показатель недоста¬
точно эффективен, так как гиперметилированная форма GSTP1 наблюдается в 85%
случаев печеночно-клеточного рака, и в некотором проценте случаев ~ при других
локализациях. В отношении тканевой специфичности анализ ПСА в сыворотке
крови более тесно связан с клетками простаты. Маркером выбора для диагностики,
мониторинга течения заболевания и эффективности терапии при карциноме про¬
статы является ПСА. При специфичности 90% чувствительность ПСА приближается
к 70%. Наблюдение за концентрацией ПСА обеспечивает более раннее обнаружение
рецидива и метастазирования, чем прочие методы. После тотальной простатэкто-
мии ПСА не должен выявляться; его обнаружение свидетельствует об остаточной
опухолевой ткани, регионарных или отдаленных метастазах. ПСА может быть реко¬
мендован для скрининговых обследований мужчин старше 50 лет. При этом важнее
динамика изменения показателя, а не его абсолютное значение, По динамике изме¬
нения концентрации ПСА карцинома простаты может быть распознана на ранней
стадии. Следует иметь в виду, что экспрессия ПСА может ингибироваться при анти-
андрогенной терапии. Уровень ПСА может увеличиваться после ректальной паль¬
пации простаты, поэтому анализ следует проводить не ранее чем через 2 нед после
этой процедуры. Концентрация ПСА в сыворотке довольно хорошо коррелирует с
размерами опухоли простаты и стадией заболевания и обычно превышает норму в
4-8 раз при ni-IV стадии заболевания. При гормональной терапии уровень ПСА
может упасть ниже нормы, хотя это не означает исчезновения опухоли.Карцинома молочной железыРаспространенность этой опухоли по отношению к общему числу раковых заболе¬
ваний составляет 18%. Она является наиболее распространенным злокачественным
образованием у женщин. Опухолевым маркером выбора при карциноме молочной
железы является СА15-3. В настоящее время данный маркер принят за эталон, отно¬
сительно которого оценивается каждый новый маркер для карциномы молочной
железы. Мониторинг течения и эффективности терапии данной патологии наилуч¬
шим образом осуществляют с помощью РЭА и СА 15-3. При специфичности 95% по
отношению к доброкачественным заболеваниям молочной железы сочетанное опре¬
деление РЭА и СА 15-3 достигает чувствительности 31 % при первичной диагностике
и 71% — при диагностике метастазирующей карциномы молочной железы.Рациональное использование опухолевых маркеров репродуктивных органов и
тканей представлено в табл. 9-9,Таблица 9-9. Рациональное использование опухолевых маркеров при опухолях репродуктивных
органов и тканейЛокализация опухолиРЭАСА 19-9СА 72-4СА125СА15-3SCCхгчЯичники--+ ++ + +--Молочная железа+ + +---+ + +--Шейка матки+ +++ + +--+ + +-Хорион------+ + +Примечание. Количество (+) отражает степень важности маркера,
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 697Карцинома мочевого пузыряКарцинома мочевого пузыря встречается в 3,5 раза чаще у мужчин, чем у жен¬
щин. Пик заболеваемости приходится на людей старше 70 лет. Особое прогности¬
ческое значение имеет разделение карцином мочевого пузыря по патологоанато¬
мическому признаку на поверхностные (T/Tj) и мышечно-инвазивные (Т2-Т4)
карциномы. Поверхностные рецидивирующие опухоли легко выявляются при
урологическом обследовании. Для инвазивных рецидивирующих опухолей мар¬
кером выбора является CYFRA 21-1. Онкомаркеры ТРА и TPS имеют несколько
меньшую чувствительность.Карцинома бронховКарцинома бронхов является наиболее распространенной опухолью у муж¬
чин. Чувствительность маркеров по отношению к доброкачественным заболе¬
ваниям легких при первичной диагностике карциномы бронхов низка. Так, при
специфичности 95% РЭЛ имеет чувствительность 27%, SCC — 15%, NSE — 16%.
Наиболее высока чувствительность у опухолевого маркера CYFRA 21-1, кото¬
рая достигает 47%. Маркером выбора при мелкоклеточной карциноме легких
как для диагностики, так и для мониторинга эффективности терапии является
нейроспецифическая енолаза (НСЕ), Сочетанное определение НСЕ и CYFRA 21-1
позволяет увеличить чувствительность. Для немелкоклеточной карциномы легко¬
го маркером выбора является CYFRA 21-1. Этот же маркер обеспечивает наилуч¬
шую дифференциальную диагностику плоскоклеточной карциномы с доброкаче¬
ственными заболеваниями легких. При аденокарциноме легких равно пригодны
онкомаркеры CYFRA 21-1 и РЭА, их диагностическая чувствительность равно¬
ценна.Опухоли носоглотки и ухаРаспространенность этих опухолей по отношению к общему числу рако¬
вых заболеваний составляет 2%. Маркерами выбора являются SCC и РЭА.
Чувствительность SCC зависит от стадии опухоли, в то время как чувствитель¬
ность РЭА от этого зависит значительно меньше. Временные профили уровней
SCC и РЭА в большинстве случаев различны. Именно поэтому рекомендуют их
сочетанное определение у пациентов с заболеваниями носоглотки и уха, что
позволяет выявлять рецидивы в 87% случаев со временем опережения 4,4 мес.
Опухолевый маркер SCC можно использовать и для мониторинга эффективно¬
сти терапии, поскольку возрастающий или устойчивый (патологический) уро¬
вень его свидетельствует о неэффективности проводимой терапии. Изменение
концентрации SCC в ответ на проводимую терапию коррелирует с клинической
картиной (ремиссией или прогрессированием).Рациональное использование опухолевых маркеров при опухолях легких и
носоглотки представлено в табл. 9-10.Таблица 9-10. Рациональное использование опухолевых маркеров при опухолях легких и носо¬
глоткиЛокализация опухолиРЗАНСЕ1 SCCCYFRAЛегкие(SCLC)-+ + +-+ +Легкие (NSCLC)+--+ + +Носоглотка+-+ + +-Примечание. Количество (+) отражает степень важности маркера.
^ 698 БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙОпухоли центральной нервной системыОбнаружение внутриоболочечного синтеза РЭА позволяет установить диа-
гноз менингеальной карциномы в 80% случаев. Но по исследованию ликвора
' не обнаружено корреляции между уровнем РЭА и массой опухолевых клеток.
Комбинированное использование цитологических и онкомаркерных методов
анализа позволяет диагностировать практически все случаи карцином твердой
мозговой оболочки. Для правильной интерпретации результатов необходимо
учитывать существование гематоэнцефалического барьера, а также тот факт, что
после успешной внутриоболочечной химиотерапии количество опухолевых кле¬
ток уменьшается значительно быстрее, чем уровень РЭА, поскольку погибшие
клетки могут не удаляться из ликвора.Множественная миелома, неходжкинские лимфомыДля прогноза и выбора терапии крайне важное значение имеет классификация
лимфом. Неходжкинские лимфомы — разнородная группа заболеваний, которые
можно рассматривать как злокачественную моноклональную пролиферацию
лимфоцитов, которые остановились на определенной стадии развития. Именно
поэтому важным моментом является обнаружение маркеров на мембранах клеток
различных дифференцировочных антигенов или антигенных кластеров. Они не
являются специфическими для лейкемических или лимфомных клеток, но харак¬
теризуют клеточную форму, на которой остановилось развитие. Заболеваемость
неходжкинскими лимфомами составляет 5,8 на 100 тыс. мужчин и 4,1 на 100 тыс.
женщин в год. Около 90% случаев приходится на В-клеточные лимфомы, осталь¬
ные 10% — на лимфомы Т-клеточного происхождения. Наиболее информативным
онкомаркером для мониторинга течения заболевания и обоснования прогноза у
пациентов с неходжкинскими лимфомами является р-2-микроглобулин (p-2-м).
Уровень p-2-м в сыворотке крови таких больных бывает повышен в зависимости
от стадии заболевания, степени злокачественности и типа клеток. При этом паци¬
енты с прогрессирующим заболеванием имеют более высокий уровень (3-2-м, чем
в период стабилизации заболевания. Пациенты с патологически высоким уровнем
p-2-м имеют значительно меньшую продолжительность жизни, чем больные с
нормальным или слегка повышенным содержанием маркера. У больных с хрони¬
ческим лимфолейкозом имеется корреляция между количеством лимфоцитов в
периферической крови и уровнем ^-2-м.Для обоснования прогноза и мониторинга течения заболевания используют
онкомаркер СТК, причем его высокий уровень характерен для агрессивной формы
заболевания. Пациенты с уровнем СТК выше 5 ЕД/л имеют более низкую продол¬
жительность жизни, чем имеющие уровень ниже этой величины. Множественную
миелому можно рассматривать как результат инфильтрации костного мозга и
реже прочих органов и тканей пролиферирующими лимфоплазмоцитоидными
клетками, сопровождающейся появлением большого количества моноклональ¬
ных иммуноглобулинов, вырабатываемых этими клетками. Наиболее важным
для постановки диагноза является выявление моноклонального иммуноглобу¬
лина (mig) или его субъединиц в сыворотке крови и/или моче. Количественное
определение mIg важно для прогнозирования, мониторинга течения заболевания
и эффективности терапии. Возрастание концентрации является прогностически
плохим признаком и указывает на прогрессирование заболевания. Особую важ¬
ность имеет определение процентного роста концентрации в единицу времени.
У пациентов с доброкачественными моноклональными гаммапатиями концентра¬
ция mig остается постоянной на протяжении нескольких лет. При вялотекущей
миеломе концентрация mig остается на одном уровне на протяжении более 10 лет
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ699даже без лечения. Переход в прогрессивную множественную миелому, требующую
лечения, характеризуется быстрым ростом концентрации этого белка.Для прогноза наиболее приемлемыми являются p-2-м и СТК. Пациенты с повы¬
шенным уровнем этих маркеров имеют значительно более низкую продолжитель¬
ность жизни (до 1,7 года), чем люди с нормальным уровнем.Названия и диапазон применения опухолевых маркеров, используемых при наи¬
более распространенных солидных опухолях, представлены в табл. 9-11-9-13.Таблица 9-11. Диапазон применения опухолевых маркеровМаркерСкринингДиагностикаМониторингПрогнозРЭАГруппы рискаС-клеточная карциномаС-клеткиТолстая кишкаАФПГруппы рискаГерминома, гепатоцел-
люлярная карциномаГерминома, гепатоцел-
люлярная карциномаГерминомаСА19-9-Поджелудочная железаПоджелудочная железа,
желчные протоки-СА 242-Поджелудочная железа,
кишечникПоджелудочная железа,
кишечник-СА 72.4--Желудок, яичники-СА125--Яичники-СА 15-3--Молочная железа-NSE-Мелкоклеточная карци¬
нома легких (SCLS)Легкие (SCLC), нейро-
бластома, апудома-SCC--Опухоли носоглотки,
уха, пищевода-CYFRA21-1--Легкие (NSCLC), моче¬
вой пузырь-ХГЧГруппы рискаГерминома, трофобла-
стические опухолиГерминома, трофобла-
стические опухолиГерминома, трофо-
бластические опухолиPSAМужчины >50
летПростатаПростата-ТРА--Мочевой пузырь-КальцитонинГруппы рискаС-клеткиС-клеткиС-клеткиР-2-М--Множественная миело-
ма(НХЛ)-Таблица 9-12. Показания к применению опухолевых маркеровМаркерНормаПоказания к использованиюПримечаниеКальцитонин<100 пг/млМедуллярная карцинома щитовид¬
ной железыТакже пригоден для скрининга
групп риска и диагностикиРаковый антиген
72-4 (СА 72-4)<3 ЕД/млКарцинома желудка, слизеобра¬
зующая карцинома яичникаВ сочетании с РЭА при карци¬
номе желудка. Маркер второй
линии выбора при карциноме
яичника(3-2-микроглобулин(Р-2-М)1,2-2,5 мг/лМножественная миелома, неход-
жкинские лимфомыТакже важен при диагностике
заболеваний почекАнтиген плоскокле¬
точной карциномы
(SCC)<2,5 нг/млМониторинг течения и терапии
плоскоклеточной карциномь!
шейки матки, носоглотки, уха, лег¬
ких и пищеводаВажно: загрязнение элементами
слюны ведет к завышенным
результатамФрагмент цито¬
кератина 19
(CVFRA21-1)<3,3 нг/млНемелкоклеточная карцинома
легкихВажно: загрязнение элементами
слюны ведет к завышенным
результатамРаковый антиген
15-3 (СА15-3)<28 ЕД/млМониторинг терапии карциномы
молочной железыВ сочетании с РЭА
seштpiш700БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙОкончание табл. 9-12МаркерНормаПоказания к использованиюПримечаниеУглеводный антиген
19-9 (СА19-9)<37 ЕД/млКарцинома поджелудочной желе¬
зыМаркер второй линии выбора
при колоректальных опухоляхУглеводный антиген
242 (СА 242)<ЕД^'млКарцинома поджелудочной желе¬
зы, желудка, кишечникаМаркер второй линии при опу¬
холях жктРаковый антиген
125 (СА125)<35 ЕД/мл
{<65 ЕД/мл)Мониторинг течения и терапии
карциномы яичникаДифференцировочный антиген
из дериватов целомического
эпителия (эпителий мюллерова
протока)Нейроспеци-
фическая енолаза<12,5 нг/млМелкоклеточная карцинома
легких, нейробластома, апудома
(например, инсулинома, феохро-
моцитома, карциноидные опухоли)Образцы крови не следует
хранить долго (ложнопо¬
ложительные результаты).
Центрифугировать не позднее
1 ч после взятия образца.В сочетании с РЭА при мелко¬
клеточной карциноме легкихХорионический
гонадотропин чело¬
века (ХГЧ)Мужчины —
0-5 МЕ/млНесеминоматозные герминомы
{48-86%): хориокарциномы яичка
или плаценты (100%); хорионаде-
нома (97%); семиномы (комбини¬
рованные опухоли) (7-14%)Тканевый поли-
пептидныи антиген
(ТРА)<80 ЕД/лКарцинома мочевого пузыряЗначение >80: карцинома моче¬
вого пузыря, бронхов, яичника,
желудка, возможны заболевания
печени, почек, легких и др,
Специфичность низкаяРаковый эмбрио¬
нальный антиген
(РЭА)<3 нг/млМониторинг течения и терапии
карциномы; колоректальной, брон¬
хиальной и желудочной5% курильщиков имеют уровень
маркера 2,5-5 нг/мл; 3% —5-10 нг/мл; 1% -10-20 нг/мла-Фето протеин
(АФП)<15 нг/млМониторинг беременности, диа¬
гностика и мониторинг течения и
терапии первичной гепатоцеллю-
лярной карциномы и терминомПреходящие повышения уровня
АФП при заболеваниях печениПростатоспеци¬
фический антиген
(ПСА)<3,7 нг/млКарцинома простатыТканеспецифический. Забор крови
для анализа следует проводить до
ректального исследования. При
карциноме простаты, как правило,
уровень выше 10 нг/млТаблица 9-13. Рекомендуемые лабораторные тесты при обследовании больных группы повышен¬
ного риска возникновения онкологических заболеванийЛокализация опухолиЛабораторные тестыПечень, поджелудочная железаРЭА, СА 19-9, ЛДГ, ЛДГ;^, АФП, ЩФ, ГГТФ, ферритин, эластаза,
паратиреоидный гормонЖелудок, тонкая, толстая, прямая кишкаРЭА, СА 19-9, ЛДГ„ серотонинЯичник, маткаРЭА, СА 125, Р-2-М, АФП , ХГЧМолочная железаРЭА, MCA, ферритин. ЛДГ, ЛДГ,, амилаза, АКТГЯичкоАФП, ХГЧ. РЭА, ЛДГ, ЛДГ,ЛегкиеРЭА, НСЕ, СА 19.9, (3-2-м, ферритин, ЛДГ,, ЛДГ^, АКТГ, корти¬
зол, паратиреодный гормонПредстательная железаКислая фосфатаза (простатический изофермент), РЭА, ПСАГемобластозыРЭА, |5-2-м, ферритин, общий анализ крови, миелограмма,
цитохимическая реакция форменных элементов крови, белок
Бенс-Джонса в моче, иммуноглобулины, определение парапро¬
теинов в крови и моче
БІ/ІОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ701МАРКЕРЫ КОСТНОГО РЕМОДЕЛИРОВАНИЯ ПРИ
ОБСЛЕДОВАНИИ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ
С ПОРАЖЕНИЕМ СКЕЛЕТАСкелет является третьей по частоте локализацией (после легких и печени)
метастазирования злокачественных опухолей. С наибольшей частотой в кости
метастазирует рак предстательной (54-85%), молочной (47-85%) и щитовидной
(28-60%) желез, рак легкого и почки (32-40%), мочевого пузыря (40-42%).Своевременная диагностика метастазирования в кости необходима для пра¬
вильного планирования лечебных мероприятий, а также оценки прогноза, однако
используемые в клинической практике инструментальные методы исследова¬
ния скелета обладают недостаточными чувствительностью и специфичностью.
Наиболее распространенный метод диагностики метастазов в костях — рентгено¬
графия, которая позволяет выявлять очаги поражения лишь при наличии в них
структурных изменений с деминерализацией костного матрикса от 30 до 50%, и,
таким образом, в связи с рентгенонегативностью до 30% метастазов не определя¬
ются на рентгенограммах. Более чувствительным методом является сцинтиграфия,
которая позволяет обнаруживать деструктивные процессы на ранних стадиях,
однако накопление индикатора в местах со сниженной плотностью костной ткани
независимо от характера ее изменения делает этот метод весьма неспецифичным.
Таким образом, ранняя диагностика метастазов, а также наблюдение за течением
процесса и оценка эффективности лечения затруднены, что делает акт^^альным
поиск более чувствительных методов.в последнее время существенно возрос интерес к развитию неинвазивных мето¬
дов диагностики и мониторинга поражения скелета у онкологических больных,
что обусловлено интенсивными исследованиями патогенеза метастазирования, а
также появлением новых подходов в лечении метастазов в костях.ОСНОВНЫЕ МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ МЕТАСТАЗИРОВАНИЯ В КОСТИ
И ЗАКОНОМЕРНОСТИ БИОХИМИЧЕСКИХ НАРУШЕНИЙВ соответствии с анатомо-рентгенологическими характеристиками поражения
костей различают остеокластические (литические) и бластические (склеротиче¬
ские) метастазы. В то же время часто встречаются смешанные формы, являющиеся
сочетанием обоих вариантов и представляющие по сути две фазы одного и того же
основного процесса.В соответствии с представлениями о патогенезе метастазирования существу¬
ет несколько механизмов костной деструкции при злокачественных процессах.
Раньше основное внимание уделялось непосредственному действию злокачествен¬
ных клеток на костную ткань, которое выражается в способности раковых клеток
разрушать окружающую их ткань в результате секреции комплекса высокоактив¬
ных протеолитических ферментов, включающего коллагеназы. Однако очевидно,
что местное деструктивное действие раковых клеток не может проявляться на
ранних стадиях развития солидных опухолей, поскольку их проникновение в
костную ткань представляет многоступенчатый, длительный и сложный процесс.
В настоящее время одним из главных механизмов метастатической деструкции
костей признается активация остеокластов в результате системного действия на
них паракринных факторов, продуцируемых злокачественными клетками.Злокачественные опухоли различного гистогенеза, включая рак молочной и
щитовидной желез, рак легкого и некоторые другие солидные опухоли способ¬
ны продуцировать и секретировать в кровь цитокины, факторы роста и другие
биологически активные соединения, которые прямо или косвенно оказывают
стимулирующий эффект на остеокласты. Критическую роль в развитии и про¬
702 БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙгрессии костных метастазов оказывают такие цитокины, как интерлейкины-1 и -6,
факторы некроза опухолей-а и -р, а также факторы роста (эпидермальный, а- и
(3-трансформирующий и тромбоцитарный) и простагландини, которые, с одной
стороны, могут проявлять активирующее действие на остеокласты, а с другой —
ингибирующее на остеобласты.Из клеток рака легкого выделен специфический белок, обладающий активно¬
стью паратиреоидного гормона (ПТГ) и получивший название «протеин, подоб¬
ный ПТГ» (ПТГпП). Эктопической продукции раковыми клетками этого белка
придается особое значение в развитии остеолиза и сопровождающей деструкцию
костной ткани гиперкальциемии. При иммуногистохимических исследованиях
установлена экспрессия ПТГпП в разных типах плоскоклеточного рака, особенно
рака легкого, молочной железы, почки, при этом с максимальной частотой ПТГпП
экспрессируется именно в клетках костных метастазов. Более того, уровень ПТГпП
и выраженность его экспрессии в злокачественных клетках предложено использо¬
вать в качестве фактора прогноза метастазирования опухолей в кости с последую¬
щим формированием групп риска для профилактического лечения.Перечень медиаторов костной резорбции при множественной миеломе включа¬
ет цитокины (интерлейкины-1 и -6 и фактор некроза опухоли-(і), продуцируемые
плазматическими клетками, а также другие, окончательно не идентифицирован¬
ные факторы, активирующие остеокласты, которые вырабатываются клетками
костного мозга и стромальными элементами в ответ на плазмоклеточную инфиль¬
трацию. Другим важным аспектом патогенеза остеолиза при множественной мие¬
ломе является снижение функциональной компетенции остеобластов, доказанное
при гистологическом и морфометрическом исследовании биопсийного материала
нормальной костной ткани и очагов деструкции. Наряду с признаками интенсив¬
ной резорбции, выражающимися в увеличении количества и размеров остеокла¬
стов, а также поверхности костной резорбции были обнаружены пролиферация
остеобластов и увеличение их поверхности. Однако скорость костеобразования
существенно отставала от скорости резорбции,В соответствии с механизмами костного ремоделирования локальный и систем¬
ный эффект злокачественных опухолей может проявляться в усилении резорбции
и потери костной массы, которые наблюдаются при раке молочной железы, лег¬
кого, других солидных опухолях, а также множественной миеломе. Таким обра¬
зом, наиболее распространенный остеолитический характер поражения скелета
реализуется при нарушении баланса между процессами резорбции и формиро¬
вания костной ткани, которое возникает в результате активации или увеличения
количества остеокластов, а также при снижении количества или функциональной
компетенции остеобластов.В то же время некоторые опухоли могут секретировать факторы, оказывающие
системное действие на остеобласты, вызывая их образование или активацию. На
клиническом материале эти данные пока не получили полного подтверждения,
однако в экспериментах на животных и клеточных культурах были получены
доказательства способности некоторых типов раковых клеток, в частности клеток
рака предстательной железы, продуцировать ^-трансформирующий и тромбоци¬
тарный факторы роста, а также фрагменты урокиназы и некоторых белков, обла¬
дающих стимулирующим эффектом на пролиферацию и активность остеобластов.
Известно, что бластические метастазы развиваются преимущественно при раке
предстательной железы, при этом индуцированное активированными остеобла¬
стами костеобразование приводит к формированию очагов с повышенной плотно¬
стью костной ткани, симулирующих на рентгенограммах картину остеосклероза.
Наряду с характерным для бластических метастазов интенсивным остеосинтезом
существуют гистологические и биохимические признаки активации остеокластов
и усиления костной резорбции при поражении скелета у больных раком пред¬
БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙ 703стательной железы. Получены данные, свидетельствующие, что клетки рака
молочной железы мог}^т секретировать факторы, стимулирующие остеобласты.
В соответствии с этим фактом можно предполагать, что в развитии остеосклероза,
признаки которого обнаруживают при метастазировании рака молочной железы и
других злокачественных опухолей, важную роль могут играть паракринные фак¬
торы, усиливающие костеобразование. Это в определенной степени противоречит
общепринятому мнению, что усиление формирования костной ткани происходит
в ответ на интенсивную резорбцию.Таким образом, ведущими в патогенезе метастазирования в кости являются
эндокринные и ауто-/паракринные факторы, которые могут формировать остео-
тропность и метастатический потенциал раковых клеток. Эти данные и теоре¬
тические предпосылки послужили основой для разработки и испытания новых
подходов в лечении костных метастазов.В настоящее время наиболее эффективными препаратами, снижающими интен¬
сивность резорбции и потерю костной массы при заболеваниях скелета различной
этиологии, являются бисфосфонаты. Механизм действия бисфосфонатов основан
на их способности ингибировать активность остеокластов, а также снижать интен¬
сивность процессов кальцификации при депонировании препарата, обладающего
высоким сродством к гидроксиапатиту, в минеральной части костного матрикса.
Бисфосфонаты (памидронат, клодронат, ибандронат) широко используют в кли¬
нической практике при заболеваниях скелета метаболического характера, а также
применяют при лечении костных метастазов.К неинвазивным методам диагностики и мониторинга заболеваний скелета
относятся биохимические маркеры метаболизма костной ткани. Для костной
ткани характерен активный метаболизм, поэтому оказалось возможным иден¬
тифицировать ряд соединений сыворотки крови и мочи, представляющих собой
продукты синтеза или деградации костного матрикса. Наиболее информативные
из них и получившие внедрение в клиническую практику в качестве маркеров фор¬
мирования и резорбции костной ткани при заболеваниях скелета представлены в
табл. 9-14.Таблица 9-14. Основные биохимические маркеры метаболизма костной тканиМаркерыТканевое происхождениеМатериалМетодыопределенияМаркеры костеобразованияАктивность щелочной фосфатазы
(общая)Костная ткань, печень,
почки, кишечникКровьФотометрияКостный изофермент щелочной фос¬
фатазы (ВАР)Костная тканьКровьИФА, преципитация
с лектином, электро¬
форезОстеокапьцин (BGP)Костная ткань, тромбоцитыКровьИФА. РИАПроколлагено вые пропептиды;• С-концевой пропептид (РЮР);* М-конц0вой пропептид (PINP)Костная ткань, мягкие
ткани, кожа.Костная ткань, мягкие
ткани, кожаКровь1/1ФА, РИАМаркеры резорбции костной тканиГидроксипролин (ОНР)Костная ткань, хрящевая
ткань, мягкие ткани, кожа,
кровьМочаКолориметрия. РИА,
ЖХВРГалактоз илгидро ксил изинКостная ткань, мягкие
ткани, кожаМочаЖХВРПиридиновые связи коллагена; пири-
динолин (PYD); дезоксипиридинолин
(DPD)Костная и хрящевая ткани,
связки, сосуды.Костная ткань, дентинМочаЖХВР, ИФА, РИА
704БИОЛОГИЧЕСКИЕ МАРКЕРЫ ОПУХОЛЕЙОкончание табл. 9-14МаркерыТканевое происхождениеМатериалМетодыопределенияКоллагеновые пептиды:• С-концевой телопептид {ІСТР, СТХ,
CrossLaps):• N-концевой телопептид (NTP, NTX)Костная ткань, кожа.
Костная ткань, кожаКровь, моча
МочаРИА. ИФА
ИФАКислая фосфатаза, не ингибируемая
тартратом (TRAP)Костная ткань, кровьКровьФотометрия, ИФАПримечание. В скобках — межд^тнгародЕіая аббревиат>’ра.
Глава 10
Лабораторная генетикаЦИТОГЕНЕТИЧЕСКАЯ ДИАГНОСТИКА
ХРОМОСОМНЫХ БОЛЕЗНЕЙМедицинская цитогенетика — изучение кариотипа человека в
норме и при патологии. Это направление возникло в 1956 г., когда
Тио и Леван усовершенствовали метод приготовления препаратов
метафазных хромосом и впервые установили модальное число
хромосом (2п=46) в диплоидном наборе. В 1959 г, была расшифро¬
вана хромосомная этиология ряда заболеваний — синдромов Дауна,
Клайнфельтера, Шерешевского-Тернера и некоторых других син¬
дромов аутосомных трисомий. Дальнейшее развитие медицинской
цитогенетики в конце 1960-х годов было обусловлено появлением
методов дифференциального окрашивания метафазных хромосом,
дающих возможность идентификации хромосом и их отдельных
районов. Методы дифференциального окрашивания не всегда обе¬
спечивали правильность установления точек разрывов в резуль¬
тате структурных перестроек хромосом, в 1976 г. Юнис разрабо¬
тал новые методы их изучения на стадии прометафазы, которые
получили название «высокоразрешающие методы». Использование
таких методов позволило получить хромосомы с разным количе¬
ством сегментов (от 550 до 850) и дало возможность проведения
идентификации нарушений с вовлечением небольших их участков
(микроперестроек), с начала 1980-х гг. цитогенетика человека всту¬
пила в новый этап развития: в практику был внедрен хромосомный
анализ молекулярно-цитогенетических методов, флюоресцентной
гибридизации ш situ {FISH ~ Fluorescence In Situ Hybridization). Этот
метод широко используют для выявления более тонких структур¬
ных аномалий хромосом, которые неразличимы при дифференци¬
альном окрашивании. В настоящее время применение различных
методов хромосомного анализа позволяет успешно проводить пре-
и постнатальную диагностику хромосомных болезней.Хромосомные болезни — большая группа клинически много¬
образных состояний, характеризуемых множественными врож¬
денными пороками развития (ВПР), этиология которых связана
с количественными или структурными изменениями кариотипа.
В настоящее время различают почти 1000 хромосомных аномалий,
из них более 100 форм имеют клинически очерченную картину и
называются синдромами; их вклад в спонтанные аборты, неона-
706 ПЛЬОРМОРНАЯ ГЕНЕТИКАтальную смертность и заболеваемость весьма значителен. Распространенность
хромосомных аномалий среди спонтанных абортов составляет в среднем 50%,
среди новорожденных с грубыми множественными БПР — 33%, мертворожден¬
ных и перинатальна умерших с ВПР — 29%, недоношенных с ВПР — 17%, ново¬
рожденных с ВПР — 10%, мертворожденных и перинатально умерших — 7%,
недоношенных — 2,5%, всех новорожденных — 0,7%.Большинство хромосомных болезней являются спорадическими, возникающи¬
ми заново вследствие геномной (хромосомной) мутации в гамете здорового роди¬
теля или в первых делениях зиготы, а не наследуемыми в поколениях, что связано
с высокой смертностью больных в дорепродуктивном периоде. Фенотипическую
основу хромосомных болезней составляют нарушения раннего эмбрионального
развития. Именно поэтому патологические изменения складываются еще в пре¬
натальном периоде развития организма и либо обусловливают гибель эмбриона
или плода, либо создают основную клиническую картину заболевания уже у
новорожденного (исключение составляют аномалии полового развития, форми-
руюш;иеся в основном в период полового созревания). Раннее и множественное
поражение систем организма характерно для всех форм хромосомных болезней.
Это черепно-лицевые дизморфии, врожденные пороки развития внутренних
органов и частей тела, замедленные внутриутробный и постнатальный рост и раз¬
витие, отставание психического развития, пороки центральной нервной системы,
сердечно-сосудистой, дыхательной, мочеполовой, пищеварительной и эндокрин¬
ной систем, а также отклонения в гормональном, биохимическом и иммунологи¬
ческом статусе. Для каждого хромосомного синдрома характерен комплекс ВПР
и аномалий развития, присущий в какой-то мере только данному типу хромо¬
сомных патологий. Клинический полиморфизм каждой хромосомной болезни в
общей форме обусловлен генотипом организма и условиями среды. Вариации в
проявлениях патологии могут быть очень широкими — от летального эффекта до
не.значительных отклонений в развитии. Несмотря на хорошую изу^іенность кли¬
нических проявлений и цитогенетики хромосомных болезней, их патогенез даже
в общих чертах еще не ясен. Не разработана общая схема развития сложных пато¬
логических процессов, обусловленных хромосомными аномалиями и приводящих
к появлению сложнейших фенотипов хромосомных болезней.Основные типы хромосомных аномалийВсе хромосомные болезни по типу мутаций можно разделить на две большие
группы: вызванные изменением числа хромосом при сохранении структуры
последних (геномные мутации) и обусловленные изменением структуры хромосо¬
мы (хромосомные мутации).Геномные мутации возникают вследствие нерасхождения или утраты хромо¬
сом в гаметогенезе или на ранних стадиях эмбриогенеза. У человека обнаружено
только три типа геномных мутаций: тетраплоидия, триплоидия и анеуплоидия.
Частота возникновения триплоидных (Зп=69) и тетраплоидных (4п=92) мутаций
очень низка, в основном их обнаруживают среди спонтанно абортированных
эмбрионов или плодов и у мертворожденных, продолжительность жизни ново¬
рожденных с такими нарушениями - несколько дней.Геномные мутации по отдельным хромосомам многочисленны, они составляют
основную массу хромосомных болезней. При этом из всех вариантов анеуплоидий
встречаются только трисомии по аутосомам, полисомии по половым хромосомам
(три-, тетра- и пентасомии), а из моносомий встречается только моносомия X.Полные трисомии или моносомии переносятся организмом тяжелее, чем
частичные, дисбаланс по крупным хромосомам встречается у живорожденных
значительно реже, чем по мелким. Полные формы хромосомных аномалий вызы-
ЛАБОРАТОРНАЯ ГЕНЕТИКА 7Q7вают значительно более серьезные отклонения, чем мозаичные. Аутосомные 'Ж '
моносомии среди живорожденных очень редки, это мозаичные формы с большой -
долей нормальных клеток. Доказан факт относительно малой генетической цен-
ности гетерохроматиновых районов хромосом. Именно поэтому полные трисомии
у живорожденных наблюдают по тем аутосомам, которые богаты гетерохрома¬
тином, — 8, 9, 13, 14, 18, 21, 22 и X. Этим объясняется хорошая переносимость
пациентами даже тройной дозы материала Y-хромосомы и почти полная утрата
длинного ее плеча. Совместимую с постнатальной жизнью полную моносомию по
Х-хромосоме, приводящую к развитию синдрома Шерешевского-Тернера, а также
тетра- и пентасомии наблюдают только по Х-хромосоме, которая гетерохромати-
зирована.Хромосомные мутации, или структурные хромосомные перестройки, — нару¬
шения кариотипа, сопровождаемые или не сопровождаемые дисбалансом генети¬
ческого материала в пределах одной или нескольких хромосом (внутри- и межхро-
мосомные перестройки).в подавляющем большинстве случаев структурные хромосомные мутации пере¬
дает потомству один из родителей, в кариотипе которого присутствует сбаланси¬
рованная хромосомная перестройка. К ним относят реципрокную (взаимную) сба¬
лансированную транслокацию без потери участков вовлеченных в нее хромосом.Она, как и инверсия, не вызывает патологических явлений у носителя. Однако при
образовании гамет у носителей сбалансированных транслокаций и инверсий могут
образовываться несбалансированные гаметы. Робертсоновская транслокация —
транслокация между двумя акроцентрическими хромосомами с потерей их корот¬
ких плеч — приводит к образованию одной метацентрической хромосомы вместо
двух акроцентрических. Носители такой транслокации здоровы, потому что поте¬
ря коротких плеч двух акроцентрических хромосом компенсируется работой таких
же генов в остальных 8 акроцентрических хромосомах. При созревании половых
клеток случайное распределение (при клеточных делениях) двух перестроенных
хромосом и их гомологов приводит к появлению нескольких типов гамет, одни из
которых нормальны, другие содержат такую комбинацию хромосом, которая при
оплодотворении дает зиготу со сбалансированным перестроенным кариотипом,
третьи дают при оплодотворении хромосомно несбалансированные зиготы.При несбалансированном хромосомном наборе (делеции, дупликации, инсер-
ции) у плода развиваются тяжелые клинические патологии, как правило, в виде
комплекса врожденных пороков развития. Недостаток генетического материала
вызывает более серьезные пороки развития, чем его избыток.Значительно реже структурные аберрации возникают de novo. Родители паци¬
ента с хромосомной болезнью обычно кариотипически нормальны. Хромосомная
болезнь в этих случаях возникает de novo в результате передачи от одного из
родителей геномной или хромосомной мутации, возникшей однократно в одной
из гамет, или такая мутация возникает уже в зиготе. Это не исключает повторно¬
го возникновения хромосомного нарушения у детей в данной семье. Есть семьи,
предрасположенные к повторным случаям нерасхождения хромосом. Мутациями,
возникшими de novo, являются почти все случаи известных полных трисомий и
моносомий. Основной механизм возникновения структурной перестройки любого
типа — разрыв в одной или нескольких хромосомах с последующим воссоедине¬
нием образовавшихся фрагментов.Клинические показания к цитогенетической диагностикеЦитогенетический метод исследования занимает ведущее место среди методов
лабораторной диагностики при медико-генетическом консультировании и в пре¬
натальной диагностике. Однако следует строго придерживаться объективных
708 ЛАБОРАТОРНАЯ ГЕНЕТИКАпоказаний для направления пациентов на исследование кариотипа. Основные
показания к пренатальной диагностике:• хромосомная аномалия у предыдущего ребенка в семье;• мертворожденный ребенок с хромосомной аномалией;• хромосомные перестройки, хромосомный мозаицизм или анеуплоидия по
половым хромосомам у родителей;• результаты исследования сыворотки крови у матери, указывающие на повы¬
шенный риск хромосомной аномалии у плода (группа риска);• возраст матери;• выявленные при ультразвуковом исследовании аномалии плода;• подозрение на мозаицизм у плода при предыдуш;ем цитогенетическом иссле¬
довании;• подозрение на синдром с хромосомной нестабильностью.Исследование кариотипа при постнатальной диагностике рекомендуют прово¬
дить при наличии у пациента:• первичной или вторичной аменореи или ранней менопаузы;• аномальной спермограммы — азооспермии или выраженной олигоспермии;• клинически выраженных отклонений в росте (низкий, высокий рост) и раз¬
мерах головы (микро-, макроцефалия);• аномальных гениталий;• аномального фенотипа или дизморфий;• врожденных пороков развития;• умственной отсталости или нарушений развития;• проявлений делеционного/микроделеционного/дупликационного синдрома;• Х-сцепленного рецессивного заболевания у женш;ин;• клинических проявлений синдромов хромосомной нестабильности;• при мониторинге после трансплантации костного мозга.Цитогенетические исследования следует провести у супружеской пары:• при хромосомных аномалиях или необычных вариантах хромосом у плода,
обнаруженных при пренатальной диагностике;• повторных выкидышах (3 и более); мертворождении, неонатальной смерти
плода, невозможности обследования пораженного плода;• наличии у ребенка хромосомной аномалии или необычного хромосомного
варианта;• бесплодии неизвестной этиологии.Показанием к цитогенетическому исследованию является наличие у родствен¬
ников пациента:• хромосомных перестроек;• умственной отсталости предположительно хромосомного происхождения;• репродуктивных потерь, врожденных пороков развития плода или мертво-
рождения неясного происхождения.Показания к исследованию FISH-методом:• подозрение на микроделеционный синдром, для которого доступна
молекулярно-цитогенетическая диагностика (наличие соответствующих
ДНК-зондов);• повышенный риск микроделеционного синдрома по анамнестическим данным;• клинические признаки, позволяющие предположить мозаицизм по опреде¬
ленному хромосомному синдрому;• состояния после трансплантации костного мозга, когда донор и реципиент
разного пола:• подозрение на хромосомную аномалию при стандартном цитогенетическом
исследовании, когда FISH-метод может быть полезным для дальнейшего
ЛАБОРАТОРНАЯ ГЕНЕТИКА 700ШШіуточнения характера аномалии, или в ситуациях, когда имеются характерные
клинические проявления;• наличие сверхчисленной маркерной хромосомы;• подозрение на скрытую хромосомную перестройку.FISH-метод при анализе метафаз показан:• при маркерных хромосомах; У®?• дополнительном материале неизвестного происхождения на хромосоме; - .йї.?'• хромосомных перестройках; -^5 ?• подозрении на потерю хромосомного сегмента;• мозаицизме.FISH-метод при анализе интерфазных ядер показан:• при численных хромосомных аномалиях;• дупликациях;• делениях;• перестройках хромосом;• определении хромосомного пола;• амплификации генов.Методы цитогенетического исследованияИсследование и описание характерных особенностей метафазных хромосом
особенно важны для практической цитогенетики. Отдельные хромосомы в преде¬
лах группы распознают с помощью методов дифференциального окрашивания.Эти методы позволяют обнаруживать неоднородность структуры хромосомы по
длине, определяемую особенностями комплекса основных молекулярных ком¬
понентов хромосом — ДНК и белков. Проблема распознавания индивидуальных
хромосом в кариотипе важна для развития цитогенетической диагностики хромо¬
сомных болезней у человека.Методы цитогенетического исследования делятся на прямые и непрямые.Прямые методы применяют в тех случаях, когда нужен быстрый результат и
имеется возможность получить препараты хромосом клеток, делящихся в орга¬
низме. Непрямые методы включают в качестве обязательного этапа более или
менее длительное культивирование клеток в искусственных питательных средах.
Промежуточное положение занимают методы, включающие кратковременное
культивирование (от нескольких часов до 2-3 сут).Основной объект цитогенетического исследования прямыми и непрямыми
методами — стадия метафазы митоза и различные стадии мейоза. Метафаза мито¬
за служит основным предметом цитогенетического исследования, так как именно
на этой стадии возможны точная идентификация хромосом и выявление их ано¬
малий. Хромосомы в мейозе исследуют для обнаружения некоторых типов пере¬
строек, по природе своей не обнаруживаемых в метафазе митоза.Биологический материал для цитогенетических исследований. Обработка
клеточных культур. Приготовление хромосомных препаратовВ качестве материала для получения хромосом человека и их исследования
могут быть использованы клетки любой ткани, доступной для биопсии. Чаще
всего используют периферическую кровь, кожные фибробласты, костный мозг,
клетки амниотической жидкости, ворсинчатого хориона. Наиболее доступны для
исследования хромосом лимфоциты периферической крови человека.В настоящее время практически во всех лабораториях мира для постановки
культуры лимфоцитов применяют метод с использованием цельной перифери¬
ческой крови. Кровь в количестве 1-2 мл заранее берут из локтевой вены в сте¬
рильную пробирку или флакон с раствором гепарина*. Во флаконе кровь можно
710 ЛАБОРАТОРНАЯ ГЕНЕТИКАхранить 24-48 ч в холодильнике при температуре 4-6 °С. Постановку культуры
лимфоцитов осуществл5£Ют в специальном боксовом помещении или в рабочей
комнате под ламинарным шкафом в стерильных условиях. Такие условия обяза¬
тельны для предотвращения заноса в культуру крови патогенной флоры. Если есть
подозрение на загрязненность крови или другого материала, необходимо в куль¬
туральную смесь добавить антибиотики. Флаконы с культуральной смесью инку¬
бируют в термостате при температуре +37 X в течение 72 ч (идет активный рост
и деление клеток). Основное назначение методических приемов при обработке
клеточных культур и приготовлении из них хромосомных препаратов — получить
на препарате достаточное количество метафазных пластинок с таким разбросом
хромосом, при котором можно оценить длину, форму и другие морфологические
признаки каждой хромосомы набора.Накопление клеток в метафазе митоза и получение на препарате качественных
пластинок происходит с помощью ряда последовательных процедур:• колхинизации — воздействия на клетки цитостатиками колхицином или кол-
цемидом, блокирующими митоз в стадии метафазы;• гипотонизации культур;• фиксации клеток смесью метилового спирта с уксусной кислотой;• нанесения клеточной взвеси на предметное стекло.Колхинизацию культур клеток осуществляют за 1,5-2 ч до начала фиксации.
После введения колхицина флаконы с клеточными культурами продолжают инку¬
бировать в термостате. По окончании инкубации культуральную смесь из каждого
флакона сливают в чистые центрифужные пробирки и подвергают центрифугиро¬
ванию. Затем к осадку клеток добавляют гипотонический раствор калия хлорида,
предварительно нагретый до температуры +37 “С.Гйпотонизацию проводят в термостате при температуре +37 "С в течение
15 мин. Гипотонический раствор КС1 способствует лучшему разбросу хромосом на
предметном стекле. После гипотонизации клетки переводят в осадок центрифуги¬
рованием и подвергают фиксации. Фиксацию проводят смесью метилового (или
этилового) спирта с уксусной кислотой.Завершающий этап — приготовление хромосомных препаратов для получения
хорошо «распластанных» метафазных пластинок с сохранением целостности,
полноты хромосомного набора в каждой из них. На мокрые, охлажденные пред¬
метные стекла наносят клеточную взвесь, после чего стекла высушивают при ком¬
натной температуре и маркируют.Методы дифференциального окрашивания хромосомС 1971 г. в цитогенетике нашли широкое распространение методы, позво¬
ляющие дифференциально окрашивать каждую хромосому набора по ее длине.
Практическое значение этих методов состоит в том, что дифференциальная окра¬
ска позволяет идентифицировать все хромосомы человека благодаря специфиче¬
скому рисунку продольной окрашиваехмости для каждой хромосомы. Для окраски
может быть пригодна любая краска, состоящая из основного красителя, посколь¬
ку главным красящим субстратом хромосом является комплекс ДНК с белками.
В практике цитогенетических исследований наибольшее применение получили
следующие методы,G-метод окраски — самый распространенный метод из-за простоты, надежно¬
сти и доступности необходимых реактивов. После окраски каждая пара хромосом
приобретает исчерченность по длине благодаря чередованию по-разному окра¬
шенных гетерохроматиновых (темных) и эухроматиновых (светлых) сегментов,
которые принято обозначать как G-сегменты,С-метод окраски обеспечивает выявление лишь некоторых районов хромосом.
Это районы гетерохроматина, локализованного в околоцентромерных участках
ЛАБОРАТОРНАЯ ГЕНЕТИКА711длинных плеч хромосом 1, 9 и 16 и в длинном плече Y-хромосомы, а также в
коротких плечах акроцентрических хромосом.R-метод окраски препаратов хромосом показывает картину дифференциальной
сегментации, обратной G-методу. Этим методом хорошо прокрашиваются дис¬
тальные сегменты хромосом, что очень важно при идентификации мелких пере¬
строек с вовлечением концевых участков.0.-МЄТОД окраски обеспечивает дифференциальную флюоресцентную окраску
индивидуальных хромосом набора, позволяет идентифицировать каждую пару
гомологов, а также определить наличие Y-хромосомы в интерфазных ядрах по
свечению тельца Y-хроматина.Принципы хромосомного анализаОбязательным этапом исследования является визуальный анализ хромосом
под микроскопом с использованием тысячекратного увеличения (хЮОО) при
окулярах ХІО и иммерсионном объективе хЮО. Оценку качества и пригодности
хромосомных препаратов для исследования, а также отбор метафазных пластинок
для анализа проводят при малом увеличении (хЮО). Для исследования выбирают
хорошо окрашенные, полные метафазные пластинки с хорошим разбросом хромо¬
сом. Исследователь подсчитывает общее количество хромосом и проводит оценку
структуры каждой хромосомы путем сопоставления исчерченности гомологов, а
также сопоставления наблюдаемой картины с цитогенетическими картами (схе¬
мами) хромосом.Использование компьютерных систем анализа изображений существенно облегча¬
ет задачу цитогенетика, повышает качество его работы и предоставляет возможность
быстрого и простого документирования результатов исследования. Для обеспечения
высокого качества работы рекомендуют участие двух специалистов в проведении
цитогенетического исследования каждого образца. Документом, подтверждающим
исследование, служит протокол, в котором указывают координаты просмотренных
клеток, количество хромосом в каждой из них, обнаруженные перестройки, формулу
кариотипа и заключение, а также фамилию пациента, дату и номер исследования,
фамилию и подпись врача (врачей), проводившего исследование. Следует сохранять
препараты и изображения хромосом для последующего просмотра.ОСНОВНЫЕ ПРАВИЛА ОПИСАНИЯ ХРОМОСОМНЫХ АНОМАЛИЙ СОГЛАСНО
МЕЖДУНАРОДНОЙ СИСТЕМЕ ЦИТОГЕНЕТИЧЕСКОЙ НОМЕНКЛАТУРЫЗапись формулы кариотипа необходимо проводить в соответствии с действую¬
щей версией Международной системы цитогенетической номенклатуры челове¬
ка — International System for human Cytogenetic Nomenclature (ISCN, 2005). Ниже
рассмотрены аспекты применения номенклатуры, которые наиболее часто встре¬
чаются в клинической цитогенетической практике.Количество и морфология хромосомв кариотипе хромосомы разделяют на семь легкоразличимых групп (A-G) в
соответствии с их размером и положением центромеры. Аутосомы — это хромосо¬
мы с 1-й по 22-ю, половые хромосомы — X и У.Группа А (1-3) — большие мета центрические хромосомы, которые можно отли¬
чить друг от друга по размеру и положению центромеры.Группа В (4-5) — большие субметацентрические хромосомы.Группа С (6-12, X) — метацентрические и субметацентрические хромосомы
среднего размера. Х-хромосому относят к самым крупным хромосомам в этой
группе.группа D (13-15) — акроцентрические хромосомы среднего размера со спутни¬
ками.
712ЛАБОРАТОРНАЯ ГЕНЕТИКАГруппа Е (16-18) — относительно небольшие метацентрические и субметацен¬
трические хромосомы.Группа F (19-20) — маленькие метацентрические хромосомы.Группа G (21-22, Y) — маленькие акроцентрические хромосомы со спутниками.
У-хромосома не имеет спутников.Каждая хромосома состоит из непрерывного ряда полос, которые размещаются
по длине плеч хромосом в строго ограниченных районах (участках). Хромосомные
районы специфичны для каждой хромосомы и имеют существенное значение для
их идентификации. Полосы и районы нумеруют в направлении от центромеры к
теломере по длине каждого плеча. Районы — участки хромосомы, расположенные
между двумя соседними полосами. Для обозначения коротких и длинных плеч
хромосом используют следующие символы: р — короткое плечо и q — длинное
плечо. Центромера (сеп) обозначена символом 10, часть центромеры, прилежащая
к короткому плечу, — р10, к длинному плечу — qlO. Район, ближайший к центро¬
мере, обозначают цифрой 1, следующий район — цифрой 2 и т.д.Для обозначения хромосом используют четырехзначную символику:• 1-й символ — номер хромосомы:• 2-й символ (р или q) — плечо хромосомы;• 3-й символ — номер района (участка);• 4-й символ — номер полосы в пределах этого района.Например, запись 1р31 указывает на хромосому 1, ее короткое плечо, район 3,
полосу 1.Если полоса подразделяется на субполосы, после обозначения полосы ставят
точку, затем пишут номер каждой субполосы. Субполосы, так же как и полосы,
нумеруют в направлении от центромеры к теломере. Например, в полосе 1р31
выделяют три субполосы: ІрЗІ.1, 1р31.2 и ІрЗІ.З, из которых субполоса ІрЗІ.І
проксимальна по отношению к центромере, а субполоса ІрЗІ.З — дистальна.Если субполосы подразделяют дополнительно на части, их нумеруют цифрами
без пунктуации. Например, субполоса ІрЗІ.1 делится на lp31.ll, 1р31.12 и т.д.Генетические и цитогенетические термины принято обозначать символами и
сокращениями в английской аббревиатуре (табл. 10-1),Таблица 10-1. Символы и сокращенные терминыСимволы
и сокращенияНаименованияaddДополнительный материал неизвестного происхождения(~)Знак обозначает приблизительные интервалы и границы сегмента хромосомыЫЗнак показывает интервалы от и до в детальной системе описания хромосом< >Знак означает уровень ппоидности[]Скобки обозначают абсолютное количество кпеток в данном клонесепЦентромераchiХимераchrХромосомаЗнак обозначает разрыв, используют в детальной системе описания хромосомЗнак обозначает разрыв и воссоединение, используют в детальной системе описания
хромосом,Запятая разделяет количество хромосом, половые хромосомы и хромосомные аномалииЗнак обозначения субполосыdelДелецияdn (de novo)Вновь возникшая хромосомная аномалия, которая не является наследственнойderПроизводная (дериватная) хромосомаdicДицентрик
ЛАБОРАТОРНАЯ ГЕНЕТИКА 713Окончание табл. 10-1Символы
и сокращенияНаименованияdirПрямойdisДистальныйdupДупликацияfernЖенскийfraЛомкий участокhКонституциональный гетерохроматиніИзохромосомаinsИнсерцияinvИнверсияmalІУІужскойmarМаркерная хромосомаmatМатеринское происхождениеHЗнак «минус» — потеряmosМозаик(X)Множественные копии перестроенных хромосомorАльтернативная интерпретацияpКороткое ллечо хромосомы0Структурно перестроенные хромосомы с точками разрывовpatОтцовское происхождение(+)Дополнительный, приобретенныйprxПроксимальный участок хромосомыqДлинное плечо хромосомы(?)Знаком вопроса обозначают тот факт, что идентификация хромосомы или хромосомной
структуры находится под вопросомrКольцевая хромосомаrepРеципрокная транслокацияrobРобертсоновская транслокацияsСпутник(;)Разделение перестроенных хромосом и точек разрывов в структурных перестройках^
затрагивающих две и более хромосом(/)Знак разделения клоновstkСпутничная нитьtТранслокацияtelТеломераterТерминальный участок хромосомыUОдинарное подчеркивание используют для того, чтобы различать между собой гомоло¬
гичные хромосомыОБЩИЕ ПРИНЦИПЫ ОПИСАНИЯ НОРМАЛЬНОГО И АНОМАЛЬНОГО КАРИОТИПАВ описании кариотипа первым пунктом указывают общее количество хромо¬
сом, включая половые хромосомы. Первое число отделяют от остальной части
записи запятой, затем записывают половые хромосомы. Аутосомы обозначают
только в случае аномалий.Нормальный человеческий кариотип выглядит следующим образом:• 46,XX — нормальный кариотип женщины;• 46.XY — нормальный кариотип мужчины.
714 ЛАБОРАТОРНАЯ ГЕНЕТИКА'3^ При хромосомных аномалиях первыми записывают аномалии половых хромо-' ^ сом, затем аномалии аутосом в порядке возрастания номеров и независимо от типа
' g аномалии. Каждую аномалию отделяют запятой. Для описания структурно пере-І ' - строенных хромосом используют буквенные обозначения. Хромосому, вовлечен-
ную в перестройку, записывают в круглых скобках после символа, обозначающего
тип перестройки, например: inv(2), del(4), r(18). Если в перестройке участвуют две
g;.:' или более хромосом, между обозначениями номера каждой из них ставят точку с
запятой (;),Знаки (+) или (-) ставят перед хромосомой для обозначения аномалии с указа¬
нием дополнительной или отсутствующей хромосомы (нормальной или аномаль¬
ной), например: +21,-7, к1ег(2). Их также используют для обозначения умень¬
шения или увеличения длины плеча хромосомы после символа (р или q); с этой
целью указанные выше знаки можно применять только в тексте, но не в описании
кариотипа, например: 4р+, 5q-.При описании размеров гетерохроматиновых сегментов, спутников и спутнич-
ных нитей знак (+) (увеличение) или (-) (уменьшение) ставят непосредственно за
обозначением соответствующего символа, например: 16qh+, 21р$-ь, 22pstk+.Знак умножения (х) используют для описания множественных копий перестро¬
енных хромосом, но его нельзя использовать для описания множественных копий
нормальных хромосом, например: 46,XX,del(6)(ql3q23) х2.Неидентифицированная хромосома или полоса могут быть обозначены знаком
вопроса (?) либо символом (~), например: 46,XX,ins(l;?)(p22;?) или 46,XX,del(l)
(q2b24).Для указания альтернативных интерпретаций аномалий используют символ
(or), например: 46,XX,del(8)(q21.1) or i(8)(pl0).Кариотипы разных клонов разделяют косой чертой (/). Квадратные скобки ста¬
вят после описания кариотипа, для обозначения абсолютного количества клеток
в данном клоне. Для того чтобы указать причину возникновения разных клонов,
используют символы mos (мозаицизм ~ клеточные линии произошли из одной
зиготы) и chi (химера — клеточные линии произошли из разных зигот), которые
приводят перед описанием кариотипа. При перечислении кариотипов нормальный
диплоидный клон всегда указывают последним, например: mos47,XY,+21/46,XY;
nms47,XXY/46,XY.Если есть несколько аномальных клонов, запись проводят в порядке увеличе¬
ния их размера: первый — наиболее часто встречаемый, затем по нисходящей.
Самым последним указывают нормальный клон, например: mos45,X[15]/47,XXX
[10J/46,XX[23]. Аналогичную запись используют и в кариотипе, имеющем два
нормальных клона, например: chi46,XX[25]/46,XY[10].Если в кариотипе присутствуют два аномальных клона, один из которых имеет
числовую аномалию, а другой — структурную перестройку, то клон с числовой
аномалией записывают первым. Например; 45,X[25]/46,X,i(X)(ql0)[25J. Когда
. оба клона имеют числовые аномалии, сначала записывают клон, имеющий ауто¬
сому с меньшим порядковым номером, например: 47,ХХ,+8[25]/47,ХХ,+21[25];
клон с аномалиями половых хромосом всегда ставят первым, например:47,XXXf 25]/47,ХХ,+21 [25J,Тот факт, что кариотип является гаплоидным или полиплоидным, будет очеви¬
ден из числа хромосом и дальнейших обозначений, например: 69,XXY. Все изме¬
ненные хромосомы должны быть обозначены относительно соответствующего
уровня плоидности, например: 70,XXY,+21,Материнское или отцовское происхождение аномальной хромосомы обознача¬
ют символами mat и pat соответственно после описываемой аномалии, например:46,XX,t(5;6)(q34;q23)niat,inv(14)(ql2q31)pat; 46,XX,t(5;6)(q34;q23)mat,inv(14)
(ql2q31)mat. Если известно, что хромосомы родителей нормальны по сравнению
ЛАБОРАТОРНАЯ ГЕНЕТИКА 715С данной аномалией, ее рассматривают как вновь возникшую и обозначают симво¬
лом de novo (dn), например: 46,XY,t(5;6)(q34;q23)mat,inv (14)(ql2q31)dn.Описание численных аномалий хромосомЗнак (+) или (-) ставят для обозначения потери или приобретения дополни¬
тельной хромосомы при описании численных аномалий.47,ХХ,+21 — кариотип с трисомией 21.48,ХХ,+ 13,+21 — кариотип с трисомией 13 и трисомией 21.45 ДХ,-22 - кариотип с моносомией 22.46,ХХ,+8,-21 — кариотип с трисомией 8 и моносомией 21,Исключением из этого правила являются конституциональные аномалии поло¬
вых хромосом, которые записывают без использования знаков (+) и (-).45,Х — кариотип с одной Х-хромосомой (синдром Шереиіевского-Тернера).47,XXY — кариотип с двумя Х-хромосомами и одной Y-хромосомой (синдром
Клайнфельтера).47,Ю(Х — кариотип с тремя Х-хромосомами.47,XYY — кариотип с одной Х-хромосомой и двумя Y-хромосомами.48,XXXY — кариотип с тремя Х-хромосомами и одной Y-хромосомой.Описание структурных аномалий хромосомв описании структурных перестроек используют как краткую, так и детальную
системы записи. При использовании краткой системы указывают только тип хро¬
мосомной перестройки и точки разрыва. Записывают тип хромосомной аномалии,
хромосому, вовлеченную в данную аномалию, и в круглых скобках — точки разры¬
ва. Краткая система не дает возможности однозначного описания сложных хромо¬
сомных перестроек, которые иногда выявляют при анализе кариотипов опухолей.Краткая система обозначения структурных перестроекЕсли в перестройку, возникшую в результате двух разрывов, произошедших в
одной хромосоме, вовлечены оба плеча, точку разрыва в коротком плече записыва¬
ют перед точкой разрыва в длинном плече: 46,XX,inv(2)(p21q31). Когда две точки
разрыва находятся в одном плече хромосомы, первой указывают проксимальную
к центромере точку разрыва: 46,XX,inv(2)(pl3p23). В случае, когда в перестройку
вовлечены две хромосомы, первой указывают либо хромосому с меньшим поряд¬
ковым номером, либо половую хромосому: 46,XY,t(12;16)(ql3;pll.l); 46,X,t(X;18)
(plLl;qll.l).Исключением из правила являются перестройки с тремя точками разрыва,
когда фрагмент одной хромосомы вставляется в район другой хромосомы.
При этом хромосому-реципиента записывают первой, а хромосому-донора
последней, даже если это половая хромосома или хромосома с меньшим поряд¬
ковым номером: 46,X,ins(5;X)(pl4;q21q25): 46,XY,ins(5;2)(pl4;q22q32). Если
перестройка затрагивает одну хромосому, первыми указывают точки разрыва
в сегменте, где образовалась вставка. В случае прямой инсерции первой запи¬
сывают проксимальную к центромере точку разрыва вставленного фрагмента,
а затем — дистальную точку разрыва. При инвертированной вставке — наобо¬
рот.Для обозначения транслокаций, в которые вовлечены три разные хромосомы,
на первом месте указывают половую хромосому или хромосому с меньшим поряд¬
ковым номером, затем хромосому, получившую фрагмент от первой хромосомы,
и, наконец, хромосому, отдавшую фрагмент первой хромосоме. 46,XX,t(9;22;17)
(q34;qll.2;q22) — фрагмент хромосомы 9, соответствующий дистальному району
9q34, перенесен на хромосому 22, в сегмент 22qll.2, фрагмент хромосомы 22,
соответствующий дистальному району 22qll.2, перенесен на хромосому 17, в
сегмент 17q22, а фрагмент хромосомы 17, соответствующий дистальному району
17q22, перенесен на хромосому 9, в сегмент 9q34,
716ЛАБОРАТОРНАЯ ГЕНЕТИКАДетальная система обозначения структурных перестроекВ соответствии с детальной системой обозначений структурные перестройки
хромосом определяют по составу полос в них. Все обозначения, употребляемые в
краткой системе, сохраняются и в детальной системе. Однако в детальной системе
приводят подробное описание состава полос в перестроенных хромосомах с примене-
Щ нием дополнительных символов. Двоеточие (:) обозначает точку разрыва, а двойное
двоеточие (:;) — разрыв с последующим воссоединением. Стрелкой (-») указывается
направление переноса фрагментов хромосомы. Концы плеч хромосом обозначают
символом ter (терминальный), pter или qter означают конец короткого или длинного
плеча соответственно. Символ сеп используют для обозначения центромеры.Типы хромосомных перестроек
Дополнительный материал неизвестного происхожденияСимвол add (от лат. additio — прибавление) используют для указания на допол¬
нительный материал неизвестного происхождения, присоединившийся к хромо¬
сомному району или полосе. Дополнительный материал, присоединившийся к
терминальному участку, будет вызывать увеличение длины плеча хромосомы.При описании хромосом с дополнительным материалом неизвестного проис¬
хождения в обоих плечах перед номером хромосомы ставят символ der. Если неиз¬
вестный дополнительный материал вставлен в плечо хромосомы, для описания
используют символы ins и (?).ДелецииСимвол del используют для обозначения терминальных (концевых) и интерсти¬
циальных делеций:46,XX,del(5)(ql3)46,XX,del(5)(pter-^ql3:)Знак (:) означает, что разрыв произошел в полосе 5ql3, в результате хромосома
5 состоит из короткого плеча и части длинного плеча, заключенной между центро¬
мерой и сегментом 5ql3.46,XX,del(5)(ql3q33)46,XX,del(5)(pter->ql3;:q33-^qter)Знак (::) означает разрыв и воссоединение полос 5ql3 и 5q33 длинного плеча
хромосомы 5. Сегмент хромосомы между этими полосами делегирован.
Производные (дериватные) хромосомыПроизводные, или дериватные, хромосомы (der) — это хромосомы, возникшие
в результате перестроек, затрагивающих две и более хромосом, а также в результа¬
те множественных перестроек внутри одной хромосомы. Номер производной хро¬
мосомы соответствует номеру интактной хромосомы, имеющей ту же центромеру,
что и хромосома-дериват:46,XY,der(9)dei(9)(pl2)del(9)(q31)46,XY,der(9)(:pl2-^q31:)Дериватная хромосома 9 является результатом двух терминальных делеций,
произошедших в коротком и длинном плечах, с точками разрыва в полосах 9р12 и
9q3I соответственно.46,XX,der (5)add(5)(pl5.1)del(5)(q]3)46,XX,der(5)(.?::pl5.1-^ql3:)Дериватная хромосома 5 с дополнительным материалом неизвестного проис¬
хождения, присоединенным к полосе 5р15.1, и терминальной делецией длинного
плеча дистальнее полосы 5ql3.Дицентрические хромосомыСимвол dic используют для описания дицентрических хромосом. Дицентри-
ческая хромосома заменяет одну или две нормальные хромосомы. Таким образом,
нет необходимости указывать недостающие нормальные хромосомы.
ЛАБОРАТОРНАЯ ГЕНЕТИКА 71745,ххліс(13а3) (ql4:q32)45,XX,dic(13;13)(13pter^l3ql4::13q32->13pter)Разрыв и воссоединение произошли в полосах 13ql4 и 13q32 на двух гомоло¬
гичных хромосомах 13, в результате чего образовалась дицентрическая хромо¬
сома.ДупликацииДупликации обозначают символом dup; они могут быть прямыми и инвертиро¬
ванными.46,XX.dup(l)(q22q25)46,XX,dup(l)(pter->q25::q22-»qter)Прямая дупликация сегмента между полосами lq22 и lq25.46,XY.dup(l)(q25q22)46,XY,dup(l)(pter^q25::q25^q22::q25-^qter) или (pter^q22::q25^q22::q22->qter)Инвертированная дупликация сегмента между полосами lq22 и lq25.
Необходимо отметить, что только детальная система дает возможность описать
инвертированную дупликацию.ИнверсииСимвол inv используют для описания пара- и перицентрических инверсий.46,XX,inv{3)(q21q26.2)46,XX,inv(3Kpter^q21;rq26.2^q21::q26.2^qter)Парацентрическая инверсия, при которой разрыв и воссоединение произошли в
полосах 3q21 и 3q26.2 длинного плеча хромосомы 3.46,XY,inv(3)(pl3q21)46,XY,inv(3)(pter-»pl3::q21~>pl3::q21^qter)Перицентрическая инверсия, при которой разрыв и воссоединение произошли
между полосой 3р13 короткого плеча и полосой 3q21 длинного плеча хромосомы
3. Участок между этими полосами, включающий центромеру, перевернут на 180“.ИнсерцииСимвол ins используют для обозначения прямой или инвертированной инсер¬
ции. Прямой считают такую инсерцию, при которой проксимальный конец района
вставки оказывается в проксимальном положении относительно второго ее конца.
При инвертированной инсерции проксимальный конец района вставки оказывает¬
ся в дистальном положении. Тип инсерции (прямая или инвертированная) также
может быть отражен символами dir и inv соответственно.46,XX,ins(2)(pl3q21q31)46,XX,ins^(pter->pl3::q31^q21::pl3^q21::q31^qter)Прямая инсерция, т.е. dir ins(2)(pl3q21q31), произошла между сегментами 2q21
и 2q31 длинного плеча и сегментом 2р13 короткого плеча хромосомы 2. Участок
хромосомы длинного плеча между сегментами 2q21 и 2q31 вставлен в короткое
плечо в районе сегмента 2р13. В новом положении сегмент 2q21 остается ближе к
центромере, чем сегмент 2q31.46,XY,ins(2)(pl3q31q21)46,XY,ins(2)(pter^pl3::q21-^q31::pl3^q21::q31-T»qter)В данном случае вставленный участок инвертирован, т.е. inv ins(2)(pl3q31q21).
Во вставке сегмент 2q21 отстоит от центромеры дальше, чем сегмент 2q31. Таким
образом, изменилось расположение сегментов по отношению к центромере.ИзохромосомыСимвол і используют при описании изохромосом, которые представляют собой
хромосомы, состоящие из двух идентичных плеч. Точки разрыва в изохромосомах
локализованы в центромерных районах р10 и qlO.46,XX,i(17)(qlO)46,XX,i(17)(qter^qlO::qlO ->qter)
718 ЛАБОРАТОРНАЯ ГЕНЕТИКАИзохромосома по длинному плечу хромосомы 17 и точка разрыва обозначены
в районе 17qlO. В кариотипе одна нормальная хромосома и одна перестроенная
хромосома 17.46,X,i(X)(qlO)46,ХЛ(Х) (qter^ql0::ql0^qter)Одна нормальная X-хромосома и Х-изохромосома по длинному плечу.Ломкие участкиЛомкие участки (fragile sites, сокращенно fra) могут проявляться как нормаль¬
ный полиморфизм, а могут быть связаны с наследственными заболеваниями или
аномалиями фенотипа.46,X,fra(X)(q27.3)Ломкий участок в субполосе Xq27.3 одной из Х-хромосом в женском кариотипе.46,Y,fra(X)(q27.3)Ломкий участок в субполосе Xq27.3 Х-хромосомы в мужском кариотипе.Маркерные хромосомыМаркерная хромосома (mar) — это структурно измененная хромосома, ни одна
часть которой не может быть идентифицирована. Если какая-нибудь из частей
аномальной хромосомы идентифицирована, ее описывают как производную хро¬
мосому (der). При описании кариотипа перед символом таг ставят знак (+).47,XX,+marОдна дополнительная маркерная хромосома.48,X,t(X:18)(pll.2:qll.2)+2marДве маркерные хромосомы в дополнение к транслокации t(X;18).Кольцевые хромосомыКольцевые хромосомы обозначают символом г. они могут состоять из одной
или нескольких хромосом.46,XX,r(7)(p22q36)46,XX,r(7)(::p22^q36::)Разрыв и воссоединение произошли в сегментах 7р22 и 7q36 с потерей участков
хромосомы, расположенных дистальнеє этих точек разрыва.Если центромера кольцевой хромосомы неизвестна, но известны сегменты
хромосом, содержащихся в кольце, кольцевые хромосомы определяются как про¬
изводные (der).46,XX,der(l)r(l;3)(p36.1q23;q21q27)46,XX,der(l)(::lp36.1^1q23::3q21^3q27::)ТранслокацииРеципрокные транслокацииДля описания транслокаций (t) используют те же принципы и правила, что и
для описания других хромосомных перестроек. Для того чтобы отличить гомоло¬
гичные хромосомы, один из гомологов может быть подчеркнут одинарным под¬
черкиванием (_).46,}CY,t(2;5)(q21;q31)46,XY,t(2;5)(2pter^2q21::5q31-> 5qter;5pter^ 5q31::2q21^2qter)Разрыв и воссоединение произошли в сегментах 2q21 и 5q31. Хромосомы обме¬
нялись участками, дистальными по отношению к этим сегментам. Первой указы¬
вают хромосому с меньшим порядковым номером.46,X,t(X;13)(q27;ql2)46,X,t(X;13)(Xpter-^Xq27::13ql2^13qter;13pter->3q 12::Xq27^Xqter)Разрыв и воссоединение произошли в сегментах Xq27 и 13ql2. Сегменты,
дистальные по отношению к этим участкам, поменялись местами. Поскольку в
транслокации участвует половая хромосома, ее записывают первой. Отметим, что
правильная запись следующая - 46,X,t(X:13), а не 46,XX,t(X;13).46,t(X;Y)(q22;qll.2)
ЛАБОРАТОРНАЯ ГЕНЕТИКА 71946,t(X;Y)(Xpter-^Xq22::Yqll.2->Yqter;Yptcr->Yqll.2::Xq22->Xqter) дРеципрокная транслокация между X- и Y-хромосомами с точками разрыва Xq22 ^
и Yqll.2. gТранслокации с вовлечением в них целых хромосомных плеч могут быть запи¬
саны с указанием точек разрыва в центромерных районах р10 и qlO, При сбалан¬
сированных транслокациях точку разрыва в половой хромосоме или в хромосоме
с меньшим порядковым номером обозначают р10.46,XY,t(l;3)(plO:qlO)46,XY,t(l;3)(lpter-^lpl0::3ql0^3qter;3pter-^3pl0::lql0^1qter)Реципрокная транслокация целых хромосомных плеч, при которой короткие
плечи хромосомы 1 присоединились к центромере с длинными плечами хромосо¬
мы 3, а длинные плечи хромосомы 1 присоединились к коротким плечам хромо¬
сомы 3.при несбалансированных транаюкациях целых хромосомных плеч перестроен¬
ная хромосома обозначается как производная (der) и замещает две нормальные
хромосомы.45,XX,der(l;3)(plO;qlO)45,XX,der(l;3)(lpter^lplO::3qlO-^3qter)Производная хромосома, состоящая из короткого плеча хромосомы 1 и длин¬
ного плеча хромосомы 3. Недостающие хромосомы 1 и 3 не обозначены, так как
они заменены производной хромосомой. Кариотип, таким образом, содержит одну
нормальную хромосому 1, одну нормальную хромосому 3 и производную хромо¬
сому der(l;3).Робертсоновские транслокацииЭто особый тип транслокаций, возникающих в результате центрического слия¬
ния длинных плеч акроцентрических хромосом 13 -15 и 21-22 с одновременной
потерей коротких плеч этих хромосом. Принципы описания несбалансированных
транслокаций, затрагивающих целые плечи, применимы и для описания робертсо¬
новских транслокаций с использованием символа (der). Символ rob также может
быть использован при описании этих транслокаций, но его нельзя применять в
описании приобретенных аномалий. Точки разрывов хромосом, участвующих в
транслокации, указывают в районах qlO.45,XX,der(13;21)(qlO;qlO)45,XX,rob(13;21)(qlO;qlO)Разрыв и воссоединение произошли в сегментах 13ql0 и 21ql0 центромерных рай¬
онов хромосом 13 и 21. Производная хромосома заменила одну хромосому 13 и одну
хромосому 21. Нет необходимости указывать недостающие хромосомы. Кариотип
содержит одну нормальную хромосому 13, одну нормальную хромосому 21 и der
(13;21). Дисбаланс возникает за счет потери коротких плеч хромосом 13 и 21.НАСЛЕДСТВЕННЫЕ БОЛЕЗНИ ОБМЕНА ВЕЩЕСТВНаследственные болезни обмена веществ (ИБО) - обширный класс наследствен¬
ных заболеваний человека, включающий более 600 различных форм. Количество
новых форм НБО и даже классов растет с каждым годом, экспоненциально возрас¬
тает количество публикаций, связанных с возможностями диагностики, профи¬
лактики и, что немаловажно, лечения НБО. Отдельные формы НБО встречаются
редко или крайне редко, однако их суммарная частота довольно высока и состав¬
ляет 1:3000-1:5000 живых новорожденных. Характерным свойством этих заболе¬
ваний являются выраженные биохимические изменения, которые проявляются до
начала первых клинических симптомов.Согласно биохимической классификации, НБО разделены на 22 группы в
зависимости от типа поврежденного метаболического пути (аминоацидопатии,
720ЛАБОРАТОРНАЯ ГЕНЕТИКАт■уіАпофермент+кофакторРис. 10-1. Патогенетические механизмы развития наследственных болезней обмена веществ.
1 — нарушения транспорта субстрата А; 2 — нарушения превращения вещества В в продукт С;
3 — увеличение концентрации D, связанное с накоплением В; 4 — нарушение взаимодействия
между апоферментом и коферментом или другим регуляторным белком; 5 — снижение скорости
реакции превращения А в В по механизму обратной связи (ингибирование продуктом реакции)
в результате недостаточности С; 6 — вторичное ингибирование превращения Е в F связанное с
накоплением D.нарушения углеводного обмена и т.д.) или в зависимости от его локализации в
пределах определенного компонента клетки (лизосомные, пероксисомные и мито¬
хондриальные болезни) (рис. 10-1).Биохимическая классификация НБО выглядит следующим образом.• Лизосомные болезни накопления.• Митохондриальные болезни.• Пероксисомные болезни.• врожденные нарушения гликозилирования.• Нарушения обмена креатинина.• Нарушения обмена холестерина.• Нарушения синтеза цитокинов и других иммуномодуляторов.• Нарушения обмена аминокислот/органических кислот.• Нарушения митохондриального {З-окисления.• Нарушения обмена кетоновых тел.• Нарушения обмена жиров и жирных кислот, липопротеинов.• Нарушения обмена углеводов и гликогена.• Нарушения транспорта глюкозы.• Нарушения обмена глицерина.• Нарушения обмена витаминов.• Нарушения обмена металлов и анионов,• Нарушения обмена желчных кислот.• Нарушения обмена нейротрансмиттеров.• Нарушения обмена стероидов и других гормонов.• Нарушения обмена гема и порфиринов.• Нарушения обмена пуринов/пиримидинов.• Нарушения обмена билирубина.Основные механизмы патогенеза НБОНАКОПЛЕНИЕ СУБСТРАТАНакопление субстрата блокированной ферментной реакции является одним
из основных механизмов патогенеза при подавляющем большинстве НБО (при¬
ЛАБОРАТОРНАЯ ГЕНЕТИКА 721меры заболеваний приведены в табл. 10-2). Прежде всего это относится к нару¬
шению катаболических реакций, таких как расщепление кр>тіньіх макромолекул,
аминокислот, органических кислот и т.д. Если накапливаемый субстрат легко
выводится из клеток и его концентрация в биологических жидкостях во много
раз превышает гомеостатический уровень, может изменяться кислотно-щелочное
равновесие (органические кислоты при органических ацидуриях), происходить
его накопление в разных тканях (гомогентизиновая кислота при алкаптонурии).
В ряде случаев субстрат создает конкуренцию сходным соединениям при транс¬
порте через гематоэнцефалический барьер, приводя к их истощению в мозге
(аминоацидопатии). Если накапливаемый субстрат плохорастворим, происходит
его накопление внутри клетки, что запускает механизмы апоптотической гибели.
Одним из дополнительных следствий накопления субстрата может быть активация
минорных метаболических путей, чей удельный вес при нормальном метаболизме
незначителен. Такой механизм, например, лежит в основе накопления фенилпиро-
виноградной кислоты при фенилкетонурии.Таблица 10-2. НБО, связанные с накоплением продуктов блокированной реакцииЗаболеваниеБиохимический дефектНакапливаемый суб¬
стратОсновные клинические
проявленияБолезнь Тея-Саксар-Гексозаминидаза А6М2-ганглиозидНейродегенеративныеизмененияНедостаточность орни-
тинтранскарбомилазыОрнитинтранс-карбомилазаИоны аммонияОстрая энцефалопатияФенил кетонурияФенилаланин-гидроксилазаФенилаланин, фенил-
лактат, фенилацетатПрогрессирующая задерж¬
ка психомоторного раз¬
витияМукополисахаридоз
типа 1а-ИдуронидазаДерматан и гепаран
сульфатПоражение скелета, соеди¬
нительной ткани, нервной
системыБолезнь ГошеГлюкозидазаГлюкоцереброзидыПоражение кроветворной
системыТирозинемия типа 1ФумарилацетоацетазаФумарилацетоацетат и
малеилацетоацетатПеченочная недостаточ¬
ностьЦистинурияДефект транспорта
аминокислот в почкахЦистинПоражение почекНакапливаемые метаболиты имеют важное диагностическое значение, в ряде
случаев их количественный или полуколичественный анализ позволяет точно
установить форму заболевания. При органических ацидуриях и аминоацидопа-
тиях накопление в больших количествах водорастворимых соединений в плазме
крови и моче позволяет быстро провести их количественное или качественное
определение с помощью хроматографических методов анализа.НЕДОСТАТОЧНОСТЬ ПРОДУКТОВ РЕАКЦИИНедостаточность продуктов реакции — второй основной механизм патогенеза
НБО. Причиной патологических изменений может быть непосредственно недоста¬
точность продукта блокированной реакции. Например, при дефекте биотинидазы
нарушается отщепление биотина от диетарных белков, и клинические проявления
болезни связаны с недостатком этого витамина. Недостаточность продуктов реак¬
ции в циклическом процессе мочевины создает примечательную метаболическую
ситуацию — некоторые аминокислоты из заменимых переходят в категорию неза¬
менимых. Так, при аргинин-янтарной ацидурии наблюдается нарушение образо¬
вания аргинина из аргинин-янтарной кислоты, что приводит к недостаточности
аргинина и орнитина.
722ЛАБОРАТОРНАЯ ГЕНЕТИКАВ ряде случаев может возникать недостаточность более удаленного в данной
метаболической цепи продукта, например альдостерона и кортизола, при адрено-
генитальном синдроме (табл. 10-3),Таблица 10-3. НБО, связанные с недостатком продуктов блокированной реакцииЗаболеваниеБиохимический дефектНедостаток продуїстаОсновные клинические
проявления^ Недостаточность вита¬
мина DНедостаточность 25-гидро-
ксихолекальциферол-1 -а-
гидроксилазы1-а,25-дигидрокси-холекальциферолПоражение скелета
(рахит)Болезнь ХартнулаНарушения транспорта ней-
тральных аминокислотНиацинамидПеллагроподобные нару¬
шенияЛизинурическая непе¬
реносимость белкаНарушение транспорта
двухосновных аминокислотОрнитинПоражение нервной
системы вследствие гипе-
раммониемииНедостаточность бис-
тинидазыБиотинидазаБиотинПоражение нервной
системы, кожи и придат¬
ков кожиМЕТАБОЛИЧЕСКАЯ ИЗОЛЯЦИЯВ отдельную группу необходимо выделить заболевания, связанные с метаболи¬
ческой изоляцией продукта реакции. Это основной механизм патогенеза при нару¬
шениях белков-переносчиков, которые не являются ферментами, но участвуют в
регуляции определенной биохимической реакции. Каскад метаболических собы¬
тий, который запускается при этих болезнях, имеет сходные для организма и клет¬
ки последствия. Синдром ННН (акроним от трех основных биохимических марке¬
ров - Hyperammonemia, Hyperornithinemia, Homocitrullinemia) связан с нарушением
транспорта орнитина. В результате наблюдается недостаточность орнитина внутри
митохондрий, что приводит к накоплению карбамоилфосфата и аммония.Выделить единственный ведущий механизм патогенеза практически невоз¬
можно, поскольку метаболические процессы тесно взаимосвязаны. Как правило,
наблюдается сочетание всех описанных механизмов, и при каждом из фермента¬
тивных блоков происходят значительные изменения во всей метаболической сети
клетки.Лабораторная диагностика наследственных
болезней обмена веществДифференциальная диагностика НБО целиком зависит от применения необы¬
чайно широкого спектра биохимических, физико-химических и молекулярно¬
генетических методов, в большинстве случаев только сочетанная интерпретация
всех полученных результатов дает возможность точно определить форму забо¬
левания. Как правило, общая стратегия диагностики НБО включает несколько
этапов,I — выявление дефектного звена метаболического пути посредством анализа
(количественного, полуколичественного или качественного) метаболитов.II — выявление дисфункции белка определением его количества и/или актив¬
ности,III — выяснение природы мутации, т.е. характеристика мутантного аллеля на
уровне гена.Такую стратегию применяют не только для решения проблем, касающихся изуче¬
ния молекулярных механизмов патогенеза НБО, выявления генофенотипических
корреляций, она необходима прежде всего для практической диагностики НБО.
ЛАБОРАТОРНАЯ ГЕНЕТИКА723Верифицировать диагноз на уровне белка и мутантного гена необходимо как
для проведения пренатальной диагностики, медико-генетического консульти¬
рования отягощенных семей, так и в ряде случаев для назначения адекватной
терапии. Например, при недостаточности дегидроптеридинредуктазы клиниче¬
ский фенотип и уровни фенилаланина будут неотличимы от классической формы
фенилкетонурии (ФКУ), но подходы к терапии этих заболеваний принципиально
отличаются. Важность локусной дифференциации НБО для медико-генетического
консультирования может бьггь проиллюстрирована на примере мукополисахари-
доза II типа (болезни Хантера). По спектру экскретируемых гликозаминогликанов
невозможно различить мукополисахаридозы I, II и VII типа, но из этих заболева¬
ний только болезнь Хантера наследуется по Х-сцепленному рецессивному типу,
что имеет принципиальное значение для прогноза потомства в семье с отягощен¬
ным анамнезом. Что касается пренатальной диагностики, то, имея данные о форме
мукополисахаридоза (это может быть установлено только при исследовании
активности ферментов), возможно проведение пренатальной диагностики уже на
8-11-й неделе беременности, если же форма не уточнена, то только на 20-й неделе.
Бе.зусловна приоритетность молекз^ярно-генетических методов при установлении
гетерозиготного носительства, а также в пренатальной диагностике заболеваний,
при которых мутантный фермент не экспрессируется в клетках ворсин хорио¬
на, например при ФКУ, некоторых гликогенозах, дефектах митохондриального
р-окисления.ВЫЯВЛЕНИЕ ДЕФЕКТНОГО ЗВЕНА МЕТАБОЛИЧЕСКОГО ПУТИАнализ метаболитов является важнейшим этапом в диагностике многих забо¬
леваний из класса НБО (табл. 10-4). Прежде всего это относится к нарушениям
межуточного обмена аминокислот и органических кислот. При большинстве этих
заболеваний количественное определение метаболитов в биологических жидко¬
стях позволяет точно установить диагноз. Для этих целей применяют методы каче¬
ственного химического анализа, спектрофотометрические методы количественной
оценки соединений, а также различные виды хроматографии (тонкослойную,
высокоэффективную жидкостную, газовую, тандемную масс-спектрометрию).
Биологическим материалом для этих исследований обычно служат плазма или
сыворотка крови и образцы мочи.При таких НБО, как нарушения энергетического обмена, обмена углеводов и
аминокислот, анализ соединений общих для многих метаболических путей (клю¬
чевых метаболитов) позволяет проводить дифференциальную диагностику забо¬
леваний и планировать дальнейшую тактику обследования.Для многих групп НБО в целях определения концентрации метаболитов исполь¬
зуют полуколичественный анализ. Иногда и качественный анализ является первым
этапом диагностического поиска и позволяет с высокой достоверностью заподо¬
зрить определенную нозологическую форму заболевания или группу болезней.Таблица 10-4. Методы анализа метаболитов, применяемые при диагностике НБОКласс НБООпределяемые метаболитыМетоды анализаАминоацидопатииАминокислоты, птеридиныАминокислотный анализатор,
ВЗЖХ, ВЭЖХ-МС/МСМитохондриальные болезниЛактат, пируват, 3-гидрокси-
бутират, ацетоацетатВЭЖХ, спектрофотометрические
методыОрганические ацидурииОрганические кислоты, ацилкар-
нитиныГХ, ХМС, ВЭЖХ. МС/МС, ВЭЖХ-МС/
МСБолезни пуринового и пирими¬
динового обменаПурины, пиримидины, мочевая
кислотаВЭЖХ. ВЭЖХ-МС/МСБолезни углеводного обменаМоно-и дисахаридыВЭЖХ. ВЭЖХ-МС/МС
724ЛАБОРАТОРНАЯ ГЕНЕТИКАОкончание табл. 10-4Класс НБООпределяемые метаболитыМетоды анализаЛизосомные болезниОлигосахариды, гликозамино-
гликаныВЭЖХ, ВЭЖХ-МС/МС, электрофорезНарушения митохондриальногоР-ОКИСЛЕНИЯКарнитин и его эфиры, разветвлен¬
ные и неразветвленные дикарбоно-
вые кислоты от Сд до С,^ ГХ, ХМС, МС/МС, ВЭЖХ-МС/МСПероксисомные болезниОДЦЖК, фитановая кислота,
желчные кислоты, плазмалогены,
липеколиновая кислотаГХ, ХМС, ВЭЖХ, МС/МС. ВЭЖХ-МС/
МСБолезни обмена металловИоны металлов, сульфатыВЭЖХНаследственные болезни транс¬
порта метаболитовСиаловыБ кислоты, хлоридыВЭЖХ, ВЭЖХ-МС/МСНаследственные болезни ЖКТМоно-и дисахаридыВЭЖХ, ВЭЖХ-МС/МСБолезни холестеринового
обменаХолестерин и его производные,
триацилглицеридыГХ, ХМСБолезни обмена нейротрансмит-
твровКатехоламины, аминокислотыВЭЖХ, ВЭЖХ-МС/МСБолезни обмена гема и порфи-
риновПорфириныВЭЖХ, ВЭЖХ-МС/МСНаследственные эндокринопатииСтероидные гормоныВЭЖХ, ВЭЖХ-МС/МСКАЧЕСТВЕННЫЕ И ПОЛУКОЛИЧЕСТВЕННЫЕ ТЕСТЫ С МОЧОЙПоскольку при многих НБО происходит накопление субстратов блокированной
ферментной реакции или их производных, избыточные концентрации этих мета¬
болитов можно обнаружить с помощью химических тестов качественного анализа.
Эти тесты чувствительны, просты в применении, отличаются низкой себестоимо¬
стью и не дают ложноотрицательных результатов, а информация, полученная при
их применении, позволяет с высокой долей вероятности заподозрить НБО у паци¬
ента. Необходимо учитывать, что на результаты этих тестов оказывают влияние
лекарственные препараты, пищевые добавки и их метаболиты. Тесты качествен¬
ного анализа применяют в программах селективного скрининга.Качественные тестыЦвет и запах: лейциноз, тирозинемия, изовалериановая ацидемия, ФКУ, алкап-
тонурия, цистинурия, З-гидрокси-З'Метилглутаровая ацидурия.Тест Бенедикта (галактоземия, врожденная непереносимость фруктозы,
алкаптонурия). Также положительный при синдроме Фанкони, сахарном диабете,
лактазной недостаточности, приеме антибиотиков.Тест с хлоридом железа (ФКУ, лейциноз, гиперглицинемия, алкаптонурия.
тирозинемия, гистидинемия). Также положительный при циррозе печени, плео-
хромацитоме, гипербилирубинемии, лактат-ацидозе, кетоацидозе, меланоме.Тест с динитрофенилгидразином (ДНФГ) (ФКУ, лейциноз, гиперглицине¬
мия, алкаптонурия). Также положительный при гликогенозах, лактат-ацидозе.Тест с п~нитроанилином: метилмалоновая ацидурия.Сульфитный тест: недостаточность молибденового кофактора.Тест на гомогентизиновую кислоту: алкаптонурия.Тест с нитрозонафтолом: тирозинемия. Также положительный при фруктозе-
мии и галактоз емии.Полуколичественные тестыТест с цианид-нитропруссидом; гомоцистинурия, цистинурия.ЦПХ-тест: мукополисахаридозы (рис. 10-2).
МПС к н,
ИП1+ VHЛАБОРАТОРНАЯ ГЕНЕТИКА 725Станда^??гы<—хсРис. 10-2. Одномерный электрофорез экскретируемых гликозам и н ОГЛ и канов (ГАГ) при мукопо-
лисахаридозах.КЛЮЧЕВЫЕ МЕТАБОЛИТЫДля многих групп НБО важным этапом дифференциальной лабораторной диа¬
гностики является измерение концентрации определенных метаболитов в раз¬
личных биологических жидкостях (крови, плазме, цереброспинальной жидкости
и моче), к этим соединениям относет глюкозу, молочную кислоту (лактат), пиро-
виноградную кислоту (пируват), аммоний, кетоновые тела (3-гидроксибутират и
ацетоацетат), мочевую кислоту. Концентрация этих соединений изменяется при
многих НБО, и их комплексная оценка позволяет разработать алгоритмы дальней¬
шей лабораторной диагностики.Лактат и пируватКонцентрации лактата, пирувата, а также кетоновых тел являются важнейшими
показателями нарушений энергетического обмена. Известно около 25 нозологи¬
ческих форм НБО, при которых наблюдается повышение уровня лактата в крови
(лактат-ацидоз) (табл. 10-5).Лактат-ацидоз — состояние, при котором уровень молочной кислоты пре¬
вышает 2,1 мМ. Первичный лактат-ацидоз может быть связан с недостаточно¬
стью пируватдегидрогеназы (пируватдегидрогеназного комплекса), нарушениями
дыхательной цепи митохондрий (подавляющее большинство форм), глюконеоге-
неза, обмена гликогена. Вторичный лактат-ацидоз наблюдается при некоторых
органических ацидуриях, нарушениях митохондриального |3-окисления, дефектах
цикла мочевины. Концентрация этих метаболитов во многом зависит от физио¬
логического статуса (до или после пищевой нагрузки), также на уровень лактата
оказывают влияние физическая нагрузка и даже стресс, связанный с процедурой
взятия крови, особенно у детей раннего возраста. Все это необходимо учитывать
при интерпретации биохимических данных.
ш726ЛАБОРАТОРНАЯ ГЕНЕТИКАТаблица 10-5. Лактат-ацидоз при наследственных болезнях обмена веществСвязь с пищевой
нагрузкойСоотношение лактат/пируватДиагнозТолько после пище¬
вой нагрузкиНе является диагностическимГликогеноз типа 111.
Гликогеноз типа 0Нормальное соотношение лактат/
лируват.Высокое соотношение лактат/пируват.
Соотношение 3-ОН-бутират/ацетоаце-
тат в норме.Парадоксальная гилеркетонвмия.
Высокое соотношение лактат/пируват.
Соотношение 3-ОН-бугират/ацетоаце-
тат повышено.Парадоксальная гиперкетонемияНарушения обмена пирувата.Дефект лируваткарбоксилазы,
дефицит биотинидазы. дефект
а-кетоглутаратдегидрогеназы.Дефекты дыхательной цепи митохондрийТолько после голо¬
данияНе является диагностическимГликогеноз типа 1.
Недостаточность фруктозо-1,6-
бифосфатазыНе является диагностическимДефекты митоходриального р-окисления.
Недостаточность фруктозо-1,6-
бифосфатазыВозможен до и после
пищевой нагрузкиНе является диагностическимОрганические ацидурии.
Недостаточность фруктозо-1,6-
бифосфатазыНе является диагностическимДефекты цикла мочевиныНе является диагностическимГликогеноз типов 1а, 1в.
Недостаточность фруктозо-1,6-
бифосфатазыСоотношение лактат/пируват имеет
высокое диагностическое значениеДефекты дыхательной цепи митохондрий,
нарушения обмена пируватаСоотношение концентрации лактат/пируват в крови является важным
дифференциально-диагностическим критерием (рис. 10-3). Биохимически это
соотношение отражает соотношение между восстановленной и окисленной фор¬
мой никотинамиддинуклеотидов (НАД/НАДН) в цитоплазме — так называемый
окислительный статус цитоплазмы.3-ОН-бутират/
ацетоацетат(<1)Дефекты
дыхательной цепи
митохондрийРис. 10-3. Дифференциальная диагностика при НБО, сопровождаемых лактат-ацидозом.
ЛАБОРАТОРНАЯ ГЕНЕТИКА 727Кетоновые телаКетоновые тела образуются в печени, их основным источником является
р-окисление жирных кислот. Затем они переносятся в различные ткани орга¬
низма. Соотношение кетоновых тел 3-гидроксибутират/ацетоацетат отража¬
ет окислительно-восстановительный статус митохондрий, так как их соот¬
ношение связано исключительно с митохондриальным п}шом НАД и НАДН.3-гидроксибутират в плазме крови относительно стабилен, в отличие от ацетоаце¬
тата, который быстро распадается.Многие дефекты митохондриального р-окисления характеризуются низким
уровнем кетоновых тел даже после продолжительного голодания, что связано с
истощением продукции ацетил-КоА, являющегося основным предшественником
кетоновых тел. При митохондриальных болезнях, связанных с дефектами дыха¬
тельной цепи митохондрий, наблюдается парадоксальная гиперкетонемия — уро¬
вень кетоновых тел после пищевой нагрузки значительно повышается (в норме
наблюдается повышение концентрации кетоновых тел после продолжительного
голодания).АммонийПри НБО, протекающих по типу острой метаболической декомпенсации, важ¬
ное значение имеет определение уровня аммония в крови. Значительное повыше¬
ние аммония в крови наблюдается при НБО, обусловленных нарушениями цикла
мочевины и обмена органических кислот. При этих заболеваниях концентрация
аммония повышается от 200 до 1000 мкМ. Піпераммониемия является не толь¬
ко важным дифференциально-диагностическим признаком, но и требует неот¬
ложных терапевтических мероприятий, поскольку быстро приводит к тяжелому
поражению головного мозга. Алгоритм дифференциальной диагностики гипер-
аммониемии приведен на рис. 10-4. Важно дифференцировать данное состояние
от транзиторной гипераммониемии новорожденных, которая встречается у недо¬
ношенных новорожденных с высокими росто-массовыми показателями и клини¬
ческими симптомами поражения легких. Уровень аммония при этом состоянии
не превышает 200 мкМ, Концентрация аммония в крови может повышаться при
тяжелом поражении печени. Нормальные значения концентрации аммония в
крови: в неонатальный период — менее ] 10 мкМ, у детей более старшего возрас¬
та — менее 100 мкМ.ГлюкозаСнижение уровня глюкозы в крови может наблюдаться при ряде НБО. Прежде
всего это относится к нарушениям обмена гликогена и дефектам митохондриаль¬
ного (3-окисления, при которых гипогликемия может быть единственным био¬
химическим изменением, выявляемым при стандартных лабораторных исследо¬
ваниях. Физиологический ответ на снижение уровня глюкозы в крови — отмена
выброса инсулина, выработка глюкагона и других регуляторных гормонов. Это
приводит к образованию глюкозы из гликогена в печени и превращению белков
в глюкозу в цепи глюконеогенеза. Также активируется липолиз, что приводит к
образованию глицерина и свободных жирных кислот. Жирные кислоты транс¬
портируются в митохондрии печени, где происходит их р-окисление и образуются
кетоновые тела, а глицерин превращается в глюкозу в цепи глюконеогенеза. Дети
имеют гораздо большую потребность в глюкозе, чем взрослые. Считают, что это
связано с тем, что соотношение размера головного мозга к телу у детей выше,
а головной мозг является основным потребителем глюкозы. Кроме того, мозг
728 ЛАБОРАТОРНАЯ ГЕНЕТИКАСимптомы в первые 24 часа жизниСимптомы после первых 24 часов жизниV І t іНедоношенныйДоношенныйАцидозНормальные
показатели КЩСДефекты цикла мочевиныАминокислоты плазмы кровиЦитруллинсниженЦитруллинповышенЦитруллинзначительноповышенжРис. 10-4, Дифференциальная диагностика НБО, сопровождаемых гипераммониемией.взрослого человека более приспособлен к использованию кетоновых тел в каче¬
стве источника энергии, чем мозг ребенка. Именно по этим причинам дети более
чувствительны к гипогликемическим состояниям, чем взрослые.при нарушениях обмена гликогена гипогликемия связана с невозможностью
образования глюкозы из гликогена, поэтому она более выражена в периоды про¬
должительного голодания.Большинство заболеваний из группы дефектов митохондриального р-окисления
также сопровождаются снижением уровня глюкозы. Эта группа болезней относит¬
ся к числу наиболее распространенных НБО. Причина гипогликемии связана с
невозможностью использовать накопленные жиры в период голодания и истоще¬
нием накопленного гликогена, который становится единственным источником
глюкозы и соответственно метаболической энергии. Гйпогликемия при дефектах
митохондриального р-окисления, в отличие от гликогенозов, не сопровождается
гиперкетонемией.Гипогликемия также может встречаться при галактоземии типа I, наследствен¬
ной непереносимости фруктозы, недостаточности фруктозо-1,6-бифосфатазы.
ЛАБОРАТОРНАЯ ГЕНЕТИКА729Метаболический ацидозМетаболический ацидоз — одно из частых осложнений при инфекционных
заболеваниях, тяжелой гипоксии, дегидратации и интоксикации. НБО, манифе¬
стирующие в раннем детском возрасте, также нередко сопровождаются метаболи¬
ческим ацидозом с дефицитом оснований.Важнейшим критерием в дифференциальной диагностике метаболического
ацидоза является уровень кетоновых тел в крови и моче, а также концентрация
глюкозы. Если метаболический ацидоз сопровождается кетонурией, это указы¬
вает на нарущения метаболизма пирувата, разветвленных аминокислот, наруше¬
ния обмена гликогена. Дефекты митохондриального [3-окисления, кетогенеза и
некоторые нарушения глюконеогенеза не сопровождаются повышением уровня
кетоновых тел в крови и моче. На рис. 10-5 приведен один из дифференциально¬
диагностических алгоритмов, помогающих в лабораторной диагностике групп
НБО, сопровождаемых метаболическим ацидозом.Наиболее частые НБО, протекающие с выраженным метаболическим ацидо¬
зом, — пропионовая, метилмалоновая и изовалериановая ацидемии. Нарушения
метаболизма пирувата и дыхательной цепи митохондрий, манифестирующие в ран¬
нем возрасте, как правило, приводят к выраженному метаболическому ацидозу.Мочевая кислотаМочевая кислота — конечный продукт метаболизма пуринов. Пуриновые осно¬
вания — аденин, гуанин, гипоксантин и ксантин — окисляются до мочевой кис¬
лоты. Мочевая кислота синтезируется преимущественно в печени, в кровеносном
русле не связана с белками, поэтому практически вся подвергается фильтрации вІіfШШГипергликемияГипераммониемияНормогликемияЛактат-ацидозКонцентрация
гактата в нормеГипогликемияЛактат-ацидозКонцентрация
лаіаата в нормеКонцентрация
аммония в нормеr>Нормогликемия—>Лактат-ацидоз—Гипогликемия(+гепатомегалия)>•ъ.КонцентрацияНормогликемиялактата в нормеОрганические ацидурии
(пропионовая,
метилмалоновая,
изовалериановая)Диабет
Нарушения кетопЁнезаНарушения метаболизма
пирувата, БЦДМ,
органические ацидурииОрганические ацидурии
Лейциноз, нарушения
кетогенеза SCADДефекты
глюкогенеза,
гликогеноэы БДЦМОрганические ацидурии
Лейциноз, АГСДефекты метаболизма
пируватаДефекты
митох в-окисления,
нарушения кетогенезаПочечно-канальцевыйацидозРис. 10-5. Дифференциальная диагностика НБО, сопровождаемых метаболическим ацидозом.
БДЦМ — болезни дыхательной цепи митохондрий: АГС — адреногенитальный синдром.
730ЛАБОРАТОРНАЯ ГЕНЕТИКАпочках. Повышение концентрации мочевой кислоты в моче строго коррелирует с
увеличением ее уровня в плазме крови.Повышенная продукция и экскреция мочевой кислоты (гиперурикемия и гипер-
урикозурия) возникают в результате гиперактивности (уникальное явление среди
ИБО) или недостаточности ферментов, участвующих в синтезе пуринов de novo,
сберегающих путях их метаболизма, или обусловлена нарушениями образования
инозинмонофосфата из аденозинмонофосфата в цикле пуриновых нуклеотидов
(табл. 10-6). Вторичная гиперурикемия также наблюдается при наследствен¬
ной непереносимости фруктозы, недостаточности фруктозо-1,6-дефосфатазы,
гликогенозах I, III, V, VII типа, недостаточности среднецепочечной ацетил-КоА-
дегидрогеназы жирных кислот.Таблица 10-6. НБО, сопровождаемые повышением уровня мочевой кислотыМеханизмы, приводящие к повышению
продукции мочевой кислотыЗаболеваниеНедостаточность фермента приводит к накоплен
нию гуанина и гипоксантина, которые метаболи*
зируются до мочевой кислотыСиндром Леша-Найяна(полная недостаточность фермента гипоксантин-
гуанин'фосфорибозилтрансферазы).Синдром Келли-Сигмиелера {частичная недо¬
статочность фермента гипоксантин-гуанин-
фрсфорибозилтрансферазы) Нарушение образования инозинмонофосфата
из аденозинмонофосфата, что сопровождается
расщеплением АТФ и гиперпродукцией МКНедостаточность миоаденилатдеаминазыПовышение концентрации 5-фосфори6озил-1-
пирофосфата в пути синтеза пуринов бе novo,
что приводит к гиперпродукции МКГиперактивность фермента 5-фосфорибозил-1-
пирофосфатсинтетазыАНАЛИЗ МЕТАБОЛИТОВ С ПОМОЩЬЮ СПЕЦИАЛЬНЫХ МЕТОДОВ
КОЛИЧЕСТВЕННОГО АНАЛИЗАХроматографические методы анализа играют важнейшую роль в диагности¬
ке НБО. Современный арсенал хроматографических технологий чрезвычайно
широк, что позволяет эффективно и информативно разделять сложные, много¬
компонентные смеси, к которым относится и биологический материал. Для
количественного анализа метаболитов при НБО успешно применяют такие
хроматографические методы, как газовая и высокоэффективная жидкостная
хроматография, хроматомасс-спектрометрия (ГХ, ВЭЖХ, ХМС). ГХ и ВЭЖХ —
самые универсальные методы разделения сложных смесей соединений, отлича¬
ются высокой чувствительностью и воспроизводимостью. Б обоих случаях раз¬
деление осуществляется в результате различного взаимодействия компонентов
смеси с неподвижной и подвижной фазами хроматографической колонки. Для
ГХ подвижной фазой является газ-носитель, для ВЭЖХ — жидкость (элюент).
Выход каждого соединения фиксируется детектором прибора, сигнал которого
преобразуется в пики на хроматограмме. Каждый пик характеризуется временем
удерживания и площадью. Следует отметить, что ГХ проводят, как правило,
при высокотемпературном режиме, поэтому ограничением для ее применения
является термическая неустойчивость соединений. Для ВЭЖХ не существует
подобных ограничений, так как в этом случае анализ проводят в мягких услови¬
ях. ХМС представляет собой комбинированную систему ГХ или ВЭЖХ с масс-
селективным детектором, что позволяет получать не только количественную, но
и качественную информацию, т.е. дополнительно определяется структура соеди¬
нений в анализируемой смеси.
ЛАБОРАТОРНАЯ ГЕНЕТИКА 73*|Органические кислотыв биохимической генетике термин «органические кислоты» относится к неболь¬
шим (молекулярная масса — менее 300 кДа), растворимым в воде карбоновым
кислотам, которые являются промежуточными или конечными продуктами мета¬
болизма аминокислот, углеводов, липидов и биогенных аминов.Для определения органических кислот применяют разнообразные хрома¬
тографические методы: высокоэффективную жидкостную хроматографию,
хроматомасс-спектрометрию и ВЭЖХ с последующей тандемной масс-
спектрометрией (ВЭЖХ-МС/МС). Более 250 различных органических кислот и
глициновых конъюгатов можно обнаружить в образце мочи. Их концентрация
зависит от диеты, приема лекарственных препаратов и некоторых других физио¬
логических причин. Известно около 65 ИБО, которые характеризуются специфи¬
ческим профилем органических кислот. Относительно небольшое количество
органических кислот высокоспецифичны, наличие их в больших концентрациях в
моче позволяет точно установить диагноз: сукцинилацетон при тирозинемии типаI, N-ацетиласпартат при болезни Канавана, мевалоновая кислота при мевалоно-
вой ацидурии. В подавляющем большинстве случаев диагноз ИБО на основании
только анализа органических кислот мочи установить довольно трудно, поэтому
требуется дополнительная, подтверждающая диагностика.Интерпретация результатов анализа органических кислот мочи представляет
определенные проблемы как из-за большого количества экскретируемых кислот и
их производных, так и из-за наложения профилей некоторых лекарственных мета¬
болитов. Для точной диагностики данные, полученные при анализе органических
кислот, должны коррелировать с клинической характеристикой заболевания и
быть подтверждены результатами других лабораторных методов анализа (анализа
аминокислот, лактата, пирувата, ацилкарнитинов в крови, активностью ферментов
и молекулярно-генетическими данными).Концентрация органических кислот при ИБО характеризуется достаточно
широким диапазоном — от повышения их уровня в несколько сотен раз до незна¬
чительного превышения, близкого к нормальному. Например, при глутаровой
ацидурии типа I уровень глутаровой кислоты у некоторых больных может нахо¬
диться в пределах нормы; при недостаточности среднецепочечной ацетил-КоА-
дегидрогеназы жирных кислот концентрация адипиновой, себациновой и субери¬
новой кислот может быть в пределах нормы. Обнаружить аномальный профиль
органических кислот мочи иногда бывает возможно только у пациентов в стадии
метаболической декомпенсации. Особенно это характерно для доброкачествен¬
ных, мягких форм заболеваний, которые, как правило, поздно манифестируют.Аминокислоты и ацилкарнитиныОпределение концентрации аминокислот и ацилкарнитинов проводят методом
тандемной масс-спектрометрии (табл. 10-7).Масс-спектрометрия — аналитический метод, с помощью которого можно
пол)^чать как качественную (структ\фа), так и количественную (молекулярная
масса или концентрация) информацию анализируемых молекул после их преоб¬
разования в ионы. Существенное отличие масс-спектрометрии от других анали¬
тических физико-химических методов состоит в том, что в масс-спектрометре
определяется непосредственно масса молекул и их фрагментов. Результаты пред¬
ставляются графически (так называемый масс-спектр). Иногда невозможно ана¬
лизировать многокомпонентные, сложные смеси молекул без их предваритель¬
ного разделения. Разделить молекулы можно либо хроматографически, либо
использовать два последовательно соединенных масс-спектрометра — тандемная
-.жж732ЛАБОРАТОРНАЯ ГЕНЕТИКАТаблица 10-7. НБО, сопровождаемые изменением концентрации отдельных аминокислот и ацил-
карнитинов, которые можно определить методом тандемной масс-спектрометрииЗаболеваниеИзменение концентрации
метаболитовБолезнь кленового сиропа (лейциноз)Лейцин Т, валин ТЦитруллинвмия типа 1, неонатальная цитруллинемияЦитруллин ТАргинин-янтарная ацидурия {АСА)/недостаточность аргининосукцинатлиазыЦитруллин ТНедостаточность орнитинтранскарбамилазыЦитруллин 1Недостаточность карбам и лфосфатсинтазыЦитруллин іНедостаточность N-ацетилглугаматсинтазыЦитруллин іНекетоническая гиперглицинемияГлицин ТТирозинемия типа 1Тирозин ТТирозинемия типа !1Тирозин ТГ 0 МО цисти нурия/недостаточность цистатионин-р-синтетазыМетионин ТФекилкетонурияФенилаланин ТТАргянинемия/недостаточность аргиназыАргинин ТПропионовая ацидемия (недостаточность пропионил-КоА-карбоксилазы}СЗТМетилмалоновая ацидемияСЗ Т (C4DC Т)Изовалериановая ацидемия (недостаточность изовалерил-КоА-
дегидрогеназы)С5ТНедостаточность 2-метилбутирил-КоА-дегидрогеназыС5ТНедостаточность изобутирил-КоА-дегидрогеназыС4ТГлутаровая ацидемия типа 1 (недостаточность глутарил-КоА-дегидрогеназы)C5DC tНедостаточность 3-метилкротонил-КоА-карбоксилазыС50Н ТМножественная карбоксилазная недостаточностьС50Н Тез ТНедостаточность биотинидазыС50НТМалоновая ацидемия (недостаточность малонил-КоА-декарбоксилазы)C3DCTНедостаточность митохондриальной ацетоацетил-КоА-тиолазыС5:1 ТС50Н ТНедостаточность 2-метил-3-гидроксибутирил-КоА-дегидрогбназыС5:1 ТС50Н ТНедостаточность З-гидрокси-З-м етил глутар ил-КоА-лиазыС50Н TC6DC ТН едостаточ ность 3- метилглутакон и л-КоА- гидратаз ыC6DCTНедостаточность среднецелочечной ацетил-КоА-дегидрогеназыС6 TG8 ТС10ТС10:1 ТНедостаточность очень длинноцепочечной ацетил-КоА-дегидрогеназыС14ТС14:1 ТС14;2 С16;1 ТНедостаточность короткоцепочечной ацетил-КоА-дегидрогеназыС4ТНедостаточность ринноцепочечной З-гидроксиацил-КоА-дегидрогеназы
(дефект трифункционального белка)С160Н ТС180Н ТС18:10Н Т
С18:20Н ТГлутаровая ацидемия типа II (недостаточность глутарил-КоА-дегидрогеназы
типа II), множественная недостаточность ацетил-КоА дегидрогеназС4 ТС5 ТСб ТС8 ТСЮТ
С12ТС14ТС16ТС18ТНарушение транспорта карнитинаСО існижение ацилкарнйтиновНедостаточность карнитик-палмитоилтрансферазы типа 1СО tC16iC18;1 iC18:2iНедостаточность карнитин-палмитоилтрансферазы типа IIС0ІС1бТС18;1 ТС18:2ТНедостаточность карнитин/ацилкарнитинтранслоказыСО ІС1бТС18:1 TC18:2tНедостаточность 2,4-диеноил-КоА-редуктазыCl 0:2 TНедостаточность среднецепочечной 3-кетоацил-КоА-тиолазыC6DC TC8DC T
ЛАБОРАТОРНАЯ ГЕНЕТИКА 733масс-спектрометрия. Метод тандемной масс-спектрометрии (МС/МС) впервые
был применен в 70-х гг. прошлого века и нашел применение в химии, биологии и
медицине. Этот метод применяют для выяснения структуры неизвестных веществ,
а также для анализа комплексных смесей с минимальной очисткой образцов.Перед масс-спектрометрическим анализом необходимо превращение нейтраль¬
ных частиц вещества в заряженные ионы, а также перевод их из жидкого состоя¬
ния в газообразное. Для этой цели сначала применяли метод ионизации бомбар¬
дированием быстрыми атомами, в последнее время предпочтение отдается методу
ионизации в электроспрее. С появлением новых методов ионизации применение
МС/МС в области аналитической биохимии стало более доступным. Впервые
анализ ацилкарнитинов с помощью МС/МС выполнили Дэвид Миллингтон и
соавт., применившие химическую дериватизацию биологических образцов для
образования бутиловых эфиров ацилкарнитинов, В 1993 г. Дональд Чейз и соавт.
адаптировали этот метод для анализа аминокислот в высушенных пятнах крови,
сформировав, таким образом, основу для скрининга множества компонентов при
ИБО. В дальнейшем метод был адаптирован к проведению крупномасштабных
анализов, необходимьЕХ для неонатального скрининга.МС/МС-анализ наиболее эффективен для соединений, имеющих сходные
дочерние ионы или нейтральные молекулы, например для анализа аминокислот и
ацилкарнитинов. Необходимо также подчеркнуть возможность МС/МС-анализа
различных химических групп в одном анализе за очень короткое время (»2 мин).
Это обеспечивает широкий спектр анализов и высокую пропускную способность,
что экономически выгодно для скрининга на большое количество заболеваний.
На основании повышения концентрации определенных ацилкарнитинов можно
заподозрить заболевания из группы нарушений митохондриального р-окисления
по изменению профиля аминокислот — аминоацидопатии. Важно отметить, что
при выявлении нарушений следует обязательно проводить подтверждающую диа¬
гностику, например анализ органических кислот мочи с помощью ГХ/МС, моле¬
кулярную диагностику, энзимодиагностику или исследование культуры кожных
фибробластов.С помощью МС/МС можно детектировать посторонние метаболиты желчных
кислот, появляющихся при нарушениях метаболизма холестерина и липидов,
желчных кислот, а также при дефектах биогенеза пероксисом. При различных
холестатических гепатобилиарных нарушениях (хроническом заболевании печени
неизвестной этиологии, синдроме Цельвегера, недостаточности пероксисомного
бифункционального белка, тирозинемии типа I, билиарной атрезии, прогрессив¬
ном фамильном внутрипеченочном холестазе неопределенного типа) с помощью
МС/МС можно определять концентрации конъюгированных желчных кислот в
различных биологических жидкостях.Описаны методы определения очень длинноцепочечных жирных кислот; эйко-
зановой (С20:0), докозановой (С22:0), тетракозановой (С24:0), гексакозановой
(С26:0), а также фитановой и пристановой кислот — с помощью МС/МС в плазме
и пятнах крови, потенциально годные для скрининга многих пероксисомных
болезней.Диагностика нарушений метаболизма пуринов и пиримидинов (недостаточ¬
ности пуриннуклеозидфосфорилазы, орнитинтранскарбамилазы, молибденового
кофактора, аденилосукциназы, дегидропиримидиндегидрогеназы) основана на
присутствии аномальных метаболитов или отсутствии нормальных метаболи¬
тов в сыворотке, моче или клетках крови. Так, разработаны быстрые ЭСИ-МС/
МС-методы, позволяющие количественно определять от 17 до 24 пуринов и пири¬
мидинов в моче в одном анализе.МС/МС также можно использовать для исследования других классов мета¬
болитов. Так, разработан новый ЭСИ-МС/МС-метод измерения тотального гек-
734 ЛАБОРАТОРНАЯ ГЕНЕТИКАсозмонофосфата в пятнах крови, маркера галактозо-1-фосфата, который можно
использовать при скрининге на галактоземию.Определение катехоламинов в моче является важным для диагностики нару¬
шения метаболизма катехоламинов и нейротрансмиттеров. Значительными недо¬
статками существующих методов являются долгое время анализа и возможная
интерференция лекарств и их метаболитов, структурно схожих с катехоламинами.
ВЭЖХ-ЭСИ-МС/МС-методы в комбинации с пробоподготовкой, специфичной к
соединениям, содержащим катехольные группы, позволяет быстро диагностиро¬
вать эту группу заболеваний, исключая недостатки БЭЖХ-методов.Исследование белковПодавляющее большинство ИБО обусловлено нарушением активности фермен¬
тов, поэтому в диагностике этих заболеваний выявление снижения активности
специфических ферментов является важнейшим, а иногда и единственным надеж¬
ным методом подтверждения диагноза.ОПРЕДЕЛЕНИЕ АКТИВНОСТИ ФЕРМЕНТОВВ настоящее время пост- и пренатальная диагностика многих НБО (прежде
всего это относится к лизосомным болезням накопления) осуществляется с помо¬
щью методов анализа ферментативной активности. Материалом для измерения
активности ферментов при НБО являются прежде всего лейкоциты перифери¬
ческой крови: практически при всех лизосомных болезнях накопления (ЛЕН),
метилмалоновой ацидурии, некоторых гликогенозах. Для диагностики GM2-
ганглиозидозов, недостаточности биотинидазы используют плазму или сыворотку
крови, в некоторых случаях объектами исследования являются мышечная или
печеночная ткань, культура кожных фибробластов.Субстраты для ферментов могут быть хромогенными, флюорогенными, содер¬
жать радиоактивную метку. Для измерения активности ферментов применяют
спектрофотометрический, флюориметрический и методы измерения радиоактив¬
ности. Общий принцип применения флюорогенных субстратов состоит в том, что
субстрат представляет собой химическое производное флюорохрома, неспособное
к флюоресценции в исходном состоянии, но под действием молекул соответствую¬
щих ферментов субстрат каталитически расщепляется с высвобождением флюо¬
рохрома, флюоресценцию которого можно измерить. Спектрофотометрические
методы позволяют измерять поглощение продуктами ферментативной реакции,
полученными после внесения хромогенных субстратов. Для многих ферментов
(например, дегидрогеназ) образующиеся продукты реакции могут быть хромо-
генными (НАД*Н, ФАД*Н). Имеется достаточно много флюорогенных субстратов
для исследования различных ферментов: эстераз разной специфичности, перокси-
даз, пептидаз, фосфатаз, сульфатаз, липаз и др. Радиоактивно-меченые субстраты
применяют в диагностике органических ацидурий, дефектов митохондриального
р-окисления, нарушениях метаболизма углеводов, лизосомных болезнях накопле¬
ния.Для каждой ферментативной реакции необходимы определенные условия: pH
и состав буферной смеси, специфический субстрат(-ы), наличие активаторов и
кофакторов, температурный режим и т.д. Практически каждая клетка содержит
свой набор ферментов, поэтому их распределение в тканях значительно варьирует.
Многие ферменты представлены в тканях различными формами (изофермента¬
ми), В большинстве случаев это связано с наличием полипептидных субъединиц,
которые, соединяясь, формируют разные изоферменты. Распределение изофер¬
ментов может варьировать от ткани к ткани. Некоторые ферменты встречаются
только в определенном органе или ткани.
ЛАБОРАТОРНАЯ ГЕНЕТИКА 735Лизосомные болезни накопленияОпределение активности ферментов является «золотым стандартом» под¬
тверждающей диагностики ЛБН. Для анализа активности ферментов используют
хромогенные и флюорогенные субстраты. Флюорогенные субстраты на основе4-метилумберифелона всегда очень чувствительны; с их помощью можно опреде¬
лять активность ферментов даже в микрсколичествах биологического материала
(пятнах высушенной крови). Как правило, активность ферментов у пациентов с
ЛБН составляет менее 10% нормы, и при биохимическом тестировании поста¬
новка точного диагноза не составляет значительных затруднений. Существует ряд
факторов, затрудняющих интерпретацию биохимических исследований. Один
из них — наличие аллелей «псевдонедостаточности», которые приводят к изме¬
нениям структуры фермента и не позволяют белку адекватно расщеплять искус¬
ственный субстрат in vitro, при этом с естественным субстратом данный фермент
не показывает снижения активности. Это явление описано для арилсульфатазы А,
[5-галактозидазы, р-глюкоронидазы, а-идуронидазы, а-галактозидазы, галактоце-
реброзидазы.Исследование мутантных геновРазвитие методов молекулярной биологии явилось настоящей революцией в
области клинической биохимии. Разработка стандартных протоколов молекуляр¬
ных исследований и автоматизация используемых методов сегодня — закончен¬
ный комплекс диагностических подходов, который может стать рутинной про¬
цедурой в клинических лабораториях. Быстрое развитие исследований в области
расшифровки генома человека и определение ДНК-последовательности генов
делает возможной ДНК-диагностику различных наследственных заболеваний.
Методы ДНК-диагностики, анализа структуры нормальных генов и их мутантных
аналогов при наследственных болезнях обмена начали использовать в течение
последнего десятилетия.Для ДНК-диагностики наследственных заболеваний используют два основных
подхода — прямую и косвенную ДНК-диагностику, Прямая ДНК-диагностика
представляет собой исследование первичной структуры поврежденного гена и
выделение мутаций, ведущих к заболеванию. Для детекции молекулярных повреж¬
дений в генах, обусловливающих наследственные болезни, используют стандарт¬
ный арсенал методов молекулярной биологии. В зависимости от характеристики и
типов мутаций, распространенности при различных наследственных заболеваниях
те или иные методы являются более предпочтительными.Для диагностики НБО в тех слу^шях, когда биохимический дефект точно изве¬
стен, легко и достоверно определяем с использованием биохимических методик,
ДНК-методы вряд ли займут приоритетное место. В этих случаях применение
ДНК-анализа является скорее научно-исследовательским, а не диагностическим
подходом. После точно установленного диагноза методы ДНК-анализа будут
полезны для последующей пренатальной диагностики, идентификации гетерози¬
готных носителей в семье и прогноза заболевания у гомозигот, а также для отбора
больных в целях проведения казуальной терапии в будущем (ферментозамести¬
тельной и генотерапии). Также в случаях, когда биохимический дефект точно не
известен, биохимическая диагностика затруднена, недостаточно достоверна или
требует инвазивных методов исследования, метод ДНК-диагностики — единствен¬
ный и незаменимый для точной постановки диагноза.В общем виде тактика проведения диагностики НБО в каждом конкретном слу¬
чае должна планироваться совместно с врачом-биохимиком и врачом-генетиком.
Необходимыми условиями успешной и быстрой диагностики являются понимание
736 ЛАБОРАТОРНАЯ ГЕНЕТИКАЭТИОЛОГИИ, механизмов патогенеза заболевания, знание специфических биохими¬
ческих маркеров.Лабораторный контроль качестваОдна из важнейших составляющих любой лабораторной диагностики — посто¬
янный контроль качества проводимых исследований. В такой сложной и много¬
гранной области, как наследственные болезни обмена веществ, внешний и вну¬
тренний контроль качества приобретает особое значение. Это связано с тем, что
лаборатория имеет дело с редкими заболеваниями, и, как правило, приобрести
опыт по диагностике каждой из болезней в достаточном количестве не представ¬
ляется возможным. Кроме того, лабораторное оборудование и методические под¬
ходы могут различаться между разными лабораториями.МАССОВЫЙ СКРИНИНГ НОВОРОЖДЕННЫХ
НА НАСЛЕДСТВЕННЫЕ БОЛЕЗНИ ОБМЕНА ВЕЩЕСТВОсновная цель генетического скрининга — выявление в популяции людей с
определенным генотипом, который либо обусловливает заболевание, либо пред¬
располагает к его возникновению, либо может вызвать заболевание у потомства.Основные принципы генетического скрининга были разработаны в 60-х гг.
прошлого века, когда его стали применять для выявления фенилкетонурии (ФКУ)
среди новорожденных, в 1968 г. группа экспертов ВОЗ по итогам скрининга на
ФКУ, проводимого в нескольких странах мира, опубликовала общие требования
к программам скрининга новорожденных на наследственные болезни обмена
веществ. Эти требования действительны и в настоящее время.Основные принципы генетического скринингак общим требованиям выполнения программ скрининга новорожденных на
наследственные болезни обмена относят следующие критерии:• частота заболевания в популяции должна быть достаточно высокой (это
требование не очень строгое, поскольку связано только с экономической
эффективностью программы);• заболевание должно быть хорошо изучено клинически и лабораторно;• заболевание должно быть тяжелым или даже летальным, так, чтобы польза
от применения программы скрининга была больше, чем стоимость ее испол¬
нения;• лабораторные тесты не должны давать ложноотрицательных результатов,
чтобы не пропустить ни одного больного; частота ложноположительных
результатов также не должна быть высокой, чтобы не снижать экономиче¬
скую эффективность программы;• лабораторные тесты должны быть простыми, безопасными и этически при¬
емлемыми;• должно быть разработано эффективное лечение скринируемых заболева¬
ний;• должен быть точно установлен промежуток времени от рождения, когда
лечение дает положительный результат;• скрининг должен быть экономически эффективным.Исходя из этих требований неонатальный скрининг — это система мероприя¬
тий, основными из которых являются выявление новорожденных с определенны¬
ми заболеваниями на доклинической стадии; раннее патогенетическое лечение.
ЛАБОРАТОРНАЯ ГЕНЕТИКА 737позволяющее дать обществу полноценных индивидуумов; медико-генетическое
консультирование семьи, имеющее целью не допустить рождения второго боль¬
ного ребенка. Скрининг на наиболее частые и тяжелые наследственные болезни
попадает в категорию высокоприоритетных среди прочих проблем здравоохране¬
ния, так как он затрагивает мотивацию населения, снижает заметную долю инва¬
лидности и обеспечивает экономию ресурсов. Неонатальный скрининг — принци¬
пиально новый подход к профилактике, предложенный медицинской генетикой
практическому здравоохранению.Перечисленным выше требованиям отвечает целый ряд наследственных болез¬
ней обмена. В России проводят скрининг новорожденных на фенилкетонурию с
1985 г., на врожденный гипотиреоз — с 1993 г.; в рамках Национального проекта
«Здоровье нации» с 2006 г, скрининг дополнен еще тремя заболеваниями — галак-
тоземией, адреногенитальным синдромом и муковисцидозом.Фенилкетонурия — наследственное заболевание с аутосомно-рецессивным
типом наследования (больные накапливаются в семье в одном поколении).
Средняя частота ФКУ в странах Европы составляет 1:10 ООО новорожденных, в
Европейской части России — 1:6500-1:7000. Основной диагностический кри¬
терий всех форм ФКУ — повышенная концентрация фенилаланина в крови.
Гетерогенная грзшпа гиперфенилаланинемий включает ряд наследственных нару¬
шений метаболизма аминокислоты фенилаланина, результатом которых является
накопление этой аминокислоты и ее производных в биологических жидкостях.
Наиболее частое нарушение — классическая форма ФКУ, обусловленная мута¬
циями в гене фенилаланингидроксилазы (ФАГ) на хромосоме 12 (12q22-q24,2).
К настоящему времени в гене ФАГ идентифицированы многие сотни мутаций,
8 из которых встречаются наиболее часто. Мажорной мутацией, встречаемой с
частотой 45%, является R408Q. В результате мутации в гене фермент оказывается
дефектным, фенилаланин не может превратиться в тирозин и накапливается в
крови. Возникает метаболический блок, в результате которого уровень фенилала¬
нина постоянно растет и достигает таких концентраций, при которых он становит¬
ся токсичным, в первую очередь для развивающегося мозга ребенка. Без лечения
у 95% детей с ФКУ развиваются тяжелая умственная отсталость, задержка мотор¬
ного развития, судороги, экзема на коже, а в старшем возрасте присоединяются
грубые нарушения в поведении.Если лечение начать рано и проводить его тщательно, клинические симптомы
ФКУ у ребенка не проявятся и он будет расти здоровым, практически не отли¬
чаясь от сверстников. Смысл лечения заключается в уменьшении содержания
фенилаланина в пище, которую получает ребенок. Обычно этого достигают за
счет специальных смесей и диеты, У ребенка постоянно контролируют содержание
фенилаланина в крови и в зависимости от лабораторных показателей корректи¬
руют состав тех продуктов, которые не будут повышать уровень фенилаланина, а
обеспечат нормальные рост и развитие ребенка.Семья, в которой есть больной с ФКУ, должна получить медико-генетическую
консультацию, при последующих беременностях может быть проведена прена¬
тальная ДНК-диагностика.Врожденный гипотиреоз проявляется серьезными нарушениями роста и
развития ребенка с рождения и обусловлен полным или частичным нарушени¬
ем функции щитовидной железы, вырабатывающей йодсодержащие гормоны.
В большинстве случаев врожденный гипотиреоз возникает в связи с отсутствием
щитовидной железы, либо ее недоразвитием, либо неправильным положением.
Если врожденный гипотиреоз не лечить, у ребенка резко замедляется рост, разви¬
вается тяжелая необратимая умственная отсталость и появляются другие клини¬
ческие признаки заболевания. Болезнь все время прогрессирует и может привести
к пожизненной инвалидности. Однако если лечение начато в первый месяц после
,-о738 ЛАБОРАТОРНАЯ ГЕНЕТИКАрождения, в абсолютном большинстве случаев ребенок развивается нормально.
Примерно 80-85% случаев врожденного гипотиреоза ненаследственные, они
возникают случайно и обычно обусловлены нарушением развития щитовидной
железы, причины которого неизвестны, в патогенезе развития транзиторных
нарушений функций гипофизарно-тиреоидной системы преимущественное зна¬
чение могут иметь как повышение активности гипофиза с увеличением синтеза
тиреотропного гормона (ТТГ), так и угнетение продукции тиреоидных гормонов.В группу риска по возникновению транзиторных изменений, сопровождаемых
снижением концентрации тиреоидных гормонов, относят:• новорожденных, родившихся от матерей с осложненным течением беремен¬
ности, особенно с фетоплацентарной недостаточностью;• новорожденных, родившихся от матерей с эндокринной патологией, особен¬
но с заболеваниями щитовидной железы;• новорожденных с функциональной незрелостью вследствие недоношенности
или внутриутробной гипотрофии.в 15-20% случаях врожденный гипотиреоз наследуется, как правило, по
аутосомно-рецессивному типу. Известно по меньшей мере 7 генов, мутации кото¬
рых ведут к гипотирео.зу. Именно поэтому молекулярно-генетический анализ
при врожденном гипотиреозе сложен и не всегда эффективен. Однако, поскольку
врожденный гипотиреоз как наследственной, так и ненаследственной природы
при раннем выявлении хорошо лечится, в таком генетическом анализе нет особой
нужды.Врожденный гипотиреоз встречается повсеместно в мире с примерно одина¬
ковой частотой — 1:3000-1:4000 новорожденных. Такая же частота врожденного
гипотиреоза и в России. У девочек по невыясненным причинам его обнаруживают
вдвое чаще, чем у мальчиков. Б программе скрининга используется в качестве пер¬
вичного теста исследование ТТГ в образцах пятен высушенной крови. В случаях
с повышенным содержанием ТТГ в образцах крови проводят ретестирование, по
результатам которого выявляют больных детей. Врач-генетик направляет боль¬
ного к эндокринологу, который назначает лечение и наблюдает за ребенком в
дальнейшем.Галактоземия — одно из наследственных наруш[ений обмена углеводов.
В основе патогенеза заболевания лежит дефект одного из ферментов метаболизма —
галактозы, которая образуется в кишечнике при гидролизе дисахарида лактозы.
Первая стадия превращений галактозы в клетках организма - ее фосфорилирова-
ние, которое осуществляется с помощью фермента галактокиназы (ГАЛК). Продукт
этой реакции - галактозо-1-фосфат метаболизируется с помощью галактозо-1-
фосфатуридилтрансферазы (ГАЛТ) в уридилдифосфогалактозу. Дальнейшее преоб¬
разование последней происходит с помощью уридилдифосфогалактозо-4-эпимеразы
(ГАЛЭ). Результат недостаточности любого из трех ферментов - ГАЛК, ГАЛТ или
ГАЛЭ — повышение концентрации галактозы в крови — галактоземия. Как правило,
под галактоземией подразумевают дефекты ГАЛТ, наиболее тяжелым из которых
является классическая форма галактоземии. Частота классической формы, по лите¬
ратурным данным, составляет 1:50 000-1:60 ООО новорожденных.Выделяют две формы галактоземии. Классическая галактоземия, обусловлен¬
ная недостаточностью ГАЛТ, наследуется по аутосомно-рецессивному типу. Ген
локализован в локусе 9р13. Начало заболевания острое, в неонатальном перио¬
де появляются рвота, диарея, желтуха, гепатомегалия, катаракта, гипотрофия,
задержка психомоторного развития, почечно-тубулярная дисфункция.Галактоземия, обусловленная системной недостаточностью ГАЛЭ, наследует¬
ся также по аутосомно-рецессивному типу. Ген локализован в локусе 1р36-р35.
Начало заболевания — в неонатальном периоде. Симптомы заболевания те же,
кроме катаракты (отсутствует), но имеется нейросенсорная глухота.
ЛАБОРАТОРНАЯ ГЕНЕТИКА 739Для ЭТИХ двух форм описан бессимптомный доброкачественный вариант галак-
тоземии (вариант Дуарте), популяционная частота которого выше частоты клас¬
сической формы.Если лечение начато рано, клинические симптомы галактоземии у ребенка не
проявятся, он будет расти здоровым. Смысл лечения заключается в исключении
пищевых продуктов, содержащих галактозу, прежде всего грудного молока и
других молочных смесей. Они могут быть заменены специальными смесями, при¬
готовленными на основе сои. Раннее назначение лечения, оптимально — до 10-го
дня жизни, позволяет избежать тяжелых кризов, которые нередко приводят к
летальному исходу.в медико-генетической консультации возможна пренатальная ДНК-диагности-
ка при последующих беременностях.Муковисцидоз — одно из наиболее частых наследственных заболеваний,
обычно имеющее тяжелое течение и плохой прогноз для жизни. Частота муковис-
цидоза колеблется среди представителей европейской расы от 1:600 до 1:12 ООО
новорожденных. Ген муковисцидоза CFTR картирован на длинном плече хромо¬
сомы 7 (7q31.1). Количество идентифицированных в настоящее время мутаций в
этом гене превышает 2000, из которых наиболее частой является delF508, обнару¬
живаемая у 54% больных с муковисцидозом в России.Ген отвечает за синтез белка, служащего каналом для ионов хлора в клетках.
Вследствие нарушения функции этого канала слизь и другие секреты в легких,
поджелудочной железе и других органах становятся очень густыми и вязкими.
Это приводит к развитию хронической инфекции, повреждению легочной ткани,
нарушению переваривания пищи, поскольку ферменты поджелудочной железы
не могут попасть в кишечник. Заболевание обычно начинается в раннем возрасте.
Различают три основные формы муковисцидоза: легочную, кишечную и смешан¬
ную. Самая частая из них — смешанная форма. Она встречается примерно у 80%
больных с муковисцидозом. Легочная форма проявляется хроническим обструк-
тивным бронхолегочным процессом. Развивается хронический воспалительный
процесс, приводящий к разрушению легочной ткани. Кровь больных плохо насы¬
щается кислородом, из-за чего страдают сердце, печень и другие органы, дети
отстают от своих сверстников в росте и по массе тела. Лечение больных с легочной
формой муковисцидоза требует применения мощных антибиотиков в больших
дозах. При кишечной форме муковисцидоза нарушен процесс переваривания
пищи, так как ферменты поджелудочной железы, расщепляющие белки и жиры, не
попадают в кишечник вследствие закупорки протоков железы. Основное лечение
кишечной формы заключается в приеме ферментов поджелудочной железы. При
смешанной форме муковисцидоза кишечные проявления усугубляют поражение
легких. Лечение смешанной формы наиболее сложное. У больных с муковисци¬
дозом, не получающих необходимого лечения, продолжительность жизни корот¬
кая. Если муковисцидоз выявляют у новорожденного и его начинают лечить уже
со 2-го месяца жизни, клинические проявления заболевания значительно легче
и ребенок практически нормально развивается физически и умственно. У него
увеличивается продолжительность жизни, которая в настоящее время благодаря
адекватному лечению составляет в развитых странах более 35 лет.Б программе скрининга используется в качестве первичного теста исследование
содержания иммунореактивного трипсина в образцах пятен высушенной крови.
Если первое и второе лабораторные исследования оказались положительными, то, в
отличие от других скринируемых наследственных болезней, это еще не означает, что
у ребенка есть муковисцидоз, хотя вероятность такого диагноза высока. Дли под¬
тверждения диагноза младенцу в возрасте 3-4 нед проводят лотовый тест — изме¬
рение концентрации хлора в потовой жидкости. Если лотовый тест отрицателен,
ребенка считают здоровым, хотя за ним еще будут наблюдать некоторое время. Если
740 ЛАБОРАТОРНАЯ ГЕНЕТИКАже потовый тест положителен, диагноз муковисцидоза считается установленным
даже до появления каких-либо клинических проявлений заболевания.Лдреногенитальный синдром — группа заболеваний, в основе которых лежит
дефект одного из ферментов или транспортных белков, принимающих участие в
биосинтезе стероидных гормонов надпочечников. Большинство случаев заболе¬
вания (около 90-95%) ассоциировано с дефицитом 21-гидроксилазы, 5-10% — с
дефицитом 11-р-гидроксилазы.Ген 21-гидроксилазы (CYP21B) картирован в локусе 6р21.3 вместе с псевдоге¬
ном СУР2ІЛ, Высокая степень гомологии и тандемное расположение двух генов
может приводить к их рекомбинации и нарушению функций активного гена.
Идентифицированы десятки мутаций, приводящих к недостаточности 21-гидрок¬
силазы. Точковые мутации составляют приблизительно 80%, на долю делеций
приходится около 20% изменений. Наиболее частые точковые мутации — 12splice,
далее I172N и др. Частота дефицита 21-гидроксилазы достаточно высока и состав¬
ляет 1:8000-1:15 ООО новорожденных. Поздняя диагностика, несвоевременное и
неправильное лечение могут привести к тяжелым последствиям: гибели ребенка
от сольтеряющих кризов, ошибкам в выборе половой принадлежности при выра¬
женной вирилизации наружных гениталий у девочек, нарушениям роста, полового
созревания, бесплодию. Внедрение неонатального скрининга позволяет своевре¬
менно выявить заболевание и избежать диагностических ошибок.Выделяют три клинических фенотипа адреногенитального синдрома:• сольтеряющую форму — с рождения «сомнительные» гениталии; в неона¬
тальном периоде — тяжелая потеря соли, проявляющаяся в виде адренало¬
вых кризов (рвоты, дегидратации, судорог, остановки сердца);• простую вирилизирующую форму — с рождения «сомнительные» гениталии
у девочек, нормальные у мальчиков, постнатально у обоих полов преждевре¬
менное появление вторичных половых признаков, низкорослость;• аттенуированную (неклассическую) форму — начало в пубертатном периоде
и только у девочек (слабое развитие молочных желез, оволосение по мужско¬
му типу, аменорея).Эти три формы составляют примерно 90% всех случаев врожденной гиперплазии
коры надпочечников, из них на долю сольтеряющей формы приходится 60-65%.
Б результате недостаточности 21-гидроксилазы нарушается превращение холесте-
рола в кортизол и альдостерон, контролируемое этим ферментом. Одновременно
происходит накопление предшественников кортизола и альдостостерона, которые
в норме превращаются в мужские половые гормоны — андрогены. Поскольку при
адреногенитальном синдроме предшественников кортизола и альдостерона нака¬
пливается много, образуется значительно больше, чем в норме, андрогенов, что
является основной причиной развития клинической картины адреногенитального
синдрома. Заболевание наследуется по аутосомно-рецессивному типу. В програм¬
ме скрининга используется в качестве первичного теста исследование концентра¬
ции 17-гидроксипрогестерона в образцах пятен высушенной крови. В случаях с
повышенным его содержанием проводят ретестирование и, таким образом, выяв¬
ляют больных детей. Лечение должно быть назначено как можно быстрее, тогда
клинические симптомы адреногенитального синдрома у ребенка не проявятся и
он будет расти здоровым, не отличаясь от сверстников. В медико-генетических
консультациях может быть проведена пренатальная ДНК-диагностика при после¬
дующих беременностях.Основные этапы неонатального скринингаУсловно можно выделить 5 этапов проведения скрининга новорожденных на
наследственные болезни.
ЛАБОРАТОРНАЯ ГЕНЕТИКА 7411-Й этап — взятие крови у новорожденных из пятки в родовспомогательных
учреждениях на 4-5-е сутки жизни. Для всех методов сбора образцов крови на
фильтровальную бумагу должны быть разработаны и опубликованы стандарты.
В идеальном варианте учреждения необходимо обеспечивать видеоматериалами.
Кроме того, система транспортировки высушенных образцов крови должна быть
проста и доступна, что позволит провести анализ и начать лечение в короткие
сроки, например при галактоземии и адреногенитальном синдроме в течение
10 дней с момента рождения, до появления кризов.2-й этап — быстрое проведение первичного скрининга по определению соот¬
ветствующих лабораторных показателей. Такой анализ проводят в лабораториях,
имеющих соответствующее оборудование.3-й этап — подтверждающая диагностика при положительных результатах, ее
необходимо проводить в тех же лабораториях в максимально короткие сроки.
ДНК-диагностику и контроль качества лабораторных анализов на 2-м и 3-м этапе
проводят в федеральных референтных центрах.4-й этап — лечение выявленных больных, которое должны проводить врачи-
генетики, неонатологи, педиатры и эндокринологи. Лечение необходимо назна¬
чать в течение первого месяца жизни. Контроль эффективности лечения проводят
с использованием клинических и лабораторных данных.5-й этап — медико-генетическое консультирование и пренатальная ДНК-
диагностика в семьях, где появился больной ребенок. Его проводят в медико-
генетических консультациях.Все этапы должны быть полностью подготовлены, тогда можно приступать к
выполнению программы. Для успешного ее развития многие проблемы должны
быть обозначены и решены на этапе планирования программы. Прежде всего
важны правительственная поддержка и финансовые ресурсы, поскольку в нашей
стране, как и в большинстве стран мира, неонатальный скрининг — государствен¬
ная программа. Непосредственно с выполнением программы связаны:• обучение персонала роддомов (сбор образцов крови);• возможности лабораторий (оборудование) и подготовка персонала;• наличие нормальнь[х значений изучаемых показателей для скринируемой
популяции новорожденных;• схема транспортировки образцов крови;• координация работы лабораторий;• создание условий для сбора данных и оповещения врачей;• создание компьютеризированной системы хранения информации об образ¬
цах крови, заключениях, оповещениях родителей, выявленных больных,
лечении и его результатах;• программа контроля качества работы лабораторий;• доступность медицинской помощи.Эффективный способ поддержания качественного выполнения всех разделов
программы — подготовка практических рекомендаций с детальным описанием
процедур каждого этапа программы. Кроме того, необходимо подготовить общее
пособие (руководство), в котором будет обобщен практический опыт по решению
возникающих проблем. Одно из важных условий успешного выполнения програм¬
мы неонатального скрининга — подготовка населения, так называемый образова¬
тельный блок программы. Люди должны знать, что такое скрининг новорожден¬
ных, как его проводят, какая польза от него каждому человеку в популяции.В проведении скрининга новорожденных, по крайней мере в нашей стране, уча¬
ствуют три учреждения: родильные дома (забор крови у новорожденных), медико-
генетические консультации (проведение 2-го и 3-го этапа, лечение некоторых
заболеваний и лабораторный контроль лечения всех скринируемых заболеваний,
медико-генетическое консультирование семьи), референсные центры (лабора¬
742 ЛАБОРАТОРНАЯ ГЕНЕТИКАторный контроль качества, ДНК-диагностика). Существует международная сеть
программ скрининга.Лабораторные исследованияОБЩИЕ ПРИНЦИПЫБиологическим материалом, используемым для неонатального скрининга, слу¬
жит кровь, высушенная на фильтровальной бумаге.Получение биологического материалаВзятие крови у каждого новорожденного выполняют строго на 4-5-й день
жизни (не ранее 72 ч после рождения) в медицинском учреждении, где в этот
момент находится ребенок, К моменту взятия крови ребенок должен не менее
суток получать полноценное питание. У недоношенных детей кровь берут на 7-й и
14-й день жизни, у детей, перенесших переливание крови или гемодиализ, взятие
крови проводят повторно через месяц іюсле последней процедуры.Взятие крови проводят только на специальные бланки фильтровальной бума¬
ги, в настоящее время — Whatman 903. Снабжение бланками всех медицинских
>'"іреждений проводит медико-генетическая лаборатория региона. Использование
для этой цели любой другой бумаги или бланков недопустимо, поскольку лабо¬
раторные измерения, их оценку и интерпретацию ос\тцествляют с использова¬
нием калибровочных проб и контрольных материалов, сделанных на этом же
типе бумаги. Перед взятием образца крови пятку новорожденного необходимо
вымыть, протереть стерильной салфеткой, смоченной 70% раствором этано¬
ла, и промокнуть сухой стерильной салфеткой. Использование вместо этанола
других дезинфицирующих растворов нежелательїіо, так как некоторые из них
могут влиять на результат измерений. Кровь берут с помощью одноразового
скарификатора. Первую каплю после прокалывания снимают сухой стерильной
ваткой во избежание гемолиза. Каждый из обозначенных на бланке кружков
пропитывают насквозь одной большой каплей крови, не касаясь бланком пятки
ребенка. Пятна крови должны быть не менее обозначенного на бланке размера,
вид пятен одинаков с обеих сторон бланка. Данного количества крови достаточно
для скрининговых исследований. Б случае неполного заполнения кружков кровью
необходимо повторить прокалывание. Бланки с кровью высушивают в течение
2-3 ч при комнатной температуре, избегая попадания прямых солнечных лучей.
У старших детей брать кровь следует обычным образом — из пальца.На бланк с кровью четко и разборчиво записывают следующую информацию;
фамилию, имя, отчество матери, если взятие крови осуществляют в родовспомоі'а-
тельном учреждении, или ребенка, если кровь берут в другом медицинском учреж¬
дении; дату рождения ребенка, дату взятия крови, гюдробный адрес прописки и
дату выбытия ребенка, номер телефона, код медицинского учреждения и фамилию
лица, взявшего кровь. Далее записывают сопутствующую информацию: массу тела
ребенка, срок гестации, недоношенность, перенесенное ребенком переливание
крови, гемодиализ, прием матерью и/или ребенком лекарственных препаратов, в
частности дексаметазона, гипербилирубинемию более 30 мг/дл и др.Бланк является документом, заполняющий отвечает за правильность взятия
крови и достоверность указанных на бланке сведений.Бланки с кровью высушивают при комнатной температуре, упаковывают в
чистый бумажный конверт и доставляют в региональную медико-генетическую
лабораторию не реже одного раза в 3 дня.Образцы крови, взятые с нарушениями, оценивают как непригодные для анали¬
за. В этом случае необходимо выполнить повторное взятие крови.
ЛАБОРАТОРНАЯ ГЕНЕТИКА 743Общие принципы процедуры анализа и контроль качества лабораторных
исследованийв медико-генетической лаборатории, осуществляющей неонатальный скрининг
в данном регионе, оценивают качество полученного биологического материала.
Бланки с кровью сортируют и регистрируют в компьютерной базе. Из каждого
образца крови выбивают пять дисков диаметром 3 мм, которые далее помеща¬
ют в пять отдельных микропланшетов, в каждом из микропланшетов проводят
измерение одного аналита, являющегося биохимическим маркером заболевания.
Для фенилкетонурии маркером служит концентрация фенилаланина в крови, для
врожденного гипотиреоза — уровень тиреотропного гормона, для муковисцидо-
за — иммунореактивный трипсиноген, для галактоземии — общая галактоза, для
адреногенитального синдрома — 17-гидроксипрогестерон.В 96-луночный микропланшет помещают калибровочные пробы, содержащие¬
ся в составе набора реагентов, контрольные материалы с известной концентрацией
аналита и исследуемые образцы крови новорожденных. Далее проводят стандарт¬
ную процедуру анализа в соответствии с инструкцией набора. Результаты измере¬
ний каждого планшета представлены в напечатанном виде, содержащем значения
флюоресценции калибраторов, калибровочную кривую, значения флюоресценции
и концентрацию аналита в контрольных материалах, флюоресценцию и значения
концентрации аналита в исследуемых образцах крови.Оценка измеренных концентраций аналитов в контрольных материалах позво¬
ляет осуществлять внутрилабораторный контроль качества. В установочной
серии, содержап^ей не менее 20 измерений, каждая лаборатория определяет соб¬
ственные федние значения и допустимые отклонения. Результаты измерений всех
планшетов вносят в контрольную карту. Если значения контрольных материалов
отвечают требованиям, изложенным в приказе М3 РФ № 45 от 07.02,2000 г.
«О системе мер по повышению качества клинических лабораторных исследований
в учреждениях здравоохранения РФ», результат измерения планшета оценивают
как приемлемый, В противном случае планшет переделывают.Лаборатории неонатального скрининга участвуют также в Федеральной системе
внешней оценки качества (ФСВОК), служащей внешним независимым контро¬
лем, который необходим для оценки правильности проводимых исследований и
выявления системных ошибок. Наряду с этим ряд лабораторий РФ данного про¬
филя являются участниками международного контроля качества, в частности CDC
{Centerfor Disease Control and prevention, Атланта, США).НЕОНАТАЛЬНЫЙ СКРИНИНГ НА ФЕНИЛКЕТОНУРИЮСкрининг на ФКУ - стандарт программ неонатального скрининга, поскольку
более чем за 40 лет его проведения накоплен огромный материал по зтиолоіии
заболевания, лабораторным методам диагностики и лечению. В настоящее время
существует широкий перечень методов измерения концентрации ФА, начиная
с используемого до настоящего времени ингибиторного микробиологического
теста и заканчивая тандемной масс-спектрометрией, В РФ определение уровня
ФА в сухих пятнах крови проводят микропланшетным флюориметрическим
методом. Принцип измерения концентрации ФА в сухом пятне крови основан
на образовании флюоресцирующего комплекса ФА с нингидрином, интенсив¬
ность флюоресценции которого усиливается при взаимодействии с дипептидом
Ь-лейцил-Ь-аланином. Флюоресценцию измеряют с помощью многофункцио¬
нального анализатора при длине волны 485 нм. Интенсивность флюоресценции
прямо пропорциональна количеству ФА в образце крови. Программное обеспече¬
ние сопоставляет интенсивность флюоресценции исследуемых проб крови с флюо¬
ресценцией калибровочных проб. Правильность проведения анализа оценивают
по значениям ФА в контрольных пробах.
'00.744 ЛАБОРАТОРНАЯ ГЕНЕТИКАИнтерпретация результатовПринципиальным является пороговое значение концентрации ФА (cut-off),
вырабатываемое лабораторией с учетом рекомендованного фирмой-производи-
телем набора реагентов, популяционных значений уровня аналита для новорож¬
денных данного региона, а также информации из аналогичных лабораторий РФ
и зарубежья. Для выбора этого показателя важна оценка количества ретестов,
которое зависит от значения cut-off. Для новорожденных и детей первого месяца
жизни наиболее часто в качестве порогового принимают уровень ФА, равный2 мг/дл (120 мкмоль/л), для детей старше одного месяца — 3 мг/дл (150 мкмоль/л).
Образцы крови, в которых результат первого измерения ФА оказался аномально
высоким, анализируют дополнительно в параллельном анализе, используя тот же
образец крови. Все дети, у которых при параллельном измерении уровень ФА ока¬
зался выше значения cut-off, подлежат повторному обследованию.Получение второго образца крови от ребенка (ретест) осуществляют по месту
жительства или в медицинском учреждении, где он находится. Для этого, в зави¬
симости от степени повышения концентрации аминокислоты, используя инфор¬
мацию на бланке с кровью, устанавливают контакт с семьей. Если превышение
уровня ФА незначительное — до 3 мг/дл (181,5 мкмоль/л), семью уведомляют
письмом о необходимости повторного исследования. При значительном увели¬
чении ФА — более 3 мг/дл — возникает необходимость экстренного контакта с
семьей. Местный контроль обеспечения ретестов осуществляет главный педиатр
управления здравоохранения района, города, с которым лаборатория осуществля¬
ет постоянный контакт по телефону или с помощью электронной почты.в большинстве случаев, особенно у детей с небольшим первичным повышением,
уровень ФА при анализе ретеста нормален. Первоначальное повышение показате¬
ля могло быть связано с незрелостью ферментных систем печени, особенностями
течения родов, недоношенностью, с тяжелым общим состоянием ребенка и т.д.Детям с повторным повышением концентрации ФА в ретесте от 3 до 8 мг/дл
(150-484 мкмоль/л) ставят диагноз «гиперфенилаланинемия^- (ГФА), Они нуж¬
даются в регулярном лабораторном контроле уровня ФА и в наблюдении врачом-
генетиком, который решает вопрос о целесообразности или нецелесообразности
назначения лечения. При обнаружении в ретесте уровня ФА, равного или более
8 мг/дл (484 мкмоль/л), диагноз «фенилкетонурия» считают подтвержденным,
поскольку этот показатель служит достоверным лабораторным критерием заболе¬
вания. Родителей с ребенком приглашают в медико-генетическую консультацию.
Врач-генетик срочно назначает ребенку соответствующее лечение с ограничением
ФА и обучает родителей расчету диеты. По современным стандартам диагноз ФКУ
должен быть поставлен и лечение начато не позже месяца жизни ребенка.Последующее лечение, проводимое многие годы, осуществляют под постоян¬
ным биохимическим контролем уровня ФА в крови, также выполняемым медико¬
генетической лабораторией. Оптимальной концентрацией аминокислоты в крови
в процессе лечения считают интервал от 1 до 6 мг/дл (60,5-363 мкмоль/л).НЕОНАТАЛЬНЫЙ СКРИНИНГ НА ВРОЖДЕННЫЙ ГИПОТИРЕОЗЭтиология врожденного гипотиреоза различна, однако для всех его форм харак¬
терна недостаточность тиреоидных гормонов. В связи с малой специфичностью
и стертостью клинических симптомов у новорожденных ранняя диагностика
врожденного гипотиреоза возможна только на основании исследования уровня
тиреоидных гормонов,в основе скрининга лежит определение уровня тиреотропного гормона, кото¬
рый повышается при первичных формах заболевания.Измерение уровня ТТГ в сухих пятнах крови проводят методом лантанид-
ного иммунофлюоресцентного анализа с разрешением по времени, используют
ЛАБОРАТОРНАЯ ГЕНЕТИКА 745«СЭНДВИЧ» высокоспецифичных моноклональных антител против двух различных
З^астков на молекуле ТТГ. Уровень флюоресценции устойчив, ее интенсивность
прямо пропорциональна количеству ТТГ в образце.Интерпретация результатовИнтерпретацию полученных при скрининге значений ТТГ проводят с учетом
рекомендованного фирмой-производителем набора реагентов и популяционных
данных об уровне ТТГ для новорожденных региона. Для анализов, взятых на
4-7-й день жизни ребенка, с«?-о^равен 14 мкМЕ/мл, для детей в возрасте старше
14 дней — 5 мкМЕ/мл. В качестве порогового значения, позволяющего заподозрить
гипотиреоз с высокой степенью вероятности, используют величину 80 мкМЕ/мл.
Все дети с уровнем ТТГ выше этого значения подлежат повторному обследованию,
т.е, вызову на ретест в экстренном порядке. Повторно полученную кровь таких
детей необходимо доставить в лабораторию в течение 48 ч после взятия.Детей с повторно обнаруженным повышением уровня ТТГ направляют к эндо¬
кринологу для верификации диагноза (врожденный или транзиторный гипотире¬
оз) и назначения лечения.НЕОНАТАЛЬНЫЙ СКРИНИНГ НА ГАЛАКТОЗЕМИЮВ настоящее время в качестве схем скрининга на галактоземию применяют раз¬
личные алгоритмы (вместе или по отдельности): измерение концентрации галак¬
тозы и галактозо-1-фосфата, анализ ферментативной активности ГАЛТ.Использование концентрации галактозы в крови в качестве диагностического
критерия позволяет одновременно с дефектом ГАЛТ выявлять дефициты ГАЛК
и ГАЛЭ, поскольку концентрации этих аналитов повышены во всех трех случаях.
Однако при введенном ограничении в диете этот показатель неинформативен.Преимущество анализа ферментативной активности ГАЛТ — ее независимость
от характера питания и пищевых ограничений, если таковые введены до обследо¬
вания. Однако в случае предшествующего переливания крови может быть получен
ложноотрицательньЕЙ результат. С другой стороны, условия получения, транс¬
портировки и хранения материала (температура, влажность) могут привести к
снижению активности термолабильного фермента, т.е, к ложноположительному
результату.В некоторых зарубежных программах неонатального скрининга применяют
молекулярно-генетические методы для поиска наиболее частых мутаций в гене
ГАЛТ. Этот поиск выполняют параллельно исследованию биохимических показа¬
телей или в качестве последующего этапа в исследовании крови из того же бланка.
Применение ДНК-анализа позволяет оптимизировать скрининг — уменьшить
количество ложноположительных результатов, дифференцировать классическую
форму и т.д. Однако возможность идентификации ограниченного количества
мутаций не дает возможности охватить все варианты заболевания.Уровень галактозы повышен при всех формах галактоземии. Именно поэтому
этот критерий используют в качестве первичного биохимического показателя.Измерение общей галактозы в сухих пятнах крови проводят микропланшет-
ным флюориметрическим методом. Используемый галактозоксидазный метод
позволяет количественно определять концентрацию общей галактозы, т.е. сумму
концентраций свободной галактозы и галактозо-1-фосфата. Правильность изме¬
рения аналита оценивают, осуществляя внутрилабораторный контроль качества
по определению его концентрации в контрольных материалах.Интерпретация результатовИнтерпретацию полученных при скрининге значений общей галактозы про¬
водят с учетом cut-off, который вырабатывают, ориентируясь на рекомендуемый
фирмой-производителем набор реагентов, популяционные данные региона и име¬
746 ЛАБОРАТОРНАЯ ГЕНЕТИКАющийся ОПЫТ. В качестве пороговой концентрации общей галактозы для новорож¬
денных в большинстве лабораторий РФ принято значение 7 мг/дл (385 мкмоль/л),
рекомендованное производителем тест-системы. Детям, в образцах крови которых
концентрация аналита выше 7 мг/дл, необходим повторный анализ.Экстренность получения второго образца крови от ребенка (ретеста) зависит
от степени повышения общей галактозы. Поскольку для классической формы
галактоземии характерна острая, тяжелая манифестация в период новорожденно-
сти, угрожающая жизни, при значении общей галактозы, превышающем 15 мг/дл
(825 мкмоль/л), необходимо срочно связываться с семьей и главным педиатром
территории для получения сведений о состоянии ребенка и получении ретеста.
В случае подтверждения в ретесте повышенного уровня этого показателя и исходя
из состояния здоровья ребенка неонатолог или педиатр может принять решениео срочном переводе ребенка на безгалактозную диету, не дожидаясь результатов
лабораторной верификации диагноза.Повышенная концентрация галактозы в крови — необходимый, но недоста¬
точный критерий для диагностики галактоземии. Небольшое повышение концен¬
трации аналита характерно для формы Дуарте. Кроме того, особенности течения
родов, тяжелое общее состояние ребенка, недостаточность функций печени, хро¬
мосомные заболевания приводят к подъему уровня галактозы в крови.Уточнение формы галактоземии требует обязательного дополнительного
обследования — исследования ферментативной активности ГАЛТ и анализа
мутаций в гене ГАЛТ или его секвенирования. Поскольку ДНК-анализ позво¬
ляет исследовать ограниченное количество мутаций, обнаружение недостаточ¬
ности ферментативной активности ГАЛТ является важным диагностическим
критерием.Если диагноз подтвержден, ребенку срочно назначают безгалактозную диету
и проводят медико-генетическое консультирование семьи. Дальнейшее лечение
ребенка осуществляют под контролем определения галактозы в крови.НЕОТАТАЛЬНЬІЙ СКРИНИНГ НА МУКОВИСЦИДОЗСуществует ряд схем неонатального скрининга на муковисцидоз, первый
этап которых — определение уровня иммунореактивного трипсиногена (ИРТ).
Трипсиноген — один из основных продуктов секреции поджелудочной железы,
единственный из ферментов, который продуцируется только поджелудочной
железой, поэтому он является специфическим маркером панкреатической функ¬
ции. При муковисцидозе наблюдают повышение уровня ИРТ в крови в первые 2
мес жизни ребенка. Далее уровень ИРТ снижается и достигает среднепопуляцион¬
ных значений. Результаты, полученные при измерении уровня ИРТ, далее допол¬
няют потовой пробой и/или ДНК-анализом в различных сочетаниях:• ИРТ потовая проба ^ ДНК-анализ;• ИРТ ДНК-анализ потовая проба;• ИРТ 1 ИРТ 2 потовая проба ДНК-анализ.В России общепринята последняя схема.Измерение уровня ИРТ в сухих пятнах крови проводят методом лантанид-
ного иммунофлюоресцентного анализа с разрешением по времени, используют
«сэндвич» высокоспецифичных моноклональных антител против двух различных
участков на молекуле ИРТ. Флюоресценция устойчива, ее интенсивность прямо
пропорциональна количеству ИРТ в образце.Интерпретация результатовИнтерпретацию полученных при скрининге значений ИРТ проводят с уче¬
том cut-off, набора реагентов, рекомендованного фирмой-производителем и
Российским центром муковисцидоза. Для детей в возрасте до 21 дня нормальны-
ЛАБОРАТОРНАЯ ГЕНЕТИКА 747МИ считают значения ИРТ до 70 нг/мл. Для детей более старшего возраста cut-off
равен 40 нг/мл.ИРТ не является специфичным маркером забалевания, по его первичному зна¬
чению невозможно поставить диагноз. Именно поэтому все дети с повышенным
уровнем ИРТ нуждаются в повторном обследовании. Для повторного обследова¬
ния на муковисцидоз (получения ретеста) существует строго ограниченный срок:
от 21 дня до 2 мес жизни. Кровь, взятая в более позднем возрасте, к исследованию
непригодна из-за неинформативности теста. Диагноз должен быть снят или под¬
твержден другими методами.Повышение уровня ИРТ может быть обусловлено особенностями течения
родов — длительным безводным периодом, стремительными родами, а также осо¬
бенностями течения послеродового периода - неонатальным стрессом, респира¬
торным дистресс-синдромом, гипогликемией, врожденными инфекциями, атрези-
ей кишечника, тяжелыми врожденными и хромосомными заболеваниями и др.Потовая проба и ДНК-анализДети с выявленным повышением ИРТ в ретесте, а также не прошедшие повтор¬
ного обследования на ИРТ по возрасту нуждаются в проведении второго этапа
скрининга — потовой пробе. Потовая проба — измерение концентрации хлора
в потовой жидкости - основной патогномоничный диагностический критерий
муковисцидоза. Классическим, но длительным по времени и трудоемким способом
проведения потового теста остается определение концентрации хлора в поте путем
его титрования по методу Гибсона и Кука. В настоящее время исследование прово¬
дят с помощью аппарата, измеряющего электрическую проводимость пота, экви¬
валентную концентрации хлора. Сбор пота осуществляют на предплечье ребенка
с предварительным проведением на месте сбора пилокарпинового электрофо¬
реза. Нормальный интервал концентраций хлора, рекомендованный фирмой-
производителем реагентов, — 0-60 ммоль/л пота. Значения 61-80 ммоль/л
считают сомнительными, требующими перепроверки, повтора и клинического
наблюдения в динамике. Концентрацию хлора более 80 ммоль/л ассоциируют с
мз^ковисцидозом.Параллельно измерению ИРТ выполняют анализ частых мутаций, в частности
delF508 и других следующих по частоте, что служит важным диагностическим кри¬
терием для данного заболевания и оптимизирует неонатальный скрининг. Однако,
поскольку количество известных мутаций в гене велико, исследование частых
мутаций не всегда позволяет подтвердить или опровергнуть диагноз. Именно
поэтому диагноз всегда должен быть подтвержден потовой пробой. Детей с под¬
твержденным диагнозом направляют для лечения и диспансерного наблюдения в
региональный центр. Врач-генетик осуществляет медико-генетическое консульти¬
рование семьи.НЕОНАТАЛЬНЫЙ СКРИНИНГ НА АДРЕНОГЕНИТАЛЬНЫЙ СИНДРОМПервый этап неонатального скрининга на адреногенитальный синдром —
определение уровня 17-гидроксипрогестерона (17-ОНП), который является
предшественником кортизола. Уровень 17-ОНП повышен при обеих формах
адреногенитального синдрома, вызванных дефицитом 21-гидроксилазы или 11-р-
гидроксилазы, что позволяет выявлять более 95% детей с адреногенитальным
синдромом. При других формах адреногенитального синдрома уровень 17-ОНП
не изменяется, однако частота этих форм низка.Определение уровня 17-ОНП в сухих пятнах крови проводят методом лантанид-
ного иммунофлюоресцентного анализа с разрешением по времени. Тест основан на
конкуренции меченного европием 17-ОНП и 17-ОНП крови новорожденного .^а
центр связывания со специфичными для 17-ОНП моноклональными антителами.
748 ЛАБОРАТОРНАЯ ГЕНЕТИКАФлюоресценция устойчива, ее интенсивность обратно пропорциональна количе¬
ству 17-ОНП в образце.Интерпретация результатовИнтерпретацию полученных значений 17-ОНП проводят с учетом рекомендо¬
ванного фирмой-производителем набора реагентов и НИИ детской эндокриноло¬
гии ГУ ЭНЦ РАМН. Для доношенных детей сроком гестации более 37 нед и массой
тела более 2000 г cut-off 17-ОНП в крови составляет 30 нмоль/л. В качестве
порогового значения, позволяющего заподозрить адреногенитальный синдром с
высокой степенью вероятности» используют величину 90 нмоль/л.Для недоношенных детей со сроком гестации 33-36 нед и массой тела менее
2000 г пороговый уровень 17-ОНП равен 60 нмоль/л. У детей с глубокой недоно¬
шенностью (срок гестации — 23-32 нед) результат считают положительным при
уровне 17-ОНП более 150 нмоль/л.Помимо недоношенности, ложноположительные результаты могут быть полу¬
чены у детей с тяжелым общим состоянием, на фоне внутривенной трансфузии,
при высокой билирубинемии (более 30 мг/дл). у детей, получающих дексамета-
зон (или в случае приема препарата матерью), может быть получен ложноотри¬
цательный результат. Детей с повторным повышением уровня 17-ОНП в ретесте
направляют к детскому эндокринологу для верификации диагноза и назначения
лечения. Всем детям с диагнозом адреногенитального синдрома, их родителям и
членам семьи необходимо проведение молекулярно-генетического исследования и
медико-генетического консультирования.в заключение следует подчеркнуть, что любая программа скрининга с исполь¬
зованием современных алгоритмов и лабораторных методов не выявляет 100%
пациентов с данным заболеванием, что объективно обусловлено различными
формами заболеваний, недостаточными чувствительностью и специфичностью
применяемых методов, недостатками организационного характера, человеческим
фактором и т.д. Именно поэтому при любом клиническом подозрении на заболе¬
вание пациента необходимо вновь обследовать по полной программе.СПИСОК ЛИТЕРАТУРЫБочков Н.П. Клиническая генетика. - М.; ГЭОТАР-МЕД, 2001.Тамазян Г.В.. Захарова Н.И., Жученко Л.А., Калиненкова С.Г. и др. Алгоритмы про-
ізедения неонатального скрининга на наследственные и врожденные заболевания:
Учебно-методическое пособие для врачей. М3 Московской области, МОНИКИ им.
М.Ф. Владимирского, МОНИИАГ. - М., 2007.Вол гарева Г. М., Ермакова М. А. Цитологические основы наследственности человека:
Учебное пособие. М., 2007.Ворсанова С.Г., Юров Ю.Б., Чернышов В.Н. Медицинская цитогенетика: Учебное посо¬
бие. — М.: Медпрактика-М, 2006, 300 с.Гинтер Е.К. Медицинская генетика. — М.: Медицина, 2003,448 с.Гинтер Е.К., Золотухина Т.В., Антоненко В.Г. и др. Цитогенетические методы диагностики
хромосомных болезней: Методическое пособие л ля врачей. — М., 2009.
Глава 11КоагулологическиеисследованияОсобенностью заболеваний, обусловленных патологией системы
гемостаза, является то, что без надежной лабораторной базы выяв¬
ление их причин невозможно. Клинические проявления этих широ¬
ко распространенных нарушений зачастую схожи. На сегодняшний
день разработан и используется обширный перечень лабораторных
методов и приемов, способных предоставить информацию о состоя¬
нии различных звеньев системы гемостаза, однако их диагности¬
ческие информативность, специфичность и воспроизводимость
значимо разнятся. В руководстве представлены наиболее исполь¬
зуемые методы исследования системы гемостаза, которые помогут
врачам сформировать необходимый перечень лабораторных про¬
цедур, способных уточнить дефект системы гемостаза у больного с
геморрагиями и/или тромбозами.Система гемостаза — сложная многокомпонентная система, кото¬
рая способна эффективно работать за счет многочисленных клеточ¬
ных взаимодействий и последовательных ферментативных реакций
активации, усиления, ингибирования. Именно поэтому прежде
всего приводятся сведения о физиологии системы гемостаза.основы ФУНКЦИОНИРОВАНИЯ
СИСТЕМЫ ГЕМОСТАЗАСистема гемостаза, обладая практически полной автономией,
позволяет осуществлять специфические функции без дополнитель¬
ного вовлечения других систем организма, поддерживающих гомео¬
стаз, что в экстремальных ситуациях весьма целесообразно.Ведущая роль в остановке кровотечений в зоне микроцирку¬
ляции {проксимальных и терминальных артериол, метартериол,
прекапилляров, капилляров и венул) принадлежит сосудам в месте
повреждения и тромбоцитам, поэтому физиологические реакции,
направленные на остановку кровотечения из мелких сосудов и
капилляров, обозначают термином «сосудисто-тромбоцитарный
гемостаз». В ответ на повреждение микрососудов возникает их
локальный рефлекторный спазм, который поддерживается и прод¬
левается вазоактивными веществами (адреналином, норадрена-
лином, серотонином и др.), попадающими в место повреждения
из стенок травмированных сосудов, эритроцитов и тромбоцитов.
После контакта тромбоцитов с обнажившимся коллагеном субэндо-
750 КОА[7ЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯтелия происходит их активация. При активации тромбоциты меняют форму, что
обусловлено структурной перестройкой их мембраны и запуском множества реак¬
ций в самих тромбоцитах (экспрессией мембранных рецепторов; синтезом проста-
гландииов Gj и Н^, тромбоксана А.; активацией актомиозиновой системы, повы¬
шением внутриклеточного давления и др.). Адгезия тромбоцитов к коллагеновым
волокнам реализуется через мембранные рецепторы тромбоцитов — гликопро¬
теины GP 1а/Па и GP Ib/V/IX, способствуют этому процессу мультимеры фактора
фон Виллебранда. В процессе адгезии тромбоциты продолжают менять форму,
высвобождают субстанции из своих гранул и формируют агрегаты. Агрегация
тромбоцитов значительно усиливается при появлении тромбина и АДФ в зоне
повреждения. Реакции агглютинации и агрегации считаются основой формирова¬
ния тромбоцитарной пробки, которая эффективно препятствует кровотечению из
мелких сосудов.в крупных сосудах гемостаз обеспечивается коагуляционным механизмом.
Коагуляционные реакции также протекают поэтапно. На первом этапе (ини¬
циации) происходит запуск коагуляции тканевым фактором (ТФ), экспрессия
которого во многих клетках значительно усиливается при их повреждении. ТФ
связывается с плазменным проконвертином (ф. VII) и образует комплекс VIla/ТФ
(в отличие от остальных факторов свертывания, малые количества фактора VII
всегда находятся в кровотоке в активироваішом состоянии — ф. Vila). Включаясь
в комплекс, фактор Vila приобретает способность активировать коагуляционные
факторы XI, IX и X. Ре.зультатом первого этапа считается формирование малого
(начального) количества тромбина. На втором этапе происходят активация тром¬
боцитов тромбином и усиление (амплификация) коагуляционных реакций, в том
числе через ф, XI, а на третьем — идет расширение и распространение реакций
коагуляции с формированием теназного (IXa/VIIIa) и протромбиназного (Ха/
Va) комплексов на поверхности активированных тромбоцитов. Завершающий
этап свертывания — генерация большого количества тромбина («тромбиновый
взрыв»), способного перевести фибриноген в фибрин и сформировать тромб.Выделение указанных выше этапов коагуляции способствует пониманию
физиологических механизмов свертывания крови, протекающих in vivo, уточне¬
нию патогенеза ряда клинических закономерностей при заболеваниях, обуслов¬
ленных недостатком факторов XI и XII (отсутствием кровоточивости), и позволя¬
ет объяснить широкий спектр гемостатической эффективности рекомбинантного
активированного фактора VII. В то же время классическая каскадная модель с раз¬
делением на внутренний и внешний пути коагуляции и сегодня не утратила своей
актуальности. Она оказалась более пригодной для понимания базовых методов
лабораторной диагностики нарушений гемостаза, основанных на исследовании
искусственной стимуляции коагуляции различными веществами (каолином, элла-
говой кислотой, тромбопластинами, коагулазами из ядов змей и др.),В норме большинство протеинов, участвующих в коагуляции, считаются про¬
ферментами, а процесс свертывания крови — это цепь последовательных биохими¬
ческих реакций, в которой проферменты, активируясь, приобретают способность
активировать другие факторы свертывания крови. В этой цепи можно условно
выделить два пути инициации коагуляции: внешний (основной) и внутренний.Запуск реакций коагуляции по внешнему пути начинается с появления ткане¬
вого фактора в просвете сосуда (при лабораторном исследовании — с добавления
тканевого тромбопластина в тестируемую плазму) и формирования комплекса
ТФ/VIIa, который активирует факторы X и IX. Далее фактор Ха трансформирует
протромбин в тромбин. Фактор V, активируемый тромбином в форму Va, значи¬
тельно ускоряет образование тромбина на фосфолипидных мембранах.Внутренний механизм свертывания крови начинается с активации фактора
Хагемана (ф. XII) коллагеном из эндотелия. В физиологических условиях роль
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 751фактора XII в гемостазе незначительна (в большей сгепени служит для активации
фибринолиза), и многими исследователями в современных схемах свертывания
крови он не представлен. В лабораторном тестировании гемостаза роль факто¬
ра XII, напротив, велика: он активируется каолином, эллаговой кислотой, солями
кремния, а затем преобразует фактор XI в Х1а. В этой реакции принимает участие
калликреин, который также активируется фактором ХПа. В свою очередь, фак¬
тор Х1а активирует фактор IX, а фактор 1Ха на фосфолипидных мембранах с уча¬
стием антйгемофильного глобулина (фактор VIII) и ионов Са^" трансформирует
фактор X в его активированную форму. Затем фактор Ха переводит протромбин
(фактор II) в тромбин (фактор Па); последнюю реакцию значительно ускоряют
коагуляционный фактор Va и фосфолипиды.Важнейшим продуктом последовательных биохимических реакций коагуля¬
ции считается тромбин (фактор Па). От фибриногена этот фермент отщепляет
два фибринопептида А и два фибринопептида В, и молекула фибриногена после
их отделения (дез-АВ-фибрин-мономер) приобретает способность полимеризо-
ваться. В процессе полимеризации образуются димеры, тримеры и олигомеры
фибрина, а затем фибриллы растворимого фибрина. Активированный тромбином
фибринстабилизирующий фактор (ХШа) в присутствии ионов Са^^ превраща¬
ет растворимый фибрин в стабильный нерастворимый фибрин. Последующая
ретракция кровяного сгустка ведет к образованию стабильного, непроницаемого
и плотного тромба, что значимо уменьшает или вовсе прекращает кровопотерю
вследствие травмы тканей. Физиологические антикоагулянты (антитромбин, про¬
теины С и S, ингибитор пути тканевого фактора — TFPI, кофактор гепарина II
и др.) предупреждают генерализацию процесса тромбообразования.Основной физиологической задачей фибринолиза считается восстановление
кровотока в сосуде после формирования в нем тромба. Ферментная фибринолити-
ческая система также контролирует заживление ран и ряд других важнейших функ¬
ций организма. Основным компонентом этой системы считается одноцепочечный
гликопротеин, состоящий из 791 аминокислоты, — плазминогсн. Частичный
протеолиз его молекулы ведет к образованию плазмина — фермента, способного
разрушить сгусток фибрина и восстановить кровоток в сосуде. Принято различа'гь
внешний и внутренний пути активации фибринолиза. Внешняя активация идет
под действием тканевого активатора плазминогена (t-PA), синтезирующегося в
эндотелиальных клетках, а также под влиянием урокина.^ы (и-РА); активации
фибринолиза способствует активированный протеин С. Внутренний путь актива¬
ции фибринолиза может быть инициирован коагуляционным фактором ХПа при
участии калликреина и высокомолекулярного кининогена. В результате лизиса
фибрина в крови появляются продукты его деградации (ПДФ), важнейший из них
и Д0СТ5ШНЫЙ для лабораторных исследований — D-димер.Наиболее сильными инактиваторами фибринолитических процессов считают¬
ся а2-антиплазмин, активируемый тромбином ингибитор фибринолиза, а также
ингибиторы активатора плазминогена PAI-1 и PAI-2, образование которых усили¬
вается при повреждении эндотелия.ПРЕАНАЛИТИЧЕСКИЙ ЭТАП ИССЛЕДОВАНИЯ ГЕМОСТАЗАДля исследования системы гемостаза разработаны и получили широкое рас¬
пространение высокоточные приборы и надежные лабораторные методы, которые
позволяют быстро и эффективно выявить нарушения, приводящие к кровоточиво¬
сти или тромбозам, однако их воспроизводимость и точность значимо снижаются
при несоблюдении правил и условий преаналитического этапа. Взятие образцов
крови, транспортировку и их подготовку для исследования системы гемостаза
следует рассматривать как важнейшие этапы получения корректных результатов.
752 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯкоторым должно быть уделено немало внимания в любой лаборатории, выпол¬
няющей исследование системы гемостаза.ПОДГОТОВКА ПАЦИЕНТАКровь для исследования гемостаза забирают утром натощак по прошествии не
менее 8 ч после последнего приема пищи. Важно, чтобы взятие венозной крови
проводилось в спокойном состоянии, поэтому перед венепункцией пациенту реко¬
мендуют посидеть в течение 20-30 мин. Для получения надежных результатов
при исследовании тромбоцитарного гемостаза за день до сдачи анализа пациенту
следует избегать стрессов, физических нагрузок, смены режима дня и изменений
в питании, приема алкоголя. Особенно тщательно необходимо соблюдать эти
условия при исследовании маркеров активации тромбоцитов (р-тромбоглобулина,
тромбоцитарного фактора-4).Врачу необходимо знать о лекарственных препаратах, которые назначены и
вводятся пациенту, поскольку ряд медикаментов способны нарушить агрегацию
тромбоцитов или вызвать изменение параметров коагуляции. В подобных ситуа¬
циях часто приходится учитывать лишь антикоагулянтный или антитромбоцитар-
ный эффект применяемых лекарственных препаратов, поскольку выявить многие
нарушения гемостаза на фоне применения антикоагулянтов или антиагрегантов
невозможно,У пациентов в реанимационном отделении нельзя брать кровь из подключично¬
го катетера, поскольку это наиболее частая причина попадания гепарина в образец
крови. У пациентов в отделении гемодиализа нельзя осуществлять забор крови из
артериовенозной фистулы. Однако при некоторых критических состояниях взятие
крови в пробирку или вакутейнер из кубитальной вены бывает невозможно из-за
снижения давления. Б ГЕОдобных ситуациях кровь для исследования допустимо
взять из подключичного катетера, но при этом следует учитывать, что перечень
выполняемых методик будет существенно ограничен вследствие возможного
наличия гепарина в образце.АНТИКОАГУЛЯНТЫ
Цитрат натрияЦитрат натрия связывает ионы кальция и останавливает реакции свертывания.
В качестве антикоагулянта для определения большинства показателей коагуля¬
ционного и тромбоцитарного звеньев системы гемостаза следует использовать
0,105-0,109 М раствор лимоннокислого натрия, который готовят растворением
3,1-3,2 г МазС^Н.О^хгН^О в 100 мл воды. Этот раствор следует хранить при тем¬
пературе от +2 до +8 “С не более 48 ч. При несоблюдении температурного режима
в таком растворе развивается микрофлора, вследствие чего концентрация цитрата
натрия уменьшается и появляются посторонние примеси, обладающие потенци¬
альной способностью стимулировать тромбоциты и активировать коагуляционные
реакции. При наличии рекомендации фирм-производителей реагентов допустимо
применение 0,129 М (3,8%) цитрата натрия, однако следует учитывать, что разные
концентрации стабилизатора по-разному влияют на ряд показателей коагуляции,
в том числе и на МНО. Такое влияние особенно заметно при сравнении реагентов
разных производителей.ЭтилекдиаминтетраацетатЭДТА также связывает кальций, останавливая свертывание. Соли этилендиа-
минтетраацетата используют для стабилизации образцов, предназначенных для
определения клеточного состава периферической крови на гематологических
анализаторах. К3- и МЗз-соли ЭДТА в концентрации 1,2-2,0 мг/мл приме¬
няют также при дальнейшем исследовании методами ИФА и ПЦР. Недопустимо
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 753использование ЭДТА для исследования коагуляции и функциональной способ¬
ности тромбоцитов.ГепаринГепарин активирует плазменный антитромбин, который необратимо связывает
ферментные факторы свертывания. Этот антикоагулянт традиционно применя¬
ют в ИФА; как правило, для стабилизации крови необходимо от 12 до 30 ЕД/мл
натриевой, калиевой или литиевой соли нефракционированного гепарина. При
получении плазмы для исследования ее коагуляционных свойств и функциональ¬
ной способности тромбоцитов этот антикоагулянт применять нельзя.ПРОБИРКИПри взятии и подготовке образцов крови для исследования гемостаза следует
применять меры для предупреждения активации тромбоцитов и коагуляционных
реакций. Для образцов крови нельзя использовать обычные стеклянные про¬
бирки, поскольку стекло активирует коагуляцию и сорбирует коагуляционные
факторы. В течение многих лет для предупреждения этих эффектов использовали
силиконирование пробирок, однако появились сведения о недостаточной способ¬
ности некоторых силиконов предупреждать активацию тромбоцитов. Кроме того,
эта процедура трудно стандартизируется и занимает дополнительное время. Как
альтернативу силиконированию следует использовать пластиковые пробирки,
однако различные сорта пластика также разнятся по способности активировать
коагуляционные реакции.Хорошие результаты дает использование вакуумных систем для взятия крови,
содержащих забуференный 3,2% раствор цитрата натрия (буферизация чаще
достигается добавкой лимонной кислоты). Цветовая кодировка по ISO/DIS 6710
для вакуумных систем, содержащих цитрат натрия, предусматривает светло-
голубой или зеленый цвет колпачков; для пробирок с ЭДТА — лиловый или крас¬
ный; для пробирок с гепарином - зеленый или оранжевый. Существуют данные о
хороших результатах использования специальных CTAD-систем (со стабилизато¬
ром, включающим цитрат натрия, трифосаденин, теофиллин и дипиридамол) для
определения [5-тромбоглобулина, тромбоцитарного фактора-4, РАІ-1, контроля
гепаринотерапии по АЧТВ или анти-Ха, определения МНО. Однако этот стабили¬
затор непригоден для исследования функциональной способности тромбоцитов.ОПТИМАЛЬНОЕ СООТНОШЕНИЕ ЦИТРАТ/КРОВЬПоскольку большинство факторов свертывающей системы содержится в плаз¬
ме, но не в эритроцитах, необходимое количество ант и коагулянта зависит от пока¬
зателя гематокрита у пациента. Для стабилизации образцов крови при значении
гематокрита в нормальном диапазоне (от 35 до 50%) принято смешивать один
объем 3,2% раствора цитрата натрия с девятью объемами крови. При отклонениях
гематокрита от указанных величин следует изменить это соотношение в соответ¬
ствии с формулой Ingram:X = V X (100 - нет) / (595 - ИСТ),где X — добавляемый объем 3,2% цитрата, мл; V — конечный объем пробирки для
крови, мл; нет — показатель гематокрита у пациента, %.Техника венепункцииИГЛА и ПРОБИРКАДля получения образцов венозной крови необходимо привлекать наиболее
опытных и квалифицированных процедурных медсестер, способных в течение
754 КОАГУЛОЛОГИЧЁСКИЕ ИССЛЕДОВАНИЯнескольких секунд пунктировать вену с наименьшими травматичностью и болез¬
ненностью для пациента. Медсестре необходимо внимательно ознакомиться с
направлением на исследование, выбрать пробирки, определить корректную после¬
довательность их наполнения, промаркировать их и указать время взятия крови.
В некоторых специализированных лабораториях на время взятия крови в помощь
процедурной медсестре направляют лабораторного техника, что позволяет зна¬
чительно увеличить пропускную способность процедурного кабинета, снизить
вероятность ошибок дозирования цитрата при сдвигах гематокрита и неточностей
маркировки проб.Образец крови предпочтительнее брать из кубитальной вены; место прокола
обрабатывают 70% спиртом и дают высохнуть. Допустимо лишь кратковременное
(не более 60 с) наложение жгута на плечо, поскольку при венозном стазе проис¬
ходит активация фибринолиза; после введения иглы в вену жгут тотчас же рас¬
слабляют или удаляют. Наилучшие результаты (с учетом травматичности, болез¬
ненности, универсальности, скорости наполнения пробирок) дает использование
иглы с калибром 21G. Желательно не брать для исследования гемостаза первые
2-3 мл крови, поэтому их набирают в пробирку без антикоагулянта и используют,
например, для получения сыворотки (биохимические, иммунологические тесты
и др.). Далее пластиковые или силиконированные пробирки с предварительно
добавленным цитратом наполняют кровью из иглы самотеком, сразу же закры¬
вают и перемешивают путем 4-6-кратного переворачивания или вращения (без
встряхивания). В связи с использованием игл увеличенного диаметра после вене¬
пункции в большинстве ситуаций руку пациента необходимо перебинтовать 2-
4 оборотами бинта, приложив к месту прокола марлевый тампон с 70% спиртом.Наполнять пробирки с цитратом с помощью шприцев для инъекций нельзя,
поскольку при насасывании крови и ее последующем переносе в пробирку проис¬
ходит активация тромбоцитов и коагуляционных факторов вследствие контакта
крови с пластиком шприца и дополнительного вспенивания, обусловленного тур¬
булентным движением крови в шприце.СПЕЦИАЛИЗИРОВАННЫЕ ВАКУУМНЫЕ СИСТЕМЫСтандартом для клинических лабораторий, в которых исследуют показатели
гемостаза, считается использование одноразовых вакуумных систем (вакутейнеров
и др.), содержащих 3,2% раствор цитрата натрия. Их использование в значительной
степени ускоряет, стандартизирует процедуру взятия крови и позволяет существенно
снизить разброс результатов. Если кровь для исследования іюказателей гемостаза
берут через катетеры или системы с иглой-бабочкой, необходимо обеспечить пол¬
ную герметичность системы и предварительное заполнение кровью всех «мертвых»
объемов — просвета самого катетера, иглы и переходника, иначе возможны частич¬
ная потеря вакуума и неполное заполнение пробирки. Для предотвращения этого,
а также попадания кусочков поврежденных тканей кровь для анализа показателей
гемостаза не рекомендуют брать в первую вакуумную пробирку.В условиях выраженного сгущения крови (полицитемии, дегидратации и др.)
стандартное количество цитрата в вакуумных системах оказывается избыточным
для уменьшенного объема плазмы. При использовании вакуумных пробирок и
уровне гематокрита у пациента выше 50% часть раствора цитрата из пробирки
следует предварительно отсосать (например, с помощью инсулинового шпри¬
ца). Подлежащий удалению из стандартной вакуумной пробирки объем цитрата
можно определить по формуле:Y - (V / 10) X (9 X нет - 405) / (595 - НСТ),где Y — подлежащий удалению объем цитрата, мл; V — конечный объем пробирки
для крови, мл; НСТ — показатель гематокрита у пациента, %.
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 755При низком (<35%) значении гематокрита, напротив, следует предварительно
добавить дополнительное количество цитрата в пробирку, подсчитав его по той же
формуле (отбросив знак «минус»).Однако скорригировать объем цитрата в вакуумных пробирках без нарушения
вакуума весьма сложно, и стандартные инструкции производителей вакуумных
систем подобной возможности не предусматривают. В связи с этим, поскольку
грубые сдвиги гематокрита в диагностической практике встречаются нечасто, при
их наличии бывает проще взять кровь с помощью иглы не в вакуумную, а в обыч¬
ную пластиковую пробирку, предварительно добавив в нее цитрат в соответствии
с приведенной выше формулой.Транспортировка и промежуточный контроль образцовСледует сократить до минимального интервал времени между взятием образца
крови из вены и центрифугированием. До центрифзтирования кровь следует хра¬
нить при комнатной температуре (от +18 до +24 °С). Недопустимо хранить образ¬
цы крови в холодильнике и тем более их замораживать. При охлаждении образцов
до 12 “С и ниже начинается холодовая агрегация тромбоцитов. Маркированные
образцы транспортируют в лабораторию в специальном контейнере. В том случае,
если образцы крови необходимо отправить в другое лечебное учреждение, их
нужно транспортировать в термоконтейнере, но без хладагентов. В зимнее время
термоконтейнер не позволит образцам охладиться до 12 "С. а в летнее время —
перегреться. Направление на исследование или иную медицинскую документацию
не следует помещать в контейнер с образцами.Перед центрифугированием необходимо визуально проверить полученные для
исследования пробы крови (маркировку, наличие гемолиза, липемии и сгустков).
Образцы, содержащие сгустки, бракуются. Для визуального выявления «подсвер-
тывания» необходимо медленно наклонить пробирку с образцом; при правильных
взятии и обработке крови происходит равномерное ее перетекание, соответствую¬
щее углу наклона пробирки, и на стенках не остается багровых образований оваль¬
ной или иной формы.Получение плазмыБОГАТАЯ ТРОМБОЦИТАМИ ПЛАЗМАЦитратная плазма, богатая тромбоцитами, получается при центрифугирова¬
нии стабилизированной цитратом крови при 150 g в течение 5 мин. Торможение
центрифуги должно быть плавным. Сразу же после центрифугирования богатую
тромбоцитами плазму переносят в пластиковые пробирки пипетками со смен¬
ными наконечниками и используют для исследования агрегационной функции
тромбоцитов, которое следует выполнить в течение 2 ч после взятия крови.
Замораживание образцов богатой тромбоцитами плазмы недопустимо.БЕДНАЯ ТРОМБОЦИТАМИ ПЛАЗМАЦитратная плазма, бедная тромбоцитами, обычно еще содержит тромбоциты,
но в малых количествах. Для ее получения стабилизированную кровь или плазму,
богатую тромбоцитами, центрифугируют при 1700-1900 g в течение 15 мин без
охлаждения, а затем надосадочную жидкость переносят в пластиковые пробирки.БЕСТРОМБОЦИТНАЯ ПЛАЗМАПодобный режим центрифугирования считается достаточным для большин¬
ства коагуляционных тестов. Однако в ряде ситуаций, например при определении
волчаночного антикоагулянта, проведении dRW-теста или при необходимости
75S КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯзамораживания и хранения материала, требуется бестромбоцитная плазма. Ее
получают путем повторного центрифугирования плазмы, бедной тромбоцитами,
при 1700-1900 g в течение 15 мин. Следует осторожно относиться к рекомендаци¬
ям центрифугировать образцы крови с ускорением более 2500 g и охлаждением,
поскольку при увеличении центробежной силы и снижении температуры возмож¬
но разрушение клеток крови.Хранение образцов плазмыЖелательно, чтобы функция как тромбоцитарного, так и коагуляционного
звена гемостаза была исследована в течение 2 ч после взятия крови у пациента.
В большинстве ситуаций обеспечить это довольно сложно, поэтому при условии
быстрого отделения плазмы от клеточных элементов допускается исследование
коагуляционных показателей в течение 4 ч. Редко выполняемые тесты коагу¬
ляционного гемостаза допустимо проводить после накопления замороженных
образцов. Хранение плазмы при -20 °С возможно до 4 нед; лучшие результаты
получаются при хранении при температуре от -40 до -70 "С. Большинство быто¬
вых холодильников неспособны удерживать температуру -20 X, поэтому хранить
образцы плазмы в них не рекомендуют. Перед исследованием плазму необходимо
быстро разморозить на водяной бане при 37 X и хорошо перемешать.ТРОМБОЦИТАРНЫЙ КОМПОНЕНТ ГЕМОСТАЗАХарактеристика структуры и свойств тромбоцитовТромбоциты — безъядерные дисковидные клетки, образующиеся из мегакарио-
цитов в костном мозге. После выхода в кровь они в течение 7-10 сут циркулируют
в кровотоке и частично депонируются в селезенке, а затем утилизируются рети-
кулоэндотелиальной системой. Размеры большинства зрелых форм составляют
2,0-3,5 мкм. Тромбоциты окружены двухслойной фосфолипидной мембраной со
значительной асимметрией слоев и многочисленными инвагинациями мембраны
внутрь клетки. Тромбоцит обладает способностью изменять форму и увеличивать
свою площадь при активации. Большая часть содержащихся в тромбоцитах биоло¬
гически активных веществ находится в плотных тельцах, а-гранулах и лизосомах.
Большое значение для гемостатических реакций имеет содержимое а-гранул —
фактор V, PDGF, фактор фон Виллебранда, антигепариновый фактор, фибриноген
и др. В плотных тельцах сконцентрированы вещества с небольшой молекулярной
массой — серотонин, адениновые нуклеотиды, пирофосфат, Са^' и другие, необхо¬
димые для поддержания спазма мелких сосудов при повреждении тканей. Б лизо¬
сомах содержатся гидролитические энзимы — р-глюкуронидаза, р-галактозидаза,
кислая фосфатаза, неспецифическая эстераза и др.РОЛЬ ТРОМБОЦИТОВ В ФИЗИОЛОГИЧЕСКИХ ПРОЦЕССАХТромбоциты участвуют в реакциях остановки кровотечения как из мелких
(формируя тромбоцитарную пробку), так и из крупных (способствуя образова¬
нию тромбоцитарно-фибринового сгустка) сосудов. В ответ на контакт с аген¬
тами, отличающимися по своим физико-химическим свойствам от нормальных
эндотелиальных клеток, тромбоциты изменяют свою дисковидную форму, на их
поверхности появляются многочисленные отростки. Одновременно происходят
структурная перестройка внутренней части клеток и транспозиция (флип-флоп-
переход) мембранных фосфолипидов с отрицательным зарядом на наружную
поверхность мембраны. Через канальцевую систему тромбоцитов вещества из гра¬
нул и других внутриклеточных структур выделяются в кровь (реакция высвобож-
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯдения). в результате структурных изменений тромбоциты становятся способными
к агрегации и формированию уникальной композиции фосфолипидов в месте
повреждения, что значительно увеличивает скорость активации коагуляционных
факторов и образование фибрина. После формирования и уплотнения фибрино¬
вого сгустка на его поверхности тромбоциты образуют атромбогенный монослой,
напоминающий по своим свойствам эндотелий. Основные физиологические функ¬
ции тромбоцитов:• ангиотрофическая функция;• регуляция проницаемости сосудистой стенки;• адгезивная и агрегационная функция;• при нарушении целостности сосудов — поддержание спазма артериол за счет
выделения биологически активных субстанций;• фиксация сгустка фибрина к месту повреждения сосуда;• участие в активации коагуляционных факторов, формирование протромби-
назного комплекса;• участие в активации протеина С;• ретракция тромбоцитарно'фибринового сгустка;• формирование гемостатически нейтральной поверхности сгустка;• репаративная функция.Преаналитические особенностиОпределение количества тромбоцитов возможно в венозной или капиллярной
крови, стабилизированной цитратом натрия или ЭДТА. При исследовании образ¬
цов венозной крови следует использовать пластиковые вакуумные пробирки или
микроконтейнеры с нанесенным на стенки мелкодисперсным порошком солей
ЭДТА (для гематологических анализаторов). При получении цитратной крови сле¬
дует точно соблюдать ее разведение цитратом 9:1; при значительном отклонении
от нормы показателей гематокрита объем цитрата необходимо скорригировать.
Пробирки с кровью важно тщательно перемешать переворачиванием или вра¬
щением (без встряхивания). Температура при транспортировке образцов крови
должна бьггь комнатной, поскольку при охлаждении происходят активация и
агрегация тромбоцитов. Подсчет тромбоцитов необходимо выполнить в течение
4 ч после взятия венозной крови.ИНТЕРФЕРЕНЦИИВ охлажденных образцах крови и при гемолизе возможно занижение количе¬
ства тромбоцитов. При наличии аутоантител к тромбоцитам соли ЭДТА нередко
индуцируют их агрегацию, в результате при исследовании на гематологических
анализаторах может наблюдаться псевдотромбоцитопения. Проблема решается
применением забуференного раствора цитрата натрия при взятии крови и опреде¬
лении количества тромбоцитов микроскопическим методом.Аналитические технологии, методики исследованияМикроскопический метод подсчета тромбоцитовОснован на подсчете тромбоцитов в камере Горяева с использованием обычно¬
го микроскопа или прибора с фазово-контрастной приставкой после разведения
крови и лизиса эритроцитов раствором оксалата аммония. Метод требует опыта,
напряжения зрения, концентрации внимания. Коэффициент вариации результатов
исследования у опытного лаборанта достигает 10%.
758 К0АГ7Л0Л0ГИЧЕСКИЕ ИССЛЕДОВАНИЯПодсчет клеток крови в гематологическом анализатореЭти приборы существенно облегчают и ускоряют процедуру и повышают точ¬
ность подсчета тромбоцитов. Большинство современных автоматических гема¬
тологических анализаторов позволяют определить дополнительные показатели
тромбоцитарного звена: MPV (Mean Platelet Volume — средний объем тромбоци¬
тов), PDW (Platelet Distribution Width — ширина гистограммы по объему тромбо¬
цитов, степень тромбоцитарного анизоцитоза), РСТ (Platelet Crit — тромбокрит).
Коэффициент вариации при подсчете тромбоцитов в гематологических анализа¬
торах составляет менее 3-5%. На точность подсчета суш^ественное влияние ока¬
зывают качество и надежность используемых калибраторов, а также соблюдение
правил преаналитического этапа.ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАДля оценки качества подсчета тромбоцитов на гематологических анализаторах
существуют контрольные образцы с разным содержанием этих клеток; в то же
время не существует общепринятых рекомендаций по использованию этих же
образцов для определения микроскопическим методом. Следует периодически
контролировать воспроизводимость результатов определения количества тромбо¬
цитов разными лаборантами.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫУ здорового человека в периферической крови содержание тромбоцитов,
согласно нормам, принятым в России, колеблется в диапазоне 180-320х10Ул. На
гематологических анализаторах, поступивших из-за рубежа, установлены рефе¬
рентные значения в диапазоне 150-400х10Ул. Различия норм могут быть связа¬
ны, в частности, с разными требованиями к подготовке пациентов к исследованию;
в России требуется сдача крови натощак, в странах Западной Европы допускается
сдача крови после завтрака.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВТромбоцитопениями считают состояния, при которых количество тромбоцитов
в периферической крови составляет менее 150х10ул, тромбоцитозами — более
400х10Ул, диапазоны 150-180х10Ул и 320-400х10^/л - «серая» зона. При
сохраненной способности к адгезии и агрегации геморрагический синдром раз¬
вивается лишь при количестве тромбоцитов менее ЗОхЮул, а угрожающие жизни
спонтанные кровотечения в большинстве клинических ситуаций возможны при
количестве тромбоцитов менее 15х10Ул. Эти значения имеют условный характер,
поскольку частота и выраженность геморрагий зависят от фонового заболевания
и функциональной способности тромбоцитов.Клиническое применение результатов исследованияТромбоцитопении широко распространены в клинической практике и могут бы
как наследственными, так и приобретенными. Их .этиологию уточняют на основе
жалоб, анамнестических, физикальных и лабораторных данных. Весьма важно
начинать диагностический поиск с исключения вторичных форм тромбоцитопе-
ний, развивающихся вследствие нарушения выработки тромбоцитов в костном
мозге (гипоплазий и аплазий костного мозга, лейкозов, аномалии Мея-Хегглина,
синдрома Вискотта-Олдрича), уменьшения продолжительности их циркуляции
при спленомегалиях (циррозе печени, синдроме Фелти, болезни Гоше, врожден¬
ных гемолитических анемиях, тромбозе селезеночной вены, некоторых инфекци¬
онных заболеваниях и др.), заболеваниях иммунного генеза (антифосфолипидном
синдроме, лекарственных тромбоцитопениях, идиопатической тромбоцитопени-
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 759ческой пурпуре) и при избыточном потреблении в ходе внутрисосудистой коагуля¬
ции (две-синдроме, болезни Мошковича, гемолитико-уремическом синдроме).Тромбоцитозы всегда носят приобретенный характер. Реактивные тромбо-
цитозы часто встречаются после спленэктомии, кровотечений, родов, гемолиза,
хирургических вмешательств, а также на фоне онкологических, воспалительных
или гнойных заболеваний. Исход подобных тромбоцитозов, как правило, благо¬
приятный, их продолжительность зависит от особенностей фонового заболевания
или состояния, а количество тромбоцитов не превышает 1000x10’/л. Тромбоцитоз
также возможен при миелопролиферативных заболеваниях (хроническом миело-
лейкозе, миелофиброзе, эссенциальной тромбоцитемии, эритремии, мегакариоци-
тарном лейкозе). Очень часто на фоне этих заболеваний наблюдаются нарушения
реологических свойств крови и/или различные аномалии тромбоцитов. В послед¬
нем случае, а также при количестве тромбоцитов более 700х10ул у пациентов
повышается риск возникновения тромбозов.Время кровотеченияОпределение длительности кровотечения является способом, позволяющим
уточнить состояние сосудисто-тромбоцитарного звена системы гемостаза in vivo.
Методический подход был впервые предложен Милианом в 1901 г. и модифици¬
рован Дьюком в 1910 г. Все его варианты предполагают выполнение микроразреза
кожного покрова с использованием скарификатора или другого стандартного
режущего устройства (с ограничением глубины раны).ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВВедущая роль в остановке кровотечений в зоне микроциркуляции (артериолах,
прекапиллярах, капиллярах и венулах) принадлежит тромбоцитам. При снижении
их количества или нарушении способности тромбоцитов к адгезии и агрегации
часто наблюдается кровоточивость из мелких сосудов кожи и слизистых оболо¬
чек (микроциркуляторный тип кровоточивости). Такие клинические проявления
очень часто сочетаются с удлинением времени кровотечения после выполнения
стандартного микроразреза кожи.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИВ помещении, где выполняют исследование, температура должна быть не ниже
18 X. При выполнении исследования методом Дьюка для улучшения кровотока
рекомендуют согреть мочку уха между пальцами. Ряд медикаментов способен
удлинить время кровотечения, в тех случаях, когда применялись лекарственные
препараты, содержащие ацетилсалициловую кислоту, и другие нестероидные про¬
тивовоспалительные средства, исследование должно быть отложено на 9-10 сут.
Во избежание инфицирования место разреза обрабатывают 70% раствором эти¬
лового спирта. Важно дождаться полного испарения спирта в месте предполагае¬
мого микроразреза, поскольку его попадание в рану приводит к преждевременной
коагуляции.Результаты теста могут быть искажены под влиянием нестандартного скарифи¬
катора, неглубокого разреза кожи, наличия анемии, из-за особенностей кожных
покровов пациента, эффекта преждевременного склеивания краев раны.Определение длительности кровотечения in vivoСуществует несколько схожих методов для оценки длительности кровотечения,
наилучшей воспроизводимостью и относительно малой травматичностью отлича¬
ется метод Айви. Стандартизация в этом методе достигается одинаковой глубиной
кожного разреза созданием стаза в венах верхней конечности путем наложения
манжеты сфигмоманометра на плечо и поддержания в ней давления на уровне
40 мм рт.ст., что предупреждает преждевременное склеивание краев раны из-за
760КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯколлапса венул в области разреза. В оригинальном варианте для получения досто¬
верных результатов наносят три разреза и вычисляют среднее время кровотечения.
Разработаны и широко используются специальные устройства для нанесения стан¬
дартного разреза кожи, такие как Simplate II (два разреза длиной 6 мм и глубиной1 мм) или Triplett bleeding time device (5 и 1 мм соответственно). При достаточном
навыке исследователя коэффициент вариации метода не превышает 10%.Моделирование длительности кровотечения (исследование In vitro с помощью
прибора PFA-100)В последнее время появились образцы оборудования, способные оценивать
адгезию и агрегацию тромбоцитов при прохождении цельной цитратной крови
через искусственные капилляры, т.е. моделировать определение времени крово¬
течения ш vitro (PFA-100). Это достигается регистрацией скорости образования
тромбоцитарных агрегатов в исследуемой крови, проходящей через сменный кар¬
тридж с капилляром и мембраной, на которой фиксированы коллаген и адреналин
(или коллаген и АДФ), и времени закрытия апертуры картриджа {closure time). При
нарушении функции тромбоцитов, недостаточном их количестве и при болезни
фон Виллебранда наблюдается удлинение времени формирования тромбоцитар-
ной пробки. Коэффициент вариации метода не превышает 10%, но результаты
зависят от гематокрита и количества тромбоцитов, что является относительным
недостатком.Приведенные варианты теста обладают невысокими диагностическими специ¬
фичностью (удлинение времени кровотечения после стандартного разреза кожи
наблюдается при тромбоцитопении, тромбоцитопатии, авитаминозе С, болезни
фон Виллебранда и др.) и чувствительностью (длительность кровотечения зача¬
стую остается нормальной при тромбоцитопении, в ряде ситуаций до 50х10ул, и
при легком течении болезни фон Виллебранда).РЕФЕРЕНТНЫЕ ПРЕДЕЛЫЗависят от применяемой методики. В оригинальном методе Айви время кро¬
вотечения в норме не превышает 8 мин, но требуется уточнять нормативы при¬
менительно к каждой лаборатории, каждому лаборанту и типу применяемого
устройства для надреза кожи. При моделировании определения длительности
кровотечения in vitro с использованием цитратной крови средние нормальные
значения не превышают 180 с для картриджа с коллагеном и АДФ, 250 с — для
картриджа с коллагеном и адреналином.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВРезультаты теста следует интерпретировать с у^іетом данных других анализов,
а также наличия или отсутствия клинических геморрагических проявлений у
обследуемого. Укорочение длительности кровотечения клинического значения
не имеет и чаще свидетельствует о нестандартности процедуры или недостаточ¬
ном опыте лаборанта. При тромбоцитопениях, тромбоцитопатиях и болезни фон
Виллебранда время кровотечения удлиняется, при гемофилиях длительность кро¬
вотечения в большинстве случаев не отличается от нормы. Значительное удлине¬
ние времени кровотечения, не соответствующее выраженности тромбоцитопении,
наблюдается при болезни Бернара-Сулье.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯТест используется как ориентировочный для выявления пациентов с наруше¬
нием сосудисто-тромбоцитарного звена гемостаза и болезнью фон Виллебранда;
дифференцировать варианты патологии этим методом нельзя.Длительность кровотечения нередко бывает нарушена вследствие применения
лекарственных препаратов, оказывающих влияние на функциональную способ¬
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 701ность тромбоцитов, но для контроля терапии антиагрегантами можно использо¬
вать только метод с моделированием определения длительности кровотечения
in vitro.Агрегационная функция тромбоцитовРОЛЬ АГРЕГАЦИИ ТРОМБОЦИТОВСпособность тромбоцитов образовывать конгломераты служит основой фор¬
мирования тромбоцитарной пробки, способствующей остановке кровотечения
из мелких сосудов. Процесс формирования тромбоцитарных конгломератов про¬
текает под действием индукторов агрегации. В физиологических условиях самым
мощным индуктором агрегации тромбоцитов является тромбоксан менее
сильными, но не менее значимыми — АДФ, адреналин, серотонин, гистамин,
тромбин, коллаген и др. При моделировании агрегации в лабораторных условиях
используют те же самые и некоторые дополнительные индукторы: АДФ, адрена¬
лин, арахидоновую кислоту, тромбин, кальциевый ионофор А23187, коллаген,
фибрин-мономер, бычий коагуляционный фактор VIII, ристоцетин и др. На прак¬
тике наиболее часто используют АДФ, адреналин, коллаген и ристоцетин.Важнейшую роль в адгезии и агрегации играют рецепторные гликопротеино-
вые белки, встроенные в цитоплазматическую мембрану тромбоцитов. Рецепторы
делятся на две основные группы — адгезивные и активационные. Некоторые
рецепторные белки строго специфичны, другие могут связываться с различны¬
ми лигандами. Наиболее изученными тромбоцитарными рецепторами являются
интегриновые комплексы GP Ilb/IIIa и GP 1а/Иа, а также крупный неинтегри-
новый комплекс GP Ib/V/IX. Рецепторы могут быть описаны и с помощью
номенклатуры кластерной дифференциации (CD) в соответствии с антигенными
свойствами и, таким образом, выявлены и классифицированы с использованием
соответствующих CD-антител на проточном цитометре (например, гликопротеи¬
ну ПЬ соответствует CD41, а 111а — CD61).После повреждения мелких сосудов и связывания мембранного комплекса
GP Ib/V/IX с коллагеном субэндотелия (при участии фактора фон Биллебранда)
происходят активация тромбоцитов, запуск синтеза тромбоксана А^ и высвобож¬
дение содержимого тромбоцитарных гранул через открытую канальцевую систе¬
му. Вследствие структурной перестройки тромбоцитарной мембраны и многочис¬
ленных метаболических реакций активированные тромбоциты изменяют форму,
у них появляются отростки, способствующие связыванию тромбоцитов между
собой и образованию конгломератов. Собственно связующими звеньями служат
фибриноген, реже фактор фон Виллебранда, фиксирующиеся на мембранных
гликопротеинах GP Ilb/IIIa. В процессе агрегации из тромбоцитов выделяются
вещества, поддерживающие спазм сосудов в месте повреждения, вовлекающие в
процесс другие тромбоциты и увеличивающие эффективность коагуляционных
реакций.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИДля определения агрегации тромбоцитов образцы венозной крови берут с
цитратом натрия (ЭДТА для этой цели непригоден). Для пункции локтевой вены
используются достаточно широкие иглы, через которые кровь самотеком попадает
в пробирки с раствором цитрата; забирать кровь шприцем нельзя. При дозирова¬
нии крови и цитрата следует учитывать значение гематокрита; при показателях
менее 30 и более 55% коррекция соотношения объемов антикоагулянта и крови
является обязательной, иначе результаты исследований будут искажены. Сразу
после взятия кровь в пробирке тщательно перемешивают путем аккуратного пере¬
ворачивания или вращения (без встряхивания). Температура при транспортировке
762 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯобразцов крови должна быть комнатной, поскольку при охлаждении происходят
активация и агрегация клеток. Исследовать агрегацию тромбоцитов необходимо в
течение 4 ч после взятия крови.Для анализа используют богатую тромбоцитами плазму. При ее получении
необходимо следить за фактором осаждения (150-200 g, 5-7 мин); завышенная
скорость вращения центрифуги или слишком продолжительное время центри¬
фугирования ведут к искажению результатов. Часть взятой крови или богатой
тромбоцитами плазмы центрифугируют в более жестком режиме (1000 g, 15 мин)
для получения бедной тромбоцитами плазмы, используемой для разведения и в
качестве точки отсчета при оценке оптической плотности.Перед анализом необходима стандартизация количества тромбоцитов в образ¬
це. Для этого проводят предварительный подсчет клеток в плазме на гематологи¬
ческом анализаторе или микроскопическим методом. В соответствии с полученны¬
ми результатами богатую тромбоцитами пла.іму разводят бедной тромбоцитами
плазмой (от того же пациента) так, чтобы итоговое количество тромбоцитов в
смеси составило 150-250х10Ул. При тромбоцитопениях (менее 120х10Ул) вос¬
производимость результатов значительно снижается.Очень важно спросить пациента о принимаемых лекарственных препаратах,
поскольку ряд медикаментов способен нарушить агрегацию тромбоцитов. Если
пациент принимал препараты, содержащие ацетилсалициловую кислоту, или
нестероидные противовоспалительные средства, исследование должно быть отло¬
жено на 9-10 сут с момента отмены препарата.ИНТЕРФЕРЕНЦИИГемолиз в образце, относительный недостаток цитрата натрия при низких зна¬
чениях гематокрита, неточное определение количества тромбоцитов и, как след¬
ствие, нестандартное их количество в образце ведут к погрешностям и плохой вос¬
производимости результатов. Царапины на пробирках/кюветах также могут быть
причиной неточностей из-за ошибок определения оптической плотности богатой
и бедной тромбоцитами плазмы. Другой причиной аналитических ошибок может
быть некачественная обработка магнитных мешалок при их повторном использо¬
вании, поэтому повторное использование пластиковых кювет и магнитных меша¬
лок недопустимо. Высокая скорость вращения магнитной мешалки индуцирует
спонтанную агрегацию тромбоцитов, что ведет к завышению результатов.Оптический способ регистрации агрегации тромбоцитовв основе записи агрегатограммы лежит принцип Борна, предполагающий гра¬
фическую регистрацию изменения оптической плотности богатой тромбоцитами
плазмы в процессе формирования тромбоцитарных агрегатов после добавления
индуктора агрегации (АДФ, адреналина, ристоцетина, коллагена и др.). Это наи¬
более распространенный вариант исследования, оценку тромбоцитарной агрега¬
ции осуществляют с помощью агрегометра. Несмотря на недостатки оптического
метода, дифференциация нарушений агрегационной функции была разработана на
основе именно его использования.Лазерный способАгрегометром с использованием лазерного источника света измеряют свето¬
рассеяние, возникающее при попадании в луч тромбоцитарных конгломератов.
Имеется возможность оценки радиуса агрегатов, а также спонтанной агрегации
тромбоцитов при механическом воздействии (вращении магнитной мешалки) без
добавления индуктора. Таким образом, появляется дополнительная возможность
оценки гиперагрегации тромбоцитов, хотя общепризнанного стандартизирован¬
ного метода пока нет. У таких приборов сохраняется возможность использования
стандартного метода Борна.
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 7S3Импедансный способАгрегометром с импедансным принципом регистрации определяют изменения
электрических свойств цельной крови при добавлении стимуляторов агрегации.
Именно поэтому из исследования исключаются этапы приготовления бедной и
богатой тромбоцитами плазмы и подгонки количества тромбоцитов к стандарт¬
ному уровню, что значительно сокращает время анализа и снижает количество
ошибок. Графики, полученные при исследовании агрегации тромбоцитов этим
способом, схожи с аналогичными «оптическими» кривыми агрегации, но времен¬
ные показатели волн агрегации и их амплитуды не совпадают. Степень агрегации
оценивается как электрическое сопротивление (Ом).РЕФЕРЕНТНЫЕ ПРЕДЕЛЫВследствие отсутствия общепринятых диапазонов нормальных значений при
измерении агрегационной функции тромбоцитов каждая лаборатория определяет
нормативы самостоятельно.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВОценка показателей агрегации тромбоцитов зависит от метода регистрации
этого процесса. В наиболее распространенном оптическом способе лучшую вос¬
производимость демонстрируют степень агрегации (%) и угол наклона кривой.
Применение низких концентраций стимуляторов агрегации дает возможность
раздельно оценить первую и вторую волны агрегации, а иногда — выявить гипер¬
агрегацию тромбоцитов. Большую ценность имеет информация о наличии или
отсутствии второй волны агрегации, поскольку именно она на агрегатограмме
отражает реакцию высвобождения содержимого а-гранул и плотных тромбоци-
тарных гранул. Для корректной интерпретации результатов желательно использо¬
вать несколько стимуляторов агрегации.Интерпретация результатов бывает затруднена при дифференциации гемор¬
рагических состояний от сходных нарушений фазы адгезии и агрегационной
функции тромбоци тов — болезни фон Виллебранда и синдрома Бернара-Сулье.
В этом случае при добавлении в исследуемую богатую тромбоцитами плазму нор¬
мальной бестромбоцитарной плазмы или криопреципитата у больных с болезнью
фон Виллебранда ристоцетиновая агрегация восстанавливается, а при синдроме
Бернара-Сулье — не исправляется.Результаты исследования следует интерпретировать с учетом клинического ста¬
туса пациента. При геморрагическом синдроме и отсутствии нарушений агрегации
тромбоцитов необходимо повторное исследование через 1-1,5 мес. При изменениях
агрегации, характерных для синдрома Бернара-Сулье, тромбастении Біанцманна и
другой патологии, также необходимо повторно исследовать аі'регационную функцию
тромбоцитов. При некоторых аномалиях тромбоцитов (синдромах Мея-Хегглина,
Фех гнера, Скотта, отсутствии GPIV) агрегационная функция клеток не нарушена,КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯНазначая тест и оценивая результаты исследования функции тромбоцитов,
необходимо иметь в виду следующие принципиальные моменты;• индуцированная агрегация тромбоцитов значительно полезнее при выявле¬
нии недостаточной функциональной способности тромбоцитов, чем при их
гиперактивности;• наследственные тромбоцитопатии встречаются очень редко, а именно рас¬
пространенность заболевания имеет подчас решающее значение для инфор¬
мативности метода;• до настоящего времени не существует окончательных международных реко¬
мендаций и стандартов по выявлению гиперактивности тромбоцитов;
764КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ• решающий вклад в результаты могут вносить особенности и ошибки на
преаналитическом этапе.Приобретенные нарушения агрегации тромбоцитов в клинической практике
встречаются довольно часто и бывают более выраженными на фоне примене¬
ния ацетилсалициловой кислоты, других нестероидных противовоспалитель¬
ных препаратов и анальгетиков. Нарушения также возможны при лечении
р-адреноблокаторами, антагонистами кальция, ксантинами и некоторыми други¬
ми препаратами, а также на фоне ряда заболеваний (почечной недостаточности,
гемобластозов, интоксикаций и др.). Алкоголь и продукты питания, содержащие
уксусную кислоту и другие консерванты, также способны нарушить агрегацию
тромбоцитов.Кривая агрегации тромбоцитов у здорового человека, полученная на опти¬
ческом агрегометре, часто (но не всегда) имеет двухфазный вид. При дефектах
высвобождения (дефиците плотных гранул, нарушении механизма секреции)
возможны отсутствие второй волны и снижение агрегации с арахидоновой кис¬
лотой. Сходные нарушения наблюдаются при ряде заболеваний (синдромах
Хержманского-Пудлака, Чедиака-Хигаси, Бискотта-Олдрича, TAR-синдроме).
Нарушение агрегации тромбоцитов, индуцируемой ристоцетином, служит частым
лабораторным проявлением болезни фон Виллебранда. Синдром «серых» тром¬
боцитов характеризуется нарушением коллагеновой и тромбиновой агрегации в
сочетании с наличием больших тромбоцитов.При редко встречающихся наследственных дефектах тромбоцитарных глико¬
протеинов (тромбастении Гпанцманна, синдроме Бернара-Сулье и др.) наблюда¬
ются нарушение адгезивно-агрегационной функции тромбоцитов и, как следствие,
развитие рецидивирующего геморрагического синдрома. При синдроме Бернара-
Сулье нарушение ристоцетиновой агрегации часто сочетается с тромбоцитопенией
(чаще до 50х10ул) и значительным увеличением размера тромбоцитов.Дифференциальная диагностика вариантов нарушения тромбоцитарной функ¬
ции основана на оценке агрегации тромбоцитов с различными индукторами
(табл. 11-1).Таблица 11-1. Показатели индуцированной агрегации тромбоцитов (по методу Борна) при нару¬
шениях сосудисто-тромбоцитарного гемостазаПатологиягемостазаАДФАрахидоноваякислотаКоллагенАдреналинРистоцетинТромбоцитопатияНорма или сни¬
жениеНорма или
снижениеНорма или
снижениеНорма или сни¬
жениеНормаВлияние аспири¬
на* или других
несгероидных
противовоспали¬
тельных препа¬
ратовНорма или сни¬
жение (часто
умеренное)с
нарушением вто¬
рой вопныОтсутствие
или значимое
снижениеНорма для
концентрации
5 мкг/мл или
снижение для
концентрации
2 мкг/млСнижение с
нарушением
формирования
второй волны на
агрегатограммеНорма или
умеренное
снижениеВлияние клопи-
догрела и тикло-
пидинаРезкое снижениеНорма или
умеренное
снижениеНорма или
умеренное
снижениеНорма или уме¬
ренное снижениеНормаНарушения пула
храненияНорма или
снижение с нару¬
шением второй
волныНормаНорма или
умеренное
снижениеСнижение с нару¬
шением форми¬
рования второй
волныНормаДефект рецептора
коллагена (GP 1а/
Па или GP V)НормаНормаОтсутствие
или значимое
снижениеНормаНормаСиндром Бернара-
СульеНормаНормаНормаНормаОтсутствие
или снижение
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 765Окончание табл. 11-1ПатологиягемостазаДефекты актив¬
ности тромбоксан-
синтетазыНарушение высво¬
бождения арахи-
доновой кислоты
из-за аномалии
фосфолипазы AjТромбастенияГланцманнаБолезнь фон
ВиллебрандаАфибриногенвмияАДФСнижение (часто
умеренное)с
нарушением вто¬
рой волныСнижение (чаще
умеренное)с
нарушением вто¬
рой волныОтсутствиеНормаСнижение или
отсутствиеАрахидоноваякислотаОтсутствие
или значимое
снижениеНормаОтсутствиеНормаСнижение или
отсутствиеКоллагенЧаще умерен¬
ное снижениеЧаще умерен¬
ное снижениеОтсутствиеНормаСнижение или
отсутствиеАдреналинСнижение с нару¬
шением форми¬
рования второй
волныСнижение с нару¬
шением форми¬
рования второй
волныОтсутствиеНормаСнижение или
отсутствиеРистоцетинНормаНормаНормаОтсутствие
или значимое
снижение
(иногда норма
при субти-
пе 2N,повы¬
шение при
субтипе 2В)НормаИсследование агрегационной функции тромбоцитов следует выполнять не
только при кровоточивости, но и у больных с тромбозами, поскольку при лече¬
нии тромбофилических состояний часто применяют лекарственные препараты,
подавляющие функцию тромбоцитов. Нормальная или высокая их агрегация при
приеме аспирина* и препаратов, его содержащих, может свидетельствовать об
аспиринорезистентности. Дополнительными тестами для выявления резистент¬
ности к аспирину* являются агрегация тромбоцитов с арахидоновой кислотой,
определение тромбоксана в сыворотке крови и 11-дегидротромбоксана в
моче.Фактор фон ВиллебрандаХАРАКТЕРИСТИКА СТРУКТУРЫ И СВОЙСТВФактор фон Виллебранда (ФВ) принадлежит к семейству адгезивных белков,
является крупным мультимером, состоящим из 50-100 одинаковых субъеди¬
ниц, имеет большую молекулярную массу (от 500 тыс. до 20 млн Да); адгезив-
ность мультимеров тем выше, чем больше их молекулярная масса. Синтез этого
белка осуществляется в эндотелиальных клетках и мегакариоцитах, димеры и
мультимеры формируются из субъединиц с помощью д и сульфидных связей.
Мультимеры ФВ хранятся в а-гранулах тромбоцитов и тельцах Вибеля-Палада
эндотелиальных клеток, откуда попадают в кровь. Циркулирующие в сосудистом
русле мультимеры ФВ расщепляются на олигомеры, димеры и мономеры метал-
лопротеиназой.ФВ, связываясь с коагуляционным фактором VIII, защищает его от протеолиза,
а также служит кофактором адгезии тромбоцитов к компонентам субэндотелия
(коллагеновым волокнам, микрофибриллам), имеющим центры связывания этого
мультимерного белка. Адгезия тромбоцитов к коллагеновым волокнам реализует¬
ся через мембранные рецепторы GP 1а-Па и GP Ib-V-IX. При повреждении тканей
и сосудов активируются тромбоциты, а мультимерные молекулы ФВ, содержащие-
766 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ•-•'■'V'.-Vv'ся в а-гранулах, выделяются в кровь, повышая концентрацию этого протеина вШЇ месте повреждения и дополнительно способствуя адгезии.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИСодержание ФВ определяется в бедной тромбоцитами нитратной плазме. При
ЩШШ нормальных значениях гематокрита можно использовать вакуумные системы
взятия крови, при значительном отклонении гематокрита от нормы венозную
кровь самотеком набирают в пробирку с соответствующим количеством раствора
цитрата натрия. Немедленно после взятия крови содержимое пробирки тщательно
перемешивают без встряхивания и при комнатной температуре транспортируют
в лабораторию (охлаждение вызывает активацию и агрегацию тромбоцитов, что
снижает точность определения ФВ). Бедную тромбоцитами плазму получают цен¬
трифугированием крови при 1000-1200 g 15 мин.ИНТЕРФЕРЕНЦИИГемолиз в образце, относительный недостаток цитрата натрия при низких зна¬
чениях гематокрита ведут к погрешностям и плохой воспроизводимости резуль¬
татов. Концентрация ФВ может возрастать после физических упражнений, при
стрессовых ситуациях, беременности, кровотечениях, инфекционных заболева¬
ниях, терапии эстрогенами. У женщин в разные фазы месячного цикла возможны
колебания уровня ФВ; для стандартизации интерпретации данных некоторые
эксперты рекомендуют для определения ФВ у женщин брать кровь на 5-7-е сутки
менструального цикла.АНАЛИТИЧЕСКИЕ ТЕХНОЛОГИИ, МЕТОДИКИ ИССЛЕДОВАНИЯФактор фон Виллебранда отличается большим разнообразием аномалий, поэ¬
тому для диагностики болезни фон Вкллебранда используют комплекс тестов.
Базовые методы исследования предназначены для выявления дефицита или
качественных аномалий фактора фон Виллебранда; они основаны на иммуно-
ферментных технологиях и определении агрегации фиксированных нормальных
тромбоцитов с ристоцетином при добавлении исследуемой бедной тромбоцитами
плазмы.Концентрация фактора фон ВиллебрандаОсновной метод определения концентрации ФВ — твердофазный ИФА, чув¬
ствительность определения — 2% медианы референтного значения, коэффициент
вариации — не более 10% (обычно 5-7%). Возможно определение ФВ с помощью
ракетного иммуноэлектрофореза, а также иммунотурбидиметрии (с суспензией
микрочастиц, покрытых специфическими анти-ФВ-антителами; коэффициент
вариации — 2-5%).Ристоцетин’кофакторная активность фактора фон ВиллебрандаОбработанные формалином тромбоциты теряют способность к образованию
агрегатов в ответ на действие большинства индукторов, однако добавка ристоце-
тина и исследуемой плазмы во взвесь таких тромбоцитов обычно приводит к их
быстрой агрегации. Ее выраженность прямо зависит от наличия ФВ в плазме, поэ¬
тому при снижении концентрации этого протеина или его качественной неполно¬
ценности агглютинация выражена слабо или вовсе отсутствует. Для количествен¬
ного определения ристоцетин-кофакторной активности необходим агрегометр;
полуколичественный метод предполагает визуальную оценку времени появления
агрегатов в смеси разведенной исследуемой плазмы, ристоцетина и обработанных
формалином тромбоцитов. Коэффициент вариации обоих методов — не более
10%.
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 767Активность плазменного фактора VIIIПоскольку в норме ФВ, образуя комплекс с коагуляционным фактором VIII,
защищает его от протеолиза, при многих вариантах болезни фон Виллебранда
активность фактора VIII из-за быстрой деградации снижается. Для определения
содержания фактора VIII оценивают время свертывания смеси дефицитной по этому
фактору субстратной плазмы, АЧТВ-реагента и разведенной исследуемой плазмы
после инкубации и добавления кальция хлорида. Результаты исследования важны
для диагностики субтипа 2N болезни фон Виллебранда. поскольку при этом вариан¬
те патологии значительно снижается активность антигемофильного глобулина.Коллагенсвязывающая активность фактора фон ВиллебрандаАдгезия тромбоцитов к коллагеновым волокнам субэндотелия реализуется
через мембранный рецептор GP Ib-V-IX в присутствии ФВ, поэтому при аномали¬
ях этого мультимерного протеина или его недостаточном количестве связывание
тромбоцитов с коллагеном нарушается. Для определения коллагенсвязывающей
активности используют модифицированный метод ИФА, в котором ФВ, содер¬
жащийся в исследуемом материале, фиксируется в покрытых коллагеном лунках
планшета и впоследствии связывается с конъюгатом антител к ФВ пероксидазой.
После отмывки и добавления хромогенного субстрата (ТМБ) появляется окра¬
шивание, интенсивность которого пропорциональна количеству и коллагенсвя¬
зывающей способности ФВ в исследуемом образце. Несмотря на то что метод
определения коллагенсвязывающей активности является иммунологическим,
его результаты свидетельствуют о функциональной активности фактора фон
Виллебранда. Коэффициент вариации метода не превышает 15%.Агрегация тромбоцитов с ристоцетиномНарушение агрегации тромбоцитов, индуцируемой ристоцетином, является
частым лабораторным признаком болезни фон Виллебранда, в частности типа 2В,
при котором наблюдается аномально высокая агрегация в ответ на добавле¬
ние низких концентраций ристоцетина. При других аномалиях ФВ этот метод
имеет вспомогательное значение, поскольку агрегация с обычной концентраци¬
ей ристоцетина может быть нарушена при различных вариантах заболевания.
Воспроизводимость исследования ристоцетиновой агрегации зависит от модели
агрегометра и профессиональной подготовки персонала.ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАВ настоящее время доступны контрольные материалы с аттестованными зна¬
чениями концентрации ФВ. Учитывая различие методик определения этого про¬
теина, необходимо тщательно выверить вариант исследования, для которого был
аттестован контрольный образец,РЕФЕРЕНТНЫЕ ПРЕДЕЛЫДиапазон концентраций и активности ФВ у здоровых людей довольно широк;
нормативы зависят от варианта методики, оборудования, группы крови, реактивов
и т.д. Референтные пределы указываются в инструкции к наборам реагентов, но
многие производители диагностических наборов, особенно основанных на тром-
боцитарной агрегации, рекомендуют лабораториям самим установить собствен¬
ный диапазон нормальных значений. У пациентов с I группой крови уровень ФВ
примерно на 10% ниже, чем при других группах крови, и это нужно учитывать при
диагностике болезни фон Виллебранда.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВРезультаты исследования концентрации и активности ФВ следует интерпре¬
тировать с учетом данных, полученных разными методами, а также (что очень1І»
768 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯважно) с учетом клинических проявлений заболевания у пациента и анализа
наследственности. Классификация болезни фон Виллебранда, основанная на осо¬
бенностях строения молекулы ФВ, представлена в табл. 11-2.Таблица 11-2. Классификация болезни фон ВиллебрандаТип и субтип заболеванияТип 1 (количественный дефект)Тип 2 (качественный дефект);субтип 2Асубтип 2Всубтип 2Мсубтяп 2NТип 3 (количественный дефект)Характеристика нарушенияНедостаточная продукция ФВОтсутствие крупных мультимеров ФВПовышенная аффинность ФВ к тромбоцитарному рецептору GP 1Ь
в сочетании с отсутствием крупных мультимеров ФВСниженная аффинность ФВ к GP 1Ь тромбоцитов без нарушения
мультимерной структуры Снижение сродства ФВ к фактору VIIIОтсутствие ФВПри 1-м типе этого заболевания наблюдается количественный дефект ФВ,
поэтому бывают сниженными результаты иммунологических и функциональных
методов его определения. При 2-м типе синтезируются аномальные молекулы
фактора, поэтому иммунологические методы часто показывают нормальное
содержание ФВ, а данные функциональных тестов, основанные на агрегации
тромбоцитов с ристоцетином, значимо нарушены. При редком 3-м типе болезни
ФВ практически отсутствует, поэтому нарушаются все перечисленные показатели.
Обобщенная информация о сдвигах лабораторных тестов при различных вари¬
антах болезни фон Виллебранда приведена в табл. 11-3, Многие лабораторные
методики при разных типах заболевания демонстрируют сходные результаты. Для
более эффективной дифференциации качественных и количественных нарушений
ранее был предложен показатель соотношения (Ratio) ристоцетин-кофакторной
активности и концентрации антигена ФВ; снижение этого показателя менее 0,7
свидетельствует о 2-м типе болезни фон Виллебранда. При дифференциации суб¬
типов заболевания необходимо учитывать следующие особенности:• низкие показатели ристоцетиновой агрегации часты при количественном
дефекте и субтипах качественного нарушения 2А и 2М;• высокая ристоцетиновая агрегация тромбоцитов малыми дозами индуктора
за счет увеличения аффинности ФВ к рецептору GP Ib характерна для субти¬
па 2В;• нормальные показатели ристоцетиновой агрегации тромбоцитов и значи¬
тельное нарушение связывания ФВ с фактором VIII, что проявляется суще¬
ственным снижением активности фактора VIII, бывают при субтипе 2N
заболевания (нередко снижение фактора VIII при этом субтипе настолько
выражено, что приходится дифференцировать заболевание от гемофи¬
лии А);• тромбоцитарный вариант болезни фон Виллебранда, схожий по клинике-
лабораторным проявлениям с субтипом 2М, является следствием мутации
а-цепи GP Ib (при этом нарушении повышена аффинность аномального
тромбоцитарного рецептора к высокомолекулярным мультимерам факто¬
ра фон Виллебранда, вследствие чего концентрация этого протеина сни¬
жается);• дополнительную информацию дает исследование мультимерности ФВ.При 1-ми 3-м типе болезни исследовать м}^льтимерность ФВ нет необходи¬
мости, поскольку результаты предсказуемы. Но при А- и В-вариантах 2-го типа
заболевания это исследование помогает выявить тип нарушения мультимерности,
что необходимо при дифференциации заболевания.
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 789Таблица 11-3. Показания лабораторных тестов при разных вариантах болезни фон ВиллебрандаВарианты болезни
фон ВиллебрандаКоллаген-связывающаяактивность(VWF;CB)Концентрацияантигена(VWF;Ag)Ристоцетин-кофакторнаяактивность(VWF:RCo)Активность
фактора VIII
(FVIII;C)Ристоцети¬
новая агрега¬
ция тронбоци-
тов (RIPA)Тип 1іііі или Nі; редко NТип 2:субтип 2 АіN; редко іІІІі или Wісубтип 2ВіN; редко ііі или NТсубтип 2МіN; редко ііі или Nі; редко Nсубтип 2IMNN; редко іNІІІNТип 3ШІІІ или 0ІІІ или 0ІІІІІІ или 0Тромбоцитарный тип
вследствие дефекта
GP 1Ь-« (псевдоформа)і или NііN; реже іТУсловные обозначения: і — снижение; ІІІ — значительное снижение; N — норма; t — повы¬
шение; О — отсутствие.Повышение концентрации ФВ свидетельствует о дисфункции эндотелия или его
повреждении при сердечно-сосудистой и других видах патологии.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕОценка ФВ может быть использована при двух принципиально различных
ситуациях — дифференциальной диагностике болезни фон Виллебранда и оценке
эндотелиальной дисфункции.Диагностика болезни фон Виллебранда — задача, требующая дорогостояще¬
го оборудования, значительного времени и профессиональных навыков. Тем не
менее это очень важно, поскольку при данной патологии в ряде случаев существен¬
но ухудшается качество жизни пациентов, а в других ситуациях это заболевание
неожиданно проявляется массивными, нередко угрожающими жизни геморра¬
гиями во время операций, родов, при травмах и других состояниях у пациентов,
считавших себя здоровыми. Имеются сообщения о гибели больных от неконтро¬
лируемого кровотечения при этой патологии. Наиболее часто опасные для жизни
кровотечения наблюдаются при 3-м типе заболевания.Знание типа болезни фон Виллебранда дает возможность выбора терапии, посколь¬
ку некоторые гемостатические препараты обладают разной эффективностью при
лечении и профилактике кровотечений у пациентов с различными вариантами этого
заболевания. Например, препараты на основе DDAVP дают неплохие результаты при
1-м типе заболевания, противопоказаны при субтипе 2В и бесполезны при 3-м типе.Использование ФВ в качестве маркера эндотелиальной дисфункции основано на
факте, что ФВ синтезируется и хранится в клетках сосудистой выстилки, повреж¬
дение эндотелия практически всегда сопровождается повышением содержания
ФВ в плазме крови. В этом слу’чае информативно только исследование антигена
ФВ, отражающего его концентрацию. Повышение содержания ФВ может отра¬
жать негативные прогностические тенденции при сердечно-сосудистой патологии,
сахарном диабете, патологии почек, гестозах и других заболеваниях.З-ТромбоглобулинХАРАКТЕРИСТИКА СТРУКТУРЫ И СВОЙСТВ ВЕЩЕСТВАТромбоглобулины - группа иммунологически идентичных протеинов, отлича¬
ющихся друг от друга лишь количеством аминокислотных остатков в цепи. В мега-
770 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯкариоцитах и неактивированных тромбоцитах содержатся два основных вещества
из этой группы — РВР (Platelet Basic Protein) и СТАР-Ш (Connective Tissue-Activating
Peptide III). Еще один представитель этой группы веществ — (З-тромбоглобулин — в
интактных тромбоцитах отсутствует и образуется в них лишь после активации и
ей-іС агрегации.тттРОЛЬ (3-ТРОМБОГЛОБУЛИНА В ФИЗИОЛОГИЧЕСКИХ ПРОЦЕССАХР-Тромбоглобулин (р-ТГ) появляется в крови Б результате высвобождения из
а-гранул тромбоцитов, где он накапливается и хранится. Окончательно физиоло¬
гическая роль этого протеина не определена; имеются сведения о его способности
тормозить образование простациклина, выступать в качестве регулятора функции
гранулоцитов при повреждении сосуда и служить мощным хемоаттрактантом для
фибробластов.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИДолжны быть приняты меры для предупреждения активации тромбоцитов
при взятии и обработке образцов крови. За день до сдачи крови пациенту следует
избегать стрессов, физических нагрузок, приема алкоголя, смены режима дня и
изменений в питании. Кровь берут утром натощак (не менее чем через 8 ч после
последнего приема пищи), в спокойном состоянии пациента. Перед венепункцией
пациенту рекомендуют отдых в течение 20-30 мин. Венозный стаз перед венепунк¬
цией должен быть максимально ограничен, вакуумные пробирки не применяют.
Для пункции вены используют иглы с широким просветом (не менее 21G) для того,
чтобы кровь могла идти самотеком; первые 3-4 мл для анализа не используют.Кровь набирают в специальные пробирки со стабилизатором CTAD (цитрат
натрия, аденозин, теофиллин и дипиридамол). Для того чтобы избежать влияния
вакуума и турбулентности на образец крови, рекомендуют открыть пробирку для
уравновешивания давления, наложить жгут только для поиска вены, пунктировать
вену иглой, удалить первые 2 мл крови, только после этого собрать необходимый
объем крови самотеком в пробирку. Пробирку с кровью немедленно помещают на
тающий лед и дают ей охладиться не менее 15 мин. Центрифугирование прово¬
дят не позднее 1 ч после взятия крови в криоцентрифуге при температуре 2-8 °С
в течение 20 мин при 2500 g. Из средней части пробирки отбирают Уз объема
супернатанта для повторного центрифугирования в тех же условиях и получения
бестромбоцитной плазмы, используемой для исследования. Все эти меры предна¬
значены для того, чтобы избежать активации тромбоцитов на преаналитическом
этапе, а также исключить попадание в исследуемый образец обломков клеток.
Образцы плазмы можно хранить при комнатной температуре в течение 4 ч,
при -20 “С — не более 4 нед; оттаивание замороженной плазмы проводят на водя¬
ной бане при 37 “С в течение 20 мин.ИНТЕРФЕРЕНЦИИЛожное завышение уровня р-ТГ возможно в образцах плазмы, содержащих
клетки (такие образцы следует повторно отцентрифугировать) или высокие
уровни липидов. Результаты исследования часто завышаются при почечной недо¬
статочности. Уровень р-ТГ может также изменяться при тромбоцитозах и тромбо-
цитопениях. причиной неточных результатов и ошибок исследования может быть
несоблюдение температурного режима при хранении реагентов.АНАЛИТИЧЕСКИЕ ТЕХНОЛОГИИ, МЕТОДИКИ ИССЛЕДОВАНИЯВ основе определения р-ТГ лежит принцип твердофазного ИФА со связыванием
антигена и антител, поэтому специфичность и чувствительность достаточно высо¬
ки. Коэффициент вариации не превышает 15%.
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 771РЕФЕРЕНТНЫЕ ПРЕДЕЛЫНе более 80 мкг/л, или 10-50 МЕ/мл (зависит от метода исследования), Б неко¬
торых лабораториях верхняя граница нормальных значений может быть иной;
возможно сформировать контрольную группу и самостоятельно определить диа¬
пазон нормальных значений.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ(3-ТГ — один из наиболее чувствительных и объективных маркеров активации
тромбоцитов, можно использовать в оценке тромбофилических состояний наряду
с маркерами активации свертывания. Уровень р-ТГ повышается при стимуляции
тромбоцитов in vivo и in vitro коллагеном, АДФ, иммунными комплексами и дру¬
гими веществами, способными вызвать агрегацию. Низкие значения уровня р-ТГ
могут служить вспомогательным диагностическим критерием дефицита тромбо-
цитарных а-гранул. При тромбоцитопениях и тромбоцитозах уровень (5-ТГ зави¬
сит от количества тромбоцитов,КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕОпределив повышение уровня |3-ТГ в плазме, можно установить гиперагрегацию
тромбоцитов при различных патологических состояниях — инфаркте миокарда,
венозном тромбоэмболизме, искусственных клапанах сердца, периферических рас¬
стройствах кровообращения, сахарном диабете, раке и др. Применение антиагре-
гантов снижает концентрацию р-ТГ, поэтому тест можно использовать в качестве
дополнительного для контроля эффективности лечения этими препаратами,11-дегидротромбоксанХАРАКТЕРИСТИКА СТРУКТУРЫ И СВОЙСТВ ВЕЩЕСТВАТромбоксан А2 — представитель группы простагландинов, синтезируемый в раз¬
личных клетках организма, в том числе и в тромбоцитах. Период полужизни этого
веш;ества составляет около 30 с, поэтому мониторинг продукции тромбоксана А,^
in vivo обычно проводят косвенно, по определению тромбоксана в плазме крови,
или более стабильного метаболита — 11-дегидротромбоксана (11-ДГТ) в моче.РОЛЬ ТРОМБОКСАНА В ФИЗИОЛОГИЧЕСКИХ ПРОЦЕССАХПредшественником тромбоксана как и ряда других простагландинов и лей-
котриенов, служит арахидоновая кислота, накапливаемая в клетках при актива¬
ции фосфолипаз. Под действием циклооксигеназы-1 арахидонат превращается в
короткоживущие простагландины (ПГ G2 и ПГ Н^) и далее — в тромбоксан при
участии тромбоксансинтетазы. Образуемый и высвобождаемый тромбоксан
вызывает быструю необратимую агрегацию тромбоцитов и дополнительный спазм
сосудов малого калибра. При метаболизме этого вещества в печени образуется
тромбоксан В^, далее — 11-ДГТ В^, удаляемый из организма с мочой.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИКонцентрацию 11-ДГТ В^ наиболее часто исследуют в утренней порции мочи.
До ее сдачи пациенту следует избегать стрессов, физических нагрузок, приема
алкоголя, смены режима дня и изменений в питании. Для предупреждения обра¬
зования тромбоксана и его метаболитов in vitro в образцы мочи можно добавлять
ингибиторы простагландинсинтетаз (индометацин). Для дозирования образцов
важно использовать одноразовые наконечники.ИНТЕРФЕРЕНЦИИВ образцах мочи, содержащих лейкоциты и эритроциты, возможно ложное
завышение уровня 11-ДГТ; такие образцы следует отфильтровать либо повторно
772 КОАГУЛОЛОГИМЕСКИЕ ИССЛЕДОВАНИЯцентрифугировать. Другие возможные причины неточностей и ошибок — несо¬
блюдение температурного режима при хранении реагентов и засорение каналов
промывателей.МЕТОДИКИ ИССЛЕДОВАНИЯДля определения 11-ДГТ используют радиоиммунный анализ с меткой а
также твердофазный ИФА. Аналит в исследуемом биоматериале и добавляемый
конъюгат 11-ДГТ с щелочной фосфатазой конкурентно связываются с поликло¬
нальными антителами в лунках микропланшета; после промывки, добавления
хромогенного субстрата, инкубации и остановки реакции определяется степень
окраски, обратно пропорциональная содержанию 11-ДГТ в пробе. При исследо¬
вании мочи во избежание эффекта разведения в ней одновременно определяют
концентрацию креатинина, результат выражают в пересчете на ммоль или грамм
креатинина.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫУ здоровых людей диапазон концентраций 11-ДГТ в моче составляет 40-
240 нг/ммоль креатинина (350-2100 нг/г креатинина). При возможности реко¬
мендуют сформировать контрольную группу и самостоятельно определить диа¬
пазон нормальных значений для каждой лаборатории.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВУровень 11-ДГТ В2 служит наиболее объективным биохимическим показателем
аспиринрезистентности, о чем свидетельствуют высокие значения аналита в моче
на фоне лечения препаратами, содержащими ацетилсалициловую кислоту. О чув¬
ствительности к аспирину может свидетельствовать 50% снижение уровня 11-ДГТ
в моче на фоне приема внутрь 325 мг аспирина* в сутки.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯЗначение определения 11-ДГТ в моче для оценки чувствительности к аспирину*
описано в разделе, посвященном лабораторному контролю антитромботической
терапии. Кроме того, определение 11-ДГТ можно использовать для оценки
активации тромбоцитов при разных заболеваниях. Доказана связь высоких значе¬
ний аналита в моче с развитием осложнений атеросклероза — инфарктов, инсуль¬
тов и др., в том числе у пациентов, получающих антиагрегантную терапию.ПЛАЗМЕННОЕ ЗВЕНО ГЕМОСТАЗА
Принципы клоттинговых и хромогенных методовДля оценки плазменной системы гемостаза в КДЛ коагулологическое исследо¬
вание выполняют в основном двумя методами — хромогенным и клоттинговым.хромогенные методы основаны на образовании окрашенных продуктов.
Принцип реакции с применением хромогенньгх субстратов в коагулологии состо¬
ит в том, что синтетический пептид (или хромогенный субстрат) добавляют в
реакционную пробу, он взаимодействует со специфическим ферментом (например,
фактором свертывания), краситель высвобождается, и его количество измеряют
фотометрически. По количеству высвободившегося красителя (интенсивности
окраски) определяют активность искомого фактора. Фотометрию проводят в
интервале длин волн 405-410 нм на фотометрах. Выполнение таких исследований
ручными методами без соответствующего оборудования невозможно.Наиболее распространенный тест с применением хромогенных субстратов —
определение активности антитромбина ІП. плазминогена, протеина С, анти-Ха,
активности гепарина (наборы выпускаются отечественными производителями:
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 773НПО «Ренам», ООО «Технология-Стандарт»). Существуют диагностические набо¬
ры для научно-исследовательской практики на определение ингибитора актива¬
тора плазминогена (ИАП), ингибитора плазмина, растворимого фибриногена,
фактора ХПа, хемотрипсина, фактора X, гранулоцитарной эластазы, активности
ингибитора калликреина, калликреина плазмы и его активатора, трипсина и уро-
киназы.Методы исследования с использованием хромогенных субстратов имеют огра¬
ничения вследствие:• отсутствия субстратов для определения всех факторов свертывания;• относительной сложности и трудоемкости выполнения методик;• низкой селективности синтетических хромогенных субстратов (могут реаги¬
ровать с другими протеазами плазмы крови);• влияния большого количества внешних факторов на протекание реакции;• высокой стоимости анализа.Тем не менее определение активности фактора свертывания более значимо, чем
измерение его количества или массы.Клоттинговые (от англ. clot — сгусток) методы основаны на измерении про¬
межутка времени с момента внесения реагента, запускающего ферментативный
процесс свертывания плазмы (каскад реакций), до момента коагуляции — обра¬
зования фибринового сгустка (нитей фибрина). Б зависимости от присутствия в
реакционной пробе тех или иных активаторов или ингибиторов, добавляемых при
исследовании, оценивают активность того или иного фактора свертывания либо
отдельных звеньев (путей) плазменного гемостаза. Клоттинговые методы наибо¬
лее распространены, поскольку характеризуются:• простотой и легкостью выполнения;• определенной стандартизированностью;• коротким временем выполнения;• доступностью специализированных наборов реагентов;• низкими затратами на исследование;• моделированием физиологических механизмов образования сгустка (тромба).При скрининговых исследованиях системы гемостаза применяют клоттинговыеметоды — протромбиновый тест (ИВ, МНО, процент по Квику), концентрация
фибриногена (по Клаусу, в г/л), активированное частичное тромбопластиковое
время (АЧТВ), тромбиновое время (ТВ), а также при расширенном обследова¬
нии — активность факторов II, V, VII, VIII, IX, X, XI, XII, активность антитромбина,
активность системы протеина С.Основными элементами коагулологического анализа являются:• дозирование плазмы;• дозирование реагентов;• измерение времени образования фибринового сгустка (для клоттинговых
методов) или фотометрирование (для хромогенных методов).Для измерения времени образования сгустка в клоттинговых тестах используют
приборы, называемые коаіулометрами, анализаторами свертывания крови (АСК)
или анализаторами показателей гемостаза (АПГ). Они бывают полуавтоматически¬
ми и автоматическими. В автоматических коагулометрах все элементы аналитиче¬
ского процесса выполняются без участия человека. В полуавтоматических анализа¬
торах дозирование плазмы и реагентов осуществляет лаборант, а измерение времени
образования сгустка и расчеты результатов анализа выполняет прибор.В некоторых лабораториях исследования системы гемостаза выполняют руч¬
ными методами с применением водяной бани (термостата с прозрачными стен¬
ками), все элементы аналитического процесса выполняет вручную лаборант.
Ручные методы не позволяют обеспечить современные требования, предъявляе¬
мые к точности биомедицинских измерений, об этом свидетельствует статистика
774КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯФедеральной системы внешней оценки качества. В связи с индивидуальными,
не повторяющимися свойствами глаза визуальные измерения субъективны и
характеризуются относительно большим количеством ошибок. Человеческий глаз
быстро устает, поэтому при выполнении множества серий точность измерения
непрерывно уменьшается. Кроме того, производительность таких исследований
крайне мала.Основополагающим различием в принципе действия коагулометров считает¬
ся механизм, предназначенный для регистрации времени образования сгустка
фибрина в тестируемой смеси. В основе регистрации момента выпадения сгустка
в коагулометрах используется несколько принципов: механический, оптический
(турбидиметрический или нефелометрический), оптико-механический (комбина¬
ция оптического и механического методов). На основе этого различия выделяют
оптические, механические и оптико-механические типы коагулометров.В коагулометрах с механическим принципом регистрации система детекции
образования сгустка основана на слежении за изменением движения металли¬
ческого предмета внутри измерительной кюветы. За длительность коагуляции
исследуемой пробы принимается промежуток времени с момента введения в пробу
реагента-коагулянта и начала движения шарика до момента его остановки обра¬
зовавшимся в ходе реакции сгустком. Анализаторы с механическим принципом
регистрации: Thrombostat 2 (Beknk Elektronik, Германия), CL4 {Behnk Elektronik,
Германия), STart 4 {Roche Diagnostics, Швейцария). Коагулометры с механическим
принципом регистрации сгустка характеризуются высокой надежностью и про¬
стотой в обслуживании. Неоспоримым преимуществом таких коагулометров счи¬
тается возможность исследования капиллярной крови, что остается актуальным
в педиатрической практике и при массовом скрининговом обследовании. Однако
при регистрации времени свертывания в крови ряда больных точность такого
исследования существенно ниже, чем при определении времени свертывания
в плазме, так как оказывает влияние величина гематокрита. В коагулометрах с
механическим принципом регистрации сгустка отсутствует автоматический запуск
отсчета времени измерения при внесении стартового реагента (функция автостар¬
та). Для запуска реакции необходим дополнительный дозатор (стартовая пипет¬
ка), соединяемый с коагулометром с помощью кабеля. Кабель снижает удобство
эксплуатации. Основные проблемы применения коагулометров с механическим
методом регистрации связаны с низкой плотностью образующегося сгустка при
различных видах дисфибриногенемий или малых количествах фибриногена в
пробе. В этих случаях, например при гепаринотерапии (концентрация фибрино¬
гена — менее 0,7 г/л), образовавшийся неплотный сгусток часто не может сразу
остановить шарик, результаты получаются плоховоспроизводимыми.В коагулометрах с оптическим принципом регистрации фибринового сгустка
момент свертывания крови определяется по резкому изменению светопропускания
(турбидиметрия) или рассеивания (нефелометрия) реакционной смеси на запро¬
граммированную величину. За длительность коагуляции исследуемой пробы при¬
нимается промежуток времени с момента введения в пробу коагулянта до момента
резкого изменения оптических свойств пробы при образовании нитей фибрина.
Обычно в оптических коагулометрах в измерительной кювете используется
мешалка, с помощью которой достигается гомогенность перемешивания пробы
и реагента, что способствует хорошей повторяемости измерений. Основным пре¬
имуществом оптических систем измерения считается высокая чувствительность,
характери.зуемая способностью регистрировать образование неплотного сгустка,
что бывает при приеме пациентами антикоагулянтов, а также в случаях коагуло-
патий (при низких концентрациях фибриногена, вплоть до 0,5-0,6 г/л). Почти у
всех коагулометров с оптическим типом регистрации старт времени коагуляции
происходит автоматически в ответ на изменение оптической плотности после
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 775добавления стартового реагента. Оптические системы имеют недостаток — требу¬
ется применение оптически прозрачных реактивов, они не позволяют проводить
исследования с цельной кровью.Оптико-механический принцип регистрации образования фибринового сгустка
делает коагулометры универсальными: их можно использовать при работе как
с цельной кровью» так и с плазмой в различных разведениях и с применением
любых реактивов, в том числе непрозрачных.Существуют автоматические анализаторы, способные выполнять как клоттин-
говые, так и хромогенные исследования. Широкое применение таких приборов
сдерживается нецелесообразностью их применения в мелких и средних лабора¬
ториях.С каждым годом растет количество людей, принимающих оральные анти¬
коагулянты. Принимать антикоагулянты приходится в течение длительного вре¬
мени. Сложности, связанные с эффективным подбором дозы, индивидуальной
переносимостью препаратов, влиянием лекарственных средств, некоторых про¬
дуктов питания на свертывание, требуют частого измерения МНО. Для решения
этой задачи существуют портативные коагулологические анализаторы (ш point of
care testing — диагностика в месте наблюдения или у постели больного, или так
называемые МНО-детекторы — устройства, позволяющие осуществлять контроль
МНО в домашних условиях.Наиболее частые и распространенные технические ошибки, возникающие при
выполнении коагулологического анализа:• неправильное взятие проб крови, при котором уже произошла активация
процесса свертывания;• неправильное соотношение объемов крови и антикоагулянта;• неправильный выбор антикоагулянта (подходит только цитрат натрия 3,8%
или 0,0025 М раствор);• попадание в пробу гепарина;• неправильная температура термостатирования при проведении клоттинго-
вых и хромогенных тестов;• использование несиликонизированной стеклянной посуды или многократное
использование пластиковой одноразовой посуды (активация свертывания);• использование для мытья посуды детергентов, влияющих на свертывание
плазмы-МЕТОДЫ ИССЛЕДОВАНИЯ КОАГУЛЯЦИОННОГО ГЕМОСТАЗА
Время свертывания цельной крови по Ли-УайтуКонтакт крови с поврежденной сосудистой стенкой или чужеродной поверхно¬
стью, замедление и остановка кровотока (стаз) приводят к последовательной акти¬
вации звеньев гемостаза: адгезии и агрегации тромбоцитов, каскадной активации
плазменных белковых факторов, формированию протромбиназы, образованию
тромбина, а затем фибринового сгустка, изолирующего поврежденное место и
способствующего ускорению регенеративных процессов.ХАРАКТЕРИСТИКА ТЕСТАВремя свертывания крови (ВСК) — время образования сгустка свежевзятой
нестабилизированной венозной крови в стеклянной пробирке.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИСпециальной подготовки пациента не требуется. Во избежание погрешностей в
результатах теста при взятии венозной крови необходимо избегать массажа пред-
776 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯплечья, немедленно расслабить жгут после появления крови и выпустить первые
ее капли, содержащие фрагменты поврежденных тканей, на ватный/марлевый
тампон.МЕТОДИКА ИССЛЕДОВАНИЯПосле обработки спиртом и высушивания области локтевого сгиба в локтевую
вену вводят сух)то широкую иглу без шприца. В сухую стеклянную несиликониро-
ванную пробирку набирают 1 мл крови, запуская секундомер сразу при ее попада¬
нии. Исследование проводят при температуре 20-25 °С. Через 2 мин после взятия
крови, а затем каждые 30 с пробирку осторожно наклоняют под углом 45-60°
и определяют, растекается ли кровь по стенкам. Секундомер останавливают по
завершении образования сгустка (кровь не переливается при наклоне пробирки).РЕФЕРЕНТНЫЕ ПРЕДЕЛЫВремя свертывания цельной крови при комнатной температуре -6-11 мин.
В связи со значительным влиянием интерферирующих факторов (температуры,
состояния стенок пробирки и иглы, частоты и амплитуды наклона пробирки, объе¬
ма крови и особенностей процедуры ее взятия) разброс результатов теста даже при
точном соблюдении условий довольно велик. Тест ориентировочный, для него не
существует калибровочных и контрольных материалов,ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВВозрастание ВСК свидетельствует о гипокоагуляционных сдвигах: выражен¬
ном дефиците фибриногена и плазменных факторов внутреннего пути гемостаза,
действии антикоагулянтов (гепарина* и др.), значительной гемодилюции, гипо-
коагуляционной фазе диссеминированного внутрисосудистого свертывания (ДВС)
крови и др. Понижение (менее 4-6 мин) клинически малоинформативно; можно
предположить гиперактивацию плазменных факторов или нарушение реологиче¬
ских свойств крови, но чаще укорочение ВСК связано с нарушением техники взятия
крови (травматичностью процедуры) или тромбоцитозом. Для дифференцировки
требуется проведение скрининговых (оценочных) коагулологических тестов.Время свертывания крови активированное (ВСКа)Действие каолина при выполнении теста считается аналогичным появлению
в кровотоке контактной поверхности - коллагена субэндотелия, искусственных
клапанов сердца, протезированных сосудов, магистралей аппаратов для экстра¬
корпоральных методов лечения и т.д. При этом происходят последовательная
каскадная активация плазменных белковых факторов внутреннего пути гемостаза,
образование тромбина и формирование фибринового сгустка.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИОсновная задача при взятии крови — минимальное травмирование тканей,
чтобы не спровоцировать высвобождение тканевого фактора. При взятии капил¬
лярной крови желательно пользоваться стандартным ланцетом с круглой иглой,
минимально травмирующей ткани при проколе. Во избежание искажения резуль¬
татов нельзя вьщавливать кровь из пальца.МЕТОДИКА ИССЛЕДОВАНИЯТест выполняют на специальных коагулометрах для цельной крови с одно¬
разовыми картриджами, содержащими стандартное количество активатора кон¬
тактной фазы - каолина. Б некоторых картриджах, кроме каолина, содержится
инактиватор гепарина, исключающий его влияние на результаты теста. Кровь
собирают в картридж прибора с помощью специальной пипетки или капилляра и
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 777быстро перемешивают; дальнейшая процедзфа определения идет автоматически.
Момент образования сгустка определяется по изменению сопротивления между
электродами, контактирующими с кровью, и образующимся сгустком (электро¬
метрическое определение) или по затруднению вращения пластикового флажка в
кювете (механический коагулометр).РЕФЕРЕНТНЫЕ ПРЕДЕЛЫВ большинстве приборов результат колеблется в пределах 80-120 с, зависит от
серии картриджей, условий их хранения и использования, количества и свойств
каолина, интенсивности и полноты перемешивания крови с каолином, типа реги¬
стратора, температуры. В связи со стандартизацией контактной активации сверты¬
вания разброс результатов существенно меньший по сравнению с тестом ВСК.ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАДля теста нет калибровочных и контрольных материалов (контрольной цель¬
ной крови), О качестве анализа можно приближенно судить по результатам иссле¬
дования венозной или капиллярной крови нескольких здоровых людей.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВУвеличение ВСКа свидетельствует о гипокоаіуляционньїх сдвигах — дефиците
или инактивации плазменных факторов, циркуляции антикоагулянтов (гепарина*
и др.), выраженной гемодилюции, гипокоагуляционной фазе ДВС крови, а также
возможно при тромбоцитопении. Уменьшение ВСКа может наблюдаться при
гиперактивации плазменных факторов, но оно не является основанием для окон¬
чательного вывода о состоянии гиперкоагуляции и принятия терапевтических мер
(необходимы дополнительные исследования).КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯВ основном определение ВСКа проводят для контроля и регулирования уров¬
ня гепаринизации пациента во время работы искусственных органов (аппаратов
искусственного кровообращения, искусственной почки, печени, гемосорбции),
расчета нейтрализующей дозы протамина сульфата и оценки полноты нейтрали¬
зации гепарина*. Достоинством метода является возможность исследования непо¬
средственно у постели больного или в операционной (poin of саге — диагностика
по месту лечения), а также относительная быстрота выявления больных, рези¬
стентных к гепарину*, когда для достижения оптимального эффекта приходится
вводить повышенные дозы препарата.Каолиновое времяХАРАКТЕРИСТИКА ТЕСТАОпределяют время свертывания бедной тромбоцитами цитратной плазмы при
37 °С после стандартной активации контактной фазы каолином (цеолитом) и рекаль¬
цификации (восстановления физиологической концентрации ионов Ca^^ ранее свя¬
занных цитратом при взятии крови). Матрицей для сборки ферментных комплексов
коагуляции служат оставшиеся в плазме после центрифугирования тромбоциты паци¬
ента и фрагменты фосфолипидных мембран, но их недостаточно для полноценного
протекания коагуляционных реакций. Именно поэтому тест, помимо коагуляционных
факторов, чувствителен к количеству фосфолипидных образований в плазме и их
свойствам, а также к присутствию антифосфолипидных антител.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИСоблюдают общие условия взятия венозной крови для исследования гемоста¬
за: накладывают жгут не более чем на 1 мин, используют одноразовые острые
778 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯиглы достаточного диаметра, расслабляют жгут после появления крови из иглы и
выпускают первые капли на ватный тампон. Кровь берутг в пробирку с 3,2% рас¬
твором цитрата натрия в соотношении 9:1 и немедленно перемешивают. Более
предпочтительны вакуумные системы для взятия крови, содержащие цитрат; их
содержимое перемешивают четырехкратным переворачиванием. Пробирки с
ци гратной кровью центрифугируют при 1500-2000 g в течение 15 мин и осторож¬
но отбирают супернатант — бедную тромбоцитами плазму (БТП). Хранить БТП до
исследования лучше в пластиковых пробирках и непосредственно перед анализом
перемешать.МЕТОДИКА ИССЛЕДОВАНИЯК бедной тромбоцитами плазме добавляют суспензию каолина, прогревают при
37 ‘'С, вносят раствор кальция хлорида и запускают секундомер (или начинают
измерение на коагулометре). Определяют время образования фибринового сгуст¬
ка на коагулометре (предпочтительно) или периодически наклоняя пробирку в
водяной бане. Рекомендуют усреднять показатели двух определений одной и той
же плазмы.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫРезультат колеблется в пределах 65-90 с.ИНТЕРФЕРЕНЦИИНа результаты теста сильно влияют условия центрифугирования крови (от
них зависит остаточное количество тромбоцитов), а также количество и свойства
добавляемого каолина.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВЗначения каолинового времени свыше 90 с могут свидетельствовать о гипокоа¬
гуляции — дефиците плазменных факторов (XII, XI, IX, VIII, X, V, II, фибриноге¬
на), гипокоагуляционной фазе ДВС крови, выраженной гемодилюции, циркуля¬
ции антикоагулянтов (гепарина* и др.) или наличии ингибиторов плазменных
факторов и антифосфолипидных антител. Каолиновое время менее 65 с часто
бывает связано с нарушением условий центрифугирования или взмучиванием
осадка при отборе супернатанта. Кроме того, аналогичные сдвиги возможны при
гиперактивации плазменных факторов (в гиперкоагуляционной фазе ДВС крови),
недостатке естественных антикоагулянтов и др.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯТест каолинового времени, выполняемый на бедной тромбоцитами плазме,
сохранил свое значение лишь при определении волчаночного антикоагулянта; в
других случаях желательно выполнение более информативного теста АЧТВ, даю¬
щего меньший разброс результатов.Активированное частичное (парциальное)
тромбопластиновое время (АЧТВ)ХАРАКТЕРИСТИКА ТЕСТАОпределяют время свертывания бедной тромбоцитами цитратной плазмы
при физиологической температуре (37 °С), в условиях стандартной активации
контактной фазы, в присутствии фосфолипидов и при добавлении ионов Са^'.
Заменителем тромбоцитарной фосфолипидной матрицы для сборки коагуляцион-
ных ферментных комплексов служат фосфолипиды мозга, эритроцитов или сои,
заменителем активационной контактной поверхности — каолин или эллаговая
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 779кислота. Благодаря отсутствию тромбоцитов в плазме и добавлению их замените¬
ля — парциального тромбопластина — на результаты теста (АЧТВ) практически не
влияют тромбоцитарные факторы. Возможно определение АЧТВ на портативных
коагулометрах со специализированными картриджами. Иногда тест обозначают
как активированное парциальное тромбопластиновое время (АПТВ), что является
аналогом АЧТВ.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИСоблюдают общие условия взятия венозной крови для исследования гемостаза
(с добавлением цитрата) и получения бедной тромбоцитами плазмы. Параметры
АЧТВ стабильны до 4 ч при комнатной температуре; при лечении гепарином*
исследование необходимо провести в течение 1 ч после взятия материала.
Возможно хранение замороженной бедной тромбоцитами плазмы до 10-20 дней
(АЧТВ меняется мало), но допустимо лишь однократное размораживание.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫСоставляют 20-45 с. Результаты теста АЧТВ зависят от точности соотношения
кровь/цитрат, вида и свойств фосфолипидного компонента и каолина (или элла-
говой кислоты), температуры, а также от способа регистрации результатов, типа и
чувствительности прибора, вида и активности реагентов, а также от типа оборудо¬
вания. Каждой лаборатории рекомендуют определить свои, локальные значения
нормы.Для снижения влияния интерферирующих факторов возможна оценка резуль¬
тата в виде индекса АЧТВ, диапазон нормальных значений которого составляет
0,8-1,2:индекс АЧТВ = АЧТВ пациента / АЧТВ контрольной нормальной плазмы.Возможные варианты контрольной плазмы для расчета индекса АЧТВ• Смесь плазм не менее чем от 10 здоровых людей, полученных в тех же услови¬
ях, что и плазма пациента (это проблематично для небольших лабораторий).
Кроме того, обычно не бывает з^веренности в том, что эти люди здоровы.• Лиофилизированная референтная нормальная пулированная плазма (РНП-
плазма), которую следует разводить за 30 мин до исследования. Лучше,
чтобы плазма была заранее протестирована на данном виде прибора и реко¬
мендована производителем оборудования в качестве референтной.• Оптимальный вариант — перекалибровка конкретного типа прибора для
определенных видов реагентов и плазм, используемых в лаборатории (так
поступают крупные производители лабораторного оборудования). В этом
случае для расчетов индекса АЧТВ можно использовать результат измерения
аттестованной контрольной плазмы нормального уровня.ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАСтандартный контрольный материал ВОЗ для теста АЧТВ отсутствует, посколь¬
ку при определении используют различные реагенты и приборы разной чувстви¬
тельности. В коагуляционных исследованиях желательно соблюдать рекомен¬
дации производителя оборудования для выбора контрольных материалов. Для
контроля качества чаще используют свежеразведенную референтную нормальную
пулированную плазму (РНП-плазму, срок годности — 2-4 ч после разведения
лиофилизированного препарата) с аттестованным значением АЧТВ. Смешанная
бедная тромбоцитами плазма от нескольких здоровых людей (годна в течение4-6 ч с момента получения) может быть использована для оценки сходимости и
воспроизводимости или как вторичный стандарт. Разброс результатов при иссле¬
довании одного образца плазмы и использовании реактивов одной серии не дол¬
жен превышать 10%.
780 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯНельзя исследовать плазму, имеющую сгустки или следы гемолиза, поскольку
из-за активации гемостаза АЧТВ такой пробы может быть уменьшено. При нали¬
чии в исследуемой плазме гепарина* АЧТВ может значительно удлиняться — до
300 с и более, вплоть до полного несвертывания. Антикоагулянт может попасть
в пробу при получении крови из катетера (что крайне нежелательно) или при
системном использовании гепарина*. В том случае, когда избежать попадания
гепарина* в пробу невозможно, для исключения эффекта антикоагулянта исполь¬
зуют АЧТВ-реагент с инактиватором гепарина либо плазму предварительно обра¬
батывают сорбентом гепарина и центрифугируют, сливая ее с осадка.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВУдлинение АЧТВ может свидетельствовать:• о врожденном или приобретенном снижении количества/активности фак¬
торов внутреннего пути гемостаза (XII, XI, IX, VIII, X, V, II, фибриногена),
реже — фактора фон Виллебранда. Снижение факторов IX, X и II возможно,
в частности, при лечении непрямыми антикоагулянтами;• об избытке в пробе цитрата ~ абсолютном (слишком большое количество
добавленного цитрата) или относительном (неполное заполнение кровью
пробирки со стандартным количеством цитрата);• о наличии в пробе гепарина* (при введении пациенту или попадании из кате¬
тера) или гирудина:• о наличии в пробе некоторых инфузионных препаратов (декстранов);• о наличии в пробе продуктов деградации фибрина/фибриногена, патологи¬
ческих ингибиторов плазменных факторов или антикоагулянтов волчаноч-
ного типа.Уменьшение АЧТВ клинического значения не имеет, поскольку часто бывает
связано с погрешностями взятия и обработки крови. Диагностика гиперкоагуля-
ционных состояний должна основываться на определении маркеров активации
гемостаза и оценке конкретной клинической ситуации.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯТест АЧТВ — один из базовых методов исследования коагуляционных свойств
плазмы, выявляющий сдвиги внутреннего пути активации свертывания (кли¬
ническое значение имеет удлинение АЧТВ). Определение АЧТВ проводят для
первичного выявления гипокоагуляционных сдвигов, диагностики гемофилии и
мониторинга состояния больных с нарушениями свертывания крови, при ДВС,
для контроля гепаринотерапии, выявления патологических ингибиторов. При
диагностике антифосфолипид ного синдрома для определения волчаночного анти-
коагулянта используют так называемый люпус-чувствительный АЧТВ-реагент со
сниженным содержанием фосфолипидов.Коррекционные пробы по тесту АЧТВХАРАКТЕРИСТИКА ТЕСТАОпределяют АЧТВ смеси исследуемой плазмы с нормальной донорской плазмой
либо плазмой, дефицитной по отдельным факторам свертывания. Пробы позво¬
ляют разграничить причину удлинения АЧТВ ~ дефицит/дисфункцию факторов
свертывания (с определением конкретного недостающего фактора) или наличие
ингибиторов свертывания.МЕТОДИКА ИССЛЕДОВАНИЯПеред выполнением проб необходимо определение АЧТВ исследуемой плазмы;
коррекцию проводят лишь при его удлинении. Отдельную порцию тестируемой
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 781плазмы смешивают в соотношении по объему 1:1 со свежей нормальной пулиро-
ванной донорской плазмой или свежеразведенной РНП-плазмой (либо плазмой,
дефицитной по отдельным факторам) и повторяют определение АЧТВ.ИНТЕРФЕРЕНЦИИНа результаты проб может влиять присутствие в тестируемых образцах прямых
антикоагулянтов (гепарина и гирудина).ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВПри наличии в исследуемой пробе ингибиторов свертывания (волчаночного
антикоагулянта, ингибиторов факторов VIII и IX) добавка нормальной плазмы не
приводит к нормализации АЧТВ. При дефиците факторов в исследуемой плазме
недостающие вещества вносят в составе добавки нормальной плазмы, после чего
удлиненное АЧТВ становится нормальным. Добавляя субстратную плазму, дефи¬
цитную по отдельным факторам, можно определить конкретный недостающий
фактор; при добавке плазмы, дефицитной именно по этому фактору, АЧТВ не при¬
ходит к норме, в то время как дефицитные плазмы по другим факторам вызывают
нормализацию параметра.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯС помощью коррекционных проб по тесту АЧТВ выявляют дефицит факторов
внутреннего пути гемостаза и/или наличие их ингибиторов (диагностика врож¬
денной и ингибиторной гемофилии, антифосфолипидного синдрома). Основные
причины удлинения АЧТВ представлены в табл. 11-4.Таблица 11-4. Основные причины удлинения АЧТВ у пациентаПричинаУдлинение АЧТВИзолированная или множественная недостаточность
факторов внутреннего пути гемостаза {фибриноген,
протромбин, факторы V. VIII, IX, X, XI), действие ингиби¬
торных антителУмеренное — до 1,5-2 раз.Выраженное — более 2 раз.Выраженное удлинение АЧТВ может сопрово¬
ждаться кровоточивостьюДефицит контактных факторов (XII, прекалликреин,
высокомолекулярный кининоген)Чаще умеренное, не сопровождается кровото¬
чивостьюНаличие волчаночного антикоагулянтаУмеренное, может сопровождаться тромбозамиДействие нефракционированного гепаринаЗависит от дозы (этот факт
используется в мониторинге терапии)Протромбиновое время (ПВ)ХАРАКТЕРИСТИКА ТЕСТАИсследование протромбинового времени (ПВ) представляет важнейший (наряду
с АЧТВ) скрининговый тест для оценки системы свертывания крови. Определяют
время образования фибринового сгустка в бедной тромбоцитами цитратной плаз¬
ме при активации внешнего пути гемостаза тканевым тромбопластином, содер¬
жащим тканевый фактор и фосфолипиды, в присутствии ионов Са^"^ при 37 "С.
Источником тромбопластина могут быть эритроциты, ткани мозга или другие
ткани; может бьггь использован и рекомбинантный тромбопластин. Возможно
определение ПВ цельной крови на портативных коагулометрах со специальными
картриджами.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИСоблюдают общие условия взятия венозной крови для исследования гемостаза.
Оптимальным является исследование венозной крови. Капиллярная кровь менее
пригодна для определения ПВ, поскольку содержит непредсказуемое количество
782 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯтканевого фактора, попадающего в нее при проколе пальца, что создает опреде¬
ленные проблемы (в частности, в педиатрии). Капиллярную кровь имеет смысл
исследовать при наличии специальных портативных коагулометров, в которых
время образования сгустка выражается в пересчете на эквивалент венозной крови
и используются картриджи с реагентами, сводящими к минимуму влияние «соб¬
ственного» тканевого фактора. Кровь из пальца берут непосредственно перед
анализом, избегая давления на мягкие ткани; первую каплю удаляют ватным там¬
поном. Взятую кровь смешивают с 3,8% раствором цитрата натрия в соотношении
9:1, капилляр для взятия предварительно промывают тем же раствором цитрата.Результаты теста ПВ остаются стабильными до 24-48 ч при хранении венозной
крови с цитратом при комнатной температуре в закрытых первичных вакуумных
пробирках. При работе с открытыми пробирками требуется отделить плазму от
клеток в течение 60 мин и провести определение ПВ в течение 2-4 ч после взятия
крови. Полученную плазму до исследования хранят при комнатной температуре:
охлаждение до 4 °С более чем на 24 ч может привести к Холодовой активации фак¬
тора VII и уменьшению ПВ.МЕТОДИКА ИССЛЕДОВАНИЯИсследуемую плазму прогревают до 37 °С, вносят тромбопластиновый реагент с
кальция хлоридом и определяют время образования фибринового сгустка (на коа-
гулометре или вручную), при определении ПВ капиллярной крови используют тот
же принцип, но применяют реагенты с иной концентрацией действующих веществ,
а измерение проводят вручную или на коагулометре с механическим принципом
регистрации (желательно в параллельных пробах с вычислением среднего резуль¬
тата).МЕТОДЫ ОЦЕНКИ РЕЗУЛЬТАТОВ ТЕСТА ПРОТРОМБИНОВОГО ВРЕМЕНИ
Протромбиновая активность плазмы по КвикуТест основан на расчетах по калибровочному графику, отражающему зави¬
симость активности протромбинового комплекса (т.е. значения ПВ) от степени
разведения нормальной плазмы, выраженной в процентах. Для построения
калибровочного графика определяют ПВ неразведенной свежей нормальной
пулированной плазмы (100%) и ее 50, 25 и 12,5% разведений. Некоторые иссле¬
дователи считают нецелесообразным разведение 12,5% из-за снижения содержа¬
ния фибриногена. Результаты откладывают на координатной сетке и соединяют
линией.При тестировании плазмы пациента измеряют значение ПВ и по калибровочно¬
му графику определяют процент протромбина по Квику, отражающий активность
факторов протромбинового комплекса в процентах к плазме здоровых людей.
Современные коагулометры автоматически рассчитывают этот показатель исходя
из результатов определения ПВ в плазме пациента и разведениях контрольной
плазмы.Протромбиновая активность плазмы по Овренукроме теста Квика, при оценке действия непрямых антикоагулянтов возмож¬
но исследование плазмы по Оврену. В нем используют реагенты с добавлением
адсорбированной бычьей плазмы, содержащей фактор V и фибриноген, что
позволяет исключить влияние этих двух компонентов на результаты теста и
исследовать активность других факторов протромбинового комплекса (VII, X и II).
При этом образцы исследуемых плазм остаются стабильными более длительное
время, так как метод оказывается не зависимым от активности термолабильного
фактора V, Сравнительная характеристика методик по Квику и Оврену приведена
в табл. 11-5.
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 783Таблица 11-5. Отличия методик исследования ПВ по Квику и ОвренуОсобенности методикиПВ ло КвикуПВ по ОвренуРазведение пробыНет1:6Состав реактизаТромбе пластин, каль¬
ция хлоридТромбопластин, кальция хлорид, адсорбиро¬
ванная бычья плазмаКонечное разведение плазмы1:2 или 1:31:20Специфичность тестаК факторам II,
X, V, IТолько к факторам II, VII, X (за снет стандарт¬
ных количеств факторов V и I)Расчетные показатели на основе ПВДля снижения влияния интерферирующих факторов рекомендуют одновремен¬
но определять ПВ исследуемой пробы и референтной нормальной пулированной
плазмы, а оценку результата проводить в виде отношений ПВ. Современные
коагулометры и анализаторы гемостаза автоматически рассчитывают показатели
исходя из результатов определения ПВ в пробе пациента и нормальной плазме.• Протромбиновое отношение (ПО):ПО = ПВ пациента / ПВ нормальной плазмы.• Показатель ПО имеет прямую логическую связь с изменениями ПВ плазмы
пациента (удлинение ПВ влечет за собой увеличение ПО). Вместе с тем на
результаты определения ПО влияет чувствительность конкретного использу¬
емого тромбонласгина к недостатку факторов внешнего пути (VII, X, V и II),
что может привести к несопоставимости данных, полученных с разными
партиями реагента.• Прием антикоагулянтов непрямого действия приводит к удлинению про-
тромбинового времени, однако измеренная степень его удлинения суще¬
ственно колеблется в зависимости от используемого тромбопластинового
реагента. Б связи с этим Комитет по стандартизации в гематологии ВОЗ в
1983 г. принял стандартизированный показатель — международное нор¬
мализованное отношение (МНО), который рассчитывают при контроле
лечения непрямыми антикоагулянтами (когда недопустимы колебания пока¬
зателей протромбинового теста в зависимости от применяемых реагентов).
МНО вычисляют исходя из протромбинового отношения и международного
индекса чувствительности (МИЧ) используемого тромбопластина к нехватке
факторов протромбинового комплекса:МНО - ПОми'1.• МИЧ для каждой серии реагента обозначается на его упаковке и обычно
составляет от 1,0 до 1,6 (более низкое значение предпочтительнее). При исполь¬
зовании тромбопластина, не аттестованного по МИЧ, расчет МНО невозмо¬
жен: в этом случае определяют протромбиновуго активность по Квику.• При определении МНО в пробе капиллярной крови вследствие влияния
форменных элементов крови результат получается менее надежным по срав¬
нению с анализом плазмы, поэтому без использования специальных порта¬
тивных коагулометров выполнять это исследование не рекомендуют.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫПВ=10-20 с (зависит от типа реагента и условий определения). Доля про¬
тромбина по Квику составляет 60-130% (зависит от препарата тромбопластина);
некоторые производители указывают только нижнюю границу нормы (например,
более 70%), подчеркивая, что уменьшение ПВ и повышение процента протромби¬
на клинического значения не имеют.
1784 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯПО=0,85-1,2. Референтные значения для МНО указывать некорректно, так как
этот показатель должен исследоваться у больных, принимающих антикоагулянты
непрямого действия; терапевтический интервал МНО выбирают в зависимости от
показаний к назначению препаратов (см. раздел «Лабораторный контроль анти-
тромботической терапии»).ИНТЕРФЕРЕНЦИИРезультаты теста ПВ зависят от объема взятой крови по отношению к количе¬
ству цитрата в пробирке, активности препарата тромбопластина и его чувствитель¬
ности к недостатку факторов VII, X, V и II, а также от температуры. При наличии
гепарина* в исследуемом образце ПВ может значительно удлиняться - до 40 с
и более; для исключения такого влияния плазму предварительно обрабатывают
сорбентом гепарина и центрифугируют.ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАВ тесте Квика калибровочный график строят для каждой новой серии исследо¬
ваний (на одни сутки) и каждой новой серии тромбопластинового реагента. Для
обеспечения корректности результатов во всех случаях используют только свежую
пулированную плазму от здоровых доноров или свежеразведенную нормальную
плазму, для контроля качества — РНП-плазму. Стандартный контрольный мате¬
риал ВОЗ для теста ПВ отсутствует, поскольку используют различные реагенты
и приборы разной чувствительности, однако производители, как правило, пред¬
лагают контрольные плазмы для конкретных условий (реагенты/оборудование).
Для оценки воспроизводимости и сходимости может быть использована свежая
смешанная плазма от нескольких здоровых доноров (не менее 10) или свежераз-
веденная лиофилизированная нормальная пулированная плазма (РНП-плазма),
срок их годности - 2-4 ч с момента получения или 2 ч после разведения лиофи-
лизированного препарата соответственно. Для повышения точности рекомендуют
проводоть определение на коагулометре; при исследовании параллельных проб
разброс результатов ПВ не должен превышать 1 с.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВУвеличение ПВ (ПО, МНО) или снижение процента протромбина по Квику
может быть связано с врожденным (редко) или приобретенным снижением
активности либо дефицитом факторов внешнего пути активации свертывания
или (реже) наличием их ингибиторов. Это возможно при заболеваниях печени,
коагулопатиях потребления (ДВС крови) и потерях факторов, дефиците вита¬
мина К, приеме некоторых лекарственных препаратов (особенно антагонистов
витамина К). При достаточном содержании факторов удлинение ПВ возможно
при снижении содержания фибриногена менее 1,5-1,0 г/л, а также под действием
прямых антикоагулянтов (гепарина* и др.), но в последнем случае тест ПВ менее
чувствителен по сравнению с АЧТВ.Уменьшение ПВ (ПО, МНО) или возрастание процента протромбина по Квику
не имеют клинического значения, хотя и способны отражать гиперактивность
факторов внешнего пути (в том числе при нарушениях процедуры взятия крови).КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯТест ПВ — один из базовых методов исследования коагуляционных свойств
плазмы и цельной крови. Определение ПВ используют для контроля лечения
антикоагулянтами непрямого действия, выявления изменений количества и актив¬
ности факторов протромбинового комплекса (VII, X, V и II) и оценки белоксинте-
зирующей функции печени. Значительное возрастание ПВ (МНО) часто связано с
риском кровотечений.
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 785ОЦЕНКА РЕЗУЛЬТАТОВ СКРИНИНГОВЫХ КОАГУЛЯЦИОННЫХ ТЕСТОВИзолированное удлинение АЧТВ:• в согетпант с кровотогивостью — недостаточность/дефект факторов VIII, IX,XI (табл. 11-6);• при отсутствии кровотогивости — недостаточность/дефект факторов XII, XI,
высокомолекул5фного кининогена, присутствие волчаночного антикоагулянта.Изолированное удлинение ПВ:• недостаточность/дефект фактора VII (редкое состояние).Сочетанное удлинение АЧТВ и ПВ:• действие лекарств — антикоагулянтов (гепарина* и др.), варфарина (степень
удлинения АЧТВ значительно меньше или отсутствует), массивных трансфу¬
зий;• патологигеские состояния ~ ДВС крови, патология печени, дефицит витамина К;• редко встрегаемые состояния — дисфибриногенемии, недостаточность/
дефект факторов X, V, II.Таблица 11-6. Интерпретация результатов тестов АЧТВ и ПВ при кровоточивости у пациентаАЧТВПВ(ПО,МНО)Наиболее часто встречаемая патологияврожденнаяприобретеннаяУдлинениеНормаДефицит факторов VHI, IX или XIИнгибитор фактора VIIIНормаУдлинениеДефицит фактора VIIПатология печени (дефицит факторов
V и VII).Гиповитаминоз К (дефицит только
фактора VII)УдлинениеУдлинениеДефицит фибриногена (<1 г/л).
Дефицит протромбина, факто¬
ров V и XДВС крови.Патология печени.Приобретенная недостаточность фак¬
торов (амилоидоз).Волчаночный антикоагулянт (кровото¬
чивости нет)НормаНормаУмеренная недостаточность
факторов.Болезнь фон Виллебранда (уме¬
ренной степени).
Недостаточность фактора XlltТромбоцитопения.Качественные нарушения тромбоцитов.
Приобретенная болезнь фон Вилле¬
брандаТромбиновое время (ТВ)ХАРАКТЕРИСТИКА ТЕСТАОпределяют время образования фибринового сгустка при добавлении стан¬
дартного раствора тромбина к исследуемой цитратной плазме при 37 °С. При этом
время реакции зависит в основном от концентрации и свойств фибриногена, а
также наличия и действия антитромбинов.МЕТОДИКА ИССЛЕДОВАНИЯК исследуемой бедной тромбоцитами плазме при 37 “С добавляют раствор
тромбина и определяют время образования фибринового сгустка (автоматически
или вручную). Параллельно тестируют нормальную плазму,РЕФЕРЕНТНЫЕ ПРЕДЕЛЫСоставляют 14-17 с (в зависимости от активности тромбина).ИНТЕРФЕРЕНЦИИПри наличии гепарина* в исследуемой плазме тромбиновое время (ТВ) может
увеличиваться до 120 с и более. Если необходимо исключить эффект антикоагу¬
786 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯлянта, плазму предварительно обрабатывают сорбентом гепарина, центрифугиру¬
ют и исследуют супернатант.ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАДля контроля качества используют РНП-плазму; коэффициент вариации значе¬
ний ТВ обычно не превышает 5%. Каждой лаборатории рекомендуют определить
свои референтные значения (с учетом конкретных условий).ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВУдлинение ТВ может быть вызвано присутствием в крови прямых антикоагу¬
лянтов (гепарина*), парапротеинов, гипофибриногенемией, дисфибриногенемией
(качественный дефект фибриногена) или накоплением в крови продуктов дегра¬
дации фибрина и фибриногена (ПДФ/ПДф), которые обладают антитромбиновой
активностью и препятствуют полимеризации мономеров фибрина.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯТВ — один из базовых методов исследования коагуляционных параметров
плазмы. Тест проводят для выявления нарушений на этапе превращения фибрино¬
гена в фибрин, зависящем в основном от количества фибриногена и ингибиторов
фибринообразования — гепарина*, ПДФ и др. Значительное удлинение ТВ свиде¬
тельствует о риске развития кровотечений.Рептилазное время (батроксобиновое, анцистроновое)ХАРАКТЕРИСТИКА ТЕСТАОпределяют время образования фибринового сгустка в цитратной плазме под
действием тромбиноподобного ферментного препарата змеиного яда — батроксоби-
на или анцисгрона, напрямую отщепляющего фибринопептид А от фибриногена и
образующего активные фибрин-мономеры, которые в ходе полимеризации форми¬
руют сгусток. Тест нечувствителен к гепарину* и его комплексу с антитромбином.МЕТОДИКА ИССЛЕДОВАНИЯК плазме добавляют один из указанных препаратов змеиного яда, содержащих
ферменты прямого фибринообразования. Определение проводят аналогично тесту
ТВ; сравнивают время свертывания исследуемой и нормальной плазмы,КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯРептилазное время уменьшается при гаперфибриногенемии и удлиняется при
снижении фибриногена и некоторых дисфибриногенемиях, а также при гипер-
фибринолизе и наличии в кровотоке большого количества продуктов деградации
фибрина, затрудняющих полимеризацию фибрин-мономеров. Тест можно про¬
водить в присутствии гепарина*. На результаты не влияют антитела к факторам
свертывания и волчаночному антикоагулянту.Фибриноген (концентрация)Фибриноген — основа для образования фибриновых сгустков ~ синтезируется
в печени и постоянно присутствует в плазме. От его молекул под действием тром¬
бина отщепляются фибринопептиды и образуются фибрин-мономеры, которые
затем самопроизвольно полимеризуются и перекрестно «сшиваются».ХАРАКТЕРИСТИКА ТЕСТАХронометрический метод предполагает определение времени образования
фибринового сгустка при добавлении избытка высокоактивного тромбина к раз¬
шКОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 787веденной в 10 раз плазме (для снижения влияния антитромбиновых компонентов)
при 37 "С. в этих условиях время реакции зависит в основном от концентрации
фибриногена, которая определяется по калибровочному графику.Реже применяемый турбидиметрический кинетический метод сводится к двух¬
точечному определению скорости нарастания мутности среды при образовании
фибрина после добавления к разведенной плазме тромбопластин-кальциевого
реагента или препарата змеиного яда.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИСоблюдают общие условия взятия венозной крови для исследования гемостаза
и получения бедной тромбоцитами цитратной плазмы. При взятии капиллярной
крови ее сразу перемешивают в пропорции 1:1 с антикоагулянтом. Материал для
исследования стабилен в течение 8 ч при хранении в закрытой пластиковой или
силиконированной стеклянной пробирке. Во избежание возможного искажения
результатов нежелательно исследовать плазму, имеющую сгустки, следы гемолиза,
а также полученную более чем за 8 ч до анализа.МЕТОДИКА ИССЛЕДОВАНИЯХронометрический метод требует предварительного построения калибровочно¬
го графика путем разведения стандартной нормальной плазмы буферным раство¬
ром для получения калибровочных проб, эквивалентных плазме с содержанием
фибриногена от 1 до 6 г/л. Исследование проводят на коагулометре при 37 “С; к
калибровочным пробам и разведенной буферным раствором в 10 раз исследуемой
плазме добавляют раствор тромбина и определяют время до образования сгустка.
Концентрацию фибриногена в исследуемой плазме находят по калибровочному
графику. Если она превышает 5-6 г/л, для получения корректных данных реко¬
мендуют повторить определение, разведя плазму буферным раствором не в 10, а в
20 раз, полученный результат умножить на 2.Турбидиметрический метод схож с тестом рептилазного времени, но исследо¬
вание проводят не на коагулометре, а на фотометрическом анализаторе, позво¬
ляющем определить кинетику нарастания мутности среды. Скорость помутнения
при образовании фибрина зависит от исходной концентрации фибриногена в
плазме, которая определяется по результатам исследования калибровочных проб
(требуется многоточечная калибровка). Турбидиметрический метод используют в
некоторых автоматических анализаторах гемостаза, в этом же тесте можно одно¬
временно определить ПВ.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫУ взрослых — 1,8-4,0 г/л, у новорожденных — 1,2-3,0 г/л.ИНТЕРФЕРЕНЦИИХронометрический метод может давать некорректные результаты при дис-
фибриногенемии, а также при попадании в кровь большого количества гепари¬
на* (например, из венозного катетера). При исследовании капиллярной крови
результат зависит от действия множества дополнительных интерферирующих
факторов (форменных элементов крови, разного гематокрита), что снижает точ¬
ность метода.ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАДля контроля качества определения фибриногена используют контрольную
РНП-плазму, для калибровки — разведения стандартной плазмы либо стандарт¬
ные растворы фибриногена. Разброс результатов при работе с одной и той же
пробой плазмы не должен превышать 5%. Показания разных методов на одной и
той же пробе плазмы могут существенно отличаться друг от друга, особенно при
788КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯгипо- или гиперфибриногенемии. Именно поэтому в лаборатории рекомендуют
придерживаться какого-либо одного метода, тщательно отладив его и регулярно
проводя калибровку и контроль качества.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВФибриноген синтезируется в печени и относится к группе белков острой фазы.
Повышение его концентрации в плазме возможно при любой острофазовой реак¬
ции (воспалении, инфекциях, ожогах, травмах, в послеоперационном периоде,
остром инфаркте миокарда), а также при болезнях почек, системных заболеваниях
соединительной ткани, злокачественных новообразованиях и др. У здоровых жен¬
щин уровень фибриногена возрастает при беременности, введении эстрогенных
препаратов и во время менструации.Основные причины снижения содержания фибриногена — гиперпотребление
при образовании большого количества микросгустков (ДВС, травмах, ожогах,
шоке, тяжелом токсикозе), распад в результате действия фибринолитических
препаратов (стрептокиназы и т.п.) или нарушение синтеза при тяжелой патоло¬
гии печени (циррозе, острой дистрофии), а также значительная гемодилюция.
Необходимо учитывать, что тяжелые гнойно-воспалительные процессы, при¬
водящие к развитию синдрома ДВС, могут способствовать повышению уровня
фибриногена как острофазного белка и тем самым маскировать его усиленное
потребление.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯОпределение концентрации фибриногена — базовый метод исследования коагу¬
ляционных свойств плазмы, входящий во все скрининговые схемы. Исследование
проводят для выявления причины и оценки степени риска кровотечений и тром¬
бозов. При увеличении концентрации фибриногена резко повышается вязкость
крови, но ее свертывание in vitro не ускоряется. Длительно повышенная концен¬
трация фибриногена опасна, поскольку возрастает риск тромбозов и ишемии
органов и тканей. При уменьшении количества фибриногена ниже 1 г/л возможны
кровотечения.Фактор VIII (активность)Плазменный фактор VIII (антигемофильный глобулин) синтезируется в печени,
селезенке, клетках эндотелия, лейкоцитах, почках. В крови фактор VIH находится
в комплексе с фактором фон Виллебранда, который стабилизирует фактор VIII и
существенно увеличивает период его циркуляции (до 12-24 ч). При воздействии
минимального количества тромбина фактор VIII высвобождается из комплекса и
проявляет свой прокоагулянтный эффект.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИСоблюдают общие условия взятия венозной крови для исследования гемоста¬
за и получения цитратной плазмы. В связи с малой стабильностью фактора VIII
плазма должна быть получена в кратчайшие сроки. В свежезамороженной плазме
при быстром и правильном оттаивании активность фактора VIII мало отличается
от свежей плазмы.МЕТОДИКА ИССЛЕДОВАНИЯВ клоттинговом тесте определяют АЧТВ смеси субстратной плазмы, дефи¬
цитной по фактору VIII (<1% нормы), и разведенной исследуемой плазмы, содер¬
жащей фактор VIII. При сохранении в субстратной плазме всех других факторов
продолжительность свертывания зависит в основном от активности фактора VIII
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 789в исследуемой плазме. К субстратной плазме, дефицитной по фактору VIII, добав¬
ляют разведенную в 5-20 раз исследуемую плазму, при 37 °С определяют АЧТБ
смеси. Активность фактора VIII в исследуемой плазме находят по калибровочному Щ
графику, для построения которого по той же схеме проводят определение АЧТВ с ^
разведениями стандартной плазмы-калибратора. Активность фактора выражают в
процентах нормальной контрольной плазмы. Для пересчета в МЕ/мл полученное
значение делят на 100. Диапазон линейности определяемых значений фактора
VIII — до 100% (при превышении нужно разводить плазму).В хромогенном методе инкубация разведенной исследуемой плазмы с добав¬
лением фактора 1Ха, фосфолипидов, и избытка фактора X приводит к
активации последнего, чему способствует фактор VIII. Образующийся фактор
Ха гидролизует специфический хромогенный субстрат с освобождением окра¬
шенного й-нитроанилина. Образующийся в смеси тромбин, также способный
гидролизовать хромогенный субстрат, блокируется добавляемым синтетиче¬
ским ингибитором. Скорость нарастания оптической плотности при Я,=405 нм
пропорциональна активности фактора VIII в исследуемой плазме. Смешивают
препараты факторов 1Ха и X, фосфолипидов, добавляют разведенную буферным
раствором исследуемую плазму, хромогенный пептидный субстрат и при 37 °С
определяют скорость нарастания оптической плотности при Л,=405 нм кинетиче¬
ским методом. Определение проводят на фотометре, биохимическом анализато¬
ре или анализаторе гемостаза с фотометрическим каналом, результат выражают
в процентах стандартной нормальной плазмы. Каждый образец исследуют дваж¬
ды, вычисляют среднеарифметическое значение. Диапазон линейности метода —
от О до 130%.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫСоставляют 50-150% (0,5-1,5 МЕ/мл).ИНТЕРФЕРЕНЦИИТе же, что в тесте АЧТВ. Активность фактора VIII нельзя определять при нали¬
чии в пробе гепарина* или на фоне его действия.ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАДля контроля качества используют контрольную плазму, активность фактораVIII в которой указывается в аттестате и соответствует нормальному (80-120%;0,8-1,2 МЕ/мл) и патологическому уровню.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВСнижение активности фактора VIII наиболее часто связано с нарушением его
синтеза (при гемофилии А) или появлением ингибиторных антител, а также
с ускоренным распадом («незащищенностью» фактора VIII при болезни фон
Виллебранда); реже — с гиперпотреблением (II-III стадия ДВС крови). При уров¬
не фактора VIII от 6 до 25% констатируют недостаточность легкой степени, от 1
до 5% — средней, менее 1% — тяжелой степени. Существенное снижение уровня
фактора VIII сопровождается кровотечением после травм и кровоизлияниями в
суставы, мышцы и другие органы и ткани. При снижении активности фактора VIII
в плазме менее 25% увеличивается риск развития послеоперационных кровотече¬
ний.Активность фактора VIII возрастает при острофазовых реакциях (воспале¬
нии, травмах и т.д.), беременности и лечении эстрогенными препаратами, после
спленэктомии, а также может увеличиваться при сахарном диабете и опухолевом
процессе. Активность фактора VIII, превышающую 175%, расценивают как тром-
бофилическое состояние.
790 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯФактор IX (активность/количество)Плазменный фактор IX, или фактор Кристмаса, синтезируется в печени (синтез
зависит от витамина К). При каскадной активации внутреннего пути гемоста¬
за активированный фактор IX в составе теназного ферментного комплекса (на
фосфолипидной матрице) способствует переходу фактора X в активную форму,
образованию протромбиназы, тромбина и фибринового сгустка, В процессе свер¬
тывания крови фактор IX не потребляется и остается в сыворотке.ХАРАКТЕРИСТИКА ТЕСТАПринцип определения клоттинговым методом такой же, как при исследовании
активности фактора VIII, но в качестве субстрата используют плазму, дефицит¬
ную по фактору IX. Иммуноферментное определение (ELISA — Enzyme-Linked
ImmunoSorbent Assaj/) основано на связывании определяемого фактора IX с фик¬
сированными на поверхности лунки планшета моноклональными антителами к
данному фактору и их конъюгатом с пероксидазой; калибровку осуществляют по
разведениям стандартной калибровочной плазмы, входящей в набор.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫСоставляют 50-150% (0,5-1,5 МЕ/мл).ИНТЕРПРЕТАЦИЯ РЕЗУПЬТАТОВСнижение активности фактора IX может быть связано с нарушением его
синтеза (гемофилией В, тяжелыми гепатитами и циррозами печени, лечением
непрямыми антикоагулянтами), а также с появлением ингибиторных антител.
При уровне фактора от 25 до 50% констатируют скрытую недостаточность, от 6
до 24% — недостаточность легкой степени, от 1 до 5% — средней степени, менее
1% — тяжелую форму недостаточности. Выраженная недостаточность фактора IX
сопровождается геморрагическими проявлениями, минимальный уровень актив¬
ности в крови для предупреждения послеоперационных кровотечений составляет
20-25% нормы.Количество/активность фактора IX могут возрастать при лечении эстрогенны¬
ми препаратами и при почечной недостаточности. Если активность фактора IX
превышает 200%, развивается тромбофилическое состояние.Фактор X (активность/количество)Витамин К-зависимый фактор X (фактор Стюарта-Прауэра) синтезируется в
печени и занимает одно из центральных мест в системе плазменного гемостаза.
При каскадной активации как внутреннего, так и внешнего пути гемостаза фактор
X превращается в активную протеазу ~ фактор Ха, который в присутствии других
компонентов протромбиназного комплекса (фактора Va, фосфолипидов и Са^^)
превращает протромбин в тромбин и способствует образованию фибринового
сгустка.ХАРАКТЕРИСТИКА ТЕСТАИзолированная недостаточность фактора X в исследуемой плазме может быть
обнаружена по удлинению АЧТВ и особенно ПВ, которые приходят к норме в
микс-тесте с нормальной донорской плазмой, но остаются удлиненными при
добавке дефицитной по ф. X плазмы.Количественное определение фактора X в клотттговом тесте проводят ана¬
логично исследованию активности фактора VIII, но вместо АЧТВ применяют тест
ПВ и исполкчуют плазму, дефицитную по данному фактору. Антиген к фактору X
может быть определен иммуноферментньш методом (ELISA) с использованием
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 791моноклональных антител. Методом определяют количество, но он не дает пред¬
ставления об активности анализа. При применении хромогенного метода фактор
X в разведенной исследуемой плазме переводится в активное состояние специфи¬
ческими протеазами из яда гадюки Рассела (Russel Viper Venom — RVV) в присут¬
ствии Са^’. Образующийся фактор Ха гидролизует специфический хромогенный
субстрат с высвобождением окрашенного «-нитроанилина: скорость нарастания
оптической плотности при ?l=405 нм пропорциональна концентрации фактора X.
Определение проводят на фотометре, биохимическом анализаторе или анализа¬
торе гемостаза с фотометрическим каналом; результаты выражаются в процентах
активности фактора в стандартной плазме (линейность метода — от 10 до 130%).РЕФЕРЕНТНЫЕ ПРЕДЕЛЫСоставляют 50-150%.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИ, ИНТЕРФЕРЕНЦИИИсследование необходимо провести не позднее 2 ч после взятия крови.
Липемичные, иктеричные и гемолизированные образцы исследовать не реко¬
мендуют: в противном случае необходим бланк-контроль с плазмой пациента.
Для контроля качества используют нормальную и патологическую плазмы с
аттестованным уровнем фактора X. Оценку метода можно проводить с использо¬
ванием РНП-плазмы или свежей (свежеразмороженной) пулированной плазмы от
нескольких здоровых людей.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВСнижение активности фактора X чаще бывает связано с нарушением его синтеза
в печени (дефицитом витамина К, действием непрямых антикоагулянтов, тяжелой
патологией печени) или исчезновением из кровеносного русла при амилоидозе
(изолированной недостаточностью фактора X). Концентрация фактора X может
также снижаться при гепаринотерапии из-за связывания и инактивации комплек¬
сом «АТ-гепарин». Врожденный дефицит фактора наблюдается редко.Исследование проводят при сочетанном удлинении АЧТВ и ПВ для выявления
причины гипокоагуляции. Минимальный гемостатический уровень активности
фактора X в крови — 5-10%, для послеоперационной остановки кровотечения —
10-20% нормы. Более выраженное уменьшение сопровождается кровоточиво¬
стью.Поскольку активность синтезируемого в печени фактора X снижается под влия¬
нием антикоагулянтов непрямого действия, наряду с активностью протромбина ее
можно применять при мониторинге терапии варфарином.Фактор VII (активность/количество)Плазменный витамин К-зависимый фактор VII (проконвертин) синтезируется
в печени и циркулирует в крови. При повреждении тканей и попадании в крово¬
ток тканевого фактора (ТФ, кофактора фактора VII) образуется активная форма
фактора Vila, которая в виде комплекса «ТФ-фактор Vila» активирует факторыIX и X, что, в свою очередь, приводит к образованию тромбина и формированию
фибринового сгустка.ХАРАКТЕРИСТИКА ТЕСТАКлоттинговый метод основан на коррекции удлиненного протромбинового
времени исследуемой плазмы добавкой нормальной пулированной плазмы, но
отсутствии коррекции в микс-тесте плазмы больного и субстратной плазмы, дефи¬
цитной по фактору VII.
792 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯИмеется информация о хромогенном методе определения фактора VII, основан¬
ном на образовании комплекса «ТФ-VIIa», активирующего добавляемый фактор
X, который впоследствии гидролизует хромогенный субстрат с образованием
окрашенного я-нитроанилина.Иммуноферментный анализ (ELISA) позволяет определять как общее коли¬
чество проконвертина и его комплекса с тканевым фактором (VII+VIIa+ТФ/
VII+T0/VIIa), так и активную форму (VIIa+TO/VIIa), которая в норме составляет
около 1% (~5 нг/мл).РЕФЕРЕНТНЫЕ ПРЕДЕЛЫСоставляют 50-200%; при определении методом ELISA — 300-800 нг/мл,
ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИ, ИНТЕРФЕРЕНЦИИТе же, что в тестах АЧТВ и ПВ. Дополнительная нестабильность результатов в
клоттинговом и хромогенном тестах связана с возможностью самопроизвольной
и ХОЛОДОВОЙ активации фактора VII (плазму крови нежелательно долго выдержи¬
вать при низкой температуре). Вместе с тем быстрое замораживание плазмы мало
изменяет активность данного фактора. Гепарин* в концентрации до 0.5 ЕД/мл не
влияет на результаты хромогенного исследования.ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАДля контроля качества используют аттестованную по фактору VII контрольную
плазму, РНП-плазму или свежую (свежеразмороженную) пулированную плазму от
нескольких здоровых людей.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВСнижение активности фактора VII возможно при нарушении его синтеза в
печени (в периоде новорожденности, при тяжелой патологии органа ~ гепатите,
циррозе, дефиците витамина К и лечении непрямыми антикоагулянтами) и при
коагулопатии потребления (ІІ-ІІІ стадия ДВС). Врожденная недостаточность
проконвертина встречается очень редко. Повышение активности фактора VII воз¬
можно при активации его синтеза в печени (действии эстрогенных препаратов, в
III триместре беременности и т.д.).КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯФактор VII отличается наиболее коротким периодом циркуляции в кровеносном
русле (Tj ,2^ 4-7 ч); прогрессирующее снижение его активности может рассматри¬
ваться как один из маркеров острой печеночной недостаточности. Повышение коли¬
чества/активности фактора VII расценивается как тромбофилическое состояние,
может сопровождаться возрастанием риска сердечно-сосудистых заболеваний.Фактор V (активность/количество)Плазменный фактор V (проакцелерин) синтезируется в печени, в крови цирку¬
лирует в неактивном виде, содержится в тромбоцитах. После протеолитической
активации фактор Va выступает в качестве основного кофактора фактора Ха,
повышая его активность на несколько порядков. В свою очередь, фактор Ха в
составе протромбиназного ферментного комплекса (факторов Ха, Va, фосфоли¬
пидов и Са^') вызывает образование тромбина и способствует формированию
фибринового сгустка.ХАРАКТЕРИСТИКА ТЕСТАНедостаточность фактора V может быть заподозрена в клоттинговом тесте
при удлинении ПВ. Показатели приходят к норме в микс-тесте с нормальной
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 793донорской плазмой, но остаются патологическими при добавке дефицитной по
фактору V плазмы. Клоттинговое определение фактора V аналогично исследова¬
нию активности фактора VIII, но проводят по тесту ПВ с использованием субстрат¬
ной плазмы, дефицитной по фактору V.Количественное определение проводят ИФА-методом с использованием моно¬
клональных антител к тяжелой цепи фактора V и конъюгата пероксидазы с поли- щр
клональными антителами к данному белку. Метод дает представление о количе-
стве, но не о реактивности фактора.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫСоставляют 50-150% уровня нормальной пулированной плазмы.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВСнижение активности фактора V может быть связано с нарушением синтеза в
печени (тяжелой патологией печени) или чрезмерным потреблением (II-III стадия
две); врожденный дефицит наблюдается очень редко. Повышение активности
фактора V возможно при ускорении его синтеза в печени (острой фазе заболеваний,
беременности и Т.Д.). Исследование проводят для дифференциации причин удлине¬
ния ПВ на фоне нормального АЧТВ. Минимальный гемостатический уровень актив¬
ности фактора V в крови составляет 5-15%, для выполнения операций — 25%.Фактор XIII (фибриназа, фибринстабилизирующий фактор)Фибриназа (фактор XIII, трансглутаминаза) путем образования перекрестных
ковалентных связей стабилизирует растворимый фибрин-полимерный сгусток и
превращает его в плотный тромб. Сгустки, образовавшиеся с участием фибриназы,
лизируются медленно. Если же активность фактора XIII снижена, сгустки распада¬
ются быстро, даже когда фибринолитическая активность крови нормальная.ХАРАКТЕРИСТИКА ТЕСТАФункциональное определение основано на оценке лизиса фибринового сгустка,
образуемого из стандартного раствора фибриногена с добавкой различных раз-
ведений исследуемой плазмы, содержащей фактор XIII, в растворе монохлоруксус-
ной кислоты (или оксалата мочевины). Метод достаточно субъективен на стадии
оценки результатов.Фотометрический энзиматигеский метод основан на действии фактора ХШа,
на синтетическом субстрате и определении количества отщепляющихся ионов
аммония в глутаматдегидрогеназной реакции на фотометре или биохимическом
анализаторе.Иммуноферментный метод (ELISA) на основе поликлональных антител к эпи¬
топам молекулы фактора XIII высокочувствителен и обладает хорошей воспро¬
изводимостью. Метод позволяет определять количество фибриназы, но не дает
информации об ее активности.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИСоблюдают общие условия взятия венозной крови для получения бедной тром¬
боцитами цитратной плазмы. Плазма должна быть исследована не более чем через
4 ч после взятия крови. Нежелательно исследовать плазму, имеющую сгустки и
следы гемолиза. Допустимо однократное замораживание плазмы с последующим
оттаиванием в теплой воде.МЕТОДИКА ИССЛЕДОВАНИЯК последовательным разведениям исследуемой плазмы буферным раствором
(от 1:2 до 1:512) добавляют стандартный раствор фибриногена, суспензию каоли-
794 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯна и тромбин-кальциевую смесь. В ходе 30-минутной инкубации при Ъ1 “С обра¬
зуется сгусток фибрина, в разной степени упрочненный действием фактора XIII.
После добавления монохлоруксусной кислоты и 5-минутной инкубации встряхи¬
вают пробирки и отмечают наименьшее разведение плазмы, при котором сгусток
разрушается на мелкие фибриновые нити. Параллельно тестируют аналогичные
разведения входящей в набор плазмы-калибратора с известной активностью
фибриназы (в процентах нормальной плазмы). Уровень фактора XIII рассчитыва¬
ют по наименьшим титрам плазмы, в которых произошел распад сгустка, с учетом
известной активности фактора XIII в плазме-калибраторе.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫСоставляют 60-150% уровня нормальной плазмы.ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАДля контроля качества анализа используют контрольные плазмы с нормальны¬
ми и патологическими уровнями фактора XIII. Функциональный метод не может
быть стандартизирован, поскольку оценка распада сгустка в значительной степени
субъективна.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВСнижение фактора XIII в крови может быть связано с нарушением его синтеза
либо с гиперпотреблением (при две). Активность фибриназы бывает сниженной у
новорожденных и детей первого месяца жизни. Приобретенный дефицит фактора
XIII может развиваться у больных с лучевой болезнью, лейкозами, гепатитами и цир¬
розами, метастазами опухолей в печень, лимфомой. Описано существенное снижение
активности фактора XIII (<20%) в острой стадии тромбоцитопенической пурпуры
(болезни Шенлейна-Геноха), в активной фазе язвенного колита и болезни Крона.Активность фактора XIII повышена у рожениц, после введения адреналина,
глюкокортикоидов, питуитрина, у больных с тромбоэмболическими осложнения¬
ми, атеросклерозом, после оперативных вмешательств.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯКлиническая значимость теста в целом невелика. Исследование активности
фактора проводят у пациентов с необъяснимой кровоточивостью и длительным
заживлением ран на фоне нормальных показателей тестов АЧТВ, ПВ и тромбо-
цитарного звена; снижение или повышение активности фибриназы рассматривают
как фактор геморрагического или тромботического риска. Вместе с тем считается,
что 10% фибриназы обеспечивают полноценный гемостаз, а 2% этого фактора
достаточны для остановки кровотечения.Антитромбин (активность/количество)в 30-е гг. XX в. при изучении антикоагулянтных свойств плазмы было пока¬
зано, что активность тромбина в ней может снижаться различными веществами,
получившими название «антитромбины». Фибрин, абсорбирующий тромбин, был
назван антитромбином I, гепариновый кофактор — антитромбином II, а термин
«антитромбин III» (единственный из реально сохранившихся) применяли для
обозначения ингибитора сериновых протеаз, наиболее активно блокирующего
тромбин и фактор Ха. В настоящее время как синоним антитромбина III чаще
используют термин «антитромбин».Антитромбин (АТ) — основной естественный ингибитор свертывания крови,
перв№шый антикоагулянт. В присутствии гепарина* АТ связывает и инактивирует
тромбин и другие активные плазменные факторы — сериновые протеазы (факторы
Ха, 1Ха, Х1а, ХПа, плазмин и др.), предотвращая неконтролируемую коагуляцию.
КОАГУЛОЛОГМЧЕСКИЕ ИССЛЕДОВАНИЯ 795ХАРАКТЕРИСТИКА ТЕСТААктивность антитромбина в исследуемой плазме определяют по его способ¬
ности инактивировать вносимый извне тромбин. При определении клоттинго-
вым методом исследуемую плазму дефибринируют путем прогревания при 56 “С,
быстрого охлаждения до 20-25 "С и центрифугирования с отбрасыванием осадка,
вносят в стандартный раствор тромбина и инкубируют при 37 “С. Далее эту смесь
добавляют к стандартной нормальной плазме (или к стандартному раствору
фибриногена) и определяют время образования фибринового сгустка на коагуло-
метре или в водяной бане при периодическом покачивании пробирки. Активность
антитромбина находят по калибровочному графику, для построения которого
проводят определение времени образования сгустка при аналогичной обработке
ряда последовательных разведений контрольной нормальной плазмы с известной
активностью антитромбина.При использовании хромогенного метода в исследуемую плазму, разведенную
буферным раствором с гепарином* для активации антитромбина, вносят стандарт¬
ное количество фактора Ха (Па) и инкубируют при 37 “С. Затем в реакционную
смесь вводят хромогенный субстрат, по истечении определенного времени оста¬
навливают реакцию добавлением уксусной кислоты и определяют оптическую
плотность исследуемых образцов при Х=405 нм против бланка (буферный рас-
твор, инкубируемый одновременно с пробой). Активность антитромбина в иссле¬
дуемой плазме находят по калибровочному графику, для построения которого по
описанной выше схеме проводят определение ряда последовательных разведений
плазмы-калибратора с известным содержанием антитромбина. Возможно коли¬
чественное определение антитромбина (антигена) иммунохимигескими методами:
ИФА, иммунохемилюминесцентным анализом (ИХЛ) и др. Методы стандарти¬
зированы, могут быть выполнены на автоанализаторах и дают хорошо воспро¬
изводимые результаты, но не позволяют судить об антикоагулянтной (гепарин-
кофакторной) активности антитромбина.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИСоблюдают общие условия взятия венозной крови для исследования гемостаза
и получения цитратной плазмы. Исследование проводят в течение 2-4 ч после взя¬
тия крови; при необходимости возможно однократное замораживание-оттаивание
плазмы. Не доп)?скается наличия в материале сгустков и следов гемолиза. Липемия
также может повлиять на результаты хромогенного теста.ИНТЕРФЕРЕНЦИИПри определении клоттинговым методом плазму пациентов, которым накану¬
не взятия крови вводили гепарин*, предварительно обрабатывают сорбентом во
избежание искажения результатов. В то же время при использовании препарата
тромбина, содержащего инактиваторы гепарина, и при условии, что концентрация
гепарина* в плазме крови пациента не превышает 1 МЕ/мл, предварительное его
удаление из плазмы сорбентом не является обязательным.При исследовании хромогенным методом образцов плазм с повышенным содер¬
жанием липидов (мутноватых) и билирубина (иктеричных) могут быть получены
заниженные результаты.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫСоставляют 70-130% уровня нормальной плазмы.ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАПроверку методики проводят путем исследования стандартной контрольной
плазмы или свежей пулированной плазмы от нескольких здоровых людей. Для
контроля качества используют референтнз^ю нормальную пулированную плазмуЖ
шш796 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ(РНП-плазма), срок ее годности — 2ч после разведения лиофилизированного пре¬
парата. Для обеспечения точности результатов при исследовании клоттинговым
методом рекомендуют проводить определение на коагулометре, хромогенным
методом — на фотометре, биохимическом анализаторе или анализаторе гемостаза
с фотометрическим каналом.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВУровень антитромбина может быть снижен при врожденной недостаточности
(возможно снижение как функциональной активности, так и концентрации анти¬
тромбина), при две, поздних гестозах, тяжелых поражениях печени, приеме
эстрогенов и пероральных контрацептивов, а также при лечении L-аспарагиназой
и длительном применении больших доз гепарина (образуются активные ком¬
плексы «гепарин-АТ», относительно быстро уходящие из кровотока). Контроль
активности антикоагулянтной системы плазмы в целом и антитромбина в частно¬
сти необходим при тромбозах, тромбофилических состояниях, две крови и ряде
лекарственных воздействий. При выраженном снижении уровня антитромбина
значительно увеличивается риск развития тромбозов; срочная коррекция этого
состояния осуществляется путем инфузии препаратов антитромбина или свежеза¬
мороженной плазмы.Некоторое повышение уровня АТ в крови вследствие ускорения синтеза в пече¬
ни возможно при беременности и во время менструации.Протеин С (активность/количество)Протеин С [Protein С (PC)] — важнейший ферментный фактор антикоагу-
лянтной системы. Он синтезируется печенью (синтез зависит от витамина К) и
постоянно циркулирует в крови в неактивном виде. После активации комплексом
«тромбин-тромбомодулин» на поверхности неповрежденных эндотелиальных
клеток и тромбоцитов PC в присутствии своего кофактора — протеина S — частич¬
но разрушает неферментные плазменные факторы Va и VHIa, сдерживая актив¬
ность коагуляционных процессов. Имеются данные об участии PC в активации
фибринолиза.ХАРАКТЕРИСТИКА ТЕСТАПротеин С, содержащийся в исследуемой плазме, переходит в активное состоя¬
ние после добавления специфического неферментного активатора из змеиного
яда. При использовании коагуляционного {клоттингового) метода об активности
PC судят по степени удлинения АЧТВ в смеси дефицитной по PC и исследуемой
плазмы, в которой при активации PC происходят частичное расщепление факто¬
ров Va и Vnia и уменьшение скорости коагуляционных реакций по сравнению с
«чистой», дефицитной по протеину с субстратной плазмой, в которой удлинения
АЧТВ в тех же условиях практически не бывает.В хромогенном методе определяют скорость расщепления пептидного хромоген¬
ного субстрата активированным протеином С, содержащимся в исследуемой плаз¬
ме; количество высвобождающегося при этом красителя прямо пропорционально
активности PC.Возможно количественное определение антигена протеина С иммунохимиге-
скими методами — твердофазным ИФА (ELISA), иммунохемилюминесцентным
и др. Достоинствами этих методов являются относительная простота, неболь¬
шое время анализа (менее 1 ч), стандартизированность, возможность работы
на автоанализаторах и хорошая воспроизводимость результатов. Вместе с тем
иммунохимическими методиками определяют лишь количество, но не функцио¬
нальную активность PC.
ш.КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 797ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИСоблюдают общие условия взятия венозной крови для исследования гемостаза
и получения цитратной плазмы. Исследование проб должно быть проведено не
позднее 2-4 ч после получения. Для более длительного хранения допускается
однократное замораживание плазмы при -20 "С; оттаивание следует проводить
быстро (в теплой воде), последующий анализ — в течение 1 ч. Не исследуют плаз- Щ
му, содержащую гепарин*, имеющую сгустки и следы гемолиза.МЕТОДИКИ ИССЛЕДОВАНИЯПри исследовании клоттинговым методом готовят смесь разведенной буфер¬
ным раствором исследуемой плазмы, активатора протеина С и дефицитной по PC
субстратной плазмы, инкубируют ее при 37 “С и определяют АЧТВ, добавляя каль¬
ция хлорид. Количественный расчет результатов проводят по калибровочному
графику, для построения которого используют разведения буфером (от 1:5 до 1:40)
стандартной плазмы с известной активностью PC, подставляя эти калибровочные
пробы взамен разведенной исследуемой плазмы и определяя их АЧТВ с помощью
коагулометра или вручную. Все исследования проводят в дублях, рассчитывая
среднее значение.При хромогенном методе в исследуемую плазму добавляют активатор протеи¬
на С и инкубируют при 37 °С. Затем в реакционную смесь вводят хромогенный
субстрат, по истечении определенного времени останавливают реакцию добав¬
лением кислоты и определяют оптическую плотность исследуемых образцов при
А,^405 нм против бланка (буферный раствор, инкубируемый одновременно с про¬
бой). Активность PC в исследуемой плазме находят по калибровочному графику,
для построения которого по той же схеме проводят определение стандартной
плазмы-калибратора (с известной активностью PC) и ряда ее последовательных
разведений. Дополнительные условия построения калибровочного графика и диа¬
пазон линейности определяются фирмой-производителем.Иммуноферментное определение проводят на планшетах с фиксированными
моноклональными антителами, с которыми связывается PC из добавляемой
исследуемой плазмы. После отмывки и добавления конъюгата анти-РС-антител с
пероксидазой образуются «сэндвич»-структуры, которые окисляют хромогенный
субстрат (ТМБ) при инкубации с перекисью водорода. Степень окраски реакци¬
онной среды, зависящая от количества ЕС в образце плазмы, определяется спек¬
трофотометрически при А,=450 нм. Расчет проводят по калибровочному графику,
построенному по данным исследования ряда разведений референтной плазмы (в
ней количество PC принимается за 100%).РЕФЕРЕНТНЫЕ ПРЕДЕЛЫСоставляют 70-140% уровня нормальной плазмы.ИНТЕРФЕРЕНЦИИПри лечении непрямыми антикоагулянтами (варфарином) у больных воз¬
можно появление форм PC, не обладающих антикоагулянтным действием, хотя
их активность, определяемая хромогенным методом, оказывается нормальной
или завышенной. В этих условиях корректные данные дает клоттинговый тест,
но его результаты могут оказаться заниженными при возрастании уровня фак¬
тора VIII в плазме крови. При исследовании образцов плазмы больных с повы¬
шенным содержанием липидов (мутноватых) и билирубина (иктеричных), а
также при наличии у пациентов волчаночного антикоагулянта и после введе¬
ния гепарина* показатели активности протеина С могут завышаться. После
введения ингибиторов сериновых протеаз (апротинина и др.) активность PC
снижается.
’?5й5‘й^'ё>й-уй?798 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАДля контроля качества используют специальную контрольную плазму с атте¬
стованной активностью PC. Для обеспечения точности результатов в клоттин-
говом тесте рекомендуют проводить определение на коагулометре, при исследо¬
вании хромогенным методом — на фотометре, биохимическом анализаторе или
анализаторе гемостаза с фотометрическим каналом.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВУменьшение активности и/или концентрации PC свидетельствует о нарушениях
его синтеза (врожденной недостаточности, периоде новорожденности и пожилом
возрасте, тяжелой патологии печени), либо о быстром расходовании (при после¬
операционных состояниях, тромбозах, тромбоэмболиях, две), либо об аномали¬
ях структуры и функциональной неполноценности (действие варфарина). Очень
низкие показатели активности PC могут наблюдаться на фоне лечения варфари-
ном. Небольшое повышение содержания протеина С возможно при беременности
и приеме эстрогенных препаратов, а также при некоторых заболеваниях почек.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯНаблюдение за активностью PC следует проводить при рекуррентных тромбо¬
зах, тромбоэмболиях, две. Врожденная недостаточность PC является тромбо-
филическим состоянием и требует профилактических мер для предупреждения
тромбозов. Снижение активности протеина С до 50% нормы и ниже на фоне тера¬
пии антикоагулянтами непрямого действия может приводить к кожным некрозам
(варфариновым некрозам), которые встречаются нечасто, но протекают тяжело. В
связи с этим использование непрямых антикоагулянтов у пациентов с дефицитом
PC следует проводить с особой осторожностью под контролем активности про¬
теина С; при необходимости — с восполнением его дефицита свежезамороженной
плазмой или препаратом рекомбинантного PC.Резистентность фактора V к активированному протеину С
{activated Protein С Resistance)Роль анализа в физиологигеских процессах. Протеин С, активируемый комплек¬
сом «тромбин-тромбомодулин», вызывает частичную деградацию плазменных
факторов Villa и Va и ограничивает скорость коагуляционных реакций. Если же
у пациента структура фактора V изменена вследствие мутации, его деградация
активным PC замедляется или прекращается, что ведет к возрастанию плазменной
концентрации фактора V и развитию тромбофилического состояния.Характеристика теста. Активированный препаратом змеиного яда проте¬
ин С из дефицитной по фактору V субстратной плазмы разрушает фактор Va в
добавляемой исследуемой плазме, причем скорость и полнота распада фактора
Va зависят от его структуры (нормальной или измененной вследствие мутации).
Снижение уровня данного фактора вследствие его распада обычно приводит к
существенному удлинению АЧТВ; если же в исследуемой плазме он резистентен
к действию активированного протеина С, удлинение АЧТВ будет менее выражен¬
ным.Преапалитигеские особенности. Те же, что в тесте протеина С.Методика исследования. Оригинальный метод, предложенный в 1993 г., заклю¬
чается в определении АЧТВ неразведенной плазмы с добавлением активированно¬
го протеина С и без него и последующем расчете аРС-отношения, которое показы¬
вает степень удлинения АЧТВ под действием аРС:отношение аРС = АЧТВ с добавлением аРС / АЧТВ без добавления аРС.
КОАГУЛ о ЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 709При резистентности к аРС это отношение составляет менее 2. Результат зави¬
сит от реагентов и оборудования, а также от активности в исследуемом образце
плазменных факторов, присутствия их ингибиторов или гепарина*. Значительно
снизить зависимость результата теста от прочих факторов исследуемой плазмы
позволяет определение аР С-резистентности с разведением исследуемого образца
субстратной плазмой, дефицитной по фактору V, в соотношении 1:5. Метод имеет
высокие специфичность и чувствительность; на его результаты может влиять лишь
присутствие волчаночного антикоагзшянта в высоком титре.Более надежные результаты дает вариант теста aPCR (activated Protein С
Resistance) с расчетом нормализованного отношения. В дефицитную по факторуV субстратную плазму добавляют активатор протеина С и инкубируют при 37 °С;
параллельно проводят инкубацию такой же плазмы без активатора. Далее в обе
пробы добавляют исследуемую плазму и с помощью коагулометра или мануаль¬
ным методом (в водяной бане) определяют АЧТВ смесей; результаты обозначают
как АЧТВ иссл. акт. и АЧТВ иссл. Аналогично проводят определение с добавлени¬
ем стандартной контрольной плазмы, заменяя ею исследуемую плазму; результаты
обозначают как АЧТВ станд. акт. и АЧТВ станд. Резистентность к активированно¬
му протеину С определяется нормализованным отношением (НО), которое рас¬
считывают по формуле;НО ^ X (АЧТВ иссл. акт. х АЧТВ станд.) / (АЧТВ станд. акт. х АЧТВ иссл.),где k - коэффициент, равный значению НО для стандартной контрольной плазмы
(указывается в паспорте набора).Возможно проведение исследования по аналогичной схеме с использованием
препарата яда гадюки Рассела (RW); есть данные, что при этом существенно
повышаются специфичность и положительная предсказательная ценность теста.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫСоставляют: аРС-отношение — более 2; НО — более 0,8 (0,8-1,5).
ИНТЕРФЕРЕНЦИИ, ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАТе же. что в клоттинговом тесте протеина с. На результаты определения влияет
гепарин*.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВЗначение аРС-отношения более 2 или НО ниже 0,8 свидетельствуют о рези¬
стентности фактора V к активированному протеину С. Основные причины ее
развития — наличие мутантного фактора V (подтверждение — на основе генети¬
ческого тестирования с обнаружением мутации гена FV, наиболее частая из них —
мутация Лейден, G1691A), а также присутствие волчаночного антикоагулянта и
увеличение активности фактора VIII. Снижение НО возможно при беременности,
приеме эстрогенов, оральных контрацептивов,КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯПриобретенная и врожденная резистентность к активированному протеину С
сопровождается тромбофилией. Женщинам с aPCR противопоказан прием эстро¬
генных препаратов и оральных контрацептивов, а при планировании и ведении
беременности необходима антитромботическая профилактика.Протеин S (количество/активность)протеин S (Пр5) — витамин К-зависимый неферментный кофактор протеина
С — синтезируется в печени и циркулирует в кровотоке. Около 60% npS в плазме
связано с С4Ь-переносящим белком, около 40% составляет свободная активная
800 КОАГУЛОЛОгаЧЕСКИЕ ИССЛЕДОВАНИЯформа. При отсутствии или недостаточной концентрации Пр8 активность протеи¬
на С существенно снижается, что ведет к нарушению функции антикоагулянтного
звена.ХАРАКТЕРИСТИКА ТЕСТА, АНАЛИТИЧЕСКИЕ ТЕХНОЛОГИИВ клоттинговом тесте к дефицитной по протеину S субстратной плазме добав¬
ляют разведенную исследуемую плазму, фосфолипиды, активный протеин С и
его субстрат — фактор Va. В ходе инкубации часть фактора Va расщепляется про¬
теином С, причем скорость распада зависит от содержания в исследуемой плазме
протеина S. Оставшееся количество фактора Va при добавлении способствует
активации фактора X, что приводит к образованию тромбина и формированию
сгустка. Степень увеличения АЧТВ смеси определяется количеством свободного
протеина S в исследуемой плазме: чем больше его содержание, тем более значи¬
тельно увеличение АЧТВ. Наряду с плазмой пациента исследуют нормальную
референтную пулированную плазму; результат выражается в процентах показате¬
ля плазмы.Иммунохимигескими методами (ИФА, РИА) определяют количество про¬
теина S, но не его функциональную активность. Прямое определение общего Пр5
(свободного и связанного) основано на использовании поликлональных антител,
свободного ПрЗ — моноклональных антител, высокоспецифичных к эпитопам
свободной формы анализа.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИТе же, что в тесте протеина С.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫОбщий протеин S - 65-140% уровня РНП-плазмы, или 0,67-1,25 ЕД/мл; сво¬
бодный протеин S — 57-120%, или 0,23-0,49 ЕД/мл.ИНТЕРФЕРЕНЦИИНа результаты ИФА-теста влияют липемия и присутствие ревматоидного
фактора. Снижение уровня Пр5 может быть связано с приемом пероральных
контрацептивов. Для нейтрализации гепарина* в концентрации до 1,2 ЕД/мл в
клоттинговом тесте в состав буферного раствора вводят синтетический антагонист
гепарина - полибрен.ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАДля контроля качества используют стандартную контрольную плазму.
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВСнижение активности (концентрации) протеина S возможно при остром вос¬
палении и во время беременности (связывание с острофазным С4Ь-связывающим
белком), а также при тяжелых поражениях печени, гиповитаминозе К, при лече¬
нии варфарином (нарушение синтеза). Существенное снижение количества ПрЗ
чаще свидетельствует о врожденной недостаточности; аномалии структуры, функ¬
циональная неполноценность наблюдаются редко. При нефротическом синдроме
снижается соотношение свободной и связанной форм Пр8 из-за потерь свободной
формы через почки.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯВыявление снижения содержания/активности протеина S важно для определе¬
ния причин тромбофилии с эпизодами венозного тромбоза и тромбоэмболии как
в молодом, так и зрелом возрасте. Дефицит протеина S может влиять на тактику
ведения больных с тромбозами и использования гормональных препаратов у
женщин.
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ gQIХПа-калликреинзависимый фибринолиз
(ХПа-зависимый лизис эуглобулинов)Активация фибринолиза протекает одновременно с запуском внутреннего пути
гемостаза, поскольку инициируется одними и теми же факторами — фактором XII
и компонентами калликреин-кининовой системы; фактор XII даже более значим
для фибринолиза, чем для гемостатических функций. Образующийся активный
плазмин постепенно разрушает фибриновые сгустки и способствует восстановле¬
нию кровотока в сосуде.ХАРАКТЕРИСТИКА ТЕСТАИз бедной тромбоцитами цитратной плазмы в слабокислой среде после добав¬
ления каолина выделяют эуглобулиновую фракцию, содержащую фибриноген,
плазминоген и активированные факторы внутреннего пути свертывания (в том
числе фактор XII, калликреин и плазмин). После отделения эуглобулинов, их рас¬
творения в буферном растворе и рекальцификации образуется фибриновый сгу¬
сток, который растворяется плазмином (определяют время лизиса сгустка).Благодаря быстрому выполнению методика выгодно отличается от теста спон¬
танного лизиса эуглобулинов, в котором их осаждение проводят при охлаждении,
каолин к плазме не добавляют и контактные факторы гемостаза дополнительно не
активируются.Метод можно применять для оценки активации фибринолиза in vivo при сти¬
муляции выброса тканевого активатора плазминогена из эндотелия в кровь. Для
этого определяют время лизиса э>тлобулинов в плазме крови, полученной из вены
до и после дозированного венозного стаза, создаваемого с помощью сфигмомано-
метра.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИСоблюдают общие условия взятия венозной крови для исследования гемостаза
и получения бедной тромбоцитами цитратной плазмы. Плазма для исследования
должна быть получена не более чем за 2 ч до анализа. Не допускается анализ плаз¬
мы, имеющей сгустки, следы гемолиза, а также замороженной и оттаянной.МЕТОДИКА ИССЛЕДОВАНИЯРазведенную водой исследуемую плазму подкисляют уксусной кислотой, добав¬
ляют суспензию каолина, инкубируют при 37 “С, центрифугируют и удаляют
супернатант. Оставшийся на дне пробирки осадок эуглобулинов разводят в буфере,
добавляют раствор СаСІ2 (при этом образуется сгусток) и инкубируют, определяя
время от момента образования до полного растворения сгустка.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫХПа-зависимый лизис эуглобулинов — 4-12 мин, В тесте стимуляции выброса
тканевого активатора плазминогена время лизиса эуглобулинов после венозного
стаза уменьшается в норме в 1,5-2 раза.ИНТЕРФЕРЕНЦИИНа результаты исследования существенно влияют концентрация фибриногена
в исследуемой плазме, введение лекарственных препаратов, стимулирующих про-
теолитические процессы (фибринолитиков), а также ингибиторов протеолиза
(контрикала*, трасилола* и др.)ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАЧеткая процедура контроля в настоящее время не определена. Проверку
качества реактивов и методики проводят путем исследования свежеразведенной
802 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯстандартной контрольной плазмы или свежей пулированной плазмы от здоровых
людей.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВЗамедление ХПа-зависимого лизиса эуглобулинов (увеличение времени фибри-
нолиза) наблюдается вследствие снижения уровня или недостаточной активации
участвующих в реакции компонентов (фактора XII, прекалликреина, высокомоле¬
кулярного кининогена, плазминогена). Чаще всего удлинение времени лизиса до
30-60 мин и более связано с дефицитом плазминогена, присутствием большого
количества ингибиторов протеолиза либо с гиперфибриногенемией (образуется
более плотный и медленнее лизируемый сгусток), в систему можно дополнитель¬
но ввести стрептокиназу или урокиназу, которые при нарушении активации плаз-
мина нормализуют лизис сгустка, а при дефиците плазминогена — существенно не
влияют на фибринолиз.При дисфункции эндотелия (тромбозах, патологии почек и прочих состояниях)
выход тканевого активатора плазминогена в кровь нарушается, и время лизиса
эуглобулинов после венозного стаза остается удлиненным или уменьшается менее
чем в 1,5 раза.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯИсследование лизиса эуглобулинов проводят для оценки состояния системы
фибринолиза у пациентов. Метод чувствителен к любой патологии плазменных
протеолитических систем, в частности при тромбозах, ДВС крови, болезнях пече¬
ни, иммунных и иммунокомплексных заболеваниях и др., а также при передози¬
ровке лекарственных препаратов — ингибиторов протеаз.Плазминоген (количество/максимальная активность)Плазминоген — главный компонент фибриколитической системы — синтези¬
руется в печени и почках и постоянно находится в крови. Образующийся из плаз¬
миногена под действием активаторов плазмин разрушает фибриновые сгустки и
способствует восстановлению кровотока.ХАРАКТЕРИСТИКА ТЕСТАПосле максимальной активации стрептокиназой плазминогена в исследуемой
плазме определяют скорость расщепления пептидного хромогенного субстрата
(по нарастанию окраски реакционной среды, метод фиксированного времени).
Количество образуемого при этом окрашенного вещества прямо пропорционально
количеству активности плазминогена. Для определения количества плазминогена
можно использовать и метод ИФА.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИТе же, что в тесте лизиса эуглобулинов.МЕТОДИКА ИССЛЕДОВАНИЯОпределение проводят на фотометре, биохимическом анализаторе или анали¬
заторе гемостаза с фотометрическим каналом. Исследуемую бестромбоцитарную
плазму разводят буферным раствором, добавляют стрептокиназу и инкубируют
при 37 °С. Затем в реакционную смесь вводят хромогенный субстрат и по исте¬
чении определенного времени останавливают реакцию добавлением уксусной
кислоты. Свежеразведенную стандартную нормальную плазму с известным
количеством плазминогена, входящую в набор, обрабатывают по такой же про¬
цедуре, пробу-бланк — так же, как стандартную, но без добавления стрептоки-
назы. После остановки реакции определяют оптическую плотность исследуемого
КОАГ7ЛОЛОП14ЕСКИЕ ИССЛЕДОВАНИЯ 8Q3И стандартного образцов против бланка при >.=405 нм и вычисляют количество
плазминогена (активность плазмина) в исследуемом образце в процентах стан- ^
дартной плазмы. '"аРЕФЕРЕНТНЫЕ ПРЕДЕЛЫСоставляют 75-135% уровня стандартной плазмы; при определении ИФА-
методом — около 200 мкг/мл.ИНТЕРФЕРЕНЦИИНа результаты исследования влияют лекарственные препараты — ингибиторы
протеолиза (контрикал*, трасилол* и др.). Прием эстрогенсодержащих препара¬
тов, стимулирующих синтез белков (в том числе плазминогена) в печени, также
может отразиться на результатах теста.ОБЕСПЕЧЕНИЕ И КОНТРОЛЬ КАЧЕСТВАПроверку качества реактивов и методики проводят путем исследования свеже-
разведенной лиофилизированной контрольной плазмы.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВАбсолютное снижение уровня плазминогена почти всегда связано с его гипер¬
потреблением в результате активации фибринолиза, сопровождающей ДВС крови,
массивные и/или длительные тромбозы, тромбоэмболии, инфаркт миокарда и др.,
а также процедуру тромболизиса. Врожденное снижение концентрации плазмино¬
гена часто сочетается с его функциональной неполноценностью и является тром-
бофилическим состоянием. Піпоплазминогенемия может также развиваться при
хронической тяжелой патологии печени и почек: в то же время к концу беремен¬
ности, при инфекциях, воспалительных процессах, опухолях, травмах концентра¬
ция/активность плазминогена может нарастать.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯТест используют для оценки состояния фибринолиза и резерва плазминогена
у пациентов. Лечение активаторами плазминогена (стрептокиназой, урокиназой,
алтеплазой и др.) может быть эффективным только при его достаточном уровне
в крови; для экстренного восполнения плазминогена можно ввести свежезаморо¬
женную плазму.Тканевый активатор плазминогенаТканевый активатор плазминогена (tPA) — важный ферментный фактор фибри-
нолитической системы, основной активатор плазминогена на поверхности фибри¬
нового сгустка. tPA синтезируется и секретируется клетками эндотелия. Бремя его
полужизни в кровотоке - около 5 мин (захватывается клетками печени), в плазме
крови — дольше. Потеря активности tPA происходит при связывании с избытком
ингибитора активатора плазминогена (ИАП-1), также секретируемым эндотели¬
альными клетками; в кровотоке в основном обнаруживают стабильные неактив¬
ные комплексы «tPA-HAH».Уровень tPA увеличивается с возрастом, после физических нагрузок и стрессов.ХАРАКТЕРИСТИКА ТЕСТАХромогенный метод основан на определении степени активации стандартного
количества плазминогена тканевым активатором, содержащимся в исследуемой
разведенной плазме. В дальнейшем плазмин расщепляет хромогенный субстрат с
образованием окраски, интенсивность которой измеряется на фотометре или био¬
химическом анализаторе методом фиксированного времени.
804 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯИлшуноферментный метод с моноклональными антителами позволяет опреде¬
лять количество как свободной, так и связанной формы tPA (антигена). В состав
набора входит плазма-калибратор, уровень tPA в которой соотнесен с междуна¬
родным стандартом.Комбинированный метод, сочетающий классический твердофазный ИФА с
хромогенным методом, позволяет определять активность и количество tPA.
Комбинированный метод основан на использовании антител, не влияющих на
функциональную активность tPA и иммобилизованных в лунках микропланшета.
Их используют для связывания tPA, содержащегося в плазме, с поверхностью
лунок. После первой инкубации несвязавшиеся компоненты плазмы удаляются
промывкой. Затем в лунки добавляют субстратный раствор для определения
активности, содержащий Glu-плазминоген, CNBr-фрагменты фибриногена и хро¬
могенный субстрат плазмина. Связавшийся tPA активирует Glu-плазминоген с
образованием плазмина. Б результате реакции между плазмином и хромогенным
субстратом плазмина образуется окрашенный продукт. Интенсивность развивше¬
гося окрашивания, пропорциональную количеству активного tPA в исследуемом
образце, измеряют фотометрически. После измерения раствор для определения
активности удаляют промывкой (tPA-антиген при этом остается связанным с анти¬
телами, сорбированными в лунках микропланшета) и в лунки добавляют конъюгат
моноклональных анти-іРА-антител, распознающих обе формы tPA — активную и
связанную с пероксидазой хрена (ПХ). По окончании инкубации антителами и
промывки в лунки добавляют субстрат, в результате чего образуется окрашенный
продукт. Интенсивность окрашивания пропорциональна общей концентрации tPA
в тестируемом образце, на этой стадии определяется как свободная форма tPA, так
и комплекс «tPA-PAI-1».О способности tPA высвобождаться из клеток сосудистой стенки при дозиро¬
ванном венозном стазе свидетельствует результат манжеточной пробы: на плечо
накладывают манжету тонометра, раздувают ее до 40 мм Hg и держат 10-15 мин;
до и после процедуры берут кровь и определяют в плазме уровень tPA или ско¬
рость фибринолиза (см. «ХПа-зависимый лизис эуглобулинов»).ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИ, ИНТЕРФЕРЕНЦИИМожно использовать цитратную или ЭДТА-плазму, полученную у пациента
утром натощак; исследование должно быть проведено не позднее 8 ч с момента
взятия крови или 4 ч после размораживания. tPA неустойчив, для предупрежде¬
ния его быстрого ингибирования in vitro пробы крови подкисляют (выпускаются
пробирки с кислым антикоагулянтом). На результаты ИФА не влияют гепарин* в
концентрации до 2 МЕ/мл и ИАП-1 — до 100 нг/мл.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫБолее 10 нг/мл (95% — в комплексе с ИАП-1). При стимуляции уровень tPA
возрастает до 15 нг/мл.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВВозрастание концентрации tPA наблюдается при остром инфаркте миокарда,
инсульте, заболеваниях печени, РДС, сепсисе и др. Быстрое увеличение концен¬
трации tPA как за счет выброса из клеточных депо, так и за счет ускорения синтеза
вызывается венозной окклюзией, физической нагрузкой, введением десмопресси-
на, катехоламинов и может повышать фибринолитическую активность. Вместе с
тем при медленном нарастании плазменной концентрации повышенный уровень
tPA (антигена) часто сочетается с высоким уровнем ИАП-1, что сопровождается
снижением фибринолитического потенциала плазмы.Уровень tPA бывает снижен у пациентов с тромботическими нарушениями
(тромбозом глубоких вен, инфарктом миокарда, ишемическим инсультом), злока-
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ $05чественными новообразованиями и тяжелым сепсисом. Снижение tPA часто ведет
к недостаточности фибринолиза и является фактором риска развития тромбозов.Определение tPA проводят для выявления причины тромбофилии у больных, Z
а также в ходе терапии активаторами фибринолиза (алтеплазой и др.) Выявлена
прямая связь между >т)овнем tPA (антигена) и степенью риска развития и про¬
грессирования сердечно-сосудистой патологии; повышение tPA после инфаркта
миокарда рассматривается как маркер дисфункции эндотелия и неблагоприятный
прогностический фактор. Нарушение высвобождения tPA из сосудистого эндоте¬
лия после венозного стаза описано у больных с тромбозами и патологией почек.Повышенные уровни tPA-антигена и активности tPAТакие результаты свидетельствуют об увеличении выброса tPA, который не
сбалансирован соответствующим усилением выброса PAI-1. Это указывает на пер¬
вичный гиперфибринолиз и, вероятно, приведет к образованию плазмина, расходу
ингибиторов плазмина и деградации других белков плазмы, таких как фибриноген
и фактор VIII.Повышенный уровень 1В\-антигена и нормальная активность tPAТакой результат отражает длительное накопление tPA из-за снижения его дегра¬
дации в печени. Это может наблюдаться при различных заболеваниях печени.Если повышение уровня антигена нейтрализуется одновременным повышением
уровня ингибитора PAI-1, заметным остается только повышение уровня антигена
tPA. Кроме того, к значительному повышению уровня tPA-антигена при низкой
или слабоповышенной активности tPA может приводить гепариновая терапия.Сниженные tPA-антиген и tR^-активностьТакой результат может быть безошибочно получен только при тестировании
образцов плазмы при венозной окклюзии. Такие образцы плазмы должны пока¬
зывать повышение как активности, так и антигена. Если и активность, и антиген
понижены в таких образцах, это свидетельствует о неспособности организма паци¬
ента адекватно реагировать на данный тип стимуляции. Приблизительно 10% всех
пациентов, страдающих тромбозом, попадают в эту группу.Сниженная tPA-активность при нормальном уровне іЕ\-антигенаАналогично предыдущему случаю такой результат может наблюдаться только
при тестировании образцов плазмы с ожидаемыми высокими значениями tPA-
активности и tPA-антигена, например при венозной окклюзии. У таких пациентов
происходит нормальная секреция tPA-антигена в ответ на венозную окклюзию
или иную стимуляцию. Однако слишком высокий уровень PAI-1 нейтрализует
увеличившуюся активность tPA, в результате чего наблюдается высокий уровень
комплекса «tPA-PAI-1». Приблизительно 20% пациентов с тромбофилией попа¬
дают в эту группу.Ингибитор активатора плазминогенаИнгибитор активатора плазминогена (ИАП-1) — основной фактор, связываю¬
щий и ингибирующий как тканевый, так и урокиназный активаторы плазминоге¬
на, — секретируется эндотелиальными клетками. ИАП-1 также может высвобож¬
даться из тромбоцитов. Синтез ИАП-1 значительно усиливается при повреждении
эндотелия, что приводит к замене антикоагулянтного потенциала эндотелия на
прокоагулянтный.ХАРАКТЕРИСТИКА ТЕСТАДвухэтапный хромогенный метод определения ИАП-1 основан на добавлении к
исследуемой плазме стандартного количества tPA; при этом активность последнего
частично подавляется присутствующим в плазме пациента ИАП-1. Оставшаяся
активной часть tPA активируется добавленным в избытке плазминогеном; обра-
ш806 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯзовавшийся плазмин гидролизуется хромогенным субстратом с образовани¬
ем окраски (ее интенсивность обратно пропорциональна содержанию ИАП-1).
Параллельно проводят исследование стандартной контрольной плазмы.Иммунохимигескими тестами можно определить как общую концентрацию
антигена ИАП-1 (классическим ИФА-методом), так и активную (свободную)
форму ИАП-1 по ее способности связываться с молекулами tPA, иммобилизи¬
рованными в лунке планшета, и с конъюгатом пероксидазы с моноклональными
антителами к ИАП-1. Тесты специфичны» на их результаты не влияют другие
ингибиторы.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИ, ИНТЕРФЕРЕНЦИЯИнгибитор активатора плазминогена неустойчив, поэтому анализ необходи¬
мо проводить в кратчайшие сроки после взятия крови, лучше с использованием
CTAD-пробирок (с добавлением стабилизаторов для гемостаза). Особое внима¬
ние уделяют режиму получения цитратной бестромбоцитной плазмы, поскольку
ИАП-1 может дополнительно высвобождаться из тромбоцитов. Плазму переносят
в пластиковые пробирки и хранят на льду до исследования. Уровень ИАП-1 в
утренней пробе крови вдвое превышает его концентрацию в крови, взятой днем.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫОбщий ИАП-1 — 2-40 нг/мл (рост уровня с возрастом), свободный (актив¬
ный) — 1-7 ЕД/мл.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ, ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВИАП-1 — белок острой фазы, его концентрация в плазме возрастает вме¬
сте с интерлейкином-1. Повышенный уровень ИАП-1 отмечается после травм
и операций, при венозных тромбозах, воспалении, инфекционных процессах
и сепсисе, злокачественных опухолях, ожирении, болезнях печени, инфаркте
миокарда и коронарных заболеваниях, синдроме привычного невынашивания
беременности, а также при лечении глюкокортикоидами. Некоторое повышение
ИАП-1 (одновременно с tPA) возможно при нормальной беременности. Уровень
общего ИАП-1 более 100 нг/мл и активность свободного ИАП-1 выше 20 ЕД/мл
могут указывать на снижение фибринолитической активности и повышенный
риск развития сердечно-сосудистых заболеваний и тромботических осложне¬
ний. Прогрессирующий подъем ИАП-1 при остром инфаркте миокарда является
неблагоприятным прогностическим признаком и свидетельствует о дисфункции
эндотелия.D-димерD-димер — продукт распада фибринового сгустка — представляет собой моле¬
кулярные фрагменты поперечно сшитого фибрина, образуемые при его про-
теолитической деградации активным плазмином. В структуре D-димера имеются
D-D-связи (поперечные сшивки), которые отсутствуют в фибриногене, фибрин-
мономере и рыхлом фибрин-полимере. D-D-связи образуются в результате дей¬
ствия фактора ХПІа, уплотняют фибриновый сгусток и не разрушаются плазми¬
ном.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИСоблюдают общие условия взятия венозной крови для исследования гемостаза
и получения цитратной плазмы. На определение D-димера мало влияют погреш¬
ности техники взятия крови и примесь тромбоцитов. Не рекомендуют исследовать
плазму, в которой образовались сгустки in vitro. Возможно определение D-димера в
сыворотке, но только при условии полного свертывания крови и предотвращения
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ gQ?фибринолиза во взятом образце (что достаточно трудно обеспечить). При пол}Т[Є-
нии сыворотки, во избежание новообразования D-димера in vitro, сгусток необхо¬
димо быстро извлечь; к пробе крови можно предварительно добавить ингибитор
фибринолиза (є-аминокапроновую кислоту).МЕТОДИКА ИССЛЕДОВАНИЯОпределение D-димера в плазме или сыворотке проводят методами латекс-
агглютинации, иммунохроматографии (мембранной иммунодиффузии), имму-
нотурбидиметрии с усилением пластиковыми частицами, иммунохемилюминес-
ценции; в цельной крови — исследованием агглютинации эритроцитов пациента
в присутствии биспецифичных антител к D-димеру и поверхностному белку эри-
троцитарных мембран.Для полуколичественной оценки в тесте латекс-агглютинации определяют
наибольшее разведение плазмы или сыворотки, дающее видимую агглютинацию
латексных частиц с фиксированными на них моноклональными антителами к
D-димеру. В иммунохроматографическом полуколичественном тесте при связыва¬
нии D-димера с конъюгатом антитело-золото интенсивность окрашивания тесто¬
вой зоны на картридже сравнивают со специальной цветовой шкалой.Для точной количественной оценки результатов используют рефлектометри-
ческие приборы, позволяющие определить содержание D-димера с точностью до
од мг/л в интервале от ОД до 20,0 мг/л. Используют также иммуноферментный
метод с латексным усилением, обладающий высокими аналитическими харак¬
теристиками. В целом для анализа D-димера предпочтительнее количественные
методы, позволяющие вести временной мониторинг анализа.Результаты характеризуются достаточно высокой специфичностью благодаря
использованию иммунных методов. ИФА-метод характеризуется более высокой
чувствительностью по сравнению с турбидиметрией и иммунохроматографией,
поэтому этот метод оптимален для мониторинга уровня D-димера, за исключени¬
ем случаев неотложных состояний.Описана возможность искажения результатов полуколичественного теста при
ревматоидном факторе.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫВ количественных тестах — 110-300 нг/мл, или менее 0,5 мг/л; в качественных
тестах D-димер у здоровых людей не выявляется (ниже минимального уровня).ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВЗначительное повышение D-димера наблюдается при ДВС крови (начиная с
ранних стадий), тромбоэмболии легочной артерии, артериальных и венозных
тромбозах, а также после травм и хирургических операций (особенно на крупных
костях и суставах). Уровень D-димера бывает повышен при инфаркте миокарда,
тромболитической терапии, некоторых инфекционных заболеваниях и злокаче¬
ственных новообразованиях. Возможен некоторый рост уровня D-димера при
беременности, сахарном диабете, длительной иммобилизации, в пожилом воз¬
расте и т.д. D-димер является достаточно инерционным показателем ввиду отно¬
сительно длительной циркуляции в кровотоке (период полу выведения — более
24 ч).Чувствительность теста в диагностике венозного тромбоэмболизма [тромбоза
глубоких вен и/или тромбоэмболии легочной артерии (ТЭЛА)] очень высока —
90-97%, специфичность же невелика (60-70%). Таким образом, отрицательный
результат анализа или значение ниже точки cut-off практически всегда свиде¬
тельствует об отсутствии тромбов в кровеносном русле. Ложноотрицательные
результаты редки (при очень малом размере тромба, угнетении фибринолиза
и/или резком дефиците плазмина).
808КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЙПри оценке результатов исследования, особенно количественного, нужно учи¬
тывать, что повышение уровня D-димера указывает на образование фибрина и его
лизис плазмином, а в каком отделе сосудистого русла, в каком объеме и по какой
причине это произошло — необходимо решать в каждом конкретном случае.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯВ целом D-димер — один из наиболее надежных ранних маркеров тромбооб-
разования и фибринолиза (распада фибрина, но не фибриногена) in vivo. Он отно¬
сится к группе маркеров активации свертывания (наряду с фибрин-мономером,
фрагментами протромбина 1+2, тромбин-антитромбиновым комплексом и др.);
именно эта группа исследований, а не укорочение АЧТВ и ПВ, свидетельствует о
гиперкоагуляции.Основная цель исследования D-димера — исключение наличия тромбов в сосу¬
дистом русле (при дифференциальной диагностике тромбоза глубоких вен нижних
конечностей, тромбоэмболии легочной артерии и др.). Его можно применять как
тест первой линии, т.е. у всех больных с подозрением на венозный тромбоэмболизм,
с последующим проведением дополнительных исследований у пациентов с положи¬
тельными результатами теста на D-димер. Другой стратегический подход — пред¬
варительная оценка по балльным шкалам. При высокой клинической вероятности
тромбоза или эмболии измерение D-димера не проводят, а сразу выполняют допол¬
нительные диагностические процедуры и начинают активную антикоагулянтную
терапию; при средней или низкой вероятности диагноза измеряют уровень D-димера
и в зависимости от полученного результата принимают решение о дальнейших дей¬
ствиях. Тест можно использовать в диагностике ДВС и при определении эффектив¬
ности антитромботической терапии. При отсутствии срочности (не в ургентной
ситуации) значение имеет только количественное определение D-димера,Растворимые фибрин-мономерные комплексы (РФМК)Образование фибрин-мономеров (ФМ) — начальная реакция формирования
сгустка; количество ФМ зависит от степени тромбинемии. В процессе физиоло¬
гической активации фибринолиза продукты деградации фибрина и фибриногена
(ПДФ) образуют комплексы с фибрин-мономерами, в результате формируются
растворимые фибрин-мономерные комплексы (РФМК).ХАРАКТЕРИСТИКА ТЕСТАРФМК-тест — паракоагуляционная проба, позволяющая оценить содержание
в плазме крови растворимых фибрин-мономерных комплексов, способных пре-
ципитироваться в присутствии некоторых химических агентов. В зависимости
от активатора преципитации обозначают конкретный метод выявления РФМК,
В частности, о-фенантролиновый метод основан на регистрации времени появле¬
ния хлопьев или зерен паракоагулята при добавлении к исследуемой плазме рас¬
твора о-фенантролина, при этом скорость образования хлопьев зависит от концен¬
трации РФМК. Б стеклянной пробирке при комнатной температуре и непрерывном
покачивании смешивают исследуемую плазму с раствором о-фенантролина; на
черном фоне в проходящем свете визуально определяют время появления хлопьев
пара коагулята. Полуколичественную оценку проводят сопоставлением времени
(если оно менее 120 с) с концентрацией РФМК по специальной таблице; чем
меньше время, тем выше содержание фибрин-мономерных комплексов. Оценка
результатов субъективна, и в целом точность метода невысока.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИСоблюдают общие условия взятия венозной крови для исследования гемостаза
и получения цитратной плазмы. Ложноположительные результаты возможны при
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ $09попадании в пробирку первых капель, содержащих фрагменты тканей, и недо¬
статочно быстром перемешивании с антикоагулянтом. Не допускается анализ
плазмы, имеющей сгустки и полученной более чем за 2-4 ч до анализа. Возможно
искажение результатов при парапротеинемии, инфузии некоторых белковых пре¬
паратов и кровезаменителей. Завышенные значения могут быть у беременных и
новорожденных.РЕФЕРЕНТНЫЕ ПРЕДЕЛЫХлопья не должны образовываться в первые 70-120 с наблюдения (отрица¬
тельный результат пробы, концентрация РФМК — <35-40 мг/л).ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВПоложительный результат является признаком тромбинемии и наблюдается
при активации свертывания, тромбофилических состояниях (в том числе при
злокачественных новообразованиях), а также при тромбозах, эмболиях и ДВС
крови. По результатам РФМК-теста судят об активности свертывания крови, а
по динамической оценке уровня РФМК — о развитии процесса и эффективно¬
сти терапевтических мероприятий. Однако ввиду невысокой чувствительности,
отсутствия калибровочных и контрольных материалов и субъективности оценки
результатов РФМК-тест можно рассматривать только как ориентировочный.
Применение паракоагуляционных тестов нецелесообразно при доступности совре¬
менных стандартизированных методик оценкі^ активации свертывания и фибри-
нолиза (D-димера, фрагментов протромбина, комплекса «тромбин-антитромбин»,
фибринопептида А, ПДФ).Волчаночный антикоагулянтВолчаночный антикоагулянт (ВА) — гетерогенная группа антител против отри¬
цательно заряженных анионных фосфолипидов и их комплексов со специфически¬
ми белками. Антикоагулянты волчаночного типа связываются с фосфолипидными
мембранами и «экранируют» их, при этом тормозится активация коагуляционных
ферментных комплексов и замедляется свертывание крови in vitro. Вследствие
повреждения антителами мембран эндотелиальных клеток, снижения продукции
простациклина и нарушений в антикоагулянтной системе протеина С у пациентов
возникает тромбофилическое состояние, чреватое развитием тромбозов (тромбо¬
эмболий) и ишемическим поражением тканей.ХАРАКТЕРИСТИКА ТЕСТАПрисутствие ВА приводит к удлинению времени образования сгустка в фос-
фолипидзависимых коагуляционных тестах, наиболее отчетливо — при низких
концентрациях активаторов свертывания. Обусловленная В А гипокоагуляция
не корригируется нормальной бедной тромбоцитами плазмой, но исправляется
добавлением к исследуемой плазме тканевых или эритроцитарных фосфолипидов
или разрушенных тромбоцитов.Дополнительным признаком наличия ВА в тесте с препаратами змеиных ядов
может служить возрастание текстарин-экаринового (или лебетокс-эхитоксового)
коэффициента. Его значимость обусловлена тем, что действие текстарина или
лебетокса (прямого активатора фактора X) зависит от присутствия фосфолипидов
и наличия ВА, а экарина или эхитокса (прямого активатора протромбина) — не
зависит.ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИСоблюдают общие условия взятия венозной крови для исследования гемостаза
и получения цитратной плазмы. Наличие тромбоцитов в пробе, превышающее
810 КОАГУЛОЛОГИЧБСКИЕ ИССЛЕДОВАНИЯ10x1 Оул, может маскировать вызванные В А коагуляционные сдвига и дать лож-
неотрицательный результат, поэтому особое внимание уделяют режиму получения
бестромбоцитной плазмы (необходимо двухэтапное центрифугирование).Определение ВА основано на клоттинговых тестах, результаты которых зависят
от использования антикоагулянтов — гепарина* и антагонистов витамина К. Во
избежание ложноположительных результатов определения ВА пациенту необходи¬
мо отменить гепарин* минимум за 2 дня, кумариновые препараты (варфарин) ~ за
2 нед до взятия крови. Однако реальная клиническая ситуация (тромбозы, тромбо¬
эмболии) не всегда позволяет отменить препараты перед лабораторнь/м исследова¬
нием; в первую очередь, это относится к гепарину*. Для подтверждения диагноза
АФС у больных с тромбозами, получающих антикоагулянты непрямого действия,
предпочтительно определение антител к р2'ГЛИК0Пр0ТеИНу-1 методом ИФА.МЕТОДИКА ИССЛЕДОВАНИЯОпределение в А проводят в соответствии с рекомендациями Международного
общества по изучению тромбозов и гемостаза (ISTH — исследовательская группа
по В А и фосфолипидзависимым антителам); критерии диагностики АФС были
приняты в 1999 г. в Саппоро и обновлены в 2004 г. в Сиднее, Учитывая, что тест на
ВА со 100% чувствительностью отсутствует, на I этапе (скрининговые исследова¬
ния) проводят минимум два теста с исследуемой и контрольной плазмой, выбирая
их из следующих;• каолиновое время бедной тромбоцитами плазмы;• АЧТВ обычное и люпус-чувсгвительное (со сниженным количеством фосфо¬
липидов);• ПВ с ослабленным тромбопластином;• тест с разведенным лебетоксом или разведенным ядом гадюки Рассела
(diluted Russel Viper Venom Test — dRWT), основан на активации фактора X
протеазами яда; выполняют аналогично ПВ, но взамен громбопластина вно¬
сят соответствующий препарат.Чаще используют тесты, основанные на АЧТВ с низким содержанием фосфоли¬
пидов (более чувствителен к в А АЧТВ-реагент на основе каолина или кремнезема),
а также dRWT. Увеличение времени свертывания по сравнению с контрольной
плазмой более чем в 1,2-1,25 раза может быть связано с наличием ВА в исследуе¬
мом образце; дальнейшему исследованию подвергают только такие пробы.На II этапе (подтверждающие исследования) проводят последовательно два
микс-теста на основе того типа исследования, которое было положительным на 1
этапе;• микс-тест с нормальной плазмой. Повторяют то исследование, которое было
проведено на I этапе, взяв вместо исследуемой плазмы ее смесь в соотноше¬
нии 1:1 с нормальной бедной тромбоцитами плазмой, прогретую при 37 ®С в
течение 1-2 ч. Если в исследуемой плазме присутствуют ингибиторы коагуля¬
ции (в том числе ВА), добавление нормальной плазмы не нормализует время
свертывания — оно остается удлиненным более чем в 1,2 раза по сравнению
с нормальной донорской плазмой. Такие пробы подвергают исследованию на
следующей стадии;• микс-тест с фосфолипидами. Повторяют исследование предыдущей стадии,
взяв смесь в соотношении 1:1 исследуемой плазмы с препаратом компен¬
сирующих фосфолипидов (тромбоцитином, эритрофосфатидом и т.д.); ана¬
логично обрабатывают контрольную плазму. Если в исходно нарушенных
коаіуляционньїх тестах происходит полная или выраженная нормализация
времени свертывания (оно становится близким к результату, полученному на
смеси контрольной плазмы с фосфолипидами), результат подтверждающих
проб на ВА считают положительным.
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 811Таким образом, заключение о наличии ВА в исследуемой плазме, согласно
руководству ISTH, делают на основании удлинения свертывания плазмы в фосфо-
липидзависимых коагуляционных тестах.• АЧТВ с люпус-чувствительным реагентом. Соотношение АЧТВ больного/
АЧТВ донора — более 1,2 (например, 40"/30"=1,33).• dRVVT — тест с разведенным ядом гадюки Рассела. Соотношение dRVVT
больного/dRVVT донора — более 1,2.• Отсутствие коррекции удлиненного АЧТВ в микс-тесте с донорской плазмой
1:1.• Укорочение или коррекция АЧТВ и dRVVT в подтверждающих тестах при
добавлении фосфолипидов (гексагональных фосфолипидов, лиофилизиро-
ванных тромбоцитов, экстракта мозга кролика и др.)РЕФЕРЕНТНЫЕ ПРЕДЕЛЫДиагностический тест на ВА дает положительные результаты только при пато¬
логии. Степень коррекции, т.е. соотношение времени свертывания без добавления
фосфолипидов и после их внесения, свидетельствующее о наличии в А, остается
предметом обсуждения; в любом случае следует придерживаться рекомендаций
производителя используемых реагентов.ИНТЕРФЕРЕНЦИИНа определение ВА мог^т' влиять многие факторы. Удлинение времени сверты¬
вания на I этапе может быть связано с наличием гепарина* в пробе; для проверки
его присутствия можно определить ТВ исследуемой плазмы исходно и после обра¬
ботки сорбентом гепарина или гепариназой. Определение ВА в период гепарино-
терапии проводить нельзя.ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВЕсли результаты скрининговых тестов не противоречат предположению о нали¬
чии ВА, микс-пробы с нормальной плазмой не дали коррекции, но после добав¬
ления фосфолипидов произопша коррекция времени свертывания, то в плазме
крови присутствует ВА. Однако это не означает наличие у больного АФС, так как
В А может транзиторно появляться при вирусных заболеваниях, после вакцинации
и приема некоторых лекарственных препаратов.Наличие в плазме ВА на фоне аутоиммунной патологии (системной красной
волчанки, ревматоидного артрита и др.) рассматривается как тромбофилическое
состояние. При этом увеличивается риск рецидивирующих тромбозов вен и арте¬
рий, нарушений мозгового кровообращения, фетоплацентарной недостаточности
и привычного невынашивания беременности (выкидышей, внутриутробной гибе¬
ли плода), наблюдается наклонность к тромбоцитопении, развитию ДВС крови,
реже — к полиаллергии и другим иммунным нарушениям.Антитела к фосфолипидамАнтифосфолипидные антитела (АФА) представляют собой гетерогенную группу
аутоантител, взаимодействующих с анионными и нейтральными фосфолипидами,
с комплексами фосфолипидов и фосфолипидсвязывающих специфических белков
плазмы крови, а также с гликопротеиновыми рецепторами клеток крови, ассоции¬
рованными с фосфолипидами. АФА реагируют не собственно с фосфолипидами,
а со связывающими их белками, поэтому правильнее считать АФА антителами к
бежово-фосфолипидным комплексам.Указанные антитела классов IgG и IgM можно обнаружить как при перви^шом,
так и при вторичном антифосфолипидном синдроме (АФС), сопровождающемся
812 К0АГ7Л0Л0ГИЧЕСКИЕ ИССЛЕДОВАНИЯрядом воспалительных и невоспалительных заболеваний. В отличие от ВА, они
редко приводят к удлинению клотгинговых тестов (за исключением антител к
ІЗ^-гликопротеину-І, часто ассоциированных с гипокоагуляционными сдвигами);
наличие АФА связывают с риском развития тромбозов и других осложнений.
Содержание антител указанных типов может быть умеренно повышено у некото¬
рых здоровых людей, а также после перенесенных вирусных или бактериальных
инфекций или приема некоторых лекарственных препаратов. В таких случаях
необходимы сопоставление результатов с клинической картиной и повторное
исследование с интервалом не менее 9-12 нед. В соответствии с критериями
ISTH определение антифосфолипидных антител следует проводить методом ИФА
(ELISA) с выявлением кардиолипинсвязанного (і^-гликопротеина-І и прямым
определением антител к анти-р^-гликопротеину-І.МЕТОДИКА ИССЛЕДОВАНИЯНа начальном этапе целесообразно определение суммарных антител к кардио-
липину (КЛ), фосфатидилсерину (ФС), фосфатидилинозитолу (ФИ), фосфатидил-
этаноламину (ФЭА), фосфатидной кислоте (ФК); при положительном результате
возможно дифференцированное определение конкретного типа антифосфолипид¬
ных антител. У 3-10% больных с АФС единственным лабораторным признаком
заболевания является обнаружение антител к р^-гликопротеину-1.РЕФЕРЕНТНЫЕ ЗНАЧЕНИЯЗависят от диагностического набора и указываются фирмой-производителем.
Так, для антител к КЛ IgG — менее 10-19 МЕ/мл, IgM — менее 10 МЕ/мл, IgA ~
менее 15 МЕ/мл.ИНТЕРФЕРЕНЦИИВ ряде ситуаций ИФА-определению антител к фосфолипидам и специфическим
белкам мешают ревматоидный, антинуклеарный факторы, криоглобулины; при
их высокой концентрации в крови для диагностики АФС проводят определение
волчаночного антикоагулянта.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯАнтифосфолипидный синдром (АФС) диагностируют лишь при постоянном
наличии антифосфолипидных антител в крови пациента. Уровень стандартизации
лабораторных исследований в этом направлении пока недостаточен, а риск гипер¬
диагностики относительно велик, поскольку у 1-5% людей в общей популяции
определение АФА дает положительный результат. Лабораторными критериями
АФС у пациента являются:• наличие в плазме волчаночного антикоагулянта, определяемого в соответ¬
ствии с рекомендациями ISTH дважды или более с промежутком не менее
12 нед;• наличие антител к кард иол ипину (IgG и/или IgM) в среднем или высоком
титре и/или aHTH-Pj-rn-l-антител (IgG и/или IgM) в высоком титре в плаз¬
ме или сыворотке крови в двух или более измерений стандартным методом
ELISA с промежутком не менее 12 нед.Определение в А и АФА показано всем пациентам с тромботическими явле¬
ниями [тромбозами, инфарктами миокарда и острыми нарушениями мозгового
кровообращения (ОНМК) по ишемическому типу, особенно у молодых людей,
повторным невынашиванием беременности и др.], даже если АЧТВ у них не удли¬
нено. Уровень антифосфолипидных антител оценивают не только для диагностики
АФС, но и для контроля эффективности его терапии (иммуносупрессивной или с
применением экстракорпоральных методов).
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 813Иммунные ингибиторы факторов свертывания
(факторов VIII, IX)Аутоантитела к плазменным белкам — факторам свертывания крови (наиболее
часто к VIII или IX) связывают соответствующие факторы и замедляют свертыва¬
ние крови in vivo и in vitro. При значительном накоплении антител возможны почти
полное блокирование плазменных факторов и развитие ингибиторной формы
гемофилии с геморрагическим синдромом.ХАРАКТЕРИСТИКА ТЕСТАПри наличии в плазме пациента иммунных ингибиторов - аутоантител к фак¬
торам VIII или IX — немедленно после смешивания с нормальной донорской плаз¬
мой в микс-тесте 1:1 АЧТВ в значительной степени приближается к референтным
пределам, но после инкубации смеси тех же плазм в течение 1-2 ч при 37 “"С АЧТВ
остается удлиненным. Добавление фосфолипидов не приводит к нормализации
АЧТВ, определение соответствующего фактора (VIII или IX) показывает снижение
его уровня.МЕТОДИКА ИССЛЕДОВАНИЯДля количественного определения ингибиторных антител последовательные
разведения исследуемой плазмы смешивают в соотношении 1:1 с нормальной
пулированной плазмой, в получившихся микс-пробах после инкубации опреде-
лют степень снижения активности факторов VIII или IX по сравнению с исходной
нормальной плазмой. Активность плазменного ингибитора в единицах Bethesda
равняется рассчитанной степени разведения исследуемой плазмы, при которой
блокируется ровно 50% фактора. Остаточная факторная активность может быть
определена отношением количества фактора в смеси исследуемой и нормальной
плазм в пропорции 1:1 к количеству того же фактора в смеси нормальной плазмы
с имидазоловым буферным раствором (после двухчасовой инкубации при 37 “С) и
выражена в процентах.КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯПри наличии ингибиторных антител к плазменным факторам VIII и IX на фоне
клинической картины геморрагического синдрома, кроме АЧТВ плазмы, бывает
удлинено время свертывания цельной крови, в то время как другие базовые коа¬
гуляционные тесты (ПВ, ТВ, фибриноген, РФМК) изменяются в гораздо меньшей
степени или остаются нормальными (табл. 11-7).Антитела к плазменным факторам часто выявляют у больных с тяжелой гемо¬
филией, которым регулярно вводят концентраты или препараты факторов VIII
и IX. Они также могут появляться при аллергических и иммунопатологических
заболеваниях, онкопатологии, миеломной болезни и как реакция на некоторые
лекарственные препараты. Антитела к факторам свертывания могут появляться
у людей пожилого возраста, после иммуносупрессивной терапии они пропадают.
Антитела, появившиеся у женщин спустя 2-5 мес после родов, могут самопроиз¬
вольно исчезнуть через 1-1,5 года.Таблица 11-7. Лабораторные показатели гемостаза при врожденном дефиците факторов VIII и IX,
наличии иммунных ингибиторов (антител) и волчаночного антикоагулянтаТестВрожденный дефицит
факторов VIII и IXАнтитела к фак¬
торам VIII и IXВолчаиочныйантикоагулянтвремя кровотеченияНормаНормаНормаКоличество тромбоцитовНормаНормаНорма или уменьшениевек, ВСКаУвеличениеУвеличениеУвеличение/норма
814 КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯОкончание табл. 11-7ТестВрожденный дефицит
факторов VIII и IXАнтитела к фак¬
торам Viil и IXВолчаночныйантикоаг7лянтПВ (ПО, МНО)НормаНормаУвеличение/нормаАЧТВУвеличениеУвеличениеУвеличениеАЧТВ в микс-тесте 1:1с нормальной
плазмой сразу после смешиванияНормализацияНормализацияУвеличениеАЧТВ в микс-тесте 1:1 с нормаль¬
ной плазмой после 1-часовой
инкубацииНормализацияУвеличениеУвеличениеАЧТВ в микс-тесте
с фосфолипидамиУвеличениеУвеличениеНормализацияАктивность факторов VIII и IXСниженаСниженаНормаТипы коагулограммыОРИЕНТИРОВОЧНАЯ ГЕМОСТАЗИОГРАММААЧТВ , ПВ (ПО, МНО), уровень фибриногена, РФМК, количество тромбоцитов.ЛАБОРАТОРНЫЕ ТЕСТЫ ДЛЯ ОЦЕНКИ ГЕМОСТАЗА• Оценочные тесты 1-го уровня — выполняют в КДЛ первичного звена:количество тромбоцитов, время кровотечения, АЧТВ, ПВ (МНО), количе¬
ство фибриногена по методу Клауса.• Оценочные тесты 2-го уровня — выполняют в лабораториях диагностиче¬
ских центров и стационаров;агрегация тромбоцитов, ТВ, D-димер (или РФМК), лизис эуглобулинов.• Дополнительные тесты — выполняют в специализированных лаборато¬
риях:^ при кровоточивости — активность фактора фон Виллебранда и плазмен¬
ных факторов свертывания (VIII, IX, XI, VII, X, V, II, HMWK, РК);<> при склонности к тромбозам — антитромбин, протеины С и S, аРС-
резистентность, гомоцистеин, волчаночный антикоагулянт, антифосфоли-
пидные антитела, генетическое тестирование (FVЛейден G1691A, мутация
гена протромбина G20210A).• Контроль антитромботической терапии — в лабораториях всех уровней:<(> терапия нефракционированным гепарином — АЧТВ;терапия непрямыми антикоагулянтами — МНО.Лабораторная диагностика ДВС крови представлена в табл. 11-8.Таблица 11-8. Лабораторные показатели гемостаза в разных стадиях ДВС кровиПоказатели коагулограммыСтадии ДВС крови1IIIIID-димерN —ТтттттРФМКN —ТТ-ТТn - тттФибриногенN —ТН — Іii — не определяетсяАЧТВм-ТПгtt — ТТТПВ (ПО, МНО)N —іN-TТТ — ТТТТВNtТТ ТТТЭритроцитыNN —іТромбоцитыN —Тм —і
КОАГУЛОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ 815ОСНОВНЫЕ ЛАБОРАТОРНЫЕ ТЕСТЫ ПРИ ДВС КРОВИ• Тесты активации свертывания и фибринолиза — D-димер^ РФМК.• Тесты потребления/гиперпотребления плазменных факторов — изменения
уровня фибриногена и значений АЧТВ, ПВ, ТВ в динамике.• «Клеточные» маркеры ДВС — динамика количества тромбоцитов и их спон¬
танной агрегации, гемоглобин, фрагментация эритроцитов.ДОПОЛНИТЕЛЬНЫЕ И ПОДТВЕРЖДАЮЩИЕ ТЕСТЫ ПРИ ДВС КРОВИ• Активация свертывания — повышение содержания фибринопептида А, фраг¬
ментов протромбина 1+2, комплекса «тромбин-ангитромбин».• Потребление факторов — снижение содержания АТ, протеинов С и S.• Активация фибринолиза — повышение фибринолитической активности,
содержания комплекса «плазмин-антиплазмин», продуктов деградации
фибрина и фибриногена; снижение содержания плазминогена.• Тромбоцитариое звено — повышение содержания тромбоцитарного факто¬
ра-4, р-тромбоглобулина.
Глава 12Лабораторная диагностика
неотложных состоянийЛюбое вмешательство в организм больного в той или иной сте¬
пени приводит к нарушению гомеостаза. Особенно четко указанные
нарушения проявляются при крупных хирургических вмешатель¬
ствах, а также у больных в отделениях интенсивной терапии как
результат развития послеоперационных осложнений, в связи с про¬
явлением какой-либо другой патологии, внезапным заболеванием
или тяжелой травмой. Правильная и своевременная лабораторная
диагностика и лабораторное заключение позволяют выбрать и про¬
вести адекватную терапию, определяющую исход лечения больных.Критическое (неотложное) состояние — это крайняя степень
любой, в том числе ятрогенной, патологии, при которой необходима
интенсивная медикаментозная поддержка жизненно важных функ¬
ций организма или их искусственное замещение. Анестезиология и
реаниматология являются основными медицинскими дисциплина¬
ми, призванными обеспечивать защиту организма в экстремальных
условиях, обе дисциплины включают обязательный лабораторный
контроль адекватности проводимой терапии у больных в крити¬
ческом состоянии. Это обстоятельство способствовало созданию
лаборатории экспресс-диагностики, осуществляющей проведе¬
ние экспресс-анализов для оценки состояния пациента в услови¬
ях острых воздействий на организм повреждающих факторов —
синдромальной диагностики. В отличие от других клинических
лабораторий, лаборатория экспресс-диагностики непосредствен¬
но участвует в активном лечебном процессе, управляя теми или
иными действиями клиницистов; анестезиологов — Б операционной
или реаниматологов — в отделении интенсивной терапии. При
этом одним из основных условий успешной работы лаборатории
экспресс-диагностики является ее размещение в операционных и
отделениях интенсивной терапии, что способствует быстрому (не
более 5 мин) получению клиницистом анализов для подбора необ¬
ходимых методов терапии.Системы, которые наиболее быстро и остро нарушаются у боль¬
ных в критическом состоянии и имеют жизненно важное значение:• кислородный баланс;• кислотно-основное равновесие крови;• водно-электролитный баланс;• гемостаз;• гемореология.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ 81 ^Контролем этих систем определяется спектр основных лабораторных показате¬
лей, которые необходимо исследовать у больных в неотложном состоянии.Кислородный статус крови: sQ^, рО^, НЬ и его фракции (FHb02, HbCO, MetHb),
общее содержание Oj, р50.Кислотно-основное равновесие крови: pH, pCOj, HCO^, SB, BE,Основные метаболиты: лактат, глюкоза*Электролитный баланс: калий, натрий, кальций, магний, хлор, остаточные
(резидуальные — R) анионы.Водный баланс: осмоляльность плазмы и мочи, коллоидно-осмотическое дав¬
ление плазмы.Показатели свертывающей системы крови: обязательные — время свертывания
по Ли-Уайту, протромбиновое время (ПВ), тромбиновое время, АЧТВ, фибри¬
ноген, количество и функция тромбоцитов; уточняющие — антитромбин, ПДФ,
РФМК, D-димер и др.Показатели реологии крови: вязкость крови и плазмы, скорость оседания эри¬
троцитов с определением их функциональных свойств.При развитии у больных шока любой этиологии, органной или полиорганной
недостаточности не менее важными являются дополнительные исследования,
такие как:• общий анализ крови;• основной ферментативный спектр крови: ACT, АЛТ, ЛДГ, паніфеатическая
амилаза, тропонин, КФК, МВ-фракция КФК, ЩФ и др.;• биохимические показатели крови ~ количество белка и альбумина, глюкозы,
билирубин и др.;• показатели функционального состояния почек — креатинин и мочевина
крови и мочи с расчетом клубочковой фильтрации;• токсины — концентрация средних молекул и активация свободных радика¬
лов кислорода.Нарушение гомеостаза наиболее часто происходит при крупных хирургических
вмешательствах и в отделении интенсивной терапии, что обусловлено послед¬
ствиями операционного или другими видами стресса. Кроме того, в отделениях
интенсивной терапии могут отмечаться самостоятельные нар)тпения гомеостаза у
больных, не связанные с оперативным вмешательством.ПРИЧИНЫ НАРУШЕНИЯ ГОМЕОСТАЗА ВО ВРЕМЯ ОПЕРАЦИИ,
ДИАГНОСТИКА И МЕТОДЫ ИХ КОРРЕКЦИИОсновными причинами нарушения гомеостаза во время операции являются:• меньшая, чем необходимо, фракция вдыхаемого кислорода;• неадекватный режим работы аппарата ИВ Л;• гемодилюция;• гипотермия;• интенсивная гемотрансфузия.Пригит 1. Результатом меньшей, чем необходимо во время операции, фракции
вдыхаемого О2, получаемой больным, является использование при контроле окси-
генации артериальной крови (5^2) пульсоксиметров, в которых s^02 определяется
только по формуле отношения окисленного и восстановленного гемоглобина, не
учитывающей патологических фракций гемоглобина (MetHb, HbCO, FetHb и др.),
которые непосредственно влияют на снижение активной фракции оксигемогло-
бина (НЬ02) и определяют количество доставки 0^ к тканям. Именно активная
фракция 0^, соединенного с оксигенированным гемоглобином, отражает обеспе¬
чение организма кислородом, так как чем выше любая из патологических фракций
818 ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙгемоглобина, тем меньше места в формуле гемоглобина остается для соединения с
кислородом и тем ниже его активная фракция.Клинический пример. Больной А., 43 лет, доставлен в клинику с открытой
травмой брюшной полости, полученной при взрыве газового баллона; требуется
экстренное хирургическое вмешательство. Обычно во время операции больному в
аппарат ИВЛ подается 40-50% фракция О2 во вдыхаемом воздухе. Пульсоксиметр
показывает, что оксигенация артериальной крови равна 97%. Казалось бы, нет
причин для беспокойства, однако больной доставлен из задымленного помещения,
что предполагает у него увеличенную фракцию НЬСО. Действительно, определе¬
ние артериальной крови на газоанализаторе показало значительное увеличение
фракции НЬСО и резкое снижение (до 68%) активной фракции оксигемоглобина
(HbOj). Данный больной нуждается в высоких (до 100%) фракциях во вдыхае¬
мом воздухе для вымывания НЬСО и увеличения активной фракции НЬО^.Таким образом, в подобной ситуации использование лишь пульсоксиметра не
дает истинной картины оксигенации артериальной крови О^. Исследования газо¬
обмена у таких больных следует проводить на газоанализаторах со встроенным
или находящимся рядом многоволновом оксиметре, позволяющем определять
патологические фракции гемоглобина.Известно, что при многокомпонентной анестезии используют ряд анестетиков
и метаболитов, снижающих потребность организма в Oj (ПО2). Кроме того, при
операциях на сердце или аорте в условиях искусственного кровообращения доста¬
точно часто напрямую используют выраженную степень охлаждения больного
(28-18 '"С), что ощутимо снижает потребность организма в О^. В свою очередь,
уменьшение потребности организма в кислороде предполагает снижение его
доставки, составляющей в норме 820-860 мл/мин на м^. До какого же уровня
может снижаться доставка О2 (ДО2), оставаясь адекватной потребностям организ¬
ма? Конкретную цифру назвать трудно, поскольку она во многом определяется
длительностью и условиями операции. Однако свидетельством адекватного снаб¬
жения тканей кислородом при снижении ДО2 на фоне увеличенной ПО^ и нормаль¬
ного НЬ является концентрация лактата, не превышающая 3 ммоль/л.Пригина 2. Гипо- или гипервентиляция являются следствием неадекватного для
больного режима ИВЛ, что приводит к острым нарушениям кислотно-основного
равновесия крови. Снижение рС©2 артериальной крови менее 32 мм Hg способ¬
ствует увеличению pH и развитию респираторного алкалоза, последствия которого
могут приводить к выраженным гемодинамическим нарушениям. Увеличение рСО^
более 50 мм Hg способствует снижению pH и развитию острого дыхательного аци¬
доза, что приводит к нарушению ритма сердца, вплоть до полной его остановки.Пригина 3. Гемодилюция во время операции обусловлена переливанием большо¬
го количества кристаллоидов для восполнения ОЦК. Наиболее часто она наблю¬
дается при длительных хирургических вмешательствах. Гемодилюцию не всегда
можно трактовать как осложнение, потому что иногда она является обязательным
условием для проведения операции, но в таком случае необходимо учитывать ее
влияние на нарушения гомеостаза, которые возникают независимо от вызвавших
гемодилюцию причин. Ведущим осложнением является нарушение кислородного
баланса крови вследствие снижения гемоглобина и, как результат, уменьшение
кислородной емкости крови, другим — снижение концентрации ионов бикарбо¬
ната, способствующее развитию метаболического ацидоза. Особенно опасным
является сочетание гипотермии и кислородного дисбаланса, что приводит к гипок-
снческому метаболическому ацидозу. Отличие двух типов метаболического аци¬
доза (вследствие разведения или в результате гипоксии) — это более выраженная
степень снижения pH и концентрации бикарбоната, а также увеличение концен¬
трации резидуальных анионов и лактата во втором случае. При этом необходимо
помнить, что если обычный метаболический ацидоз, обусловленный разведением,
ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ 819не требует корреляции кислотно-основного состояния крови и достаточно быстро
нормализуется при стимуляции диуреза, гипоксический метаболический ацидоз
нуждается в одновременном введении растворов бикарбоната натрия и увеличе¬
нии количества кислорода, необходимого органам и тканям.Снижение концентрации основных электролитов, таких как калий, натрий, каль¬
ций и хлор, уменьшение количества прокоагулянтных факторов крови также могут
являться следствием гемодилюции и нуждаются в коррекции. Метаболический
алкалоз во время операции отмечается лишь в случаях исходных нарушений
электролитного баланса или большего, чем необходимо, переливания растворов
бикарбоната натрия. Это нарушение достаточно быстро корригируется введением
необходимых электролитов или стимуляцией диуреза для выведения избыточных
ионов бикарбоната натрия,Пригина 4. Гипотермия, особенно при операциях, требуюших снижения тем¬
пературы тела до менее 28 “"С, приводит к выраженным нарушениям гемостаза
и гемореологии. В свою очередь, изменениями микроциркуляции из-за увеличе¬
ния вязкости плазмы крови и нарушения функциональных свойств эритроцитов
определяется развитие циркуляторной гипоксии, нарушающей метаболизм как в
клетках, так и в организме в целом.Пригит 5. Избыточная гемотрансфузия также является одной из причин наруше¬
ния гомеостаза во время операции. Значительное переливание донорской крови и ее
компонентов при выраженной интраоперационной кровопотере опасно возможно¬
стью инфицирования больного, снижением иммунитета, развитием кислородного
дисбаланса, что влияет на течение раннего послеоперационного периода, способ¬
ствуя развитию органных поражений и/или полиорганной недостаточности.ПРИЧИНЫ НАРУШЕНИЙ ГОМЕОСТАЗА У БОЛЬНЫХ
В ОТДЕЛЕНИИ ИНТЕНСИВНОЙ ТЕРАПИИНормальный метаболизм и выработка энергии в организме возможны при
нескольких составляющих, в том числе:• достаточном количестве кислорода;• нормальном транспорте метаболитов;• целостности ферментных систем.Ключевым фактором, определяющим последовательное нарушение выработки
энергии, является кислородный дисбаланс, наблюдаемый в различной степени у
всех больных в критическом состоянии. Чувствительность органов к ишемиче¬
скому поражению различна; в первую очередь поражаются главные органы (мозг,
сердце, легкие), утяжеляя состояние больных, вплоть до развития органных пора¬
жений. Полиорганную недостаточность можно оценить как состояние, при кото¬
ром одновременно или последовательно поражаются жизненно важные системы,
состоянием которых определяется исход лечения: или больной выздоравливает,
или, несмотря на все усилия клиницистов, он умирает.Нарушения кислородного метаболизма, обусловленные гемодинамическими
изменениями, можно разделить на четыре основные группы.Повышенная потребность в 0^ при нормальном
его транспортеОтмечаются нормальные величины сердечного индекса (СИ) и доставки кис¬
лорода к тканям (ДО2) на фоне увеличенных потребления кислорода (ПО^) и
утилизации кислорода (УО2), умеренное снижение р^.02 и небольшое увеличе¬
ние лактата. Это состояние в основном наблюдается при гипертермии, а также
820 ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙВ раннем послеоперационном периоде при согревании больного и переводе его
на самостоятельное дыхание. Обычно в этих условиях не требуется какой-либо
специальной терапии, поскольку организм самостоятельно компенсирует дефицит
кислорода, увеличивая скорость его утилизации, что приводит к восстановлению
кислородного баланса.Из многих лабораторных показателей наиболее четко о наличии или отсут¬
ствии гипоксии в этом случае свидетельствует одновременное динамическое
наблюдение за изменением p^Oj и лактата. Наиболее частым нарушением явля¬
ется метаболический ацидоз, который достаточно быстро компенсируется орга¬
низмом.Снижение транспорта 0^ на фоне отсутствия или неэффективной его компенсацииУказанное нарушение сопровождается резким снижением СИ, уменьшением
ДО2 на фоне увеличения ПО2 и, несмотря на повышение УО^, выраженным сни¬
жением p^Oj и увеличением концентрации лактата. Данное состояние характерно
для больных с синдромом низкого сердечного выброса, обусловленного сердечной
недостаточностью или гиповолемией (более 30%). Метаболическим контролем
степени гипоксии и эффективности проводимого лечения служит одновременное
динамическое наблюдение за р^О^ и лактатом. Нарушение кислотно-основного
состояния (КОС) крови: на начальном этапе — метаболический ацидоз, затем сме¬
шанное нарушение — метаболический и респираторный алкалоз.Снижение транспорта 0^ с компенсаторным увеличением его экстракции тканямив данной ситуации наблюдаются умеренное снижение СИ и ДО^, нормальное
значение nOj, выраженное увеличение УО^, нормальные величины р^02 и лакта¬
та. Такое состояние обычно наблюдается в первые часы после операции (когда
прекращают свое действие анестетики) или в условиях умеренной (до 30%)
гиповолемии. при нормальных параметрах гемодинамики каких-либо действий,
направленных на коррекцию кислородного дефицита, не требуется, поскольку
за счет сдвига кривой диссоциации оксигемоглобина вправо (ослабление связи
НЬ с О2) ткани получают адекватное их потребностям количество кислорода.
Лабораторный контроль включает одновременное динамическое наблюдение за
р^О^ и лактатом. Наиболее часто при этом наблюдается метаболический ацидоз,
который достаточно быстро нейтрализуется введением щелочных растворов.
Если больной находится на ИВЛ, используемый режим гипервентиляции может
способствовать развитию респираторного алкалоза, вызывающего нарушение
электролитного баланса.Снижение транспорта 0^ на фоне централизации кровообращения
или низкой потребности в кислородепри данном нарушении отмечаются резкое снижение СИ с одновременным
уменьшением ДО2 и ПО^, нормальные значения УО^ и рр^» значительное увеличе¬
ние концентрации лактата. Указанная ситуация может быть обусловлена гипотер¬
мией, использованием препаратов, снижающих метаболизм, а также синдромом
низкого сердечного выброса при сердечной недостаточности или снижении ОЦК,
В данном случае решение о необходимости коррекции кислородного дисбаланса
и гемодинамики может быть принято только после согревания больного, отмены
или окончания действия вышеуказанных препаратов. В данном случае наблюда¬
ются два ответа организма пациента на действие клинициста. В первом все показа¬
тели гемодинамики и метаболизма, включая КОС крови и концентрацию лактата,
нормализуются. Во втором степень нарушения указанных показателей еще более
углубляется, что позволяет определить причину централизации кровообращения
и провести коррекцию данного состояния.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ 821В такой ситуации одновременного наблюдения за динамикой изменения р^Оз и
лактата достаточно для оценки состояния кислородного баланса и эффективности
проводимой терапии. Однако более полную картину дает параллельное исследо¬
вание концентрации НЬ, КОС крови и электролитного баланса. Нарушение КОС
крови в первые часы характеризуется метаболическим ацидозом, в дальнейшем —
гипокалиемическим метаболическим алкалозом.Влияние дыхательной недостаточности на кислородный баланс главным обра¬
зом обусловлено снижением насыщения кислорода (sp^) и парциального напря¬
жения кислорода (ррг) ® артериальной крови. Определенную роль при этом игра¬
ет и низкое насыщение кислородом смешанной венозной крови (s^Oj — <50%),
затрудняющее адекватное присоединение кислорода к гемоглобину за нормаль¬
ный цикл его прохождения в легочных капиллярах.Высокую диагностическую значимость имеет определение концентрации обще¬
го гемоглобина, что позволяет оценить его вклад в возникновение гипоксии,
в условиях нормального уровня гемоглобина даже значительная артериальная
гипоксемия (рР^ — <55 мм Hg; sp^ — <75%) сопровождается лишь умеренной
тканевой гипоксией (лактат — 1,6 ммоль/л). При этом в крови отмечается уме¬
ренный метаболический ацидоз. Однако на фоне сниженного гемоглобина при
аналогичных кислородных показателях артериальной крови степень тканевой
гипоксии значительно увеличивается (лактат — 4,5 ммоль/л), что характеризует¬
ся нарушением КОС крови: выраженным метаболическим ацидозом с умеренной
компенсацией респираторным алкалозом.Влияние циркуляторной гипоксии на микроциркуляцию определяется тем, что
скопление жидкости и электролитов в интерстициальном пространстве нарушает
капиллярно-тканевые обмены, снижает чресстеночное давление ниже крити¬
ческой величины давления заклинивания, а также определяет резкое уменьше¬
ние и даже прекращение кровотока в области микроциркуляторного русла, что
может наблюдаться и на фоне нормального системного артериального давления.
Внешнее сдавление сети микроциркуляции поддерживает ее в коллабированном
состоянии даже после ослабления суживающего действия катехоламинов — пер¬
вичной адаптации сосудистой системы на гипоксию. Застой и ацидоз в области
микроциркуляторного русла придают крови вискозно-эластические качества геля,
что усугубляет степень циркуляторной гипоксии.Влияние гипоксии на гемостаз в первую очередь определяется ее действием на
тромбоциты. Гипоксия стимулирует агрегацию тромбоцитов, при этом количество
кровяных пластинок и их тенденция к склеиванию возрастают до 20-го дня от
начала интенсивной терапии. Вещества, способные активировать тромбоциты и
вызывать скопление кровяных пластинок при гипоксии, — катехоламины, щелоч¬
ная фосфатаза, свободные жирные кислоты, АДФ, коллаген, кальций и тромбин.
При выраженной гипоксии возникает дисбаланс между про- и антикоагулянтной
системами, что наряду с нарушением гемореологии может приводить к активации
фибринолиза и способствовать развитию полиорганной недостаточности. При
этом нарушения гемостаза и гемореологии проявляются раньше, чем признаки
полиорганной недостаточности. Это обстоятельство указывает на необходимость
исследования показателей гемостаза и гемореологии у больных в критическом
состоянии и создания определенных условий для предупреждения этих нарушений
в первые часы и сугки интенсивной терапии.Основным условием адекватной коррекции гипоксии является своевременная ее
диагностика. Общепринято, что критериями соответствия потребления тканями кис¬
лорода (ПО2) и их потребности в нем являются SO2 и pOj смешанной венозной крови
(в норме — 72-75% и 40-42 мм рт.сг, соответственно), снижение которых указывает
на наличие дефицита кислорода. Однако у больных в критическом состоянии на
фоне интенсивной терапий нормальные или даже высокие их значения не гаранти-
822 ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙруют адекватного кислородного баланса в организме в связи с централизацией кро¬
вообращения и наличия токсинов, затрудняющих поступление Oj в периферические
ткани. Для оценки состояния кислородного баланса, помимо SO2 и рО^ артериальной
и смешанной венозной крови, необходимо проводить динамическое исследование
концентрации лактата, который быстро увеличивается в условиях дефицита Oj.
Лактат — наиболее быстроизменяющийся лабораторный показатель гипоксии —
имеет прогностическое значение. Содержание лактата в большинстве сл}^аев повы¬
шается до появления других признаков недостаточного количества таких как;• снижение pH;• изменения АД и ЧСС;• электролитные сдвиги (изменения кальция и калия).Кроме того, если недостаток ионов бикарбоната нейтрализуют введением
щелочных растворов, то лактат не буферируется. В аэробных условиях утилизация
лактата, образовавшегося в результате метаболизма, осуществляется различными
органами (в первую очередь сердцем и почками), но при гипоксии эти процессы
значительно ослаблены, что, в свою очередь, увеличивает концентрацию лактата,
определяющего степень гипоксии.Клинически значимая концентрация лактата у больных в критическом состоя¬
нии, определяемая как умеренно увеличенная, — 2,5-4,0 ммоль/л и значительно
увеличенная — более 4 ммоль/л.Основные патологические состояния, сопровождаемые увеличением лактата:
остановка сердца, отек легких, выраженная анемия, шок любой этиологии, после¬
операционные осложнения.Для адекватной оценки содержания лактата у больных в неотложном состоянии
на фоне интенсивной терапии идеальной для исследования является артериальная
кровь, при невозможности ее забора можно использовать смешанную венозную
кровь, в которой одновременно определяется и газовый состав. Последнее осо¬
бенно важно, поскольку различное содержание кислорода в разных венозных
бассейнах может вносить существенные ошибки в оценку перфузии, установление
наличия или отсутствия тканевой гипоксии. Капиллярная кровь у больных в кри¬
тическом состоянии отражает в основном состояние микроциркуляторного русла,
поэтому использование ее для суждения об оксигенирующей функции легких
вносит ошибки в оценку степени кислородного дисбаланса и истинной величины
лактата в организме в целом.Исследование концентрации лактата позволяет оценить адекватность медика¬
ментозной терапии. Снижение этого показателя свидетельствует о правильном
выборе метода терапии, а увеличение — о необходимости дополнительных мер
для лечения основного заболевания. Кроме того, динамическое исследование
концентрации лактата является четким прогностическим критерием итога лече¬
ния больных, если, несмотря на интенсивную терапию, концентрация лактата
не снижается менее 5 ммоль/л, вероятность выживания больного значительно
уменьшается. Таким образом, у больных в критическом состоянии лактат является
ценным показателем:• раннего признака неадекватного кислородоснабжения тканей;• метода мониторинга и оценки проводимой терапии;• диагностики степени гипоксии;• прогностического показателя исхода лечения.При невозможности определения лактата используют показатель остаточных
(резидуальных — R) анионов, который весьма просто можно рассчитать непосред¬
ственно у постели больного:К(ммоль/л) = (Na" + К')-(НСОз + СІ’),Значение R в норме составляет 12+4 ммоль/л.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ 823Корреляционная связь между лактатом и R следующая:• в условиях дефицита кислорода: R = 0,92; р <0,05;• при диабете: R == 0,18; р >0,05;• при почечной недостаточности: R = 0,3; р <0,05,Очевидно, что при отсутствии у больного диабета или выраженной почечной
недостаточности увеличение остаточных анионов будет свидетельствовать о
дефиците кислорода в организме. Кроме того, одновременное определение КОС
крови и остаточных анионов позволяет достаточно легко определить, вызваны ли
нарушения КОС гипоксией.Артериальная кровь является одним из наиболее чувствительных образцов,
поступающих в лабораторию для исследования, но большинство клиницистов
традиционно используют полученные результаты, а именно р^Оз, только для опре¬
деления оксигенирующей функции легких. Датский ученый о. Siggaard-Andersen
(1990), проведя многочисленные изучения всех возможных параметров в арте¬
риальной и смешанной венозной крови, создал компьютерную программу Oxygen
status algoritm, позволяющую на основании исследования артериальной крови
оценивать также транспорт кислорода и высвобождение его в ткани. Данная про¬
грамма внесена в газоанализаторы фирмы Radiometer (Дания). Ее можно использо¬
вать при работе с газоанализаторами других фирм, если имеются многоволновые
оксиметры, позволяющие определять наряду с оксигемоглобином патологические
фракции гемоглобина.Весьма перспективным у больных в критическом состоянии является одно¬
временное динамическое измерение как лактата, так и «глубокой картины» кис¬
лородного статуса, что улучшает мониторинг больных. Лактат определяет степень
опасности, а «глубокая картина» выявляет причину развития и уровень гипоксии
тканей.Другим, не менее важным, чем лактат, метаболитом, который необходимо
исследовать у больных в критическом состоянии, является глюкоза, поскольку в
интра- и послеоперационном периоде ее увеличение может наблюдаться и у боль¬
ных, не имеющих в исходе сахарного диабета (шок любой этиологии, нарушение
мозгового кровообращения, хирургические вмешательства, острый инфаркт мио¬
карда, кровопотеря и др.). Однако при этом моїут иметь место все негативные про¬
явления сахарного диабета. Кроме того, в условиях гипоксии активность инсулина
угнетается, тормозя поступление глюкозы в клетки, концентрация глюкозы увели¬
чивается практически пропорционально повышению лактата, утяжеляя тем самым
клиническое состояние больных, в данной ситуации терапия недиабетического
увеличения глюкозы возможна лишь со снижением концентрации лактата, т.е.
улучшением кислородного баланса. Именно поэтому в современных газоанали¬
заторах обязательно имеются электроды, определяющие лактат и глюкозу — два
важнейших метаболита, которые непосредственно зависят от состояния кисло¬
родного баланса и, в свою очередь, влияют на нарушения водно-электролитного
баланса.ВЛИЯНИЕ ГИПОКСИИ НА МЕТАБОЛИЧЕСКИЕ ПОКАЗАТЕЛИ
И ВОДНО-ЭЛЕКТРОЛИТНЫЙ БАЛАНСВ норме во всех водных секторах организма строго соблюдается закон электро¬
нейтральности, поддерживающий необходимое количество электролитов (коли¬
чество катионов всегда равно количеству анионов). Различные пространства раз¬
делены селективно проницаемыми мембранами. Транспорт электролитов между
ними осуществляется тремя способами; пассивной диффузией, активным перено¬
сом и осмосом. Активный перенос электролитов — энергопотребляющий процесс.
РшШ824 ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЬІХ СОСТОЯНИЙи, следовательно, он нарушается при недостатке энергии в условиях гипоксии.
Изменение заряда и проницаемости клеточных мембран при гипоксии приводит
к нарушению КОС и водно-электролитного обмена в организме. Правильная диа¬
гностика этих изменений позволяет выбрать действенные методы коррекции, кото¬
рые должны быть направлены на предупреждение нарушений гомеостаза и отека
органов и тканей. Так, в условиях гипоксии с каждым миллиэквивалентом Na^ в
клетки поступает 7 мл воды, что приводит к развитию искусственной гиповолемии.
В ответ на уменьшение количества воды в сосудах увеличивается осмоляльность
плазмы, что приводит к снижению диуреза. Кроме того, уменьшение ОЦК сопро¬
вождается увеличением секреции альдостерона, который задерживает Na"^ и жид¬
кости в организме. Возникает недостаток жидкости в сосудистом русле и избыток
ее в клетках, В этих условиях попытка быстро увеличить ОЦК переливанием кри¬
сталлоидов приводит к выраженному отеку органов и тканей.Гипоксический метаболический ацидоз, развивающийся на фоне дефицита кис¬
лорода, весьма опасен, так как значительно угнетает ферментативные процессы в
клетках и непосредственно влияет на сердечную деятельность, поскольку протека¬
ет на фоне гипокалиемии и гипокальциемии. Необходимо помнить, что введение
только растворов бикарбоната натрия не купирует гипоксический ацидоз, так как,
несмотря на увеличение содержания ионов бикарбоната, концентрация лактата
остается прежней. Кроме того, попьггка корригировать данный метаболический
ацидоз быстрым введением растворов бикарбоната натрия в условиях кислород¬
ного дисбаланса может привести к еще более значимым осложнениям, таким как
усугубление гипокалиемии и гипокальциемии, что сопровождается нарушениями
сердечных сокращений. Для адекватного лечения в арсенал терапии должны быть
включены препараты, способствующие улучшению крово- и кислородоснабжения
тканей. Только коррекция гипоксии позволит адекватно лечить нарушения КОС и
водно-электролитного баланса.В раннем послеоперационном периоде метаболический алкалоз встречает¬
ся довольно часто. Причины развития метаболического алкалоза у больных в
критическом состоянии различны. Он может быть обусловлен цитратом натрия
(вследствие переливания компонентов крови и/или различных кристаллоидных
растворов во время операции), интраоперационной передозировкой растворов
бикарбоната натрия, что способствует потере ионов хлора, а также может раз¬
виваться в результате увеличения концентрации бикарбонат-ионов вследствие
снижения ОЦК на фоне усиленного диуреза. Данный алкалоз протекает с pH до
7,48 и BE крови до +5 ммоль/л, не нуждается в коррекции, поскольку избыточные
ионы бикарбоната усиленно выделяются почками, доказательством чего служит
увеличение pH мочи более 6,8,Наиболее опасен для больного гипоксический метаболический алкалоз, про¬
текающий на фоне вторичного гиперальдостеронизма, возникающий обычно
на 2-3-й день интенсивной терапии, поскольку протекает на фоне гипоксии с
выраженными нарушениями электролитного баланса. Его весьма трудно корри¬
гировать, потому что в этой ситуации почки не выделяют, а реабсорбируют ионы
бикарбоната (pH мочи резко снижается), увеличивая тем самым их содержание в
плазме и соответственно pH крови, что, в свою очередь, препятствует коррекции
электролитных нарушений.Гипоксический метаболический алкалоз сопровождается гипокалиемией и
гипокальциемией, при этом показатели кислородного баланса смешанной веноз¬
ной крови могут быть нормальными, однако концентрация лактата всегда значи¬
тельно увеличена. Значение pH мочи менее 4,0 является отличительной чертой
гипоксического гипокалиемического метаболического алкалоза.Для успешного лечения гипоксического метаболического алкалоза необходи¬
мо четко определять критерии его диагностики и методы коррекций. Наш опыт
ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ 825ПОЗВОЛИЛ выделить основные пункты диагностики и лечения гипоксического
метаболического алкалоза, наблюдаемого как после крупных хирургических опе¬
раций, так и у больных в критическом состоянии.Диагностика:• pH мочи — менее 3,5; остаточные анионы — более 22 ммоль/л;• лактат — более 3,5 ммоль/л; калий плазмы — менее 4 ммоль/л;• калий мочи — более 60 ммоль/л; соотношение натрий/калий мочи — менее 2;• осмоляльность плазмы — более 315 мосмоль/кг; ОЦК снижен.Коррекция:• увеличение ОЦК;• введение ингибиторов альдостерона и карбоангидразы;• введение калия в составе смеси, содержащей кальций, магний и инсулин в
растворе глюкозы, с учетом его суточных потерь с мочой;• поддержка режима гиповентиляции (если больной на ИВ Л);• увеличение фракции во вдыхаемом воздухе;• введение закисляющих растворов;• весьма эффективным является плазмаферез.Недостаток энергии, возникающий из-за нарушения метаболизма вследствие
дефицита кислорода, оказывает непосредственное влияние на изменение водных
секторов и электролитного баланса организма. Осмос определяет движение жид¬
кости не только между водными секторами, но также между плазмой и эритро¬
цитами. Именно поэтому показатели осмоляльности плазмы и мочи необходимо
исследовать у больных в критическом состоянии. При кислородном дисбалансе
высокая корреляция между концентрацией лактата и осмоляльностью плазмы
позволяет использовать последнюю как один из признаков наличия гипоксии.
Кроме того, соотношение осмоляльности мочи и плазмы {норма — 2,2-2,4) дает
возможность не только диагностировать причину олигурии, часто наблюдаемую у
больных в критическом состоянии, но и определить адекватные методы ее лече¬
ния. Увеличение этого показателя свидетельствует о недостатке жидкости в орга¬
низме, использование диуретиков в этом случае будет ошибкой и усугубит состоя¬
ние больного. Снижение данного соотношения должно насторожить клинициста в
отношении наличия гипоксии и/или нарушения функций почек.Не менее важным является показатель коллоидно-осмотического давления
плазмы (КОД), основу которого составляют белки. Одной из причин снижения дан¬
ного показателя является увеличение проницаемости капилляров, обусловленное
гипоксией. Снижение КОД приводит к интерстициальному отеку органов и тканей,
в первую очередь мозга, сердца и легких. Так, при отсутствии сердечной недостаточ¬
ности снижение КОД уменьшает соотношение коллоидно-осмотического давления
и конечного давления заклинивания легочных капилляров. Это не только является
частой причиной развития артериальной гипоксемии, но и определяет степень ее
выраженности, вплоть до отека легких при снижении этого соотношения менее
4 мм Hg. Увеличение КОД вследствие дегидратации может стать причиной развития
олигурии. Кроме того, в условиях массивной кровопотери указанный показатель
позволяет правильно определить характер начальной терапии, а именно соспгноше-
ние вводимых коллоидных и кристаллоидных растворов.При дефиците кислорода из-за недостатка энергии нарушается баланс электро¬
литов. Изменение калия, натрия, кальция, магния и хлора значительно утяжеляет
клиническое состояние больных, а также является непосредственной причиной раз¬
вития или усугубления степени нарушения кислотно-основного равновесия крови.
Так, нарушение концентрации натрия и хлора, которые являются основными ионами
внеклеточного пространства, приводит к резким изменениям водного баланса, стано¬
вясь причиной дегидратации или отека органов и тканей. Содержание калия в плазме
невысоко, однако его нарушения приводят к развитию таких опасных осложнений.ш
826ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙкак изменения сердечного сокращения и возникновение психологической неста¬
бильности состояния больного при pH крови более 7,53. Кальций и магний являются
часто антагонистами в электрохимических и биохимических процессах в организме,
достаточно часто повышение концентрации одного сопровождается противопо¬
ложными изменениями другого. Однако в условиях гипоксии отмечается снижение
обоих показателей. Кроме того, несмотря на то что их концентрация в плазме весьма
мала, осложнения, вызванные нарушениями этих электролитов, идентичны и могут
являться причиной, усугубляющей тяжесть состояния больного.ЛАБОРАТОРНАЯ ДИАГНОСТИКА ПРИ ОСТРЫХ СОСТОЯНИЯХ,
ПОЛИОРГАННОЙ НЕДОСТАТОЧНОСТИ, ШОКЕ, ДВС
Острая дыхательная недостаточностьДанное состояние часто возникает при остром нарушении системы внешнего
дыхания, когда не обеспечивается нормальный газовый состав артериальной
крови или его поддержание на нормальном уровне достигается за счет чрезмерно¬
го функционального напряжения этой системы. При острой дыхательной недоста¬
точности (ОДН) любой этиологий происходит нарушение транспорта кислорода
к тканям и выведения из организма углекислого газа. Этиология ОДН классифи¬
цируется как первичная, обусловленная нарушением доставки кислорода к аль¬
веолам, вторичная, определяемая нарушением транспорта кислорода от альвеол к
тканям, и смешанная, сочетающая вентиляционную и паренхиматозную дыхатель¬
ную недостаточность. ОДН определяют как гипоксемическую, когда артериальная
кровь не оксигенируется в достаточной степени, и гиперкапническую, сопрово¬
ждаемую повышением содержания СО^ в крови и тканях. Виды и степень тяжести
ОДН представлены в табл. 12-1.Таблица 12-1. Виды и степень тяжести острой дыхательной недостаточностиСтепень тяжестиВидвентиляционная,
p^COj, мм рт.ст.паренхиматозная,
р,Оу мм рт-ст.Умеренная<50>70Выраженная50-7070-50Тяжелая>70<50Гиперкапническая кома90-130-Гипокапническая кома-39-30Лабораторные показатели при ОДННарушения КОС крови;• при умеренной ОДН отмечается небольшой респираторный алкалоз;• при выраженной — респираторный и умеренный метаболический ацидоз;
при тяжелой — выраженный респираторный и метаболический ацидоз;• при гиперкапнической коме — декомпенсированный респираторный и мета¬
болический ацидоз;• при гипокапнической коме — декомпенсированный респираторный алкалоз
и выраженный метаболический ацидоз.Лактат:• умеренная ОДН — норма или увеличение до 3 ммоль/л;• выраженная — увеличение до 4 ммоль/л;• тяжелая — увеличение до 5 ммоль/л;• при коме различной этиологии — увеличение более 7 ммоль/л.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ 827Электролитный баланс: увеличение калия, снижение кальция и натрия по мере
выраженности ОДН,Диурез:• при умеренной и выраженной ОДН может быть в пределах нормы;• при тяжелой ОДН — снижен;• при коме любой этиологии отмечается олигурия.В анализе мочи наблюдаются протеинурия и микрогематурия.Общий анализ крови:• лейкоцитоз со сдвигом лейкоцитарной формулы влево;• повышение СОЭ.Степень указанных нарушений увеличивается в зависимости от выраженности
ОДН.Биохимический анализ крови:• увеличивается активность ACT, АЛТ, ЛДГ, особенно ЛДГ3;• снижается общий белок, увеличиваются уровни a^-vi у-глобулинов;• отмечаются увеличение мочевины и креатинина, снижение клубочковой
фильтрации по мере увеличения степени выраженности ОДН.Свертывающая система и реология крови:• наблюдается гиперкоагуляция на фоне значительного увеличения концен¬
трации фибриногена, который при тяжелой степени ОДН и коме может
составлять более 10 г/л;• вязкость крови и плазмы увеличена, нарушены функциональные свойства
эритроцитов, определяющие состояние кровотока на уровне микроциркуля-
торного русла.Нарушения лабораторных показателей более выражены при респираторном
дистресс-синдроме и коме любой этиологии.Если больной находится на самостоятельном дыхании, по мере прогрессирова¬
ния нарушений газообмена он нуждается в переводе на ИВЛ. Абсолютными пока¬
заниями к переводу больного на ИВЛ являются:• гипоксемическая ОДН (p^j менее 50 мм рт.ст.);• гиперкапническая ОДН (р^СО^ более 60 мм рт.ст.);• критическое снижение резервного дыхания (соотношение дыхательный
объем/масса тела больного — менее 5 мл/кг);• неэффективность дыхания (при МОД более 15 л/мин и нормальном или
умеренно повышенном p^COj не достигается адекватного насыщения артери¬
альной крови кислородом).Острая сердечная недостаточностьОстрая сердечная недостаточность (ОСН) — клинический синдром, при кото¬
ром сердце не обеспечивает достаточного кровообращения органов и тканей в
соответствии с их метаболическими потребностями. Основными патогенетиче¬
скими механизмами ОСН являются: первичное поражение миокарда, приводящее
к систолической дисфункции левого желудочка; перегрузка давлением — систоли¬
ческая перегрузка левого желудочка; перегрузка объемом — диастолическая пере¬
грузка левого желудочка; снижение наполнения желудочков — преимущественно
диастолическая недостаточность; высокий сердечный выброс. ОСН подразделя¬
ется на острую левожелудочковую (ОЛЖН), сопровождаемую интерстициальным
или альвеолярным отеком легких, и острую правожелудочковую недостаточность
(ОПЖН), при этом первая встречается чаще.Основным патогенетическим фактором развития ОЛЖН является выраженное
снижение сократительной способности левого желудочка с соответствующим сни¬
жением сердечного выброса, при сохраненном или даже повышенном венозном
828 ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙвозврате, что приводит к увеличению гидростатического давления в системе малого
круга кровообращения. При повышении гидростатического давления в легочных
капиллярах более 28-30 мм Hg происходит транссудация жидкой части крови в
интерстициальное пространство легочной ткани, что вызывает развитие интерсти¬
циального отека легких. Наиболее часто такая ситуация наблюдается при остром
инфаркте миокарда (ОИМ). Со стороны сердечно-сосудистой системы при альвео¬
лярном отеке легких наблюдаются тахикардия, протодиастолический ритм галопа,
акцент II тона на легочной артерии и его расщепление, а также хрипы в легких.
Лечебная тактика направлена на снижение преднагрузки на сердце, повышение
сократительной способности миокарда и разгрузку малого круга кровообращения.Острая правожелудочковая сердечная недостаточность развивается при ОИМ
правого желудочка, разрыве межжелудочковой перегородки и тромбоэмболии
легочной артерии. Патофизиологический механизм — перегрузка малого круга
кровообращения, клиническими проявлениями которой являются одышка, набу¬
хание шейных вен и высокое центральное венозное давление. Крайним проявле¬
нием ОСН является кардиогенный шок — синдром, развивающийся вследствие
резкого нарушения насосной функции левого желудочка, характеризуемый неа¬
декватным кровоснабжением жизненно важных органов с последующим наруше¬
нием их функций.Лабораторные показатели при ОСННарушения КОС крови:• выраженный гипоксический метаболический ацидоз (pH — менее 7,26; BE —
7 и ниже):• снижение кислородных показателей артериальной (р^О^ — менее 60 мм Hg,
независимо от фракции кислорода во вдыхаемом воздухе) и венозной
(р^О^ — менее 26 мм Hg) крови;• гипокапния (PgCOj — менее 26 мм Hg) при ОЛЖН и гиперкапния (р^СО^ —
более 50 мм Hg) при ОПЖН;• степень гипоксемии и гиперкапнии усугубляется при ОИМ.Лактат:• увеличение лактата всегда выше 5 ммоль/л;• при прогрессировании ОСН концентрация лактата может достигать
15 ммоль/л и более.Электролитный баланс:• увеличение или резкое снижение концентрации калия и натрия;• уменьшение содержания кальция и магния;• увеличение концентрации хлора;• может наблюдаться гипо- или гиперосмоляльная кома.Диурез:• гипоксическая полиурия с последующим переходом в олигурию в случае при¬
соединения острой почечной недостаточности;• увеличение содержания белка в моче.Общий анализ крови:• лейкоцитоз, анэозинофилия, сдвиг лейкоцитарной формулы влево;• увеличение СОЭ.Биохимический анализ крови:• увеличение ферментативного спектра крови — ACT по отношению к АЛТ
всегда увеличена более чем в три раза;• повышение ЛДГ и ее изоферментов (ЛДГ^, ЯДХ^);• повышение КФК;• снижение белка и альбумина;• увеличение С-реактивного белка и уровня а^- и у-глобулинов; повышение в
крови иммуноглобулинов А и G, гаптоглобина.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ 829При ОИМ основными изменениями является увеличение МВ-фракции КФК и
миоглобина. Особую ценность при диагаостике ОИМ представляет определение
уровня тропонинов в крови (Тп-1 и Тп-Т), которые возрастают уже через 3-4 ч и
достигают через 12 ч максимального — 100-400-кратного1 — увеличения. Весьма
важным является обстоятельство, что именно увеличение тропонинов бывает диа-
гносгически значимым для выявления атипичного (без изменений ЭКГ) ОИМ.
Чувствительность данного теста через 3 ч составляет 60%, через 10 ч — почти 100%.Свертывающая система и реология крови:• наблюдаемая гаперкоагуляция постепенно переходит в гипокоагуляцию с
опасностью развития ДВС-синдрома;• вязкость крови и плазмы увеличена;• нарушены функциональные свойства эритроцитов, провоцирующие резкое
ухудшение кровотока на уровне микроциркуляторного русла.Острая печеночная недостаточностьОстрая печеночная недостаточность (ОПеН) — патологический синдром, в
основе которого лежит острое поражение гепатоцитов с последующим нарушени¬
ем их основных функций. Этиология ОПеН весьма разнообразна, остановимся на
одной из причин ее возникновения — экстремальных воздействиях на организм,
которые наблюдаются при крупных хирургических вмешательствах, т.е. на эндо¬
генной ее форме, в основе эндогенной печеночно-клеточной формы ОПеН лежит
некроз печени различной степени, возникающий в результате прямого поражения
паренхимы. Среди многочисленных факторов возникновения ОПеН весьма значи¬
тельную роль играет гипоксия-Лабораторные показатели при ОПеННарушения КОС крови:• респираторный алкалоз, обусловленный гипервентиляцией при высоких
концентрациях аммиака, раздражающих дыхательный центр;• нередко сочетание с метаболическим алкалозом, возникающим на ранних
стадиях ОПеН в результате гипокалиемии или усиления реабсорбции бикар¬
боната в почечных канальцах;• кислородные показатели смешанной венозной крови высокие вследствие
гистотоксической гипоксии, препятствующей поступлению кислорода в клет¬
ки. Данное состояние бывает при нарушении биологического окисления, что
ведет к снижению синтеза мочевины из аммиака, уровень которого в крови
может превышать нормальный в 5-6 раз.Лактат:• j'poBeHb лактата в сыворотке крови превышает 5 ммоль/л лишь при выра¬
женной степени ОПеН, обусловливающей развитие комы.Водно-электролитный баланс:• снижение концентрации калия, хлора и магния;• увеличение концентрации кальция;• высокое содержание натрия, чаще всего в результате увеличения уровня
альдостерона из-за низкого его разрушения в печени, что вызывает задержку
воды в организме и усиливает отеки;• осмоляльность крови резко увеличивается в результате гипоксической гипо-
волемии.Диурез:• снижен вследствие активации антидиуретического гормона в ответ на гипер-
осмоляльность крови и высокой концентрации альдостерона;• в моче увеличена концентрация белка, определяются билирубин и уробилин,
возможна микрогематурия.
830 ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙОбщий анализ крови:• анемия, нейтрофильный лейкоцитоз;• повышение СОЭ.Биохимический анализ крови:снижение белоксинтезирующей функции (гипоальбуминемия);• снижение общего уровня холестерина;• гипер-или гипогликемия;" гипербилирубинемия (главным образом за счет прямой фракции);• увеличение ферментов, причем АЛТ всегда более чем в 3 раза выше ACT;• резкое повышение активности щелочной фосфатазы (ЩФ), содержания
желчных кислот, активности у-глутамилтранспептидазы (ГГТ);• отмечается накопление аммиака в венозной крови (показатель информати¬
вен в 70% случаев).Свертывающая система и реология крови:• увеличение АЧТВ, ПВ, витамин К-зависимых и -независимых факторов;• резкое уменьшение тромбоцитов и нарушение их функциональных свойств.
Отмеченными нарушениями определяется состояние гипокоагуляции, одна¬
ко вязкость крови и плазмы при этом увеличена, нарушены функциональные
свойства эритроцитов, влияющие на изменение кровотока на уровне микроцир-
куляторного русла, В условиях ОПеН весьма высока опасность развития ДВС-
синдрома и геморрагии.Острый панкреатитОстрый панкреатит (ОП) — состояние, в основе которого лежит ферментный
аутолиз поджелудочной железы, а при тяжелых формах — ее некроз. Наиболее
частой причиной развития ОП в раннем послеоперационном периоде является
интраоперационная гипоксия.Лабораторные показатели при ОП
Нарушения КОС крови:• респираторный алкалоз в сочетании с метаболическим ацидозом;• показатели кислородного баланса артериальной крови в норме, венозной -
снижены или увеличены.Лактат:• в зависимости от степени ОП обычно в пределах 2-4 ммоль/л и редко превы¬
шает эти величины.Водно-электролитный баланс:• содержание калия, кальция, магния и хлора снижено;• концентрация натрия увеличена;• отмечается гиперосмоляльность плазмы;• по мере выраженности ОП увеличивается объем интерстициальной жидко¬
сти.Диурез:• в норме или умеренно снижен (олигурия может отмечаться на фоне панкрео-
некроза);• незначительные протеинурия, цилиндрурия;• возрастает отношение уровня активности а-амилазы к клиренсу креатинина
(норма — 1-4%).Общий анализ крови:• умеренный лейкоцитоз, при тяжелых формах — выраженный;• сдвиг лейкоцитарной формулы влево;• увеличение СОЭ;• снижение гемоглобина;
ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ 831• часто отмечается лейкопения, выраженность которой отражает тяжесть забо¬
левания, реже — эозинопения.Биохимический анализ крови:• резкое увеличение активности а-амилазы (которая снижается при панкрео-
некрозе) и эластазы-1. В первые часы отмечается повышение активности
амилазы в моче;• повышается уровень трипсина и липазы:• возрастает активность АЛТ, ACT и ЛДГ;• при прогрессирование ОП может наблюдаться гипергликемия, усиливается
протеолиз;• при обострении ХП повышается уровень билирубина, и у-глобулинов,
серомукоида, сиаловых кислот, гаптоглобина, активности ЩФ, ГГТ, снижа¬
ется количество В- и Т-лимфоцитов и уровня иммуноглобулина А.Свертывающая система и реология крови:• отмечается состояние гиперкоагуляции на фоне увеличения продуктов рас¬
пада фибриногена;• вязкость плазмы и крови увеличена;• нарушаются функциональные свойства эритроцитов.Весьма велика опасность развития ДВС-синдрома, особенно в условиях гемор¬
рагического панкреатита.Острая почечная недостаточностьОстрая почечная недостаточность (ОПН) — синдром, патологической основой
которого является острое поражение нефрона с последующим нарушением его
основных функций: мочеобразовательной и мочевьщелительной.По классификации Е.А, Тареева (1983) ОПН относительно уровня «поражения»
определяется как преренальная, ренальная и постренальная. Причиной прере-
нальной ОПН является уменьшение периферического кровотока. Если крово¬
снабжение почек страдает не более 2 ч, их морфологическая структура поражается
незначительно и функциональные изменения имеют преходящий характер, при
этом резко падают фильтрационное давление в клубочках и фильтрация. Если
кровоток не восстанавливается в течение 2 ч, в почках начинают формироваться
серьезные морфологические изменения. Клинически это проявляется уменьшени¬
ем диуреза (менее 25 мл/ч) и угнетением концентрационной способности почек.
Через 10-12 ч (даже при нормальном АД) нарастают азотемия и гиперкалиемия,
что указывает на поражение канальцевого эпителия и переход преренальной
формы ОПН в ренальную.При ренальной форме ОПН отмечаются олиго- или анурия, продолжительность
которых зависит от масштаба морфологического поражения базальной мембраны
почечных канальцев. В крови концентрация мочевины может увеличиваться до
55 ммоль/л и более. Для олигурии характерно уменьшение относительной плот¬
ности мочи в результате угнетения концентрационной функции почек. Стрессовым
состоянием вызывается усиленный катаболизм в тканях, что сопровождается
выделением большого количества эндогенной воды с последующим формирова¬
нием гипотонической гипергидратации, приводящей к повышению температуры
тела больного, АД и ЦВД. При анурии в плазме крови быстро возрастает концен¬
трация калия и эндогенных токсинов. При сниженном гематокрите (менее 26%)
изменения концентрации калия могут быть незначительными. Длительная ану¬
рия (более 14 дней) указывает на полный некроз базальной мембраны почечных
канальцев и является плохим прогностическим признаком.При постренальной форме ОПН, вызванной обструкцией мочевыводящих
путей, отмечается выраженная уремическая интоксикация. Купирование непрохо-
832 ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙдимости паллиативными или радикальными методами довольно быстро устраняет
признаки ОПН. При гипоксических поражениях почек постренальная ОПН может
перейти в преренальную или ренальную форму. Переход в преренальную форму
ОПН возможен в том случае, если фаза полиурии сопровождается большим ди¬
урезом, так как потери большого количества воды и электролитов могут привести
к выраженному уменьшению периферического кровотока. Переход в ренальную
форму ОПН возможен при длительном повышении внутриканальцевого давления
на фоне нарушенного оттока мочи, что вызывает изменение почечной микроцир¬
куляции и приводит к формированию органической канальцевой недостаточности.
В этих условиях быстрое восстановление мочевыделительной функции имеет боль¬
шое значение в профилактике необратимых изменений почечной паренхимы.
Лаборагторные показатели ОПН
Нарушения КОС крови:• респираторный алкалоз в сочетании с метаболическим ацидозом в период
олигоанурии или метаболическим алкалозом при полиурии, степень измене¬
ний увеличивается по мере выраженности ОПН;• кислородные показатели артериальной крови в пределах нормы, венозной —
в норме или умеренно увеличены из-за сдвига кривой диссоциации оксигемо-
глобина влево (усиление связи гемоглобина с кислородом).Лактат:• по мере выраженности ОПН концентрация лактата увеличивается от 1,5 до
3,5 ммоль/л, но редко превышает 4 ммоль/л.Водно-электролитный баланс:• увеличивается концентрация калия, магния и фосфора;• снижены натрий, кальций и хлор в плазме крови в период олигоанурии; при
полиурии вследствие значительного выделения электролитов с мочой кон¬
центрация практически всех их в крови резко снижается;• осмоляльность плазмы снижена или увеличена в зависимости от стадии
ОПН, что способствует резкому нарушению водного баланса.Диурез:• в период олигоанурии снижается от 500 мл в сутки до полного исчезновения,
в период полиурии увеличивается более 1800 мл в сутки;• плотность мочи снижена, в осадке определяются гиалиновые цилиндры, эри¬
троциты, лейкоциты, клетки почечного эпителия, эозинофилы;• наличие в моче большого количества эпителиальных клеток и грубых зерни¬
стых цилиндров является показателем острого канальцевого некроза.Общий анализ крови:• гипохромная анемия, нейтрофильный лейкоцитоз;• повышение СОЭ.Биохимический анализ крови:• нарушение белкового обмена — снижено содержание общего белка и альбу¬
мина, повышен уровень «2 и у-глобулинов, мочевины, креатинина;• увеличивается активность ACT и умеренно ЛДГ и ЩФ;• по мере выраженности ОПН снижается клубочковая фильтрация.
Свертывающая система и реология крови:• резкое снижение тромбоцитов и нарушение их функциональных свойств,• увеличение активности прокоагулянтных факторов на фоне повышения про¬
дуктов деградации фибриногена;• вязкость плазмы умеренная, а крови — значительно увеличенная.
Нарушение кровотока на уровне микроциркуляторного русла опасно высокимриском образования микротромбов, особенно в почечных капиллярах. Все это
в конечном итоге приводит к геморрагии на фоне микротромбообразования и
может закончиться ДБС-синдромом.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ 833Своевременное динамическое исследование крови и мочи позволяет проводить
дифференциальную диагностику стадий ОПН (табл. 12-2).Таблица 12-2. Лабораторная дифференциальная диагностика форм острой почечной недостаточ¬
ностиПоказательПреренальнаяРенальнаяПостренальнаяДиурез, мл/24 ч<500Варьирует<500Относительная плотность
мочи>1 0201010<1008Осмоляльность мочи,
мосмоль/кгяао<380<300Соотношение осмоляльности
мочи и плазмы крови1,5-1,31.3-1,1<1,1Соотношениб мочевины в моче и
плазме>10:1<4:1>8:1Соотношение креатини на в моче
и плазме>10:1<10:1>1:1Натрий мочи, ммоль/л<20>30>40Состав мочевого осадкаГиалиновыецилиндрыТубулярные эпителиаль¬
ные клетки и цилиндры,
эритроциты, свободный
гемоглобин, миоглобинЭритроциты, лейкоци¬
ты, атипичные клетки,
кристаллыв зависимости от формы клиницист может выбрать методы терапии, позволяю¬
щие корригировать ОПН и предупреждать ее прогрессирование.При неэффективности консервативных методов лечения для выведения азоти¬
стых шлаков и избытка калия при ОПН используют экстракорпоральные методы:
гемодиализ, гемофильтрацию, гемодиафильтрацию, комбинацию ультрафильтра¬
ции с гемосорбцией и др. При поражении почек вследствие переливания иногрупп-
ной крови гемосорбция неприемлема, поскольку высока вероятность повторного
гемолитического криза.Применение любого из указанных экстракорпоральных методов необходимо
при сочетании у больного следующих лабораторных показателей:• мочевины плазмы 55 ммоль/л с приростом более 5 ммоль/л в сутки;• гиперкалиемии более 6,7 ммоль/л;• снижения SB до 10 и BE крови —16 ммоль/л и ниже;• соотношения мочевины в моче и плазме менее 10 (при норме 20);• концентрации натрия в суточной моче около 30 ммоль/л.В раннем послеоперационном периоде, особенно у больных после крупных
хирургических вмешательств, единичные органные нарушения встречаются реже,
чем поражения нескольких органов одновременно. Наиболее часто причинами
развития полиорганной недостаточности (ПОН) являются интра- и послеопера¬
ционная геморрагии, сопровождаемые массивной гемотрансфузией и/или гипок¬
сией, обусловленной длительностью и условиями операции, а также меньшей, чем
необходимо организму, величиной сердечного выброса при острой недостаточ¬
ности кровообращения любой этиологии. ПОН определяют как тяжелое общее
патологическое состояние, которое возникает в ответ на значительную травму,
хирургическую агрессию или гнойно-септическое заболевание и сопровождается
функциональной несостоятельностью двух и более систем, играющих важную
роль в жизнеобеспечении организма. В патогенетических механизмах ПОН раз¬
личают одно- или двухфазный вариант развития. Однофазный вариант развития
ПОН характеризуется тем, что уже в первые сутки после операции или травмы
возникают и прогрессируют острые нарушения газообмена, а уже к ним последова¬
тельно присоединяется функциональная недостаточность печени, почек, системы
834 ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙгемостаза и др. В таком варианте ПОН является финальным осложнением, пред¬
шествующим летальному исходу. Течение двухфа.зной ПОН характеризуется вре¬
менной стабилизацией состояния больного, однако из-за присоединения инфек¬
ции и сепсиса развивается дисфункция важнейших систем жизнеобеспечения
организма. ПОН при стрессе или септической инфекции состоит из двух стадий.
На I стадии возникают нарушения газообмена, свертывающей системы крови,
наблюдается уменьшение количества тромбоцитов; в крови нарастает билирубин
и повышается активность трансаминаз (ACT, АЛТ). Присоединение инфекции сти¬
мулирует неспецифические механизмы защиты, что сопровождается активацией
системы кининов, комплемента, а также стимуляцией хемотаксиса гранулоцитов,
отмечается нарушение кровообращения в системе микроциркуляторного русла.
Последнее обусловливает развитие легочной, почечной, печеночной недостаточ¬
ности, анемии и др. Во И стадии наступает декомпенсация, когда на субклеточном
уровне формируются необратимые изменения. В связи с прогрессирующей функ¬
циональной недостаточностью митохондрий и других субклеточных структур
вместо утилизации углеводов для выработки энергии начинают использоваться
аминокислоты. Это приводит к угнетению синтеза белков и специфических про¬
теинов, таких как ферменты, факторы свертывания крови, иммуноглобулины.
Нарушаются барьерные свойства стенки желудка и кишечника, возникают неу¬
странимые формы гипергликемии, гиперлактатацидемии, стойкая тромбоцитопе-
ния и др. Прогноз при ПОН всегда очень серьезен, так как при нарушении функции
двух органов летальность составляет 30-40%, при четырех и более — выздоровле¬
ния практически не бывает. Именно поэтому своевременная диагностика и выбор
адекватного лечения ПОН являются основой для профилактики прогрессирова¬
ния ПОН и предупреждения расстройств прежде всего в сфере жизненно важных
систем организма.Шоковые состоянияШок — понятие, обозначающее ряд клинически сходных состояний, характери¬
зуемых критическим снижением кровотока в тканях и развитием циркуляторной
гипоксии с неадекватной оксигенацией тканей и органов.Выделяют три категории шока в зависимости от нарушения того или иного
компонента кровообращения:1) гиповолемический (постгеморрагический);2) кардиогенный;3) сосудистый, связанный с пониженной резистентностью сосудов.В данном разделе рассмотрены типы шока, которые наиболее часто встречаются
как осложнения длительных и сложных хирургических вмешательств и продолжи¬
тельной интенсивной терапии.Пусковым механизмом развития гиповолемигеского шока является синдром
малого сердечного выброса, формирующийся в ответ на снижение венозного воз¬
врата. Данный вид шока развивается, как правило, в результате интенсивной кро-
вопотери. При кровопотере более 10% ОЦК приток крови с периферии в малый
круг кровообращения начинает уменьшаться, снижается давление заклинивания
легочных капилляров, падает давление наполнения правых отделов сердца, ЦВД
становится ниже нормы, что приводит к снижению ударного объема сердца. При
истощении компенсаторных механизмов (уменьшении венозного возврата на
25-30%) ударный объем снижается ниже критической величины, развивается
синдром малого выброса, сопровождаемый централизацией кровообращения.Основные патогенетические признаки гиповолемического шока — низкий сер¬
дечный выброс, низкое давление заклинивания легочных капилляров и высокое
общее периферическое сосудистое сопротивление. Все это в конечном итоге при-
ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ 835ВОДИТ к циркуляторной гипоксии вследствие неадекватного кроно- и кислородо-
снабжения тканей.В основе развития кардиогенного шока лежит острая сердечная недостаточность.
Наиболее частой причиной является острый инфаркт миокарда. Происходит паде¬
ние ударного объема сердца и сердечного выброса, возрастают давление закли¬
нивания легочных капилляров и общее периферическое сопротивление, а правые
отделы сердца фактически продолжают работать в прежнем режиме, т.е. приток
крови с периферии в малый круг кровообращения остается в пределах нормы.
Указанный дисбаланс в работе правых и левых отделов сердца быстро приводит к
переполнению малого круга кровообращения, значительно возрастают давление
наполнения правых отделов сердца и ЦВД. Симпатоадреналовая активизация
усугубляет спазм периферических сосудов, в результате чего наблюдается центра¬
лизация кровообращения.Отавными патогенетическими признаками кардиогенного шока являются низ¬
кий сердечный выброс, высокое давление заклинивания легочных капилляров и
общее периферическое сосудистое сопротивление. Все это в конечном итоге при¬
водит к циркуляторной гипоксии вследствие неадекватного Кр0В0“ и кислородо-
снабжения тканей.в основе септигеского шока лежит воздействие эндотоксинов на систему микро¬
циркуляции, что сопровождается раскрытием артериовенозных анастомозов.
В развитии септического шока выделяют две стадии: гипердинамическую, при
которой отмечается увеличение минутного объема в результате повышения удар¬
ного объема и частоты сердечных сокращений с одновременным снижением обще¬
го периферического сосудистого сопротивления, и гиподинамическую, когда по
мере нарастания интоксикации ударный объем сердца прогрессивно снижается.В целом патогенетическими признаками септического шока являются высокий
сердечный выброс, низкое давление заклинивания легочных капилляров и общее
периферическое сосудистое сопротивление. Все это в конечном итоге также при¬
водит к циркуляторной гипоксии вследствие неадекватного крово- и кислородо-
снабжения тканей.В основе анафилактигеского шока лежит выброс в кровоток гистамина, серото¬
нина и других биологически активных веществ в ответ на попадание в организм
аллергена. Эти метаболиты оказывают паралитическое влияние на прекапилляр-
ный сфинктер в системе микроциркуляции, что приводит к резкому снижению
периферического сосудистого сопротивления, и, таким образом, имеющийся
объем крови становится неадекватным величине сосудистого русла. Данный
процесс можно оценить как децентрализацию кровообращения, т.е. фактически
возникает внезапная гиповолемия без потери ОЦК. Под влиянием биологически
активных веществ быстро повышается проницаемость клеточных мембран, в
результате этого возникают интерстициальные отеки, которые наиболее быстро
прогрессируют в головном мозге, сердце и легких.В основе патогенетических признаков анафилактического шока лежит низкое
общее периферическое сосудистое сопротивление и давление заклинивания легоч¬
ных капилляров, а также нормальный или сниженный сердечный выброс. Все это
в конечном итоге приводит к циркуляторной гипоксии вследствие неадекватного
крово- и кислородоснабжения тканей.Таким образом, любое шоковое состояние сопровождается гипоперфузией, а следо¬
вательно, и дисбалансом между потреблением кислорода тканями и истинной потреб¬
ностью в нем. При шоке различной этиологии отмечаются наиболее выраженные
нарушения гомеостаза практически всех звеньев организма, которые диагностируют с
помощью описанных вьшіе лабораторных показателей. При этом наиболее быстрым
и информативным методом выявления признаков дисбаланса кислорода в организме
является динамическое исследование транспорта и концентрации лактата.
836ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙСиндром эндогенной интоксикацииДанный синдром можно определить как патологическое состояние, в основе
которого лежит поражение органов и систем организма, вызванное накоплением в
тканях и биологических жидкостях эндогенных токсинов. Воспалительный ответ
организма на крупное хирургическое вмешательство, а также на развитие таких
осложнений, как полиорганная недостаточность и шок любой этиологии, всег¬
да сопровождается увеличением в крови токсинов, среди которых особое место
занимают свободные радикалы кислорода и средние молекулы, а их содержание
можно быстро определить в крови. Активация свободнорадикальных процессов и
увеличение концентрации средних молекул угнетают функции собственных деток¬
сицирующих и защитных систем организма и значительно ухудшают клиническое
состояние больных, усугубляя степень тканевой гипоксии.Свободные радикалы кислорода — это высокореактивные молекулы, которые
образуются в результате окислительно-восстановительных реакций в организме
и являются частью нормального клеточного метаболизма. Кислород в организме
утилизируется за счет двух процессов: оксидазного и оксигеназного. Оксидазный
путь функционирует на этапе окислительного фосфорилирования при выработке
энергии в клетках. Оксигеназный путь сопровождается образованием продуктов
перекисного окисления липидов (ПОЛ), в условиях гипоксии ферменты оксиге¬
назного пути более чувствительны к снижению напряжения кислорода в клетках,
этот путь прерывается и весь остаточный кислород переключается на оксигеназ¬
ный путь, что сопровождается активизацией ПОЛ и накоплением свободных ради¬
калов кислорода. В результате нарушается структура клеточных мембран, активи¬
руются протеолитические ферменты, в кровь попадают токсины. Основные виды
свободных радикалов кислорода в организме человека — это супероксид-радикал
(О^), который является наиболее токсичным; гидроксил-радикал (ОН ); радикал
оксида азота (N0 ) и пероксид-радикал (R00 ).Количество свободных радикалов строго контролируется антиоксидантной
системой, при дисфункции которой происходит увеличение количества свобод¬
ных радикалов кислорода, что становится причиной развития многочисленных
патологических процессов в организме. Компоненты антиоксидантной системы
делятся на несколько групп. Первичные — предотвращают образование новых
свободных радикалов кислорода, к ним относят ферменты супероксиддисмутазу,
глутатионпероксидазу, церулоплазмин и др. Вторичные — удаляют свободные
радикалы, прежде чем они смогут инициировать цепные реакции, поражающие
клетки. Это витамины Е, С, р-каротин, мочевая кислота и др. Третичные компонен¬
ты восстанавливают клеточные структуры, пораженные свободными радикалами
кислорода, — ферменты восстановления ДНК и метионинсульфоксидредуктаза.
Активность первых двух практически всегда снижается у больнь[х в критическом
состоянии, и лишь при адекватном динамическом лечении, восстанавливающем
кислородный баланс, в действие вступают третичные ферменты антиоксидантной
системы. Основные причины увеличения свободных радикалов в организме — это
стресс любой этиологии, воспалительные реакции, гипоксия и гипероксия.в ответ на любое внешнее воздействие организм реагирует ускорением обмена
веществ, которое способствует адаптации к новым условиям, а затем наступает ста¬
дия стабилизации. Однако у больных в критическом состоянии нагрузка превыша¬
ет возможность компенсации, в результате возникают поражения, обусловленные
в первую очередь нарушением свободнорадикальных реакций, что приводит к так
называемому окислительному стрессу. Этот процесс имеет место в операционных
и отделениях интенсивной терапии, поскольку при управляемом дыхании в соче¬
тании с многокомпонентной и разнонаправленной фармакологической терапией
полностью блокируются физиологические системы защиты организма.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ 837Последствия активизации свободнорадикального окисления — изменение
структуры и функции биомембран, лейкоцитарная инфильтрация тканей, повы¬
шение микроваскулярной проницаемости, поражение нуклеиновых кислот, белков
и т.д.Эндогенная интоксикация всегда наблюдается на фоне увеличения уровня
средних молекул, которые являются одним из ранних признаков развития ослож¬
нений. Группа средних молекул включает многие компоненты, оказывающие
непосредственное влияние на гомеостаз: пептиды, гликопептиды, аминосахара,
полиамины, многоатомные спирты и др. Наиболее изученными по влиянию на
организм являются 4 вида пептидов, каждый из которых нарушает определенные
звенья гомеостаза: олигопептиды вызывают угнетение углеводного обмена и био¬
синтеза белка; пентапептид обладает нейротоксической активностью; дипептид
оказывает цитотоксический и трипептид — иммунотоксический эффект.У больных с полиорганной недостаточностью всегда наблюдаются нарушения
перекисного окисления липидов, выражающиеся в активации прооксидантных
реакций и угнетении антиоксидантных защитных ферментов, а также увеличе¬
нии уровня средних молекул. Степенью этих изменений во многом определяется
исход оперативного вмешательства, а наиболее эффективным средством лече¬
ния в данных условиях является раннее (и при необходимости многократное)
использование плазмафереза. Увеличение проницаемости мембран, выход в кровь
протеолитических ферментов и токсинов влияют практически на все клеточные
структуры и увеличивают частоту и степень органного поражения. Своевременная
диагностика и адекватная терапия этих нарушений вносят значительный вклад в
положительный исход заболевания.Диссеминированное внутрисосудистое свертывание кровиСиндром диссеминированного внутрисосудистого свертывания крови (ДВС-
синдром) — неспецифическое нарушение гемостаза, которое является достаточно
частым осложнением многих заболеваний. ДВС-синдром ~ сложный патологиче¬
ский процесс, в основе которого лежит массивное свертывание крови, ведущее к
блокаде микроциркуляции в жизненно важных органах (сердце, легких, печени,
почках, надпочечниках и др.) с последующей их дисфункцией. Смертность зави¬
сит от тяжести патологического процесса, вызвавшего ДВС: чем тяжелее течение
основного заболевания, тем более выражены проявления ДВС-синдрома. Для
ДВС-синдрома характерны следующие изменения в органах:• микрососудистый тромбоз, признаки воспаления, кроточивость тканей;• дисфункция метаболических процессов в клетках.Острый ДВС-синдром - приобретенное тромбогеморрагическое нарушение,
возникающее в результате чрезмерного образования тромбина и плазмина в
периферической крови. Данное явление всегда вторично и является следствием
основного патологического процесса, способствующего активации системы свер¬
тывания крови и генерации тромбина. Это может бьпь хирургическая травма,
сопровождаемая большой кровопотерей, требующей массивной гемотрансфузии,
а также нарушением кровоснабжения тканей вследствие развития полиорганной
недостаточности или шока. Патогенетическая картина ДВС-синдрома включает
следующие стадии его развития:• гиперкоагуляцию и тромбообразование (характеризуемые поступлением в
кровоток тромбопластина);• нарастающую коагулопатию потребления с усилением фибринолитической
активности;• дефибринационно-фибринолитическую стадию (характеризуется выражен¬
ной гипокоагуляцией и тромбоцитопенией);
838 ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕОТЛОЖНЫХ состояний• восстановительную или стадию остаточных тромбозов и блокад, при которой
восстанавливаются факторы свертывания крови.Синдром две — наиболее частая причина опасных нарушений гемостаза, он
сопутствует тяжелым формам травматического шока, острой массивной кровопо-
тере, гнойно-септическим осложнениям и др. в клинической практике при выра¬
женных интра- и/или послеоперационных геморрагиях, а также при развитии
полиорганной недостаточности или шока любой этиологии наиболее часто при¬
ходится иметь дело с коагулопатией потребления, сопровождаемой выраженной
гипокоагуляцией. Основные лабораторные показатели острого ДВС-синдрома
связаны с истощением тромбоцитов, потреблением факторов свертывания крови и
вторичным фибринолизом. Именно поэтому на фоне выраженной геморрагии, как
правило, для диагностики ДВС-синдрома ограничиваются показателями, пред¬
ставленными в табл.12-3.Таблица 12-3. Скрининг-тесты при диагностике синдрома диссеминированного внутрисосудисто-
го свертывания кровиПоказательДВС-синдромКоличество тромбоцитов<100 000/мклпвУвеличение более чем на 30%АЧТВУвеличение более чем на 30%Фибриноген<1 г/лПДФ>20 м кг/млD-димерПоложительныйО внутрисосудистом свертывании свидетельствуют и другие показатели гемоста¬
за: протромбиновый фрагмент 1,2, соотношение фибринопептидов А/в, активиро¬
ванные протеины с и S, комплекс «тромбин-антитромбин», содержание фактора
фон Виллебранда и др., которые можно определять по желанию исследователей.
Вместе с тем при выраженной геморрагии сочетания лабораторных параметров,
указанных в табл. 12-3, вполне достаточно для быстрой и четкой диагностики ДВС-
синдрома, требующего срочной коррекции, включающей массивную трансфузию
свежезамороженной плазмы, введение наряду с гемостатиками антиагрегантов и
в ряде случаев тромболитиков. В то же время нельзя забывать, что оптимальным
лечение может быть лишь при одновременной медикаментозной терапии и кор¬
рекции других нарушений гомеостаза. В этой ситуации весьма эффективным может
быть один из методов экстракорпоральной детоксикации — плазмаферез.ПРИБОРЫ, НЕОБХОДИМЫЕ ДЛЯ ОЦЕНКИ БОЛЬНЫХ В КРИТИЧЕСКОМ СОСТОЯНИИ• Газоанализатор с электролитным блоком.• Осмометр.• Биохимический экспресс-анализатор.• Коагулометры.• Гематологический анализатор.• Агрегометр тромбоцитов с подсчетом их количества.• Вязкозиметр.• Прибор для определения свободных радикалов и антиоксидантов.СПИСОК ЛИТЕРАТУРЫДементьева И.И. Лабораторная диагностика и клиническая оценка нарушений гомеостаза
у больных в критическом состоянии / УПМ МИПК. — М.: POLIGRAF-центр, 2007. — 161 с.Сумин С.А. Неотложные состояния. — М.: Медицинское информационное агентство,
2004. - 655 с.Шанин В.Ю. Патофизиология критических состояний. - СПб.: ЭЛБИ-СПб, 2003. —
435 с.
Глава 13Лабораторный мониторинг
при беременностиМЕХАНИЗМ ВЗАИМОРЕГУЛЯЦИИ В СИСТЕМЕ
«МАТЬ-ПЛАЦЕНТА-ПЛОД»Механизм взаиморегуляции в системе «мать-плацента-плод» до
настоящего времени считается одним из самых сложных аспектов
репродуктивной эндокринологии человека. Для зачатия прежде
всего необходимы созревание гамет (яйцеклетки и сперматозоидов)
и реализация процесса оплодотворения. Имплантация бластоци¬
сты возможна при условии прекращения циклической активности
яичников (т.е, менструального цикла). В связи с тем что половина
хромосомного набора эмбриона имеет чужеродное для матери про¬
исхождение, необходимо снизить иммунный ответ матери. Для
защиты от внешних воздействий требуется максимальная изоляция
эмбриона от окружающей среды. Обеспечение его всеми необходи¬
мыми компонентами питания происходит через организм матери.
Соответственно изменения метаболизма женщины во время бере¬
менности должны определяться интересами плода. Наконец, родо¬
вая активность наступает, когда ребенок готов появиться на свет, т.е.
плод должен «сообщить» матери о начале родов.В эндокринной регуляции гестационного процесса ведущую роль
выполняет фетоплацентарный комплекс. Перечень основных гор¬
монов и плацентарных белков приведен в табл. 13-1.Первое условие наст}шления беременности — формирование
полноценной яйцеклетки и реализация процесса овуляции.Овуляция обычно происходит за 13-15 дней до ожидаемой
менструации и заключается в выходе ооцита 2-го порядка из разо¬
рвавшегося доминантного фолликула. Попадая в маточную трубу,
ооцит в момент оплодотворения претерпевает второе редукционное
деление, превращается в зрелую яйцеклетку и после оплодотво¬
рения формирует зигот}^ в течение 3-5 дней зигота продвигается
по трубе и в стадии бластоцисты опускается в полосгь матки.
Образовавшееся на месте фолликула желтое тело активно синтези¬
рует половые гормоны — прогестерон и эстрадиол, необходимые
для подготовки слизистой оболочки маточной трубы и матки для
транспорта зиготы и имплантации раннего эмбриона.Овуляция у человека — спонтанный процесс, для реализации
которого необходим зрелый доминантный фолликул. Изменение
физиологических соотношений гонадотропных гормонов наруша-
^т.шшм840ЛАБОРАТОРНЫЙ МОНИТОРИНГ ПРИ БЕРЕМЕННОСТИТаблица 13-1. Содержание основных гормонов и биологически активных соединений в крови
беременнойСоединенияИсточнмкм соединенийСроки повышения концентраций пока¬
зателей в крови материХорионический гонадотропин
человека(ХГЧ)Бластоциста.Трофобласт.Плацента5-8-й день после зачатияПрогестеронЖелтое тело.
Трофобласт.
ПлацентаДо 7-й недели — желтое тело,
далее — плацента, трофобластЭстрадиолЖептое тело.
Трофобласт.
ПлацентаДо 7-й недели — желтое тело,
далее — плацента, трофобластЭстриолФетальная зона надпочечников
плода.Плацента6-7-я неделя беременности17-ОНПЖелтое тело.Фетоплацентарный комплекс1-я неделя беременностиКортизолПреимущественно кора надпочеч¬
ников матери1-я неделя беременностиТиреотропный гормон (ТТГ)Аденогипофиз матери.
Плацентав 1 триместре возможно снижение
концентрации с дальнейшим возвра¬
щением к нормеТироксин (Т^).
Трийодтиронин (Т,)Щитовидная железа материс 1 триместра беременностиПролактинАденогипофиз матери.
Децидуальная тканьИндивидуально (у некоторых беремен¬
ных уже в 1 триместре)Адреиокортикотропный гор¬
мон (АКТГ)Аденогипофиз матери.
Трофобласт.Плацентас 1 триместра беременностиПлацентарный лактоген
(соматомаммотропин)ПлацентаПоявляется после 5-6-й недели бере¬
менностиИнгибинЖелтое тело.Плацента.Фетальная зона коры надпочеч¬
ников плодас 5-й недели беременностиа-Фетопрогеин(АФП)Желточный мешок плода.
Печень плодас 5-й недели беременностиТестостеронСтрома яичников и надпочечники
материНе меняетсяДегидроэпиандростерон(ДГЭА)Кора надпочечников матери.
Фетальная зона коры надпочеч¬
ников плодас 5-й недели беременностиТранскортин.Тестостерон-эстрадиолсвязывающийглобулин.Тироксинсвязывающий гло¬
булинПечень материс 1-й недели беременностиСпецифические белки бере¬
менности (трофобластиче-
ский р-глобулин и др.)Трофобласт.ПлацентаПоявляются с 1 -й недели беремен¬
ности
ЛАБОРАТОРНЫЙ МОНИТОРИНГ ПРИ БЕРЕМЕННОСТИ841ет созревание фолликула и приводит к выходу неполноценного ооцита. Таким
способом осуществляется отбор наиболее полноценных яйцеклеток. Весь процесс
подготовки к овуляции и оплодотворению (включая половое поведение, измене¬
ние функционального состояния репродуктивной системы, коитус) регулируется
половыми гормонами, синтезируемыми в организме матери.После зачатия для сохранения оплодотворенной яйцеклетки необходимы
прекращение циклической деятельности яичников и предотвращение отслойки
эндометрия. Данный процесс обеспечивается специфическим гормоном беремен¬
ности — хорионическим гонадотропином человека (ХГЧ). Молекула ХГЧ состо¬
ит из двух субъединиц — аир, различающихся по аминокислотному составу;
а-субъединица (а-цепь) имеет такую же структуру, как и а-цепи лютеинизирую-
щего (ЛГ), фолликулостимулирующего (ФСГ) и тиреотропного (ТТГ) гормонов.
р-Субъединица отличается от аналогичных структур ФСГ, ЛГ и ТТГ и определяет¬
ся специфической биологической активностью ХГЧ. Нативная молекула содержит
также углеводные компоненты, представленные галактозой, маннозой и сиаловой
кислотой,ХГЧ продуцируется клетками синцитиотрофобласта. Этот гормон, имитируя
активность ЛГ и ФСГ, стимулирует выработку в желтом теле половых гормонов.
Ко времени достижения зиготой (бластоцистой) полости матки синтезируется
такое количество ХГЧ, которое необходимо для предотвращения атрезии желтого
тела.Технологии экстракорпорального оплодотворения (ЭКО) и высокоспецифич¬
ные методы определения гормонов позволяют проследить сроки появления
ХГЧ в крови женщины. Гормон определяется уже через 4-5 дней после переноса
эмбриона в полость матки. При нормальном развитии эмбриона уровень ХГЧ в
крови матери удваивается каждые 2 дня. В процессе селекции жизнеспособных
эмбрионов сохраняются только те из них, которые активно синтезируют ХГЧ, так
как в этих условиях функционирует желтое тело. Прогестерон изменяет частоту
ритма секреции и угнетает синтез гонадолиберина гипоталамусом, что приводит
к резкому снижению продукции гонадотропинов. Ингибин, синтезируемый жел¬
тым телом, блокирует секрецию фоллитропина аденогипофизом. Циклическая
активность яичников прекращается, и обеспечивается адекватная трансформация
эндометрия. Недостаточный синтез ХГЧ приводит к атрезии желтого тела и насту¬
плению менструации, в результате эмбрион не имплантируется.Ряд препаратов, применяемых для лечения невынашивания (синтетические
гестагены), активируют синтез ХГЧ. При многоплодной беременности содержа¬
ние этого гормона в крови увеличивается пропорционально количеству плодов.
В последние годы появились данные о том, что ХГЧ на поздних сроках беремен¬
ности выполняет функцию эндогенного токолитика, снижая сократительную
активность матки.МОНИТОРИНГ БЕРЕМЕННОСТИДинамика концентрации ХГЧ во время беременностиНачалом беременности считается момент имплантации оплодотворенной яйце¬
клетки, а именно 14-16-й день после начала последней менструации. В настоящем
руководстве представлены нормативные показатели концентрации ХГЧ для каж¬
дой недели физиологической беременности (табл. 13-2).Максимальную концентрацию ХГЧ в течение беременности обнаруживают на
6-8-й неделе (считая от зачатия), затем она постепенно снижается приблизитель¬
но до 15-й недели; с 15-й недели и до конца беременности концентрация практи¬
чески не меняется, составляя в среднем 10 000-30 ООО МЕ/л.
842ЛАБОРАТОРНЫЙ МОНИТОРИНГ ПРИ БЕРЕМЕННОСТИТаблица 13-2. Нормативные показатели концентрации ХҐЧ в сыворотке крови в течение беремен¬
ности*Срок беременности, недМедиана МЕ/лРеферентные пределы, МЕ/л1-215050-3003^20001500-50004-520 ООО10 000-30 ООО5-650 ООО20 000-100 ООО6-7100 ООО50 000-200 ООО7-870 ООО20 000-200 ОООS-965 ООО20 000-100 ООО9-1060 ООО20 000-95 ООО10-1155 ООО20 000-95 ООО11-1245 ООО20 000-90 ООО13-1435 ООО15 000-6000015-2522 ООО10 000-35 ООО26-3728 ООО10 000-60 ООО“^Суммированы и обработаны данные 95 лабораторий, использующих для определения ХГЧ реак¬
тивы концерна Hoffman La Roslie, Германия.С появлением в лабораторной практике тест-систем для определения ХГЧ
появилась возможность диагностики ранней беременности с 7-9-го дня после
оплодотворения яйцеклетки. Развитие технологии ЭКО позволило создать базу
нормативных показателей концентрации ХГЧ в крови женщины, начиная с первых
дней после имплантации.Однако синтез ХГЧ в первые недели развития эмбрионов может различаться.
В большинстве случаев отмечается быстрое повышение концентрации гормона
после попадания эмбриона в полость матки. У женщин старше 40 лет и пациенток
программы ЭКО наблюдается латентный период — в течение 10 дней уровень
ХГЧ не изменяется, лишь с 11-го дня концентрация гормона быстро возрастает.
Возможно, наблюдаемая динамика объясняется медленным развитием хориона в
первые дни жизни эмбриона. В дальнейшем такие беременности могут завершить¬
ся своевременным рождением здоровых детей.Прерывание беременности, неразвивающаяся и эктопическая беременностьНаиболее часто встречаемые акушерские патологии в I триместре — самопро¬
извольное прерывание беременности, неразвивающаяся и эктопическая беремен¬
ность.Нарушение транспорта яйцеклетки в результате неадекватной перистальтики
маточных труб вызывает эктопическую беременность (наступающую в естествен¬
ных условиях). В зависимости от локализации плодного яйца возникает первич¬
ная брюшнополостная, яичниковая или трубная беременность.Появление высокочувствительных и высокоспецифичных методов определения
концентрации ХГЧ и разработка нормативных показателей гормона решили про¬
блему дифференциальной диагностики физиологической и эктопической бере¬
менности. Синтез ХГЧ при эктопической беременности наблюдают с первых дней
после прикрепления оплодотворенной яйцеклетки. Однако при данной патологии
концентрация увеличивается медленнее, уровень ХГЧ в крови достоверно ниже
соответствующих нормативных показателей для физиологической беременности.
Снижение, по сравнению с нормой, концентрации ХГЧ можно расценивать как
первый признак эктопической беременности, а жалобы пациенток на боли или
особенности последней менструации являются дополнительным подтверждени-
ЛАБОРАТОРНЫЙ МОНИТОРИНГ ПРИ БЕРЕМЕННОСТИ $43ем. Окончательный диагноз должен быть установлен только после обнаружения
плодного яйца с помощью УЗИ или лапароскопии. Так, ХГЧ можно обнаружить не
только при беременности, снижение его концентрации можно выявить при нераз-
вивающейся маточной беременности. Тем не менее на ранних сроках развития
трубной беременности (как правило, до 2 нед) динамика концентрации ХГЧ не
отличается от соответствующих показателей нормы.В связи с этим был разработан алгоритм дифференциальной диагностики экто¬
пической беременности.1. Опрос пациентки. Любые нарушения менструального цикла: несвоевременное
наступление менструации, межменструальные кровянистые вьщеления, боле¬
вой синдром — являются основанием для анализа содержания ХГЧ в крови.2. При положительном результате анализа концентрация ХГЧ должна быть
сопоставлена с нормативным показателем для данного срока физиологиче¬
ской беременности.3. При несоответствии концентрации ХГЧ сроку беременности необходимо
назначить УЗИ в целях обнаружения плодного яйца.4. Выявление тубоовариального образования или новообразования в брюшной
полости при положительной реакции на ХГЧ с высокой точностью свиде¬
тельствует об эктопической беременности,5. при отрицательном результате УЗИ и положительной реакции на ХГЧ целе¬
сообразно повторное определение концентрации ХГЧ в крови пациентки с
интервалом 2-3 дня. Отсутствие динамики или незначительное повышение
концентрации гормона следует расценивать как дополнительное подтверж¬
дение внематочной беременности и назначить повторное проведение УЗИ в
целях визуализации плодного яйца.6. При отрицательной реакции на ХГЧ (концентрации менее 10 МЕ/л) не может
быть поставлен диагноз «беременность». Концентрации ХГЧ от 10 до 20
МЕ/л следует расценивать как сомнительную реакцию, и анализ целесоо¬
бразно повторить через 5-7 дней.Динамика содержания ХГЧ при самопроизвольном прерывании беременности
и после медицинского аборта идентична. Поскольку период полувыведения ХГЧ
составляет 36 ч, при полном удалении хориона концентрация его в крови будет
уменьшаться каждые 3 сут примерно в 4 раза. Отсутствие остатков хориона можно
проконтролировать, измерив концентрацию ХГЧ в крови через 2-3 нед после
медицинского или самопроизвольного аборта. За этот период гормон, как прави¬
ло, полностью выводится из кровотока. Уровень ХГЧ ниже 10 МЕ/л расценивается
как отрицательная реакция и свидетельствует об отсутствии хориона.При многоплодной беременности концентрация ХГЧ кратна количеству развиваю¬
щихся хорионов, а не эмбрионов. В случае монохориальной двуплодной беременности
уровень ХГЧ в крови соответствует нормативным показателям, а при бихориальной
превьшіает соответствующий показатель для одношюдной беременности в 2 раза.Для благополучного течения беременности необходима защита эмбриона
(фетоплацентарного комплекса) от воздействия иммунной системы материнского
организма. На мембранах клеток трофобласта зародыша расположены материн¬
ские и отцовские антигены. Локальные иммунорегуляторные реакции на границе
«мать-плод» обеспечивают плаценте функцию иммунологического барьера. Во
время беременности активно образуются элементы белой крови и увеличивается
общее количество лейкоцитов. На этом фоне относительное и абсолютное коли¬
чество лимфоцитов снижается, уменьшая риск иммунологического отторжения
плода с первых недель беременности. Тем не менее в крови всех беременных обна¬
руживают антитела к некоторым HLА-антигенам плода. При физиологическом
течении беременности в организме матери формируются механизмы, подавляю¬
щие развитие иммунных реакций.
844 ЛАБОРАТОРНЫЙ МОНИТОРИНГ ПРИ БЕРЕМЕННОСТИПредполагается, что основными иммунодепрессантами являются ХГЧ и белки
децидуальной ткани плаценты (трофобласта). Среди последних наибольшей
активностью обладают трофобластический р-гликопротеин (ТБГ; SP-1), плацен¬
тарный лактоген, плацентарный белок-14 (РР-14) и ассоциированный с беремен¬
ностью белок плазмы-А (РАРР-А).АЛГОРИТМ ПРЕНАТАЛЬНОГО МОНИТОРИНГАИзменение репродуктивного поведения человека за последние 100 лет и широкое
использование вспомогательных репродуктивных технологий повысили риск сохра¬
нения в поп5'ляции наследственных заболеваний. Врожденная и наследственная пато¬
логии занимают 2-3-е место в структуре заболеваемости и перинатальной смертности
новорожденных. В связи с этим для дальнейшего повышения эффективности профи¬
лактических мероприятий Научный центр акушерства, гинекологии и перинатологии
РАМН разработал -^Алгоритм пренатального мониторинга» беременных.Алгоритм пренатального мониторинга в I триместре беременности1. Общеклиническое обследование.2. Определение группы крови и Rh-фактора.3. Тесты на выявление сифилиса, ВИЧ, гонореи, гепатита В и С, цитомегалови-
руса, токсоплазмоза, хламидиоза.4. Тест на выявление антител к вирусу краснухи.5. Туберкулиновая проба.6. Гемостазиограмма.7. Консультация специалистов (терапевта, стоматолога).8. УЗИ (9-11 нед).По показаниям:• медико-генетическое консультирование;• определение кариотипа супругов;• HLA-типирование супругов;• определение гетерозиготного носительства;• инвазивная пренатальная диагностика (биопсия хориона, амниоцентез);• определение волчаночного антикоагулянта в крови.Совершенствование методов лабораторной диагностики позволило расширить
алгоритм гормонального мониторинга в I триместре беременности с целью ран¬
него выявления таких хромосомных патологий, как синдромы Дауна и Эдвардса.
Скрининг сывороточных маркеров в крови матери в I триместре беременности
(10-13 нед) — определение концентрации РАРР-А и свободной р-субъединицы
ХГЧ. Наилучшие результаты получаются при комбинации с данными УЗИ; для
расчета рисков используют копчико-теменной размер (КТР) и толщину воротни¬
кового пространства (ТВП).При наличии данных УЗИ расчет фока беременности ведется по величине КТР,
а не по дате менструации.Ассоциированный с беременностью белок плазиы-АРАРР-А — гликопротеин с молекулярной массой 820 кДа, впервые вьщелен-
ный из плаценты. Белок синтезируется в высокой концентрации трофобластом и
выявляется в крови беременных, функциональное значение этого белка неясно.
Предполагают, что он воздействует на секреторную и пролиферативную активность
клеток иммунной системы, а также обладает антипротеазной активностью. Во время
нормальной беременности концентрация РАРР-А в крови постоянно повышается.
При экстракорпоральном оплодотворении данный белок служит маркером раннего
невынашивания беременности. Снижение концентрации РАРР-А (особенно выра¬
женное на 10-11-й неделе) связано с хромосомньили аномалиями плода и наиболее
ЛАБОРАТОРНЫЙ МОНИТОРИНГ ПРИ БЕРЕМЕННОСТИ 845значимо для выявления синдрома Дауна. Именно поэтому данный белок использу¬
ют в качестве маркера хромосомной патологии плода в I триместре беременности.
Комбинированное обследование включает определение РАРР-А, уровня свободной
(3-субъединицы хорионического гонадотропина человека, а также ультразвуковое
измерение толщины ворсугниковой зоны {nuchal translucency). Данный подход позво¬
ляет выявить 85-90% случаев синдрома Дауна уже в I триместре беременности.
Клинико-диагностическое значение определения РАРР-А• Повышение концентрации РАРР-А: многоплодная беременность, прибли¬
жающиеся роды.• Снижение концентрации РАРР-А:❖ патология со стороны плода:- трисомия хромосом 21,18 и 13, анеуплоидии и триплоидии по половым
хромосомам;- гипотрофия плода;❖ патология со стороны матери:- сахарный диабет;- хроническая гипертензия;^ патология беременности:- преждевременные роды.Свободная ^-субъединица хорионического гонадотропина человекаКонцентрация свободной субъединицы р-ХГЧ (р-ХГЧ свободная) в крови бере¬
менных максимальна. В моче ее содержание составляет 9% общего количества
производных ХГЧ. Значительное увеличение этого показателя в крови и моче
наблюдается при синдроме Дауна у плода, осложненной преэклампсии (позднем
токсикозе) беременности, а также при трофобластических заболеваниях. При
скрининговых исследованиях установлена целесообразность определения свобод¬
ной субъединицы р-ХГЧ для выявления синдрома Дауна в I триместре беременно¬
сти. Одновременное определение содержания РАРР-А и свободной субъединицы
р-ХГЧ является оптимальным. Референтные значения показателей в течение бере¬
менности представлены в табл. 13-3.Таблица 13-3. Нормативные показатели концентрации свободной субъединицы р-ХГЧ и РАРР-А в
зависимости от срока беременностиСрок беременности, недСвободная субъединица р-ХГЧ, иг/илРАРР-А, мМЕ/л971-94357-5971052-68648-10301140-501108-16741234-381785-25621334-362709-3692Клинико-диагностическое значение определения свободной субъедини¬
цы р-ХГЧПовышение концентрации свободной субъединицы р-ХГЧ:• трисомия по хромосоме 21 (синдром Дауна);• поздний токсикоз;• трофобластические заболевания (пузырный занос, трофобластические опу¬
холи и хориокарцинома).Результаты определения РАРР-А и свободной субъединицы (3-ХГЧ в крови
беременных выражают как отношение полученного при исследовании значения к
медиане референтного значения для беременных того же срока — МоМ (кратность
медиане). Норма составляет 0,5-2,0 МоМ. Таким способом можно нормализовать
результаты, полученные в разных лабораториях, и, выбирая порог нормативных
846ЛАБОРАТОРНЫЙ МОНИТОРИНГ ПРИ БЕРЕМЕННОСТИзначений МоМ, регулировать частоту выявления ложноположительных и ложноо¬
трицательных результатов. Во II триместре беременности большое внимание
уделяется анализу результатов определения концентрации ХГЧ и АФП. Скрининг
сывороточных маркеров в крови матери во II триместре беременности включает
определение а-фетопротеина, хорионического гонадотропина человека, неконъю-
гированного эстриола, 17-гидроксипрогестерона.Исследование проводят на 17-20-й неделе беременности.При обработке полученных результатов возникает необходимость в исполь¬
зовании компьютерных программ, а также в проведении подтверждающей инва¬
зивной пренатальной диагностики. Ниже представлены нормативные показатели
концентрации АФП, эстриола (Е3) и 17-гидроксипрогестерона (17-ОП) в течение
беременности (табл. 13-4-13-6).Таблица 13-4. Нормативные показатели концентрации сс-фетопротеина (АФП) в течение беременностиСрок беременнастм, недМедиана, МЕ/млРеферентные значения, МЕ/мл0-12-До 15131915-25142415-30152915-60163317-65173819-75184322-35194825-95205327-105215832-110226337-115236842-120247347-125257852-130268357-135278862-140289367-145299872-1503010377-15531-32140100-250Таблица 13-5. Нормативные показатели концентрации эстриола (Е.) в течение беременностиСрок беременности, недМедиана, нмоль/лРеферентные значения, нмоль/л1-6-До 0,66-71.20.6-2.58-91.60.8-3,510-1242,3-8,513-1485,7-1515-16106-2117-18126,6-2519-20157,5-2821-222412^123-242818,2-5125-263120-60
ЛАБОРАТОРНЫЙ МОНИТОРИНГ ПРИ БЕРЕМЕННОСТИ 847Окончание табл.13-5Срок беременности, недМедиана, нмоль/лРеферентные значения, нмоль/л27-283220,5-63,529-303521-6831-323822-7033-344323-8135-365225-10137-386430-112ЗМО6535-115Таблица 13-6. Нормативные показатели концентрации 17-гидроксипрогестерона {17-ОП) в тече¬
ние беременностиСрок беременности, нед17-ОП, нмоль/л1-64-107-143-715-245-1425-336^034-408-36Содержание ХГЧ и АФП может меняться в различных популяциях и этни¬
ческих группах населения и зависит от метода определения. Именно поэтому
индивидуальные уровни маркеров у беременных следует оценивать с помощью
показателя МоМ {Multiple of Median). Нормативный диапазон МоМ составляет
0,5-2,0. Одновременное повышение концентрации ХГЧ и АФП (более 2 МоМ) с
высокой степенью достоверности свидетельствует о наличии открытых дефектов
у плода {spina bifida, незаращения брюшной стенки и т.п.). При низком уровне
а-фетопротеина в сочетании с высоким содержанием хорионического гонадотро¬
пина человека в сыворотке беременной для исключения синдрома Дауна показаны
проведение амниоцентеза или кордоцентеза, определение кариотипа плода.Используемые сывороточные маркеры неспецифичны для синдрома Дауна
(вероятность выявления не превышает 60-70%). Кроме того, данные изменения
могут наблюдаться при других патологических состояниях плода, сопутствующей
акушерской патологии у матери и даже у здорового эмбриона (табл. 13-7).В регуляции иммунного статуса матери определенную роль играют стероидные
гормоны фетоплацентарного комплекса. Синтез эстрадиола и прогестерона в тро-
фобласте начинается на 4-5-й неделе, а после 7-й недели замещает их продукцию
желтым телом.Таблица 13-7. Информативность определения уровней ХГЧ и АФП в программе профилактики
врожденных и наследственных заболеваний у детейАФП, МЕ/млХП,МЕ/лПредположительный диагнозттттттОткрытые дефектыттСиндром ДаунатттыВнутриутробная гибель плодатттУгроза прерывания беременности-ттРезультат приема гестагенов в 1 триместреNРезультат приема гестагенов в III триместреііФетоплацентарная недостаточность (ФПН)iiиТяжелая форма ФПНттКрупный плод
ш848 ЛАБОРАТОРНЫЙ МОНИТОРИНГ ПРИ БЕРЕМЕННОСТИПо мере увеличения срока беременности содержание в крови матери как эстра-
диола, так и прогестерона непрерывно растет (табл. 13-8, 13-9). Под влиянием
этих гормонов в женском организме начинаются изменения основных систем жиз¬
необеспечения, которые проявляются в увеличении сердечного выброса, объема
циркулирующей крови, скорости клубочковой фильтрации мочи, дыхательного и
минутного объема легких.Таблица 13-8. Нормативные показатели концентрации прогестерона в течение беременностиСрок беременности, недМедиана, нмоль/лРеферентные значения нмоль/л1-24838-583-47463-855-66459-€97-87065-759-108173-8811-1210192-11013-1411196-12715-16151124-17717-18150110-18919-20161133-18821-22185150-22023-2421818&-24725-26238197-27827-28296251-34129-30298270-32631-32363323-40333-34379325-43335^641235&^6837-38485422-54739^0612478-746В крови беременных эстрадиол находится преимущественно в связанной форме,
уровень тестостерон-эстрадиолсвязывающего белка (ТЭСГ) растет параллельно
уровню эстрадиола. Прогестерон синтезируется плацентой из предшественников,
поступающих из организма матери. К концу беременности вырабатывается около
260 мг прогестерона в сутки, что в 10-15 раз превышает синтез этого гормона
активным желтым телом. Прогестерон регулирует сократительную активность
матки, секреторную трансформацию эндометрия и подготовку к родам, а также
выполняет иммуносупрессивную функцию.Таблица 13-9. Нормативные показатели концентрации эстрадиола (Е,) в течение беременностиСрок беременности, недМедиана, пмоль/лРеферентные значения, лмоль/л1-21100800-14003-419001300-25005-647004000-54007-857005000-64009-1073006100-850011-1299008400-11 40013-1413 30010 800-15 80015-1621 15018 100-24 20017-1827 40022 600-32 200
ЛАБОРАТОРНЫЙ МОНИТОРИНГ ПРИ БЕРЕМЕННОСТИ 849Окончание табл.13-9Срок беременности, нед19-2021-2223-2425-2627-2829-3031-3233-3435-3637-3839-40Медиана, пмоль/л32 30038 6504510048 40048 00049 80051 70059 70066 35070 75078100Референтные значения, пмоль/л29 300-35 30035100-42 20039 800-5040045 000-51 80042 700-53 30040 000-59 60045 600-57 80051 200-68 20057 000-77 70057 500-8400058100-98100Недостаточный синтез прогестерона желтым телом в I триместре приводит к
нарушению процесса имплантации и прерыванию беременности на ранних сроках.
Угроза потери беременности вследствие гипофункции желтого тела и снижения
продукции прогестерона трофобластом (плацентой) наблюдается у 8-10% бере¬
менных и требует адекватной заместительной терапии.Ингибин АГетеродимерный гормон белковой природы, супрессирующий секрецию ФСГ
гипофизом. Ингибин А состоит из а- и рА-субъединиц (ингибин В состоит из а- и
рВ-субъединиц). Только димерные формы обладают биологической активностью.
В течение менструального цикла и ранней беременности ингибин А продуцируется
желтым телом, в I триместре, кроме яичников, синтезируется плодом, плацентой и
плодными оболочками, полностью подавляя синтез ФСГ. В течение беременности
повышается до 10-й недели, затем снижается до минимума к 17-й неделе, после
чего снова медленно растет до родов. Определение ингибина А имеет диагности¬
ческое значение для пренатального скрининга синдрома Дауна и трисомии 18, а
также в качестве маркера угрожающего аборта в I триместре (пониженный уро¬
вень) и пузырного заноса (повышенный уровень). Во II триместре повышенный
уровень ингибина А, так же как активина А и npo-ANP, прогнозирует развитие
преэклампсии. Использование ингибина А имеет экономическое преимущество —
он уже включен в пренатальный скрининг трисомий в квадротесте (скрининг
синдрома Дауна во II триместре вместе с а-фетопротеином, свободным эстриолом
и ХГЧ). Предлагают использовать квадротест также для расчета риска развития
преэклампсии: первые результаты показывают чувствительность 42% при частоте
ложноположительных результатов 6%.РЕГУЛЯЦИЯ МЕТАБОЛИЗМА ОРГАНИЗМОВ МАТЕРИ И ПЛОДАВ начале 3-го месяца беременности масса плода составляет около 4 г, плацен¬
ты — 20-30 г, величина ее обменной поверхности достаточна для удовлетворения
метаболических и энергетических потребностей плода. Далее масса плаценты воз¬
растает только в 15-20 раз, а масса плода увеличивается в 800-900 раз, возникает
потребность в дополнительном энергообеспечении.Основным источником энергии для плода служит глюкоза, поступающая из
крови матери через плацентзі”. По мере роста плода его потребность в энергии
непрерывно возрастает. Характерное изменение метаболизма организма матери
выражается в нарушении толерантности к углеводам, возникает состояние (раз¬
ной степени тяжести), известное как диабет беременных. Потребление глюкозы
850ЛАБОРАТОРНЫЙ МОНИТОРИНГ ПРИ БЕРЕМЕННОСТИтканями материнского организма сокращается, обеспечивая повышенный транс¬
плацентарный перенос.Изменение толерантности к глюкозе вызывается в основном плацентарным
лактогеном (соматомаммотропином). Этот гормон состоит из 151 аминокислоты
и близок по структуре к гормону роста. Синтез его клетками синцитиотрофобласта
усиливается во время беременности, гормон практически полностью попадает в
кровь матери. Основная биологическая роль плацентарного лактогена заключает-
ся в активации липолиза. Как резз^ьтат — в крови матери повышается содержание
свободных жирных кислот, что нарушает инсулинозависимое потребление глюко¬
зы клетками. Возникает гипергликемия, которая не только стимулирует секрецию
инсулина поджелудочной железой матери, но и обеспечивает плод необходимым
для роста энергетическим субстратом. Свободные жирные кислоты плохо про¬
ходят через плацентарные мембраны и используются материнским организмом в
качестве источника энергии.Таким образом, беременность является своеобразным метаболическим нагрузоч¬
ным тестом, выявляющим состояние поджелудочной железы, при физиологическом
течении беременности избыток глюкозы полностью используется плодом, уровень
сахара в крови матери не повышается. У беременных, страдающих диабетом, доступ¬
ность глюкозы (и аминокислот) существенно вьшіе нормы, в результате чего плод
усиленно растет, а его поджелудочная железа резко активируется. Диагностическая
значимость определения содержания плацентарного лактогена в крови незначитель¬
на, поскольку этот показатель отражает состояние углеводного обмена матери. При
гипогликемии уровень гормона повышается, а при гипергликемии — снижается.В регуляции метаболизма организма матери (и плода) принимают активное уча¬
стие и другие эндокринные системы, в первую очередь тиреоидная и гипофизарно¬
адреналовая,Тиреоидные системы матери и плодаТиреоидные системы матери и плода независимы друг от друга. Гормоны щито¬
видной железы слабо проникают через зрелую плаценту. В то же время функцио¬
нальным состоянием тиреоидной системы беременной определяются ее сомати¬
ческое благополучие и соответственно характер течения гестационного процесса.
Как правило, беременность протекает на фоне эутиреоидного состояния матери,
т.е. при нормальных уровнях тиреотропного гормона (ТТГ), свободных тироксина
(Т3), трийодтиронина (Т^ в крови (табл. 13-10). В I триместре повышается синтез
эстрадиола в трофобласте (плаценте) и приводит к усилению синтеза тироксинсвя-
зывающего глобулина печенью. Концентрация свободных тиреоидных гормонов
несколько снижается, но вскоре устанавливается новое равновесие между фрак¬
циями Т3, и ТТГ.Таблица 13-Ю. Нормативные показатели концентрации тиреоидных гормонов в крови матери в
течение беременностиКонцентрация гормонаСрок беременности1-12 нед13-24 нед25-40 недПГ, мМЕ/п0,S-2,21-2,31.2-2.4Т,„ нмоль/л1.5-2,31,8-2,41,8-2,2т., нмоль/л4’133,1-179,9142,6-177,8141,5-178,5Т,св., пмоль/л5-7,05,2-7,24,4-9.0Т/в., пмоль/л9,9-16.58,8-14,49,1-11,9Антитела к тиреоглобулину
(АТ-ТГ), МЕ/млДо 40До 40До 40Антитела к тиреоидной перок-
сидазе (АТ-ТРО), МЕ/млДо 35До 35До 35
ЛАБОРАТОРНЫЙ МОНИТОРИНГ ПРИ БЕРЕМЕННОСТИ851Помимо гипофизарного ТТГ, на состояние тиреоидной системы матери ока¬
зывают влияние ХГЧ и хорионический тиреотропин. Во время формирования
трофобласта (плаценты) тиреоидные гормоны матери служат для развития и
дифференцировки плода. Именно поэтому любые нарушения тиреоидной системы
женщины в эти фОки отражаются на судьбе будущего ребенка.Хорионический тиреотропин в небольших количествах вырабатывается пла¬
центой и по структуре а-цепи отличается от гипофизарного ТТГ.Во время беременности увеличивается потребность матери в йоде (элемент
посгупает к плоду через маточно-плацентарный кровоток), из-за усиления крово¬
снабжения возрастает базальный метаболический уровень и увеличивается объем
щитовидной железы. Эутиреоидное состояние поддерживается всеми компонента¬
ми тиреоидной системы и плацентарными гормонами. Тиреоидная система плода
не зависит от материнской и начинает функционіфовать на 10-12-й неделе бере¬
менности, окончательно формируясь к 14-й неделе. Йод накапливается тканью
щитовидной железы, появляется плодовый тиреотропный гормон. Тиреоидные
гормоны необходимы прежде всего для развития ЦНС. В условиях дефицита йода
возникает компенсаторная гиперплазия щитовидной железы плода. При сниже¬
нии уровня тиреоидных гормонов в крови плода нарушается формирование мозга
ребенка, вплоть до тяжелых форм эндемического кретинизма.НадпочечникиПипоталамо-гипофизарно-адреналовая (ГГА) система обеспечивает адаптацию
организма к окружающей среде. Экскреция метаболитов глюкокортикоидов и
17-кетостероидов во время беременности меняется незначительно. Содержание
кортизола в крови растет начиная с конца I триместра и до момента родов. Эти
данные послужили основой представления о «гестационном стрессе», согласно
которому беременность рассматривалась как фактор стрессорного воздействия
на организм женщины. Впоследствии было показано, что уровень кортизола в
крови при беременности отражает связывание этого гормона с транскортином —
белком-переносчиком глюкокортикоидов (а не активацию коры надпочечни¬
ков). Плацентарный эстрадиол активирует синтез транскортина, тестостерон-
эстрадиолсвязывающего глобулина и тироксинсвязывающего глобулина (ТСГ) в
печени матери. Соответственно возрастает концентрация белоксвязанной формы
кортизола в крови, при этом уровень свободного гормона не изменяется и повы¬
шается только на сроке 35-40 нед беременности.Функциональная активность коры надпочечников матери во время беременно¬
сти регулируется как аденогипофизом самой женщины, так и фетоплацентарным
комплексом. Со II триместра плацента синтезирует кортиколиберин и соответ¬
ственно адренокортикотропный гормон (АКТГ).В настоящее время определение уровня кортиколиберина в крови беременных
используют для оценки риска преждевременных родов. Этот гормон не только
стимулирует выработку плацентарного АКТГ, но и регулирует сократительную
активность миометрия, усиливая эффект окситоцина во время родов.Физиологические эффекты изменений концентрации кортизола в крови бере¬
менной многообразны. Благодаря повышению уровня кортизола во ІІ-ІІІ три¬
местре снижается чувствительность ГГА-системы к стрессам, уменьшается угроза
прерывания беременности. Этот гормон активирует процессы глюконеогенеза в
печени, и концентрация глюкозы в крови повышается. Угнетая образование анти¬
тел, кортизол подавляет активность иммунной системы матери. Подъем уровня
свободного кортизола за 2 нед до родов, возможно, является сигналом к началу
предродовой перестройки материнского организма.К концу 2-го месяца эмбрионального развития происходит дифференцировка
коры надпочечника на вн)ггреннюю фетальную и наружную дефинитивную зоны.
К концу I триместра надпочечники плода достигают размера его почек. Фетальная
852 ЛАБОРАТОРНЫЙ МОНИТОРИНГ ПРИ БЕРЕМЕННОСТИзона составляет при этом более 80% объема железы. Синтез кортизола в дефини¬
тивной коре начинается на 10-11-й неделе беременности. К середине II триместра
аденогапофиз плода уже секретирует АКТГ в количествах, достаточных для полно¬
ценной работы ГГА-системы. Печень зародыша практически не синтезирует транс-
кортин, поэтому почти весь плодовый кортизол находится в свободном состоянии.
Вполне вероятно, что подъемы уровня свободного кортизола в крови матери в
определенные сроки беременности (табл. 13-11) обусловлены активацией надпо¬
чечников плода, так как гормон может свободно проникать через плаценту.Таблица 13-11. Нормативные показатели концентрации кортизола в крови матери в течение
беременностиСрок беременности, недМедиана, нмоль/лРеферентные значений, нмоль/л1-2335246-4235-6413360-4667-е503416-5909-10577446-70711-12584430-73813-14702532-87215-16733484-98317-18791552-103019-20887720-105421-221017773-126023-241066858-127525-261096995-119727-281069926-121229-30998898-109731-32988859-111833-3410181001-114335-361056982-112937-3811521070-123539-4012161014-1328При переходе через плацентарный барьер кортизол материнской крови пре¬
вращается в кортизон — малоактивный кортикостероид. Тем самым секреция
АКТГ плодовым аденогипофизом не блокируется, угнетения ГГА-системы плода
не происходит.Основной продукт фетальной зоны коры — дегидроэпиандростерон-сульфат
(ДГА-С) — при попадании в плаценту превращается в свободный ДГА, а затем в
эстрадиол. Если же ДГА-С поступает в печень плода, образуется 160Н-ДГА-С. Это
соединение в плаценте превращается в эстриол, который затем переходит в кровь
матери. Эстриол защищает организм беременной от действия эстрадиола, синте¬
зируемого фетоплацентарным комплексом, а также участвует в подготовке матки
(особенно шейки) к родам. Как правило, содержание эстриола в крови матери
коррелирует с функционированием надпочечников плода, так как сульфатазная
активность плаценты снижается очень редко.Помимо перечисленных гормонов, плацента вырабатывает целый спектр био¬
логически активных соединений. К ним относятся цитокины (ростовые факторы,
ИФ-І, ИФ-П), ингибин, активин и либерины, аналогичные либеринам гипотала¬
муса. Кроме того, желтое тело вырабатывает релаксин.Одним из специфических соединений, появляющихся во время беременности,
является а-фетопротеин. В I триместре этот гликопротеин начинает синтезиро¬
ЛАБОРАТОРНЫЙ МОНИТОРИНГ ПРИ БЕРЕМЕННОСТИ 853ваться в желточном мешке эмбриона, а затем продуцируется в печени. Уровень
а-фетопротеина в крови матери отражает активность печени плода. При наруше¬
нии структуры ЦНС (дефектах развития нейральной трубки) его концентрация
в амниотической жидкости, а затем и в крови матери повышается. Содержание
АФП в крови увеличивается и при других врожденных пороках развития, поэтому
определение концентрации этого гликопротеина широко используют в прена¬
тальной диагностике. Предполагается, что АФП связывает стероидные гормоны
в крови плода (печень плода практически не синтезирует транскортин) и наряду с
ростовыми факторами стимулирует пролиферацию клеток.С I триместра в крови беременной повышается содержание пролактина
(табл. 13-12), и к ПІ триместру этот показатель достигает величин, характерных
для пациентов с пролактиномами.Таблица 13-12. Нормативные показатели концентрации пролактина и дегидроэпиандростерон-
сульфата (ДГА-С) в крови матери в течение беременностиСрок беременности, НЕДПролактмн, мМе/лДГА-С, мкмоль/л1-2500-20001-9,7713-242000-60001,9-5,1625-^74000-10 0000,54-2,99Физиологическая роль повышения секреции пролактина во время беремен¬
ности заключается в подготовке молочных желез к лактации. Кроме того, про-
лактин амниотической жидкости з^частвует в регуляции водно-электролитного
обмена плода. Следует отметить, что назначение бромокриптина (бромэргона*)
беременным приводит к снижению уровня пролактина в крови матери и плода, но
в амниотической жидкости содержание гормона не меняется, что свидетельствует
об автономности его секреции децидуальной тканью.Таким образом, в течение гестационного процесса:• физиологическое течение беременности определяется прежде всего эндо¬
кринными сигналами, поступающими в кровь матери от эмбриона (фетопла¬
центарного комплекса);• нарушение способности плода к секреции соответствующих гормонов приво¬
дит к прерыванию беременности;• соматическое благополучие организма матери является необходимым усло¬
вием для адекватного ответа на «команды» плода.ш
Глава 14Химико-токсикологическийанализОБЩИЕ ВОПРОСЫ ХИМИКО¬
ТОКСИКОЛОГИЧЕСКОГО АНАЛИЗАХимико-токсикологический анализ (ХТА) - специфический ана¬
лиз объектов биологического и небиологического происхождения
на присутствие токсичных веществ (токсикантов). Задача ХТА —
установить природу и концентрацию разнообразных токсичных
веществ (органических и неорганических, природных и промыш¬
ленных или изготовленных кустарным способом, твердых, газоо¬
бразных и жидких) с устойчивыми свойствами или активно метабо-
лизирующихся в организме и дать заключение об их токсичности.
Объектами ХТА могут быть кровь и моча, слюна и потожировые
выделения, спинномозговая жидкость, содержимое желудочно-
кишечного тракта, печень, мозг, селезенка, почки, кожа, волосы, а
также ткани мышц и зубов, запахи и др.Обнаружение веществ разнородного по структуре, неясно очер¬
ченного круга соединений в различных сложных и непостоянных
биологических объектах и высокая точность их идентификации
при обычной аналитической работе в режиме дефицита времени
возможны путем стратегической концепции, состоящей в первую
очередь Б систематизации аналитического процесса.Систематизация предполагает необходимые компромиссы при
выборе оптимальных условий аналитического процесса (подготов¬
ку пробы к анализу, выбор методов, собственно анализ, грамотную
интерпретацию результатов). Относительная вероятность обнару¬
жения какого-либо вещества в исследуемом материале не зависит от
токсичности соединения и статистической частоты его употребле¬
ния, ее рассматривают только как причину отравления.Помимо систематизации, необходимы адекватные данные для
упорядочения аналитических сигналов, т.е. стандартные вещества
сравнения, способные привести к настоящим соединениям и их
безупречной идентификации.Именно поэтому система методов в ХТА является широкопро¬
фильной, содержащей большое количество аналитических методов.
Используемые методы должны обладать весьма низкими пределами
обнаружения, обеспечивать получение достоверных аналитических
сигналов от минимального количества вещества.
ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ 855в зависимости от поставленных задач выделяют три варианта химико- 3
токсикологического исследования. Щ• Анализ объектов с известными токсичными веществами, в том числе и
известной дозой принятого токсиканта, — анализ на известное, или так назы¬
ваемый направленный анализ, т.е. при установленных обстоятельствах попа¬
дания токсиканта в организм (внутривенный, оральный, ингаляционный и
другие пути поступления).• Если об обстоятельствах отравления имеются только косвенные сведения,
указывающие на возможную его причину, природу токсичного вещества
можно прогнозировать на основе клинической картины отравления или выя¬
вить в результате патологоанатомического вскрытия трупа (в случае смерти
пациента).• Наиболее сложен третий вариант, когда вообще отсутствуют какие-либо
сведения о природе и концентрации токсичного вещества. В ХТА такой тип
называют ненаправленным, т.е. анализом на неизвестное. При этом исполь¬
зование одного, даже самого информативного метода не дает оснований для
вывода о полном определении компонентов смеси, так как в принципе неиз¬
вестно, соответствует ли полученный сигнал одному или нескольким индиви¬
дуальным соединениям.Сгратегию анализа строят в зависимости от его особенностей (направленный или
ненаправленный). Если в первом случае для выбора оптимальных условий анализа
можно воспользоваться справочной информацией или другими литературными
данными, то в третьем, самом сложном варианте используют методический прием,
называемый скринингом, т.е. поэтапное обнаружение групповой принадлежности, а
затем индивидуальное обнаружение и идентификацию токсичных веществ.Во всех случаях ХТА получают ложноположительные и ложноотрицательные
результаты. Первые из них связаны с недостаточной селективностью методов обнару¬
жения, а вторые — с недостаточной чувствительностью выбранных методов анализа.Ложноотрицательный ответ — отрицательный результат на исследуе¬
мое вещество, полученный при анализе объекта, содержащего это вещество.
Ложноотрицательный ответ обратно пропорционален чувствительности анали¬
тического метода: чем выше чувствительность, тем меньше ложноотрицательных
ответов и больше положительных.Ложноположительный ответ — положительный результат на исследуемое
вещество, полученный при анализе объекта, не содержащего этого вещества.
Ложноположительный ответ — самая тяжелая ошибка химика-аналитика, он свя¬
зан со специфичностью используемого метода. Например, для иммунных методов
можно снизить уровень разделительной концентрации {cut-off) до порога чувстви¬
тельности метода, который обычно в несколько раз ниже cut-off и 150 нг/мл).В этом случае снизится количество ложноотрицательных результатов и возрастет
количество ложноположительных.При прочих равных условиях один из наиболее важных параметров надежности -
гувствителъностъ применяемых методов исследования (определяют как минималь¬
ную концентрацию вещества в объекте, открываемую с высокой вероятностью).Другой, еще более существенный параметр — специфигность применяемых
методов, определяемая способностью метода различать то или иное соединение
среди множества других.Надежность положительного или отрицательного ответа зависит от многочис¬
ленных факторов:• давности и частоты потребления токсичного вещества (контакта с ним);• пути попадания его в организм человека;• возрастных, весовых, диетических, динамических, этнических, индивидуаль¬
ных вариаций в поглощении, метаболизме и выведении ксенобиотиков;
Щр 856 ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗШ • состояния печеночной и почечной функций;• pH и объема мочи;• чувствительности и специфичности применяемого метода анализа;• правильной организации получения, приема и хранения объектов исследова¬
ния (биоматериала, объектов небиологического происхождения);• продуманного и четкого документирования всего процесса работы;• постоянного надзора за исправностью оборудования и чистотой всех реагентов;• высокой профессиональной подготовкой персонала.Каждую стадию ХТА необходимо контролировать пофедством:• применения стандартного вещества сравнения;• проверки правильности (калибровки проведенных операций);• проверки воспроизводимости (статистической обработки);• контроля условий анализа;• моделирования.Систематическая проверка необходима на самых уязвимых стадиях.• Пробоотбор. Устраняют возможность уничтожения вещественных доказа¬
тельств или фальсификации объекта, а также в связи с малой массой пробы,
ее загрязнением или изменением химического состава под воздействием
окружающей среды.• Пробоподготовка (стадия оправданного риска частичной или даже полной
потери определяемых веществ). Операция должна состоять из строгих и
логически оправданных действий, направленных на сохранение определяе¬
мого вещества. Рекомендуют проведение экспрессных тест-анализов. На этой
стадии только ограниченное количество методов позволяет провести анализ
без предварительной подготовки, т.е. непосредственно в биоматериале и дру¬
гих объектах (иммунологические, химические и др.).Для большинства методов стадии пробоподготовки и концентрирования обя¬
зательны. В настоящее время нет метода, с помощью которого в одной простой
процедуре быстро обнаруживали бы и точно идентифицировали все встречаемые
токсичные вещества при их низкой концентрации. Именно поэтому процесс обна¬
ружения и идентификации проходит в два методических этапа: скрининговый
(указательный) и подтверждающий (идентифицирующий).Скрининговые тестыМетоды первого этапа должны обладать высокими производительностью и
уровнем чувствительности, достаточно широким охватом классов токсичных
соединений, но необязательно высокой специфичностью. На этом этапе важно
получить минимум отрицательных ответов и максимум положительных, однако
при таком методологическом подходе бывает значительное (10-15%) количество
ложноположительных результатов. Второй этап — удаление (в идеале) ложнопо¬
ложительных результатов. Его методы часто менее производительны, но более
высокоспецифичны, в практике ХТА стандартными методами первого этапа явля¬
ются тонкослойная хроматография и иммунологические методы исследования.Тонкослойная хроматография (ТСХ) — доступна, дещева, охватывает широкий
диапазон разнообразных классов токсичных веществ, достаточно высокопроиз¬
водительна. К недостаткам ТСХ относят трудоемкость, работу с вредными веще¬
ствами (растворителями), трудности в интерпретации результатов. Значительно
большей чувствительностью обладает высокоэффективная ТСХ.Подтверждающие тестыв аналитической токсикологии принято, что первичное обнаружение токсично¬
го вещества должно быть подтверждено, если возможно, с помощью исследований,
основанных на других физико-химических принципах. При некоторых обстоя-
шшХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ 857тельствах может быть приемлемо в качестве подтверждающего теста использо¬
вание той же аналитической системы, что и при первичном исследовании, как,
например, в газожидкостной хроматографии (ГЖХ), если применяют химическую
дериватизацию (силилирование или ацетилирование), ведущую к изменению вре¬
мени удерживания. В то же время подтверждающий анализ с повторным использо¬
ванием ГЖХ системы с подобной, но не идентичной колонкой обычно непригоден,
так как данные об относительном времени удерживания многих веществ не будут
существенно различаться.Повторное использование радиоиммунного анализа (РИА) для подтверждения
положительных результатов, полученных другим иммунным методом (в частности,
поляризационным флюороиммунологическим анализом), не может быть принято
как приемлемое. Исследуемые вещества в первом методе будут иметь те же самые
перекрестные реакции, что и во втором, поскольку специфичные антитела могут
реагировать на те же самые токсичные вещества или вещества, сходные с ними.Иммунные методы обладают высокой чувствительностью, превосходящей чув¬
ствительность тех (кроме высокоэффективной тех), и более высокой спец¬
ифичностью в отношении класса веществ, для которого они изготовлены. Они
поддаются простой автоматизации. Иммунные методы явно превосходят ТСХ-
скрининг в обнаружении токсичных веществ, потребляемых в миллиграммовых и
субмиллиграммовых количествах (например, галлюциногенов). В случаях острых
отравлений, летальных исходов, когда дозы токсичного вещества повышены из-за
передозировки, ТСХ-скрининг — вполне удовлетворительный метод.Недостатки иммунных методов:• выпускаемые наборы (диагностикумы) в настоящее время еще слишком
дороги для скринингового поиска:• ассортимент диагностикумов достаточно ограничен;• иммунные методы служат методом определения групповой принадлежности
веществ;• течение иммунной реакции может быть нарушено простой фальсификацией
пробы.Тазовая хроматография с масс-спектрометрией (ГХ/МС) — второй подтверж¬
дающий метод, в нем соединяются высокоэффективное хроматографическое раз¬
деление на капиллярных колонках и молекулярно-идентифицирующий высоко¬
чувствительный масс-спектрометр.Газожидкостная хроматография с плазменно-ионизационным детектором (ГЖХ/
ДИП) и высокоэффективная жидкостная хроматография (ВЭЖХ) — следующие
по надежности подтверждающие методы. У этих методов более значительная
разделительная сила, чем у ТСХ, обусловливающая их большую пригодность для
подтверждения результатов, полученных методом ТСХ.Использовать ТСХ в качестве подтверждающего метода для иммунных тестов
или наоборот — единой точки зрения на этот вопрос не существует. С одной сторо¬
ны, его считают недостаточно надежным подтверждающим методом при решении
юридических задач, но достаточно надежным для решения клинических вопросов.
Что касается использования иммунного метода для подтверждения данных ТСХ,
необходимо помнить, что иммунные методы подтверждают наличие не какого-
либо индивидуального вещества, а целого класса веществ, нередко имеющих раз¬
ное токсикологическое значение. Кроме того, в анализе на каннабиноиды иммун¬
ные методы могут давать от 4 до 21% ложноположительных результатов, что вряд
ли говорит о надежности подтверждения в данном исследовании. Комбинации
«иммунные методы-TCXs»- или «ТСХ-иммунные методы» требуют использования
еще одного подтверждающего метода.Иммуноферментный метод с разлигной перекрестной реактивностью может
бьггь иногда повторно использован для аргументации первичного скрининга.
858ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗНапример, за неспецифичным ИФА с широким спектром перекрестных реакций
на опиаты следует более специфичный иммунологический тест на конъюгиро¬
ванный морфин. Эти результаты все равно в норме требуют подтверждения более
специфичным методом, в частности ГХ/МС.Подтверждение результата в единичном экстракте одного и того же образца
не рассматривают как приемлемое, поскольку это не исключает возможность
загрязнения экстракта в процессе экстракции. Правильно — подтверждать иден¬
тичность обнаруженного вещества в различных экстрактах одной и той же пробы.
Определение количественного содержания искомого вещества может быть одно¬
временно и подтверждающим методом идентификации, если определяемое веще¬
ство было изначально обнаружено методом, значительно отличающимся от перво¬
го (например, ИФА и ГХ/МС).Для проверки идентификации того или иного токсичного вещества рекомен¬
дуют, если возможно, иметь несколько проб образца. Если имеется только одна
проба, следует обязательно проводить повторное определение в разных случаях
и с использованием адекватных контрольных положительных и отрицательных
опытов на подобной матрице в образцах сходного типа.Использование подтверждающих методов идентификации рекомендуют в отно¬
шении всех видов токсичных веществ, включая этанол и оксид углерода.ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯВ настоящее время в ХТА используют широкий арсенал методов аналитической
химии: химические, спектральные, иммунологические, различные виды хрома¬
тографии и др. Использование одного или комплекса методов определяется кон¬
кретными аналитическими задачами (направленный и ненаправленный анализы,
обнаружение металлических, лекарственных ядов, летучих токсикантов, наркоти¬
ческих средств и др.) (табл. 14-1).Таблица 14-1. Сравнение наиболее часто используемых методов в химико-токсикологическом
анализеМетодИдентификацияспецифич¬ностьчувствитель¬ностьвозмож¬ностьанализасмесейструктур¬
ный каче¬
ственный
анализколичествен¬
ный анализтрудоем-коспьэкспер¬тизаЦветовыетесты++Да+Иногда++UV-Vis++Нет++++Да++++Иммунныеметоды++++ИногдаНетИногда++ГЖХ++++Да++Да++++ТСХ+++Да++Нет++++++ВЭЖХ++++Да++Да++++ГХ/МС++++++++Да++++Да+++++++ААС++++++Нет+++++++++++++ИСП/МС++++++++Да++++++++++++++++примечания. UV-Vis — спектроскопия в ультрафиолетовой и видимой областях; ГЖХ — газо¬
жидкостная хроматография: ТСХ — тонкослойная хроматография; ВЭЖХ — высокоэффек¬
тивная жидкостная хроматография: ГХ/МС — газовая хроматография с масс-спектрометрией;
ААС — атомно-абсорбционная спектроскопия; ИСП/МС — индуктивно связанная плазма с масс-
спектрометрией.
ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ 859Фактически все клинические и судебно-химические лаборатории используют
тесты с окрашиванием в целях получения предварительного результата на при- ё
сутствие потенциальных источников отравления. ^Прямое обнаружение в моче• Определение глюкозы, кетоноБ и pH. Анализ глюкозы должен быть соотне¬
сен с определением ее в крови. Положительный результат на кетоны может
указывать на интоксикацию ацетоном или изопропанолом (тест также может
быть положительным у больных сахарным диабетом).• Цветовой тест на салицилаты (включая ацетилсалициловую кислоту) — тест
Триндера. При добавлении 100 мкл реактива Триндера (смеси 40 г хлори¬
да ртути в 850 мл воды, 120 мл соляной кислоты и 40 г гидратированного
нитрата железа, разбавленной водой до объема 1 л) к моче объемом 2 мл и
перемешивании в течение 5 с образуется фиолетовое окрашивание в присут¬
ствии салицилатов. Тест лучше всего проявляется в образцах мочи и хуже —
в содержимом желудка. Если при этом анализе получен положительный
результат, следует предпринять количественный анализ образцов плазмы и
сыворотки с использованием ГЖХ.• Обнаружение фенотиазинов (этацизина*) проводят с помощью теста FNP
(смеси растворов FeCl.^, НСЮ^ и HNO3). Появление фиолетовой, красной,
оранжевой, чернильной, голубой окраски указывает на присутствие про¬
изводных фенотиазина. Окраска возникает сразу. Положительный резуль¬
тат можно наблюдать после приема терапевтических доз. Положительные
результаты должны быть подтверждены посредством тех.• Трициклические антидепрессанты (имипрамин, дезипрамин* и др.) обнару¬
живают по реакции с реактивом Форреста, Добавление водных растворов
дихроматов калия, серной, перхлорной и азотной кислот к 0,5 мл образца в
течение 5 с в присутствии соединений данной группы ведет к образованию
желто-зеленой окраски с переходом в темно-зеленую, а затем и в синюю.Важно помнить, что аналогичную окраску дают фенотиазины.• Трихлорсодержащие соединения (включая хлоралгидрат, хлороформ, дих-
лоральфеназон, трихлороэтилен и другие гемтрихлорсодержащие соеди¬
нения) обнаруживают с помощью теста Фуаживора. При положительном
тесте необходимо провести подтверждающее исследование с помощью
ГЖХ.• Парацетамол и фенацетин могут быть обнаружены тестом с аммиачным рас¬
твором с?-крезола. При положительном результате следует провести количе¬
ственное определение парацетамола в плазме или сыворотке.• Для обнаружения токсичных веществ окислительного характера (гипохлори-
тов, хлоратов, нитратов, нитритов и др.) используют тест с дифениламином.
Образование интенсивного голубого окрашивания указывает на присутствие
подобного рода окислителей в образце.Спектроскопия в ультрафиолетовой и видимой областяхВ спектральных методах используются свойства молекул или атомов вещества
специфически поглощать, испускать, отражать электромагнитное излучение.
Характер спектра аналита специфичен, а его интенсивность в определенном
интервале длины волны (подчинение закону Бугера-Ламберта-Бера) пропор¬
циональна концентрации аналита в растворе, что создает возможность иденти¬
фицировать вещество и оценить его количественное содержание. В то же время
определение содержания какого-либо соединения возможно только в чистом
растворе, для использования спектральных методов при анализе смесей имеются
ограничения.
860ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗИммунные методыВсе иммунные методы принципиально основаны на взаимодействии токсично¬
го вещества (антигена) со специфичными к нему антителами в присутствии хромо¬
генного агента. Для фиксации химической реакции между ними в один из компо¬
нентов вводят специальную метку, по способу детектирования которой различают
несколько видов иммунохимического анализа с гарантированными пределами
обнаружения в диапазоне от ОД до 500 нг/мл вещества: иммунохроматографиче-
ский (ИХА), иммуноферментный (ИФА), поляризационный флюороиммунологи-
ческий (ПФИА), радиоиммунологический (РИА).В гомогенном ИФА все компоненты реакции находятся в одном агрегатном
состоянии - растворе. В наиболее распространенных модификациях гетероген¬
ного анализа антитела скапливаются на твердом носителе (пробирках, планшетах,
бусинах). Основная проблема ИФА — лабильность ферментов. Как и все белки,
они теряют активность под действием таких факторов, как нагревание, заморажи¬
вание, разведение образцов, изменение pH, присутствие солей тяжелых металлов,
антикоагулянтов, микроорганизмов. Некоторые компоненты крови, метаболиты
лекарственных средств и т.п. могут изменять скорость ферментативных реакций.
Таким образом, в ИФА часты случаи ложноположительных или ложноотрицатель¬
ных результатов. Именно поэтому его результаты значимы только в комбинации с
подтверждающими методами (ГЖХ, ГХ/МС, ВЭЖХ).Наиболее чувствительный и удобный в использовании иммунологический
метод — ПФИА. Принцип проведения реакции тот же, что в гомогенном ИФА.
В качестве метки используют флюоресцеин натрия. Изменение поляризации флю¬
оресценции зависит от степени связывания меченого антигена с антителом. Для
регистрации результатов используют специальную оптическую систему.Общая проблема для всех иммунохимических методов — кросс-реактивность.
Поскольку антитела формируют места связывания не на конкретную молекулу,
а на некоторый характерный ее фрагмент, то и иммунная реакция может про¬
исходить с веществами, имеющими его в своей структуре. Именно поэтому при
иммзшном анализе определяют не конкретное вещество, а группу соединений, т.е.
метод имеет групповую специфичность. Положительный ответ дается, например,
на опиаты (а не на морфин), барбитураты (а не на фенобарбитал) и т.д. Кроме того,
возможна реакция с другими химическими соединениями, не принадлежащими
к этой группе лекарств. Обычно каждый выбор характеризуется относительной
реактивностью к другим соединениям, что исключает возможный ложноположи¬
тельный и ложноотрицательный результат.Таким образом, при экспресс-анализе токсикантов иммунными методами при
получении отрицательного аналитического значения требуется обязательное под¬
тверждение результата другими методами.Газожидкостная хроматографияГазовую хроматографию в анализе наркотических средств используют в газо¬
жидкостном варианте, когда анализируемая смесь находится в состоянии газа
(подвижной фазы), который принудительно движется вдоль тонкой пленки жид¬
кости, нанесенной на твердый носитель. Неподвижные жидкие фазы бывают раз¬
ной полярности (неполярные — апиезоны, OV-101, полярные — карбоваксы, сред¬
ней полярности — 0V-17). Значительно эффективнее разделение происходит на
капиллярных колонках. Колонка — стеклянный капилляр диаметром 0,1-0,5 мм
и длиной несколько десятков метров. Жидкую фазу наносят на стенку капилляра
(носитель). Удлинение колонки ведет к лучшему формированию концентрацион¬
ных зон, в этом случае разделение происходит значительно эффективнее.Детектирование в ГЖХ осуществляют самыми различными типами аналитиче¬
ских устройств, основанными на различных способах фиксации веществ. Это детек-
*ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ 861тор теплопроводности (ДТП, катарометр), плазменно-ионизационный (ДИП),
термоионный (ДТ), детектор по захвату электронов (ДЭЗ), масс-селективный
(МС) и др. Широкий выбор детекторов позволяет решать самые разнообразные
задачи. Минимальный обнаруживаемый уровень анализируемых веществ — от
400 пг/мл (катарометр) до 0,1 пг/мл (ДЭЗ). Идентификацию веществ осущест¬
вляют сравнением характеристик удерживания (абсолютное, исправленное, отно¬
сительное время удерживания и индексы удерживания) с таковыми эталонных
(стандартных) веществ.ГЖХ — качественный и количественный метод анализа. Количественный ана¬
лиз может быть осуществлен путем абсолютной градуировки с использованием
внешнего или внутреннего стандарта по измерению площади или высоты пика.Тонкослойная хроматографияв методе тех неподвижную твердую фазу тонким слоем наносят на стеклян¬
ную, металлическую или полимерную пластинку. На расстоянии 0,5-1 см от края
пластинки на стартовую линию наносят пробу (концентрированный экстракт
мочи) и метчики — вещества сравнения. Край пластинки погружают в систему рас¬
творителей, которая действует как подвижная фаза жидкостной адсорбционной
хроматографии. Под действием капиллярных сил растворитель движется вдоль
слоя сорбента и с разной скоростью переносит компоненты анализируемой смеси,
что приводит к их пространственному разделению.Диффузия в тонком слое происходит в продольном и поперечном направлени¬
ях, поэтому процесс рассматривают как двухмерный. Стационарная фаза обычно
представляет однородный слой толщиной 0,25 мм силикагеля (средний размер
частиц — 20 мкм). Пластинки для высокоэффективной ТСХ (ВЭТСХ) от обычных
отличаются меньшим размером частиц (5-10 мм) и повышенной чувствитель¬
ностью. Существуют также пластинки для ТСХ с обращенной фазой, на кото¬
рых гидрофобная часть (обычно С^, Cg, Cj^j) связана с силикагелевой матрицей.
Результаты ТСХ регистрируют в виде коэффициентов удерживания {RJ).Более удобен показатель Rf 10Q (hRf), особенно при использовании стандартной
длины пластин 10 см, поскольку в этом случае его величина равна расстоянию (в
миллиметрах), пройденному анализируемым веществом от старта. Существует
много факторов, влияющих на воспроизводимость однако их влияние может
быть минимальным, если вместе с каждым образцом анализируют стандартные
(эталонные) соединения.ТСХ обычно применяют для качественного и полуколичественного определения.Высокоэффективная жидкостная хроматографияВЭЖХ существует в нескольких вариантах:• нормально-фазовая (НФХ) — жидкая неполярная фаза, состоящая из смеси
неполярных растворителей; движется вдоль полярной неподвижной фазы
(силикагеля);• обращенно-фазовая (ОФХ) — жидкая полярная фаза, состоящая из смеси
воды и полярных растворителей, движется вдоль неполярной неподвижной
фазы (модифицированного силикагеля с химически привитыми углеродны¬
ми цепями Cj, Cj,, C^jj, C^g или другими привитыми группами — CN, диолами,
SH и др.);• ионообменная хроматография (ИОХ) — полярная подвижная фаза; движется
вдоль неподвижной, состоящей из катионообменной или анионообменной
смолы;• другие разновидности ВЭЖХ.Основное преимущество ВЭЖХ перед другими хроматографическими методами
в том, что разделение происходит при комнатной температуре, в отличие, напри-Щ
862 ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ^ мер, от ҐЖХ, где анализируемую смесь необходимо с помощью нагревания пере-
водить в газообразное состояние, что может привести к термодеструкции некого-
g' рых термолабильных веществ.Широкий набор детекторов [ультрафиолетовый (УФ-детектор), химический,
ИК- и особенно МС-детекторы] делает ВЭЖХ надежным методом качественного
и количественного обнаружения наркотических средств.Хроматомасс-спектрометрияСреди спектральных методов необходимо выделить масс-спектрометрию (МС),
поскольку метод часто используют в качестве детектирующей системы для таких
разделительных методов, как ГЖХ, ВЭЖХ, ААС. Методы ГХ/МС, ВЭЖХ/МС,
А АС считают наиболее надежными подтверждающими методами в ХТА.Молекулы вещества, попадая в масс-спектрометр и находясь в газообразном
состоянии, подвержены ионизации под действием электронов (деструктивная
ионизация) или специального газа (химическая деструкция). При этом молекула
вещества распадается по определенным правилам на фрагменты с разными масса¬
ми. Получаемые ионы разделяются по массе и составляют масс-спектр. По срав¬
нению со спектрами стандартных веществ можно идентифицировать вещество, а
зная законы фрагментации-ионизации — предположить структуру анализируемо¬
го вещества.ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ
в КЛИНИЧЕСКОЙ токсикологииЦель ХТА в клинической токсикологии (ХТА острых отравлений) — установле¬
ние причины отравления и контроль эффективности методов лечения по ускорен¬
ному выведению ядов из организма.ХТА в клинической токсикологии имеет три основные целевые задачи:• специфические токсикологические исследования для экстренного обнаруже¬
ния и идентификации токсичных веществ в биологических средах;• специфические биохимические исследования для определения характерных
изменений биохимического состава крови для данной патологии;• неспецифические биохимические исследования для определения степени
тяжести токсического поражения функций печени, почек и других систем.в анализе по значимости на первое место выходят идентификация вещества,
вызвавшего отравление, и определение концентрации яда в биологических жид¬
костях. Очень важная особенность — анализ проходит в условиях недостатка
времени. Если диагноз острого отравления не установлен в течение ближайшего
времени, лечение вряд ли будет эффективным. Судьба пациента в значительной
степени зависит как от определения причин отравления, так и от точности опреде¬
ления яда.Особенность ХТА в клинической токсикологии — необходимость использова¬
ния высокоскоростных методов определения токсичных веществ в биологических
средах организма с высокими чувствительностью и специфичностью (ИФА, ГЖХ,
ВЭЖХ, ГХ/МС и др.). Кроме того, необходимо знание токсикокинетики и динами¬
ки токсичных веществ, что позволяет не только получить информацию о степени
тяжести отравления, но и контролировать процессы детоксикации ядов в процессе
лечения.в ХТА клинических отравлений применяют направленный, ненаправленный
анализы и их комбинацию. При направленном анализе, когда врачу-токсикологу
ясна причина отравления на основании клинической симптоматики и других
обстоятельств, схема аналитического процесса состоит из отбора пробы, ее под¬
готовки и анализа по известной методике.
ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ 863При ненаправленном анализе сначала образцы биологических жидкостей под¬
вергают предварительному исследованию с помощью химических тестов, затем
определению грзшповой принадлежности яда с помощью скрининговых методов
(чаще всего методом тонкослойной хроматографии) и только затем результаты
устанавливают с помощью подтверждающих методов исследования.Необходимо установить корреляцию между результатами лабораторных иссле¬
дований и данными клинических наблюдений (способ попадания токсиканта в
организм), а также токсикокинетику и динамику предлагаемого яда — метаболизм,
параметры полужизни почечного клиренса, кажущегося объема распределе¬
ния (V„) и других параметров. Используют известные табличные данные. Анамнез
(включая перечень назначаемых в прошлом лекарств и возможные психические
заболевания, род занятий и увлечений) имеет значение, поскольку может указать
на возможный доступ к конкретным ядам. Необходимо учитывать также возмож¬
ность диагноза, не связанного с отравлением. Например, кома может быть вызвана
не только отравлением, но и инсультом или нелеченым диабетом и т.д. Наконец,
при отравлении некоторыми соединениями может быть поставлен ошибочный
диагноз, особенно при обследовании пациента на поздней стадии патологического
процесса. Если природа принятого яда не вызывает сомнений, данные количе¬
ственного анализа не влияют на выбранный метод лечения. При сомнительном
диагнозе токсикологические исследования играют значительную роль.Работу химика-аналитика в случае отравления разделяют на три этапа: преда-
налитический — знакомство с обстоятельствами дела и сбор анамнеза, аналитиче¬
ский — выполнение анализа и постаналитический — интерпретация полученных
результатов. Интерпретация данных в клиническом токсикологическом анализе
должна быть очень четкой, так как индивидуальные особенности пациента (такие
как толерантность организма к действию какого-либо химического соединения),
хронический или одномоментный прием токсичного вещества будут определять
разброс аналитических данных. Методологически в клинической токсикологии
очень важно определить уровень терапевтических и токсичных доз и установить
корреляцию между ними, в клинико-токсикологическом анализе (КТА) очень
важно быстро коррелировать выбор метода исследования и результаты, полу¬
ченные с его помощью. Иногда достаточно качественного обнаружения, когда
выбор метода лечения не зависит от названия лекарственного препарата данной
группы (например, большинство бензодиазепинов одинаковы по своей токсично¬
сти), в других случаях в пределах одной группы необходимо вычленить наиболее
токсичный. При отравлении высокотоксичными веществами (амитриптилином,
метанолом, дихлорэтаном, соединениями тяжелых металлов и др.) необходимы
количественные результаты, так как от этого будет зависеть метод детоксикации.
При корреляции данных анализа с клинической картиной отравления могут быть
варианты:• полное их совпадение, в этом случае нет необходимости дальнейшего лабо¬
раторного исследования;• клиническая картина указывает, что диагностирована только часть токсич¬
ных веществ, вызвавших отравление; с этом случае исследование нужно про¬
должить;• полученные результаты полностью противоречат наблюдаемой клинической
картине отравления. Подобная ситуация требует, с одной стороны, дополни¬
тельного исследования и, с другой стороны, пересмотра клинического диа¬
гноза.Существуют две аналитические схемы, которые позволяют быстро идентифи¬
цировать токсичные вещества или их групповую принадлежность в различных
биологических объектах. Первая схема дает возможность получить максимальную
информацию в течение минимального времени. Она включает проведение пред¬
864ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗварительных тестов, позволяющих быстро провести групповую идентификацию,
с последующей стадией экстракции предполагаемого яда и ТСХ-обнаружением.
Если с помощью предварительных химических реакций невозможно определить
групповую принадлежность, проводят ТСХ-скрининг. При КТА необходимо пом¬
нить, что пациент редко принимает только одно вещество. Как правило, причиной
отравлений, которые исследуют в КТА, являются лекарственные яды и средства
бытовой химии. На летучие яды проводят ГЖХ-исследование, а на лекарствен¬
ные — химические тесты.Вторую схему используют в случаях, когда для проведения анализа имеется
достаточное количество времени. Она включает более длительную экстракцию с
разделением на фракции сильно-, слабокислых, нейтральных и основных веществ
(скрининг).АНАЛИЗ НАРКОТИЧЕСКИХ СРЕДСТВХТА наркотических и других одурманивающих средств проводят в целях
установления факта их присутствия в биологических объектах пациента, подо¬
зреваемого человека. Особенность ХТА данного вида веществ в том, что он имеет
два основных направления для исследования — судебно-правовой и клинический.
Задачей первого является установление факта употребления запрещенного сред¬
ства; ее решают с помощью клинической диагностики состояния наркотического
опьянения с последующим химико-токсикологическим лабораторным исследо¬
ванием. Клиническое направление анализа нацелено на диагностику, лечение и
реабилитацию. В этом случае лабораторные методы исследования используют для
контроля хода лечения (аналогия с КТА). Особое внимание в ХТА наркотических
и других одурманивающих веществ уделяют моменту отбора пробы, который дол¬
жен осуществляться под строгим контролем, с учетом возможности уничтожения
пробы или ее фальсификации. По этим же причинам транспортировка пробы и ее
хранение строго регламентируются.В ХТА наркотических соединений различают два методических этапа: скри¬
нинг (предваротельные исследования) и подтверждающие методы исследования,
поскольку данное направление ХТА — всегда ненаправленный анализ, так как
человек, употребивпшй запрещенное средство, тщательно скрывает не только
название использованного наркотического вещества, но и сам факт его употребле¬
ния. Именно поэтому на первом этапе необходимо добиваться получения миниму¬
ма ложноотрицательных ответов (что зависит от чувствительности аналитических
методов). На втором этапе с использованием методов исследования, обладающих
равной или большей чувствительностью, чем методы первого этапа, но имеющих
более высокую специфичность, получают определенную долю (до 15%) ложно¬
положительных результатов. Полу^іение ложноположительных результатов в
анализе биологических объектов на содержание наркотических средств связано
с падением специфичности используемого метода за счет перекрестных реакций.
Например, при исследовании ТСХ идентификация каких-либо сильнодействую¬
щих средств затруднена употреблением кофе, чая, какао (кофеина и других ксан¬
тинов), присутствием в биологической пробе продуктов курения (никотина и его
метаболитов), «безвредных?» лекарственных средств, некоторых пищевых доба¬
вок, оказавшихся в организме.Полученный в результате анализа отрицательный ответ может означать, что
обследуемый:• никогда не употреблял наркотических препаратов;• употреблял наркотические вещества нерегулярно, а в последнее время не
принимал их;
ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ 8g5• прекратил употребление наркотического средства для получения отрица¬
тельного результата анализа, зная, что будет ему подвергнут;• разбавил образец во время отбора пробы, выпил большое количество жидко¬
сти или мочегонное средство перед тем, как у него должны забирать пробу;• подменил пробу «чистой», принесенной с собой биологической жидкостью.в связи с вышесказанным получение ложноотрицательных результатов связаносо следующими моментами:• снижением чувствительности используемого аналитического метода (чем
выше чувствительность, тем меньше ложноотрицательных результатов);• преднамеренной фальсификацией аналитической пробы;• недостаточной квалификацией эксперта-аналитика;• систематическими ошибками.В свою очередь, положительный результат может означать, что обследуемый:• принимает наркотические вещества постоянно;• принимает наркотические средства нерегулярно;• принимает наркотические препараты по рецепту врача или самостоятельно;• находится под воздействием наркотического вещества во время отбора
пробы.Получение ложноположительных результатов связано прежде всего с падением
специфичности аналитического метода и недостаточной квалификацией эксперта.
Надежности результатов аналитической диагностики достигают правильными
организационными мероприятиями (приемом, хранением биологического мате¬
риала, постоянным контролем работы оборудования, чистотой реагентов и др.),
чувствительностью и специфичностью используемых методов, знанием природы
вещества, способа его введения в организм, распределения, метаболизма, путей
выведения, индивидуальных особенностей организма, грамотной интерпретацией
полученных результатов с корректным заключением. При анализе с использова¬
нием различных хроматографических систем должны быть отмечены любые нео¬
познанные пики, потому что они могут указывать на присутствие других летучих
веществ в образце крови. Качественную гарантию достоверности результатов обе¬
спечивает следующий прием. Известно, что точность анализа будет уменьшаться с
увеличением концентрации этанола, поэтому чем выше концентрация, тем больше
различия в результатах (результат «вчера-сегодня»). Соответственно качество
анализа будет зависеть от правильной аналитической стратегии, например повтор¬
ного анализа после длительных периодов хранения и др.Правила отбора проб биологических материалов для анализаХТА биологических объектов на содержание наркотических веществ начинают
с пробоотбора, где решают вопросы о типе объекта, необходимого для осуществле¬
ния анализа, его количества, хранения, деления на аликвоты и т.д., т.е. необходи¬
мых организационных мероприятий и технических манипуляций, обеспечиваю¬
щих надежность исследования.Биологическим объектом от живого человека могут служить смывы с рук и губ,
полости рта, слюна, моча, волосы, ногти, потожировые выделения и в отдельных
случаях (по предписанию!) кровь. Отбор пробы не должен доставлять обсле¬
дуемому болевых или неприятных ощущений. Количество отобранного материала
установлено приказом Минздрава РФ от 05.10.98 № 289 и соответствующими
утвержденными методическими рекомендациями и справочными пособиями по
обнаружению наркотических средств и, как правило, лимитировано чувствитель¬
ностью предлагаемых для исследования аналитических методов. Эффективность
анализа на содержание токсичного вещества может быть снижена манипулиро¬
ванием (с умыслом или без) с образцом, отбираемым для анализа (особенно у
живых обследуемых). Образец может быть разбавлен, подменен или загрязнен.
866 ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ.x-.«.-.v=?A-nV.;Ш Информация о том, как замаскировать тест, имеет широкий доступ (от устного
распространения до Интернета и популярных журналов). Кроме того, существует
достаточное количество данных по премедикации, в которых показано, какими
способами можно создать интерференцию в тестировании (например, наркоти-
т ческих веществ для получения ложноотрицательных результатов). Не исключен
вариант выпуска подпольными синдикатами готовых форм, заведомо содержащих
химические вещества, которые способны маскировать употребление запрещенно¬
го средства. Для противостояния возможным манипуляциям с образцом лаборато¬
рии должны обладать развитой системой защиты процедуры отбора пробы, чтобы
обеспечить надежность как самого факта отбора, так и результатов тестирования.
Эти мероприятия охватывают все этапы ХТА, включая отбор проб, пробоподго-
товку, предварительные и подтверждающие методы анализа.Подмена образца чаще всего происходит при отборе пробы у живых пациентов.
Подмена донорского образца, изъятого у них, может быть легко обнаружена, так
как «чистая» моча может быть взята у членов семьи, друзей и даже животных.
Однако при замене мочи обследуемого на пробу, взятую у другого человека,
существует очевидный риск того, что и в другой моче содержится какое-либо
наркотическое вещество. Другой общий прием — замена образца жидкостью,
схожей с мочой по цвету и консистенции. Подобная фальсификация может быть
осуществлена заменой мочи разбавленным вином, пивом, смесью воды и других
веществ, симулирующих мочу (яблочный сок, разбавленный чай). Учитывая, что
температура отобранной биологической жидкости должна находиться в пределах
32-38 °С, подмененные образцы часто хранятся на теле подозреваемого в гибких
контейнерах (презервативах, грелках). Доноры также умеют катетеризировать
сами себя, чтобы заполнить мочой, свободной от наркотических средств, свой
мочевой пузырь.Один из наиболее общих приемов для изменения результатов тестирования —
значительное разбавление исследуемого образца. Разбавление может уменьшить
концентрацию токсичного вещества в образце по отношению к наиболее низкому
уровню обнаружения (например, cut-off для ИФА - юридически достоверный
предел обнаружения). Для разбавления используют различные приемы:• введение большого количества воды в организм;• использование предписанных медикаментозных средств или их антагони¬
стов;• введение других веществ, которые могут продуцировать диурез;• добавление воды непосредственно в отобранный образец.Хотя разбавление — эффективный прием, в лаборатории его можно контро¬
лировать соответствующими тестами, в частности экспресс-тестами «Мультичек»
(JND Diagnostic Inc., Канада), с помощью которых можно определять плотность
мочи, ее pH и другие параметры. Вещества, способные вызвать повышенный
диурез: классические диуретики, бензодиазепины, калийсохраняющие препара¬
ты, ингибиторы карбоангидразы, осмотические диуретики, алкоголь, аммония
хлорид, кофеин, фитопрепараты. При отрицательном результате анализа на
исследуемое вещество попутное обнаружение вышеуказанных веществ должно
насторожить исследователя.Для фальсификации пробы используют также ее загрязнение. Загрязнители,
используемые подозреваемыми для сокрытия факта злоупотребления какими-
либо веществами, можно разделить на две группы: in vivo и in vitro. Загрязнители,
используемые in vivo, — соединения, предназначенные для создания интерферен¬
ции во время анализа на подозреваемое вещество. Как правило, люди, использую¬
щие этот прием, прекрасно знают физико-химические основы методов, применяе¬
мых в ХТА, их возможности и недостатки. Так, можно отметить подкисление мочи,
которое изменяет введение слабых оснований (фенциклидина, амфетаминов) за
ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ 867счет употребления больших количеств аскорбиновой кислоты (витамина С) или
гаппуровой кислоты* (подкисленных фруктовых соков). Подщелачивание мочи
может быть вызвано употреблением больших количеств питьевой соды, которое
приводит к увеличению элиминации слабых кислот (например, барбитуратов).Использование известных схем лечения (большими дозами) также может
изменить результат теста. Основные метаболиты ацетилсалициловой кислоты
потенциально будут способствовать получению ложноотрицательных резуль¬
татов, поскольку они интерферируют с измерением NADH, лежащего в основе
многочисленных методов ИФА. Интерференция связана с увеличением молярного
поглощения NADH при длине волны 340 нм. Подобной интерференции можно
избежать, если использовать альтернативную длину волны.Загрязнение образца in vitro достигается добавлением посторонних веществ.
Хотя объективно присутствие загрязнителей приводит к ложноотрицательным
результатам, окончательный эффект загрязнителей часто непредсказуем, могут
наблюдаться ложноположительные результаты. Большинство загрязнителей
добавляют с целью повлиять на иммунохимическую реакцию. Загрязнители могут
изменить pH и/или ионную силу образца, повлиять на химическую структуру
обнаруживаемого вещества, ингибировать связывание с антителами, интерфери¬
ровать на этапе измерения. Это могут быть в первую очередь доступные бытовые
химикалии — аммиак, алкоголь, сок лимона, перекись водорода, сода, отбелива¬
тели и т.д.Предотвращение загрязнения проб для анализа на наркотические и психотропные
веществаДля того чтобы предотвратить подмену образца, его разбавление и/или исполь¬
зование загрязнителей, при отборе образца следует выполнить несколько простых
процедур.• Необходимо проверить личность донора (документом с фотографией, пред¬
ставителем администрации или другим специалистом, имеющим право иден¬
тифицировать личность).• Необходимо измерить температуру образца мочи (спустя 4 мин после отбора
температура образца должна быть в интервале 32-38 '"С).• Вода туалетного бачка должна быть подкрашена (например, голубым цве¬
том).• Ограничить доступ обследуемого к воде, мылу, другим моющим, дезодори¬
рующим средствам.• Наблюдать (прямо или косвенно) за донором в момент отбора,• Сохранять образец (маркировка).• Донор должен снять верхнюю одежду, сдать личные вещи, вымыть и высу¬
шить руки перед сдачей анализа мочи, а также расписаться в рабочем журна¬
ле, что его образец не был заменен.В случаях когда есть подозрение на подмену, разбавление или загрязнение
образца, донор обязан сдать повторный анализ под непосредственным наблюдени¬
ем обслуживающего персонала. Оба образца должны быть подвергн}ты исследо¬
ванию в лаборатории. Внимательный внешний осмотр отобранных биологических
образцов может помочь в идентификации загрязнителей. Сильный запах жидкого
мыла, отбеливателей, аммиака, уксуса или духов обычно проявляется в момент
вскрытия контейнера. Ненормальный цвет, осадок — также важная характеристи¬
ка возможного присутствия химических загрязнителей. Кроме того, детергенты
образуют обильную пену при встряхивании. Необходимо знать бактериальный
фон, изменение цвета, pH, запаха и другие обстоятельства. Идентичность потен¬
циально разбавленных образцов необходимо оценивать по содержанию в моче
креатинина, которое определяют на уровне 20 мг/100 мл, и его плотности.
868 ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗПредварительный анализ биологических образцов на наркотические
и психотропные веществаДля анализа наркотических веществ используют предварительные и доказа¬
тельные методы. В качестве предварительных методов используют химические
и биохимические тесты, иммунохимические методы, тех. Все положительные
результаты, полученные посредством одного или нескольких предварительных
методов, должны быть обязательно подтверждены другими доказательными (под¬
тверждающими) методами. Поскольку критерием положительного результата
обнаружения наркотического вещества или его метаболита служит доказательство
присутствия, подтверждающие методы должны обладать более высокими чувстви¬
тельностью, селективностью и специфичностью, чем предварительные.Иммунохроматографический анализ. Тест-системы, основанные на методе
иммунохроматографического анализа, позволяют в течение нескольких минут
определить прием наркотических или психотропных веществ и их метаболитов в
моче человека. Результаты такого скринингового исследования — предваритель¬
ные. Тем не менее на предварительном этапе эта быстрая и простая диагностика,
не требующая дополнительного оборудования, реактивов и специальных навыков,
может быть очень полезна.Принцип метода. Исследуемая моча за счет капиллярных сил мигрирует вдоль
тест-полоски. При наличии в образце искомого наркотического вещества или его
метаболитов в концентрации, превышающей пороговый уровень, исследуемые
соединения вступают в реакцию со специфическими антителами, меченными
частицами коллоидного золота, образуя комплекс «антиген-антитело». Этот
комплекс вступает в реакцию конкурентного связывания с антигеном, иммоби¬
лизованным в тестовой зоне тест-полоски, при этом образования цветной поло¬
сы окрашивания в данной зоне не происходит. Такой результат имеет положи¬
тельное значение. При отсутствии искомого наркотического или психотропного
вещества или в случае, когда его концентрация меньше порогового значения,
несвязанные меченые антитела связываются с иммобилизованным антигеном
в тестовой зоне тест-полоски с образованием цветной полосы. Такой результат
имеет отрицательное значение. Б контрольной зоне тест-полоски цветная поло¬
са образуется всегда и служит контролем, указывающим на правильность про¬
ведения процедуры теста и работоспособность его компонентов. Тест-полоски
не предназначены для определения количественного уровня наркотических и
психотропных веществ.Сбор и подготовка образцов моги. Свежие пробы мочи нужно собирать в чистые
пластиковые или стеклянные контейнеры, не использованные ранее для сбора
мочи и не содержащие консервантов. Пробы можно исследовать немедленно
или хранить в холодильнике (+2-8 ‘’С) сроком до 48 ч. Для более длительного
хранения пробы мочи замораживают при температуре -20 °С или более низкой.
Все компоненты теста и образца мочи перед проведением анализа должны быть
согреты до комнатной температурыИнтерпретация результатов. Выявление двух полос розового цвета любой чет¬
кости и интенсивности окраски в тестовой и контрольной зоне свидетельствует,
что в анализируемом образце мочи соответствующее наркотическое или психо¬
тропное вещество отсутствует или его концентрация ниже порогового значения.Выявление в контрольной зоне одной П(5лосы розового цвета любой четкости и
интенсивности и полное отсутствие второй полосы в тестовой зоне свидетельству¬
ет о наличии в анализируемом образце мочи соответствующего наркотического
или психотропного вещества.Если в течение 5 мин полосы не выявляются или появляется полоса на уровне
тестовой зоны, результат оценивать нельзя, необходимо повторить тестирование
с помощью новой тест-полоски. Пороговые уровни определения наркотических
S-4-'S&ХИМИКО^ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ 869и психотропных веществ с помощью тест-полосок (метода ИХА) приведены в
табл. 14-2.Таблица 14-2. Пороговые уровни определения {cut-off) наркотических и психотропных веществ
иммунохимическими методами, нг/млВеществоМорфин (опиаты, в том числе
кодеин и героин)КаннабиноидыАмфетаминМетамфетамин®Амфетамин/метамфетамин*ЭкстазиМетадон*Кокаин и его метаболитБарбитуратыБензодиазепиныФенциклидинТрициклические антидепрессантыФентанил и его производныеКлофелин* (клонидин)ПФИА2002530025030020020025150ИХА (тест-лолоски)3005010001000 (500)500300300300300251000ИФА10101010100,10.1примечание. ПФИА — поляризационный флюороиммунологический анализ; ИХА — иммунохи-
мический анализ; ИФА — иммуноферментный анализ.Положительный результат исследования, полученный с помощью тест-полосок,
далеко не всегда свидетельствует об употреблении наркотических и психотропных
веществ и не всегда в 100% случаев подтверждается другими специфическими
методами.Ввиду высокой чувствительности иммунохимических методов следует осто¬
рожно подходить к оценке и интерпретации полученных результатов при анализе
образцов с крайне малым содержанием наркотических веществ и возможным
влиянием пищевых добавок и общедоступных распространенных «безобидных»
лекарственных средств. Так, при умеренном (обычном) употреблении кондитер¬
ских изделий с маком иммунохимические методы анализа (особенно ИХА и ИФА)
дают положительный результат на опиаты образца мочи, собранной спустя 1-8 ч
после употребления. При анализе методом ГХ/МС обнаруживают морфин в следо¬
вых количествах, А при однократном приеме валокордина* в дозе 1 мл (содержа¬
щего 20 мг фенобарбитала) возможно срабатывание иммунохимических тестов и
наборов на барбитураты даже через 5-7 сут после употребления. Тест-полоска на
каннабиноиды может дать ложноположительный результат, если в образце мочи
в относительно больших количествах содержится папаверин с дибазолом* (в част¬
ности, лекарственный препарат папазол*).Прием терапевтических доз лекарственных препаратов барбитуратов, бен-
зодиазепинов может дать положительный результат анализа тест-системой, но
это не свидетельствует о немедицинском использовании указанных веществ для
одурманивания. Именно поэтому положительный результат без дополнительного
исследования другими методами имеет только предварительное значение, интер¬
претировать его может только специалист, особенно для дифференцирования
злоупотребления с целью наркотического или одурманивающего эффекта и лекар¬
ственного употребления.Минздравсоцразвития РФ разрешило к применению иммунохроматографи-
ческие экспресс-тесты российского и импортного производства для выявленияIts,г
870 ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗсодержания наркотических и психотропных средств и/или их метаболитов в
моче человека: амфетамина, каннабиноидов (при употреблении марихуаны или
ее продуктов), морфина (опиатов), кокаина, бензодиазепинов, барбитуратов,
фенциклидина, экстази и трициклических антидепрессантов. Используют также
тест-системы для одновременного определения в моче от 2 до 6 видов наркоти¬
ков, Наиболее качественные тесты представлены на российском рынке фирмами-
изготовителями ООО «Прогрессивные биомедицинские технологии«>, ООО
«Инновационные биотехнологии», ООО «Фактор-мед», SureScreen Corporation
(Канада), DRG International (США), Pharmatech (США), Human (Германия), имею¬
щими регистрацию в Минздраве РФ.Разработан новый метод определения скрытых форм наркомании, в основе
которого — ИФА наличия антител к наркотическим веществам в сыворотке крови.
Антитела к ним определяют, даже если испыт>'емый воздерживался от употребле¬
ния наркотиков более недели, поскольку они циркулируют в кровеносном русле
после последнего употребления до 2-3 мес. Разработаны наборы для определения
антител в крови к опиатам, каннабиноидам, амфетаминам.ЧАСТНЫЕ МЕТОДИКИ ОБНАРУЖЕНИЯ
токсичных ВЕЩЕСТВПОДГОТОВКА ПРОБЫ К АНАЛИЗУОбъекты исследования в аналитической токсикологии — кровь (цельная, сыво¬
ротка или плазма) и моча. Для этих биологических объектов характерно содержа¬
ние анализируемых веществ и их метаболитов в низких концентрациях и наличие
большого количества фоновых эндогенных соединений (пептидов, аминокислот,
сахаров, стероидов, пигментов, низкомолекулярных продуктов их метаболизма).
Цель пробоподготовки — максимально возможное удаление фоновых веществ и
концентрирование анализируемых образцов. Способ зависит от природы объекта,
анализируемого вещества и используемого метода анализа. При использовании в
анализе хроматографических методов обычно применяют жидкость-жидкостную
экстракцию (ЖЖЭ), концентрирование, твердофазную экстракцию (ТФЭ), дери-
ватизацию или сочетание этих приемов,ЖЖЭ основана на распределении вещества между двумя несмешиваемыми жид¬
кими фазами, которое зависит от природы исследуемого вещества, состава жидких
фаз, значения pH, внешних факторов (температуры, техники перемешивания и
др.). Общепринято использование постадийной экстракции при кислых и щелоч¬
ных значениях pH хлороформом, эфиром диэтиловым или другими подходящими
растворителями, что приводит к разделению веществ на две большие группы
кислого и нейтрального основного характера. Полученные экстракты упаривают,
растворяют в малом количестве органического растворителя и используют для
анализа методами ТСХ, ГЭХ, ВЭЖХ, ГХ/МС и т.п. Часто для ГЖХ, особенно ГХ/
МС, используют образцы, которые дополнительно очищают хроматографически.Сущность ТФЭ заключается в адсорбции компонентов пробы на твердом носи-
теле с последзтощим фракционным элюированием соответствующими раствори¬
телями или их смесями, в качестве сорбентов в зависимости от природы аналита
можно использовать макропористые сорбенты типа полисорба*, ионообменные
смолы, модифицированные силикагели с привитой фазой. ТФЭ обеспечивает луч¬
шую очистку от фоновых веществ и концетрирование компонентов пробы. Далее
элюаты упаривают и анализируют необходимым методом.Для анализа веществ с низкими температурами кипения, так называемых лету¬
чих токсикантов (в основном органических растворителей), используют ГЖХ в
парогазовой фазе. При этом в герметично закрытую пробу вводят внутренний
ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ 871стандарт, депротеинизирующие агенты (трихлоруксусную, серную кислоты и др.)
и нагревают. На анализ отбирают газовую фазу. В сл>'чае спиртов их предваритель¬
но переводят в летучие эфиры — алкилнитриты, которые находятся в газовой фазе
при нормальной температуре, и анализируют методом ГЖХ.Барбитуратыпроизводные барбитуровой кислоты (более 2500 соединений) находят широкое
применение в медицинской практике как противосудорожные, успокоительные,
снотворные средства, препараты для наркоза. К чисто наркотическим средствам
отнесены только два барбитурата — барбамил и этаминал-натрий. Оба препарата
убраны из фармакопейных каталогов. Тем не менее Всемирная организация здра¬
воохранения рекомендовала взять под контроль эту группу лекарственных средств,
оказывающую влияние на центральную нервную систему, как потенциально опас¬
ную. Кроме того, препараты барбитуровой кислоты часто обнаруживают в био¬
логических объектах наркоманов, использующих так называемые лекарственные
коктейли. Постоянный комитет по контролю наркотиков включил барбитураты в
группу веществ для обязательного обнаружения.Для обнаружения барбитуратов по системе скрининга используют имму-
нохимические методы. Они имеют отрицательное химико-токсикологическое
значение, т.е. при отрицательном результате анализа на содержание барби¬
туратов дальнейшее исследование не проводят. В случаях положительного
результата необходим хроматографический скрининг соединений слабокис¬
лого и нейтрального характера. Скрининг может быть проведен напрямую
методами ГХ/МС, ГЖХ, ВЭЖХ на экстрактах крови, чтобы идентифицировать
специфические барбит}фаты, присутствующие в биологических образцах тела
человека.В рутинном ХТА применяют метод комплексного сочетания ТСХ и
УФ-спектрофотометрии, При ТСХ исследуют экстракт биологической жидко¬
сти, полученный при кислых значениях pH. Кроме общих систем растворителей
используют частные для барбитуратов: «бензол-этилацетат» (2:1), «хлороформ-
изопропанол-аммиак» (5:5:1), Классический реагент для проявления барби¬
туратов — сульфат ртути в серной кислоте и дифенилкарбазон. Образующееся
сине-фиолетовое окрашивание пятен, по ^ совпадающих со стандартами, свиде¬
тельствует о присутствии барбитуратов. Количественное определение произво¬
дных барбитуровой кислоты основано на измерении разности оптической плот¬
ности щелочного раствора барбитурата (в боратном буфере) при двух .значениях
pH среды: pH = 13 и pH = 10 при длине волны 260 нм.ГЖХ-определение производных барбитуровой кислоты проводят на жидких
фазах типа SE-30 или 0V-17. Используют ступенчатый температурный режим
колонки 180 “С; 200 °С - для барбитала, барбамила®. нембутала®; 230 °С — для
фенобарбитала или другие варианты программирования. Температура испари¬
теля — 250 С. Для подготовки пробы в образец вводят серную кислоту в дозе
0,25 моль, такой же объем очищенного хлороформа. Смесь центрифугируют при
8000 об,/мин. На анализ отбирают 1-5 мкл хлороформного извлечения.ГХ/МС проводят на элюатах с ТСХ-пластин по нативным соединениям или
дериватам. Хроматографические условия общие, как для других лекарственных
соединений.Для анализа барбитуратов может бьггь применен метод ВЭЖХ. Используют
колонку с обращенно-фазным сорбентом типа C^g. Подвижная фаза: смесь
«ацетонитрил-дистиллированная вода» (35:65) или «0,05 моль водный двузаме-
щенный фосфат аммония-метанол» (60:40). Детектирование в УФ-свете при 220
или 240 нм. Пробоподготовка к анализу включает осаждение белков 40% раство¬
ром перхлоруксусной кислоты.
872 ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗПроизводные 1,4-бензодиазепинаБензодиазепины — группа транквилизаторов высокой активности с широким
терапевтическим действием и относительно малой токсичностью. Они отнесены
к группе веществ, подлежащих контролю над производством, распространением
и употреблением наркотиков. Относительная доступность делает их частой при¬
чиной злоупотребления и передозировок. Экспресс-анализ бензодиазепинов обе¬
спечивают с помощью иммунохимических методов. Химический анализ бензодиа¬
зепинов проводят по двум направлениям: по нативным веществам и метаболитам
и по продуктам их гидролиза — бензофенонам. Второй вариант оценивает суммар¬
ное количество бензодиазепинов и их метаболитов, так как продукт их кислотного
гидролиза дает один и тот же бензофенон.Доступные иммунохимические анализы демонстрируют положительные резуль¬
таты в анализе мочи для метаболитов, служащих общими для различных бензоди¬
азепинов. Исключение — лоразепам и флунитразепам. ГХ/МС и ГЖХ могут быть
использованы для анализа мочи или крови с целью дифференцировать бензодиа¬
зепины, не обнаруживаемые при иммунохимическом исследовании. Использовать
или нет более трудоемкие хроматографические методы при отрицательном имму¬
нотесте — зависит от потенциальной значимости бензодиазепина.Для тех предложены общие системы и несколько частных, например
«хлороформ-метанол» (9:1), «этилацетат-метанол-аммиак» (85:10:5), метанол.
Обнаружение можно проводить реагентами, дающими различное окрашивание.
Эффективно проводить гидролиз на пластинке и обнаруживать бензодиазепины
по бензофенонам, но 1?/будут, как у нативных веществ.Для обнаружения производных бензодиазепина методом ГЖХ используют
общую систему: фазу типа SE-30 или 0V-17, температуру колонки 230 °С (для
феназепама* и нитразепама — 250 '’С), детектор пламенно-ионизационный или
электронно-захватный. Возможные осложнения в анализе, связанные с термола¬
бильностью бензодиазепинов и их водорастворимых метаболитов, решают за счет
использования реакционной хроматографии.ГХ/МС проводят на элюатах с ТСХ-пластин по нативным соединениям или
дериватам. Хроматографические условия общие, как для других лекарственных
соединений.Возможен ВЭЖХ-анализ производных бензодиазепина по нативным веществам
или продуктам гидролиза. Используют колонку с обращенно-фазным сорбентом
типа C^g. Подвижная фаза: ацетонитрил-0,05 моль водный двузамещенный фос¬
фат аммония (35:65 для нативных и 55:45 для бензофенонов). Для детектирования
используют УФ-детектор.ОпиатыТермин «опиаты» объединяет большую группу растительных продуктов, выде¬
ляемых из опийного мака (опий, маковая соломка, другие части растений). — мор¬
фин, кодеин, а также полусинтетические продукты на основе морфина. В зависи¬
мости от региона произрастания содержание основных алкалоидов колеблется:
морфин — 4-21%, кодеин — 0,7-3%, наркотин очищенный* — 2-6%, тебаин ~
0,2-1%, папаверин — 0,5-1,3%. Экстракт из маковой соломки может содержать
морфин до 5%. Сильным фармакологическим действием обладает морфин, еще
более сильным — героин (продукт ацетилирования морфина).Все опиаты относят к тяжелым наркотическим веществам, вызывающим физи¬
ческое привыкание после 3-5 инъекций. В настоящее время опиаты — один из
основных видов наркотических веществ в России.Попадая в организм, опиаты быстро метаболизируются. Период полужизни
морфина — 2-3 ч, героина — 0,1-0,5 ч. В течение 8 ч выводится 80% введен¬
ной дозы морфина, за 24 ч — до 90%, через 72 ч определяют лишь его следы.
ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ 873Аналогично ведет себя героин. Именно поэтому ХТА на обнаружение опиатов —
практически всегда поиск следовых количеств, требует очень чувствительных
методов, обладающих высокой специфичностью.Анализ на присутствие опиатов включает обнаружение морфина, 6-моноацетил-
морфина, кодеина, гидроморфона. В качестве предварительных методов анализа
используют иммунохимические методы и ТСХ-скрининг,Иммунохимические методы могут детектировать как родоначальное соеди¬
нение, так и его метаболиты. Для дифференциации опиатов обычно используют
метод ГХ/МС, включающий предварительный кислотный или ферментативный
гидролиз и дериватизациго для обеспечения максимальной чувствительности и
специфичности.Конкретные методики обнаружения опиатов указаны в рекомендуемых литера¬
турных ссылках.Каннабиноидык этой группе мягких наркотических средств относят препараты, изготовленные
из различных частей конопли. В зависимости от способа приготовления и кон¬
центрации психоактивных компонентов различают марихуану, гашиш (анашу),
гашишное масло. Из большого числа каннабиноидов (может быть, до 400 компо¬
нентов) выделяют A-9-тетрагидроканнабинол (А-9-ТГК), А-8-ТГК, каннабинол,
каннабидиол, но наивысшей физиологической активностью обладает А-9-ТГК.
Его содержание колеблется от 0,5 до 5% в марихуане, от 2 до 10% в гашише и до
30% в гашишном масле.Основной способ употребления — курение, другие способы встречаются редко,
при курении А-9-ТГК быстро всасывается, накапливаясь в тканях, богатых липи¬
дами, откуда медленно депонируется в кровь, где в течение длительного периода
поддерживается постоянная концентрация как самого А-9-ТГК, так и его важней¬
шего метаболита — Д-9-ТГК-кислоты.Такое поведение каннабиноидов позволяет надежно их определять в моче
с помощью различных иммунохимических методов по основному метаболиту
(A-9-ТГК-кислоте) до 30 дней.Для установления факта курения с помощью ТСХ анализируют спиртовые
смывы с рук, губ и полости рта. В качестве подтверждающих методов используют
более селективные и чувствительные методы — ГХ/МС и ГЖХ.При подготовке пробы мочи к анализу этими методами необходимо проводить
щелочной гидролиз конъюгатов Д-9-ТГК-кислот. Образуемую А-9-ТГК-кислоту
экстрагируют и после упаривания растворителя переводят в метиловый эфир.
ГХ-анализ осуществляют в виде эфира. Характерные масс-фрагменты для метило¬
вого эфира A-9-ТГК-кислоты — m/z 372, 357, 313.При анализе плазмы крови гидролиз не выполняют, в остальном анализ прово¬
дят так же. Определяют как A-9-ТГК-кислоту, так и А-9-ТГК. Характерные масс-
фрагменты для А-9-ТГК — m/z 314, 299, для метил-Д-9-ТГК -- m/z 328, 313.КокаинКокаин — алкалоид, получаемый из сухих листьев растений рода Erythroxylon
или синтетически из экгонина. Гидрохлорид кокаина* — эффективный местный
анестетик. Системно оказывает возбуждающее и стимулирующее действие. Острое
отравление вызывает эйфорию, беспокойство, рвоту, расширение зрачков, тремор,
артериальную гипертензию, гипервентиляцию, судороги, сердечную недостаточ¬
ность. Минимальная летальная доза для взрослых составляет 1-2 г.Кокаин используют путем инъекций или ингаляций, прием внутрь оказывает
более слабое действие за счет гидролиза в ЖКТ. Кокаин в виде сводного основания
(крека) быстро адсорбируется через слизистые при вдыхании или курении.
874 ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗОсновные метаболиты кокаина: бензоилэкгонин, экгонин и его метиловый
эфир — неактивны, норкокаин — активный метаболит, образуется в малых ксли-
чествах и неустойчив, другие метаболиты — метилэкгонин, этилэкгонин, гидро-
ксикокаин. С мочой выводится примерно 1-9% внутривенной дозы в виде кокаи-
на, 35-55% — в виде бензоилэкгонина. Уменьшение pH мочи способствует выве-
дению нативного вещества. Объем распределения кокаина — 1-3 л/кг, клиренс —
10-30 мл/мин на 1 кг, период полувыведения — 0,7-1,5 ч. Кокаин продолжает
активно метаболизировать в отобранной пробе мочи, поэтому в пробу для анализа
добавляют консервант — фторид натрия, и обнаружение метаболитов кокаина
указывает на его употребление.Для скринингового анализа на кокаин (бензоилэкгонин) используют иммунные
методы. Подтверждающие методы — ГХ/МС и ГЖХ.Экстракцию из мочи проводят при pH = 9-10. ГХ-анализ проводят по нативным
веществам или метиловым эфирам. Характерные масс-фрагменты для кокаина и
метилэкгонина — m/z 421 и 300.ФенилалкиламиныК этой группе психоактивных средств относят амфетамин, метафетамин (пер-
витин), эфидрин, эфедрон и другие стимуляторы этой группы, в последние годы
получили распространение метилендиоксипроизводные амфетаминов — МДМА
(метилендиоксиметамфетамин, экстази), МДА (3,4-метилендиоксиамфетамин),
МДЭА (3,4-метиленэдиокси-Ы-эфиламфетамин) и др. Длительность их действия
составляет примерно 4-6 ч. Максимальная концентрация в крови достигается
через 2 ч. За сутки из организма выводится до 90% дозы, что свидетельствует об
их активной биотрансформации.Для предварительного обнаружения фенилалкиламинов используют имму-
нохимические исследования на группу амфетаминов в целом; на амфетамин/
метамфетамин®; отдельно на амфетамин, метамфетамин^, МДМА. Проводят также
ТСХ-скрининг.Выделение из мочи осуществляют бензолом при pH = 11. После обезвоживания
к экстракту добавляют 5% метанольный раствор НСІ, так как вещества данной
группы в виде оснований летучи и/или легко окисляются, затем экстракт упари¬
вают. Остаток растворяют в этаноле. Для целенаправленного ТСХ-исследования
используют системы «метанол-аммиак» (49:1), «бензол-диэтиламин-этанол»
(9:1:1). Значения R/в последней системе: эфедрон - 0,65, эфедрин — 0,41.Для ГЖХ-анализа используют различные методики с дериватизацией и без
нее, в изотермическом режиме или с программированием температур. В качестве
детектора можно использовать ПИД, азотно-фосфорный и масс-детекторы.Одна из предлагаемых методик: колонка стеклянная насадочная силани-
зированная 1 мхЗ мм. Сорбент 10% карбовакс 1500 на инертоне AW-HMDS.
Температура испарителя и детектора — 200 °С, температура колонки - от 130
до 200 °С, 15 °С/мин, конечная температура — 12 мин или изотерма 170 “С для
эфедрона, эфедрина, норэфедрина и 130 °С для амфетамина и метамфетамина®.
Предел обнаружения — от 0,08 мкг/мл для метамфетамина® и до 0,5 мкг/мл для
эфедрина при анализе 10 мл мочи.Анализ фенилалкиламинов методом ГХ/МС осложнен тем, что они плохо раз¬
деляются и имеют сходные масс-спектры. Именно поэтому рекомендуют прово¬
дить дериватизацию и анализировать в виде пентафторпропионатов, трифтораце-
татов и др.ВЭЖХ-анализ предпочтительнее проводить на колонках с обращенной фазой
типа C^g — «Лихросфер», «Партисил», «Силасорб», «Бондапак». В качестве под¬
вижной фазы используют различные смеси растворителей, но обычно сочетание
метанола или ацетонитрил-водно-фосфатного буфера. Детектор — УФ-фотометр
ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ 875для нативных соединений, реже хемилюминесцентный или флюоресцентный для
соответствующих дериватов.ФенотиазиныГруппа лекарственных соединений, производных фенотиазина, используе¬
мых в качестве транквилизаторов, антидепрессантов, антигистаминных средств.
Наиболее известные представители этой группы; хлорпромазин (аминазин*), про-
мазин (пропазин*), левомепромазин (тизерцин*), прохлорперазин (метеразин*),
тиоридазин, хлорпротиксен, трифлуоперазин (трифтазин*) и др.Производные фенотиазина химически очень лабильны и подвергаются в
организме активному метаболизму. Основные метаболические реакции — суль-
фоокисление, N-деметилирование, гидроксилирование, окисление и конъюгация
с глюкуроновой кислотой.Для экспресс-определения фенотиазинов в моче используют реакцию с FNP-
реактивом. который состоит из смеси водных растворов хлорида железа, пер¬
хлорной и азотной кислот (1:9:10). Появляющаяся окраска от розового до сине¬
фиолетового цвета свидетельствует о возможном присутствии фенотиазинов или
их метаболитов. Возможны ложные реакции, например имипрамин (трицикличе-
ский антидепрессант) дает зеленое окрашивание, а тиоридазин (сонапакс*) не дает
окраски.Дальнейшие исследования осуществляют методами ТСХ, ГЖХ, ВЭЖХ, ГХ/МС.
При подготовке пробы мочи и крови к анализу проводят гидролиз, затем извле¬
чение смесью «гептан-изопентанол 3% раствор». Для ТСХ используют системы:
«бензол-диоксан-аммиака 25% раствор» (60:35:5) и «этилацетат-ацетон-аммиак
25% раствор в этаноле» (50:45:4) или общие системы для основных веществ:
«толуол-ацетон-этанол-аммиак 25% раствор» (45:45:7,5:2,5) и «диоксан-
хлороформ-ацетон-аммиак 25% раствор» (47,5:45:5:2,5). Детектирование про¬
водят опрыскиванием пластин этанольным раствором концентрированной серной
кислоты или реактивом Марки. Все фенотиазины дают красное или темно-красное
окрашивание, кроме левомепромазина, имеющего голубой цвет. Количественное
определение предлагают делать фотометрически по интенсивности окраски про¬
изводного фенотиазина с метилоранжем.Для ГЖХ-анализа используют тот же экстракт и следующие условия: непод¬
вижную жидкую фазу типа SE-30 или 0V-17, температуру колонки изотерма
230 “С или программирование от 130 до 290 °С, 20 “С/мин, испарителя - 250 °С.
Детектор ДИП — азотно-фосфорный или термоионный.Возможность обнаружения токсикантов психогенного характера указана в
табл. 14-3.Таблица 14-3. Время возможного определения наркотических и психотропных веществ и некото¬
рых их метаболитовВеществоВремя возможного выявленияПсихостимуляторы:амфетамин2-3 сутМДМА (экстази)2-3 сутметамфетамин®2 суткокаин6-8 чметаболит кокаина/бензоилэкгонин2 сутБар6ит7раты;кратковременного действия (циклобарбитал®)24 чсреднего времени действия (пентобарбитап®)2-3 сугдлительного действия (фенобарбитал)7 сут
876 ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗОкончание табл. 14-3ВеществоВремя возможного выявленияПроизводные бензодиазепина:кратковременного действия (триазолам®)24 чсреднего времени действия (темазепам®, хлордиазепоксид)2-3 сутдлительного действия {диазелам, нитразепам)7 сутОпиаты:метадон® (дозы для поддерживающего лечения)7-9 суткодеин/морфин24 чморфина глюкуронид2 суткодеина глюкуронид3 сутлролоксифен/норпролоксифен6-^8 4дигидрокодеин24 чбулренорфин2-3 сугсоединения бупренорфина7 сутКаннабиноиды (марихуана):однократное употребление3 сутупотребление со средней частотой4 сутчастое употребление (ежедневное)10 сутдлительное частое употребление36 сутдругиеМетаквалон®7 сутФенциклидин (РСР)8 сутДиэтиламид лизергиновой кислоты (ЛСД)24 чСпирты, их суррогаты, промышленные хлорорганические продукты,
технические жидкостиОсновной, наиболее специфичный, широко используемый метод определения
растворителей и технических жидкостей в различных биологических объектах —
газовая хроматография, позволяющая сочетать идентификацию и количественную
оценку. Газохроматографические методы обладают ценными преимуществами,
особенно для целей клинической токсикологии: точностью, быстротой, простотой
выполнения и универсальностью, в одной и той же пробе малого объема опреде¬
ляют сразу несколько соединений.Официальный метод для анализа промышленных хлорорганических соедине¬
ний и других летучих растворителей — парогазовый анализ.Для анализа этанола (см. ниже) и других алифатических спиртов используют
пробоподготовку, сочетающую дериватизацию с переведением в летучие соеди¬
нения: для спиртов — в а л кил нитриты, для этиленгликоля — в фенилборонатный
эфир. Для извлечения нелетучих соединений класса гликолей применяют специ¬
альные методики.в ряде работ используют прямой ввод депротеинизированных биологических
проб в хроматографическую колонку. В условиях работы лабораторий клини¬
ческой токсикологии этот подход наиболее интересен, так как обеспечивает
быстроту анализа. Негативная сторона прямого ввода — снижение чувствитель¬
ности метода анализа, образование осадков сопутствующих веществ мочи и
плазмы крови на колонках и устройствах ввода, спекание биологической пробы
в игле при шприцевом вводе. Для того чтобы устранить эти недостатки, приме¬
няют предколонки с адсорбентами или инжекторы с программированием темпе¬
ратуры ввода.
ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ 877Большинство методик определения летучих растворителей и гликолей предпо¬
лагает детектирование по ионизации плазмы (ДИП), При анализе спиртов С^-С^
в виде алкилнитритов используют детектор по теплопроводности — катарометр.Для обнаружения следовых доз хлорсодержащих соединений применяют ДЭЗ,
селективный к хлору. Малые размеры молекулы четыреххлористого углерода
обусловливают недостаточную чувствительность к нему ДИП. Поскольку отрав¬
ления этим соединением происходят в основном ингаляционным путем и уровень Щ
концентраций в биологических жидкостях низок, необходимо использование ДЭЗ,
селективного к хлору.Определение этанола в организме человекаЭтанол и вода смешиваются между собой в любых пропорциях, поэтому после
употребления спиртных напитков все жидкости органов и тканей будут содержать
этанол пропорционально массе воды в них. Количество воды у взрослого мужчины
составляет в среднем 60% его массы, у женщин — 50%.Скорость нарастания концентрации алкоголя в крови непостоянна и зависит от
многих условий; количества и крепости принятых напитков, количества и состава
принятой до и после употребления алкоголя пищи, уровня всасываемости, мотор¬
ной деятельности ЖКТ, возраста человека, количества жировой ткани. При неза¬
полненном желудке концентрация алкоголя в крови нарастает быстро и достигает
максимума через 30-80 мин; если алкоголизации предшествовал прием пищи,
всасывание протекает медленнее — максимум алкоголя в крови наблюдают через
90-180 мин.Естественно, наиболее прямой и определенный способ доказательства приема
алкоголя — выявление содержания алкоголя в образце крови, вьщыхаемом воз¬
духе, моче и слюне.Длительность нахождения алкоголя в организме человека обусловлена в пер¬
вую очередь количеством выпитого и может быть определена с учетом окисления7-10 г/ч.в наркологической практике при медицинском освидетельствовании принято
определять алкоголь или его концентрацию в выдыхаемом воздухе, слюне, моче и
крови, но это не позволяет окончательно судить о степени опьянения из-за неоди¬
наковой реакции различных индивидов и непостоянной реакции одного человека
на одни и те же дозы алкоголя, а также фазы алкогольной интоксикации. Однако
определение в биологических средах организма содержания алкоголя, превы¬
шающего эндогенный уровень, свидетельствует о факте употребления спиртных
напитков. Установление факта употребления само по себе может быть первосте¬
пенной задачей при обследовании отдельной категории пациентов с профессией,
требующей повышенного внимания.Запах алкоголя — возможно, самый давний и наиболее очевидный признак его
употребления, поэтому считают, что лучший способ его выявления — измерение
содержания (концентрации) алкоголя в выдыхаемом воздухе. Однако положи¬
тельная проверка на алкоголь должна быть подтверждена повторным анализом
через 20 мин, чтобы отличить присутствие алкоголя в ротовой полости от алкого¬
ля, принятого ранее, и соответственно не может быть свидетельством алкогольно¬
го опьянения.при отборе пробы крови обследуемый должен быть проинформирован о необ¬
ходимости данной процедуры, после чего следует получить его письменное согла¬
сие. Все операции по отбору крови осуществляет только обученный персонал.При поступлении в лабораторию все доставленные образцы тщательно осма¬
тривают и при необходимости в журнале приема делают замечания. Должны быть
зарегистрированы любые нарушения упаковки образца, поломка, утечка крови,
дата и время поступления. Информация о пробирках должна быть сравнима с дру-
878 ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗгой документацией, сопровождающей пробу. Присвоение специального или штри¬
хового кода позволит контролировать прохождение образца через лабораторию.При анализе с использованием различных хроматографических систем необ¬
ходимо отметить любые неопознанные пики, поскольку они могут указывать на
присутствие других летучих веществ в образце крови.Качественную гарантию достоверности результатов обеспечивает следующий
прием. Известно, что точность анализа будет уменьшаться с увеличением кон¬
центрации этанола, поэтому чем выше концентрация, тем более явные различия
в результатах.В последние годы широко стали использовать индикаторные полоски для визу¬
ального качественного и полуколичественного экспресс-определения алкоголя в
слабоокрашенных биологических жидкостях - слюне, моче, сыворотке и плазме
крови. Принцип действия основан на строго специфическом ферментативном
окислении этанола (фермента алкогольоксидазы), сопровождающемся образо¬
ванием пероксида водорода, который вызывает стехиометрическое образование
окрашенного хромогена синего или зеленого цвета. Интенсивность окрасюі про¬
порциональна количеству этанола в пробе.Диапазон определяемых концентраций алкоголя в биологических жидкостях
составляет 0-1 или 0-2 %о. Шкала на этикетке содержит цветовые поля, соот¬
ветствующие концентрациям алкоголя: 0-0,1-0,3-1,0 или 0-0,15-0,3-1,0-2,0%о.
Минимально определяемая концентрация в биологических жидкостях составляет
0,1-0,15%о.Определение алкоголя проводят следующим образом: реагентную зону инди¬
катора смачивают избытком исследуемой жидкости, через 10 с избыток жидкости
удаляют резким движением руки (или фильтровальной бумагой), через 3 мин
(не более 5 мин) с момента нанесения пробы определяют содержание алкоголя
с помощью цветовой шкалы. Данный метода анализа — предварительный (скри¬
нинговый), для окончательного результата необходимо проводить подтверждаю¬
щий анализ.Среди известных хроматографических методик для определения алкоголя в
биологических жидкостях к настоящему времени Министерство здравоохранения
РФ рекомендует к использованию две модификации алкилнитритного метода
(методическое письмо от 22.04.68 № 10-95/14-32 с дополнениями от 12.08.71,
методические указания «О повышении качества исследований при количествен¬
ном определении этилового спирта в крови и моче», 1976),Алкилнитритный метод заключается в превращении спиртов в алкилнитриты
(более летучие, чем спирты) и дальнейшем их хроматографировании. Разделенные
на хроматографической колонке компоненты смеси последовательно поступают в
детектор по теплопроводности — катарометр, сигналы которого регистрируют в
виде хроматографических пиков на хроматограмме. Идентификацию вещества
проводят по времени его удерживания, которое исчисляют от момента введения
анализата в колонку до появления максимума пика. Чувствительность для эти¬
лового спирта составляет 0,01 %о. Расчет концентрации этанола проводят после
калибровки по методу вн>треннего стандарта. Внутренним стандартом служит
пропиловый (или изопропиловый) спирт. Для работы могут быть использованы
отечественные хроматографы МХК, ЛХМ, модель 3700, «Кристалл», «Цвет» и др.,
укомплектованные детектором по теплопроводности.Отбор проб и их подготовка к анализу. Из жидких биологических сред при
освидетельствовании для установления факта употребления алкоголя и алкоголь¬
ного опьянения наиболее часто исследуют мочу и слюну. Кровь можно забирать
только при соответствующих медицинских показаниях.Содержание эндогенного алкоголя в крови, согласно опубликованным дан¬
ным, — в пределах 0,008-0,4%о. Результаты определения эндогенного алкоголя
ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ 879зависят прежде всего от используемого метода. При применении неизбирательных
способов, обладающих большой погрешностью измерения (способов Видмарка,
Никлу, фотоколориметрического метода), максимальными уровнями эндогенного
алкоголя в биологических жидкостях принято считать 0,3-0,4%о. При газох¬
роматографическом исследовании эндогенного алкоголя определяют не более
0,02-0,07%о.Результаты исследования во многом зависят от точности соблюдения методики
пробоотбора биологических жидкостей, условий хранения пробы и транспортиров¬
ки, погрешности метода, ошибок при проведении исследований. С учетом изложен¬
ного, обнаружение алкоголя в биологической жидкости в концентрации менее 0,3%о
не может достоверно свидетельствовать о факте употребления алкоголя.Забор биологических сред у освидетельствуемых для установления состояния
алкогольного опьянения должны проводить в любое время суток. Отбор пробы
необходимо проводить в условиях, исключающих подмену или замену ее другими
жидкостями.Маркированные образцы должны быть опечатаны таким образом, чтобы
предотвратить неправомочную обработку (или фальсификацию). Для анализа
должны быть отобраны два одинаковых образца, один из которых маркируют
(контрольный образец), хранят в течение 2 мес и анализируют в случае необходи¬
мости повторного контрольного исследования.Мочу отбирают в стерильный сухой пенициллиновый флакон, который тотчас
же закрывают пробкой.Слюну собирают в стерильный сухой пенициллиновый флакон в количестве3-5 мл и тут же закрывают пробкой.Кровь отбирают из вены с помощью специальных вакуумных пробирок в коли¬
честве 3-5 мл. Для этих целей используют вакуумные пробирки с добавлением
антикоагулянтов - гепарина натрия, цитрата натрия, ЭДТА. Место пункции долж¬
но быть обработано водным раствором фурацилина или этакридина (риванола*), а
не органическим растворителем типа эфира, изопропанола или этанола. Понятно,
что образцы крови не должны быть взяты из вены, находящейся в данный момент
под капельницей.Пробы биологических сред следует хранить в холодильнике при температуре от
О до +4 X. В случае длительного хранения образца крови необходимо добавление
консерванта — фторида натрия.У всех пенициллиновых флаконов с отобранными пробами фиксируют пробки
алюминиевыми колпачками с помощью приспособления ПОК-1, обеспечиваю¬
щего герметизацию флакона. В случае герметизации другим способом флаконы
должны быть опечатаны. На каждый флакон наклеивают этикетку с указанием
номера пробы (по регистрационной книге), даты, времени забора пробы, фамилий
освидетельствуемого и медицинского работника, подготовившего пробу.Б лабораторию пробы мочи, крови и слюны передают вместе с направлением.
Биологические среды, как правило, должны быть исследованы не позднее суток с
момента их отбора. Допускают их хранение до исследования в холодильнике при
температуре от О до +4 “С в течение 5 сут. При длительном хранении биологи¬
ческих сред без добавления консерванта, с нарушением температурного режима
хранения в них развиваются бродильные и гнилостные процессы, которые могут
существенно исказить результаты количественного определения.Наиболее надежно установить факт употребления алкоголя и состояние опьяне¬
ния, количественное определение алкоголя в биологических жидкостях методом
ГХ. Этот метод обладает высокими специфичностью и точностью.Приказом М3 РФ от 14.07.2003 № 308 установлен порог с концентрацией 0,5%о
при анализе крови на алкоголь, выше которого выносят заключение об алкоголь¬
ном опьянении.
880ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗгаАппаратура. Газовый хроматограф с детектором по теплопроводности. Газ-
носитель — гелий или азот, скорость потока — 24 мл/мин. Колонка металлическая,
диаметром 3 мм и длиной 2 м, температура колонки — 60 °С. Неподвижная фаза —
полиэтиленгликоль-1500, твердый носитель — инзинский кирпич или целит С-22,
фракция — 60-80 меш, модифицированный металлическим серебром, соотно¬
шение фаз - 1:10. В приборах с раздельными термостатами детектора и колонок
температура термостата — 60-70 “С, детектора — 100 °С.Для анализа используют кровь, сыворотку крови, мочу и слюну.Количественный анализ проводят с помощью калибровки по методу внутрен¬
него стандарта, используя для расчета отношение высот пика этанола к пику про-
панола. График зависимости от концентрации этанола строят по четырем точкам,
используя точные растворы этилового спирта в воде.Для построения графика используют эталонные растворы этанола в концентра¬
ции 0,4-1,0-2,0-4,0%о, которые подвергаются газохроматографическому иссле¬
дованию в тех же условиях, что и исследуемые пробы. На графике на оси абсцисс
откладывают значения соотношения высот пиков этилнитрита к пропилнитриту,
во избежание дробных чисел среднее значение соотношения высот пиков для
каждой концентрации этанола умножают на 100. Масштаб: 1 см = 0,1%о. На оси
ординат — соответствуюш;ие им значения концентрации эталонных растворов.
Масштаб: 1 см = 0,4%о,Пробу биологической среды подготавливают к вводу в прибор следующим
образом: в пенициллиновый флакон, содержащий 0,5 мл трихлоруксусной кисло¬
ты, вносят 0,5 мл раствора пропанола (внутренний стандарт) и 0,5 мл исследуемой
пробы; флакон закрывают резиновой пробкой, которую фиксируют. Содержимое
флакона перемешивают и во флакон шприцем вводят 0,25 мл раствора нитрита
натрия. Флакон энергично встряхивают (30 маятникообразных движений) и
оставляют на 1 мин. Затем из флакона шприцем путем прокола пробки отбирают
0,3 мл парогазовой фазы, которую сразу вводят в прибор. Для получения досто¬
верных результатов проводят три параллельных исследования. На хроматограмме
измеряют высоту пиков.Для расчета концентрации этилового спирта удобнее использовать величину
фактора чувствительности (fr), который рассчитывают по формуле:fr = (hC„^i = lh,)/h,где h — число текущих измерений.Величина fr постоянна для данной пары веществ на каждой колонке и зависит
от летучести определяемых соединений в условиях опыта.Концентрацию этилового спирта (С^^^) соответственно определяют по формуле:Cr/. = frx(h/hJ.Для вычисления концентрации этанола необходимо найденную концентрацию
умножить на коэффициент пересчета (для крови — 0,95, для мочи — 1,06).В последние годы для количественного определения этанола в биологических
жидкостях стали использовать аппаратно-программные комплексы на базе газо¬
вых хроматографов, состоящие из хроматографа, компьютера и интерфейсного
блока с программным обеспечением. Время проведения одного анализа с автома¬
тической обработкой результата составляет 2-3 мин.В настоящее время также широко используют ГЖХ в паровой фазе (ГЖХ-ПФ).
Этот вариант требует, чтобы образец крови, водные стандарты с добавленным (1:5
и 1:10) внутренним стандартом (ВС) выдерживались для установления равно¬
весной паровой фазы в герметически закрытом сосуде при 50 или 60 ‘’С в течение
15-20 мин. Газовым шприцем отбирают часть паровой фазы и вводят в хромато¬
граф. Сигнал пика этанола соседствует с пиком ВС (пропанола). Длительное нагре¬
ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ 881вание при 60" с может привести к частичному неферментативному окислению
этанола оксигемоглобином. Предварительное добавление азида натрия может
помочь этого избежать. Для разделения сложных смесей необходимо использо¬
вать капиллярные колонки. Добавление к образцу крови хлорида или карбоната
натрия — полезный прием для доказательства следовых количеств эндогенного
алкоголя.Преимущество ГЖХ-ПФ перед другими методами настолько велико, что он
стал надежнейшим методом обнаружения этанола в химико-токсикологических и
судебно-химических лабораториях.Количественпвгое определение этанола в выдыхаемом воздухе. Небольшие
количества алкоголя при употреблении человеком спиртных напитков выделяют¬
ся вместе с выдыхаемым воздухом, что позволяет быстро и неинвазиБНО контро¬
лировать присутствие алкоголя в организме для клинических и судебных целей.Для экспресс-обнаружения этанола в крови и выдыхаемом воздухе во внелабо-
раторных условиях используют различные переносные устройства — алкометры.В большинстве надежных портативных устройств используется электрохимиче¬
ская ячейка, в которой этанол окисляется до ацетальдегида. Количество электро¬
нов, образуемое в результате этой окислительно-восстановительной реакции,
пропорционально исходной концентрации этанола. Ацетон (наиболее избыточное
эндогенное мешающее соединение, выделяемое с выдыхаемым воздухом) не окис¬
ляется на поверхности электрода, так что этот кетон не дает ложноположительной
реакции. Однако, если присутствуют высокие концентрации метанола или изопро-
панола, они будут окислены в той же самой электрохимической реакции. Это осо¬
бенно важно при интерпретации результатов, потому что изопропанол может быть
образован эндогенно за счет восстановления ацетона, уровень которого в крови
может возрасти у людей, долгое время лишенных пищи (голодание намеренное
или вынужденное, диета), или диабетического кетоацидоза.Другая группа устройств идентифицирует алкоголь и его концентрацию за счет
поглощения в ИК-области (валентные и деформацргонные колебания С-О-Н-
связей). Селективность для идентификации этанола может бьггь повышена за счет
комбинации ИК- и электрохимического детектирования.Необходимо различать результаты, получаемые в начале и конце выдоха. Если
первые значения превышают конечные, это означает присутствие «алкоголя рта»
(прием алкоголя за 15-20 мин до анализа), недавний прием пищи или нарушение
функции ЖКТ (отрыжка, «бурчание» и др.). Интерпретация количественных дан¬
ных по выдыхаемому воздуху зависит от целей анализа.Если пациент находится под влиянием алкоголя в клинике на лечении, кон¬
центрацию алкоголя пересчитывают в предполагаемую концентрацию в веноз¬
ной крови. Для этого используют фактор калибровки, который постоянен для
всех индивидуумов. Считают, что концентрация 0Д%о в крови приравнивается к
0,1 г/моль воздуха, т.е. 2100:1. Иногда используют фактор 2300:1 для улучшения
аналитической точности.Все приборы, используемые в анализе, калиброваны для оценки концентрации
алкоголя в цельной крови, а не в ее плазме или сыворотке. При калибровке прибо¬
ра на анализ в плазме фактор пересчета должен быть равен 2600:1, так как цельная
кровь содержит примерно на 14% алкоголя меньше, чем такой же объем ее плазмы
или сыворотки.На практике, как правило, количественное содержание алкоголя оценивают по
выдыхаемому воздуху. Определение алкоголя в выдыхаемом воздухе — простей¬
шее исследование по исполнению — проводят при профилактических осмотрах и
медицинском освидетельствовании на установление состояния опьянения. При
выборе технических средств в этих случаях необходимо помнить, что применяе¬
мые технические средства должны быть зарегистрированы и разрешены для этой
882 ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ анализцели Министерством здравоохранения и социального развития (МЗСР) РФ. а
специалисты, их использующие, должны иметь соответствующие подготовку и
специализацию, также определяемые МЗСР РФ.В настоящее время приоритет обнаружения алкоголя в парах выдыхаемого воз¬
духа принадлежит приборам, в основе которых — электрохимическая детекция
(фиксация окислительно-восстановительного потенциала реакции окисления
спирта) или измерение валентных колебаний ОН-группы, связанной водородной
связью, или хемосорбции. Такие алкометры компактны, их можно использовать в
передвижных лабораториях. Они обладают широким диапазоном измерения — от
О до 4%о, с относительной погрешностью 3% по международным сертификатам и
10% — по российским, временем измерения до 60 с, временем установления рабо¬
чего режима — не более 30 с. Встроенные компьютеры позволяют удерживать в
памяти до 100 исследований и более.СПИСОК ЛИТЕРАТУРЫЕремин С.К„ Изотов Б.Н., Веселовская Н.Б. Анализ наркотических средств. - М.: Мысль,
1993. - 268 с.Токсикологическая химия. Метаболизм и анализ токсикантов / Под ред.
Н.И. Калетиной. - М.: ГЭОТАР-Медиа, 2008. - 1008 с.Энциклопедия клинических лабораторных тестов / Под ред. Н. Тица. — М.: Лабинформ,
1997.-239 с.Clark E.G.C. Analysis of drugs and poisons. — London: Pbarm Press, 2004. —Vol. 1-2. —
P. 18S4.
Глава 15
Терапевтический лекарственный
мониторингТерапевтический лекарственный мониторинг (ТЛМ) — определе¬
ние концентрации лекарственных средств в биологических жидко¬
стях, которое проводят для выявления передозировки лекарствен¬
ного средства и выработки режима дозирования лекарств.Показания к проведению ТЛМ:• возможность передозировки препарата;• необходимость определения его терапевтической дозы;• отсутствие клинического эффекта от применяемой дозы лекар¬
ственного препарата;• схожесть симптомов болезни с симптомами токсического дей¬
ствия лекарственного препарата;• возможность взаимодействия применяемых лекарств;• возможность изменения фармакокинетики лекарственного
препарата при текущем заболевании.Цели лекарственного мониторинга:• индивидуальный аодбор правильного режима приема и дози¬
ровки лекарственного препарата для каждого пациента;• определение эффективной концентрации препарата;• предупреждение развития токсических эффектов препарата;• изменение дозы препарата в зависимости от состояния паци¬
ента в течение определенных периодов лечения;• определение взаимозависимых факторов, влияющих ка лечение;• контроль содержания лекарственного препарата (в плазме
крови) в течение всего периода лечения.Критерии отбора лекарственных препаратов для ТЛМ:• узкий диапазон терапевтической концентрации препарата;• токсичность лекарственного препарата;• выраженная внутривидовая (этническая) и индивидуальная
вариабельность фармакокинетики лекарства;• отсутствие выраженных токсических эффектов при эмпириче¬
ском подходе;• возможность изменения фармакокинетики препарата (в том
числе путей его выведения из организма) при сопутствующих
заболеваниях;• подозрение на недобросовестный прием препарата пациен¬
том;• возможность взаимодействия лекарственных препаратов при
одновременном применении;
884 ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ• необходимость длительного медикаментозного лечения;• при проведении судебно-медицинской экспертизы;• при распределении лекарственного препарата во многие органы и ткани;• если терапевтический/токсический эффект препарата не может быть уста¬
новлен при физикальном обследовании пациента;• зависимость фармакокинетики препарата от физиологического состояния
пациента:• резкий подъем концентрации препарата в плазме после его поступления в
организм пациента;• нелинейная фармакокинетика препарата.Лекарственные препараты, подлежащие ТЛМ:• противосудорожные;• противоаритмические;• противоастматические;• антидепрессанты и нейролептики;• имуносупрессоры;• противовирусные;• противоопухолевые;• анальгетические (неопиодные анальгетики: НПВС, селективные ингибиторы
циклооксигеназы-2, производные пиразолона, метамизола/анальгина, про¬
изводные параацетаминофенола, препаратов на основе парацетамола);• антибиотики.После приема концентрация препарата в месте действия должна находиться
в равновесии с концентрацией этого препарата в крови. Это означает, что опти¬
мальный терапевтический эффект препарата достигается при его определенной
средней концентрации (или среднем диапазоне концентраций) в крови. На стадии
разработки новых лекарственных препаратов проводят обязательные фармакоки¬
нетические исследования, позволяющие выяснить оптимальный терапевтический
«коридор» для многих лекарств, т.е. концентрацию препарата в крови, при кото¬
рой достигается хороший лечебный эффект, а побочные и токсические эффекты
сведены к минимуму. Подбор такого режима дозировки — основная задача врача
при назначении лекарственного препарата,МЕТОДЫ ИССЛЕДОВАНИЯДля количественного определения концентраций лекарственных средств важно
использовать технологии с высокими чувствительностью и специфичностью в отно¬
шении эндогенных соединений, других лекарств, аккумулированных метаболитов.• Иммунохимические методы; иммунофлюоресценция (ИФ), иммунофермент-
ный анализ (ИФА).• Хроматографические методы: тонкослойная хроматография (ТСХ), газовая
хроматография (ГХ), газовая хроматография/плазменная ионизация (ГХ/
ПИ), газовая хроматография/захват электронов (ГХ/ЗЭ), высокоэффектив¬
ная жидкостная хроматография (ВЭЖХ).• Масс-спектрометрия: газовая хроматография/масс-спектрометрия (ГХ/МС),
жидкостная хроматография/масс-спектрометри я (ЖХ/МС).ФАРМАКОКИНЕТИЧЕСКИЕ ПАРАМЕТРЫПроцессы, происходящие с лекарственными препаратами в организме, могут
быть описаны с помощью ряда фармакокинетических параметров.• Константа скорости элиминации (Kelj характеризуется скоростью исчезно¬
вения препарата из организма путем его биотрансформации и выведения.• Константа скорости абсорбции (Ка) характеризуется скоростью поступления
препарата из места его введения в кровь.
шТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ 885• Константа скорости экскреции (Кех) характеризуется скоростью выведения
препарата из организма.• Период полувыведения — время, необходимое для уменьшения кон¬
центрации препарата в плазме вдвое. Зависит от константы скорости элими¬
нации, которая равна 0,693 (Т^^2=0,693/Ке1).• Период полуабсорбции ~ время, которое необходимо для всасывания
половины дозы препарата из места его введения в кровь. Этот показатель '
пропорционален константе скорости абсорбции (Т ^^,а=0,693/Ка).• Период полураспределения (Т^.^.р) — время, необходимое для достижения
концентрации препарата в крови, равной 50% его равновесной концен¬
трации. Определяется при равновесии между кровью и тканями [период
распределения лекарственного препарата между плазмой крови, хорошо
перфузируемыми органами (сердцем, печенью, почками, легкими) и плохо
перфузируемыми тканями (кожей, жировой, мышечной тканями)].• Кажущаяся начальная концентрация (С^) — концентрация препарата, кото¬
рая была бы достигнута в плазме при внутривенном его введении и мгновен¬
ном распределении по органам и тканям,• Равновесная концентрация (С^ — концентрация препарата, которая устано¬
вится в плазме (сыворотке) крови при поступлении препарата в организм с
постоянной скоростью.• Максимальную (С,^ат) ^ минимальную (С равновесные концентрации
вьщеляют при прерывистом введении (приеме) препарата через одинаковые
промежзтки времени в одинаковых дозах.• Объем распределения препарата (Vd) — условный объем жидкости, в кото¬
ром нужно растворить всю попавшую в организм дозу препарата (D), ’ггобы
получилась концентрация, равная кажущейся начальной концентрации в
сыворотке крови (CJ. Характеризует степень захвата препарата тканями из
плазмы крови. Объем распределения определяется по формуле: Vd=D/CQ.• Общий клиренс препарата (Clt) характеризуется скоростью выведения из
организма лекарственного препарата. Выделяют почечный (С1г) и внепо-
чечный (Cler) клиренс. Эти показатели отражают выведение лекарственного
препарата через почки (с мочой) и другими путями (прежде всего с желчью).
Общий клиренс — сумма почечного и внепочечного клиренса,• РВ — белоксвязывающая молярная доля.• F - биодоступная молярная доля.Для полноценного проведения ТЛМ нужны четко определенные количествен¬
ные фармакокинетические параметры с установленными референтными интер¬
валами. На выбор критерия ТЛМ влияют физико-химические свойства веществ,
входящих в состав готовой лекарственной формы и обусловливающих характер
взаимодействия с биологическим объектом.Эффективность ТЛМ зависит от правильности забора биологического материа¬
ла и времени последнего приема лекарства. Приведенные ниже референтные пре¬
делы соответствуют общепринятым в литературе и согласованы с современными
научными данными. Однако это справочные показатели, так как фармакокинетика
препарата зависит от возраста пациента, состояния его здоровья, течения основно¬
го заболевания, приема других лекарственных средств.АМАНТАДИНАмантадин — противовирусный препарат. У молодых здоровых людей при
приеме препарата в дозе 200 мкг/сут концентрация в плазме составляет около
30 мкг/мл в спокойном состоянии. Объем распределения обратно пропорцио¬
нален дозе препарата. Дозозависимые побочные эффекты: депрессия, отрешен¬
ность, неспособность сконцентрироваться, трудность запоминания информации,
сонливость или, наоборот, бессонница, нервозность, ортостатическая гипотен-
886 ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГзия, диспепсия. При концентрации препарата в сыворотке более 1000 мкг/л
(6,61 мкмоль/л) может развиваться психоз.Метод исследованияКонцентрацию препарата определяют методом ГХ/ПИ.Требования к пробеПри исследований с помощью ГХ/ПИ необходима сыворотка или плазма, в
которую добавлен гепарин.Метод исследованияКонцентрацию препарата определяют методами ГХ/МС, ГХ/ПИ.Требования к пробеДля исследования методами ГХ/МС или ГХ/ПИ биологический материал -
моча. Пробу хранят при температуре -20 '’С.Референтные пределыТерапевтическая концентрация ~ более 30 мкг/л (>1,98 мкмоль/л). Такая кон¬
центрация препарата необходима для профилактики гриппа.АМИНОКАПРОНОВАЯ КИСЛОТААминокапроновая кислота — ингибитор фибринолиза. Использ>тот при лече¬
нии повышенной кровоточивости, вызванной гиперфибринолизом. Концентрация
препарата в сыворотке крови - 200-400 мкг/мл (1,52-3,05 мкмоль/л), корре¬
лирует со временем лизиса тромба стрептокиназой в течение 36-48 ч. Наиболее
значимые побочные эффекты — тромбоэмболические осложнения.Методы исследованияКонцентрацию препарата определяют методами ВЭЖХ, ГЖХ.Требования к пробеКонцентрацию лекарственного препарата определяют в сыворотке или плазме
крови (в плазму добавляют гепарин или ЭДТА). Забор крови проводят на спаде
концентрации.Референтные пределыТерапевтическая концентрация — 100-400 мкг/мл (0,76-3,05 мкмоль/л).
Токсическая концентрация не определена.Фармакокинетические параметры• Т,,-1-2ч.• Vd — 0,4 л/кг.• РВ незначительное.Факторы, влияющие на факрмакокинетику препаратаПрепарат выводится почками. При заболеваниях, поражающих почки, повыша¬
ется период полувыведения препарата и снижается его общий клиренс.АМИОДАРОН (КОРДАРОН*)Препарат относится к ПІ классу антиаритмических лекарственных средств и
является йодированным производным бензофурана. Терапевтический диапазон
недостаточно хорошо определен. Как правило, побочные эффекты возникают не
ранее чем через год от начала лечения амиодароном. К ним относятся повышение
активности аминотрансфераз и щелочной фосфатазы в сыворотке крови, желтуха,
токсическое влияние на легкие.
ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ В87Метод исследованияКонцентрацию препарата определяют методом ВЭЖХ.Требования к пробеКонцентрацию лекарственного препарата определяют в сыворотке или плазме
крови (в плазму добавляют гепарин или ЭДТА). Проба стабильна в течение 6 мес
при температуре -20 ‘’С.Референтные пределыДиапазон терапевтических концентраций — 0,5-2,5 мкг/мл (0,8-3,9 мкмоль/л).
Токсическая концентрация ~ >2,5 мкг/мл (>3,9 мкмоль/л).Фармакокинетические параметры• Пик концентрации в плазме крови достигается в течение 3-7 ч. двух¬
фазный: начальная фаза — 2,5-10 дней, конечная — 26-107 дней. для
N-дезэтиламйодарона — 61 день.• Vd — 66±44 л/кг.• CLj, — 1,9±0,4 мл/мин на кг массы тела.• РВ — 95,7-96,9% (белоксвязывающая молярная доля: РВхО,01=0,957-
0,969).• F — 26-44% (биодоступная молярная доля: FxO,01=0,26-0,44).Факторы, влияющие ка фармакокинетику препаратаВыведение осуществляется печенью. Метаболизируется в печени с образовани¬
ем одного активного метаболита — N-дезэтиламиодарона.ИнтерференцияНекоторые методы ВЭЖХ недостаточно специфичны в отношении амидарона.
В таком случае определяют его главный метаболит — диэтиламиодарон.АМИТРИПТИЛИНАмитриптилин — трициклический антидепрессант, применяемый для купи¬
рования симптомов эндогенной депрессии, у детей и подростков амитриптилин
применяют для лечения энуреза. Наиболее активный метаболит амитриптилина —
нортриптилин — также определяется при исследовании.Методы исследованияКонцентрацию препарата определяют методами ИХА, ВЭЖХ, ГХ.Требования к пробеКонцентрацию лекарственного препарата определяют в сыворотке или плазме
крови (в плазму добавляют гепарин или ЭДТА). Для хранения материала про¬
бирки с гелем применять нельзя, так как препарат связывается с ним. Забор крови
проводят в момент наименьшей концентрации препарата в крови при равновес¬
ном состоянии (через 12 ч после приема последней дозы препарата). Плазму от
форменных элементов крови отделяют как можно быстрее и охлаждают. Проба
стабильна в течение 4 мес при температуре -20 “С.Референтные пределыДиапазон терапевтической концентрации амитриптилина составляет
80-200 нг/мл (289-722 нмоль/л), токсическая концентрация — более 300 нг/мл
(1080 нмоль/л). Диапазон терапевтической концентрации нортриптилина составля¬
ет 50-150 нг/мл (190-570 нмоль/л). При комбинированном тесте терапевтическая
концентрация — 120-250 нг/мл, токсическая концентрация — более 500 нг/мл.
Критический уровень концентрации препарата более 1000 нг/мл.
888 ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГФармакокинетические параметры• Tj 2- 20-40 4.. Vd - 10-36 л/кг.• С1^ — 6,1+1,7 мл/мин на кг массы тела.• РВ- 85-95%.• F- 56-70%.Факторы, влияющие на фармакокинетику препаратаВыведение — печенью. Болезнь — гиперлипопротеинемия: РВ Т. Возраст —
пожилые: t,, Т, Vd Т, РВ Диализ — гемодиализ (-), перитонеальный диа¬
лиз (-).Лекарственные взаимодействияБарбитураты и карбамазепин могут ускорять метаболизм этого препарата.
Фенитоин, фенилбутазон, ацетилсалициловая кислота, оральные контрацептивы,
галоперидол, хлорамфеникол и фенотиазины могут ингибировать метаболизм
препарата. Терапевтические и токсические концентрации включают уровни вто¬
ричных аминированных метаболитов. Амитриптилин метаболизируется в два
активных метаболита (нортриптилин и 10-гидроксинортриптилин). Метаболизм
препарата у пациентов очень вариабелен. Побочные эффекты: сухость во рту, дис¬
комфорт в эпигастрии, запоры, сердцебиение, нечеткость зрения, задержка мочи,
тахикардия, артериальная гипотензия, аритмии. Может возникать эозинофилия,
описаны случаи апластической анемии и тромбоцитопении.АМОБАРБИТАЛАмобарбитал — барбитурат промежуточного действия. Увеличение дозы препа¬
рата приводит к следующим побочным эффектам: гипнотическому, седативному,
к коме, задержке дыхания и смерти. Токсичность препарата увеличивается при
совместном приеме с этанолом.Методы исследованияКонцентрацию препарата определяют методами И ФА, РИА, ГЖХ, ВЭЖХ.Требования к пробеКонцентрацию лекарственного препарата определяют в сыворотке крови.Референтные пределыДиапазон терапевтической концентрации — 1-5 мкг/мл (4-22 мкмоль/л).
Токсическая концентрация — более 10 мкг/мл (>44 мкмоль/л).Фармакокинетические параметры• Т -8-24Ч.• Vd - 0,9-1,4 л/кг.• РВ - 57,4-59,6%.Факторы, влияющие на фармакокинетику препаратаВыведение — печенью (первичное). Диализ — гемодиализ (+), гемоперфузия
(+), перитонеальный диализ (-).Лекарственные взаимодействияАмобарбитал активирует микросома л ьные ферменты печени. Именно поэто¬
му при одновременном с ним применении возможно уменьшение времени дей¬
ствия доксициклина, противосудорожных средств — производных сукцинимида,
антикоагулянтов, карбамазепина, трициклических антидепрессантов. Возможны
усиление метаболизма производных ксантина и снижение снотворного эффекта
ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ 889барбитуратов, увеличение длительности угнетающего действия на ЦНС ингибито¬
рами моноаминооксидазы (МАО) и другими лекарственными средствами.АМФЕТАМИНАмфетамин — синтетический аналог психостимулятора кокаина. Показания к
назначению амфетамина: нарколепсия и дополнительное лечение нарушения вни¬
мания, связанного с гиперактивностью. Хроническое злоупотребление амфетами¬
ном может привести к эмоциональной лабильности, потере аппетита, сонливости,
умственной отсталости. Симптомы острого отравления амфетамином: бледность,
прилив крови к лицу, тахикардия, тахипноэ, тремор, артериальная гипер- или
гипотензия, боль в груди, нарушения ритма и проводимости сердца, судороги,
кома и сердечно-сосудистый коллапс. Минимальная летальная доза для взрослых
(не наркоманов) — 200 мкг. Специфического антидота нет.Для выявления злоупотребления амфетамином проводят скрининг методом
ИХА. Человек злоупотребляет амфетамином, если концентрация препарата в
сыворотке/плазме не менее 1000 нг/мл (7400 нмоль/л). Для подтверждения
проводят ГХ/МС (подтверждающая концентрация — 500 нг/мл). При этой кон¬
центрации амфетамин может быть определен в моче в течение 1-3 дней после
применения.Методы исследованияКонцентрацию препарата определяют методами ИХА, РИА, флюориметрии,
колориметрии, ВЭЖХ (скрининг). Подтверждающий метод — ГХ/МС.Требования к пробеИсследуемые материалы — сыворотка и плазма. В плазму добавляют ЭДТА.
Для определения концентрации препарата методом ГХ/МС исследуемый мате¬
риал — моча.Референтные пределыДиапазон терапевтической концентрации препарата в плазме/сыворотке —
20-30 нг/мл (148-222 мкмоль/л). Токсическая концентрация — 0,2 мкг/мл
(1,48 мкмоль/л).Токсическая концентрация при исследовании мочи — 25-250 мкг/мл (180-
1850 мкмоль/л).Фармакокинетические параметрыАмфетамин и метамфетамин определяются в моче на 2-4-й день после приема
препарата.• Tj - 5-10 ч (pH мочи менее 7,0).• Tj 2 — 10-20 ч (моча с неопределенным pH).• Vdf — 3-4 л/кг.• РВ-15-40%.Факторы, влияющие на фармакокинетику препаратаВыведение — печенью (первичное), почками (вторичное).Лекарственные взаимодействияОкисление мочи увеличивает экскрецию препарата, ощелачивание — умень¬
шает.ИнтерференцияНатрия хлорид дает ложноположительный результат при ИФА. Слабительные
препараты и диетические добавки, содержащие эфедрин и фенилпропаноламин,
могут давать положительные результаты при ИФА и РИА. Бензфетамин^, фенфлу-
890 ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГрамин®, мефентермин^^, фенметразин<^, фентермин® также могут давать ложнопо¬
ложительные результаты при ИФА.АЦИКЛОВИРАцикловир — селективный противовирусный препарат (высокая эффективность
против вируса герпеса). Применяют наружно, внутрь и внутривенно. Системная
Щ абсорбция через кожу ограничена. Биодоступность ацикловира уменьшается при
Щ увеличении дозы препарата. Средняя пиковая концентрация ацикловира после
многократного внутривенного введения в дозах 2,5-5,0; 10; 15 мкг/мл (11,1; 22,2;
44,4; 66,6 мкмоль/кг) каждые 8 ч составляет 5,2; 9,9; 20,7; 23,6 мкг/кг (23; 44; 92;
105 мкмоль/кг) соответственно.Методы исследованияКонцентрацию препарата определяют методами ВЭЖХ, РИА, МА.Требования к пробеИсследуемый материал — сыворотка или плазма крови. Проба стабильна 7 дней
при температуре -12 °С.Референтные пределыТерапевтическая и токсическая концентрации препарата не определены.Фармакокинетические параметры. Т^.,-2-Зч.• Vd-0,50-0,88 л/кг.• С1^ — 4,09-5,23 мл/мин на кг массы тела.• РВ-9-22%.• F - 15-30%.При приеме ацикловира внутрь всасывается примерно 22%. После приема
200 мг ацикловира максимальная сывороточная концентрация составляет 0,3-
0,9 мкг/мл.Факторы, влияющие на фармакокинетику препаратаПервичная экскреция осуществляется почками. При заболеваниях, поражаю¬
щих почки, увеличиваются период полувыведения и объем распределения пре¬
парата, снижается общий клиренс. У новорожденных увеличивается период
полувыведения препарата, снижаются объем распределения и общий клиренс.
Диализ — гемодиализ (+).Побочные эффектыПри парентеральном введении возможны флебит, воспаление или болезнен¬
ность в месте инъекции, транзиторное повышение содержания мочевины и креа-
тинина в сыворотке, острая почечная недостаточность. При приеме внутрь часто
наблюдаются головная боль и желудочно-кишечные расстройства.ВАЛЬПРОЕВАЯ КИСЛОТАВальпроевая кислота широко применяется в лечении судорожных расстройств,
В исследованиях показано, что у пациентов с эпилепсией увеличены период
полувыведения, объем распределения и общий клиренс препарата по сравнению
со здоровой контрольной группой. Побочные эффекты возникают редко и вклю¬
чают анорексию, тошноту, рвоту, депрессию, лейкопению, тромбоцитопению,
поражение печени. Связывание препарата с белком зависит от его концентрации
в сыворотке (чем выше концентрация, тем меньше вальпроевая кислота связы¬
вается с белками). Концентрацию свободного лекарства можно мониторировать,
применяя ультрафильтрацию для отделения свободного лекарства от связанного.
ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ 891Вальпроевая кислота обладает выраженным тератогенным эффектом (частота
дефектов развития нервной трубки при приеме данного препарата увеличивается
в 10 раз). Именно поэтому назначать вальпроевую кислоту во время беременности
можно только при выраженных судорожных расстройствах. Плод в период орга¬
ногенеза необходимо обследовать на наличие дефектов нервной трубки.Методы исследованияКонцентрацию препарата определяют методами ГЖХ, ГХ/МС, ИФА.Требования к пробеИсследуемый материал - сыворотка или плазма. Забор крови проводят на спаде
концентрации препарата. Проба стабильна при комнатной температуре несколько
часов, при температуре -20Х она стабильна в течение года.Референтные пределыДиапазон терапевтической сывороточной концентрации — 50-100 мкг/мл
(346-693 мкмоль/л). Диапазон терапевтической сывороточной концентрации
свободной вальпроевой кислоты — 2,5-11 мкг/мл (17-76 мкмоль/л).Токсическая концентрация — более 100 мкг/мл (>693 мкмоль/л).Фармакокинетические параметры• у новорожденных — 40 ч, у детей — 8-11 ч. у взрослых — 8-15 ч.• Vd — ОД “0,4 л/кг.• С1^ — 0,12 мл/мин на кг массы тела.• РВ-90%.. F-100%.Факторы, влияющие на фармакокинетику препаратаПервичная экскреция осуществляется печенью, при заболеваниях, сопровождае¬
мых снижением функций печени, наблюдаются увеличение и Vd; снижение
РВ до 70%. При почечной недостаточности РВ снижается до 80%. При ожогах, гипо-
альбуминемии, беременности происходит снижение РВ. У новорожденных повышены
Т и Vd, снижен РВ. У детей снижен Т, и повышены Vd, С1^ У пожилых людей ->,
vd. РВ снижен. Диализ — гемодиализ (-), перитонеальный (-).Лекарственные взаимодействияИндукторы микросомальных ферментов (фенобарбитал, фенитоин) повышают
метаболизм вальпроевой кислоты и уменьшают время ее действия.ВАРФАРИНВарфарин — антикоагулянт. Применяют в виде рацемической смеси, где
S-энантиомер более активен, чем R-энантиомер. Эффективность препарата л)^ше
определять по активности протромбина плазмы, чем по концентрации лекарства в
сыворотке. Связывание с белками плазмы является главным фактором выведения
варфарина из организма и важной причиной индивидуальных вариаций клиренса
препарата. Повышение свободной фракции варфарина в плазме ведет к повыше¬
нию клиренса препарата.Факторы, способствующие усугублению гипопротромбинемии: неадекватная
диета; заболевания тонкой кишки; болезни, связанные с дефицитом витамина К;
болезни печени; хронический алкоголизм; лихорадка, гипертиреоидизм и старе¬
ние.Факторы, которые приводят к снижению эффективности варфарина: беремен¬
ность, гипотиреоз, наследственная резистентность.
892 ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГМетоды исследованияКонцентрацию препарата определяют методами ВЭЖХ, ГЖХ, спектрофотоме-
трией.Требование к пробеИсследуемый материал — сыворотка или плазма.Референтные пределыДиапазон терапевтической концентрации — 1-10 мкг/мл (3,2-32,4 мкмоль/л).
Токсическая концентрация — более 10 мкг/мл (>32,4 мкмоль/л).Фармакокинетические параметры• Т, ..2- 22-52 4.• Vd - 0Д0-0Д2 л/кг.• С1^ — 0,0021-0,0069 мл/мин на кг массы тела., рв-99о/„^• F-77,6-100%.. -2 ч.Факторы, влияющие на фармакокинетику препаратаПервичная экскреция осуществляется печенью. Болезни — почечная недоста¬
точность: Vd Т, С1^ 4-, РВ і. У пожилых людей ^ , Vd С1^Лекарственные взаимодействияАцетилсалициловая кислота, фенилбутазон, хлоралгидрат, фенитоин выводят
варфарин из связи с альбумином. При употреблении барбитуратов, этхлорвино-
ла^, глютетимида^, карбамазепина, гризеофульвина, рифампина® и фенитоина
повышается С1^ за счет печеночных микросомальных ферментов.Хлорамфеникол, дисульфирам, метронидазол, аллопуринол, изониазид и
фенилбутазон ингибируют печеночные микросомальные ферменты. Абсорбция
варфарина снижается при одновременном приеме с холестирамином®. Дисульфирам
может потенцировать эффекты варфарина.Побочные эффектыКровоизлияния, анорексия, тошнота, рвота и различные кожные высыпания
(пурпура, крапивница), алопеция. Во время лечения варфарином отмечается обра¬
тимое повышение активности печеночных ферментов. Специфическое лечение
тяжелого токсикоза проводят витамином К. Варфарин обладает тератогенным
эффектом, поэтому его не следует применять во время беременности.ГАЛОПЕРИДОЛГалоперидол — антипсихотический препарат. Частые побочные эффекты:
седативный эффект, экстрапирамидные расстройства и артериальная гипотензия.
Описаны редкие случаи поражения печени и лейкопении.Методы исследованияКонцентрацию препарата определяют методами ВЭЖХ, ГЖХ, РИА, ЖХ/МС.
Требования к пробеИсследуемые материалы — сыворотка, плазма. Для хранения пробы нельзя исполь¬
зовать пробирки с разделительным гелем. Пробу хранят при температуре -4 '’С.Референтные пределыДиапазон терапевтической концентрации — 5-20 нг/мл (10-40 нмоль/л).
Токсическая концентрация — более 50 нг/мл (>100 нмоль/л).
ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ 893Фармакокинетические параметры• Tj <2 при приеме внутрь — 24 ч, при внутримышечном введении — 21 ч, при
вщггривенном введении — 14 ч.• Vd - 18-30 л/кг.• С1^ — 8-17 мл/мин на кг массы тела.• РВ-90%.• F-60%.При приеме внутрь галоперидол абсорбируется из ЖКТ на 60%. Максимальная
концентрация в плазме при приеме внутрь достигается через 3-6 ч, при внутримы¬
шечном введении — через 10-20 мин, при внутримышечном введении галопери-
дола деканоата* — через 3-9 дней. Для галоперидола характерен эффект «первого
прохождения» через печень. Активных метаболитов нет. Легко проникает через
гистогематические барьеры, включая гематоэнцефалический. Выделяется с груд¬
ным молоком. Галоперидола деканоат выводится в течение 3 нед. Препарат выво¬
дится почками (40%) и с желчью через кишечник (15%).Факторы, влияющие на фармакокинетику препаратаПервичная экскреция осушіествляется печенью. Диализ — гемодиализ (-), пери¬
тонеальный (-).Лекарственные взаимодействияПри одновременном применении галоперидола с лекарственными средствами,
оказывающими угнетающее влияние на ЦНС (или с этанолом), возможно потен¬
цирование этого эффекта, а также угнетение дыхания и развитие артериальной
гипотензии. При одновременном применении с препаратами, вызывающими экс-
трапирамидные расстройства, возможно повышение их частоты и тяжести. При
одновременном применении с лекарственными средствами, обладающими антихо-
линергической активностью, возможно усиление антихолинергических эффектов.
При одновременном применении с противосудорожными средствами возможно
изменение вида и/или частоты эпилептиформных припадков, а также снижение
концентрации галоперидола в плазме крови. При одновременном приеме гало¬
перидола с трициклическими антидепрессантами (в том числе с дезипрамином®)
снижается скорость метаболизма трициклических антидепрессантов, повышается
риск развития судорог.Галоперидол потенцирует действие препаратов, снижающих артериальное дав¬
ление.ДИАЗЕПАМДиазепам — препарат класса бензодиазепинов. Используют для лечения трево¬
ги, эпилептического статуса, острой алкогольной абстиненции. Терапевтические и
токсические концентрации не очень хорошо определены. Диазепам метаболизиру-
ется в активные метаболиты — десметилдиазепам и оксазепам. Злоупотребление
диазепамом определяют при обнаружении этих метаболитов методом ИФА. Для
подтверждения применяют ГХ/МС. Препарат хорошо растворим в липидах и
откладывается в жировой ткани. К побочным эффектам относят сонливость, уста¬
лость, летаргию, мышечную дискоординацию и атаксию, поведенческие расстрой¬
ства, отсутствие аппетита или, наоборот, повышенный аппетит. Описаны случаи
лейкопении и поражения печени. Поражение ЦНС при передозировке диазепама
можно предотвратить приемом антагониста бензодиазепина — флумазенила.
Период полураспада десметилдиазепама (основного метаболита) — 50-100 ч.Методы исследованияКонцентрацию препарата определяют методами ВЭЖХ, ГЖХ, РИА.
894 ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГТребования к пробеИсследуемый материал — сыворотка или плазма. Забор крови проводят при
снижении концентрации препарата.Референтные пределыДиапазон терапевтической концентрации — 100-1000 нг/мл (0,35-
3,51 мкмоль/л). Токсическая концентрация — более 5000 нг/мл (>17,55
мкмоль/л).Фармакокинетические параметры• Т^ ,^-20-90 4.• V(l — 1,2 л/кг.• С1^ — 0,26-0,38 мл/мин на кг массы тела.• РВ-96-99%.Факторы, влияющие на фармакокинетику препаратаПервичная экскреция осуществляется печенью. При заболеваниях, поражаю¬
щих печень, происходит удлинение 59,7-112 ч, Vd — до 1,53-1,95 л/кг
и снижение С1^ до 0,2 мл/мин на кг массы тела, РВ также снижается. При гипо-
альбуминемии снижается РВ, повышаются С1| и Vd. Во время беременности
снижается РВ. У недоношенных новорожденных наблюдаются удлинение до
75 ч и снижение РВ. У детей снижен до 18 ч, повышены Vd до 2,6 л/кг и С1^
до 1,67 мл/мин на кг массы тела. У пожилых: t, Vd Т, РВ Диализ —
гемодиализ (-).Лекарственные взаимодействияЦиметидин®, эстрогены, дисульфирам, эритромицин, изониазид, вальпроевая
кислота значительно замедляют метаболизм диазепама. Карбамазепин и рифам-
пин® могут повышать метаболизм диазепама. Антацидные препараты могут сни¬
жать степень абсорбции диазепама.дигитоксинДигитоксин — сердечный гликозид, используемый в лечении застойной сер¬
дечной недостаточности и для контроля желудочкового ритма у пациентов с
фибрилляцией или трепетанием предсердий. Препарат подвергается значительной
кишечно-печеночной циркуляции. Влияние тяжести болезни на фармакокинетику
дигитоксина описано недостаточно. К побочным эффектам относят отсутствие
аппетита, тошноту, рвоту, дискомфорт и боль в животе, нарушение зрения («пеле¬
ну перед глазами»).Встречаются многочисленные нарушения ритма и проводимости сердца;• АВ-блокада;• желудочковая тахикардия;• синусовая брадикардия;• блокада синусно-предсердного узла;• фибрилляция предсердий.Описаны случаи развития эозинофилии и тромбоцитопении.Методы исследованияКонцентрацию препарата определяют методами РИА, ИФА, ТСХ.Требования к пробеИсследуемые материалы — сыворотка, плазма. Образец должен быть взят в
момент самой низкой концентрации, по крайней мере, через 8-12 ч после получе¬
ния дозы препарата.
ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ 895Референтные пределыДиапазон терапевтической концентрации — 20-35 нг/мл (26-46 нмоль/л).
Токсическая концентрация — более 45 нг/мл (>59 нмоль/л).Фармакокинетические параметры• Т^,2 — 150-250 ч (6-10 дней).• Vd - 0,7 л/кг.• С1^ — 0,04 мл/мин на кг массы тела.• РВ- 90-97%,• F-90-100%.• С достигается в течение 8-14 ч.шахФакторы, влияющие на фармакокинетику препаратаПервичная экскреция осуществляется печенью. При нефротоксическом син¬
дроме повышаются С1^, снижается РВ. При уремии: t,. Vd Cl^-^чі, РВ і,
У детей: Vd Т, СІ^Т, РВ Диализ — гемодиализ (-), перитонеальный (-),Лекарственные взаимодействияМетаболизм дигитоксина ускоряется под воздействием фенилбутазона, фено¬
барбитала, фенитоина, рифампина*®. Концентрация препарата в плазме повыша¬
ется при одновременном применении с амиодароном, хинидином, верапамилом,
дилтиаземом. Холестирамин^'' и холестерол^ снижают кишечно-печеночную цир¬
куляцию дигитоксина (уменьшают период пол^фаспада препарата). Антацидные
препараты, холестирамин^, холестерол^, каолин-пектинметоклопрамид, нео-
мицин, сульфасалазин могут понижать абсорбцию дигитоксина.ДИКЛОФЕНАХДиклофенак — нестероидное противовоспалительное средство. Прием пищи
может снижать скорость, но не степень абсорбции препарата. Возраст не влияет на
распределение лекарства. Побочные эффекты: тошнота, рвота, головокружение,
сонливость, отеки, сыпь, пептические язвы, желудочно-кишечные кровотечения.
Средние пиковые концентрации диклофенака в плазме после приема внутрь 50
или 75 мкг составляют 1,5 мкг/л (4,7 мкмоль/л) и 1,9 мкг/л (6,0 мкмоль/л) соот¬
ветственно.Методы исследованияКонцентрацию препарата определяют методами ВЭЖХ, ГХ.Требование к пробеИсследуемые материалы — сыворотка, плазма, моча.Референтные пределыНет общепризнанных терапевтических границ.Фармакокинетические пераметрыТ,.-1-2ч.• Vd - 0,12 л/кг.• С1^ — 266 мл/мин на кг массы тела,• РВ-99%.• F-60%.Концентрация активного вещества в плазме находится в линейной зависимости
от величины применяемой дозы. Препарат не кумулирует, проникает в синовиаль¬
ную жидкость.
т896 ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГФакторы, влияющие на фармакокинетику препаратаПервичная экскреция осуществляется почками, вторичная — печенью.
Приблизительно 60% дозы препарата выводится в виде метаболитов почками,
менее 1% экскретируется с мочой в неизмененном виде, остальная часть выводит¬
ся в виде метаболитов с желчью. При ревматических болезнях І. Диализ —
гемодиализ (-), перитонеальный (-).ЗИДОВУДИН (АЗИДОТИМИДИН*)Зидовудин — противовирусный препарат с высокой активностью против ретро¬
вирусов, в том числе и вируса иммунодефицита человека. Препарат избирательно
ингибирует репликацию вирусной ДНК за счет конкурентной блокады обратной
транскриптазы. Пиковый уровень препарата в плазме крови отмечается через
30 мин после приема внутрь. Терапевтические границы зидовудина недостаточно
хорошо установлены.Методы исследованияКонцентрацию препарата определяют методами ВЭЖХ, ИФА,Требования к пробеИсследуют сыворотку или плазму крови, в которую добавлены гепарин или
этилендиаминтетрауксусная кислота (ЭДТА). Проба стабильна в течение 1 ч при
комнатной температуре, 24 ч — при температуре +4 “С, 60 дней ~ при -20 *С,
Забор крови проводят во время устойчивой минимальной концентрации препа¬
рата, перед следующим приемом зидовудина. На пробе должна бьггь маркировка:
«Инфекционно опасный материал?>.Референтные пределыПик концентрации — 1,5 мкг/мл в сыворотке крови развивается через 60-90 мин
после приема препарата в дозе 200 мг. Низшая точка концентрации (только перед
следующим приемом препарата) — менее <0,02 мг/мл. Диапазон терапевтической
концентрации — 0,15-0,27 мкг/мл (0,56-1,01 мкмоль/л).Критический уровеньКритический уровень не установлен. Доза 50 г не привела к смертельному
исходу. При концентрации в сыворотке более 1,8 мкг/мл может увеличиться риск
токсического действия препарата.Фармакокинетические параметры• т.-1ч.• Vd — 1,4 л/кг.• РВ - 25%.Препарат метаболизируется в печени и экскрецируется почками в неизменен¬
ном виде и в виде глюкуронидов.Лекарственные взаимодействияОдновременное применение зидовудина с гидрохлортиазидом может повлиять
на результаты исследования.При одновременном применении парацетамола с зидовудином з^величивается
частота возникновения нейтропении, по-видимому, вследствие угнетения метабо¬
лизма зидовудина (оба препарата глюкуронируются в печени). Другие препараты
(ацетилсалициловая кислота, морфин, кодеин, индометацин, оксазепам, цимети-
дин®, клофибрат®) также изменяют метаболизм зидовудина путем ингибирования
активности глюкуронидазы или прямого ингибирования микросомального мета¬
болизма в печени. Одновременное лечение препаратами, обладающими нефро-
ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ 897 Штоксическим действием или подавляющими функцию костного мозга (амфоте-
рицином, ганцикловиром, винкристином, винбластином и др.), увеличивает риск
токсического действия зидовудина.ИМИПРАМИНИмипрамин — антидепрессант. Терапевтическая и токсическая концентрация
включает концентрацию дезипрамина® — активного метаболита имипрамина.Методы исследованияКонцентрацию препарата определяют методами ВЭЖХ, ГХ, ГХ/МС, ИХ А.Требования к пробеИсследуемый материал — сыворотка или плазма крови. Пробу нельзя хранить
в пробирке с разделительным гелем. Забор крови проводят при стабильной мини¬
мальной концентрации препарата (через 12 ч после приема последней его дозы).Плазму от форменных элементов крови необходимо отделить как можно быстрее.Проба стабильна 4 мес при температуре -20 “С.Референтные пределыДиапазон терапевтической концентрации (имипрамин + дезипрамин*) - 100-
300 нг/мл (350-1070 нмоль/л). Токсическая концентрация — более 500 нг/мл
(>1780 нмоль/л). Критическая концентрация — не менее 1000 нг/мл
(>3570 нмоль/л).Фармакокинетические параметры• Т -16-18 4.• Vd-9-23 л/кг.• С1^ — 10-24 мл/мин на кг массы тела.• РВ- 60-95%.• F- 29-79%.Факторы, влияющие на фармакокинетику препаратаЭкскреция препарата осуществляется печенью. При гиперлипопротеинемии
повышается РВ. У пожилых людей снижается Clj,. Диализ — гемодиализ (-), пери¬
тонеальный диализ.Лекарственные взаимодействияБарбитураты и карбамазепин могут ускорять метаболизм этого препарата.
Фенитоин, фенилбутазон, скополамин, фенотиазины могут уменьшать связывание
имипрамина с белком. Флуоксетин, оральные контрацептивы, галоперидол, циме-
тидин, хлорамфеникол, фенотиазины могут ингибировать метаболизм препарата.Побочные эффектыСухость во рту, дискомфорт в эпигастрии, запоры, тахикардия, нечеткость виде¬
ния предметов, задержка мочи, артериальная гипотензия, аритмии. Редкие побоч¬
ные эффекты: желтуха, повышение активности печеночных ферментов. Описаны
случаи агранулоцитоза и тромбоцитопении.ИНДОМЕТАЦИНИндометацин — нестероидное противовоспалительное средство. Зависимость
между дозой препарата и терапевтическим эффектом была показана при опреде¬
лении скорости синтеза простагландинов. Нет значительных различий в средних
стабильных плазменных концентрациях индометацина у тех пациентов, для
которых доза препарата эффективна, и тех, у кого эта доза не дала положи-
898 ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГтельного результата (исследования у пациентов с ревматоидным артритом).
Индометацин почти полностью абсорбируется при приеме внутрь. Он подвер¬
гается кишечно-печеночной рециркуляции, что обусловливает вариабельность
его периода полувыведения. Побочные эффекты: пептические язвы, лейкопения,
агранулоцитоз, тромбоцитопения, тошнота, рвота, головокружение и шум в
Жфх ушах. Побочные эффекты нарастают при повышении плазменной концентрации
индометацина.Методы исследованияКонцентрацию препарата определяют методами ВЭЖХ, ГХ, ГХ/МС, ТСХ, РИА,
ИФА.Требования к пробеИсследуемый материал — сыворотка или плазма крови. Проба стабильна14 дней при температуре -20 “С.Методы исследованияКонцентрацию препарата определяют методами ГХ, ВЭЖХ, ТСХ, РИА.Требование к пробеИсследуемый материал — моча.Референтные пределыДиапазон терапевтической концентрации — 0,5-3,0 мкг/мл (1,4-8,4 мкмоль/л).Фармакокинетические параметры. Т -1-16Ч.• Va — 0,12 л/кг.• С1^ — 70-140 мл/мин на кг массы тела.• РВ — не менее 90%.• Т -1-2ч,maxФакторы, влияющие на фармакокинетику препаратаВыведение препарата осуществляется печенью. У недоношенных новорожден¬
ных повышен период полувыведения. Диализ — гемодиализ (-), перитонеальныйН-Лекарственные взаимодействияАнтацидные препараты, содержащие магний и алюминий, могут снижать ско¬
рость, но не степень абсорбции индометацина. Натрия бикарбонат повышает
скорость абсорбции индометацина. Пробенецид^’ повышает концентрацию индо¬
метацина в плазме крови. При одновременном приеме с индометацином в плазме
может повышаться концентрация дигоксина, метотрексата (препарат снижает
почечную экскрецию). Индометацин может ингибировать диуретический эффект
фуросемида.КАРБАМАЗЕПИНКарбамазепин — противосудорожное средство, оказывает умеренное антима-
ниакальное, антидепрессивное и анальгетическое действие. Карбамазепин повы¬
шает собственный метаболизм за счет индукции ферментов печени. Препарат
метаболизируется в активный метаболит (10,11-эпоксид), который может нака¬
пливаться при почечной недостаточности и вносить свой вклад в терапевтическую
и токсическую концентрацию карбамазепина. Значение этого метаболита опреде¬
лено недостаточно хорошо. Период полувыведения эпоксида составляет примерно
ТЕРАПЕВТИЧЕСКИИ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ 89917 ч. Зависимые от концентрации токсические эффекты: нечеткое видение пред¬
метов, нистагм, нарушение координации движений, головокружение, сонливость
и диплопия. Побочные эффекты, не связанные с концентрацией: уртикарная сыпь,
поражение печени, эозинофилия, угнетение гемопоэза. Карбамазепин обладает
умеренным тератогенным эффектом. Не совсем ясно, развивается он по типу
идиосинкразии или связан с уровнем препарата в сыворотке. Однако необходимо
сохранять минимально низкую концентрацию карбамазепина, дающую хороший
терапевтический эффект.Методы исследованияКонцентрацию препарата определяют методами ВЭЖХ, ГЖХ, ГХ/МС, ИФА.Требования к пробеИсследуемые материалы — сыворотка, плазма. Забор крови проводят в момент
наименьшей концентрации. Необходимо избегать гемолиза. Проба стабильна при
комнатной температуре несколько часов.Референтные пределыДиапазон терапевтической концентрации — 4-12 мкг/мл (17-51 мкмоль/л).
Токсическая концентрация — более 15 мкг/мл (>63 мкмоль/л).Фармакокинетические параметры• яри однократном приеме — 24-26 ч, при многократном приеме —8-20 ч.• Vd у детей — 1,0-1,5 л/кг; у взрослых — 0,79-1,86 л/кг.• С1^ — 0,39 мл/мин на кг массы тела.. РВ- 60-80%.• F — более 70%.Факторы, влияющие на фармакокинетику препаратаВыведение препарата осуществляется печенью. При заболеваниях, поражаю¬
щих печень, повышается ^ снижается CL,. При беременности повышается С1^,
Диализ — гемодиализ (-), перитонеальный (~).Лекарственные взаимодействияКарбамазепин — индуктор микросомальных ферментов: может ускорять
выведение этосуксимида, варфарина и бензодиазепинов. Циметидин, дилтиа-
зем, эритромицин, изониазид, верапамил могут повышать концентрацию кар¬
бамазепина, Фенобарбитал, примидон, фенитоин ускоряют его метаболизм.
Бальпроевая кислота может увеличивать период полувыведения карбамазепина
и понижать РВ.КЕТАМИНКетамин — средство для неингаляционного наркоза. Этот препарат вызывает
потерю чувственного восприятия (диссоциативную анестезию), сходную с таковой
при применении фенциклидина^ (возможно развитие зависимости). В течение15 с после внутривенного введения препарата наблюдается дезориентация, затем
бессознательное состояние, В течение 1-2 ч после пробуждения наблюдаются
аналгезия и амнезия. Часто наблюдаются неприятные сновидения или галлюцина¬
ции. Метаболит — норкетамин, может быть активен. Применение кетамина может
привести к повышению активности АЛТ и ACT. Кетамин потенцирует действие
средств для ингаляционного наркоза. Кетамин несовместим с барбитуратами
вследствие образования преципитата.
900 ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГМетод исследованияКонцентрацию препарата определяют методом ГЖХ.Требование к пробеИсследуемый материал — плазма.Референтные пределыДипазон терапевтической концентрации — 4-12 мкг/мл (17-51 мкмоль/л).
Токсическая концентрация — более 15 мкг/мл (>63 мкмоль/л).Фармакокинетические параметры. Т^,^-2-4ч.• Va — 4 л/кг.• С1^ — 17 мл/мин на кг массы тела.• РВ-20-50%.Фактор, влияющий на фармакокинетику препаратаВыводится почками преимущественно в виде конъюгированных метаболитов.Лекарственные взаимодействияИнгаляция галогенизированных углеводородных анастетиков (например, гало-
тана) может увеличивать период полувыведения кетамина.КЛОНАЗЕПАМКлоназепам — противосудорожный препарат из группы бензодиазепинов.
Проявления токсичности слабо коррелируют с плазменными или сывороточными
концентрациями. Клоназепам хорошо растворим в липидах и поэтому имеет дли¬
тельный ^ большой Vd. Побочные эффекты: сонливость, усталость, летаргия,
потеря мышечной координации, нарушение координации движений, поведенче¬
ские расстройства, отсутствие или, наоборот, повышенный аппетит. Клоназепам
метаболизируется в 7-аминоклоназепам — активный метаболит (не обладает
противосудорожной активностью).Методы исследованияКонцентрацию препарата определяют методами ВЭЖХ, ГЖХ, РИА.Требования к пробеИсследуемые материалы — сыворотка, плазма. Забор крови осуществляют
в момент падения концентрации препарата. Проба стабильна при температу¬
ре -20 “С,Референтные пределыДиапазон терапевтической концентрации — 15-60 нг/мл (48-190 нмоль/л).
Токсическая концентрация — более 80 нг/мл (>254 нмоль/л).Фармакокинетические параметры• Т -20-60 4.• Vd - 1,8-6,2 л/кг.• С1^ — 0,67-1,17 мл/мин на кг массы тела.• РВ-86%.• F-70-98%.Факторы, влияющие на фармакокинетику препаратаПрепарат выводится печенью преимущественно в виде метаболитов. При забо¬
леваниях, поражающих печень, и у детей снижается С1^.
ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ 901Лекарственные взаимодействияФенитоин, фенобарбитал, карбамазепин з^еличивают скорость метаболизма
клоназепама. Циметидин, эстрогены, дисульфирам и эритромицин мог>т ингиби¬
ровать его метаболизм.ИнтерференцияХлордиазепоксид может влиять на исследование методом ГЖХ.клонидинКлонидин ~ противогипертензивный препарат, обладающий как а-адрено-
блокирующей, так и агонистической активностью. Сухость во рту развивает¬
ся при концентрации в сыворотке более 1 нг/мл (4,4 нмоль/л), седативный
эффект — при 1,5 нг/мл (6,6 нмоль/л). Существует линейная взаимосвязь
концентрации препарата в сыворотке с изменением среднего артериального
давления. Побочные эффекты: сухость во рту, седативный эффект, импотенция,
ортостатическая гипотензия, брадикардия, судороги и кома. При внезапной
отмене клонидина иногда развивается резкий подъем артериального давления
(гипертонический криз).Методы исследованияКонцентрацию препарата определяют методами ГХ/МС, ГЖХ, РИА.Требование к пробеИсследуемые материалы ~ сыворотка, плазма.Референтные пределыДиапазон терапевтической концентрации — 1-2 нг/мл (4,4-8,7 нмоль/л).
Токсическая концентрация не определена.Фармакокинетические параметры• 5.2-23.4 4.• Vd - 1,7-2,5 л/кг.• Cl^ — 1,9-4,3 мл/мин на кг массы тела.• РВ-20-40%., F-71-79%,• Т_-2-4ч.Факторы, влияющие на фармакокинетику препаратаПервичное выведение осуществляется почками, вторичное — печенью.
Диализ — гемодиализ (-).ЛИДОКАИНЛидокаин — антиаритмический препарат (эффективен при желудочковых
аритмиях). Лидокаин может быть вьщелен из связанного с белками состояния
с помощью пластификаторов в устройствах для сбора проб. Важные метаболи¬
ты — моноэтилглицинэксилидид (MEGX) и глицинэксилидид (GX). Первый из
них обладает антиаритмическим эффектом. И MEGX, и GX, вероятно, вносят свой
вклад в токсичность препарата. Лидокаин подвергается первичному метаболизму,
выведение его зависит от печеночного кровотока. При удлинении времени приема
лидокаина отмечено увеличение Связывание лидокаина с белками зависит от
его концентрации и pH. Сильно коррелирует с а-ацидгликопротеином — белком,
концентрация которого повышается в ответ на воспаление или стресс. Побочные
эффекты: парестезии, сонливость, возбуждение, нарушение слуха, дезориентация,
мышечные подергивания, конвульсии, артериальная гипотензия, асистолия, арит¬
мии, остановка дыхания.
902 ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГМетоды исследованияКонцентрацию препарата определяют методами ВЭЖХ, ГЖХ, ГХ/МС, РИА.Требования к пробеИсследуемые материалы — сыворотка, плазма. Забор крови проводят не ранее
чем через 30 мин после болюсной дозы. Проба стабильна при нейтральном pH и
температуре '20 '"С в течение года.Референтные пределыДиапазон терапевтической концентрации — 1,5-6,0 мкг/мл (6,4-25,6 мкмоль/л).
Токсическая концентрация — 6-8 мкг/мл (25,6-34,2 мкмоль/л); развиваются
депрессия, нарушения со стороны ЦНС, сердечно-сосудистой системы. Судороги,
снижение минутного объема сердца развиваются при концентрации препарата
более 8 мкг/мл (>34,2 мкмоль/л).Фармакокинетические параметры. 1,5-2,04.• Уй-1,3л/кг.• С1^ — 6,7-11,7 мл/мин на кг массы тела.• РВ-43-59%.• F-35%.Факторы, влияющие на фармакокинетику препаратаВыведение препарата осуществляется печенью. При заболеваниях, поражаю¬
щих печень, наблюдаются удлинение и Vd, снижение Сердечная недоста¬
точность: Vd і, Clp і; инфаркт миокарда: t,, Т, Vd і, РВ Т; шок: Cl,j. U уремия: РВ Т;
сердечно-легочный байпас; Ц Vd X, Cl^ і, РВ Т, Возраст — новорожденные; Т,
Vd Т, Clp I, РВ і; пожилые: Vd Cl,^ Диализ — гемодиализ (-).Лекарственные взаимодействияПрепараты, повышающие активность микросомальных ферментов (фенобарби¬
тал и фенитоин), могут ускорять метаболизм лидокаина. Препараты, снижающие
сердечный выброс или печеночный кровоток (пропранолол, норэпинефрин),
могут снижать клиренс лидокаина. Циметидин может снижать печеночный кли¬
ренс лидокаина.МЕТОТРЕКСАТМетотрексат применяют при онкологических заболеваниях. Терапевтическая
концентрация препарата зависит от схемы лечения. При назначении больших доз
метотрексата обычно применяют также кальция фолинат (лейковорин*). Кальция
фолинат применяют через 24,48 или 72 ч после приема метотрексата (в зависимо¬
сти от его концентрации). Биодоступность метотрексата снижается с увеличением
его дозы. Побочные эффекты: угнетение кроветворения, обратимое поражение
почек, лейкопения, тромбоцитопения, анемия, стоматит, воспаление слизистых
оболочек, тошнота, рвота, диарея, пятнисто-папулезная сыпь, лихорадка, пнев¬
моторакс, холестаз, повышение активности ACT и АЛТ, повышение содержания
креатинина в сыворотке крови.Методы исследованияКонцентрацию препарата определяют методами ИХА, ВЭЖХ.Требования к пробеИсследуемые материалы — сыворотка, плазма, ликвор. Необходимо центри¬
фугировать кровь и отделить форменные элементы сразу после сбора анализа.
Проба стабильна при температуре +4 “С в течение 24 ч; при температуре -20 °С она
ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ 9Q3стабильна 1 мес. Забор крови проводят через 30-60 мин после внутривенного вве¬
дения препарата, через 1-2 ч после приема внутрь. После внутривенного введения
большой дозы метотрексата забор крови проводят через 24. 48 или 72 ч. Пробы
необходимо хранить в темноте.Референтные пределыТерапевтическая концентрация вариабельна. Токсическая концентрация достига¬
ется через 1-2 над приема низких доз препарата. В этом случае токсическая концен¬
трация — более 0,02 мкмоль/л. При приеме больших доз препарата токсическая кон¬
центрация не менее 0,5 мкмоль/л достигается через 24 ч после введения препарата.Фармакокинетические параметры• т -8-15Ч.• Vd — 0,4-0,8 л/кг,• С1^ — 1,5 мл/мин на кг массы тела.• РВ-50-70%.• F-65%• Т - 1-2 ч.maxФакторы, влияющие на фармакокинетику препаратаПервичное выведение почками, вторичное — печенью. При заболеваниях почек
снижен С1^ и удлинен При асците снижен С1^. Диализ — гемодиализ (+), пери¬
тонеальный (-), гемоперфузия (+).Лекарственные взаимодействияр-Аминобензойная кислота^, фенилбутазон, салицилаты могут снижать связы¬
вание препарата с белком. Пробенецид*’ и салицилаты могут уменьшать почечную
экскрецию метотрексата.МОРФИНМорфин — анальгетический препарат наркотического действия. Побочные
эффекты: сонливость, изменения настроения, помрачение сознания, тошнота,
рвота, миоз, угнетение дыхания. Антидот при отравлении морфином — налоксон.
Минимальная летальная доза для взрослых - 200 мкг (700 нмоль/л). У нарко¬
манов возможно развитие толерантности к морфину. Для того чтобы установить
факт злоупотребления морфином, иммунологически определяют отсекающую
концентрацию. Эта концентрация отделяет положительные пробы на опиаты от
отрицательных. Величина отсекающей концентрации — 300 нг/мл (1050 нмоль/л)
эквивалентов морфина (при ГХ/МС). Если концентрация морфина больше отсе¬
кающей концентрации, препарат может быть обнаружен в моче в течение 1-2 дней
после применения.Методы исследованияКонцентрацию препарата в сыворотке, плазме крови определяют методами
ГЖХ, ВЭЖХ, РИА, ИФА, ГХ/МС, флюорометрии.Определение концентрации морфина в моче проводят методом ФПИА.Требования к пробеИсследуемый материал — сыворотка, плазма. Стеклянная посуда должна
быть стерилизована перед применением. Проба стабильна 9 мес при температу¬
ре -20 "С.Исследуемый материал — моча. Проба стабильна 9 мес при температу¬
ре -20 °С.
904 ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГРеферентные пределыТерапевтическая концентрация — 0-80 нг/мл (35-280 нмоль/л). Токсическая
концентрация — более 200 нг/мл (>700 нмоль/л).Фармакокинетические параметры• -1,8-4,2 ч,• Vd - 2,5-3,9 л/кг.• С1.,, — 13-17 мл/мин на кг массы.• РВ-35%.• F-20-33%.Факторы, влияющие на фармакокинетику препаратаВыведение препарата осуществляется печенью. При заболеваниях, поражаю¬
щих печень, наблюдается Vd РВ І. При гипербилирубинемии, гипо-
альбуминемии наблюдается снижение РВ. Диализ — гемодиализ (-).ОКСАЗЕПАМОксазепам — транквилизатор, препарат короткого действия из бензодиазе-
пинового ряда. Не имеет активных метаболитов и экскретируется в виде глюку-
ронидных конъюгатов. К побочным эффектам относятся спутанность сознания,
нарушение координации движений, возбуждение, транзиторная артериальная
гипотензия, головокружение, лихорадка и диспептические явления, лейкопения
и поражение печени. Оксазепам — метаболит диазепама, хлордиазепама^, меда-
зепама, темазепама*. Применение этих бензодиазепинов можно мониторировать
исследованием мочи методом ГХ/МС.Методы исследованияКонцентрацию препарата в сыворотке, плазме крови определяют методами
ГЖХ, ВЭЖХ, ГХ/МС.Определение концентрации оксазепама в моче проводят методами ИФА,
ФПИА.Референтные пределыТерапевтическая концентрация — 0,2-1,4 мкг/мл (0,7-4,9 мкмоль/л).
Токсическая концентрация не определена.Фармакокинетические параметры• Т,,,2-5-15ч.• Vd — 0,6-2,0 л/кг.• С1^ — 0,9-2,0 мл/мин на кг массы тела.• РВ-96-98%.ШдхФакторы, влияющие на фармакокинетику препаратаВыведение — печенью. Болезни — печени: t.^ Vd РВ почек; t,Vd Т, Cl^T, РВ t; гипертиреоз: t., і, CI^ t. Возраст - пожилые: Vd PBДиализ — гемодиализ (-).Лекарственные взаимодействияПробенецид^^ может нарушать связывание с глюкуронидами.ПРОКАИНПрокаин быстро метаболизируется холинэстеразой плазмы. Как правило, про¬
каин применяют для спинномозговой, местной или проводниковой анестезии.
Мониторирование лекарства или метаболита показывает степень его перифери¬
ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ 9Q5ческой абсорбции. Побочные эффекты: артериальная гипертензия, тахикардия,
мидриаз, судороги.Методы исследованияКонцентрацию препарата определяют с помощью колориметрии, ГЖХ.Требования к пробеИсследуемый материал — плазма. В пробу необходимо добавить 2 капли натрия
арсенета* 50% на 1 мл крови (или 1 мкг экотиопата*’).Референтные пределыТерапевтическая концентрация ~ менее 11 мкг/мл (<47 мкмоль/л). Токсическая
концентрация — более 21 мкг/мл (>89 мкмоль/л).Фармакокинетические параметры• Т - 6,5-8,5 мин.• Vd-0,66-0,94 л/кг.• CLp — 80,0 мл/мин на кг массы тела.Препарат плохо абсорбируется через слизистые оболочки. При парентераль¬
ном введении хорошо всасывается и быстро гидролизуется эстеразами плазмы и
тканей с образованием двух основных фармакологически активных метаболитов:
диэтиламиноэтанола (обладает умеренным сосудорасширяющим действием) и
парааминобензойной кислоты (ПАБК).Фактор, влияющий на фармакокинетику препаратаПрепарат выводится преимущественно почками в виде метаболитов (80%).
ПРОКАИНАМИДПрокаинамид — антиаритмический препарат IA класса. Лекарство подвер¬
гается метаболизму печеночной N-ацетилтрансферазой. Основной метаболит
прокаинамида — N-ацетилпрокаинамид (NAPA) — обладает значительной фар¬
макологической активностью и должен быть мониторирован. К побочным эффек¬
там прокаинамида относятся аритмогенное действие, желудочковые нарушения
ритма вследствие удлинения интервала 0.-Г, замедление атриовентрикулярной и
внутрижелудочковой проводимости, артериальная гипотензия, головокружение,
слабость, нарушения сознания, депрессия, бред, галлюцинации, аллергические
реакции. Реакции гиперчувствительности включают лихорадку, поражение пече¬
ни, агранулоцитоз, СКВ-подобный синдром.Медленные ацетиляторы дают большой риск развития прокаина мидиндуци-
рованной системной красной волчанки. Концентрации прокаинамида должны
рассматриваться одновременно с уровнями NAPA. Если сумма концентраций про¬
каинамида и NAPA более 25-30 мкг/мл, возрастает риск токсичности.Методы исследованияКонцентрацию препарата определяют методами ГЖХ, ВЭЖХ.Требования к пробеИсследуемые материалы — сыворотка, плазма. Проба стабильна 2 нед при тем¬
пературе 2-8 °С и 6 мес — при температуре -20 '’С. Забор крови проводят на спаде
концентрации препарата.Референтные пределыТерапевтическая концентрация — 4-10 мкг/мл (17-42 мкмоль/л). Токсическая
концентрация — более 10-12 мкг/мл (>42-51 мкмоль/л). При определении кон¬
центрации необходимо учитывать концентрацию N-ацетилпрокаинамида.
906 ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГФармакокинетические параметры• Т,,-2-6ч.• Vd — 2-4 л/кг.• С1^ — 7,5-12,1 мл/мин на кг массы тела (быстрые ацетиляторы).• С1^ — 5,5-11,7 мл/мин на кг массы тела (медленные ацетиляторы).• РВ - 10-20%.• F-80-90%.Факторы, влияющие на фармакокинетику препаратаПервичное выведение препарата осуществляется почками (50-60%); вторич¬
ное — печенью. Болезни — почек: Т, 11,5 ч; CLj. і, 3,5-6,9 мл/мин на кг массы
тела; застойная сердечная недостаточность: Vd і, С!.^, і; t,. Т, Cl^ і; ожирение: t,.Vd і. Возраст — дети: і, Vd Cl^ Т. Диализ — гемодиализ (+).Лекарственные взаимодействияуровень прокаинамида может быть повышен при одновременном приеме с
амиодароном, цимитидином и ранитидином.ПРОПРАНОЛОЛПропранолол - неселективный р-адреноблокатор, действует на и Рз^ЭДР^но-
рецепторы. Лекарственный мониторинг пропранолола рекомендуют проводить у
пациентов с аритмией, стенокардией и артериальной гипертензией. Пропранолол
подвергается метаболизму при первичном обороте. Основной метаболит —4-гидроксипропранолол — также обладает |3-блокирующей активностью (определе¬
но на животных при приеме внутрь). При длительном приеме пропранолола внутрь
происходит накопление этого метаболита. Связывание препарата с белком сильно
зависит от содержания в сыворотке крови кислого а-гликопротеина (часто повыша¬
ется в ответ на воспаление или стресс). Побочные эффекты: тошнота, рвота, легкая
диарея или запор, галлюцинации, ночные кошмары, бессонница, повышенная утом¬
ляемость, головокружение, депрессия, сердечная недостаточность и реже поражение
печени с повышением активности специфических ферментов. Зависимости между
плазменной концентрацией препарата и его терапевтическим эффектом нет.Методы исследованияКонцентрацию препарата определяют методами ВЭЖХ, ГЖХ.Требования к пробеИсследуемые материалы — сыворотка, плазма. Проба стабильна при комнатной
температуре 1 нед. Стабилизация 4-гидроксипропранолола может быть достиг¬
нута добавлением натрия метадисульфита. Пробы необходимо собирать на спаде
концентрации препарата.Референтные пределыТерапевтическая концентрация — 50-100 нг/мл (193-386 нмоль/л).
Токсическая концентрация не определена. Критическая концентрация — более
1000 нг/мл (>3860 нмоль/л). Смертельная концентрация — более 2000 нг/мл
(>7720 нмоль/л).Фармакокинетические параметры• Т^ ^2 У детей — 2-4 ч, у взрослых — 4-6 ч.• Vd - 3,6-1,0 л/кг.• Ci^ — 11,4 мл/мин на кг массы тела.• РВ-90-95%.• F-30%.• Фракция экстракции — 0,64.
ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ 9Q7Факторы, влияющие на фармакокинетику препаратаВыведение — печенью. Болезни или состояния — печени: Т, Vd Т, С1^ і
почечная недостаточность: С1^ І; гипертиреоидизм: Vd t. Cl^ t; курение: Cl^ Т
недостаточность питания: С1^ -I; гипотермия: С1^ І; воспаление: РВ Т; ожирение
РВ Т; беременность: РВ Т. Возраст — пожилые: Vd Диализ — гемо¬диализ (-).Лекарственные взаимодействияГель гидроксида алюминия* снижает абсорбцию препарата в ЖКТ. Барбитураты
и другие активаторы микросомальных ферментов печени могут повышать ско¬
рость метаболизма пропранола. Фенотиазины и циметидин могут повышать кон¬
центрацию пропранолола в плазме крови.СЕРТРАЛИНСерталин — антидепрессант, специфический ингибитор обратного захвата
серотонина (5-НТ) в нейронах. Оказывает очень слабое влияние на обратный
захват норэпинефрина (норадреналина) и допамина. В терапевт№іеских дозах
препарат блокирует захват серотонина в тромбоцитах человека. Не оказывает
стимулирующего, седативного или антихолинергического действия. Вследствие
селективного угнетения захвата 5-НТ сертралин не усиливает адренергическую
активность. Он не обладает сродством к мускариновым холинорецепторам, рецеп¬
торам серотонина, допамина, гистамина, GABA-рецепторам (рецепторам гамма-
аминомасляной кислоты), бензодиазепиновым и адренорецепторам. Сертралин не
вызывает лекарственной зависимости, не приводит к увеличению массы тела при
длительном приеме. Побочные эффекты: тошнота, рвота, сухость во рту, задержка
эякуляции. Серталин нельзя принимать одновременно с ингибиторами МАО или
в течение 14 дней после их отмены. Повышенная чувствительность к сертралину
также является противопоказанием.Методы исследованияКонцентрацию препарата определяют методами ВЭЖХ, ГХ/МС, ГХ.Требования к пробеИсследуемый материал — плазма. Проба стабильна в течение 1 нед при комнат¬
ной температуре или 7 мес при температуре -20 °С.Референтные пределыНет общепринятых терапевтических или токсических значений концентрации
препарата.Фармакокинетические параметры• 22-36 4.• Va — 20 л/кг.• РВ — 98% (РВх0,01=0,98 — белоксвязывающая молярная доля).При приеме серталина внутрь в дозах 50-200 мг 1 раз в сутки в течение 14
дней максимальная концентрация в плазме крови достигается через 4,5-8,4 ч.
Соответственно периоду полувыведения наблюдается примерно двукратная куму¬
ляция активного вешіества до достижения равновесного состояния через 1 нед
лечения. Основной метаболит — N-десметилсертралин обладает слабой фарма¬
кологической активностью. Период полувыведения N-десметилсертралина —
62-1044.Факторы, влияющие на фармакокинетику препаратаВыведение препарата осуществляется печенью. Он выводится в виде метабо¬
литов в равных количествах через кишечник и с мочой. Менее 0,2% выводится
908 ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГС мочой в неизмененном виде. Состояние — возраст: t,^ Т, Ci^i. Диализ - гемо¬
диализ (-).Лекарственные взаимодействияСертралин необходимо отменить за 2 нед до начала приема ингибиторов МАО.
В период лечения нельзя допускать употребление алкоголя. При одновременном
применении с антикоагулянтами, производными кумарина значительно увеличи¬
вается протромбиновое время. Сертралин может вытеснять из связи с белками
плазмы другие препараты (повышаются концентрация в плазме соответствующего
активного вещества, риск развития побочных эффектов). При одновременном
применении серталина с препаратами, метаболизм которых происходит при уча¬
стии изофермента CYP2D6, возможно повышение концентрации этих препаратов
в плазме крови вследствие ингибирования изофермента сертралином. При одно¬
временном применении с солями лития*^ возможно усиление тремора, при одно¬
временном применении с дезипрамином® возможно повышение концентрации
дезипрамина® в плазме крови, с циметидином — значительное снижение клиренса
сертралина.При одновременном применении с ингибиторами МАО (в том числе с селеги-
лином<^, моклобемидом) возможно развитие серотонинового синдрома, который
характеризуется повышением температуры, мышечной ригидностью, клонически-
ми судорогами, а также нестабильностью психики, вплоть до развития делирия.
При этом синдроме возможно развитие комы.ТЕОФИЛЛИНТеофиллин относится к группе метилксантинов. Часто применяют в лече¬
нии бронхиальной астмы и хронических обструктивных заболеваний легких.
Метаболизм теофиллина в 3-метилксантин (первичный метаболит) имеет огра¬
ниченные возможности. Именно поэтому скорость выведения препарата зависит
от соотношения его дозы и концентрации. Существует ряд солей теофиллина
(например, аминофиллин). Режим дозирования теофиллина должен основываться
на концентрации ангидрида теофиллина в плазме крови. Токсические эффекты
зависят от концентрации. К ним относятся тошнота, рвота, тахикардия, аритмии и
судороги. Один из метаболитов — кофеин. У недоношенных новорожденных 50%
теофиллина экскретируется в неизмененном виде с мочой, а оставшиеся 50% под¬
вергаются метаболизму в кофеин и 1,3-диметилмочевуто кислоту.Методы исследованияКонцентрацию препарата определяют методами ГЖХ, ВЭЖХ, РИА, ИФА,
ФПРЇА, ФИА, колориметрией.Требования к пробеИсследуемые материалы — сыворотка, плазма. Забор крови можно проводить
на спаде концентрации препарата, на ее пике (приблизительно в течение 2 ч после
приема внутрь) или при устойчивой концентрации (в течение продолжительной
внутривенной инфузии либо через 30 мин после внутривенного введения дозы
препарата). Рекомендуют проводить забор пробы при устойчивой концентрации
препарата.Референтные пределыТерапевтическая концентрация для снятия спазма бронхов — 8-10 мкг/мл (44-
111 мкмоль/л), при преждевременном апноэ ~ 6-13 мкг/мл (33-72 мкмоль/л).
Токсическая концентрация — более 20 мкг/мл (>111 мкмоль/л).
ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ 9Q9Фармакокинетические параметры• Tj ,2 У новорожденных — 23,5-36,5 ч, у детей — 2,3-4,5 ч, у некурящих взрос¬
лых — 6,5-10,9 ч, у курящих — 3,3-5,3 ч.• Vd - 0,45-0,48 л/кг.• Cl^y взрослых некурящих — 0,54-0,80, у курящих — 0,73-1,37 мл/мин на кг
массы тела.• РВ-56%.• F-90-100%.Факторы, влияющие на фармакокинетику препаратаВыведение - печенью. Болезни — цирроз: Т : 14,1 ч); С1^ч1(Х : 0,43 мл/мин
на кг массы тела); РВІ, ЗСН: Cl^i; острый отек легких: Т, 19 ч (3-82 ч); С1^ і
(0,07-2,35 мл/мин на кг массы тела); отек легких: (0,28-0,68 мл/мин на кг
массы тела); легочное сердце: Т, Cl^i; пневмония: ожирение: Т,1,07 мл/мин на кг массы тела (на основе ИБТ). Возраст — недоношенные: t, VdT,
новорожденные: T, Cl^i, PB i; пожилые: Cl^-», Vd ->,PB i. Диализ —
гемодиализ (+), гемоперфузия (+), перитонеальный (-).Лекарственные взаимодействияпри одновременном приеме с триацетилолеандомицином снижается общий
клиренс теофиллина С1^ I; эритромицина С1^ І; фенобарбитала С1^. І; циметидина
С1^. I. Курение С1^ Т. Концентрация теофиллина в сыворотке крови может возрас¬
тать при одновременном назначении аллопуринола, метопролола, пропранолола,
пероральных контрацептивов; может понижаться при одновременном назначении
карбамазепина, фуросемида, изониазида, фенитоина. После физической активно¬
сти (прогулки, бега трусцой) концентрация теофиллина в сыворотке может пони¬
жаться на 20%. Флюорохинолоны (ципрофлоксацин, офлаксацин и др.) снижают
клиренс теофиллина.ТИОПЕНТАЛ НАТРИЯТиопентал натрия — препарат короткого действия, применяемый дж неинга¬
ляционного наркоза. В токсических концентрациях препарат обычно применяют
при клинической смерти (для реанимации головного мозга). При этом проводят
дополнительное обеспечение сердечной и легочной деятельности. Тиопентал
натрия хорошо растворим в жирах и интенсивно распределяется в жировой ткани.
Его метаболит пентобарбитал также может быть найден в низких концентрациях.
Главный токсический эффект препарата — угнетение ЦНС. Минимальная леталь¬
ная доза для тиопентала натрия — 1 г (4,1 мкмоль). При высоких концентрациях
(60 мкг/мл) кинетика выведения препарата становится нелинейной и период
полувыведения может удлиняться до 60 ч. Описаны редкие случаи поражения
печени.Методы исследованияКонцентрацию препарата определяют методами ГЖХ, ГХ/МС, ВЭЖХ.
Требования к пробеИсследуемые материалы — сыворотка, плазма. Забор крови проводят на спаде
концентрации препарата. Проба стабильна до 24 ч при комнатной температуре и
8 нед при температуре -20 °С.Референтные пределыТерапевтическая концентрация для гипнотического эффекта — 1-5 мкг/мл
(4-21 мкмоль/л). Для искусственной комы - 30-100 мкг/мл (124-413 мкмоль/л);
91 о ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГДЛЯ неингаляционного наркоза — 7-130 мкг/мл (29-537 мкмоль/л). Токсическая
концентрация — более 10 мкг/мл (>41 мкмоль/л).Фармакокинетические параметры• V-6-7 4.• Vd - 0,5-4 л/кг.• С1^ — 1-4 мл/мин на кг массы тела.• РВ - 75-90%.Факторы, влияющие на фармакокинетику препаратаВыведение — печенью. Болезни — печени: t С1^ РВ І; ожирение: Т,
Vd Т, С1^^. Возраст - пожилые: t^T, Vd T, РВ і. Диализ — гемодиализ (-).ТИОРИДАЗИНТиоридазин — нейролептик. В организме образуется несколько его метаболи¬
тов, некоторые из них активны. Кинетические параметры недостаточно хорошо
определены. Побочные эффекты: ортостатическая артериальная гипотензия, экс-
трапирамидные расстройства, пигментация кожи, анемия, лейкопения, тромбоци-
топения, редко поражение печени, нарушение функций сердца.Методы исследованияКонцентрацию препарата определяют методами ГЖХ, ВЭЖХ, флюорометрией.Требование к пробеИсследуемые материалы — сыворотка, плазма.Референтные пределыТерапевтическая концентрация - 1,0-1,5 мкг/мл (2,7-4,1 мкмоль/л).
Токсическая концентрация ~ более 10 мкг/мл (>27,0 мкмоль/л).Фармакокинетические параметры• Т, 2 - 10-36 ч.• vd - 18 л/кг.• РВ — более 99,5%.Фактор, влияющий на фармакокинетику препаратаВыведение препарата осуществляется печенью.ИнтерференцияФяюорометрическим методом определяют метаболиты и исходный препарат.
Более специфичны ГЖХ и ВЭЖХ.ФЕНИТОИНФенитоин широко применяют в лечении эпилепсии. Метаболизм и, следова¬
тельно, Т^ ,2 фенитоина зависят от соотношения дозы препарата и концентрации,
что затрудняет титрование дозировки на основе сывороточной или плазменной
концентрации. Именно поэтому повышение дозы следует проводить ступенча¬
то. Продемонстрирована широкая вариабельность биодоступности метаболитов
препарата. Побочные эффекты: изменение поведения, диспептические явления,
гиперплазия десен, остеомаляция, мегалобластная анемия, поражение печени,
гирсутизм. Описаны редкие случаи тромбоцитопении, лейкопении, эозинофи-
лии. Иногда при внутривенном введении препарата со значительной скоростью
[>50 мкг/мин(198 мкмоль/мин)] возможны резкое падение артериального дав¬
ления и выраженное угнетение ЦНС. При общей плазменной концентрации
фенитоина более 35 мкг/мл (>39 мкмоль/л) снижается судорожная активность.
ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ 011Свободный препарат можно мониторировать путем ультрацентрифугирования
(для отделения связанного с белками препарата от свободного). Связывание
фенитоина с белками зависит от температуры. Фенитоин обладает выраженным
тератогенным эффектом. Именно поэтому его сывороточная концентрация у
женщин с возможной беременностью и в течение всей беременности должна быть
минимальной.Методы исследованияКонцентрацию препарата определяют методами ГЖХ, ВЭЖХ, РИА, ИХА.
Требования к пробеИсследуемые материалы — сыворотка, плазма. Забор крови проводят в момент
устойчивого спада концентрации. Проба стабильна при комнатной температуре
несколько часов, при температуре -20 “С — 1 ч.Референтные пределыТерапевтическая концентрация — 10-20 мкг/мл (40-79 мкмоль/л). Токсическая
концентрация — более 20 мкг/мл (>79 мкмоль/л) — дальний боковой нистагм;
нарушение координации движений — при концентрации более 30 мкг/мл
(>119 мкмоль/л); угнетение мыслительных способностей — при концентрации
более 40 мкг/мл (>158 мкмоль/л).Фармакокинетические параметры• Т^ 2 - 20-40 ч, у детей — 10 ч.• Vd-0,65 л/кг.• РВ-85-95%.• F- 70-90%.• Т„ - 3-12Ч.maxФакторы, влияющие на фармакокинетику препаратаВыведение — печенью. Болезни или состояния — печени: Cl^i, РВ і; почек:
tj. і, Vd Т, 1 л/кг; РВ: 70%; беременность; Cl^t, РВ І', ожог; РВ І. Возраст — недо¬
ношенные: Т, Cl^i; новорожденные; tj,. Т, Vd Т, CLj,i, РВ І; дети: X, Vd Т, Cl^t;
пожилые; Cl^i. Диализ — гемодиализ (-), перитонеальный (-).Лекарственные взаимодействияМетаболизм препарата замедляется изониазидом, хлорамфениколом, варфа-
рином, дисульфирамом и амиодароном^. Тиоридазин и имипрамин могут повы¬
шать концентрацию препарата в плазме. Метаболизм фенитоина активируется
карбамазепином, клоназепамом, фенобарбиталом, рифампином® и алкоголем.
Салицилаты, фенилбутазон и сульфонилмочевина^ конкурируют с фенитоином
за связывание с белками сыворотки (снижение концентрации фенитоина в сыво¬
ротке). Вальпроат натрия^ выделяет фенитоин из связей с белками и замедляет
его метаболизм. Антацидные препараты и сукральфат могут повышать биодоступ¬
ность фенитоина.ФЕНОБАРБИТАЛФенобарбитал широко применяют в лечении эпилепсии. В начале лечения наи¬
более частым побочным эффектом является седативный эффект. Однако с течени¬
ем времени развивается толерантность к препарату. Токсические эффекты; угне¬
тение ЦНС, дыхания, кома. Минимальная летальная доза — 1,5 г (6,5 мкмоль).
Описаны случаи поражения печени, лейкопении, тромбоцитопении. Поскольку
препарат имеет длительный период полураспада, достижение новой устойчивой
концентрации может занимать несколько недель. Применение фенобарбитала
912 ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГМОЖНО установить, тестируя мочу иммунологическим исследованием для барбиту¬
ратов. Подтверждение осуществляется методом ГХ/МС.Методы исследованияКонцентрацию препарата определяют методами ГЖХ, ВЭЖХ, ИХА,Требования к пробеИсследуемые материалы — сыворотка» плазма. Забор крови проводят в момент
устойчивого спада концентрации. Проба стабильна при комнатной температуре
несколько часов и год при температуре -20 “С.Референтные пределыТерапевтическая концентрация — 15-40 мкг/мл (65-172 мкмоль/л).
Токсическая концентрация (медлительность, нарушение координации движений,
нистагм) — 35-80 мкг/мл (151-345 мкмоль/л). Концентрация, при которой наблю¬
дается кома с сохранением рефлексов, — 65-117 мкг/мл (280-504 мкмоль/л);
кома без сохранения рефлексов наблюдается при концентрации препарата более
100 мкг/мл (>431 мкмоль/л).Фармакокинетические параметры• Т^ 2 У Д^тей — 40-70 ч, у взрослых — 50-140 ч.• Vd~ 0,5-1.0 л/кг.• РВ-40-50%.• F — при приеме внутрь/введении внутримышечно — 80-100%.• Т^^^ при приеме внутрь — 6-18 ч, при введении внутримышечно — 1-2 ч.Факторы, влияющие на фармакокинетику препаратаВыведение — печенью (первично), почками (вторично). Болезни или состоя¬
ния — печени: Ц Т, Cl^i; беременность: Сі^Т. Возраст — новорожденные:Vd Т, РВ і; дети: і, пожилые: Т, РВ Диализ ~ гемодиализ (+),
гемоперфузия (+), перитонеальный (±).Лекарственные взаимодействияВальпроевая кислота и салицилаты могут повышать концентрацию фенобарби¬
тала на 40%. При щелочном значении pH мочи повышается ионизация лекарства
и уменьшаетя почечная канальцевая реабсорбция. Фенобарбитал повышает ско¬
рость метаболизма ксенобиотиков после 1-2 нед лечения.ФЛУОКСЕТИНФлуоксетин — антидепрессант. Плазменные концентрации флуоксетина и
его активного метаболита норфлуоксетина можно предсказать в зависимости
от доз, выраженных в мкг/кг в день. Устойчивые концентрации флуоксетина —
210 и 360 нг/мл при режиме дозирования 40 и 60 мкг/день соответственно.
Антидепрессивный эффект не коррелирует с концентрацией флуоксетина и норф¬
луоксетина в плазме крови. Летальная доза норфлуоксетина неизвестна. Побочные
эффекты флуоксетина: беспокойство, нервозность, диарея, сонливость, тошнота, бес¬
сонница, головная боль.Методы исследованияКонцентрацию препарата определяют методами ВЭЖХ, ГХ.Требования к пробеИсследуемый материал — сыворотка или плазма. Для хранения пробы нельзя
использовать пробирки с разделительным гелем. Проба стабильна 10-15 дней при
температуре 4 °С. Пробы плазмы можно хранить при температуре -20 "С до 19 мес.
ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ 913Референтные пределыТерапевтическая концентрация флуоксетина — 100-800 нг/мл (289-
2314 нмоль/л); норфлуоксетина — 100-600 нг/мл (289-2173 нмоль/л); комбина¬
ции флуоксетин + норфлуоксетин — 300-1200 нг/мл. Токсическая концентрация
комбинации флуоксетин + норфлуоксетин — более 2000 нг/мл (>5784 нмоль/л).Фармакокинетические параметры• Т — 2-3 дня (норфлуоксетин — 7-9 дней).• Vd - 12-42 л/кг.• РВ - 90-98%.• F-72%.Факторы, влияющие на фармакокинетику препаратаВыведение — печенью. Болезни или состояния — дисфункция печени: Т, С1^ І.
Возраст — Т, но незначительно. Диализ — гемодиализ (-).Лекарственные взаимодействияФлуоксетин ~ ингибитор ферментов цитохрома Р-450. При одновременном
приеме с флуоксетином в плазме повышается концентрация фенитоина, карбама-
зепинов. галоперидола, диазепама. Одновременный прием флуоксетина и ингИ'
биторов МАО ИЛИ L-триптофана может вызвать серотонинергический синдром.
Ингибиторы МАО нельзя назначать в течение 5 нед после завершения приема
флуоксетина.ХЛОРАМФЕНИКОЛХлорамфеникол — антибиотик широкого спектра действия. Хлорамфеникола
пальмитат и сукцинат в организме подвергаются гидролизу до хлорамфеникола
(активной формы). Побочные эффекты: угнетение кроветворения (лейкопения,
тромбоцитопения, аплазия костного мозга с панцитопенией), тошнота, рвота,
диарея, раздражение кожи в области промежности. Угнетение кроветворения воз¬
никает в результате гиперчувствительности или идиосинкрастической реакции.
Возможно развитие дозозависимых лейкопении и тромбоцитопении. Редко встре¬
чается поражение печени.Методы исследованияКонцентрацию препарата определяют методами ВЭЖХ, ГЖХ, ИХА.Требования к пробеИсследуемые материалы — сыворотка, плазма. Забор крови проводят в момент
устойчивого спада концентрации препарата. Проба должна быть отцентрифугиро-
вана, разделена и заморожена, если не исследуется немедленно.Референтные пределыТерапевтическая концентрация — 10-25 мкг/мл (31-77 мкмоль/л). Токсическая
концентрация — более 25 мкг/мл (>77 мкмоль/л). Синдром серого ребенка разви¬
вается при концентрации препарата 40-100 мкг/мл (124-309 мкмоль/л).Фармакокинетические параметры• Т^,2 У новорожденных до 2-й недели — 24 ч; до 2-4-й недели — 12 ч, у взрос¬
лых — 1,5-5 ч.• Vd — 0,9 л/кг.• С1^, — 3,6-5,8 мл/мин на кг массы тела.• РВ-50-60%.• F-75-90%.
914 ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГФакторы, влияющие на фармакокинетику препаратаВыведение — печенью (первично), почками (вторично). Болезни — цирроз: t,^ Т,
РВ І, Возраст — недоношенные и неонатальный: t,^ Т, Cl^i, РВ І. Диализ —
гемодиализ (+), перитонеальный (-).Лекарственные взаимодействияш Хлорамфеникол замедляет метаболизм лекарств, подвергаемых окислительнымреакциям.ХЛОРДИАЗЕПОКСИДХлордиазепоксид — транквилизатор из группы бензодиазепинов. Тера¬
певтические и токсические концентрации определены недостаточно хорошо.
Уменьшение состояния тревоги коррелирует с концентрацией метаболитов
препарата (десметилхлордиазепоксида и демоксепама), а не хлордиазепоксида.
К побочным эффектам относятся сонливость, нарушение координации дви¬
жений, головная боль, сексуальные расстройства, головокружение, угнетение
дыхания, артериальная гипотензия. Описаны редкие случаи холестаза и лей¬
копении.Методы исследованияКонцентрацию препарата определяют методами ВЭЖХ, ГЖХ, ИХ А.Требования к пробеИсследуемые материалы — сыворотка, плазма. Забор крови проводят в момент
падения концентрации (через 40-60 ч после приема внутрь), на пике концентра¬
ции (через 4 ч после приема препарата).Референтные пределыТерапевтическая концентрация — 700-1000 нг/мл (2,34-3,34 мкмоль/л).
Токсическая концентрация — более 5000 нг/мл (>16,7 мкмоль/л).Фармакокинетические параметры• Tj 2 — 8-12 ч; при заболеваниях почек — 30-63 ч.• Vd — 3,0 л/кг.• С1^ — 0,22 мл/мин на кг массы тела.• РВ- 90-95%• F - 100%.Факторы, влияющие на фармакокинетику препаратаВыведение — печенью (первично), почками (вторично). Болезни печени: Т, Vd
Т, CI, 4-, РВ І. Возраст — пожилые: Т, Vd Т, Диализ — гемодиализ (-).Лекарственные взаимодействияКарбамазепин может повышать скорость метаболизма препарата. Цимети-
дин, эстрогены, дисульфирам, эритромицин могут снижать скорость его
метаболизма.ХЛОРПРОМАЗИНХлорпромазин — фенотиазин, широко применяемый как нейролептик.
Терапевтические и токсические пределы определены недостаточно хорошо,
в организме образуются метаболиты препарата, значительно осложняющие
интерпретацию сывороточных концентраций. Спектрофотометрические методы
неприменимы, так как исходный препарат и метаболиты не дифференцируются.
К побочным эффектам относятся обмороки, тахикардия, заложенность носа,
сухость во рту, запор, ортостатическая артериальная гипотензия, снижение или
ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ 915повышение температуры, экстрапирамидные расстройства (синдром Паркинсона),
острые дистонические реакции, поздняя дискинезия, желтушность, лейкоцитоз,
тромбоцитопения, лейкопения, эозинофилия, кожные реакции, положительный
тест Кумбса, повышение активности АЛТ и ACT в сыворотке крови.Методы исследованияКонцентрацию препарата определяют методами ГЖХ, ГХ/МС, ВЭЖХ, ИХА.Требования к пробеИсследуемые материалы — сыворотка, плазма. Забор крови проводят в момент
падения концентрации. Пробу необходимо хранить при температуре -70 °С до
исследования.Референтные пределыТерапевтическая концентрация у детей — 40-80 нг/мл (126-251 нмоль/л), у
взрослых — 50-300 нг/мл (157-942 нмоль/л). Токсическая концентрация — более
750 нг/мл (>2355 нмоль/л).Фармакокинетические параметры• Т,-30ч.• — 20 л/кг.• С1^ 5,7-10,7 мл/мин на кг массы тела.• РВ-95-98%.• F-30%.Факторы, влияющие на фармакокинетику препаратаВыведение — печенью. Возраст — дети; Cl^i, пожилые: CIj.i. Диализ — гемодиа¬
лиз (-), перитонеальный (-).Лекарственные взаимодействияприменение с циклическими антидепрессантами повышает риск развития зло¬
качественного нейролептического синдрома. Трициклические антидепрессанты,
ингибиторы МАО могут увеличивать антихолинергический и седативный эффек¬
ты хлорпромазина, а циклические антидепрессанты могут снижать скорость мета¬
болизма фенотиазинов. Литий<^ может снижать абсорбцию хлорпромазина.ЦИКЛОСПОРИНЦиклоспорин — иммуносупрессор, в высокой степени связывается с эритроци¬
тами и плазменными апопротеинами. Связывание препарата зависит от темпера¬
туры и его концентрации. Основной побочный эффект — дозозависимая нефро-
токсичность. К другим побочным реакциям относятся гирсутизм, гиперплазия
десен, поражение печени, артериальная гипертензия, анафилаксия, нейротоксич¬
ность и лимфопролиферативные нарушения. Для циклоспорина описана кишечно¬
печеночная рециркуляция.Методы исследованияКонцентрацию препарата определяют методами ИХА, ВЭЖХ.Требование к пробеИсследуемый материал — цельная кровь.Референтные пределыпри пересадке почек терапевтическая концентрация через 12 ч после вве¬
дения дозы - 100-400 нг/мл (83-333 нмоль/л); через 24 ч - 100-200 нг/мл
(83-166 нмоль/л).
916 ТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГПри пересадке сердца терапевтическая концентрация — 12 ч после дозы
100-300 нг/мл (83-250 нмоль/л); через 24 ч после дозы - 100-200 нг/мл (83-
166 нмоль/л).При пересадке костного мозга терапевтическая концентрация через 12 ч после
дозы — 1100-250 нг/мл (83-208 нмоль/л).Токсическая концентрация — более 400 нг/мл (>333 нмоль/л).Фармакокинетические параметры• Т -19ч.• Vd - 0,7-6,2 л/кг.• С1^ — 8,3-10,3 мл/мин на кг массы тела.• РВ-96%.• F-23-45%.• Т - 3-5 ч.саах . „Циклоспорин распределяется главным образом вне кровеносного русла, В плаз¬
ме крови — от 33 до 47% активного вещества, в лимфоцитах — от 4 до 9%, в гра¬
нулоцитах - от 5 до 12%, в эритроцитах - от 41 до 58%. В организме образуется
около 15 метаболитов.Факторы, влияющие на фармакокинетику препаратаВыведение препарата осуществляется печенью, 6% выводится почками в основ¬
ном в виде метаболитов и лишь 0,1% выводится в неизмененном виде. Болезни
печени: Cl^i. Возраст: Cl^t. Диализ — гемодиализ (-), перитонеальный (-).Лекарственные взаимодействияАндрогенные гормоны, циметидин, даназол, дилтиазем, эритромицин, эстро¬
гены, кетоканозол, миконазол могут увеличивать концентрацию циклоспорина в
плазме. Фенитоин, комбинация рифампин + изониазид®, фенобарбитал повышают
общий клиренс препарата. Длительная терапия глюкокортикоидами также повы¬
шает общий клиренс циклоспорина. Аминогликозиды, амфотерицин Б, котримок-
сазол^, мелфалан, фуросемид и нестероидные противовоспалительные средства
могут потенцировать нефротоксичность циклоспорина. Абсорбция циклоспорина,
принятого внутрь, может зависеть от времени после операции, введенной дозы,
состояния ЖКТ, внешнего дренажа желчи, заболеваний печени и от пищи.ЦИМЕТИДИНЦиметидин — блокатор Н2-рецепторов. При концентрации препарата в сыво¬
ротке более 1 мкг/мл (>мкмоль/л) кислотность желудочного сока уменьшается
на 88-90%, К побочным эффектам относятся головная боль, головокружение,
слабость, мышечные боли, запор, диарея, кожная сыпь, бред, галлюцинации,
гинекомастия и кома. Большинство из этих эффектов описаны у пожилых людей
и/или при почечной недостаточности. Описаны редкие случаи панцитопении, гра-
нулоцитопении, тромбоцитопении.Метод исследованияКонцентрацию препарата определяют методом ВЭЖХ.Требования к пробеИсследуемые материалы — сыворотка, плазма. Забор крови проводят в момент
снижения концентрации препарата.Референтные пределыТерапевтическая концентрация — 0,5-1,2 мкг/мл (2-5 мкмоль/л). Токсическая
концентрация - более 1,3 мкг/мл (>5,1 мкмоль/л).
шТЕРАПЕВТИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ МОНИТОРИНГ 917Фармакокинетические параметры• Т,-1.5ч.• Vd — 1,1-ЗД л/кг.• С1^ — 12 мл/мин на кг массы тела.• РВ - 15-20%.• F-60-70%.• Т_-1,0-1,5 4.Факторы, влияющие на фармакокинетику препаратаВыведение — почками (первично), печенью (вторично). Болезни почек: Т,
Vd Возраст — пожилые: Т, Vd і, Cl^ i. Диализ — гемодиализ (±), пери¬тонеальный (-), гемоперфузия (+),ЭТОСУКСИМИДЭтосуксимид — противоэпилептический препарат. Токсические эффекты не
коррелируют с сывороточной концентрацией. К зависимым от концентрации
побочным эффектам относятся тошнота, рвота, отсутствие аппетита, головная
боль, усталость, летаргия и головокружение. Препарат может вызывать апластиче-
скую анемию, лейкопению, тромбоцитопению. Описано, что при приеме этосукси-
мида возможны положительная реакция Кумбса и повышенный титр антиядерных
антител. Может быть повышена активность ACT в сыворотке крови.Методы исследованияКонцентрацию препарата определяют методами ВЭЖХ, ГЖХ, ИХ А.Требования к пробеИсслед}''емые материалы — сыворотка, плазма. Забор крови осуществляют в
момент спада концентрации препарата. Проба стабильна несколько часов при
комнатной температуре.Референтные пределыТерапевтическая концентрация — 40-100 мкг/мл (283-708 мкмоль/л), токси¬
ческая концентрация — более 150 мкг/мл (>1062 мкмоль/л).Фармакокинетические параметры• Т, у детей — 30-50 ч, у взрослых — 24-72 ч,• Vd — 0,7 л/кг.• С1^ —0,21-0,31 мл/мин на кг массы тела.• РВ незначительно.• Т , - 3-7 ч.maxФакторы, влияющие на фармакокинетику препаратаВыведение — печенью. Возраст — дети: 4^, Vd Clj,t. Диализ — гемодиализ (+).Лекарственные взаимодействияКарбамазепин, фенобарбитал, фенитоин, пиримидон могут повышать скорость
метаболизма лекарства. Вальпроевая кислота может повышать или понижать кон¬
центрацию этосуксимида в плазме крови.
Предметный указательААденокарцинома- желудка 690- поджелудочной железы 691- простаты 691
Акантоцитоз 371
Акромегалия 269
Аланинаминотрансфераза 178
Алгоритм пренатального мониторинга844Альбумин 192, 361
Альдостерон 299
Альфа-амилаза- общая 179
-панкреатическая 181
Альфа-антитрипсин 215
Альфа-макроглобулин 217
Аменорея 291Амилаза мочи 180
Аммоний 727
Анализ- гибридизационный 150- иммуноферментный 135- в микропланшетном формате 140- иммунохимический 135- крови общий 492- мультиплексный иммунный 143- радиоиммунный 142- химико-токсикологический 854- - барбитураты 871- в клинической токсикологии 862- каннабиноиды 873- кокаин 873- наркотических средств 864- опиаты 872- спирты 876- фенилалкиламины 874- фенотиазины 875- хромосомный 711- цитогенетический 516
Аналитика лабораторная 28
Ангиотензин 300
Андрогены 296Анемия 530- апластическая 540- гемолитическая 548- аутоиммунная 561- гипохромная 534- Доната-Ландштейнера 564- железодефицитная 534- мегалобластная 542- нормохромная 537- постгеморрагическая 532- серповидноклеточная 557
-Фанкони 540
-фолиеводефицитная 546
Аномалии хромосомные 706
Антикоагулянты 752
Антистрептолизин-0 217
Антитрипсин 363
Антитромбин 218,794
Аполипротеины 219
Аспартатаминотрансфераза 181
Ахилия 366Ахолия 366Ацидоз метаболический 729Белок-Бене-Джонса 322
-мочи 195
-общий 193- Тамма-Хорсфалля 195- фракции сыворотки крови 194
Билирубин 196Болезнь-Аддисона 299,310- Альцгеймера 382- базедова 271- Бернара-Сулье 760- Винкеля 337- Гоше 508- Иценко-Кушинга 299- Клайнфельтера 382
-Крона 361- Кушинга 268, 288- Маркиафавы-Микели 337, 566- миеломная 597- Минковского-Шоффара 549
-Мошковица 565
-накопления 735- наследственные обмена веществ 719
- Ниманна-Пика 508- Педжета 231- Рейтера 401- Скотта 763- тяжелых цепей 600- Уиппла 611- Фехтнера 763ВВитамин 253
254
Время- активированное частичное
тромбопластиновое 778- протромбиновое 781- рептилазное 786- свертывания крови 775- активированное 776- каолиновое 777- тромбиновое 785Галактоземия 738
Галактозилоксилизин 264
Гамма-глутамилтрансфераза 182
Гаптоглобин 221
Гемоглобин гликированный 198
Гемопоэз 475- гранулоцитопоэз 481- лимфоцитопоэз 487- мегакариоцитопоэз 485- моноцитопоэз 484- регуляция 477- эритропоэз 479
Генетика 705
Гипертиреоз 271
Гиперхлоргидрия 366
Гипогонадизм женский 290
Гипопитуитаризм 268
Лдпотиреоз 272
І)іюкагон 302Віюкоза 727- крови 199- мочи 201
Гнюкозурия 326
Гомоцистеин 256
Гонадотропин хорионический 298
Гормон- адренокортикотропный 299- антимюллероБ 295- лютеииизирующий 281- паратиреоидный 308- соматотропний 310- тестостерон 282ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 910— тиреотропный 275— фолликулостимулирующий 281дДегидроэпиандростерон 288
Дезоксипиридинолин 263
Дефензин 364
Диагностика— биохимическая 175— лабораторная 23— аналитика 25— аналитическая надежность 47— аналитические характеристики
методов 55— информативность исследований 66— контроль качества 51, 68
федеральная система 69— контрольные правила 54— критерии эффективности 40— неотложных состояний 816
гипоксия 823— две 826 острая печеночнаянедостаточность 829 острая почечнаянедостаточность 831 острая сердечнаянедостаточность 827 острый панкреатит 830 полиорганная недостаточность 826 причины нарушений гомеостаза 819 шок 826, 834— обеспечение качества 42— объекты исследований 25— оперативность информации 33— патобиология 25— при беременности 839— стандартизация 37— формы организации 31— молекулярная клиническая 147— контроль качества 163— методы 149,162— преимущества 158— скрининг 162— стандартизация 163ЖЖелезо 240
3Запор 369Звено гемостаза плазменное 772
Зоб эутиреоидный 273яИщш
920 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
ИИзменения— крови реактивные 519— базофилия 524— лейкопения 521— лейкоцитоз 519— лимфоцитоз 525— лимфоцитопения 527— моноцитоз 525— нейтрофилез 520— тромбоцитоз 528— тромбоцитопения 529
—эозинопения 524— эозинофилия 523— эритроцитов 527— эритроцитопения 528
Иммуноглобулин-А 223
-D 224
-Е 224— G 225
-М 226Иммунофлюоресценция 142
Инсулин 303
Интерлейкин 256
Исследование— гемопоэтических клеток
цитохимическое 508— желчи 467— микроскопическое 470— жидкости серозных полостей 403— асцитическая жидкость 425— микроскопическое 406— перикардиальный выпот 421— плевральный выпот 407— кала 352— иммунохимическое 360— макроскопическое 356— микроскопическое 359— коагулологическое 749— тромбоцитов 756— крови— автоматизированное 494
-мокроты 457— микроскопическое 460— мочи 312— содержание глюкозы 325— бактериурия 341— гемоглобинурия 337— запах 317— количество 314— микрогематурия 334
--прозрачность 317— содержание белка 319— содержание билирубина 330— содержание крови 334— содержание лейкоцитов 339— содержание уробилиногена 332— цвет 315— осадка мочи 347— элементы 348— почек— проба Зимницкого 346 на концентрирование 345 на разведение 345— функциональные 344— пунктата костного мозга 503— синовиальной жидкости 398— клинико-диагностическое
значение 401— физические свойства 399— цитология 400— спермы 432— биохимическое 456— иммунологическое 452— макроскопическое 438— микроскопическое 440— сперматограмма 445— спинномозговой жидкости 372— билирубинархия 377— гликоархия 382— кетонархия 383— микроскопическое 384— нитриты 384—протеинархия 379— физико-химические свойства 373— эритроцитархия 375— физико-химическое 858— цитогенетическое 709
-цитологическое 607— выпотных жидкостей серозных
полостей 644— заболевания молочной железы 637— заболевания нервной системы 656— заболевания органов дыхания 640— заболевания тела матки 633— заболевания шейки матки 623— заболевания эндокринных желез 653— органов желудочно-кишечного
тракта 646— основные принципы 611ККалий— в моче 243— сыворотки 242
Кал ребенка 370
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 921Кальпротектин 362
Кальций 244
Кальцитонин 304
Кальцитриол 302
Кариотипирование 518
Карцинома- бронхов 697- гепатоцеллюлярная 694- колоректальная 693- молочной железы 696- мочевого пузыря 697- пищевода 694- простаты 696- шейки матки 695- эндометрия 692- яичника 695
Катехоламины 305
Кетонурия 328
Кислота- аминолевулиновая 253- мочевая 205,729- свободная жирная 209- фолиевая 258
Клетки- Купфера 485- Мотта 599- стволовые 476
Комплемент- СЗ 227- С4 228
Кортизол 306
Креатинин- клиренс 203
-мочи 203- сыворотки крови 202
Креатинкиназа 185ЛЛаборатория клинико-
диагностическая 84
Лактат 204.725
Лактатдегидрогеназа 187
Лейкозы 570- лимфобластные 594- острые 570
Лептин 228
Лизоцим 362
Лимфома- Беркитта 603- В-крупноклеточная 603
Липаза 188
Липопротеин(а) 221ММагний 247Макроглобулинемия Вальденстрема 600
Маркеры— опухолевые 416— CYFRA211 679
~ НЕ4 671— ProGRP 681— Tu М2-РК 682— антиген плоскоклеточного рака 675— антиген рака мочевого пузыря 683— белок S-100 682— биохимические 693— иммунохимические 693— молекулярно-генетические 684— нейроспецифическая енолаза 680— простатоспецифический антиген 667— раково-эмбриональный антиген 671— СА15-3 678— СА 19-9 676— СА72-4 678
~ СА 125 669
~ СА 242 677— серологические 665— фетопротеин 672— хорионический гонадотропин
человека 674Медь 248
Миелолейкоз— хронический 586— эритремия 590
Миелопероксидаза 365,509
Микрогематурия 334
Миоглобин 229
Мониторинг
-беременности 841— терапевтический лекарственный 883— амантадин 885— аминокапроновая кислота 886— амиодарон 886— амитриптилин 887— амобарбитал 888— амфетамин 889— ацикловир 890— варфарин 891— галоперидол 892— диазепам 893— диклофенак 895— зидовудин 896— имипрамин 897— индометацин 897— карбамазепин 898
922 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ^5,-% — кетамин 899— клоназепам 900
—лидокаин 901— метотрексат 902— морфин 903— оксазепам 904— прокаин 904— прокаинамид 905— пропранолол 906— серталин 907— теофиллин 908— тиопентал натрия 909— тиоридазин 910— фармакокинетические параметры 884— фенитоин 910— фенобарбитал 911— флуоксетин 912— хлорамфеникол 913— хлордиазепоксид 914
—хлорпромазин 914— циклоспорин 915— циметидин 916— этосуксимид 917
Мочевина
-мочи 208— сыворотки крови 206
Муковисцидоз 371, 739
Мурамидаза 362ННатрий— в моче 250— а сыворотке 249ООксипрогестерон 307
Оксипролин 263
Опухоль— гипофиза 268— молочной железы 691— толстой и прямой кишки 689
Орозомукоид 216
Остеокальцин 230, 261ППептид мозговой натрийуретический 230
Пиридинолин 263
Пируват 725
Плазминоген 802
Плазмоцитома 599
Планшет 96-луночный 93
Пневмония 465
Порфобилиноген 208
Преальбумин 231Прокальцитонин 232
Пролактин 283, 293
Протеине 796
Протеинурия 319Рак— желудка 694— поджелудочной железы 693— шейки матки 692
~ эндометрия 660
Реакция— полимеразная цепная 151— аналитические характеристики 156— в акушерстве 165— в гастроэнтерологии 169— в гематологии 168— в гинекологии 165— в дерматологии 167— в иммунологии 172— в неврологии 168— в онкогинекологии 166— в пульмонологии 168— в стоматологии 172— Б урологии 171— во фтизиатрии 168— приборное оснащение 158— секвенирование генов 157
Регистрация— видеоцифровая 89— изображения объектов 91— иммуноферментный анализ 99— латекс-агглютинационные тесты 94— миниатюризация 99— пассивная гемагглютинация 97— перспективы 102— программное обеспечение 91— сканерная 93Регуляция менструального цикла 289
Ренин 309Рецепторы стероидных гормонов 659Саркоидоз 389
Саркома Капоши 611
Секвенирование генов 157
Синдром- адреногенитальный 740- Дауна 581, 705- Дель Кастильо 283- дисахаридазной недостаточности 371- диссеминированного
внутрисосудистого свертывания 837- Имерслунда-Гресбека 545
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 923- Иценко-Кушинга 231,288, 290, 299- Каллмана 284- Клайнфельтера 283,611, 705- Конна 300- Костманна 522- Кушинга 276- Лауренса-Муна-Бидля 284- Леша-Найхана 547- мальабсорбции 367- миелодиспластический 567- Нельсона 299
-Роджерса 547
-Руда 284- Сезари 605- Селена-Геллерстедта 463- Сиппла 306
-Фелти 522- Чедиака-Хигаси 522- Швахмана-Даймонда 361- Шерешевского-Тернера 287, 611,705- эндогенной интоксикации 836
Система- лабораторная информационная 84- функции 84
Система гемостаза 749
Скрининг новорожденных 736
С-пептид 304
Сперматограмма 445
С-реактивный белок 233Талассемия 555
Тестостерон 282
Техника венепункций 753
Тиреоидит 274
Тироксин 276
Транссудат 404
Трансферрин 235
Триглицериды 210
Трипсин 189
Тромбоглобулин 769
Тропонины 236Умножители фотоэлектронные 105
фФактор- IX 790- V 792- VII 791- VIII 788
-X 790- ХПа 801- XIII 793- некроза опухоли 236- фон Виллебранда 765
Фенилаланин 258
Фенилкетонурия 737
Фенотипирование лимфоцитовпериферической крови 127
Ферменты 177- ангиотензинпревращающий 301
Ферритин 237Фибриноген 238
Фибронектин 239
Фосфатаза- кислая 183,512- щелочная 191, 261, 512
Фосфор 251XХашимото тиреоидит 273
Химотрипсин 360
Хлориды 252
Холестерин- липопротеидов- высокой плотности 213- низкой плотности 214- очень низкой плотности 215- общий 211
Холинэстераза 190
Хроматография- высокоэффективная жидкостная 861- газожидкостная 860
-тонкослойная 861
Хроматомасс-спектрометрия 862ЦЦелиакия 370
Церулоплазмин 239
Цитогенетика 705
Цитометрия- проточная 103, 514- аналитические характеристики 107- клетки иммунной системы 129- ограничения метода 109- основы 105- оценка клеточного звена
иммунитета 110- преимущества 109- фенотипирование лимфоцитов
периферической крови 127ЭЭкссудат 404Энтеропатия экссудативная 372
Эстрадиол 293