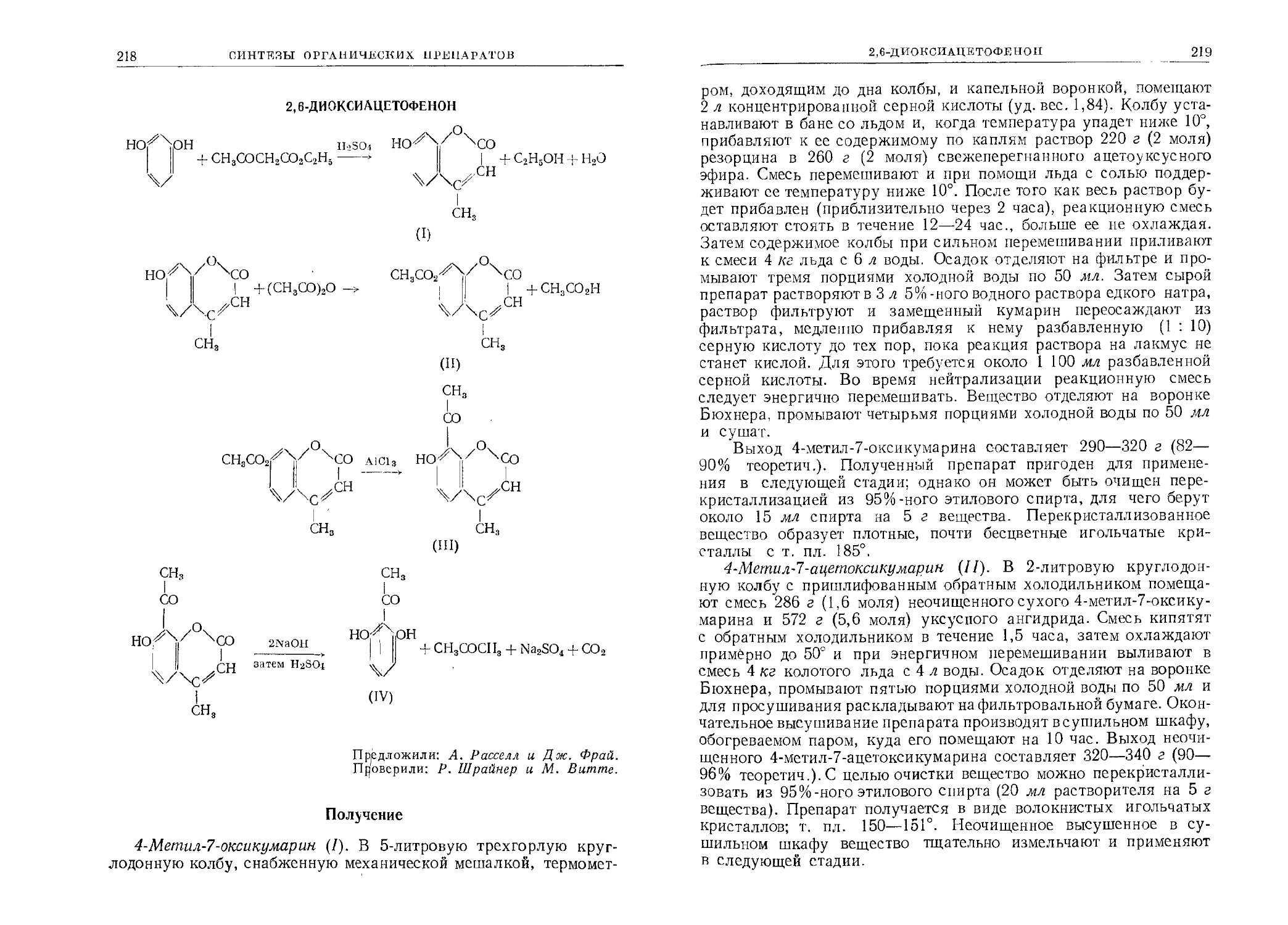
Tags: химия
Year: 1952
Text
ORGANIC SYNTHESES
An Annual Publication of Satisfactory
Methods for the* Preparation
of Organic Chemicals
ANNUAL VOLUMES 20—25
Volume 20. С F. H. ALIEN
Volume 21. N. L. DRAKE
Volume 22. LEE IRVIN SMITH
Volume 23. ЬЕЕ IRVIN SMITH
Volume 24. N. L. DRAKE
Volume 25. W. E. BACHMANN
Editors-in-Chief
NEW YORK
СИНТЕЗЫ
ПРЕПАРАТОВ
Сборник 3
Перевод с английского
проф. А. Ф. П Л А ТЭ
Под редакцией
акад. Б. А. КАЗАНСКОГО
1952
ИЗДАТЕЛЬСТВО
ИНОСТРАННОЙ ЛИТЕРАТУРЫ
Москва
ПРЕДИСЛОВИЕ РЕДАКТОРА
Сборник 3 «Синтезы органических препаратов» по своему
построению не отличается от сборников 1 и 2, выпущенных
в 1949 г. Издательством иностранной литературы. Он предста-
представляет собой перевод американских ежегодных выпусков «Organic
Syntheses» B0—25), изданных в 1940—1945 гг., и содержит
проверенные прописи получения более 200 органических соеди-
соединений, которые могут служить ценными исходными веществами
в лабораторной практике.
За последние годы в советской литературе появилось большое
число оригинальных монографий и работ по синтезам в области
органической химии. Среди последних особо следует отметить:
сборник 1 «Синтезы органических соединений», выпущенный Инсти-
Институтом органической химии АН СССР A950), фундаментальное изда-
издание—«Справочник по магнийоргапическим соединениям», состав-
составленный С. Т. Иоффе и А. Н. Несмеяновым (Изд. АН СССР, 1950),
и многотомную серию под общей редакцией А. Н. Несмеянова
и К- А. Кочешкова «Синтетические методы в области металло-
органических соединений» (Изд. АН СССР, 1945—1949).
Тем не менее настоящий сборник, содержащий прописи полу-
получения наиболее употребительных препаратов, будет желательным
дополнением к оригинальной отечественной литературе и ценной
настольной книгой в любой лаборатории органической химии.
Следует отметить, что по сравнению с предыдущими сборниками
в методиках, вошедших в сборник 3, значительно более широко
использована новая лабораторная техника: ректификационные
колонны, автоклавы, аппаратура для проведения каталитических
процессов и т. п. В результате этого многие препараты, ранее
почти недоступные, теперь могут быть получены в чистом виде,
притом без особых затруднений.
Чтобы облегчить химику пользование материалом, сборник
снабжен рядом указателей: 1) по типам реакции, 2) по типам
соединений, 3) по формулам, 4) указателем рисунков, 5) общим
предметным указателем и 6) указателем составителей прописей.
Таким образом, это издание выгодно отличается от американских
ежегодных выпусков, коюрые снабжены только общими пред-
предметными указателями. Как показал опыт, наличие перечисленных
ПРЕДИСЛОВИЕ РЕДАКТОРА
указателей в предшествующих сборниках полностью себя оправ-
оправдало. Во многих случаях пользование этим материалом, в част-
частности указателями по типам реакций и по типам соединений,
дает возможность получать не только препараты, описание син-
синтезов которых вошло в сборник, но по аналогии и другие органи-
органические соединения.
К тексту сделан ряд примечаний, касающихся восстановления
приоритета русских ученых. В ближайшем будущем последует
выход в свет сборника 4 «Синтезы органических препаратов»,
который охватит американские ежегодные выпуски «Organic
Syntheses» B6—31), изданные в 1946—1951 гг.
Акад. Б. Казанский.
АЗОБЕНЗОЛ
Предложили: X. Бигелов и Д. Робинсон.
Проверили: В. Бахман и В. Струве.
Получение
Трехгорлую круглодонную колбу емкостью 5 л, снабженную
мешалкой с ртутным затвором и обратным холодильником, уста-
устанавливают на паровом нагревателе. В колбу помещают 250 г
B08 мл, 2 моля) нитробензола, 2 500 мл метилового спирта и
раствор 325 г (8,1 моля) едкого натра (примечание 1) в 750 мл
дестиллированной воды. К смеси прибавляют 265 г D,1 моля)
цинковой пыли (примечание 2), пускают в ход мешалку и смесь
кипятят в течение 10 час. (примечание 3). Смесь фильтруют в горя-
горячем состоянии и осадок цинката натрия промывают на фильтре
небольшим количеством теплого метилового спирта. От фильтрата
отгоняют метиловый спирт, остаток охлаждают льдом и отфильтро-
отфильтровывают кристаллический азобензол.
С целью отделить соли цинка от неочищенного. азобензола
последний прибавляют к 500 мл 2%-пой соляной кислоты, смесь
нагревают до 70°, чтобы расплавить азобензол, и энергично пере-
перемешивают в течение 5 мин. Не останавливая мешалки, смесь
охлаждают, чтобы азобензол затвердел. Препарат отфильтровы-
отфильтровывают, тщательно промывают водой и перекристаллизовывают
из смеси 720 мл 95%-ного спирта и 60 мл воды. Выход азобензола
с т. пл. 66—67,5° составляет 150—160 г (84—86% теоретич.).
Примечания
1. Это количество едкого натра относится к реагентам 100%-ной
чистоты. Проверявшие синтез использовали 342 г 95%-ного едко-
едкого натра.
2. Это количество цинковой пыли подразумевается при
100%-пой чистоте ее. Проверявшие синтез использовали 288 г
цинковой пыли 92%-ной чистоты.
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
3. К концу этого времени смесь, окрашенная в красноватый
цвет, не должна иметь запаха нитробензола. Если запах все же
не исчез, то кипячение продолжают в течение еще 2—3 час.
Другие методы получения
Азобензол был получен целым рядом способов. Приведенная
выше пропись является видоизменением метода, примененного
Алексеевым1.
'Алексеев, Z. Chem., 4, 497 A868).
АЗОБЕНЗОЛКАРБОНОВАЯ КИСЛОТА
(п-Фенилазобензойная кислота)
C6H5NO + H2NC6H4COOH -» C,H,N = NCeH4COOH + Н2О
Предложил: Г. Анспон.
Проверили: В. Бахман и И. Дено.
Получение
В 1-литровой конической колбе растворяют 54 г @,39 моля)
л-аминобензойной кислоты в 390 мл теплой ледяной уксусной
кислоты. Раствор охлаждают до комнатной температуры, при-
прибавляют к нему 42 г @,39 моля) нитрозобензола (стр. 354) и смесь
встряхивают до полного растворения нитрозобензола. Затем
колбу закрывают пробкой и раствор оставляют стоять в течение
12 час. при комнатной температуре. Примерно через 15 мин.
вещество начинает кристаллизоваться.
я-Фенилазобензойную кислоту отфильтровывают на воронке
Бюхнера (см. примечание) и промывают уксусной кислотой
и водой. Выход воздушносухой кислоты, которая плавится при
245—247° (исправл.), составляет 62 г G0% теоретич.). При пере-
перекристаллизации из 95%-ного спирта F0 мл спирта на 1 г вещества)
кислоту получают в виде оранжево-золотистых пластинок, кото-
которые плавятся при 248,5—249,5° (исправл.); выход вещества после
перекристаллизации составляет 54 г F1% теоретич.).
Примечание
До фильтрования раствор не следует охлаждать ниже комнат-
комнатной температуры; охлаждение ниже 20 приводит к тому, что
в осадок выпадают также и примеси.
АЛЛОКСАН
Другие методы получения
Приведенный выше метод в основном описали Анжели и Ва-
лори1.
1Angeli, Valor i, Atti accad. Lincei, 22, I, 132 A913) [C. A., 7,
2223 A913)].
АЛЛОКСАН
NH —CO
I I
CO С
I I \
NH —CO
HO,
CO —NH
I ™М
- О -С
CO • 21 [2O
! |
CO —NH
HNO3
NH —CO
i I
2 CO CO + 3H2O
! !
NH—CO
Предложили: В. Хартмэн и О. Шеппард.
Проверили: К. Мареел и Б. Войцик.
Получение
В колбу емкостью 500 мл (примечание 1), снабженную меха-
механической мешалкой, помещают 36 мл воды и 25 г @,078 моля)
мелкокристаллического дигидрата аллоксантина (стр. 14). Содер-
Содержимое колбы нагревают на паровой бане до 50° и прибавляют к
нему тонкой струей 3,6 мл дымящей азотной кислоты (уд. вес 1,62).
При этом смесь энергично перемешивают и следят, чтобы темпе-
температура не поднималась выше 60° (примечание 2). После того как
вся дымящая азотная кислота будет прибавлена, температуру
доводят до 55е и мешалку останавливают. Через несколько минут
начинается бурная реакция с выделением большого количества
окислов азота. Снова пускают в ход мешалку и дают реакции
проходить без постороннего вмешательства, несколько охлаждая
смесь лишь в том случае, если процесс пойдет слишком бурно.
Реакцию можно считать законченной, когда струя воздуха, вве-
введенная в колбу над смесью, больше не вызывает появления замет-
заметной окраски, обусловленной образованием четырехокиси азота
(примечание 3). Затем смесь нагревают в течение 10—15 мин.
до 60—65". причем твердое вещество практически полностью
растворяется. Реакционную смесь выливают в чашку из стекла
пирекс и оставляют на ночь при 0° или при еще более низкой
температуре. Большие триклинические бесцветные кристаллы
тетрагидрата аллоксана разбивают, фильтруют с отсасыванием,
промывают ледяной водой и как можно лучше отжимают. Затем
кристаллы прибавляют к 25—26 мл горячей воды (примечание 4)
и смесь взбалтывают до полного растворения. Раствор немедленно
фильтруют и фильтрат охлаждают в течение ночи при 0° в чашке.
Кристаллы разбивают, фильтруют, промывают ледяной водой
10
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
и как можно тщательнее отжимают. Сырые кристаллы тетрагидрата
аллоксана, выход которых составляет 22—24 г, сушат до постоян-
постоянного веса в стеклянной чашке над концентрированной серной
кислотой. Полученное в результате вещество представляет собой
мелкий белый порошок (примечание 5), выход которого соста-
составляет 16 г.
Маточный раствор от перекристаллизации помещают в колбу
емкостью 250 мл, а затем при пониженном давлении и при тем-
температуре, не превышающей 30—40° (примечание 6), упаривают
до объема 8—10 мл. Концентрат после охлаждения в течение
ночи при 0° выделяет твердое вещество, которое отфильтро-
отфильтровывают, перекристаллизовывают из равного по весу количества
кипящей воды и сушат над серной кислотой. Вес полученного
вещества составляет около 2 г. Маточные растворы от обеих пере-
перекристаллизации присоединяют к первоначальному маточному
раствору от окисления и все вместе выпаривают досуха при пони-
пониженном давлении и при температуре, не превышающей 30—40е.
Полученный твердый остаток слегка окрашен в желтый цвет и
имеет резкий запах азотной кислоты. Его оставляют на несколько
дней в стеклянной чашке до исчезновения запаха, а затем раство-
растворяют в равном по весу количестве B—3 г) кипящей воды. Раствор
в течение нескольких дней охлаждают при температуре ниже 0°
(примечание 7); твердое вещество отфильтровывают, перекристал-
перекристаллизовывают из воды и сушат над серной кислотой (примечание 8).
Эта порция препарата весит около 0,5 г. Общий выход аллоксана
составляет 18—19 г (82—87% теоретич., считая, что вещество
после высушивания над концентрированной серной кислотой1
не содержит кристаллизационной воды; примечание 9).
Примечания
1. Такая большая колба необходима потому, что во время
реакции смесь сильно пенится.
2. Во время прибавления азотной кислоты реакция проходит
в очень незначительной степени, а потому и температура почти
не повышается. Прибавление кислоты занимает несколько минут.
3. Реакция проходит до конца приблизительно за полчаса.
4. Воду нельзя кипятить ни во время, ни после прибавления
кристаллов, так как это будет вызывать разложение аллоксана
на углекислоту, парабановую кислоту и аллоксантин.
5. Тетрагидрат аллоксана легко выветривается, постепенно
теряя часть кристаллизационной воды, и становится влажным,
если ему дать постоять при комнатной температуре. Поэтому
хранить тетрагидрат неудобно. При высушивании его над серной
кислотой большая часть кристаллов отдает всю воду; однако
если твердое вещество было недостаточно измельчено или не стояло
АЛЛОКСАН
11
над серной кислотой в течение нескольких недель, то, по всей
вероятности, некоторое количество моногидрата остается. Высу-
Высушивание тетрагидрата в сушильном шкафу может привести к мест-
местным перегревам и к разложению, которое, повидимому, начинается
при температуре, несколько превышающей 100°. При высушивании
в сушильном шкафу вещество может, кроме того, легко окра-
окраситься в красноватый цвет, если в воздухе имеются даже лишь
следы аммиака или аминов.
6. Более высокая температура может вызвать окисление и в
результате привести к бурной и даже взрывной реакции, возмож-
возможность которой возрастает по мере повышения концентрации азот-
азотной кислоты.
7. Аллоксан кристаллизуется из раствора значительно медлен-
медленнее, если он почти не содержит азотной кислоты и если в нем
присутствуют другие растворимые примеси; однако в разбавлен-
разбавленной азотной кислоте он менее растворим, чем в воде.
8. В растворе все еще содержится небольшое количество аллок-
аллоксана, так как маточный раствор продолжает медленно окраши-
окрашивать кожу в красный цвет и при стоянии выделяет аллоксантин
в результате разложения аллоксана. Аллоксантин можно выде-
выделить и снова использовать для реакции окисления. После того
как фильтрат простоит в течение некоторого времени, может выде-
выделиться еще около 0,3—0,5 г аллоксантина.
9. Авторы синтеза получили тот же выход (в процентах) при
применении исходных веществ в количествах, приблизительно
в 65 раз больших. Так, при окислении 1 610 г E молей) дигидрата
аллоксантина в 22-литровой колбе авторы получили первую пор-
порцию в 1 085 г, вторую в 160 г и третью в 28 г, т. е. всего было
получено 1 273 г аллоксана.
Другие методы получения
Аллоксан был получен медленным окислением аллоксантина
азотной кислотой при комнатной температуре2; непосредственным
окислением мочевой кислоты азотной кислотой3; окислением
мочевой кислоты хлором4, хлором и иодом5 или бромом6. Был
описан также синтез моногидрата аллоксана из бензальбарбиту-
ровой кислоты (стр. 12).
1Abderhalden, Biochemisches Handlexikon, Band 4, S. 1160.
2 L i e b i g, Ann., 147, 366 A868).
3 L i e b i g, Wohler, Ann., 26, 256 A838).
• В i 1 t z, Hehn, Ann., 413, 60 A916).
5 Brugnatelli, Ann. chim. phys., B), 8, 201 A818).
«Hardy, Ann. chim. phys., D), 2, 372 A864).
12
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
NH--CO
СО СНг + C6HSCHO
NH —CO
NH —CO
! I
со с=снсбн5
NH —СО
АЛЛОКСАН-МОНОГИДРАТ
NH —СО
> СО
L
,-сс
СНС6Н5 + Н2О
СгОз
NH —CO
NH —CO
CO . -
i IXOH
NH-CO
1/ОН
Х
С9Н5СО2Н
Предложили: Дж. Спир а Т. Дабович.
Проверили: В. Бахман и Р. Эджертон.
Получение
Бензальбарбитурсвая кислота. В 2-литровую трехгорлую
кругло донную колбу, снабженную эффективной мешалкой и обрат-
обратным холодильником, помещают смесь 128 г A моль) барбитуровой
кислоты («Синт. орг. преп.», сб. 2, стр. 79) и 1 250 мл воды и нагре-
нагревают ее на паровой бане до полного растворения (примечание 1).
После этого к раствору прибавляют 115 г (ПО мл, 1,08 моля)
бензальдегида, не прекращая нагревания и перемешивания. Из
раствора вскоре выпадает в осадок нерастворимая бензальбар-
битуровая кислота. Для завершения реакции смесь нагревают
на паровой бане в течение 1 часа, а затем фильтруют с отсасы-
отсасыванием (примечание 2). Отфильтрованное вещество промывают не-
несколькими порциями горячей воды и сушат при 100°. Выход бен-
зальбарбитуровой кислоты, слабо окрашенной в светложелтый
цвет, составляет 190—205 г (88—95% теоретич.). Вещество пла-
плавится при 254—256° и не нуждается в дальнейшей очистке.
А ллоксан- моногидрат. В 2-литровую трехгорлую кругло дон-
донную колбу, снабженную мешалкой и термометром, помещают
730 мл уксусной кислоты, 95 мл воды и 162 г A,62 моля)
хромового ангидрида (примечание 3). Пускают в ход мешалку
и нагревают смесь до 50°. В течение получаса к раствору доба-
добавляют небольшими порциями 180 г @,83 моля) бензальбарбитуро-
вой кислоты, а для поддержания температуры в пределах 50—60е
колбу охлаждают в бане с холодной водой. После того как вся
кислота будет прибавлена, для завершения реакции продолжают
перемешивание и поддерживают температуру при 50—60° с помощью
бани с теплой водой в течение еще получаса. Обычно аллоксан-
моногидрат начинает кристаллизоваться из еще теплого раствора.
Затем смесь охлаждают до 15° и фильтруют. Полученный препа-
препарат промывают на фильтре холодной ледяной уксусной кислотой
до тех пор, пока промывная жидкость не потеряет зеленой окраски;
затем с целью высушивания вещество промывают эфиром. Выход
АЛЛОКС АН-МОНОГИДРАТ
13
аллоксан-моногидрата, имеющего вид кристаллов желтого цвета,
составляет 105—112 г G9—84% теоретич.). Вещество плавится
(с разложением) при температуре около 254° (примечание 4); для
большинства целей оно достаточно чисто. В том случае, если
требуется получить совершенно бесцветный аллоксан-моногидрат
(примечание 5), 25 г желтых кристаллов растворяют в 37 мл горя-
горячей воды, раствор кипятят с активированным березовым углем и
фильтруют в горячем состоянии в круглодонную колбу емкостью
500 мл. Около 15—20 мл воды отгоняют на водяной бане при
пониженном давлении. Бесцветный кристаллический остаток
растворяют в минимальном количестве горячей воды, раствор
несколько охлаждают и приливают к нему 250 мл ледяной уксусной
кислоты. После стояния на холоду E—10°) в течение 4—6 час.
выпавший в осадок аллоксан-моногидрат отфильтровывают. Ве-
Вещество получается в виде бесцветных кристаллов; т. пл. 254°
(с разложением; примечание 6). Выход составляет 20—21 г
(80—84% взятого количества; примечание 7).
Примечания
1. Авторы синтеза сообщают, что в одном из опытов был исполь-
использован водно-спиртовой раствор пеперекристаллизованной барби-
барбитуровой кислоты, синтезированной по методу, описанному
в «Синт. орг. преп.», сб. 2, стр. 79. При этом было получено
с превосходным выходом вещество, повидимому, изомерного
строения, не пригодное для синтеза аллоксана.
2. Фильтровать можно в горячем или в холодном состоянии
по усмотрению работающего.
3. Технический хромовый ангидрид (в хлопьях) оказался
вполне пригодным.
4. Этот результат был получен при использовании капилляра
из стекла пирекс. Вещество остается желтым примерно до 254 ,
после чего оно внезапно разлагается с образованием жидкой
массы красного цвета и с бурным выделением газа. В случае
применения капилляра из легкоплавкого стекла вещество окра-
окрашивается в красный цвет при температуре около 180—200°
и плавится при 240—250°.
5. При перекристаллизации желтого препарата из ледяной
уксусной кислоты A2 мл кислоты на 1 г вещества) с применением
активированного березового угля проверявшие синтез неизменно
получали желтые кристаллы (с выходом 75—80% взятого коли-
количества) вместо бесцветных, как об этом сообщали авторы при-
приведенного метода. При прибавлении к горячему раствору аллок-
аллоксан-моногидрата в уксусной кислоте воды в объеме (в миллилит-
миллилитрах), равном весу (в граммах) растворенных кристаллов, проверяв-
проверявшие синтез получали вещество, слегка окрашенное в желтый цвет.
14
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
6. Этот результат был получен при использовании капилляра
из стекла пирекс. Бесцветное твердое вещество начинает желтеть
около 180°; оно плавится около 254° (иногда при 258—260°)
с образованием красной жидкости при бурном выделении газа.
7. Эти данные относятся к первой порции кристаллов.
Другие методы получения
Аллоксан-моногидрат был получен окислением мочевой кис-
кислоты хлором1'2 или хлорноватокислым калием и соляной кисло-
кислотой3; окислением аллоксантина4, ксантина8, урамила4 и тиоура-
мила6; гидролизом дибромбарбитуровой кислоты7. Описанный
здесь метод первоначально разработали Бильман и Берг8.
1 М с Е 1 v a i n, J. Am. Chem. Soc, 57, 1303 A935).
2 В i 1 t z, Heyn, Ann., 413, 60 A917).
'Fischer, Helferich, Anlcitung zur Darstellung organischer
Praparate, 10-te Auf., Braunschweig, 1922, S. 66.
' Wohler, L i e b i g, Ann., 26, 256 A838).
5 Fischer, Ann., 215, 310 A882).
«Fischer, А с h, Ann., 288, 160A895).
7 В а е у е г, Ann., 127, 230 A863); 130, 131 A864).
8 В i i 1 m a n n, Berg, Ber. 63,2201A930).
HN-C=O
АЛЛОКСАНТИ Н-ДИГИДРАТ
20=C C-NH
HN-C-NH
KC1O3
2O=
HN —C = 0
.OH
I X)H
H2S
HN-C =
HN —C =
O = C — NH
O =
¦O-
HN -
:=o • 2H,o
= 0
HO'
O = C — NH
Предложила: Д. Найтингел.
Проверили: Р. Шрайнер и К. Тилфорд.
Получение
В трехгорлую колбу емкостью 500 мл, снабженную мешалкой,
помещают 15 г @,09 моля) тщательно измельченной мочевой кис-
кислоты, 30 г B5,2 мл) концентрированной соляной кислоты и 40 мл
воды. Смесь нагревают до 30°, пускают в ход мешалку и в течение
не менее 45 мин. прибавляют к смеси небольшими порциями 4 г
@,014 моля) хлорноватокислого калия, растертого в мелкий поро-
АЛЛОКСАНТИН-ДИГИДРАТ
15
шок (примечание 1). Большая часть мочевой кислоты растворяется;
нерастворившийся остаток удаляют фильтрованием через пори-
пористый стеклянный фильтр. Прозрачный фильтрат разбавляют 30 мл
воды, а затем пропускают через него быстрый ток сероводорода
до полного насыщения (около 10—15 мин.). В осадок выпадают
сера и аллоксантин. Смесь охлаждают в бане со льдом до тех
пор, пока осаждение не закончится; для этого требуется 2—3 часа.
Твердое вещество отфильтровывают на воронке Бюхнера
и промывают тремя порциями холодной воды по 30 мл. Аллоксан-
Аллоксантин растворяют, для чего неочищенное вещество кипятят в течение
15 мип. с 250 мл воды и горячий раствор фильтруют для удаления
серы (примечание 2). Аллоксантин-дигидрат кристаллизуется из
фильтрата в виде блестящих пластинок, которые отжимают по
возможности досуха на воронке Бюхнера, промывают 30 мл
эфира и сушат в вакуум-эксикаторе (примечание 3). Выход
составляет 8—10 г E5—69% теоретич.; примечание 4). Вещество
плавится (с разложением) при 234—238° (примечание 5); оно доста-
достаточно чисто для большинства целей.
Примечания
1. Важно поддерживать температуру реакционной смеси око-
около 30°. Хлорноватокислый калий следует прибавлять медленно.
2. Так как аллоксантин плохо растворим, желательно обра-
обработать серу вторично, чтобы иметь уверенность в том, что весь
аллоксантин отделен.
3. При стоянии на воздухе соединение постепенно окраши-
окрашивается в розовый цвет. Его следует сохранять в герметически
закрытой склянке или держать в вакуум-эксикаторе над хлори-
хлористым кальцием.
4. Если желательно получить большие количества конечного
вещества, то лучше окислять несколько порций мочевой кислоты
по 15 г и перед экстрагированием объединять смеси серы и алло-
аллоксантина,- полученные в разных опытах.
5. Кристаллизационную воду можно удалить, нагревая ди-
гидратв течение 2час. при 120—150° ввакууме. Указанные в лите-
литературе величины температуры плавления значительно разнятся
между собой. Безводное вещество становится желтым при
225—230° и разлагается в температурных пределах от 238—242°
до 253—255° в зависимости от скорости нагревания. Темпе-
Температура мгновенного разложения, определенная с помощью блока
Макенна, равна 270—275°.
Другие методы получения
Приведенная выше методика в основном та же, что и описанная
в лабораторном руководстве Фишера и Гельфериха1.
16
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Аллоксантин был получен окислением мочевой кислоты азот-
азотной кислотой с последующим восстановлением сероводородом2;
окислением мочевой кислоты хлорноватокислым калием с после-
последующим восстановлением хлористым оловом3; конденсацией аллок-
сапа с диалуровой кислотой в водном растворе4; окислением диа-
луровой кислоты0.
1 Fischer, Helferi ch, Anleilung zur Darstellung organischer
Priiparate, 10-te Auf., Braunschweig, 1922, S. 66, 67; D о j a, M о k e e t,
J. Indian Chem. Soc, 13, 542 A936).
2 D e n i g e s, Bull. soc. pharm. Bordeaux, 66, 8—12 A928) [C. A.,
23, 4160 A929I.
3 D a v i d s о n, E p s t e i n, J. Org. Chem., I. 305 A936).
4 W 6 h 1 e r, L i e b i g, Ann.. 26, 279 A838); В e h r e n d, Frie-
d e r i с h s, там же, 344, 1 A906).
5 В а е у е г, Ann., 127, 11 A863).
АЛЬДЕГИД МЕЗИТИЛЕНКАРБОНОВОЙ КИСЛОТЫ
B,4,6-Триметилбензальдегид)
СПОСОБ ПОЛУЧЕНИЯ ПО РОЗЕНМУНДУ ВОССТАНОВЛЕНИЕМ ХЛОРАНГИДРИДА
сн,
ЧС0С1
112
Pd-BaSOi
сн
СН3
' ,сно
сня
-на
Предложил: Р. Барнес.
Проверили: Н. Дрэйк, Г. Анспон и Р. Мозинго.
Получение
Трехгорлую колбу емкостью 1 л снабжают мешалкой с ртутным
затвором (примечания 1 и 2), стеклянной трубкой с внутренним
диаметром 6 мм, доходящей до дна колбы, и змеевиковым холо-
холодильником, защищенным хлоркальциевой трубкой. В приборе все-
соединения должны быть на шлифах. В колбу помещают раствор
90 г @,49 моля) хлорангидрида 2,4,6-триметилбензойной кислоты
(стр. 462) в 270 г тщательно высушенного ксилола, а также 20 г
палладия, осажденного на сернокислом барии, в качестве ката-
катализатора (примечание 3). Содержимое колбы поддерживают при
слабом кипении, одновременно пропуская через реакционную
массу ток водорода (примечание 4), предварительно освобож-
освобожденного от кислорода пропусканием через раствор Физера1 и вы-
высушенного пропусканием сперва через концентрированную сер-
серную кислоту, а затем через осушительную трубку с драйери-
том* (примечание 5). Водород пропускают до тех пор, пока
* Драйерит—гранулированный безводный сернокислый кальций, специ-
специально предназначенный для применения в качестве осушителя. (Прим. ред.).
АЛЬДЕГИД МЕЗИТИЛЕНКАРВОНОВОЙ КИСЛОТЫ
17
не прекратится выделение хлористого водорода (примечание 2).
Катализатор отфильтровывают и ксилол отгоняют. Оставшуюся
жидкость переносят в специальную колбу Клайзена емкостью
125 мл и перегоняют. Температура кипения полученного веще-
вещества 96—98° F мм); выход составляет 53—60 г G0—80%теоретич.;
примечание 6).
Примечания
1. Применение мешалки не обязательно, однако без мешалки
время, необходимое для восстановления, увеличивается почти
втрое.
2. За течением реакции удобно следить, если отходящие газы
пропускать в воду и оттитровывать примерно 1 н. раствором едкого
натра. Для полного восстановления требуется 6—7 час. в случае
применения мешалки и около 18 час. при работе без мешалки,
3. Катализатор—палладий на сернокислом барии—получают
по методу, который описал Губен2. Сернокислый барий должен
быть свежеосажденным.
4. Проверявшие синтез нашли, что при применении электроли-
электролитического водорода, непосредственно взятого из баллона без пред-
предварительной очистки, выход получается лишь немного меньшим.
5. Не следует применять ангидрон (дегидрит)*, так как имеется
опасность, что на него могут попасть брызги серной кислоты.
Драйерит значительно эффективнее хлористого кальция.
6. Этот синтез является примером применения метода Розен-
мунда для получения альдегидов без отравления катализатора.
Более общая методика приведена на стр. 328.
СПОСОБ ПОЛУЧЕНИЯ ИЗ МЕЗИТИЛЕНА,
ЦИАНИСТОГО ЦИНКА И ХЛОРИСТОГО АЛЮМИНИЯ
СН3
+ Zn(CNJ + 4HC1
сн3
СН = NH • НС1
AICI3
СН = NH • НС1
няс/чсня
+ ZnCl3
н.,с
сно
+ Н2О _"
HCI
СН3
Предложили: Р. Фьюзон, Э. Хорнинг, С. Роулэнд и М. У орд.
Проверили: Ч. Аллен и Дж. ВанАллан.
* Ангидрон и дегидрит—различные названия гранулированного без-
безводного перхлората магния, специально предназначенного для применения
в качестве осушителя. (Прим.. ред.)
2 Сборник 3
18
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Получение
В 1-литровую трехгорлую круглодонную колбу, снабженную
эффективной мешалкой, обратным холодильником, трубкой для
ввода газа и термометром (примечания 1 и 2), помещают 102 г
A18 мл, 0,85 моля) мезитилена («Синт. орг. преп.», сб. 1, стр. 242),
147 г A,25 моля) цианистого цинка (примечание 3) и 400 мл тетра- •
хлорэтана (примечание 4). Трубку для ввода газа соединяют
с источником хлористого водорода (примечание 5) и перемеши-
перемешивают смесь при комнатной температуре, одновременно пропуская
через нее быстрый ток сухого хлористого водорода до тех пор,
пока цианистый цинк не разложится; обычно это занимает 3 часа.
Затем колбу погружают в баню со льдом, трубку для ввода газа
удаляют и к смеси прибавляют при очень энергичном перемеши-
перемешивании 293 г B,2 моля) тщательно измельченного безводного хлори-
хлористого алюминия (примечания 6 и 7). После этого баню со льдом от-
отставляют и возобновляют пропускание хлористого водорода в тече-
течение всего остального периода реакции. Теплота реакции доста-
достаточна для того, чтобы смесь медленно разогревалась; через 1 час
температура ее повышается примерно до 70D. Температуру поддер-
поддерживают при 67—72° в течение еще 2,5 часа. Охлажденную смесь
разлагают, осторожно выливая ее при перемешивании от руки
в 4-литровый сосуд, до половины заполненный колотым льдом,
к которому добавлено 100 мл концентрированной соляной кислоты.
Смесь оставляют на ночь; затем ее переносят в 3-литровую кругло-
круглодонную колбу и кипятят с обратным холодильником в течение
3 час. Слой органического вещества отделяют, а водный слой
экстрагируют один раз 50 ял тетрахлорэтана. Соединенные вместе
растворы вещества в тетрахлорэтане промывают 150 мл 10%-ного
раствора соды и перегоняют с водяным паром. Первые 800—900 мл
дестиллата собирают отдельно для регенерирования растворителя
(примечания 8 и 9); вторую порцию собирают до тех пор, пока
в приемник не перестанут переходить маслянистые капли (при-
(примечание 10). Этот дестиллат экстрагируют 500 мл бензола, раство-
растворитель отгоняют на паровой бане и остаток перегоняют из спе-
специальной колбы Клайзсна емкостью 250 мл (стр. 68). При
118—12Г A6 мм) после отделения небольшого головного погона
перегоняется альдегид мезитиленкарбоновой кислоты. Выход
составляет 95—102 г G5—81% теоретич.; примечания 11 и 12).
Примечания
1. Ввиду ядовитых свойств тетрахлорэтана и цианистого водо-
водорода все стадии синтеза до конечной перегонки следует проводить
в хорошо действующем вытяжном шкафу.
АЛЬДЕГИД МЕЗИТИЛЕНКАРБОНОВОЙ КИСЛОТЫ
19
2. Термометр удобно поместить в трубку для ввода газа.
Шарик его должен быть погружен в жидкость, тогда как сама
трубка должна оканчиваться только немного ниже поверхности
жидкости.
3. Можно пользоваться продажным цианистым цинком или же
получить его согласно указаниям Адамса и Левина3. Однако
цианистый цинк хуже вступает в реакцию, если он слишком тща-
тщательно очищен4.
4. Тетрахлорэтан является ядовитым веществом, поэтому рабо-
работать с ним следует с должной осторожностью.
5. Удобнее всего пользоваться хлористым водородом из бал-
баллона. Однако его можно легко получить и в лаборатории («Синт.
орг. преп.», сб. 1, стр. 214).
6. Удобнее прибавлять цианистый
цинк и хлористый алюминий вместе;
однако применение такой методики ве-
ведет к понижению выхода.
7. Прибор, изображенный на рис. 1,
весьма удобен. Коническая колба ем-
емкостью 250 мл соединена с боковым гор-
горлом круглодонной колбы при помощи
тонкостенной резиновой трубки5 диа-
диаметром 20 лш и длиной 13 см.
8. Если слой органического веще-
вещества плохо отделяется, то можно под-
подвергнуть перегонке с водяным паром
весь раствор.
9. Первая порция дестиллата состоит
почти целиком из тетрахлорэтана и во-
воды. Растворитель можно регенериро-
регенерировать, для чего отделяют органический
слой, сушат его над хлористым каль-
кальцием и перегоняют.
10. Получают около 9 л воды. Для этого требуется около
4 час.
11. Если можно удовольствоваться меньшим выходом, а же-
желательно сократить время синтеза, то последний проводят без
растворителя, по методике, в которую внесены следующие изме-
изменения. Цианистый цинк и хлористый алюминий смешивают пу-
путем встряхивания, к смеси прибавляют мезитилен и реакцион-
реакционную колбу погружают в масляную баню при температуре 100°.
Пускают в ход мешалку и в смесь, под поверхность жидкости,
пропускают в течение 4 час. очень быстрый ток сухого хлористого
водорода; по истечении этого времени доступ газа прекращают,
а перемешивание и нагревание продолжают в течение еще 2 час.
После этого реакционную смесь разлагают и обрабатывают,
2*
Рис. 1.
20
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
как было описано выше. Фракция, кипящая при ПО—120°
(9—10 мм), представляет собой альдегид мезитиленкарбоновой
кислоты; выход составляет 73% теоретического количества.
(Д. Гласе, частное сообщение.)
12. 2,4,6-Триэтилбензальдегид и 2,4,6-триизопропилбензальде-
гид можно получить с выходами соответственно 69 и 65% по
описанной выше методике при длительности реакции 8 час. В про-
пропись вносятся следующие изменения:
Углеводород
Цианистый цинк
Хлористый алюминий
Температура кипения
Триэтилбензальдегид
100 г @,62 моля)
115 » @,97 » )
215 » A,60 » )
146—149° B1 мм)
Триизопропилбензальдегид
100 г @,49 моля)
102 » @,74 » )
134 » A,0 моль)
123—126° D мм)
Другие методы получения
Альдегид мезитиленкарбоновой кислоты был получен из мези-
тилгляоксилозой кислоты 6'17; из мезитилена, карбонила никеля и
хлористого алюминия8; с прекрасным выходом из мезитилена,
цианистого водорода и хлористого водорода; из мезитилена, угле-
углекислоты и хлористого водорода в присутствии хлористого алю-
алюминия и хлористой меди9. Методику восстановления хлорангид-
рида Розенмунд и Цетцше10 предложили для получения других
альдегидов. Способ получения альдегида мезитиленкарбоновой
кислоты из мезитилена, цианистого цинка и хлористого водорода
в присутствии хлористого алюминия опубликован в литера-
литературе113.
1 F i e s e г,
2 Г у б е н,
1941, стр. 443.
3 Adams,
4 Arnold
5 F i e s e r,
J. Am. Chem. Soc, 46, 2639 A924).
Методы органической химии, т. 2, вып. 1, Госхнмиздат,
L e v i n e, J. Am. Chem. Soc
Sprung. J. Am. Chem. Soc
45, 2375 A923).
. ., Experiments in Organic Chemistry, N. Y., 1941, p. 311.
6 Bouveault, Compt. rend., 124, 157 A897).
' Fei t h, Ber., 24, 3542 A891).
8 D e w a r, Jones, J. Chem. Soc, 1904, 219.
•Bayer und Ко., герм. пат. 98706 [Chem. Zentr., 69, II, 952
A898)]; герм. пат. 99568 [Chem. Zentr., 70, I, 461 A899)].
10 Rosenmund, Ber., 51, 585 A918); Rosenmund, Zetz-
s с h e, там же, 54, 425 A921).
11 F о s о в, Horning, Ward, Rowland, Marsh, J. Am.
Chem. Soc, 64, 31 A942).
12 H i n k e 1, А у 1 i n g, Morgan, J. Chem. Soc, 1932, 2797,
13 H i n k e 1, А у 1 i n g, В с у п о n, J. Chem. Soc., 1936, 342.
АЛЬДЕГИДОФТАЛЕВАЯ КИСЛОТА
АЛЬДЕГИДОФТАЛЕВАЯ КИСЛОТА
О О
хсн.
о
¦О+НВг
СНВг
/О + Н2О
I |
I /'СНО
+НВг
Предложили: Р. Шрайнер и Ф. Вольф.
Проверили: Л. Смит, Р. Арнольд и В. Фраджола.
Получение
2-Бромфталид. Для бромирования применяют прибор, изобра-
изображенный на рис. 2. Емкости колб А и Б равны 200 мл. Бром вводят
при помощи тока углекислого газа, который пропускают через
счетчик пузырьков с минеральным маслом или серной кислотой,
затем через бром в колбе Б и, наконец, через осушительную колон-
колонку. Последнюю удобнее всего изготовить из рубашки холодиль-
холодильника и заполнить безводным хлористым кальцием. Колбу А
погружают в масляную баню и снабжают термометром, трубкой
большого диаметра для отвода газа, соединенной с ловушкой для
улавливания газов, и трубкой для ввода газа с внутренним диаме-
диаметром 2 'мм. Трубка для ввода газа должна доходить до дна колбы.
В реакционную колбу А помещают 134 г A моль) фталида
(примечание 1). В колбу Б помещают 160 г E3,5'мл, 1 моль) брома.
Температуру масляной бани поддерживают при 140—155°; угле-
углекислый газ начинают пропускать, когда температура фталида до-
достигнет 140°. Температуру внутри колбы А поддерживают при
135—150° в течение всего времени протекания реакции (примеча-
(примечание 2). Углекислый газ пропускают с такой скоростью, чтобы в
трубке для отвода газа не наблюдалось присутствия паров брома
E—8 пузырьков в секунду). После того как в приборе не будет
более заметна окраска брома, углекислый газ пропускают в тече-
течение еще получаса. Реакция заканчивается через 10—13 час, в за-
зависимости от скорости, с которой бром вводится в реакционную
смесь.
Еще теплую реакционную массу переносят в специальную
колбу Клайзена емкостью 250 шл («Синт. орг. преп.», сб. 1,
22
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
<тр. 142, рис. 8), приспособленную для перегонки в вакууме. Если
в реакционной смеси осталось небольшое количество бромистого
водорода, то его удаляют нагреванием смеси до 120° в вакууме
водоструйного насоса, после чего вещество перегоняют при пони-
жснном]давлении. Головная фракция (менее 15 г) состоит главным
Стемяниая_
вата
СО,-
Нловушне для
—•- улавливания
газов
Бром
Рис. 2.
образом из фталида (примечание 3). Выход 2-бромфталида, кото-
который перегоняется при 138—142° D мм) [128—132° B мм)], соста-
составляет 175—178 г (82—83% теоретич,, считая на фталид; примеча-
примечание 4). Препарат получается в виде прозрачной бесцветной жид-
жидкости, которая превращается в твердое вещество с т. пл. 69—73°.
Перегнанный препарат пригоден для последующего гидролиза,
однако его можно очистить перекристаллизацией из 100 мл
четыреххлористого углерода. По охлаждении получают 100 г
чистого 2-бромфталида с т. пл. 75°. Упариванием маточного
раствора получают дополнительно 30—-40 г вещества желтоватого
цвета.
Альдегидофталевая кислота. Все количество дестиллата поме-
помещают в колбу емкостью 500 мл и приливают к нему 230 мл воды.
Колбу снабжают механической мешалкой и нагревают на паро-
паровом нагревателе. Гидролиз можно считать законченным, когда
исчезнет слой 2-бромфталида (примерно через полчаса). Реак-
Реакционную смесь помещают на ночь в холодильник, в результате
чего вся масса затвердевает. Твердое вещество отфильтровы-
АЛЬДЕГИДОФТАЛЕВАЯ КИСЛОТА
23
вают, промывают двумя порциями ледяной воды по 50 мл и сушат
на воздухе. Выход неочищенной альдегидофталевой кислоты
ст. пл. 60—65° (примечание 5) составляет 140—160 г.
Сырой препарат перекристаллизовывают из 400 мл горячей
воды и сушат на воздухе. Перскристаллизованное вещество бес-
бесцветно; оно плавится при 95—96°. Выход составляет 97—102 г
G8—83% теоретич., считая на 2-бромфталид, или 65—68%, счи-
считая на фталид).
Примечания
1. Авторы синтеза и проверявшие его применяли продаж-
продажный фталид; его можно также синтезировать с выходом 82,5%
гидрированием фталевого ангидрида в бензольном растворе при
270° под давлением 210 am в присутствии хромита меди1 или
с выходом 61—71 % из фталимида по методу, описанному в «Синт.
орг. преп.», сб. 2, стр. 533.
2. При температуре ниже 135° бромирование протекает с тру-
трудом; при температуре выше 155° реакционная масса сильно темнеет
и выход бромфталида падает.
3. После удаления всего фталида наблюдается изменение кри-
кристаллической структуры дестиллата.
4. Проверявшие синтез неизменно получали выходы не ниже
87°о; в одном из опытов выход вещества с т. пл. 78° составлял 95%.
5. В одном из опытов проверявшие синтез получили 180 г
вещества с т. пл. 67°. После перекристаллизации этот препарат
плавился при 94,5—95°; выход составлял 121 г, что соответ-
соответствует 84,9% теоретического количества, считая на 2-бромфталид,
или 80%, считая на фталид. Неочищенное вещество упорно удер-
удерживает воду, которую можно удалить, если оставить препарат
в вакуум-эксикаторе над драйеритом*.
Другие методы получения
К методам, перечисленным в «Синт. орг. преп.», сб. 2, стр. 28,
можно прибавить два следующих: гидролиз 2-хлорфталида2
и действие углекислоты и металлического натрия под давлением
на о-хлорбензальдегид3. Метод, описанный выше, в основном раз-
разработан Расином4.
1Austin, Bousquet, Lazier, J. Am. Chem. Soc, 59, 864
A937).
11 Austin, Bousquet, ам. пат. 2047946 [С. А., 30, 6011 A936)].
3Morton, Le Fevre, Hechenbleikner, J. Am. Chem.
Soc, 58, 754 A936).
4 Racine, Ann., 239, 79 A887).
* См. подстрочное примечание на стр. 16.
24
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
(СН3JСНСООН
АМИД ИЗОМАСЛЯНОЙ КИСЛОТЫ
(И зобу/пирамид)
NHs
soci2
(СН3JСНСОС1
(CH3JCHCONH2
Предложили: Р. Кент и С. Мак-Эльвен*
Проверили: К- Ноллер и Д. Фразиер.
Получение
Хлорангидрид изомасляной кислоты. Трехгорлую колбу емко-
емкостью 1 л снабжают капельной воронкой емкостью 250 мл, эффек-
эффективной мешалкой с затвором из резиновой трубки, смазанной гли-
глицерином (стр. 225), и эффективным холодильником (примечание 1).
Воду, подаваемую в холодильник, охлаждают до 0°, а колбу погру-
погружают в большую баню с холодной водой. Прибор устанавливают
в вытяжном шкафу и к верхней части холодильника присоединяют
ловушку для поглощения газов («Синт. орг. преп.», сб. 2, стр. 78,
рис. 3).
В колбу помещают 542 г D,55 моля) хлористого тионила и
прибавляют к нему по каплям при быстром перемешивании 352 г
D моля) изомасляной кислоты (примечание 2). Происходит обиль-
обильное выделение хлористого водорода и сернистого газа. Когда все
количество кислоты будет прибавлено, водяную баню нагревают
до 80°, и эту температуру поддерживают в течение получаса, не
прерывая перемешивания. Затем реакционную смесь перегоняют
с елочным дефлегматором высотой 30 см на масляной бане, кото-
которую нагревают на электрической плитке (примечание 3). Голов-
Головной погон, отгоняющийся до 89°, составляет 44 г. Выход хлорап-
гидрида изомасляной кислоты, который собирают при 89—93°,
составляет 351 г. Вес остатка равен 49 г. Если соединить вместе
головной погон и остаток и вновь подвергнуть их медленной пере-
перегонке, то можно получить дополнительно 33 г хлор ангидрида.
Общий выход составляет 384 г (90% теоретич.). Повторная пере-
перегонка дает препарат, окрашенный в бледножелтый цвет, с т. кип.
90—92° (примечания 4 и 5).
Амид изомасляной кислоты. В 3-литровую колбу, погруженную'
в охлаждающую смесь из льда и соли и снабженную эффективной
мешалкой и капельной воронкой емкостью 500 мл, помещают
1 250 мл холодного концентрированного водного аммиака (около
28%). К этому раствору прибавляют по каплям при быстром пере-
перемешивании 318 г C моля) хлорангидрида изомасляной кислоты
с такой скоростью, чтобы температура реакционной смеси не под-
поднималась выше 15° и чтобы выделение белых паров (главным обра-
образом хлористого аммония) не стало слишком бурным. Перемеши-
Перемешивание продолжают в течение еще 1 часа после того, как будет
закончено прибавление хлорангидрида.
АМИД ИЗОМАСЛЯЫО11 КИСЛОТЫ
Колбу нагревают с помощью пара в большой жестяной банке
и реакционную смесь выпаривают досуха в вакууме (примеча-
(примечание 6). Сухой остаток хлористого аммония и амида изомасляной
кислоты кипятят в течение 10 мин. с 2 л сухого этилацетата и кипя-
кипящий р аствор быстро фильтр уют через складчатый бумажный фильтр,
помещенный в большую воронку с обогревом. Остаток на фильтре
экстрагируют таким же образом двумя порциями этилацетата
по 1 л. Соединенные вместе вытяжки охлаждают до 0° и выделив-
выделившиеся кристаллы амида отфильтровывают. Фильтрат упаривают
примерно до 300 мл, охлаждают и получают вторую порцию амида
(примечания 7 и 8). Обе порции амида изомасляной кислоты соеди-
соединяют вместе и сушат сперва в течение 3 час. в сушильном шкафу
при 70е, а затем в вакуум-эксикаторе. Выход вещества, имею-
имеющего вид блестящих бесцветных игл, составляет 203—215 г G8—
83% теоретич.); т. пл. 127—129° (примечание 9). Этот препарат
пригоден для получения нитрила изомасляной кислоты.
Примечания
1. Можно рекомендовать эффективный холодильник Фридрихса.
В нем имеется внутренний охлаждающий змеевик, вокруг кото-
которого конденсируются проходящие пары. Авторы синтеза поль-
пользовались при сборке приборов только резиновыми пробками.
2. Продажная изомасляная кислота была перегнана и взята
фракция с т. кип. 151—153°.
3. Авторы синтеза пользовались масляной баней с электри-
электрическим подогревом.
4. При использовании в реакции 5 молей хлористого тионила
и 4 молей изомасляной кислоты выход вещества при первой пере-
перегонке составлял 83% теоретического количества; при повторной
перегонке головного погона было получено дополнительно 7%.
Высококипящий остаток практически отсутствовал.
5. Авторы получали тот же выход (в процентах) и в опытах
с четырехкратными количествами исходных реагентов.
6. Железная банка должна быть достаточно велика для того,
чтобы реакционная колба помещалась в ней целиком. В противном
случае выпаривание будет происходить очень медленно.
7. Если смесь амида и хлористого аммония не была абсолютно
сухой, то отделяемый на этой стадии этилацетат будет содержать
воду, и его, прежде чем применять вновь, необходимо высушить
и перегнать.
8. Фильтрат, полученный после отделения второй порции
амида, можно выпарить досуха и остаток перекристаллизовать
из смеси этилацетата и фракции петролейного эфира с т. кип.
60—68°. Перерабатывать фильтрат от второй порции амида с
целью получения третьей порции имеет смысл только в том
26
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
случае, если будут собраны маточные растворы от нескольких
синтезов.
9. Авторы синтеза получали тот же выход (в процентах) при
применении удвоенных количеств исходных веществ.
Другие методы получения
Амид изомасляной кислоты был получен действием концентри-
концентрированного водного аммиака на хлорангидрид изомасляйой кисло-
кислоты1 или на метиловый эфир изомасляной кислоты2; перегонкой
аммонийной соли изомасляной кислоты3или смеси изомасляной
кислоты и роданистого калия4. Омыление изобутиронитрила также
приводит к образованию амида изомасляной кислоты5.
1 A s с h а п, Вег., 31, 2348 A898).
2 М е у е г, Monatsh., 27, 43 A906).
3 Н о f га а п п, Вег., 15, 982 A882).
4 Letts, Вег., 5, 671 A872).
¦'Hoffmann, В а г Ь i e r, Bull. soc. chim. Belg., 45, 565 A936)
[С. А., 31, 919 A937)].
АМИД МИНДАЛЬНОЙ КИСЛОТЫ
н
сен5снонсоон + сн3сосн3
H2SO4
I
свн,с — с=о + н2о
J I
о о
\/
с
/\
СН С
н
С6Н5С— С = О +NH3 -> C6H6CHOHCONH2+CH3COCH3
о о
V
/\
сн3 сн3
Предложили: Л. Аудрит и М. Сведа.
Проверили: Г. Адкинс и У. Бэйтмэн.
Получение
В 440 мл F,2 моля) ацетона растворяют 146 г @,96 моля) мин-
миндальной кислоты и полученный раствор переносят в 2-литровую
трехгорлую колбу, снабженную эффективной мешалкой, капель-
АМИД МИНДАЛЬНОЙ КИСЛОТЫ
27
ной воронкой и термометром. Реакционную колбу устанавливают
в баню со льдом и солью и через капельную воронку прибавляют
к ее содержимому 98 г концентрированной серной кислоты (уд.
вес 1,84) с такой скоростью, чтобы температура смеси не поднима-
поднималась выше —10°. Затем реакционную смесь выливают в охлажден-
охлажденный до 0° раствор соды, содержащий 200 г безводного углекислого
натрия в 1 800 мл воды. Из раствора выпадает в осадок продукт
взаимодействия миндальной кислоты и ацетона. Неочищенный
препарат с целью промывания растирают с водой B00 мл),
а затем фильтруют и сушат над хлористым кальцием в ваку-
вакууме. Выход неочищенного вещества составляет 181 г (приме-
(примечание 1).
Продукт взаимодействия миндальной кислоты и ацетона при-
прибавляют небольшими порциями к 1 800 мл жидкого аммиака
(примечание 2), помещенного в два посеребренных шаровых
сосуда Дьюара. Каждый из сосудов закрывают пробкой, через
которую проходит капиллярная трубка, служащая для отвода
газообразного аммиака. Сосуды оставляют стоять в течение
ночи, для того чтобы дать возможность завершиться про-
процессу аммонолиза, а затем содержимое их переливают в от-
открытые стаканы с целью облегчения быстрого испарения жидкого
аммиака.
После того как аммиак будет удален, к оставшейся порошко-
порошкообразной массе приливают 475 мл горячего абсолютного спирта
и полученный раствор отфильтровывают от нерастворимых при-
примесей на воронке для горячего фильтрования. По охлаждении
в бане со льдом из фильтрата выпадают в осадок блестящие белые
кристаллы амида миндальной кислоты с т. пл. 132°; выход со-
составляет 90 г F2% теоретич., считая на миндальную кислоту;
примечания 3 и 4).
Примечания
1. Неочищенное вещество содержит различные количества
углекислого натрия, которые трудно удалить. Эти примеси
нерастворимы в жидком аммиаке, и поэтому полученный препарат
можно подвергнуть аммонолизу без дальнейшей очистки.
Продукт взаимодействия миндальной- кислоты и ацетона можно
очистить, если перекристаллизовать его из абсолютного спирта.
Получается вещество ст. пл. 45°.
2. Растворимость продукта взаимодействия миндальной кис-
кислоты и ацетона в жидком аммиаке при температуре его кипения
составляет окол'о 10 г на 100 мл.
3. Если осторожно упарить спиртовой маточный раствор, то
можно получить дополнительное количество амида миндальной
кислоты.
28
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
4. Настоящий метод является общим методом получения ами-
амидов а-окси кислот.
Другие методы получения
Амид миндальной кислоты был получен при действии на эти-
этиловый эфир кислоты концентрированного водного аммиака x-2
или при действии на метиловый эфир кислоты насыщенного
спиртового раствора аммиака3. Эфиры миндальной кислоты обра-
обрабатывали также жидким аммиаком при температуре его кипе-
кипения4; этот процесс был усовершенствован применением аммиака
при повышенном давлении и при более высокой температуре5.
Описанную в настоящем синтезе методику впервые применил
Оеда6.
1 В е у е г, J. prakt. Chem., B), 31, 390 A885).
8 Е i n h о г п, Feibelmann, Ann., 361, 145 A908).
3 М с К е n z i e, Wren, J. Chem. Soc, 93, 311 A908).
4 G 1 a t t f e 1 d, M а с M i 1 1 a n, J. Am. Chem. Soc, 58, 898 A936).
6 Kleinberg, Audrieth, J. Org. Chem., 3, 312 A938).
6 б е d a, Bull. Chem. Soc. Japan, 11, 385 A936).
АМИД МОЛОЧНОЙ КИСЛОТЫ
(Лактамид)
СН3СН(ОН)СОаС2Н, + NH3 -^ CH3CH(OH)CONH2 + C2H6OH
Предложили: Дж. Клейнберг и Л. At/dpum.
Проверили: Г. Адкинс и У. Бэйтмэн.
Получение
В сосуд из стекла пирекс помещают 125 г A,06 моля) этилового
эфира молочной кислоты, после чего сосуд охлаждают смесью
твердой углекислоты и ацетона. Когда эфир молочной кислоты
будет охлажден ниже температуры кипения аммиака (примеча-
(примечание 1), к нему прибавляют 125 мл жидкого аммиака (примечание
2). Затем смесь помещают в специально сконструированный
стальной сосуд для работы под давлением (примечание 3) и оста-
оставляют стоять до тех пор, пока она не примет комнатную темпе-
температуру. По истечении суток (примечание 4) избытку аммиака
предоставляют медленно испаряться через выходное отверстие
сосуда. Последние следы аммиака удаляют в вакууме. Продукт
реакции перемешивают с 200 мл абсолютного эфира, чтобы пере-
амид молочной кислоты
29
вести в раствор непрореагировавший эфир молочной кислоты
и спирт. Остаток отфильтровывают, промывают эфиром и сушат
на воздухе. Выход амида молочной кислоты с т. пл. 74—75° со-
составляет 65—70 г G0—74% теоретич.; примечание 5).
Примечания
1. Необходимо соблюдать осторожность и охладить эфир
молочной кислоты ниже температуры кипения аммиака прежде,
чем будет прибавлен жидкий аммиак, во избежание потерь эфира
вследствие разбрызгивания.
вентиль для выпусна
аттиана диам. 6,4мм
Г
Рис. 3. Все размеры даны в миллиметрах.
2. Относительно экспериментальной методики по работе
с жидким аммиаком см. книгу Франклина «Система азотистых
соединений» (Franklin, The Nitrogen System of Compounds,
A. C. S. Monograph 68, приложение, Reinhold Publishing Corpo-
Corporation, N. Y., 1935), а также статью Фернелиуса и Джонсона
[Fernelius, Johnson, J. Chem. Education, 6, 441 A929)].
30
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
3. Стальной автоклав, в котором проводят реакцию, изображен
на рис. 3. Он состоит из изготовленной из обыкновенной стали
цилиндрической трубки А, к которой приварено стальное дно Б.
К верхней части сосуда приварен 25-миллиметровый фланец В,
выступающий над верхней частью сосуда приблизительно на
4,7 мм. Крышка из нержавеющей стали укрепляется при помощи
шести стальных болтов Г. Герметичность достигается за счет того,
что в выемку Д помещают свинцовую прокладку Е. Верхняя
часть Ж сделана таким образом, что она плотно прижимает про-
прокладку Е. Стальной аммиачный вентиль диаметром около 6 мм
служит для вывода газа. Соответствующие размеры приведены
на рисунке. Проверявшие синтез проводили реакцию в стек-
стеклянном стакане, который вставлялся в стальной автоклав,
обычно применяемый для гидрирования при давлениях
50—500 am 1.
4. Большая продолжительность проведения реакции не при-
приводила к увеличению выхода амида.
5. Эта методика применялась для получения большого числа
амидов2. Однако в случае целого ряда сложных эфиров реакцион-
реакционную смесь следует нагревать в течение нескольких часов при
200—250°. Этиловый эфир миндальной кислоты, аналогично этило-
этиловому эфиру молочной кислоты, дает хороший выход амида мин-
миндальной кислоты G5—80?4 теоретич.) уже при комнатной тем-
температуре.
Другие методы получения
Амид молочной кислоты был получен действием газообразного
аммиака на этиловый эфир молочной кислоты3, на ангидрид молоч-
молочной кислоты4, а также на лактид5. Амид был синтезирован с пре-
превосходными выходами при действии аммиака на продукт конден-
конденсации ацетона с молочной кислотой0. Амиды были также полу-
получены взаимодействием жидкого аммиака со сложными эфирами
при температурах от —33 до +250° 2-'-8.
1 A d k i n s. Reactions of Hydrogen with Organic Compounds over
Copper-Chromium Oxide and Nickel Catalysts, University of Wisconsin Press,
Madison, Wisconsin, 1937, p. 31; Ind. Eng. Chem., Anal. Ed., 4, 342 A932).
2 W о j с i k, A d к i n s, J. Am. Chem. Soc, 56, 2421 A934); P a A e n,
A d к i n s, там же, 58, 2497 A936).
3 В runing, Ann., 104, 197 A857).
' Wurtz, Friedel, Ann. chim. phys., C), 63, 108 A861).
Wislicenus, Ann., 133, 259 A865).
бе da, Bull. Chem. Soc. Japan, 11, 385 A936).
G 1 a t t f с I d, M а с M i 1 1 a n, J. Am. Chem. Soc, 58, 898 A936).
Audrieth, К 1 с i n b e г g, J. Org. Chem., 3, 312 A938).
АМИД НАТРИЯ
31
АМИД НАТРИЯ
(Натрий-амид)
2Na + 2NH3 -*- 2NaNH2
Предложил: Ф. Бергстром.
Проверили: Ч. Аллен и К- Вимсон.
Получение
Прибор собирают, как показано на рис. 4. Газообразный аммиак
поступает в прибор из баллона (примечание 1) через трубку К-
Н—ртутная ловушка, которая играет роль предохранительного
N выгпяжн!
шкафу
Рис. 4.
клапана, если система благодаря случайному понижению темпера-
температуры окажется забитой затвердевшим амидом. И представляет со-
собой U-образную трубку, в которой находится ртуть в количестве,
достаточном для того, чтобы заполнить изогнутую часть; наблю-
наблюдая прохождение аммиака через трубку, можно судить о скорости
его пропускания. 3—ловушка Кьельдаля, которая предохраняет
от проникновения ртути в котелок А, где проводится сплавление
(примечание 2). Котелок установлен на треножнике; последний,
в свою очередь, опирается на кирпичи, благодаря чему котелок
32
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
оказывается поднятым над горелкой Л на надлежащую высоту.
Через крышку котелка проходят трубка Б для отвода газа, кар-
карман для термометра Т и комбинированная трубка для ввода газа
ВГД. Карман для термометра заварен наглухо и выступает при-
примерно на 6 мм из более широкой трубки для ввода газа, к верхней
части которой он припаян. Сальник М, через который проходит
трубка для ввода газа, уплотняют несколькими оборотами асбе-
асбестового шнура, после чего верхнюю шестигранную гайку завин-
завинчивают гаечным ключом так, чтобы аммиак не мог пройти через
сальник и чтобы было создано достаточное сопротивление для
удержания трубки ВГД на любой высоте, на которую она может
быть поднята (примечание 3). Резиновые трубки Ж и Ж' должны
быть достаточной длины E—7 см), для того чтобы обладать боль-
большой гибкостью и тем самым облегчать обращение с горячей крыш-
крышкой. Отводная трубка Б должна быть не менее 10 мм в диаметре.
В начале опыта котелок для сплавления А вместе с карманом
для термометра, установленным, как показано на рисунке, нагре-
нагревают в течение 10 мин. примерно до 120° в слабом токе аммиака
{примечание 4). Это делают для того, чтобы вытеснить из системы
воздух и следы влаги. Затем прибору дают охладиться до темпе-
температуры 70—80°, снимают крышку и в котелок помещают нике-
никелевый тигель Е емкостью 250 мл. Трубку ВГД для ввода аммиака
поднимают так, чтобы она находилась как раз над верхним
краем никелевого тигля, в который затем помещают около 175 г
G,6 грамматома) чистого натрия (примечание 5). Сосуд нагревают
полным пламенем горелки; через 5—Юмин. натрий расплавляется,
после чего трубку ВГД опускают через сальник до тех пор, пока
она не дойдет до дна тигля. Когда термометр будет показывать
320°, пламя горелки уменьшают и температуру поддерживают
при 350—360°. Скорость прохождения аммиака регулируют таким
образом, чтобы пузырьки в трубке И уже нельзя было бы сосчи-
сосчитать. Через 3,5—4 часа (примечания 6 и 7) температуру снижают
до 320° и немного приподнимают крышку котелка, чтобы по-
посмотреть, не остался ли непрореагировавший натрий; если этого
не случилось, то горелку отставляют и тиглю дают охладиться
до 230—240°; при этой температуре нагревание возобновляют
и продолжают его в течение получаса, чтобы обеспечить удаление
большей части гидрида натрия.
Затем горелку гасят, ток аммиака прекращают и с котелка
снимают крышку, разъединив трубки Ж и Ж'¦ Тигель вынимают
из котелка щипцами и расплавленный амид выливают в неглу-
неглубокую железную сковороду, которую предварительно прогре-
прогревают для удаления следов влаги (примечание 8). На этой стадии
очень важно работать быстро, чтобы избежать затвердевания амида
в тигле (примечание 9). Как только вещество достаточно затвер-
затвердеет, сковороду помещают в большой эксикатор, где ей дают охла-
АМИД НАТРИЯ
33
диться. Когда сковорода охладится настолько, что можно будет
продолжать работу, ее переворачивают над листом толстой чистой
бумаги. Амид выгружают, слегка постукивая по дну сковороды,
и сразу же переносят в широкогорлые банки, заливая поверх-
поверхность препарата нефтяной фракцией (примечания 10 и 11). Выход
колеблется от 267 до 282 г (90—95% теоретич.; примечания
12—14).
Полученный таким образом амид натрия легко измельчить;
его можно растереть в ступке подслоем какого-либо углеводород-
углеводородного растворителя. В тех случаях, когда в качестве реакционной
среды предполагают применить эфир, безопаснее, хотя это и не
обязательно, сперва растереть амид натрия под слоем углеводо-
углеводорода, а затем перенести смесь в реакционную колбу и заменить
углеводород на эфир таким образом, как это обычно делается
(примечания 15—17).
Примечания
1. Были применены обычные, имеющиеся в продаже баллоны
с аммиаком. Сушить газ нет необходимости.
2. Для сплавления был применен 1-литровый чугунный коте-
котелок с крышкой.
3. Сальник М можно заменить муфтой или втулкой, удержи-
удерживая ее в любом желаемом положении с помощью стопорного винта
или зажима.
4. При достижении температуры, необходимой для реакции,
можно сэкономить значительное количество времени, если поль-
пользоваться горелкой Мексра или тройной горелкой. Однако вообще
для проведения этой реакции достаточно и обычной горелки.
5. Перед применением продажного натрия с его поверхности
удаляют масло и снимают окисную пленку. Удобнее взять около
175 г натрия, а не пытаться отрезать точную навеску.
6. Продолжительность реакции зависит главным образом от
скорости, с которой поступает аммиак. Если ток аммиака слиш-
слишком силен, то происходит значительное разбрызгивание и боль-
большое количество расплавленного амида собирается в чугунном
котелке. Обычно приведенное в методике количество натрия
полностью вступает в реакцию в течение указанного здесь вре-
времени. Продолжительность проведения этого синтеза составляет
немного менее 6 час, из которых наибольшего внимания требуют
не. более 2—2,5 часа.
7. Непрореагировавший натрий легко заметить, так как он
образует шарик, плавающий на поверхности более темной жид-
жидкости. Для наблюдения удобно пользоваться переносной лампой
или карманным фонарем.
8. Для опытов такого масштаба удобно использовать сковороду
высотой 2 см и диаметром 13 см. Предварительно необходимо
3 Сборник 3
АМИД НАТРИЯ
34
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
35
удалить с поверхности сковороды пленку окиси; для этого сковоро-
сковороду раскаляют докрасна, а затем охлаждают и чистят наждачной
бумагой. В противном случае в местах соприкосновения со сково-
сковородой препарат окрашивается в темный цвет. Одну и ту же сково-
сковороду можно применять несколько раз, не подвергая ее другой
обработке, кроме очистки и высушивания.
9. Некоторая часть амида натрия неизбежно разбрызгивается
из тигля по стенкам котелка. Если количество вещества, попав-
попавшего в котелок, велико (при слишком быстром токе аммиака), то
его можно вылить, если же это количество незначительно, то амид
после охлаждения выкалывают.
10. Лучше использовать продажный «нефтяной гептан» с
т. кип. 90—100°, но можно применять также и другие фракции. Для
хранения амида натрия, полученного в результате одного опыта,
достаточна склянка емкостью 750 мл.
11. Можно также дать амиду полностью охладиться в никеле-
никелевом тигле в медленном токе аммиака и по охлаждении удалить его
из тигля. В этом случае трубку ВГД перед охлаждением подни-
поднимают над плавом.
12. Уменьшение выхода обусловлено главным образом поте-
потерями от разбрызгивания; удалить амид, застывший на стенках
чугунного котелка, трудно. Часть потерь вызвана тем, что гидрид
натрия выносится с отходящим газом.
13. В той же аппаратуре можно проводить опыты и с другими
количествами исходного натрия. Если взять половину указанного
в прописи количества, то регулирование температуры требует
значительно большего внимания. При использовании больших
количеств исходного натрия можно обходиться и без никелевого
тигля, а проводить синтез непосредственно в тщательно вычищен-
вычищенном чугунном котелке. Проверявшие синтез применяли для реак-
реакции 260—270 г натрия и получали выход амида натрия, равный
в среднем 94%; продолжительность процесса в этом случае увели-
увеличивалась только на полчаса. При установке двух параллельных
приборов, присоединенных к общему баллону с аммиаком, водном
из них почти за равный промежуток времени можно получить
вдвое большее количество амида натрия, чем в другом.
14. Если котелок для плавления и железная сковорода будут
тщательно вычищены, то амид натрия получается почти бесцвет-
бесцветным, однако он может получиться также окрашенным в серый
цвет.
15. Внимание! Амид натрия является веществом в выс-
высшей степени реакционноспособным; он соединяется с кислоро-
кислородом, а с водой реагирует со взрывом. Авторы синтеза советуют
хранить препарат в запаянных стеклянных ампулах в атмо-
атмосфере аммиака. Проверявшие синтез предпочитают применять
нефтяные фракции, что более удобно в обращении. Амид натрия
хранился под этим растворителем в течение 3 лет без заметной
потери активности.
При соприкосновении с воздухом амид натрия быстро погло-
поглощает влагу и углекислый газ. В случае малых количеств воздуха,
как, например, при плохо запаянных ампулах, амид натрия обра-
образует вещества, которые придают всей смеси весьма взрывчатые
свойства1. Образование продуктов окисления сопровождается
появлением желтой или коричневатой окраски. Если такое изме-
изменение будет замечено, то амид натрия следует без промедления
уничтожить. Удобно это сделать, заливая вещество большим
количеством бензола, толуола или керосина и при перемешивании
медленно прибавляя к нему разбавленный спирт.
16. После того как синтез будет закопчен, охлажденный ап-
аппарат разбирают и отдельные части его немедленно промывают
спиртом. Необходимо позаботиться о том, чтобы малейшие следы
амида натрия были уничтожены прежде, чем какая-либо часть
оборудования подвергнется действию воды.
17. Авторы синтеза получили амид калия с выходом 95%
с помощью того же способа, но поддерживая на протяжении всего
процесса температуру в пределах 350—360°. Аппаратуру следует
промывать смесью спирта с бензолом.
Другие методы получения
Амид натрия был получен действием газообразного2 или жид-
жидкого3 аммиака на натрий; действием аммиака на сплавы натрия4;
электролизом раствора цианистого натрия5 в жидком аммиаке
с электродом из амальгамы натрия. Обзор по химии амидов ще-
щелочных металлов дали Бергстром и Фернелиус1.
1 В е г g s t г о ш, Fernelius, Chem. Rev., 12, 43 A933); 20, 413
A937).
2 W i s 1 i с e n u s, Ber., 25, 2084 A892); T i t h e r 1 y, J. Chem.
Soc, 65, 504 A894); Неорганические синтезы, сб. 1, Издатинлит, 1951,
стр. 75; Неорганические синтезы, сб. 2, Издатинлит, 1951, стр. 125; D е
Foreran d, Compt. rend., 121, 60 A895); Dennis, Browne, J. Am.
Chem. Soc, 26, 587 A904); Winter, там же, 26, 1484 A904); Ruff,
Geisel, Ber., 39, 828 A906); К г a u s, С u y, J. Am. Chem. Soc,
45, 712 A923); G u n t z, В e n о i t, Bull. soc. chim. D), 41, 434 A927);
Fernelius, Bergstrom, J. Phys. Chem., 35, 740 A931); G i 1-
bert, Scott, Timmerli, Hausley, Ind. Eng. Chem., 25,
740 A933); Shrevc, Ricchers, Rubenkoenig, Goodman»
там же, 32, 173 A940).
3 J о a n n i s, Compt. rend., П2, 392 A891); M с G e e, J. Am. Chem.
Soc, 43, 586A921); англ. пат. 222718A923) [С. А., 19, 1143 A925)]; Vaughn,
V о g t, N i e u w 1 a n d, J. Am. Chem. Soc, 56, 2120 A934).
4 Am. пат. 1359080 [С. А., 15, 415 A921)].
6 Англ. пат. 222718 A923) [С. А., 19, 1143 A925I; ам. пат. 1570467 [С. А.,
20, 714 A926)].
3*
36
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
9-АМИНОАКРИДИН
( 5- Аминоакридин)
С1
3 o-C4HiNHCeH4COOH + 2РОС13
(NHiJUO3
NH3 Cl
+ NaOH —>
3HC1 + 2H3PO4
СОа + НаО
+ KaCl + H2O
Предложили: А. Альберт и Б. Ршпчи,
Проверили: Р. Шрайнер и Дж. Робинсон, мл.
Получение
В круглодонной колбе емкостью 500 мл, снабженной холо-
холодильником с водяным охлаждением, смешивают 50 г @,23 моля)
N-фепилантраниловой кислоты («Синт. орг. преп.», сб. 2, стр. 18)
[или 46 г акридона («Синт. орг. преп.», сб. 2, стр. 18)] со 160 мл
B70 г, 1,76 моля) хлорокиси фосфора (примечание 1). Смесь мед-
медленно нагревают (около 15 мин.) до 85—90° на водяной бане.
Начинается энергичная реакция, и колбу сразу же вынимают
из горячей бани. Если течение реакции будет слишком бурным,
то колбу погружают на короткий срок в стакан с холодной водой.
По истечении 5—10 мин., когда интенсивность кипения несколь-
несколько уменьшится, колбу погружают в масляную баню. Температуру
бани повышают до 135—140° и поддерживают на этом уровне
около 2 час. Избыток хлорокиси фосфора отгоняют на масляной
бане при 140—150° в вакууме порядка 50 мм. Остаток охлаждают
и выливают в энергично перемешиваемую смесь 200 мл концентри-
концентрированного раствора аммиака, 500 г льда и 200 мл хлороформа.
Колбу обмывают, для чего ее встряхивают с небольшим количе-
количеством (около 25—30 мл) смеси хлороформа и аммиака. Когда
больше не останется нерастворившихся твердых частиц (на это
требуется около получаса), хлороформенный слой отделяют и вод-
водный слой экстрагируют еще 40 мл хлороформа. Соединенные вместе
хлороформенные вытяжки сушат над 10 г хлористого кальция,
фильтруют и растворитель отгоняют. В результате получается
9-АМИПОАПРИДИП
37
зеленовато-серый порошок, который сушат при 70° в течение
20 мин. (примечания 2 и 3). Выход неочищенного 9-хлоракридина
составляет 50 г (т. е. практически выход равен теоретическому);
т. пл. 117—118° (примечание 4).
В 1-литровый стакан помещают 50 г @,23 моля) неочищенного
9-хлоракридина и 250 г B,7 моля) фенола (примечание 5). Смесь
нагревают на масляной бане до 70° (температура внутри стакана)
и одновременно перемешивают с помощью механической мешалки.
Продолжая перемешивание, к смеси прибавляют 30 г @,38 моля)
измельченного углекислого аммония (примечание 6) с такой ско-
скоростью, какую допускает обильное выделение углекислого газа.
Температура реакционной смеси быстро поднимается до 120°; ее
поддерживают на этом уровне в течение 45 мин., не прекращая
перемешивания смеси. Затем смесь охлаждают до 30° и приливают
к 600 мл ацетона, который находится в стакане, охлаждаемом
снаружи льдом. Примерно через 1 час выпадение в осадок хло-
хлористоводородного 9-амипоакридина можно считать законченным;
вещество отфильтровывают и отмывают от фенола 250 мл ацетона
(примечание 7). Осадок три раза кипятят с водой, используя
поочередно 800, 200 и 100 мл воды, причем к последней порции
добавляют 2 мл концентрированной соляной кислоты. Горячие
растворы фильтруют, чтобы избавить их от небольшого количества
осмолившегося вещества, и фильтраты соединяются вместе. Если
выпадет осадок, то его переводят в раствор путем нагревания;
после этого к полученному раствору прибавляют раствор 60 г
едкого натра в 300 мл воды. Смесь охлаждают и фильтруют;
твердый осадок промывают 300 мл холодной воды и сушат при 120°.
Выход составляет 34—38 г G6—85% теоретич., считая на фенил-
антраниловую кислоту или на акридон). Вещество получается
в виде светложелтого порошка; т. пл. 230°. Препарат доста-
достаточно чист для большинства целей, однако сырое вещество можно
очистить кипячением с ацетоном A 200 мл ацетона на 38 г препа-
препарата). Смесь фильтруют с отсасыванием и фильтрат охлаждают
в бане со льдом и солью. Выход первой порции 9-аминоакридина
составляет 26—27 г; в результате упаривания маточного раствора
до объема 500 мл можно получить еще 6—7 г вещества. Темпера-
Температура плавления обеих порций равна 232—233°; выход при пере-
перекристаллизации составляет 32—34 г (84—89%; примечание 8).
Примечания
1. Хлорокись фосфора должна быть свежеперегнанной.
2. 9-Хлоракридин легко гидролизуется в нейтральном и кис-
кислом растворах; поэтому после удаления хлорокиси фосфора и до
обработки аммиаком нельзя оставлять его на открытом воздухе.
Если сушить 9-хлоракридин при более высокой температуре,
38
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
то вследствие возгонки происходит потеря вещества. Следует
принимать меры предосторожности против попадания 9-хлор-
9-хлоракридина в глаза, так как это вызывает сильное раздражение.
3. Было найдено весьма удобным сушить 9-хлоракридин сле-
следующим образом. Концентрированные хлороформенные вытяжки
переливают непосредственно в 1-литровый стакан, в котором про-
проводится последующая стадия синтеза; масляную баню нагре-
нагревают до 70° в продолжение требуемых 20 мин.
4. Если желательно получить чистый 9-хлоракридин, то сырой
препарат растворяют в небольшом количестве кипящего спирта
и приливают к нему 0,5%-ный аммиак до тех пор, пока раствор
не станет мутным. Затем прибавляют 0,5 г активированного бере-
березового угля; раствор быстро фильтруют и немедленно охлаждают
в бане со льдом. Получают бесцветные кристаллы с т. нл. 119—120°.
Препарат лучше всего хранить в эксикаторе над поташом. При
нагревании 9-хлоракридина с различными первичными и вторич-
вторичными аминами легко получаются многие замещенные 9-амино-
акридины.
5. 9-Феноксиакридин, повидимому, является промежуточным
продуктом в этой реакции.
6. Углекислый аммоний, согласно данным анализа, должен
содержать 30% аммиака. Пригоден продажный реактив, если из-
известны результаты его анализа.
7. Ацетон и фенол, полученные обратно из фильтрата соот-
соответственно при простой перегонке и при перегонке в вакууме,
могут быть снова использованы.
8. Солянокислый 9-аминоакридин представляет собой одно
из наиболее сильно флюоресцирующих веществ. Его водный
раствор, разведенный до концентрации 1 : 1 000, окрашен в светло-
желтый цвет и обладает лишь слабой зеленой флюоресценцией,
тогда как раствор 1 : 100 000 бесцветен и обладает интенсивной
голубой флюоресценцией.
9-Аминоакридин представляет собой сравнительно сильное
основание1; константа диссоциации его равна 3-Ю (у ани-
анилина 5-100).
Другие методы получения
9-Хлоракридин был получен нагреванием тиоакридона1, ак-
ридона2 или N-фенилантраниловой кислоты3'5 с пятихлористым
фосфором, с хлорокисью фосфора или со смесью обоих галоидных
соединений фосфора с прибавлением или без прибавления угле-
углеводородных растворителей. Приведенную методику в основном
разработал Магидсон3; имеющиеся в его способе затруднения при
фильтровании клейкого и легко гидролизующегося 9-хлоракри-
9-хлоракридина были обойдены в настоящей методике в результате приме-
применения хлороформа.
АМИНОАЦЕТАЛЬ
39
Приведенная пропись по превращению 9-хлоракридина
в 9-аминоакридин была разработана на основе использования
методов, описанных в литературе; к ним относятся: превращение
9-хлоракридина через 9,9-дифеноксиакридан в 9-феноксиакридин,
который затем нагревают с хлористым аммонием6; нагревание
9-хлор-, 9-этокси- или 9-феноксиакридина с аммиаком и соедине-
соединением меди под давлением7 или с фенилгидразином с последующим
восстановлением полученного продукта в кислой среде8. Кроме
того, 9-аминоакридин был получен гидролизом 9-цианакридина
(из акридина или 9-хлоракридина) до соответствующего амида
кислоты и последующим превращением амида в желаемый амин9,
а также разложением азида кислоты10. Представляют интерес
также некоторые методы, разработанные для получения амино-
этоксиакридинов11.
1 Е d i n g e r, J. prakt. Chem., B), 64, 471 A901).
'Graebe, Lagodinzski, Ann., 276, 48A893).
s M а г и д с о н, Вег., 66, 866 A933).
4 D е г s с h е г 1, Ann., 504, 300A933).
6 Дроздов, ЖОХ, 4, 117 A934).
«Дроздов, ЖОХ, 5, 1576, 1736 A935).
7 М е i s t е г, Lucius, В г 0 п i n g, герм. пат. 360421 [Frdl, 14,
800 A921—1925); С. А., 18, ИЗО A924)]; герм. пат. 364032 [Frdl., 14, 802
A921 —1925); С. А., 18, 1130A924)]; герм. пат. 367084 [Frdl., 14, 803A921 —
1925); С. А., 18, ИЗО A924)].
8 М е i s t е г, Lucius, В г (in i n g, герм. пат. 364031 [Frdl., 14,
801 A921—1925); С. А., 18, 1131 A924)].
9 Lehrnstedt, Ber., 64, 1232 A931).
"Meister, Lucius, Bruning, герм. пат. 364035—364036
[Frdl., 14, 805—806 A921 — 1925); С. А., 18, 1131 A924)].
11 М е i s t e r, Lucius, Bruning, герм. пат. 393411 [Frdl., 14,
807 A921—1925)]; герм. пат. 395683 [Frdl., 14, 812 A921 — 1925)].
АМИНОАЦЕТАЛЬ
(Диэтилац еталь аминоацетальдегида)
BrCH2CH(OC2H5J + 2NH3 -> H3NCH2CH(OC2H5J+NH4Br
Предложили: Ч. Аллен и Дж. Кларк.
Проверили: А'. Снайдер, Р. Роулэнд и X. Сэмпсон, мл.
Получение
В автоклав для гидрирования емкостью 1 100 мл помещают
раствор 197 г A моль) бромацеталя (стр. 109I в 250 мл абсолют-
абсолютного спирта; автоклав охлаждают смесью сухого льда с ацетоном и
прибавляют к его содержимому около 300 г (примерно 18 молей)
жидкого аммиака (примечание 1). Автоклав закрывают крышкой,
соединяют с манометром и нагревают до 120—130°, встряхивая
40
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
на качалке, в течение 12 час. Давление при этом повышается
примерно до 160 am.
После этого автоклав охлаждают, избыток аммиака выпускают
(примечание 2) и раствор выливают. Автоклав дважды ополаски-
ополаскивают абсолютным спиртом порциями по 200 мл (примечание 3)
и раствор вместе с промывной жидкостью фильтруют. От филь-
фильтрата отгоняют спирт на паровой бане при атмосферном давлении
(примечания 4 и 5). Жидкий остаток растворяют в 1 50,0 мл эфира,
выделившуюся неорганическую соль отфильтровывают и эфир-
эфирный раствор сушат над 125 г гранулированного едкого кали. Затем
эфир отгоняют, а остаток перегоняют в вакууме (примечание
6). Часть дестиллата, перегнавшуюся до 180° A5 мм), фракциони-
фракционируют при атмосферном давлении в специальной колбе Клайзена.
Головную фракцию, кипящую до 161°, количество которой состав-
составляет 15 г, отбрасывают. Аминоацеталь перегоняется при 161—162°.
Выход составляет 43—52 г C2—39% теоретич.). Остаток дости-
достигает 18 г (примечания 7—9).
Примечания
1. Автоклав охлаждают, помещая его в железный сосуд, вы-
высота которого составляет две трети высоты автоклава. Сосуд
наполняют до половины ацетоном, к которому прибавляют сухой
лед в кусках до тех пор, пока не прекратится обильное выделе-
выделение углекислого газа, сопровождающее попадание в ацетон каждо-
каждого нового куска. Если ввести жидкий аммиак в недостаточно охла-
охлажденный раствор бромацеталя в спирте, то аммиак будет уле-
улетучиваться настолько энергично, что значительная часть исход-
исходного вещества окажется потерянной. Проверявшие синтез пода-
подавали аммиак из маленького баллона в автоклав, содержащий
спирт и бромацеталь, при комнатной температуре с помощью
сжатого водорода (стр. 448).
2. Некоторая часть реакционной смеси может быть увлечена
из автоклава вместе с отходящим аммиаком. Если аммиак выпу-
выпускать через трубку, отведенную в стакан или колбу, то увле-
увлеченное им вещество может быть уловлено.
3. На стенках автоклава собирается значительное количество
липкого вещества. Повидимому, оно состоит из бромистого аммо-
аммония с примесью солей железа, полученных в результате растворе-
растворения стенок автоклава под действием аммиака. Количество веще-
вещества, которое может быть выделено в результате тщательной пере-
переработки этого материала, составляет менее 2 г.
4. Если в остатке окажется много спирта, то при высушивании
эфирного раствора едким кали выпадет значительное количество
неорганической соли; потому эфирный раствор целесообразнее
фильтровать, а не декантировать. Выход от этого не изменяется.
АМИНОАЦЕТАЛЬ
41
5. Более тщательный способ переработки этого остатка состо-
состоит в следующем. Остаток прибавляют к равному по объему коли-
количеству воды (около 175 мм); выделившееся масло отделяют, а вод-
водный слой экстрагируют двумя порциями эфира по 150 мл. Водный
слой (А) обрабатывают так, как это описано ниже. Вытяжки су-
сушат над гранулированным едким кали, эфир отгоняют и остаток
фракционируют. Головную фракцию D0 г), которая отгоняется до
150э A5 мм), вторично фракционируют при атмосферном давлении.
Фракцию (Б), которая перегоняется ниже 180° и количество кото-
которой достигает 19 г, присоединяют к основной порции вещества,
как на это указано далее.
К водному слою (А), остающемуся от описанного выше экстра-
экстрагирования эфиром, прибавляют 175 г безводного поташа. Выде-
Выделившийся маслянистый слой отделяют, а водный слой экстраги-
экстрагируют два раза эфиром порциями по 150лм. Масло и эфирные вытяж-
вытяжки соединяют вместе, сушат над гранулированным едким кали и пе-
перегоняют при давлении 15 мм. Фракция, перегоняющаяся при
указанном давлении ниже 180"составляет 63 г. К ней присоединя-
присоединяют дестиллат (Б), полученный как было описано выше, и все вместе
фракционируют при атмосферном давлении.. Выход вещества с
т. кип. 161—162° составляет 50 г C7% теоретич.).
6. Остаток содержит значительное количество растворенных
твердых примесей, от которых желательно отделить препарат
при возможно более низкой температуре.
7. Низкокипящая фракция исследована не была. Остаток
представляет собой главным образом диацетиламин [т. кип.
124—127° G мм); 11—14% теоретич.].
8. Аминоацеталь был получен тем же способом из хлорацеталя
с выходом 46%.
9. Имеются указания на то, что при аналогичном процессе,
но с прибавлением к реакционной смеси йодистого калия, выход
получается несколько выше2. Проверявшие синтез убедились
в том, что прибавление йодистого калия к реакционной смеси
при работе по описанной выше методике не приводит к повышению
выхода.
Другие методы получения
Аминоацеталь был получен действием аммиака на галоид-
замещенные ацетали2-8; восстановлением нитроацеталя нат-
натрием в кипящем спирте9; восстановлением хлористоводородной
соли эфира глицина амальгамой натрия10.
1Bedoukian, J. Am. Chem. Soc, 66, 651 A944).
2 С я s s, J. Am. Chem. Soc, 64, 785 A942).
3 Wolil, Ber., 21, 617 A888); 39, 1953 A906).
4 Wolff, Ber., 21, 1482 A888); 26, 1832 A893).
5 W о 1 f f, Marburg, Ann., 363, 179 A908).
42
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
с М а г с к w a I d, Ber., 25, 2355 A892).
'Hartung, Adkins, J. Am. Chem. Soc, 49, 2521 A927).
'Buck, Wrenn, J. Am. Chcm. Soc, 51, 3613 A929).
'Losanitsch, Ber., 42, 4049 A909).
"Fischer, Ber., 41, 1021 A908).
Постоянный ток
1Юв
о-АМИНОБЕНЗИЛОВЫЙ СПИРТ
•)-NH2CeH4CO2H + 4H -^ o-NH2C6H4CH2OH + Н2О -
Предложили: Дж. Кольмян и Г. Джонсон.
Проверили: Р. Фысзон и Э. Кливлэнд.
Получение
Восстановление проводят в четырех ячейках типа, изображен-
изображенного на рис. 5. Каждая ячейка состоит из 1-литрового стакана С,
пористого цилиндра П, механической мешалки и электродов из
листового свинца Эх и Э2- По-
Поверхность каждого электрода рав-
равна 100 см* (примечание 1). В ка-
катодное пространство каждой ячей-
ячейки помещают 25 г @,18 моля)
антраииловой кислоты (примеча-
(примечание 2) и 400 мл 15%-ной серной
кислоты. В каждый пористый
цилиндр вводят по 200 мл
15%-пой серной кислоты.
Ячейки соединены последова-
последовательно, как указано на рисунке.
В цепь включают также ампер-
амперметр А и соответствующий рео-
реостат Р (примечание 3).
Пускают в ход мешалки, вклю-
включают ток (постоянный, напря-
напряжением ПО е) и устанавливают
реостат так, чтобы амперметр по-
показывал силу тока 10—12 а. Тем-
Температуру раствора в ячейках под-
поддерживают в пределах 20—30°,
охлаждая их в бане с холодной
водой (примечание 4). Восстанов-
Восстановление можно считать законченным
по истечении 60—70 а-ч. На окон-
окончание этого процесса указывают
увеличение выделения водорода и
полное растворение антраниловой
Рис 5. кислоты.
о-АМИНОБЕНЗИЛОВЫЙ СПИРТ
43
Катодную жидкость выливают из ячеек и нейтрализуют твер-
твердым углекислым аммонием или концентрированным водным ра-
раствором аммиака. Чтобы освободить раствор от некоторых смо-
смолистых примесей, его фильтруют, насыщают сернокислым аммо-
аммонием и экстрагируют порциями хлороформа по 80 мл (приме-
(примечание 5). Хлороформенный раствор сушат над 20 г безводного
сернокислого натрия или магния, фильтруют и хлороформ отго-
отгоняют на паровой бане (примечание 6). Выход о-аминобензилового
спирта, полученного в четырех ячейках, составляет 62—70 г
F9—78% теоретич.).
Препарат получается окрашенным в светлобурый цвет; он
плавится при 75—80е. После перекристаллизации из петролейного
эфира температура плавления повышается до 80—81° (примеча-
(примечание 7).
Примечания
1. Вполне пригоден обычный листовой свинец 99,9%-ной
чистоты.
2. Была использована антраниловая кислота с т. пл. 143—144°.
3. Для данного прибора требуются реостаты общим сопро-
сопротивлением 10—12 ом. При проведении реакции может оказаться
нужным несколько раз регулировать реостаты.
4. Проверявшие настоящий синтез нашли необходимым для
охлаждения ячеек часто прибавлять лед в баню с холодной водой.
5. Вместо хлороформа можно использовать этиловый эфир,
однако последний менее пригоден для экстрагирования, так как
для выделения из водного раствора того же количества вещества
экстрагирование этиловым эфиром требуется провести большее
число раз.
6. Отгонку следует производить таким образом, чтобы можно
было регенерировать растворитель.
7. Для перекристаллизации применяется петролейный эфир
с т. кип. 65—75°. Растворимость препарата даже в горячем раство-
растворителе ограничена, а потому для этой цели последний приходится
брать в сравнительно большом количестве.
Другие методы получения
о-Аминобензиловый спирт был получен восстановлением о-нит-
робензальдегида1>2 или о-нитробензилового спирта3'4 цинком
и соляной кислотой в спиртовом растворе. Приведенная выше
пропись получения о-аминобензилового спирта является видо-
видоизменением методики, которую предложил Меттлер5. Описан-
Описанным способом были получены и другие замещенные бензиловые
спирты.
44
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
1 F г i e d 1 а п d e r, Henriques, Ber., 15, 2109 A882)
! Р а а 1, Senniger, Ber., 27, 1084 A894).
3Gabriel, Posncr, Ber., 27, 3512 A894).
4 A u w e r s Ber., 37, 2260 A904).
5 M e t t 1 er, Ber., 38, 1751 A905).
4-АМИНО-2,6-ДИМЕТШ1ПИРИМИДИН
.N.
3 CH3CN
СНзОК
HaNC CCH3
HC N
V
CH3
Предложили: Л. Ронзио и У. Кук.
Проверили: К. Стукеиш и Г. Гильман.
Получение
В колбу Вюрца емкостью 500 мл помещают 70 г A моль) све-
свежеприготовленного метилата калия (примечание 1) и 41 г A моль)
только что очищенного ацетопитрила (примечание 2). В горло
колбы вставляют через резиновую пробку холодильник, сделан-
сделанный из пробирки, до дна которой доходит трубка, подающая воду.
Трубка холодильника достигает шарообразной части колбы.
К боковому отводу колбы присоединяют короткий кусок рези-
резиновой трубки с винтовым зажимом. Эту трубку соединяют с водо-
водоструйным насосом и создают в колбе разрежение, которое со-
сохраняют до тех пор, пока ацетонитрил не начнет кипеть, после
чего зажим перекрывают и колбу нагревают в течение 5 час. на
масляной бане, температуру которой поддерживают на уров-
уровне 140°.
К концу нагревания содержимое колбы затвердевает. К холод-
холодной смеси прибавляют 40 мл воды, для того чтобы гидролизовать
метилат калия и осадить пиримидин; мелкие кристаллы отфильтро-
отфильтровывают и сушат. Неочищенное, вещество помещают в колбу Вюрца
емкостью 500 мл вместе с 250 мл очищенного керосина (примеча-
(примечание 3). В результате кодистилляции пиримидин отгоняется вместе
с керосином и затвердевает в приемнике в белоснежную кристал-
кристаллическую массу. Последнюю отфильтровывают, тщательно про-
промывают петролейным эфиром и сушат в сушильном шкафу при
100°. Выход чистого вещества с т. пл. 182—183° составляет
27,5—28,7 г F7—70% теоретич.; примечание 4).
4-АМШШ-2,6-ДЕМИТШШИРИММДИН
45
Примечания
1. Для получения метилата калия поступают следующим обра-
образом. В 1-литровую трехгорлую колбу, из которой воздух вытеснен
азотом, помещают 39 г A грамматом) металлического калия*,
нарезанного под слоем толуола на кубики с ребром 1 см.
Колбу, снабженную обратным холодильником, механической
мешалкой и капельной воронкой, погружают в охлаждающую
баню, температуру которой поддерживают при —30°, а затем
через воронку прибавляют абсолютный метиловый спирт, пока
весь калий не растворится. Избыток метилового спирта отгоняют
на паровой бане (к концу процесса — при пониженном давлении)
и метилат калия сушат в течение ночи в вакуум-эксикаторе над
серной кислотой.
2. Продажный ацетонитрил обрабатывают твердым углекислым
натрием до тех пор, пока не перестанет выделяться углекислый
газ. Затем ацетонитрил перегоняют над фосфорным ангидридом
и сохраняют в тщательно закупоренных склянках. Перед
употреблением ацетонитрил снова перегоняют над фосфорным
ангидридом.
3. С целью очистки керосин взбалтывают в течение суток
с концентрированной серной кислотой. Затем его отделяют от
кислоты, промывают несколько раз разбавленным раствором ед-
едкого натра, затем водой, сушат над хлористым кальцием и пере-
перегоняют с воздушным холодильником. Очищенный керосин пред-
представляет собой бесцветную жидкость с приятным запахом.
4. Выход (в процентах) понижается при использовании боль-
больших или меньших количеств исходных веществ.
Другие методы получения
4-Амино-2,6-диметилпиримидип был получен нагреванием про-
продукта реакции уксусного ангидрида с ацетамидином1; действием
аммиака на 4-хлор-2,6-диметилпиримидин2; нагреванием ацето-
нитрила с этилатом натрия в запаянной трубке3 или с натрием4'5.
'Pinner, Ber., 22, 1600 A889).
2 Schmidt, Ber., 35, 1577 A902).
3Schwarze, J. prakt. Chem., B), 42, 3 A890).
"Keller, J. prakt. Chem., B), 31, 365 A885).
'Meyer, J. prakt. Chem., B), 27, 153 A883).
* В ряде синтезов описано применение металлического калия при про-
проведении органических реакций или при получении в качестве реагентов
алкоголятов калия (см. «Синт. орг. преп.»., сб. 2, стр. 54, примечание 1,
и настоящий том, стр. 224, 258).
Так как на воздухе калий самовозгорается, то его следует резать и вооб-
вообще измельчать только под слоем инертного углеводородного растворителя,
например керосина, толуола или ксилола. Воздух из реакционной колбы
следует вытеснить инертным газом, например азотом. Таким путем опасность
пожара при обращении с металлическим калием можно свести до минимума.
46
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
«-ЛМИНОДИЭТИЛУКСУСНАЯ КИСЛОТА
(я-Амино-я.-этилмасляная кислота)
С2Н6СОС2Н5 + NaCN + КН4С1 -* (C,H5)aC(OH)CN + NaCl + NH3
(C2H6JC(OH)CN + NHS _> (C2H5JC(NH2)CN
Охлаждение
(C2H5JC(NH2)CN +
(C2H6)aC(NH2 ¦ HC1)CONH2 + H2O + HC1
(C2H5JC(NH2-HC1)CONH2
Нагревание
(C2H6JC(NH2- HC1)CO2H + NH4C1
(C2H6JC(NH2- HC1)CO2H +4 Pb(OHJ
(C2H6JC(NH2)CO2H--i-PbCla +-1 H2O
Предложил: Р. Штейгер.
Проверили: В. Бахман и Чао Юн-тзунг.
Получение
В 2-литровую круглодонную колбу (примечание 1) со стеклян-
стеклянной притертой пробкой помещают раствор 50 г A моль) цианистого
натрия (98%-ной чистоты) в 100 мл воды и прибавляют к нему
раствор 58,9 г A,1 моля) хлористого аммония в 140 мл тепловатой
воды, а затем 67 мл A моль) концентрированного аммиака (уд.
вес 0,90). Смесь перемешивают механической мешалкой и охла-
охлаждают струей воды; одновременно с этим к смеси прибавляют
раствор 86,1 г A моль) диэтилкетона в 160 мл метилового спирта
(примечание 2). Колбу закрывают пробкой (примечание 3) и в те-
течение 5 час. оставляют ее погруженной наполовину в водяную
баню, температуру которой поддерживают при 55—60°. Затем
реакционную смесь охлаждают в бане со льдом и осторожно (т. е.
в хорошо действующем вытяжном шкафу) выливают в 800 мл кон-
концентрированной соляной кислоты (уд. вес 1,18), находящейся в
5-литровой круглодонной колбе, которая погружена до горла в
смесь воды со льдом. Реакционную колбу ополаскивают двумя
порциями воды по 25 мл. Смесь насыщают при 0—5° газообраз-
газообразным хлористым водородом и оставляют стоять в течение ночи в
вытяжном шкафу, после чего кипятят в течение 2,5 часа с обрат-
обратным холодильником(примечание 4).
Раствор выпаривают досуха при пониженном давлении на
водяной бане. Чтобы отогнать возможно полнее соляную кис-
кислоту, к концу перегонки температуру бани повышают до 100°.
ш-АШШОДИЭТИЛУКСУСНАЯ КИСЛОТА
47
Остаток, состоящий из хлористоводородной соли аминокис-
аминокислоты и неорганических солей, суспендируют в 500 мл абсо-
абсолютного этилового спирта. Суспензию в течение короткого вре-
времени кипятят на паровой бане, затем охлаждают до комнатной тем-
температуры и фильтруют через воронку Бюхнера. Остаток неорга-
неорганических солей промывают 500 мл абсолютного этилового спирта.
Ф.ильтраты соединяют вместе и к раствору прибавляют 400 мл
этилового эфира (химически чистого, для наркоза), чтобы осадить
неорганические примеси. Через несколько часов смесь фильтруют
и остаток промывают смесью 5 частей абсолютного спирта
и 2 частей эфира. Фильтрат переносят в 5-литровую круглодон-
круглодонную колбу, прибавляют к нему около 200 мл воды и жидкие ком-
компоненты отгоняют в вакууме. Почти сухой остаток растворяют
в 2 л воды и раствор обрабатывают избытком свежеприготовленной
гидроокиси свинца (примечание 5). Суспензию разбавляют водой
до объема 3 500 мл, а затем в вакууме при возможно более низкой
температуре упаривают до объема 2 л. После этого суспензию
фильтруют с отсасыванием (примечание 6) и остаток свинцовых
солей тщательно промывают водой. Мутный фильтрат, который
все еще содержит небольшое количество свободного аммиака,
упаривают в вакууме до объема примерно 300—400 мл. Смесь
фильтруют, фильтрат насыщают сероводородом и осадок серни-
сернистого свинца отфильтровывают с отсасыванием (примечание 6).
Затем раствор упаривают на водяной бане в вакууме и к почти
сухому остатку аминокислоты прибавляют 1 л 95%-ного этилового
спирта. Суспензию кипятят с обратным холодильником до тех
пор, пока не растворится почти вся аминокислота, после чего
смеси дают охладиться до комнатной температуры. Аминокислоту,
которая выпадает в осадок в виде мелких игл, отфильтровывают на
воронке Бюхнера и промывают небольшим количеством 95%-ного
этилового спирта. Чтобы получить вторую порцию кристаллов,
соединенные вместе фильтраты выпаривают досуха, остаток
растворяют в небольшом количестве горячей воды и раствор обра-
обрабатывают 95%-ным этиловым спиртом. Аминокислоту сушат на
воздухе, а затем в вакуум-эксикаторе над фосфорным ангидри-
ангидридом. Общий выход а-аминодиэтилуксусной кислоты составляет
58,8—65 г C9—43% теоретич., если принять, что препарат содер-
содержит точно одну молекулу кристаллизационной воды; примечание 7).
Примечания
1. Проверявшие синтез применяли 1-литровую коническую
колбу с притертой стеклянной пробкой.
2. Метиловый спирт не должен содержать ацетона, так как
в присутствии последнего будет образовываться а-аминоизо-
масляная кислота.
48
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
3. Притертую стеклянную пробку следует слегка покрыть
смазкой для кранов. Пробку необходимо укрепить с помощью
изоляционной ленты, так как во время нагревания колбы создается
небольшое давление.
4. Гидролиз необходимо проводить в вытяжном шкафу. Верх-
Верхнюю часть обратного холодильника следует соединить при помощи
стеклянной трубки с вентиляционным каналом. Метиловый
спирт, содержащийся в реакционной смеси, улетучивается в виде
хлористого метила вместе с небольшим количеством Хлористого
водорода.
5. Гидроокись свинца приготовляют следующим образом.
К непрерывно перемешиваемому раствору 569 г A,5 моля) уксус-
уксуснокислого свинца (СН3СО2J РЬ • ЗН2О в 1 350 мл воды прибав-
прибавляют через капельную воронку 1 500 мл 2п. раствора едкого
натра C моля). Осадок отфильтровывают на воронке Бюхнера
диаметром 13 см и тщательно промывают водой, чтобы уда-
удалить растворимые в воде примеси. Гидроокись свинца в виде
пасты переносят в раствор, который хотят освободить от ионов
хлора.
6. Применяют воронку Бюхнера соответствующего размера
с двумя фильтрами из уплотненной фильтровальной бумаги,
покрытыми тонким слоем увлажненного активированного бере-
березового угля.
7. Проверявшие синтез получили сперва 65 г чистой амино-
аминокислоты; вторая порция в 5 г содержала ионы хлора. При нагре-
нагревании в незапаянном капилляре чистый препарат возгонялся
при 255° не плавясь.
Другие методы получения
а-Аминодиэтилуксусная кислота была получена из а-бром-
диэтилуксусной кислоты и аммиака1 и омылением а-аминодиэтил-
ацетонитрила соляной . кислотойг. Требуемый нитрил был
получен нагреванием циангидрина диэтилкетона с эквивалентным
количеством раствора аммиака в этиловом спирте2; нагреванием
диэтилкетона со спиртовым раствором цианистого аммония3;
нагреванием диэтилкетона с раствором цианистого калия и хло-
хлористого аммония 1-4.
1 Rosenmund, Ber., 42, 4472 A909).
2Tiemann, Friedlander, Ber., 14, 1973 A881).
3 Гулеввч, В а с м у с, Ber., 39, 1191 A906).
4 Fr е у t ag, Ber., 48, G49 A915).
2-АМИНО-6-МЕТИЛБЕНЗОТИАЗОЛ
49
2-АМИНО-6-МЕТИЛБЕНЗОТИАЗОЛ
A-Амино-5-метилбензотшзол)
Н3С
Н3С
\/
NH
C = NH
HS
NaSCN
H2SO4
so2ci2
H3C
H,d
NH
\
C=NH
!
H
\/\s/
C—NH2
Предложили: Ч. Аллен и Дж. ВанАллан.
Проверили: В. Бахман и Н. Мак-Нотон.
Получение
В 3-литровой трехгорлой круглодонной колбе, снабженной
мешалкой, обратным холодильником, термометром и капельной
воронкой, приготовляют раствор 107 г A моль) я-толуидина (при-
(примечание 1) в 700 мл хлорбензола. К раствору в течение 5 мин.
прибавляют по каплям 54 г B9,3 мл, 0,55 моля) концентрирован-
концентрированной серной кислоты. К мелко раздробленной суспензии сернокис-
сернокислого л-толуидина прибавляют 90 г A,1 моля) роданистого нат-
натрия и нагревают смесь на масляной бане в течение 3 час. при 100°
(температура внутри колбы; примечание 2). Раствор, который
теперь содержит тиомочевину, охлаждают до 30° и в течение 15 мин.
прибавляют к нему 180 г A08 мл, 1,34 моля) хлористого сульфу-
рила, следя за тем, чтобы температура не поднялась выше 50°.
Температуру смеси поддерживают при 50° в течение 2 час. (пока
не прекратится выделение хлористого водорода), после чего
осадок отфильтровывают от хлорбензола (примечание 3).
Этот осадок растворяют в 1 л горячей воды, а оставшийся
растворитель удаляют из раствора перегонкой последнего с водя-
водяным паром (примечание 4). Раствор отфильтровывают от неболь-
небольшого количества твердой примеси и подщелачивают до щелочной
реакции на лакмус, прибавляя 200мл концентрированного амми-
аммиака (уд. вес 0,90). Выпавший в осадок аминометилбензотиазол
отфильтровывают и промывают 200 мл воды. Твердое вещество,
плавящееся в пределах 123—128°, растворяют в 300 мл горячего
спирта (примечание 5); к раствору прибавляют 10 г активирован-
активированного березового угля и полученную суспензию фильтруют в горя-
горячем состоянии. Фильтрат разбавляют 500 ~мл горячей воды, смесь
энергично перемешивают и быстро охлаждают. Через полчаса
светложелтое зернистое вещество отфильтровывают, промывают
4 Сборник 3
50
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
150 мл 30%-ного спирта и сушат до постоянного веса. Выход
составляет 100—105 г. 2-Амино-6-метилбензотиазол плавится при
135—136° (предварительно при 130—131° происходит усадка веще-
вещества; примечание 6). Если к фильтрату прибавить 200 мл воды,
то можно получить еще 5—8 г вещества, так что общий выход
достигает 105—ПО е F4—67% теоретич.).
Примечания
1. Были использованы продажные реактивы. Проверявшие син-
синтез применяли л-толуидин, перегнанный непосредственно перед
использованием.
2. При желании на этой стадии можно выделить л-толилтио-
мочевину, для чего ее отфильтровывают и промывают эфиром.
Высушенный осадок A72 г) представляет собой смесь л-толилтио-
мочевины и сернокислого натрия, Цоследний извлекают 250 мл
теплой E0—60°) воды. Оставшаяся л-толилтиомочевина с
т. пл. 188—189° целиком растворима в спирте. Выход составляет
139 г (84% теоретич.).
3. Обратно выделяется около 600 мл хлорбензола. Его можно
вновь использовать в реакции без дополнительной очистки.
4. Если на этой стадии обработать раствор активированным
березовым углем, то это не приведет к улучшению качества конеч-
конечного препарата.
5. Если взять меньшее количество спирта, то вещество выкри-
выкристаллизовывается во время фильтрования.
6. Значения температур плавления, приведенных в литературе,
находятся в интервале 128—142°. Более высокую температуру
плавления обычно имеет аминометилбепзотиазол, полученный
через его солянокислую соль (т. пл. 250—253°). Авторы синтеза
указывают, что температура плавления препарата, полученного
по данной прописи, не изменяется после превращения его в гид-
гидрохлорид и обратного выделения. Однако в результате такой
обработки вещество удается обесцветить.
Другие методы получения
2-Амино-6-метилбензотиазол был получен действием родани-
роданистой меди 1-3 или хлорамина и роданистого аммония4 на л-толу-
л-толуидин; действием хлора на ди-л-толилтиомочевину3 или действием
брома на ацетилди-л-толилтиомочевинув; обработкой л-толилтио-
мочевины галоидами7 или галоидангидридами 8~12. С превосход-
превосходным выходом 2-аминобензотиазол был получен действием гид-
роксиламина на бензотиазол13.
1 R a u f m a n n, Oehring, Clauberg, Arch. Pharm., 266,
197 A928) [С. А., 22, 2166 A928)].
З-АМИНО-2-НАФТОЙНАЯ КИСЛОТА
51
2 Kaufman n, Kuchler, Ber., 67, 946 A934).
3 Kaufmann, герм. пат. 579818 [С. А., 28, 1053 A934)].
4Лихошерстов, Петров, ЖОХ, 3, 759 A933).
5 I. G. Farbenindustrie A.-G., франц. пат. 688867 [С. А., 25, 968 A931)].
«Hunter, Jones, J. Chern. Soc, 1930, 2197.
'Hunter, J. Chem. Soc, 1926, 1399. ,
8 H e r z, Schubert, ам. пат. 2003444 [С. А., 29, 4774 A935)].
9 I. G. Farbenindustrie A.-G., англ. пат. 345735 [С. А., 26, 1944 A932)].:
10 E. I. du Pont de Nemours and Co., франц. пат. 727410 [С. А., 26, 5103
A932I.
11 II e r z, Schubert, герм. пат. 537105 [Frdl., 17, 615 A932); С. А.,
26, 1000 A932)].
12 Schubert, Schutz, герм. пат. 604639 [Frdl., 21, 227 A934);
С. А., 29, 819 A935)].
13 S k r a u p, Ann., 419,65A919).
З-АМИНО-2-НАФТОЙНАЯ КИСЛОТА
NH3
OH
\/\/
NH2
Предложили: '/. Алмн и А. Белл.
Проверили: Н. Драйк, Э. Рив и Дж. Ван Хоок.
Получение
В автоклав (примечание 1) последовательно загружают
600 мл (9,5 моля) 28%-ного водного аммиака, 78 г хлористого
цинка @,57 моля; примечания 2 и 3) и 167 г З-окси-2-нафтойной
кислоты @,89 моля;примечание 4). Автоклав закрывают и затем при
непрерывном перемешивании или взбалтывании его содержимого
(примечание 5) постепенно нагревают таким образом, чтобы по ис-
истечении 3 час. температура достигла 195°. На этом уровне темпера-
температуру поддерживают в течение 36 час; давление в автоклаве достига-'
ет около 28 am (примечание 6). Автоклав оставляют охлаждаться
до комнатной температуры, продолжая непрерывное перемеши-
перемешивание или взбалтывание. Затем крышку автоклава снимают,
соскабливают твердые частицы с его стенок и реакционную смесь
переносят в 5-литровую колбу. Автоклав ополаскивают двумя
порциями воды по 700 мл и эту воду присоединяют к реакционной
смеси.
К содержимому колбы добавляют 660 г концентрированной
соляной кислоты (уд. вес 1,18) и полученную суспензию кипятят в
течение получаса, а затем фильтруют в еще горячем состоя-
состоянии через воронку Бюхнера. Твердый остаток переносят в колбу
и снова кипятят в течение получаса со смесью 500 мл воды и 30 мл.
концентрированной соляной кислоты, после чего реакционную
смесь фильтруют, как было указано выше.
4*
52
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Из соединенных вместе фильтратов после их охлаждения выпа-
выпадает в осадок хлористоводородная соль аминонафтойной кислоты,
которую отфильтровывают с отсасыванием и отжимают по возмож-
возможности досуха. Для получения второй порции хлористоводородной
соли фильтрат нагревают до 85°, прибавляют к нему 500 г пова-
поваренной соли и раствор охлаждают.
.. Полученные в результате обоих фильтрований твердые остат-
остатки помещают во влажном состоянии вместе с 1 300 мл* воды в
5-литровую колбу; а затем при перемешивании добавляют в нее
40%-ный раствор едкого натра в количестве, как раз достаточном
для1того, чтобы реакция смеси на желтую тиазоловую бумажку
Клейтона была щелочной (примечание?). Для этого требуется около
ПО мл щелочи. Смесь нагревают до 85° и фильтруют, чтобы уда-
удалить небольшое количество нерастворимых примесей. Фильтрат
подкисляют до, кислой реакции на конго прибавлением кон-
концентрированной соляной кислоты (около 100 мл). Смесь пере-
перемешивают в течение 15 мин., а затем прибавляют к ней 10%-ный
раствор уксуснокислого натрия в количестве, достаточном, чтобы
красная бумажка конго не окрашивалась более в синий цвет.
Необходимое количество раствора уксуснокислого натрия зави-
зависит от кислотности смеси. Обычно бывает достаточно 15 мл.
Смесь фильтруют в горячем состоянии; аминонафтошгую кис-
кислоту промывают на воронке Бюхнера 400 мл горячей воды и от-
отжимают по возможности досуха. Препарат сушат до постоянного
веса при 50° B4—36 час). З-Амино-2-нафтойная кислота
представляет собой желтое порошкообразное вещество с т. пл.
214—215° (примечание 8). Выход составляет 110—115 г F6—70%
теоретич.; примечание 6). Количества применяемых в этом син-
синтезе исходных реагентов ограничены исключительно объемом
имеющегося автоклава. Выход (в процентах) при опытах с боль-
большими количествами был таким же, как указано выше.
Примечания
1. Необходим автоклав, снабженный мешалкой, или качаю-
качающийся автоклав. Если использовать обычный автоклав для ката-
каталитического гидрирования, то после синтеза аппарат стано-
становится непригодным и помещенный в него катализатор отравляется.
Автоклав можно очистить, для чего следует наполнить его 5%-ной
соляной кислотой и протереть стенки с внутренней стороны тряп-
тряпкой или щеткой. Затем автоклав необходимо промыть водой и вы-
высушить; все твердые частицы, приставшие к стенкам, надо уда-
удалить, протерев стенки наждачной бумагой. Следует соблюдать
осторожность и не поцарапать при этом уплотняющее устройство
автоклава. Все части автоклава для гидрирования, в том числе
U крышка, должны быть тщательно очищены. Если даже следы
З-АМИНО-2-НАФТОЙНАЯ КИСЛОТА
53
препарата останутся на стенках, то под действием кислорода
воздуха произойдет разъедание автоклава и внутренняя поверх-
поверхность его станет шероховатой.
После того как автоклав будет очищен, лучше всего провести
в нем один или два процесса гидрогенолиза сложных эфиров
с медно-хромитным катализатором, чтобы избавиться от последних
следов «яда»; лишь после этого автоклав можно использовать для
каталитического гидрирования.
2. Хлористый цинк не должен содержать заметных следов
хлорокиси.
3. Так как хлористый цинк и водный раствор аммиака реа-
реагируют с выделением тепла, то хлористый цинк следует прибав-
прибавлять постепенно и при размешивании от руки. Лучше всего про-
проводить эту операцию в вытяжном шкафу.
4. Применялась техническая З-окси-2-нафтойная кислота е
т. пл. 211—214°.
5. Необходимо постоянное перемешивание или взбалтывание
с момента начала нагревания и до того времени, когда реакцион-
реакционная смесь снова достигнет комнатной температуры. При исполь-
использовании применяемых для гидрирования автоклавов легко поддер-
поддерживать герметичность; в случае же автоклава, снабженного мешал-
мешалкой, в сальнике может образоваться течь. При этом давление
будет падать и для проведения синтеза потребуется больше време-
времени. Если произойдут значительные потери аммиака, то выход мо-
может уменьшиться; однако следует довести опыт до конца, выделить
обратно не вошедшую в реакциюоксинафтойную кислоту и исполь-
использовать ее в другом опыте.
6. В опыте, проводившемся в автоклаве, сальник которого
имел течь, давление все время не превышало 14 am. Автоклав
с мешалкой работал в течение 5 дней; выход составил 67% теоре-
теоретического количества.
7. Желтая бумажка Клейтона (тиазоловая бумажка) пред-
представляет собой бумагу, пропитанную красителем, который обра-
образуется при сочетании диазотированной примулинсульфокислоты
с примулинсульфокислотой. Изменение окраски для этого инди-
индикатора имеет место при рН 11—12. Если такой бумажки не имеется,
то щелочь следует взять в количестве несколько меньшем, чем
вычисленное. Смесь нагревают до 85°, отбирают небольшую пробу
и нагревают ее е дополнительной порцией щелочи. Если при этом
наблюдается растворение заметных количеств нерастворимых
примесей, то следует взять больше щелочи.
8. Для большинства целей этот препарат достаточно чист.
Его можно перекристаллизовать из спирта (Юг препарата рас-
растворяют в 100 мл горячего спирта); выход при перекристаллиза-
перекристаллизации составляет 78% G,8 г); очищенное вещество плавится при
216—217°.
54
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Другие методы получения
З-Амино-2-нафтойная кислота была получена нагреванием
З-окси-2-нафтойной кислоты с аммиаком под давлением в присут-
присутствии катализаторов. Катализаторы содержат хлористый цинк
или хлористый кальций *~4 как без добавки, так и с добавкой
хлористого алюминия5. Применялись также окись цинка, или угле-
углекислый цинк и хлористый аммоний 6~8, или железо-аммиачные
соли9' 10. Если нагревать натриевую соль оксинафтойной кислоты
с 35%-пым водным аммиаком при 260—280°, то полученный препа-
препарат будет содержать значительные количества C-нафтола и р-наф-
тиламина в качестве примесей11.
1 Soc. anon, pour 1'ind. chim. a Bale, англ. пат. 250598 [Frdl., 16, 487
A927—1929); С. А., 21, 1127 A927)].
2 T о b 1 e г, ам. пат. 1629894 [Frdl., 16, 487A927—1929); С. А., 21,
2273 A927)].
3 I. Q. Farbenindustrie A.-G., англ. пат. 284998 [Frdl., 16, 484 A927—
1929); С. А., 22, 4540 A928)].
4 H e n 1 e, L a n z, ам. пат. 1871990 [С. А., 26, 5971 A932)].
5 Fierz, Tobler, Helv. Chim. Acta, 5, 558 A922).
c D u i 1 a, Ber., 67, 1321 A934).
» I. Q. Farbenindustrie A.-G., англ. пат. 330941 [Frdl., 16, 2999 A927—
1929); С. А., 24, 5768 A930)].
8 S ch w e i t z e г, аи. пат. 1806714 [Frdl., 16, 2998 A927—1929);
С. А., 25, 4012 A931)].
9 I. G. Farbenindustrie A.-G., англ. пат. 282450 [Frdl., 16, 487 A927—
1929); С. А., 22, 3669 A928I.
10 H о t z, L a n z, ам. пат. 1690785 [Frdl., 16, 487 A927—1929); С. А.,
23, 397 A929)].
11 M 6 h 1 a u, Ber., 28, 3096 A895).
OH
I NO2
2-АМИ Н0-4-Н ИТРОФЕНОЛ
ОН
NH2
+ 3Na2S + 6NH4C1 ¦
NO2
+ 2H2O+6NH3 + 6NaCl + 3S
NO2
Предложили: В. Хартмэн и К. Силловей.
Проверили: X. Снайдер и Дж. Кнейсли.
Получение
В 5-литровую трехгорлую колбу, под которой установлена
паровая баня, помещают 300 г A,63 моля) технического 2,4-ди-
нитрофенола и 2 500 мл воды. Колбу снабжают эффективной мешал-
2-АМИНО-4-НИТРОФЕНОЛ
55
кой, обратным холодильником и термометром, шарик которого
должен находиться ниже поверхности смеси. Пускают в ход
мешалку, после чего к содержимому колбы прибавляют 600 г
A1,6 моля) хлористого аммония и 100 мл концентрированного
водного аммиака (примерно 28%-ного) и смесь нагревают до 85°.
Затем доступ пара прекращают и смеси дают охладиться. Когда
температура упадет до 70° (примечание 1), к смеси прибавляют
700 г E,4 моля) 60%-ного плавленого сернистого натрия порция-
порциями по 100 г с перерывами в 5 мин. После прибавления двух-трех
таких порций температура реакционной смеси поднимается до
80—85°; ее поддерживают на этом уровне, для чего либо прибав-
прибавляют оставшиеся порции сернистого натрия с 10-минутными пере-
перерывами, либо охлаждают колбу мокрым полотенцем и продол-
продолжают прибавление через каждые 5 мин. После того как весь
сернистый натрий будет добавлен, температуру реакционной смеси
поддерживают при 85° в течение еще 15 мин. затем смесь филь-
фильтруют через нагретую воронку Бюхнера диаметром 15 см (приме-
(примечание 2).
Горячий фильтрат переливают в 5-литровую круглодонную
колбу и охлаждают в течение ночи струей холодной воды. Смесь
фильтруют и кристаллы отжимают почти досуха. Твердое веще-
вещество растворяют в 1 500 мл кипящей воды и раствор подкисляют
ледяной уксусной кислотой (требуется около 100 ял; примечание 3).
Раствор нагревают с 10 г активированного березового угля,
фильтруют в горячем состоянии, а затем охлаждают до 20е. Бурые
кристаллы отфильтровывают и сушат в течение нескольких часов
в сушильном шкафу при 65е или в вакуум-эксикаторе (примеча-
(примечание 4). Выход 2-амино-4-нитрофенола с т. пл. 140—142° состав-
составляет 160—167 г F4—67% теоретич.). Если желательно получить
более чистый препарат, то неочищенное вещество следует подверг-
подвергнуть повторной перекристаллизации из 1 500 мл горячей воды;
при этом получают 147—153 г E8—61% теоретич.) 2-амино-4-нит-
рофенола с т. пл. 142—143°.
Примечания
1. Если вести реакцию при температуре ниже 70°, то получить
чистый препарат невозможно даже после нескольких перекри-
перекристаллизации.
2. Для того чтобы нагреть воронку Бюхнера, ее укрепляют
в перевернутом положении над паровой баней и пропускают
через нее в течение не менее 10 мин. сильный ток пара. При
фильтровании применяют слабое отсасывание, время от времени
прерывая его, чтобы избежать чрезмерного охлаждения в резуль-
результате испарения в нижней части воронки. Если фильтрование не
будет проведено быстро и внимательно, то неочищенный препарат
56
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
способен закристаллизоваться в воронке. Можно раствор и не
фильтровать, однако наличие в нем нерастворимых примесей
осложняет последующую стадию, так как затрудняет определение
того момента, когда растворение сырого препарата можно будет
считать полным.
3. Необходимое количество кислоты зависит от степени влаж-
влажности отфильтрованной массы. Процесс подкисления можно кон-
контролировать, наблюдая окраску тонкого слоя раствора, разбрызги-
разбрызгиваемого по стенкам сосуда. Цвет меняется, начиная от тёмнокрас-
тёмнокрасного и становясь к концу реакции оливково-бурым. Обе окраски
настолько интенсивны, что различить их нелегко, почему прихо-
приходится следить за цветом раствора в тонком слое. После того как
реакция будет кислой, к раствору прибавляют еще 10 мл уксус-
уксусной кислоты.
4. Если вещество высушено недостаточно, то препарат пла-
плавится при 80—90° благодаря присутствию в нем кристаллиза-
кристаллизационной воды.
Другие методы получения
2-Амино-4-нитрофенол был получен частичным химическим 1-5
и электролитическим6 восстановлением 2,4-динитрофенола, а также
действием серной кислоты на 3-нитроазидобензол7.
1 Laurent, G е г h a r d i, Ann., 75, 68 A850).
2Post, Stuckenberg, Ann., 205, 72A880).
3 A u w e r s, Rohrig, Ber., 30, 995 A897).
4Pomeranz, герм. пат. 289454 [Frdl., 12, 117 A914—1916)].
5 Г е р ш з о н, ЖПХ, 9, 879 A936).
«Hofer, Jacob, Ber., 41, 3196 A908).
'Kehrmann, Idzkowska, Ber., 32, 1066 A899).
1-АМИНО-1,3,4-ТРИАЗОЛ
D- Амино- 7,2,4-триазол)
HCO2C2H5 + NH2NH2-H2O -
2HCONHNH2
Нагревание
NH2N<
,CH=N
2H2O
Предложили: Ч. Аллен и А. Белл.
Проверили: В. Бахман и Дж. Джонсон.
Получение
В 1-литровую кругло донную колбу, снабженную эффективным
обратным водяным холодильником, помещают 148 г B моля)
1-АМИНО-1,3,4-ТРИАЗОЛ
57
этилового эфира муравьиной кислоты (т. кип. 52—53°) и 150 мл
95%-ного этилового спирта. К этому раствору осторожно прибав-
прибавляют (примечание 1) в течение 10 мин. при взбалтывании 120 г
B моля) 85%-ного гидразин-гидрата. После того как интенсив-
интенсивность реакции немного уменьшится, раствор кипятят в течение
18 час. на паровой бане. Затем большую часть воды и спирта
отгоняют при пониженном давлении до тех пор, пока объем жидко-
жидкости, оставшейся в колбе, не будет равен примерно 150 мл. Получен-
Полученную сиропообразную жидкость—неочищенный формилгидразин—
нагревают в течение 3 час. при атмосферном давлении, повышая
постепенно температуру бани от 150 до 200°. После охлаждения,
примерно до 100° маслянистую массу растворяют в 50 мл 95%-ного
этилового спирта и к раствору прибавляют 5 г активированного
березового угля. Затем раствор фильтруют, разбавляют 75 мл
эфира и помещают для охлаждения в ледник. Кристаллическое
вещество отфильтровывают, промывают 50 мл спирто-эфирной
смеси A : 2) и сушат. Выходаминотриазола с т. пл. 77—78° состав-
составляет 55—60 г F5—71 % теоретич.; примечание 2). Если желательно
получить более чистый препарат, то сырое промытое вещество-
можно перекристаллизовать; для этого используют теплый
95%-ный этиловый спирт B мл спирта на 1 г препарата); к полу-
полученному раствору добавляют эфир B,5 мл эфира на 1 г препарата)
и раствор сильно охлаждают. Температура плавления очищенного-
препарата 81—82°.
Амин, оставшийся в фильтрате, можно выделить в виде его-
хлористоводородной соли. С этой целью соединенные вместе рас-
растворы выпаривают на паровой бане, прибавляют к остатку 50 мл
концентрированной соляной кислоты и продолжают нагревание
в течение 2 час. По охлаждении сиропообразная жидкость закри-
сталлизовывается. Массу разбалтывают с 50 мл этилового спирта
и хлористоводородную соль 1-амино-1,3,4-триазола отфильтро-
отфильтровывают, промывают небольшим количеством этилового спирта
и сушат. Выход хлористоводородной соли составляет 10—18 г
(8—15% теоретич.); т. пл. 147—148°; соль можно перекристалли-
перекристаллизовать из 95%-пого этилового спирта, используя 10 мл спирта на
1 г препарата; в результате перекристаллизации температура
плавления повышается до 151—152°.
Примечания
1. Реакция протекает очень бурно; однако, если гидразин-
гидрат прибавлять осторожно, то реакцию вполне можно контро-
контролировать.
2. Суммарный выход основания и хлористоводородной соли
всегда составляет около 80—81%. Если выход основания падает,.
то выход хлористоводородной соли возрастает.
58
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Другие методы получения
1-Амино-1,3,4-триазол был получен из ортомуравьиного эфира
и гидразин-гидрата в запаянной трубке при температуре 12O01;
нагреванием формилгидразина до 150—210°2~4; нагреванием
N, N'-диформилгидразинадо 160°5; декарбоксилированием4-амино-
1,2,4-триазолдикарбоиовой кислоты6; сплавлением 1,2-дигидро-
1,2,4,5-тетразина6; нагреванием 1,2-дигидро-1,2,4,5-тетразин-
дикарбоновой кислоты выше температуры ее плавления /''6'7.
1 S t о 1 1 е, J. prakt. Chem. B), 68, 467 A903).
2Ruhemann, Stapleton, J. Chem. Soc, 75, 1132 A899).
3 R u h e m a n n, Merriraan, J. Chem. Soc, 87. 1772 A905).
«Hantzsch, Silberrad, Ber., 33, 85 A900).
s P с 1 1 i z z а г i, Atti accad. Lincei E), 8 (I) 331 (Chem. Zentr., 1899,
I, 1240); Gazz. chim. ital., 39 (I), 530 A909).
«Curtius, Darapsky, Mflller, Ber., 40, 835, 1194 A907).
' С u r t i u s, Lang, J. prakt. Chem. B), 38, 549 A888).
dJ-a-АМИНО-а-ФЕНИЛПРОПИОНОВАЯ КИСЛОТА
(а-фенил-дХ-аланин)
C6H6COCH3 + NaCN + NH4C1 -> QH5C(CH3)(NH2)CN + H2O + NaCl
Охлаждение
C6H5C(CH3)(NH2)CN + HiiO+HCl >¦ C6H6C(CH3)(NH3C1)CONH2
Нагревание
C6H5C(CH3)(NH3C1)CONH2 + H2O + HC1 >
-> C6H5C(CHS)(NH3C1)CO2H + NH4C1
C6H6C(CHS)(NHSC1)CO2H + C6H6N -> CGH5C(CH3)(NH2)COaH +C5H6NHC1
Предложил: P. Штейгер.
Проверили: P. Шрайнер и С. Роулэнд.
Получение
В 2-литровую круглодонную колбу помещают в указанном
ниже порядке раствор 50 г A моль) 98%-ного цианистого натрия
в 100 мл воды, раствор 58,9г A,1 моля) хлористого аммония в
140 мл тепловатой воды (около 35°) и 134 мл B моля) водного
аммиака (уд. вес 0,90). К смеси при взбалтывании прибавляют
раствор 120 г A моль) ацетофенона в 300 мл 95%-ного этилового
спирта. Горло колбы закрывают резиновой пробкой и, закрепив
последнюю проволокой (примечание 1), погружают колбу в водя-
водяную баню, температуру которой поддерживают около 60°. Колбу
время от времени встряхивают, и примерно через полчаса раствор
становится гомогенным. Реакционную смесь нагревают в течение
5 час. при температуре 60°, затем сильно охлаждают в смеси льда
йг-а-АМИНО-а-ФЕНИЛПРОПИОНОВАЯ КИСЛОТА
59
с водой и осторожно (в хорошо действующем вытяжном шкафу)
выливают в погруженную до горла в смесь льда с водой 5-литро-
5-литровую круглодонную колбу, содержащую 800 мл концентрированной
соляной кислоты (уд. вес 1,18—1,19). Реакционную колбу опо-
ополаскивают двумя порциями воды по 25 мл, которые потом прибав-
прибавляют к раствору в соляной кислоте. Раствор аминонитрила насы-
насыщают сухим хлористым водородом (примечание 2) при 0—5°, а за-
затем оставляют стоять в течение ночи в бане со льдом и водой, при-
причем за это время лед тает и температура бани повышается до
комнатной. К образовавшейся смеси твердого и жидкого веществ
прибавляют 1 л воды и энергично кипятят реакционную массу
в течение 2,5 часа с обратным холодильником в хорошо дейст-
действующем вытяжном шкафу (примечание 3). Продукт гидролиза,
окрашенный в темный цвет, упаривают в вакууме, чтобы удалить
ацетофенон и другие летучие примеси. Под конец раствор пере-
переносят в фарфоровую чашку диаметром 25 см и, время от времени
перемешивая его, выпаривают почти досуха. После обильного
осаждения минеральных солей толчки при упаривании почти не
имеют места. Твердый остаток дважды выпаривают на водяной
бане с водой (порциями по 100 мл), чтобы удалить как можно
больше соляной кислоты. Остаток измельчают и прибавляют
к нему 600 мл абсолютного этилового спирта. Образовавшуюся
суспензию в течение короткого времени нагревают на паровой
бане; затем ее тщательно взбалтывают и охлаждают в смеси льда
с водой. Минеральные соли удаляют фильтрованием через во-
воронку Бюхнера диаметром 15 см и осадок промывают небольшими
порциями абсолютного спирта, общее количество которого состав-
составляет 600 мл. Фильтрат и промывную жидкость, соединенные вместе,
помещают в 3-литровый стакан и, перемешивая смесь от руки
толстой стеклянной палочкой, прибавляют к ней пиридин. При-
Прибавление пиридина продолжают до тех пор, пока реакция
раствора на конго не будет почти нейтральной, после чего при-
прибавляют дополнительно еще 50 мл пиридина; общее количе-
количество прибавленного пиридина составляет 80—100 мл (приме-
(примечание 4).
Полученную почти твердую пасту охлаждают в течение 1 часа
в смеси льда с водой. Осадок отфильтровывают на воронке Бюх-
Бюхнера диаметром 15 см и промывают абсолютным этиловым спиртом
порциями по 25 мл до тех пор, пока препарат не станет белым,
а фильтрат—бесцветным (на это требуется 100—200 мл спирта).
Объемистый препарат сушат в вакуум-эксикаторе над едким на-
натром (в хлопьях). Выход составляет 66 г D0% теоретич.).
Аминокислота содержит небольшое количество хлористого
аммония, который можно удалить, если препарат растворить
в воде B1 весовая часть воды на 1 весовую часть аминокислоты)
и осадить прибавлением абсолютного этилового спирта D2 весо-
60
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
вые части спирта на 1 весовую часть аминокислоты (примечание 5).
Смесь оставляют стоять в течение ночи в холодильнике. Амино-
Аминокислоту отделяют на воронке Бюхнера и промывают водным
раствором этилового спирта, в котором последний содержится
в количестве 80% (по весу). Препарат сушат в вакуум-эксикаторе
над едким натром (в хлопьях). Выход очищенного вещества дости-
достигает 70% (примечание 6).
Примечания
1. Для проведения этой стадии удобно применять колбу с при-
притертой стеклянной пробкой. Пробку следует слегка покрыть обычной
смазкой для кранов. Так как во время нагревания реакционной
смеси создается некоторое давление, пробку необходимо плотно
укрепить при помощи изоляционной ленты.
2. Требуется 500—600 г сухого хлористого водорода. По-
Поскольку хлористый водород поглощается очень быстро, можно
воспользоваться аппаратом для его получения с большой произ-
производительностью.
3. Гидролиз аминонитрила необходимо проводить в хорошо
действующем вытяжном шкафу. Верхнюю часть обратного холо-
холодильника следует соединить с вентиляционным коробом при
помощи стеклянной трубки.
4. Минимальное количество необходимого пиридина опреде-
определяется количеством оставшейся соляной кислоты.
5. При соприкосновении с водой вещество не сразу смачивается,
а потому растворяется очень медленно. Растертый в мелкий поро-
порошок препарат лучше всего суспендировать в большом избытке
воды, например в 30-кратном по весу количестве ее. Суспензию
кипятят с обратным холодильником и часто взбалтывают до тех
пор, пока препарат не растворится. Затем избыток воды отгоняют
при атмосферном давлении до тех пор, пока не получится раствор
аминокислоты в воде, отвечающий соотношению: 21 часть воды
на 1 часть аминокислоты (но весу). После этого раствор охлаждают
и обрабатывают абсолютным спиртом.
6. Аминокислота не имеет резкой температуры плавления.
Она возгоняется (с разложением) примерно при 265—270°.
Другие методы получения
а-Амино-а-фенилпропионитрил был получен нагреванием циан-
гидрина ацетофенона со спиртовым раствором аммиака A экви-
эквивалент) в закрытом сосуде в течение 6—8 час. при 70о1>2 и нагре-
нагреванием ацетофенона со спиртовым раствором цианистого аммония
в закрытом сосуде в течение 4 час. при 80°3. а-Амино-а-фенилпро-
пионитрил был омылен при действии сначала дымящей соляной
<г1-р-АМИНО-р-ФЕНИЛПРОПИОНОВАЯ КИСЛОТА
61
кислоты при комнатной температуре, а затем разбавленной соля-
соляной кислоты при температуре кипения смеси в присутствии неко-
некоторого количества этилового спирта. Этот метод дает хороший
выход хлористоводородной соли аминокислоты. Обычно амино-
аминокислоту выделяют из ее хлористоводородной соли водным аммиа-
аммиаком 1-3. Метод выделения аминокислоты при помощи обработки
спиртового раствора ее хлористоводородной соли пирддином
в основном тот же, что и разработанный для получения глицина4
и а-аминоизомасляной кислоты5.
1 Т i e m а п п,
2 М с Kenzi e
К oh 1 е г, Вег., 14, 1981 A881).
С 1 о u g h, J. Chem. Soc, 101, 395 A912).
'McKenzie, Clough, J. Chem. Soc, 101, 395 (
3 J a w e 1 о w, Ber., 39, 1195, 1197 A906).
4Анслоу, Кинг, Синт. орг. преп., сб. 1, стр. 167.
'Кларк, Бин, Синт. орг. преп., сб. 2, стр. 34.
Л-Р-АМИНО-р-ФЕНИЛПРОПИОНОВАЯ КИСЛОТА
(dl-^-Аминогидрокоричная кислота)
C6H5CH = C11CO2H + NH2OH -> С6Н5СНСНаСО2Н
NHOH
С6Н6СНСН2СО2Н + Ш20Н -н> С6Н5СНСН2СО2Н
NHOH NH2
Предложил: Р. Штейгер.
Проверили: В. Бахман и Чао Юн-тзунг.
Получение
В 3-литровой круглодонной колбе приготовляют горячий рас-
раствор этилата натрия из 46 г B грамматома) натрия и 1 600 мл абсо-
абсолютного этилового спирта. При взбалтывании к содержимому
колбы прибавляют раствор" 139 г Bмоля) солянокислого гидроксил-
амина в 100 мл горячей воды. Полученную суспензию быстро
охлаждают, поместив колбу в смесь льда с водой, а затем филь-
фильтруют с отсасыванием через воронку Бюхнера. Оставшийся на
фильтре хлористый натрий промывают небольшими порциями
абсолютного этилового спирта (всего 200 мл). Фильтрат снова
переливают в ту же 3-литровую колбу и прибавляют к нему 148 г
A моль) коричной кислоты, в результате чего образуется объеми-
объемистый осадок. Смесь кипятят с обратным холодильником на паровой
бане в течение 9 час. (примечание 1). Через 5—6 час. начинает
выпадать в осадок аминокислота; наличие взвешенных твердых
частиц вызывает кипение смеси толчками (примечание 2). Суспен-
Суспензию оставляют стоять в течение ночи при комнатной температуре,
62
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
после чего кристаллы отфильтровывают на воронке Бюхнера (при-
(примечание 3) и промывают сперва небольшими порциями абсолют-
абсолютного этилового спирта (всего 300 мл), затем небольшим количест-
количеством ледяной воды, чтобы удалить весь хлористый натрий, и, на-
наконец, 300 мл абсолютного этилового спирта, также небольшими
порциями. Бесцветные кристаллы аминокислоты сушат в вакуум-
эксикаторе над измельченным едким натром. Выход составляет
56 г C4% теоретич.).
Если требуется получить более чистый препарат, то сырую
аминокислоту растворяют в 16-кратном (по весу) количестве кипя-
кипящей воды и прибавляют к раствору абсолютный этиловый спирт
D6 мл спирта на 1 г кислоты). Раствор охлаждают в смеси льда
с водой при перемешивании механической мешалкой. Через
3 часа белоснежные кристаллы отфильтровывают на воронке
Бюхнера, промывают 300 мл 95%-ного этилового спирта (неболь-
(небольшими порциями) и сушат, как было указано выше. Выход при
перекристаллизации составляет 81%. Аминокислота плавится
(с разложением) при 221° (примечание 4).
Примечания
1. Когда будет достигнута температура кипения, раствор
становится прозрачным. Для того чтобы обеспечить полноту
превращения гидроксиламинокислоты в аминокислоту, очень
существенно кипятить смесь в течение указанного времени. Обе
кислоты обладают почти одинаковой растворимостью.
2. Иногда горячий раствор остается пересыщенным и кри-
кристаллизация не происходит до тех пор, пока он не охладится.
В таких случаях проверявшие синтез получали низкие выходы.
Поэтому в дальнейших опытах во время процесса кипячения они
вносили в раствор затравку, чтобы вызвать кристаллизацию.
Познер1 для этой цели прибегал к упариванию раствора до поло-
половины его первоначального объема.
3. Если получен указанный в прописи выход, то, повидимому,
маточные растворы после перекристаллизации не содержат более
аминокислоту. В числе других веществ в маточных растворах
присутствует не менее 19 г ацетофеноноксима A4 %), который обра-
образуется в результате побочной реакции
C6HSCHCH2CO2H -> С6Н5ССН2СО2Н -> С5Н5ССН3+СО2
NHOH
NOH
NOH
Ацетофеноноксим можно выделить, если маточные растворы выпа-
выпарить почти досуха, прибавляя к ним несколько раз воду для уда-
удаления спирта, и обработать затем маслянистый остаток 1 н. рас-
раствором углекислого натрия.
сП-а.-АМИНОФЕНИЛУКСУСНАЯ КИСЛОТА
63
4. Температура плавления зависит от скорости и продолжи-
продолжительности нагревания. В литературе указаны различные величины
температуры плавления в пределах от 215 до 231°. Повидимому,
полученный препарат вполне стоек и не проявляет склонности
окрашиваться в розовый цвет, как это утверждает Познер1.
Другие методы получения
Приведенная пропись, за исключением небольших измене-
изменений и добавлений, была разработана Познером1. й/-Амино-C-
фенилпропионовая кислота была также получена кипячением гид-
гидрата оксима C-гидроксиламиногидрокоричногидроксамовой кис-
кислоты с водой2 и декарбоксилированием р-амино-[5-фенилэтан-а,а-
дикарбоновой кислоты3.
1 Posner, Ber., 38, 2320 A905); Ann., 389, 120 A912); Fischer
Scheibler, G г о h, Ber., 43, 2024 A9H).
2 Posner, Ber., 40, 227 A904).
3 Родионов, Малевинская, Ber., 59, 2956 A926); Родио-
Родионов, J. Am. Chem. Soc, 51, 851 A929); Evans, Johnson, там же,
52, 5001 A930); Johnson, L i v a k, там же, 58, 301 A936).
<#-а-АМИНОФЕНИЛУКСУСНАЯ КИСЛОТА
(dl-Фенилглицин; dl-a-амино-а-толуиловая кислота)
C6H5CHO + NaCN + NH4Cl -> C6H5CH(NH2)CN + NaCl + H2O
C6II6CII(NH2)CN + 2HC1 + 2H2O —>¦ C6II5CH(NH2-HC1)CO2H + NH4C1
C5H5CH(NH2-HC1)CO2H + NH3 -> C6H6CH(NH2)CO2H + NH4C1
Предложил: Р. Штейгер.
Проверили: P. Шрайнер, С. Роулэнд и К- Тилфорд.
Получение
В 3-литровую круглодонную колбу, снабженную мешалкой
Гершберга («Синт. орг. преп.», сб. 2, стр. 298, рис. 12), поме-
помещают раствор 100 г B,0 моля) 98%-ного цианистого натрия
в 400 мл воды и прибавляют к нему 118 г B,2 моля) хлористого
аммония. Смесь перемешивают при комнатной температуре
в хорошо работающем вытяжном шкафу. Когда хлористый аммо-
64
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ний растворится, к содержимому колбы в один прием прили-
приливают раствор 212 г"B,0 моля) бензальдегида в 400 мл метило-
метилового спирта. Быстро начинается реакция, и температура повы-
повышается до 45°. Перемешивание продолжают в течение 2 час,
после чего гетерогенную смесь, прибавив к ней 1 л воды, экстра-
экстрагируют 1 л бензола и водный слой отбрасывают. Бензольный
слой промывают тремя порциями воды по 50 мл и аминонитрил
извлекают в виде его гидрохлорида путем взбалтывания бензоль-
бензольного раствора с 6 н. соляной кислотой, сперва с одной порцией
в 600 мл, а затем с двумя порциями по 300 мл.
Соединенные вместе кислотные вытяжки помещают в 3-лит-
3-литровую круглодопиую колбу и кипятят с обратным холодильни-
холодильником в течение 2 час. (примечание 1). Продукт гидролиза разба-
разбавляют водой, доводя объем раствора до 2 л, и подвергают его
перегонке в вакууме B0—30 мм), для того чтобы удалить весь
бензальдегид и прочие летучие примеси (примечание 2). Чтобы
освободиться от некоторого количества смолистых примесей,
выпавших в осадок во время гидролиза, смесь обрабатывают
10 г активированного березового угля и фильтруют через воронку
Бюхнера. Желтый фильтрат переносят в 3-литровый стакан и при
перемешивании от руки толстой стеклянной палочкой прили-
приливают к нему через капельную воронку аммиак (уд. вес 0,90)
„до тех пор, пока реакция жидкости на лакмус не станет слегка
щелочной (примечание 3). Смесь разогревается, появляется силь-
сильный запах бензальдегида, и аминокислота выпадает в осадок
в виде желтых кристаллов. Смесь охлаждают до комнатной тем-
температуры и кристаллы отфильтровывают на воронке Бюхнера
диаметром 15 см. Для удаления хлористого аммония полученные
кристаллы промывают небольшими порциями воды (всего 1 л),
а затем последовательно 150 мл этилового эфира, тремя порциями
горячего 95%-ного этилового спирта по 50 мл и, наконец, 500 мл
воды. Кристаллы тщательно отсасывают и отжимают. Выход
составляет 220—240 г (примечание 4). Окончательное высушива-
высушивание кристаллов производят в вакуум-эксикаторе над фосфорным
ангидридом. Выход неочищенной аминокислоты составляет 102—
116 г C4—39% теоретич.).
С целью очистки вещество растворяют в 800 мл 1 н. раствора
едкого натра, прибавляют 500 мл этилового спирта и раствор
фильтруют. Фильтрат переносят в 2-литровый стакан и нагре-
нагревают до кипения. Затем, перемешивая раствор от руки, медленно
прибавляют к нему через капельную воронку 160 мл 5 н. раствора
соляной кислоты. Смесь охлаждают до комнатной температуры
и фильтруют с отсасыванием. Кристаллы промывают 100 мл
этилового спирта, затем 200 мл воды и сушат в вакуум-эксика-
вакуум-эксикаторе над фосфорным ангидридом. Вещество, полученное в виде
почти бесцветных блестящих пластинок, не имеет определен-
df-a-АМИНОФЕНИЛУКСУСПАЯ 1ШСЛОТА
65
ной температуры плавления (примечание 5). Выход чистой
аминокислоты составляет 98—112 г C3—37% теоретич.; приме-
примечание 6).
Примечания
1. Омыление аминонитрила следует проводить в вытяжном
шкафу, так как при этом выделяется некоторое количество синиль-
синильной кислоты.
2-. Во время перегонки в вакууме объем раствора следует под-
поддерживать равным приблизительно 2 л, часто прибавляя к нему
воду через капельную воронку. Если этого не делать, то может
выделиться хлористоводородный dZ-фенилглицин, который плохо
растворим в концентрированной соляной кислоте.
3. Требуется от 375 до 425 мл аммиака уд. веса 0,90.
4. Неочищенное вещество содержит кристаллизационную воду.
5. Разложение наступает в пределах 270—280°, причем спе-
спекание наблюдается при 258°. Другой образец, который был поме-
помещен в прибор для определения температуры плавления, предва-
предварительно нагретый до 280—300е, спекся, а затем разложился
при 300—302°.
6. Если исходные количества цианистого натрия и хлористого
аммония увеличить до 3 молей, то выход от этого заметно не
улучшится.
Другие методы получения
dZ-Фенилглицин был получен нагреванием до 100—110°а-бром-
фенилуксусной кислоты с тройным (по весу) количеством аммиака
(уд. вес 0.90I; омылением а-амипофепилацетопитрила разбав-
разбавленной соляной кислотой2»3; восстановлением фенилгидразона
бензоилмуравьиной кислоты амальгамой натрия в разбавлен-
разбавленном едком натре4. Описанная выше методика представляет собой,
с некоторыми изменениями и дополнениями, способ, который
разработали Марвелл и Пойес3*.
1 Stockenius, Ber., И, 2002 A878).
2 Т i e m а п п, Вег., 13, 383 A880); U 1 г i с h, там же, 37, 1688 A904);
Зелинский, Стадников, ЖРХО, 38, 473 A906); Inge r s oil,
Adams, J. Am. Chem. Soc, 44, 2933 A922).
'Marvel Noyes, J. Am. Chem. Soc, 42 2264 A920).
4 E 1 bcrs, Ann., 227, 343 A885).
* Штеттен (D. S t e t t e n, jr., частное сообщение) установил, что если
синтез di-a-аминофенилуксусной кислоты проводить по методу Зелинского
и Стадникова [ЖРХО, 40, 792 A908)] и выделять аминокислоту описанным
выше способом, то полученный выход будет не намного больше того, который
указан в приведенной методике.
5 Сборник 3
66
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
2-АМИНО-л-ЦИМОЛ
(Карвакриламин)
сн3
^Ч N02
СН3СНСН3
СН3
+ 2Н2О
СН3СНСН3
Предложили: Ч. Аллен и Дж. ВанАллан.
Проверил: Г. Адкинс.
Получение
В стальной реакционный сосуд для гидрирования под давле-
давлением («Синт. орг. преп.», сб. 1, стр. 51, рис. 3) помещают смесь
179 г A67мл, 1 моль) 2-нитро-л-цимола (стр. 360), 300 мл абсолют-
абсолютного спирта и 3—5 г никеля Ренея (стр. 338). Автоклав закры-
закрывают и вводят в него водород до тех пор, пока давление при 25°
не достигнет 70 am. Автоклав встряхивают и температуру быстро
повышают до 80—90°, после чего обогрев выключают (примеча-
(примечание 1). Поскольку реакция весьма экзотермична, происходит
дальнейшее повышение температуры, которая достигает 120°;
одновременно быстро падает давление. Во время энергичного
протекания реакции A5 мин.) давление в автоклаве поддерживают
при 50—105 am, добавляя водород из баллона. После того
как спад давления прекратится, реакционную смесь поддер-
поддерживают при 100—120° в течение еще получаса. Затем авто-
автоклав охлаждают, водород медленно спускают и катализатор
отделяют от реакционной смеси либо центрифугированием, либо
фильтрованием через стеклянный фильтр или через воронку Бюх-
нера (примечание 2). Спирт и воду отгоняют и вещество подвергают
дробной перегонке в соответствующем приборе (примечания3—7).
Амин перегоняется при 239—240° G40 мм); 242° (исправл.)
G60 мм); 110° A0 мм); 92—94° B мм). При первой перегонке
фракцию, кипящую ниже 225° G40 мм) [или ниже 100° (9 мм)]
отбрасывают. Выход составляет 130—135 г (87—90% теоретич.).
Примечания
1. При гидрировании нитросоедипений выделяется такое
значительное количество тепла и процесс может пойти настолько
быстро, что необходимо принять меры предосторожности против
чрезмерного повышения температуры реакции. При 150—200°
могут образоваться вторичные амины; при еще более высо-
высокой температуре возможны реакции разложения, проходя-
проходящие со взрывом. Чтобы устранить эту опасность, применяют
небольшие порции катализатора и в начале реакции вво-
вводят в реакционный сосуд недостаточное количество водорода.
2-Л1ШН0-Л"-ШШОЛ
67
После того как произойдет поглощение водорода в количестве,
необходимом для гидрирования половины взятого нитросоеди-
нения, можно более не опасаться, что реакция пойдет слишком
быстро. Тем не менее всегда желательно провести гидрирование
как можно быстрее, следя, однако, за тем, чтобы температура
не поднималась выше 120°. Применение спирта в качестве раство-
растворителя препятствует выделению слоя воды, который мог бы по-
покрыть большую часть катализатора, что привело бы к замедле-
замедлению реакции гидрирования и, возможно, помешало бы протека-
протеканию процесса до конца.
2. Если используют недостаточно чистый образец нитроци-
мола или если взятый катализатор обладает низким качеством,
то процесс гидрирования может пройти не до конца и раствор
вещества в соляной кислоте получается мутным. В этом случае
конечную смесь (после отделения отработанного катализатора)
можно вновь подвергнуть гидрированию. По другому варианту
сперва отгоняют с водяным паром вещества не основного харак-
характера, для чего перегонке подвергают реакционную смесь вместе
с 350 мл воды и 90 мл концентрированной соляной кислоты. Амин
выделяют из его соли добавлением 45 г едкого натра с последую-
последующими экстрагированием 500 'мл эфира. Эфирный слой можно отде-
отделить от водного с помощью сифона. Эфир отгоняют, а остаток
фракционируют, как это описано в методике. Для перегонки
с водяным паром авторы применяли аллонж, изображенный
на рис. 6 (стр. 68). С таким аллонжем прибор является более ком-
компактным, чем обычный прибор, поскольку приемник может слу-
служить отчасти и холодильником, как при перегонке в вакууме.
3. Прибор состоит из специальной колбы Клайзена или же
из обыкновенной колбы, соединенной с елочным дефлегматором,
обычным или видоизмененным дефлегматором Видмера или с ка-
какой-либо другой колонкой. Проверявшие синтез применяли видо-
видоизмененный дефлегматор Видмера (стр. 465) и проводили отгон-
отгонку при давлении 9 мм. Авторы синтеза вели отгонку при атмо-
атмосферном давлении в колбе, которая показана на рис. 7 (стр. 68). По
сравнению со стандартной колбой Клайзена колба, использован-
использованная авторами, имеет ряд преимуществ. Она обладает дефлегма-
дефлегматором; содержимое колбы редко перебрасывается, следовательно,
в такой колбе при одинаковом объеме может поместиться боль-
большее количество вещества; наконец, вещество, пришедшее в сопри-
соприкосновение с резиновой пробкой, не может загрязнять дестиллат.
Ни для колбы, ни для описанного в примечании 2 аллонжа не при-
приведены размеры; их можно делать различной величины в зави-
зависимости от индивидуальных потребностей.
4. Обычно нитроцимол содержит около 8% п-нитротолуола.
Полное отделение оставшегося л-толуидина от 2-амино-я-цимола
требует более тщательного фракционирования.
68
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
5. Если горячие пары амина придут в соприкосновение с воз-
воздухом, то конечный препарат окажется окрашенным. Однако
при перегонке вещества при давлении 9 мм с капилляром был
получен препарат, лишь слегка окрашенный в желтый цвет.
6. Восстановление можно провести и при более низких дав-
давлениях в обычной лабораторной аппаратуре («Синт. орг. преп.»,
Р и с. 6.
р и с.
сб. 1, стр. 47, рис.2). Восстановлению подвергают смесь50гнитрс-
цимола, 200 мл 95%-ного спирта и 5 г никеля Ренея при темпера-
температуре 85 — 90° и при начальном давлении 3,8 — 4,2 am. Реакция
продолжается в течение 6 час. Вещество выделяют, как описано
выше. Общий выход составляет 33 — 36 г (80—85% теоретич.).
7. Нитроцимол можно также восстановить железом в порошке
примерно тем же способом, который описан для получения 2,4-дк-
аминотолуола («Синт. орг. преп.», сб. 2, стр. 176; К- Ко у б, частное
сообщениеI.
Другие методы получения
Ввиду доступности я-цимола единственным методом полу-
получения 2-аминоцимола, имеющим практическое значение, является
восстановление нитроцимола. Для этой цели были применены
олово2 или железо5'6 и соляная кислота. В одном из патентов5
упоминается о гидрировании водородом в присутствии никеле-
никелевого катализатора.
1 Doumani, Kobe, J. Am. Chem. Soc, 62, 563 A910).
2Soderbaum, W id man, Бег., 21. 2127 A888).
з Wheeler, Smithey, J. Am. Chem. Soc, 43. 2613 A921).
АММОНИЙНАЯ СОЛЬ 1,2-НАФТОХ1ШОИ-4-СУЛЬФОКИСЛОТЫ 69
4Demonbreun, Kremers, J. Am. Pharm. Assoc, 12, 296
A923) [C. A., 17, 3906 A923)j.
5 A n d r e w s, ам. пат. 1314920 [С. А., 13, 2765 A919)].
e D о u m a n i, Kobe, Ind. Eng. Chem., 31, 264 A939).
АММОНИЙНАЯ И КАЛИЕВАЯ СОЛИ 1,2-НАФТОХИНОН-4-СУЛЬФОКИСЛОТЫ
О
NH2 || п
IINO3 f X/ N^ NH4CI
SO3H
SO3H
О
КС! >^А,
SO3NH4 SO3K
Предложили; Э. Мартин и Л. Физер.
Проверили: Р. Шрайнер и Э. Уэлч.
Получение
В бане со льдом и водой охлаждают до 30° смесь 145 мл азот-
азотной кислоты (уд. вес 1,42) и 400 мл воды, помещенную в стакан
емкостью 2 л; в другом 2-литровом стакане отвешивают 350 г
A,46 моля) чистой, безводной 1-амино-2-нафтол-4-сульфокислоть1
(примечание 1). Первый стакан вынимают из бани и к раствору
при помешивании добавляют порцию в 10 г 1-амино-2-нафтол-
4-сульфокислоты, после чего жидкость оставляют в полном покое.
Обычно окисление начинается во время прибавления сульфо-
кислоты; если же это не произойдет, то по стенке стакана следует
осторожно прилить 2 мл концентрированной азотной кислоты без
перемешивания. Окисление начинается через 1—2 мин., и смесь
приобретает желтую окраску (примечание 2).
Стакан помещают обратно в баню со льдом и к смеси, переме-
перемешиваемой от руки, прибавляют 20—25 г 1-амино-2-нафтол-4-суль-
фокислоты. Немедленно вслед за этим прибавляют вторую пор-
порцию в 20—25 г и смесь перемешивают. Когда последняя начинает
пениться, ее покрывают слоем эфира в 100 мл, который является
эффективным средством для осаждения пены (примечание 3).
Оставшееся количество 1-амино-2-пафтол-4-сульфокислоты прибав-
прибавляют к смеси в течение 3—4 мин. порциями по 20—25 г, причем
после прибавления каждой порции смесь тщательно переме-
перемешивают. Происходит обильное выделение окислов азота и полу-
получается густая желто-оранжевая паста. Температуру поддержи-
поддерживают при 25—30° путем энергичного перемешивания и регулиро
70
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
АММОНИЙНАЯ СОЛЬ i,2-НАФТОХИНОН-4-СУЛЬФОКИСЛОТЫ
71
вания скорости прибавления 1-амино-2-нафтол-4-сульфокислоты
(примечание 4). Окисление заканчивается через 3—4 мин. после
прибавления последней порции; выделение газа при этом прекра-
прекращается. Густую массу перемешивают до тех пор, пока температура
не понизится до 5—10°, после чего к ней прибавляют 175 мл насы-
насыщенного раствора хлористого аммония C0е).
После охлаждения смеси до 0° аммонийную соль 1,2-нафто-
хинон-4-сульфокислоты отфильтровывают на воронке Бюхнера
диаметром 20 см и тщательно отжимают от маточного раствора
с помощью фарфорового шпателя или стеклянной пробки. Полу-
Полученное вещество промывают тремя равными порциями холодной
смеси 150 мл насыщенного раствора хлористого аммония и 100 мл
воды. Промывной раствор возможно тщательнее удаляют и веще-
вещество дважды промывают спиртом (всего 100 мл), я затем 300 мл
эфира, который добавляют небольшими порциями (примеча-
(примечание 5). Аммонийную соль 1,2-нафтохинон-4-сульфокислоты рассы-
рассыпают тонким слоем и сушат до постоянного веса при 35—40°.
Таким образом получают блестящий мелкокристаллический пре-
препарат оранжевого цвета. Выход составляет 350—365 г (94—98%
теоретич.). Аммонийная соль получается хорошего качества
и пригодна для многих целей. Способ дальнейшей ее очистки
пока не разработан, однако эту соль можно превратить в чистую
калиевую соль следующим образом.
В 2-литровой конической колбе нагревают до 50° на паровой
бане 1 700 мл воды, к которой добавлено 0,3 мл жидкого брома
(примечание 6). Колбу вынимают из бани, прибавляют к ее содер-
содержимому 50 г аммонийной соли 1,2-нафтохинон-4-сульфокислоты
и смесь взбалтывают в течение нескольких минут до полного
растворения. Затем в колбу прибавляют 3 г активированного
березового угля и раствор перемешивают в течение 2—3' мин.,
после чего фильтруют с отсасыванием и прозрачный фильтрат
светлооранжевого цвета переносят в 4-литровую коническую
колбу. К фильтрату в один прием быстро прибавляют 400 мл.насы-
мл.насыщенного раствора хлористого калия C0°) и колбу оставляют
спокойно стоять. Немедленно начинают выпадать в осадок оран-
оранжевые кристаллы калиевой соли. После того как колба простоит
в течение получаса, ее содержимое охлаждают до 0° в бане со
льдом и солью, а затем отфильтровывают калиевую соль1,2-наф-
тохинон-4-сульфокислоты на воронке Бюхнера диаметром 15 см.
Твердое вещество промывают 150 мл холодного разбавленного
раствора хлористого калия (для получения этого раствора 30 мл
насыщенного раствора хлористого калия прибавляют к 120 мл
воды), затем 150 мл спирта (небольшими порциями) и, наконец,
300 мл эфира. Калиевую соль сушат до постоянного веса при
40—50°. Выход составляет 48—50 г (90—92?^ теоретич., считая на
взятую аммонийную соль). Препарат получается в виде оранжевых
игольчатых кристаллов, свободных от окрашенных продуктов раз-
разложения, но все еще содержащих следы аммонийных солей. Веще-
Вещество, свободное от аммонийных солей, получается в результате
второй перекристаллизации. Для этого в 2-литровой конической
колбе нагревают до 60° на паровой бане 1 700 мл воды, к которой
добавлено 0,2 мл жидкого брома; колбу отставляют и прибавляют
к ее содержимому 50 г калиевой соли, которая быстро растворяется;
раствор фильтруют с отсасыванием и прозрачный оранжевый
фильтрат переносят в коническую колбу емкостью 4 л. К филь-
фильтрату быстро прибавляют в один прием 300 мл насыщенного рас-
раствора хлористого калия и колбу оставляют спокойно стоять.
Через несколько секунд начинают выделяться оранжевые иголь-
игольчатые кристаллы калиевой соли. После того как смесь простоит
в течение получаса, ее охлаждают до 0° в бане со льдом и солью.
Кристаллы отделяют, промывают и сушат, как было указано выше.
Выход полученной таким образом соли составляет 45—49 г
(90—98% теорети" считая на взятую калиевую соль 1,2-нафтохи-
нон-4-сульфокислоты). В отношении окраски, присутствия окра-
окрашенных продуктов разложения и содержания аммонийной соли
полученный препарат вполне выдерживает сравнение с натрие-
натриевой солью, которую получают более сложным путем с применением
буры1 (примечания 7 и 8).
Примечания
1. 1-Амино-2-нафтол-4-сульфокислота, получение которой было
описано ранее («Синт. орг. преп.», сб. 2, стр. 51), недостаточно
чиста и дает продукт окисления несколько более низкого качества.
В итоге указанного процесса получается препарат серого цвета,
содержащий кристаллизационную воду [таким образом, указан-
указанный выход (в процентах) ошибочен]. В результате дополнитель-
дополнительного исследования этого вопроса было найдено, что темную окрас-
окраску препарата можно свести до минимума или даже устранить пол-
полностью и что окрашенные примеси можно нацело удалить путем
экстрагирования спиртом. Бесцветную безводную сульфокислоту,
которая требуется для настоящего синтеза, получают, следова-
следовательно, введя в прежнюю пропись следующие изменения. Смесь
иитрозо-р-нафтола и раствора бисульфита натрия энергично
перемешивают от руки деревянной лопаточкой, причем все, что
может раствориться, переходит в раствор через 3—4 мин. Раствор
по возможности быстро фильтруют, применяя две воронки Бюх-
пера диаметром 15 см и часто меняя фильтровальную бумагу.
После фильтрования прозрачный золотисто-желтый фильтрат
немедленно подкисляют. В этом случае препарат получается светло-
светлосерого цвета, тогда как, если до подкисления бисульфитного
раствора пройдет много времени, раствор становится красным
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
и аминонафтолсульфокислота может получиться темного пурпур-
пурпурно-серого цвета. После того как вещество отделено и промыто
водой, его дополнительно промывают теплым спиртом до тех
пор, пока фильтрат не станет бесцветным; на это требуется 1 500—
2 000мл растворителя. Затем вещество промывают двумя порциями
эфира по 100 мл и сушат до постоянного веса в отсутствие света
при 60—80°. Таким образом получают чистое белое порошкооб-
порошкообразное сухое вещество, выход которого составляет 370—380 г
G5—78% теоретич., считая на р-нафтол). Этот препарат приме-
применяют в приведенном выше синтезе.
При использовании технической 1-амино-2-нафтол-4-сульфо-
кислоты выход аммонийной соли 1,2-нафтохшгон-4-сульфокисло-
ты составляет 313г (84% теоретич.), причем полученный препарат
окрашен в цвет ржавчины. Если техническую кислоту промыть
2 л теплого 95%-ного спирта, то выход составит 337 г (90% теоре-
теоретич.), причем аммонийная соль будет окрашена в оранжевый цвет.
2. Существенно, чтобы окисление началось именно в этот
момент. Если окисление не начнется, то к смеси следует приба-
прибавить вторую порцию в 1—2 мл концентрированной азотной кисло-
кислоты; кислоту приливают по стенке стакана по возможности так,
чтобы жидкость оставалась в покое.
3. Время от времени необходимо добавлять эфир для возме-
возмещения испарившегося его количества.
4. Температуру необходимо поддерживать в указанных пре-
пределах. При более низкой температуре окисление проходит мед-
медленно и с неудовлетворительным результатом; при более высо-
высокой температуре хинон несколько разлагается.
5. Промывание спиртом и эфиром позволяет удалить неболь-
небольшое количество продуктов разложения и способствует быстрому
высушиванию препарата. Рекомендуется сушить препарат по
возможности быстро.
6. Если водные растворы 1,2-нафтохинон-4-сульфокислоты на-
нагревать до указанной температуры без добавления брома, то они
начинают разлагаться.
7. Реакции для определения степени чистоты препарата раз-
разработал Фолин; позднее их усовершенствовал Даниельсон1.
При непосредственном сравнении обоих препаратов различие
в степени чистоты не обнаруживается.
8. Эта очищенная соль вполне пригодна для применения в син-
синтезах, методики которых разработали Фолин и Сюлливан для опре-
определения аминокислот.
Другие методы получения
Соли 1,2-нафтохинон-4-сульфокислоты были получены окис-
окислением 2-амино-1-нафтол-4-сульфокислоты азотной кислотой2
АНИЛИД ЕЕНЗОИЛУКСУСНОЙ КИСЛОТЫ
73
или же окислением более доступной 1-амино-2-нафтол-4-суль-
фокислоты тем же реагентом3—5.
1 D a n i e I s о n, J. Biol. Chem., 101, 507 A933).
2 W i t t, Kaufman, Ber., 24, 3162 A891).
» F о 1 i n J. Biol. Chern., 51, 386 A922).
4 Boniger, Ber., 27, 24 A894).
5 F i e s e r, J. Am. Chem. Soc, 48, 2929 A926).
АНИЛИД БЕНЗОИЛУКСУСНОЙ КИСЛОТЫ
(а.-Бензоилацетанилид)
C6H5COCH2CO2C2H6 + C6H6NH2 -5. C6H5COCH3CONHC6H5 + C2H6OH
Предложили: Ч. Киблер и А. Вейсбереер.
Проверили: Р. Шрайнер и Ф. Нейман.
Получение
Трехгорлую круглодонную колбу емкостью 250 мл снабжают
капельной воронкой, механической мешалкой и дефлегматором
(высотой 15—20 см) с обогреваемой паром рубашкой и головкой,
расположенной, как у колонок, в верхней его части. Эта головка
снабжена термометром и соединена с обращенным вниз холодиль-
холодильником. В колбу помещают 42,2 г @,22 моля) этилового эфира бензо-
илуксусной кислоты (стр. 503) (примечание 1) и 50 мл сухого кси-
ксилола, после чего ее погружают в масляную баню. Последнюю нагре-
нагревают до 145—150°; затем начинают перемешивание смеси и в тече-
течение получаса прибавляют к ней по каплям 18,2 мл A8,6 г, 0,20 мо-
моля) анилина. Примерно через 5 мин. после начала прибавления
температура в головке повышается до 75—78° и начинает отго-
отгоняться спирт. В течение 1 часа собирают в мерный цилиндр емко-
емкостью 25 мл около 12—14 мл дестиллата (примечание 2); о заверше-
завершении реакции судят по понижению температуры в головке.
Реакционную колбу вынимают из масляной бани и раствор
переливают в стакан емкостью 250 мл; колбу ополаскивают
10 мл бензола и присоединяют его к содержимому стакана. Раствор
оставляют стоять, предоставляя бензоилацетанилиду кристалли-
кристаллизоваться. Когда начнется кристаллизация, к теплой смеси, пере-
перемешивая ее от руки, прибавляют 50 мл петролейного эфира (т. кип.
35—55°). Затем смесь охлаждают в бане со льдом, кристаллы
отфильтровывают с отсасыванием и промывают 100 мл смеси пет-
петролейного эфира с бензолом A : 1). Осадок вынимают из воронки,
размешивают в кашицу со 100 мл указанной смеси растворителей,
фильтруют и осадок опять промывают 50 мл той же смеси. В резуль-
результате этих промываний большая часть окрашенных примесей уда-
удаляется и получается порошкообразное бесцветное вещество. После
этого препарат оставляют стоять в течение ночи в теплом месте.
74
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Выход составляет 35,5—36,5 г G4—76% теоретич.); т. пл.
104—105°. С целью дальнейшей очистки препарат можно пере-
перекристаллизовать из бензола C,7 мл бензола на 1 г вещества).
Выход бесцветного бензоилацетанилида составляет 32—34г; т. пл.
106—106,5° (исправл.).
Примечания
1. Этиловый эфир бензоилуксусной кислоты, анилин и ксилол
предварительно должны быть подвергнуты перегонке. Необхо-
Необходимо, чтобы колба и реагенты не содержали влаги. Наличие при-
примесей и особенно следов кислот снижает выход. Авторы синтеза,
исходя из тщательно очищенного ксилола, получали беизоил-
ацетанилид с выходом 82—83%.
2. Дестиллат представляет собой смесь ксилола и спирта. Если
к дестиллату прибавить 100 мл воды, то слой ксилола можно
отделить и измерить. В 14 мл дестиллата содержится около 3,5 мл
ксилола, а оставшиеся 10,5 мл (89% теоретич.) представляют
собой спирт.
Другие методы получения
а-Бензоилацетанилид был получен нагреванием анилина и ме-
метилового эфира бензоилуксусной кислоты в автоклаве при 15001,
а также нагреванием анила CCH6NHCOCH2C(=NC6H6)C6H5 с раз-
разбавленной кислотой1.
1 К п о г г, Ann., 245, 372 A888).
9-АНТРАЛЬДЕГИД; 2-ЭТОКСИ-1-НАФТАЛЬДЕГИД
сно
РОС la
C6H5N(CH3)CHO
-ОС2Н5 РОС1з
+ C,H5N(CH3)CHO —
+ C5H5NHCH3
+ C6H5NHCH,
Предложили: Л. Физер. Дж. Хартвелл и Дж. Джонес;
Дж. Вуд и Р. Вост.
Проверили: Ч. Аллен и Дж. ВанАллан.
Получение
9-Антральдегид. В 2-литровую круглодонную колбу, снабжен-
снабженную механической мешалкой и обратным холодильником, поме-
9-АНТРАЛЬДЕГИД; 2-ЭТОКСИ-1-НАФТАПЬДЕГИД
75
щают 35 г C2 мл, 0,26 моля) метилформанилида (стр. 320), 35 г
B1 мл, 0,23 моля) хлорокиси фосфора, 20 мл о-дихлорбензола
и 22,5 г @,13 моля) антрацена (примечание 1). Смесь нагревают
в течение 20 мин. при перемешивании на паровой бане до 90—95°;
за это время антрацен растворяется с образованием тёмнокрасного
раствора и начинает выделяться хлористый водород (примечание 2).
Нагревание продолжают в течение 1 часа (примечание 3), после че-
чего к охлажденной смеси прибавляют раствор 140 г кристалличе-
кристаллического уксуснокислого натрия в 250 мл воды (примечание 4) и быст-
быстро (в течение 15—20 мин.) отгоняют с водным паром одихлорбен-
зол и большую часть метиланилина. Оставшееся красноватое масло
при охлаждении затвердевает. Твердый остаток разбивают
и, после того как водный раствор будет слит через воронку Бюх-
нера, промывают декантацией двумя порциями 6 н. раствора соля-
соляной кислоты по 100 мл, чтобы удалить амин, а затем тщательно
водой A 000—1 200 мл). Неочищенное твердое вещество B2—
24 г; т. пл. 97—101°) перскристаллизовывают из 50 мл горя-
горячей ледяной уксусной кислоты; полученный альдегид, окрашен-
окрашенный в яркожелтый цвет, по охлаждении отфильтровывают с отса-
отсасыванием и промывают на фильтре 30 мл метилового спирта (приме-
(примечание 5). Выход составляет 20—22 г G7—84% теоретич.); т. пл.
104,5—105° (примечание 6).
2-Этокси-1-нафтальдегид. В круглодонную колбу емкостью
500 мл, снабженную воздушным холодильником (примечание 2),
помещают смесь 45 г @,33 моля) метилформанилида (стр. 320),
51 г @,33 моля) хлорокиси фосфора и 43 г @,25 моля) этилового
эфира [3-нафтола и нагревают ее в течение 6 час. на паровой бане.
Горячую смесь выливают тонкой струей в 700 мл холодной воды
при очень энергичном перемешивании, чтобы избежать образо-
образования больших комков (примечание 7). Выделившийся альдегид
имеет зернистое строение. Его отфильтровывают с отсасыванием
и тщательно промывают 1 л воды. Сырой альдегид, не высушивая,
растворяют в 450 мл спирта, раствор обесцвечивают прибавле-
прибавлением 4 г активированного березового угля, кипятят в течение
15 мин. и в горячем состоянии фильтруют (примечание 8) через
двойной слой фильтровальной бумаги. Фильтрат охлаждают,
вещество отфильтровывают и промывают 40 мл холодного спирта;
препарат кристаллизуется в виде бледножелтых игольчатых
кристаллов с т. пл. 111—112°. Выход составляет 37—42 г G4—84%
теоретич.).
Примечания
1. Выход чистого антральдегида зависит от качества исходного
углеводорода. Приведенные выше данные относятся только к ан-
антрацену, который плавится при 213° или выше. При использовании
76
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
антрацена ст. пл. 208—210° выход составляет 19—20г, а темпера-
температура плавления препарата равна 103—104° (примечание 6).
2. Следует проводить реакцию в вытяжном шкафу или приме-
применять ловушку для поглощения газов («Синт. орг. преп.», сб. 2,
стр. 78, рис. 3).
3. При использовании для проведения синтеза исходных ве-
веществ, взятых в количествах, в четыре раза превышающих указан-
указанные, период нагревания следует увеличить до 2 час. Более длитель-
длительное нагревание приводит к осмолению.
4. Уксуснокислый натрий, повидимому, разлагает продукт кон-
конденсации метиланилина с хлорокисью и бромокисью" фосфора;
за исключением альдегида остальные вещества в значительной
степени удерживаются в растворе уксуснокислого натрия.
5. В результате указанного промывания обеспечивается полу-
получение препарата с более светлой окраской.
6. Альдегид существует также в виде низкоплавкой формы
с т. пл. 98,5—99,5°, причем иногда в результате реакции образуется
именно эта модификация. Последняя менее устойчива, чем высо-
высокоплавкая форма, в которую ее легко превратить с помощью
затравки.
7. Необходимо остерегаться образования комков при выливании
продукта реакции в воду. Если они все-таки образовались, то раз-
разложение водой будет происходить медленно и дальнейшая очистка
препарата становится более затруднительной. Образовавшиеся
комки необходимо разбить; реакционную смесь следует оставить
стоять в течение ночи в соприкосновении с водой. Колбу, в кото-
которой проводилась реакция, надо также наполнить водой, чтобы раз-
разложить приставшее к ее стенкам вещество. Последнее очищают
вместе с основным материалом.
8. Желательно применение воронки для горячего фильтрова-
фильтрования. Часть вещества обычно кристаллизуется во время фильтро-
фильтрования.
Другие методы получения
Настоящий синтез альдегидов применим к соединениям аро-
ароматического ряда, имеющим подвижной атом водорода (фенило-
вые эфиры1, нафтолы2, диалкиланилины 3>4, нафтостирил2, антро-
ны2), и к некоторым углеводородам, обладающим необходимой
реакционной способностью (антрацен 5'6, 1,2-бензантрацен6,
3,4-бензпирен 3<7, пирен8, стирол9 и а, а-диарилэтилены9). В случае
многоядерных углеводородов наилучшие результаты получаются
при применении растворителя, например о-дихлорбепзола.
9-Антральдегид был также получен действием цианистого водорода
и хлористого алюминия на антрацен в растворе хлорбензола10.
В случае жидких или низкоплавких эфиров растворитель не
требуется. 2-Этокси-1-иафтальдегид был также получен этилиро-
d-АРАБИНОЗА
77
ванием соответствующего оксисоединения11 и, кроме того, из
C-нафтилэтилового эфира по реакции Гаттермана12.
1 Wood, Bost, J. Am. Chem. Soc, 59, 1722 A937).
2 Герм. пат. 514415 [Frdl.. 171, 564 A922)].
3 Vilsmeier, H a a k, Ber., 60, 119A927).
4 Герм. пат. 547108 [Frdl., 182, 2973 A933)].
5 Герм. пат. 519444 [Frdl., 17», 565 A932)[.
« Fieser, Hartwell, J. Am. Chem. Soc, 60, 2556 A938).
7 Fieseer, Hershberg, J. Am. Chem. Soc, 60, 2547 A938).
Wollmann, Becker, Corell, Streeck, Ann., 531,
1 A937
Англ. пат. 504125 [С. А., 33, 7313 A939)].
Hinkel, Ayling, Beynon, J. Chem. Soc, 1936,
Bart sen, Ber., 36, 1975 A903).
Gattermann, Ann., 357, 367 A907).
344.
СНаОСОСН3 (СНОСОСН3L CN
rf-АРАБИНОЗА
CHjONa
СНзОН
> CH2OH(CHOHK
CHO + NaCN + 5СН3СОгСН3
Предложил: Г. Браун.
Проверили: X. Кларк и С. Нэджи.
Получение
В 1-литровой конической колбе приготовляют раствор 100 г
@,26 моля) нитрила пентаацетилглюконовой кислоты (стр. 372)
в 150 мл хлороформа и охлаждают его до —12°. К полученному
раствору прибавляют при непрерывном охлаждении и встряхи-
встряхивании охлажденный до - 12° раствор 16 г @,7 грамматома) нат-
натрия в 250 мл безводного метилового спирта. Вскоре смесь затвер-
затвердевает в бледножелтую желатинообразную массу. Последнюю
выдерживают при —12° в течение 10 мин., а затем разбивают
толстой стеклянной палочкой и растворяют в 600 мл смеси льда
с водой. Полученный раствор подкисляют охлажденной до 0°
смесью 33 г A8 мл, 0,32 моля) 95%-ной серной кислоты, 5 мл уксус-
уксусной кислоты и 45 г льда. Водный слой отделяют, промывают один
раз 50 мл хлороформа и без промедления (примечание 1) упаривают
в вакууме. Получившийся густой сироп растворяют в 300 мл
воды и вновь упаривают в вакууме, по возможности полнее, чтобы
удалить оставшийся цианистый водород (примечание 2). Весьма
вязкий остаток, в котором содержится большое количество кри-
кристаллов сернокислого натрия, растворяют в 500 мл горячего мети-
метилового спирта. Примерно через 10мин. сернокислый натрий отфиль-
отфильтровывают с отсасыванием и промывают двумя порциями метило-
78
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
АЦЕНАФТЕНОЛ-7
79
вого спирта по 25 мл. Фильтрат упаривают в вакууме при 40° до
получения густого сиропа, который еще в теплом состоянии выли-
выливают в коническую колбу емкостью 200 мл. Перегонную колбу
ополаскивают два раза горячим этиловым спиртом порциями по
20 мл и промывную жидкость прибавляют к фильтрату. Из полу-
полученного спиртового раствора вскоре начинают выделяться кри-
кристаллы арабинозы. Во время кристаллизации раствор переме-
перемешивают от руки и постепенно разбавляют спиртом так, чтобы
в течение 1 часа было прибавлено в общей сложности 100 мл. Смесь
оставляют стоять в течение 4 — 5 час. Затем кристаллы отфильтро-
отфильтровывают, промывают двумя порциями этилового спирта по 25 мл
и сушат при 40°. Выход бесцветной d-арабииозы с т. пл. 158 —
158,5° и [а]Ь°—105° (конечная величина) составляет 23,5—26,3 г
F1—68% теоретич.; примечание 3).
Примечания
1. После того как реакционная смесь будет растворена в воде
и подкислена, необходимо как можно скорее удалить цианистый
водород, так как арабиноза способна вступать с ним в реакцию
даже в разбавленном растворе.
2. Можно получить несколько больший выход кристаллической
арабинозы, если удалять цианистый водород уксуснокислым сереб-
серебром. В этом случае вместо серной кислоты для подкисления при-
применяют уксусную кислоту, после чего к раствору прибавляют избы -
ток уксуснокислого серебра, смесь в течение 1 часа взбалтывают,
фильтруют, насыщают раствор сероводородом, вновь фильтруют
и прибавляют к фильтрату серную кислоту, как было указано
выше. В дальнейшем поступают так, как описано в методике. Выход
кристаллической арабинозы в этом случае составляет 27,1 г
G0% теоретич.).
3. Дополнительное количество арабинозы можно выделить из
маточного раствора при помощи дифенилгидразина; для этого
к раствору 22 г хлористоводородной соли дифенилгидразина
в 100 мл абсолютного метилового спирта прибавляют раствор 3,3 г
натрия в 50 'мл метилового спирта. Через 15 мин. хлористый нат-
натрий отфильтровывают и промывают метиловым спиртом. Фильтрат,
в котором содержится около 18 г свободного дифенилгидразина,
прибавляют к спиртовому маточному раствору, полученному после
отфильтрования арабинозы, и вносят в смесь затравку дифенилгид-
дифенилгидразона, приготовленного из небольшого количества кристалличе-
кристаллической арабинозы. Смесь оставляют стоять в течение ночи, кристалли-
кристаллический дифенилгидразон отфильтровывают, промывают 95%-ным
этиловым спиртом и сушат в вакуум-эксикаторе. В синтезе, в кото-
котором выход кристаллической арабинозы составлял 23,5 г, выход дифе-
дифенилгидразона был равен 16,5 г, что соответствует 7,8 г этого сахари-
да. Арабинозу можно выделить из дифенилгидразона, обработав его
формальдегидом в водном растворе. Однако ввиду малой доступ-
доступности дифенилгидразина сомнительно, чтобы использование его для
проведения указанной операции было целесообразным.
Другие методы получения
Впервые d-арабинозу получил Воль1 при действии на нитрил
пснтаацетилглюконовой кислоты аммиачным раствором азотно-
азотнокислого серебра, d-Арабиноза была получена также из d-глюконо-
вой кислоты различными способами, к которым относятся: окисле-
окисление ее кальциевой соли перекисью водорода в присутствии уксусно-
уксуснокислого железа2; кипячение водного раствора ее ртутной соли3;
электролиз4; действие гипохлорита натрия на ее амид5. Описан-
Описанный выше метод, который разработали Цемплен и Кисе6, дает более
высокие выходы, чем метод Воля.
1 Wohl, Ber., 26, 730 A893).
2 Ruff, Ber., 32, 550 A899).
3 Guerbet Bull. soc. chira., D) 3, 427 A908).
4 Neuberg, Biochem. Z., 7, 527 A908).
5 Weermann, Rec. trav. chim., 37, 16 A917).
«Zemplen, Kiss, Ber., 60, 165 A917).
H2C—CH2
АЦЕНАФТЕНОЛ-7
O4 + 7CH3CO2H ->
H2C — СНОСОСНз
H2C—СНОСОСНз
I i
/
+ 3Pb(CH3CO2J + 4Н2О
H2C—СНОН
+ CH3CO2Na
+ NaOH —>
Предложил: Дж. Кейзон.
Проверили: Р. Шрайнер и Э. Добрапщ.
Получение
Аценафтенолацетат. В 2-литровую круглодонную колбу поме-
помещают 154 г A моль) аценафтена (примечание 1) и 1 100 мл ледяной
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
уксусной кислоты (примечание 2). Колбу снабжают мешалкой из
танталовой или нихромовой проволоки («Синт. орг. преп.», сб. 2,
стр. 298, рис. 12I и термометром, шарик которого погружен
в жидкость. Раствор перемешивают и нагревают до 60°. По дости-
достижении этой температуры источник тепла удаляют и к раствору
добавляют 820 г сурика (примечание 3) порциями примерно по
50 г, причем каждую следующую порцию прибавляют после того,
как исчезнет окраска раствора, вызванная предыдущей порцией. Во
время этой операции, которая продолжается в течение30—40 мин.,
температуру поддерживают около 60—70° (примечание 4), охлаждая
колбу снаружи. Процесс можно считать законченным, когда проба
раствора даст отрицательную реакцию на присутствие тетраацетата
свинца (примечание 5). Тёмнокрасный сиропообразный раствор
(который может содержать во взвешенном состоянии небольшие
количества сурика и двуокиси свинца) выливают в 2 л воды, находя-
находящейся в 4-литровой делительной воронке. Аценафтенолацетат
экстрагируют двумя порциями эфира сперва в 350, а затем в 250 мл.
Соединенные вместе вытяжки промывают 100 мл воды, а затем 300 мл
насыщенного раствора хлористого натрия, после чего их сушат
над 50 г безводного сернокислого натрия. Сернокислый натрий
отфильтровывают и промывают до тех пор, пока он не станет бес-
бесцветным, для чего используют три порции по 50 мл абсолютного
эфира. Фильтрат и промывную жидкость помещают в колбу Клай-
зена емкостью 500 мл с направленным внутрь боковым отводом
и после отгонки растворителя перегоняют ацетат в вакууме.
Аценафтенолацетат перегоняется почти целиком при 166—168°
E мм) (температура бани 180—185°; к концу перегонки темпе-
температуру повышают до 220°) в виде подвижного масла желтого
цвета. Выход составляет 170—175 г (80—82% теоретич.; приме-
примечание 6).
Аценафтенол. Полученный, как было указано выше, ацетат рас-
растворяют в 2-литровой круглодонной колбе в 275 мл метилового
спирта; затем к содержимому колбы прибавляют раствор 40 е( 1,2 эк-
эквивалента) едкого натра в 400 мл воды (примечание 7). Эту смесь
кипятят с обратным холодильником в течение 2 час. (примечание 7),
после чего охлаждают ее до температуры ниже 20°. Кристаллы аце-
нафтенола, окрашенные в желтый цвет, отсасывают и на фильтре тща-
тщательно промывают 1 500 мл воды. Неочищенный препарат сушат
на воздухе (выход составляет 138—143 г) и затем растворяют в 2 л
кипящего бензола. Раствор обрабатывают 6—8 г угля для обес-
обесцвечивания (примечание 8) и фильтруют через воронку с обо-
обогревом.
Оранжево-красный фильтрат упаривают до объема 1 л и предо-
предоставляют аценафтенолу кристаллизоваться. Кристаллы отфиль-
отфильтровывают с отсасыванием и промывают холодным бензолом
(около 500 мл) до тех пор, пока промывная жидкость не станет
АЦЕНАФТЕНОЛ-7
81
бесцветной. Аценафтенол получается в виде бесцветных игольча-
игольчатых кристаллов с т. пл. 144,5—145, 5° (исправл.; примечание 9).
Выход составляет 117—121 г. Из фильтрата можно получить до-
дополнительное количество вещества, которое после одной перекри-
перекристаллизации дает только 3—5 г чистого аценафтенола. Общий
выход достигает 120—126 г G0—74% теоретич., считая на аце-
нафтен).
Примечания
1. Продажный, так называемый 95%-ный, аценафтен,который
плавится при 92,5—93,5° {исправл.), вполне пригоден для примене-
применения в этой реакции. Если исходить из перекристаллизованного
или продажного аценафтена (т. пл. 93—93,5°), то выход чистого
аценафтенола не увеличится.
2. Ледяную уксусную кислоту необходимо очистить перегонкой
с добавлением перманганата калия. На каждые 1 500 мл кислоты
следует взять 30—50 г перманганата калия.
3. Был применен сурик 85—90%-ной чистоты. Предваритель-
Предварительно приготовленный уксуснокислый свинец для целей этого
окисления не имеет никаких преимуществ по сравнению с су-
суриком.
4. Если окисление проводить при 50°, то выход не изменяется,
однако прибавление всего количества сурика занимает в этом слу-
случае несколько часов. При 40° реакция протекает очень медленно
и выход падает.
5. Каплю реакционной смеси переносят на влажную иодкрах-
мальную бумажку. Появление голубой окраски указывает на при-
присутствие уксуснокислого свинца.
6. Аценафтенолацетат содержит небольшую примесь аценафтена
и аценафтенона, однако препарат достаточно чист для дальнейшего
применения.
7. Появление темнофиолетовой окраски при прибавлении щело-
щелочи вызывается, повидимому, присутствием аценафтенона. Кристал-
Кристаллический аценафтенол начинает выделяться почти немедленно после
прибавления щелочи. При нагревании следует соблюдать осторож-
осторожность, так как, если производить его слишком быстро, происходит
внезапная кристаллизация аценафтенола и в результате выделяю-
выделяющегося при этом тепла часть раствора может быть выброшена через
холодильник.
8. Если обработку углем не производить, то полученный аценаф-
аценафтенол будет иметь слегка желтую окраску; однако препарат все же
является практически чистым.
9. По данным Маркиза2 температура плавления аценафтенола
равна 148°; по данным Брауна и Байера3 она равна 146°.
6 Сборник 3
82
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Другие методы получения
Аценафтенол был получен с небольшим выходом окислением
аценафтена перекисью свинца2; он был найден также в продуктах
гидрирования ацснафтснхинона3. Приведенная выше методика в
основном описана в литературе4, однако в более сжатом виде.
1 Hershberg, Ind. Eng. Chem., Anal. Ed., 8, 313 A936).
'Marquis, Compt. rend., 182, 1227 A926).
¦Braun, Bayer, Ber., 59, 920 A926).
4 F i e s e г, С a s о n, J. Am. Chcm. Soc, 62, 432 A940).
АЦЕНАФТЕНХИНОН
Н2С—СН2
o=c—c=o
I I
Предложили: Ч. Максвелл и Ч. Аллен.
Проверили: Р. Шрайнер и К- Тилфорд.
Получение
В 2-литровую трехгорлую круглодонную колбу, снабженную
механической мешалкой, обратным холодильником и воронкой
большого диаметра с короткой ножкой, помещают 30 г @,195 моля)
аценафтена (примечания 1 и 2) и 210 мл ледяной уксусной кислоты.
Пускают в ход мешалку и нагревают смесь примерно до 95°. Затем
источник тепла отставляют ив течение 15—30 мин. через воронку
прибавляют к смеси 130 г @,43 моля) технического бихромата натрия
в виде крупнозернистого порошка. Прибавление ведут по возможно-
возможности быстро, однако так, чтобы в результате бурного кипения не была
утрачена возможность контроля над реакцией. Если начнется вспе-
вспенивание, то колбу немедленно погружают в сосуд с холодной водой.
После того как весь бихромат будет прибавлен, воронку заменяют
пробкой и смесь кипятят в течение 15 мин., причем за это время она
становится очень вязкой. Затем к содержимому колбы прибавляют
700 мл горячей воды, смесь перемешивают в течение 10 мин. и филь-
фильтруют с отсасыванием. Красный осадок промывают на фильтре
400 жл горячей воды, чтобы удалить соли хрома.
Осадок переносят в 1-литровый стакан и прибавляют 220 мл
10%-ного раствора соды. Раствор нагревают на паровой бане в те-
течение 1 часа и фильтруют в горячем состоянии. В результате такой
обработки удаляют нафталевый ангидрид, образующийся в каче-
качестве побочного продукта (примечание 3). Оставшееся твердое веще-
вещество красного цвета помещают в 2-литровую трехгорлую колбу,
АЦЕНАФТВНХИИОН
83
снабженную мешалкой и обратным холодильником, верхняя часть
которого присоединена к ловушке для поглощения сернистого
газа. Затем к содержимому колбы прибавляют 300 мл 40%-ного
раствора бисульфита натрия и смесь кипятят при перемеши-
перемешивании в течение 45 мин., после чего прибавляют к ней 500 мл
воды и продолжают кипячение в течение еще 10 мин. Горячий рас-
раствор фильтруют с отсасыванием. Затем фильтрат нагревают до
кипения и подкисляют, медленно и осторожно прибавляя к нему
ПО мл концентрированной серной кислоты (примечание 4). Смесь
при помешивании нагревают в течение 15 мин. на небольшом пла-
пламени горелки и затем фильтруют. Желтый осадок тщательно про-
промывают 200 мл воды и 100 мл разбавленного аммиака [1 часть кон-
концентрированного аммиака на 10 частей воды (по объему)]. Выход
промытого и высушенного аценафтенхинона составляет 15—21 г
D2—60% теоретич.); т. пл. 243—245°.
Примечания
1. Аценафтен должен быть высшего качества, так как при при-
применении бурого технического препарата образуются смолистые
вещества, от которых трудно отделить хинон. Некоторые препараты
аценафтена можно использовать, перекристаллизовав их из мети-
метилового спирта; температура плавления очищенного вещества 94—
95°.
2. Можно окислять и большие количества E0—100 г) аценафтена, '
однако в этом случае очень трудно извлечь весь хинон. Если для
окисления берутся большие количества, то продукт реакции еле- '
дует разделить на небольшие порции и каждую из них обработать
так, как это указано выше при описании экстрагирования бисуль- ¦
фитом. Выход в значительной степени обусловлен тщательностью
экстрагирования.
3. Для выделения нафталевого ангидрида D—11 г) фильтрат
подкисляют. Это вещество является основным продуктом реакции,
если окисление протекает слишком бурно. Нафталевый ангидрид
можно получать из технического аценафтена.
4. Подкисление следует проводить в вытяжном шкафу, так как
при этом выделяется большое количество сернистого газа. Соляная
кислота не осаждает всего хинона.
Другие методы получения
Аценафтенхинон был получен из аценафтена окислением хромо-
хромовой кислотой 1~3, марганцовокислым кальцием*, кислородом воз-
воздуха в присутствии катализаторов в различных растворителях 6^',
а также через стадию образования оксима при действии амилнит-
рита с последующим гидролизом8.
6*
84
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
1 Q г а Ь е, Вег., 20, 659 A887); 25, 654 A892); Ann., 276, 3 A893).
2Дашевский, Каришин, Пром. орг. хим., 1, 729 A936).
"Киприанов, Дашевский, ЖПХ, 7, 944 A934).
"Morgan, J. Soc. Chem. Ind., 49, 420 A930).
5 J a e g e г, англ. пат. 318617 [С. А., 24, 2145A930)].
6 Duckert, Arch. sci. phys. nat., 15, 244 A933) [C. A., 28, 1255 A934)].
7 P a i 1 1 a r d, Helv. Chim. Acta, 16, 775 A933).
8 К e i s s e r t, Ber., 44, 1750 A911).
Р-C-АЦЕНАФТ0ИЛ)-ПР0ПИ0Н0ВАЯ КИСЛОТА
($-3-Аценафтенилкарбонилпропионозая кислота)
СОСН2СН2СО2Н
I
I I
Л2С—С
СН2СО
СН2СО
AlCls
Н2С — CH2
Предложил: Л. Физер.
Проверили: В. Хартмэн и А. Вейсбергер.
Получение
В 3-литровой круглодопной трехгорлой колбе (примечание 1)
растворяют при нагревании 100 г @,65 моля) чистого аценафтена
((примечание 2) и 72 г @,72 моля) янтарного ангидрида («Синт. орг.
преп.», сб. 2, стр. 56) в 600 мл Нитробензола. Колбу, установленную
в большой бапе со льдом, укрепляют на штативе. В среднее гор-
горло колбы вставляют механическую мешалку с ртутным затвором.
Через второе горло колбу соединяют с ловушкой для поглощения га-
газа («Синт. орг. преп.», сб. 2, стр. 78, рис. 3); в это же горло вставляют
термометр. Третье горло предназначено для добавления хлористого
алюминия. Смесь охлаждают до 0°, а затем в течение 1 часа при-
прибавляют к ней небольшими порциями 195 г A,46 моля) хлористого
алюминия, следя за тем, чтобы температура не поднималась выше 5°.
Перемешивание продолжают в течение еще 4 час, поддерживая
температуру при 0°, после чего смесь оставляют не менее чем на
12 час; за это время лед тает, а прозрачный красный раствор посте-
постепенно нагревается до комнатной температуры.
Содержимое колбы охлаждают, погружая ее в смесь льда и во-
воды, и продукт присоединения разлагают, прибавляя к нему постепен-
постепенно 200 г льда, 100 мл воды и 100 мл концентрированной соляной
кислоты (лучше всего проводить эту операцию в вытяжном шкафу).
Кетокислота выделяется в виде густой серовато-белой пасты. Рас-
Растворитель удаляют перегонкой с водяным паром, причем рекомен-
рекомендуется пропускать сильную струю пара и при этом пользоваться
Р-C-АЦЕНАФТОИП)-ПРОПИОНОВАЯ КИСЛОТА
85
эффективной конденсационной системой, например такой, какая
показана на рис. 8. Объем колбы, служащей холодильником, может
не превышать 1 л; выводная трубка должна быть центрирована и до-
доходить почти до самого дна колбы, чтобы последнюю можно было
опорожнять полностью. Некоторая часть конденсата обычно остает-
остается в колбе и служит затвором для пара; это значительно увеличи-
увеличивает эффективность конденсации. С целью контроля колбу можно
опорожнить, отклонив на короткое время струю воды в одну
Рис. 8.
сторону колбы. Пробки, находящиеся под давлением, необходимо
закрепить проволокой. Перегонную колбу для предупреждения
слишком большой конденсации пара подогревают (примечание 3).
Основная масса нитробензола отгоняется примерно за 1,5
часа; тогда препарат выделяется в виде пасты, которая медленно
распадается в порошок. В течение этого последнего процесса отгон-
отгонка нитробензола протекает очень медленно, однако пропускание
водяного пара следует продолжать до тех пор, пока не останется
лишь несколько небольших комков D—5 час), хотя удаление по-
последних следов растворителя и не является обязательным (приме-
(примечание 4). Смесь охлаждают водопроводной водой, неочищенную
.86
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Р-C-АЦЕНАФТОИЛ)-11Р011ИОНОВАЯ КИСЛОТА
87
кислоту отфильтровывают, а затем снова возвращают в колбу
и прибавляют к ней 115 г кристаллической соды Na2CO3-10H2O
и такое количество воды, чтобы колба была наполнена несколько
менее, чем на половину своего объема. Затем смесь, взбалтывая,
нагревают на голом пламени горелки до тех пор, пока большая
часть твердого вещества не растворится и пока не уменьшится вспе-
вспенивание. Для разрушения пены к смеси можно прибавить несколь-
несколько капель каприлового спирта. Темнобурый раствор перегоняют
с водяным паром, чтобы удалить последние следы нитробензола
(около получаса), а затем фильтруют с отсасыванием, чтобы осво-
освободить его от очень легкого осадка. В полученном горячем'растворе
(объем которого равен около 1 500 мл) растворяют 100 г хлористого
натрия, а затем дают раствору спокойно охладиться. Натриевая соль
(З-(З-аценафтоил)-пропионовой кислоты выпадает в осадок в виде
бесцветных волокнистых игольчатых кристаллов, тогда как изомер-
изомерная 1-кислота в основном остается в растворе (примечание 5). Препа-
Препарат отфильтровывают на большой воронке Бюхнера и отмывают от
темного маточного раствора полунасыщенным раствором хлористого
натрия (около 150 мл); соединенные вместе фильтраты сохраняют.
Натриевую соль перекристаллизовывают еще один раз из кипящей
воды A 000—1 500 мл; примечаниеб), используя, если потребуется,
активированный березовый уголь; затем к горячему профильтрован-
профильтрованному раствору прибавляют 50 г хлористого натрия. Маточный рас-
раствор также сохраняют. Очищенную соль растворяют в 1 200 мл
горячей воды и раствор подкисляют. Свободная кислота выделяется
в виде белого порошка в очень чистом состоянии. Выход |3-C-аце-
нафтоил)-пропионовой кислоты, плавящейся (с разложением) при
206—208°, составляет 133 г (81% теоретич.; примечание 7).
Примечания
1. Если использовать колбу, пригодную для перегонки с водяным
паром, то можно избежать потери времени и материалов, связанной
с перенесением реакционной массы в другую колбу.
2. Был взят продажный препарат.
3. По сравнению с прибором, изображенным на рисунке («Синт.
орг. преп.», сб. 1, стр. 461, рис. 23), описанная конденсационная
система требует применения значительно меньшей колбы и при этом
дает возможность работать с неограниченно большими объемами.
Она предоставляет также возможность работающему лицу более
внимательно наблюдать характер дестиллата.
4. Если колба наполнится сконденсировавшимся паром, то
содержимое ее следует охладить, профильтровать и остаток воз-
возвратить обратно в колбу. Процесс измельчения можно уско-
ускорить, если разбить комки стеклянной палочкой со сплюснутым
концом.
5. Из полученных при последующей обработке и соединенных
вместе маточных растворов можно выделить небольшое количество
изомерной 1-кислоты. При подкислении первого раствора полу-
получается темная смолистая масса, которая при охлаждении и пере-
перемешивании скоро затвердевает. Ее растворяют в 1 л воды, содержа-
содержащей 25—30 з кристаллической соды Na2COs • 10Н2О, раствор кипятят
в течение получаса с активированным березовым углем, фильтруют,
охлаждают и подкисляют. Вещество, которое теперь сразу же за-
затвердевает, получается менее окрашенным. Его сушат и соединяют
с веществом, полученным подкислением второго маточного раство-
раствора (общее количество составляет 23,9 г). Из сырой смеси неочищен-
неочищенных кислот приготовляют суспензию в 170 мл холодного метилового
спирта, прибавляют к ней 8,5 мл концентрированной серной кис-
кислоты и в течение примерно 10 мин. нагревают смесь на паровой ба-
бане, в результате чего наступает полное растворение и завершается
этерификация. Темное вещество, кристаллизующееся при Охлаж-
Охлаждении раствора, в основном представляет собой эфир изомерной
1-кислоты, который значительно менее растворим, чем эфир 3-кисло-
ты. Эфир 1-кислоты A3,1 г) отмывают от непрореагировавшей ки-
кислоты и перекристаллизовывают из этилового спирта, обрабаты-
обрабатывая раствор углем для обесцвечивания. Эфир выпадает в осадок в
виде длинных игольчатых кристалловс. т. пл. 126°; выход составляет
9 е (см. примечание 8). Для омыления эфира последний нагревают
со 100 мл спирта и 30 мл 25%-ного раствора едкого натра до тех
пор, пока он не растворится; затем раствор разбавляют водой
и подкисляют. р-A-Аценафтоил)-пропионовая кислота плавится
при 180° (после перекристаллизации из разбавленного спирта—
при 181°). Выход составляет 8,4 г E% теоретич.; см. примечание 9).
6. Если в результате гидролиза натриевая соль полностью не
растворится, то к смеси следует прибавить необходимое количе-
количество щелочи.
7. 3-Кислота хорошо кристаллизуется из ледяной уксусной ки-
кислоты, из спирта или ксилола; однако для перекристаллизации
требуется большое количество растворителя. Температура плавле-
плавления вещества остается неизменной.
8. Эфир 3-кислоты плавится при 89°.
9. Обычно маточные растворы, оставшиеся в процессах полу-
получения и очистки эфира 1-кислоты, выбрасываются; однако из них
можно выделить небольшое дополнительное количество 3-кислоты,
если эти соединенные вместе растворы выпарить, прибавить к остат-
остатку щелочь, чтобы омылить эфир, прилить воду и смесь подкислить.
С целью очистки выпавшую в осадок натриевую соль дважды
перекристаллизовывают и получают при этом 8 г E% теоретич.)
чистой 3-кислоты.
Относительные количества 3-кислоты и 1-кислоты зависят от тем-
температуры реакции. Более низкая температура благоприятствует
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
образованию 3-кислоты. При —15° выход 3-кислоты составляет 87%,
а 1-кислоты—5%. При комнатной температуре это соотношение
изменяется в сторону увеличения количества образующейся
1-кислоты, однако препарат получается окрашенным в очень темный
цвет, с трудом поддается обработке, а суммарный выход оказы-
оказывается ниже, несмотря на то, что хлористый алюминий добавляется
в растворе нитробензола.
Другие методы получения
Приведенная пропись основана на разработке1 метода, изложен-
изложенного в общих чертах в патентной литературе2. Методика является об-
общей, и ее можно применять для конденсации янтарного ангидрида с
нафталином и с моно- и диметилнафталинами, хотя процессы очистки
и выделения изомеров в случае гомологов нафталина более затруд-
затруднительны. В этой конденсации особого типа, как и в некоторых реак-
реакциях Фриделя—Крафтса других типов, нитробензол является зна-
значительно лучшим растворителем, чем растворители, имеющие
более широкое применение. Отчасти это обусловлено большой рас-
растворяющей способностью нитробензола, а отчасти и тем, что он
образует молекулярное соединение с хлористым алюминием и та-
таким образом понижает способность катализатора ускорять побоч-
побочные реакции.
1 F i с s e r, J. Am. Chem. Soc, 54, 4350 A932).
2 Франц. пат. 636065 [Chem. Zentr., I, 2751 A928)]; швейц. пат. 131959
[Chem. Zentr., I, 1539A930I; ам. пат. 1759111 [Chem. Zentr., II, 806
A930)]; герм. пат. 376635 [Frdi., 14, 285 A926)].
АЦЕТАЛЬ АКРОЛЕИНА И АЦЕТАЛЬ 0-ЭТОКСИПРОПИОНОВОГО АЛЬДЕГИДА
С2Н6ОН
СН2=СНСНО — ——> СН2 = СНСН (ОС2Н5J + C2H5OCH2CHSCH (OC2H5J
Предложил: Ф. Пингерт.
Проверили: Н. Дрэйк, и В. Смит.
Получение
В 1-литровую колбу Флоренса помещают смесь 158 г E,6 моля)
акролеина (примечание 1) и 450 мл абсолютного спирта (приме-
(примечание 1). В горло колбы вставляют комок ваты (стр. 95) и колбу
по горло погружают в баню, содержащую около 1 500 г льда.
Когда смесь охладится примерно до 0°, к пей прибавляют 50 мл
абсолютного спирта, содержащего 2 г хлористого водорода, причем
во время прибавления реакционную смесь взбалтывают круго-
АЦЕТАЛЬ АКРОЛЕИНА
образным движением. Обычно температура быстро повышается.
Колбу укрепляют в штативе и оставляют на 2—2,5 суток; лед при
этом тает и его не заменяют свежим.
Раствор переносят в круглодонную колбу емкостью 1 500 мл,,
прибавляют к нему 0,5—1 г углекислой меди и перегоняют жид-
жидкость в вакууме, пользуясь колонкой с насадкой из одиночных
витков спирали (рис. 9; примечания 2 и 3). Собирают следующие-
фракции:
До 45° B4 мм) Акролеин и спирт (примечание 4)
» 45° B4 » ) Ацеталь акролеина (примечание 5)
„ gQ g4° B1 мм) Ацеталь р-этоксипропионового
альдегида (примечание 6)
Выход ацеталя акролеина составляет 89—108 г B4—30% тео-
ретич.); выход ацеталя [3-этоксипропионового альдегида равен
Ю4—132 г B1—26% теоретич.; примечание 7).
Примечания
1. Были применены продажные исходные реагенты. Удаление-
антиоксиданта, который обычно бывает прибавлен к акролеину,
не производилось.
2. Изображенная на рис. 9 (стр. 90) колонка Фенске1 состоит из.
стеклянной трубки А, в которой помещается насадка. Трубка Л
окружена обогревательной и теплоизоляционной рубашками Б и В
и снабжена головкой Г, Д, Е для полной конденсации и регули-
регулируемого отбора дестиллата. Колонка сделана из стекла пирекс и
заполнена одиночными витками спирали из медной проволоки
(стр. 406). Хотя приведенные на рисунке размеры и не являются
единственно возможными, однако на основании опыта можно
утверждать, что такая колонка весьма удобна, эффективна
и пригодна для проведения разнообразных перегонок в лабора-
лабораторных условиях. С помощью этой колонки были с успехом прове-
проведены ректификации смесей соединений, кипящих в пределах от 0
до 400° при давлениях от 1 до 760 мм.
Обогревательный элемент 3 состоит примерно из 165 витков
нихромовой проволоки диаметром 0,5 мм, намотанной непосред-
непосредственно на рубашку Б или, лучше, поверх асбестовых лент, на-
наклеенных по образующей рубашки Б; такое устройство предотвра-
предотвращает сдвиг и короткое замыкание отдельных витков проволоки.
Внутренняя обогревательная муфта Б является обязательной, так.
как обогревательный элемент нельзя наматывать непосредственно
на центральную трубку А, в которой находится насадка. Такое
упрощение привело бы к отрицательным результатам, так как
в значительной степени был бы нарушен равномерный тепловой
градиент колонки и сделался бы возможным крекинг в результате-
90
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
АЦЕТАЛЬ АКРОЛЕИНА
91
-ж
( %
28(нар.Ц>'
ЬО(нао.д)!
местного перегрева, особенно при работе в
вакууме. Корковые пробки К и Л, на которых
укреплены муфты, должны быть тщательно по-
подогнаны с помощью наждачной бумаги и раш-
рашпиля, так как вес всей колонки удерживается
наружной муфтой. Если это не сделано, то од-
одного толчка перегретой жидкости при пере-
перегонке бывает достаточно для того, чтобы поло-
поломать колонку. Если окажется необходимым
сменить пробки, то прибор можно не разби-
разбирать, а, разрезав заготовленные пробки на
две половинки (по диаметру),, сперва подо-
подогнать их, а затем склеить с помощью какого-
либо цементирующего средства. Наружную
муфту В можно заменить изоляцией, однако
для экспериментальных работ стеклянная
q трубка удобнее.
^ Обогревательный элемент присоединяют к
сети на ПО в через реостат (например, через
реостат на 140 ом и 3 а)*; температуру регу-
регулируют с помощью двух термометров {Тг и Т2),
допуская приемлемую разность температур,
зависящую от характера перегоняемой смеси**.
Водяной холодильник Д должен быть до-
достаточно большим, чтобы обеспечить высокую
степень орошения; при работе с высококипя-
щими веществами может оказаться целесооб-
целесообразным пользоваться охлаждением с помощью
воздуха или водяного пара. Приспособление Ж
предусматривает перегонку в вакууме, для чего
колонку присоединяют к насосу при помощи
стеклянного тройника и вакуумных каучуков.
Цельнопаянная головка1 более изящна, но не
так гибка в работе. Шлифы в местах Hi vi-H2
удобны, по не обязательны.
Детали нижней части колонки показаны на
рис. 10. Я—резиновая пробка, пригнанная к
горлу перегонной колбы. К. и Л—корковые
пробки. Наружная рубашка В кончается у
нижней части пробки К- М представляет собой
ряд асбестовых кружков, которые служат бу-
буфером между пробками Н и К,; они необхо-
Р и с. 9. Все раз-
размеры даны в мил-
миллиметрах.
* Значительно удобнее для этой цели пользоваться лабораторным авто-
автотрансформатором (ЛАТР № 2). (Прим.. ред.)
** Очень удобно регулировать температуру обогрева не с помощью двух
термометров, как рекомендуется в данной прописи, а пользуясь для этого
димы при работе в вакууме. Эти кружки легко снимаются, что
позволяет без труда менять пробки разных размеров. К описан-
описанной колонке можно присоединять перегонные кубы емкостью от
250 .ил до 12 л.
3. Пользуясь относительно высокой упругостью пара головного
погона, можно собирать ацеталь акролеина почти автоматически
следующим образом. Кран Е закрывают и давление уменьшают
до 25 мм. Перегонный куб не подогревают и устанавливают ми-
минимальный ток охлаждающей воды через хо-
холодильник. Головной погон уходит через при-
приспособление Ж и его собирают, если это нуж-
нужно, в соответствующих ловушках. Когда испа-
испарение прекратится (через 4—5 час), кран Е
открывают, ток охлаждающей воды значи-
значительно усиливают,, температуру обогреватель-
обогревательной рубашки устанавливают на уровне 45°
(по термометру Т2) и куб осторожно нагре-
нагревают паром низкого давления. После того
как будут установлены нужная степень оро-
орошения и скорость отбора дестиллата с по-
помощью крана Е, дальнейшая перегонка аце-
таля акролеина не требует внимания. Удоб-
Удобно эту перегонку осуществить в течение ночи.
Разделение фракций производится автомати-
автоматически, поскольку выше кипящий ацеталь
р-этоксипропионового альдегида при ука-
указанных условиях перегоняться не может
и процесс просто прекращается. Для пере-
перегонки высококипящей фракции требуется
масляная баня. Хотя при описанном ведении
процесса возможны некоторые потери, они
-возмещаются в результате экономии времени, затрачиваемого
экспериментатором, и большей чистоты получаемого препарата.
4. Выделенные обратно акролеин и спирт после соответствующе-
соответствующего высушивания могут быть применены в последующих синтезах.
5. Температура кипения ацеталя акролеина при других да-
давлениях: 40° A8 мм); 52° C6 мм).
6. Температура кипения ацеталя [З-этоксипропионового аль-
альдегида при других давлениях: 78° A4 мм); 92° C2 мм).
7. Среди преимуществ настоящего метода по сравнению с опи-
описанным ранее2 можно указать на следующие. Вещество получается
в одну стадию с помощью способа, который позволяет избежать
большей части неприятных особенностей прежнего двухстадий-
Р и с. 10.
счетчиками капель (см., например, М. И. Р о з е н г а р т, Техника лаборатор-
лабораторной перегонки и ректификации, Госхимиздат, 1951, стр.62—63). (Прим. ред.)
92
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ного процесса. Общий выход при использовании старого метода,
в лучшем случае, составлял 25% теоретического количества и ока-
оказывался значительно ниже, если едкое кали было не особенно тща-
тщательно высушено. Кроме того, ацеталь акролеина, полученный
отщеплением элементов галоидоводородной кислоты от ацеталя
р-хлорпропионового альдегида3, плохо сохраняется, тогда как при
храненииобразцов, синтезированных с помощью настоящего мето-
метода, в холодильном шкафу в течение 18 месяцев не наблюдалось
изменения ни в цвете, ни в пределах кипения. По истечении этого
времени был замечен лишь слабый запах акролеина.
Другие методы получения
Описание других методов получения было приведено ранее2.
1 W h i t m о г е, Lux, J. Am. Chem. Soc, 54, 3448 A932).
2Витпеман, Эванс, Хае с, Шредер, Синт. орг. преп.,
сб. 2, стр. 64.
3Витцеман, Э в а и с, Хае с, Шредер, Синт. орг. преп.,
¦сб. 2, стр. 67.
АЦЕТИЛАЦЕТОН
(Диацетилметан; 2,/1-пентандион)
СПОСОБ ПОЛУЧЕНИЯ С ПРИМЕНЕНИЕМ ТРЕХФТОРИСТОГО ВОРА
BF3
CH3COCH3 + (CH3CO)SO »• СН3СОСН2СОСН
Предложил: К. Денун мл.
Проверили: Г. Адкинс и И. Вольф.
Получение
В 2-литровую трехгорлую колбу помещают 160 г B моля)
ацетона (примечание 1) и 510 г E молей) чистого уксусного ангид-
ангидрида и смесь охлаждают в бане со льдом и солью. Одно горло колбы
закрывают пробкой; во второе горло вставляют трубку, через ко-
которую вводят трехфтористый бор; третье горло снабжают отводной
трубкой, присоединенной к ловушке со щелочью для улавлива-
улавливания непоглотившегося трехфтористого бора. Продажный трехфто-
ристый бор (примечание 2) пропускают через брызгоуловитсль
Кьельдаля, чтобы предупредить засасывание реакционной смеси
обратно в баллон; затем газ пропускают в реакционную смесь
с такой скоростью, чтобы 500 г его поглотилось примерно за
5 час. B пузырька в 1 сек.). После этого реакционную смесь вы-
выливают в раствор 800 г кристаллического уксуснокислого натрия
в 1 600 мл воды, который находится в 5-литровой колбе. Смесь
перегоняют с водяным паром и собирают дестиллат порциями в
1 000, 500 и 400 мл.
АЦЕТИЛАЦЕТОН
93
Для приготовления раствора кристаллической уксуснокислой
меди 240 г этой соли (ч. д. а.) растворяют в 3 л воды при темпе-
температуре около 85° и раствор фильтруют, чтобы освободить его от
основной уксуснокислой соли, если она имеется. Затем осаждают
медную соль ацетилацетона, прибавляя 1 400 мл горячего раствора
уксуснокислой меди к первой фракции ацетилацетона, 700 мл — ко
второй, 500 мл — к третьей и 400 мл—к четвертой. Смесь остав-
оставляют в холодильном шкафу на 3 часа или еще лучше на ночь;
затем соль отфильтровывают, промывают один раз водой и тща-
тщательно отсасывают. В делительной воронке соль встряхивают
с 800 мл 20%-ной серной кислоты и с 800 мл эфира, после чего
эфирный слой отделяют, Водный слой экстрагируют сперва 400 мл,
а затем 200 мл эфира. Соединенные вместе вытяжки сушат над250 г
безводного сернокислого натрия и эфир отгоняют. Остаток пере-
перегоняют, применяя колонку Видмера (примечание 3). Выход аце-
ацетилацетона с т. кип. 134—136° составляет 160—170 г (80—85%
теоретич., считая на ацетон).
Примечания
1. Лучше всего сушить ацетон над безводным поташом или без-
безводным сернокислым кальцием, а затем, если требуется особенно
сухой препарат, над фосфорным ангидридом. Часто для этой цели
применяют хлористый кальций A00—150 г хлористого кальция
на 1 л ацетона); однако он менее пригоден, так как образует с
ацетоном химическое соединение1. Проверявшие синтез пользова-
пользовались ацетоном, высушенным над хлористым кальцием и затем
перегнанным над фосфорным ангидридом.
2. Был применен продажный трехфтористый бор в баллонах.
3. Была применена колонка Видмера со спиралью высотой
15 см и диаметром 13 см с 15 витками.
СПОСОБ ПОЛУЧЕНИЯ С ПРИМЕНЕНИЕМ ЭТПЛАТА НАТРИЯ
CH3COsCsH5 + CH3COCH3 + NaOC2H6 -^ CH3C(ONa) = CHCOCH3 + 2C2H5OH
CH3C(ONa) = CHCOCH3 + H2SO4 —> СН3СОСН2СОСН3 + NaHSO4
Предложили: Г. Адкинс и Дж. Рэйни.
Проверили: Р. Шрайнео и Н. Мун.
Получение
В 1-литровую круглодонную колбу помещают 69 г C грамм-
атома) натрия, тщательно освобожденного от корок гидроокиси,
и 400 мл сухого ксилола (примечание 1). Колбу нагревают до тех
пор, пока натрий не расплавится, после чего закрывают ее рези-
резиновой пробкой (примечание 2) и распыляют натрий сильным
встряхиванием. Содержимое колбы переносят в 3-литровую трех-
94
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
горлую колбу, ксилол сливают и натрий промывают с помощью
декантации двумя порциями абсолютного эфира по 100 мл (при-
(примечание 3). Затем к распыленному натрию прибавляют 1 л
абсолютного эфира; колбу устанавливают на паровой бане и снаб-
снабжают ее холодильником, мешалкой Гершберга («Синт. орг. прсп.»,
сб. 2, стр. 298, рис. 12) и капельной воронкой емкостью 250 мл.
Холодильник и капельную воронку защищают хлор кальциевыми
трубками с гигроскопической ватой (примечание 4). В капельную
воронку наливают 138 г A75 мл, 3 моля) абсолютного этилового
спирта и пускают в ход мешалку. Спирт приливают по каплям
в течение 2—3 час, поддерживая слабое кипение смеси. После
прибавления спирта реакционную смесь кипятят с обратным
холодильником при работающей мешалке в течение еще 6 час.
(примечание 5). Затем мешалку останавливают, обратный холодиль-
холодильник заменяют на обращенный вниз и эфир отгоняют по возможно-
возможности полностью на паровой бане (примечание 6).
Затем вновь устанавливают обратный холодильник и как мож-
можно быстрее прибавляют к теплому этилату натрия из делительной
воронки 1 200 мл этилацетата (примечание 7). Немедленно пускают
в ход мешалку и в течение 15—20 мин. прибавляют к смеси по
каплям 174г B20мл, 3 моля) ацетона (стр. 93, примечание 1), при-
причем, для того чтобы раствор кипел, колбу, если это требуется,
подогревают. Прибавлять ацетон следует начать тотчас же после
того, как будет закончено прибавление этилацетата. Во время
прибавления ацетона раствор становится совершенно красным,
а затем смесь приобретает бурую окраску (примечание 8). Смесь
кипятят в течение 1 часа; после этого мешалку выключают и оста-
оставляют содержимое колбы на 12 час. при комнатной температуре,
причем за это время выпадают в осадок кристаллы натриевой соли.
Жидкость декантируют в 5-литровую колбу, а натриевую соль
дикетона растворяют и смывают в колбу с помощью 2 500 мл ледя-
ледяной воды. После растворения соли слой сложного эфира по воз-
возможности быстро отделяют (примечание 9). Водный слой дважды
экстрагируют эфиром порциями по 300 ил и эфирные вытяжки
отбрасывают. К водному раствору прибавляют охлажденную
до 0° разбавленную серную кислоту A50 г концентрированной
кислоты и 400 г колотого льда) до тех пор, пока реакция раство-
раствора на лакмус не будет слегка кислой. Дикетоп извлекают из рас-
раствора четырьмя порциями эфира по 300 мл. Соединенные вместе
эфирные вытяжки сушат в течение суток над 60 г безводного сер-
сернокислого натрия в холодильном шкафу. Эфирный раствор декан-
декантируют в 2-литровую круглодонную колбу и сернокислый натрий
экстрагируют 100 мл абсолютного эфира. Вытяжки прибавляют к
эфирному раствору и эфир отгоняют на паровой бане. Остаток пе-
переносят в другую колбу емкостью 500 мл, смывают последние следы
вещества небольшим количеством эфира и перегоняют раствор,.
АЦЕТИЛАЦЕТОН
95
применяя колонку Видмера, причем собирают фракцию, кипя-
кипящую в пределах 130—139°. Эту фракцию сушат в течение 1 часа
над 5 г безводного поташа, а затем отделяют от осушителя и снова
перегоняют, пользуясь колонкой Видмера. Собирают фракцию,
кипящую при 134—136°; выход ацетилацетона составляет
115—136 г C8—45% теоретич., считая на ацетон).
Примечания
1. Ксилол сушат перегонкой над натрием.
2. На всех стадиях синтеза необходимо пользоваться только
резиновыми пробками (что относится также и к процессу высуши-
высушивания реагентов), так как в корковых пробках содержится неко-
некоторое количество влаги. Пробки следует прокипятить в течение
2 час. в 10%-ном растворе едкого натра, тщательно промыть раз-
разбавленной уксусной кислотой и высушить.
3. Вполне пригодны продажные абсолютный этиловый эфир
и абсолютный этиловый спирт. В случае отсутствия продажных
реагентов эфир следует очистить так, как это делается для приме-
применения его в реакции Гриньяра. Получение абсолютного спирта
описано в «Синт. орг. преп.», сб. 1, стр. 555, примечание 1.
4. Гигроскопическая вата является прекрасным осушителем,
значительно более удобным для применения в осушительных труб-
трубках, чем безводный хлористый кальций2. Малеиповый ангидрид
можно хранить в колбе, закрытой только пробкой из ваты, в те-
течение 3 недель без изменения степени чистоты препарата, определяе-
определяемой титрованием (Ф. Пингерт, частное сообщение).
5. Длительность нагревания может быть различной в зависимо-
зависимости от размера частиц распыленного натрия. Почти весь натрий
должен быть использован до удаления эфира; однако наличие не-
небольшого количества мелких кусков вреда не приносит.
6. Успех реакции зависит от качества приготовленного этилата
натрия. На этой стадии этилат натрия должен быть белого цвета
и находиться в очень мелко распыленном состоянии. При его
получении необходимо исключить возможность проникновения
в прибор влаги, чтобы избежать образования едкого натра, что
заметно снижает выход.
7. Этилацетат оставляют стоять над хлористым кальцием в те-
течение 2 дней, время от времени взбалтывая его. Хлористый каль-
кальций отфильтровывают, после чего препарат оставляют на не-
несколько часов над фосфорным ангидридом. Этилацетат перегоняют
непосредственно 5вд этим осушителем.
8. После прибавления примерно половины ацетона смесь обыч-
обычно превращается в плотную массу. Мешалку приводят в движение
от руки и продолжают прибавлять ацетон. Через несколько минут
массу снова можно перемешивать свободно.
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
9. Слой этилацетата промывают водой, раствором бисульфита
натрия, насыщенным раствором хлористого кальция и снова
водой. Дальнейшую очистку производят согласно указаниям,
данным в примечании 6; в результате получают 316—400 г веще-
•ства. Количество полученного обратно этилацетата зависит от вре-
времени, в течение которого оба слоя до их разделения находились в
соприкосновении.
Другие методы получения
Ацетилацетон был получен взаимодействием хлористого ацети-
ацетила с хлористым алюминием с последующими гидролизом3 и конден-
конденсацией ацетона с этилацетатом под действием натрия4, амида нат-
натрия5 и этилата натрия5"', а также взаимодействием ацетона с
уксусным ангидридом в присутствии трехфтористого бора8.
1 В a g s t e r, J. Chem. Soc, 1917, 494.
2Obermiller, Goertz, Z. physik. Chem., 109, 162 A924).
3 Combes, Ann. chim. phys., F), 12, 207 A887).
4Claisen, Ann., 277, 168A893).
6 С 1 a i s e n, Ber., 38, 695 A905).
6 С 1 a i s e n, Ehrhardt, Ber., 22, 1010 A889).
'Sprague, [В е с I h a m, Adkins, J. Am. Chem. Soc, 56,
2665 A934).
"Meerwein, Vossen, J. prakt. Chem., 141, 149 A934).
АЦЕТОАЦЕТАНИЛИД
Предложили: Дж. Уильяме и Дж. Криницкий.
Проверили: Н. Дрэйк и Дж. Ланн.
Получение
В трехгорлую круглодонную колбу емкостью 500 мл, снабжен-
снабженную обратным холодильником, капельной воронкой и мешалкой
с ртутным затвором (примечание 1) помещают раствор 46 г @,5 мо-
моля) сухого анилина в 125 мл чистого сухого бензола. Пускают в
ход мешалку, после чего в течение получаса прибавляют по каплям
раствор 42 г @,5 моля) димера кетена (стр. 180) в 75 мл чистого
сухого бензола. Затем реакционную смесь в течение 1 часа нагре-
нагревают с обратным холодильником на паровой бане, после чего
большую часть бензола отгоняют на той же бане, а оставшееся
количество — в вакууме. Остаток в колбе растворяют в 500 мл
горячего 50%-пого водного спирта, из которог& ацетоацетанилид
выпадает в осадок при охлаждении. Перед фильтрованием смесь
охлаждают до 0е. Для получения дополнительной порции кристал-
кристаллов к маточному раствору прибавляют 250мл воды и жидкость
вновь охлаждают (примечание 2). Общий выход вещества с т. пл.
АЦЕТОБРОМГЛЮКОЗА
97
82—83,5е составляет 65 г G4% теоретич.). С целью дополнительной
очистки препарат перекристаллизовывают из 300 мл 50%-ного
спирта и получают 55 г вещества с т. пл. 84—85е.
Примечания
1. Вполне пригоден более простой затвор (стр. 225, примеча-
примечание 1), изготовленный из резиновой трубки и смазанный глице-
глицерином.
2. Если вторичный маточный раствор упарить до половины
его первоначального объема, то можно получить в небольшом
количестве третью порцию весьма загрязненных кристаллов.
Другие методы получения
Ацетоацетанилид был получен взаимодействием анилина с аце-
тоуксусным эфиром1 и реакцией димера кетена с анилином4.
1 К nor r, Ann., 236, 69 A886).
2 R о о s, Ber., 21, 624 A888).
! Knorr, Reuter, Ber., 27, 1169 A894).
4 Chick, Wi Is more, J. Chem. Soc, 1908, 946; В о е s e, Ind.
Eng. Chem., 32, 16 A940).
АЦЕТОБРОМГЛЮКОЗА
(Бромистый 2,3,4,6-тетраацетил-а-с1-глюкопиранозил)
HOCH2CH (СНОНK СНОН • HSO + 6 (СН3СОJО -=>
-о
СН3СООСН2СН (CHOCOCHj)sCHOCOCHj + 7СН3СО2Н
L
-о-
СН3СООСН2СН (CHOCOCHj)jCHOCOCH8 + НВг
> СН3СООСН2СН (СНОСОСН3KСНВг + СН3СО2Н
I о 1
Предложили: /(. Редеман и К- Ниман.
Проверили: Л. Смит, Р. Арнольд и И. Лероль.
Получение
В 1-литровую круглодонную колбу помещают 66 г @,33 моля)
d-глюкозы (с 1 молекулой Н2О; примечание 1) и 302 г 95%-ного
уксусного ангидрида B80 мл, 2,81 моля). К этой смеси прибав-
прибавляют из медицинской пипетки (примечание 2) три небольшие кап-
капли концентрированной серной кислоты. Чтобы частично переве-
7 Сборник 3
98
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
сги глюкозу в суспензию, колбу встряхивают кругообразным
движением. Почти немедленно начинается реакция. Если темпе-
температура смеси повысится настолько, что будет близка к температуре
кипения, то колбу сейчас же погружают в сосуд с холодной водой.
Через 10—15 мин. почти вся глюкоза растворяется и температура
реакционной смеси повышается почти до 100°. Колбу неплотно
закрывают пробкой и в течение 2 час. нагревают на паровой бане.
Затем в вакууме отгоняют около 200 мл смеси уксусной кислоты
и уксусного ангидрида (примечание 3).
К теплому вязкому светложелтому сиропу прибавляют 65 г
F0 мл, 0,64 моля) уксусного ангидрида; смесь слегка подогревают
и перемешивают кругообразным, движением до .тех пор, пока
раствор не станет однородным. Затем колбу закрывают резино-
резиновой пробкой с двумя отверстиями, в одно из которых вставлена
трубка для ввода газа, а в другое — для вывода. Конец трубки
для ввода газа лишь на 5 мм не достигает дна колбы. Смесь охла-
охлаждают в бане со льдом и пропускают в нее бромистый водород
до тех пор, пока увеличение в весе не составит 140—160 г (при-
(примечание 4). Затем колбу закрывают резиновой пробкой и оста-
оставляют на ночь при 5°.
От раствора, окрашенного в соломенно-желтый цвет, отгоняют
в вакууме бромистый водород, уксусную кислоту и уксусный ангид-
ангидрид; для нагревания смеси пользуются водяной баней, температура
которой не должна превышать 60° (примечание 5). Во время отгон-
отгонки раствор несколько темнеет. Когда дестиллат перестанет отго-
отгоняться или когда остаток закристаллизуется, отгонку прекращают,
прибавляют к остатку 250—300.ил сухого диизоиропилового эфира
(примечание 6) и колбу осторожно подогревают на водяной бане,
чтобы ускорить растворение (примечание 7). Горячий раствор
переносят в 1-литровую коническую колбу и быстро охлаждают
холодной водой примерно до 45°. После этого смесь оставляют
медленно охлаждаться до комнатной температуры, а затем поме-
помещают ее на 2 часа или даже на большее время в холодиль-
холодильный шкаф.
Ацетобромглюкозу отфильтровывают на воронке Бюхнера,
тщательно отжимают и промывают 50 мл абсолютного изопро-
пилового эфира. Бесцветные кристаллы сушат в вакуум-эксика-
вакуум-эксикаторе над гидратом окиси кальция (или натрия); выход соста-
составляет ПО—120 г (80—87% теоретич.; примечание 8).
Примечания
1. Применялась продажная глюкоза с одной молекулой кри-
кристаллизационной воды.
2. Если возникнет какая-либо неясность относительно вели-
величины капель, то вначале лучше прибавить две капли и выждать
АЦЕТОБР0МГЛЮК03А
99
не менее 10 мин., прежде чем прибавить третью. Если количество
прибавленной серной кислоты слишком велико, то течение реак-
реакции может стать настолько бурным, что ее будет невозможно
регулировать.
3. Вполне достаточен вакуум, который получают с по-
помощью хорошо действующего водоструйного насоса. Уксусную
кислоту можно быстро отогнать при температуре бани, не превы-
превышающей 100°. В течение примерно 35 мин. собирают 200 мл дестил-
лата. Полное удаление уксусной кислоты не является обязатель-
обязательным; ее удаляют с единственной целью — уменьшить необходи-
необходимое количество бромистого водорода.
4. Бромистый водород можно получать, либо приливая по
каплям жидкий бром к кипящему тетралину, либо каталитиче-
каталитическим путем из водорода и брома («Синт. орг. преп.», сб. 2, стр. 109).
От бромистого водорода следует отделить свободный бром, для
чего газ пропускают над красным фосфором. Вначале бромистый
водород можно пропускать очень быстро, но когда раствор станет
более насыщенным, скорость пропускания газа следует умень-
уменьшить. При энергичном перемешивании раствора поглощение 140 г
бромистого водорода занимает около 2 час; если перемешивание
производится недостаточно интенсивно, то потребуется более про-
продолжительное время.
5. Такую отгонку лучше всего проводить следующим образом.
Бромистый водород удаляют по возможности полностью при тем-
температуре бани 40—50° в вакууме, который можно получить при
помощи хорошо действующего водоструйного насоса; иа это тре-
требуется около 1 часа. Затем, в течение примерно получаса темпера-
температуру бани медленно повышают до 50—60°; за это время отгоняется
значительное количество уксусной кислоты и уксусного ангидрида.
Содержимое приемника выливают и прибор присоединяют к масля-
масляному насосу, который может обеспечить вакуум порядка 5 мм.
Поддерживая температуру бани при 55—60° в течение 30—45 мин.,
отгоняют достаточное количество уксусной кислоты и уксусного
ангидрида. Масляный насос необходимо соответствующим обра-
образом предохранить от действия паров; прежде чем попадать в насос,
пары должны проходить через ловушку, охлаждаемую смесью
твердой углекислоты со спиртом, а затем через колонку высотой
30—40 см с едким натром в хлопьях. Можно работать и с одним
только хорошо действующим водоструйным насосом. В этом случае
приходится поддерживать более высокую температуру бани,
в результате чего реакционная смесь темнеет и препарат получает-
получается более низкого качества.
6. Диизопропиловыйэфир, который некоторое время находился
в соприкосновении с воздухом, содержит перекиси. Их следует
удалить; для этого эфир промывают сперва раствором бисульфита
натрия, затем раствором едкого натра и, наконец, водой. Эфир
100
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
сушат (в течение суток над хлористым кальцием и в течение суток
над фосфорным ангидридом), а затем перегоняют.
7. Нагревание, которое производят для того, чтобы завершить
растворение, должно быть по возможности более кратковремен-
кратковременным. Следует поддерживать температуру водяной бани около 100°
и колбу погружать в баню только на очень короткие периоды
времени. В продолжение этого процесса колбу необходимо не-
непрерывно встряхивать.
8. Получаемое вещество ст. пл. 87—88° вполне пригодно для
большинства целей. После одной перекристаллизации из диизо-
пропилового эфира получается препарат с т. пл. 88—89°.
Другие методы получения
а-Ацетобромглюкоза была получена действием бромистого
ацетила на безводную глюкозу 1~i; действием бромистого водорода
в уксусной кислоте на [3-пентаацетилглюкозу 5~8; действием бро-
бромистого водорода в уксусном ангидриде на безводную глюкозу9-10;
действием бромистого водорода в уксусном ангидриде на крахмал
или мальтозу11.
1 Koenigs, Кпогг, Вег., 34, 961 A901).
2 С о 1 1 е у, Вег., 34, 3206 AЕ01).
3 М о 1 1 van Charante, Rec. trav. chim., 21, 43 A902).
4 В r a u n s, J. Am. Chem. Soc, 47, 1280 A925).
6 Fischer, Вег., 49, 584 A916).
«Freudenberg, Noe, Knopf, Вег., 60, 241 A927).
'Fischer, Armstrong, Вег., 34, 2892 A901).
8 Fischer, Ber., 44, 1S01 A911).
"Dale, J. Am. Chem. Soc, 38, 2187 A916).
i»Levene, Raymond, J. Biol. Chem., 90, 247 A931).
ii Bergman n, Beck, Ber., 54, 1576 A921).
БЕНЗИЛОВЫЙ ЭФИР ХЛОРУГОЛЬНОИ КИСЛОТЫ И ЕГО ПРОИЗВОДНЫЕ
(К^арбобензоксихлорид)
С6Н5СН2ОН + СОС12 -> CjH6CH2OCOCl + HC1
QH6CH2OCOC1 + 2NH3 -* CSH5CH2OCONH2 + NH4C1
C6H0CH2OCOCl+H2NCH2C02H + NaOH ->
-> C6H5CH2OCONHCH2CO2H + NaCl4-H2O
Предложили: Г. Картер, Р. Франк и X. Джонстон.
Проверили: Н. Дрэйк и Ч. Икер.
Получение
Бензиловый эфир хлоругольнои кислоты. Круглодонную колбу
емкостью 3 л закрывают резиновой пробкой, в которую вставляют-
БЕНЗИЛОВЫЙ ЭФИР ХЛОРУГОЛЬНОИ КИСЛОТЫ И ЕГО ПРОИЗВОДНЫЕ 101
ся отводная трубка и трубка для ввода газа, доходящая до дна
колбы. Трубки снабжены кранами, так что реакционную колбу
можно отъединить. В колбу помещают 500 г сухого толуола (при-
(примечание 1) и прибор взвешивают. Затем колбу охлаждают в бане
со льдом и через толуол пропускают фосген (примечание 2) до тех
пор, пока не поглотится 109 г его A,1 моля; примечание 3). Отхо-
Отходящие газы пропускают через колбу с толуолом, чтобы удалить
фосген; затем газы проходят через трубку с хлористым кальцием
в ловушку для поглощения газов («Синт. орг. преп.», сб. 2, стр. 78,
рис. 3).
Когда поглощение фосгена будет закончено, реакционную кол-
колбу отъединяют от баллона с фосгеном и присоединяют к ней дели-
делительную воронку. Слегка встряхивая колбу, быстро вводят в нее
через делительную воронку 108 г A04 мл, 1 моль) свежеперег-
нанного бензилового спирта. После этого колбу оставляют стоять
в течение получаса в бане со льдом и в течение 2 час. при ком-
комнатной температуре. Затем раствор упаривают в вакууме при
температуре, не превышающей 60°, для того чтобы удалить хлори-
хлористый водород, избыток фосгена (примечание 4) и большую часть
толуола. Остаток весит 200 — 220г и содержит 155— 160 г бензи-
бензилового эфира хлоругольнои кислоты (91 —94% теоретич. из рас-
расчета на бензиловый спирт; примечание 5). Для того чтобы точно
определить количественное содержание этого эфира в растворе,
из небольшой аликвотной порции можно получить амид; можно
также вполне надежно вычислить содержание эфира, принимая,
что минимальный выход его составляет 90% теоретического коли-
количества из расчета на взятый в реакцию бепзиловый спирт.
Бензиловый эфир карбаминоеой кислоты. Определенное количе-
количество (удобно взять 10 мл) раствора бензилового эфира хлоругольнои
кислоты, полученного указанным выше способом, медленно и при
энергичном перемешивании прибавляют к пятикратному по объему
количеству холодного концентрированного аммиака (уд. вес 0,90)
и оставляют реакционную смесь стоять в течение получаса при
комнатной температуре. Осадок отфильтровывают с отсасыванием,
промывают холодной водой и сушат в вакуум-эксикаторе. Выход
практически чистого бензилового эфира карбаминовой кислоты
с т. пл. 85 — 86° составляет 7,0 — 7,2г (91—94% теоретич.,
считая на бензиловый спирт, взятый для синтеза бензилового
эфира хлоругольнои кислоты). Чистый бензиловой эфир карбами-
карбаминовой кислоты с т. пл. 87° получают перекристаллизацией из
двухкратного количества (по объему) толуола.
Карбобензоксиглицин. Раствор 7,5 г @,1 моля) глицина в 50 мл
2 н. раствора едкого натра помещают в трехгорлую колбу емко-
емкостью 200 мл, снабженную механической мешалкой и двумя капель-
капельными воронками. Колбу охлаждают в бане со льдом и в течение
20 — 25 мин. при сильном перемешивании прибавляют к ее содер-
102
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
жимому одновременно 17 г @,1 моля) бензилового эфира хлор-
угольной кислоты B1—24 г раствора, полученного по приве-
приведенной выше методике) и 25 мл 4 н. раствора едкого натра. Смесь
перемешивают в течение еще 10 мин. Толуольный слой отделяют,
а водный слой экстрагируют один раз эфиром. Водный раствор
охлаждают в бане со льдом и подкисляют концентрированной
соляной кислотой до кислой реакции на конго (примечание 6).
Осадок отфильтровывают, промывают небольшими порциями хо-
холодной воды и сушат на воздухе. Полученное вещество пред-
представляет собой чистый карбобензоксиглицин. Выход составляет
18—19 г (86—91% теоретич.); т. пл. 119—120°. Вещество можно
перекристаллизовать из хлороформа; тогда оно, плавится при
120° (примечание 7).
Примечания
1. Высушить толуол можно перегонкой.
2. Был применен продажный фосген.
3. В течение некоторого времени фосген поглощается быстро,
но с повышением его концентрации поглощение замедляется. Эта
стадия требует около 1 часа. Количество поглощенного фосгена
проверяют, для чего время от времени взвешивают колбу вместе
с трубками.
4. Чтобы предотвратить утечку фосгена, между прибором и во-
водоструйным наессом устанавливают толуольную ловушку. Для
этой цели удобно применять погруженную в баню со льдом 2-лит-
2-литровую колбу, которая содержит около 1 л толуола. Колбу снаб-
снабжают вводной трубкой, доходящей почти до дна колбы.
5. Удалять толуол полностью нецелесообразно; кроме того,
толуол не препятствует получению производных.
6. Это производное может выделиться в виде масла. Однако
кристаллизацию легко вызвать, если раствор охладить и внутрен-
внутреннюю стенку сосуда потереть стеклянной палочкой.
7. Карбобензоксиаланин (т. пл. 114—115°) получают тем
же методом с выходом 80—90% из аланина и бензилового эфира
хлоругольной кислоты.
Другие методы получения
Бензиловый эфир хлоруголыюй кислоты был получен дей-
действием фосгена на бензиловый спирт1'2. Описанную выше методику
получения бензилового эфира хлоругольной кислоты и карбобенз-
оксипроизтюдных глицина и аланина в основном разработали
Бергман и Зервас2. Карбобензоксипроизводные других амино-
аминокислот удобно получать таким же способом. Бензиловый эфир
карбаминовой кислоты был получен действием аммиака на бензи-
БЕНЗОИЛМУРАВЫШАЯ КИСЛОТА
103
ловый эфир хлоругольной кислоты1'3. Приведенную методику
разработали Мартелл и Хербст3.
1 Т h i e 1 е, Dent, Ann., 302, 257 A898).
2 Bergman n, Zervas, Ber., 65, 1192 A932).
3 M a r t e 1 1, H e г b s t, J. Org. Chem., 6, 882 A941).
БЕНЗОИЛМУРАВЬИНЛЯ КИСЛОТА
(Фенилглиоксиловая кислота)
C6H5COCN + 2H2O + HC1 -> С6Н5СОСО2Н + NH4C1
Предложили: Т. Оквуд и К- Вейсгербер.
Проверили: Р. Шрайнер и Ч. Расселл.
Получение
В 1-литровую колбу помещают 50 г @,38 моля) цианистого бен-
зоила (стр. 488) и 500 мл концентрированной соляной кислоты
(уд. вес 1,18). Время от времени смесь взбалтывают до тех пор, пока
твердое вещество полностью не растворится; затем ее оставляют
стоять при комнатной температуре в течение 5 дней (примечание 1).
По истечении этого времени прозрачный желтый раствор выливают
в 2 л воды и экстрагируют эфиром сперва порцией в 400 мл, а затем
тремя порциями по 250 мл. Эфир отгоняют на паровой бане, а остав-
оставшееся масло помещают в вакуум-эксикатор с фосфорным ангид-
ангидридом и твердым едким натром; масло оставляют в эксикаторе
до тех пор, пока оно не высохнет (примечание 2). Выход неочи-
неочищенной твердой кислоты с т. пл. 57—64° составляет около 55—56 г
(96—98% теоретич.). Неочищенную кислоту растворяют в 750мл
горячего четыреххлористого углерода и прибавляют к раствору
2 г активированного березового угля (примечание 3). Раствор
фильтруют и дают ему охладиться до комнатной температуры,
а затем охлаждают в смеси льда с водой до тех пор, пока не за-
закончится кристаллизация. Твердую кислоту отфильтровывают
с отсасыванием и растворитель, удержанный кристаллами, уда-
удаляют, помещая препарат на 2 дня в вакуум-эксикатор. Получен-
Полученное вещество имеет светложелтую окраску. Выход бензоилму-
равьиной кислоты с т. пл. 64—66° составляет 42—44 г G3—77%
теоретич.; примечание 4).
Примечания
1. Чтобы завершить растворение твердого цианистого бензоила
требуется около 1 дня, причем в течение этого времени смесь не-
необходимо периодически взбалтывать. При взбалтывании раство-
растворяется выделяющаяся желтая маслянистая жидкость. Иногда
к концу растворения в осадок выпадает некоторое количество хло-
хлористого аммония.
104
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
2. Если маслянистая жидкость не кристаллизуется, то ее сле-
следует охладить смесью льда с водой, пока она полностью не затвер-
затвердеет. Для того чтобы затвердевшее вещество окончательно вы-
высушить, его вновь помещают в эксикатор. Последний следует
эвакуировать медленно, так как иначе может произойти раз-
разбрызгивание вещества.
3. Если не применять угля для обесцвечивания, то кислота мо-
может выделиться в виде масла, которое затвердевает при охлаждении.
4. Титрование стандартным раствором едкого натра пока-
показывает, что чистота кислоты достигает почти 99%.
Другие методы получения
Бензоилмуравьиную кислоту можно получить окислением аце-
тофенона перманганатом калия в щелочном растворе1; окислением
миндальной кислоты перманганатом калия в щелочном рас-
растворе2'3; омылением цианистого бензоила концентрированной
соляной кислотой4.
'Clans, Neukranz, J. prakt. Chem., B), 44, 80 A891).
2 Acree, Am. Chem. J., 50, 391 A913).
3Корсон, Додж, Гарри с, Хазен, Синт. орг. преп., сб. 1,
стр. 537.
*Boeseken, Felix, Rec. trav. chim., 40, 569 A921).
1,2,3-БЕНЗОТРИАЗОЛ
-NH2
-NH2
11NO2
-PI 2O
Предложили: Р. Дамшродер и В. Петерсон.
Проверили: В. Бахман и В. Струве.
Получение
В 1-литровый стакан помещают смесь 108 г A моль) о-фенилен-
диамина («Синт. орг. прсп.», сб. 2, стр. 509), 120 г A15 мл, 2 моля)
ледяной уксусной кислоты и 300 мл воды. Если смесь слегка на-
нагреть, то получится прозрачный раствор. Стакан помещают в ледя-
ледяную воду и охлаждают его содержимое до 5°. Как только будет
достигнута эта температура, к смеси в один прием прибавляют
холодный раствор 75 г A,09 моля) нитрита натрия в 120 мл воды
и перемешивают ее стеклянной палочкой или с помощью медленно
работающей механической мешалки. Реакционная смесь становится
темнозелепой, и температура ее быстро поднимается до 70—80°
1,2,3-БЕНЗОТРИАЗОЛ
105
(примечание 1). Затем окраска раствора меняется, и последний
принимает светлый оранжево-красный цвет. После этого стакан
вынимают из охлаждающей бани и оставляют стоять в течение
1 часа. По мере охлаждения раствора бензотриазол выделяется
в виде масла. Стакан окружают льдом и перемешивают смесь до
тех пор, пока она не превратится в твердую массу. После стояния
на холоду в течение 3 час. кристаллы отфильтровывают на воронке
Бюхнера, промывают 200 мл ледяной воды и по возможности досу-
досуха отсасывают, отжимая резиновой трамбовкой. Выход окрашен-
окрашенного в светлобурый цвет препарата после высушивания его в тече-
течение ночи при 45—50° составляет 110—116 г.
Неочищенный бензотриазол помещают в специальную колбу
Клайзена емкостью 200 мл («Синт. орг. преп», сб. 1, стр. 142, рис. 8)
и перегоняют в вакууме (примечание 2). Выход белого (с желтым
оттенком) твердого вещества с т. кип. 201—204° A5 мм) [156—159°
B мм)] составляет 92—99 г. Препарат расплавляют в приемнике
с помощью коптящего пламени горелки и выливают в 250 мл бен-
бензола. Прозрачный раствор перемешивают до тех пор, пока не нач-
начнется кристаллизация; затем раствор в течение 2 час. сильно
охлаждают и препарат отфильтровывают на воронке Бюхнера.
Выход бесцветного бензотриазола составляет 90—97 г G5—81%
теоретич.; примечание 3); т. пл. 96—97°.
Примечания
1. Следует избегать слишком эффективных охлаждения и пере-
перемешивания. Очень существенно, чтобы температура поднялась
до 80°. Слишком быстрое охлаждение после того, как будет достиг-
достигнута эта температура, приводит к получению более низких выхо-
выходов. При проведении опытов с количествами исходных веществ,
составляющими одну десятую указанных выше, рекомендуется
вынимать смесь из охлаждающей бани немедленно после при-
прибавления нитрита натрия, чтобы обеспечить последующее повы-
повышение температуры.
2. Сырой препарат можно очистить повторной перекри-
перекристаллизацией из бензола или воды. Этот кропотливый процесс
очистки сопровождается большими потерями, чем обыкновенная
перегонка.
3. Авторы синтеза сообщают, что при работе с удвоенными коли-
количествами исходных веществ получаются одинаково хорошие резуль-
результаты.
Другие методы получения
1,2,3-Бензотриазол был получен непосредственно действием
азотистой кислоты на о-фенилендиамин1, а также омылением аци-
лированного или ароилированного бензотриазола, предварительно
106
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
синтезированного действием азотистой кислоты на соответствую-
соответствующий моноацилированный или моноароилированный о-фенилен-
диамин2-4. Изложенный выше процесс, проводимый в одну ста-
стадию, в конечном итоге дает лучшие результаты, чем методы с
несколькими промежуточными стадиями. В большинстве способов,
описанных в литературе, применяется минеральная кислота.
Уксусная кислота дает более удовлетворительные результаты.
1 Ladenburg, Вег., 9, 219 A876).
2 В е 1 1, Kenyon, J. Chem. Soc, 1926, 954.
3 F i е s е г, Martin, J. Am. Chem. Soc, 57, 1838 A935).
4Charrier, Beretta, Gazz. chim. ital., 51, (часть 2), 267 A921).
БИСУЛЬФИТНОЕ СОЕДИНЕНИЕ ГЛИОКСАЛЯ
(СН3СНОK + 3H2Se03 -> ЗОСНСНО + 3Se + 6Н2О
ОСНСНО + 2NaHSO3 + Н2О —> OCHCHO-2NaHSO3.H2O
Предложили: А. Ронзио и Т. Во.
Проверили: Ч. Аллен и Дж. ВанАллан.
Получение
В 2-литровую круглодонную колбу, снабженную эффектив-
эффективным обратным холодильником (примечание 1) и установленную
в горячей водяной бане, помещают 222 г A,72 моля) селенистой
кислоты (примечание 2), 270 мл паральдегида (примечание 3),
540 мл диоксана и 40 мл 50%-ной уксусной кислоты (примеча-
(примечание 4). Смесь кипятят с обратным холодильником в течение 6 час.
(примечание 5). Затем раствор с помощью декантации отделяют
от неорганического осадка (примечание 6), который промывают
двумя порциями воды по150ла. Соединенные вместе растворы пе-
перегоняют с водяным паром, пользуясь специальной насадкой
(стр. 68), до тех пор, пока не отгонятся паральдегид и диоксан;
на это требуется около 3,5 часа (примечание 7). Смесь отделяют
с помощью декантации от небольшого количества селена (приме-
(примечание 6) и к этому раствору, не фильтруя его, прибавляют неболь-
небольшой избыток 25%-ного раствора уксуснокислого свинца (при-
(примечания 8 и 9). Свинцовую соль селенистой кислоты отфильтровы-
отфильтровывают и фильтрат насыщают сероводородом в вытяжном шкафу
(примечание 8). Затем к смеси прибавляют 20 г активированного
березового угля и нагревают все вместе до 40° под тягой, после
чего смесь фильтруют с отсасыванием. Прозрачный бесцветный
раствор упаривают па горячей водяной бане в вакууме, пользуясь
обычным прибором, примерно до 150 мл (примечание 10).
Полученный концентрированный раствор прибавляют к заранее
приготовленному и профильтрованному раствору бисульфита на-
БИСУЛЬФИТНОЕ СОЕДИНЕНИЕ ГЛИОКСАЛЯ
107
трия в 40%-ном спирте (примечание 11). Этот последний раствор
находится в 4-литровом стакане, снабженном механической мешал-
мешалкой (примечание 12). Смесь перемешивают в течение 3 час; затем
продукт присоединения отфильтровывают с отсасыванием на во-
воронке Бюхнера диаметром 18 ел и промывают сперва двумя пор-
порциями спирта по 150 мл, а затем эфиром A50 мл). Выход высу-
высушенного на воздухе вещества составляет 350—360 г G2—74% тео-
ретич., считая на взятую селенистую кислоту; примечание 13).
Примечания
1. Потери больших количеств ацетальдегида можно избежать,
применяя змеевиковый холодильник и нагревая реакционную смесь
достаточно интенсивно для того, чтобы сконденсировавшиеся пары
образовали гидравлический затвор; жидкость внутри холодиль-
холодильника должна занимать примерно две трети спирали. Зимой водо-
водопроводная вода обычно бывает достаточно холодной, так что для
проведения синтеза можно удовлетвориться любым длинным
эффективным холодильником или двумя холодильниками, устано-
установленными последовательно.
2. Не обязательно применять свежеприготовленную селенистую
кислоту. Если взять большее ее количество, то выход не увели-
увеличится. Авторы синтеза указывают, что ими в качестве окислителя
была применена двуокись селена. При проверке окислитель
получали выпариванием досуха водного раствора двуокиси селена
на водяной бане; поэтому проверявшие синтез полагали, что
окислителем в данном случае является селенистая кислота, и рас-
рассчитывали выход конечного вещества на этой основе. Если же
окислитель в действительности является двуокисью селена, то
взятое для синтеза количество этого реагента, равное 222 г,
соответствует 2 молям, а выход вещества составляет 62—64%
теоретического количества.
3. Указанное количество паральдегида представляет значитель-
значительный избыток по сравнению с теоретическим. Однако было найдено,
что при использовании именно такого количества получаются наи-
наиболее удовлетворительные результаты.
4. Уксусная кислота, повидимому, выполняет две функции,
являясь ускорителем окисления и ингибитором перегруппировки
в гликолевую кислоту.
5. Температуру водяной бани поддерживают в пределах
65—80°.
6. Этот осадок^ представляющий собой загрязненный селен,
может быть вновь окислен1, после чего можно применять его в по-
последующих синтезах. На этой стадии регенерируется около 130 г
селена, а после упаривания — еще 8—10 г.
108
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
7. Можно также применить прямую перегонку; этот процесс
занимает около 2,5 часа, но требует большего внимания. Объем
раствора уменьшают до 200—300 мл, после чего прибавляют к нему
800 мл воды.
8. Пробу фильтруют и прозрачный фильтрат обрабатывают до-
дополнительным количеством реагента, чтобы проверить полноту
завершения реакции.
9. Для удаления селенистой кислоты удобнее применять уксус-
уксуснокислый свинец, а не сернистый ангидрид, но необходимо следить
за тем, чтобы раствор оставался холодным и чтобы не было боль-
большого избытка реагента.
10. С указанным объемом раствора легче всего работать. Если
желательно иметь собственно глиоксаль, то раствор можно
выпарить досуха в эксикаторе. Полученное таким образом
вещество идентично с препаратом, известным под названием
«полиглиоксаль».
11. Для получения указанного раствора 312 г техниче-
технического бисульфита натрия растворяют в 2 100 мл теплой (около 40°)
воды и прибавляют к раствору 1 400 мл 95%-ного этилового
спирта.
12. Эту операцию можно проводить также и в колбе, содержи-
содержимое которой следует часто встряхивать от руки для того, чтобы
предупредить образование твердой массы. При применении мешал-
мешалки вещество получается в гранулированном виде. Маточный рас-
раствор удерживает около 7 г бисульфитного соединения глиоксаля
в 1 л.
13. Полученный препарат достаточно чист для большинства це-
целей. Его можно перекристаллизовать, растворив в воде и добавив
такое количество спирта, чтобы раствор был 40%-ным. Выход
составляет 90—92%.
Другие методы получения
Глиоксаль был получен несколькими методами, но только не-
немногие из них имеют препаративное значение. Наиболее пригодны-
пригодными оказались следующие: окисление ацетальдегида азотной2 или
селенистой6 кислотой; гидролиз дихлордиоксана6; гидролиз про-
продукта, полученного при действии дымящей серной кислоты на те-
трагалоидированные этаны'.
1 Рилей, Грей, Синт. орг. преп., сб. 2, стр. 508, приме-
примечание 2.
2 Л ю б а в и н, Вег., 8, 768 A875)
3 Wyss, Ber., 10, 1366 A877).
4Bebrend, К о 1 1 п, Ann., 416, 230 A918).
5 R i 1 е у, Мог ley, Friend, J. Chem. Soc, 1932, 1881.
«Butler, Cretcher, J. Am. Chem. Soc, 54, 2988 A932).
7 О t t, герм. пат. 362743 [С. А., 18, 991 A924)].
БРОМАЦЕТАЛЬ
109
БРОМАЦЕТАЛЬ
(Диэтиловый ацеталь бромацетальдегида)
СН3СО2СН = СН2 + Вг2 -> СН3СО3СНВгСНаВг
СН3СО2СНВгСН2Вг + С2Н5ОН -> ВгСН2СНО + СН3СО2С2Н6+НВг
ВгСН2СНО + 2С2Н5ОН
НВг
ВгСН2СН (ОСгН5J + Н2О
Предложили: С. Мак-Эльвен и Д. Кундигер.
Проверили: Р. Шрайнер и К- Тилфорд.
Получение
Прибор в собранном виде показан на рис. 11. Трехгорлая круг-
лодонная колба А емкостью 3 л снабжается механической мешал-
мешалкой, пропущенной через хорошо смазанную резиновую муфту.
Кводоструйному,
насосу
В одно горло колбы вставлены термометр и стеклянная трубка,
ведущая через предохранительную ловушку Б к водоструйному
насосу. В другое горло вставлена стеклянная трубка диаметром
7 мм, доходящая до дна колбы и соединенная со склянкой В
емкостью 500 мл, в которую помещают 255 мл E молей) брома (при-
(примечание 1). Склянка В соединена с промывной склянкой Г ем-
емкостью 500 мл, которая содержит 250 мл серной кислоты. Трубка
для введения воздуха в склянку Г защищена хлоркальциевой
трубкой.
В колбу А помещают раствор 430 г E молей) винилацетата (при-
(примечание 2) в 1 500 мл B6 молей) абсолютного этилового спирта.
Раствор охлаждают в смеси льда с солью до —10° и пускают в ход
мешалку. Через отводную трубку предохранительной ловушки Б
производят легкое отсасывание, и бром вносится в колбу А вместе
с быстрым током воздуха. Скорость введения брома, контроля-
110
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
БРОМИСТЫЙ ДЕКАМЕТИЛЕН
111
руемую при помощи зажима Д, регулируют таким образом, чтобы
испарение всего брома заняло 8—10 час. Затем перемешивание
прекращают и реакционную смесь оставляют на ночь, чтобы она
охладилась до комнатной температуры. После этого смесь выли-
выливают в 1 700 мл ледяной воды (примечание 3); нижний слой бром-
ацеталя и этилацетата отделяют (примечание 4), дважды промы-
промывают холодной водой порциями по 300 мл, один раз—300 мл хо-
холодного 10%-ного раствора углекислого натрия и сушат в течение
получаса последовательно над двумя порциями безводного хлори-
хлористого кальция по 25 г. Неочищенный препарат весит 990—1010 г;
его очищают перегонкой в вакууме водоструйного насоса, поль-
пользуясь дефлегматором Видмера высотой 15 ел или елочным дефлег-
дефлегматором высотой 20 см. Первая фракция состоит из этилацетата.
За ней следует фракция чистого бромацеталя с т. кип. 62—63°
A5 мм) [84—85° C0 мм)]; выход бромацеталя составляет 610—
625 г F2—64% теоретич.; примечание 5).
Примечания'
1. Предварительно бром промывают 100 мл концентрированной
серной кислоты.
2. Винилацетат отгоняют от прибавленного антиоксиданта;
первую мутную порцию, содержащую воду, отбрасывают и исполь-
используют фракцию с т. кип. 69—71° G40 мм).
3. Если на этой стадии образуется эмульсия, то прибавляют
320 г кристаллического сернокислого натрия.
4. Бромацсталь является очень сильным лакриматором, и луч-
лучше всего работать с ним в вытяжном шкафу.
5. При незначительных изменениях вышеописанной методики
был получен выход бромацеталя, равный 78%. Применяли поло-
половинное количество указанных выше исходных веществ и, после
того как бромирование было закончено, реакционную смесь перед
дальнейшей обработкой оставляли стоять в течение 64 час. Выход
бромацеталя составил 380 г1.
Другие методы получения
Описанная выше методика в основном представляет собой
применение к большим масштабам способа, разработанного Фила-
чионе2. Бромацеталь был получен непосредственным бромирова-
нием ацеталя3 или бромированием ацеталя в присутствии углекис-
углекислого кальция4; действием этилата натрия на а,|3-дибромди-
этиловый эфир5; бромированием наральдегида* с последующим
* М. Н. Щукина получала ацетали бромацетальдегида, в том числе диэти-
ловый ацеталь, бромированием ацетальдегида с последующим действием абсо-
действием этилового спирта6; действием этилового спирта на
бромацетальдегид7.
1 С F. Н. А 1 1 е п, частное сообщение.
2 F i 1 а с h i о и е J. Am. Chem. Soc., 61, 1705 A939).
3 Pinner, Ber., 5, 149 A872).
4 Fischer, Landsteiner, Ber., 25, 2551 A892).
5 Wislicenus, Ann., 192, 112 A878).
"Freundler, Ledru, Bull. soc. chim., D), 1, 75 A907).
7 Rotbart, Ann. chim., A1), 1, 451 A934).
БРОМИСТЫЙ ДЕКАМЕТИЛЕН
(/, / О-Дибромдекан)
НО(СН2)]0ОН + 2НВг - > Br(CH2I0
Предложил: В. Мак-Юэн.
Проверили: Р. Фыозон и Э. Кливленд.
Получение
В 2-литровую трехгорлую колбу, погруженную в масляную
баню и снабженную механической мешалкой и трубкой для ввода
газа, которая доходит почти до дна колбы, помещают 696 г D моля)
декаметиленгликоля («Синт. орг. преп.», сб. 2, стр. 170). После того
как температура масляной бани достигнет 95—100°, через гликоль
пропускают при перемешивании быстрый ток бромистого водорода
(«Синт. орг. преп.», сб. 2, стр. 109). Когда смесь будет насыщена га-
газом, что заметно по обильному образованию белых паров у откры-
открытого горла колбы (примечание 1), температуру бани повышают
до 135° и в течение 6 час. пропускают через гликоль медленный
ток бромистого водорода (примечание 2).
После охлаждения неочищенный препарат переносят в дели-
делительную воронку, нижний водный слой сливают и отбрасывают.
Верхний слой промывают один раз равным по объему количеством
теплой воды, а затем последовательно несколькими порциями
10%-ного раствора соды до полного исчезновения кислоты. После
этого вещество промывают один раз теплой бодой, которую по
возможности лучше отделяют (примечание 3). Промытый таким
образом препарат перегоняют в вакууме из колбы Клайзена.
Первые несколько капель дестиллата, содержащие некоторое
количество воды, отбрасывают; основная фракция перегоняется
при 139—142° B мм). Выход составляет 1 080 г (90% теоретич.;
примечание 4).
лютного спирта. Выход ацеталя составил 69—73% [М. Н. Щукина,
ЖОХ, 18, 1661 A948)]. (Прим. ред.)
112
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Примечания
1. При опытах с большими количествами исходных веществ
предпочтительнее на этой стадии остановить мешалку, прекратить
пропускание газа и дать отделиться нижнему водному слою, кото-
который затем удаляют с помощью сифона.
2. Общее количество брома, необходимого для получения бро-
бромистого водорода, составляет около 950 г.
3. Если во время промывания встретятся затруднения при
разделении слоев, то вещество можно растворить в равном по
объему количестве эфира.
4. Авторы синтеза, применяя различные количества гликоля
(от 150 до 2 000 г), получали почти всегда один и тот же выход
(в процентах).
По этому же методу были получены следующие дибромиды:
Бромистый триметилен
» гексаметилен
» нонаметилен
Выход, %
75
90
93
Т. кип.
165—167
108—112 (8 мм)
128—130B »)
Другие методы получения
Впервые бромистый декаметилен был получен нагреванием гли-
гликоля с дымящей бромистоводородной кислотой в запаянной трубке1.
В дальнейшем он был синтезирован по способу, описанному выше2-*.
1 Frank e, Hankam, Monatsb., 31, 181 A910).
2 С h u i t, Helv. Chim. Acta, 9, 264 A926).
3Carothers, Hill, Kirby, Jacobson, J. Am. Chem. Soc,
52, 5279 A930).
БРОМИСТЫЙ ПЕНТАМЕТИЛЕН
A,5-Цибромпентан)
H,
H2C
|
н2с
CH2 H2SO4
| +2HBr BrCH2CH2CH2CH2CH2Br + H20
CH2
Предложил: Д. Андрюс.
Проверили: Н. Дрэйк и Ч. Икер.
Получение
В круглодонной колбе емкостью 500 мл приготовляют раствор
бромистоводородной кислоты («Синт. орг. преп.», сб. 1, стр. 109),
БРОМИСТЫЙ ПЕНТАМЕТИЛЕН
113
пропуская сернистый газ в смесь 120 г C7,7 мл, 0,75 моля) брома,
50 мл воды и 150 г измельченного льда. Этот раствор эквивалентен
смеси 253 г A,5 моля) 48%-ной бромистоводородной кислоты и 74 г
концентрированной серной кислоты. К смеси прибавляют 21,5 г
@,25 моля) тетрагидропирана (стр. 403), колбу соединяют с обрат-
обратным холодильником и светлокоричневую гомогенную смесь ки-
кипятят в течение 3 час. (примечание 1).
Тяжелый нижний слой отделяют (примечание 2), промывают
один раз насыщенным раствором двууглекислого натрия, один
раз водой и сушат над 4—5 г безводного хлористого кальция.
Неочищенное вещество отделяют декантацией от осушителя,
который промывают один или два раза небольшим количеством бро-
бромистого этила, прибавляя затем последний к основной массе
препарата. Смесь перегоняют в вакууме и при 104—106° A9 мм)
собирают бромистый пентаметилен, выход которого составляет
46—47 г (80—82% теоретич.).
Примечания
1. Авторы синтеза кипятили смесь в течение 10 час, однако
проверявшие синтез получали столь же хороший выход и через
3 часа.
2. Верхний водный слой содержит значительное количество
непрореагировавшей бромистоводородной кислоты. Если этот
слой перегнать, то можно выдслитьоколо 150 г @,9 моля) постоянно
кипящей бромистоводородной кислоты [т. кип. 123—124° G48 мм)].
Другие методы получения
Методы получения бромистого пентаметилена описаны в «Синт.
орг. преп.», сб. 1, стр. 124, где детально изложено получение этого
соединения из бензоилпиперидина и пятибромистого фосфора.
Приведенная выше методика основана на работах Поля1.
'Paul, Bull. soc. chim., D), 53, 1489 A933).
114
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
БРОМИСТЫЙ ТЕТРАГИДРОФУРФУРИЛ
[2-(Бромметил)-тетрагидрофуран]
СН2—СН2
СЫ2—СН2 c5h5n
3 | | +РВг3
сн2 снсн2он
3 | | +Н3РО3
СН2 СНСН2Вг
Предложил: Л. Смит.
Проверили: Дж. Джонсон и Р. Сойер.
Получение
В трехгорлую колбу емкостью 500 мл, снабженную механиче-
механической мешалкой, термометром, делительной воронкой и хлоркаль-
циевой трубкой, помещают 96 г E6,5 мл, 0,36 моля) свежепере-
гнанного трехбромистого фосфора [т. кип. 174—175° G40 мм)]
и 50 мл сухого бензола. В течение 15 мин. через делительвую во-
воронку прибавляют при перемешивании 15 г сухого пиридина.
Затем колбу погружают в смесь льда с солью, охлаждают ее со-
содержимое до —5° и в течение 4 час. через делительную воронку
медленно при перемешивании прибавляют смесь 102 г A моль)
дважды перегнанного тетрагидрофурфурилового спирта [т. кип.
79—80° B0 мм)] и 5 г сухого пиридина (общее количество пириди-
пиридина составляет 20 г, 0,25 моля). В продолжение .этого периода
температуру внутри колбы поддерживают в интервале от —5
до —3°. Перемешивание продолжают в течение еще 1 часа, после
чего бане дают нагреться до комнатной температуры.
Смесь оставляют на сутки или на 2 суток (примечание 1) и затем
переносят в колбу Клайзена емкостью 500 мл. Предварительно
колбу ополаскивают два раза небольшими порциями бензола. Бен-
Бензол отгоняют, постепенно понижая давление примерно до 60 мм
и осторожно нагревая колбу на масляной бане (температура не
выше 90°). После отгонки бензола давление снижают до 5—10 мм
и баню медленно нагревают до 150—155°, пока не прекратится
отгонка вещества (примечание 2). Полученный дестиллат
(ПО—126 г) перегоняют вторично с эффективным дефлегматором
и собирают очищенный бромистый тетрагидрофурфурил при
69—70° B2 мм) [61—62° A3 мл); 49—50° D мм)] (примечание 3).
Выход составляет 90—102 г E3—61% теоретич.).
Примечания
1. Выходы были несколько выше, если смесь оставляли стоять
в течение 2 суток.
2. Большая часть вещества перегоняется при температуре
бани 100—120°. К°гда температура бани достигает 155—160°,
6-БРОМ-2-НАФТОЛ
115
смесь начинает разлагаться, причем происходит обильное выделе-
выделение белых паров.
3. Если не подвергнуть вещество тщательному фракциониро-
фракционированию, то оно будет содержать в качестве примеси некоторое
количество пиридина и через несколько дней начнет окраши-
окрашиваться. После тщательного фракционирования вещество остается
бесцветным в течение 2 месяцев и больше. В перегонной колбе
остается значительное количество темного вязкого остатка.
Другие методы получения
Бромистый тетрагидрофурфурил был получен с низкими вы-
выходами действием бромистоводородной кислоты или трехброми-
трехбромистого фосфора на соответствующий спирт1. Выход заметно возрас-
возрастает при применении трехбромистого фосфора и пиридина2'3.
Этот бромид был также получен действием едкого кали на
4,5-дибромпентанол-14.
1 D о х, Jones, J. Am. Chem. Soc, 50, 2033 A928).
2 P a u 1, Bull. soc. chim., D), 53, 417 A933).
3 Robinson, Smith, J. Chem. Soc., 1936, 195.
4 P a u 1, Ann. chim., A0), 18, 303 A932).
6-БРОМ-2-НАФТОЛ
C10H7OH + 2Br2 -> C]0H5 (OH) Br2 B,1,6) + 2HBr
C]0H5(OH)Br2+HBr + Sn -> ClcHe(OH)BrB,6) + SnBr2
Предложил: К- Кельш.
Проверили: В. Бахман и С. Кушнер.
Получение
В 3-литровую круглодонную колбу, снабженную капельной
воронкой и обратным холодильником (примечание 1), помещают
144 г A моль), р-нафтола и 400 мл ледяной уксусной кислоты.
Через капельную воронку к смеси прибавляют раствор 320 г
B моля) брома в 100 мл уксусной кислоты. В течение прибавления,
которое продолжается 15—30 мин., колбу осторожно встряхивают.
За это время f-нафтол растворяется с выделением тепла. К концу
прибавления смесь несколько охлаждают, чтобы избежать излиш-
излишней потери бромистого водорода. Затем к смеси прибавляют
100 мл воды и нагревают ее до кипения; после этого смесь охла-
охлаждают до 100°, прибавляют к ней 25 г моховидного олова (при-
(примечание 2) и продолжают кипячение до тех пор, пока металл
не растворится. Затем к смеси прибавляют вторую порцию олова
и растворяют ее при кипячении. Наконец, вводят третью порцию
8*
116
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
олова в количестве 100 г (всего 150 г, 1,27 грамматома). После
этого смесь кипятят в течение 3 час, затем охлаждают до 50° и
фильтруют с отсасыванием. Кристаллические соли олова, которые
при этом отделяются, промывают на воронке 100 мл холодной
уксусной кислоты и промывную жидкость прибавляют к основ-
основной порции фильтрата.
Этот раствор размешивают с 3 л холодной воды. Выпавший
в осадок 6-бром-2-нафтол отфильтровывают с отсасыванием, уда-
удаляют с воронки и промывают при перемешивании 1 л холодной
воды. Кристаллы вновь отфильтровывают и сушат при 100°.
Выход 6-бром-2-нафтола составляет 214—223 г (96—100% тео-
ретич.). Неочищенный препарат окрашен в яркорозовый цвет;
т. пл. 123—127°. Вещество содержит небольшое количество олова,
но является достаточно чистым для большинства целей.
Бесцветный препарат получают в результате перегонки сырого
вещества в вакууме с последующей перекристаллизацией.
Из 25 г неочищенного препарата после перегонки (примечание 3)
получают 20—24 г дестиллата с т. кип. 200—205° B0 мм), который
закристаллизовывается. После перекристаллизации вещества из
смеси 75 мл уксусной кислоты и 150 мл воды выход достигает
17,5—22,5 г. Чистый 6-бром-2-нафтол плавится при 127—129°.
Примечания
1. Значительные преимущества имеет прибор, сделанный цели-
целиком из стекла. При отсутствии такого прибора корковые пробки
обертывают свинцовой фольгой.
Рис. 12.
2. Чтобы прибавить олово, обратный холодильник отъединяют,
но держат наготове так, чтобы можно было быстро установить
его вновь. Первые две порции олова реагируют очень энергично,
З-БРОМ-4-ОКСИТОЛУОЛ
11/
и растворение металла сопровождается выделением водорода и
потерей некоторой части бромистого водорода.
3. Для перегонки применяют либо саблевидную колбу, либо
прибор, состоящий из двух колб, вторая из которых служит прием-
приемником1 (рис. 12).
Другие методы получения
6-Бром-2-нафтол был получен восстановлением 1,6-дибром-2-
нафтола иодистоводородной кислотой2, оловом и соляной кисло-
кислотой3 или хлористым оловом и соляной кислотой в водном или спир-
спиртовом растворе3 или в водном растворе уксусной кислоты4.
1 F i e s е г, Experiments in Organic Chemistry, Heath and Co., N. Y.,
1935, p. 246.
2 Armstrong, Chem. News, 74, 302 A897).
3Franzen, Staubel, J. prakt. Chem., B), 103, 369 A922);
F.ries, S с h i m m e 1 s с h m i d t, Ber., 58,2840A925).
4 Fries, Schimmelschmidt, Ann., 484, 293A930).
CH3
Вг
NH2
З-БРОМ-4-ОКСИТОЛУОЛ
B-Бром-п-крезол)
СН3
H2SOj
H2O
N2SO4H
СП я
Br
ОН
Предложили: X. Унгнаде и Э. Орволл.
Проверили: Ч. Аллеи и Л. Белл.
Получение
В 2-литровый стакан помещают 75 г @,4 моля) З-бром-4-амино-
толуола (примечание 1) и приливают к нему горячую разбавлен-
разбавленную кислоту, полученную прибавлением 72 мл концентрирован-
концентрированной серной кислоты к 200 мл воды. Прозрачный раствор пере-
перемешивают и охлаждают до 15°, после чего прибавляют к нему
180 г льда; обычно при этом выпадает в осадок сернокислая соль
амина. Как только температура раствора спустится ниже 5°, из
капельной воронки, ножка которой опущена в жидкость, к нему
прибавляют раствор 32,2 г @,47 моля) нитрита натрия в 88 мл
воды. Во время прибавления, которое занимает около 15 мин.,
температуру раствора поддерживают ниже 5°. После прибавления
118
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
всего нитрита натрия раствор перемешивают в течение 5 мин.,
а затем последовательно прибавляют к нему 300 г холодной воды,
3 г мочевины и 300 г колотого льда. Раствор сохраняют в бане
со льдом до применения.
К 1-литровой колбе Клайзена, снабженной капельной ворон-
воронкой и термометром, шарик которого погружен в жидкость,
присоединяют обращенный вниз холодильник, приспособленный
для отгонки. В колбу помещают 150 г безводного сернокислого
натрия, 200 г A08 мл) концентрированной серной кислоты
и 100 мл воды. Колбу нагревают на проволочной сетке и, под-
поддерживая температуру жидкости при 130—135°, прибавляют
к ней раствор соли диазония порциями по 25 мл, причем приба-
прибавление ведут с той же скоростью, с которой собирается дестиллат
(примечание 2). Когда эта операция закончится, к содержимому
колбы добавляют 200 мл воды порциями по 25 мл и продолжают
перегонку до тех пор, пока не будет собрано дополнительно
200 мл дестиллата. Вся перегонка занимает 3—3,5 часа.
Дестиллат обрабатывают двумя порциями эфира по 150 мл
и промывают соединенные вместе вытяжки последовательно 100мл
воды и 150 мл 10%-ного раствора двууглекислого натрия. Затем
для извлечения фенола из эфирного слоя последний взбалтывают
с 10%-ным раствором едкого натра, один раз с порцией в 200 мл
и два раза с порциями по 50 мл. Соединенные вместе щелочные
растворы подкисляют при охлаждении 100 мл концентрированной
соляной кислоты. При этом выделяется фенол, который экстра-
экстрагируют эфиром, одной порцией в 200 мл и двумя порциями
по 100 мл; соединенные вместе эфирные вытяжки промывают
100 мл воды и сушат над 50 г безводного сернокислого натрия.
Эфирный раствор фильтруют и эфир отгоняют на водяной бане.
Остаток, 65—72 г бурого масла (примечание 3), перегоняют
из колбы Клайзена со специальным боковым отводом (стр. 68);
температура кипения З-бром-4-окситолуола 102—104° B0 мм).
Выход составляет 60—69 г (80—Ч&% теоретич.; примечание 4).
Примечания
1. Применяется продажный З-бром-4-аминотолуол; его можно
также получить, как указано в «Синт. орг. преп.», сб. 1, стр. 102.
Использованный для данного синтеза препарат плавился при
12—13°.
2. Если раствор диазония прибавлялся слишком быстро и тем-
температура жидкости упала, то прибавление следует прервать до
тех пор, пока температура вновь не станет выше 130°.
3. Неочищенный препарат пригоден для большинства целей,
например, для превращения его в о-бром-п-метиланизол.
mpem-БУТИЛАТ АЛЮМИНИЯ
119
4. Эта методика была применена авторами синтеза также для
превращения ж-броманилина в ж-бромфенол с т. кип. 234—237°
G42 мм) [105—107° A1 мм)]. Выход составлял 66% теоретического
количества.
Другие методы получения
о-Бром-л-крезол был получен непосредственным бромирова-
нием л-крезола в растворе хлороформа1.2; бромированием сухого
натриевого производного л-крезола3; разложением сульфата
З-бром-4-аминотолуилдиазония4. Последний метод является общим
для получения таких фенолов5*6.
iVogt, Henninger, Ber., 15, 1081 A882).
2 Zincke, Wiederhold, Ann., 320, 202A902).
3 S с h a 1 1, Dralle, Ber., 17, 2530 A894).
'Cain, Norman, J. Chem. Soc, 89, 24 A906).
5 Kalle und Ко., герм. пат. 95339 [Frdl., 4, 124 A894—1897)].
•Niemann, Mead, Benson, J. Am. Chem. Soc, 63, 609 A941).
трет-ВУТИЛАТ АЛЮМИНИЯ
3(CH3KCOH + A1 -> A1[OC(CH3K]3
Предложили: У. Уэйн и Г. Адкинс.
Проверили: Н. Дрэйк, У. Соудер мл., и Р. Мозинго.
Получение
В 2-литровую круглодонную колбу с обратным холодильни-
холодильником, снабженным хлор кальциевой трубкой, помещают 64 г
B,37 грамматома) алюминиевых стружек, 200 г B54 мл, 2,7 моля)
сухого т/?ет-бутилового спирта и 5—10 г m/?em-бутилата алю-
алюминия (примечание 1). Смесь нагревают до кипения на паровой
бане, после чего прибавляют к ней около 0,4 г сулемы и колбу
энергично встряхивают (примечание 2). Нагревание продолжают,
причем цвет реакционной смеси постепенно меняется: прозрач-
прозрачный раствор становится молочным, а затем черным; происходит
выделение водорода. Когда смесь почернеет, нагревание пре-
прекращают.
Реакции предоставляют идти в течение 1 часа без нагревания,
а затем к содержимому колбы прибавляют дополнительно 244 г
C09 мл, 3,3 моля) сухого трет-бутилового спирта (общее коли-
количество составляет 6 молей) и 200 мл сухого бензола. После неболь-
небольшого нагревания реакция возобновляется и энергично продол-
продолжается уже без дальнейшей подачи тепла. Примерно через 2 часа
реакция замедляется, после чего смесь кипятят с обратным холо-
холодильником около 10 час.
120
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Бензол и не вошедший в реакцию т/?ет-бутиловый спирт отго-
отгоняют на паровой бане, причем последние их следы удаляют пере-
перегонкой в вакууме при 10—30 мм. К остатку прибавляют 1 л абсо-
абсолютного эфира и растворяют твердый mpem-бутилат алюминия,
для чего в течение короткого времени реакционную смесь нагре-
нагревают до кипения. По охлаждении к раствору прибавляют 35 мл
не абсолютного эфира и немедленно энергично встряхивают колбу
(примечание 3). После стояния в течение 2 час. раствор подвер-
подвергают центрифугированию в течение получаса для того, чтобы
отделить не вошедший в реакцию алюминий, гидроокись алюми-
алюминия и ртуть (примечание 4).
Растворитель отгоняют на паровой бане, а.последние следы
его удаляют в вакууме при 10—30 мм. К колбе присоединяют
хлоркальциевую трубку и содержимому колбы дают охладиться.
Препарат после измельчения его шпателем переносят в склянки
и герметически закрывают для предохранения от влаги. Выход
вещества, имеющего белую или сероватую окраску, составляет
394—418 г (80—85% теоретич.).
Примечания
1. В этом синтезе можно применять продажный mpem-бутило-
вый спирт, высушенный над окисью кальция. Чтобы удалить
следы воды, вместо т/?ет-бутилата алюминия можно взять изо-
пропилат или этилат алюминия1-2. Проверявшие синтез при-
применяли стружки, сделанные из алюминиевого литья, перепла-
переплавленного из старой кухонной посуды. В другой лаборатории
трет-бутилат алюминия был успешно получен из продажного
чистого алюминия (Л. Физер, сообщение). Проверявшим этот
синтез удалось получить значительно более высокий выход бути-
лата алюминия, исходя из чистого алюминия, чем при работе
с медно-алюминиевым сплавом.
2. Применение больших количеств сулемы затрудняет полу-
получение конечного препарата в неокрашенном состоянии. Эти за-
затруднения можно избежать, если заранее подвергнуть алюминий
амальгамированию3-4. Смесь встряхивают для того, чтобы равно-
равномерно распределить в ней сулему и тем самым способствовать
равномерному амальгамированию алюминия.
3. Небольшое количество воды, которое вводится вместе
с влажным эфиром, образует гидроокись алюминия, способ-
способствующую выпадению в осадок черного вещества, находящегося
во взвешенном состоянии. Процесс встряхивания является суще-
существенным для равномерного образования гидроокиси алюминия
во всей реакционной массе.
4. Центрифугирование можно осуществить в закупоренных
склянках емкостью по 250 мл при 2000 об/мин. После центрифуги-
тпрет-БУТИЛАДЕТАТ
121
рования раствор должен быть бесцветным или иметь светлобурую
окраску. Если раствор все же останется темным, необходимо при-
прибавить к нему еще одну порцию в 25 мл не абсолютного эфира
и повторить центрифугирование.
Другие методы получения
m/?em-Бутилат алюминия можно получить нагреванием с об-
обратным холодильником сухого трет-бутилового спирта с амаль-
амальгамированным алюминием1'5'6 или с алюминием и сулемой6.
Описанную методику разработали Адкинс и Кокс6. Приготовле-
Приготовление амальгамированного алюминия описано в литературе3.4.
Изопропилат алюминия можно получить из абсолютного изопро-
пилового спирта и алюминия1'2 по методике, приведенной для
получения этилата алюминия («Синт. орг. преп.», сб. 2, стр. 486,
примечание 2).
1 Т и щ е н к о, ЖРФХО, 31, 694 A899).
! Young, Hartung, Crossley, J. Am. Chem. Soc, 58,
100 A936).
3Wislicenus, Kaufman, Ber., 28, 1325 A895).
4 A d k i n s, J. Am. Chem. Soc, 44. 2175 A922).
5 Oppenauer, Rec. trav. chim., 56, 137 A937).
6 A d k i n s, Cox, J. Am. Chem. Soc, 60, 1151 A938).
отреот-БУТИЛАЦЕТАТ
(трет-Бутиловый эфир уксусной кислоты)
СПОСОБ ПОЛУЧЕНИЯ С ПРИМЕНЕНИЕМ УКСУСНОГО АНГИДРИДА
(СН3KСОН + (СН3СОJ О
СН3СО2С(СН3K + СН3СО2Н
Предложили: Р. Бекер и Ф. Бордвелл.
Проверили: Р. Шрайнер и Ф. Нейман.
Получение
В 1-литровую колбу, снабженную обратным холодильником,
защищенным хлор кальциевой трубкой, помещают 200 мл B,1 моля)
mpem-бутилового спирта (примечание 1), 200 мл B,1 моля) уксус-
уксусного ангидрида и 0,5 г безводного хлористого цинка. После тща-
тщательного взбалтывания смесь медленно нагревают до кипения,
поддерживают ее при слабом кипении в течение 2 час, а затем
охлаждают. Обратный холодильник заменяют елочным дефлег-
дефлегматором высотой 20 см и смесь перегоняют до тех пор, пока темпе-
температура не достигнет 110°. Неочищенный дестиллат, количество
которого составляет 200—250 г, промывают двумя порциями воды
но 50 мл , а затем 10%-ным раствором поташа порциями по 50 мл
до тех пор, пока реакция эфирного слоя на лакмус не станет
122
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
нейтральной; после этого препарат сушат над безводным поташом
(около 20 г).
Осушитель отделяют и mpem-бутилацетат подвергают фрак-
фракционированной перегонке, используя эффективную колонку (при-
(примечание 2). Головной погон B1—37 г) отбирают до темпера-
температуры 95°. Чистый эфир перегоняется между 95 и 96°. Выход
достигает 129—148 г E3—60% теоретич.; примечание 3).
Примечания
1. Для данного синтеза требуются чистые исходные материалы.
В случае отсутствия таковых mpem-бутиловый спирт сушат над
негашеной известью и перегоняют; уксусный ангидрид также пред-
предварительно перегоняют.
2. Пригодна, например, ректификационная колонка Стедмэна,
имеющая эффективность, равную 16 теоретическим тарелкам, или
колонка высотой 30 см (стр. 406) с насадкой из зерен карборунда.
3. В литературе для mpem-бутилацетата указывается темпе-
температура кипения 97,9° (исправл.I.
СПОСОБ ПОЛУЧЕНИЯ С ПРИМЕНЕНИЕМ ХЛОРИСТОГО АЦЕТИЛА
И ДИМЕТИЛАНШШНА
COH + CHaCOCl + CeHeN(CHa)a -» CHaCOaC(CH8)a + C,H5N(CH,)a.HCl
Предложили: Ч. Хаузер, Б. Худзон, мл., Б. Абрамович и Док. Шивере.
Проверили: Р. Шрайнер и Ф. Нейман.
Получение
В 2-литровую колбу, снабженную обратным холодильником,
мешалкой с ртутным затвором и капельной воронкой, помещают
147 мл A14 г, 1,5 моля) mpem-бутилового спирта (примечание 1),
212 мл B02 г, 1,67 моля) диметиланилина и 200 мл абсолютного
эфира. Раствор нагревают до кипения и приливают к нему при
перемешивании 113 мл A24 г, 1,58 моля) хлористого ацетила
с такой скоростью, чтобы поддерживать умеренное кипение после
того, как источник нагревания будет отставлен. После прибавле-
прибавления около двух третей всего количества хлористого ацетила
начинает кристаллизоваться хлористоводородная соль диметил-
диметиланилина и смесь очень бурно вскипает. Немедленно колбу погру-
погружают в баню со льдом, а когда кипение прекратится, прибавляют
к ее содержимому оставшееся количество ацетила, после чего
смесь нагревают в течение 1 часа на водяной бане. Затем смесь
охлаждают до комнатной температуры, прибавляют к ней около
200 мл воды и продолжают перемешивание до тех пор, пока твер-
mpem-БУТИЛАЦЕТАТ
123
дый осадок не растворится. Эфирный слой отделяют и экстраги-
экстрагируют 10%-ным раствором серной кислоты порциями по 50 мл
до тех пор, пока вытяжки не перестанут делаться мутными при
подщелачивании едким натром. После окончательного промыва-
промывания насыщенным раствором двууглекислого натрия B5 мл)
эфирный раствор сушат, взбалтывая его с 10 г безводного серно-
сернокислого натрия. Раствор декантируют и оставляют стоять в тече-
течение ночи над 10 г драйерита*. Затем раствор фильтруют и эфир
отгоняют, применяя эффективную колонку (примечание 2). Оста-*
ток подвергают дробной перегонке, в результате которой
получают ПО—119 г F3—68% теоретич.) mpem-бутилацетата
с т. кип. 95'—98° (примечание 2). Большая часть эфира кипит
при температуре 97,0—97,5° (примечание 3).
Примечания
1. Исходные вещества должны быть чистыми и безводными.
mpem-Бутиловый спирт следует высушить над негашеной изве-
известью, а диметиланилин—предварительно перегнать. Следует поль-
пользоваться чистым хлористым ацетилом.
2. Можно применять либо ректификационную колонку высо-
высотой 30 см с насадкой из зерен карборунда (стр. 406), либо колонку
Видмера той же высоты. Чистый mpem-бутилацетат собирают в
пределах 94,5—95,5°.
3. Авторы настоящего синтеза сообщают, что они получали
тем же способом следующие mpem-бутиловые эфиры:
а) трет-Бутиловый эфир пропионовой кислоты. Смесь 221 мл
A71 г, 2,31 моля) трет-бутилового спирта и 318 мл C03 г, 2,5 моля)
диметиланилина после прибавления к ней 206 мл B20 г, 2,38 моля)
хлористого пропионила. кипятили с обратным холодильником
в течение 3 час; в результате было получено 184гF1,4% теоретич.)
mpem-бутилового эфира пропионовой кислоты с т. кип. 117—
118,5°, причем большая часть вещества кипела при 118,0—118,5°.
б) трет-Бутиловый эфир изомасляной кислоты. Смесь 94,5 мл
G3,4 г, 0,99 моля) mpem-бутилового спирта и раствора 127 мл
A21 г, 1 моль) диметиланилина в 200 мл эфира после прибавления
к ней раствора 105 мл A08 г, 1 моль) хлорангидрида изомасляной
кислоты в 50 мл эфира была оставлена стоять в течение 15 час.
при комнатной температуре. После отгонки эфира и нагревания
остатка в течение 5 час. на водяной бане было получено 102 г
G1 % теоретич.) mpem-бутилового эфира изомасляной кислоты
с т. кип. 127—128,3°.
в) трет-Бутиловый эфир изовалериановой кислоты. Смесь
121,4 г A,64 моля) mpem-бутилового спирта и 198,5 г A,64 моля)
! См. примечание иа стр. 16.
124
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
диметиланилина после прибавления к ней 200,7 г A,66 моля)
хлорангидрида изовалериановой кислоты была оставлена стоять
в течение ночи. После отгонки эфира и нагревания остатка в тече-
течение 5 час. на водяной бане было получено 67,3 гB6% теоретич.)
mpem-бутилового эфира изовалериановой кислоты с т. кип.154—
157°.
г) трет-Бутиловый эфир коричной кислоты. Из 100г @,675 мо-
моля) коричной кислоты и 400 г C,37 моля) хлористого тионила был
получен хлорангидрид коричной кислоты; последним была обра-
обработана смесь 64 мл D9,5 г, 0,67 моля) mpem-бутилового спирта
и 90 мл (86,0 г, 0,71 моля) диметиланилина. Реакционную массу
кипятили в течение 12 час. с обратным холодильником, после
чего оставили ее стоять при комнатной температуре в течение
12 час. В результате перегонки смеси было получено 78,8 г
E8%теоретич.) mpem-бутилового эфира коричной кислоты
с т. кип. 144° (8 мм).
д) /прет-Бутиловый эфир хлоруксусной кислоты (предложил
Р. Бекер). К смеси 30,6 мл @,4 моля) хлорангидрида хлоруксус-
хлоруксусной кислоты и 50 мл @,4 моля) диметиланилина приливали в те-
течение 10 мин. 35,4 мл @,4 моля) mpem-бутилового спирта, следя
за тем, чтобы температура не поднималась выше 30°. Эта смесь
после стояния в течение 45 мин. при комнатной температуре была
вылита в воду и обработана обычным способом. mpem-Бутиловый
эфир хлоруксусной кислоты был перегнан с применением колонки
Видмера высотой 15 см. Выход составлял 38 г F3% теоретич.);
т. кип. 48—49° A1 мм); п% 1,4259—1,4260.
СПОСОБ ПОЛУЧЕНИЯ С ПРИМЕНЕНИЕМ ХЛОРИСТОГО АЦЕТИЛА 11 МАГНИЯ
2 (CHs)aCOH + 2СН3СОС1 + Mg -> 2СН3СООС (СН,K + MgCl2 + Н2
Предложил: А. Спасов.
Проверили: В. Бахман и Дж. Кормэн.
Получение
В 1-литровую круглодонную колбу помещают смесь 12 г
@,5 грамматома) магния в порошке, 37 г @,5 моля) трет-бутн-
лового спирта и 100 г абсолютного эфира (примечание 1). Горло
колбы снабжают рогатым форштоссом, в один отвод которого
вставляют обратный холодильник, а в другой — капельную воронку.
При взбалтывании смеси от руки прибавляют к ней по каплям
раствор 55 г @,7 моля) хлористого ацетила (примечание 2) в 50 г
абсолютного эфира (примечание 3). Постепенно начинается энер-
энергичная реакция с выделением водорода, который увлекает из смеси
npem-ВУТИЛАЦЕТАТ
125
пары эфира и небольшое количество хлористого водорода (при-
(примечание 4). После того как весь хлористый ацетил будет прибавлен,
реакционную смесь оставляют стоять в течение 1 часа в бане
с холодной водой (примечание 5), а затем в течение еще 1 часа при
комнатной температуре. После этого смесь нагревают в течение
получаса на водяной бане до 40—45°, чтобы завершить процесс.
Твердый продукт реакции охлаждают в ледяной воде и разла-
разлагают прибавлением охлажденного до 0° раствора 20 г поташа
в 250 мл воды при непрерывном охлаждении (примечание 6).
Смесь экстрагируют три раза эфиром порциями по 35 мл; эфир-
эфирные вытяжки сушат над хлористым кальцием и перегоняют
( примечание 7). Из фракции, кипящей при 85—98е, mpem-бутил-
ацетат получают дробной перегонкой с помощью эффективной
колонки (примечание 8). Выход очищенного вещества соста-
составляет 37—45 г D5—55% теоретич.); т. кип. 95—97° G40 мм).
Примечания
1. трет-Бутиловый спирт должен быть совершенно безвод-
безводным. Его сушат над натрием и перегоняют непосредственно перед
применением. Эфир также сушат над натрием.
2. Хлористый ацетил перед применением перегоняют.
3. Прибавление хлористого ацетила продолжается около 15 мин.
После прибавления примерно двух третей хлористого ацетила
реакционная смесь быстро становится полутвердой.
4. За течением процесса этерификации лучше всего следить
по выделению водорода, который отводят через трубку из верхней
части холодильника и пропускают через промывную склянку
с небольшим количеством воды. Умеренная скорость реакции
достигается большим или меньшим погружением реакционной
колбы в баню с холодной водой в течение всего времени прове-
проведения процесса.
5. Через полчаса реакция становится более бурной; при этом
смесь делается жиже.
6. Раствор поташа прибавляют в один прием. Выделяющийся
углекислый газ не служит препятствием при экстрагировании
mpem-бутилацетата.
7. Так как mpem-бутилацетат очень летуч, то эфир отгоняют,
применяя елочный дефлегматор высотой 60 см. По достижении 40°
перегонку прерывают и дефлегматор заменяют другим, высотой
40 см. Собирают фракции, кипящие до 85° и между 85 и 98°. Первую
фракцию, которая содержит значительное количество трет-бутил-
ацетата, подвергают повторной перегонке; собирают порцию,
кипящую выше 85°, и прибавляют ее ко второй фракции. Вес фрак-
фракции, кипящей между 85 и 98°, составляет 43—48 г.
126
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
8. Для этой перегонки применяют елочный дефлегматор или
колонку Видмера высотой 40 см. Головной погон вновь пере-
перегоняют из той же колбы.
Другие методы получения
mpem-Бутиловый эфир уксусной кислоты был получен из со-
соответствующего спирта и хлористого ацетила в присутствии
пиридина1, диметиланилина2 или магния; из соответствующего
спирта и уксусного ангидрида в присутствии безводного хло-
хлористого цинка2, небольшого количества цинковой пыли2 или
безводного уксуснокислого натрия3. Приведенные выше методы
основаны на указаниях, которые опубликовали Норрис и
Ригби2.
"Bryant, Smith, J. Am. Chem. Soc, 58, 1016 A936).
'Norris, Rigby, J. Am. Chem. Soc, 54, 2097 A932).
3Тронов, Сибгатуллин, Ber., 62, 2850 A929).
я-БУТИЛБЕНЗОЛ
:4Н„Вг -» «-С4Н8С5Н6 + 2NaBr
Предложили: Р. Рид, Л. Фостер, А. Расселл и В. Симрил.
Проверили: Ч. Аллен и Дж. ВанАллан.
Получение
Сухую 3-литровую трехгорлую круглодонную колбу (приме-
(примечания 1 и 2) снабжают защищенным хлор кальциевой трубкой
эффективным обратным холодильником (примечание 3), капель-
капельной воронкой и термометром, шарик которого должен быть погру-
погружен в реакционную смесь (примечание 4); колбу устанавливают
так, чтобы ее можно было охлаждать снаружи (примечание 5).
В колбу помещают 161 г G грамматомов) натрия, нарезанного
в виде стружек толщиной 1—2 мм (примечания 6 и 7), и приливают
к нему абсолютный эфир в таком количестве, чтобы последний
едва покрывал натрий (около 300 мл\ примечание 8). Затем
в течение 2,5 часа через капельную воронку к содержимому
колбы медленно прибавляют смесь 411 г C21 мл, 3 моля) бро-
бромистого «-бутила и 471 г C15 мл, 3 моля) бромбензола (при-
(примечание 9), причем температуру в колбе поддерживают по
возможности ближе к 20°; вся масса окрашивается в голубоватый
цвет.
Колбу оставляют стоять в течение 2 дней при комнатной
температуре, время от времени взбалтывая ее содержимое, после
и-БУТИЛЕЕНЗОЛ
127
чего жидкость декантируют (примечание 10). Затем к смеси осто-
осторожно приливают 300 мл метилового спирта и кипятят ее с1 обрат-
обратным холодильником в течение 4 час. на паровой бане. После этого
к смеси прибавляют 800 мл воды, чтобы растворить соль, угле-
углеводородный слой отделяют и прибавляют его к декантированной
жидкости. Водный слой экстрагируют один раз 250 мл эфира
(примечание 11), после чего углеводородную часть, декантирован-
декантированный раствор и эфирные вытяжки соединяют вместе и сушат над
40 г хлористого кальция. Большую часть эфира отгоняют на паро-
паровой бане, а остаток перегоняют, пользуясь колонкой с рубашкой
и электрообогревом (примечание 12). Собирают фракцию с т. кип.
180—182,5° G50 мм), которая и представляет собой я-бутилбензол
(примечания 13 и 14); выход составляет 261—281 г F5—70%
теоретич.; примечание 15).
Примечания
1. Размер кусочков натрия, регулирование температуры и при-
применение ректификационной колонки с рубашкой и электрообо-
электрообогревом являются важными факторами для успешного проведения
данного синтеза.
2. Медные колбы и холодильник более безопасны, так как
исключается возможность их поломок, однако применение этой
аппаратуры необязательно, а при использовании указанных коли-
количеств и менее удобно.
3. Если реакция протекает нормально, то функция холодиль-
холодильника состоит лишь в том, чтобы предотвращать потери эфира.
Однако если температура поднимется выше 30°, то реакция ста-
становится бурной и с помощью одного только холодильника регу-
регулировать ее делается невозможно.
4. Рекомендуется использовать термометр, шкала которого
находилась бы значительно выше поверхности реакционной
смеси; пригоден термометр с делениями от —50 до +50°.
5. Температуру необходимо регулировать в узких пределах.
Ниже 15° реакция идет чрезвычайно вяло, однако через некоторое
время она неожиданно становится бурной, в результате чего часть
реагентов выбрасывается через холодильник. При температуре
выше 30° реакция не поддается регулированию (см. приме-
примечание 3).
6. Приготовление натрия является весьма неприятной зада-
задачей. Лучше всего разрешить ее следующим образом: обыкновен-
обыкновенный брусок натрия расплющивают молотком и режут сплющенные
полоски ножницами. Можно также натрий в виде кусков весом
по 500 г раскатать тяжелым катком, применяемым для устройства
теннисных площадок (Рид и Фостер).
128
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
7. Если натрий нарезан слишком крупными кусками, то боль-
большая часть его не вступит в реакцию, если же применить распы-
распыленный натрий, то реакция будет протекать весьма бурно, однако
выход синтезируемого вещества получится низким.
8. Для опытов с большими количествами исходных веществ
требуется больше эфира. Эфир можно применять непосредственно
после того, как он был высушен над хлористым кальцием.
9. Бромистый «-бутил и бромбензол можно предварительно
не перегонять.
10. Рид и Фостер советуют экстрагировать остаток бензолом,
применяя аппарат Сокслета.
11. Хотя эта вытяжка содержит не более 2—3 г углеводорода,
экстрагирование эфиром облегчает последующее высушивание
и снижает потери вследствие иногда наблюдающегося плохого
разделения слоев.
12. Необходимым является применение таких колонок, как,
например, колонки типа Уитмора—Люкса или Фенске (стр. 90,
рис. 9) с электрически обогреваемой рубашкой.
13. Можно также собрать фракцию сырого препарата с т. кип.
160—185°; при вторичной перегонке собирают вещество с т. кип.
181 —184е (Рид и Фостер).
14. Вес головного погона составляет около 45 г. Остаток пред-
представляет собой главным образом дифенил. Можно дополнительно
получить небольшое количество бромбензола, если соединить
вместе эти фракции от нескольких опытов и повторно подвергнуть
их дробной перегонке.
15. Если отказаться от применения колонки с обогреваемой
рубашкой, то выход упадет до 221 г E4% теоретич.).
Другие методы получения
н-Бутилбензол был получен действием натрия на хлористый
или бромистый бензил и бромистый «-пропил без применения
разбавителей1; действием натрия на бромистый «-бутил и бром-
бензол как без растворителя2, так и в растворе бензола3; восста-
восстановлением по Клемменсену «-бутирофенона4 (пропилфенил-
кетона); действием хлористого бензилмагния на «-пропиловый
эфир п-толуолсульфокислотыв. Остальные методы получения
н-бутилбензола, повидимому, не имеют препаративного зна-
значения.
1 Radzi szewski, Ber., 9, 261 A876).
8 Read, Foster, J. Am. Chem. Soc, 48, 1606 A926).
3 В a 1 b i a n o, Ber., 10, 296 A877); Gazz. chim. ital., 7, 343 A877).
4Clemmenseri, Ber., 46, 1839 A913).
5Gilman, Beaber, J. Am. Chem. Soc, 47, 523 A925).
1-Н-ЕУТИЛГШРРОЛИДИН
129
1-и-БУТИЛПИРРОЛИДИН
(N-н-Бутилпирролидин)
cii> h2so4 СИ
(h-C4H9JNH > (h-C4H9JNC1 > j .
CHjCHa^
!\л
— С,Н9-я
Предложили: Дж. Кольмзн, Г. Иикольс и Т. Мартене.
Проверили: Ч. Аллен и Дж. Ван Аллан.
Получение
Этот синтез от начала до конца, включая процесс циклиза-
циклизации, необходимо проводить без перерывов.
Прибор собирают так, как показано на рис. 13. В склянку
емкостью 1 500 мл помещают 64,5 г @,5 моля) ди-«-бутиламина\
К баллону с хлором
Манометр Предохранительная Реакционный сосуд,
склянка баня со льдом и водой
Рис. 13.
350 мл легкого бензина (примечание 1) и 350мл 3 н. раствора едкого
натра (примечание 2). Склянку закрывают пробкой, в которую вста-
вставлена трубка для ввода газа, выступающая за нижнюю поверх-
поверхность пробки на 25 мм. Смесь охлаждают в бане со льдом (приме-
СОорнш; 3
130
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
чание 3) и пропускают в нее под давлением хлор из баллона
(примечание 4). Склянку продолжают держать в бане со льдом
и во время пропускания хлора встряхивают ее, что способ-
способствует поглощению газа. Скорость встряхивания и положение
вентиля баллона с хлором регулируют таким образом, чтобы
поддерживать давление, показываемое манометром, между 100
и 150 мм (примечание 5). Пропускание хлора продолжают до тех
пор, пока не исчезнут белые пары хлористоводородной соли
амина, которая образуется при соприкосновении хлора с парами
амина, и пока органический слой не окрасится в зеленовато-
желтый цвет за счет небольшого избытка хлора. Это служит при-
признаком того, что хлорирование закончено (примечание 6).
Бензиновый раствор хлорамина отделяют от водного слоя
в охлажденной 1-литровой делительной воронке с короткой
ножкой и промывают последовательно 50 мл охлажденного до 0°
3 н. раствора едкого натра (примечание 7), 50 мл ледяной воды
и 50 мл холодного 2 н. раствора серной кислоты. Бензиновый рас-
раствор становится почти бесцветным. Хлорамин извлекают из рас-
раствора с помощью серной кислоты следующим образом. Смесь
200 мл концентрированной серной кислоты (уд. вес 1,84) и 80 мл
воды охлаждают до 0° и оставляют стоять в соприкосновении
с бензиновым раствором в течение 10 мин. без взбалтывания,
а затем в течение еще 20 мин., взбалтывая ее время от времени;
содержимое реакционного сосуда поддерживают в холодном со-
состоянии, погружая сосуд в баню со льдом. После отделения кис-
кислотного слоя бензин экстрагируют двумя порциями холодной
концентрированной серной кислоты по 60 мл. Соединенные
вместе сернокислотные вытяжки используют в реакции цикли-
циклизации (примечание 8). Бензин, который содержит лишь следы
хлорамина, отбрасывают.
Широкогорлую коническую колбу емкостью 1 л, снабженную
мешалкой пропеллерного типа и термометром, устанавливают
в масляной бане. В колбу помещают смесь 40 мл концентрирован-
концентрированной серной кислоты и 10 'мл воды, масляную баню нагревают
до 120° и холодный раствор хлорамина в серной кислоте прили-
приливают через делительную воронку с короткой ножкой к нагретой
кислоте (примечание 9). Прибавление занимает 30—40 мин.
(примечание 10); его ведут с такой скоростью, чтобы сперва тем-
температура реакционной смеси в колбе при прибавлении холодного
раствора хлорамина быстро упала бы со 120 до 95°, а затем дер-
держалась бы в пределах 90—100° (лучше около 95°). Реакция эта
экзотермична, и повышение температуры смеси регулируют при-
прибавлением холодного раствора хлорамина. Чтобы избежать
чрезмерного разогревания после прибавления последней порцни
хлорамина, масляную баню отставляют и содержимому колбы
дают охладиться до комнатной температуры.
1-к-ВУТИЛПИРРОЛИДИН
131
Колбу емкостью 5 л, снабженную делительной воронкой,
приспособляют для перегонки с водяным паром (стр. 68, рис. 6).
Колбу на две пятых ее объема заполняют измельченным льдом и
медленно прибавляют к нему сернокислотный раствор, охлажден-
охлажденный до 0°. Затем к смеси прибавляют через делительную воронку
холодный концентрированный раствор едкого натра F50 г едкого
натра в 1 500 мл воды), выделяя тем самым амины в свободном со-
состоянии (примечание 11). Амины отгоняют с водяным паром;
дестиллат собирают в приемник, содержащий раствор 100 мл
концентрированной соляной кислоты (уд. вес 1,19) в 200 мл воды
(примечание 12). Перегонку продолжают до тех пор, пока пол-
полностью не отгонятся амины, на что указывает отрицательная
проба на лакмусовую бумажку. Обычно отгоняется около 2 л
дестиллата.
Раствор хлористоводородных солей аминов выпаривают на па-
паровой бане почти досуха (примечание 13) и остаток вместе с 300 мл
воды переносят в 1-литровую трехгорлую колбу, снабженную
мешалкой («Синт. орг. преп.», сб. 1, стр. 116, рис. 5), делитель-
делительной воронкой и холодильником. Пускают в ход мешалку, раствор
кислоты охлаждают до 0°, погружая колбу в баню со льдом,
и выделяют амины в свободном состоянии, медленно прибавляя
к содержимому колбы раствор 100 г едкого натра в 250 мл воды.
Отделение по методу Хинсберга. Полученный раствор охла-
охлаждают до 5—8°, прибавляют к нему 23 г хлорангидрида бензол-
сульфокислоты2 и в течение получаса энергично перемешивают
смесь. Затем делительную воронку заменяют пробкой, в которую
вставлен термометр; содержимое колбы нагревают до 40° и пере-
перемешивают до тех пор, пока не исчезнет запах сульфохлорида.
Это обычно занимает около получаса. 1-н-Бутилпирролидин от-
отделяют (примечание 14) от нелетучего ди-н-бутилбепзосульфамида
перегонкой с водяным паром, причем амин собирают, как и ранее,
в приемник, содержащий разбавленную кислоту (примечание 12).
После этого кислый раствор выпаривают досуха и амин вы-
выделяют в свободном состоянии, прибавляя 20%-ный раствор ед-
едкого натра до тех пор, пока водный слой не будет окрашивать
в синий цвет красную лакмусовую бумажку. Амин экстрагируют
один раз порцией эфира в 200 мл и эфирный раствор сушат над
15—20 зернами едкого кали. Раствор декантируют, эфир отго-
отгоняют и остаток перегоняют на масляной бане. Выход 1-н-бутил-
пирролидина составляет 44—51 г G0—80% теоретич.); т. кип.
154—155° G58 мм); пЩ 1,437 (примечание 15).
Примечания
1. Можно воспользоваться любой нефтяной фракцией с темпе-
температурой кипения, лежащей в пределах 60—90°.
132
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
2. Указанный раствор получают из 42 г едкого натра и 350 мл
воды.
3. Вся посуда, все растворы, в том числе и раствор хлорамина,
должны быть охлаждены до 0°, чтобы предотвратить разложение
хлорамина во время синтеза. Прибор можно держать в холодиль-
холодильном шкафу.
4. Как только будет начато пропускание хлора, на короткий
момент открывают пробку реакционной склянки, чтобы хлор
вытеснил из системы большую часть воздуха.
5. Когда хлор начинает поступать в сосуд, давление быстро
повышается. Взбалтывание в значительной степени увеличивает
скорость поглощения хлора, и давление падает. Затем вентиль
баллона с газом регулируют таким образом, чтобы поддер-
поддерживать необходимое давление при взбалтывании. Наиболее под-
подходящим было найдено давление в 100 мм, гак как хлориро-
хлорирование в этих условиях происходит с удовлетворительной ско-
скоростью.
6. Большой избыток хлора нежелателен и может вызвать
значительное уменьшение выхода. Необходимая продолжитель-
продолжительность пропускания газа меняется в широких пределах и зависит
от величины поддерживаемого давления хлора и от интенсивности
взбалтывания. Проверявшие синтез пришли к выводу, что в усло-
условиях опыта вполне достаточно пропускать газ в течение 20 мин.;
авторы синтеза указывают, что реакция продолжается в течение
60—90 мин.
7. Если в результате одного промывания не удается освобо-
освободить раствор от зеленой окраски, вызванной избытком хлора,
то эту операцию надо повторить столько раз, сколько по-
потребуется.
8. Сернокислотные вытяжки переносят непосредственно в де-
делительную воронку с короткой ножкой емкостью 500 мл, чтобы
использовать их в следующей стадии. Раствор, который обычно
бывает светлобурого цвета, до его применения в реакции цикли-
циклизации должен быть охлажден и хорошо перемешан. Большое
значение имеет отношение количества кислоты к количеству воды.
Кислоту и воду следует брать именно в указанных выше коли-
количествах.
9. Воронку с ее содержимым во время прибавления можно
укрепить над реакционной колбой и более не охлаждать.
10. Прибавление следует проводить с максимальной быстротой,
однако так, чтобы поддерживалась необходимая температура.
Отклонение температуры смеси более чем на 5° от оптимальной
величины (95°) влечет за собой уменьшение выхода.
11. Указанная реакция протекает бурно, а потому раствор
щелочи следует прибавлять медленно, в то же время осторожно
взбалтывая колбу кругообразным движением.
1 -н-БУТИЛПИРГОЛИДИП
133
12. Нижний конец аллонжа (стеклянная трубка, присоеди-
присоединенная к холодильнику с помощью резиновой трубки) должен
быть погружен в кислоту, налитую в приемник. Чтобы умень-
уменьшить выделение паров, поверхность раствора кислоты защищают
слоем бензина в 3—4 мм. Время от времени раствор кислоты
можно перемешивать.
13. Применение вакуума значительно сокращает время, необ-
необходимое для выпаривания.
14. Для отделения амина от сульфамида можно также извлечь
оба вещества эфиром, раствор высушить над твердым едким кали
и подвергнуть фракционированию. Пирролидин перегоняется
легко, но выход его при таком способе получается несколько
ниже.
15. Пользуясь описанным общим методом, можно получить
и некоторые другие пирролидины того же ряда. Температура,
необходимая для циклизации, и выход (в процентах) бывают
различными в зависимости от применяемых аминов. Ниже приве-
приведены температуры, при которых происходит циклизация N-хлоро-
производных перечисленных аминов. При получении более низко-
кипящих пирролидинов неполное отделение от эфира может при-
привести к снижению выхода.
Получаемый пирролидгш
1-Метилпирролидин
1-Этилпирррлидип
1-н-Пропилпирролидин
1,2-Диметилпирролидин
1-Этил-2-ыетилпирролидин
1-Метил-2-я-бутилпирролидин
Амин
Метил-«-бутиламин
Этил-я-бутиламин
я-Пропил-я-бутиламин
Метил-я-амиламин
Этил-к-амиламин
Метил-«-октиламин
Оптимальная
температура,
СС
100—110
.110-115
80-85
90—100
80—90
60—70
Другие методы получения
1-н-Бутилпирролидин можно также получить нагреванием
соответствующего N-бромамина в концентрированной серной
кислоте3 и; каталитическим восстановлением N-бутилпиррола4.
Приведенная выше методика заимствована из опубликованной
работы5, в которой, однако, синтез описан с меньшими подроб-
подробностями.
1 В л и е, Синт. орг. преп., сб. 1, стр. 180., примечание 2.
2 А д а м с, М а р в е л, Синт. орг. преп., сб. 1, стр. 467.
3 В г i t t о п, ам. пат. 1607605 [С. А., 21, 249 A927)].
4 О с h i a i, T s u d e, Y о k о у a m a, Ber., 68, 2293 A935).
5Coleman, Goheen, J. Am. Chem. Soc, 60, 730 A938).
134
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
он
NOa
о-к-БУТОКСИ Н ИТРОБЕНЗОЛ
(Бутил-о-нитрофениловый эфир)
ОСН2СН,СН2СН3
A/N°;
+ СН3СН2СН2СН2Вг+ К2СО3 -> +КВг+ КНСО3
Предложили: Ч. Аллен и Дж. Гейтс мл.
Проверили: В. Бахман и Дж. Джонсон.
Получение
В 1-литровую круглодонную колбу помещают 28 г @,2 моля)
о-нитрофенола (примечание 1), ЗОг @,22 моля) бромистого н-бути-
ла, 28г @,2 моля) безводного поташа и 200 мл сухого ацетона и ки-
кипятят эту смесь с обратным холодильником на паровой бане в те-
течение 2 суток (примечание 2). К концу этого времени ацетон отго-
отгоняют; к остатку прибавляют 200 мл воды и препарат экстрагируют
двумя порциями бензола по 100 мл. Соединенные вместе бензоль-
бензольные вытяжки промывают тремя порциями 10%-ного раствора
едкого натра по 100 мл, бензол отгоняют при атмосферном давле-
давлении, а оставшееся масло перегоняют в вакууме. Выход препарата
с т. кип. 118—-121° A мм) (примечание 3) составляет 29—31 г
G5—80% теоретич.; примечания 4 и 5).
Примечания
1. Был применен технический о-нитрофенол; при работе
с чистым реагентом выход не возрастает. Вместо бромистого
«-бутила можно взять соответствующее количество C6,8 г) йоди-
йодистого «-бутила, причем выход не изменяется.
2. При проверке синтеза в течение первых 1,5 часа колбу время
от времени встряхивали, чтобы предотвратить образование комков.
3. Температура кипения при других давлениях: 126—129°
B мм) и 171—172° A9 мм).
4. Другие нитрофениловые эфиры также можно получить по
описанному способу и примерно с такими же выходами. При
увеличении количества исходных реагентов до 2 молей выход
увеличился до 85—90%. Для гексильных производных продол-
продолжительность реакции составляет 72 часа.
Ниже приведены температуры кипения некоторых эфиров,
полученных по данному методу.
dl-ВАЛИН
135
АлкоксинитроОензол
л<-к-Бутоксинитробензол
л-«-Бу токсин итробензол
л-Изопропоксииитробензол
о-«Тексоксииитробензол
п-«-Гексоксинитробензол
Т. кип.
120-124° ( 2 мм)
150—154° ( 5 » )
283—286° G60 » )
145—148° ( 1 )> )
170—174° ( 5 » )
5. При восстановлении алкоксинитробензолов в спиртовом
растворе в присутствии никеля Ренея в качестве катализатора
легко могут быть получены алкоксианилины (стр. 66). Темпера-
Температуры кипения некоторых из них приведены ниже.
Алкоксиапилия
м-н- Бутоксианилин
л-«-Бутоксианилин
л-Изопропоксианилин
л-«Тексоксианилин
Т. кип.
120—124° ( 2 мм)
135—138° ( 5 » )
145-147° B0 » )
155—158° ( 5 » )
Другие методы получения
Настоящий метод, при использовании которого отпадает необ-
необходимость в получении фенолятов, имеет общее значение. Впервые
его применил Клайзен1 для синтеза аллиловых эфиров. В литера-
литературе описано также получение этим способом о-«-бутоксинитро-
беизола2. ля-Нитро- и тг-нитробутоксибензолы были получены
алкилированием фенолятов8-4. Соответствующие амины были
получены восстановлением нитросоединений железом и водой2,
а также хлористым оловом и соляной кислотой4.
1 С 1 a i s e n, E i s I e b, Ann., 401, 39,59A913).
2 L i, Adams, J. Am. Chern. Soc, 57, 1567 A935).
8 Hodgson, Clay, J. Chem. Soc, 1933, 661.
4 G u t e k u n s t, Gray, J. Am. Chem. Soc, 44, 1742 A922).
сМ-ВАЛИН
(а-Аминоизовалериановая кислота)
(СН3JСНСН2СО2н + Вг2
(CH3JCHCHBrCO2H + 2NH3
РС1з
(СН3JСНСНВгСО2Н + НВг
(СН3JСНСН (NH2) CO2H + NH4Br
Предложил: К- Марвел.
Проверили: Ч. Аллен и Дж. ВанАллан.
Получение
а-Бромизовалериановая кислота. В 3-литровую круглодонную
колбу помещают 1 кг продажной изовалериановой кислоты
136 СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
(с 1 молекулой воды) и 500 мл бензола. Воду и бензол отгоняют,
используя небольшой дефлегматор, до тех пор, пока температура
паров не достигнет 100°. После удаления бензола температура
быстро поднимается. Остаток охлаждают и 878 г (934 мл, 8,6 моля)
его помещают в 3-литровую круглодонную колбу, снабженную
длинным обратным холодильником. Верхнюю часть холодиль-
холодильника соединяют с помощью стеклянной трубки с пустой кониче-
конической колбой емкостью 500 мл, которая служит предохранитель-
предохранительной склянкой. Вторая трубка соединяет коническую колбу с ло-
ловушкой для поглощения газов (примечание 1). К кислоте при-
прибавляют I 500 г D80 мл) сухого брома (примечание 2), а затем
через верхнюю часть холодильника — 15 мл треххлористого
фосфора.
Смесь нагревают на масляной бане до 70—80° в течение 10—20
час. или до тех пор, пока в холодильнике не будут более за-
заметны тёмнокрасные пары брома. После этого к смеси приба-
прибавляют вторую порцию брома B5 мл) и колбу снова нагревают.
Когда окраска в холодильнике опять исчезнет, температуру бани
медленно повышают до 100—1053 и поддерживают ее на этом
уровне в течение 1,5—2 час.
Неочищенную бромзамещенную кислоту помещают в 2-лит-
2-литровую специальную колбу Клайзена и перегоняют в ва-
вакууме.
Низкокипящая фракция представляет собой главным образом
непробромированную кислоту (примечание 3). Собирают фракцию
с т. кип. ПО—125° A5 мм). Выход ее составляет 1 364—1 380 г
(87,5—88,6% теоретич.).
dl-Валин. К 2 л технического водного аммиака (уд. вес 0,90)
в 3-литровой круглодонной колбе прибавляют 330 г A,82 моля)
о-бромизова,лериановой кислоты. Колбу закрывают пробкой,
укрепляя ее проволокой, и оставляют стоять в течение недели
при комнатной температуре. Содержимое трех таких колб со-
соединяют вместе в одной 12-литровой колбе и аммиак удаляют,
нагревая колбу на паровом нагревателе в течение ночи. Затем
раствор упаривают в вакууме водоструйного насоса до тех
пор, пока не получится не особенно густая пастообразная масса
(около 800 мл; примечание 4). Твердый осадок отфильтровывают
и сушат. Количество его составляет 470 г. Препарат перс-
кристаллизовывают, для чего растворяют его в 2 400 мл воды
при нагревании до 95' на паровом нагревателе, раствор кипя-
кипятят в течение получаса с 10 г активированного березового
угля и фильтруют в горячем состоянии. К фильтрату при-
прибавляют равный объем 95%-ного спирта и охлаждают раствор
в течение ночи в холодильном шкафу. Валин отфильтровывают
и промывают 150 мл холодного абсолютного спирта. Выход со-
составляет 200—235 г. Для выделения второй порции вещества
(Н-ВАЛИН
137
фильтрат, полученный от перекристаллизации, выпаривают в ва-
вакууме водоструйного насоса до начала образования кристал-
•лов, прибавляют к нему равный объем 95%-ного спирта и охла-
охлаждают, как было указано выше. Выход полученной таким образом
аминокислоты составляет 34 г.
Второй фильтрат, полученный от перекристаллизации, и филь-
фильтрат, полученный после первоначального упаривания, соединяют
вместе, выпаривают досуха и экстрагируют 500 мл ледяной уксус-
уксусной кислоты на паровом нагревателе. Неорганические соли от-
отфильтровывают и уксусную кислоту отгоняют в вакууме. К остатку
прибавляют 1 л воды, которую также отгоняют в вакууме. Эту
операцию повторяют еще один раз. Для проведения указанных
трех перегонок требуется 1 день. Остаток растворяют в минималь-
минимальном количестве горячей воды (около 300 мл), раствор обрабаты-
обрабатывают активированным березовым углем, как это было описано
выше, и фильтруют в горячем состоянии. К фильтрату прибавляют
равный объем 95%-ного спирта и охлаждают раствор в течение
ночи в холодильном шкафу. Выход полученного валина состав-
составляет 34 г. Можно выделить дополнительно 8 г вещества из ма-
маточного раствора, который выпаривают и разбавляют спиртом,
так же как и в случае первоначального маточного раствора.
Общий выход валина составляет 300—311 г D7—48% теоретич.).
В запаянном капилляре валин разлагается при 280—282° (при-
(примечания 5.и 6).
Примечания
1. Бромистый водород можно поглощать водой, в результате
чего образуется бромистоводородная кислота с постоянной темпе-
температурой кипения («Синт. орг. прсп.», сб. 1, стр. 109).
2. Для того чтобы высушить бром, его взбалтывают с 1 л кон-
концентрированной серной кислоты.
3. Низкокипящую фракцию E6—80 г) можно присоединить
к последующей порции изовалсриановой кислоты и подвергнуть
бромированию; можно также собрать несколько таких фракций
и бромировать их вместе. В этом последнем случае берут только
три пятых, того количества брома, которое было взято в первом
опыте.
4. В перегонной колбе останется пастообразная масса после
того, как будет собрано 1 850—1 950 мл дестиллата E час).
5. Количества отдельных фракций, приведенные здесь, толь-
только приблизительны. Если выделение вещества было непол-
неполным, то температура плавления препарата окажется равной
275—280°.
6. Полученный таким образом валин содержит вычисленное
количество азота.
138
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ВИНИЛУКСУСНАЯ КИСЛОТА
139
Другие методы получения
Валин был получен действием спиртового раствора аммиак
на а-хлоризовалериановую кислоту1; действием водного аммиак
на а-бромизовалериановую кислоту2; действием аммиака и угле-
углекислого аммония на а-бромизовалериановую кислоту3; нагре-
нагреванием моноазида изопропилмалоновой кислоты с последующ^
гидролизом4; действием аммиака и цианистого водорода на изо-
масляный альдегид с последующим гидролизом6. а-Бромизовале-
риановая кислота была получена несколькими способами, как
это описано в «Синт. орг. преп.», сб. 2, стр. 107.
1 Schlebusch, Ann., 141, 326 A867).
2 С 1 а г k, F i t t i g, Ann., 139, 202 A866);
S а с h t 1 e b e n, там же, 193, 105 A878).
3 S 1 i m m e r, Ber., 35, 401 A902).
4 С u r t i u s, J. prakt. Chem., 125, 228 A930).
5 L i p p, Ann., 205, 18 A880).
Schmidt,
ВИНИЛУКСУСНАЯ КИСЛОТА
(З-Бутеновая кислота)
2 = CHCH2CN + 2H2O-f HCl -^ CHa=CHCH2CO2H
NH4C1
Предложил: Э. Ритц.
Проверили: Ч. Аллен и Док. ВанАллан.
Получение
В колбу емкостью 500 мл, соединенную с обратным холодиль-
холодильником, помещают смесь 67 г A04 мл, 1 моль) цианистого аллила1
(примечание 1) и 100 мл A,2 моля) концентрированной соляной
кислоты (уд. вес 1,19). Смесь нагревают на небольшом пламени
горелки и часто взбалтывают. Реакция начинается через 7—8 мин.;
при этом выпадает объемистый осадок хлористого аммония, темпе-
температура быстро повышается и смесь закипает. Через 15 мин. горелку
отставляют, приливают к смеси 100 мл воды и верхний слой,
представляющий собой кислоту, отделяют (примечание 2). Вод-
Водный слой экстрагируют двумя порциями эфира по 100 мл. Эфир-
Эфирные вытяжки и кислоту соединяют вместе и перегоняют. Большую
часть эфира отгоняют при атмосферном давлении (примечания 3—5),
а оставшийся эфир перегоняется в постепенно возрастающем
вакууме. После головного погона, который составляет около 40 г,
отгоняется кислота, которую собирают при 70—72° (9 мм). Выход
неочищенного вещества составляет 50—53 г E2—62% теоретич.;
примечание 5).
Хотя препарат достаточно чист для большинства целей, он
содержит небольшие количества побочных продуктов, которые
нельзя удалить перегонкой. Дальнейшую очистку вещества можно
произвести следующим образом. В трехгорлой круглодонной
колбе емкостью 250 мл, снабженной мешалкой, небольшой капель-
капельной воронкой и термометром для измерения низких температур,
растворяют 24 г едкого натра в 80 мл воды. Поддерживая темпера-
температуру раствора путем охлаждения извне в пределах 8—15°, к нему
в течение 25 мин. прибавляют 45 г D0,5 мл) неочищенной винил-
уксусной кислоты. Полученный раствор переносят в коническую
делительную воронку емкостью 600 мл и экстрагируют 50 мл хло-
хлороформа (примечания 6 и 7). Щелочной раствор немедленно перено-
переносят в 1-литровый стакан и при перемешивании прибавляют к нему
300 мл разбавленной серной кислоты (примечания 8 и 9). Кислый
раствор сразу же экстрагируют тремя порциями хлороформа
по 100 мл (примечания 7 и 10). Растворитель отгоняют сперва
при атмосферном давлении, а затем в вакууме из специальной
колбы Клайзена («Синт. орг. преп.», сб. 1, стр. 142, рис. 8)
емкостью 200 мл. Остаток перегоняют в вакууме. Почти вся полу-
полученная кислота перегоняется при 69—70° A2 мм) [163° G60 мм)].
Выход после перекристаллизации составляет 30—33 г G5—82%;
примечание 11).
Примечания
1. Улучшенный способ получения цианистого аллила (нитрила
3-бутеновой кислоты) состоит в следующем. В сухую (промытую
абсолютным спиртом и абсолютным эфиром) трехгорлую колбу
емкостью 500 мл, снабженную механической мешалкой (стр. 225)
и шариковым холодильником высотой 90 см, установленным вер-
вертикально и защищенным хлор кальциевой трубкой, помещают
85 г сухой цианистой меди (продажной или приготовленной, как
было указано ранее2, и высушенной в течение 72 час. в сушиль-
сушильном шкафу при 110° непосредственно перед применением), 0,25 г
йодистого калия и 72,5 г хлористого аллила (высушенного над
хлористым кальцием и свежеперегнанного; т. кип. 45—47°).
Пускают в ход мешалку и нагревают смесь на водяной бане; при-
примерно через 6 час. реакция в основном заканчивается, что можно
заметить по прекращению кипения. После этого нагревание
продолжают в течение еще 1 часа. Если синтез проводят
с большими количествами реагентов, то в случае бурного кипе-
кипения приходится отставлять водяную баню, чтобы уменьшить
интенсивность протекания реакции. Обычно это случается через
3—5 час. после начала нагревания. При работе с указанными
выше количествами особого наблюдения не требуется. Водяную
баню заменяют масляной, обратный холодильник заменяют на
обращенный вниз и, не прекращая перемешивания, отгоняют
цианистый аллил, собирая дестиллат в перегонную колбу
емкостью 100 мл. К концу перегонки перемешивание иногда при-
140
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ходится прекратить; рекомендуется также несколько понизить
давление, чтобы облегчить перегонку последней порции вещества.
Дестиллат подвергают повторной перегонке; при этом получают
50—53 г G9—84% теоретич.) цианистого аллила с т. кип. 116—122°.
(К. Смит и X. Снайдер, частное сообщение; проверили В. Бях-
ман и Дж. Джонсон.)
2. Указанная операция дает 90—95 г вещества. Наиболее
удобна делительная воронка емкостью около 600 мл.
3. Первая эфирная вытяжка содержит Юг нитрила, вторая —
4,5 г.
4. Этот способ короче и менее утомителен, чем более обычный
метод высушивания и фракционирования эфирного раствора.
5. Между масляным насосом и прибором помещают ловушку,
охлаждаемую сухим льдом; в ней собирается 5—10 г не вступив-
вступившего в реакцию цианистого аллила. Выход неочищенной кислоты
с учетом полученного обратно нитрила составляет 62—72%.
6. С помощью этого экстрагирования удаляют около 1 г
примесей, не имеющих кислого характера.
7. Хлороформ можно заменить на эфир без ущерба в выходе.
8. Разбавленную серную кислоту получают путем прибавле-
прибавления к 16,5 мл концентрированной кислоты 283,5 мл воды.
9. При контакте со щелочью винилуксусная кислота изомери-
зуется в кротоновую кислоту.
10. В результате первых двух экстрагирований получают
27—28 г вещества; последнее экстрагирование дает 3 — 4 г.
11. Если кислоту охлаждать в сосуде Дьюара с твердой угле-
углекислотой и ацетоном, то жидкость сперва остается прозрачной,
а затем закристаллизовывается в интервале от —36 до —35°.
Это указывает на отсутствие в препарате кротоновой кислоты3.
Другие методы получения
Практически важными методами получения винилуксусной
кислоты следует считать омыление цианистого аллила4, насыщение
углекислотой бромистого аллилмагния5-8 и синтез из малоновой
кислоты7.
1 С у п н е в с и и и, Зальцберг, Синт. орг. преп., сб. 1, стр. 500.
-Су и невский, Зальцберг, Синт. орг. преп., сб. 1, стр. 500,
раздел А.
3 F i с h t е г, Бег., 35, 938 A902).
4 F a I a i s e, F г о g n i e r, Bull. soc. chim. Belg., 42 433 A933)
[С. А., 28 2329 A934)].
5 H о u b e n, Ber., 36, 2897 A903).
6 G i 1 m a n, McGlumphy, Bull. soc. chim., D), 43, 1327 A928).
'Linstead, Noble, Boorman, J. Chem. Soc, 1933, 560.
ГЕМИП
141
ГЕМИН
Предложил: Г. Фишер.
Проверили: К. Ноллер и Г. Смит.
Получение
В 5-литровую круглодонную колбу, снабженную термометром,
обратным холодильником и капельной воронкой, помещают 4 л
ледяной уксусной кислоты и 1 г хлористого натрия. Содержимое
колбы нагревают на песчаной бане до тех пор, пока хлористый
натрий не перейдет в раствор, а затем в течение примерно получаса
прибавляют к нему тонкой струей через капельную воронку 1 л
дефибринизированной крови (примечание 1). Кровь не должна
попадать на стенки колбы. R течение этого времени температуру
поддерживают при 100—105°; после того как вся кровь будет
прибавлена, нагревание продолжают в течение еще 10 мин. Затем
горелку отставляют, смеси дают охладиться и оставляют ее на ночь.
Выпавший в осадок гемин отделяют центрифугированием
(примечание 2). Если центрифугирование проводят в стаканчиках
емкостью 100 мл, то каждый комплект стаканчиков центрифуги-
центрифугируют по 10 мин., жидкость декантируют, в стаканчики приба-
прибавляют еще некоторое количество исходной смеси и центрифуги-
центрифугирование повторяют. Таким образом гемин накапливают в стакан-
стаканчиках до тех пор, пока вся смесь не будет переработана, после
чего препарат перемешивают стеклянной палочкой и вымывают
из нескольких стаканчиков в один с помощью 75 мл 50%-ного
водного раствора уксусной кислоты. После центрифугирования
и декантирования гемин промывают таким же образом последо-
последовательно двумя порциями по 75 мл дестиллированной воды, одной
порцией в 50 мл 95%-ного спирта и одной порцией в 50 мл эфира.
Затем эфир декантируют и гемин переносят на часовое стекло
с помощью стеклянной палочки, на конец которой надета рези-
резиновая трубка; для перенесения используют 5 мл эфира. После
выпаривания досуха получают 3,5—4,5 г неочищенного вещества.
Для перекристаллизации 5 г неочищенного гемина помещают
в коническую колбу емкостью 100 мл, прибавляют к нему 25 мг
пиридина и колбу встряхивают до тех пор, пока весь гемин не рас-
растворится. К содержимому колбы прибавляют 40 мл хлороформа,
колбу закрывают корковой пробкой и в течение 15 мин. встряхи-
встряхивают ее; пробку время от времени осторожно открывают, чтобы
спустить давление. Затем раствор фильтруют со слабым отсасы-
отсасыванием через небольшую воронку Бюхнера, а коническую колбу
и фильтр промывают 15 мл хлороформа.
Во время встряхивания 350 мл ледяной уксусной кислоты
нагревают до кипения в вытяжном шкафу в стакане емкостью
600 мл и прибавляют к ней 5 мл насыщенного раствора хлори-
142
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
о-н-ГЕПТИЛФЕНОЛ
143
стого натрия и 4 мл концентрированной соляной кислоты. Го-
Горелку гасят и к горячей смеси приливают ровной струей профиль-
профильтрованный раствор гемина при непрерывном перемешивании.
Склянку для отсасывания ополаскивают 15 мл хлороформа.
Смесь оставляют стоять в течение 12 час, после чего кристаллы
отфильтровывают с отсасыванием, пользуясь небольшой воронкой
Бюхнера, и промывают их последовательно 50 мл 50%-ного вод-
водного раствора уксусной кислоты, 100 >гл дестиллированной воды,
25 мл спирта и 25 мл эфира. Отсасывание продолжают до тех пор,
пока кристаллы не высохнут, после чего их можно легко высыпать.
Выход после кристаллизации составляет 75—85%.
Примечания
1. Свежую кровь, получаемую с бойни, дефибринизируют,
для чего ее сбивают жесткой щеткой из растительных волокон,
а затем фильтруют с отсасыванием через большую воронку Бюх-
Бюхнера. Во время фильтрования кровь перемешивают, чтобы пре-
предупредить осаждение эритроцитов. При проверке этого синтеза
была взята бычья кровь.
2. Гемин можно выделить также и фильтрованием, однако
в этом случае препарат получается в мелкодисперсном состоянии;
поэтому обычно его предпочитают центрифугировать, что проще
и связано с меньшими потерями.
Другие методы получения
Хотя гемин и был приготовлен синтетически1, его всегда полу-
получают из крови2.
1 Fischer, Zeile, Ann., 468, 98 A929)
1ui1ki ^ hiL h
OH
О-и-ГЕПТИЛФЕНОЛ
OH
I
Предложили: Р. Рид и Дж. Вуд мл.'
Проверили: В. Бахман и М. Клётцель.
Получение
В 1-литровую трехгорлую колбу, снабженную мешалкой
(примечание 1) и обратным холодильником, помещают 200 г амаль-
гамированной цинковой ваты (примечание 2). К последней при-
прибавляют смесь 200 мл воды и 200 мл концентрированной соляной
кислоты, а затем раствор 60 г о-энантоилфенола (примечание 3)
в 100 мл спирта. Смесь энергично перемешивают и кипятят с об-
обратным холодильником до тех пор, пока не будет достигнуто пол-
полное восстановление (примечание 4).
Затем к смеси прибавляют 120 мл толуола и продолжают пере-
перемешивание в течение еще нескольких минут. Толуольный рас-
раствор отделяют от водного и промывают три раза водой. Раствор
отфильтровывают от взвешенных в нем примесей и толуол отго-
отгоняют из колбы Клайзена, продолжая этот процесс до тех пор,
пока термометр, погруженный в жидкость, не покажет 170°
(примечание 5). Остаток перегоняют в вакууме и собирают фрак-
фракцию с т. кип. 118—123° A мм) (примечание 6). Выход бесцветного
о-н-гептилфенола составляет 45—47 г (81—86% теоретич.; при-
примечание 7).
Примечания
1. Металла должна быть массивной и настолько большой,
насколько это позволяют размеры колбы, так как скорость вос-
восстановления в значительной степени зависит от полноты эмульги-
эмульгирования масла.
2. Цинк амальгамируют непосредственно в реакционной колбе,
заливая его раствором 4 г сулемы в 300 мл воды. Для того чтобы
амальгамирование завершилось, достаточно время от времени
взбалтывать эту смесь в течение получаса. Затем раствор сливают
и цинк промывают один раз водой.
3. о-Энантоилфепол может быть получен по методу, который
разработали Миллер и Хартунг («Синт. орг. преп.», сб. 2, стр.426).
Проверявшие настоящий синтез нашли, что если оставить смесь
орто- и пара-изомеров в холодном месте в течение ночи, то боль-
большая часть шг/?а-изомеров выкристаллизовывается и может быть
отфильтрована. После этого можно получить орто-изомер в ре-
результате двух- или трехкратной дробной перегонки фильтрата
в вакууме. Температура кипения о-энантоилфенола 135—140°
C мм), п-энантоилфенола — 200—207° D мм).
4. Восстановление требует по меньшей мере 8 час, но может
занять и вдвое больше времени. Для испытания на полноту вос-
восстановления из колбы берут 0,1 мл маслянистого вещества и рас-
растворяют его в 2 мл спирта; к раствору прибавляют 2—4 капли
10%-ного спиртового раствора хлорного железа. В присутствии
кетона наблюдается тёмнокрасное или красновато-бурое окраши-
окрашивание. Светлая буровато-желтая окраска указывает на полноту
восстановления. Для сравнения применяют стандартный раствор,
содержащий 0,5 г кетона на 1 л спирта, и к 2 мл этого раствора
144
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ГИДРОХЛОРИД ПИКОЛИНОВОЙ КИСЛОТЫ
145
прибавляют несколько капель раствора хлорного железа. По-
Поскольку /шра-ацилфенолы, как правило, не дают с хлорным желе-
железом ясно выраженной окраски, то для их восстановления должно
быть отведено по меньшей мере 8 час.
5. Толуольные вытяжки можно не сушить, так как удаление
воды происходит при отгонке толуола. Если потребуется, то для
полного отделения воды отогнанный толуол можно еще раз воз-
возвратить в колбу.
6. Остаток от перегонки обычно составляет менее 5 г, и им
можно пренебречь.
7. С помощью приведенного метода можно восстанавливать
и другие кетоны. По сообщению авторов ими был-и восстановлены
с выходами 70—90% следующие кетоны: о- и п-бутирилфенолы,
о- и я-валерилфенолы, о- и л-капроилфенолы, о- и п-энантоилфе-
нолы, о- и п-каприлоилфенолы, о- и п-пеларгонилфенолы, о- и п-ун-
деканоилфенолы. Эта же методика применима и к ацилрезорцинам
и ацилхлоррезорципам. Капроил- и каприлоилрезорцины восста-
восстанавливаются до соответствующих алкильных производных с вы-
выходами 70—80%. Бутирил-, валерил-, капроил-, энантоил-
и каприлоилхлоррезорцины восстанавливаются в соответствующие
алкилхлоррезорцины с выходами 60—75%.
Другие методы получения
Алкилфенолы с первичными радикалами были получены вос-
восстановлением ацилфенолов1; деметилированием соответствующих
простых эфиров1'2; диазотированием соответствующих аминов3;
при щелочной плавке эфиров сульфокислот4. Алкилрезорцины
были получены восстановлением ацилрезорцинов 1>5'6. Алкил-
Алкилхлоррезорцины были получены восстановлением соответствую-
соответствующих ацилхлоррезорцинов7.
'Johnson, Hodge, J. Am. Chem. Soc, 35, 1014 A913);
Coulthard, Marshall, Pyman, J, Chem. Soc, 1930, 280.
2 К 1 a g e s, Ber., 32, 1438 A899).
3 M a p в е л, Мак-Эльвен, Синт. орг. преп., сб. 1, стр. 491;
М а н с к е, там же, стр. 313.
4 U 1 I m a n п, Enzyklopiidie der technischen Chemie, Band 9, Urban
und Schwarzenberg, Berlin, 1921, S. 35.
5 J о h n s о n, Lane, J. Am. Chem. Soc. 43,348A921).
6 D о h m e, Cox, Miller, J. Am. Chem. Soc, 48, 1688 A926).
'Read, Reddish, Burlingame, J. Am. Chem. Soc, 56,
1377 A934).
ГИДРОХЛОРИД ПИКОЛИНОВОЙ КИСЛОТЫ
о
HC1
-сн.
KMnO4
-COOH
— COOH
XN
Cl
Предложили: А. Синеер и С. Мак-Эльвен.
Проверили: Ч. А длен и А. Белл.
Получение
В 5-литровую трехгорлую колбу, снабженную обратным хо-
холодильником и мешалкой, помещают 2 500 мл воды и 50 г а-пико-
лина @,54 моля; примечание 1). К содержимому колбы приба-
прибавляют 90 г @,57 моля) перманганата калия и нагревают раствор
на паровой бане, пока практически не исчезнет красное окраши-
окрашивание (около 1 часа). После этого в колбу вводят вторую порцию
перманганата в 90 г, затем наливают 500 мл воды и нагревание
продолжают, пока не исчезнет красная окраска B—2,5 часа).
Реакционной смеси дают несколько охладиться; выпавшие в оса-
осадок окислы марганца отфильтровывают и тщательно промывают
1 л горячей воды (примечание 2). Фильтрат упаривают в вакууме
до объема 150—200 мл, фильтруют, если нужно, и подкисляют
до кислой реакции на красное конго концентрированной соляной
кислотой F5—70 мл, уд. вес 1,19). Кислый раствор выпаривают
досуха в вакууме, а твердый остаток кипятят в течение 1 часа
с обратным холодильником вместе с 250 мл 95%-ного спирта,
после чего смесь фильтруют и экстрагирование повторяют еще
с одной порцией 95%-ного спирта в 150 мл. Спиртовые вытяжки
соединяют вместе и пропускают через раствор сухой хлористый
водород до тех пор, пока не начнут выпадать в осадок кристаллы.
Затем раствор охлаждают примерно до 10° в смеси льда с солью
и продолжают пропускать хлористый водород до полного насы-
насыщения раствора. Выделившиеся кристаллы гидрохлорида пико-
линовой кислоты отфильтровывают и сушат на воздухе. Выход
составляет 43—44 г E0—51% георстич.); т. пл. 228—230°
(примечание 3).
В некоторых случаях полученный гидрохлорид содержит
следы хлористого калия, которые можно удалить следующим
образом. Препарат растворяют в горячем абсолютном спирте
A л спирта на 50 г гидрохлорида) и отфильтровывают нераствори-
нерастворимые примеси; затем к теплому спиртовому раствору прибавляют
равное по объему количество абсолютного эфира и по охлаждении
раствора отфильтровывают кристаллы. Выход вещества после
перекристаллизации составляет 40—43 г; т. пл. 210—212° B30°;
примечания 3 и 4).
Ю Сборник 3
146
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Примечания
1. Авторы синтеза применяли фракцию пиколина с т. кип.
128—132°, тогда как при проверке был взят пиколин с т. кип.
128—134°. Выход остался тем же самым и при использовании
пиколина, полученного в результате тщательного фракциониро-
фракционирования и кипящего в пределах Г при 128—129°.
2. Промытая перекись марганца не содержит заметных коли-
количеств кислоты.
3. При определении температуры плавления обычным способом
она равна 228—230° (с разложением). Если же при приближении
к температуре плавления скорость нагревания уменьшить до 1°
за 5 мин., то температура плавления оказ'ывается равной
210—212°.
4. При перекристаллизации отделяется около 2 г хлористого
калия. Для большинства целей может быть использован неочи-
неочищенный препарат.
Другие методы получения
Обычно пиколиновую кислоту получали окислением а-пико-
лина перманганатом калия, причем кислота выделялась в виде
медной соли1. В одном случае6 она была выделена непосредствен-
непосредственно, так же как это имеет место и при использовании настоящего
метода. Пиколиновая кислота была также получена гидролизом
ш-трихлор пиколина7.
1 W ei del, Der., 12, 1992 A879).
2 Pinner, Bcr., 33, 1226 A900).
'Camps, Arch. Pharm., 240, 345 A902).
4 L e y, F i с k e n, Ber., 50, 1132 A917).
5 С 1 e m o, R a m a g e, J. Chem. Soc, 1931, 440.
s M e n d e, Ber., 29, 2887 A896).
'Dyson, Hammick, J. Chcm. Soc, 1939, 781.
ГОМОФТАЛЕВАЯ КИСЛОТА
CH2CN
50%H2SO4
л. /
oH
Предложил: Ч. Прайс.
Проверили: В. Бахман и Р. Морин.
Получение
В колбу емкостью 200 мл помещают смесь 50 г о-карбоксифенил-
ацетонитрила (стр. 267) и 50 г 50%-ной серной кислоты. Содер-
ГОМОФТАЛЕВАЯ КИСЛОТА
147
жимое колбы нагревают на паровой бане в течение 10—12 час,
а затем выливают в смесь льда с водой, взятую в двойном
объеме. Осадок отфильтровывают через воронку Бюхнера и сушат
на воздухе. Выход кислоты составляет 40—42 г G1—75%
теоретич.). Препарат можно перекристаллизовать; с этой целью
его растворяют в 1 л кипящей воды, обрабатывают активиро-
активированным березовым углем, раствор в горячем состоянии филь~
труют и фильтрат охлаждают в бане со льдом. Выход, полу-
полученный при перекристаллизации бесцветной кислоты (примеча-
ние 1) с т. пл. 180—181°, составляет 32—35 г (примечание 2),
Примечания
1. В одном из опытов при проверке синтеза был использован
о-карбоксифенилацетонитрил, имевший окраску, причем оказа-
оказалось необходимым дважды перекристаллизовать гомофталевую
кислоту, применяя оба раза активированный березовый уголь.
Выход бесцветной кислоты составлял 34,5 г.
2. Температура плавления зависит от скорости нагревания.
Если капилляр поместить в баню, нагретую до 170°, то кислота
плавится при 182—183° с предварительным размягчением. Если же
капилляр поместить в баню при комнатной температуре, то кислота
плавится около 174—175°.
Другие методы получения
Гомофталевая кислота была получена из нафталина через фтало*
новую кислоту1; из гидриндона путем нитрозирования, гидролиза
2
и окисления перекисью водорода2; из гидриндена окислением
смесью хромовой и серной кислот3; из о-толуиловой кислоты
путем бромирования хлорангидрида кислоты с последующими
процессами воздействия на продукт реакции спиртом и цианистым
натрием и омыления 50%-ной серной кислотой4. Так как в на-
настоящее время фталид является легко доступным соединением,
то приведенная выше пропись, в основном не отличающаяся от
методики Вислиценуса5, опубликованной в 1886 г., является
безусловно наиболее пригодной.
1 Graebe, Trump у, Ber., 31 375 A898).
2 Р е г k i n, Roberts, R о b i n s о n, J. Chem. Soc, 101, 232 A912).
3Meyer, Vittenet, Compt. rend., 194, 1250 A932).
4 P r i с e, Lewis, M e i s t e r, J. Am. Chem. Soc, 61, 2762 A939).
5 W i s 1 i с е n u s, Ann., 233, 102 A886).
148
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ГУАНИДИЛУКСУСНАП КИСЛОТА
149
ГУАНИДИЛУКСУСНАЯ КИСЛОТА
(Гликоциамин)
NH2CSNH2 + C2H5Br -> HN = C(SC2H5)NH2.HBr
HN = C(SC2H5)NH2 + NH2CH2COOH -s- NH2CNHCHaCOOH+C2H5SH
I!
NH
Предложили: Э. Бранд и Ф. Бранд.
Проверили: Ч. Аллен и Дж. Гейтс мл.
Получение
Бромистоводородная S-этилтиомочевина. В 1-литровую кругло-
донную колбу, снабженную эффективным холодильником, поме-
помещают смесь 150 г порошкообразной тиомочевины A,97 моля; при-
примечание 1), 250 г бромистого этила B,29 моля) и 200 мл абсолют-
абсолютного спирта. Смесь нагревают, время от времени взбалтывая, на
водяной бане (температура бани 55—65°) в течение 3 час. За это
время тиомочевина полностью растворяется. Затем обратный холо-
холодильник заменяют на обращенный вниз и спирт вместе с избытком
бромистого этила отгоняют в вакууме водоструйного насоса.
Во время перегонки температуру водяной бани медленно повы-
повышают до температуры кипения (примечание 2). Оставшееся масло
переливают в стакан емкостью 500 мл и предоставляют ему
кристаллизоваться (примечание 3). Твердое вещество растирают
в порошок и сушат в эксикаторе (примечания 4 и 5). Выход
составляет 340—360 г (93—99% теорегич.).
Гуанидилуксусная кислота. Эту реакцию необходимо про-
проводить в вытяжном шкафу с хорошей тягой, так как во вре-
время процесса выделяются значительные количества этилмеркап-
тана.
В 1-литровую коническую колбу помещают 92,5 г @,50 моля)
бромистоводородной S-этилмочевипы. Колбу погружают в баню со
льдом и прибавляют к гидробромиду 252 мл 2 н. раствора едкого
натра. Затем к содержимому колбы быстро приливают горячий
(выше 80°) раствор 41 г глицина («Синг. орг. преп.», сб. 1, стр. 167)
в 90 мл воды. Когда температура достигнет 25° (примечание 6),
колбу вынимают из охлаждающей бани; примерно через полчаса
начинается кристаллизация. Вслед за этим к смеси прибавляют
около 100 мл эфира и оставляют ее на ночь в вытяжном шкафу
(примечание 7). Затем смесь охлаждают в течение 2 час. в бане
со льдом, эфирный слой декантируют и осадок отфильтровывают
с отсасыванием. Кристаллы промывают на воронке последова-
последовательно двумя порциями ледяной воды по 20 мл (примечание 8),
двумя порциями 95%-ного спирта по 150 мм и двумя порциями
эфира по 150 мл. Выход высушенной на воздухе гуанидилуксусной
кислоты составляет 47—53 г (80—90% теоретич.). Полученный
препарат достаточно чист для большинства целей (примечание 9);
т. пл. 280—284° (с разложением).
Примечания
1. Продажная тиомочевина обычно бывает достаточно мелко
дисперсной, так что ее можно применять непосредственно.
2. Последние следы можно удалить значительно быстрее, если
колбу непосредственно присоединить к насосу.
3. Если внести затравку, то жидкость мгновенно затвердеет.
4. Неочищенная гуанидилуксусная кислота пригодна для
последующей реакции. Если хранить препарат в холодном месте
без доступа воздуха, то он останется достаточно стойким в течение
нескольких месяцев.
5. Этот метод является общим для получения бромистоводород-
ных и иодистоводородных S-алкилтиомочевин. Во всех случаях
выходы оказываются выше 90%. Хлористоводородные S-алкил-
тиомочевины получаются не так легко; оптимальные условия для
синтеза каждого гидрохлорида необходимо выявить опытным
путем.
6. Температура может либо повыситься, либо понизиться
до 25°, в зависимости от температуры сливаемых растворов.
7. Выход окажется несколько ниже D5 г), если смесь филь-
фильтровать после того, как она простоит в течение только 3 час.
8. Препарат заметно растворим в воде.
9. С целью дальнейшей очистки этого препарата можно либо
перекристаллизовать его из горячей воды A25 мл воды на
5 г вещества), либо растворить в несколько большем, чем вычис-
вычисленный, объеме 2 н. раствора соляной кислоты и вновь осадить
прибавлением эквивалентного количества 2 н. раствора едкого
натра. Результаты анализа на содержание азота (по методу
Дюма) для неочищенного и чистого вещества следующие:
Вычислено 35,9%
Найдено:
в кислоте не перекристаллизованной 35,4%
в кислоте перекристаллизованной один раз 35,9%
в кислоте переосажденной 35,7%
Другие методы применения
S-Этилтиомочевина была получена в виде ее гидробромидаг~3
и гидроиодида2-4. Гуанидилуксусная кислота была ранее получена
из йодисто во дородной S-этилтиомочевины2.
150
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
1 Cl a us, Вег., 7, 236 A874).
2 Wheeler, Merriam, Am. Chem. J., 29, 483 A903).
3 Schotte, Priewe, Roescheisen, Z. physiol. Chem., 174,
119 A928).
4 С 1 a u s, Ber., 8, 41 A875).
2CH3COCH2CO2C2H5
ДЕГИДРАЦЕТОВАЯ КИСЛОТА
CH3C = CH —CO
I - +2C2H5OH
O—CO —CHCOCH,
Предложил: Ф. Арндт.
Проверили: В. Хартмэн и А. Вейсбергер.
Получение
КруглОдонную колбу емкостью 250 мл снабжают термометром,
доходящим почти до дна ее (примечание 1), и дефлегматором
с тремя или четырьмя шариками, но без отводной трубки. К верх-
верхней части дефлегматора присоединяют головку для частичной
'конденсации паров (рис. 14; примечание 2). Боковой отвод А
головки снабжают термометром со шкалой до 110° и присоединяют
к обращенному вниз холодильнику. Карман головки Б наполо-
наполовину заполняют толуолом, добавляют в последний кусочек битой
глиняной тарелки и к верхней части кармана присоединяют
обратный холодильник.
В колбу емкостью 250 мл помещают 100 г @,78 моля) свеже-
перегнанного в вакууме ацетоуксусного эфира и 0,05 г двуугле-
двууглекислого натрия (примечание 3); содержимое колбы нагревают так,
чтобы поддерживать слабое кипение толуола, до тех пор, пока тем-
температура жидкости в колбе не достигнет 200—210° (примечание 4).
Обычно продолжительность нагревания составляет 7—8 час,
в течение которых собирается 27 г дестиллата с т. кип. 72° (глав-
(главным образом спирт), а реакционная смесь окрашивается в темно-
бурый цвет. Горячую дегидрацетовую кислоту (примечание 5)
переносят в перегонную колбу емкостью 200 мл (примечание 6)
и перегоняют в вакууме. После того как будет отделен кипящий
до 128° A2 мм) головной погон, который состоит из ацетоуксусного
эфира, приемник меняют и собирают дегидрацетовую кислоту
при 140° A2 мм). Выход дегидрацетовой кислоты с т. пл. 104—110°
составляет 34 г E3% теоретич.; примечание 7). Более чистый
препарат ст. пл. 108° можно получить с выходом, равным 80%,
перекристаллизацией из этилового спирта, для чего берут по 2 мл
растворителя на 1 г вещества (примечание 8).
ДЕГИДРАЦЕТОВАЯ КИСЛОТА
151
Рис. 14. Все размеры даны в сантиметрах.
Примечания
1. Шарик термометра должен быть погружен в жидкость.
2. Головка для частичной конденсации паров представляет
собой видоизмененный дефлегматор Гана1. Она очень эффективна
в отношении сокращения времени, необходимого для дробной
перегонки некоторых смесей. Лучше всего сделать головку из
стекла пирекс. Приведенные размеры носят ориентировочный
характер и их можно изменять в зависимости от потребностей
в каждом отдельном случае. Карман головки представляет собой
пробирку из стекла пирекс размером 30X 140 мм, впаянную в своей
152
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
верхней части в стандартную трубку из стекла пирекс. Такая
головка весьма эффективна при очистке циклогексена («Синт.
орг. преп.», сб. 1, стр. 510, примечание 4)а. Сырую смесь
помещают в колбу, а в карман головки наливают этиловый спирт;
нагревание продолжают до тех пор, пока не прекратится отгонка
дестиллата. После этого спирт заменяют на дихлорэтан и отгоняют
циклогексен.
3. Применение двууглекислого натрия совершенно необхо-
необходимо для получения воспроизводимых результатов.
4. При более высокой температуре наступает значительное
разложение. Необходимое для достижения указанной температуры
время бывает различным в зависимости от величины загрузки;
оно сокращается в случае меньших количеств исходных реагентов.
5. При охлаждении остаток затвердевает. На этой стадии
дегидрацетовую кислоту можно профильтровать и промыть,
однако выход вещества будет ниже вследствие его растворимости
в реакционной смеси.
6. Наилучшие результаты были получены при использовании
обычной перегонной колбы емкостью 200 мл с низко припаянным
боковым отводом большого диаметра. Вспенивания и разбрызгива-
разбрызгивания не наблюдалось.
7. При больших загрузках выход падает. Так, например,
из 500 г ацетоуксусного эфира была получена дегидрацетовая
кислота с выходом только 35% теоретического количества.
8. Кислоту можно выделять и через ее натриевую соль, но
в этом случае качество препарата будет ниже, а выход—меньше.
Другие методы получения
Дегидрацетовая кислота была получена действием уксусного
ангидрида на ацетондикарбоновую кислоту3; в качестве побоч-
побочного продукта при пиролизе ацетона с целью получения кетепа4;
действием пиридина на димер кетена8; отщеплением спирта от
ацетоуксусного эфира6. Очистку дегидрацетовой кислоты произ-
производят обычно через ее натриевую соль.
1 Н a h п, Вег., 43, 419 A910).
2 Hutchison, частное сообщение.
3Pechmann, Ber., 24, 3600 A891); Pechmann, Neger,
Ann., 273, 194 A893).
4 Н u r d, Sweet, Thomas, J. Am. Chem. Soc, 55, 336 A933).
s С h i с k, W i 1 s m о г e, J. Chem. Soc, 93, 946 A908); 97, 1987
A910).
6 A r n d t, Nachtwey, Ber., 57, 1489 A924); А г n d t, E i s t e г t,
S с h о 1 z, А г о л, там же, 69, 2373 A936).
нор-ДВЗОКСИХОЛВВАЯ КИСЛОТА
153
ио/>-ДЕЗ(ЖСИХОЛЕВАЯ КИСЛОТА
C,72-Диокси-нор-холановая кислота)
СН3
СН (СН3) СН2СН = С (С6Н5J
сн2со2 ¦
н3с
/\
СН3С0.
\/\/
СгОз
СН3СО2Н
сн,со.
\
СН3
СН (СН„) СН2СО2Н
I
/\
/\л
кон
2\/\/
сн3
но
н3с
СН (СН3) СН2СО2Н
' но\/\/
Предложили: Б. Ригель, Р. Моффетт и А. Мак-Интош.
Проверили: Р. Тзрнер и Л. Физер.
Получение
При нагревании приготовляют раствор 59,6 г @,1 моля)
3,12-диацетокси-быснор-холанилдифенилэтилена (стр. 164) в 60 мл
хлороформа и переливают его в 1-литровую круглодонную колбу,
содержащую 300 мл ледяной уксусной кислоты, нагретой до 40°.
Колбу снабжают мешалкой, термометром, шарик которого должен
находиться ниже поверхности раствора, и капельной воронкой и по-
погружают в водяную баню, через которую может протекать холод-
холодная вода. Из капельной воронки приливают раствор 37 г хромово-
хромового ангидрида в смеси 30 мл воды и 200 мл уксусной кислоты с та-
такой скоростью, чтобы температура смеси держалась на уровне
примерно 50°; при этом смесь перемешивают и охлаждают. При-
Прибавление хромового ангидрида занимает около 10 мин. Когда
температура смеси начнет падать, водяную баню подогревают
154
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
и температуру поддерживают около 50° в течение еще 20 мин.
После этого раствор охлаждают и избыток хромовой кислоты
разрушают, осторожно прибавляя к смеси около 30 мл метилового
спирта, причем температуру поддерживают ниже 50° (примечание 1).
Реакционную смесь упаривают, для чего растворитель отго-
отгоняют в вакууме. Сперва его можно отгонять быстро, но после того,
как смесь станет сиропообразной, перегонку следует вести при
температуре ниже 30° и продолжать ее до тех пор, пока остаток
не будет почти твердым. Такое упаривание занимает 2 часа
при давлении 10 мм. Остаток разбавляют 500 мл холодной воды,
которую прибавляют в несколько приемов при тщательном взбал-
взбалтывании, имеющем целью размельчить все комки. Вещество от-
отфильтровывают и промывают разбавленной соляной кислотой до
тех пор, пока фильтрат не станет идти бесцветным. Твердую
массу кристаллов (примечание 2) растворяют примерно в 400 мл
эфира и экстрагируют 500 мл 2,5%-ного раствора едкого кали
(примечание 3). Щелочной раствор немедленно подкисляют
10%-ной соляной кислотой B00 мл) и неочищенную 3,12-диацет-
окси-яор-холановую кислоту отфильтровывают (примечание 4).
Неочищенный диацетат омыляют; с этой целью его растворяют
в 350 мл 10%-ного водного раствора едкого кали и раствор кипятят
в течение 2 час. с обратным холодильником. Щелочной раствор
разбавляют примерно до 700 мл, охлаждают и фильтруют. Филь-
Фильтрат выливают в 300 мл 10%-ной соляной кислоты, отфильтровы-
отфильтровывают яор-дезоксихолевую кислоту и сушат ее. Неочищенный
препарат растворяют примерно в 600 мл ацетона и раствор филь-
фильтруют в горячем состоянии, чтобы удалить небольшое количест-
количество соли. По охлаждении получают в два приема 25—30 г
{57—68% теоретич.) белых кристаллов с т. пл. 209—211°
(примечание 5). Препарат содержит одну молекулу кристаллиза-
кристаллизационного ацетона. Хорошо очищенное вещество размягчается
при 160° (потеря ацетона) и плавится при 213,5—214,5°.
Примечания
1. При взаимодействии твердой хромовой кислоты и метило-
метилового спирта происходит самопроизвольное воспламенение; необхо-
необходимо соблюдать осторожность и следить, чтобы метиловый спирт
не пришел в соприкосновение даже с незначительным количеством
раствора хромовой кислоты, который мог высохнуть на краях
капельной воронки.
2. Если твердая масса не получится бесцветной или почти бес-
бесцветной, то ее необходимо размешать с 250 мл 10%-ной соляной
кислоты и экстрагировать смесь 400 мл эфира. После этого эфирный
раствор экстрагируют 2,5%-ным раствором едкого кали, как
указано в прописи.
ДИАЗОМЕТАН
155
3. Следует избегать сильного перемешивания, чтобы не вызвать
образования эмульсии.
4. 3,12-Диацетокси-но/?-холановую кислоту можно очистить, пе-
перекристаллизовав ее из ацетона. Препарат плавится при207—208°.
5. Этот процесс в сочетании с процессом, описанным на стр.164,
является примером систематического укорочения цепи карбоно-
вых кислот по методу Барбье—Виланда. При повторении описан-
описанного здесь процесса, исходя из нор-дезоксихолевой кислоты,
можно получить быснор-дезоксихолевую кислоту. Если продукт
окисления хромовой кислотой после разбавления его водой
не будет достаточно твердым для того, чтобы его можно было
отфильтровать, то смесь следует экстрагировать эфиром и промыть
разбавленной соляной кислотой, прежде чем проводить экстраги-
экстрагирование щелочью, биснор-Дезоксихолевую кислоту можно пере-
перекристаллизовать из этилового спирта. Она плавится при 239—241°.
Другие методы получения
нор-Дезоксихолевая кислота была получена из дезоксихолевой
кислоты по видоизмененному способу Барбье—Виланда1, заклю-
заключающемуся в укорочении цепи карбоновых кислот.
1 Н о е h п, Mason, J. Am. Chem. Soc, 60, 1493 A938); S a w 1 e-
wi с z, Roczniki Chem., 18, 250, 755 A938); К a z u n o, Simizii, J.
Biochem. (Japan), 29, 421 A939); Reichstein, Arx, Helv. Chim.
Acta, 23, 747 A940)
ДИАЗОМЕТАН
*
CH3NH2 HN02
(CH3JC=CHCOCH3 > (CH3JC — CH2COCH3 >
NH
CH,
—> (CH3JC —CH2COCHS
Алкоголят натрия
N —NO
CH:i
(CH3JC = CHCOCH3 + CH2N2 + H2O
Предложили: К. Редеман, Ф. Райе, Р. Роберте и X. Уорд.
Проверили: Н. Дрэйк, Ч. Икер, Р. Престон и В. Смит.
Получение
N-Иитрозо-^-метиламиноизобутилметилкетон. В 2-литровую
трехгорлую колбу, снабженную механической мешалкой,
156
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
термометром и капельной воронкой, помещают 250 мл B, 1 моля)
30%-ного водного метиламина (примечание 1). Колбу погружают
в баню со льдом и пускают в ход мешалку. Когда температура
раствора упадет до 5°, к нему прибавляют через капельную во-
ропку 196 г B моля) окиси мезитила с такой скоростью, чтобы
температура держалась ниже 20° (примечания 2 и 3). После при-
прибавления окиси мезитила смесь оставляют стоять в течение полу-
получаса, не охлаждая ее.
Затем смесь охлаждают до 10° при помощи бани со льдом
и через капельную воронку прибавляют к ней 125 мл ледяной
уксусной кислоты с такой скоростью, чтобы температура дер-
держалась ниже 15°. После этого к смеси быстро приливают допол-
дополнительно 75 мл кислоты.
Баню со льдом отставляют и к перемешиваемому раствору,
температуру которого поддерживают в пределах 25—35°, время
от времени охлаждая его, прибавляют в течение 20—30 мин.
300 мл 8 н. раствора нитрита натрия (примечание 4). После этого
перемешивание прекращают и смесь оставляют стоять в течение
6 час. или дольше (примечание 5).
Маслянистый слой отделяют от водного; последний экст-
экстрагируют двумя порциями эфира по 200 мл и соединенные
вместе вытяжки и масло сушат над хлористым кальцием. Осушаю-
Осушающее средство отфильтровывают, а эфир отгоняют на водяной бане;
под конец все низкокипящие вещества отгоняют от смеси на кипя-
кипящей водяной бане в вакууме водоструйного насоса (примечание 6).
Нитрозоамипокетон, который остается в колбе, достаточно чист
для использования его при получении диазометана (примечание 7).
Выход составляет 221—257 г G0—80% теоретич., считая на окись
мезитила).
Вели для других целей желательно получить более чистый
препарат, то нитрозоаминокетон следует перегнать в вакууме
(см. Внимание!). Вещество кипит при 119° E мм), ИГ (Змм)
или при 101° A,5 мм).
Внимание! В один прием следует перегонять только
небольшое количество нитрозоаминокетона. Имеются указа-
указания на то, что иногда вещество это претерпевает бурное разложе-
разложение. Сотрудник, ведущий перегонку, должен быть защищен или
соответствующим экраном или пластиной из небьющегося стек-
стекла (примечание 8).
Диазометан. Способ получения с применени-
применением изопропилата натрия (примечание 9).
Внимание! Диазометан очень ядовит. Его получение
можно вести только в вытяжном шкафу с хорошей тягой. Отдель-
Отдельные лица по-разному подвержены его действию. Иногда от очень
небольших концентраций диазометана развиваются симптомы,
ДИАЗОМЕТАН
157
напоминающие астму. В то же время даже при больших коли-
количествах диазометана некоторые лица не испытывают никакого
вредного воздействия. Во всех случаях рекомендуется применять
предохранительные экраны.
В колбу Клайзена емкостью 250 мл, установленную в водя-
водяной бане, помещают 30 мл раствора изопропилата натрия, полу-
полученного из 1 г натрия и 100 мл изопропилового спирта. Колбу снаб-
снабжают капельной воронкой, холодильником и приемником, кото-
который охлаждают сухим льдом. Этот приемник соединен с другим
приемником, в котором находится 20 мл абсолютного эфира;
трубка для ввода газа во втором приемнике должна быть погру-
погружена ниже поверхности эфира.
Водяную баню нагревают до 70—75° и через капельную воронку
прибавляют к содержимому колбы половину раствора, получен-
полученного растворением 15,8 г @,1 моля) N-нитрозо-р-метиламиноизо-
¦бутилметилкетона в смеси 80 мл абсолютного эфира и 12 мл изо-
изопропилового спирта, причем прибавление ведут со скоростью,
несколько превышающей скорость отгонки. Когда капельная во-
воронка опустеет, к смеси прибавляют дополнительно 15 мл раствора
изопропилата натрия, после чего к ней приливают остаток рас-
раствора нитрозосоединения, производя это тем же путем, что и в пер-
первый раз. Затем через капельную воронку к смеси постепенно при-
прибавляют абсолютный эфир до тех пор, пока эфир не станет отго-
отгоняться бесцветным. Диазометан перегоняется вместе с эфиром
в виде золотисто-желтого дестиллата. Процесс можно продолжать
до тех пор, пока не разложится весь нитрозоаминокетон. Вы-
Выход диазометана, который бывает различным в зависимости от
чистоты нитрозоаминокетона, составляет 1,9—2,5 г D5—60%
теоретич.).
Диазометан. Способ получения с применением нат-
натриевого производного циклогексанола (примечание 10).
В 2-литровой колбе приготовляют раствор натриевого производно-
производного циклогексанола из 4 г натрия и 100 мл циклогексанола (примеча-
(примечание 11). Чтобы ускорить образование алкоголята, циклогексанол
нагревают до кипения с обратным холодильником. Как только
натрий растворится, нагревание прекращают и холодильник отъ-
отъединяют. Когда из раствора начнет выпадать в осадок твердое веще-
вещество, смесь перемешивают толстой палочкой, чтобы воспрепятство-
воспрепятствовать образованию твердой массы. Затем колбу погружают в баню
со льдом, и когда температура смеси упадет до 10°, прибавляют
к ней 300 мл абсолютного эфира и раствор 49 г @,33 моля)
N-нитрозо-р-метиламиноизобутилметилкетона в 600 мл абсолютно-
абсолютного эфира. К колбе присоединяют дефлегматор высотой 25 еж (приме-
(примечание 12) и эффективный холодильник с водяным охлаждением.
К нижнему концу холодильника должен быть присоединен
158
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
аллонж, конец которого погружен в эфир E0 мл), налитый в 1-ли-
1-литровую коническую колбу, охлаждаемую в бане со льдом. Смесь
нагревают на водяной бане, температуру которой поддерживают
в пределах 50—55°. Перегонку продолжают до тех пор, пока эфир
не станет отгоняться бесцветным. Обычно собирают 700—750 мл
дестиллата, в котором содержится 10—11 г G7—84% теоретич.;
примечание 13) диазометана (примечания 14 и 15). Раствор диазо-
метана в эфире можно подвергнуть дальнейшей очистке с неболь-
небольшими потерями, высушивая его над гранулированным едким кали
(примечание 16) и перегоняя с дефлегматором.
Примечания
1. Метиламин имеется в продаже обычно в виде водных рас-
растворов, содержащих 30—33% амина. Допустимо также применение
в соответствующем количестве и растворов другой концентра-
концентрации. Раствор амина можно получить из гидрохлорида, если мед-
медленно прибавлять 210 мл 10 н. раствора едкого натра к охлажден-
охлажденному до 0° раствору 142 г B,1 моля) хлористоводородной соли
метиламина в 250 мл воды. Полученный раствор применяют без
дальнейшей обработки.
2. Окись мезитила должна быть свсжеперегнанной.
3. Продолжительность прибавления окиси мезитила зависит
от эффективности охлаждающей бани; обычно для этого требуется
от 30 мин. до 1 часа.
4. Применяют почти насыщенный раствор нитрита натрия.
Последний может и не быть химически чистым; если препарат
менее чист, то при приготовлении раствора надо взять большее его
количество.
5. Лучше оставлять смесь на ночь. Однако следует при-
принять меры, чтобы за это время температура ее не поднялась вы-
выше 35°.
6. Давление не должно быть выше 30 мм; наиболее предпоч-
предпочтительно давление в 20 мм.
7. Виду доступности исходных материалов и стабильности
нитрозоаминокетона при хранении это вещество является прекрас-
прекрасным промежуточным продуктом для получения диазометана.
Один из авторов синтеза (Редемап) сообщил, что образец неочи-
неочищенного вещества хранился в лаборатории в склянке из корич-
коричневого стекла в течение более 2 лет без заметного разложения.
Следы уксусной кислоты, остающиеся в кетоне, повидимому,
стабилизируют его.
8. Один из авторов синтеза (Редеман) сообщил, что при пере-
перегонке нитрозоаминокетона он никогда не испытывал затруднений.
9. Предложили Ф. Райе, Р. Роберте н X. Уорд.
10. Предложил К- Редеман.
диазометан
159
11. Циклогексанол можно заменить бензиловым спиртом.
Имеются указания на то, что в случае применения бензилового
спирта несколько ускоряется образование диазометана и полу-
получается более концентрированный эфирный раствор его. Однако
конечный выход оказывается немного ниже. Если требуется
только небольшое количество диазометана, то раствор алкого-
лята циклогексанола можно заменить концентрированным вод-
водным раствором едкого натра. Выход при этих условиях составляет
40—50%.
12. Следует применять дефлегматор с гладкой насадкой или
с,гладкой внутренней поверхностью; шершавая поверхность ката-
каталитически ускоряет разложение диазометана. Использование деф-
дефлегматора способствует отделению окиси мезитила.
13. Содержание диазометана в эфирном растворе можно опре-
определить по методу, описанному ранее1.
14. Раствор диазометана в абсолютном эфире можно сохра-
сохранять в колбе или склянке с гладкими стенками в холодильном
шкафу в течение нескольких недель. Поскольку медленное раз-
разложение диазометана все же происходит, перед применением
необходимо проверить концентрацию его раствора.
15. По приведенному общему методу можно легко полу-
получать и другие алкилдиазосоединения, внеся некоторые изме-
изменения в методику в связи с меньшей летучестью высших го-
гомологов2.
16. Рекомендуется использовать гранулированное едкое кали,
которое, ввиду гладкой поверхности зерен лишь незначительно
разлагает диазометан.
Другие методы получения
Диазометан был получен из нитрозометилмочевины1, из ни-
трозометилуретана 3>4 и из смеси хлороформа с гидразин-гидра-
гидразин-гидратом при помощи реакции с едким кали5. Описанные выше способы
получения заимствованы из работ Кеппера 6-7.
Обзоры по получению и применению диазометана имеются
в литературе 8>9.
1 А р н д т, Синт. орг. преп., сб. 2, стр. 174.
2 A d a m s о п, К е п n e r, J. Chem. Soc, 1937, 1551.
3 Р е с h m a n n, Bcr., 27, 1888 A894); 28, 855 A895).
iMeerwein, Burneleit, Ber., 61, 1845 A928).
5 Staudinger, Knpfer, Ber., 45, 505 A912).
«Jones, Kenner, J. Chem. Soc, 1933, 3G3.
7 A d a in s о п, Kenner, J. Chem. Soc, 1935, 286; 1937, Io5l.
8 S m i t h, Chem. Revs., 23, 193 A938).
9 E i s t e r t Z. angew. Chem., 54, 99, 124 A941).
160
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
4,4'-ДИАМИНОДИФЕНИЛСУЛЬФОН
(л ,п' -Сульфонил-бис-анилин)
n-CH8CONHC6H4SO2Na + n-NOaQHiCl -> n-CH3CONHC6H4SO2C6H4NO2-n'
/r-CHaOONHC,H4SOaC,H4NO2-n'
Sncia
НС I
4,4'"NH2C,H1SO2CeH4NHa
Предложили: К. Ферри, Дж. Бэк и Р. Балтцли.
Проверили: Ч. Аллен и Дж. ВанАллан.
Получение
В 1-литровом стакане, установленном на паровой бане, при-
приготовляют суспензию из 155 г @,78 моля) п-ацетаминобензолсуль-
финовой кислоты («Синт. орг. преп.», сб. 1, стр. 68) и 310 мл
воды. Суспензию перемешивают от руки, слабо нагревают и одно-
одновременно нейтрализуют, прибавляя к ней раствор 31,5 г едкого нат-
натра в 125 мл воды (примечание 1). Затем раствор переносят в 2-лит-
2-литровую колбу и большую часть воды отгоняют в вакууме эффектив-
эффективного водоструйного насоса; в течение 1,5 часа отгоняется 330—
350 мл воды. При этом начинает выделяться твердая соль. Когда
дальнейшее кипячение становится затруднительным в результате
сильных толчков, колбу охлаждают, погружая ее на полчаса
в баню со льдом, и соль отфильтровывают с отсасыванием, От филь-
фильтрата продолжают отгонять воду, как это указано выше, и новую
порцию соли присоединяют к первой. Второй фильтрат после от-
тонки воды дает уже менее чистую соль, которую можно перера-
переработать отдельно. Выход составляется из 107—124 г F3—73%
теоретич.) соли от первой порции, 25—34 г A5—20%) от второй
порции и из 12—17 г G—10%) вещества более низкого качества.
В трехгорлую круглодонную колбу емкостью 500 мл, снабжен-
снабженную обратным холодильником, механической мешалкой и термо-
термометром, помещают 48,5 г @,22 моля) натриевой соли сульфиновой
кислоты и 60 мл смеси, полученной из 75 мл этиленгликоля и
120 мл метилового или этилового эфира диэтиленгликоля. Смесь
перемешивают и нагревают на масляной бане до полного раство-
растворения, после чего к раствору прибавляют 31,5 г @,2 моля) 4-хлор-
нитробензола (т. пл. 76—78°). Смесь нагревают в течение 3,5 часа
при температуре 141—143° (термометр погружен в смесь) при
непрерывном перемешивании, а затем оставляют ее охлаждать-
охлаждаться на ночь. После прибавления 20 мл воды пастообразные
куски разбивают и все вместе' фильтруют с отсасыванием; осадок
промывают 50—75 мл горячей воды. Твердую массу переносят
в 1-литровую колбу и в продолжение 15 мин. кипятят с обратным
холодильником вместе с 250 мл 95%-ного спирта. После охлажде-
охлаждения л-нитро-л-ацетиламинодифенилсульфон отфильтровывают с от-
отсасыванием, промывают на фильтре сперва 25 мл спирта, а затем
4,4'-ДИАМИНОДИФВНИЛСУЛЬФОН
161
25 мл эфира и сушат на воздухе. Выход окрашенного в рыже-
рыжевато-коричневый цвет вещества составляет 32—33 г E0—52%
теоретич.); т. пл. 226—228° (примечание 2).
К раствору 300 г кристаллического хлористого олова
SnCl2-2H2O в 300мл концентрированной соляной кислоты (уд. вес
1,19), находящемуся в 1-литровом стакане, прибавляют 96 е
сульфона и смесь время от времени перемешивают. Происходит
довольно сильное выделение тепла, так что для предотвращения
бурного кипения смеси с возможной потерей вещества приходится
через 10—15 мин. прибегнуть к наружному охлаждению (приме-
(примечание 3). После того как почти весь осадок растворится, смесь на-
нагревают в течение 2 час. на паровой бане. Раствор охлаждают и
приливают его к 1 350 мл 40%-ного раствора едкого натра, поме-
помещенного в 3-литровый стакан; во время этой операции необходимо
перемешивать смесь с помощью механической мешалки; для охла-
охлаждения к реакционной смеси прибавляют около 1 500 г льда.
Конечная температура должна быть около 10°. После того как
смесь простоит в течение получаса, неочищенный амин отфильтро-
отфильтровывают с отсасыванием (примечание 4) и промывают водой B00—
250 мл) до полного удаления щелочи.
Амин перекристаллизовывают; с этой целью его растворяют
в 250 мл 95%-ного спирта, кипятят в течение нескольких минут
с 5 г активированного березового угля и фильтруют. Прозрач-
Прозрачный фильтрат упаривают до небольшого объема или разбавляют
200—250 мл воды (примечание 5) и оставляют на ночь в холо-
холодильном шкафу. Кристаллический 4,4'-диаминодифенилсульфон
(т. пл. 176°) отфильтровывают и сушат на воздухе. Выход соста-
составляет 55—57 г G4—77% теоретич.; примечание 6).
Примечания
1. Часто раствор окрашивается в голубой цвет. Если окраска
не исчезнет, к раствору следует прибавить небольшое дополни-
дополнительное количество раствора едкого натра.
2. Если взять удвоенные количества исходных реагентов,
то выход (в процентах) не изменится. Для реакции восстановления
удобно объединить порции препарата, полученные в результате
нескольких опытов.
3. Иногда восстановление начинается не сразу. Если это слу-
случится, то стакан следует осторожно подогреть; однако необхо-
необходимо предварительно обеспечить возможность быстрого охлажде-
охлаждения реакционной смеси.
4. Фильтрование облегчается, если применять фильтр из по-
пористого стекла пирекс или из стеклянной ткани; рекомендуется
использовать воронку диаметром 30 см.
5. Обычно часть амина кристаллизуется во время фильтрова-
11
Сборник 3
162
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
1,2-ДПАМИНО-4-НИТРОКТ?НЗОЛ
ния. Для ее растворения смесь нагревают, после чего прибавляют
к ней воду до тех пор, пока раствор не станет слегка мутным.
6. Если температура плавления оказывается низкой, то тре-
требуется повторная перекристаллизация.
Другие методы получения
4,4'-Диаминодифенилсульфон, а также 4,4'-диацетиламиноди-
фенилсульфон были получены различными способами, исходя из
4,4'-динитродифенилсульфида1 или из 4,4'-дихлордифенилсуль-
фона2'3. 4,4'-Диаминодифеннлсульфон был получен из соли суль-
финовой кислоты и галоидонитробензола1; из 4-ацетиламино-
бензолсульфонилхлорида и ацетанилида5; из ацетанилида и хло-
хлористого тионилае; из 4-нитро-4'-аминодифенилсульфида7; в резуль-
результате ацетилирования тиоанилииа D,4'-диаминодифенилсульфида)
с последующим окислением перекисью водорода8. 4,4'-Диацетил-
аминодифенилсульфон, полученный по одному из указанных выше
способов, легко подвергается гидролизу с отщеплением ацетиль-
ацетильного остатка 7'8. Метод, до некоторой степени аналогичный опи-
описанному выше, был запатентован9.
1 F г о m m, W i t t m a n n, Ber., 41, 2270 A908).
2 I. G. Farbeninduslrie A.-G., англ. пат. 506227 [C. A., 33, 9328A939)].
2 I. G. Farbenindustrie A.-G., франц. пат. 829926 [С. А., 33, 1760A939)].
4 S с h e r i n g A. G., англ. пат. 510127 [С. А., 34, 4079 A940I.
6 Kereszty, Wolf, венг. пат. 120021 [С. А., 33, 4600 A939)].'
6 S u g a s a w a, S a k u r a i, J. Pharm. Soc. Japan 60 22 A940)
[C. A., 34, 3704 A940)].
' Raiziss, Clemence, Severac, Moetsch, J. Am. Chern.
Soc, 61, 2763 A939).
8 Van Arendonk, Kleiderer, J. Am. Chem. Soc. 62,
3521 A940).
• Roblyn, Williams, ам. пат. 2227400 [С. А., 35, 2531 A941)].
1,2-ДИАМИНО-4-НИТРОБЕНЗОЛ
NH.
Ano
NH2
'2 NH4OIJ м
f3H2S ¦ > I
NO,
N02
Предложили: К. Гриффин и В. Петерсон.
Проверили: Н. Дрэйк, Р. Мозинго и Дж. Уильяме.
Получение
В 5-литровую трехгорлую колбу, снабженную механической ме-
мешалкой, обратным холодильником, термометром и трубкой для
ввода газа, доходящей до дна колбы (примечание 1), помещают
смесь 238 г A,3 моля) 2,4-динитроанилипа («Сипт. орг. преп.»,
163
сб. 2, стр. 223), 2 400 ми 95°6-ного этилового спирта и 1 200 мл
концентрированного водного аммиака (уд. вес 0,90).
Смесь нагревают до 45° и, поддерживая температуру в интер-
интервале между 45 и 55°, при энергичном перемешивании пропуска-
пропускают через нее сероводород (примечания 2 и 3). Взвешенные частицы
2,4-динитроанилина, окрашенные в желтый цвет, медленно рас-
растворяются и образуют раствор интенсивно красного цвета. Реак-
Реакцию можно считать законченной, когда все желтые частицы ис-
исчезнут; восстановление должно завершиться по истечении
30 мин. — 1 часа (примечание 4). Реакционную смесь оставляют
на 16—18 час. в холодильном шкафу для полного выделения
вещества, которое образует мелкие, правильной формы кристаллы
тёмнокрасного цвета. 1,2-Диамиио-4-нитробепзол фильтруют с
отсасыванием, промывают 150—250 мл холодной воды и досуха
отсасывают на воронке (примечание 5).
Для очищения сырого продукта его растворяют в кипящей
смеси 900 мл воды и 110 мл концентрированной соляной кислоты
(уд. вес 1,19) и затем горячий раствор фильтруютс отсасыванием че-
через слог! активированного березового угля. Уголь промывают кипя-
кипящей смесью 90мл воды и 10 мл концентрированной соляной кислоты
и промывную жидкость прибавляют к основному раствору. Еще
горячий фильтрат обрабатывают 100 мл концентрированного вод-
водного аммиака (уд. вес 0,90). Выпавший в осадок 1,2-диамино-
4-нитробеызол отфильтровывают от горячего раствора на ворон-
воронке Бюхнера, здесь же промывают 150 мл воды и сушат в сушиль-
сушильном шкафу при 40—50°. Выход очищенного вещества с т. пл.
197—198° составляет 105—115 г E2—58% теоретич.).
Примечания
1. Трубка для ввода газа должна иметь в диаметре около 15 мм.
2. Во время реакции выделяется тепло, поэтому для того,
чтобы поддерживать заданную температуру, необходимо время
от времени охлаждать колбу струей холодной воды.
3. Сероводород следует пропускать с максимальной скоростью,
при которой все еще имеет место полное поглощение.
4. Выделение вещества может начаться в течение нескольких
последних минут.
5. При упаривании маточного раствора можно выделить только
несколько граммов вещества (8—10), представляющего собой смесь
1,4-диамино-2-нитробензола и 1,2-диамино-4-нитробензола.
Другие методы получения
1.2-Диамино-4-нитробензол может быть получен частич-
частичным восстановлением 2,4-динитроанилина в спиртовом растворе
11*
164
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
3,12-ДИЛЦЕТОКСИ-бшжор-ХОЛАНИЛДИФЕ НИЛ ЭТИЛЕН
165
гидросульфидом натрия г или сернистым аммонием 2-3. Описанная
здесь методика является видоизменением способа, предложенного
Керманом3.
1 В г a n d, J. prakt. Chem., B), 74, 471 A907).
2 Heim, Bcr., 21, 2305 A888).
3 К e h r m a n n, Ber., 28, 1707 A895).
3,12-ДИАЦЕТОКХИ-#исиор-ХОЛАНИЛДИФЕНИЛЭТИЛЕН
CH3
CH (CHS) CH2CH2CO2H
HO
H3C
HO!
CH3COC1
\/\/
CH3OH
HOI
н3с
HO
CH3
CH (CH3
/\
CeH5MgBr
CH3
CH (CH3) CH2CH2COH (C6H5J
HO
/\
/\
(CH3COJO+CHSCO2H
\/\
CH»
СН3СО2 ...
Н3С
\
CH (CH3) CH2CH = С (CeH5J
/\
СНз.
Предложили: Б. Ригель, P. Моффетт и А. Мак-Интош.
Проверили: Р. Тзрнер и Л. Физер.
Получение
Метиловый эфир дезоксихолевой кислоты. К охлажденному
раствору 100 г @,255 моля) дезоксихолевой кислоты (примечание 1)
в 1 л метилового спирта осторожно приливают 50 мл хлористого
ацетила. Раствор оставляют на ночь при комнатной температуре
(примечание 2), после чего разбавляют его холодной водой до тех
пор, пока не начнет появляться муть. Иногда, чтобы вызвать кри-
кристаллизацию, приходится потереть стенки сосуда стеклянной па-
палочкой или внести в раствор затравку. После того как большая часть
метилового эфира дезоксихолевой кислоты закристаллизуется,
смесь еще более разбавляют, доводя ее объем до 2 500 мл, и оста-
оставляют стоять в течение получаса, пока кристаллизация не закон-
закончится полностью. Препарат отфильтровывают, промывают водой
и сушат. Выход составляет 100—103 г (97—100% теоретич.);
т. пл. 95—100° (примечание 3).
3,12-Диацетокси-биснор-холанилдифенилэтилен. В 5-литровой
трехгорлой колбе, снабженной капельной воронкой, эффектив-
эффективным обратным холодильником и механической мешалкой, при-
приготовляют раствор фенилмагнийбромида из 97,2 г D грамматома)
магния, 675 г D50 мл, 4,3 моля) бромбензола и 1 250 мл абсолют-
абсолютного эфира1.
К раствору реактива Гриньяра прибавляют раствор 102 г
@,25 моля) метилового эфира дезоксихолевой кислоты в 700 мл
сухого бензола (примечание 4). Капельную воронку после нахо-
находившегося в ней эфира дезоксихолевой кислоты ополаскивают
сухим бензолом E00 мл), который приливают в реакционную колбу,
и смесь кипятят с обратным холодильником в течение 3 час. при
перемешивании. Затем смесь охлаждают и разлагают, выливая
бензольный раствор в сосуд, содержащий смесь 4 кг льда и 700 мл
концентрированной соляной кислоты. После тщательного взбалты-
взбалтывания жидкость расслаивается; слои разделяют и водный слой
экстрагируют два раза эфиром. Соединенные вместе эфирные
вытяжки промывают разбавленной соляной кислотой, водой,
5%-ным раствором едкого натра и вновь водой. Растворитель и
небольшое количество образовавшегося дифенила отгоняют с водя-
водяным паром; чтобы удалить дифенил, образовавшийся при получении
реактива Гриньяра, требуется около 5 час. Если нужно, то время
от времени образовавшиеся комки следует разламывать. Остаток,
содержащий неочищенный 3,12-диокси-яор-холанилдифенилкарби-
нол, охлаждают, отфильтровывают и сушат.
Неочищенный карбинол ацетилируют и дегидратируют, для чего
раствор его в смеси 1 л ледяной уксусной кислоты и 500 мл уксус-
уксусного ангидрида кипятят в течение 1 часа с обратным холодильни-
холодильником. Затем часть растворителя отгоняют до тех пор, пока объел
раствора в перегонной колбе не уменьшится примерно до 500 мл.
После стояния в течение ночи в охладительной смеси выпавшие
кристаллы 3,12-диацетокси-биснор-холанилдифенилэтилена от-
отфильтровывают и промывают уксусной кислотой. Выход со-
составляет 95—105 г F3,5—70% теоретич.); т. пл. 154—157'
1GG
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
(примечание 5). Полученный препарат обладает достаточной чи-
чистотой; его можно применять для получения иор-дезоксихолевой
кислоты (стр. 153). После одной перекристаллизации из ацетона
получают белые кристаллы с т. пл. 156—157,5°; температура пла-
плавления совершенно чистого препарата 159,5—160,5°.
Примечания
1. Следует применять дезоксихолевую кислоту высокого ка-
качества.
2. Если после стояния раствора в нем окажется некоторое ко-
количество нерастворимых примесей, то раствор следует профиль-
профильтровать.
3. Полученный метиловый эфир дезоксихолевой кислоты до-
достаточно чист для большинства целей, однако при желании его
можно перекристаллизовать из метилового спирта или из смеси
этилового эфира с петролейным эфиром.
4. Для получения раствора метилового эфира дезоксихолевой
кислоты в сухом бензоле целесообразно растворить препарат
в 900 мл обыкновенного бензола и отогнать избыток раство-
растворителя.
5. Можно получить дополнительно 5—7 г вещества, если филь-
фильтрат упарить и остаток перекристаллизовать из ацетона. Если
препарат предназначается для получения нор-дезоксихолевой
кислоты (стр. 1F3), то удобнее окислять хромовой кислотой непо-
непосредственно фильтрат, а затем выделять вещество в виде кис-
кислоты.
Другие методы получения
Имеющиеся в литературе методы получения 3,12-диацстокси-
быснор-холанилдифеннлэтидена те же, что и приведенные при
описании получения нор-дезоксихолевой кислоты (стр. 155).
1 А л л е н, К о н в е р с, Спит. орг. преп., сб. 1, стр. 207.
ДИБЕНЗОИЛМЕТАН
167
ДИБЕНЗОИЛМЕТАН
G,3-Дифенил-1,3-пропандион)
ONa
С6НьСО2С2Н5 + СН3СОС0Н5 |-NaOC2H5 ->
ONa
5C = CHC0C6H5
H2SO4 -> C6H5COCH2COC6H5 + NaHSO4
Предложили: А. Маньяни и С. Мак-Эльвен.
Проверили: Р. Шрайнер и Ф. Вольф.
Получение
В сухую 2-литровую трехгорлую колбу помещают 600 г D мо-
моля) свежеперегна иного этилового эфира бензойной кислоты и 60 г
@,5 моля) свежеперегна иного ацетофенона (примечание 1). Колбу
снабжают мешалкой с ртутным затвором, причем эта мешалка
должна быть достаточно мощной, чтобы перемешивать реакцион-
реакционную смесь даже тогда, когда она станет очень вязкой (примеча-
(примечание 2). К одному из горл колбы присоединяют обращенный вниз
холодильник, а в качестве приемника применяют склянку для от-
отсасывания емкостью 500 мл. Этот приемник присоединяют к водо-
водоструйному насосу через предохранительную склянку, снабженную
резиновой пробкой с двумя отверстиями, причем одно из них
остается открытым. Реакционную колбу нагревают па масляной
бане при 150—160° и, когда смесь нагреется, прибавляют к
ней через чретье горло колбы 44 г @,65 моля) этилата натрия
(примечание 3) порциями по 1—2 г. Прибавлять этилат натрия
удобно с помощью ложки, которая могла бы проходить в горло
колбы, или же с помощью большой воронки с короткой нож-
ножкой, которую вставляют в горло и через которую этилат про-
проталкивают небольшой стеклянной палочкой или шпателем из
проволоки. Реакционная смесь немедленно окрашивается в оран-
оранжевый цвет. После прибавления первых же порций этилата на-
натрия начинает отгоняться спирт; с этого момента отгонка спирта
протекает энергично. Прибавлять этилат натрия следует с такой
скоростью, с какой это допускает процесс выделения спирта.
Чтобы пары спирта не выходили через третье горло колбы и не
мешали прибавлению этилата натрия, во время этой операции
через колбу пропускают слабый ток воздуха с помощью водоструй-
водоструйного насоса, к которому присоединен рриемпик (примечание 4).
После того как весь этилат будет прибавлен B0—30 мин.) жела-
тинообразную реакционную смесь перемешивают до тех пор, пока
168
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
не прекратится отгонка дестиллата A5—30 мин.).Выход дестил-
лата составляет 38—45 г (примечание 5).
Масляную баню отставляют и, продолжая перемешивание,
охлаждают реакционную смесь до комнатной температуры холод-
холодной проточной водой. Затем, чтобы растворить реакционную
массу, к ней прибавляют 150 мл воды и оба слоя переносят
в делительную воронку. После этого к содержимому воронки
прибавляют охлажденный до 0° раствор 25 мл концентрирован-
концентрированной серной кислоты в 200 мл воды и смесь энергично взбалтывают.
Эфирный слой отделяют и промывают 200 мл воды; затем его по-
последовательно взбалтывают с несколькими порциями 5%-ного
раствора двууглекислого натрия по 200 мл до тех пор, пока не пре-
прекратится выделение углекислого газа, после чего промывают 20 мл
воды. Раствор двууглекислого натрия отделяют и экстрагируют
100 мл эфира (примечание 6). Эфирные вытяжки промывают 50 мл
воды и присоединяют к сложному эфиру. Полученный эфирный
раствор сушат над 40 г хлористого кальция. Эфир отгоняют на во-
водяной бане, а избыточный этиловый эфир бензойной кислоты уда-
удаляют перегонкой в вакууме. Количество выделенного обратно
эфира бензойной кислоты с т. кип. 80—83° (8 мм) составляет 475—
490 г. После его отгонки медленно повышают температуру масля-
масляной бани до 180—185°, поддерживая в приборе давление, равное
8 мм. При этом отгоняется небольшое количество жидкости, тем-
температура которой выше, чем температура кипения эфира бензой-
бензойной кислоты. Когда отгонка дестиллата при этой температуре
прекратится, оставшееся масло, пока оно еще не остыло, перели-
переливают в коническую колбу емкостью 500 мл и оставляют кристаллизо-
кристаллизоваться. Количество неочищенного дибензоилметана составляет
92—108 г; обычно препарат бывает окрашенным в бурый цвет. С
целью перекристаллизации вещество растворяют в 150 мл горячего
метилового спирта, добавляют к раствору 1 г активированного бе-
березового угля, фильтруют и охлаждают фильтрат до 0° (примеча-
(примечание 7). Выход дибензоилметана, полученного таким образом в виде
желтых кристаллов ст. пл. 77—-78° (примечание 8), составляет
70—80 г F2—71% теоретич., считая на ацетофенон).
Примечания
1. Как прибор, так и все реагенты необходимо тщательно высу-
высушить.
2. Удобно пользоваться мешалкой из толстой стеклянной палоч-
палочки, согнутой по форме колбы. Смесь получается слишком вяз-
вязкой для того, чтобы ее можно было перемешивать с помощью
мешалки Гершберга.
3. Этилат натрия должен быть свежеприготовленным, согласно
указаниям, приведенным при описании синтеза ацетилацетона
тпранс-ДИБЕНЗОИЛЭТИЛЕН
169
(стр. 94). Хранить препарат необходимо в плотно закупоренной
склянке; работать с ним следует быстро.
4. Скорость прохождения воды через насос регулируют таким
образом, чтобы не допустить создания заметного вакуума в реак-
реакционной колбе при закрытом боковом горле, через которое приба-
прибавляют алкоголят.
5. Количество этого дестиллата зависит отчасти от скорости
просасывания воздуха через прибор. Если в приборе будет создан
заметный вакуум, то возможно, что дестиллат будет содержать
небольшое количество ацетофенона.
6. При подкислении водного слоя двууглекислого натрия
можно получить 20—25 г бензойной кислоты.
7. Если препарат все же будет окрашен в темный цвет, то его
можно очистить перекристаллизацией из 400 мл 90%-ного мети-
метилового спирта, обесцвечивая растворе помощью активированного
березового угля. При любом методе перекристаллизации из ма-
маточного раствора можно выделить 4—6 г препарата более низ-
низкого качества.
8. Иногда получают кристаллы, плавящиеся при 71—72°, при-
причем по истечении некоторого времени их температура плавления
повышается и достигает температуры плавления высокоплавкой
формы.
Другие методы получения
В дополнение к методам получения дибензоилметана, пере-
перечисленным в «Синт. орг. преп.», сб. 1, стр. 188, можно упо-
упомянуть об образовании этого соединения при действии на неко-
некоторые эфиры бензойной кислоты этилатом натрия1.
1 Magnani, М с Е 1 v a i п, J. Am. Chem. Soc, 60, 813 A938).
/яраяс-ДИБЕНЗОИЛЭТИЛЕН
G,4-Дифенил-2-бутен- 7,4-дион)
НССОС1 НССОС„Н6
II А1С1г II
асосн +2С6н6 > с6нйсосн +гна
Предложил: Р. Лютц.
Проверили: Ч. Аллен и Ф. Пингерт.
Получение
В 3-литровую трехгорлую колбу, снабженную механической
мешалкой, капельной воронкой (примечание 1), содержащей
153 г A моль) хлорангидрида фумаровой кислоты (стр. 464)
170
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
и обратным холодильником (примечание 2), помещают 1 800 мл
бензола (примечание 3) и 350 г тщательно измельченного безвод-
безводного хлористого алюминия B,6 моля; примечание 4). К обратному
холодильнику присоединяют ловушку для поглощения хлористого
водорода («Синт. орг. преп.», сб. 2, стр. 78, рис. 3).
Реакционную массу тщательно перемешивают и нагревают
в бане с горячей водой E0—60°; примечание 5); затем баню отста-
отставляют и приливают к смеси хлорангидрид фумаровой кислоты
с большой скоростью, ограниченной лишь необходимостью избе-
избежать слишком быстрого выделения хлористого водорода; прили-
прилипание продолжается в течение 15—25 мин. (примечание 6 и 7).
Смесь окрашивается в тёмнокрасный цвет, и температура ее
быстро достигает температуры кипения. Происходит энергич-
энергичное выделение хлористого водорода. После этого смесь
поддерживают при слабом кипении в течение 10 мин., переме-
перемешивая ее.
Пастообразную смесь, окрашенную в красный цвет, выливают
по частям в сосуд, содержащий 4 кг колотого льда, к которому
прибавлено 75 мл концентрированной соляной кислоты, причем
перед выливанием каждой следующей порции реакционную массу
в колбе тщательно перемешивают, чтобы не давать комплексу,
содержащему хлористый алюминий, оседать на дно. Остаток
в колбе разлагают, прибавляя к нему некоторое количество
льда и воды.
Через 20—30 мин. к содержимому сосуда прибавляют очень
горячую воду (примечание 8), чтобы вызвать таяние оставшегося
льда и расплавление выкристаллизовавшегося бензола и вообще
чтобы поднять температуру смеси. Основную массу водного слоя
отбрасывают, отсосав ее с помощью стеклянной трубки, соеди-
соединенной со склянкой для отсасывания. Бензольный слой промы-
промывают не менее четырех раз горячей водой (примечания 8 и 9).
Под конец теплый бензольный слой переносят в большую дели-
делительную воронку, отдельные корки дибензоилэтилена, пристав-
приставшие к различным частям прибора (примечание 10), растворяют
в горячем бензоле и растворы соединяют вместе; небольшой вод-
водный слой отделяют и отбрасывают. Горячий бензольный слой
фильтруют, собирая фильтрат в 3-литровую круглодонную колбу;
'фильтрование производят через стеклянную воронку большого
размера или через воронку Бюхнера с отсасыванием. Основную
массу растворителя отгоняют, прибавив к раствору несколько
кусочков битой фарфоровой тарелки, на паровой или кипящей
водяной бане. Большую часть оставшегося растворителя удаляют
в вакууме водоструйного насоса, нагревая раствор до тех пор,
пока сиропообразная жидкость не начнет внезапно кристалли-
кристаллизоваться (примечание 11). На этой стадии нагревание и отсасы-
отсасывание прекращают и быстро прибавляют к массе 125 мл 95%-ного
транс-ДИБВНЗОИЛЭТИЛВН
171
этилового спирта, перемешивая ее деревянным шпателем, чтобы
разбить все комочки. Колбу охлаждают в течение нескольких
минут под краном и отделяют светложелтый препарат на воронке
Бюхнера диаметром около 125 мм. Твердое вещество размешивают
на воронке в течение 10 мин. с холодным спиртом, чтобы
удалить маточный раствор, а затем отсасывают как можно
суше.
Выход составляет 186—197 г G8—83% теоретич.; примеча-
примечание 11); т. пл. 109—110° (примечания 12 и 13).
Примечания
1. Капельную воронку следует предпочесть обычной дели-
делительной, так как скорость прибавления хлорангидрида фумаро-
фумаровой кислоты имеет большое значение.
2. Применение холодильника с форштоссом большого диаметра
способствует более быстрому течению реакции, что благоприят-
благоприятствует увеличению выхода и улучшению качества конечного
вещества.
3. При проверке синтеза был применен бензол, не содержа-
содержащий тнофена, с т. пл. 5°. В этом случае был получен препарат луч-
лучшего качества, чем при использовании продажного бензола.
Большой избыток бензола берется для того, чтобы облегчить
перемешивание.
4. Пригоден дважды возогнанный хлористый алюминий;
последний не требует дальнейшего измельчения. Избыток хло-
хлористого алюминия сверх требующихся по реакции 2 молей обес-
обеспечивает полноту протекания процесса и получение неокрашен-
неокрашенного препарата.
5. Если смесь не нагреть до прибавления хлорангидрида
фумаровой кислоты, то реакция будет протекать вяло; когда тем-
температура смеси, наконец, повышается, накопившийся хлорангид-
хлорангидрид и промежуточные продукты реагируют настолько бурно, что
происходит вспенивание и реакционная масса выбрасывается
из колбы.
6. Если почему-либо перемешивание будет прервано, при-
прибавление хлорангидрида фумаровой кислоты необходимо немед-
немедленно прекратить; снова пускать в ход мешалку следует с большой
осторожностью.
7. Чем меньше продолжительность прибавления, тем выше ка-
качество полученного вещества и тем больше выход.
8. Желательно применение очень горячей воды: если бензоль-
бензольный раствор не будет действительно теплым E0—60°), то расслое-
расслоение происходит плохо и вещество с трудом растворяется. По этой
же причине используют горячую воду и при последующих про-
промываниях.
172
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
9. Первую и вторую порции промывных вод следует подкислить
25 мл концентрированной соляной кислоты, что облегчает рас-
расслоение.
10. Если была взята достаточно горячая вода и бензол дей-
действительно нагрелся E0—60°), то никаких корок не образуется.
11. Обычно количество вещества во второй порции не превыша-
превышало 8 г; однако если растворитель был удален не в достаточной
степени, то вторая порция может оказаться больше за счет соот-
соответствующего уменьшения первой порции. Общий выход составляет
194—205 г (82—86% теоретич.). Поэтому, если вес первой пор-
порции больше 190 г, обрабатывать маточные растворы нецелесооб-
нецелесообразно.
12. В некоторых опытах препарат при 106° слегка спекался,
но температура плавления его при этом не изменялась.
13. Вещество с более низкой температурой плавления, незави-
независимо от его происхождения, можно перекристаллизовать из 95%-
ного спирта C мл спирта на 1 г вещества).
Другие методы получения
траяс-Дибепзоилэтилен был получен по изложенному выше
методу1; нагреванием дибензоиляблочной кислоты2; конденсацией
бензоилформальдегида с ацетофеноном3; по реакции Фриделя—
Крафтса, исходя из хлорангидрида бензоилакриловой кислоты4.
Аналоги его можно получить из других ароматических углеводо-
углеводородов, например, из мезитилена гА6.9, применяя в качестве
растворителя сероуглерод, а также исходя из хлорангидридов
других кислот, как, например, из хлорангидридов мезаконовой6,
дибромфумаровой7 и диметилфумаровой8 кислот.
1 С о n a n t,
там же, 45, 2159
l
Lntz, J. Am. Chem. Soc, 45, 1305 A923); Oddy,
A923).
Paal, Schulze, Ber., 33, 3798 A900).
3 S m e d 1 e y, J. Chem. Soc, 95, 219 A909).
4 L u t z, J. Am. Chem. Soc, 52, 3432 A930).
5 С о n a n t, Liitz, J. Am. Chem. Soc, 47, 891 A925).
' L о t 7, Taylor, J. Am. Chem. Soc, 55, 1177 A933).
' L u t г, J. Am. Chem. Soc, 52, 3421 A930).
3 L u t z, Taylor, J. Am. Chem. Soc, 55, 1599 A933).
' Wcygand, Lanzcndorf, J. prakt. Chem., 151, 209 A938).
Т-ДИ-н-БУТИЛАМИНОПРОПИЛАМИН
у-ДИ-я-БУТИ Л АМИ НОПРОПИЛ АМИ H
{Н,Н-Ди-н-бутил-1,3-пропандиамин)
co
\
NCH2CH2CH2Br + 2(H-C4H,)aNH
со
173
4NCH2CH2CH2N (я-С4Н9J + (H-C4H9JNH2Br
/
СО
\
NCH2CH2CH2N (rt-C4H9J + 2HC1 + 2H2O
CO
H2N (CH2KN (н-С4НэJ • 2HC1
/Чсо,н
\/
CO2H
H2N(CH2KN(K-C4H9J-2HCl+2KOn
+ O + H2N(CH2KN(*-C4H9J
Предложили: Л. Амундсен и Дж. СэнЭерсон.
Проверили: Р. Шрайнер и Дж. РенЭалл.
Получение
В перегонной колбе емкостью 500 мл при нагревании раство-
растворяют 107 г @,4 моля) -["бр°мпР0ПИЛФталимиДа (примечание 1)
в 240 мл ксилола, после чего для удаления следов влаги отгоняют
24 мл ксилола. Раствор охлаждают, а затем переносят в 1-лит-
1-литровую круглодонную колбу со шлифом и обрабатывают 107 г
A40 мл, 0,83 моля) ди-«-бутиламина. К колбе присоединяют на
шлифе обратный холодильник и нагревают ее содержимое в тече-
течение 10 час, время от времени встряхивая колбу. Для нагревания
используют масляную баню, температуру которой поддерживают
при 140—150°.
Раствору дают охладиться и выделившуюся в результате реак-
реакции бромистоводородную соль ди-н-бутиламина отфильтровывают
с отсасыванием (примечание 2). Фильтрат переносят в перегонную
колбу емкостью 500 мл и отгоняют ксилол. Неочищенный -j-ди-
я-бутиламинопропилфталимид в виде масла бурого цвета переносят
в круглодонную колбу со шлифом емкостью 500 мл и обрабаты-
обрабатывают смесью 20мл воды и 120 мл 12 н. раствора соляной кислоты-
174
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Колбу соединяют на шлифе с обратным холодильником и раствор
нагревают в течение 6 час. на масляной бане, температуру которой
поддерживают при 140—150°. Затем раствору дают охладиться до
комнатной температуры, выпавшую в осадок фталевую кислоту
отфильтровывают и промывают четырьмя порциями холодной воды
по 25 мл. Соединенные вместе фильтраты переносят в стакан
емкостью 600 мл и нагревают на паровой бане, чтобы выпарить
воду и соляную кислоту.
Остаток—густое масло бурого цвета—представляет собой не-
неочищенную хлористоводородную соль у-ди-я-бутиламинопропил-
амина. Ее обрабатывают раствором 80 г едкого кали в 80 мл воды.
Над водным слоем, в котором содержится значительное количество
твердого хлористого калия, собирается бурое масло. Оба слоя
экстрагируют одной порцией бензола в 200 мл и двумя порциями
его по 50 мл (примечание 3.). Соединенные вместе вытяжки помеща-
помещают в коническую колбу емкостью 500 мл и сушат в течение ночи
над 50 г едкого кали.
Высушенные бензольные вытяжки помещают в круглодонную
колбу со шлифом емкостью 500 мл. К колбе присоединяют с по-
помощью шлифа елочный дефлегматор и от раствора отгоняют бен-
бензол при атмосферном давлении. Источником нагревания служит
масляная баня, температуру которой поддерживают при 100—
110°. Неочищенный 7~Ди-я-бутиламинопропиламин подвергают
фракционированной перегонке в вакууме из колбы Клайзена
емкостью 250 мл; колбу нагревают в масляной бане, температуру
которой поддерживают при 170—180°. Выход составляет 57—60 г
G7—80% теоретич.; примечание 4); т. кип. 108—110,5" E—6 мм)
[98—100% B мм)].
Примечания
1. 7-Бромпропилфталимид получают из фталимида калия и бро-
бромистого триметилена с выходом 78%, применяя молярные соот-
соотношения, указанные в методике получения у-бромэтилфталимида,
и придерживаясь приведенных п ней условий1. З-Бромпропилфтал-
имид можно получить также из фталимида, поташа и бромистого
триметилена3.
2. Получают около 55—58 г бромистоводородной соли ди-
н-бутиламина.
3. Увеличение объема первой порции составляет около
75 жл, тогда как обе порции по 50 мл почти не изменяются в
объеме.
4. Этот же метод был применен для синтеза у-диэтиламино-
пропиламина и у-ди-н-пропиламинопропиламина. При получении
указанным выше методом этих веществ выходы были соответствен-
соответственно равны 60 и 67% теоретического количества.
р-ДИ-н-ВУТИЛАМИНОЭТИЛАМИН
175
Другие методы получения
Описанная здесь методика основана на работах Сандерсона3.
1 Зальцберг, С у п н с в с к и й, Синт. орг. преп., сб. 1, стр. 143.
'Млеке, Скнт. орг. преп., сб. 2, стр. 84, примечание 5.
3 Sanderson, Диссертация, University of Connecticut, 1942.
р-ДИ-я-БУТИЛАМИНОЭТИЛАМИН
(N ,К-Дибутилэтилендиамин)
(C4H9JNCH2CH2Br-HBr + 2NH<> -» (C4HJ2NCH>CH2NH2-HBr + NH4Br
(C4H9JNCH2CH,NH2.HBr-rNa0H -> (CJI3JNCH,CH2NK2 + NaBr + H2O
Предложили: Л. Амундсен, К. Крантц и Дж. Сэндерсон.
Проверили: Р. Шрайнер и Дж. Рендалл.
Получение
Баллон с жидким аммиаком перевертывают вниз вентилем,
присоединяют к отводу баллона резиновую трубку, которая окан-
оканчивается стеклянной трубкой, и погружают последнюю в 325 мл
90%-ного этилового спирта, находящегося в конической колбе
емкостью 500 мл. Аммиак пропускают в спирт до тех пор, пока при-
привес не составит 41 г B,4 моля). Колбу время от времени охлаждают
в ледяной воде, для того чтобы ускорить поглощение аммиака.
В 1-литровую круглодонную колбу помещают 49 г @,16 моля)
бромистоводородного ди-я-бутиламиноэтилбромида («Синт. орг.
преп.», сб. 2, стр. 127, примечание 5) (примечание 1) и прибавляют
к нему спиртовой раствор аммиака. Колбу плотно закрывают и
оставляют стоять в течение 6 дней при комнатной температуре.
Затем раствор переносят в чашку и при перемешивании выпари-
выпаривают в вытяжном шкафу до получения кристаллической пасты.
Последнюю помещают в стакан емкостью 400 мл и прибавляют
к ней раствор 16 г едкого натра в 18 мл воды. Раствор расслаи-
расслаивается: верхний слой представляет собой бурое масло, а нижний—
содержит значительное количество нерастворенного бромистого
натрия. Чтобы растворить большую часть осадка, к смеси прибав-
прибавляют около 10 мл воды. Затем всю реакционную смесь экстраги-
экстрагируют тремя порциями бензола по 50 мл. Соединенные вместе
вытяжки помещают в колбу емкостью 250 мл и сушат в течение
ночи над 15 г поташа.
Высушенный бензольный раствор помещают в колбу емкостью
250 мл, снабженную дефлегматором высотой 30 см, и отгоняют
бензол при атмосферном давлении. Остаток фракционируют в ва-
вакууме из колбы Клайзена емкостью 50 мл с припаянным елочным
Дефлегматором высотой 15 еж и собирают фракцию, кипящую при
100—103°A3лш). Выход составляет 11—14,7гD1— 55% теоретич.;
примечание 2).
176
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
2,3-ДИГИДРОПИРАИ
177
Примечания
1. Можно и не выделять бромистоводородный ди-н-бутил-
аминоэтилбромид. Неочищенный препарат, полученный из 405 г
B,34 моля) ди-н-бутилэтаноламина, растворяют в 600 мл воды
и извлекают смолистые примеси тремя порциями бензола по
200 мл. Из очищенного раствора выпаривают около 400 мл воды
и к остатку прибавляют 2 800 мл спиртового раствора аммиака,
для приготовления которого применяют абсолютный этиловый
спирт. Концентрация спирта в реакционной смеси должна рав-
равняться 90% по отношению к воде. Выход составляет 114 г B8%
теоретич. из расчета на 405 г этаноламина). Общий выход при
использовании такой методики составляет 27%, считая на эта-
ноламин.
2. Авторы синтеза указывают, что по тому же методу были
получены диэтиламиноэтиламин и ди-н-пропиламиноэтиламин.
Другие методы получения
Ди-н-бутиламиноэтиламин был получен действием спиртового
раствора аммиака на бромистоводородный ди-н-бутиламиноэтил-
бромид1.
1 Amundsen, К г а п t г, J. Am. Chem. Soc, 63, 305 A941).
2,3-ДИГИДРОПИРАН
сн2
/ \
АЬОз HSC CH
I и +н2о
С С
НСН2ОН
I
Н2С
и
СН
Предложили: Р. Сойер и Д. Андрюс.
Проверили: Н. Дрэйк и Ч. Икер.
Получение
Реакцию проводят в нагреваемой в печи каталитической труб-
трубке аналогично тому, как это описали Хербст и Манске («Синт.
орг. преп.», сб. 2, стр. 313); отличие состоит лишь в том, что в на-
настоящем опыте аллонж Б (рис. 14, см. там же) не должен иметь
бокового отвода, а к выводному концу трубки присоединен охла-
охлаждаемый водой холодильник длиной 10 см, который ведет непо-
непосредственно к приемнику. Трубка наполнена активированной
окисью алюминия (примечание 1), которая с обоих концов удер-
удерживается стеклянной ватой.
Печь нагревают до 300—340° (примечание 2) и через капельную
воронку вводят в трубку 204 г A95 мл, 2 моля) тетрагидрофурфу-
рилового алкоголя (примечание 3) со скоростью 50мл в час. Продукт
реакции, собираемый в конической колбе, в которую предвари-
предварительно помещают 30 г прокаленного поташа, состоит из светло-
бурого масла и нижнего водного слоя. После того, как из реак-
реакционной трубки стечет вся жидкость, нижний водный слой отде-
отделяют и отбрасывают. Верхний слой фракционируют, пользуясь
небольшим дефлегматором, и собирают фракцию, кипящую при
70—86°. Последняя состоит из смеси воды и дигидропирана,
большая часть которого перегоняется при 83—86°. Остаток
B5—35 г) представляет собой главным образом неизменившийся
тетрагидрофурфуриловый -алкоголь (примечание 4).
Фракция, содержащая воду и дигидропиран, расслаивается.
Нижний водный слой отделяют и отбрасывают. Верхний слой,
состоящий из почти чистого дигидропирана, сушат над 5—6 г
безводного поташа, декантируют, кипятят, применяя обратный хо-
холодильник, в течение 1 часа с 2—3 г металлического натрия и пере-
перегоняют затем над натрием (примечание 5). Выход дигидропирана,
кипящего при 84—86°, составляет ПО—118 г F6—70% теоретич.).
Примечания
1. Было применено несколько различных сортов технической
активированной окиси алюминия. После 3—4 опытов катализа-
катализатор покрывается бурой смолой и выход дигидропирана падает.
Катализатор можно регенерировать, прогревая его в токе воздуха
при температуре красного каления до тех пор, пока не выгорит
смола. Проверявшие синтез применяли активированную окись
алюминия с размером зерна 8—14 меш. Катализатор с целью
регенерирования нагревали при 450° в слабом токе воздуха до
полного выгорания смолы.
2. Температуру измеряли термометром, который помещали
в печи вне стеклянной трубки. Температуру следует поддерживать
при 330—340°; лишь по краям печи, на расстоянии 10 см от обоих
концов, температура может быть равной 300—340°, в зависимости
от конструкции печи.
3. Согласно указаниям авторов синтеза, тетрагидрофурфури-
тетрагидрофурфуриловый алкоголь следует очистить перегонкой; была применена
фракция, кипящая при 79—80° B0 мм). Проверявшие синтез
применяли тетрагидрофурфуриловый алкоголь высшего каче-
качества без дополнительной очистки. Выходы были одинаково хоро-
хорошими.
4. Регенерированный тетрагидрофурфуриловый алкоголь при
стоянии приобретает желтый оттенок и для дальнейших опытов
непригоден. В случае его применения выход дигидропирана
178
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
падает до 36—38%, и катализатор приходится регенерировать
после каждого опыта.
5. Дигидропиран очень трудно поддается высушиванию. Даже
после такой обработки продукт часто содержит следы воды.
Другие методы получения
Изложенная выше пропись представляет собой в основном
описание метода, который разработал Поль1. Взаимодействие
бромистого тетрагидрофурфурила с амидом натрия ведет к обра-
образованию главным образом 1,4-эпокси-4-пентена и лишь неболь-
небольшого количества дигидропирана. 1,4-Эпокси-4-пентен при 380°
в присутствии окиси алюминия перегруппировывается с образова-
образованием дигидропирана2.
1 Р a u I, Bull. soc. chim., D), 53, 1489 A933).
2 Р a u 1, Bull. soc. chim., E), 2, 745 A935).
ДИ-р-КАРБЭТОКСИЭТИЛМЕТИЛАМИН
(Дизтиловый эфир $,$'-метилимино-бис-пропионовой кислоты)
CH3NH2+2CH2 = CHCO2C2H5 -> CH3N (СН2СН2СО2С2НбJ
Предложили: Р. Мозинго и Дж. Мак-Крекен.
Проверили: Ч. Аллсн и Дж. Дж.
Получение
В 2-литровую колбу, снабженную резиновой пробкой, в кото-
которую вставлены хлоркальциевая трубка с натронной известью
и стеклянная трубка, доходящая почти до дна колбы, помещают
325 г D20 мл) абсолютного этилового спирта. Прибор вместе с его
содержимым взвешивают, устанавливают в бане со льдом и при-
присоединяют трубку для ввода газа к источнику сухого метиламина.
Прибор для получения метиламина состоит из 1-литровой
колбы, снабженной капельной воронкой и отводной трубкой,
которая соединена с осушительной колонкой высотой 25 см,
наполненной натронной известью; колонка, в свою очередь, соеди-
соединена с 1-литровой предохранительной ловушкой (примечание 1).
В колбу помещают 200 г технического едкого натра в хлопьях
и медленно по каплям прибавляют к нему 263 г 33—35%-ного рас-
раствора метиламина в воде (примечание 2) с такой скоростью, что-
чтобы ток выделяющегося газа был равномерным. Когда прибавле-
прибавление метиламина будет закончено и газ начнет барботировать через
спирт очень медленно, колбу с ее содержимым отъединяют и взве-
взвешивают; увеличение в весе должно составлять 84—86 г B,71 —
2,77 моля; примечание 3).
ДИ-р-КАРСЭТОКСИЭТИЛМЕТИЛАМИН
179
Колбу снова погружают в баню со льдом и прибавляют к реак-
реакционной смеси 900—925 г E,4—5,5 моля в зависимости от количе-
количества метиламина) 60%-ного раствора этилового эфира акриловой
кислоты в этиловом спирте (примечание 4) порциями по 100 мл,
причем прибавление ведут с такой скоростью, чтобы температура
смеси не поднималась выше 40°; на проведение этой операции тре-
требуется около 10 мин. После каждого прибавления колбу закры-
закрывают пробкой, чтобы предохранить ее содержимое от действия
влаги. Когда весь эфир будет прибавлен, колбу закрывают рези-
резиновой пробкой и оставляют стоять в течение 6 дней (примечание 5).
Большую часть спирта отгоняют (в течение полутора часов) на
паровой бане, а остаток переносят в специальную колбу Клайзена
и перегоняют. Фракцию, кипящую ниже 50° B0 мм) (примечание 6),
отгоняют с помощью водоструйного насоса, а остаток перегоняют
с применением масляного насоса (при давлении 3 мм; примеча-
примечание 7). Фракция, кипящая при 105—108° C мм) (примечание 8),
представляет собой ди-|3-карбэтоксиэтилметиламин (примеча-
(примечание 9); выход составляет 519—550 г (83—86% теоретич.; примеча-
примечание 10).
Примечания
1. Применение предохранительной ловушки имеет большое
значение, так как спирт очень легко может засосаться обратно.
2. Был применен готовый раствор метиламина в воде C3—35%).
3. Значительно более удобно определить фактическое коли-
количество поглотившегося метиламина, чем добиваться точного
привеса.
4. Был применен этиловый эфир акриловой кислоты в виде-
его 60%-ного раствора в спирте. Раствор, содержащий ингиби-
ингибитор полимеризации, применяют без предварительной обработки.
Этот ингибитор удалять не следует.
5. Если продолжительность стояния сократить, то соответ-
соответственно понизится выход вещества.
6. Большая часть этого дестиллата перегоняется при темпе-
температуре масляной бани, равной 75°; под конец температуру повы-
повышают до 150°. Боковой отвод колбы Клайзена изолируют асбес-
асбестовым шнуром.
7. Весь образовавшийся этиловый эфир N-метил-р-амино-
пропионовой кислоты содержится в первой или средней фракции
F—8 мл). Среднюю фракцию собирают до 105° C мм) после пере-
перехода от водоструйного насоса к масляному. Прежде чем перейти
к более глубокому вакууму, масляную баню охлаждают до 100°.
8. Наблюдаемая температура кипения может быть различной
в зависимости от особенностей применяемого прибора. ;
9. Ввиду того что полученный сложный эфир во время пере-
перегонки отчасти разлагается, масляный насос следует защитить.
12*-
180
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
от действия этилового эфира акриловой кислоты и метиламина
с помощью ловушки с сухим льдом. Перегонку прерывать не
следует.
10. Ди-р-карбометоксиэтилметиламин можно получить с та-
таким же выходом, если в описанном выше методе применить экви-
эквивалентное количество раствора метилового эфира акриловой кис-
кислоты в метиловом спирте.
Другие методы получения
Ди-^-карбэтоксиэтилметиламин был получен действием эти-
этилового эфира [3-бромпропионовой кислоты на хлористоводородную
соль метиламина в присутствии окиси серебра1; действием метил-
метиламина на этиловый эфир акриловой кислоты2; нагреванием этило-
этилового эфира р-хлорпропионовой кислоты, метиламина и бензола
в автоклаве3.
1 McElvain J. Am. Chem. Soc, 46, 1724 A924).
2Morsch, Monatsh., 63, 229A933).
3 Герм. пат. 491877 [Frdl., 16, 2908 A931)] [С. Л., 24, 24S8 A930)}.
ДИМЕР КЕТЕНА
(Лцетилкетен; дикетен)
2СН2 = С = О -* СН,С = СН ;± СН3СОСН = С =
Предложили: Дж. Уильяме и Дж. Криницкий.
Проверили: Н. Дрэйк и Дж. Ланн.
Получение
Три промывные склянки емкостью по 300 'мл (примечание 1)
соединяют последовательно, причем во вторую и третью склянки
помещают по 150 мл сухого ацетона. Каждую из промывных скля-
склянок помещают в сосуд Дьюара, так чтобы они были погружены
наполовину в охлаждающую смесь, состоящую из сухого льда
и ацетона. Газообразный кетен, полученный пиролизом ацетона
(примечание 2), пропускают через склянки (примечание 3) до тех
пор, пока не будет поглощено 2 моля его, что занимает 4—4,5
часа. После того как от начала пропускания кетена пройдет пол-
полтора часа, охлаждающую смесь выливают из того сосуда Дьюара,
в котором находится первая склянка, а затем склянку вновь поме-
помещают в тот же холодный еще сосуд. Через 2 часа после того, как
будет закончено пропускание кетена, выливают охлаждающую
смесь из второго сосуда Дьюара, а еще через 6 час. — из третьего,
ДИМЕР КЕТЕНА
181
причем обе вынутые склянки немедленно помещают на прежнее
место. Вся система должна принять комнатную температуру че-
через 24 часа после начала опыта.
^Жидкое вещество из всех трех склянок соединяют вместе
и подвергают дробной перегонке (примечание 4). Большую часть
ацетона отгоняют при комнатной температуре и давлении 20 мм.
Последние следы его удаляют при атмосферном давлении. Когда
температура перегонки достигнет 120°, в системе создают вакуум
в 80—100 мм (примечание 5) и собирают димер кетена в пределах
67—69° (92 мм). Выход чистого вещества составляет 42—46 г
E0—55% теоретич.; примечания 6'И 7).
Примечания
1. Лучше пользоваться промывными склянками без закраинок.
Авторы синтеза применяли склянки, сделанные из трубок из
стекла пирекс диаметром 45 мм; высота склянок была 28 см,
они были снабжены пробками на стандартных шлифах. Трубки
для ввода газа были опущены на две трети высоты склянки.
2. Кетен удобно получать из ацетона, применяя «кетеновую
лампу»1. Этот прибор был использован как авторами синтеза,
так и проверявшими его. Можно применять также и другие прибо-
приборы («Синт. орг. преп.», сб. 1, стр. 226, рис. 10).
3. Газ, выходящий из третьей промывной склянки, следует
отводить в хорошо действующий вытяжной шкаф или пропускать
через промывную склянку с 10%-ным водным раствором едкого
натра.
4. Авторы синтеза и проверявшие его применяли колонку
типа Уитмора—Люкса (стр. 266, примечание 3).
5. Для такой перегонки давление в указанных пределах
является оптимальным. При более высоком давлении происходит
значительная полимеризация с образованием дегидрацетовой кис-
кислоты; при более низком давлении необходимо принимать специаль-
специальные меры для охлаждения дестиллата, чтобы предотвратить поте-
потери его вследствие испарения.
6. В перегонной колбе остается вязкий тёмнокрасный остаток,
состоящий в основном из дегидрацетовой кислоты.
7. Димер кетена может быть сохранен в герметически закры-
закрытой склянке в темном месте в течение недели без заметной даль-
дальнейшей полимеризации313.
Другие методы получения
Описанный процесс является видоизменением методики, кото-
которую предложили Чик и Уилсмор3 и которую разрабатывали мно-
многие другие исследователи2.
182
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Р,Р-ДИМЯТИЛАКРИЛОВАН КИСЛО.ТА
183
1 W i I I i a m s, Hurd, J. Org. Chem., 5, 122 A940).
2 a) H u г d, Sweet, Thomas, J. Am. Chem. Soc, 55, 335 A933);
6) Hurd, Williams, там же, 58, 962 A936); в) В о е s e, Ind. Eng.
Chem., 32, 16 A940).
3Chick, Wilsmore, J. Chem. Soc, 1908, 946; 1910, 1978.
P.g-ДИМЕТИЛАКРИЛОВАЯ КИСЛОТА
2(CH3JC=CHCO2K4-H2S04 -^ 2(CH3JC=CHCO2H+K2SO4
Предложили: Л. Смит, В. Причард и Л. Спиллен.
Проверили: Н. Дрэйк и Г. Анспон.
Получение
Круглодонную трехгорлую колбу емкостью 5 л снабжают мешал-
мешалкой с затвором Киридеса (стр. 225, примечание 1) и двумя
длинными обратными холодильниками и прибор собирают так,
чтобы в случае необходимости можно было быстро использовать
воду, выходящую из холодильника, для охлаждения колбы.
В колбу помещают 200 мл диоксана, 100 г A,02 моля) окиси
мезитила и раствор 4,6 моля хлорноватистокислого калия в 3 л
воды (примечание 1) и пускают в ход мешалку. Смесь немедленно
разогревается, и через 5 мин. из холодильников начинает стекать
хлороформ. Когда реакция делается слишком бурной, мешалку
останавливают и колбу охлаждают проточной водой (примеча-
(примечание 2). Перемешивание возобновляют, как только это становится
возможным, и продолжают его в течение 3—4 час. до тех пор,
тюка температура смеси не понизится до комнатной. Затем к со-
содержимому колбы прибавляют бисульфит натрия (около 5 г)
для того, чтобы раскислить избыток гипохлорита (примечание 3).
После этого один из холодильников заменяют капельной ворон-
воронкой и к реакционной смеси прибавляют при перемешивании и
охлаждении 50%-ную серную кислоту (около 200 мл) до кислой
реакции на конго. Когда раствор охладится, его экстрагируют
восемью порциями эфира по 400 мл (примечание 4). Эфирные
вытяжки осторожно перегоняют на паровой бане до тех пор,
пока не отгонятся эфир и хлороформ.
Остаток помещают в специальную колбу Клайзена (стр. 68)
и перегоняют при пониженном давлении. Диметилакриловая кис-
кислота отгоняется при 100—ЮГ B0 мм). Выход белого твердого
вещества составляет 49—53 г D9—53% теоретич.). Этот препарат
плавится при 60—65°. Его можно подвергнуть дальнейшей очи-
очистке перекристаллизацией из петролейного эфира (т. кип. 60—70°)
или из воды (примечание 5).
Примечания
1. Гипохлорит получают согласно указаниям, изложенным
в «Синт. орг. преп.» , сб. 2, стр. 352, примечание 2. Прежде чем
поместить в колбу, его следует охладить до 10°.
2. Колбу охлаждают лишь настолько, насколько это необхо-
необходимо для того, чтобы поддержать слабое кипение хлороформа.
Через полчаса реакция протекает уже достаточно спокойно, так
что дальнейшее охлаждение не является необходимым.
3. Можно считать, что бисульфит натрия прибавлен в доста-
достаточном количестве, когда несколько миллилитров раствора не
выделяют больше иода из слегка подкисленного раствора йодисто-
йодистого калия.
4. Весьма существенно при экстрагировании энергично встря-
встряхивать эфир с раствором.
5. При перекристаллизации из воды 48—50 г кислоты раство-
растворяют в 450 мл горячей воды. Раствор охлаждают в течение не-
нескольких часов на льду; кристаллический осадок отфильтровы-
отфильтровывают с отсасыванием и сушат в течение ночи в эксикаторе. Выход
чистой диметилакриловой кислоты, плавящейся при 66—67,5°,
составляет 35—40 г; выход при перекристаллизации составляет
70—83%.
Другие методы получения
Р,р-Диметилакриловая кислота была получена из различных
производных а-галоидизовалериановой кислоты путем отщепле-
отщепления галоида вместе с одним из р-атомов водорода i~'1; из производ-
производных р-оксиизовалериановой кислоты путем отщепления воды6"8;
действием изобутилата натрия на йодоформ9; конденсацией мало-
малоновой кислоты с ацетоном102; действием щелочи на 2,4-дибром-
2-метилбутанон 13, неполным озонированием форона14; действием
спиртового раствора едкого кали на 2,5,5,7-тетраметилокта-
2,6-диен-4-он15; действием хлористого алюминия на а,<х-диметил-
янтарный ангидрид16; конденсацией ацетоуксусного эфира с аце-
ацетоном и действием окиси бария на полученный продукт — изо-
пропилиденацетоуксусный эфир17; действием хлорновати-
хлорноватистых, бромноватистых и иодноватистых солей на окись мезити-
ла18-20
1 D u v i I I i с г, Compt. rend. , 88, 913 A879); Ann. chim. phys., E),
19, 428 A880); Bull. soc. chim., C), 3, 507 A890); C), 5, 848 A891).
2 Wei. nig, Ann., 280, 252 A894).
3 P e г k i n, J. Chem. Soc, 69, 1470 A896).
4 3 e p н о в, ЖРФХО, 32, 804 A900).
5 Friedman n, Bcitr. Chem. Physiol. Path., 11, 374 A908) [C. A.,
4, 3094' A910)].
«Земляницин, Зайцев, Ann., 197, 72 A879).
184
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
'Miller, Ann., 200, 261 A880).
«Neubauer, Ann., 106. 63 A858).
'Горбов, Кесслер, ЖРФХО, 19, 428A887).
10 D u t t, J. Indian Chem. Soc, 1, 297 A924).
11 M a s s о t, Bcr., 27, 1225 A894).
12 Knoevenagel, Chem. Zcntr., 1905, II, 726.
"Фаворский, Ваншейдт, ЖРФХО, 44, 1351 A912);
J. prakt. Chem., B), 88, 665 A913); A. E. Ф а в о р с к и н, Сборник избран-
избранных трудоп, Изд. АН СССР, 1940, стр. 247.
"Harries, Turk, Ann., 374, 347 A910).
;5 Deux, Compt. rend., 208, 522 A939).
" Desfontaines, Compt. rend., 134 293 A902).
Pauly, Ber., 30, 481 A897).
К о h n, Monatsh., 24, 770 A903).
Barbie r, Leser, Bull. soc. chim., C), 33, 815 A905).
"Cuculescn, Bull. Fac. Stiintc Cernauti, 1, 53 A927) 1С. A., 26,
1897 A932)].
Р-диметиламинопропиофенон солянокислый
CeH5COCH3 + CH2O + (CH3JNH2C1 —> C6H5COCH2CH2N(CH3J • HCl-rHaO
Предложил: Ч. Максвелл.
Проверили: Ч. Аллгн и Дж. Ван Аллан.
Получение
В круглодонную колбу емкостью 500 мл, соединенную с обрат-
обратным холодильником, помещают 60 г E8,5 мл; 0,5 моля) ацетофе-
нона (примечание 1), 52,7 г @,65 моля) солянокислого диметил-
амина и 19,8 г @,22 моля) параформальдегида. К смеси прибавляют
раствор 1 мл концентрированной соляной кислоты (уд. вес 1,19)
в 80 мл 95%-ного этилового спирта и затем кипятят ее в течение
2 час. на паровой бане (примечание 2). Желтоватый раствор филь-
фильтруют, если он не прозрачен (примечания 3 и 4), и переносят
в 1-литровую широкогорлую коническую колбу. Еще теплый,
раствор разбавляют 400 мл ацетона (примечание 5), дают ему
медленно охладиться до комнатной температуры, а затем поме-
помещают на ночь в холодильник. Большие кристаллы отфильтровы-
отфильтровывают и промывают 25 мл ацетона. После высушивания в течение
2,5 часа при 40—50е выход неочищенного вещества составляет
72—77 г F8—72% теоретич.); т. пл. 138—141° (примечания 6 и 7).
Препарат пригоден для многих реакций.
Полученное вещество можно перекристаллизовать, растворив
его в 85—90 мл горячего 95%-ного этилового спирта и медленно
прибавив к раствору 450 мл ацетона. Выход при перекристалли-
перекристаллизации составляет около 90%. Очищенное вещество, высушенное
при 70°, плавится при 155—156° (примечания 8 и 9).
р-ДИМЕТИЛАМИНОПРОПИОФЕНОН СОЛЯНОКИСЛЫЙ
185
Примечания
1. Были применены ацетофенон с т. пл. 19—20° и практически
чистый солянокислый диметиламин (см. «Синт. орг. преп.», сб. 2,
стр. 26, подстрочное примечание).
2. Реакционная смесь, состоящая в начале из двух слоев,
вскоре становится гомогенной, и параформальдегид растворяется.
3. Фильтровать следует быстро; лучше применять воронку
с обогревом. Если часть вещества закристаллизуется в приемни-
приемнике, его вновь переводят в раствор нагреванием на паровой бане.
4. Другой способ состоит в том, что реакционную смесь сразу
охлаждают и отфильтровывают твердое вещество. Фильтрат три-
трижды последовательно концентрируют и охлаждают, причем
каждую порцию кристаллов промывают ацетоном. Например,
в одном из опытов, где было взято 480 г ацетофенона, полученные
количества вещества составляли соответственно 297, 92, 53 и 16 г;
кроме того, 42 г было выделено из ацетона, служившего для про-
промывания. Общий выход составлял, таким образом, 500 г, или 66%
теоретического количества.
5. Избыток солянокислого диметиламина остается в ацетоне
в растворенном состоянии.
6. Вещество несколько гигроскопично и упорно удерживает
следы воды. Присутствие влаги ведет к понижению температуры
плавления; обычно наблюдается предварительное спекание кри-
кристаллической массы.
7. Если сушить вещество дополнительно в течение 4 час,
то оно будет плавиться при 152—153°. Препарат плавится при
той же температуре, если его выдержать в течение 60 час. в вакуум-
эксикаторе, однако в этом случае предварительного спекания
не наблюдается.
8. Эти указания вполне применимы также и к опытам с боль-
большими исходными количествами.
9. Если взять солянокислый диэтиламин, то образуется р-ди-
этиламинопроп иофенон.
Другие методы получения
Описанная методика является примером проведения общей
реакции (реакции Манниха) i-z, обзор которой с эксперименталь-
экспериментальной точки зрения был недавно опубликован3.
1 М a n n i с h, Heilner, Ber., 55, 359 A922).
2 В 1 i с к е, В и г с k h a 1 t e r, J. Am. Chem. Soc, 64, 453 A942).
3 Блик, Органические реакции, сб. 1, Издатинлит, 1948, стр. 399.-
186
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
О
2,3-ДИМЕТИЛАНТРАХИНОН
О
о
\/\У
II
о
СН2 = С-СН3
сн, = с-сн3
\/
\/\/\\/
!СН3 спирт. КОН
сн.
II
о
II
о
Предложили: Ч. Аллен и А. Белл.
Проверили: Р. Шрайнер и Дж. Робинсон мл.
Получение
В 1-литровой круглодонной колбе, соединенной с эффективным
• обратным холодильником, кипятят в течение 5 час. раствор 80 г
@,5 моля) 1,4-нафтохинона («Синт. орг. преп.», сб. 1, стр. 286)
и 80 г A моль) 2,3-диметилбутадиена-1,3 (стр. 187) в 300 мл спирта.
Смесь охлаждают и помещают на 10—12 час. в холодильный шкаф.
Затем кристаллическую массу разбивают шпателем, продукт при-
присоединения отфильтровывают и промывают 50 мл холодного спир-
спирта. Полученный препарат имеет вид бесцветных легких кристаллов;
т. пл. 147—149° (примечание 1). Выход составляет 116 г
¦ (96% теоретич., считая на 1,4-нафтохинон).
Реакцию дегидрогенизации проводят следующим образом.
В 1-литровой трехгорлой колбе, снабженной обратным холо-
холодильником и трубкой для ввода газа, растворяют 40 г получен-
полученного, как указано выше, продукта присоединения в 600 мл 5%-но-
го спиртового раствора едкого кали (примечание 2). В течение
суток через раствор пропускают ток воздуха; при этом выде-
выделяется значительное количество тепла и вскоре первоначальный
зеленый цвет раствора меняется на желтый. Выделившийся хинон,
окрашенный в желтый цвет, отфильтровывают с отсасыванием
и промывают сперва 200 мл воды, затем 100 мл спирта и, наконец,
50 мл эфира. Выход воздушносухого препарата составляет
36,5—37,5 г (94—96% теоретич.); т. пл. 209—210° (примеча-
(примечание 3). Общий выход в обеих стадиях составляет 90% (приме-
(примечание 4).
Примечания
1. Обычно продукт присоединения бывает пригодным для
использования в следующей стадии. С целью очистки вещество
можно перекристаллизовать из ацетона и этилового или метидо-
2,3-ДИМЕТИЛБУТАДИЕН-1,3
187
вого спирта, после чего оно плавится точно при 150°. Если неочи-
неочищенный препарат окрашен в темный цвет, то его следует перекри-
перекристаллизовать с применением угля для обесцвечивания.
2. Для получения спиртового раствора щелочи 30 г едкого
кали растворяют в 570 мл 95%-ного этилового спирта.
3. Значения температур плавления, приведенных в литературе,
находятся в интервале от 1831 до 208°2.
4. Почти тот же выход (в процентах) был получен также и
в опытах с утроенными количествами указанных выше исходных
реагентов.
Другие методы получения
2,3-Диметилантрахинон был получен циклизацией соответ-
соответствующей о-бензоилбензойной кислоты1; окислением соответ-
соответствующего антрона4; из 2-хлор- и 2,3-дихлор-1,4-нафтохинона
и 2,3-диметилбутадиена-1,3 под действием едкого натра5; из 2-ме-
тил-1,4-нафтохинона и 2,3-диметилбутадиена-1,3 с последующей
дегидрогенизацией с помощью серы8. В литературе описано также
получение продукта присоединения, упомянутого в прописи,
однако с применением большого избытка углеводорода7.
1 Е 1 b s, Emich, Ber., 20, 1361 A887); J. prakt. Chem. B), 41, 6
A890).
2 H с 1 1 с г, Вег., 43, 2891 A910).
3 Fairbourne, J. Chem. Soc, 119, 1573 A921).
HimpricH, Martens, Ann., 312, 103 A900).
6 I. Q. Farbenindustrie A.-G., герм. пат. 500160 [Frdl., 17, 1143 A932);
С. А., 24, 4790 A930)].
«Ficser, Seligman, J. Am. Chem. Soc, 56, 2690 A934).
'Fieser, Webber, J. Am. Chem. Soc, 62, 1362 A940).
2,3-ДИМЕТИЛ БУТАДИЕН-1,3
СПОСОБ ПОЛУЧЕНИЯ С ПРИМЕНЕНИЕМ БРОМИСТОВОДОРОДНОЙ КИСЛОТЫ
он
I
СН3 —С —СН3 НВг СНз —С=СН2
I I +(СН3KС-СОСНз
СНз — С — СН3 СНз — С = СНз (Побочный продукт)
Н
Предложили: Ч. Аллен и А. Белл.
Проверили: Р. Шрайнер и Дж. Робинсон мл.
Получение
В 2-литровую круглодонную колбу, снабженную ректифика-
ректификационной колонкой с насыпной насадкой (примечание 1), помещают
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
2,3-Д ИМ Е ТИ ЛБУ ТАД ИЕН-1,3
189
смесь 354 г C моля) пинакона (примечание 2) и 10 мл продажной
48%-ной бромистоводородной кислоты. В колбу прибавляют
несколько кусочков битой глиняной тарелки и медленно на-
нагревают ее содержимое на бесцветном пламени горелки высо-
высотой около 75 мм (примечание 3). Дестиллат собирают до тех пор,
пока температура не достигнет 95°; если перегонку вести со ско-
скоростью 20—30 капель в минуту, то для этого потребуется около
2 час.
Верхний органический слой промывают дважды водой пор-
порциями по 100 мл и прибавляют к нему 0,5 г гидрохинона. Препа-
Препарат сушат в течение ночи над 15 г безводного хлористого кальция
и подвергают дробной перегонке с той же колонкой, но из 1-лит-
1-литровой колбы; отбирают фракции, указанные ниже (примечание 4).
Фракции
2,3-Диметилбу тадиен
Промежуточная фракция
Пинаколин
Остаток
Т. шга..
°с
69—70,5
70,5—105
105—106
Выход
3
135—147
10—15
66—75
7-8
О/
55—60
22-25
Примечания
1. Вполне пригодна колонка, описанная на стр. 406, с насадкой
из одиночных витков стеклянной спирали и с асбестовой изоля-
изоляцией. В качестве насадки можно применить также зерна карбо-
карборунда, однако в этом случае для перегонки потребуется больше
времени. Через холодильник, находящийся в головке колонки,
пропускают ток холодной воды.
2. Можно применять как продажный пинакон, так и получен-
полученный дегидратацией пинакон-гидрата. Дегидратацию удобно про-
проводить следующим образом. К 1 кг пинакон-гидрата («Синт. орг.
преп.», сб. 1, стр. 342) прибавляют 2 л бензола, после чего произ-
производят отгонку смеси воды с бензолом. Нижний слой отделяют,
а верхний бензольный слой снова помещают в перегонную колбу
и повторяют перегонку до тех пор, пока бензольный дестиллаг
не станет прозрачным. Безводный пинакон подвергают перегонке
и собирают фракцию с т. кип. 168—173°. В зависимости от качества
исходного материала из 1 кг пинакон-гидрата получается около
500 г безводного пинакона.
3. Если пламя будет слишком большим, то колонка «захлеб-
«захлебнется», т. е. насадка колонки полностью или частично зальется
флегмой.
4. 2,3-Диметилбутадиен не претерпевает заметных изменений
при хранении в течение некоторого времени в холодильном шкафу.
Если препарат пе предполагают использовать в течение ближай-
ближайшего времени, то рекомендуется прибавить к нему в качестве ин-
ингибитора небольшое количество гидрохинона.
СПОСОБ ПОЛУЧЕНИЯ С ПРИМЕНЕНИЕМ ОКИСИ АЛЮМИНИЯ
Предложили: Л. Ньютон и 9. Кобурн.
Проверили: Н. Дрэйк и Р. Толлефсон.
Получение
Колбу Клайзена с обычным капилляром для поступления воз-
воздуха присоединяют к трубке из стекла пирекс (примечание 1),
которая оттянута с одного конца и наполнена окисью алюминия
в кусочках размером 8 меш (примечание 2). Трубку помещают в
трубчатую электрическую печь (примечание 3), с помощью которой
температуру можно поддерживать при 420—470°; температуру
измеряют термометром, который помещают в печь рядом с труб-
трубкой. Оттянутый конец трубки присоединяют с помощью резино-
резиновой пробки к эффективному змеевиковому холодильнику из стек-
стекла пирекс. Последний с помощью резиновой пробки соединяют
с первым из двух приемников, установленных последовательно
и соединенных друг с другом короткой каучуковой трубкой.
Каждый приемник представляет собой склянку для отсасывания
емкостью 500 мл, в которую вставлена трубка для ввода газа
(примечание 4), конец которой находится несколько ниже середи-
середины колбы. Первый приемник погружают в смесь льда с солью
(примечание 5), а второй — в смесь сухого льда с метиловым спир-
спиртом, находящуюся в сосуде Дьюара. Отводная трубка второго
приемника соединена с манометром (примечание 6) и с водоструй-
водоструйным насосом.
Пинакон (примечание 7) или пинаколин помещают в колбу
Клайзена и перегоняют в вакууме водоструйного насоса, пропу-
пропуская пары через трубку из стекла пирекс с окисью алюминия,
в которой поддерживают температуру 420—470°. Перегонка 100 г
пинакона продолжается в течение 15 мин.; затем прибор проду-
продувают, для чего вакуум в нем поддерживают в течение еще 15 мин.
Воду и смолистые примеси, собравшиеся в охлаждаемом льдом
приемнике, отбрасывают (примечание 8). Второй приемник в ни-
мают из охлаждающей бани и предоставляют его содержимому
расплавиться. При этом образуются два слоя; когда слои разде-
190
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
2,3-ДИМЕТИЛБУТАДИЕН-1,3
191
лятся, приемник вновь помещают в охладительную смесь и ос-
оставляют его там до тех пор, пока нижний водный слой не за-
замерзнет. Неочищенный диметилбутадиен сливают со льда, полу-
полученную желтую жидкость сушат над безводным сернокислым
кальцием и фракционируют (примечание 9) с применением деф-
дефлегматора Видмера или какой-либо иной колонки; собирают фрак-
фракцию с т. кип. 67—70°. Выход диметилбутадиена из 100 г пинакона
составляет 55—60 г G9—86% теоретич.; примечание 10). Хранить
диен лучше всего в холодильном шкафу над небольшим количест-
количеством гидрохинона.
Примечания
1. Трубка из стекла пирекс должна быть диаметром 3 см
и длиной 70 см.
2. Большое значение имеет качество окиси алюминия. При
использовании обычного препарата, применяемого для осуше-
осушения, проверявшие синтез не смогли получить указанных выше
результатов. С успехом был использован один из продажных образ-
образцов активированной окиси алюминия. В результате работы ката-
катализатор темнеет, однако его можно легко регенерировать, для
чего после каждого опыта или, во всяком случае, после каждых
двух-трех опытов трубку нагревают до 420—470° и пропускают
через нее медленный ток воздуха до тех пор, пока окись алюминия
не станет белой B—5 час).
3. Очень удобную печь можно изготовить, если обернуть же-
железную трубу диаметром 40 мм и длиной 90 см асбестовым листом
и на асбест намотать около 15 м нихромовой проволоки диаметром
1 мм. Прибор целиком заключают в изоляцию для паровых труб.
Температуру регулируют при помощи соответствующего лабора-
лабораторного автотрансформатора (ЛАТР № 1).
4. Диаметр трубки для ввода газа должен быть равен 10 мм.
5. Этот приемник служит для того, чтобы собрать большую
часть воды и образовавшегося полимера.
6. Можно применять также и другой приемник, который пред-
представляет собой пробирку размером 3x30 ел с боковым отводом.
Ее погружают в сосуд Дьюара и охлаждают смесью сухого льда с
метиловым спиртом. В таком втором приемнике можно собирать
лишь небольшие порции вещества.
7. Безводный пинакон можно получить перегонкой пинакон-
гидрата («Синт. орг. преп.», сб. 1, стр. 342). Собирают фракцию
с т. кип. 172—178° и дестиллат подвергают повторной перегонке.
Однако значительно удобнее получать безводный пинакон из
пинакон-гидрата по методу, описанному в примечании 2 к перво-
первому разделу данного синтеза (стр. 188). В качестве исходного сырья
можно применять также и пинакон-гидрат; однако выход при этом
будет несколько ниже, чем при применении безводного пинакона.
8. Содержимое этого приемника следует тщательно исследо-
исследовать в отношении присутствия в нем 2,3-диметилбутадиена; про-
проверявшие синтез обычно обнаруживали в приемнике заметные
количества этого углеводорода.
9. Если дегидратация протекала с недостаточной полнотой,
то препарат может содержать некоторое количество пинаколина
(т. кип. 107°). Пинаколин можно вновь пропустить над окисью
алюминия.
10. Согласно указаниям авторов синтеза, выход из 100 г пи-
пинаколина составляет 57—63 г G0—77% теоретич.).
Другие методы получения
Наиболее удобным методом получения 2,3-диметилбутадиена
является дегидратация пинакона. Для этой реакции применялись
различные катализаторы, как, например, бромистоводородная1,
иодистоводородная1 и серная кислоты 2~4; сульфокислоты бен-
бензольного5 и нафталинового рядов б~8; кислый сернокислый ка-
калий9; квасцы 10; бромистоводородная соль анилина1; иод11, медь,
нагретая до 450—48001; окись алюминия при 400°12~14. Этот
диен был также получен перегонкой продукта взаимодействия
йодистого метилмагния с этиловым эфиром а-метакриловой кис-
кислоты 15; обработкой дихлорида тетраметилэтилена спиртовым рас-
раствором едкого кали*4; взаимодействием гидрохлорида пинакона
и углекислого натрия18; действием натрия или пиридина на
<х,а,р-триметил-р,т-диброммасляную кислоту17; пропусканием;
1,2,4-триметил-4-изопропенилциклогексепа над нагретой медью18;
дегидратацией диметилизопропенилкарбинола соляной19 или.
серной17 кислотой.
1 Kyriakides, J. Am. Chem. Soc, 36, 985 A914).
2 Bayer und Ко., герм. пат. 253081 [Frdl., 10, 1006A910—1912)].
3 С о ц t u r i e r, Ann. chim. F), 26, 485 A892).
4 Кондаков, J. prakt. Chem. B), 62, 172 A900).
5 Остромыс. ленский, ЖРФХО, 47, 1973A915).
6 Bayer und Ко., герм. пат. 24S030 [Frdl., 10, 1004 A910—1912); С. А., 6,
3200 A912)].
7 Bayer und Ко., герм. пат. 253082 [Frdl., 10, 1005 A910—1912); С. А.,
7, 1109 A913)].
8Ruzicka, Schinz, Helv. Chim. Acta, 23, 963 A940).
9 Bayer und Ко., герм. пат. 246660[Frdl., 10, 1003 A910—1912); С. А., 7,
908 A913)].
10 Bayer und Ко., герм. пат. 250086 [Frdl., 10, 1005 A910—1912); С. А.,
6, 3200 A912)].
11 H i b b e r t, J. Am. Chem. Soc, 37, 1754 A915).
12 Badische Anilin- u. Soda-Fabrik, герм. пат. 235311 [Frdl., 10, 1003
A910—1912); С. А., 5, 3175 A911)].
* В американском оригинале ошибочно указано «спиртовым раствором
поташа». (Прим. ред.)
192
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
13 Badische Anilin- u. Soda-Fabrik, герм. пат. 256717 IFrdl 11 796
A912—1914); С. А., 7, 2488 A913)].
14 F i e s e r, Martin, J. Am. Chcm. Soc, 59, 1019 A937); F i e-
s e r, Seligman, тям же, 56, 2694 A934); F i e s e r, Experiments
in Organic Chem., 2nd Ed., D. С Heath and Co., N. Y., 1941, p. 383.
15 В 1 a i s e, С о u r t о t, Compt. rend., 'l40. 371 A905)
"Harries, Ann., 383, 182 A911).
" С о n г t о t, Bull. soc. chim. C), 35, 972 A906).
18 О с т р о м ы с л е н с к и й, ЖРФХО 47 1949 A915)
" М а р и у ц ы, ЖРФХО, 21, 435 A889).
5,5-ДИМЕТИЛГИДАНТОИН
Н3С ОН
V -
Н3С CN
+ (NH4JCO3
ХС NH
HsC/ I CO -f
co-nh/
+ 2H2O + NHS
Предложили: Э. Вагнер и М. Байзер.
Проверили: Ч. Аллен и Г. Фрэйм.
Получение
В стакане емкостью 600 мл смешивают 85 г A моль) циан-
гидрина ацетона (примечание 1) и 150 г A,31 моля) свежеизмель-
ченного углекислого аммония. Смесь нагревают на паровой бане,
лучше в вытяжном шкафу (примечание 2), и перемешивают ее
термометром (примечание 3). Спокойная реакция начинается при
температуре около 50° и продолжается в течение примерно 3 час.
при 68—80°. Для завершения реакции и для разложения избытка
углекислого аммония температуру под конец повышают до 90°
и поддерживают ее на этом уровне до тех пор, пока жидкая смесь
не станет неподвижной (полчаса). Остаток получается бесцвет-
бесцветным или бледножелтым (примечание 1) и при охлаждении затвер-
затвердевает. Его растворяют в 100 мл горячей воды, обрабатывают
активированным березовым углем и быстро фильтруют через во-
воронку с обогревом. Фильтрат выпаривают на электрической плитке
до тех пор, пока на поверхности жидкости не появятся кристаллы,
после чего смесь охлаждают в бане со льдом. Белые кристаллы от-
отфильтровывают с отсасыванием; осадок отжимают досуха и дважды
промывают эфиром порциями по 5—7 мл, причем каждую порцию
хорошо перемешивают с кристаллами и затем тщательно отсасы-
отсасывают. Маточный раствор упаривают, как и раньше, до объема
25 мл или даже меньше, охлаждают и, повторяя указанные выше
операции, получают дополнительную порцию кристаллов (при-
(примечание 4). Выход составляет 65—72 г E1—56% теоретич.). Пер-
5,0-ДИМЕТИЛПЩАНТОИН
193
вая порция получается почти чистой и плавится при температуре
173°; вторая порция плавится около 164°.
Диметилгидантоин растворяют в минимальном количестве
кипящей воды (около 65 мл), обрабатывают активированным дре-
древесным углем и горячий раствор фильтруют через воронку с обо-
обогревом. Фильтрат охлаждают, а выпавшие кристаллы отфильтро-
отфильтровывают с отсасыванием и промывают небольшим количеством
холодной воды. Выход после перекристаллизации составляет
N0—85% неочищенного вещества. Перекристаллизованный пре-
препарат плавится при 174—175° [178° (исправл.)]. Еще одну порцию
менее чистого вещества (т. пл. 171—172°) можно получить, если
маточный раствор выпарить до небольшого объема (примечание 5).
Примечания
1. Вполне удовлетворителен циангидрин ацетона, получен-
полученный по описанному ранее методу («Синт. орг. преп.», сб. 2,
стр. 566). Для немедленного применения может служить менее
чистый циангидрин, который легко получить следующим спосо-
способом1.
Раствор 165 г бисульфита натрия (считая на 100%-ную соль)
в 300 мл холодной воды помещают в 1-литровую колбу, охлаждае-
охлаждаемую в бане со льдом; вращая колбу, медленно по каплям прили-
приливают к ее содержимому 87 г ацетона. Затем к реакционной смеси
постепенно прибавляют раствор 100 г цианистого калия (считая
на 100%-ную соль) или 75 г цианистого натрия в 300 мл холодной
воды. Циангидрин выделяется в виде верхнего слоя; при приме-
применении цианистого натрия это расслоение протекает медленнее
и не доходит до конца, пока температура смеси не достигнет ком-
комнатной. Слой циангидрина отделяют и сушат в течение нескольких
часов над сернокислым натрием в закрытой колбе, которую ста-
ставят в темное место. Выход составляет около 90 г G0%теоретич.);
его можно несколько увеличить, если водный слой экстрагиро-
экстрагировать эфиром.
Полученный таким способом циангидрин ацетона представляет
собой бесцветную или почти бесцветную жидкость; в случае не-
немедленного применения препарат вполне пригоден для получения
диметилгидантоина. Если же со времени получения вещества
прошло более 1 или 2 дней, то циангидрин может окраситься в тём-
тёмнокрасный цвет и придать полученному из него диметилгидантоину
красную окраску, от которой бывает трудно его избавить.
2. Реакционная смесь медленно выделяет аммиак в количе-
количествах, которые хотя и неприятны, но в хорошо вентилируемой
комнате терпимы.
3. В течение большей части времени при этой реакции смесь
бывает частично твердой или очень вязкой, и ее нельзя надлежа-
'^ Сборшш 3
194
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
щим образом перемешивать мешалкой обычного типа. Мешалка
Гершберга («Синт. орг. преп.», сб. 2, стр. 298, рис. 12) непригодна.
4. В горячей воде диметилгидантоин растворим очень легко,
в холодной воде его растворимость все еще значительна. Можно
выделить несколько порций кристаллов последовательным выпа-
выпариванием маточных растворов, доводя их в конце концов до очень
небольшого объема. Превращение циангидрина ацетона в диметил-
диметилгидантоин, повидимому, протекает количественно2.
5. Описанный метод может служить для получения различ-
различных 5-замещенных и 5,5-двузамещенных гидантоинов на основе
соответствующих циангидринов. 5-Метил-5-этилгидантоин был
получен с выходом 75% при использовании циангидрина метил-
этилкетона; т. пл. 141,5°.
Другие методы получения
Гидантоины с одним или двумя заместителями в положении 5
были получены нагреванием циангидринов с мочевиной и обра-
обработкой реакционной смеси соляной кислотой умеренной концен-
концентрации3; нагреванием сернокислого аланина с циановокислым
калием4; действием фосгена или хлорангидрида щавелевой кисло-
кислоты5 или эфиров угольной кислоты6 на С-замещенные аминоацет-
амиды; сплавлением аминокислот с мочевиной'; действием циано-
вокислого калия на хлористоводородные соли а-аминонитрилов
и нагреванием полученных уреидонитрилов с разбавленной соля-
соляной кислотой8; нагреванием альдегидов или кетонов с цианистой
щелочью и углекислым аммонием под давлением углекислого газа
в несколько атмосфер9; нагреванием циангидринов с углекислым
аммонием2; взаимодействием кетона или альдегида и углекислого
аммония с цианистым водородом или с цианистой щелочью в ли-
лигроине или 50%-ном спирте при комнатной температуре или при
50—80°10; взаимодействием бисульфитных соединений кетона или
альдегида с цианистой солью и углекислым аммонием 10. Описан-
Описанную методику11 предложили Бухерер и Штейнер2.
1 Г у б е н, Методы органической химии, т. Ill, вып. 2, Госхимиздат,
1935, стр. 58.
! Biicherer, Steiner, J. prakt. Chem., 140, 291 A934).
3 Pinner, Ber., 20, 2355 A887); 21, 2320 A888).
4Urech, Ann., 165, 99 A873).
5 Герм. пат. 310427 [Frdl., 13, 803 A923—1924)].
'Read, J. Am. Chem. Soc, 44, 1749 A922).
7 G r i e s s, Ber., 2, 47 A869); H a 1 p e r n, Monatsh., 17, 243 A896).
8 Herbs t, Johnson, J. Am. Chem. Soc, 54, 2465 A932).
9 Bergs, герм. пат. 56G094 A929) [С. А., 27, 1001 A933)].
10 В u с h e r e r, L i e b, J. prakt. Chem., 141, 5 A934).
"Wagner, Simons, J. Chem. Education, 13, 266 A936).
2,5-ДИМЕТИЛМИНДАЛЬНАЯ КИСЛОТА
195
сн3
2,5-ДИМЕТИЛМИНДАЛЬНАЯ КИСЛОТА
(п-Ксилилгликолевая кислота)
+ СО(СООС2П6J
SnCl4
КОН
]-С(ОН)(СООС2НвJ
затем НС1 и нагревание
сн3
сн3
I
^\—СН (ОН) СООН
Y
сн3
Предложили: Дж. Рибзомер а Дж. Ирвин.
Проверили: X. Снайдер а Р. Роулэнд.
Получение
Этиловый эфир 2,5-диметилфенилоксималоновой кислоты.
В 1-литровой трехгорлой колбе, снабженной эффективной ме-
мешалкой, капельной воронкой и хлоркальциевой трубкой, переме-
перемешивают 174 г A моль) диэтилового эфира мезоксалевой кислоты
(примечание 1) и 265 г B,5 моля) л-ксилола. Чтобы предохранить
реакционную смесь от влаги принимают соответствующие меры
предосторожности. При охлаждении в бане со льдом и водой и
энергичном перемешивании к смеси прибавляют из капельной
воронки по каплям 325 г A,25 моля) безводного хлорного олова.
После того как прибавление будет закончено, охлаждающую баню
отставляют, а перемешивание продолжают в течение еще 3 час.
Затем при перемешивании реакционную смесь выливают в сосуд,
содержащий смесь 300 г колотого льда и 50 мл концентрированной
соляной кислоты. При стоянии смесь разделяется на два слоя;
к ней прибавляют 200 мл эфира, эфирный слой отделяют и промы-
промывают водой порциями по 100 мл до тех пор, пока промывные воды
не станут идти свободными от хлор-иона. Эфирный раствор сушат
над безводным сернокислым натрием и перегоняют. После отгон-
отгонки эфира и избытка исходных реагентов (примечание 2) соби-
собирают фракцию с т. кип. 154—156° E мм). Выход 2,5-диметил-
фенилоксималонового эфира составляет 144,5—160 г E1,5—57%
теоретич.).
13*
196
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
2,5-Диметилминдальная кислота. В 1-литровой круглодонной
колбе приготовляют смесь 140 г @,5 моля) 2,5-диметилфенил-
оксималонового эфира и холодного раствора 140 г едкого кали
в 560 мл воды и нагревают ее в течение 5 час. на паровой бане.
Щелочной раствор охлаждают и экстрагируют одной порцией
эфира в 100 мл, для того чтобы удалить некоторые вещества, не
растворимые в щелочи. Щелочной раствор подкисляют 300 мл
концентрированной соляной кислоты, а затем нагревают на паро-
паровой бане и перемешивают в течение 2 час. (или до тех пор, пока не
исчезнут признаки выделения углекислого газа). После этого
смесь охлаждают, маслянистый слой экстрагируют эфиром, эфир-
эфирный раствор сушат над безводным сернокислым натрием и эфир
отгоняют в небольшом вакууме (примечание 3). Маслянистый
остаток перекристаллизовывают из бензола. Выход 2,5-диметил-
миндальной кислоты составляет 55—63 г F7—70% теоретич.);
т. пл. 116,5—117° (примечание 4).
Примечания
1. Диэтиловый эфир мезоксалевой кислоты должен быть высот
кого качества. Для получения этого реагента оказалось возмож-
возможным применение двуокиси азота (непосредственно из баллона).
Общие условия получения не отличаются от описанных ранее1,
с тем лишь исключением, что вместо колбы с мышьяковистым
ангидридом и азотной кислотой был установлен баллон с дву-
двуокисью азота. Этот метод дает значительно лучшие результаты.
2. Избыточный л-ксилол легко может быть получен обратно.
3. Валено избежать длительного нагревания после удаления
эфира.
4. Изложенный общий метод был применен также и для син-
синтеза различных алкилзамещенных миндальных кислот2.
Другие методы получения
2,5-Диметилминдальная кислота была получена описанным
выше способом2, а также по реакции между бромистым
2,5-диметилфенилмагнием и хлоралем с последующим гидро-
гидролизом щелочью3.
1 Цоке, Синт. орг. преп., сб. 1, стр. 550.
2 A n d о, J. Chem. Soc. Japan, 56, 745 A935) [С. Л., 29, 7960 A935I;
Riebsomer, Irvine Andrews, J. Am. Chem. Soc, 60, 1015
A938); Proc. Indiana Acad. Sci., 47, 139 A938); Riebsomer, Bald-
Baldwin, Buchanan, Burkett, J. Am. Chem. Soc, 60, 2974 A938);
Riebsomer, Stauffer, Glfck, Lambert, J. Am. Chem.
Soc, 64, 2080 A942)].
3 S a v a r i a n, Compt. rend., 146, 297 A908) [C. A., 2. 1443 A908)].
2,4-ДИМКТИЛТИАЗОЛ
107
2,4-ДИМЕТИЛТИАЗОЛ
CH3CONH2+P2S5 -» CH3CSNH2
SH C1CH2 S — CH
CH
-C
C-CH3
II I!
NH О
СНз— С С — СНз
N-HC1
H2O
Предложил: Дж. Шварц.
Проверили: Л'. Гамильтон и Э. Крэео, мл.
Получение
В 2-литровую круглодонную колбу, снабженную обратным
холодильником, помещают 200 мл сухого бензола (примечание 1).
Затем быстро приготовляют смесь из 300 г E,08 моля) тщательно
измельченного ацетамида и 200 г @,9 моля) пятисернистого фос-
фосфора в порошке и немедленно переносят ее в колбу. Туда же доба-
добавляют 20 мл смеси 400 мл D,97 моля) хлорацетона (примечание 2)
и 150 мл сухого бензола. Затем осторожным нагреванием на водя-
водяной бане вызывают экзотермическую реакцию. Баню отставляют
и постепенно через обратный холодильник приливают к содержи-
содержимому колбы остальное количество смеси хлорацетона с бензолом
(примечания 3 и 4). После того как прибавление реагента будет
закончено и течение реакции станет уже незаметным, смесь кипя-
кипятят с обратным холодильником на водяной бане еще полчаса.
При взбалтывании к 'смеси прибавляют около 750 мл воды.
Через полчаса смесь переливают в делительную воронку и верх-
верхний красноватый слой, состоящий из бензола и некоторых приме
сей, отбрасывают. Нижний слой подщелачивают (примечание 5),
прибавляя к нему 5 н. раствор едкого натра или едкого кали, и сы-
сырой тиазол, отслаивающийся в виде черного верхнего слоя, отде-
отделяют с помощью некоторого количества эфира, а нижний водный
слой экстрагируют пятью порциями эфира по 120 мл. Соединенные
вместе эфирные вытяжки сушат над безводным сернокислым на-
натрием и фильтруют через стеклянную вату. Эфир отгоняют на па-
паровой бане (примечание 6), а оставшееся масло фракционируют
при атмосферном давлении; фракцию, кипящую при 140—150е,
собирают и подвергают повторной перегонке. Выход 2,4-диметил-
тиазола с т. кип. 143—145° (примечание 7) составляет 210—230 г
D1—45% теоретич., считая на пятисернистый фосфор).
Примечания
1. Можно применять продажный бензол, но предварительно
следует высушить его над хлористым кальцием и перегнать.
2. Продажный хлорацетон следует перегнать и использовать
фракцию, кипящую в пределах 116—122°.
198
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
3. Течение реакции регулируют прибавлением смеси хлор-
ацетона и бензола. Если внести сразу слишком большое ее коли-
количество, то реакция может пойти слишком бурно. Безопасно при-
прибавлять смесь порциями по 20 мл. К концу реакции эти порции
можно увеличить.
4. Как только реакция начинается, смесь приобретает вид
маслянистой жидкости серо-черного цвета.
5. Щелочность окрашенного в темный цвет раствора можно
проверить по фенолфталеиновой бумажке. Края смоченной бу-
бумажки заметно окрашиваются в красный цвет. Необходимо удо-
удостовериться в том, что испытанию подвергается водный раствор,
а не выделившийся тиазол, плавающий на поверхности жидкости.
6. Тиазол гигроскопичен, и его следует предохранять от влаги
воздуха.
7. Указаны следующие температуры кипения: 144—145,5°
G19 ммI и 143°2. Во время перегонки 2,4-диметилоксазол (т. кип.
108°) обнаружен не был.
Другие методы получения
2,4-Диметилтиазол был получен из хлорацетона и тиоацетами-
да1; однако следует предпочесть образование необходимого тио-
ацетамида непосредственно в реакционной смеси, так как это спо-
способствует упрощению методики. Приведенную здесь пропись
в основном разработал Э. Мерк2. Практически по этому же спо-
способу можно получить и другие замещенные тиазолы2. 2,4-Диметил-
2,4-Диметилтиазол был получен сухой перегонкой 2-метилтиазил-4-уксусной
кислоты8, а также нагреванием 2,4-диметилтиазол-5-карбоновой
кислоты с окисью кальция4.
1 Hantzsch, Ann., 250, 265A889).
2 М е г с к, герм. пат. 670131 [С. А., 33, 2909 A939)].
3 S t e u d e, Ann., 261, 41 A891).
* Р у 6 л е в, Ann., 259, 266 A890).
ДИМЕТИЛЭТИНИЛКАРБИНОЛ
( 2-М етил- 3- бутин-2-ол)
СН3СОСН3 + NaNH2 -> (CH3COCH2) Na + NH3
(CH3COCH2)Na + QH2 -^ (CH3JC(C=CH)ONa
(СН3JС(С=СН) ONa + H2SO4 -> (СН3JС —С=СН +NaHSO4
ОН
Предложил: Д. Коффман.
Проверили: Ч. Аллен и А. Белл.
Получение
В 2-литровую круглодонную колбу, закрытую пробкой с тремя
отверстиями, через которые проходят механическая мешалка,
ДИМЕТИЛЭТИНИЛКАРБИНОЛ
199
делительная воронка и трубка для газа, отводимого в вытяжной
шкаф (примечание 1), помещают 1 000 мл абсолютного эфира
(примечание 2) и 156 г D моля) тщательно измельченного амида
натрия (стр. 31) (примечание 3). Колбу помещают в баню, плотно
набитую льдом с солью. Сильно перемешивая реакционную смесь,
к ней по каплям прибавляют в течение 3 час. 232 г D моля) сухого
ацетона (примечание 4). При охлаждении содержимого колбы
до температуры -=—10° (примечание 5) через реакционную смесь
пропускают в течение 2 час. слабый ток ацетилена (примечание 6)
для того, чтобы вытеснить аммиак. Затем пробку с тремя отвер-
отверстиями заменяют пробкой с двумя отверстиями, в одно из кото-
которых вставлен кран, а через другое пропущена трубка для ввода
газа, доходящая до дна колбы и присоединенная к баллону с аце-
ацетиленом. Пробку закрепляют проволокой. Колбу помещают
в смесь льда и соли (примечание 5); весь прибор устанавливают
на качалке и сильно взбалтывают реакционную смесь в течение
10 час.
Избыточное, давление ацетилена в колбе поддерживают
при 0,7 am. Каждые полчаса давление спускают при помощи
крана, чтобы освободиться от аммиака, образовавшегося за
счет небольшого количества непрореагировавшего ранее амида
натрия.•
Реакционную смесь осторожно выливают в сосуд, содержащий
800 г колотого льда, и в холодном состоянии подкисляют, приба-
прибавляя 400 мл 10 н. раствора серной кислоты (примечание 7). Эфир-
Эфирный слой отделяют, а водный экстрагируют дважды эфиром, порци-
порциями по 100 мл. Соединенные вместе эфирные вытяжки сушат над
100 г безводного поташа, а затем профильтрованный раствор
фракционируют (примечание 8). Собирают погон, кипящий при
103—107°; нижекипящие фракции сушат и подвергают вторичной
перегонке. Общий выход бесцветного вещества, кипящего при
103—107°, составляет 135—155 г D0—46% теоретич.) (примеча-
(примечания 9,10 и 11).
Примечания
1. В холодную погоду удобно проводить эту реакцию вне
помещения. Этим сводится к минимуму внимание, которое при-
приходится уделять тому, чтобы заменять тающий лед новыми
его порциями. Отходящие газы выпускаются непосредственно в
воздух.
2. Продажный абсолютный эфир был высушен над натрием.
3. Амид натрия, смоченный гептаном, был быстро измельчен,
после чего растворителю дали испариться.
4. Продажный ацетон был предварительно высушен над без-
безводным поташом.
200
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
5. Было найдено удобным прибавлять к охладительной смеси
сухой лед, что дает возможность реже заменять обыкновенный
лсд. Температура в течение всего времени не поднималась выше
•—10°, а обычно была значительно ниже.
6. Продажный ацетилен, применяемый для сварки, был высу-
высушен путем пропускания его над безводным хлористым кальцием.
7. Такая кислота получается прибавлением 110 мл концентри-
концентрированной серной кислоты к 290 мл воды.
8. При проверке была применена специальная колонка Вид-
мера (стр. 465).
9. Образуется значительное количество высококипящих при-
примесей; последних больше, и пределы их выкипания шире, если
взбалтывание было недостаточным.
10. Реакцию можно прерывать на нескольких стадиях. После
того как аммиак будет вытеснен ацетиленом, удобно поместить
смесь на ночь в холодильный шкаф и начинать взбалтывание
на следующий день. Взбалтывание также может не быть непре-
непрерывным; в случае перерыва охлажденную смесь помещают в холо-
холодильный шкаф.
11. По этому же методу авторы синтеза получали метилэтил-
этинилкарбинол ст. кип. 119—123° (выход 33%), применяя метил-
этил кетон1-2, и 1 -этинилциклогексапол-1 с т. кип. 53—55е B мм)
(выход 55%), применяя циклогексанои и удвоенное количество
эфира.
Другие методы получения
Диметилэтинилкарбинол обычно получали присоединением
ацетилена к натриевому производному ацетона 3^8, ко были также
применены в качестве конденсирующего средства металлический
калий9 и этилат натрия10. Изложенная выше методика основана
на способе, который описал Сунг Ву-сенг3. Согласно позднее опуб-
опубликованному методу, для еишеза применяют едкое кали, карбид
кальция и ацетон31*. В дальнейшем был опубликован12 общий
метод получения этинилкарбинолов, который проще изложен-
изложенного здесь и дает выходы до 80%8. Колбу при прибавлении аце-
ацетона погружают в баню с сухим льдом и во время реакции про-
пропускают через реакционную смесь ацетилен**.
* Чрезвычайно простой в экспериментальном отношении способ Л. Ка-
заряна дает выход диметилэтинилкарбинола, составляющий около 70%
теоретического, т. е. значительно более высокий, чем указанный в приведен-
приведенной прописи. [Прим. ред.)
** Еще в 1901-—1С05 гг. А. Е. Фаворским был найден общий способ полу-
получения ацетиленовых спиртов из ацетиленовых углеводородов и кетонов в при-
присутствии порошкообразного едкого кали [ЖРХО, 33, 357 A901); ЖРХО,
37, 643 A905); Пром. орг. хим., 3, 138 A937)]. Таким образом, все перечислен-
перечисленные выше способы получения диметилэтинилкарбинола и других подобных
спиртов являются лишь видоизменениями реакции А. Е. Фаворского. Сле-
2,6-ДИМЕТОКСИБЕНЗОЫИТРИЛ
201
1 Герм. пат. 289800 [Frdl., 12, 57 A914—1916)].
2 Герм. пат. 285770 [Frdl., 12, 55 A914—1916)].
3 Sung Wou-seng, Ann. chim., A0), 1, 359 A924).
4 S с h e i b 1 e r, Fischer, Ber., 55, 2903 A922).
5 Герм. пат. 280226 [Frdl., 12, 51 A914—1916)].
6 Am. пат. 2106180 [С. А., 32, 2547 A938)].
' Герм. пат. 286920 [Frdl., 12, 54 A914—1916)].
sFroning, Hennion, J. Am. Chem. Soc, 62, 654 A940).
9 Герм. пат. 284764 [Frdl., 12, 53 A914—1916)].
10 Герм. пат. 291185 [Frdl., 12, 56 A914—1916)].
11 К а з а р я н, ЖОХ, 4, 1347 A934).
"Campbell, Campbell, E b y, J. Am. Chem. Soc, 60, 2882 A938).
2,6-ДИМЕТОКСИБЕНЗОНИТРИЛ
CN CN
OaN^NNOa kcn CH3O^4NO2 K0H CHSO^XPCH3
CH3CH
CH3OH
4/
Предложили: А. Расселл и В. Теббенс.
Проверили: Р. Шрайнер и Р. Борис.
Получение
2-Ншпро-6-метоксибензонитрил. В 12-литровой круглодон-
ной колбе, снабженной эффективной механической мешалкой,
растворяют 500 г B,97 моля) технического л-динитробензола
(т. пл. 88—89°) в 7 500 мл абсолютного метилового спирта. Содер-
Содержимое колбы нагревают на водяной бе не до 40° и, поддерживая
эту температуру, прибавляют к нему при перемешивании раствор
230 г цианистого калия в 400 мл воды. Сыесь, окрашенную в темно-
пурпуровый цвет, перемешивают в течение 2 час, а затем оста-
оставляют при комнатной температуре ка 2—3 дня. Черный осадок
отфильтровывают с отсасыванием на воронке Бюхнера, по воз-
возможности лучше отжимают и сушат на воздухе. Количество его
-составляет 185—188 г.
Фильтрат разбавляют 60 л холодной воды (примечание 1)
и оставляют на ночь. Бурый шлам отфильтровывают с отсасыва-
отсасыванием (примечание 2), тщательно отжимают на воронке и сушат.
Количество его составляет около 164 г. Соединенные вместе осадки
кипятят с обратным холодильником последовательно с порциями
в 650, 500 и 500 мл хлороформа, причем кипячение каждый раз
продолжают в течение получаса. Хлороформенные вытяжки
дует, кроме того, отметить, что выход диметилэтинилкарбинола при полу-
получении его по способу А. Е. Фаворского достигает 75% теоретического коли-
количества. (Прим. ред.)
202
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
в еще горячем состоянии фильтруют, яркокрасные фильтраты
соединяют вместе и, отгоняя часть хлороформа, доводят объем
остатка до 500 мл. Затем к раствору прибавляют 1 л петролей-
ного эфира (т. кип. 60—90°), в результате чего неочищенный
2-нитро-6-метоксибензонитрил выпадает в осадок в виде крас-
красного порошка. Его отфильтровывают и сушат на воздухе. Выход
составляет 120—125 г B2—23% теоретич.); т. пл. 148—157° (при-
(примечание 3). Препарат применяют без дальнейшей очистки (приме-
(примечание 4).
2,6-Диметоксибензонитрил. Неочищенный нитрил помещают
в 3-литровую колбу и кипятят в течение 2 час. с раствором 75 г
едкого кали в 1 900 мл метилового спирта. Раствор концентри-
концентрируют, для чего часть метилового спирта отгоняют, доводя объем
раствора до 400 мл, и выливают его в 4 л холодной воды. Коричне-
Коричневатый осадок отфильтровывают, промывают холодной водой
и сушат. Неочищенный препарат (85—95 г) растворяют в 300 мл
хлороформа и кипятят с обратным холодильником в течение полу-
получаса с 8 г животного угля. Горячую смесь фильтруют и к
фильтрату прибавляют 500 мл горячего петролейного эфира
(т. кип. 60—90°). Раствор охлаждают и 2,6-диметоксибензопит-
рил, имеющий вид игольчатых кристаллов с кремовым оттенком,
отфильтровывают. Выход составляет 75—86 г A5—17% теоретич.);
т. пл. 116'—117° (примечание 5).
Примечания
1. Перед разбавлением фильтрат удобно разделить на семь
частей и каждую из них поместить в сосуд емкостью 12 л.
2. Смесь фильтруют через воронку Бюхнера диаметром 18,5 см,
присоединенную к 12-литровой колбе, которая в свою очередь
присоединена к водоструйному насосу. Из глиняных сосудов
смесь подают с помощью сифона.
3. Четвертое экстрагирование с помощью 500 мл хлороформа
дает дополнительно только 4 г вещества.
4. Диоксан является превосходным растворителем для мытья
колб и сосудов, использованных на этой стадии синтеза.
5. Препарат является достаточно чистым для большинства
целей. Совершенно бесцветные игольчатые кристаллы с т. пл.
117—118° можно получить, если вещество повторно перекристал-
перекристаллизовать из смеси хлороформа и петролейного эфира. Выход при
перекристаллизации составляет примерно 89—90%.
Другие методы получения
Впервые действие спиртового раствора цианистого калия
на iw-динитробензол изучил Лобри де Брюин1. Предлагаемая
3,3'-ДИМЕТОКСИДИФЕНИЛ И 3,3'-ДИМЕТИЛДИФВНИЛ
203
здесь пропись представляет собой видоизменение метода, который
описал Маутнер2.
ЧоЬгу de Bruyn, Rec. trav. chim., 2, 205 A883).
2 M a u t h n e r, J. prakt. Chem., B), 121, 259 A929).
З.З'-ДИМЕТОКСИДИФЕНИЛ И 3,3'-ДИМЕТИЛДИФЕНИЛ
— NH2
НС1
HNO^
H3PO2
C1N2-
S ^_>
3
(CH3)
3
(CH3)
Предложил: Н. Корнблюм.
Проверили: В, Бахман и С. Кушнер.
Получение
З,3'-Диметоксидифенил. В стакан емкостью 1 500 мл поме-
помещают 400 мл воды и 31 мл концентрированной соляной кислоты
(уд. вес 1,19). Раствор нагревают до кипения, источник тепла
отставляют и к раствору прибавляют 40 г @,16 моля) о-дианизи-
дина (примечание 1). Горячую смесь перемешивают до тех пор,
пока останется лишь небольшое количество твердых частиц, что
занимаетоколоЗмин. Затем стакан помещают в смесь льда с солью
и продолжают перемешивание до тех пор, пока температура
смеси не понизится до 15°, после чего прибавляют к ней еще 35 мл
концентрированной соляной кислоты. Когда температура смеси
понизится до 10—13°, к ней прибавляют из капельной воронки
в продолжение 10—15 мин. раствор 23,3 г @,33 моля) 97%-ного
нитрита натрия (или эквивалентное количество нитрита натрия
большей или меньшей степени чистоты) в 50 мл воды. Содержи-
Содержимое стакана перемешивают в течение еще 15—20 мин. при темпе-
температуре 5—10°, после чего раствор быстро фильтруют с отсасыва-
отсасыванием, чтобы освободить его от довольно значительного количества
примеси, имеющей темную окраску (примечание 2).
Холодный прозрачный фильтрат, окрашенный в красный цвет,
быстро выливают в 2-литровую колбу, в которой находятся 325 мл
30%-ного раствора фосфорноватистой кислоты, предварительно
охлажденного до 0° (примечание 3). Немедленно начинает выде-
выделяться азот; колбу неплотно закрывают пробкой и помещают на
8—10 час. в холодильный шкаф, после чего оставляют стоять в тече-
течение еще 8—10 час. при комнатной температуре (примечание 4).
204
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Продукт реакции переносят в 2-литровую делительную ворон-
воронку и нижний темнокоричневый слой отделяют от водной фа-
фазы; водный слой экстрагируют двумя порциями эфира по 125 мл
(примечание 5). Бурое масло соединяют с эфирными вытяжками
и все вместе дважды промывают в делительной воронке 20%-ным
раствором едкого натра порциями по 30 мл (примечание 6).Жидкость
быстро разделяется на два слоя, однако случается, что водная фа-
фаза в течение некоторого времени остается мутной. Если пренебречь
последним обстоятельством, то можно считать, что потери при
промывании совершенно ничтожны. Эфирный раствор сушат
над минимальным количеством безводного поташа; обычно бывает
достаточно 5 г (примечание 7).
Эфирный раствор фильтруют, чтобы освободить его от
смеси твердых частиц поташа и выпавших в осадок примесей
темного цвета, эфир отгоняют на паровом нагревателе из спе-
специальной колбы Клайзена емкостью 50 мл с дефлегматором вы-
высотой 15 см. Обычно, чтобы удалить последние следы эфира,
приходится применять небольшой вакуум водоструйного насоса.
Остаток перегоняют при давлении 4 мм и при температуре 200°.
Небольшая головная фракция A —1,5 г) светложелтого цвета
перегоняется при 155—157°. Основная фракция, кипящая при
157—159°, практически бесцветна; выход ее составляет 19—22 е.
Когда температура в парах начнет падать, температуру бани
постепенно повышают до 240е. Таким путем получают еще 3—4 г
дианизила, слегка окрашенного в оранжево-желтый цвет. Общий
выход всех трех фракций составляет 23—27,5 г F6—78% теоретич.).
Обычно фракции закристаллизовываются самопроизвольно; если
же кристаллизация не начинается, то фракции следует охладить
и потереть стенки колбы стеклянной палочкой.
Температура плавления основной фракции 41—43° (примеча-
(примечание 8), а двух опальных—обычно на 1—2° ниже. Полученный
препарат достаточно чист для большинства целей; при желании
его можно перекристаллизовать из минимального количества
спирта, необходимого для растворения вещества при 45—50°.
Раствор охлажадают до 35°; если при этом выделяется небольшое
количество масла, то его переводят в раствор, осторожно при-
прибавляя спирт. Насыщенный раствор затравляют кристалликом,
дают ему охладиться до комнатной температуры, а затем поме-
помещают в холодильный шкаф не менее, чем на 4 часа. Таким обра-
образом получают 20—21 г вещества в виде плоских бесцветных
игольчатых кристаллов; препарат плавится при 42—43,5°.
З,3'-Диметилдифенил. 27 г @.13 моля) о-толидина (примеча-
(примечание 9) диазотируют (обе аминогруппы), как это указано в «Синт.
орг. преп.», сб. 2, стр. 244. Приведенные там меры предосторож-
предосторожности против небольшого избытка азотистой кислоты в данном
случае не являются необходимыми. Прозрачный оранжевый
3,3'-ДИМЕТОКСИДИФЕНИЛ И 3,3'-ДИМЕТИЛДИФЕНИЛ
205
раствор тетразопия приливают к 290 мл 30%-ной фосфорнова-
тнетой кислоты (примечание 10) и смесь в неплотно закрытой
колбе оставляют стоять при колшатной температуре в течение
16—18 час. (примечание 11).
Вещество переносят в 2-литровую делительную воронку и отде-
отделяют маслянистый слой красного цвета от водной фазы. Водный
слой экстрагируют один раз 60 мл бензола. Окрашенное в крас-
красный цвет масло и бензольные вытяжки соединяют вместе и сушат
над 1—5 г безводного сернокислого натрия (примечание 12).
Бензол отгоняют из специальной колбы Клайзена емкостью
500 мл с дефлегматором высотой 15 см. Затем колбу нагревают
па масляной бане до 150°, чтобы обеспечить удаление последних
следов бензола. Остаток перегоняют под давлением 3 мм и при
температуре бани 155°. Практически бесцветная головная фрак-
фракция A — 1,5 г) перегоняется при 109—114°. Следующий погон
A14—115°) слабо окрашен в лимонно-желтый цвет; количество
его составляет 15,5—16 г. Когда температура в парах начинает
падать, температуру бани повышают до 170° и получают допол-
дополнительно 1 —1,5 г вещества, окрашенного в светлый лимонно-
желтый цвет (примечание 13). Общий выход составляет 17,5—
19 г G6—82% теоретич.; примечания 14 и 15).
Примечания
1. Был применен продажный технический о-дианизидин с т. пл.
loo—lob .
2. Обычно после того как половина смеси профильтрована,
поры фильтровальной бумаги частично забиваются и скорость
фильтрования резко падает. В этом случае следует взять другую
воронку со свежим фильтром.
3. Если взять меньшее количество раствора фосфор иоватистой
кислоты, то по сравнению с данными приведенной методики выход
получается несколько ниже, вещество окрашено интенсивнее
и для завершения реакции потребуется значительно больше
времени. При дезаминировании больших количеств какого-либо
доступного амина имеет смысл исследовать вопрос о применении
меньших количеств фосфорноватистой кислоты. В одном из опы-
опытов на 40 г дианизидина было взято 645 мл раствора фосфорнова-
тистой кислоты. Выход составлял 29 г (83% теоретич.). В случае
трудно доступных аминов, повидимому, целесообразнее применять
большие количества фосфор новатистой кислоты, чем это указано
выше. Так, для дезаминирования 33 г 2,2'-диметил-4,4'-диамино-
5,5'-диметоксидифенила было взято 1 200 мл 30%-пой фос-
форноватистой кислоты. В этом случае выход очищенного 2,2'-ди-
метил-5,5'-диметоксидифенила составлял 24,5 г (83% теоре-
теоретич.).
206
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
4. Если непосредственно после того как оба раствора будут
смешаны, оставить содержимое колбы стоять при комнатной тем-
температуре, то выход несколько падает по сравнению с достигнутым
в указанных выше условиях и окраска вещества получается более
интенсивной. Реакция целиком может быть проведена при темпе-
температуре холодильного шкафа, однако в этом случае, прежде чем
подвергать продукт реакции дальнейшей переработке, следует
выждать 25—30 час.
При применении настоящей реакции к производным анилина,
повидимому, целесообразно вести ее полностью при температуре
холодильного шкафа вследствие меньшей термической стойкости
диазониевых соединений по сравнению с солями тетразония,
получаемыми из бензидина и его производных.
5. Если проводить всю реакцию при температуре холодиль-
холодильного шкафа, то сырой продукт получается в виде твердого веще-
вещества светлобурого цвета, которое лучше всего отфильтровать
с отсасыванием и растворить в эфире; в остальном следует посту-
поступать так, как указано выше.
6. Если промывание щелочью не производить, то конечное
вещество будет содержать растворимую в щелочи твердую при-
примесь белого цвета, а сам препарат быстро приобретет оранжево-
коричневую окраску.
7. Обычно поташ удерживает некоторое количество дианизила.
Его следует промыть небольшим количеством уже отогнанного
эфира и этот эфирный раствор вновь перегнать.
8. Проверявшие этот синтез получили (в согласии с данными
других авторов) вещество с т. пл. 31,5—33,5°. После перекристал-
перекристаллизации из спирта 3,3'-диметоксидифенил плавился при 33,5—
35°. Эта низкоплавкая форма быстро переходит в форму с т. пл.
42—43,5°, если ее раствор, или плав, или даже твердое вещество
придут в соприкосновение с кристаллами высокоплавкой формы
(сообщение авторов настоящего синтеза).
9. Был применен продажный о-толидин с т. пл. 128—129°.
10. При применении 175 мл фосфорноватистой кислоты выход
составлял 17,8 г G7% теоретич.). Первая и последняя фракции
были мутными.
11. Выход и качество полученного вещества такие же, как
и в случае проведения реакции при температуре холодильного
шкафа.
12. Было найдено, что промывание бензольного раствора вод-
водным раствором щелочи является излишним.
13. Несмотря на некоторое различие в окраске вещества, по-
показатели преломления всех трех фракций почти одинаковы
(nS 1,5945).
14. В одном из опытов было применено 27 г продажного о-толи-
дина с т. пл. 121—125°. Единственное отличие в проведении про-
З.З'-ДИМЕТОКСИДИФЕНИЛ И З.З'-ДИМЕТИЛДИФЕНИЛ
207
цесса от описанной методики заключалось в том, что бензоль-
бензольный раствор промывался один раз40жл10%-ного раствора щелочи.
Было получено 18,9 г (82% теоретич.) жидкости, слегка окрашен-
окрашенной в оранжево-желтый цвет, причем се показатель преломления
был в основном таким же, как и в случае препарата, полученного
из о-толидина лучшего качества.
15. Этот способ дезаминирования ароматических аминов
является, повидимому, общим синтетическим методом, особенно
в отношении бензидина и его производных. Дезаминирование
самого бензидина было проведено с выходом 60%. Для этого
процесса применению спирта следует предпочесть применение
фосфор новатистой кислоты потому, что в последнем случае ме-
методика проще, выход выше и полученный препарат отличается
лучшим качеством.
Начало применению фосфор новатистой кислоты для дезамини-
дезаминирования ароматических аминов положил Май1. Недавно для той
же цели эту кислоту использовали Райфорд и Оберет2.
Другие методы получения
З,3'-Диметоксидифенил был получен метилированием 3,3'-ди-
оксидифенила йодистым метилом8 или диметилсульфатом4 и дез-
аминированием продукта диазотирования обеих аминогрупп о-диа-
низидина спиртом 6~7. Приведенная выше пропись представляет
собой незначительно измененную методику Мая.
З,3'-Диметилдифенил можно получить из ж-бромтолуола8 или
м-иодтолуола9 и натрия; действием медного порошка на я-иод-
толуол10; обработкой 4,4'-диокси-3,3'-диметилдифенила цинковой
пылью11; нагреванием 4,4'-дихлор-3,3'-диметилдифенила с иоди-
стоводородной кислотой и фосфором11; обработкой о-толидина
азотистой кислотой в спиртовом растворе12; разложением диазо-
тированного о-толидина метиловым или этиловым спиртом в при-
присутствии цинковой пыли13-14. З,3'-Диметилдифенил был также
получен восстановлением ж-бромтолуола гидразин гидр а том в при-
присутствии палладироваиного углекислого кальция в качестве
катализатора13. Небольшое количество 3,3'-диметилдифенила обра-
образуется при действии кислорода на ж-толиллитий16.
'Mai, Ber., 35, 162 AS02).
2 R a i f о г d, Oberst, Am. J. Pharm., 107, 242 A935) [С. А., 29,
6216 A935)].
3 В а г t h, Ann., 156, 98 A870).
4Schultz, Kotilhaiis, Ber., 39, 3343 A906).
5 S t a r k e, J. prakt. Chem., B), 59, 226 A899).
6Haeussermann, Teichmann, Ber., 27, 2108 A894).
' M a s с a r e 1 1 i, Visintin, Gazz. chim. Hal., 62, 358 A932).
8 P e r r i e r, Bull. soc. chim., C), 7, 182 A892).
» S с h и I t z, Rohde, Vicar i, Ber., 37, 1401 A904); Ann., 352,.
112 A907).
208
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
10 U 1 1 m a n п, Meyer, Ann., 332, 43 A901).
11 S t о 1 1 с, Ber., 21, 1096 A888).
12 S с h u 1 t z, Ber., 17, 468 A884).
"Winston, Am. Chcra. J., 31, 128 A904).
" Schlenk, В г a u n s, Ber., 48, 666 A915).
15 В u s с h, Halm, Mathauser, J. prakt. Chem., 146, 22 A936).
is М п 1 1 e г, Т б p e 1, Ber., 72, 273 A939).
ДИНИТРИЛ СЕБАЦИНОВОЙ КИСЛОТЫ И w-ЦИАНПЕЛАРГОНОВАЯ КИСЛОТА
СООН Nl-Ia CONIIj
(СН3K + СО -> (СН^ +
I Г
CONH2
СООН NH2
CONI-Ь
I
Сильнпр
нагревание
-> NC (CH2K CN
- > NC (CH3)S СООН
CONH2
Предложили: Б. Биггс и В. Бишоп.
Проверили: Ч. А длен и Дж. ВанАллан.
Получение
Динитрил себациновой кислоты. Трехгорлуго колбу емкостью
3 л (примечание 1), снабженную механической мешалкой (приме-
(примечание 2) и термометром, погруженным в жидкость, нагревают
на масляной бане до 160°. В кслбу помещают 505 г B,5 моля)
продажной себациновой кислоты (примечание 3) и 180 г C моля)
мочевины (примечание 4) и нагревают этот плав, перемешивая
его, в течение 4 час. при температуре около 160° (примечание 5).
После этого масляную баню отставляют, колбу тщательно выти-
вытирают и покрывают теплоизоляцией (примечание 6), а затем нагре-
нагревают на асбестовой сетке, повышая при помощи тройной горелки
температуру смеси до 220° с такой быстротой, какую только допу-
допускает вспенивание. Очень существенно продолжать перемешива-
перемешивание в течение по крайней мере 5 мин. после того как будет достиг-
достигнута температура 220°; в противном случае при последующей
перегонке масса может вспениться и выброситься из колбы.
Затем мешалку заменяют короткой насадкой, которую при-
присоединяют к длинному (90 см) воздушному холодильнику с прием-
пиком (примечание 7). Вещество перегоняют при атмосферном
давлении до тех пор, пока не перестанет отгоняться дестиллат.
Температура в парах постепенно повышается до 340°. Дестиллат,
который состоит главным образом из воды, динитрила, мононитрила
и себациновой кислоты, переливают в большую B л) делительную
ДИНИТРИЛ СЕЕАЦИНОВОЙ КИСЛОТЫ
209
воронку, прибавляют к нему 500 мл эфира (примечание 8) и рас-
раствор экстрагируют последовательно тремя порциями 5%-ного
раствора углекислого аммония по 650 мл (примечание 9). Неочи-
Неочищенный динитрил, который остается после отгонки эфира, пере-
перегоняют в вакууме; после отделения небольшого головного погона
B0—25 мл) основную массу собирают при 185—188° A2 мм) (при-
(примечание 10). Выход динитрила себациновой кислоты составляет
190—200 г D6—49% теоретич.; примечание 11).
ы-Цианпеларгоновая кислота. Соединенные вместе аммонийные
вытяжки нагревают почти до кипения в большом эмалированном
сосуде или в 4-литровом стакане и нейтрализуют по фенолфталеину
концентрированной соляной кислотой (около 120 мл; примеча-
примечание 12). Затем медленно при перемешивании к жидкости приба-
прибавляют горячий раствор 400 г хлористого бария и полученный
раствор в еще горячем состоянии отфильтровывают от выпавшей
в осадок бариевой соли себациновой кислоты (примечание 13)
через складчатый фильтр или на воронке Бюхнера диаметром
20 см с щелоче- и кислотоустойчивой фильтровальной бумагой.
Бариевую соль цианокислоты, выпадающую в осадок при охла-
охлаждении, отфильтровывают на воронке такого же размера и
растворяют в 1 л горячей воды; раствор подкисляют до кислой
реакции на лакмус добавлением концентрированной соляной
кислоты (около 30 мл). Цианокислота выделяется в виде прозрач-
прозрачного масла. Фильтрат, полученный после отделения бариевой
соли, подкисляют таким же образом до кислой реакции на лакмус
концентрированной соляной кислотой (около 50 мл). Оба масля-
маслянистых слоя соединяют вместе. Цианокислоту промывают с по-
помощью декантации тремя порциями горячей воды по 200 мл,
полностью отделяют от воды и сушат в вакуум-эксикаторе над
хлористым кальцием. Выход ш-цианпеларгоновой кислоты с т. пл.
48—49° составляет 146—155 г C2—34% теоретич.; примечание 14).
Примечания
1. Лучше работать с прибором, собранным на шлифах, так
как к концу реакции температура становится настолько высокой,
что резиновые или корковые пробки разрушаются.
2. Мешалка представляет собой согнутую стеклянную палочку,
которая может разбивать образующуюся пену.
3. Были применены продажные препараты себациновой кис-
кислоты (т. пл. 127—130°) и мочевины (т. пл. 132—134°); при исполь-
использовании чистой себациновой кислоты (т. пл. 132—133°) был
получен лишь не намного A3%) лучший выход. Так как эта
кислота легка и объемиста, то удобнее плавить ее в эмалирован-
эмалированном сосуде и выливать в жидком виде в предварительно на-
нагретую колбу.
14 Сборник 3
210
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
4. Очень важно брать именно то количество мочевины, которое
указано в прописи. Когда 2 моля мочевины было взято на 1 моль
себациновой кислоты, выход динитрила себациновой кислоты
упал до 27%.
5. К. концу указанного периода продукт реакции состоит почти
целиком из амида себациновой кислоты, который можно выделить.
6. Для теплоизоляции лучше всего обмотать колбу асбестовым
шнуром, начиная с горла и спускаясь по возможности ниже до
наиболее широкой части ее. После того как колба будет укреплена
на асбестовой сетке, нижнюю часть ее изолируют дополнительно
с помощью тонкого листа асбестового картона. Для изоляции
можно использовать также и магнезию.
7. Если в распоряжении имеется только короткий холодиль-
холодильник, то рекомендуется после первого установить второй прием-
приемник, гоедин нный с. обратным холодильником, так как некоторое
количество дииитрила может быть увлечено не сконденсировав-
сконденсировавшимся водяным паром. Однако перед первым приемником не сле-
следует помещать холодильник с водяным охлаждением, так как
дестиллат содержит некоторое количество твердых примесей
(себациновая кислота и вещества, образующиеся из мочевины).
8. Хотя добавление эфира не является абсолютно необходи-
необходимым, однако эфир облегчает экстрагирование. Бензол для этой
цели непригоден.
9. Водный аммиак (примерно 3%) также вполне пригоден для
экстрагирования. Водные вытяжки сохраняют.
10. При давлении 16 мм температура кипения динитрила себа-
себациновой кислоты 201—203°.
11. В результате опытов с удвоенными количествами исход-
исходных реагентов авторы синтеза получили 410—450 г E0—55%
теоретич.) динитрила.
12. При проверке был применен прибор для определения кон-
концентрации водородных ионов, и нейтрализация проводилась до
рН 7,8.
13. Количество бариевой соли составляет 43—45 г.
14. Если цианокислоту, полученную из выпавшей в осадок
бариевой соли, обработать отдельно, то она будет плавиться при
51—52°.
Другие методы получения
Динитрил себациновой кислоты был получен нагреванием
себациновой кислоты в токе аммиака1; пиролизом2'3 или дегидра-
дегидратацией пятихлористым фосфором4 или хлорокисью фосфора*
амида себациновой кислоты. Последний был получен из этилового
эфира3 или из хлорангидрида7 себациновой кислоты и аммиака,
а также нагреванием себациновой кислоты с мочевиной 2>3'8 или
с роданистым аммонием9.
2,5-ДИНИТРОБЕНЗОЙНАЯ КИСЛОТА
211
1 Qreenewalt, Rigby, ам. пат. 2132849 [С. А., 33, 178 A939)].
2 В i g g s, Bishop, J. Am. Chera. Soc, 63, 944 A941).
3 Biggs, ам. пат. 2322914 [С. А., 38, 118 A944)].
4Phookan, Krafft, Ber., 25, 2252 A892).
6 W i 1 с k e, ам. пат. 1828267 [С. А., 26, 735 A932)].
6 R о w n e у, Ann., 82, 123A852).
7 A s с h a n, Ber., 31, 2350 A898).
8 D'A 1 e 1 i o, Reid, ам. пат. 2109941 [С. А., 32, 3419 A938)].
«Солонина, ЖРФХО, 28, 558 A896).
2,5-ДИНИТРОБЕНЗОЙНАЯ КИСЛОТА
сн3 сн3
А.
сн:
O,N'
К2СГ2О7, H2SO4
CO2H
Предложил: В. Лангли.
Проверили: В. Бахман и Д. Холмс.
Получение
2-Нитрозо-5-нитротолуол. В 5-литровую круглодонную кол-
колбу, снабженную механической мешалкой, помещают 50 г @,33 мо-
моля) 2-амино-5-нитротолуола в порошке (примечание 1) и приба-
прибавляют к нему охлажденный до 0° раствор 200 мл концентрированной
серной кислоты в 500 мл воды. Пока происходит перемешивание
суспензии при комнатной температуре, приготовляют раствор
кислоты Каро, для чего к 175 мл серной кислоты (уд. вес 1,84).
находящейся в 2-литровом стакане и охлажденной до 0°, приба-
прибавляют 300 г A,11 моля) порошкообразного персульфата калия.
Смесь тщательно перемешивают стеклянной палочкой и приба-
прибавляют к ней 900 г колотого льда и 300 мл воды.
Хорошо перемешанный раствор кислоты Каро приливают
к суспензии нитроаминотолуола. Смесь перемешивают и нагревают,
но как только температура поднимется до 40°, нагревание пре-
прекращают. После перемешивания раствора в течение еще 2 час.
к нему дополнительно прибавляют в один прием 100 г @,37 моля)
персульфата калия в порошке. Теплота, выделяющаяся во время
реакции, достаточна для того, чтобы температура держалась на,,
уровне 40°. Перемешивание продолжают в течение еще 2 час;
затем суспензию разбавляют водой до объема 4 л. Осадок отфиль-»
тровывают с отсасыванием (примечание 2) и промывают 400 мл,
воды. Влажное вещество переносят в 5-литровую круглодонную
14*
212
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
колбу, добавляют к нему около 700 мл воды и подвергают смесь
перегонке с водяным паром. 2-Нитрозо-5-нитротолуол отфильтро-
отфильтровывают от дестиллата (примечание 3). Общий выход высушенного
на воздухе вещества составляет 30—39 г E5—71% теоретич.;
примечание 4).
2,5-ДинитробенЗойная кислота. В конической колбе емкостью
500 мл приготовляют суспензию 20 г @,12 моля) высушенного на
воздухе 2-нитрозо-5-нитротолуола в 100 мл воды и прибавляют
к ней 50 г @,17 моля) двухромовокислого калия в порошке (при-
(примечание 5). Колбу помещают в баню со льдом и солью и смесь
энергично перемешивают с помощью эффективной мешалки. Когда
температура понизится до 5°, к смеси приливают тонкой струей
175 мл концентрированной серной кислоты (примечание 6) и сле-
следят, чтобы температура не поднималась выше 35°. После того как
вся серная кислота будет прибавлена, смесь перемешивают и нагре-
нагревают до 50°. Затем источник тепла отставляют и поддерживают
температуру при 50—55°, охлаждая реакционную смесь в бане со
льдом, поскольку реакция экзотермична (примечание 7). Через
20 мин. температуру смеси повышают до 65°+ 3° и поддерживают
ее на этом уровне в течение еще 1 часа.
Раствор охлаждают до 20° и прибавляют к нему 250 г льда.
Смесь перемешивают в течение нескольких минут, а затем фильтруют
с отсасыванием (пользуясь уплотненной фильтровальной бумагой)
и осадок промывают 35 мл ледяной воды. Затем осадок взбал-
взбалтывают с .25 мл воды, находящейся в стакане емкостью 600 мл,
и медленно переводят его в раствор, постепенно прибавляя 55—
65 мл 10%-ного раствора углекислого натрия. Раствор фильтруют
(примечание 8) .и приливают к нему разбавленную соляную кисло-
кислоту A : 1) до сильно кислой реакции на красное конго. Смесь охла-
охлаждают в течение i часа льдом и затем фильтруют. Полученное
вещество промывают 12 мл ледяной воды и сушат на воздухе.
Кислота плавится при 174—176°; выход составляет 14—17 е
E5—66% теоретич.). Кислоту можно перекристаллизовать, если
растворить 10 г ее в 250 мл кипящей 5%-ной соляной кислоты
(примечание 9). При охлаждении раствора льдом выпадает в оса-
осадок 9,4г 2,5-динитробензойной кислоты в виде почти бесцветных
кристаллов; т'. пл. 177—178° (примечание 10).
Примечания
1. Был применен продажный 5-нитро-2-аминотолуол.
2. Из фильтратов после стояния в течение ночи выпадает
в осадок 5—5,6 г неочищенного 2-нитрозо-5-нитротолуола; при
вычислении приведенного в прописи выхода, это количество не
было учтено. Дополнительную порцию вещества можно прибавить
к препарату, полученному при перегонке с водяным паром.
2,5-ДИНИТРОБЕНЗОЙЫАЯ КИСЛОТА
213
3. Авторы синтеза указывают, что при фильтровании последо-
последовательно собранных порций дестиллата по 2 500 мл ими были по-
получены соответственно 14,5, 10,7, 9 и 2 е 2-нитрозо-5-нитротолуола
(иначе говоря, 36,2 е вещества из 10 л дестиллата). Проверявшие
синтез в одном из опытов получили 19, 12, 6 и 2 г (т. е. всего 39 г)
2-нитрозо-5-нитротолуола. В некоторых случаях для получения
30 г вещества приходилось собирать от 15 до 30 л дестиллата.
Авторы синтеза указывают, что если во время перегонки с водя-
водяным паром в смеси присутствует непрореагировавший амин, то
последний конденсируется с нитрозосоединением с образованием
смолистых веществ, в результате чего выход нитрозосоединения
уменьшается.
4. В благоприятных случаях вещество получается бесцветным
и плавится при 135—136°.
5. Методы, описанные в «Синт. орг. прсп.», сб. 1, стр. 296
и 416, непригодны для проведения окисления нитрозонитротолу-
олов. При применении метода, описанного на стр. 296, выход
динитрокислоты получается низким, а при использовании пропи-
прописи, помещенной на стр. 416, образуется динитрокислота с интен-
интенсивной окраской.
6. Для этого требуется 20—25 мин.
7. Проверявшие синтез указывают, что в одном из опытов
с удвоенными количествами исходных реагентов на этой стадии
некоторая часть полутвердой пены, находящейся на поверхности
перемешиваемого раствора, воспламенилась. Горение прекрати-
прекратилось через несколько минут. Выход конечного вещества был не-
несколько ниже. Следует обратить особое внимание на необходи-
необходимость следить за температурой во время процесса окисления дву-
хромовокислым калием для того, чтобы предотвратить слишком
бурное протекание реакции.
8. Нерастворившийся остаток в основном представляет собой
2,5-динитротолуол, который может быть использован в последую-
последующих синтезах 2,5-динитробензойной кислоты. Более значительные
выходы 2,5-динитротолуола получаются в том случае, если сокра-
сократить период перемешивания во время процесса окисления.
9. Дополнительные данные по перекристаллизации 2,5-дини-
2,5-динитробензойной кислоты следующие: из раствора 6,83 г вещества
в 200 мл кипящего толуола после фильтрования и охлаждения
было получено 5,9 г; из раствора 10 г вещества в ПО мл кипящей
воды после фильтрования и охлаждения было получено 9,18 г.
10. При использовании З-нитро-4-аминотол.уола была получена
3,4-динитробензойная кислота примерно с тем же выходом, какой
был указан при описании получения 2,5-динитробензойной кис-
кислоты. Авторы настоящей прописи сообщают:
«З-Нитро-4-аминотолуол легко растворяется в серной кислоте
при добавлении кислоты Каро; выделившийся З-нитро-4-нитрозо-
214
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
толуол фактически не содержит амина. Таким образом, можно пере-
перегонку с водяным паром не производить и подвергнуть нитрозосоеди-
нение непосредственному окислению до динитрокислоты, которая
получается в виде светлоокрашенного препарата. Из 100 г 3-нит-
ро-4-аминотолуола таким путем было -получено 102 г желтого
нитрозонитротолуола, при окислении которого образовалось
85 г 3,4-динитробензойной кислоты. Температура плавления по-
последней 158—162°; после однократной перекристаллизации была
получена чистая кислота. Из раствора 10 г кислоты в 210 мл кипя-
кипящей воды после охлаждения выделилось 9,1 г кислоты. Ана-
Аналогичным образом раствор 10 г кислоты в 280 мл горячей 5%-ной
соляной кислоты был быстро профильтрован и затем охлажден. Из
фильтрата выпала в осадок кислота в количестве 9,4 г».
Другие методы получения
2,5-Динитробензойная кислота была получена нитрованием
о-нитробензойной кислоты и дробной кристаллизацией кислот
в виде их бариевых солей1, а также окислением 2,5-динитро-
толуола2.
1 G г i e s s, Вег., 7, 1223 A874).
2 G г е 1 1, Вег., 28, 2564 A895).
3,5-ДИНИТРОБЕНЗОЙНАЯ КИСЛОТА
H2SO.j
C6HBCO2H + 2HNO3
(NO2J C6H3CO2H + 2Н2О
Предложили: Р. Брюстер и Б. Уильяме; Р. Филлит.
Проверили: Г. Адкинс и Дж. Ругов.
Получение
Способ 1. В 2-литровую круглодонную колбу помещают 61 г
@,5 моля) бензойной кислоты и 300 мл концентрированной серной
кислоты (уд. вес 1,84). К этой смеси прибавляют 100 мл дымящей
азотной кислоты (уд. вес 1,54) порциями по 2 или 3 мл. Во время
прибавления кислоты температуру поддерживают в интервале
между 70 и 90°, охлаждая колбу снаружи холодной водой (приме-
(примечание 1). Прибавление азотной кислоты следует проводить в хо-
хорошо действующем вытяжном шкафу. Колбу покрывают часовым
стеклом и оставляют в вытяжном шкафу на 1 час или, лучше, на
ночь. Затем, не вынимая колбу из вытяжного шкафа, нагревают ее
на паровой бане в течение 4 час; при этом выделяется значитель-
значительное количество бурых паров. Реакционной смеси дают охладиться
до комнатной температуры (примечание 2), в результате чего из
3,5-ДИНИТРОБЕНЗОЙНАЯ КИСЛОТА
215
раствора выпадают в осадок желтые кристаллы. К раствору при-
прибавляют еще 75 мл дымящей азотной кислоты и смесь нагревают
на паровой бане в течение 3 час, а затем на масляной бане
при 135—145° в течение еще 3 час. (в вытяжном шкафу).
В продолжение всего этого времени происходит непрерывное выде-
выделение бурых паров, особенно при нагревании на масляной бане.
Цвет реакционной смеси может быть от светложелтого до крас-
красновато-желтого.
Реакционной смеси дают охладиться и выливают ее в смесь
800 г льда и 800 мл воды. После стояния смеси в течение получаса
3,5-динитробензойную кислоту отфильтровывают с отсасыванием
и промывают водой до тех пор, пока она не будет более содержать
сульфат-иона. Выход сырого препарата составляет 62—65 г;
т. пл. 200—202е. Бго перекристаллизовывают из 275 мл горячего
50%-ного этилового спирта. Выход очищенной 3,5-динитробснзой-
ной кислоты составляет 57—61 г E4—58% теоретич.); т. пл. 205—
207° (примечание 3).
Способ 2. К 1 л концентрированной серной кислоты, нахо-
находящейся в 3-литровой круглодонной колбе, прибавляют при пере-
перемешивании 200 г бензойной кислоты A,6 моля). Колбу погружают
в холодную воду и, поддерживая температуру смеси ниже 45°,
прибавляют к ней 80 мл дымящей азотной кислоты. Когда темпе-
температура упадет до 30°, к смеси прибавляют 240 мл дымящей
азотной кислоты, горло колбы покрывают опрокинутым стаканом
и оставляют смесь стоять в течение 6 недель.
По прошествии этого времени колбу нагревают в течение 4 час.
на паровой бане, а затем на масляной бане при 145° до полного
растворения всех кристаллов. После охлаждения до комнатной
температуры образуется сплошная масса кристаллов. Их отфиль-
отфильтровывают на воронке Бюхнера, не пользуясь никаким филь-
фильтром. Кристаллы отжимают досуха, основательно размешивают
с 1 500 мл холодной воды, фильтруют через бумажный фильтр и су-
сушат на воздухе. Выход составляет 200—213 г F0% теоретич.).
Препарат плавится при 205—207° (исправл.; примечание 4).
Примечания
1. Температуру регулируют таким образом, чтобы выделение
бурых паров было минимальным.
2. Механическое перемешивание желательно, но не обязательно.
3. Температуры плавления определялись при помощи укоро-
укороченного термометра полного погружения.
4. По способу 2 работа проводилась также с количествами,
в 10 раз превышающими указанные в прописи, причем был полу-
получен выход на несколько процентов больше указанного выше.
216
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Другие методы получения
3,5-Динитробензойная кислота была получена нитрованием
бензойной кислоты смесью серной и дымящей азотной кислот1;
нитрованием 3-нитробензойной кислоты2; окислением 3,5-дини-
тротолуола х>3. Наряду с другими веществами она была получена
также при действии азотной кислоты на 1,5-динитронафталин1.
1 С a h о u r s, Jahresber. Fortsch. Chem., 1847—1848, 533; V о i t,
Ann., 99, 104 A856); Michler, там Ace, 175, 152 A875).; H п b n e r,
там же. 222, 72 A884).
'Tieraann, Judson, Ber., 3, 224 A870).
3 S t a e d e 1, Ann., 217, 194 A883).
4Бейльштейн, Кульбсрг, Ann., 202, 220 A880).
2,2'-ДИНИТРОДИФЕНИЛ
+ 2CuCl
NO,
Предложили: Р. Фьюзон и Э. Кливлэнд.
Проверили: В. Бахман, А. Уайлдс и Дж.
Получение
В 1-литровую колбу, снабженную механической мешалкой,
помещают 200 г A,27 моля) о-нитрохлорбензола и 300 г чистого
сухого песка. Смесь нагревают на масляной бане до 215—225°
и затем медленно прибавляют к ней 200 г медной бронзы (примеча-
(примечание 1); прибавление занимает около 80 мин. (примечание 2). Тем-
Температуру 215—225° поддерживают после этого в течение еще полуто-
полутора часов, не прекращая перемешивания. Смесь в еще горячем состоя-
состоянии переливают в стакан (примечание 3), содержащий 300—500 г
песка, и затем перемешивают ее до тех пор, пока не образуются
небольшие комки; по охлаждении их измельчают в ступке. Смесь
кипятят в течение 10 мин. с каждой из двух порций спирта по
1 500 мл и оба раза фильтруют ее после кипячения. Фильтраты
охлаждают в бане со льдом и отфильтровывают 2,2'-дипитродифе-
нил (примечание 4). Упариванием фильтрата получают вторую
порцию кристаллов. Вещество растворяют в горячем спирте (при-
(примечание 5), раствор обрабатывают активированным березовым
углем, фильтруют и охлаждают в бане со льдом. Препарат пере-
кристаллизовывают из горячего спирта и получают его в виде
чистых желтых кристаллов; т. пл. 123,5—124,5° (исправл.).
Выход составляет 80—95 г E2—61% теоретич.).
2,2'-ДИНИТРОДИФЕНИЛ
217
Примечания
1. Обычная медная бронза не всегда дает удовлетворительные
результаты в реакции Улльмана. Можно достигнуть более воспро-
воспроизводимых данных, если применять медную бронзу, получен-
полученную так, как это предложили Клейдерер и Адаме1. Согласно их
способу, медную бронзу обрабатывают в течение 5—10 мин. 2л
2%-ного раствора иода в ацетоне. Затем порошок отфильтровы-
отфильтровывают на воронке Бюхнера, вынимают из воронки, размешивают
в кашицу с 1 л раствора концентрированной соляной кислоты в аце-
ацетоне A : 1) и вновь фильтруют. Йодистая медь растворяется, а мед-
медная бронза остается на фильтре, где ее промывают ацетоном,
после чего сушат в вакуум-эксикаторе. Применять ее следует
немедленно.
2. Нельзя допускать, чтобы температура смеси поднималась
значительно выше 240°, так как может произойти восстановление
нитрогрупп, в результате чего образуется карбазол.
3. Нельзя допускать, чтобы реакционная смесь охлаждалась
в колбе, так как она застывает в твердую массу, удалить которую
из колбы невозможно.
4. Если в результате первых двух экстрагирований спиртом
не будет получено около 90 г неочищенного препарата, то имеет
смысл произвести экстрагирование песка и остатка в третий раз
(при проведении этой реакции выход неочищенного препарата во
всех случаях составлял не менее 90 г).
5. Если неочищенное вещество перекристаллизовать из мини-
минимального количества спирта, то фильтр при отсасывании очень
быстро будет забит, что вызовет соответствующую потерю времени
и материалов. Лучше всего брать 2 л спирта на ЮОг 2,2'-динитро-
дифенила. Все фильтраты были упарены до небольшого объема
и полученный неочищенный препарат был дважды перекристал-
перекристаллизован с применением активированного березового угля. (Полу-
(Полученное количество составляло около 10% общего выхода.)
Другие методы получения
2,2-'Динитродифенил был получен действием меди на о-нитро-
хлорбензол или о-нитробромбензол2 и на диазотированный
о-нитроанилин3.
1 Kleiderer, Adams, J. km. Chem. Soc, 55, 4225 A933).
1 U 1 1 m a n n, Bielecki, Ber., 34, 2174 A901).
1 Niementowski, Ber., 34, 3325 A901).
218
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
2,6-ДИОКСИАЦЕТОФЕНОИ
219
2,6-ДИОКСИ АЦЕТОФЕНОН
ГН H..SO4
+ CH3COCH2CO2C2H5 >
\/\с/
I
сн
(I)
,хн
+ С2Н5ОН + Н2О
но
чсо
I ¦
сн
+ (СН3ЮJО
сн
+ СН3СО2Н
сн3
сн,
сн,
со
ЧСО А1С13
I >
сн
сн3
сн3
со
I
НОГЧ/ ^СО 2Na0H Н°^Х
сн:
(III)
сн
сн3
со
затем H2SO1
сня
(IV)
+ СМ3СОСП3 + Na2SO4 + СО2
Предложили: А. Расселл и Дж. Фрай.
Проверили: Р. Щрайнер и М. Витте.
Получение
4-Метил-7-оксикумарин (/). В 5-литровую трехгорлую круг-
лодонную колбу, снабженную механической мешалкой, термомет-
термометром, доходящим до дна колбы, и капельной воронкой, помещают
2 л концентрированной серной кислоты (уд. вес. 1,84). Колбу уста-
устанавливают в бане со льдом и, когда температура упадет ниже 10°,
прибавляют к ее содержимому по каплям раствор 220 г B моля)
резорцина в 260 г B моля) свежеперегнанного ацетоуксусного
эфира. Смесь перемешивают и при помощи льда с солью поддер-
поддерживают се температуру ниже 10°. После того как весь раствор бу-
будет прибавлен (приблизительно через 2 часа), реакционную смесь
оставляют стоять в течение 12—24 час, больше ее не охлаждая.
Затем содержимое колбы при сильном перемешивании приливают
к смеси 4 кг льда с 6 л воды. Осадок отделяют на фильтре и про-
промывают тремя порциями холодной воды по 50 мл. Затем сырой
препарат растворяют в 3 л 5% -ного водного раствора едкого натра,
раствор фильтруют и замещенный кумарин переосаждают из
фильтрата, медленно прибавляя к нему разбавленную A : 10)
серную кислоту до тех пор, пока реакция раствора на лакмус не
станет кислой. Для этого требуется около 1 100 мл разбавленной
серной кислоты. Во время нейтрализации реакционную смесь
следует энергично перемешивать. Вещество отделяют на воронке
Бюхнера, промывают четырьмя порциями холодной воды по 50 мл
и сушат.
Выход 4-метил-7-оксикумарина составляет 290—320 г (82—
90% теоретич.). Полученный препарат пригоден для примене-
применения в следующей стадии; однако он может быть очищен пере-
перекристаллизацией из 95%-ного этилового спирта, для чего берут
около 15 мл спирта на 5 г вещества. Перекристаллизованное
вещество образует плотные, почти бесцветные игольчатые кри-
кристаллы с т. пл. 185°.
4-Метил-7-ацетоксикумарин (II). В 2-литровую круглодон-
ную колбу с пришлифованным обратным холодильником помеща-
помещают смесь 286 г A,6 моля) неочищенного сухого 4-метил-7-оксику-
марина и 572 г E,6 моля) уксусного ангидрида. Смесь кипятят
с обратным холодильником в течение 1,5 часа, затем охлаждают
примерно до 50° и при энергичном перемешивании выливают в
смесь 4 кг колотого льда с 4 л воды. Осадок отделяют на воронке
Бюхнера, промывают пятью порциями холодной воды по 50 мл и
для просушивания раскладывают на фильтровальной бумаге. Окон-
Окончательное высушивание препарата производят в сушильном шкафу,
обогреваемом паром, куда его помещают на 10 час. Выход неочи-
неочищенного 4-метил-7-ацетоксикумарина составляет 320—340 г (90—
96% теоретич.). С целью очистки вещество можно перекр'исталли-
зовать из 95%-ного этилового спирта B0 мл растворителя на 5 г
вещества). Препарат получается в виде волокнистых игольчатых
кристаллов; т. пл. 150—151°. Неочищенное высушенное в су-
сушильном шкафу вещество тщательно измельчают и применяют
R следующей стадии.
220
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
2,6-ДИОКСИАЦЕТОФЕНОН
221
4-Метил-7-окси-8-ацетилкумарин (III). В чистую сухую
5-литровую круглодонную колбу помещают 200 г @,92 моля) сухого
порошкообразного 4-метил-7-ацетоксикумарина и 453 г C,4 моля)
технического безводного хлористого алюминия. Колбу закупо-
закупоривают пробкой и с целью полного смешения ингредиентов сильно
встряхивают в течение 3—5 мин.; затем пробку вынимают и к кол-
колбе присоединяют обратный холодильник, который в свою очередь
присоединен к ловушке для поглощения газов («Синт. орг. преп.»,
сб. 2, стр. 78, рис. 3). Колбу погружают в масляную баню, темпе-
температуру которой быстро повышают до 125° и затем медленно в тече-
течение 2 час. доводят до 170°. По истечении этого времени колбу выни-
вынимают из масляной бани, дают ей охладиться и погружают в баню
со льдом. К содержимому колбы прибавляют около 1 кг колотого
льда, после чего в течение 2 час. приливают 2 400 мл разбавленной
A : 7) соляной кислоты. Затем, чтобы обеспечить полное разложе-
разложение, смесь нагревают на паровой бане при энергичном переме-
перемешивании в течение получаса. По истечении этого времени смесь
фильтруют, осадок промывают четырьмя порциями холодной
воды по 50 мл и отсасывают досуха. Неочищенный препарат пере-
кристаллизовывают, для чего растворяют его в 4 л горячего
95%-ного этилового спирта, горячий раствор фильтруют через
воронку с обогревом и фильтрат сильно охлаждают. Кристаллы
отделяют на воронке и сушат на воздухе. Вещество плавится при
162—163°; выход составляет 145—155 г G2,5—77,0% теоретич.;
примечание 1).
2,6-Диоксиацетофенон (IV). Трехгорлую круглодонную колбу
емкостью 5 л снабжают обратным холодильником, капельной
воронкой и стеклянной трубкой, которая доходит до дна колбы
и присоединена к баллону с азотом (примечание 2). В колбу
помещают 148 г @,68 моля) 4-метил-7-окси-8-ацетилкумарина
и 500 мл дестиллированной воды. Через водную суспензию про-
пропускают быстрый ток азота до тех пор, пока из прибора не бу-
будет вытеснен весь воздух, а затем продолжают пропускать через
раствор слабый ток газа (примечание 3). С помощью капельной
воронки к содержимому колбы прибавляют раствор 129 г C,23 мо-
моля) едкого натра в 580 мл воды и смесь нагревают в течение 5 час.
на паровой бане. Затем раствор охлаждают и подкисляют, приба-
прибавляя к нему около 1 л разбавленной A:3) соляной кислоты.
Как при нагревании, так и при охлаждении смеси через нее про-
продолжают пропускать азот. После того как раствор будет подкис-
подкислен, пропускание азота можно прекратить. Сырой 2,6-диоксиацето-
фенон, который выделяется при подкислении, собирают на
фильтре, промывают три раза холодной водой порциями по 50 мл
и сушат на воздухе. Выход твердого вещества, окрашенного
в светложелтый цвет, составляет 90—95 г (87—92% теоретич.,
считая на 4-метил-7-окси-8-ацетилкумарин).
С целью очистки полученный препарат растворяют в 1 л
95%-ного этилового спирта, прибавляют к раствору 20 г бере-
березового активированного угля и нагревают смесь в течение 15 мин.
на паровом нагревателе, время от времени встряхивая ее. После
этого к раствору прибавляют 800 мл теплой воды, нагревают его
в течение еще 5 мин. и фильтруют через воронку с обогревом.
Зеленоватый фильтрат охлаждают в бане со льдом и солью и от-
отфильтровывают первую порцию (около 65 г) 2,6-диоксиацетофено-
на в виде игольчатых кристаллов лимонно-желтого цвета. Фильтрат
упаривают в вакууме до объема 800 мл, вновь сильно охлаждают
его и отфильтровывают вторую порцию вещества (около 15 г).
Общий выход очищенного 2,6-диоксиацетофенона с т. пл.
154—155° составляет 75—85 г (выход перекристаллизованного
препарата равен 83—89%, считая на неочищенное вещество;
примечание 4).
Примечания
1. В маточном растворе после этой перекристаллизации содер-
содержится изомерное ацетильное производное, 4-метил-6-ацетил-
7-оксикумарин.
2. Вместо азота можно применять водород или светильный газ,
однако в этом случае следует принять должные меры предосто-
предосторожности и отвести газ из холодильника в вытяжной шкаф.
3. Существенным является предотвращение соприкосновения
щелочного раствора 2,6-диоксиацетофенона с кислородом, так как
это вызывает образование продуктов окисления, что заметно
снижает выход и затрудняет очистку. До тех пор, пока смесь
не подкислена, она должна находиться в атмосфере инертного
газа.
4. Первые две стадии этого синтеза были проведены, исходя
из количеств, в четыре раза превышающих указанные в прописи,
что не приводило к уменьшению выходов. В третьей стадии (пере-
(перегруппировка Фрайса) в этом случае обычно получаются меньшие
выходы. Исходные количества в четвертой стадии могут быть уве-
увеличены вдвое.
Другие методы получения
2,6-Диоксиацетофенон был получен действием йодистого метил-
магния на 2,6-диметоксибензонитрил1 с последующим расщепле-
расщеплением эфирных связей хлористым алюминием. Приведенная выше
пропись основана на методиках, которые описали Лимай2
и Бекер3.
1Mauthner, J. prakt. Chem., 139, 290 A934).
2 Li m a ye, Ber., 67, 12 A934).
3 В a k e r, J. Chem. Soc, 1934, 1953.
222
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
СООН
/Ч
3,5-ДИОКСИБЕНЗОЙНАЯ КИСЛОТА
(а-Резорциловая кислота)
СООН
HO,S
ВаСОз
SO,H
coo
о.
Ва,
NaOI-I, КОН
затем НС1 НО
СООН
Предложили: А. Вестон и Ч. Сьютер.
Проверили: Ч, Аллен и Дж. Гейтс, мл.
Получение
В 1-литровую колбу Кьельдаля, в верхнюю часть которой вста-
вставлена свободно входящая пробирка, через которую циркулирует
вода (примечание 1), помещают 200 г A,64 моля) бензойной кисло-
кислоты и приливают к ней 500 мл дымящей серной кислоты (примеча-
(примечание 2). Смесь нагревают на масляной бане в течение 5 час. при
240—250° (температура бани).
Реакционную смесь оставляют на ночь, после чего медленно
при перемешивании выливают сиропообразную жидкость в гли-
глиняный сосуд емкостью 15/, в котором находится 3 кг льда (при-
(примечание 3). Затем раствор нейтрализуют прибавлением 2 400—
2 500 г углекислого бария порциями по 100 г. Перед прибав-
прибавлением каждой порции смесь перемешивают до тех пор, пока
выделение газа не замедлится. Пастообразную массу фильтруют
с отсасыванием через воронку Бюхнера диаметром 30 см и
промывают сернокислый барий пятью порциями воды по 300 мл.
Соединенные вместе фильтраты выпаривают на паровой бане почти
досуха и затем сушат в сушильном шкафу при 125—140° (примеча-
(примечание 4). Выход неочищенной бариевой соли составляет 640—800 г.
Для проведения следующих двух операций работающий дол-
должен надеть предохранительные очки и перчатки с длинными об-
обшлагами. Высушенную и растертую в порошок бариевую соль вво-
вводят порциями по 200 г в расплавленную смесь 600 г едкого натра
и 600 г едкого кали, помещенную в медный котелок размером
14x20 см. Смесь перемешивают медной мешалкой и измеряют ее
температуру с помощью термометра, помещенного в медный кар-
карман (примечание 5). Каждую порцию до прибавления следующей
3,5-ДИОКСИВЕНЗОЙНАЯ КИСЛОТА
223
необходимо тщательно размешивать. Затем смесь медленно нагре-
нагревают до 250—260е; при этой температуре начинается бурная реак-
реакция с обильным выделением газа. После того как интенсивность
реакции несколько уменьшится (примерно через полчаса) темпера-
температуру смеси повышают до 280—310° и поддерживают ее на этом
уровне около 1 часа; затем смесь оставляют стоять до тех пор,
пока температура ее не понизится до 200°. Плав выливают в 6/ во-
воды (примечания 6 и 7). Сульфит бария отфильтровывают с отса-
отсасыванием и фильтрат подкисляют концентрированной соляной
кислотой (требуется около 2 500 мл).
Полученный раствор (около 9 л) делят на две части и каждую
из них экстрагируют три раза эфиром порциями по 600 мл (приме-
(примечание 8). Соединенные вместе вытяжки упаривают примерно до
1 л и сушат в течение ночи над 150 г безводного сернокислого
натрия.
После фильтрования и отгонки эфира остается 137—160 г
E8—65% теоретич.) слегка окрашенного вещества, которое пла-
плавится (с разложением) при 227—229°. Для большинства целей
препарат является достаточно чистым (примечания 9 и 10).
Примечания
1. Обыкновенная стеклянная воронка, вставленная в горло
колбы, дает менее удовлетворительные результаты; водяной холо-
холодильник также неудобен, так как он легко засоряется твердым
серным ангидридом.
2. Эту кислоту, содержащую около 30% серного ангидрида,
приготовляют смешением 500 г дымящей серной кислоты, содержа-
содержащей 60% свободного серного ангидрида, и 500 г концентриро-
концентрированной серной кислоты (уд. вес 1,84); применяют 500 мл этой
смеси.
3. Сначала продукт реакции может затвердеть, однако в даль-
дальнейшем он растворяется.
4. Выпаривание раствора удобно провести в течение ночи. Для
окончательного высушивания препарат лучше всего поместить
в плоские металлические чашки. Длительность высушивания зави-
зависит от температуры. Проверявшие синтез оставляли чашки на
паровом змеевике в течение 2 дней.
5. В качестве кармана применяется медная трубка диаметром
10—12 мм и длиной 18 см, заклепанная с нижнего конца. Мешалку
можно сделать из такой же трубки.
6. Прибавление горячего плава вызывает некоторое разбрыз-
разбрызгивание.
7. Можно также вылить плав в неглубокие металлические
чашки и дать ему охладиться и затвердеть. Затем плав растирают
в порошок и растворяют. Однако измельчение плава является
224
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ДИПНОН
225
трудной и неприятной операцией. Не следует допускать затвер-
затвердевания плава в реакционном сосуде.
8. Еще удобнее пользоваться большим автоматическим экстрак-
экстрактором.
9. Чтобы избавить вещество от окраски, можно перекристал-
перекристаллизовать его из горячей уксусной кислоты с применением угля для
обесцвечивания. Раствор 16 г неочищенной кислоты в 85 мл горя-
горячей уксусной кислоты фильтруют через 2-миллиметровый слой угля
в воронке с обогревом; после охлаждения выделяется 13,4 г ве-
вещества в виде белых игольчатых кристаллов. В результате вы-
высушивания при 100° C5 мм) в течение 2 час. получается безвод-
безводный препарат, который плавится (с разложением) при 234—235°
(исправл.). Температура плавления может изменяться в зависи-
зависимости от скорости нагревания.
10. Этот препарат получается в частично гидратированной
форме1. После перекристаллизации из воды температура плавления
не изменяется.
Другие методы получения
Удобнее всего синтезировать 3,5-диоксибеизойную кислоту
методом щелочного плавления дисульфокислоты, полученной
сульфированием бензойной кислоты1^3. Ее получали также
щелочным плавлением 3,5-дигалоидбензойных4'5 кислот или
З-бром-5-сульфобензойной кислоты8. Бензойную кислоту сульфи-
сульфируют серной кислотой различной концентрации с применением
катализаторов или без них'.
1 В а г t h, Senhoefer, Ann., 159, 222 A871); 164, 109 A872).
'Graves, Adams, J. Am. Chem. Soc, 45, 2439 A923).
3 Hohenemser, Ber., 35, 2305 A902).
4 Герм. пат. 286266 [Frdl.. 12, 158 A914—1916)].
5 Am. пат. 1321271 [С. А., 14, 186 A920)].
6 В 6 t t i n g e r, Ber., 8, 374 A875); 9, 180 A876); Bilow, R i e s s,
там же, 35, 3901 A902); К о 1 1 e r, Klein, Monatsh., 64, 85 A935).
'Herzig, Epstein, Monatsh., 29, 661 A901); В г u n n e r,
там же, 50, 216 A928); Lock, К о t t e s, там же, 68, 51 A936); S u t e г.
W e s t о n, J. Am. Chem. Soc, 61, 232 A939).
ДИПНОН
А1[ОС{СН3K]з
2CeH5COCH3 > C6H5(CH3)C = СНСОС6Н5 + Н2О
Предложили: У. Уэйн и Г. Лдкинс.
Проверили: Н. Дрэйк, У. Соудер, мл., и Р. Мозинео.
Получение
В 1-литровую кругло донную колбу стремя горлами, снабжен-
снабженную термометром, эффективной механической мешалкой (примеча-
(примечание 1) и елочным дефлегматором высотой 35 см с присоединенным
к нему холодильником и приемником, защищенным хлоркальцие-
вой трубкой, помещают 345 г D00 мл) сухого ксилола, 120 г
A17 мл, 1 моль) сухого ацстофенона и 135 г @,55 моля) трет-
бутилата алюминия (стр. 119) (примечание 2). Пускают в ход
мешалку и колбу нагревают на масляной бане так, чтобы темпе-
температура реакционной смеси держалась в интервале 133—137°. трет-
Бутиловый спирт начинает медленно отгоняться при 80—85° (темпе-
(температура в парах).
Если поддерживать температуру масляной бани при 150—155°,
то отгонку спирта можно завершить через 2 часа после начала
процесса (примечания 3 и 4).
Реакционную смесь охлаждают до 100° и при постоянном пере-
перемешивании осторожно приливают к ней небольшими порциями
40 мл воды. По мере того как происходит прибавление воды, смесь
загустевает в гель. После прибавления последней порции воды
и легкого постукивания по реакционной колбе затвердевшая
масса разжижается и начинается кипение. Чтобы обеспечить
полный гидролиз трет-бутялата алюминия, продолжают нагре-
нагревать масляную баню и поддерживать кипение в течение еще
15 мин.
Затем реакционную массу охлаждают, переносят примерно рав-
равными порциями в четыре сосуда для центрифугирования и отде-
отделяют гидроокись алюминия на центрифуге (примечание 5). Верх-
Верхний слой жидкости отделяют и гидроокись алюминия при помощи
шпателя тщательно растирают в пасту с 250 мл эфира (считая на
все четыре порции). Гидроокись алюминия вновь центрифугируют
и эфирные вытяжки сливают вместе. Центрифугирование повторя-
повторяют еще три раза, расходуя таким образом для отделения полу-
полученного вещества от гидроокиси алюминия около 1 л эфира (при-
(примечание 6).
Эфир и mpem-бутиловый спирт отгоняют при атмосферном да-
давлении без дефлегматора; для отгонки ксилола (давление 25—50 мм)
применяют елочный дефлегматор высотой 35 см. Остаток перено-
переносят в колбу меньшего объема и отгоняют сперва ацетофенон при-
примерно при 80° A0 мм), а затем дипнон при 150—155° A мм)
(примечания 7 и 8). Препарат получается в виде желтой жидко-
жидкости. Выход составляет 85—91 г G7—82% теоретич.).
Примечания
1. Вместо обычного ртутного затвора рекомендуется приме-
применять простой затвор из резиновой трубки, который предложил
Л. Киридес. В пробку вставляют стеклянную трубку диаметром
10 мм и длиной 8 см и на верхнюю часть ее надевают резиновую
15 Сборник 3
226
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ДИТИЗОН
227
трубку диаметром 6 мм и длиной 2 см таким образом, чтобы се
верхний конец выступал над концом стеклянной трубки на 5 мм.
Этот конец резиновой трубки образует герметичный затвор вокруг
стержня мешалки диаметром 8 мм, проходящего через стеклянную
трубку. Место соприкосновения стекла и резины покрывают гли-
глицерином, который служит не только для смазки, но и для созда-
создания герметичности. Такой тип затвора можно успешно приме-
применять при вакууме до 10 мм.
2. Для отщепления 1 моля воды следует взять немного больше
1 моля т/?ет-бутилата алюминия, так как алкоголят становится
менее реакционноспособным после замещения одной алкоксиль-
ной группы на гидроксильную.
3. Вначале реакция может протекать настолько бурно, что
температура при перегонке достигает 100° и даже выше. Однако
это не оказывает вредного действия, так как вскоре температура
начинает понижаться.
4. По мере протекания реакции окраска смеси меняется от
желтой до темноораижевой, а сама смесь становится вязкой. При-
Примерно через 45 мин. температура при перегонке начинает падать
и доходит иногда до 70° вследствие того, что из т/?ет-бутилата
алюминия, который при этой температуре частично разлагается,
образуется изобутилен.
5. Обыкновенный не абсолютный эфир применяют для уравно-
уравновешивания склянок при центрифугировании, при удалении гид-
гидроокиси алюминия и вещества, оставшегося в колбе, а также при
последующем экстрагировании гидроокиси алюминия.
6. При этом методе отпадает необходимость в промывании
и высушивании, обычных для проведения процесса экстрагирова-
экстрагирования. Незначительное количество остающейся влаги отгоняется
вместе с растворителем. Экстрагирование следует проводить тща-
тщательно и полностью. Если оно выполнено должным образом, то
гидроокись алюминия получается белого или слегка желтоватого
цвета. После того как будет проведена последняя перегонка,
количество синтезированного дипнона и полученного обратно
ацетофенона отвечает не менее 95% взятого в реакцию ацето-
фенона.
7. Ацетофенон и дипнон могут быть легко разделены с по-
помощью любой обычной колонки. Последняя должна быть короткой
A2—18 см) и иметь элсктрообогрев, ввиду высокой температуры
кипения полученного препарата. Остаток от перегонки состав-
составляет 5—10 г.
8. Температура кипения может быть весьма различной в зави-
зависимости от скорости перегонки и от того, насколько энергично
кипит жидкость.
Другие методы получения
Дипнон был получен действием этилата натрия1, бромистого
алюминия2, пятихлористого фосфора8, трифенилалюминия4, ди-
этилцинка8, гидроокиси кальция6, безводного хлористого водоро-
водорода5'', хлористого алюминия4 и трет-бутилата алюмкпия8 на аце-
ацетофенон. Он был получен действием хлористоводородной соли
анилина на ацетофенонанил с последующей обработкой соля-
соляной кислотой9. Получение mpem-бутилата алюминия описано
ка стр. 1198-10. Приведенная пропись является видоизменением
методики, которую предложили Адкинс и Кокс8.
Е i j k m а п, Chem. Weekblad, I, 349 A904).
Коновалов, Финогеев, ЖРФХО 34 944 (l^O9)
Т а > 1 о г, J. Chem. Soc, 1937, 304.
С а 1 1 о w а у, Green, J. Am. Chem. Soc, 59 809 A937)
H e n r l с h, Wirth, Monatsh., 25, 423 A904)
Porlezza, Gatti, Gazz. cliim. ital., 56, 265 A926)
Del a ere, Bull, classe sci. Acad. roy. Belg. C) 20 467 A898V
93 Kohle^ Am- Chem- J'>
()
8 A d к i n s, Cox, J. Am. Chem. Soc,
9 R e d d e 1 i e n, Ber., 46, 2712 A913).
10 Oppenauer, Rec. lrav. chim., 56, 137
60, 1151 A938)
A937).
ДИТИЗОН
(Дифенилшиокарбазон)
2 C6H5NHNH2 + CS2 ~> C8H5NHNH-C-SH.NH2NHC«H,
II
s
Нагревание
C,H5NHNH-C-SH.NH2NHC6H5
s
C6H5NHNHV
C6H5NHNH,
C-RNHNH^
+ C.H.NH,
Предложили: Дж. Биллман и Э. Клегэнд-
Проверили: Л. Смит и Б. Тиффсти.
Получение
Соль фенилгидразина и $-фенилдитиогидразинкарбоновой кис-
кислоты. В 1-литровую трехгорлую колбу, снабженную механиче-
15*
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ской мешалкой, холодильником и капельной воронкой, помещают
раствор 128 ли A,3 моля) чистого свежеперсгнанного фенилгидра-
зина в 600 мл не абсолютного диэтилового эфира. При энергичном
перемешивании к смеси прибавляют в течение получаса 52 мл
@,86 моля) сероуглерода (примечание 1). После этого смесь пере-
перемешивают в течение еще получаса; осадок отфильтровывают с от-
отсасыванием, промывают 50 мл эфира и оставляют разложенным на
фильтровальной бумаге в течение 15—20 мин., чтобы дать воз-
возможность испариться эфиру. Выход соли составляет 181—185 г
(96—98% теоретич.).
Дифенилтиокарбазид. Полученную, как было указано выше,
соль переносят в 1-литровый стакан и при непрерывном перемеши-
перемешивании от руки (примечание 2) нагревают (в вытяжном шкафу) на
водяной бане, температуру которой поддерживают в пределах
96—98° (примечание 3). Примерно через 10—15 мин. соль раз-
размягчается, становясь похожей на карамельную массу, окраши-
окрашивается в желтый цвет, вспенивается и выделяет сероводород.
Примерно через 20—30 мин. начинает выделяться аммиак. Как
только будут обнаружены первые признаки характерного запаха
аммиака (примечание 4), стакан снимают с бани, помещают на
1 мин. в сосуде холодной водой, а затем немедленно ставят в коло-
колотый лед. После этого к содержимому стакана прибавляют около
150 мл абсолютного спирта и смесь слегка нагревают, чтобы раз-
размягчить массу до состояния, в котором она напоминает карамель
(примечание 5); полученную массу перемешивают до тех пор, пока
она не превратится в зернистый осадок. Смесь оставляют стоять
в течение 1 часа при комнатной температуре, после чего осадок
отфильтровывают на воронке Бюхнера и промывают 50 мл абсолют-
абсолютного спирта (примечание 6). Выход неочищенного дифенилтиокар-
базида составляет 100—125 г F0—75% теоретич., считая на фенил-
гидразин; примечание 7).
Дитизон. Неочищенный дифенилтиокарбазид прибавляют к рас-
раствору 60 г едкого кали в 600 мл метилового спирта, помещенному
в 1-литровую кругло донную колбу. Последнюю погружают в ки-
кипящую водяную баню и смесь кипятят с обратным холодильником
точно в течение 5 мин. (примечание 8). Красный раствор охлажда-
охлаждают ледяной водой и фильтруют без отсасывания. К фильтрату при
энергичном перемешивании механической мешалкой прибавля-
прибавляют 1 н. раствор серной кислоты (900—1 100 мл), охлажденный до
0°; прибавление продолжают до тех пор, пока реакция раствора
на конго не будет кислой (примечание 9). Сине-черный осадок от-
отфильтровывают с отсасыванием и промывают 50 мл холодной воды
(примечание 10). Сырой карбазон растворяют в 500 мл 5%-ного
раствора едкого натра, смесь фильтруют с отсасыванием, фильтрат
охлаждают в бане со льдом и немедленно подкисляют охлажден-
охлажденным до 0° 1 н. раствором серной кислоты (требуется около 650 мл)
дитизон
229
до появления кислой реакции на конго. Осадок отфильтровы-
отфильтровывают с отсасыванием и промывают, для чего переносят его в 2-ли-
2-литровый стакан и тщательно размешивают с 1 600—1 800 мл холод-
холодной воды. Смесь фильтруют и процесс промывания повторяют до
тех пор, пока в промывных водах не перестанут обнаруживаться
следы сульфат-иона (примечание 11). Через осадок на воронке
Бюхнера в течение 20—30 мин. просасывают воздух, после чего
твердое вещество сушат в сушильном шкафу при 40°. На этой
стадии выход дитизона составляет 63—85 г. С целью очистки в
гильзу аппарата Сокслета (примечание 12) помещают 5—10 г
вещества, заливают его эфиром и оставляют стоять в течение
1 часа, а затем экстрагируют в течение 1,5 часа. После этого веще-
вещество из гильзы немедленно переносят в стакан, размешивают
с 50 мл эфира и смесь фильтруют с отсасыванием, пока большая
часть жидкости (но не вся жидкость) не будет удалена. Затем
сырое вещество сушат, отжимая его между листами фильтроваль-
фильтровальной бумаги. Выход чистого дитизона (дифенилтиокарбазона) соста-
составляет 43—54,8 г E0—64% теоретич., считая на фенилгидразин);
он имеет резко выраженную температуру разложения в интервале
165—169° (примечание 13).
Примечания
1. Осадок образуется немедленно после прибавления серо-
сероуглерода; смесь самопроизвольно нагревается, и ее температура
вскоре приближается к температуре кипения. Температуру смеси
поддерживают немного ниже этой последней, для чего может ока-
оказаться необходимым охлаждение ледяной водой. По мере прибав-
прибавления сероуглерода смесь становится пастообразной, затем не-
несколько более жидкой и под конец снова пастообразной.
2. В качестве эффективной мешалки может служить массивная
стеклянная палочка, изогнутая или сплюснутая па конце.
3. Необходимо следить за тем, чтобы температура бани не под-
поднималась выше 98°. Если вещество будет находиться долгое время
при температуре, превышающей 98°, или если его не охладить
немедленно после того, как оно будет снято с водяной бани, то
соль бурно разлагается, постояв в течение 10—15 мин.
4. Присутствие аммиака можно обнаружить при помощи лак-
лакмусовой бумажки еще прежде, чем будет заметен его запах; одна-
однако нагревание следует продолжать до тех пор, пока запах аммиака
не будет обнаруживаться бесспорно (но не дольше). Выход зависит
от скорости, с которой будет прекращено нагревание после появ-
появления первых признаков запаха аммиака.
5. Эта масса, пока она в горячем состоянии, бывает олив-
ково-зеленого цвета, но по охлаждении становится светлобу-
рой.
230
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
6. Осадок почти бесцветен. Если окрашенному в красный цвет
фильтрату и промывной жидкости предоставить медленно испа-
испаряться, то в осадок выпадет еще некоторое количество дифенил-
тиокарбазида. Если смесь перед фильтрованием оставить стоять
в течение некоторого времени, то количество осадка увеличится,
а количество вещества, остающегося в фильтрате, уменьшится.
7. Дифенилтиокарбазид не имеет отчетливой температуры плав-
плавления. Имеются указания на то, что это соединение при 130°
становится зеленым и при 150° плавится, образуя темнозеленую
жидкость, которая при дальнейшем нагревании разлагается.
8. Раствор нагревают до тех пор, пока он не закипит, после
чего продолжают кипячение в течение только 5 мин. Если раствор
будет кипеть в течение более продолжительного времени, то вы-
выход вещества уменьшится.
9. На завершение реакции указывает изменение цвета маточно-
маточного раствора, который теряет красную окраску и становится
бесцветным.
10. При работе с полученным осадком или с его суспензией
следует соблюдать осторожность. Если какое-либо количество ве-
вещества будет разлито или разбрызгано, то необходимо сразу же
удалить его, так как при высыхании вещество превращается в лег-
легкий порошок, который легко разносится. Он окрашивает кожу
в черный цвет, а все остальное—в яркорозовый.
11. Обычно бывает необходимо провести четыре или пять про-
промываний.
12. Емкость аппарата Сокслета, примененного авторами син-
синтеза, была равна 85 мл (до верхнего конца сифонной трубки).
Размер гильзы составлял 33x80 мм.
13. Чистое соединение полностью растворимо в хлороформе.
Другие методы получения
Настоящая пропись представляет собой видоизменение методи-
методики, примененной Э. Фишером1. Аналогичные методы описали
Г. Фишер2, Вертхейм3 и Груммитт и Стикл*.
1 Е. Fischer, Ann., 190, 118 A878); 212, 316 A882).
2 Н. Fischer, Leopold i, AViss. Veroffentl. Siemens-Konzern,
12, 44 A933) [C. A., 27, 3418 A933)].
MV e г t h e i m, Organic Chemistry Laboratory Guide', 2nd Ed.,
P. Blakiston's Son & Co., p. 504.
4 G r u m m i t t, Stickle, Ind. Eng. Chem., Anal. Ed., 14, 953
A942).
ДИФЕНИЛАЦЕТИЛЕН
231
ДИФЕНИЛАЦЕТИЛЕН
(Толан)
-> C6H5CHBrCHBrC6H5
C6H5C ~ C
C6H5CH=CHC6H5
CeH5CHBrCHBrCeHs + 2KOH
Предложили: Л. Смит и М. Фалков.
Проверили: В. Бахман и Ч. Максвелл.
Получение
В 1-литровой трехгорлой круглодонной колбе, снабженной об-
обратным холодильником, эффективной механической мешалкой
и капельной воронкой, приготовляют раствор 45 г @,25 моля)
/лраяс-стильбена в 750 мл эфира. К этому раствору в течение
10 мин. при энергичном перемешивании прибавляют 13,8 мл D3 г,
0,27 моля) брома. Через 5 мин. начинается выделение твердого
осадка, однако перемешивание продолжают в течение 1 часа. Затем
осадок отфильтровывают на воронке Бюхнера и промывают эфи-
эфиром до тех пор, пока он не станет бесцветным. Выход дибромстиль-
бена составляет 65,8—69,1 г G7—81% теоретич.); т. пл.^235—237°.
В круглодонной колбе емкостью 500 мл, снабженной обратным
холодильником, приготовляют раствор 90 г едкого кали в 150 мл
абсолютного этилового спирта (примечание 1). Раствор немного
охлаждают и затем прибавляют к нему несколькими порциями
дибромстильбен (примечание 2). Затем смесь кипятят в течение
суток на масляной бане (примечание 3) и в горячем состоянии
выливают в 750 мл холодной воды. Осадок отфильтровывают и про-
промывают 50 мл воды. Неочищенный дифенилацетилен сушат в ва-
вакуум-эксикаторе над хлористым кальцием в течение 18 час. при
комнатной температуре. Комкообразные светложелтые кристал-
кристаллы плавятся при 58—60°; выход составляет 33,7—37,8 г. При
перекристаллизации этого вещества из 50 мл 95%-ного этилового
спирта получают 29,2—30,5 г F6—69% теоретич., считая на стиль-
бен) чистого дифеиилацетилепа, который образует бесцветные
игольчатые кристаллы с т. пл. 60—61° (примечание 4).
Примечания
1. Чтобы достигнуть полного растворения щелочи в спирте,
колбу помещают в масляную баню при 130—140°.
2. Прибавление дибромстильбена немедленно вызывает бур-
бурную реакцию с выделением тепла. После каждого прибавления
необходимо снова устанавливать обратный холодильник на то
время, пока продолжается кипение.
3. Применение масляной бани с электрообогревом дает воз-
возможность поддерживать постоянную температуру бани, равную
130—140°.
232
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ДИФЕНИЛДИАЗОМЕТАН
233
4. Авторы синтеза получили тот же выход (в процентах) в опы-
опытах с количествами исходных реагентов, в четыре раза превышаю-
превышающими указанные в прописи. На проведение реакции было затрачено
столько же времени, сколько указано в прописи, за исключением
того, что прибавление брома продолжалось в течение получаса.
Другие методы получения
Дифенилацетилен был получен по изложенному выше методу1;
действием амида натрия на монохлорстильбен2; действием амида
калия на дихлорстильбен3; нагреванием 1,1-дифенил-2-хлорэтапа
с этилатом натрия в запаянной трубке4; из бензила через его
гидразон5.
1 S m i t h, H о e h n, J. Am. Chem. Soc, 63, 1180 A941); S 6 d e r-
b а с k, Ann., 443, 161 A925).
2 P a i 1 1 a r d, W i e 1 a n d, Helv. Chim. Acta, 21, 1363 A938).
3Coleman, Maxwell, J. Am. Chem. Soc, 56, 133 A934).
4Buttenberg, Ann., 279 327 A894).
5Schlenk, Bergman n, Ann., 463, 76 A928).
ДИФЕНИЛДИАЗОМЕТАН
( Диазодифенилметан)
(C,H6JCO-
(CeH5JC=NNH2 + H2O
Предложили: Л. Смит и К. Хоуард.
Проверили: X. Снайдер, Р. Роулэнд и X. Сэмпсон, мл.
Получение
Безводный гидразин (примечание 1). Перегонную колбу емко-
емкостью 250 мл устанавливают в масляной бане и соединяют с холо-
холодильником с помощью пробки, обернутой оловянной фольгой (при-
(примечание 2). В качестве приемника служит склянка для отсасывания
емкостью 250 мл. Эта склянка защищена хлоркальциевой трубкой
и соединена с холодильником также с помощью пробки, обернутой
оловянной фольгой. В перегонную колбу помещают 60 г 85%-ного
водного гидразин-гидрата (примечание 3) и 60 г гранулированного
едкого натра (примечание 4). Температуру масляной бани повыша-
повышают до 113° и поддерживают ее на этом уровне в пределах 2° в
течение 2 час. Затем температуру масляной бани постепенно повы-
повышают до 150°; за это время жидкий гидразин перегоняется в при-
приемник. Выход безводного гидразина составляет 30—30,5 г
(94—95,5% теоретич.). Препарат получается достаточно чистым
для применения в следующей стадии.
Гидразон бензофенона. В автоклав для гидрирования помеща-
помещают 25,2 г @,138 моля) бензофенона, 7,46 г @,23 моля) безводного
гидразина и Ымл абсолютного спирта. Автоклав закрывают крыш-
крышкой, на которой вместо обычного манометра устанавливают пре-
предохранительный клапан, и затем нагревают при 150° в течение
4 час. После того как автоклав охладится, его вскрывают и гидра-
гидразон бензофенона отделяют от смеси. Выход составляет 26,4 г;
т. пл. 94—99°. После перекристаллизации из 75 мл 95%-кого
спирта гидразон получается в виде длинных белых игольчатых
кристаллов с т. пл. 97—98°. Выход составляет 21,5—22,0 г
(80—82% теоретич.).
Дифенилдиазометан. В склянку для проведения реакции под
давлением помещают 19,6 г @,1 моля) гидразона бензофенона, 22 г
@,1 моля) желтой окиси ртути и 100 мл петролейного эфира (т. кип.
30—60°). Склянку закрывают, заворачивают в мокрое полотенце
и встряхивают на качалке в течение 6 час. при комнатной темпе-
температуре. Затем, чтобы удалить ртуть и азин бензофенона, если он
образуется (примечание 5), смесь фильтруют и фильтрат выпа-
выпаривают в вакууме досуха при комнатной температуре. Остав-
Оставшийся после выпаривания кристаллический дифенилдиазометан
плавится при достижении комнатной температуры (примечание 6);
очистка этого препарата затруднительна, однако для всех прак-
практических целей чистота его вполне достаточна. Выход составляет
17,3—18,6 г (89—96% теоретич.). Препарат должен быть исполь-
использован немедленно после его получения (примечание 7).
Примечания
1. Авторы синтеза считают, что настоящий метод получения1
безводного гидразина лучше метода, описанного на стр. 271,
примечание 7.
2. Для приборов, которые используют для работы с безводным
гидразином, необходимо применять хорошие корковые пробки,
обернутые оловянной фольгой.
3. Был применен продажный 85% -ный, гидразин-гидрат.
4. При отсутствии гранулированного едкого натра используют
едкий натр в палочках, который измельчают в ступке на куски
размером с горошину и быстро переносят в колбу.
5. Этот кетазин нерастворим в петролейном эфире.
6. По литературным данным, дифенилдиазометан плавится при
29—30°а; однако такая температура плавления Достигается только
после перекристаллизации вещества из петролейного эфира.
7. При стоянии дифенилдиазометан разлагается с. образованием
азина бензофенона. В одном из опытов при проверке синтеза ве-
шество хранилось при комнатной температуре; через 2 дня были
обнаружены кристаллы азина. На этой стадии препарат был испы-
234
СИНТЕЗЫ ОРГхАНИЧЕСКИХ ПРЕПАРАТОВ
тан на реакцию с бензойной кислотой следующим образом. К рас-
раствору 17 г бензойной кислоты в 90 мл эфира было осторожно
прилито 6,8 г дифенилдиазометана. Через полчаса избыток бен-
бензойной кислоты был извлечен разбавленным едким натром, после
чего эфир был отогнан. Выход неочищенного бензгидрилового
эфира бензойной кислоты с т. пл. 83—85° составил 7,4 гG5%тео-
ретич.). Из свежеприготовленного диазосоединения при работе
по той же методике был получен неочищенный сложный эфир
с количественным выходом.
Другие методы получения
Дифенилдиазометан был получен только окислением гидразо-
на бензофенона2. Приведенный выше метод разработали Штаудин-
гер, Антее и Пфеннингер; в него были внесены лить незначитель-
незначительные изменения. Описанный способ получения гидразона бензофе-
бензофенона является видоизменением прописи Курциуса и Раутерберга3.
1 R a s с h i g, Ber., 43, 1927 A910).
2Staudinger, Anthes, Pfcnninger, Ber., 49, 1932
A916).
3 С u г t i u s, Rauterberg, J. prakt. Chem. B), 44, 194 A891).
ДИФЕНИЛКЕТЕН
C,H5CCOCeH, + HgO -^ C,H5CCOCeH5 + Hg
ll /\
NNH2 N = N
С0Н5ССОС„Н5 -. N2 + (C6H5JC = C =
Предложили: Л. Смит и X. Хпен.
Проверили: Н. Дрэйк и Дж. Уильяме.
Получение
В ступке смешивают Е6 г @,25 моля) бензилмоногидразона
(«Синт. орг. преп.», сб. 2, стр. 506; примечание 1) с 81 г
@,38 моля) желтой окиси ртути и 35 г безводного сернокислого
кальция (примечание2). Смесь переносятв 1-литровую трехгорлую
колбу, снабженную мешалкой, холодильником и термометром.
Колбу помещают в водяную баню, прибавляют к ее содержимому
200 мл сухого бензола, не содержащего тиофена, и в течение 4 час.
перемешивают эту суспензию при 25—35° (термометр в растворе;
примечания 3 и 4). Реакционную смесь фильтруют через мелко-
мелкопористую фильтровальную бумагу с легким отсасыванием и остаток
промывают сухим бензолом до тех пор, пока промывная жидкость
не станет идти бесцветной.
ДИФЕНИЛКЕТЕН
235
Бензольный раствор диазосоединения переливают в капельную
воронку, защищенную хлоркальциевой трубкой и присоединенную
к перегонной колбе Клайзена емкостью 125 мл. Последняя снаб-
снабжена обращенным вниз холодильником и установлена так, чтобы
ее можно было нагревать в бане из сплава Вуда. Поддерживая тем-
температуру металлической бани при 100—110°, бензольный раствор
медленно прикапывают в горячую колбу. В этих условиях бен-
бензол отгоняется, а диазосоединение превращается в дифенилкетен.
Остаток перегоняют в вакууме в атмосфере азота и собирают фрак-
фракцию с т. кип. 115—125° C—4 мм) (примечание 5). Выход дифенил-
дифенилкетена составляет 31 г F4% теоретич.), из которых после повтор-
повторной перегонки получают 28 г вещества с т. кип. 119—121° C,5 мм)
E(S% теоретич.). Дифенилкетен лучше всего хранить в атмосфере
азота; прибавление к нему небольшого кристаллика гидрохинона
предотвращает полимеризацию (примечание 6).
Примечания
1. Бензилмопогидразоп можно также получить с практически
количественным выходом, пользуясь гидразин-гидратом, по мето-
методу, который впервые предложили Курциус и Тун1. Гидразин-гид-
Гидразин-гидрат [45 г @,75 моля) 85%-ного раствора гидразин-гидрата в воде]
медленно по каплям прибавляют при перемешивании к горячему
раствору бензила A58 г, 0,75 моля) в спирте C00 мл). Продукт
реакции начинает выпадать в осадок из горячего раствора после
прибавления трех четвертей всего количества гидразин-гидрата.
Когда будет прибавлен весь гидразин-гидрат, раствор нагревают
с обратным холодильником в течение 5 мин.: затем колбу охлажда-
охлаждают до 0° и гидразон отфильтровывают и промывают на воронке
двумя порциями холодного спирта по 100 мл. Температура плав-
плавления бензилгидразона 149—151° (с разложением).
2. Безводный сернокислый калий связывает воду, образовав-
образовавшуюся при окислении.
3. В начале реакции выделяется значительное количество теп-
тепла; поэтому для того чтобы поддержать температуру в указанных
выше пределах, к воде в бане приходится добавлять лсд. Через
10—15 мин. лед отставляют и поддерживают температуру 25—35°
при помощи водяной бани.
4. Наилучшие результаты получаются, если реакционную смесь
перемешивать в течение 4 час.
5. В перегонной колбе всегда остается вязкий красный остаток,
так что для удаления последних следов дифенилкетена приходится
прибегать к перегреву.
6. По сообщению авторов синтеза, последний был проведен
с удвоенными количествами всех реагентов. Выходдифенилкетена
при этом не понизился.
236
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
2,6-ДИХЛОРАНШШН И 2,6-ДИБРОМАИИЛИН
237
Другие методы получения
Дифенилкетен был получен действием трипропиламина на хлор-
ангидрид дифенилуксусной кислоты2; действием гранулирован-
гранулированного цинка на хлорангидрид дифенилхлоруксусной кислоты3; дей-
действием хинолина на хлорангидрид дифенилуксусной кислоты4.
Удобнее всего получать дифенилкетен нагреванием фенилбензоил-
диазометана по методу, который впервые описал Шротер6, а позд-
позднее применил Штаудингер6.
1 С u r t i u s, T h u n, J. prakt. Chem., B), 44, 176 A891).
2Staudinger, Ber., 44, 1619 A911).
3 Staudi nger, Ber., 38, 1735 A905).
«Staudinger, Ber., 40, 1148 A907).
5Schroeter, Ber., 42, 2346 A909).
«Staudinger, Ber., 44, 1623 A911).
2,6-ДИХЛОРАНИЛИН И 2,6-ДИБРОМАНИЛИН
_^
2HCl(HBr) + 2H2O2
CKBr)
NH<_)S
3 + 4H2O
Cl(Br)
>SO,NH,
Cl(Br)
Cl(Br)
Предложила: М. Сейкел.
Проверили: Х. Снайдер и А. Спрэдлинг.
Получение
Амид 3,5-дцхлорсульфаниловой кислоты. В 2-литровую кругло-
донную колбу, закрытую пробкой с двумя отверстиями, в которые
вставлены механическая мешалка и термометр, помещают 50 г
@,29 моля) амида сульфаниловой кислоты и 500 мл воды. Отмеряют
500 мл (около 6 молей) чистой концентрированной соляной кислоты
и 50 мл из этого количества приливают в реакционную колбу,
после чего смесь перемешивают (примечание 1); когда раствор
станет прозрачным, к нему приливают оставшееся количество
соляной кислоты. Если температура реакционной смеси не подни-
поднимется до 45°, то, продолжая перемешивание, раствор осторожно
нагревают на голом пламени горелки, пока его температура не
достигнет указанного уровня. Тогда к раствору прибавляют 65 г
E9 мл, 0,58 моля) 30%-ной перекиси водорода (уд. вес 1,108)
и энергично перемешивают его (примечание 2). Температура быст-
быстро повышается за счет теплоты реакции. Через 5 мин. начинает
появляться белый осадок; количество последнего быстро увеличи-
увеличивается, и он приобретает слабую окраску. Когда температура дости-
достигнет 60°, т. е. примерно через 10 мин. после прибавления перекиси
(примечание 3), дальнейшее повышение температуры смеси жела-
желательно предотвратить надлежащим охлаждением (примечание 4).
Реакции предоставляют идти в течение еще 15 мин. при 60°, а за-
затем колбу охлаждают в бане со льдом, не прекращая перемешива-
перемешивания. Когда температура понизится до 25—30°, смесь фильтруют
в один прием. Выход 3,5-дихлорсульфаниламида составляет
45—50 г F5—71% теоретич.). Неочищенный препарат окрашен
в темнорозовый цвет; он плавится в пределах 1—2° в интервале
200—205° (примечание 5).
2,6-Ди^лоранилин. Неочищенный амид 3,5-дихлорсульфанило-
вой кислоты прибавляют к 200—250 мл E мл на 1 г) 70%-ной сер-
серной кислоты A50 мл концентрированной кислоты, прибавленной
к 93 мл воды), находящейся в колбе емкостью 500 мл; в течение
2 час. смесь поддерживают при слабом кипении на масляной бане,
температура которой должна оставаться в интервале 165—195°
(примечание 6). Смесь, окрашенную в темный цвет, выливают в 2-ли-
2-литровую круглодонную колбу, куда предварительно помещают 1 л
воды; при этом происходит частичное выделение черного масла
в виде эмульсии. Колбу соединяют с холодильником при помощи
изогнутой стеклянной трубки; трубка, входящая в колбу, должна
быть согнута под небольшим утлом и обрезана таким образом, чтобы
ее отверстие находилось под прямым углом к поверхности раствора
(примечание 7). Вещество перегоняют с водяным паром, для чего
смесь нагревают до кипения на голом пламени горелки; приемник
охлаждают льдом. Твердое вещество выделяют из дестиллата и
сушат на воздухе (примечание 8). Выход имеющего белый цвет 2,6-
дихлоранилина равен 23,4—26 г G8—80% теоретич., считая
на 3,5-дихлорсульфаниламид, или 50—55%, считая на сульфанил-
сульфаниламид); т. пл. 39—40°. Если препарат окрашен, то его можно очи-
очистить повторной перегонкой с водяным паром; при этом выход со-
составляет более 90%.
Амид 3,5-дибромсульфаниловой кислоты.-Бромирование амида
сульфаниловой кислоты производят примерно таким же образом,
как и его хлорирование. Следует установить более эффективную
мешалку (примечание 9); при большой скорости вращения удовле-
удовлетворительные результаты дает мешалка с двойным рядом лопастей.
В смеси 850 мл воды (примечание 9) и 100 мл @,68 моля) 40%-ной
бромистоводородной кислоты (примечание 10) растворяют 50 г
@,29 моля) амида сульфаниловой кислоты. Раствор нагревают тем
же путем, как было указано выше, но до температуры 70—75°,
и прибавляют к нему 65 г E9 мл, 0,58 моля) 30%-ной перекиси
водорода (примечания 2 и 11). Через 2—3 мин. выпадает осадок,
238
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
и раствор окрашивается в желтый цвет. За счет теплоты реакции
уже через 10 мин. температура реакционной массы повышается до
85—90° без дальнейшего обогрева колбы извне. К концу реакции
температура падает примерно до 70° (примечание 12). Через полча-
полчаса от начала реакции (за это время смесь почти затвердевает и
перемешивание становится весьма затруднительным) (примеча-
(примечание 13) препарат в еще горячем состоянии фильтруют (примеча-
(примечание 14). Выход 3,5-дибромсульфаниламида составляет 85—90 г
(90—94% теоретич.). Неочищенное вещество, обладающее рыже-
рыжевато-коричневой окраской (примечание 15), плавится в пределах
1—2° в интервале 230—237° (примечание 16).
2,6-Диброманилин. В 2-литровую колбу, закрытую пробкой
с двумя отверстиями, в которые вставлены отводная трубка, соеди-
соединяющая колбу с холодильником, и трубка для ввода водяного пара,
помещают 50 г неочищенного амида 3,5-дибромсульфаниловой
кислоты (примечания 17 и 18) и 250 мл 70% -ной серной кислоты
E мл кислоты на 1 г препарата). Колбу нагревают на масляной
бане; когда температура последней достигнет 175—180°, через
смесь быстро пропускают водяной пар (примечание 19). Гидро-
Гидролиз продолжают таким путем в течение 2 час; при этом отго-
отгоняется небольшое количество диброманилина (примечание 20).
Затем бане дают охладиться до 105—110° и при этой температуре
отгоняют с водяным паром главную массу вещества. Выход слегка
окрашенного 2,6-диброманилина составляет 25—30 г F6—79%
теоретич., считая на 3,5-дибромсульфаниламид); т. пл. 84—86°
(примечание 21). С целью очистки препарат можно перекристал-
перекристаллизовать из 70%-ного спирта G мл спирта на 1 г вещества).
После перекристаллизации диброманилин получают в виде длин-
длинных бесцветных игольчатых кристаллов; т. пл. 87—88°. Выход
при перекристаллизации составляет 85—90%
Примечания
1. Таким путем можно значительно скорее растворить амид
сульфаниловой кислоты, чем при обработке его 6 н. раствором
кислоты в один прием. В последнем случае сперва выпадает
в осадок соль, которая снова растворяется медленно. Если при-
применять более концентрированную соляную кислоту, чем 6 н., то
для растворения хлористоводородной соли амида сульфаниловой
кислоты потребуется больший объем соляной кислоты. Следует
отметить, что если раствор не будет разбавлен, то амид дихлор-
сульфаниловой кислоты будет частично находиться в растворе
в виде его хлористоводородной соли. Если применить 4 н. раствор
кислоты, то реакция будет протекать гораздо медленнее, тогда как
интенсивность окраски полученного препарата не уменьшится
сколько-нибудь заметно.
2,6-ДИХЛОРАНИЛИН И 2,6-ДИВРОМАНИЛИН
239
2. С целью более экономного ведения процесса берут эквивалент-
эквивалентные количества амида сульфаниловой кислоты и перекиси водо-
водорода, так как при избытке одного из реагентов выходы не увели-
увеличиваются. Если взят избыток амида сульфаниловой кислоты, то
вещество приобретает не розовый, а скорее оранжево-рыжий
оттенок и уже не становится красным при последующем окислении.
Если же в избытке находится перекись водорода, то реакция проте-
протекает быстрее; однако к концу процесса происходит быстрое окисле-
окисление, в результате которого препарат приобретает темную окраску.
3. Если использовать меньшие количества реагентов, то для
того, чтобы достигнуть 60° и поддерживать температуру на этом
уровне, необходимо нагревание.
4. При отсутствии охлаждения температура поднимается вы-
выше 70° и побочные продукты окисления окрашивают осадок
в темнорозовый цвет. Однако появление окраски, повидимому, не
влияет в сколько-нибудь заметной степени на выход или на чистоту
дихлоранилина.
5. Цвет препарата может быть различным. Более высокая тем-
температура, значительный избыток перекиси, большая продол-
продолжительность реакции, более высокая кислотность и более высокие
концентрации реагентов приводят к образованию более сильно окра-
окрашенного конечного вещества. От окраски можно освободиться в ре-
результате нескольких перекристаллизации из ледяной уксусной
кислоты с применением угля для обесцвечивания. Если требуется
получить более чистый амид дихлорсульфаниловой кислоты, то
можно рекомендовать следующую методику. На каждые 10 г
@,058 моля) амида сульфаниловой кислоты берут 200 мл воды,
200 мл концентрированной соляной кислоты и 24 мл @,23 моля
или 2 эквивалента) 30%-ной перекиси водорода и реакцию ведут
при 25° в течение не более 2 час. Получается практически бесцвет-
бесцветный препарат с выходом 45—60% теоретического количества.
Его можно перекристаллизовать из очень большого объема воды,
из 95%-ного спирта или из ледяной уксусной кислоты. Темпера-
Температура плавления перекристаллизованного препарата 205—205,5°.
6. Отщепление сульфамидной группы происходит быстрее при
применении 75%-ной серной кислоты; однако выход в этом случае
оказывается ниже. При использовании 65%-ной серной кислоты
реакция протекает очень медленно, что весьма неудобно.
7. Такой изгиб предотвращает механическое увлечение окра-
окрашенных в темный цвет примесей из кипящего темного раствора.
Пользоваться обычной колбой Вюрца нельзя, так как темная
маслянистая жидкость поднимается по стенкам колбы и посту-
поступает в боковой отвод.
8. Трудно определить выход с точностью. Препарат приходит-
приходится сушить на воздухе вследствие его низкой температуры плавле-
плавления. При стоянии же он сильно улетучивается.
240
СИНТЕЗЫ ОКГАНИЧЕСШ1Х ПРЕПАРАТОВ
9. Ввиду получения большего количества вещества требуется
большее разбавление первоначального раствора и одновременно
применение эффективной мешалки, способной производить доста-
достаточное перемешивание.
10. Реакция может быть проведена быстрее и при более низкой
температуре с получением более светло окрашенного сырого веще-
вещества, если взять удвоенное (полчаса при 45Э) или четырехкратное
B0 мин. при 25°) количество бромистоводородной кислоты. Если
же использовать минимальное, т. е. указанное выше количество
кислоты (кратное примерно 1,15 требуемого по теории количества),
то можно получить такой же выход препарата со столь же высо-
высокой температурой плавления, как это указано в методике, но про-
произвести при этом меньшие затраты.
Вместо 100 мл 40%-ной бромистоводородной кислоты можно
взять 75 мл 48%-ной кислоты.
11. Применение избытка перекиси водорода при бромировании
вызывает образование также и триброманилина1^4. Если исполь-
использовать только 0,29 моля перекиси, то получится однобромистое
производное.
12. Если проводить опыт с небольшими количествами реаген-
реагентов, то для достижения и поддержания температуры внутри колбы
в пределах 80—85е в течение получаса, пока продолжается реак-
реакция, необходимо применять баню для подогревания.
13. Реакцию можно считать законченной, когда будет отмечено
внезапное усиление или появление желто-бурой окраски свобод-
свободного брома. Это может быть более или менее заметно при описан-
описанных выше условиях, так как раствор интенсивно окрашен, что
является следствием высокой температуры и лишь очень неболь-
небольшого избытка бромистоводородной кислоты; появление брома
ясно видно в случае большего избытка кислоты или при более
низкой температуре.
14. Горячее фильтрование дает возможность удалить следы
монобромпроизводного, растворимого в воде и кислотах.
15. Если реакцию проводить при более низкой температуре
с избытком бромистоводородной кислоты, то неочищенный пре-
препарат получится менее окрашенным. Однако температура плавле-
плавления вещества при этом не повышается, процесс очистки его не ста-
становится проще и выход при перекристаллизации увеличивается
лишь очень незначительно.
16. С целью очистки сырое вещество перекристаллизовывают
из ледяной уксусной кислоты или, лучше, из 95%-ного спирта
B5 мл спирта на 1 г препарата) с применением угля для обес-
обесцвечивания; после двух перекристаллизации получают бесцветные
игольчатые кристаллы с т. пл. 239—240°.
17. Неочищенное вещество, применяемое для процесса отщеп-
отщепления сульфамидной группы, следует предварительно испы-
2,6-ДИХЛОРАНИЛИН II 2,6-ДИВРОМАНИЛИН
241
тать на отсутствие в нем примеси силш-триброманйлина.
С этой целью выясняют растворимость вещества в 1 н. растворе
щелочи. Должен получиться прозрачный, хотя и окрашенный
раствор. Если же раствор окажется мутным, то необходимо очи-
очистить загрязненное вещество, для чего препарат растворяют в ще-
щелочи, раствор фильтруют и амид осаждают вновь.
18. Чтобы в указанных выше условиях неизменно получать
чистое вещество с высокой температурой плавления, следует,
повидимому, исходить максимально из 50 г 3,5-дибромсульфанил-
амида. Если желательно получить особенно чистый препарат, то
исходное вещество следует взять в еще меньшем количестве.
19. Было найдено, в полном согласии с указаниями более
ранних исследователей''3'5, что на этой стадии абсолютно необ-
необходимо в процессе отщепления сульфамидной группы от дибром-
производного применять струю водяного пара. Без применения
водяного пара образуются значительные количества симм-три-
броманилина6; перегретый пар в данном случае не требуется. Сте-
Степень чистоты сырого препарата изменяется в зависимости от от-
отношения количества пара к объему реакционной смеси; ток водя-
водяного пара должен быть очень быстрым или же количество ве-
вещества, перерабатываемое за одну операцию, должно быть не-
небольшим.
20. В течение указанного времени было собрано 1 500 :мл де-
стиллата.
21. Если неочищенное вещество плавится при более низкой
температуре, то это обстоятельство означает, что в препарате
содержится слишком большое количество триброманилина, при-
примесь которого будет мешать удовлетворительной очистке вещества.
Перекристаллизация в данном случае не помогает. Повторная
дробная перегонка с паром приводит к цели лишь очень медленно.
Другие методы получения
Бейльштейн7 и Кернер8 получали 2,6-дихлоранилин восстано-
восстановлением 2,6-дихлорнитробензола. Лучший метод, описанный гораз-
гораздо позднее9, заключается в хлорировании сульфаниловой кисло-
кислоты в 1 %-ном растворе свободным хлором с последующим выпари-
выпариванием раствора и отщеплением сульфогруппы, как было указано
выше. Настоящий метод (о котором уже сообщалось ранее в не-
несколько измененной форме и для получения небольших коли-
количеств10), хотя и требует использования менее доступных исходных
реагентов, представляет большие удобства и дает более высокие
выходы.
2,6-Диброманилин был получен многократно 1.з,5,б,н бро-
мированием сульфаниловой кислоты и отщеплением сульфогруппы
от продукта реакции или его солей. Фукс12 бромировал амид
сульфаниловой кислоты свободным бромом и отщеплял сульф-
16 Сборник 3
242
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
амидную группу обычным путем. Кроме того, был применен спо-
способ, заключающийся в восстановлении соответствующего нитро-
соединения13; также были использованы и другие методы14.
1 Н е i n i с h e n, Ann., 253, 274 A889).
2 Н е i n i с h e n, Ann., 253, 269 A889).
3 О г t о п, Pearson, J. Chem. Soc, 93, 735 A908).
4Sudborough, Lakhumalani, J. Chem. Soc, 111, 45
A917).
6Montagne, Moll Van Charante, Rec. trav. chim.,
31, 334 A912).
• Liinpricht, Ber., 10, 1541 A877).
'Бейльштейн, Курбатов, Ann., 196, 219, 228 A879).
8 Кбгпе г, Contardi, Atti accad. Lincei, E), 18, I, 100
[C. A., 4, 1619 A910)].
'Dyson, George, Hunter, J. Chem. Soc, 1926, 3043.
"Seikel, J. Am. Chem. Soc, 62, 1214 A940).
11 W i 1 1 ge г о d t, J. prakt. Chem., B), 71, 562 A905).
12Fuchs, Monatsh., 36, 124 A915).
13 С 1 a u s, Weil, Ann., 269, 220 A892).
11 В u n i n g, Rec. trav. chim., 40, 345, 347 A921).
я, а-Д И ХЛ ОРАЦЕТАМИД
CC18CH(OHJ + 2NH4OH >¦ CHC12CONH2+NH4C1 + 3H2O
Предложили: Дж. Кларк, В. Шайб и Р. Коннор.
Проверили: Р. Шрайнер и Н. Мун.
Получение
Раствор 134 г @,81 моля) хлоральгидрата (примечание 1) в
400 мл эфира (примечание 2) помещают в 2-литровую круглодон-
ную трехгорлую колбу, которую снабжают капельной воронкой,
обратным холодильником и эффективной мешалкой с ртутным
затвором (примечание 3). Из капельной воронки в течение 15 мин.
к содержимому колбы прибавляют раствор 12 г цианистого калия
(примечание 4) в 220 мл концентрированного водного аммиака
(уд. вес 0,90) с такой скоростью, чтобы вызвать сильное кипение
эфира. Перемешивание продолжают в течение еще 20 мин. (при-
(примечание 5). Слои разделяют и эфирный слой промывают один раз
75 мл воды и один раз 75 мл 10%-ного водного раствора серной
кислоты (примечание 6; промывные растворы сохраняют и позд-
позднее используют снова). Водный слой из реакционной смеси экс-
экстрагируют тремя порциями эфира по 75 мл и каждую эфирную вы-
вытяжку промывают последовательно теми же порциями воды и вод-
водного раствора серной кислоты, которые были применены ранее.
Соединенные вместе эфирные вытяжки сушат над 40 г сернокислого
натрия, эфир отгоняют, а остаток перекристаллизовывают из
200 мл бензола. Кристаллы отфильтровывают с отсасыванием и
а.о-ДИХЛ ОРАЦЕТАМИД
243'
промывают два раза холодным бензолом порциями по 25 мл.
Выход вещества с т. пл. 97,5—99,5° (исправл.) составляет 66—76 г.
Если фильтрат упарить, то молено получить еще 1—5 г препарата,
температура плавления которого несколько ниже [96—97° (ис-
(исправл.)]. Таким образом, общий выход а,а-дихлорацетамида со-
составляет 67—81 г F5—78% теоретич.).
Примечания
1. Был применен хлоральгидрат фармакопейной чистоты.
2. В присутствии эфира уменьшается осмоление, вероятно, бла-
благодаря регулированию температуры реакционной смеси.
3. Очень трудно предотвратить улетучивание аммиака и эфи-
эфира. Реакцию следует проводить в вытяжном шкафу.
4. Был применен 94—96%-ный цианистый калий.
5. Значительное увеличение продолжительности реакции вызы-
вызывает осмоление и приводит к получению препарата, который с тру-
трудом поддается очистке. Реакцию нельзя прерывать до тех пор,
пока эфирные вытяжки не будут промыты, как это было указано
выше.
6. Эфирные вытяжки реакционной смеси содержат примеси,
которые при отгонке растворителя служат причиной осмоления.
Обработка водой и кислотой служит для удаления этих примесей.
Столь же хорошие выходы вещества можно получить, если пе
производить этих промываний, но тогда необходимо при перекри-
перекристаллизации из бензола обесцветить раствор активированным бере-
березовым углем; для получения бесцветного препарата может потре-
потребоваться вторичная перекристаллизация.
Другие методы получения
Дихлорацетамид был получен из этилового эфира дихлоруксус-
ной кислоты действием на него спиртового1 или водного2 раствора
аммиака; взаимодействием этилового эфира дихлормалоновой
кислоты и спиртового раствора аммиака3; действием аммиака на
пентахлорацетон4, хлоральциангидрин5 и гексахлор-1,3,5-цикло-
гексантрион6; взаимодействием хлоральаммиака и цианистого
калия7, действием хлористого водорода на дихлорацетонитрил8,
взаимодействием аспарагина с натриевой солью N-хлор-тг-толуол-
сульфонамида9 и действием цианистой щелочи и аммиака на
хлоральгидрат10.
1 Geuther, Jahresbericht der Chemie, 1864, 317.
! d ' О u v i 1 1 e, Connor, J. Am. Chem. Soc, 60, 33 A938).
'Conrad, Bruckner, Der., 24, 2993 A891); Dootson,
J. Chem. Soc, 75, 169 A899).
4 Cloez, Compt. rend., 53, 1122 A864).
'Pinner, Fuchs, Ber,, 10, 1058A877).
244
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
1 Z i n с к е, Kegel, Ber., 23, 230 A890).
7Schiff, Special e, Gazz. chim. ital., 9, 335 A879).
8 S te inkop f , Malinowski, Bcr., 44, 2898 A911).
9 D а к i n, Biochem. J., 11, 79 A917).
10 С h a t t a w a y, Irving, J. Chem. Soc, 1929, 1038.
ДИЭТИЛАЦЕТАЛЬ КЕТЕНА
BrCH2CH(OC2H5J + (CH3KCOK —> CH2
Предложили: С. Мак-Эльвен и Д. Кундигер.
Проверили: Р. Шрайнер и К. Тилфорд.
Получение
В 2-литровую круглодониую колбу, лучше всего в колбу,
снабженную сменяемыми частями на шлифах, помещают 650 г
(820 мл) абсолютного mpem-бутилового спирта (примечание 1)
и 39,1 г(\ грамма том) калия* (примечание 2). Колбу соединяют с об-
обратным холодильником и смесь кипятят, пока весь калий не рас-
растворится (около 8 час). Затем раствору дают слегка охладиться
и быстро прибавляют к нему 198 г A моль) бромацеталя (стр. 109)
и несколько кусочков битой глиняной тарелки (примечание 3).
Немедленно начинает выпадать осадок бромистого калия, окра-
окрашенный в кремовый цвет. Колбу сразу присоединяют к елочному
дефлегматору высотой 46 см с частой наколкой, снабженному
стеклянной изоляционной рубашкой и головкой для полной кон-
конденсации и регулируемого отбора дестиллата1 (примечание 4).
На масляной бане A20—130°) отгоняют mpe/л-бутиловый спирт
со скоростью 25 капель в 1 минуту при флегмовом числе, равном
6:1. Отгонка занимает 16—18 час. (примечание 5), причем к кон-
концу этого периода температуру масляной бани повышают до 160°
и поддерживают на этом уровне до тех пор, пока не прекратит-
прекратится отгонка спирта. Затем баню отставляют и дают ей охладиться;
в это время давление внутри прибора постепенно снижают до
200 мм и поддерживают на этом уровне при помощи маностата
(примечание 6).
При 51—52° B00 мм) в приемник переходит небольшое коли-
количество спирта, затем после возобновления нагревания с помощью
бани перегоняется 4—6 ли промежуточной фракции. За ней сле-
следует фракция, кипящая при 83—86° B00 мм), которую собирают
в качестве чистого ацеталя кетена. Общий выход составляет
78—87 г F7—75% теоретич.). Большую часть дестиллата соби-
собирают при температуре бани 120—140°, а остальное количество
получают, повышая температуру до 170—180°.
* См. подстрочное примечание иа стр. 45.
ДИЭТИЛАЦЕТАЛЬ КЕТЕНА
245
Ацеталь кетена лучше всего хранить в склянке из щелочного
стекла. Желательно использовать новую склянку и обсыпать ее
внутренние стенки пылевидным mpem-бутилатом натрия (примеча-
(примечание 7). Стеклянную пробку следует тщательно смазать. Однако
даже при таких предосторожностях все же образуются небольшие
количества объемистого осадка белого полимера.
Примечания
1. трет-Бутиловый спирт кипятят с негашеной известью, пере-
перегоняют и затем снова повторяют перегонку в присутствии металли-
металлического калия A г калия на 100 г спирта). При использовании mpem-
бутилового спирта, регенерированного в ходе предшествующего
синтеза ацеталя кетена, получаются повышенные выходы аце-
ацеталя.
2. Калий следует нарезать кусочками, достаточно мелкими для
того, чтобы они могли пройти через горло колбы. Можно восполь-
воспользоваться также и натрием в mpem-бутиловом спирте, но тогда
последующую реакцию следует проводить в запаянных трубках при
125°. Указанного количества mpem-бутилового спирта достаточно
для полного перехода калия в его mpem-бутилат.
3. Для последующей перегонки при пониженном давлении поль-
пользовались капилляром, через который поступал сухой азот, однако
лучше применять кусочки битой глиняной тарелки (около шести
кусочков). Учитывая быстроту реакции ацеталя кетена с водой,
его следует предохранять от влаги воздуха.
4. Для регулирования этой перегонки удобнее всего пользо-
пользоваться головкой Уитмора и Люкса1. Отводная трубка головки со-
соединена с приемником при помощи паука, защищенного от влаги
воздуха большой хлор кальциевой трубкой. Проверявшие синтез
заменили елочный дефлегматор колонкой с насадкой из одиноч-
одиночных витков стеклянной спирали. Колонка окружена нагреватель-
нагревательной^ рубашкой; высота ее равна 50 см. Проводимая с помощью
этой колонки отгонка mpem-бутилового спирта занимала 3—5 час.
5. Уменьшение скорости перегонки не ведет к увеличению выхо-
выхода, однако перерывы во фракционировании вызывают его сокра-
сокращение.
6. Необходим хороший маностат. Регулирование пониженного
давления путем использования сообщения системы с атмосферой
через каучуковую трубку с зажимом или через капилляр совер-
совершенно неудовлетворительно, так как в результате незначитель-
незначительного увеличения давления жидкость перестает кипеть, флегма из
колонки стекает в колбу и кусочки битой глиняной тарелки, ис-
используемые в качестве кипелок, становятся неэффективными.
Авторы синтеза применяли маностат, описанный Эллисом2, в кото-
¦246
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ром обычное реле было заменено электронным. Устройство послед-
последнего описали Ваддл и Саемап3.
7. Колонку и прибор не следует промывать хромовой смесью,
так как поверхность стекла, на которой в этом случае остается
кислота, служит катализатором полимеризации ацеталя кетена4.
Тонкая пленка полимера на стенках прибора безвредна. Если
полимер необходимо удалить, то лучше всего растворить его в
10%-ном растворе хлористого водорода в ацетоне; в результате
получается тёмнокрасный раствор.
Другие методы получения
Ацеталь кетена был получен действием трет-бутилата калия
на иодацеталь5 или бромацеталь*.
1 W h i t m о г е, Lux, J. Am. Chem. Soc., 54, 3451 A932); Розен-
г а р т, Техника лабораторной перегонки и ректификации, Госхимиздат,
1951, стр. 86.
3 Ellis, Ind. Eng. Chem.. Anal. Ed., 4, 318 A932).
3 Waddle, Saeman, Ind. Eng. Chem., Anal. Ed., 12, 225 A940);
Ferry, там же, 10, 647 A938).
'Johnson, Barnes, McElvain, J. Am. Chem. Soc, 62,
964 A940).
1 Beyerstedt, McElvain, J. Am. Chem. Soc, 58, 529 A936).
w-ДОДЕЦИЛМЕРКАПТАН
(Лаурилмеркаптан)
ж\
н-С]2Н25Вг + S = С (,NH2J -> С,2Н26—S-Cf • НВг
XNH2
#NH
VNH,
НВг + 2NaOH
NH
-4,2C,2H25SH + H2N—B— NHCN + 2NaBr + 2H2O
Предложили: Г. Уркварт, Дж. Гейтс, мл. и Р. Коннор.
Проверили: Л. Смит, Р. Арнольд и К. Стивенсон.
Получение
Смесь 125 г @,5 моля) бромистого н-додецила (примечание 1),
38 г @,5 моля) тиомочевины и 250 .ил 95%-ного этилового спирта
кипятят в колбе с обратным холодильником в течение 3 час. на па-
паровой бане (примечания 2—4). Затем к содержимому колбы приба-
прибавляют раствор 30 г @,75 моля) едкого натра в 300 мл воды и снова
Н-ДОДЕЦИЛМБРКАПТАН
247
кипятят смесь в продолжение 2 час. В течение этого времени мер-
меркаптан выделяется в виде масла, окрашенного в розовый или крас-
красный цвет. Верхний слой отделяют; водный слой подкисляют раз-
разбавленной серной кислотой G мл концентрированной серной кис-
кислоты на 50 мл воды), а затем экстрагируют один раз бензолом
порцией в 75 мл (примечание 5). Вытяжку прибавляют к неочищен-
неочищенному меркаптану (верхний слой), все вместе промывают дважды
водой порциями по 200 мл и сушат над 20 г безводного сернокисло-
сернокислого натрия (примечание 6). Растворитель отгоняют, а оставшееся
масло перегоняют из специальной колбы Клайзена. Головной по-
погон весьма незначителен (примечание 6). Выход н-додецилмеркап-
тана с т. кип. 165—169° C9 мм) составляет 80—84г G9—83% тео-
ретич.; примечания 7 и 8).
Примечания
1. Получение бромистого /i-додецила было описано ранее
(«Синт. орг. преп.», сб. 1, стр. 112). Если внести в методику приве-
приведенные ниже изменения, то можно избежать образования эмуль-
эмульсии при промывании бромистого н-додецила серной кислотой.
Полученный в результате реакции сырой бромид тщательно про-
промывают водой, а затем раствором поташа. Промывать водой сле-
следует весьма тщательно, чтобы удалить большую часть кислоты
и тем самым предотвратить сильное вспенивание при промы-
промывании поташом. Затем бромид сушат над хлористым кальцием
и перегоняют. Дестиллат промывают концентрированной серной
кислотой и обрабатывают, как указано в методике («Синт. орг.
преп.», сб. 1, стр. 112). Однако проверявшие синтез считают, что
следует предпочесть метод с применением безводного бромистого
водорода («Синт. орг. преп.», сб. 2, стр. 112).
2. Образующуюся в качестве промежуточного продукта броми-
стоводородную соль я-додецилизотиомочевины можно выделить,
если спиртовой раствор охладить льдом и отфильтровать осадок.
С целью дополнительной очистки его можно промыть эфиром.
Еще лучших результатов можно достигнуть, пользуясь следующей
методикой. Спиртовой раствор разбавляют 150 мл воды и нагревают
до тех пор, пока он не станет гомогенным; затем раствор слегка
охлаждают и добавляют к нему 200 мл концентрированной соляной
кислоты; хлористоводородная сольн-додецилизотиомочевины выде-
выделяется количественно в виде воскообразного твердого вещества
белого цвета.
3. Продолжительность кипячения, необходимая для заверше-
завершения реакции, бывает различной в зависимости от строения галоид-
галоидного соединения. Для некоторых бромистых алкилов требуется
нагревание в течение более 3 час. В случае хлористых алкилов
часто требуется 16 час, а иногда и сутки.
248
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
4. Этот процесс может быть применен и для получения других
меркаптанов, причем выходы бывают того же порядка. Температу-
Температуры кипения меркаптанов следующие:
н-Гептилмеркаптаи
к-Октилмеркаптан
к-Нонилмеркаптан
к-Децилмеркаптан
к-Ундецилмеркаптан
к-Октадецилмеркаптан
198—200°;
220—222°;
88—91° Aмм):
174—176°
98—100°
98—100°
96- 97°
B2 мм)
A5 » )
( 5 » )
103-104° ( 3 » )
170—175° ( 4 » )
5. В этом случае наиболее подходящим растворителем для
экстрагирования является бензол, однако иногда при примене-
применении его для экстрагирования других меркаптанов образуются
эмульсии. Для того чтобы избежать это затруднение, можно
заменить бензол таким же количеством эфира, если только предва-
предварительно отогнать спирт на паровой бане.
6. Если эфирные вытяжки не будут тщательно высушены, то
при последующей перегонке меркаптан получится слегка мутным.
Проверявшие синтез пришли к заключению, что помутнение часто
бывает обусловлено присутствием коллоидальной серы, которую
можно удалить, если взболтать эфирный раствор мутного препа-
препарата с костным углем, профильтровать его и перегнать.
7. н-Додецилмеркаптан не обладает неприятным запахом, и при
работе с ним не требуется принимать каких-либо особых мер пре-
предосторожности. При получении меркаптанов меньшего молеку-
молекулярного веса для устранения неприятного запаха следует поста-
поставить ловушку с щелочным раствором перманганата калия.
8. Температуры кипения при других давлениях: 107—109°
B мм); 133—135° G мм); 145—147° A5 мм); 150—152° B0 мм);
158—160° B8 мм); 168—170° C8 мм).
Другие методы получения
н-Додецилмеркаптан был получен действием щелочи на соли
S-н-додецилтиомочевины1 и восстановлением ди-я-додецилдисуль-
фида2-3.
1 Backer, Terpstra, Dijkstra, Rec. trav. chim., 51, 1166
A932).
2 N о 1 I e r, Gordon, J. Am. Chem. Soc, 55, 1090 A933).
s Henkel et С i e., франц. пат, 751117; ам. пат. 2031529 [С. А.,
30, 2202 A936)].
н-ДОДБЦИЛОВЫЙ (ЛАУРИЛОВЫЙ) ЭФИР Л-ТОЛУОЛСУЛЬФОКИСЛОТЫ 249
«-ДОДЕЦИЛОВЫЙ (ЛАУРИЛОВЫЙ) ЭФИР Л.ХОЛУОЛСУЛЬФОКИСЛОТЫ
«-CHaCeH4SO2C1 + СН3 (СН2I0 СН2ОН + C5H5N -*
Предложили: К- Марвел и В. Секера.
Проверили: Ч. Аллен и К. Вильсон.
Получение
В 1-литровую трехгорлую колбу, снабженную мешалкой и тер-
термометром, помещают 93 г @,5 моля) додеканола (примечание 1)
и 158г B моля) пиридина. Колбу погружают в баню с водой, доста-
достаточно холодной для того, чтобы понизить температуру смеси до 10°-
При этой температуре к смеси прибавляют 105 г @,55 моля) я-то-
луолсульфохлорида отдельными порциями в течение 20—30 мин.,
т. е. с такой скоростью, чтобы температура в продолжение всего
времени не поднималась выше 20°. Смесь перемешивают в те-
течение 3 час. при температуре, не превышающей 20°, после чего
разбавляют раствором 300 мл соляной кислоты (уд. вес 1,19)
в 1 л ледяной воды.Выкристаллизовавшийся продукт реакции филь-
фильтруют через охлажденную воронку Бюхнера и по возможности
тщательнее отсасывают. Осадок переносят в стакан емкостью
600 мл, прибавляют 250—300 мл метилового спирта и нагре-
нагревают смесь на паровой бане до тех пор, пока сложный эфир не
расплавится. Затем массу охлаждают в охладительной смеси при
непрерывном перемешивании; препарат выпадает в осадок в мелко-
мелкодисперсном состоянии. Его фильтруют через воронку с охлаж-
охлаждением и сушат на воздухе, лучше при температуре ниже 20°.
Выход н-додецилового эфира л-толуолсульфокислоты составляет
152—156 г (88—90% теоретич., считая на взятый додеканол); его
т. пл. 20—25° (примечание 2). Полученный препарат пригоден
для большинства целей.
Если требуется более чистый препарат, то его перекристалли-
зовывают из петролейногоэфира (т. кип. 30—60°; 4 мл петролейно-
го эфира на 3 г вещества) и затем сушат над безводным сернокис-
сернокислым натрием. Раствор охлаждают до 0° и кристаллы отфильтровы-
отфильтровывают через охлажденную воронку; выход при перекристаллизации
составляет 90%; т. пл. 28—30°. Если упарить растворитель до не-
небольшого объема, то можно получить еще некоторое количество
вещества (примечание 3).
Примечания
1. Были применены: додеканол (лауриловый спирт) ст. пл.
22—24°, пиридин с т. кип. 113—115° и я-толуолсульфохлорид
с т. пл. 66—68°.
2. «-Додециловый эфир я-толуолсульфокислоты содержит сле-
следы воды, которая делает определение температуры плавления не-
ненадежным; температура замерзания 24—25°.
250
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
3. С таким же выходом были получены следующие слож-
сложные эфиры: бутиловый эфир я-толуолсульфокислоты («Синт. орг.
преп.», сб. 1, стр. 149); н-тетрадециловый эфир л-толуолсульфо-
кислоты, т. пл. 35°; н-гексадециловый эфир я-толуолсульфокис-
лоты, т. пл. 49°; н-октадециловый эфир я-толуолсульфокислоты,
т. пл. 56°; я-дециловый эфир я-бромбензолсульфокислоты,
т. пл. 43—44°; н-додециловый эфир я-бромбензолсульфокислоты,
т. пл. 49°; н-тетрадециловый эфир я-бромбензолсульфокислоты,
т. пл. 51,5°; н-гексадециловый эфир я-бромбензолсульфокислоты,
т. пл. 60°; н-октадециловый эфир я-бромбензолсульфокислоты,
т. пл. 64—65°.
Другие методы получения
н-Додециловый эфир л-толуолсульфокислоты был получен
только взаимодействием я-толуолсульфохлорида с додеканолом
в присутствии пиридина1 в соответствии с общим методом синтеза
сложных эфиров сульфокислот, который разработали Паттерсон
и Фрью2.
1 S e k e r a, Marvel, J. Am. Chem. Soc, 55, 345 A933).
2 P a t t e r s о n, Frew, J. Chem. Soc, 89, 332 A906).
«М-ИЗОЛЕЙЦИН
(а- Амино-^-метилвалериановая кислота)
CH,
CHqCHq
KOH
CH
'\
затем HCI CH3OV
•CHCH(CO2HJ
Br2
CH,
\
;CHCBr(CO2HJ
Нагревание
NH3
CH,
\
CH,
/
¦CHCHBrCOoH
:CHCHNH,CO»H
Предложил: К. Марвел.
Проверили: В. Бахман и Д. Холмс.
Получение
Диэтиловый эфир втор-бутилмалоновой кислоты. В 2-литровую
трехгорлую круглодонную колбу, снабженную длинным обратным
Ш-ИЗОЛЕЙЦИН
251
холодильником с широкой внутренней трубкой, помещают 700 мл
абсолютного спирта и добавляют к нему 35 г A,52 грамматома)
натрия, нарезанного кусочками соответствующего размера. Когда
весь натрий вступит в реакцию, колбу помещают на паровой на-
нагреватель и снабжают мешалкой с ртутным затвором, капель-
капельной воронкой и обратным холодильником, защищенным хлоркаль-
циевой трубкой (примечание 1). Колбу нагревают и при работаю-
работающей мешалке приливают к ее содержимому ровной струей 250 г
A,56 моля) малонового эфира. Затем к смеси прибавляют 210 г
A,53 моля) emop-бутилбромида с такой скоростью, чтобы теплота
реакции вызывала кипение смеси. После этого смесь продолжают
перемешивать и кипятить в течение 2 суток. По истечении этого
времени обратный холодильник заменяют на обращенный вниз
и спирт отгоняют (примечание 2). Остаток обрабатывают 200 мл
воды, взбалтывают и оставляют стоять до тех пор, пока не отде-
отделится слой б/лор-бутилмалоната. Последний отделяют от водного
слоя и перегоняют из двухгорлой колбы емкостью 500 мл, снаб-
снабженной елочным дефлегматором высотой 45 см с хорошей тепло-
теплоизоляцией.
Фракция, кипящая при 110—120° A8—20 мм), представляет
собой диэтиловый эфир emop-бутилмалоновой кислоты. Выход
составляет 274—278 г (83—84% теоретич.).
а-Бром-$-метилвалериановая кислота. В поставленной на паро-
паровой нагреватель 2-литровой трехгорлой круглодонной колбе,
снабженной мешалкой и капельной воронкой, растворяют 250 г
технического едкого кали в 200 мл воды. К горячему раствору при
энергичном перемешивании прибавляют ровной струей 250 г
A,16 моля) диэтилового эфира emop-бутилмалоновой кислоты
(примечание 3). Трубка, присоединенная к вакуум-насосу, способ-
способствует удалению спирта. Затем в течение 5 час. смесь перемеши-
перемешивают и нагревают (примечание 4), после чего содержимое колбы
переносят в стакан, погруженный в баню со льдом и снабженный
мешалкой. Охлаждение ускоряют добавлением в стакан 50 г льда;
когда температура смеси понизится до 15°, к ней прибавляют тех-
техническую соляную кислоту с такой скоростью, чтобы температура
не поднималась выше 20°. После прибавления примерно 250 мл
кислоты в осадок выпадает кислая калиевая соль, что вызывает
необходимость перемешивать смесь вручную до тех пор, пока соль
вновь не перейдет в раствор. Когда раствор будет обнаруживать
кислую реакцию на (примечание 5), его переносят в делительную
воронку (примечание 6).
бяюр-Бутилмалоновую кислоту экстрагируют тремя порциями
эфира по 200 мл и соединенные вместе вытяжки сушат в течение
ночи над хлористым кальцием. Затем эфирный раствор сливают
в 2-литровую трехгорлую колбу, снабженную мешалкой с ртут-
ртутным затвором, обратным холодильником и капельной воронкой.
252
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
сП-ИЗОЛЕЙЦИН
253
К содержимому колбы прибавляют в один прием 5 мл брома
и перемешивают смесь до тех пор, пока она не станет бесцветной
(примечание 7).
Затем к смеси по каплям прибавляют еще 50 мл брома с такой
скоростью, чтобы эфир слабо кипел. Когда весь бром будет
прибавлен, к смеси через капельную воронку приливают по
каплям 200 мл воды так, чтобы не вызвать ни вспенивания, пи
бурного течения реакции.
Эфирный слой, содержащий броммалоновую кислоту, отделяют
от водного слоя и эфир отгоняют на паровом нагревателе. Оста-
Остаток декарбоксилируют, для чего кипятят его в продолжение 5 час.
в круглодонной колбе емкостью 500 мл на масляной бане, нагре-
нагретой до 130°. Затем бромзамещепную кислоту отделяют от неболь-
небольшого количества воды и перегоняют. Вещество, переходящее
при 125—140° A8—20 мм), представляет собой а-бром-8-метил-
валериановую кислоту (примечание 8). Выход составляет 150,5 г
F6,7% теоретич.).
dl-Изолейцин. В круглодонную колбу емкостью 1 500 мл поме-
помещают 150 г @,77 моля) а-бром- [3-метилвалериановой кислоты и при-
прибавляют к ней 645мл технического водного аммиака (уд. вес 0,90).
Колбу закрывают пробкой, которую укрепляют проволокой,
и оставляют стоять при комнатной температуре в продолжение
недели (примечание 9). Затем пробку вынимают и смесь нагре-
нагревают в течение ночи на паровом нагревателе, чтобы удалить
аммиак.
Водный раствор упаривают в вакууме до тех пор, пока
жидкость не начнет кипеть толчками (примерно до 300 мл). Тогда
смесь охлаждают до 15°, кристаллы отделяют на фильтре, про-
промывают 40 мл спирта и сушат. Фильтрат вновь упаривают при-
примерно до 150 мл и получают вторую порцию кристаллов, которые
промывают 25 мл воды, а затем 25 мл 95%-ного спирта. Выход
неочищенного вещества составляет 65 г.
С целью перекристаллизации изолейцин растворяют в 850 мл
воды при нагревании на паровом нагревателе до 95°. Раствор обес-
обесцвечивают, обрабатывают его в течение получаса активированным
березовым углем A г), и фильтруют в горячем состоянии. К горя-
горячему раствору прибавляют 425 мл 95%-ного спирта, и колбу оста-
оставляют на ночь в холодильном шкафу. Выход чистого продукта
составляет 38 г. Добавочную порцию в 12 г можно получить, если
упарить маточный раствор после перекристаллизации примерно
до 100 мл и прибавить к нему равный объем спирта. Вторую
порцию промывают 10 мл холодной воды и 10 мл холодного
спирта. Общий выход составляет 50 г D9% теоретич.). Вещество
разлагается в запаянном капилляре при 278—280° (примеча-
(примечание 10).
Примечания
1. Авторы синтеза проводили каждый опыт с количествами
реагентов, в десять раз превышающими указанные в прописи,
и применяли 12-литровую круглодонную колбу. После того как
весь натрий вступал в реакцию, колбу закрывали пробкой, через
которую проходили мешалка и две согнутые под углом трубки,
в одну из которых вставлялся обратный холодильник, а в другую—
капельная воронка. Время, необходимое для протекания отдель-
отдельных стадий реакции, было таким же, как и при работе с меньшими
исходными количествами. Выход (в процентах) на отдельных ста-
стадиях практически не изменялся.
2. В одном из производившихся таким образом опытов с удеся-
удесятеренными количествами исходных веществ спирт отгоняли в
другую 12-литровую колбу, оборудованную двурогим форштоссом
и снабженную тем же обратным холодильником с внутренней
трубкой большого диаметра, который применялся на первой ста-
стадии синтеза. Натрий, необходимый для проведения следующего
синтеза, прибавляли во вторую колбу по мере того, как в нее пере-
перегонялся спирт; в опыте с увеличенной загрузкой для этого
потребовалось 4—6 час.
3. Вначале, пока реакция еще расходится, emop-бутилмалонат
прибавляют довольно медленно; в дальнейшем скорость прили-
вания эфира увеличивают.
4. Если нужно, то прибавляют воду, чтобы масса на загустела.
5. Требуется около 400 мл кислоты.
6. При работе с десятикратным количеством исходных веществ
раствор переносят в 12-литровую круглодонную колбу, закрытую
пробкой, в которую вставлены большой кран, конец которого не
должен выступать за нижний срез пробки, и стеклянная трубка,
доходящая до дна колбы. Оборудованная таким образом колба
может служить в качестве большой делительной воронки. Когда
колбу переворачивают, пробку предварительно закрепляют про-
проволокой.
7. Существенно, чтобы первая порция в 5 мл брома прореаги-
прореагировала полностью; в противном случае бромирование не будет ид-
идти гладко и раствор может вспениться и выброситься через холо-
холодильник.
8. Если декарбоксилирование прошло не полностью, то оно
завершается на этой стадии. Иногда приходится затрачивать
некоторое время, прежде чем с помощью хорошего водоструйного
насоса удается установить постоянное давление.
9. При опыте с большими количествами исходных веществ
авторы синтеза оставляли стоять 350 г бромзамещенной кислоты
и 1 500 мл водного аммиака в течение недели в 3-литровой колбе.
Содержимое четырех таких колб вместе с твердым веществом
254
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ИМИДАЗОЛ
255
соединяли вместе в 12-литровой круглодонной колбе и нагревали
на паровом нагревателе в продолжение ночи.
10. Количество аминного азота в полученном таким образом
препарате соответствует теоретическому.
Другие методы получения
rfZ-Изолейцин был получен восстановлением и последующим
гидролизом этилового эфира а-оксимино-[3-метил-н-валериановой
кислоты1; действием водного аммиака на а-бром-[3-метил-н-вале-
риановую кислоту2; омылением этилового эфира етор-бутилбром-
малоновой кислоты с последующим декарбоксилированием и ами-
нированием3. Приведенная выше пропись представляет собой
сочетание двух последних методов*.
1 В о u v e a u I t, Locquin, Compt. rend., 141, 115 A905); Bull,
soc. chim., C), 35, 965 A906).
2 E h r 1 i с h, Ber., 41, 1453 A908); Brasch, Friedman, Beitr.
Chem. Physiol. Path., B), 376 A908).
3 Romburgh, Rec. trav. chim., 6, 150 A887).
ИМИДАЗОЛ
A,3-Диазол; глиоксалин)
HNO3
ЫО2ССНОНСНОНСО2Н
HO2CCH (ONO2) CH (ONOj) CO2H.
НО2ССН @N02) СН @N02) CO2H
СНаО НО2СС— N
"¦ II II
NHa НО2СС СН
\
НО2СС -
НОзСС1
\ /
NH
-N Cu0 НС—N
с'н - не сн+2Ша
NH
\
N
Предложили: X. Снайдер, Р. Хандрик и Л. Брукс.
Проверили: Ч. Аллен, Ч. Киблер и Дж. ВанАллан.
Получение
В трехгорлую колбу емкостью 2 л, снабженную термометром,
механической мешалкой и 1-литровой капельной воронкой, поме-
помещают 200 г A,33 моля) измельченной в порошок с?-винной кислоты
* D. В. Феофилактовым изолейцин был получен из етор-бутилацето-
уксусного эфира через феиилгидразои метилэтилпировииоградной кислоты.
Подробнее см. примечание редактора на стр. 277. (Прим. ред.)
(примечание 1), к которой прибавляют последовательно 432 мл
азотной кислоты (уд. вес 1,42) и 432 мл дымящей азотной кислоты
(уд. вес. 1,50). Смесь перемешивают до тех пор, пока винная кис-
кислота не перейдет полностью или почти полностью в раствор
E—10 мин.; примечание 2). Затем через капельную воронку мед-
медленно приливают 800 мл концентрированной серной кислоты
(уд. вес 1,84). Как только температура реакционной смеси достиг-
достигнет 38°, колбу погружают в сосуд с ледяной водой и скорость при-
прибавления кислоты регулируют таким образом, чтобы температура
оставалась на уровне 38—43° (примечание 3). В некоторых случаях
к концу прибавления (примерно через 15 мин.) начинается кри-
кристаллизация динитрата винной кислоты. После того как вся сер-
серная кислота будет прибавлена, смесь оставляют стоять в течение
3 час. в прохладном месте B0—25°).
Кристаллическую массу разбивают стеклянной палочкой и
фильтруют через фильтр из стеклянной ткани (примечание 4) на
воронке Бюхнера диаметром 18 см. Твердую массу отжимают почти
досуха большой плоской стеклянной пробкой или дном кониче-
конической колбы емкостью 125 мл. Когда большая часть маточного рас-
раствора будет отделена (примечание 5), твердый осадок переносят по
частям в 4-литровый стакан, на три четверти заполненный мелко
наколотым льдом. После прибавления каждой порции лед переме-
перемешивают, чтобы облегчить растворение вещества. Перемешивание
рекомендуется производить деревянной палочкой с плоским
концом. Вся операция должна занимать не более 10 мин.
Холодный раствор немедленно переливают в заранее собран-
собранный прибор, состоящий из 5-литровой трехгорлой колбы, которая
погружена в сосуд диаметром около 50 см, содержащий смесь льда
с солью (примечание 6), и снабжена мешалкой, капельной воронкой
и термометром для измерения низких температур. Раствор нейтра-
нейтрализуют 600—700 мл концентрированного аммиака (уд. вес 0,90),
который прибавляютс такой скоростью, чтобы температура в тече-
течение всего времени не поднялась выше—5° (примечание 7); кончик
капельной воронки должен находиться как раз над конусом,
образуемым мешалкой. Когда будет введено 500 мл аммиака, реак-
реакцию раствора после прибавления каждых последующих 50 мл
испытывают на конго; для нейтрализации требуется 3—4 часа.
После этого к раствору добавляют еще 100 мл аммиака.
Пока протекает процесс нейтрализации, следует приготовить
раствор гексаметилентетрамина (примечание 8), осторожно прибав-
прибавляя 520 мл формалина (уд. вес 1,08; около 7 молей) к 500 мл амми-
аммиака (уд. вес 0,90; около 7,5. моля). Температуру поддерживают
ниже 20°, охлаждая реакционную смесь снаружи ледяной во-
водой. Затем раствор охлаждают до 0° и прибавляют его по каплям
к холодному аммиачному раствору динитрата винной кисло-
кислоты; температура при этом не должна подниматься выше 2°.
256
СИНТЕЗЫ -ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
На эту операцию требуется полчаса. Затем перемешивание прекра-
прекращают и смесь оставляют стоять на ночь, в течение которой охлаж-
охлаждающая баня и реакционная смесь принимают комнатную тем-
температуру.
После этого раствор фильтруют, к фильтрату прибавляют
100 мл спирта и подкисляют его (в вытяжном шкафу) до кислой
реакции на конго, медленно (в течение получаса) прибавляя около
400 мл концентрированной соляной кислоты (уд. вес. 1,19).
Подкисленную смесь помещают в холодильный шкаф на 4—5 час.
и нмидазол-4,5-дикарбоновую кислоту отфильтровывают на во-
воронке Бюхнера диаметром 18 см. Осадок переносят в 1-литровый
стакан, перемешивают с 400—500 мл воды и снова фильтруют.
На воронке его промывают последовательно тремя порциями
воды по 150 мл, двумя порциями метилового спирта по 75 мл и,
наконец, 75 мл эфира. После высушивания вещества на воздухе
выход его составляет 90—100 г D3—48% теоретич.); температура
плавления кислоты 280= (с разложением).
Имидазол-4,5-дикарбоновую кислоту делят на две части.
Каждую часть тщательно смешивают с 0,5 г медио-хромового ката-
катализатора («Синт. орг. преп.», сб. 2, стр. 301) или окиси меди в по-
порошке (примечание 9) и полученную смесь переносят в колбу
Клайзена емкостью 250 мл со специальным боковым отводом
(стр. 68). Колба, служащая приемником, свободно висит на боко-
боковом отводе. Колбу Клайзена осторожно нагревают голым пламенем
горелки. После небольшого головного погона (95—100°) температу-
температура резко повышается до 260° (примечание 10) и имидазол перегоня-
перегоняется при 262—264°. С целью очистки вещество растворяют в
60—70 г бензола, раствор кипятят в течение нескольких минут
с 2—Зг угля для обесцвечивания (примечание 11), смесь фильтруют
через предварительно нагретую воронку Бюхнера и охлаждают
фильтрат до 103 в течение 2 час. Выход составляет 13—14,5 г
F8—76% теоретич.). Препарат бесцветен; т. пл. 88—90° (примеча-
(примечание 12).
Примечания
1. Авторы синтеза применяли фармакопейную винную ки-
кислоту; при проверке была взята продажная кислота с т. пл.
169—171°.
2. Можно осуществить этот синтез, не прибегая к перемешива-
перемешиванию механической мешалкой, а пользуясь одногорлой колбой
и взбалтывая ее содержимое от руки. Однако при этих условиях не
так легко регулировать температуру.
3. При более низких температурах динитрат винной кислоты
выделяется уже во время прибавления серной кислоты. В этих
условиях он образует очень мелкие кристаллы, которые трудно
отфильтровать.
ИМИДАЗОЛ
257
4. Такие же хорошие результаты получаются при фильтрова-
фильтровании через ткань из синтетического волокна винион*. Если филь-
фильтра из подходящей ткани не имеется, то в воронку помещают слой
стеклянной ваты; затем осадок вместе со стеклянной ватой при-
прибавляют к колотому льду.
5. Достаточно сухая масса получается примерно за 45 мин.
Так как вещество на воздухе разлагается, то не рекомендуется
оставлять его на более длительное время.
6. Эффективное охлаждение крайне необходимо; небольшая
баня со льдом не достаточна.
7. Температура разложения лежит около 0°. Рекомендуется
применять мешалку центробежного действия.
8. Когда на этой стадии был использован твердый гексаме-
тилентетрамин, ожидаемого конечного продукта получить не
удалось.
9. В случае применения окиси меди получается несколько
меньший выход.
10. Если взять обычную перегонную колбу емкостью 250 мл,
то в качестве неочищенного имидазола следует собирать фракцию
с т. кип. 200—270°. Головной погон содержит около 1 г имидазола,
который можно выделить, если кипятить эту фракцию дестиллата
с бензолом до полного удаления воды, а затем упарить до начала
кристаллизации.
11. Если при выделении сырого имидазола применяется колба
с дефлегматором, то неочищенный препарат бывает бесцветным;
в противном случае он получается окрашенным.
12. Бензольный фильтрат после перекристаллизации содержит
около 0,5 г имидазола.
Другие методы получения
Имидазол был получен из глиоксаля и аммиака с прибавлени-
прибавлением1 или без прибавления2 формальдегида; из имидазолтиона-2
и азотной кислоты3; декарбоксилированием имидазол-4,5-дикарбо-
новой кислоты4"8. Приведенную выше методику в основных чертах
предложили Фаргер и Паймэн".
1 W а 1 1 a ch, Ber., 15, 645 A882).
2 В е h г е n d, S с h m i t z, Ann., 277, 338 A893).
3 M а г с k w a 1 d, Ber., 25, 2361 A8C2).
"Maquenne, Ann. chira., F), 24, 525 A891).
5 D e d i с h e n, Ber., 39, 1835 AE06).
«Fargher, Pyman, J. Chera. Soc, 115, 227 A919).
* Винион—искусственное волокно, по своему внешнему виду напоми-
напоминающее капрон и нейлон, но изготовляемое не из полиамидных смол, а из
винильных полимеров. (Прим. ред.)
17 Сбориик 3
258
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
индол
o-CH3C6H4NHCHO + (CH3KCOK -» o-CH3CeH4N(CHO)K + QF
o-CH3CeH4N(CHO)K -> o-CH3CeH4NHK + CO
o-CH3C6H4NHK + o-CH3CeH4N(CHO)K ->
-+ o-CHaC,H4NH2+KOH +
к
+ H2O
\/\N/
К
+ KOH
H
Предложил: Ф. Тайсон.
Проверили: Р. Шрайнер и К- Тилфорд.
Получение
Трехгорлую круглодонную колбу емкостью2 л снабжают обрат-
обратным холодильником и стеклянной трубкой для ввода газа, кото-
которую присоединяют к баллону с азотом, Третье горло колбы закры-
закрыто пробкой. Верхнюю часть холодильника соединяют с ловушкой,
которая состоит из двух колб для отсасывания емкостью по 500 мл,
соединенных последовательно. Первая колба пуста; вторая содер-
содержит 100 мл парафинового масла, причем вводная трубка в этой
колбе оканчивается несколько ниже поверхности масла.
В реакционную колбу помещают 600 мл продажного mpem-бути-
mpem-бутипового спирта (примечание 1) и вытесняют из нее воздух сухим азо-
азотом. Затем к спирту прибавляют по частям 29 г @,75 грамматома)
металлического калия*. Смесь нагревают на водяной бане до тех пор,
пока не растворится весь калий, после чего прибавляют 68 г @,5 мо-
моля) о-формтолуида (примечание 2) и переводят его в раствор. Обрат-
Обратный холодильник меняют на обращенный вниз; в качестве прием-
приемника применяют колбу для отсасывания. Приемник предохраняют
от доступа воздуха, соединяя его с ловушкой, которая применялась
в начале процесса. Реакционную колбу погружают в металличе-
металлическую баню и избыток спирта отгоняют. Остаток нагревают около
20 мин. до 350—360" (примечание 3), затем ему дают охладиться
в токе азота. Остаток разлагают, прибавляя к нему 300 мл воды,
и смесь перегоняют с водяным паром, чтобы отделить индол. Де-
стиллат экстрагируют последовательно 300 мл и 100 мл эфира
и соединенные вместе эфирные вытяжки взбалтывают с холодным
разбавленным раствором 5% -ной соляной кислоты для удаления
* См. подстрочное примечание на стр. 45.
индол
259
остатков о-толуидина. Эфирные вытяжки промывают 100 мл воды,
затем 100 мл 5%-ного раствора соды и сушат над 20 г сернокислого
натрия. Эфир отгоняют и остаток перегоняют в вакууме. Индол
переходит при 142—144° B7 мм) [128° A0 мм), 12Р E мм)] в виде
бледножелтого масла, которое затвердевает, а затем плавится при
52—53°. Выход составляет 23 г G9% теоретич.; примечание 4).
Примечания
1. Вместо mpem-бутилового спирта можно воспользоваться
и другими спиртами, как, например, метиловым, этиловым, н-бу-
тиловым или изобутиловым, однако выход при этом понижается.
Если mpem-бутиловый спирт заменить метиловым или этиловым,
то следует прибавлять калий меньшими порциями и регулировать
более бурно протекающую реакцию применением внешнего охла-
охлаждения. Кроме того, если применять метиловый спирт, то коли-
количество прибавляемого калия следует уменьшить с 0,75 до
0,50 грамматома.
2. о-Формтолуид можно получить нагреванием на паровой ба-
бане в течение 3 час. смеси 856 г (8 молей) о-толуидина и 403 г (8,4 мо-
моля) 90%-ной муравьиной кислоты, после чего следует оставить
реакционную смесь на ночь. Смесь фракционируют при понижен-
пониженном давлении; выход о-формтолуида с т. кип. 173—175° B5 мм) и
ст. пл.55—58°составляет920—963г(85—89% теоретич.). Получен-
Полученный препарат представляет собой твердое вещество бледножелтого'
цвета, содержащее следы толуидина; запах вещества указывает"
на присутствие в нем следов изонитрила. Тем не менее этот препарат
достаточно чист для превращения его в индол. При применении
99%-ной муравьиной кислоты можно достигнуть количественного
выхода. Если желательно получить более чистое вещество, то пер-
первоначальную реакционную массу смешивают с 1 л воды, сырой
формтолуид отфильтровывают и промывают 1 %-ной соляной кис-
кислотой и водой. После высушивания неочищенный формтолуид пере-
кристаллизовывают из смеси бензола и петролейного эфира. Прак-
Практически выход вещества получается тем же самым, что и при
непосредственной перегонке; т. пл. 61°. Чтобы иметь уверенность
в отсутствии влаги, перекристаллизованный препарат можно пере-
перегнать при пониженном давлении; потери при этой перегонке ни-
ничтожны.
3. В течение этого периода выделяются горючие газы, главным
образом окись углерода и водород, и перегоняется жидкость, со-
состоящая в основном из о-толуидина.
4. Вещество окрашено в бледножелтый цвет. От окраски можно
избавиться перекристаллизацией вещества из смеси 100 мл петро-
петролейного эфира и примерно 10 мл этилового эфира. Выход при пе-
перекристаллизации составляет 21 г (91% теоретич.).
17*
260
СИНТЕаЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Другие методы получения
Индол был синтезирован многими путями, но все они как методы
получения почти не имеют значения. Помимо этих синтезов, индол
был получен нагреванием 2-амино-с;-хлорстирола с метилатом
натрия1; пиролизом солянокислого 2,2'-диаминостильбена при по-
пониженном давлении2; восстановлением индоксила цинковой пылью
и щелочью3; восстановлением 2-аминоиндола натрием и спир-
спиртом4; восстановлением 2-нитрофенилацетальдегида5; нагреванием
0-формилф~нилглицина с уксусным ангидридом и уксуснокислым
натрием8; пропусканием смеси ацетилена и анилина через желез-
железную трубку при 700°7; восстановлением ш-2-дипитростирола желе-
железом и уксусной кислотой8. Описанная выше методика сходна с син-
синтезами 2-алкилиндолов, разработанными Маделунгом9; она была
опубликована в 1941 г.10 Шорыгин и Полякова ", проводившие
сравнительные опыты по получению индола различными метода-
методами, рекомендуют метод Рейссерта12, заключающийся в конден-
конденсации о-нитротолуола с этиловым эфиром щавелевой кислоты с по-
последующим восстановлением продукта реакции до индол-2-карбоно-
вой кислоты и декарбоксилированием последней.
1 L i p р, Вег., 17, 1072 A884).
2 Т h i е 1 е, Вег., 28, 1413 A895).
s V о г 1 a n d е г, Вег., 37. 1134 AР04).
4 Pschorr, Вег., 43, 2550 A910).
6 Weerman, Ann., 401, 12 A913).
6 G 1 u u d, Ber., 48, 422 A915).
'Majima, Ber., 55, 3854 A922).
8 N с n i t z e s с u, Ber., 58, 1063 A925).
9 M a d e 1 u n g, Ber., 45, 1130A912); V e г 1 e y, Bull. soc. chim.,
D), 35, 1039 A924).
10 T у s о a, J. Am. Chem. Soc, 63, 2024 A941).
11 Ш о р ы г и н и Полякова, Синтезы душистых веществ, сбор-
сборник, 1939, стр. 130.
12 R e i s s e r t, Ber., 30, 1045 A897).
ЙОДИСТЫЙ ДИФЕНИЛИОДОНИЙ
но-
QH6JO + C6H5JO2 >¦ [(CeH5JJ]JO3
[(CbH5JJ]JO3 + KJ
[(QH5JJ]J +
Предложили: X. Люкас и Э. Кеннеди.
Проверили: Дж. Джонсон и М. Формо.
Получение
Смесь, состоящую из 22 г @,1 моля) иодозобензола (стр. 264),'
24 г @,1 моля) иодобензола (стр. 261) и 200 мл 1 н. раствора едкого
натра (см. примечание), осторожно перемешивают в течение суток.
Полученный коричневый шлам тщательно перемешивают с 1 л
холодной воды; после того как осадок опустится на дно, раствор
ИОДОЕЕНЗОЛ
261
иодноватокислого дифенилиодония декантируют через фильтр.
Твердый остаток экстрагируют двумя порциями воды по 500 мл;
вытяжки декантируют и пропускают через фильтр, чтобы освобо-
освободить от небольшого количества смолистого остатка. К соединенным
вместе фильтратам прибавляют водный раствор 20 г @,12 моля)
йодистого калия. Объемистый белый осадок йодистого дифенил-
дифенилиодония оставляют стоять в течение 1—2 час, время от времени
взбалтывая его, а затем отфильтровывают с отсасыванием, промы-
промывают водой и сушат при комнатной температуре на пористой
тарелке. Выход йодистого дифенилиодония составляет 29—30 г
G0—72% теоретич.); т. пл. 172—175° (с бурным разложением).
Примечание
Поскольку гидроксильные ионы оказывают каталитическое
влияние на эту реакцию, количество взятого основания можно
изменять в широких пределах. До прибавления щелочи целесо-
целесообразно растереть твердые реагенты с 50 мл воды.
Другие методы получения
Йодистый дифенилиодоний был получен действием сернистого
ангидрида или водного раствора йодистого калия на растворы, со-
содержащие иодноватокислый дифенилиодоний1'2. Эти растворы
могут быть получены действием влажной окиси серебра или вод-
водного раствора едкого кали или едкого натра на эквимолекулярную
смесь иодозобензола и иодобензола1'2; взбалтыванием иодозобен-
иодозобензола с влажной окисью серебра3; взбалтыванием иодобензола с ед-
едким натром2; перегонкой с водяным паром смеси иодозобензола
с иодобензолом2. Йодистый дифенилиодоний был получен также
нагреванием иодобензола с водным раствором йодистого калия
и гидратом окиси бария*.
1Hartmann, Meyer, Ber., 27, 504, 506 A894).
2 Н а г t m a n n, Meyer, Ber., 27, 1598 A894).
3 Н а г t m a n n, Meyer, Ber., 27, 503 A894).
4 W i I I g е г о d t, Ber., 29, 2009 A896).
И0Д0БЕН30Л
ДИСПРОПОРЦИОНИРОВАНПЕ ИОДОЗОБЕНЗОЛА
Перегонка с
2C.H.JO
CeH5JO2 +
водяным паром
Предложили: X. Люкас и Э. Кеннеди.
Проверили: Дж. Джонсон и М. Формо.
Получение
В 5-литровой колбе (примечание 1) приготовляют жидкую па-
пасту из ПО г @,5 моля) иодозобензола (стр. 264) и воды; эту смесь
262
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
-быстро перегоняют с водяным паром (примечание 2) до тех пор,
пока не отгоните я почти весь иодбензол (примечание 3). Перегон-
Перегонку не рекомендуется продолжать дольше, чем это необходимо;
содержимое колбы следует сразу же охладить. Белое твердое веще-
вещество отфильтровывают с отсасыванием и сушат на воздухе при ком-
комнатной температуре. Затем его промывают хлороформом, вновь
сушат и полученную массу слегка растирают в ступке, чтобы
облегчить удаление влаги при окончательном высушивании. Вы-
Выход составляет 54—56 г (92—95% теоретич.). Чистота препарата
при определении иодометрическим титрованием составляет 99%
(примечание 4). Препарат можно перекристаллизовать из горячей
воды (примечание 5).
Примечания
1. Необходимо применять большую колбу, так как во время
реакции происходит вспенивание.
2. Непосредственного нагревания следует избегать ввиду того,
что при этом как реагент, так и продукт реакции (в твердом виде)
могут разложиться со взрывом, особенно в сухом состоянии.
3. Выделенный обратно иодбензол получается совершенно чи-
чистым и может быть использован для получения хлористого иод-
бензола. Количество выделенного вещества составляет около 46 г
(90% теоретич.).
4. Иодометрический метод, приведенный при описании синтеза
иодозобензола (стр. 265), применим и в данном случае. Основной
примесью к иодобензолу является иодозобензол.
5. Растворимость иодобензола в 1 л воды составляет 2,8 г
при 12° и около 12 г при 100°.
ОКИСЛЕНИЕ ФЕНИЛИОДИДХЛОРИДА ГИПОХЛОРИТОМ
C6H5JC12 + NaOCl + Н2О -» С6Н5JO2 + NaCl + 2HC1
Предложили: М. Форма и Дж. Джонсон.
Проверили: Л. Смит, Р. Арнольд и Л. ДеМитт.
Получение
В 2-литровую круглодонную колбу, снабженную эффективной
механической мешалкой (примечание 1), помещают ПО г @,4 мо-
моля) свежеприготовленного хлористого иодбензола в порошке
(стр. 475) (примечание 2), такое количество раствора гипохлорита
натрия, в котором содержится 1 моль этой соли (примечание 3)
и 2 мл ледяной уксусной кислоты. Энергично перемешиваемую
смесь нагревают на водяной бане, поддерживая ее температуру при
И0Д0БЕН30Л
263
65—75°. Через 15—10 мин. нагреваемая смесь начинает пениться
и желтая окраска ее исчезает вследствие перехода хлористого иод-
бензола в бесцветный иодобензол. Через 1 час перемешивание пре-
прекращают и колбу охлаждают в бане со льдом. Осадок отфильтро-
отфильтровывают с отсасыванием, отжимают стеклянной пробкой и перено-
переносят в стакан емкостью 800 мл. Вещество тщательно размешивают
с 300 мл воды, фильтруют с отсасыванием, промывают на фильтре
100 мл воды, отжимают и сушат на воздухе. Выход неочищенного
вещества составляет 85—89 г (90—94% теоретич.). Его чистота,
определенная иодометрическим титрованием, составляет 97—99%
(примечание 4). Высушенный на воздухе препарат можно про-
промыть 50—60 мл хлороформа и высушить сперва на воздухе, а за-
затем в вакуум-эксикаторе. Выход полученного чистого вещества
составляет82—87г (87—92% теоретич.); его чистота, определенная
иодометрическим титрованием, равна 99,0—99,9% (примечание 5).
Примечания
1. Для перемешивания пастообразной суспензии вполне при-
пригодна мешалка Гершберга («Синт. орг. преп.», сб. 2, стр. 298,
рис. 12).
2. Если имеются комки хлористого иодбензола, то их следует
измельчить, разбивая шпателем; в противном случае реакция
может не дойти до конца.
3. Пригодны стабилизированные продажные растворы гипо-
гипохлорита натрия. Авторы синтеза использовали 1150 мл такого
продажного раствора, содержащего 5,25% (по весу) гипохлорита
натрия.
4. Иодометрический метод, изложенный при описании синтеза
иодозобензола (стр. 265), применим и в данном случае. Неочищен-
Неочищенный препарат пригоден для получения йодистого дифенилиодония
(стр. 260).
5. Проверявшие синтез получили указываемый здесь выход.
Однако чистота препарата до промывания его хлороформом обыч-
обычно составляла 90%, а после промывания — 95,7%.
Другие методы получения
Иодобензол был получен окислением иодбензола кислотой
Каро1'2; действием на иодбензол хлорноватистой кислоты или
водного раствора едкого натра и брома3; действием хлора на
раствор иодбензола в пиридине4; окислением иодозобензола
хлорноватистой кислотой или белильной известью5; нагреванием
иодозобензола6; перегонкой иодозобензола с водяным паром7;
264
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ИОДОЗОБЕНЗОП
265
нагреванием хлористого иодбензола с водным раствором гипо-
хлорита натрия, к которому добавлено некоторое количество ук-
уксусной кислоты8; окислением иодбензола концентрированным рас-
раствором хлорной кислоты °.
1 В a m b e r g e г, Hill, Ber., 33, 534 A900).
2Masson, Race, Pounder, J. Chem. Soc., 1935, 1678.
3 W i 1 1 ge г о d t, Ber., 29, 1571, 1572 A8G6).
4 О r t о 1 e v a, Chem. Zentr., 1900, I, 743.
5 Wi llgerodt, Ber., 29, 1568, 1569 A896).
6 Willgerodt, Ber., 25, 3500 A892); 26, 1806 A893); Askenasy,
Meyer, Ber., 26, 1356 A893).
7 Willgerodt, Ber., 26, 358, 1307 A8ЁЗ).
«Willgerodt, Wiegand, Ber., 42, 3765 AC09).
1 Datta, Choudhury, J. Am. Chem. Soc, 38, 1085 A916).
ИОДОЗОБЕНЗОЛ
-> C6H5JO + 2NaCl
C6H5JCl2 + 2
Предложили: X. Люкас, Э. Кеннеди и М. Форма.
Проверили: Л. Смит, Р. Арнольд и Р. Матьюс.
Получение
В большую ступку, охлаждаемую в бане со льдом, помещают
55 г @,2 моля) хлористого иодбензола (стр. 475), 50 г безводного
углекислого натрия и 100 г мелко наколотого льда. Смесь тщатель-
тщательно растирают (примечание 1) до тех пор, пока весь лед не растает
и не образуется густая паста. К этой суспензии прибавляют
140 мл 5 н. раствора едкого натра порциями по 20 мл, тщательно
растирая смесь после каждого прибавления. В заключение к смеси
приливают 100 мл воды, чтобы сделать ее более жидкой; затем
смесь оставляют стоять в течение ночи. Осадок отфильтровывают
с отсасыванием, по возможности лучше отжимают на фильтре,
переносят в стакан и тщательно промывают 300 мл воды (приме-
(примечание 2). Осадок отфильтровывают с отсасыванием, вновь промы-
промывают в стакане 300 мл воды, отфильтровывают с отсасыванием
и промывают на фильтре 250 мл воды. После тщательного высу-
высушивания на воздухе вещество размешивают с небольшим количе-
количеством хлороформа до образования жидкой кашицы (примечание 3),
освобождают от растворителя при помощи фильтрования с от-
отсасыванием и сушат на воздухе на фильтровальной бумаге. Вы-
Выход составляет 26—27 г F0—62% теоретич.); чистота препарата,
определенная иодометрическим титрованием, составляет 99%
(примечания 4 и 5).
Примечания
1. Твердое вещество образует комок, который растирают,
чтобы постепенно его измельчить.
2. Фильтрат содержит некоторое количество солей дифенил-
иодония, которые можно выделить в виде плохо растворимой
йодистой соли, для чего к растверу прибавляют йодистый калий
(стр. 261). Обычно получается 7—9 г йодистого дифенилиодония.
3. С помощью хлороформа удаляют иодбензол, который
можно выделить обратно.
4. Для анализа иодозо- и иодосоединений применяется следую-
следующая методика. В колбу для титрования емкостью 200 мл с притер-
притертой пробкой помещают 100 мл воды, 10 мл 6 н. раствора серной
кислоты, 2 г йодистого калия, свободного от ионов йодноватой
кислоты, 10 мл хлороформа и, наконец, навеску вещества, содер-
содержащую около 0,25 г. Смесь взбалтывают в течение 15 мин. (или
дольше, если реакция не закончится) и титруют 0,1 н. раствором
тиосульфата натрия. Если образец чистый, то о конце титрования
можно судить по изменению цвета хлороформенного слоя, если же
образец содержит примеси, то к нему следует добавить раствор
крахмала, так как примеси окрашивают хлороформенный раствор
в буроватый цвет. Применение хлороформа в качестве растворителя
наиболее желательно, так как он облегчает реакцию с йодистым
калием, растворяя продукты реакции. Иодозобепзол можно отли-
отличить от иодобензола на основании того, что первый восстанавли-
восстанавливает ионы иода в насыщенном растворе борнокислого натрия,
в то время как иодобензол такого действия не оказывает1. Метод
анализа основан на следующих реакциях:
C6H5JO2 + 4HJ --> CeH6J + 2
5- Если вещество требуется для получения иодобензола путем
диспропорционирования (стр. 261), то сушить неочищенный пре-
препарат и промывать его хлороформом с целью удаления иодбен-
иодбензола нет необходимости. Неочищенный влажный иодозобепзол
можно также применять непосредственно для получения йоди-
йодистого дифенилиодония (стр. 260), однако желательно произвести
анализ влажного вещества для того, чтобы определить необходи-
необходимое количество иодобензола.
Другие методы получения
Иодозобензол был получен действием водного раствора едкого
натра или кали на хлористый иодбензол2 и повторными приба-
прибавлениями воды к хлористому иодбензолу3.
266
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
1 М a s s о и, Race, Pounder, J. Cbem. Soc, 1935, 1G78.
2Willgerodt, Ber., 25, 3495 A892); 26, 357, 1807 A893);
Askenasy, Meyer, там же, 26, 1356 A893); H a r t m a n n, Meyer,
там же, 27, 505 A894).
3 W i 1 1 g e г о d t, Ber., 26, 357 A893); О r t о 1 e v a, Chem. Zentr.,
1900, I, 722.
я-капроновый Ангидрид
2СН3(СН214СО
Предложили: Дж. Уильяме и Дж. Криницкий.
Проверили: Н. Дрэйк и Дж, Ланн.
Получение
В склянку для промывания газов помещают 116 г A26 мл,
1 .моль) н-капроновой кислоты. Склянку помещают в баню со
льдом и в кислоту пропускают 0,50—0,55 моля кетена со ско-
скоростью около 0,45" моля в час (примечания 1 и 2).
Полученную смесь переносят в колбу для перегонки и тща-
тщательно фракционируют на масляной бане (примечание 3). Низко-
кипящую фракцию, состоящую из ацетона с некоторой примесью
кетена, уксусной кислоты и уксусного ангидрида, отгоняют при
атмосферном давлении. Постепенно температуру масляной бани
повышают, так чтобы примерно через 1 час после начала пере-
перегонки она достигла 220°, и поддерживают ее на этом уровне до
тех пор, пока от начала перегонки не пройдет 3 час. (примеча-
(примечание 4).
После этого перегонку при атмосферном давлении прекращают,
дают жидкости несколько охладиться, а затем продолжают этот
процесс в вакууме при давлении 3—10 мм. После головной фракции,
которая составляет менее 20 г, собирают н-капроновый анги-
ангидрид [т. кип. 109—112° C мм); 118—121° F мм)]. Общий выход
составляет 86—95 г (80—87% теоретич.; примечание 5).
Примечания
1. Кетен можно весьма удобно получать с нужной скоростью
в приборе, который описали Уильяме и Хёрд1.
2. Если взять 1 моль кетена на 1 моль кислоты, то выход не
увеличится. В этих условиях в низкокипящей фракции будет
содержаться большее количество уксусного ангидрида.
3. Авторы настоящего синтеза и проверявшие его пользовались
колонкой типа Уитмора—Люкса2 диаметром 12 мм, высотой
50 см с насадкой из одиночных витков стеклянной спирали
и с обычной рубашкой для обогрева. Для получения капронового
о-КАРБОКСИФЕНИЛАЦЕТОНИТРИЛ
267
ангидрида можно применять и менее эффективную колонку;
однако в случае синтеза ангидрида пропионовой или масляной
кислоты следует применять колонку указанного выше типа.
4. Перегонку при атмосферном давлении крайне необходимо
продолжать до тех пор, пока не будет полностью завершено пре-
превращение всего количества смешанного ангидрида в капроновый
ангидрид. Уксусная кислота, образующаяся при этом превраще-
превращении, отгоняется очень медленно, и для завершения перегонки при
атмосферном давлении требуется около 3 час.
5. Согласно сообщению предложивших этот синтез, с одина-
одинаково хорошими выходами по данному методу получаются анги-
ангидрид пропионовой кислоты и ангидрид «-масляной кислоты.
Другие методы получения
«-Капроновый ангидрид был получен нагреванием капроно-
бой кислоты с уксусным ангидридом3; нагреванием капроново-
кислого натрия и уксусного ангидрида в запаянной трубке4; дей-
действием хлорокиси фосфора на капроиовокислый барий5; дей-
действием хлористого ацетила на капроновую кислоту6; действием
хлора на смесь капроновокислого натрия и серы7. Первоначально
приведенную выше методику описали Хёрд и Дулл8.
1 W i 1 1 i a m s, Hnrd, J. Org. Chem., 5, 122 A940).
2 Whit more, Lux, J. Am. Chem. Soc, 54, 3451 A932).
8 Autenrieth, Ber., 34, 168 A901).
4 M i ch a e 1, Ber., 34, 918 A901).
5 С h i о z z a, Ann., 86, 359 A853).
6 F о u r n i e r, Bull. soc. chim., D), 5, 920 A909).
7 Англ. пат. 24842 A908) 1С A., 4, 2190, 2719 A910)].
8 H u r d, Dull, J. Am. Chem. Soc, 54, 3427 A932).
о-КАРБОКСИФЕНИЛАЦЕТОНИТРИЛ
/СНо
CH2CN
>0 ^
180-
HCI
CH2CN
¦A/
V\Co2k
Предложили: Ч. Прайс и P. Роджерс.
Проверили: В. Бахман и Р. Морин.
Получение
В 2-литровую круглодоппую колбу, снабженную мешалкой
и термометром, помещают смесь 100 г фталида (примечание 1)
и 100 г цианистого калия в порошке. Смесь перемешивают и нагре-
268
СИНТЕЗЦ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
вают на масляной бане до 180—190° (температура внутри колбы)
в течение 4—5 час. (примечание 2). К, охлажденной массе прили-
приливают 1 л воды и смесь перемешивают до тех пор, пока не раство-
растворятся твердые соли (примечание 3). Небольшое количество нера-
нерастворимых примесей отфильтровывают (примечание 4). В вытяж-
вытяжном шкафу к водному раствору, окрашенному в темный цвет,
прибавляют 6 н. соляную кислоту B0—60 мл) до тех пор, пока
раствор не станет мутным (примечание 5); после этого раствор
осторожно нейтрализуют двууглекислым натрием (примечание 6),
прибавляют несколько граммов активированного березового угля,
смесь перемешивают в течение нескольких минут и фильтруют.
Почти бесцветный фильтрат подкисляют 40—50 мл концентриро-
концентрированной соляной кислоты и после охлаждения в бане со льдом
фильтруют с отсасыванием. Выход составляет 80—100 г F7—83%
теоретич.). Вещество получается в виде бесцветных кристаллов;
т. пл. 113—115° (примечание 7).
Примечания
1. Авторы синтеза применяли продажный фталид, а прове-
проверявшие его приготовляли фталид по методике, изложенной
в «Синт. орг. преп.» сб. 2, стр. 533.
2. К концу реакции смесь должна иметь темнокоричневую
окраску и быть почти твердой. Температура не должна подни-
подниматься выше 200°; проверявшие синтез поддерживали ее при 180°.
3. Чтобы измельчить и растворить массу, требуется около
1 часа.
4. В некоторых случаях при этом может быть выделено
обратно от 5 до 15 г фталида.
5. В некоторых случаях на этой стадии из щелочного раствора
выпадало в осадок небольшое количество кристаллического гомо-
фталимида ст. пл. 235°х.
6. Проверявшие синтез нашли, что на этой стадии для того
чтобы перевести в осадок темноокрашенные примеси, целесо-
целесообразно слегка подкислить раствор.
7. Препарат вполне пригоден для большинства целей. Его
можно очистить перекристаллизацией из бензола или уксусной
кислоты; однако это связано со значительными потерями.
Другие методы получения
Описанный метод в основном разработан Вислиценусом2; по
существу этот способ является единственно пригодным.
1 Gabriel, Ber., 19, 1655A886).
2 Wislicenus, Ann., 233, 102 A886).
КРИПТОПИРРОЛ
269
КРИПТОПИРРОЛ
B,4-Диметил-З-этилпиррол)
CH3COCH2CO2C2H5 + HNO2 -> CH3COC(NOH)CO3QH5
Zn+СНзСОаН
CH3COC(NOH)CO2C2H5
CH3COCH (NH2) CO2C2H5 + CH3COCH2COCH3
СН3СОСН (NH2) CO2C2H5 + H2O
СН3С ССОСН3
--> "|| II +2Н2О
С2Н5О2СС ССН3
н
СН3С ССОСН3 n2H4-H2O
QH5O2CC CCH3 C2H5ONa
н
С2Н5ОН + Н2О + СО2 + N2
Предложил: Г. Фишер.
Проверили: Г. Адкинс и И. Вольф.
Получение
Трехгорлую колбу емкостью 3 л, снабженную мешалкой,
погружают в баню со льдом и помещают в нее 402 г C,09 моля)
ацетоуксусного эфира (примечание 1) и 1 200 мл ледяной уксус-
уксусной кислоты. К этому раствору прибавляют по каплям при пере-
перемешивании раствор 246 г C,55 моля) нитрита натрия в 400 мл
воды. Скорость прибавления регулируют таким образом, чтобы
температура не поднималась выше 12е. После того как весь раствор
нитрита натрия будет прибавлен, смесь перемешивают в течение
еще 2—3 час, после чего ей дают нагреться до комнатной темпе-
температуры и оставляют стоять в течение примерно 12 час. Затем
к смеси в один прием прибавляют 348 г C,48 моля) ацетилацетона
(стр. 92).
При энергичном перемешивании к реакционной массе прибав-
прибавляют 450 г цинковой пыли порциями по 10 г (примечание 2). Ско-
Скорость прибавления регулируют таким образом, чтобы темпера-
температура ни в коем случае не поднималась выше 60°. Когда вся цинко-
цинковая пыль будет прибавлена (примечание 3), смесь кипятят на
270
СИНТЕЗЫ, ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
электрической плитке до тех пор, пока непрореагировавшая цин-
цинковая пыль не соберется в комки; для этого требуется 2—3 часа.
Горячий раствор фильтруют при перемешивании через мелкое
медное сито непосредственно в сосуд, содержащий 30 л ледяной
воды. Выделившееся неочищенное вещество загрязнено цинком
(примечание 4). Перекристаллизацией из 1 500 мл 95%-ного эти-
этилового спирта получают 360—390 г 2,4-диметил-3-ацетил-5-карб-
этоксипиррола с т. пл. 143—144° E5—60% теоретич., считая на
ацетоуксусный эфир; примечание 5). Для получения совершенно
бесцветного препарата может потребоваться вторая перекристал-
перекристаллизация, однако и после первой перекристаллизации вещество
достаточно чисто для превращения его в криптопиррол.
В 430 мл абсолютного спирта растворяют 30 г натрия; причем
для растворения последних порций его раствор нагревают с обрат-
обратным холодильником. Горячий спиртовой раствор переливают
в автоклав (примечание 6), смешивают с 75 г @,36 моля) 2,4-ди-
метил-З-ацетил-5-карбэтоксипиррола и прибавляют к смеси 36 мл
гидразин-гидрата (примечание 7). Автоклав нагревают и в течение
12 час. поддерживают в нем температуру 165—170°. По охлажде-
охлаждении содержимое автоклава переносят в 2-литровую круглодон-
ную колбу. Автоклав споласкивают небольшим количеством абсо-
абсолютного спирта, которое присоединяют к основной массе. Затем
в колбу прибавляют 50 мл воды и отгоняют спирт на паровой
бане, после чего криптопиррол перегоняют с водяным паром.
Спиртовой отгон собирают отдельно. При перегонке с водяным
паром пользуются стеклянным холодильником, так как в неко-
некоторых опытах после отгонки примерно 1 л дестиллата в холодиль-
холодильнике начинает выделяться белое твердое вещество, которое пла-
плавится при комнатной температуре. Время от времени доступ
воды в холодильник прекращают, чтобы дать расплавиться застыв-
застывшему в нем твердому веществу. Перегонку с водяным паром про-
продолжают до тех пор, пока капли дестиллата не перестанут идти
мутными, что обычно наступает после отгонки 1 700 мл. Во время
перегонки с водяным паром над поверхностью дестиллата про-
пропускают медленный ток азота (примечание 8).
Спиртовой отгон разбавляют 2 л дестиллированной воды
и экстрагируют эфиром порциями в 500, а затем в 300 мл. Дестил-
лат, полученный при перегонке с водяным паром, экстрагируют
два раза этим эфирным раствором, а затем еще два раза свежим
эфиром порциями по 250 мл. Эфирные вытяжки соединяют вместе
и сушат над 150 г безводного сернокислого натрия, причем пустое
пространство над раствором заполняют азотом. Эфирный раствор
декантируют и сернокислый натрий промывают три раза пере-
перегнанным эфиром; затем эфир отгоняют, повышая под конец пере-
перегонки температуру бани, в которую погружена колба, до 130°.
Затем криптопиррол фракционируют при пониженном давлении
криптопиррол
271
(примечание 9). Выход бесцветного препарата, кипящего в преде-
пределах 1,5° [85,5—87° A2,5 мм); 92,5—94°A8 мм)], составляет
22—25,5 г E0—58% теоретич.).
Примечания
1. Был применен продажный ацетоуксусный эфир без допол-
дополнительной очистки.
2. Цинковая пыль должна быть не ниже 80%-ной чистоты.
3. До кипячения реакционная смесь должна стоять в течение
достаточно долгого времени, чтобы цинковая пыль полностью
вступила в реакцию; в противном случае могут встретиться серьез-
серьезные затруднения в результате вспенивания.
4. Неочищенное пиррольное соединение темнеет под действием
света, в особенности под действием прямого солнечного света. Пе-
Перекристаллизованный препарат к действию света не чувствителен.
5. Синтез можно проводить с большими или меньшими количе-
количествами исходных веществ, взятых в необходимой пропорции, поль-
пользуясь аппаратурой соответствующих размеров, причем это не
оказывает влияния на выход. Указанные выше количества состав-
составляют 60% загрузок, которые применял автор синтеза.
6. Проверявшие синтез применяли стальной автоклав для ги-
гидрирования емкостью 650 мл, причем трубка с манометром была
снята и заменена глухой стальной пробкой. Температура регу-
регулировалась с помощью автоматического терморегулятора, причем
реакционная смесь не подвергалась ни взбалтыванию, ни пере-
перемешиванию.
7. Гидразин-гидрат можно получить действием аммиака на
сернокислый гидразин1 с последующим прибавлением воды.
Жидкий аммиак помещают в сосуд Дьюара емкостью 500 мл
и небольшими порциями прибавляют к нему 60 г сернокислого
гидразина, перемешивая жидкость с помощью механической
мешалки. После окончания прибавления перемешивание продол-
продолжают в течение еще получаса. Затем смесь фильтруют в другой
сосуд Дьюара через складчатый бумажный фильтр и дважды
промывают твердый осадок жидким аммиаком; для этой цели
его вновь переносят в первый сосуд Дьюара, перемешивают
и опять фильтруют. После испарения жидкого аммиака остается
7,5—10 г бесцветной жидкости; если считать полученное вещество
за безводный гидразин, то указанный выход составляет 51—68%
теоретического количества. Затем к препарату прибавляют 5 мл
воды. Чтобы получить гидразин-гидрат в количестве, необхо-
необходимом для данного синтеза, такой опыт следует!повторить три-
четыре раза.
8. Криптопиррол очень чувствителен к окислению; поэтому
он должен как можно меньше соприкасаться с воздухом. Лучше
272
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
всего сохранять его в запянных стеклянных ампулах. Если при
перегонке в вакууме пользуются капилляром, то его следует
присоединить к источнику азота.
9. Для этой цели можно воспользоваться елочным дефлегма-
дефлегматором, дефлегматором Видмера или каким-либо иным.
Другие методы получения
Криптопиррол был получен при расщеплении билирубина,
гемина, родопорфирина и пр.2 Приведенный выше синтез основан
на работах Кнорра и Гесса3.
'Browne, Welsh, J. Am. Chem. Soc, 33, 1728 A911).
2 Fischer — Orth, Die Chemie des Pyrrols, Akademisehe Verlags-
gesellschaft, Leipzig, 1934, S. 53.
3Knorr, Hess, Ber., 44, 2765 A911).
КУМАРИЛОВАЯ КИСЛОТА
(Кумарон-2-карбоноеая кислота)
2KBi -ьан,0
-i-KCI
Предложили: Р. Фьюзон, Док. Кнгйсли и Э. Кайзер.
Проверили: В. Бахман и Дж. Джонсон.
Получение
Дибромкумарин. В 1-литровую трехгорлую колбу, снабженную
механической мешалкой, капельной воронкой и холодильником,
который соединен с ловушкой для бромистого водорода, помещают
146 г A моль) ку|марина и 200 мл хлороформа. Раствор тщательно
перемешивают Ц в течение 3 час. при комнатной температуре
прибавляют к неку по каплям раствор 160 г A моль) брома в 85 мл
КУМАРИЛОВАЯ КИСЛОТА
273
хлороформа (примечание 1). Для удаления избытка брома через
капельную воронку прибавляют около 200 мл 20%-ного рас-
раствора сульфита натрия. Бесцветный хлороформенный слой отде-
отделяют, промывают двумя порциями воды по 200 мл и сушат над сер-
сернокислым магнием (примечание 2). Смесь оставляют стоять в те-
течение только нескольких минут (примечание 3), а затем серно-
сернокислый магний отфильтровывают и раствор дибромида упаривают
до объема 100 мл в быстром токе сухого воздуха (примечание 4).
Дибромкумарин отфильтровывают и маточный раствор упари-
упаривают почти досуха, пользуясь вентилятором. Смесь фильтруют,
и оставшийся раствор, слегка желтого цвета, выпаривают досуха.
Вещество, полученное после третьего выпаривания, получается
слегка окрашенным; его промывают два раза эфиром порциями
по 15 мл (примечание 5). Суммарное количество препарата со-
составляет 215 г G0% теоретич.); т. пл. 102—105° (примечание 6).
Кумариловая кислота. В 5-литровой трехгорлой колбе, снаб-
снабженной механической мешалкой и обратным холодильником,
растворяют 450 г (8 молей) твердого едкого кали в 700 мл абсолют-
абсолютного спирта. Раствор щелочи охлаждают до 15°, погружая колбу
в баню со льдом. Затем, тщательно перемешивая раствор, к нему
прибавляют 215 г @,7 моля) хорошо измельченного дибромкума-
рина порциями по 10—15 г. Скорость прибавления регулируют
таким образом, чтобы в течение всего времени температура не под-
поднималась выше 20°; при этих условиях прибавление занимает око-
около получаса. После того как весь дибромид будет прибавлен, реак-
реакционную массу кипятят с обратным холодильником в течение еще
получаса при перемешивании (примечание 7). Затем к содержи-
содержимому колбы приливают 1 500 мл воды и полученный раствор пере-
перегоняют с водяным паром до тех пор, пока не будет отогнано 2 500 мл
дестиллата (примечание 8). Остаток охлаждают до комнатной
температуры, прибавляя к нему 1 кг колотого льда (примечание 9),
а затем подкисляют, приливая 1 200 мл 6 н. раствора соляной
кислоты. Неочищенную кумариловую кислоту отфильтровывают
и перемешивают с 600 мл холодной воды. Вещество отделяют от
воды фильтрованием, тщательно отжимают на фильтре и пере-
кристаллизовывают из смеси 250 мл спирта и 250 мл воды (при-
(примечание 10). Очищенная кумариловая кислота бесцветна; вы-
выход составляет 93—100 г (82—88% теоретич.; примечание 11);
т. пл. 190—193°.
Примечания
1. Время от времени, чтобы предупредить повышение темпера-
температуры, приходится охлаждать колбу при помощи бани со льдом.
2. Если еще до удаления сернокислого магния выделится не-
некоторое количество дибромкумарина, то для растворения послед-
последнего необходимо прибавить достаточное количество хлороформа.
18 Сбориин 3
274
СИНТЕЗ^! ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
3. Смесь следует обрабатывать немедленно, чтобы избежать
разложения дибромида.
4. При проверке настоящего синтеза было найдено, что на
этой стадии происходит значительное разложение. Возможно,
что причиной разложения послужило то обстоятельство, что опыт
был проведен в теплый сырой день; проверявшие пришли к заклю-
заключению, что как в этой стадии синтеза, так и в последующих, луч-
лучше удалять хлороформ перегонкой на водяной бане в вакууме.
Ввиду неустойчивости дибромида рекомендуется превращать
его в кумариловую кислоту в тот же день, когда он был получен.
5. После первого выпаривания получают 136 г, после второго—
63 г и после третьего—16 г неокрашенных кристаллов (после
промывания кристаллов эфиром).
6. Первая порция кристаллов плавится при 102—105°. Тем-
Температура плавления кристаллов, полученных при последующих
упариваниях маточного раствора, несколько ниже, однако этот
препарат достаточно чист для применения в последующей стадии.
7. Суспензию бромистого калия необходимо энергично пере-
перемешивать во избежание сильных толчков при кипении.
8. Чтобы произвести перегонку с водяным паром, реакцион-
реакционный сосуд снабжают трубкой для ввода водяного пара и обращен-
обращенным вниз холодильником. Колбу следует нагревать так, чтобы
конечный объем жидкости в ней не превышал 3 л.
9. Если перегонка с водяным паром проведена очень эффек-
эффективно, то может выпасть тяжелый осадок, состоящий из калиевой
соли кумариловой кислоты и бромистого калия. При прибавле-
прибавлении соляной кислоты осадок растворяется.
10. Неочищенную кислоту растворяют в 250 мл кипящего
абсолютного спирта, к которому прибавляют 3 г активированного
березового угля. Раствор фильтруют и к фильтрату прибавляют
250 мл воды, предварительно нагретой до 85°.
11. Суммарный выход, считая на кумарин, составляет 57—62%
теоретического количества.
Другие методы получения
Кумариловая кислота была получена при действии на дибром-
кумарин спиртового раствора едкого кали с последующим под-
кислением соляной кислотой. Этот метод в основном разработал
Перкин1. Он же получил кумариловую кислоту из 3-хлоркумарина
и из 3-бромкумарипа действием спиртового раствора едкого кали2.
Дибромкумарин был получен прибавлением брома к раствору
кумарина в хлороформе1-2.
1 Р е г k i n, J. Chem. Soc, 23, 368 A870).
2 Р е г к i n, J. Chem. Soc, 24, 37 A871).
сП-ЛЕИЦИН
275
rf/ЛЕЙЦИН
(а-Аминоизокапроновая кислота)
(СН3J СНСН2СН2СО2Н + Вг2
(СН3J CHCH2CHBrCO2H + 2NH3
PCL
(СН3J СНСН2СНВгСО3Н + НВг
- (СН3J CHCH2CHNH2CO2H + NH4Br
Предложил: К- Марвел.
Проверили: Г. Адкинс и Р. Гандер~.
Получение
а-Бромизокапроновая кислота. В 2-литровой круглодонной
колбе смешивают 500 г D,3 моля) продажной изокапроновой кис-
кислоты с 250 мл бензола; после этого воду и бензол отгоняют с корот-
коротким дефлегматором до тех пор, пока температура в парах не достиг-
достигнет 100°. Как только будут удалены остатки бензола, температура
начинает быстро повышаться. Оставшуюся кислоту охлаждают
до комнатной температуры и прибавляют к ней 743 г D,65 моля;
243 мл) сухого брома (примечание 1); к колбе присоединяют длин-
длинный холодильник и устанавливают ее в масляную баню. Верхнюю
часть холодильника присоединяют к пустой конической колбе
емкостью 500 мл, которая служит в качестве предохранительной
склянки и которую в свою очередь присоединяют к ловушке-для
поглощения газов (примечание 2). Через верхнюю часть холо-
холодильника к смеси добавляют 10 мл треххлористого фосфора и на-
нагревают колбу до 80—85°. Процесс бронирования протекает при
этой температуре гладко; ему предоставляют продолжаться до
тех пор, пока в холодильнике не исчезнет тёмнокрасная окраска
брома, на что требуется 8—15 час. После этого температуру по-
повышают до 100—105° и поддерживают ее на этом уровне в течение
2 час. Затем содержимое колбы переносят в 1-литровую специаль-
специальную колбу Клайзена или в колбу, к которой присоединена колонка
Видмера. Реакционную смесь перегоняют, собирая фракцию,
кипящую в пределах 125—131° A2 мм). Выход а-бромизокапро-
новой кислоты составляет 530—550 г F3—66% теоретич.). Низко-
кипящая фракция представляет собой главным образом изокап-
роновую кислоту (примечание 3).
dl-Лейцин. В 3-литровую круглодонную колбу наливают
1 500 мл технического водного аммиака (уд. вес 0,90) и прибав-
прибавляют к нему 300 г A,56 моля) а-бромизокапроновой кислоты.
Колбу закрывают резиновой пробкой, которую укрепляют про-
проволокой, и оставляют стоять в течение недели при комнатной
температуре. Неочищенный лейцин из четырех таких колб отде-
отделяют на фильтре и промывают 400 мл спирта. Полученные кри-
кристаллы весят около 300 г. Аммиак из фильтрата удаляют нагре-
нагреванием раствора в продолжение ночи на паровом нагревателе
в 12-литровой колбе. Раствор упаривают в вакууме до тех пор,
18*
276
СИНТЕЗЫ 'ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ЛИНОЛЕВАЯ КИСЛОТА
277
пока кипение жидкости не станет сопровождаться сильными толч-
толчками (приблизительно до 2 500 мл). Затем смесь охлаждают до 15°
и фильтруют. Осадок промывают 250 мл холодной воды и 250 мл
95%-ного" спирта. Общий выход неочищенного лейцина (в обеих
порциях) составляет 440—460 г.
Полученную аминокислоту перекристаллизовывают, растворяя
все количество неочищенного вещества в 12,5 л воды при нагре-
нагревании до 95° на паровом нагревателе. Горячий раствор обраба-
обрабатывают 20 г активированного березового угля в течение полу-
получаса и фильтруют в горячем состоянии. К фильтрату немедленно
прибавляют равное по объему количество 95%-ного спирта и по-
помещают колбу на ночь в холодильный шкаф. Кристаллическое
вещество отделяют на фильтре и промывают 200 мл 95%-ного
спирта. Полученная порция чистого лейцина составляет 290—
300 г. Добавочную порцию можно получить, если выпаривать ма-
маточный раствор в вакууме до тех пор, пока не. выделится значи-
значительное количество твердого вещества (объем жидкости составляет
около 1 л), а затем прибавить к нему равное по объему количество
спирта и смесь охладить. Эту порцию кристаллов промывают спер-
сперва 100 мл холодной воды, а затем 200 мл спирта. Полученное ве-
щество весит 60—65 г. Общий выход чистого лейцина составляет
350—365 г D3—45% теоретич.). В запаянном капилляре лей-
лейцин разлагается при 290—292° (не исправл.; примечание 4).
Примечания
1. Предварительно бром сушат взбалтыванием с 500 мл хими-
химически чистой концентрированной серной кислоты.
2. Бромистый водород можно собрать в воду и перегнать;
получается бромистоводородная кислота с постоянной темпера-
температурой кипения («Синт. орг. преп», сб. 1, стр. 109).
3. Низкокипящую фракцию A05—115 е) можно присоединить
к следующей порции кислоты, подвергаемой бромированию.
Можно также собрать несколько таких фракций и бромировать
их вместе. Если избрать последний путь, то следует взять только
две трети того количества брома, которое было применено в пер-
первоначальном опыте.
4. Содержание аминного азота в лейцине, полученном указан-
указанным способом, соответствует теоретическому количеству.
Другие методы получения
^/-Лейцин был получен омылением изобутилгидантоина гидра-
гидратом окиси бария1; восстановлением и омылением эфира з-оксимино-
изокапроновой кислоты2; рацемизацией /-лейцина3; действием
аммиака и цианистого водорода на изовалериановый альдегид
с последующим омылением4; нагреванием моноазида изобутилма-
лоновой кислоты с последующим омылением5; действием аммиака
на а-бромизокапроновую кислоту6; конденсацией изобутилгало-
генидов с натрийаминомалоновым эфиром7 или с бензоилиатрий-
аминомалоновым эфиром8 с последующим омылением; конденсаци-
конденсацией изомасляного альдегида с гиппуровой кислотой с последующим
восстановлением и омылением9. Методика, описанная выше, в ос-
основном предложена Фишером6. Это, несомненно, лучший и наи-
наиболее доступный способ синтеза больших количеств dZ-лейцина*.
1 Pinner, Spilker, Ber., 22, 696 A889).
2 Bonvcault, Locquin, Bull. soc. chim., C), 31, 1181 A904).
3Schulze, Bosshard, Ber., 18, 389 A885); Z. physiol. Chem.,
10, 135 A886); Fischer, Ber., 33, 2372 A900).
4 Limprichl, Ann., 94, 243 A855); H fl fner, J. prakl. Chem.,
B), 1, 10 A870),; Schulze, Likiernik, Z. physiol. Chem., 17, 516
A893); Abderhalden, Wybert, Ber., 49, 2455 A916).
5 С u r t i u s, J. prakt. Chem., B), 125, 211 A930).
6 Fischer, Ber., 37, 2486 A904).
'Locquin, С h e г с h e z, Corapt. rend., 186, 1360 A928).
8 Redeman n—S с h m i d t, Chemistry of the Amino Acids and
Proteins, Thomas, Baltimore, Md., 1938, p. 50.
'Erlenmeyer, К u n 1 i n, Ann., 316, 145 A901).
ЛИНОЛЕВАЯ КИСЛОТА
CH3 (CH2L СН = СНСН2СН = СН (СН2)Т СО.2Н + 2Вг„ -*
-5- СН3 (СП2L СПВгСНВгСН2СНВгСНВг (СН2), СО2Н
СН3 (СИ2L CHBrCHBrCH2CHBrCHBr (СН2), СО2Н + 2Zn —^^>
IICI
-^СН3(СН2LСН = СНСН.2СН = СН (СН./O СОаС3Н5-1 2ZnBr2
СН3 (СН2L СН = СНСН2СН = СН (СН2O СО,С2Н3 + NaOH 1—l
-, СН3(СН2LСН = СНСН2СН = СН(СН2),СОоН + NaHSO4 + Q>H5OH
Предложил: Док. Мак-Катион.
Проверили: Р. Шрайнер и С. Роулэнд.
Получение
Жирные кислоты. В 1-литровую коническую колбу помещают
250 мл очень чистого (динамитного) глицерина (примечание 1)
* Очень большое значение в качестве общего метода получения а-амино-
кислот имеет разработанный В. В. Феофилактовым с сотрудниками простой
способ получения этих кислот из алкилацетоуксусных эфиров. Последние
сочетанием с диазобензолом превращаются в фенилгидразопы алкилпиро-
виноградных кислот; в результате восстановления названных гидразонов
с хорошим выходом получаются а-аминокислоты. Так, из кзобутилацето-
уксуснош эфира был получен фенилгидразон изопропилпировиноградной
кислоты с выходом 72% теоретического количества, а в результате вос-
восстановления фенилгидразона—лейцин с выходом 80% теоретического коли-
количества. [В. В. Феофилактов, ЖОХ, 10, 251 A940)]. (Прим. ред.)
278
СИНТЕЗЫ' ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ЛИНОЛЕВАЯ КИСЛОТА
279
и 40 г @,71 моля) едкого кали. Смесь нагревают до 120—140°
и взбалтывают от руки до тех пор, пока щелочь не растворится.
К еще горячему раствору прибавляют в один прием (примечание 2)
110 мл A00 г, 0,11 моля) подсолнечного масла (примечания 3 и 4),
предварительно подогретого до 110—115°. Горячий раствор энер-
энергично размешивают кругообразным движением до тех пор, пока
не завершится процесс омыления (примечание 5); признаком этого
служит образование неисчезающей мыльной пены. После того,
как смесь несколько охладится к ней осторожно прибавляют
150 мл серной кислоты B5% по объему; примечание 6), встря-
встряхивая содержимое колбы кругообразным движением. Затем
к смеси прибавляют 200 мл горячей воды и, если это окажется
необходимым, нагревают смесь до тех пор, пока слой жирных
кислот не станет прозрачным. Водный слой отделяют, а кислотный
промывают двумя порциями горячей воды по 500 мл и фильтруют
с отсасыванием через большую воронку Гиргаа*, в рубашку кото-
которой пропускается пар или горячая вода. Смесь кислот (90—95 г)
(примечание 7) тщательно сушат, для чего ее быстро при пере-
перемешивании нагревают до 130°.
Тетрабромстеариновая кислота. В 4-литровом стакане, снаб-
снабженном механической мешалкой, растворяют выделенную смесь
жирных кислот в 2 л петролейпого эфира (примечание 8) и раствор
охлаждают до 0—10°. Через 20—25 мин. из раствора выпадают в оса-
осадок в количестве около 10 г твердые предельные жирные кислоты,
которые быстро отфильтровывают с легким отсасыванием. Филь-
Фильтрат переносят в 4-литровый стакан, охлаждают доО—10° и через
капельную воронку (примечание 9) медленно при перемешивании
приливают к нему 30,7 мл (90 г, 0,56 моля) брома (примечание 10).
Бром прибавляютс такой скоростью, чтобы температура держалась
в интервале между 10 и 15°; обычно эта операция занимает око-
около 20 мин. К концу прибавления брома начинает выпадать в оса-
осадок тетрабромстеариновая кислота. Раствор, который должен со-
содержать небольшой избыток брома (красноватый цвет), оставляют
на 15—20 мин. в бане со льдом (примечание 11). Быстро выпадает
осадок; большую часть жидкости декантируют, после чего оса-
осадок отфильтровывают с отсасыванием на воронке Бюхнера диа-
диаметром 12,5 см и промывают 200 мл петролейного эфира. Затем
осадок тщательно размешивают с 300 мл петролейного эфира
(примечание 12) в стакане емкостью 600 мл и фильтруют так же,
как и в первый раз. Серовато-белый тетрабромид после высуши-
высушивания при 50° переносят в 2-литровый стакан и растворяют в
90—100 мл горячего дихлорэтана (примечание 13). Раствор фильт-
* Воронка Гирша представляет собой воронку Бюхнера, окруженную
рубашкой с вводами для воды или пара, причем воронка, рубашка и вводы
изготовляются из фарфора и составляют единое целое. (Прим. ред.)
руют через бумажный фильтр и оставляют кристаллизоваться при
комнатной температуре. Осадок отфильтровывают и промывают
на воронке 200 мл свежего петролейного эфира. Тетрабромид
переносят на стеклянную тарелку и при помощи шпателя расти-
растирают в порошок (примечание 14). Белоснежные игольчатые кри-
кристаллы с серебристым отливом плавятся при 114,7—115,2°.
Выход (примечание 15) составляет 35—40 г C2—36% теоретич.;
примечание 16). Препарат следует хранить в банках из коричне-
коричневого стекла с навинчивающимися крышками и предохранять от
действия солнечного света.
Этиловый эфир линолевой кислоты. В коническую колбу емко-
емкостью 300 мл помещают 26—30 г перекристаллизованной тетра-
бромстеариновой кислоты, 85 мл абсолютного этилового спирта
и 30 г гранулированного цинка B0 меш). Смесь слегка на-
нагревают до тех пор, пока не начнется процесс отщепления
брома. Поскольку эта реакция экзотермична, обычно прихо-
приходится время от времени замедлять ее ход, погружая колбу
в сосуд с холодной водой. Бурное протекание реакции стано-
становится менее интенсивным примерно через 5 мин., после чего
к колбе присоединяют обратный холодильник и кипятят смесь
в течение получаса. Для того, чтобы этерифицировать линолевую
кислоту, к кипящей смеси приливают через верхнюю часть холо-
холодильника 10 мл 4 н. раствора хлористого водорода в этиловом
спирте (примечание 17), а затем через каждые полчаса в течение
последующих 2 час. приливают еще по 5 мл указанного реагента.
К концу этого времени раствор отделяют от непрореагировавшего
цинка декантацией в другую колбу.Чтобы полнее перенести рас-
раствор, цинк промывают 15 мл абсолютного спирта. Затем к рас-
раствору прибавляют 10 мл 4 н. спиртового раствора хлористого водо-
водорода и кипятят смесь в течение 1 часа с обратным холодильни-
холодильником, причем через полчаса после начала кипения прибавляют вто-
вторую такую же порцию спиртового раствора кислоты. Смесь выли-
выливают в 300 мл горячего насыщенного раствора поваренной соли,
находящегося в делительной воронке емкостью 500 мл, и дают смеси
расслоиться в течение 10—20 мин. Раствор соли отделяют, а слой
сложного эфира промывают (примечание 18) при комнатной тем-
температуре 300 мл 0,5%-ного раствора углекислого натрия. Чтобы
разрушить довольно устойчивую эмульсию, ее центрифугируют
в пробирках емкостью 100 мл в течение 5 мин. при 3 300 об/мин.
Сложный эфир и небольшое количество оставшейся эмульсии
промывают 80 мл теплой воды, после чего эмульсию вновь разру-
разрушают с помощью центрифугирования. Промывание продолжают
(примечание 19) до тех пор, пока реакция промывных вод на метил-
метилоранж не станет нейтральной. Нейтральный сложный эфир пере-
переносят в перегонную колбу емкостью 50 мл и перегоняют в вакууме;
т. кип. 175° B,5 м) [193° F мм)}. Препарат получается бесцвет-
280
СИНТЕЗЫ, ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ным (примечание 20); он дает отрицательную пробу по Бейль-
штейну; йодное число (по Вийсу, выдержка полчаса)
162,3—162,5; п^ 1,4489; истинный удельный вес d\b'b 0,8846. Вы-
Выход (примечание 15) составляет 12—15 г.
Линолевая кислота. Эфир линолевой кислоты растворяют
в 200 мл 5%-ного спиртового (примечание 21) раствора едкого
натра, находящегося в стакане емкостью 400 мл, и оставляют
раствор омыляться в течение ночи при комнатной температуре.
Получившуюся студнеобразную массу растворяют в 200 мл теп-
теплой воды и, пропуская в жидкость медленный ток углекислого
газа, подкисляют ее 50 мл разбавленной серной кислоты A : 1 по
объему). Пропускание тока углекислого газа не прерывают и при
последующих операциях. Линолевая кислота всплывает на поверх-
поверхность в виде прозрачного слоя. Водный слой сифонируют; кислоту
промывают один раз горячей водой, а затем сушат над безводным
сернокислым натрием. Препарат хранят под углекислым газом.
Выход составляет 10—12 г; температура плавления лежит в ин-
интервале от —9 до —8° (примечание 22).
Примечания
1. Динамитный глицерин рекомендуется применять вслед-
вследствие того, что содержание в нем глицерина весьма высоко (более
99%). Присутствие воды затрудняет процесс омыления.
2. Нельзя допустить, чтобы масло текло по стенкам колбы,
так как это препятствует полноте омыления.
3. Ниже приведен ряд масел, которые можно рекомендовать
для получения линолевой кислоты. Масла расположены в по-
порядке убывающей пригодности их для получения линолевой кис-
кислоты; в скобках приведены числа, показывающие примерное содер-
содержание в маслах линолевой кислоты: подсолнечное масло F0),
маковое масло F0), хлопковое масло D5).
4. Применяемый образец должен давать отрицательную гек-
сабромидную пробу, что указывает на отсутствие в нем кислот
более ненасыщенных, чем линолевая. Пробу производят сле-
следующим образом: 2 мл масла и 25 мл смеси этилового эфира и ле-
ледяной уксусной кислоты, взятых в отношении 4:1, охлаждают
в течение 15—20 мин. до 0°; если эта смесь не прозрачна, то ее
фильтруют; к полученному раствору прибавляют такое количество
брома, чтобы раствор окрасился в тёмнокрасный цвет, и оста-
оставляют смесь стоять в течение 15 мин. Отсутствие осадка означает,
что реакция отрицательна.
5. Обычно бывает достаточно энергичного перемешивания кру-
кругообразным движением в течение 4—6 мин., однако если встре-
встретятся затруднения, то необходимо снова нагреть смесь до 150°.
ЛИНОЛЕВАЯ КИСЛОТА
281
Если омыление началось, то оно доходит до конца в течение не-
нескольких секунд. Эмульсия загустевает в вязкую пасту, которая
в результате длительного- размешивания превращается в проз-
прозрачный раствор.
6. Если кислоту приливать к горячему раствору при сильном
взбалтывании, то слой жирных кислот быстрее становится проз-
прозрачным.
7. Если требуется получить большое количество жирных
кислот, то удобно пользоваться следующим методом. В 5-лит-
5-литровую круглодонную колбу, снабженную механической мешалкой
и обратным холодильником, помещают 1 500 мл метилового спирта
и 350 г едкого кали. После того как растворение закончится,
к раствору прибавляют 1 100 мл A кг) хлопкового масла. Раствор-
перемешивают и кипятят в течение 1—2 час, после чего метило-
метиловый спирт отгоняют. К остатку прибавляют 1 л воды и (медленно)
1 500 мл холодной 20%-ной серной кислоты. Слой жирных кислот
отделяют от водного слоя, промывают двумя порциями горячей
воды по 1 500 мл и фильтруют через воронку для горячего филь-
фильтрования. Кислоты сушат, как указано выше. Выход неочищен-
неочищенной кислоты составляет 950—975 г.
8. Температура кипения применяемого в э.том синтезе петро-
лейного эфира должна лежать в пределах 40—60°.
9. Конец капельной воронки должен находиться непосред-
непосредственно над раствором жирных кислот; это необходимо для того,
чтобы не забивалась ножка воронки.
10. Количество брома не зависит от процентного содержания
линолевой кислоты в образце, но зависит от йодного числа \ Для
целей данного опыта количество брома (в граммах) можно вычис-
вычислить, умножив на 0,7 йодное число масла. При этом избыток
брома составляет 10—11%.
11. Тетрабромстеариновая кислота легко образует пересыщен-
пересыщенный раствор в петролейном эфире.
12. Растворимость тетрабромида2 при комнатной температуре
составляет около 2—3 г на I л петролейного эфира; следователь-
следовательно, можно не опасаться потерять значительные количества тетра-
тетрабромида при промывании.
13. Другой менее удовлетворительный способ очистки состоит
в следующем. Неочищенный тетрабромид растворяют в 800 мл
этилового эфира, раствор фильтруют и переосаждают тетрабро-
тетрабромид, выливая фильтрат при перемешивании в 800 мл петролей-
петролейного эфира. Полученный раствор охлаждают ниже 20° и остав-
оставляют на ночь. В течение первых двух часов выпадает 90%
осадка. Последний отфильтровывают и промывают на воронке,
как указано выше.
14. Легкость, с которой препарат высыхает и поддается измель-
измельчению в порошок, служит указанием на его чистоту. Обычно-
282
СИНТЕЗЫ, ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
вещество распадается, образуя мелкий белый порошок, уже
в результате прикосновения шпателем. Для перенесения неочи-
неочищенного вещества до перекристаллизации следует- пользоваться
стеклянным шпателем.
15. Эти данные основаны на применении подсолнечного масла,
содержащего 57% линолевой кислоты. При применении других
масел выход может быть пропорционально большим или меньшим
в зависимости от результатов анализа масла. Приблизительные
выходы для трех видов масла можно вычислить на основании
данных, приведенных в примечании 3. Выход их хлопкового
масла составляет 26—30 г. Проверявшие синтез бромировали
количества, примерно в девять раз превышающие указанные
выше, и получали тот же выход (в процентах).
16. При бромировании образуются два изомера—твердый
и жидкий.
17. Для получения 4 н. спиртового раствора соляной кислоты
в слегка подогретый абсолютный этиловый спирт пропускают
¦сухой газообразный хлористый водород до тех пор, пока не будет
достигнуто вычисленное увеличение в весе.
18. Полученный сложный эфир содержит около 0,5% свобод-
свободной жирной кислоты, что при использовании его для некоторых
целей, например, для синтеза самой кислоты, не может служить
препятствием (стр. 286, примечание 9). Поэтому можно посове-
посоветовать там, где это возможно, опустить указанную стадию, так
как выход, особенно при работе с небольшими количествами,
может оказаться не выше 80%, считая на взятый неочищенный
¦сложный эфир. Если не производить промывания щелочью, то
и центрифугирование оказывается излишним, так как одна лишь
вода не вызывает образования эмульсии.
19. Обычно трех промываний бывает достаточно.
20. До фильтрования может быть прибавлено небольшое
количество угля для обесцвечивания; однако обычно этого не
требуется, и, если возможно, прибавления угля следует избегать
ввиду того, что он может засорить аппаратуру.
21. В данном случае пригоден обыкновенный 95%-ный дена-
денатурированный спирт.
22. Этиловый эфир линолевой кислоты значительно более
устойчив по отношению к окислению, чем сама эта кислота; по-
поэтому вещество рекомендуется хранить в виде сложного эфира,
а кислоту получать только непосредственно перед применением.
. Кислота до некоторой степени окисляется даже при наилучших
условиях хранения и, в отличие от своего эфира, не может быть
перегнана без некоторого разложения. По этой причине кон-
константы определяют для сложного эфира, а не для кислоты.
ЛИНОЛЕНОВАЯ КИСЛОТА
283
Другие методы получения
Этиловый эфир линолевой кислоты можно получить отщепле-
отщеплением брома от его тетрабромида при действии цинка или водорода
в момент выделения в результате реакции между цинком и ле-
ледяной уксусной кислотой3; при действии цинка и спиртового
раствора хлористого водорода2'4; при действии цинка и спиртового
раствора серной кислоты5. Чистая кислота может быть получена
омылением ее. эфира и непосредственным действием цинка и
пиридина (хинолина, анилина, пиперидина) на тетрабромстеари-
новую кислоту в.
1 Official and Tentative Methods of the American Oil Chemists Society,
Gillette Pub. Co., 330 S. Wells St., Chicago, 1941, p. 31.
2McCutchcon, Can. J. Research, B16, 158—175 A938).
3Erdmann, Bedford, Ber., 42, 1324 A909); E r d m a n n,
Bedford Raspe, Ber., 42, 1334 A909).
4 R о 1 1 e t t , Z. physiol. Chem., 63, 410—421 A909).
5 К i m u r a, Fettchem. Umschau, 4, 78 A935).
6 Kaufman n, Mestern, Ber., 69, 2684 A936).
ЛИНОЛЕНОВАЯ КИСЛОТА
CH3CH2CH= CHCH2CH = СНСН2СН = СН(СН2OСО2Н + ЗВг2 -*
—*¦ CH3CH3CHBrCHBrCH2CHBrCHBrCH2CHBrCHBr(CH2OCO2H
CH3CH2CHBrCHBrCH2CHBrCHBrCH2CHBrCHBr(CH2OCO2H + 3Zn
С2Н5ОН
—> СН3СН2СН = СНСН2СН = СНСНоСН = CH(CH2OCO2C2HS + 3ZnBr,
H2SO4
СН3СН2СН = СНСН2СН = СНСН2СН = СН(СН2OСО2С2Н5 + NaOH >
—> СН3СН2СН = СНСН2СН = СНСН2СН = СН(СН2),СО2Н 4- NaHSO4 -4- С2Н5ОН
Предложил: Дж. Мак-Катчон.
Проверили: Р. Шрайнер и С. Роулэнд.
Получение
Жирные кислоты. Следует выполнить синтез по методике,
изложенной выше при описании получения линолевой кислоты
(за исключением примечаний 3 и 4) (стр. 277). Исходным сырьем
служит льняное масло.
Гексабромстеариновая кислота. В 4-литровом стакане, снаб-
снабженном механической мешалкой (примечание 1), растворяют
90—95 г смеси жирных кислот в 2 500 мл этилового эфира и рас-
раствор охлаждают до 0—10°. Затем через капельную воронку (при-
(примечание 2) медленно при перемешивании приливают к раствору
35 мл брома (примечания 3 и 4) с такой скоростью, чтобы темпера-
температура не поднималась выше 20°. Обычно на эту операцию требуется
около 50 мин. Раствор, который должен содержать избыток брома
(тёмнокрасный цвет), оставляют на ночь в бане со льдом при
2 84
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
О—10°. Чтобы избавиться от избытка брома, к раствору приба-
прибавляют небольшое количество амилена, после чего белый осадок
отфильтровывают е отсасыванием на воронке Бюхнера диамет-
диаметром 12,5 см и промывают 200 мл этилового эфира. Гексабромид
тщательно размешивают с 300 мл этилового эфира в стакане
емкостью 600 мл и вновь отфильтровывают, как было указано
выше. Выход серовато-белой гексабромстеари новой кислоты со-
составляет 20—22 г (примечание 5). Прежде чем приступать кследую-
щей стадии, рекомендуется накопить 100 г неочищенного гексабро-
мида (примечание 6).
В 1-литровом стакане нагревают до 70—80° 100 г неочищенной
гексабромстеариновой кислоты с 600 мл диоксапа (примечание?).
Смесь фильтруют и фильтрат оставляют стоять при 15—20° в тече-
течение нескольких часов или, лучше, в течение ночи. Осадок отфиль-
отфильтровывают на воронке Бюхнера с несильным отсасыванием и
здесь же тщательно промывают несколькими порциями этило-
этилового эфира по 300 мл. Затем гексабромид переносят на стек-
стеклянную тарелку, раскладывают стеклянным шпателем и сушат
на воздухе. Выход мелких белоснежных кристаллов составляет
80 г; т. пл. 181,5—181,9° (примечание 8).
Этиловый эфир линолсновои кислоты. В 1-литровой кониче-
конической колбе растворяют 80 г чистого гексабромида в 190 мл абсо-
абсолютного этилового спирта и прибавляют к раствору 40 г грану-
гранулированного цинка B0 меш). Смесь кипятят в течение 1 часа,
причем к концу этого времени раствор должен стать прозрачным.
Затем в раствор вносят 10 г цинковой пыли и продолжают кипя-
кипячение в течение еще некоторого времени, после чего прибав-
прибавляют 10 мл 4 н. раствора хлористого водорода в этиловом спирте
(стр. 282). Смесь кипятят в течение 6 час. с обратным холодильни-
холодильником, прибавляя к ней через каждые полчаса по 5 мл указанного
реагента. Через 6 час. раствор отделяют от непрореагировавшего
цинка декантацией в другую колбу. Чтобы полнее перенести рас-
раствор, цинк промывают 15 мл абсолютного спирта. Затем к раствору
прибавляют 10 мл 4 н. спиртового раствора хлористого водорода
и кипятят смесь в течение 3 час. с обратным холодильником,
прибавляя к ней по 5 мл того же реагента через каждые полчаса.
Смесь выливают в 500 мл горячего насыщенного раствора поварен-
поваренной соли, находящегося в 1-литровой делительной воронке, и нео-
неочищенному сложному эфиру дают отслоиться в течение 10—20 мин.
Раствор соли отделяют, а слой сложного эфира промывают (при-
(примечание 9) при комнатной температуре 500 мл 0,5%-ного раствора
углекислого натрия. Довольно стойкую эмульсию разрушают
центрифугированием смеси в течение 5 мин. при 3 300 об/мин.
Сложный эфир и небольшое количество оставшейся эмульсии
промывают 150 мл теплой воды и эмульсию вновь разрушают
с помощью центрифугирования. Промывание (примечание 10)
ЛИН ОЛЕ НОВАЯ КИСЛОТА
285
продолжают до тех пор, пока реакция промывных вод на метил-
метилоранж не станет нейтральной. Нейтральный сложный эфир пере-
перегоняют в вакууме; т. кип. 174° B,5 мм) [198° F,5 мм)].
Линоленовая кислота. Сложный эфир растворяют в 400 мл
5%-ного спиртового раствора едкого натра, находящегося в 1-лит-
1-литровом стакане, и оставляют раствор на ночь при комнатной тем-
температуре. Полученную студнеобразную массу растворяют в 400 мл
теплой воды и, пропуская в жидкость медленный ток углекислого
газа, подкисляют ее 50 мл разбавленной серной кислоты A : 1 по
объему). Пропускание тока углекислого газа не прерывают и при
последующих операциях. Линоленовая кислота всплывает на
поверхность в виде прозрачного слоя, который промывают один
раз горячей водой. Кислоту сушат над безводным сернокислым
натрием и хранят под углекислотой. Выход составляет 22—24 г;
температура плавления лежит в интервале от — 17 до —16°
(примечание 11).
Примечания
1. С целью предохранения от опасности пожара рекомендуется
перемешивать смесь от руки в том случае, если не имеется надле-
надлежащего оборудования.
2. Конец капельной воронки должен находиться непосред-
непосредственно над раствором жирных кислот; это необходимо для того,
чтобы не забивалась ножка воронки.
3. Необходимо соблюдать осторожность и следить, чтобы не
выскочила пробка крана капельной воронки.
4. Количество брома не зависит от процентного содержания
линоленовой кислоты в образце, но зависит от йодного числа.
Для целей данного опыта количество брома (в граммах) можно
вычислить, умножив на 0,7 йодное число масла. При этом избыток
брома составляет 10—11%.
5. При вычислении выхода предполагалось, что льняное
масло содержит около 45% линоленовой кислоты. Вследствие
образования стерео изомеров только 25% бромокислоты выпадает
в виде твердого осадка. Если применять смесь продажных пере-
перегнанных бесцветных льняных жирных кислот, то выход твердой
бромокислоты может достигнуть 48—53 г.
6. Теоретический выход этилового эфира линоленовой кислоты
нз 20 г чистого гексабромида составляет 8 г. Потери при перекри-
перекристаллизации, перегонке и т. д. составляют приблизительно 50%;
таким образом, действительный выход сложного эфира составляет
около 4 г.
7. Побочный продукт, нерастворимый в диоксане, предста-
представляет собой гептабромстеариновую кислоту. Если на этой стадии
раствор окажется желтым, то к нему следует прибавить неболь-
небольшое количество угля для обесцвечивания.
286
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
8. Температура плавления изменяется в зависимости от ско-
скорости нагревания. Можно пользоваться любым, но всегда одним
и тем же методом определения температуры плавления. Оказа-
Оказалось, что наиболее удобно вводить капилляр в баню, когда ее-
температура на 5° ниже ожидаемой температуры плавления, и за-
затем повышать температуру со скоростью Г в минуту.
9. Полученный сложный эфир содержит около 0,5% свобод-
свободной жирной кислоты, что при использовании его для некоторых
целей, например, для синтеза самой кислоты не может служить
препятствием. Поэтому можно посоветовать там, где это воз-
возможно, опустить указанную стадию, так как выход, особенно при
работе с небольшими количествами, может оказаться не выше
80%, считая на взятый неочищенный сложный эфир. Если не
производить промывания щелочью, то и центрифугирование
оказывается излишним, так как одна лишь вода не вызывает
образования эмульсии.
10. Обычно трех промываний бывает достаточно.
11. Этиловый эфир линоленовой кислоты значительно более
устойчив по отношению к окислению, чем сама кислота. Поэтому
вещество рекомендуется хранить в виде сложного эфира, а кислоту
получать только непосредственно перед применением. Кислота
до некоторой степени окисляется даже при наилучших условиях
хранения и в отличие от своего эфира не может быть перегнана
без некоторого разложения. По этой причине константы опреде-
определяют для сложного эфира, а не для кислоты.
Другие методы получения
Линоленовую кислоту всегда получают из природных источ-
источников, главным образом из масел различных семян, например из
семян конопли1, из грецких орехов3, из семян мака2, из семян
хлопчатника2 и, лучше всего, из семян льна3-4. Сырую кислоту
очищают через твердый гексабромид либо непосредственно5'6, либо
через омыление се метилового или этилового эфира, которые
в свою очередь получают отщеплением брома от гексабромстеа-
риновой кислоты и ее этерификацией, проводимыми одновре-
одновременно5'7. Описанная выше пропись представляет собой видоизме-
видоизменение8'9 метода, который предложил Роллетт7.
iHazura, Monatsh., 8, 268 A887).
2Hazura, Grussner, Monatsh., 9, 204 A888).
3 H a z u r a, Monatsh., 8, 158 A887); Erdmann, Bedford,
Ber., 42, 1328 A909).
4 Erdmann, Z. physiol. Chem., 74, 180 A911).
5 Erdmann, Bedford, Ber,, 42,1330A909).
6 H a z u r a, Monatsh., 8, 267 A887).
7 R о 1 1 e t t, Z. physiol. Chem., 62, 422 A909).
8 M cC u t ch e о n, Can. J. Research, B16, 158 A938).
•McCutclieon, Can. J. Research, B18, 231 A940).
d-MAHTTO3A
287
d-MAHHO3A
+ j^O _y csHlaO, + CH3OH
Предложили: Дж. Шихан, В. Фрейденберг.
Проверили: Г. Адкинс, У. Узйн и Р. Джюдей.
Получение
В 5-литровой колбе подвергают перегонке с водяным паром
в течение 1 часа раствор 200 г A,03 моля) а-метил-^-маннозида
(«Синт. орг. преп.», сб. 1, стр. 258) в 3 200 мл 2 н. раствора сер-
серной кислоты A78 мл концентрированной серной кислоты, разба-
разбавленной до объема 3 200 мл). При этом колбу нагревают снаружи
так, чтобы объем раствора оставался неизменным. Смесь перено-
переносят в глиняный сосуд емкостью 8—12 л, прибавляют к ней 10 г
активированного березового угля и при энергичном переме-
перемешивании нейтрализуют (на лакмус) углекислым барием (приме-
(примечание 1).
Смесь фильтруют с отсасыванием, пользуясь воронкой Бюх-
нера диаметром 25 см, через слой асбеста, наложенный на фильт-
фильтровальную бумагу, и промывают сернокислый барий двумя пор-
порциями воды по 100 мл. Фильтрат и промывные воды соединяют
вместе и прозрачный бесцветный раствор сахара упаривают в ва-
вакууме водоструйного насоса до объема 300 мл на водяной бане,
температура которой не должна превышать 60°. Смесь фильтруют
и твердый осадок промывают на фильтре небольшим количеством
воды.
Фильтрат и промывные воды, соединенные вместе, упари-
упаривают до объема 100 мл при уже описанных выше условиях. Теплый
окрашенный в светлобурый цвет сироп переливают в кониче-
коническую колбу емкостью 500 мл. Чтобы полнее перенести остатки,
перегонную колбу ополаскивают пять раз ледяной уксусной
кислотой порциями по 40 мл, причем перед выливанием каждую^
порцию уксусной кислоты нагревают на водяной бане до 50°.
В раствор сахара в уксусной кислоте вносят затравку кристал-
кристаллической d-маннозы (примечание 2); после стояния в течение
ночи при комнатной температуре раствор помещают на 1—2 дня
в холодильный шкаф.
Кристаллическую cf-маннозу отфильтровывают и промывают
последовательно двумя порциями холодной ледяной уксусной
кислоты по 20 мл, двумя порциями холодного сухого этилового
спирта по 20 мл и тремя порциями холодного абсолютного эфира
по 30 мл (примечание 3). Препарат сушат на воздухе в течение
Здней, после чего выход его составляет 112—115 г F0% теоретич.;
примечание 4); т. пл. 126,5—127,5° (примечание 5).
288
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
МЕЗИТИЛУКСУСНАЯ КИСЛОТА
289
Примечания
1. Вычисленное количество чистого углекислого бария, необ-
необходимого для нейтрализации серной кислоты, составляет 630 г.
Однако проверявшие синтез нашли, что реакция смеси после пере-
перемешивания ее в течение 2—3 час. с 780 г углекислого бария все
еще была кислой. Для того чтобы довести реакцию смеси до ней-
нейтральной, потребовалось еще 100 г углекислого бария. Проверяв-
Проверявшие синтез нашли, что лучше всего прибавить к смеси 975 г гид-
гидрата окиси бария Ва(ОНJ-8Н2О и перемешивать ее в течение
получаса, а затем, чтобы завершить нейтрализацию, добавить
75 г углекислого бария и продолжать перемешивание.
2. Если не имеется кристаллической rf-маннозы, то можно
вызвать кристаллизацию потиранием стенок колбы стеклянной
палочкой.
3. Сахар следует растирать с каждой порцией промывной жид-
жидкости, чтобы добиться наилучшей очистки при минимальном коли-
количестве растворителя.
4. Авторы синтеза получили из маточных растворов еще
18—19 г кристаллической rf-маннозы, что увеличило выход
до 70% теоретического количества.
5. Полученный таким образом сахар, повидимому, предста-
представляет собой главным образом d-маннозу. При желании получить
более чистое вещество сахар перекристаллизовывают из80%-ного
этилового спирта. В результате получается препарат, который
плавится при 131 —132°; его удельное вращение [а]в +15°. Вы-
Выход вещества при перекристаллизации составляет около 80%.
Другие методы получения
d-Манпоза была получена гидролизом маннаиа, содержащегося
б каменном орехег; однако, повидимому, кристаллический сахар
лучше всего получать из манна на через промежуточное выделение
а-метил-^-маннозида2. Приведенная выше пропись аналогична
методике, которую предложили Худзон и Джексон2, с тем исклю-
исключением, что по данной прописи для гидролиза а-метил-^-манно-
зида вместо соляной кислоты применяется серная. Левин3
описал, повидимому, наилучший метод для превращения маннана
в d-маннозу без выделения ос-метилманнозида. d-Манноза, кото-
которую получил Левин, представляла собой в основном р-изомер.
1 II u d s о n, Sawyer, J. Am. Chem. Soc., 39, 470 A917).
^Hudson, Jackson, J. Am. Chcm. Soc, 56, 958 A934).
3 Levene, J. Biol. Chem., 108, 419 A935).
МЕЗИТИЛУКСУСНАЯ КИСЛОТА
B,4,6-Триметил-а-толуиловая кислота)
СН2С1
НХ
СН,
СН,
нсно
ПС1
NaCN"
СН,
СН,
н3с
CH2CN
сн.
няс
снхоон
СН3
СН,
СН,
Предложили: Р. Фьюзон и Н. Рэбджон.
Проверили: В. Бахман, Э. Дженнер и Дж. Джонсон.
Получение
а?-Хлпризодурол. В 2-литровую круглодонную колбу, снабжен-
снабженную механической мешалкой с затвором (примечание 1), трубкой
для ввода газа и обратным холодильником, помещают 200 г A,66
моля) мезитилена, 1 л концентрированной соляной кислоты и 63 мл
@,84 моля) раствора формальдегида C7%-ного формалина; приме-
примечание 2). Хлористый водород вводят непосредственно в смесь (приме-
(примечание 3), которую сильно перемешивают и нагревают на водяной
бане; температуру бани поддерживают при 55°. Эти условия
сохраняют в течение, всей реакции, которая продолжается 5,5 часа.
По прошествии 2 ч. 45 мин. к реакционной смеси прибавляют
дополнительно 63 мл @,84 моля) раствора формальдегида (приме-
(примечание 4).
После того как смесь охладится до комнатной температуры
(примечание 5), ее экстрагируют тремя порциями бензола по 300 мл.
Соединенные вместе бензольные вытяжки промывают последо-
последовательно водой, разбавленным раствором едкого натра и вновь
водой, сушат над хлористым кальцием и фильтруют. Смесь пере-
перегоняют, используя насадку, в вакууме; при отгонке бензола дав-
давление понижают лишь незначительно. Выход ос2-хлоризодурола
с т. кип. 130—131° B2 мм) составляет 155—170 г E5—61% теоре-
тич.; примечание 6). Дестиллат застывает в кристаллическую
массу, которая плавится при 37°.
19 Сборник 3
290
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Мезитилацетонитрил. В 1-литровую трехгорлую колбу, снаб-
снабженную механической мешалкой, обратным холодильником и ка-
капельной воронкой, помещают 77 г A,57 моля) цианистого натрия,
ПО мл воды и 160 мл спирта. Колбу нагревают на кипящей водя-
водяной бане и ее содержимое перемешивают до тех пор, пока не рас-
растворится весь цианистый натрий. После этого к раствору медленно
прибавляют 152 г @,90 моля) ос2-хлоризодурола и перемешивание
продолжают в течение еще 3 час.
Затем реакционной смеси дают охладиться примерно до 40°
(примечание 7) и экстрагируют ее тремя порциями бензола по
300 мл. Бензольный раствор тщательно промывают водой, сушат
над хлористым кальцием, фильтруют и перегоняют при слегка
пониженном давлении до тех пор, пока не отгонится весь бензол.
Затем остаток перегоняют в вакууме из колбы Клайзена с широким
боковым отводом. Выход мезитилацетонитрила с т. кип. 160—165°
B2 мм) составляет 128—133 г (89—93% теоретич.; примечание 8).
Полученный препарат достаточно чист для применения в после-
последующей стадии. Если его перекристаллизовать из петролейного
эфира, то он плавится при 79—80°.
Мезитилуксусная кислота. В 3-литровую трехгорлую колбу
помещают 900 мл воды, к которой прибавляют 750 мл концентри-
концентрированной серной кислоты. Когда смесь охладится до 50°, в нее
вводят 127 г @,80 моля) мезитилацетонитрила (примечание 9),
после чего смесь кипятят с обратным холодильником и перемеши-
перемешивают механической мешалкой в течение 6 час. К концу этого вре-
времени из раствора выпадает в осадок большое количество мезитил-
уксусной кислоты. Содержимое колбы охлаждают и выливают
в сосуд, содержащий 3 л ледяной воды. Кислоту отфильтровывают
на воронке Бюхнера и тщательно промывают водой. Затем раствор
мезитилуксуспой кислоты в разбавленной щелочи кипятят с акти-
активированным березовым углем, фильтруют и кислоту осаждают из
раствора, подкисляя его разбавленной соляной кислотой. Веще-
Вещество отфильтровывают, тщательно промывают водой и сушат
в сушильном шкафу при 80°. Выход мезитилуксусной кислоты
с т. пл. 163—166° составляет 123г (87% теоретич.). После перекри-
перекристаллизации из разбавленного спирта или из легкого бензина
т. пл. 167—168°.
Примечания
1. При проверке была применена мешалка с затвором, в кото-
котором герметичность достигается за счет того, что ось мешалки
пришлифована к стеклянному подшипнику.
2. Был применен продажный формалин. Этот водно-метаноль-
ный раствор содержит 37% (по весу) формальдегида. Иногда его
называют 40%-ным формалином, так как 100 мл раствора содер-
содержат 40 г формальдегида.
МЕЗИТИЛУКСУСПАЯ КИСЛОТА
29!
3. Хлористый водород вводят с такой скоростью, чтобы пу-
пузырьки образовывались несколько быстрее, чем их можно было
сосчитать.
4. Выход монохлор метального соединения, повидимому, не-
несколько повышается благодаря тому, что формалин прибавляют
в два приема, а не вводят весь сразу в начале реакции.
5. Если реакционную смесь охладить до слишком низкой тем-
температуры, то хлорметильные производные затвердевают; между
тем экстрагирование проводить значительно легче, пока смесь
находится еще в жидком состоянии.
6. Остаток состоит главным образом из а2, а4-дихлорпентаметил-
бензола. Собирают фракцию с т. кип. 131—200° B2 мм) и перекри-
сталлизовывают ее из петролейного эфира. Температура плавле-
плавления препарата 105°.
7. Если реакционной смеси дать охладиться значительно ниже
40°, то она затвердевает в колбе.
8. Описанный метод был с успехом использован для получе-
получения 2,4,6-триэтилфенилацетонитрила [т. кип. 127° C—4 мм);
выход 72%]; дурилацетонитрила (т. пл. 80—8Г; выход 75%)
и изодурилацетонитрила (т. пл. 74—75°; выход 74%).
9. Если мезитилацетонитрил не был очищен перегонкой или
если прибавить его к кипящему раствору серной кислоты, то реак-
реакционная смесь обычно становится очень темной.
Другие методы получения
ос2-Хлоризодурол можно получить действием хлорметиловогс»
эфира на мезитилен в присутствии хлорного олова1 или уксусной
кислоты2. Описанный метод основан на работе, проведенной Наута
и Динске 3.
Мезитилацетонитрил был получен действием цианистого калия
на ос2-хлоризодурол4 или обработкой сс2-хлоризодурола цианистой
медью в присутствии пиридина5. Приведенная пропись основана
на методе получения цианистого бензила из хлористого бензила.
Мезитилуксусная кислота была получена из 2,4,6-триметил-
ацетофенона обработкой его желтым сернистым аммонием и после-
последующим гидролизом полученного амида щелочью8; сухой перегон-
перегонкой 2,4,6-триметилыиндальной кислоты7; нагреванием 2,4,6-три-
метилфенилглиоксиловой кислоты с иодистоводородной кислотой
и красным фосфором8; действием па мезитилацетонитрил едким
кали4.
1 Sommelet, Compt. rend., 157, 1443 A913).
2 V a v о п, В о 1 1 е, Compt. rend., 204, 1826 A932).
1 Nanta, Dienske, Rec. trav. chim 55, 1000 A936)
4 Hoch, Compt. rend., 192, 1464 A931).
'Newman, J. Am. Chem. Soc, 59, 2472 A937).
!9*
292
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
6 С 1 a u s, J. prakt. Chem., B), 41, 508A890); W i llgerodt, там же,
B), 80, 185 AS09); W i 1 1 g e г о d t, M e г к, т а и . ж е, B), 80, 193 AS09).
'Meyer, M о 1 z, Ber., 30, 1274 A897).
8 D i t t r i с h, Meyer, Ann., 264, 140 A891).
г-МЕНТОКСИУКСУСНАЯ КИСЛОТА
2CJ0H19OH
+ ClCII2CO2H
OR,
CH
нас
I
НоС
CHOCH2CO2Na
> 2C10H19ONa + H2
C10M,9OCH2CO2Na +С,0Н19ОН+NaCl
+ HC1
/
CH
i
i
CH
/\
H3C CH3
CH3
CH
/ \
H2C CH2
-* I I + NaCl + HaO
H2C CHOCH2CO2H
\ /
CH
I
CH
H3C CH3
Предложили: М. Леффлер и А. Калкинс,
Проверили: Р. Шрайнер и К. Тилфорд.
Получение
Трехгорлую кругло донную колбу емкостью Зл снабжают меха-
механической мешалкой (примечание 1) и обратным холодильником,
защищенным хлор кальциевой трубкой. В колбу помещают раствор
400 г B,56 моля) /-ментола (кристаллы, т. пл. 41—42°) в 1 л сухого
толуола (примечание 2) и прибавляют туда же 70 г C,04 грамм-
атома) натрия с чистой поверхностью. Затем третье горло колбы
плотно закрывают корковой пробкой и колбу нагревают на масля-
масляной бане до тех пор, пока не начнется слабое кипение толуола.
Как только натрий расплавится, включают мешалку и перемеши-
I-МЕПТОКСИУКСУСНАЯ КИСЛОТА
293
вают массу с такой скоростью, чтобы натрий разбивался на мелкие
шарики.
Реакционную смесь кипятят в течение 15 час, после чего
останавливают мешалку, дают смеси охладиться и избыток на-
натрия (примечание 3) тщательно удаляют. Вновь собирают таким же
образом прибор (примечание 1), но в третье горло колбы вста-
вставляют 1-литровую делительную воронку (примечание 4). Темпера-
Температуру масляной бани повышают до 85—90" и при непрерывном пере-
перемешивании прибавляют к реакционной смеси через делительную
воронку раствор 95 г A,01 моля) монохлоруксусной кислоты
(примечание 5) в 800 мл теплого сухого толуола с такой ско-
скоростью, чтобы кипение не было едишком сильным. Тотчас же
образуется тяжелый осадок натриевой соли хлоруксуснои кис-
кислоты. После прибавления всего количества хлоруксуснои кислоты
смесь кипятят и перемешивают в течение 2 суток. В продолже-
продолжение этого времени перемешивание должно быть насколько воз-
возможно более энергичным. Необходимо прибавить 1 000—1 500 мл
сухого толуола; мешалку следует часто останавливать, чтобы
удалять твердое вещество со стенок колбы.
По завершении реакции колбу вынимают из масляной бани,
охлажденную реакционную смесь переносят в 5-литровую дели-
делительную воронку и экстрагируют тремя порциями воды по 1 л
(примечание 6). Водные вытяжки осторожно подкисляют 20%-ной
соляной кислотой и неочищенную ментоксиуксусную кислоту
в виде бурого масла, образующего верхний слой, экстрагируют
тремя порциями бензола по 200 мл. Бензольные вытяжки соеди-
соединяют вые'сте и растворитель отгоняют на паровом нагревателе.
Остаток подвергают дробной перегонке при попижепном давлении.
Фракция, кипящая до 100° B0 мм), состоит главным обра-
образом из воды и толуола. Вторая фракция, которая кипит при
100—115° (8—10 мм), представляет собой неочищенный /-ментол;
ее следует сохранить и подвергнуть вторичной перегонке (при-
(примечание 6). Выход /-ментоксиу ксусной кислоты составляет
166—180 г G8 — 84% теоретич.); т. кип. 134—137° B мм)
[150—155° {4 мм)]; [ос]Ь5-92,4°.
Примечания
1. Успех реакции в значительной степени зависит от типа при-
применяемой мешалки. Мешалка из нержавеющей стали якорного
типа с газонепроницаемым резиновым или металлографитовым
подшипником весьма пригодна ввиду ее мощности. Во время пер-
первой стадии мешалку следует пускать с большой скоростью,
чтобы хорошо измельчить натрий; во второй стадии сильное пере-
перемешивание не настолько существенно, однако твердая и жидкая
фазы должны быть тщательно смешаны.
294
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРКПАРАТОВ
2. Толуол можно высушить кипячением в течение нескольких
часов над металлическим натрием. Затем его перегоняют и соби-
собирают в приемнике, который защищен от влаги воздуха хлоркаль-
циевой трубкой.
3. Избыток натрия составляет около 11 г. Если натрий остается
в мелкораздробленном состоянии, то для его удаления горячую
смесь фильтруют через стеклянную вату.
4. Не рекомендуется оставлять делительную воронку в горле
колбы в течение последующего длительного времени перемеши-
перемешивания, так как последнее сопровождается значительными вибра-
вибрациями, ослабляющими связь между колбой и воронкой. Как толь-
только надобность в воронке отпадет, ее следует тотчас же заменить
хорошо пригнанной корковой пробкой.
5. Продажную монохлоруксусную кислоту (т. пл. 61—63°)
следует измельчить в ступке и сушить в течение 2 дней в вакуум-
эксикаторе над концентрированной серной кислотой. При при-
применении хлоруксусной кислоты без предварительного основа-
основательного высушивания выход снижался примерно на 10%.
6. Толуольный слой, содержащий ментол, образовавшийся
в результате реакции, сохраняют с целью выделения толуола
и ментола, которые разделяют перегонкой при атмосферном
давлении. /-Ментол собирают при 210—212° (исправл.); выход
составляет 150—225 г.
Другие методы получения
/-Ментоксиуксусная кислота была получена только действием
натриевого алкоголята ментола на монохлоруксусную кислоту х.
1Frankland, O'S u 1 1 i v a n, J. Chem. Soc, 99, 2325A911);
Rule, T о d d, там же, 1931, 1929.
g-МЕТИЛГЛУТАРОВАЯ КИСЛОТА
2CNCH2CONH2 + CH3CHO -s- CH3CH[CH(CN|CONH2]2 + H2O ^
CHSCH[ CH(CN)CONH2]2 + 6H2O -f 4HC1 ->¦
->¦ HO2CCH2CH(CH3)CH2CO2H + 4NH4C1 + 2CO2
Предложили: Р. Кент и С. Мак-Эльвен.
Проверили: Л. Смит и Г. Бойак.
Получение
а.,а.'-Дициан-$-метилглутарамид. В 6-литровой колбе раство-
растворяют в 3 400 мл воды 520 г F,2 моля) перекристаллизованного циан-
Р-МЕТИЛГЛУТАРОВАЯ КИСЛОТА
295
ацетамида («Синт. орг. преп.», сб. 1, стр. 498) (примечание 1). Рас-
Раствор охлаждают до 10° и, если он не прозрачен, фильтруют (при-
(примечание 2). При непрерывном встряхивании колбы к раствору
последовательно прибавляют 137,5 г C,1 моля) свежеперегнанного
ацетальдегида и 20 мл пиперидина. Смесь оставляют на 2 часа при
комнатной температуре, после чего колбу помещают в баню со
льдом и солью и содержимое ее частично замораживают. Во время
этой операции колбу следует встряхивать. Через полчаса начи-
начинает выпадать в осадок а,а'-дициан-р-метилглутарамид. После
того как осаждение закончится (около 1 часа), смесь оставляют
стоять до тех пор, пока температура ее не поднимется до комнат-
комнатной; это необходимо для того, чтобы растаял образовавшийся лед.
Осадок отфильтровывают с отсасыванием и тщательно промы-
промывают холодной дестиллированной водой. Выход белого порошко-
порошкообразного твердого вещества с т. пл. 152—157° составляет
420—425 г G1% тсоретич.; примечание 3).
ф-Метилглутаровая кислота. В 5-литровую колбу помещают
400 г амида и 1 л концентрированной соляной кислоты; смесь на-
нагревают на паровой бане до полного растворения амида, после чего
ее разбавляют 1 л воды и кипятят в течение 8 час. с обратным холо-
холодильником. Окрашенный в янтарно-желтый цвет раствор насы-
насыщают хлористым натрием и экстрагируют пятью порциями эфира
по 600 мл. Соединенные вместе эфирные вытяжки сушат в течение
часа над фосфорным ангидридом и отгоняют растворитель. Оста-
Остаток—неочищенная р-метилглутаровая кислота —- весит 238—240 г
(80% теоретич.) и плавится при 79—82° (с предварительным раз-
размягчением). Препарат перекристаллизовывают из 250 мл 10%-ной
соляной кислоты. Выход при перекристаллизации составляет
около 90% (примечание 4); очищенное вещество плавится при
85—86°.
Примечания
1. Присутствие аммиака оказывает отрицательное влияние на
реакцию конденсации, поэтому при применении неочищенного
цианацетамида выход значительно снижается.
2. Иногда при 10° цианацетамид выкристаллизовывается.
Смесь можно фильтровать лишь в том случае, если имеется уве-
уверенность, что в осадке не содержится цианацетамид. Выпавший
цианацетамид вновь быстро переходит в раствор после прибавле-
прибавления ацетальдегида и пиперидина.
3. В обычных растворителях этот амид нерастворим, однако
при желании его можно подвергнуть дальнейшей очистке расти-
растиранием с разбавленной соляной кислотой с последующим промы-
промыванием горячим абсолютным спиртом. После такой обработки
, амид плавится точно при 160—161е.
296
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
4. Проверявшие синтез применяли одну десятую указанного
количества реагентов. В двух опытах были получены следующие
средние выходы: неочищенного а,а'-дициан-р-метилглутарамида
(т. пл. 152—157°)—75°/о; неочищенной C-метилглутаровой кислоты
(т. пл. 79—82°)—78%; очищенной C-метилглутаровой кислоты
(т. пл. 84—85°)—80*6 (выход при перекристаллизации). Однако
во втором опыте выходы (за исключением выхода при перекри-
перекристаллизации) были несколько выше, чем приведенные для опытов
с большими количествами.
Другие методы получения
Изложенная выше методика разработана на основании иссле-
исследований Дэя и Торпе1. р-Метилглутаровая кислота была получена
гидролизом ее нитрила2, конденсацией кротонового эфира с натрий-
циануксусным3 и с натриймалоновьш эфирами4 и конденсацией
ацетальдегида с малоновым эфиром5.
1 D а у, Thorpe, J. Chem., Soc, 117, 1465 A920).
2 В 1 a i s e, G a u 1 t, Dull. soc. chim., D), 1, 88 AS07).
'Howies, Thorpe, Udall, J. Chem. Soc, 77 948 A900V
D a r b i s h i r e, Thorpe, там же, 87, 1716 A905).
4Auwers, Kobner, Meyenburg, Ber., 24, 2887 A891)
5 Knoevenagel, Ber., 31, 2585 A898).
OH
М-МЕТИЛ-3,4-ДИОКСИФЕНИЛАЛАНИН
сн3
/ он
CHO
CO — NH
,сн, + н2о
4
CO—NH
OH
II
!l
нс=с—¦
со-
HgNa
,сн3 i^r
-N
^>C=NH
-NH
OH
сня
\/ /
CH3— CH—N
CO—NH
n
К-МЕТИЛ-3,4-ДИОКСИФЕНИЛАЛАНИН
297
OH
OH
CH
Ba(OH)»
3 затем H2SOj
CH2 —CH—N
CO —NH
OH
CO2 + (NH4JSO4 + BaSO4
CH2 — CH — NHCH3
CO2H
Ш
OH
Ш
+ CH3J
V
CH2 —CH —NHCHS
CO2H
CHa —CH —NHCH,
I
CO2H
IV
Предложили: В. Делофе и Т. Герреро.
Проверили: Г. Адкинс, Г. Геллер и Э. Боуден.
Получение
5-C-Метокси-4-оксибензаль)-креатинин (I). Тщательно сме-
смешивают 11,3 г @,1 моля) креатинина («Синт. орг. преп.» сб. 1,
стр. 230) и 24 г @,16 моля) ванилина. Смесь помещают в большую
пробирку из стекла пирекс (наружный диаметр 51 мм, высота
200 мм). Пробирку погружают в масляную баню, которую затем
нагревают до 170°, и при непрерывном помешивании (приме-
(примечание 1) расплавляют смесь. Через 10 мин. температура смеси
достигает 155°, после чего начинается реакция и выделяется вода.
Еще через 3—5 мин. выделение воды прекращается и смесь за-
затвердевает. Пробирку продолжают нагревать в течение 3 мин.
затем ее вынимают из бани и оставляют охлаждаться.
Когда температура смеси понизится до 50—60°, к ней приба-
прибавляют 50 мл этилового спирта; затем смесь осторожно нагревают,
погружая ее время от времени в теплую масляную баню. Твердое
вещество частично рассыпается и образует суспензию. Послед-
Последнюю фильтруют, а оставшееся в пробирке твердое вещество
нагревают со второй порцией спирта в 50 мл. Эту операцию
повторяют до тех пор, пока весь продукт конденсации (окрашен-
(окрашенный в оранжевый цвет) не будет перенесен на фильтр. После
этого осадок на фильтре последовательно промывают тремя пор-
порциями воды (по 30 мл), нагретой до 60°.
После высушивания неочищенное вещество весит 24 г (95 %
теоретич.); оно плавится при 261—263° и пригодно для примене-
применения в следующей стадии. Чистый препарат, плавящийся при
298
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
]М-МЕТИЛ-3,4-ДИОКСИФЕНИЛАЛАНИН
299
273е, можно получить перекристаллизацией сырого вещества из
уксусной кислоты.
5-C-Метокси-4-оксибензил)-креатинин {II). К суспензии 24 г
@,1 моля) неочищенного продукта конденсации в 150 мл воды,
находящейся в стакане емкостью 500 мл, прибавляют при непре-
непрерывном перемешивании 180 г 3%-ной амальгамы натрия (приме-
(примечание 2). Амальгаму прибавляют через 5-мипутные промежутки
порциями по 30г. Твердое вещество растворяется, и первоначаль-
первоначальный оранжево-красный цвет раствора по мере восстановления
медленно исчезает. Если исходное вещество было чистым, то при
тщательном перемешивании полное обесцвечивание наступает
через 45—60 мин. При применении неочищенного продукта конден-
конденсации окраска раствора постепенно бледнеет, однако он сохра-
сохраняет слабый, но постоянный желтый оттенок, наличие которого
и служит признаком окончания процесса восстановления.
Раствор сливают с ртути и фильтруют, чтобы освободить от
взвешенных примесей. Фильтрат при перемешивании подкисляют
соляной кислотой до рН 6,6, применяя в качестве индикатора
феноловый красный (примечание 3). После стояния в течение
2 час. при 0° смесь фильтруют, осадок промывают небольшим
количеством холодной воды и сушат. Препарат (свободное осно-
основание) получается в микрокристаллическом виде. Выход состав-
составляет 17,5—18 г G2—74% теоретич.); обычно вещество плавится
при 167—169е (примечание 4). После затвердевания расплава
вещество вновь плавится при 226—228°. Если его перекристалли-
перекристаллизовать из воды, то температура плавления будет равна 231—233°.
Для последующего гидролиза может быть использован неочищен-
неочищенный препарат.
Ы-Метил-{3-метокси-4-оксифенил)-аланин (III). В 2-литровой
круглодонной колбе (примечание 5) кипятят с обратным холо-
холодильником в течение 12 час. 18 г @,07 моля) неочищенного про-
продукта восстановления с раствором 180 г кристаллического гид-
гидрата окиси бария в 270 мл воды. Горячий раствор разбавляют
1 200 мл воды и осаждают барий прибавлением 250—270 мл 6 н.
раствора серной кислоты (примечание 6). Выпавший в осадок
сернокислый барий отделяют с помощью центрифугирования
и промывают двумя порциями воды по 100 мл; промывные
воды выпаривают при 50е в вакууме до объема около 50 мл. Кислый
раствор подщелачивают на лакмус прибавлением 10 мл 12%-ного
водного аммиака. Смесь оставляют на сутки при 0°, после
чего ее фильтруют, осадок промывают холодной водой и су-
сушат. Выход составляет 12 г G4% теоретич.; примечание 7). При
быстром нагревании вещество плавится при 273—275°. После
перекристаллизации из воды температура плавления вещества
276—278°. В последующей стадии может быть использован неочи-
неочищенный препарат.
Ы-Метил-3,4-диоксифенилаланин (IV). В атмосфере углекис-
углекислого газа поддерживают при слабом кипении в продолжение 3 час.
12 г @,05 моля) метоксисоединсния и 24 г красного фосфора вместе
со смесью 60 мл уксусного ангидрида и 60 мл иодистоводородной
кислоты (уд. вес 1,70). Затем фосфор отфильтровывают и промы-
промывают 25 мл 50%-ной уксусной кислоты. Фильтраты соединяют
вместе и упаривают до образования сиропа в токе углекислого
газа при 50° под давлением 35 мм. Затем к сиропу прибавляют
60 мл теплой воды и раствор упаривают, как было указано выше.
Остаток растворяют в 100 мл воды и прибавляют к раствору раз-
разбавленный аммиак A0% по объему) до тех пор, пока раствор не
перестанет окрашивать красную бумажку конго в синий цвет
(примечание 8). Смесь оставляют стоять в течение 2 час. при 0°,
а затем белый кристаллический осадок отфильтровывают. Осадок
промывают на воронке небольшим количеством воды, содержащей
сернистый ангидрид, и сушат, промывая спиртом и эфиром. Выход
составляет 9,5 г (82% теоретич.). При медленном нагревании
вещество становится бурым при 230° и плавится при 282—283°;
при быстром нагревании оно становится слегка буроватым при
255—260° и плавится при 290—292°.
Очистка препарата может быть осуществлена следующим обра-
образом: вещество кипятят с водой E0 мл воды на 1 г вещества), содер-
содержащей сернистый ангидрид. Затем раствор фильтруют и филь-
фильтрат оставляют на сутки при 0°. Очищенный препарат @,74 г)
при медленном нагревании становится слегка буроватым при
245° и плавится при 287°; при быстром нагревании он принимает
указанную окраску при 260° и плавится при 298—300°.
Примечания
1. Иногда выделение воды происходит настолько быстро,
что масса сильно вспенивается. Интенсивность протекания ре-
реакции можно уменьшить, если пробирку вынуть из масляной
бани.
2. Для приготовления амальгамы поступают следующим
образом. В ступку или в коническую колбу помещают 175 г ртути;
последнюю нагревают до 30—40° и прибавляют к ней 5,4 г натрия
в виде кубиков с длиной ребра 5 мм. Ступку при этом покрывают
листом асбеста, в центре которого имеется небольшое отверстие.
Кусочки натрия насаживают на острый конец стеклянной палочки
и быстро вводят их через это отверстие под поверхность ртути.
Более удобный метод приготовления амальгамы описан в книге
Fieser, Experiments in Organic Chemistry, 2nd Ed., D. С Heath
and Co., N. Y., 1941, p. 419.
3. Если оставить раствор на ночь, то он приобретет темную
окраску.
300
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
4. В некоторых случаях температура плавления может быть
равна даже 98°; однако после того, как вещество расплавится
и затем снова затвердеет, оно плавится при 226—228°.
5. Следует применять большую колбу, так как во время гидро-
гидролиза смесь вспенивается.
6. Следует прибавить избыток серной кислоты, чтобы вся ами-
аминокислота безусловно перешла в раствор.
7. Выход можно несколько увеличить, если упарить маточ-
маточный раствор.
8. Если реакция раствора будет слишком щелочной, то в оса-
осадок выпадут окрашенные примеси. Нейтрализацию следует про-
проводить весьма осторожно, так как завершение реакции, опреде-
определяемое по красному конго, наступает как раз перед тем, как на-
начинают выпадать в осадок окрашенные примеси.
Другие методы получения
5-C-Метокси-4-оксибензаль)-креатинин впервые синтезировали
с помощью аналогичного метода Ричардсон, Уэлч и Кальверт 1..
Ы-Метил-3,4-диоксифенилаланин был получен метилирова-
метилированием ос-ацетамино-3,4-метилендиоксикоричной кислоты с после-
последующим восстановлением и гидролизом2, а также по методике,
сходной с изложенной выше3.
N-Метиламиноароматические кислоты были получены различ-
различными методами: взаимодействием метиламина и ос-бромкислоты4;
конденсацией метилгидантоина с ароматическими альдегидами5;
конденсацией креатинина6 или бензоилметилсаркозина с арома-
ароматическими альдегидами7; метилированием толуолсульфопроизвод-
ного аминокислоты8; при замене метиламина на аммиак в син-
синтезе Штрекера9.
1 Richardson, Welch, Calvert, J. Am. Chem. Soc,
51, 3075 A928).
2 Heard, Biochcm. J., 27, 54 A933).
'Guerrero, Deulofeu, Ber., 70, 947 A937).
4 Friedman n, Gutmann, Biochem. Z., 27 491 A910).
'Johnson, N i с о 1 e t, Am. Chem. J., 47, 459 A912).
«Nicole t, Campbell, J. Am. Chem. Soc, 50, 1155 A928);
Deulofeu, Mendivelzua, Ber., 68, 783 A935).
' Deulofeu, Ber., 67, 1542 A934).
«Fischer, L i p s с h i t z, Ber., 48, 360 A915).
"Каневская, J. prakt. Chem., B), 124, 48 A929).
МЕТИЛИ30ТИ0ЦИАНАТ
301
МЕТИЛИ30ТИ0ЦИАНАТ
(Метиловый эфир изотиоциановой кислоты)
CH3NH2-|-CS2 + NaOH -^ CH3NHCS2Na+H2O
CH3NHCS2Na + ClCO2C2H5 -> CH3NHCS2CO2C2H5 + NaCl
CH3NHCS2CO2C2H5 -^ CH3NCS + COS + C2H5OH
Предложили: М. Moop и Ф. Кроссли.
Проверили: Н. Дрзйк и Р. Мозинго.
Получение
В 1-литровую круглодонную трехгорлую колбу, погруженную
в баню со льдом и снабженную механической мешалкой, обрат-
обратным холодильником, термометром и капельной воронкой емко-
емкостью 250 мл, помещают 137 г (ПО мл, 1,8 моля) сероуглерода
и холодный раствор 72 г A,8 моля) едкого натра в 160 мл воды.
К этой смеси, охлажденной до 10—15°, прибавляют в течение
получаса при работающей мешалке 180 мл 35%-ного водного рас-
раствора метиламина E6 г, 1,8 моля метиламина) (примечания 1
и 2). Продолжая перемешивание, смесь осторожно нагревают
на паровой бане в течение 1—2 час, чтобы завершить реакцию
(примечание 3). Яркокрасный раствор охлаждают до 35—40°
и в течение 1 часа прибавляют к нему при перемешивании 196 г
A75 мл, 1,8 моля) этилового эфира хлоругольной кислоты (при-
(примечание 4). После того как все количество этого реагента будет
прибавлено, перемешивание продолжают в течение еще полу-
получаса, причем за это время температура смеси должна понизиться
до 30—40°. Метилизотиоцианат, который образует верхний слой,
отделяют от реакционной смеси. Количество его составляет
170—190 г.
Вещество сушат над 10 г сернокислого натрия, а затем пере-
перегоняют при атмосферном давлении с коротким елочным дефлег-
дефлегматором; собирают фракцию с т. кип. 115—121°. Выход состав-
составляет 85—100? F5—76% теоретич.; примечания 5 и 6). Препарат
можно подвергнуть дальнейшей очистке путем повторной пере-
перегонки, причем собирают фракцию с т. кип. 117—119°.
Примечания
1. Был применен продажный 35%-ный раствор метиламина.
2. Вместо продажного водного раствора метиламина можно
использовать его хлористоводородную соль, внося лишь неболь-
небольшие изменения в приведенную пропись. В колбе смешивают серо-
сероуглерод и раствор 122 г A, 8 моля) хлористоводородной соли метил-
метиламина в 200 мл воды; затем к содержимому колбы прибавляют
в течение получаса при перемешивании холодный раствор 144 г
C,6 моля) едкого натра в 320 мл воды. В этом случае приходится
302
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
брать 2 эквивалента едкого натра. В остальном пропись остается
такой же, как и при работе со свободным основанием.
3. К концу прибавления раствора метиламина температура
реакционной массы примерно равна 25°; постепенно она повы-
повышается до 75—85е.
4. Во время этого прибавления может произойти довольно
быстрое повышение температуры; рекомендуется вести прибавле-
прибавление с постоянной скоростью, так чтобы течение реакции не
было слишком бурным.
5. При работе с большими исходными количествами сероугле-
сероуглерода, вплоть до 5,4 моля, выход снижался лишь незначительно.
6. Эта реакция является общей для получения алкилизотио-
цианатов с хорошими выходами; так, авторы указывают, что,
исходя из хлористоводородной соли этиламина, можно получить
этилизотиоцианат с выходом 60—70%.
Другие методы получения
Метилизотиоцианат был получен в результате перегруппи-
перегруппировки, происходящей при нагревании метилтиоцианата1, и из
М,Ы'-диметилтиурамдисульфида при действии на него иода2
или при нагревании его с водой или спиртом3. Наиболее удобный
метод получения основан на реакции метиламина с сероуглеродом,
приводящей к образованию метилдитиокарбаминовой кислоты,
которую разлагают путем перегонки с водяным паром ее свинцо-
свинцовой соли4 или при помощи реакции с этиловым эфиром хлор-
угольной кислоты5.
1 Н о f m a n п, Вег., 13, 1349 A880).
2 В г а и п, Вег., 35, 817 A902).
3 Freund, Asbrand, Ann., 285, 166A895).
"Delepine, Bull. soc. chim., D), 3, 641 AS08); D e 1 e p i n e,
Compt. rend., 144, 1125 A907); Worrall, J. Am. Chem. Soc, 50, 1456
A928).
5 S 1 о t t a, Dressier Bcr., 63, 888 A930).
2-МЕТИЛИНДОЛ
.(а-Метилиндол)
nhcoch,
H2O +
¦CCR,
Предложили: Ч. Аллен и Дж. ВанАллан.
Проверили: Н. Дрзйк и Р. Толлефсон.
2-МЕТИЛИНДОЛ
303
Получение
В 1-литровую колбу Клайзена помещают смесь 64 г тщательно
измельченного амида натрия (стр. 31) (примечание 1) и 100 г
о-ацеттолуида (примечание 2). К смеси прибавляют около 50 мл
абсолютного эфира (примечание 3) и прибор продувают сухим
азотом. Затем, пропуская через смесь слабый ток азота, нагревают
реакционную колбу (примечание 4) на металлической бане (при-
(примечание 5). В течение получаса температуру повышают до
240—260° и поддерживают ее на этом уровне в течение 10 мин.
Происходит обильное выделение газа; когда оно прекратится,
реакцию можно считать законченной (примечание 6). Метал-
Металлическую баню отставляют, колбе дают охладиться и к реак-
реакционной смеси последовательно прибавляют 50 мл 95%-ного
этилового спирта и 250 мл теплой (около 50°) воды. Чтобы за-
завершить разложение натриевого производного 2-метилиндола
и избытка амида натрия, если он имеется, смесь осторожно подо-
подогревают на горелке Бунзена. Охлажденную реакционную смесь
экстрагируют двумя порциями эфира по 200 мл (примечание 7).
Соединенные вместе эфирные вытяжки фильтруют и фильтрат упа-
упаривают до объема примерно 125 мл. Раствор переносят в специ-
специальную колбу Клайзена емкостью 250 мл (стр. 68; «Синт. орг.
преп.», сб. 1, стр. 142, рис. 8) и подвергают перегонке. 2-Метил-
индол перегоняется при 119—126° C—4 мм) в виде бесцветной
жидкости, которая в приемнике быстро затвердевает в белую
кристаллическую массу. Препарат плавится при 56—57°. Выход
составляет 70—72 г (80—83% теорстич.; примечание 8).
Вещество можно подвергнуть дальнейшей очистке; с этой
целью препарат растворяют в 100 мл метилового спирта, при-
прибавляют к раствору 30 мл воды и оставляют его на 5 час. в холо-
холодильном шкафу. Кристаллы, имеющие вид совершенно бесцвет-
бесцветных пластинок E2 г), плавятся при 59°. Можно выделить до-
дополнительно 10 г вещества, если фильтрат охладить, предвари-
предварительно разбавив его 20 мл воды.
Примечания
1. Амид натрия был измельчен в открытой ступке, причем
никаких затруднений при этом не встретилось. Из предосторож-
предосторожности вещество можно измельчать под слоем эфира.
2. Применялся продажный о-ацеттолуид с т. пл. ПО—111°.
После того как реагенты будут введены в колбу, их следует тща-
тщательно перемешать длинным шпателем.
3. Эфир прибавляют, чтобы облегчить образование натриевой
соли амида.
4. Рекомендуется закоптить дно реакционной колбы, чтобы
предотвратить приставание металла к стеклу.
304
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
5. Песчаные и соляные бани в данном случае непригодны.
6. Реакция начинается, когда температура бани достигает
примерно 200°. Происходит вспенивание, и пена затвердевает.
Проверявшие синтез нашли необходимым вмешивать затвердев-
затвердевшую пену в реакционную массу, чтобы вся она прогревалась рав-
равномерно. Перемешивание необходимо производить от начала про-
процесса до его конца, т. е. от начала обильного выделения газа
до завершения периода нагревания.
7. Можно выделить индол перегонкой с водяным паром, хотя
это и менее удобно. Кристаллическое вещество (т. пл. около
56—57Э) можно отфильтровать от холодного дестиллата.
8. Описанная здесь методика является общей для получения
замещенных о-ацет- и о-бензтолуидов.
Другие методы получения
2-Метилиндол был получен с очень незначительным выходом
перегонкой о-ацеттолуида с цинковой пылью 1 и с лучшим выхо-
выходом—нагреванием толуидида с этилатом натрия или с окисью ба-
бария в токе водорода при 360—380°2. Описанный здесь метод был
применен для синтеза веществ, родственных физостигмину3;
он является видоизменением процесса Верлея4.
1 М a u t h n с г, Suida, Monatsh., 7, 230, 237 A886).
2 М a d e 1 u n g, герм. пат. 26232/ [Frdl., 11, 278 A912—1914)]; Вег.,
45, 1128 A912).
3 S а 1 w а у, J. Chem. Soc, 103, 351 A913).
4 V е г 1 е у, Bull. soc. chim., D), 35, 1039 A924).
4-МЕТИЛКАРБОСТИРИЛ
сн3
CH.,COCH2CONHCeH6
H2SO4
\/
он
+ Н2О
Предложили: В. Лауер и К- Кэзлоу.
Проверили: Ч. Аллгн и Г. Крессман.
Получение
В I-литровую трехгорлую колбу, снабженную механической
мешалкой и термометром, погруженным в реакционную жид-
жидкость, помещают 185 мл концентрированной серной кислоты.
Последнюю преварительно нагревают до. 75° (см. примечание),
а затем прибавляют к ней небольшими порциями при помощи
шпателя 177 г A моль) ацетоацетанилида (стр. 96). Смесь под-
поддерживают при температуре 70—75°, время от времени охлаждая
ее, пока не будет прибавлен почти весь ацетоацетанилид. Послед-
4-МЕТЛЛ КУМАРИН
305
ние 10—15 г прибавляют без охлаждения, и температура при
этом повышается до 95°; весь процесс прибавления продолжается
в течение 20—30 мин. За счет теплоты реакции температура со-
сохраняется на достигнутом уровне (около 95°) в течение еще 15 мин.;
после этого реакционную смесь поддерживают при указанной
температуре в течение еще 15 мин. с помощью внешнего нагрева-
нагревания. Затем раствор охлаждают до 65° и при сильном перемеши-
перемешивании выливают в 5 л воды.
По охлаждении раствор фильтруют с отсасыванием, осадок
промывают водой порциями по 500 мл и двумя порциями мети-
метилового спирта по 250 мл, после чего сушат на воздухе. Выход
4-метилкарбостирила составляет 138—144 г (86—91% теоретич.).
Препарат, температура плавления которого 219—22Г, вполне
пригоден для получения 2-хлорлепидина (стр. 480). С целью очист-
очистки его можно перекристаллизовать из 95%-ного этилового спирта.
Для перекристаллизации 39 г вещества растворяют в 650 ил рас-
растворителя; выход составляет 33—33,5 г; температура плавления
перекристаллизованного препарата 222—224°.
Примечание
Реакционную колбу следует установить так, чтобы ее можно
было быстро охладить. Авторы синтеза сообщают, что в одном из
опытов, в котором температура поднялась до 120°, выход пони-
понизился до 72%.
Другие методы получения
Единственным способом получения 4-метилкарбостирила яв-
является метод Кнорра1, примененный к данному случаю Г. Ми-
Михайловым2.
1 К п о г г, Ann., 236, 83 A88G).
2 М и х а й л о в, ЖОХ, 6, 511 A936).
4-МЕТИЛКУМАРИН
А1СН
л/
'он
_ + сн3ссн,соос2н5 —-—
о
СНз
со
- С2НдОН + Н2О
Предложил: Э. Вудрафф.
Проверили: Н. Дрэпк и К. Блюменштепн.
Получение
В 5-литровую трехгорлую круглодонную колбу, снабженную
мешалкой с жидкостным затвором, капельной воронкой и воздуш-
20 Сборник 3
306
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ным холодильником, открытый конец которого присоединен к ло-
ловушке для поглощения газов, помещают 188 г B моля) фенола
и раствор 268 г B моля) ацетоуксусного эфира в 300 мл сухого
нитробензола (примечания 1 и 2). Смесь нагревают до 100° на
масляной бане, пускают в ход мешалку и в течение 30—45 мин.
прибавляют к смеси 532 г D моля) безводного хлористого алю-
алюминия, растворенного в 2 100 мл сухого нитробензола (приме-
(примечание 3). Затем капельную воронку заменяют термометром;
температуру раствора повышают до 130° и поддерживают ее на
указанном уровне в течение 3 час. (примечание 4). К этому
времени выделение хлористого водорода практически прекра-
прекращается.
Раствор охлаждают примерно до комнатной температуры и при
перемешивании прибавляют к нему 500 мл смеси равных частей
конценчрированной соляной кислоты и воды. Колбу приспособ-
приспособляют для перегонки с водяным паром и, нагревая реакционную
смесь на голом пламени горелки, пропускают через нее водяной
пар до тех пор, пока не будет собрано около 200 мл дестиллата
(примечание 5). Находящуюся в еще горячем состоянии смесь
выливают в большую делительную воронку и нижний водный
слой отделяют; нитробензольный слой фильтруют через воронку
Бюхнсра (примечания.6 и 7).
Сперва в вакууме отгоняют из 2-литровой колбы Клайзена
нитробензол, затем перегоняют остаток; собирают фракцию,
кипящую при 180—195° A5 мм) (примечания 8 и 9). Выход красно-
желтого масла, затвердевающего при охлаждении, составляет
128—176 г D0—55% теоретич.); для ряда целей получаемое веще-
вещество является достаточно чистым (примечание 10). Почти белый
препарат может быть получен, если неочищенное вещество раство-
растворить в эфире, взболтать эфирный раствор с несколькими порциями
5%-ного раствора едкого натра, производя эту операцию до тех
пор, пока водные слои не станут получаться бесцветными, выпа-
выпарить эфир, а остаток перекристаллизовать из смеси петролейпого
эфира (т. кип. 60—90°) и бензола (примечание 11). Перекристалли-
Перекристаллизованный препарат плавится при 83—84°; выход после перекри-
перекристаллизации составляет 80—85%.
Примечания
1. Был применен также метиловый эфир ацетоуксусной кислоты,
однако для того, чтобы судить о выходе, имеющиеся пока данные
недостаточны.
2. Продажный нитробензол сушат, перегоняя в вакууме до тех
пор, пока дестиллат не станет прозрачным; остаток может быть
использован без дополнительной обработки.
4-МЕТИЛКУМАРИН
307
3. Сухой нитробензол в количестве 2 100 мл помещают в 5-лит-
5-литровую круглодонную колбу и прибавляют к нему хлористый алю-
алюминий порциями по 25—50 г, причем после каждого прибавления
раствор перемешивают. Температура во время прибавления может
подняться до 80 — 90°; время от времени колбу приходится
охлаждать проточной водой. Когда весь хлористый алюминий
будет прибавлен, раствор охлаждают до комнатной температуры.
Небольшое количество хлористого алюминия может осесть
на дно.
В одном из опытов, в котором заключительное охлаждение про-
произведено не было, температура продолжала подниматься, причем
выделилось большое количество хлористого водорода. Остаток
в колбе представлял собой густую пасту. При прибавлении неко-
некоторой части пасты к воде происходило отделение нитробензола,
однако препарат, полученный в этом опыте, оказался непригод-
непригодным для конденсации.
4. При температуре ниже 100° конденсация не происходит;
при температуре 150° образуется смола и кумарин выделить не
удается.
5. До нитробензола отгоняется небольшое количество не вошед-
вошедшего в реакцию ацетоуксусного эфира; удаление его способствует
последующему расслаиванию.
6. Если достаточно большая делительная воронка отсутствует,
то разделение можно осуществить, производя фильтрование ча-
частями и используя имеющиеся в распоряжении воронки. Если
во время перегонки сконденсировалось слишком много пара„
то водный слой может оказаться сверху.
7. Смолистые побочные продукты немедленно забивают филь-
фильтровальную бумагу. Добавление пористых порошков иногда
облегчает фильтрование. Если конденсация была проведена удо-
удовлетворительно, то отфильтровывается лишь небольшое количе-
количество примесей, и эту операцию можно тогда опустить. Иногда при-
приходится удалять значительное количество смолистых примесей,
образующих комки. В этих случаях производить фильтрование
гораздо труднее и выход оказывается ниже. При перегонке смолы
кумарин не получается.
8. Регенерированный нитробензол после его промывания водой
и высушивания, как это указано в примечании 2, можно приме-
применять снова. Потери составляют 400—700 мл.
9. Значительное количество смолы остается в перегонной колбе.
Смолу лучше всего немедленно перелить в плоскую чашку с водой
(или вылить в раковину); она затвердевает при этом в твердую,
хрупкую массу. -Смолу, приставшую к стенкам колбы, легко уда-
удалить, если внести в колбу 100—200 мл нитробензола и затем на-
нагреть растворитель до температуры кипения при атмосферном
давлении.
20*
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
10. Согласно указаниям автора синтеза, при работе с утроен-
утроенными количествами исходных веществ выход перегнанного пре-
препарата составляет 38—50% теоретического количества.
11. Отношение количества петролейного эфира к количеству
бензола должно равняться 8 : 2.
Другие методы получения
4-Метилкумарни получают конденсацией фенола и ацетоуксус-
ного эфира. В качестве конденсирующего средства применялась
концентрированная''2 и 73%-ная3-4 серная кислота. Приведенный
выше метод кратко описали Сетна, Шах и Шах5; те*же авторы
применили его для получения другого производного кумарина6.
Последняя работа была положена в основу данной методики.
1 Р е с h m a n n, D u i s b e r g, Her., 16, 2127 A883).
- Р е с h m a n и, Kraft, Ber., 34, 421 A901).
'Peters, S i га о n i s, Ber., 41, 831 A908).
4 Fries, V о 1 k, Ann., 379, 94 A911), подстрочное примечание 1.
5 S e t h n a, Shah, Shah, Current Sci., 6, 93 A937) [С. Л., 32,
549 A938)].
6 S e t h n a, Shah, S h a h, J. Chem. Soc, 1938, 228.
МЕТИЛОВЫЙ ЭФИР Р-5Р0МПР0ПИ0Н0В0Й КИСЛОТЫ
CH, = CHCOOCII3 + HBr -* BrCH.2CH2CO0CH3
Предложили: Р. Мозинео и Л. Паттерсон.
Проверили: Н. Дрэйк и Г. Кархарт.
Получение
К 650 г 60%-ного раствора метилакрилата в метиловом спирте
прибавляют 4 г гидрохинона (примечание 1) и последовательно
промывают все вместе 7%-ным раствором сернокислого натрия
порциями в 800, 400 и 200 мл. Затем слой метилакрилата сушат,
взбалтывая в течение 20—30 мин. с 45 г безводного сернокислого
натрия, после чего отфильтровывают от осушителя и применяют
далее без перегонки. Выход составляет 280—325 г.
Раствор 258 г C моля) промытого и высушенного метилакри-
метилакрилата в 500 мл абсолютного эфира помещают в 1-литровую кругло-
дойную колбу. Последнюю закрывают резиновой пробкой, в кото-
которую вставлены хлоркальциевая трубка и стеклянная трубка диа-
диаметром 8 мм для ввода бромистого водорода. Трубку для ввода
газа, доходящую почти до дна колбы, присоединяют через 1-лит-
1-литровую предохранительную ловушку к генератору бромистого
водорода (примечание 2). Колбу помещают в баню со льдом и в
раствор пропускают 245 г C,03 моля) безводного бромистого водо-
МЕТИЛОВЫИ ЭФИР В-БРОМПРОПИОНОГГ КИСЛОТЫ
309
рода (примечание 3). После того как необходимое количество по-
последнего вступит в реакцию, колбу закрывают пробкой и оставляют
стоять в течение примерно 20 час. при комнатной температуре.
Затем эфир отгоняют (примечание 4) на горячей водяной бане.
К концу перегонки водяную баню нагревают до 80—85° и, когда
жидкость перестанет перегоняться при этой температуре, остаток
переливают в специальную перегонную колбу Клайзена емкостью
500 мл и перегоняют в вакууме. Метиловый эфир р-бромпропионо-
вой кислоты перегоняется при 64—66°A8лш); выход составляет
410—428 г (80—84°о теоретич.; примечания 5 и 6).
Примечания
1. Был применен готовый раствор метилакрилата в метиловом
спирте. Так как метилакрнлат в присутствии перекисей полимери-
зуется, то необходимо прибавить к нему в качестве ингибитора
небольшое количество гидрохинона. Мстилакрилат не следует
оставлять стоять в течение долгого времени даже в присутствии
гидрохинона. Хранить его необходимо в холодильном шкафу.
2. Бромистый водород («Синт. орг. преп.», сб. 2, стр. 109) можно
полностью освободить от примеси брома, если пропустить его че-
через промывалку с раствором фенола в четыреххлористом углероде.
3. Присоединение бромистого водорода можно вести с желаемой
быстротой, но без потери эфира в результате экзотермической
реакции.
4. Эфир можно отогнать в таких условиях, в которых он не
становится влажным и остается абсолютным; такой эфир может
быть использован в последующих синтезах метилового эфира
•^-бромпропионовой кислоты без дальнейшей обработки.
5. Этиловый эфир ^-бромпропионовой кислоты можно получить
по описанному выше способу с выходом около 9096. Температура
кипения этилового эфира 77—79° A9 мм).
6. Остаток состоит в основном из C-бромпропионовой кис-
кислоты, которая может быть выделена, если остаток перегнать
[т. кип. 115—120° A8 мм)] и полученный препарат перекристал-
перекристаллизовать из четыреххлористого углерода. Выход этой кислоты
обычно не превышает 5% теоретического количества.
Другие методы получения
Метиловый эфир Js-бромпропионовой кислоты был получен
этерификацией C-бромпропионовой кислоты метиловым спиртом
без катализатора1 и с применением в качестве катализатора бро-
бромистого водорода2, а также непосредственным присоединением
бромистого водорода и к метилакрилату2.
Че Мег, К a m n e r, J. Am. Chem., Soc, 53, 2833 A931).
2 М о и г е и, М и г a t, J. T a mp i e r, Ann. chim., 15,221A921).
310
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
МЕТИЛОВЫЙ ЭФИР МИРИСТИНОВОИ КИСЛОТЫ, МЕТИЛОВЫЙ ЭФИР
ПАЛЬМИТИНОВОЙ КИСЛОТЫ И СООТВЕТСТВУЮЩИЕ КИСЛОТЫ
II2SO4
Воск из плодов Myrica cerifera +CH3OH >•
— > С13Н27СО2СН3 + С15НпСО2СН3
Предложили: Дж. Зауер, Б. Хейн и П. Бутвелл.
Проверили: Г. Адкинс и Р. Бэркс мл.
Получение *
В 3-литровую круглодонную колбу помещают 500 г лаврового
воска (примечание 1), 600 е метилового спирта и 31 е серной кис-
кислоты. К содержимому колбы прибавляют кусочки битой глиняной
тарелки и кипятят смесь с обратным холодильником в течение
2 суток на паровой бане. Затем около половины метилового спирта
отгоняют, а к оставшейся смеси прибавляют 500 им воды. Верхний
слой, содержащий смесь сложных эфиров, отделяют и промывают
несколько раз водой. Получают около 500 г смеси неочищенных
метиловых эфиров.
Эфиры подвергают дробной перегонке, пользуясь соответст-
соответствующей ректификационной колонкой (примечание 2). Затем полу-
полученные фракции подвергают повторной дробной перегонке, причем
каждую последующую фракцию прибавляют в перегонную колбу
лишь после того, как температура собираемой фракции достигнет
верхнего предела. В результате получают 170—190 е метилового
эфира миристиновои кислоты с т. кип. 91—94° @,5 мм) [112—116°
A мм); 157—162° A0 мм)] и 170—190 г метилового эфира паль-
пальмитиновой кислоты с т. кип. 115—118° @,5 мм) [129—133° A0 мм)]
(примечания 3—6).
Примечания
1. Воск, известный в США под названием «миртового» или «лав-
«лаврового», а главным образом под названием «bayberry wax», полу-
получают из плодов различных видов Myrica. Чаще всего в продажу
поступает воск из плодов Myrica cerifera. Относительное содержа-
содержание миристина и пальмитина в этом воске несколько колеблется,
однако оба компонента составляют около 95% воска.
2. Для этой цели пригодно несколько типов колонок. Авторы
синтеза применяли трехшариковую колонку Снайдера высотой
26 см, припаянную к специальной колбе Клайзена емкостью 500
или 200 мл. Способ обращения с ней был таким, как это рекомен-
* Хотя воск из плодов Myrica cerifera не представляет интереса для со-
советских химиков, данная пропись все же включена в сборник ввиду того, что
приведенные подробности разделения миристиновои и пальмитиновой кислот
могут быть полезными при выделении этих кислот из других, более доступ-
доступных исходных материалов. (Прим. ред.)
метиловый эфир миристиновои кислоты
311
дуют Симоне и Вагнер1. Колонка не имела элсктрообогрева, но
была тщательно обернута асбестовой бумагой. Скорость пере-
перегонки составляла около 20 капель в минуту, а флегмовое число
было 2 : 1 или 3:1. Следует тщательно избегать «захлебывания»
колонки. При проверке синтеза была применена видоизмененная
колонка Видмера с 11-витковой спиралью длиной 14 см, помещен-
помещенной внутри стеклянной трубки с внутренним диаметром 12 мм.
Для первой перегонки была использована колба емкостью 500 мл,
а для повторной — емкостью 250 мл. Колонка была снабжена
электрообогревом; масляная баня также нагревалась электриче-
электричеством. Колонка была присоединена к колбе с помощью шлифа.
Описание колонки и методика использования ее приведены в ра-
работе Смита и Адкинса2. Температура обогрева колонки и темпе-
температура бани были подобраны таким образом, чтобы скорость
перегонки составляла 3—4 капли в минуту и чтобы спираль
была покрыта обильной флегмой.
3. Подходящими пределами температуры кипения для отбора
фракций при различных давлениях при первом фракционировании
являются следующие: 6 г, 152—157° A0 мм); 176 г, 157—160°
A0 мм); 119 г, 160—180° A0 мм); 126 г, 180—183° A0 мм); 163 г,
115—123° A мм); 115 г, 123—130° A мм); 141 г, 130—133° A мм);
29 г, ниже 91,5° @,5 мм); 116 е, 91,5—94,5° @,5 мм); 71 г, 94—115°
@,5 мм); 170 г, 115—118° @,5 мм); 28 г, 118—125° @,5 мм). При
повторном фракционировании фракции отбирались в следующих
пределах: 6 г, 152—157° A0 мм); 161 г, 157—162° A0 мм); 81 г,
162—171° A0 мм); 64 г, 171—180° A0 мм); 120 г, 180—183° (\0 мм);
198 г, 112—116° A мм); 72 г, 116—129° A мм); 147 г, 129—133°
A мм); 8 г, ниже 91,5° @,5 мм); 172 г, 91,5—94,5° @,5 мм); 10 г,
94,5—115,2° @,5мм); 200г, 115,2—118,2° @,5жл);25г, 118,2—125°
@,5 мм). Температура, при которой отгоняются эфиры, меняется
в зависимости от скорости перегонки, а также от деталей конструк-
конструкции колонки и условий работы на ней. Приведенные выше данные
служат лишь для того, чтобы примерно наметить пределы отбора
фракций.
4. Подобный способ с успехом применялся в течение ряда лет
для получения этиловых эфиров лауриновой, каприловой и мири-
миристиновои кислот алкоголизом кокосового масла A кг) в растворе
этилового спирта A 900 е) с применением хлористого водорода
E0 г) в качестве катализатора3. Метод синтеза в данном случае
несколько отличается от описанного выше. Алкоголиз заканчи-
заканчивается через 15—20 час, после чего раствор нейтрализуют по
метилоранжу углекислым барием. Смесь приливают к равному
объему насыщенного раствора хлористого натрия, в результате
чего выделяется 1 100—1 300 г смеси неочищенных этиловых эфи-
эфиров. Эту смесь промывают водой и подвергают дробной перегонке,
как было указано выше. Из 1 000 г кокосового масла было полу-
312
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
чено около 50 г этилового эфира каприловой кислоты, 350 г эти-
этилового эфира лауриновой кислоты и 60 г этилового эфира мири-
стиновой кислоты.
5. Полученный метиловый эфир миристиновой кислоты
(«d 1,4353) плавился в равновесии с жидкой фазой при температуре
19°. Метиловый эфир пальмитиновой кислоты (лЬ5 1,4391 при пере-
переохлаждении) имел температуру плавления 29,5°.
6. Миристиновую и пальмитиновую кислоты можно получить,
исходя из их эфиров, по методике, описанной в «Синт. орг. преп.»,
сб. 1, стр. 274. Из 100 г метилового эфира миристиновой кислоты
было получено 85—89 г (90—95% теоретич.) бесцветной миристи-
миристиновой кислоты с т. пл. 52—53°. Из 100 е метилового эфира пальми-
пальмитиновой кислоты было получено 84—88 г (90—95% теоретич.)
бесцветной пальмитиновой кислоты с т. пл. 62—63°.
Другие методы получения
Из ранее сообщенных способов получения метиловых эфиров
миристиновой и пальмитиновой кислот лишь немногие имеют
препаративное значение. Метиловый эфир миристиновой кислоты
можно получить дробной перегонкой метиловых эфиров, содер-
содержащихся в жире ucuhubai и в кокосовом масле5'6. Метиловый эфир
пальмитиновой кислоты можно получить аналогичным образом из
кокосового масла8 и из воска Myrica cerifera1.
1 S i m о n s. Wagner, J. Chem. Education, 9, 122 A932).
'-Smith, Ad k ins, J. Am. Chem. Soc, 60, 662 A938).
3 Organic Chemical Reagentb, Vol. 3, University of Illinois, Urbana,
Illinois, 1921, p. 62.
4 Verkade, Coops, Rec. trav. chim., 46, 528 A927).
5 T а у 1 о r, Clarke, J. Am. Chem. Soc, 49, 2829 A927).
6 L e p k о v s k y, Feskov, Evans, J. Am. Chem. Soc, 58,
978 A936).
7 W e n z e 1, Ind. Eng. Chem., Anal. Ed., 6, I A934).
МЕТИЛОВЫЙ ЭФИР МОНОАМИДА СЕБАЦИНОВОЙ КИСЛОТЫ
соон
(СН2)8
соосн,
SOCI2
СОС1
I
(СН2K
соосн,
CONHj
(СН2)8
I
соосн,
Предложил: В. Бишоп.
Проверили: Ч. Аллен и Дж. ВанАллан.
Получение
Хлорангидрид ^-карбометоксипеларгоновой кислоты. В 2-лит-
2-литровой круглодонной колбе, соединенной с помощью стандартного
МЕТИЛОВЫП ЭФИР МОНОАМИДА СЕБАЦИНОВОЙ КИСЛОТЫ
313
шлифа с вертикальным холодильником, кипятят на паровой бане
в течение 5 час. смесь 216 г A моль) кислого метилового эфира
себациновой кислоты (примечание 1) и 147 г A,24 моля) хлори-
хлористого тионила. Обратный холодильник заменяют на насадку со
специальным боковым отводом и отгоняют не вошедший в реак-
реакцию хлористый тионил. Оставшийся хлорангидрид ш-карбо-
метоксипелартоновой кислоты вполне пригоден для применения
в следующей стадии. Если требуется более чистый препарат,
то его перегоняют в вакууме. Выход хлорангидрида карбомет-
оксипеларгоновой кислоты с т. кип. 158—160° A0 мм) составляет
194—201 г (83—86% теоретич.).
Метиловый эфир моноамида себациновой кислоты. В 4-лит-
4-литровом стакане или в эмалированном сосуде энергично перемеши-
перемешивают с помощью эксцентрично установленной мешалки 2 500 мл
концентрированного водного аммиака (примерно 28%-ного), а
затем охлаждают его в бане со льдом до 8°. Через капельную
воронку к этому раствору медленно прибавляют неочищенный
хлорангидрид, полученный как было указано выше, причем в
течение всего времени прибавления температуру поддерживают
ниже 8°.
Происходит бурная реакция, и в осадок немедленно выпадает
метиловый эфир моноамида себациновой кислоты. Когда при-
прибавление будет закончено, осадок отфильтровывают с отсасыва-
отсасыванием и промывают 200 мл холодной воды. Препарат сушат в тече-
течение 3 дней в вакуум-эксикаторе. Выход составляет 200—204 г
(93—95% теоретич.); т. пл. 72—74° (примечание 2).
Примечания
1. Кислый метиловый эфир себациновой кислоты [т. кип.
168—170° C мм)} был получен при проверке синтеза с выходом
52—61% из себациновой кислоты и метилового спирта по методу,
описанному для получения соответствующего этилового эфира1.
Этот этиловый эфир может быть использован для синтеза этило-
этилового эфира моноамида себациновой кислоты. Получение хлор-
ангидрида из кислого этилового эфира себациновой кислоты
упомянуто в примечании 12 на стр. 461.
2. При применении перегнанного хлорангидрида выход не
увеличивается.
Другие методы получения
Синтез этих соединений описан в литературе2'3.
1 Ш. С в а н н, мл., Э л е р, Б у с в е л л, Синт. орг. преп., сб. 2, стр. 345_
2Biggs, Bishop, J. Am. Chem. Soc, 63, 944 A941).
3 В i s h о p, ам. пат. 2277033 [С. А., 36, 4636 A942)].
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
МЕТИЛОВЫЙ ЭФИР ПИРОВИНОГРАДНОЙ КИСЛОТЫ
CHsCeH4S03n
СН3СОСО2Н+СН3ОН > СН3СОСО2СН3 + Н2О
Предложили: А. Вейсбергер и Ч. Циблер.
Проверили: К. Гамильтон и Р. Колес.
Получение
В 1-литровую круглодонную колбу, к которой на шлифу
(примечание 1) присоединена специальная колонка (рис. 15I
(примечание 2), помещают раствор 88 г A моль) свежеперегнаннои
пировиноградной кислоты2, 128 г D моля) абсолютного метило-
метилового спирта, 350 мл бензола и 0,2 г л-толуолсульфокислоты.
Верхняя часть колонки снабжена холодильником, сделанным
из пробирки, до дна которой доходит трубка, подающая воду,
термометром и эффективным обратным холодильником. Раствор
энергично кипятят на масляной бане, температуру которой под-
поддерживают при 150—155°. Температура в верхней части колонки
59—60°. После кипячения раствора в течение ночи жидкость
в нижнем барботере становится мутной и расслаивается. Нижний
слой удаляют по мере его образования (т. е. каждые 20—30 мин.)
в течение целого дня. Кипячения не прерывают в течение ночи,
после чего нижний слой снова продолжают отделять до тех пор,
пока жидкость не станет мутной также и в верхних барботерах
(примечание 3). После этого из оставшейся жидкости дробной
перегонкой выделяют эфир пировиноградной кислоты. Собирают
фракцию, кипящую при нормальном давлении при 136—140°
(примечание 4). Выход составляет 66—73 г F5—71% теоретич.;
примечания 5 и 6).
Примечания
1. Целесообразнее, чтобы колонка была на шлифе, ввиду про-
продолжительности кипячения. Резиновые пробки набухают от дей-
действия бензола, а корковые—разъедаются пировиноградной
кислотой.
2. На рис. 15 показана колонка Кларка—Рарса для полу-
получения метиловых эфиров1. А—кран, над которым собирается
водная фаза и через который по мере необходимости она спу-
спускается; Б—стандартный шлиф; В—ловушка, наружный диаметр
которой равен 12 jam; в точке Г показано расстояние между после-
последовательными барботерами; Д—гильза для термометра, устано-
установленная под углом 45°; на гильзу надет кусок резиновой трубки 3,
в которую вставлен термометр; Е—запаянный конец верхней
сливной трубки (запаивается только верхняя сливная трубка);
если последняя не будет запаяна, то аппарат не будет действо-
действовать. Следует обратить внимание на то, чтобы верхние концы
Ри с. 15. Все размеры даны в миллиметрах.
316
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
всех сливных трубок были расположены как раз над сгибом, как
это показано в точке Ж; в противном случае в приборе создается
слишком большое давление за счет высокого столба жидкости.
Приведенная на рисунке общая высота не является строго обяза-
обязательной.
3. К тому времени, когда помутнение появится в четвертом
и пятом барботерах, отделится уже 300 мл жидкости. При охла-
охлаждении собранная жидкость разделяется на два слоя. Она содер-
содержит лишь следы пировиноградной кислоты.
4. Вес смолистого остатка составляет 10—17 г. Если при пере-
перегонке не применять эффективной колонки, то головной погон
будет содержать 5—10 г эфира пировиноградной кислоты, кото-
который может быть выделен. Указанный выход является суммарным.
5. Трудность получения метилового эфира пировиноградной
кислоты обусловливается тем, что это соединение очень легко
гидролизуется и что равновесие эфир—продукты его омыления
сильно сдвинуто вправо.
6. По приведенному методу могут быть получены и другие
метиловые эфиры кислот.
Другие методы получения
Метиловый эфир пировиноградной кислоты был получен из
серебряной соли пировиноградной кислоты и йодистого метила3
и из свободной кислоты и спирта в паровой фазе без применения
катализатора1. Эфиры пировиноградной кислоты были полу-
получены также дегидрогенизацией эфиров молочной кислоты5.
1 R a h r s, Synthetic Org. Chemicals, Vol. XI, No. 1, The Eastman
Kodak Co., февраль, 1938.
2 X о у а р д, Фрезер, Синт. орг. прей., сб. 1, стр. 345.
3Oppenheim, Ber., 5, 1051 A872).
< Baker Laufer, J. Chem. Soc, 1937, 1345.
s Hanssler, ям. пат. 1614195 [С. А., 21, 746 A927)].
МЕТИЛОВЫЙ ЭФИР w-ЦИАНПЕЛАРГОНОВОИ КИСЛОТЫ
CONH2 CN
(СН2)8 ^U (СН,)8 -{-Н.0
СООСН3 СООСНз
Предложил: В. Бишоп.
Проверили: Ч. Аллен и Дж. ВанАллан.
Внимание! Тетрахлорэтан ядовит; синтез необходимо
проводить в вытяжном шкафу.
МЕТИЛОВЫЙ ЭФИр ш-ИИАНПКЛАРГОНОВОИ КИСЛОТЫ
317
Получение
В конической колбе емкостью 1 500 мл, снабженной обратным
холодильником, растворяют 190 г @,88 моля) метилового эфира
моноамида себациновой кислоты в 200 мл кипящего тетрахлор-
тетрахлорэтана. Раствору дают охладиться до 40—50° (примечание 1) и при-
прибавляют к нему 95 г @,67 моля) фосфорного ангидрида (приме-
(примечание 2); затем содержимое колбы тщательно перемешивают стек-
стеклянной палочкой и нагревают на масляной бане до 120° (термо-
(термометр в масле), после чего прибавляют вторую порцию фосфорного
ангидрида в 95 г. Смесь нагревают в течение еще получаса при 145°
я жидкость декантируют, время от времени перемешивая ее от
руки. Остаток нагревают с 200 мл тетрахлорэтана до 145° в тече-
течение получаса, периодически перемешивая смесь, и жидкость вновь
декантируют. Этот процесс повторяют еще один раз. Соединенные
вместе вытяжки помещают в 1-литровую колбу и большую часть
растворителя отгоняют в вакууме водоструйного насоса. Остаток
переносят в колбу емкостью 300 мл и отгоняют оставшийся рас-
растворитель (примечание 3). Когда перестанет поступать дестиллат,
приемник меняют, прибор отъединяют от водоструйного насоса и
присоединяют к масляному и остаток фракционируют (примеча-
(примечание 4). Выход метилового эфира м-цианпеларгоновой кислоты
с т. кип. 121—124° A мм) (примечание 5) составляет 119—124 г
F9—71 °о теоретич.).
Примечания
1. Получаемая при охлаждении масса легко смешивается
с фосфорным ангидридом.
2. Фосфорный ангидрид быстро взвешивают на листе бумаги,
откуда его сейчас же ссыпают в колбу.
3. Обратно получают около 550—560 мл тетрахлорэтана. При
перегонке лучше пользоваться прибором, собранным на шлифах.
4. Головной погон отсутствует. При давлении 1 мм первая
капля дестиллата появляется в конце бокового отвода перегонной
колбы, когда термометр показывает 118°. Отгоняется фракция с
т. кип. 124—135° A мм) E—6 г), и в колбе остается небольшое
количество жидкости.
5. Температура кипения при других давлениях: 154° E мм)
и 170° A4 мм).
Другие методы получения
Метиловый эфир ш-циаппеларгоновой кислоты был получен
зтерификацией ш-цианпеларгоновой кислоты диметилсульфатом1
или метиловым спиртом2.Приведенный метод описан в литературе1'3.
1 Biggs, В i s h о р, J. Am. Chem. Soc, 63, 944 A941)
2 Biggs, ам. пят. 2339072 [С. А., 38, 3990 A944)].
3 В i s h о р, ам. пат. 2277033 [С. А., 36 4636 A942)]
318
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
МЕТИЛТИОМОЧЕВИНА
CH3NCS + NH3 -» CH3NHCSNH2
Предложили: М. Моор и Ф. Просели,
Проверили: Н. Дрэйк и Р. Мозинео.
Получение
В трехгорлую колбу емкостью 500 мл, снабженную мешалкой,
обратным холодильником и капельной воронкой, помещают
НО мл концентрированного водного аммиака C4г, 2 моля аммиака)
и затем в течение 1 часа при перемешивании прибавляют к нему
95 г A,3 моля) метилизотиоцианата (стр. 301) с т. кип. 115—121е
(примечание 1). Когда прибавление будет закончено, холодильник
отъединяют и раствор нагревают в течение получаса на водяной
бане, чтобы удалить избыток аммиака. Затем раствор кипятят
с 2 г активированного березового угля, фильтруют и фильтрат
охлаждают в бане со льдом. Метилтиомочевина кристаллизуется
в виде бесцветной компактной плотной массы, которую отделяют
на фильтре, промывают три раза ледяной водой порциями по
25 мл и сушат. Первая порция кристаллов весит 65—75 г. Для
получения второй порции, которая весит 15—20 г, маточный
раствор и промывные воды упаривают до объема 75 мл и вновь
охлаждают в бане со льдом. Общий выход метилтиомочевины с
т. пл. 119—120,5° (примечание 2) составляет 85—95 г G4—81%
теоретич.; примечания 3 и 4).
Примечания
1. Реакция начинается медленно, поэтому прибавлять метил-
изотиоцианат следует равномерно; если смесь перегреется, то тече-
течение реакции становится бурным и регулировать се очень трудно.
2. При дальнейшей очистке путем кристаллизации из кипящего
абсолютного спирта получается препарат с т. пл. 120,5—121Э.
3. Если применять более чистый метилизотиоцианат, то выход
повышается лишь незначительно.
4. Этот метод является общим для получения алкилзамещен-
ных тиомочевины. Из этилизотиоцианата таким же образом была
получена этилтиомочевина с т. пл. 103—106°. Если вместо аммиа-
аммиака взять эквивалентное количество раствора амина, то, исходя
из алкилизотиоцианатов, можно получить по тому же методу
ди- и триалкилтиомочевины. Так, из метилизотиоцианата и рас-
раствора метиламина можно получить силш-диметилтиомочевину.
Из раствора диметиламина и метилизотиоцианата получается
триметилтиомочевина.
МЕТИЛ ФЕНИЛГЛИОИСАЛЬ
319
Другие методы получения
Метилтиомочевина была получена из метилизотиоцианата
и аммиака в спиртовом1 или водном2 растворе, из роданистого
метиламмония3 и нагреванием метилового или этилокого эфира
N-метилдитиокарбаминовой кислоты со спиртовым раствором
аммиака4.
1 N a f, Ann., 265, 108 A891).
2 Andreaseh, Monatsh., 2, 276 A881).
3 Salkowski, Ber., 26, 2497 A893).
4 D e 1 ё р i n e, Compt. rend., 134, 1222 A902); Bull. soc. chim. C),
27, 812 A902).
МЕТИЛФЕНИЛГЛИОКСАЛЬ
( Ацетилбензоил; 1 -фенил-1,2-пропандион)
H2SO<i
СН3С (= NOH) СОСвН5 + Н2О > СН3СОСОСвН5 + NH.OH
Предложили: В. Хартмэн и Л. Ролл.
Проверили: А. Блэтт и Л. Ротште н.
Получение
В 1-литровой колбе, приспособленной для перегонки с водяных
паром (примечание 1), смешивают 50 г @,31 моля) изонитрозо-
пропиофенона («Синт. орг. преп.», сб. 2, стр. 264) и 500 е 10%-ной
серной кислоты, после чего смесь перегоняют с водяным паром
до тех пор, пока не будет собрано около 2 л дестиллата. Во время
перегонки колбу нагревают таким образом, чтобы объем реакцион-
реакционной смеси оставался более или менее неизменным. Перегонка
занимает около 6 час, причем к концу этого периода жидкость
в колбе становится прозрачной (примечание 2).
Нижний слой в дестиллате, слой дикетона, окрашенный в жел-
желтый цвет, отделяют; затем водный слой насыщают солью и экстра-
экстрагируют эфиром, для чего применяют на каждый литр водного
раствора одну порцию эфира в 80 мл и две порции по 25 мл. Эфир-
Эфирные вытяжки присоединяют к основной фракции дикетона и все
вместе сушат над сернокислым натрием. Эфир отгоняют на паро-
паровой бане, а остаток перегоняют при пониженном давлении из
колбы Клайзсна. Метилфенилглиоксаль собирают при 114—116°
B0 мм) (примечание 3). Выход составляет 30—32 г F6—70%
теоретич.; примечание 4).
Примечания
1. Между колбой и холодильником необходимо установить
каплеотбойник; в противном случае некоторая часть изонитрозо-
кетона может перейти в дестиллат.
320
СИНТЕЗЫ ОРГАНИЧНС1ШХ ПРЕПАРАТОВ
2. При охлаждении реакционной, смеси из нее выпадает в оса-
осадок 3—7 г диоксима ацетилбензоила, плавящегося при 234—236°
{с разложениемI.
3. Температура кипения метилфенилглиоксаля при других
давлениях: 216—218°; 164—165° A16 мм); 102—103° A2 мм).
4. По указаниям авторов, эту реакцию можно провести с тем
же выходом, применяя и пятикратные количества исходных
веществ.
Другие методы получения
Метилфенилглиоксаль был получен дегидрогенизацией ацетил-
фенилкарбинола над медью при 350°2; окислением 1-метил-2-фенил-
этиленгликоля3; действием амилнитрита на изонитрозопропио-
феноп4; кислотным расщеплением изонитрозопропиофенока5 или
изонитрозобензилыетилкетона6. Как указывают, последняя реак-
реакция дает количественный выход ацетилбензоила, однако исходное
вещество мало доступно. Имеются данные, говорящие о том, что
действие амилнитрита B моля) на пропиофенон без выделения
изонитрозосоединения может служить методом получения метил-
метилфенилглиоксаля4, однако выход дикетона значительно выше в
случае выделения изонитрозосоединения7.
1 М й 1 1 е г, Pechmann, Ber., 22, 2128 A889).
2 М a i I h e, Bull. soc. chim., D), 15, 326 A914).
8 Z i n с k e, Z e h n. Ber., 43, 855 A910).
4 M a n a s s e, Ber., 21, 2177 A888).
3 P e с h m a n n, Muller, Ber., 21, 2119 A888).
6 К о 1 b, Ann., 291, 286 A896); Borsclic, Ber., 40, 740 A907).
'Coles, Manske, Johnson, J. Am. Chcm. Soc, 51, 2269 A929).
N-МЕТИЛФОРМАНИЛИД
4- HCOOH -->¦ CeH5N (CH3) CHO + H2O
Предложили: Л. Физер и Дж. Джонсе.
Проверили: Ч. Аллен и Дж. ВанАллан.
Получение
В 3-литровую круглодонную колбу, снабженную большим
елочным дефлегматором высотой 90 см, к которому, в свою
очередь, присоединен обращенный вниз холодильник, поме-
помещают 321 г C моля) метиланилина, 300 г муравьиной кислоты
(85—90%-ной) и 1 800 мл толуола (примечание 1). Раствор медлен-
медленно перегоняют, причем, пока отгоняется азеотропная смесь, содер-
содержащая воду, температура в парах держится на уровне 87—88°.
После того как вода будет удалена, температура повышается
до 108—110° (примечание 2). Перегонку продолжают до тех пор,
пока не будет собрано около 1 500 мл толуола E—6 час). Остаток
ш-МЕТОКСИАЦЕТОФЕНОН
321
переносят в специальную колбу Клайзена («Синт. орг. преп.»,
сб. 1, стр. 142, рис. 8), перегоняют в вакууме и собирают фракцию
с т. кип. 114—121° (8 мм). Температура замерзания получен-
полученного препарата 13,6—13,7°; «п 1,553—1,555. Выход составляет
380—393 г (93—97% теоретич.). Препарат пригоден для получе-
получения альдегидов (стр. 74). При повторной перегонке его т кип.
117—121° (8 мм) [130—132° B2 мм)]. Температура замерзания
и показатель преломления вещества в результате вторичной
перегонки не изменяются.
Примечания
1. Толуол служит для удаления воды; присутствие его сводит
к минимуму побочные реакции.
2. Водный слой дестиллата отделяют; количество его дости-
достигает 140—150 мл.
Другие методы получения
Метилформапилид был получен с выходом 67,5% при нагре-
нагревании метиланилина с амидом муравьиной кислоты в растворе
ледяной уксусной кислоты1. Изложенный выше метод является
видоизменением способа, который разработали Морган и Грист2.
Последние нагревали амин и муравьиную кислоту в отсутствие
растворителя или вещества, с которым отгоняется вода. (При
использовании такой методики авторы настоящей прописи полу-
получили выход только в 40—50%.)
1 Hirst, Cohen, J. Chem. Soc, 67, 830 A895).
2 M о r g a n, Grist, J. Chem. Soc, 113, 690 A918).
w-МЕТОКСИАЦЕТОФЕНОН
CGH5MgBr + CH3OCH2CN -> CH0OCH2C( = NMgBr)C8H5
2CH3OC (= NMgBr) C6H5 + H2O + 2H2SO4 ~>
-> 2CH3OCH2COCeH6 4- (NH4J SO4 + MgSO4 + MgBr2
Предложили: P. Моффетт и Р. Шрайнер.
Проверили: В. Бахман и В. Струве.
Получение
В 2-литровой трехгорлой колбе, снабженной большой капель-
капельной воронкой, обратным холодильником и мешалкой с ртутным
затвором, приготовляют по методу, описанному в «Сипт. орг.
преп.», сб. 1, стр. 207, раствор бромистого фенилмагния, исходя
из 8,8 е @,36 грамматома) магния, 56,5 г C8 мл, 0,36 моля) бром-
бензола и 350 мл (в общей сложности) абсолютного эфира.
К раствору реактива Гриньяра, охлажденному в бане со льдом
и солью, при работающей мешалке медленно прибавляют смесь
21 Сборник 3
322
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
21,3 г @,3 моля) метоксиацетонитрила («Синт. орг. преп.», сб. 2,
стр. 343) и 55 мл абсолютного эфира. Сразу же выделяется бес-
бесцветный продукт присоединения. Смесь оставляют стоять в тече-
течение 2 час. при комнатной температуре; затем ее снова охлаждают
и разлагают, прибавляя при перемешивании сперва 500 мл воды
и колотого льда, а затем 100 мл холодной разбавленной серной
кислоты (примечание 1). Когда разложение закончится (приме-
(примечание 2), эфирный слой отделяют, а водный — экстрагируют не-
небольшим количеством эфира. Эфирные вытяжки присоединяют
к основному эфирному раствору и вес вместе промывают 5%-ным
водным раствором соды, а затем водой, после чего раствор сушат
над безводным сернокислым натрием.
Эфир отгоняют на паровой бане, а остаток перегоняют в ваку-
вакууме. и>-Метоксиацетофенон представляет собой бесцветную
жидкость с т. кип. 118—120° A5 мм) [228—230° G60 мм)] (при-
(примечание 3). Выход составляет 32—35 г G1—78% теоретич., счи-
считая на метоксиацетонитрил).
Примечания
1. Один объем концентрированной серной кислоты приба-
прибавляют к двум объемам воды и охлаждают смесь в бане со льдом
и солью.
2. Оба слоя должны иметь светложелтую окраску и содержать
лишь небольшое количество твердых или смолистых веществ.
3. Проверявшие синтез получили препарат с т. кип.
110—112° (9 мм).
Другие методы получения
Описанная методика является в основных чертах той, которую
предложили Пратт и Робинсон1.
1 Р г a t t, Robinson, J. Chem. Soc, 1923, 748.
МИНДАЛЬНАЯ КИСЛОТА
C6H5COCHCla
C6H5COCHC12 + 3NaOH
C0H5CHOHCO2Na + НС1 ¦
C6H5CHOHCO2Na + 2NaCl + H2O
C6H5CHOHCOaH + NaCl
Предложили: Дж. Астон, Дою. Ныокирк, Д. Дженкинс и Дж. Царский.
Проверили: Р. Шрайнер и К- Тилфорд.
Получение
Дихлорацепгофенон. Кругло донную колбу емкостью 3 л за-
закрывают резиновой пробкой с тремя отверстиями, через которые
МИНДАЛЬНАЯ КИСЛОТА
323
вставляют трубку для ввода газа, доходящую до дна колбы,
отводную трубку и термометр. Трубку для ввода газа присоеди-
присоединяют к баллону с хлором через счетчик пузырьков. Последний
состоит из промывной склянки емкостью 500 мл, которая содер-
содержит около 200 мл концентрированной серной кислоты. Отводная
трубка присоединена к ловушке для поглощения газа («Синт.
орг. преп.», сб. 2, стр. 78), где выделяющийся хлористый водород
поглощается проточной водой.
Лучше всего собрать прибор в хорошо действующем вы-
вытяжном шкафу.
В колбу помещают 240 г B моля) ацетофенона и 1 л ледяной
уксусной кислоты. Термометр устанавливают таким образом, чтобы
шари.к его находился значительно ниже поверхности раствора,
и хлор впускают с такой скоростью, чтобы температура смеси не
поднималась выше 60° (примечание 1). Хлорирование продол-
продолжают до тех пор, пока не будет поглощен избыток хлора; для
этого требуется около 5 час. На завершение реакции указывает
появление желтой окраски. Реакционную смесь выливают в
7-литровый сосуд, на шесть седьмых заполненный толченым льдом.
Смесь в течение некоторого времени перемешивают (примечание 2),
после чего оставляют ее стоять до тех пор, пока не растает
лед. Дихлорацетофенон, который выделяется в виде тяжелого
масла со слезоточивыми свойствами, отделяют. Выход составляет
340—370 г (90—97% теоретич.). Полученный препарат, содержа-
содержащий только небольшой процент воды и уксусной кислоты, до-
достаточно чист для применения в синтезе миндальной кислоты.
Препарат можно очистить, если прибавить к нему около 100 мл
бензола, отогнать воду и бензол и подвергнуть затем остав-
оставшееся масло дробной перегонке в вакууме. Этим путем получают
302—305 г (80—94% теоретич.) бесцветного масла, кипящего при
132—134° A3 мм) [142—144° B5 мм)].
Миндальная кислота. В 2-литровую трехгорлую круглодон-
ную колбу, снабженную эффективной мешалкой, капельной
воронкой и термометром, помещают 156 г C,9 моля) едкого натра,
растворенного в 1 400 мл воды. Раствор подогревают до 60° (при-
(примечание 3) и при энергичном перемешивании через капель, _,ю
воронку прибавляют к нему 200 г A,06 моля) дихлорацетофенона
(неочищенного или перегнанного). Вначале дихлорацетофенон
прибавляют медленно, так, чтобы температура смеси не подни-
поднималась выше 65° (примечание 4). Прибавление занимает около
2 час. Перемешивание продолжают в течение еще 1 часа, поддер-
поддерживая при этом температуру на уровне 65° при помощи водяной
или паровой бани. Затем к реакционной смеси прибавляют 170 мл
12 М соляной кислоты (примечание 5) и раствор экстрагируют
эфиром. Для этой цели можно с успехом применить экстрактор
непрерывного действия, изображенный на рис. 16. Для экстра-
21*
324
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
гирования берут 250—300 мл эфира и продолжают этот процесс
до тех пор, пока миндальная кислота не будет выделена пол-
полностью. При помощи такого прибора за 1 сутки можно выделить
около 130 г неочищенной миндальной кислоты, а за 2 суток—
150 г. Объем жидкости в большей колбе экстрактора должен
быть достаточно велик для
того, чтобы при использо-
использовании для экстрагирова-
экстрагирования 250—300 мл эфира
мог бы начаться непре-
непрерывный слив из большей
колбы в меньшую; послед-
последняя служит в качестве «ки-
«кипятильника».
Эфирные вытяжки пе-
переносят в 1-литровую
круглодонную колбу, эфир
отгоняют и остаток неочи-
неочищенной миндальной ки-
кислоты сушат, нагревая
на паровой бане в ваку-
вакууме водоструйного насоса.
К высушенному веществу
прибавляют около 400 мл
бензола и смесь перего-
няют Д° тех П0Р> пока не
будет собрано 100 мл де-
с™ата- Кислоту в остав-
оставшейся смеси переводят
полностью в раствор, при-
прибавляя 6—10 мл этилового спирта. Затем горячий раствор филь-
фильтруют через обогреваемую воронку Бюхнера и фильтрат остав-
оставляют на ночь при 6°. Первая порция чистой миндальной ки-
кислоты составляет 100—120 г. Вторую порцию получают выпа-
выпариванием маточного раствора примерно до одной четверти его
объема; количество второй порции составляет 20—40 г. Общий
выход равен 136—144 г (85—90% теоретич., считая на дихлор-
ацетофенон, или 76—87%, считая на ацетофенон). Белое кри-
кристаллическое вещество плавится при 115—117° (примечание 6).
Примечания
1. Согласно указаниям, приведенным в справочнике Бейль-
штейна (т. VII, стр. 283), хлорированием ацетофенона при высо-
высоких температурах получают трихлорацетофенон1. Однако при
60° образуется менее 1% трихлорацетофенона.
Р и с. 16. Все размеры даны в сантиметрах.
МИНДАЛЬНАЯ КИСЛОТА
325
2. Перемешивание способствует лучшему отделению уксусной
кислоты от масла; кроме того, перемешивание препятствует обра-
образованию эмульсии.
3. При более низких температурах гидролиз протекает мед-
медленно.
4. При значительном повышении температуры реакционной
смеси протекают побочные реакции, в результате чего умень-
уменьшается выход и препарат получается менее чистым. Теплота реак-
реакции достаточна для поддержания требуемой температуры.
5. Если на этой стадии реакционную смесь охладить, то часть
миндальной кислоты может выкристаллизоваться. Если это слу-
случится, то осадок не следует отфильтровывать, так как он за-
загрязнен хлористым натрием.
6. Авторы синтеза указывают, что из 1 кг ацетофенона можно
получить 0,98—1,06 кг миндальной кислоты.
Другие методы получения
Дихлорацетофенон был получен хлорированием ацетофе-
ацетофенона с добавлением или без добавления хлористого алюминия1;
действием хлорангидрида дихлоруксусной кислоты на бензол
и хлористый алюминий1; действием хлорноватистой кислоты
на фенила цети лен2; нагреванием трихлорметилфенилкарби-
нола3; хлорированием фенилацетилена в спиртовом рас-
растворе4.
Миндальная кислота была получена гидролизом ее нитрила
(получаемого, в свою очередь, из бензальдегида и цианистого водо-
водорода или из бензальдегида, бисульфита натрия и цианистого
натрияM; действием воды при температуре 180е на трихлорметил-
фенилкарбинол6; действием углекислого калия на нагретую смесь
бензальдегида и хлороформа7; действием теплой разбавленной
щелочи на дибромацетофенон8; действием теплого разбавленного
раствора едкого натра на фенилглиоксаль9.
1 G a u t i e r, Ann. chim. phys., F), 14, 348, 379, 385, 396 A888).
2 Витторф, ЖРФХО, 32, 88 A900).
3 Kotz, J. prakt. Chera., B), 90, 299, 304 A914).
«Jackson, J. Am. Chem. Soc, 56, 977 A934).
s Корсов, Додж, Гарри с, Яу , Синт. орг. преп., сб. 1,
стр. 270; Spiegel, Ber., 14, 239 A881); U It e e, Rec. irav. chim.,
28, 254 A909); Mailer, Ber., 4, 980 A871).
«Иоцич, ЖРФХО, 29, 100 A897).
' S a v a r i a u, Compt. rend., 146, 297 A908).
8 E n g 1 e r, Wohrle, Ber., 20, 2202 A887).
oPecbmann, Ber., 20, 2905 A887).
326
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
МОНОНАДФТАЛЕВАЯ КИСЛОТА
(Моногидроперекись фталила; фталевая моноперкислота)
н4/
/со
с6н4
-СО2ОН
со„н
Предложил: X. Боме.
Проверили: Г. Адкинс и Э. Формэн.
Получение
В 1-литровую кругло донную колбу, снабженную механической
мешалкой и охлаждаемую в бане со льдом и солью, помещают 275 г
B50 мл, около 1 моля) 15%-ного раствора едкого натра. Раствор
охлаждают до—-10° (примечание 1) и прибавляют к нему в один
прием 115 г A05 мл, около 1 моля) 30%-ной перекиси водорода,
предварительно также охлажденной до —10е. За счет теплоты
реакции температура смеси заметно повышается. Когда темпера-
температура вновь понизится до —10°, к содержимому колбы как можно
быстрее при энергично работающей мешалке прибавляют 75 г
@,5 моля) фталевого ангидрида, предварительно измельченного
так, чтобы он проходил через сито в 40 меш (примечания 2 и 3).
Как только весь ангидрид растворится, к смеси прибавляют 250 мл
@,5 моля) 20%-ной серной кислоты, которую предварительно
охлаждают до —10е, но не замораживают (примечание 4).
Кислый раствор фильтруют без отсасывания через стеклян-
стеклянную вату непосредственно в 2-литровую делительную воронку
и немедленно экстрагируют один раз 500 мл эфира, а затем три
раза тем же растворителем порциями по 250 мл. Соединенные
вместе эфирные вытяжки взбалтывают с тремя порциями 40%-ного
раствора сернокислого аммония по 150 мл и сушат в течение
суток, лучше всего в холодильном шкафу, над 50 г безводного
сернокислого натрия.
Если эфир выпарить в вакууме (примечание 5), то получится
кристаллическая мононадфталевая кислота. Однако более удоб-
удобно непосредственно применять эфирный раствор (примечание 6).
Содержание в нем надкислоты определяют, прибавляя к 2 мл
раствора 30 мл 20%-ного раствора йодистого калия и титруя
выделившийся иод по прошествии 10 мин. 0,05 н. раствором гипо-
гипосульфита. Выход составляет 60—65 г F5—70% теоретич., считая
на фталевый ангидрид; примечание 7).
Примечания
1. Если растворы будут охлаждены до —10°, то кислород
выделяется в незначительном количестве и получаются хорошие
МОНОНАДФТАЛЕВАЯ КИСЛОТА
327
выходы надкислоты. Если же реакцию проводить при 0°, то выде-
выделяется большое количество кислорода и выходы получаются'
низкими.
2. Продажный фталевый ангидрид можно применять непосред-
непосредственно. Однако если этот реагент уже значительно разложился,
то его следует очистить перегонкой в вакууме.
3. Ангидрид следует прибавлять большими порциями; еще
лучше прибавить все количество его в один прием.
4. Решающим фактором для успешности синтеза является
период времени между прибавлением ангидрида и подкислением
реакционной смеси. Ангидрид должен нацело раствориться, однако
продолжительное перемешивание приводит к чрезмерному выде-
выделению кислорода. Чем быстрее растворится ангидрид и чем
меньше будет количество выделившегося кислорода, тем выше
окажется выход надкислоты. Следовательно, перемешивание дол-
должно быть энергичным.
5. Если желательно иметь кристаллическую мононадфталевую
кислоту, то ее удобно получить следующим образом. Высушен-
Высушенный эфирный раствор помещают в перегонную колбу, снабжен-
снабженную капилляром, защищенным осушительной трубкой (стр. 95),
и колбу присоединяют к водоструйному насосу. Эфир выпаривают
в полученном таким образом вакууме, не подогревая колбу (на
колбе образуется лед), до тех пор, пока останется не слишком
густой сироп (примерно 150 мл). Последний переносят в чашку
для выпаривания, а колбу ополаскивают небольшим количеством
абсолютного эфира, который прибавляют к сиропу. После этого
остатку эфира предоставляют испаряться в вакуум-эксикаторе
над концентрированной серной кислотой. Для получения хоро-
хороших результатов в этом синтезе необходимо производить очень
тщательное высушивание, так как присутствие в эфирном растворе
хотя бы 1 % воды более чем достаточно для того, чтобы разру-
разрушить все количество надкислоты.
6. Если в реакциях окисления, в которых должна быть при-
применена полученная надкислота, нельзя пользоваться эфиром,
то после удаления эфира можно растворить кислоту в другом
растворителе. Прекрасным растворителем для реакции окисле-
окисления с помощью мононадфталевой кислоты является диоксан;
раствор надкислоты в диоксане легко получить, если прибавить
последний к высушенным эфирным вытяжкам, а затем удалить
эфир в вакууме при 15°. Необходимо, чтобы диоксан не содержал
перекисей1.
7. Авторы предложили проводить описанный синтез с коли-
количествами, в пять раз меньшими указанных в прописи. Однако
при проверке оказалось, что проведение синтеза и в большем
масштабе затруднений не встречает.
328
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Р-НАФТОЙНЫЙ АЛЬДЕГИД
329
Другие методы получения
Мононадфталевая кислота была получена гидролизом пере-
перекиси фталила едким натром2 и взбалтыванием фталевого ангид-
ангидрида с избытком щелочного раствора перекиси водорода2. Приве-
Приведенная выше пропись представляет собой видоизменение послед-
последнего метода3.
1Eigenberger, J. prakt. Chem. B), 130, 75 A931).
2 В а е у е г, V i I I i g e r, Ber., 34, 764 A901).
3 Bohme, Ber., 70,379A937).
g-НАФТОЙНЫЙ АЛЬДЕГИД
(Альдегид нафталин-2-карбоновой кислоты)
ВОССТАНОВЛЕНИЕ ХЛОРАНГИДРИДА Р-НАФТОЙНОЯ КИСЛОТЫ
ПО РОЗЕНМУНДУ
+ НС1
\/\/'
Предложили: Э. Гершберг и Дж. Кейзон.
Проверили: Н. Дрэйк, Г. Анспон и Р. Мозинео.
Получение
Весь прибор должен быть собран на шлифах. Трехгорлую
колбу емкостью 500 мл снабжают мешалкой с ртутным затвором
(примечание 1), обратным холодильником и трубкой для ввода газа,
кончающейся непосредственно над лопастями мешалки. В колбу
помещают 57 г @,30 моля) хлорангидрида р-нафтбйной кислоты
(примечание 2), 200 мл ксилола (примечание 3), 6 г катализатора
(палладий, осажденный на сернокислом барии1) и 0,6 мл раствора
стандартного каталитического яда (примечание 4). Верхнюю часть
холодильника соединяют при помощи каучуковой трубки со сте-
стеклянной трубкой диаметром б мм, доходящей до дна конической
колбы емкостью 500 мл, в которую налито 400 мл дестиллирован-
ной воды и добавлено несколько капель раствора фенолфталеина
в качестве индикатора. Над колбой устанавливают бюретку при-
примерно с 5 н. 'раствором едкого натра [последний получают раство-
растворением в воде 20,5 г едкого натра (ч. д. а.) и доведением объема
раствора до 100 мл]. С целью безопасности колба должна быть
установлена на расстоянии не менее 60 см от источника пламени.
Из баллона непосредственно в реакционную колбу пропускают
электролитический водороде такой скоростью, чтобы через колбу
проходило 100—300 пузырьков в минуту.
После того как воздух в реакционной колбе будет вытеснен водо-
водородом, ее нагревают на масляной бане до температуры 140—150°,
пускают в ход мешалку (примечание 5) и в колбу приливают
1 мл щелочи. За ходом реакции следят по скорости выделения
хлористого водорода. Первые 5 мл щелочи должны нейтрализо-
нейтрализоваться в течение 12—15 мин.; реакция в целом должна быть закон-
закончена примерно за 3 часа. Во время процесса выделяется около
92% теоретического количества хлористого водорода, что эквива-
эквивалентно 55 мл 5 н. раствора едкого натра. О завершении реакции
судят по внезапному прекращению выделения хлористого водо-
водорода; на этом проведение процесса заканчивают.
Колбу охлаждают, прибавляют к ее содержимому при пере-
перемешивании 1—2 г активированного березового угля и раствор
фильтруют с отсасыванием через толстую фильтровальную бумагу
(примечание 6). Ксилол быстро отгоняют в вакууме от почти бес-
бесцветного фильтрата. С этой целью для перегонки в вакууме под-
подготавливают специальную колбу Клайзена емкостью 125 мм,
в которой обычный капилляр заменяют большой капельной ворон-
воронкой, ножка которой должна доходить до дна колбы. Колбу нагре-
нагревают на масляной бане до температуры 90—100° и вливают в нее
через воронку раствор как можно быстрее, однако так, чтобы не
происходило накапливания ксилола. Когда весь раствор будет
прибавлен, капельную воронку заменяют капилляром и повышают
температуру бани. После небольшой головной фракции, состоя-
состоящей главным образом из нафталина, при 147—148е A1 мм) (тем-
(температура бани 170—180°) перегоняется р-нафтойный альдегид,
и в колбе остается небольшое количество нелетучего остатка.
Таким образом получают 34,5—38 г G4—81% теоретич.) бес-
бесцветного р-нафтойного альдегида с т. пл. 59—60° (примечание 7).
Примечания
1. Весьма удобна мешалка из танталовой или платиновой про-
проволоки2, ось которой вращается в шарикоподшипнике; однако
можно применять и обычную стеклянную мешалку. Следует
пользоваться быстро вращающейся мешалкой, так как скорость
реакции в значительной степени зависит от скорости перемеши-
перемешивания. Важно, чтобы мешалка была хорошо центрирована и чтобы
ртуть из затвора не разбрызгивалась. Если ртуть попадет в колбу,
то реакция не сможет протекать должным образом (примечание 5).
2. Удобнее всего получать хлорангидрид C-нафтойной кис-
кислоты, исходя из этой кислоты («Синт. орг. преп.», сб. 2, стр. 351)
и пятихлористого фосфора. В вытяжном шкафу нагревают на паро-
паровой бане в специальной колбе Клайзена емкостью 250 мл смесь
57,4 г @,33 моля) кислоты и 69 г @,33 моля) пятихлористого фос-
фосфора. Как только начнется бурная реакция, колбу снимают
330
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
с паровой бани и оставляют стоять до тех пор,, пока не замедлится
быстрое выделение хлористого водорода; затем ее снова нагре-
нагревают на паровой бане в течение еще получаса. После удаления
хлорокиси фосфора хлорангидрид перегоняют в вакууме водо-
водоструйного насоса. Выход фракции с т. кип. 160—162° A1 мм) (тем-^
пература бани 170—180°) составляет 57—60 г (90—95% теоретич.).
Температура плавления хлорангидрида 51—52°. Перегонку сле-
следует вести тщательно, в результате должно получиться совер-
совершенно бесцветное вещество.
3. В течение ночи кипятят с обратным холодильником 1 л
технического ксилола и 2 г натрия; затем ксилол перегоняют
и хранят над натрием.
4. Для получения каталитического яда Розенмунда и Цетцше3,
содержащего хинолин и серу, 1 г серы и 6 г хинолина кипятят
с обратным холодильником в течение 5 час, после чего доводят
объем полученной темно коричневой жидкости до 70 мл добавле-
добавлением очищенного ксилола. В литературе о восстановлении по Ро-
зенмунду содержится много противоречивых данных относительно
необходимости применения каталитического яда; однако работа
Цетцше и его сотрудников4 показала, что степень чистоты раство-
растворителя является в этом отношении решающим фактором. Указан-
Указанные исследователи нашли, что при применении технического кси-
ксилола без специально добавленного яда обычно можно синтезировать
альдегид с хорошим выходом; однако в тех же условиях после
очистки ксилола перегонкой над безводным хлористым алюми-
алюминием альдегид практически не получался5, а образовывались про-
продукты дальнейшего его восстановления. Учитывая такие резуль-
результаты, рекомендуется применять специальный яд, что обеспечит
возможность контролировать реакцию. Авторы настоящего син-
синтеза утверждают, что применение двойной порции указанного
выше яда не вызывает иного эффекта, кроме замедления реакции;
выход и качество полученного вещества не изменяются.
5. Быстрое перемешивание, которое является желательным
для достижения максимальной скорости реакции, часто вызывает
разбрызгивание мелких капелек ртути из затвора. Избежать
этого можно, если налить на поверхность ртути слой парафино-
парафинового масла. Существенно, чтобы трубка для ввода газа оканчи-
оканчивалась ниже поверхности перемешиваемой жидкости, так как
поглощение водорода происходит главным образом на поверх-
поверхности раздела между жидкостью и газом при быстром переме-
перемешивании.
6. Чтобы регенерировать палладий, использованный катали-
катализатор прокаливают и остаток растворяют в царской водке6.
7. Согласно указаниям авторов, эта реакция протекает вполне
удовлетворительно и в малых масштабах, причем можно приме-
применять и другие хлорангидриды. Так, по этому методу В-нафтойный
р-НАФТОЙНЫЙ АЛЬДЕГИД
331
альдегид был получен с выходом 83% при работе с количеством
хлорангидрида Р-нафтойной кислоты, равным 0,05 моля. 1-Ацетокси-
3-нафтальдегид (т. пл. 112—114°) был получен с выходом 70%,
исходя из 0,85 г соответствующего хлорангидрида. С выходом
65% был получен также метиловый эфир [3-формилпропионовой
кислоты [т. кип. 69—70° A4 мм)], исходя из соответствующего
хлорангидрида; в этом случае восстановление протекало быстро
при температуре 110°.
ВОССТАНОВЛЕНИЕ НИТРИЛА Р-НАФТОЙНОЙ КИСЛОТЫ ХЛОРИСТЫМ ОЛОВОМ
С1
НС1
\/\/
SnCIa
HCI
= KH-HCl.SnCl4 Но0
Предложил: Дж. Уильяме.
Проверили: Ч. Аллсн и До/с. ВанАллан.
Получение
В 2-литровую трехгорлую круглодонную колбу, снабженную
механической мешалкой, обратным холодильником, защищенным
хлоркальциевой трубкой, и трубкой для ввода газа, доходящей
почти до дна колбы, помещают 76 г @,4 моля) безводного хлори-
хлористого олова (примечание 1) и 400 мл абсолютного эфира. Затем
при медленном перемешивании смесь насыщают сухим хлористым
водородом; на это требуется 2,5—3 часа, в течение которых
хлористое олово образует нижний вязкий слой.
Трубку для ввода газа заменяют делительной воронкой и
быстро прибавляют к смеси раствор 30,6 г @,2 моля) нитрила
Р-нафтойной кислоты ст. пл. 60—62° (примечание 2) в 200 мл
сухого эфира. Через смесь снова пропускают хлористый водород
до ее насыщения, затем энергично перемешивают смесь в течение
1 часа, после чего оставляют ее на ночь. За это время полностью
выделяется альдимин хлорного олова, окрашенный в желтый
цвет.
Эфирный раствор декантируют, а твердое вещество промы-
промывают двумя порциями эфира по 100 мл, после чего переносят его
в 5-литровую колбу, приспособленную для перегонки с водяным
паром. Колбу погружают в масляную баню, температуру которой
332
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
поддерживают при 110—120° (примечание 3). Через смесь про-
пропускают перегретый пар (примечание 4) до полного удаления
альдегида, на что требуется 8—10 час; при этом собирают 8—10 л
дестиллата.
Белое твердое вещество отфильтровывают и сушат на воздухе.
Выход составляет 23—25 г G3—80% теоретич.); т. пл. 53—54°.
Для дальнейшей очистки препарат перегоняют при пониженном
давлении (примечание 5); бесцветный и прозрачный, как вода,
дестиллат [т. кип. 150—158° A5 мм)] выливают в еще горячем
состоянии в ступку; по охлаждении вещество растирают в поро-
порошок. Выход составляет 93—95%; т. пл. 57—58°.
Примечания
1. Успех проведения реакции такого типа зависит от качества
катализатора. Безводное хлористое олово, пригодное в качестве
активного и надежного катализатора7, получают следующим обра-
образом. В стакан емкостью 600 мл помещают 204 г A89 мл, 2 моля)
уксусного ангидрида (99—100%-ного) и, перемешивая жидкость
от руки, прибавляют к ней 226 г A моль) продажного химически
чистого кристаллического хлористого олова с двумя молекулами
кристаллизационной воды. Эту операцию следует проводить
в вытяжном шкафу, так как выделяющееся в результате реакции
тепло вызывает кипение уксусного ангидрида. Через полтора
часа безводное хлористое олово отфильтровывают на большой
воронке Бюхнера, промывают двумя порциями абсолютного
эфира по 50 мл и сушат в течение ночи в вакуум-эксикаторе.
Выход количественный A89 г). Хранить хлористое олово до его
употребления следует в герметически закрытой склянке. Пре-
Препарат, получаемый обезвоживанием кристаллического хло-
хлористого олова на масляной бане при 195—200°, во многих слу-
случаях бывает вполне пригодным, однако он недостаточно на-
надежен.
2. Нитрил Р-нафтойной кислоты получают по методу, описан-
описанному для синтеза о-толунитрила в «Синт. орг. преп.», сб. 1, стр. 391.
3. Применение сухого немного перегретого пара сокращает
время перегонки, но не является обязательным.
4. Перед пароперегревателем ставилась ловушка для удаления
конденсирующейся воды. Термометр перегревателя показывал 260°.
5. Для перегонки удобно объединить вещество, полученное ,
в результате нескольких опытов.
Другие методы получения
р-Нафтойный альдегид был получен из C-хлор- или р-бром-
метилнафталина под действием гексаметилентетрамина5 или при
Р-НАФТОЙНЫЙ АЛЬДЕГИД
333
окислении азотнокислым свинцом8; из C-нафтойной кислоты
перегонкой с муравьинокислым кальцием9 или восстановлением
амальгамой натрия в растворе борной кислоты10; из р-нафтил-
карбинола окислением хромовой кислотой11; из [З-нафтилгли-
оксиловой кислоты омылением, нагреванием с анилином и гидро-
гидролизом анила12. Кроме того, C-нафтойный альдегид был получен
из бромистого р-нафтилмагния и этоксиметиленанилина18 или
ортомуравьиного эфира14. Бромистый р-нафтилмагний был также
превращен в дитио кислоту действием сероуглерода, а эта кислота
переведена в [3-нафтойный альдегид через его семикарбазон15.
(З-Нафтойный альдегид был получен восстановлением нитрила
р-нафтойной кислоты16 по методу Стефена и восстановлением
хлорангидрида (З-нафтойной кислоты17 по методу Розенмунда18,
а также из 2-бромметилнафталина и гексаметилентетрамина
в кипящей уксусной кислоте19. Первая из приведенных выше про-
прописей основана на методике, разработанной Розенмундом3-18, кото-
которую он, а также и другие исследователи применяли для получе-
получения целого ряда альдегидов. Вторая пропись основана на работах
Стефена7-16.
1 Г у б е н, Методы органической химии, т. 2, вып. 1, Госхимиздат,
1941, стр. 443.
2 Гершберг, Синт. орг. преп., сб. 2, стр. 298, примечание 1.
3Rosenmund, Zetzsche, Ber., 54, 436 A921).
4Zetzsche, A r n d, Helv. Chim. Acta, 9, 173 A926); Zetzsche,
E n d e r 1 i n, Flutsch, Menzi, там же, 9, 177 A926).
5Wahl, Goedkoop, Heberlein, Bull. soc. chim., E),
6, 533 A939).
«Froschl, Maler, Heuberger, Monatsh., 59, 256 A932).
'Stephen, J. Chetn. Soc, 1930, 2786.
'Schuhe, Ber., 17, 1530 A884); Kikkoji, Biochem. Z., 35,
71 A911).
» Battershall, Ann., 168, 116 A873); L u d e w i g, там же, 379,
352 A911).
10 W e i 1, Ber., 44, 3058 A911); Weil, О s t e r m e i e г, там же,
54, 3217 A921).
"Bamberger, Boekraann, Ber., 20, 1118 A887).
12 Rousset, Bull. soc. chim., C), 17, 305 A897).
13 Monier — Williams, J. Chcm. Soc, 1906, 275; G a t t e r-
m a nn, Ann., 393, 228 A912).
14 Чичнбабин, Ber., 44, 447 A911).
15 \V u у t s, В e r m a n, L а с о u r t, Bull. soc. chim. Belg., 40,
665 A931).
16 F u 1 t о n, Robinson, J. Chem. Soc, 1939, 200; Williams,
J. Arn. Chem. Soc, 61, 2248 A939); Stephen, J. Chem. Soc, 127, 1874
A925).
"Fieser, H e r s h b e r g, J. Am. Chem. Soc, 62, 52 A940).
isRosenmund и сотрудники, Ber., 51, 585, 594 A918); 54, 2888
<1921); 55, 609 A922).
"Badger, J. Chem. Soc, 1941, 536.
334
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
НАФТ0РЕ30РЦИН
A,3-Диоксинафталин; 1,3-нафталиндиол)
Mg + CH2(COOC2H5J -» С2Н,ОМ§СН (СООС2Н,
+ C2H5OMgCH (COOC2H5J ->
СН2СОС1
ос2н5
^\
ОС
он
H2SO4
|
СООС2Н5
со
\6it
Ва(ОНJ
он
он
I соон
затеи H2SO4
он
Нагревание
ОН
он
Предложили: К- Мгйер и Г. Блох.
Проверили: X. Снайдер и К. Смит.
Получение
Этиловый эфир фенилацетилмалоновой кислоты. Трехгорлую
круглодонную колбу емкостью 1 л снабжают капельной воронкой
(примечание 1) и обратным холодильником, защищенным хлор-
кальциевой трубкой. Перед сборкой прибор промывают абсолют-
абсолютным спиртом, полученным в перегонной колбе (примечание 2).
Для этого через капельную воронку в прибор перегоняют 90 мл
спирта, ополаскивают им колбу и затем спирт выливают. В реак-
реакционную колбу помещают 12,5 г @,52 грамматома) магниевых
стружек, 1 мл четыреххлористого углерода (примечание 3) и 40 г
@,25 моля) малонового эфира (примечание 3); затем в капельную
воронку перегоняют 90 мл абсолютного спирта и вливают его
в колбу. Реакция начинается при нагревании; когда холодильник
начнет «захлебываться», ход .реакции регулируют, погружая
колбу в баню со льдом. После того как интенсивность протекания
реакции несколько уменьшится, к смеси прибавляют в один
прием еще 40 г @,25 моля) малонового эфира. Когда ход реакции
снова замедлится, колбу слегка охлаждают, прибавляют к ее
содержимому 180 мл абсолютного эфира и реакционную смесь
нагревают в течение 1 часа на паровой бане. Затем через капель-
НАФТОРЕЗОРЦИН
335
ную воронку к смеси медленно (в течение примерно получаса)
прибавляют небольшими порциями 88 г G4 мл, 0,57 моля) хлор-
ангидрида фенилуксусной кислоты, разбавленного 90 мл абсо-
абсолютного эфира. Скорость прибавления регулируют таким обра-
образом, чтобы бурное протекание реакции перед прибавлением
каждой новой порции успевало стать менее интенсивным. После
того как весь хлорангидрид будет прибавлен, колбу нагревают
на паровой бане в течение 10 мин. и после охлаждения смеси
прибавляют к ней в течение получаса по каплям 100 мл воды.
Маслянистый слой промывают двумя порциями воды по 100 мл,
сушат над сернокислым натрием и эфир отгоняют в вакууме
водоструйного насоса. Неочищенный этиловый эфир фенилацетил-
фенилацетилмалоновой кислоты (87 мл) остается в колбе в виде красноватого
довольно вязкого масла.
Этиловый эфир 1,3-диокси-2-нафтойной кислоты. В 1-литро-
1-литровую колбу помещают 3 объема B61 мл) концентрированной сер-
серной кислоты и к ней без охлаждения сразу добавляют 1 объем
(87 мл) сырого этилового эфира фенилацетилмалоновой кислоты;
раствор оставляют стоять примерно в течение недели (примеча-
(примечание 4). После этого смесь вместе с осадком, который мог обра-
образоваться, медленно при помешивании выливают в сосуд, содер-
содержащий 1 кг льда и 500 мл воды (примечание 5); эфир 1,3-диокси-
2-нафтойной кислоты, получающийся в виде желтого осадка„
отфильтровывают с отсасыванием, промывают небольшим коли-
количеством холодной воды, отжимают в течение получаса на фильтре
с помощью резиновой трамбовки и сушат в вакуум-эксикаторе-
Выход сложного эфира ст. пл. 80° составляет 58—68 г E0—59%
теоретич., считая на взятый малоновый эфир).
В результате перекристаллизации 50 г сложного эфира из
300 мл 70%-ного спирта (примечание 6) получают 45 г желтых
игольчатых кристаллов с т. пл. 82°.
1,3~Диокси-2-нафтойная кислота. В 1-литровую трехгорлую
круглодонную колбу, снабженную механической мешалкой, труб-
трубкой для ввода азота и обратным холодильником, в верхней части
которого с помощью пробки с вырезами укреплена делительная
воронка, помещают 20,9 г @,09 моля) перекристаллизованного
этилового эфира 1,3-диокси-2-нафтойной кислоты, растворенного
в 300 мл диоксана. Через прибор пропускают ток азота; содержи-
содержимое колбы перемешивают и, нагревая раствор на паровой бане,
прибавляют к нему в течение 1 часа раствор 40 г @,13 моля) гидрата
окиси бария Ва(ОНJ-8Н2О. Нагревание и перемешивание про-
продолжают в течение 3 час. Осадок бариевой соли, которая может
быть окрашена (от желтого до зеленовато-серого цвета), отфиль-
отфильтровывают из горячего раствора и немедленно переносят в холод-
холодный B5°)'раствор 11 мл концентрированной серной кислоты в \&5мл
воды, который помещен в трехгорлую круглодонную колбу емкостью
336
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
500 мл, снабженную трубкой для ввода азота, механической
мешалкой и обратным холодильником. Смесь перемешивают
в атмосфере азота в течение 5 мин. без нагревания (примечание?).
Осадок отфильтровывают, промывают небольшим количеством
дестиллированной воды, переносят в стакан и экстрагируют
двумя порциями горячего абсолютного спирта по 100 мл. К теп-
теплому фильтрату прибавляют 200 мл воды и оставляют раствор
охлаждаться в течение 2 час. в бане со льдом. Неочищенную
кислоту отфильтровывают; она имеет вид мелкого желтого порошка;
т. пл. 135° (примечание 8). Выход кислоты составляет 16,5 г
(90% теоретич.).
Нафторезорцин. В трехгорлую круглодонную колбу емкостью
200 мл, снабженную трубкой для ввода азота, мешалкой и обрат-
обратным холодильником, помещают 65 мл воды и кипятят ее, чтобы
удалить растворенный кислород. К кипящей воде прибавляют
16,5 г неочищенной кислоты (примечание 9) и смесь кипятят в тече-
течение 2 час. при перемешивании в атмосфере азота. С пастообраз-
пастообразного остатка сливают воду; остаток кипятят в течение 2 час. с 35 мл
воды, которую затем декантируют через фильтр и соединяют
с первым раствором. К полученной красной жидкости прибавляют
гидросульфит натрия в количестве @,3—0,5 г), как раз достаточ-
достаточном для ее обесцвечивания; затем в этой жидкости растворяют
15 г хлористого натрия и смесь оставляют стоять при 5° в течение
суток. Часть нафторезорцина выделяется в виде масла, которое
при дальнейшем охлаждении затвердевает в красноватую твер-
твердую массу; остальной нафторезорцин выпадает в осадок в виде
бесцветных или желтоватых пластинок. Выход составляет
7,0—7,3 г E4—56% теоретич.). После стояния в течение суток
в вакуум-эксикаторе над хлористым кальцием кристаллы плавят-
плавятся при 119—122°, а твердая масса — при 110—118°.
К 100 мл горячей воды прибавляют 3,5 г красноватого твердого
вещества и такое количество гидросульфита натрия, которое
как раз достаточно для удаления красной окраски; к смеси доба-
добавляют 0,3 г активированного березового угля. Смесь фильтруют,
в фильтрате растворяют 7 г хлористого натрия, и оставляют
раствор стоять в. закрытом сосуде при 5° в течение суток. Выход
нафторезорцина, выпадающего в осадок в виде больших, почти
прозрачных пластинок с т. пл. 122—124° (примечание 10), соста-
составляет 2,6 г (выход при перекристаллизации равен 75%).
Примечания
1. Чтобы измерить объем спирта, который должен быть исполь-
использован, в капельную воронку наливают такое же количество воды
(90 мл) и на уровне ее поверхности приклеивают полоску бумаги.
После этого воду выливают и воронку тщательно высушивают.
НАФТОРЕЗОРЦИН
337
2. В 2-литровую перегонную колбу, снабженную обратным
холодильником, помещают 1 л продажного абсолютного спирта
и сушат его нагреванием с металлическим натрием и диэтиловым
эфиром фталевой кислоты1. На боковой отвод колбы надевают
короткий кусок резиновой трубки, запертой винтовым зажимом.
В следующей стадии обратный холодильник заменяют холодиль-
холодильником, обращенным вниз.
3. Этиловый эфир, четыреххлористый углерод и малоновый
эфир сушат над безводным сернокислым магнием. Малоновый
эфир перед применением следует перегнать.
4. Если раствор в серной кислоте оставить стоять в течение
только 2 дней, то выход этилового эфира 1,3-диокси-2-нафтойной
кислоты снизится до 45%.
5. После прибавления 25 мл раствора полученного эфира
в серной кислоте смесь перемешивают до тех пор, пока не выпа-
выпадает желтый осадок. В этом случае осаждение основной порции
вещества после прибавления остального количества раствора
будет происходить весьма гладко.
6. Можно также перекристаллизовать эфир, растворив его
в диоксане и затем осадив водой.
7. Бариевую соль можно разложить также и соляной кисло-
кислотой. Однако при проверке не удалось в этом случае получить
препарат, свободный от бария.
8. Авторы синтеза выделяли чистую кислоту следующим
образом. К 0,5 г сырой кислоты они прибавляли 200 мл кипящей
воды и смесь нагревали в течение короткого времени, чтобы уско-
ускорить растворение, а затем немедленно фильтровали ее. Фильтрат
охлаждали энергичным взбалтыванием в бане со льдом. Прибавле-
Прибавление к раствору 1 мл концентрированной соляной кислоты вызы-
вызывало выделение кристаллов, которые отфильтровывали после
дополнительного охлаждения льдом в течение получаса, промывали
ледяной водой и сушили в вакууме над фосфорным ангидридом.
Выход вещества с т. пл. от 138,5—140,5 до 146,5° составлял 62%.
9. Вещество имеет тенденцию стать полупластичным; объем
массы уменьшается по мерс декарбоксилирования.
10. Если часть нафторезорцина выделяется в виде масла и затем
затвердевает, то препарат уже не получается в виде прозрачных
пластинок, хотя температура плавления его не изменяется
A22—124°). Выделение в виде масла можно предотвратить, если
охлаждать вещество медленно при взбалтывании, внося в него
затравку. Другой метод окончательной очистки нафторезорцина
состоит в его возгонке при 120—130° A5-10~4 мм).
Другие методы получения
Нафторезорцин был получен нагреванием 1-амино-3-окси-4-
нафталинсульфокислоты или ее соли в воде или в слегка кислом
22 Сборник 3
338
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
растворе2, а также циклизацией этилового эфира фенилацетил-
малоновой кислоты3 или этилового эфира фенилацетоуксусной
кислоты4. Фенилацетилмалоновый эфир был получен конденса-
конденсацией хлорангидрида фенилуксусной кислоты с малоновым эфиром
в эфирной среде под действием натрия3.
1 М а н с к е, Синт. орг. преп., сб. 2, стр. 170, примечание 1.
2Friedlander, Rudt, Ber., 29, 1609 A896); герм. пат. 84990
IFrdl., 4, 229 A894—1897)]; герм. пат. 87429 [Frdl., 4, 584 A894—1897)];
герм. пат. 90096 [Frdl., 4, 585A894—1897)].
3Metzner, Ann., 298, 374 A897); W a g r e i с h, Roberts,
Harrow, Chemist-Analyst, 31, 59 A942).
«Soliman, West, J. Chem. Soc, 1944, 53.
НИКЕЛЬ РЕНЕЯ (КАТАЛИЗАТОР)
—> Ni + 2Na3AlO3+ 3H
Предложил: P. Мозинго.
Проверили: Г. Адкинс и Л. Ричарде.
Получение
В 4-литровый стакан (примечание 1), снабженный эффектив-
эффективной мешалкой (примечание 2), помещают раствор 380 г едкого
натра в 1 500 мл дестиллированной воды. Раствор охлаждают в бане
со льдом до 10° и затем прибавляют к нему небольшими порциями
при перемешивании 300 г сплава никеля с алюминием (примеча-
(примечание 3) с такой скоростью, чтобы температура не поднималась
выше 25° (примечание 4). Реакционный стакан во время этой
операции остается в бане со льдом. После прибавления всего
сплава (на что требуется около 2 час.) мешалку останавливают,
стакан вынимают из бани и оставляют стоять до тех пор, пока
его содержимое не примет комнатную температуру. После того
как выделение водорода замедлится, стакан с реакционной смесью
устанавливают на паровую баню и нагревают до тех пор, пока
выделение водорода не замедлится вновь (8—12 час). Нагрева-
Нагревание вначале не должно быть слишком быстрым, так как иначе
раствор в результате вспенивания может перелиться через верх
стакана. В течение этого времени объем раствора поддерживают
постоянным, для чего, если это потребуется, к нему прибавляют
дестиллированную воду. Когда нагревание будет окончено, никелю
дают осесть и большую часть раствора декантируют. Вновь дово-
доводят раствор до первоначального объема, прибавляя дестиллиро-
дестиллированную воду; массу перемешивают, чтобы перевести никель во
взвешенное состояние, снова дают ему осесть и раствор деканти-
декантируют. После этого никель переносят с помощью дестиллирован-
дестиллированной воды в 2-литровый стакан (примечание 5) и вновь деканти-
НИКЕЛЬ РЕНЕН (КАТАЛИЗАТОР)
339
руют воду. Затем к содержащемуся в стакане никелю прибавляют
раствор 50 г едкого натра в 500 мл дестиллированной воды; ката-
катализатор приводят во взвешенное состояние и дают ему осесть,
после чего щелочь декантируют. Никель промывают путем раз-
размешивания его в дестиллированной воде и декантации до тех пор,
пока реакция промывных вод на лакмус не станет нейтральной,
а затем еще десять раз, чтобы полностью удалить щелочь
(требуется 20—40 промываний; примечание 6). Затем никель
промывают три раза 200 мл 95%-ного спирта и три раза абсо-
абсолютным спиртом. Катализатор сохраняют в плотно закупоренных
склянках, доверху наполненных абсолютным спиртом (приме-
(примечание 7). Полученный препарат является весьма пирофорным,
и хранить его следует всегда под слоем жидкости. Выход никеля
Ренея, содержащегося в суспензии, составляет около 150 г (при-
(примечание 8).
Для получения катализатора в среде метилциклогексана (при-
(примечание 9) препарат, приготовленный так, как было указано
выше, и отмытый водой от щелочи, но не обработанный еще спир-
спиртом, заливают 1 л метилциклогексана. Затем этот углеводород
отгоняют на масляной бане до тех пор, пока вместе с ним не отго-
нится вся вода. Время от времени в колбу добавляют метилцикло-
гексан, так чтобы никель постоянно находился под слоем жидкости.
Когда катализатор окажется свободным от воды, он образует
с метилциклогексаном суспензию.
Для получения никеля в среде диоксана используют приве-
приведенную выше методику, заменяя метилциклогексан на диоксан
(примечание 10); в этом случае перегонку продолжают до тех.
пор, пока температура в парах не достигнет 101°.
(Внимание! Не следует пользоваться никелем в диоксане при
температуре выше 21СР, так как в этом случае реакция диоксана
с водородом и никелем может сопровождаться взрывом.)
Примечания
1. Батарейный толстостенный стакан из стекла пирекс емко-
емкостью 10 л также пригоден для получения никеля Ренея в коли-
количестве, в два-три раза превышающем приведенное в прописи.
2. Мешалка должна приводиться во вращение таким двигате-
двигателем, который не вызывал бы воспламенения водорода. Поэтому
следует применять индукционный мотор или мешалку, приво-
приводимую в действие воздухом. Лопасти мешалки могут быть сде-
сделаны из стекла, монель-металла или из нержавеющей стали.
3. Применяемый сплав содержал около 50% никеля.
4. Термометр не следует оставлять в щелочи, иначе его шарик
может оказаться разъеденным, а от действия ртути катализатор
22*
340
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
потеряет активность. Если при этой температуре смесь будет
слишком сильно пениться, к ней можно прибавить 2 мл н-октило-
вого спирта; однако обычно в этом нет необходимости.
5. Мерный цилиндр с притертой пробкой емкостью в 2 л более
подходит для этой цели, чем обыкновенный 2-литровый стакан.
6. Число необходимых промываний можно существенно умень-
уменьшить, если предоставить некоторое время для диффузии щелочи
с поверхности катализатора в окружающую промывную воду.
Для этой цели катализатор каждый раз тщательно перемешивают
с 1 500 мл волы, после чего в течение 3—10 мин. предоставляют
возможность идти диффузии. Затем смесь опять перемешивают
и промывную воду декантируют, как только катализатор осядет
на дно. При таком методе для полного удаления следов щелочи,
адсорбированной на поверхности катализатора, достаточно 20 про-
промываний.
7. Количество приготовляемого катализатора не должно пре-
превышать шестимесячной потребности, так как при хранении свой-
свойства катализатора ухудшаются.
8. Более правильно измерять объем катализатора, а не взве-
взвешивать его. Никель Ренея в спирте содержит около 0,6 г катали-
катализатора в 1 мл осевшей массы. Для измерения количества катализа-
катализатора удобно пользоваться чайной или столовой ложкой. Чайная
ложка (наполненная до краев) соответствует примерно 3 е никеля.
9. Необходимо, чтобы во время восстановления катализатор
находился в реакционной смеси во взвешенном состоянии. По-
Поэтому жидкость, под которой хранится никель, в течение всего
процесса должна быть растворимой в восстанавливаемой смеси,
т. е. как в исходном веществе, так и в продукте восстановления.
10. Применяемый диоксап должен быть сухим, не содержащим
галоидов и перегнанным над натрием.
Другие методы получения *
Никель Ренея был получен из сплава никеля и алюминия1
при действии раствора едкого натра2.
1 R a n e у, ам. пат. 1628190 A927).
2 С о v e r t, A d k i n s, J. Am. Chem. Soc, 54, 4116 A932).
* Большой интерес представляет скелетный никелевый катализатор,
приготовленный по способу А. А. Бага с сотрудниками (А. А. Баг,
Д. Ф. В о л о к и т и н, Т. П. Е г у п о в, сов. пат. 23523 от 31 октября
1931 г) По предложенной прописи сплав никеля с алюмавием готовится с го-
гораздо большим содержанием алюминия G0% А1 и 30% Ni), чем по методике
Ренея- при этом выщелачивание производится с таким расчетом, чтобы алю-
алюминии'был выщелочен только с поверхности. Такой катализатор-сплав обла-
обладает большей стойкостью, чем катализатор Ренея, и дает возможность прово-
проводить реакцию в проточной системе. (Прим. ред.)
нитрил изомасляной кислоты
341
НИТРИЛ ИЗОМАСЛЯНОЙ КИСЛОТЫ
(Изобутиронитрил)
(СН3J CHCN + Н2О
(СН3J CHCONH2 — -
Предложили: Р. Кент и С. Мак-Эльвен.
Проверили: К- Ноллер и Д. Фразиер.
Получение
К 308 г B,1 моля) фосфорного ангидрида, помещенным в 3-лит-
3-литровую круглодонную колбу, прибавляют 174 г B моля) тщательно
измельченного сухого амида изомасляной кислоты (примечание 1).
Колбу плотно закрывают пробкой и встряхивают, чтобы тщатель-
тщательно перемешать оба находящихся в ней сухих твердых вещества.
Затем к колбе присоединяют обращенный вниз холодильник с во-
водяным охлаждением, к которому в качестве приемника присоеди-
присоединяют при помощи резиновой пробки склянку для отсасывания
емкостью 500 мл. Боковой отвод приемника защищают хлоркаль-
циевой трубкой и приемник погружают в колотый лед. Реакцион-
Реакционную колбу нагревают в течение 8—10 час. на масляной бане с элек-
электрическим обогревом; температуру бани поддерживают в пределах
200—220°. Почти сразу начинает отгоняться нитрил. Реакционная
смесь превращается в густой, бурого цвета сироп, который к кон-
концу перегонки начинает сильно пениться. Продолжительность
реакции можно сократить до 1—2 час, если прибор присоединить
к водоструйному насосу и отгонять нитрил в вакууме (примеча-
(примечание 2). В результате дальнейшего нагревания реакционной смеси
можно получить дополнительно лишь очень незначительное ко-
количество вещества.
Содержимое приемника переносят в специальную колбу Клай-
зена1 емкостью 500 мл, прибавляют к нему 10—15 г фосфорного
ангидрида (примечание 3) и вещество перегоняют на масляной
бане, температуру которой поддерживают в интервале 145—155°.
После отделения нескольких капель головного погона основ-
основная фракция перегоняется при 99—102° G40 мм). Выход вещества
составляет 96—120 г F9—86% теоретич.). Перегнанный препарат
бывает бесцветным, но через несколько дней приобретает желтый
оттенок. Если вещество снова перегнать' над фосфорным анги-
ангидридом или безводным сернокислым кальцием, то оно кипит при
101 —103° и остается бесцветным. Показатель преломления пре-
препарата лЬ5 1,3713.
Примечания
1. Амид изомасляной кислоты должен быть совершенно сухим,
так как, в противном случае, реакция начнется немедленно с выде-
342
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
НИТРИЛ МАЛОНОВОЙ КИСЛОТЫ
343
лением значительного количества тепла и выход нитрила умень-
уменьшится в результате того, что реагирующие вещества не будут
должным образом перемешаны. Если амид не будет тщательно
измельчен, то выход нитрила резко сократится.
2. Такое изменение методики не оказывает влияния на ве-
величину выхода, если принять меры против того, чтобы нитрил
изомасляпой кислоты не испарялся в приемнике. Если склянку
держать погруженной в колотый лед и между приемником и водо-
водоструйным насосом установить предохранительную ловушку, охла-
охлаждаемую смесью сухого льда с ацетоном, то потери нитрила
исключаются.
3. При прибавлении фосфорного ангидрида к нитрилу изо-
масляной кислоты жидкость застывает в полутвердый гель, ко-
который трудно вынуть из колбы. Поэтому прибавлять один реагент
к другому следует только в той колбе, из которой будет вестись
перегонка.
Другие методы получения
Нитрил изомасляной кислоты был синтезирован с помощью
целого ряда каталитических реакций в паровой фазе при повышен-
повышенных температурах. Этим путем он был получен из изобутиламина
над медью2 или никелем3; из амида изомасляной кислоты над
окисью алюминия4; из смеси аммиака и изомасляного альдегида
над двуокисью тория5; из смеси аммиака и изобутилового спирта
над медью6. Нитрил изомасляпой кислоты был также получен
декарбоксилированием 2-метил-2-цианпропионовой кислоты7 и вза-
взаимодействием изомасляной кислоты с роданистым калием8. Выше-
Вышеизложенная пропись представляет собой видоизменение метода,
который применяли Вальтер и Мак-Эльвен8.
1 Синт. орг. нреп., сб. 1, стр. 142, рис. 8.
2 Mai I h e, d e G о d о n, J. pharra. chira., G), 16, 225 A917) (Chem.
Zentr., 1918, 1, 819).
3 M a i 1 h e, d e G о d о n, Bull. soc. chim., D), 21, 288 A917).
4 В о е h m e r, Andrews, J. Am. Chem. Soc, 38, 2504 A916).
5 M a i 1 h e, Compt. rend., 166, 216 A918).
' H a r a, Koraatsu, Mem. Coll. Sci. Kyoto Imp. Univ., 8A, 241
A925) [C. A., 19, 3248 A925)].
'Hoffmann, Barbie r, Bull. soc. chim. Belg., 45, 565 A936)
[C. A., 31, 919 A937)].
8 Letts, Ber., 5, G71 A872).
«Walter, M с E 1 v a i n, J. Am. Chem. Soc, 56, 1615 A934).
НИТРИЛ МАЛОНОВОЙ КИСЛОТЫ
2NCCH2CONH2 + POC13 ->. 2CH2 (CNJ +HPO3 + 3HC1
Предложил: А. Сюррей.
Проверили: Ч. Аллен и Дж. ВанАллан.
Получение
В 12-литровую трехгорлую круглодонную колбу, снабженную
мощной мешалкой (примечание 1) и обратным холодильником,
помещают 1 260 г A5 молей) цианацетамида1, 1 кг соли''(приме-
соли''(примечание 2) и 5 л дихлорэтана. Смесь быстро перемешивают в течение
15 мин., после чего к ней прибавляют 800 мл (8,75 моля) хлор-
окиси фосфора и кипятят содержимое колбы в течение 8 час. на
масляной бане (примечание 3). После того как смесь охладится
до комнатной температуры, ее фильтруют и осадок промывают
500 мл дихлорэтана. Соединенные вместе фильтраты помещают
в 12-литровую колбу, растворитель отгоняют и оставшийся сы-
сырой нитрил отделяют от небольшого количества выпавшего осад-
осадка путем декантации в 1-литровую колбу (примечание 4). К по-
последней присоединяют колонку, холодильник и несколько прием-
приемников и перегоняют нитрил малоновой кислоты в вакууме. Выход
фракции ст. кип. 113—118° B5мм) составляет570—654гE7—66%
теоретич.; примечание 5). Препарат можно освободить от не-
незначительного количества содержащейся в нем хлорокиси фос-
фосфора повторной перегонкой. После отделения головного погона,
собирающегося в количестве около 5 мл, нитрил малоновой кис-
кислоты перегоняется при 92—94° (8 мм).
Примечания
1. Рекомендуется использовать массивную мешалку с мото-
мотором, так как выделяющееся твердое вещество часто содержит
некоторое количество вязких примесей, затрудняющих переме-
перемешивание.
2. Прибавление соли дает возможность получать вещество
более светлой окраски, которое можно легко отфильтровать и про-
промыть.
3. Можно проводить реакцию в вытяжном шкафу или же выде-
выделяющийся хлористый водород улавливать с помощью газовой
ловушки для поглощения газов («Синт. орг. преп.», сб. 2, стр. 78,
рис. 3).
4. Целесообразнее пользоваться прибором на шлифах. В ка-
качестве дефлегматора применяют стандартный специального типа
дефлегматор Клайзена.
5. В опытах, проведенных автором синтеза с указанными ко-
. личествами исходных веществ, нитрил малоновой кислоты был по-
получен на этой стадии с выходом 70—72%, а в опытах с меньшими
количествами —с выходом 80%. Автор синтеза получал выход
того же порядка и при применении смеси хлорокиси фосфора
с небольшим количеством пятихлористого фосфора.
344
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Другие методы получения
Методы получения нитрила малоновой кислоты были уже
саны ранее2, за исключением приведенного выше варианта, при-
принадлежащего автору настоящей прописи3.
1 Корсон, Скотт, Возе, Синт. орг. преп., сб. 1, стр. 498.
! К о р с о н, Скотт, Возе, Синт. орг. преп., сб. 2, стр. 355.
3 S u r r e у, J. Am. Chera. Soc, 65, 2471 A943).
НИТРИЛ а-НАФТОЙНОЙ КИСЛОТЫ
a-C10H7Br+CuCN -> a-C10H,CN+CuBr
Предложил: М. Ньюмэн.
Проверили: Р. Шрайнер и Ф. Вольф.
Получение
В сухую колбу емкостью 200 мл, снабженную обратным хо-
холодильником на шлифе, защищенным от влаги воздуха хлор-
кальциевой трубкой, помещают в порядке перечисления 66 г
@,32 моля) a-бромнафталина (примечание 1), 35 г @,39 моля) сухой
порошкообразной закисной цианистой меди (примечание 2) и 30мл
пиридина (примечание 3). Смесь нагревают в течение 15 час. при
215—225° в бане из сплава Вуда (примечание 4). Полученный
гемнокоричневый раствор выливают еще горячим (около 100°)
в колбу, содержащую 150 мл водного аммиака (уд. вес 0,90)
и 150 мл воды. К смеси прибавляют 140 мл бензола, колбу закры-
закрывают пробкой и встряхивают до измельчения крупных кусков.
После того как смесь охладится до комнатной температуры,
к ней прибавляют 100 мл эфира и фильтруют ее (примечание 5).
Фильтрат переливают в делительную воронку емкостью 1 л и отде-
отделяют водный слой (примечание 6). Эфирно-бензольный слой промы-
промывают последовательно четырьмя порциями разбавленного водного
раствора аммиака по 100 мл (примечание 7), двумя порциями 6 н.
раствора соляной кислоты по 100 мл (примечание 8), двумя пор-
порциями воды по 100 мл и двумя порциями насыщенного раствора
хлористого натрия. Эфир и бензол отгоняют на водяной бане,
а остаток перегоняют в вакууме из специальной колбы Клайзсна
емкостью 125 мл. Температура быстро повышается, и выход бес-
бесцветного нитрила a-нафтойной кислоты с т. кип. 173—174° B7 мм)
[166—169° A8 мм)] составляет 40—44 г (82—90% теоретич.;
примечания 9 и 10).
Примечания
1. a-Бромнафталин («Синт. орг. преп.», сб. 1, стр. 127) пере-
перегоняют непосредственно перед применением и берут фракцию
с т. кип. 153—154° B2 мм).
НИТРИЛ a-НАФТОЯНОЯ КИСЛОТЫ
345
2. Применялась продажная закисная цианистая медь (в по-
порошке). Препарат должен быть сухим.
3. Применялся чистый пиридин, высушенный над окисью ба-
бария. При прибавлении пиридина к смеси выделяется значитель-
значительное количество тепла.
4. Температура плавления смеси расплавленных солей, при-
применяемой в качестве бани и состоящей из 8,5 части (по весу)
нитрита натрия и 10 частей нитрата калия, примерно равна 140°;
такая баня может заменить металлическую.
5. Медноаммиачный раствор действует на фильтровальную
бумагу, и его лучше всего фильтровать через стеклянный фильтр.
Можно использовать также двойной слой обыкновенной полот-
полотняной ткани в воронке Бюхнера.
6. Иногда, чтобы облегчить разделение, приходится дополни-
дополнительно прибавлять 50—100 мл эфира.
7. Если последняя порция раствора аммиака, служившего
для промывания, не бесцветна, то следует продолжать промыва-
промывание эфирно-бензольного раствора разбавленным водным аммиа-
аммиаком порциями по 100 мл.
8. Если при этом промывании выпадает осадок, то его сле-
следует отфильтровать.
9. Выходы бывают различными в зависимости от качества циа-
цианистой меди. Выходы, полученные при использовании партии этого
реагента, составляли только 60—75%. Можно работать также
и с большими количествами исходных веществ, однако количество
применяемого пиридина следует в таком случае сократить, иначе
кипение смеси будет слишком энергичным. При работе с 2 молями
a-бромнафталина оказалось достаточным применение 160 мл пи-
пиридина. Выход при больших загрузках составлял 81%.
10. Вместо a-бромнафталина можно использовать а-хлор-
нафталин [т. кип. 144—146,5° B9мм)]; однако в этом случае смесь
необходимо нагревать при 245—250° в течение суток. Выход
получается примерно таким же.
Другие методы получения
Нитрил a-нафтойной кислоты был получен из а-нафтиламина
по реакции ЗандмейераН* из a-хлорнафталина2 или из a-бром-
a-бромнафталина3 нагреванием с закисной цианистой медью; нагреванием
натриевой соли нафталинсульфокислоты с цианистым натрием4;
нагреванием амида a-нафтойной кислоты с пятихлористым фос-
фосфором5.
1 Rupe, Breutano, Helv. Chim. Acta., 19, 581 A936); McRae,
J. Am. Chem. Soc, 52, ;4550 A930); Clarke, Read, там же, 46, 001
A924).
2 Герм. пат. 293094 A916) [Frdi., 13, 269 A923)].
346
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
'Newman, J. Am. Chem. Soc, 59, 2472 A937).
4 W h i t m о r e, Fox, J. Am. Chem. Soc. 51, 3363 A929).
5 Bli eke, J. Am. Chem. Soc, 49, 2848 A927).
НИТРИЛ ЦИКЛОПРОПАНКАРБОНОВОЙ КИСЛОТЫ
(Циклоп ропилцшшд)
2Na + 2NH3 — 2NaNH2 + H2
CH2
/ \
С1СН2СНгСН2СЫ + NaNH2 -> CH2 — CHCN + NaC! -1- NH3
Предложил: М. Шлаттер.
Проверили: Р. Шрайнер и К. Бест.
Получение
Изображенный на рис. 17 прибор собирают в хорошо действую-
действующем вытяжном шкафу. В 2-литровую трехгорлую. колбу А, снаб-
снабженную мешалкой и специальным обратным холодильником,
Нононко
с патронной известью
Нолонна
с патронной известью
Рис. 17.
охлаждаемым сухим льдом, помещают 1 л жидкого аммиака и
0,5 г кристаллического водного азотнокислого железа. Холо-
Холодильник соединен с колонкой с натронной известью; колонка при
помощи тройника В соединена с источником сжатого воздуха.
В течение примерно 45 мин. к жидкому аммиаку прибавляют 92 г
D грамматома) металлического натрия в виде чистых стружек
и смесь перемешивают, пока не исчезнет синяя окраска A—2 часа).
В 5-литровую трехгорлую колбу Б, оборудованную подобным
же образом, помещают 1 500 мл жидкого аммиака и 440 г D,25 mo-
нитрил ЦИКЛОПРОПАНКАРБОНОВОИ КИСЛОТЫ
347
ля) нитрила у-хлормасляной кислоты («Синт. орг. преп.», сб. 1,
стр. 495). Колба Б соединена с колбой А, в которой находится
амид натрия, при помощи 12-миллиметровой стеклянной трубки Г,
которая доходит до дна колбы А и оканчивается на 1 см ниже
резиновой пробки в одном из горл колбы Б. Энергично переме-
перемешивая реакционные массы в обеих колбах, медленно и не-
небольшими порциями (Внимание! Примечание 1) передавливают
суспензию амида натрия из колбы А в реакционную колбу Б
при помощи сжатого воздуха, подаваемого через тройник В. Ско-
Скорость прибавления контролируют, закрывая пальцем открытый
конец тройника. Вначале реакция протекает бурно, и раствор
амида натрия следует прибавлять только небольшими порциями.
В дальнейшем прибавление ведут с такой скоростью, чтобы общее
количество времени, требующееся для прибавления всего рас-
раствора, составляло 1—1,5 часа. Колбу с амидом натрия ополаски-
ополаскивают 300 мл жидкого аммиака и прибавляют промывную жидкость
к реакционной смеси, после чего перемешивание продолжают
еще 2 часа. В течение второго часа прекращают прибавление
сухого льда в обратный холодильник и аммиаку предоставляют
медленно испариться. После перемешивания в течение 2 час.
вводную трубку заменяют капельной воронкой и медленно при-
прибавляют через нее 1 л абсолютного эфира (примечание 2). Реак-
Реакционную смесь быстро фильтруют через воронку с пористым стек-
стеклянным фильтром и оставшийся на фильтре осадок промывают
двумя порциями абсолютного эфира по 200 мл (примечание 3).
Аммиак и эфир отгоняют иа водяной бане, пользуясь колонкой
с насадкой (примечание 4). Затем остаток перегоняют с той же
колонкой в вакууме водоструйного насоса (примечание 5). Выход
циклопропилцианида, кипящего при 69—70° (80 мм) [75—76°
(95 мм)], составляет 149—152 г E2—53% теоретич., считая на ни-
нитрил у-хлор масля ной кислоты; примечания 6 и 7). Затем давле-
давление снижают и неизменный нитрил -["Мормасляной кислоты со-
собирают при 93—97° B6 мм). Количество его достигает 52—62 г.
Примечания
1. Реакция протекает очень бурно, поэтому следует избегать
прибавления больших количеств раствора амида натрия. Не ре-
рекомендуется для регулирования прибавления применять краны
или зажимы.
2. Если не прибавить эфир еще до полного испарения аммиака,
то выход циклопропилцианида будет очень незначительным.
3. На этой стадии можно оставить смесь стоять в вытяжном
шкафу и предоставить аммиаку самопроизвольно испариться.
4. Вполне пригодна колонка с насадкой из зерен карборунда,
описанная на стр. 406.
348
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
5. Чтобы предотвратить потерю нитрила, желательно между
приемником и насосом поместить ловушку с сухим льдом; не сле-
следует также проводить перегонку в слишком глубоком вакууме.
6. Авторы синтеза указывают, что нитрил у-хлормасляной
кислоты может быть заменен эквивалентным количеством молей
нитрила -рброммасляной кислоты или смесью нитрилов f-хлор-
и у-броммасляных кислот. В случае применения бромпроизвод-
ного реакционную смесь следует кипятить в течение 6 час, при-
причем необходимо отфильтровать бромистый натрий непосредствен-
непосредственно перед окончательной перегонкой в вакууме.
7. Выход рассчитан на основании взятого количества ни-
нитрила у-хлормасляной кислоты. Если принять во внимание вы-
выделенное обратно количество этого реагента E2 — 62 г), то
выход циклопропилцианида составляет около 60% теоретического
количества.
Другие методы получения
Циклопропилцианид был получен повторной перегонкой нит-
нитрила -["хл0Рмаслян°й кислоты над порошкообразным едким
кали1" или над смесью едкого натра и окиси алюминия6. Полу-
Получение в небольших количествах циклопропилцианида из нитрила
f-хлормасляной кислоты действием на него натрия в жидком аммиа-
аммиаке или суспензии натрия в эфире описано в литературе7. Настоя-
Настоящая пропись основана па методике, которую разработал Шлаттер8.
1 Henry, Rec. trav. chim., 18, 228 A898).
2 Dalle, Bull. acad. roy. Belg., 1902, 36—79 (Chem. Zentr., 1902, I, 913).
3 В r u у 1 a n t s, Strassens, Bull. acad. roy. Belg., 1921, 702—719
fC. A., 17, 2872 A923)].
"Braun, Fussganger, К u h n, Ann., 485, 210 A925).
5 Nicolet, Sattler, J. Am. Chem. Soc, 49, 2068 A927).
6 С 1 о k e, J. Am. Chem. Soc, 51, 1180 A929).
' Cloke, Anderson, Lachman, Smith, J. Am. Chem.
Soc, 53, 2791 A931).
8 S с h 1 a t t e r, J. Am. Chem. Soc, 63, 1733 A941).
o-H ИТРОБЕНЗАЛЬДЕГИД
0-O2NCaH4CHs + 2 (CH3COJO
CrO3
o-O2NCbH4CH (OCOCH3)a + 2CH3COOH
HCI
o-02NCeH4CH(OCOCH3J-i-H20 —-^ 0-O2NC6H4CHO + 2CH8COOH
Предложили: С. Тзане, Э. Вуд и Дж. Джонсон.
Проверили: Л. Смит и Дж. Опи.
Получение
о-Ншпробензальдиацетат. В 2-литровую трехгорлую кругло-
донную колбу, снабженную эффективной механической мешалкой
о-Н ИТРОБЕНЗАЛ ЬДЕГИД
349
и термометром и погруженную в баню со льдом, помещают 600 г
E70 мл) ледяной уксусной кислоты, 565 мл F12 г, 6 молей)
уксусного ангидрида и 50 г @,36 моля) о-нитротолуола. К, этому
раствору медленно при перемешивании прибавляют 156 г (85мл,
1,5 моля) концентрированной серной кислоты. Когда смесь охла-
охладится до 5°, к ней небольшими порциями прибавляют 100 г A моль)
хромового ангидрида с такой скоростью, чтобы температура не под-
поднималась выше 10°; на это требуется около 2 час. (примечание 1).
После прибавления хромового ангидрида перемешивание про-
продолжают в течение еще 5 час. (примечание 2). Затем реакцион-
реакционную смесь переливают в большой глиняный сосуд, на две трети
заполненный колотым льдом, и добавляют к ней холодную воду
в таком количестве, чтобы общий объем содержимого сосуда со-
составлял около 6 л. Смесь энергично перемешивают в течение не
менее 15 мин., чтобы ускорить затвердевание маслянистого слоя
(примечание 3). Твердое маслянистое вещество отфильтровывают
с отсасыванием на воронке Бюхнера, промывают холодной водой,
а затем перемешивают механической мешалкой с 500 ли холодного
2%-ного раствора соды. Твердое вещество отфильтровывают,
промывают холодной водой и сушат на воздухе. Неочищенный
препарат нагревают при перемешивании в течение получаса
со 150 мл петролейного эфира (т. кип. 60—70°), охлаждают
и фильтруют (примечание 4). Затем вещество высушивают в
вакуум-эксикаторе. Выход составляет 21—22 г B3—24% тео-
ретич.); т. пл. 87—88° (примечание 5).
о-Нитробензальдегид. Суспензию 51,6 г диацетата в смеси
500 г B72 мл) концентрированной соляной кислоты, 450 мл воды
и 80 мл спирта перемешивают и кипятят с обратным холодиль-
холодильником в течение 45 мин. Затем смесь охлаждают до 0°; твердое
вещество отфильтровывают с отсасыванием и промывают водой
(примечания 6 и 7). Сырой препарат очищают быстрой перегон-
перегонкой с водяным паром. При этом применяют эффективный холо-
холодильник длиной 100 см и тщательно охлаждают приемник. В те-
течение получаса собирают приблизительно 3500 мл дестиллата;
последний по охлаждении фильтруют и о-нитробензальдегид су-
сушат в эксикаторе иад хлористым кальцием. Выход о-нитробенз-
альдегида составляет 23,7 г G4% теоретич.); т. пл. 44—45°.
Примечания
1. Очень существенно во время прибавления хромового анги-
ангидрида регулировать температуру в указанных пределах, так как,
если она поднимется значительно выше, реакция может стать
бурной.
2. На последней стадии окисления образуется твердая смо-
смолистая масса. Поэтому перемешивание становится все более
350
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
затруднительным и требует применения мощного мотора. В ре-
реакционную колбу после декантации жидкой части реакцион-
реакционной массы прибавляют лед и небольшое количество воды (общий
объем должен составлять 1 л, учитывая количества всех ука-
указанных выше компонентов) и массу разбивают шпателем. Затем
суспензию присоединяют к смеси, находящейся в большом гли-
глиняном сосуде.
3. Очень важно энергично перемешивать масляный слой
до тех пор, пока он не затвердеет; в противном случае при по-
последующем фильтровании будут большие потери.
4. Эта обработка приводит к удалению не вступившего в ре-
реакцию о-нитротолуола.
5. При проверке исходные реагенты были взяты также в коли-
количествах, в три раза превышающих указанные в прописи. Выход,
выраженный в процентах, оставался таким же.
6. В одном из опытов авторы синтеза заменили соляную кис-
кислоту эквивалентным количеством серной кислоты и, не производя
фильтрования, непосредственно перегнали смесь с водяным па-
паром. Выход о-нитробензальдегида составлял 74,7% теоретиче-
теоретического количества; его температура плавления не изменилась
D4—45°).
7. Неочищенный альдегид можно высушить, а затем очистить,
перегонкой в вакууме. Можно использовать обычную колбу Клай-
зена. Фракционирование не является обязательным; перегонка
служит только для того, чтобы удалить небольшое количество
смолистых примесей. Пределы кипения довольно широки [120—
144°C—6 мм)], но весь дестиллат в целом C0 г из 66 г диацетата)
затвердевает и плавится при 44—45°. Альдегид можно также пе-
перекристаллизовать, хотя и с некоторыми потерями. С этой целью
11 г твердого вещества растворяют в толуоле B—2,5 мл толуола
на 1 г вещества) при комнатной температуре, раствор разбавляют
петролейным эфиром (т. кип. 30 — 60°; 7 мл эфира на 1 мл
раствора) и охлаждают до --10° или до более низкой темпера-
температуры. Выход бледножелтых игольчатых кристаллов составляет
9 г; т. пл. 44—45°.
Другие методы получения
о-Нитробензальдегид был получен действием окислов азота
на о-нитробензиловый спирт1; окислением о-нитрокоричной кис-
кислоты или ее эфира перманганатом или азотистой кислотой2; окис-
окислением о-нитрофенилпировиноградной кислоты перманганатом3.
о-Нитробензальдегид может быть также получен различными пу-
путями, исходя из о-нитротолуола. Сюда относятся: действие изо-
амилнитрита и этилата натрия с последующим омылением полу-
полученного о-нитро-аи/тш-бензальдоксима концентрированной соля-
п-НИТРОБЕНЗПЛАЦЕТАТ
351
ной кислотой*; непосредственное действие ряда окислителей,
как, например, двухромовокислого калия и серной кислоты6,
двуокиси марганца6, окиси никеля7 и двуокиси церия8; действие
окиси ртути в присутствии щелочи с последующим гидролизом
полученного о-нитробензальд'имеркуриоксида азотистой или азот-
азотной кислотой9; действие раствора хромовой кислоты в уксусной
кислоте и уксусном ангидриде с последующим гидролизом полу-
полученного о-нитробепзальдиацетата1и. о-Нитробензальдегид обра-
образуется также, наряду с большим количеством ж-нитробенз-
альдегида, при непосредственном нитровании бензальдегида11.
'Cohen, Harrison, J. Chem. Soc, 71, 1057 A897).
2Friedla'nder, Hcnriqucs Ber., 14, 2803 A881).
3 R e i s s e r t, Ber., 30, 1042A897).
4Lapworth, J. Chem. Soc, 79, 1274 A901); Farbwerke vorm.
Meister, Lucius und Burning, герм. пат. 107095 (Chem. Zentr., 1900, I, 886).
5 L a u t h, Bull. soc. chim. C), 31, 133 A904).
6 Q i 1 1 i a r d, M о n n e t, С a r t i e г, герм. пат. 101221 (Chem.
Zentr., 1899, I, 959); Badische Anilin- u. Sodafabr., герм. пат. 175295 (Chem.
Zentr., 1906, II, 1589).
' Badische Anilin- u. Sodafabr., герм. пат. 127388 (Chem. Zentr.,
1902, I, 150).
8 Farbwerke vorm. Meister, Lucius und Briining, герм. пат. 174238
(Chem. Zentr., 1906, II, 1297).
9 R e i s s e r t, Ber., 40, 4216, 4220 A907); герм. пат. 186881 (Chem.
Zentr. 1907, I 1295).
10 T h i e 1 e, Winter, Ann.. 311, 356 A900).
"Friedlander, Henrique s, Ber., 14, 2801 A881).
л-Н ИТРОБЕНЗИЛАЦЕТАТ
(п-Ншпробензиловый эфир уксусной кислоты)
n-0jNC6H4CH2Cl + Na0C0CHs —> п-О,ЫС6Н4СН2ОСОСН3 +NaCl
Предложили: В. Хартмян и Э. Рарс.
Проверили: Р. Шрайнер и Ч. Расселл.
Получение
В 2-литровую колбу помещают 250 г A,46 моля) хлори-
хлористого п-нитробензила, 225 г B,74 моля) расплавленного уксусно-
уксуснокислого натрия и 375 г F,25 моля) ледяной уксусной кислоты
и кипятят эту смесь с обратным холодильником в течение 8—10 час.
на масляной бане, поддерживая температуру последней в преде-
пределах 160—170° (примечание 1). По истечении этого времени бане
дают охладиться до 125° и отгоняют уксусную кислоту в вакууме.
Необходимо соблюдать осторожность и не понижать давление
слишком быстро в начале перегонки. По мере того, как этот процесс
замедляется, давление продолжают понижать до тех пор, пока
оно не достигнет 50 мм или еще более низкого значения, причем
352
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
температуру медленно повышают до 160°. Для полного удаления
уксусной кислоты требуется 2,5—3 часа. После этого к остатку
прибавляют около 500 мл воды и твердую массу разбивают
стеклянной палочкой (примечание 2).
Затем все содержимое колбы переносят в стакан емкостью
1 500 мл и перемешивают с помощью механической мешалки, пока
все кусочки не будут разбиты, на что потребуется около получаса;
тщательно измельченную массу фильтруют через воронку Бюх-
Бюхнера и промывают 200 мл холодной воды. Перемешивание, филь-
фильтрование и промывание повторяют дважды. После этого вещество
помещают в стакан емкостью 1 500 мл и, прибавив к нему
500 мл метилового спирта, нагревают до кипения, чтобы пере-
перевести в раствор. Горячий раствор фильтруют через обогреваемую
воронку Бюхнера и оставляют медленно охлаждаться. Когда
температура раствора упадет до 20°, вещество отфильтровывают с
отсасыванием и сушат на воздухе. Первая порция препарата со-
состоит из желтых игольчатых кристаллов ст. пл. 74—77", выход
которых составляет 215—225 г. Фильтрат выпаривают до 100 мл
и охлаждают. В осадок выпадает дополнительно 25—30 г твер-
твердого ве'щества. Обе порции вновь промывают холодной водой и
перекристаллизовывают из 500 мл горячего метилового спирта.
Первая порция вещества, получающаяся при этой второй пере-
перекристаллизации, составляет 210—218 г; т. пл. 77—78°. Выпари-
Выпаривание фильтрата до объема 100 мл и последующее охлаждение
дают дополнительно 15—18 г ацетата, который очищают перекри-
перекристаллизацией из метилового спирта; таким образом получают
еще 12—15 г вещества. Общий выход л-нитробензилацетата, по-
полученного в виде желтых кристаллов с т. пл. 77—78°, достигает
222—233 г G8—82% теоретич.).
Примечания
1. Был применен продажный хлористый л-нитробензил.
2. Твердую массу можно удалить из колбы, если в последнюю
внести 500 мл кипящей воды; ацетат плавится и образует масля-
маслянистый слой. Если колбу быстро^охладить в бане со льдом, энер-
энергично перемешивая расплавленную жидкость, то эфир затвердеет
в виде небольших кусочков. Очистка такого рода, повторенная
два или три раза, не приводит, повидимому, к лучшим результа-
результатам, чем очистка холодной водой.
Другие методы получения
п-Нитробензилацетат был получен действием спиртового
раствора уксуснокислого калия на хлористый1 или бромистый2
л-нитробензил, а также нитрованием бензилацетата3.
п-НИТРОБЕНЗИЛОВЫЙ СПИРТ
353
Grim a ux, Zcit. fur Chem., 1867, 562.
Reid, J. Am. Chem. Soc, 39, 130 A917).
Бейльштейн, Кульберг, Arm., 147, 340 A868).
л-НИТРОБЕНЗИЛОВЫЙ СПИРТ
n-O2NCeH4CH2OCOCH3 -f NaOH -> n-O2NCeH4CH2OH + CH3CO2Na
Предложили: В. Хартман и Э. Рарс.
Проверили: Р. Шрайнер и Ч. Расселл.
Получение
В 2-литровой колбе приготовляют раствор 218 г A,12 моля)
л-нитробензилацетата (стр. 351) в 500 мл горячего метилового
спирта. К горячему раствору прибавляют 380 г A,43 моля)
15%-ного раствора едкого натра, причем для предотвращения
слишком бурного кипения щелочь прибавляют сперва медленно
и при взбалтывании. После того как смесь постоит в течение
5 мин.,ее выливают в 4 500 г смеси измельченного льда с водой
при энергичном перемешивании от руки. Осадок отфильтровывают
с отсасыванием на воронке Бюхнера и перекристаллизовывают из
3 000—3 700 мл горячей воды с добавлением 15 г активированного
березового угля. л-Нитробензиловый спирт сушат в течение не-
нескольких часов при 60—65° в сушильном шкафу. Препарат хра-
хранят в герметически закупоренных банках (примечание 1). Выход
вещества, имеющего вид тонких почти бесцветных игольчатых
кристаллов, составляет ПО—121 г F4—71% теоретич.); т. пл.
92—93° (примечание 2).
Примечания
1. Препарат желтеет, если его разложить тонким слоем и
сушить на воздухе.
2. Авторы синтеза сообщают, что таким же способом можно
получить л-иодбензиловый спирт, причем ацетат в этом случае
выделять не требуется. Синтез производят следующим образом.
Смесь 148 г бромистого л-иодбеизила, 52 г уксуснокислого калия
и 750 мл 95%-ного этилового спирта кипятят с обратным холо-
холодильником в течение 8 час; затем ее охлаждают и выпавшую в
осадок соль отфильтровывают. К фильтрату прибавляют 33,6 г
едкого кали и кипятят смесь с обратным холодильником в тече-
течение 6 час. Затем ее разбавляют 2 л воды и экстрагируют масло
500 мл хлороформа. Раствор упаривают до 150 мл и сильно
охлаждают, в результате чего выкристаллизовывается л-иодбен-
л-иодбензиловый спирт. Последний отфильтровывают и промывают петро-
лейным эфиром; петролейный эфир, служивший для промывания,
23 Сборник 3
354
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
прибавляют к маточному раствору, в результате чего выделяется
дополнительное количество л-иодбензилового спирта. Общий вы-
выход составляет 95—100 г (81—86% теоретич.); температура пла-
плавления полученного вещества 70—72°.
Другие методы получения
л-Нитробензиловый спирт был получен электролитическим1
или химическим2 окислением л-нитротолуола, а также омылением
л-нитробензилацетата3>4. л-Иодбензиловый спирт был получен
омылением бромистого л-иодбензила или л-иодбензилацетата5'6.
1 Е 1 b s, Ber. (Ref.), 29, 1122 A896).
2 D i e f f e n b а с h, герм, пат, 214949 [Frdl,, 9, 156 A908-1910)].
» Бемьштейн, Кульберг, Ann., 147, 343 A868).
1 В a s I e r, Ber., 16, 2715 A883).
5 М a b e r у, Jackson, Ber., 11,56A878).
«Jackson, Mabery, Am. Chem. J., 2, 251 A880).
НИТР030БЕН30Л
Zn
C°H*NO* W C'H*NHOH -Si5T QH5N°
Предложили: Дж. Кольмэн, Ч. Мак-Клоски и Ф. Стюарт.
Проверили: В. Бахман, Н. Депо и Р. Эдоюертон.
Получение
В глиняный сосуд емкостью 20 л (примечание 1) помещают
250 мл B,44 моля) нитробензола (примечания 2 и 3) и раствор
150 г хлористого аммония в 5 л воды; смесь энергично пере-
перемешивают (примечание 4) и в течение 5 мин. прибавляют к ней
небольшими порциями 372 г E,15 моля) цинковой пыли с содержа-
содержанием цинка 90%. Примерно через 5 мин. после прибавления цин-
цинка начинается протекание основной реакции и температура смеси
повышается. Когда температура достигнет 65°, к смеси при пере-
перемешивании добавляют лед в количестве, достаточном для того,
чтобы снизить температуру до 50—55° (примечание 5). Через
20 мин. после того, как было начато прибавление цинка, раствор
фильтруют через воронку Бюхнера диаметром 24 см и окись цинка
промывают на воронке 3 л кипящей воды. Фильтрат и промывные
воды сливают вместе в глиняный сосуд емкостью 22 л (примеча-
(примечание 6) и немедленно охлаждают (примечание 7) прибавлением льда
в количестве, достаточном для того, чтобы температура жидкости
оставалась в интервале от 0 до —2°. При этом не менее чем 1 кг
льда должен остаться не растаявшим.
НИТРОЗОЕЕНЗОЛ
355
К полученному холодному раствору или суспензии р-фенил-
гидроксиламина прибавляют при перемешивании холодный раствор
серной кислоты G50 мл концентрированной кислоты и лед в коли-
количестве, достаточном для того, тобы снизить температуру раствора
до —5°). После этого к смеси как можно быстрее приливают
охлажденный до 0° раствор 170 г бихромата натрия NaCr2Cy2H2O
в 500—750 мл воды. Смесь в это время перемешивают или взбал-
взбалтывают кругообразным движением (примечание 8). Через
2—3 мин. осадок нитрозобензола, имеющий соломенно-желтый
цвет, отфильтровывают на воронке Бюхнера и промывают 1 л
воды (примечание 9).
Сырой нитрозобензол подвергают перегонке с водяным паром
(примечание 10) и дестиллат собирают в приемнике, охлаждаемом
льдом (примечание 11). Полученный нитрозобензол тщательна
измельчают в ступке, переносят в воронку Бюхнера и промывают
водой до тех пор, пока промывные воды не перестанут идти окра-
окрашенными в бурый цвет. Препарат как можно лучше отсасывают,
после чего отжимают его между листами фильтровальной или
какой-либо иной пористой бумаги. Бумагу необходимо сменить
один или два раза. Выход нитрозобензола с т. пл. 64—67° составляет
128—138 г D9—53% теоретич.; примечания 12 и 13). Если тре-
требуется получить более чистое вещество, то сырой нитрозобензол
можно перекристаллизовать из небольшого количества спирта
при хорошем охлаждении, а затем полученный препарат высу-
высушить над хлористым кальцием при -атмосферном давлении.
Примечания
1. При проверке синтеза была применена 12-литровая кругло-
донная колба.
2. Вполне пригоден продажный нитробензол хорошего качества.
3. Следует избегать действия нитробензола, фенилгидрсксил-
амина и нитробензола на кожу, а также длительного вдыхания
паров этих реагентов,
4. Сильное перемешивание необходимо для того, чтобы пред-
предотвратить образование корки из цинковой пыли на дне гли-
глиняного сосуда. Авторы синтеза для поддержания цинкоеой пыли
во взвешенном состоянии применяли две механические мешал-
мешалки. При проверке с успехом была применена простая лопастная
мешалка.
5. При более высокой температуре протекают вторичные
реакции.
6. При проверке была применена 22-литровая круглодонная
колба.
7. Ввиду того что ^-фенилгидроксиламин при стоянии разла-
разлагается, следует охладить фильтрат, как только закончится филь-
23*
356
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
трование, и окислять его в нитрозобензол немедленно. В реак-
реакционной смеси лед должен иметься в избытке, так как реакция
окисления экзотермична, а температура раствора по окончании
процесса все еще должна быть около 0°. При более высокой тем-
температуре происходит образование не нитрозобензола, а других
продуктов окисления.
8. Чтобы получить хороший выход легко фильтрующегося
препарата, очень важно провести прибавление бихромата быстро.
В одном из опытов, когда прибавление раствора бихромата про-
продолжалось в течение 25 мин., нитрозобензол был получен с выходом
только 10%.
9. Полученный сырой нитрозобензол стоек в течение недели,
если его хранить при 0°.
10. Все соединения в приборе должны быть на шлифах, так
как корковые пробки и резина легко разрушаются. Ввиду того что
нитрозобепзол' разлагается при высокой температуре, его необхо-
необходимо перегонять с водяным паром как можно быстрее. Если про-
проводится несколько опытов, то для перегонки следует соединять
вместе порции сырого вещества, полученные в результате не более
чем 4—5 синтезов. Чтобы предотвратить перебрасывание, удобно
применять насадку Гопкинса.
Нитрозобензол образует зеленую жидкость, которая затвер-
затвердевает в бесцветную массу. Необходимо следить за тем, чтобы
это твердое вещество не забило холодильник. Перегонку прекра-
прекращают, когда в холодильнике появляются желтые маслянистые
капли.
11. Охлаждать приемник необходимо потому, что при комнат-
комнатной температуре нитрозобензол обладает очень высокой упруго-
упругостью паров.
12. При проведении синтеза с меньшими количествами исход-
исходных веществ выход достигал 65—70%.
13. Нитрозобензол можно хранить при комнатной температуре
в закрытых сосудах в течение 1—2 дней. Если препарат требуется
сохранять в течение более продолжительного времени, то его сле-
следует держать при 0°.
Другие методы получения
Нитрозобензол можно получить окислением анилина мононад-
серной кислотой1 (кислотой Каро) или надуксусной кислотой2,
а также окислением ^-фенилгидроксиламина3, который полу-
получают восстановлением нитробензола.
1 С а г о, Z. angew. Chem., 11, 845 A898).
2 D'A n s, Kneip, Ber., 48, 1144 A915).
3Bamberger, Ber., 27, 1555 A894); Parsons, В a i 1 a r,
J. Am. Chenu Soc , 58, 268 A936).
5-НИТРОИНДАЗОЛ
357
\/
5-НИТРОИНДАЗОЛ
СН3 сн3соон \ N02—"\—СН;
—NH
NaNOa
—N = NOH
-H2O
N
Предложили: Х. Портер и В. Петерсон.
Проверили: Н. Дрэйк и А. Фримэн.
Получение
В 5-литровую круглодонную колбу, снабженную эффективной
механической мешалкой, помещают раствор 55 г @,36 моля)
2-амино-5-нитротолуола (т. пл. 129—132°) в 2 500 мл ледяной
уксусной кислоты. К содержимому колбы прибавляют в один прием
(примечание 1) раствор 25 г @,36 моля) нитрита натрия в 60 мл
воды, причем во время прибавления следят за тем, чтобы темпе-
температура смеси не поднималась выше 25° (примечание 2). После того
как раствор нитрита натрия будет прибавлен, перемешивание
продолжают в течение еще 15 мин., для того чтобы завершить
диазотирование. Если в продолжение нескольких последующих
часов образуется желтый осадок, то его отфильтровывают и отбра-
отбрасывают (примечание 3).
Раствор оставляют на 3 дня при комнатной температуре, а
затем выпаривают на паровой бане в вакууме водоструйного
насоса до тех пор, пока разбрызгивание не сделает дальнейшее
продолжение этого процесса невозможным. К остатку прибавляют
200 мл воды и содержимое колбы смывают в небольшой стакан,
в котором его размешивают до тех пор, пока не образуется одно-
однородная паста. Полученную пасту фильтруют, тщательно промы-
промывают на воронке холодной водой и сушат в сушильном шкафу при
80—90°.Температура плавления неочищенного вещества 204—206°;
выход составляет 47—57 г (80—96% теоретич.). Препарат очищают
перекристаллизацией из 650 мл кипящего метилового спирта с при-
применением 5 г активированного древесного угля для обесцвечива-
обесцвечивания. После перекристаллизации 5-нитроиндазол получается в виде
бледножелтых игольчатых кристаллов с т. пл. 208—209°. Выход
вещества составляет 42—-47 г G2—80% теоретич.; примечание 4).
Дальнейшая перекристаллизация не приводит к повышению тем-
температуры плавления.
Примечания
1. Если раствор нитрита натрия прибавлять медленно, то
образуется значительное количество желтого осадка, вероятно*
представляющего собой диазоаминосоединение.
358
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
2. Если до прибавления раствора нитрита натрия охладить
раствор 2-амино-5-нитротолуола в бане со льдом до 15—20°,
то во время диазотирования температура смеси не поднимется
выше 25й.
3. Повидимому, желтый осадок представляет собой диазоамино-
соединение, нерастворимое в большинстве органических раство-
растворителей. Оно плавится около 200°*.
4. Незамещенный о-толуидин образует незамещенный индазол
с очень небольшим выходом C—5%)
Другие методы получения
Приведенную методику в основном разработал Нёльтинг2.
1Meunier, Bull. soc. chim. C), 31, 641 A904).
- Noel ting, Ber., 37, 2584 A904).
2-НИТРО-4-МЕТОКСИАНИЛИН
B-Нитро-п-анизидин)
NH2
NHCOCHS NHCOCH3
I I NO2
(CH3COJO
ОСЦ-,
HN03
осн. осн,
KOH
Предложили: П. Фанта и Д. Тарбелл.
Проверили: В. Бахман и Н. Дено.
Получение
2-Нитро-4-мепгоксиацетанилид. В 2-литровую трехгорлую
круглодонную колбу, снабженную механической мешалкой и тер-
термометром, помещают 123 г A моль) п-анизидина (примечание 1),
300 мл ледяной уксусной кислоты и 217 мл воды. Пускают в ход
мешалку и, когда я-апизидин растворится, прибавляют к содер-
содержимому колбы 350 г льда. Когда температура понизится до 0—5°,
к смеси прибавляют в один прием при быстром перемешивании
103 мл A,1 моля) уксусного ангидрида. Через несколько секунд
содержимое колбы превращается в кристаллическую массу и тем-
^пература повышается до 20—25°. Колбу нагревают на паровой
бане до тех пор, пока кристаллическая масса не растворится,
и затем при перемешивании охлаждают раствор до 45°. При этой
температуре начинают выделяться кристаллы. Колбу помещают
2-НИТРО-4-МЕТОКСИАНИЛИН
359
в баню со льдом и в один прием добавляют к ее содержимому
100 мл E5%-ный избыток) концентрированной азотной кислоты
(уд. вес 1,42). Температура смеси быстро повышается до 70° и
вскоре начинает падать. Регулируя надлежащим образом охлажде-
охлаждение, температуру поддерживают в течение 10 мин. при 60—65 ,
а затем в течение 10 мин. доводят до 25° (примечание 2).
Раствор помещают на ночь в холодильный шкаф. Выпавшие в
осадок желтые кристаллы отфильтровывают на воронке Бюхнсра
диаметром 19 ел. Затем их промывают 270 мл ледяной воды и отжи-
отжимают как можно лучше резиновой трамбовкой. Осадок можно
высушить (примечание 3) на воздухе или в вакуум-эксикаторе над
хлористым кальцием и натронной известью. Выход 2-нитро-
4-метоксиацетанилида с т. пл. 116—116,5° составляет 158—168 г
G5—79% теоретич.).
2-Цитро-4-метоксианилин. В 2-литровый стакан помещают
смесь 160 г 2-нитро-4-метоксиацетапилида и 250 мл холодной щело-
щелочи Клайзена (примечание 4); содержимое стакана перемешивают
и нагревают в течение 15 мин. на паровой бане. Сперва смесь ста-
становится жидкой, а затем превращается в густую пасту красного
цвета. К последней прибавляют 250 мл горячей воды, смесь раз-
размешивают в течение еще 15 мин. при нагревании на паровой бане,
после чего охлаждают до 0—5°. Осадок отфильтровывают на ворон-
воронке Бюхнера диаметром 19 см, промывают тремя порциями ледяной
воды по 160 мл и отжимают как можно лучше с помощью резино-
резиновой трамбовки. После высушивания в вакууме выход препарата
с т. пл. 122,5—123° составляет 122—124 г (95—97% теоретич.).
Примечания
1. Был применен продажный я-анизидин.
2. В одном из опытов, в котором смеси предоставили возмож-
возможность охлаждаться самопроизвольно, продукт реакции потемнел.
3. Если полученный 2-нитро-4-метоксиацетанилид предпола-
предполагают применить в последующей стадии, то сушить его не обяза-
обязательно. Препарат можно перекристаллизовать (с выходом 97%)
из разбавленного водного спирта B мл 95%-ного спирта и 4 мл
воды на 1 г вещества) Температура плавления полученного та-
таким образом препарата 116,5—117°.
4. Для получения щелочи Клайзена 88 г едкого кали раство-
растворяют в 63 мл воды, раствор охлаждают и разбавляют до объема
250 мл.
Другие методы получения
2-Нитро-4-метоксиацетанилид был получен нитрованием л-ацет-
анизида1. Методика нитрования в основном оставалась той, кото-
которую применял Лотроп1г.
360
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
2-НИТРО-л-ЦИМОЛ
361
2-Нитро-4-метоксианилин был получен нагреванием димети-
лового эфира нитрогидрохинопа с водным аммиаком2; нагрева-
нагреванием тетраметиламмониевой соли З-нитро-4-аминофенола8; гид-
гидролизом 2-нитро-4-метоксиацетанилида1а спиртовым раствором
едкого кали 1б> 1в или соляной кислотой 1г; гидролизом следующих
производных •? 2-нитро-4-метоксианилина: я-толуолсульфамида 4,
3-нитробензолсульфамида 6, 3-нитро-л-толуолсульфамида 5, а так-
также ацетильного производного я-толуолсульфамида6 концентриро-
концентрированной серной кислотой.
1 а) Н i п s b e r g, Ann., 292, 249 A896); б) R e v e r d i n, Ber., 29,
2595A896); Jahrcsb., I896, 1156; Bull. soc. chira. C), 17, 115A897);
в) Hat a, Tatematsu, Kubota, Bull. Chem. Soc. Japan, 10,
425 A935 ) [C. A., 30, 1056 A936)]; r) L о t h г о p, J. Am. Chem. Soc, 64,
1698 A942).
2 Scheidel, герм. пат. 36014 [Frdl., I, 221 A888)].
3 H a h 1 e, J. prakt. Chem. B), 43, 66 (I891)-
f Reverdin, Ber., 42, 1525A909); Симонов, ЖОХ, 10, 1580
A940).
5 R e v e r d i n, d e Luc, Ber., 45, 352 A912).
«Reverdin, de Luc, Ber., 43, 3461 A910).
2-НИТРО-п-ЦИМОЛ
CH.
\/
CH,
NO,
HNOS
CH3CHCH3
Предложили; К- Коуб и Т. Думани.
Проверили: Ч. Аллен и Дж. ВанАллан.
Получение
Эмалированное ведро емкостью 5 л или соответствующую водя-
водяную баню снабжают двумя эксцентрически расположенными меха-
механическими мешалками (примечание 1), термометром для низких
температур и капельной воронкой, конец которой заканчи-
заканчивается как раз над конусом, образуемым лопастями одной из
мешалок, так что каждая капля приливаемой жидкости немед-
немедленно смешивается с охлажденной реакционной массой и в ней
растворяется.
В ведро помещают 1 кг E44 мл) концентрированной серной кис-
кислоты и 300 мл ледяной уксусной кислоты (примечание 2); эту смесь
охлаждают сухим льдом до температуры, лежащей в интервале от 0
до —5°. Затем из капельной воронки к смеси прибавляют при энер-
энергичном перемешивании 500 г E85 мл) я-цимола (примечание 3),
причем повышение температуры предотвращают непосредственным
добавлением сухого льда (примечание 4). Одновременно готовят
нитрующую смесь, для чего берут 369 г B62 мл) азотной кислоты
(уд. вес 1,42) и 1 кг E44 мл) концентрированной серной кислоты;
смесь охлаждают до 0—5° непосредственным добавлением мелких
кусков сухого льда (примечание 4).
Эмульсию углеводорода охлаждают до температуры, находя-
находящейся в интервале от —10 до —15°, и из капельной воронки при-
прибавляют к ней по каплям нитрующую смесь в течение примерно
2 час, не допуская повышения температуры (примечания 4 и 5).
Перемешивание продолжают в течение еще 10 мин., после чего
все содержимое ведра при достаточно энергичном перемешивании
выливают в сосуд, содержащий смесь 1 кг мелко наколотого льда
с 1 л воды. Примерно через 2 часа происходит расслаивание,
после чего нижний кислотный слой отделяют с помощью сифона
или большой делительной воронки (примечание 6) и экстрагируют
двумя порциями петролейного эфира по 50 мл или двумя порциями
диэтилового эфира по 500 мл (примечание 7). Эфирные вытяжки и
неочищенный нитроцимол соединяют вместе и промывают тремя
порциями по 300 мл воды (примечание 8); эфирный слой сушат
над 50 г хлористого кальция. Раствор фильтруют, эфир отгоняют
и оставшуюся жидкость фракционируют в вакууме, применяя 1-лнт-
ровую специальную колбу Клайзена с елочным дефлегматором*.
Собирают следующие фракции (при давлении 15—17 мм): до 125°,
25—30 г (примечание 9); 125—139°, 520—550г G8—82%), ng 1,5280;
смолистый остаток 25—30 г. Полученный препарат представляет
собой главным образом 2-нитро-я-цимол, но содержит около 8%
я-нитротолуола; он пригоден для восстановления1 до 2-амино-
я-цимола, от которого легко можно отделить «-толуидин. При
повторном фракционировании смеси нитросоединений вторая по-
половина дестиллата в основном представляет собой чистый 2-нитро-
п-цимолст. кип. 137—139° (П мм) [128—131°A2мм); 108° (Змм)];
«о 1,5290. Свойства чистого 2-нитро-п-цимола следующие: т. кип.
126° A0 мм) [142° B0 мм)]; «!? 1,5287.
Примечания
1. Рекомендуется применять для мешалок более мощные
моторы, чем обычно используемые в лабораториях органической
химии, так как успех синтеза в значительной степени зависит
от получения хорошей эмульсии. Проверявшие синтез применяли
мешалки, оси и лопасти которых были изготовлены из монель-
металла.
Такую колбу обычно называют колбой Фаворского. (Прим. переа.)
.362
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
2. При прибавлении кислоты температура повышается почти
до 60°.
3. Авторы синтеза рекомендуют применять технический цимол,
так как присутствие терпенов в качестве примесей облегчает
получение эмульсии. Проверявшие синтез использовали как тех-
технический препарат, так и препарат, не содержащий терпенов;
никаких затруднений с получением эмульсии не наблюдалось.
При применении очищенного вещества был получен несколько
более высокий выход (на 3—4%). Образцы технического цимола
различного происхождения значительно отличаются по своему
составу.
4. Необходимые количества сухого льда указаны приблизи-
приблизительно. Действительные количества зависят от первоначальной
температуры смеси и от желаемой скорости охлаждения. Для
-охлаждения нитрующей смеси обычно требуется 200 г сухого
льда, для охлаждения смеси цимола с серной и уксусной кисло-
кислотами—500 г и непосредственно при нитровании—1500 г. Если
нитрующую смесь охладить слишком сильно, то она может за-
затвердеть. Чтобы обеспечить хороший выход, чрезвычайно важно
поддерживать указанную температуру; не следует скупиться на
сухой лед. Выделяющийся углекислый газ способствует пере-
перемешиванию смеси.
5. Чрезмерное охлаждение смеси ведет к разрушению эмульсии.
6. Расслаивание происходит не очень четко; в результате этого
можно потерять вместе с кислотным слоем 10—15 г вещества
¦(см. примечание 7).
7. Кислотный слой можно не экстрагировать, однако это
приводит к некоторому уменьшению выхода. Так, при первом
экстрагировании получают около 15 г нитросоединения, а при
втором — 7 г.
8. Иногда при промывании образуется эмульсия; ее можно
разрушить, если прибавить к раствору несколько миллилитров
серной кислоты и смесь взболтать.
9. Из головного погона в результате вторичной перегонки
при атмосферном давлении можно получить 4—6 г неочищенного
я-цимола с т. кип. 160—165° и 10—13 г нитросоединения. Послед-
Последнее количество учтено при вычислении общего выхода, который
приведен выше.
Другие методы получения
2-Нитро-я-цимол обычно получают нитрованием л-цимола,
либо смесью серной и азотной кислот с прибавлением2 или без
прибавления3 уксусной кислоты, либо раствором дымящей азот-
азотной кислоты в уксусной кислоте*.
1 Doumani, Kobe, Ind. Eng. Chem., 31, 264 A939).
2S6derbaum, Widman, Ber., 21, 2126 A888); Andrews,
л»-ОКСИБЕНЭАЛЬДЕГИД
363
Ind. Eng. Chem., 10, 453 A918); Wheeler, S m i t h e y, J. Am. Chem.
Soc, 43, 2613 A921); Phillips, там же, 44, 1777 A922); De m о n b r e u m,
Kremers, J, Am, Pharm. Assoc, 12, 296 A926) [C. A., 17, 3906 A923I-
K о b e, Doumani, Ind. Eng. Chem., 31, 257 A939).
'Andrews, ам. пат. 1314920 [С. A., 13, 2765 A919)]; S e 1 d e n,
англ. пат. 142226 [С. А., 14, 2645 A920)].
4 Шумов, ЖРФХО, A), 19, 119 A887).
ж-ОКСИБЕНЗАЛЬДЕГИД
SnCl2 NaNO2
.m-NO2C6H4CHO -^->- >(-NH2C6H4CHO • (SnCl4)x
HCl
HC1
-> (л*-СШ2С6Н4СНО)а • SnCl4
H2O
Нагревание
jh-HOC6H4CHO
Предложил: Р. Вудвард-
Проверили: К. Гамильтон и Р. Андрее.
Получение
В 3-литровый стакан, снабженный эффективной механической
мешалкой, помещают раствор 450 г B моля) порошкообразного
двухводного хлористого олова SnCl2-2H2O (примечание 1)в 600 мл
концентрированной соляной кислоты и охлаждают его в бане со
смесью льда и соли. Когда температура раствора понизится до 5°,
охлаждающую баню отставляют и к раствору в один прием при-
прибавляют 100 г @,66 моля) л-нитробензальдегида (примечание 2).
Вначале температура повышается медленно и примерно через
5 мин. достигает 25—30°. В дальнейшем она быстро возрастает
примерно до 100°, и стакан поэтому вновь погружают в баню со
льдом и солью. Перемешивание должно быть весьма энергичным,
так как иначе реакционная смесь может выброситься из стакана
(примечание 3). Во время реакции л-нитробензальдегид раство-
растворяется, причем раствор становится красным и почти прозрачным.
В течение 2,5 часа последний охлаждают в смеси льда и соли
при слабом перемешивании (примечание 4). Продукт присоедине-
присоединения хлорного олова кл-аминобензальдегиду, выделяющийся в виде
пасты оранжевого цвета (примечание 5), отфильтровывают через
фильтр из пористого стекла (примечание 6). Из полученного веще-
вещества и 600 мл концентрированной соляной кислоты приготовляют
суспензию, проводя эту операцию в 3-литровом стакане, устано-
установленном в бане со льдом и солью, при перемешивании механиче-
механической мешалкой. Поддерживая температуру смеси при 4—5° (при-
(примечание 7), к ней медленно прибавляют раствор 46 г нитрита натрия
в 150 мл воды через капельную воронку емкостью 250мл, ножка ко-
которой должна находиться ниже поверхности суспензии. После того
как прибавление будет закончено (примерно через 80 мин.), переме-
перемешивание при охлаждении в бане со льдом и солью продолжают в те-
течение еще 1 часа, чтобы завершить кристаллизацию продукта при-
364
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
соединения хлорного олова к соли диазония. Красновато-бурую
соль отфильтровывают через фильтр из пористого стекла (приме-
(примечание 6).
Влажную соль осторожно прибавляют в течение 40 мин. неболь-
небольшими порциями к 1 700 мл кипящей воды, помещенной в 4-литро-
4-литровый стакан. Во время реакции возмещают потерю воды вследствие
испарения (примечание 8). Раствор обрабатывают 4 г активиро-
активированного березового угля, кипятят в течение нескольких минут
и фильтруют в горячем состоянии. Фильтрат, окрашенный в крас-
красный цвет, оставляют на 12—16 час. в холодильном шкафу; в тече-
течение этого периода стенку сосуда время от времени потирают сте-
стеклянной палочкой, чтобы вызвать кристаллизацию (примечание 9).
Выход ж-оксибснзальдегида, получающегося в виде кристаллов
оранжевого цвета, составляет 48—52 г E9—64% теоретич.);
т. пл. 99—101°. Раствор этого вещества в 1 л кипящего бензола
обрабатывают активированным березовым углем, фильтруют и упа-
упаривают до 300 мл. По охлаждении получают 41—45 г E1—56%
теоретич.) светлобурых кристаллов с т. пл. 101—102° (примеча-
(примечание 10).
Примечания
1. Следует применять химически чистое двухводное хлори-
хлористое олово SnCl2-2HaO. При использовании технического пре-
препарата получаются более низкие выходы.
2. Авторы синтеза использовали лг-нитробензальдегид ст. пл.
52—55°. При проверке применялся более высококачественный
реактив с т. пл. 57—58°.
3. Если замедлить ход реакции, прибавляя л-нитробензальде-
гид в несколько приемов, то получаются менее удовлетворитель-
удовлетворительные выходы.
4. Перемешивание должно быть не сильным, так как по-
получение частиц, достаточно больших для того, чтобы их можно
было быстро отфильтровать, возможно только при постепенном
охлаждении.
5. Точная формула продукта присоединения хлорного олова
к л-аминобензальдегиду неизвестна.
6. Фильтр из пористого стекла можно заменить большой ворон-
воронкой Бюхнера, в которой под фильтровальную бумагу положен слой
асбестовой ваты. Последнюю можно промывать и применять
повторно.
7. Наилучшие результаты были получены в том случае, когда
во время диазотирования температура держалась на уровне 4—5°.
Ниже 0° скорость этого процесса сильно падает, а выше 5е соль
диазония начинает разлагаться.
8. При упаривании раствора до объема менее чем 1 700 мл
получается препарат • заметно меньшей степени чистоты.
2-0КСИ-1-НАФТ0ЙНЫЙ АЛЬДЕГИД
365
9. Если потирание стенки сосуда стеклянной палочкой не
вызывает кристаллизации, то берут небольшую пробу раствора
и упаривают ее для получения затравки.
10. Согласно указаниям автора, дальнейшую очистку можно
осуществлять с помощью возгонки. Для этого вещество помещают
на дно эксикатора из стекла пирекс, который затем эвакуируют
и оставляют в течение ночи на паровой бане. Налет из тесно пере-
переплетенных игольчатых кристаллов можно легко удалить. В ре-
результате однократной перекристаллизации из бензола получают
37—40 г D7—49% теоретич.) игольчатых кристаллов с т. пл.
103—104°.
Другие методы получения
л«-Оксибензальдегид был получен восстановлением л-окси-
бензойной кислоты амальгамой натрия в слабокислом растворе1;
окислением эфира арилсульфокислоты ArSO2OCeH4CHs перекисью
марганца и серной кислотой в соответствующее производное
л*-оксибензальдегида ArSO2OCeH4CHO и гидролизом этого соедине-
соединения концентрированной серной кислотой 2; из л-дихлорметилфени-
лового эфира бензойной кислоты нагреванием его с водой и угле-
углекислым кальцием3 под давлением 4—5 am. Настоящий метод за-
заимствован у Тимана и Людвига 4 и аналогичен способу получения
л-хлорбензальдегида5.
'Sandmann, Ber., 14, 969 A881).
2 Герм. пат. 162322 (Chera. Zentr., 1905, II, 726).
3 R a s с h i g, герм. пат. 233631 [Chem. Zentr., 1911, I, 1388; Frdl.,
10, 163 A910—1912)].
4Tiemann, Ludwig, Ber., 15, 2045 A882); Rieche, Ber., 22,
2348 A889); герм. пат. 18016 [Frdl., 1, 586 A888)]; S u b a k, Monatsh., 24,
167 A903)'.
5 Б е. к, А й д и, Синт. орг. иреи., сб. 2, стр. 551.
2-0КСИ-1-НАФТ0ЙНЫЙ АЛЬДЕГИД
сно
NaOH
СНС13
Предложили: А. Расселл и Л. Локхарт.
Проверили: В. Вахман и Ч. Максвелл.
Получение
В 2-литровую трехгорлую круглодонную колбу (примечание 1),
снабженную обратным холодильником длиной 1 м, мешалкой с
ртутным затвором и капельной воронкой, помещают 100 г @,69 моля)
366
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
C-нафтола и 300г95%-ного этилового спирта. Пускают в ход
мешалку и быстро прибавляют к содержимому колбы раствор 200 г
E молей) едкого натра в 415 мл воды.
Полученный раствор нагревают на паровой бане до 70—80а
и прибавляют к нему по каплям хлороформ. После того как
реакция начнется (примечание 2), дальнейшего нагревания не
требуется. Хлороформ (всего 131 г, 1,1 моля) прибавляют со
скоростью, необходимой, чтобы поддерживать спокойное кипение
смеси (примечание 3). Когда прибавление приближается к концу,
в осадок выпадает натриевая соль оксинафтойного альдегида.
После того как весь хлороформ будет прибавлен, перемешивание
продолжают в течение еще 1 часа.
Спирт и избыток хлороформа отгоняют на паровой бане.
К остатку при энергичном перемешивании прибавляют по каплям
соляную кислоту (уд. вес 1,18) до тех пор, пока реакция содер-
содержимого колбы на конго не будет кислой (примечание 4). Выде-
Выделившееся темное масло смешано со значительным количеством
хлористого натрия. Для удаления этой соли прибавляют доста-
достаточное для се растворения количество воды. Затем масло отделяют
и промывают несколько раз горячей водой. После перегонки его
в вакууме получают 87,5—93,7 г слегка окрашенного дестиллата,
который кипит при 163—166° (8 мм) (примечание 5) и затверде-
затвердевает при охлаждении. В результате перекристаллизации из 75 мл
спирта получают 45,2—57,5 г C8—48% теоретич.) чистого
2-окси-1-нафтойного альдегида, который плавится при 79—80е.
Примечания
1. Для опыта с количествами исходных реагентов, в четыре
раза превышающими указанные в прописи, авторы синтеза пользо-
пользовались 5-литровой колбой. Выход в процентах оставался таким же.
2. О начале реакции можно судить по голубому окрашиванию
реакционной смеси.
3. Хлороформ прибавляют в течение 1—1,5 часа.
4. Для нейтрализации избытка едкого натра и для выделения
в свободном состоянии оксинафтойного альдегида из его натрие-
натриевой соли требуется около 175 мл соляной кислоты.
5. Альдегид перегоняется в пределах 177—180° B0 мм).
Чтобы избежать разложения, лучше работать при более низком
давлении. Проверявшими синтез была отмечена температура
кипения, равная 139—142° D мм). Цвет дестиллата в отдельных
опытах различен; он может быть зеленым, розовым или янтарным.
Другие методы получения
2-Окси-1-нафтойный альдегид был получен из [3-нафтола, хло-
хлористого цинка и цианистого водорода1; из C-нафтола, циани-
2-ОКСИ-1,4-НАФТОХИНОН
367
стого цинка и безводного хлористого водорода2; из C-нафтола, хло-
хлороформа и едкого натра (реакция Реймера—ТиманаK.
iGattermann, Horlacher, Ber., 32, 285 A899).
! Adams Levin e, J. Am. Chera. Soc, 45, 2373 A923).
' Fosse Bull. soc. chim., C), 25, 373 A901).
О
SO3NH4
2-ОКСИ-1,4-НАФТОХИНОН
4 + 2CH3OH-
—> 2
OCH3 + (NH4J SO4 + 2SO2 + 2H2O
\/\/
О
II
OCH2
+ H2O
Предложили: Л. Физер и Э. Мартин.
Проверили: Р. Фыозон и Э. Кливленд.
Получение
В 3-литровой круглодонной колбе охлаждают до 0° в бане со
льдом и солью 1 л абсолютного метилового спирта и медленно
прибавляют к нему 80 мл концентрированной серной кислоты;
в это время колбу тщательно встряхивают и поддерживают тем-
температуру смеси при 0°. Затем колбу вынимают из охлаждающей
смеси, прибавляют к ее содержимому 255 г A моль) аммонийной
соли 1,2-нафтохинон-4-сульфокислоты (стр. 69) и энергично встря-
встряхивают, чтобы образовалась однородная паста. После этого колбу
оставляют на полчаса, в течение которых температура смеси повы-
повышается до 15—20°; затем колбу постепенно нагревают на паровой
бане, не переставая встряхивать и вращать ее, так чтобы раствор'
Зба
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
нагрелся до температуры кипения примерно через 15 мин. Раствор
приобретает красную окраску, выделяется сернистый газ и начи-
начинает выпадать в осадок метоксинафтохинон. Очень слабое кипение
смеси поддерживают при непрерывном взбалтывании в течение
15 мин., в результате чего масса значительно загустевает. Затем
к смеси прибавляют 250 мл метилового спирта и продолжают
нагревать и вращать колбу в течение еще 15—20 мин. После этого
реакционную смесь охлаждают до 20—25°, прибавляют к ней
воду и лед до тех пор, пока колба не станет почти полной, и
фильтруют метоксинафтохинон через 15-сантиметровую воронку
Бюхнера, в которой его промывают холодной водой до тех пор,
пока фильтрат не станет почти бесцветным; для этого требуется
около 2 000—2 500 мл воды (примечание 1).
Сырой препарат смывают в раствор 30 г едкого натра в 1 500 мл
воды и смесь быстро нагревают почти до кипения. Примерно через
10 мин. метоксинафтохиион гидролизуется, образуя тёмнокрас-
тёмнокрасный раствор (примечание 2). Горячий раствор фильтруют с отса-
отсасыванием, чтобы освободить его от следов твердого остатка, пере-
переносят в 2-литровый стакан и в еще горячем состоянии подкисляют,
медленно прибавляя 130 мл 6 н. раствора соляной кислоты
при энергичном перемешивании. Полученную таким образом
желтую суспензию оксинафтохинона охлаждают до 0° и оставляют
на 2 часа (примечание 3). Оксинафтохинон собирают, промывают
2 л холодной воды, сушат в течение ночи при комнатной темпе-
температуре, а затем доводят до постоянного веса при 60—80°. Выход
составляет 101—112 г E8—65% теоретич., считая на аммонийную
соль 1,2-нафтохинон-4-сульфокислоты; 99% теоретич., считая на
метоксинафтохинон; примечание 4). Полученный таким образом
оксинафтохинон окрашен в яркожелтый цвет, имеет вид зерен
и плавится (с разложением) при 188—189° (примечание 5). Качество
его весьма высоко, и для обычных целей не требуется дополни-
дополнительной очистки (примечание 6).
Примечания
1. Количество метоксинафтохинона составляет 111 —112 г
E9—65% теоретич.). Вещество плавится при 181—182° и может
быть дополнительно очищено перекристаллизацией из спирта.
Очищенный препарат представляет собой бледножелтые игольча-
игольчатые кристаллы с т. пл. 183,5°.
2. Если во время нагревания или фильтрования выделится
натриевая соль, то ее переводят в раствор путем прибавления 1 л
воды и нагревания.
3. Если осадок оставляют стоять в течение указанного вре-
времени, то конечный препарат получается в виде зерен, и фильтрова-
фильтрование идет быстро.
2-ОКСИ-1,4-НАФТОХИНОН
369
4. Были испытаны многочисленные изменения методики, что,
однако, не привело к улучшению выхода. Повидимому, потери
обусловлены частичным восстановлением соли хинонсульфокис-
лоты выделяющимся сернистым газом, но этот процесс нельзя было
предотвратить прибавлением к реакционной массе двуокиси мар-
марганца и из маточного раствора не удалось выделить чистого
вещества.
5. Температура разложения бывает различной, что зависит
как от скорости нагревания, так и от природы стеклянного капил-
капилляра.
6. При кристаллизации из спирта, к которому добавлено незна-
незначительное количество уксусной кислоты, получаются блестящие
желтые игольчатые кристаллы, которые плавятся с разложением
при температуре 191'—192°. Окрашенные в красный цвет препа-
препараты оксинафтохинона, на которые имеются многочисленные ука-
указания в литературе, не являются вполне чистыми. Такие пре-
препараты, так же как и вообще сырое вещество, лучше всего
очищать через натриевую соль или через метиловый эфир.
Другие методы получения
Из многочисленных реакций, при которых получается окси-
оксинафтохинон1^2, только две получили развитие в качестве препара-
препаративных методов, причем в обоих случаях в качестве исходного
сырья используется доступный [3-нафтол. Согласно первому методу,
р-нафтол превращают в [3-нафтохинон («Синт. орг. преп»., сб. 2, стр.
353), который в результате реакции с уксусным ангидридом и сер-
серной кислотой образует триацетат 1,2,4-триоксинафталина; послед-
последний гидролизуют и окисляют в оксинафтохинон. Выход при реакции
ацетилирования составляет около 75%; выход в последней стадии
может быть доведен до 93% теоретического количества, если гидро-
гидролиз проводить при помощи спиртовой щелочи в атмосфере азота
в присутствии небольшого количества гидросульфита натрия
с последующим разведением водой, подкислением и прибавле-
прибавлением хлорного железа. Суммарный выход, считая на р-нафтол,
можно таким образом довести до 54%. Этот метод следует считать
хорошим; его можно с успехом применять для получения многих
аналогичных оксихинонов. Однако при работе с обычным лабора-
лабораторным оборудованием приходится ограничиваться загрузками
до 0,5 моля; при использовании этого метода в один прием нельзя
получить больше 50 г вещества.
Вторым методом получения оксинафтохинона является при-
приведенная выше пропись. [З-Нафтол через стадию нитрозопроизвод-
ного и 1-амино-2-нафтол-4-сульфокислоты превращают в соль
нафтохинонсульфокислоты, которую подвергают кислотному ги-
гидролизу. Соль сульфокислоты можно непосредственно превратить
24 Сборник 3
370
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
в оксинафтохинон действием концентрированной сер ной кислоты3'4,
однако такой процесс не настолько легко поддается контролю,
как в том случае, когда хинон этерифицируют в момент его обра-
образования и затем эфир гидролизуют*. Суммарный выход, считая
на ^-нафтол, составляет 46% теоретического количества; однако
все реагенты легко доступны, и при обычном оборудовании в ре-
результате одного опыта можно без труда получить 150 г оксинаф-
тохинона (из 300 г ^-нафтола).
1 В е i I s t e i n, Handbuch der organischen Chemie, VIII, 1925, S. 300.
2 T h i e 1 e, Winter, Ann., 311, 347 A900).
3 Akt.-Ges. Anilinf., герм. пат. 100703 [Chem. Zentr., 70, 766 A899)].
1 Fieser, J. Am. Chem. Soc, 48, 2929 A926).
Р-ОКТААЦЕТИЛГЕНЦИОБИОЗА
(Октаацепгат $-генциобиозы)
2C6H12O9
Эмульсин
-> С12НиО3(ОСОСН3)8+8СН3СО2Н
Предложили: Б. Хельферих и Дж. Лит.
Проверили: Г. Адкинс и Э. Боуден.
Получение
Из 1 650 г кристаллической глюкозы или из 1 500 г безводной
глюкозы (8,3 моля) приготовляют раствор нагреванием твердого
вещества на паровой бане с 1 350 мл дестиллированной воды.
Раствор охлаждают и переливают в склянку емкостью 2 500 мл
с притертой пробкой. К раствору прибавляют 15 г эмульсина
(примечание 1), а затем 20 мл толуола, после чего склянку закры-
закрывают и оставляют стоять при комнатной температуре в течение
5 недель, время от времени взбалтывая ее содержимое. Затем
раствор нагревают до кипения, разбавляют 8 500 мл воды и
фильтруют. К фильтрату прибавляют 56 г хлебопекарных дрож-
дрожжей, разведенных в 650 мл воды, и поддерживают температуру
смеси около 28—32° в течение 12—14 дней (примечание 2). После
этого смесь кипятят в течение получаса с избытком углекислого
кальция в порошке и фильтруют.
Фильтрат упаривают при давлении 20—30 мм до получения
возможно более густого сиропа. Для этого раствор помещают
в 12-литровую колбу, установленную на паровой бане и соединен-
соединенную при помощи изогнутой трубки с холодильником, который,
в свою очередь, соединен с приемником, в качестве которого
применяется склянка для отсасывания или перегонная колба.
В колбу вставляют очень тонкую капиллярную трубку, чтобы
Р-ОКТААЦЕТИЛГЕНЦИОБИОЗА
371
предотвратить возможность бурного вскипания (примечания 3
и 4).
К густому сиропу A70—185 г) прибавляют 100 г безводного
уксуснокислого натрия и 1 125 мл уксусного ангидрида. Смесь
осторожно нагревают до кипения, имея под рукой мокрое поло-
полотенце для охлаждения колбы на случай, если ацетилирование
будет протекать слишком бурно. Когда реакция закончится (на
это требуется около 20 мин.), раствор выливают в 10 л ледяной
воды. Дважды с интервалами в сутки воду декантируют и заме-
заменяют свежей, для того чтобы проацетилированный сахар можно
было отфильтровать.
Темиобурое вещество отфильтровывают, сушат на воздухе
и экстрагируют эфиром в аппарате Сокслста. Эфир отгоняют
и светлоокрашенный остаток A70 г) перекристаллизовывают
из 1 650 мл горячего метилового спирта. Кристаллы промывают
метиловым спиртом на воронке Бюхнера до тех пор, пока они не
будут больше содержать окрашенных примесей. Выход вещества
с т. пл. 187—190° составляет 77—87 г. После повторной перекри-
перекристаллизации из метилового спирта A,25 мл спирта на 1 г вещества)
получается чистая [3-октаацетилгенциобиоза; потери составляют
около 10%. Чистый препарат плавится при 196е (исправл.).
Примечания
1. Был применен продажный эмульсин. Если имеется в распо-
распоряжении свежеприготовленный эмульсин хорошего качества, то
можно взять его в количестве в 10 и более раз меньшем указан-
указанного в прописи.
2. Дрожжи вызывают брожение глюкозы, не превратившейся'
в генциобиозу, и тем способствуют ее удалению. Применялись
продажные дрожжи. Колбу следует закрыть пробкой и присоеди-
присоединить к ней обычный затвор для выпуска выделяющегося угле-
углекислого газа.
3. Авторы синтеза предложили для проведения этой операции
более сложный прибор (см. примечание 4). Однако проверявшие
синтез при применении описанного выше простого прибора не
встретили никаких затруднений, которые могли бы быть вызваны
вспениванием или кипением толчками. В приемнике, который
служит предохранительной ловушкой на случай перебрасывания
в результате вспенивания или толчков, собирается очень мало,
воды.
4. Авторы синтеза применяли количества, в четыре раза пре-
превышающие указанные выше. Для ведения отгонки воды они дают
следующие указания:
«Раствор медленно вливают через стеклянную трубку, снаб-
снабженную краном, в 3-литровую перегонную колбу, установленную'
24*
372
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ПЕНТЛЛЦЕТИЛ-ег-ГЛЮКОНОНИТРИЛ
373
в бане с бурно кипящей водой. Небольшое количество раствора,
которое перебрасывается в результате вспенивания, собирают
и выпаривают во второй перегонной колбе, также установленной
в бурно кипящей воде. Дестиллат пропускают через эффективный
холодильник и собирают в толстостенной склянке или колбе, при-
присоединенной к вакуумному (масляному или водоструйному) насосу.
Существенно, чтобы вакуум был достаточно глубоким. Трубка,
соединяющая холодильник с приемником, снабжена краном, так
что дестиллат можно слить, не спуская вакуума сколько-нибудь
заметно».
Другие методы получения
Основные методы получения генциобиозы и ее октаацетата
изложены в статье Рейнольдса и Эванса1'2. Среди этих методов
можно упомянуть следующие: выделение генциобиозы из корня
горечавки3'4; действие эмульсина на глюкозу 5>6; каталитический
гидрогенолиз амигдалина7; выделение из маточного раствора,
получаемого при производстве глюкозы8; конденсация ацетобром-
глюкозы с 1,2,3,4-тетраацетил-р-^-глюкозой1'9. Рейнольде и Эванс
рекомендуют последний из приведенных методов.
Пропись, помещенная выше, является видоизменением методов,
которые описали Буркло3 и Цемплен10.
1 Reynolds, Evans, J. Am. Chem. Soc, 60, 2559 A938).
2 H a w о r t h, W у 1 a tn, J. Chem. Soc, 1923, 123.
3 Bourqueloi, Herissey, Compt. rend., 132, 571 A901).
4Bourquelot, Herissey, Bull. soc. chim., C), 29, 363 A903).
5Bourquelot, Herissey, Compt. rend., 157, 732 A913).
6 L e e t e, Диссертация, Univ. of Greifswald, 1929.
7 Bergman n, Freudenberg, Ber., 62, 2783 A929).
8 В e r 1 i n, J. Am. Chem. Soc, 48, 2627 A926).
9 H e 1 f e r i с h, Klein, Ann., 450, 219 A926).
10 Z e m p 1 6 n, Ber., 48, 232 A915).
ПЕНТААЦЕТИЛ-й-ГЛЮКОНОНИТРИЛ
CH2OH (CHOHLCHO -* CH2OH(CHOHLCH = NOH ->
-s- CH2OCOCHS (CHOCOCHs)j CN
Предложили: Х. Кларк и С. Нэджи.
Проверили: В. Бахман и У. Кол.
Получение
В 1-литровую трехгорлую круглодонную колбу, снабженную
обратным холодильником, защищенным хлор кальциевой трубкой,
помещают 350 мл абсолютного метилового спирта, к которому
прибавляют 20 г @,87 грамматома) натрия в виде больших кусков
(примечание 1). Реакцию регулируют при помощи охлаждения
колбы в бане с ледяной водой. К полученному раствору метилата
натрия прибавляют раствор (примечание 2) 61 г хлористоводород-
хлористоводородного гидроксиламина @,88 моля) в 20 мл воды; во время прибавле-
прибавления содержимое колбы взбалтывают кругообразным движением,
чтобы избежать разбрызгивания. Через 20 мин. смесь охлаждают
до 0°, фильтруют с отсасыванием и промывают хлористый натрий
350 мл абсолютного метилового спирта. Фильтрат и промывную
жидкость соединяют вместе, нагревают до 65° в 3-литровой кругло-
донной колбе и при перемешивании прибавляют к содержимому
колбы раствор 100 г тщательно измельченной продажной кристал-
кристаллической глюкозы (с 1 молекулой кристаллизационной воды;
0,50 моля) в 200 мл теплого 25%-ного водного метилового спирта.
Температуру полученного раствора поддерживают при 65° в тече-
течение 2 час, а затем выпаривают его в вакууме до тех пор, пока не
прекратится отгонка дестиллата. Вес остатка составляет 155—160г.
Полученную сиропообразную жидкость (примечание 3) разбавляют
300 мл метилового спирта и вновь перегоняют, после чего повто-
повторяют этот процесс еще один раз (примечание 4).
В 3-литровой круглодонной колбе с эффективным обратным
холодильником нагревают на паровой бане смесь 100 г безводного
уксуснокислого натрия в порошке и 677 мл 90%-ного уксусного
ангидрида (примечание 5). Через капельную воронку к горячей
смеси прибавляют, не прекращая нагревания, раствор сиропообраз-
сиропообразного оксима глюкозы в 50 мл ледяной уксусной кислоты и 100 мл
холодного уксусного ангидрида (примечание 6). Эта операция зани-
занимает около 1 часа (примечание 7). Нагревание продолжают в тече-
течение еще 1 часа, а затем всю массу уксусной кислоты C80—420 мл)
и не вошедший в реакцию уксусный ангидрид отгоняют в вакууме
на водяной бане. Остаток немедленно размешивают с 2 л холодной
воды, после чего смесь оставляют на ночь, причем в течение пер-
первых 3 час. ее время от времени перемешивают.
Затем смесь охлаждают до 0е, бурую кристаллическую массу
отфильтровывают с отсасыванием и промывают 500 мл воды. Твер-
Твердое вещество растворяют в 300 мл 95%-ного этилового спирта,
раствор нагревают в течение 5 мин. с 10—15 г активированного
березового угля и фильтруют с отсасыванием. Фильтрат посте-
постепенно охлаждают до 0°. Кристаллы отфильтровывают с отсасы-
отсасыванием и промывают 20 мл холодного спирта. Выход кристаллов
первой порции составляет 90—93 г. Для получения второй пор-
порции вещества маточный раствор выпаривают в вакууме до объема
25 мл, после чего кипятят его с активированным березовым углем,
фильтруют и охлаждают фильтрат до 0°. Общий выход бесцвет-
бесцветного пентаацетил-й-глюкононитрила с т. пл. 82,5—83,5е соста-
составляет 95—96 г E0% теоретич.).
374
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
4-ПЕНТЕН-1-ОЛ
375
Примечания
1. При получении свободного гидроксиламина натрий берут
в количестве, несколько меньшем теоретического, чтобы избежать
присутствия в реакционной смеси свободной щелочи.
2. Хлористоводородный гидроксиламин растворяется в указан-
указанном небольшом количестве воды при нагревании примерно до 125°.
3. Выделение оксима глюкозы, согласно этой методике, не
является необходимым.
4. Перегонку с метиловым спиртом производят для того,
чтобы по возможности полностью удалить воду.
5. Если имеется уксусный ангидрид более высокой концентра-
концентрации, то можно применить соответственно меньшее его количество.
6. Вязкий сиропообразный оксим глюкозы растворяется с
трудом, и может оказаться необходимым слабое нагревание смеси.
В последнем случае следует иметь под рукой баню с ледяной водой,
чтобы смесь можно было охладить, если начнется быстрое повы-
повышение ее температуры.
7. Согласно методике, описанной в литературе, реакцию между
оксимом, уксуснокислым натрием и уксусным ангидридом про-
проводят без дополнительного разбавления смеси. Это часто приво-
приводит к тому, что. процесс протекает бурно и его не удается регу-
регулировать.
Другие методы получения
Изложенный выше способ получения оксима глюкозы является
видоизменением метода, предложенного Якоби1 и далее разрабо-
разработанного Волем2, который первым превратил оксим в пентаацетил-
глюкононитрил с помощью уксусного ангидрида. Последнюю реак-
реакцию позднее применили для тех же целей Цемплен и Кисе3.
1 J а с о b i, Bcr., 24, 696 A891).
2 W о h 1, Ber., 26, 730 A893).
3 Z e m p 1 ё n, Kiss, Ber., 60, 165 A927).
CH2-CH2
4-ПЕНТЕН-1-ОЛ
CH2 CH2
+ SOC12
^
CH2 CHCH3OH
CH2-CH2
CH2 CHCH2C1
+ SO2 + HC!
Ha CHCH2C1
2Na ~> NaOCH2CH2CII2CH =
NaOCH2CHaCH2CH=CH2 I H2O -* HOCH3CH2CH2CH=CH2+NaOH
Предложили: Л. Брукс и X. Снайдгр.
Проверили: Н. Дрэйк и В, Смит.
Получение
Хлористый тетрагидрофурфурил. В 2-литровую трехгорлую
колбу, снабженную механической мешалкой, капельной воронкой
и термометром, помещают 408 г D моля) свежеперегнанного
тетрагидрофурфурилового спирта (примечание 1) и 348 г D,4 моля)
пиридина. К этой смеси, которую энергично перемешивают и
охлаждают в бане со льдом, через капельную воронку прибавляют
500 г D,2 моля) свежеперегнанного хлористого тионила (примеча-
(примечание 1) со скоростью 3—5 капель в секунду. После того как будет
прибавлено от одной трети до половины всего количества хлори-
хлористого тионила, начинает выпадать в осадок пастообразная кри-
кристаллическая масса и температура смеси быстро повышается.
Нельзя допускать, чтобы температура поднялась выше 60°. По мере
того как будет продолжаться прибавление хлористого тионила,
масса снова растворяется с образованием темнобурой жидкости.
Когда прибавление будет закончено, баню отставляют и смесь
перемешивают в течение еще 3—4 час. Жидкость (или кашеобраз-
кашеобразную массу, если произошла частичная кристаллизация) перели-
переливают в стакан (примечание 2) и экстрагируют семь раз эфиром
порциями по 500 мл (примечание 3); эфирные вытяжки деканти-
декантируют и соединяют вместе. Эфир отгоняют, а остаток промывают
три раза водой порциями по 100 мл, сушат над безводным серно-
сернокислым магнием и перегоняют в вакууме. Выход хлористого тетра-
гидрофурфурила ст. кип. 41—42е A1 мм) [47—48° A5 мм)] соста-
составляет 354—360 г G3—75% теоретич.).
4-Пентен-1-ол. Трехгорлую колбу емкостью 2 л, содержащую
112 г D,87 моля) распыленного натрия (примечание 4) под слоем
абсолютного эфира G00 мл), снабжают механической мешалкой,
делительной воронкой и обратным холодильником, защищенным
хлоркальциевой трубкой. К быстро перемешиваемой суспензии
прибавляют несколько миллилитров B—3 ) смеси 300 г B,5 моля)
хлористого тетрагидрофурфурила и 300 мл абсолютного эфира.
Начинается бурная реакция, и раствор становится голубым. После
этого в течение 5 час. к смеси прибавляют по каплям оставшееся
количество раствора хлорида, охлаждая при этом колбу в бане
со льдом (примечание 5). После того как все количество реагента
будет прибавлено, перемешивание продолжают в течение еще
2 час. Суспензию отделяют с помощью декантации от небольшого
количества оставшегося натрия (примечание 6) и сливают ее в су-
сухой стакан, где разлагают достаточным количеством ледяной воды,
так чтобы получилось два слоя жидкости. Эфирный слой отде-
отделяют и сушат над сернокислым магнием. Эфир отгоняют на
паровом нагревателе и затем перегоняют остаток. Выход 4-пен-
тен-1-ола с т. кип. 134 — 137° составляет 161 — 178 г G6—83%
теоретич.).
376
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Примечания
1. Можно применять продажный хлористый тионил и про-
продажный тетрагидрофурфуриловый спирт без предварительной
перегонки, однако выходы в этом случае оказываются несколько
ниже F5—70%).
2. Проверявшие синтез нашли, что отделять эфирные вытяжки
от остатка легче, если смесь находится в большой делительной
воронке.
3. Выход будет низким, если вещество экстрагировано не пол-
полностью. Рекомендуется перемешивать смесь толстой стеклянной
палочкой и разбивать ею образующиеся комки.
4. Распыленный натрий приготовляют в среде горячего кси:
лола (стр. 93) с помощью мешалки Гершберга («Синт. орг. преп.»,
сб. 2, стр. 298, рис. 12); ксилол декантируют и заменяют эфиром.
5. Баню со льдом применяют только после того, как реакция
действительно начнется.
6. Иногда па дне колбы остается небольшое количество натрия.
Его разрушают добавлением спирта; затем колбу промывают
ледяной водой.
Другие методы получения
Хлористый тетрагидрофурфурил был получен из соответ-
соответствующего спирта и хлористого тионила1 или треххлористого фос-
фосфора. 4-Пентен-1-ол был получен из бромистого или хлористого
тетрагидрофурфурила при действии магния или натрия2-1.
1 К i r n e r, J. Am. Chera. Soc, 52, 3251 A930).
2 Paul, Bull. soc. chira., D), 53, 424 A933); E), 2, 745 A935).
' Robinson, Smith, J. Ghem. Soc, 1936, 196.
4Gambert, Lin stead, Rydon, J. Chem. Soc, 1937, 1972;
ПЕРЕКИСЬ л-НИТРОБЕНЗОИЛА
2 n-O2NC6H4COCl + Na2O2 -^ [n-O2NC6H4COO]2
Предложили: Ч. Прайс и Э. Кребс.
Проверили: Р. Шрайнвр и К. Тилфорд.
Получение
В стакан емкостью 600 мл, снабженный эффективной мешал-
мешалкой, термометром и делительной воронкой емкостью 200 мл, нали-
наливают 100 мл воды и погружают его в баню со льдом и водой. Когда
температура воды понизится до 0—5°, к содержимому стакана
прибавляют 10 г @,13 моля) перекиси натрия (примечание 1),
после чего при сильном перемешивании прибавляют по каплям
ПЕРЕКИСЬ п-НИТРОБЕНЗОИЛА
377
в течение получаса раствор 37 г @,2 моля) хлористого я-нитробен-
зоила в 100 мл сухого толуола. Смесь перемешивают дополни-
дополнительно в течение еще полутора часов, осадок отфильтровывают
и промывают 200 мл холодной воды (примечание 2). Выход пере-
перекиси я-питробензоила ст. пл. 155—156° составляет 28,5—29 г
(86—88% теоретич.).
Для перекристаллизации вещества наиболее удобно раство-
растворить его по возможности быстрее (примечание 3) в 500 мл сухого
толуола, предварительно нагретого до 80—85°. Как только твер-
твердое вещество полностью растворится (после 2—3 мин. перемеши-
перемешивания), раствор фильтруют через нагретую воронку Бюхнера
и фильтрат немедленно охлаждают в бане с водой и льдом. Пре-
Препарат получается в виде бледножелтых блестящих игольчатых
кристаллов. Выход составляет 25—26 г (86—89% после перекри-
перекристаллизации); т. пл. 156° (с бурным разложением; примечание 4).
Примечания
1. В параллельном опыте, в котором было взято 25 г перекиси
натрия, осадок представлял собой не перекись, но, очевидно,
натриевую соль п-нитропербензойной кислоты.
2. Подкислив фильтрат, можно выделить п-нитробензойную-
кислоту.
3. Чрезмерное нагревание во время перекристаллизации
приводит к значительному разложению перекиси.
4. По методу, который был описан для получения перекиси
я-нитробензоила, были также синтезированы перекись л-нитро-
бензоила (т. пл. 136—137°) с выходом 90%, перекись анизоила
(т. пл. 126—127°) с выходом 86—89%, перекись я-бромбензоила
(т. пл. 144°) с выходом 73% и перекись 3,4,5-трибромбензоила
(т. пл. 116°) с выходом 40%1. Этот метод оказался неудовлетвори-
неудовлетворительным для получения перекиси ацетилсалициловой кислоты,
которую удобнее синтезировать действием перекиси водорода на
раствор соответствующего хлорангидрида в ацетоне.
Другие методы получения
Перекись я-нитробензоила2, а также перекиси ж-нитробензоила2
и анизоила3 были получены с выходом около 50%из соответствую-
соответствующих хлорангидридов и раствора перекиси водорода в ацетоне
в присутствии таких основных веществ, как пиридин, уксусно-
уксуснокислый натрий или едкий натр. Перекись .и-нитробензоила
была получена также нитрованием перекиси бензоила холодной
концентрированной азотной кислотой4, а также холодной5 или
горячей2 смесью азотной и серной кислот;
1 Price, Kell, Krebs, J. Am. Chem. Soc, 64, 1104 A942).
2Vanino, Uhlfelder, Ber., 33, 1046 A900).
:378
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
3 Vanino, Uhlfelder, Ber., 37, 3624 A904).
4 В г о d i e, J. Chem. Soc, 17, 271 A864).
l
5 Vanino,
.'58, 285 A925).
, 17, 271 A864).
Ber., 30, 2004 A897); Gelissen, Hermans, Ber.
1-(«-ПИРИДИЛ)-2-ПРОПАНОЛ
[2-(ф-Оксипропил)-пиридин]
CeHsBr i-2Li —C6H5Li + LiBr
CBH5Li +
jCH,
+ СН3СНО —-
Jch2chch3
OLi
H2O
+ LIOH
Предложил; Л. Вальтер.
Проверили: Ч. Аллен и Дж. ВанАллан.
Получение
Через 1-литровую трехгорлую колбу, снабженную капель-
капельной воронкой, механической мешалкой и обратным холодильни-
холодильником, защищенным от влаги воздуха, пропускают ток сухого азота
и одновременно вливают в нее 400 мл абсолютного эфира и до-
добавляют 6,9 г A грамматом) лития (в мелких кусочках; примеча-
примечание 1). Пускают в ход мешалку и через капельную воронку при-
прибавляют 10—15 мл раствора 79 г @,25 моля) сухого бромбензола
в 100 мл абсолютного эфира. Обычно реакция начинается немед-
немедленно. Если же это не произойдет, то колбу можно нагреть; тогда
остаток раствора следует прибавлять с такой скоростью, чтобы
эфир слегка кипел. Смесь перемешивают до тех пор, пока весь
литий не исчезнет (примечание 2).
После этого к содержимому колбы прибавляют 46 г @,5 моля)
а-пиколина (примечание 3) и перемешивают смесь в течение 1 часа
при комнатной температуре, причем образуется тёмнокрасный
раствор пиколиллития. Затем колбу погружают в баню со льдом
и солью и, когда смесь полностью охладится, прекращают про-
пропускание азота и колбу отъединяют. После этого в течение 20 мин.
1-(»-ПИрИДИЛ)-2-ПР0ПАН0Л
379
в смесь медленно по каплям прибавляют раствор 20 г сухого ацет-
альдегида в 50 мл абсолютного эфира (примечание 4). Красная
окраска полностью исчезает. Через 15 мин. к смеси медленно при-
прибавляют 100 мл воды, а затем 100 мл концентрированной соляной
кислоты (уд. вес 1,20). Водный слой отделяют и выливают при
перемешивании в теплый раствор 300 г кристаллической соды
Na2CO3-10H2O в 100мл воды (примечание 5). Неочищенный про-
продукт реакции выделяется в виде масла; его извлекают 300 мл хлоро-
хлороформа. Углекислый литий, выпавший в осадок, отфильтровывают,
переносят в стакан и перемешивают с четырьмя порциями хлоро-
хлороформа по 200 мл. Хлороформенные вытяжки декантируют или филь-
фильтруют и все порции хлороформенного раствора соединяют вместе
(примечание 6). Хлороформ отгоняют, а остаток фракционируют
в вакууме с эффективным дефлегматором. 1-(а-Пиридил)-2-пропанол
перегоняется в узких пределах: 116—117° A7 мм) [124—125°B0лш)].
Небольшой головной погон и значительное количество высоко-
кипящего остатка отбрасывают. Выход составляет 30—34 г
D4—50% теоретич., считая на а-пиколин; примечания 7 и 8). Под
действием света вещество темнеет, поэтому его необходимо хра-
хранить в сосуде из коричневого стекла.
Примечания
1. Наиболее затруднительная операция в этом синтезе заклю-
заключается в подготовке лития. Литий можно хорошо измельчить,
натирая его о грубый рашпиль для дерева так, чтобы опилки прямо
через большую воронку из бумаги попадали непосредственно
в эфир, причем одновременно через колбу пропускают быстрый
ток сухого азота. Такая методика наиболее удобна в случае измель-
измельчения большого куска лития; количество опилок при этом можно
определить на основании потери в весе исходного куска. С успе-
успехом (см. примечание 2) можно применить также куски большего
размера, нарезанные ножом («Синт. орг. преп.», см. 2, стр. 517).
Удобный способ для получения литиевого песка опубликовали
Бартлетт, Свэйн и Вудвард1.
2. Продолжительность реакции зависит от размера кусков
лития; перемешивание раствора в течение суток не оказывает
влияния на выход.
3. Авторы синтеза применяли продажный а-пиколин с т. кип.
128—130°. Проверявшие синтез использовали а-пиколин с т. кип.
128—134°, свежеперегнанный в вакууме. Если пиколин содержит
воду, то его следует тщательно фракционировать, чтобы отделить
¦ее в виде азеотропной смеси а-пиколин — вода с т. кип. 93°.
4. По другому способу ацетальдегид непосредственно перего-
перегоняют в колбу через трубку для ввода азота. Во время перегонки
трубку для отвода газов следует значительно поднять над поверх-
380
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ностью смеси, чтобы она не забилась. Введение альдегида пре-
прекращают, как только исчезнет красная окраска раствора.
5. Этот раствор можно заменить раствором 111 г безводного
углекислого натрия в 150 мл воды.
6. Если для выделения аыиноспирта из его соли применить
едкий натр, то при экстрагировании хлороформом образуются
нерасслаивающиеся эмульсии.
7. Высокие выходы 1-(а-пиридил)-3-пропанола с т. кип.
116—118° D мм) можно также получить, применяя вместо ацеталь-
дегида окись этилена.
8. Выходы, полученные авторами синтеза, достигали 43 г
F0% теоретич.).
Другие методы получения
Описанный метод основан на работе Циглера2. 1-(<х-Пиридил)-
2-пропанол был также получен с низкими выходами D—6%)
нагреванием в запаянных трубках а-пиколина с водным раствором
ацетальдегида3-4.
1 Bartlett, Swain, Woodward, J. Am. Chem. Soc, 63,
3230 A941).
2 Z i e g 1 e r, Z e i s e r, Ann., 485, 174 A931).
3 L a d e n b u r g, Ann., 301, 140 A898).
4Meisenheimer, Mahler, Ann., 462, 308 A928).
ПСЕВДОИОНОН
CH3C = CHCH2CH2C = CHCHO + CH3COCH3
NaOC2H5
C2H5OII
CH,
CH3C = CHCH2CH2C = CHCH = CHCOCHS + H
CHS
CH3
Предложили: А. Расселл а Р. Кенион.
Проверили: Л. Смит, В. Ренфроу, мл. и, Л. ДеМитт.
Получение
Очистка цитраля. В 4-литровую склянку помещают 1 л воды,
1 кг измельченного льда, 450 г безводного сульфита натрия (или
эквивалентное количество кристаллического сульфита натрия),.
320 г двууглекислого натрия и 270 г C04 мл, 1,78 моля) продаж-
продажного цитраля (примечание 1). Склянку закупоривают хорошей
пробкой, которую надежно укрепляют проволокой; затем в тече-
течение 5—6 час. склянку энергично встряхивают на качалке. После
этого раствор, содержащий лишь очень небольшое количество не-
неизменившегося цитраля, дважды экстрагируют эфиром порциями
по 300 мл (примечание 2).
ПСЕВДОИОНОН
381
Круглодонную колбу емкостью Ъл снабжают 1-литровой капель-
капельной воронкой, горло которой соединяют с трубкой, проходящей
через пробку колбы, и весь этот прибор жестко прикрепляют к
качалке (примечание 3). В колбу помещают около половины суль-
сульфитного раствора и приливают к нему 800 мл эфира. В капельную
воронку помещают 800мл 10%-ного водного раствора едкого натра.
Начинают встряхивание и, когда содержимое колбы хорошо пере-
перемешается, приливают к нему в течение примерно 1 часа неболь-
небольшой непрерывной струей раствор едкого натра. После прибавле-
прибавления всего раствора встряхивание продолжают в течение не более
5 мин.; затем смесь переливают в большую делительную воронку.
Водный слой сливают, а эфирный— переливают в отдельный сосуд.
Затем водный слой снова возвращают в делительную воронку,
добавляют к нему 300 мл эфира и 200 мл 10%-ного водного
раствора едкого натра и встряхивают. После разделения слоев
водный слой экстрагируют один раз 150 мл эфира, а затем соеди-
соединенные вместе эфирные вытяжки сушат над безводным серно-
сернокислым натрием.
Оставшуюся половину сульфитного раствора подвергают такой
же обработке. Все эфирные вытяжки соединяют вместе и после
высушивания отгоняют эфир на водяной бане, а остаток перего-
перегоняют в вакууме. Выход почти бесцветного цитраля с т. кип.
84—85° B мм) [93—95° E мм)] составляет 200—215 г.
Псевдоионон. В 2-литровую круглодонную колбу, снабженную
механической мешалкой, капельной воронкой и термометром, по-
помещают 203 г B30 мл, 1,33 моля) чистого цитраля и 800 г A 010 мл,
13,8 моля) ацетона (химически чистого, высушенного над безвод-
безводным поташом). Смесь охлаждают до —5° (или ниже) в бане со льдом
и солью и при энергичном перемешивании прибавляют к ней
из капельной воронки холодный раствор 9,2 г @,4 моля) металли-
металлического натрия в 200 мл абсолютного спирта. Раствор этилата
натрия прибавляют с максимальной скоростью, при которой можно
еще поддерживать температуру —5° или ниже (быстро идущие
капли). После того как прибавление будет окончено, перемеши-
перемешивание продолжают в течение еще 3—4 мин. Затем к смеси приба-
прибавляют раствор 30 г @,2 моля) винной кислоты в 200 мл воды
и немедленно перегоняют ее с водяным паром, чтобы удалить избы-
избыток ацетона. При прибавлении винной кислоты может выпасть
белый осадок, который исчезает во время перегонки с водяным
паром (примечание 4). Смесь в перегонной колбе охлаждают в бане
со льдом, после чего верхний слой (около 380 мл) отделяют и энер-
энергично кипятят в течение 5—6 час. с тройным объемом 25%-ного
водного раствора бисульфита натрия.
По охлаждении смесь дважды экстрагируют эфиром порциями
по 200 мл, чтобы удалить вещество, не вступившее в реакцию
с бисульфитом. Половину водного раствора вместе с 650 мл эфира
382
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
помещают в экстрактор, укрепленный на качалке. Туда же
прибавляют вычисленное количество 10%-ного водного раствора
едкого натра A моль едкого натра на 1 моль взятого бисуль-
бисульфита натрия), как это указано при описании способа . очистки
цитраля. После того, как прибавление щелочи будет закон-
закончено, встряхивание продолжают в течение еще 15 мин. (при-
(примечание 5). Слои разделяют (примечание 6); водный слой воз-
возвращают в делительную воронку и приливают к нему 200 мл
эфира. После прибавления 100 мл 10%-ного раствора едкого
натра смесь энергично взбалтывают, водный слой отделяют
и экстрагируют свежей порцией эфира в 200 мл. Затем повторно
дважды экстрагируют водный слой эфиром — один раз с прибавле-
прибавлением едкого натра, другой раз без него. Вторую половину бисуль-
фитного раствора подвергают аналогичной обработке, после чего
все эфирные вытяжки соединяют вместе (примечание 7) и сушат
над безводным сернокислым натрием. Эфир отгоняют на водяной
бане и оставшееся масло желто-зеленого цвета перегоняют в
вакууме. Выход имеющего бледножелтую окраску псевдойонона
ст. кип. 114—116° B мм) [124—126° D мм)] составляет 120—130 г
D5—49% теоретич., из расчета на 210 г чистого цитраля).
Примечания
1. Если не требуется получить чистый псевдоионон, свободный
от изомеров, то пет необходимости производить тщательную
очистку цитраля или псевдойонона. Проверявшие синтез работали
с продажным цитралем, 90% которого выкипало в пределах трех
градусов [100—103° Gмм)]. Проверявшие синтез исходили из рас-
раствора 203 г такого перегнанного цитраля в 1 л продажного ацетона
и разработали следующую методику. Раствор цитраля охлаждают
в бане со льдом и солью до —10° и одну четвертую часть его пере-
передавливают с помощью сжатого сухого воздуха в круглодонную
трехгорлую колбу емкостью 500 мл, снабженную мешалкой,
капельной воронкой и подвижной выводной трубкой такой длины,
чтобы она достигала дна колбы. Затем туда же прибавляют по кап-
каплям одну четвертую часть раствора 9,2 г натрия в 200 мл абсо-
абсолютного спирта, причем температуру поддерживают в интервале
от 0 до —5°. После прибавления всего количества алкоголята
перемешивание продолжают в течение еще 3 мин., а затем пере-
передавливают реакционную смесь в сосуд, содержащий одну чет-
четвертую часть раствора 33 г винной кислоты в 200.мл воды-
От момента прибавления первой капли алкоголята до начала
передавливания смеси в кислоту проходит 14 мин. Таким же
образом конденсацию повторяют еще три раза и соединенную
вместе подкисленную смесь перегоняют с водяным паром до тех
пор, пока не отгонится 1 л дестиллата. Весьма важно, чтобы
ПСЕВДОИОНОН
383-
во время перегонки с паром реакция раствора оставалась слегка
кислой. Остаток в колбе охлаждают, слои разделяют и водный
слой экстрагируют эфиром. Верхний слой остатка и эфирные
вытяжки соединяют вместе, сушат над сернокислым натрием
и перегоняют. Выход псевдойонона с т. кип. 123—124° B,-5 мм)
составляет 177,8 г G0% теоретич., считая на цитраль). Если про-
проводить конденсацию небольшими порциями, то регулировать
температуру становится значительно легче; выходы при этом
сильно повышаются. При каталитическом восстановлении полу-
полученного псевдойонона в автоклаве образовывался гексагидро-
псевдоионол с т. кип. 124—128° A0 мм); выход составлял более
90% теоретического количества.
2. При переработке таких значительных количеств лучшие
результаты достигаются в том случае, если экстрагирование и
прочие операции проводить с отдельными небольшими порциями.
3. Можно предусмотреть также установку предохранительного
клапана для спуска давления, однако описанное здесь устройство
вполне достаточно. Как цитраль, так и псевдоионон быстро поли-
меризуются при действии водной щелочи. Описанный прибор не-
непрерывно обеспечивает тщательное перемешивание сульфитного
раствора с эфиром. По мере распада бисульфитного соединения
выделившийся свободный кетон немедленно извлекается эфиром,
в результате чего удается избежать продолжительного соприко-
соприкосновения кетона с едким натром.
4. После того как будет закончено прибавление раствора алко-
алкоголята и до начала перегонки с водяным паром следует работать
быстро; аппаратура должна быть полностью собрана до того
момента, когда начнется прибавление алкоголята. Если до приба-
прибавления винной кислоты оставить раствор стоять, то он потемнеет
и частично осмолится. Важно, чтобы во время перегонки с водя-
водяным паром реакция раствора оставалась слегка кислой.
5. Продукт присоединения бисульфита к исевдоионону, в от-
отличие от продукта присоединения бисульфита к цитралю, по-
видимому, разлагается довольно медленно; если разделить слои
слишком быстро, то в растворе останется некоторое количество
неизменного бисульфитного соединения. В дальнейшем оно разла-
разлагается и под действием щелочи полимеризуется с образованием
смолы тёмнокрасного цвета.
6. Проверявшие синтез получали при этом три слоя: нижний
водный слой, тёмнокрасный маслянистый слой и верхний эфир-
эфирный слой. Эфирный слой отделяли, а остальные два слоя подвер-
подвергали повторной обработке. При последующих экстрагированиях
темный маслянистый слой постепенно исчезал.
7. Проверявшие синтез промывали эфирные вытяжки неболь-
небольшим количеством воды, чтобы обеспечить удаление щелочных
веществ.
384
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Другие методы получения
• Псевдоионон был получен конденсацией цитраля и ацетона
с применением в качестве конденсирующих агентов насыщенного
раствора гидрата окиси бария1, спиртового раствора этилата
натрия2'3 или металлического натрия4. Псевдоионон (не индиви-
индивидуальный препарат) был получен из цитраля и ацетона в случае
применения в качестве конденсирующего агента спиртового рас-
раствора едкого натра4, а также обработкой лемопграссового масла
и ацетона хлорной известью, азотнокислым кобальтом и спир-
спиртом5-7.
1 Т i e m a n п, К г u g е г, Вег., 26, 2692 A893).
2 S t i e h I, J. prakt. Chem., B), 58, 84 A898).
3 T i e m a n n, Ber., 32. 115 A899).
* H i b b e r t, Cannon, J. Am. Chem. Soc, 46, 1 19 A924).
5 Z i e g 1 e r, J. prakt. Chem., B). 57, 493 A898).
«Tiemann, Ber., 31, 2313 A898).
7 Haarmann und Reimer Ко., герм. пат. 73098 [Frdl., 3, 889
A890—1894)].
РЕЗАЦЕТОФЕНОН
B,4-Диоксиацетофенон)
ZnCIa
HO
X.
он
Предложил: С. Купер.
Проверили: Н. Дрдйк, Г. Антон и Р. Мозинго.
Получение
В стакане емкостью 1 л растворяют при нагревании 165 г
A,2 моля) безводного хлористого цинка (примечание 1) в 165 г
A58 мл, 2,7 моля) ледяной уксусной кислоты. К горячей смеси
(около 140°) прибавляют при непрерывном перемешивании ПО г
A моль) резорцина. Раствор нагревают на песчаной бане только
до начала кипения (около 152°). Затем источник нагревания уда-
удаляют и предоставляют реакции заканчиваться самопроизвольно
при температуре, не превышающей 159° (примечание 2). После того
как стакан простоит на песчаной бане без нагревания в течение
20 мин., раствор разбавляют смесью 250 мл концентрированной
соляной кислоты и 250 мл воды; при этом образуется тёмнокрас-
тёмнокрасный раствор. Стакан помещают в баню со льдом и содержимое его
охлаждают до 5°. Образовавшийся осадок собирают на фильтре
и отмывают от солей цинка разбавленной A : 3) соляной кислотой
^ЁЗАЦЁТОФВНОН
383
порциями по 200 мл (всего 1 л). После высушивания количество
оранжево-красного вещества составляет 104—ПО г; т. пл. 141—143°.
Вещество перегоняют в вакууме (примечание 3); оно переходит
при 180—181° (Юла) [147—152° C—4 мм)]. После того как боль-
большая часть вещества будет перегнана, температура начинает резко
повышаться; перегонку прекращают, когда температура дости-
достигает 190°. Светложелтый дестиллат удаляют из приемника с по-
помощью горячего этилового спирта, а затем спирту дают испариться
(примечание 4). Вес полученного препарата составляет 100—106 г.
Дальнейшая очистка состоит в следующем. Вещество растворяют
в 1 800 мл горячей разбавленной A:11) соляной кислоты, горя-
горячий раствор фильтруют и охлаждают до 5°. Кристаллы отфильтро-
отфильтровывают, промывают двумя порциями по 200 мл ледяной воды
и сушат. Выход резацетофенона, окрашенного в рыжевато-коричне-
рыжевато-коричневый цвет, составляет 93—99гF1—65% теоретич.); т. пл. 142—144°.
Примечания
1. Хотя мелко растертый хлористый цинк растворяется быстрее,
пригоден также и хлористый цинк в кусках или палочках.
2. Если температура поднимется значительно выше началь-
начальной температуры кипения, то увеличится выход окрашенного
в красный цвет вещества и уменьшится образование резацето-
фенона. Температура кипения полученного препарата также может
несколько измениться.
3. Можно применить любой прибор, пригодный для перегонки
твердых веществ.
4. Для удаления большей части вещества удобно его распла-
расплавить и вылить из приемника. Остаток удаляют с помощью спирта.
Другие методы получения
Резацетофенон был получен нагреванием резорцина с хлори-
хлористым цинком и уксусной кислотой1-2, с хлористым цинком и уксус-
уксусным ангидридом2 и с хлористым цинком и хлористым ацетилом3.
Он был получен также действием хлористого цинка па диацетат
резорцина2; нагреванием 4-метилумбеллиферона с едким кали4;
нагреванием резацетофенонкарбоновой кислоты5; действием хло-
хлористого ацетила на резорцин6.
'Robinson, Shah, J. Chem. Soc, 1934, 1491.
2 N e n с k i, Sieber, J. prakt. Chem., B), 23, 147 A881).
3 E i j k m a n, Chem. Weekblad, I, 453 A904) [Chem. Zentr., 75, II,
1597 A904)].
4Pechmann, Duisberg, Ber., 16, 2119 A883).
5Liebermann, Lindenbaum, Ber., 40, 3570 A907)
•Cox, Rec. trav. chim., 50, 848 A931).
25 соорник 3
386
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
C6H6MgBr
СЕЛЕНОФЕНОЛ
Se
затем НС1
C6H5SeH+MgClBr
Предложил: Д. Фостер.
Проверили: Ч. Аллен и Г. Крессмэн.
Получение
Внимание! Большинство соединений селена ядовито, а
многие из них обладают отвратительным запахом. Обычно реко-
рекомендуется работать с ними через день. Вся работа должна прово-
проводиться в хорошо действующем вытяжном шкафу. Следует надевать
резиновые перчатки; стекло вытяжного шкафа лучше опустить,
так чтобы оно находилось между прибором и лицом работающего.
Селенистый водород, один из возможных побочных продуктов
реакции, очень ядовит; в этом отношении его можно сравнивать
с цианистым водородом. Случайное вдыхание его, даже в незна-
незначительном количестве, может вызвать заболевание гортани.
Трехгорлую круглодонную колбу емкостью 500 мл снабжают
эффективным обратным холодильником, механической мешалкой
с глицериновым затвором (стр. 225), капельной воронкой и труб-
трубкой для ввода газа, доходящей почти до лопастей мешалки
(примечание 1). Верхний конец обратного холодильника присоеди-
присоединен к системе поглотителей, причем поглотительная склянка /
дополнительно (по сравнению с прибором, описанным в «Синт.
орг. преп.», сб. 1, стр.. 551, рис. 28) снабжается предохранитель-
предохранительной трубкой, доходящей почти до ее дна (примечание 2). В склянку
j наливают воду слоем в 2 см высотой; эта склянка служит счет-
счетчиком пузырьков. Склянку К на одну треть наполняют 50%-ным
раствором едкого кали. Все части прибора устанавливают в затем-
затемненном вытяжном шкафу и продувают аппаратуру сухим водоро-
водородом (примечания 3 и 4). Бромистый фенилмагний получают в колбе
обычным способом1 из 78,5г @,5 моля) бромбензола, 12 г @,5 грамм-
атома) магния и 500 мл абсолютного эфира. Затем капельную
воронку удаляют и вместо нее присоединяют колбу (стр. 19),
содержащую 38 г @,48 грамматома) сухого селена в виде черного
порошка (примечание 5). Раствор подогревают до тех пор, пока
не начнется спокойное кипение, а затем в течение получаса посте-
постепенно прибавляют к нему селен с такой скоростью, чтобы поддер-
поддерживать спокойное кипение без нагревания извне. Перемешивание
продолжают в течение еще получаса (примечание 6).
После этого содержимое колбы выливают в сосуд, содержащий
600 г колотого льда, и, помешивая от руки, прибавляют к смеси
75 мл соляной кислоты (уд. вес 1,18). Затем холодную смесь филь-
фильтруют через стеклянную вату, находящуюся в обычной воронке, не-
непосредственно в 2-литровую делительную воронку. Водный слой
отделяют и экстрагируют один раз 250 мл эфира (примечание 7).
СЕЛЕНОФЕПОЛ
387
Вытяжки и основной продукт соединяют вместе и сушат над 30 г
хлористого кальция, после чего эфир отгоняют на паровой бане,
а остаток перегоняют из специальной колбы Клайзена («Синт.
орг. преп.», сб. 1, стр. 142, рис. 8) емкостью 500 мл. Селено-
фенол собирают при 57—59° (8 мл) [84—86е B5 мм)]; выход состав-
составляет 43—54 г E7—71% теоретич.; примечания 6 и 9—14).
Полученный селенофенол следует немедленно запаять в стеклян-
стеклянной ампуле (примечание 8).
Примечания
1. Можно пользоваться сухим водородом или сухим азотом,
причем эти газы не должны содержать кислород. Присутствие
водорода способствует уменьшению возможности окисления до
диселенида.
2. Авторы синтеза применяли более простую поглотительную
систему, состоящую из двух небольших широкогорлых склянок,
соединенных последовательно и закрытых пробками со вставлен-
вставленными в них необходимыми трубками для ввода и вывода газа;
были использованы стеклянные трубки диаметром 10 мм или
более. В каждую склянку было налито небольшое количество
50%-ного раствора едкого кали; трубка для отвода газа из первой
склянки доходила почти до поверхности раствора и была погру-
погружена ниже этого уровня во второй склянке.
3. Солнечный свет действует на большинство соединений селе-
селена; на многие из них оказывает влияние вообще яркий свет. По-
Поэтому часто бывает весьма важным пользоваться посудой из жел-
желтого стекла или обертывать сосуды светонепроницаемой бумагой.
4. Соединения селена, содержащие группу SeH, легко окисля-
окисляются кислородом воздуха до диселенидов. Поэтому целесообразно
заменить воздух на инертный газ и работать как можно быстрее.
5. Селен сушат в течение ночи в вакуум-эксикаторе над кон-
концентрированной серной кислотой.
6. Отсутствие воздуха, быстрое перемешивание и не слишком
быстрое прибавление селена способствуют более высоким выходам
селенофенола.
7. Можно применить также и другую методику, согласно кото-
которой селенофенол извлекают раствором едкого натра, а затем
подкисляют полученный раствор и экстрагируют выделившееся
вещество. В случае синтеза самого селенофенола выход при таком
методе работы не улучшается, однако при получении некоторых за-
замещенных селенофенолов эта методика может оказаться полезной.
8. Селенофенол бесцветен, но при соприкосновении с воздухом
быстро желтеет.
9. Остаток в колбе (или примеси, нерастворимые в щелочи
и оставшиеся в эфирном слое, если было использовано указание,
388
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
сделанное в примечании 7) содержит дифенилселенид [т. кип. 167°
A6 мм)] и дифенилдиселенид (т. пл. 63°). Их можно выделить,
сочетав перегонку с перекристаллизацией из спирта; однако полу-
получаемые количества незначительны и процесс выделения не находит
оправдания, если не имеют в виду объединить остатки от несколь-
нескольких опытов.
10. Приведенная выше реакция является общей. Ее можно
применить для получения также и других селенофенолов в тех
¦случаях, когда доступен соответствующий реактив Гриньяра.
Автор синтеза получил этим методом все три селено крезола,
я-бромфенилселенофенол и н-бутилселенол. При замене селена
на серу автором были получены также тиофенолы.
П. Автор синтезировал девять алкилфенилселенидов с выхо-
выходом 85—95% теоретического количества при действии спиртовых
растворов натриевой соли (для получения которых селенофенол
растворяют в вычисленном количестве 50%-ного водного раствора
едкого нятра, разбавленного спиртом) на соответствующий алкил-
галогенид или диалкилсульфат.
12. Многие селенофенолы значительно целесообразнее полу-
получать омылением арилселеиоцианатов.
13. Для очистки прибора удобно в том же вытяжном шкафу
иметь баню с горячей смесью серной и азотной кислот, чтобы
можно было не выносить отдельные части установки из вытяж-
вытяжного шкафа на лабораторные столы. Большая делительная ворон-
воронка хорошо очищается, если в нее налить 50 мл концентрирован-
концентрированной азотной кислоты. Через несколько минут кислота начинает
бурно реагировать с селенидами, оставшимися на стенках. Обра-
Образующиеся окислы азота хорошо очищают воронку, которую после
этого можно ополоснуть водой.
14. Растворимые в воде соединения селена выливают в нахо-
находящийся в вытяжном шкафу- сток, который затем промывают
большим количеством проточной воды. Резиновые пробки и пер-
перчатки можно обезвредить, погрузив их на несколько минут в бром-
бромную или хлорную воду, а затем в разбавленный раствор едкого
натра.
Другие методы получения
Селенофенол был получен из четыреххлористого селена и бен-
бензола в присутствии безводного хлористого алюминия2, а также
по описанной выше прописи3, которая представляет собой даль-
дальнейшую разработку метода Табури*.
'Аллеи, К о н в е рс, Синт. орг. преп., сб. 1, стр. 207.
2 Ch abri e, Bull. soc. chim., B), 50, 133 A888); Ann. chim. phys.,
F), 20, 229 A890).
3 Foster, Brown, J. Am. Chem. Soc, 50, 1184 A928).
4 Taboury, Bull. soc. chim., C), 29, 762 A903); Ann. chim. phys..,
(8), 15, 36, 38 A908).
dl-СЕРИН
389
Й/-СЕРИН
2 = CHCO2CH3
Hg (ОСОСНз)з
KBr
CH3OCH2CII (HgOCOCH 3) CO2CH, —^
СН3ОН
СН3ОСН2СН (HgBr) CO2CH3 —Д. CH3OCH2CHBrCO2CH3
—> CHsOCH2CHBrCO2H
NHa
CH3OCH2CH (NH
Nils
IIBr
Nils
-» CHjOHCH (NH3Br) CO2H > CH2OHCH (NH2) CO2H
Предложили: Г. Картер и Г. Вест.
Проверили: Н. Дрэйк и У. Стэнтон.
Получение
Метиловый эфир а-бром-^-метоксипропионовой кислоты.
В 5-литровую колбу помещают 450 г 60%-ного раствора метил-
акрилата в метиловом спирте (примечание 1), содержащего 3,1 моля
метилакрилата (примечание 2). К этому раствору прибавляют
180 г метилового спирта и 960 гC моля) уксуснокислой ртути (при-
(примечание 3). Смесь оставляют стоять в течение 3 дней при комнат-
комнатной температуре, время от времени взбалтывая ее (примечание 4).
Затем содержимое колбы охлаждают в бане со льдом и в течение
15 мин. при перемешивании прибавляют к нему раствор 360 г
C моля) бромистого калия в 1 200 мл воды. Выделившееся тяже-
тяжелое масло экстрагируют 2 400 мл хлороформа (примечание 5),
и водный слой вновь экстрагируют 600 мл того же растворителя.
Хлороформенные растворы соединяют вместе, три раза промы-
промывают водой и тщательно сушат над безводным сернокислым маг-
магнием (примечание 6).
Раствор фильтруют, чтобы освободить его от осушителя, а
затем помещают в 4-литровый стакан и нагревают до 50°. Содер-
Содержимое стакана подвергают действию прямого солнечного света
(примечание 7) и при перемешивании прибавляют к нему 450 г
B,81 моля) брома (примечание 8) с максимальной скоростью, при
которой он успевает обесцвечиваться. Вначале реакция идет
медленно, но затем она быстро ускоряется и проходит с выделе-
выделением значительного количества тепла. Температуру раствора сле-
следует поддерживать ниже 55° (примечание 9). Обычно бромирование
занимает 20—30 мин. К концу реакции колбу охлаждают в течение
15 мин. в смеси льда с солью, после чего отфильтровывают бром-
бромную ртуть. Хлороформ отгоняют в вакууме с дефлегматором высо-
высотой 50 см, а остаток фракционируют в вакууме, пользуясь специ-
специальной колбой Клайзена («Синт. орг. преп.», сб. 1, стр. 142, рис. 8).
Выход вещества составляет 480—510 г (81—86% теоретич., считая
на уксуснокислую ртуть). Температура кипения полученного
метилового эфира а-бром-^-метоксипропионовой кислоты 70—80°
F мм). Препарат содержит 5—10% метилового эфира а,C-дибром-
390
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
пропионовой кислоты, удалить который не легко. Так как эта
примесь не мешает при проведении синтеза серина, то получен-
полученный бромоэфир применяют в следующей стадии без дополнитель-
дополнительной очистки (примечание 10).
а-Бром-В-метоксипропионовая кислота. Трехгорлую колбу
емкостью 5 л снабжают эффективной мешалкой и делительной
воронкой и охлаждают ее проточной водопроводной водой. В колбу
помещают 800 г полученного, как было указано выше, бромо-
эфира и 1 л 0.5 н. раствора едкого натра. Пускают в ход мешалку
и в течение 2 час. прибавляют к смеси еще 800 г 5 н. раствора едкого
натра. Когда прибавление будет закончено, раствор дополнительно
перемешивают в течение 1 часа, а затем нейтрализуют эквивалент-
эквивалентным количеством серной кислоты (примечание 11). Нейтрали-
Нейтрализованный раствор экстрагируют эфиром, один раз порцией в 1 л
и три раза порциями по 500 мл. Эфирные вытяжки соединяют
вместе, промывают один раз холодным насыщенным раствором
сернокислого натрия, сушат над безводным сернокислым натрием
и эфир отгоняют (примечание 12). Остается 700—750 г сырой
а-бром -[3-метоксипропионовой кислоты, которую без дополнитель-
дополнительной очистки применяют для получения серина (примечание 13).
dl-Серин. Половину C50—375 г) неочищенной а-бром-C-мет-
оксипропионовой кислоты, полученной омылением 800 г мети-
метилового эфира этой кислоты, нагревают с 3 500 мл концентриро-
концентрированного водного аммиака в'автоклаве со стеклянным вкладышем
(примечание 14) в течение 10—15 мин. при температуре 90—100°.
Затем раствор выливают из автоклава и выпаривают его в вакууме
до консистенции густого сиропа (примечание 15). К последнему
прибавляют 2 л воды и раствор выпаривают досуха. Сухой остаток
растворяют в 1 500 мл 48%-ной бромистоводородной кислоты
и раствор кипятят в течение 2,5 часа с обратным холодильником.
Полученную темную жидкость выпаривают до объема 500 мл,
а затем охлаждают под краном. Выпавший в осадок бромистый
аммоний отфильтровывают и фильтрат выпаривают до консистен-
консистенции густого сиропа (примечание 16). К последнему прибавляют
1 л воды и раствор снова выпаривают до консистенции густого
сиропа, который растворяют в 375 мл теплой воды, после чего
к раствору осторожно прибавляют водный аммиак до тех пор,
пока после сильного взбалтывания не будет все же заметен слаоый
запах аммиака. Затем к раствору медленно приливают 1 500 мл
абсолютного спирта (примечание 17) и смесь оставляют стоять в те-
течение ночи. Неочищенный серии отфильтровывают и фильтрат от-
отбрасывают. Осадок растворяют в 500 мл кипящей воды (примечание
18), нагревают в течение 10 мин. на паровом нагревателе с 10—15 г
животного угля (примечание 19) и фильтруют. К фильтрату ме-
медленно при перемешивании прибавляют 500 мл абсолютного
спирта. Смесь охлаждают до 0° и, перемешивая ее время
di-СЕРИН
391
от времени, поддерживают при этой температуре в течение
1 часа, чтобы обеспечить образование мелкозернистого осадка
(примечание 20). Серии отфильтровывают, промывают спиртом
и эфиром и сушат на воздухе. Порции осадка, полученные от
нескольких опытов, можно соединить вместе и перекристаллизо-
вать, как было указано выше, из 50%-ного спирта, повторяя эту
операцию до тех пор, пока не будет получен бесцветный препарат
(одна или две повторные перекристаллизации).
Все фильтраты следует соединить вместе и выпарить в вакууме
досуха, а остаток—перекристаллизовать, как было указано выше.
Фильтрат от последней перекристаллизации и раствор от допол-
дополнительной обработки фильтров и животного угля, если они окра-
окрашены в темный цвет, можно до перекристаллизации переосадить
из 70%-ного спирта. Работая таким образом, удается выделить
почти все количество вещества.
Общий выход составляет 30—40% теоретического количества,
считая на уксуснокислую ртуть (примечание 21).
Примечания
1. Был применен продажный раствор метилакрилата в мети-
метиловом спирте.
2. При использовании раствора метилакрилата, уже стояв-
стоявшего в течение некоторого времени, рекомендуется применять
его с 10%-ним избытком, так как концентрация раствора при
стоянии уменьшается. Низкий выход бромоэфира обычно вызы-
вызывается недостаточным количеством взятого метилакрилата.
3. С таким же успехом вместо уксуснокислой ртути можно
использовать 648 г C моля) окиси ртути и 345 мл C60 г, 6 молей)
уксусной кислоты. Раствор этих веществ следует охладить в бане
со льдом; после того как все реагенты будут смешаны, их необхо-
необходимо энергично взбалтывать в течение нескольких минут, так как
реакция окиси ртути с уксусной кислотой протекает с выделением
значительного количества тепла.
4. К этому времени в смеси все еще остается небольшое коли-
количество нерастворенной уксуснокислой ртути (а также окиси ртути
в случае ее применения). Более продолжительное стояние не улуч-
улучшает выхода.
5. С растворами ртутных соединений следует обращаться
с осторожностью, так как на некоторые лица они оказывают на-
нарывное действие.
6. Вромирование протекает более гладко, если хлороформен-
ный раствор отмыт от метилового спирта и высушен.
7. Бромирование можно с таким же успехом проводить при
освещении реакционной смеси двумя сильными лампами для фото-
фотографирования. Лампы, снабженные соответствующими рефлек-
392
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
торами, следует установить по возможности ближе к поверхности
раствора. Продолжительность реакции в этом случае может
несколько увеличиться.
8. Требуется применение эффективной мешалки. К концу
бромирования осадок бромной меди становится тяжелым и его
трудно перемешивать.
9. Температуру раствора можно регулировать, если в стакан
опустить стеклянный змеевик (диаметр трубки 8 мм), через кото-
который проходит водопроводная вода. Бромирование протекает
быстро при 45—55°, значительно медленнее при 35—40° и практи-'
чески прекращается ниже 30°.
10. Неочищенный сложный эфир может быть применен непо-
непосредственно для получения серина. Однако большая легкость
ее очистки и возможность получения лучших выходов делают
выгодным промежуточное выделение свободной кислоты. Чистый
метиловый эфир а-бром-3-метоксипропионовой кислоты получают
дробной перегонкой неочищенного вещества в вакууме, пользуясь
колонкой Видмера. Из 100 г сырого препарата получают 80—90 г
чистого эфира с т. кип. 73—75° F мм) и с показателем преломле-
преломления nld 1,4586.
11. При гидролизе и при нейтрализации рекомендуется поддер-
поддерживать температуру ниже 30°.
12. Кислоту не следует нагревать в течение длительного вре-
времени. Последние следы эфира необходимо удалять в вакууме.
13. Если неочищенная бромокислота простоит в течение 2—3
дней, то из нее выпадет в осадок аморфное твердое вещество, кото-
которое, повидимому, является продуктом полимеризации а-бромакри-
ловой кислоты. Удалением этой примеси до аминирования бромо-
кислоты значительно облегчается последующая очистка серина.
14. Проверявшие синтез пользовались простым автоклавом,
состоящим из трубы длиной 28 см и диаметром 25 см, с обоих концов
которой сделаны винтовые нарезки. С одной стороны на трубу на-
навинчивается стандартная заглушка, с другой стороны —стандарт-
—стандартный фланец. Второй такой же фланец навертывается па аммиачный
вентиль и является крышкой автоклава. Батарейный толстостен-
толстостенный стакан из стекла пирекс высотой 25 см и диаметром 22 см
свободно вставляется в трубку. Чтобы он не разбился, между
стаканом и стенками автоклава помещают кольца, сделанные
из резиновых трубок. Батарейный стакан покрывают переверну-
перевернутой стеклянной чашкой Петри, которая препятствует стеканию
конденсата с крышки в реакционную смесь. Бромокислоту поме-
помещают в батарейный стакан, после чего кольцевое пространство
между стаканом и трубой заполняют концентрированным водным
аммиаком для обеспечения лучшей теплопроводности. Автоклав
нагревают в стиральном баке, в котором вода кипит под действием
парового змеевика.
СОРБИНОВАЯ КИСЛОТА
393
15. Во всех стадиях настоящего синтеза выпаривание в вакууме
проводилось при помощи эффективного водоструйного насоса.
16. С целью выделения бромистоводородной кислоты дестиллат
можно перегнать при атмосферном давлении.
17. Абсолютный спирт B00 мл) прибавляют к теплому F0—70°)
раствору и, чтобы вызвать кристаллизацию, потирают стенки
колбы стеклянной палочкой; оставшееся количество спирта при-
прибавляют затем в течение 1 часа большими порциями и при пере-
перемешивании.
18. Чистый dl-серин растворим в воде в количестве 50 г на
1 л при 25°, 200 г при 80° и примерно 30 г при 5—10°. Однако нали-
наличие примесей значительно увеличивает его растворимость.
19. Животный уголь дает лучшие результаты по сравнению
с древесным активированным углем.
20. При медленной кристаллизации образуются большие кри-
кристаллы, в которые вкраплены окрашенные примеси.
21. Величина выхода находится в прямой зависимости от каче-
качества взятого метилакрилата.
Другие методы получения
Серин был получен по методу Штрекера из гликолевого альде-
альдегида1 и из этоксиацетальдегида 2-3; конденсацией этилового эфира
муравьиной кислоты с этиловым эфиром гиппуровой кислоты
с последующим восстановлением и гидролизом 4>5; из продукта
реакции хлорметилового эфира с натрийфталимидмалоновым
эфиром6; аминированием а-бром-8-метоксипропионовой кислоты
с последующим деметилированием7.
1 Е. Fischer, Leuchs, Ber., 35, 3788 A902).
2Leuchs, Geiger, Ber., 39, 2644 AГ06).
3Dunn, Rcdcmann, Smith, J. Biol., Chem., 104, 511 A934).
«Erlenmeyer, Ber., 35, 3769 A902).
5Erlenmeyer, Stoop, Ann., 337, 236 AS04).
6 M i t r a, J. "Indian Chem. Soc, 7, 799 A930).
'Schlitz, Carter, J. Biol. Chem., 116, 793 A936).
СОРБИНОВАЯ КИСЛОТА
Пиридин
CHSCH = CHCHO + HaC (CO2HJ
Предложили: Ч. Аллен и Дж. ВанАллан.
Проверили: К- Гамильтон и Р. Альбети.
Получение
В 1-литровую колбу помещаютсмесь80г(93,2.шг, 1,14моля) кро-
тонового альдегида (т. кип. 102—103°), 120 г A,15 моля)малоновой
394
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
кислоты1 (т. пл. 134—135°) и 120 г A22 мл, 1,52 моля) пири-
пиридина (т. кип. 113—115°). Смесь кипятят в течение 3 час. с обратным
холодильником на паровой бане. К концу этого времени выделение
углекислого газа практически прекращается. Затем содержимое
колбы охлаждают льдом и при взбалтывании прибавляют к нему
раствор 42,5 моля @,76 моля) концентрированной серной кислоты
в 100 мл воды. Большая часть сорбиновой кислоты выделяется
сразу; остальное количество получают после сильного охлажде-
охлаждения раствора в бане со льдом в течение 3 час. Неочищенную
кислоту отфильтровывают с отсасыванием и промывают один раз
небольшим количеством ледяной воды; препарат тотчас же пере-
кристаллизовывают из 250 мл кипящей воды. Очищенную кислоту,
которая выпадает в осадок после того, как раствор простоит в тече-
течение ночи в холодильном шкафу, отфильтровывают; вещество
плавится при 134°. Выход составляет 36—41 г B8—32% теоретич.;
примечания 1—3).
Примечания
1. Авторы синтеза показали, что выход (в процентах) не изме-
изменяется в случае применения удвоенных по сравнению с указан-
указанными выше количеств реагентов.
2. Приведенная реакция является общей. Если в качестве
растворителя применить уксусную кислоту, то можно получить
замещенные малоновые кислоты, тогда как органические основа-
основания облегчают отщепление углекислоты. Обычно получаемый
препарат представляет собой смесь, из которой можно выделить
только одно вещество.
3. Применение простых альдегидов даст лучшие выходы непре-
непредельных кислот; это особенно можно заметить при использовании
ароматических альдегидов2. Имеются указания на получение
смесей а, C- и [^-[--ненасыщенных кислот при применении алифа-
алифатических альдегидов и некоторых катализаторов основного харак-
характера
,3,4
Другие методы получения
Сорбиновая кислота была получена из кротонового альдегида5
или альдоля6 и малоновой кислоты в пиридиновом растворе;
окислением перекисью водорода продукта конденсации кротоно-
кротонового альдегида и пировиноградной кислоты7; действием щелочи
на З-окси-4-гексеновую кислоту8-9, р,3-дисульфо-я-капроновую
кислоту10 и парасорбиновую кислоту11-12.
1 В е й н е р, Синт. орг. прей., сб. 2, стр. 309.
2Pandya Pandya, Proc. Indian Acad. Sci., 14A, 112A941)
[C. A., 36, 1599 A942)].
троис-СТИПЬБЕН
395
3 Auwers, Ann., 432, 58 A923).
4 Boxer, Linstead, J. Chem. Soc, 1931 740
5 D о e b n e r, Ber., 33, 2140 A900).
6 Ri edel, Ann., 361, 90 A908).
7 S medley, Lubrzynska, Biochem. J., 7, 370 A913)
8 Яворский, ЖРФХО, 35, 274 A903).
"Яворский, Реформатский, Ber., 35, 3636 A902)
10 N о t e b о h n, Ann., 412, 77 A916).
11 H о f m a n n, Ann., 110, 132 A859).
12 D о e b n e r, Ber., 27 351 A894).
wpawc-СТИЛЬБЕН
C6HBCH(OH)COC6H5 + 4H -!1^!)Д CeH5CH-CHCeHB
HC]
Предложили: Р. Щрайнер и А. Берджер.
Проверили: В. Бахман и Ч. Максвелл.
Получение
В 4-литровый стакан, снабженный мощной механической ме-
мешалкой, доходящей почти до дна стакана, помещают 500 мл воды
и 50 г сулемы. Пускают в ход мешалку и в полученную суспен-
суспензию быстро присыпают 200 г C,06 грамматома) цинковой пыли.
Перемешивание продолжают до тех пор, пока сулема не рас-
растворится (около 20—30 мин.). Затем цинку дают осесть, жид-
жидкость декантируют, а амальгаму цинка отфильтровывают и про-
промывают 200 мл воды. Затем амальгаму возвращают в стакан,
который погружают в баню со льдом, и прибавляют к ней 500 мл
95%-ного этилового спирта и 100 г @,48 моля) бензоина («Синт.
орг. преп.», сб. 1, стр. 95). Пускают в ход мешалку и через ка-
капельную воронку прибавляют к смеси 500 мл концентрированной
соляной кислоты с такой скоростью, чтобы прибавление было
закончено примерно через 2 часа; в течение всей реакции темпе-
температуру поддерживают ниже 15°. Перемешивание продолжают еще
около 2 час.
К реакционной смеси прибавляют около 2 л холодной воды
и отделяют осадок на воронке Бюхнера, после чего его переносят
его в 2-литровый стакан и экстрагируют двумя порциями горя-
горячего этилового спирта по 600 мл. Из соединенных вместе вытяжек
по охлаждении выпадает в осадок стильбен в виде длинных иголь-
игольчатых кристаллов в количестве 55—59 г; вещество плавится при
116—121°. Кристаллы отфильтровывают с отсасыванием и пере-
кристаллизовывают из 600 мл 95%-ного этилового спирта. Ве-
Вещество получается в виде бесцветных игольчатых кристаллов
с т. пл. 123—124°. Выход составляет 45—48 г E3—57% теоретич.).
396
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Другие методы получения
В основном приведенную выше методику разработали Баллард
и Дэн1. Стильбен был также получен восстановлением дезокси-
бензоина2а, бензальдегида20 и бензила2а'2в; дегидрогенизацией этил-
бензола33, толуола3а'3б-зв и дибснзилазб>Зг; щелочным восстановле-
восстановлением фенилнитрометана4а, фенилнитроацетонитрила4а и дезокси-
бензоина46; перегонкой бензилсульфона5а, бензилсульфида5а> 5б,
кальциевой соли коричной кислоты513, коричной кислоты61', фенило-
вого эфира коричной кислоты5д- 5е и дифенилового эфира фумаро-
вой кислоты6д; отщеплением элементов галоидоводородной кислоты
от а, а'-дихлордибензила6а и хлористого бензила66; дегалоидирова-
нием а, а, а', а'-тетрахлордибензила7а и бензальхлорида70; сочета-
сочетанием коричной кислоты и хлористого фенилдиазония8; дегидрата-
дегидратацией бензилфенилкарбинолава'9а, бензилового эфира 9б и бензило-
вого спирта06'013. Реакция сочетания солей диазония8, повидимому,
имеет наиболее широкое применение для синтеза замещенных
стильбенов.
1 В а 1 1 а г d, D e h n, J. Am. Chetn. Soc, 54, 3969 A932).
2 a) Irvine, W e i г, J. Chcm. Soc, 91, 1384 AG07); 6)W illiams,
Jahresb., 1867, 672; Barbaglia, Marquardt, Gazz. chim. ital.,
21, 195 A891); Baumann, Klett, Ber., 24, 3307 A89J); Law,
J. Chem. Soc, 91, 748 AS07); S с h e p p s, Ber., 46, 2564 A913); в) J e n a,
Limprich t, Ann., 155, 89 A870); В 1 a n k, там же 248, 1 A888).
3 a) Meyer, H о f m a n n, Monatsh., 37, 681 A916); б) В е h r,
Dorp, Ber., 6, 753 A973); Aronstein, van Nierop, Rec. trav.
chim., 21, 448 A902); в) L о г е n z, Ber., 7, 1096 A874); 8, 1455A875);
L a n g e, там же, 8, 502 A875); Michael is, Lang e, там же, 8, 1313
A875); Michaelis, Paneck, Ann., 212, 203 A882); r) D r e h e r,
Otto, там же, 154, 171 A870); В a r b i e r, Compt. rend., 78, 1769 A874);
Radziszewski, Ber., 8, 756 A875); К a d e, J. prakt. Chem., B), 19,
461 A879).
4 a) W i s 1 i с e n u s, E n d e s, Ber., 36, 1194 A903); 6) S u d b o-
rough, J. Chem. Soc, 67, 601 A895).
s a) F г о m m, А с h с г t, Ber., 36, 534 A903); б) М а г с к с r, Ann.,
136, 75 A865); L i m p r i с h t, S с h w a n e r t, там же, 145, 330 A868);
F о r s t, там же, 178, 370 A875); в) Е n g 1 е г, Lei s t, Ber. 6, 254 A873);
г) M i 1 1 e r, Ann., 189, 338 A877); д) Anschutz,' Ber., 18, 1945 A885);
e) S k r a u p, В е n g, там же, 60, 942 AS27).
6a)Meisenheimer, Hcim, Ann., 355, 249 A907); 6) Ч и ч и-
бабин, ЖРФХО, 34, 130 A902); L о е b Ber., 36, 3059 A903); А с г е е,
Am. Chem. J., 29, 593 A907).
7 a) L i е b е г m а и п, Н о m е у е г, Ber., 12, 1971 A879); б) L i m р-
r i с h t, Ann., 139, 303 A866); L i p"p m a n n, H a w 1 i с z e k, Jahresb.,
1877, 405.
8Meerwein, Buchner, van Emster, J. prakt. Chem., B),
152, 237 A939).
9 a) L i m p г i с h t, Schwanert Ann. 155 59 A870); Hell,
Ber., 37, 453 A904); 6) S z p e r 1, Chemik Polski, 15, 23 A917) fC. A.,
13, 2865 A919)]; в) G u e r b e t, Compt. rend., 146, 298 A908); Bull. soc.
chim., D), 3, 500 A908).
ТЕРЕФТАЛЕВЫЙ АЛЬДЕГИД
397
ТЕРЕФТАЛЕВЫЙ АЛЬДЕГИД
.сн3
,CHBr2
+4Вг2
2Н2О
,CHBr3
C6H4<_ +4HBr
H2SO4
Сн0
+4НВг
Предложили: Дж. Снелл и А. Вейсбергер.
Проверили: Р. Щрайнер и Н. Мун.
Получение
а, а, а', а'-Тетрабром-п-ксилол. Трехгорлую 1-литровую колбу
снабжают механической мешалкой с масляным затвором, капель-
капельной воронкой емкостью 500 мл и обратным холодильником, верх-
верхняя часть которого соединена с ловушкой для поглощения газов
(«Синт. орг. преп.», сб. 2, стр. 78, рис. 3). Электрическую лампу
мощностью 300 em с вольфрамовой нитью закрепляют в таком
положении, чтобы ее шарообразная часть была на расстоянии
2,5 см от колбы (примечание 1). В колбу вводят 100 г @,94 моля)
сухого л-ксилола (т. пл. 11—12°) и нагревают ее на масляной бане,
поддерживая температуру в пределах 140—160°. Пускают в ход
мешалку и, когда ксилол начнет кипеть, постепенно прибавляют
к нему через капельную воронку 700 г B24 мл, 4,38 моля) сухого
брома (примечание 2) с такой скоростью, чтобы в колбе ни в коем
случае не было большого количества непрореагировавшего брома.
Перемешивание и нагревание продолжают в течение всей реакции,
которая продолжается от б до 10 час. После того как весь бром
вступит в реакцию, смесь охлаждают и растворяют в 1 л теплого
хлороформа. Хлороформенный раствор охлаждают в бане со льдом
и выпавшие в осадок кристаллы отфильтровывают. Полученный
а, а, а', а'- тетрабром-л-ксилол окрашен в светлосерый цвет. Выход
составляет 250—258 г\ т. пл. 165—169°. После второй перекри-
перекристаллизации из 1 л хлороформа получают 190—200 г светлосерых
кристаллов с т. пл. 168—170°. Можно выделить дополнительно
15—20 г вещества, для чего хлороформенный фильтрат следует
упарить до 250 мл и осадок перекристаллизовать из свеже-
свежего хлороформа. Общий выход составляет 205—220 г E1—55%
теоретич.).
Терефталееый альдегид. Круглодонную колбу емкостью 2 л
снабжают насадкой с отводной трубкой для перегонки и капил-
капилляром и собирают обычный прибор для перегонки в вакууме.
В колбу помещают 84,3 г @,2 моля) хорошо измельченного тетра-
398
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
бром-л-ксилола и 200 мл концентрированной серной кислоты
(95%-ной). Реагенты тщательно смешивают, встряхивая колбу.
Для создания некоторого разрежения прибор присоединяют к
водоструйному насосу и через капиллярную трубку пропускают
в колбу ток воздуха, чтобы облегчить быстрое удаление броми-
бромистого водорода. Содержимое колбы нагревают на масляной бане
до 70° и, по мере того как выделение газа становится менее бурным,
температуру бани постепенно повышают до 110° (примечание 3).
Реакцию можно считать законченной, когда получится совершенно
прозрачный раствор и прекратится выделение газа (примерно
через 2,5 часа). После этого колбу охлаждают и содержимое ее
выливают в сосуд, в котором находятся 600 г измельченного льда.
Твердое кристаллическое вещество отфильтровывают, промывают
небольшим количеством воды и перекристаллизовывают из
600 мл 10%-ного метилового спирта с добавлением 1 г угля для
обесцвечивания, чтобы освободить препарат от желтой окраски.
Небольшое количество нерастворившегося тетрабромкеилола от-
отфильтровывается вместе с углем; все вместе промывают на фильтре
двумя порциями горячего 10%-ного метилового спирта по 100 мл.
Выход чистого терефталевого альдегида составляет 21,7—22,5 г
(81—84% теоретич.); т. пл. 115—116°.
Примечания
1. Имеет большое значение, чтобы в течение всего времени
бромирования реакционная смесь подвергалась действию света.
Реакцию бромирования можно проводить также установив колбу
на прямом солнечном свету.
2. Чтобы высушить бром, его взбалтывают с двумя порциями
концентрированной серной кислоты по 200 мл.
3. Смесь сильно пенится, и за ней необходимо присматривать.
Вспенивание можно контролировать, если температуру повышать
медленно и регулировать давление. Поэтому гидролизовать боль-
большие количества тетрабромида затруднительно.
Другие методы получения
Терефталевый альдегид был получен действием азотнокислого
свинца на а, а'-дихлор-л-ксилол1 или а, а'-дибром-п-ксилол2; дей-
действием дымящей азотной кислоты на дибром-л-ксилол3; омылением
тетраацетата терефталевого альдегида4; действием пятихлористого
фосфора на моноэтиловый эфир л-ксилиленгликоля5; гидролизом
а, а, а', а'-тетрахлор-л-ксилола"; гидролизом а, а, а', а'-тетрабром-
п-ксилола7. Приведенная здесь пропись в основном представляет
собой видоизменение метода, который описали Вейсбергер и Бах8.
1,2,3,4-ТЕТРААЦЕТИЛ-М-ГЛЮКОЗА
399
1 G ri m a u х, Bull. soc. cliim., B), 25, 337 A876); Compt. rend., 83'
825 A877).
2 L о w, Ann. 231, 361 A885).
3 Low, Ber., 18. 2072 A885).
4 T h i e 1 e, Winter, Ann., 311, 341 AS00).
5 С о 1 s о n, Bull. soc. chim., (i), 42, 152 A884).
6 С о 1 s о n, G a u t i e г, Bull., soc. chim., B), 45, 506 A886); Ann
chim., F), 11, 25 A887).
' H 6 n i g, Monatsh., 9, 1150 A888); T h i e 1 e, G u n t h e r, Ann.,
347, 106 A906).
1 Weissberger, Bach, Ber., 65, 24 A932).
1,2,3,4-ТЕТРААЦЕТИЛ-М-ГЛЮКОЗА
A,2,3,4-Тетраацетат ^-d-глюкозы)
HOCH2CH (CHOHK СНОН + (С6Н6K СС1 + C6H5N -ч>
о '
—> (CSH6K СОСН2СН (СНОНK СНОН + QsHj
—о—
(С,Н,K СОСН2СН
СНОН + 4 (СН3СОJ O + 4C5H6N
-о
- ' (СвН5K СОСН2СН (СНОСОСН3K СНОСОСНз + 4CSH5N • СН3СООН
о 1
(С6Н6K СОСН2 СП (СПОСОСН3)з СНОСОСН3 + НВг
- > (С6Н5K С Вг + НОСН3 СН (СНОСОСНзK СНОСОСН
Предложили: Д. Рейнольде и У. Эванс.
Проверили: Л. Смит, Р. Арнольд, Н. Бортник, А. Лернер и Э. Шультц.
Получение
1,2,3,4-Тетраацетил-6-трифенилметил-^-й-глюкоза. На паро-
паровом нагревателе подогревают до полного растворения (примечание 1)
смесь, состоящую из 120 г @,67 моля) безводной глюкозы, 193,2 г
@,7 моля) трифенилхлорметана и 500 мл безводного пиридина
(стр. 345; см. также «Синт. орг. преп.», сб. 1, стр. 93, примечание 2).
Не охлаждая реакционной смеси, к ней в один прием прибавляют
360 мл уксусного ангидрида (примечание 2). После того как реак-
реакционная смесь простоит в течение 12 час, ее медленно выливают
в 10 л ледяной воды, к которой добавлено 500 мл уксусной кис-
кислоты; полученную смесь энергично перемешивают в течение 2 час.
400
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
механической мешалкой (примечание 3). Осадок отфильтровывают
и непосредственно после этого размешивают в течение короткого
времени с 10 л ледяной воды. Белый зернистый осадок отфильтро-
отфильтровывают, тщательно промывают холодной водой и сушат на воздухе
(примечание 4). Высушенное вещество обрабатывают 500 мл эфира
(примечание 5); нерастворившуюся в эфире часть растворяют в го-
горячем 95% -ном этиловом спирте (около 3 л), раствор обесцвечивают
и фильтруют в горячем состоянии. Из фильтрата после охлажде-
охлаждения выпадают в осадок мелкие игольчатые кристаллы 1,2,3,4-тетра-
ацетил-6-трифенилметил-р-й-глюкозы. Препарат получается доста-
достаточно чистым для дальнейшего применения. На этой стадии выход
составляет около 169 г D3% теоретич.). При перекристаллизации
из 95%-ного этилового спирта получается чистое вещество с т. пл.
166—166,5°. Его удельное вращение в пиридине [ос]Ь9 + 44,8°;
[otJD8+ 45,3°. Выход очищенного тетраацетата составляет 137гC5%
теоретич.; примечание 6).
1,2,3,4-Тетраацетил-^-й-глюкоза. При нагревании на паро-
паровой бане приготовляют раствор 46 г @,078 моля) 1,2,3,4-тетра-
ацетил-6-трифенилметил-C-й-глюкозы в 200 мл уксусной кислоты.
Раствор охлаждают до температуры примерно 10°, прибавляют
к нему 18 мл насыщенного раствора сухого бромистого водорода "
в уксусной кислоте и взбалтывают реакционную смесь около 45 сек.
Образовавшийся в результате реакции трифеиилбромметан от-
отфильтровывают в один прием и фильтрат немедленно выливают
в сосуд, содержащий 1 л холодной воды. Тетраацетат извлекают
250 мл хлороформа; хлороформенные вытяжки промывают четыре
раза ледяной водой и сушат над безводным сернокислым натрием.
Осушитель отделяют и хлороформ выпаривают в вакууме при ком-
комнатной температуре. К оставшейся сиропообразной массе прили-
приливают 100 мл абсолютного эфира и потирают стенки колбы стеклян-
стеклянной палочкой, что приводит к немедленной кристаллизации.
Кристаллы отфильтровывают и очищают, для чего их растворяют
в минимальном количестве хлороформа и прибавляют к раствору
абсолютный эфир до начала кристаллизации. Очищенный препа-
препарат плавится при 128—129°. Удельное вращение в хлороформе
[а]о°+12,1°. Выход составляет 15 г E5% теоретич.).
. Примечания
1. Применяемые для этой реакции реагенты и аппаратура
должны быть абсолютно сухими; это необходимо, чтобы предотвра-
предотвратить гидролиз трифенилхлорметана.
2. Более высокая температура благоприятствует образованию
Р-изомера.
3. Перемешивание должно быть чрезвычайно быстрым; прили-
приливать раствор к воде следует медленно и тонкой струей. Если эти
2,3,4,6-ТЕТРААЦЕТИЛ-Р-Й-ГЛЮКОЗА
401
условия не-соблюдать, то осадок не получится зернистым йот
фильтровывать его будет крайне трудно.
4. Если во время высушивания осадок нагреется до комнат-
комнатной температуры, то он становится чрезвычайно липким, что
сильно затрудняет дальнейшую работу с ним. Это явление, пови-
димому, обусловлено присутствием следов пиридина. Проверяв-
Проверявшие синтез нашли, что в результате перекристаллизации из пири-
пиридина чистого препарата с т. пл. 166—166,5° получается липкое
вещество.
5. а-Изомер растворим в эфире, тогда как[3-изомер в нем нерас-
нерастворим. В некоторых случаях препарат растворяется полностью,
но при стоянии раствора выделяется ^-изомер.
6. Авторы синтеза указывают, что выход чистого препарата
в отдельных опытах колеблется от 148 до 180 г.
Другие методы получения
Настоящая пропись является видоизменением методов, которые
применяли для получения -1,2,3,4-тетраацетил-В-й-глюкозы Хель-
ферих и Клейн1, хотя, повидимому, Олдхэм получил это соедине-
соединение еще ранее гидролизом 6-мононитрата тетраацетилглюкозы2.
1 Н elf е rich, Klein, Ann., 450, 219A926); Н е 1 f е г i с h,
М о о g, 'Junger, Ber., 58, 877 A925).
2 О 1 d h a m, J. Chem. Soc, 127, 2840 A925).
2,3,4,б-ТЕТРААЦЕТИЛ-g d-ГЛЮКОЗА
B,3,4,6-Тетраацетат ^-d-глюкозы)
О
2CH3COOCH2CH(CHOCOCH3KCHBr + H2O + Ag3CO3
О
2CH0CO3CH2CH(CHOCOCH3KCHOH+2Ag
Предложили: Ч. Мак-Клоски и Дж. Кольмзн.
Проверили: /(. Гамильтон, Р. Анжир и И. Баумеарт.
Получение
В колбе емкостью 250 мл приготовляют раствор 82,2 г @,2 моля)
ацетсбромглюкозы (стр. 97) (примечание 1) в 125 мл сухого
ацетона (примечание 2) и охлаждают его до 0° в бане со льдом.
К холодному раствору прибавляют 2,3 мл воды, а затем неболь-
26 Сборник 3
402
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
шими порциями в течение 15 мин. 46,5 г @,17 моля) углекислого
серебра (примечание 3). Как во время прибавления, так и в течение
последующего получаса смесь энергично встряхивают (примечание
4). Затем ее нагревают до 50—60° и фильтруют. Соли серебра
промывают 65 мл сухого ацетона (примечание 5), удаляют их с
воронки, нагревают в колбе с 65 мл ацетона и вновь промывают
на воронке.
Соединенные вместе фильтраты упаривают в вакууме в склянке
для отсасывания емкостью 500 мл (примечание 6) до тех пор, пока
большая часть раствора не закристаллизуется. После этого смесь
нагревают, чтобы растворить кристаллы, раствор переливают
в стакан емкостью 600 мл и добавляют к нему равное по объему
количество абсолютного эфира и такое же количество легкого
бензина. Полученный раствор охлаждают в смеси льда с. солью
при слабом перемешивании. Быстро образуются кристаллы тетра-
ацетилглюкозы, которые примерно через 10 мин. отфильтро-
отфильтровывают и сушат на воздухе. Полученные таким образом кристаллы
плавятся при 132—134° (примечание 7). Если требуется более
чистый препарат, то кристаллы растворяют в ацетоне и к раствору
прибавляют, как было указано выше, эфир и легкий бензин. Выход
один раз перекристаллизованного вещества составляет 52—56 е
75—80% теоретич.); т. ил. 132—134°.
Примечания
1. Была применена тетраацетилбромглюкоза с т. пл. 87—88е.
2. Ацетон сушат над хлористым кальцием.
3. Углекислое серебро должно быть свежеприготовленным
и тщательно измельченным. Его можно получить прибавлением
раствора углекислого натрия E3 г в 600 мл воды) к раствору азот-
азотнокислого серебра A72 г в 2 л воды), которое, таким образом, ока-
оказывается в небольшом избытке. Раствор углекислого натрия
прибавляют медленно (в течение 10 мин.), энергично перемешивая
реакционную смесь механической мешалкой. Углекислое серебро
отфильтровывают, промывают небольшим количеством ацетона,
чтобы облегчить высушивание, а затем сушат на воздухе. Все опе-
операции проводят при ослабленном освещении.
4. К концу этого периода выделение углекислого газа не должно
быть более заметным. Время, необходимое для реакции, в большой
степени зависит от интенсивности перемешивания углекислого
серебра. В опытах с большими количествами исходных веществ
требуется механическое перемешивание.
5. Все применяемые в настоящем синтезе реагенты должны
быть безводными, так как присутствие заметных количеств воды
препятствует кристаллизации тетраацетилглюкозы.
ТЕТРАГИДРОПИРАН
408
6. Во время упаривания раствор не нагревают, так что темпе-
температура поддерживается ниже комнатной в результате испарения*
растворителя. Если желают пользоваться капилляром, то его еле--
дует снабдить хлоркальциевой трубкой.
7. 2,3,4,6-Тетраацетил-[3-й-глюкоза несколько разлагается при
продолжительном хранении; по прошествии 1—2 месяцев она.
плавится в пределах 5—8°. Такой препарат можно очистить
перекристаллизацией.
Другие методы получения
2,3,4,6-Тетраацетил-р-й(-глюкозу обычно получали гидролизом
тетраацетилбромглюкозы1.
1 Fischer, Delbruck, Бег., 42, 2776 A909); О е о г g, Helv.
Chim. Acta., 15, 924 A932); Hendricks, Wulf, I. i d d e 1, J. Am.
Chem. Soc, 58, 1998 A936); McCloskey, Pyle, С о 1 e rn a n,
там же, 66, 349 A944).
ТЕТРАГИДРОПИРАН
сн2
/ \
Н2С СН
Н2С СН
сна
11дкель Н,/ СН2
Рснея | |
Н/4 /~*Т I
Предложили: Д. Андрюс и Дж. Джонсон.
Проверили: Н. Дряйк и Ч. Икер.
Получение
Гидрирование осуществляют в аппарате для каталитического
восстановления («Синт. орг. преп.», сб. 1, стр. 46). Катализатором
может служить никель Ренея (стр. 338); последний промывают
три раза эфиром на воронке Бюхнера, а затем 8 г его переносят
подслоем эфира в сосуд для гидрирования. Сосуд снабжен рези-
резиновой пробкой, в которую вставлены небольшая капельная воронка
и стеклянная трубка, ведущая к одному из отводов трехходового
крана. Два остальных отвода крана присоединены соответственно к
водоструйному насосу и к источнику, инертного газа (примечание 1)
таким образом, чтобы эфир можно было откачать и затем напол-
наполнить сосуд инертным газом. После того как это будет выполнено,
в сосуд через капельную воронку вводят 50,5 г @,6 моля) ди-
гидропирана (стр. 176).
26*
404
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Сосуд присоединяют к аппарату для гидрирования и дважды
попеременно эвакуируют его и наполняют водородом. Затем
в систему вводят водород до тех пор, пока давление, отмечаемое
манометром, не достигнет 2,8 am. Пускают в ход качалку, после
чего за 15—20 мин. давление падает до теоретической величины,
соответствующей поглощению 0,6 моля водорода; дальнейшее
встряхивание не вызывает уже поглощения водорода (примеча-
(примечание 2). Сосуд отъединяют и никелевому катализатору дают осесть.
Тетрагидропиран декантируют, но при этом оставляют в сосуде
в таком количестве, чтобы он мог покрыть катализатор (приме-
(примечание 3). Вещество перегоняется при 85—86°, однако в ряде слу-
случаев его можно и не перегонять. Выход практически количествен-
количественный.
Примечания
1. Подходящим инертным газом может служить очищенный
азот; пригодным является также природный газ (метан), не содер-
содержащий кислорода или сернистых соединений. Проверявшие син-
синтез применяли для этой цели водород.
2. По мере старения катализатор частично теряет свою актив-
активность; в результате этого увеличивается время, необходимое для
того, чтобы давление упало до вычисленной на основании теории
величины.
3. Одну и ту же порцию катализатора можно применить не-
несколько раз. При последующих опытах дигидропиран просто нали-
наливают в сосуд с катализатором, смоченным тетрагидропираном,
полученным в предыдущем опыте.
Другие методы получения
Тетрагидропиран был получен гидрированием дигидропирана
в присутствии платиновой черни в качестве катализатора1; нагре-
нагреванием бромистого пентаметилена с водой2'3; нагреванием броми-
бромистого пентаметилена с водой и окисью цинка в запаянной трубке*;
нагреванием пентамстиленгликоля с тройным объемом 60%-ной
серной кислоты в запаянной трубке5.
1 Р a u I, Bull. soc. chira., D), 53, 1489 A933).
2 Hochstetter, Monatsh., 23, 1073 AG02).
3 H. Я. Демьянов, ЖРФХО, 45, 169 A913);
сборник, Изд. АН СССР, 1936, стр. 85.
1 Clarke, J. Chum. Soc, 101, 1802 A912); А 1
J. Am. Chera. Soc, 56, 1398 A934).
8 H. Я. Демьянов, ЖРФХО, 22, 389 A890); Избранные труды,
сборник, Изд. АН СССР, 1936, стр. 40.
Избранные труды,
е п, II i b b e r t,
а-ТЕТРАЛОН
«-ТЕТРАЛОН
NaOH
Н,
Предложил: Р. Томпсон.
Проверили: Р. Шрайнер и Л. Ползнд.
Получение
В 1-литровую кругло донную колбу, снабженную термометром,
трубкой, доходящей до дна колбы, и эффективным обратным холо-
холодильником (примечание 1), помещают 500 г тетралипа C,78 моля;
примечание 2). Верхнюю часть холодильника присоединяют к
водоструйному насосу и через тетралин просасывают медленный ток
воздуха. Пропускание воздуха продолжают в течение 50—55 час.
(примечание 3); в продолжение этого времени содержимое колбы
поддерживают при температуре 72—78° с помощью паровой бани.
По истечении указанного времени частично окисленный тетра-
тетралин выливают при сильном перемешивании с помощью меха-
механической мешалки в сосуд, содержащий 500 мл 2 н. раствора едко-
едкого натра (примечание 4). Продолжая перемешивание, смесь нагре-
нагревают на паровой бане до 60°; на этой стадии может потребоваться
охлаждение, которое производят путем добавления к смеси льда,
для того, чтобы температура ее не поднялась выше 70°. Смесь охла-
охлаждают до комнатной температуры и почти доводят до нейтральной
реакции прибавлением 6 н. раствора серной кислоты (примеча-
(примечание 5). Верхний слой смеси тетралина с а-тетралоном отделяют
и промывают 100мл 0,5 н. раствора серной кислоты, а затем 100-мл
1%-ного раствора сернокислой закиси железа (примечание 6).
Смесь сушат над 25 г безводного сернокислого натрия, а затем
подвергают дробной перегонке в вакууме, используя колонку
с насадкой (примечание 7). Непрореагировавший тетралин пере-
перегоняется при 65—72° B мм); количество его составляет 320—385 г.
Затем температура повышается и отгоняется фракция с т. кип.
105—107° B мм) [123—124° (9 мм)), которая представляет собой
практически чистый а-тетралон. Выход колеблется от 70 до
87 г D4—56% теоретич., считая на тетралин, вошедший в ре-
реакцию).
Примечания
1. Вполне пригодным оказался холодильник Либиха длиной
65 см, к верхней Части которого присоединен змеевиковый холог
.406
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
2,3,4,6-ТЕТРАЛТЕТИЛ-Й-ГЛЮКОЗА
407
дильник длиной 150 см. Можно использовать также холодильник
Либиха длиной 100 см, если форштосс его набить стеклянной
ватой. Барботер для воздуха должен иметь 4—5 мелких отверстий,
чтобы обеспечивать прерывистый ток воз-
воздуха в виде мелких пузырьков.
2. Был применен продажный тетралин
с т. кип. 206—209°.
3. Продолжать окисление в течение бо-
более 55 час. оказалось бесполезным; в неко-
некоторых случаях это приводит даже к сниже-
снижению выхода.
4. Другой способ выделения а-тетрало-
на, заключающийся в отгонке в вакууме
избытка тетралина от перекиси и после-
последующей обработке перекиси щелочью,
использовать не рекомендуется, так как
нагревание перекиси может привести к
сильному взрыву.
5. Если раствор остается щелочным, то
это препятствует извлечению тетралином
сильно окрашенных веществ кислого харак-
характера. Насыщение раствора хлористым на-
натрием ускоряет процесс экстрагирования.
6. Если на этой стадии образуется эмуль-
эмульсия, то ее можно разрушить, подкислив
раствор серной кислотой и прибавив к нему
50 г хлористого натрия. Промывание серно-
сернокислой закисью железа имеет существен-
существенное значение, так как оно способствует раз-
разрушению последних следов перекисей.
7. Вполне пригодна описанная Уитмо-
ром и Люксом1 колонка с насадкой из оди-
одиночных витков стеклянной спирали. Кон-
Конструкция простой колонки показана на
рис. 18. В качестве насадки в этой колонке
могут быть использованы стеклянные2 или
. . металлические спирали. Можно применять
I также кристаллы карборунда или любую
-*- "" иную насыпную насадку (см. примечание 8).
Колонку изолируют асбестовой бумагой.
При перегонке высококипящих веществ
колонку приходится обогревать, для чего
на нее наматывают нихромовую проволоку,
к которой подводят ток через соответствующее сопротивление.
Для разделения веществ с близкими температурами кипения сле-
следует применять насадку из одиночных витков стеклянной или
Рис. 18. Все размеры
даны в миллиметрах.
проволочной спирали. В настоящем синтезе, так же как и при
обычной работе, хорошие результаты могут быть получены, если
в качестве насадки применить кристаллы карборунда размером
с набухшее пшеничное зерно. Колонки* с такого рода насадками
н головкой для регулируемого отбора дестиллата оказались
весьма эффективными3.
8. Проволочные спирали изготовляют из медной или нихро-
мовой проволоки диаметром 1,2—1,5 мм. Проволоку (или лучше
одновременно две проволоки) наматывают на стальной стержень
диаметром 6 мм, который укреплен на оси электромотора. Спирали
разрезают на одиночные витки при помощи тонкого наждачного
круга, после чего их снимают со стержня.
Другие методы получения
Приведенный метод в основном разработали Хок и Сюземиль4.
Описания аналогичного процесса были опубликованы и другими
авторами5. Обзор прочих методов получения а-тетралона приведен
в «Синт. орг. преп.», сб. 2, стр. 448.
1 Whitmore, Lux, J. Am. Chem. Soc, 54, 3451 A932).
2 P ri се, М с D e r m о t t, lnd. Eng. Chem., Anal. Ed., 11. 289 A939).
3 Fenske и сотрудники, lnd. Eng. Chem., 24, 408 A932); 26, 1169,
1213 A934); 28, 644 A936).
4 H о с k, Snsemihl, Ber., 66, Rl A933).
5Brown, Widiger, Letang. J. Am. Chem. Soc, 61, 2601
A939).
2,3,4,б-ТЕТРАМЕТШ1-?(-ГЛЮКОЗА
HOCH2CH (CHOH), CHOH + 5 (CH3)a SO4 + 5NaOH -^
О
—> СН3ОСНгСН (CHOCHSKCHOCII3 + 5CH3NaSO4 + 5H2O
О
CH3OCII2CH (CHOCH3KCHOCH3 -f H2O ->
I o—l
-^ CH3OCH2CH(CtlOCH3KCHOH-t-CH3OH
Предложили: Э. Вест и Р. Хольден.
Проверили: В. Хартмзн и А. Швадерер.
* См. также М. И. Р о з е н г а р т, Техника лабораторной перегонки
и ректификации, Г'осхимиздат, 1951, стр. 52. (Прим. ред.)
408
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Получение
Этот синтез следует проводить в вытяжном шкафу с хорошей
тягой. Несмотря на высокую температуру кипения, диметилсуль-
фат обладает высокой упругостью паров и очень ядовит. Специфи-
Специфическим противоядием является аммиак, который необходимо иметь
под рукой, чтобы разрушить случайно разлитый диметилсульфат.
Рекомендуется часто мыть руки разбавленным раствором аммиака.
В 2-литровую перегонную колбу, погруженную в водяную
баню емкостью 4 л, помещают 25 г @,14 моля) безводной глюкозы
(примечание 1) и 15 мл воды. Колбу закрывают корковой пробкой,
через которую проходят эффективная и прочная механическая
мешалка (примечание 2) и трубка для прибавления жидкости,
соединенная при помощи резиновой трубки с винтовым зажимом
со склянкой емкостью 500 мл, имеющей нижний тубус. Боковой
отвод перегонной колбы присоединяют к холодильнику с водяным
охлаждением. В качестве приемника служит склянка для отсасы-
отсасывания, из которой пары отводят при помощи резиновой трубки в вы-
вытяжной шкаф. Температуру водяной бани повышают до 55° и глю-
глюкозу переводят в раствор при энергичном перемешивании, которое
не прекращают в течение всего процесса. В колбу прибавляют
из склянки с нижним тубусом по возможности быстро смесь 90 мл
A20 г, 9,5 моля) диметилсульфата и 125 мл четыреххлористого
углерода. Зажим закрывают и в склянку с тубусом помещают
400 мл E80 г) 40%-ного (по весу) раствора едкого натра. Щелочь
приливают в колбу со скоростью 1 капли в 2 сек. в течение 5 мин.,
со скоростью 1 капли в 1 сек. в течение следующих 5 мин. и, нако-
наконец, со скоростью 3 капель в 1 сек. до тех пор, пока не замедлится
или не прекратится отгонка четыреххлористого углерода. Обычно
это происходит через 15—20 мин., после того, как будет при-
прибавлено 70—90 мл щелочи. Температура смеси поддержи-
поддерживается за счет теплоты реакции в течение всего процесса при-
прибавления на желаемом уровне, т. е. в пределах 50—55е, а поэтому
нет необходимости подогревать водяную баню извне. Остаток
щелочи прибавляют по возможности быстрее; температуру бани
поднимают до 70—75° и затем поддерживают ее на этом уровне.
В склянку с тубусом помещают 160 мл B08 г, 1,65 моля) диметил-
диметилсульфата и немедленно же начинают приливать его в колбу со
скоростью 3—4 капель в секунду (если смесь будет сильно пениться,
то немного медленнее).
После того как будет прибавлен весь диметилсульфат, баню
кипятят в течение получаса, не прекращая перемешивания. Затем
содержимое колбы охлаждают, разбавляют достаточным коли-
количеством воды, чтобы растворить большую часть выпавшего в осадок
сернокислого натрия, и экстрагируют четыре раза хлороформом
порциями по 150 мл; хлороформенный слой тщательно отделяют
2,3,4,6-ТЕТРАМЕТИЛ-сг-ГЛЮКОЗА
409
от водного. Соединенные вместе хлороформенные вытяжки (приме-
(примечание 3) помещают в 2-или 3-литровую перегонную колбу, к кото-
которой присоединен холодильник, добавляют к содержимому колбы
400 мл 2 н. раствора соляной кислоты и отгоняют хлороформ.
Затем через раствор пропускают в течение 1 часа сильный ток пара,
причем следят за тем, чтобы объем раствора оставался постоянным,
для чего колбу подогревают. К горячему раствору прибавляют
5 г активированного березового угля, раствор охлаждают и филь-
фильтруют. Фильтрат насыщают сернокислым натрием и экстрагируют
четыре раза хлороформом порциями по 150 мл. Соединенные вместе
хлороформенные вытяжки сушат над сернокислым натрием, при-
прибавляют к раствору 1 г активированного березового угля и смесь
фильтруют. Хлороформ отгоняют по возможности полнее на кипя-
кипящей водяной бане сперва при атмосферном давлении, а затем в
вакууме водоструйного насоса. Полученный густой сироп обра-
обрабатывают 40—50 мл петролейного эфира (т. кип. 30—60°) и в тече-
течение короткого времени взбалтывают, в результате чего смесь пре-
превращается в кристаллическую массу. После охлаждения в бане
со льдом в течение получаса кристаллы отфильтровывают, про-
промывают небольшим количеством холодного петролейного эфира
и сушат в вакууме над хлористым кальцием. Выход составляет
15—18 г D6—55% теоретич.; примечание 3). Удельное вращение
[а]2п в воде составляет около +79—79,5° при с=4; чтобы уско-
ускорить достижение равновесия, к воде была прибавлена 1 капля
15%-ного аммиака, причем отсчет был произведен через 1 час
после приготовления раствора (в трубке длиной 20 см).
Не совсем чистый препарат перекристаллизовывают из петро-
петролейного эфира (т. кип. 30—60°), содержащего 0,5% абсолютного
эфира, в экстракторе непрерывного действия. На 6—7 г вещества
берут 100 мл растворителя. Для получения чистого препарата
обычно бывает достаточно одной перекристаллизации. Удельное
вращение [gc]d° чистой тетраметил-^-глюкозы, полученной по опи-
описанному методу, равно примерно +81,3° (примечание 4).
Примечания
1. а-Метилглкжозид можно метилировать по тому же способу,,
что и глюкозу, взяв четыре пятых указанных количеств реаген-
реагентов и гидролизуя тстраметил-а-метилглюкозид в хлороформенном
растворе в течение 3 час. вместо 1 часа, как это требуется в случае
смеси а- и [3-тетраметилметилглюкозидов, полученных непосред-
непосредственно из глюкозы. Тетраметилглюкоза, полученная по описан-
описанному методу, может обладать нужным удельным вращением и без
перекристаллизации.
2. Мешалка представляет собой сделанный из монель-металла
стержень диаметром 5 мм, которому на одном конце придана форма
410
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
несколько сплющенной петли диаметром 25 мм. Мешалка плотно
входит в бронзовый подшипник A0x75 мм), в нижней части
которого помещается сальник, а в верхней имеется углубление,
служащее для того, чтобы облегчить смазку, в качестве которой
применяют густое машинное масло. Такая металлическая мешалка
обеспечивает значительно более сильное перемешивание (что весь-
весьма существенно), чем обыкновенная стеклянная мешалка.
3. Тетраметилметилглюкозиды можно выделить из хлорофор-
хлороформе иного раствора, для чего последний сушат над сернокислым
натрием, отгоняют от него хлороформ и затем сиропообразную
массу перегоняют в вакууме. Перегонка может быть легко про-
проведена из перегонной колбы (емкостью 100 мл) с низко припаян-
припаянным боковым отводом; колбу наполняют стеклянной ватой, при-
присутствие которой успешно предотвращает толчки при кипении.
Применение стеклянной ваты способствует значительному сни-
снижению температуры перегонки. Смесь а- и ^-глюкозидов (в которой
содержится около 85% C-глюкозида) и чистая а-форма перего-
перегоняются в указанных выше условиях при 88—90° @,15 мм); после
удаления растворителя они и составляют весь дестиллат. Удельное
вращение [a]D колеблется от +9 до +12°, в зависимости от соотно-
соотношения изомеров в дестиллате; для чистой а-формы оно равно
—¦—151° при 25°. Показатель преломления п2и 1,4445 для смеси а-
и [3-изомеров; для чистого а-изомера я г? 1,4460.
4. Правильную величину для любой температуры между 5 и 37°
можно вычислить по уравнению [ос]?=85 — 0,18Ш. Температура
плавления препарата меняется в зависимости от соотношения
в нем а- и р-изомеров. После продолжительной и многократной
обработки вещества петролейным эфиром а-изомер становится
преобладающим и температура плавления повышается. Проба
препарата, перекристаллизованного один раз, плавится при 90—93°;
после пяти перекристаллизации вещество плавится при 98°, причем
оптическое вращение его не изменяется.
Другие методы получения
Тетраметил-^-глюкоза была получена действием йодистого
метила и окиси серебра на метилглюкозид1; действием диметил-
сульфата и щелочи на метилглюкозид и на глюкозу2; гидролизом
различных метилированных полисахаридов.
1 Purdi e, Irvine, J. Chem. Soc., 83, 1021 A903).
2 Н a w о г t h, J. Chem. Soc, 107, 8 A915); 113, 188 A918).
ТЕТРАТШТРОМЕТАН
411
ТЕТРАНИТРОМЕТАН
4(CH3COJOj 4HNO3 -^ C(NO2L + 7CH3CO
Предложил: П. Лианг.
Проверили: Н. Дрэйк и Р. Мозинго.
Получение
Коническую колбу емкостью 250 мл закрывают пробкой с двумя
отверстиями. На пробке делают надрез, который служит для сообще-
сообщения колбы с атмосферой. В одно из отверстий пробки вставляют
термометр, шарик которого должен доходить почти до дна колбы.
В колбу наливают 31,5г @,5 моля) безводной азотной кислоты (при-
(примечание!). Колбу охлаждают до 10° в ледяной воде и во второе отвер-
отверстие пробки вставляют бюретку, через которую медленно приба-
прибавляют 51 г @,5 моля) уксусного ангидрида порциями по 0,5мл
(примечание 2). Температуре реакционной массы ни в коем случае
не дают подниматься выше 10е (примечание 3). После прибавления
примерно 5 мл уксусного ангидрида течение реакции становится
менее бурным и в колбу можно вводить уже большие его порции,
постепенно увеличивая их с 1 до 5 мл при непрерывном взбалты-
взбалтывании. После того как прибавление уксусного ангидрида будет
закончено, пробку и термометр удаляют. Горло колбы тщательно
вытирают полотенцем, колбу накрывают перевернутым стаканом
и, не вынимая из бани со льдом, предоставляют ее содержимому
принять комнатную температуру (примечание 4).
Затем смесь оставляют стоять при комнатной температуре
в течение 7 дней (примечание 5), после чего для выделения тетра-
нитрометана ее выливают в 300 мл воды, находящейся в кругло-
донной колбе емкостью 500 мл. Полученную смесь перегоняют
с водяным паром (примечание 6). Тетранитрометап отгоняется
с первыми 20 мл дестиллата. Тяжелое вещество отделяют от верх-
верхнего водного слоя, промывают сперва разбавленной щелочью,
а затем водой и сушат над безводным сернокислым натрием. Выход
тетранитрометана составляет 14—16 г E7—65% теоретич.). Веще-
Вещество нельзя перегонять, так как оно может разложиться с сильным
взрывом. Нельзя допустить, чтобы тетранитрометан пришел в со-
соприкосновение с ароматическими соединениями, за исключением
очень небольших проб, так как реакция может пройти с сильным
взрывом (примечание 7).
Примечания
1. Безводную азотную кислоту (уд. вес>1,53) легче всего полу-
получить медленной перегонкой обыкновенной дымящей азотной кис-
кислоты в смеси с равным по весу количеством концентрированной
412
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ТЕТРАФЕНИЛФТАЛЕВЫЙ АНГИДРИД
413
серной кислоты. Если используется обычная концентрированная
азотная кислота (уд. вес 1,42), то рекомендуется перегнать ее
дважды с равным (по объему) количеством серной кислоты. Было
установлено, что техническая дымящая азотная кислота (уд. вес
1,60), если ее применять без дальнейшей обработки, позволяет
получать удовлетворительные выходы, в то время как эквивалент-
эквивалентное количество более слабой продажной кислоты, соответствую-
соответствующей по удельному весу 98%-ной азотной кислоте, дало значительно
худшие результаты. Применение азотной кислоты в количествах
больших, чем вычисленное, приводит к уменьшению выхода тетра-
нитрометана.
2. Согласно указаниям автора синтеза, чистота уксусного ан-
ангидрида не имеет такого значения, как чистота азотной кислоты.
При использовании эквивалентных количеств 99—100%-ного
и 94—95%-ного уксусного ангидрида был получен практически
один и тот же выход тстранитрометана.
3. Если колбу не охлаждать, то по мере повышения темпера-
температуры реакция будет протекать все более и более энергично; при
отсутствии регулирования реакция может стать бурной.
4. Если после прибавления уксусного ангидрида колбу вынуть
из бани со льдом и оставить стоять при комнатной температуре,
то течение реакции может стать очень бурным, что поведет к зна-
значительной потере вещества.
5. После 2 дней выход составляет только 35%, а после
10—15 дней — не более 65%. Если требуется получить вещество
в более короткое время, то можно оставить реакционную смесь
стоять в течение 2 суток при комнатной температуре, а затем в те-
течение 3 час. медленно нагреть ее до 70э и выдержать в течение
еще 1 часа при этой температуре, прежде чем вылить в воду. В опы-
опыте, который был проведен указанным образом, выход, по данным
автора, составил 40%.
6. Чтобы определить примерный выход тетранитрометана,
весьма удобно при перегонке с водяным паром использовать в ка-
качестве приемника градуированную делительную воронку емкостью
50 мл; при этом следует учесть, что удельный вес тринитро-
метана при 15° равен 1,65.
7. Тетранитрометан является ценным реагентом для опреде-
определения наличия двойных связей, особенно таких, которые не дают
реакций, характерных для кратных связей1.
Другие методы получения
Описанную выше методику в основном разработал Чаттавей2.
Тетранитрометан был также получен нитрованием нитроформа3;
из уксусного ангидрида действием на него диацетилортоазотной
кислоты4; из иодпикрина и азотистокислого серебра6; из ацетил-
нитрата нагреванием его с уксусным ангидридом или ледяной
уксусной кислотой6; из нитробензола перегонкой его со смесью азот-
азотной и дымящей серной кислот7; в результате прибавления уксусного
ангидрида к азотному ангидриду или к смеси азотного ангидрида
и двуокиси азота8; действием уксусного ангидрида на очень кон-
концентрированную азотную кислоту9; нитрованием толуола10; из
ацетилена действием на него азотной кислоты11; из нитробензола
и смеси азотной и дымящей азотной кислот12; из ацетилена
и этилена действием на них азотной кислоты в присутствии ката-
катализатора13.
1 Мей ер, Анализ и определение строения органических веществ,
Гос научно-техн. изд. Украины, Харьков—Киев, 1935, стр. 606; R u z i с к а,
Huyser, Pfeifier, Seidel, Ann., 471, 21 A929).
iChattaway J. Chem. Soc, 1910, 2099; Chera. News, 102, 307 A910).
"Шишков, Ann., 119, 247A861).
» pj ctet, Genequand, Ber., 36, 2225 A903).
5 H a n t z s с h, Ber., 39, 2478 A906).
« Pi ctet, Khotinsky, Corapt. rend., 144, 210 A907); Ber.,
40, 1163 AE07).
' С 1 a e s s e n, герм. пат. 184229 (С. А., 1, 2524 AS07)].
8 S с h e n с к, герм. пат. 211198, 211199 [С. А., 3, 2205 A609)].
« Bayer und Ко., англ. пат. 24299 [С. А., 5, 2305 A911)]; герм. пат. 224057;
В е г g е г, Corapt. rend., 151, 813 A910); Bull. soc. chim., D), 9, 26 A911).
«Wil 1, Ber., 47, 704 A914).
"Orion, англ. пат. 125000; О г t о n, М с К i e, J. Chera. Soc,
1920, 283.
12 М с Ki e, J. Soc. Chem. Ind., 44, 430Т A925).
13 М с К i e, J. Chem. Soc, 1927, 962.
ТЕТРАФЕНИЛФТАЛЕВЫЙ АНГИДРИД
= 0
сне
11
сне
У/0
•/
о
с„нЙ
о
с
)о + со
чо
„о
с.н.
Л/
С6Н5
CJL
О
сЙн
<
-ч
;О
-О + 2НВг
•бП5
О
Предложил: О. Груммитт.
Проверили: Н. Дрэйк и Ч. Икер.
Получение
Тщательно перемешанную смесь 35 г @,094 моля) тетрафенил-
циклопентадиенона (стр. 415) и 9,3 г @,095 моля) малеинового
ангидрида помещают в круглодонную колбу емкостью 200 мл
414
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
(примечание 1) и прибавляют к ней 25 мл бромбензола. Смесь под-
поддерживают при слабом кипении в продолжение 3,5 часа (приме^
чание2); послеэтого смесь охлаждают (примечание 3) и прибавляют
к ней через холодильник раствор 7 мл брома в 10 мл бромбензола.
Затем колбу встряхивают так, чтобы реагенты хорошо переме-
перемешались. После того как интенсивность экзотермической реакции
несколько уменьшится, смесь поддерживают при слабом кипении
в течение 3 час. (примечание 4); затем колбу погружают в баню
со льдом и в течение 2—3 час. поддерживают температуру смеси
при 0—10°. Смесь фильтруют с отсасыванием и кристаллическое
вещество три раза промывают петролейным эфиром (т. кип. 60—68°)
порциями по 10 мл. После высушивания на воздухе выход те-
трафенилфталевого ангидрида составляет 37—38 г (87—89% теоре-
тич.); т. пл. 289—290°. Вещество окрадиено в светлокоричневый
цвет, однако при растирании в порошок оно оказывается почти
бесцветным. Из фильтрата после разбавления равным по объему
количеством петролейного эфира и после охлаждения до 0—1СР
можно получить дополнительно 2—3 г менее чистого вещества
с т. пл. 285—288°. Недостаточно чистый препарат можно очистить
перекристаллизацией из бензола, применяя для этого 8—9 мл по-
последнего на 1 г твердого вещества (примечание 5).
Примечания
1. Лучше пользоваться прибором на шлифах; корковые проб-
пробки разъедаются бромом, который применяется в реакции.
2. Эту операцию следует проводить в вытяжном шкафу, так
как она сопровождается выделением окиси углерода.
3. Тетрафенилдигидрофталевый ангидрид можно выделить
на этой стадии с почти количественным выходом, если охладить
смесь, профильтровать ее. с отсасыванием и промыть твердое веще-
вещество тремя порциями петролейного эфира (т. пл. 60—68°) по 10 мл.
Выход составляет 41—42 г; т. пл. 235—240°.
4. Эту операцию также следует проводить в вытяжном шкафу;
однако можно и не прибегать к этому, если верхнюю часть холо-
холодильника присоединить к соответствующей ловушке («Синт. орг.
преп.», сб. 1, стр. 100, рис. 4 и сб. 2, стр. 78, рис. 3).
5. Перекристаллизованное вещество следует сушить при 110°
в течение 1—1,5 часа; в противном случае кристаллы удерживают
неопределенно долгое время бензол (возможно, что вещество кри-
кристаллизуется с бензолом).
Другие методы получения
Тетрафенилфталевый ангидрид был получен конденсацией
тетрафенилциклопентадиенона с малеиновым ангидридом в рас-
ТЕТРАФЕШ1ЛЦИКЛ0ПЕНТАДИЕН0Н
415
творе нитробензола1 с последующей дегидрогенизацией тетрафенил-
дигидрофталевого ангидрида с помощью серы 3'3.
1 D i I t h е у, Schommer, T г о s k e n, Ber., 66, 1627 A933).
2 D i 1 t h е у, Thewalt, Trosken, Ber., 67, 1959 A934).
-Allen, S h e p s, Can. J. Research, 11, 171 A934).
ТЕТРЛФЕНИЛЦИКЛОПЕНТЛДИЕНОН
с.н.,п—г;С„нв
C6HSCOCOC6H5 + (C6H5CH2J CO
KOH
Спирт
с6н.
C,H5
+ 2H2O
Предложили: Дж. Джонсон и О. Груммитт.
Проверили: Н. Дрэйк и С. Хейвуд.
Получение
В круглодонной колбе емкостью 500 мл растворяют 21 е @,1 мо-
моля) бензила («Синт. орг. преп.», сб. 1, стр. 83) и 21 г @,1 моля)
дибензилкетона (примечание 1) в 150 мл горячего спирта. Колбу
снабжают обратным холодильником, раствор нагревают почти
до температуры кипения и через холодильник медленно прибав-
прибавляют двумя порциями раствор 3 г едкого кали в 15 мл спирта. После
того как вспенивание прекратится, смесь кипятят в течение
15 мин. и затем охлаждают ее до 0°. Окрашенный в темный цвет
кристаллический препарат отфильтровывают с отсасыванием
и промывают тремя порциями 95% -ного спирта по 10 мл. Выход
вещества с т. пл. 218—220° составляет 35—37 г (91—96% теоретич.;
примечание 2).
Примечания
1. Дибензилкетон должен иметь температуру плавления, рав-
равную 34—35°.
2. Этот препарат достаточно чист для большинства целей. Его
можно перекристаллизовать из смеси спирта и бензола, применяя
155—160 мл растворителя на 5 г тетрафенилциклопентадиенона;
температура плавления перекристаллизованного вещества равна
219—220°.
Другие методы получения
Тетрафенилциклопентадиенон был получен действием броми-
бромистого фенилмагния на бензальдифенилмалеид1, а также восста-
восстановлением, дегидратацией и окислением метилендезоксибензоина,
полученного конденсацией формальдегида с дезоксибензоином2.
Настоящий метод в основном разработал Дильтей3.
416
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
1Lowenbein, Uhlich, Ber., 58, 2662 A925).
2 Z г е g 1 е г, Schnell, Ann., 445, 266 A925).
3 D i 1 t h e у, Quint, J. prakt. Chera., B), 128, 146 A930); герм,
пат. 575857 [Frdl., 20, 503 A933); С. А., 28, 1356 A934)].
jt-ТОЛИЛБЕНЗИЛАМИН
(N-Бензил-м-толуидин )
io т' СаНсСНО ¦—> 0H.3I| N == СНСяНк ~
|| Ni
Предложили: Ч. Аллен и Дж. ВанАллан.
Проверили: Н. Дрэйк и Р. Мозинго.
Получение
В подходящей колбе смешивают 106 г A моль) бензальдегида
(примечание 1) и 107 г A моль) ж-толуидина; температура повы-
повышается примерно до 60° (примечания 2 и 3). Смесь охлаждают ниже
35° холодной водой, прибавляют к ней 200 мл эфира и помещают
раствор в стальной автоклав для гидрирования под высоким дав-
давлением. Затем к смеси прибавляют 8—10 г никеля Ренея в каче-
качестве катализатора (стр. 338); автоклав закрывают и наполняют
водородом до тех пор, пока давление не будет равно 70 am
(примечание 4). В течение 15 мин. автоклав непрерывно встряхи-
встряхивают при комнатной температуре (примечание 5). Содержимое авто-
автоклава выливают и автоклав промывают двумя порциями эфира
по 200 мл. Катализатор отфильтровывают (примечание 6), эфир
отгоняют и продукт реакции перегоняют из специальной колбы
Клайзена (примечание 7). После небольшого головного погона пере-
перегоняется N-бснзил-л-толуидин при температуре 153—157° D мм)
[315—317° G60 мм)]. Выходсогтавляет175—185г (89—94% теоре-
тич.; примечания 8 и 9).
Примечания
1. Вполне пригодны продажные препараты бензальдегида
[т. кип. 57—59° (8 мм)] и ж-толуидипа [т. кип. 76—77° G мм)].
2. Нет необходимости выделять шиффово основание.
3. Эфир, применяемый в качестве растворителя, можно заме-
заменить равным количеством 95%-ного спирта. В случае применения
спирта охлаждение раствора не обязательно.
4. Величина начального давления водорода обусловлена при-
dl-ТРЕОШШ
417
меняемой аппаратурой. Падение давления зависит от емкости
автоклава.
5. В случае применения менее активного препарата никеля
Ренея приходится проводить реакцию при несколько более высо-
высокой температуре. Если потребуется, то реакционную смесь мож-
можно медленно нагреть до 60° и проводить восстановление при этой
температуре. Выход получается несколько ниже указанного в ме-
методике (82—84%).
6. Катализатор отфильтровывают на воронке Бюхнера через
фильтровальную бумагу. Учитывая активность катализатора, отса-
отсасывание следует прекратить, как только будет отфильтрована
вся жидкость. Если этой предосторожности не соблюдать, то
фильтр может загореться.
7. В некоторых случаях, например в случае получения о-толил-
бензиламина, часть вещества выкристаллизовывается и ее можно
отфильтровать.
8. Для характеристики л-толилбензиламина может служить
его хлористоводородная соль с т. пл. 198—199°.
9. Согласно указанию авторов синтеза, другие ароматические
альдегиды и амины могут быть использованы аналогичным обра-
образом, причем получаются такие же выходы конечного вещества.
Точная методика выделения амина зависит от физических свойств
последнего. Из бензальдегида и о-толуидина получается о-толил-
бензиламин с т. пл. 56—57° (температура плавления хлори-
хлористоводородной соли 165—166°), тогда как л-толилбензиламин,
полученный из л-толуидипа, имеет температуру кипения, равную'
162—163° E мм) (температура плавления хлористоводородной
соли 181—182°).
Другие методы получения
N-Бензил-л-толуидин был получен электролитическим восста-
восстановлением бензаль-ж-толуидина1.
1 Law, J. Chem. Soc, 1912, 154.
СНЭСН = СНШ2Н
««-ТРЕОНИН
Tig (OCOCH3J
СНэОН ^
Продукт присоединения
КВг
КВг
-> СН3СН (ОСН3) CH (HgBr) СО2К — ^ СН3СН (ОСН3) СНВгСО2К
НВг
СН3СН (ОСН3) СНЕгСО2Н
NH3
-» СН8СН (ОСН3) CH (NH2) СООН
27 сборшн; 3
псо2н
(СНаСОJО
418
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
СН3СН (ОСН3) СН (NHCHO) СО2Н
NH3
НВг
—> СН3СНОНСН (NH3Br) СО2Н > СН3СНОНСН (NH2) СО2Н
Предложили: Г. Картер и Г. Вест.
Проверили: Н. Дрэйк и У. Стэнтон.
Получение
а-Бром-^-метокси-н-масляная кислота. В 5-литровую колбу
помещают 3 л метилового спирта, 640 г B моля) уксуснокислой
ртути (примечание 1) и 172 г B моля) кротоновой кислоты (приме-
(примечание^). Колбу нагревают на паровом нагревателе и сильно встря-
встряхивают до тех пор, пока уксуснокислая ртуть не растворится (около
10 мин.). Раствор оставляют стоять при комнатной температуре
в течение 2 суток (примечание 3), после чего осадок отфильтровы-
отфильтровывают, дважды промывают метиловым спиртом порциями по 300 мл
и сушат на воздухе. Выход составляет 625—650 г (примечание 4).
Полученное вещество измельчают и растворяют в растворе 360 г
C моля) бромистого калия в 2 л воды. Затем жидкость переливают
в 4-литровый стакан, который охлаждают в бане со льдом и вы-
выставляют на прямой солнечный свет (примечание 5). При пере-
перемешивании к содержимому стакана прибавляют в течение
20—40 мин. раствор 320 г B моля) брома и 360 г C моля) бромистого
калия в 600 мл воды, избегая вводить большой избыток брома.
После того как раствор простоит в течение 10—15 мин., избыток
брома,' если он все еще имеется, разрушают бисульфитом натрия.
Бромзамещенные кислоты выделяют следующим образом. Раствор
экстрагируют один раз 300 мл эфира, чтобы удалить небольшую
примесь слезоточивого вещества, и после окисления посредством
400 мл 40%-ной бромистоводородной кислоты вновь экстрагируют
его шестью порциями эфира по 800 мл. Эфирные вытяжки соеди-
соединяют вместе, промывают один раз небольшим количеством холод-
холодной воды и сушат над безводным сернокислым натрием. Получен-
Полученный после отгонки эфира остаток представляет собой смесь не-
неочищенных бромзамещенных кислот.
Выход этих кислот составляет 350—370 г (88—93% теоретич.,
считая на кротоновую кислоту, взятую в первой стадии). Получен-
Полученный препарат можно применять без дальнейшей очистки для полу-
получения аминометоксимасляной кислоты.
Неочищенные бромзамещенные кислоты можно освободить от
примесей путем дробной перегонки в вакууме. Фракцию, кипящую
ниже 125° A0 мм) [105° C мм)], отбрасывают; остаток перегоняется
п ри 125— 128° A0 мм) [ 105— 107° C мм) ]; он состоит из смеси стерео-
изомерных кислот. Выход составляет 75—85% теоретического ко-
количества, считая на кротоновую кислоту, взятую впервой стадии.
dl-ТРЕОНИЫ
dl-Треонин. В автоклаве со стеклянным вкладышем нагре-
нагревают 175 г неочищенной а-бром-р-метокси-н-масляной кислоты
с 2 л концентрированного водного аммиака в течение 6 час. при
90—100е (стр. 392) (примечание 6). Раствор упаривают в вакууме до
состояния густой смолистой массы (примечание 7), прибавляют
к последней воду и полученный раствор вновь выпаривают в ва-
вакууме. К остатку приливают ацетон и оставляют смесь стоять,
время от времени взбалтывая ее (примечание 8), до тех пор, пока
не завершится кристаллизация A—2 дня). Ацетон декантируют
и остаток растворяют в 1 л 85—90% -ной муравьиной кислоты
(примечание 9). Раствор нагревают до 45° и прибавляют к нему
в течение 10 мин. при перемешивании 350 г C30 мл) уксусного-
ангидрида. Температура раствора за счет теплоты реакции по-
повышается до 70—80°; на этом уровне ее поддерживают еще около
15 мин. Затем раствор выпаривают в вакууме досуха, а остаток
растворяют при нагревании на паровой бане в минимальном коли-
количестве воды (примечание 10), после чего раствор охлаждают в те-
течение ночи в холодильном шкафу. Кристаллы отфильтровывают
и сушат на воздухе. Полученный препарат представляет собой
смесь формильных производных (примечание 11). После одной пе-
перекристаллизации из 150 мл горячей воды получают 25 г практиче-
практически чистого формил-б!/-О-метилтреонина ст. пл. 174—176°. Допол-
Дополнительно можно получить еще 3—5 г вещества в результате пере-
переработки фильтратов. Выход составляет 25% теоретического количе-
количества (примечание 12).
В течение 2 час. кипятят с обратным холодильником 25 г @,16
моля) формил-йИ-О-метилтреонина вместе с 360 мл бромистоводо-
родной кислоты с постоянной температурой кипения. Раствор
упаривают в вакууме (примечание 13) и к остатку прибавляют
достаточное для его растворения количество воды, после чего
раствор вновь упаривают в вакууме. Смолистый остаток растворяют,
в 450 мл абсолютного спирта и к раствору прибавляют концентри-
концентрированный водный аммиак до тех пор, пока запах последнего не со-
сохранится даже после сильного взбалтывания. Раствор охлаждают
в течение ночи в холодильном шкафу, после чего выделившиеся
кристаллы отфильтровывают и растворяют в трехкратном по
объему количестве горячей воды (около 5 мл воды на 1 г неочищен-
неочищенного вещества). Затем к раствору прибавляют семикратное по
объему количество абсолютного спирта и охлаждают его до комнат-
комнатной температуры, причем, для того чтобы вызвать кристаллизацию,
стенки колбы потирают стеклянной палочкой. После этого смесь
охлаждают в течение ночи в холодильном шкафу, кристаллы
отфильтровывают и дважды промьтают абсолютным спиртом пор-
порциями по 90 мл и один раз эфиром. Выход чистого Л-треонина
ст. пл. 234—235° (с разложением; примечание 14) составляет
18—20 г (85—90% теоретич., считая наформил-сИ-О-метилтреонин).
27*
420
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Примечания
1. Уксуснокислую ртуть можно заменить эквивалентным ко-
количеством окиси ртути и ледяной уксусной кислоты.
2. Была применена продажная кротоновая кислота, которую
не подвергали дополнительной очистке.
3. Рекомендуется через 3—4 часа потереть стенки колбы стек-
стеклянной палочкой. Обычно такая операция вызывает выпадение
в осадок продукта присоединения в мелко дисперсном состо'янии.
Если этого не сделать, то вещество может медленно выкристалли-
выкристаллизовываться на стенках колбы в виде плотной массы, удаление ко-
которой удается только с очень большими затруднениями. Целесо-
Целесообразно также перемешивать смесь в течение нескольких часов
после того, как начнется кристаллизация, чтобы помешать образо-
образованию плотной массы.
4. Точный выход вычислить нельзя, поскольку строение про-
продукта присоединения неизвестно. Однако выход получается почти
количественным, так как содержание ртути в фильтрате очень
незначительно.
5. Бромирование можно с таким же успехом проводить при
освещении реакционной смеси двумя сильными лампами для фото-
фотографирования, снабженными соответствующими рефлекторами.
Лампы устанавливают непосредственно над поверхностью жидко-
жидкости. Однако в этих условиях продолжительность прибавления
брома увеличивается па 10—15 мин.
6. По сообщению авторов синтеза, аминирование можно про-
проводить в обычных склянках емкостью 500 мл, если температура
реакционной смеси не превышает 85°. В этом случае продолжитель-
продолжительность нагревания должна быть увеличена до 8—10 час.
7. В настоящем синтезе все процессы выпаривания проводятся
в вакууме эффективного водоструйного насоса.
8. Если вещество оставить стоять, не взбалтывая его, то оно
затвердевает, образуя плотную массу. Взбалтывание благоприят-
благоприятствует извлечению некоторых смолистых примесей, которые пре-
препятствовали бы последующему выделению препарата.
9. Если требуется получить смесь <й-треонина и с(/-аллотрео-
яина вместо одного лишь Л-треонина, то остаток можно непосред-
непосредственно растворить в 1 200 мл 48%-ной бромистоводородной ки-
кислоты и раствор кипятить в течение 2 час. После удаления броми-
бромистоводородной кислоты в вакууме смолистый остаток растворяют
в теплой воде и. к раствору медленно прибавляют концентриро-
концентрированный водный аммиак до тех пор, пока даже после сильного взбал-
взбалтывания не сохранится слабый запах аммиака. Раствор упаривают
до появления кристаллов, а затем прибавляют к нему 3—4 объема
спирта. Кислоты перекристаллизовывают, растворяя их в ми-
минимальном количестве воды D—5 мл воды на 1 г кислоты) и при-
dl-Tl'EOIIHH
421
бавляя к раствору 4—5 объемов спирта. Раствору дают охладить-
охладиться и оставляют его на ночь при комнатной температуре.
10. Если после того, как при нагревании на паровой бане оста-
остаток полностью растворится, добавить к раствору еще 10% воды»
то качество препарата улучшится, но выход несколько уменьшится»
11. Формил-Л-О-метилтреонин плавится при 173—174°. Фор-
мил-й(/-О-метилаллотреонин плавится при 152—153°.
12. Неочищенный Л-аллотреонин можно получить из маточного
раствора, для чего последний выпаривают досуха, остаток кипятят
с десятикратным пообъему количеством 48%-ной бромистоводород-
бромистоводородной кислоты и далее обрабатывают раствор так, как это было указано
в случае d/-треонина. Препарат содержит незначительную примесь
сЯ-треонина, от которой его можно полностью освободить, если
перекристаллизовать 3—4 раза из 50%-ного спирта. При этом
получают Л-аллотреонин с т. пл. 242—243°.
13. Если дестиллат перегнать при атмосферном давлении, то
можно вновь получить бромистоводородную кислоту с постоянной
температурой кипения.
14. Температура плавления всех образцов, полученных при
проверке, была на 3—4° выше приведенной в прописи. Вообще
температура плавления этих соединений может быть различной
в зависимости от метода ее определения.
Другие методы получения
а-Амино-C-оксимасляная кислота была получена методом,
подобным описанному выше, исходя из этилового эфира крото-
новой кислоты1. Смесь я-амино-р-окси- и а-окси-^-аминомасляныХ
кислот была получена обработкой кротоновой.кислоты хлорно-
хлорноватистой кислотой и нагреванием продукта реакции с безводным
аммиаком под давлением2. Смесь, содержащая треонин, была
получена при действии на ацетоуксусный эфир нитрита натрия
и уксусной кислоты. Затем полученный этиловый эфир оксимино-
ацетоуксусной кислоты был превращено, помощью диэтилсульфата
в этиловый эфир О-этилоксиминоацетоуксусной кислоты. Это ве-
вещество было восстановлено водородом в присутствии никеля Ре-
нея с образованием этилового эфира я-амино-р-оксимасляной.
кислоты (неочищенного), который затем был гидролизован в смесь
^/-треонина и Л-аллотреонина3. Приведенный здесь метод был
описан в литературе4. Согласно более поздним исследованиям5,
с?/-аллотреонин можно превратить в Л-треонин.
1 A b d e r h a I d e n, Heyns, Вег., 67, 530 A934).
2 Burch J Chera. Soc, 137, 310 A930).
3 A d k i п s R e e v e, J. Am. Chem. Soc, 60, 1330 A938).
«West Carter, J. Biol. Chera., 119, 109 A937).
5 С a r t с r, Handler, Melville, J. Biol. Chera., 129,
362 A939).
422
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ТРИ-л-ВИФЕНИЛКАРБИНОЛ
423
ТРИ-л-БИФЕН И Л КАРБИ НОЛ
ЗС6 Н5С6Н4С1 О) + (С2Н5ОJ СО + 6Na -»
-> ("-С6Н5С6Н4K CONa + 3NaCl + 2NaOC2H5
(Л-С6Н5С6Н4K CONa + НаО -^ (я-С6Н5С6Н4K СОН + NaOH
Предложили: Э. Мортон, Дж. Майлс и В. Эмерсон.
Проверили: Р. Шрайнер, Дж. Дэк и Дж. Харкема.
Получение
В 3-литровую трехгорлую круглодонную колбу, снабженную
мешалкой с ртутным затвором и 12-шариковым обратным холо-
холодильником, помещают 188,5 г A моль) я-хлордифенила (приме-
(примечание 1), 47,2 г @,4 моля) этилового эфира угольной кислоты (при-
(примечание 2) и 1 500 мл безводного бензола, не содержащего тиофена.
Одно боковое горло колбы закрывают корковой пробкой, пускают
в ход мешалку и нагревают смесь на электрической плитке (при-
(примечание 3). Как только смесь начнет кипеть, к ней прибавляют 2 г
.распыленного натрия (примечание 4). Реакция начинается
через 1—2 мин., показателем чего служит переход к более энер-
энергичному кипению и изменение цвета, который из желтого пре-
превращается в коричневый (примечание 5). Затем в течение 1 часа
в колбу вводят небольшими порциями распыленный натрий
до тех пор, пока не будет прибавлено 28 г его (общее количество
натрия составляет 30 г). Реакционную смесь в течение 2 час. кипя-
кипятят и энергично перемешивают (примечание 6). Когда смесь не-
несколько охладится, к ней прибавляют 75—100 мл абсолютного
спирта. После того как весь натрий прореагирует, к содержимому
колбы прибавляют 500 мл воды, обратный холодильник заменяют
на обращенный вниз и бензол и непрореагировавший я-хлордифе-
нил отгоняют, нагревая колбу на паровой бане (примечание 7).
Неочищенный препарат, оставшийся в колбе, отфильтровывают,
промывают 100—200 мл воды и по возможности тщательно отжи-
отжимают. Твердое вещество растворяют в 600 мл ксилола в перегон-
перегонной колбе емкостью 1 л и раствор подвергают перегонке до тех пор,
пока не отгонится 25—50 мл дестиллата (ксилол и вода). Раствор
слегка охлаждают, прибавляют к нему 1—2 г активированного бере-
березового угля, а затем кипятят все вместе в течение 5 мин. Горячий
раствор быстро фильтруют и фильтрат охлаждают. Выпавшие в оса-
осадок кристаллы отфильтровывают, промывают сперва 25—50 мл хо-
холодного ксилола, затем 200 мл петролейного эфира и сушат. Три
п-бифенилкарбинол образует мелкие белые кристаллы с т. пл.
207—208°. Выход составляет 57—65 г C5—40% теоретич.; приме-
примечание 8).
Примечания
1. С целью очистки 300 г технического я-хлордифенила были
перекристаллизованы из 750 мл петролейного эфира. Выход состав-
составлял 240—250 г.
2. Технический этиловый эфир угольной кислоты был промыт
последовательно 10%-ным водным раствором углекислого натрия
и насыщенным раствором хлористого кальция. Затем он был высу-
высушен над сернокислым магнием и перегнан. Применялась фракция
с т. кип. 124—125°.
3. Следует применять электрическую плитку закрытого типа
для предотвращения опасности пожара. Поблизости не должно
быть огня.
4. Распыленный натрий получают расплавлением 30 г
чистого металлического натрия в 1 л сухого ксилола. Смесь
энергично перемешивают с помощью металлической мешалки до
полного распыления натрия.
5. Если применять безводные реагенты, то реакция начинается
немедленно, как только раствор бензола будет нагрет до кипения.
Необходимо, чтобы процесс начался до того, как будет добавле-
добавлено основное количество натрия.
6. Перемешивание должно быть достаточно энергичным/чтобы
предотвратить образование корки на стенках колбы.
7. Непрореагировавший п-хлордифеиил отгоняется с водяным
паром вместе с бензолом. Полное удаление его является очень суще-
существенным, так как при перекристаллизации три-п-бифенилкарби-
нола трудно получить это вещество в чистом виде, если имеется
примесь исходного хлорида.
8. При работе с меньшими количествами можно добиться луч-
лучших выходов, если применять мелко нарезанный натрий. Раствор
19 г л-хлордифенила, 5 г этилового эфира угольной кислоты и 50 мл
сухого бензола, не содержащего тиофена, нагревают на паровой
бане до начала кипения. В течение получаса через верхнюю часть
холодильника к смеси добавляют 5 г натрия, нарезанного кусоч-
кусочками с площадью сечения 0,5 мм2 и толщиной 2 мм. Смесь кипя-
кипятят в течение 12 час, после чего разлагают ее и три-я-бифенилкар-
бинол выделяют так, как это было описано выше, но с примене-
применением одной десятой количества растворителей. Выход составляет
7—9 е D7—55% теоретич.), однако продолжительность нагревания
и утомительность измельчения натрия делают этот метод пригод-
пригодным только при работе с малыми количествами. Пользование
указанной прописью при работе в более крупном масштабе при-
привело к получению выхода, равного только 31%.
Другие методы получения
Три-л-бифенилкарбинол был получен действием йодистого
4-ксснилмагния на 4,4'-дифенилбензофенон или на метиловый
424 СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
эфир я-фенилбензойной кислоты1 и действием л-хлордифенила
на этиловый эфир угольной кислоты в присутствии распылен-
распыленного натрия2 или натриевой проволоки3.
1 S с h I e n k, Ann., 368, 295 A909).
2 М о г t о n, Stevens, J. Am. Chem. Soc, 53, 4028 A931);
Morton, Emerson, там же, 59, 1947A937); Morton, Wood, част-
частное сообщение.
3 В а с h m a n n, W i s e 1 о g 1 e, J. Org. Chem., 1, 372 A936).
ТРИФЕНИЛКАРБИНОЛ .
2C6H5MgBr + QH5CO2C2H5
(C6H5KCOMgBr + H2O
(С6Н5K COMgBr + BrMgOCzH5
Э -> (СН6)з СОН-|-MgBrOH
Предложили: В. Бахман и X. Хетцнер.
Проверили: Р. Шрайнер и П. Саузвик.
Получение
В 2-литровой трехгорлой колбе, снабженной капельной ворон-
воронкой, обратным холодильником и мешалкой с ртутным затвором,
пользуясь методикой, описанной в «Синт. орг. преп.», сб. 1, стр. 207,
получают бромистый фенилмагний, исходя из 27 г A,1 грамм-
атома) магния, 181 г A22 мл, 1,15 моля) бромбензола и 450 мл
общего количества абсолютного эфира (примечание 1). Холодиль-
Холодильник и капельную воронку снабжают хлоркальциевыми труб-
трубками, чтобы предотвратить проникновение в прибор влаги воз-
воздуха. В некоторых случаях, для того чтобы весь магний раство-
растворился, необходимо, после того как прибавление реактивов будет
закончено, продолжать перемешивание более 10 мин., указанных
в прописи.
К раствору магнийорганического реактива прибавляют раствор
75 г G1,5 мл, 0,5 моля) этилового эфира бензойной кислоты («Синт.
орг. преп.», сб. 2, Госхимтехиздат, 1932, стр. 293)* в 200 мл сухого
бензола (примечание 2) со скоростью, необходимой, чтобы под-
поддерживать слабое кипение смеси. Прибавление продолжается
около 1 часа; при этом колбу охлаждают в большой бане с холод-
холодной водой. После окончания прибавления смесь кипятят в течение
1 часа на паровой бане, затем охлаждают в бане со льдом и солью,
после чего медленно выливают при непрерывном перемешивании
в смесь 1 500 г колотого льда и 50 мл концентрированной серной
* В новом издании «Синт. орг. преп.» данная пропись отсутствует
{Прим. ред.) J ' '
ТРИФЕ1ШЛКАРБИН0Л
42»
кислоты. Периодическое перемешивание смеси продолжают до тех
пор, пока твердое вещество, выделившееся на грани раздела бен-
бензол—вода, не растворится. Если нужно, то для облегчения разло-
разложения магниевого комплекса прибавляют 50 г хлористого аммо-
аммония, а также дополнительное количество бензола, если ранее взя-
взятое количество окажется недостаточным для растворения всего
вещества. Когда твердая фаза растворится, бензольный слой отде-
отделяют и промывают последовательно 200 мл воды, 200 мл 5%-ного
раствора двууглекислого натрия и, наконец, снова 200 мл воды.
Растворители (эфир и бензол) отгоняют по возможности полнее на
паровой бане, а оставшийся раствор или твердую массу подвер-
подвергают перегонкес водяным паром, чтобыудалить дифенил и непрореа-
гировавший бромбензол. Основную массу вещества отфильтровыва-
отфильтровывают, осадок промывают водой и сушат. Неочищенный трифенилкарби-
нол A20—125 г) перекристаллизовывают из четыреххлористого
углерода D мл растворителя на 1 г твердого вещества). Вес первой
порции бесцветного трифенил карбинола составляет 110—115 г
(примечание 3). Вторую порцию можно получить, если фильтрат
нагреть с 1 г активированного березового угля, а затем упарить
раствор до объема около \2Ъмл и охладить. Общий выход трифенил-
карбиноласт. пл. 161—162° составляет 116—121 г (89—93% теоре-
тич.; примечание 4).
Примечания
1. Перед применением продажный абсолютный эфир следует вы-
высушить над кусочками натрия; бромбензол должен быть высушен
перегонкой.
2. Бензол можно высушить над безводным сернокислым маг-
магнием.
3. Трифенилкарбинол кристаллизуется из четыреххлористого
углерода, образуя с последним сольват. При высушивании кри-
кристаллов на воздухе растворитель легко улетучивается. Приведен-
Приведенное выше количество (в граммах) относится к веществу, освобо-
освобожденному от растворителя.
4. Практически такой же выход трифенилкарбинола был полу-
получен при применении бензофенона и бромистого фенилмагния; для
этой реакции требуется только половинное количество магний-
органического реактива по сравнению с необходимым для реакции
с этиловым эфиром бензойной кислоты. К охлажденному магний-
органическому реактиву, полученному из 13,5 г @,55 грамматома)
магния, был прибавлен раствор 91 г @,5 моля) бензофенона
(«Синт. орг. преп.», сб. 1, стр. 99) в 200 мл сухого бензола со
скоростью, необходимой, чтобы поддерживать слабое кипение
смеси. Затем смесь кипятили в течение еще 1 часа и выделяли
трифенилкарбинол так, как это описано выше.
426
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Другие методы получения
Трифенилкарбинол был получен взаимодействием бромистого
фенилмагния с бензофеноном1, метиловым эфиром бензойной
кислоты2 или фосгеном8; действием фенилнатрия на бензофенон,
хлористый бензоил, этиловый эфир хлоругольной кислоты или эти-
этиловый эфир бензойной кислоты4; гидролизомтрифенилхлорметана5;
окислением трифенилметана8.
1 А с г е е, Вег., 37, 2755 A904).
2 U 1 1 m a n n, Mtinzhuber, Ber., 36, 406 A903).
3 S а с h s, L о е v у, Вег., 36, 1588 AУ03).
4 А с г е е, Am. Chem. J., 29, 594 A903).
5 М е i s s e 1, Ber., 32, 2422 A899).
•Law, P e r k i n, J. Chem. Soc, 93, 1637A908); S с h w a r z,
J. Am. Chem. Soc., 31, 848 A909).
ТРИФЕНИЛХЛОРМЕТАН
(Хлористый трифенилметил)
СПОСОБ ПОЛУЧЕНИЯ ИЗ ТРПФЕНИЛКАРБИНОЛА II ХЛОРИСТОГО АЦЕТИЛА
(С6Н5KСОН + СН3СОС1 -» (С6Н5K СС1 + СНдСООН
Предложил: В. Бахман.
Проверили: Р. Шрайнер и Э. Уэлч.
Получение
В 1-литровую круглодонную колбу, снабженную обратным
холодильником, помещают смесь 250 г чистого трифенилкарбинола
(стр. 424) и 80 мл сухого бензола. Холодильник защищают хлор-
кальциевой трубкой (примечание 1). Смесь нагревают на паровой
бане, после чего через верхнюю часть холодильника к ней прибавля-
прибавляют 50 мл хлористого ацетила (примечание 2). Нагревание продолжа-
продолжают, сопровождая его энергичным взбалтыванием смеси. Примерно
через 5 мин. твердый трифенилкарбино'л исчезает и образуется
прозрачный раствор. Затем в течение 10 мин. к раствору приба-
прибавляют дополнительно 100 мл хлористого ацетила порциями
по 10 мл, после чего кипятят его еще полчаса.
Раствор охлаждают, взбалтывая колбу в струе проточной воды,
и одновременно прибавляют к нему через верхнюю часть холодильни-
холодильника 200мл петролейного эфира (примечание 3); при этом трифенил-
хлорметан выделяется в виде похожих на сахар кристаллов. Смесь
охлаждают в течение 1—2 час. в бане со льдом, вещество отфиль-
отфильтровывают, промывают 100—150 мл петролейного эфира (примеча-
(примечание 4) и высушивают в эксикаторе над натронной известью и пара-
парафином (примечание 5). Препарат получается б виде бесцветных
кристаллов. Выход составляет 212—224 г G9—83% теоретич.);
ТРИФЕНИЛХЛОРМЕТАН
427
т. пл. 111—112° (с небольшим предварительным размягчением).
Можно дополнительно получить 30—37 г бесцветного вещества,
выпарив фильтрат до объема примерно 75 мл. С этой целью петро-
лейный эфир и хлористый ацетил отгоняют при атмосферном да-
давлении, а уксусную кислоту — в вакууме. Теплый раствор обраба-
обрабатывают 2 г активированного березового угля, фильтруют и снова
нагревают с 2 г активированного угля. Смесь фильтруют, к филь-
фильтрату прибавляют 50 мл петролейного эфира и охлаждают затем
раствор в бане со льдом. Кристаллы трифенилхлорметана отфиль-
отфильтровывают и на воронке промывают 70 мл холодного петролейного
эфира. Эта вторая порция вещества, так же как и первая, полу-
получается бесцветной; т. пл. 110,5—112° (с предварительным размяг-
размягчением; примечание 6). Общий выход составляет 249—254 г
(93—95% теоретич.).
Примечания
1. Реакцию лучше всего проводить в вытяжном шкафу.
2. Хлористый ацетил должен быть хорошего качества; непо-
непосредственно перед применением его следует перегнать.
3. Следует применять петролейный эфир с т. кип. 30—60°, так
как его легко отогнать от полученного вещества.
4. Фильтровать следует быстро, так как трифенилхлорметан
гидролизуется под действием влаги воздуха.
5. Конечный препарат совершенно бесцветен и не должен обла-
обладать резким запахом. Полученное вещество достаточно чисто
для большинства целей. Его можно перекристаллизовать, для
чего препарат растворяют в \00мл горячего бензола, раствор раз-
разбавляют 200 мл петролейного эфира и затем охлаждают. Если ве-
вещество хранится в склянке, то для предохранения его от влаги
воздуха пробку склянки следует залить парафином.
6. Трифенилбромметан может быть получен по аналогичному
методу, если хлористый ацетил заменить на бромистый ацетил.
СПОСОБ ПОЛУЧЕНИЯ ИЗ БЕНЗОЛА II ЧЕТЫРЕХХЛОРПСТОГО УГЛЕРОДА
ПО РЕАКЦИИ ФРПДЕЛЯ—КРАФТСА
ЗС6Н6+ ССЦ + А1С18 -» (CSH5K CC1 • А1С13 + ЗНС1
НС1
(С6Н5KСС1 • А1С13 + д:Н2О <¦ (ОДЛзСа + АЮз-хНгО
Предложили: Ч. Хаузер и Б. Худзон мл.
Проверили: Р. Шрайнер и Ф. Уаймэн.
Получение
Трехгорлую колбу емкостью 5 л, снабженную механической
мешалкой с ртутным затвором и обратным холодильником, соеди-
соединенным с ловушкой для поглощения хлористого водорода (приме-
428
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
чание 1), погружают в баню со льдом. В колбу помещают смесь 2 кг
B 280 мл, 25,6 моля) сухого бензола, не содержащего тиофена
(примечание 2) и 800 г D70 мл, 5,2 моля) сухого четыреххлористого
углерода, не содержащего серы (примечание 3). Третье горло>
колбы соединяют с 1-литровой конической колбой при помощи
небольших кусков стеклянной и каучуковой трубок большого
диаметра A5 мм; см. рис. 1 на стр. 19). В коническую колбу по-
помещают 600 г D,51 моля) свежевозогнанного хлористого алю-
алюминия (примечание 4). Колбу наклоняют и слегка постуки-
постукивают по ней, так чтобы хлористый алюминий поступал в реакцион-
реакционную смесь небольшими порциями и с такой.скоростью, чтобы при-
прибавление можно было закончить за 1,5—2 часа. Во время приба-
прибавления хлористого алюминия реакционная смесь не должна кипеть.
Через 15 мин. после прибавления всего хлористого алюминия
баню со льдом отставляют и предоставляют реакции продолжаться
без дальнейшего охлаждения. Когда прекратится выделение тепла,
смесь нагревают до кипения и кипятят до тех пор, пока почти
полностью не прекратится выделение хлористого водорода (около
2 час). После этого смеси дают охладиться до комнатной темпера-
температуры.
Медный сосуд емкостью Юл (диаметром 22,5 см и высотой30 см;
примечание 5) снабжают мощной механической мешалкой и тер-
термометром и погружают на глубину 20 см в баню со льдом. В сосуд
помещают смесь 1 л бензола, не содержащего тиофена, и 2 л б н.
раствора соляной кислоты. Затем к содержимому сосуда прибавля-
прибавляют полученную, как было описано выше, реакционную смесь при
энергичном перемешивании и с такой скоростью, чтобы температу-
температура не поднималась выше 25° (на это требуется около 2 час). Когда
прибавление будет закончено, реакционную колбу споласкивают
небольшим количеством ледяной воды и прибавляют ее к
основной массе. После этого перемешивание продолжают в те-
течение еще 10 мин. Бензольный слой декантируют, а водный слой
разбавляют 1 л ледяной воды и экстрагируют 500 мл бензола, после
чего нижний слой выливают. Соединенные вместе бензольные рас-
растворы промывают 250 мл охлажденной до 0° соляной кислоты и
сушат в течение 2 час. в закрытой колбе над 250г безводного хло-
хлористого кальция.
Высушенный бензольный раствор фильтруют через стеклянную
вату в 5-литровую колбу. Колбу закрывают пробкой, в которую
вставлены стеклянная трубка для отгонки паров и термометр,
не доходящий на 5см до дна колбы. В колбу прибавляют несколько
кусочков битой глиняной тарелки и бензол отгоняют (к концу пе-
перегонка идет медленно) до тех пор, пока температура жидкости не
достигнет 120°. Остаток переносят в 2-литровую коническую колбу
с помощью 40—50 мл сухого бензола и охлаждают примерно до 40°.
К содержимому колбы прибавляют 25 мл хлористого ацетила (при-
ТРИФВНИЛХЛОРМЕТАН
429
мечание 6), нагревают смесь почти до температуры кипения, а за-
затем быстро охлаждают до комнатной температуры при энер-
энергичном взбалтывании. После этого содержимое колбы охлаждают
в ледяной воде в течение 2 час. Твердый трифенилхлорметан тща-
тщательно измельчают фарфоровым шпателем и фильтруют с отса-
отсасыванием. Фильтрат сохраняют, а кристаллы промывают тремя
порциями по 300 мл легкого бензина (т. кип. 70—90°; примечание 7).
Для удаления растворителя вещество оставляют на одни сутки
в вакуум-эксикаторе над минеральным маслом или стружками
парафина. Время от времени кристаллы перемешивают, а экси-
эксикатор эвакуируют до давления 5—10 мм (примечание 8). Кристал-
Кристаллы, имеющие зеленовато-желтый цвет, плавятся при 111—112°;
выход составляет 870—940 г F9—75% теоретич., считая на хлори-
хлористый алюминий).
Вторую порцию кристаллов можно получать, если от фильтрата
и от промывной жидкости (по отдельности) отгонять раствори-
растворитель до температуры соответственно ПО и 100°, а затем при взбал-
взбалтывании быстро охладить остатки. Кристаллы промывают мини-
минимальным количеством бензиновой фракции (т. кип. 70—90е) и сушат
так, как это было указано при описании получения первой порции.
Выход второй порции кристаллов, полученной из фильтрата,
равен 70—80s; т. пл. 111—112° (со спеканием при 108°); выход
второй порции, выделенной из промывной жидкости, равен
50—135 г; т. пл. ПО—111° (со спеканием при 107°). Вещество,
полученное из второй порции, имеет более темную окраску, чем
полученное из первой, причем зеленовато-желтые кристаллы,
выделенные из промывной жидкости, окрашены в более темный
цвет, чем кристаллы, выделенные из фильтрата. Общий выход
колеблется от 1 060 до 1 085 г (84—86% теоретич., считая на
хлористый алюминий; примечание 9).
Примечания
1. Присутствие в исходных реагентах сернистых соединений,
особенно тиофена, приводит к низким выходам и вызывает темную
окраску препарата. Необходимо применять высококачественный
бензол, не содержащий тиофена. Бензол можно высушить или
перегонкой, или оставив его стоять над хлористым кальцием.
Регенерированный в этом синтезе бензол можно применять в после-
последующих опытах, для чего нужно обработать его щелочью, про-
промыть и высушить. Небольшая примесь четыреххлористого угле-
углерода в бензоле не может служить препятствием, так как бензол
и четырехлористый углерод берутся в избытке по отношению к хло-
хлористому алюминию.
2. Можно пользоваться продажным четыреххлористым углеро-
углеродом хорошего качества (т. кип. 75—76°) без заметного снижения
430
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
выхода. Однако, если желательно получить бесцветный препарат,
рекомендуется применять химически чистый четыреххлористый
углерод, не содержащий серы. Четыреххлористый углерод
можно сушить тем же способом, что и бензол.
3. Удобная ловушка для поглощения растворимых в воде газов
описана в «Синт. орг. преп.», сб. 1, стр. 100, примечание 2.
4. Выход трифенилхлорметана в значительной степени зависит
от качества используемого хлористого алюминия. В данном случае
применялся продажный свежевозогнанный хлористый алюминий
в порошке.
Р и с 19.
5. Высокая теплопроводность меди позволяет быстро отводить
тепло во время гидролиза; повидимому, наличие меди не оказы-
оказывает нежелательного влияния на реакционную смесь. Если нет ме-
металлического сосуда, можно применить эмалированное ведро
емкостью 10 л.
6. Можно воспользоваться техническим хлористым ацетилом,
так как присутствие в нем небольшого количества уксусной кисло-
кислоты не препятствует протеканию реакции. Хлористый ацетил слу-
служит для превращения трифенилкарбинола, который может присут-
присутствовать в виде примеси, в трифенилхлорметан.
7. Перед применением нефтяную фракцию с т. кип. 70—90°
несколько раз обрабатывают концентрированной серной кислотой,
промывают и сушат.
8. Весьма удобным при работе с большими количествами веще-
вещества является вакуум-эксикатор, конструкция которого изображе-
изображена на рис. 19. К одной из двух одинаковых круглодопных колб (Б)
припаяна трубка для присоединения к вакуум-насосу. Удобно,
хотя и не обязательно, снабдить эту трубку стеклянным краном,
что дает возможность применять колбу в качестве большой дели-
делительной воронки. Стеклянная трубка В, которая не должна слиш-
слишком свободно входить в горла колб, служит направляющим при-
приспособлением для соединения между собой колб А и Б. На трубку В
надета резиновая прокладка Г, которую удобнее всего вырезать
из старой резиновой трубки. Прокладка обеспечивает герметиче-
герметическое соединение между колбами, а направляющее приспособление
предотвращает боковое скольжение примыкающих поверхностей.
ТРИФЕНИЛХЛОРМЕТАН
43!
Без направляющей трубки прибор не надежен. Можно применять
специальные направляющие зажимы, однако они не представляют
особого преимущества. Во время работы в колбе А находится ве-
вещество, а в колбе Б—осушитель. Д представляет собой паровую
баню, а Е — подходящую подставку. При применении высококаче-
высококачественной вакуумной смазки прибор, собранный из двух обычных
5-литровых колб, держит вакуум в 2 мм в течение суток. Такой
эксикатор с двумя отделениями особенно удобен для синтетиче-
синтетических работ. Использование его часто дает возможность опустить
одну из операций, так как колба А, в которой проводилась реакция
или производилось упаривание, может одновременно служить
также для высушивания вещества или применяться в качестве сосу-
сосуда, в котором будет проводиться последующая реакция. Во время
высушивания вещество можно перемешивать, вращая весь прибор.
Кроме того, в определенных пределах такой эксикатор может
быть сделан любого требующегося размера. Желательно покрыть
колбы с внешней стороны тонкой пленкой какой-либо раство-
растворимой пластмассы, чем сильно снижается возможность несчастных
случаев; когда покрытые таким образом эвакуированные колбы
во время опытов «разрывались», разбрасывание осколков было весь-
весьма незначительным. Сравнительные опыты при работе с чрезвычайно
гигроскопичной сиропообразной массой показали, что в вакуум-
эксикаторе указанной формы при одинаковом количестве осушите-
осушителя процесс можно проводить почти в два раза быстрее, чем в обыч-
обычном эксикаторе. Если колбу А слегка подогревать, то эффектив-
эффективность описанного прибора окажется по меньшей мере в четыре
раза выше эффективности обычного эксикатора (Ф. Пингерт,
частное сообщение).
9. Препарат можно сохранять в обыкновенных банках с на-
навинчивающимися крышками, если только они хорошо залиты
парафином или каким-нибудь подобным материалом. Под дей-
действием влаги воздуха трифенилхлорметан медленно гидролизуется,
образуя трифенилкарбинол. Частично гидролизованный трифенил-
трифенилхлорметан можно очистить перекристаллизацией из одной третьей
(повесу) части бензола, в котором содержится 5—25% хлористого
ацетила. Вещество промывают легким бензином с добавлением
небольшого количества хлористого ацетила.
Другие методы получения
Трифенилхлорметан был получен действием пятихлористого
фосфора1, хлористого водорода2 или хлористого ацетила3 на три-
трифенил карбинол. Он был также получен взаимодействием четырех-
хлористого углерода с бензолом в присутствии хлористого алю-
алюминия* или хлорного железа5 и действием пятихлористого фосфора6
или хлористого сульфурила в присутствии перекисей7 на три-
432
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ФЕШШАЗИД
433
фенилметан. Процесс, описанный в первом из приведенных выше
разделов, основан на методике, которую предложили Гомберг
и Дэвис3; процесс, изложенный во втором разделе, является
видоизменением прописи, которую первоначально предложил
Гомберг4, а позднее описали Гаттерман и Виланд8.
1 Н е m i I i a n, Ber., 7, 1207 A874); Fischer, Fischer, Ann.,
194, 257 A878).
2 G о m b с г g, Bcr., 35, 2401 A902).
3 G о m b e r g, Davis, Ber., 36, 3925 A903).
4 G о m b p r g Ber., 33, 3147 A900).
5 W e r t у р о г о с h, Kowalski, Roeske, Ber., 66, 1237
A933).
'Cone, Robinson, Bcr., 40, 2163 A907).
7 К h a r a s с h, Brown, J. Am. Chem. Soc, 61, 2148 A939).
8 Гаттерман — Вилянд, Практические работы по органиче-
органической химии, 5-е изд., Госхимиздат, 1948, стр. 388.
УНДЕЦИЛИЗОЦИАНАТ
(Ундециловый эфир изоциановой кислоты)
Нагревание
н-С„НазСОС1
Предложили: Ч. Аллен и А. Белл.
Проверили: //. Дрэйк и Дж. Стерлинг.
Получение '
В 1-литровую трехгорлую колбу, снабженную мешалкой и тер-
термометром и погруженную в баню со льдом, помещают раствор 46 г
@,7моля) азида натрия (примечание 1) в 150 мл воды. Затем к рас-
раствору при тщательном перемешивании прибавляют из капельной
воронки смесь 109 г @,5 моля) хлорапгидрида лауриновой кислоты
[т. кип. 134—137° A1 мл) и 150 мл ацетона с такой скоростью,
чтобы температура раствора удерживалась в пределах 10—15°.
После перемешивания смеси при указанной температуре в течение
1 часа мешалку останавливают и, когда смесь расслоится, нижний
водный слой осторожно удаляют, отсасывая его через стеклянный
капилляр (примечание 2). Верхний слой медленно приливают
к 500 мл бензола, предварительно нагретого до 60° (примечание 3).
В результате происходит обильное выделение газа; температуру
смеси поддерживают при 60—70° (примечание 4) до тех пор, пока
не прекратится выделение азота; превращение азида в изоцианат
продолжается около 1 часа. Раствор фильтруют, чтобы освободить
его от небольшого количества нерастворимых примесей, а бензол
отгоняют из специальной колбы Клайзена. В результате перегонки
остатка получают 80—85 г ундецилизоцианата (81—86% теоретич.;
примечания 5 и 6).
Примечания
1. Удовлетворительные результаты получаются при исполь-
использовании продажного азида натрия.
2. Весьма важно до прибавления азида лауриновой кислоты
к нагретому бензолу по возможности полностью удалить воду.
Если этого не сделать, то при разложении азида образуется
с«лш-двузамещенная мочевина. Если же вода была отделена тща-
тщательно, то отпадает необходимость фильтровать раствор бензола
перед окончательной перегонкой.
3. Если азид прибавлять слишком быстро, то раствор иногда
вспенивается и может частично выброситься из сосуда; лучше всего
проводить эту реакцию в 1-литровом стакане.
4. Обычно теплота реакции достаточна для того, чтобы темпе-
температура смеси держалась в пределах 60—70°.
5. При повторной перегонке препарат целиком переходит при
103° C мм). Вторичная перегонка не является обязательной; полу-
полученный ундецилизоацианат достаточно чист для всех практиче-
практических целей.
6. Изложенная методика является общей для получения изо-
цианатов .
Другие методы получения
Шрётер1 применял описанный выше метод для получения
ал килизоциа натов.
1 S с h г б t e r, Ber., 42, 3356 A909).
C6H5NHNH2 + НС1
ФЕНИЛАЗИД
6 NaNO2 —> G6H6N3 + NaCl + 2H2O
Предложили: Р. Линдсей и Ч. Аллен.
Проверили: Р. Шрайнер и Дж. Лоулгр.
Получение
В 1-литровую трехгорлую колбу, снабженную мешалкой, тер-
термометром и капельной воронкой, помещают 300 мл воды и 55,5 мл
концентрированной соляной кислоты. Колбу погружают в баню
со льдом и солью, пускают в ход мешалку и к содержимому колбы
прибавляют по каплям (на это требуется от 5 до 10 мин.) 33,5 г
@,31 моля) фенилгидразина (примечание 1). Хлористоводородная
соль фенилгидразина выпадает в осадок в виде мелких бесцветных
пластинок. Перемешивание продолжают и, когда температура
понизится до 0°, прибавляют к содержимому колбы 100 мл эфира.
28 сборник ;)
434
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Затем через капельную воронку приливают заранее приготовлен-
приготовленный раствор 25 г технического нитрита натрия в 30 мл воды с та-
такой скоростью, чтобы температура в течение всего времени не под-
поднималась выше 5°. На это требуется 25—30 мин.
Реакционную смесь подвергают перегонке с водяным паром
до тех пор, пока не будет получено около 400 мл дестиллата.
Эфирный слой в дестиллате отделяют, а водный — экстрагируют
один раз 25 мл эфира. Соединенные вместе эфирные растворы
сушат над 10ебезводного хлористого кальция. Высушенный рас-
раствор помещают в обыкновенную колбу Клайзена емкостью 200 мл,
приспособленную для перегонки в вакууме. Колбу необходимо
оградить проволочным щитом цилиндрической формы, а между
работником, производящим перегонку, и прибором следует поста-
поставить экран из небьющегося стекла (примечание 2). Колбу погру-
погружают в водяную баню при 25—30° и эфир отгоняют в вакууме.
Затем температуру водяной бани повышают до 60 —65° и веще-
вещество перегоняют в вакууме. Температура кипения фенилазида
49—50° E мм) (примечание 3). Выход составляет24—25 г F5—68%
теоретич.). Фенилазид представляет собой маслянистую жидкость
светложелтого цвета с неприятным запахом (примечание 4).
Примечания
1. Для синтеза был применен продажный фенилгидразин выс-
высшего качества. При использовании технического или заметно окра-
окрашенного препарата выход был значительно меньшим D5—50%),
причем образовывалось большое количество смолы.
2. При проведении этой перегонки следует соблюдать осто-
осторожность. Фенилазид взрывается, если его нагревать при атмосфер-
атмосферном давлении; иногда он взрывается и в случае пониженного
давления. Нельзя допускать, чтобы температура водяной бани
поднялась выше 80°.
3. Фенилазид кипит при 66—68° B1 мм) при температуре бани
70—75°. Рекомендуется поддерживать возможно более низкую
температуру бани и работать при давлении 5 мм или даже при еще
более низком. Проверявшие синтез неоднократно следовали при-
приведенным указаниям, и перегонки обходились без взрывов.
4. Препарат следует хранить в склянке из коричневого стекла.
Его можно сохранять в течение месяца в холодном темном месте.
Другие методы получения
Фенилазид был получен действием азотистой кислоты на соля-
солянокислый фенилгидразин1; действием аммиака на диазобензол-
пербромид2; взаимодействием между солью диазосоединения
и азидом натрия3 или гидроксиламином4.
(И-ФЕНИЛАЛАНИН
435
1 D i m г о t h, Bcr., 35, 1032 A902)
2 G r i e s s, Ann., 137, 68 A866).
3 N 6 1 t i n g, Ber., 26, 86 A893).
4 Fischer, Ann., 190, 96 A877); Mai, Ber., 25 372 A892)- 26
1271 A893); Forster, F i e r z, J. Chera. Soc, 91, 855, 1350 A907I
Л-ФЕНИЛАЛАНИН
(dl-а- Амино-§-фенилп ропионовая кислота)
NaOC2H5
CH2(CO2C2H5J + CeH5CH2Cl у СвН5СН2СН (СО2С2Н5J
С6Н5СН2СН (СО2С2Н5J
кон
С6П5СН2СН(СО2НJ
затем НС1
С6Н5СН2СН (СО2НJ + Вг2 -» СвН5СН2СВг (СО2НJ + НВг
Нагревание
С„Н5СН2СВгССО2П)а >¦ CeHsCH2CHBrCOaH + CO2
CdH6CHaCHBrCOaH + 2NHS - > C6H5CH2CHNH2CO2H+ N^4Br
Предложил: К. Марвел.
Проверили: Л. Смит, Р. Арнольд и К. Хоуард.
Получение
Диэтиловый эфир бензилмалоновой кислоты. В 5-литровую трех-
горлую колбу, установленную на паровом нагревателе и снабжен-
снабженную мешалкой с ртутным затвором, обратным холодильником
и капельной воронкой емкостью 500 мл, помещают 2 500 мл абсо-
абсолютного этилового спирта и прибавляют к нему 115 г E грамм-
атомов) натрия, нарезанного мелкими ломтиками. Когда весь натрий
вступит в реакцию, холодильник снабжают хлоркальциевой труб-
трубкой и к содержимому колбы приливают через делительную воронку
ровной струей 830 г E,18 моля) малонового эфира. После этого
к смеси прибавляют по каплям в течение 2 — 3час. 632 г E мо-
молей) хлористого бензила. Смесь кипятят с обратным холодиль-
холодильником при работающей мешалке до тех пор, пока она не будет
обнаруживать нейтральную реакцию на влажную лакмусовую
бумажку (около 8—11 час.). Затем обратный холодильник заме-
заменяют на обращенный вниз и отгоняют спирт в другую 5-литровую
трехгорлую колбу, снабженную обратным холодильником (при-
(примечание 1). Чтобы удалить весь спирт, требуется около 3 час.„
причем регенерируется немного более 2 л.
Остаток обрабатывают не более чем 2 л воды (примечание 2)
и затем взбалтывают его; если потребуется, то для того, чтобы
достигнуть более четкого отделения слоя бензилмалоната от вод-
водного слоя, к реакционной смеси прибавляют соль. Сложный эфир,
полученный в результате двух таких опытов, перегоняют из
5-литровой двугорлой колбы с хорошо изолированным елочным
дефлегматором диаметром 18 мм. Собирают фракцию, кипящую
при 145 — 155° E мм); количество ее составляет 1265—1 420. г-
436
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
E1—57% теоретич.). Остаток представляет собой главным обра-
образом диэтиловый эфир дибензилмалоновой кислоты.
а-Бром-$-фенилпропионовая кислота. В 12-литровой кругло-
донной колбе, снабженной мешалкой и установленной на большом
паровом нагревателе, растворяют 860 г технического едкого кали
в 850 мл воды. К еще горячему раствору прибавляют через капель-
капельную воронку в течение 1 часа 1 кг D моля) диэтилового эфира бен-
зилмалоновой кислоты. Чтобы облегчить удаление паров спирта,
в горло колбы помещают трубку, соединенную с водоструйным
насосом. Нагревание и перемешивание продолжают в течение
3 час; если потребуется, то для того, чтобы реакционная масса
на затвердела, к смеси прибавляют еще некоторое количество
воды. Затем колбу охлаждают и ее содержимое переливают в гли-
глиняный сосуд, погруженный в баню со льдом и снабженный мешал-
мешалкой. Для понижения температуры в сосуд прибавляют 500 г льда;
когда температура достигнет 20°, прибавляют техническую соляную
кислоту с такой скоростью, чтобы температура смеси не повыша-
повышалась. Вначале прибавление ведут медленно, но когда избыток
щелочи будет нейтрализован, кислоту прибавляют более быстро.
Выделившуюся твердую однокалиевую соль переводят в раствор,
прибавляя кислоту еще быстрее и перемешивая массу от руки.
Когда реакционная смесь будет обнаруживать кислую реакцию
на конго, к ней прибавляют избыток в 150 мл кислоты и содержи-
содержимое глиняного сосуда переносят в 12-литровую круглодонную кол-
колбу, которую закрывают пробкой; в пробку вставляют большой
кран, конец которого не должен выступать за нижний срез пробки,
и стеклянную трубку, доходящую до дна колбы. Таким образом,
если пробку укрепить проволокой, то колбу можно применять
в качестве большой делительной воронки.
Бензилмалоновую кислоту экстрагируют четырьмя порциями
эфира по 1 л\ эфирные вытяжки соединяют вместе в 5-литровой
колбе и оставляют стоять в течение ночи над 150 г хлористого
кальция. Затем эфирный слой декантируют в 5-литровую колбу,
снабженную эффективным обратным холодильником, мешалкой
с ртутным затвором и капельной воронкой. К раствору по каплям
прибавляют 225 мл сухого брома с такой скоростью, чтобы эфир
кипел (примечание 3). На это требуется около 4 час. После прибав-
прибавления всего количества брома через капельную воронку добав-
добавляют 1 л воды с такой скоростью, чтобы не прекращалось слабое
кипение эфира (примечание 4).
Эфирный слой бромбензилмалоновой кислоты отделяют де-
декантацией и эфир отгоняют. Остаток декарбоксилируют, нагревая
его в 3-литровой колбе в течение 5 час. на масляной бане при тем-
температуре 130—135°.
dl-Фенилаланин. Неочищенную бромзамещенную кислоту раз-
разделяют на четыре части и каждую часть приливают к порциям по 2 л
Ш-ФЕШШАЛАШШ
437
технического водного аммиака (уд. вес. 0,90), находящимся в четы-
четырех круглодонных колбах емкостью по 3 л. Каждую колбу после
тщательного взбалтывания ее содержимого закрывают резиновой
пробкой, которую укрепляют проволокой, и оставляют стоять
в течение недели. Затем содержимое всех четырех колб, в которых
осуществлялось аминирование (примечание 5), соединяют вместе
в 12-литровой колбе, прибавляют туда же 20 г активированного
березового угля и в течение ночи нагревают раствор на паровом
нагревателе. Выделяющийся через стеклянную трубку аммиак ула-
улавливают в ловушке или просто отводят в воду. Раствор фильтруют
в горячем состоянии", по охлаждении большая часть фенилалани-
на выпадает в виде осадка. Его отфильтровывают, промывают
250 мл метилового спирта и фильтрат упаривают в вакууме водо-
водоструйного насоса до тех пор, пока снова не начнут образовы-
образовываться кристаллы. Раствор охлаждают и получают дополнитель-
дополнительную порцию фенилаланина, которую также промывают метиловым
спиртом. Выход неочищенного вещества составляет 500 г, однако
оно слегка влажно; если препарат сушить в течение ночи в су-
сушильном шкафу при 80°, то количество вещества будет составлять
460 г. Следует отметить, что производить эту операцию нет необхо-
необходимости, так как выход чистого фенилаланина не изменяется неза-
независимо от того, будет ли неочищенный препарат высушен или нет..
Фенилаланин перекристаллизовывают следующим образом.
Неочищенный препарат растворяют в 9 л воды при нагревании на
паровом нагревателе до 95°, раствор обрабатывают 15 г активиро-
активированного березового угля и фильтруют. Затем к раствору прибавляют
3 л спирта и охлаждают его в холодильном шкафу в течение ночи.
Выход чистого препарата составляет около 367 г. Можно допол-
дополнительно получить еще 45 г вещества, если маточный раствор
упарить в вакууме до начала выделения кристаллов, после чего
прибавить к нему спирт в количестве, равном одной трети остав-
оставшегося объема маточного раствора, и смесь охладить. Если про-
продолжать упаривание маточных растворов, то можно получить еще
некоторое количество вещества. Выход составляет 412 г F2,4%
теоретич., считая на диэтиловый эфир бензилмалоновой кислоты).
Вещество получается в виде белых кристаллов; оно разлагается
при271—273° (не исправл.) в запаянном капилляре (примечание 6).
Примечания
1. Натрий, необходимый для проведения следующего синтеза,
можно прибавлять во вторую колбу в то время, когда в нее пере-
перегоняется спирт.
2. Обычно обработка 1 500 мл воды бывает достаточной и при-
прибавлять соль не требуется.
3. Чтобы началось бромирование, к раствору прибавляют
10 мл брома и раствор перемешивают до тех пор, пока он не станет
438
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
бесцветным. После того как реакция начнется, она будет npcf-
текать гладко. Если требуется получить большие количества ами-
аминокислоты, то в стадии бромирования удобнее работать с двойной
порцией.
4. Следует соблюдать осторожность и не приливать воду слиш-
слишком быстро, так как реакционная смесь может вспениться и выбро-
выброситься из колбы.
5. Обычно растворы после аминирования получаются окрашен-
окрашенными, и часто на дне колб выделяется небольшое количество
маслянистого вещества. При последующей обработке это масля-
маслянистое вещество исчезает.
6. Полученный таким образом препарат содержит теоретиче-
теоретическое количество аминного азота.
Другие методы получения
Методы получения df-фенилаланина были приведены ранее
{«Синт. орг. прей.», сб. 2, стр. 496). Помещенная здесь пропись
в основных чертах повторяет методику, первоначально разработан-
разработанную Фишером1. Для получения больших количеств д!/-фенил-
аланина она, несомненно, является наиболее пригодной*.
1 Fischer, Ber., 37, 3064 A904).
2-ФЕНИЛИНДОЛ
(а-Фенилиндол)
!
CBH5NHN-CC3H5
Предложили; Р. Шрайнер, В. Эшли и Э. Увлч.
Проверили: Г. Адкинс, А. Робэк и Г. Коонрадт
Получение
В высокий 1-литровый стакан помещают смесь 53 г @,25 моля)
свежеприготовленного фенилгидразона ацетофенона (примеча-
(примечание 1) и 250 г безводного измельченного хлористого цинка (приме-
(примечание 2). Стакан погружают в масляную баню, нагретую до 170°,
и смесь энергично перемешивают от руки. Через 3—4 мин. масса
становится жидкой и начинается выделение белых паров. Стакан
вынимают из бани и смесь перемешивают в течение 5 мин. Чтобы
* По способу В. В. Феофилактова (см. dZ-лейцин, примечание редактора
г//-фенилаланин был получен из бензилацетоуксусного эфира через фенил-
гидразон фенилпировиноградной кислоты. Фенилгидразон был получен
с выходом 68% теоретического количества, dZ-фенилаланин— с количествен-
количественным выходом [В. В. Феофилактов, Е. Виноградова ЖОХ
10, 255 A940)]. (Прим. ред.)
2-ФЕНИЛИНДОЛ
439
предотвратить затвердевание, в реакционную смесь тщательно
вмешивают 200 г чистого песка. Хлористый цинк растворяют, для
чего реакционную массу обрабатывают в течение ночи при нагре-
нагревании на паровом нагревателе смесью 800 мл воды и 25 мл кон-
концентрированной соляной кислоты (уд. вес около 1,20). Песок
и сырой фенилиндол отфильтровывают и кипятят с 600 мл 95% -ного
спирта. Смесь в еще горячем состоянии обесцвечивают активиро-
активированным березовым углем и фильтруют через нагретую воронку
Бюхнера диаметром 10 см. Песок и активированный березовый
уголь промывают 75 мл горячего спирта. Соединенные вместе
фильтраты охлаждают до комнатной температуры, после чего
2-фенилиндол отфильтровывают через воронку Бюхнера диаметром
10 еж и три раза промывают небольшими количествами A5—20 мл)
холодного спирта. Кристаллы, полученные в первой порции,
совершенно чисты. Препарат высушивают в) вакуум-эксикаторе
над хлористым кальцием, после чего выход вещества составляет
30—33 г; т. пл. 188—189° (исправл.; примечания 3 и 4).
К фильтрату и промывной жидкости, соединенным вместе, при-
прибавляют небольшое количество активированного березового угля;
затем раствор выпаривают до объема 200 мл и фильтруют. Из
фильтрата после охлаждения выделяется вторая порция вещества
в 5—6 г (примечание 5). Этот препарат недостаточно чист; он пла-
плавится при 186—188-°. Общий выход 2-фенилиндола составляет
35—39 г G2—90% теоретич.).
Примечания
1. Фенилгидразон ацетофенона получают1 нагреванием смеси
40 г @,33 моля) ацетофенона и 36 г @,33 моля) фенилгидразина в те-
течение 1 часа на паровом нагревателе. Горячую смесь растворяют
в 80 мл 95%-ного спирта и перемешиванием вызывают кристал-
кристаллизацию. Затем смесь охлаждают в бане со льдом, препарат отфиль-
отфильтровывают и промывают 25 мл спирта. Таким путем получают
54—57г бесцветного вещества. Вторую порцию в 4—Юг получают
выпариванием фильтрата и промывной жидкости, соединенных
вместе. Оба осадка объединяют и сушат в течение 1 часа в вакууме
над хлористым кальцием. Общий выход фенилгидразона ацето-
ацетофенона с т. пл. 105—106° составляет 61—64 г (87—91 % теоретич.).
2. В литературе имеется указание2 на то, что применение такого
большого количества хлористого цинка не обязательно, однако
авторы синтеза нашли, что в случае использования равных частей
фенилгидразона ацетофенона и хлористого цинка выход полу-
получается ниже.
3. Применяя количества исходных веществ, в 3,2 раза превы-
превышающие указанные выше, и не пользуясь песком при выделении
продукта реакции, проверявшие синтез получили выход 2-фенил-
2-фенилиндола, составляющий 75—80%.
440
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
4. При высушивании препарат окрашивается с поверхности
в светлозеленый цвет.
5. Фильтрат все еще содержит некоторое количество 2-фенил-
индола, но попытка очистить этот сырой материал встречает боль-
большие затруднения.
Другие методы получения
2-Фенилиндол был получен нагреванием бензоил-о-толуида
в атмосфере водорода3, причем эта реакция была улучшена приме-
применением в качестве конденсирующего средства амилата натрия;
нагреванием фенилгидразона фенилуксусного альдегида с пятью
частями безводного хлористого цинка4; нагреванием бромистого
фенацила с 2 молями анилина5; отщеплением одной молекулы воды
от о-аминодезоксибензоинав — соединения, полученного из о-нитро-
дезоксибензоина; дегидрогенизацией бензаль-о-толуидйна7; дей-
действием безводного хлористого цинка на фенилгидразон ацето-
фенона8.
1 Rei senegger, Ber., 16, 662 A883).
2 А. Е. А р б у з о в, Тихвинский, ЖРФХО, 45, 70 A913).
aMadelung, Ber., 45, 113] A912).
4 Fi scher, S с h га i t t, Ber., 21, 1072 A888).
5 M о h 1 a u, Ber., 15, 2480 A882); В i s с h 1 e г, там же, 25, 2860A892).
6 Pi с t e t, Ber., 19, 1064 A886).
7 E t a r d, Compt. rend., 95, 730 A882).
8 Fi schcr, Ann., 236, 133 A886).
1-ФЕНИЛНАФТАЛИН
( з.-Феналнафтам1н )
+ C6H5MgBr
Hcl
2 (CH3COJ О
н2 "
-f H,S
Предложил: Р. Вейс.
Проверили: Ч. Аллен и Ф. Пинеерт.
Получение
Фенилдиалин. Из 11 г @,45 грамматома) магния, 75г @,48 моля)
бромбензола и 175 мл эфира по общепринятому методу приго-
1-Ф1ШИЛНАФТАЛИН
441
товляют раствор бромистого фенилмагния1. Как только магний
прореагирует, из капельной воронки начинают прибавлять раствор
58,4 г @,4 моля) с-тетралона (стр. 405) в 60 мл эфира; прибавле-
прибавление ведут по возможности быстро, так чтобы поддерживать
энергичное кипение эфира; эта операция занимает около получаса.
Затем реакционную смесь кипятят с обратным холодильником
в течение еще получаса и оставляют ее стоять в течение 1 часа.
После этого магниевый комплекс разлагают с помощью примерно
250 г льда и 40 мл концентрированной соляной кислоты. Эфирный
слой отделяют и перегоняют с водяным паром, чтобы удалить
примеси (примечание 1); для проведения этой операции требуется
около 6 час, причем собирают около 4 500 мл дестиллата. Остав-
шиееся тяжелое масло отделяют от воды и прибавляют к нему
80 мл эфира и 10 мл хлористого кальция. Через 4-—5 мин. хлори-
хлористый кальций отфильтровывают, а эфир отгоняют на паровой
бане. Затем к остатку прибавляют 20 мл уксусного ангидрида
и нагревают содержимое колбы в течение 20—25 мин. на паровой
бане (примечание 2). Окончательно смесь перегоняют в вакууме,
применяя колонку Видмера (стр. 465) высотой 40 см (примеча-
(примечание 3). Собирают фракцию, кипящую при 135—140° B мм); выход
составляет 35—40 г D2—48% теоретич.).
1-Фенилнафталин. Смесь 6 г @,18 моля) порошкообразной
серы и 35 г @,17 моля) 1-фенилдиалина нагревают в колбе Клай-
зена емкостью 200 мл со специальным боковым отводом («Синт.
орг. преп.», сб. 1, стр. 142, рис. 8) в течение получаса на металли-
металлической бане, температуру которой поддерживают в пределах
250—270° (примечание 4). К концу этого времени выделение серо-
сероводорода прекращается; тяжелое масло (примечание 5) перегоняют
из той же колбы. Выход составляет 32—33 г (91—94% теоретич.);
температура кипения 1-фенилнафталина 134—135° B мм) [189—190е
A2 мм)] (примечания 6 и 7).
Примечания
1. Перегонкой с водяным паром удаляют не вступивший в реак-
реакцию бромбензол, дифенил и т. д.
2. Лучше всего проводить реакцию в конической колбе емко-
емкостью 500 мл или в стакане, которые можно погрузить в паровую
баню и удерживать там с помощью тряпки.
3. Если при перегонке не применять ректификационную колон-
колонку, то для получения препарата, кипящего в указанных выше тем-
температурных пределах, приходится проводить несколько пере-
перегонок. Если же проводить этот процесс так, как указано в про-
прописи, то последующие операции облегчаются и применять колонку
при окончательной перегонке углеводорода не требуется. В случае
обеих перегонок желательно пользоваться капилляром.
442
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
4. Температура внутри колбы должна быть равна 250°.
5. Каждая смена колбы влечет значительную потерю углево-
углеводорода. Поэтому рекомендуется проводить дегидрогенизацию
и перегонку в одной и той же колбе.
6. Иногда углеводород оказывается окрашенным в голубой
цвет, что, по всей вероятности, обусловлено примесью следов азу-
лена. Эту примесь легко удалить, если растворить углеводород
в равном по объему количестве гексана или петролейного эфира
и взбалтывать этот раствор с равным по объему количеством
85%-ной сиропообразной фосфорной кислоты до исчезновения
окраски. Углеводород получают после выпаривания растворителя;
повторно его можно не перегонять.
7. Общий выход, считая на а-тетралон, составляет 40% тео-
теоретического количества.
Другие методы получения
1-Фенил нафталин был получен в результате взаимодействия
а-галоидзамещенных нафталинов с дифенилртутью2 или с бензолом
в присутствии хлористого алюминия2, а также по рекции Гринья-
ра, исходя либо из бромбензола, циклогексилхлорида и а-тетра-
лона 3-4, либо из а-бромнафталииа и циклогексанона 3'6-s. Для
дегидрогенизации декагидронафталинового ядра применялись
сера3, бром5, платиновая чернь или селен4. Образование углево-
углеводорода в результате диазореакции
7-10
представляет, повидимому,
меньший препаративный интерес, чем описанный здесь метод.
1 Ч. Алле н, К о н и е р с, Синт. орг. преп., сб. 1, стр. 207.
2 С h a t t a w а у, J. Chem. Soc, 63, 1187 A893).
'Weiss, W о i d i с h, Monatsh., 46, 455 A925).
4 С о о k, Lawrence, J. Chem. Soc, 1936, 1432.
5 Sherwood, Short, Clausfield, J. Chem. Soc, 1932, 1834.
6 V e s с 1 у, ?> t u r s a, Collection Czechoslov. Chem. Commun. 5,
344 A933) [C.'A., 28, 144 A934)].
'Grieve, Hey, J. Chem. Soc, 1938, 113.
«Water, J. Chem. Soc, 1939, 864.
"Hodgson, M a r s d e n, J. Chem. Soc, 1940, 208.
10 Б a x м а н, Гофман, Органические реакции, сб. 2, Издат-
инлит, 1950, стр. 268.
ФЕНИЛОВЫЙ ЭФИР КОРИЧНОЙ КИСЛОТЫ
(Коричнофениловый эфир)
С6Н6СН = СНСО2Н + SOC12 -* C6HSCH = СНСОС1 + НС1 + SO2
C6H5CH = CHCOC1 + C6H5OH -> CGH5CH
Предложили: Э. Вожак и Дж. Мак-Уиртер.
Проверили: Р. Шрайнер, Н. Мун и С. Кельтон мл.
Получение
В колбу Клайзена емкостью 500 мл помещают смесь 148 г
A моль) коричной кислоты и 119 г A моль) хлористого тионила
ФЕНИЛОВЫЙ ЭФИР КОРИЧНОЙ КИСЛОТЫ
443
(примечание 1). Боковой отвод и одно из горл колбы закрывают
пробками и к колбе присоединяют обратный холодильник. Прибор
устанавливают под таким углом, чтобы конденсат не попадал
в боковой отвод. К верхней части холодильника присоединяют
отводную трубку для выделяющихся хлористого водорода и сер-
сернистого газа, ведущую к ловушке для поглощения газов («Синт.
орг. преп.», сб. 2, стр. 78, рис. 3). Смесь нагревают на паровой
бане (сначала осторожно), пока не прекратится выделение хлори-
хлористого водорода (от 45 мин. до 1 часа); затем смеси дают охла-
охладиться и прибавляют к ней 94 г A моль) фенола (примечание 2).
После этого смесь снова нагревают на паровой бане, пока не
прекратится выделение хлористого водорода (около 1 часа). Затем
колбу помещают на песчаную баню и нагревают ее содержимое до
начала кипения, чтобы завершить реакцию и полностью удалить
хлористый водород (примечание 3).
Реакционную смесь охлаждают и перегоняют в вакууме (при-
(примечание 4). Собирают фракцию, кипящую в пределах 190—210°
A5 мм). Дестиллат затвердевает, образуя бледножелтую массу,
которая плавится при 64—69°. Выход составляет 186 — 200 г
(83—89% теоретич.).
С целью очистки вещество растирают в ступке и промывают
500 мл холодного 2%-ного раствора двууглекислого натрия.
Остаток перекристаллизовывают из 300 мл 95%-ного этилового
спирта. Выход полученных в результате перекристаллизации
чистых бесцветных кристаллов составляет 141 —168 г F3 — 75%
теоретич.); т. пл. 75—76°.
Примечания
1. Хлористый тионил перед употреблением следует пере-
перегнать. В настоящем синтезе был применен препарат с т. кип.
75,0 — 75,5°.
2. Был взять фенол марки ч. д. а.
3. Смесь кипит при температуре песчаной бани, равной при-
примерно 350°. Продолжительное кипячение на песчаной бане приво-
приводит к значительной потере вещества в результате разложения и
полимеризации, а также превращения кислоты в стильбен вслед-
вследствие выделения углекислого газа.
4. При перегонке в вакууме лучше не включать в систему мано-
манометр до тех пор, пока не будут удалены непрореагировавший фе-
фенол и большая часть хлористого водорода. Чтобы смесь не кипела
толчками, колбу следует нагревать пламенем горелки, придавая
последней от руки вращательное движение и направляя пламя
на поверхность кипящей жидкости. Если пары перегреть слиш-
слишком сильно, то температура кипения может возрасти до 220°
A5 мм).
444
синтезы органических препаратов
Другие методы получения
Фениловый эфир коричной кислоты и.другие сложные эфиры
фенола были получены нагреванием кислоты и фенола в присут-
присутствии хлорокиси фосфора1 и нагреванием ангидрида кислоты
и фенола в присутствии таких дегидратирующих средств, как
плавленый хлористый цинк или безводный уксуснокислый натрий2.
Фениловый эфир коричной кислоты был получен также осторож-
осторожной перегонкой фенилового эфира фумаровой кислоты3.
1 Nencki, Compt. rend., 108, 254 A889).
- Fr anchi m о n t, Ber., 12, 2059 A879); Liebermann, там же,
21, 1172 A888).
3 A n s с h fl t z, Ber., 18, 1945 A885).
ФЕНИЛПРОПАРГИЛОВЫЙ АЛЬДЕГИД
(Фенилпропиоловый альдегид)
Вг2 КоСО3
СвН6СН = СНСНО > СеН5СНВгСНВгСНО >¦
НС (ОС21Ь)з
-> С6Н5СН = СВгСНО > С6
= СВгСН(ОО2Н5J
КОН
CGH5C = ССН (ОС2Н5J
н2о
с6н5с = сено
Предложили: Ч. Аллен и К- Эденс, мл,
Проверили: К- Хитон и К. Ноллер.
Получение
а-Бромкоричный альдегид. Смесь 44 г @,33 моля) коричного
альдегида и 167 мл уксусной кислоты помещают в трехгорлую
круглодонную колбу емкостью 500 мл. Колбу снабжают мешал-
мешалкой, обратным холодильником и капельной воронкой и погружают
ее в баню с холодной водой. При энергичном перемешивании к сме-
смеси прибавляют сперва 17,1 мл E3,5 г; 0,33 моля) брома, а затем
23 г @,17 моля) безводного поташа. Когда выделение газа пре-
прекратится, смесь кипятят в течение еще получаса; затем ее охлаж-
охлаждают и переливают в 1-литровую колбу, куда предварительно по-
помещают 435 мл воды. Неочищенный а-бромальдегид выделяется
в виде нижнего красноватого слоя. Колбу закрывают пробкой,
охлаждают проточной водой и энергично встряхивают. Получив-
Получившееся твердое гранулированное вещество отфильтровывают с отса-
отсасыванием- и, не просушивая его, растворяют при нагревании
в 220 мл 95%-нога спирта. Затем к раствору прибавляют 50 мл
воды и жидкость нагревают до тех пор, пока она не станет прозрач-
прозрачной, после чего раствор оставляют кристаллизоваться сперва при
ФЕНИЛПРОПАРГИЛОВЫЙ АЛЬДЕГИД
445
комнатной .температуре, а затем в холодильном шкафу. <х-Бром-
коричный альдегид выделяется в виде почти бесцветных игольча-
игольчатых кристаллов, которые отфильтровывают с отсасыванием, промы-
промывают 17 мл 80%-ного спирта и сушат на воздухе. Выход препарата
с т. пл. 72.—73° составляет 52—60 г G5—85% теоретич.; приме-
примечание 1).
Ацеталь а-бромкоричного альдегида. В колбу емкостью 250 мл
помещают 45 г @,21 моля) а-бромкоричного альдегида, 50 мл
@,3 моля) этилового эфира ортомуравьиной кислоты1, 40 мл абсо-
абсолютного этилового спирта и 0,5 г хлористого аммония. Смесь
кипятят в течение получаса, после чего ее переносят в специаль-
специальную колбу Клайзена («Синт. орг. преп.». сб. 1, стр. 142, рис. 8)
и при атмосферном давлении отгоняют низко кипящие компоненты
при постепенном повышении температуры бани до 150° (примеча-
(примечание 2). Выход ацеталя с т. кии. 146—149° E мм) и показателем
преломления п2и 1,5500 составляет^50—52 г (82—86% теоретич.).
Ацеталь фенилпропаргилового альдегида. К 50 г @,18 моля1)
ацеталя а-бромкоричного альдегида, находящегося в колбе емко-
емкостью 500 мл, прибавляют раствор 20,7 г @,25 моля) едкого кали в
200 мл абсолютного этилового спирта. Смесь кипятят в течение
1,5 часа, а затем выливают в 3-литровую делительную воронку,
в которую предварительно помещают 1 500 мл воды. Выделив-
Выделившееся масло экстрагируют тремя порциями хлороформа по 170 мл;
соединенные вместе хлороформенные вытяжки промывают тремя
порциями воды по 75 мл и затем сушат над 15 г безводного серно-
сернокислого натрия. Хлороформ отгоняют, а оставшееся масло пере-
перегоняют из специальной колбы Клайзена. Выход ацеталя фенил-
фенилпропаргилового альдегида с т. кип. 153—156° A9 Мм) составляет
28—31 г (80—86% теоретич.).
Фенилпропаргиловый альдегид. К 140 мл воды и 10 жл кон-
концентрированной серной кислоты прибавляют 29 е @,14 моля)
ацеталя и в течение получаса нагревают эту смесь на паровой
бане, время от времени взбалтывая ее. Затем альдегид отгоняют
с водяным паром и извлекают его из дестиллата двумя порциями
эфира по 250 мл. Эфирный раствор сушат над 20 г безводного
сернокислого натрия, растворитель отгоняют, а остаток перего-
перегоняют из специальной колбы Клайзена емкостью 100 мл. Выход
фенилпропаргилового альдегида с т. кип. 114—117° A7 мл) и по-
показателем преломления пЩ 1,6032 составляет 13—15 г G0—81%
теоретич.).
Примечания
1. Тот же выход (в процентах) был получен при опытах с
утроенными количествами реагентов.
2. Перегнать вещество можно из той же колбы, в которой про-
проводилась реакция.
446
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Другие методы получения
Описанный процесс получения фенилпропаргилового альдеги-
альдегида представляет собой видоизменение метода Клайзена2, которое
частично было разработано Кальфом3. Получение монобромкорич-
ного альдегида описал Цинке4. Другой метод, имеющий препара-
препаративную ценность для получения ацеталя, состоит во взаимодей-
взаимодействии натриевого производного фенилацетилена 5~8 или реактива
Гриньяра, полученного из фенилацетилена9'10 с этиловым. эфи-
эфиром ортомуравьиной кислоты.
1 Кауфман, Дреджер, Синт. орг. преп., сб. 1, стр. 554.
2 С 1 a i s e п, Вег., 31, 1020 A898).
3 К а 1 f f, Rec, trav. chim., 46, 594 A927).
4Zincke, Ha gen, Ber., 17,1815A884).
5 Moureu, Delange, Compt. rend., 133, 106 A901).
"Moureu, Delange, Bull. soc. chim., C), 31, 1329 A904).
Brachi m, Bull. soc. chim.. E). ЗЯ HfiS nqnfi\
' Brachi m, Bull. soc. chim., C), 35, 1165 A906).
•Charon, Dugoujon, Compt. rend., 137, 126 A903).
9 M о u r e u, Delange, Compt. rend., 138, 1341 A904).
'" " Delange, Bull. soc. chim., C), 31, 1332 A904).
j-i и u I c U,
10 M о u r e u,
«-ФЕНИЛПРОПИОНОВЫЙ АЛЬДЕГИД
(Гидратроповый альдегид)
CeHsC (CH?) CHCOaC2H5
затем HCI
C6H5CH(CHS)CHO
Предложили: Ч. Аллен и Дж. ВанАллан..
Проверили: Н. Дрэйк и К. Блюменштейн..
Получение
В 1-литровой круглодонной колбе приготовляют спиртовой
раствор этилата натрия из 15,5 г @,67 грамматома) натрия и 300 мл
абсолютного этилового спирта (примечание 1). К этому раствору
медленно при взбалтывании прибавляют 133 г @,64 моля) этилового
эфира фенилметилглицидной кислоты. Содержимое колбы охла-
охлаждают до 15° и медленно прибавляют к нему 15 мл воды; при этом
выделяется значительное количество тепла и вскоре начинает
выпадать в осадок натриевая соль. Смесь оставляют стоять в те-
течение ночи, после чего соль отфильтровывают с отсасыванием
и промывают 50 мл спирта, а затем таким же количеством эфира.
Вес сухой соли составляет 102—108 г (80—85% теоретич.); т. пл.
255—256° (с разложением).
а-ФЕНИППРОШЮНОВЫЙ АЛЬДЕГИД
447
Соль добавляют к разбавленному раствору соляной кислоты,
приготовленному из 56 мл концентрированной кислоты (уд. вес
1,18) и 300 мл воды; раствор кислоты должен находиться в 1-лит-
1-литровой колбе, снабженной обратным холодильником. Смесь слабо
нагревают, в результате чего выделяется углекислый газ и обра-
образуется слой масла. Колбу нагревают на паровой бане в течение
1,5 часа; затем содержимое колбы охлаждают и экстрагируют
масло 150 мл бензола. Бензольные вытяжки промывают один раз
водой B00 мл) и перегоняют в вакууме из обычной колбы Клай-
Клайзена емкостью 500 мл. Гидратроповый альдегид перегоняется
при 90—93° A0 мм) [73—76° D мм)] (температура масляной бани
120—130°). Вес остатка в колбе не превышает 3 — 5 г. Выход
составляет 50—60 г F5—70% теоретич.; примечания 2 и 3).
Примечания
1. Натрий помещают в колбу и прибавляют к нему спирт
через верхнюю часть холодильника d такой скоростью, с какой это
допускает эффективность холодильника (стр. 491, примечание 1).
2. Приведенная реакция имеет общий характер, и ее примени-
применимость ограничена только доступностью глицидных эфиров.
3. 2,4-Динитрофенилгидразон а-фенилпропионового альде-
альдегида кристаллизуется в виде желтых призматических кристаллов,
которые плавятся при 135°.
Другие методы получения
Гидратроповый альдегид был получен гидролизом эфира фенил-
фенилметилглицидной кислоты 1'3; окислением кумола с помощью хло-
хлористого хромила4; отщеплением галоидоводородной кислоты или
воды от галоидгидринов или гликолсйй~7; перегонкой при атмо-
атмосферном давлении окиси метилфенилэтилена8'9.
1 С 1 a i s e я, Вег., 38, 703 A905).
2 1. G. Farbenindustrie A.-G герм. пат. 602816 {Frdl., 20, 217A935)].
3 D u t t a, J. Indian Cliern. Soc, 18, 235 A941) [C. A., 36, 161
A942)].
'Miller, R о h d e, Ber., 24, 1359 A889).
5 Bougault, Ann. chim. phys., G), 25, 548 A902).
«Tiffeneao, Bull. soc. chim., C), 27, 643 A902); Compt. rend.,
134, 846 A902); 137, 1261 AS03); 142, 1538 A906); Ann. chim. phys., (8),
10 353 A907).
'Stoermer, Ber., 39, 2298, AP06).
8 К 1 a g e s, Ber., 38, 1971 (K05).
9 T i f f e n e a u, Compt. rend., 140 1459 A905); Ann. chim. phys.,.
(8), 10, 192 A907).
448
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
«-ФЕНИЛЭТИЛАМИН
A -Фенил-1 -аминоэтан )
Никель Ренея
loll0
QH5CHCH3
NH,
Предложили: Д ж. Робинсон мл. и X. Снайдер.
Проверили: Н. Дрэйк и Д. Дрейпер.
Получение
В 2-литровый автоклав помещают 720 г F молей) чистого ацето-
фенона и 1 столовую ложку никеля Ренея (стр. 338). После того
как крышка автоклава с манометром будет плотно закреплена,
в него вводят 700 мл C0 молей) жидкого аммиака (примечание 1).
Смесь гидрируют при 150° под давлением 250—350 am (примеча-
(примечание 2). Реакции предоставляют идти до тех пор, пока происходит
поглощение водорода, что обычно занимает 4—6 час. После этого
автоклав охлаждают, избыток аммиака выпускают, а содержимое
автоклава отфильтровывают от катализатора. Смесь охлажда'ют
в бане со льдо;и, подкисляют концентрированной соляной кислотой
B00—300 мл) до кислой реакции на конго и перегоняют затем
с водяным паром в течение 10—12 час, чтобы удалить избыток
ацетофенона (примечание 3). Остаток охлаждают -и медленно
прибавляют к 200 г твердого едкого натра, содержащегося в кол-
колбе, погруженной в баню со льдом. Амин отделяют, а водный
слой экстрагируют тремя порциями бензола по 150 мл. Вытяжки
и основную порцию амина соединяют вместе и сушат над твер-
твердым едким натром. Бензол отгоняют, а остаток фракционирует
в вакууме. Выход а-фенилэтиламина (примечание 4) с т. кип.
80—81° A8 мм) составляет 320—380 г D4—52% теоретич.; при-
примечание 5).
Примечания
1. Жидкий аммиак вводят в 2-литровый автоклав следующим
образом. Сперва плотно укрепляют крышку этого автоклава.
Из крышки другого, меньшего автоклава (емкостью около 250 мл)
вынимают внутреннюю трубку для ввода газа (если такая трубка
имеется). К этому небольшому автоклаву подбирают большую про-
пробирку, плотно в него входящую, и, охлаждая в бане с сухим льдом,
наполняют ее жидким аммиаком. Пробирку вставляют в малый
автоклав и быстро A5—30 сек.) укрепляют на нем крышку с мано-
манометром. Затем этот автоклав наполняют водородом под высоким
давлением и соединяют его с большим автоклавом при помощи
короткой капиллярной трубки. Малый автоклав переворачи-
а-ФЕНИЛЭТИЛАШШ
449
вают и открывают вентили. При такой операции вводится около
150 мл жидкого аммиака в один прием, причем ее можно повто-
повторять столько раз, сколько это потребуется-
2. Необходим компрессор, так как очень важно поддерживать
давление выше минимальной величины в 250 am. Температура
восста.повления превышает критическую температуру аммиака,
и давление не падает значительно ниже 250 am. В последнем слу-
случае в автоклав приходится вводить водород, пока давление не
достигнет 350 am; этот процесс повторяют до тех пор, пока не за-
закончится реакция. Если автоклав снабжен манометром, то послед-
последний не должен быть медным, так как аммиак даже при давлении
в 2 — 3 am быстро разрушает медь. Необходим специальный
манометр из стали, никеля или какого-нибудь другого подхо-
подходящего металла.
3. Колбу при этом необходимо нагревать снаружи пламенем
горелки, так как иначе при длительной перегонке с водяным
паром объем раствора значительно увеличится.
4. Согласно указаниям авторов синтеза, точно таким же спо-
способом метиламилкетон (800 г) и аммиак F00 мл) были превращены
в 2-аминогептан с т. „кип. 139—141°; выход составлял 50—55%.
Немного видоизмененный метод был применен для получения
н-гептиламина и фурфуриламина. Гептальдегид C20 г) был рас-
растворен в 500 мл метилового спирта и к нему было прибавлено
150 мл жидкого аммиака; восстановление осуществлялось так, как
это было описано выше. н-Гептиламин [т. кип. 57—58° B3 мм)}
был получен с выходом 53 — 63% теоретического количества.
Свежсперегнанный фурфурол B90 г) был растворен в 500 мл мети-
метилового спирта, в раствор было введено 150 мл жидкого аммиака
и восстановление проводилось обычным путем. Полученное веще-
вещество было профильтровано и немедленно подвергнуто дробной
перегонке. Фурфуриламин (т. кип. 144 —146°) был получен с
выходом 50% теоретического количества.
5. Выходы определены, считая на количество первоначально
взятого ацетофенона и не учитывая ацетофенона, выделенного
обратно после перегонки с водяным паром. Из остатков можно
получить небольшое количество ди-(а-фенилэтил)-амина с т. кип.
61— 62° B мм).
Другие методы получения
Обзор методов получения а-фенилэтиламина был приведен
в «Синт. орг. преп.», сб. 2, стр. 525. Там же (стр. 523) детально
описано получение этого амина из ацетофенона и муравьино-
кислого аммония. Приведенная выше методика основана на спо-
способе, который разработали Швёглер и Адкинс1.
1 S с h w о е g 1 е г, Adkins, J. Am. Chem. Soc, 61, 3499 A939).
29 Сборник 3
450
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
CfH6CH2CN +
Р-ФЕНИЛЭТИЛАМИН
A-Фенил-2-аминоэтан )
Никель Ренея
CeH6CH2CH2NH2
Предложили: Дж. Робинсон мл. и X. Снайдер.
Проверили: Н. Дрэйк и Д. Дрейпер.
Получение
В 2-литровый автоклав помещают 1 кг (8,55 моля) чистого
(примечание 1) цианистого бензила и 1 столовую ложку никеля
Ренея (стр. 338). После того как крышка автоклава будет плотно
закреплена, в него вводят сперва 150 мл жидкого аммиака (при-
(примечание 2), а затем такое количество водорода, чтобы давление до-
достигло 140 am. После этого автоклав нагревают до температуры
120—130° и включают качалку. Восстановление заканчивается
менее чем через 1 час (примечание. 1). Автоклав охлаждают,
вскрывают и содержимое его выгружают, после чего автоклав
ополаскивают небольшим количеством эфира. Полученное веще-
вещество и промывную жидкость соединяют вместе и фильтруют,
чтобы освободить от катализатора. Эфир отгоняют и остаток
фракционируют в вакууме. Выход [3-фенилэтиламина с т. кип.
90—93° A5 мм) составляет 860—890 г (83—87% теоретич.; приме-
примечания 3—5).
Примечания
1. Цианистый бензил, который получают согласно методике,
приведенной в «Синт. орг. преп.», сб. 1, стр. 502, следует перегнать
над никелем Ренея. Минимальные следы галоидного соединения
оказывают на катализатор сильное отравляющее действие. Если
по истечении 1 часа восстановление не закончится, содержимое
автоклава следует выгрузить и профильтровать, после чего при-
прибавить к нему свежую порцию катализатора и процесс повторить.
2. Наличие аммиака в смеси, подлежащей восстановлению,
уменьшает количество образующегося вторичного амина. Указа-
Указания, как вводить жидкий аммиак, даны в примечании 1 к мето-
методике получения а-фенилэтиламина (стр. 448).
3. Если приходится проводить несколько опытов, то из остат-
остатков можно выделить небольшое количество вторичного амина.
Температура кипения ди-(р-фенилэтил)-амина равна 155—157°
D мм).
4. Аналогичным образом цианистый н-амил был превращен
в н-гексиламин (т. кип. 128—130°) с выходом 67—70% теорети-
теоретического количества.
5. Было указано (Р. Икке и К- Редемап, частное сообще-
сообщение), что [3-фенилэтиламин, а также многие замещенные C-фенилэтил-
Р-ФЕПИЛЭТИЛАМИН
451
амины могут быть получены с прекрасными выходами каталитиче-
каталитическим восстановлением соответствующих нитрилов в 10 н. растворе
аммиака в метиловом спирте. Для этого применяется следующая
методика. Продажный безводный метиловый спирт насыщают
газообразным аммиаком при 0°; такой раствор и является пример-
примерно 10 н. В автоклав для гидрирования под высоким давлением
помещают раствор 58,5 г @,5 моля) цианистого бензила в 300 мл
10 н. раствора аммиака в метиловом спирте (отношение аммиака
к цианистому бензилу должно быть не ниже 5:1; это необходимо
для того, чтобы свести до минимума образование вторичного
амина), прибавляют туда же 5—10 мл никеля Ренея в качестве
катализатора (стр. 338), после чего укрепляют крышку автоклава
и давление водорода доводят до 35—70 am. Автоклав качают
и поддерживают его содержимое при 100—125° до тех пор, пока
не прекратится поглощение водорода (около 2 час). Затем авто-
автоклав охлаждают, вскрывают и содержимое его выгружают. Опо-
Опорожненный автоклав ополаскивают двумя или тремя порциями
метилового спирта по 100 мл; затем эти порции соединяют вместе
и фильтруют через складчатый фильтр, чтобы освободить от
катализатора. (Внимание! Если катализатор высохнет, то он
может легко воспламениться.) Растворитель и аммиак отгоняют
и остаток фракционируют, применяя небольшой дефлегматор.
Выход р-фенилэтиламина с т. кип. 92—93° A9 мм) [62—63° D мм)]
составляет 51—54,5 г (84—90% теоретич.). Температура плавле-
плавления хлористоводородной соли амина после перекристаллизации
из абсолютного этилового спирта равна 218—219°. С помощью этой
методики из нитрилов были также получены следующие заме-
замещенные р-фенилэтиламины: 3,4-диметоксифенилэтиламин, т. кип.
119—119,5° A мм); о-метилфенилэтиламин, т. кип. 67° @,5 мм);
jw-метилфенилэтиламин, т. кип. 68° B мм); л-метилфенилэтиламин,
т. кип. 71° B мм); 3,4-метилендиоксифенилэтиламин, т. кип. 109°
B мм). Перечисленные амины были получены с высокими выхо-
выходами.
Другие методы получения
[З-Фснилэтиламин был получен с помощью большого числа реак-
реакций, многие из которых не пригодны для препаративных целей.
Ниже приведены только наиболее существенные препаративные
методы. Настоящий способ заимствован у Адкинса1, метод кото-
которого в свою очередь основан на работах Миньонака2, Брауна
с сотрудниками3 и Майля4. Цианистый бензил был превращен
в амин каталитическим восстановлением в присутствии палладия,
осажденного па угле6, палладия, осажденного на сернокислом
барии6, и катализатора Адамса7, а также химическим восстанов-
восстановлением натрием и спиртом8 и цинковой пылью и минеральными
кислотами9. Гидрокоричная кислота была превращена в азид.
452
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
а затем перегруппировкой по Курциусу в fS-фенилэтилймин10;
с успехом была применена также перегруппировка амида гидро-
гидрокоричной кислоты по Гофману11. При восстановлении [3-нитрости-
рола12, фенилтиоацетамида13 и бензоильного производного нитрила
миндальной кислоты14 также образуется [3-фенилэтиламин. По-
Последний был, кроме того, получен расщеплением Ы-(р-фенилэтил)-
фталимида15 гидразином; по способу Дслепина из йодистого [3-фе-
16.
нилэтила и гексаметилентетрамина"; гидролизом соответствую-
соответствующих замещенных уретана
фенилацетальдоксима18.
или мочевины1
восстановлением
* A d k i n s, The Reaction of Hydrogen with Organic Compounds over
Copper-Chromium Oxide and Nickel Catalysts, Univ. of Wisconsin Press,
JVladison, Wis., 1937, pp. 53—54.
3 M i g п о n а с, франц. пат. 638550 [С. А., 23, 154 A929)]; англ. пат.
282038 [С. А., 22, 3668 A928)].
3Braun, Blessing, Zobcl, Bcr., 56, 1988 A923).
4 М a i 1 h e, Bull. soc. chim., D), 23, 237 A918).
s S t г а с к, Schwaneberg, Ber., 65, 710 A932).
«Rosenmund, Pfannkuch, Ber.. 56, 2258 A923).
'Carothers, Jones, J. Am. Chem. Soc, 47, 3051A925).
' Wohl, Berthold, Bcr., 43, 2184 A910).
' Bertilhsej, Ann., 184, 304 A877).
10 S a h, К а о, Science Repts. Natl. Tsing Hua Univ. (A), 3, 525A936)
[C. A., 31, 3889 A937)].
11 M с R a e, V i n i n g, Can. J. Research, 6, 409 A932).
1! Kindlcr, Brandt, Gehlhaar, Ann., 511, 209 A934).
13 Kindler, Ber., 57, 775 A924).
14 H a r t u n g, J. Am. Chem. Soc, 50, 3373 A928).
15 I n g, Manske, J. Chem. Soc, 1926, 2348.
16 G a 1 a t, E 1 i о n, J. Am. Chem. Soc, 61, 3585 A939).
17 С u r t i u s, Jordan, J. prakt. Chem., B), 64, 308 A901).
. 13Bischler, Napieralski, Ber., 26, 1905 A893).
g-ФЕНИЛЭТИЛДИМЕТИЛАМИН
(N ,Ы-Диметилфенэтиламин)
C6H5CH2CH2NH2 + 2HCHO + 2HCOOH
•СН»
-^ C.H5CH,CH2N( +2COa + 2H2O
4CH3
Предложили: P. Икке, Б. Уайзгарвер и Г. Аллее,
Проверили: X. Снайдер и Дж. Саундерс.
Получение
В круглодонную колбу емкостью 500 мл (примечание ^поме-
^помещают при охлаждении проточной водой 51,2 г A моль) 90%-ной
муравьиной кислоты и медленно прибавляют к ней 24,2 г @,2 моля)
р-ФЕНИЛЭТИЛДИМЕТИЛАМИН
453
Р-фенилэтиламина (стр. 450). К полученному прозрачному раство-
раствору приливают 45 мл @,6 моля) раствора формальдегида C7%-ной
концентрации; примечание 2) и вносят в него один небольшой
кусочек битой глиняной тарелки. К колбе присоединяют обрат-
обратный холодильник и устанавливают ее в масляной бане, нагретой
до 90—100°. Через 2 — 3 мин. начинается обильное выделение
углекислого газа. Колбу вынимают из бани и выжидают, пока
выделение газа не станет заметно менее интенсивным A5—20 мин.),
после чего ее вновь помещают в баню и нагревают в течение 8 час.
при 95—100°.
После этого раствор охлаждают, прибавляют к нему 100 мл
4 н. раствора соляной кислоты и выпаривают досуха на водяной
бане в вакууме водоструйного насоса, охлаждая приемник в бане
со льдом. Светложслтый сиропообразный остаток (или кристал-
кристаллическое твердое вещество) растворяют в 60—75 мл воды и выде-
выделяют органическое основание прибавлением 50 мл 18 н. раствора
едкого натра. Верхний (органический) слой отделяют, а нижний
(водный)—экстрагируют двумя порциями бензола по 30 мл. Бен-
Бензольные, вытяжки присоединяют к органическому основанию и все
вместе сушат над 10 г безводного плавленого поташа (примеча-
(примечание 3)i Жидкость переносят в колбу Клайзена емкостью 125 мл
и медленно отгоняют бензол при слегка пониженном давлении;
затем давление снижают еще больше и перегоняют р-фенилэтил-
диметиламин. Выход бесцветного вещества с т. кип. 97—98°
B2 мм) (примечание 4) составляет 22—24,7 г G4—83% теоретич.;
примечание 5).
Примечания
1. Колбу указанного размера применяют потому, что во время
выделения газа раствор имеет тенденцию пениться. При получении
данного амина обычно не наблюдается особенно сильного вспени-
вспенивания, однако оно причиняет значительные затруднения при мети-
метилировании высших алифатических аминов (от дециламина до окта-
дециламина).
2. Был применен продажный формалин фармакопейной чистоты.
Продажный водно-метанольный раствор содержит 37% (по весу)
формальдегида. Иногда его называют 40%-ным формалином, так
как 100 мл раствора содержат 40 г формальдегида.
3. Если полное отделение бензольных вытяжек от водного рас-
раствора затруднительно, то целесообразно предварительно высу-
высушить бензольный раствор над 10 г безводного поташа, а затем
перенести полученную прозрачную жидкость при помощи декан-
декантации в другую колбу, где ео можно досушить над 5 г све-
свежего осушителя. Использованный осушитель ополаскивают бензо-
бензолом A5 — 20 мл) и эту жидкость прибавляют к основному
раствору.
454
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
4. При давлении 6 мм температура кипения [З-феннлэтил-
диметиламина 66—68°. Если препарат перегнать, применяя неболь-
небольшую колонку A2—15 см) с насадкой из одиночных витков
стеклянной спирали, то он будет кипеть в точке при 98° B2 мм).
Выход при использовании колонки оказывается несколько более
низким. Препарат не дает карбиламинной реакции и, следова-
следовательно, не содержит заметных количеств неизмененного первич-
первичного амина.
5- .Описанный способ метилирования вполне пригоден и в слу-
случае других простых первичных и вторичных аминов. Для метили-
метилирования вторичного амина требуется вдвое меньше формальде-
формальдегида, хотя большее его количество ничуть не вредит. Авторы
синтеза получали с. неизменно хорошими выходами бензилдодецил-
метиламин [т. кип. 180—182° D мм)\ из бензилдодециламина и
я-амилгексилдиметиламин [т. кип. 115° A6 мм)] из а-амилгексил-
амина. Имеются указания1 на то, что описанная реакция может
быть успешно применена к метилированию бутиламина, бензил-
амина, тетраметилендиамина, пиперидина и а-фенил-а-амино-
масляной кислоты.
Другие методы получения
Приведенная выше пропись представляет собой видоизменение
метода, который впервые применили Соммелет и Ферранд2, а затем
более полно разработали Кларк, Джиллеспи и Вейсхаус1. р-Фе-
нилэтилдиметиламин был получен из [3-феннлэтиламина алки-
лированием диметилсульфатом3; взаимодействием 8-фенилэтил-
амина и N-метил-р-фенилэтиламина с формальдегидом4; каталити-
каталитическим восстановлением фенилацетонитрила в присутствии ди-
метиламина6; взаимодействием диметиламина с хлористым6"8 и бро-
бромистым8 р-фепилэтилом; взаимодействием фенилацетальдегида
с диметиламином-
1 С 1 a r ke,
55, 4571 A933).
2Sommclct, Ferr
3 J о h n s о n, Guest,
4 Decker, B
s В u с k, В
s В a r g e r,
G i 1 1 е s p i e, W е i s s h a u s, J. Am. Chem. Soc,
nd,
, soc. chim., D), 35, 446 A924).
J. Am. Chcm. Soc, 32, 761
g ,
' Tiffeneau,
8 В г a u n, Ber.,
9 Г
Bull.
, __, .'61 A910).
Becker, Ber., 45, 2404 A912); Ann., 395, 34-1 A913).
a 1 t z 1 y, I d e, .7. Am. Chem. Soc, 60, 1789 A938).
J. Chem. Soc, 95, 2193 A909).
c,
Fuhrer, Bull,
43, 3209 A910).
2 802
soc chim., D), 15, 173 A914).
В г a u n, Be., 43, 3209 A910).
Герм. пат. 291222 [Frdl., 12, 802 A914—1916)].
ФУРИЛАКРИЛОВАЯ КИСЛОТА
455
ФУРИЛАКРИЛОВАЯ КИСЛОТА
B-Фуранакриловая кислота)
КОНДЕНСАЦИЯ ФУРФУРОЛА ПО РЕАКЦИИ ПЕРКИНА
!^ ^L-CHO + CH3CO2K + (CH3COJ О
-СН = СН—СО2К + 2СН3СО2Н
= СНСО2
\п/
- СН = СН—СО2Н + КС1
Предложил: Дж. Джонсон.
Проверили: Р. Шрайнср и К- Стивене.
Получение
В 3-литровую круглодонную колбу, снабженную механической
мешалкой и холодильником длиной 90 см с воздушным охлажде-
охлаждением, помещают 288 г C моля) свежеперегнанного фурфурола,
460 г D25 мл, 4,5 моля) уксусного ангидрида и 294 г C моля) сухого
свежеплавленого и растертого в порошок уксуснокислого калия
(примечание 1). Все вместе тщательно смешивают, после чего пу-
пускают в ход мешалку и колбу нагревают на масляной бане, тем-
температуру которой поддерживают при 150° без перерыва в течение
4 час. (примечание 2). Выделяющиеся через воздушный холо-
холодильник пары уксусной кислоты следует отвести в вытяжной шкаф
или удалить с помощью каких-либо других мер.
После того как реакционная смесь несколько охладится, ее
переносят в большую колбу и обрабатывают 3 500 мл воды. Часть
воды употребляют для ополаскивания реакционной колбы. Затем
смесь кипятят в течение примерно 10 мин. с 30 г активированного
березового угля и в еще горячем состоянии фильтруют с отсасы-
отсасыванием через предварительно подогретую воронку Бюхнера. Фу-
рилакриловая кислота имеет тенденцию к быстрому выделению,
в результате чего иногда забивается фильтр. Фильтрат подкисляют
до кислой реакции на конго, прибавляя к нему раствор концентри-
концентрированной соляной кислоты в воде A : 1). После этого фильтрат
охлаждают до 20° или до более низкой температуры, лучше при
перемешивании, и оставляют стоять в течение не менее 1 часа,
а затем кислоту отфильтровывают с отсасыванием и промывают
небольшим количеством ледяной воды. Выход составляет 270—290 г
{65 — 70% теоретич.). Неочищенная кислота окрашена в светло-
бурый цвет; она плавится при 138—139° (примечание 3).
456
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Примечания
1. Если применять плавленый уксуснокислый натрий, то реак-
реакция протекает медленнее и для проведения ее требуется нагрева-
нагревание в течение 6—8 час.
2. Когда температура бани приближается к 145—150°,наступает
быстрая экзотермическая реакция. Ход ее следует замедлить
(приложив к колбе холодное мокрое полотенце), чтобы избежать
слишком бурного вскипания.
3. Фурилакриловая кислота с т. пл. 138 — 139° пригодна для
большинства целей."Чистая кислота совершенно бесцветна, однако,
чтобы достигнуть такого состояния, препарат требуется несколько
раз перекристаллизовать из бензола или бензиновой фракции
(90—100°) с прибавлением активированного березового угля. По-
Потери достигают около 20—25%; температура плавления перекри-
перекристаллизованного препарата 139—140° (иногда 140—141°).
КОНДЕНСАЦИЯ ФУРФУРОЛА С МАЛОНОВОЙ КИСЛОТОЙ
Нагревание
+ НаС(СО2НJ
BНО Пиридин
ч >-СН = СНСО2Н
+ н2о + сог
Предложили: С. Раджагопалан и П. Роман,
Проверили: К. Гамильтон и Р. Альберта.
Получение
В 1-литровую круглодонную колбу, снабженную обратным
холодильником, помещают 192 г A66 мл, 2 моля) свежеперегнан-
ного фурфурола (примечание 1), 208 г B моля) малоновой кислоты
(примечание 2) и 96 мл A,2 моля) пиридина (примечание 3). Колбу
нагревают в течение 2 час. на кипящей водяной бане, после чего
реакционную смесь охлаждают и добавляют к ней 200 мл воды.
Кислоту растворяют, прибавляя к смеси концентрированный вод-
водный аммиак. Раствор фильтруют через складчатый бумажный
фильтр и промывают последний тремя порциями воды по 80 мл.
Соединенные вместе фильтраты подкисляют при перемешивании
избытком разбавленной A:1) соляной кислоты. Смесь охлаждают
проточной водой и затем оставляют стоять в течение не менее 1 часа
в бане со льдом. Фурилакриловую кислоту отфильтровывают.
ФУРИЛАКРИЛОВАЯ КИСЛОТА
45?'
промывают четырьмя порциями воды по 100 мл и сушат. Выход
вещества, имеющего вид бесцветных игольчатых кристаллов,
составляет 252—254 г (91—92% теоретич.); т. пл. 141°. Если'
требуется более чистая кислота, препарат лучше всего вторично
перекристаллизовать из разбавленного спирта (примечание 4).
При медленном охлаждении из раствора выпадают в осадок иголь-
игольчатые кристаллы с т. пл. 141°.
Примечания
1. Продажный фурфурол был подвергнут однократной перегон-
перегонке; т. кип. 160—161°.
2. Продажную малоновую кислоту сушат в течение 2 час. при
100° и хранят в закупоренной склянке.
3. Продажный пиридин сушат в течение нескольких часов над
едким кали в палочках и затем фильтруют.
4. Удобна следующая методика. Кислоту растворяют в не-
небольшом избытке 50%-ного спирта, раствор кипятят в течение
5—10 мин. с активированным древесным углем E г угля на 100 г
кислоты), а затем фильтруют через складчатый фильтр, пользуясь
предварительно подогретой воронкой. Некоторое количество твер-
твердого вещества, которое выделяется к концу этой операции, пере-
переводят в раствор прибавлением нескольких капель спирта. Остаток
тщательно промывают кипящей водой. После этого горячий раствор
разбавляют холодной водой до тех пор, пока не выпадут в осадок
кристаллы, нагревают все вместе до кипения, медленно охлаждают
и затем на несколько часов помещают в холодильный шкаф. Если-
в последующих синтезах применять для растворения полученные
маточные растворы, то обычные потери,при перекристаллизации
B—3%) снижаются более чем вдвое.
Другие методы получения
Фурилакриловую кислоту обычно получали из фурфурола
по реакции Перкина1. Применение уксуснокислого калия более
предпочтительно, так как в этом случае реакция протекает быст-
быстрее и при относительно более низких температурах. Фурилакри-
Фурилакриловая кислота была также получена конденсацией фурфурола с
малоновой кислотой в присутствии пиридина2 и окислением фур-
фуральацетона белильной известью3.
1 Баеуег, Вег., 10, 357 A877); М а г с k w a I d, там же, 20, 2812'
A887); Gibson, Kahnweiler, Am. Chem. J., 12, 314 A890).
2 D u t t, J. Indian Chem. Soc, 1, 297 A925) [C. A., 19, 2475 A925)):.
Kurien, Pandya, Surange, J. Indian Chem. Soc, 11, 824 A934>
[C. A., 29, 3325 A935)].
3 H u r d, Thomas, J. Am. Chem. Soc, 55, 1646 A933).
458
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ХЛОРАНГИДРИД АЗОБЕНЗОЛКАРБОКОВОЙ КИСлЪты
(Хлорангидрид п-фенилазобензойыой кислоты)
C6HSN = NCeH4CO2H + SOC12 -> CeH5N=NC6H4COCl + HC1 + S02
Предложили: Дж. Кольмэн, Г. Никольс, Ч. Мак-К,лоски и Г. Анспон.
Проверили: В. Бах.чан и Н. Дено.
Получение
В 1-литровую колбу помещают 50 г @,22 моля) перекристалли-
перекристаллизованной азобензолкарбононой кислоты (стр. 8) (примечание 1)
и 50 г @,47 моля) безводного углекислого натрия (примечание 2)
и реагенты тщательно смешивают, встряхивая колбу. К смеси
прибавляют 250 мл C,5 моля) хлористого тионила (примечание 3);
колбу соединяют с обратным холодильником, защищенным хлор-
кальциевой трубкой, и смесь кипятят в течение 1,5 часа (приме-
(примечание 4). Обратный холодильник заменяют холодильником для
перегонки и отгоняют на паровой бане по возможности большее
количество хлористого тионила (примечание 5).
Хлорангидрид растворяют при кипячении с обратным хо-
холодильником в 500 мл бензиновой фракции с т. кип. 90—100° и
горячий раствор сливают с углекислого натрия через складчатый
фильтр. Этот процесс повторяют три раза, применяя по 150 мл
указанного растворителя. Соединенные вместе фильтраты упари-
упаривают до 500 мл, фильтруя их, если это необходимо, и охлаждают
до 0°. Хлорангидрид отфильтровывают на воронке Бюхнера и по
возможности насухо отжимают; затем его дважды промывают
петролейным эфиром (т. кип. 30 — 60°). Препарат сохраняют
в вакуум-эксикаторе над фосфорным ангидридом и парафиновыми
стружками (примечание 6). Выход оранжево-красных кристаллов
с т. пл. 94,5—95,5° составляет 48 г (89% теоретич.).
Примечания
1. Проверявшие синтез нашли, что при использовании 50 г
неперекристаллизованной кислоты выход хлорангидрида с т. пл.
92—94° составляет 45 г. Перекристаллизация этого препарата
из бензиновой фракции A0 мл растворителя на 1 г вещества)
с т. кип. 90—100° приводит к получению 41,5 г оранжево-красных
кристаллов с т. пл. 94,5—95,5°. Общий выход чистого хлор-
ангидрида, считая на неперекристаллизованную кислоту, остается
тем же. Применение неперекристаллизованной кислоты имеет то
преимущество, что объем растворителя, необходимого для пере-
перекристаллизации хлорангидрида, значительно меньше его объема,
необходимого для перекристаллизации кислоты.
ХЛОРАНГИДРИД {З-КАРЕОМЕТОКСИПРОПИОНОВОЙ КИСЛОТЫ 459
2. Использование углекислого натрия в данном случае является
несколько необычным. Имеются указания на то, что этот реагент
предотвращает разложение и осмоление во время реакции.
3. При проверке синтеза был применен продажный хлористый
тионил высшего качества.
4. Кипячение следует проводить либо в вытяжном шкафу, либо
в приборе, снабженном ловушкой для поглощения кислых паров
(«Синт. орг. преп.», сб. 1, стр. 100, рис. 4).
5. Можно выделить обратно около 170 мл хлористого тионила
высокого качества.
6. Бензин упорно удерживается хлорангидридом; для полного
удаления бензина требуется около недели.
Другие методы получения
Хлорангидрид азобензолкарбоновой кислоты был получен дей-
действием хлористого тионила на соответствующую кислоту 1>2.
Приведенный выше метод представляет собой видоизменение спо-
способа, который предложили Ладенбург, Фернхольц и Валлис2.
1 Reich, Biochem. J., 33, 1001 A939).
2Ladenburg, Fernholz, Wallis, J. Org. Chem., 3, 294
1938).
ХЛОРАНГИДРИД р-КАРБОМЕТОКСИПРОПИОНОВОЙ КИСЛОТЫ
СН2СС\ сНзОН СН2СО2СН3 SOC1-. СН2СОаСН3
, I , I
СН2СО,Н СН2СОС1
Предложил: Дж. Кейзон.
Проверили: Ч. Аллен и К. Вильсон.
Получение
Кислый метиловый эфир янтарной кислоты. В 1-литровой кру-
глодонной колбе кипятят с обратным холодильником на паровой
бане смесь 400 г D моля) янтарного ангидрида (примечание 1)
и 194 мл D,8 моля) метилового спирта (примечание 2). Примерно
через 35 мин. смесь начинают часто взбалтывать кругообразным
движением. Взбалтывание продолжают до тех пор, пока смесь
не станет гомогенной (это занимает 15—30 мин.); затем колбу
до половины погружают в паровую баню еще на 25—30 мин. (при-
(примечание 3).
Избыток метилового спирта отгоняют на паровой бане в ва-
вакууме водоструйного насоса, а оставшуюся жидкость переливают
460
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
в фарфоровую чашку диаметром 18—25 см, которую охлаждают
в плоском сосуде с холодной водой. По мере того как происходит
кристаллизация кислого эфира, его перемешивают и соскаблива-
соскабливают со стенок чашки, чтобы предотвратить образование твердой
массы. Вещество сушат до постоянного веса в вакуум-эксикаторе
E—8 дней); выход составляет 502—507 г (95—96% теоретич.).
Температура плавления кислого эфира 57—58° (примечания 4 и 5).
Хлорангидрид ^-карбометоксипропионовой кислоты. В 1-лит-
1-литровую колбу (примечание 6), снабженную обратным холодильни-
холодильником, помещают 264 г B моля) кислого метилового эфира янтарной
кислоты и 290 мл D моля) хлористого тионила (примечание 7)
и в течение 3 час. нагревают раствор на водяной бане при темпе-
температуре 30 — 40° (примечание 8). Затем обратный холодильник
заменяют специальной насадкой Клайзена и избыток хлористого
тионила удаляют в вакууме на паровой бане, после чего перего-
перегоняют хлорангидрид р-карбометоксипропионовой кислоты (приме-
(примечания 9 и 10). Выход бесцветного препарата составляет 270—278 г
(90—93% теоретич.); т. кип. 92—93° {18 мм) (примечания 11 и 12).
Примечания
1. Был применен продажный янтарный ангидрид с г. пл.
115-116°.
2. Был применен синтетический метиловый спирт. Так как без-
безводный препарат гигроскопичен, то спирт, находящийся в не-
неполных склянках, которые в лаборатории неоднократно откры-
открывались, для этого синтеза не пригоден.
3. Если растворение наступило через 15 мин. после начала
взбалтывания, то раствор следует дополнительно прогреть в паро-
паровой бане в течение получаса, если же гомогенный раствор был по-
получен через полчаса после начала взбалтывания, го в бане следует
греть его в течение 25 мин.
Время является весьма существенным фактором. В одном из опы-
опытов, когда смесь нагревали в общей сложности в течение 55 мин.,
титрование показало, что в препарате содержится около 6% ангид-
ангидрида. Более длительное, чем указанное в прописи, нагревание
увеличивает выход димегилового эфира. Всякое изменение в коли-
количествах исходных веществ может привести к необходимости искать
для получения максимального выхода новых условий работы.
4. Проверявшие синтез предпочитали пользоваться изложен-
изложенным ниже методом, при помощи которого синтез можно провести
в один день. На паровой бане нагревают суспензию примерно
половины полученного количества сырого вещества в 750 мл серо-
сероуглерода; образуются два слоя, в которых некоторая доля твер-
твердого вещества остается во взвешенном состоянии. Его растворяют
прибавлением 350 мл эфира. Все вместе охлаждают до 0° и выде-
ХЛОРАНГИДРИД р-КАРВОМЕТОКСИПРОПИОНОВОЙ КИСЛОТЫ 461
лившееся твердое вещество отфильтровывают с отсасыванием.
Затем в полученном фильтрате растворяют вторую половину
сырого препарата, раствор вновь охлаждают до 0° и твердое веще-
вещество отфильтровывают. Вес обеих порций моноэфира с т. пл.
57—58° составляют 438—449 г (83—85% теоретич.). Если фильтрат
упарить до половины его объема и охладить до 0°, то можно полу-
получить еще 32—37 г F—7%) менее чистого препарата с т. пл. 56—57°.
5. Полученное вещество достаточно чисто для применения в
следующей стадии; оно содержит не менее 98% кислого метилового
эфира янтарной кислоты, как это следует из данных титрования
и из результатов перегонки при использовании колонки Подбель-
няка высотой 45 см.
6. Прибор должен быть собран па шлифах.
7. Был применен продажный хлористый тионил с т. кип.
75—76°. Проверявшие синтез получили такой же выход хлор-
ангидрида, используя хлористый гионил с избытком только в 20%.
Смесь нагревали в течение 1 часа при 403, оставляли стоять.
в течение ночи и снова нагревали в течение 2 час. при 40°.
8. Так как во время реакции выделяется хлористый водород,
то рекомендуется проводить работу в вытяжном шкафу или поль-
пользоваться ловушкой для поглощения газов. («Синт. орг. преп.»,
сб. 2, стр. 78, рис. 3).
9. Удобно применить рубашку с электрическим обогревом.
10. Температура кипения при других давлениях: 85,5—87°
A3 мм); 89—90° A5 мм). Рекомендуется работать при возможно
более низком давлении, так как вещество имеет тенденцию отще-
отщеплять хлористый метил с образованием янтарного ангидрида.
11. Авторы синтеза получили тот же выход при замене хлори-
хлористого тионила на пятихлористый фосфор. При использовании
последнего воспроизводимые результаты получались только в том
случае, если хлорангидрид был перегнан при давлении ниже 3 мм
(г. кип. 58—59° B,5 мм)]
12. Кислый этиловый эфир адипиповой кислоты и кислый эти-
этиловый эфир себациновой кислоты можно превратить в хлорангид-
риды соответствующих карбэтоксикислот с помощью того же метода
и примерно с. теми же выходами. Перегонку следует вести быстро
и при давлении 4 мм или при еще более низком.
Другие методы получения
Кислый метиловый эфир янтарной кислоты был получен нагре-
нагреванием янтарной кислоты с диметиловым эфиром янтарной кисло-
кислоты1; действием на диэтиловый эфир янтарной кислоты метилатом
натрия2; нагреванием янтарного ангидрида с метиловым спиртом 3~6.
Хлорангидрид ^-карбометоксипропионовой кислоты был полу-
получен из кислого метилового эфира янтарной кислоты при действии
на него хлористого тионила5 или пятихлористого фосфора4.
462
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
1 F о u г п е а и, Sabetay, Bull. soc. chim., D), 45, 841 A929).
2 Komnenos, Monatsh., 32, 77 A911).
'Bone, Sudborough, Sprankling, J. Chem. Soc, 85,
539 A904).
* С a s о n, J. Am. Chem. Soc, 64, 1107 A942).
3 Ruggli, M a e d e r, Helv. Chim. Ada, 25, 943 A942).
ХЛОРАНГИДРИД 2,4,6-ТРИМЕТИЛБЕНЗОЙНОЙ КИСЛОТЫ
(Хлорангидрид мезитилёнкарбоновой кислоты; хлорангидрид
^-изодуриловой кислоты)
СН8
4MgBr CO2 /Vo2MgBr Hzo
—> >-
,сн3 нДх ]!сн3
сн2
Н8С
сн3
¦\/
сн.
НС1
сн,
СНо
н,о
СО2Н soci2
V
сн,
н3с!
С0С1
¦сн.
Предложил: Р. Барнес.
Проверили: Н. Дрзйк и Р. Мозинго
Получение
В 2-литровую трехгорлую колбу, снабженную защищенным
хлоркальциевой трубкой холодильником, капельной воронкой и
мешалкой с затвором, помещают 24,3 г A грамматома) магниевых
стружек, кристаллик иода, абсолютный эфир в количестве, доста-
достаточном для того, чтобы покрыть магний, и 10 г @,05 моля) бром-
броммезитилена («Синт. орг. преп.», сб. 2, стр. 118). Дно колбы нагре-
нагревают рукой или теплым полотенцем, пока не начнется реакция.
Затем смесь слабо перемешивают и постепенно прибавляют к ней
раствор 190 г @,95 моля) броммезитилена в 500 г G00 мл) абсолют-
абсолютного эфира. Когда весь эфирный раствор будет прибавлен, реак-
реакционную смесь кипятят с обратным холодильником до тех пор, по-
пока не растворится весь магний, на что требуется около 2 час. После
этого, энергично перемешивая смесь, медленно прибавляют к пей
небольшими кусками значительный избыток твердой углекислоты
(примечание 1). Полученную густую массу разлагают; для этого
его приливают при перемешивании к большому количеству мелко-
наколотого льда, к которому прибавлено 100 мл A,2 моля) кон-
концентрированной соляной кислоты. Эфир отгоняют, а оставшуюся
маслянистую затвердевшую массу отфильтровывают и растворяют
в 200—400 мл горячего метилового спирта; раствор фильтруют
ХЛОРАНГИДРИД 2,4,6-ТРИМЕТИЛБЕНЗОЙНОЙ КИСЛОТЫ
463
и кислоту осаждают добавлением 1 л ледяной воды. Неочищенная
2,4,6-триметилбензойная кислота плавится между 135 и 148°;
количество ее составляет ПО—120 г. Кислоту перекристаллизо-
вывают из петролейного эфира (т. кип. 90—100°), причем на 1 г
неочищенной кислоты берут 10 мл растворителя. После одной
перекристаллизации получают 90—100 г вещества E5—61 ?о теоре-
тич.; примечание 2) с т. пл. 150—152°.
Берут широкогорлую колбу Клайзена емкостью 500 мл, закры-
закрывают ее боковой отвод и примыкающее к нему горло, а во второе
горло вставляют обратный холодильник, защищенный хлоркаль-
циевой трубкой. В колбу помещают 90 г @,55 моля) 2,4,6-
триметилбензойной кислоты и 100 г F3 мл, 0,84 моля) хлористого
тионила и поддерживают слабое кипение смеси до тех пор, пока
не прекратится выделение сернистого ангидрида и хлористого
водорода (примечание 3). Избыток хлористого тионила отгоняют
при атмосферном давлении, а оставшийся в колбе хлорангидрид
перегоняют при 143—146° F0 мм) (примечание 4). Выход состав-
составляет 90—97 г (90—97% теоретич.).
Примечания
1. Чтобы карбоксилировать реактив Гриньяра, можно также
медленно вылить его на сухой лед, находящийся в стакане емко-
емкостью 2 л. Выход в этом случае не изменяется.
2. Можно выделить еще небольшое количество 2,4,6-триметил-
бензойной кислоты, если упарить фильтрат до небольшого объема
и затем его охладить.
3. На это требуется 1—2 часа. Реакционную смесь можно также
оставить на ночь при комнатной температуре; в этом случае
ее можно не нагревать.
4. Температура кипения может быть различной в зависимости
от скорости перегонки.
Другие методы получения
2,4,6-Триметилбензойная кислота была получена гидролизом ее
амида, который был синтезирован из мезитилена, хлорангидрида
карбаминовой кислоты и хлористого алюминия в среде сероугле-
сероуглерода1. Она была получена также нагреванием изодурола с раз-
разбавленной азотной кислотой 2>3. С небольшими выходами 2,4,6-
триметилбензойная кислота была получена при перегонке 2,4,6-
триметилминдальной кислоты4; при сухой перегонке 2,4,6-три-
метилфенилглиоксиловой кислоты4'5; окислением 2,4,6-триметил-
фенилглиоксиловой кислоты марганцовокислым калием6; дей-
действием на 2,4,6-триметилфзнилглиоксиловую кислоту концентри-
концентрированной серной кислотой при нагревании7 или на холоду8.
464
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Получение кислоты из бромистого 2,4,6-триметилфенилмагния при
действии па него газообразной кислоты уже описано в литературе9.
Методика получения хлорангидрида является общей для син-
синтеза хлорангидридов ароматических кислот с помощью хлористого
тионила10; эта методика была применена и для получения хлоран-
.гидрида 2,4,6-триметилбепзойной кислоты9.
1 М i с h а е 1, О е с h s I i n, Ber., 42, 317 A909).
1 Jannascli, Weiler, Ber., 27, 3441 A894).
3Jacobsen, Ber., 15, 1853 A882).
4 Meyer, M о 1 z, Ber., 30, 1270 A897).
0 Fei t h, Ber., 24, 3542 A891).
6 С 1 a u s, J. prakt. Chem. B), 41, 506 A890).
'Van Scherpenzeel, Rec. trav. chim., 19, 377 A900).
"Iloogewerff, van Dorp, Rec. trav. chim., 21, 349 A902).
s К о h 1 с г, В a 1 t z 1 у, J. Am. Chem. Soc, 54, 4015 A932).
Jo Meyer, Monatsh., 22, 415 A901).
СНСО
г
ХЛОРАНГИДРИД ФУМАРОВОЙ КИСЛОТЫ
(Хлористый фумарил)
СНСОС1
О + С6Н4 (СОС1)а >¦ С1СОСН
С6Н
/со\
О
СНСО'
Предложил: Л. Киридес.
Проверили; Ч. Аллен и Ф. Пингерт.
Получение
Смесь 98 г A моль) малеинового ангидрида ст. пл. 52—54°,
240 г продажного хлорангидрида фталевои кислоты (примечание 1)
и 2 г безводного хлористого цинка помещают в трехгорлую кругло-
донную колбу емкостью 500 мл. Последнюю снабжают термометром,
шарик которого должен быть погружен в жидкость и почти дохо-
доходить до дна, и эффективным дефлегматором (примечания 2—4). К бо-
боковому отводу дефлегматора присоединяют охлаждаемую водой
перегонную колбу емкостью 500 мл, которая служит приемником.
Реакционную смесь нагревают в течение 2 час. на масляной ба-
бане (температура реакционной смеси 130—135°), стараясь избегать
перегрева (примечание 5), а затем дают ей охладиться до 90—95°.
Хлорангидрид фумаровой кислоты как можно быстрее отгоняют
B0 мин.) и собирают фракцию, кипящую в пределах 25° [60—85°
A3—14 лш)]. Эту фракцию подвергают повторной перегонке (мед-
(медленно, в течение 1 часа) и собирают погон, кипящий в пределах
2° [62—64° A3 мм); примечание 6°]. Выход вещества составляет
125—143 г (82—95% теоретич.; примечания 7 и 8).
ХЛОРАНГИДРИД ФУМАРОВОЙ КИСЛОТЫ
465
«5
Примечания
1. Продажный хлор-
ангидрид фталевои кисло-
кислоты содержит около 94%
хлорангидрида и немного
фталевого ангидрида.Ука-
ангидрида.Указанное выше количество
хлорангидрида соответ-
соответствует небольшому из-
избытку по сравнению с тео-
теоретически необходимым.
2. Проверявшие син-
синтез применяли специаль-
специальный дефлегматор Видме-
ра1 (рис. 20), который ис-
используется во многих ла-
лабораториях органической
химии, но не был описан
в литературе. При про-
проверке применяли также
елочный дефлегматор (вы-
(высота эффективной части
50 см, внутренний диа-
диаметр 2,7 см); в этом слу-
случае первая перегонка за-
занимала 90 мин., а выход
составлял 82—83%. Ко-
Конечная температура реак-
реакционной смеси и наблю-
наблюдаемая температура кипе-
кипения зависят от типа при-
применяемого прибора.
3. Приведенная выше
методика была также про-
проверена с применением рек-
ректификационной колонки
высотой 30 см с внутрен-
внутренним диаметром 1,5 см и
с насадкой из стеклян-
стеклянных колец Вильсона2; колонка была снабжена обычной рубаш-
рубашкой для электрообогрева. Перегонка продолжалась 3 часа. При
использовании такой колонки в результате одной перегонки был
получен препарат, достаточно чистый для большинства целей.
Колонка примерно тех же размеров с наколкой, но без насадки
дала неудовлетворительные результаты (проверил Н. Дрэйк).
30 СОорпш; 3
оа
о,зЛ
24
3,4
t
\
2,6
J_
1
Рис. 20. А —четыре отверстия диаметром
0,6 см. Все размеры даны в сантиметрах.
466
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
4. В приведенном синтезе во всех приборах применяются
резиновые пробки. Соединения на шлифах хотя и удобны, но
не обязательны. Третье горло используют в тех случаях, когда
хлорангидриды получают из соответствующих кислот (см. при-
примечание 9).
5. При температуре выше 135° реакцию трудно регулировать;
в результате этого происходит разложение, что приводит к замет-
заметному снижению выхода. Поэтому не следует глубоко погружать кол-
колбу в масляную баню (ее следует погрузить примерно на одну треть
глубины слоя жидкости).
6. При использовании некоторых образцов хлорангидрида
фталевой кислоты вследствие присутствия в веществе неизвестных
примесей первые несколько капель дестиллата оказываются окра-
окрашенными в красноватый цвет. В тех случаях, когда приходилось
прерывать перегонку и впускать в систему воздух, было замечено,
что при возобновлении операции наблюдается аналогичное
явление.
7. Обычно получаемый выход ближе к 95%. Проверявшие син-
синтез применяли пятикратное количество исходных реагентов и
использовали 3-литровую колбу. Первая перегонка продолжалась
в течение 1 часа, а конечная — в течение 3 час.
8. Хлорангидрид фумаровой кислоты лучше всего хранить в за-
запаянных стеклянных ампулах. Для кратковременного хранения
можно пользоваться склянками, закрытыми резиновыми пробками,
не содержащими серы. Склянки с притертыми пробками непригод-
непригодны, так как последние в результате гидролиза хлорангидрида
«заедаются».
9. Согласно указаниям авторов, исходя из хлорангидрида фта-
фталевой кислоты A моль хлорангидрида на 1 моль одноосновной
кислоты и 2 моля хлорангидрида на 1 моль двухосновной кислоты),
можно получать с выходом порядка 95% и другие хлорангидриды.
При взаимодействии большинства кислот и их ангидридов с хлор-
ангидридом фталевой кислоты применение хлористого цинка
в качестве катализатора не является обязательным. Если исходить
из кислот, то лучше всего прибавлять один из компонентов мед-
медленно, чтобы при нагревании избежать слишком бурного выделе-
выделения хлористого водорода.
Другие методы получения
Хлорангидрид фумаровой кислоты был получен из фумаровой
кислоты и хлорангидрида фталевой кислоты3; из малеиновой
кислоты действием на нее хлористого тионила в присутствии
хлористого цинка; взаимодействием малеинового ангидрида
с хлорангидридом фталевой кислоты в присутствии хлористого
цинка4.
о-ХЛОРБРОМБЕНЗОЛ
467
1 Widmcr, Helv. Chim. Acta, 7, 59 A927).
! Wi lson, Parker, Laughlin, J. Am. Chem. Soc, 55, 2795
A933).
3 Van Dorp, Van Dorp, Rec. trav. chim., 25, 96 AS06).
4 К у ri d e s, J. Am. Chem. Soc, 59, 207 A937).
о-ХЛОРБРОМБЕНЗОЛ
A' -Хлор-2-бромбензол )
+ 2HBr+NaNO2
Cl
+ NaBr+2H2O
AN.
,Br
CuBr
Cl
Br
Cl
Na + CuBr
Предложил: Дж. Хартвелл.
Проверили: X. Снайдер и 3. У икс, мл.
Получение
В 2-литровую колбу помещают смесь 127,5 г A моль) продаж-
продажного о-х лор анилина высокого качества и 300 мл B,5 моля)
48%-ной бромистоводородной кислоты (примечание 1). Колбу уста-,
навливают в бане со льдом и, прибавляя к содержимому колбы лед,
охлаждают его до 0°. Затем к смеси быстро приливают при переме-
перемешивании раствор 70 г A моль) нитрита натрия в 125 мл воды, причем
температуру смеси поддерживают ниже 10°, прибавляя к ней не-
небольшие кусочки льда. Когда останется около 5 мл раствора нитри-
нитрита натрия, дальнейшее прибавление производят с осторожностью
и продолжают его до тех пор, пока в растворе не будет обнаружен
избыток азотистой кислоты (примечание 2).
Одновременно смесь 79 г @,55 моля) бромистой меди (примеча-
(примечание 3) и 80 мл @,6 моля) 48%-ной бромистоводородной кислоты
(примечание 1) нагревают до кипения в 5-литровой круглодонной
трехгорлой колбе, снабженной обращенным вниз холодильником,
к которому в качестве приемника присоединена 2-литровая колба,
трубкой для ввода пара, которая перекрывается винтовым зажи-
зажимом, и делительной воронкой. Примерно одну четвертую часть
раствора диазония переносят, не фильтруя, в делительную воронку,
и немедленно приливают к раствору бромистой меди в бромистово-
бромистоводородной кислоте, который нагревают до кипения на голом пла-
пламени горелки. Приливание ведут с1 такой скоростью, чтобы кипе-
кипение было непрерывным. Когда п делительной воронке останется не-
небольшое количество реагента, в нее переносят следующую порцию
30*
468
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
холодного раствора диазония, не прерывая прибавления его к бро-
бромистой меди. Весь раствор диазония прибавляют таким образом
в продолжение получаса; в течение этого времени большая часть
вещества перегоняется с водяным паром. Когда прибавление
будет закончено, край делительной воронки закрывают, откры-
открывают винтовой зажим на паропроводе и в смесь пропускают сильную
струю водяного пара до тех пор, пока не перестанет перегоняться
органическое вещество. Всего собирают около 1 000—1 500 мл
дестиллата.
От дестиллата отделяют тяжелый слой органического веще-
вещества и промывают его концентрированной серной кислотой порция-
порциями по 10 мл до тех пор, пока кислота не начнет при этом лишь
слабо окрашиваться; обычно бывает достаточно повторить промы-
промывание, четыре раза. После этого полученную маслянистую жидкость
промывают один раз водой порцией в 100 мл, два раза 5%-ным
водным раствором едкого натра порциями по 50 мл и, наконец, еще
один раз водой A00 мл). Полученное вещество сушат над 3 г хло-
хлористого кальция и перегоняют из колбы емкостью 250 мл. Выход
чистого бесцветного о-хлорбромбензола с т. кии. 199—201° G42 мм)
составляет 170—183 г (89—95% теоретич.; примечания 4 и 5).
Примечания
1. Если применять как при диазотировании, так и в реакции
Зандмейера 40%-ную бромистоводородную кислоту, то выход
достигает только 75%.
2. При соприкосновении с иодокрахмальной бумажкой свобод-
свободная азотистая кислота немедленно вызывает синее окрашивание.
Постепенное появление окраски или окраска по периферии смо-
смоченной площади не имеют значения. В течение всего времени про-
проведения реакции необходимо наличие избытка минеральной кисло-
кислоты (синее окрашивание красной бумажки конго).
3. Авторы синтеза применяли продажную бромистую медь.
При проверке синтеза бромистую медь получали растворением
600 г B,4 моля) продажной кристаллической сернокислой окиси
меди и 350 г C,4 моля) бромистого натрия в 2i теплой воды;
к этому раствору в течение 10 мин. при перемешивании прибав-
прибавляли 151 г A,2 моля) твердого сернистокислого натрия. Иногда
приходилось добавлять еще некоторое количество этой соли,
чтобы обесцветить раствор, окрашенный в голубой цвет. Затем
смесь охлаждали, твердый осадок отфильтровывали на воронке
Бюхнера диаметром 20 см, промывали один раз водой, отжимали
почти досуха и сушили в течение ночи на воздухе. Выход бромистой
меди составлял 320 г (93% теоретич.).
4. Синтез с утроенными количествами указанных выше реаген-
реагентов дает соответственно пропорциональный выход.
ш-ХЛОРИЗОНИТРОЗОАЦВТОФВНОН
469
5. При проверке настоящего синтеза по этой же методике-
были получены следующие бромиды: .w-хлорбромбензол (т. кип.
191 —194°) из ж-хлоранилина с выходом 91—94% теоретического
количества; ж-дибромбензол (т. кип. 215—217°) из л-броманилина
с выходом 80—87% теоретического количества; о-броманизол
[т. кип. 114—116° B9 мм)] из о-апизидина с выходом 88—93%
теоретического количества. При получении о-броманизола про-
промывание серной кислотой не производилось.
Другие методы получения
о-Хлорброыбензол был получен диазотированием о-броманили-
на с последующим замещением группы диазония на хлор1; элими-
элиминированием аминогруппы в З-хлор-4-броманилине2; хлорированием
бромбензола в присутствии однохлористого таллия3, хлористого
алюминия* или хлорного железа*; бромированием хлорбензола без
катализатора6 или в присутствии алюминия4, железа4 или
бромного железа5; диазотированием о-хлоранилина с последую-
последующим замещением группы диазония на бром4-6; действием брома
на хлористую о-хлорфенилртуть7.
1 D о b b i e, Marsden, J. Chem. Soc, 73, 254 A898).
2 \V h e e 1 e r, Valentine, Am. Chcm. J., 22, 266 A899).
3 T h о m a s, Compt. rend., 144, 33 A907).
4 Van der Linden, Rec. trav. chim., 30, 305 A911).
5 Van Loon, W i b a u t, Rec. trav. chim., 56, 815 A937).
о N a r b u t t, Ber., 52, 1028 A919).
7 H a n k e, J. Am. Chem. Soc, 45, 1321 A923).
«-ХЛОРИЗОНИТРОЗОАЦЕТОФЕНОН
(Оксим хлорангидрида фенилглиоксиловой кислоты)
TTCl
C6H5COCH2C1 + k-C4H9ONO > C,H5COC (NOH) Cl + «-CtH9OH
Предложили: Н. Левин и В. Хартуме.
Проверили: Ч. Аллея и Дж. ВанАллан,.
Получение
Круглодонную трехгорлую колбу емкостью 500 мл снабжают
небольшой капельной воронкой, механической мешалкой с жид-
жидкостным затвором, обратным холодильником, соединенным с ло-
ловушкой для поглощения газов, и трубкой для поступления хло-
хлористого водорода, которая должна доходить до дна колбы.
В реакционную колбу помещают 15,4 г @,1 моля) хлористого
фенацила (примечание 1) и 100 мл абсолютного эфира. Пускают
в ход мешалку и после того, как твердое вещество растворится,
в смесь начинают пропускать со скоростью 2—3 пузырьков в се-
секунду безводный хлористый водород (примечание 2). Затем из
¦470
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
капельной воронки порциями от 0,5 до 1,0 мл к смеси приливают
10,3 г A1,8 мл, 0,1 моля) свежеперсгнанного я-бутилнитрита1
(примечание 3). После прибавления первой порции нитрита реак-
реакционная смесь окрашивается в оранжево-бурый, а через несколько
минут — в светложелтый цвет; затем прибавляют вторую порцию
нитрита, что сопровождается аналогичным изменением цвета реак-
реакционной массы; после этого прибавляют третью порцию; таким же
образом прибавляют и остальные порции, пока весь бутилнитрит
не будет перенесен в колбу. Реакционная смесь разогревается,
и начинается слабое кипение эфира (примечание 4). После того
как весь нитрит будет прибавлен (на что требуется около полу-
получаса), перемешивание и пропускание хлористого водорода продол-
продолжают в течение еще 15 минут. На этой стадии раствор практически
перестает кипеть и принимает оранжевую окраску.
Реакционную смесь оставляют стоять в течение 1—2 час. (или
на всю ночь, если это более удобно), после чего раствор при-
принимает бледножелтую окраску и становится прозрачным. Затем
обратный холодильник заменяют на обращенный вниз, переме-
перемешивание возобновляют и растворитель отгоняют на паровой бане
(примечание 5). После того как почти весь эфир будет отогнан,
перегонку продолжают в вакууме D0—50 мм) до тех пор, пока не
прекратится кристаллизация. Остаток, состоящий из желтых кри-
кристаллов неочищенного вещества, помещают в вакуум-эксикатор
с концентрированной серной кислотой, натронной известью и без-
безводным хлористым кальцием; препарат оставляют в эксикаторе до
тех пор, пока он не высохнет (примечание 6).
Высушенное вещество перекристаллизовывают из 30—35 'мл
кипящей смеси бензола и четыреххлористого углерода (примеча-
(примечание 7), взятых в отношении 1 : 3. Выход белоснежных кристаллов
составляет 15—15,7 г (82—86% теоретич.); перекристаллизо-
перекристаллизованное вещество плавится при 131—132° и достаточно чисто для
синтетических целей. После второй перекристаллизации полу-
получается препарат с т. пл. 132—133° (примечания 8 и 9),
Примечания
1. Можно применять продажный хлористый фенацил; при отсут-
отсутствии этого препарата его получают с выходом 85—88% теоретиче-
теоретического количества по реакции Фриделя—Крафтса, исходя из 234 г
B65 мл, 3 моля) абсолютного бензола и 79,5 г E3 мл, 0,70 моля)
хлорангидрида хлоруксусной кислоты, в присутствии 103 г
@,77 моля) порошкообразного безводного хлористого алюминия;
температура кипения полученного хлористого фенацила 122—125°
D мм); т. пл. 56—57°. Хлористый фенацил является сильным
лакриматором и отравляющим веществом нарывного действия.
При обращении с ним необходимо соблюдать осторожность.
ш-ХЛОРИЗОНИТРОЗОАЦЕТОФЕНОН
471
2. Хлористый водород может быть взят из баллона.
3. Можно воспользоваться любым алкилнитритом. Авторы син-
синтеза предпочитали применять изопропилнитрит, так как вслед-
вследствие низкой температуры кипения образующегося изопропило-
вого спирта его легче удалить.
Изопропилнитрит может быть получен согласно методике, при-
приведенной при описании получения я-бутилнитрита1.
Смесь 147 г (80 мл, 1,5 моля) концентрированной серной кислоты
(уд. вес 1,84), 60 мл воды и 180 г B30 мл, 3 моля) 97%-иого изопро-
пилового спирта, предварительно охлажденную до 0°, приливают
к раствору 227,7 з C,3 моля) 97%-ного нитрита натрия в 1 л воды,
охлажденному до—5°. Прибавление спиртового раствора занимает
около 2 час, в течение которых температуру реакционной массы
поддерживают в пределах от —2 до 0°. Вещество можно выделить
и очистить так, как это указано для бутилнитрита. Полученный
препарат сушат над 15—20 г безводного сернокислого натрия;
затем нитрит перегоняют на паровой бане с дефлегматором высотой
20 см. Практически весь изопропилнитрит перегоняется при
39—40° G45 мм) в виде бледножелтого масла; выход составляет 191 г
G1,4% теоретич.). Изопропилнитрит при хранении в холодильном
шкафу оказался значительно более стойким, чем бутилнитрит.
При проверке этого синтеза был применен я-бутилнитрит, ко-
который имеется в продаже; при удалении я-бутилового спирта за-
затруднений не встречалось.
4. Скорость перемешивания необходимо сохранять постоянной,
так как внезапное увеличение ее может вызвать нежелательное
резкое усиление кипения эфира. Скорость прибавления нитрита
также следует соразмерять с интенсивностью кипения эфира.
5. Выделенный обратно эфир можно использовать в качестве
растворителя в следующих опытах без дополнительной очистки.
6. (о-Хлоризонитрозоацетофенон хорошо растворим в бутило-
бутиловом спирте, а потому до перекристаллизации неочищенного веще-
вещества спирт следует отогнать по возможности полностью.
7. Удобнее всего сперва растворить препарат в бензоле, а затем
разбавить раствор четыреххлористым углеродом.
8. Эта методика вполне пригодна и при проведении синтеза с
количествами исходных веществ, в пять раз превышающими ука-
указанные выше.
9. Описанная здесь методика с небольшими изменениями может
быть применена к получению различных замещенных в ядре хло-
хлористых фенацилов. Выходы колеблются от 74 до 92%2>8.
Другие методы получения
Изложенная выше пропись2 разработана по образцу методики,
приведенной при описании нитрозирования арилэтилкетонов4'5.
472
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
м-Хлоризонитрозоацетофенон был получен хлорированием изо-
нитрозоацстофснона6-8; действием на аммонийную соль ш-нитро-
ацетофенона безводным хлористым водородом9 или кипячением
с обратным холодильником ю-нитроацетофенона с разбавленным
спиртовым раствором хлористого водорода10; нитрозохлорирова-
нием ацетофенона хлористым нитрозилом11. В литературе описано
также выделение небольших количеств ю-хлоризонитрозоацето-
фенона из продукта реакции, полученного при нитрозировании
ацетофенона в присутствии хлористого водорода12-13.
1 Н о й е с, Синт. орг. преп., сб. 2, стр. 131.
2 Levin, Диссертация, University of Maryland, 1941.
Levin, H a r t u n g, J. Org. Chem., 7, 408 'A942).
* H a r t u n g, Munch, J. Am. Chem. Soc, 51, 2264 A929).
J X a p т у н г, Кроссли, Синт. орг. прсп., сб. 2 стр 264
6Claisen, Manas s e, Ann., 274, 95 A893).
7 Р о n z i о, Chafrier, Gazz. chim. ital., B), 37 65 A907)
8 P о n z i o, Gazz. chim. ital., 61, 946 A931).
9 S t e i n k о р f, Jurgens, J. prakt. Chem., B), 84, 712 A911).
10 Якубович, J. prakt. Chem., 142, 46 A935).
11 R h e i n b о 1 d t, Schmitz-Dumont, Ann., 444 125 A925)
12 С 1 a i s e n, Ber., 20, 252 A887).
13 С 1 a i s с n, Manasse, Ber., 22, 526 A889).
ХЛОРИСТОВОДОРОДНЫЙ 4-МЕТИЛОЛИМИДАЗОЛ
(Хлористоводородный 4-имидазолилкарбинол)
CH2OH
I
со
I
(СНОНK
I
СН2ОН
СНаОН
СН2ОН
СН2О, NH3, O2
CuCO3-Cu(OHJ
HCI
NH —
NH —
НС1
Предложили; Дж. Тоттер и У. Дарби.
Проверили: X. Снайдер и Р. Роулэнд.
Получение
Пикрат метилолимидазола. В 5-литровую колбу помещают 222 г
A моль)основной углекислой меди (примечание 1) и приливают
к ней 1 500 мл дестиллированной воды и 720 г (800 мл, 12 молей)
28%-юго аммиака. Большую часть углекислой меди переводят
в раствор, взбалтывая смесь кругообразным движением; затем
к содержимому колбы прибавляют 112 г A00 мл, 1,3—1,4 моля)
37—40%-ного формалина и 90 г @,475 моля) продажной 95%-ной
фруктозы. Раствор тщательно перемешивают, помещают на паро-
паровую баню в вытяжном шкафу и нагревают в течение получаса,
время от времени взбалтывая; после этого, пропуская через раствор
ХЛОРИСТОВОДОРОДНЫЙ 4-МЕТИЛОЛИМИДАЗОЛ
473
слабый ток воздуха E00—600 мл в минуту), продолжают нагре-
нагревание в течение еще 2 час. (примечания 2 и 3).
Смесь охлаждают в бане со льдом в течение не менее 3 час,
после чего отфильтровывают оливково-бурый осадок плохо рас-
растворимого медного комплекса производных имидазола. Осадок про-
промывают 500 мл холодной воды, суспендируют еще во влажном состо-
состоянии (примечание 4) в 1 л воды и добавлением концентрирован-
концентрированной соляной кислоты (около 40 мл ) подкисляют до слабо кислой
реакции на лакмус. Затем при частом взбалтывании через суспен-
суспензию пропускают сероводород до полного осаждения меди
B—3 часа). После этого осадок отфильтровывают и экстрагируют
500 мл горячей воды в два или три приема. Соединенные вместе
прозрачный светлобурый или красновато-бурый фильтрат и про-
промывные воды кипятят в течение 15 мин.; затем к раствору при
перемешивании прибавляют 60 г @,26 моля) пикриновой кислоты.
Нагревание продолжают до полного ее растворения.
Выпавшие в осадок при охлаждении раствора до комнатной
температуры зеленовато-желтые пластинки отфильтровывают,,
промывают три раза водой порциями по 150—200 мл и сушат на
воздухе. Фильтрат и первую порцию использованной для промы-
промывания воды соединяют вместе и нагревают, прибавляя к раствору
10 г пикриновой кислоты; затем смесь охлаждают и фильтруют.
Этот процесс повторяют, применяя каждый раз по 10 г пикрино-
пикриновой кислоты, до тех пор, пока получаемый таким образом пикрат
не будет плавиться ниже 195° (примечание 5).
Пикрат порций, в которых температура плавления его выше
200° (примечание 5), соединяют вместе и перекристаллизовывают
из воды, причем на каждые 30 г кристаллов берут 700 мл воды.
Смесь кипятят в покрытом стакане до растворения кристаллов,
обрабатывают раствор активированным древесным углем и филь-
фильтруют через воронку с обогревом. Кристаллы выпадают в осадок
при малейшем охлаждении. Желтые иглы (иногда пластинки),
выпавшие в осадок после охлаждения раствора, отфильтровывают,
промывают и сушат на воздухе; препарат плавится при 204° или
выше (с разложением; примечание 5). Пикрат порций, в которых
он плавится в пределах 195—200° (примечание 5), перекристал-
перекристаллизовывают таким же образом до тех пор, пока температура
плавления вещества не достигнет 203°. Выход неочищенного
пикрата составляет 95—100 г F1—64% теоретич.). Выход пере-
перекристаллизованного препарата равен 84—94гE4—60% теоретич.;
примечание 6). Температура плавления вещества зависит от
скорости нагревания и колеблется между 203,5 и 206°, причем
вещество плавится с разложением (примечание 5).
Хлористоводородный 4-метилолимидазол. В 2-литровую кругло-
донную колбу помещают 120 г A00 мл, 1,2 моля) 37%-ной соля-
соляной кислоты, 250 мл воды и 500 мл бензола, а затем погружают
474
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ее в водяную баню, температуру которой поддерживают при 80°.
К смеси прибавляют 100 г @,306 моля) чистого пикрата и содержи-
содержимое колбы тщательно взбалтывают до тех пор, пока пикрат не рас-
растворится. Бензольный слой декантируют; водный слой экстраги-
экстрагируют пятью порциями бензола по 330 мл, обрабатывают 3 г
активированного березового угля и фильтруют через влажную,
фильтровальную бумагу. Прозрачный бледножелтый фильтрат
выпаривают досуха при 60—70° в вакууме. Полученные кристаллы
бледножелтого или свстлобурого цвета растворяют в минимальном
количестве C0—35 мл) горячего абсолютного этилового спирта.
По охлаждении в осадок выпадают бесцветные игольчатые кристал-
кристаллы. К смеси прибавляют трех- или четырехкратный объем этило-
этилового эфира и помещают ее на ночь в холодильный шкаф. Почти
бесцветные кристаллы отфильтровывают, промывают небольшим
количеством эфира и сушат в вакуум-эксикаторе. Выход состав-
составляет 37—39 г (90—95% теоретич.); т. пл. 107—109°, причем при
температуре па несколько градусов более низкой наступает спека-
спекание (примечание 6).
Примечания
1. Одинаково хорошие результаты были получены при исполь-
использовании как технической, так и чистой основной углекислой меди
СиСО3 • Си(ОНJ. Удовлетворительные результаты были достигну-
достигнуты также и тогда, когда этот реагент был синтезирован путем
прибавления к раствору сернокислой меди эквивалентного коли-
количества раствора углекислого натрия с последующим промыванием
полученного осадка до тех пор, пока он не становился почти сво-
свободным от сульфат-иона. При использовании реагента, получен-
полученного указанным способом, на каждый моль фруктозы берут 4 моля
сернокислой меди и влажную основную углекислую медь применя-
применяют в реакции без предварительного просушивания или взвеши-
взвешивания.
2. Если не производить пропускания воздуха, то выход будет
примерно на 10% ниже.
3. Попыток получить обратно аммиак, который выделяется во
время пропускания воздуха, произведено не было.
4. При высушивании медного осадка последний не изменяется,
однако в этом случае он с трудом разлагается сероводородом.
5. Обычно приходится таким образом прибавлять пикриновую
кислоту от одного до трех раз. Приведенные температуры плавле-
плавления даны авторами синтеза и наблюдались при погружении капил-
капилляров с веществом в баню, предварительно нагретую до темпера-
температуры, не достигающей ожидаемой температуры плавления вещест-
вещества на 20—50°, и последующем довольно быстром нагревании бани.
При проверке синтеза температура плавления определялась обыч-
обычным способом; начальная температура бани была комнатной. В этом
ХЛОРИСТЫЙ И0ДБЙН30Л
475
случае температура плавления оказалась примерно на 5° ниже
приводимой авторами. В одном из опытов при проверке синтеза
кристаллы основной порции неочищенного пикрата были полу-
получены в количестве 86 г и плавились при 193—194°, кристаллы вто-
второй порции были получены в количестве 12 г и плавились при
191 — 193°, третья порция кристаллов с т. пл. 186—188° была отбро-
отброшена. После одной перекристаллизации температура плавления
кристаллов первой порции повысилась до 199° (получено 75 г),
а второй порции — до 197° (получено 9,5 г). Перекристаллизован-
Перекристаллизованные один раз препараты были соединены вместе и использованы
для получения хористоводородной соли. Выход последней не отли-
отличался от вышеуказанного; температура плавления препарата была
равна 107—108°.
6. Одинаково высокие выходы были получены с удвоенными
количествами реагентов.
Другие методы получения
4-Метилолимидазол был синтезирован в несколько стадий
из лимонной кислоты1. Вейденхагсн и Херрман2 получили его из
диоксиацетона. Реакция, лежащая в основе проведенной здесь
методики3, была открыта Парродом*; в дальнейшем ее разработали
Вейденхаген, Херрман и Вегнер5. Следует, однако, отметить,
что метод, разработанный этими последними, дает значительно
меньшие выходы, чем описанный выше.
1 Р у m а п, J. Chem. Soc, 99, 668 A911); Koessler, Hanke,
J. Am. Chem. Soc, 40, 1716 A918).
2Weidenhagen, Herrmann, Ber., 68, 1953 A935).
3 D a r b y, Lewis Totter, J. Am. Chem. Soc, 64, 463 A942).
4 P a r г о d, Bull. soc. chim. D), 51, 1424 A932).
s Weidenhagen, Herrmann, Wegner, Ber., 70, 570 A937).
ХЛОРИСТЫЙ ИОДБЕНЗОЛ
( Фенилиодидхлорид)
CeH5J4-Cla -> C6H6JC12
Предложили: X. Люкас и Э. Кеннеди.
Проверили: Дж. Джонсон и М. Формо.
Получение
В 1-литровую трехгорлую колбу, защищенную от действия све-
света и снабженную механической мешалкой, трубкой для посту-
поступления хлора (примечание 1) и выводной трубкой, защищенной
хлоркальциевой трубкой, помещают 150 мл сухого хлороформа
476
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
(примечание 2) и 102 г @,5 моля) иодбензола («Синт. орг. преп.»,.
сб. 2, стр. 278). К^олбу охлаждают смесью льда и соли и вводят
в нее сухой хлор (примечание 3) с наибольшей скоростью, при
которой он будет все еще полностью поглощаться раствором; ука-
указанный процесс продолжают до тех пор, пока в растворе не ока-
окажется избыток хлора (обычно на это требуется около 3 час). Жел-
Желтый кристаллический хлористый иодбензол отфильтровывают
с отсасыванием, промывают небольшим количеством хлороформа
и сушат на воздухе на фильтровальной бумаге. Выход составляет
120—134 г (87—94% теоретич.; примечания 4 и 5). Вещество полу-
получается совершенно чистым и может быть использовано непосред-
непосредственно для получения иодозобензола или иодобензола. Так как
хлористый иодбензол при стоянии медленно разлагается, его не
следует хранить в течение неопределенно долгого времени.
Примечания
1. Трубка для поступления хлора должна иметь не менее 10 мм
в диаметре; конец ее должен отстоять от поверхности жидкости
примерно на 5 мм.
2. Хлороформ сушат и освобождают от спирта, оставляя на
сутки над безводным хлористым кальцием. Затем его декантируют
через фильтр и перегоняют в сухом приборе. Головную низко-
кипящую фракцию отбрасывают.
3. Хлор сушат, пропуская его не менее чем через две промыв-
промывные склянки с серной кислотой. Чтобы освободить газ от увле-
увлеченных им капель кислоты, хлор пропускают через комок стеклян-
стеклянной ваты. Выходы получаются значительно ниже, если использо-
использованные реагенты были недостаточно сухими.
4. В некоторых опытах можно получить дополнительное коли-
количество вещества, если упарить хлороформенный фильтрат в ваку-
вакууме до небольшого объема. Растворитель не следует выпаривать
целиком, если желательно получить чистый препарат.
5. Авторы синтеза указывают, что по приведенному методу
с хорошими выходами можно получить все три изомерных хлори-
хлористых иодтолуола; однако при их получении следует упарить хло-
хлороформенный раствор в вакууме (примечание 4), поскольку эти
толуольные производные лучше растворимы в хлороформе.
Другие методы получения
Хлористый иодбензол всегда готовился прямым взаимодей-
взаимодействием иодбензола и хлора в присутствии хлороформа1.
1 W i I I g е г о d t, J. prakt. Chcm., B), 33, 155 A886).
ХЛОРИСТЫЙ (-МВНТОКСИАЦВТИЛ
477
ХЛОРИСТЫЙ г-МЕНТОКСИАЦЕТИЛ
(Хлорангидрид l-ментоксиуксусной кислоты)
СН, СН3 .
СН
НоС СН2
! +SOC12 ->
СНОСН2СО2Н
Н2С
СН
н,с
сн3
СН
/ \
н2с сн2
Н2С СНОСН2СОС1
\ /
СН
СН
/ \
Н3С СН3
+ на + so2
Предложили: М. Леффлер и А. Калкинс.
Проверили: Р. Шрайнер и К- ТилфорЭ.
Получение
Трехгорлую круглодонную колбу емкостью 1 л устанавли-
устанавливают на паровом нагревателе и снабжают делительной воронкой
емкостью 250 мл и обратным холодильником, присоединенным
к ловушке для поглощения газов (примечание 1). В колбу по-
помещают 325 г A98 мл, 2,73 моля) хлористого тионила (приме-
(примечание 2) и к нему прибавляют в течение 1 часа 125 г @,58 моля)
/-мептоксиуксусной кислоты (стр. 292). Во время прибавления
кислоты колбу часто встряхивают и, если нужно, подогревают,
чтобы началась реакция. После прибавления всего количества
кислоты (примечание 3) поддерживают слабое кипение реак-
реакционной смеси в течение 5 час. Когда реакция закончится,
избыток хлористого тионила отгоняют на паровой бане (примеча-
(примечание 4), а остаток перегоняют при пониженном давлении. Выход
хлористого /-ментоксиацетила составляет 115—118 г (85 87%
теоретич.; примечание 5); т. кип. 117—120° {Змм) [120—125° E мм)];
[а]Щ —89,6°. Вещество при стоянии темнеет; его следует хранить
в склянке из темного стекла с притертой пробкой.
Примечания
1. Можно применить ловушку для поглощения газов, описан-
описанную в «Синт. орг. преп.», сб. 1, стр. 100, примечание 2.
2. Был применен продажный хлористый тионил (т. кип. 74—78 ).
3. Ввиду того, что кислота обладает большей вязкостью, следует
сполоснуть делительную воронку небольшим количеством хлори-
хлористого тионила, который затем прибавляют к реакционной смеси.
4. Выделенный обратно хлористый тионил можно вторично
перегнать и применить для следующих опытов. Последние следы
478
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
хлористого тионила лучше всего удалить нагреванием неочищен-
неочищенного вещества до 140° в вакууме водоструйного насоса.
5. Авторы синтеза указывают, что ими были получены те же вы-
выходы (в процентах) при работе с удвоенными количествами исход-
исходных веществ.
Другие методы получения
Приведенная выше пропись заимствована из методики Рида
и Грубба1. Иные методы получения хлористого /-ментокси-
ацетила в литературе не описаны.
1 R e a d, G r u b b, J. Soc. Chem. Ind., 51, 330T A932).
OH
ХЛОРИСТЫЙ 2-ОКСИ-5-НИТРОБЕНЗИЛ
(а-Хлор-2-окси-5-нитротолулол)
ОН
I
-СНа(ОСН3J+НС1
H2SO4
NO,
^ J]- СНаС1
+ 2CH.OH
NO2
Предложили: К. Бюхлер, Ф. Кирхнер и Дж. Дибел.
Проверили: Ч. Аллен и А. Белл.
Получение
В 1-литровую круглодонную трехгорлую колбу, снабженную
механической мешалкой, коротким обратным холодильником и
согнутой стеклянной трубкой для ввода хлористого водорода,
опущенной в жидкость, помещают 50 г @,36 моля) л-нитрофенола
(примечание 1), 650 м концентрированной соляной кислоты, 5 мл
концентрированной серной кислоты (примечание 2) и 76 г A моль)
метилаля (примечание 3). Смесь перемешивают в течение 4—5 часов,
поддерживая с помощью водяной бани температуру при 70°±2°
(примечание 4). В течение этого времени в реакционную смесь
пропускают через согнутую стеклянную трубку ток хлористого
водорода; избыток газа через обратный холодильник отводится
в вытяжной шкаф или в ловушку для поглощения газов («Синт.
орг. преп.», сб. 2, стр. 78, рис. 3) (примечание 5).
Хлористый 2-окси-5-нитробензил начинает выделяться в виде
твердого вещества примерно через 1 час после начала реакции.
По окончании процесса смесь охлаждают в течение 1 часа льдом, в
результате чего выделяется еще некоторое количество кристаллов;
затем отработанную кислоту фильтруют или сливают с вещества
ХЛОРИСТЫЙ 2-ОКОИ-6-НИТРОЕЕНЗИЛ
479
(примечание 6). Хлористый 2-окси-5-нитробензил очищают пере-
перекристаллизацией из 125 мл горячего бензола (примечание 7).
Выход бесцветного препарата с т. пл. 129—130° составляет 46 г
F9% теоретич.; считая на л-нитрофенол).
Примечания
1. Наилучшие результаты были получены при использовании
л-нитрофенола с температурой плавления, превышающей 112°.
2. Реакция может протекать и в отсутствие серной кислоты,
но в ее присутствии скорость реакции возрастает.
3. Метилаль, который берется в избытке, получают по мето-
методике, описанной в книге Губена1. В 5-литровую круглодонную
колбу, снабженную обратным, холодильником, помещают 1 200 г
метилового спирта и 800 г безводного хлористого кальция. К смеси
прибавляют 24 г концентрированной соляной кислоты, а затем,
при охлаждении, через капельную воронку медленно по каплям
приливают 800 г технического 35—40%-ного формалина. Реак-
Реакция сильно экзотермична, и для прибавления всего количества
реагента требуется около 2 час. После того как весь формалин
будет прибавлен, смесь нагревают на пламени бунзеновской
горелки до тех пор, пока жидкость бурно не закипит (несколько
минут). Метилаль быстро образует верхний слой, который,
после того как смесь простоит в течение б час, отделяют и под-
подвергают дробной перегонке, для чего лучше всего применять
колонку Кларка и Рарса2. Вполне пригодной является фракция
с т. кип. 42—46°.
4. При температуре, превышающей 72°, может образоваться
маслянисто-смолистая примесь, что приводит к соответствующему
уменьшению выхода хлорида. Реакция близка к своему заверше-
завершению уже через 4 часа; однако дополнительная продолжительность
нагревания способствует некоторому увеличению выхода.
5. Резиновые трубки следует применять с осторожностью,
так как хлористый водород вызывает разбухание резины внутри
трубки, что ведет к закупорке коммуникаций.
6. Высокая концентрация кислоты обычно затрудняет фильтро-
фильтрование. Если оставить реакционную смесь стоять в течение 1 часа
в бане со льдом, то твердое вещество плотно соединится в единую
массу, после чего жидкость можно легко фильтровать с небольшим
отсасыванием или же декантировать.
7. Чтобы перед перекристаллизацией из горячего бензола уда-
удалить из твердого препарата всю воду, вещество следует сушить
в течение нескольких часов или, лучше, в течение ночи на воздухе.
Атом хлора в хлористом 2-окси-5-нитробензиле очень подвижен
и легко гидролизуется с образованием 2-окси-5-нитробензилового
спирта.
480
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Другие методы получения
Хлористый 2-окси-5-нитробензил можно также получить из
2-окси-5-нитробензилового спирта, пропуская в течение 2 час.
при 70° + 2° в спиртовой раствор этого алкоголя хлористый водо-
водород. В указанном случае выход хлорида бывает почти количест-
количественным. Настоящая методика разработана на основании .герман-
.германского патента3 132475.
1 Г у б е н, Методы органической химии, т. III, вып. 1, Госхимиздат,
1934, стр. 229.
2 С 1 а г k e, R a h r s, Ind. Eng. Chem., 18 1092A926).
3 Frdl., 6, 142 A904).
2-ХЛОРЛЕПИДИН
CH,
CH,
!OH
+ POC13
\/\N/
cl
+ HPO3 + HC1
Предложили: К. Кэзлоу и В. Лауср.
Проверили: Ч. Аллен и Г. Крессмэн.
Получение
В колбе емкостью 500 мл, снабженной обратным воздушным
холодильником, открытый конец которого защищен ватой или
хлор кальциевой трубкой (стр. 95), смешивают 119 г @,75 моля)
4-метилкарбостирила (стр. 304) и 138 г (82,5 мл, 0,9 моля) свеже-
пере.гнанной хлорокиси фосфора. Смесь нагревают на водяной
бане и поддерживают при температуре 80—85° до тех пор, пока
большая часть твердого вещества не растворится (на это требуется
около 15 мин.); затем смесь осторожно нагревают в течение еще
15 мин. на металлической сетке, пока растворение не будет закон-
закончено полностью. Горячую реакционную смесь вливают в 1 л воды,
в которой находится 1 кг колотого льда.
2-Хлорлепидин экстрагируют двумя порциями эфира по 750 мл
(см. примечание). Вытяжки взбалтывают с двумя порциями воды
по 200 мл, а затем сушат над 50 г поташа. После отгонки эфира
оставшееся масло перегоняют из специальной колбы Клайзена
(«Синт. орг. преп.», сб. 2, стр. 64, рис 1) емкостью 200 мл. В ре-
результате получается бесцветный дестиллат с т. кип. 132—135°
C мм) в количестве 118—122 г (89—92% теоретич.). Если нужно,
дестиллат расплавляют и выливают в 250 мл петролейного эфира
(т. кип. 40—50°); затем раствор помещают в охладительную смесь.
1-Х ЛОРМЕТИ Л НАФТАЛИН
481
Кристаллы отфильтровывают с отсасыванием и сушат в вакуум-
эксикаторе над парафином. Белоснежный 2-хлорлепидин плавит-
плавится при 58—59°; выход достигает 114—118 г (86—89% теоретич.).
Примечания
Дополнительное количество в 5—8 г слегка окрашенного пре-
препарата можно получить, если нейтрализовать водный раствор
200 г углекислого натрия, экстрагировать его эфиром E00 мл) и,
отогнав растворитель, перегнать остаток. В этом случае суммарный
выход перегнанного продукта составляет 125—130 г (95—97%
теоретич.).
Другие методы получения
Приведенная выше пропись основана на методе Кнорра1,
который в последнее время использовали Михайлов2, Кралер
и Бургер3. 2-Хлорлепидин был получен также действием хлори-
хлористого бензоила на 4-метилкарбостирил*.
1 К п о г г, Ann., 236, 98 A886).
2 Михайлов, ЖОХ, 6, 511 A936).
3 К г a h I e r, Burger, J. Am. Chem. Soc, 63, 2368 A941).
4 E 1 1 i n g e r, Reisser, Ber., 42, 3338 A909).
1-ХЛОРМЕТИЛНАФТАЛИН
CH2C1
+ H2O
Предложили: О. Груммитт и А. Бэк.
Проверили: Ч. Аллен и Дж. ВанАллан.
Получение
Внимание! Хлорметилнафталин и побочные продукты,
получаемые при его синтезе, обладают лактриматорным и нарыв-
нарывным действием. При обращении с этими веществами и с аппарату-
аппаратурой следует соблюдать осторожность, хотя и нет необходимости
проводить синтез в вытяжном шкафу.
В 3-литровую трехгорлую колбу, снабженную обратным холо-
холодильником и мешалкой Гершберга, помещают 256 г B моля) наф-
нафталина, 110 г параформальдегида (примечание 1), 206 мл ледяной
уксусной кислоты, 165 мл 85%-ной фосфорной кислоты и 428 г
C62 мл, 4,2 моля) концентрированной соляной кислоты. Смесь
нагревают на водяной бане до 80—85° и энергично перемешивают
в течение 6 час. (примечание 2).
31 Сборник 3
482
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
После того как смесь охладится до 15—20°, ее переносят в
2-литровую делительную воронку и неочищенное вещество промы-
промывают сперва два раза водой, охлажденной до 5—15°, порциями
по 1 л, затем холодным 10%-ным раствором поташа E00 мл) и,
наконец, холодной водой E00 мл). При всех этих промываниях
синтезируемое вещество содержится в нижнем слое. Затем к рас-
раствору прибавляют 200 мл эфира и с. целью предварительного осу-
осушения оставляют его стоять в течение 1 часа над 10 г безводного
поташа при частом взбалтывании. Образовавшийся водный ниж-
нижний слой отделяют, а эфирный раствор вновь сушат в течение
8—Ю час. над 20г поташа (примечание 3).
Высушенный раствор перегоняют сперва при атмосферном дав-
давлении, чтобы отделить большую часть растворителя (примеча-
(примечание 4), а затем в вакууме (примечание 5). Головной погон, состоя-
состоящий из 35—40 г не вошедшего в реакцию нафталина, собирают
при 90—110° E мм) (примечание 6). Затем собирают 1-хлор-
метилпафталин с т. кип. 128—133° E мм) [148—153° A4 мм)],
количество которого составляет 195—204 г G4—77% теоретич.,
считая на вошедший в реакцию нафталин; примечания 7 и 8).
Примечания
1. Был применен продажный параформальдегид.
2. Уровень воды в бане следует поддерживать на такой высоте,
чтобы он совпадал с уровнем перемешиваемой реакционной смеси.
3. Промывание и высушивание следует производить очень
тщательно, так как присутствие даже малых количеств воды или
кислоты может вызвать осмоление вещества при заключительной
перегонке.
4. Проверявшие синтез перед отгонкой растворителя, прибав-
прибавляли к раствору 50 мл абсолютного бензола для удаления сле-
следов воды в результате азеотропной перегонки.
5. Чтобы ослабить возможность осмоления конечного ве-
вещества, следует брать для перегонки чистую сухую колбу и про-
проводить процесс с умеренной скоростью.
6. Необходимо следить за тем, чтобы нафталин не забивал
отводную трубку.
7. Масляный насос следует предохранить от действия хлори-
хлористого водорода при помощи ловушки с щелочью.'
8. Остаток от перегонки состоит главным образом из бис-
(хлорметил)-нафталина и ди-1-нафтилметана.
Другие методы получения
1-Хлорметилнафталин был получен при действии на нафталин
различных реагентов, к которым относятся: мстилхлорметиловый
2-ХЛОРЦИКЛОГЕКСАНОН
483
эфир1; водный раствор формальдегида и хлористого водорода
с добавлением или без добавления серной кислоты в качестве кон-
конденсирующего агента2-8; параформальдегид и хлористый водород
или соляная кислота'-9. В качестве катализаторов были приме-
применены хлористый цинк 2.io-i2) ХЛОрИСТЬ[й алюминий11 и фосфорная
кислота13^15. В качестве растворителей были использованы пет-
ролейный эфир и ледяная уксусная кислота. Приведенная выше
пропись представляет собой видоизменение метода Камброна13.
Обзор методов хлорметилирования ароматических углеводоро-
углеводородов дали Фьюзон и Мак-Кивер16.
8628
V a v о п, В о 1 1 е, С а 1 i n, Bull. soc. chim., E) 6, 1032A939)
Blanc, Bull. soc. chim., D), 33 319 A923)
аи. пат. 2212099 [С. А., 35, 462 A941)).
D о d d s, J. Am. Chem. Soc, '60, 853 A938).
lien, L a n g e, герм. пат. 508890 [С. А., 25, 716
6 R о b 1 i n, Hechenbleikner, аы. пат. 2166554 [С.
Darzcns, Levy, Compt. rend., 202, 74 A936).
N о v e 1 1 o, J. Am. Chem. Soc, 62, 1856 A940)
Gates, J. Am. Chem. Soc, 62, 2338 A940).
*. A + 7 T _ 1 _. i^1"_ * i ,.
Jones,
Coles,
Redde
F i e s e r,
F i e s e r,
A931)].
A., 33,
"Ruggli, Burckhardt, Helv. ^ _„,
T s с h u n k u r, E i с h 1 e г, герм. пат. 509149 [С. А 25 711
"Anderson, Short, J. Chem. Soc. 1933 '"
13 С a m b г о n, Can. J. Research, 17B, 12 A939)
14 M a n s k e, L e d i n g h a m, Can. J. ~
15 Lock, Waller, Ber., 75, 1158 A942).'
"Фьюзон, Ma k-K и в е p, Органические реакции
инлит, 1948, стр. 84.
Chim. Acta, '23 443
.-,..... .39149 [С. А
Chem. Soc, 1933, 485
A939).
Research, 17B, 15
сб. 1,
A940).
A931)].
A939).
Издат-
2-ХЛОРЦИКЛОГЕКСАНОН
H2
H2C CO
I
н2с
i
сн2
+ С1,
Н2С
Н2С
со
СНС1
НС1
н3
Предложили: М. Ньюмзн, М. Фарбмэн и X. Хипшер.
Проверили: К. Гамильтон и К- Уайтхед.
Получение
В 3-литровую трехгорлую круглодонную колбу, снабженную
трубкой для ввода газа, доходящей почти до дна колбы, механи-
механической мешалкой с затвором (примечание 1) и трубкой для отвода
31*
484
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
газа, соединенной с ртутным затвором (примечание 2), помещают
294 г C моля) циклогексанона (примечание 3) и 900 мл воды.
Воздух из прибора вытесняют хлором, после чего трубку для от-
отвода газа присоединяют к ртутному затвору, колбу охлаждают
в бане со льдом, пускают в ход мешалку и пропускают через смесь
215 г (несколько больше 3 молей) хлора с максимальной скоростью,
при которой газ может полностью поглотиться (около 45 мин.;
примечание 4).
Более тяжелый слой хлорциклогексанона отделяют; водный
слой экстрагируют три раза эфиром порциями по 150 мл и эфир-
эфирные вытяжки присоединяют к основной массе хлорциклогекса-
хлорциклогексанона. Все вместе промывают 150 мл воды, а затем 200 мл насыщен-
насыщенного раствора хлористого натрия. После этого раствор фильтруют
(без отсасывания) через безводный сернокислый натрий, эфир от-
отгоняют и остаток перегоняют в вакууме из специальной колбы
Клайзена.
Собирают фракцию C00—340 е), кипящую ниже 100° A0 мм)
(примечания 5 и 6). Затем эту фракцию подвергают дробной
перегонке в вакууме с видоизмененным елочным дефлегмато-
дефлегматором (с обогреваемой рубашкой) высотой 100 см, снабженным го-
головкой для полной конденсации и регулируемого отбора дестил-
лата (примечание 7). Выход 2-хлорциклогексанона с т. кип.
90—91° A4— 15мм) составляет 240—265гF1—66% теоретич.; при-
примечания 8 и 9).
Примечания
1. Вполне пригодна большая мешалка пропеллерного типа.
Лопасти ее должны быть расположены так, чтобы жидкость сни-
снизу подавалась вверх, причем пропеллер должен находиться не-
непосредственно под поверхностью жидкости, чтобы обеспечить раз-
разбрызгивание. Проверявшие синтез применяли затвор из резино-
резиновой трубки, смазанной глицерином (стр. 225).
2. Ртутный затвор состоит из трубки, погруженной примерно
на 12 мм в ртуть, налитую в пробирку. Это позволяет вести реак-
реакцию под небольшим давлением хлора. Проверявшие синтез нашли,
что лучшие результаты дает применение водяного затвора. Трубка
для отвода газа была погружена на 18 ел в воду, налитую в стек-
стеклянную пробирку. Между водяным затвором и реакционной кол-
бои была помещена ловушка (склянка для отсасывания емкостью
125 мл), служащая для того, чтобы предотвратить засасывание
воды в реакционную смесь.
3. Проверявшие синтез применяли циклогексанон с т. кип.
154—156°. Авторы синтеза указывают, что при использовании
циклогексанона несколько худшего качества получаются точно
такие же хорошие выходы.
2-ХЛОРЦИКЛОГЕКСАНОН
485
4. Тщательное регулирование температуры не является обя-
обязательным, так как результаты, примерно совпадающие с указан-
указанными, были получены и в тех случаях, когда температура подни-
поднималась до 50° или когда она падала ниже 20°. Однако при более
низкой температуре удается выделить обратно большее количество
непрореагировавшего циклогексанона.
5. Температура кипения при других давлениях: ниже 110°
A3 мм); 92° D мм).
6. Прежде чем производить тщательное фракционирование,
рекомендуется получить указанную широкую фракцию.
7. Была применена головка, подобная той, которую описали
Турк и Матусзак1; исключение составляет кран, описание кото-
которого приводит Ньюмэн2.
8. На кривой время — температура охлаждения этот препарат
дает большое плато при 23,2Э (исправл.). Препарат можно
хранить в течение долгого времени в холодильном шкафу в
залитых парафином склянках без того, чтобы он приобрел
окраску.
9. Обратно получают 15—40 г E—13% теоретич.) цикло-
циклогексанона с т. кип. 52° A4—15 мм).
Другие методы получения
2-Хлорциклогексанон можно получить хлорированием цикло-
циклогексанона в растворе ледяной уксусной кислоты3; пропусканием
хлора в смесь циклогексанона4 или циклогексанола5 и воды в при-
присутствии порошкообразного углекислого кальция; электрохими-
электрохимическим хлорированием циклогексанона в соляной кислоте6; дей-
действием монохлормочевины в уксусной кислоте на циклогекса-
циклогексанон7; окислением 2-хлорциклогексанола8.
1 Т и г k, Matuszak, Ind. Eng. Chera., Anal. Ed., 14, 72 (!942).
Newman, Ind. Eng. Chera., Anal. Ed., 14, 902 A912).
3Dartlett, Rosenwald, J. Am. Chem. Soc, 56, 1992 (!934).
* К о t z, G r e t h e, J. prakt. Chem., B), 188, 487 A909).
6 E b e 1, Helv. Chim. Acta., 12, 9 A929); Bouveault, Chereau
Compt. rend., 142, 1086 A906); Meyer, Hclv. Chim. Acta, 16, 129! A933V
Vavon, Mitchovitch, Bull. soc. chim., D), 45, 961 A929).
6 S z p e r, Bull. soc. chim., D), 51, 653 A932).
'Godchot, Mousseron, Bull. soc. chim., D), 51, 361 A932)
8 D e t о е u f, Bull. soc. chim., D), 31, 178 A922).
486
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ХОЛЕСТЕНОН
с,н.
[(CHs)sCO]3Al
н3с
н3с
/\
+ СНзСНОНСН.
Предложил: Р. Оппенауер.
Проверили: Дж. Кейзон и Л. Физер.
Получение
В тщательно высушенную 5-литровую круглодонную колбу,
снабженную обратным холодильником, защищенным хлор каль-
кальциевой трубкой, помещают 100 г холестерина (примечание 1),
750 мл ацетона (примечание 2) и 1 000 мл бензола (примечание 3).
В колбу вводят капилляр, чтобы предупредить толчки при кипении
(примечание 4), и нагревают смесь до кипения на масляной бане,
поддерживая температуру последней во время продолжения-реак-
продолжения-реакции при 75—85°. К кипящему раствору прибавляют в один прием
раствор 80 г mpem-бутилата алюминия (стр. 119) в 500 мл сухого
бензола. Смесь становится непрозрачной и через 10—15 мин.
окрашивается в желтый цвет. Слабое кипение смеси при температуре
бани 75—85° поддерживают в течение 8 час. После этого смесь
охлаждают, приливают к ней 200 мл воды, затем 500 мл 10%-ной
серной кислоты, энергично взбалтывают все вместе и переносят
в 5-литровую делительную воронку. Смесь разбавляют 1 500 мл
воды и взбалтывают в течение нескольких минут; затем водный
слой, окрашенный в желтый цвет, сливают во вторую делительную
воронку, где его взбалтывают с небольшим количеством бензола
(примечание 5). Соединенные вместе бензольные вытяжки тщатель-
тщательно промывают водой и с целью высушивания фильтруют через слой
сернокислого натрия. Растворитель отгоняют, а последние следы
его удаляют нагреванием остатка при 60° в вакууме водоструйного
насоса. Маслянистый остаток желтого цвета по охлаждении
ХОЛЕСТЕНОН
487
смесью льда с солью и при потираний стенок колбы стеклянной
палочкой затвердевает. Для перекристаллизации вещество раство-
растворяют в смеси 70 мл ацетона и 100 мл метилового спирта. Раствор
оставляют очень медленно охлаждаться и в качестве затравки
вносят в него кристаллик вещества; в противном случае препарат
часто выделяется в виде масла. После того как основная масса вы-
выпадет в осадок в виде кристаллов, смесь оставляют стоять в течение
1 дня при температуре 0°; затем кристаллы отфильтровывают, про-
промывают 100 мл метилового спирта, предварительно охлажденного
до 0°, и сушат в вакууме при комнатной температуре. Выход почти
бесцветного холестенона с т. пл. 77—79° составляет 70—81 г
G0—81% теоретич.). В результате повторной перекристаллизации
по тому же методу получается препарат ст. пл. 78,5—80,5°,выход
которого составляет 90% теоретического количества (примеча-
(примечания 6 и 7).
Примечания
1. Холестерин следует высушить до постоянного веса в ваку-
вакууме при температуре 80—100°. Продажный препарат с т. пл.
146—148,5° дает удовлетворительные результаты; выход повышает-
повышается на 5—10% при применении холестерина, очищенного через ди-
бромид.
2. Ацетон перегоняют один раз с добавлением перманганата
калия и дважды над свежеплавленым едким кали.
3. Бензол перегоняют над натрием.
4. В случае использования кусочков битой глиняной тарелки
их следует добавлять через известные промежутки времени; ка-
капилляр обеспечивает равномерное кипение, если баню поддержи-
поддерживать при температуре, указанной в приведенной выше методике.
5. Иногда образуется весьма неприятная эмульсия; от нее
легко избавиться, если отфильтровать взвешенные в жидкости
твердые частицы.
6. Для выделения вещества из маточных растворов последние
подвергают перегонке с водяным паром, чтобы удалить раство-
растворители и продукты конденсации ацетона. Процесс этот продол-
продолжают до тех пор, пока не начнет перегоняться дестиллат, лишен-
лишенный запаха (от 1 до 2 час); затем оставшееся масло сушат, на-
нагревая его в вакууме на паровой бане. Из раствора в ацетоне и ме-
метиловом спирте (соответственно 20 и 50 мл) после ряда операций
(медленное охлаждение, потирание стенок сосуда стеклянной
палочкой) получают 3,3 г неочищенного холестенона с т. пл.
72—80э (плавится с образованием непрозрачной жидкости).
7. Если уменьшить количества ацетона и бензола по сравне-
сравнению с приведенными выше наполовину и взять только 50г трет-
бутилата алюминия, то выход падает примерно на 5%.
488
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Другие методы получения
Холестенон был получен окислением дибромида холестерина
хромовой кислотой1 или перманганатом калия2 с последующим
отщеплением брома; дегидрогенизацией холестерина над окисью
меди3'4, а также описанным выше методом5.
1 Windaas, Ber., 39, 518 A906).
3Schoenheimer, J. Biol. Chcm., 110, 461 A935).
3Die!s, Abderhalden, Ber., 37, 3099 (!904).
4 D i e 1 s, G a d k e, Kording, Ann., 459, 21 (!927).
5Oppenauer, Rec. trav. chim., 56, 137 A937).
ЦИАНИСТЫЙ БЕНЗОИЛ
CeH5COCl + CuCN -* CeH5COCN4-CuCl
Предложили: Т. Оквуд и К- Вейсгербер.
Проверили: Р. Шрайнер и Ч. Расселл.
Получение
В перегонную колбу емкостью 500 мл (примечание 1), снабжен-
снабженную термометром, который установлен таким образом, чтобы его
шарик не доходил до дна колбы на 1 см, помещают 110 г A,2 моля)
цианистой закиси меди (примечание 2) и 143 г A18мл, 1,02 моля)
очищенного хлористого бензоила (примечание 3). Содержимое
колбы взбалтывают, чтобы смочить почти всю цианистую медь,
и колбу помещают в масляную баню (примечание 4), которую
предварительно нагревают до 145—150°. Затем температуру бани
повышают до 220—230° и поддерживают ее на этом уровне в тече-
течение 1,5 часа. Во время нагревания колбу часто вынимают из бани
(примерно каждые 15 мин.) и содержимое ее энергично взбалты-
взбалтывают (примечание 5). По истечении 1,5 часа к колбе присоединяют
обращенный вниз воздушный холодильник. Температуру бани мед-
медленно повышают до 305—310° и перегонку продолжают до тех пор,
пока дестиллат не перестанет поступать в приемник (примеча-
(примечание 6). Всего получается 100—112 г неочищенного цианистого
бензоила с т. кип." 207—218° G45 мм).
Сырой цианистый бензоил очищают фракционированной пере-
перегонкой на колонке (примечание 7). Головную фракцию отбирают
при флегмовом числе 25—30 до тех пор, пока температура не до-
достигнет 208°. Таким образом собирают около 15 г. Цианистый бен-
бензоил отбирают при флегмовом числе, равном 1, и при темпера-
температуре 208—209° G45 мм) (температура бани 260—280°). Дестиллат
затвердевает в бесцветные кристаллы, которые плавятся при
32—33°; выход составляет 80—86 г F0—65% теоретич.).
ЦИАНИСТЫЙ БЕНЗОИЛ
Примечания
1. Рекомендуется обернуть горло колбы асбестовым листом
или асбестовым шнуром.
2. Предварительно цианистую закись меди сушат в течение
3 час. при 110°.
3. Продажный хлористый бензоил можно очистить следующим
образом. Раствор 300 мл C63 г) хлористого бензоила в 200 мл
бензола промывают два раза холодным 5%-ным раствором соды
порциями по 100 мл. Бензольный слой отделяют, сушат над хло-
хлористым кальцием и перегоняют. После того как отгонится весь
бензол, собирают чистый хлористый бензоил, который кипит
при 196,8е (исправл.) G45 мм). Выход составляет 225 г.
4. Для бани следует применять масло хорошего качества;
можно также пользоваться металлической баней из сплава Вуда.
5. При прибавлении хлористого бензоила к цианистой меди
нельзя добиться полного их смешения путем взбалтывания. После
того как смесь будет прогрета в течение получаса, твердое веще-
вещество приобретает зернистый характер и смешение осуществляется
легко.
6. Дестиллат следует собирать в круглодонную колбу емкостью
200 мл, которая затем используется для последующего фракцио-
фракционирования. Перегонка занимает около 1 часа. Удалять из колбы
оставшиеся медные соли лучше всего с помощью концентрирован-
концентрированного раствора аммиака.
7. Была применена ректификационная колонка типа Уитмора—
Люкса1, имевшая эффективность, равную примерно 14 теорети-
теоретическим тарелкам. Высота рабочей части была равна 37 см, внеш-
внешний диаметр колонки составлял 1,1 см,. Насадка представляла
собой одновитковые стеклянные спирали диаметром 2,4 мм. В ка-
качестве перегонной колбы применялась круглодонная колба ем-
емкостью 200 мл. Нагревание последней можно осуществлять с по-
помощью металлической или масляной бани, как это описано в при-
примечании 4.
Другие методы получения
Цианистый бензоил может быть получен термическим разло-
разложением ш-изонитрозоацетофенона2; взаимодействием цианистого
серебра и хлористого бензоила3; взаимодействием безводного циа-
цианистого водорода и хлористого бензоила в присутствии пиридина4;
термическим разложением нитрохлорцианфенилметана5'6.
1 W hi t more, Lux, J. Am. Chcm. Soc, 54, 3451 A932).
3Claisen, Manasse, Ber., 20, 2195 A887).
3 N e f, Ann., 287, 307 A895).
4 Cl ai sen, Ber., 31, 1024 A898).
5Wis!icenus, Shafer, Ber., 41, 4170 A908).
6Staudinger, Kon, Ann., 384, 115 A911).
490
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
1,1 -ЦИКЛ ОБУТАНДИКАРБОНОВ АЯ
И ЦИКЛОБУТАНМОНОКАРБОНОВАЯ КИСЛОТЫ
Вг (СН3K Вг + СН3 (СО2С3Н5K + 2NaOC2H5 ->
СН2 —С(СО2С2Н5J
сн3—сн3
СН3 —С (СО3СаН5J кон СН2 — С(СО2НJ
2NaBr + 2С2Н5ОН
СН3-СН2
затем T1CI
o — СН2
+ 2С2Н5ОН
СН3 —С(СО2НJ нагревание СН2—СНСО2Н
I I > I I +СО3
СН2— СН2 СН2— СН2
Предложили: Г. Хейсиг и Ф. Стодола.
Проверили: Ф, Уитмор, Т. Оквуд и Д. Грин.
Получение
1,1-Циклобутандикарбоновая кислота. В 3-литровую трехгор-
лую круглодонную колбу, снабженную делительной воронкой,
механической мешалкой, обратным холодильником, защищенным
хлор кальциевой трубкой, и термометром, помещают 160 г A моль)
малонового эфира и 212 г A,05 моля) бромистого триметилена
(«Синт. орг. преп.», сб. 1, стр. 112). Термометр укрепляют таким
образом, чтобы его шарик был погружен в жидкость. Пускают в ход
мешалку и через делительную воронку прибавляют к содержимому
колбы раствор 46 г B грамматома) натрия в 800 мл абсолютного
спирта, причем температуру реакционной смеси поддерживают при
60—65° (примечание 1). При прибавлении первой четверти нужного
количества раствора этилата натрия B0 мин.) необходимо время
от времени охлаждать реакционную смесь, чтобы поддерживать
заданную температуру; затем оставшийся этилат натрия прибав-
прибавляют с такой скоростью, чтобы поддерживать реакционную смесь
при температуре 60—65°. На прибавление этой части требуется
около получаса.
Реакционную смесь оставляют стоять до тех пор, пока ее тем-
температура не понизится до 50—55°, после чего колбу нагревают на
паровой бане, пока проба, разбавленная водой, не даст нейтраль-
нейтральную реакцию на фенолфталеин (около 2 час). Чтобы растворить
осадок бромистого натрия, прибавляют воду, после чего спирт
отгоняют. Затем приспособляют колбу для перегонки с водя-
водяным паром и отгоняют этиловый эфир 1,1-циклобутандикарбоновой
кислоты и неизмененный малоновый эфир с водяным паром (при-
(примечание 2); при этом собирают около 4 л дсстиллата. Слой сложного
эфира в дестиллате отделяют, а водный слой экстрагируют один
раз 1 л эфира (примечание 3). Эфирные вытяжки и слой сложного
эфира соединяют вместе и эфир отгоняют на паровой бане.
1, i -ЦИКЛОБУ ТАНД ИК АРБ О НОВАЯ КИСЛОТА
491
Смесь сложных эфиров гидролизуют кипячением в течение
2 час. с раствором 112 г едкого кали в 200 мл спирта. Большую
часть спирта отгоняют, а затем упаривают смесь на паровой бане
досуха. Остаток растворяют в минимальном количестве горячей
воды A00—125 мл) и прибавляют к нему концентрированную
соляную кислоту (примерно 90—95 мл) до слабо кислой реакции
(примечание 4). Раствор кипятят в течение нескольких минут,
чтобы удалить углекислый газ, после чего слегка подщелачивают
его аммиаком. Затем к кипящему раствору прибавляют небольшой
избыток хлористого бария. Горячий раствор фильтруют для уда-
удаления бариевой соли малоновой кислоты. Фильтрат охлаждают
и прибавляют к нему 100 мл 12 н. раствора соляной кислоты.
Затем раствор экстрагируют четыре раза эфиром порциями по
250 мл. Вытяжки соединяют вместе, сушат над хлористым каль-
кальцием и отгоняют эфир на паровой бане. Оставшуюся пастообразную
массу (около 38 г) отжимают на пористой тарелке, чтобы удалить
приставшее масло, и затем растворяют в 30—50 мл горячего уксус-
ноэтилового эфира. По охлаждении раствора льдом с солью из
него выпадает в осадок чистая 1,1-циклобутандикарбоновая кис-
кислота, которую отфильтровывают; фильтрат после упаривания дает
еще некоторое количество кислоты в виде пастообразной массы,
которую перекристаллизовывают из уксусноэтилового эфира.
Выход чистой 1,1-циклобутапдикарбоновой кислоты с т. пл.
156—158° составляет 30—34 г B1—23% теоретич.).
Циклобутанмонокарбоновая кислота. Полученную выше двух-
двухосновную кислоту помещают в перегонную колбу емкостью 75 мм,
снабженную термометром и соединенную с колбой Клайзена ем-
емкостью 75 мл, которая служит в качестве приемника. Охлаждая
приемник проточной водой, колбу с двухосновной кислотой на-
нагревают на металлической или масляной бане (температура бани
160—170J) до тех пор, пока не прекратится выделение углекисло-
углекислого газа. Затем температуру бани повышают до 210—220° и соби-
собирают фракцию с температурой кипения 189 —195°. Неочищенную
циклобутанкарбоновую кислоту A9—22 г) вторично перегоняют
из той же колбы Клайзена, в которой она была собрана. Чистая
кислота кипит при 191,5—193,5° G40 мм) (примечание 5); выход
составляет 18—21 г A8—21% теоретич., считая на малоновый
эфир). Кроме того, получают еще небольшое количество высоко-
кипящей фракции с т. кип. 193,5—196° G40 мм).
Примечания
1. Авторы синтеза и проверявшие его получали этилат натрия
по общепринятому способу. Однако этот реагент, так же как и мети-
лат натрия, очень удобно получать при помощи «обратного» про-
процесса, описанного Тишлером в книге Физера1. Металл помещают
492
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
в колбу и прибавляют через верхнюю часть холодильника спирт
с такой скоростью, чтобы поддерживать энергичное кипение. Необ-
Необходимо в качестве предохранительной меры зажать колбу в лапку
и не полагаться только на прочность контакта между резиновой
пробкой и колбой для удержания последней на месте. Если такая
предохранительная мера принята, то вполне безопасно можно поль-
пользоваться охлаждающей баней. Колбу необходимо охлаждать; нель-
нельзя допускать, чтобы металл расплавлялся, так как в результате
этого образуется большая масса натрия и поверхность металла
значительно уменьшится (Ч. Л л лен, частное сообщение).
2. В результате перегонки с водяным паром достигается отде-
отделение малонового эфира и этилового эфира 1,1-циклобутандикар-
боновой кислоты от этилового эфира пентан-1,1,5,5-тетракарбо-
новой кислоты, образующегося в результате побочной реакции
между малоновым эфиром B моля) и триметиленбромидом A моль).
Тетраэтиловый эфир содержится в остатке от перегонки с водя-
водяным паром. В нескольких опытах, в которых применялось около
двух третей указанных выше количеств, выход тетраэтилового
эфира составлял 30—40% теоретического количества, считая на
взятый этилат натрия.
3. Если это экстрагирование эфиром не производить, то выход
1,1-циклобутандикарбоновой кислоты будет на 3—4 г меньше.
4. Авторы синтеза применяли на этой стадии 55 мл соляной
кислоты; проверявшие синтез констатировали, что для нейтрали-
нейтрализации смеси этого количества было недостаточно. Цель подкисле-
ния состоит не в выделении в свободном состоянии циклобутан-
дикарбоповой кислоты, а только в удалении углекислых солей
и избытка едкого кали. После того как углекислота будет уда-
удалена, раствор подщелачивают аммиаком; поэтому следует из-
избегать значительного избытка соляной кислоты. Авторы син-
синтеза применяли соляную кислоту в количестве, достаточном толь-
только для того, чтобы реакция раствора на лакмус была кислой.
Когда раствор будет подщелочен аммиаком, к нему прибавляют
раствор хлористого бария до тех пор, пока не прекратится
выпадение в осадок бариевой соли малоновой кислоты.
5. Эта кислота вполне чиста. Проверявшие синтез перегоняли
52,5 г ее, пользуясь аналитической колонкой; за исключением
головного погона A,5—2,0 г) весь препарат перегоняется в точке
кипения и имеет постоянный показатель преломления.
Другие методы получения
1,1-Циклобутандикарбоновая кислота была получена омыле-
омылением ее этилового эфира2 или полунитрила—1-циан-1-карбокси-
циклобутана8. Этиловый эфир 1,1-циклобутандикарбоновой кисло-
кислоты был получен конденсацией малонового эфира с триметилен-
1,1-ЦИКЛОБУТАНДИКАРБОНОВАЯ КИСЛОТА
493
бромидом2 или триметиленхлорбромидом4*. Полунитрил был по-
получен конденсацией триметиленбромида с циануксусным эфиром
с последующим омылением эфира до кислоты3.
Циклобутанмонокарбоновая кислота была получена декарбо-
ксилированием 1,1-циклобутандикарбоновой кислоты2'5 и дс-
карбоксилированием 1-циан-1-карбоксициклобутана с последую-
последующим омылением нитрильной группы3.
1 F i e s е г, Experiments in Organic Chemistry, 2nd Ed., D. C. Heath
and Co., N. Y., 1941, p. 385 (внизу).
2 P e r k i n, J. Chem. Soc, 51, 1 A887); Riipe, Ann., 327, 183 A903).
"Carpenter, Perkin, J. Chem. Soc, 75, 930 A899).
4 К и ж н е р, ЖРФХО, 37, 507 A905).
5 Р е г k i n, Sinclair, J. Chem. Soc, 61, 40 A892).
* Этот метод, предложенный Н. М. Кижнером, имеет особенно большое
значение, так как благодаря пониженной реакционной способности хлора по
сравнению с бромом выход эфира иентан-4,4,5,5-тетракарбоновой кислоты,
являющегося одним из главных побочных продуктов при получении эфира
1,1-циклобутандикарбоновой кислоты по способу Перкина, заметно уменьшает-
уменьшается. Поэтому выход 1,1-циклобутандикарбонового эфира при получении его по
способу Кижнера гораздо выше (до 40%), чем при использовании приведенной
здесь прописи, в основе которой лежит способ Перкина.
Дальнейшим усовершенствованием способа Кижнера является предложен-
предложенное В. П. Гольмовым и Б. Л. Казанским проведение реакции в две стадии
с выделением промежуточного продукта—^-хлорпропилмалонового эфира. Как
показало исследование механизма реакции, выход 1,1-циклобутандикарбонового
эфира прн получении его но методу Кижнера заметно снижается благодаря
обратимой реакции
СООСзН5 СООСаН5
С1СН2СН,СН„СН, +CHNa ^±
СООС3Н5
СООС„Н5
/ "
\
СООС2Н5
СООС,Н5
/
/
ClCH3CH2CH2CHNa
СООС2Н5
/
+CH2
СООС2Н5
Возникающий таким образом -у-хлорпропилнатриймалоновый эфир может
вступать во взаимодействие с непрореагировавшим еще триметилеихлорброми-
дом, образуя ди-[-у-хлорпропил]-малоновый эфир (С1СН2СНаСНгJС(СООС2Н3J.
Чтобы сдвинуть реакцию образования ^"хлоРпРопилнатРиймалонового эфира
влево, Гольмов и Казанский предложили прибавлять на первой стадии реакции
избыток малонового эфира, который может быть затем выделен обратно. При
таком способе синтеза 1,1-циклобутандикарбоновый эфир получается с выходом
60% от теоретического количества, считая на триметиленхлорбромид. Подроб-
Подробная пропись получения диэтилового эфира 1,1-циклобутандикарбоновой кисло-
кислоты по указанному способу приведена в книге «Синтезы органических соединений»,
сб. 1 изд. АН СССР, 1950, стр. 93, а также в журнале ДАН, 33, 37 A941).
Недавно Т. Л. Фаворской и И. П. Яковлевым [ЖОХ, 22, 125 A952)]
первая стадия этой реакции была проведена при более низкой температуре,
чем в опытах Гольмова и Казанского (при 35J вместо нагревания на кипя-
кипящей водяной бане). {Прим. ред.)
494
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
С
=\_
CH2CN
>- CHCN
«-ЦИКЛОГЕКСИЛФЕНИЛАЦЕТОНИТРИЛ
NaNI-l2
СбИцВг
Толуол
Предложили: Э. Хэнкок и А. Коп
Проверили: Н. Дрвйк и В. Смит.
Получение
Трехгорлую колбу емкостью в 1 л снабжают мешалкой с ртут-
ртутным затвором, трубкой для ввода аммиака и обратным холодиль-
холодильником, который соединяют при помощи трубки, содержащей
натронную известь, с ловушкой для поглощения газов («Синг. орг.
преп.», сб. 2, стр. 78, рис. 3). Отдельные части прибора сушат
в сушильном шкафу и прибор быстро собирают, чтобы исключить
попадание в него влаги воздуха. Рекомендуется устанавливать
прибор под тягой, так как во время реакции случайно может
выделиться аммиак. Колбу охлаждают в бане с сухим льдом и
трихлорэтиленом и затем вводят в нее через трубку для ввода
газа 200 мл безводного аммиака (применяемого для рефрижера-
рефрижераторов) из баллона, который либо повернут вентилем вниз, либо
снабжен сифоном. Непосредственно перед сборкой прибора от-
отрезают 8,1 г @,35 грамматома) натрия, взвешивают его и помещают
в небольшой стакан под керосин. Баню с сухим льдом отставляют,
трубку для ввода газа заменяют резиновой пробкой ив колбу
вносят кристаллик (около 0,2 г) водного азотнокислого железа.
Затем от взвешенного куска натрия отрезают небольшой кубик
(с ребром около 5 мм), быстро обтирают его фильтровальной бума-
бумагой и немедленно помещают в жидкий аммиак. Раствор перемеши-
перемешивают до тех пор, пока не исчезнет его голубая окраска, после чего
прибавляют оставшийся натрий в виде узких тонких полосок с
такой скоростью, с какой только можно их нарезать и обтереть,
причем во время прибавления раствор энергично перемеши-
перемешивают (примечание 1). Когда цвет жидкости из голубого станет
серым, реакционную смесь взбалтывают от руки кругообраз-
кругообразным движением до тех пор, пока голубые крапинки натрия,
разбрызганные по верхней части колбы, не будут смыты
в раствор.
Колбу вновь охлаждают в бане с сухим льдом и затем в те-
течение 10 мин. прибавляют к ее содержимому через сухую капель-
капельную воронку 41 г @,35 моля) цианистого бензила (примечание 2).
а-ЦИКЛОГЕКСИЛФЕНИЛАЦЕТО НИТРИЛ
495
Баню с сухим льдом отставляют, прозрачный раствор перемеши-
перемешивают около 15 мин., после чего прибавляют к нему по каплям
через капельную воронку 200 мл сухого, не содержащего серы то-
толуола (примечание 3) и 25 мл абсолютного эфира, в то время как
аммиаку предоставляют испаряться. Раствор оставляют стоять
или нагревают на водяной бане до тех пор, пока он не примет
комнатной температуры. Аммиаку можно дать испаряться с ма-
максимальной скоростью, при которой газ не вырывается через ртут-
ртутный затвор мешалки. Чтобы удалить оставшийся аммиак, прекра-
прекращают доступ воды в обратный холодильник, нагревают колбу
на горячей водяной бане и отгоняют большую часть эфира (и ам-
аммиака) через обратный холодильник.
Затем обратный холодильник снабжают свеженаполненной
осушительной трубкой, вновь пускают в него воду и в течение при-
примерно 20 мин. к теплому раствору в колбе прибавляют 65,2 г
@,4 моля) бромциклогексана (примечание 4). Реакция протекает
бурно, и может потребоваться охлаждение. Кипячение с обратным,
холодильником продолжают в течение еще 2 час. на масляной
бане. Затем реакционную смесь охлаждают и промывают 300 мл
воды. Водный слой экстрагируют двумя порциями бензола по
50 мл и соединенные вместе бензольный и толуольные растворы
промывают двумя порциями воды по 50 мл и перегоняют в вакууме
из специальной колбы Клайзена емкостью 500 мл. Выход а-цикло-
гексилфенилацетонитрила с т. кип. 174—176е A3 мм) (примеча-
(примечание 5) составляет 45—53 г F5—77% теоретич.). Дестиллат затвер-
затвердевает в кристаллическую массу, температура плавления которой
50—53,5°. Нитрил можно перекристаллизовать из продажного
пентана. Потери при этом составляют около 15%. Температура
плавления после перекристаллизации 56—58°.
Примечания
1. Сильное перемешивание и прибавление натрия маленькими
кусочками сокращают время, необходимое для полного превраще-
превращения натрия в амид натрия.
2. Был применен дважды перегнанный цианистый бензил1
с т. кип. 108—110° A3 мм).
3. Был применен толуол, хранившийся над натриевой прово-
проволокой. Вместо толуола можно использовать бензол, не содер-
содержащий тиофена; однако этот реагент менее пригоден, так как
при прибавлении к раствору в жидком аммиаке он затвер-
затвердевает.
4. Продажный бромциклогексан был высушен над хлори-
хлористым кальцием и перегнан.
5. При давлении 9 мм т. кип. 165—167°.
496
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Другие методы получения
а-Циклогексилфенилацетонитрил был получен при действии
на натриевое производство, синтезированное из цианистого бен-
бензила и амида натрия, бромциклогексаном в растворе бензола2
или эфира3.
1Адамс, Таль, Синт. орг. преп.,- сб. 1, стр. 502.
2Венус-Данилова, Большущ, ЖОХ", 7, 2823 A937).
3 V a s i I i u, Bui. Soc. Chim. Romania, 19A, 75 A937) [C. A., 33,
4207 A939)].
Cl (CHaKCN
ЦИКЛОПРОПАНКАРБОНОВАЯ КИСЛОТА
Na0H сн2—chcn н.о сн3—снсоон
/
CH2
CH2
Предложили: '/. Мак-Клоски и Дж. Кольмэн.
Проверили: Ч. Аллен и Г. Крессмэн.
Получение
В 2-литровую круглодонную трехгорлую колбу, снабженную
двумя большими холодильниками (примечания 1 и 2) помещают,
150 г C,75 моля) едкого натра в порошке (примечание 3) и 103,5 г
A моль) нитрила -рхлормасляной кислоты1. Колбу встряхивают,
тщательно перемешивая ее содержимое, и нагревают смесь на па-
паровой бане; это приводит к довольно бурной реакции (примеча-
(примечание 4). Образующаяся в ходе процесса вода омыляет часть нитрила
циклопропанкарбоновой кислоты, так что через 1 час после на-
начала нагревания в колбе остается очень небольшое количество
жидкости. Омыление нитрила завершают добавлением к смеси
воды небольшими порциями в течение примерно 2 час. Сперва
прибавляют 15—20 мл воды, а затем с перерывами в 10—15 мин.
порции по 60—75 мл, продолжая эту операцию до тех пор, пока не
будет прибавлено всего 500 мл. Затем при периодическом переме-
перемешивании смесь нагревают в течение еще 1,5 часа; к концу этого
времени маслянистый слой исчезает.
Раствор охлаждают в бане со льдом и подкисляют 200 г кон-
концентрированной серной кислоты (уд. вес 1,84), к которой пред-
предварительно прибавлено 300 г колотого льда. Раствор вновь охла-
охлаждают в бане со льдом. Всплывший слой довольно густой жид-
жидкости, содержащей циклопропанкарбоновую кислоту и смесь
полимеров, отделяют, а холодный водный раствор экстрагируют
один раз 1 л эфира, причем вместо встряхивания применяют пе-
перемешивание с помощью механической мешалки (примечание 5).
Эфирные вытяжки и неочищенную кислоту соединяют вместе
ЦИКЛОПРОПАНКАРБОНОВАЯ КИСЛОТА
497
и сушат над 50 г безводного сернокислого кальция, после чего
растворитель отгоняют на паровой бане из специальной колбы
Клайзена («Синт. орг. преп.», сб. 1, стр. 142, рис. 8) емкостью
500 мл, а остаток перегоняют в вакууме. Выход циклопропан-
циклопропанкарбоновой кислоты ст. кип. 94—95° B6 мм) [117—118° G5 мм)]
составляет 63,5—68 г G4—79% теоретич.; примечание 6).
Примечания
1. Рекомендуется установить прибор в вытяжном шкафу, так
как при реакции выделяется небольшое количество изонитрила.
2. Выход можно несколько увеличить, если при первоначаль-
первоначальной бурной реакции не применять внешнего охлаждения.
3. Если не имеется едкого натра в порошке, то' используют
гранулированный едкий натр, измельченный в ступке. С таким же
успехом можно применять продажное едкое кали в порошке.
4. Реакция начинается примерно через 15 мин. При примене-
применении едкого кали начало реакции наступает уже через 5 мин.
5. Так как имеется тенденция к образованию стойких эмуль-
эмульсий, то рекомендуется избегать сильного взбалтывания. Если
смесь перемешивать в течение 15 мин. с помощью механической
мешалки, то образования эмульсии можно избежать; если эмуль-
эмульсия все же образуется, то ее можно уничтожить обработкой смеси
безводным сернокислым натрием.
6. Авторы синтеза проводили опыты с двойными количест-
количествами исходных реагентов и получали при этом выходы, пропор-
пропорциональные указанному выше.
Другие методы получения
Циклопропанкарбоновая кислота была получена омылением
нитрила этой кислоты (стр. 346), хотя в выделении нитрила нет
никакой необходимости 2~4; нагреванием циклопропандикарбоно-
вой кислоты5'6; действием щелочи на этиловый эфир -[-хлормас-
ляной кислоты7. Последние два метода не имеют, повидимому,
практического значения.
1 Аллен, Синт. орг. преп., сб. !, стр. 495.
2 Н е п г у, Bull. sci. acad. roy. Be!g., C), 36 34 A898) (Chem. Zentr.,
1899, I, 975).
8 К и ж н е р, ЖРФХО, 37, 304 A905); Н. М. К и ж н е р, Исследо-
Исследования в области органической химии, Изд. АН СССР, 1937, стр. 208.
1 В г и у I а п t s, Stassen, Bull, sci acad. roy. Be!g., E) 7 702
A921) (Chem. Zentr., 1922, I, 1229) [C. A., 17, 2872 A923)].
6 P e r k i n, J. Chem. Soc, 47, 815 A885).
«Skraup, Binder, Ber., 62, 1132 A929).
7 R a m b a u d, Bull. soc. chim., E), 5, 1564 A938).
32 Сборник 3
498
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ЦИСТЕИНОВАЯ КИСЛОТА (МОНОГИДРАТ)
[SCH2CH (COaH) NH2 ¦ НС1]2 + 5Вга + 7Н2О -->
—> 2HSO3CH2CH (NH2) CO3H ¦ Н3О + 2НС1 + ЮНВг
Предложил: X. Кларк.
Проверили; Г. Гильман и X. Харвуд.
Получение
К раствору 24 г @,1 моля) цистина («Синт. орг. преп.», сб. 1,
стр. 520) в холодной смеси 150 мл воды и 50 мл концентрированной
соляной кислоты прибавляют в течение 40 мин. по каплям, время
от времени перемешивая раствор, 80 г B5 мл, 0,5 моля) продаж-
продажного брома. Температура смеси поднимается примерно до 60°.
Полученный раствор, в котором содержится немного непрореаги-
ровавшего брома, выпаривают в вакууме на паровой бане. Окра-
Окрашенный в темный цвет кристаллический остаток растворяют
в 100 мл десгиллированной воды и отфильтровывают от неболь-
небольшого количества аморфной нерастворимой примеси. Фильтрат
концентрируют, выпаривая до объема 65 мл на водяной бане,
и оставляют кристаллизоваться в течение ночи в холодильном
шкафу. Кристаллы отфильтровывают с отсасыванием и тщательно
промывают несколькими порциями 95%-ного этилового спирта
(всего около 100 мл), причем промывную жидкость собирают от-
отдельно. Кристаллы сушат в вакууме над фосфорным ангидридом.
Для получения второй порции кристаллов промывную жидкость
разбавляют равным по объему количеством воды, выпаривают
разбавленный раствор до полного удаления спирта (примечание 1)',
прибавляют остаток к маточному раствору и выпаривают соединен-
соединенные вместе растворы досуха на водяной бане. Остаток растворяют
в 30—40 мл воды и обесцвечивают с помощью 0,5—1,0 г активиро-
активированного древесного угля, после чего раствор упаривают до 15 мл
и по охлаждении обрабатывают 30 мл 95%-ного этилового спирта.
Полученные таким образом кристаллы отфильтровывают, промы-
промывают этиловым спиртом и сушат, как было указано выше (приме-
(примечание 2). Общий выход чистого моногидрата цистеиновой кислоты
составляет 30,5—33,5г (81—90% теоретич.). Вещество плавится
с обильным выделением газа при 278 B89° исправл.; примеча-
примечание 3) и обладает удельным вращением [а]Ц6 + 9,36° F% в воде).
Примечания
1. Цистеиновая кислота, повидимому, легко подвергается
этерификации при нагревании с этиловым спиртом, но получен-
полученный эфир быстро гидролизуется при нагревании с разбавленьой
минеральной кислотой.
о-ЭВГЕНОЛ
499
2. Из конечных маточных растворов при выпаривании досу-
досуха получают 2—3 г светлобурого аморфного вещества, которое
легко растворимо вводе, но нерастворимо в95%-номспирте. В кон-
концентрированной бромистоводородной кислоте этот побочный про-
продукт образует темный раствор, окраска которого при разбавлении
водой бледнеет.
3. Температуры разложения, равной 278°, можно достигнуть,
если поместить капилляр в баню, предварительно нагретую до
260—270°. Если пробу нагревать медленно, начиная с комнатной
температуры, то наблюдается температура разложения 257—258°.
Другие методы получения
Наиболее удобным окислителем для получения цисгеиновой
кислоты из цистина является водный раствор брома1. Иод2 и пере-
перекись водорода3 также вызывают эту реакцию, однако при их при-
применении некоторое количество серы отщепляется в виде серной
кислоты.
1 Friedmann, Beitr. Chera. Physiol. u. Pathol., 3, 1A903).
2 Y a m a z a k i, J. Biochem. (Japan), 12, 207 A930); Shi n о h a r a
J, Biol. Chem., 96, 285 A932).
8Sch6berl, Z. physiol. Chem., 216, 193 A933).
о-ЭВГЕНОЛ
OH
BrCH2CH=CH2
K2CO3
OCH2CH = CH
CH2CH = CH2
A/OH
Нагревание
OCH3
Предложили: Ч. Аллен и Дж. Гейтс, мл.
Проверили: В. Бахман и I/. Дено.
Получение
Аллиловый эфир гваякола. В круглодонной колбе емкостью
500 мл кипятят с обратным холодильником в течение 8 час. на
паровой бане смесь 63 г @,5 моля) гваякола,' 66 г @,55 моля)
бромистого аллила1, 70 г безводного поташа @,5 моля) и 100 мл
сухого ацетона, после чего смесь охлаждают, разбавляют водой
B00 мл) и экстрагируют двумя порциями эфира по 100 мл. Со-
32*
500
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
единенные вместе вытяжки промывают двумя порциями 10%-ного
едкого натра по 100 мл (примечание 1) и сушат над 50 г безводного
поташа. После отгонки растворителя оставшееся масло (примеча-
(примечание 2) перегоняют в вакууме. Выход аллилового эфира гваякола с
т. кип. 110—113° A2 мм) составляет 66—75 г (80—90% теоретич.).
о-Эвгенол. Аллиловый эфир гваякола G0 г) осторожно (приме-
(примечание 3) нагревают до кипения в колбе емкостью 500 мл и остав-
оставляют его кипеть с обратным холодильником в течение 1 часа,
а затем охлаждают. Маслянистую жидкость растворяют в 100 мл
эфира (примечание 4) и раствор экстрагируют тремя порциями
10%-ного раствора едкого натра по 100 мл. Соединенные вместе
щелочные вытяжки подкисляют 100 мл концентрированной соля-
соляной кислоты, разбавленной 100 мл воды, и смесь экстрагируют
тремя порциями эфира по 100 мл. Объединенные эфирные вытяжки
сушат над 50 г безводного сернокислого натрия, эфир отгоняют,
а оставшееся масло перегоняют в вакууме. Выход о-эвгенола
с т. кип. 120—122° A2 мм) (примечание 5) составляет 56—63 г
(80—90% теоретич.).
Примечания
1. Можно выделить обратно небольшое количество гваякола
при подкислснии щелочных промывных вод и экстрагировании
их эфиром.
2. Если сырой аллиловый эфир гваякола подвергуть перегруп-
перегруппировке без предварительной перегонки, то выходы о-эвгенола
будут примерно на 10% ниже, чем получаемые в случае перегнан-
перегнанного эфира.
3. Иногда эта перегруппировка протекает довольно бурно,
причем, после того как она начнется, требуется лишь незначитель-
незначительное подогревание. Имеются указания на то, что для перегруппи-
перегруппировок такого типа хорошим растворителем является диметил-
анилин2.
4. Во всех стадиях данного синтеза эфир можно заменять
бензолом.
5. Температура кипения при других давлениях: 250—251°
G60 ям), 125° A4 мм) и 115° (9 мм).
Другие методы получения
Аллиловый эфир гваякола был получен из гваякола, спир-
спиртового раствора едкого кали и нодистого аллила3 или из гваякола,
бромистого аллила и поташа в растворе ацетона4'5. о-Эвгенол был
получен перегруппировкой аллилового эфира гваякола''-5; нагре-
нагреванием до 210° З-метокси-2-аллилоксибензальдегида6; нагрева-
нагреванием З-метокси-2-аллилоксибензойной кислоты до температуры,
превышающей ПО0'.
ЭТИЛОВЫЙ ЭФИР БЕНЗАЛЬМАЛОНОВОИ КИСЛОТЫ
501
1 К а м м, Марвел, Синт. орг. преп., сб. 1, стр. 110.
2 Тарбэлл, Органические реакции, сб. 2, Издатинлит, 1950, стр. 32.
3 М arf ori, Annali di chimica e di farmacologia, E), 12 115; Jahresb.,
1890, 1196.
4 Claisen, Eisleb, Ann., 401, 52 A913).
5 Clai sen, Ber., 45, 3161 A912); герм. пат. 268099 [Chem. Zentr.,
1914, I, 308; Frdl., 11, 181 A912—1914)].
«Claisen, Eisleb, Ann., 401, 112, 114 A913).
'Claisen, Ann., 418, 117 A919).
ЭТИЛОВЫЙ ЭФИР БЕНЗАЛЬМАЛОНОВОЙ КИСЛОТЫ
С6Н5СНО+СН2(СООС2Н5J
пиперидин
= С(СООС2Н5)„
Предложили: Ч. Аллен и Ф. Спэнглгр.
Проверили: Р. Шрайнгр и Ф. Нейман.
Получение
В 1-литровую колбу, снабженную колонкой Кларка — Рарса
(стр. 314) с водоотделителем, к которому присоединен обратный
холодильник, помещают 100 г @,63 моля) малонового эфира (при-
(примечание 1), около 72—76 г продажного бензальдегида (примеча-
(примечание 2), 2—7 мл пиперидина (примечание 3) и 200 мл бензола.
Смесь энергично кипятят на масляной бане при 130—140° до тех
пор, пока не перестанет собираться вода (всего 12—13 мл); эта
операция занимает 11 —18 час. После того как смесь охладится,
к ней прибавляют 100 мл бензола и раствор промывают двумя
порциями воды по 100 мп, двумя порциями 1 н. раствора соляной
кислоты по 100 мл и, наконец, 100 мл насыщенного раствора
двууглекислого натрия. Водные промывные растворы взбалтывают
с одной порцией бензола в 50 мл и бензольную вытяжку присоеди-
присоединяют к промытому слою органического вещества. Раствор сушат
над 30 г безводного сернокислого натрия. Бензол отгоняют на
паровой бане под пониженным давлением и остаток перегоняют
в вакууме из специальной колбы Клайзсна емкостью 250 мл
(стр. 68, рис! 7), которую тщательно изолируют асбестом. Выход
бесцветного этилового эфира бензальмалоновой кислоты с
т. кип. 140—142° D мм) (примечание 4) составляет 137—142 г
(89—91% теоретич.; примечание 5).
Примечания
1. Температура кипения малонового эфира 94—96е A6 мм).
При проверке применялся предварительно перегнанный малоно-
малоновый эфир.
502
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
2. Вполне пригоден продажный бензальдегид, содержащий
2—8% бензойной кислоты. Титрованием образца в нейтральном
этиловом спирте стандартной щелочью определяют содержание
в нем кислоты и берут такое количество альдегида, которое со-
содержит 70 г @,66 моля) чистого вещества. Проверявшие исполь-
использовали 76 г продажного бензальдегида, который содержал 8%
бензойной кислоты. Если применять чистый бензальдегид, то
к нему следует прибавить 2 г бензойной кислоты.
Было показано1, что именно соли пиперидина, а не свободное
основание, действуют в качестве катализатора в реакции Кновс-
нагеля. При проверке в случаях применения бензальдегида, со-
содержащего менее 0,2% бензойной кислоты, был получен выход
только в 71%.
3. Количество пиперидина, которое берут для реакции, за-
зависит от содержания бензойной кислоты в бензальдегиде; оно долж-
должно несколько превышать количество, необходимое для нейтрали-
нейтрализации бензойной кислоты. На 1 г кислоты требуется около 1,2 мл
пиперидина.
4. При давлении 10 мм т. кип. 179—181°. Данные для темпе-
температуры кипения этилового эфира бензальмалоновой кислоты,
встречающиеся в литературе, колеблются очень сильно. Наблю-
Наблюдаемая температура зависит от степени перегрева и от скорости
перегонки.
5. Метиловый эфир бензальмалоновой кислоты [т. кип.
143—146° B мм); 169—171° {10мм)] можно получить по той же
методике и в том же приборе с выходом 90—94%.
Другие методы получения
Этиловый эфир бензальмалоновой кислоты был получен эте-
рификацией бензальмалоновой кислоты в присутствии концен-
концентрированной серной кислоты2; действием бензальдихлорида на
натриймалоновый эфир3; конденсацией бензальдегида с малоновым
эфиром в присутствии хлористого водорода4'5, уксусного ангид-
ангидрида8 или спиртового раствора пиперидина или аммиака7;
действием бромистого фенилмагния на оксиметиленмалоно-
вый эфир8.
1 К u h п, Badstubner, Grundmann, Ber., 69, 98 A936).
2 S t u a r t, J. Chem. Soc. 47, 158 A885).
3 A v e г у, В о u t о n. Am. Chem. J., 20 510 A898)
4 Cl a i s e n, Ber., 14, 348 A891).
5 Claisen, Crismer, Ann., 218, 131 A883).
6 Knoevenagel, Ber., 31, 2591 A898); Gravel, Nat. canadien,
57, 181 A931) [C. A., 28, 169 A934)].
7 Герм. пат. 97734 [Frdl., 5, 906 A898—1900)].
8 Reynolds, Am. Chem. J., 44, 314 A910)'.
ЭТИЛОВЫЙ ЭФИР БЕНЗОИЛУКСУСНОЙ КИСЛОТЫ
503
ЭТИЛОВЫЙ ЭФИР БЕНЗОИЛУКСУСНОЙ КИСЛОТЫ
СН3СОСНаСО2С2Н5 + QjH5ONa —> [CH3COCHCO2C2Fe] Na + C2HSOH
[СН3СОСНСО3С2Н5] Na-C6H5CO2C2H5-> lCeH5COCHCO2C2H5] Na+CH3CO2C2H5
[C6H5COCHCO2C2H5]Na + H2
-> CeHsC0CHaCO2C2H5 + NaHSO4
Предложили: С. Мак-Эдьвен и К- Вебер.
Проверили: Р. Шрайнер и К- Тилфорд.
Получение
Трехгорлую колбу емкостью 2 л устанавливают на паровой
бане и снабжают обратным холодильником, делительной ворон-
воронкой и эффективной мешалкой с жидкостным затвором. В колбу
помещают 600 мл абсолютного спирта и к нему постепенно прибав-
прибавляют 46 г B грамматома) чистого натрия, нарезанного мелкими
кусками*. Раствор этилата натрия перемешивают и охлаждают до
комнатной температуры, после чего через делительную воронку
к нему медленно прибавляют 267 г B60 мл, 2,05 моля) ацетоук-
сусного эфира (примечание 1). Затем обратный холодильник заме-
заменяют невысокой насадкой и спирт отгоняют при комнатной темпе-
температуре в вакууме водоструйного насоса. После отгонки примерно
половины спирта выпадает в осадок такое количество натрий-
адетоуксусного эфира, что перемешивание приходится прекратить.
Когда остаток становится сухим (примерно через 2 часа), по-
последние следы спирта отгоняют, нагревая колбу в течение 1 часа
на паровой бане при давлении 2 мм. Колбу оставляют охлаждаться
до комнатной температуры, не снимая вакуума.
К охлажденному остатку натрийацетоуксусного эфира прибав-
прибавляют 600 г E70 мл, 4 моля) этилового эфира бензойной кислоты.
Паровую баню заменяют масляной, температуру которой повышают
до 140—150° и поддерживают на этом уровне в течение 6 час.
Затем в течение еще 1 часа температуру бани постепенно повышают
до 180° (примечание 2). Дестиллат, собранный за этот последний
период нагревания, состоит главным образом из уксусноэтило-
вого эфира и этилового спирта. Выход составляет 200—210 г.
Реакционную смесь охлаждают, прибавляют к ней 250 мл
воды и подкисляют до кислой реакции на лакмус прибавлением
охлажденного раствора 100 г концентрированной серной кислоты
в 200 мл воды. Если потребуется, то для поддержания смеси в хо-
холодном состоянии прибавляют колотый лед. Верхний слой слож-
сложного эфира отделяют, а водный слой экстрагируют 200 мл эфира.
Эфирную вытяжку присоединяют к основной массе и раствор
взбалтывают с 350 мл насыщенного раствора двууглекислого нат-
натрия до тех пор, пока не прекратится выделение углекислого газа,
* Более удобный способ получения этилата натрия приведен на
стр. 491, примечание 1.
504
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
после чего органический слой промывают 200 мл воды. Водный
слой присоединяют к раствору двууглекислого натрия и все вме-
вместе экстрагируют 400 мл эфира. Соединенные вместе эфирные рас-
растворы сушат над сернокислым натрием. Эфир отгоняют на паровой
бане; затем избыток этилового эфира бензойной кислоты и ацето-
уксусного эфира (примечание 3) отгоняют при пониженном давле-
давлении, пользуясь дефлегматором высотой 15 см. Этиловый эфир
бензоилуксусной кислоты перегоняют (примечание 3) при
101 — 106° A лш)[130—135° (Злш)]. Выход сложного эфира, кипя-
кипящего в пределах 5°, составляет 190—210 г E0—55% теоретич.,
считая на ацетоуксусный эфир).
Примечания
1. Продажный ацетоуксусный эфир был перегнан и была ис-
использована фракция с т. кип. 68—69° A1 мм).
2. В продолжение последнего часа нагревания отгоняется
около 20 г смеси уксусноэтилового эфира и спирта.
3. Смесь ацетоуксусного эфира и этилового эфира бензойной
кислоты A00—150 г) была собрана при 75—90° A2 мм), после
чего отогналось 250—300 г чистого этилового эфира бензойной
кислоты с т. кип. 90—93° A3 мм). Отгонка этих фракций произво-
производилась с дефлегматором высотой 15 см. Оставшийся этиловый
эфир бензоилуксусной кислоты был перегнан с невысокой насад-
насадкой без дефлегматора.
Другие методы получения
Другие методы получения этилового эфира бензоилуксуспой
кислоты приведены в «Синт. орг. преп.», сб. 2, стр. 584.
ЭТИЛОВЫЙ ЭФИР БРОМУКСУСНОЙ КИСЛОТЫ
Пиридин
СНзСООН + Вг2 > ВгСНаСООН + НВг
(СН3СОJО
H2SO4
ВгСНаСООН + С2Н5ОН > ВгСНаСООСаН5 + Н2О
Предложили: С. Нательсон и С. Готтфрид.
Проверили: Н. Драйк и С. Хейвуд.
Получение
Бромуксусная кислота (примечание 1). В 3-литровую колбу,
снабженную капельной воронкой, конец которой погружен в
жидкость, и обратным холодильником, защищенным хлоркаль-
циевой трубкой (примечание 2), помещают смесь 1 л A7,5 моля,
ЭТИЛОВЫЙ ЭФИР БРОМУКСУСНОЙ КИСЛОТЫ
505
30 (нар д)
избыток) ледяной уксусной кислоты, 200 мл уксусного ангидрида
и 1 мл пиридина. Прибавляют несколько стеклянных бусинок
и смесь нагревают до кипения. После этого источник нагревания
удаляют, прибавляют к смеси около 1 мл брома и предоставляют
реакции идти до тех пор, пока жидкость не станет бесцветной
(примечание 3). Затем прибавляют остальное количество брома,
равное 1 124 г C60 мл, 7,03 моля; примечание 4), с такой скоростью,
с какой он будет вступать в реакцию (примечание 5); в продол-
продолжение этого периода (около 2,5 часа) с помощью горелки поддер-
поддерживают слабое кипение реакционной
массы. Когда будет прибавлено около
половины брома, жидкость окраши-
окрашивается в вишневый цвет, который со-
сохраняется в течение остального време-
времени бромирования. После прибавления
всего брома смесь нагревают до тех
пор, пока она не станет бесцветной.
Затем смеси дают охладиться и мед-
медленно прибавляют к ней 75 мл воды,
чтобы гидролизовать уксусный ангид-
ангидрид. Избыток уксусной кислоты и воду
отгоняют на кипящей водяной бане при
давлении около 35 мм. Когда выпа-
выпаривание будет закончено, остаток при
охлаждении начинает кристаллизо-
кристаллизоваться; выход чистой бромуксусной ки-
кислоты, из которой почти целиком состо-
состоит этот остаток, равен 845—895 г (при-
(примечание 6).
Этиловый эфир бромуксусной кис-
кислоты. Для этерификации можно при-
применить прибор, рассмотренный при опи-
описании получения безводной щавелевой кислоты («Синт. орг. преп.»,
сб. 1, стр. 522); однако в данном случае отделитель устроен так,
что более легкая жидкость возвращается в реакционную колбу,
а более тяжелую (воду) спускают из нижней части отделителя.
Можно пользоваться несколько более простым прибором, в кото-
котором отделитель для воды имеет вид, изображенный на рис. 21
(примечание 7). Неочищенную бромуксусную кислоту помещают
в 3-литровую колбу вместе с 610 мл спирта (9,9 моля, избыток)
и 950 мл бензола. Для ускорения реакции туда же прибавляют
около 1,5 мл концентрированной серной кислоты (примечание 8)
и кипятят смесь на водяной бане, причем во время реакции воду
из отделителя сливают и измеряют. От бензола отделяется около
296 мл жидкости (состоящей примерно на 50% из спирта и на
50% из воды); в это количество входит вся вода, образующаяся
;; (нар.д.)
Рис. 21. Все размеры даны
в миллиметрах.
506
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
во время реакции, а также избыток спирта. Когда отделение
воды от бензола прекратится, к реакционной смеси прибавляют
75 мл спирта и продолжают нагревание в течение получаеа.
Если реакция закончена, то дестиллат более не расслаивается.
Показателем окончания реакции является также то, что бензол,
поступающий из боковой трубки отделителя, становится про-
прозрачным и скорость стекания флегмы из холодильника значительно
уменьшается. Количество бензола, которое па этой стадии
конденсируется и удаляется через отделитель, составляет 150 мл.
Смесь переносят в делительную воронку и промьтают один
раз 1 500 мл воды, один раз 1 500 мл 1 %-ного раствора двуугле-
двууглекислого натрия и, наконец, 1 500 мл воды. Затем смесь сушат
над безводным сернокислым натрием и фракционируют при атмо-
атмосферном давлении на масляной бане с применением елочного дефлег-
дефлегматора высотой 30 см (примечание 9). Собирают фракцию, кипя-
кипящую при 154—155° G59 мм) (примечание 10). Выход составляет
примерно 818 г F5—70% теоретич.).
Примечания
1. Пары этилового эфира бромуксусной кислоты чрезвычайно
раздражающе действуют на глаза. Препарат необходимо хранить
в герметически закрытых сосудах и применять в открытой по-
посуде только в хорошо действующем вытяжном шкафу.
2. Рекомендуется работать с целыюспаянным стеклянным
прибором. Если это невозможно, применяют асбестовые пробки
с одним отверстием. Для приготовления таких пробок полоски
асбеста пропитывают водой и оборачивают ими стеклянные трубки
нужного размера до тех пор, пока не будет достигнут желаемый
диаметр, после чего пробки сушат при 110°.
3. Индукционный период до начала реакции и до исчезновения
окраски, вызванной бромом, продолжается около 10 мин.
4. Химически чистый бром можно применять непосредственно.
Технический бром следует высушить взбалтыванием с концентри-
концентрированной серной кислотой.
5. Бром следует прибавлять не слишком быстро, так, чтобы
не было потерь через холодильник.
6. Чистую бромуксусную кислоту можно получить перегонкой
сырого препарата из колбы Клайзена, которую погружают в ма-
масляную баню и снабжают закутанным елочным дефлегматором
высотой 20 см. Собирают фракцию с т. кип. 108—110° C0 мм).
Выход составляет 775—825 г (80—85% теоретич.).
7. Отделитель, показанный на рис. 21, является видоизменением
этого прибора, применяемого для определения содержания воды
по методу Дина и Старка1. Размеры отделителя можно изменять
в зависимости от индивидуальных целей, поскольку этот вопрос
этиловый эфир бромуксусной кислоты
507
касается главным образом удобства. Отделитель можно применять
без внутренней воронки, но при ее наличии (К- Келын, частное
сообщение) конденсат разделяется на два слоя быстро и полностью,
причем жидкость, стекающая из холодильника, не вызывает
перемешивания обеих фаз в отделителе. Ножка воронки должна
быть такой длины, чтобы верхний край воронки находился выше
бокового отвода отделителя. Трубку отделителя можно градуиро-
градуировать, однако это не обязательно.
8. В отсутствие катализатора реакция протекает медленнее
и выходы получаются меньшими. Серную кислоту можно заменить
фосфорной, однако применение серной кислоты дает лучшие выходы
в более короткое время.
9. Если не применять дефлегматора, то в головном погоне
можно потерять 15—20% вещества.
10. Собирают фракцию, кипящую в пределах одного градуса.
В различные дни, в зависимости от атмосферного давления,
наблюдались колебания температуры кипения в пределах от
154—155° до 158—159°.
Другие методы получения
Бромуксусная кислота была получена прямым бромированием
уксусной кислоты при высоких температурах и давлениях2
или бромированием в присутствии в качестве катализатора без-
безводного хлористого водорода5, а также при проведении этого про-
процесса в присутствии красного фосфора с образованием броманги-
дрида бромуксусной кислоты60. Кроме того, бромуксусная кисло-
кислота была получена из хлоруксусной кислоты и бромистого водорода
при высоких температурах"; окислением бромистого этилена
дымящей азотной кислотой7; окислением спиртового раствора бром-
ацетилена кислородом воздуха8; гидролизом этил-а,р-дибромвини-
лового эфира8. Уксусная кислота была превращена в бромангидрид
бромуксусной кислоты действием брома в присутствии красного
фосфора, а этиловый эфир бромуксусной кислоты был синтезиро-
синтезирован действием спирта на этот бромангидрид104. Этиловый эфир
бромуксусной кислоты был также получен непосредственным
бромировапием уксуспо-этилового эфира при высоких темпера-
температурах 15'16; действием спирта на бромуксусный ангидрид17; дей-
действием трехбромистого фосфора на этиловый эфир гликолевой
кислоты18; действием бромистого водорода на диазоуксусный
эфир18. Описанная выше пропись основана на методике, которую
разработали Нательсон и Готтфрид20.
1 D e a n, Stark, Ind. Eng. Chem., 12, 486 A920).
2 P e r k i n, D u p p a, Ann., 108, 106A858).
3 M i с h a e 1, Am. Chem. J., 5, 202 A883).
'Hell, Muhlhauser, Ber., 11, 241 A878); 12, 735 A879).
508
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
5 L a p w о г t h, J. Chem, Soc, 85, 41 A904).
«Demote, Ber., 9, 561 A876).
' К а с h 1 e r, Monatsh., 2, 559 A881).
«Gloeckner, Ann. Suppl., 7, 115 A870).
9 Imbert and Konsort. Electrochem. Ind герм пят. 216716 [Frdl , 9 28
A908—1910); С. Л., 4, 952 A910)].
10 Ward, J. Chem. Soc, 121, 1161 A922).
11 N a u m a n n, Ann., 129, 268 A864).
13 A u w e r s, Bernhardi, Ber., 24, 2218A891),
13Lassar-Cohn, Ann., 251, 341 A889).
14 V о 1 h a r d, Ann., 242, 161 A887).
15 Crafts, Compt. rend., 56, 707 A863); Ann., 129, 50 A864).
16 Schutzenberger, Ber., 6, 71 A873).
17 G a 1, Compt. rend., 71, 274 A870).
"Henry, Ann., 156, 176 A87Q).
970 A939).
19 Curti'u s, J. 'prakt'. Cheni.,"B),' 38, 430 A888).
20 N a t e 1 s о n, Gottfried, J. Am. Chem. Soc, 61,
ЭТИЛОВЫЙ ЭФИР 1,16-ГЕКСАДЕКАНДИКАРБОНОВОЙ КИСЛОТЫ
Электролиз
2С2Н6О2С(СН2KСО2К > QH5O2C (СН,,Iв СО2С2Н6
Предложили: Ш. Сванн, мл., Р. Элер и П. Пинкни.
Проверили: Л. Смит, Дж. Хорнер, мл. и Дж. Клегг.
Получение
К 86,5 г @,38 моля) кислого этилового эфира себаиионовой
кислоты («Синт. орг. преп.», сб. 2, стр. 345) при охлаждении
медленно прибавляют 125—130 мл примерно 3 н. раствора едкого
кали, после чего объем раствора доводят до 250 мл. В результате
получают 1,5 н. раствор калиевой соли моноэтилового эфира себа-
себациновой кислоты.
Приготовленный раствор (примечание 1) переливают в высокий
стакан емкостью 500 мл, снабженный змеевиком для охлаждения
(примечание 2), термометром, мешалкой, платиновым анодом
с поверхностью в 45—55 ом2 (примечание 3) и двумя катодами из
платиновой проволоки (примечание 4). К этому раствору добавля-
добавляют 10 г моноэтилового эфира себациновой кислоты (примечание 5).
Электроды присоединяют к соответствующему источнику посто-
постоянного тока и через элемент пропускают ток в 10 а. Затем
к раствору прибавляют еще 40 г моноэтилового эфира себациновой
кислоты четырьмя равными порциями с интервалами по 10 мин.
(примечание 6). Температуру в элементе поддерживают ниже
50°, пропуская через змеевик холодную воду (примечание 7).
Процесс заканчивается в течение 60—70 мин. Реакцию можно
считать завершенной, когда несколько капель электролита, ото-
отобранные пипеткой, обнаруживают щелочную реакцию на фенол-
фенолфталеин. По истечении первых 45 мин. пробу на щелочную реакцию
следует производить через каждые 10 мин.
ЭТИЛОВЫЙ ЭФИР 1,16-ГЕКСЛДЕКАНДИКАРБОНОВОЙ КИСЛОТЫ 509
Когда электролит становится щелочным, маслянистое веще-
вещество, всплывающее наверх, удаляют при помощи пипетки (приме-
(примечание 8). Это масло промывают равным объемом 10%-ного раство-
раствора поташа (примечание 9), затем равным объемом 3,5%-ной соляной
кислоты и, наконец, два раза водой, каждый раз половинным объ-
объемом. (Если на этой стадии образуется эмульсия, то ее с успехом
можно разрушить добавлением небольшого количества эфира.)
Полученное вещество кристаллизуют из метилового спирта, филь-
фильтруют с отсасыванием и дважды промывают на фильтре охлажден-
охлажденным до 0° метиловым спиртом (примечание 10). Белоснежный
и воскообразный по внешнему виду препарат сушат в эксикаторе
над серной кислотой. Выход вещества с т. пл. 41—42° составляет
16—22 г D0—55% теоретич.). Приведенные данные, касающиеся
процентного выхода, рассчитаны, однако, исходя только из 50 г
кислого этилового эфира себациновой кислоты, израсходован-
израсходованного во второй части синтеза; использованные на приготовление
начального электролита 86,5 г его во внимание не принимаются.
Поэтому приведенный синтез целесообразно проводить лишь в том
случае, если надо поставить несколько последовательных опытов
(примечание 8).
Примечания
1. Чтобы раствор стал гомогенным, приходится иногда слегка
подогревать реакционную смесь на водяной бане.
2. Проверявшие синтез применяли для охлаждения медный
змеевик. Во время электролиза он несколько разрушался: раствор
становился синим й на катодах откладывалась медь.
3. Подходящие размеры для анода: 3,75 X 6,0 еж (двухсторон-
(двухсторонняя поверхность анода, примененного проверявшими синтез, рав-
равнялась 52 см2). Анод следует опустить в раствор на такую глубину,
чтобы масло, собирающееся на поверхности во время электролиза,
не изолировало бы электрода, что может повести к увеличению
плотности тока. Проволоку, отходящую от платиновой пластинки,
можно впаять в стеклянную трубку таким образом, чтобы дей-
действию раствора подвергалась только пластинка.
4. Катоды надо установить на одинаковом расстоянии от анода,
чтобы обеспечить с обеих сторон анода однородную плотность тока.
5. По мере того как в результате электролиза происходит раз-
разложение калиевой соли моноэтилового эфира себациновой кислоты,
свободная кислота образует новую соль. Следовательно, щелочная
реакция раствора может служить указанием на завершение элек-
электролиза.
6. Если 50 г моноэтилового эфира себациновой кислоты при-
прибавить в один прием, то это вызовет очень сильное вспенивание.
7. Прибавление большего количества воды E0 мл) позволяет
более успешно контролировать температуру.
510
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
8. Если требуется получить большее количество вещества,
то к раствору, не выключая тока, можно снова прибавить свобод-
свободную кислоту, после того как образовавшийся препа'рат будет
удален с помощью пипетки. Таким путем можно переработать
от 10 до 15 порций по 50 г моноэтилового эфира себациновой кис-
кислоты. С увеличением числа опытов длительность каждого из них
постепенно возрастает. После 10—15 опытов для превращения
50 г моноэтилового эфира себациновой кислоты необходимо затра-
затрачивать 3,5—4 часа. После этого электролит следует обновить.
9. Непрореагировавший моноэтиловый эфир можно выделить,
если подкислить жидкость, полученную при промывании вещества
поташом, а затем экстрагировать ее эфиром.
10. В растворе в метиловом спирте содержится почти столько
же побочного продукта, сколько и основного вещества. Сперва
выкристаллизовывается в чистом виде основное вещество.
Другие методы получения
Диэтиловый эфир 1,16-гексадекандикарбоновой кислоты был
получен электролизом калиевой соли моноэтилового эфира себа-
себациновой кислоты1.
1 В г о w п, Walker, Proc. Roy. Soc. Edin., 17, 297 A890); Trans.
Roy. Soc. Edin., 36, 222 A890); Ann., 261, 125 A891); Fairweather,
Proc. Roy. Soc. Edin., 45, 283 A925); S h i i n a, J. Soc. Chem. Ind. Japan,
40, Suppl. binding 324 A937) [C. A., 32, 499 A938)].
ЭТИЛОВЫЙ ЭФИР ГИДРАЗИНКАРБОНОВОЙ КИСЛОТЫ И ДИАМИНОБИУРЕТ
(Этиловый эфир гидразинугольной кислоты)
2N(CO2C2H6)S + 5NH2NI12 + H,O _>
—> 3NH2NHCO,C2II5 + NH (CONHNH2J + CO2 + 3QH5OH + NH3
Предложили: Ч. Аллен и А. Белл.
Проверили: Н. Дрэйк и К. Блюмешитейн.
Получение
В 3-литровую круглодонную колбу, снабженную обратным
холодильником, помещают 582 г B,5 моля) эфира N-трикарбоновой
кислоты (стр. 515) и 800 г F,7 моля) 42%-ного гидразин-гидрата
(примечание 1). Колбу встряхивают от руки, чтобы смешать оба
слоя. Вскоре начинается реакция со значительным выделением'
тепла, и все количество эфира N-трикарбоновой кислоты пере-
переходит в раствор (примечание 2). Когда интенсивность реакция
уменьшится, раствор нагревают в течение 1 часа на паровой бане,
а затем упаривают в вакууме до тех пор, пока смесь не превра-
ЭТИЛОВЫЙ ЭФИР ГИДРАЗИН КАРЕ ОН О ВОЙ КИСЛОТЫ
511
тится в густую кашеобразную массу, состоящую из кристаллов
диаминобиурета (примечание 3). Смесь охлаждают, прибавляют
к ней 1л 95%-ного этилового спирта и выкристаллизовавшийся
диаминобиурет отфильтровывают, промывают этиловым спиртом
B50 мл) и сушат. Препарат плавится при 205° (с разложением).
Выход составляет 115—125 г F9—75% теоретич.).
Фильтрат для удаления спирта выпаривают при атмосферном
давлении, а оставшееся масло перегоняют, применяя елочный де-
дефлегматор. Этиловый эфир гидразинкарбоновой кислоты кипит при
92—95° A3 мм). Выход составляет 350—370 г (90—95% теоретич.).
После перегонки в вакууме полученный препарат может закристал-
закристаллизоваться; кристаллы плавятся при 51—52°.
Примечания
1. Эту реакцию можно успешно проводить с указанными выше
количествами; если же брать большие количества исходных веще-
веществ, то целесообразно эфир N-трикарбоновой кислоты разбавить
спиртом, а гидразин-гидрат приливать медленно. Для полного
завершения реакции смесь следует кипятить в течение нескольких
часов с обратным холодильником на паровой бане. При работе
с меньшими количествами исходных веществ никаких затруднений
не встречается.
2. Рекомендуется держать наготове баню со льдом на тот слу-
случай, если реакция пойдет слишком бурно и потребуется быстрое
охлаждение смеси.
3. Если при выпаривании не будет удалено достаточное коли-
количество воды, то в растворе остается слишком много диаминобиу-
диаминобиурета, который будет мешать при перегонке этилового эфира гидра-
гидразинкарбоновой кислоты.
Другие методы получения
Диаминобиурет был получен только из эфира N-трикарбоновой
кислоты и гидразин-гидрата1. Этиловый эфир гидразинкарбоновой
кислоты был получен электролитическим восстановлением нитро-
уретана2 или восстановлением его цинковой пылью и уксусной
кислотой3, а также действием гидразин-гидрата на диэтилуголь-
ный эфир4-5, хлоругольный эфир6 и эфир N-трикарбоновой кис-
кислоты1.
1 D i e I s, Вег., 36, 736 A903).
2 Backer, Rec. trav. chim., 31, 20 A912).
3Thiele, Lachmann, Ann., 288, 293 A895).
4 Diets, Ber., 47, 2186 A914).
5 Merck, герм. пат. 285800 [Frdl., 12, 94 A914—1916)].
«Sidle, Benrath, J. prakt. Chem., B), 70, 276 A904).
512
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ЭТИЛОВЫЙ ЭФИР ДИАЗОУКСУСНОЙ КИСЛОТЫ
СН2 (NH3C1) CO2C2H5 + NaNO2 -> N2CHCO2C2H5 + NaCl + 2Н2О
Предложили: Э. Вомак и А. Нельсон.
Проверили: Р. Шрайнер и К. Тилфорд.
Получение
Круглодонную 1-литровую трехгорлую колбу снабжают дели-
делительной воронкой емкостью 50 мл и механической мешалкой,
затвором которой служит хорошо смазанная резиновая трубка.
Третье горло закрывают пробкой, в которую вставлена стеклянная
трубка, доходящая до дна колбы; другой конец этой трубки вво-
вводится через верхнюю часть в делительную воронку емкостью
1 л и доходит до ее крана.
В колбу наливают раствор 140 г A моль) хлористоводородной
соли этилового эфира глицина1 и 3 г уксуснокислого натрия
в 150 мл воды и охлаждают его, погружая колбу в баню
со льдом и солью, до температуры 2°. Затем к содержимому колбы
прибавляют холодный раствор 80 г A,15 моля) нитрита натрия
в 100 мл воды и перемешивают смесь до тех пор, пока.температура
ее не понизится до 0°. При непрерывном перемешивании темпе-
температуру поддерживают ниже 2° в продолжение всех дальнейших
операций. К холодной смеси приливают 80 мл холодного,
освобожденного от спирта этилового эфира (примечание 1) и Ъ мл
холодной 10%-ной серной кислоты. Через 5 мин. реакционную
смесь передавливают с помощью сжатого воздуха в 1-литровую
делительную воронку. Нижний водный слой быстро пересасывают
обратно в реакционную колбу. Эфирный слой отделяют и немед-
немедленно промывают холодным 10%-ным раствором углекислого
натрия E0 мл). Эфирный раствор должен иметь нейтральную реак-
реакцию на влажную лакмусовую бумажку, в противном случае про-
промывание содой следует повторить. Наконец, эфирный раствор
сушат над 10 г безводного сернокислого натрия.
После этого к реакционной смеси прибавляют при перемеши-
перемешивании вторую порцию в 80 мл освобожденного от спирта этилового
эфира, а затем в течение 5 мин. приливают еще 15 мл холодной
10%-ной серной кислоты. После трехминутного перемешивания
(примечание 2) эфирный слой отделяют так, как это было сделано
в первый раз, немедленно промывают 50 мл свежего 10%-ного
раствора углекислого натрия и сушат над 10 г сернокислого
натрия. Этот процесс повторяют F—7 раз) до тех пор, пока эфир-
эфирный слой не перестанет окрашиваться в желтый цвет. Соединенные
вместе эфирные растворы подвергают перегонке при 20° или при
более низкой температуре в вакууме водоструйного насоса. Пере-
Перегонку продолжают до тех пор, пока не будет отогнан весь эфир.
ЭТИЛОВЫЙ ЭФИР ДИАЦЕТОУКСУСНОЙ КИСЛОТЫ
513
Длительная перегонка может вызвать разложение диазоэфира
и привести к уменьшению выхода. Оставшееся масло желтого
цвета представляет собой практически чистый этиловый эфир
диазоуксусной кислоты, который вполне пригоден для большин-
большинства синтетических целей (примечание 3). Выход составляет око-
около 98 г (85% теоретич.; примечания 4 и 5).
Примечания
1. Для удаления спирта из 600 мл продажного этилового эфира
последний тщательно промывают 75 мл насыщенного раствора
хлористого кальция.
2. Эфирный слой -необходимо отделить от водного слоя как
можно скорее, так как этиловый эфир диазоуксусной кислоты
быстро разлагается кислотой.
3. Этиловый эфир диазоуксусной кислоты можно очистить
перегонкой с водяным паром в вакууме, однако это сопряжено
со значительными потерями2.
4. Авторы метода проводили синтез, используя двойные коли-
количества исходных веществ по сравнению с указанными выше.
5. Препарат следует хранить в темных коричневых склянках
в холодном месте. Использовать его надо по возможности скорее.
Перегонка вещества даже в вакууме представляет опасность,
так как оно иногда взрывается.
Другие методы получения
Этиловый эфир диазоуксусной кислоты был получен действием
нитрита натрия на хлористоводородную соль этилового эфира
глицина3.
1 М а р в е л, Синт. орг. преп., сб. 2, стр. 577.
2 Гаттерман — Виланд, Практические работы по органиче-
органической химии, 5-е изд., Госхимиздат, 1948, стр. 318.
3 С u r t i u s, J. prakt. Chem., B), 38, 396 A888); Silberrad,
J. Chem. Soc, 81, 600 A902).
ЭТИЛОВЫЙ ЭФИР ДИАЦЕТОУКСУСНОЙ КИСЛОТЫ
Mg
СН3СОСН2СО2С2Н5 + СН3СОС1 -> (CH3COJCHCOgC2Hf + (Hg-t-MgCl2)
Предложил: А. Спасов.
Проверили: Н. Дрэйк, Л. Смит и Дж. Уильяме.
Получение
В 1-литровую круглодонную колбу, установленную в масля-
масляной бане (85—90°; примечание 1) и соединенную с обратным холо-
холодильником, защищенным хлоркальциевойтрубкой, помещают 12 г
33 Сборник 3
514
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
@,50 грамматома) магниевых стружек, 130 г A моль) ацето-
уксусного эфира, 200 г бензола (высушенного над металлическим
натрием) и 120 г A,50 моля) хлористого ацетила и кипятят эту
смесь в течение 2 час. Реакционную смесь желтого цвета охлаж-
охлаждают в бане со льдом и сливают жидкую часть в делительную во-
воронку. Остаток в колбе промывают двумя порциями эфира по
50 мл и эфирный раствор выливают в сосуд со льдом. Затем эту
смесь эфира и воды прибавляют к бензольному раствору в делитель-
делительной воронке и все вместе основательно взбалтывают (примеча-
(примечание 2); водный слой отделяют и отбрасывают. Бензольно-эфирный
раствор промывают один раз 500 мл 5%-ного раствора двуугле-
двууглекислого натрия, один раз 50 мл воды и затем сушат над хлори-
хлористым кальцием. Эфир и большую часть бензола отгоняют на водя-
водяной бане, а оставшийся бензол — в вакууме при 50° E0мм). Затем
этиловый эфир диацетоуксусной кислоты осаждают из остатка
в виде медного производного, для чего к остатку приливают 1 200 мл
насыщенного водного раствора уксуснокислой меди (примеча-
(примечание 3). После прибавления указанного реагента колбу время от
времени сильно встряхивают и затем оставляют стоять в течение
1 часа, чтобы обеспечить полное осаждение медного производного.
Медное производное, окрашенное в синий цвет, отфильтровывают
на воронке Бюхнера, промывают двумя порциями воды по 50 мл
и переносят непосредственно в делительную воронку, в которой
его смешивают с 600 мл эфира.
Затем к смеси прибавляют 400 мл 25%-ной серной кислоты
и содержимое воронки непрерывно взбалтывают до тех пор, пока
не исчезнет медное производное E—10 мин.). После отделения
эфирного слоя водный слой экстрагируют двумя порциями эфира
по 100 мл, и соединенные вместе эфирные вытяжки сушат над хло-
хлористым кальцием. Эфир отгоняют на паровой бане, а остаток
(сложный эфир) перегоняют в вакууме. До 90° отгоняется только
несколько капель вещества, основная же масса его перегоняется
при температуре92—98° A2 мм). (После повторной перегонки полу-
получается чистый этиловый эфир диацетоуксусной кислоты с т. кип.
95—97° A2 мм). Выход составляет 80—90 г D6—52% теоретич.).
Примечания
1. При синтезе выделяются водород и хлористый водород;
работать следует в вытяжном шкафу.
2. Большая часть магния остается неизмененной. Ее следует от-
отделить фильтрованием раствора через достаточно тонкую стек-
стеклянную вату, помещенную в обыкновенную воронку.
3. Насыщенный раствор уксуснокислой меди приготовляют
растворением 100 г тщательно измельченного препарата в 1 200 мл
кипящей воды. Если препарат содержит основную соль, то к рас-
ЭТИЛОВЫЙ ЭФИР N-ТРИКАРБОНОВОЙ КИСЛОТЫ
515
твору прибавляют несколько миллилитров уксусной кислоты
и фильтруют его. Перед употреблением раствор охлаждают
до 35°.
Другие методы получения
Клайзен получил этиловый эфир диацетоуксусной кислоты
из натриевого производного ацетилацетона и этилового эфира
хлоругольной кислоты1. Вещество было также получено из нат-
натриевого производного ацетоуксусного эфира и хлористого аце-
ацетила2 и из ацетоуксусного эфира и хлористого ацетила в при-
присутствии магния5.
xClaisen, Ann., 277, 171 A893).
2 J a m e s, Ann., 226, 211 A884).
3 E 1 i о n, Rec. trav. chim., 3, 250 A884).
«Michael, Ber., 38, 2088 A905).
5 О g a t a, Nosaki, Takagi, J. Pharm. Soc. Japan, 59, 105 A939)
[C. A., 33, 4230 A939)].
ЭТИЛОВЫЙ ЭФИР N-ТРИКАРБОНОВОЙ КИСЛОТЫ
(N-Трикарбоновый эфир)
NH2CO2C2H5 + 2ClCO2C2Hs + 2Na -^ N (CO2C2HSK+2NaCl +H2
Предложили: Ч. Аллен и А. Белл.
Проверили: Н. Дрэйк и К. Влюменштейн.
Получение
В 12-литровую круглодопную колбу, снабженную мешалкой,
капельной воронкой и эффективным обратным холодильником, по-
помещают 450 г E молей) уретана (т. пл. 46—48е), 7 500 мл абсолют-
абсолютного эфира и 218 г натрия в виде проволоки (примечания 1 и 2)..
Смесь нагревают; вскоре начинается выделение водорода, сопро-
сопровождаемое образованием натриевого соединения; через 2—3 ча-
часа большая часть металлического натрия переходит в желатино-
образный белый осадок. Пускают в ход мешалку и смесь нагре-
нагревают с обратным холодильником в течение 2 час. Затем колбу
охлаждают снаружи проточной водой и в течение 2 час. медленно
прибавляют к ее содержимому 1 050 г (9,6 моля) этилового эфира
хлоругольной кислоты. Желатинообразный осадок переходит
в порошкообразный, и оставшийся натрий растворяется. После
того как весь сложный эфир будет прибавлен, смесь перемешивают
в течение ночи при комнатной температуре, а затем фильтруют
(примечание 3). Бесцветный остаток промывают 1 л эфира, после
чего эфирные растворы соединяют вместе и эфир отгоняют на
паровой бане (примечание 4). Оставшееся масло перегоняют;
после отделения головного погона, содержащего некоторое коли-
количество уретана, собирают вещество, которое перегоняется при'!
33*
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
143—147° A2 мм). Выход составляет 575—640г E1—57° теоретич.).
После вторичной перегонки весь препарат переходит при
146—147° A2 мм).
Примечания
1. Так как урстан обычно содержит воду, то перед использова-
использованием этого реагента рекомендуется перегнать его и отбросить
первые 10%.
2. Применение натрия в виде проволоки не обязательно.
Реакция будет протекать с тем же успехом при использовании
натрия, нарезанного на кусочки величиной с мелкую горошину.
Самое существенное заключается в том, чтобы натрий был нарезан
на мелкие куски; в противном случае на поверхности металла
образуется защитная пленка, препятствующая дальнейшему
течению реакции.
3. Хлористый натрий выпадает в осадок в очень мелко раздроб-
раздробленном состоянии и быстро забивает поры фильтровальной бумаги.
Перед фильтрованием необходимо оставить смесь стоять в тече-
течение некоторого времени, чтобы дать соли уплотниться; в этом слу-
случае находящуюся над осадком прозрачную жидкость можно
будет быстро профильтровать.
4. При выбрасывании этого остатка следует соблюдать осто-
осторожность, так как в нем неизменно содержится некоторое коли-
количество непрореагировавшего натрия.
Другие методы получения
Этиловый эфир N-трикарбоновой кислоты был получен из уре-
тана при взаимодействии его с натрием и хлоругольным эфиром1,
а также из калиевой соли этилового эфира имидодикарбоновой
кислоты2.
1 Di e I s, Вег., 36, 740 A903).
2 Di e I s, Вег., 36, 742 A903).
ЭТИЛОВЫЙ ЭФИР ФЕНИЛМЕТИЛГЛИЦИДНОЙ КИСЛОТЫ
(Этиловый эфир $-метил-ф-фенилглицидной кислоты)
CjHsCOCHa + ClCHaCO2C2Hs -f NaNH2 ->
-> CeH5C(CH3)—CHCOaQsHs + NaCl + NB,
\/
О
Предложили: Ч. Аллен и Дж. ВанАллан.
Проверили: Н. Дрэйк, и К,. Блюменштейн.
Получение
В 1-литровую круглодонную трехгорлую колбу, снабженную
мешалкой и термометром для измерения низких температур, по-
ЭТИЛОВЫЙ ЭФИР ФЕНИЛМЕТИЛГЛИЦИДНОЙ КИСЛОТЫ
517
метают 120 г A18,5 мл, 1 моль) ацетофенона (примечание 1), 123 г
A09 мл, 1 моль) этилового эфира монохлоруксусной кислоты
и 200 мл сухого бензола. К этой смеси прибавляют в течение 2 час.
47,2 г A,2 моля) тщательно измельченного амида натрия (стр. 31).
Температуру поддерживают в пределах 15—20° при помощи внеш-
внешнего охлаждения (примечание 2). После того как прибавление бу-
будет закончено, реакционную массу перемешивают в течение 2 час.
при комнатной температуре и красноватую смесь выливают в сосуд,
содержащий 700 г колотого льда, при перемешивании от руки.
Верхний слой отделяют; водный слой экстрагируют один раз
200 мл бензола. Соединенные вместе бензольные вытяжки промы-
промывают тремя порциями воды по 300 мл, а к последней порции
добавляют 10 мл уксусной кислоты. Бензольный раствор сушат
над 25 г безводного сернокислого натрия, фильтруют и промывают
осушитель небольшим количеством сухого бензола. После отгонки
растворителя остаток фракционируют в вакууме из специальной
колбы Клайзена. Фракцию с т. кип. 107—113° C мм) собирают
отдельно и применяют для получения гидратропового альдегида
(стр. 446). После вторичной перегонки получается вещество
с т. кип. 111—114° C мм) (примечание 3); выход составляет
128—132 г F2—64% теоретич.; примечание 4).
Примечания
1. Были использованы продажные ацетофенон и этиловый
эфир монохлоруксусной кислоты.
2. Эта реакция сильно экзотермична; происходит обильное
выделение аммиака.
3. Температура кипения при других давлениях: 272—275°
G60 мм) (с разложением); 153—159° B0 мм); 147—149° A2 мм).
4. Ряд побочных реакций приводит к уменьшению выхода.
В низкокипящей фракции всегда содержатся не вступившие в
реакцию ацетофенон и этиловый эфир хлоруксусной кислоты,
а также некоторое количество эфира хлоркоричной кислоты.
Другие методы получения
Настоящий метод является примером использования общей
реакции конденсации эфиров галоидозамещенных кислот с кето-
нами при помощи натрия1, этилата натрия2'3 или амида натрия4^6.
1 Erlenmeyer, Ann., 271, 161 A892).
2Darzens, Compt. rend., 139, 1215A904).
3 D u t t a J. Indian Chem. Soc, 18, 235 A941) [C. A., 36, 761 A942)].
4Claisen, Feycrabend, Ber., 38, 702 A905).
5 I. G. Farbenindustrie, A.-G., герм. пат. 591452 [Frdl., 19, 288 A934);
С. А., 28, 2367 A934)].
• I. G. Farbenindustrie, A.-G., герм. паг. 602816 [Frdl., 20, 217A935);
С. А., 29, 1438 A935)].
518
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
ЭТИЛОВЫЙ ЭФИР g-ФЕНИЛ-р-ОКСИПРОПИОНОВОЙ КИСЛОТЫ
OZnBr
С6Н5СНО + BrCH2CO2C2H5 + Zn -> С6Н5СНСН2СО2С2Н5
OZnBr
C6H5CHCH2CO2CaH5 + H2SO4 -> С6Н5СНОНСН2СО2С2Н5 + ZnSO4 + HBr
Предложили: Ч. Хаузер и Д. Бресло.
Проверили: Р. Шрайнер, В. Хоен и В. Паттерсон.
Получение
В чистую сухую трехгорлую колбу емкостью 500 мл, снабжен-
снабженную механической мешалкой, делительной воронкой емкостью
250 мл и обратным холодильником (примечание 1), верхний
конец которого защищен хлор кальциевой трубкой, помещают 40 г
@,62 грамматома) цинковой пыли (примечание 2).
В делительную воронку наливают раствор 83,5 г @,50 моля)
этилового эфира бромуксусной кислоты (примечание 3) и 65 г
@,61 моля) бензальдегида (примечание 4) в 80 мл сухого бензола
и 20 мл абсолютного эфира. Около 10 мл этого раствора приливают
к цинку и колбу нагревают до тех пор, пока не начнется реакция
(примечание 5). Затем смесь перемешивают и прибавляют к ней
остальной раствор с такой скоростью, чтобы реакционная смесь
кипела; при этом следует соблюдать осторожность и следить,
нтобы реакция не пошла слишком бурно. Прибавление раствора
занимает около 1 часа. После того как оно будет закончено,
реакционную смесь кипятят на водяной бане в течение еще полу-
получала.
Затем колбу охлаждают в бане со льдом и реакционную смесь
гидролизуют, прибавляя к ней 200 мл холодной 10%-ной серной
кислоты при энергичном перемешивании. Кислотный слой отде-
отделяют, а бензольный слой экстрагируют двумя порциями 5%-ной
серной кислоты по 50 мл. После этого бензольный раствор про-
промывают один раз 25 мл 10?^>-ного раствора соды, один раз 25 мл
5%-иой серной кислотой (примечание 6) и, наконец, двумя пор-
порциями воды по 25 мл. Соединенные вместе кислые растворы экстра-
экстрагируют двумя порциями эфира по 50 мл и сушат затем соединен-
соединенные вместе эфирные и бензольные растворы над 5 г сернокислого
магния или драйерита*. Раствор фильтруют, растворитель отго-
отгоняют на паровой бане при атмосферном давлении и остаток фрак-
фракционируют в вакууме. Сложный эфир собирают при 151—154°
A1—12 мм) [128—132° E—7 мм)}. Общий выход составляет
59—62 г F1—64% теоретич.; примечание 7).
: См. примечание на стр. 16.
ЭТИЛОВЫЙ ЭФИР р-ФЕНМЛ-р-ОКСИПРОПИОНОВОЙ КИСЛОТЫ
519
Примечания
1. Для предотвращения потери растворителя необходим эф-
эффективный обратный холодильник. При проведении реакции Ре-
Реформатского необходимо соблюдать те же меры предосторожности
в отношении чистоты приборов и устранения влаги, что и в маг-
нийорганическом синтезе.
2. С целью очистки цинковую пыль последовательно и быстро
промывают разбавленным раствором едкого натра, водой, разба-
разбавленной уксусной кислотой, снова водой, спиртом, ацетоном
и эфиром. Затем ее сушат в вакууме при 100°.
3. Этиловый эфир бромуксусной кислоты является сильным
лакриматором, а потому при обращении с ним следует соблюдать
осторожность. В расчете на тот случай, если бромистый эфир про-
прольется, необходимо для его нейтрализации иметь под рукой
10%-ный водный раствор аммиака.
4. Бензальдегид следует промыть двумя порциями 10%-ного
раствора двууглекислого натрия по 50 мл, а затем высушить
и перегнать.
5. Очень существенно, чтобы реакция началась до того, как
будет прибавлено дополнительное количество этилового эфира
бромуксусной кислоты и бензальдегида.
6. Экстрагирование кислотой следует продолжать до тех пор,
пока не прекратится образование белого осадка гидроокиси цинка
при извлечении раствором углекислой соды. Эта стадия имеет боль-
большое значение, так как цинковый комплекс гидролизуется значи-
значительно труднее, чем соответствующий магниевый комплекс. На
грани раздела между бензольным и кислотным растворами
образуется небольшое количество негидролизованного ком-
комплекса. Его легче всего удалить при первом экстрагировании
щелочью.
7. По этой же методике можно получить этиловый эфир
а,а-диметил-C-фенил-^-оксипропионовой кислоты. Например, из
100 г этилового эфира а-бромизомасляной кислоты и 65 г бензаль-
бензальдегида можно получить 82,5 г G3% теоретич.) этилового эфира
а.а-диметил-р-фенил-р-оксинропионовой кислоты с т. кип. 153—158°
A1 мм). Препарат можно перекристаллизовать, для чего следует
растворить его при 30° в 100 мл петролейного эфира (т. кип.
30—60°), сильно охладить раствор в течение нескольких дней
и затем слить с осадка прозрачную жидкость; т. пл. 38,5—39°.
Другие методы получения
Этиловый эфир (З-фенил-^-оксипропионовой кислоты был полу-
получен этерификацией C-фенил-р-оксипропионовой кислоты, синтези-
синтезированной присоединением бромистого водорода к коричной кислоте
520
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
и последующим гидролизом1-2. Приведенный выше метод основан
на способе, который разработали Андриевский3 и Блез и Герман4*.
1Findlay, Hickmans, J. Chem. Soc, 1909, 1004.
2 F i 1 t i g, Binder, Ann., 195, 131 A877).
3 Андриевский, ЖРФХО, 40, 1635 A908).
4 В 1 a i s с, Herman, Ann. chim. phys., (8), 23, 532 A911).
ЭТИЛОВЫЙ ЭФИР а-ЦИАН-р,р-ДИЭТИЛАКРИЛОВОЙ КИСЛОТЫ
(Этиловый эфир 2-циан-3-этил-2-пентеновой кислоты)
cii3coonh4
(C,H6)a СО+ СН2 (CN) СООС2Н5
СН3СООН
(a5J (C)COOC2H, + H2O
Предложил и: А. Коп и Э. Хэнкок.
Проверили: X. Снайдер и Д ж. Саундерс.
Получение
В круглодонную колбу емкостью 500 мл, соединенную со спе-
специальной насадкой Дина и Старка для отделения воды1 (приме-
(примечание 1), к которой присоединен обратный холодильник, помещают
67,8 г @,60 моля) циануксусного эфира (примечание 2), 56,8 г
@,66 моля) диэтилкетона (примечание 3), 9,2 г @,12 моля) уксус-
уксуснокислого аммония, 30 г @,48 моля) ледяной уксусной кислоты
и 100 мл бензола. Колбу нагревают на масляной бане при
160—165°, а воду, которая отгоняется от смеси вместе с бензолом,
время от времени сливают. Кипячение продолжают в течение
суток (в течение нескольких часов после того, как отделение
воды прекратится; примечание 4).
Раствор охлаждают и промывают тремя порциями 10%-ного
раствора хлористого натрия по 25 мл, после чего бензол отгоняют
в вакууме. Остаток переносят в 1-литровую склянку, прибавляют
к нему раствор 78 г @,75 моля) продажного бисульфита натрия
в 310 мл воды и смесь взбалтывают в течение 2 час. на качалке.
Мутный раствор разбавляют 500 мл воды и экстрагируют тремя
порциями бензола по 50 мл; вытяжки отбрасывают (примечание 5).
Раствор бисульфита охлаждают в бане со льдом и прибавляют к не-
нему по каплям при механическом перемешивании охлажденный
до 0° раствор 32 г @,8 моля) едкого натра в 130 мл воды. Выделив-
* Приведенная здесь пропись является классическим примером реакции
Реформатского, дающей возможность получения многочисленных непредель-
непредельных кислот и оксикислот, исходя из карбонильных соединений (альдеги-
(альдегидов, кетонов или сложных эфиров) и эфиров а-галоидзамещенных кислот.
Подробная статья, посвященная реакции Реформатского, имеется в книге
«Органические реакции», сборник 1, Издатинлит, 1948, стр. 9- (Прим. ред.)
ЭТИЛОВЫЙ ЭФИР *-ЦИАИ-Р, р-ДИЭТИЛАКРИЛОВОЙ КИСЛОТЫ 521
шийся сложный эфир немедленно экстрагируют четырьмя порциями
бензола по 25 мл (примечание 6). Бензольный раствор промывают
1%-ной соляной кислотой E0 мл), сушат в течение короткого вре-
времени над 20 г безводного сернокислого натрия, после чего фильт-
фильтруют в специальную колбу Клайзена емкостью 250 мл и перего-
перегоняют в вакууме. Выход сложного эфира с т. кип. 123—125° A2 мм)
(примечание 7) составляет 65,4—75 г F0,5—68% теоретич.;
примечания 8—10).
Примечания
1. Другая пригодная насадка для отделения воды описана на
стр. 505. Можно применять любой водоотделитель непрерывного
действия, который возвращал бы бензол обратно в реакционную
смесь.
2. Продажный циануксусный эфир был предварительно пере-
перегнан; т. кип. 93—94° A2 мм).
3. Диэтилкетон применялся либо продажный (после предва-
предварительной перегонки), либо полученный путем медленного про-
пропускания пропионовой кислоты над смесью окиси марганца с ку-
кусочками битой глиняной тарелки в трубчатой печи при 420—440°2;
используемая аппаратура аналогична описанной ранее («Синт.
орг. преп.», сб. 2, стр. 314, рис. 14). Полученный по этому ме-
методу кетон перегоняли, сушили над поташом и вновь перегоняли;
т. кип. 100—ЮГ.
4. Водный слой B0—25 мл) содержит некоторое количество
уксусной кислоты и ацетамида, причем последний образуется
из уксуснокислого аммония, служащего в качестве катализатора.
5. При экстрагировании водного слоя циануксусный эфир от-
отделяется от водного раствора продукта присоединения бисульфита
натрия к этиловому эфиру я-циан-р,^-диэтилакриловой кислоты.
6. Непредельный сложный эфир выделяется при нейтрализа-
нейтрализации бисульфитного раствора едким натром. Во время нейтрализа-
нейтрализации и экстрагирования раствор должен быть холодным; чтобы
предотвратить гидролитическое расщепление сложного эфира до
диэтилкетона и циануксусного эфира, применяют лишь неболь-
небольшой избыток едкого натра.
7. Температура кипения при других давлениях: 135—137°
B5 мм); 88—89° A мм).
8. По приведенному способу была осуществлена конденсация
многих кетонов с циануксусным эфиром. Такие реакционно-
способные кетоны, как алифатические метилкетоны и циклоге-
ксанон, конденсируются с циануксусиым эфиром значительно бы-
быстрее и дают лучшие выходы алкилиденовых эфиров. При работе
с указанными кетонами выгоднее применять меньшие относитель-
относительные количества катализатора уксуснокислый аммоний — уксус-
уксусная кислота1.
522
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
9. Стадию очистки через продукт присоединения бисульфита
натрия можно опустить и очищать алкилиденовый эфир непосред-
непосредственно перегонкой. Циануксусный эфир следует тщательно от-
отделить от продукта реакции путем фракционирования с примене-
применением достаточно эффективной колонки. Очистка через промежу-
промежуточное образование продукта присоединения бисульфита натрия
может быть рекомендована лишь в случае эфиров алкилиденциан-
уксусных кислот, получаемых из кетопов, содержащих 4 или
5 углеродных атомов, но не в случае высших гомологов.
Проверявшие синтез получили несколько более высокий вы-
выход F4% вместо 60,5%), пользуясь дробной перегонкой, однако
качество препарата было, повидимому, немного ниже (nv 1,4645
вместо 1,4649).
10. Следы растворимой в воде белой твердой примеси могут
вызвать помутнение дестиллата; вещество можно освободить от
этих примесей, промыв его водой и подвергнув повторной пере-
перегонке.
Другие методы получения
Изложенная выше пропись представляет собой с очень неболь-
небольшими изменениями опубликованный ранее1 общий метод кон-
конденсации кетонов с циануксусным эфиром.' Этиловый эфир
а-циан-р,C-диэтилакршювой кислоты был получен также путем
конденсации диэтилкетона с циануксусным эфиром в присутствии
пиперидина или уксусного ангидрида и хлористого цинка3 или
пиперидина и безводного сернокислого натрия в склянке для
проведения реакций под давлением при 100°4.
'Соре, Hofmann, Wyckoff, Hardenbergh, J. Am.
Chem. Soc, 63, 3452 A941).
2 S a b a t i e r, M a i 1 h e, Compt. rend., 158. 831 A914).
s Birch, Коп, J. Chem. Soc, 1923, 2448.
4 С о w a n, V о g e 1, J. Chem. Soc, 1940, 1528.
ЭТИЛОВЫЙ ЭФИР а-ЦИАН-Р-ЭТИЛИДЕН-я-ВАЛЕРИАНОВОЙ КИСЛОТЫ
(Этиловый эфир 2-циан-2-метил-3-этил-3-пентеновой кислоты)
NaOO2H5
CH3J
(C2H5JC = C(CN)COOC2H5
-> [СН3СН = С (С2Н6) Се (CN) COOQHS1 Na®
-> CH3CH = C(C2H5)C(CH3)(CN)COOC2H5
Предложили: Э. Хенкок и А. Коп.
Проверили: X. Снайдер и Дж. Сауядерс,
Получение
В 1-литровой трехгорлой колбе, снабженной капельной во-
воронкой, термометром, мешалкой с ртутным затвором и обратным
ЭТИЛОВЫЙ ЭФИР а-ЦИАН-З-ЭТИЛИДЕП-и-ВАЛЕРИАНОВОЙ КИСЛОТЫ 523
холодильником, защищенным хлоркальциевой трубкой, приго-
приготовляют раствор этилата натрия из 9,2 г @,40 моля) свеженарезан-
ного натрия и 400 мл абсолютного спирта (примечания 1 и 2).
К этому раствору, температуру которого поддерживают при
—5° (удобнее всего путем частичного погружения колбы в сосуд
с сухим льдом), прибавляют по каплям через капельную воронку
при перемешивании в течение 8—10 мин. 72,4 г @,40 моля) эти-
этилового эфира а-циан-|В,р-диэтилакриловой кислоты (стр. 520).
Смесь перемешивают дополнительно в течение еще 20 мин. при
—5°, а затем через капельную воронку прибавляют к ней с возмож-
возможной быстротой 62,5 г @,44 моля) йодистого метила. Колбу немед-
немедленно нагревают на сильном пламени горелки, которую отставляют,
как только раствор достигнет температуры кипения. Процесс
алкилирования проходит бурно, но колбу не охлаждают, если
только не становится неизбежной потеря вещества через обратный
холодильник (примечание 3). После того как интенсивность само-
самопроизвольной реакции уменьшится, раствор кипятят с обратным
холодильником до тех пор, пока красная лакмусовая бумажка,
опущенная в жидкость, а затем смоченная, не укажет, что реак-
реакция раствора стала нейтральной A5—30 мин.).
После этого раствор охлаждают, добавляют к нему 1 л воды
и отделяют слой сложного эфира. Водный слой экстрагируют че-
четырьмя порциями бензола по 50 мл и соединенные вместе сложный
эфир и бензольные вытяжки промывают двумя порциями воды
по 25 мл, а затем перегоняют из специальной колбы Клайзена
емкостью 500 мл. Фракцию (около 75 г), собранную при 95—118°
A0 мм), взбалтывают на качалке со 100 мл 20%-ного раствора
бисульфита натрия в течение 4 час.( примечание 4). Слой сложного
эфира отделяют, водный слой экстрагируют тремя порциями бен-
бензола по 25 мл и соединенные вместе сложный эфир и бензольные
вытяжки промывают 25 мл воды. Остаток после отгонки бензола
перегоняют в вакууме из специальной колбы Клайзена емкостью
250 мл или из колбы с дефлегматором Видмера. Выход сложного
эфира с т. кип. 112—113° (8 мм) составляет 63,5—68 г (81—87%
теоретич.).
Примечания
1. Продажный абсолютный спирт сушат натрием и этил-
фталатом1 и перегоняют. Значительно меньший выход был полу-
получен при проверке в случае применения спирта, высушенного над
метилатом магния.
2. Различные части прибора сушат в сушильном шкафу и
прибор быстро собирают, чтобы исключить попадание в него вла-
влаги воздуха.
3. Быстрое проведение процесса алкилирования позволяет
избежать чрезмерного расщепления (алкоголиза) продукта ре-
524
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
акции. В настоящей методике время, в течение которого послед-
последний находится в соприкосновении еэтилатом натрия, сведено к ми-
минимуму.
4. В результате такой обработки достигают удаления этилового
эфира а-циан-р,^-диэтилакриловой кислоты в виде растворимого
в воде продукта присоединения бисульфита натрия (стр. 520).
Другие методы получения
Изложенная выше пропись является примером общего метода
получения отдельных представителей гомологического ряда эти-
этиловых эфиров (диалкилвинил)-алкилциануксусных кислот алки-
лированием этиловых эфиров алкилиденциануксусных кислот2.
1 М а н с к е, Синт. орг. преп., сб. 2, стр. 170, примечание 1.
! С о р е, Hancock, J. Am. Chem. Soc, 60, 2903 A938).
2-ЭТИЛХРОМОН
/Noh
+ СН3СН2СО2С2Н6 + 3Na ->
Ц^СОСН,
2-ЭТИЛХРОМОН
525
,ONa
= CHCOCaH,
4-C2H5ONa+-3(H)
СОСН2СОС2Н5
+ 2CH3COsNa
iOH
О
НС1
\/
!C0CHaC0C2Ht сн3со2н
+ н2о
о
Предложил: Р. Мозинго.
Проверили: Г. Адкинс и Р. Гандер.
Получение
В 1-литровую трехгорлую колбу, снабженную обратным холо-
холодильником, капельной воронкой и мешалкой (примечания 1 и 2),
помещают 24 г A,05 грамматома) натрия, свободного от окиси,
и 200 мл ксилола (примечание 3). Холодильник должен быть защи-
защищен трубкой с натронной известью. Колбу погружают в масляную
баню, которую нагревают до тех пор, пока не расплавится нат-
натрий. Пускают в ход мешалку и после измельчания натрия отстав-
отставляют масляную баню. Когда содержимое колбы охладится до ком-
комнатной температуры, мешалку останавливают, декантируют кси-
ксилол и промывают натрий 100 мл абсолютного эфира, чтобы удалить
следы ксилола.
После этого колбу ставят на место и целиком погружают в
баню со льдом (примечание 4). Через содержимое колбы пропу-
пропускают в течение 5 мин. ток азота, пользуясь присоединенной
к капельной воронке резиновой трубкой. Затем трубку для пропу-
пропускания азота отъединяют и в капельную воронку помещают смесь
60 г @,44 моля) о-оксиацетофенона (примечание 5) и 125 е A40 мл,
1,2 моля) этилового эфира пропионовой кислоты (примечание 3).
Капельную воронку закрывают пробкой, в которую вставлена
трубка с натронной известью. Смесь сложного эфира с кетоном
медленно по каплям прибавляют к измельченному натрию. После
того как будет прибавлено небольшое количество смеси B—5 мл),
баню со льдом отставляют и колбу нагревают рукой, чтобы удо-
удостовериться, что реакция началась (примечание 6). После начала
реакции кран воронки открывают таким образом, чтобы половину
всей смеси можно было прибавить в течение 1,5—2 час. Скорость
дальнейшего прибавления регулируют так, чтобы вторая половина
смеси была прибавлена за полчаса.
После того как все количество смеси сложного эфира и кетона
¦будет прибавлено и течение реакции замедлится, баню со льдом
отставляют и заменяют паровой баней. Образовавшуюся корку
разламывают и смесь нагревают на паровой бане до тех пор, пока
не прореагирует весь натрий C0—60 мин.). Реакционной смеси
дают охладиться, а затем при перемешивании приливают ее
к 300 г измельченного льда. После этого в реакционный сосуд
прибавляют раствор 95 мл ледяной уксусной кислоты в 350 мл
воды и смесь перемешивают в течение получаса. Выделившийся
слой органического вещества отделяют с помощью делительной
воронки, а водный слой экстрагируют три раза эфиром порциями
по 200 мл. Эфирные вытяжки присоединяют к отделенному орга-
органическому веществу и эфир отгоняют на паровой бане. К остатку
прибавляют 150 мл ледяной уксусной кислоты и 10 мл концен-
концентрированной соляной кислоты; раствор кипятят в течение получаса
• с обратным холодильником, после чего оставляют его охлаждаться
до комнатной температуры (примечание 7).
Затем всю реакционную смесь подвергают фракционированной
перегонке, пользуясь колонкой Видмера (примечание 8). Фрак-
Фракцию, кипящую до 120° при атмосферном давлении, отбрасывают.
- Содержимое колбы охлаждают и давление уменьшают до 7 мм.
526
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
Фракцию, кипящую до 80° G мм), также отбрасывают. Вещество,
которое кипит в интервале 80—90° G мм), собирают. После того
как содержимое колбы охладится, давление уменьшают до 2 мм
и все вещество, кипящее до 110° B мм), собирают и соединяют
с фракцией, кипящей в интервале 80—90° G мм). Следующую
фракцию, кипящую при 110—138° B мм), собирают отдельно.
При повторном фракционировании низкокипящих" фракций
[т. кип. 80° G мм)—110° B мм)] получают 13—15 г о-оксиацето-
фенона [т. кип. 87—88° G мм)]. К остатку после выделения
о-оксиацетофенона прибавляют фракцию, кипящую при ПО—138°
D мм). Давление снова понижают до 2 мм и собирают фракцию,
кипящую при 124—126° B мм). Эта фракция представляет собой
чистый 2-этилхромон, выход которого составляет 42—45 г
G0—75% теоретич., считая на прореагировавший кетон; приме-
примечание 9).
Примечания
1. Все применяемые пробки должны быть резиновыми; перед
применением их следует кипятить в течение 2 час. в 10%-ном
растворе едкого натра, а затем тщательно промыть и высушить.
2. Подходящую мешалку можно сделать из латунного 6,5-мил-
лимстрового стержня с диском диаметром 25 мм. В диске просвер-
просверливают четыре отверстия и в каждое отверстие пропускают петлю
из нихромовой проволоки диаметром 1 мм. Петли располагают
так, чтобы скрученный конец их был обращен к стержню мешалки;
каждую из петель скручивают посередине, получая таким обра-
образом двойные петли. Затем стержень мешалки пропускают через
стеклянную трубку длиной 100 мм, в которую он должен плотно
входить. На стеклянную трубку и латунный стержень надевают
кусок резиновой трубки. Последняя должна выступать на 3 мм
над концом стеклянной трубки, плотно облегая стержень мешалки.
Капля глицерина служит в качестве смазки и для создания гер-
герметичности. Этот затвор подобен тому, который рассмотрен при
описании синтеза дипнона (стр. 225, примечание 1).
3. Ксилол сушат над металлическим натрием, а затем над
ним же перегоняют. Этиловый эфир пропионовой кислоты сушат
над фосфорным ангидридом, причем в сосуд время от времени
прибавляют свежие порции последнего до тех пор, пока на дне
не останется небольшое количество твердого осушающего агента.
Затем эфир декантируют в колбу со свежим фосфорным ангидри-
ангидридом и фракционируют его. Собирают фракцию, кипящую при
98-99° G45 мм).
4. Чтобы предотвратить слишком бурное течение реакции,
колбу охлаждают в бане со льдом. Не следует применять ба-
баню со льдом и солью, так как это может замедлить начало
реакции.
Р-ЭТОКСИПРОПИОНИТРИЛ
527
5. о-Оксиацетофенон был получен по методике Миллера
и Хартунга («Синт. орг. преп.», сб. 2, стр. 426), приведенной для
синтеза о- и п-оксипропиофенона, за исключением способа выделе-
выделения вещества, который был видоизменен следующим образом.
Охлажденное и частично затвердевшее масло, выделившееся после
подкисления, разбавляют бензолом и экстрагируют водный слой
этим же углеводородом. После отгонки растворителя остаток пере-
перегоняют при 17 мм до тех пор, пока в холодильнике не начнет со-
собираться твердый л-изомер. Затем дестиллат фракционируют с
применением колонки Вндмера, причем собирают фракцию с т. кип.
90—110° A7 мм). При повторном фракционировании получают
о-оксиацетофенон с т. кип. 105—106° B0 мм) [87—88° G мм)];
выход составляет 30% теоретического количества, считая на фенил-
ацетат. ~~
6. Очень существенно, чтобы перед дальнейшим прибавлением
смеси сложного эфира и кетона работающий удостоверился, что
реакция действительно началась, и чтобы первая половина смеси
была прибавлена медленно, так как в противном случае реакция
может протекать со взрывом. Обычно после того как отставлена
охлаждающая баня, о начале реакции можно судить по местному
выделению тепла и по появлению соли дикетона, окрашенной
в желтый цвет.
7. До этой стадии синтез следует вести без перерывов.
8. Колонка Видмера имела спираль длиной 15 см и рубашку
с электрообогревом1.
9. Авторы проводили этот синтез с удвоенными количествами
всех указанных в прописи реагентов. Выход достигал 68—77 г
E6—64% теоретич.).
Другие методы получения
2-Этилхромон был получен конденсацией этилового эфира про-
пропионовой кислоты с о-оксиацетофеноном в присутствии металли-
металлического натрия2'3.
1 S m i t h, A d k i n s, J. Am. Chem. Soc, 60, 662 A938).
! Heilhron, Hey, Lowe, J. Chem. Soc, 1934, 1312.
3Mozingo, Adkins, J. Am. Chem. Soc, 60, 669 A938).
g-ЭТОКСИПРОПИОНИТРИЛ
C3H5OCH.2CH2Br-rNaCN -> C2H5OCH2CH2CN +NaBr
, Предложили: Дж. Гаррисон и Г. Диль.
Проверили: Р. Шрайнер и К. Тилфорд.
Получение
В 3-литровую трехгорлую колбу, снабженную мешалкой
Гершберга («Синт. орг. преп.», сб. 2, стр. 298, рис. 12), обратным
528
СИНТЕЗЫ ОРГАНИЧЕСКИХ ПРЕПАРАТОВ
холодильником и капельной воронкой, помещают 175 г C,6 моля)
цианистого натрия и 125 мл дестиллированной воды (примеча-
(примечание 1). Смесь перемешивают до тех пор, пока не растворится циа-
цианистый натрий, а затем, продолжая энергичное перемешивание,
в течение 15 мин. прибавляют к ней раствор 535 г C60 ли; 3,5 моля)
Р-этоксиэтилбромида (стр. 528) в 260 мл 95%-ного этилового
спирта. После этого делительную воронку заменяют термометром
на 360° и нагревают смесь (слабое кипение) в течение 10 час. при
постоянном перемешивании.
Затем смесь подвергают дробной перегонке до тех пор, пока
температура не достигнет 140°. Первую фракцию, кипящую при
75—95°, которая состоит главным образом из спирта и воды,
отбрасывают. Фракция, кипящая между 95 и 140°, содержит воду
и 25—30 г р-этоксипропионитрила. Эту фракцию экстрагируют
двумя порциями бензола по 50 мл и бензольные вытяжки прибав-
прибавляют к охлажденному остатку в перегонной колбе. Затем смесь
фильтруют (примечание 2), твердое вещество промывают 75 мл
бензола, которые прибавляют к фильтрату, и все вместе перего-
перегоняют. Собирают фракцию, кипящую при 169—174°; выход состав-
составляет 178—200 г E2—58% теоретич.).
Примечания
1. Реакцию следует проводить в вытяжном шкафу.
2. Если продукт реакции перегонять без фильтрования, то
бромистый аммоний может забить холодильник.
Другие методы получения
Р-Этоксипропионитрил был получен действием цианистого калия
на р-этоксиэтилбромид1.
1 Henry, Bull. soc. chim., B), 44, 458 A885).
Р-ЭТОКСИЭТИЛБРОМ ИД
A-Бром-2-этоксиэтан)
ЗС2Н6ОСН2СН2
-> ЗС2Н5ОСН2СН2Вг + Р(ОНK
Предложили: Дж. Гаррисон и Г. Диль.
Проверили: Р. Шрайнер и К. Тилфорд.
Получение
В 2-литровую трехгорлую колбу, снабженную механической
мешалкой (примечание I), обратным холодильником и капельной
воронкой, помещают 630 г F70 мл, 7 молей) р-этоксиэтилового
спирта (примечание 2). Пускают в ход мешалку и в течение
1,5—2 час. через капельную воронку добавляют 600 г B10 мл,
е-ЭТОКСИЭТИЛБРО-МИД
529
2,2 моля; примечание 3) трехбромистого фосфора. Температуре
предоставляют повышаться до тех пор, пока реакционная смесь не
начнет слабо кипеть.
Затем смесь перегоняют и дестиллат, кипящий ниже 150°,
собирают в 2-литровую колбу, содержащую 1 л воды. Нижний
слой неочищенного бромистого {3-этоксиэтила отделяют и сушат
над 10 г хлористого кальция. Жидкость декантируют и перего-
перегоняют с дефлегматором высотой 25 см, собирая фракцию, кипящую
при 125—127° G60 мм) (примечание 4). Выход чистого вещества
составляет 660—670 г F5—66% теоретич., считая на трехброми-
стый фосфор).
Примечания
1. Удобным затвором для мешалки может служить резиновая
муфта, смазанная каплей масла.
2. Технический р-этоксиэтиловый спирт в продаже носит также
название «целлосольв»; его следует высушить над окисью кальция
и перегнать.
3. Небольшой избыток р-этоксиэтилового спирта дает наилуч-
наилучшие результаты.
4. Первая фракция, кипящая при 38—40°, представляет со-
собой бромистый этил; выход ее составляет 120—130 г. Если не
пользоваться дефлегматором, то выход бромистого 8-этоксиэтила
получается более низким E6—59%). Однако при перегонке нельзя
перегревать остаток, так как при высокой температуре фосфори-
фосфористая кислота разлагается с образованием фосфористого водорода
и, возможно, даже элементарного фосфора. Поэтому при попада-
попадании в прибор воздуха может произойти взрыв. Имеются указания
на то, что при выполнении этого синтеза действительно однажды
произошел небольшой взрыв (Н. Дрэйк, частное сообщение);
аналогичный случай наблюдался и при реакциях с треххлористым
фосфором1.
Другие методы получения
fJ-Этоксиэтилбромид был получен действием этилата натрия
на бромистый этилен2, действием брома на йодистый р-этокси-
этил3, а также по указанной выше методике, которую впервые
применил Чалмерс4. Действие бромистого натрия и серной кис-
кислоты на р-этоксиэтиловый спирт вызывает расщепление эфирной
связи.
1 С о g h i 1 1 J. Am. Chem. Soc, 60, 488 A938).
2 For an, J. Soc. Chem. Ind., 44, 173—174 A925).
3 Henry, Jahresb., 1885, 1163.
«Chalmers, Can. J. Research, 7, 464—471 A932).
34 сборник 3
УКАЗАТЕЛЬ
СИНТЕЗОВ ПО ТИПАМ РЕАКЦИЙ
В этом указателе большинство препаратов, которые входят в материал
настоящего сборника, отнесено к какому-либо определенному типу реакций;
в указатель включены только такие препараты, которые можно с достаточной
определенностью классифицировать по намеченным рубрикам. Как типы реак-
реакций, так и препараты в пределах каждого типа расположены в алфавитном
порядке. ^ -
АЛКИЛИРОВАНИЕ (см. также Гринъ-'
яра реакция, замещение, конденса-
конденсация, Фриделя—Крофтса реакция)
Аллиловый эфир гваякола 499
Бромацеталь 109
Бромистоводородная S-этилтио-
мочевина 148
о-н-Бутоксинитробензол 134
Гуанидилуксусная кислота 148
1,2,3,4-Тетрааиетил-6-трифенил-
метил-р-а!-глюкоза ЗУ9
2,3,4,6-Тетраметил-й-глюкоза
407
{5-Фенилэтилдиметиламин 452
АМИДИРОВАНИЕ И АМИНИРОВАНИЕ
Амид миндальной кислоты 26
Амид молочной кислоты 28
а-Амилгексилдиметиламин 454
Аминоацеталь 39
2-Аминогептан 449
Анилид бензоилуксусной кис-
кислоты 73
Ацетоацетанилид 96
Бензилдодецилметнлампн 454
Л-Валин 135
я-Гептиламин 449
си-И-и-Диметилтиомочевипа 318
Дихлоряцетамид 242
dZ-Изолейцин 250
dZ-Лейцин 275
Метилтиомочевииа 318
N-Метилформанилид 320
Л-Серин 389
dZ-Треонин 417
Триметилтиомочевина 318
dZ-Фенилаланин 435
а-Фенилэтиламин 448
о-Формтолуид 258
Фурфуриламин 449
Этилтиомочевина 318
АЦИЛИРСВАНИЕ (см. также зтери-
фикация)
Адеталь а-бромкоричного аль-
альдегида 445
Ацетобромглюкоза 97
4-Метил-7-ацетоксикумарип 219
2-Нитро-4-метоксиацетанилид
358
fi-Оиаацетилгенциобиоза 370
1,2,3,4-Тетраацетил-[Ы-глю:;оза
399
ВОССТАНОВЛЕНИЕ
СН = СН-»СН2СН2
[HgNa] 5-C-Метокси-4-оксибен-
зил)-креатинин 2S8
[Каталитическое, №] Тетрагид-
ропиран 403
С = О—>СН2
[Zn + HCl] о-н-Гептилфенол 142
СО2Н -> СН2ОН
[Электролитическое] о-Амино-
бекзиловый спирт 42
> CH = N-* >СН2 —NH —
[Каталитическое, Ni] л«-Толил-
бензиламин 416
[Каталитическое, Ni] о-Толил-
бензиламин 417
[Каталитическое, Ni] л-Толил-
бензиламин 4 7
_C = N ->¦ — CH2NH2
[Каталитическое, Ni] 3,4-Димет-
оксифенилэтиламин 451
УКАЗАТЕЛЬ СИНТЕЗОВ ПО ТИПАМ РЕАКЦИЙ
531
[Каталитическое, Ni] 3,4-Мети-
лендиоксифенилэтиламин 451
[Каталитическое, Ni] л-Метил-
фенилэтиламин 451
[Каталитическое, Ni] о-Метил-
фенилэтиламин 451
— С= N ->¦ — CH2NH2
[Каталитическое, Ni] л-Метил-
фенилэтиламин 451
[Каталитическое, Ni] fi-Фенил-
этнламин 452
NO2 -* NHOH
[Zn, NH4C1] Нитрозобензол 354
NO2-> — N = N —
[Zn+NaOH] Азобензол 7
NO2 -> NH2
[Na2S, NH,C1] 2-Амино-4-нитро-
фенол 54
[Каталитическое, Ni] 2-Амино-
л-цимол 66
[Каталитическое, Ni] л<-н-Бут-
оксианилин 135
[Каталитическое, Ni] л-я-Бут-
оксианилин 135
[Каталитическое, Ni] л-н-Гекс-
оксианилин 135
[SnCb] 4,4'-Диаминодкфенил-
сульфон 160
[H2S + NH4OH] 1,2-Диамино-
4-нитробензол 162
[Каталитичгское, Ni] лг-Изо-
пропоксианилин 135
[SnCl2] л<-Оксибензальдегид
363
NHOH ->¦ NH2
[КН2ОН] й/-Амиио-р-фенилпро-
пионовая кислота 58
С0С1 -¦ СНО
[Каталитическое, Pd — BaSO4]
1-Ацетскси 3-нафтальдегид 331
[Каталитическое, Pd—BaSOJ
Метиловый эфир ;3-формил-
пропионовой кислоты 331
[Каталитическое, Pri — BaSO4]
fi-Нафтойный альдегид 328
[Каталитическое, Pu —BaSO4]
2,4,6-Триметилбензальдегид 16
Восстаносление с одновременным
аиинированнеи
[Каталитическое, Ni] а-Фенил-
этиламин 448
Другие реакции восстановления
[H2S] Аллоксантин-дигидрат 14
[Na2S + NH4Cl] 2-Амино-4-нитро-
фенол 54
[SnCl2] Jl-Нафтойный альдегид
328
[Zn (Hg)x] /праяс-Стильбен 395
ГАБРИЭЛЯ РЕАКЦИЯ
т-Ди-я-бутиламинопропиламин
173
7-Ди-я-пропиламинопропиламин
174
7-Диэтиламинопропилами-н 174
ГАЛОГЕНИРОВАНИЕ
Хлорирование
Альдегидофталевая кислота 21
1-н-Бутилпирролидин 129
2,6-Дихлоранилин 236
Дихлорацетсфенон 323
Хлорангидрид р-карбометоксн
проиионовой кислоты 459
Хлористый иодбензол 475
— ж-иодтолуол 476
— о-иодтолуол 476
— л-иодтолуол 476
2-Хлорциклогексанон 483
Бромирование
Бромацеталь 109
а-Бромизовалериановая кисло-
кислота 135
а-Бромизокапроновая кислота
275
а-Бром-3-метилвалериановая ки-
кислота 251
а-Бром-[3-метокси-я-масляная
кислота 418
а-Бром-^-метоксипропионовая
кислота 390
6-Бром-2-нафтол 115
Бромуксусная кислота 504
а-Бром-^-фенилпропионовая ки-
кислота 436
2-Бромфталид 21
Гексабромстеариновая кислота
283
Гептабромстеариновая кислота
285
2,6-Диброманилин 236
а,а,а',с1'-Тетрабром-л-ксилол 397
Тетрабромстеариновая кислота
278
34*
532
УКАЗАТЕЛЬ СИНТЕЗОВ ПО ТИПАМ РЕАКЦИИ
Иодирование
Иодобензол 261
ГАЛОФОРМЕННАЯ РЕАКЦИЯ
P.fi-Диметилакриловая кислота
182
ГИДРОЛИЗ Подзаголовки иллюстри-
иллюстрируют типы соединений, подвергае-
подвергаемых гидролизу. Гидролизующий
агент заключен в скобки перед на-
названием препарата
Амиды кислот
[НС1] а-Аминодиэтилуксусная
кислота 46
¦[НС1] fi-Метилглутаровая кис-
кислота 294
[Ва (ОНJ] N-Метил-О-метокси-
4-окс1-,фенил)-аланинч 298
I КОН] 2-Нитро-4-метокснанилип
358
Ангидриды кислот
[НС1, СгН5ОН] о-Нитробенз-
альдегид 348
Ацетали
[HoS04] Ацеталь фенилпропар-
гилового альдегида 445
Двугалоидные производные
[NaOH] Миндальная кислота 322
[H2SO4] Терефталевый альдегид
397
Имины
[Н2О] З-Нафтойныи альдегид 328
Нитрилы
[НС1] Л-а-Амннофеннлуксусная
кислота 63
[НС1] Беизоилмуравьиная кисло-
кислота 103
[НС1] Винилуксусная кислота
138 '
[H-SOJ Гомофталеван кислота
146
[Нагревание] Динитрил себа-
циновой кислоты 208
[H2SO4] Мезитилуксусная ки-
кислота 28S
[Нагревание] ш-Цианпеларгоно-
вая кислота 208
[NaOH] Циклопропанкарбоновая
кислота 496
Оксимы
[HoSOJ Метилфенилглиоксаль
319
Простые эфиры
[HjSOJ d-Манноза 287
[HJ] Кт-Метил-3,4-диоксифенил-
аланин 296
[NaOH] 2-Окси-1,4-нафтохинон
367
Сложные эфиры
[NaOH] Аценафтенол-7 79
[NaOH]a-BpoM-[j-MeioKCHnporiHO-
новая кислота 390
[Ва(ОН),] 1,3-Диокс-и-2-нафтой-
ная кислота 335
[NaOH] л-Иодбензиловый спирт
353
[H2SOJ Линолевая кислота 277
[HoSO4] Линоленовая кислота
2~83
[NaOH] ге-Нитробензиловый
спирт 353
[А§2СОз]2,3,4,6-Тетраацетил-[3-
d-глюкоза 401
[НС1] 2,3,4,6-Тетраметил-й-глю-
коза 407
[C»H5ONa] а-Фенилнропионовый
альдегид 446
[КОН] Этиловый эфир 2,5-
диыетилфеннлоксималоновой
кислоты 195
Сульфокислоты
[NaOH, КОН] Диоксибензойная
кислота 222
Углеводы
[CH3ONa] d-Арабкноза 77
Другие реакции гидролиза
[Ва (ОНJ] №Метил-C-метокси-
4-оксифенил)-аланпн 298
[H2SO4] Фенилпропаргиловый
альдегид 444
ГРИНЬЯРА РЕАКЦИЯ
3,12-Диацетокси-бисиор-хола-
нилдифенилэтилен 164
ш-Меюксиацетофенон 321
Селенсфенол 386
Трифеннлкарбннол 424
1-Фенилнафталин 440
Хлорангидрид 2,4,6-триметил-
бензойной кислоты 462
ДЕГИДРАТАЦИЯ (см. также замеще-
замещение, конденсация, эшерифика-
ция) Применяемые реагенты
заключены в скобки перед
названием ппепарата
[СН2 = С = О] Ангидрид «-кап-
«-капроновой кислоты 266
[СН2 = С=О] Ангидрид н-мас-
ляной кислоты 267
УКАЗАТЕЛЬ СИНТЕЗОВ ПО ТИПАМ РЕАКЦИЙ
533
ДЕГИДРАТАЦИЯ
[СН2 = С = О] Ангидрид про-
пионовой кислоты 267
[NaOH] Гидразин безводный 232
[А1,О3] 2,3-Дигидропиран 176
[НВг; каталитическая, А12О3]
2,3-Диметилбу-1адиен-1,3 187
[Р2О5] Метиловый эфир ю-циан-
пеларгоновой кислоты 316
[РОС13] Нитрил изомасляной
кислоты 341
Нитрил малоновой кислоты 342
ДЕГИДРОГЕНИЗАЦИЯ (см. также
окисление) Применяемые ре-
реагенты заключены в скобки
перед названием препарата
[О2, КОН] 2,3-Диметилантра-
хинон 186
[КОИ, CllsOIl] Дитизон 227
[Вг2] Тстрафенилфталевый
ангидрид 413
[S] 1-Фенилнафталин 440
ДЕКАРБОКСИЛИРОВАНИЕ
Ацетофеноноксим 62
2,5-Диыетилминдальная ки-
кислота 195
Имидазол 254
Нафторезорцин 334
Циклобутанкарбоновая кислота
490
ДИАЗОТИРОВАНИЕ
Получение соли диазония
1,2,3-Бензотриазол 104
5-Нитроиндазол 357
л-Оксибензальдегид 363
Замещение группы диазония
на ОН
З-Бром-4-окситолуол 117
ж-Бромфенол 119
ж-Оксибензальдегид 363
на Вг
о-Броманизол 469
л-Дибромбснзол 469
л-Хлорбромбензол 469
о-Хлорбромбензол 467
на Н
2,2'-Диметил-5,5'-диметоксиди-
фенил 205
З,3'-Диметилдифенил 203
З,3'-Диметоксидифенил 203
ДИЕНОВЫЙ СИНТЕЗ
2,3-Диметилантрахинон 186
Тетрафенилфталевый ангидрид -
413
ЗАМЕЩЕНИЕ (см. также Гриньяра
реакция, диазотирование) Подза-
Подзаголовки иллюстрируют типы реак-
реакции замещения, причем X представ-
представляет собой галоид
ОН на Вг
Ацетобромглюкоза 97
Бромистый гексаметилен 112
— декаметплеп 111
— ноняметилен 112
— тетрагидрофурфу-
рил 114
— триметилен 112
— трнфенилметил 427
^-Этоксиэтилбромид 528
ОН на CI
Трифенилхлорметан 426
Хлорангидрид азобепзолкарбо-
новой кислоты 458
— изомасляной кислоты 24
— ш-карбометоксипеларго-
новой кислоты 312
— карбэтоксиадипино-
вой кислоты 461
— мезитиленкарбоновой
кислоты 458
Хлористый ^-ментоксиацетил477 •
— тетрагидрофурфурил
375
2-Хлорлепидин 480
ОН иа NH2
3-Амшю-2-11афтойчая кислота 51
X на CN
Дурилацетонитрил 291
Изодурилацетоннтрил 291
Мезитилацетонитрил 290
Нитрил а-нафтойной кислоты 344
2,4,6-Триатилфенилацетонитрил
291
Цианистый аллил 138
Цианистый бснзоил 488
р-Этоксипропионитрил 527
X на ОН
2,3,4,6-Тетраацетил-|5-й-глкжо-
за 401
X иа NH2 или на замещенные ами-
аминогруппы
Амид изомасляной кислоты 24
9-Аминоакридин 36
Амичогщеталь 39
Бензиловый эфир карбаминовой
кислоты 101
^/-Изолейцин 250
Карбобензоксиаланин 102
534
УКАЗАТЕЛЬ СИНТЕЗОВ ПО ТИПАМ РЕАКЦИЙ
Карбобензоксиглицин 101
dZ-Лейцин 275
Метиловый эфир моноамида се-
бациновой кислоты 312
d/Фенилаланин 435
X на N3
Ундецилизоцианат 431
X на OR
mpem-Бутилацетат 121
Бутиловый эфир л-толуолсуль-
фокислоты 250
л-н-Бутоксинитробензол 135
л-н-Бутоксинитробензол 135
Гексадециловый эфир л-бром-
бензолсульфокислоты 250
н-Гексадециловый эфи?> л-толу-
олсульфокислоты 250
о-н-Гексоксинитробензол 135
л-к-Гексоксинитробензол 135
к-Дециловый эфир л-бромбен-
золсульфокислоты 250
к-Додецнлсвый эфир л-бромбен-
золсульфокислоты 250
н-Додециловый эфир л-толуол-
сульфокислоты 249
л-Изопропоксинитробензол 135
н-Октадециловый эфир л-бром-
бензолсульфокислоты 250
н-Октадецвловый эфир л-толуол-
сульфокислоты 250
н-Тетрадециловый эфир л-бром-
бензолсульфокислоты 250
«-Тетрадецилсвый зфир л-толу-
олсульфокислоты 250
Фениловый эфир коричной ки-
кислоты 442
X на ОСОСН3
л-Нитробензиловый эфир уксус-
уксусной кислоты 351
X на другие группы
Иодозобензол 264
Н на металл
Амид калия 35
Амид натрия 31
mpem-Бутилат алюминия 119
NO2 на OAlk
2,6-Диметоксибснзоиитрил 201
/Ментоксиуксусная кислота 292
КЛЕММЕНСЕНА ВОССТАНОВЛЕНИЕ
о-н-Гептилфенол 142
КОНДЕНСАЦИЯ (см. также алкили-
роеание, восстановление, Гриньяра
реакция, дегидратация, диазотиро-
вание, перегруппировки, присоедине-
присоединение, Фриделя — Крафтса реакция)
Термин «конденсация» применяется
здесь в ограничительном смысле
и относится к тем реакциям, интра-
интрамолекулярным или интермолекуляр-
интермолекулярным, которые ведут к образованию
связи углерод—углерод," обычно в
результате отщепления простейшей
неорганической молекулы Подзаго-
Подзаголовки иллюстрируют типы образую-
образующихся соединений Применяемые реа-
реагенты заключены в скобки перед наз-
названием препарата
С=С—С—R
{А1[ОС(СН:))зЫ Дипнон 224
[NaOC2H5] Псевдоионон 380
с=с—с—он
о1
[Пиридин] Сорбиновая кислота
393
[СН3СООК] Фурилакриловая
кислота 455
[Пиридин] Фурилакриловая ки-
кислота 456
С=С—C-OR
О
[Бензойнокислый пиперидин]
Метиловый эфир бензальма-
лоновой кислоты 502
[Бензойнокислый пиперидин]
Этиловый зфир бензалмалоно-
вой кислоты 501
Углеводород
[Na] н-Бутилбензол 126
Спирты
[NaNH2] Диметилэтинилкарби-
иол 198
[NaNH2] Метилэтилэтинилкар-
бинол 200
[Li] 1-(а-Пиридил)-2-пропанол
378
[Li] 1-(а-Пиридил)-3-пропанол
380
[Na] Три-л-бифенилкарбинол
422
[NaNH2] 1-Этинилциклогексанол
200
Эфиры оксикислот
[SnCl4] Этиловый эфир 2,5-ди-
метилфенилоксималоновой
кислоты 195
УКАЗАТЕЛЬ СИНТЕЗОВ ПО ТИПАМ РЕАКЦИЙ
535
Эфиры оксикислот
[Zn] Этиловый эфир а,а-димстил-
(з-фенил-р-оксипропионовой ки-
кислоты 519
[NaNH2] — — фенилметил-
глицидной кислоты 516
[Zn] — — р-фенил-[5-окси-
пропионовой кислоты 518
Кислоты
[NaCN, NH4C1] а-Аминодиэтил-
уксусная кислота 46
[NaCN, NH4CI]d/-a-AMHHO-a-<j>e-
нилпропионовая кислота 58
[NaCl, NH4C1] Л-о-Аминофенил-
уксусная кислота 63
[Пиридин] Сорбиновая кислота
393
Сложные эфиры
[NaOC2H5] Диэтиловый эфир
бензилмалоновой кислоты 435
[NaOC2H5] Диэтиловый эфир
emop-бутилмалоновой кислоты
251
[NaOC2H5] 1,1-Циклобутан-
дикарбоновая кислота 490
[NaOC2Hs] Этиловый эфир бен-
зоилуксусной кислоты 503
[Mgl Этиловый эфир диацето-
уксусной кислоты 513
[CH3COONHil Этиловый эфир
2-циан-^,р-дизтил акриловой
кислоты 520
[NaOC2H5] Этиловый эфир а-ци-
ан-[1-этилиден-н-валериановой
кислоты 522
Кегоны
[BF3 или NaOC2H5j Ацетилаце-
тон 92
[NaOC2H5] Дибензоилметан 167
[ZnCl,] Резацетофенон 384
[КОН, С2Н5ОН] Тетрафенил-
циклопентадиенон 415
Альдегиды
1А1С13] Альдегид мезитиленкар-
боновой кислоты 16
[РОС13] 9-Антральдегид 74
[А1С13] 2,4,6-Триизопропилбспз-
альдегид 20
[А1С13] 2,4,6-Триэтилбензальде-
гид 20
[РОС13] 2-Этокси-1-нафтальде-
гид 74
Гетероциклические соединения
[Нагревание] Беизальбарбиту-
ровая кислота 12
[Нагревание] Дегидрацетовая
кислота 150
[СН2О; NH3] Имидазол 254
|(СН3KСОК] Индол 258
[Zn + CH3COOH] Криптопиррол
269
[ZnCl2] Метилиндол 302
[HsS04l 4-Метилкарбостирил 304
[А1С13; C6H6NO2] 4-Метилкума-
рин 305
[А1С13] 4-Метил-7-оксикумарин
219
[Нагревание] 5-C-Метокси-
4-оксибензаль)-креатинин 297
[NaNH2] 2-Фенилиндол 438
[H2SO4] Этиловый эфир 1,3-ди-
окси-2-нафтойной кислоты 335
[Mg] Этиловый эфир фенилаие-
тилмалоновой кислоты 334
[НС1 +СН,СООН] 2-Этилхромон
524
Кетоальдегид
[NaOH!2-Oкcи-l-нaфтoйный аль-
альдегид 365
Аминокетон
[НС1] р-Диметиламинопропио-
фенон солянокислый 184
Нитрилы
[KCNJ о-Карбоксифенилацето-
нитрил 267
[NaNfi2] Нитрил цнклопропан-
карбоновой кислоты 346
[KCN] 2-Нитро-6-метоксибензо-
нитрил 201
[NaNH2] а-Циклогексилфенил-
ацетонитрил 494
Другие реакции конденсации
[Си] 2,2'-Динитродифенил 216
[Пиперидин] а,э:'-Дициан-р-ме-
тилглутарамид 294
[НС1] а2-Хлоризодурол 289
[H2SO4] Хлористый 5-окси-
5-нитробензил 478
[Н.,РО4] 1-Хлорметилнафталин
481
[Электролиз] Этиловый эфир
1,16-гексадекандикарбоновой
кислоты 508
НИТРОВАНИЕ
3,5-Динитробензойнаи кисло-
кислота 214
2-Нитро-4-метоксиацстанилид
358
536
УКАЗАТЕЛЬ СИНТЕЗОВ ПО ТИПАМ РЕАКЦИЙ
2-Нитро-л-цимол 360
Тетранитрометан 411
НИТРОЗИРОВАНИЕ
N-Нитрозо-Р-метиламиноизо-
бутилметилкетон 155
ш-Хлоризонитрозоацетофе-
нон 469
ОКИСЛЕНИЕ (см. также дегидрогени-
дегидрогенизация) Подзаголовки иллюстрируют
тип окисления. Окислитель заклю-
заключен в скобки перед названием пре-
препарата
СН3 -* СНО
[H2Se03] Бисульфитное соеди-
соединение глиоксаля 10й
[СгО3] о-Нитробснзальди-
ацетат 348
сн3 -> со2н
[КМпО4] Гидрохлорид пиколи-
новой кислоты 145
[К2Сг,О7, H»SO4] 3,4-Динитро-
бензойная кислота 214
сн2 -* с=о
[Ка2Сг2О7] Аценафтенхинон 82
[О2] а-Тетралон 405
СНОН -у С=О
{[(СН3)зСО]3А1} Холестенон 486
С=С-* СО2Н
[СгО3] Аллоксан-мопогидрат 12
[СгО3] бигно/;-Дезоксихолевая
кислота 155
[СгО3] яор-Дезоксихолевая ки-
кислота 153
Другие реакции окисления
[HNO3] Аллоксан 9
[КС1О3| Аллоксантин-дигид-
рат 14
[HNO3] Аммонийная и калиевая
соли 1,2-нафтохинон-4-сульфо-
кислоты 69
[РЬаО4] Аценафтенолацетат 79
[КОС1] p.fi-Диметилакриловая
кислота 182
[К2Сг207] 2,5-Динитробензойная
кислота 211
[HgO] Дифенилдиазометан 232
[NaOCll Иодобензол 261
[Н2О2] Мононядфталевая кисло-
кислота 326
[Na2Cr207] Нитрозобензол 354
[K2S2O8] 2-Нитрозо-5-нитрото-
луол 211
[Na2O2] Перекись анизоила 37/
|Na2O2] Перекись п-бромбензо-
ила 377
[Na2O2] Перекись л-ннтробензо-
ила 377
[Na2O2] Перекись я-нитробен
зоила 3/6
[Na2O2] Перекись 3,4,5-трибром-
бензоила 377
[Вг5 + Н2О] Цкстеиновая кислота
(моногидрат) 498
ОТЩЕПЛЕНИЕ Реагент, применяемый
для отщепления, заключен в скобки
перед названием препарата
Отщепление галоидоводородной ки-
кислоты.
[КОН] Ацеталь фсннлпропарги-
лового альдегида 445
[(СН3K СОК] Диэтнлацеталь ке-
тена 244
[КОН] Дифеннлацетклен 231
[NaOH] Циклопропанкарбоно-
вая кислота 496
Отщепление H2S
[Нагревание] Дифеннлтиокгрб-
азид 228
ПЕРЕГРУППИРОВКИ
Кумариловая кислота 272
Метилизотиоцианат 301
о-Эщенол 499
Этилизотиоцканат 302
ПРИСОЕДИНЕНИЕ (см. также восста-
восстановление, гидролиз, Гриньяра реак-
реакция) Реагенты, которые присоеди-
присоединяются, заключены в скобки перед
названием препарата
к С = С
[Н —NHOH] d/.Э-Амино-З-фе-
нилпропноновая кислота 61
[Вг—Вг] а-Бромкоричный аль-
альдегид 444
[СН3О —HgBr] а-Бром-?-мет-
окси-«-масляная кислота 418
[Н —NHCH3j Диазометан 155
[Вг — Вг] Дибромкумарин 272
[Вг—Вг] Дифенилацетилен 231
[Вг —Вг] Лииолевая кислота 277
[Вг — Вг] Линоленовая кисло-
кислота 283
[CH3O-HgOCOCH3] Метило-
Метиловый эфир а-бром-|5-метокси-
иропионовой кислоты 389
[Н— ВгЩетиловый эфир ^-бром-
пропионовой кислоты 308
УКАЗАТЕЛЬ СИНТЕЗОВ ПО ТИПАМ РКАКЦИЙ
537
ПРИСОЕДИНЕНИЕ
[Н — NHCH3] N-HnTp030-fi-Me-
тиламиноизобутилметилкетон
155
[Н — Вг] Этиловый эфир р-бром-
пропионовой кислоты 309
РЕФОРМАТСКОГО РЕАКЦИЯ
Этиловый эфир р-фенил-р-окси-
пропионовой кислоты 518
ФРАНСА ПЕРЕГРУППИРОВКА
4-Метил-7-окси-8-ацетилку ма-
марин 220
ФРИДЕЛЯ—КРАФТСА РЕАКЦИЯ
C-( 1-Аценафтоил)-пропионовая
кислота 87
Р-C-Аценафтонл)-пропионовая
кислота 84
«jt/анс-Дибензоилэтилен 169
Трифенилхлорметан 427
, Хлористый фенацил 469
ЦИКЛИЗАЦИЯ
9-Аминоакридин 36
4-Амино- 2,6-диметилпирими-
дин 44
2-Амино-6-метилбеизотиазол 49
4-Амино-1,2,4-триаяол 56
1,2,3-Бензотриазол 104
1-к-Бутилпирролидин 129
Дегидрацетовая Кислота 150
Димер кетена 180
5,5-Диыетилгидантоин 192
1,2-Диметилпирролидин 133
2,4-Диметилтиазол 197
Имидазол 254
Индол 258
1-Метил-2-н-бутилгшрроли-
дин 133
2-Метилиндол 302
4-Метнлкарбостирнл 304
1-Метилпирролидин 133
5-Метил-5-этилгидантоин 194
5-Нитроиндазол 357
1-я-Пропилпирролидин 133
Тетрафенилциклопснтадие-
нон 415
2-Фенилиндол 438
Хлористоводородный метилол-
имидазол 4J
1,1-Циклобутапдикарбоновая
кислота 490
Циклопропанкарбоновая кисло-
кислота 496
1-Этил-2-метплпирролидин 133
Этиловый зфир 1,3-диоксн
2>нафтойной кислоты 335
1-Этилпирролидин 133
ЭТЕРИФИКАЦИЯ (см. также ацили-
роеание)
Ацеталь акролеина 88
— р-этиксипропионового
альдегида 88
Бензиловый гфнр хлоруголь-
ной кислоты 100
mpem-Бутилацетят 121
mpem-Bytиловый гфнр изовале-
риановой кислоты 123
— — изо.масляной кисло-
кислоты 123
— — коричной кислоты 124
— — пропионовой кисло-
кислоты 123
— — хлеруксусной кисло-
кислоты" 124
Кислый метиловый эфир себа-
циновой кислоты 313
— —. — янтарной кисло-
кислоты 459
Метиловый эфир дезоксихоле-
вой кислоты 165
— — мирисп новой кисло-
кислоты 310
— — пальми1 иновой кисло-
кислоты 310
— — пировнноградной кисло-
кислоты 314
Пентаацетил-^-глюкононитрил
372
Этиловый эфир бромуксусной
кислоты 503
—• — каприловой кисло-
кислоты 311
— — лауриновой кислоты 311
— — линолевой кислоты 279
— —¦ линоленовой кисло-
кислоты 284
— — миристиновой кисло-
кислоты 311
УКАЗАТЕЛЬ
СИНТЕЗОВ ПО ТИПАМ СОЕДИНЕНИЙ
Каждый препарат отнесен к тому илн иному типу в зависимости от
того, какая группа вводится в описанном синтезе. Так, например, .и-бром-
иитробензол, получаемый бромнрованием нитробензола, был бы помешен
в разделе галоидопроизводных, а не в разделе нитросоединений. Если нет
особых указаний, двойная углерод-углеродная связь не рассматривается
как заместитель. Соли помещены прн соответствующих кислотах и осно-
основаниях.
2-Окси-1-нафтойный альдегид
АЗИДЫ
Фенилазид 433
АЗОСОЕДИНЕНИЯ
Азобензол 7
Азобензолкарбоновая кислота 8
АЛЬДЕГИДЫ
Незамещенные альдегиды
Альдегид мезитилеикарбоно-
вой кислоты 16
9-Антральдегид 74
Бисульфитное соединение гли-
оксаля 106
р-НафтоЙР1ЫЙ альдегид 328
Терефталевый альдегид 397
2,4,6-Триизопропилбензальде-
гид 20
2, 4,6-Триэтилбензальдегнд21
Фепилпропаргиловый альде-
альдегид 444
а-Фенилпропноновый альде-
альдегид 446
Замещенные альдегиды
Альдегидофталевая кислота 2J
1-Ацетокси-З-нафтальдегид
331
а-Бромкорнчный альдегид
444
р-Диметиламинопропиофенон
солянокислый 184
Метиловый эфир 3-формилпро-
пионовой кислоты 331
о-Ннтробензальдегнд 348
л«-0ксибензальдегид 363
365
о-Формтолуид 258
2-Этокси-1-нафтальдегид 74
АМИДЫ
Амид изомасляпой кислоты 24
— калия 35
— миндальной кислоты 26
— молочной кислоты 28
— натрия 31
Анилид бензоилуксусной ки-
кислоты 73
Бензиловый эфир карбамино-
вой кислоты 101
а,а-Дихлорацетаыид 242
а,а'-Дициан-р-метилглутар-
амид 294
Метиловый эфир моноамида
себациновой кислоты 312
АМИНЫ
Незамещенные амины
1. Первичные
9-Аминоакридин 36
2-Аминогептян 449
2-Амипо-л-цимол 66
я-Гептйламин 449
л-Метилфенилэтиламнн 451
о-Метилфенилэтиламин 451
л-Метилфенилэтиламин 451
а-Фенилэтиламин 448
Р-Фенилэтиламин 450
2. Вторичные
Ж-Толилбензиламин 416
о-Толилбензнламин 417
УКАЗАТЕЛЬ СИНТЕЗОВ ПО ТИПАМ СОЕДИНЕНИЙ
539
2. Вторичные
77-Толилбензнламин 417
3. Третичные
а-Амилгексилднметнламин 454
Бензилдодецилметиламин 454
fi-Фснилэтилдиметиламин 452
4. Диамины
f-Ди-н-бутиламннопропил-
амин 173
р-Ди-я-бутиламиноэтнламнн
175
f-Ди-я-пропиламинопропил-
амип 174
Ди-я-пропиламиноэтиламин
176
Диэтилаыиноэтиламин 176
Замещенные амииы
Аминоацетяль 39
Ацетоацетанилид 96
.и-я-Бутоксианилин 135
л-я-Бутоксиапилин 135
л-я-Гексоксианилин 135
1,2-Диамино-4-нитробензол 162
2,6-Диброманнлин 236
Дн-^-карбометоксиэтилметнл-
амин 180
Ди-[5-карбэтоксиэтилметнл-
амин 178
fl-Диметиламинопропиофенон
солянокислый 184
3,4-Диметокснфенилэтиламнн
451
2,6-Дихлоранилин 236
л-Изопропоксианилин 135
3,4-Метилендиоксифенилэтил-
амин 451
2-Нитро-4-метоксианилин 358
о-Формтолуид 258
Фурфуриламин 449
АНГИДРИДЫ КИСЛОТ
Ангидрид я-капроновой кне-
лоты 266
— я-масляной кислоты 267
— прбпноновой кислоты 267
Тетрафенилфталевый ангид-
ангидрид 413
АЦЕТАЛИ
Аминоацеталь 39
Ацеталь акролеина 88
— а-бромкоричного альде-
альдегида 445
— фенилпропаргилового аль-
альдегида 445
—р-этоксипропиопового аль-
альдегида 88
Бромацеталь 109
Диэтилацеталь кетена 244
о-Нитробензальднацетат 348
ГАЛОИДОАНГИДРИДЫ КИСЛОТ
Хлорангидрид азобензолкар-
боновой кислоты 458
— изомасляной кислоты 24
— ш-карбометоксипеларгоно-
вой кислоты 312
— fi-карбометоксипропионо-
вой кислоты 459
— карбэтоксиадипнновой кн-
слоты 461
— карбэтоксисебациновой
кислоты 461
— мезнтиленкарбочовой ки-
кислоты 462
— фумаровой кислоты 464
Хлористый i-ментоксиацетнл
477
ГАЛОИДОПРОИЗВОДНЫЕ УГЛЕ-
УГЛЕВОДОРОДОВ
Моногалоидные алкилы
1. Бромиды
Трифенилбромметан 427
2. Хлориды
Трифенилхлорметан 426
а2-Хлоризодурол 289
1-Хлорметилнафталин 481
Полигалоидные производные
Бромистый гексаметилен 112
— декаметилен 111
—¦ нонаметилен _112
— пентаметилен 112
— триметилен 112
.и-Дибромбензол 469
Йодистый дифенилиодоннн 260
а,а,а',а'-Тетрабром-ге-КСИЛОЛ
397
.и-Хлорбромбеизол 469
о-Х лорбромбензол 467
Хлористый иодбензол 475
— ж-иодтолуол 476
— о-нодтолуол 476
— л-иодтолуол 476
ГАЛОИДОПРОИЗВОДНЫЕ ДРУ-
ДРУГИХ КЛАССОВ
Галоидоальдегиды
а-Бромкоричный альдегид 444
Галоидоамины
2,6-Диброманилин 236
2,6-Дихлоранилнн 236
540
УКАЗАТЕЛЬ СИНТЕЗОВ ПО ТИПАМ СОЕДИНЕНИЙ
УКАЗАТЕЛЬ СИНТЕЗОВ ПО ТИПАМ СОЕДИНЕНИЙ
541
Галоидокетоны
Дихлорацетофенон 323
ш-Хлоризонитрозоацетофенон
469
2-Хлорциклогексанон 483
Галоидонитросоединения
Хлористый 2-окси-5'нитробен-
зил 478
Галоидосгирты и галоидофенолы
6-Бром-2-нафтол 115
Галоидоэфиры
о-Броманизол 469
fs-Этокснэтилбромид 528
Прочие галоидопроизводные
Бромистый тстрагидрофурфу-
рил 114 ' .
2-Бромфталид 21
Дибромкумарин 272
Метиловый эфир а-бром-р-мет-
оксипропионовой кислоты
389
Хлористый тетрагидрофурфу-
рил 375
2-Хлорлепидин 480
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИ-
СОЕДИНЕНИЯ
Азотсодержащие гетероциклы
Аллоксан 9
Аллоксан-моногидрат 12
Аллоксантин-дигидрат 14
4-Амино-2,6-диметилпирими-
дин 44
1-Амино-1,3,4-триазол 56
Бензальбарбитуровая кислота
12
1,2,3-Бензотриазол 104
1-я-Бутилпирролидин 129
Гемии 141
5,5-Диметилгидантоин 192
1,2-Диметилпирролидин 133
Имидазол 254
Индол 258
Криптопиррол 269
1-Метил-2-н-бутилпирроли-
дин 133
2-Метилипдол 302
4-Метилкарбостирил 304
1-Метилпирролидин 133
5-C-Метокси-4-оксибензаль)-
креатинин 297
5-C-Метокси-4-оксибензил)-кре-
атинин 298
5-Нитроиндазол 357
1-(а-Пиридил)-2-пропанол 378
1-(а-Пиридил)-3-пропанол 380
1-л-Пропилпирролидин 133
2-Фенилиндол 438
Хлористоводородный метилол-
имидазол 472
2-Хлорлепидин 480
1-Этил-2-метилпирролидин 133
1-Этилппрролиднн 133
Кислородсодержащие гетероциклы
Бромистый тетрагндрофурфу-
рил 114
2-Бромфталид 21
Дибромкумарин 272
2,3-Дигндропиран 176
4-Метил-7-ацетоксикумарин
219
4-Мстилкумарин 305
4-Метил-7-оке и-8-ацетил кума-
кумарин 220
4-Метил-7-оксикумарин 219
Тетрагидропиран 403
Фурфуриламин 449
Хлористый тетрагидрофурфу-
рил 375
2-Этилхромон 524
Гетероциклы, содержащие два раз-
различных гетероатома
2-Амино-6-метилбензотиазол
49
2,4-Диметилтиазол 197.
ГИДРАЗИН И ЕГО ПРОИЗВОД-
ПРОИЗВОДНЫЕ
Гидразин безводный 232
Гидразон бензофенона 233
Диаминобиурет 510
Этиловый эфир гидразинкарбо-
новой кислоты 510
ДИАЗОСОЕДИНЕИИЯ
Диазометан 155
Дифенилдиазометан 232
Этиловый эфир диазоуксусной
кислоты 512
ИЗОТИОЦИАНАТЫ И ИЗОЦИА-
11АТЫ
Метилизотиоцианат 301
Ундецилизоцианат 432
Этилизотиоцианат 302
ИМИНЫ (см. гетероциклические
соединения)
ИОДО- и ИОДОЗОСОЕДИНЕНИЯ
Иодобензол 261
Иодозобензол 264
КАТАЛИЗАТОРЫ
Катализатор никель Ренея 338
КЕТЕН И ЕГО ПРОИЗВОДНЫЕ
Димер кетена 180
Дифенилкетен 234
КЕТОНЫ
Монокетоны
Дипнон 224
Псевдоионон 380
а-Тетралон 405
Тетрафенилциклопентадиенон
415
Холестенон 486
Дикетоны
Ацетил ацетон 92
Дибензоилметан 167
траяс-Дибензоилэтилеи 169
2,3-Диметилантрахинон 186
Метилфенилглиоксадь 319
Замещенные кетоны
1. Галоидокетоны
Дихлорацетофенон 323
2-Хлорциклогексанон 483
2. Различные кетоны
З-Диметиламинопропиофенон
солянокислый 184
ш-Метоксиацетофенон 321
N- Нитроз о-Ь-метиламинои зо-
бутилыетилкетон 155
Резацетофенон 384
ш-Хлоризонитрозоацетофенон
469
КИСЛОТЫ
Незамещенные кислоты
Одноосновные
Вииилуксусиая кислота 138
Гндрохлорид пнколиновой
кислоты 145
Р [J-Диметилакриловая кисло-
кислота 182
Кумариловая кислота 272
Линолевая кислота 277
Лииоленовая кислота 283
Мезитилуксусная кислота 289
Сорбиновая кислота 393
Циклобутанмонокарбоновая
кислота 490
Циклопропанкарбоновая ки-
кислота 496
Многоосновные
Гомофталевая кислота 146
fi-Метилглутаровая кислота
294
1,1-Ци к л обу та нди карболовая
кислота 490
Замещенные кислоты
1. Аминокислоты
а-Аминодиэтилуксусная ки-
кислота 46
З-Амино-2-нафтойная кислота
51
Л-з-Амино-а-фенилпропионо-
вая кислота 58
^^ф
вая кислота 61
dl-a- Аминофенилуксусная ки-
кислота 63
Л-Валин 135
dZ-Изолейцин 250
dZ-Лейцин 275
d/-Cepmi 389
d.'-Фенилаланин 435
2. Галоидокислоты
а-Бромнзовалериановая ки-
кислота i 35
а-Броыизокапроновая кисло-
кислота 275
а- Бр ом- Ь- мет и л валериановая
кислота 251
Бромуксусная кислота 504
а-Бром-3-фенилпропионовая
кислота 436
Гексаоромстеариновая кислота
283
Гептабромстеариновая ки-
кислота 2 85
Тетраоромстсаршговая ки-
кислота 278
3. Кетокислоты
й-A-Ацеиафтоил)-пропионовая
кислота 87
?-C-Ацснафтоил)-пропионо-
вая кислота 84
Бензоилмуравьиная кислота
103
Дегидрацстовая кислота 150
4. Нитрокяслоты
3 4-Динитробензойная кисло-
кислота 213
5. Окснкислоты
2,5-Диметилминдальная ки
слота 195
1,3-Диокси-2-нафтойная ки-
кислота 335
Миндальная кислота 322
542
УКАЗАТЕЛЬ СИНТЕЗОВ ПО ТИПАМ СОЕДИНЕНИЙ
6. Различные кислоты
Альдегидофталевая кислота 21
а-Бром-'-метокси-«-масляная
кислота 418
а-Dp ом-р-метоксипропионовая
кислота 390
Гуанндилуксусная кислота
148
бискор-Дезоксихолевая кисло-
кислота 155
wop-Дезоксихолевая кислота
153
Карбобензоксиаланин 102
Карбобензоксиглицин 101
i-Ментоксиуксусная кислота
2S2
Ы-Метил-3_14>а,иоксифенил-
аланин 2Г6
Ы-Метил-C-метокси-4-окси-
фенил)-аланин 2Е8
d.'-Треонин 417
Фурилакриловая кисдота 455
w-Цианпеларгоновая кислота
208
Цистеиновая кислота (моно-
(моногидрат) 4S8
МОЧЕВИНЫ И ТИОМОЧЕВИНЫ
ПРОИЗВОДНЫЕ
смлш-Диметилтиомочевина 318
Лаурилизотиомочевнны броми-
стоводородная соль 247
Метилтиомочевина 318
Триметилтиомочевина 318
Этилтиомочевина 318
НИТРИЛЫ
Незамещенные нитрилы
Динитрил себациновой ки-
кислоты 208
Дурилацетонитрил 291
Изодурилацетонитрил 291
Мезитилацетонитрил 2Е 0
Нитрил изомасляной кислоты
341
— малоновой кислоты 342
— а-нафтойной кислоты 344
— циклопропанкарбоновой
кислоты 346
2,4,6-Триэтилфенилацето-
нитрил 291
а-Циклогексилфенилацетони-
трил 494
Замещенные нитрилы
2,6-Диметоксибензонитрил201
и-Карбоксифенилацетонитрил
267
2-Нитро-6-метоксибензо-
нитрил 201
Пентаацетил-й-глюконо-
нитрил 372
Цианистый бензоил 488
[З-Этоксипропионитрнл 526
НИТРОЗОСОЕДИНЕНИЯ
Нитрозобензол 354
Ы-Нитрозо-[з-метиламино-
изобутилметилкетон 155
2-Нитрозо-5-нитротолуол 211
НИТРОСОЕДИНЕНИЯ
Незамещенные
2,2'-Динитродифенил 216
2-Нитро-л-цимол 360
Тетранитрометан 411
Замещенные
1,2-Диамино-4-нитробензол 162
2,5-Динитробснзойная кисло-
кислота 211
3,5-Динитробензойная кисло-
кислота 214
о-Нитробензальдегид 348
2-Нитро-4-метоксианилин 35&
2-Нитро-4'Метоксиацетанилид
358
Хлористый 2-окси-5-нитро-
бснзил 478
ОКИСИ (см. простые эфиры, гетеро-
гетероциклические соединения)
ПЕРЕКИСИ
Мононадфталевая кислота 326
Перекись анизоила 377
¦— ге-бромбензоила 377
— ж-нитробензоила 377
— ге-нитробензоила 376
— 3,4,5-трибромбензоила 377
ПРОСТЫЕ ЭФИРЫ (см. также ге-
гетероциклические соединения)
Аллиловый эфир гваякола 499
о-Вроманизол 469
ж-«-Бутоксианилин 135
п-к-Бутоксиаиилии 135
ж-«-Бутоксинитробензол 135
о-и-Бутоксинитробензол 134
тг-л-Бутоксинитробензол 135
п-м-1 ексоксианилин 135
о-н-Гексоксииитробензол 135
п-н-l ексоксинитробензол 135
2,2'-Диметил-э,э'-диметокси-
дифенил 205
УКАЗАТЕЛЬ СИНТЕЗОВ ПО ТИПАМ СОЕДИНЕНИЙ
54а
ПРОСТЫЕ ЭФИРЫ
З,3'-Диметоксидифенил 203
3,4-Диметоксифенилэтиламин
451
п-Изопропоксианилин 135
гс-Изопропоксннитробензол
135
Метиловый эфир а-бром-р-мет-
оксипропионовой кислоты
389
ш-Метоксиацетофенон 321
5-C-Метокси-4-оксибензаль)-
креатинин 297
5-C Метокси-4-оксибензил)-
креатинин 2S8
2-Нитро-4-метоксианилин 358
о-Эвгенол 4?9
2-Этокси-1-нафтальдегид 74
Р-Этоксиэтилбромид 528
СЕЛЕНОРГАНИЧЕСКИЕ СОЕДИ-
СОЕДИНЕНИЯ
п-Бромфенилселенофенол 388
я-Бутилселенол 388
Селенокрезолы 388
Селенофенол 386
СЕРУСОДЕРЖАЩИЕ СОЕДИНЕ-
СОЕДИНЕНИЯ (см. также гетероциклические
соединения)
Бромистоводородная S-этил-
тиомочевина 148
Бутиловый эфир тг-толуолсуль-
фокислоты 250
к-Гексадециловый эфир
п бромбензолсульфокислоты
250
н-Гексадсциловый эфир ге-то-
луолсульфокислоты 250
«-Гептилмеркаптан 248
н-Децилмеркаитан 248
«-Дециловый эфир л-бромбен-
золсульфокислоты 250
4,4'-Диаминодифенилсульфон
160
Дитизон 227
Дифенилтиокарбазид 228
н-Додецилмсркаптан 246
н-Додециловый эфир ге-бром-
бензолсульфокислоты 250
^-Додециловый эфир п-толу-
олсульфокислоты 249
Метилизотиоцианат 301
н-Нонилмеркаптан 248
«-Октадецилмеркаптан 248
к-Октадециловыйэфир тг-бром-
бензолсульфокислоты 250
— — rz-толуолсульфокислоты
250
и-Октилмеркаптан 248
Соль фенилгидразина и [3-фе-
нилдитиогидразинкарбоно-
вой кислоты 227
и-Тетрадециловыйэфирге-бром-
бензолсульфокислоты 250
— — п-толуолсульфокисло-
ты 250
«-Ундецилмеркаптан 248
Этилизотиоциаиат 302
СЛОЖНЫЕ ЭФИРЫ ОРГАНИЧЕ-
ОРГАНИЧЕСКИХ КИСЛОТ
Незамещенные сложные эфиры
1. Одноосновных кислот
Аценафтенолацетат 79
mpem-Бутилацетат 121
mpem-Бутиловый эфир изо-
валериановой кислоты 123
изомасляной кислоты 123
— — коричной кислоты 124
— — пропионовой кислоты
123'
Метиловый эфир бензальмало-
новой кислоты 501
— — миристиновой кислоты,
310
— — пальмитиновой кислоты
310
Фениловый эфир коричной
кислоты 442
Этиловый эфир каприловой
кислоты 311
лауриновой кислоты 311
— — линолевой кислоты 279
— — линоленовой кислоты
284
¦— — миристиновой кислоты
311
2. Многоосновных кислот
3,12-Диацетокси-биснор-хола-
нилдифенилэтилен 164
Диэтиловый эфир бензилма-
лоновой кислоты 435
— — еягор-бутилмалоновой
кислоты 251
Кислый метиловый эфир себа-
себациновой кислоты 313
— — — янтарной кислоты
459
Этиловый эфир бензальмалоно-
вой кислоты 501
544
УКАЗАТЕЛЬ СИНТЕЗОВ ПО ТИПАМ СОЕДИНЕНИИ
Этиловый эфир 1,16-гексадекан-
дикарбоиовой кислоты 508_
Замещенные сложные эфиры
1. Галоидоэфиры
Бензиловый эфир хлоруголь-
ной кислоты 100
трет-Ъутидовый эфир хлор-
уксусной кислоты 124
Метиловый эфир fs-бромпро-
пионовой кислоты 308
Этиловый эфир [i-бромпропио-
новой кислоты 309
бромуксусной кислоты 504
2. Кетоэфиры
Метиловый эфир пировино-
градной кислоты 314
Этиловый эфир бензоилуксус-
ной кислоты 503
— — днацетоуксусной кисло-
кислоты 513
— — фенилацетилмалоновой
кислоты 334
3. Прочие сложные эфиры
Ацетоацетанилид 66
Ацетокси-3-нафтальдегид 331
Ди-р- кар бометокснэти л метил-
метиламин 180
Ди-^-карб&токсиэтилметил-
амин 178
Метиловый эфир а-бром-р-мет-
оксипрошюновой кислоты
389
— — дезоксихолевой кислоты
165
— — fs-формилпропиоиовой
кислоты 331
ю-цианнеларгоновой ки-
кислоты 316
л-Нитробензиловьш эфир ук-
уксусной кислоты 351
Этиловый эфир 2,5-диметил-
фенилоксималоновой кисло-
кислоты 195
— — а,а-диметил-?-феннл-
3-оксипропионовой кисло-
кислоты 519
— — 1,3-диокси-2-нафтойной
кислоты 335
— — N-трикарбоновой ки-
кислоты 515
фенилметилглицидной
кислоты 516
р-фенил-?-оксипропио
новой кислоты 518
Этиловый эфир а-циан-Р,Р-диэтил-
акриловой кислоты 520
— — а-циан -fs-этилиден-н-ва
лериановой кислоты 522
СОЛИ (см. кислоты, амины) ¦
СПИРТЫ
Незамещенные спирты
1. Первичные
4-Пентен-1-ол 374
2. Вторичные
Аценафтенол-7 79
3. Третичные
Диметилэтииилкарбинол 198
Мети лэтилэтини л карбинол
200
Три-л-бифенилкарбинол 422
Трифенилкарбинол 424
Этинилдиклогексанол 200
Замещенные спирты
о-Амнкобензиловый спирт 42
трет- Б ути лат алюминия 119
л-Иодбензиловый спирт 353
л-Нитробензиловый спирт 353
.и-Оксибеизальдегид 363
2-Окси-1-нафтойный альдегид
365
Резацетофенон 384
Хлористый 2-окси-5-нит.ро-
бензил 478
УГЛЕВОДОРОДЫ
Алифатические
2,3-Димитилбутадиен-1,3 187
Ароматические
к-Бутилбензол 126
З,3'-Димепыдифенил 203
Дифенилацетилен 231
п!/?снс-Стильбен 395
1-Фенилнафталии 440
УГЛЕВОДЫ И ИХ ПРОИЗВОД-
ПРОИЗВОДНЫЕ
d-Арабиноза 77
Ацетобромглюкоза 97
rf-Манноза 287
[1-Октаацетилгенциобиоза 370
1,2,3,4-Тетраацетил-р-й-глюко-
за 399
2,3,4,6- Тетраацетил-P-d- глюко-
глюкоза 401
1,2,3,4-Тетраацетил-6-трифенил-
ыетил-р-а-глюкоза 399
УКАЗАТЕЛЬ СИНТЕЗОВ 110 ТИПАМ СОЕДИНЕНИИ
545
УГЛЕВОДЫ И ИХ ПРОИЗВОДНЫЕ
2,3,4,6-Тетраметил-й-глюкоза
407
ФЕНОЛЫ
Незамещенные фенолы
о-н-Гептилфенол 142
Нафторезорцнн 334
Замещенные][фенолы
2-Амино-4-нитрофенол 54
6-Бром-2-нафтол 115
З-Бром-4-окситолуол 117
ж-Бромфенол 119
2,6-Диоксиацетофенон 218
5-C-Метокеи-4-оксибензал ь)-
креатинин 297
Д-C-Метокси-4-оксибензил)-
креатинин 298
о-Эвгенол 498
о-Энантоилфенол 143
хиноны
Аммонийная и калиевая соли
1 ,2-нафтохинон-4-суль-
фокислоты 69
Аценафтенхинон 82
2-Метокси-1;4-нафтохинон368
2 Окси-1 ,4-нафтохинон 367
ЦИАНИДЫ (см. нитрилы)
УКАЗАТЕЛЬ ВЕЩЕСТВ ПО ФОРМУЛАМ
В этом указателе перечислены все препараты. Принятая в указателе систе-
система та же, что и в Chemical Abstracts. Основные принципы ее состоят в сле-
следующем: 1) все обозначения химических элементов в формулах расположены
в алфавитном порядке, за исключением того, что в органических соединениях
на перзом месте всегда стоит С, а непосредственно за ним Н, если соединение
содержит также и водород; 2) сами формулы расположены по возрастающему
числу атомов углерода; при равном числе атомов углерода— по возрастающему
числу атомов водорода; при равном числе атомов углерода и водорода —
в алфавитном порядке названий остальных входящих в формулу элементов;
3) соединения, имеющие одинаковую формулу, расположены в алфавитном
порядке названий изомеров; 4) неорганические соли органических кислот и про-
продукты присоединения неорганических соединений к органическим расположены
при формуле тех соединений, производными которых они являются; 5) при
написании приводимых формул кристаллизационная вода во внимание не при-
принималась.
CH2N2 Диазометан 155
CN4O8 Тетранитрометан 411
С2Н2О2 Бисульфитное соединение гли-
оксаля 106
С2Н3Вг02 Бромуксусная кислота 504
C2H3Q2NO а,а-Дихлорацетамид 242
C2H3NS Метилизотиоцианат 301
C2H4N4 1-Амино-1,3,4-триазол 56
C2HeN2S Метилтиомочевина 318
C2H7N5O» Диаминобиурет 510
C3H2N2 Нитрил малоновой кислоты 342
C3H4N2 Имидазол 254
C3H5NS Этилизотиоцианат 302
С3НвВг2 Бромистый триметилен 112
C3H,NO2 Амид молочной кислоты 28
C3H7NO3 <2/-Серин 389
C3H7NO5S Цистеиновая кислота (мо-
(моногидрат) 498
C3H7N3Oo Гуанидилуксусная кислота
148
C3H8N2O2 Этиловый эфир гидразин-
карбоновой кислоты 510
C3H8N2S сыжж-Диметилтиомочевина
318
QsHsN^S Этилтиомочевина 318
C3HeBrN2S Бромистоводородная
S-этилтиомочевина 148
С4Н2С12О2 Хлорангидрид фумаровой
кислоты 464
C4H2N2O4 Аллоксан 9
C4H4N2O5 Аллоксан-моногидрат. 12
С4Н4О2 Димер кетсна 180
C4H6N Нитрил циклопропанкарбоно-
вой кислоты 346
C4H6N2O Хлористоводородный ме-
тилолимидазол 472
C4HeN2O2 Этиловый эфир диазоуксус-
ной кислоты 512
С4НвО2 Винилуксусная кислота 138
С4Н0О2 Циклопропанкарбоновая ки-
кислота 496
С4НвО3 Метиловый эфир пировино-
градной кислоты 314
С4Н7Вг02 Метиловый эфир р-бром-
пропионовой кислоты 308
С4Н7Вг02 Этиловый эфир бромуксус-
ной кислоты 504
QH7Br03 а-Бром-р-метоксипропиоио-
вая кислота 390
С4Н,СЮ Хлорангидрид изомасляной
кислоты 24
C4H7N Нитрил изомасляной кислоты
341
С4Н9Вг0 р-Этоксиэтилбромид 528
C4H9NO Амид изомасляной кислоты
24
C4H9NO., с!/-Треоиин 417
C4H10N2S Триметилтиомочевина 318
УКАЗАТЕЛЬ ВЕЩЕСТВ ПО ФОРМУЛАМ
547
С5Н7СЮ3 Хлорангидрид р-карбомет-
оксипропиоиовой кислоты 459
C5H7NO Фурфуриламин 449
C3H8C1NS 2,4-Диметилтиазол 197
C5HSN2O2 5,5-Диметилгиданр1"оин 192
С5Н8О 2,3-Дигидропиран 176
С5Н8О Диметилэтинилкарбинол 198
С5Н8О2 Ацетилацетон 92
С6Н8Оо р, р-Диметилакриловая кисло-
кислота 182
С6Н8О2 Циклобутанмонокарбоновая
кислота 490
С5Н3О3 Метиловый эфир р-формил-
пропионовой кислоты 331
CJ18O4 Кислый метиловый эфир ян-
янтарной кислоты 459
С5Н9Вг0 Бромистый тетрагидро- -
фурфурил 114
С6НвВг02 Этиловый эфир р-бром-
пропионовой кислоты 309
С5НвВг02 а-Бромизовалериановая ки-
кислота 136
С5Н9Вг03 Метиловый эфир а-бром-
р-метоксипропионовой кислоты 389
C6HflBr03 а-Бром-р-метокси-к-масля-
ная кислота 418
С5Н9С1О Хлористый тетрагидро-
фурфурил 375
СзНвКЮ р-Этоксипропионитрил 527
С5Н]0Вг2 Бромисшй пентаме'илен 112
С5Н]0О Тетрагидропиран 403
С6Н1оО 4-Пентеп-1-ол 374
C5Hi0O6 d-Арабиноза 77
QHuN 1-Метилпирролидин 133
C6HiiNOa Л-Валин 135
С6Н4ВгС1 ж-Хлорбромбензол 469
С6Н4ВгС1 о-Хлорбромбензол 467
С6Н4Вг2 ,и-Дибромбензол 469
С6Н6Вг0 ж-Бромфенол 119
С,НбВг2 2,6-Диброманилин 236
СвП6С12 2,6-Днхлоранилин 236
C6H5C12J Хлористый иодбеизол 475
C6H5JO Иддозобензол 264
C6H5JO2 Иодобензол 261
C6H6NO Нитрозобензол 354
C6II5NO2 Гидрохлорид пиколиновой
кислоты 145
C6H5N3 1,2,3-Бензотриазол 104
CeH5N3 Фенилазид 433
C6HeN2O3 2-Амино-4-нитрофенол 54
CeH6Se Селеногренол 386
CBH7N3O2 1,2-Диамино-4-нитробензол
162
С8Н8О2 Сорбиновая кислота 393
С6Н3О4 1,1-Циклобутандикарбоновая
кислота 490
СвН9СЮ 2-Хлорциклогексанон 483
C6H9N3 4-Амино-2,6-диметил пирими-
пиримидин 44
С6Н,0 2,3-Диметилбутадиеи-1,3 187
C6H]0N2Oo 5-Метил-5-этилгидантоин
194
С6Н10О Метилэтилэтинилкарбинол 200
C6Hj0O3 Ангидрид пропионовой ки-
кислоты 267
C6Hj0O4 р-Метилглутаровая кислота
294
CjHnBrOj а-Бромизокапроновая ки-
кислота 275
С6НпВг02 а-Бром-Р-метилвалериано-
вая кислота 251
С6НПС1О2 mpem-Бутиловый эфир
хлоруксусной кислоты 124
СвН12Вг2 Бромистый гексаметилен 112
С8Н12О2 m/jem-Бутилацетат 121
CSH12O2 Диэтилаиеталь кетена 244
С6Н12О6 d-Манноза 287
С6Н13ВЮ2 Бромацеталь 109
C6H]3N 1-Этилпирролидин 133
QH13N 1,2-Диметилпирролидин 133
CaHi3NO2 з-Аминодиэтилуксусная ки-
кислота 46
CeH,3NO2 Л-Изоленцин 250
CeH]3NO2 Л-Лейцин 275
C6H,5NO2 Аминоацеталь 29
C0Hi,N2 Диэтиламиноэтиламин 176
C7H4N2O6 2,5-Динитробензойная ки-
кислота 211
C7H4N2Oe 3,4-Дннитробензойная ки-
кислота 213
C7H4N2OS 3,5-Динитробензойная ки-
кислота 214
C7H5NO3 о-Нитробензальдегид 348
C7H5N3OS 5-Нитроиндазол 357
С7Н6С1О3 Хлористый 2-окси-5-нитро-
бензил 478
C7HeN2O3 2-Нитрозо-5-нитротолуол
211
С7НвО2 .и-Оксибензальдегид 363
С7НвО3 Фурилакриловая кислота 455
С7Н6О4 3,5-Диоксибензойная кисло-
кислота 222
С7Н7Вг0 о-Броманизол 469
С7Н7Вг0 З-Бром-4-окситолуол 117
C7H7C12J Хлористый ж-иодтолуол 476
C7H7C12J Хлористый о-иодтолуол 476
C7H7C12J Хлористый ге-иодтолуол 476
C7H7JO п-Иодбензиловый спирт 353
C7H7NO3 п-Нитробензиловый спирт
353
C7H8N2O3 2-Нитро-4-метоксианилин
358
C7H8N2S 2-Амино-6-метилбензотиазол
49
548
УКАЗАТЕЛЬ ВЕЩЕСТВ ПО ФОРМУЛАМ
C7H9NO о-Аминобензиловый спирт 42
С7Н14О2 Аце.таль акролеина 88
С7НИО2 mpem-Бутиловый эфир про-
пионовой кислоты 123
C,H15N 1-/г-Пропилпнрролидип 133
C7H,5N 1-Этил-2-метилпирролидин 133
G.H15NO N-Нитрозо-З-метилампноизо-
бутилметилкетон 155
C,Hl6S н-Гептилмеркаптан 248
C7H17N 2-Амнногептаи 449
C7Hl7N н-Гептилаыин 449
C7Hl8N2 7-Диэтиламинопропиламнн 174
С3Н5Вг0» 2-Бромфталид 21
C3H5NO Цианистый бензоил 488
С3НвВг, а,а,а',а'-Тетрабром-л-ксилол
397
C8H6C1NO2 ы-Хлоризонитрозоацетофе-
нон 469
GjHjCTjO u>, ш-Дихлороацетофенон 323
C3HeN2O3 2-Нитро-6-метоксибензо-
нитрил 201
C3HGN4O3 Аллоксантин-дигидрят 14
С3Н6О2 Терефталевый альдегид 397
С3НвО3 Бензоилмуравьиная кислота
103
С3Н6О3 Альдегидофталевая кислота
21
С3Н6О5 Мононадфталевая кислоia 326
CSH7QO2 Бензиловый эфир хлор-
уголыюй кислоты 106
C8H7N Индол 25В
CSHSO3 2,6-Диоксиацетофенон 218
С8Н8О3 Миндальная кислота 322
С8Н8О3 Резацетофенон 384
С3НЭО4 Дегидрацетовая кислота 150
CSH9NO о-Формотолуид 258
C8H9NO N-Метилформанилид 320
CsH9NOo Амид миндальной кислоты
26
CSH9NO2 Л-о-Амшюфеиилуксусная
кислота 63
C8H9NO2 Бензиловый эфир карбами-
новой кислоты 101
C8H10N4Oo а,я'-Дициан-3-метил-
глутарамид 294
C8HnN а-Фенилэтиламин 448
CsHnN й-Фенилэтиламин 450
C8H,,NO 1-(а-Пиридил)-2-пропанол 378
CsHnNO 1-(я-Пиридил)-пропанол 380
С,Н12О 1-Этинилциклогексанол-1 200
C8Hi204 Этиловый эфир диацетоук-
сусной кислоты 513*
CSH13C1O3 Хлорангидрид карбэтокси-
адипиновой кислоты 461
C8H13N Крпптопиррол 269
С,НиО,ч Ангидрид н-масляной кисло-
кислоты 267
С8Н1бО2 mpem-Бутиловый эфир изо-
масляной кислоты 123
C8H17N 1-и-Бутилпирролидин 129
C8H18S н-Октилмеркаптан 248
C8H2ON2 Ди-я-пропиламино^тиламин
176
С9Н6Вг202 Дибромкумарин 272
С9Н6О Фенилпропаргиловый альдегид
444
С9НвО3 Кумариловая кислота 272
С9Н,ВЮ а-Бромкоричиый альдегид
444
CeH7N02 о-Карбоксифенилацегонитрил
267
CeH7NO4 Ди-3-карбометоксиэтилметил-
амин 180
,С9НаО2 Метилфенилглиоксаль 319
С9Н8О4 Гомофталевая кислота 146
С9Н9Вг02 а-Бром-[1-фенилпропионовая
кислота 436
C9H9N 1-Метилиндол 302
C9H9NOa 2,6-Диметоксибензонитрил
201
C9H9NO4 77-Нитробензиловый эфир
уксусной кислоты 351
C9H10N2O4 2-Нитро-4-метоксиацетани-
лид 358
С9Н]0О я-Фенилпронионовый альде-
альдегид 446
С9Н10О2 м-Метоксиацетофенон 321
C9HnNO2 ^/-а-Амино-р-фенилпропио-
новая кислота 58
C9HnNO2 ^/-Э-Амино-^-фенилиронио-
новая кислота 61
C9H-[]NO2 Л-Фенилал^нин 435
C9HnNO2 3,4- Мети лендиоксифенил-
этиламин 451
C9H3,NOo п-Изопропоксинитробензол
135"
C9H13N о-Метилфенилэтиламин 451
C9H13N ж-Метилфенилэтиламин 451
С9Н13К ге-Метилфенилэтиламин 451
C9H]3NO тг-Изопропоксианилин 135
C9H15NO6 Этиловый эфир N-трикар-
боновой кислоты 515
С9Н18Вг2 Бромистый нонаметилен
112
С9Н18О2 т^иет-Бутиловый эфир изо-
валериановой кислоты 123
C9H19N 1 -Метил-2-н-бутилпирролидин
С9Н20О3 Ацеталь Э"этоксипропионо-
вого альдегида 88
C9H2OS н-Нонилмеркаптан 248
C9H22NT2 7"Ди"н"пРопиламинопропил-
амин 174
^юНвО3 2-Окси-1,4-нафтохинон 367
УКАЗАТЕЛЬ ВЕЩЕСТВ ПО ФОРМУЛАМ
549
C10H6O5S Аммонийная и калиевая
соли 1,2-нафтохинон-4-сульфоки-
слоты 69
С10Н,ВгО 6-Бром-2-нафтол 115
C1OH3C1N 2-Хлорлепидин 480
С10Н8О2 4-Метилкумарин 305
С10НэО2 Нафторезорцин 334
С10Н3О3 4-Метил-7-оксикумарин 219
C10H9NO 4-Метилкарбостирил 304
С10Н10О а-Тетралон 405
С10ПпС1О Хлорангидрид 2,4,6-три-
метилбензойной кислоты 462
CjqH^NOj Ацетоаиетанилид 96
Ci0Hi]NO4 Карбобензоксиглицин 102
Ci0H12O Альдегид мезитиленкарбоно-
вой кислоты 16
С10Н12О2, Аллиловый эфир гваякола
500
С10Н12О2 о-Эвгенол 499
CjoHi202 2,5-Диметилминдальная ки-
кислота 195
С10Н13С1 аа-Хлоризодурол 289
C10H13NO2 2-нитро-л-цимол 360
CinHi3NO3 о-н-Бутоксинитробензол
134
C10Hi3NO3 ге-н-Бутоксинитробензол 135
C10H13NO3 лг-н-Бутоксинитробензол 135
C10H13NO4 ГО\етил-3,4-диоксифенил-
аланин 296
С10Н14 н-Бутилбензол 126
C10HMN 2-Амкио-гг-цимол 66
C10H]6N р-Фенилэтилдиметиламин 452
CioHijNO ге-н-Бутоксианилин 135
C10H15NO ж-«-Бутоксианилин 135
C10H]5NO2 3,4-Диметоксифенилэтил-
амин 451
C10HJ5NO2 Этиловый эфир а-циан-
р, р-диэтилакриловой кислоты 520
C10HltiNo Динитрил себациновой кис-
кислоты" 208
C10H]7NO2 м-Цианпеларгоновая кис-
кислота 208
С]0Н20Вг Бромистый декамегилен 111
С]0Н20О2 Этиловый эфир каприловой
кислоты 311
CioH20Oe 2,3,4 6-Тетраметил-^-глюкоза
407
C10H22S н-Децилмеркаптан 248
C]0H24N2 р-Ди-«-бутиламиноэтиламин
175
CnH7N Нитрил а-нафтойной кисло-
кислоты 344
Cj]H3N2O3 Бензальбарбитуровая кис-
кислота 12
СПН8О р-Мафтойный альдегид 328
СцНяО2 2-Окси-1-нафтойный альдегид
365
СцН8О3 2-Метокси-1,4-нафтохинон 368
СцН804 1,3-Диокси-2-нафтойная кис-
кислой 335
СПН9С1 1-Хлорометилнафталин 481
СцН9ЫО2 З-Амино-2-нафтойная ки-
кислота 51
СцН]0Оа 2-Этилхромон 524
СПН12О3 Этиловый эфир бензоилук-
сусиой кислоты 503
CuH13N Мезитилацетонитрил 290
CuHl3NO4 Карбобензоксиаланин 102
СцНнОг Мезитилуксусная кислота
289
Ci]HHO3 Этиловый эфир р-фенил-
р-оксипропионовой кислоты 518
CiiH]5NO р:Диметиламинопропиофенон
солянокислый 184
CnHI6NO4 %'-Метил-C-метокси-4-окси-
фенил)-аланин 298
CnHleO3S Бутиловый эфир л-толуол-
Й;льфокислоты 250
i-NO2 Этиловый эфир а-циан-
р-этилидеи «-валериановой кислоты
522
СцН19С1О3 Хлорангидрид и>-карбо-
метоксипеларгоновой кислоты 313
СцН19КО2 Метиловый эфир ш-циан-
пеларгоиовой кислоты 316
CnHjoO, Диэтиловый эфир втор-
бутилмалоновой кислоты 250
СцН20О4 Кислый метиловый эфир
себациновой кислоты 312
СцН21ЫО3 Метиловый эфир моно-
моноамида себациновой кислоты 312
^iiH2]NO4 Ди-р-карбэтоксиэтилметил-
амин 178
CnH21S н-Ундецилмеркаптан 248
СцН26Ы2 7"Дн"К-бутиламинопропил-
амин 173
С12НвО3 Аценафтенхинон 82
Ci2H8N2O4 2,2'-Динитродифеиил 216
С12Н10/2 Йодистый дифенилиодоний
60
C]2H10N2 Азобензол 7
С12Н10О Аценафтенол 79
С] оН10О3 1 -Ацетокси-3-нафтальдегид
31
С]2Н]0О4 4-Метил-7-ацетоксикумарин
219
С12Н]0О4 4-Метил-7-окси-8-ацетилку-
марин 220
C12Hi2N2O2S 4,4'-Диаминодифенил-
сульфон 160
Ci2H12O4 Метиловый эфир бензаль-
малоноаон кислоты 502
C12H13N3O3 5C-Метокси-4-окснбен-
заль) креатинин 297
550
УКАЗАТЕЛЬ ВЕЩЕСТВ ПО ФОРМУЛАМ
эфир фенил-
метилглицидной кислоты 516
C12H15N Дурилацетонитрил 291
Ci2H15N Изодурилацстопитрил 291
C|2H15N3O3 5-C-Метокси-4-окси-
бензил)-креатпнин 298
Ci2H],NO. л-и-Гексоксинитробензол
135
C12H17NOo о- и Тексоксинитробепзол
135 " Н
C]2H19NO п-к-Гексоксианилин 135
С]2Н21С1О2 Хлористый /-менюкси-
ацетил 477
C12H2iC103 Хлорангидрид карбэт-
оксисебацкновой кислоты 461
С12Н22О3 Ангидрид к-капроновой кис-
кислоты 266
С12Н22О3 /-Ментоксиуксусная кислота
292
C12H23NO Ундецилизоцканат 432
Ci2H26S н-Додецилмеркаптан 246
С12Н27О3А1 ягрет-Бутилат алюминия
119
Cl3HflClN2O Хлорангидрид азобензол-
карбоновой кислоты 458
CiaH10N2 Дифенилдиазометан 232
C13H10N2 9-Аминоакридин 36
Ci3H]oN202 Азобензолкарбоновая кис-
кислота 8
C13H12N2 Гидразон бензофенона 233
C13H12N4S Дитизон 227
Ci8H12O2 2-Этокси-1-нафтальдегид 74
С13Н]2О4 Этиловый эфир 1,3-диокси-
2-нафтойной кислоты 335
C13H14N4S Дифенилтиокарбазид 228
C13H]6N,S2 Соль фенилгидразина
и fs-фенилдитиогидразинкарбоновой
кислоты 227
С]3Н1вО2 Ацеталь феннлпропаргнло-
вого альдегида 445
CisHi6O2 /лргт-Бутиловый эфир ко-
коричной кислоты 124
Ci3H]7BrO2 Ацеталь а-бромкоричного
альдегида 445
С]3Н]ВО 2,4,6-Тркэтилбензальдегид 20
С13Н18О2 о-Энантоилфенол 144
С13НИО3 Этиловый эфир а, а-диметил-
р-фенил-[}-оксипропионовой кисло-
кислоты 519
С]3Н20О о-и-Гептилфенол 142
С13Н20О Псевдоионон 380
C13H23N2S Додецилизотиомочевины
бромистоводородная соль 247
C]3H2!)N о-Амилгексилдимстиламип
454
CuH4Br304 Перекись 3,4,5-трибром-
бензоила 377
С]4Н8Вг2О4 Перекись л-бромбензоила
377
Ci4H8N2O8 Перекись .и-нитробензоила
377
C]4H8N2O8 Перекись п-нитробензоила
376
С]4Н10 Дифенклацетилен 231
CuHi0O Дифенилкетен 234
С14НцЫ 2-Фенилиндол 438
C14Hi2 транс-Стильбен 395
СцН|2О2 Аценафтенолацетат 80
C14Hi4 З,3'-Диметилдифенил 203
С14Н14О, З.З'-Димстоксидифенил 203
C]4H15N л«-Толилбензиламин 416
C14H15;N о-Толилбензиламин 417
Ci4H16N п-Толилбензиламин 417
C14Hl6N о-Циклогексилфенилацетонит-
рил 494
С]4Н]6О4 Этиловый эфир бензаль-
малоновой кислоты 501
Ci4H18O4 Диат иловый эфир бензил-
малоновой кислоты 435
С14Н19ВгО9 Лцетобромглюкоза 97
Ci4H]9N 2,4,6-Триэтилфенилацетонит-
рил 291
С14Н„0О,0 1,2,3,4-Тетраацетил-р-й-глю-
коза 399
С]4Н20О,0 2,3,4,6-Тетраацетил-Э-й-глю-
коза 401
С14Н28О2 Этиловый эфир лауркновой
кислоты 311
С15Н10О 9-Антральдегид 74
CjsHjsjOg Перекись анизоила 377
С15Н12О2 Дибензоилметан 167
С15Н12О2 Фениловый эфир коричной
кислоты 442
C15H13NO2 Анилид бепзоилуксусной
кислоты 73
С15Н18О5 Этиловый эфир фенилацетил-
малоновой кислоты 334
С15Н20О5 Этиловый эфир 2,5-диметил-
фенилоксималоповой кислоты 195
С15Н30О2 Метиловый эфир миристи-
новой кислоты 310
С16Н]2 1-Фенилнафталин 440
Ci6H12O2 2,3-Диметилантрахинон 186
С,вН]2О2 транс-Дибензоилэтилен 169
С1вН14 Дипнон 224
С1бН]4О3 р-( 1-Аценафтоил)-пропионо-
вая кислота 87
Ci6H14O3 (Ь-(З-Аценафтоил)-пропионо-
вая кислота 84
CieHu°2 2,2'-Диметил-5,5'-димет-
оксидифенил 205
CleH2,NO,0 Пентаацетил-й-глюконо-
нитрил 232
УКАЗАТЕЛЬ ВЕЩЕСТВ ПО Ф0РШ71А.М
551
С]6Н21О 2,4,6-Триизопропнлбепзаль-
дегид 20
CleH25BrO3S н-Дециловый эфир
ге-бромбензолсульфокислоты 250
CieH32O2 Этиловый эфир мирнстино-
вой кислоты 311
С]7Н34О2 Метиловый эфир пальмити-
пальмитиновой кислоты 310
С18Н29Вг7О2 Гептабромстеариновая кис-
кислота 285
С]8Н29ВгОз5 н-Додециловый эфир
ге-бромбензолсульфокислоты 250
С,8НяоВг602 Гексабромстеариновая
кислота 283
С]8Н30О2 Линоленовая кислота 283
Ci8H32Br4O2 Тетрабромстеариновая
кислота 278
CisII32O2 Линолевая кислота 277
CjeH3sS н-Октадецилмеркаптан 248
С19Н15Вг Трифенилбромметан 427
CieHuCl Трифенилхлорметан 426
CiaHijO Трифенилкарбинол 424
Qi9H32OsS н-Додециловый эфир п-то-
луолсульфокислоты 249
C2oH33Br03S н-Тетрадециловый эфир
. л-бромбензолсульфокислоты 250
С2оН3402 Этиловый эфир линолено-
вой кислоты 284
C20H35N Бензилдодецилыетиламин 454
СгоНзв02 Этиловый эфир линолевой
кислоты 279
C2iH36O3S н-Тетрадециловый эфир
л-толуолсульфокислоты 250
С22Н36О4 биснор-Дезоксихолевая кис-
кислота 155
C22H37BrO5S Гексадециловый эфир
л-бромбензолсульфокислоты 250
С22Н42О4 Этиловый эфир 1,16-гекса-
декандикарбоновой кислоты 508
С2зН3*О4 нор-Дезоксилолевая кисло-
кислота 153
C23H40O3S н-Гексадециловый эфир-
ге-толуолсульфокислоты 250
Q4H4iBr03S н-Октадециловый эфир
тг-бромбензолсульфокислоты 25D
С25Н4гО4 Метиловый эфир дезокси-
холевой кислоты 164
C25H44C>3S н-Октадециловый эфир
толуолсульфокислоты 250
С27Н„О Холестенон 486
С28Н38О]в |1-Октаацетилгенциобиоза 370
С29Н20О Тетрафенилциклопентадиенон
415
С32Н2о03 Те1рафепилфталевый ан-
ангидрид 413
С33Н34ОШ 1,2,3,4-Тетраацетил-6-трифе-
нилметил-р-с!-глюкоза 399
C31H32O4N4FeCl Гемин 141
С37Н28О Три-(л-бифенил)-карбинол 422
Г,40Н50О4 3,12-Диацетокси-баснор-
холанилдифенилэтилен 164
H2NK Амид калия 35
H3NNa Амид натрия 31
H4Na Гидразин безводный 232
Ni Никель Ренея, катализатор 838
УКАЗАТЕЛЬ РИСУНКОВ
Автоклав 29
Аллонж 68
Аппаратура для перегонки с водяным
паром 85
— — получения альдсгидофталевой
кислоты 22
— — получения амида натрия 31
— — получения бромацеталя 109
— — получения н-бутилпирролиди-
на 129
— — получения нитрила циклопро-
панкарбоновой кислоты 346
— — постепенного прибавления в
колбу твердых реагентов 19
— — электролитического восстано-
восстановления 42
Вакуум-эксикатор, сделанный из
двух колб 430
Водоотделитель 505
Голоака для частичной конденсации
паров 151
Колба для перегонки в вакууме
твердых при комнатной темпера-
температуре веществ 11G
— Клайзена с дефлегматором 68
Колонка для получения метиловых
эфиров кислот 315
— с насадкой из одиночных витков
спирали 90
— — — — — — — детали к ней
91
Колонки ректификационные 406, 465
Перегонка с водяным паром 85
Экстрактор непрерывного действия
324
Электролитическое восстановление 42
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Автоклав 29, 39, 51, 66, 233, 270, 383,
390, 392, 416, 419, 448, 450, 451
— очистка 52
Азеотропная перегонка 136, 320, 505
Азид лауриновой кислоты 433
— образование из гидразина 433
Азобензол 7
Азобснзолкарбоновая кислота 8
Азот, двуокись 196
Азотная кислота 69, 359, 3G1
— — безводная 411
дымящая 9, 214, 215, 255
Азулен, отделение от углеводорода
442
Акридон 36
Акролеин 88
Алании 102
Алкилены бромистые 111
Алкилиденциануксусные эфиры 522
Алкилирование алкилидеициануксу-
сных эфиров 524
— нитрофенолов 134
— тиомочевнны 149
Алкнлфенилселениды 388
Алкилхлоррезорцины, получение 144
Алкоголнз 310
— дибромэтилового эфира уксусной
кислоты 109
Алкоксианилнны 135
Алкоксинитробензолы 135
Аллнл бромистый 499
— хлористый 139
— цианистый 138
Аллиловый эфир гваякола 499
Аллоксан 9
Аллоксан-моногидрат 12
Аллоксан-тетрагидрат 10
Аллоксантнн 11, 15
Аллоксантин-дигидрат 9, 14
Аллонж для перегонки с водяным
паром 67, 08
Л-Аллотреонин 420
Альдегида синтез 77
Альдегид мезитиленкарбоновой кис-
кислоты 16, 17
Альдегиднафталин-2-карбоновой кис
лоты 328
Альдегидокислота 21
Альдегидофталевая кислота 21
Альдегиды, синтез из хлор ангидридов
кислот по реакции Розенмунда 16,
328
Алюминий 119
— хлористый 17, 84, 170, 220, 306,
428, 470
Алюминия трет-бутвлат 119
— окись 176, 189
— сплав 120
— этилат 120
Амальгамирование алюминия 120
— цинка 143, 395
Амид 24, 26, 197, 242, 295, 312
— 3,5-дибромсульфаниловой кисло-
кислоты 237
— 3,5-дихлорсульфаниловой кисло-
кислоты 236
— из кислоты и мочевины 208
— нзомасляной кислоты 24, 341
— калия 35
— миндальной кислоты 26, 28
— молочной кислоты 28
— натрия 31, 303, 347, 517
— получение аммонолизом 27
— сульфаннловой кислоты 236, 237
Амиды а-оксикислот, общий метод
получения 28
а-Амилгекснламин 454
а-АмилгексилДИметидамин 454
Амилен 284
н-Амил цианистый 450
Аминирование бромацеталя в авто-
автоклаве 39, 40
— а-бромизокапроновой кислоты 275
— а-бром-р-метилвалериановой кис-
кислоты 252
— а-бром-р-фенилпропионовой кис-
кислоты 437
— З-окси-2-нафтойной кислоты 51
— при восстановлении кетона в при
сутствии аммиака 448
554
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
5 Аминоакридин 36
9-Аминоакридин 36
9-Аминоакридины замещенные 38
Аминоацеталь 39
.w-Аминобензальдегид, продукт при-
присоединения хлорного олова 363
о-Аминобензиловый спирт 42
с-Аминобензил цианистый 64
п-Амииобензойная кислота 8
2-Аминобензотиазол 50
2-Аминогептан 449
Л-Р-Аминогидрокоричная кислота 61
4-Амино-2,6-диметилпиримидин 44
о-Аминодиэтилуксусная кислота 46
о-Аминоизовалериановая кислота 135
о-Аминоизокапроновая кислота 275
Аминокислоты 46. 51, 58, 61 63
135, 250, 275, 389, 435
1-Амино-5-метилбензотиазол 49
2-Амино-6-метилбснзотиазол 49
«- Амино-р- мети л валериановая кисло-
кислота. 250
З-амино-2-иафтойная кислота 51
1 -Амино-2-нафтол-4-сульфокислота69
2-Амино-5-нитротолуол 211, 357
2-Амино-4-нитрофенол 54
Л-а-Амино-а-толуиловая кислота 63
Г-Амино-1,3,4-триазол 56
4-Амино-1,2,4-триазол 56
4-Амино-1,2,4-триазола хлористо-
хлористоводородная соль 57
Аминоуксусная кислота 148
dZ-a-Амино-а-фенилпропионовая кис-
кислота 58
<й-а-Амино-р-феиилпропионовая кис-
кислота 435
rfZ-fi-Амино-р-фенилпропионовая кис-
кислота 61
rfi-a-Аминофенилуксусная кислота 63
2-Амино-п-цимол 66
ot-Амино-а-этилмасляная кислота 46
Аммиак, введение в автоклав 448
— водный концентрированный 24, 46,
4'9, 51, 55, 58, 101, 136, 163,
210, 242, 252, 255, 298, 313, 318,
344, 390, 419, 437
— газообразный 31
¦— действие на медные манометры 449
— жидкий 27, 28, 39, 175, 271, 346,
448, 450, 494
-- раствор в метиловом спирте 451
•- раствор в спирте 175
— раствор в хлороформе 36
Аммоний углекислый 37, 192
— уксуснокислый 519
— хлористый 46, 55, 58, 63, 354,
445
Аммонийная соль 1,2-нафтохинон-
4-сульфокислоты 69
Аммонолиз 27
Анализ иодозо- и иодосоединений 265
Ангидрид н-капроновой кислоты 266
— я-масляной кислоты 267
— мышьяковистый 196
— нафталевый 82
— пропионовой кислоты 267
— серный 223
— уксусной кислоты 92,98, 121,
219, 266, 299, 349, 358, 371, 373,
399, 411, 441, 455, 505
— хромовой кислоты 12, 153, 349
Апгидрон 17
о-Анизидин 469
л-Анизидин 358
Анизоил, перекись 377
— хлористый 377
Анилид бснзоилуксусной кислоты 73
— получение из сложного эфира 73
Анилин 73, 96
9-Антральдегид 74
Антраниловая кислота 42
Антрацен 75
Аппарат Сокслета 128, 229
Аппаратура, водоотделитель при азео-
тропной перегонке 501, 505, 520
— для введения брома с помощью
тока газа 22, 109
— — каталитической дегидратации
189
— — нагревания под давлением 392
— — перегонки с водяным паром 85
— — перегонки твердых веществ 116
— — перегонки фракционирован-
фракционированной 89, 151, 315, 406, 465
— — получения амида натрия 31
— — получения сухого метиламина
178
— — прибавления твердого веще-
вещества при исключении действия на
него воздуха 19, 428
— — работы с жидким аммиаком 346
— — хлорирования при небольшом
давлении 129, 483
— — частичной конденсации паров
при перегонке 151
— каплеотбойник 319
— специальная колба Клайзена с де
флегматором 68
— экстрактор непрерывного действия
324
d-Арабиноза 77
Арилселеноцианаты 388
Асбестовый фильтр для воронки Бюх-
нера 364
11РКДМЕТНЫЙ УКАЗАТЕЛЬ
555
Аценафтен 79, 82, 84
^-З-Аценафтенилкарбоиилпропионо-
вая кислота 84
Аценафтенол-7 79
Аценафтенолацетат 79
Аценафтенон 81
Аценафтенхинон 82
?-A -Аценафтоил)-пропионовая кис-
кислота 87
р-C-Аценафгоил)-пропионовая кис-
кислота 84
Ацеталь 88; 109, 245, 445
— акролеина 88
— а-бромкоричного альдегида 445
— кетена 245
— метод получения с помощью этило-
этилового эфира ортомуравьиной кис-
кислоты 445
— фенилпропаргилового альдегида
445
Ацеталь fi-этоксипропионового альде-
альдегида 88
Ацетальдегид 107, 295, 379
Ацетамид 197
Ацетилацетон 92, 269
— медная соль 03
Ацетилбензоил 319
Ацетил бромистый 427
— хлористый 122, 124, 165, 426,
430, 514
Ацетилен 199
Ацетилирование 121, 164, 372
— амина в водном растворе 358
— генциобнозы 371
— глюкозы 97
— 6-трифенилметил-^-глюкозы 399
Ацетилкетен 180
Ацетоацетанилид 96, 304
Ацетобромглюкоза 97, 401
1-Ацетокси-З-нафтальдегид 331
Ацетон 26, 92, 94, 134, 180, 184, 193,
199, 377, 381, 401, 432, 486, 499
— высушивание 93
— пиролиз с образованием кетена
180, 181
Ацетона циангидрин 192, 193
Ацетонитрил 44
Ацетоуксусный эфир 150, 219, 269,
306, 503, 514
Ацетофенон 58, 167, 184, 225, 323,
439, 448, 517
Ацетофенона фенилгидразон 438, 439
Ацетофеноноксим 62
о-Ацеттолуид 303
о-Ацеттолуиды замещенные, превра-
превращение в замещенный индол 303,
304
Ацилирование с помощью сложного
эфира 503
Ацилрезорцины 144
Ацилхлоррезорцины 144
Барбитуровая кислота 12
Барбье—-Виланда способ укорочения
цепи карбоновых кислот 153, 155
Бариевая соль малоновой кислоты
491
— — ш-цианпеларгоновой кислоты
209
Барий углекислый 222, 287
— хлористый 209, 491
Бария гидрат окиси 288, 298, 335
Бензальбарбитуровая кислота 12
Бепзальдегид 12, 64, 416, 501, 518,
519
— определение содержания в нем
бензойной кислоты 502
Бензгидриловый эфир бензойной кис-
кислоты 234
Бензил 235, 415
Бснзиламин, метилирование его 454
Бензилдодециламин 454
Бензилдодецилметиламин 454
Бензилмалоновая кислота 436
Беизиловый спирт 101, 159
— эфир карбаминовой кислоты 101
— — хлормуравьиной кислоты 102
— — хлоругольной кислоты 100
N-Бензил-ж-толуидин 416
Бензил хлористый 435
— цианистый 450, 494
а-Бензоилацетанилид 73
Бензоилирование ацетоуксусного
эфира этиловым эфиром бензой-
бензойной кислоты 503
Бензоилумуравьипая кислота 103
Бензоил хлористый 488
— — очистка 489
Бензоин 395
Бензойная кислота 169, 214, 215, 222,
234, 502
Бензол 96, 114, 119, 165, 170, 188,
197, 234, 275, 314, 422, 426, 470,
473, 486, 501, 514, 517, 518, 520
— применение в азеотропной пере-
перегонке 314, 505
1,2,3-Бензотриазол 104
Бензофенон 233, 425
Бензофенона азии 233
— гидразон 233
о-Бензтолуиды замещенные, превра-
превращение в замещенный индол 303,
304
556
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Бисульфитное соединение глиоксаля
106
— — применение для очистки алки-
лиденциануксусных эфиров 519
— — — — — альдегида 380
— •— — — •— кетона 381
Блана реакция хлорметилирования
ароматических соединений 289,
478, 481
Бор трехфтористый 92
Брожение 370
Бром 21, 109, 115, 136, 231, 252, 272,
275, 278, 280, 283, 389, 397, 414,
418, 436, 444, 498, 505
— высушивание 137, 270
З-Бром-4-аминотолуол 117
о-Броманизол 469
.и-Броманилин 119
Бромацеталь 39, 109, 244
Бромбензилмалоновая кислота 436
Бромбензол 126, 165, 322, 378. 386,
414, 424, 441
ге-Бромбензол хлористый 377
ct-Бромизовалериановая кислота 135
а-Бромизокапроновая кислота 275
Бромирование лактона, фталида
21
— сульфаниламида перекисью водо-
водорода и бромистоводородной кисло-
кислотой 237
— уксусной кислоты 504
Бромистоводородная кислота 112,
187, 237, 240, 390, 419, 467
— — выделение в виде постоянно
кипящей смеси 113, 137, 276
Бромистый водород 22, 98, 111,
247, 276, 308, 400
— — не содержащий брома 99, 309
Бромистоводородный ди-к-бутиламино-
этилбромид 175
Бромистый декаметилен 111
— пентаметилен 112
— 2,3,4,6-тетраацетил a-d-глюкозо-
пиранозил 97
— тетрагидрофурфурил 114
— фенилмагний 321, 386
а-Бромкоричный альдегид 444
2-Бром-л-крезол 117
о-Бром-л-креяол 117
Броммалоновая кислота 252
Броммезитилен 462
о-Бром-л-метиланизол 118
а-Б р ом-р-мети л валериановая кисло-
кислота 251
2-(Бромметил)-тетрагидрофуран 114
ct-Бром-р-метокси-к-масляная кисло-
кислота 418
а-Бром-|3-метоксипропионовая кисло-
кислота 390
а-Бромнафталин 344
6-Бром-2-нафтол 115
З-Бром-4-окситолуол 117
т-Бромпропилфталимид 173
р-Бромпропионовая кислота 309
Бромуксусная кислота 504
ct-Бром-р-фенилпропионовая кислота
436
л-Бромфенилсслснофенол 388
.и-Бромфенол 119
2-Бромфталид 21
Бромциклогексан 495
f-Бромэтилфталимид 174
1-Бром-2-этоксиэтан 528
З-Бутеновая кислота 138
н-Бутиламин, метилирование, его 454
mpem-Бутилат алюминия 119, 225
486
mpem-Бутилацетат 121
н-Бутилбензол 126
н-Бутил бромистый 126, 134
втор-Ъутип бромистый 251
н-Бутил йодистый 134
emop-Бутилмалоиовая кислота 251
н-Бутилнитрит 470
Бутил-о-нитрофениловый эфир 134
н-Бутиловый спирт 259
трет- Бутиловый спирт 119, 121,
122, 123, 124, 225, 244, 258
— — безводный 125, 245
— эфир изовалерияногюй кислоты 123
— — изомасляной кислоты 123
— ¦— коричной кислоты 124
— — пропионовой кислоты 123
н-Бутиловый эфир л-толуолсульфо-
.кислоты 250
/Hpem-Бутиловый эфир уксусной кис-
кислоты 121
— — хлоруксусной кислоты 124
1-н-Бутилпирролидин 129
N-н-Бутилпирролидин 129
н-Бутилселенол 388
Бутирилхлоррезорцин 144
о-Бутирилфепол 144
л-Бутирилфенол 144
ж-н-Бутоксианилин 135
л-к-Бутоксианилин 135
ж-к-Бутоксинитробензол 135
о-н-Бутоксинитробензол 134
л-н-Бутоксинитробензол 135
Вакуум-эксикатор 430
о-Валерилфенол 144
л-Валерилфенол 144
Валерилхлоррезорцин 144
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
557
rfZ-Валин 135
Ванилин 297
Вата гигроскопическая как осуши-
осушитель 89, 94, 95
Видмера колонка 93, 95, ПО, 126,
200, 311, 392, 465
Вильсона стеклянные кольца (на-
(насадка для колонок) 465
Винилацечат 109
Винилуксусная кислота 138
d-Винная кислота 254, 381
Винной кислоты динитрат 255
Водоотделитель 501, 505, 520
Водород 16, СС, 328, 386, 404, 416, 450
Возгонка в вакуум-эксикаторе 365
Воск лавровый 310
— миртовый 310
Восстановление амальгамированным
цинком и соляной кислотой бен-
бензоина до стильбена 395
— водородом в присутствии никеля
Ренея алкоксинитробензолов до
алкоксианилинов 135
— — — — — — дигидропирана до
тетрагидропирана 403
— — — — — — при низких давле-
давлениях 68
— — •— — — — — повышенном
давлении 66
— — — — •— — псевдоионона до
гексагидропсевдоинола 383
— — •— — — — (с одновременным
аминированием под действием
аммиака) ацетофенона до а-фенил-
этиламина 448
-- — — — — — цианистого бен-
бензила до р-фенилэтиламина 450
— гидроксиламинокислоты до ами-
аминокислоты при помощи гидр-
оксиламина 61
— двойной связи амальгамой натрия
298
— нитросоединения до азосоедине-
ния 7
-— — •— амина 54, 66, 363
— — — замещенного гидроксил-
амнна 354
— — хлористым оловом 160, 363
— по методу Клемменсена 143
— по методу Розенмунда (Pd—DaSO4)
16, 20, 328, 330
— сернистым натрием и хлористым
аммонием 54
— сероводородом 15, 163
— хлористым оловом по методу Сте-
фена нитрила р-нафтойной кисло-
кислоты до р-иафтойного альдегида 331
Восстановление цинком и соляной
кислотой 143
— — — хлористым аммонием 354
— — — щелочью 7
— электролитическое 42
Высушивание с применением ги-
гигроскопической ваты 89, 94, 95
Вюрца—Фиттига реакция 126
Галоформенная реакция 182
Гаттермана реакция, синтез альде-
альдегидов 17
Гваякол 499
Гексабромидная проба 280
Гексабромстеариновая кислота 283
Гексагидропсевдоионол 383
н-Гексаде.циловый эфир л-бром-
бензолсульфокислоты 250
— — п-толуолсульфокислоты 250
Гексаметилен бромистый 112
Гексаметилентетрамин 255
н-Гекс.иламин 450
ге-н-Гексоксианилин 135
о-н-Гексоксинитробензол 135
п-н- Гексоксинитробснзол 135
Гемин 141
Гептабромсте.ариновая кислота 285
Гептальдегид 449
Гептан 199
н-Гептиламин 449
и-Гептилмеркаптан 248
о-н-Гептилфенол 142
Гершберга мешалка 63, 194, 263, 481,
527
Гидразин безводный 271, 282
Гидразин-гидрат57, 232, 235, 270, 271
Гидразин сернокислый 271
Гидратроповый альдегид 446
Гидрирование, меры предосторож-
предосторожности при работе под давлением 6f
— нитросоединений 66, 135
Р-Гидроксиламино-р-фенилпропионг
вая кислота 59
Гидроксиламин солянокислый 58, 373
Гидролиз 195, 335, 3?0, 397, 407
— амида до кислоты 46, 295
— ацеталя 445
— ацетиламиносоединения 161, 359
— глюкозида 287
— изонитрозокетона до а-дикетона
319
— метилглюкозида 287
— нитрила до амида 46
— • кислоты 60, 103, 138, 146,
290, 496
— производного креатииииа до ами-
аминокислоты 298
558
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Гидролиз тстраацетилбромглюкозы 401
Гидрохинон 188, 235, 308
— в качестве ингибитора 189, 235
Гидрохлорид пиколиновой кислоты
145
Гликолевая кислота 107
Глиоксалин 254
Глиоксаль 108
Глиоксаля бисульфитное соединение
106
Глицерин 278, 283
Глицин 101, 148
Глюкоза 97, 370, 373, 399
— безводная 370, 408
Глюкозы оксим 373
— пснтаацетат 97
Головка для частичной конденсации
паров 151
Гомофталевая кислота 146
Гомофталимид 268
Гриньяра реакция 322, 386, 424,
441, 462
— — л-бромфенилселенофенол 388
— — н-бутилселенол 388
— — 3,12-диокси-нор-холанилди-
феиилкарбинол 165
— — 1-окси-1-фенил-1,2,3,4-тетра-
гидронафталин 440
— — селенокрезолы 388
— — селенофенол 386
— — тиофенолы 388
Гуанидилуксусная кислота 148
Дегидратация амида 208, 317, 341, 342
— 3,12-диокси-нс1р-холанклдифенил-
карбинола 165
— каталитическая 188, 189
Дегидрацетовая кислота 150, 181
Дегидрит 17
Дегидрогенизация под действием
брома 414
— — — кислорода воздуха и щелочи
186
— — — серы 415, 441
Дезаминирование 205
Дезокснхолевая кислота 153
бнскор-Дезоксихолевая кислота 155
нор-Дезоксихолевая кислота 153
Декаметилен бромистый 111
Декаметиленгликоль 111
Декарбоксилирование 491
— 1,3-диокси-2-нафтойной кислоты
336
— имидазол-4,5-дикарбоновой кис-
кислоты 256
— гидроксиламинокислоты до окси-
ма 62
Деметилирование при помощи ио-
дистоводородной кислоты 299
Десульфоамидирование 3,5-ди бром-
сульфаниламида 238
— 3,5-дихлорсульфаниламида 237
Дефибринизированная кровь 141
к-Децилмеркаптан 248
к-Дециловый эфир л-бромбензолсуль-
фокислоты 250
Диазодифенилметан 232
1,3-Диазол 254
Диазометан 155
— высушивание 156
Диазония соли, восстановление 203
Диазотирование 104, 118, 203, 204,
357, 363, 467
Диаминобиурет 509
4,4'-Диамииодифснилсульфон 160
1,2-Диамино-4-нитробензол 162
1,4-Диамино-2-нитробензол 163
о-Дианизидин 203
Диацетиламин 41
4 4'-Диацетиламннодифенилсульфон
162
Диацетилметан 92
3,12-Диацетокси-биснор-холанил-
дифенилэтилен 153, 164
Дибензилкетон 415
Дибензоилметан 167
тракс-Дибензоилэтилен 169
2,6-Диброманилин 236
ж-Дибромбензол 469
1,10-Дибромдекан 111
Дибромкумарин 272
1,5-Дибромпентан 112
Дибромстильбен 231
3,5-Дибромсульфаниламид 237, 241
Ди-к-бутиламин 129, 173
— бромкетоводородный 174
f-Ди-к-бутиламинопропиламин 173
7-Ди-н-бутиламинопропилфталимид
173
fi-Ди-к-бутиламипоэтиламин 175
Ди-н-бутиламиноэтилбромид бро-
мистоводородный 175
Ди-н-бутилбензосульфамид 131
М,М-Ди-к-бутил-1,3-пропандиамин
173
Ди-я-бутилэтаноламин 176
М,М-Дибутилэтилендиамин 175
1,4-Дигидро-2,3-диметилантрахинон
186
2,3-Дигидропиран 176, 403
Диеновый синтез 186, 413
Диизопропиловый эфир 98
Ди-р-карбометоксиэтилметиламин 180
Ди-8-карбэтоксиэтилметиламин 178
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
559
Дикетен 180
1,3-Дикетон 92, 167
з-Дикетона синтез 312
Дильса—Альдера реакция 186, 413
Димер кетена ISO
3,^-Диметилакриловая кислота 182
Диметиламин 318
— солянокислый 184
Диметиланилин 122, 123, 124
¦s-Диметиламинопропиофенон соля-
солянокислый 184
2,3-Диметилантрахинои 186
2,4-Диметил-3-ацетил-5-карбэтокси-
пкррол 270
2,3-Диметилбутадиен-1,3 186, 187
5,5-Диметилгидантоин 192
2 2'-Диметил-5,5'-диметоксидифенил
205
З,3'-Диметилдифенил 203
2,5-Диметилминдальная кислота 195
1,2-Днметилпирролиднн 133
Диметилсульфат, противоядие 408
2,4-Диметилтиазол 197
силш-Диметилтиомочевина 318
М,М-Диметилфенилэтиламин 452
2,4-Диметил-З-этилпиррол 269
Диметилэтинилкарбинол 198
2,6-Диметоксибензонитрил 201
З,3'-Диметоксидифенил 203, 406
3,4-Димстоксифенилэтиламин 451
Ди-1-нафтиламин 482
Динитрил себациновой кислоты 208
2,4-Динитроанилин 163
2,5-Динитробензойная кислота 211
3,4 Динитробснзойная кислота 213
3,5-Динитробензойная кислота 214
л-Динитробензол 201
2,2'-Динитродифенил 216
2,5-Динитротолуол 213
2,4-Динитрофенол 55
Диоксан 106, 182, 202, 284, 335
— применение в качестве раство-
растворителя при гидрогенизации с ни-
никелем Ренея 339
2,4-Диоксиацетофенон 384
2,6-Диоксиацетофенон 218
3,5-Диоксибензойная кислота 184,
222
1,3-Диокси-2-нафтойная кислота 335
1,3-Диоксинафталин 334
Диоксим ацетилбензоила 320
3,12-Диокси-нор-хол а ни л дифен ил-
карбинол 165
3,12-Диокси-кор-холановая кислота
153
Дипнон 224
1-Ди-я-пропиламинопропиламин 174
Ди-н-пропиламиноэтиламин 176
Д и спр опор цио пиров анис дифенил-
тиокарбазида 228
— иодозобеняола при перегонке с во-
водяным паром 261
— иодозо- и иодосоединений 260
Дитизон 227
силл<-Диундецилмочевина 433
Дифенилацетилен 231
1,4-Дифенил-2-бутен-1,4-дион 169
Дифенилгидразнн 78
— солянокислый 78
Дифенилгидразон d-арабинозы 78
Дифенилдиазометан 232
— анализ 233
Дифзнилдиселенид 388
Дифенилиодоний йодистый 260, 263
265
— иодноватокислый 261
Дифенилиодония соли 263
Дифенилкетен 234
1,3-Дифенил-1,3-пропаидион 167
Дифенилселенид 388
Дифенилтиокарбазид 228
Дифенилтиокарбазон 227
Ди-(с-фенилэтил)-амин 449
Ди-C-фенилэтил)-амин 450
1,2-Дифенилэтилен 395
2,6-Дихлоранилин 236
а,а-Дихлорацетамид 242
о>,ш-Дихлорацетофенон 323
о-Дихлорбензол 75
а2,а4-Дихлорпентаметилбензол 291
3,5-Дихлорсульфаниламид 236
Дихлорэтан 152, 278, 343
а,а'-Дмциан-[3-метилглутарамид 294
f-Диэтиламинопропиламин 174
Ii-Диэтиламинопропиофенон соляно-
солянокислый 185
Диэтиламиноэтиламин 176
Диэтиламин солянокислый 185
Дйэтилацеталь акролеина 88
— аминоацетальдегида 39
— бромацетальдегида 39, 109
— кетена 244
Диэтилкетон 46, 520
Диэтиловый эфир бензальмалоновой
кислоты 501
— — бензилмалоновой кислоты
435
— — emop-бутилмалоновой кислоты
251
¦— — малоновой кислоты 334, 490,
501
— — мезоксалевой кислоты 195
Додекаиол 249
н-Додецил бромистый 246
560
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
н-Додецилизотиомочевины бромисто-
водородная соль 247
н-Додецилмеркаптан 246
н-Додециловый эфир л-бромбензол-
сульфпкислоты 250
— (лауриловый) эфир п-толуолсуль-
фокислоты 249
— спирт 249
Драйерит 16
Дрожжи 370
Дурилацетонитрил 291
Едкий натр 7, 48, 102, 103, 123, 129,
139, 159, 160, 161, 178, 197, 204,
219, 220, 222, 232, 246 260, 264,
280, 285, 289, 301, 326, 338, 353,
366, 381, 390, 408
Едкое кали 174, 186, 222, 228, 251,
273, 278,281,386, 415, 436, 445,
508
Железо азотнокислое, окисное 346,
494
— в порошке в качестве восстанови-
восстановителя 68
Жирные кислоты, гексабромидная
проба 280
— — из льняного масла 283
— — — подсолнечного масла 278
— — — природных масел 278, 280
281, 283
— — непредельные 278, 283
— — предельные, отделение от не-
непредельных 278
Замещение аминогруппы на атом
брома (диазореакция) 467
— атома брома на гидроксильную
группу (диазореакция) 117, 363
— — — — циангруппу 344, 527
— — хлора на аминогруппу 36
— — — —сульфогруппу 160
— — циангруппу 138, 290
— — водорода в ot-пиколине с по-
помощью фениллития 378
— на циангруппу 201
— гидроксильной группы на ами-
аминогруппу 51
— — — — атом брома с помощью
трехбромистого фосфора 528
— — — и пи-
пиридина 114
— — хлора 480
— — — — — — с помощью хло-
хлористого тионила 375
— — — ¦— — — или брома с по-
помощью галоидангидридов уксус-
уксусной кислоты 426, 427
Замещение глюкозидного атома брома
на гидроксильпую группу 401
— глюкозидной гидроксильной груп-
группы на атом брома 97 >
— нитрогруппы на метоксильную
группу 201
— сульфамидной группы на водород
237, 238
Зандмейера реакция 467
Затвор, резиновая трубка в качестве
затвора для мешалки 225
Защитный экран 434
Изобутиловый спирт 259
Изобутирамид 24
Изобутиронитрил 341
Изовалериановая кислота 135
Изодурилацетонитрил 291
Изокапроновая кислота 275
Л-Изолейцин 250
Изомасляная кислота 24
Изонитрозопропиофенон 319
Изопропилат алюминия 120
Изопропилнитрит 471
Изопропилогшй спирт 157, 471
— эфир, освобожденный от переки-
перекисей 100
— — перекристаллизация из него 98
л-Изопропоксианилин 135
ге-ИзопрОпоксинитробензол 135
Изоцианаты, общий метод получения
433
Имидазол 254
Имидазол-4 5-дикарбоновая кислота
256
Ингибиторы 107, 188, 189, 235
Индазол 358
Индол 258
Иод 462
л-Иодбензил бромистый 353
л-Иодбензиловый спирт 353
Иодбензол 326
— хлористый 262, 264, 475
Иодистоводородиая кислота 117, 299
Йодистый дифенилиодонйй 260
Иодобензол 260 261, 262
Иодозобензол 260, 261,262, 264
Иодозо- и иодосоединения, установ-
установление различия 265
Иодометрическое титрование 262, 263
Иодония соединения 260
Калиевая соль 1,2-нафтохинон-4-
сульфокислоты 69
Калий 244, 258
— бромистый 389, 418
— двухромовокислый 212
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
561
Калий йодистый 41, 139, 265
— предосторожности при обращении
с ним 45
— уксуснокислый 353, 455
— хлористый 145, 175
— хлорноватистокислый 182
— хлорноватокислый 15
— цианистый 193, 201, 242, 267
Калия mpem-бутилат 244, 258
— метилат 44, 259
— перманганат 145
— персульфат 211
— этилат 258
Кальций сернокислый 234
Каплеотбойник 319
Каприлоилрезорцин 144
о-Каприлоилфенол 144
л-Каприлонлфенол 144
Каприлоилхлоррезорцин 144
о-Капроилфенол 144
л-Капроилфенол 144
Капроилхлоррезорцин 144
н-Капроновая кислота 266
н-Капроновый ангидрид 266
Карбобензоксиаланин 102
Карбобензоксиглицин 102
я-Карбоксифенилацетонитрил 146,
267
Карбобензоксихлорид 100
Карборунда зерна в качестве насадки
для колонок 188, 348, 407
Карвакриламин 66
Катализатор бензойнокислый пипе-
пиперидин 501
— бромистоводородная кислота 187
— двууглекислый натрий 148
— медная бронза 216
— медно-хромовый для декарбокси-
лирования 256
— никель Ренея 66, 135, 338, 403,
416, 448, 450
— — — хранение под спиртом, ди-
оксаном, метилциклогексаном 339
— окись алюминия 176, 189
— — меди для декарбоксилирования
257
— палладий, осажденный на серно-
сернокислом барии 16, 328
— пиридин 114
— серная кислота 98
— трехфтористый бор 92
— уксуснокислый аммоний—уксус-
аммоний—уксусная кислота 521
— хромит меди 23
Каталитический яд для восстановле-
восстановления по методу Розенмунда 328, 330
Керосин очищенный 45
Кетен 266
Кетена димер 96, 180
Кетеновая лампа 181
Кислого этилового эфира себацино-
вой кислоты электролиз 508
Кислота Каро 211, 263
Кислый метиловый эфир янтарной
кислоты 459
— — — себациновой кислоты 313
— этиловый эфир адипиновой кис-
кислоты 461
— — — себациновой кислоты 461,
508
Клайзена перегруппировка 499
— реакция 93, 167
— щелочь 359
Клейтона желтая бумажка 53
Клемменсена восстановление 142
Кневенагеля конденсация 294 393
502
Кокосовое масло 311
Колба перегонная с двумя шарами
116
Колонка для получения метиловых
эфиров кислот 315
— Кларка—Рарса 314, 501
— Уитмора—Люкса 128, 181, 266.
406. 489
— Фенске 89, 90, 128
Компрессор, применение при гидри
ровании 449
Конденсация альдегида и кислоты
455
— — — креатинина 296
— — — малонового эфира 501
— — —¦ малоновой кислоты 393,
456
— бензила с дибензилкетоном 415
— кетона и ангидрида 92
— — — оксикислоты 26
— — -- сложного эфира 93, 167
— — — — циануксусного эфира
520
— кислоты и амина 320
— натриевой соли сульфиновой кис-
кислоты и л-нитрохлорбензола 160
— нитрозосоединения и амина 8
— сложного эфира 150
— цитраля и ацетона 381
Коричная кислота 61, 124, 443
Коричнофениловый эфир 442
Коричный альдегид 444
Креатинин 297
л- Крезол 119
Криптопиррол 269
Кровь дефибринизированная 141
Кротоновая кислота 140, 418
562
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Кротоновый альдегид 394
л-Ксилилгликолевая кислота 195
Ксилол 73, 93, 173, 195, 225, 397,
524
л-Ксилол 195, 397
Ксилол очищенный для восстановле-
восстановления по Розенмунду 16, 330
Кумариловая кислота 272
Кумарин 272
Кумарон-2-карбоновая кислота 272
Курциуса реакция 432
Лавровый воск 310
Лактамид 28
Лаурилмеркаптан 246
Лауриловый спирт 249
— эфир-л-толуолсульфокислоты 249
^/-Лейцин 275
Линолевая кислота 277
Линолевой кислоты тетрабромид 278
Линоленовая кислота 283
Линоленовой кислоты гексабромид
Литий 378
Ловушка для поглощения газов 76,
84, 101, 136, 170, 323 397, 428
443, 477
Льняное масло 283, 285, 286
Магний 124,321,386, 424 441, 462
514
— в синтезе с малоновым эфиром 334
Маковое масло 280
Малеиновый ангидрид 95, 413, 464
Малоновая кислота 456
Малоновый эфир 334, 490, 501
Малоновых кислот замещенных бро-
мирование 250, 435
— — — декарбоксилирование 195,
250, 435
Манниха реакция ]84
rf-М'анноза 287
Маностат 244, 245
Масло кокосовое 311
— маковое 280
— плодов Myrica cerifera 310
— подсолнечное 278, 282
— хлопковое 280, 281
я-Масляный ангидрид 267
Медная бронза 216
Медное производное ацетилацетона
93
— — этилового эфира диацетоук-
сусной кислоты 513
Медно-хромовый катализатор 256
Медные спирали в качестве насадки
для колонки 89
Медный реакционный сосуд 428
Медь бромистая закисная 467, 468
— йодистая 217
— основная углекислая 89, 472
— сернокислая 468, 474
— уксуснокислая 93, 514
— цианистая закисная 139, 344, 488
Мезитилацетонитрил 290
Мезитилен 17, 289
Мезитилуксусная кислота 289
/-Ментоксиацетил хлористый 477
/-Ментоксиуксусная кислота 292,
477
d-Мснтол 292
Металлическая баня, предотвраще-
предотвращение приставания металла к стеклу
303
Металлический реакционный сосуд
488
Метилакрилат 180, 308, 389
Метилаль 478, 479
Метил-н-амиламин 133
Метиламилкетон 449
Метилакин 156, 178, 301, 318
— прибор для получения безводного
препарата 178
— хлористоводородный 301
Мети.чанилин 75, 320
4-Метил-б-ацет ил-7-оксикумарин 221
4-Метил-7-ацетоксикумарин 219
А\етил-«-бутиламин 133
2-Метил-3-бутин-2-ол 198
1-Метил-2-к-бутилпирролидин 133
Р-Метилглутаровая кислота 294
а-Метилглюкозид 409
М-Метил-3,4-диоксифенилаланин 296.
299
р-C,4-Метилендиоксифенил)-этил-
амин 451
Метилизотиоциаиат 301, 318
2-Метилипдол 302
о-Метилиндол 302
Метил йодистый 523
Апеллирование 407, 454, 522
4-Метилкарбостирил 304, 480
4-Метилкумарин 305
а-Метил-й-маннозид 287
М-Метил-C-метокси-4-окснфенил)-
аланин 298
Метиловый спирт 7, 46, 63, 83, 126,
154, 165, 189, 202, 228, 249, 256,
259, 281, 303, 310, 353, 389, 418,
459, 479
абсолютный 77, 201, 314, 367,
372
— эфир ацетоуксусной кислоты 306
— — бепзальмалоновой кислоты 502
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
563
Метиловый эфир а-бром-р-метокси-
пропионовой кислоты 389
— — [З-бромпропионовой кислоты
308
— — дезоксихолевой кислоты 165
— — а,(з-дибромпропионовой кисло-
кислоты 389
— — диэтиленгликоля 160
— — изотиоциановой кислоты 301
— — миристииовой кислоты 310
— — моноамида себацнновой кисло-
кислоты 312, 317
— — пальмитиновой кислоты 310
— — пировиноградной кислоты 314
— — р-формилпропионовой кисло-
кислоты 331
— — 8-цианпеларгоновой кислоты
316
— — ш-цианпеларгоновой кислоты
316
4-Метил-7-окси-8-ацетил кумарин 220
4-Метил-7-оксикумарин 219
Метил-н-октиламин 133
1-Метилпирролидин 133
Метилтиомочевина 318
Метилфенилглиоксаль 319
[з-B-Метилфенил)-этиламин 451
р-C-Метилфепил)-этиламип 451
[Ц4-Метилфенил)-этиламин 451
N-Метилформанилид 75, 320
Метилциклогексан 339
5-Метил-5-этилгидантоин 194
Мстилэтилкетон 200
Метилэтилэтинилкарбинол 200
Метоксиацетонитрил 322
(в-Метоксиацетофенон 321
2-Метокси-1,4-нафтохинон 368
5-C-Метокси-4-оксибензаль)-крсати-
нин 297
5-C-Метокси-4-оксибензил)-креати-
• нин 298
Мешалка 209, ?25, 290
— Гершберга 63, 94, 263, 481, 527
— из монсль-мсталла 409
— из нержавеющей стали 253
•— латунная 526
— с глицериновым затвором 225
Миндальная кислота 26, 322
Миристин 310
Миристиновая кислота 310,
Моногидразон бензила 234, 235
Моногидроперекись фталила 326
Мононадфталевая кислота 326
Монохлоруксусная кислота 293
Моноэтиловый эфир себациновой кис-
кислоты, калиевая соль 508
Мочевая кислота 14
Мочевина 118, 208
Муравьиная кислота 259, 320, 452
Надкислоты 211, 263, 326
Насадки для колонок 406
Натр едкий 7, 48, 102, 103, 123, 129.
139, 159, 160, 161, 178, 197, 204,
219, 220, 222, 232, 246, 260, 264,
280, 285, 289, 301, 326, 338, 353
366, 381, 390, 408
Натриевая соль л-ацетаминобензол-
сульфиновой кислоты 160
— — ацетилацетона 94
— — л-нитропербензойной кислоты
377
Натриевое производное /-ментола
292
— — циклогексанола 157
Натрий 77, 126, 127, 157, 251, 270,
292, 346, 373, 375, 381, 422, 435,
446, 490, 494, 503, 515, 523, 524
Патрийамид (см. амид натрия)
Натрийацстоуксуспый эфир 503
Натрий борнокислый 265
— бромистый 468
— двууглекислый 150, 268, 380
— двухромовокислый 82
— роданистый 49
— сернистокислый 468
— сернистый 55, 380
— сернокислый безводный 118
— углекислый 264, 402, 474
— уксуснокислый 75, 92, 351, 371,
373, 512
— хлористый 141
— хлорноватистокислый 262
— цианистый 46, 63, 193, 290, 528
Натрия азид 432
— амальгама 298, 299
— бисульфит 71, 83, 106, 182, 193,
381, 418
— бихромат 82
— трет-бутилат 245
— гидросульфит 336
— гипохлорит 262
— изопропилат 156
— метилат 77, 373
¦— — получение при помощи «об
ратного» процесса 491
— нитрит (см. также диазотироеи-
ние) 104, 117, 156, 203, 269, 357
434, 363, 467, 471
— перекись 376
— тиосульфат 265
— циикат 7
— этилат 93, 167, 381, 446, 490,
491, 503, 523
564
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Натрия этилат получение при помо-
помощи «обратного* процесса 491
Нафталин 481
1,3-Нафталиндиол 334
8-Нафтальдегидимин, комплекс с
хлорным оловом 331
р-Нафтилэтиловый эфир 75
р-Нафтойная кислота 329
,8-Нафтойный альдегид 328, 331
8-Нафтол 115, 366
Нафторезорцин 334
1,4-Нафтохинон 186
1,2-Нафтохинон-4-сульфокислота, ам-
аммонийная и калиевая соли 69, 367
Никель-алюминия сплав 338, 339
Никель Ренея, катализатор 66, 135,
338, 403, 410, 448, 450
Нитрил а-амино-а-фенилпропионовой
кислоты 60
—f-броммасляной кислоты 348
— 3-бутеновой кислоты 139
— изоыасляной кислоты 25, 341
— малоновой кислоты 342
— а-нафтойной кислоты 344
— 3-нафтойной кислоты 331
— пентаацетилглюконовой кислоты
77
— Y-хлормасляпоп кислоты 347, 496
— циклопропанхарбоновоп кислоты
346, 496
Нитрила образование 208, 290, 316,
341, 342, 344, 372
2-Нитро-4-амииотолуол 213
5-Нитро-2-аминотолуол 211
2-Нитро-л-анизидин 358
л-Нитро-4'-ацетаминодифенилсуль-
фон 160
.и-Нитробензальдегид Зл.З
о-Нитробензальдегид 349
о-Нитробензальдиацетат 348
л-Нитробензилапетат 351, 353
л-Нитробензиловый спирт 353
— эфир уксусной кислоты 351
л-Нитробензил хлористый 351
.и-Нитробензоила перекись 377
л-Нитробепзоила перекись 376
л-Нитробензоил хлористый 377
л-Нитробензойная кислота 377
Нитробензол 7, 84, 306, 354
Нитрование в уксусной кислоте 358
Нитрозирование-fJ-метил аминоизо-
бутилметилкетона 155
— хлористого фенацила 469
Нитрозобеизол 8, 354
N-Нитрозо-Э-метиламиноизобутил-
метилкетон 155
Нитрозо-р-нафтол 71
2-Нитрозо-5-нитротолуол 21 1
5-Нитроиндазол 357
2-Нитро-4-метоксианилин 358
2-Нитро-4-метоксиацетанилид 358
2-Нитро-6-мстоксибснзонитрил 201
З-Нитро-4-нитрозотолуол 213
о-Нитротолуол 349
л-Нитротолуол 68
и-Нитрофенол 134
л-Нитрофепол 478
о-Нитр ох лор бензол 216
л-Нитрохлорбензол 160
2-Нитро-и-цимол 66, 360
Нитроэфиров получение 254
Нитрующая смесь 361
Нихромовые спирали в качестве на-
насадки для колонок 407
Нонаметилеи бромистый 112
и-Нонилмеркаптан 248
Окисление альдегида селенистой кис-
кислотой 106
— амина до нитрозосоединения 211
213
— бромной водой 498
— шдроксиламина до нитрозосо-
нитрозосоединения 354
— двухромовокислым натрием и сер-
серной кислотой 354
— дымящей азотной кислотой 9
— подбензолдихлорнда до иодокси-
бензола 262
— кислородом воздуха 405
— кислородом воздуха и щелочью
182
— метилыюй группы до карбоксиль-
карбоксильной группы 212
— нитрозосоединения до нитросо-
единения 214
— о-нитротолуола до о-нитробензаль-
ди ацетата 348
— олефина до кислоты 153
— перекисью водорода 326
— пермаиганатом калия 145
— углеводорода до хинона 82
— хлорноватокислым калием 14
Окись алюминия активированная
176, 189
— меди 257
— мезитила 156
— этилена 380
о-Оксиацетофенон 525, 527
л-Окснбензальдегид 363
Оксим глюкозы 373
Оксиметилолимидазола пикрат 472
Оксим хлорангидрида фенилгли-
оксиловой кислоты 469
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
565
З-Окси-2-нафтойная кислота 51
2-Окси-1-нафтойный альдегид 365
2-Окси-1,4-нафтохинон 367
2-Окси-5-нитробензил хлористый 478
2-(р-Оксипропил)-пиридин 378
Октаацетат 3-генциобиозы 370
й-Октаацетилгенциобиоза 370
к-Октадецилмеркаптан 248
к-Октадециловый эфир п-бромбепзол-
сульфокислоты 250
— — и-толуолсульфокислоты 250
к-Октилмеркаптан 248
Олово 115
— хлористое безводное 331
— — двухводное 161, 363
— хлорное безводное 195
Омыление л-нитробензилового эфира
уксусной кислоты 353
— растительных масел 278, 281,
283
— этилового эфира линолевой кис-
кислоты 280
— — — лииоленовой кислоты 285
Отщепление брома от гексабромстеа-
риновой кислоты 284
-- — — тетрабромстеариновой кис-
кислоты 279
— бромистого водорода от винил-
галогенида 445
•— — — — дибромида 231, 444
— — — с перегруппировкой 272
Палладий 16, 328, 330
Пальмитин 310
Пальмитиновая кислота 310
Парабановая кислота 10
Паральдегид 106
Парафиновое масло 258
Параформальдегид 184, 481
о-Пеларгонилфенол 144
л-Пеларгоиилфеиол 144
Пена, ее разрушение 86
Пентаацетил-й-глюкононитрил 77,
372
Пентаметилен бромистый 112
2,4-Пентандион 92
4-Пентен-1-ол 374
Пентоза, синтез 77
Перегонная колба сдвоенная 116
Перегруппировка ш,о)-дихлорацетофе-
нона до миндальной кислоты 323
.— Клайзена 499
— ретропинаколиновая 189
Перекиси, удаление из диизопропн-
лового эфира 100
Перекись анизоила 377
— ацетилсалициловой кислоты 377
Перекись л-бромбензоила 377
— водорода 236, 237, 326, 377
— л-нитробензоила 377
— и-нитробснзонла 376
— отделение от нее а-тетралона 406
— 3,4,5-трибромбенчоила 377
Перкина реакция 455
Печь электрическая трубчатая 176,
189, 190
я-Пнколиллитий 378
а-Пиколин 145, 378
Пиколиновой кислоты гидрохлорид
145
Пикрат оксимстилолимидазола 472
Пикриновая кислота 473
Пинаколин 188, 189
Пинакон безводный 188, 189
Пинакон-гидрат 188, 190
Пиперидин 295, 454, 501
1-(о-Пиридил)-2-пропанол 378
1-(а-Пиридил)-3-пропанол 380
1-B-Пиридил)-2-пропанол 378
1-B-Пиридил)-3-пропанол 380
Пиридин 61, 114, 249, 344, 393, 396,
456, 505
Пировиноградная кислота 314
Полиглиоксаль 108
Присоединение ариллития к альде-
альдегиду 378
— — — окиси этилена 380
— брома к двойной связи 109, 231,
272
— — — непредельной кислоте 277,
283
— — — непредельному альдегиду
444
— бромистого водорода к метило-
метиловому эфиру акриловой кислоты
308
— — — — этиловому эфиру акри-
акриловой кислоты 309
— гидроксиламина к коричной кис-
кислоте 61
— метиламина к метиловому эфиру
акриловой кислоты 180
— — — окиси мезитила 155
— — — этиловому эфиру акрило-
акриловой кислоты 178
— нитрила к лактону 267
— фенилгидразина к сероуглероду
227
— хлора к ароматическому нодо-
соединению 475, 476
— этилового спирта к акролеи-
акролеину 188
«-Пропил-к-бутиламин 133
1-я-Пропилпирролидин 133
56S
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Пропионил хлористый 123
Псевдоионон 380
Псевдоионона бисульфитное соедине-
соединение 381
Разложение соли диазония с обра-
образованием фенола 117, 364
Расщепление дисульфида 498
— кольца в результате гидролиза
под действием гидрата окиси ба-
бария 298
— тетрагидрофуранового кольца 375
Реакции под давлением 28, 39, 51,
66, 233, 270, 383, 390, 403, 419,
448, 449, 450, 451
Резацетофенои 384
а-Резорциловая кислота 222
Резорцин 219, 384
Реймера?—Тимана реакция 365
Ректификационная колонка типа
Уитмора—Люкса 128, 181, 266,
406, 489
Фенске 89, 90, 128
Ренея никель, катализатор 66, 135,
338, 403, 416, 448, 450
Реформатского реакция 520
Розенмунда синтез альдегида 16
— — нитрила 344
Ртути окись 233, 234, 391, 420
Ртуть 298, 299
— уксуснокислая 389, 418
— хлорная 119, 143, 395
Света влияние на реакцию 389, 397,
418
Свинец уксуснокислый 48, 106
Свинца гидроокись 47
— двуокись 80
— тетраацетат 80
Ссбациновая кислота 208
Себациновой кислоты амид 210
— — динитрил 208
Селен 106, 386
Селена двуокись 107
— соединения, их легкая окисляе-
мость 387
— — их чувствительность к свету
387
— — предосторожности при работе
с ними 386
Селенистая кислота 106
Селенистый водород 386
Селенокрезолы 388
Селенофенол 386
Селенофенолы, получение гидроли-
гидролизом арилселсноцианатов 388
Се.ра 330, 441
Серебро азотнокислое 402
— углекислое 402
— уксуснокислое 78
dl-Серин 389
Серная кислота 27, 42, 49, 117 130,
146, 168, 182 211, 214, 219, 222,
228, 237, 238, 242, 247, 254,
265, 278, 280, 281, 285, 290, 304,
310, 319, 335. 349, 360, 361, 367,
478, 505, 512
— — как циклизующий агент 129,
334
Сернистый ангидрид 299
— газ 113
Сероводород 15, 47, 106, 163, 228,
473
Сероуглерод 228, 301
Синильная кислота 65
Снайдера колонка 310
Солевая баня для нагревания, ее
состав 345
Соляная кислота 14, 51, 59, 84, 103,
117, 138, 142, 143, 161, 165, 170,
173, 195, 203 209, 221, 249,251,
256, 268, 273, 289, 290, 295, 298,
349, 386, 395, 433, 473, 478, 479,
481, 498
Сорбиновая кислота 393
Сочетание двух арильных остатков
216
Спекание, добавление песка или со-
соли для его предотвращения 343,
439
Спирали в качестве насадки' для
ректификационных колонок 406
Спиртовой раствор соляной кислоты
279, 282, 284
Стефена восстановление 331
траис-Стильбен 231, 395
Сулема 119, 143, 395
Сульфон 160
л, л'-Сульфонил-бис-анилин 160
Сульфурил хлористый 49
Сурик 80, 81
Сухой лед (см. также углекислота
'твердая) 39, 180, 200, 494
— — как охлаждающее средство для
холодильника 346
— — применение для внутреннего
охлаждения при нитровании 360
Терефталевый альдегид 397
Тетраацетат свинца 80
1,2,3,4-Тетраацетат fi-d-глюкозы 399
2,3,4,6-Тетраацетат P-d-глюкозы 401
Тетраацетилбромглюкоза 401
Ш'КДЫБТНЫЙ УКАЗАТЕЛЬ
567
1,2,3,4-Тетраацетил-р-с!-глюкоза 399
2,3,4,6-Тетраацстил-^-с!-гл1окоза 401
2,3,4,6-Тетраацетил-а-с!-глюкозпира-
нозил бромистый 97, 401
1,2,3,4-Тетраацетил-6-трифеиилме-
тил-р-й-глюкоза 399
а,а,а',а'-Тетрабром-л-ксилол 397
Тетрабромстеариновая кислота 278,
281
Тетрагидрат аллоксана 10
Тетрагидропиран 113, 403
Тетрагидрофурфурил бромистый 114
— хлористый 375
Тетрагидрофурфуриловый спирт
114, 177, 375
и-Тетрадециловый эфир ге-бромбен-
золсульфокислоты 250
— — л-толуолсульфокислоты 250
Тетралин 405
а-Тетралои 405, 441
2,3,4,6-Тетраметил-<2-глюкоза 407
Тетр а мети лен диамин, метилирование
454
Тстрамстил-а-метилглюкозид 409
а-и Р-Тетраметилметилглюкозиды 409
Тетранитрометан 411
— как реактив для определения двой-
двойных связей 412
Тетрафенилдигидрофталевый ангид-
ангидрид 414
Тетрафенилфталевый ангидрид 413
Тетрафенилциклопентадиенон 413,
415
Тетрахлорэтан 18, 317
— предосторожности при обращении
с ним 18, 316
Тигель для сплавления 31
Тиоацетамид 197
Тиомочсвина 49, 148, 149, 246
Тионил хлористый 24, 124, 313,
375, 443, 458, 460, 463, 477
Тиофенолы 388
Ткань из синтетического волокна
винион для фильтрования 257
— стеклянная для фильтрования 161,
255
Толан 231
о-Толидин 204, 206
л-Толилбензилаыин 416
о-Толилбензиламин 417
л-Толилбензиламин 417
л-Толилмочевина 50
Л4-Толуидин 416
о-Толуидин 259
л-Толуидин 49
л-Толуидин сернокислый 49
Толуол 101, 150, 292, 320, 370,
495
л-Толуолсульфокислота 314
л-Толуолсульфохлорид 249
^-Треонин 417
Три-(л-бифенил)-карбинол 422
симм-Триброманилин 241
3,4,5-Трибромбензоила перекись
377
3,4,5-Трибромбензоил хлористый
377
2,4,6-Триизопропилбензальдегид 20
N-Трикарбоновый эфир 509, 514
2,4,6-Триметилбензальдегид 16
2 4 6-Триметилбензойная кислота
463
Триметилен бромистый 112, 174, 490
Триметилтиомочевина 318
2,4,6-Триметил-а-толуиловая кисло-
кислота 289
Трифенилбромметан 400, 427
Трифенилкарбинол 424, 426
Трифенилметил бромистый 400, 427
— хлористый 399, 426, 427
Трифенилметилирование глюкозы 399
Трифеиилхлорметаи 399, 426, 427
Трихлорацетофенон 325
2,4,6-Триэтилбензальдегид 20
2,4,6-Триэтилфенилацетонитрил 291
Углекислота твердая (см. также
сухой лед) 28, 462
Углекислый газ 21, 280, 285, 299
Уксусная кислота 8, 12, 80, 82,
98, 104, 106, 115, 141, 153, 156,
165, 262, 266, 269, 280, 323, 349,
351, 357, 358, 360, 373, 384, 391,
444, 481
Ульмана синтез 216
о-Ундеканоилфенол 144
л-Ундеканоилфенол 144
Ундецилизоцианат 432
к-Ундецилмеркаптан 248
Ундециловый эфир изоциановой кис-
кислоты 432
Уретан 515
Фаворского колба 361
— метод получения ацетиленовых
спиртов 200
Фенацил хлористый 469, 470
Фенилазид 433
л-Фенилазобензойиая кислота 8, 458
dZ-Фенилаланин 435
а-Фенил-й/-аланин 58
568
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
а-Фенил-а-аминомасляной кислоты
метилирование 454
1-Фенил-1-аминоэтан 448
1-Фенил-2-аминоэтан 450
N-Фенилантраниловая кислота 36
Фенилгидразин 228, 433, 439
— хлористоводородный 433
З-Фенилгидроксиламин 355
Фениглиоксалевая кислота 103
dZ-Фенилглицин 63
1-Фенилдиалин 441
З-Фенилдитиогидразинкарбоновой
кислоты соль 227
о-Фенилендиамин 104
2-Фенилиндол 438
а Фенилиндол 438
Фенилиодидхлорид 262, 475
Фсниллитий 378
Фенилмагний бромистый 321, 386,
424, 441
— — реакция с бензофеноном 425
— — — — этиловым эфиром бен-
бензойной кислоты 424
1-Фенилнафталин 440
а-фенилнафталин 440
Фениловый эфир коричной кислоты
442
1-Фенил-1,2-пропандион 319
Фенилпропаргиловый альдегид 444
Фенилпропиоловый альдегид 444
а-Фенилпропионового альдегида 2,4-
динитрофенилгидразон 447
а-Фенилпропионовый альдегид 446
Фенилтиосемикарбазид 227
а-фенилэтиламин 448
[З-Фенилэтиламин 450, 453
р-Фенилэтилдиметиламин 452
9-Феноксиакридин 38
Фенол 37, 306, 443
Феноловый красный 298
Феофилактова метод получения
а-аминокислот 277
Физера раствор 16
Фильтровальная ткань из синтетиче-
синтетического волокна винноп 257
— — стеклянная 161, 255
Фишера синтез индола 438
Флуоресценция солянокислого 9-ами-
ноакридина 38
Формалин 255, 289, 453, 472, 479
Формальдегид 289, 453
Формгидразин 57
Формил-Л-О-метилаллотреонин 421
Формил-Л-О-метилтреонин 419, 421
о-Формтолуид 258
Фосгена раствор в толуоле 101
Фосфора хлорокись 36, 75, 343, 480
Фосфор красный 299
— пятисернистый 197
— пятихлористый 329, 343, 461
— трехбромистый 114, 529
— — его опасность и предосторож-
предосторожности при обращении с ним 529
— треххлористый 136, 275
— — его опасность и предосторож-
предосторожности при обращении с ним 529
Фосфорная кислота 481
Фосфор новатистая кислота 203
Фосфорный ангидрид 317, 341
Фрайса перегруппировка 220, 221
Фриделя—Крафтса реакция 84, 169,
427, 470
Фруктоза 472, 474
Фталевая кислота 174
— мопоперкислота 326
Фталевый ангидрид 23, 326
Фталид 21, 267
Фталимид 23, 174
— калия 174
2-Фурапакриловая кислота 455
Фурилакриловая кислота 455
Фурфуриламин 449
Фурфурол 449, 455, 456
Хинолин 330
Хиноны 83, 186
Хинсберга метод разделения аминов
131
Хлор 129, 323, 484
9-Хлоракридин 37
Хлоральгидрат 242
N-Хлорамины 130
— циклизация в N-алкилпирро-
лидины 133
Хлор ангидрид азобеизолкарбоновой
кислоты 458
— 1 -ацетокси-3-нафталинкарбоновой
кислоты 331
— беизолсульфокислоты 131
— л-бромбензойной кислоты 377
— изовалериановой кислоты 124
— ^-изодуриловой кислоты 462
— изомасляной кислоты 24, 123
— ю-карбометоксипеларгоновой ки-
кислоты 312
— р-карбометоксипропионовой ки-
кислоты 459
— карбэтоксиадипиновой кислоты
461
— 6-карбэтоксивалериановой кисло-
кислоты 461
-- ш-карбэтоксипеларгоновой кисло-
кислоты 461
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
569
Хлораигидрид карбэтоксисебацино-
вой кислоты 461
— коричной кислоты 124, 443
— лауриновой кислоты 432
— ыезитиленкарбоновой кислоты
462
— /-ментоксиуксуспой кислоты 477
— ^-нафтойной кислоты 328
— л-ннтробепзонпой кислоты 377
— л-нитробензойной кислоты 377
— л-толуолсульфокислоты 249
— 3,4,5-трибромбензойпой кислоты
377
— 2,4,6-триметилбензойной кислоты
16, 462
— л-фенилазобензойной кис'лоты 458
— фенилуксусной кислоты 335
— фталевой кислоты 464
— фумаровой кислоты 169, 464
— хлор уксусной кислоты 124, 470
ж-Хлоранилип 469
о-Хлоранилин 467
Хлорацеталь 41
Хлорацетон 1S7
Хлорбензол в качестве растворителя
49
1-Хлор-2-бромбензол 467
ж-Хлорбромбензол 469
о-Хлорбромбензол 467
•у-Хлорбутиронитрил 347, 495
4-Хлордцфепил 422
я2-Хлоризодурол 289
ш-Хлорияочитрозоацетофенон 469
Хлорирование амида сульфаниловой
кислоты перекисью водорода
и соляной кислотой 236
— вторичных аминов 130
— кетона 323, 483
Хлористоводородный 4-имидазолил-
карбинол 472
— метилолимидазол 472
Хлористые фенацилы замещенные
471
Хлористый водород 18 279, 282,
284, 289, 331, 469, 478
Хлористый иодбензол 475
— /-ментоксиацетил 477
— л-нитробензил 351
— 2-окси-5-нптробензил 478
— тетрагидрофурфурил 375
— тионил 24, 124, 313, 375, 443
458, 460, 463, 477
— фенацил 469
— фумарил 464
Хлористые иодтолуолы 476
2-Хлорлепидин 480
Хлорметилнрование 289, 478, 481
бгл'-(Хлорметил)-нафталИн 482
1-Хлорметилнафталин 481
а-Хлорнафталин 345
4-Хлорнитробензол 160
о-Хлорнвтробензол 216
Хлорокись фосфора 36, 75, 343, 480
а-Хлор-2-окси-5-нитротолуол 478
Хлороформ 77, 272, 366, 475
Холестенон 486
Холестерин 486
Хлоруксусная кислота 293
2-Хлорциклогексанон 483
Хромит меди 23
Хромовая кислота 154, 166
Царская водка 330
Целлосолыз 529
Центрифуга 279, 284
Цианацетамид 294, 343
Циангидрин ацетона 192, 193
— метилэтилкетона 194
Циангидрины 46, 194
Цианистый бензоил 103, 488
ш-Цнанпсларгоновая кислота 208
(u-Цианпеларгоновой кислоты барие-
бариевая соль 209
Циануксусный эфир 520
Цианциклопропан 346, 496
Циклизация 104, 150, 192, 357
— арилтиомочевины в амипобензо-
тиазол 49
— ацетоацетанилида в 4-метилкар-
бостирил 304
— о-ацеттолуида в 2-метилиндол 303
— а-дикетона и кетона в циклопен-
тадиенон 415
— динитровинной кислоты в имида-
зол-4,5-дикарбоновую кислоту 255
— синтез индола 258
— синтезциклобутанкарбоновых ки-
кислот с помощью малонового эфи-
эфира 490
— фенилантраниловой кислоты до
хлоракридина 36
— фенилгидразопа кетона в индол
438
— N-хлораминон в N-алкилпирро-
лидины 459
— 1-хлорбутиронитрила в нитрил
циклопропанкарбоновой кислоты
346
— этилового эфира фенилацетилма-
лоновой кислоты 335
1,1-Циклобутандикарбоновая ки-
кислота 490
Циклобутанмонокарбоновая кислота
490
570
предметный указатель
Циклогексанола натриевое произ-
производное 157
Циклогексанон 200, 483, 522
Циклогексен 152
Циклогексил бромистый 495
а-Циклогексилфенилацетонитрил 494
Циклопропанкарбоновая кислота 496
Циклопропилцианид 346, 495
л-Цимол 361
Цинк 142, 279, 284
— амальгамированный 142, 395
— хлористый 51
безводный 121, 384, 438, 464
— цианистый 17
Цинковая пыль 7, 269, 354, 395,
518
Цинковой пыли очистка 519
Цистеиновая кислота (моногидрат)
498
Цистин 498'
Цитраль, бисульфитное соединение
380
— очистка 380
Четыреххлористый углерод 334, 408,
427
о-Эвгенол 499
Экран защитный 434
Электролиз 508
Эмульсин 370
Энантоилрезорции 144, 370
о-Энантоилфенол 143, 144
л-Энантоилфенол 144
Энантоилхлоррезорцин 144
Энзимы, синтез с их использованием
370
Этерификация 87, 121, 122, 123, 124,
125, 249, 313, 442, 499, 505
— азотной кислотой 254
— дезоксихолевой кислоты 164
— линолевой кислоты 279
— линоленовой кислоты 286
— пировиноградной кислоты с при-
применением колонки для получения
метиловых эфиров кислот 314
— с помощью азеотропной перегон-
перегонки с бензолом 505
Этил-н-амиламин 133
Этилацетат 94, ПО
— безводный 95
Этил бромистый 148, 529
— — в качестве растворителя 113
Этил-и-бутиламин 133
Этиленгликоль 160
Этилизотиоцианат 302, 318
Этилмеркаптан 148
1-Этил-2-метилпирролидин 133
Этиловые эфиры алкилиденциан-
уксусных кислот 522
— — (диалкилвинил)-алкилцианук-
сусных кислот 524
Этиловый спирт 58, 60, 143, 163,
175, 349, 353, 415
абсолютный 39, 61, 66, 88,
109, 145, 148, 178, 279, 284, 287,
334, 415, 435, 445, 446, 503,
523
— эфир акриловой кислоты 179
— — бензальмалоновой кислоты 501
— — бензоилуксусной кислоты 73,
503
— — бензойной кислоты, 167, 424,
503
— —сс-бромизомасляной кислоты 519
— — р-бромпропионовой кислоты
309
— — бромуксусной кислоты 504,
518
— — 1,16-гексадекандикарбоновой
кислоты 508
— — гидразинкарбоновой кислоты
510
— — гидразинугольной кислоты 510
— — глицииа, хлористоводородная
соль 512
— — диазоуксусной кислоты 512
— — диацетилуксусной кислоты,
его медное производное 514
— — 2,5-диметилфенилоксималоно-
вой кислоты 195
— — а, а-диметил-р-фенил-^-окси-
пропионовой кислоты 519
— — 1,3-диокси-2-нафтойной кисло-
кислоты 335
— — дициантиоуксусной кислоты
513
— — диэтиленгликоля 160
— — изотиоцианоиой кислоты 302
— — каприловой кислоты 311
— — лауриновой кислоты 311
— — линолевой кислоты 279
— — линоленовоч кислоты 284
— — малоновой кислоты 334, 490,
501
мезоксалевой кислоты 195
— — N-метил-Р-аминопропионовой
кислоты 179
— — р-метил-р-фенилглицидиой
кислоты 516
— — миндальной кислоты 30
— — миристиновой кислоты 311
— — молочной кислоты 28
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
571
Этиловый эфир монохлоруксусной ки-
кислоты 517
— — муравьиной кислоты 57
— — ортомуравьиной кислоты 445
— — пентаи-1,1,5,5-тетракарбоиовой
кислоты 492
— — пропионовой кислоты 525
— — N-трикарбоновой кислоты 515
— — угольной кислоты 422
•— — фенилацетилмалоновой кисло-
кислоты 334
¦— — фенилметилглицидной кис-
кислоты 446, 516
— — р-фенцл-?3-оксипропионовой
кислоты 518
— — хлоркоричной кислоты 517
— — хлоругольной кислоты 301, 515
— — а-циан-р, р-диэтилакриловой кис-
кислоты 520, 523
2-циан-2-метил-3-этил-3-пентено-
вой кислоты 522
циануксусной кислоты 520
Этиловый эфир а-циан-^-этилиден-к-
валериановой кислоты 522
— — 2-циан-3-этил-2-пентеновой
кислоты 520
— — 1,1-циклобутандикарбоновой
кислоты 490
1-Этилпирролидин 133
Этилтиомочевина 318
S-Этилтиомочевина бромистоводород-
бромистоводородная 148
2-Этилхромон 524
Этинилкарбинолы 198, 200
1-Этинилциклогексанол-1 200
2-Этокси-1-нафтальдегид 74
р-Этоксипропионитрил 527
р-Этоксиэтилбромид 528
р-Этоксиэтиловый спирт 529
.Зфир абсолютный 120, 122, 124, 126,
145, 157, 165, 198, 287, 303, 322,
331, 375, 378, 386, 424, 462, 495,
512
Ядовитость реагентов 18, 386, 408.
Янтарный ангидрид 84, 459
УКАЗАТЕЛЬ СОСТАВИТЕЛЕЙ РЕЦЕПТУРЫ
Абрамович Б. (Abramovitch В.) 122
Адкинс Г. (Adkins H.) 26, 28, 66,
92, 93, 119, 214, 224, 269, 275
287, 297, 310, 326, 338, 370,' 438,
Б24
Аллен Ч. (Allen С. F. Н.) 17,
39, 49, 51, 56, 66, 74, 82, 106,
126, 129, 134, 135, 138, 145,
160, 169, 178, 184, 186, 187,
198, 208, 222, 249, 254,
304, 312, 316, 320, 331, 342,
378, 386, 393, 416, 432 433,
444, 446 459, 464, 469, 478,
481, 496, 499, 501, 510, 515,
Аллее Г. (Alles G. А.) 452
Альберт A. (Albert A.) 36
АльбертиР. (Alberty R. А.) 393,
Амундсен Л. (Amundsen L. Н.)
175
Андрее P. (Andres R. J.) 363
Андрюс Д. (Andrus D. W.) 112,
403
Анжир P. (Angier F.) 401
Анспин Г. (Anspon H. D.) 8,
182, 328, 384, 458
Арндт Ф. (Arndt F.) 150
Арнольд P. (Arnold R. Т.) 21,
246, 262, 264, 399, 435
Астои Дж. (Aston J, G.) 322
Аудрит Л. (Audrieth L. F.) 26
31,
117,
148,
192,
302,
360,
440,
480,
516
456
173,
176,
16,
97,
28
Байзер М. (Baizer M.) 192
Балтцли P. (Baltzly R.) 160
Барнес P. (Barnes R. Р.) 16, 462
Баумгарт И. (Baumgart I.) 401
Бахман В. (Bachmann W. Е.) 7,
8, 12, 46, 49, 56, 61 104, 115,
124, 134, 142, 146 203, 211, 216,
231, 250, 267, 272, 289, 321, 354,
358, 365, 372, 395, 424, 426, 458,
499
Бекер P. (Baker R. Н.) 121
Белл A. (Bell A.) 51, 56, 117, 145,
186, 187, 198, 432, 478, 510, 515
Бергстром Ф. (Bergstrom F. W.) 31
Берджер A. (Berger A.) 395
Бест К. (Best С.) 346
Биггс Б. -(Biggs В. S.) 208
Бигелов X. (Bigelow H. Е.) 7
Биллмэн Дж. (Billman J. H.) 227
Бишоп В. (Bishop W. S.) 208, 312,
316
Блох Г. (Bloch H. S.) 334
Блэтт A. (Blatt A. H.) 319
Блюменштейн К- (Blumenstein С.)
305, 446, 510, 515, 516
Бойак Г. (Boyack G. А.) 294
Боме X. (Bohme H.) 326
Бордвелл Ф. (Bordwell F. Q, ) 121
Бортник Н. (Bortnick N.) 399
Бост P. (Bost R. W.) 74
Боуден Э. .(Bowcien E. E.) 297, 370
Бранд Ф. (Brand F. С.) 148
Бранд Э. (Brand E.) 148
Браун Г. (Braun Q.) 77
Бресло Д. (Breslow D, S.) 518
Брукс Л. (Brooks L. А.) 254, 374,
Брюстер P. (Brewster R. Q.) 214
Бутвелл П. (Boutwell P. W.) 310
Бэйтмэн У. (Bateman W. Н.) 26,
28
Бэк A. (Buck A.) 481
Бэк Дж. (Buck J. S.) 160
Бэркс Р. мл. (Burks R. E. jr.) 310
Бюхлер К. (Buehler С. А.) 478
Вагнер Э. (Wagner E. С.) 192
Вальтер Л. (Walter L. A.) 378
Ван Аллан Дж. (Van Allan J.)
17, 49, 66, 74 106 126, 129, 135,
138, 160, 184, 208, 254, 302, 312,
316, 320, 331, 342, 360, 378, 393,
416, 446, 469, 481, 516
Ван Хоок Дж. (Van Hook J.) 51
Вебер К. (Weber К. Н.) 503
Вейс P. (Weiss R.) 440
Вейсбергер A. (Weissbcrger A.) 73
84, 150, 314, 397
Вейсгербер К. (Weisgerber С. А.)
103, 488
УКАЗАТЕЛЬ СОСТАВИТЕЛЕЙ РЕЦЕПТУРЫ
573
Вест Г. (West H. D,) 389, 418
Вест Э. (West E. S.) 407
Вестон A. (Wcston A. W.) 222
Вильсон К. (Wilson С. V.) 31, 249,
459
Витте М. (Witte M.) 218
Во Т. (Waugh Т. D.) 106
Войцик Б. (Wojcik В. Н.) 9
Вольф И. (Wolff I. A.) 92, 269
Вольф Ф. (Wolf F. J.) 21, 167, 344
Воыак Э. (Womack E. В.) 442,512
Ворис P. (Voris R. S.) 201
Вуд Дж. (Wood J. H.) 74
Вуд Дж. мл. (Wood J. jr.) 142
Вуд Э. (Wood E. H.) 348
Вудвард P. (Woodward R. В.) 363
Вудрафф Э. (Woodruff E. Н.) 305
Гамильтон К- (Hamilton С. S.) 197,
314, 363, 393, 401, 456, 483
Гандер P. (Gander R. J.) 275, 524
Гаррисон Дж. (Harrison G. С.) 527,
528
Гейтс Дж. мл. (Gates J. W. jr.)
134, 148, 222 246, 499
Геллер Г. (Geller H. H.) 297
Герреро Т. (Guerrero T. J.) 297
Гершберг Э. (Hershberg E. В.) 328
Гильыан Г. (Giltnan H.) 44, 497
Готтфрид С. (Gottfried S.) 504
Грин Д, (Green D. L.) 490
Гриффин К- (Griffin К. Р.) 162
Груммнтт О. (Grummitt О.) 413,
415, 481
Дибович Т. (Dabovich Т. С.) 12
Дамшродер P. (Damschroder R. Е.)
104
Дарби У. (Darby W. J.) 472
Делофе В. (Deulofeu V.) 297
ДеМитт Л. (DeMytt L. Е.) 262, 380
Дено II. (Deno N. С.) 8, 354, 358,
458, 499
Денун К. мл. (Denoon С. Е. jr.) 92
Дженкинс Д. (Jenkins D. М.) 322
Дженнер Э. (Jenner E. L.) 289
Джонес Дж. (Jones J. E.) 74, 320
Джонсон Г. (Johnson H. L.) 42
Джонсон Дж. (Johnson G. D.) 56,
134, 272, 289
Джонсон Дж. (Johnson J. R.) 114,
260, 261, 262, 348, 403 415 455,
475
Джонстон X. (Johnston H. W.) 100
Джюдей P. (Juday R.) 287
Дибел Дж. (Deebel G. F.) 478
Диль Г. (Diehl H.) 527, 528
Добратц Э. (Dobratz E, H.) 79
Дорский Дж. (Dorsky J.) 322
Дрсйпср Д, (Draper D.) 448, 450
Дрэйк H. (Drake N. L.) 16, 51, 88,
96, 100, 112, 119, 155, 162, 176,
180, 182, 189, 224, 234, 266, 301,
302, 305, 308, 318, 328, 357,
374, 384, 389, 403, 411, 413, 415,
416, 418, 432, 446, 448, 450, 462,
494, 504, 510, 513, 515, 516.
Думани Т. (Doumani Т. F.) 360
Дэк Дж. (Dec J.) 178, 422
Зауер Дж. (Sauer J. С) 310
Икер 4. (Eaker С. М.) 100, 112, 153,
176, 403, 413 '
Икке P. (lcke R. N.) 452
Ирвин Дж. (Irvine J.) 195
Кайзер Э. (Kaiser E. W.) 272
Калкинс A. (Calkins A. E.) 292, 477
Картер Г. (Carter H. Ь\) 100, 389,
418
Кархарт Г. (Carhart H.) 308
Кейзон Дж. (Cason J.) 79, 328, 459,-
486
Кельтон С. мл. (Kelton S. С. jr.)
442
Кельш К. (Koelsch С. F.) 115
Кенион Р. (Кепуоп R. L.) 380
Кеннеди Э. (Kennedy E. R.) 260,
261, 264, 475
Кент P. (Kent R. Е.) 24, 294, 341
Киблер Ч. (Kibler С, J.) 73, 254,314
Киридес Л. (Kyrides L. Р.) 464
Кирхнср Ф. (Kirchncr F. К.) 478
Кларк Дж. (Clark J. H.) 39
Кларк Дж. (Clark J. R.) 242
Кларк X. (Clarke И. Т.) 77, 372,498
Клегг Дж. (Clegg J. \V.) 508
Клейнбсрг Дж. (Kleinberg J.) 28
Клелэнд Э. (Cleland E. S.) 227
Клётцель М. (Kloetzel M. С.) 142
Кливлэнд Э. (Cleveland E.A.) 42,
111, 216, 367
Кнейсли Дж. (Kneisley J. W.) 54,
272
Кобурн Э. (Coburn E. R.) 189
Кол У. (Cole W.) 372
Колес P. (Coles R. F.) 314
Кольмэн Дж. (Coleman G. П.) 42,
129, 354, 401, 458, 496
Коннор P. (Connor R.) 242, 246
Коонрадт Г. (Coonradt H.) 438
Коп А. (Соре А. С.) 494, 520, 522
574
УКАЗАТЕЛЬ СОСТАВИТЕЛЕЙ РЕЦЕПТУРЫ
Кормэн Дж. (Korman J.) 124, 216
Корнблюм Н. (Kornblum N.) 203
Коуб К. (Kobe К. А.) 360
Коффман Д. (Coffman D. D.) 198
Крантц К. (Krantz К. \\.) 175
Кребс Э. (Krebs E.) 376
Крессмэн Г. (Cressman H. W. J.)
304, 386, 480, 496
Криницкий Дж. (Krynitsky J. A.)
96, 180, 266
Кроссли Ф. (Crossley F.S.K01, 318
Крэго Э. ыл. (Cragoe E. J. jr.) 197
Кук У. (Cook W. В.) 44
Кундигер Д. (Kundiger D.) 109, 244
Купер С. (Cooper S. R.) 384
Кушнер С. (Kushner S.) 115, 203
Кэзлоу К. (Kaslow С. Е.) 304, 480
Лангли В. (Langley W. D.) 211
Ланн Дж. (Lann J.)96, 180, 266
Лауер В. (Lauer W. М.) 304, 480
Левин Н. (Levin N.) 469
Лернер A. (Lerner A.) 399
Лероль И. (Lerohl I.) 97
Леффлср М. (Lefflcr М. Т.) 292, 477
Лианг П. (Liang P.) 411
Линдсей P. (Lindsay R. О.) 433
Лит Дж. (Leete J. F.) 37.0
Лою.арт Л. (Lockhart L. В.) 365
Лоулср Дж. (Lawlcr J. С.) 433
Люкас X. (Lucas H. J.) 260, 261, 264,
475
ЛютцР. (Lutz R. Е.) 16?
Майлс Дж. (Myles J. R.) 422
Мак-Интош A. (Mclntosh A. V.) 153,
164
Мак-Катчон Дж. (McCutdieou J. \V.)
277, 283
Мак-Клоски Ч. (McCloskey С. М.)
354, 401, 458, 496
Мак-Крекен Дж. (McCracken J. H.)
178
Мак-Нотон Н. (McNaughton N. W.)
49
Максвелл Ч. (Maxwell С. Е.) 82, 184,
231, 365, 3S5
Мак-Упртер Дж. (McWhirter J.) 442
МакЭльвен С. (McEIvain S. М.) 24,
109, 145, 167, 244, 294, 341, 503
Мак-Юэн В. (McEwen W. L.) Ill
Маньяни A. (Magnani A.) 167
Марвел К. (Marvel С. S.) 9, 135, 249,
250, 275, 435
Мартене Т. (Martens Т. F.) 120
Мартин Э. (Martin E. L.) 69, 367
Мейер К- (Meyer К.) 334
Мозинго P. (Mozingo R.) 16, 119,
162, 178, 224, 301, 308, 318, 328,
338, 384, 411, 416, 462, 524
Moop M. (Moore M. L.) 301, 318
Морин P. (Morin R. D.) 146, 267
Мортон Э. (Morton А. А.) 422
Моффетт P. (Moffelt R. В.) 153, 164,
321
Мун Н. (Moon N. S.) 93, 242, 397,
442
Мэтьюс P. (Matthews R. А.) 264
Найтингел Д. (Nightingale D.) 14
Нательсон С. (Natelson S.) 504
Нейман Ф. (Neumann F. W.) 73, 121,
122, 501
Нельсон A. (Nelson А. В.) 512
Никольс Г. (Nichols G.) 129, 458
Пиман К. (Niemann С.) 97
Ноллер К. (Noller С. R.) 24, 141,
341, 444
Ньюкирк Дж. (Newkirk .1. D.) 322
Ньюмэн М. (Newman M. S.) 344, 483
Ньютон Л. (Newton L. R.) 189
Нэджи С. (Nagy S. М.) 77, 372
Оквуд Т. (Oakwood T. S.) 103, 488,
490 • ¦
Опи Дж. (Opie J. W.) 348
Оппенауер P. (Oppenauer R, V.) 486
Op вол л Э. (Orwoll E. F.) 117
Паттерсон В. (Patterson V. A.) 518
Паттерсон Л. (Patterson L. A.) 308
Петер сон B\ (Peterson W. D.) 104,
162, 357
Пингерт Ф. (Pingert F. P.) 88, 169,
440, 464
Пинкни П. (Pinkney P. S.) 508
Полэнд Л. (Poland L. B.) 405
Портер X. (Porter H. D.) 357
Прайс Ч. (PriceC. C.) 146, 267, 376
Престон P. (Preston R. K.) 155
Причард В. (Prichard \V. \V.) 182
Раджагопалан С. (Rajagopalan S.)
456
Райе Ф. (Rice F. O.) 155
Раман П. (Raman P. V. A.) 456
Рарс Э. (Rahrs E. J.) 351 353
Расселл Л. (Russell A.) 126, 201, 218,
365, 380
Расселл Ч. (Russell С R.) 103, 351,
353, 488
Редеыан К. (Redemann С. Е.) 97, 155
Рейнольде Д. (Reynolds D. D.) 3P9
УКАЗАТЕЛЬ СОСТАВИТЕЛЕЙ РЕЦЕПТУРЫ
575
Рендалл Дж. (Rendall J. L.) 173,
175
Ренфроу В. мл. (Renfrow W. В. jr.)
380
Рибзомер Дж. (Ricbsomer J. L.) 195
Рив Э. (Reeve E. W.) 51
Ригель Б. (Riegel В.) 153, 164
Рид P. (Read R. R.) 126, 142
Ритц Э. (Rietz E.) 138
Ритчи Б. (Ritchie В.) 36
Ричарде Л. (Richards L.) 338
Роберте P. (Roberts R.) 155
Робинсон Д. (Robinson D. В.) 7
Робинсон Дж. мл. (Robinson J. С.
jr.) 36, 186, 187, 448, 450
Робэк A. (Roebuck А. К.) 438
Роджерс P. (Rogers R. Q.) 267
Ролл Л. (Roll L. J.) 319
Ронзио A. (Ronzio A. R.) 44, 106
Ротштейн Л. (Rothstein L.) 319
Роулэнд P. (Rowland R. L.) 39, 195,
232, 472
Роулэнд С. (Rowland S. Р.) 17, 58,
G3, 277, 283
Ругов Дж. (Ruhoff J.) 214
Рэбджон Н. (Rabjohn N.) 289
Рэйни Дж. (Rainey J. L.) 93
Саузвик П. (Southwick P. L.) 424
Саундсрс Дж. (Saunders J. H.) 452,
520, 522
Сванн Ш. мл. (Swann Sh. jr.) 508
Свела М. (Sveda M.) 26
Сейкел М. (Seikel M. К.) 236
Секера В. (Sekera V. С.) 249
Сйлловей X. (Sillowav H. Т..) 54
Сиырил В. (Simril V. *L.) 126
Сингер A. (Singer A. W.) 145
Смит В. (Smith W. М.) 88, 155, 374,
494
Смит Г. (Smith G. А.) 141
Смит К. (Smith С. R.) 334
Смит Л. (Smith L. Н.) 114
Смит Л. (Smith L.) 513
Смит Л. (Smith L. I.) 21, 97, 182,
227, 231, 232, 234, 246, 262, 264,
294, 348, 380, 399, 435, 508
Снайлер X. (Snyder H. R.) 39, 54,
195, 232, 236, 254, 334, 374, 448,
450, 452, 467, 472, 520, 522
Сиелл Дж. (Snell J. M.) 397
Сойер P. (Sawyer R. L.) 114, 176
Соудер У. ыл. (Souder W. H. jr.)
119, 224
Спасов A. (Spassow A.) 124, 513
Спиллен Л. (Spillane L. I.) 182
Спир Дж. (Speer J. H.) 12
236
Спрэдлинг A. (Spradling А. В.)
Спэнглер Ф. (Spangler F. W.) 501
Стерлинг Дж. (Sterling J.) 432
Стивене К. (Stevens С. М.) 455
Стивенсон К. (Stevenson К.) 246
Стодола Ф. (Stodola F. Н.) 490
Струве В. (Struve W. S.) 7, 104, 321
Стуквиш К. (Stuckwisch С. G.) 44
Стэнтон У. (Stanton W. А.) 389,418
Стюарт Ф. (Stuart F. А.) 354
Сьютер Ч. (Suter С. М.) 222
Сэмпсон X. мл. (Sampson H. J. jr.)
39, 232
Сэндерсон Дж. (Sanderson J. J.) 173,
175
Сюррей A. (Surrey A. R.) 342
Тайсон Ф. (Tyson F. Т.) 258
Тарбелл Д. (Tarbell D. S.) 358
Теббенс В. (Tebbens W. G.) 201
Тзанг С. (Tsang S. М.) 348
Тилфорд К. (Tilford С. Н.) 14, 63,
82, 109, 244, 258, 292, 322 376,
477, 503, 512, 527, 528
Тиффани Б. (Tiffany В. D.) 227
Толлфсон P. (Tollefson R.) 189, 302
Томпсон P. (Thompson R. В.) 405
Тоттер Дж. (Totter J. R.) 472
Тэрнер P. (Turner R. В.) 153,
164
Уайзгарвер В. (Wisegarver В. В.)
452
Уайлдс A. (Wilds A. L.) 216
Уаймэн Ф. (Wyman F. W.) 427
Уайтхед К. (Whitehead С. W.) 483
Уикс 3. мл. (Wicks Z. jr.) 467
Уильяме Б. (Williams В.) 214
Уильяме Дж. (Williams Л. W.) 96,
162, 180, 234, 266, 331, 513
Уитмор Ф. (Wliitmore F. С.) 490
Унгнаде X. (Ungnadc H. Е.) 117
Уорд М. (Ward M. L.) 17
Уорд X. (Ward H. Р.) 155
Уркварт Г. (Urquhart G. G.) 246
Уэйн У. (Wayne W.) 119, 224, 287
Уэлч Э. (Welch E.) 69, 426, 348
Фальков М. (Falkof M. М.) 231
Фанта П. (Fanta P. E.) 358
Фарбмэн М. (Farbman M. D.) 483
Ферри К. (Ferry С. W.) 160
Физер Л. (Fieser L. F.) 69, 74, 84,
153, 164, 320, 367, 486
Филлипс P. (Phillips R.) 214
Фишер Г. (Fischer H.) 141, 269
576
УКАЗАТЕЛЬ СОСТАВИТЕЛЕЙ РЕЦЕПТУРЫ
Формо М. (Formo M. W.) 260 261
262, 264, 475
Формэн Э. (Foreman E. L.) 326
Фостер Д. (Foster D. G.) 386
Фостер Л. (Foster L. S.) 126
Фраджола В. (Frajola W.) 21
Фоазиер Д. (Frazier D.) 24, 341
Фрай Дж. (Frye J. R.) 218
Франк P. (Frank R. L.) 100
Фрсйдснберг В. (Freudenberg W.)
287
Фримэн A. (Freeman A. F.) 357
Фрэйм Г. (Frame G. F.) 192
Фьюзон P. (Fuson R, С.) 17, 42, 111,
216, 272, 289, 367
Хандрик P. (Handrick R. G.) 254
Харвуд X. (Harwood H. J.) 497
Харкема Дж. (Harkema J.) 422
Хартвелл Дж. (Hartwell J. L.) 74,
467
Хартмэн В. (Hartman W. W.) 9, 54,
84, 150, 319, 351, 353 407
Хартунг В. (Hartung W. H.) 469
Хаузер Ч. (Hauser С. R.) 122, 427,
518
Хейвуд С. (Haywood S.) 415, 504
Хейн Б. (Hain В. Е.) 310
Хейсиг Г. (Heisig G. В.) 490
Хельферих Б. (Ilelferich В.) 370
Хетцнер X. (Hetzncr H. Р.) 424
Хипшер X.(Hipsher H.) 483
Хитон К. (Heaton С. D.) 444
Хоен В, (Hoehn W. М.) 518
Хоен X. (Hoehn Н. Н.) 234
Холмс Д. (Holmes D. W.) 211, 250
Хольден p. (Holden R. F.) 407
Хорнер Дж. мл. (Horner J. W. jr.)
508
Хорнинг Э. (Horning E. С.) 17
Хоуард К. (Howard К. L.) 232, 435
Худзон Б. мл. (Hudson В. Е. jr.)
122, 427
Хэнкок Э. (Hancock E. М.) 494, 520,
522
Чао Юн'тзунг (Chao Yun-Tsung) 46,
61
Шайб В. (Shibe W. J.) 242
Швадерер A. (Schwaderer А. Л.) 407
Шварц Дж. (Schwarz G.) 197
Шеппард О. (Sheppard О. Е.) 9
Шивере Дж. (Shivers J. С.) 122
Шихан Дж. (Sheehan J. T.) 287
ПТлаттер М. (Schlatter M. J .) 346
Шрайнер P. (Shriner R. L.) 14, 21,
36, 58, 63, 69, 73, 79 82, 93, 103,
109, 121, 122, 167, 173, 175, 186,
187, 201, 218, 242, 244, 258, 277,
283, 292, 321, 322, 344, 346, 351,
353, 376, 395, 397, 405, 422, 424,
426, 427, 433, 438, 442, 455, 477,
488, 501, 503, 512, 518, 527, 528
Штейгер P. (Steiger R. Е.) 46, Е8,
61, 63
Шультц Э. (Schultz E.) 399
Эванс У. (Evans W. L.) 3G9
Эденс К. мл. (Edens С. О. jr.) 444
Эджертон P. (Edgerton R.) 12, 354
Элер P. (Oehler R.) 508
' Эмерсон В. (Emerson W. S.) 422
Эшли В. (Ashley W. С.) 438
СОДЕРЖАНИЕ
Предисловие редактора 5
Азобензол 7
Азобензолкарбоновая кислота 8
Аллоксан 9
Аллоксан-моногидрат 12
Аллоксантин-дигидрат 14
Альдегид мезитиленкарбоновой кислоты 16
Альдегидофталевая кислота 21
Амид изомасляной кислоты 24
Амид миндальной кислоты 26
Амид молочной кислоты 28
Амид натрия 31
9-Аминоакридин • 36
Аминоацеталь 39
о-Аминобензиловый спирт 42
4-Амино-2,6-димстилпирнмидин 44
а-АминодиэтилуКсусная кислота 46
2-Амино-6-метилбеизотиазол 49
З-Амино-2-нафтойная кислота , -51
2-Амино-4-нитрофенол . 54
1-Амино-1,3,4-триазол 56
й/-а-Амино-а-фенилпропионовая кислота • . . 58
Л-р-Амино-^-фенилпропионовая кислота 61
Л-а-Аминофепилуксусная кислота 63
2-Амино-ге-цимол 66
Аммонийная и калиевая соли 1,2-нафтохинон-4-сульфокислоты .... 69
Аиилид бензоилуксусной кислоты 73
9-Антральдегид; 2-этоксн-1-нафтальдегид ¦ 74
d-Арабиноза 77
Аценафтенол-7 79
Аценафтенхинон 82
р-C-Аценафтоил)-пропиоиовая кислота 84
Ацеталь акролеина и ацеталь fl-этоксипропиоиового альдегида ..... 88
Ацетилацетон 92
Ацетоацетаннлид 96
Ацетобромглюкоза 97
Бензиловый эфир хлоругольной кислоты и его производные 10О
37 сборник 3
.578
СОДЕРЖАНИЕ
Бензоилмуравьиная кислота 103
1,2,3-Бензотриазол 104
Бисульфитное соединение глиоксаля 106
Бромацеталь 109
Бромистый дскаметилсн 111
Бромистый пентаметилен ... 112
Бромистый тетрагидрофурфурил 114
6-Бром-2-нафтол 115
З-Бром-4-окснтолуол 117
трет-Вутилат алюминия 119
mpem-Бутилацетат 121
и-Бутилбензол 126
1-и-Бутнлпирролидин 129
о-к-Бутоксинитробеизол 134
Л-Валин 135
Винилуксусная кислота 138
Гемин • 141
о-н-Гептилфснол 142
Гидрохлорид пиколиновой кислоты 145
Гомофталевая кислота 146
Гуанидилуксусная кислота 148
Дегидрацетовая кислота 150
нор-Дезоксихолевая кислота • 153
Диазометан 155
4,4'-Диаминодифенилсульфон 160
1,2-Диамино-4-нитробензол 162
3,12-Диацетокси-бисяо/?-холанилдифенилэтнлен 104
Дибензоилметан 167
т/?янс-Дибензоилэтилен 169
f-Ди-м-бутиламинопропиламин 173
р-Ди-н-бутиламиноэтиламин 175
2,3-Дигидропиран 176
Ди-8-карбэтоксиэтилметиламин 178
Димер кетена 180
р,В-Диметилакриловая кислота 182
р-Диметиламинопропиофенон солянокислый 184
2,3-Диметилантрахинон 186
2,3-Диметилбутадиен-1,3 187
5,5-Днметилгидантоин 192
2,5-Диметилминдальная кислота 195
2,4-Диметилтиазол 197
Диметилэтииилкарбннол 198
2,6-Димстокснбензопитркл 201
З,3'-Диметоксидифенил и 3,3'-дг;метилдифеннл 203
Динитрил себациновой кислоты и ы-цианпеларгоновая кислота .... 208
2,5-Динитробензойная кислота "..... 211
СОДЕРЖАНИЕ
579
13,5-Динитробснзойная кислота 214
2,2'-Дннитродифенил 216
2,6-Дноксиацетофенон 218
3,5-Дноксибензойная кислота 222
Днпнон 224
Дитизон 227
Дифеннлацетиден 231
Дифенилдиазометаи 232
Дифенилкетен 234
2,6-Дих.торапилин и 2,6 - днброманилин 236
а,а-Дихлорацетамид 242
Диэтилаиеталь кетена 244
я-Додецшшеркаптаи 246
к-Додециловый (лауриловый) эфир л-толуолсульфокислоты 249
<Я-Изолейцин 250
Имидазол 254
Индол 258
Йодистый дифеннлнодоний 260
Иодобензол 261
Иодозобензол '. 264
н-Капроновый ангидрид 266
о-Карбоксифенилацетонитрил 267
Кряптопиррол 269
Кумариловая кислота 272
dl-Леицин 275
Линолевая кислота 277
Линолсновая кислота 283
Л-Л\анноза , . 287
Мезитилуксусная кислота 289
i-Ментоксиуксусная кислота 292
^-Метилглутаровая кислота 294
М-Метил-3,4-диоксифенилалгнин 296
Метилизотяоцианат 301
2-Метилиндол 302
4-,Метнлкарбостирил 304
4-Метилкумарин 305
Метиловый ьфир З-бри^припноновой кислоты 308
Метиловый эфир миристиновой кислоты, метиловый эфир пальмитиновой
кислоты и соответствующие кислоты 310
Метиловый эфир моноамида себациновой кислоты 312
Метиловый эфир.пировиноградной кислоты 314
Метиловый эфир ш-цианпеларгоновой кислоты 316
Метилтиомочевина 318
Метилфспилглиоксаль 319
N-Метилформани.шд 320
. ш-Метоксиацетофенон 321
580
СОДЕРЖАНИЕ
Миндальная кислота 322
Мононадфталевая кислота 326
р-Нафтойный альдегид 328
Нафторезорции 334
Никель Репея (катализатор) 338
Нитрил изомасляной кислоты 341
Нитрил малоновой кислоты 342
Нитрил а-нафтойной кислоты 344
Нитрил циклопропанкарбоновой кислоты 346
е-Нитробензальдегид 348
л-Нитробензилацетат 351
л-Нитробензиловый спирт 353
Нитрозобензол 354
5-Нитроиндазол 357
2-Нитро-4-метоксианилии 358
2-Нитро-л-цимол 360
л«-Оксибензальдегид 363
2-Окси-1-нафтойный альдегид 365
2-Окси-1,4-иафтохинон 367
Р-Октаацетилгеициобиоза 370
ПентаацетюыУ-глюкононитрил 372
4-Пентен-1-ол 374
Перекись л-нитробеизоила 376
1-(а-Пиридил)-2-пропаиол 378
Псевдоионон 380
Резацетофенон 384
Селенофенол 386
Л-Серии 389
Сорбиновая кислота 393
транс-Стилъбеи • 395
Терефталевый альдегид 397
1,2,3,4-Тетраацетил-р-й-глюкоза 399
2,3,4,6-Тетраацетнл-р-й-глюкоза 401
Тетрагидропиран 403
о-Тетралои ' 405
2,3,4,6-Тетраметил-й-глюкоза 407
Тетранитрометан 411
Тетрафенклфталевый ангидрид 413
Тетрафенилциклопентадиенон 415
.и-Толилбензиламин 416
Л-Треонин 417
Три-л-бифснилкарбинол 422
Трифенилкарбинол 424
Трифеиилхлорметаи 426
Ундецилиаоциаиат ¦ 432
Фенилазид 433
СОДЕРЖАНИЕ 581
dZ-Фенилаланин 435
2-Фепилиидол 438
1-Фенилнафталин 440
Феииловый эфир коричной кислоты 442
Фенилпропаргиловый альдегид . 444
а-Фенилпропионовый альдегид . 446
а-Фснилэтиламии 448
р-Фенилэтиламш 450
,р-Феиилэтилдиметиламин 452
Фурилакриловая кислота 455
Хлорангидрид азобензолкарбоиовой кислоты ' 458
Хлорангидрид [i-карбсметоксипропиоиовой кислоты 459
Хлорангидрид 2,4,6-триметилбензойной кислоты 462
Хлорангидрид фумаровой кислоты 464
о-Хлорбромбензол 467
(u-Хлоризонитрозоацетофенои 469
Хлористоводородный 4-метилолимндазол 472
Хлористый иодбензол 475
Хлористый /-ментоксиадетил 477
Хлористый 2-окси-5-нитробензил .... ¦ 478
2-Хлорлепидин . 480
1-Хлорметилнафтаяин 481
2-Хлорциклогексаион 483
Холестсиоп 486
Цианистый беизоил 488
1,1-Циклобутандикарбоновая и циклобутанмопокарбоновая кислоты . . 490
а-Циклогексилфеиилацетонитрил 494
Циклопропаикарбоновая кислота 496
Цистеиновая кислота (моногидрат) 498
о-Эвгеиол 499
Этиловый эфир бензальмалоновой кислоты 501
Этиловый эфир бензоилуксусиой кислоты 503
Этиловый эфир бромуксусной кислоты 504
Этиловый эфир 1,16-гексадекандикарбоновой кислоты 508
Этиловый эфир гидразиикарбоновой кислоты и диаминобиурет 510
Этиловый эфир диазоуксусной кислоты 512
Этиловый эфир диацетоуксусной кислоты 513
Этиловый эфир Л?-трикарбоиовой кислоты 515
Этиловый эфир феиилметилглицйдной кислоты 516
Этиловый эфир S-фенил-р-оксипропионовой кислоты 518
Этиловый эфир а-циаи-р,р-диэтилакриловой кислоты 520
Этиловый эфир а-циан-р-этилиден-н-валериановой кислоты 522
2-Этилхромон 524
^-Этоксипропионитрил 527
^-Этоксиэтилбромид 528